Автор: Тимофеев В.С. Серафимов Л.А.
Теги: производство органических веществ органические соединения химическая технология химические производства органическая химия органический синтез
ISBN: 5-06-004267-7
Год: 2003
Текст
В.С.ТИМОФЕЕВ
Л.А.СЕРАФИМОВ
ПРИНЦИПЫ
ТЕХНОЛОГИИ
основного
ОРГАНИЧЕСКОГО
И НЕФТЕХИМИЧЕСКОГО
СИНТЕЗА
ИЗДАНИЕ ВТОРОЕ, ПЕРЕРАБОТАННОЕ
Допущено Министерством образования
Российской Федерации в качестве учебного
пособия для студентов высших учебных
заведений, обучающихся по направлению
«Химическая технология и биотехнология»
и направлению подготовки дипломированных
специалистов «Химическая технология
органических веществ и топлива»
МОСКВА
"ВЫСШАЯ ШКОЛА"
2003
УДК 661.7(0.75.8)
ББК 35.61
Т415
Рецензенты:
кафедра технологии основного органического и нефтехимического синтеза
Российского химико-технологического университета им. Д.И. Менделеева
(зав. кафедрой д-р хим. наук, проф. В.Ф. Швецу, д-р хим. наук, проф.
Ю.А. Трегер (ФГУП НИИ «Синтез» с КБ)
Тимофеев, В.С.
Т415 Принципы технологии основного органического и нефтехи-
мического синтеза: Учеб, пособие для вузов/B.C. Тимофеев,
Л.А. Серафимов.— 2-е изд., перераб.— М.: Высш, шк., 2003.—
536 с.: ил.
ISBN 5-06-004267-7
Рассмотрена технология основного органического и нефтехимического
синтеза. Даны режимы работы технологических объектов. Изложены систем-
ные закономерности, используемые при создании и оптимизации производств,
а также принципы автоматизированного проектирования производств. Приве-
дены теоретические основы и технологические принципы оформления реакци-
онных подсистем и совмещенных процессов. Представлены физико-химичес-
кие основы и технологическое оформление массообменных подсистем. Изло-
жены принципы создания безотходных производств. Рассмотрена технология
получения основных продуктов основного органического и нефтехимического
синтеза (парафинов, олефинов, ароматических углеводородов, метанола и др.)
на базе изложенных принципов.
Для студентов химико-технологических вузов. Может быть полезно науч-
ным сотрудникам и проектировщикам, работающим в данной и смежных
отраслях.
УДК 661.7(0.75.8)
ББК 35.61
ISBN 5-06-004267-7 © ФГУП «Издательство «Высшая школа», 2003
Оригинал-макет данного издания является собственностью издательства
«Высшая школа», и его репродуцирование (воспроизведение) любым спосо-
бом без согласия издательства запрещается.
ОГЛАВЛЕНИЕ
Введение.......................................9
Часть 1. Теоретические основы технологии
крупнотоннажных производств
органических продуктов........................14
Diaea 1. Технологическое оформление производств
основного органического и нефтехимического
синтеза (ОО и НХС)......................................... 14
Химическая технология как наука................14
Особенности технологии основного
органического и нефтехимического синтеза.......16
Структура производства и отрасли...............20
Режимы работы технологических объектов.........22
Общие принципы создания технологических
процессов......................................25
Diaea 2. Системные закономерности в технологии основного
органического и нефтехимического синтеза................30
Производство как сложная система...............32
Система и ее составные части...............32
Свойства и характеристики систем...........35
Системное представление производства.......39
Модели технологических установок
и комплексов производств.......................41
Виды и общая характеристика моделей........43
Матричное представление моделей............46
Варианты соединения аппаратов
и передаточные функции.........................49
Последовательное соединение элементов......51
Параллельное соединение элементов..........52
Соединение элементов по схеме с обратной связью.53
4
Оглавление
Системный подход к разработке технологии
производства.....................................56
Методологические принципы...................56
Разработка схем химико-технологических систем.61
Выбор технологии производства продуктов.....63
Математическое моделирование
химико-технологических объектов..................65
Оптимизация производства.........................72
Декомпозиция химико-технологических систем....72
Оптимизация химико-технологических систем.....73
Надежность работы отдельных аппаратов
и химико-технологических систем..................79
Оценка работоспособности системы...................88
Гтава 3. Технологическое оформление
реакторных подсистем..............................90
Классификация химических реакций...................91
Классификация процессов.........................102
Классификация реакторных устройств..............120
Выбор реакторных устройств......................130
Пути интенсификации работы
реакторных устройств............................134
Гтава 4. Подсистема разделения............................144
Фазовое равновесие..............................148
Термодинамические основы фазовых равновесий
в многокомпонентных неидеальных системах...149
Математическое моделирование
фазовых равновесий.........................152
Общие подходы к синтезу
технологических схем разделения.................159
Методы синтеза технологических схем разделения.....162
Термодинамико-топологический анализ структур
диаграмм фазового равновесия....................171
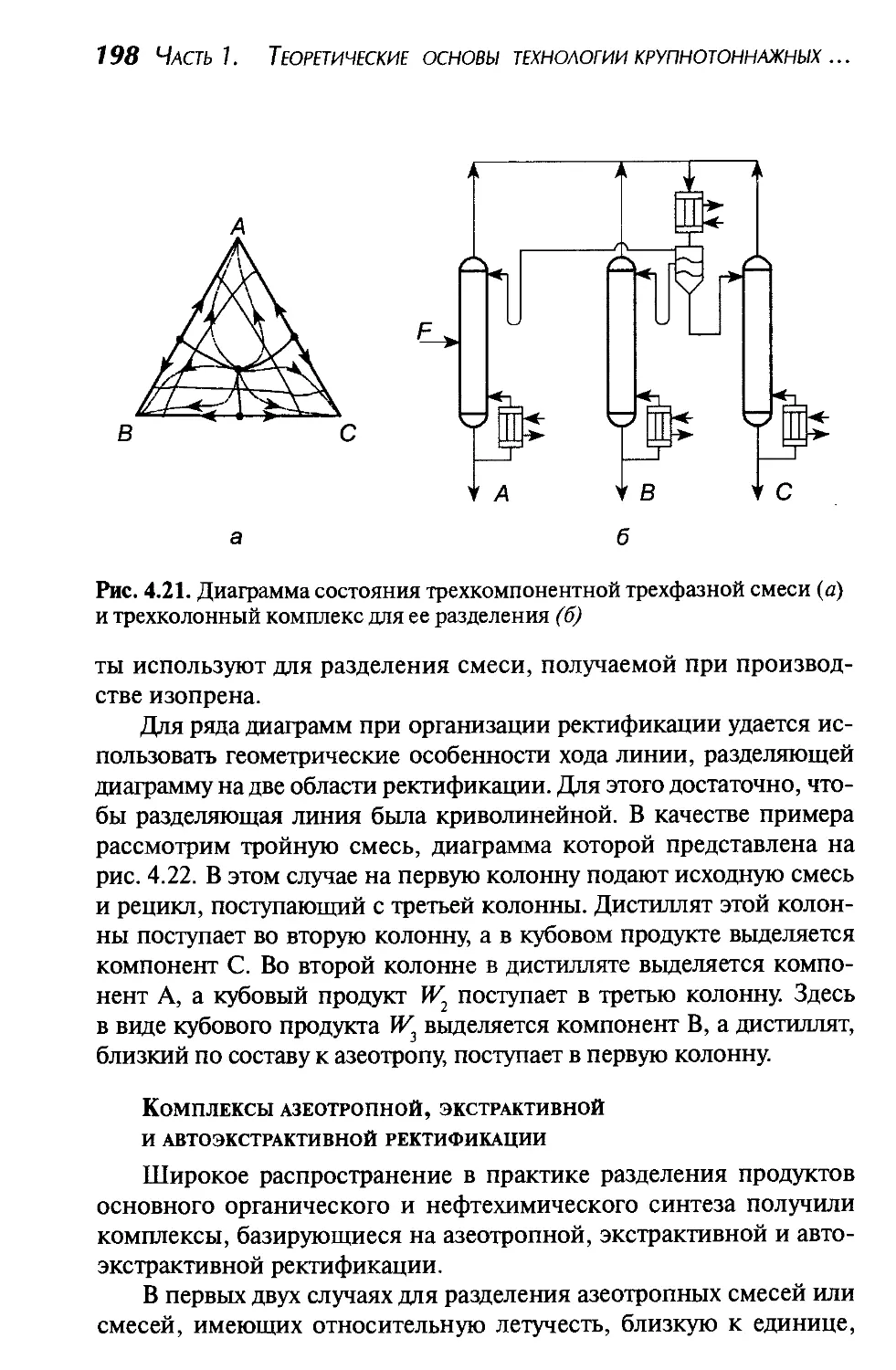
Методы разделения и принципы их выбора.............183
Разделительные комплексы...........................188
Комплексы для разделения зеотропных смесей....189
Комплексы для разделения азеотропных смесей...189
Комплексы азеотропной, экстрактивной
и автоэкстрактивной ректификаций...........198
Оглавление
5
Diaea 5. Совмещение как метод улучшения технологии.....203
Классификация совмещенных процессов.........206
Анализ статики непрерывных совмещенных
реакционно-ректификационных процессов (НСРРП). ... 209
Правила определения принципиальной
протяженности реакционной зоны..............212
Общие принципы организации НСРРП............214
Примеры непрерывных совмещенных
реакционно-массообменных процессов..........217
Diaea 6. Принципы создания безотходных
(малоотходных) производств..............................226
Общие подходы к созданию
безотходных производств.....................229
Методологические принципы...................234
Химические принципы.........................236
Технологические принципы....................241
Организационные принципы....................259
Условия применения принципов создания
безотходных производств.....................262
Экономическое обоснование
безотходных технологий......................266
Часть 2. Технология крупнотоннажных производств
органических продуктов...........................271
Diaea 7. Алкилирование ароматических углеводородов...........271
Теоретические основы процесса алкилирования.......272
Технология алкилирования бензола олефинами........281
Производство этилбензола и изопропилбензола
в присутствии А1С13..........................282
Производство этилбензола и изопропилбензола
на гетерогенных катализаторах................290
Принципы в технологии алкилирования
бензола олефинами.................................295
Принципы в технологии
жидкофазного алкилирования...................296
Принципы в технологии алкилирования бензола
на гетерогенном катализаторе.................298
6
Оглавление
Гтава 8. Производство стирола и оксидов олефинов..............299
Производство стирола дегидрированием этилбензола. 299
Теоретические основы процесса дегидрирования.299
Технологическое оформление процесса..........302
Принципы в технологии получения стирола
дегидрированием этилбензола..................310
Совместное получение стирола и пропиленоксида.....311
Теоретические основы технологии совместного
получения стирола и пропиленоксида...........312
Технология совместного получения стирола
и пропиленоксида.............................317
Принципы в технологии совместного получения
стирола и пропиленоксида.....................321
Производство оксидов олефинов прямым
окислением олефинов...............................322
Теоретические основы процесса................324
Технология производства оксида этилена
парциальным окислением этилена...............329
Принципы в технологии производства оксида
этилена окислением этилена...................333
Гтава 9. Производство фенола и ацетона
из изопропилбензола...........................................335
Теоретические основы процесса.....................337
Окисление изопропилбензола...................337
Разложение гидропероксида изопропилбензола...339
Технология совместного производства
фенола и ацетона из изопропилбензола..............341
Совместное получение фенола, ацетона
и пропиленоксида из изопропилбензола..............345
Принципы в технологии производства фенола
и ацетона из изопропилбензола.....................348
Гтава 10. Технология производства метанола....................350
Теоретические основы процесса.....................351
Технологическое оформление процесса
синтеза метанола..................................359
Принципы в технологии производства метанола.......367
Гтава 11. Производство кислородсодержащих
органических соединений методом оксосинтеза..................369
Оглавление
7
Теоретические основы процесса оксосинтеза..........370
Технологическое оформление процесса.................382
Принципы в технологии оксосинтеза...................398
Diaea 12. Производство этилового
и изопропилового спиртов........................................400
Сернокислотная гидратация олефинов..................400
Теоретические основы процесса сернокислотной
гидратации низших олефинов.....................400
Технология сернокислотной гидратации этилена...406
Основные недостатки технологии сернокислотной
гидратации этилена и пути их устранения........410
Технология сернокислотной гидратации пропилена.419
Технология совместного получения этилового
и изопропилового спиртов сернокислотной
гидратацией....................................422
Прямая гидратация низших олефинов...................425
Теоретические основы прямой гидратации
низших олефинов................................425
Технология прямой гидратации низших олефинов..431
Принципы в технологии гидратации
низших олефинов в спирты............................438
Diaea 13. Производство ацетальдегида............................440
Получение ацетальдегида из ацетилена
на ртутных катализаторах............................441
Теоретические основы процесса..................441
Технологическое оформление процесса............443
Принципы в технологии получения
ацетальдегида гидратацией ацетилена............445
Получение ацетальдегида из ацетилена
на нертутном катализаторе...........................446
Получение ацетальдегида из ацетилена
двухстадийным методом...............................447
Технология двухстадийного способа производства
ацетальдегида из ацетилена.....................448
Получение ацетальдегида из этилена..................454
Теоретические основы процесса..................454
Технологическое оформление процесса............460
Принципы в технологии окисления
этилена в ацетальдегид.........................465
8
Оглавление
Глава 14. Производство винилацетата..........................467
Получение винилацетата
из ацетилена и уксусной кислоты..................469
Теоретические основы процесса...............469
Технологическое оформление процесса.........473
Принципы в технологии производства
винилацетата из ацетилена...................483
Получение винилацетата окислением
этилена в присутствии уксусной кислоты...........483
Теоретические основы жидкофазного
метода получения винилацетата................484
Технологическое оформление
жидкофазного процесса.......................488
Теоретические основы парофазного
метода получения винилацетата................491
Технологическое оформление
парофазного процесса........................493
Принципы в технологии производства
винилацетата окислением этилена
в присутствии уксусной кислоты..............496
Сравнение различных методов
получения винилацетата...........................497
Diaea 15. Производство хлорорганических продуктов............499
Производство 1,2-дихлорэтана.....................499
Получение 1,2-дихлорэтана прямым
хлорированием этилена.......................500
Получение 1,2-дихлорэтана окислительным
хлорированием этилена.......................506
Производство винилхлорида........................511
Получение винилхлорида из ацетилена.........511
Производство винилхлорида из этилена
сбалансированным по хлору способом..........517
Комбинированный процесс получения винилхлорида
из ацетилена и этилена......................524
Глава 16. Производство продуктов основного
органического синтеза окислительным
метилированием...............................................525
Заключение....................................................529
Рекомендуемая литература......................................534
Cftnuoii памяти Haiutto У1ипиля
п^оф. Се^ия ЗЗасилыМа JfotoSa
пообяцаам эту киту
ВВЕДЕНИЕ
В учебном пособии рассмотрены теоретические основы и, прежде
всего, системные закономерности технологии основного органичес-
кого и нефтехимического синтеза (00 и НХС). Представлены тео-
ретические основы и технологические принципы реакторных под-
систем и подсистем разделения, а также совмещенных процессов.
Рассмотрены технологическое оформление процессов и принципы
создания безотходных или малоотходных производств. На примере
технологий производства замещенных ароматических углеводородов
(в том числе мономеров), кислородсодержащих и хлорорганических
соединений показано, каким образом реализуются или могут быть
реализованы данные принципы.
Данное пособие предназначено для студентов, обучающихся
в бакалавриате (направление 550800 «Химическая технология
и биотехнология»), магистратуре (направление 550800 «Химичес-
кая технология и биотехнология») и инженерном направлении хи-
мико-технологического профиля 655000 (специальность 250100
«Химическая технология органических веществ»). Оно также мо-
жет быть полезно для аспирантов, научных сотрудников, проекти-
ровщиков и работников предприятий данной отрасли. К настоя-
щему времени в мире синтезировано огромное количество
органических соединений, отнесенных к продуктам основного ор-
ганического и нефтехимического синтеза и обладающих ценными
химическими и физико-химическими свойствами. Многие из них
являются целевыми продуктами, а другие полупродуктами при про-
изводстве полимеров, лекарственных и других веществ. Потреб-
ность в каждом из них как в мире, так и в России исчисляется де-
сятками и сотнями тысяч тонн в год.
Главная цель отрасли ОО и НХС заключается в получении
большого ассортимента мономеров, растворителей, исходных про-
дуктов для синтеза лекарственных препаратов, средств защиты
10
Введение
растений и других продуктов наиболее простыми, дешевыми спо-
собами из доступного сырья. Кроме того, в связи с многотоннаж-
ностью производств технологии должны быть экологически бе-
зопасными.
Таким образом, отрасль основного органического и нефтехи-
мического синтеза является ведущей и определяет прогресс хими-
ческой промышленности — важного звена экономики страны.
А поскольку она обеспечивает сырьем все остальные подотрасли
органического синтеза, то и должна развиваться опережающими
темпами. Главными предпосылками ускоренного развития промы-
шленности основного органического и нефтехимического синтеза
являются:
необходимость обеспечения основным сырьем практически
всех отраслей химической промышленности, выпускающих
синтетические материалы;
возможность использования многочисленных источников сы-
рья (нефти, газа, угля, древесины, отходов многих нехими-
ческих производств и т.д.), в том числе и таких, как воздух
и вода;
возможность получения одних и тех же конечных продуктов
из различных исходных соединений, что обусловливает гиб-
кость всей отрасли и ее приспособляемость к меняющимся ис-
точникам сырья;
быстрое развитие систем нефте- и газопроводов, а также ли-
ний электропередач, обеспечивающих сырьем и энергией как
действующие, так и строящиеся предприятия отрасли.
Предприятия отрасли основного органического синтеза пред-
ставляют важнейшие звенья крупных промышленных комплексов,
включающих мощные строительные организации и энергопроиз-
водящие предприятия. Создание таких комплексов необходимо
вследствие весьма высокой капитало- и энергоемкости предприя-
тий отрасли.
От качества продукции данной отрасли в значительной степени
зависит качество всех остальных товарных и промежуточных про-
дуктов, выпускаемых другими отраслями. Однако производство лю-
бого нового продукта, пусть даже самого необходимого, может быть
организовано только тогда, когда для его получения разработана
рациональная промышленная технология, позволяющая достаточ-
но дешево из доступного сырья получать этот продукт в необходи-
Введение
11
мых количествах и требуемого качества. Еще Д. И. Менделеев ука-
зывал: «Главная цель передовой технологии — отыскание способов
производства полезного из бросового, бесполезного».
В связи с этим создание современной, экономически целесо-
образной и экологически безопасной технологии производства про-
дуктов основного органического и нефтехимического синтеза,
а также принципов управления установками и производствами яв-
ляется важной задачей химиков-технологов разного уровня. Так на
уровне бакалавриата изучаются общеинженерные дисциплины
и общие принципы химических технологий.
Инженер химик-технолог, подготовленный на базе бакалав-
риата, может проектировать производства и управлять ими. При
этом он должен уметь выбирать, как уже было отмечено, эконо-
мически целесообразную и экологически безопасную технологию.
И наконец, магистр занимается разработкой теоретических ос-
нов и технологических принципов технологий основного органи-
ческого и нефтехимического синтеза. Эти же задачи решаются при
выполнении кандидатских и докторских диссертаций. При этом
инженер и магистр должны использовать основы специальных тех-
нологий, владеть методиками экономических расчетов, умеТь вы-
бирать наиболее подходящее оборудование и надежную систему
контроля и регулирования параметров производства. Для этого
они должны знать на необходимом уровне основы конструирова-
ния аппаратов и функционирования контрольно-измерительных
приборов с целью создания системы автоматизации производст-
ва. Все эти задачи в настоящее время решаются с помощью элек-
тронно-вычислительной техники и компьютеров. Следовательно,
специалисты всех уровней должны уметь пользоваться такой тех-
никой и программным обеспечением. Более того, инженер дол-
жен владеть системами автоматизированного проектирования
и управления производством.
Вопросы охраны труда, техники безопасности и охраны окру-
жающей среды для производств основного органического и нефте-
химического синтеза представляют большую актуальность. Знания
в этих областях для специалистов, работающих в отрасли 00
и НХС, необходимы для всех направлений их подготовки.
И наконец, несмотря на то, что технолог является централь-
ной фигурой при разработке технологии, проектировании и экс-
плуатации производства, он должен работать в контакте с другими
специалистами (механиками, автоматчиками, экономистами, элек-
12
Введение
триками и т. д.). Поэтому именно у технолога должно быть особен-
но развито чувство коллективизма и руководителя.
Необходимо также отметить, что технология особенно дина-
мична в отрасли основного органического и нефтехимического син-
теза, в которой достаточно быстро меняются не только режимы,
конструкции аппаратов, но и сами способы производства различ-
ных продуктов. Следовательно, необходимо готовить высококва-
лифицированных химиков-технологов, а также систематически по-
вышать квалификацию уже работающих.
В связи с этим настоящее пособие будет полезным не только
в процессе подготовки специалистов, но и при их переподготовке.
В данном пособии изложены все принципы технологий основ-
ного органического и нефтехимического синтеза с иллюстрацией
их применения в конкретных производствах, которые рассматри-
ваются в Московской государственной академии тонкой химичес-
кой технологии им. М. В. Ломоносова в курсе «Принципы химиче-
ских технологий».
Эти курсы систематизируют ранее полученные знания по тео-
ретическим основам реакционных процессов, физико-химическим
основам разделительных и совмещенных реакционно-массообмен-
ных процессов, а также по оборудованию заводов и основам проек-
тирования производств отрасли.
Задачи создания и совершенствования производств основного
органического и нефтехимического синтеза должны решаться на
базе системного подхода, изучающего технологии во взаимосвязи
с окружающими его объектами. Системный подход позволяет в про-
цессе разработки технологии и проектирования производств учесть
большинство факторов, влияющих на работоспособность как все-
го производства (системы в целом), так и отдельных ее элементов
(установок, цехов), а также взаимосвязи между отдельными аппа-
ратами, установками, входящими в производство или в его состав-
ные части, например цеха.
Другими словами, системный подход дает возможность при со-
здании и проектировании производства рассматривать его как це-
лое, когда разрабатываются отдельные его части и способ их объе-
динения. В связи с этим в пособии рассматривается системный
подход, который позволяет создавать и проектировать сложные про-
изводства основного органического и нефтехимического синтеза.
Пособие состоит из двух частей. В первой части изложены тео-
ретические основы технологий основного органического и нефте-
ВВЕЛЕНИЕ
13
химического синтеза, в состав которых входят системные законо-
мерности, теоретические основы процессов, протекающих
в реакторных узлах, физико-химические основы и технологичес-
кие принципы разделительных и совмещенных реакционно-мас-
сообменных процессов и, наконец, принципы создания безотход-
ных (малоотходных) производств.
Во второй части рассмотрены как теоретические основы, так
и сами технологии ряда важнейших производств основного орга-
нического и нефтехимического синтеза. Эти производства выбра-
ны таким образом, чтобы в их технологиях проанализировать все
принципы, при этом в каждой технологии рассматриваются прин-
ципы, которые использованы при создании производства, или те,
на базе которых может быть усовершенствована технология.
В данном варианте пособия отдельные главы написаны совме-
стно с проф. А.В. Тимошенко.
Авторы выражают благодарность ст.н.с. Л. В. Костиковой и
ст. преп. В.А. Сысоеву за полезные замечания, сделанные в ходе
работы над рукописью, а также проф. Ю. А. Писаренко за помощь
в подготовке книги к изданию.
1
Теоретические основы технологии
крупнотоннажных ПРОИЗВОДСТВ
ОРГАНИЧЕСКИХ ПРОДУКТОВ
Глава 1. Технологическое оформление
производств основного ОРГАНИЧЕСКОГО
И НЕФТЕХИМИЧЕСКОГО СИНТЕЗА (00 И НХС)
S Химическая технология как наука.
S Особенности технологии основного
органического и нефтехимического синтеза.
S Структура производства и отрасли.
S Режимы работы технологических объектов.
S Общие принципы создания технологических
процессов.
ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ КАК НАУКА
Технология - это совокупность знаний о способах и средствах
проведения производственных процессов (от греч. «техно» — искус-
ство, ремесло или производство; «логос» — учение, наука).
Можно сформулировать технологию как науку о производстве.
За последнее время появились более полные определения техноло-
гии. В частности, технологию характеризуют как науку о рациональ-
ных средствах и способах осуществления производственных про-
цессов или науку о рациональных методах и процессах переработки
сырья в продукты потребления и средства производства.
Согласно другому определению, технология — наука, изучаю-
щая способы и процессы переработки продуктов природы (сырья)
в предметы потребления и средства производства.
Технологическое оформление производств СЮ и НХС
15
По характеру использования исходного вещества издавна от-
личают химическую технологию от механической. В производст-
венных процессах, связанных с применением механической тех-
нологии, у обрабатываемого исходного материала происходит
в основном изменение лишь внешней формы. При этом материал
качественно не изменяется.
Химическая технология за счет реакций приводит к качест-
венным преобразованиям исходных веществ. В ней они проявляют
свою внутреннюю активность в отличие от пассивной роли
в механической технологии. Следовательно, в результате химичес-
кого процесса изменяется не только форма, что может быть
и в любом физико-механическом процессе, не только агрегатное
состояние, что наблюдается при осуществлении физических про-
цессов, но и молекулярная структура исходных веществ. Сле-
довательно, в химической технологии протекают прежде всего про-
цессы, приводящие к изменению состава, свойств, внутреннего
строения и агрегатного состояния исходных веществ. Поэтому хи-
мическая технология позволяет использовать химическую актив-
ность веществ для получения новых соединений и материалов, ко-
торые отличаются по своим физико-химическим свойствам от
исходных и могут быть использованы человеком.
Химическая технология может рассматриваться в четырех ас-
пектах:
О с точки зрения анализа путей превращения сырья в готовые
продукты, т. е. с точки зрения выбора способов и методов пе-
реработки сырья на основе изучения различных процессов;
© с точки зрения анализа работы типовых аппаратов и машин
(выбора конструкций и параметров их работы) и их взаимо-
связи между собой;
© с экономической и социальной точек зрения;
О с точки зрения экологической безопасности.
Как наука химическая технология базируется на законо-
мерностях общей, органической и физической химии, физики, ма-
тематики, общехимических и общеинженерных дисциплин,
а также на общетехнологических закономерностях, в основу кото-
рых положен прежде всего системный подход.
Главнейшей задачей технологии является определение наивы-
годнейших условий проведения технологических процессов.
Таким образом, химическая технология фокусирует самые суще-
ственные черты развития науки о производстве. Для нее характе-
16 Часть 1. Теоретические основы технологии крупнотоннажных ...
рен также качественно более высокий уровень производственного
использования самого вещества, его внутренней активности. Кро-
ме того, химической технологии присуща возможность более пол-
ного использования отходов производства за счет их превращения
в ценное сырье для других производств.
В задачу химической технологии в настоящее время входит не
только создание необходимых видов веществ и материалов, но
и производство энергии, защита окружающей среды и др. Химиче-
ская технология охватывает широкий круг методов и процессов,
которые связаны не только с молекулярным изменением исходных
продуктов, но и с фазовыми переходами, используемыми при раз-
делении продуктов химического синтеза.
В связи с этим, химическая технология как наука связана с изу-
чением химических, физико-химических, массо- и теплообменных
и других процессов, с выбором методов и способов переработки
исходного сырья в продукты и предметы потребления, а также сред-
ства производства и, наконец, с выбором маршрута прохождения
сырья и полупродуктов по различным аппаратам, связанным в еди-
ную технологическую схему.
ОСОБЕННОСТИ ТЕХНОЛОГИИ ОСНОВНОГО
ОРГАНИЧЕСКОГО И НЕФТЕХИМИЧЕСКОГО СИНТЕЗА
Технологии основного органического и нефтехимического син-
теза присущи все преимущества химической технологии, к числу
которых можно отнести: использование внутренней активности ис-
ходных продуктов; возможность получения продуктов требуемого
состава за счет изменения молекулярной структуры исходных ве-
ществ; объективная возможность более полного использования
отходов производства; получение энергетически выгодных продук-
тов из природного сырья и др.
Эти технологии обладают рядом особенностей. К их числу мож-
но отнести многотоннажность, непрерывность, многовариантность,
многомаршрутность, кооперирование и комбинирование; быстрое об-
новление производства, высокие производительность труда, капита-
ле- и энергоемкость, высокая степень автоматизации, многообразие
аппаратурного оформления и др.
Многотоннажность. Производства основного органического
и нефтехимического синтеза обеспечивают сырьем практически все
другие отрасли народного хозяйства, поэтому они ответственны не
Технологическое оформление производств ОО и НХС 17
только за выпуск продуктов большого ассортимента, но и за их
крупномасштабное производство. Так, например, мировое производ-
ство составляет (в млн т/год) этилового спирта — >2; стирола — >8;
фенола — >3; винилацетата — ~2,7. Следовательно, технология долж-
на разрабатываться для многотоннажных экономически целесообраз-
ных производств.
В свою очередь, следствием многотоннажности является, во-пер-
вых, применение в технологии аппаратов большой единичной мощ-
ности и, во-вторых, непрерывность производства. Так, например, еди-
ничная мощность агрегатов синтеза метанола уже достигает 300 тыс.
т в год, а в перспективе не исключена возможность создания устано-
вок синтеза метанола с единичной мощностью 500 и даже 1 000 тыс.
т в год. В странах СНГ единичная мощность агрегатов производст-
ва этанола достигает 140, изопропанола — 100, агрегатов оксосин-
теза — 120—150 тыс. т в год. Действующие установки дальнего зару-
бежья по производству фенола имеют производительность 120—150,
а по ацетону - 75—90 тыс. т в год.
Увеличение мощностей единичных агрегатов приводит к сокра-
щению удельных капитальных вложений, энергетических затрат,
расхода воды и повышению производительности труда.
Непрерывная технология позволяет достигать не только боль-
шую производительность, но и более высокое качество продуктов.
Предприятия, работающие по непрерывной технологии и имею-
щие агрегаты большой единичной мощности, являются капитало-
емкими и, главное, энергоемкими, так как в непрерывной схеме
используется большое количество аппаратов, расположенных на
большой территории. Это требует обоснованного выбора точки
строительства предприятия, так как для этого необходимо обла-
дать достаточно дешевой энергией и требуемой площадью.
Многовариантность путей получения одного и того же конечного
продукта также характерна для этой отрасли. Это обусловлено, во-
первых, тем, что один и тот же продукт может быть получен из раз-
личных видов сырья. Например, винилацетат, являющийся одним
из важнейших мономеров, может быть получен из ацетилена или
этилена; фенол, используемый для синтеза капролактама и различ-
ных смол, может быть получен из продуктов переработки угля, неф-
ти, сланцев, древесины и др. В то же время один вид сырья может
быть использован для получения различных продуктов. Например,
из этилена можно получить уксусную кислоту, уксусный ангидрид,
этиловый спирт, винилацетат и другие вещества.
18 Часть 1. Теоретические основы технологии крупнотоннажных ...
Все это приводит к расширению сырьевой базы отрасли. Появ-
ляется возможность выбора наиболее экономичного сырья, а так-
же более полного его использования.
Кроме того, для получения одного и того же продукта могут
быть использованы различные химические процессы переработки
сырья. Например, стирол мс жет быть получен из этилбензола тер-
мическим дегидрированием, каталитическим дегидрированием,
окислительным дегидрированием, а также через гидропероксид
этилбензола. За счет этого появляется возможность выбора про-
цесса, позволяющего более полно использовать сырье для получе-
ния целевого продукта.
Снижение затрат на производство возможно не только посред-
ством выбора наиболее дешевого сырья, но и благодаря уменьше-
нию норм его расхода.
Многомаршрутность прохождения промежуточных продуктов
обусловлена многочисленностью и многообразием процессов и ап-
паратов, применяемых в технологии основного органического
и нефтехимического синтеза. Так, например, если рассматривать
только основные процессы и аппараты производства винилацетата
из ацетилена и уксусной кислоты, то можно предложить свыше 30
вариантов технологических схем. При этом на каждом этапе были
проанализированы следующие варианты:
® использование в качестве катализатора ацетата цинка на акти-
вированном угле или ацетат кадмия на оксиде алюминия;
® проведение основного химического процесса в реакторе со ста-
ционарным слоем катализатора или в реакторе с псевдоожи-
женным слоем катализатора;
® улавливание частиц катализатора с помощью циклонов, уста-
новленных на реакторе, или с помощью струйного скруббера
с трубкой Вентури;
® конденсация газообразных продуктов, выходящих из реакто-
ра, в трубчатых теплообменниках или в смесительных аппара-
тах (скрубберах);
® ректификация реакционной смеси проводится по первому ва-
рианту, когда вначале отделяют легколетучие компоненты,
а затем выделяют винилацетат, или по второму варианту, когда
вначале отделяют винилацетат вместе с легколетучими компо-
нентами, а затем последние отделяют от винилацетата.
На самом деле при исследовании и проектировании рас-
сматривается еще больше технологических схем (до 40 вариантов).
Технологическое оформление производств ОО и НХС
19
Такие затраты считаются оправданными, если выбран даже не оп-
тимальный, а наиболее приемлемый вариант. Важную роль здесь
играет технике-экономическое сравнение вариантов с учетом всех
технологических и физико-химических ограничений.
Кооперирование и комбинирование различных процессов, уста-
новок и производств, взаимосвязанных единой технологией, поз-
воляет более полно использовать сырье, утилизировать отходы про-
изводства, объединить последовательные стадии переработки.
Например, в пределах одного комбината можно получать ацеталь-
дегид, уксусную кислоту, поливинилбутираль и другие продукты на
базе производства винилацетата. В производствах, объединенных
единой технологией, в качестве сырья используется этилен, полу-
чаемый при переработке нефтяных фракций. При этом одновре-
менно образуется пропилен, являющийся сырьем для оксосинтеза,
а далее 2-этилгексанола и пластификаторов. Для этих же целей мо-
жет использоваться и ацетальдегид.
Широкий ассортимент продуктов основного органического
и нефтехимического синтеза требует большого количества произ-
водств. Строительство комбинатов приводит к их сокращению
и снижению себестоимости продуктов за счет сокращения вспомо-
гательных служб, например, водо-, энергоснабжения и др.
Высокая степень автоматизации является важной особенностью
производств основного органического и нефтехимического синте-
за. В настоящее время для управления производством применяют-
ся компьютеры, что позволяет более точно соблюдать все техноло-
гические параметры, а следовательно, и повышать качество
выпускаемых продуктов и производительность труда.
Совмещенные процессы получили значительное распростра-
нение в производствах основного органического и нефтехимиче-
ского синтеза. Причем имеет место совмещение как нескольких
реакционных процессов, так и реакционных процессов с массо-
обменными. Примером первых могут служить сложные химиче-
ские процессы, в которых одна реакция является экзотермической,
а другая — эндотермической. В частности, к таким процессам мож-
но отнести окислительное дегидрирование углеводородов.
Примерами реакционно-массообменных процессов могут слу-
жить реакционно-ректификационные, реакционно-экстракцион-
ные процессы. Такое совмещение наиболее широко и эффективно
применяется в обратимых реакциях с целью достижения высоких
выходов целевых продуктов.
20 Часть 1. Теоретические основы технологии крупнотоннажных ...
СТРУКТУРА ПРОИЗВОДСТВА И ОТРАСЛИ
С технической точки зрения производство основного органиче-
ского и нефтехимического синтеза представляет функциональную
систему, в которой осуществляются химико-технологические про-
цессы в определенных аппг ратах, имеющих вещественные, энер-
гетические и информационные входы и выходы.
Производство как физическая система представляет собой сово-
купность средств переработки сырья в соответствии с разработанной
технологией, так как наиболее полно отражает не только существо-
вание практически всех аппаратов, машин, коммуникаций, прибо-
ров и других реальных предметов, но и материальные и энергетиче-
ские связи между ними.
Любое производство характеризуется системой связанных меж-
ду собой элементов технологического процесса. При этом сырье
и вспомогательные вещества в такой системе постоянно находят-
ся в контакте с аппаратами, машинами и приборами. Трубопро-
воды в данном случае также являются элементами системы, по ко-
торым материальные и энергетические потоки перемещаются
между аппаратами. Каждая технология основана на определенном
способе производства, заключающемся в совокупности всех опе-
раций, которые проходят сырье и полупродукты до получения из
них целевых продуктов.
К химико-технологическим можно отнести такие производствен-
ные процессы, которые целенаправленно изменяют химический со-
став сырья, его фазовое и энергетическое состояние с помощью хи-
мических реакций и физико-химических процессов, направленных
на достижение определенного состояния реакционной массы и ее
разделение на отдельные компоненты или фракции.
Критериями качества функционирования химических процес-
сов служат технологические показатели (производительность, сте-
пень превращения, выход, концентрации, чистота продуктов и др.).
Иногда используют технико-экономические показатели (себестои-
мость, расходные коэффициенты и др.).
Состояние процессов характеризуется технологическими параме-
трами — координатами (температура, давление, расходы, концентра-
ции и др.). Число контролируемых переменных в разных процессах
колеблется от нескольких десятков до нескольких сотен.
Как известно, производство состоит из ряда связанных между
собой химико-технологических и технологических процессов, ко-
Технологическое оформление производств ОО и НХС
21
торые направлены на выпуск целевых продуктов из определенного
исходного сырья. Производство может осуществляться в цехе или
на заводе.
Для обозначения наименьшей технологической единицы,
в которой, как правило, получается определенный полупродукт или
заканчивается часть технологического процесса, часто используется
термин «установка». Каждая такая единица характеризуется произ-
водительностью — количеством вырабатываемого продукта или пе-
рерабатываемого сырья, отнесенным к единице времени. Кроме того,
каждая установка характеризуется проектной (максимально возмож-
ной или допустимой) производительностью, которая называется про-
изводственной мощностью или просто мощностью.
Промышленное предприятие (завод, комбинат) состоит из ряда
производств, объединенных однотипностью химических и физи-
ко-химических процессов, общностью источников сырья и энер-
гии, возможностью использования целевых продуктов одного про-
изводства в качестве сырья на другом.
Подотраслью называется группа предприятий, объединенных
общностью сырьевых источников, технологией получения и видом
выпускаемой продукции.
В отрасль входят подотрасли и, как правило, крупные объе-
динения, характеризуемые едиными принципами получения про-
дукции. В частности, отрасль ОО и НХС характеризуется полу-
чением преимущественно многотоннажных органических
продуктов, применяемых непосредственно в народном хозяйстве
(растворители, поверхностно-активные вещества, составные ча-
сти топлива, средства защиты растений и др.) или являющихся
полупродуктами в других отраслях органической технологии (мо-
номеры для полимерной промышленности, полупродукты для ле-
карственной промышленности и т.д.).
Технологические объекты часто называются производственными
комплексами. Под производственным комплексом понимается от-
дельное производство, завод, комбинат и даже отрасль.
При изучении производств основного органического и неф-
техимического синтеза, как связанных систем, можно установить,
что в них регулярно повторяются простые элементы системы
и определенные технологические связи (коммуникации, соедине-
ния, включения) этих элементов. Причем от связи элементов
между собой зависят капитальные и энергетические затраты
на получение целевых продуктов. Кроме того, исследование тех-
22 Часть 1. Теоретические основы технологии крупнотоннажных ...
нологических связей должно показать, какое действие на количе-
ство и качество продуктов оказывает способ соединения простых
элементов технологического процесса.
К числу отдельных элементов могут быть отнесены не только
отдельные аппараты (реактор, ректификационная колонна, теп-
лообменник и т.д.), но и некоторые комплексы аппаратов. При
изучении сложного технологического объекта целесообразно его
разделение на отдельные звенья, в которых протекают химичес-
кие, физико-химические или другие процессы. По характеру ма-
териальных и энергетических связей все многообразные процес-
сы химической технологии можно разделить на следующие
основные классы:
Ф химические, диффузионные или массообменные;
Ф тепловые;
Ф гидро- и аэродинамические и механические.
Каждый из этих классов подразделяется на типовые процессы.
Так, массообменные процессы делятся на ректификационные, экс-
тракционные, абсорбционные, адсорбционные и др.
РЕЖИМЫ РАБОТЫ ТЕХНОЛОГИЧЕСКИХ ОБЪЕКТОВ
Основная задача технолога-исследователя, изучающего мето-
ды создания технологии производств 00 и НХС, заключается преж-
де всего в нахождении взаимосвязи между входными и выходными
параметрами как отдельных элементов, так и системы в целом с
учетом многофакторности и возмущающих воздействий (часто слу-
чайного характера). При этом необходимо иметь в виду, что на од-
них производствах основные параметры сохраняются постоянны-
ми во времени и они (по подаче исходных материалов и получе-
нию товарных продуктов) относятся к непрерывным, а на других
производствах параметры меняются во времени и они называются
периодическими.
Как правило, в производствах основного органического и неф-
техимического синтеза применяются непрерывные технологические
процессы. Но, вместе с тем, на вспомогательных производствах мо-
гут применяться и периодические технологические процессы. К не-
прерывным технологическим процессам относятся такие, в кото-
рых сохраняется практически неизменным режим работы установок
во времени, т. е. постоянны технологические параметры (давление,
Технологическое оформление производств 00 и НХС
23
расход, температура и т. д.), поступление сырья, отвод целевых про-
дуктов.
В периодических процессах при переходе от одной стадии про-
цесса к другой, а часто и на одной стадии, наблюдается изменение
режима работы аппаратов, проводится периодическая загрузка сы-
рья и выгрузка реакционной массы.
Непрерывное производство рассчитано на выпуск одного вида
продукции. В периодическом производстве на одних и тех же ус-
тановках возможен выпуск различных продуктов.
В том случае если на технологической установке, работающей
по непрерывному принципу, предусматривается возможность сме-
ны продукции через какой-то промежуток времени, то такие про-
изводства называют полунепрерывными.
Режим работы отдельных аппаратов или целого технологи-
ческого комплекса может быть статическим или динамическим,
а объекты химической технологии могут быть описаны статичес-
кими и динамическими характеристиками, отражающими взаимо-
связь между входными и выходными параметрами.
Статические характеристики определяют для установившегося
во времени режима работы объекта. Они необходимы для правиль-
ного проектирования объекта, определения нормальных режимов
работы оборудования, оптимизации технологических процессов.
В общем случае статические характеристики объекта зависят от фи-
зико-химических свойств перерабатываемых исходных веществ, сте-
пени достижения стационарности процессов, конструкции аппа-
ратов и определяются из материальных и энергетических балансов
объекта для стационарных состояний.
Под динамической характеристикой понимается взаимосвязь
изменения во времени выходных параметров под действием вход-
ных возмущающих параметров.
В промышленных объектах возмущения являются либо мед-
ленно изменяющимися во времени, либо скачкообразными.
Для определения динамических характеристик объекта и воз-
можности их сравнения друг с другом приняты типовые законы из-
менения входных параметров, близкие к законам, которые наблю-
даются в реальных условиях работы объектов. Динамические
характеристики объекта в зависимости от вида входного возмуще-
ния имеют различную графическую интерпретацию.
Объекты химической технологии характеризуются опреде-
ленной инерционностью, которая может быть определена как вре-
24 Часть 1. Теоретические основы технологии крупнотоннажных ...
мя, которое проходит от начала мгновенного изменения входной
переменной до начала изменения выходной переменной.
Изменение режима работы любого технологического под-
разделения определяется изменением параметров входных и выход-
ных потоков.
Передаточные характеристики установок могут быть ста-
тическими или динамическими. К статическим передаточным ха-
рактеристикам относятся такие, при которых в каждый момент вре-
мени параметры выходных потоков полностью определяются
параметрами входных потоков в тот же момент времени. Если же
значения параметров выходных потоков установки существенно за-
висят также от предшествующих значений параметров входных по-
токов, то считается, что установка имеет динамические передаточ-
ные характеристики. Наличие динамических характеристик
установки обусловлено тем, что материальные и энергетические по-
токи проходят через нее за какое-то конечное время.
Для описания статических свойств и режима работы установки
или технологического процесса с распределенными по простран-
ственной переменной / координатами (переменными) использует-
ся обычно векторное дифференциальное уравнение:
dx/dl = f(x,z,u,a), 1-1
где х, z, й — векторы выходных возмущающих и управляющих коорди-
нат; а — вектор параметров; f — вектор-функция.
Математическая модель статики объектов с сосредоточенными
координатами чаще всего имеет следующий вид:
f(x,z,u, ~a} = $. 1.2
Неустановившиеся во времени t процессы в объектах с со-
средоточенными координатами описываются уравнениями типа:
dx/dt = f(x,z,u,aj. 1.3
Системы уравнений 1.1—1.2 применяются для описания так на-
зываемых стационарных объектов, свойства которых остаются не-
изменными во времени.
В математических моделях нестационарных объектов вектор-
функция должна явно или косвенно зависеть от времени. Чаще все-
Технологическое оформление производств 00 . и НХС
25
го в моделях нестационарных объектов параметр а рассматривает-
ся как функция времени. Тогда уравнения статики и динамики бу-
дут иметь вид:
/[x,z,w,a(/)]=0, 1.4
dx/dt 1.5
Статика отдельных технологических аппаратов чаще всего
характеризуется уравнениями типа 1.1 и реже 1.2. Для описания ста-
тических режимов технологических процессов, установок, произ-
водств, предприятий и отрасли применяют, как правило, уравне-
ние вида 1.2. Математические модели, описывающие динамику
процесса вида 1.3, используются для характеристики неустановив-
шихся явлений в отдельных аппаратах и реже для технологических
процессов.
Математические модели статики типа 1.2 широко применяют
при решении задач планирования (оптимального планирования)
работы объекта, а также для оптимизации статических режимов.
Математические модели динамики, выражаемые уравнением
1.3, используют для оптимизации переходных режимов работы объ-
екта, например при пуске и остановке аппаратов, а также при вы-
числении текущих значений параметров работы объекта.
ОБЩИЕ ПРИНЦИПЫ СОЗДАНИЯ
ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ
При получении продуктов основного органического и неф-
техимического синтеза используют различные процессы (химиче-
ские, физико-химические, гидродинамические, диффузионные,
тепловые, механические), причем многие из них протекают од-
новременно в одном аппарате. Ход этих процессов, а следователь-
но, и нормальное функционирование всего производства, опре-
деляется их параметрами. Совокупность технологических
параметров характеризует технологический режим различных под-
систем химико-технологических систем.
Среди параметров процесса различают экстенсивные, завися-
щие от количества вещества (например, объем), и интенсивные, не
зависящие от количества вещества (температура, давление, концен-
трация веществ и др.).
26 Часть 1. Теоретические основы технологии крупнотоннажных ...
Наиболее важными в химико-технологических процессах яв-
ляются интенсивные параметры.
Переменные химико-технологических процессов делятся так-
же на независимые, которые могут изменяться независимо друг от
друга, и зависимые, численные значения которых определяются зна-
чением независимых переменных (параметров).
Общее число независимых параметров определяет число сте-
пеней свободы или вариантность процесса. На основе числа сте-
пеней свободы всей сложной химико-технологической системы
(ХТС) производится выбор технологических связей элементов
процесса.
В соответствии с организацией потоков химико-технологические
процессы, а также все системы подразделяются, как было указано
ранее, на периодические, непрерывные и полунепрерывные.
В периодических процессах выходные потоки, а также любые
интенсивные характеристики (переменные) различных процессов
(температура, концентрации и др.) меняются во времени и явля-
ются периодическими функциями с периодом ти:
Ти =Т1+Т2+Тз+Т4,
где тм - продолжительность полного цикла;
Т1 ,т2’тз»т4 ~ время загрузки, выхода на режим, работы и подготовки ап-
парата к новой загрузке соответственно.
Коэффициент использования оборудования цо(7=т /ти (где
т — продолжительность основного процесса) для периодического
процесса всегда ниже единицы.
Следовательно, производительность аппаратов периодического
действия будет ниже, чем производительность аппаратов непрерыв-
ного действия. Кроме того, первые труднее автоматизировать и в них
получается неоднородная по качеству продукция.
Вместе с тем, часто при малых масштабах производства эконо-
мически целесообразно применять аппараты периодического дей-
ствия, в частности из-за компактности их установки.
В связи с тем, что промышленность основного органического
синтеза выпускает многотоннажную продукцию, в этой отрасли ис-
пользуются, главным образом, процессы непрерывного действия,
так как они обладают рядом преимуществ по сравнению с перио-
дическими.
Технологическое оформление производств 00 и НХС
27
При осуществлении непрерывных процессов входные и вы-
ходные потоки от запуска до остановки производства в идеальном
случае в течение длительного времени являются постоянными или
стационарными потоками.
Интенсивные характеристики этих процессов также постоян-
ны во времени. Такое состояние непрерывного процесса называет-
ся стационарным или установившимся.
Установившийся процесс представляет собой предельный слу-
чай непрерывного процесса. Вместе с тем, практически такого со-
стояния добиться невозможно, так как колеблются, правда в допу-
стимых пределах, значения многих технологических параметров:
состав и состояние сырья, активность катализатора, температура
и давление в аппаратах, атмосферные условия. Многие отклоне-
ния объясняются, главным образом, динамикой процесса.
Следовательно, непрерывный процесс может быть устано-
вившимся, но практически никогда не бывает полностью уста-
новившимся. Вместе с тем, установившийся, или стационарный,
процесс всегда является непрерывным.
Таким образом, в непрерывных процессах имеется возможность
поддерживать постоянными заранее выбранные технологические
параметры (Т, р и др.) во всех точках ХТС. Это позволяет:
Ф получать полупродукты и продукты постоянного качества;
Ф достигать высокого коэффициента использования оборудова-
ния, который приближается к единице;
Ф механизировать и автоматизировать производство;
Ф легко управлять производством, в том числе с использованием
ЭВМ;
Ф обеспечивать высокую производительность труда, значительно
облегчать труд обслуживающего персонала, делать его безопас-
нее, чем на предприятиях, использующих периодические про-
цессы.
Непрерывность исключает простои всех аппаратов и требует
меньших их размеров при более высоком коэффициенте ис-
пользования, т. е. непрерывный процесс является более высокой
ступенью развития технологии по сравнению с периодическим.
Для осуществления непрерывного процесса требуются сле-
дующие условия:
О пространственная (конструктивная) разделенность входов и вы-
ходов всех аппаратов;
28 Часть /. Теоретические основы технологии крупнотоннажных ...
© непрерывные и в достаточной степени стационарные подачи
исходных веществ (загрузка) и вывод из аппаратов продуктов
(выгрузка);
© номенклатура составляющих сырья и целевых продуктов долж-
на быть постоянной на протяжении работы аппаратуры (от пу-
ска до остановки);
О непрерывное перемещение всех продуктов внутри аппаратов
и между ними.
Соблюдение этих условий обычно не вызывает трудностей, ес-
ли транспортируемые вещества находятся в жидком или газо-
образном состоянии, но они могут возникать при работе с тверды-
ми веществами или вязкими жидкостями.
Все аппараты, применяемые в технологии основного органиче-
ского синтеза, могут работать по непрерывному принципу. Вместе
с тем, организация работы некоторых реакционных и массообмен-
ных аппаратов по непрерывной схеме затруднена. Так, например,
для проведения некоторых гомогенных реакций в жидкой фазе с це-
лью организации непрерывного процесса создают батарею из по-
следовательно соединенных реакторов смешения (рис. 1.1).
Рис. 1.1. Батарея реакторов смешения
Определенная трудность возникает при организации непре-
рывной адсорбции (рис. 1.2). С этой целью применяется:
О каскад адсорберов, в каждом из которых в различное время
цикла выполняются различные операции (адсорбция, сушка
и охлаждение адсорбента, десорбция);
© процесс в движущемся слое адсорбента, в том числе в псевдо-
ожиженном слое адсорбента.
Установки первого типа обладают тем основным недостатком,
что требуют относительно частого переключения больших потоков.
Технологическое оформление производств 00 . и НХС
29
Рис. 1.2. Схема непрерывной адсорбции:
1,2 — адсорберы; 3 - конденсатор; 4 — сепаратор; 5 — сборник; 6 — газодувка;
7 - калорифер
Для установок второго типа характерно сильное истирание ад-
сорбента, что приводит к его потерям и усложнению процесса за
счет пылеулавливающих установок и перемещения адсорбента.
Эти же трудности возникают при создании установок кри-
сталлизации, фильтрации и др.
Однако и в этих случаях непрерывные процессы являются бо-
лее выгодными.
Глава 2. Системные закономерности
в технологии основного органического
и нефтехимического синтеза
® Производство как сложная система.
® Модели технологических установок
и комплексов производств.
® Варианты соединения аппаратов
и передаточные функции.
® Системный подход к разработке технологии
производства.
® Математическое моделирование химико-
технологических объектов.
® Оптимизация производства.
® Надежность работы отдельных аппаратов
и химико-технологических систем.
® Оценка работоспособности системы.
Одним из главных этапов создания производства основного ор-
ганического и нефтехимического синтеза является разработка и оп-
тимизация его технологической схемы. При этом перед разработ-
чиками новой технологии стоит задача получения целевых
продуктов (необходимого количества и качества) при минималь-
ном расходе сырья и энергии, а также без загрязнения окружаю-
щей среды.
Современное промышленное предприятие представляет собой
настолько сложный технологический комплекс, что научно обос-
нованный подход к его разработке, проектированию и эксплуата-
ции с целью достижения высокой эффективности производства
все настойчивее требует системного подхода. Актуальность при-
менения системного подхода возрастает при разработке техноло-
гии безотходных производств. Для этого производство должно рас-
сматриваться как сложная система. Для реализации системного
подхода при создании безотходных производств и их функциони-
ровании получают распространение автоматизированные системы
научных исследований (АСНИ), автоматизированные системы про-
ектирования технологических процессов или производств (САПР),
автоматизированные системы технологической подготовки про-
Глава 2. Системные закономерности в технологии...
31
изводства (АСТПП), автоматизированные системы управления
технологическими процессами (АСУТП) и т. д.
Таким образом, применение системного подхода к решению ра-
нее названных задач требует широкого использования ЭВМ. Сис-
темный подход является междисциплинарным. В связи с этим для
его применения в настоящее время развиваются три области сис-
темных исследований:
О создание универсальных системных концепций - разработка
общей теории систем;
© развитие системного подхода — разработка методологических
подходов для исследования систем разного типа (общая
междисциплинарная методология);
© развитие системного анализа — набора методологических
приемов для решения сложных задач со слабовыраженной
структурой.
При этом для решения конкретных задач, например при со-
здании технологии, выделяют четыре основные этапа системного
исследования:
® анализ изучаемой технологии и определение иерархической
структуры, т. е. выделение уровней элементов и взаимосвязей
между ними на основе фундаментальных знаний, экспе-
риментальных данных и опыта;
О формализация знаний о рассматриваемой технологии и ее эле-
ментах, принятие разумных упрощений с целью получения ма-
тематического описания;
® реализация математического описания с использованием
средств вычислительной техники в виде комплекса приклад-
ных программ;
® идентификация математических моделей, т. е. установление
степени соответствия результатов, полученных на модели
и на реальном объекте.
При синтезе химико-технологической системы (ХТС) особую
роль играют эффекты, связанные с оптимальным выбором струк-
туры и элементов системы. Экономический эффект от оптималь-
ной структуры ХТС на порядок выше эффектов оптимальной орга-
низации отдельных элементов или управления процессом.
Для того чтобы решать задачи, связанные с выбором оптималь-
ного варианта ХТС на основе системного подхода, следует знать
все понятия, используемые в нем. Кроме того, необходимо дока-
32 Часть 1. Теоретические основы технологии крупнотоннажных ...
зать, что установка, для которой разрабатывается технологическая
схема, представляет собой целостную систему.
ПРОИЗВОДСТВО КАК СЛОЖНАЯ СИСТЕМА
Современное крупное предприятие основного органического
и нефтехимического синтеза почти всегда состоит из нескольких про-
изводств. Предприятие представляет собой функциональную систе-
му, а производственные подразделения, входящие в нее, - функци-
ональные подразделения, подсистемы. К подсистемам можно
отнести любой узел системы: установку, аппаратурно-процессорную
единицу или типовой химико-технологический процесс. При этом
функциональная система рассматривается как совокупность узлов,
каждый из которых соответствует некоторому типовому химико-тех-
нологическому процессу, представляющему простой элемент систе-
мы. Все элементы связаны между собой технологическими потока-
ми или коммуникациями. Способ соединения элементов в большой
степени определяет качество продуктов и затраты на их получение.
К простым элементам относятся такие химико-технологические
объекты, которые нельзя расчленить, они обладают определенными
известными свойствами. К сложным химико-технологичес-
ким объектам относятся, соответственно, такие, которые могут
быть расчленены на более простые.
Таким образом, любой химико-технологический объект должен
быть рассмотрен как часть сложной функциональной системы.
Под сложной химико-технологической системой (СХТС) понимает-
ся совокупность процессов и аппаратов, объединенных материальными
и энергетическими потоками, для выполнения единой технологической цели
в условиях внешних и внутренних возмущающих воздействий. Следователь-
но, СХТС свойственны все характерные признаки больших или слож-
ных систем, обусловливающие задачи анализа и синтеза и требующие
разработки специальных методов и средств решения этих задач на ос-
нове применения вычислительной техники.
Разработка, проектирование и управление СХТС должны ба-
зироваться на использовании системного подхода к анализу и син-
тезу технологических схем производства.
Система и ее составные части
При рассмотрении многих объектов применяется системный
подход. Этот подход в общем виде рассмотрен В. Г. Афанасьевым.
Глава 2. Системные закономерности в технологии...
33
Системный подход является элементом общей методологии, поз-
воляющей в определенном, именно системном аспекте рассматри-
вать различные объекты.
В. Н. Садовский отмечал, что идеи системности, целостности,
структурности, универсальности, многообразия форм связи и т. д., кото-
рые на конкретно-научном уровне разрабатываются в рамках системного
подхода и общей теории систем, органически присущи диалектическому
методу и пронизывают все его важнейшие понятия и принципы.
В связи с этим все большее значение при создании производств
основного органического и нефтехимического синтеза приобретают сис-
темные исследования, на основе которых осуществляется проектирова-
ние новых и анализ действующих производств. При этом важное значе-
ние имеют такие общесистемные вопросы, относящиеся к общей структуре
производства, как понятие системы, взаимосвязи элементов, взаимодей-
ствие системы с внешней средой, характеристические свойства систем, их
признаки и т. д.
Основу этих исследований составляет представление разрабатываемо-
го и проектируемого объекта, например цеха или какого-нибудь
технологического узла, как системы, состоящей из множества взаимосвя-
занных элементов и выступающих как единое целое. Причем к категории
системных относятся не все объекты и процессы, а только те, которые
обладают целостностью. Свойства и функции таких систем не сводятся
непосредственно к функции и свойствам составляющих их элементов. По-
этому множество аппаратов и узлов еще не является системой.
Чтобы выяснить принадлежность производств основного ор-
ганического и нефтехимического синтеза и отдельных его со-
ставляющих к системам, целесообразно дать определение системы
и указать признаки, характеризующие большую систему.
В настоящее время имеется несколько десятков определений
«системы». Одни из них основаны на понятиях «элемент», «от-
ношение», «целое», «структура» и т. д., а другие — на понятиях «вход
и выход», «управление» и т. д.
Под системой, в частности, понимается регулярное или упо-
рядоченное устройство, производственное подразделение и т. д., со-
стоящее из взаимосвязанных частей, действующих как одно целое
и предназначенное для достижения какой-либо определенной цели.
Наиболее полная характеристика системы, с нашей точки зре-
ния, дана С.А. Саркисяном и Л. В. Головановым: «Система — это
не просто совокупность множества единиц, в которой каждая еди-
2 я-б
34 Часть 1. Теоретические основы технологии крупнотоннажных ...
ница подчиняется законам причинно-следственных связей, а единство
отношений и связей отдельных частей, обусловливающих выполнение
определенной сложной функции, которая и возможна лишь благодаря
структуре и большому числу взаимосвязанных и взаимодействующих
друг с другом элементов».
Необходимо отметить, что имеется не только большое число
определений понятия «системы», но и большое число клас-
сификаций систем, в основу которых положены различные при-
знаки, принципы и основания. В. Г. Афанасьев, в частности, делит
все системы на четыре класса.
К первому классу относятся системы, которые существуют в объ-
ективной действительности, живой и неживой природе, обществе.
Во второй класс входят системы концептуальные, идеальные,
с различной степенью полноты и точности, в той или иной мере
отражающие реальные системы. Эти системы часто называются аб-
страктными.
К третьему классу относятся системы, которые спроек-
тированы, сконструированы и созданы человеком в определен-
ных, нужных для него целях. Эти системы называются ис-
кусственными.
Четвертый класс систем — «смешанные» системы, в которых
органически слиты элементы, являющиеся продуктом естествен-
ной или общественной природы, и элементы, «придуманные», со-
зданные человеком.
Мы будем рассматривать только системы третьего класса, так
как все производства основного органического и нефтехимического
синтеза разработаны, спроектированы и смонтированы человеком.
В дальнейшем мы будем рассматривать как общие свойства сис-
тем, так и свойства, присущие системам третьего класса.
Предварительно определим, что же представляют собой основ-
ные части любой системы. Так, компонент — это часть системы,
вступающая в определенные отношения с другими ее частями. Ком-
понентами могут служить любые подсистемы и элементы.
Подсистема — такая часть системы, которая сама образована
из компонентов, имеющих аналогичные свойства. Следовательно,
это тоже система, входящая в систему более высокого порядка.
И наконец, элемент — это часть системы, являющаяся преде-
лом членения в рамках данного качества системы. Он не состоит
из компонентов и представляет собой нерасчленяемый далее, эле-
ментарный носитель данного качества.
Глава 2. Системные закономерности в технологии...
35
В нашем случае, в зависимости от уровня анализа производства,
в качестве элемента может рассматриваться отдельный аппарат (ре-
актор, теплообменник, ректификационная колонна, насос и т. д.),
если рассматривается в качестве системы производство, цех, отде-
ление, т. е. любая часть технологии. Если же в качестве системы рас-
сматривается аппарат, то его элементами будут отдельные детали.
В дальнейшем мы будем рассматривать только членение до отдель-
ного аппарата.
Свойства и характеристики систем
Наиболее важной характеристикой системы является ее струк-
тура, представляющая внутреннюю организацию целостной систе-
мы и специфический способ взаимосвязи, взаимодействия образу-
ющих ее компонентов.
При разработке оптимальной технологии структура системы
имеет очень большое значение, так как от взаимосвязи аппаратов
в значительной степени зависит качество переработки сырья и рас-
ход энергии на производство продуктов. Именно благодаря струк-
туре набор элементов превращается в единое целое, в систему, где
каждый элемент оказывается связанным с другими элементами. При
этом свойства элементов могут быть выявлены только с учетом всех
их связей в системе.
Необходимо также отметить, что структура может периодичес-
ки меняться во времени. Следовательно, ее необходимо рассмат-
ривать в пространственно-временном аспекте.
Целостным системам свойственны специфические связи и от-
ношения. Наиболее характерными из них являются координация
и субординация. Координация выражает пространственную, го-
ризонтальную упорядоченность компонентов системы, т. е. отра-
жает взаимодействие компонентов одного уровня организации.
Субординация — вертикальная упорядоченность, предусмат-
ривающая подчинение и соподчинение, т. е. отражает взаимо-
действие компонентов разного уровня организации.
Для оценки принадлежности любой части производства к сис-
темам необходимо знать свойства системы. К числу основных свойств
системы можно отнести наличие:
1. Подсистем или элементов;
2. Взаимосвязей и отношений между элементами и средой;
3. Разнотипных связей;
4. Существенных связей;
36 Часть 1. Теоретические основы технологии крупнотоннажных ...
5. Структуры отношений и взаимосвязей;
6. Цели, которая достигается функционированием системы;
7. Среды, в которой функционирует система;
8. Единства функции и структуры (т.е. структура определяет
функцию, и наоборот —наблюдается диалектическое един-
ство);
9. Организации внутри структуры (иерархия);
10. Целенаправленности поведения;
11. Способности сохранять цель;
12. Способности к эволюции;
13. Самоорганизации;
14. Способности к выбору цели;
15. Способности к самосознанию.
Любая техническая система может обладать только первыми
одиннадцатью свойствами. При этом если любая техническая ус-
тановка (или производство) имеет отмеченные свойства, то она
представляет собой систему. И тогда к ней применимы все систем-
ные закономерности, в том числе и методология их создания.
Рассмотрим приведенные выше свойства по отношению
к производствам основного органического и нефтехимического
синтеза.
1. Любое производство может быть разделено на подсистемы
и даже элементы. В частности, если мы рассматриваем за-
вод, то подсистемой может быть цех или отдельная
технологическая установка. Элементами в данном случае
могут быть аппарат, машины и т. д.
2. Между цехами и даже отдельными аппаратами (элементами)
существуют материальные, энергетические и инфор-
мационные связи. Эти связи особенно наглядно просматри-
ваются в непрерывных производствах. Такое производство
связано с другими системами, одни из которых поставляют
сырье, энергию, воду и т.д., а другие потребляют продукты
и отходы. Эти системы отображают среду, в которой сущест-
вует рассматриваемое производство.
3. Как уже отмечалось, связи между элементами и под-
системами могут быть разными: материальные, энергетиче-
ские, информационные и др. При этом одни из связей
(материальные и энергетические) являются главными, так
как разрыв одной из них может привести к прекращению
Глава 2. Системные закономерности в технологии...
37
функционирования производства. Производство ОО и НХС
не может содержать изолированных аппаратов, т. е. каждый
аппарат (реактор, ректификационная колонна, теплообмен-
ник и т. д.) из множества аппаратов состоит в определен-
ном отношении, по крайней мере, еще с одним аппаратом
этого множества.
4. Отрасль основного органического и нефтехимического
синтеза, как и любая ее часть, обладает еще определенной
структурой отношений и взаимосвязей. В частности, в рам-
ках отрасли имеются определенные отношения между
объединениями и заводами в виде взаимной передачи сы-
рья и продуктов. Это же относится и к цехам, но уже в рам-
ках завода.
5. Любое производство либо создается для получения необ-
ходимых продуктов, либо выделено из отрасли для выясне-
ния, например, возможности его реконструкции.
6. Как уже отмечалось, любое производство функционирует
только при непрерывной подаче сырья, энергии, воды из
других производств. Следовательно, любое производство
может функционировать только в среде, т. е. при наличии
других систем.
7. Любое производство базируется на конкретной технологии,
которая определяет его структуру. Для производства тех или
иных продуктов создается определенная технология, отра-
жающая структуру. И наоборот, производство определен-
ной структуры может выдавать также только определенные
продукты.
8. Внутри любого производства имеется своя иерархия, напри-
мер завод — цех — отделение — установка — аппарат. Это же
отражается и в технологии.
9. Производство или установка функционирует таким образом,
чтобы выпускать какие-то продукты или полупродукты.
10. В зависимости от того, как протекают процессы во времени
и пространстве, возможно непрерывное или периодическое
их функционирование. Если процессы протекают в одном
аппарате и распределены во времени, то такие установки
являются установками периодического действия. Если же
каждый процесс протекает в своем аппарате, а все они осу-
ществляются одновременно, то такие установки являются
установками непрерывного действия.
38 Часть 1. Теоретические основы технологии крупнотоннажных ...
11. Если установка непрерывная, то она длительное время (до
уничтожения) будет выпускать единожды заданные про-
дукты. Периодические установки также будут выпускать
только определенные продукты, но дискретно во времени.
12. Все существующие технологические установки могут совер-
шенствоваться и, следовательно, изменяться, сохраняя пер-
воначально поставленную цель. При этом, как правило,
изменения в одной подсистеме или элементе повлекут за
собой изменения в других взаимосвязанных элементах или
подсистемах.
Следовательно, все 12 свойств полностью относятся к любому
подразделению отрасли и поэтому они могут быть отнесены к сис-
темам.
Иногда рассматриваются и другие свойства систем: наличие большо-
го количества элементов, сложность, стохастическая природа входных
воздействий на системы, наличие конкурентных ситуаций и др. Доста-
точно легко можно показать, что и эти свойства относятся к производст-
вам основного органического и нефтехимического синтеза.
А. И. Кухтенко рассмотрены некоторые другие признаки: многомер-
ность, многообразие структуры системы (сети, деревья, иерархические
структуры и т. д.); многосвязность элементов системы (взаимосвязанность
подсистем в одном уровне и между различными уровнями иерархии); мно-
гообразие природы элементов (машины, аппараты, автоматы, люди-опе-
раторы), многократность изменения состава и состояния системы (пере-
менность структуры связей и состава системы); многокритериальность
системы; многоплановость в научном отношении. Из них главенствую-
щими являются многомерность и многосвязность.
Все технологические системы, в том числе и производства 00
и НХС, обладают характеристическими свойствами. К их числу от-
носятся: надежность, чувствительность, управляемость, устойчи-
вость, помехозащищенность, эмерджентность, интерэктность и др.
Рассмотрим кратко каждое из этих свойств.
Под чувствительностью обычно понимают свойства систе-
мы изменять технологические режимы функционирования под вли-
янием изменения собственных параметров системы и внешних воз-
мущающих воздействий.
Управляемость — это свойство системы достигать желаемой
цели (заданного состава продукта, производительности в каждой
Глава 2. Системные закономерности в технологии ...
39
подсистеме и т. д.) при тех ограниченных ресурсах управления, ко-
торые имеются в реальных условиях эксплуатации.
Помехозащищенность^, е. способность системы эффектив-
но функционировать в условиях действия внутренних и внешних
помех.
Устойчивость — это способность системы возвращаться в пер-
воначальное состояние после прекращения действия возмущений.
В отрасли основного органического и нефтехимического син-
теза, имеющей дело с многотоннажными производствами, а также
аппаратами и технологическими линиями большой единичной мощ-
ности, наиболее важной характеристикой ХТС является ее надеж-
ность. Это свойство системы характеризуется частотой отказов от-
дельных ее элементов выполнять и сохранять заданные функции,
выпускать требуемую продукцию в заданных пределах времени.
До сих пор мы рассматривали характеристики, которые от-
носятся как к системе в целом, так и к отдельным ее подсистемам
или элементам. Вместе с тем, имеются характеристики, которые от-
носятся только к системам. Это эмерджентность и интерэктность.
Под эмерджентностью понимают способность системы приоб-
ретать новые свойства, которые отличаются от свойств отдельных
элементов, образующих эту систему. Интерэктность — спо-
собность элементов, образующих систему, взаимодействовать между
собой в процессе ее функционирования.
Таким образом, технология производства основного органи-
ческого и нефтехимического синтеза представляет целостный ком-
плекс взаимосвязанных элементов (аппаратов), обладающий оп-
ределенной структурой, допускающий вычленение иерархии
элементов, в том числе и комплексов. Взаимодействуя со средой,
т. е. с другими частями производства, любая технологическая ус-
тановка может рассматриваться как элемент высшей, более ши-
рокой системы (например, цех, завод). В свою очередь эти систе-
мы могут быть подсистемами еще больших систем — комбинатов,
компаний, корпораций.
Следовательно, такие производства обладают многоэтапной
иерархичностью.
Системное представление производства
В зависимости от целей анализа каждое производство может быть
представлено в виде некоторой совокупности систем или их состав-
ляющих. Можно рассматривать производство с точки зрения физи-
40 Часть 1. Теоретические основы технологии крупнотоннажных ...
ческих, кибернетических, экономических и социальных систем.
Анализ технологии как кибернетической системы, представляю-
щей совокупность управляемой и управляющих подсистем, свя-
занных потоками информации, применяется при больших объе-
мах производства.
Однако его представление как физической и кибернетической
системы является неполным, особенно когда необходимо решать во-
просы (например, расширения предприятия), влияющие на объем,
номенклатуру, качество продукции и выходящие за пределы функ-
ционирования технологического процесса. Это можно учесть, если
рассматривать производство и как экономическую систему. Вхо-
дом такой системы являются капитальные затраты на разработку,
проектирование и строительство, а также текущие затраты произ-
водства. Выходом является стоимостная оценка выпускаемой про-
дукции. Следовательно, если основной задачей производства, рас-
сматриваемого в виде физической системы, является выпуск
наибольшего количества продукции при заданном расходе сырья
и трудовых ресурсов, то при рассмотрении его как экономической
системы — максимальная прибыль за счет реализации готовой про-
дукции при заданных затратах. Как правило, эти две задачи не про-
тиворечат друг другу, но имеют различные формы. Производство как
экономическая система, в отличие от физической, имеет дело не
с реальными процессами и объектами, а с их изоморфными отобра-
жениями в экономической области. Это означает, что, регулируя эко-
номические показатели технологии, можно в определенных преде-
лах изменять экономические характеристики производства в целом.
Производство может рассматриваться как экологическая под-
система, характеризующаяся отношением к окружающей среде.
И наконец, производство необходимо рассматривать как
социальную систему. Это особенно важно для таких крупно-
тоннажных химических производств, каковыми являются про-
изводства ОО и НХС. При этом производство анализируется как
система практических отношений общества с самой системой
и веществом. Комплексное, всестороннее использование вещест-
ва для нужд экономики, превращение отходов производства, за-
грязняющих окружающую среду, в полезные продукты или сырье
для других производств — задача производства основного органи-
ческого и нефтехимического синтеза. Следовательно, технология
производства должна быть разработана так, чтобы производить
целевые продукты в условиях, безопасных для человека и окру-
Глава 2. Системные закономерности в технологии...
41
жающей среды. Это возможно при разработке технологии, обес-
печивающей создание безотходных производств.
Для этого в настоящее время предусматривается:
<§> очистка газовых выбросов и жидких стоков;
очистка и многократное оборотное использование воды;
регенерация и использование в самом процессе или для иных
нужд тепла реакций, а также выводимых из систем потоков.
Однако такой подход при разработке технологии не является
перспективным, так как требует затрат на получение целевых про-
дуктов и переработку отходов. Необходимо разрабатывать принци-
пиально новую технологию, позволяющую создать безотходное про-
изводство. При этом должна создаваться оптимальная технология,
ориентируемая на экономический критерий, а в качестве ограни-
чения приниматься «безотходность».
МОДЕЛИ ТЕХНОЛОГИЧЕСКИХ УСТАНОВОК
И КОМПЛЕКСОВ ПРОИЗВОДСТВ
Производство 00 и НХС в целом может рассматриваться как
функциональная система, представляющая совокупность тех-
нологических узлов или объектов (аппаратов, комплексов ап-
паратов, цехов, заводов), в каждом из которых осуществляется не-
который типовой химико-технологический процесс или несколько
процессов (рис. 2.1).
Рис. 2.1. Структура объекта
Независимо от сложности узлов или объектов они находятся
под влиянием различных факторов (параметров, переменных). Со-
вокупность параметров, которые воздействуют на объект, делится на:
входные (входы) - х2, ..., хп; выходные (выходы) — ур у2, ..., ут; уп-
равляющие воздействия (управление) — цр и2, ..., ик; возмущающие
воздействия (возмущения) — ..., zs.
В качестве таких узлов (объектов) выделяются отдельные пов-
торяющиеся аппараты (реакторы, массообменные аппараты, теп-
42 Часть 1. Теоретические основы технолории крупнотоннажных ...
лообменники и т. д.) и их элементы, последовательности аппаратов
или комплексы (двухколонные установки для гетероазеотропной
осушки, реакционно-ректификационные установки, абсорбер-де-
сорбер) и многие другие.
Все узлы системы объединены технологическими потоками или
коммуникациями, которые называются связями. Поток, входящий
в технологический узел, является его входом, выходящий — выхо-
дом. Одна и та же связь может быть входом одного узла и выходом
другого. Способ производства рассматривается как последова-
тельное описание операций, протекающих при определенных ус-
ловиях в соответствующих аппаратах. Такое описание называется
технологической схемой. Технологическая схема производст-
ва дает полную информацию об аппаратах, потоках, автоматичес-
ком регулировании параметров и включает следующие данные:
♦ количество и химический состав исходных, промежуточных,
вспомогательных и конечных веществ, т. е. содержит все све-
дения, необходимые для составления материального баланса
по производству в целом;
♦ термодинамические и физико-химические характеристики всех
веществ, т. е. содержит все сведения, необходимые для состав-
ления энергетического баланса производства в целом;
♦ последовательность отдельных процессов и операций;
♦ типы, число и взаимосвязь применяемых аппаратов и машин;
♦ способы автоматическою регулирования всех потоков
и контроля параметров, при которых протекают процессы.
Таким образом, технологическая схема отображает процессы
массо- и энергообмена, а также способы управления этими про-
цессами.
Технологическая схема, включающая аппараты, материальные
потоки, энергоснабжение и т. д., является изоморфным ото-
бражением физической системы. Под изоморфизмом в данном
случае понимается взаимно-однозначное соответствие между эти-
ми двумя множествами. Изоморфными называют такие системы,
в которых сохраняются соотношения между составляющими их
элементами.
Объекты технологии основного органического и нефтехими-
ческого синтеза многообразны по сложности, типам включенных
аппаратов и физической природе процессов. При этом они могут
состоять из большего или меньшего числа элементов, взаимосвя-
занных между собой.
Г/\ава 2. Системные закономерности в технологии ...
43
Для изучения сложных объектов их расчленяют на отдельные
звенья, из которых состоит химико-технологический комплекс
(объект). Степень детализации при создании структурной схемы
комплекса определяется его сложностью. В частности, технологи-
ческое звено не обязательно должно соответствовать одному аппа-
рату, а может объединять группу (комплекс) аппаратов, имеющую
разветвленную топологическую структуру.
В непрерывном производстве связь соответствует непре-
рывному материальному или энергетическому потоку. В этом слу-
чае она выступает как скалярная величина. Однако во многих слу-
чаях технологическая связь определяет некоторые дополнительные
характеристики потока (температура, давление, состав и т. д.), яв-
ляясь в этом случае векторной величиной.
Виды и ОБЩАЯ ХАРАКТЕРИСТИКА МОДЕЛЕЙ
Для анализа и выявления отдельных элементов, а также комплек-
сов любая система (в нашем случае химико-технологическая) может
быть представлена различными моделями: символическими, мате-
матическими, иконографическими, топологическими, блочными
(блок-схемами) и сетевыми.
Каждая из моделей характеризуется своей степенью абстрак-
ции и используется в зависимости от поставленных целей анализа.
Так, например, если необходимо выявить все взаимосвязи и слож-
ную структуру в целом, удобно применять символические и топо-
логические модели. Если при этом необходимо подчеркнуть функ-
циональное действие аппаратов или узлов, используются блочные
и иконографические модели. Последние позволяют представить
контуры аппаратов.
В проектной практике, как правило, используются иконогра-
фические модели в виде технологических схем. В связи с широким
внедрением ЭВМ в практику исследований СХТС получили рас-
пространение более абстрактные матричные модели.
Некоторые технологические схемы можно представить сим-
волически в виде одномерной последовательности:
L = X.S + + ... + А, 5, 2.1
11 2 2 п п’
где 5р S2, Sn - одномерные ориентированные симплексы; А,р А2, -
целые числа.
Последовательность 2.1 есть линейная комбинация перемен-
ных 5р S7,Sr с коэффициентами Хр Х2, Хд.
44 Часть 1. Теоретические основы технологии крупнотоннажных ...
В частности, ХТС можно представить в виде топологической
структуры—графа с указанием входных и выходных переменных.
Ориентированный граф, вершинами которого являются
технологические звенья (операторы, см. рис. 2.2), а дугами — тех-
нологические связи, носит название топологической структу-
ры схемы производства или графа производства. Обычно
сложный технологический граф, соответствующий сложному объ-
екту, является комбинацией различного числа простейших элемен-
тарных структур (последовательных, параллельных и охваченных
обратной связью).
Рис. 2.2. Обозначения операторов
Исходя из технологических соображений, в любой ХТС уста-
навливается основное направление материальных потоков. Нуме-
руя узлы модели ХТС, целесообразно всегда придерживаться этого
направления. При этом потоки, идущие из узлов с меньшими но-
мерами к узлам с большими номерами, называются прямыми, а иду-
щие в обратном направлении — обратными. Рассмотрим описание
графом F(С, 0) функции технологического процесса.
F(c,0)=co(p1c1(p2c2(p3...q.1(pq. 2.2
Глава 2. Системные закономерности в технологии...
45
Этот граф представляет объединение графов-функций Ф отдель-
ных операций:
к
F(C, 0) = Ф,и Ф2и Ф3 U... U Ф* = |JOy. 2.3
7=1
Для реализации этой операционной функции F(C, 0) требуется
выполнить определенное число основных и вспомогательных пе-
реходов. При этом общая функция расчленяется на ряд более мел-
ких функций отдельных переходов. На любом к-м уровне расчле-
нения характеристика любого узла и процесса, происходящего
в нем, описывается множеством параметров:
Z* = (Z„Z7,...,Z.,...,Z), 2.4
где Z. - параметр, описывающий определенное функциональное свойст-
во системы.
Структура перехода от одного состояния химических веществ
к другому как совокупность упорядоченных во времени методов
(приемов) описывается графом F{С, 0). В этом графе множеству вер-
шин С, отвечающих аппаратам технологической схемы, соответст-
вуют основные и вспомогательные методы (приемы), а множеству
дуг 0 — отношения, характеризующие совмещения методов (приемов)
во времени (последовательное р, параллельное со и последователь-
но-параллельное т).
Анализ сложной системы или процесса позволяет установить
перечень элементов системы (простых операций процесса) и опре-
делить систему бинарных отношений на множестве этих элемен-
тов, т. е. составить матрицу непосредственных путей. Такая матри-
ца позволяет построить ориентированный граф, анализ которого
связан с очень большими, иногда практически непреодолимыми
трудностями.
Первым структурным параметром, оценивающим вид и ка-
чество схемы при представлении ее графом, является связность
графа.
Связность графа определяется полной матрицей связей (Г).
Если вершина к связана с вершиной /, то Гк1 = 1.
При исследовании структуры той или иной системы, что рав-
носильно изучению структуры графов вообще, чаще всего первым
этапом является рассмотрение матрицы смежности (матрица не-
посредственных связей, путей).
46 Часть 1. Теоретические основы технологии крупнотоннажных ...
В качестве параметров, определяющих качество структурной
схемы, при представлении ее графом, можно выделить следующие:
связность графа, ранг элемента, множество сочленения.
Эти параметры позволяют распределить элементы схемы в по-
рядке их значимости. Значимость элемента определяется здесь ко-
личеством связей данного элемента с другими. Исходя из общего опре-
деления понятия множества сочленения, его можно трактовать
также как некоторый структурный параметр, указывающий на со-
стояние системы при удалении элементов, т. е. при удалении каких
элементов из схемы она перестает существовать как единое целое.
На рис. 2.35 представлен граф, соответствующий техноло-
гической схеме разделения (рис. 2.3а).
Рис. 2.3. Технологическая схема (а) и соответствующий ей ориентирован-
ный граф (б)
Матричное представление моделей
С целью синтеза и особенно анализа ХТС с помощью ЭВМ тех-
нологические схемы представляют в виде информационных схем,
т. е. закодированных в виде различных матриц: процесса, потоков,
инциденций и смежности.
Глава 2. Системные закономерности в технологии ...
47
Матрица процесса. Каждый блок информационной схемы за-
дается одной строкой матрицы процесса, содержащей номера или
обозначения аппаратов, их наименования, номера потоков на вхо-
де (положительные) и на выходе (отрицательные). В табл. 2.1 со-
держится матрица технологической схемы, представленная на
рис. 2.3 а.
Таблица 2.1. Матрица процесса
Обозначение блока (аппарата) Название блока (аппарата) Номер потоков, связанных с блоком (аппаратом)
1 2 3 4
А Ректификационная колонна 1 4 -2 -3
Б Отгонная колонна 6 -5 - 7
Ректификационная колонна 3 -8 -9
г Ректификационная колонна 9 -10 -11
д Флорентийский сосуд 2 5 -4 -6
Матрица процесса кодирует внутреннюю структуру инфор-
мационной схемы: какой поток с каким аппаратом связан; на-
звание каждого аппарата; расположение входных и выходных по-
токов аппарата.
Матрица потоков. Матрица потоков представляет последо-
вательность с тремя целыми числами в каждой строке, где первое
число — номер потока, второе — номер аппарата, из которого этот
поток выходит, и третье — номер аппарата, в который он входит.
Матрица потоков (табл. 2.2) может быть записана на основе техно-
логической схемы (рис. 2.3) или матрицы процесса (табл. 2.1).
Таблица 2.2. Матрица потоков
Номер потока Из блока (аппарата) В блок (аппарат) Номер потока Из блока (аппарата) В блок (аппарат)
1 0 А 7 Б 0
2 А д 8 В 0
в 9
4 д А 10 г 0
Д 11
6 д Б
48 Часть 1. Теоретические основы технологии крупнотоннажных ...
Необходимо отметить, что питающие потоки показаны по-
ступающими из блока 0, а потоки продукта или выводимые из сис-
темы — в блоке 0. Под блоком 0 подразумевается внешняя среда —
источник сырья и сток продуктов. Эта матрица не содержит указа-
ний ни о типе аппарата, ни о порядке ввода и вывода потоков.
Матрица инциденций и смежности. Для расчленения и анализа
технологических схем по частям, особенно при наличии рецирку-
ляционных процессов, важное значение имеют матрицы инциден-
ций и смежности.
Их можно построить на основе технологической схемы или со-
ответствующего ей графа.
Допустим, что С], С2, ..., Сп — вершины графа, а 0р 02, —,0т —
его дуги. Кроме того, введем обозначения:
-1, если 6j выходит из С;;
• +1, если 0у входит в С(.;
0, если Qj не инцидентна С(.
1, если имеется дуга, соединяющая вершину i с вершиной у;
0, если такой дуги нет.
Матрица .у = (j ) порядка пит будет названа матрицей инци-
денций для дуг графа, а квадратная матрица R—(r3) порядка пхт —
матрицей смежности графа.
Для технологической схемы (рис. 2.3) матрица инциденций
представлена в табл. 2.3.
Таблица 2.3. Матрица инциденций
Блок (аппарат) Номер потока
1 2 3 4 5 6 7 8 9 10 11
Б -1 +1 -1
Г +1 -1 -1
Д________+1 -1 +1 -1______________________
Е - 1 0 0 0 0 0 -1 0 -1 -1
Если сумма столбца равна 0, то поток связан с двумя блоками.
Если же она равна +1, то поток является питающим, а если — 1, то
продуктовым. Наличие в процессе рециркуляционного потока мож-
но определить по матрице инциденций (см. табл. 2.3), если ника-
Глава 2. Системные закономерности в технологии ...
49
кой перестановкой строк нельзя получить —1 под +1 в каждом
столбце, имеющем в сумме 0.
Матрица инциденций содержит ту же информацию, что и мат-
рица потоков, т. е. меньше, чем матрица процесса.
В квадратной матрице смежности (табл. 2.4) номера строк
и столбцов соответствуют определенным аппаратам. При этом 1
указывает на связь аппарата, отмеченного номером строки, с аппа-
ратом, отмеченным номером столбца, 0 — обозначает отсутствие та-
кой связи.
Таблица 2.4. Матрица смежности (связи)
А Б в г
А Б В Г Д 0 0 0 0 1 0 0 0 0 1 1 0 0 0 0 0 0 0 1 1 0 0 0
Поскольку ни один аппарат не связан сам с собой, все диа-
гональные элементы равны 0.
Несмотря на то, что матрица смежности имеет наименьший
объем информации из всех рассмотренных матриц (в ней не нахо-
дят отражения питающие потоки, потоки продуктов, номера пото-
ков), она наиболее полезна при нахождении рециклов.
ВАРИАНТЫ СОЕДИНЕНИЯ АППАРАТОВ
И ПЕРЕДАТОЧНЫЕ ФУНКЦИИ
В принципе, все блоки, входящие в технологическую схему,
можно разделить на два типа: блоки разомкнутых и блоки рецир-
куляционных последовательностей. Процесс исследования любой
технологической схемы включает следующие операции:
♦ определение разомкнутых и рециркуляционных последова-
тельностей и расположение их в удобном для вычисления виде;
♦ нахождение методики расчета каждой рециркуляционной по-
следовательности.
Необходимо отметить, что система называется замкнутой, если
определяющее ее отношение связано, т. е. если выполняется условие:
х,уе М—илиуЯх). 2.5
50 Часть 1. Теоретические основы технологии крупнотоннажных ...
Каждые две вершины системы одновременно служат вер-
шинами одного из ее элементов, где х, у — элементы системы.
Замкнутыми схемами являются те, в которых выходящий из
блока поток влияет, по крайней мере, на один из его входных пото-
ков. Если все непосредственно вычисляемые блоки определены,
а в схеме еще остались невычисленные блоки и имеется хотя бы
один контур, то это и будет замкнутая схема.
Различают структурные схемы последовательного, парал-
лельного соединений и схемы с обратной связью. Передаточные
функции этих схем определяются по правилам блок-алгебры.
Объекты химической технологии, состоящие из элементов, со-
единенных между собой различными способами, т. е. имеющие со-
ответствующие структурные схемы, могут быть описаны статичес-
кими и динамическими характеристиками, представляющими
собой взаимосвязь между входными и выходными параметрами. Во
многих случаях математическое описание объекта химической тех-
нологии имеет вид дифференциальных уравнений, устанавливаю-
щих связь между основными переменными процесса. Однако ре-
шение дифференциальных уравнений усложняется с повышением
их порядка и зависит от вида производных.
В связи с этим широко применяется операционное исчисление
с использованием оператора Далласа, позволяющего относительно
просто решать дифференциальные уравнения. Преобразование Ла-
пласа дает возможность вместо дифференциальных уравнений опе-
рировать алгебраическими уравнениями и заменить операции диф-
ференцирования и интегрирования более простыми операциями
(умножение и деление). В результате действия с дифференциаль-
ными уравнениями в операционной форме можно получить так на-
зываемую передаточную функцию W(P)=y(P)/xBx(P), представ-
ляющую отношение изображений выходной и входной величины.
Смысл этого понятия можно проиллюстрировать на примере
преобразования дифференциального уравнения второго порядка.
«У + а^’ + v = *bx’ 2-6
где у и лвх — выходная и входная величины, соответственно; а0, а{, а2 -
постоянные коэффициенты.
В результате преобразования по Лапласу (при нулевых на-
чальных условиях) получаем уравнение в операторной форме:
о2Р2у(Р) + а{Ру(Р) +адУ(Р) = х Х(Р) 2.7
Гмел 2. Системные закономерности в технологии ...
51
или
у(Р)/х х(Р) = 1/[(«2Р2) + (о,Р + о0)] = W(P). 2.8
Если объект представить как совокупность элементов (звеньев),
то его характеристику можно составить, используя передаточные
функции этих элементов. При этом элементарные звенья следует под-
бирать так, чтобы их передаточные функции имели простой вид.
Последовательное соединение элементов
В этом случае технологические звенья (элементы) соединены
таким образом, что выход предыдущего является входом последу-
ющего звена (рис. 2.4). И между ними существует следующая зави-
симость:
х, =х0; х. =у.- уп =у0; i = I, 2, 3,..., п, 2.9
где хд и у() - общий вход и общий выход последовательной цепочки.
Примером такой связи может служить последовательное соеди-
нение нескольких реакторов: участками производства являются от-
дельные реакторы, технологическими связями — векторные вели-
чины, составляющими которых служат нагрузки реакторов, а также
концентрации целевых и побочных продуктов. Управляющими воз-
действиями могут быть, например, температура, давление и др.
Такие технологические связи широко представлены в непрерыв-
ных химических производствах, так как при переходе от периоди-
ческого процесса к непрерывному последовательность технологи-
ческих операций во времени заменяется последовательностью
технологических аппаратов в пространстве.
Передаточная функция W(P) двух последовательно соеди-
ненных элементов может быть записана так:
W(P) = у(Р)/х(Р) = W2(P) У1(Р)/х(Р) = W2(P) W, (Р) . 2.10
Для п последовательно соединенных элементов:
W(P)=W,(P)W2(P)...W„(P). 2.11
Рис. 2.4. Последовательное соединение элементов
52 Часть!. Теоретические основы технологии крупнотоннажных ...
Таким образом, передаточная функция последовательно соеди-
ненных элементов равна произведению их передаточных функций.
Параллельное соединение элементов
Технологические схемы, представляющие параллельную струк-
туру, имеют объединенные входы и выходы (рис. 2.5).
В этом случае общий вход равен сумме входов отдельных зве-
ньев, общий выход — сумме выходов:
х0 = £*, ; То =£тг . 2.12
1=1 /=1
Связи х0, х.; у0, у. могут быть как скалярными, так и векторными
величинами. Однако для соблюдения равенств (2.12) необходимо,
чтобы составляющие векторов х. и у. были представлены в форме,
допускающей такое суммирование. Это означает, что составляю-
щими векторов могут быть, например, такие величины, как мощ-
ность, энтальпия (но не температура), содержание компонентов
смеси в абсолютных единицах (но не в долях от общего количества
смеси). Примером параллельной технологической связи может слу-
жить группа параллельно работающих реакторов, полимеризаторов,
теплообменников и т. д.
Передаточная функция такой цепочки W(P) имеет вид:
W(P) =у(Р)Д(Р) = (У/Р) +у2(Р))/х(Р) =W,(P) + W2(P). 2.13
Следовательно, для п параллельных элементов передаточная
функция будет иметь вид:
W(P) = W1(P) + W2(P) + ... +W„(P), 2.14
т. е. передаточная функция для п параллельно соединенных элемен-
тов равна сумме их передаточных функций.
Рис. 2.5. Параллельное
соединение элементов
Глава 2. Системные закономерности в технологии...
53
Соединение элементов по схеме
С ОБРАТНОЙ СВЯЗЬЮ
Характерной особенностью системы с обратной связью (рецик-
лом) (рис. 2.6) является то, что часть продукта с выходом, напри-
мер, из последнего звена поступает на вход первого (рис. 2.6,а).
Если х0 — общий вход схемы, а у0 — ее выход, то уравнение обрат-
ной связи для схемы 2.6,5имеет вид:
Х1 =Vay„;>'o:=y/1-a)- 115
а для схемы 2.6,в:
п п п
^х,.=х0+а^у,., Уо=Е^(1-а)-
/=1 /=1 /=1
2.16
Величина а, называемая степенью рециркуляции, опреде-
ляет часть общего потока, возвращаемого на вход системы (0<а<1).
Схема с обратной связью, как правило, отвечает требованию эко-
номичности, так как обратные связи или рециклы чаще всего поз-
воляют наиболее полно использовать сырье и увеличивать выход
б
Рис. 2.6. Соединение элементов по схеме с обратной связью
54 Часть 1. Теоретические основы технологии крупнотоннажных ...
целевого продукта, обеспечивают утилизацию тепла, дают возмож-
ность повторно использовать какой-либо продукт (например, рас-
творитель).
В соответствии с рис. 2.6 значения передаточных функции мо-
гут быть выражены следующим образом:
W(P) =у(Р)А(Р); W,(P) =у(Р)А1(Р);
\¥2(Р) = У1(Р)/у(Р); 2.17
х,(Р) =х(Р)+ у(Р) - при положительной обратной связи (об-
ратное воздействие усиливает процесс); х1(Р) = х(Р) —у,(Р) - при
отрицательной обратной связи (обратное воздействие замедляет
процесс).
При решении системы уравнений 2.17 в случае положительной
обратной связи (рис. 2.6,а) получаем следующее выражение для пе-
редаточной функции:
W(P) = W,(P)/[1-(W1(P)/W2(P))], 2.18
а для отрицательной обратной связи:
W(P) = W,(P)/[1 + (W1(P)/W2(P))]. 2.19
Структурные схемы в качестве наглядных образов проек-
тируемых комплексных систем, отображающих различные тех-
нологические объекты, используются давно. Применение струк-
турных схем позволяет наглядно представлять причинные
отношения между входом и выходом каждого элемента системы,
а также взаимосвязь между ними.
Каждый блок структурной схемы имеет свою передаточную
функцию. Как правило, блоки структурных схем являются мно-
гопараметрическими и имеют более одного входа и выхода, свя-
занных между собой векторно-матричными уравнениями. Боль-
шинство из используемых структурных схем преобразований
сигналов, отвечающих отдельным элементам технологических
схем производств, представлено в табл. 2.5.
Данная таблица применима для представления технологичес-
ких схем как при их синтезе, так и анализе, в процессе которого
проводится расчленение всей схемы на отдельные элементы.
Следует также иметь в виду, что связь между параметрами про-
ектируемых систем и их динамикой может быть потеряна, если они
представляются только системой математических уравнений.
Глава 2. Системные закономерности в технологии...
55
Таблица 2.5. Типовые структурные схемы и эквивалентные соотношения,
применяемые в структурном анализе
№ пп Преобразование Типовая структура Эквивалентная схема Уравнение
1 Перемена блоков а У1 —» ь —► a I I -Hzd—► b b=ayt у2
2 Взаимный обмен сумматоров d=a-b+c
3 Перестроение сумматоров ——►(?) Ь с ——►(£)« — -fz> -fc d-a-b-c
4 Смещение блока за сумматор а У b+^ d —» >1 У с— d-ay-c
т с 1/у*
5 Смещение сумматора за блок —►[ у а —► У + c=(a-b)y
у
0
6 Смещение блока за точку ответвления а ь У а \Ь У Р» b=ay
ь У 4 а
7 Смещение точки ответвления за блок а Г—}Ь а у b=ay a=b/y
а F F- а 1/у
<— J ь
8 Смещение сумматора за точку ответвления а + С __ с “ —►0-<> с +о«—' b * - ь c=a-b
х и
9 Смещение точки ответвления за сумматор а - ь а о с а /^\ ~ь c=a-b a=c+b
я
ТО Объединение каскадных блоков а । 1 б —Н У1У2 Н* 1 1 Ь=аУ!У2
11 Удаление блока из прямой петли d=afy1-y2)
12 Выделение блока в прямую петлю ।— d-ay^a
13 Устранение прямой петли 1— —У1-у2 Н» d=a (УрУ2)
56 Часть 1. Теоретические основы технологии крупнотоннажных ...
Продолжение табл. 2.5.
Преобразование Типовая структура Эквивалентная схема Уравнение
/У Устранение блока из контура обратной связи а ।—I я 3 d- ayl 1+У,У2
15 Введение блока в контур обратной связи —0^4 ay. d~ i+yt
16 Устранение контура обратной связи Д + р—, » L 04-J а —► У, 1+У,У2 d —► . °y, d 1+У1У2
17 То же а 1+У, d —► d=a--~ 1 + У,
18 а +о d т а 1 1+Уз d ► d=a—^-L— 1+У2
19 Введение контура обратной связи 5—из—* а +о ~У1_ 1+У2 d d^ayj
20 То же *—®+ + z-x £~' - d T d^ayj
СИСТЕМНЫЙ ПОДХОД К РАЗРАБОТКЕ ТЕХНОЛОГИИ
ПРОИЗВОДСТВА
Методологические принципы
Разработка технологии производства основного органического
и нефтехимического синтеза — многоэтапный процесс, характери-
зующийся различными техническими и организационными меро-
приятиями. На каждом из этапов разработки технологии возни-
кает множество вопросов, ответы на которые могут быть найдены
только в результате достаточно глубокого исследования как функ-
ционирования отдельных аппаратов или установок, так и всего про-
изводства. Такая совокупность методов, включая системный под-
ход, представляющая логически стройную последовательность
операций разработки и проектирования сложных систем, называ-
ется системотехникой.
Глава 2. Системные закономерности в технологии...
57
Системотехника обеспечивает взаимосвязь между фундамен-
тальными областями науки и технологией, а также максимально
эффективное использование теории на практике, что может быть
сделано только на системной основе. Системотехник объединяет
специалистов разных профилей для совместного решения сложной
задачи. Наиболее эффективно такие задачи могут решать опытные
инженеры-химики-технологи широкого профиля.
Разработка любого реального химико-технологического объекта
базируется на анализе комплекса химических, физико-химических,
механических, теплотехнических и экономических явлений, харак-
теризующих все процессы, поскольку производство нельзя рассма-
тривать как сумму отдельных технологических операций и процес-
сов. Каждый отдельный агрегат производства непосредственно или
косвенно влияет на другие узлы. В частности, нельзя разрабаты-
вать технологию разделения сложных смесей, не учитывая узел хи-
мического превращения сырья, и, наоборот, нельзя не учитывать
особенности разделения реакционной смеси при создании реактор-
ного узла. Решение этих задач осуществляется на основе систем-
но-структурного анализа, рассматривающего каждую операцию как
часть всего сложного процесса получения продукта ОО и НХС.
В задачи системно-структурного анализа входят:
♦ разработка формализованных моделей, описывающих струк-
туру, функции и свойства систем;
♦ характеристика иерархического строения систем и взаимо-
связей объектов различных уровней;
♦ определение общих свойств системы, исходя из свойств состав-
ляющих ее подсистем;
♦ определение интегральной функции системы на основе функ-
ций отдельных элементов.
Следует отметить, что многоуровневый подход к решению
сложных задач, таких как разработка и проектирование произ-
водства ОО и НХС, как правило, является важным методом в си-
стемотехнике.
С системных позиций технологическая операция задается на-
бором характеристик z, функций Ф и структурой Q.
Определение материальных и энергетических потоков, обла-
дающих определенными свойствами и параметрами, а также пара-
метров работы отдельных аппаратов позволяет оценить как харак-
теристику, так и структуру любой подсистемы технологического
58 Часть!. Теоретические основы технологии крупнотоннажных ...
объекта. При этом имеется в виду, что рассматриваемый объект
предназначен для выполнения определенной функции, т. е. осуще-
ствления каких-либо технологических операций, результатом ко-
торых является выход продукта или полупродукта. Все это должно
учитываться при разработке новой технологии.
Таким образом, разработку технологии производства, как хими-
ко-технологической системы, осуществляют по следующим этапам:
® согласование и распределение материальных и энергетических
потоков, определение общей нагрузки на аппараты;
@ выбор и расчет технологического оборудования;
® определение затрат на все производство и рассмотрение раз-
личных вариантов технологических схем;
® окончательный выбор технологической схемы производства.
Выполнение первого этапа возможно только после изучения
химических превращений, физико-химических свойств различных
смесей, образующихся на разных этапах, и выявления всех огра-
ничений.
Как было отмечено ранее, каждую технологию производства
продуктов ОО и НХС, представляющую систему, необходимо рас-
сматривать как единство противоположных сторон: целостности
и расчлененности.
Расчлененность отражает одну из общих сторон структуры сис-
темы и характеризуется тремя признаками: качественной спе-
цификой частей системы; числом частей, на которые расчленяется
рассматриваемая система; их взаимным расположением в простран-
стве и во времени.
При рассмотрении любого производства как сложной системы
предварительно необходимо изучить связи между элементами (ап-
паратами), выявить совокупность управляемых и неуправляемых
параметров, способных влиять на показатели разрабатываемого
процесса. К ним обычно относят составы потоков, их расходы
и температуры, температуру и давление в аппаратах, количество
подводимого и отводимого тепла, параметры теплоносителя и хла-
дагента и т. д., т. е. те, от которых прежде всего зависит протекание
химического превращения сырья, чистота и полнота выделяемых
компонентов, энергетические и капитальные затраты на производ-
ство продуктов.
При разработке и исследовании сложных систем, характеризу-
ющих любой технологический объект, выделяют, как правило, два
класса основных задач:
Глава 2. Системные закономерности в технологии ...
59
О задачи синтеза, сводящиеся к выбору структуры и значений па-
раметров на основе заданных свойств системы;
© задачи анализа, связанные с изучением свойств и поведения
системы в зависимости от ее структуры и значений параметров.
Другими словами, синтез ХТС — это операция выбора типов
элементов и структуры технологических связей между ними, опре-
деления параметров элементов и технологических потоков систе-
мы, которые в конечном счете обеспечивают оптимальное значе-
ние критерия эффективности.
Анализ ХТС — это операция изучения свойств и эффективности
функционирования системы в зависимости от структуры техноло-
гических связей между подсистемами и элементами, от значений тех-
нологических и конструкционных параметров, технологических ре-
жимов элементов.
При синтезе ХТС могут решаться следующие задачи технологии
ОО и НХС:
Ф Определить оптимальный маршрут синтеза целевых про-
дуктов из различных исходных веществ, используя известные
типы реакции.
® При заданном химическом маршруте синтеза целевых продук-
тов из исходных веществ определить топологию ХТС (выявить
технологическую схему), выбрать параметры элементов и по-
токов, которые будут обеспечивать функционирование систе-
мы при оптимальном значении критерия эффективности.
® При заданных типах и свойствах элементов ХТС, обеспечиваю-
щих осуществление различных технологических процессов, вы-
брать элементы и определить структуру технологических свя-
зей ХТС, при которой будет достигаться оптимальный
показатель эффективности.
® При заданных типах разделительных элементов необходимо оп-
ределить технологическую схему разделения, параметры эле-
ментов и параметры технологических потоков.
При подходе к синтезу ХТС выделяют два направления на базе:
О поиска оптимальной ХТС строгими алгоритмическими мето-
дами: решения сложных оптимизационных задач с использо-
ванием быстродействующих ЭВМ;
© использования эвристических методов.
Правда, необходимо отметить, что последние имеют ряд не-
достатков и дают противоречивые, неоднозначные результаты. Од-
60 Часть!. Теоретические основы технологии крупнотоннажных ...
нако и алгоритмические методы обладают недостатками: требуют
большого объема информации и чрезвычайно громоздки.
При разработке технологии производства продуктов ОО и НХС
и проектировании отдельных цехов или их усовершенствовании,
а также при определении оптимальных режимов работы отдель-
ных аппаратов и правильной их взаимосвязи в технологической
схеме задачи анализа этих систем интерпретируются как оценка
возможных вариантов отдельных комплексов или схемы в целом
(выбор структуры схемы, значений параметров и т. д.). Именно со-
поставляя различные характеристики, можно получить первое
представление о преимуществах и недостатках различных вариан-
тов технологических схем.
Так, применение нескольких разделительных комплексов, ос-
нованных на различных методах разделения, позволяет снять огра-
ничения, обусловленные физико-химическими свойствами или тех-
нологическими возможностями, и приводит к нескольким
вариантам технологических схем. Эти технологические схемы
отличаются типом, числом и последовательностью соединения
аппаратов, а следовательно, разными энергетическими и капиталь-
ными затратами, но приводят к выделению продуктов одинакового
качества. В связи с этим, возникает сложная многовариантная за-
дача разработки, проектирования и выбора наиболее рациональ-
ного варианта технологической схемы.
Такие же проблемы возникают при разработке реакторного
узла, где может быть использовано несколько типов реакторных ус-
тройств, несколько вариантов подвода или отвода тепла, несколь-
ко вариантов отделения продуктов реакций от катализатора и т. д.
Кроме того, при создании производства в целом и различных его
подсистем необходимо учитывать все ограничения, как обусловлен-
ные свойствами веществ и их смесей, так и технологические и др.
В частности, при разработке и исследовании различных вариантов
технологических схем разделения необходимо прежде всего опре-
делить допустимые пределы изменения входных и выходных пере-
менных, т. е. выделить соответствующие ограничения для подсис-
тем и всей системы, обусловленные:
♦ диаграммой фазового равновесия смеси;
♦ химической активностью и термической стойкостью компо-
нентов при разделении;
♦ степенью чистоты выделяемых продуктов;
♦ пределами изменения концентрации исходной смеси;
Глава 2. Системные закономерности в технологии...
61
♦ возможностью применения определенного теплоносителя
и хладагента в теплообменной аппаратуре;
♦ возможностью использования технологических параметров, на-
пример давления;
♦ конструктивными особенностями аппаратов.
Кроме того, при выборе варианта схемы ХТС необходимо учи-
тывать, что эффективность функционирования данной схемы
зависит не только от топологии и параметров отдельных эле-
ментов, но и всей системы, ее характеристических свойств. Среди
них, как уже отмечалось, наиболее существенной для многотон-
нажных непрерывных производств является надежность. Поэто-
му важно уметь ее оценивать.
Разработка схем химико-технологических систем
Решение задачи разработки схемы химико-технологической си-
стемы с помощью простого перебора всех возможных вариантов
и последовательной их оптимизации практически невозможно, по-
скольку их число становится огромным уже при сравнительно не-
большом числе аппаратов. Такой прием тем более не может быть
использован для производства, где работают десятки, а иногда
и сотни аппаратов. В связи с этим необходимо опираться на другие
методы синтеза ХТС с меньшими затратами.
На первом этапе разработки технологических схем ХТС часто
используются эвристические методы.
Наиболее широко эвристический метод применяется при раз-
работке технологических схем разделения многокомпонентных сме-
сей, образующихся в производствах основного органического и
нефтехимического синтеза (см. гл. 4).
Более полно и точно синтез ХТС можно осуществить на осно-
ве анализа всех термодинамических закономерностей процессов.
Кроме того, эта задача должна быть сформулирована и решена ма-
тематически.
С целью синтеза ХТС может быть использован двухуров-
невый подход, в котором на первом уровне проводят оп-
тимизацию некоторой фиксированной структуры, а на втором —
минимизацию нелинейной функции двоичных переменных.
В случае одноуровневого подхода решается смешанная дис-
кретно-непрерывная задача минимизации. В частности, для реше-
ния такой задачи может быть использован метод структурных
переменных.
62 Часть 1. Теоретические основы технологии крупнотоннажных ...
Знание путей оптимизации существующих ХТС позволяет ре-
шать задачи и по синтезу оптимальной их структуры.
Например, пусть известны исходные вещества х., где i = 1,2, ...р
и вещества, которые требуется получить у. где /= 1,2,... ,т, а также
имеется набор аппаратов или блоков nQ (реакторы, блоки разделе-
ния, теплообменники и т. д.). Задача технолога состоит в том, что-
бы выбрать и соединить п. (nj < п0) блоков таким образом, чтобы
получить заданные количества целевых веществ у. при минималь-
ных приведенных затратах. В математическом виде это можно пред-
ставить следующим образом.
Пусть к-й блок имеет Мк входных и Nk выходных потоков. При
этом X(kt} = {х(к‘\...,х(к^) будет вектором переменных z-го входного
потока /с-го блока, a Y(kl) = (у}*'у(к^) — вектором переменных
у-го выходного потока к-го блока. Следовательно, x(ki) ,Y{ki) будут
обозначать, соответственно, векторы входных и выходных перемен-
ных к-го блока.
При условии, что все векторы X(ki),Y(ki) обладают одними и теми
же компонентами, соотношение связи между блоками можно запи-
сать в виде:
2.20
где структурные параметры ос определяются из условия:
1, еслиу-й выходной поток / -го
Sj —
ак. ~ 1 блока подается на s - й вход к - го блока;
(0, если такого потока нет.
Задача синтеза заданной ХТС, т. е. определения взаимосвязи
всех аппаратов, может быть решена математически только при на-
личии математического выражения для всех элементов и системы,
а также ограничений на все переменные.
Подсистемы или отдельные блоки в общем виде могут быть
описаны уравнениями:
у**> =fk^Xk\ и™), 2.21
где Х{к) =(х\к>,х(2к),...,х(^к) - векторы входных переменных Л-го блока;
Y(k) =(.yik),у2к),-.,У(„кк) — векторы выходных переменных Л-го блока;
U(k) =(и[к) ,и2к) ,...,и(кк) - векторы управлений к-ro блока.
Если же рассматривать отдельные типы аппаратов, то они мо-
гут описываться различными уравнениями. В частности, аппараты
Глава 2. Системные закономерности в технолотии ...
63
с распределенными параметрами (реакторы, абсорберы с насадкой
и др.) описываются системой дифференциальных уравнений типа:
dz(k) / dl = (zf, z(2k\..., z(p ,i^k\ u(2k)u(k>) 2.22
или
dx/dl=f(x, z, u, d),
а аппараты с сосредоточенными параметрами (реакторы идеального
смешения, ректификационные колонны и др.) в общем случае опи-
сываются конечными уравнениями типа:
=f(*k\ и^). 2.23
Далее структура схемы должна быть задана системой соот-
ношений связи, например
yW-x^=Q, 2.24
где q -я выходная переменная л-го блока равна z-й входной пере-
менной к-то блока. Следовательно, показана связь между этими
блоками.
И наконец, накладываются ограничения на переменные в виде:
^(<,м^,...,4>)<0. 2.25
Условия ограничений можно выразить и соотношением вида:
= Х<-1 = 0. 2.26
При этом задаются нижние и верхние пределы изменения уп-
равляющих воздействий и выходных координат.
Таким образом, с математической точки зрения в задачу син-
теза входит отыскание значения непрерывных управляющих воз-
действий и двоичных переменных а-кк>, при которых выбран-
ный предварительно критерий принимает экстремальное значение.
При этом используют математические модели, ограничения и струк-
турные схемы, выраженные уравнениями типа 2.22—2.26. Если ка-
кой-либо выходной поток может подаваться только на один вход,
т.е. если =1, то =0 для всех/:/ lus^p.
Выбор технологии производства продуктов
При разработке технологических схем производства 00 и НХС
и их проектировании чаще всего решаются две задачи:
64 Часть!. Теоретические основы технологии крупнотоннажных ...
О выбор технологической схемы и экспериментальная проверка
ее работоспособности;
© оптимизация разработанной технологии.
Задача выбора оптимального варианта технологической схемы,
в свою очередь, разбивается на две части:
♦ нахождение варианта получения целевых продуктов не-
обходимой чистоты с минимальными энергетическими
и капитальными затратами;
♦ рассмотрение этой схемы с точки зрения надежности и устой-
чивости работы.
Таким образом, разрабатываются, сравниваются и оптими-
зируются различные варианты технологических схем производства
и из них выбирается оптимальный. Причем, как уже отмечалось,
во многих случаях количество возможных технологических схем
значительно сокращается за счет физико-химических, технологи-
ческих и экономических ограничений.
При разработке и проектировании стремятся:
❖ достигнуть минимальных энергетических и капитальных затрат;
❖ получить продукты необходимой степени чистоты;
❖ достигнуть максимального выхода целевых продуктов;
❖ выбрать наиболее устойчивые режимы работы аппаратов;
❖ достигнуть минимального сброса химических продуктов в ок-
ружающую среду.
Решение всех задач одновременно, как правило, невыполнимо,
так как наблюдаются конкурентные ситуации. В связи с этим, не-
обходимо накладывать дополнительные требования на условия оп-
тимизации. Но во всех случаях, как правило, выбирается такое со-
четание задач, чтобы были достигнуты минимальные затраты на
получение продуктов необходимой степени чистоты без загрязне-
ния окружающей среды.
Причем задачу выбора оптимальной технологической схемы
вообще следует считать неосуществимой, если не введены ограни-
чения на систему. При разработке технологических схем имеется
два вида ограничений: ограничения первого вида, обусловленные
законами природы (физико-химические и химические свойства
компонентов и др.), и ограничения второго вида, обусловленные
невозможностью на данном этапе выполнить конкретную задачу
(отсутствие необходимой конструкции аппаратов, отсутствие ин-
гибиторов термополимеризации и т. д.).
Глава 2. Системные закономерности в технологии...
65
Решить задачу выбора оптимальной технологической схемы
можно, рассматривая производство как сложную систему — цело-
стный комплекс взаимосвязанных элементов, обладающих опре-
деленной структурой. Системный подход в данном случае
предусматривает:
♦ определение цели, границ системы, независимых переменных,
ограничений и внешних параметров. С этой целью изучаются
термодинамика и кинетика процессов, физико-химические
свойства как отдельных компонентов (термическая и химиче-
ская стойкость, температура кипения, упругость паров и т.д.),
так и их смесей (растворимость, фазовое равновесие жидкость-
жидкость и жидкость-пар, зависимость температуры кипения
от состава и т. д.) и другие свойства;
♦ разработка технологических схем и предварительный выбор
практически подходящего варианта.
Задача может рационально решаться при рассмотрении всей
технологической схемы (сложной системы) по частям, т. е. при
разделении системы на подсистемы. Причем экспериментальная
проверка работоспособности подсистем (элементов и комплексов)
позволяет, в конечном счете, определять работоспособность произ-
водства с выбранным вариантом технологической схемы. Примене-
ние подобной методологии разработки, анализа и проверки работо-
способности технологических схем производства позволяет
проектировать цеха, предусматривающие меньшие энергетические
и капитальные затраты с получением продуктов необходимой сте-
пени чистоты. Вместе с тем эта методология дает возможность при
разработке технологических схем производства 00 и НХС и их про-
ектировании использовать вычислительную технику, что, с одной
стороны, сокращает время разработки и проектирования, а с дру-
гой — обеспечивает переход к автоматизированному проектированию
химико-технологических комплексов, включающих реакторные
узлы, узлы разделения и другие узлы любой сложности.
МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ
ХИМИКО-ТЕХНОЛОГИЧЕСКИХ ОБЪЕКТОВ
Для исследования, проектирования и особенно оптимизации
производства или химико-технологической системы, а также со-
здания системы управления с помощью ЭВМ необходимо рас-
3 я-б
66 Часть!. Теоретические основы технологии крупнотоннажных ...
полагать моделями. Выбор такой модели обусловлен практическими
соображениями. При этом модель должна быть во всех аспектах
проще исходной системы за исключением тех, которые обеспечи-
вают выполнение выбранного отношения эквивалентности. Выбор
модели во многом предопределяет методику исследования и даже
конечные результаты.
В случае ХТС для этой цели лучше всего использовать аб-
страктные математические модели. При этом, как правило, эле-
ментарную модель следует сводить к статической детерминиро-
ванной линейной.
Модель общего вида, учитывающая влияние времени t на вид
функции f представляет динамическую модель, т. е. значения пере-
менных на выходе модели в момент времени t зависят от значения
переменных на ее входе не только в момент времени t, но и в пред-
шествующие. На основе анализа химических, физико-химических
процессов, происходящих в объекте, и экономических зависимос-
тей может быть введена вектор-функция f. В/будут входить уравне-
ния материального и энергетического балансов, скоростей химиче-
ских и физико-химических процессов и др.
Для математического описания объекта в целом, как правило,
предварительно составляются математические модели отдельных
аппаратов для технологических звеньев. Степень детализации объ-
екта чаще всего определяется наличием реальной возможности ре-
шения получаемых уравнений при математическом моделировании
выбранных звеньев.
Как правило, элементарные звенья описываются дифферен-
циальными уравнениями или характеризуются передаточными
функциями. Общая передаточная функция объекта зависит от ко-
личества звеньев и их передаточных функций, а также от порядка
соединения звеньев между собой.
Математическая модель процесса (математическое опи-
сание) — это связь параметров состояния процесса в виде:
Z(0 =/[У(0, ИШ 2.27
где Z(l) - вектор выходов (управляемых параметров); У(/) - вектор входов
(управляющих воздействий); W(t) - вектор контролируемых возмущений.
В ряде случаев при описании процессов распределения ма-
териальных и энергетических ресурсов параметры состояния объ-
екта удобнее интерпретировать как физические входы и выходы ма-
териальных и энергетических потоков химико-технологической
Глава 2. Системные закономерности в технологии...
67
системы. В этом случае математическую модель называют моделью
материальных или энергетических потоков.
Таким образом, под математической моделью понимают мате-
матическую запись всех условий, накладываемых на любое реше-
ние задачи, т. е. математическая модель представляет собой систе-
му равенств и неравенств, связывающих между собой переменные
(величины, подлежащие определению при решении задачи) и за-
дающих область определения этих переменных.
При рассмотрении общей математической модели производ-
ства удобно подразделять переменные и параметры модели на вну-
тренние, характеризующие функционирование и взаимосвязь от-
дельных установок или блоков, и внешние, определяющие
внешние входы и выходы производственного комплекса или ХТС.
Кроме переменных в систему ограничений входят параметры мо-
дели — величины, известные к началу решения задачи.
В модели ХТС существенную роль играют связи между отдель-
ными производствами, цехами, установками. Описание этих свя-
зей всегда в том или ином виде присутствует в модели
и отражает структуру технологической схемы.
Математическая модель ХТС содержит математические модели
отдельных блоков, математическое описание структуры ХТС и ог-
раничения, задающие области определения переменных модели.
Любой блок представляет установку или комплекс установок
(отделение, цех, производство). Такой блок — простейший, так как
в нем не выявляется какая-либо внутренняя структура. Математи-
чески он описывается в виде системы уравнений типа:
f(Y, Z, W, 0=0, Xo=X(Z = O), 2.28
где Y, Z, W- векторы, некоторые из них зависят от времени t; (У, Z, W, f) -
вектор параметров состояния процесса, множество компонент которого
включает множество компонент векторов У, Zh W,X- состояние процес-
са в начальный момент времени (,;/(У, Z, W, t) - вектор-функция.
Уравнение вида:
dZ/dt =f\Z, Y, 0; Z(0) = Zo 2.29
обычно называют динамическим уравнением состояния про-
цесса.
Чаще всего для описания структуры ХТС используются урав-
нения балансового типа — уравнения материального, энергетичес-
кого балансов и т. п.
68 Часть!. Теоретические основы технологии крупнотоннажных ...
Практически при записи модели ХТС балансовые уравнения
объединяют с математическими моделями отдельных блоков. Раз-
личные способы такого объединения приводят к матричным или
сетевым моделям ХТС.
Матричная математическая модель ХТС связывает между со-
бой векторы выходных Zh входных У переменных с помощью таб-
лицы, элементы которой отображают эту связь.
Матричное соотношение для статической модели ХТС может
быть выражено следующим образом:
Z=AF, 2.30
где А - матрица.
Или в развернутом виде:
Z, = У j = 1,2,...,п. 2.31
i=l
Здесь матричная модель требует аддитивности функций Z (вы-
ходных переменных), а коэффициенты а., могут зависеть от У.
Общая модель ХТС является линейной, и матрица А не зависит
от входных переменных У Так как непосредственное описание ста-
тической линейной модели ХТС в матричной форме неприемлемо,
то целесообразнее пользоваться методами теории матриц, позво-
ляющих описать соединение моделей отдельных элементов, т. е. эле-
ментарных моделей в модель ХТС.
В частности, необходимым и достаточным описанием топо-
логии соединения моделей будет квадратная булева матрица соеди-
нений:
Я=(й..), 2.32
у которой элемент й равен нулю, если выходу не соединен со вхо-
дом /, в противном случае h.. равен единице.
Число строк (столбцов) в матрице соединений равно:
п~П\ + mQ=mx + п0, 2.33
где В] — общее число выходов элементарных моделей; т, - число выхо-
дов ХТС; п0 - общее число входов элементарных моделей; mQ — число
входов ХТС.
Степень свободы элементарной модели составляет f=m+n0—rQ,
где г0-ранг матрицы А. Поэтому из т0+п0 только /переменных
являются свободными, остальные же т,+ nt—f переменных опре-
деляются их значением.
Глава 2. Системные закономерности в технологии ...
69
Матрица соединений Н является квадратной, так как каждый
выход элементарной модели (или вход ХТС) соединен только с од-
ним входом (выходом) некоторой элементарной модели.
Коэффициенты а непрерывной элементарной модели могут
быть переменными. В этом случае они становятся неизвестными
и определяются с помощью специальных методов, например линей-
ного программирования. Кроме моделей отдельных блоков и мате-
матического описания структуры ХТС область допустимых значений
переменных (допустимая область) задается дополнительными огра-
ничениями. Все ограничения могут быть разделены на внешние
и внутренние. Как правило, физические ограничения связаны с па-
раметрами технологических процессов. Эти ограничения носят вну-
тренний характер. К внешним ограничениям можно отнести, напри-
мер, качество продукта, производительность установки и др.
Таким образом, можно говорить о математической модели ап-
парата или технологического процесса, производства, предприятия
и отрасли. Эти модели различаются полнотой учета и глубиной опи-
сания различных процессов в объекте, а также размерностями век-
торов х, и, a, f Обычно с увеличением размеров рассматриваемого
объекта размерность этих векторов возрастает, задача построения
даже статической модели ХТС оказывается очень громоздкой,
и приходится упрощать структуру самой математической модели.
Математические модели описывают разные режимы работы объ-
екта, что позволяет делить их на модели динамики и статики.
Математические модели динамики описывают переход-
ные, неустановившиеся режимы функционирования объекта.
Структура и вид уравнений таких моделей зависят от свойств объ-
екта. Выбор модели определяется объемом исходной информации
о создаваемой ХТС и желаемой детализации ее исследования. Кро-
ме того, модели зависят от режима работы ХТС, и можно выделить
следующие их виды:
1. Стационарная математическая модель динамики объекта
с сосредоточенными координатами х, и и не изменными во време-
ни t свойствами:
F[dx/dt, x(f), и(/), а] =0. 2.34
Такую модель чаще всего записывают как систему диффе-
ренциальных уравнений в нормальной форме:
dx/dt =f\x(i), u(f), а].
2.35
70 Часть 1. Теоретические основы технолотии крупнотоннажных ...
2. Если координаты х. и распределены по пространственной пе-
ременной / (длина, радиус, высота), то рассматривается стацио-
нарная математическая модель динамики объекта с распре-
деленными координатами:
F[Эх/Э/, Эх/Э/, x(t, I), u(t, I), а(/)] = 0. 2.36
Здесь параметр а может быть функцией /.
3. Нестационарная математическая модель динамики объекта с
сосредоточенными координатами представляет систему уравнений:
dx/dt =f[x(t), u(t), a(t), Г]. 2.37
4. Нестационарные математические модели динамики объек-
тов с распределенными координатами, которые описываются чаще
всего уравнениями первого порядка с частными производными:
F [Эх/Э Г, Эх/Э/, и(/, /), х(/, Г), a(t, Г), /]. 2.38
5. Установившиеся (статические) режимы объекта с сосре-
доточенными координатами, которые описываются стационарной
математической моделью статики:
F(x,u,a)=0 2.39
и часто могут быть разрешены относительно х:
x=f(u,a). 2.40
6. Установившиеся режимы объектов с сосредоточенными ко-
ординатами и медленно изменяющимися во времени характе-
ристиками иногда описываются нестационарными математиче-
скими моделями статики:
F[x(r), и, а(/)] = 0. 2.41
Подобные режимы могут описываться уравнениями типа:
dx/dt =f{ [х(0, и, а(/)], 2.42
da/dt =J^[x(/), а(/)], 2.43
где - функции, учитывающие причины нестационарного поведения
объекта; t - продолжительность работы объекта; а — некоторый параметр
или фактор (активная поверхность катализатора, коэффициент теплопе-
редачи и др.); и -воздействующий параметр.
Глава 2. Системные закономерности в технологии...
71
7. Если dx/dt мала по абсолютной величине, то уравнения 2.42
и 2.43 преобразуются в квазистатическую модель:
/][х(0, и, а(0] “ 0, 2.44
da/dt=f2[x(f), о(/)].
8. Стационарные модели статики объектов с координатами,
распределенными по пространственной переменной I, имеют вид:
F[dx/dl,x(J), и(1), а([)] =0. 2.45
Объекты такого класса с изменяющимися во времени харак-
теристиками могут быть описаны нестационарными математи-
ческими моделями:
F[ Эх/Э/, x(t, Г), u(l), a(t, Г) ] = 0 2.46
и квазистатическими математическими моделями:
/j [Эх/Э/, х (t, [), и(Г), a(t, Г)] = 0, 2.47
da/dt =f2[ x(t, I), u([), a(t, /)]. 2.48
По структуре функции f математические модели, в свою оче-
редь, делятся на линейные и нелинейные.
Как уже отмечалось, всегда стремятся к созданию линейной мо-
дели, что может быть достигнуто за счет линеаризации. Так, линеа-
ризация элементарной модели означает применение полиномиаль-
ного разложения модели по степеням составляющих и сохранение
в полученном ряду только нулевых и первых степеней.
В ряде случаев искомое решение должно отвечать нескольким
требованиям, т. е. различным критериям.
При решении таких задач требуется нахождение разумного ком-
промисса между этими критериями. К числу многокритериальных
задач можно отнести случаи, когда:
<$> эффективность действия нескольких взаимосвязанных аппара-
тов оценивается по отдельным критериям для каждого из них;
❖ работа одного аппарата оценивается при различных внешних
условиях (например, при различных составах сырья и разных
критериях работы аппарата для каждого состава);
Ф решение оценивается по различным критериям.
72 Часть 1. Теоретические основы технологии крупнотоннажных ...
ОПТИМИЗАЦИЯ ПРОИЗВОДСТВА
Современное производство основного органического и нефте-
химического синтеза состоит из большого числа разнотипных ап-
паратов, связанных между собой в единую технологическую систе-
му. Характер этих связей различен: продукты и полупродукты,
получаемые в одних аппаратах, передаются в другие; тепло, выде-
ляемое в результате различных реакций в одних аппаратах,
утилизируется в других и т. д.
При разработке технологии того или иного производства не-
обходимо не только выбрать наиболее эффективный режим работы
каждого аппарата, но и установить между элементами системы связи,
обеспечивающие оптимальную работу всего производства в целом.
Создание производства связано с большими трудностями, при-
чиной которых является высокая размерность исходной задачи.
Поэтому целесообразно общую задачу разбить на ряд подзадач.
Декомпозиция химико-технологических систем
При создании производства мы имеем дело со сложными иерар-
хическими системами, состоящими из комплекса взаимосвязанных
подсистем разного рода. Это отдельные аппараты или комплексы не-
скольких аппаратов. Следовательно, исследование и проектирова-
ние такого производства требует предварительного изучения «пове-
дения» как всей системы, так и ее элементов. При этом решаются
задачи синтеза и анализа технологических схем производства, а так-
же оптимизации отдельной установки или всего производства. Для
решения этих задач широкое применение получил метод декомпо-
зиции сложной системы, в результате которого проводится расчле-
нение большой исходной задачи на более простые.
Для этой цели чаще всего используются методы, лежащие в ос-
нове теории сложных систем. В частности, применяя метод деком-
позиции для синтеза и анализа ХТС, математическое описание за-
ключается в получении уравнений состояния всей системы на основе
уравнений состояния отдельных ее частей. Поэтому если разраба-
тывается производство, представляющее сложную физико-химиче-
скую и технологическую систему, то для разработки, проектирова-
ния и создания системы его часто разбивают на отдельные
подсистемы.
Подразделение подсистем по типам осуществляется в соот-
ветствии с различными уровнями рассмотрения процесса, т. е. имеет
Глава 2. Системные закономерности в технолотии ...
73
место многослойная иерархия. Кроме того, отдельные аппараты,
комплексы аппаратов, цехи или отделения, заводы и, наконец, ком-
бинаты представляют иерархию различных систем, в которых завод
является более простой системой в системе комбината, цех —
в системе завода и т. д. В этом случае имеет место многоэтапная ор-
ганизационная иерархия. Такое же расчленение необходимо и при
проверке работоспособности выбранной технологии производства.
В связи с этим, на первом этапе часто ведется разработка и оп-
тимизация отдельных аппаратов или подсистем, а затем разработка
технологической схемы и оптимизация всей технологии производ-
ства, объединяющей аппараты между собой. При этом необходимо
иметь в виду, что при независимой оптимизации критерии оптималь-
ности отдельных аппаратов или подсистем могут противоречить друг
другу и формальное соединение оптимальных подсистем не приво-
дит еще к оптимизации системы. Поэтому технологию всего произ-
водства (системы) создают таким образом, чтобы общий критерий
достигал оптимального значения.
Оптимизация химико-технологических систем
Под оптимизацией в данном случае понимают деятельность
научных, проектных и производственных коллективов, на-
правленную на создание производства, дающего наилучшие резуль-
таты в принятых условиях. Решение этой задачи начинается с вы-
явления цели оптимизации.
При наличии конкурирующих свойств системы (количество
продукции - качество продукции, количество продукции - расход
сырья и др.) за основу оптимизации можно взять только одну ве-
личину.
Оптимизация технологических процессов особенно необходима
при разработке производств основного органического и нефтехими-
ческого синтеза, так как для этой отрасли характерна многомарш-
рутность процесса. Следовательно, из многих вариантов необходи-
мо выбирать наилучший. Решение такой задачи возможно, так как
среди параметров всей системы существуют переменные, которые
в определенных пределах могут быть заданы произвольно. При этом
каждый набор независимых параметров определяет вариант процес-
са, и процесс технологически осуществим при любом их допусти-
мом значении.
Для решения некоторой оптимальной задачи (синтез ХТС,
проектирование ХТС, определение оптимального режима аппарата,
74 Часть 1. Теоретические основы технологии крупнотоннажных ...
создание математической модели объекта по экспериментально по-
лученным характеристикам и т. д.) требуется ее формализация.
Чтобы приступить к оптимизации, необходимо решить четыре
основные задачи:
1. Выбрать критерий эффективности производства. Эффек-
тивность оценивается количественными показателями или кри-
териями эффективности. При всем многообразии частных ха-
рактеристик, определяющих эффективность, эти характеристики
могут быть сгруппированы по:
Е производительности;
Е надежности;
Е стоимости;
В капитальным затратам;
Е энергетическим затратам.
Следовательно, в качестве критерия эффективности можно вы-
брать максимальную скорость превращения исходного сырья, ми-
нимальную стоимость целевых продуктов или какую-либо комби-
нацию переменных. Чаще всего этот критерий называют целевой
функцией или функцией отклика.
2. Определить переменные, значения которых в процессе оп-
тимизации можно изменять независимо. Такие переменные назы-
ваются варьируемыми (например, температура, с которой подают-
ся исходные продукты в реактор или хладагенты в теплообменник).
3. Определить влияние ограничений на технологические пе-
ременные или на некоторую их функцию. Так, температура в реак-
торе может быть ограничена верхним и нижним пределами, так как
при низких температурах будет мала скорость реакции, а при вы-
соких интенсивно идут побочные реакции.
4. Выбрать метод оптимизации. Количественной мерой, по-
зволяющей сравнивать все технологически осуществимые процессы
и определять оптимальный вариант работы объекта, является кри-
терий оптимизации, на основе которого выявляется целевая
функция.
К целевой функции предъявляются следующие требования: она
должна быть численной и однозначной, а также универсальной, учи-
тывающей адекватно как все затраты (стоимость) производства, так
и все доходы (прибыль) при функционировании производства.
Если целевая функция выбрана правильно, то ее максимальное
или минимальное значение будет критерием оптимальности пред-
ложенного варианта технологии.
Глава 2. Системные закономерности в технолотии ...
75
Наиболее распространенным критерием оптимизации про-
изводства выступает прибыль, которая может быть определена по
формуле:
= 2.49
/
где Р - прибыль; у. - производительность производства по целевым про-
дуктам; q — цена продукта I; S — затраты производства.
Целью оптимизации в данном случае является максимизация
целевой функции, т. е. прибыли Р.
В качестве критерия может быть выбрана себестоимость про-
дукции:
С= S/y.. 2.50
Такой критерий наиболее удобен, если выпускается один глав-
ный целевой продукт уг При этом стоимость побочных продуктов
производства qpyp вычитается из затрат 5:
151
Тогда целью оптимизации будет достижение минимума себес-
тоимости С при заданной производительности.
Возможен выбор и других критериев оптимизации производства.
Критерии оптимизации выбираются для всего производства,
т. е. для всей системы. Однако чаще всего приходится сталкиваться
с оптимизацией части технологического процесса (аппарат, ком-
плекс аппаратов, цех или завод, входящий в комбинат). Следова-
тельно, решаются частные задачи оптимизации.
В частных задачах оптимизации, когда требуется получить экс-
тремальное значение какого-либо параметра работы отдельного
аппарата, речь идет о некоторых экстремальных свойствах самого
объекта оптимизации, которые обусловлены химическими или
физико-химическими свойствами проходящего в данном объекте
процесса.
Следовательно, в таких случаях критерием оптимальности слу-
жат технологические характеристики, косвенно оценивающие эко-
номичность работы агрегата (время пребывания реакционной сме-
си, выход продукта, конечная концентрация, температура и т. д.).
Примерами таких задач являются, например, выбор опти-
мального времени пребывания компонентов реакционной смеси,
оптимального температурного профиля в реакторе вытеснения, вы-
бор флегмового числа при заданной чистоте дистиллята и др.
76 Часть!. Теоретические основы технологии крупнотоннажных ...
Таким образом, сама постановка задачи оптимизации пред-
полагает наличие:
♦ объекта и выявление цели оптимизации. При этом устанав-
ливается экстремальное значение только одной величины;
♦ возможности выбора значений некоторых параметров опти-
мизируемого объекта. При этом объект должен обладать опре-
деленными степенями свободы, т. е. при воздействии внешних
факторов на систему можно изменять ее первоначальное со-
стояние в соответствии с заданными требованиями;
♦ количественной оценки оптимизируемой величины, позволя-
ющей выявлять влияние управляющих воздействий.
При решении конкретных задач оптимизации ее критерий дол-
жен быть выражен в аналитическом виде. Это особенно необходи-
мо в случае применения вычислительной техники.
В общем случае критерий оптимальности является функцией
входных, выходных параметров и управляющих воздействий:
Ф=Ф(х1,х2,...,хл,у1,у2,..., и2,...,и). 2.52
Для описания совокупности входных, выходных и управляющих
параметров часто применяют векторную форму записи:
X=(Xl,x2,... ,х),
7=^,^,...,^),
U=(ul,u2,...,un).
Тогда функция принимает вид:
Ф=Ф(Х,Г,Ц). 2.53
Задачи статической оптимизации решаются для процес-
сов, протекающих в установившихся режимах, а задачи динами-
ческой оптимизации решаются для процессов, протекающих
при неустановившихся режимах. В последнем случае требуется изу-
чение динамики процесса (например, периодического перевода
объекта с одного режима работы на другой или осуществления пе-
риодического процесса).
Для оптимизации сложных систем, каковыми являются произ-
водства, часто применяют декомпозиционный метод, который сво-
дит решение общей задачи к последовательному решению задач оп-
тимизации отдельных блоков системы по соответствующим
критериям.
Глава 2. Системные закономерности в технологии ...
77
При декомпозиционной оптимизации сложных химико-тех-
нологических систем, соответствующих разным частям произ-
водств, необходимо:
© разбить систему на составные части - подсистемы;
® выбрать метод, с помощью которого глобальная задача опти-
мизации системы сводится к последовательности ее локальных
задач для отдельных подсистем;
© определить показатель сходимости предложенной, в том чис-
ле итерационной процедуры;
® показать, что полученное решение соответствует истинному
Предположим, что ХТС разбита на подсистемы (блоки), каж-
дая из которых описывается уравнениями типа 2.34—2.48. Для оп-
тимизации ХТС может быть выбран, например, двухуровневый де-
композиционный метод. Первому уровню будет соответствовать
алгоритм локальной оптимизации отдельных блоков ХТС, а второ-
му уровню — алгоритм коррекции локальных задач оптимизации.
При решении задачи оптимизации необходимо прежде всего учесть
взаимное влияние блоков ХТС при проведении оптимизации от-
дельных частей или подсистем на первом уровне. Для этого можно
использовать алгоритм, который сводит задачи условной миними-
зации к последовательности задач безусловной минимизации.
В общем виде задача оптимизации ХТС решается следующим
образом:
♦ выявляется математическая модель каждого из аппаратов, вы-
раженная уравнениями типа 2.22—2.23;
♦ определяется структура схемы, которая может быть задана си-
стемой соотношений связи вида 2.24;
♦ выявляется критерий оптимизации, который может быть за-
писан в виде:
2.54
к=\ ' '
г де Ф(*’ - часть критерия, связанная с ^-блоком, принимает
минимальное значение;
♦ накладываются ограничения на переменные в виде уравнений
типа 2.25 или 2.26.
При подобной постановке задачи оптимизации задаются ниж-
ние и верхние пределы изменения управляющих воздействий и вы-
ходных координат соответственно.
78 Часть 1. Теоретические основы технологии крупнотоннажных ...
Таким образом, задача оптимизации формулируется следующим
образом: требуется найти уравнения (координаты) ик (i= 1, 2,... , г);
(к = 1, 2,..., N), удовлетворяющие ограничениям, при которых фазо-
вые переменные (координаты) удовлетворяют уравнениям типа 2.22,
2.23, а также соотношениям связи вида 2.24, при которых критерий Ф
(2.54) принимает экстремальное значение.
Следовательно, общая схема такого подхода базируется на сле-
дующих основных положениях:
О соотношения 2.24 преставляют ограничения типа равенства;
© в каждом блоке варьируемыми являются не только уравнения,
но и входные переменные; выходные переменные полагаются
свободными и подсчитываются с помощью уравнений 2.21, 2.23;
© применяя один из способов сведения задач на условный экс-
тремум к задачам на безусловный экстремум, соотношения свя-
зи 2.24 вносят в критерии.
При оптимизации химико-технологических процессов или объ-
ектов в математические модели входят параметры, определяемые
с разной степенью точности. Кроме того, при реализации процес-
са возможны непредсказуемые изменения некоторых параметров.
Следовательно, для окончательного решения задачи необходимо
знать влияние такого рода факторов на выбор оптимального вари-
анта. Это возможно сделать при анализе чувствительности целевой
функции по отношению к отклонению параметров от оптималь-
ного режима. При этом необходим определенный компромисс меж-
ду оптимальностью и чувствительностью.
Действительно, пусть Ф(и,Р) — критерий оптимизации; и*—
точка минимума функции Ф(и, Р), где Р — некоторые средние зна-
чения параметров Р.
Если точка и * лежит в области высокой параметрической чув-
ствительности, то неизбежные неточности в параметрах Р могут
существенно снизить эффект оптимального режима. Если же вести
его поиск с учетом параметрической чувствительности, то получим
точку и**, в которой критерий Ф (и, Р) будет принимать худшее зна-
чение. Однако этот режим окажется менее подверженным влиянию
изменения параметров Р и и, и в результате может стать более вы-
годным, чем первый режим.
Задача оптимизации с учетом чувствительности практически
является задачей векторной оптимизации с двумя критериями и ре-
шается одним из следующих способов:
Глава 2. Системные закономерности в технолоеии ...
79
© формированием обобщенного критерия;
® введением ограничения на чувствительность;
® последовательной минимизацией критериев.
Отметим, что выбор оптимальной технологии производства
продуктов основного органического и нефтехимического синтеза
прежде всего зависит от теоретических основ и технологических
принципов организации важнейших подсистем, реакторных узлов
и узлов разделения. На этом этапе выбираются лучшие способы как
синтеза целевых продуктов, так и их выделения из реакционной
смеси. В последующих главах эти подсистемы будут рассмотрены
более детально.
НАДЕЖНОСТЬ РАБОТЫ ОТДЕЛЬНЫХ АППАРАТОВ
И ХИМИКО-ТЕХНОЛОГИЧЕСКИХ СИСТЕМ
В технологических линиях непрерывного производства наруше-
ние в работе одного из аппаратов, по крайней мере, ухудшает его
технические характеристики (производительность, качество про-
дукции и т. д.), а чаще приводит к нарушению работы всего произ-
водства.
Следовательно, применение в непрерывных производствах ап-
паратов большой единичной мощности является экономически и
социально целесообразным, если обеспечены их надежные и безо-
пасные для персонала и окружающей среды условия эксплуатации.
Под надежностью работы любой установки или производства
подразумевается свойство сохранять свои параметры в заданных
пределах в определенных условиях эксплуатации в течение длитель-
ного времени.
Надежность — неотъемлемый показатель как любого тех-
нологического узла, так и всего производства. Как правило, надеж-
ные установки являются и более безопасными. Однако одна надеж-
ность еще не означает технического совершенства производства или
отдельного его узла. Последние могут быть весьма надежными, но
иметь устаревшую технологию с низкими показателями. Анализ ра-
боты многочисленных аппаратов и технологических установок по-
казал, что чем они проще, тем более надежны.
С другой стороны, если установка не обладает необходимой на-
дежностью, то все технологические преимущества теряют смысл,
так как они не могут быть полностью реализованы. Следовательно,
80 Часть!. Теоретические основы технологии крупнотоннажных ...
даже для технологически совершенного производства необходимо
всегда оценивать его надежность.
Надежность технологического процесса определяется как фак-
тор, обеспечивающий получение заданной продукции в безопас-
ных условиях и в полном соответствии с требованиями к ней.
Надежность технологического процесса характеризуется часто-
той его нарушений, которые подразделяются на нарушения:
ф оказывающие сильное влияние на качество продукции;
❖ не оказывающие сильного влияния на качество продукции;
❖ выявленные в ходе технологического процесса;
❖ не выявленные в ходе технологического процесса.
При этом надежность технологического процесса и его составных
частей характеризуется общим (О) и относительным (г = О/п) чис-
лом отказов. Здесь п — число параметров, претерпевающих измене-
ния в ходе технологического процесса.
Элементная надежность любого аппарата или технологической
линии в целом оценивается как произведение вероятности безот-
казной работы Р\t) на коэффициент готовности К'.
P0(t)=P'(t)K. 2.55
Поскольку надежность должна учитывать влияние внезапных,
параметрических и эксплуатационных отказов, то она может быть
представлена в виде произведения отдельных вероятностей событий:
P(t) = Pn(t)/P(t) P(t) , 2.56
где P(t) — надежность системы; PQ(t) — элементная надежность (ве-
роятность безотказной работы любого аппарата или отсутствие вне-
запных отказов); P(t) —параметрическая надежность (вероятность
безотказного функционирования или отсутствие параметрических
отказов); Р(1)экспл — эксплуатационная надежность (вероятность на-
дежной эксплуатации или отсутствие эксплуатационных отказов).
Если надежность выступает в качестве одной из мер эффек-
тивности производства или установки, то оптимальным ее значением
является такое, при котором стоимость эксплуатации является ми-
нимальной. Оптимальное значение показателя надежности может
быть оценено графически (рис. 2.7).
В некоторых случаях решается задача достижения макси-
мальной надежности при фиксированных затратах или других за-
крепленных условиях.
Глава 2. Системные закономерности в техноаотии ...
81
Рис. 2.7. Зависимость затрат
от надежности:
5э - эксплуатационные затраты;
5р — затраты на разработку
Так как надежность значительно сказывается на эффективности
работы установок или всего производства, то уже на стадии проек-
тирования необходимо рассчитывать и учитывать в проекте надеж-
ность работы с учетом оптимальных режимов эксплуатации в раз-
личных условиях.
Расчет надежности и эффективности производства при про-
ектировании дает возможность заранее выявить наиболее надежное
оборудование, разработать мероприятия по обеспечению требуемой
надежности, выбрать оптимальный (с точки зрения надежности)
вариант технологической схемы и оборудования.
Таким образом, мероприятия по обеспечению надежности лю-
бых установок должны закладываться прежде всего на стадии про-
ектирования, затем обеспечиваться при изготовлении оборудова-
ния и его монтаже, а также при эксплуатации.
Для определения надежности существуют как теоретические
методы расчета, так и рабочие методики. Именно на основе таких
расчетов вырабатываются практические мероприятия по повыше-
нию надежности работы как отдельных элементов технологических
установок, так и их работы в целом.
На раннем этапе проектирования необходимо применять та-
кую методику оценки и расчета ожидаемой надежности, которая
позволит работать с минимумом исходных данных, даст достовер-
ные результаты, позволит рассмотреть и сравнить нужное, но огра-
ниченное число вариантов технологических схем производства.
Среди математических методов встречаются методы расчета на-
дежности отдельных аппаратов и машин, целых установок и, нако-
нец, технологических процессов или производства.
На начальной стадии проектирования чаще всего используются
рабочие методики, основанные на простых моделях, или элемен-
тарные методики расчета надежности, исходящие из предположе-
ния о самостоятельности отдельных элементов. Отказом элемента
при такой методике считается всякое показание его параметров, вы-
82 Часть 1. Теоретические основы технологии крупнотоннажных ...
ходящее за пределы заданных технологических или других условий.
Однако предварительно необходимо выяснить допустимость при-
меняемых ограничений и оценить достоверность получаемых ре-
зультатов.
Как уже отмечалось, в теоретических методах расчета надеж-
ности наиболее широкое распространение получили методики рас-
чета по элементам. При этом функциональные зависимости и па-
раметры, характеризующие надежность работы отдельного
элемента, например одного аппарата, могут быть выражены следу-
ющими формулами:
для частоты отказов:
/(/) = dq{f)ldt = -dP{f)/dt- 2.57
для интенсивности отказов:
МО = [1/Р(0] [dq(f)/dt\ = -[ 1/Р(0] \dP(t)/dt\’, 2.58
для среднего времени безотказной работы:
2.59
о
где Р- вероятность безотказной работы элемента (подсистемы), системы:
q - вероятность отказа элемента (подсистемы), системы.
Эти формулы применимы к системам с любым числом эле-
ментов и произвольным их отношением.
Если известно аналитическое выражение для вероятности безот-
казной работы (вероятности отказа) Q некоторой системы, опреде-
ленное через вероятности безотказной работы составляющих ее эле-
ментов qP то справедливы следующие уравнения:
для частоты отказов:
Fit^dQ/dq^^dP/dP^, 2.60
i=i /=1
где Pt — вероятность безотказной работы элемента;
для интенсивности отказов:
2.61
р
для среднего времени безотказной работы:
r,=pF(<)* = 2.62
Эти выражения справедливы, если все элементы системы тож-
дественны по надежности, т. е. Р = 0.
Глава 2. Системные закономерности в технологии ...
83
Расчеты надежности сложных технологических систем с ис-
пользованием хорошей математической модели на стадии про-
ектирования позволяют сопоставить количественные показатели
надежности системы, полученные расчетным путем, с заданны-
ми и своевременно внести соответствующие коррективы, позво-
ляющие увеличить надежность. При этом необходимо иметь
в виду, что только системный подход при рассмотрении всех ха-
рактеристик, в том числе и надежности, позволит найти целесо-
образные решения, так как многие из них зачастую являются про-
тиворечивыми. Например, имеется противоречие между обеспе-
чением высокой надежности и снижением затрат на изготовле-
ние и функционирование системы. Системный подход и здесь
позволяет найти правильную взаимосвязь различных характери-
стик как отдельных элементов, так и всего технологического ком-
плекса. Одним из самых важных вопросов, ответ на который мо-
жет быть получен только при системном рассмотрении техноло-
гического комплекса с применением математических методов уже
на этапе проектирования, является определение требований по
надежности как отдельных аппаратов, так и всей технологической
установки. Тем более что оценка эффективности системы в це-
лом обязательно включает учет надежности как отдельных состав-
ных частей, так и всей системы.
Вероятность безотказной работы или отказа системы является
функцией вероятностей безотказной работы или отказа входящих
в систему элементов, например:
Q=f2[Q^’
Взаимосвязь функций для отдельных элементов может быть раз-
ной. В частности, вероятность безотказной работы или функция
надежности системы, состоящей из п произвольно соединенных
элементов, может быть выражена в виде полинома:
Р = £а(.Р(,). 2.63
i=i
В случае независимого влияния отдельных элементов (ап-
паратов, машин и т.д.) на работоспособность установки схема
структурных надежных отношений представляется в виде по-
следовательного соединения элементов. Если же элементы влияют
84 Часть 1. Теоретические основы технологии крупнотоннажных ...
друг на друга, то схема структурных надежных отношений будет
параллельной или смешанной.
Графическая схема структурных надежных отношений имеет
вид последовательного соединения, если отказ каждого из элемен-
тов приводит к отказу всей системы. В этом случае вероятность без-
отказной работы системы определяется произведением вероятнос-
тей безотказной работы элементов:
русп (0- П Р°„, (0=К (ОТ 2.64
/=1
Если отказ элемента не приводит к отказу системы, то в схеме
структурных надежных отношений этот элемент включается парал-
лельно, а при вычислении надежности системы перемножаются ве-
роятности отказов параллельных элементов и полученное произ-
ведение вычитается из единицы:
(')]" 2-«
При некоторых допущениях в расчетах требуемые надежности
отдельных видов оборудования системы для последовательного
и параллельного соединений могут быть выражены, соответствен-
но, следующим образом:
?,w=O 166
2-67
Для расчета норм надежности исходными данными являются:
технологическая схема установки, требуемый показатель надежно-
сти установки, схема структурных надежностных отношений, ко-
личество элементов установки (аппаратов, машин и т.д.), требуе-
мое время ее непрерывной работы.
Надежность работы элементов не всегда удобно характери-
зовать вероятностью безотказной работы, так как для малых пе-
риодов времени работы элементов значения Р (/) будут близ-
кими к единице. В этом случае лучше использовать интен-
сивность отказов, которая характеризует плотность вероятности
появления отказа отдельно взятого элемента. Она определяется
количеством отказов njgmK в единицу времени А/ , отнесенных
к количеству исправно работающих в данный момент однотип-
ных элементов N , т. е.
эд’
Глава 2. Системные закономерности в технологии...
85
Х = п. / (N Д0 . 2.68
ютк' v эл '
Вероятность безотказной работы связана с интенсивностью от-
казов следующим соотношением:
Р(/) = ехр -.
о
2.69
Статистическое определение функции А(0 для отдельных эле-
ментов и системы в целом характеризуется кривой, представленной
на рис. 2.8.
Рис. 2.8. Изменение интен-
сивности отказов системы
в течение срока службы
Первый участок повышенной интенсивности отказов харак-
теризует период, отказы в котором возникают главным образом в
результате скрытых неисправностей, допущенных при проекти-
ровании, нарушении технологии изготовления системы или свя-
занных с трудностями освоения производства. Наиболее длитель-
ное время система эксплуатируется в нормальных условиях (учас-
ток II). Именно этот период работы системы принимается во вни-
мание при расчете надежности в процессе проектирования.
Участок III характеризует период увеличения интенсивности от-
казов вследствие износа оборудования и его старения.
Таким образом, для нормального периода эксплуатации ха-
рактерен экспоненциальный закон интенсивности появления от-
казов и при ориентировочном расчете надежности системы можно
принять, что надежность каждого элемента выражается следующим
образом:
(0 = ехР(-А0- 2.70
Поскольку производства 00 и НХС чрезвычайно сложны, то
представляется целесообразным оценивать параметрическую надеж-
ность при проектировании установок методом статистических ис-
пытаний. Этот метод позволяет решать задачи практически любой
сложности, так как в этом случае не требуется знать законы распре-
86 Часть 1. Теоретические основы технологии крупнотоннажных ...
деления определяющих параметров системы. Необходимо знать толь-
ко статистические характеристики изменений параметров элемен-
тов в процессе эксплуатации и учитывать все характеристики обору-
дования и процессов, влияющих на надежность работы установки.
На старение оборудования и увеличение числа отказов большое
влияние оказывают агрессивность среды, рабочие температуры, ка-
чество материала и изготовления аппаратуры и другие факторы. При
обработке статистических данных можно определить поправочный
коэффициент и ввести его в формулу интенсивности отказов:
К =К,К К К К К К , 2.71
У,р t к р м хк п н ’
где Кур~ поправочный коэффициент, учитывающий условия работы; Kt —
температурный коэффициент; Кк — коэффициент, учитывающий качест-
во материала и изготовления аппарата; Кр - коэффициент, учитывающий
точность расчета оборудования; К - коэффициент, учитывающий ослаб-
ление конструкции вследствие появления местных напряжений; К к — ко-
эффициент, учитывающий коррозионное влияние среды; Кп — коэффици-
ент, зависящий от прочности материала; Кн - коэффициент неучтенных
факторов.
Как было показано ранее, экономическая эффективность ме-
роприятий по повышению надежности работы установки тесно
связана с качеством продукции. Чтобы учесть изменения качест-
ва продукции при определении оптимального уровня надежности,
применяют такие экономические показатели, как прибыль, рен-
табельность и др. Кривые зависимости стоимости от надежности
изображены на рис. 2.9. Определение оптимального значения на-
дежности осуществляется нахождением максимума критерия эф-
фективности Э .
т опт
Рис. 2.9. Зависимость составляющих стоимости от надежности:
С — показатель стоимости реализации; 9 — критерий эффективности объекта
в процессе эксплуатации с учетом приведенных затрат
Глава 2. Системные закономерности в технологии ...
87
Таким образом, с точки зрения надежности работу системы
и ее элементов можно разбить на три этапа:
♦ первый этап - период пуска установки, цеха или производства.
В этот период надежность не очень высокая, главным образом,
из-за ошибок, допущенных при проектировании и монтаже ус-
тановок, недостаточно высокого качества поставляемого обо-
рудования (прежде всего механического); ошибок в техно-
логических параметрах ведения процесса и просчетов,
допускаемых обслуживающим персоналом, недостаточных экс-
плуатационных качеств внешних систем (энергообеспечения,
сырьевого обеспечения и т.д.);
♦ второй этап - период нормальной работы. В этот период на-
дежность является самой высокой. При этом количество не-
поладок и отказов является практически постоянной или
уменьшающейся величиной;
♦ третий период — период износа. В этот период надежность рез-
ко уменьшается, так как количество отказов и неполадок рез-
ко увеличивается из-за старения аппаратов, машин и вспомо-
гательных коммуникаций. При этом замена устаревших
элементов не повышает значительно надежность, так как по-
являются трудности первого этапа.
Поэтому очень важно знать, по крайней мере с определенной
точностью, продолжительность этих периодов (особенно конец пер-
вого и начало второго), чтобы провести профилактический ремонт
отдельных элементов. Это необходимо знать и для проведения ка-
питального ремонта всего оборудования.
Наиболее типичные технологические причины отказов обо-
рудования следующие: дефекты конструкционных материалов, кор-
розия, механические поломки, загрязнения и др.
Следовательно, учитывая многотоннажность производств ос-
новного органического и нефтехимического синтеза, использую-
щих установки большой единичной мощности, каждая остановка
производства приводит к значительным и невосполнимым поте-
рям целевого продукта, а следовательно, к ухудшению технико-
экономических показателей производства.
Кроме того, частые непредвиденные остановки предприятия или
отдельных узлов могут приводить к загрязнению окружающей среды.
В связи с этим, на всех стадиях создания, пуска и эксплуатации
производства должны обеспечиваться:
88 Часть 1. Теоретические основы технологии крупнотоннажных ...
О повышенный контроль за высококачественным изготовлени-
ем и монтажом оборудования вообще и в особенности обору-
дования, устанавливаемого без резерва;
© исключение простоев из-за неправильного ведения процесса
и его контроля обслуживающим персоналом. Здесь желатель-
но применение для контроля ЭВМ, что возможно, однако, при
нормально протекающем, отлаженном процессе;
© привлечение к пуску производства наиболее высококвалифи-
цированных специалистов с целью быстрого и безболезненно-
го отлаживания процесса.
ОЦЕНКА РАБОТОСПОСОБНОСТИ СИСТЕМЫ
Показатели, характеризующие работу отдельных элементов или
комплексов и всего технологического объекта, могут быть оп-
ределены:
Ф путем обработки данных натурного эксперимента;
ф методом моделирования функционирования сложных систем
на компьютере;
Ф сочетанием этих методов.
При разработке технологии производства продуктов основного
органического и нефтехимического синтеза и его проектировании,
в принципе, могут использоваться все эти способы.
В настоящее время проверку работоспособности отдельных уз-
лов производства или его отдельных элементов и комплексов при-
нято проводить экспериментально, по крайней мере, в лаборатор-
ных условиях.
Экспериментальная проверка работоспособности предложен-
ной технологии практически целесообразна при следующих ус-
ловиях:
О система допускает такое изменение режимов функционирова-
ния, которое обеспечивает решение поставленных перед экс-
периментатором задач;
© имеется возможность фиксации всей необходимой информа-
ции без чрезмерно больших затрат на датчики и накопители
информации;
© фиксация и статистическая обработка информации в реальном
времени позволяет в практически приемлемые сроки накопить
данные для решения задач исследования;
Глава 2. Системные закономерности в технологии...
89
О изменение режимов функционирования оборудования, свя-
занное с проведением экспериментов, не приводит к значи-
тельным потерям, авариям и другим нежелательным послед-
ствиям.
Учитывая все эти факторы, желательно всю информацию для
дальнейшего использования вычислительных систем получить
экспериментальным путем, главным образом, на лабораторных
установках, требующих минимальных затрат времени и средств.
Таким образом, необходимые параметры для отдельных ап-
паратов или их комплексов можно получить, сочетая эксперимент
с математическим моделированием. В связи с этим важно точно оп-
ределить, на какие подсистемы делится рассматриваемая техноло-
гическая схема, представляющая сложную систему.
Глава 3. Технологическое оформление
РЕАКТОРНЫХ ПОДСИСТЕМ
® Классификация химических реакций.
® Классификация процессов.
® Классификация реакторных устройств.
® Выбор реакторных устройств.
® Пути интенсификации работы
реакторных устройств.
В технологии основного органического и нефтехимического син-
теза, как практически и в любой химической технологии, одной из
основных является подсистема, включающая реактор. Химический
реактор — это аппарат, в котором осуществляются химические реак-
ции с целью получения необходимых веществ в условиях технологи-
ческого процесса. Основными показателями процессов, протекаю-
щих в реакторе, являются конверсия реагентов, выход продуктов
и селективность химического процесса.
В подсистему помимо реактора могут входить и другие аппара-
ты: теплообменники для подогрева или охлаждения сырья и продук-
тов реакций, отвода или подвода тепла к реактору, пылеуловители
для отделения катализаторной пыли, циркуляционные насосы и др.
Так как в производствах основного органического и нефте-
химического синтеза применяются аппараты большой единичной
мощности, использование теплоты химических реакций и, наобо-
рот, минимизация подвода тепла для осуществления реакций пред-
ставляют важную задачу. В связи с этим такие производства часто
реализуются как энергохимические комплексы. Во многих случаях
теплота реакций используется для получения водяного пара, при этом
реактор выполняет одновременно роль котла-утилизатора. Получен-
ный пар может быть использован для различных целей.
Однако основная задача рассматриваемой подсистемы за-
ключается в достижении оптимальных конверсии сырья и се-
лективности химического процесса. Для этого необходимо не
только правильно выбрать все значения параметров процесса, про-
текающего в реакторе, но и провести его строго в этих условиях.
Следовательно, необходимо знать основные факторы, влияющие
как на скорость и пути химического превращения исходных ве-
Глава 3. Технологическое оформление реакторных подсистем
91
ществ, так и на их конверсию, т.е. знать способы, позволяющие
управлять химическими процессами. Для этого необходимо преж-
де всего изучить термодинамические и кинетические закономер-
ности химических реакций и других процессов, протекающих
в реакторах. Кроме того, для выбора и технико-экономического
сравнения реакторов нужно располагать сведениями о классифи-
кации как химических реакций и процессов, так и химических
реакторов.
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
В реакторе, как правило, протекает несколько реакций. В боль-
шинстве случаев такое совмещение произвольно: наряду с основ-
ной имеется и ряд побочных реакций. При этом они могут проте-
кать как параллельно, так и последовательно. Сейчас интенсивно
развивается направленное совмещение реакций. Наиболее харак-
терным примером такого совмещения является окислительное де-
гидрирование углеводородов. В ряде случаев наряду с реакциями
органических веществ одновременно протекают реакции неорга-
нических веществ. Как правило, последние являются компонен-
тами каталитической системы.
В технологии основного органического и нефтехимического
синтеза встречаются практически все реакции органических, а ча-
сто и неорганических веществ: окисление и дегидрирование, гид-
рирование и нитрование, сульфирование и этерификация и др.
Выбор реактора в значительной степени зависит от типа протека-
ющих в нем реакций. Все встречающиеся в отрасли химические
реакции можно классифицировать по следующим основным при-
знакам: 1) по числу стадий химических превращений; 2) по тер-
мическим условиям; 3) по агрегатному (фазовому) состоянию ре-
агентов; 4) по наличию и типу катализаторов.
По числу стадий химические реакции можно разделить на про-
стые и сложные. Простые реакции обычно подразделяют на практи-
чески необратимые (односторонние) и обратимые (двусторонние).
Последние, в свою очередь, можно разделить на реакции, которые
могут проводиться как в закрытых, так и в частично открытых сис-
темах (например, за счет удаления одного из целевых продуктов из
зоны реакции). Кроме того, простые реакции могут быть мономоле -
кулярными и бимолекулярными, а также элементарными и неэле-
ментарными.
92 Часть 1. Теоретические основы технологии крупнотоннажных ...
1. Обратимые и необратимые реакции. В зависимости от зна-
чения суммы показателей степени в уравнении 3.1
r = 3.1
реакции подразделяются на реакции первого порядка, второго и бо-
лее высоких порядков.
При реализации обратимых реакций, как правило, на первом
месте стоит задача сдвига равновесия в нужную сторону или орга-
низация ее проведения в частично открытой системе. При прове-
дении практически необратимой реакции главной задачей являет-
ся обеспечение ее протекания с высокой скоростью. Ускорить
необратимую реакцию можно, например, за счет увеличения на-
чальных концентраций реагирующих веществ, повышения темпе-
ратуры.
При осуществлении простых обратимых реакций побочные ре-
акции практически не протекают. Такие реакции можно представить
стехиометрическим уравнением:
nA + rBB+- + /YY^±/cC + /DD+-+/zZ- 3-2
Процесс протекает до установления динамического равновесия,
когда скорость прямой реакции станет равной скорости обратной,
и характеризуется равновесным выходом продуктов. Изменить рав-
новесный выход можно за счет изменения внешних условий: тем-
пературы, давления, концентрации одного из компонентов и т. д.
Достигнуть же в пределе полного превращения исходных веществ
можно при удалении из зоны реакции одного или нескольких про-
дуктов реакций, т. е. организации процесса в открытой системе
с избирательным массообменом.
Сдвиг равновесия в значительной степени зависит от тер-
модинамических характеристик реакций (температуры и давления).
Так, например, если реакция эндотермическая, то равновесный вы-
ход целевого продукта (продуктов) увеличивается при повышении
температуры в реакторе, если же реакция экзотермическая, то, на-
оборот,— при понижении температуры. Однако здесь наблюдается
конкурентная ситуация, заключающаяся в том, что с понижением
температуры увеличивается равновесный выход, но уменьшается
скорость реакции.
Глава 3. Технологическое оформление реакторных полсистем
93
Следовательно, необходимо в каждом отдельном случае вы-
бирать оптимальные температурные условия. Этот же вывод мож-
но сделать, проанализировав зависимость константы химического
равновесия от температуры:
d\nKT/(1Т = \Нй/ RT2, 3.3
где АН0 - стандартная теплота реакции.
Из этого уравнения видно, что для экзотермических реакций
(ДЯ° < 0 ) Кт уменьшается при повышении температуры, а для эн-
дотермических (ДЯ° >0) Кт возрастает с повышением тем-
пературы.
Рассмотрим в качестве примера реакцию:
/?СЯ = СЯ2 + Я2СМЯСЯОЯ-СЯ3; ДЯ°8 = 46 кДж/моль. 3.4
Процесс гидратации олефинов протекает с уменьшением чис-
ла молей вещества. Поэтому увеличение давления способствует
протеканию прямой реакции. Так, при 250-300 °C и атмосферном
давлении равновесная конверсия олефина составляет всего 0,1 —
0,2 %, а при 7—8 МПа и тех же температурах конверсия возрастает
до 12-20 %.
Процесс дегидратации спиртов протекает с увеличением чис-
ла молей веществ, следовательно, снижение давления способствует
протеканию обратной реакции. На рис. 3.1 представлена зависи-
мость равновесной конверсии этилена при его гидратации от дав-
ления.
Теперь рассмотрим роль температуры. Как известно, константа
термодинамического равновесия Кт связана с изменением стандарт-
ного изобарно-изотермического потенциала Дб° уравнением
\GQ = RT{nKT. 3.5
Гидратация олефинов протекает с выделением тепла. Следова-
тельно, согласно 3.3, равновесие смещается вправо при понижении
температуры. Дегидратация спиртов, наоборот, лучше протекает при
повышении температуры. Изменение изобарно-изотермического
потенциала Дб° при гидратации этилена, пропилена и изобутиле-
на в зависимости от температуры представлено на рис. 3.2.
94 Часть 1. Теоретические основы технологии крупнотоннажных ...
Из рисунка видно, что равновесие неблагоприятно для про-
текания гидратации олефинов, так как при 150—300 °C (400—600 К)
Рис. 3.1. Зависимость равновесной конверсии этилена в этиловый спирт
от давления (соотношение С2Н2.Н2О = 1:1)
Рис. 3.2. Зависимость изменения изобарно-изотермического потенциала
гидратации этилена (1), пропилена (2), изобутилена (3) от температуры
катализатор работает активно и AG0 имеет большое положительное
значение, что способствует протеканию реакции дегидратации.
Для повышения выхода большое значение имеет удаление од-
ного или нескольких продуктов реакции. Наиболее легко удаля-
ются газообразные, плохо конденсируемые или, наоборот, твер-
дые продукты. Более трудно удаляются продукты, имеющие
свойства, близкие к исходным реагентам. В последнем случае час-
то проводят совмещенные процессы, когда одновременно с реак-
циями осуществляют направленный массообмен (дистилляция,
простая ректификация, азеотропная ректификация, дистилляция
и ректификация в токе инертного газа, экстракция и др.). Так, при
получении высококипящих эфиров малолетучих кислот и спир-
тов достаточно легко из реакционной массы удаляется вода. При
получении же летучих эфиров они могут удаляться с водой в виде
азеотропов, но в соотношениях, не соответствующих стехиомет-
рическим соотношениям химической реакции. Лучше, если обра-
зуется гетерогенный азеотроп. В этом случае после расслаивания
из системы удаляется тот слой, в котором сконцентрирован необ-
ходимый продукт. При этом другой слой может возвращаться це-
ликом или частично в зону реакции.
Наиболее совершенным является способ, когда реакционная
зона размещается, например, в ректификационной колонне. Тог-
Глава 3. Технологическое оформление реакторных полсистем
95
да продукты реакций могут выделяться в виде как дистиллята, так
и кубового продукта. Организация таких совмещенных процес-
сов более подробно рассмотрена в гл. 6.
2. Сложные реакции. В основном органическом и нефтехимиче-
ском синтезе наряду с простыми реакциями широко встречаются
сложные реакции (последовательные, параллельные и после-
довательно-параллельные) .
Так, при алкилировании ароматических углеводородов олефи-
нами, хлорировании низших олефинов и других процессах проте-
кают многоступенчатые последовательные реакции. В частности,
уравнения последовательной четырехступенчатой реакции можно
записать в следующем виде:
Y + X -А-> Z + М, Л + X U + М,
3.6
Z + X Л + м, и + X —Р + м.
Для этих уравнений скорости реакций могут быть выражены
в виде следующих дифференциальных уравнений:
dy / dr = -kxxy,
dx/dr = kxxy - k2xz - к3хЛ - k4x,
dz/dT=-kxxy-k2xz, 3.1
dA / dT = k2zx-k3Az,
dp/dr = k^zu ит.д.
Необходимо иметь в виду, что реакционная способность ве-
ществ с увеличением числа замещений изменяется, чаще всего па-
дает. Поэтому при неизменном режиме подачи параллельного ком-
понента происходит увеличение его концентрации в реакционной
массе, т. е. происходит постоянное изменение его количества.
Так, при алкилировании ароматических углеводородов в при-
сутствии различных катализаторов происходит последовательное
замещение атомов водорода, и образуется смесь различных алкил-
производных. Например, метилирование и этилирование бензола
протекает последовательно, вплоть до получения гексаалкилбен-
золов. В частности, этилирование протекает следующим образом:
сл6-^с2я5-сл5-^с6я4(с2я5)2-^с6я4(с2я5)3 ит.д. з.8
96 Часть!. Теоретические основы технологии крупнотоннажных ...
Другая картина наблюдается при проведении параллельных ре-
акций. Все параллельные или конкурирующие реакции делятся на
две группы:
1) параллельные реакции с одинаковыми исходными реаген-
тами:
иА,А + vY,Y —r"k' > vRB+ v7,Z,,
/1,1 t , 1 D Z. , 1 1 '
+ ИУ,2 K > ^DD + K?,2Z2
3.9
К ним прежде всего относятся реакции расщепления, дегид-
рирования и др. Так, при дегидрировании бутана получаются бу-
тен-1, а также цис- и щрйнс-бутен-2:
СЯ3 - СН2 - СН2 - СН-,—
гхСН2 = СН -СН2-СН3
х Н
-хСН3-С =с-сн3+сн3-с =с-сн3
3.10
К этой же группе параллельных реакций относится реакция ги-
дроформилирования, в результате которой из олефинов, СО и Н2
получаются изомерные альдегиды:
г-хСН}—(СН2)2—СНО
СН3-СН=СН2+СО+Н2
^СН3-СН-СНО
СН3
3.11
2) параллельные реакции, в которых один реагент одинаковый,
а остальные — разные:
УЛ.\А + ИД
VA.2A + VY.2Y2 ri,k^>VDD.
3.12
Такой тип реакций является более распространенным в отрасли
основного органического и нефтехимического синтеза. К их числу
можно отнести окисление ацетальдегида в уксусную кислоту: на-
Глава 3. Технологическое оформление реакторных полсистем
97
ряду с уксусной кислотой в этой реакции получаются метилацетат,
этилидендиацетат, муравьиная кислота и диоксид углерода:
СНОСНО
>0,5СЯ3-ОСО-СН, +Q,5CO2 +0,5Н2О
-^^^СЯ3СЯ(ОСО-СЯ3)2 +Я2О 3.13
-^-+2НС00Н—^-х2СО2 + 2Н2О
Широкое распространение имеют последовательно-па-
раллельные реакции. Для такого типа реакций на каждой последо-
вательной стадии в реакции участвует общий реагент, который па-
раллельно взаимодействует с исходным веществом и промежуточ-
ным продуктом:
vAA+yYiY-^vB3B,
Vb2B+Vy2Y^^vD2D.
3.14
К такого рода реакциям относятся многие процессы хлориро-
вания, окисления, сульфирования, нитрования, гидрирования, ал-
килирования.
Характерным примером является способ получения алифати-
ческих аминов каталитическим взаимодействием аммиака со спир-
тами. Аммонолиз метанола протекает в три стадии:
СН3ОН + ЯЯ3 СЯ3 ЯЯ2 + Я2О
СЯ3ОЯ + СЯ3ЯЯ2<А>(СЯ3)2ЯЯ+Я2О 3.15
СН3ОН + (СЯ3 )2 NH ^±(СН3 )3N+H2O
Наряду с этими реакциями могут протекать и реакции диспро-
порционирования:
CHiNH1 + (СЯ3 )3 N т=> 2(СН3 )2 NH
(CH3)2NH + NH3^=±2CH3NH2 3.16
CH3NH2 + (СЯ3 )2 NH <=^(СН3 )3 N + NH3
4я-б
98 Часть 1. Теоретические основы технологии крупнотоннажных ...
Из приведенных реакций только три являются независимыми,
а остальные могут быть получены их сложением или вычитанием.
3. По термическим показателям реакции делятся на экзотер-
мические, эндотермические.
Экзотермические реакции протекают с выделением тепла. Сле-
довательно, в реакторах, в которых проводятся такого рода реак-
ции, необходимо предусматривать отвод тепла. Наиболее характер-
ным примером экзотермических реакций являются все реакции
окисления.
Эндотермические реакции протекают с поглощением тепла. По-
этому при осуществлении этого рода реакций в реакторах предус-
матривается подвод тепла. К эндотермическим относятся реакции
дегидрирования, крекинга и другие, например, дегидрирование
этилбензола в стирол, дегидрирование н-бутиленовой фракции
с получением бутадиена-1,3 (дивинила) и др.
До сих пор мы рассматривали индивидуальные реакции, про-
текающие с соответствующей теплотой. Однако в ряде случаев в
реакторе могут протекать одновременно две или несколько реак-
ций (совмещенный процесс) с противоположными теплотами. Тог-
да при проведении процесса можно добиться таких условий, когда
не потребуется подводить (или отводить) тепло в реактор, так как
разнонаправленные теплоты реакций компенсируют друг друга. Та-
ким образом, адиабатический процесс можно превратить в изотер-
мический.
4. Фазовые условия. Так как реагенты могут находиться при оп-
ределенных условиях в газообразном, жидком или твердом состоя-
нии, то в зависимости от их фазового состояния и сочетания фаз
реакции могут протекать в одной фазе, на границе фаз или в не-
скольких фазах. К гомогенным каталитическим реакциям относятся
реакции, в которых катализатор и реагенты находятся в одной фа-
зе. К числу гомогенных реакций относят гомофазные.
Гомофазными называются реакции, которые протекают в пре-
делах одной фазы, так как все компоненты (в том числе и ката-
лизатор) находятся только в этой фазе. В свою очередь эти реак-
ции делятся на газофазные, если все компоненты (реагенты
и продукты) газообразны, и жидкофазные, когда все реагенты и про-
дукты являются жидкими.
Гетерофазными называются такие реакции, которые протекают
на границе фаз, т. е. когда компоненты (реагенты и продукты) на-
ходятся в двух или более фазах. В этом случае имеют место систе-
Глава 3. Технологическое оформление реакторных полсистем
99
мы газ—жидкость, жидкость—жидкость, т. е. две несмешивающие-
ся фазы.
Следовательно, гомогенные и гетерогенные реакции различают
по зоне протекания самой химической реакции. Так, гомогенные
реакции осуществляются в объеме одной фазы, а гетерогенные —
на поверхности раздела фаз. Понятия фазового состояния компо-
нентов реакции и зоны ее протекания не совсем однозначны, так
как существуют гомофазные гетерогенные процессы (в частности,
газофазные реакции на твердом катализаторе) и гетерофазные го-
могенные реакции, когда реагенты находятся в двух несмешиваю-
щихся жидких фазах, но реакция протекает только в объеме одной
из фаз, куда второй компонент проникает из другой фазы за счет
растворения.
К числу газофазных реакций можно отнести газофазное хло-
рирование углеводородов, например хлорирование метана при по-
лучении хлороформа. Примером жидкофазной реакции может слу-
жить гидратация пропилена на сульфокатионите с получением
изопропилового спирта. И наконец, наиболее характерными при-
мерами гетерофазных реакций являются многие из известных в на-
стоящее время процессов окисления (в частности, окисление эти-
лена до ацетальдегида).
Свыше 90 % всех реакций основного органического синтеза
проводятся в присутствии различных катализаторов. Однако есть
реакции, которые могут протекать без катализатора. В связи с этим
реакции могут делиться на каталитические, которые протекают
в присутствии катализаторов, и некаталитические, протекающие в
их отсутствие.
Практически все реакции алкилирования, дегидрирования,
гидрирования, гидратации, этерификации протекают в присут-
ствии катализаторов (жидких и твердых). Катализаторы при-
меняются для ускорения реакций, изменения температуры и дав-
ления процесса и т. д. Иногда катализаторы используют для
снижения скорости реакции. Эти катализаторы называют инги-
биторами. К числу некаталитических чаще всего относятся ради-
кально-цепные реакции, например хлорирование и окисление уг-
леводородов, пиролиз и др. Характерным примером такой реакции
является окисление изопропилбензола в кумольном методе полу-
чения фенола и ацетона.
Каталитические (гомогенные) реакции, в свою очередь, можно
разделить на кислотно-основные, окислительно-восстанови-
100 Часть 1. Теоретические основы технологии крупнотоннажных ...
тельные, координационно-каталитические и энзиматические (фер-
ментативные).
Разные реакции имеют различные зависимости их скорости от
концентраций реагирующих компонентов и подразделяются по по-
рядку реакции. Порядок реакции вытекает из кинетического урав-
нения, выражающего зависимость скорости от концентрации реа-
гентов:
...с? =кХ\с?
3.17
где г — скорость реакции; к — константа ее скорости; с. — концентрация
реагентов.
В таких уравнениях я. — порядок реакции по данному реагенту,
а Хи — общий порядок реакции.
Для неэлементарных реакций порядок может выражаться не
только положительными целыми числами, но также дробными
или отрицательными, поэтому кривые зависимости скорости ре-
акции от концентрации (парциального давления) имеют разный
вид (рис. 3.3).
Таким образом, по кинетическому признаку, определяющему
зависимость скорости реакции от концентрации или парциального
давления реагента, реакции делятся на реакции нулевого порядка,
первого порядка, более высокого порядка и дробного порядка. Для ре-
акций нулевого порядка скорость постоянна и не зависит от кон-
центрации или парциального давления реагента, для реакций пер-
вого порядка эта зависимость прямолинейна, а для реакций более
высокого порядка характеризуется экспоненциальной кривой.
В случае реакций дробного порядка, прежде всего гетерогенно-
каталитических, зависимость скорости от концентрации реаген-
тов описывается уравнением:
Рис. 3.3. Зависимость скорости ре-
акции от концентрации реагентов
(парциального давления) для ре-
акций:
1 — нулевого порядка; 2 — первого по-
рядка; 3 — второго порядка; 4 — дроб-
ного порядка; 5 — переменного порядка
Глава 3. Технологическое оформление реакторных полсистем 101
<<=^[^/(l+W)] 3.18
и характеризуется затухающей кривой (рис. 3.3, кривая 4). Для ряда
гетерогенно-каталитических реакций эта зависимость имеет вид:
<.=*,[Л/(1 + М’,)!]- 3.19
В этом случае кривая зависимости скорости реакции от кон-
центрации реагентов (парциального давления) проходит через мак-
симум (рис. 3.3, кривая 5), т. е. существует оптимальное значение
начальной концентрации (давления).
И наконец, реакции подразделяются в зависимости от того,
какой стадией определяется их общая скорость (химической или
диффузией реагентов и продуктов реакций). При этом необходимо
иметь в виду, что скорость процесса лимитируется скоростью са-
мой медленной стадии. Следовательно, для ускорения процесса
в целом необходимо прежде всего увеличить скорость именно этой
стадии.
Все это относится, главным образом, к гетерогенным процес-
сам, в которых реакции могут протекать как на поверхности раз-
дела сред (фаз), так и в одной из сред (фаз). При этом реакция
может протекать и в кинетической, и в диффузионной области.
Если скорость процесса лимитируется скоростью диффузии, на-
пример газа в жидкость, то процесс протекает во внутренней диф-
фузионной области. Если же скорость процесса лимитируется
скоростью диффузии в дисперсной фазе, например для системы
жидкость—жидкость, то процесс протекает во внешней диффу-
зионной области.
Вместе с тем если скорость процесса лимитируется скоростью
реакции, протекающей в одной из фаз, например жидкой, то про-
цесс протекает во внутренней кинетической области. И наконец,
если реакция протекает на поверхности раздела фаз, то скорость
процесса зависит от скорости химических превращений,
и процесс протекает во внешней кинетической области.
Рассмотренная классификация реакций с технологической точ-
ки зрения является, вероятно, не полной и, более того, условной,
так как некоторые реакции очень трудно отнести к тому или ино-
му классу (изотопные, ионные и др.). Однако подавляющее боль-
шинство реакций относится к определенному классу или типу ре-
акций рассмотренной классификации.
102 Часть 1. Теоретические основы технологии крупнотоннажных ...
КЛАССИФИКАЦИЯ ПРОЦЕССОВ
Процессы, протекающие в реакторе, определяются фазовым
состоянием исходных реагентов и продуктов реакций (фазовая ха-
рактеристика), видом катализатора (твердый или жидкий), теп-
лотой реакций и, соответственно, тепловым режимом (энерге-
тические и термодинамические характеристики), динамикой
процессов, характером движения реагентов и продуктов реакций,
а также гидродинамикой системы. Кроме того, следствием энер-
гетической и термодинамической характеристик является режим
теплообмена.
Исходные реагенты и продукты реакций в реакторе могут на-
ходиться в разном фазовом состоянии: в виде пара (газа), жидкос-
ти и твердого тела. Более того, реагенты и продукты реакций могут
присутствовать одновременно в разных фазовых состояниях. При
этом необходимо отметить, что одни реагенты и продукты могут
легко быть переведены из одной фазы в другую, тогда как другие
в пределах реальных изменений условий в реакторе (температуры
и давления) не могут быть переведены из одной фазы в другую.
В последнем случае процесс проводят в растворе газов или твердых
веществ или в специально подобранном растворителе.
По фазовому состоянию исходных реагентов и продуктов реак-
ции процессы, протекающие в реакторах, делятся на гомогенные па-
рофазные, гомогенные жидкофазные и гетерогенные процессы.
К первым относятся процессы, в которых все реагенты и продукты
реакций в условиях проведения процесса находятся в газовой фазе.
Характерным примером такого процесса является парофазная гид-
ратация этилена с получением этилового спирта. К гомогенным
жидкофазным относятся процессы, в которых реагенты и продукты
находятся в жидком состоянии. К характерным примерам таких про-
цессов относятся: этерификация, гидролиз, дегидратация и др.
На практике широко применяются гетерогенные процессы,
в которых реагенты и продукты реакций присутствуют в разных фа-
зах. Наиболее распространены гетерогенные процессы, в которых
часть веществ находится в паровой фазе, а остальные — в жидкой
(процесс газ—жидкость). Примером может служить сернокислот-
ная гидратация олефинов с получением спиртов. Довольно распро-
странены и процессы, протекающие в системе газ—твердое тело.
Существуют также процессы, когда в реакторе находятся несме-
шивающиеся жидкости (процесс жидкость—жидкость). Примером
Глава 3. Технологическое оформление реакторных подсистем 103
такого процесса служит жидкофазная гидратация олефинов с по-
лучением изопропилового и в/иор-бутилового спиртов. И наконец,
в технологии основного органического и нефтехимического син-
теза встречаются процессы, когда одни вещества находятся в виде
жидкости, а другие — в виде твердых тел (процесс жидкость-твер-
дое тело). Однако последние процессы встречаются крайне редко.
Как известно, свыше 70 % всей химической продукции полу-
чают каталитическими методами, а в современных производствах
объем выпускаемой таким путем продукции приближается к 90 %.
В технологии основного органического и нефтехимического син-
теза в присутствии катализаторов протекает еще большая часть про-
цессов. При этом катализаторы выполняют различные функции:
изменяют скорость реакции, диапазон рабочих температур и дав-
лений, конверсию сырья и селективность процесса.
Катализатор, как правило, ускоряет как прямую, так и обратную
реакцию. При этом он не изменяет равновесного состояния про-
цесса, но ускоряет его достижение. Вместе с тем правильный вы-
бор катализатора позволяет сделать преобладающим один из не-
скольких возможных путей реакции и обеспечивает желаемую
селективность процесса.
Большое значение имеет и энергетическая сторона катализа.
Так, введение катализатора в реакционную систему снижает энер-
гетический барьер, результатом чего и является увеличение скоро-
сти реакции. Так как константа скорости экспоненциально зави-
сит от высоты барьера (рис. 3.4), то снижение последнего всего лишь
на 4,18 кДж/моль приводит к увеличению скорости в 10—20 раз.
Если же барьер уменьшить на 20—25 кДж/моль, то это приведет
к увеличению скорости в десятки тысяч раз. Все это видно из урав-
нения Аррениуса:
Рис. 3.4. Энергетическая схема
протекания экзотермической го-
могенной реакции А -^Б без ката-
лизатора (1) и гетерогенно-ката-
литической (2):
— энергия активации некатали-
тической реакции; Елгет — энергия ак-
тивации реакции на поверхности ка-
тализатора; 9/* — теплота адсорбции
вещества A; — теплота десорбции
вещества Б
Координата реакции
104 Часть 1. Теоретические основы технологии крупнотоннажных ...
K = K^E/RT, 3.20
где Ко — константа, представяющая собой предэкспоненциальный мно-
житель; е — основание натуральных логарифмов; R - газовая постоянная,
равная 8,314 Дж/(град-моль); Т — абсолютная температура, К; Е - энер-
гия активации, Дж/моль.
Следовательно, высокоактивная каталитическая система долж-
на обладать оптимальной (не слишком сильной или слабой) адсорб-
ционной способностью.
Необходимость повышения активности и особенно селектив-
ности современных промышленных катализаторов обусловлена
прежде всего значительным ростом цен на сырье, в качестве кото-
рого выступают в основном углеводороды нефти. Для экономии
сырья процесс следует проводить при более низких температурах
и давлениях, так как в этом случае селективность процесса уве-
личивается.
Наиболее важна для технологической организации процесса и
прежде всего для выбора типа реактора классификация ката-
лизаторов по их агрегатному состоянию. Подобно тому как хи-
мические реакции подразделяют в зависимости от агрегатного со-
стояния реагентов и продуктов реакций на гомогенные
и гетерогенные, так и катализ подразделяется на гомогенный
и гетерогенный. При этом определяющим является агрегатное со-
стояние прежде всего катализатора, т. е. в зависимости от агрегат-
ного состояния катализатора и реагентов процессы, протекающие
в реакторе, подразделяются на гомогенные и гетерогенные.
К гетерогенному катализу и, соответственно, к гетерогенным
процессам относят процессы, в которых катализатор и реагенты на-
ходятся в разных фазах и реакции протекают на границе раздела
этих фаз. К ним относятся прежде всего процессы взаимодействия
газообразных или жидких реагентов с твердым катализатором,
именно эти процессы имеют в настоящее время наибольшее прак-
тическое значение.
Характерными примерами такого рода процессов являются;
синтез спиртов гидратацией олефинов (катализатор Н3РО^ на SiO2
или активированном угле), алкилирование ароматических угле-
водородов (Н3РО^ на SiO2), окисление этилена в оксид этилена (Ag),
дегидрирование этилбензола в стирол (/е3О4), синтез винилацетата
из ацетилена и уксусной кислоты [Zn(CH3COO)2 на активирован-
ном угле] и многие другие.
Глава 3. Технологическое оформление реакторных подсистем 105
Такого рода процессы очень многообразны.
В том случае когда катализатор и реагенты находятся в одной
фазе, процесс называется гомогенным (реакции протекают в объе-
ме). Широко применяются жидкофазные гомогенные процессы,
протекающие в присутствии металлокомплексных катализаторов.
Например, в процессе оксосинтеза реакция гидроформилирования
протекает в присутствии металлокомплексных катализаторов (кар-
бонилов металлов) и является гомогенно-каталитической.
Широкое распространение имеют также процессы, включающие
ионный катализ (кислотный и основной). К процессам, катализи-
руемым кислотами и основаниями, относятся: этерификация, омы-
ление и многие другие, базирующиеся на окислительно-восстано-
вительных реакциях.
Гомогенные каталитические процессы имеют ряд преимуществ
перед традиционными гетерогенными: высокую общую актив-
ность и низкие температуры и, как следствие, высокую се-
лективность и др. Однако они имеют и ряд существенных недо-
статков. Прежде всего, как правило, они не технологичны. Это
объясняется тем, что осуществление таких процессов требует вве-
дения в технологический процесс сложной стадии отделения ка-
тализатора от реагентов и продуктов, что увеличивает трудо-
емкость, металлоемкость и затрудняет создание непрерывного
процесса. Большие трудности возникают при регенерации, на-
пример, металлокомплексных катализаторов, тогда как регене-
рация традиционных гетерогенных катализаторов обычно сво-
дится к выжиганию смолообразных продуктов в токе воздуха.
Кроме того, гомогенные металлокомплексные катализаторы не
могут быть применены для реакций, которые по требованиям тер-
модинамики должны проводиться при высоких температурах.
Верхняя температурная граница применения гомогенных катали-
заторов определяется прежде всего температурой кипения раство-
рителей и температурой разрушения комплексов.
Если удается преодолеть основные недостатки гомогенного ка-
тализа, используя, например, направленно совмещенные процессы,
то он найдет еще более широкое применение. С целью повышения
технологичности таких катализаторов можно также осуществить их
гетерогенизацию (нанести их на носители), сохранив активность
и селективность. Гетерогенизация комплексов переходных метал-
лов позволит создавать принципиально новые процессы, объеди-
няющие преимущества гомогенного и гетерогенного катализа.
106 Часть!. Теоретические основы технологии крупнотоннажных ...
В некоторых процессах (реакциях) каталитическое действие
может оказывать один из продуктов, образующийся в результате
реакций. Такие процессы называют автокаталитическими (авто-
катализ). Чаще всего к их числу относят цепные процессы.
Выход целевых продуктов в значительной степени зависит от
температурного режима в реакторе. Поэтому важно подобрать та-
кие температурные условия, которые обеспечат максимальный вы-
ход целевого продукта. При этом определяющим фактором явля-
ется теплота реакций, протекающих в реакторе.
Температурный режим в реакторе может быть изотермическим,
адиабатическим и политермическим.
Изотермический режим характеризуется постоянством темпера-
туры во всем реакционном объеме. При этом все процессы проте-
кают при постоянной температуре (/ = /к= const). Такой режим мо-
жет быть достигнут, если при проведении экзотермических реакций
тепло будет отводиться в таком количестве, в каком оно будет вы-
деляться, и наоборот, при проведении эндотермических реакций
должно подводиться такое же количество тепла, которое поглоща-
ется в результате проведения различных процессов.
Для поддержания постоянства температуры подвод тепла мо-
жет осуществляться в виде подогрева исходного сырья через по-
верхность теплообмена, ввода в зону реакций водяного пара и т. д.,
а отвод тепла — за счет испарения части сырья и продуктов реак-
ций, через поверхность теплообмена, ввода в зону реакций захоло-
женного сырья и т. д.
Примером осуществления процесса в изотермическом режиме
при проведении эндотермической реакции является получение сти-
рола дегидрированием этилбензола. В этом случае тепло подводится
частично за счет подогретого этилбензола, а в основном — в виде
перегретого водяного пара.
Другим примером может служить процесс получения алкилбен-
золов, в котором протекает экзотермическая реакция. При этом ос-
новное количество тепла отводится за счет испарения некоторой
части бензола, а остальное — через теплообменную поверхность (че-
рез рубашку).
Процесс гидроформилирования также может быть изотерми-
ческим. При этом отвод тепла может быть внутренним (за счет ис-
парения продуктов), внешним и смешанным.
Адиабатический режим характеризуется отсутствием теплооб-
мена с окружающей средой. Поэтому выделяемое тепло экзотер-
Глава 3. Технологическое оформление реакторных подсистем 107
мических реакций приводит к повышению температуры системы;
в этом случае температура на входе реагентов ниже, чем на выходе.
При проведении же эндотермических реакций имеет место обрат-
ная картина, т.е. наблюдается понижение температуры системы;
температура исходного сырья на входе в реактор будет выше, чем
на выходе из него.
Характеристическое уравнение адиабатического режима при
осуществлении простейшей реакции А —> В будет иметь вид:
3.21
где tK и tH — температура реакционной массы соответственно на выходе и
на входе в реактор, °C; — теплота реакции, Дж/моль; - концентра-
ция основного реагента, мольные доли; с - теплоемкость реакционной
массы, Дж/(моль°С).
Следует учитывать, что в таком процессе отсутствует теплооб-
мен с окружающей средой и все тепло отводится с реакционной
массой или подводится с исходным сырьем. В ряде случаев тепло
может вводиться дополнительно с водяным паром. Примером осу-
ществления адиабатического режима является дегидрирование
этилбензола в стирол. Здесь в реактор вместе с этилбензолом пода-
ется определенное количество водяного пара, который выполняет
роль не только теплоносителя, но и разбавителя и «регенератора»
катализатора.
Другим примером адиабатического режима является прямая
гидратация этилена.
Политермический режим характеризуется таким внешним теп-
лообменом, который не является пропорциональным теплоте ре-
акций. Подача или отвод тепла в этом случае может осуществлять-
ся через стенку, разделяющую охлаждающие или нагревающие
потоки, или непосредственное их смешение. При этом теплообмен
может быть непрерывным или ступенчатым, когда теплообменные
устройства вынесены из зоны реакций. В качестве теплоносителей
могут служить сырье, инертные газы, катализаторный раствор.
Возможны случаи, когда тепла, выделяющегося в результате ре-
акций, достаточно, чтобы нагреть сырье (исходные реагенты) до
нужной температуры, и исключается необходимость подвода тепла
извне. Такие процессы называются автотермическими.
Необходимо отметить, что тепловой режим процессов, проте-
кающих в реакторе, определяется с одной стороны теплотой ре-
108 Часть!. Теоретические основы технологии крупнотоннажных ...
акций (термодинамическая составляющая), а с другой стороны —
теплосодержанием потоков: сырьевых и продуктов синтеза (энер-
гетическая составляющая). Достижение же определенного режима,
особенно изотермического, возможно только при дополнительном
подводе или отводе тепла за счет подачи водяного пара через по-
верхность теплопередачи или при введении захоложенных потоков,
а также отводе тепла через поверхность.
Характер движения исходных реагентов и продуктов реакций
в значительной степени определяется объемом выпускаемой про-
дукции. В зависимости от объема продукции используют периоди-
ческие, полунепрерывные, непрерывные и циклические или смен-
но-циклические процессы.
В технологии основного органического синтеза периодические
процессы применяются, как правило, только для получения вспо-
могательных продуктов, в том числе и катализаторов.
Для периодических процессов во времени можно выделить сле-
дующие отдельные этапы:
Подготовка сырья:
загрузка исходных веществ, й
перемешивание и нагрев, < Т|
Химическое превращение сырья
отвод тепла реакции Тз'
Подготовка реакционной смеси
к выделению продуктов:
охлаждение реакционной массы. Т4
выгрузка реакционной массы, т;, тщ
очистка и осмотр реактора, т,,
Продолжительность операций, т0ПТ
При этом степень (коэффициент) использования аппарата или
устройства по прямому назначению выражается отношением:
n = <4’ 3.22
а для реакционного пространства:
n=s/'roiri=sAA+'rp)> 123
где A=Tj +тп.
Глава 3. Технологическое оформление реакторных полсистем 109
Такие процессы обладают следующими преимуществами: харак-
теризуются большой гибкостью (в одном и том же реакторе можно
получать разные продукты); реактор периодического действия пре-
дусматривает меньшие капиталовложения, чем реактор, работающий
в непрерывном режиме. Однако периодические процессы имеют и
существенные недостатки: низкая производительность; их трудно
эксплуатировать, в том числе автоматизировать; в среднем качество
продукции хуже, чем в непрерывном процессе, так как в периоды
выхода на режим и подготовки реактора к новой загрузке получает-
ся продукция, не отвечающая необходимому качеству, в связи с тем,
что процессы протекают в неоптимальных условиях.
Процессы полупериодического действия широко применяются
при использовании реакторов, в которых катализатор требует реге-
нерации. Примером такого процесса является триадная схема про-
цесса оксосинтеза. В этом случае в одном реакторе протекает ос-
новной процесс, а в другом — регенерация катализатора. А затем
они переключаются и меняют свои функции.
Кроме того, к числу полупериодических процессов можно отне-
сти такие, когда одни реагенты вводятся непрерывно, а другие — пе-
риодически. Подобные процессы используют, как правило, в случае
высокоэкзотермических реакций. При этом за счет периодического
ввода наиболее реакционноспособного реагента удается регулиро-
вать скорость химического процесса и, соответственно, отвод тепла.
Наиболее широкое распространение в технологии основного
органического и нефтехимического синтеза получили непрерывные
процессы. Именно они применяются в технологических линиях
большой единичной мощности. Эти процессы имеют следующие
преимущества: более низкие по сравнению с периодическими
процессами эксплуатационные расходы из-за отсутствия таких опе-
раций, как многократные загрузки и выгрузки аппаратов; легко
поддаются автоматизации, что также снижает эксплуатационные
расходы; устойчивость технологического режима, так как легко под-
держивать постоянными параметры процесса. Это в свою очередь
приводит к стабильности качества выпускаемого продукта.
Вместе с тем при осуществлении непрерывных процессов
капитальные затраты выше, чем в случае периодических про-
цессов, так как разные стадии (операции) выполняются в от-
дельных аппаратах.
Основные факторы, определяющие периодичность и непре-
рывность процессов, представлены в табл. 3.1.
110 Часть!. Теоретические основы технологии крупнотоннажных ...
Таблица 3.1. Основные факторы, определяющие периодичность
и непрерывность процессов
Фактор Тип процесса
периодический непрерывный
Лт-»0
т/Дт->°о
Параллельно
Период процесса*
Степень непрерывности
процесса**
Последовательность
осуществления отдельных
стадий процесса
Место проведения
отдельных стадий
процесса
Характер изменения
концентраций реаги-
рующих веществ в
реакционном объеме
Характер изменения
параметров
т/Дт<1
Последовательно
В одном аппарате
Различен во времени для
одной и той же точки
объема
В разных аппаратах
Постоянен во времени для
одной и той же точки
объема
Изменяются в широком
диапазоне
Остаются постоянными
в пределах допустимых
колебаний
" Время между отдельными аналогичными стадиями процесса, например меж-
ду двумя смежными загрузками или подачами исходного сырья.
" т — время, необходимое для проведения всех стадий процесса.
Полунепрерывные процессы занимают промежуточное поло-
жение между периодическими и непрерывными процессами.
И наконец, к циклическим или сменно-циклическим процессам
относятся такие, в которых для достижения непрерывности при-
меняется каскад реакторов. Причем в разных реакторах могут про-
текать разнонаправленные по теплоте химические реакции,
а через определенный промежуток времени реакторы переключа-
ют и в них осуществляют другие стадии или циклы процесса. Обыч-
но такое переключение реакторов происходит автоматически.
По характеру движения исходных реагентов и продуктов реак-
ций процессы могут быть подразделены на прямоточные, перекре-
стноточные, процессы с постепенным добавлением реагентов
и противоточные. Характер движения потоков определяет движу-
щую силу процесса. Применительно к газожидкостной гетероген-
ной системе направление движения реагирующих фаз (потоков)
представлено на рис. 3.5.
Глава 3. Технологическое оформление реакторных подсистем 111
а б в
Рис. 3.5. Направление движения потоков в системе газ-жидкость:
a — противоток; б — прямоток; в — перекрестный ток
Аналогичная картина может быть и в реакторах другого типа.
При этом изменение концентраций соответственно при прямотоке
и противотоке будет иметь качественно иной вид, представленный
на рис. 3.6.
Из рис. 3.6 видно, что при прямотоке движущая сила процесса
Ас велика только на входе в реактор и стремится к нулю на выхо-
де из него. При этом скорость процесса в реакторе неравномерна.
При противотоке движущая сила процесса по длине пути в реак-
торе меняется значительно меньше. Причем даже при одном и том
же значении De при прямотоке в конце процесса ск' < ск, а при
противотоке ск' > ск. Это значит, что при прочих равных условиях
в случае противотока выход продукта должен быть значительно
больше.
Рис. 3.6. Изменение концентраций при прямотоке (а) и противотоке (б):
с, с/ — начальные концентрации; ск, ск'— конечные концентрации
7 72 Часть!. Теоретические основы технологии крупнотоннажных ...
В связи с этим в отрасли основного органического и нефте-
химического синтеза чаще всего применяется противоток. Но ино-
гда в случае необходимости длительного контакта реагентов исполь-
зуется прямоток или перекрестный ток.
Характерным примером противоточного осуществления про-
цесса являются процессы окисления углеводородов. В частности,
в производстве фенола и ацетона кумольным методом окисление изо-
пропилбензола воздухом проводят в противоточной колонне тарель-
чатого типа. Другим примером может служить сернокислотная гид-
ратация этилена или пропилена, осуществляемая в противоточной
колонне.
Примером прямоточного осуществления процесса является ал-
килирование бензола олефинами в колонне непрерывного действия.
В этом случае бензол, олефин и катализаторный раствор подаются
в нижнюю часть колонны, а газообразные и жидкие продукты вы-
водятся из верхней части.
И наконец, характерным примером перекрестного тока слу-
жит процесс алкилирования изобутана н-бутиленом, который осу-
ществляют в горизонтальном аппарате с мешалками. Причем ката-
лизатор (Я25О4) и изобутан перетекают вдоль аппарата, н-бутилен
подается снизу в каждый отсек аппарата.
С точки зрения гидродинамики процессы, протекающие в ре-
акторах, могут быть подразделены на процессы с полным пере-
мешиванием реагентов, с многоступенчатым (секционным) пе-
ремешиванием и без перемешивания. Другими словами, может
происходить полное перемешивание (идеальное смешение реаген-
тов) как во всем реакторе, так и в отдельных его секциях, а также
вытеснение реагентов.
Перемешивание реагентов в реакторе влияет на общий режим
его работы. При этом необходимо иметь в виду, что при полном
перемешивании (идеальном смешении) температурный режим во
всех точках один и тот же. Следовательно, и скорость реакции долж-
на быть одинаковой во всех частях реактора. Такого рода процессы
могут быть как периодического, так и непрерывного действия. Для
перемешивания часто применяют мешалки, но можно использо-
вать также и инертный газ, который, пробулькивая через реакци-
онную массу, будет ее перемешивать.
Перемешивание можно проводить как в единичном аппарате,
если в нем достигается необходимая конверсия, так и в каскаде ре-
акторов (рис. 3.7), в каждом из которых достигается определенная
Глава 3. Технологическое оформление реакторных полсистем 113
Рис. 3.7. Каскад реакторов полного смешения
конверсия. При этом реакционная масса переводится постепенно
из одного реактора в другой. В такого рода процессах концентра-
ция целевого продукта будет изменяться от 0 до СА (рис. 3.8).
Следовательно, в этом случае наблюдается как секционирован-
ное, так и многоступенчатое перемешивание реагентов: при этом
можно все реагенты вводить в первый реактор или один из них —
частями в каждый из реакторов.
Такая организация процесса позволяет предотвратить обра-
зование застойных зон, а при большом числе реакторов можно соз-
дать гидродинамический режим, близкий к режиму полного вы-
теснения.
На основе уравнений материального баланса каждого реактора
можно определить концентрацию реагентов на выходе из любого
реактора каскада (при постоянном объеме каждого реактора и тем-
пературе в них) по уравнению:
с™=с°/(1 + ^)'", 3.24
где с°А - концентрация реагентов на входе в первый реактор; К — констан-
та скорости реакции; т— время пребывания реагентов; т — число реак-
торов.
Из уравнения 3.24 можно получить выражение для расчета чис-
ла реакторов в каскаде:
/n = lg(C“/c;)/lg(l + ^). 3.25
В уравнении 3.25 наиболее сложно определить с™.
При идеальном вытеснении все частицы реакционной массы
перемещаются в одном направлении и имеют одну и ту же скорость
перемещения (при постоянных значениях всех других параметров)
и, следовательно, практически одинаковое время пребывания в ре-
114 Часть!. Теоретические основы технологии крупнотоннажных ...
акторе. Поэтому временной характеристикой процессов такого типа
служит уравнение:
т'=т=и/И0, 3.26
где / — время пребывания в реакторе любой молекулы или частицы; т -
среднее время пребывания; и - объем реактора; Ио - объем вещества, по-
ступающего в реактор в единицу времени.
Изменение концентрации продукта реакции в реакторе иде-
ального вытеснения показано на рис. 3.9.
Следует иметь в виду, что в аппаратах с идеальным вытеснением
состав и температура реакционной смеси в центре аппарата и у его
стенок различаются; наиболее сильно отличаются концентрации
и температуры на входе в реактор и на выходе из него.
Теперь можно провести сравнение процессов с разной гидро-
динамикой на основе движущей силы процесса, определяющей
производительность реактора, используя уравнение для среднело-
гарифмической, движущей силы:
^ = (c”-c«)/[2,3.1g(c«/^)]- 3-27
В случае реакторов полного смешения с° = с*, следовательно,
средняя движущая сила процесса будет всегда ниже, чем в реак-
торах полного вытеснения или в реакторах периодического дей-
ствия. Снижение концентраций реагентов и, соответственно, дви-
жущей силы процесса Де в реакторах смешения, по сравнению
с реакторами вытеснения, тем больше, чем выше конверсия реа-
гентов и порядок реакции. Следовательно, при прочих равных ус-
ловиях для проведения процесса и достижения заданной конвер-
Рис. 3.8. Зависимость концентрации реагента сА от времени пребывания
в ступенях каскада
Рис. 3.9. Изменение концентрации продукта реакции сА в реакторе
полного вытеснения
Длина пути в реакторе
Глава 3. Технологическое оформление реакторных полсистем 115
сии в реакторах смешения требуется большая продолжительность
процесса.
Кроме того, важное значение имеют энергетические затраты
при осуществлении соответствующего процесса, которые для ре-
акторов полного смешения могут быть в несколько раз выше, чем
для реакторов полного вытеснения. Вместе с тем реактор полного
смешения, в котором во всех точках наблюдаются постоянные кон-
центрации и температуры, легче автоматизировать, чем реактор
полного вытеснения. Более того, при наличии в реакторах режи-
мов, близких к полному вытеснению, трудно подводить и отводить
тепло, а при наличии интенсивного перемешивания условия пере-
дачи тепла улучшаются. Поэтому не случайно в аппаратах со взве-
шенным слоем катализатора, которые приближаются к реакторам
полного смешения, отвод тепла при экзотермических реакциях осу-
ществляется проще, чем в трубчатых аппаратах. Однако в аппара-
тах с псевдоожиженным слоем катализатора наблюдается его силь-
ное истирание и унос в виде пыли.
Как уже отмечалось, создание технологий для безотходных про-
изводств в значительной степени зависит от правильной организа-
ции подсистемы реакционного процесса. При этом основная зада-
ча заключается в достижении не только максимальной конверсии
сырья, но и селективности процесса. Достижение необходимой кон-
версии и селективности процесса зависит не только от организа-
ции процесса (теплообмена, переноса массы, гидродинамики и
т.д.), но и, главным образом, от выбора каталитической системы.
Типы каталитических систем были рассмотрены ранее. Теперь же
рассмотрим характеристики катализаторов, которые необходимо
учитывать при их выборе.
К основным характеристикам катализаторов относят:
О специфичность, выражающуюся в том, что определенный тип
катализаторов применяют для осуществления конкретных про-
цессов (гидрирование, дегидрирование, окисление и др.);
© избирательность, или селективность, т.е. способность ускорять
целевую реакцию (реакции), по которой получается продукт;
© активность, которая определяется количеством целевого про-
дукта, получаемого с единицы массы или объема катализатора
в единицу времени.
Наиболее важной характеристикой катализаторов является их
активность, которая зависит от следующих факторов:
116 Часть!. Теоретические основы технологии крупнотоннажных ...
Ф температуры (или интервала температур). Для каждого ката-
лизатора существует оптимальный температурный режим, при
котором достигается его максимальная активность. При более
низких температурах активность катализатора будет мала, а при
более высоких — усиливается протекание побочных реакций
и происходит дезактизация катализатора. Чем активнее ката-
лизатор, тем ниже его оптимальный температурный режим;
® давления, определяющего концентрацию реагирующих ве-
ществ в реакционном объеме (при жидкофазном катализе) или
на поверхности катализатора (при гетерогенном катализе);
® размера частиц катализатора, определяющих поверхность кон-
такта между реагентами и катализатором. Уменьшение размера
частиц катализатора снижает его диффузионное и тепловое со-
противление и, следовательно, увеличивает активность;
® содержания примесей в сырье, которые могут вызывать час-
тичную или полную дезактивацию (отравление) катализатора;
® способа приготовления катализатора, его активации, носите-
лей и др.
Наиболее эффективно катализаторы применяются для хи-
мических процессов, протекающих в кинетической области.
Так как значительное число промышленных процессов ос-
новного органического и нефтехимического синтеза протекает в ге-
терофазных системах, особенно часто в системах газ—жидкость или
жидкость—жидкость, то для протекания химических реакций не-
обходимо обеспечить межфазный перенос вещества. При этом
в зависимости от относительных скоростей массопередачи и хими-
ческой реакции процесс может протекать в различных областях: ки-
нетической, когда химическая реакция идет много медленнее про-
цесса массопереноса; диффузионной, в которой самым медленным
является процесс переноса вещества; переходной области, харак-
теризующейся сравнимыми скоростями химической реакции и мас-
сопереноса.
Следует также учитывать, что реакция может протекать как
в одной, так и в нескольких фазах. Поэтому возникает задача вы-
явления определяющей или лимитирующей стадии процесса.
В зависимости от скорости реакции и массопереноса можно
выделить четыре основных случая протекания процессов.
Первый случай характеризуется медленной реакцией. Скорость
процесса в этом случае лимитируется скоростью химических пре-
вращений, так как концентрации в фазах быстро выравниваются
Глава 3. Технологическое оформление реакторных подсистем 117
за счет диффузии. Следовательно, процесс протекает во внутрен-
ней кинетической области. Для увеличения скорости процесса не-
обходимо увеличивать как объем фазы, так и температуру. В этом
случае особенно велика роль катализатора.
Второй случай характеризуется быстрой реакцией. Скорость
процесса лимитируется скоростью диффузии реагентов из одной
фазы в другую (например, газа в жидкость) и вовнутрь катализатора.
Следовательно, процесс протекает во внутренней диффузионной об-
ласти. Для ускорения процесса необходимо увеличить скорость дис-
пергирования за счет более интенсивной турбулизации (перемеши-
вания) системы.
Третий случай определяется очень быстрой реакцией, проте-
кающей на поверхности раздела фаз при осуществлении, напри-
мер, процесса газ—жидкость. Следовательно, процесс лимитируется
самой химической реакцией, протекающей на внешней поверхно-
сти зерна катализатора, что возможно, если ее скорость значитель-
но превосходит скорость внутренней диффузии, но намного мень-
ше скорости внешней диффузии. В этом случае процесс протекает
во внешнекинетической области.
Четвертый случай характеризуется плохим перемешиванием
в дисперсной фазе. Следовательно, скорость процесса определяется
скоростью диффузии реагентов из потока к внешней поверхности
зерна катализатора или, наоборот, скоростью диффузии продуктов
от катализатора в поток.
Подобный гетерогенно-каталитический процесс протекает,
главным образом, во внешней диффузионной области. Для увеличе-
ния общей скорости процесса необходимо в этом случае увеличи-
вать поверхность раздела фаз.
Для гетерогенных процессов наиболее характерно их протека-
ние в диффузионной области. Однако применение современных ин-
тенсивных приемов турбулизации потоков и развития поверхности
соприкосновения фаз позволяет перевести процесс из диф-
фузионной области в кинетическую. Кроме того, при повышении
температуры гетерогенный процесс может перейти из кинетичес-
кой области во внешнедиффузионную.
Таким образом, для достижения необходимых результатов лю-
бого химического процесса целесообразно располагать техноло-
гическими способами ведения этого процесса. Для этого необхо-
димо уметь: правильно выбирать вариант осуществления процесса
(последовательный или параллельный, периодический, непрерыв-
118 Часть!. Теоретические основы технологии крупнотоннажных ...
ный или полунепрерывный); управлять рабочими концентрациями;
управлять температурными режимами; создавать развитую поверх-
ность контакта гетерогенных фаз; поддерживать активность ката-
лизатора.
Организация периодических, полупериодических, сменно-цик-
лических и непрерывных процессов была рассмотрена ранее.
Что касается управления рабочими концентрациями, то на
практике для этой цели используются следующие способы: рецир-
куляция непревращенных реагентов; рециркуляция одного из реа-
гентов (или самого продукта реакции); многоточечный подвод ис-
ходных веществ в один реактор или в разные реакторы каскада;
секционирование реакционного объема аппарата.
Рециркуляция непрореагировавших исходных веществ позволяет
не только изменять концентрации реагентов в реакторе, но и более
полно использовать сырье. Рециркуляция одного из реагентов (обыч-
но менее реакционноспособного) дает возможность достигнуть боль-
шей конверсии и селективности химического процесса. В ряде слу-
чаев за счет такой рециркуляции удается регулировать (иногда
тормозить) некоторые высокоэкзотермические процессы.
Подвод же реагентов в разные точки реактора или в разные ап-
параты каскада способствует не только регулированию скорости хи-
мического процесса, а следовательно, и скорости выделения тепла
при протекании реакций, но и повышению селективности процес-
са. Как правило, в разные точки подается наиболее реакционно-
способный компонент. Секционирование приводит к увеличению
средней движущей силы процесса за счет снижения продольного
перемешивания и поэтому находит наибольшее применение в ап-
паратах смешения. Секционирование может быть выполнено в од-
ном аппарате путем расчленения его на отдельные составные час-
ти, последовательно или параллельно соединенные между собой,
либо путем разделения одного реакторного устройства на ряд са-
мостоятельных реакторов, соединенных последовательно, т.е. на
каскад реакторов меньшего объема.
Организация движения реагентов в секционированном аппара-
те может быть построена как по принципу прямотока, так и по прин-
ципу полного или ступенчатого противотока, который чаще всего
применяют в гетерогенных системах, например газ—твердое тело.
Как уже отмечалось, в зависимости от способа подвода или от-
вода тепла в реакционном устройстве тепловой режим может быть
изотермическим, адиабатическим или политермическим.
Глава 3. Технологическое оформление реакторных полсистем 119
Управление температурным режимом может осуществляться
двумя способами: непрерывным и ступенчатым. Для непрерывно-
го отвода или подвода тепла реактор должен иметь поверхность теп-
лообмена, расположенную в зоне реакций. С целью ступенчатого
теплообмена поверхность теплообмена размещается вне зоны ре-
акции, те. выносится в отдельную часть реактора или вообще вы-
носится из него. При этом тепло может отводиться как при подаче
теплоносителя в теплообменное устройство, так и за счет испаре-
ния части сырья, продуктов реакции (в случае жидкофазного про-
цесса), а также за счет подачи захоложенного сырья. Подвод тепла
может осуществляться при подаче теплоносителя в теплообменное
или реакционное устройство. Следовательно, в качестве теп-
лоносителей могут быть использованы сырье и продукты реакции,
традиционные теплоносители, катализаторный раствор и др.
В некоторых случаях требуется сочетать непрерывный теп-
лообмен со ступенчатым отводом или подводом тепла.
Методы управления температурными режимами процессов не-
обходимо рассматривать во взаимосвязи с управлением рабочими
концентрациями. Действительно, количество выделяемого или по-
глощаемого тепла в значительной степени зависит от скорости ре-
акций, которая в свою очередь определяется концентрацией реа-
гентов. Следовательно, регулировать рабочие температуры можно,
изменяя концентрации реагентов. Вместе с тем температурный ре-
жим в значительной степени определяет концентрации реагентов
в реакторе.
Для гетерогенных процессов большое значение имеет созда-
ние развитой поверхности контакта фаз. Причем в таких процессах
скорость подвода и отвода как реагентов и продуктов реакций,
так и тепла определяется размером поверхности взаимодей-
ствующих фаз. Увеличить эту поверхность можно следующими
методами: эмульгированием (в случае несмешивающихся жидко-
стей), распылением систем газ—жидкость, барботажем, создани-
ем пленки, созданием движущегося, кипящего или суспендиро-
ванного слоя, а также измельчением твердых частиц для процес-
сов с твердой фазой.
Для каталитических процессов самое большое значение имеет
поддержание активности катализатора. Она может поддерживаться
на должном уровне частичной сменой отработанного катализато-
ра, регенерацией катализатора в самом реакторе или вне его, цир-
куляцией катализатора с его регенерацией и другими способами.
120 Часть 1. Теоретические основы технологии крупнотоннажных ...
КЛАССИФИКАЦИЯ РЕАКТОРНЫХ УСТРОЙСТВ
В реакторных устройствах при проведении собственно химиче-
ского превращения протекают различные физические процессы (ги-
дродинамические, тепловые, диффузионные и др.), с помощью ко-
торых создаются необходимые условия.
Для осуществления физических процессов в реакторных уст-
ройствах используются различные конструктивные элементы (ме-
шалки, контактные устройства, теплообменники и др.). Так как со-
четаний этих элементов и реакционных процессов может быть
много, то и количество реакторных устройств также значительно.
Для реакторов существуют общие принципы, на основе кото-
рых можно найти связь между их конструкцией и основными зако-
номерностями химического процесса, в них протекающего.
Как процессы, протекающие в реакторных устройствах, так
и сами реакторные устройства можно классифицировать по сле-
дующим признакам: режиму работы (периодические или непре-
рывные), гидродинамическим и тепловым режимам, а также физи-
ческим свойствам реагентов и продуктов реакций.
Выбор того или иного типа реакторного устройства обуслов-
ливается требуемой селективностью химических превращений ис-
ходных веществ, а также производительностью по целевому про-
дукту (целевым продуктам). Реакторное устройство должно также
удовлетворять ряду требований, позволяющих эффективно прово-
дить химические процессы. К таким требованиям относятся:
Ф возможность размещения в реакторе необходимого количества
катализатора максимальной активности;
Ф создание требуемой поверхности контакта взаимодействующих
реагентов и катализатора, а также отдельных фаз;
Ф обеспечение необходимого гидродинамического режима дви-
жения реагентов и фаз;
Ф обеспечение необходимого теплообмена при подводе или от-
воде тепла;
Ф наличие необходимого реакционного объема;
Ф поддержание необходимого режима процесса и др.
Реакторные устройства должны также обеспечивать опти-
мальную скорость реакций. Кроме того, выбор конструктивного
типа реактора зависит от условий проведения процессов и свойств
участвующих в них веществ.
Глава 3. Технологическое оформление реакторных полсистем 121
Таким образом, к важнейшим факторам, определяющим уст-
ройство реакторного аппарата, можно отнести:
Ф режим работы (периодический, непрерывный или полунепре-
рывный);
Ф температуру и давление, при которых протекают процессы; фи-
зические и химические свойства исходных веществ и продук-
тов реакций;
Ф агрегатное состояние исходных веществ и продуктов реакций;
Ф теплоты реакций и процесса в целом, а также скорость под-
вода (отвода) тепла;
ф способы интенсивного перемешивания реагентов; способы
подвода реагентов и отвода продуктов реакций;
Ф способ регенерации катализатора или его замены.
Все реакторы, применяемые в отрасли основного органичес-
кого и нефтехимического синтеза, могут быть отнесены к тому или
иному типу в зависимости от:
Ф состояния реагентов (газ, жидкость, твердое тело, газ—жид-
кость, жидкость—жидкость, газ—твердое тело, жидкость—твер-
дое тело);
Ф состояния катализатора: твердый (в стационарном состоянии,
в псевдоожиженном состоянии, в диспергированном состоя-
нии), жидкий;
Ф расположения поверхности теплообмена (внешнее, внутреннее);
Ф способа отвода тепла (через поверхность теплообмена, за счет
испарения реагентов или продуктов реакций, за счет подачи
холодных реагентов);
Ф способа диспергирования газа, жидкости и твердых частиц (ре-
агентов и катализатора);
Ф способа развития поверхности контакта фаз.
Рассмотренные факторы в значительной степени определяют
конструкции вспомогательных устройств (перемешивающие, теп-
лообменные устройства и т. д.).
По конструкции реакторные устройства разделяют на:
О реакторы типа реакционной камеры;
© реакторы типа колонны;
© реакторы типа теплообменника;
0 реакторы типа печи.
В частности, для процессов газ—жидкость конструктивное
оформление определяется методом развития поверхности контакта
122 Часть 1. Теоретические основы технологии крупнотоннажных ...
газовой и жидкой фаз, т. е. приемом увеличения поверхности жид-
кой фазы. Процессы газ—жидкость проводят в:
Ф пленочных реакторах с насадкой (насадочных колоннах): жид-
кость распределяется по поверхности насадки пленкой и стека-
ет вниз противотоком взаимодействующему с ней газовому реа-
генту, иногда применяется прямоток;
Ф колонных реакторах трубчатого типа (полые колонны);
Ф барботажных реакторах, которые могут иметь от одной до не-
скольких десятков колпачковых или ситчатых тарелок;
Ф полых башнях с разбрызгиванием жидкости (а также полых ка-
мерах с разбрызгиванием жидкости), в которых развитие по-
верхности жидкой фазы происходит за счет ее диспергиро-
вания, т. е. разбрызгивания, распыления пневматическим или
механическим путем в объеме или потоке газа;
Ф пенных реакторах, в которых газ проходит снизу вверх через
решетку и находящийся на ней слой жидкости, а иногда в мно-
гополочных пенных аппаратах;
Ф трубчатых реакторах (типа «труба в трубе»), которые исполь-
зуются главным образом для высокотемпературных процессов.
Для осуществления процессов газ—твердое тело в основном
применяются печи различного типа. И наконец, для осуществле-
ния процессов в системе жидкость—твердое тело применяют:
Ф реакторы с фильтрующим слоем, состоящие из ситчатых или
колпачковых тарелок (иногда колосниковых), на которых рас-
полагается слой пористого материала, через который пропуска-
ется жидкость;
Ф реакторы со взвешенным слоем зернистого твердого материала
в жидкости или с фонтанирующим слоем;
Ф реакторы с механическими мешалками, а также с пневма-
тическими перемешивающими устройствами (для растворения,
выщелачивания и т. д.). Эти же реакторы применяются для про-
ведения гомогенных реакций в жидкой фазе и взаимодействия
несмешивающихся жидкостей;
Ф реакторы со шнеком, которые редко используются в отрасли
основного органического и нефтехимического синтеза.
Реакторы для гетерогенных реакций в жидкой фазе обычно снаб-
жены мешалками разного типа и имеют теплообменные устройства
(обычно для косвенного теплообмена). Эти реакторы с мешалками
работают при режиме, близком к режиму полного смешения.
Глава 3. Технологическое оформление реакторных полсистем
123
Рис. 3.10. Типы перемешиваю-
щих устройств:
а —сопло; б — горелка; в —ме-
шалка; г — пневматический сме-
ситель
А, В
-г-
а
На рис. 3.10 представле-
ны наиболее часто встреча-
ющиеся устройства для пе-
ремешивания взаимодейст-
вующих реагентов или фаз.
Классификация реак-
торных устройств по конст-
руктивным элементам дана
в табл. 3.2. Там же приведены
гидродинамические режимы, агрегатное состояние реагентов,
формы теплообмена и примеры химических процессов, осуществ-
ляемых в этих реакторах. Конструкционные схемы реакторных ус-
тройств показаны на рис. 3.11-3.13.
По фазовому признаку реагентов, продуктов и катализатора ре-
акторы для гетерогенных процессов можно разделить на четыре
класса (см. табл. 3.3).
В химических реакторах подводить или отводить тепло можно
разными методами. Выбор способа теплообмена определяется
прежде всего теплотами реакций и температурными условиями хи-
мического процесса. Необходимо также учитывать физические, теп-
Рис. 3.11. Колонные реакторы (см. табл. 3.2)
124 Часть 1. Теоретические основы технологии крупнотоннажных ...
Рис. 3.12. Колонные реакторы (см. табл. 3.2)
а
Рис. 3.13. Реакторы (см. табл. 3.2):
a — шахтный; б — реакционная камера; в — печь
Таблица 3.2. Классификация реакторов по конструктивным элементам
Типы реакторов Конструкционная схема реактора Гидродинамический режим Агрегатное состояние реагентов Форма теплообмена и наличие поверхности теплообмена Пример химического процесса
без поверх- ности теплооб- мена с наружной поверхностью с внутренней поверхностью
Трубчатый Рис. 3,11, а Полное вытеснение Синтез винилацетата газофазным методом, окисление этилена до оксида этилена
Рис. 3.11,6 Тоже ж — + — Алкилирование бензола
Рис. 3.11, а. нввмимнвв ж-ж Получение диметилдиоксана
Колонный Рис. 3.12, а Полное вытеснение г-ж — — + Окисление углеводородов
Рис. 3.12,6 г-ж Нейтрализация НО
Рис. 3.12,в Полное вытеснение (газ), полное смешение (жидкость) г-ж — + — Окисление твердых парафинов
Рис. 3.12, а Полное вытеснение г-ж Окисление ацетальдегида
Рис. 3.12, д Полное вытеснение (газ), полное смешение (твердая фаза) г-г-т — + Синтез акрионитрила
Глава 3. Технологическое оформление реакторных полсистем 125
Продолжение табл. 3.2.
Колонный Рис. 3.12. е Тоже г + Хлорирование углеводо- родов
Рис. 3.12, ж Полное вытеснение (газ), полное смешение (твердая фаза) г-т — + — Получение оксида этилена
Рис. 3.12,3 Полное вытеснение г-г-т Фторирование углеводо- родов
Шахтный Рис. 3.13, а Тоже г-т + — — Дегидрирование этил- бензола
Реакционные камеры с перемешива- нием Рис. 3.13,6 Полное смешение |В111И1И^^мМИ! Гомогенный гидролиз жиров имасол,хлорбензола; получение винилхлорида из дихлорэтана
Тоже г-ж + + + Хлорирование этилена
ж-ж Сульфирование бензола
Печи Рис. 3.13,8 Полное вытеснение г-г — + + Парциальное окисление углеводородов в олефи- ны
126 Часть 1. Теоретические основы технологии крупнотоннажных .
Таблица 3.3. Классификация реакторов по фазовым состояниям реагентов и катализатора
Класс Фазовое состояние реагентов или среды Фазовое состояние катализатора Вид катализатора Конструктивный тип реактора Пример химического процесса
1 Труба и ли сетка Контактный Синтез синильной кислоты, окислительное дегидрирование спиртов
г т Фильтрующий или не- подвижный слой Трубчатый Гидрирование ароматических углеводородов и насыщенных альдегидов
мим —I Взвешенный спой Реакционная камора Хлорирование углеводородов
г т Движущийся Тоже Каталитический крекинг
2 ж т Неподвижный слой Трубчатый Реакции гидрирования
ж т Взвешенный слой Реакционная камера Получение олефинов
Взвесь в жидкости Колонный Синтез уксусной кислоты из метанола и СО при высоком давлении
ж т Равномерно распреде- ленные частицы в жид- кости Аппарат с мешалкой Алкилирование бензола жидкими олефинами
3 .. •н Хлорирование бензола
Тоже Тоже Тоже Барботажные колонны (барботаж газа через жидкость или взвесь твердого в жидкости) Окисление ацетальдегида в уксусную кислоту; гидратация ацетилена
Тоже Тоже Типа «Эрлифт» Жидкофазное окисление алкилбензолов
Тоже Тоже Тоже Аппарат с мешалкой Синтез этилхлорида и дихлорэтана
Алкилирование углеводородов в присутствии H.SO4
Колонные (эжектор-отстойник, тур- босмеситель-отстойник) Получение алкилсульфатов, нейтрализация сложных эфиров, хлорпроизводных углеводо- родов водным раствором щелочи
Глава 3. Технологическое оформление реакторных подсистем
128 Часть 1. Теоретические основы технологии крупнотоннажных ...
лофизические и химические свойства теплоносителя. По этому при-
знаку все реакторы могут быть разделены на два типа: 1) реакторы
с прямым теплообменом; 2) реакторы с косвенным теплообменом.
В случае прямого теплообмена передача тепла в реакторе осуще-
ствляется при непосредственном контакте реакционной смеси
и теплоносителя (при этом тепло может выделяться за счет экзо-
термической реакции или его необходимо подводить для осуще-
ствления эндотермической реакции).
Классификация реакторов с фильтрующим слоем катализато-
ра по типу подвода или отвода тепла приведена в табл. 3.4.
Таблица 3.4. Классификаияреакторов с фильтрующим (стационарным)
слоем катализатора по типу подвода и отвода тепла
Класс Тип подвода (отвода) тепла Вид реак- торного устройства Тип процесса Примеры химиче- ских процессов
1 Периодический Реактор с мешалкой Изотермический Реакции полимери- зации, поликонден- сации
2 За счет внешних теплооб- менников Трубчатый реактор Изотермический Получение акрило- вой кислоты окис- лением пропилена
3 За счет внутренних тепло- обменников: Колонный аппарат Политермический (на ступенях адиа- батический) Получение уксусной кислоты окислени- ем уксусного альде- гида
3.1. ступенчатый
3.1.1. с теплообменниками меж- ду полками Газофазное гидрирование
3.1.2. с охлаждением между полками за счет дополни- тельного введения холод- ных реагентов Гидрирование на- сыщенных альдеги- дов; синтез метано- ла из СО и Нг
Как было показано ранее, по гидродинамическому режиму ре-
акторы делятся на: 1) реакторы идеального вытеснения; 2) реакто-
ры полного смешения; 3) каскад реакторов полного смешения;
по температурному режиму на: адиабатические, изотермические
и политермические.
Глава 3. Технологическое оформление реакторных полсистем 129
Таблица 3.5. Классификация реакторов для гомогенных химических процес-
сов по температурному режиму
Процесс Тип реактора Температурный режим работы Пример химического процесса
Гомогенный процесс в газовой фазе Камерные реакторы с эжекторными смеси- телями газов и паров Камерный реактор с центробежным пере- мешиванием газовой смеси Трубчатый реактор с теплообменом между двумя газами Реактор типа «труба в трубе» с водным или другим охлаждением или нагревом Адиабатический Близок к изотермическому Политермический полного вытесне- Политермический идеального вытес- нения Прямая гидратация этилена Крекинг углеводородов Пиролиз углеводоро- дов в олефины, пиро- лиз ацетона в кетен
Гомогенный процесс в жидкой фазе Прямоточные аппараты большой длины с теп- лообменом Батарея из нескольких реакторов Многосекционные аппараты Реакторы с различными мешалками или други- ми перемешивающими устройствами Изотермический полного вытесне- Политермический идеального вытес- нения Тоже Изотермический полного смешения Полимеризация эти- лена, теломеризаиия олефинов, синтез альдоля Алкилирование угле- водородов жидкими олефинами Сульфатирование спиртов, нитрование ароматических угле- водородов
Гомогенный процесс в жидкой Колонные аппараты с теплообменными эле- ментами Изотермический идеального вытес- нения Нитрование парафи- нов Сю
фазе Насадочные колонны или колонны, секциони- рованные решетками Автоклавы периодиче- ского действия То же Тоже при повышенном давлении Реакция нейтрализа- ции Гомогенные реакции в жидкой фазе или гетерогенные - в сис- теме жидкость- жидкость
а х
130 Часть 1. Теоретические основы технологии крупнотоннажных ...
Классификация реакторов для гомогенных процессов по тем-
пературному режиму представлена в табл. 3.5.
ВЫБОР РЕАКТОРНЫХ УСТРОЙСТВ
Учитывая сложность процессов, протекающих в реакторах,
а также поливариантность самих реакторных устройств, выбор кон-
струкции реакторного устройства должен проводиться на основе
системного подхода. Тем более что очень часто наблюдаются кон-
курентные ситуации при организации технологического процесса
только в рамках реакторного устройства.
В связи с этим при выборе реакторного устройства необхо-
димо учитывать все технологические и экономические требова-
ния. При этом на каждом этапе следует проводить сравнение раз-
ных вариантов.
Одной из важнейших характеристик реакторных устройств яв-
ляется удельная производительность, численно равная количеству
основного продукта, получаемого с единицы реакционного объема
в единицу времени. В случае гетерогенно-каталитических процес-
сов объем продукта может относиться к единице массы катализа-
тора. Удельная производительность реактора связана непосредст-
венно с кинетикой химических процессов и типом реактора.
Сравнение непрерывно действующего реактора и реактора пе-
риодического действия показывает, что для достижения одной и той
же удельной производительности в аппаратах требуется разное вре-
мя. В реакторах периодического действия ко времени химического
процесса т необходимо добавлять время т0, затрачиваемое на за-
грузку, выгрузку, охлаждение и нагревание потоков.
Влияние дополнительного времени сильнее всего проявляется
при проведении быстрых химических реакций. В этом случае явно
невыгодно использовать реакторы периодического действия. И на-
оборот, для реакций, протекающих медленно и в малом объеме, мо-
гут применяться реакторы периодического действия.
Другим очень важным фактором при выборе реакторного уст-
ройства является метод подвода или отвода тепла. Известно, что
количество тепла, которое выделяется или поглощается при осу-
ществлении химического процесса, всегда пропорционально коли-
честву реагирующих веществ (реакционному объему). Вместе с тем
количество тепла, подводимого или отводимого при осуществле-
нии процесса, должно быть пропорционально поверхности тепло-
Глава 3. Технологическое оформление реакторных полсистем 131
обмена реактора. В свою очередь, объем реактора и его поверхность
неодинаково зависят от его диаметра.
Отсюда следует, что с увеличением размеров аппарата, в том чис-
ле его реакционного объема, уменьшается удельный отвод тепла
в нем, т. е. количество тепла, приходящегося на единицу объема ре-
актора. Поэтому с увеличением реакционного объема термические
условия работы реактора должны приближаться к адиабатическим,
а в небольшом по размеру реакторе — к изотермическим. Это зна-
чит, что при неинтенсивном теплообмене с окружающей средой на
практике целесообразно использовать реакторы большого размера
(аппараты с большими реакционными объемами), а при интенсив-
ном — с малыми реакционными объемами (небольшие аппараты).
При выборе типа реактора основное значение имеет анализ ки-
нетических факторов, их взаимосвязи, а также механизма процесса.
Сравнение выходов продукта (продуктов) в непрерывно рабо-
тающих реакторах идеального смешения и вытеснения, а также пе-
риодически действующего реактора идеального смешения и их ре-
акционных объемов при постоянной конверсии показывает, что
в случае последовательных реакций целесообразно использовать ре-
актор периодического действия или реактор вытеснения. Однако
если необходимо иметь интенсивный тепло- и массообмен между
реагирующими веществами, то можно применять каскад реакто-
ров с перемешиванием (при незначительном снижении выхода).
Для последовательных реакций, когда продуктом служит промежу-
точное вещество, объем реактора вытеснения всегда меньше объе-
ма реактора смешения (при одинаковой степени превращения). Та-
кое же соотношение между реакционными объемами реакторов
наблюдается в случае, когда скорость реакции уменьшается вслед-
ствие накопления продуктов.
Для проведения простых реакций первого порядка в каскаде
аппаратов идеального смешения их реакционные объемы должны
быть одинаковыми, а в случае когда реакции сложные и порядок
основной реакции выше, чем побочных реакций, объем каждого
последующего аппарата в каскаде больше объема предыдущего. При
низких концентрациях исходных веществ требуемый реакционный
объем будет меньше в случае использования аппаратов смешения,
а не аппаратов вытеснения.
Для реакций, протекающих медленно и требующих длительного
времени, наименьший реакционный объем будет при использова-
нии каскада реакторов с перемешиванием.
132 Часть 1. Теоретические основы технологии крупнотоннажных ...
Когда температура реакционной среды постоянна, а скорость
превращения не зависит от состава реакционной смеси, необхо-
димый реакционный объем аппарата не зависит от гидродина-
мического типа последнего.
Зависимость относительной производительности реакторов
вытеснения и смешения от конверсии для реакций различных по-
рядков приведена на рис. 3.14, из которого видно, что различие по
производительности тем больше, чем выше конверсия и порядок
реакции. Следовательно, в большинстве случаев наиболее высоко-
производительными являются реакторы непрерывного действия
идеального вытеснения. Вместе с тем широко распространенные
гетерогенные процессы, особенно сопровождаемые быстрыми вы-
сокоэндотермическими реакциями, требуют применения аппара-
тов с интенсивным перемешиванием взаимодействующих фаз. Для
увеличения производительности таких реакторных устройств час-
то применяют их секционирование или используют каскад после-
довательно соединенных аппаратов.
При выборе и сравнении реакторов по кинетическим харак-
теристикам процесса часто пользуются зависимостью между вели-
чиной обратной скорости реакции и конверсией. Этот метод поз-
воляет подобрать оптимальный по производительности вариант
аппаратурного оформления процесса для кинетического уравнения
практически любого типа реакции.
Большое влияние тип реактора оказывает на селективность
процесса и, следовательно, на качество получаемого продукта. Это
обусловлено прежде всего разным характером распределения кон-
центраций реагентов и продуктов в реакционном объеме аппара-
та. Этот факт особенно важно учитывать при проведении после-
довательных и параллельных реакций различного порядка.
Рис. 3.14. Зависимость относи-
тельной производительности ре-
акторов смешения и вытеснения
от конверсии для реакций:
1 — нулевого порядка; 2 — первого
порядка; 3 — второго порядка
Глава 3. Технологическое оформление реакторных полсистем 133
На качество продуктов основное влияние оказывает время их пре-
бывания в объеме реактора. Эти факторы изменяются по-разно-
му в реакторах разного типа. Например, в реакторе вытеснения
трудно обеспечить высокое качество продукта, так как наблю-
дается большой диапазон изменения времени пребывания про-
дуктов по сечению аппарата.
Существует общее правило, по которому на основе вида кри-
вой в координатах «конверсия — селективность» устанавливают
связь между селективностью химического процесса и его аппа-
ратурным оформлением. Если кривая этой зависимости падает, то
следует выбирать или аппарат смешения периодического действия,
или аппарат вытеснения. Для реакций же с возрастающей зависи-
мостью — аппарат смешения непрерывного действия.
На избирательность химического процесса большое влияние
может оказывать также способ подачи реагирующих веществ в ап-
парат. Реагенты могут вводиться одновременно для сохранения
высоких концентраций и, наоборот, подаваться постепенно для
обеспечения низких концентраций и, наконец, один реагент бу-
дет загружаться единовременно, а другой — подаваться постепен-
но (при сильно эндотермических реакциях).
Таким образом, при выборе и сравнении типов реакторных ус-
тройств одним из главных факторов являются кинетические зако-
номерности процесса.
Но, естественно, при выборе реакторного устройства необходимо
учитывать экономическую эффективность, основными из слагаемых
которой являются себестоимость продуктов и ее составляющие, а так-
же доход от удельной производительности реактора (рис. 3.15).
Необходимость экономической оценки объясняется тем, что,
как было показано ранее, технологические параметры (концент-
рации, температура, давление, соотношение реагирующих потоков
Рис. 3.15. Зависимость экономичес-
ких показателей от удельной произ-
водительности реактора:
1 — затраты на амортизацию и обслу-
живание; 2 — условно постоянные рас-
ходы; 3 — переменные затраты; 4 - себе-
стоимость; 5 — доход
134 Часть 1. Теоретические основы технологии крупнотоннажных ...
и др.) могут по-разному влиять на такие показатели, как конвер-
сия, селективность, удельная производительность реактора, а сле-
довательно, и на себестоимость продуктов.
ПУТИ ИНТЕНСИФИКАЦИИ РАБОТЫ
РЕАКТОРНЫХ УСТРОЙСТВ
Эффективность работы реакторной подсистемы определяется
прежде всего интенсивностью реакции (реакций). Главными пока-
зателями эффективности химических процессов являются: средняя
скорость реакции, конверсия за один проход через реактор, выход
целевого (целевых) продукта (продуктов) в расчете на израсходован-
ное сырье. При этом скорость реакции часто определяет производи-
тельность или интенсивность всего технологического процесса. Кон-
версия сырья за один проход в значительной степени определяет
расход энергии, так как ее затраты требуются на выделение непро-
реагировавшего сырья, доведение его до необходимых условий (тем-
пература, давление) и транспортировку. И наконец, выход целевых
продуктов определяет энергетические затраты на разделение и фор-
мирует предпосылки для создания безотходных производств, так как
чем больше эта величина, тем меньше побочных продуктов, кото-
рые требуется перерабатывать или доводить до товарного вида.
Скорость основной реакции и эффективность работы всей ре-
акторной подсистемы зависит от сочетания скоростей прямой, об-
ратной и побочных реакций, скорости диффузии (транспортиров-
ки) реагентов в зону реакции и продуктов химического превращения
из нее, а также интенсивности подвода (отвода) тепла.
В общем виде скорость всего процесса для гомогенных и ге-
терогенных превращений (для последних при неизвестной по-
верхности соприкосновения фаз) может быть представлена сле-
дующим образом:
и = KV\с или и = КЛс, 3.28
а для гетерогенных превращений при фазовом переходе веществ
u = KF\c, 3.29
где К — константа скорости процесса; Ас - изменение концентрации
реагирующих веществ или движущая сила процесса; F— поверхность
соприкосновения реагирующих фаз в гетерогенной системе; V— реакци-
онный объем.
Глава 3. Технологическое оформление реакторных подсистем 135
Отсюда видно, что для повышения скорости процесса необ-
ходимо увеличивать основные параметры Ac, F и К. Способы их
увеличения зависят от типа процесса. Константа скорости процес-
са представляет сложную величину и зависит от свойств и физиче-
ских характеристик реагирующих веществ, тепло- и массообмена,
гидродинамических условий проведения процесса (скоростей по-
токов, степени перемешивания). Однако определяющее значение
для повышения скорости процесса имеет скорость реакций, а она,
в свою очередь, зависит от чистоты реагирующих веществ, условий
(температуры, давления и т.д.) в реакторе, а также типа и состоя-
ния катализатора.
Таким образом, интенсифицировать работу реакторной под-
системы можно прежде всего за счет выбора наиболее интенсивного
катализатора, который позволит не только увеличить конверсию ре-
агентов за один проход, но и повысить селективность процесса.
При выбранном катализаторе процесс можно интенсифици-
ровать, меняя в определенных пределах условия проведения про-
цесса (температуру, давление). Для этого необходимо определить
их оптимальные значения, так как зависимость скоростей реакций
от условий процесса достаточно сложна. Интенсивность всего про-
цесса в значительной степени зависит от интенсивности подвода
реагентов в зону реакций и отвода продуктов реакций из нее.
Теперь рассмотрим влияние различных параметров на все про-
цессы, протекающие в реакторной подсистеме. Тогда будет ясно, за
счет каких параметров в каждом случае можно интенсифицировать
процесс при выбранном катализаторе.
В целом повышение температуры значительно увеличивает
константу скорости реакции. Для большинства процессов, про-
текающих в кинетической области, зависимость константы ско-
рости реакции от температуры определяется уравнением Аррени-
уса 3.20.
Из уравнения 3.20 видно, что реакции с большими энергиями
активации значительно более чувствительны к изменениям темпе-
ратуры, чем реакции с малыми энергиями активации, первые бо-
лее чувствительны и к изменению температуры в области низких
температур, чем в области высоких.
Кроме того, из этого уравнения также видно, что скорость пря-
мой реакции с повышением температуры должна все время уве-
личиваться. Тем не менее на практике для интенсификации об-
щего процесса не всегда требуется беспредельное увеличение
136 Часть 1. Теоретические основы технологии крупнотоннажных ...
температуры. Как было показано ранее, для всех обратимых эк-
зотермических процессов с повышением температуры снижается
равновесный выход продуктов и при некоторой температуре ки-
нетика процесса вступает :в противоречие с термодинамикой. Это
обусловлено тем, что, несмотря на повышение скорости прямой
реакции, выход ограничивается равновесием и, более того, с по-
вышением температуры равновесие сдвигается влево. Общая за-
висимость выхода от температуры для такого типа реакции пред-
ставлена на рис. 3.16,а. С увеличением температуры начинает
интенсивно идти обратная реакция и общая скорость процесса
снижается, поэтому необходимо проводить процесс при оптималь-
ной температуре. При наличии же побочных реакций повышение
температуры часто приводит к их интенсификации, в результате
чего снижается выход продукта (рис. 3.16,6) и оптимальная тем-
пература будет ниже, чем в случае отсутствия побочных реакций.
Это относится к таким процессам, как производство метанола,
высших спиртов и т. д.
Для эндотермического процесса высокие температуры более
благоприятны, чем для экзотермического, поскольку с повышени-
ем температуры повышается как константа скорости, так и кон-
станта равновесия. Однако и в этом случае выход растет только до
определенного значения (рис. 3.17). Следовательно, температуру це-
лесообразно повышать только до конкретного предела.
Во многих процессах при высоких температурах реагирующие
вещества начинают интенсивно испаряться из зоны реакций.
а
Рис. 3.16. Зависимость выхода продукта от температуры для экзотермиче-
ской обратимой реакции (а) и для процесса, сопровождающегося побоч-
ными реакциями (б):
хРавн ~ равновесный выход; хтах — максимальный выход, соответствующий
оптимальной температуре Т, пунктирная кривая — выход в отсутствие побочных
реакций
Глава 3. Технологическое оформление реакторных полсистем 137
Рис. 3.17. Зависимость выхода продукта от температуры для эндотермиче-
ских обратимых реакций
Рис. 3.18. Зависимость константы скорости реакции к (1) и коэффициен-
та диффузии D (2) от температуры Т
В общем случае для реакций, протекающих в кинетической об-
ласти, значение константы скорости с повышением температуры
обычно резко возрастает, следовательно, скорость всего процесса
значительно увеличивается. Для реакций, протекающих в диффу-
зионной области, значение константы растет медленнее, так как
в данном случае она зависит от коэффициента диффузии, в свою
очередь меняющегося с изменением температуры (рис. 3.18).
В общем случае оптимальная температура процессов зависит
от природы и концентрации реагентов, конверсии их в продукты
реакций, давления в реакторе, степени перемешивания и, нако-
нец, активности катализатора. Поэтому выбор температуры дол-
жен осуществляться в каждом конкретном случае с учетом этих
факторов.
В целом для гетерогенных химических процессов, общая ско-
рость которых определяется как скоростью собственно химических
реакций, так и скоростью массопереноса, зависимость константы
скорости процесса от температуры оказывается достаточно слож-
ной (рис. 3.19).
Одним из важных факторов, влияющих на скорость химических
процессов, является давление. Для реакций, протекающих в присут-
ствии катализатора, давление может влиять на значение константы
скорости, время контакта, адсорбцию и др. Изменение давления мо-
жет оказывать влияние на смещение химического равновесия и, сле-
довательно, на конверсию исходных веществ в продукты реакций.
Наибольшее влияние оказывает давление на скорость про-
цессов, идущих в газовой фазе или же при взаимодействии газов
138 Часть 1. Теоретические основы технологии крупнотоннажных ...
Рис. 3.19. Зависимость 1п£ от \/Г.
I - диффузионная область; II — промежуточная область; III — кинетическая
область
Рис. 3.20. Зависимость скорости газофазных реакций от давления
для реакций различного порядка п
с жидкостями и твердыми реагентами. В меньшей степени давле-
ние влияет на процессы, протекающие в жидкой и твердой фазах.
В гомогенных процессах, протекающих в газовой фазе или в гете-
рогенных с участием газообразных реагентов, повышение давления
уменьшает объем газовой фазы и, соответственно, увеличивает кон-
центрации взаимодействующих веществ. Следовательно, повыше-
ние давления в этих случаях равносильно росту концентрации реа-
гентов.
Влияние давления отражается кинетическими уравнениями.
В частности, скорость гомогенного процесса в газовой фазе мож-
но выразить следующим образом:
г - dPn / dr = К\Р, 3.30
где Рп — парциальное давление продукта в газовой фазе; ДР-движущая
сила процесса.
Давление наиболее сильно интенсифицирует реакции высокого
порядка (рис. 3.20). В общем случае:
г = (р(Ру-\ 3.31
где п - порядок реакции.
Однако с ростом давления порядок реакции может меняться,
а константа скорости реакции — уменьшаться.
В промышленности широко применяют повышенное давление
для ускорения абсорбции, адсорбции, конденсации и других про-
цессов перехода компонентов из паровой фазы в жидкую или твер-
Глава 3. Технологическое оформление реакторных подсистем 139
дую. Это обусловлено тем, что скорость данных процессов прямо
пропорциональна давлению:
u = dc/dr = K{FP. 3.32
Если же в процессе синтеза требуется осуществлять десорбцию
газов и испарять жидкости, то для ускорения процесса и повыше-
ния выхода продукта необходимо снижать давление, а часто при-
менять вакуум.
Для оценки влияния давления на константу равновесия можно
использовать принцип Ле-Шателье:
KN = K0P~^, 3.33
где KN — константа равновесия; Р— общее давление газовой смеси; АГ- мольная
доля компонентов.
Из уравнения 3.33 видно, что с увеличением давления при про-
ведении реакций, идущих с уменьшением объема (A7V < 0), кон-
станта равновесия увеличивается. Если же реакция протекает с уве-
личением объема (A7V> 0), то наблюдается обратный эффект.
Следовательно, для обратимых реакций, протекающих
с уменьшением объема, скорость реакции и выход продуктов бу-
дут возрастать с повышением давления за счет увеличения текущих
концентраций (парциальных давлений) компонентов и пониже-
ния равновесных парциальных давлений, т. е. сдвига равновесия
в сторону образования продуктов. При этом выход продуктов не-
прерывно увеличивается при повышении давления (рис. 3.21).
Вместе с тем скорость повышения выхода постепенно падает, по-
этому целесообразно повышать давление до определенного зна-
чения, т. е. до тех пор, пока наблюдается еще заметное увеличе-
ние выхода.
Для обратимых реакций, протекающих в газовой фазе с уве-
личением объема, увеличение давления приводит к увеличению вы-
хода до достижения равновесия. Это обусловлено возрастанием те-
кущих концентраций исходных реагентов. При приближении
к равновесию выход продуктов достигает максимального значения,
начинает снижаться (см. рис. 3.21). Это обусловлено уменьшением
KN и соответственным увеличением равновесных концентраций ис-
ходных реагентов.
Отметим, что в промышленности применение повышенного дав-
ления для проведения реакций в газовой фазе, идущих с увеличени-
ем объема, как правило, связано с использованием давления в пре-
140 Часть 1. Теоретические основы технологии крупнотоннажных ...
дыдущих или последующих операциях, а также стадиях производст-
ва. По крайней мере, после проведения реакций должна быть воз-
можность использовать это давление.
Кроме того, необходимо учитывать, что при повышенных дав-
лениях применяется реактор меньших размеров.
Для процессов, протекающих в жидкой и твердой фазах, не-
большое повышение давления не сказывается заметно на скорости
процесса.
Влияние концентрации реагентов на скорость реакций и всего
процесса хорошо видно из уравнения 3.28, из которого следует, что
скорость прямо пропорциональна Ас. Увеличение Ас может быть
достигнуто повышением концентрации исходных реагентов. Имен-
но этот путь интенсификации процессов наиболее распространен
в технологии.
Однако этот путь не всегда может быть приемлем, так как вы-
сокие начальные концентрации реагентов могут вызвать чрез-
мерное увеличение скорости процесса и при большой теплоте ре-
акций могут возникнуть трудности с отводом тепла. Кроме того,
существуют реакции, для которых повышение концентраций ре-
агентов не только не дает существенного эффекта, но может даже
привести к снижению скорости процесса. Это обусловлено спе-
цификой зависимости скорости от концентрации (рис. 3.22, кри-
вая 4). На рис. 3.22 представлена зависимость скорости реакций
от концентраций для реакций различного порядка. Так, для реак-
Рис. 3.21. Зависимость выхода продукта от давления для обратимых
реакций; в газовой фазе (t, Т, сА, св = const)
Рис. 3.22. Зависимость скорости процесса от концентрации реагентов для
реакций:
1 — нулевого порядка; 2 — первого порядка; 3 — выше первого порядка;
4 — гетерогенно-каталитических
Глава 3. Технологическое оформление реакторных подсистем 141
ций нулевого порядка (кривая 1) скорость постоянна и не зави-
сит от концентрации реагентов; для реакций первого порядка
(кривая 2) наблюдается линейная зависимость; для реакций выше
первого порядка (кривая 5) - экспоненциальная, а для гетероген-
но-каталитических реакций (кривая 4) кривая зависимости ско-
рости от концентрации проходит через максимум, т. е. при опре-
деленной концентрации наблюдается снижение скорости реакции.
Для обратимых реакций влияние начальных концентраций на
скорость проявляется в большей степени, чем для необратимых.
Так, для обратимых реакций, протекающих с увеличением общего
числа молей, повышение концентрации реагента увеличивает ско-
рость прямой реакции, но одновременно уменьшается движущая
сила процесса из-за снижения равновесия конверсии. Следователь-
но, для каждой конверсии реагентов необходимо выбирать такую
начальную концентрацию реагентов, которая обеспечила бы мак-
симальную скорость превращения.
Кроме того, необходимо учитывать, что при взаимодействии
нескольких реагентов содержание каждого из них влияет на ско-
рость. Причем избыток одного из них (нестехиометрическое соот-
ношение) позволяет создавать благоприятные условия для скоро-
сти процесса и более полного превращения другого за один проход
(например, синтез винилхлорида).
Увеличение концентрации каждого из компонентов может быть
достигнуто не только за счет подачи реагентов в разных соотноше-
ниях, но и за счет рециклов по компонентам.
Одним из основных способов увеличения скорости химиче-
ского процесса является перемешивание реагентов. Причем пе-
ремешивание увеличивает коэффициент массопередачи или кон-
станту скорости процесса вследствие перехода от молекулярной
диффузии к конвективной. При этом снижается диффузионное
сопротивление, препятствующее взаимодействию компонентов.
Наиболее целесообразно увеличивать степень перемешивания вза-
имодействующих веществ при осуществлении процессов, про-
текающих в диффузионной области. При этом увеличивать сте-
пень перемешивания можно до тех пор, пока общая константа
скорости процесса не перестанет зависеть от коэффициентов пе-
реноса D, т. е. до перехода процесса из диффузионной области
в кинетическую. Дальнейшее увеличение перемешивания в про-
точных аппаратах снижает движущую силу процесса и скорость
реакции.
142 Часть 1. Теоретические основы технологии крупнотоннажных ...
Следовательно, в гетерогенных процессах, особенно проте-
кающих в диффузионной области, основное значение перемеши-
вания состоит в создании высокоразвитой поверхности контакта
взаимодействующих фаз, в быстром обновлении этой поверх-
ности, в ускорении процессов тепло- и массопереноса в реакци-
онном объеме.
В гомогенных процессах более интенсивное перемешивание со-
действует выравниванию концентраций исходных веществ и тем-
ператур во всем объеме.
Вместе с тем перемешивание реагентов в аппаратах может ока-
зывать неблагоприятное влияние на работу реактора. К таким отри-
цательным гидродинамическим явлениям в потоке реагентов отно-
сятся: неравномерное распределение скорости в осевом (продольном)
направлении; случайное отклонение скоростей, возникающее в ре-
зультате теплового движения; турбулентные завихрения; нарушение
распределения скоростей вследствие молекулярной диффузии, осо-
бенно при ламинарном движении потока.
В гетерогенных системах увеличение скорости процесса в зна-
чительной степени зависит от увеличения поверхности со-
прикосновения фаз. Оно различно в зависимости от вида системы:
Г-Ж, Г—Т, Ж-Т, Ж—Ж (несмешивающиеся) и Т—Т. (Последний вид
системы встречается очень редко в технологии основного органи-
ческого и нефтехимического синтеза.)
Причем чаще всего стремятся увеличивать поверхность более
плотной фазы: в системах Г—Т и Ж—Т — твердой фазы, а в системе
Г-Ж — жидкой фазы. Для этого используют различные способы.
В частности, в системе Г-Ж основные способы создания развитой
поверхности соприкосновения фаз (F) можно разделить на 4 типа:
О распределение жидкости в виде тонкой пленки на поверхнос-
ти насадки, заполняющей реакционный объем реактора;
® развитие поверхности жидкой фазы диспергированием, т. е.
за счет разбрызгивания или распыления ее как пневматичес-
ким, так и механическим способами в объеме или потоке газа,
проходящего через реактор;
© развитие поверхности взаимодействия фаз диспергированием
газа в объеме жидкости путем барботажа;
© развитие поверхности контакта за счет создания слоя подвиж-
ной пены при пропускании газа снизу вверх через решетку пен-
ного аппарата и находящуюся на ней жидкость. В результате
образуется взвешенный слой подвижной пены в виде движу-
Глава 3. Технологическое оформление реакторных подсистем 143
щихся пленок, струй и капель жидкости, тесно перемешанных
с пузырьками и струями газа.
В системах Г—Т и Ж—Т большая площадь соприкосновения фаз
достигается за счет измельчения твердой фазы и следующих спосо-
бов перемешивания: перемешиванием измельченного твердого ма-
териала механическими мешалками; перемешиванием тонко из-
мельченного материала в объеме газа или жидкости при помощи
пневматических сопел; пропусканием потоков газа или жидкости
через неподвижный слой кусков или гранул твердого материала;
перемешиванием во взвешенном (кипящем, псевдоожиженном)
слое при пропускании газа или жидкости снизу вверх через слой
измельченного твердого материала.
Необходимо отметить, что в производствах основного орга-
нического синтеза твердые материалы в качестве реагентов встре-
чаются редко. Поэтому системы Г—Т и Ж—Т чаще всего встреча-
ются при использовании в качестве реагентов газов или жидкостей,
а твердыми материалами являются катализаторы.
В системе двух несмешивающихся жидкостей (Ж—Ж) по-
верхность контакта фаз создается за счет механического или пнев-
матического перемешивания, а также распыления одной из них,
и тогда капли этой жидкости поднимаются (если она легкая) или
опускаются (если она тяжелая) по аппарату, заполненному другой
жидкостью.
Суммарная скорость обратимой реакции может быть увеличена
за счет избирательного отвода одного или нескольких продуктов
из зоны реакции.
Отвод продуктов реакций может происходить за счет испарения
жидкости, кристаллизации, конденсации, избирательности абсорб-
ции или адсорбции. Для этого иногда используются совмещенные
реакционно-массообменные процессы, в том числе с применени-
ем мембран (см. главу 6).
Интенсификация работы реакторных подсистем будет наиболее
эффективной, если: их рассматривать в совокупности с другими под-
системами; использовать все закономерности реакционных процес-
сов, а также все способы интенсификации рассматривать совмест-
но, т. е. как сложную систему.
Глава 4. Подсистема разделения
S Фазовое равновесие.
S Обшие подходы к синтезу технологических
схем разделения.
S Методы синтеза технологических схем
разделения.
S Термодинамико-топологический анализ
структур диаграмм фазового равновесия.
S Методы разделения и принципы их выбора.
S Разделительные комплексы.
Массообменные процессы играют значительную роль в произ-
водствах основного органического и нефтехимического синтеза.
Они используются на разных этапах получения целевого продукта:
при очистке сырья, в реакторах при осуществлении реакций, при
улавливании целевых и побочных продуктов, а также непрореаги-
ровавшего сырья и, наконец, при выделении целевых продуктов,
веществ, образующихся при протекании побочных реакций, а так-
же вспомогательных веществ.
На первом этапе во многих случаях проводится очистка сырья.
Это обусловлено тем, что некоторые примеси являются «ядами»
для катализатора или, полимеризуясь на нем, резко снижают его
активность. Если даже примеси инертны по отношению к ката-
лизатору, их все равно необходимо выделять, так как они могут
накапливаться в системе и изменять оптимальные условия проте-
кания основных химических процессов (по крайней мере, за счет
разбавления реагентов). На этапе их выделения чаще всего исполь-
зуют ректификацию, хемосорбцию, адсорбцию, гетероазеотроп-
ную сушку и др.
Прежде чем смеси, получаемые в результате различных хими-
ческих реакций, направляются на улавливание целевых и побоч-
ных продуктов, а также непрореагировавших реагентов, они про-
ходят предварительную очистку от механических (твердых или
нелетучих) примесей, к числу которых относятся частицы катализа-
тора, полимерные примеси и др. Для их улавливания применяются
различные типы аппаратов (фильтры, центрифуги, циклоны, мем-
браны и др.).
Глава 4. Полсистема разделения
145
В ряде случаев в качестве катализатора используют вещества
кислотного или щелочного характера, которые попадают в про-
дукты реакций. Очистку продуктов реакций от этих примесей про-
водят нейтрализацией. Для улавливания продуктов реакций ис-
пользуют абсорбцию, конденсацию, в том числе конденсацию
смешения, и др.
Наибольшее применение процессы массообмена находят на
последнем этапе — при разделении смесей продуктов, получаю-
щихся в результате синтеза в реакционном устройстве. В зави-
симости от числа и состояния фаз для разделения используют раз-
личные методы и, соответственно, различную аппаратуру. Чаще
всего применяют не один метод, а сочетание нескольких методов
разделения, осуществляемых в комплексе аппаратов. Это связано
с тем, что разделению подвергают, как правило, сложные смеси,
содержащие различное число компонентов, включая частично рас-
творимые, а также смеси, содержащие во многих случаях термиче-
ски нестойкие и химически активные вещества. Кроме того, в ре-
акционных смесях часто присутствуют азеотропы, образованные
различным числом компонентов.
При разработке технологии безотходных, или «чистых», про-
изводств возникает сложная задача очистки сточных вод и газовых
выбросов. При этом также применяются различные методы разде-
ления. Если в подсистемах очистки сырья, предварительной очи-
стки реакционных продуктов и их улавливания задача решается
сравнительно просто с использованием одного или, по крайней
мере, двух методов разделения, то разделение всей реакционной
смеси с выделением целевых продуктов определенной степени чи-
стоты сопряжено с большими трудностями.
Эта подсистема является наиболее сложной вследствие большо-
го числа различных методов разделения и аппаратов, используемых
в ней. Поэтому большая часть энергетических затрат (часто >70%)
при производстве продуктов основного органического и нефтехи-
мического синтеза приходится на эту подсистему.
Энергозатраты на разделение зависят от технологической схе-
мы разделения, а выбор той или иной схемы определяется физико-
химическими и химическими свойствами как отдельных компонен-
тов, так и разделяемых смесей в целом. На определенных стадиях
разделения смеси любой сложности выделяются фракции, содер-
жащие различное число компонентов, которые, в свою очередь, так-
же подвергаются разделению. В связи с этим возникает необходи-
146 Часть 1. Теоретические основы технологии крупнотоннажных ...
мость в исследованиях физико-химических свойств всех смесей,
составляющих первоначальную сложную смесь. Число различных
г-компонентных составляющих z (где г=2,3,4,...) в «-компонент-
ной смеси можно определить по уравнению:
Z = n\/ г\(п-г)\ 4.1
В производствах основного органического и нефтехимическо-
го синтеза в реакционных узлах получаются, как правило, мно-
гокомпонентные смеси, состоящие из соединений различных клас-
сов, которые обладают различными свойствами (температуры
кипения, упругости паров, взаимная растворимость и др.). Многие
вещества (мономеры, полупродукты) являются химически актив-
ными и термически нестойкими. Как известно, соединения, при-
надлежащие к разным гомологическим рядам, склонны к образо-
ванию азеотропов различного типа, содержащих различное число
компонентов (гомогенные азеотропы, гетероазеотропы, седловин-
ные азеотропы, тангенциальные азеотропы и др.).
Большая энергоемкость процессов разделения определяет не-
обходимость создания оптимальных условий разделения реак-
ционной смеси на целевые продукты (или фракции, имеющие то-
варную ценность). Последнее может быть достигнуто в результате
исследования химических и физико-химических свойств отдельных
компонентов, различных составляющих смеси (бинарных, тройных
и других смесей), а также разделяемой смеси в целом. Именно на
этом этапе удается выявить все технологические ограничения для
процессов разделения, которые обусловлены как химическими
свойствами разделяемых веществ (термолабильность, реакционная
способность в условиях разделения и т.д.), так и их физико-хими-
ческими свойствами (азеотропия, относительная летучесть компо-
нентов и т. д.). В условиях этих ограничений и выбираются методы
разделения, позволяющие их преодолеть. Из всех отобранных та-
ким образом вариантов технологических схем на основе критерия
оптимальности выбирается наилучший. Так, например, возможные
последовательности выделения компонентов или фракций из ис-
ходной смеси определяются свойствами разделяемой смеси
и прежде всего термодинамическими ограничениями, обуслов-
ленными ее фазовой диаграммой. Для преодоления этих огра-
ничений и разделения разных смесей на чистые компоненты или
фракции применяют как отдельные приемы и методы разделения,
так и их сочетание.
Глава 4. Полсистема разлеления
147
Учитывая необходимость создания безотходных или малоот-
ходных производств, в каждом конкретном случае важно создать тех-
нологическую схему разделения смесей, позволяющую выделить все
чистые компоненты (продукты или полупродукты) и реже фракции,
которые могут найти применение в промышленности или исполь-
зоваться в качестве исходных реагентов, т. е. имеют товарную цен-
ность. При разработке технологии разделения смесей следует учи-
тывать многотоннажность производств, большую номенклатуру
продуктов и необходимость достижения достаточно высокой степе-
ни чистоты выделяемых продуктов.
Поэтому при разработке технологии разделения необходимо
решить следующие основные технологические задачи:
О определить последовательность выделения компонентов или
фракций из разделяемой смеси;
® выбрать разделительные комплексы функционально на-
правленного действия для разделения смесей с усложненной
структурой диаграмм фазового равновесия (азеотропных и ге-
тероазеотропных смесей, смесей, содержащих неконденсируе-
мые или нелетучие компоненты, смесей, содержащих химиче-
ски активные компоненты,и т.д.);
© осуществить синтез вариантов технологической схемы раз-
деления, т. е. определенной совокупности операторов разделе-
ния, связанных материальными и тепловыми потоками;
© выбрать оптимальную технологическую схему;
© выбрать конструкции разделительных аппаратов, входящих
в технологическую схему;
© уточнить параметры и показатели работы каждого аппарата
и технологической схемы в целом.
Все методы разделения основываются на определенных тер-
модинамических свойствах компонентов и их смесей. Важную
роль в данном случае играют законы о фазовом равновесии раз-
личного типа. Так, например, ректификация базируется на законах
о фазовом равновесии системы жидкость—пар, экстракция — жид-
кость-жидкость, адсорбция — газ—твердое тело или жидкость—
твердое тело, абсорбция — газ—жидкость и т.д. Кроме того, для
расчета аппаратов широко используют ряд физико-химических
свойств компонентов и их смесей таких, как вязкость, плотность,
поверхностное натяжение, теплопроводность, теплоемкость и др.
Все эти свойства, за небольшим исключением, зависят от состава
148 Часть 1. Теоретические основы технологии крупнотоннажных ...
многокомпонентной смеси нелинейно и определяются в основ-
ном экспериментально. В ряде случаев возможно применение и
расчетных методов.
ФАЗОВОЕ РАВНОВЕСИЕ
Для расчета массообменных процессов между отдельными фа-
зами, протекающих в системах жидкость—пар, жидкость—жидкость,
жидкость—жидкость—пар, жидкость—твердое тело, жидкость—газ,
необходимо знать составы равновесных фаз при определенных тем-
пературах и давлениях. Наиболее надежно эти данные могут быть
получены экспериментальным путем в соответствующих приборах.
Данные по фазовому равновесию жидкость—жидкость, полученные
при 20°C, необходимы, главным образом, для предварительных оце-
нок эффективности метода экстракции по сравнению с другими
методами разделения, а также для расчета экстракционных устано-
вок, флорентийских сосудов, используемых при гетероазеотропной
ректификации. Данные же, полученные при температурах кипения
и атмосферном (реже при других) давлении, необходимы для рас-
чета установок ректификации гетероазеотропных и расслаива-
ющихся смесей.
Фазовое равновесие системы жидкость—пар для гомогенных (по
жидкости) смесей чаще всего исследуется в изобарных условиях
(процесс ректификации протекает при Р=const).
Необходимо иметь в виду, что в реально отводимое время мож-
но изучить фазовое равновесие только в системах, содержащих не
более четырех компонентов. Более того, экспериментально мож-
но получить только дискретные данные, тогда как для расчетов
соответствующих процессов необходимо располагать аналитиче-
ским выражением, связывающим составы равновесных фаз. В свя-
зи с этим возникает задача получения аналитической зависимос-
ти одного состава фазы от другого в многокомпонентных системах.
Такого рода зависимости рассчитываются на компьютере с целью
выяснения всех физико-химических ограничений на процесс раз-
деления и для проведения автоматизированного проектирования
соответствующих установок.
Математические модели, отражающие взаимосвязь составов рав-
новесных фаз, могут быть получены на основе физических представ-
лений, удовлетворяющих термодинамике гетерогенных равновесий.
Глава 4. Полсистема разлеления
149
Термодинамические основы фазовых равновесий
В МНОГОКОМПОНЕНТНЫХ НЕИДЕАЛЬНЫХ СИСТЕМАХ
Если система, состоящая из г фаз и п компонентов, равновес-
на, то термодинамика позволяет установить взаимосвязь между раз-
личными ее переменными (температура, давление, состав и др.).
Для исследования общих качественных закономерностей фа-
зового равновесия как бинарных, так и многокомпонентных мно-
гофазных систем может быть использовано термодинамическое
уравнение фазового обмена, предложенное для бинарных и трех-
компонентных смесей Ван-дер-Ваальсом и обобщенное на много-
компонентные смеси А. В. Сторонкиным.
Уравнение Ван-дер-Ваальса — Сторонкина содержит всю инфор-
мацию о гетерогенной системе в равновесных условиях и для двух
равновесных фаз имеет вид:
п-1 п-1 _ _
v12JP=s12JT-х/)^]' 4-2
;=1 ;=1 L
где v12 - изменение объема при фазовом переходе 1—2; Р— равновес-
ное давление; 2 — изменение энтропии при фазовом переходе 1-2; Т-
температура, К; и-число компонентов; g-изобарно-изотермич^:
потенциал Гиббса; х., у. — составы жидкой и паровой фаз соответствен-
но, мол. доли.
При большом числе фаз уравнения типа 4.2 могут быть за-
писаны для любой пары фаз, и фазовое равновесие будет пред-
ставлено системой дифференциальных уравнений, в которой чис-
ло независимых уравнений будет на единицу меньше числа фаз.
В уравнении Ван-дер-Ваальса — Сторонкина изобарно-изотермиче-
ский потенциал Гиббса (G) является характеристической функцией
и позволяет определить все термодинамические свойства фазы. Ча-
стные производные от этого потенциала по числу молей одного из
компонентов были названы химическими потенциалами, которые
выражаются с помощью уравнения:
Pt =(dG/dnt )Т Р п,,
где п. — число молей z-го компонента; п — число молей иных компонентов
смеси.
При переходе к концентрациям х и, учитывая, что Ех,= 1, по-
лучаем:
150 Часть 1. Теоретические основы технологии крупнотоннажных ...
(Э?/Эх,)ГР;с =д,-дл, 4.3
где тс и ц„ — химические потенциалы z-го и и-го компонентов.
Удельный термодинамический потенциал Гиббса g для каждой
фазы многофазной многокомпонентной системы определяется
с помощью уравнения:
Л-1
dg = -sdT + vdP + У (ц,. - )Л,., 4.4
/=1
где -s = (dg/dT)Px, v = (dg/дР)Тх, fii-fin=(dg/дх^т.р^-
Для качественных исследований используется также уравнение
для нулевого потенциала, которое имеет вид:
sdT-vdP + ^ xid/j.i=0. 4.5
i=i
Из этого уравнения, в частности, и выводится приведенное ра-
нее уравнение Ван-дер-Ваальса — Сторонкина.
Условия равновесия между двумя фазами могут быть пред-
ставлены следующим образом:
Г(1)=Г(2).р(1)=р(2).д(1)=д(2). 46
Следовательно, многофазная многокомпонентная система бу-
дет находиться в состоянии равновесия, если температуры, давле-
ния и химические потенциалы во всех фазах равны.
Уравнение Ван-дер-Ваальса — Сторонкина, как уже указы-
валось, полезно для качественных исследований поведения ге-
терогенных систем, а именно для исследования общих законо-
мерностей фазовых равновесий при различных способах изменения
состава одной из фаз, исследования влияния температуры и давле-
ния на фазовое равновесие, общих свойств азеотропных смесей
и т. д. На основе этого уравнения А. В. Сторонкиным и его учени-
ками была построена общая качественная термодинамическая тео-
рия гетерогенных систем.
Что касается количественных закономерностей, то при реше-
нии дифференциального уравнения 4.2 возникают в общем случае
серьезные трудности. Последнее связано с тем, что химические по-
тенциалы не поддаются непосредственному экспериментальному
определению. Поэтому на практике пользуются величинами, ко-
торые могут быть определены экспериментально и дают возмож-
ность оценивать значения химических потенциалов расчетным пу-
Глава 4. Полсистема разделения
151
тем. В частности, такой величиной является фугитивность (лету-
честь), введенная Г. Льюисом. Обычно оценивают отношение ле-
тучести компонентов в реальных и стандартных условиях. В каче-
стве стандартного состояния для реальных газов принимается
состояние идеального газа при давлении, равном единице, и тем-
пературе, равной температуре реального газа. Для конденсирован-
ных фаз за стандартное принимается состояние чистой жидкости
при температуре кипения раствора.
Учитывая, что уравнение фазового равновесия предусматривает
равенство как химических потенциалов, так и стандартных хими-
ческих потенциалов, обычно в исследованиях фазового равновесия
жидкость—пар за стандартное состояние для обеих фаз принимает-
ся состояние чистого компонента при температуре кипения рас-
твора как для жидкой, так и для паровой фаз.
Выражение для химического потенциала любого компонента
можно записать в виде:
д,.=М1»+йПп///», 4.7
где д? - стандартный химический потенциал; /• и /-0 — летучесть /-го
компонента в рассматриваемом и стандартном состояниях соответственно.
Отношение летучестей принято называть активностью. Следо-
вательно, активность выражается равенством
4.8
Для количественной оценки отклонений реальной системы от
идеальной были введены соответствующие коэффициенты:
<Pi=ai /Ун
где - коэффициент летучести f-го компонента в паровой фазе; у, -
коэффициент активности /-го компонента в жидкой фазе.
В условиях фазового равновесия химические потенциалы ком-
понентов в равновесных фазах равны, а так как равны и стандарт-
ные химические потенциалы, то равны и их активности, т. е. of =а[ .
В случае отсутствия ассоциации в паровой фазе и при отно-
сительно небольших давлениях (1,5-105 Па) можно считать паровую
фазу идеальным газом. Для идеального газа
где If — давление насыщенных паров чистого /-го компонента.
152 Часть 1. Теоретические основы технологии крупнотоннажных ...
Так как af =Yixi-> то, приравнивая активности, получим:
4.9
Уравнение 4.9 широко используется для расчетов фазовых рав-
новесий, так как при принятых допущениях оно имеет достаточную
для инженерных расчетов точность. Если система жидкость—пар
рассматривается при повышенных давлениях или наблюдается ас-
социация молекул в паровой фазе, то в уравнение 4.9 вводится ко-
эффициент летучести, и оно принимает вид:
У,$Р = ТЛР?- 4Л0
Коэффициенты ф(к могут быть рассчитаны через вторые ви-
риальные коэффициенты. Тогда, при наличии данных о давлени-
ях паров чистых компонентов, задача моделирования фазового
равновесия жидкость—пар сводится к нахождению зависимости
коэффициентов активности отдельных веществ от состава жид-
кой фазы.
Математическое моделирование фазовых равновесий
Приемлемая математическая модель равновесной системы,
представляющая ее свойства, может быть получена на основе соот-
ветствующих теорий растворов.
Главным препятствием для широкого применения этих теорий
пока остается невозможность априорного расчета потенциала меж-
молекулярного взаимодействия с помощью статистической термо-
динамики и квантовой механики.
Лишь в очень простых случаях коэффициент активности мо-
жет быть рассчитан только по данным для чистых компонентов.
Для практических расчетов фазовых равновесий в настоящее
время используются упрощенные модели растворов, в которых про-
изводится некоторое усреднение величин, характеризующих меж-
молекулярное взаимодействие. К их числу относятся решеточные
модели, модели локальных составов, ячеечные модели, групповые
модели и их сочетания.
Решеточные модели. Используя эти модели, получают выра-
жение для избыточной свободной энергии Гиббса 6е, которая свя-
зана с коэффициентами активности. Избыточные функции удоб-
ны для характеристики отклонений реальных систем от свойств
идеальных. Так, например, для жидкой фазы избыточная свобод-
ная энергия Гиббса определяется соотношением:
Глава 4. Полсистема разлеления
153
GE =О-Оид = ЯТ^п^. 4.11
(=1
Для реальной смеси, взятой в произвольном количестве, связь
свободной избыточной энергии с коэффициентом активности /-го
компонента может быть выражена уравнением:
ЛПпу,.=(а<7/Эл,)рГ^^., 4.12
где п. — число молей компонента /.
В частности, на основе теории Флори и Хаггинса, базирующейся
на решеточной модели, избыточная свободная энергия для линей-
ных молекул разной длины может быть выражена соотношением:
gE =RT'^xi]n((pi/xj), 4.13
где <Pj = TjXj / X rjxj ~ объемная доля z-ro компонента; г. - число мест ре-
шетки, занимаемых z-й молекулой.
Для оценки и у. по формулам Флори и Хаггинса достаточно
знать отношение размеров молекул компонентов, данное отношение
приближенно можно приравнять к отношению молярных объемов.
Вместе с тем модели растворов такого типа характеризуются до-
вольно трудоемкими, плохо формализуемыми расчетами основных
свойств растворов, что затрудняет моделирование многоступенча-
тых процессов разделения.
Наиболее общий вариант решеточной модели раствора, пред-
ложенный Д. А. Баркером, учитывает как фактор молекулярных раз-
меров, так и зависимость энергии взаимодействия от способа кон-
тактирования молекул.
Формулы Баркера для коэффициента активности компонента
А раствора имеют следующий вид:
пА ( пА
1пГл = £0/1п(х;./х,охл)+гл(г/2-1)1п Xw/
i=i i=i
4.14
А >
где пА - число типов контактных участков молекулы A; Q - число контакт-
ных участков молекулы, относящихся к типу z (z = 1,..., Лд ).
Для молекулы спирта (0 = 1, Qo = 2, Q{ = 5) х. находят, решая
систему уравнений:
п
xi^x°jexp(-(Oy/kT)=yi, 4.15
i=i
где и - общее число типов контактных участков в системе; у. - доля кон-
тактных участков z-ro типа; х° - решение системы уравнений для чистого
компонента; (Оу — энергетические параметры.
154 Часть 1. Теоретические основы технологии крупнотоннажных ...
Модель Баркера позволяет описывать концентрационные за-
висимости различных термодинамических функций в весьма слож-
ных системах, за исключением водных.
Все приведенные уравнения дают термодинамически согла-
сованные концентрационные зависимости расчетных коэффи-
циентов активности компонентов, так как были выведены из вы-
ражения для величин g£(x;, ..., хкс учетом соотношения
Гиббса—Дюгема, в соответствии с формулами:
4.16
1пу,=1пуЛ +
Модели локальных составов. Плодотворной оказалась теория,
основанная на концепции локальных составов. В соответствии
с этой теорией раствор рассматривается как упорядоченная струк-
тура, в которой можно выделить для бинарной смеси два вида мо-
лекулярных микроансамблей с определенным координационным
числом.Один тип имеет в центре молекулу первого компонента,
другой — молекулу второго компонента. Зависимость между кон-
центрациями компонентов внутри микроансамбля с общей моляр-
ной концентрацией компонентов в растворе описывается соотно-
шением, учитывающим вероятность возникновения связей между
разноименными молекулами через распределение Больцмана:
хи/ха =[х/ ехР<-^' /ЛГ)]/[ху exp(-g^ /ЛТ)]. 4.17
Первое уравнение из этой серии было предложено в 1964 г.
Дж. М. Вильсоном. Он подставил в уравнение 4.13 вместо объемной
доли локальные объемные доли
z,- = nPiiV‘ , 4.18
j=i
где р — вероятность появления молекулы i вблизи молекулы J.
Полагая, что вероятность нахождения некоторой молекулы
в данной точке раствора описывается уравнением Больцмана,
ГMBA 4. ПОАСИСТЕМА РАЗАЕАЕНИЯ
155
Дж. М. Вильсон получил выражение для избыточной энергии Гиббса
для /с-компонентного раствора в следующем виде:
g£//?T = -Jx,.ln Хх,.Л..
,=1 L>!
4.19
Лу = и/ /• ехр(-<т / RT), 4.20
где (-у 8у > 4.21
- молярный объем /-го компонента в растворе.
Дифференцирование уравнения 4.19 по составу дает следую-
щую формулу для коэффициента активности /-го компонента:
С учетом уравнения 4.21, в котором Л и Л являются функ-
циями параметров с и с , бинарная система i—j характеризуется
двумя энергетическими параметрами с и с.;. Параметры су и cjt не-
посредственно связаны с разностью энергий взаимодействия меж-
ду парой молекул i—j (gtJ) и парой молекул i—i (g.i). С хорошим при-
ближением можно считать, что указанная разность энергий,
а следовательно, и параметры с., при небольшом изменении тем-
пературы не зависят от последней.
Влияние температуры на коэффициенты активности учиты-
вается через величины Л , см. 4.20. Это облегчает расчет парожид-
костного равновесия при моделировании ректификации.
Более того, уравнение Вильсона позволяет описывать фазовое
равновесие в многокомпонентных смесях на основе параметров би-
нарных составляющих.
Уравнением Вильсона удается описывать фазовое равновесие
в различных сильно неидеальных системах (например, в системах
спирты—углеводороды), за исключением расслаивающихся систем.
Концепция локального состава использовалась также в других
уравнениях. В частности, в уравнении Ренона—Праузница, в кото-
ром представление о локальных составах сочетается с двухжидко-
стной теорией Скотта, известное как уравнение NRTL'.
* От англ. «Non-Random Two Liquids» — «неслучайное (упорядоченное) двух-
жидкостное», что указывает на использование при выводе этого уравнения двух-
жидкостной теории Скотта и концепции локальных составов.
156 Часть 1. Теоретические основы технологии крупнотоннажных ...
В уравнении NRTL использовалось следующее выражение для
избыточной энергии Гиббса для ^-компонентного раствора:
gE /RT = Jx,. m/xffl I 4.23
1=1 \J=1 / т=1 ,
Коэффициент активности компонента i в этом случае опре-
деляется выражением
ltSjiGTJiXj
^Ъ=-к-----------
X GT,miXm
т=1
X Gt
J Т ,ij
к
V Gt X
T,ny m
m=l
^ijGT,ijXi
-----------
V GT x
T ,ny m
m=l
4.24
где Gr{, =exp(-a^); Ту =(giJ -gji)/RT=cv/RT; ay =ajt, 4.25
и для всех i справедливо: ац = т,7 =с(, =0. Здесь су, т - основные и приве-
денные энергетические параметры; а.. - параметр, характеризующий сте-
пень упорядоченности распределения молекул в растворе (проводя анало-
гию с квазихимической теорией Гуггенгейма, можно заключить, что
параметр ос. приближенно связан с координационным числом жидкости
соотношением а..~ 1/z).
Уравнение NRTL, как и уравнение Вильсона, позволяет опи-
сывать фазовое равновесие в неидеальных системах, но с его помо-
щью можно также описывать фазовое равновесие жидкость—жид-
кость—пар расслаивающихся растворов. Уравнение также пригодно
для описания фазового равновесия жидкость—жидкость. Д. С. Аб-
рамсоном и Д.М. Праузницем было предложено новое уравнение,
основанное также на концепции локальных составов — двухпара-
метрическое уравнение UNIQUAC", в котором была использована
квазихимическая решеточная теория Гуггенгейма. В предложенном
уравнении величины gE, и у. включают комбинаторную и остаточ-
ную части. Соотношения для коэффициентов активности в случае
бинарной смеси имеют следующий вид:
1пу,.=1пуГб+1пуГ, 4.26
1пукаиб =ln—+ —a In—+ ф L-^-L
х. 2 r/J
4.27
* От англ. « Universal Quasi Chemical» — универсальное, квазихимическое.
Глава 4. Подсистема разделения
157
т т-
1пуГт=-д,- 1п(0, +0;Т,7)+0Д -----J---------*—
JJ 1 0;+^
Ту = exp[-(z/j. - и* )ЛТ] = ехр[-су / 7?Т],
4.28
4.29
= (z /2) • (гу -qj) -(гу -1), z = Ю, 4.30
где с.., т - основные и приведенные энергетические параметры уравне-
ния соответственно; z — координационное число; в, <р. — соответственно
поверхностная и объемная доли молекул вида I.
0i=QiXl/^qjXj; 4.31
j j
где г. и q. — ван-дер-ваальсовый объем и поверхность молекулы i в едини-
цах стандартного сегмента, оцениваемые по Бонди.
Уравнение UNIQUACпри описании равновесия жидкость-жид-
кость дает лучшие результаты, чем уравнение NRTL.
Для практического использования уравнений, описывающих
зависимость у, (х), необходимо провести оценивание энергетичес-
ких параметров су. Наибольшее распространение получил метод на-
именьших квадратов. Часть переменных фазового равновесия рас-
сматривают как независимые (обычно состав и давление жидкой
фазы), остальные (зависимые) переменные рассчитывают на осно-
вании математической модели фазового равновесия.
Сумма квадратов расхождений экспериментальных и расчетных
зависимых переменных для п точек (целевая функция F) миними-
зируют по значениям энергетических параметров, например, для
бинарной смеси:
п п
4.32
1=1 1=1
или
F = (oy'£tfac,‘ - у^+Ейт^Т1™ - Тжсп}], 4.33
/=1 /=1
где (о - весовые факторы.
Групповая модель. Интерес для описания фазовых равновесий
представляет групповая модель. Эта модель исходит из предполо-
жения об аддитивности вкладов различных химических групп в тер-
модинамические свойства компонентов и смесей.
158 Часть 1. Теоретические основы технологии крупнотоннажных ...
Наибольшее развитие групповой метод получил в модели
UNIFAC", предложенной А. Фреденслундом, Р. Л. Джонсом
и Д.М. Праузницем. В этой модели сочетается групповой метод
и квазихимический метод Гуггенгейма в варианте модели локаль-
ных составов UNIQUAC. Комбинаторная часть коэффициента ак-
тивности в уравнении UNIFAC такая же, как и в уравнении
UNIQUAC. Остаточная часть коэффициента подсчитывается как
сумма групповых вкладов:
4.34
где v(i - число групп вида к в молекуле /; и - остаточные коэф-
фициенты активности группы к в растворе и чистой жидкости I
соответственно; суммирование производится по всем группам.
Зависимость коэффициента активности от группового со-
става раствора описывается аналогично соотношению 4.28:
1 - /YenWnm
т\ п
1п1\=^
9т = Qmxm / У Q„x„; х = У v^xi / У У v^Xj,
т т/ / j п> т if / к /’
Wnm =ехр[-(млш -«ии)/ЛТ]=ехр[-али/Т],
4.35
4.36
4.37
где хт — мольная доля групп т в растворе; апт, атп — параметры, характе-
ризующие взаимодействие каждой пары групп.
Расчеты показали, что модель UNIFAC обеспечивает точность
предсказания коэффициентов активности и парожидкостного рав-
новесия, достаточную для технологических целей. Ошибка в зна-
чении коэффициентов активности для большинства систем не пре-
вышает 10—12%. Модель позволяет также описывать равновесие
между жидкими фазами.
В настоящее время уже рассчитаны значения групповых па-
раметров для многих практически важных функциональных групп,
поэтому для применения модели UNIFAC необходимы только пара-
метры, учитывающие молекулярную структуру чистых компонентов.
На сегодняшний день известна целая серия модификаций рас-
смотренных уравнений, позволяющих упростить процедуру расче-
та коэффициентов активности и получить более точные данные.
’ От англ. «Universalfunctional group Activity Coefficients» — универсальные функ-
циональные групповые коэффициенты активности.
Глава 4. Поасистема разделения
159
Если известны коэффициенты активности компонентов в жид-
кой фазе, то, зная состав жидкой фазы при условии, что паровая
фаза идеальна, можно рассчитать концентрации компонентов в па-
ровой фазе, используя уравнение:
4.38
7=1
где а,л = /?°г, /(^гл) - относительная летучесть компонентов I и п; у.,
ул — коэффициенты активности компонентов i и п; If и 7^ - давления
паров чистых компонентов при температуре кипения раствора; п — число
компонентов.
Температура кипения раствора определяется в этом случае по
уравнению:
п
4.39
1=1
Задача построения качественных (адекватных эксперименталь-
ным данным и обладающих хорошими экстраполяционными свой-
ствами) моделей фазового равновесия не является на сегодняний
день окончательно решенной. При использовании быстродействую-
щих компьютеров и надежных алгоритмов численной оптимизации
целевых функций Fbcc очевиднее становится тот факт, что для слож-
ных фазовых равновесий имеет место неадекватность используемых
моделей, подтверждаемая статистическими методами. Отмеченная
проблема требует проверки тех положений теории растворов, кото-
рые лежат в основе распространенных уравнений для представле-
ния зависимости коэффициентов активности от состава раствора.
Данные по фазовому равновесию могут использоваться для вы-
яснения термодинамических ограничений на разделение реакцион-
ной смеси, а следовательно, и для последующего синтеза технологи-
ческих схем разделения смесей компонентов, полученных
в результате целевых химических реакций.
ОБЩИЕ ПОДХОДЫ К СИНТЕЗУ
ТЕХНОЛОГИЧЕСКИХ СХЕМ РАЗДЕЛЕНИЯ
Любую технологическую схему разделения можно представить
как набор операторов разделения (ректификационных, экстрак-
ционных, абсорбционных и других колонн), определенным обра-
зом взаимосвязанных между собой.
160 Часть!. Теоретические основы технологии крупнотоннажных ...
Задача синтеза оптимальной технологической схемы разделения
в самом общем виде заключается в следующем.
При известном составе и состоянии сырья, получаемого в ре-
зультате химических реакций (т. е. в реакционной подсистеме),
и заданных компонентах или фракциях, которые должны быть вы-
делены, и их качестве, необходимо выбрать: методы, которые мо-
гут быть применены на каждом этапе разделения, оптимальный на-
бор разделительных операторов, оптимальную схему потоковых
взаимосвязей между операторами и оптимальные параметры рабо-
ты каждого оператора (оптимальные не по отдельным операторам,
а для всей схемы разделения).
В качестве критерия оптимальности, как правило, выбирают-
ся минимальные суммарные приведенные затраты на разделение
для всей схемы в целом. Точный расчет приведенных затрат весьма
трудоемок и требует расчета всего оборудования, входящего в тех-
нологическую схему разделения. Поэтому для предварительных
оценок часто используют другие критерии, например, только энер-
гозатраты, так как они составляют большую часть от общих затрат
(от 50 до 80 %).
Расчет энергетических затрат на процесс разделения, например
ректификации, сравнительно прост, для него требуются только дан-
ные, полученные при статическом расчете ректификации. Для каж-
дой колонны эти затраты (пренебрегая затратами электроэнергии
на перекачку жидкостей) равны:
Э ~ Св.п (Qnod + Якуб ) + Сх.а
^конд + холод ’
4.40
где Свп, Сха — стоимость водяного пара и хладагента, руб; Qnod, Q^ — рас-
ход греющего пара в подогревателе исходной смеси и кипятильнике ко-
лонны, т или кДж; qKtmi, qxmod- расход хладагента в конденсаторе и хо-
лодильниках продуктов, т или кДж.
Если принять, что капитальные затраты К пропорциональны
энергетическим:
= 4.41
где а — коэффициент пропорциональности (величина постоянная или за-
висящая от диаметра колонны, числа тарелок, типа тарелки, рабочего дав-
ления и т.д.), то в качестве критерия оптимальности можно использовать
величину Э(1+а).
Глава 4. Поасистема разделения
161
Задача создания оптимальных схем разделения продуктов ос-
новного органического и нефтехимического синтеза является наи-
более сложной. Сложность этой задачи определяется прежде всего
поливариантностью выбора структуры технологической схемы.
Если рассматривать только ректификационное разделение на
чистые компоненты гомогенных зеотропных смесей, то число ва-
риантов технологических схем может быть выражено следующим
соотношением’, предложенным С.В. Львовым:
N =[2(п-1)]!/[п!(п-1)’.], 4.42
где п — число разделяемых компонентов.
Так, для разделения смеси, состоящей из 7 компонентов, воз-
можно 132 различных варианта схемы ректификации, а для смеси
из 10 компонентов — 4 862.
Сложность заключается в том, что ни один из вариантов не мо-
жет быть отброшен без тщательного исследования, так как любой
из них может оказаться оптимальным в данной области перемен-
ных (состав исходной смеси, набор относительных летучестей ком-
понентов, давления).
Если же учесть число возможных типовых процессов разде-
ления (5), то число вариантов технологических схем разделения
значительно увеличится и может быть определено по следующей
формуле:
АГ=[2(«-1)]!/[л!(«-1)!]лУ"-1. 4.42а
В отрасли основного органического и нефтехимического син-
теза очень редко встречаются многокомпонентные зеотропные сме-
си, состоящие из химически и термически стойких компонентов.
Обычно разделению подвергаются азеотропные, расслаивающиеся
смеси, смеси, состоящие из химически активных и термически не-
стойких веществ, и т. д. Перечисленные выше свойства отдельных
компонентов и смесей формируют определенные ограничения на
процессы разделения.
Учет всех ограничений приводит к значительному сокращению
числа вариантов технологических схем разделения. Важно только
* В уравнении 4.42 не учитываются схемы со связанными тепловыми и мате-
риальными потоками, которые пока не используются из-за трудности управления,
но являются самыми экономичными.
бас
162 Часть 1. Теоретические основы технологии крупнотоннажных ...
правильно выявить все ограничения и учесть их при синтезе тех-
нологической схемы.
МЕТОДЫ СИНТЕЗА ТЕХНОЛОГИЧЕСКИХ
СХЕМ РАЗДЕЛЕНИЯ
Для проведения синтеза оптимальных технологических схем
необходимо знать:
О Физико-химические и химические свойства как чистых компо-
нентов, так и всех смесей, составляющих данную много-
компонентную смесь. Наиболее важно знать температуры
кипения компонентов и смесей, параметры фазового равнове-
сия жидкость—жидкость, жидкость-газ, жидкость—пар, жид-
кость—твердое тело, а также химическую активность компо-
нентов и их термическую стойкость в процессе разделения. Эти
свойства позволяют выявить все термодинамические, химиче-
ские и технологические ограничения, которые необходимо учи-
тывать при синтезе технологических схем разделения.
© Возможности различных методов разделения, области их ис-
пользования, преимущества и недостатки.
© Конструктивные особенности и возможности применения раз-
личных разделительных аппаратов, располагать классифи-
кацией таких аппаратов с описанием их основных характе-
ристик.
О Структуру технологических комплексов различного функ-
ционального действия, состоящих из ряда аппаратов и приме-
няемых для разделения смесей, обладающих определенными
специфическими свойствами. Эти комплексы позволяют
преодолеть различные технологические ограничения, связан-
ные с азеотропией, и получить продукты нужного состава. Ком-
плексы могут состоять как из однотипных, так и разнотипных
разделительных аппаратов.
© Методы синтеза технологических схем разделения. С этой це-
лью должны быть рассмотрены как безмашинные методы, так
и методы, основанные на применении вычислительной тех-
ники. В последнем случае необходимо располагать математи-
ческими моделями как отдельных элементов и комплексов, так
и системы в целом.
© Методы оптимизации технологических схем разделения. Важ-
но помнить, что оптимизацию технологической схемы необ-
Глава 4. Полсистема разлеления
163
ходимо начинать с оптимизации структуры диаграммы фазово-
го равновесия разделяемой смеси, которая определяет термоди-
намические ограничения, связанные с азеотропией, и, следова-
тельно, последовательность выделения компонентов или
фракций. Далее могут быть использованы методы, базирующи-
еся на применении ЭВМ с использованием как глобальных
критериев оптимизации (например, минимальные суммарные
приведенные затраты), так и частных. Общий алгоритм разра-
ботки технологических схем разделения представлен на рис. 4.1.
Цель Операции
Рис. 4.1. Алгоритм разработки технологических схем разделения
164 Часть 1. Теоретические основы технологии крупнотоннажных ...
Как уже отмечалось, трудности синтеза схем разделения про-
мышленных многокомпонентных смесей обусловлены большим
числом компонентов и наличием в таких смесях азеотропов раз-
личной размерности, т. е. азеотропов, содержащих различное чис-
ло компонентов. Эти трудности усугубляются наличием областей
расслаивания, химически активными и термически нестойкими
компонентами и т. д.
В связи с этим, с одной стороны, с увеличением числа ком-
понентов количество вариантов схем увеличивается почти экспо-
ненциально, а, с другой стороны, с учетом всех ограничений, обус-
ловленных азеотропией и другими факторами, отсеивается или
исключается из рассмотрения большая их часть. Вместе с тем ис-
пользование различных способов преодоления ограничений фи-
зико-химического характера приводит к поливариантности тех-
нологических схем разделения. Следовательно, при выборе
оптимального варианта технологической схемы разделения весь-
ма актуальными являются задачи снижения размерности и разра-
ботка алгоритмов выбора схем при минимальном количестве про-
сматриваемых решений.
Существует несколько подходов к решению этих задач, в основе
которых лежат формальные методы снижения размерности. К их чис-
лу можно отнести использование различных эвристических правил,
применение метода динамического программирования для целена-
правленного поиска оптимального варианта на основе критерия оп-
тимальности, использование метода ветвей и границ, позволяющего
установить допустимые границы критерия оптимальности, интег-
рально-гипотетический, информационно-энтропийный, эволюци-
онный и другие методы, а также их сочетание.
Методы синтеза, основанные на эвристических правилах, за-
ключаются в том, что в результате предварительного анализа дей-
ствующих схем разделения формируется набор специальных пра-
вил, определяющих стратегию синтеза технологических схем. Эти
правила в целом отражают физико-химические закономерности
протекающих процессов и могут быть формализованы для исполь-
зования в процессе компьютерного моделирования.
Эвристические правила, предложенные различными авторами,
сводятся к следующим:
О для зеотропных смесей при ректификационном методе разде-
ления предпочтение отдается «прямой» последовательности
разделения, т. е. последовательности, в которой компоненты
Глава 4. Поасистема разделения
165
выделяются один за другим, начиная с компонента, обладаю-
щего наибольшей летучестью (имеющего наименьшую темпе-
ратуру кипения) в отдельных колоннах;
© компонент, содержание которого существенно превышает со-
держание всех остальных компонентов исходной смеси, дол-
жен отбираться первым в общей последовательности выделе-
ния компонентов или фракций компонентов;
© процесс разделения наиболее трудноразделимой пары компо-
нентов или наиболее трудноразделимых фракций должен про-
водиться последним в общей последовательности разделения;
О наиболее «агрессивный» по воздействию на аппаратуру ком-
понент должен выводиться из системы разделения в первую
очередь;
© выбирается вариант схемы, в котором отношение количеств
верхнего и нижнего продуктов в каждой колонне близко
к единице;
© выбирается вариант схемы, в котором разделение осуще-
ствляется в порядке уменьшения различий в значениях отно-
сительных летучестей разделяемых ключевых компонентов;
О разделяющий агент необходимо выделять непосредственно по-
сле аппарата, в который он вводился.
Рассмотренные правила не охватывают все методы и случаи раз-
деления. Они часто противоречат друг другу и отражают некоторые
приближенные оценки, применимые, главным образом, к ректифи-
кации зеотропных смесей, состоящих из химически и термически
стойких веществ.
Синтез технологических схем только на основе указанных эв-
ристических правил не может быть осуществлен достаточно надеж-
но. Некоторые из этих правил все же могут быть использованы
в случае выделения отдельных фракций при разделении полиазео-
тропных смесей или на определенном этапе, когда разделяются уже
зеотропные смеси. Такой этап возможен после выделения азеотро-
пообразующих компонентов азеотропной подсистемы, после «уда-
ления» азеотропов и выделения «агрессивных» компонентов, а так-
же химически активных и термически нестойких веществ.
По мере накопления опыта разделения различных смесей спи-
сок эвристических правил будет, безусловно, дополняться, а сами
правила трансформироваться и в ряде случаев расширяться. Вмес-
те с тем наиболее полно и точно можно осуществить синтез техно-
логических схем разделения (TCP) на основе глубокого изучения
166 Часть 1. Теоретические основы технологии крупнотоннажных ...
физико-химических свойств разделяемых смесей и анализа термо-
динамических закономерностей.
Эвристики часто могут выступать в качестве ограничений на
количество вариантов схем и позволяют свести задачу синтеза тех-
нологических схем к анализу значительно меньшего числа вариан-
тов. При этом остаются трудности формализации отбора и генери-
рования эвристик.
Метод динамического программирования в последнее время ис-
пользуется достаточно широко при синтезе технологических схем
разделения. Основная идея метода заключается в том, что опти-
мальные схемы синтезируют шаг за шагом, начиная с конца схе-
мы. В данном случае технологическая схема рассматривается как
многостадийный процесс разделения без обратных массовых
и энергетических потоков. На начальном этапе рассматриваются
колонны, в которых делятся бинарные смеси, а далее трех-, четы-
рехкомпонентные и т.д., с учетом оптимального варианта на пре-
дыдущем этапе.
В каждом случае отыскивается оптимальная по отношению
к принятому критерию технологическая схема разделения. Сле-
довательно, принцип динамического программирования заклю-
чается в том, что любая часть оптимального пути является оп-
тимальной. Это позволяет отыскать оптимальный путь поэтапно,
используя на каждом этапе части этого пути, найденные на преды-
дущих этапах.
В конечном счете можно вычислить значения критерия оп-
тимальности для всех схем и выбрать оптимальный вариант. До-
стоинством данного метода синтеза оптимального варианта техно-
логической схемы разделения многокомпонентных смесей является
строгий математический подход и снижение размерности задачи,
т. е. сокращение расчетов всех возможных колонн при разделении
многокомпонентной смеси. Однако учет рециркулируемых пото-
ков существенно усложняет метод динамического программирова-
ния. В связи с этим данный метод широко используется для синте-
за технологических схем разделения идеальных и зеотропных
смесей и весьма ограниченно для азеотропных.
Метод ветвей и границ является другим методом синтеза оп-
тимальных технологических схем разделения, заключающийся в ге-
нерировании дерева разделения исходной смеси и выделении на
этом дереве методом «поиска в глубину» оптимальной схемы раз-
деления. При этом используются соответствующие верхние и ниж-
Глава 4. Подсистема разделения
167
ние оценки критерия оптимальности синтезируемой схемы разделе-
ния. Согласно методу ветвей и границ, расчет каждого варианта схе-
мы производится от начала схемы к ее концу. Некоторое сокраще-
ние числа рассматриваемых вариантов различных элементов
достигается путем отбрасывания «ветвей дерева» разделения, если
значение критерия оптимальности для части схемы превосходит зна-
чение верхней оценки критерия оптимальности. За значение верх-
ней оценки критерия оптимальности принимается его значение для
наилучшей из рассчитанных к данному моменту схем разделения.
Недостатком этого метода является то, что одни и те же раздели-
тельные элементы, входящие в разные схемы, рассчитываются много-
кратно, т. е. в каждой схеме. Вместе с тем метод ветвей и границ дает
достаточно надежные результаты (так же как и предыдущий метод)
в случае разделения зеотропных смесей. Что касается азеотропных
смесей, то использование его в предлагаемом виде невозможно.
Интегрально-гипотетический метод предполагает синтез от не-
которой всеобъемлющей глобальной схемы к конкретной оп-
тимальной схеме разделения. Глобальная схема должна включать
все возможные варианты. Таким образом, интегрально-ги-
потетический метод включает в себя два основных этапа:
О синтез гипотетической обобщенной технологической схемы
разделения;
© анализ и оптимизация гипотетической обобщенной техно-
логической схемы.
В целом решение задачи синтеза оптимальной схемы разде-
ления с использованием этого метода сводится к решению задачи
определения значений коэффициентов структурного разделения
потоков и параметров элементов, входящих в исходную ги-
потетическую схему, которые обеспечивают оптимальное функ-
ционирование системы. Таким образом, задача синтеза в данном
случае сводится к непрерывной оптимизации. Синтез оптималь-
ных схем с использованием этого метода связан с большим объе-
мом вычислений. В этом случае постоянно приходится сталкиваться
с локальным оптимумом, и трудно найти глобальный оптимум, со-
ответствующий оптимальному варианту схемы.
Эволюционный метод заключается в том, что для исходной
(принятой за основу) схемы разделения генерируются «соседние»
схемы разделения с помощью определенных правил. Затем из них
выбирается схема, по которой достигается разделение с меньшими
затратами, и вновь генерируются «соседние» с выбранной схемой.
168 Часть 1. Теоретические основы технологии крупнотоннажных ...
Процесс прекращают, если найдена схема, характеризующаяся ми-
нимальными затратами. Таким образом, общая стратегия эволю-
ционного метода включает следующие этапы:
О синтез какого-либо простейшего исходного варианта схемы;
© определение в соответствии с некоторым коэффициентом эф-
фективности наименее эффективного элемента в исходном ва-
рианте;
© исключение этого элемента из схемы;
О модификация данного элемента;
© стыковка модифицированного элемента с оставшейся частью
схемы и коррекция схемы;
© определение коэффициента эффективности для вновь полу-
ченного варианта схемы. Указанные этапы итерационно повто-
ряются до тех пор, пока не будет синтезирована оптимальная
схема.
Недостатком этого метода является, как было указано ранее,
значительная вероятность получения локальных оптимумов.
Информационно-энтропийный метод можно рассматривать как
разновидность эвристического метода, хотя он имеет опре-
деленное теоретическое обоснование. По этому методу опти-
мальная схема разделения сопоставляется с наиболее эффек-
тивным процессом получения информации. Следовательно,
оптимальной системе соответствует максимум суммы информа-
ционных критериев разделительной способности всех раздели-
тельных аппаратов. Применение информационно-энтропийного
подхода приводит к тем же результатам, что и при использовании
эвристического правила дихотомии. Сравнение получаемых этим
методом оптимальных вариантов технологических схем с вари-
антами, являющимися оптимальными по приведенным затратам,
показали значительное их расхождение.
Кроме рассмотренных применяется также рекурсивный метод
и метод «случайных матриц». В ряде случаев можно использовать
сочетание нескольких методов.
Сопоставление рассмотренных методов синтеза оптимальных
технологических схем разделения проведено на примере синтеза
оптимальной технологической схемы газофракционирующей уста-
новки производительностью 12 млн т нефти в год. На этой уста-
новке выделяют семь товарных продуктов, из которых получают
сырье для продуктов основного органического и нефтехимическо-
го синтеза. К ним относятся следующие фракции; пропановая, изо-
Глава 4. Подсистема разделения
169
бутановая, бутановая, изопентановая, пентановая, изогексановая и
гексановая.
Расход, состав сырья и производительность по продуктам раз-
деления приведены в табл. 4.1.
Таблица 4.1. Расход, состав сырья и производительность по продуктам
разделения
Компонент Расход сырья ' Содержа- ние приме- сей, % (мае.) Производительность, тыс. т/год
ТЫС. т/год % {мае.) лег- ких тяже- лых про- пан изо- бутан бутан изо- пен- тан пентан изо- гек- сан гексан
Пропан 61,2’ %.6 0.0’ *.«. .’••м
Изобутан 69,0 9,7 2,6 1,6 1,8 67,2 1,1 - -
Изопентан 72,5 10,1 1,6 3,0 — 1,0 61,5 1,9 —
Изогексан 49,0 6,8 4,3 4,8 - - - - 1,6 34,1 1,8
Итого: 716,0 100,0 - - 61,2 69,0 32,5 72,6 193,5 49,0 238,3
Исходя из уравнения 4.42, в случае смеси, содержащей 7 ком-
понентов, возможны 132 варианта технологических схем разделе-
ния этой смеси, некоторые из них представлены на рис. 4.2. Ре-
зультаты расчетов по капитальным, энергетическим и приведенным
затратам для каждой схемы можно видеть на рис. 4.3. Суммарные
приведенные затраты существенно различны для разных схем раз-
деления. При этом максимальная разница достигает 87 %, а в слу-
чае десятой и первой схем она составяет 10 %. Основная доля в при-
веденных затратах приходится на энергетическую составляющую.
Было проведено сравнение оптимальной схемы разделения
(рис. 4.2,с) со схемами, полученными по эвристическим правилам:
«разделение в первой по ходу схемы колонне — самое дешевое»
(рис. 4.2,6); прямая последовательность отделения легких компо-
нентов (рис. 4.2,в), правила «дихотомии» и на базе информацион-
ного подхода (рис. 4.2,6). Кроме того, для сравнения представлена
схема, разработанная без ЭВМ (рис. 4.2,г), а также схема с после-
170 Часть!. Теоретические основы технологии крупнотоннажных ...
Рис. 4.2. Варианты схем установки газофракционирования с получением
семи продуктов
№ варианта
Рис. 4.3. Затраты на разделение
смеси продуктов для разных вари-
антов схемы фракционирующей
установки:
1 — суммарные приведенные; 2 - энер-
гетические; 3 — капитальные
Глава 4. Полсистема разделения
171
довательным отделением тяжелых компонентов (рис. 4.2,е). Резуль-
таты сравнения этих схем приведены ниже:
Вариант схемы (рис. 4.2) б в г д е
Место, занимаемое по затратам 6 10 11 75 132
Превышение затрат по сравнению с оптимальными, % 3 10 12 33 87
Из этих данных следует, что использование только эврис-
тических правил или информационного подхода не позволяет по-
лучать приемлемые результаты.
ТЕРМОДИНАМИКО-ТОПОЛОГИЧЕСКИИ АНАЛИЗ
СТРУКТУР ДИАГРАММ ФАЗОВОГО РАВНОВЕСИЯ
Как известно, свыше 50 % всех систем, для которых изучено фа-
зовое равновесие жидкость—пар, являются азеотропными. В отрас-
ли основного органического и нефтехимического синтеза процент
азеотропных смесей еще выше.
Для разработки технологических схем разделения полиазеотроп-
ных смесей наиболее эффективным является метод, основанный на
термодинамико-топологическом анализе (ТТА) структур диаграмм
фазового равновесия, предложенный Л.А. Серафимовым и В.Т. Жа-
ровым. В дальнейшем этот метод был развит В. С. Тимофеевым для
гетероазеотропных смесей и М.И. Балашовым для смесей с актив-
ными химическими компонентами.
Термодинамике-топологический анализ базируется на общих
термодинамических закономерностях фазового равновесия жид-
кость-пар, которые отражаются диаграммой фазового равновесия.
Каждая диаграмма подчиняется общим топологическим законо-
мерностям, как некоторый геометрический объект. Таким обра-
зом, физико-химическая природа той или иной смеси отражается
как в общетермодинамических свойствах фазового равновесия, так
и в топологических закономерностях структуры диаграммы фазо-
вого равновесия.
Составы фаз могут быть представлены в виде ряда симплексов
(фигур): отрезка для бинарных смесей, треугольника для тройных
смесей, тетраэдра для четверных смесей и т. д. Такие симплексы на-
зываются концентрационными. В любом симплексе вершины фи-
гуры соответствуют чистым компонентам, ребра, соединяющие вер-
шины, — бинарным составляющим, грани — тройным составляю-
172 Часть!. Теоретические основы технологии крупнотоннажных ...
А Рис. 4.4. Концентрационные симп-
лексы, соответствующие чистому ком-
поненту (о), бинарной (б), тройной (в)
и четырехкомпонентной (г) смесям
а б в
г
щим. На рис. 4.4 представлены
симплексы, соответствующие чис-
тому компоненту, бинарной, трой-
ной и четверной смесям.
Фазовое равновесие, отражаю-
щее физико-химическую природу
многокомпонентной смеси, может
быть в самом общем виде представлено функцией отображения
множества (т. е. симплекса) составов одной фазы х в множество (т. е.
симплекс) составов другой фазы
(р: х(1) —> х(2)
4.43
где (р означает, что каждому составу первой фазы, который харак-
теризуется набором концентраций (х1(1),Х21),...,х’1_)1,х*1)), ставится
в соответствие термодинамически равновесный ему состав второй
фазы, с концентрациями (xj2),xfx’2j,x’2)) • Для бинарной смеси
такое соответствие обеспечивается построением кривой фазового
равновесия, например кривой равновесия жидкость—пар. Для мно-
гокомпонентных смесей построение такого типа в принципе не-
возможно, так как состав каждой из фаз имеет уже не скалярную,
а векторную природу. В общем случае составы равновесных фаз
различаются. Это различие и служит основой, позволяющей осу-
ществить различные процессы разделения. Степень такого отли-
чия в случае бинарных смесей определяется степенью удаления кри-
вой фазового равновесия от диагонали в диаграмме у=гр(х) (рис. 4.5).
Для многокомпонентных смесей, если мы наложим концент-
рационный симплекс одной фазы на концентрационный симплекс
другой и соединим равновесные фазы некоторыми отрезками, то
указанная степень отличия будет определяться длиной каждого от-
резка. Отрезки такого типа называются равновесными нодами (нода
жидкость—пар, нода жидкость—жидкость и т. д.).
Совокупность нод образует в совмещенном концентрационном
симплексе некоторое векторное поле, покрывающее весь симплекс
или его часть. Данное векторное поле, которое является стацио-
Глава 4. Полсистема разлеления
173
Рис. 4.5. Кривые фазового равновесия жидкость — пар бинарных зеот-
ропных смесей (а) и азеотропных (б):
1 — с минимумом температуры кипения; 2 — с максимумом температуры кипения
нарным, т.е. не зависит от времени, геометрическим образом отра-
жает физико-химическую природу рассматриваемой смеси. На
рис. 4.6 приведено векторное поле нод жидкость—пар для зеотроп-
ной тройной смеси.
Точки, в которых длина вектора ноды равна нулю, а на-
правление его неопределенно, называются неподвижными точками
функции отображения или особыми точками диаграммы фазового
равновесия. В особых точках
/:х(1) ->х(1). 4.43а
К таким точкам относятся, например в случае фазового равно-
весия жидкость—пар точки, соответствующие чистым компонен-
там, и точки, соответствующие бинарным, тройным, четверным азе-
отропам. В этих точках составы равновесных фаз равны друг другу,
что соответствует (для случая азеотропов) законам Коновалова.
Диаграмма равновесия может быть представлена не только по-
лем равновесных нод, но и полем равновесных температур кипе-
ния жидкой фазы смеси при заданном давлении. Например, для
Рис. 4.6. Векторное поле
нод жидкость-пар тройной
смеси (стрелками показано
направление от состава
жидкости к составу пара)
174 Часть!. Теоретические основы технологии крупнотоннажных ...
трехкомпонентных смесей диаграмма равновесия характеризуется
некоторыми линиями, называемыми изотермо-изобарами. Для че-
тырехкомпонентных смесей изотермо-изобары являются уже неко-
торыми поверхностями и т.д. Скалярное стационарное поле рав-
новесных температур кипения может быть представлено так же, как
и поле равновесных нод в векторном виде. Для этого используется
вектор-градиент, который всегда направлен в сторону возрастания
температур ортогонально изотермо-изобаре. Вектор-градиент опи-
сывается соотношением:
gradT = {дТ/dxvdT/дхг,дТ/дх3,...,дТ/Ъхп}. 4.44
Связь между вектором-градиентом равновесных температур и
вектором равновесной ноды жидкость—пар дается модифици-
рованной формой уравнения Ван-дер-Ваальса—Сторонкина. Так,
при постоянном давлении это уравнение имеет вид
-Д5 • gradT = ||g(y ||? т (х(2> —х(1>), 4.45
где As - энтропия фазового перехода; ||^ ||р Г - матрица вторых производ-
ных потенциала Гиббса G по составу; х*2), х°> — векторы составов паровой
и жидкой фаз, соответственно.
Отображение рассматриваемого типа характеризуется просто
переходом от поля равновесных нод к полю равновесных темпера-
тур кипения жидкой смеси при постоянном давлении. Так как
определенному составу жидкой фазы соответствует определенная
нода жидкость—пар и определенная температура кипения, то рас-
сматриваемое отображение однозначно. Особая точка, например
для «-компонентного азеотропа, характеризуется равенством соста-
вов х(2) — х(1) и нулевым градиентом температур gradT = 0. Для трех-
компонентных смесей равенство нулю градиента температур озна-
чает, что данному составу соответствует или экстремум температуры
(минимум или максимум), или седловина. В первом случае реали-
зуются азеотропы с минимумом или с максимумом температуры
кипения, во втором случае — седловидный азеотроп, не имеющий
ни максимума, ни минимума температуры кипения.
Рассмотрим влияние структуры диаграммы фазового равновесия
на некоторый процесс, мгновенная скорость которого, харак-
теризуемая изменением состава многокомпонентной смеси, соответ-
ствует направлению и длине ноды жидкость—пар. Такой процесс мо-
Глава 4. Полсистема разделения
175
жег выступать в качестве характеристики диаграммы фазового рав-
новесия и отражать все особенности фазового равновесия.
Перечисленным выше требованиям удовлетворяет процесс рав-
новесной открытой дистилляции, уравнение которого имеет вид:
dx(l} /dt = х(2} - хт,
dt = d\nm, 4.46
где т — количество молей жидкой фазы в перегонной колбе; сЬ6'} - измене-
ние состава (dx^\ dx2w, dx}w ... dxnei) жидкой фазы; /2) - х0’ - нода жид-
кость—пар.
Согласно уравнению 4.46, если dx^/dt-^Q, то х<2) = x°> и реа-
лизуется особая точка.
Интегральные линии дифференциального уравнения дистил-
ляции называются траекториями дистилляции. Эти траектории
в окрестности особой точки имеют своеобразный ход. Установле-
но, что из всех известных типов хода траекторий в окрестности
особых точек в диаграммах фазового равновесия реализуются осо-
бые точки только типа узла и седла (рис. 4.7). В первом случае все
траектории сходятся в особой точке {устойчивый узел) или выхо-
дят из нее (неустойчивый узел). Во-втором часть траекторий схо-
дятся к особой точке, часть выходят из нее и часть траекторий
имеют в окрестности особой точки гиперболический ход, сначала
приближаясь к ней, а потом удаляясь от нее (седло). Таковы зако-
номерности векторного поля равновесных нод жидкость—пар, ко-
торые названы локальными закономерностями диаграмм фазового
равновесия жидкость—пар многокомпонентных зеотропных и азео-
тропных смесей. Естественно поставить вопрос, существуют ли об-
щие закономерности диаграмм такого типа, т. е. существует ли об-
щий закон соотношения в диаграммах различных особых точек?
Ответ на этот вопрос связан с понятием индекса особых точек.
Индексом особой точки поля нод называется число поворотов век-
a б в
Рис. 4.7. Типы особых точек для трехкомпонентных смесей:
а — устойчивый узел; б — неустойчивый узел; в — седло
176 Часть!. Теоретические основы технологии крупнотоннажных ...
тора ноды на 360° при обходе вокруг этой точки вдоль замкнутой
линии, охватывающей ее. Так, если ноды поворачиваются на 360°
при обходе особой точки, причем в ту же сторону, в какую совер-
шается обход, то индекс особой точки равен +1, а если нода пово-
рачивается в противоположную сторону на 360°, то индекс особой
точки равен —1. Если при обходе вектор-нода остается неподвиж-
ным или совершает равные колебания в стороны, то индекс осо-
бой точки будет равен нулю. Все простые (не особые) точки имеют
поэтому индекс, равный нулю. Если теперь будет обойдено не-
которое многообразие по замкнутой кривой, которое содержит не-
сколько особых точек с разными индексами, то индекс много-
образия, т. е. число поворотов вектора-ноды на его границе, вдоль
которой осуществляется движение, будет равен сумме индексов осо-
бых точек этого многообразия, т. е.
/ = £/. 4.47
Для замкнутых многообразий, например сферы, индекс не за-
висит от конкретного векторного поля, размещенного на этой сфе-
ре, а определяется некоторым инвариантом, который называется
характеристикой Эйлера. Характеристика Эйлера может быть рас-
считана в топологии по уравнению:
Э=1 + (-1)т, 4.48
где т — размерность сферы.
Алгебраическая сумма индексов особых точек равна на сфере
характеристике Эйлера:
/=1 + (-1)т. 4.49
Этот фундаментальный результат топологии и был принят за
основу в исследованиях общих законов структуры диаграмм фа-
зового равновесия, характеризуемых разным числом особых то-
чек различного типа. Как видно из уравнения 4.49, суммарный
индекс сферы будет равным нулю, если т — нечетное число,и ра-
вен двум, если т — четное число. Таким образом, с учетом общего
индекса сферы, задачу подсчета алгебраической суммы особых то-
чек диаграммы фазового равновесия сводим к задаче построения
сферы из концентрационных симплексов той же размерности
и подсчета повторяющихся при этом особых точек.
Если обозначить: N+ — узлы с положительным индексом, N~ —
узлы с отрицательным индексом, С+ — седла с положительным
Глава 4. Полсистема разделения
177
индексом и С~ — седла с отрицательным индексом, то уравнение
связи этих особых точек, предложенное В.Т. Жаровым, имеет вид:
п
£ 2" ( n;+с; - N-t - с;)=1 4.50
£=1
где п — число компонентов; к — число к—х составляющих «-компонент-
ной смеси, изменяющихся от 1 до п; 2" отражает повторяемость данной
особой точки на сфере.
Используя несколько другой метод построения сферы из кон-
центрационных симплексов, Л. А. Серафимов получил новое урав-
нение:
2(л'.‘ +<7-c;)+(n: +c;-n;-c;)=i+(-ir, 4.51
в котором индекс п относится к и-компонентным азеотропам, а ин-
декс «г» — к граничным особым точкам концентрационного симп-
лекса, т. е. к любому азеотропу, содержащему от п-1 до двух компо-
нентов, включая точки, соответствующие чистым веществам.
В отличие от уравнения 4.50 в уравнение 4.51 входят только те
особые точки, которые при «склеивании сферы» имеют индекс +1
или —1. Ряд граничных точек, которые при склеивании имеют ин-
декс 0, в уравнение не входят. К таким точкам относятся положи-
тельно-отрицательные узлы N+N~, седло-узлы C+N~ и C~N*, по-
ложительно-отрицательные седла С+С~. Каждое из уравнений
позволяет воспроизвести все диаграммы фазового равновесия,
удовлетворяющие термодинамическим и топологическим законо-
мерностям.
Уравнения 4.50 и 4.51 являются составляющими единой сис-
темы диофантовых уравнений. Они взаимно дополняют друг друга
и не противоречат одно другому. Для трехкомпонентных систем оба
уравнения приводятся к виду, полученному Ю. В. Гуриковым:
2N3 + N2 + ^=2С3+С2 +2. 4.52
Здесь индекс соответствует числу компонентов. Уравнения 4.50
и 4.51 являются общими и применимы для любой полиазеотроп-
ной многокомпонентной смеси.
Таким образом, фундаментальной основой термодинамико-то-
пологического анализа являются теоремы о локальных и общих за-
кономерностях структуры диаграмм фазового равновесия. Знание
общих закономерностей позволяет выделить целые классы эквива-
178 Часть!. Теоретические основы технологии крупнотоннажных ...
лентных диаграмм, отличающиеся ходом траекторий дистилляции
и поведением отдельных компонентов в процессе дистилляции. На
этой основе была составлена классификация диаграмм для смесей
с любым числом компонентов. Диаграммы траекторий дистилля-
ции для трехкомпонентных смесей приведены на рис. 4.8. Анало-
гичные диаграммы могут быть выявлены для четырех-, пяти- и бо-
лее компонентных смесей.
Первый строгий алгоритм синтеза структур диаграмм фазового
равновесия «жидкость—пар» приведен в работах Л. А. Серафимова. В ка-
честве инварианта класса эквивалентности фазового портрета использо-
валось взаимное расположение единичных ^-многообразий, т. е. линий
поверхностей, расположенных в концентрационном симплексе и обла-
дающих тем свойством, что коэффициент распределения одного из ком-
понентов между фазами равен единице к.=у./х. = \. Дальнейшее разви-
тие этот алгоритм получил в работах Л.А. Серафимова, Т.М. Кушнер,
С. В. Бабич для смесей, содержащих до 10 компонентов и имеющих би-
нарные и тройные азеотропы. Далее были разработаны Ф.Б. Петлюком,
Л. А. Серафимовым алгоритмы для анализа структур диаграмм фазового
равновесия с помощью ЭВМ. Составленные В.Я. Киевским и Ф.Б. Пет-
люком специальные программы позволили проводить синтез диаграмм
фазового равновесия для сложных полиазеотропных смесей, содержащих
до 40 компонентов и до двухсот азеотропов.
Принципиальным шагом вперед было распространение В. С. Тимофее-
вым, Л.А. Серафимовым и В.Т. Жаровым области использования уравне-
ний алгебраической суммы особых точек, которые были названы прави-
лами азеотропии, для случая многофазных систем, включая гетероазеот-
ропные. В.Т. Жаровым и М.И. Балашовым был изложен анализ диаграмм
для смесей, в которых протекают химические реакции. Были исследова-
ны также системы с нераспределенными между фазами компонентами.
Термодинамико-топологический анализ позволил теоретичес-
ки обосновать часто встречающееся в практике явление, которое
открыл и подробно описал В. Свентославский. Это явление назва-
но им тангенциальной азеотропией.
Все диаграммы векторного поля равновесных нод делятся на
два обширных класса. К первому относятся так называемые гру-
бые структуры фазовых «портретов», которые под воздействием
внешних параметров, например таких, как давление, остаются то-
пологически неизменными, т. е. сохраняют число и типы особых
Глава 4. Полсистема разделения
179
0.0-1
1.0-1а
1.0-16
1.0-2
1.1-1Э
1.1-16
1.1-2
2.0-1
2.0-2а
2.0-26
2.0-26 2.1-1 2.1-2а 2.1-26 2.1-За
2.1-36 3.0-1а 3.0-16
3.0-2
3.1-1 а
3.1-16 3.1-1в 3.1-2 3.1-3а 3.1-36
3.1-4
Рис. 4.8. Типы диаграмм трехкомпонентных смесей
точек. Эволюция таких систем приводит к изменению состава и
температуры кипения азеотропов, т. е. количественным измене-
ниям фазового «портрета», оставляя неизменной его качествен-
ную структуру.
180 Часть 1. Теоретические основы технологии крупнотоннажных ...
Ко второму классу относятся так называемые тонкие структу-
ры, которые существуют только при определенном значении пара-
метров. Эти структуры являются границей перехода от одной гру-
бой структуры к другой и содержат так называемые тангенциальные
азеотропы, обладающие всеми свойствами обычного «-компонент-
ного азеотропа. Отличаются эти структуры тем, что концентрация
одного или нескольких компонентов в отличие от обычных азеот-
ропов равна нулю. Переход от одной к другой грубой структуре со-
провождается, как правило, исчезновением одних азеотропов или
появлением других, что приводит к топологическим изменениям
в фазовом портрете. Переходы такого типа осуществляются по оп-
ределенным законам и связывают все грубые структуры в единый
комплекс структур с термодинамически непротиворечивыми вза-
имными переходами друг в друга. На рис. 4.9 приведены такие
переходы, осуществляемые при полном соблюдении правил азеот-
Рис. 4.9. Эволюция структур диграмм (К. = 1 -единичные Х-линии;
К. - коэффициент распределения компонента i)
Глава 4. Подсистема разделения
181
ропии. Подобные переходы имеют принципиальное значение
в практике ректификации, так как позволяют во многих случаях
создавать более благоприятные условия разделения смеси за счет
изменения структуры ее диаграммы равновесия. Выявление тан-
генциальных и почти тангенциальных азеотропов (т. е. азеотро-
пов, содержащих ряд компонентов в виде малых примесных кон-
центраций) важно при решении задач, связанных с получением
особо чистых веществ.
Таким образом, термодинамико-топологический анализ яв-
ляется областью знаний, в которой сформулированы законы соот-
ношения особых точек различных типов в диаграммах фазового рав-
новесия полиазеотропных многокомпонентных смесей, т.е. законы
формирования фазового «портрета» диаграмм. Как же практически
использовать основные закономерности и следствия, вытекающие
из общих положений термодинамико-топологического анализа?
Основным вопросом организации любого процесса разделения
является определение предельно возможных составов получаемых
продуктов или отдельных фракций с необходимым выходом. Для
любой зеотропной многокомпонентной смеси решение этого во-
проса связано только с эффективностью процесса и протяженнос-
тью аппарата, в котором осуществляется разделение. Правда, часто
протяженность оказывается настолько большой, что приходится
отказываться от данного метода разделения и заменять его другим
методом (например, при ректификации, если относительная лету-
честь разделяемых компонентов очень мала, т. е. близка к едини-
це). В этих случаях теоретически разделение возможно, но практи-
чески трудноосуществимо. Для азеотропных многокомпонентных
смесей появляются иные ограничения, связанные с особенностью
фазового «портрета» траекторий процесса разделения, причем оп-
ределяющее значение здесь имеет поле равновесных нод. Исследо-
вания допустимых фазовых «портретов» траекторий открытого
равновесного испарения показали (см. рис. 4.8), что для большин-
ства диаграмм концентрационный симплекс распадается на ряд об-
ластей дистилляции, причем траектории, принадлежащие каждой
из областей, или начинаются, или кончаются в разных особых точ-
ках. Такое «расслоение» концентрационного симплекса, в преде-
лах которого развивается процесс разделения, является характер-
ной особенностью азеотропных смесей.
В общем случае качественный характер расположения пучков
траекторий в концентрационном симплексе для процесса дистил-
182 Часть!. Теоретические основы технологии крупнотоннажных ...
ляции и процесса ректификации (при бесконечном флегмовом чис-
ле с достаточно большим числом ступеней разделения) идентичен.
Как известно, наибольшая эффективность ректификационных
колонн достигается при флегмовом числе, равном °°. Сле-
довательно, и возможность достижения того или иного состава азе-
отропной многокомпонентной смеси должна рассматриваться для
этого режима. Вместе с тем по мере приближения к азеотропному
составу, например бинарной смеси при бесконечном флегмовом
числе или при приближении к чистому компоненту, число теоре-
тических тарелок стремится к бесконечности.
Таким образом, предельно достижимые составы необходимо
определять в режиме четкой ректификации, при которой число та-
релок и флагмовое число стремятся к бесконечности. Было пока-
зано, что в этом случае фазовые «портреты» траекторий ректифи-
кации качественно подобны фазовым «портретам» траекторий
дистилляции, т.е. пучки траекторий этих процессов начинаются
и кончаются в одних и тех же особых точках и имеют одну и ту же
конфигурацию. Следовательно, процесс ректификации может раз-
виваться в пределах области, границы которой определяются гра-
ницами определенного пучка траекторий. Эти области и были на-
званы областями непрерывной четкой ректификации. Если допустить,
что количество отбираемого дистиллята и кубового продукта, а так-
же количество подаваемой исходной смеси определенного состава
бесконечно мало, то составы дистиллята исходной смеси и кубово-
го продукта будут лежать на одной прямой линии. В то же время
составы дистиллята и кубового продукта будут практически при-
надлежать одной и той же траектории ректификации при флегмо-
вом числе, стремящемся к бесконечности.
Последнее позволяет определить предельные значения составов
дистиллята и кубового продукта при четком разделении. Можно
приближенно выявить все ограничения на составы конечных про-
дуктов непрерывной ректификации, которые обусловлены структу-
рой диаграммы фазового равновесия. Каждая область четкой рек-
тификации имеет точку наинизшей температуры кипения и точку
наивысшей температуры кипения. Первая точка соответствует на ди-
аграмме траекторий неустойчивому узлу, вторая — устойчивому. Раз-
деление ректификацией, при котором в качестве дистиллята выде-
ляется смесь или компонент, имеющий наинизшую температуру ки-
пения, принято называть первым заданным разделением. Разделение,
при котором в качестве кубового продукта выделяется фракция или
Глава 4. Полсистема разделения
183
Рис. 4.10. Предельные составы дис-
тиллята D и кубового продукта И' для
двух составов исходной смеси, лежа-
щих в разных областях ректификации
(Fp F2) для тройной системы, диа-
грамма которой принадлежит классу 1
типу 2
компонент, имеющие наивысшую
температуру кипения, называется
вторым заданным разделением. Ос-
тальные составы дистиллятов и ку-
бовых продуктов соответствуют про-
межуточным заданным разделениям. Каждому заданному разделению
соответствует свое отношение числа молей кубового продукта к чис-
лу молей дистиллята W/D. На рис. 4.10 для диаграммы класса 1 типа
2 приведены предельные составы дистиллята и кубового продукта
для первого и второго заданных четких разделений. Эта диаграмма
имеет две области четкой ректификации. В каждой из областей рек-
тификации при переходе от первого заданного разделения ко второ-
му наблюдается вращение линии материального баланса вокруг точ-
ки, соответствующей составу исходной смеси.
На рис. 4.11 представлены крайние и промежуточные заданные
разделения для всех диаграмм трехкомпонентных смесей. Таким
образом, термодинамико-топологический анализ позволяет уста-
новить все типы диаграмм фазового равновесия, соответствующие
смесям, содержащим разное число компонентов. Эта область зна-
ний позволяет при минимальной информации физико-химического
характера получить в каждом конкретном случае ограничения на
составы получаемых в процессе разделения фракций, обусловлен-
ные азеотропией. В настоящее время созданы алгоритмы и про-
граммы, позволяющие провести термодинамико-топологический
анализ с помощью ЭВМ.
МЕТОДЫ РАЗДЕЛЕНИЯ И ПРИНЦИПЫ ИХ ВЫБОРА
В производствах основного органического и нефтехимическо-
го синтеза применяются практически все известные методы разде-
ления многокомпонентных смесей на чистые компоненты или
фракции веществ.
184 Часть 1. Теоретические основы технологии крупнотоннажных ...
0.0-1 1.0-1а 1.0-16 1.0-2 1.1-1а
3.1-4
Рис. 4.11. Диаграммы крайних и промежуточных заданных разделений
тройных смесей
Это обусловлено постоянным расширением номенклатуры про-
дуктов промышленного органического синтеза, широким диа-
пазоном свойств синтезируемых веществ и повышением требова-
ний к их чистоте.
Глава 4. Полсистема разделения
185
Так как при синтезе того или иного продукта получаются слож-
ные многокомпонентные смеси, часто в одном производстве ис-
пользуется несколько методов разделения. Если получаемая смесь
многофазна, то на первой стадии производится разделение фаз. От-
деленные одна от другой фазы подвергаются дальнейшему разде-
лению на чистые компоненты или фракции, имеющие товарную
ценность.
Все методы разделения распадаются на 3 большие группы:
О методы, основанные на различных физических свойствах раз-
деляемых веществ;
© методы, -основанные на фазовых переходах первого рода;
© методы, основанные на применении химических реакций.
К первой группе методов относятся: осаждение твердых частиц
под действием инерционных сил, фильтрование твердых частиц,
очистка газов от пыли промыванием, осаждение частиц в поле элек-
тростатических сил и др.
Использование того или иного метода второй группы чаще все-
го определяется фазовым состоянием разделяемых веществ. Клас-
сификация методов второй группы была предложена В. С. Хайло-
вым и Б. Б. Брандтом. Основные методы разделения, относящиеся
к этой группе, применяемые для смесей разного фазового состоя-
ния, приведены ниже:
Смеси жидких продуктов
Газовые или парогазовые смеси
Растворы твердых продуктов
Смеси твердых продуктов
Дистилляция, различные виды ректи-
фикации экстракция, кристаллизация,
диффузия через мембраны.
Парциальная конденсация, различные
виды ректификации, абсорбция, ад-
сорбция, диффузия через пористые
и непористые мембраны.
Экстракция, выпаривание, кристаллиза-
ция, адсорбция, диализ, электродиализ.
Кристаллизация и перекристаллизация
из растворов, сублимация (возгонка),
зонная плавка.
К третьей группе методов относится хемосорбция и все типы
совмещенных реакционно-массообменных процессов, в которых
сначала образуется новое соединение с веществами, подлежащими
выделению, а потом это соединение разлагается с выделением це-
левого компонента.
186 Часть!. Теоретические основы технологии крупнотоннажных ...
МеТсзды, осуществляемые с добавлением
в исходную смесь новых, растворимых
в ней веществ.
Методы, в которых введенное вещество
образует новую фазу.
В технологии получения крупнотоннажных органических про-
дуктов наиболее распространены методы разделения, основанные
на фазовых переходах. Особенно часто используются процессы дис-
тилляции, ректификации, экстракции, абсорбции и парциальной
конденсации. Остальные методы используются при разделении раз-
личных смесей в малотоннажных производствах.
Все методы, основанные на фазовых переходах, можно раз-
делить на два класса. К первому классу относятся методы, с помо-
щью которых можно непосредственно обрабатывать разделяемые
смеси. Ко второму классу относятся методы, для осуществления ко-
торых необходимо вводить в исходную смесь новые вещества, ко-
торые или растворимы в смеси, подвергаемой разделению, или об-
разуют новую фазу. Методы, связанные с добавлением в исходную
систему различных веществ, приведены ниже:
Экстрактивная ректификация, азеотроп-
ная ректификация, экстракция (введение
растворителя), кристаллизация из специ-
иготовлеИйого раствора.
Абсорбция, гетероазеотропная ректифи-
кация, адсорбция, перегонка в токе
инертного газа или перегретого пара,
экстракция специально подобранным
экстрагентом.
За исключением перегонки в токе инертного газа или перегре-
того пара, в которой добавляемое в систему вещество понижает пар-
циальное давление отгоняемого вещества и, следовательно, пони-
жает температуру перегонки, все остальные приведенные методы
связаны со специфическими взаимодействиями добавляемого веще-
ства с компонентами разделяемой смеси. В настоящее время сфор-
мировалась целая область знаний, связанная с подбором новых ве-
ществ, участвующих в разделении (теории подбора экстрактивных
агентов, азеотропных агентов, экстрагентов, абсорбентов и адсорбен-
тов различных растворителей в кристаллизации, экстракции и т.д.).
В основе такого подбора лежат исследования специфических
взаимодействий добавляемого вещества и компонентов разде-
ляемой смеси. Характеристиками взаимодействий такого типа яв-
ляются или коэффициент распределения компонента разделяемой
смеси между фазами i и j к* =xls /xJs или коэффициент относи-
тельного распределения разделяемых компонентов между фаза-
ми at =х\х{ / х{х\ (где х — концентрации компонентов).
Глава 4. Полсистема разлеления
187
Задача, таким образом, сводится к подбору вещества со спе-
цифическими свойствами, которые бы увеличивали коэффициент
распределения одного компонента и уменьшали другого, тем са-
мым увеличивая коэффициент относительного распределения раз-
деляемых веществ между фазами.
Различные методы разделения, основанные на фазовых пере-
ходах, можно разделить по их универсальности. На базе одних мето-
дов можно целиком построить схему разделения. Такие схемы назы-
вают однородными, а сами методы обладают большой степенью
универсальности. К методам такого типа относится, например, ректи-
фикация и ее различные виды. Другие методы обладают меньшей уни-
версальностью, и их использование приводит, как правило, к разно-
родной схеме разделения, т. е. к необходимости привлечения по
крайней мере еще одного метода. Например, абсорбция сопровожда-
ется десорбцией, адсорбция — также десорбцией, экстракция — рек-
тификацией и т. д. Обычно к этой группе относятся методы, в резуль-
тате использования которых получаются новые растворы или смеси,
которые подлежат дальнейшему разделению.
Иногда методы разделения, основанные на использовании хи-
мических реакций, относят к методам, связанным с добавлением
новых веществ в разделяемую смесь. Основанием для такой клас-
сификации служит тот факт, что специфические взаимодействия
добавляемых веществ с компонентами разделяемой смеси могут
включать межмолекулярные взаимодействия физико-химического
характера, образование водородных связей, л-комплексов, а также
образование стойких химических соединений. Для использования
химических методов разделения необходимо изучить кинетику про-
текающей химической реакции, а также выбрать способ разложе-
ния получаемого химического соединения на последующих стади-
ях с выделением целевого продукта.
Из методов разделения, базирующихся на перераспределении
вещества в среде, наиболее широкое распространение в отрасли ос-
новного органического и нефтехимического синтеза могут полу-
чить следующие: разделение испарением через полунепроницаемую
мембрану, ультрафильтрация и обратный осмос.
В процессе создания схемы разделения инженер-технолог, исходя из
поставленных целей, вынужден обращаться к различным методам разделе-
ния, учитывая при этом возможности каждого метода. Необходимо также
принимать в расчет:
188 Часть!. Теоретические основы технологии крупнотоннажных ...
® свойства разделяемой смеси, ее агрегатное состояние, число фаз,
степень идеальности;
® возможность достижения заданного разделения, требуемой чисто-
ты выделяемых веществ и выхода по целевым продуктам и фрак-
циям; энергоемкость того или иного метода;
® экологическую чистоту метода;
® возможность организации непрерывного процесса разделения;
® возможность выбора аппаратов необходимой единичной мощности;
® простоту в управлении процессом разделения.
Естественно, задача выбора того или иного метода разделения полива-
риантна, т. е. имеет множество решений. Степень удовлетворения этих
решений перечисленным выше требованиям и определяет набор тех или
иных методов разделения для достижения поставленных целей. Обычно
в практике стремятся минимизировать набор методов разделения. Основ-
ная стратегия выбора, например для жидких смесей, заключается в том,
что перебор начинают с наиболее простых, весьма распространенных ме-
тодов, дающих однородные схемы (дистилляция, ректификация). Затем
обращаются к специальным методам разделения (экстрактивная ректи-
фикация, экстракция, разделение с варьированием давления). И нако-
нец, рассматривают методы с использованием химической реакции.
РАЗДЕЛИТЕЛЬНЫЕ КОМПЛЕКСЫ
Для разделения зеотропных смесей методом ректификации
обычно используют определенные последовательности ректифи-
кационных колонн, в каждой из которых осуществляется выделение
отдельного продукта или продуктовой фракции.
Основной особенностью схем разделения зеотропных смесей яв-
ляется отсутствие потоков (рециклов), идущих из последующих ко-
лонн в предыдущие. В общем случае даже для смесей зеотропных,
как правило, используют более сложные разделительные системы,
имеющие обратные связи материальных и тепловых потоков. Отказ
от применения простых, последовательно связанных колонн, и пе-
реход к системам с обратными связями определяется для зеотроп-
ных смесей стремлением уменьшить энергетические затраты на раз-
деление, на которые приходится основная доля всех затрат.
Уменьшение энергозатрат может быть здесь достигнуто за счет
использования комплексов с рекуперацией тепла, комплексов с об-
ратимым смешением потоков, комплексов со связанными и частич-
Глава 4. Полсистема разделения
189
но связанными потоками, а также комплексов с разделяющими аген-
тами. Последние используются для зеотропных смесей с очень низ-
кой относительной летучестью. Уменьшение энергозатрат достига-
ется в основном за счет некоторого усложнения разделительного
процесса, увеличения числа аппаратов, усложнения схемы органи-
зации внешних потоков и, как следствие, усложнения схемы регу-
лирования.
Для азеотропных смесей разделение с применением только по-
следовательно соединенных колонн, за очень редким исключением,
вообще невозможно в силу физико-химических ограничений.
Комплексы для разделения зеотропных смесей
К комплексам с рекуперацией тепла условно относят все рек-
тификационные комплексы, в которых снижение энергозатрат на
разделение достигается в результате теплообмена между потоками и
подвода тепла или холода на промежуточных между верхней
и нижней изотермах, т.е. при температурах, которые находятся меж-
ду температурами дистиллята и кубового продукта. К комплексам
такого типа относятся комплексы с тепловым насосом. Они использу-
ются при малой разности температур между верхом и низом колон-
ны (близкокипящая смесь), при больших флегмовых потоках
и низких температурах верха колонны. Примером использования та-
кого комплекса может служить разделение пропилена и пропана.
Если температуры верха одной колонны и низа другой имеют доста-
точную положительную разность, то возможна организация тепло-
обмена между конденсирующимися и испаряющимися потоками, что
приводит к комплексам с теплообменом. Комплексы с промежуточ-
ным подводом тепла или холода и несколькими вводами сырья при-
ближают процесс ректификации к термодинамически обратимому
процессу. Дальнейшее развитие этой тенденции связано с использо-
ванием комплексов с обратимым смешением потоков, схемы некото-
рых комплексов такого типа приведены на рис. 4.12, 4.13.
В производстве пока используются только комплексы с частич-
но связанными тепловыми потоками (рис. 4.13,6).
Комплексы для разделения азеотропных смесей
Для разделения азеотропных смесей используются комплексы
функционального действия, которые позволяют преодолеть огра-
ничения физико-химического характера и получать продукты тре-
190 Часть!. Теоретические основы технологии крупнотоннажных ...
Рис. 4.12. Схемы некоторых ви-
дов ректификационных ком-
плексов с рекуперацией тепла и
термодинамически выгодным
подводом и отводом тепла:
а — комплекс с тепловым насосом;
б — комплекс с промежуточным от-
водом и подводом тепла
буемой чистоты. Часть комплексов базируется на принципе пере-
распределения полей концентраций между областями разделения. Ча-
стным случаем этого принципа является принцип перераспреде-
ления полей концентраций между областями ректификации.
Комплексы для разделения азеотропных смесей на основе принци-
па «перераспределений». Принцип перераспределения полей концен-
траций между областями ректификации наиболее наглядно демон-
стрируется на примерах разделения азеотропных смесей, которое ос-
новано на изменении состава азеотропов с изменением давления.
На рис. 4.14 представлены кривые фазового равновесия жидкость —
пар для систем, имеющих азеотропы с минимумом температуры ки-
пения и максимумом температуры кипения при разных давлениях.
Из рисунка видно, что составы азеотропов при разных дав-
лениях различны, причем в зависимости от давления участок при-
надлежит то одной, то другой области ректификации. Именно это
свойство используется в двухколонных комплексах (рис. 4.15), пред-
Рис. 4.13. Схемы ректификационных комплексов:
а — с обратимым смешением потоков: б— со связанными тепловыми потоками
Глава 4. Полсистема разлеления
191
Рис. 4.14. Кривые фазового равновесия жидкость—пар для бинарных
смесей при разных давлениях:
а — азеотропная смесь с минимумом температуры кипения: б — азеотропная смесь
с максимумом температуры кипения
назначенных для разделения азеотропных смесей, в которых ко-
лонны работают при разных давлениях. Количество рецикла в об-
щем случае зависит от состава исходной смеси, поступающей на
разделение, и разности концентраций компонента А в азеотропах
при двух выбранных давлениях. Причем чем меньше эта разность,
тем больше будет рецикл. Непременным условием разделения в та-
ком комплексе бинарной смеси на чистые компоненты является
более высокое содержание компонента А в азеотропе, выходящем
из первой колонны, по сравнению с его содержанием в азеотропе,
Рис. 4.15. Комплексы, предназначенные для разделения азеотропных
смесей с изменением давления:
а — для смесей с минимумом температуры кипения; б — для смесей с максимумом
температуры кипения
192 Часть!. Теоретические основы технологии крупнотоннажных ...
Вода
//[ Рис. 4.16. Особые точки и разделяю-
/ / щие линии в Диаграмме смеси вода -
/ муравьиная кислота - уксусная кис-
\ лота (С - седловой азеотроп; Az - би-
IV парный азеотроп с максимумом тем-
Уксусная Муравьиная пературы кипения; I—IV - области
кислота кислота ректификации)
выходящем из второй колонны и поступающем в первую. Поскольку
изменение состава азеотропа, приходящееся на один градус темпе-
ратуры, согласно закону Вревского, зависит от разности молярных
теплот испарения компонентов, то рассматриваемый метод разделе-
ния будет тем эффективнее, чем больше будут отличаться теплоты
испарения разделяемых веществ. Этот принцип может использоваться
также при разделении многокомпонентных азеотропных смесей.
Структура диаграммы фазового равновесия жидкость—пар для
системы вода—муравьиная кислота—уксусная кислота представле-
на на рис. 4.16. В этой системе имеется один бинарный отрицатель-
ный азеотроп и один тройной седловой азеотроп, все концентра-
ционное пространство делится на четыре области ректификации.
Для разделения составов смесей, расположенных в области
ректификации I, может быть использован трехколонный ректи-
фикационный комплекс, представленный на рис. 4.17.
Исходная смесь F, состав которой расположен в области ректи-
фикации I, подается на первую колонну, работающую при атмосфер-
ном давлении. В качестве верхнего продукта можно выделить воду
(Dl соответствует неустойчивому узлу в данной фазовой диаграмме).
Точка состава кубового продукта (HQ будет находиться в окрестнос-
ти, разделяющей области ректификации /и ГУ. Этот кубовый про-
дукт подается в колонну 2, работающую при давлении 6,6—26,6 кПа.
При этом давлении тройной седловой азеотроп, бинарный азеотроп
и разделяющие линии сместятся (новое положение разделяющих ли-
ний представлено пунктирными линиями). Следовательно, состав ку-
бового продукта (WQ колонны 1 окажется в области ректификации
ГУ. Тогда из него можно выделить в виде верхнего продукта (Z>2) му-
равьиную кислоту, состав которой соответствует неустойчивому узлу
в этой области ректификации, а в качестве кубового продукта полу-
Глава 4. Подсистема разделения
193
Рис. 4.17. Реализация принципа перераспределения на трехколонном
комплексе:
а — сеть материальных балансов; б — трехколонный комплекс
чить смесь (WQ, состав которой будет находиться в окрестности, раз-
деляющей области ректификации I и ГУ (но для пониженного дав-
ления). Кубовый продукт колонны 2 может быть разделен в колон-
не 3, работающей при атмосферном давлении, на уксусную кислоту
(кубовый продукт Ж3) и смесь (Z>3), состав которой будет находиться
в окрестности разделяющей области I и II. Смесь Z>3 в качестве ре-
цикла возвращается в колонну 1. Оптимальные параметры работы
ректификационных колонн рассмотренного комплекса для выделе-
ния указанных компонентов из фракции оксидата прямогонного бен-
зина представлены в табл. 4.2. При этом оказалось, что рецикл дол-
жен составлять 35,5 % от количества исходной смеси.
Таким образом, без применения других методов разделения
и добавления новых веществ (а их потребуется несколько) удается
разделить смесь со сложной структурой диаграммы фазового рав-
новесия на чистые компоненты. Этот принцип может быть исполь-
зован для разделения и других азеотропных смесей. Однако в на-
стоящее время он не нашел еще практического применения.
Необходимо также отметить, что смещение состава азеотропа
может быть осуществлено за счет не только давления, но и других
внешних сил (например, переменных магнитных полей), влияю-
щих на межмолекулярное взаимодействие молекул.
Неоднородные комплексы разделения. Принцип перераспре-
деления полей концентраций между областями ректификации мо-
жет быть проиллюстрирован на примерах разделительных комплек-
сов, включающих ректификацию, с помощью которой достигается
7 я-6
194 Часть 1. Теоретические основы технологии крупнотоннажных ...
необходимая чистота продукта, и вспомогательного метода разде-
ления, предназначенного для расслаивания, экстракции, кристал-
лизации, разделения с помощью мембран и др.
Таблица 4.2. Параметры работы ректификационных колонн при разделении
прямогонного бензина
Компоненты, выделяемые в колоннах Флегмовое число Номер тарелки питания Количество, кмоль
питание дистиллят кубов npoflj
Веда 5.5 21 2.98 1.12 1.
Муравьиная кислота 16.0 43 1.86 0.16 1.
/ксусная кислота 60 24 1,70 1.08 0,
Наиболее широко для разделения азеотропных смесей при-
меняются двухколонные и трехколонные комплексы с флорен-
тийскими сосудами.
Двухколонный комплекс с флорентийским сосудом использу-
ют также для разделения гетероазеотропных смесей типа «-бутило-
вый спирт—вода, винилацетат—вода, масляный альдегид—вода и др.
(рис. 4.18).
Такой же комплекс применяется для разделения гомоазеотроп-
ных смесей с добавкой новых компонентов, образующих гетероазе-
Рис. 4.18. Кривая фазового равновесия:
(а) для гетероазеотропных смесей и (б) двухколонный комплекс
Гмел 4. Полсистема разделения
195
отропы с компонентами исходной смеси. Наиболее характерным
примером такого разделения может служить гетероазеотропная
осушка спиртов (этилового, изопропилового) в присутствии угле-
водородов (бензола, толуола, гексана и др.). Например, при произ-
водстве изопропилового спирта осушка его может быть осуществ-
Состав, % (мол.)
питание дистиллят кубовый продукт
вода муравьиная кислота уксусная кислота вода муравьиная кислота уксусная кислота вода муравьиная кислота уксусная кислота
f S' 20 29 99,3 0 0,7 22 32 46
22 32 46 0 99,9 0,1 24 26 50
L2L 50 ||||И — 0,06 99.94
лена на таком комплексе при сочетании гетероазеотропной ректи-
фикации с расслаиванием.
При добавлении к водному изопропиловому спирту бензола по-
лучается тройная смесь, фазовая диаграмма которой представлена
на рис. 4.19,а. В этой системе оказывается максимальное число азе-
отропов (один тройной и три бинарных). Наличие же гетерогенной
области дает возможность разделить смесь на чистые компоненты,
точнее выделить с заданной чистотой на двухколонном комплексе
а
Рис. 4.19. Диаграмма фазового равновесия в системе изопропиловый
спирт—бензол-вода (а) и двухколонный комплекс гетероазеотропной
ректификации (б)
196 Часть 7. Теоретические основы технологии крупнотоннажных ...
изопропиловый спирт и воду (рис. 4.19,6). В колонну 1 подается ис-
ходная смесь изопропилового спирта и воды азеотропного состава.
Бензол может быть подан при пуске установки (и в дальнейшем про-
водится только подпитка для компенсации его потерь) в колонну 1
или флорентийский сосуд 3. Паровой поток колонны 1 после
конденсации поступает во флорентийский сосуд 3. Верхний слой
флорентийского сосуда 3, содержащий основную часть бензола, воз-
вращают в колонну 1 для орошения и образования азеотропов, а ниж-
ний слой, содержащий большую часть воды и спирта, направляют
в колонну 2. В ней отделяют спирт и бензол в виде азеотропов с во-
дой от избытка воды, которая выводится в виде кубового продукта.
Параметры работы колонн комплекса представлены в табл. 4.3.
Таблица 4.3. Параметры работы двухколонного комплекса
гетероазеотропной ректификации
Компоненты Расход, моль/час
1-я колонна 2-я колонна
питание кубовый продукт пар на выходе из колонны орошение кубовый продукт пар на выходе из колонны орошение
Изопропиловый спирт 68,0 68,0 85.32 83 32 0.0 3.08 3.06
Вода 32.0 0.0 85,30 55 30 32,0 16,99 49,02
Бензол 0.0 0,0 194.17 194,17 0.0 0,14 0.13
Итого: 100,0 68,0 364,79 332,79 32,0 20,21 52,21
Таким образом, наличие четырех азеотропов и трех областей
ректификации в данном случае не является препятствием к выде-
лению спирта и воды в чистом виде благодаря тому, что гетероген-
ная по жидкости область охватывает часть областей ректификации,
что и позволяет осуществить принцип перераспределения.
Подобный же двухколонный комплекс может быть использован
для отделения азеотропообразующего агента для систем, имеющих
гомологичные структуры диаграмм. В частности, для расслаиваю-
щихся систем гомологичными будут структуры, в которых один
компонент образует гетероазеотропы со всеми остальными компо-
нентами, число которых может изменяться от 1 до п~1, а два бино-
дальных многообразия, отделяющие гомогенные области от гетеро-
Глава 4. Подсистема разделения
197
генной, являются открытыми (рис. 4.20,а). В частности, на рассмот-
ренном выше комплексе колонн может быть осуществлена осушка
смеси изомасляного и к-масляного альдегидов, а также изобутилово-
го и «-бутилового спиртов, получаемых в процессе оксосинтеза
с последующим разделением этой смеси на чистые компоненты
(рис. 4.20,6), разделения продуктов оксосинтеза пропилена, в кото-
рой предусмотрено отделение каждого из компонентов в виде гете-
роазеотропов с водой и их гетероазеотропная осушка (рис. 4.20,в).
Для разделения трехкомпонентных гетерогенных смесей, име-
ющих три жидкие фазы, могут быть использованы трехколонные
агрегаты с флорентийским сосудом (рис. 4.21). Подобные агрега-
в
Рис. 4.20. Диаграмма фазового равновесия в системе н-масляный альде-
гид - изомасляный альдегид - вода (а) и технологические комплексы для
разделения этой смеси (б, в)
198 Часть!. Теоретические основы технологии крупнотоннажных ...
Рис. 4.21. Диаграмма состояния трехкомпонентной трехфазной смеси (а)
и трехколонный комплекс для ее разделения (б)
ты используют для разделения смеси, получаемой при производ-
стве изопрена.
Для ряда диаграмм при организации ректификации удается ис-
пользовать геометрические особенности хода линии, разделяющей
диаграмму на две области ректификации. Для этого достаточно, что-
бы разделяющая линия была криволинейной. В качестве примера
рассмотрим тройную смесь, диаграмма которой представлена на
рис. 4.22. В этом случае на первую колонну подают исходную смесь
и рецикл, поступающий с третьей колонны. Дистиллят этой колон-
ны поступает во вторую колонну, а в кубовом продукте выделяется
компонент С. Во второй колонне в дистилляте выделяется компо-
нент А, а кубовый продукт W2 поступает в третью колонну. Здесь
в виде кубового продукта выделяется компонент В, а дистиллят,
близкий по составу к азеотропу, поступает в первую колонну.
Комплексы азеотропной, экстрактивной
И АВТОЭКСТРАКТИВНОЙ РЕКТИФИКАЦИИ
Широкое распространение в практике разделения продуктов
основного органического и нефтехимического синтеза получили
комплексы, базирующиеся на азеотропной, экстрактивной и авто-
экстрактивной ректификации.
В первых двух случаях для разделения азеотропных смесей или
смесей, имеющих относительную летучесть, близкую к единице,
Глава 4. Полсистема разлеления
199
в
Рис. 4.22. Диаграмма состояния трехкомпонентной системы с криволиней-
ной разделяющей (а), балансовая сеть трехколонного комплекса (б) и ком-
плекс, основанный на использовании кривизны разделяющей линии (в)
предусматривается введение новых разделяющих агентов. Причем
в случае азеотропной ректификации добавляются вещества, обра-
зующие новые азеотропы с компонентами первоначальной сме-
си. При экстрактивной ректификации новые вещества меняют от-
носительную летучесть компонентов исходной смеси. В случае
автоэкстрактивной ректификации роль экстрактивного агента вы-
полняет один или несколько компонентов, содержащихся в пер-
воначальной исходной смеси, но подающиеся в верхнюю часть
колонны и в другом соотношении.
Под азеотропной ректификацией чаще понимают гетероазеот-
ропную ректификацию, предусматривающую сочетание азеотроп-
ной ректификации с расслаиванием. В этом случае достаточно про-
сто осуществляется регенерация азеотропного агента. При наличии
гомогенных азеотропов это сделать трудно или невозможно. Это
200 Часть 1. Теоретические основы технологии крупнотоннажных ...
обусловлено тем, что при получении нового гомогенного азеотро-
па возникает задача его разделения с целью регенерации азеотроп-
ного агента. А это, в свою очередь, потребует применения специ-
ального метода разделения азеотропной смеси. И только тогда,
когда новая азеотропная смесь (азеотропообразующего компонен-
та с одним из компонентов исходной смеси) может быть далее ис-
пользована без разделения, то гомоазеотропная ректификация мо-
жет быть целесообразной. Примером такого разделения служит
обезвоживание этилового спирта с помощью этилендиамина. Эти-
лендиамин образует с водой гомогенный азеотроп с максимумом
температуры кипения и в отсутствие воды неустойчив. Поэтому с
его помощью проводится обезвоживание этилового спирта. Но это
частный и редкий случай.
Что же касается в целом азеотропной ректификации, то она
в большинстве случаев энергетически невыгодна, так как азеотро-
пообразующий агент испаряется многократно пропорционально
(7?+1), где R — флегмовое число.
Экстрактивная и автоэкстрактивная ректификация энерге-
тически более выгодны по сравнению с азеотропной ректифи-
кацией, так как экстрактивный агент практически не испаряется.
Необходимо обратить внимание на еще одно отличие азео-
тропной и экстрактивной ректификации. Если при азеотропной рек-
тификации разделяющий агент может подаваться как в исходную
смесь, так и в верхнюю часть колонны, то при экстрактивной и ав-
тоэкстрактивной ректификации экстрактивный агент обязательно
должен подаваться выше уровня подачи исходной смеси в случае
тяжелолетучего экстрактивного агента или ниже уровня последней —
в случае легколетучего. Схемы комплекса экстрактивной и автоэкс-
трактивной ректификации представлены на рис. 4.23.
Необходимо отметить, что во всех учебных пособиях и мо-
нографиях экстрактивная ректификация рассматривается только по
варианту (б), т. е. когда в колонну наряду с экстрактивным агентом
подается флегма. При этом флегму направляют на самый верх ко-
лонны, а экстрактивный агент — несколько ниже. В этом случае ко-
лонну можно разделить на три части: исчерпывающую, в которой
удаляется легколетучий компонент из кубового продукта (она ниже
тарелки питания), укрепляющую, в которой повышается концент-
рация легколетучего компонента (между вводом исходной смеси
и разделяющего агента), и регенерационную, в которой дистиллят от-
деляется от примесей разделяющего агента (между вводом разде-
Глава 4. Полсистема разделения
201
а
Рис. 4.23. Технологические комплексы экстрактивной и автоэкстрактив-
ной ректификации:
a — с тяжелолетучим экстрактивным агентом; б — с тяжелолетучим экстрактив-
ным агентом и флегмой; в — с легколетучим агентом
ляющего агента и флегмы). Однако такой вариант организации про-
цесса эффективен в том случае, когда действие разделяющего агента
и флегмы является однонаправленным, т. е. когда делится зеотроп-
ная смесь или смесь, в фазовой диаграмме которой (вместе с раз-
деляющим агентом) компоненту, выделяемому в виде дистиллята,
соответствует неустойчивый узел.
При разделении же азеотропных смесей экстрактивной рек-
тификацией флегма оказывает отрицательное действие на основной
процесс. Это обусловлено тем, что во флегме содержится один из
компонентов (легколетучий) разделяемой азеотропной смеси и его
возврат в колонну приводит к снижению активности разделяюще-
го агента из-за наличия в нем значительного количества (тем боль-
ше, чем больше флегмовое число) выделяемого компонента. Кро-
ме того, возврат в колонну в виде флегмы выделяемого компонента
ведет к образованию первоначального азеотропа, что приводит
в свою очередь к увеличению расхода разделяющего агента.
Для того, чтобы унос тяжелолетучего разделяющего агента был
незначительным, его необходимо подавать в колонну в захоложен-
ном виде. При этом за счет парциальной конденсации тяжелоки-
пящего компонента легкокипящий компонент будет полнее отде-
ляться в виде дистиллята.
В связи с этим при разделении азеотропных смесей экстрак-
тивной ректификацией более целесообразно осуществлять процесс
по схеме, представленной на рис. 4.24,а.
202 Часть 1. Теоретические основы технологии крупнотоннажных ...
Рис. 4.24. Технологическая схема
комплекса солевой ректификации
К экстрактивным агентам предъ-
является ряд требований. Они
должны быть:
О избирательными, т. е. изменять относительную летучесть раз-
деляемых компонентов в нужном направлении;
О обладать достаточной емкостью, которая характеризуется мак-
симальной концентрацией разгоняемого продукта в разделя-
ющем агенте без отделения слоев второй жидкой фазы или вы-
мораживания растворителя;
© легко отделяться от продукта;
О легко регенерироваться из смесей с компонентами, уходящи-
ми с разделяющим агентом;
О инертными по отношению к компонентам разделяемой смеси
и аппаратуре, а также термостабильными;
© доступными, дешевыми и нетоксичными.
В ряде случаев, особенно при разделении гомоазеотропных сме-
сей с высокими температурами кипения, может быть применен про-
цесс, симметричный экстрактивной ректификации. Это процесс
разделения смесей с разновысокой подачей исходной смеси и раз-
деляющего агента, причем разделяющий агент имеет температуру
кипения ниже температуры кипения разделяемых компонентов и
подается ниже исходной смеси (см. рис. 4.23,в).
Другой разновидностью экстрактивной ректификации является
солевая ректификация, когда в качестве экстрактивного агента ис-
пользуется раствор соли. При этом соль изменяет относительную
летучесть разделяемых компонентов.
Примером такого разделения может служить ректификация
водной смеси уксусной кислоты в присутствии ацетата метоксиди-
этиленгликоля (5). Технологическая схема этого комплекса пред-
ставлена на рис. 4.24. Однако на таком комплексе возможно толь-
ко концентрирование уксусной кислоты с 10 до 87 %.
Глава 5. Совмещение как метод
УЛУЧШЕНИЯ ТЕХНОЛОГИИ
S Классификация совмещенных процессов.
S Анализ статики НСРРП.
S Правила определения принципиальной
протяженности реакционной зоны.
S Общие принципы организации НСРРП.
S Примеры непрерывных совмещенных
реакционно-массообменных процессов.
В промышленности основного органического и нефтехимиче-
ского синтеза непрерывную технологию, как правило, разраба-
тывают таким образом, чтобы каждый процесс и каждая операция
(реакция, разделение, передача тепла и т.д.) осуществлялись
в отдельных аппаратах. Однако с целью создания более экономич-
ной технологии, а также технологии безотходных производств очень
часто выгодно проводить несколько процессов в одном аппарате.
Совмещать можно реакционные процессы с массообменными,
несколько массообменных процессов, несколько реакционных про-
цессов (например, в одном реакторе проводить несколько реакций,
направленных на получение целевого продукта, несколько после-
довательных реакций) и т. д. Такое совмещение позволяет более пол-
но использовать сырье, получать целевые продукты с меньшими
энергетическими и капитальными затратами.
Совмещение химических реакций. В ряде производств органи-
ческого синтеза в одном аппарате проводят несколько реакций. Так,
можно совмещать две реакции, одна из которых является экзотер-
мической, а другая — эндотермической. В этом случае режим про-
цесса в целом может оказаться адиабатическим, и степень прибли-
жения его к адиабатическому зависит от теплоты каждой из
реакций. Особенно удобно совмещать реакции, когда производи-
тельность по каждой из них можно варьировать. Тогда, изменяя
производительность по одной из реакций, относительно легко до-
стигнуть адиабатического режима. При этом не только сокраща-
ются энергетические затраты, но и повышается конверсия реаген-
тов. Примером такого совмещения реакций может служить
204 Часть]. Теоретические основы технологии крупнотоннажных ...
окислительное дегидрирование углеводородов при получении бу-
тадиена-1,3, стирола и а-метилстирола.
Совмещать несколько реакций в одном аппарате можно также,
когда скорость протекания первой реакции зависит от скорости
протекания второй, а скорость протекания второй — от скорости
третьей и т. д. Характерным примером одновременного проведения
трех реакций в одном аппарате может служить процесс получения
ацетальдегида и винилацетата на палладиевом катализаторе. Одна-
ко такое совмещение наряду с преимуществами имеет и недостат-
ки. В частности, очень трудно подобрать условия, которые были
бы оптимальными для всех реакций, и, следовательно, некоторые
из них будут протекать в неоптимальных условиях. Поэтому пред-
почтительно процесс проводить при наилучших условиях для ли-
митирующей реакции. Иногда целесообразнее проводить эти ре-
акции в отдельных аппаратах. Это определяется, с одной стороны,
эффективностью работы всего технологического комплекса, а
с другой стороны, косвенными показателями (техникой безопас-
ности, экологией и т.д.). При получении ацетальдегида и винила-
цетата на палладиевом катализаторе сдерживающим фактором для
совмещения реакций является соотношение между этиленом и кис-
лородом.
Очень часто приходится сталкиваться с нежелательным само-
произвольным совмещением нескольких реакций, когда наряду с
основной (основными) реакцией (реакциями) протекают побочные
реакции. Характерным примером этого может служить производ-
ство этилбензола алкилированием бензола. В этом случае условия
проведения процесса и катализатор подбирают так, чтобы преиму-
щественно протекала основная реакция.
Совмещение массообменных процессов. Разделение много-
компонентных смесей можно проводить в последовательно со-
единенных аппаратах и различных комплексах. Однако можно так-
же объединить несколько массообменных процессов в одном
аппарате. В последнем случае, естественно, капитальные затраты
и затраты на управление будут меньше. Но такое объединение це-
лесообразно, если оно позволит сократить расход энергии. Как по-
казали многочисленные исследования, в большинстве случаев при
совмещении массообменных процессов энергетические затраты со-
кращаются.
Так, например, для разделения газов пиролиза используют аб-
сорбционно-ректификационные и конденсационно-ректифика-
Глава 5. Совмещение как метол улучшения технологии
205
ционные методы, основное различие которых заключается в ста-
дии деметанизации. При абсорбционно-ректификационном мето-
де деметанизацию осуществляют абсорбцией при Р= 3,5—4,0 МПа
и /=30—40 °C с использованием пропанового и аммиачного холо-
дильных циклов. При конденсационно-ректификационном мето-
де применяют глубокое охлаждение до —100 °C.
Сравнение конденсационно-ректификационного и абсорбци-
онно-ректификационного методов разделения пирогаза показывает,
что первый по энергетическим показателям предпочтителен, одна-
ко последний более удобен в эксплуатации, проще в аппаратурном
оформлении и требует меньшего расхода электроэнергии. К досто-
инствам конденсационно-ректификационного метода следует так-
же отнести возможность получения высококонцентрированных уг-
леводородных фракций при высокой степени их извлечения. В связи
с этим при необходимости получения этановой и этиленовой фрак-
ций чистотой 99,0 и 99,9 % используют конденсационно-ректифи-
кационный метод, а при меньшей требуемой чистоте целевых фрак-
ций — абсорбционно-ректификационный метод.
Однако такое совмещение пока используют только при раз-
делении углеводородных фракций, т. е. при получении сырья для
основного органического и нефтехимического синтеза, да и то толь-
ко на стадии деметанизации.
При разделении продуктов основного органического и неф-
техимического синтеза совмещение нескольких методов разделения
в одном аппарате используют при организации экстрактивной, ав-
тоэкстрактивной ректификации и азеотропно-экстрактивной рек-
тификации.
Например, при разделении азеотропных и зеотропных смесей,
содержащих компоненты с относительными летучестями, близкими
к единице, применяют экстрактивную или автоэкстрактивную рек-
тификацию без подачи флегмы, но при предварительном захолажи-
вании экстрактивного агента. В верхней части колонны (до уровня
ввода исходной смеси) протекают процессы парциальной конден-
сации и экстракции (из паровой фазы в межтарельчатом простран-
стве или в паровой фазе в насадочных колоннах), а на тарелках или
в жидкой фазе в насадочных колоннах — процесс экстракции (при
разделении расслаивающихся смесей). В нижней части колонны на-
ряду с этими процессами протекает процесс ректификации.
Таким образом, в одной колонне совмещены несколько массо-
обменных процессов. При этом исключение флегмы, на обра-
206 Часть 1. Теоретические основы технологии крупнотоннажных ...
зование которой требуются наибольшие затраты энергии (для ее
испарения и конденсации), позволяет значительно сократить рас-
ход энергии на разделение смеси продуктов. Но в этом случае не-
обходимо использовать эффективный экстрактивный агент.
Совмещение химических реакций с массообменными процессами.
Совмещенные реакционно-массообменные процессы широко ис-
пользуются в производствах основного органического и нефтехи-
мического синтеза. К их числу можно отнести реакционно-ректи-
фикационные процессы (когда в одном аппарате протекают
реакции и ректификация); реакционно-экстракционные процессы
(когда в одном аппарате протекают реакции и процесс экстракции),
процессы, в которых совмещается несколько реакций и разделе-
ние через мембраны (при этом мембраны устанавливаются в реак-
торе) и др.
КЛАССИФИКАЦИЯ СОВМЕЩЕННЫХ ПРОЦЕССОВ
Совмещенные реакционно-массообменные процессы можно
разделить на:
Сорбционные:
• реакционно-абсорбционные
реакционно-адсорбционные
• реакционно-десорбционные
Реакционно-кристаллизационные
Реакционно-осмотические
Реакционно-отгонные (перегонные,
дистилляционные)
Реакционно-отделительные
Реакционно-ректификационные
Рекционно-хроматографические
Реакционно-экстракционные
Данная классификация проведена по методам разделения или
отделения продуктов. В дальнейшем мы будем пользоваться глав-
ным образом этой классификацией. Но так как существует боль-
шое разнообразие химических реакций и процессов и все они име-
ют свои особенности, то можно провести классификацию по типу
реакций или реакционных процессов.
Как известно, по типу совмещенные реакционно-массообмен-
ные процессы делятся на самопроизвольно-совмещенные и направ-
ленно-совмещенные процессы.
Большинство каталитических процессов можно отнести к само-
произвольно-совмещенным процессам. Например, при исполь-
зовании твердых катализаторов необходимо за счет массообменных
процессов подавать реагенты к катализатору и удалять продукты ре-
акций из катализатора. В жидкофазных процессах отвод тепла реак-
ций осуществляют за счет испарения продуктов реакций или части
Глава 5. Совмещение как метол улучшения технологии
207
реагентов; в этом случае также протекает самопроизвольно-совме-
щенный процесс. Наиболее характерными примерами такой орга-
низации процесса является алкилирование бензола этиленом или
пропиленом. Все самопроизвольно-совмещенные процессы можно
разделить на две группы:
О когда целевые химические процессы сопровождаются самопро-
извольным разделением реакционной смеси (все ранее рассмо-
тренные процессы можно отнести к этой группе);
© когда целевые процессы разделения сопровождаются самопро-
извольными реакциями.
Первая группа самопроизвольно-совмещенных процессов ча-
ще всего сопровождается образованием новой фазы (или новых фаз)
из ранее полученной жидкой смеси реагентов и продуктов реак-
ций. Ко второй группе прежде всего относятся процессы рек-
тификации химически активных и термически нестойких веществ.
В процессе ректификации реагенты взаимодействуют между собой,
некоторые соединения подвергаются термополимеризации и поли-
конденсации, а термически нестойкие вещества разлагаются. Чаще
всего эти реакции являются нежелательными и нередко сильно ус-
ложняют процессы разделения. В этих случаях стараются органи-
зовать процесс разделения таким образом, чтобы исключить эти ре-
акции (за счет снижения температуры и давления, введения
ингибиторов и т. д.).
Большинство химических превращений протекают с процес-
сами переноса вещества и энергии (чаще тепла). Эти процессы вза-
имосвязаны и взаимообусловлены. Следовательно, можно рассма-
тривать как самопроизвольно, так и специально организованные
совмещенные реакционно-массообменные процессы.
В отрасли основного органического и нефтехимического син-
теза в основном используются непрерывные реакционно-ректифи-
кационные процессы (НСРРП).
НСРРП в значительной степени позволяют более полно ис-
пользовать сырье и энергию, а в конечном счете создавать безот-
ходные или малоотходные производства.
Совмещенными реакционно-ректификационными процессами на-
зываются также процессы, в которых химическая реакция проводится
совместно и одновременно (в одном аппарате) с частичным или пол-
ным разделением образовавшейся реакционной смеси посредством рек-
тификации.
208 Часть 1. Теоретические основы технологии крупнотоннажных ...
Такая организация процессов отличается от раздельного про-
ведения химических реакций и процессов разделения и имеет ряд
преимуществ:
ф достижение за один проход реагентов выхода продуктов, пре-
вышающего равновесный в закрытых или проточных системах;
ф более высокая селективность процесса в случае сложных реак-
ций;
ф более высокая движущая сила процесса организации естест-
венного противотока реагентов и больших концентраций реа-
гентов в зоне реакций;
Ф мягкие условия подвода и отвода тепла в объеме, а также воз-
можность полного использования тепла химических реакций;
ф простота организации;
ф компактность технологических схем и др.
Однако, несмотря на широкое распространение совмещенных
процессов, вопросы их теории разработаны далеко неполно. Такие
процессы можно изучать:
О на базе основополагающих теоретических разработок и эврис-
тических правил с последующей экспериментальной провер-
кой;
© путем математического моделирования с последующей экспе-
риментальной проверкой моделей.
Второй путь будет намного более результативным при исполь-
зовании ЭВМ. Этапу расчета параметров процесса предшествует не-
сколько стадий исследования совмещенных процессов, в том чис-
ле разработка оптимальных технологических схем, включающих эти
процессы.
Одной из самых первых стадий исследования совмещенных
процессов является анализ их статики, при котором необходимо
определить принципиальные возможности процесса, т. е. выявить
предельные конверсии реагентов за один проход при различных их
исходных соотношениях и при различных вариантах организации
совмещенного процесса. В задачи анализа статики входит также оп-
ределение состава и количества выделяемых в совмещенном про-
цессе фракций и синтез принципиальных схем процесса.
Необходимо отметить, что организация НСРРП зависит от типа
химических реакций, условий их протекания, структуры диаграм-
мы фазового равновесия жидкость—пар получаемой брутго-смеси,
а также от типа катализатора, его вида и состояния.
Глава 5. Совмещение как метол улучшения технологии
209
АНАЛИЗ СТАТИКИ НЕПРЕРЫВНЫХ СОВМЕЩЕННЫХ
РЕАКЦИОННО-РЕКТИФИКАЦИОННЫХ ПРОЦЕССОВ
(НСРРП)
Основные понятия. Для анализа статики НСРРП используют
следующие основные понятия.
Параметр управления процессом идеальной или четкой ректи-
фикации (заданное разделение) — P/W, где Р— дистиллят, W— ниж-
ний продукт.
Конверсия реагентов — вг
Принципиальная протяженность реакционной зоны — часть ко-
лонны, в которой принципиально могут (должны) протекать хи-
мические реакции.
Псевдоисходная смесь — реакционная смесь, образующаяся в ус-
ловиях НСРРП и отвечающая стехиометрии химического взаимодей-
ствия. Именно эта смесь подвергается разделению в НСРРП. Ее со-
став определяют из уравнения материального баланса:
F'=P + W+Z,
F*xfj = Рхр. + Wxw. + ZxZi, 5.1
где F — суммарный поток, поступающий в колонну (или суммарный по-
ток, выходящий из нее), в кг или молях (псевдоисходная смесь); Z — поток,
отбираемый из колонны (кроме дистиллята Р и нижнего продукта JF);
x/,i’ xp,i’ xw,i~ брутто концентрации компонента i в псевдоисходной сме-
си, дистилляте, нижнем продукте и отбираемом из колонны потоке соот-
ветственно, % (мае.) или % (мол.).
Предельное стационарное состояние процесса — состояние, при
котором достигается максимальная конверсия реагентов при при-
нятых ограничениях 0™ -^(0™)^ •
Траектория химического взаимодействия — геометрическое ме-
сто точек на концентрационном симплексе составов псевдоисход-
ных смесей, соответствующее некоторому закрепленному составу
исходной смеси. Положение траектории химического взаимодей-
ствия определяется только по уравнениям химических реакций.
Многообразия химического равновесия — полная совокупность хи-
мически равновесных составов в концентрационном симплексе,
включающем также вспомогательные для НСРРП вещества.
Локализация реакционной зоны. Реакционная зона локализова-
на, если она сосредоточена в некоторой конкретной части колон-
ны. В этом случае в результате НСРРП образуются такие потоки,
210 Часть!. Теоретические основы технологии крупнотоннажных ...
в которых при последующем разделении не будут протекать даль-
нейшие химические превращения.
Четкое разделение — разделение, при котором составы продук-
тов разделения (дистиллята и нижнего продукта) соответствуют гра-
ничным многообразиям области ректификации.
Получеткиеразделения — разделения, при которых составы дис-
тиллята и нижнего продукта соответствуют следующим условиям:
P/W<PJWX, 5.2
P/W>P1/WY 5.3
Причем, если P/W<PJWV то имеет место первое получеткое
разделение. При этом состав дистиллята соответствует его составу
при первом четком разделении, а нижний продукт содержит все
компоненты исходной смеси, но имеет другой состав.
Если P/WyPJW^, то осуществляется второе получеткое разде-
ление. При этом состав нижнего продукта соответствует его соста-
ву при втором четком разделении, а дистиллят включает все ком-
поненты исходной смеси, но имеет другой состав.
Этапы анализа. Анализ статики НСРРП проводят в следующей
последовательности:
1. Выбирают условия совмещенного процесса.
2. В зависимости от типа катализатора оценивают локализацию
реакционной зоны.
3. Определяют структуру диаграммы фазового равновесия реак-
ционной смеси.
4. Для оценки параметра управления процессом Р/W уточняют
плотность смесей.
5. Определяют относительную летучесть компонентов с целью
оценки целесообразности совмещения реакции с ректи-
фикацией.
6. Оценивают взаимосвязь параметра управления P/We. составом
псевдоисходной смеси хв.
7. Определяют зависимость параметра управления от состава
псевдоисходной смеси для четких разделений.
8. Определяют множества Р/РКдля различных заданных разделе-
ний во взаимосвязи с составом исходных смесей.
9. Определяют предельные стационарные состояния процесса для
выбранной совокупности составов исходных смесей и условий
0,. -^>0™*.
Глава 5. Совмещение как метод улучшения технологии
211
Рис. 5.1. Схемы НСРРП
10. Определяют принципиальную протяженность реакционной
зоны для предельного стационарного состояния.
11. Выбирают стационарное состояние для организации НСРРП.
При этом условию 0. —>0™* отвечают составы исходной сме-
си в окрестности эквимольной концентрации.
12. Сопоставляют стационарное состояние совмещенного процес-
са, в котором обеспечивается полное превращение реагентов,
с несовмещенным процессом, в котором может быть получена
максимальная конверсия, близкая к равновесной.
13. Строят схемы НСРРП для предельного стационарного состоя-
ния, начиная с реакционно-ректификационного аппарата
тройственной структуры, а затем выбирают оптимальный вари-
ант схемы НСРРП. Например, для осуществления реакции
А+В^±С при условии, что компоненты В и С образуют азео-
троп с минимумом температуры кипения и последовательность
температур кипения имеет вид Твс < Тс < Тв < ТА . При органи-
зации НСРРП возможны следующие варианты. В случае избытка
реагента В в исходной смеси могут быть предложены варианты,
представленные на рис. 5.1,а,б, в случае же избытка реагента А
в исходной смеси — варианты, представленные на рис. 5.1,в,г.
14. Предлагают принципиальные технологические схемы по-
лучения товарного (товарных) продукта (продуктов), включаю-
щие НСРРП.
Следует учитывать, что реакционную зону располагают в ап-
парате так, чтобы в ней при стационарных условиях процесса ин-
тенсивно протекали целевые реакции, способствующие достиже-
212 Часть 1. Теоретические основы технологии крупнотоннажных ...
нию стационарного состояния. Важно и вторую составляющую
совмещенного процесса (ректификационную) направить на это.
С этой целью выбирают вариант разделения, в том числе с при-
менением специальных методов разделения (азеотропная, экс-
трактивная и автоэкстрактивная ректификация), позволяющих не
только выделить необходимые компоненты или фракции компо-
нентов, но и создать необходимый концентрационный профиль
по реагентам в реакционной зоне.
Следовательно, в задачу идентификации переменных, связан-
ных с ректификационной составляющей, входит определение:
О составов и количества фракций, на которые может быть разде-
лена псевдоисходная смесь. При этом устанавливают и пара-
метр управления процессом P/W;
О таких параметров процесса ректификации, как флегмовое чис-
ло и эффективность колонны (общей, а также укрепляющей
и исчерпывающей частей). При использовании специальных
методов ректификации (азеотропной, экстрактивной и др.) до-
полнительно определяют качество, количество и уровень вво-
да разделяющих агентов.
ПРАВИЛА ОПРЕДЕЛЕНИЯ ПРИНЦИПИАЛЬНОЙ
ПРОТЯЖЕННОСТИ РЕАКЦИОННОЙ ЗОНЫ
Правила определения принципиальной протяженности реакци-
онной зоны для предельных стационарных состояний и анализа ста-
тики НСРРП формализованы на основе представлений о концент-
рационном пространстве.
Правило 1. Реакционная зона имеет конечную протяженность,
если точка состава дистиллята (верхнего продукта) расположена на
дуге орграфа’, включившейся в последовательный обход области
дистилляции от вершины неустойчивого узла, и при этом не про-
исходит исключения (включения) из состава дистиллята (в состав
верхнего продукта) компонентов на всех предшествующих (после-
дующих) вершинах по отношению к рассматриваемой точке дис-
тиллята (верхнего продукта) от) гачала (до конца) обхода.
Если точка состава дистиллята (верхнего продукта) расположена
в вершине орграфа, то эта вершина рассматривается по правилу 1
как предшествующая.
" Орграф — ориентированный граф, т. е. граф с ориентированными ребрами.
Глава 5. Совмещение как метод улучшения технологии
213
Правило 2. Когда точка состава дистиллята (верхнего про-
дукта) не расположена в вершине или на дуге орграфа, а рас-
положена внутри граничного подпространства области дистил-
ляции, то реакционная зона имеет конечную протяженность, если
по крайней мере одна ветвь этого контура граничного под-
пространства полностью включается в последовательный обход об-
ласти непрерывной ректификации (или дистилляции) от вершины
неустойчивого узла и не происходит исключения (включения) ком-
понентов при переходе через предшествующие (последующие) вер-
шины контура, включая первую (последнюю) вершину контура, от
начала (до конца) обхода.
Эти правила определения принципиальной протяженности ре-
акционной зоны применимы во всех случаях при сочетании обра-
тимой реакции с четкой простой непрерывной ректификацией в про-
цессе с локализованной реакционной зоной.
Необходимо отметить, что в случае реакционных смесей, ха-
рактеризующихся наличием азеотропов различной размерности,
для одних и тех же составов исходной смеси и значения параметра
управления возможны несколько стационарных состояний НСРРП,
которые могут отличаться друг от друга одним или несколькими
факторами. К числу этих факторов можно отнести:
О статическую устойчивость процесса непрерывной ректи-
фикации;
© сосредоточение областей постоянных концентраций (ОПК) по
концам колонны. В этом случае обе части колонны обладают
эффективностью, равной бесконечности;
© последовательность стационарных состояний, неразличимых по
первым двум факторам на траектории химического вза-
имодействия. В этом случае протяженность реакционной зоны
определяют для одного стационарного состояния, выделенного
с учетом рассмотренных факторов.
Приведенные выше факторы являются также достаточными для
установления предельного стационарного состояния.
Для предсказания реализации одного или нескольких воз-
можных стационарных состояний в выбранной модели НСРРП для
закрепленного состава исходной смеси и параметра управления ис-
пользуется следующее правило: из нескольких стационарных со-
стояний НСРРП реализуется такое, которое отвечает одновремен-
но статической устойчивости, большему числу областей постоянных
214 Часть 1. Теоретические основы технологии крупнотоннажных ...
концентраций (ОПК) по концам колонны и наименьшей конвер-
сии реагентов. После выявления стационарного состояния опре-
деляется принципиальная протяженность реакционной зоны.
Правило о реализации стационарного состояния базируется на фи-
зико-химических основах процесса дистилляции: статической ус-
тойчивости и ОПК.
Эвристической частью правила о реализации стационарного
состояния является та его часть, в которой рассматриваются состо-
яния, неразличимые в статической устойчивости и ОПК. Предпо-
чтение отдается стационарному состоянию, обеспечивающему на-
именьшую конверсию, так как не удается выявить какие-либо
причины для последовательного перехода от исходной смеси через
это стационарное состояние к новому, более удаленному стацио-
нарному состоянию.
Необходимо также отметить, что из нескольких стационарных
состояний НСРРП реализуется то, которое отвечает одновременно
наибольшей статической устойчивости и большему числу областей
постоянных концентраций (ОПК) по концам колонны.
ОБЩИЕ ПРИНЦИПЫ ОРГАНИЗАЦИИ НСРРП
Мы рассмотрим те принципы, которые являются общими, т. е.
зависят от типа химических реакций и конструктивного оформ-
ления аппаратов. К числу таких принципов относятся: формиро-
вание новой структуры диаграммы фазового равновесия жид-
кость-пар, расположение и протяженность реакционной зоны;
противоток реагентов, организация потоков, перемена за-
мыкающего потока, выбор заданных разделений, компактность
технологических схем.
Вначале остановимся на технологических принципах организа-
ции НСРРП, позволяющих увеличить число типовых случаев ис-
пользования совмещенных реакционно-массообменных процессов.
Одним из важнейших является принцип противотока реа-
гентов, который обеспечивается выбором уровня их подачи в ко-
лонну. Он необходим для создания наиболее высокой движущей
силы химической реакции. Уровень подачи, как правило, опре-
деляется концентрационным профилем компонентов по высоте
колонны, который, в свою очередь, зависит от структуры диа-
граммы фазового равновесия жидкость—пар реакционной смеси.
При этом летучий компонент подается в нижнюю часть реакци-
Глава 5. Совмещение как метод улучшения технологии
215
онной зоны или еще ниже, а менее летучий, наоборот, в верх-
нюю ее часть или еще выше (рис. 5.1). При выборе уровня пода-
чи реагентов необходимо учитывать влияние их концентрации на
относительную летучесть продуктов. Количественная оценка это-
го влияния может быть сделана на основе анализа фазового рав-
новесия жидкость—пар.
Для достижения полной конверсии реагентов большое значение
имеет уровень отбора продуктов из колонны или приемы организа-
ции потоков. При сочетании реакции с простой ректификацией
чаще всего отбирают два потока — дистиллят и нижний продукт. Од-
нако возможны и варианты, когда протяженность реакционной
зоны в направлении какого-либо из отбираемых потоков неопре-
деленная, а проводимая реакция сравнительно медленная. В таких
случаях целесообразно один из потоков не отбирать и вести про-
цесс в одноотборном режиме, позволяющем исключить неопре-
деленность протяженности реакционной зоны (рис. 5.1).
Для быстрых химических реакций реакционная зона может
иметь принципиально неопределенную, но реально — конечную
протяженность. Тогда необходимость замыкания потока отпадает.
Другие варианты организации работы аппарата при Р= 0 или W= О
вытекают непосредственно из анализа статики НСРРП, как обес-
печивающие наивысшие конверсии реагентов.
В ряде случаев при перемене замыкающего потока может быть
исключена неопределенная протяженность реакционной зоны и
обеспечена наивысшая конверсия. Например, если в анализе ста-
тики предсказывается наивысшая конверсия реагентов при
Р/ИЛ=оо, т. е. при И^=0, но стационарное состояние характеризу-
ется неопределенной протяженностью реакционной зоны, то це-
лесообразно рассмотреть возможность проведения процесса при
Р/ИЛ=0, т. е. при P=Q.
Для организации совмещенного реакционно-ректификацион-
ного процесса очень важно правильно разместить катализатор в ко-
лонне или определить расположение реакционной зоны. Расположе-
ние реакционной зоны тесно связано с концентрационным
профилем компонентов в колонне и схемой отбираемых из колон-
ны потоков.
Из статики НСРРП следует, что если реакционная зона имела
принципиально неопределенную протяженность в направлении ка-
кого-либо потока и этот поток не отбирается, то реакционная зона
распространяется до того конца колонны, на котором поток замк-
216 Часть 1. Теоретические основы технологии крупнотоннажных ...
нут. Если же реакционная зона имеет принципиальную конечную
протяженность в направлении какого-либо отбираемого потока, то
этот поток отбирается из ректификационной секции аппарата (про-
межуточный отбор).
Таким образом, если реакционная зона имеет определенную
протяженность в направлении обоих отбираемых потоков, то она
располагается в некоторой части колонны. При этом нижняя и верх-
няя части колонны являются чисто ректификационными.
Реальная протяженность реакционной зоны в основном опре-
деляется соотношением скоростей реакции и массопереноса. При-
чем, чем больше скорость реакции, тем меньше протяженность ре-
акционной зоны.
Заданное разделение в значительной степени формирует наибо-
лее благоприятный концентрационный профиль для реакции
в реакционно-ректификационном процессе и предварительно оце-
нивается на основе реакций и диаграммы фазового равновесия ре-
акционной смеси. Из возможных выбирается такое заданное раз-
деление, которое обеспечивает в реакционной зоне наибольшую
концентрацию реагентов и наименьшую концентрацию продуктов
реакции.
Технологические схемы получения того или иного продукта
с применением совмещенного процесса должны быть просты и ком-
пактны. В этом случае, как правило, обеспечиваются наименьшие
энергетические и капитальные затраты, потери и загрязнение ок-
ружающей среды.
Для организации профиля концентраций, необходимого для до-
стижения максимальной конверсии реагентов, можно также изме-
нять структуру диаграммы фазового равновесия жидкость—пар
за счет как введения новых компонентов, таки изменения давления.
Если нельзя организовать НСРРП так, чтобы химическая ре-
акция сочеталась с простой ректификацией, то тогда используют:
О вспомогательные, не вступающие в химические реакции ве-
щества;
© компоненты реакционной смеси в качестве разделяющих
агентов.
Для преодоления ограничений, определенных правилами ор-
ганизации НСРРП, можно использовать компоненты, участвующие
в реакции, или другие вещества в качестве автоэкстрактивного аген-
та, экстрактивного агента и т.д.
Глава 5. Совмещение как метол улучшения технологии
217
При низкой скорости реакции можно вводить химически не
взаимодействующее вещество, которое будет служить сред некипя-
щим компонентом. Такая однажды введенная добавка может долго
находиться в аппарате, работающем в стационарных условиях,
и обеспечить увеличение скорости химической реакции конверсии.
Увеличение скорости реакции при соответствующем подборе до-
бавляемого вещества возможно при двух условиях:
О когда оно влияет на относительную летучесть разделяемой сме-
си и обусловливает снижение концентрации продуктов в ре-
акционной зоне;
© когда данное вещество влияет как растворитель на скорость
реакции.
ПРИМЕРЫ НЕПРЕРЫВНЫХ СОВМЕЩЕННЫХ
РЕАКЦИОННО-МАССООБМЕННЫХ ПРОЦЕССОВ
Как уже отмечалось, в производствах основного органического
и нефтехимического синтеза используются непрерывные совмещен-
ные реакционно-массообменные процессы. Например, при произ-
водстве этилового спирта сернокислотной гидратацией этилена при-
меняется реакционно-абсорбционный процесс. На гидратацию
поступает этилен—этановая фракция, которая барботирует через
98 %-ную серную кислоту. В тарельчатой колонне при противотоке
реагентов протекают с выделением тепла две основные реакции:
CH2=CH2 + H2SO^CH2CHOSO2H, = -146,54 кДж 5.4
Моноэтилсульфат
CHfH0S0.H+CH2=CH2^CH^CH2O)2S01. Д//^ =-96,3 кДж 5.5
Диэтилсульфат
При этом за счет хемосорбции практически полностью погло-
щается этилен (в этане остается 0,5% этилена), и, следовательно,
разделяется этилен и этан.
Вторая стадия этого процесса — гидролиз этилсульфатов — мо-
жет быть отнесена к реакционно-отгонным процессам, так как от-
носительная летучесть разделяемых компонентов очень высока. По-
этому гидролиз этилсульфатов можно проводить как в отгонной
колонне, так и перегонном кубе. При этом протекают следующие
реакции:
(сн2сн20)2 so2+н2о c2Hpso2H+с2нрн
5.6
218 Часть 1. Теоретические основы технологии крупнотоннажных ...
C2H3OSO3H + H2O^>C2H3OH + H2SO4 5.7
(C2H3O)2SO2+C2HsOH -+(С2Н5)2О + CH3CH2OSO3H 5.8
Для снижения выхода диэтилового эфира, являющегося в дан-
ном случае побочным продуктом, необходимо быстро провести ги-
дролиз и отогнать образующийся этиловый спирт из гидролизата.
Именно совмещенный процесс позволяет это сделать.
Другим примером совмещенного реакционно-массообменно-
го процесса может служить разделение бутадиена и бутиленов хе-
мосорбцией бутадиена раствором следующего состава (в моль/л):
Си2О — 3,0; СиО~ 0,3; СН3СООН~ 4,0; NH3 - 31,3. При этом про-
текает основная реакция:
(CH3COO)2Cu2(NH3)i + C4ff6 <=> C4H6(NH3)3Cu2(CH3COO)2 + NH3 5.9
Поглощение бутадиена проводят в колонне при противотоке
реагентов. Этот процесс относится к реакционно-экстракционным.
Вторая стадия процесса — разложение комплекса и выделение кон-
центрированного бутадиена (>98 %) — относится к реакционно-де-
сорбционным процессам. Такие хемосорбционные процессы явля-
ются достаточно селективными.
Хемосорбция используется при выделении изобутилена мо-
номерной чистоты из фракции С4 углеводородов, в которой при-
сутствуют различные изомеры бутилена. В этом случае применяют
селективную гидратацию изобутилена в триметилкарбинол (ТМК).
Гидратацию, а затем и дегидратацию проводят на формованном
сильнокислотном катионообменном катализаторе КУ—ФПП, ко-
торый как гетерогенный катализатор обладает значительными пре-
имуществами по сравнению с традиционным катализатором кис-
лотно-основных процессов — серной кислотой. На этом катализа-
торе скорость гидратации изобутилена значительно выше, чем ско-
рость гидратации других изомеров, в связи с этим последние
практически не вступают в реакцию гидратации.
В результате такого выделения изобутилена содержание при-
месей в выделенном продукте не превышает 0,05 %.
Рассмотрим более детально вторую стадию процесса — дегид-
ратацию триметилкарбинола. Эту реакцию проводят при атмосфер-
ном давлении в условиях кипения реакционной смеси в аппарате
колонного типа, верхняя часть которого заполнена катализатором
КУ—2ФПП (рис. 5.2). Температура кипения изобутилена (7,01 °C)
Глава 5. Совмещение как метод улучшения технологии
219
Рис. 5.2. Технологическая
схема дегидратации триме-
тилкарбинола (ТМК):
1 - колонна; 2 - кипятильник;
3 — конденсатор; 4 - сепаратор
Вода+
полимеры
значительно ниже темпера-
туры кипения азеотропной
смеси ТМК—вода (==70°С).
Кроме того, растворимость
изобутилена в воде при тем-
пературе 70 °C составляет
примерно 0,07%, а растворимость триметилкарбинола - 80%. По-
этому этот процесс может быть отнесен к реакционно-десорб-
ционным или реакционно-отделительным.
На дегидратацию в нижнюю часть катализаторного слоя по-
дается смесь ТМК и воды азеотропного состава. Изобутилен вме-
сте с небольшим количеством ТМК и воды поступает в кон-
денсатор 3, где конденсируются ТМК и вода. В сепараторе 4 ТМК
и вода отделяются от изобутилена и возвращаются в колонну 1.
Из куба колонны 1 отводится вода, содержащая полимерные при-
меси. Нижняя часть колонны предназначена для исчерпания
и концентрирования ТМК. Следовательно, в этой колонне про-
текает и ректификация. Поэтому рассмотренный процесс может
быть отнесен одновременно к нескольким классам совмещенных
процессов: реакционно-десорбционным, реакционно-отделитель-
ным и реакционно-ректификационным.
Подвод тепла через кипятильник необходим как для отгонки
ТМК в виде азеотропа с водой, так и для протекания эндотерми-
ческой реакции дегидратации.
Промышленный процесс выделения мономерного изобутиле-
на с применением совмещенного процесса на катионообменном
катализаторе разработан в нашей стране впервые в МИТХТ и НИИ
«Ярсинтез». Этот процесс является не только более экономичным,
но и экологически чистым по сравнению с аналогичным процес-
сом с использованием серной кислоты (отсутствует коррозия, кис-
лые сточные воды и т. д.).
220 Часть 1. Теоретические основы технологии крупнотоннажных ...
Рис. 5.3. Технологическая схема
производства бутилацетата в две
ступени
Необходимо отметить, что
ионообменные смолы находят
все более широкое примене-
ние в качестве катализатора
кислотно-основных процессов. А формованные ионообменные
катализаторы широко распространены в совмещенных реакцион-
но-массообменных процессах. Такие процессы как этерификация,
гидролиз, переэтерификация относительно легко могут быть орга-
низованы как совмещенные.
Примером организации непрерывного совмещенного реак-
ционно-ректификационного процесса является получение бути-
лацетата, который используется в качестве растворителя, этерифи-
кацией уксусной кислоты бутанолом-1.
Принципиальная схема процесса производства бутилацетата
представлена на рис. 5.3. Смесь уксусной кислоты и бутанола-1 в со-
отношении 1:1,04 подают в форколонну 1, заполненную мелкозер-
нистым катионитом. Температуру в этой колонне поддерживают не
ниже 90 °C. Смесь химически равновесного состава из колонны 1 по-
ступает в реакционно-ректификационную колонну 2 для доэтери-
фикации и разделения реакционной смеси. Верхняя и нижняя части
колонны 2 — чисто ректификационные, средняя — заполнена фор-
мованной катионообменной насадкой, содержащей Амберлит IR-
120. В этой колонне поддерживают остаточное давление — 17,3 кПа;
температуру в реакционной зоне — 70°С. Пары из колонны 2, со-
держащие бутилацетат, бутанол-1 и воду в азеотропном соотношении,
после конденсации поступают во флорентийский сосуд 4. Водный
слой выводят из системы, а верхний слой возвращают в колонну 2.
Образовавшийся бутилацетат выводят из нижней части колонны 2
в виде кубового продукта. Перед началом этерификации в колонну
2 вводят бутанол-1 в количестве, соответствующем полному насы-
щению катионообменного катализатора.
Глава 5. Совмещение как метол улучшения технологии
221
С точки зрения технологии целесообразность организации
НСРРП, обеспечивающего полную конверсию бутанола и ук-
сусной кислоты, очевидна. В частности, был предложен вариант
организации НСРРП (рис. 5.4) с одноотборным режимом в реак-
ционно-ректификационной колонне, работающей при давлении
33,2 кПа, в котором в качестве катализатора используется формо-
ванный КУ—2ФПП в виде цилиндров размером 6x6x4 мм. Ис-
ходные реагенты — бутанол-1 и уксусную кислоту подают в ко-
лонну в эквивалентном соотношении, а воду — с учетом ее
количества, выделяющегося в дистиллят в составе азеотропа бу-
тилацетат—вода. Бутанол-1 подают в нижнюю часть колонны 1,
а уксусную кислоту — в верхнюю часть катализаторного слоя. Ко-
лонна 1 орошается брутто-составом. Отгонные колонны 2 и 3
предназначены для выделения воды и чистого бутилацетата.
В настоящее время спрос на бутилацетат в России превышает
предложение. Это обусловлено дефицитностью исходных реаген-
тов: уксусной кислоты и бутанола-1. Вместе с тем в производстве
поливинилового спирта в качестве побочного продукта образуется
метилацетат, который не находит квалифицированного приме-
нения. Поэтому в настоящее время пытаются подвергнуть его гид-
ролизу:
СЯ3 - (СО) - О - СН. + Я2О <=> СН.СООН + СН.ОН 5.10
Образующиеся по этой реакции уксусная кислота и метанол
могут быть использованы при производстве винилацетата и поли-
Рис. 5.4. Технологическая схема получения бутилацетата
с одноотборным режимом
222 Часть 1. Теоретические основы технологии крупнотоннажных ...
винилового спирта. Этот процесс также может быть организован
в режиме НСРРП. Метилацетат может быть успешно использован
при получении бутилацетата в режиме непрерывного совмещенно-
го реакционно-ректификационного процесса с использованием
сильнокислотных ионообменников:
СЯ3 - (СО) - СЯ3 + СЯ3СЯ2СЯ2СЯ2ОЯ <=>
СН. - (СО) - ОСН,СН,СН,СНЛ + СН.ОН 5.11
Применение метилацетата в качестве реагента для получения
бутилацетата вместо уксусной кислоты предпочтительнее, так как
последняя вызывает коррозию оборудования. Температура кипения
метилацетата — 56,3 °C, а уксусной кислоты — 118 °C, поэтому в слу-
чае использования метилацетата процесс можно проводить при бо-
лее низких температурах, а следовательно, и катализатор (ионооб-
менник) будет работать более длительный срок.
Области непрерывной четкой ректификации смеси метилаце-
тат—метанол—бутилацетат—бутиловый спирт представлены на
рис. 5.5.
В результате анализа статики совмещенного реакционно-рек-
тификационного процесса было предложено несколько вариантов
совмещенного процесса получения бутилацетата из метилацетата,
два из которых представлены на рис. 5.6. Эти варианты организа-
ции совмещенного процесса отличаются различной конверсией ис-
ходных реагентов.
В варианте, представленном на рис. 5.6,а, конверсия бутано-
ла-1 составляет 100% и в дальнейшем будет необходимо разде-
лять азеотропную смесь метилацетата с метанолом. В варианте,
представленном на рис. 5.6,5, конверсия метилацетата составляет
100 % и в дальнейшем будет необходимо разделять азеотропную
смесь бутанола-1 и бутилацетата.
Б(117,8°С)
Рис. 5.5. Области непрерывной
четкой ректификации в системе
метилацетат-метанол- бута-
нол- 1 - бутилацетат
Глава 5. Совмещение как метол улучшения технологии
223
а
Бутанол-1,
Бутилацетат
б
Рис. 5.6. Варианты организации совмещенного процесса получения
бутилацетата из метилацетата
Технологические схемы, соответствующие рассмотренным ва-
риантам организации совмещенных процессов, представлены, со-
ответственно, на рис. 5.7 и 5.8.
В первом варианте (рис. 5.7) азеотропная смесь метилацетата
и метанола делится на двухколонном агрегате (колонны 2 и 5), ко-
лонны которого работают при разных давлениях. Причем колонна 2
работает при повышенном давлении (Р = 0,8105—1,0132 МПа), а ко-
Рис. 5.7. Технологическая схема получения бутилацетата из метилацетата
и бутанола-1 (вариант 1):
1 - реакционно-ректификационная колонна; 2 - ректификационная колонна
выделения метилацетата; 3 - ректификационная колонна выделения метанола
224 Часть 1. Теоретические основы технологии крупнотоннажных ...
Рис. 5.8. Технологическая схема получения бутилацетата из метилацетата
и бутанола-1 (вариант 2):
1 — реакционно-ректификационная колонна; 2 — ректификационная колонна
выделения метанола (Р= 0,1013 МПа); 3 — ректификационная колонна выделе-
ния бутилацетата (Р— 0,013 МПа); 4 - ректификационная колонна выделения
бутанола-1 (7*= 0,1013 МПа)
лонна 3 — при атмосферном давлении. При повышенном давлении
азеотроп содержит 45-47 % (мол.) метилацетата. Экономически вы-
годно поддерживать в колонне 5пониженное давление (Р= 0,04 мПа).
При таком давлении азеотроп содержит 70—72 % (мол.) метилацета-
та (при атмосферном давлении — 62—64 %), поэтому уменьшаются
рециклы. Снижение давления позволяет повысить относительную ле-
тучесть компонентов.
Во втором варианте (рис. 5.8). азеотропную смесь бутанол-1 -
бутилацетат также делят на двухколонном агрегате, колонны кото-
рого (3 и 4) работают при разных давлениях, но при пониженном
давлении азеотроп обогащается спиртом, а не эфиром. Так, в азео-
тропе при Р= 0,022 МПа содержится около 50 % (мол.) бутанола-1
и его температура кипения равна 76,4°С, а при Р=0,0065 МПа-
37% (мол.) бутанола-1 и его температура кипения равна 50,7 °C.
Однако окончательный выбор варианта может быть сделан
только после детального технико-экономического сравнения схем
процесса.
Следует отметить, что первые два приведенных в этом разделе
примера базируются на традиционной организации хемосорбци-
онно-десорбционного процесса. Остальные же три базируются на
новой концепции: специально подобранном и расположенном
в определенной зоне катализаторе и специально подобранных уело-
Глава 5. Совмещение как метол улучшения технологии
225
виях проведения процессов разделения, позволяющих, с одной сто-
роны, отводить продукты реакций из реакционной зоны, а с другой
стороны, создавать такой профиль концентраций компонентов по
высоте колонны, чтобы наибольшая концентрация реагентов была
в зоне реакций. Задача оптимизации НСРРП может решаться за счет
применения специальных методов разделения (экстрактивной,
автоэкстрактивной и азеотропной ректификации и др.). Этот про-
цесс можно также проводить в токе инертного газа с целью более
быстрого отвода продуктов реакций из реакционной зоны, а также
снижения температурных режимов (вместо применения вакуума).
В данном разделе были рассмотрены главным образом процессы,
базирующиеся на фазовом переходе жидкость—пар, жидкость—газ
или жидкость—жидкость. Но могут использоваться и процессы, ос-
нованные на применении мембран, а также реакционно-кристал-
лизационные процессы.
Следует отметить, что совмещенные процессы приобретают все
более широкое распространение при создании безотходных или ма-
лоотходных производств.
8 я-6
Глава 6. Принципы создания безотходных
(малоотходных) производств
S Обшие подходы к созданию
безотходных производств.
S Методологические принципы.
S Химические принципы.
S Технологические принципы.
S Организационные принципы.
S Условия применения принципов создания
безотходных производств.
S Экономическое обоснование
безотходных технологий.
Защита окружающей среды от загрязнений промышленными
выбросами — одно из главных требований, предъявляемых к совре-
менным химическим производствам. С этой целью создаются такие
технологические процессы, которые обеспечивают не только
количественные и качественные требования к целевым продуктам,
но и комплексное использование сырья, разрабатываются и внедря-
ются высокоэффективные методы очистки пылегазовых выбросов
и сточных вод, системы контроля за их состоянием. Однако уже в
ближайшем будущем такой подход к решению экологических про-
блем будет неприемлем.
На основе принципиально новой технологии необходимо соз-
давать малоотходные или безотходные производства, позволяющие
превращать сырье в целевые продукты без теплового загрязнения ок-
ружающей среды, предусматривающие вывод из системы только про-
дуктов, составляющих биосферу. Особую актуальность эта проблема
приобретает в связи с ростом масштабов и концентрации производств,
увеличением потребления сырьевых и энергетических ресурсов.
Вместе с тем в настоящее время отсутствуют общие принципы
разработки технологии как для малоотходных, так и для безотход-
ных производств.
Создание безотходных или малоотходных производств по-
зволяет решать две взаимосвязанные задачи: экологическую и эко-
номическую. Поэтому усилия ученых и инженеров должны быть
направлены прежде всего на создание и внедрение ресурсо- и энер-
ГMBA 6. Приниипы СОЗДАНИЯ БЕЗОТХОДНЫХ ПРОИЗВОДСТВ
227
госберегающих технологий. Такой подход будет определять путь
интенсивного развития отрасли.
Современное производство, в том числе и химическое, пока еще
с многоотходной технологией, оказывает на природу серьезное не-
гативное воздействие. В атмосферу земли ежегодно выбрасывается
более 230 млн т оксида углерода, более 50 млн т различных углево-
дородов, около 170 млн т диоксида серы, свыше 50 млн т оксидов
азота и т. д. Не лучше обстоит дело с загрязнением водных бассейнов
и земли. А если к этому добавить тепловые, радиоактивные и другие
виды загрязнений, которые также отрицательно влияют на многие
экологические системы, то будет ясно, что все это сильно сказыва-
ется на условиях жизни вообще и здоровье человека, в частности.
Следовательно, учитывая большие масштабы производств, в том чис-
ле основного органического и нефтехимического синтеза, нельзя их
создавать и эксплуатировать без учета воздействия на окружающую
среду. Необходимо не только отказаться от «потребительского» от-
ношения к природе, от ранее поставленной задачи «покорения ди-
кой природы», а решать задачу гармонического развития человека и
природы как единой системы.
В настоящее время необходимо ставить задачу использования
природных ресурсов с максимальной не только экономической,
но и прежде всего социальной эффективностью. А это значит, что
технологические процессы необходимо рассматривать в тесной
связи с экономическими, социальными и биологическими про-
цессами.
Учитывая тот факт, что в отрасли основного органического
и нефтехимического синтеза производится большой ассортимент
(сотни наименований) и большое количество (от десятков до сотен
тысяч тонн в год) продуктов, способных загрязнять биосферу, то
необходимо создавать технологию, которая позволяла бы сбрасы-
вать в биосферу вещества, которые могут усваиваться природными
биологическими системами, только в безвредных количествах.
Необходимо также учитывать, что в производствах 00 и НХС ис-
пользуется большое количество сырья, воды и энергии, а, кроме
того, за счет химических превращений часто выделяется значитель-
ное количество тепла. Следовательно, необходима такая организа-
ция производства, при которой утилизируются не только большое
количество побочных продуктов, но и все выделяемое тепло, как
внутри данной системы, так и частично в соседних взаимосвязан-
ных экологических подсистемах.
228 Часть 1. Теоретические основы технологии крупнотоннажных ...
Во многих производствах выбрасывается в биосферу значи-
тельное количество различных химических веществ (углеводороды,
оксиды углерода, азота, серы и др.), загрязняющих ее. Вместе
с тем эти вещества могут быть успешно применены в качестве сы-
рья. Для этого необходимо разработать индустрию улавливания та-
ких продуктов и новую высокоэффективную технологию их ис-
пользования.
Уже в настоящее время многие из выбрасываемых продуктов ис-
пользуются в существующих производствах основного органичес-
кого и нефтехимического синтеза. Так, например, на основе СО
можно получать муравьиную кислоту (через формиаты), фосген (при
хлорировании СО), метан и метанол (при гидрировании СО), пара-
финовые углеводороды (синтез Фишера—Трогала), альдегиды, спир-
ты и другие кислородсодержащие продукты (процесс оксосинтеза).
На основе СО2 можно получать СО (над раскаленным углем), моче-
вину и карбамид (при взаимодействии с аммиаком), СО и серу (при
взаимодействии с сероуглеродом), этиленкарбонат (при взаимодей-
ствии с оксидом этилена), оксикислоты и другие продукты. Кроме
того, СО2 может применяться, как «сухой лед» в пищевой промыш-
ленности. На основе оксидов азота можно синтезировать азотную
кислоту, а из нее получать нитропарафины (например, нитротолу-
ол, тринитротолуол, нитробензол, анилин) и другие продукты. Прак-
тически все углеводороды могут быть использованы в качестве сы-
рья при производстве различных продуктов основного орга-
нического и нефтехимического синтеза. Растворители после их улав-
ливания и регенерации можно применять многократно.
Таким образом, перед отраслью основного органического
и нефтехимического синтеза уже на ближайший период времени
встают следующие важные задачи:
Ф разработка технологий, которые позволили бы увеличивать вы-
пуск необходимой продукции, не нарушая требований эко-
логии, т. е. безотходных или малоотходных технологий;
Ф создание новых производств, использующих в качестве сырья
«собственные» отходы и выбросы, а также производств других
отраслей промышленности;
Ф определение перечня продуктов, которые могут быть усвоены
природными биологическими системами;
❖ научное определение допустимых количеств различных про-
дуктов основного органического и нефтехимического синтеза,
ГЛАВА 6. Приниипы СОЗДАНИЯ БЕЗОТХОДНЫХ ПРОИЗВОДСТВ
229
которые могут попадать в биосферу без вредных последствий
для окружающей среды и человека;
Ф создание малоэнергоемких производств и производств с ма-
лым потреблением воды.
ОБЩИЕ ПОДХОДЫ К СОЗДАНИЮ
БЕЗОТХОДНЫХ ПРОИЗВОДСТВ
В настоящее время в ряде районов нашей страны из-за кон-
центрации предприятий химической промышленности создалась
критическая экологическая обстановка. Однако, если рассредото-
чить химические производства и за счет этого снизить концентра-
цию загрязнения, то экономическая эффективность этих произ-
водств будет ниже (вследствие того что будет нужно организовывать
транспортировку сырья и продуктов). Концентрация производств
позволяет проще решать экологические задачи (так как в этом слу-
чае побочные продукты или отходы одного производства могут ис-
пользоваться в качестве сырья на другом производстве) и энерге-
тические проблемы; во многих случаях организовывать совместную
очистку сточных вод, например за счет нейтрализации «кислых»
вод одного производства «щелочными» водами другого.
Выход в каждой конкретной ситуации только один: создавать
оптимальную концентрацию безотходных (или малоотходных) про-
изводств на базе технологических или территориальных комплексов.
Неотъемлемой особенностью прогресса в химической промышлен-
ности является неуклонное повышение степени комплексности пе-
реработки сырья. Более того, наблюдаемое во всех странах стремле-
ние сократить потребление природных ресурсов и увеличить степень
использования вторичных материальных и энергетических ресурсов
приводит к значительным изменениям структуры промышленного
производства. Тем более, как показывает накопленный за последнее
время мировой и отечественный опыт, 80 % экономии материаль-
ных ресурсов связано с внедрением ресурсосберегающих техноло-
гий и лишь 20% с другими мероприятиями. Таким образом, если
экономия самый дешевый и эффективный способ умножения ре-
сурсов расширенного воспроизводства, то ресурсосберегающие тех-
нологии — главный инструмент этого способа.
Более 50 % экономии топливно-энергетических ресурсов в хи-
мической промышленности нашей страны можно получить за счет
совершенствования технологических процессов, примерно 20 % —
230 Часть 1. Теоретические основы технологии крупнотоннажных ...
путем более полного использования вторичных энергетических ре-
сурсов и около 25 % - за счет организационно-технических меро-
приятий. Основой повышения энергетической эффективности хи-
мической промышленности считается не только внедрение новых
типов технологических установок, но и повышение уровня регене-
рации тепла потоков нагретых продуктов, и на этой базе широкое
использование энерготехнологических схем. Следовательно, актуаль-
на задача разработки схем, предусматривающих полную переработ-
ку сырья в продукты с использованием вторичных энергоресурсов
на базе принципов рециркуляции и цикличности. При рециркуляции
предусматривается создание замкнутых технологических комплек-
сов с возвратом на вход непрореагировавшего сырья, комплексного
использования энергии за счет теплообмена между прямыми и об-
ратными потоками.
Кроме того, при создании безотходных и малоотходных про-
изводств необходимо относить к отходам только те вещества, кото-
рые сразу не могут быть использованы в качестве товарных продук-
тов вместе с целевыми продуктами; вовлекать отходы в хозяйствен-
ный оборот в виде сырья, полученного из этих отходов; разрабатывать
технологические установки по превращению отходов во вторичное
сырье, которое будет более дешевое, чем природное.
Следовательно, в безотходном производстве должен быть ис-
пользован принцип рационального использования всех компонентов
сырья и энергии. Все принципы создания безотходных производств,
по существу, предназначены для превращения сырья только в про-
дукты при полном использовании энергии системы и малых затра-
тах внешней энергии.
Однако в настоящее время не всегда могут быть разработаны
технологии, позволяющие сделать производство безотходным. По-
этому на первом этапе будут разрабатываться и внедряться техно-
логии малоотходных производств. Под технологиями малоотходных
производств понимается такой способ производства, при котором
количество образующихся отходов вредных веществ меньше их до-
пустимых концентраций в воздушном бассейне, водоемах и почве.
Эта технология не является замкнутой, но в ней реализуется прин-
цип максимальной изолированности производства от окружающей сре-
ды. Следовательно, малоотходное производство должно представ-
лять систему, в которой осуществляется принцип круговорота
веществ и энергии за исключением сырья и целевых продуктов. Вме-
сте с тем в настоящее время на функционирующих производствах
ГMBA 6. Приниипы СОЗДАНИЯ БЕЗОТХОДНЫХ ПРОИЗВОДСТВ
231
трудно создать даже малоотходные технологии. При условии роста
масштабов производства и высоких экологических требованиях
можно определить два принципиально отличных друг от друга на-
правления получения продуктов основного органического и неф-
техимического синтеза.
Первое направление предусматривает реконструкцию дейст-
вующих производств и создание технологии с глубокой очисткой
газовых выбросов, воды, вводимой из производства, и твердых от-
ходов от вредных для природы и здоровья человека веществ. Такой
путь уже нашел в настоящее время широкое распространение в про-
мышленности основного органического и нефтехимического син-
теза, но он малоэффективен, поскольку не позволяет решить про-
блему кардинально. С помощью очистных сооружений не всегда
удается полностью освободить выбросы от вредных продуктов, сле-
довательно, не удается предотвратить их попадание в биосферу. Та-
кой путь имеет и другие недостатки: очистные сооружения явля-
ются дорогостоящими, так как они занимают большие площади,
создают новые проблемы уничтожения твердых выбросов и отсто-
ев, потребляют значительное количество материалов, энергии и др.
Следовательно, этот путь неперспективен, но в течение еще неко-
торого времени он будет применяться.
Второе направление, в котором безотходные и малоотходные тех-
нологические процессы в максимальной степени имитируют при-
родные процессы (особенно кругооборот в природе), является пер-
спективным, более радикальным и экономичным. Однако оно пока
не нашло широкого распространения: реконструировать сущест-
вующие производства до такой степени практически невозможно,
так как в них заложена технология, по которой предусматривается
вывод из системы разных потоков; технология для безотходных про-
изводств часто дороже, если рассматривать ее с позиций узкове-
домственных или с позиций сегодняшнего дня, т. е. без учета эко-
логического и даже экономического ущерба от вредных выбросов
или очистки от них, и не учитывать стоимость утилизируемых по-
бочных продуктов.
Тем не менее в настоящее время пока необходимо использовать
оба пути, чтобы доводить технологию действующих производств до
«чистой». На данном этапе к решению таких задач требуется под-
ходить с учетом экономического фактора.
Как уже отмечалось, такие производства на первых порах мо-
гут оказаться более дорогими и неконкурентоспособными. В таких
232 Часть 1. Теоретические основы технологии крупнотоннажных ...
случаях на определенном этапе необходимо создавать производст-
ва с очистными сооружениями. Вместе с тем следует иметь в виду,
что одним из главных направлений охраны природы в условиях раз-
вития отрасли основного органического и нефтехимического син-
теза все-таки является такая организация производства, при кото-
рой все виды вовлекаемого в переработку сырья используются
полностью и полностью превращаются в товарные продукты. Это
может быть сделано только при создании безотходной технологии.
В настоящее время при проектировании производств все большее
значение приобретают показатели материале- и энергоемкости про-
дукции, так как они не только показывают затраты сырьевых и
энергетических ресурсов, но и приобретают «экологическое» зву-
чание. Эти показатели позволяют конкретно установить эффектив-
ность природопользования, т. е. определить, сколько конечного
продукта будет дано обществу из взятого у природы сырья и сколь-
ко на это будет затрачено энергии.
Для наиболее эффективного использования многокомпонент-
ного сырья в безотходном производстве должен соблюдаться прин-
цип его комплексного использования', материальный субстант, вве-
денный в технологический процесс, полностью перерабатывается,
а полученная при его переработке продукция используется
в полном объеме и ассортименте. При этом вовлечение каждого
продукта в производственно-хозяйственный оборот на практике
связано со многими одновременно действующими факторами ор-
ганизационного, технического, экономического и социального ха-
рактера. Повышение уровня комплексного использования много-
компонентного сырья в значительной степени будет способствовать
упразднению деления продукции на основную (целевую) и побоч-
ную (нецелевую). Побочная продукция приобретает все свойства
целевой продукции, но полученной в специализированном (неком-
плексном) производстве или в комплексном, как основная. Более
того, основная и побочная продукция общего производственного
процесса образуется одновременно из многокомпонентного сырья
при одних и тех же технологических условиях и в одних и тех же
технологических аппаратах. Необходимо отметить, что для полу-
чения одних продуктов эти условия и аппараты являются оптималь-
ными, а для других нет. Поэтому последние получаются в меньших
количествах. Следовательно, деление на продукты, имеющие раз-
ную экономическую значимость, неправомерно.
ГMBA 6. Приниипы СОЗДАНИЯ БЕЗОТХОДНЫХ ПРОИЗВОДСТВ
233
В задачу технологов входит прежде всего разработка таких тех-
нологий, в которых бы максимально использовался кругооборот
природных веществ и энергии при получении из сырья только це-
левых продуктов. При этом необходимо иметь в виду, что с этой
целью могут применяться технологические комплексы разных
масштабов.
Энергосберегающая технология. Цель энергосберегающей поли-
тики, проводимой в химической промышленности, — не только
снижение энергопотребления при росте выпуска продукции, но и
снижение тепловыделений и других энергетических составляющих
в окружающую среду. Комплексное использование энергетических
ресурсов в химико-технологических процессах — один из наиболее
эффективных методов совершенствования производства, позволя-
ющий ликвидировать или резко сократить выделение тепла в окру-
жающую среду, достичь полного использования энергетического
потенциала.
В химической промышленности энергоемкие производствен-
ные процессы часто являются одновременно источниками вто-
ричных энергетических ресурсов. К вторичным энергоресурсам
(ВЭР) относятся: горючие (топливные) отходы химических про-
изводств, тепловые выбросы, возникающие как побочный резуль-
тат экзотермических реакций или содержащиеся в отработанных
материалах, в том числе в сбросных жидкостях и газах сравни-
тельно низкой температуры (низкотемпературные тепловые
ВЭР), энергия избыточного давления и др. Горючие отходы, как
правило, используют на предприятиях полностью, за исключе-
нием тех случаев, когда их сжигание сопряжено с техническими
трудностями.
Энергия же избыточного давления продуктов почти не ис-
пользуется, так как отсутствует необходимое оборудование. Низко-
потенциальные ВЭР в перспективе можно использовать в абсорб-
ционно-холодильных установках для производства холода и установ-
ках для выработки тепловой энергии. Выработка холода в абсорбци-
онных холодильных установках с использованием бросового тепла
и создание станций теплохолодоводоснабжения на базе абсорбци-
онных насосов позволяет обеспечить предприятия теплом (/=80°C),
холодом (t=—5 +7°С), охлажденной технической водой (/=20°C)
и одновременно существенно повысить качество технологического
водоснабжения.
234 Часть 1. Теоретические основы технологии крупнотоннажных ...
Главным же направлением в энергосберегающей технологии
является создание замкнутых энерготехнологических циклов, где
энергетический потенциал, недоиспользованный на одной из ста-
дий процессов, используется на смежных стадиях.
МЕТОДОЛОГИЧЕСКИЕ ПРИНЦИПЫ
В декларации Общеевропейского совещания по сотрудничест-
ву в области охраны окружающей среды (Женева, 1979) содержит-
ся следующее определение: «Безотходная технология есть практи-
ческое применение знаний, методов и средств с тем, чтобы в рамках
потребностей человека обеспечить рациональное использование
природных ресурсов и энергии и защитить окружающую среду».
Другими словами, под безотходными подразумеваются такие про-
изводства, которые позволяют из сырья при воздействии различ-
ных видов энергии, вспомогательных материалов, катализаторов и
других технологических факторов в специально взаимосвязанных
аппаратах получать только целевые продукты без выхода из техно-
логической системы потоков, содержащих вещества и различные
виды энергии, загрязняющие биосферу.
При создании безотходных производств применяются следу-
ющие методологические принципы:
1. По возможности полное использование сырья для про-
изводства продукции при максимальной экономии энергии,
вспомогательных материалов и, в первую очередь, воды в рам-
ках функционирования каждого предприятия.
2. Использование побочных продуктов и отходов одного произ-
водства для другого, для которого они могут служить сырьем;
создание на этой основе комбинатов, на предприятиях которых
происходит последовательное углубление переработки сырья.
3. Территориальное и функциональное объединение в систему
комплексного производства комбинатов разнотипных пред-
приятий, перерабатывающих различные химические вещества.
4. Дополнение указанных производственных комплексов пред-
приятиями, осуществляющими завершающую переработку от-
ходов в вещества, которые могут служить сырьем для других
производственных комплексов или являются составляющими
биосферы.
5. Расширение производственных связей между разными безот-
ходными производственными комплексами и повышение тем
ГЛАВА 6. Приниипы СОЗДАНИЯ БЕЗОТХОДНЫХ ПРОИЗВОДСТВ
235
самым степени замкнутости общей производственной системы
как в хозяйственном, так и в биогеохимическом отношении.
6. Ликвидация ранее допущенных нарушений равновесия в при-
роде.
7. Повышение надежности работы всех установок и производств
в целом.
Таким образом, в задачу безотходных производств входит ком-
плексная переработка определенного количества сырья в целевые
продукты, являющиеся сырьем для других производств, и в чистые
природные вещества (воздух, воду, нейтральную минеральную мас-
су, способную включаться в качестве материнской породы в обра-
зование плодородной почвы и т. д.).
Однако решить эту задачу в рамках одной отрасли трудно, так
как должны охватываться все аспекты проблемы: технологические,
социально-экономические, экологические, образовательные
и культурно-воспитательные, правовые, информационно-обеспе-
чивающие и даже международные. Для этого должна действовать
общегосударственная долгосрочная комплексная программа охра-
ны природы, рационального использования и воспроизводства
природных ресурсов, поддержания оптимального состояния окру-
жающей природной среды, включающая подпрограммы решения
вышеназванных проблем.
Обобщающим принципом при организации безотходных произ-
водств является системный подход, который следует использовать
при создании, проектировании и эксплуатации производства. При-
менение системного подхода при создании и проектировании про-
изводств основного органического и нефтехимического синтеза крат-
ко рассмотрено в гл. 2.
Остальные более конкретные принципы, направленные на
полное использование сырья и энергетических ресурсов, а также
на охрану окружающей среды, могут быть подразделены на три
группы:
О химические;
® технологические;
® организационно-управленческие.
Во многих случаях один и тот же принцип может быть направ-
лен как на полное применение сырья, так и на сокращение ис-
пользования внешних энергетических ресурсов, а также защиту
окружающей среды.
236 Часть 1. Теоретические основы технологии крупнотоннажных ...
ХИМИЧЕСКИЕ ПРИНЦИПЫ
Химические принципы отражают общую тенденцию в созда-
нии новых производств и совершенствовании действующих. Общ-
ность их заключается в том, что все они реализуются в виде кон-
кретных химических приемов и методов, позволяющих приблизить
производство к безотходному ресурсосберегающему производству.
Создание малостадийных (одностадийных) химических процессов.
Сокращение химических стадий при получении из сырья целевых
продуктов снижает, как правило, количество побочных продуктов.
При этом также не только сокращаются расходы энергии, но и умень-
шается число потоков, которые необходимо перерабатывать и энер-
гию которых необходимо утилизировать. В таких технологических
процессах в большинстве случаев сокращается количество газовых
потоков и воды, которые следует очищать от вредных примесей.
В конечном счете себестоимость продукта, полученного по методу
с меньшим числом стадий, как правило, ниже. В этом случае необ-
ходимо проводить сравнение затрат на производство одного и того
же продукта разными методами на базе одного и того же сырья. Это
обусловлено тем, что затраты на сырье и материалы в общей сумме
эксплуатационных затрат составляют в производствах основного ор-
ганического и нефтехимического синтеза от 60 до 95 %.
Так, например, если принять приведенные затраты в производстве
бутадиена и изопрена методом двухстадийного дегидрирования «-бу-
тана и изопентана за 100 %, то приведенные затраты при одностадий-
ном дегидрировании н-бутана до бутадиена составят 77 %, а при од-
ностадийном дегидрировании изопентана до изопрена — 83%. Дру-
гой пример: производство 2-этилгексанола, основанное на альдоль-
ной конденсации ацетальдегида, включает следующие стадии
превращения реагентов: этилен —> ацетальдегид —> кротоновый
альдегид —> масляный альдегид 2-этилгексеналь —> 2-этилгексанол.
В процессе оксосинтеза, позволяющего сразу из пропилена получить
н-масляный альдегид, число стадий значительно сокращается: про-
пилен —> н-масляный альдегид —> 2-этилгексеналь —> 2-этилгексанол.
В последнем случае себестоимость 2-этилгексанола значительно ниже.
Разработка методов получения продуктов из доступного и дешево-
го сырья. Как правило, все новые методы получения продуктов ос-
новного органического и нефтехимического синтеза направлены на
замену сырья более дешевым, сокращение числа стадий, уменьшение
энергетических затрат, а также количества побочных продуктов.
ГMBA 6. Приниипы СОЗДАНИЯ БЕЗОТХОДНЫХ ПРОИЗВОДСТВ
237
Рассмотрим несколько примеров. Наиболее характерным яв-
ляется замена пищевого сырья на непищевое (в основном нефтя-
ное) в производстве бутадиена. Такая замена в свое время позволи-
ла существенно уменьшить издержки производства, поскольку
себестоимость бутадиена из синтетического спирта в 2 раза ниже
себестоимости бутадиена из пищевого сырья, а удельные капиталь-
ные вложения при производстве бутадиена из синтетического сы-
рья ниже в 3 раза.
Анализ зарубежных технико-экономических показателей про-
изводства винилхлорида разными методами, использующими раз-
ное сырье, показал, что себестоимость винилхлорида, полученного
по комбинированному методу из этилена и ацетилена,на 15 % ниже,
а при оксохлорировании этилена — на 30 % ниже, чем себестоимость
винилхлорида, полученного гидрохлорированием ацетилена. Таким
образом, в результате замены ацетилена этиленом в производстве
винилхлорида доля затрат на сырье снизилась с 80 до 65 %.
При производстве ацетальдегида прямым окислением этилена
достигается экономия эксплуатационных затрат на 15% по срав-
нению с затратами на парофазную гидратацию ацетилена. Подоб-
ным же примером может служить производство винилацетата из
ацетилена и этилена. Сравнение технико-экономических показа-
телей производства винилацетата парофазным методом из ацети-
лена и уксусной кислоты и винилированием уксусной кислоты по-
казывает преимущество последнего (издержки производства ниже
на 15 %). Причем основная часть экономии достигается за счет сни-
жения затрат на сырье.
Оценка новых методов производства может быть проведена на
примерах производства крупнотоннажных мономеров: бутадиена
и изопрена. Если принять приведенные затраты в процессах двух-
стадийного дегидрирования н-бутана при получении бутадиена
и изопрена при производстве изопрена за 100%, то приведенные
затраты в новых процессах составят соответственно (в %):
Производство бутадиена:
одностадийное дегидрирование 77
н-бутана
окислительное дегидрирование 68
н-бутана
диспропорционирование олефинов 85
извлечение из фракции гидролиза 42
Производство изопрена:
одностадийное дегидрирование 83
изопентана
Жидкофазное окисление 59
изопентана
диспропорционирование олефинов 92
238 Часть 1. Теоретические основы технологии крупнотоннажных ...
Замена сырья часто приводит к тому, что для получения про-
дукта используется другой метод производства. Таким образом,
в отрасли основного органического и нефтехимического синтеза
идет постепенная замена ацетилена более дешевыми нефтехими-
ческими продуктами: в производстве нитрила акриловой кислоты —
пропиленом, в производстве хлоропрена — бутадиеном и т.д.
Во многих случаях усовершенствование технологии касается вы-
теснения не только дорогостоящих, но и загрязняющих атмосферу
и воду исходных видов сырья и полупродуктов. Особенно харак-
терно это проявилось в производствах этиленоксида и про-
пиленоксида, где технология, основанная на использовании хлора
(хлоргидринный процесс), была заменена технологией прямого
окисления этилена и пропилена. При этом одновременно удалось
снизить и затраты на производство. Так, переход на метод прямого
окисления этилена в производстве этиленоксида позволил более
чем в 2 раза снизить затраты на его производство.
Разработка высокоэффективных процессов. Одним из основных
принципов, позволяющих наиболее полно использовать сырье для
получения целевых продуктов, является повышение селективнос-
ти процессов. Селективность процесса зависит прежде всего от ка-
тализатора, а также от условий проведения процесса: температуры,
давления, концентрации реагентов, растворителя (в случае жидко-
фазных процессов), времени пребывания реагентов в зоне реакции
и других параметров, а также типа реактора. При этом выбор опти-
мальных параметров позволяет достигнуть максимальной селектив-
ности процесса.
Применение «сопряженных» методов. Наиболее ярким при-
мером такого производства является «кумольный» метод получения
фенола и ацетона. По данному методу из изопропилбензола одно-
временно получают два ценных продукта: фенол и ацетон. В этом
случае себестоимость фенола значительно ниже, чем себестоимость
фенола, получаемого другими методами (из каменноугольной смо-
лы — в 1,8—3,0, из сланцев — в 4,5, из торфа — в 1,1, из продуктов
лесохимии — в 1,05 раза). Отметим, что качество фенолов, получен-
ных из природного сырья, значительно ниже, чем синтетических.
Себестоимость «кумольного» ацетона в 2,5—3 раза ниже, чем
его себестоимость при получении путем окисления изопропило-
вого спирта. Кроме того, кумольный метод (по показателям аце-
тона) может конкурировать со способом, основанным на окисле-
нии пропилена.
ГЛАВА 6. Приниипы СОЗДАНИЯ БЕЗОТХОДНЫХ ПРОИЗВОДСТВ
239
При взаимодействии пропилена и гидропероксида этилбензола
одновременно получается два ценных продукта: пропиленоксид
и стирол; при взаимодействии пропилена и гидропероксида — трет-
бутила — пропиленоксид — изобутилен и триметилкарбинол; совме-
стное окисление пропилена и ацетальдегида позволяет получать про-
пиленоксид и уксусную кислоту, а совместное окисление пропилена
и изопропилового спирта — пропиленоксид и ацетон и т. д.
Предварительные расчеты показали, что «сопряженные» методы
синтеза пропиленоксида обеспечивают снижение затрат на произ-
водство по сравнению с хлоргидринным процессом на 30%. Сле-
дует также отметить, что все «сопряженные» методы позволяют бо-
лее полно использовать сырье на получение целевых продуктов,
характеризуются меньшим количеством побочных продуктов, а так-
же меньшими энергетическими затратами.
Такой подход особенно целесообразен, если получать несколько
целевых продуктов не только из традиционного сырья, как это было
рассмотрено выше, но и при использовании в качестве сырья про-
дуктов, которые не находят еще широкого применения. Таким при-
мером может служить процесс окислительного метилирования то-
луола, разработанный во ОАО «ВНИИОС». Этот процесс позволяет
в одну стадию получать из толуола, метана и кислорода одновре-
менно стирол, этилбензол, фенол и крезолы в различных соотно-
шениях. Получение продуктов этим методом обходится значитель-
но дешевле. Так, из 4,63 т толуола, 4,8 м3 природного газа и 4,26 т
кислорода можно получить 1 т стирола, 1,243 т бензола, 0,848 т этил-
бензола, 0,67 т фенола и 0,215 т крезола. Себестоимость стирола
в этом случае будет в 1,4 раза, а удельные капиталовложения в 2 раза
ниже тех же показателей базового варианта получения стирола. Та-
ким образом, данный принцип позволяет полнее использовать до-
ступное сырье и получать важные продукты при меньших затратах
сырья и энергии.
Разработка технологии, позволяющей достигать высоких конвер-
сий. Достижение высоких конверсий реагентов за один проход име-
ет большое значение при создании безотходных производств. Это
обусловлено тем, что при малых конверсиях необходимы большие
рециклы по сырью, которые будут приводить к значительным энер-
гетическим и капитальным затратам; кроме того, при больших ре-
циклах будут и большие потери этих веществ в окружающую среду.
Конверсия зависит от параметров процесса (температуры, дав-
ления, скорости подачи реагентов, их соотношения, теплового эф-
240 Часть 1. Теоретические основы технологии крупнотоннажных ...
фекта и т. д.). Вместе с тем некоторые параметры, которые приво-
дят к повышению конверсии, могут вести к понижению селек-
тивности, а это приводит, в свою очередь, к увеличению выхода
побочных продуктов. В связи с этим необходимо подбирать оп-
тимальные условия проведения процесса.
Естественно конверсия сырья в значительной степени обус-
ловлена техникой безопасности. В частности, взрывоопасные кон-
центрации часто не позволяют достигать высоких конверсий по
всем компонентам за один проход сырья.
Совмещение нескольких реакций, направленных на получение од-
ного и того же целевого продукта. При получении многотоннажных
продуктов требуется, как правило, подводить большое количество
тепла или отводить его из реакционных устройств, что представля-
ет сложную задачу. В процессах, требующих подвода тепла, как
правило, в дальнейшем возникает задача утилизации тепла нагре-
тых продуктовых потоков. При осуществлении же экзотермичес-
ких реакций требуется отводить значительное количество тепла.
Вместе с тем, в одном аппарате можно проводить, по крайней мере,
две реакции, имеющие противоположные теплоты, т. е. одна из них
должна протекать с подводом тепла, а другая — с его отводом. В этом
случае условия их протекания в реакторе приближаются к адиаба-
тическим. Степень приближения условий процесса к адиабатичес-
ким зависит от теплоты каждой из реакций; если они равны, то
будет наблюдаться адиабатический режим. Добиться адиабатичес-
кого режима можно и при разных значениях теплот реакций, если
имеется возможность менять производительность по отдельным ре-
акциям. Подобная организация значительно снижает теплоту сум-
марного процесса и сокращает энергию на его проведение.
Кроме того, при совмещении реакций, как правило, повыша-
ются конверсии основного сырья и выход целевого продукта. Это
обусловлено тем, что один из продуктов основной реакции вступа-
ет в следующую реакцию, что смещает равновесие в сторону обра-
зования целевого продукта.
Таким примером могут служить технологии окислительного де-
гидрирования различных углеводородов и спиртов. В этих процес-
сах применяются в качестве катализаторов оксиды и соли металлов
переменной валентности IV, V и VI групп, на которых выделяющий-
ся водород связывается кислородом. Благоприятное воздействие на
такие процессы оказывают инертные разбавители, такие как вода,
азот, оксид углерода и др.
ГЛАВА 6. Приниипы СОЗДАНИЯ БЕЗОТХОДНЫХ ПРОИЗВОДСТВ
241
В частности, окислительным дегидрированием бутенов или изо-
пентанов можно получать бутадиен-1,3, стирол и а-метилстирол,
соответственно, из этилбензола и изопропилбензола, альдегиды -
из спиртов и т. д. При этом, в отличие от обычного дегидрирова-
ния, когда необходим подвод значительного количества тепла (210—
250 кДж/моль при дегидрировании н-бутана и и-бутенов), при окис-
лительном дегидрировании выделяется тепло, которое можно
регенерировать и использовать в производстве.
Таким образом, этот принцип позволяет, с одной стороны, бо-
лее полно использовать сырье для получения целевого продукта,
а с другой стороны, экономить энергию. Выделяемое тепло не-
обходимо утилизировать, если оно целиком не поглощается в сум-
марном процессе.
ТЕХНОЛОГИЧЕСКИЕ ПРИНЦИПЫ
Технологические принципы, так же как и химические, отра-
жают общие тенденции в создании новых и в совершенствовании
действующих производств, но отличаются от последних тем, что
их реализация связана с технологическими приемами и метода-
ми, такими, как организация потоков, использование совмещен-
ных процессов и др.
Использование рециркуляции по компонентам и потокам. Любой
технологический процесс в производствах отрасли осуществляется
с учетом:
❖ положения равновесия обратимой реакции, которое может
быть неблагоприятным и обусловливать низкую конверсию
сырья;
химической активности продуктов реакции, т. е. способности
их вступать в дальнейшие химические превращения в услови-
ях получения; это вынуждает проводить процесс при малых
конверсиях за один проход и, следовательно, при циркуляции
непрореагировавшего сырья;
необходимости использования одного из реагентов в большом
избытке для обеспечения желаемого направления реакции,
а следовательно, его рециркуляции;
❖ скорости реакций: при наличии очень быстрых реакций иног-
да часть реакционных продуктов возвращают обратно в реак-
тор, чем достигается их торможение;
242 Часть!. Теоретические основы технологии крупнотоннажных ...
< $> использования рециклов; при организации рециркуляции мно-
гократно используют множество вспомогательных веществ.
Все это необходимо учитывать для достижения оптимальных па-
раметров, которые часто можно достигнуть, только применяя раз-
личные рециклы. В промышленности с целью полноты ис-
пользования сырья и тепла широко распространена рециркуляция
различных продуктов и потоков. В частности, наиболее широко при-
меняется рециркуляция сырья с целью достижения 100 % общей кон-
версии сырья, так как она за один проход редко достигает такого
значения. Применение фракционированной рециркуляции позво-
ляет осуществить в промышленности химические процессы, для ко-
торых невозможны другие технологические решения. Можно ука-
зать на четыре аспекта эффективного применения рециркуляции:
технический, химический, технико-экономический и экологический.
Рециркуляция является эффективным приемом для отвода теп-
ла и поэтому позволяет осуществлять в промышленности высоко-
экзотермические процессы. Рециркуляция широко используется
для достижения 100%-ной конверсии реагентов при равновесных
реакциях, реакциях, протекающих с малыми скоростями, и т.д.
В частности, в случае реакции с низкой конверсией сырья за один
проход вывод из системы продуктов позволяет увеличить ее ско-
рость, а возврат со стадии разделения непрореагировавших ве-
ществ — достичь 100 %-ной конверсии сырья. Следовательно, при-
менение рециркуляции непрореагировавшего сырья, независимо от
кинетических и термодинамических ограничений, позволяет дости-
гать более полной конверсии сырья.
На основе метода рециркуляции, комбинируя и кооперируя
различные производства, технологические установки и комплек-
сы, можно создать технологически замкнутый комплекс, рабо-
тающий с максимальным использованием сырья. При этом ре-
циркуляция дает возможность комплексно использовать не только
сырье, но и энергию за счет более полной утилизации тепловой
энергии потоков, отходящих из каждого химико-технологического
элемента, что дает высокую экономию топлива и сокращает вы-
брос не только веществ, но и тепла в окружающую среду. Такой
подход одновременно повышает и экономичность производства.
Однако наиболее экономичной технологическая система будет при
минимальных рециклах. Замкнутые технологические циклы поз-
воляют с максимально возможной полнотой использовать сырье
и исключить или снизить до допустимых выбросы отходов во
ГЛАВА 6. Приниипы СОЗДАНИЯ БЕЗОТХОДНЫХ ПРОИЗВОДСТВ
243
внешнюю среду. В частности, рециркуляция позволяет многократ-
но применять растворители, катализаторы, абсорбенты, экстраген-
ты, экстрактивные и азеотропные агенты, хладагенты и теплоно-
сители.
Некоторые побочные продукты после повторного прохождения
через реактор превращаются в целевые продукты. Следовательно,
они возвращаются в реактор в виде рецикла. Примером такой ре-
циркуляции может служить процесс алкилирования, в котором од-
новременно, например, с этилбензолом получаются полиалкилбен-
золы, которые после отделения вновь возвращаются в реактор, что
повышает выход этилбензола. Многократное использование таких
потоков, во-первых, экономит расход сырья на получение целево-
го продукта, а во-вторых, позволяет не выводить из системы раз-
личные продукты, которые могут загрязнять как воздух, так и воду.
Широко применяют также рециркуляцию реакционных про-
дуктов. Этот прием может быть использован для отвода тепла за
счет испарения рециркулята (например, в процессе оксосинтеза).
Также рецикловый поток применяется в качестве хладагента или
абсорбента в конденсаторах смешения реакционной смеси. С этой
целью можно использовать отдельные компоненты или смеси, име-
ющие высокую теплоту парообразования.
Рециркуляцию по отдельным или нескольким компонентам
применяют в автоэкстракгивной, экстрактивной, азеотропной рек-
тификации, экстракции, абсорбции, что позволяет разделять азео-
тропные или близкокипящие смеси и значительно сократить за-
траты энергии на их разделение.
Таким образом, рециркуляция применяется в следующих
подсистемах:
< $> при подготовке сырья (куда возвращаются непрореагировавшие
продукты);
<§> в реакторном узле (циркуляция хладагента или теплоносите-
ля, а также непрореагировавших продуктов);
на стадии конденсации или улавливания продуктов реакций
(циркуляция хладагентов и абсорбентов);
при разделении реакционной смеси (рециркуляции абсорбен-
тов, экстрагентов, азеотропных и экстрактивных агентов, ав-
тоэкстрактивных агентов и компонентов или их смесей с це-
лью перераспределения полей концентраций между областями
ректификации или изменения относительной летучести раз-
деляемых компонентов).
244 Часть!. Теоретические основы технологии крупнотоннажных ...
Следовательно, применение рециркуляционных процессов, ле-
жащих в основе комплексного производства, является одним из
важнейших принципов решения двух главных проблем экологии —
избежания загрязнения окружающей среды и истощения природ-
ных ресурсов. Так как одной из основных причин, сдерживающих
применение рециркуляции, являются дорогостоящие процессы раз-
деления, необходимо расширение исследований по интенсифика-
ции и созданию новых, более совершенных способов разделения с
минимальным расходом энергии.
Применение совмещенных процессов. Правильное применение
совмещения различных процессов позволяет повысить не только
конверсию реагентов, но и выход целевых продуктов при меньших
затратах энергии. Для этого можно совмещать реакционные и мас-
сообменные процессы, а также несколько массообменных и реак-
ционных процессов.
Наиболее важное значение имеют реакционно-массообменные
процессы, позволяющие, например, в случае равновесных реакций
достигать полной конверсии реагентов при высокой селективности.
При этом сокращаются энергетические затраты, так как исключа-
ются рециклы по сырью и не нужны аппараты, предназначенные
для отделения сырья от целевых продуктов. Особенно большой эф-
фект достигается при использовании специального формованного
катализатора, который одновременно выполняет функции массо-
обменной насадки. В технологии основного органического и неф-
техимического синтеза находят и будут находить еще большее при-
менение реакционно-абсорбционные процессы (хемосорбция),
реакционно-ректификационные и реакционно-экстракционные
процессы. Такое сочетание позволяет улучшать показатели не толь-
ко реакционных процессов (повышать конверсию и селективность),
но и массообменных процессов (за счет протекания реакции
преодолеваются ограничения, обусловленные структурой диаграм-
мы фазового равновесия), а следовательно, и процесс в целом.
Применение конденсационно-отпарных колонн позволяет
в одном аппарате конденсировать часть компонентов, а остав-
шуюся часть — отгонять. Этот процесс наиболее эффективен при
разделении веществ с различными физико-химическими свойст-
вами. Применение такого метода может быть рекомендовано толь-
ко после экономического анализа.
Широкое распространение найдут также такие методы разде-
ления, как автоэкстрактивная ректификация, когда в качестве
ГЛАВА 6. Приниипы СОЗДАНИЯ БЕЗОТХОДНЫХ ПРОИЗВОДСТВ
245
экстрактивного агента используются компоненты, содержащиеся
в самой разделяемой смеси, а также автоабсорбционный
и автоконденсационный процессы, в которых в качестве абсор-
бента или хладагента используются компоненты или фракции кон-
денсата реакционных продуктов. Все эти процессы являются слож-
ными, т. е. в них одновременно протекает несколько массо-
обменных процессов. Совмещенные процессы экономически эф-
фективны и экологически чисты. Они не требуют введения новых
веществ в систему и, следовательно, эти вещества не загрязняют
целевые продукты. Более детально совмещенные процессы рас-
смотрены в гл. 5.
Полнота выделения продуктов из реакционной смеси. В мно-
готоннажных производствах при незначительном содержании при-
месей в сырье они будут выделяться в значительных количествах
(иногда десятки тысяч тонн в год). Любые продукты (побочные для
одного процесса) могут служить сырьем для других процессов или
производств. При получении одновременно нескольких целевых
продуктов их себестоимость будет ниже, чем в случае, когда их по-
лучают отдельно каким-либо методом. Вместе с тем, если возмож-
но использовать на последующих этапах смесь нескольких компо-
нентов или какую-то фракцию, выделять все индивидуальные
вещества не обязательно, учитывая то, что на разделение тратится
большое количество энергии.
Выделение же всех продуктов из реакционных смесей в виде
индивидуальных компонентов или их фракций позволяет наиболее
полно использовать сырье с целью получения целевых продуктов
без загрязнения окружающей среды, т. е. решает одновременно эко-
номическую и экологическую задачи. Кроме того, в результате раз-
личных процессов получают такие продукты, которые после выде-
ления можно использовать в качестве топлива на этом же
производстве. К ним могут быть отнесены водород, метан и неко-
торые другие химические вещества. Таким образом, практически
все побочные продукты, в том числе и примесные, должны нахо-
дить свое применение.
В качестве отходов можно выделять только те продукты, кото-
рые нельзя использовать в народном хозяйстве, но можно вклю-
чить в кругооборот природы, не нарушая его.
Разработка процессов с низким энергопотреблением. Одним из
главных принципов создания технологии производств основного
органического и нефтехимического синтеза является создание та-
246 Часть!. Теоретические основы технологии крупнотоннажных ...
кой технологии, которая позволяла бы производить целевые про-
дукты с минимальными затратами энергии. При таком осуществ-
лении процессов значительно проще решать задачу регенерации
тепла. Кроме того, если сокращается расход пара, то уменьшается
и количество водяного конденсата, который необходимо исполь-
зовать в производстве.
Сокращение расхода холода также позволяет упростить решение
экологических задач. Это обусловлено тем фактом, что в качестве
хладагента во многих случаях используется вода. При охлаждении
технологических потоков, как правило, получается значительное ко-
личество теплой воды с невысокой температурой, которую прихо-
дится сбрасывать в водоемы без утилизации тепла. Это приводит
к «тепловому загрязнению» водоемов. Следовательно, наряду с ре-
шением проблемы сокращения расхода холода необходимо решать
задачу регенерации тепла из потоков низкотемпературных парамет-
ров, что, в свою очередь, позволит решать и экологические задачи.
Применение циркуляции оборотной воды с охлаждением в гра-
дирнях или переход к воздушным холодильникам не решают про-
блемы как утилизации тепла, так и теплового загрязнения. Кроме
того, применение градирен приводит к выбросу в атмосферу боль-
шого количества пара и капельной воды.
Таким образом, основным направлением в повышении энерге-
тической эффективности производств является снижение их энер-
гоемкости, в том числе за счет использования внутренних ресурсов
самой химико-технологической системы.
Полнота использования энергии системы. В производствах ос-
новного органического и нефтехимического синтеза многие про-
цессы протекают с выделением большого количества тепла, кото-
рое должно отводиться с целью поддержания оптимальной темпе-
ратуры в реакторе, а следовательно, достижения оптимальных кон-
версий сырья, выходов целевых продуктов и производительности
систем, а также обеспечения безопасных условий ведения процес-
са. Кроме того, многие даже эндотермические процессы протека-
ют при высоких температурах, а последующее улавливание реак-
ционных продуктов и их разделение на чистые компоненты или
фракции протекают при более низких температурах. Следователь-
но, необходимо охлаждать реакционные смеси, что также приво-
дит к появлению вторичных энергетических ресурсов. Наконец,
в большинстве химических процессов образуются побочные про-
дукты, которые могут служить топливом и на данном производст-
MBA 6. Приниипы СОЗДАНИЯ БЕЗОТХОДНЫХ ПРОИЗВОДСТВ
247
ве. Отсюда появляется необходимость утилизации тепла практи-
чески во всех технологиях.
Использование вторичных энергетических ресурсов не только
снижает расход энергии в каждом производстве, но и предотвращает
сброс тепла в окружающую среду.
Таким образом, важным резервом экономии тепла в процессах
производств ОО и НХС является повышение эффективности ис-
пользования вторичных энергетических ресурсов (тепла газовых
и жидких потоков), уровня регенерации тепла охлаждаемых про-
дуктов, а также внедрение современных энерготехнологических си-
стем. Источниками вторичных энергетических ресурсов в отрасли
являются: физическое тепло контактных и уходящих газов техно-
логических печей, нагретых продуктовых потоков, тепло парового
конденсата и др. Утилизация имеющихся вторичных топливно-
энергетических ресурсов зависит от их количества, энергетическо-
го потенциала, возможности использования полученной энергии.
При этом в качестве утилизационного оборудования в отрасли уже
применяются воздухоподогреватели различных конструкций и раз-
меров, котлы-утилизаторы различных типов, теплообменники, га-
зовые холодильники и другое оборудование.
Использование вторичных ресурсов высокого энергетического
потенциала не вызывает затруднений на разных стадиях самого тех-
нологического процесса, например, при подогреве исходного сырья
и других потоков. Пар, получаемый в котлах-утилизаторах, может
применяться в кипятильниках ректификационных колонн и других
теплообменных аппаратах.
Труднее использовать вторичные ресурсы низкого энергети-
ческого потенциала. Но тем не менее это возможно. Так, водяной
конденсат можно применять в котлах-утилизаторах, а его избыток
и просто горячую воду — для отопления предприятия и обогрева
трубопроводов, заменяя ими водяной пар. На примере одного из
заводов по выпуску синтетического каучука ниже приведены дан-
ные о выработке тепла за счет вторичных энергетических ресурсов
и его использовании (в %):
Выработка тепла за счет вто- Использование тепла, полученного
ричных энергетических за счет использования вторичных
ресурсов: энергетических ресурсов:
пар с котлов-утилизаторов, 47,0 пар, подаваемый в сырье в про- 44,1
использующих тепло контакт- цессе дегидрирования
ных газов
248 Часть 1. Теоретические основы технологии крупнотоннажных ...
пар с котлов-утилизаторов, использующих тепло газов регенерации 7,8 обогрев кипятильников ректифи- кационных колонн 43,5
пар с испарителей- дефлегматоров 10,9 питание котлов-утилизаторов 7,5
вода горячая с закрытых теп- лообменников (конденсато- ров, холодильников) 14,5 подогрев и испарение различных продуктов 4,5
Вода горячая с контактных аппаратов-скрубберов 10,5 обогрев спутников 0,2
пар вторичного вскипания 7,5 Отопление и вентиляция 0,2
прочие источники 1,8
Итого: 100,0 Итого: 100,0
Одним из эффективных методов использования вторичных
энергетических ресурсов является производство холода в аб-
сорбционных холодильных машинах, в которых в качестве теп-
лоносителя может применяться вторичный пар, перегретый кон-
денсат, горячая вода, горючие газы и др. Наиболее эффективным
мероприятием по снижению потерь тепла на предприятиях высту-
пает максимальная замена греющего пара горячей водой.
Разработка технологии с минимальным расходом воды и ис-
пользованием ее кругооборота. Большинство предприятий отрасли
основного органического и нефтехимического синтеза относится
к числу наиболее водоемких. Только один из заводов потребляет
около 50—100 тыс. т воды в час. Так, на производство 1т
нитрилоакриловой кислоты расходуется 1960 м3 воды. Вода ис-
пользуется как охлаждающий, так и нагревающий агент для при-
готовления различных растворов, в качестве исходного сырья или
полупродукта, для улавливания газообразных выбросов, для про-
мывки оборудования и продуктов и других целей. Возможность
загрязнения воды ставит задачи сокращения ее потребления
и многократного использования. Уже в настоящее время эти за-
дачи решаются.
Таким образом, одним из основных принципов разработки тех-
нологии для безотходных производств является сокращение потреб-
ления свежей воды и переход на замкнутые системы промышленного
водоснабжения с повторным использованием в этих системах отра-
ботанных сточных вод. С этой целью на первом этапе решаются сле-
дующие задачи:
ГЛАВА 6. Приниипы СОЗДАНИЯ БЕЗОТХОДНЫХ ПРОИЗВОДСТВ
249
О разделение систем канализации по характерным видам стоков,
подлежащих обязательной очистке на очистных сооружениях,
осуществление систем водооборота всех охлаждающих вод;
® возврат в системы промышленного водоснабжения условно чи-
стых и ливневых стоков;
© строительство новых, расширение и реконструкция существу-
ющих локальных и общезаводских установок по обезврежива-
нию высококонцентрированных специфических сточных вод
и осадков, получаемых при очистке сточных вод и отходов
в процессе производства, с обязательной утилизацией тепла
и концентрированных минерализованных рассолов.
Высокое качество очищенной воды достигается за счет приме-
нения комбинированной или многоступенчатой очистки сточных
вод, которая может включать в себя следующие методы очистки: ме-
ханический, биологический, химический, физико-химический, очи-
стку активным углем, обратным осмосом, ультрафильтрацией и др.
При этом в каждом производстве в зависимости от количества обо-
ротной воды, количества и качества примесей в ней должна приме-
няться своя система очистки.
Второй этап создания системы оборотного водоснабжения свя-
зан с охлаждением оборотной воды. Возможны следующие систе-
мы оборотного водоснабжения: с охлаждением воды, с очисткой
воды, а также с очисткой и охлаждением воды. В настоящее время
наибольшее распространение получили системы оборотного водо-
снабжения с охлаждением воды, которые, в свою очередь, подраз-
деляются на замкнутые, полузамкнутые и комбинированные. При
этом в замкнутой системе охлаждение технологических потоков или
продуктов осуществляется оборотной водой в закрытых теплооб-
менных аппаратах, а оборотная вода охлаждается воздухом в закры-
том оребренном теплообменнике.
В полузамкнутой системе охлаждение технологических про-
дуктов происходит также в закрытых теплообменных аппаратах,
а охлаждение воды — на градирне или других охладителях. В ком-
бинированной системе обессоленная или умягченная вода охлаж-
дается оборотной водой в закрытых теплообменных аппаратах,
а оборотная вода охлаждается в градирне. В некоторых случаях це-
лесообразнее охлаждать обессоленную или умягченную воду в оро-
сительных холодильниках.
Однако главный путь заключается в сокращении потребления
воды. Это возможно за счет создания новой технологии, требую-
250 Часть 1. Теоретические основы технологии крупнотоннажных ...
щей меньшего количества воды, замены водных холодильников воз-
душными, создания наиболее эффективных холодильно-конденса-
ционных процессов, лучших способов промывки, отработки про-
дуктов сухими газами и т. д.
В последние годы в России развиваются работы по совершен-
ствованию и применению воздушно-конденсационных установок
охлаждения. Наиболее перспективным вариантом будет, очевидно,
орошаемая воздушно-конденсационная установка, в которой ис-
пользуется незначительное количество воды. Особенно ощутимо
преимущество применения таких установок в южных районах стра-
ны. Эти установки позволяют улучшить микроклимат в данных рай-
онах, так как в атмосферу в процессе работы установки выбрасы-
вается большое количество сухого подогретого воздуха в холодную
и сырую погоду, а увлажненный воздух подается в атмосферу в жар-
кую и сухую погоду.
Вместе с тем применение воздушных холодильников, градирен,
воздушно-конденсационных установок и др., как отмечалось ра-
нее, не решает важных проблем утилизации тепла и теплового за-
грязнения атмосферы. Это связано с тем, что, с одной стороны, из
теплой воды не утилизируется тепло, а с другой стороны, при ис-
пользовании воздушных холодильников или воздушно-конденса-
ционных установок в атмосферу выбрасывается значительное ко-
личество теплого воздуха, а в градирнях — большое количество пара
и капелек воды.
Следовательно, необходимо создавать:
О технологию с минимальным использованием воды;
© способы утилизации тепла из подогретой воды.
Экономические показатели систем очистки воды значительно
улучшаются при кооперировании данных систем с основным про-
изводством. В этом случае значительная часть воды может быть ис-
пользована в системе замкнутого технического водоснабжения. При
этом нет необходимости очищать воду до санитарных норм, что су-
щественно снижает расходы на ее очистку. В то же время исполь-
зование этой воды в теплообменной аппаратуре значительно улуч-
шает ее работу, так как из-за отсутствия солей и других примесей
уменьшается процесс образования «накипи», коррозия аппаратуры
и биологическое обрастание поверхностей теплообмена происхо-
дит более медленно. В то же время предприятие или прекращает,
или значительно сокращает забор свежей воды, требующей специ-
альной очистки.
Глава 6. Принципы созлания безотходных производств
251
Полнота использования газовых потоков и очистка газовых вы-
бросов. В производствах основного органического и нефтехи-
мического синтеза выделяется значительное количество газо-
образных побочных продуктов (СО, СО2, HCl, Cl2, Н2, N2, О2 и др.),
а следовательно, получается большое количество газовых выбро-
сов, содержащих продукты реакций, а также растворители и дру-
гие вспомогательные вещества. В связи с этим очистка газовых по-
токов от названных веществ позволяет решать одновременно две
задачи:
Ф экологическую, когда очищаются газовые выбросы;
@ экономическую, когда «уловленные» продукты могут быть ис-
пользованы на производствах отрасли в качестве сырья или вновь
выполнять вспомогательную роль (например, растворителя).
В настоящее время этот принцип широко используется пре-
имущественно для решения первой задачи. Со временем вторая за-
дача будет приобретать большее значение и этот принцип найдет
комплексное применение.
При циркуляции различных газовых потоков (с целью полной
конверсии сырья или повторного их использования) они должны
очищаться от вредных примесей, которые могут быть, например,
ядами катализатора. Кроме того, в циркуляционных газах накап-
ливаются инертные примеси. Следовательно, необходимо частич-
но выводить газовые потоки из системы для очистки от инертных
примесей.
Наибольшее количество циркуляционных газов получается за
счет большого избытка одного из газовых реагентов в процессе по-
лучения целевого продукта. Это обусловлено условиями проведе-
ния химического процесса и безопасностью его осуществления.
Например, при производстве винилацетата из этилена и уксусной
кислоты соотношение этилена и воздуха (кислорода) определяется
нижними и верхними пределами взрываемости. Следовательно,
должен вводиться избыток этилена или воздуха (кислорода), что
приводит к созданию циркуляционных газовых потоков, в кото-
рых накапливаются инертные газы.
Во многих процессах специально добавляются инертные газы
с целью понижения парциального давления исходных реагентов или
для отвода тепла. В этом случае для их повторного использования
требуется очистка от продуктов реакций.
В окислительных процессах чаще всего в качестве окислителя
применяется кислород воздуха. Следовательно, всегда присутству-
252 Часть 7. Теоретические основы технологии крупнотоннажных ...
ют газовые выбросы в виде азота и других инертных газов, которые
уносят продукты реакций.
К числу наиболее распространенных методов очистки газовых
потоков относятся: абсорбционный, хемосорбционный, ад-
сорбционный и каталитический.
Так как полностью очистить газовые выбросы нельзя, то следует
учитывать предельно допустимые концентрации вредных примесей
в атмосферном воздухе.
В производствах основного органического и нефтехимического
синтеза для обеспечения безопасной работы широко используется
вентиляция. Вентиляционные выбросы также необходимо очищать
от вредных химических веществ. Для наиболее полного извлече-
ния примесей из воздушных и газовых потоков следует использо-
вать совершенные и высокоскоростные методы и соответствующее
оборудование. На первом этапе, как правило, происходит отделе-
ние мелкодисперсных твердых частиц (катализатора, твердых ре-
агентов и т. д.) с помощью таких гидромеханических методов, как
осаждение и фильтрация (в гравитационном, центробежном, эле-
ктрическом или другом силовом поле). Далее для очистки от га-
зообразных примесей с целью их повторного использования или
превращения в легко улавливаемые вещества применяются сорб-
ционные или каталитические методы (адсорбция, абсорбция, кон-
денсация, хемосорбция, каталитическое превращение и другие
процессы).
Так как очистке подвергаются очень большие потоки газов, то
требуется выбирать наиболее эффективные методы с минимальны-
ми затратами энергии. Для этого необходимо знание сравнитель-
ных характеристик всех методов и путей повышения эффективно-
сти газоочистных установок.
В ряде случаев целесообразно проводить комбинированную пе-
реработку и очистку жидких и газообразных потоков. В частности,
возможна взаимная нейтрализация различных загрязняющих про-
дуктов. Так, в работе Г. Г. Русаковой показано, что одновременная
переработка нескольких потоков хлорорганических продуктов, на-
ходящихся в жидкой и паровой фазах, позволяет достигать лучше-
го эффекта.
Применение аппаратов и технологических линий большой единич-
ной мощности. В последние три десятилетия непрерывно наращи-
валась мощность отдельных агрегатов и установок производств ос-
новного органического и нефтехимического синтеза. Причем уже
Глава 6. Приниипы созлания безотходных производств
253
тридцать лет назад практически все производства отрасли были
многотоннажными, но часто за счет использования нескольких па-
раллельно работающих аппаратов или технологических линий
с меньшей мощностью. За последние 30 лет производительность ос-
новных аппаратов увеличилась в 5—10 раз. Так, они достигают по
производству: метанола — 750—1500 тыс. т/год; стирола — 350; ок-
сида этилена — 150—180; винилхлорида — 250—500; нитрила акри-
ловой кислоты — 50—170; винилацетата — 140; пропиленоксида—
150 тыс. т/год.
Повышение концентрации производства или агрегатной кон-
центрации производства, т. е. внедрение укрупненных агрегатов и
высокопроизводительных линий, как правило, позволяет увеличить
выпуск продукции с меньшими капитальными затратами. Напри-
мер, при увеличении мощности технологических линий в 4 раза
удельные капитальные вложения в производство этилового спирта
возросли только в 2,3 раза. Эта экономия достигается в результате
сокращения (в расчете на единицу мощности) затрат на изготовле-
ние оборудования и его монтаж, а также на строительство зданий
и сооружений. Кроме того, снижаются эксплуатационные затраты,
возрастает производительность труда.
Укрупнение мощностей агрегатов создает дополнительные ус-
ловия для внедрения и эффективного использования более про-
грессивных систем управления, основанных на применении со-
временных средств автоматизации, передачи информации
и вычислительной техники. Сейчас автоматическое управление
является обязательным условием эффективной работы крупных
агрегатов.
Однако следует отметить, что существуют определенные огра-
ничения укрупнения агрегатов. К таким ограничениям относятся:
О потребность народного хозяйства в продукции и распределе-
ние ее по отдельным районам;
© затраты на доставку сырья и продукции потребителям (они, как
правило, возрастают при концентрации производства);
© эксплуатационная надежность, так как остановка высокопро-
изводительных агрегатов не только приводит к недополуче-
нию продукции, но и в ряде случаев к остановке смежных
агрегатов (остановка крупного агрегата на ремонт или в свя-
зи с производственными неполадками может вызывать за-
держки с поставкой продукции потребителям, простой смеж-
ного оборудования и т. д.).
254 Часть 1. Теоретические основы технологии крупнотоннажных ...
Вместе с тем увеличение мощности агрегатов и технологических
линий приводит к сокращению капитальных затрат на единицу про-
дукции и, в меньшей степени, к сокращению эксплуатационных за-
трат, так как большая часть этих расходов приходится на сырье, энер-
гию и материалы, которые в расчете на единицу продукции мало
зависят при неизменной технологии от мощности агрегата. Со-
кращение эксплуатационных расходов связано с увеличением мощ-
ности агрегата, а также со снижением затрат труда прежде всего на
управление процессом, при этом повышается производительность
труда. Кроме того, уменьшается расход воды на единицу продукции.
Однако применение аппаратов большой единичной мощности
как с экономической, так и с экологической точки зрения требует
более тщательного анализа всей технологии с учетом других прин-
ципов ее создания. В частности, наличие агрегатов большой еди-
ничной мощности, работающих непрерывно, требует, как было от-
мечено ранее, высокой надежности работы основного и всего
вспомогательного оборудования, применения ЭВМ для управления.
Это обусловлено как экономическими факторами (внеплановые
простои приводят к очень большим потерям не только на самой
установке, но и у потребителей продукции), так и экологическими
факторами (даже при наличии защитных устройств и очистных со-
оружений загрязняющие вещества могут в значительных количест-
вах попадать в воздух и водоемы). Кроме того, при наличии агрега-
тов и технологических линий большой единичной мощности
получается большое количество побочных продуктов, для перера-
ботки которых необходимо обязательно создавать установки на этом
же производстве, так как транспортировка их на другие предприя-
тия затруднена. Создание же сложных комплексов приводит к уд-
линению сроков ввода мощностей.
Имеются и другие сложности в применении аппаратов и тех-
нологических линий большой единичной мощности: необходи-
мость в специальном монтажном оборудовании, транспортировка
его к месту установки, трудности проведения ремонтных работ.
Таким образом, проблема обоснования мощности агрегатов
и технологических линий включает не только непосредственное со-
поставление технико-экономических показателей установок раз-
личной мощности, но и рассмотрение влияния множества эконо-
мических, экономике-географических и экологических условий.
Применение непрерывных процессов. Одним из важнейших
принципов создания безотходных технологий является примене-
Глава 6. Принципы создания безотходных производств
255
ние непрерывных процессов. Это объясняется следующими пре-
имуществами таких процессов:
О создание технологий для безотходных производств требует вне-
дрения новых методов регулирования и управления этими про-
цессами, поддержания стабильности и точности всех парамет-
ров работы аппаратов, что в значительной степени облегчается
при непрерывном режиме работы установки и производства
в целом;
© возможность достижения значительно большей производитель-
ности оборудования за счет полноты его использования;
© получение более однородной по качеству продукции, что при-
водит к значительному сокращению объема некачественной
продукции, которая в большинстве случаев не находит квали-
фицированного использования и требует дальнейшей перера-
ботки или утилизации;
О легкость автоматизации, в частности, с применением микро-
процессоров;
© высокая производительность труда;
© отсутствие периодической загрузки сырья и выгрузки продук-
тов синтеза, что значительно уменьшает загрязнение окружа-
ющей среды, а также улучшает условия труда;
0 большая безопасность производства за счет малой вероятнос-
ти попадания веществ в окружающую среду
Следовательно, возможность при непрерывных процессах дли-
тельно поддерживать во всех аппаратах и во всей химико-техно-
логической системе стационарное состояние обеспечивает мак-
симальную производительность системы при минимальных
затратах на средства автоматизации и необходимое качество всех
продуктов и полупродуктов.
Таким образом, применение непрерывных процессов позволяет
не только повышать экономические показатели производства, улуч-
шать условия труда, но и повышать его экологические показатели,
сокращая количество побочных продуктов или продуктов, не соот-
ветствующих стандартам. Поэтому этот принцип является наибо-
лее важным при создании безотходных технологий.
Полнота использования жидких и твердых отходов. В производстве
основного органического и нефтехимического синтеза образуется зна-
чительное количество жидких отходов (полиалкилбензолы при алки-
лировании бензола, этилидендиацетат при производстве винилацета-
256 Часть!. Теоретические основы технологии крупнотоннажных ...
та и др.) и значительно меньше твердых отходов (отработанные ка-
тализаторы, адсорбенты, полимеры и др.). При создании безотходных
производств необходима прежде всего их утилизация или переработ-
ка. Это возможно сделать при переработке данных веществ в рамках
основных технологических процессов (полиалкилбензолы при про-
изводстве алкилбензолов) или на отдельных установках в рамках
основного производства (регенерация катализаторов, адсорбентов
и т.д.). И наконец, некоторые отходы (полимеры, олигомеры) мо-
гут использоваться в других производствах в качестве сырья. При-
мером может служить добавка в строительные материалы полимер-
ных отходов, которые обеспечивают водоотталкивание. И только
в исключительных случаях жидкие отходы могут использоваться
в качестве топлива, если их регенерация сильно затруднена и не най-
ден способ их использования.
Высокая степень автоматизации. Разработка технологии без-
отходных производств предопределяет взаимосвязь технологии
и автоматизации. Ранее отмечалось, что наиболее эффективными
с точки зрения создания безотходных производств являются непре-
рывные процессы. А они, в свою очередь, наиболее эффективны,
когда регулируются автоматически. Такие процессы автоматизиро-
вать легче, так как значения параметров регулирования обычно ме-
няются незначительно.
В безотходных производствах предъявляются жесткие требо-
вания к выходным величинам процессов (в частности, максими-
зация выхода основных продуктов, минимизация отходов данно-
го производства и исключение потерь различных продуктов).
Автоматизация позволяет значительно повысить надежность
и эффективность работы как отдельных аппаратов, так и всей си-
стемы в целом. При этом наибольшая эффективность автома-
тизированных систем управления достигается при широком ис-
пользовании вычислительной техники. Особенно это существен-
но для управления производствами основного органического
и нефтехимического синтеза, так как для них характерно наличие
большого числа разнотипных аппаратов, связанных между собой
значительными материальными и энергетическими потоками.
Причем задачи управления подобным классом производств мож-
но подразделить на задачи управления режимом работы отдельных
технологических агрегатов, решаемые локальными системами уп-
равления при фиксированных входных и выходных потоках, и зада-
чи оперативного управления, состоящие в согласовании работы аг-
ГMBA 6. Приниипы СОЗДАНИЯ БЕЗОТХОДНЫХ ПРОИЗВОДСТВ
257
регатов между собой с учетом как внутренних, так и внешних для
всего комплекса агрегатов возмущений. Эти задачи реализуются от-
дельными функциональными подсистемами (АСУТП).
Следовательно, в условиях непрерывного увеличения скоро-
стей реакций, роста температур и давлений, укрупнения единич-
ных мощностей агрегатов, технологических линий производств,
повышения требований к качеству выпускаемой продукции важ-
ное значение имеет внедрение автоматизированных систем уп-
равления технологическими процессами (АСУТП). Причем пе-
реход от локальной автоматизации к АСУТП позволяет снизить
материальные затраты на производство продукции, повысить про-
изводительность технологического оборудования и труда, внед-
рить более рациональные формы организации производства и по-
высить надежность всей технологической установки.
Наиболее распространенной в настоящее время является двух-
уровневая структура технической реализации управления, когда
на нижнем уровне имеется ряд мини-ЭВМ, выполняющих задачи
подсистемы контроля, управления и частично или полностью ре-
шающих задачи подсистемы оперативного управления. На верх-
нем уровне находится более мощная ЭВМ, которая получает часть
информации от мини-ЭВМ и выполняет функции, относящиеся
к подсистемам планирования, учета и т.д.
Любой непрерывный технологический процесс характеризу-
ется параметрами состояния, которые с точки зрения АСУТП мож-
но разделить на две группы: системные, определяющие кон-
структивные особенности элементов системы (мощность уста-
новки и отдельных аппаратов, тип оборудования, взаимное рас-
положение аппаратов установки и т.д.), и режимные (скорости
потоков, давление, температура, концентрации потоков и т.д.).
Некоторые из этих параметров являются управляемыми, а дру-
гие — неуправляемыми. Управляемые параметры должны удов-
летворять следующим требованиям:
О точно и однозначно характеризовать технологический процесс;
© быть связанными с критерием оптимизации, при этом целе-
вая функция должна либо измеряться непосредственно, либо
вычисляться по другим измеряемым параметрам;
© быть высокочувствительными и существенными;
О позволять создавать наиболее простые математические модели
стационарных и переходных режимов управляемого процесса;
© быть измеримыми.
9 я-б
258 Часть!. Теоретические основы технологии крупнотоннажных ...
Таким образом, при создании безотходных производств тре-
буется высокая степень автоматизации, в том числе с применени-
ем микропроцессорной техники, позволяющая достигать высокой
надежности и эффективности всего производства.
Обеспечение высокой надежности и стабильности работы хими-
ко-технологической системы. Как было отмечено ранее, в отрасли
основного органического и нефтехимического синтеза в большин-
стве многотоннажных производств применяется непрерывная тех-
нология с аппаратами большой единичной мощности. При этом
экономические и экологические преимущества укрупнения уста-
новок при определенных условиях могут быть утрачены, если из-за
низкой надежности часто будут выходить из строя отдельные ап-
параты или подсистемы.
На современном этапе проблема повышения надежности стала
весьма актуальной и без ее решения вряд ли возможно дальнейшее
укрупнение ведущих технологических агрегатов по производству мно-
готоннажной химической продукции. В данном случае непрерыв-
ность предопределяет равную надежность всех аппаратов, входящих
в химико-технологическую систему. Кроме того, многотоннажность
и применение аппаратов большой единичной мощности требует так-
же высокой надежности всех аппаратов ХТС, так как выход из строя
одного из аппаратов не только нарушает работу производства (ино-
гда останавливается все производство), но и может серьезно влиять
на окружающую среду. В этом случае значительное количество вред-
ных для животного и растительного мира продуктов может попасть
как в воздушное пространство, так и в водоемы. Следовательно, вы-
сокая надежность работы технологических установок позволяет не
только исключить большие потери продуктов, вызванные простоя-
ми аппаратов большой единичной мощности, но и предотвратить ра-
зовые выбросы химических веществ в окружающую среду.
Вместе с тем надежность работы ХТС с точки зрения экологии
должна быть не только механической, но и технологической. На-
пример, обязательно применение специальных аварийных емкос-
тей и аппаратов, в которые сбрасываются газовые и жидкие выбро-
сы при срабатывании соответствующих клапанов в случае значитель-
ного отклонения параметров от нормы. Предусматривается и ава-
рийный сброс газов на факел. Это может происходить при
повышении давления в аппаратах, при их переполнении жидкими
продуктами, при необходимости сброса некондиционных продук-
тов, полупродуктов и т. д.
ГЛАВА 6. Приниипы СОЗДАНИЯ БЕЗОТХОДНЫХ ПРОИЗВОДСТВ
259
Значительное влияние на надежность аппаратуры оказывает
коррозия. Поэтому создание безотходного производства должно
предусматривать условия работы, исключающие коррозию. На на-
дежность работы ХТС влияют и многие другие факторы.
Большое значение при работе уже действующих малоотходных
производств имеет их стабильность. В частности, значительные ко-
лебания состава продуктов реакций, направляемых на разделение
и очистку, нарушают оптимальный режим работы соответствующих
установок разделения и могут привести не только к ухудшению ка-
чества целевых продуктов, но и к увеличению количества отходов
и даже к выбросам токсичных веществ. Следовательно, здесь также
требуется не только высокая надежность, но и стабильность рабо-
ты установок, т. е. поддержание на определенном уровне всех пара-
метров, что позволяет исключить потери в результате образования
некондиционных продуктов.
Таким образом, при проектировании безотходных производств
необходимо заранее проводить расчет надежности работы не толь-
ко отдельных аппаратов, но и всей ХТС, а также создавать условия
ее стабильной работы.
ОРГАНИЗАЦИОННЫЕ ПРИНЦИПЫ
Организационные принципы имеют большое значение в созда-
нии безотходных (малоотходных) производств. К ним относятся
принцип кооперирования и комбинирования производств, прин-
ципы создания безотходных территориально-промышленных ком-
плексов и технологии переработки отходов.
Кооперирование и комбинирование различных производств. В от-
расли основного органического и нефтехимического синтеза име-
ется несколько форм организации производств, позволяющих по-
вышать их концентрацию за счет создания: 1) комбинатов внутри-
и межотраслевого типа, на которых создаются производства, раз-
личные по технологии и вырабатываемой продукции, но позволя-
ющие комплексно перерабатывать сырье; 2) специализированных
предприятий, на которых вырабатывается однородная продукция
по технологии своего производства или использования.
Однако с целью создания безотходных или малоотходных про-
изводств постепенно отрасль будет переходить на организацию про-
изводств первого типа. При этом внутри комбинатов или производ-
ственных объединений будут формироваться специализированные
260 Часть!. Теоретические основы технологии крупнотоннажных ...
заводы или новые комплексы со сложными сырьевыми и техноло-
гическими связями.
Таким образом, будут создаваться производственные объ-
единения или комбинаты, включающие отдельные специализи-
рованные заводы с углубленной специализацией, рациональным
комбинированием и использованием укрупненных агрегатов и тех-
нологических линий, позволяющих превращать исходное сырье
в целевые продукты с минимальными затратами и отходами. При
этом предусматривается использование этих отходов в других от-
раслях или их захоронение, если это безопасно для природы.
В дальнейшем заводская концентрация в отрасли основного
органического и нефтехимического синтеза будет развиваться в сле-
дующих направлениях:
О межотраслевое комбинирование производств преимуществен-
но путем создания многономенклатурных комбинатов и мно-
гоотраслевых предприятий;
© отраслевая специализация промышленных объектов;
© создание производственных и научно-производственных объ-
единений.
Успешной формой организации в нашей стране были научно-
производственные объединения, которые включали промыш-
ленные предприятия, научно-исследовательские и проектные ин-
ституты и опытно-экспериментальную базу. При этом создаются
наиболее благоприятные условия для разработки новой техноло-
гии и использования научных достижений при реализации от-
дельных принципов разработки безотходных технологий в про-
изводстве.
Кроме того, концентрация производства в масштабах объ-
единения и развития специализации должна служить расширению
выпуска продукции отрасли на основе интенсивных методов про-
изводства, технического перевооружения, использования новейших
достижений науки и техники. Все это дает значительный экономи-
ческий и экологический эффект.
Наиболее характерным примером такой организации произ-
водства является ПО «Нижнекамскнефтехим», в котором объ-
единены специализированные производства, имеющие аппараты
или технологические линии большой единичной мощности. Се-
бестоимость продукции этого объединения примерно на 20—30%
ниже, чем на специализированных заводах, выпускающих анало-
ГЛАВА 6. Приниипы СОЗДАНИЯ БЕЗОТХОДНЫХ ПРОИЗВОДСТВ
261
гичную продукцию. Кроме того, уже в настоящее время на этом
ПО успешно решаются экологические проблемы, так как приме-
няются многие из принципов, изложенных нами ранее.
Таким образом, при создании производственных или научно-
производственных объединений необходимо учитывать следующие
факторы:
О технологическую общность получения продукции;
О возможность кооперирования производств, совокупность ко-
торых обеспечивает выпуск конечной подотраслевой или от-
раслевой продукции;
© последовательную или комплексную переработку сырья;
© централизацию вспомогательных или обслуживающих произ-
водств и служб;
О рациональное территориальное размещение объединяемых
производств или предприятий;
® включение в состав объединений научно-исследовательских
и проектных институтов, конструкторских бюро соответству-
ющего профиля.
Учитывая тот факт, что еще некоторое время развитие про-
изводств будет связано с наличием отходов, необходимо изыски-
вать возможности для их применения в других отраслях. Предпри-
ятия этих отраслей могут строить свои производства, используя
вторичные материалы — отходы как сырье. Следовательно, при ор-
ганизации безотходных промышленных производств большое зна-
чение имеет кооперирование предприятий различных отраслей про-
мышленности. Такие примеры уже имеются: полимерные отходы
химических производств используются в строительной индустрии.
Наиболее благоприятные возможности для такого кооперирования
появляются при организации территориально-промышленных ком-
плексов.
Создание безотходных территориально-промышленных ком-
плексов. Создание производственных или научно-производствен-
ных объединений и комбинатов позволяет в значительной степени
использовать отходы отдельных производств и более полно пере-
рабатывать сырье в целевые продукты.
Вместе с тем некоторые отходы даже в рамках таких объ-
единений не удается использовать. В этом случае большую роль иг-
рает кооперирование производств различных отраслей про-
мышленности, находящихся в одном территориальном регионе, т. е.
262 Часть 1. Теоретические основы технологии крупнотоннажных ...
создание безотходных территориально-промышленных комплексов
(ТПК). В такие комплексы могут входить производства отрасли
основного органического и нефтехимического синтеза и других от-
раслей промышленности (например, строительной индустрии),
энергетические объекты (например, атомная электростанция)
и даже городские коммуникации, дающие бытовые отходы.
В рамках ТПК могут эффективно использоваться отходы, очи-
щаться воздушные выбросы и сточные воды. Так, имеются уста-
новки по переработке промышленных и бытовых отходов пласт-
масс методом пиролиза.
Создание технологии по переработке отходов производств. Ути-
лизация, переработка или своевременное удаление и обезврежи-
вание твердых, жидких и газообразных отходов производств ос-
новного органического и нефтехимического синтеза имеют
большое народнохозяйственное значение, способствуют не толь-
ко увеличению полноты использования сырья с целью получения
важных продуктов, но и улучшению состояния водоемов и воздуш-
ного бассейна.
При создании безотходных производств прежде всего пре-
дусматривается утилизация и переработка отходов производства,
превращая их в ценные для народного хозяйства продукты, а также
в сырье для других производств.
И только при отсутствии в настоящее время путей переработки
отходов в нужные для народного хозяйства продукты эти отходы
могут уничтожаться. Но при этом необходимо воспользоваться их
внутренней энергией. В частности, они могут быть использованы
в качестве топлива.
Частично переработка газообразных отходов была рассмотрена
выше. Что касается жидких и твердых отходов, то они могут быть
в условиях пиролиза или плазмохимического процесса перерабо-
таны в разные виды сырья или целевые продукты.
УСЛОВИЯ ПРИМЕНЕНИЯ ПРИНЦИПОВ СОЗДАНИЯ
БЕЗОТХОДНЫХ ПРОИЗВОДСТВ
Разработка безотходных производств или комплексов представ-
ляет сложную комплексную проблему, при решении которой необ-
ходимо учитывать не только современное состояние технологии,
но и ее будущее, а также экономические аспекты.
ГЛАВА 6. ПРИНЦИПЫ СОЗДАНИЯ БЕЗОТХОДНЫХ ПРОИЗВОДСТВ
263
Так как проходит длительный срок от принятия решения о со-
здании производства по новой технологии до его реализации, то
необходимо тщательно выбирать вариант технологии, отвечающей
рассмотренным принципам. Усредненные сроки этапов создания
нового производства следующие: принятие решения - 2 года; раз-
работка технологии — 2—4; проектирование и строительство про-
мышленных установок - 2-3 года. Суммарная длительность про-
мышленной реализации процессов — 6—9 лет. Эти сроки, естествен-
но, будут сокращаться, особенно за счет интенсивного примене-
ния вычислительной техники. Однако они и в дальнейшем будут
заметными. Следовательно, проблема выбора технологии и в даль-
нейшем будет актуальной. Необходимо иметь в виду, что процесс
совершенствования существующей технологии в каждом конкрет-
ном случае конечен, т. е. существует предел как с точки зрения по-
вышения эффективности производства, так и с точки зрения ути-
лизации отходов производства.
Итак, существует предельно эффективная технология (ПЭТ),
к которой мы стремимся. Но она, как правило, не достигается, так
как появляется новая технология, которая вытесняет существую-
щую. Каждая технология после реализации в промышленном мас-
штабе совершенствуется, достигает определенного предела и затем
заменяется новой.
Таким образом, при выборе наиболее эффективной техноло-
гии можно использовать понятие ПЭТ. Однако необходимо рас-
полагать конкретными показателями ПЭТ. Этими показателями
могут быть конверсия за проход, селективность процесса и энер-
гетические затраты, так как они могут быть в значительной сте-
пени оценены на базе теоретических расчетов, основанных на тер-
модинамических характеристиках и данных о кинетике и меха-
низме реакций.
При этом, естественно, необходимо оценивать выход не толь-
ко целевых продуктов, но и отходов данного производства с целью
выяснения возможности их использования в народном хозяйстве
и оценки метода в целом.
Кроме того, при создании технологий для безотходных про-
изводств необходимо критически относиться к кажущимся «про-
стыми и легкими» решениям и принципам. В ряде случаев приме-
нение на данном этапе простого решения значительно усложняет
последующие решения.
264 Часть!. Теоретические основы технологии крупнотоннажных ...
Так, в технологии разделения различных смесей часто ис-
пользуют простой способ отпарки различных летучих веществ из
их водных растворов с применением «острого» пара. Такой способ
прост, не требует применения дополнительной теплообменной ап-
паратуры и позволяет сократить расход водяного пара. Но в резуль-
тате появляется дополнительное количество загрязненных сточных
вод в виде водяного конденсата. Для его очистки потребуется до-
полнительный расход, в частности энергии.
Применение же поверхностных конденсаторов потребует уве-
личения расхода пара и применения теплообменной аппаратуры,
но не увеличивает количество загрязненного конденсата.
Следовательно, наблюдается конкурентная ситуация. Поэто-
му необходима экономическая и экологическая оценка целесо-
образности применения «острого пара». А именно, необходимо
выявить:
О имеется ли выигрыш в энергии при применении «острого пара»
по сравнению с затратами энергии на очистку конденсата, по-
лучаемого из него;
© насколько возможно этот конденсат использовать повторно;
© применяется ли конденсат в качестве реагента или, например,
азеотропного агента.
Все эти факторы необходимо учитывать, так как зачастую
требуются дополнительные расходы не только в цехах очистки сточ-
ных вод, но и на стадии водоподготовки на ТЭЦ.
Другой пример. В настоящее время во многих производствах
вакуум создается с использованием пароструйных насосов, паро-
эжекционных установок и других барометрических конденсаторов.
Однако их применение приводит к получению значительных ко-
личеств загрязненного конденсата, собираемого в барометричес-
ких емкостях. Следовательно, также возникает задача его очист-
ки, требующая определенных энергетических затрат. Вместе с тем
применение, например, вакуумнасосов не создает таких труднос-
тей. Таким образом и здесь возникает конкурентная ситуация.
А именно: применение простейших и на первый взгляд наиболее
экономичных способов создания вакуума в дальнейшем приводит
к определенным трудностям и дополнительным затратам энергии.
Приведем более общий пример. Простейшим и в большинстве
случаев доступным решением является традиционная очистка га-
зов и воды, выводимых из системы. Это решает главные проблемы
Глава 6. Приниипы создания безотходных производств
265
охраны окружающей среды. Но применение таких способов ме-
шает решению главной задачи - разработке принципиально новой
технологии, безотходной, т. е. без выбросов или с эффективной ути-
лизацией отходов.
Эти примеры свидетельствуют о том, что применение любо-
го метода и технологического приема может быть оценено толь-
ко при рассмотрении всех без исключения принципов, т. е. требуется
комплексный, системный подход к решению любой, даже част-
ной задачи.
Более того, применение всех принципов позволяет дать все-
стороннюю оценку предложенной технологии, а главное показать
их взаимосвязь и облегчить решение одних задач за счет других.
Это обусловлено, во-первых, тем, что многие из принципов свя-
заны между собой, т. е. реализация одного принципа, как правило,
облегчает реализацию других принципов. Например, увеличение
конверсии сырья приводит к уменьшению рециклов по сырью,
а это, в свою очередь, приводит к сокращению энергетических и
капитальных затрат, в том числе и при разделении.
Применение аппаратов и технологических линий большой еди-
ничной мощности приводит к облегчению автоматизации и управ-
ления производством, так как сокращается число аппаратов в хи-
мико-технологической системе. Далее, одновременное получение
нескольких целевых продуктов обеспечивает более полное исполь-
зование сырья и облегчает полноту выделения всех продуктов из
реакционной смеси, так как при раздельном получении целевых
продуктов имелось бы больше побочных продуктов и пришлось бы
делить две реакционные смеси, содержащие наряду с целевыми
продуктами непрореагировавшее сырье и побочные вещества.
При одновременном рассмотрении всех принципов исключа-
ется возможность применения «простых» решений, которые, как
было показано ранее на нескольких примерах, впоследствии будут
затруднять создание технологий для безотходных или малоотход-
ных производств.
Таким образом, при создании безотходных или малоотходных
производств необходим системный подход, позволяющий рассма-
тривать не только материальную, но и другие системы (кибернети-
ческую, экономическую, социальную). Системный подход необхо-
дим при использовании предложенных принципов, так как только
их комплексное использование с учетом взаимосвязи даст наиболь-
ший эффект.
266 Часть!. Теоретические основы технологии крупнотоннажных ...
ЭКОНОМИЧЕСКОЕ ОБОСНОВАНИЕ БЕЗОТХОДНЫХ
ТЕХНОЛОГИЙ
При планировании, проектировании и эксплуатации безотходных
технологических систем наряду с технологическими и экологичес-
кими требованиями рассматриваются и экономические требования.
При этом необходимо, чтобы уровень рентабельности работы пред-
приятия с безотходной технологией был равен уровню рентабельно-
сти (или выше) аналогичного предприятия с существующей в насто-
ящее время технологией. Предусматривается, что на предприятии
с безотходной технологией себестоимость основной продукции долж-
на быть ниже (или равна), эксплуатационные затраты могут быть
выше, чем на предприятиях с существующей технологией.
При экономической оценке эффективности безотходных тех-
нологических систем необходимо учитывать эффект от утилизации
и переработки отходов на всех стадиях, включая и другие отрасли.
Оценка затрат на создание технологии для безотходного произ-
водства производится с учетом определения затрат на: производство
основной товарной продукции, попутной продукции, товарной про-
дукции, получаемой при переработке отходов, использование сбро-
сового тепла; получение тепла и электроэнергии из отходов.
Суммарная эффективность такой технологии определяется как
совокупность экономических эффектов от: производства целевой
продукции, полученной при полном использовании сырья; эконо-
мии затрат на разведку, добычу, транспортировку сырья; снижения
затрат на производство продукции; сохранения чистых земель для
народного хозяйства; сокращения импорта сырья или увеличения
экспорта продукции; уменьшения ущерба, вызываемого загрязне-
нием окружающей среды отходами производства.
Следовательно, суммарная эффективность Э' безотходных про-
изводств должна стремиться к максимуму:
У->тах[(£Э-У)/Зя],
где суммарный экономический эффект; У-размер ущерба от
загрязнения окружающей среды отходами; Зп — затраты на осуществление
безотходного производства.
Такой подход к оценке эффективности технологии для без-
отходного производства используется в промышленности основного
органического и нефтехимического синтеза. Вместе с тем макси-
мальный эффект должен достигаться не только за счет увеличения
Э‘, но и за счет уменьшения У.
ГMBA 6. Приниипы СОЗДАНИЯ БЕЗОТХОДНЫХ ПРОИЗВОДСТВ
267
Основная задача состоит в создании технологии, позволяющей
получать целевые продукты без загрязнения окружающей среды, при
полном использовании сырья и минимальных энергетических затра-
тах. Следовательно, и в этом случае необходимо использовать в ка-
честве критерия оптимизации экономический критерий, а в качест-
ве ограничений - допустимые концентрации различных продуктов
в потоках, выводимых из системы, т. е. из всего производства.
Показателями функционирования производства являются рас-
ходные нормы на сырье, топливо, электроэнергию, греющий пар,
охлаждающую воду и т.д. Чем ближе расходные коэффициенты
по этим показателям к стехиометрическим, тем лучше будут эко-
номические показатели производства. И тем не менее при оценке
эффективности производства помимо технологических критери-
ев необходимо учитывать экономические показатели, к числу ко-
торых можно отнести: мощность, себестоимость продукции, при-
веденные затраты, фондоотдачу, прибыль, рентабельность и т.д.
К числу основных показателей производств следует отнести: ко-
личество реализованной продукции, качество продукции, экс-
плуатационные и капитальные затраты на производство продукции.
В качестве же обобщенного показателя экономической эф-
фективности производства можно использовать так называемый
приведенный доход (в руб/час):
О„=ЪУ1ВГ3э-ЕК„
J=l
где у. - отпускная цена на продукт у-го вида (или утилизируемую энер-
гию), учитывающая его качество, руб.; В - годовой объем выпуска и ре-
ализации у-го вида конечного продукта или количество утилизируемой
энергии, год1; Зэ — суммарные эксплуатационные затраты, руб/год; Е —
нормальный коэффициент экономической эффективности капиталовло-
жений (величина, обратная нормативному сроку окупаемости), год1: Kt —
производственные фонды, руб.
Таким образом, обобщенный показатель эффективности всей
химико-технологической системы является глобальным критерием
оптимизации, включающим достаточно общие экономические ха-
рактеристики производства. Но этот приведенный доход должен
быть достигнут без ущерба не только для человека, но и природы.
Рассмотренные принципы могут быть использованы не только
при создании новой технологии для безотходных производств, но
и при анализе существующей технологии. При этом на первом эта-
пе должны быть вскрыты принципиальные недостатки традицион-
268 Часть!. Теоретические основы технологии крупнотоннажных ...
ных технологий и выявлены технологические процессы, которые
приводят к появлению побочных продуктов и потоков, требующих
дополнительной очистки.
Кроме того, необходимо иметь в виду, что себестоимость про-
дукции, получаемой по условно безотходной технологии, т. е. по ста-
рой технологии, но с очисткой всех потоков, выходящих из систе-
мы, будет всегда выше себестоимости продукции, получаемой по
технологии, не предусматривающей дополнительной очистки воды
и газовых выбросов, а также переработки жидких и твердых отхо-
дов. Поэтому создание такой безотходной технологии может при-
вести к сокращению выпуска такой продукции или даже к ее пол-
ному прекращению. Вместе с тем себестоимость продукции,
получаемой по безотходной технологии, разработанной с учетом
всех принципов, будет ниже себестоимости продукции, получае-
мой по существующей технологии, так как новая безотходная тех-
нология является оптимальной с точки зрения именно экономиче-
ского критерия оптимизации, а также с учетом ограничений,
определяющих безотходность производства.
Следует учитывать, что здесь также наблюдается конкурент-
ная ситуация, обусловленная тем, что, с одной стороны, требуется
получать основную продукцию с минимальными затратами, а с дру-
гой — необходимо соблюдать «безотходность» производства, т. е.
иметь так называемую «чистую технологию». Именно применение
всех принципов позволяет не только решать экологическую задачу,
создавать безотходное производство, но и получать продукцию при
минимальных затратах, так как эти принципы помогают выявить
оптимальные условия проведения всех процессов и создавать оп-
тимальную технологию.
Безотходные производства характеризуются высокими выхода-
ми целевых продуктов, большой надежностью и стабильностью,
а также минимальными затратами на эксплуатацию. Причем, если в
качестве экономического критерия использовать параметры, опре-
деляющие безотходность производства, то при оценке производства
должны быть учтены ограничения, связанные с безотходностью.
Следует также иметь в виду, что выгоднее сразу создавать но-
вые безотходные технологические процессы и производства, чем
превращать существующие производства в производства с «чис-
той» технологией. Так, например, эволюция технологии производ-
ства анилина показывает, что лучшим способом создания его без-
отходной технологии оказывается не совершенствование методов
ГЛАВА 6. Приниипы СОЗДАНИЯ БЕЗОТХОДНЫХ ПРОИЗВОДСТВ
269
очистки образующихся стоков, а коренное улучшение технологии
или создание новой технологии, предотвращающей образование
этих стоков и отходов. Такой подход в значительной степени от-
носится ко всем производствам.
Вместе с тем в настоящее время необходимо на существующих
производствах создавать установки по очистке различных потоков,
выходящих из системы, и переработке отходов. Новые же произ-
водства должны работать на базе новой безотходной технологии.
Таким образом, разработка технологий для безотходных про-
изводств основного органического и нефтехимического синтеза яв-
ляется сложной комплексной проблемой, требующей не только ре-
шения технологических, организационных и управленческих задач,
но и преодоления многочисленных психологических барьеров, ме-
шающих отысканию оптимальных решений. При этом поиск оп-
тимальных вариантов безотходных технологий предполагает опре-
деленную последовательность решения всей проблемы:
О с учетом всех рассмотренных принципов вскрытие принципи-
альных недостатков существующих технологий, определение
потоков, которые выводятся из системы с целью их очистки
или утилизации;
© выяснение основных причин и противоречий, мешающих соз-
данию безотходных технологий;
© разработка нового метода получения целевого продукта или
принципиальное совершенствование одного из существующих,
удовлетворяющих основным принципам создания безотходных
технологий;
© разработка нескольких безотходных технологий, базирующих-
ся на выбранном методе;
© выбор наиболее экономичной технологии при сохранении ее
безотходности.
Алгоритм создания безотходных производств представлен на
рис. 6.1.
Решая проблему создания безотходной технологии производ-
ства любого продукта основного органического и нефтехимического
синтеза, необходимо использовать системный подход как к произ-
водству, так и множеству взаимосвязанных между собой принци-
пов создания безотходных технологий.
В данной главе не предусматривалось полное раскрытие путей
реализации каждого принципа. Эти вопросы достаточно полно рас-
крыты в литературе, отражающей физико-химические основы и тех-
270 Часть 1. Теоретические основы технологии крупнотоннажных ...
Рис. 6.1. Алгоритм создания безотходных производств
нологические принципы осуществления различных стадий или под-
систем технологии основного органического и нефтехимического
синтеза, а также в 1—5 гл. настоящего пособия.
2
Технология крупнотоннажных
производств ОРГАНИЧЕСКИХ ПРОДУКТОВ
Глава 7. Алкилирование ароматических
углеводородов
н
а
а
Теоретические основы проиесса алкилирования.
Технология алкилирования бензола олефинами.
Принципы в технологии алкилирования бензола
олефинами.
Алкилароматические соединения широко используются в химии
и химической технологии для получения полимерных материалов,
поверхностно-активных веществ, высокооктановых добавок к топ-
ливу и в качестве полупродуктов. Наибольшее значение имеют этил-
бензол и изопропилбензол как исходные вещества при получении
таких мономеров, как стирол и а-метилстирол. Изопропилбензол
также является полупродуктом при производстве фенола и ацетона
«кумольным» методом. Полиалкил бензолы используются как добав-
ки к топливам. Промышленное производство этилбензола в России
впервые было организовано в 1936 г. Во время Великой Отечествен-
ной войны изопропилбензол широко применяли в качестве
высокооктановой добавки к топливу. И в настоящее время он явля-
ется одним из важнейших продуктов органического синтеза.
Непрерывный рост производства алкилароматических углево-
дородов обусловлен высокой потребностью в продуктах, получае-
мых на их основе. В качестве алкилирующих агентов могут приме-
няться не только олефины, но и спирты и ал кил галогениды. Ката-
литическое алкилирование бензола олефинами занимает ведущее
место среди многочисленных процессов основного органического
и нефтехимического синтеза. Около 80 % общего потребления бен-
272
Часть 2. Технология крупнотоннажных производств ...
зола приходится на долю производства алкилбензолов. Структура по-
требления бензола в промышленно развитых странах примерно оди-
накова: около 50% бензола идет на производство этилбензола и око-
ло 20% — на производство изопропилбензола. Поэтому мы подробно
рассмотрим процесс алкилирования на примерах этих производств.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПРОЦЕССА
АЛКИЛИРОВАНИЯ
Алкилирование ароматических углеводородов — сложный мно-
гостадийный процесс, состоящий из ряда взаимосвязанных реакций:
алкилирование, изомеризация, диспропорционирование, переалки-
лирование, полимеризация и др. Поэтому расчет равновесия про-
цесса алкилирования с учетом всех побочных реакций представляет
сложную задачу.
В качестве катализаторов процесса алкилирования могут быть
использованы протонные и апротонные кислоты. Протонные кис-
лоты широко применяют при алкилировании бензола олефинами
и спиртами, причем их активность падает в ряду HF > H2SO4 >
Н3РО4. Кислоты Льюиса, как катализаторы алкилирования бен-
зола, по своей активности могут быть расположены в следующем
порядке: AlBr3 > А1С13 > FeCl3 > ZrCl4 > TaCl5 > BF3 > UCl4 > TiCl3 >
WClb > CdCl5 > ZnCl2 >SnCl4 > TiCl4 >BeCl2 > SbCl5 >HgCl2 > BiCl3 >
AsF3. Активность, селективность и стабильность катализаторов на-
ходятся в сложной зависимости от температуры, давления, при-
роды и структуры алкилирующих агентов и т. д.
При алкилировании могут использоваться твердые и жидкие
катализаторы. Использование твердых гетерогенных катализаторов
является более предпочтительным, так как в этом случае легче от-
деляются продукты реакций от каталитической системы, а следо-
вательно, снижаются затраты на подготовку сырья, промывку и ней-
трализацию реакционной массы, очистку и нейтрализацию сточных
вод. Кроме того, существенно снижается коррозия аппаратуры.
Преимущество гетерогенного алкилирования проявляется при
осуществлении процесса в паровой фазе. Однако для этого необ-
ходимо располагать катализатором, обладающим не только высо-
кой активностью и стабильностью, но и способностью проводить
переалкилирование полиалкилбензолов в моноалкилбензолы.
В последнее время стали успешно применять в качестве ка-
тализаторов алкилирования бензола олефинами и спиртами син-
Гмед 7. Алкилирование ароматических углеводородов
273
тетические цеолиты общей формулы Mx/AlxSiyO2(x+y)zH2O (М — ме-
талл, п — степень окисления, х — число атомов А1, у — число ато-
мов Si; z — число молекул воды). Кроме того, для этой цели пыта-
ются использовать катионообменные смолы (катиониты), представ-
ляющие гетерополикислоты, состоящие из высокомолекулярной ма-
трицы и катионогенных групп (чаще всего SO3H, СООН, РО,Нг,
АзО3Н2). В большинстве случаев полимерной матрицей является по-
листирол, который подвергается, например, сульфированию. Нако-
нец, могут применяться металлоорганические катализаторы общей
формулы MRn (R — алкильная группа). Эти катализаторы обычно ис-
пользуют в комплексе с солями тяжелых металлов, например TiCl3
и TiCl^. Чрезвычайно активным является триэтилалюминий, одна-
ко его активность быстро падает при контакте с воздухом или вла-
гой. Таким образом, из многочисленных катализаторов, испытан-
ных в процессе алкилирования бензола, в промышленности могут
быть использованы только некоторые из них, позволяющие полу-
чить лучший суммарный эффект.
Многочисленные исследования процесса алкилирования бензола
с получением этилбензола и изопропилбензола позволили выбрать
оптимальные условия проведения этого процесса (катализатор, ал-
килирующий агент, температуру и давление). В табл. 7.1 представле-
ны основные результаты алкилирования бензола с получением этил-
бензола и изопропилбензола. Как видно из табл. 7.1, состав
и структура алкилароматических углеводородов зависят от условий
проведения реакции алкилирования и катализатора.
Большое влияние на реакцию алкилирования оказывают про-
межуточные комплексы, состав, структура и реакционная способ-
ность которых в значительной степени определяют направленность
процесса в целом, его технологическое оформление и основные тех-
нико-экономические показатели.
В промышленности в качестве алкилирующих агентов при про-
изводстве этилбензола и изопропилбензола чаще всего используют
олефины или их углеводородные фракции (в частности, этилен
и пропилен). Если в качестве алкилирующего агента используют
олефины, то в качестве катализаторов, как отмечалось выше, при-
меняют протонные кислоты и кислоты Льюиса. Причем непредель-
ные углеводороды (олефины) в этом случае можно рассматривать
как основания Льюиса благодаря легкой поляризуемости л-элек-
тронов двойной связи и способности олефинов образовывать при
взаимодействии с кислотами л- или о-комплексы. Эти комплексы
Таблица 7.1. Условия процесса алкилирования бензола и выход продуктов’
Алкилирующий агент Катализатор Условия реакции Продукты реакции (выход % мае.)
t,°C Р, МПа загрузка катализатора на 1 т продукта, кг
Этилен BFa / Оксиды металлов 18-260 М»|ИИ»11 1-200 Этилбензол (83.9 в расчете на бензол, 95,2—на этилен)
Этилен (1,5-10/1) Перфторированный полимер 175 0,355 78 Этилбензол (17,5)
Этилен (1-10/1) А1-С.Н Ск(С,Нб)гО нц Этилбензол (40,1); диэтилбензол (4,5); полиалкилбензолы (0-6)
YAI2O3/T1F4, TiFaCI, Этилбензол (23,9); диэтилбензол (7,7);
Этилен (2,5/1) катализатор на основе полифторсульфоновой 83-197 0,025-0,355 32-36 триэтилбензол (1,8); тетраэтилбензол (0,7); пентаэтилбензол (0,3)
кислоты
Этилен (4,22/1) 1,5% Ni; 0,3% СгаОз; 96,5-= SiOa/AlaO» 3,200 Этилбензол (в отсутствие Ni - полиэтилбензрл^)
Пропилен Гумбрин, активированный HCI 50-60 - 2-3 Изопропилбензол (34)
Пропилен НэРОд-ВРа ИНв Изопропилбензол (82); дийзопропилбензол (15);. полиалкилбензолы и полимеры (3)
Пропилен WCIe, M0CI5 150 - - Изопропилбензол (55); диизопропилбензолы (31); триизопропилбензолы (14)
274 Часть 2. Технология крупнотоннажных производств ..
Пропилен
(1-3,5 0.5-1)
Пропилен (1/8)
Пропилен (1/1)
Пропилен (5,24,0)
Пропилен
Пропилен (2,6/1,0)
Пропиле» (371)
Пропилен (2,5-8/1)
Этипбромид
Этилфторид
Этилбромцд (3/1)
Цеолиты 25-250
СиЗОд-бНгО уд
AJ+TiCk (в органическом
инертном растворителе)
60% HpTiFe/AlzOa 120-180 0,250-0,355
ВЕз/Кислые и (или.
средние фосфаты'
щелочноземельных 100 0.167 |И1
металлов
T1CI4 (или Т1Е4)/Оксиды
металлов I и III групп ^4Ь 0,557 —
Н3РО4 на твердом
носителе 270 0,355 2,94
Алюмоциркониевый 125 0,015-0.050
Гумбрин, активированный HCI . вминай ИИИ 0.17
ВЕзилиВСЬ 20 - 0,17
А1СЬграфит 25 24-48
Изопропилбензол (40-55);
диизопропилбензол (30-35);
полиалкилбензолы (15-20)
Изопропилбензол (32,8);
диизопропилбензолы (41,2);
триизопропилбензолы (9,5);
тетраизопропилбензолы (12,7)
Изопропилбензол (30,3);
м-диизопропилбензол (14.9);
о-диизопропипбензол (7,3);
л-диизопропилбензол (14,4);
триизопропилбензопы (4,7); полиалкилбензолы (3,4)
Изопропилбензол (56,8-70,2)
Изопропилбензол (87)
Изопропилбензол (39.2): н-пропилбензол (0,1);
другие алкилбензолы
Изопропилбензол (40,7); диизопропилбензолы (1,2);
Изопропилбензол (35-65)
Этилбензол (30)
Этилбензол (69-77)
Этилбензол (40,13)
‘В первой графе таблицы в скобках дано
соотношение бензол/алкилирующий агент.
Глава 7. Алкилирование ароматических углеводородов 275
27Ь
Часть 2. Технология крупнотоннажных произволом ...
получаются при атаке двойной связи олефинов или ароматических
соединений протонами или другими положительно заряженными
частицами:
тг-комплексы
о-комплексы
7.1
Образование л- и о-осомплексов зависит от наличия в реак-
ционной смеси промоторов типа НС! и Н2О, поскольку чистые оле-
фины при контакте с безводными металлгалогенидами МХ3 в реак-
цию не вступают:
А!С13 + НС! -> Н+ [А1СЦ ]' Сз-6 > [С3Н2 ]+ [AlCl4 ]'
7 2
А1С13 + Н2О->Н+ [А1С1.ОН] >[С3Я7 ]+ [А!С13ОН[
I П
Комплексы типа I следует рассматривать как гипотетические,
но соли их довольно устойчивы.
В настоящее время считается, что л- и о-комплексы способны
к взаимным переходам и высказывается предположение о важной
роли интермедиатов, предшествующих образованию о-комплексов.
Протонирование олефинов протекает по правилу Марковни-
кова, что обусловлено выигрышем энергии в 25—29 кДж/моль:
СН3-СН=СН2 + Н+------► СН3—С+Н-СН3
7.3
СН3 х. __ , СН3 +
3:с=сн2 + н+ —► /С— сн3
сн< сн<
Скорость атаки олефинов протонами или другими положи-
тельными частицами зависит от основности непредельных уг-
леводородов. Эта величина возрастает при введении электронодонор-
ных заместителей. При наличии заместителей R, обусловливающих
Глава 7. Алкилирование ароматических углеводородов
277
пространственные затруднения, процесс алкилирования протекает
в более мягких условиях. Так, образование карбокатионов протекает
при алкилировании бензола 2-метилпропеном при контакте с 80—
90%-ной H2SO4, а пропиленом и этиленом — с 96 и 98%-ной H2SOV
Вместе с тем изучение закономерностей алкилирования оста-
ется актуальной задачей, так как еще не полностью ясен механизм
этой реакции. В частности, ранее предполагали, что при примене-
нии катализатора AlCl^HCl в качестве промежуточного продукта
образуются ал кил галогениды:
сн2 = сн2+[Aici3 + на] -> сн3 - сн2а+Aia3 7.4
В последнее же время высказывается другая точка зрения.
А именно, указывается на то, что взаимодействие катализатора с
олефинами происходит за счет поляризации последнего.
В общем виде образование промежуточных комплексов при ал-
килировании бензола олефинами можно представить следующей
схемой:
[СпН2п+11 [MX3Y]
CnHzn+HY+МХз
[MX3Y]
СпН2п+1
—* О+ ну+мхз
Считают, что при алкилировании бензола олефинами на ка-
тализаторе BF3H2O его активной формой являются комплексы
H+[BF3OH\ или H3O+ [BFOH\~. При взаимодействии с олефинами
последние образуют эфироподобные комплексы:
С3Н6 СНзХ §+ 5-
BF3 • Н2О *• H+«BF3OH >СН — BF3OH 7.6
CH3Z
Было показано, что этилен с BF3 не образует о-комплекс, тогда
как полярные олефины дают о- и л-комплексы, которые и участ-
вуют в реакции алкилирования.
278
Часть 2. Технология крупнотоннажных производств ...
Образование комплексов и механизм реакции алкилирования
ароматических соединений олефинами в присутствии H2SO4 мож-
но представить в следующем виде:
н2с=сн2+h2so4 н3с - сщ + hso;
с6н6+hso; с6я; + h2so4 77
с6н: + н3с - сн: с6я5 - сн2сн3
Образование комплексов при реакции алкилирования арома-
тических углеводородов олефинами в присутствии сильных про-
тонсодержащих кислот может быть представлено в упрощенном
виде следующим образом:
2Я3ро4 н2ро;+я4ро4+
с3я6+я4ро; с3я7++н3ро4
с6н6+с3н^с6н5с3н2+н+
Н2РО3+Н -^Н3РО4
7.8
Таким образом, реакция алкилирования протекает по слож-
ному многомаршрутному механизму. Долевое участие отдельных
направлений зависит от природы катализаторов, алкилирующих
агентов и растворителей, соотношения компонентов и условий
проведения реакции, структуры образующихся комплексов и дру-
гих факторов. Следовательно, управлять процессом можно, ме-
няя указанные условия.
Процесс алкилирования ароматических углеводородов можно
представить упрощенной схемой:
+ кд + / +В ।
АгН + R - Аг --------------------► ArR + ВН 7.9
к-1 \R к2
Если принять во внимание, что промежуточный продукт об-
ладает высокой энергией (в результате чего его концентрация до-
статочно мала), то можно применить принцип стационарности
и представить зависимость скорости реакции в следующем виде:
r=d[ArR]/dT=kAk2[ArH][R+][B]/(k_i+k2[B]). 1AQ
Глава 7. Алкилирование ароматических углеводородов
279
Как было отмечено ранее, скорость реакции алкилирования за-
висит от многих факторов, следовательно, возможны различные
предельные случаи:
О Распад о-комплекса на исходные компоненты протекает зна-
чительно медленнее, чем отрыв протона; тогда к2[В\»к}
и величиной к} в знаменателе можно пренебречь. В этом слу-
чае выражение 7.10 преобразуется в г = А:ДЛгЛ][Л+], т.е. ре-
акция имеет второй порядок и концентрация основания не
влияет на ее скорость;
© Если кu » к^В\, то г = {кхк2/к ^){АгН\[/?+][В], т. е. реакция имеет
третий порядок и скорость реакции определяется концентра-
цией основания;
© Если кл~к2[В\ >к}, то скорость реакции описывается выраже-
нием 7.10 и нелинейно зависит от концентрации основания;
© Если к} = к_ > к2[В\, то скорость реакции зависит от концентра-
ции основания и находящегося в избытке исходного реагента.
Для осуществления процесса алкилирования необходимо оп-
ределить его лимитирующую стадию.
В качестве главных причин, снижающих выход целевых про-
дуктов и способствующих протеканию побочных реакций, можно
отметить следующие:
Ф недостаточная чистота исходного сырья и наличие примесей
приводит к дезактивации катализатора, затруднению выде-
ления целевых продуктов из-за образования азеотропов или
трудноразделяемых смесей, к их накоплению в некоторых мес-
тах установки, что также может через некоторое время при-
вести к ухудшению условий протекания процесса или качест-
ва продукта;
❖ изменение состава катализаторного комплекса приводит к сни-
жению селективности реакции, а в ряде случаев — к прекра-
щению протекания реакции переалкилирования;
ф образование прочных комплексов полиалкилароматических со-
единений с катализатором приводит к его дезактивации;
Ф изомеризационные превращения целевых продуктов реакции
и превращение их в побочные продукты за счет вторичных ре-
акций приводят к снижению селективности реакции.
Эти и другие причины обязательно необходимо учитывать как
при выборе катализатора и условий проведения процессов и реак-
ций, так и при управлении процессами.
280
Часть 2. Технология крупнотоннажных производств ...
Указанные причины являются общими, т. е. относятся и к дру-
гим технологическим объектам, предназначенным для получения
продуктов основного органического и нефтехимического синтеза.
Рассмотрим влияние указанных выше причин на процесс ал-
килирования.
В качестве примесей, отрицательно влияющих на процесс, мож-
но отметить ацетилен, бутадиен-1,3, СО, СО2, ацетальдегид, эфиры
и др. Они по-разному сказываются на уменьшении выхода целевых
продуктов. Так, ацетилен и бутадиен-1,3 полимеризуются на кис-
лых катализаторах с образованием смолистых веществ, которые за-
бивают катализаторы и тем самым дезактивируют их. Также дез-
активирует катализатор оксид углерода, который трудно отделить
от олефинов.
Наличие в углеводородных газах кислорода приводит к резкому
увеличению выхода полиалкилбензолов и заметному изменению
активности катализаторного комплекса. Это может происходить за
счет образования катион-радикалов, изменяющих направленность
основного процесса. Альдегиды и эфиры также приводят к увели-
чению выхода полиалкилбензолов и дезактивации катализатора.
Следовательно, исходное сырье необходимо подвергать до-
полнительной очистке от указанных примесей.
Наличие в бензоле и алкилирующем агенте влаги приводит
к необратимой дезактивации хлорида алюминия, который пре-
вращается в гидроксид алюминия. Следовательно, исходное сырье
необходимо подвергать глубокой осушке. Кроме того, бензол не-
обходимо очищать от тиофена и других серосодержащих соедине-
ний, которые способствуют образованию смолистых веществ, не
только снижающих активность катализатора, но и загрязняющих
целевые продукты.
Наконец, увеличение концентрации примесей в алкилате на-
блюдается при повышении температуры, увеличении времени
контакта и концентрации катализатора, при ухудшении переме-
шивания, изменении соотношения реагентов. Правда, влияние
этих параметров различно. Например, при алкилировании бензо-
ла этиленом и пропиленом на А1С1у выход побочных продуктов
зависит в большей степени от концентрации катализатора, чем от
температуры. Следовательно, процесс лучше проводить при по-
вышенных температурах, с малым количеством активного ката-
лизатора.
Глава 7. Алкилирование ароматических углеволоролов
281
Обычно выбирают оптимальные условия проведения процесса
и поддерживают их в течение всего периода работы установки на
рекомендованном уровне.
Кроме того, для образования комплекса в исходном сырье дол-
жен присутствовать хлористый водород (0,5 моля на 1 моль AlClj.
Его можно получить, добавляя к сырью соответствующее количе-
ство алкилхлорида, который реагирует с бензолом с образованием
алкилбензола и хлористого водорода, или за счет частичного раз-
ложения хлорида алюминия водой.
Процесс алкилирования бензола олефинами (наиболее распро-
страненными промышленными алкилирующими агентами) может
проводиться как в жидкой, так и паровой фазе. Следовательно, про-
цесс может быть как жидкофазным, так и парофазным. Использу-
ются катализаторы кислотного типа (AlClv H2SOV безводный HF, BFV
фосфорная кислота на носителях, алюмосиликаты, цеолиты, ионо-
обменные смолы). Наиболее перспективными катализаторами яв-
ляются цеолиты и ионообменные смолы, которые позволяют ис-
ключить проблемы, связанные с загрязнением окружающей среды.
ТЕХНОЛОГИЯ АЛКИЛИРОВАНИЯ БЕНЗОЛА
ОЛЕФИНАМИ
В последние годы за рубежом получил распространение про-
цесс фирмы «Mobil—Badger» (США), в котором используется ка-
тализатор на основе цеолитов. Эта технология применена на не-
скольких действующих крупных установках получения этилбен-
зола с единичной мощностью 335—465 тыс. т этилбензола в год.
Процесс производится при температуре 370—500 °C и давлении
1,4—2,8 МПа. По этой технологии образующиеся в процессе по-
лиалкилбензолы возвращаются в узел алкилирования. Конверсия
этилена составляет 100 %, а выход этилбензола в расчете на эти-
лен достигает =98 %.
Однако свое значение сохраняют и технологии, базирующиеся
на использовании в качестве катализатора комплексов на основе
хлорида алюминия. Это обусловлено тем, что в его присутствии про-
текает изомеризация алкилбензолов и переалкилирование диал-
килбензолов. Поэтому технологию процесса алкилирования мы
рассмотрим на примерах с использованием различных каталити-
ческих систем.
282
Часть 2. Технология крупнотоннажных произвоаств ...
Производство этилбензола
и изопропилбензола в присутствии А1С13
Исходные продукты (бензол и олефины) для процесса алки-
лирования необходимо очищать от разных примесей, в том числе
и воды, так как при наличии влаги будет гидролизоваться А1С13 с
образованием НС1. Как очистка, так и осушка требуют значитель-
ных энергетических затрат. В связи с этим чаще всего осуществ-
ляют гетероазеотропную осушку исходных продуктов только до
0,002—0,005%. Кроме того, необходимая активность А1С13 дости-
гается только в присутствии НС1, который требуется для образо-
вания каталитического комплекса. Для образования комплекса,
как правило, используют алкилхлориды (например, С2Н5С1). Мож-
но использовать и безводный НС1 (если таковой имеется на про-
изводстве), однако его содержание в реакционной массе регули-
ровать трудно.
При наличии безводного НС1 катализаторный комплекс го-
товится централизованно из отходов алюминия по следующей ре-
акции:
2А1 + 6АгН + НО -> (АгН\ • АЮЪ НО 7.11
В противном случае в качестве исходного сырья для получения
каталитического комплекса используют хлорид алюминия.
Процесс алкилирования бензола олефинами, катализируемый
комплексом на основе AlClv является жидкофазным и протекает
с выделением тепла. Для проведения процесса можно предложить
три типа реактора. Наиболее простым является трубчатый аппарат
(рис. 7.1,а), в нижней части которого размещается мощная мешал-
ка, предназначенная для эмульгирования катализаторного раство-
ра и реагентов. Такой тип аппарата часто используется при органи-
зации периодического процесса.
Реагенты (бензол и олефины), а также катализаторный раствор
подают в нижнюю часть реактора. Эмульсия поднимается вверх по
трубам, охлаждаясь за счет воды, подаваемой в межтрубное прост-
ранство. Продукты синтеза (алкилаты), непрореагировавшие бен-
зол и олефины, а также катализаторный раствор выводятся из верх-
ней части реактора и поступают в сепаратор. В сепараторе
происходит отделение катализаторного раствора от остальных про-
дуктов (алкилата). Катализаторный раствор возвращается в реак-
тор, а алкилаты направляются на разделение.
Глава 7. Алкилирование ароматических углеводородов
283
а б
Рис. 7.1. Схемы реакционных узлов для жидкофазного алкилирования
в присутствии AlCly
a — трубчатый реактор; б — каскад реакторов; в — реактор колонного типа
Для обеспечения непрерывности процесса может быть при-
менен каскад из 2—4 трубчатых реакторов. На рис. 7.1,6 представлен
каскад из двух реакторов. Катализаторный раствор подают в оба
реактора, реагенты — в верхнюю часть первого реактора. Оба реак-
тора представляют пустотелые аппараты с мешалками. Тепло отво-
дится с помощью воды, подаваемой в «рубашки». Реакционная мас-
са из верхней части первого реактора поступает в сепаратор, из
которого нижний (катализаторный) слой возвращается в реактор,
а верхний — поступает в следующий реактор. Из верхней части вто-
рого реактора реакционная масса также поступает в сепаратор.
Нижний (катализаторный) слой из сепаратора поступает в реак-
тор, а верхний слой (алкилаты) направляется на разделение. Кон-
версия реагентов определяется числом реакторов. Процесс прово-
дится при 40—60°С.
Непрерывное алкилирование ароматических углеводородов га-
зообразными олефинами можно проводить в барботажных колон-
нах (рис. 7.1,в). Как правило, внутреннюю поверхность колонн за-
щищают кислотоупорными плитками. Верхняя часть колонн запол-
нена кольцами Рашига, которые играют роль каплеотбойника, ос-
тальная часть — катализаторным раствором. Реагенты (бензол
и олефины) подают в нижнюю часть колонны. Газообразный оле-
фин, барботируя через колонну, интенсивно перемешивает реак-
ционную массу. Конверсия реагентов зависит от высоты катализа-
284
Часть 2. Технология крупнотоннажных производств ...
торного слоя. Частично тепло отводится через «рубашку», разде-
ленную на секции, а основная часть тепла — за счет нагрева реа-
гентов и испарения избыточного количества бензола. Пары бензо-
ла вместе с другими газами, содержащимися в олефине, поступают
в конденсатор, в котором конденсируется главным образом бен-
зол. Конденсат возвращают в реактор, а несконденсированные ве-
щества выводят из системы для утилизации. В этом случае можно
установить автотермический режим, варьируя давление и количе-
ство отходящих газов (концентрацию исходной олефиновой фрак-
ции). При работе на разбавленных фракциях олефинов желательно
применять давление 0,5—0,6 МПа для облегчения конденсации бен-
зола и поддерживать температуру 130—140 °C. Однако увеличение
температуры приводит к повышению степени смолообразования и,
соответственно, дезактивации катализатора. В связи с этим про-
цесс целесообразно проводить при Р= 0,15—0,20 МПа и незначи-
тельном количестве отходящих газов. В этом случае температура
не превышает 100 °C и уменьшается смолообразование. Катализа-
торный раствор вместе с продуктами алкилирования и непрореа-
гировавшим бензолом выводят из верхней части колонны (перед
насадкой) и направляют в сепаратор. Нижний (катализаторный)
слой возвращают в колонну, а верхний (алкилатный) слой направ-
ляют на разделение.
Технология жидкофазного алкилирования имеет следующие
подсистемы:
О гетероазеотропная осушка бензола;
® реакторный узел;
© очистка газов от НС1;
О очистка продуктов алкилирования от НС1;
© разделение продуктов алкилирования.
Рециклы по бензолу и полиалкилбензолам (для приготовления
катализаторного комплекса и улавливания бензола) объединяют эти
подсистемы в систему. В систему входят потоки: AlClv этилхлорид
(изопропилхлорид), бензол, этан-этиленовая (пропан-пропилено-
вая) фракция, бензол, водный раствор щелочи. Выходят из систе-
мы следующие потоки: алкилбензолы (этилбензол или изопропил-
бензол, полиалкилбензолы), абгазы, водный раствор щелочи,
водный раствор хлороводородной кислоты, катализаторный рас-
твор. Следовательно, наряду с продуктами выводятся потоки, ко-
торые требуют утилизации, нейтрализации и очистки. От этих
Глава 7. Алкилирование ароматических углеводородов
285
процессов в значительной степени зависит как экономическая, так
и экологическая эффективность предлагаемой технологии.
Технологическая схема рассматриваемой технологии пред-
ставлена на рис. 7.2. В двухколонном агрегате гетероазеотропной
ректификации, состоящем из ректификационной колонны 1, от-
гонной колонны 3 и флорентийского сосуда 2, происходит осушка
исходного бензола. Из куба колонны 1 выводится обезвоженный
бензол, часть которого поступает в аппарат 4 для приготовления
катализаторного раствора, а остальная часть в качестве реагента —
в реактор 5. В колонну 1 поступает как свежий, так и возвратный
бензол. Верхние паровые потоки колонн 1 и 3 представляют гете-
роазеотропные смеси бензола и воды. После конденсации в кон-
денсаторе и расслаивания во флорентийском сосуде 2 верхний
слой — обводненный бензол, поступает в колонну 1, а нижний
слой — вода, содержащая бензол (по растворимости), направляется
в колонну 3.
Каталитический комплекс готовится в аппарате с мешалкой 4,
в который подают бензол, а также хлорид алюминия, этиленхло-
рид и полиалкилбензолы. Максимальной активностью обладают
комплексы, полученные на шихте, в которой мольное соотноше-
ние бензол: алкилбензолы составляет (3—5): 1, а мольное соотно-
шение Л/С/3: ароматические углеводороды — 1: (2,5—3,0). Реактор
заполняют катализаторным раствором, а затем в ходе процесса
для подпитки подают катализаторный раствор, так как он час-
тично выводится из реактора для регенерации, а также с реакци-
онной массой.
Реактором алкилирования служит колонный аппарат 5, отвод
тепла реакции в котором осуществляется за счет подачи охлажден-
ного сырья и испарения бензола. Катализаторный раствор, осушен-
ный бензол и этан-этиленовую (пропан-пропиленовую) фракцию
подают в нижнюю часть реактора 5. После барботажа из колонны
(реактора) выводят непрореагировавшую парогазовую смесь и на-
правляют ее в конденсатор 6, где прежде всего конденсируется бен-
зол, испарившийся в реакторе. Конденсат возвращают в реактор,
а несконденсированные газы, содержащие значительное количест-
во бензола (особенно при использовании разбавленного олефина
в качестве реагента), и НС1 поступают в нижнюю часть скруббе-
ра 8, орошаемого полиалкилбензолами для улавливания бензола.
Раствор бензола в полиалкилбензолах направляют в реактор, а не-
сконденсированные газы поступают в скруббер 9, орошаемый во-
Ill
Рис. 7.2. Технологическая схема производства этилбензола (изопропилбензола) с использованием катализатора на
основе AlCly
1,3,15—17 — ректификационные колонны; 2 — флорентийский сосуд; 4 — реактор приготовления катализатора; 5 — реактор алкили-
рования; 6 — конденсатор; 7 — сепаратор жидкость-жидкость; 8,9,11,13 — скрубберы; 10,12 — насосы; 14 — подогреватель; 18 — ваку-
ум-приемник; 19 — холодильник полиалкилбензолов; I — этилен (пропилен); II — бензол; III — диэтилбензолы; IV — раствор щело-
чи; V — этил(изопропил)бензол; VI — полиалкилбензолы; VII — к вакуумной линии; VIII — вода; IX — газы на факел; X — этил(изо-
пропил)хлорид и хлорид алюминия; XI — сточные воды
286 Часть 2. Технология крупнотоннажных производств ..
Глава 7. Алкилирование ароматических углеводородов
287
дой для улавливания НС1. Водный раствор НС1 (разбавленная со-
ляная кислота) направляют на нейтрализацию, а газы — на утили-
зацию тепла.
Катализаторный раствор вместе с продуктами алкилирования
поступает в отстойник 7, нижний слой которого (катализаторный
раствор) возвращается в реактор, а верхний слой (продукты алкили-
рования) с помощью насоса 10 направляется в нижнюю часть скруб-
бера 11. Скрубберы 11 и 13 предназначены для отмывки хлороводо-
рода и хлорида алюминия, растворенных в алкилате. Скруббер 11
орошается раствором щелочи, который перекачивается насосом 12.
Для подпитки в рециркуляционный поток щелочи подают свежую
щелочь в количестве, необходимом для нейтрализации НС1. Далее
алкилат поступает в нижнюю часть скруббера 13, орошаемого водой,
которая вымывает щелочь из алкилата. Водный раствор щелочи на-
правляют на нейтрализацию, а алкилат через подогреватель 14 — на
ректификацию в колонну 15. В ректификационной колонне 75 в дис-
тиллят выделяется гетероазеотроп бензола с водой. Бензол направ-
ляется в колонну 1 для обезвоживания, а кубовый продукт — на
дальнейшее разделение. Если производство предназначено для
получения этилбензола, то кубовый продукт колонны 15 направля-
ют в ректификационную колонну 16 для выделения в качестве дис-
тиллята продуктового этилбензола. Кубовый продукт колонны 16 на-
правляют в ректификационную колонну 7 7 для разделения полиал-
килбензолов на две фракции. Эта колонна работает под вакуумом
(Р= 5,3 кПа). Верхний продукт направляют в аппарат 4 и реактор 5,
а нижний продукт (продукты осмоления) выводят из системы в ка-
честве целевого продукта. Выход целевых продуктов достигает 94—
95 % при расходе 5-10 кг А1С13 на 1 т моноалкилбензола.
С целью улучшения экологической чистоты рассматриваемого
производства целесообразно организовать взаимную нейтра-
лизацию кислых и щелочных вод. Для этого необходимо создать
такие условия, чтобы соблюдалось определенное соотношение кис-
лоты и щелочи. В этом случае рассмотренная технология будет бо-
лее приемлемой. Следует отметить, что раствор хлорида алюминия
(отработанный катализатор) может быть использован как коагулянт
для очистки сточных вод в нефтеперерабатывающей и целлюлоз-
но-бумажной промышленности. Смола, получаемая в процессе,
в настоящее время используется как топливо. Однако это не луч-
ший способ ее применения, она может быть использована более
эффективно в строительстве. Основным недостатком этой техно-
288
Часть 2. Технология крупнотоннажных производств ...
логии является отсутствие регенерации теплоты реакции, которая
отводится водой в конденсаторе 6.
Технология жидкофазного алкилирования, разработанная фир-
мой «Monsanto» (США), позволяет ликвидировать недостатки рас-
смотренного выше процесса. Предложено использовать небольшое
количество Л/С/3 (около 2 г на 1 кг алкилата) без его регенерации.
Давление при жидкофазном алкилировании зависит от температу-
ры процесса, так как реакционная смесь должна находиться в жид-
ком состоянии. Несмотря на повышенные температуры (160—200°С
при соответствующем давлении), вследствие небольшого количест-
ва катализатора степень смолообразования низкая, что очень важно
для создания безотходных производств. Однако в этом случае при
условиях процесса алкилирования не протекает переалкилирование
полиалкилбензолов, поэтому в технологии предусмотрен дополни-
тельный реактор. Если полиалкилбензолы используются как целе-
вые продукты, то необходимость в этой стадии отпадает.
Так как подсистемы подготовки сырья и разделения алкилата
в жидкофазном и парофазном процессах близки, мы рассмотрим
только реакторный узел жидкофазного алкилирования.
Технологическая схема реакторного узла приведена на рис. 7.3.
В алкилатор колонного типа 1 подают этилен, бензол и необ-
ходимое количество каталитического комплекса. Теплота реакции
отводится кипящим водным конденсатом, который подают в тру-
бы встроенного теплообменника. Генерируемый технологический
Рис. 7.3. Технологическая схема реакторного узла процесса жидкофазного
алкилирования (фирма «Monsanto»):
1 — алкилатор; 2 — переалкилатор; 3 — дроссель; 4 — сепаратор пар—жидкость,
5,6 — холодильники; I — этилен (пропилен); II — хлорид алюминия; III — бензол;
IV — полиалкилбензолы; V — алкилат
Глава 7. Алкилирование ароматических углеводородов
289
пар может быть использован в этом же производстве, например при
разделении алкилата. Полученный алкилат поступает в пере-
алкилатор 2, куда подают полиалкилбензолы из подсистемы разде-
ления, при этом образуется дополнительное количество моноал-
килбензола. Алкилат из аппарата 2 дросселируется до атмосферного
давления. При этом испаряется основная часть непрореагировав-
шего бензола, который возвращается на алкилирование. Алкилат
после нейтрализации направляют на разделение.
Необходимо отметить, что технология алкилирования бензола
пропиленом в присутствии хлорида алюминия аналогична техно-
логии получения этилбензола. В качестве алкилирующего агента,
кроме пропилена, может использоваться пропан-пропиленовая
фракция, которая предварительно тщательно очищается от влаги,
диоксида углерода и других примесей.
Основные показатели процесса синтеза изопропилбензола при-
ведены ниже:
Мольное соотношение бензол: пропилен 2,5:1,0 Выход пропилбензола с 1 м3 реактора за 1 час, кг 150-250
Температура, °C 70-90 Состав продукта, % (мае.):
Давление, МПа 0,1-0,5 бензол 60-62
Концентрация пропилена, этилбензол 1-2
% (об.) 35-60 изопропилбензол 26-33
Конверсия пропилена полиалкилбензолы,
за один проход, % (мае.) 99 смолы 7-9
Расход катализатора, кг/1 т продукта 20
Таким образом, жидкофазное алкилирование ароматических уг-
леводородов позволило решить многие технологические задачи и по-
лучить ряд ароматических углеводородов в промышленности. Вме-
сте с тем данная технология имеет ряд недостатков: промышленные
катализаторы являются недостаточно стабильными и активными;
такие промышленные катализаторы, как AlClv H2SO4 и другие,вы-
зывают коррозию аппаратуры и плохо регенерируются; протекание
вторичных реакций снижает селективность основной реакции, а так-
же требует затрат на очистку основных алкилбензолов и регенера-
цию вторичных продуктов; образуется большое количество сточных
вод, в том числе и кислых, что требует затрат на их очистку.
В связи с этим необходимо искать другие технологические ре-
шения. Следует отметить, что ряд недостатков можно избежать,
290
Часть 2. Технология крупнотоннажных произволств ...
если использовать в качестве катализаторов цеолиты и ионооб-
менники.
Производство этилбензола
и изопропилбензола на гетерогенных катализаторах
В настоящее время известны следующие гетерогенные катали-
заторы алкилирования бензола пропиленом: фосфорнокислотный,
катализаторы на основе оксидов и солей металлов, оксиды,
модифицированные BPV аморфные алюмосиликаты, цеолиты и ка-
тиониты. Применение твердых катализаторов намного упрощает
технологическую схему, позволяет автоматизировать процесс,
исключает проблему коррозии аппаратуры, облегчает отделение
продуктов реакции, не требующих дополнительной очистки, кото-
рая в гомогенном катализе приводит к образованию стойких эмуль-
сий и больших объемов сточных вод. Эти катализаторы можно ре-
генерировать и использовать многократно. В данном случае мы
рассмотрим технологию алкилирования на цеолитах и катионитах.
Первый пример промышленной реализации процесса позволяет
приблизить производство к безотходному, а второй — применить
совмещенный реакционно-ректификационный процесс. Перспек-
тивными представляются цеолитсодержащие катализаторы «СаНУ»,
содержащие редкоземельные элементы, на которых переалкилиро-
вание протекает в условиях реакции алкилирования, так как ука-
занные ранее побочные реакции снижают селективность цеолит-
содержащих катализаторов, вызывают их дезактивацию и старение.
В связи с этим катализаторы периодически необходимо регенери-
ровать при 400-500°C кислородсодержащим газом или воздухом.
При использовании цеолитов в качестве катализаторов ал-
килирования используется простой адиабатический реактор со ста-
ционарным слоем катализатора. Процесс сопровождается выделе-
нием значительного количества тепла, что влияет на температуру
и отражается на скорости протекающих реакций. Зависимость тем-
пературы от скорости образования z-ro компонента описывается
уравнением:
7.12
где М — средняя молекулярная масса сырья; ср - средняя теплоемкость,
Дж/(моль-К,); Rj - скорость образования z-ro вещества, моль/(г ч); AHf —
теплота образования i-ro вещества в жидком состоянии, кДж/моль.
Глава 7. Алкилирование ароматических углеводородов
291
Основными переменными, которые определяют эффективность
работы реактора на цеолитных катализаторах, являются соотноше-
ние бензола и олефина (например, пропилена), температура и вре-
мя контакта. А главным показателем, по которому можно контро-
лировать работу реактора, — селективность. Следует отметить, что
при постоянной средней температуре селективность по кумолу
(изопропилбензолу) возрастает с увеличением соотношения бен-
зол : пропилен независимо от времени контакта. Влияние же тем-
пературы более сложно. В частности, так как в большей части ре-
акционного объема протекает обратимая и экзотермическая
реакция переалкилирования, то селективность возрастает при сни-
жении температуры, когда условия переалкилирования близки
к равновесным. При оптимизации процесса необходимо учитывать,
что с возрастанием соотношения бензол: пропилен в сырье селек-
тивность возрастает по трем причинам:
О равновесная концентрация кумола велика при высокой кон-
центрации бензола;
О кинетика двух реакций алкилирования благоприятствует обра-
зованию кумола при высоких соотношениях бензол:пропилен;
© при одной и той же температуре на входе в реактор высокая
концентрация бензола способствует снижению температуры на
выходе, что в свою очередь увеличивает константу равновесия
переалкилирования. В целом же селективность превращения
в кумол составляет 93,7 %.
Полученные данные позволили предложить вариант органи-
зации промышленного алкилирования бензола на цеолитных ка-
тализаторах. На рис. 7.4 приведена принципиальная техно-
логическая схема данного процесса. В этом варианте один реактор 1
выполняет роль алкилатора, а в другом реакторе 2 проводится пе-
реалкилирование и регенерируется катализатор. Алкилирование
необходимо проводить при высоких скоростях подачи жидкого сы-
рья (15—25 час1), мольном соотношении бензола и пропилена, рав-
ном (7—8): 1, температуре на входе в реактор 210—215 °C и 250—
255 °C — на выходе из реактора.
Продукты алкилирования перед подачей их в реактор пере-
алкилирования изотермического типа охлаждаются в холодильнике 7
до 220 °C. Катализатор при этом не дезактивируется, так как не кон-
тактирует с пропиленом. Затем их направляют в депропанизатор 3
для отделения прежде всего пропана, содержащегося в пропан-про-
292
Часть 2. Технология крупнотоннажных производств ...
Рис. 7.4. Технологическая схема производства изопропилбензола алкили-
рованием бензола на цеолитных катализаторах:
1 — реактор алкилирования; 2 - реактор переалкилирования; 3 — депропанизатор;
4,5 - ректификационные колонны; 6 — подогреватель; 7 — холодильник; 8 — теп-
лообменник; I — пропан-пропиленовая фракция; II — бензол; III — диизопропил-
бензолы; IV — кумол; V — полиизопропилбензолы; VI — пропан
пиненовой фракции. Кубовый продукт аппарата 3 направляют в ко-
лонну ‘/для отделения непрореагировавшего бензола. Последний воз-
вращают в реактор 1. Кубовый продукт колонны 4 направляют в ко-
лонну 5, где из него выделяют целевой продукт — кумол (изопропил-
бензол). В качестве промежуточного продукта в колонне 5 выделяют
диизопропилбензолы, которые направляют в реактор 1. В качестве
кубового продукта в колонне 5 выводят полиалкилбензолы. Смесь
исходных реагентов вначале нагревается за счет тепла продуктов
переалкилирования в теплообменнике 8, охлаждая их, а затем пере-
гревается до температуры алкилирования в подогревателе 6.
Необходимо отметить, что мы рассмотрели только принци-
пиальную технологию из-за отсутствия данных по длительной про-
мышленной реализации процесса алкилирования на цеолитных ка-
тализаторах. Естественно, мы не остановились на всех возможных
путях создания экологически чистого производства на основе этой
технологии. Однако только отсутствие в ней кислот приводит к рез-
кому уменьшению образования кислых сточных вод, а следователь-
но, исключает стадию их нейтрализации. С этой точки зрения та-
кая технология более приемлема, чем существующие в промыш-
ленности и основанные на кислотных катализаторах или на А1С1у
Однако одновременно с моноалкилбензолами на цеолитных ката-
лизаторах получаются полиалкилбензолы, протекают процессы кре-
Глава 7. Алкилирование ароматических углеводородов
293
кинга изопропилбензола с образованием этилбензола и толуола,
изомеризация изопропилбензола в н-пропилбензол и полимериза-
ция пропилена. Следовательно, для создания безотходного произ-
водства необходимо найти применение перечисленным веществам
в качестве целевых продуктов.
Этилбензол может также получаться при алкилировании бензо-
ла как чистым этиленом, так и газами, содержащими не менее 10 %
этилена, в паровой фазе в присутствии кристаллического алюмоси-
ликатного цеолита (фирма «Mobil—Badger» США). Такой катализа-
тор не вызывает сильную коррозию и позволяет использовать обыч-
ные конструкционные материалы. В частности, применение
цеолитного катализатора ZSM-5 позволяет проводить реакцию
с разбавленным этиленом при концентрациях 15—20 % (мае.). При
этом можно использовать отходящий газ многих нефтехимических
производств (например, каталитический крекинг в псевдоожижен-
ном слое). Обычно эти газы используют в качестве топлива.
Газы нефтехимических процессов требуют той же очистки пе-
ред алкилированием, что и топочные газы (главным образом уда-
ление оксида углерода). Основными разбавителями этилена явля-
ются этан, метан, водород, азот и оксид углерода, которые могут
использоваться в качестве топлива после отделения алкилата. Про-
цесс алкилирования можно проводить и без предварительной очи-
стки газов от СО2, воды и H2S (их отделение проводят с помощью
стандартных операций), но тогда будет наблюдаться повышенное
«старение» катализатора. Если провести отмывку щелочью H2S
и СО2 и осушку охлаждением, то полученный газ будет иметь сле-
дующий состав (% об.): метан — 37; этан — 19; этилен — 19; Н2 — 9;
N2 — 13; СО — 3. Однако в результате очистки образуется большое
количество сточных вод, загрязненных щелочью, и потребуется за-
тратить значительное количество энергии на осушку газа.
Принципиальная технологическая схема алкилирования по та-
кому способу представлена на рис. 7.5. Исходный бензол смешива-
ют с возвратным и направляют на орошение в колонну 4. Пары ко-
лонны 4 поступают в конденсатор 11, из которого большая часть
бензола направляется в теплообменник 10, где бензол нагревается за
счет тепла продуктов алкилирования. Далее бензол нагревается в
печи 3 и поступает в реактор 1 или 2. Пары бензола предварительно
смешиваются с этиленом (этиленовой фракцией), диэтилбензолом
и другими алкилбензолами. Эта смесь подается в реактор 1 или 2.
Реакторный узел состоит из двух реакторов. В одном из реакторов
294
Чаоь2. Технология крупнотоннажных производств ...
Рис. 7.5. Технологическая схема получения этилбензола на цеолитных
катализаторах по методу фирмы «Mobil—Badger»'.
1,2 — реакторы; 3 —печь перегреватель; 4,5,7-9 — ректификационные колонны,
6 — сепаратор; 10 — теплообменник; 11 — конденсатор; I — этан-этиленовая фрак-
ция; II — бензол; III - этилбензол; IV — водный слой на очистку; V — газы на очи-
стку; VI — тяжелый остаток; VII - полиалкилбензолы
протекает алкилирование, а в другом проводится регенерация ката-
лизатора. Через определенное время происходит их переключение.
Каждый из реакторов заполнен цеолитным катализатором.
Газообразные продукты алкилирования на выходе из реакто-
ра 1 (или 2) охлаждаются конденсатом бензола и поступают на пред-
варительное разделение в колонну 4. В этой колонне происходит
отделение бензола и газов от алкилбензолов. При этом одновре-
менно обезвоживаются алкилбензолы за счет отделения воды в виде
гетероазеотропа. Несконденсированные в холодильнике 11 про-
дукты направляются в колонну 5 для отделения газов
и обезвоживания бензола. Конденсат колонны поступает в сепара-
тор 6, в котором происходит отделение газов и разделение на вод-
ный и бензольный слои. Бензольный слой возвращается в колон-
ну 5, а водный выводится из системы. (Для очистки воды от рас-
творенных углеводородов необходимо установить дополнительную
отгонную колонну, которой нет в схеме.) Отходящие газы могут
быть использованы как топливо. Этилбензол-сырец из куба колон-
ны «/направляется в ректификационную колонну 7 для отгонки бен-
зола, который возвращается на алкилирование. В ректификаци-
онной колонне <? выделяется целевой этилбензол в виде дистиллята.
В ректификационной колонне 9 происходит отделение диэтилбен-
зола и других алкилбензолов от смолы. Алкилбензолы возвращают
Гмел 7. Алкилирование ароматических углевоаороаов
295
в реактор для деалкилирования, а смолу используют в смежных от-
раслях промышленности.
Рассмотренная технология характеризуется высокой эффек-
тивностью использования энергии. Подводимое тепло рекупери-
руется на 95 %, теплота реакции обеспечивает получение пара сред-
него давления, в дефлегматорах ректификационных колонн 7 и 8
генерируется пар низкого давления. Однако для повышения эф-
фективности использования энергии еще есть резервы. Так, аппа-
рат 11 при колонне 7 должен быть дефлегматором, позволяющим
только частично конденсировать пар для получения флегмы; про-
дукт в паровой фазе следует сразу подавать в печь 3, а в колонне 4
следует организовать полное отделение бензола, тогда отпадает не-
обходимость в колонне 7. В ректификационной колонне 9 можно
не конденсировать продукт, а направлять его в паровой фазе сразу
в реактор. Возможны и другие варианты технологических схем по-
лучения этилбензола алкилированием бензола на цеолитных ката-
лизаторах (процесс фирмы «Union Oil», процесс фирмы «Mobil»,
США). Они отличаются возможностью использования вторичной
энергии, регенерации катализатора и т. д.
Ионообменники в качестве катализаторов алкилирования в про-
мышленности пока не используются. Однако этот вариант может быть
как экономически, так и экологически наиболее выгодным, посколь-
ку он может быть реализован как совмещенный реакционно-ректи-
фикационный процесс, повышающий селективность и снижающий
затраты на разделение, так как в реакторе может быть достигнута кон-
версия бензола до 100 %. Схема такого узла представлена на рис. 7.6.
ПРИНЦИПЫ В ТЕХНОЛОГИИ
АЛКИЛИРОВАНИЯ БЕНЗОЛА ОЛЕФИНАМИ
Для оценки различных катализаторов в процессе алкилирования
рассмотрим некоторые показатели производства кумола (изопропил-
бензола, ИПБ), представленные в табл. 7.2 и 7.3. Из табл. 7.2 видно,
что самая низкая себестоимость изопропилбензола соответствует
процессу, в котором в качестве катализатора используется фосфор-
ная кислота на кизельгуре, чуть более высокая — процессу с цеолит-
содержащими катализаторами. Однако в первом случае наблюдает-
ся значительный унос фосфорной кислоты и требуется очистка от
нее продуктов, а во втором — нет необходимости в очистке, кроме
того, не образуются сточные воды.
296
Часть 2. Технология крупнотоннажных производств ...
Рис. 7.6. Технологическая
схема непрерывного совме-
щенного реакционно-рек-
тификационного процесса
алкилирования бензола оле-
финами
Принципы в технологии жидкофазного алкилирования
Технология жидкофазного алкилирования бензола олефина-
ми на катализаторах на основе хлорида алюминия характеризует-
ся одностадийностъю и непрерывностью. Бензол и олефины или
олефин-парафиновая фракция являются дешевым и доступным сы-
рьем. Технология обладает высокой эффективностью и при кон-
версии олефина до 99 % дифференциальная селективность по мо-
ноалкилбензолу достигает 91 %. Конверсия бензола за один про-
ход — 30—40 %. Образующиеся в ходе процесса побочные продук-
ты диалкилбензолы используются для получения целевого
продукта за счет совмещения реакции алкилирования с реакцией пе-
реалкилирования. Для обеспечения полного использования бензо-
ла используется принцип рециркуляции. Характерной особенностью
данной технологии является наличие нескольких рециркуляцион-
ных циклов, охватывающих реакторную и разделительные подси-
стемы. В данном случае они направлены на полное использова-
ние исходного сырья — рецикл по бензолу, на использование по-
бочных продуктов для получения целевого моноалкилбензола
{принцип полноты использования отходов) — рецикл по диалкилбен-
золу, на повышение эффективности процесса — рецикл по бен-
золу, ди- и полиалкилбензолам, обеспечивающий оптимальную
структуру каталитического комплекса. Организация этих рецир-
куляционных потоков становится возможной за счет реализации
принципа полноты выделения всех продуктов из реакционной смеси.
Таблица 7.2. Показатели процесса алкилирования бензола пропиленом на различных катализаторах
Катализатор Мольное соотношение бензол: олефин Р.МПа t,°C Расход катализатора, кг/т ИПБ Выход ИПБ с 1 м3 реактора, кг /ч Концентрация пропилена в исходном сырье, % (об.) Конверсия пропилена, % Состав алкилата, % (мае.)
бензол ИПБ ПАБ
150-250 35-80 99 60-70 31-26 3-6
Фосфорная кислота 4,0:1,0 1,5-2,5 250 4-6 150-300 35 70-90 76 21 3
на кизельгуре ерная кислота ИНН 200 35-80 99 73 24 2-3
Алюмосиликат 3,0:1,0 3,0-1,0 350 10 - 35-80 50-70 72 24 3
Ортофрсфрр^.ая pyyjgra 4 фторид бора (1.1)- wr й 45 44 1
Таблица 7.3. Технико-экономические показатели установок производства изопропилбензола на различных
катализаторах мощностью 200 тыс. т/год
Катализатор Расход катализато- ра, % от изопропил- бензола Общее число аппара- тов, шт. Капитальные вложения, усл. ед. Численность обслуживающе- го персонала Эксплуатацион- ные расходы, усл.ед. на т Себестоимость изопропилбензола усл.ед. на т Основные меро- приятия по ох- ране природы
Хлорид алюминия 0,ЙЮ имнов 15,22 14612 Очистка сточных вод
Фосфорная кисло- та на кизельгуре 0,400 40 2,877 52 14,15 143,58 -
‘ ’рифторид бора на А1:&г . • '4S * .? « .< it*: 145,80 Очистка отхо- дящих газов алкилирования
Цеолитсодержа- щие катализаторы 0,030 45 2,952 52 14,52 145,20 -
Глава 7. Алкилирование ароматических углеводородов
SO
298
Часть 2. Технология крупнотоннажных произвоаств ...
Технология обладает невысоким энергопотреблением за счет ис-
пользования тепла реакции, хотя необходимо отметить, что эта
энергия используется недостаточно из-за низкого ее потенциала.
Существенным недостатком технологии жидкофазного алкилиро-
вания на катализаторах на основе хлорида алюминия является вы-
сокое потребление воды, которая идет для приготовления щелоч-
ных растворов и промывки в скрубберах и превращается в кис-
лотные, щелочные или солевые стоки.
Принципы в технологии алкилирования бензола
на ГЕТЕРОГЕННЫХ КАТАЛИЗАТОРАХ
Технология вобрала в себя все принципы, характерные для жид-
кофазного алкилирования, но кроме того обладает и рядом допол-
нительных черт, делающих ее особенно привлекательной. В гетеро-
генно-каталитическом алкилированиии существенно выше степень
использования тепла реакции. Это становится возможным, поскольку
температура проведения процесса достигает 250 °C. Практически от-
сутствуют водные солевые, щелочные и кислотные стоки (реализо-
ван принцип минимального расходования воды и использования ее круго-
оборота), так как отсутствует необходимость очистки алкилата
от каталитического комплекса. Наконец, использование парофазных
гетерогенно-каталитических процессов позволяет с большей легко-
стью нежели для жидкофазных создавать аппараты и технологичес-
кие линии большой единичной мощности.
Глава 8. Производство стирола
и оксидов ОЛЕФИНОВ
S Производство стирола
дегидрированием этилбензола.
S Совместное получение стирола
и пропиленоксида.
S Производство оксидов олефинов
прямым окислением олефинов.
Стирол является одним из многотоннажных мономеров для
производства как пластических масс (полистирол), так и синте-
тических каучуков. Его производство только в США превышает
4,0 млн т в год. Основным методом производства стирола являет-
ся дегидрирование этилбензола. В последнее время все большее
значение начало приобретать совместное получение стирола и ок-
сида пропилена. В этом случае его получение основано на дегид-
ратации метилфенилкарбинола, который образуется в результате
эпоксидирования олефина гидропероксидом этилбензола. В свою
очередь, оксиды олефинов можно получать рядом различных спо-
собов. Например через соответствующий хлоргидрин или прямым
окислением олефинов. Наибольшее распространение получили
производства оксидов этилена и пропилена.
ПРОИЗВОДСТВО СТИРОЛА
ДЕГИДРИРОВАНИЕМ ЭТИЛБЕНЗОЛА
Теоретические основы процесса дегидрирования
Основную реакцию дегидрирования можно представить следу-
ющим образом:
С6Я5С2Я5 С6Я5СЯ = СЯ2 + Я2 8.1
Процесс дегидрирования относится к типу гомолитических
превращений, в которых важную роль играет хемосорбция реа-
гентов на активных центрах (за счет электронных переходов с уча-
стием катализатора ослабляются или полностью разрываются хи-
мические связи в адсорбированной молекуле). В равновесном
300
Часть 2. Технология крупнотоннажных производств ...
процессе гидрирования — дегидрирования каждая элементарная
стадия обратима.
Реакция дегидрирования — эндотермичная, поэтому высокая
температура способствует ее протеканию (табл. 8.1).
Таблица 8.1. Конверсия этилбензола (при разбавлении его водяным паром
в мольном соотношении п:1)
Температура, °C Константа равновесия К, моль Конверсия этилбензола, %
п = 0 п= 16 п = 18 п = 19 п=20
520 0,034 18 54 55 56 57
540 0.056 23 62 68 68 69
IMMilMIt 0,089 29 70 72 73
580 0.135 35 76 -7-7 78 79
600 0,199 41 82 83 84 85'
620 0,295 48 86 87 88 89
640 0.432 55 90 ‘ 90 91
Кажущаяся энергия активации процесса дегидрирования этил-
бензола довольно высокащ равна 152кДж/моль. Это определяет
сильную зависимость скорости реакции от температуры. Равновесие
реакции определяется уравнением изменения свободной энергии:
Д(7=29720 - 31,17. 8.2
Согласно принципу Ле-Шателье—Брауна, повышению конвер-
сии способствует снижение исходного парциального давления этил-
бензола (см. табл. 8.1). Этого можно добиться, проводя процесс при
пониженном общем давлении или разбавляя этилбензол инертным
веществом, например водяным паром, азотом или диоксидом уг-
лерода, при сохранении общего давления, близкого к атмосферно-
му. Для того чтобы определить оптимальное разбавление, выведем
общее уравнение для равновесия такого процесса.
Если в исходной смеси содержится 1 моль этилбензола и Мн^0
молей водяного пара, Мд, Мв, Mz молей этилбензола, водорода
и стирола, а равновесная конверсия этилбензола составляет ха , то
при равновесии общее число молей будет равно
Ма=\-Ха, Мв=Мz =Ха, Мн2о = Мно',
= 1-Ха +2ха =1 + ^Л + Мg2of
ГЛАВА 8. Произволство стирола и оксилов олефинов
301
тогда Кр = Км(£М) ’ Робщ ~ ХА ?общ /[(1 Ха)(1 + Ха +Л/д2о)]. 8.3
Если температура реакции равна 580°С, то Кр =0,150, и тогда
при Р = 0,1 МПа (1 кгс/см2) и в отсутствие разбавителя получим:
Кр(\-ха)(1 + ха) = х2л. 8.4
Решая это квадратное уравнение, находим хл = 0,36. Если же
исходный этилбензол разбавить водяным паром (в мольном соот-
ношении 10:1), то, решая квадратное уравнение
Кр(1-ха)(1+ха+\0) = х2а, 8.5
получим Ха =0,713.
Таким образом, процесс дегидрирования этилбензола необхо-
димо проводить при достаточно высокой температуре (600—630 °C)
при разбавлении водяным паром в массовом соотношении (2,5—
3): 1 и общем атмосферном давлении. При дегидрировании этил-
бензола происходит отщепление водорода. Таким образом, при
протекании реакции объем системы возрастает. Следовательно, по-
вышению степени конверсии благоприятствует низкое давление.
Так, при 595 °C и Р~ 0,1 МПа равновесная конверсия этилбензо-
ла равна 40%, а при Р~ 0,01 МПа — 80%.
В качестве катализаторов дегидрирования применяют сложные
композиции на основе оксидов цинка или железа. Раньше наибо-
лее распространенным был катализатор стирол-контакт на основе
ZnO. В последнее время используют, главным образом, железоок-
сидные катализаторы, содержащие 55—80 % Fe2O}, 2—28 % Cr2Ov 15—
35 % и некоторые оксидные добавки. В нашей стране широ-
ко используется катализатор К-24 следующего состава (% мае.):
Fe2O2 - 66-70; К2СОу - 19-20; Cr2O}- 7-8; ZnO2 - 2,4-3,0; K2SiO3 -
2,0—2,6. Значительное содержание K2CO2 в катализаторе обус-
ловлено тем, что данное химическое соединение способствует до-
полнительной самогенерации катализатора за счет конверсии уг-
леродистых отложений водяным паром. Катализатор работает
непрерывно в течение двух месяцев, после чего он подвергается ре-
генерации, предусматривающей выжигание кокса воздухом. При
этом общий срок работы катализатора составляет два года.
При дегидрировании этилбензола наряду со стиролом проис-
ходит образование ряда побочных продуктов. В частности, в соот-
ветствии со схемой химических превращений, приведенной ниже,
в наибольших количествах получают бензол и толуол:
302
Часть 2. Технология крупнотоннажных производств ...
8.6
Поэтому в образующемся газе кроме водорода содержатся ме-
тан, этилен, этан и оксиды углерода (за счет конверсии кокса). Та-
ким образом, селективность дегидрирования этилбензола зависит
от катализатора, температуры, степени разбавления водяным па-
ром и конверсии этилбензола. Дифференциальная селективность
по стиролу выражается следующим уравнением:
Фст = d [Стирол]/d [Этилбензол] =
=[1 - (r4 + - С,)]/[ 1 + (r2 + г3)/(г, - г_,)]. 8.7
Видно, что селективность сильно падает, если фактическая сте-
пень конверсии приближается к равновесной (г j = Г]). Следователь-
но разбавление паром, которое увеличивает равновесную степень
конверсии, способствует росту селективности. Повышение темпе-
ратуры увеличивает как равновесную конверсию, так и выход по-
бочных продуктов, в том числе кокса, за счет активизации побоч-
ных реакций. Оптимальными, таким образом, оказываются
температурные условия 580—600 °C, при которых одновременно
обеспечиваются удовлетворительная конверсия и селективность.
Кроме того, при соответствующих степенях разбавления водяным
паром и температурах существует своя оптимальная фактическая
степень конверсии (см. табл. 8.1). Следовательно, можно выбрать
необходимые условия, позволяющие достигать экономически це-
лесообразную степень конверсии. При надлежащем подборе ката-
лизатора и условий проведения процесса можно проводить дегид-
рирование этилбензола в стирол с селективностью ~ 90 %.
Технологическое оформление процесса
Возможны три основных варианта оформления реакторного
узла. Первоначально процесс проводили в трубчатом реакторе со
стационарным слоем катализатора, в межтрубное пространство ко-
торого подавался для обогрева топочный газ (рис. 8.1 ,а). В этом ап-
Глава 8. Производство стирола и оксидов олефинов
303
Пары этилбензола
Пар70СРС
Рис. 8.1. Контактные аппараты для получения стирола:
a — трубчатый; б — адиабатический с промежуточным обогревом; в — кольцевой
(вертикальный в'и. горизонтальный «"разрезы)
парате профиль температуры близок к изотермическому, что поз-
воляет получать достаточно высокую конверсию при хорошей се-
лективности. В таких аппаратах тепло частично подводится с пере-
гретым паром, которым разбавляется этилбензол, а остальное
тепло — с помощью топочных газов. Однако с ростом единичной
производительности трубчатого реактора (увеличением его диаме-
тра) сильно проявляется температурная неравномерность по радиу-
су аппарата. Поэтому для достижения необходимой мощности при-
304
Часть 2. Технология крупнотоннажных производств ...
ходится параллельно устанавливать ряд аппаратов, что приводит
к увеличению капитальных затрат и усложнению управления таки-
ми установками. В связи с этим в 1970-х годах появились аппараты
со сплошным слоем катализатора без поверхностей теплообмена.
В этих аппаратах тепло целиком подводится в виде перегретого во-
дяного пара, и они работают в адиабатических условиях. В таком
единичном аппарате происходит изменение температуры по высо-
те аппарата с 600—620 °C до 540—570 °C, что позволяет достигнуть
конверсии этилбензола порядка 40 % (как и в изотермических ап-
паратах). Впоследствии в промышленности начали применять мно-
гоступенчатые (2-х или 3-х ступенчатые) адиабатические аппараты
с промежуточным обогревом реакционной массы. При этом в про-
межуточных теплообменниках реакционная масса вновь подогре-
вается перегретым паром до 600—630 °C. Такие аппараты обеспечи-
вают высокую конверсию этилбензола при относительно низких
капитальных затратах (используется только один реактор).
В последнее время начали применять так называемые кольце-
вые реакторы (рис. 8.1,в). В этих аппаратах имеется два-три слоя
катализатора, в которые подается смесь этилбензола и водяного
пара. В первый слой подают весь этилбензол и часть водяного пара,
а в последующие слои подают только дополнительное количество
водяного пара для поддержания необходимой температуры. В та-
ких аппаратах при сохранении высокой селективности (89—90 %)
удается достигать высоких конверсий этилбензола (60—75%) при
относительно низком расходе пара и капитальных затратах.
Рассмотрим один из вариантов части технологической схемы,
включающей три подсистемы: подготовка сырья, процесс дегидри-
рования, конденсация продуктов дегидрирования (рис. 8.2). В дан-
ном случае применяется двухступенчатый адиабатический реактор.
В верхней части реактора 5 смешиваются перегретые этилбензол (до
550 °C) и водяной пар (до 630 °C). Парогазовая смесь поступает в верх-
ний катализаторный слой. В результате эндотермической реакции
дегидрирования этилбензола температура продуктов реакции сни-
жается до 585 °C. Эти продукты проходят встроенный теплообмен-
ник-перегреватель 4, в котором нагреваются до 630 °C за счет пере-
гретого пара. Далее они поступают во вторую ступень (второй катали-
заторный слой). Продукты поступают в котел-утилизатор 7, в кото-
ром за счет тепла продуктов дегидрирования этилбензола из водного
конденсата получается водяной пар. Этот пар перегревается в паро-
перегревателе 6 и поступает в теплообменник-перегреватель 4.
ГЛАВА 8. Производство стирола и оксидов олефинов
305
Рис. 8.2. Технологическая схема реакционного узла дегидрирования
этилбензола:
1 — теплообменник; 2 — испаритель; 3 — перегреватель; 4 - межступенчатый
перегреватель; 5 — реактор; 6 - пароперегревательная печь; 7 — котел-утилизатор;
8 - пенный аппарат; 9 — воздушный конденсатор; 10—12 — сепараторы; 13 — ком-
прессор; 14 — рассольный конденсатор; 15 — отстойник; I — этилбензол; II — вод-
ный конденсат; III — пар; IV — печное масло на ректификацию
Исходный этилбензол смешивается с возвратным этилбензолом,
поступающим из подсистемы разделения, и направляется в тепло-
обменник, который обогревается конденсатом, поступающим из пен-
ного аппарата 8.
Далее этот конденсат направляется на очистку от углеводородов
и катализаторной пыли. Этилбензол с температурой 80 °C поступа-
ет в испаритель 2, где происходит испарение за счет водяного пара.
Основная часть водяного пара поступает в межтрубное простран-
ство, а около 10 % непосредственно предварительно смешивается с
этилбензолом. В испарителе 2 этилбензол не только испаряется, но
и перегревается до температуры 210 °C. Перегретая парогазовая
смесь поступает в перегреватель 3, в котором перегревается до тем-
пературы 550 °C за счет водяного пара, поступающего из теплооб-
менника 4, при этом пар охлаждается с 590 °C до 385 °C и поступает
для перегрева в пароперегревательную печь 6.
Продукты дегидрирования охлаждаются в котле-утилизаторе 7
до температуры 180 °C и поступают в пенный аппарат 8. Туда же
поступает нижний слой из отстойника 15, в котором расслаивают-
306
Часть 2. Технология крупнотоннажных производств ...
ся продукты конденсации, а также водяной пар. Парогазовая смесь
из пенного аппарата <? поступает в воздушный конденсатор при тем-
пературе 118—120°C. Далее парожидкостная смесь направляется в се-
паратор 10, где отделяется конденсат от несконденсированных про-
дуктов, которые поступают в сепаратор 11. Парожидкостная смесь
поступает в сепаратор 12. И наконец, после сжатия в компрессо-
ре 13 несконденсировавп иеся продукты поступают в рассольный
конденсатор 14 для окончательной конденсации. Конденсат из се-
параторов 10, 12 и конденсатора 14 поступает в отстойник 15. Верх-
ний углеводородный слой (печное масло) из этого отстойника на-
правляется на ректификацию.
Технологическая схема ректификации представлена на рис. 8.3.
В ректификационной колонне 1 отделяется основное количество
этилбензола вместе с бензолом и толуолом. Далее в ректификаци-
онной колонне 2 отделяются бензол и толуол от этилбензола. В ко-
лонне 3 в качестве дистиллята отгоняется весь этилбензол и часть
стирола. Эта фракция возвращается как питание в колонну 1. Та-
ким образом, колонны 1—3 работают как трехколонный комплекс.
Окончательная очистка стирола от смол осуществляется в колон-
не 4 (часто для этого используют дистилляционный куб).
Все колонны, в которых присутствует стирол, работают при глу-
боком вакууме, чтобы температура в кубе не превышала 100°C.
Рис. 8.3. Типовая промышленная схема выделения стирола:
1-4 - ректификационные колонны; I - печное масло; II - этилбензол на рецир-
куляцию в реакторную подсистему; III — бензол-толуольная фракция; IV — сти-
рол; V — смолы
Глава 8. Производство стирола и оксидов олефинов
307
Рассмотрим некоторые особенности приведенной тех-
нологической схемы разделения. В такой схеме производства
обычно используется вариант, в котором на первом этапе осу-
ществляется второе заданное разделение. А именно, в первой ко-
лонне отгоняются вместе с этилбензолом бензол и толуол, а затем
от этилбензола отгоняются легколетучие компоненты. С точки
зрения затрат энергии этот вариант менее выгоден. Вместе с тем,
учитывая реакционную способность стирола (высокая активность
и способность к термополимеризации), этот вариант является бо-
лее предпочтительным. Тем более, если принять во внимание не-
большое содержание бензола и толуола в реакционной смеси.
Учитывая высокую реакционную способность стирола, для раз-
деления пары «этилбензол—стирол» обычно используется «двойная
ректификация», позволяющая снизить гидравлическое сопротив-
ление ректификационных колонн, а следовательно, и температуру
в кубах, которая должна быть не выше 100 °C (при необходимом
вакууме). Именно при этой температуре начинается термополиме-
ризация стирола. В общем случае любая «двойная ректификация»
является неприемлемой как в энергетическом отношении, так и по
капитальным затратам. Использование такого варианта является
вынужденной мерой.
В данном случае возможны два варианта «двойной ректи-
фикации» (рис. 8.4,а,б). В первом варианте в первой колонне на-
ряду с полной отгонкой этилбензола (или легколетучего компонента
а
Рис. 8.4. Технологическое оформление «двойной» ректификации:
a — вариант I; б— вариант II; 1—2 — ректификационные колонны; I — смесь этил-
бензола и стирола; II — стирол и полимеры; III — этилбензол
б
308
Часть 2. Технология крупнотоннажных производств ...
для любой другой системы) отгоняется часть стирола. При этом со-
отношение между этилбензолом и стиролом в дистилляте первой
колонны выбирается таким, чтобы кубовая жидкость колонны 2по
своему составу примерно соответствовала составу исходной смеси
колонны 1.
Во втором варианте в колонне 1 отгоняется чистый этилбен-
зол. В кубе этой колонны остается такое количество этилбензола,
которое позволяет при допустимом вакууме поддерживать темпе-
ратуру не более 100 °C. В колонне 2 в качестве дистиллята отгоня-
ется оставшийся этилбензол вместе со стиролом, количество ко-
торого определяется соотношением этилбензола и стирола в ис-
ходной смеси первой колонны. В случае разделения этилбензола
и стирола предпочтение может быть отдано первому варианту
«двойной ректификации», в котором в колонне 2 подвергается на-
греванию только часть стирола, тогда как во втором варианте весь
стирол подвергается нагреванию в кубах обеих колонн, а это даже
при вакууме приводит к его потерям за счет термополимеризации.
Правда большая разница в энергозатратах может окупить потери
стирола, но для этого требуется более детальное сравнение. Для
решения задачи разделения пары «этилбензол — стирол» может
быть предложен вариант с одной колонной, заполненной насад-
кой с малым гидравлическим сопротивлением. В этом случае, учи-
тывая большие потоки флегмы, будут разные количества потоков
жидкости и пара по высоте колонны. Следовательно, для устойчи-
вой работы насадочной колонны необходимы разные диаметры
верхней и нижней частей колонны (рис. 8.5). Такая колонна поз-
воляет разделить эту пару компонентов при температуре в кубе ко-
лонны не выше 100 °C.
Более предпочтительное изменение тех-
нологии разделения реакционной смеси за-
ключается в подаче ее в паровой фазы.
В этом случае не нужно конденсировать ре-
акционные пары (исключается как водная,
так и рассольная конденсации). А это при-
водит к значительному сокращению энер-
гии, расходуемой в системе в целом. Кроме
Рис. 8.5. Насадочная колонна с укрепляющей
и исчерпывающей частями разного диаметра:
I — смесь этилбензола и стирола; II — стирол и поли-
меры; III — этилбензол
ГЛАВА 8. Производство стирола и оксидов олефинов
309
того, так как процесс дегидрирования этилбензола проводится в при-
сутствии водяного пара, а все углеводороды (бензол, толуол, этил-
бензол, стирол и др.) образуют гетероазеотропы с водой (табл. 8.2),
то даже при атмосферном давлении температура в колоннах будет
ниже 100 °C, поскольку температура кипения гетероазеотропов уг-
леводородов с водой всегда меньше 100 °C. В колоннах необходимо
поддерживать некоторый вакуум только для того, чтобы предотвра-
тить повышение температуры за счет гидравлического сопротивле-
ния колонн. Кроме того, стирол нагревается в присутствии воды, т. е.
находится в разбавленном состоянии, что снижает его реакционную
способность.
Таблица 8.2. Азеотропные смеси
Один из вариантов технологической системы разделения про-
дуктов дегидрирования этилбензола в присутствии воды представлен
на рис. 8.6. Исходная смесь при температуре, близкой к температуре
конденсации, в паровой фазе подается в колонну 1. В этой колонне
Рис. 8.6. Технологическая схема разделения продуктов дегидрирования
этилбензола в стирол при подаче продуктов реакции в паровой фазе:
1—6 — ректификационные колонны; 7 — сепаратор жидкость-жидкость; I — бензол-то-
луольная фракция; II - этилбензол; III - стирол; IV - смолы; V - фузельная вода
310
Часть 2. Технология крупнотоннажных произволств ...
отгоняются бензол и толуол в виде гетероазеотропов с водой. Паро-
вой поток, выходящий из верхней части колонны, конденсируется,
и конденсат поступает во флорентийский сосуд 7. Нижний водный
слой возвращается в колонну 1, а верхний углеводородный слой по-
дается в верхнюю часть колонны 2. В этой колонне отгоняется вода
от бензола и толуола в виде гетероазеотропа. Паровой поток колон-
ны 2 объединяется с паровым потоком колонны 1. Из куба колон-
ны 2 выводятся обезвоженные бензол и толуол. Кубовый поток ко-
лонны 1 также в паровой фазе направляется в двухколонную
установку, состоящую из колонн 3 и 4. В колонне 3 отгоняется этил-
бензол в виде гетероазеотропа с водой. Пары конденсируются, и кон-
денсат поступает во флорентийский сосуд 7. Нижний водный слой
возвращается в колонну 3, а верхний углеводородный слой поступа-
ет в колонну 4. В этой колонне отгоняется вода от этилбензола в виде
гетероазеотропа. Паровой поток этой колонны объединяется с па-
ровым потоком колонны 3. Из куба колонны 4 выводится обезво-
женный этилбензол. Кубовый продукт колонны 3 поступает во
флорентийский сосуд 7, верхний стирольный слой поступает в от-
гонную колонну 5, в которой отгоняется вода в виде гетероазеотро-
па. Пары конденсируются,и конденсат поступает во флорентийский
сосуд 7, верхний стирольный слой возвращается в колонну 5, а ниж-
ний водный слой поступает в отгонную колонну 6. Туда же поступа-
ет нижний слой из флорентийского сосуда 7, в котором расслаива-
ется кубовый продукт ректификационной колонны 3. Пары
колонны 6 объединяются с парами колонны 5. Из нижней части ко-
лонны 5в паровой фазе может быть выведен стирол, а из куба — рас-
твор смолы. Из куба колонны 6 выводится фузельная вода. Верхние
слои флорентийских сосудов — углеводороды, содержащие воду
(0,01-0,02 % мае.), а нижние слои - вода, содержащая углеводоро-
ды (0,01 % мае.). Поэтому отгонные колонны 2 и 4 могут быть ис-
ключены из технологической схемы, так как растворимость воды
в углеводородах мала, а этилбензол возвращается на дегидрирова-
ние, которое проводится в присутствии воды.
Принципы в технологии получения стирола
ДЕГИДРИРОВАНИЕМ ЭТИЛБЕНЗОЛА
Технология производства стирола дегидрированием этилбензо-
ла относится к одностадийным химическим процессам. В качестве
исходного сырья используется доступный этилбензол, получаемый
алкилированием бензола олефинами. Применяемые в промышлен-
Глава 8. Производство стирола и оксидов олефинов
311
ности технологические решения с введением пара между двумя-тре-
мя слоями катализатора, использование встроенных в реактор теп-
лообменных устройств, а также эффективная каталитическая сис-
тема позволяют при достаточно высокой селективности около 90 %
добиться конверсии этилбензола за один проход на уровне 60—75 %.
Рециркуляционный поток бензола, связывающий разделительную
и реакторную подсистемы технологии, обеспечивает полную кон-
версию исходного сырья.
Снижение энергозатрат на процесс дегидрирования может до-
стигаться не только за счет эффективного теплообмена между вхо-
дящими и выходящими потоками (см. рис. 8.2.), но и за счет ис-
пользования вместо водяного пара (энергоноситель и разбавитель)
инертного газа. В этом случае тепло должно подводиться между сло-
ями катализатора с помощью встроенных теплообменников. Заме-
на пара на инертный газ (азот, СО2) позволяет избежать многократ-
ного испарения и конденсации воды, обладающей высокой скрытой
теплотой испарения. В этом случае также снизятся и затраты на
очистку водного конденсата, загрязненного ароматическими соеди-
нениями, и в целом уменьшится суммарное потребление воды про-
изводством.
Важной составляющей частью технологии выступает подсис-
тема разделения. В данном случае, как отмечено ранее, существен-
ным фактором, влияющим на суммарные показатели технологии,
являются режимы ректификационного разделения. Они должны
обеспечивать условия, при которых отсутствует термополимериза-
ция стирола. Энергетически наиболее целесообразно применять
вместо двойной ректификации одну насадочную колонну с низким
гидравлическим сопротивлением, либо схему из комплексов гете-
роазеотропной ректификации.
Наконец, гетерогенно-каталитический характер процесса поз-
воляет достаточно просто создавать аппараты и технологические
линии большой единичной мощности.
СОВМЕСТНОЕ ПОЛУЧЕНИЕ СТИРОЛА
И ПРОПИЛЕНОКСИДА
Сырьем для совместного получения стирола и оксида пропи-
лена являются продукты нефтехимии: этилбензол и пропилен.
Поэтому себестоимость целевых продуктов в значительной степе-
ни зависит от стоимости сырья (в основном этилбензола). Оба
312
Часть 2. Технология крупнотоннажных производств ...
продукта (стирол и оксид пропилена) имеют большое значение в от-
расли основного органического и нефтехимического синтеза. Если
первый является важнейшим мономером для производства широко-
го круга каучуков и полимеров, то второй используется не только
для производства каучуков (пропиленоксидных каучуков), но и важ-
ных продуктов и полупродуктов основного органического и нефте-
химического синтеза (проггиленгликолей, неионогенных ПАВ — про-
ксанолов и проксаминов, аллилового спирта, пропиленкарбоната,
изопропанол аминов).
Конечно же, целесообразно совместное получение нескольких
целевых продуктов, чем их получение с помощью самостоятельных
процессов (см. гл. 2). Кроме того, такой способ получения продук-
тов не только экономически, но и экологически более чистый, так
как в нем образуется меньше побочных продуктов, на выделение
которых тратится энергия и сырье.
Технология совместного получения стирола и пропиленоксида
состоит из следующих стадий: получение гидропероксида этилбен-
зола, выделение гидропероксида этилбензола, эпоксидирование
пропилена и разделение продуктов эпоксидирования, дегидрата-
ция метилфенилкарбинола и выделение стирола, гидрирование аце-
тофенона в метилфенилкарбинол. Таким образом, это производст-
во является многостадийным.
Теоретические основы технологии совместного получения
СТИРОЛА И ПРОПИЛЕНОКСИДА
Получение гидропероксида этилбензола
В основе технологии получения гидропероксида этилбензола
лежит реакция жидкофазного окисления этилбензола молекуляр-
ным кислородом. Окисление этилбензола до гидропероксида про-
текает труднее, чем окисление изопропилбензола.
В результате окисления этилбензола наряду с гидропероксидом
(на него расходуется более 98 % этилбензола) образуются метилфе-
нилкарбинол и ацетофенон. Кроме того, в продуктах окисления об-
наружены бензальдегид, бензойная и муравьиная кислоты, перок-
сид водорода, 2,3-дифенилбутан.
Для интенсификации процесса окисления этилбензола пред-
лагалось использовать в качестве катализатора соли металлов пе-
ременной валентности (Си, Со, Мп, Sn, Ni, V, Bi, Мо, И) и редкозе-
мельных элементов. Однако в присутствии этих катализаторов
основными продуктами реакции являются ацетофенон и метилфе-
Глава 8. Производство стирола и оксидов олефинов
313
нилкарбинол. Поэтому чаще используют металлы постоянной ва-
лентности. Инициирующее действие на процесс окисления оказы-
вают соединения натрия. Это объясняется тем, что в их присутст-
вии увеличивается скорость инициирования цепей и уменьшается
действие ингибиторов.
В настоящее время установлено, что реакция получения гид-
ропероксида этилбензола протекает по схеме, учитывающей парал-
лельно-последовательный механизм образования ацетофенона
и возможность рекомбинации радикалов RO2 непосредственно в ме-
тилфенилкарбинол и ацетофенон (а не через стадию образования
гидропероксида). Следовательно, схему окисления этилбензола
можно представить следующим образом:
8.8
Результаты исследования кинетики реакции окисления этил-
бензола показывают, что скорости образования метилфенилкарби-
нола и ацетофенона по реакциям (3), (6) и (4), (7) равны между
собой. Это свидетельствует о том, что скорости образования кето-
на и спирта через пероксидные радикалы одинаковы. Однако при
накоплении в системе определенного количества метилфенилкар-
бинола скорость реакции (5) превышает суммарную скорость ре-
акций (4) и (7), а метилфенилкарбинол становится основным ис-
точником образования ацетофенона.
Что касается условий проведения этого процесса, то необ-
ходимо отметить, что окисление этилбензола при температурах
100—120 °C (применяемых при окислении изопропилбензола) про-
текает с очень низкой скоростью [0,05—0,07 моль/(л час)]. Увели-
чить скорость окисления этилбензола при высокой селективности
образования гидропероксида можно лишь за счет повышения тем-
пературы и с использованием катализаторов. В частности, при тем-
пературе 140—160 ° С скорость накопления гидропероксида дости-
гает 1 моль/(л-час) при селективности 82—91 %.
Реакции последовательного разложения гидропероксида в усло-
виях окисления вносят довольно заметный вклад в образование по-
314
Часть 2. Технология крупнотоннажных производств ...
бочных продуктов. Чтобы избежать последовательных превращений
гидропероксида, ограничивают конверсию этилбензола (до 10%).
Кроме того, для повышения селективности образования гидроперок-
сида этилбензола реакторная система должна быть максимально при-
ближена по гидродинамическому режиму к системе идеального вы-
теснения (по жидкой фазе). На практике окисление осуществляют
в каскаде последовательных реакторов-колонн (обычно больше трех)
(рис. 8.7,а). Для получения алкилароматических гидропероксидов
также используют реакторы типа тарельчатой колонны с встроен-
Рис. 8.7. Реакционные узлы для жидкофазного окисления ароматических
углеводородов:
а - каскад колонн; б — тарельчатая колонна; в — колонный реактор с внутренним
охлаждением
ными змеевиками на каждой тарелке (рис. 8.7,6) или пустотелой ко-
лонны также с встроенными змеевиками (рис. 8.7,в).
В последовательных реакторах-колоннах (рис. 8.7,а) отвод тепла
осуществляется за счет испарения углеводородов или растворите-
ля. Их пары конденсируются в обратных конденсаторах, которыми
снабжен каждый реактор-колонна, и конденсат возвращается в со-
ответствующий реактор. В реакторах типа тарельчатой и пустоте-
лой колонн отвод тепла производится за счет воды, подаваемой во
встроенные змеевики. Причем в первом случае (см. рис. 8.7,6) при-
меняется противоток, а во втором (см. рис. 8.7,<?) — прямоток меж-
ду исходной смесью и воздухом (кислородом).
Таким образом, окисление этилбензола осуществляют при t =
140—160°С и давлении 0,25 МПа до достижения выхода гид-
ропероксида 10-13% (мае.).
Глава 8. Производство стирола и оксидов олефинов
315
В ряде случаев процесс окисления проводят в водно-угле-
водородной смеси с добавкой Na2CO3 в каскаде барботажных реак-
торов. Добавление небольших количеств Na2CO2 (или NaOH) не-
обходимо для нейтрализации образующейся муравьиной кислоты.
Полученный раствор гидропероксида концентрируют путем от-
гонки углеводородов. Концентрирование проводят при достаточно
глубоком вакууме.
Эпоксидирование пропилена
Эпоксидирование пропилена протекает по уравнению
/°\
ROOH+R'CH=CH2 —► ROH+R'CH-CH2 8.9
В качестве катализаторов этой реакции используют металло-
комплексные катализаторы: соли и различные комплексы (ацетил-
ацетонаты, карбонилы) молибдена, вольфрама, ванадия, титана,
ниобия и других переходных металлов, растворимых в реакцион-
ной массе.
Скорость и селективность реакции по гидропероксиду сильно
зависят от природы металла и формы, в которой он применяется.
Эффективность различных нафтенатов металлов в реакции гидро-
пероксида этилбензола с пропиленом (температура 100 °C, продол-
жительность 1 час) приведена ниже:
Металл Мо W Ti Nb Та Re
Конверсия, % 97 83 54 22 25 100
Селективность, % 71 65 55 20 23 10
Селективность процесса по олефину высокая и близка к 100%.
Процесс осуществляют в жидкой фазе (обычно в растворе того уг-
леводорода, из которого был получен гидропероксид), при 90—
НО °C и 2—5-кратном избытке олефина по отношению к гидропе-
роксиду. Процесс проводят при Р = 2,5—3 МПа, т. е. при том
давлении, при котором реакционная масса находится в жидком со-
стоянии. В этих условиях реакция имеет достаточно высокую ско-
рость при концентрации катализатора 0,001—0,005 моль на 1 моль
гидропероксида, что позволяет не проводить его регенерацию. Про-
цесс эпоксидирования можно проводить как в каскаде реакторов
(рис. 8.8,а), так и в колонне эпоксидирования (рис. 8.8,6). Выделя-
ющееся тепло отводят с помощью встроенных змеевиков, что поз-
воляет достигать полной конверсии гидропероксида при высокой
316
Часть 2. Технология крупнотоннажных производств ...
ГjdponepA торный
Газы
Катализа-
оксид раствор
а б
Рис. 8.8. Реакторные узлы эпоксидирования пропилена:
a — каскад реакторов; б — колонна эпоксидирования
удельной производительности и безопасных условиях работы. Про-
дукты эпоксидирования затем подвергают разделению.
Дегидратация метилфенилкарбинола
В промышленности дегидратацию метилфенилкарбинола в сти-
рол проводят в паровой фазе на гетерогенном катализаторе кис-
лотного типа при температуре около 300 °C. Дегидратацию можно
осуществлять как в жидкой, так и в паровой фазах, однако в про-
мышленных условиях жидкофазный процесс не реализован. Это,
по-видимому, обусловлено сложностью оформления такого процес-
са (организации подвода тепла, выделения и переработки отрабо-
танного катализатора и т.д.). Парофазный процесс дегидратации
чаще всего проводят на у-оксиде алюминия, хотя для гидратации
метилфенилкарбинола были опробованы самые различные катали-
заторы. Конверсия и селективность процесса дегидратации метил-
фенилкарбинола на различных катализаторах приведены в табл. 8.3.
Все катализаторы испытывали при постоянном составе исход-
ной шихты (мольное соотношение вода: метилфенилкарбинол
= 10:1). Для каждого катализатора подбиралась температура, позво-
ляющая достигать конверсии МФК =90%. Эти испытания показа-
ли, что другие катализаторы не дают особых преимуществ перед
у-оксидом алюминия. Однако оксид титана на носителе тоже может
использоваться в качестве катализатора. Дегидратацию на этом ката-
лизаторе проводят также в каскаде реакторов, затем стирол отделяют
от непрореагировавшего метилфенилкарбинола и ацетофенона.
Глава 8. Производство стирола и оксидов олефинов
317
Таблица 8.3. Конверсия и селективность процесса дегидратации
метилфенилкарбинола
Катализатор t,»C К, % 8, %
Силикагель подвергнутый гидротермальной обработке; ^=30^ 360 89 94,5
у-оксид алюминия (ГОСТ 8136-76) 260 92 97.8
Диоксид титана (рутил) 240 89 93,4
Диоксид титана (анатаз) 260 90 98,5
Алюмосиликат (=-20% А1гОз) 290 93 75,0
Цеолитсодержащий алюмосиликат (Цеокар-1) 330 90 90.0
Цеолитсодержащий алюмосиликат (Цеокар-2) 320 91 88,0
Катализатор КДВ-15 220 91 96.6
Титаносиликат (1% ТЮг) 265 91 96,6
Титаносиликат (10% ТЮг) 255 92 97,5
Борфосфат (40% В?Оз) 180 93 99,0
Силикофосфат (25% Р2О5) 160 93 98,8
С целью увеличения выхода метилфенилкарбинола и, соот-
ветственно стирола, выделенный ацетофенон гидрируют с по-
лучением метилфенилкарбинола при t =150°С и давлении 1,6—
2,5 кПа на медь-хром-железном или барий-хром-медь-цинковом
катализаторе:
С6Я5 - СО - СН3 + Н2^> С6Н3СНОН - СН3
8.10
Технология совместного получения стирола
И ПРОПИЛЕНОКСИДА
Общая технологическая схема совместного получения стирола и
пропиленоксида представлена на рис. 8.9. В данной технологии окис-
ление этилбензола проводится в тарельчатой колонне 1. При этом
как подогретый этилбензол, так и воздух подаются в низ колонны.
Колонна снабжена змеевиками, расположенными на тарелках. Теп-
ло отводится водой, подаваемой в эти змеевики. Если для интенси-
фикации процесса использовать катализатор, то процесс необходи-
мо проводить в ряде последовательно соединенных барботажных ре-
акторов, в которые подают противотоком к воздуху этилбензольную
шихту (смесь свежего и возвратного этилбензола с катализаторным
раствором). При этом продукты окисления проходят последовательно
через реакторы, в каждый из которых подают воздух.
Парогазовая смесь из верхней части реактора поступает в кон-
денсатор 2, в котором конденсируется главным образом унесенный
Рис. 8.9. Технологическая схема совместного получения стирола и оксида пропилена:
1 — колонна окисления; 2 — конденсатор; 3,7—10,18 — ректификационные колонны; 4 — скруббер щелочной очистки; 5,12,14 —
теплообменники; 6 — колонна эпоксидирования; 11 — испаритель смешения; 13,15 — реакторы дегидратации; 16 — холодиль-
ник; 17 - флорентийский сосуд; I - воздух; II — этилбензол; III —пропилен; IV — раствор щелочи; V — газы; VI - катализатор-
ный раствор; VII —оксид пропилена; VIII — смолы; IX — водный слой; X — стирол; XI — на дегидрирование; XII —пар
318 Часть 2. Технология крупнотоннажных произволств .
Глава 8. Производство стирола и оксидов олефинов
319
этилбензол, а также примеси бензойной и муравьиной кислот. По-
сле отделения конденсата от газов он направляется в скруббер 4 для
нейтрализации кислот щелочью. После нейтрализации этилбензол
возвращается в реактор 1. Туда же подается этилбензол из колон-
ны 10. Газы выводятся из системы. Оксидат из нижней части ко-
лонны 1, содержащий около 10% гидропероксида, направляют
в ректификационную колонну 3 для концентрирования. Концент-
рирование гидропероксида проводят при глубоком вакууме. Несмо-
тря на большие затраты энергии, этот процесс лучше проводить на
установке двойной ректификации. При этом на первой колонне от-
гоняется часть этилбензола при более низком вакууме, а во второй
колонне при более глубоком вакууме отгоняется остальная часть
этилбензола с примесями. Дистиллят этой колонны возвращается
в первую колонну, а в кубе получается концентрированный (до 90 %)
гидропероксид, который направляется на эпоксидирование. Пред-
варительно оксидат охлаждается в теплообменнике 5 исходным
этилбензолом.
В колонне 3 отгоняется этилбензол с примесями кислот, поэто-
му верхний продукт также направляется в скруббер 4. Из куба ко-
лонны 3 сконцентрированный гидропероксид поступает в колонну
эпоксидирования 6. (Эпоксидирование можно также проводить
в каскаде реакторов.) В нижнюю часть колонны подается катали-
заторный раствор из куба колонны 9. Туда же проводится подпитка
свежим катализатором. Свежий и возвратный (из колонны 7) про-
пилен также подается в нижнюю часть колонны. Продукты реак-
ции вместе с катализаторным раствором выводят из верхней части
колонны и направляют в ректификационную колонну 7 для отгон-
ки пропилена. Газы выводят из верхней части колонны и из систе-
мы для утилизации или сжигания. Кубовый продукт колонны /по-
ступает в ректификационную колонну 8 для выделения в качестве
дистиллята продуктового оксида пропилена. Кубовая жидкость ко-
лонны <? поступает в колонну 9 для отделения продуктов синтеза от
катализаторного раствора. Катализаторный раствор из куба колон-
ны возвращается в колонну эпоксидирования 6, а верхний продукт
поступает в ректификационную колонну 10 для отделения этилбен-
зола от метилфенилкарбинола и ацетофенона. Смесь метилфенил-
карбинола (МФК) и ацетофенона подается в испаритель 11, в ко-
тором с помощью перегретого пара испаряются и отделяются от смол
метилфенилкарбинол и ацетофенон. Смесь паров, перегретая до
300 °C, поступает в реактор 13 для дегидратации метилфенилкар-
320
Часть 2. Технология крупнотоннажных производств ...
бинола. В этом реакторе частично проходит дегидратация. Так как
реакция дегидратации является эндотермической, то прежде чем
продукты дегидратации поступают в другой реактор (реактор 15),
продукты дегидратации перегреваются в теплообменнике 14.
Конверсия метилфенилкарбинола после двух реакторов до-
стигает 90%. Продукты дегидратации охлаждаются водой в холо-
дильнике 16 и поступают во флорентийский сосуд 17, в котором ор-
ганический слой отделяется от водного. Верхний углеводородный
слой поступает в ректификационную колонну 18 для отделения сти-
рола от ацетофенона. Ацетофенон затем гидрируется на отдельной
установке в метилфенилкарбинол, который поступает в отделение
дегидратации.
Селективность процесса по оксиду пропилена составляет 95—
97%, а выход стирола достигает 90% по этилбензолу. При этом из
1 т пропиленоксида получается 2,6—2,7 т стирола.
Таким образом, рассмотренная технология представляет слож-
ную систему, включающую множество рециклов по этилбензолу,
пропилену и катализатору. Эти рециклы приводят, с одной сторо-
ны, к увеличению затрат энергии, а с другой, позволяют вести про-
цесс в безопасных условиях (при низкой концентрации гидропе-
роксида — 10—13%) и достигать полной конверсии реагентов:
этилбензола и пропилена.
Следовательно, данный процесс необходимо оптимизировать.
В предложенной технологической схеме достаточно полно ис-
пользуется тепло реакций и потоков. Однако вместо холодильника
16лучше использовать котел-утилизатор, в котором можно получать
пар низкого давления. Для этого в котел-утилизатор необходимо по-
давать водный конденсат, из которого будет получаться пар. Кроме
того, следует предусмотреть более полное использование отходящих
газов и смолы, щелочного раствора солей из скруббера 4, а также до-
очистку водного слоя флорентийского сосуда. Наиболее сущест-
венным усовершенствованием технологической схемы может слу-
жить замена реакторов дегидратации на колонну, в которой можно
организовать совмещенный реакционно-ректификационный про-
цесс. Этот процесс протекает на ионообменном катализаторе в па-
рожидкостном варианте, т. е. при температуре кипения смесей, про-
ходящих через колонну, и может быть оформлен в следующем виде
(рис. 8.10). В таком варианте процесса конверсия и селективность
могут достигать 100 %, так как процесс протекает при низких темпе-
ратурах и малом времени пребывания продуктов синтеза в реакторе.
Глава 8. Производство стирола и оксидов олефинов
321
Преимущество данного варианта
процесса заключается еще и в том,
что стирол не попадает в куб ко-
лонны, а выделяется в виде гете-
роазеотропа с водой (температура
кипения ниже 100°C), что позво-
ляет исключить его термополиме-
ризацию.
Рис. 8.10. Принципиальная схема
оформления совмещенного процесса
Принципы в технологии совместного получения
стирола и пропиленоксида
Технология производства стирола и оксида пропилена исполь-
зует в качестве сырья доступные, производимые в больших количе-
ствах этилбензол и пропилен. Этот процесс нельзя отнести к мало-
стадийным, поскольку он включает в себя несколько химических
реакций: окисление этилбензола в гидропероксид, эпоксидирова-
ние пропилена, дегидратация метилфенилкарбинола, гидрирование
ацетофенона. Тем не менее, даже такая многоступенчатая структу-
ра технологии дает возможность получать целевые продукты
с селективностью по оксиду пропилена 95—97 % и выходом стиро-
ла по этилбензолу до 90 %. Таким образом, рассматриваемое про-
изводство можно отнести к высокоэффективным. Более того, такая
технология является ярким примером «сопряженных» производств,
обеспечивающих одновременное получение нескольких целевых
продуктов, позволяет выпускать стирол с качеством более высо-
ким, чем при дегидрировании (с точки зрения процессов полиме-
ризации) и заменить экологически грязное производство оксида
пропилена хлоргидринным способом. В связи с многостадийным
характером технологии следует выделить в ней узлы, обеспечиваю-
щие высокие конверсии за один проход — эпоксидирование, дегидрата-
ция, гидрирование, и не обладающие таким характером — получение
гидропероксида этилбензола. В этом случае ограничения по кон-
версии этилбензола связаны с последовательным характером по-
бочных реакций и взрывоопасностью гидропероксида при высо-
ких концентрациях в температурных условиях (140-160°С)
протекания реакции. Соответственно, рециркуляционные потоки,
направленные на полное использование исходного сырья, имеют
11 Я-6
322
Часть 2. Технология крупнотоннажных произволств ...
большие объемы на стадии окисления (аппараты 1—3—2—4—5—1)
и меньшие для остальных стадий (рецикл по катализаторному рас-
твору стадии эпоксидирования 6—7—8—9—6; рецикл по возвратно-
му этилбензолу 10—5—1). Данная технология из-за многостадийно-
сти требует реализации в полной мере принципа полноты выделения
продуктов из реакционной массы, поскольку именно чистые соеди-
нения, поступающие на каждую из стадий химического превраще-
ния, обеспечивают высокие показатели процесса в целом. Экзотер-
мичный характер процессов окисления и эпоксидирования дает
возможность применять получаемые на этих стадиях энергоресур-
сы (пар) для процессов разделения и, тем самым, обеспечить реа-
лизацию принципа полноты использования энергии системы. В целом
разработанное и реализованное в нашей стране технологическое
решение обладает высокой эффективностью.
ПРОИЗВОДСТВО ОКСИДОВ ОЛЕФИНОВ
ПРЯМЫМ ОКИСЛЕНИЕМ ОЛЕФИНОВ
Оксиды олефинов используются при промышленном произ-
водстве поверхностно-активных веществ, пластификаторов, анти-
фризов и полиуретанов. В промышленном масштабе освоено про-
изводство оксидов этилена и пропилена. На получение оксида эти-
лена в мире расходуется 16—20% всего производимого этилена.
Суммарные мировые мощности в 1995 г. составили около 12 мнл
т/год. Производство оксида этилена является одним из наиболее ди-
намично развивающихся. Так, например, в США в 1992 г. мощности
по производству этого продукта составили 2800 тыс. т/год, а в
1995 г. — уже 3 975 тыс. т/год. В Японии соответственно 600
и 880 тыс т/год.
Структура современного потребления оксида этилена и этилен-
гликоля, производимого на его основе, представлена в табл. 8.3.
Исторически первым способом получения оксида этилена был
хлоргидринный метод, основанный на гипохлорировании этилена
хлорноватистой кислотой в водных растворах хлора:
С12уН2О^±НОС1+НС1 8.11
СН2 = СН2 + НОС1 -э СН2С1СН2ОН 8.12
сн2 = сн2+а2+н2о -э сн2асн2он+на
Глава 8. Производство стирола и оксидов олефинов
323
Второй стадией процесса являлось омыление кислых раство-
ров этиленхлоргидрина концентрированными растворами едких
щелочей:
СН2С1СН2ОН +1 /2Са(ОН)1 -лСН2 -СН2+1/ 2СаС12 + Н2О 8.13
Технология позволяла использовать разбавленные этиленсодер-
жащие газовые смеси, имела простое аппаратурное оформление.
Наряду с оксидом этилена в качестве побочного продукта получа-
ли 1,2-дихлорэтан
СН2 = СН2 + С12 -> СН2С1 - СН2С1 8.14
Причем его количество 200 кг на 1 т оксида этилена позволяло
говорить о совместном получении двух целевых продуктов в ходе
одного технологического процесса.
Тем не менее, применение этой технологии практически пре-
кращено. Это связано с использованием хлора и едких щелочей,
а также с образованием большого количества сточных вод, содер-
жащих наряду с растворами солей значительное количество хлор-
органических соединений (дихлорэтан, хлорекс). Промышленное
значение хлоргидринная технология имеет еще только для получе-
ния оксида пропилена.
Таблица 8.3. Структура потребления оксида этилена и этиленгликоля
Оксид этилена Этиленгликоль
Моноэтиленгликоль 58,4 Полиэфирные волокна 55,2
Этоксилаты 17,5 Антифризы 18,1
Ди- и триэтиленгликоли 6,9 Упаковочный материал
Этаноланины 5,6 на основе полиэтилентерефталата 11,0
Гликолиевые эфиры 4,1 Полиэфирная пленка 5,9
Полиолы 2,7 Другие 9,8
Полиэтиленгликоли 1,4
Другие 3,4
В настоящее время оксиды олефинов производятся в основном
рассмотренным ранее способом гидроперекисного эпоксидирова-
ния, а также прямым окислением этилена.
324
Часть 2. Технология крупнотоннажных производств ...
Единственным известным в настоящее время катализатором
прямого окисления олефинов в соответствующие оксиды является
активное серебро.
Теоретические основы процесса
В качестве катализатора на всех производствах оксидов олефи-
нов используется серебро с промотирующими и структурообразу-
ющими добавками, нанесенное на пористый корундовый носитель
в виде шариков или колец.
Реакция
СН2 =СН2+1/2О2 ->С2Н4О + 121,5кДж/моль 8.15
сопровождается полным окислением этилена
СН2 = СН2 + ЗО2 -> 2СО2 + 2Н2О + 1383 кДж/моль 8.16
При более высоких температурах проявляется реакция полно-
го окисления окиси этилена
С2Н4О + \/2О2 -+ 2СО2 + 2Н2О +1257 кДж/моль 8.17
Значительное число исследований, посвященных выяснению
механизма окисления олефинов в оксиды олефинов, к сожалению,
до настоящего времени не привело к выработке единого мнения.
Одним из широко известных механизмов этого процесса является
механизм, предложенный М.И. Темкиным и Н.В. Кульковой. В со-
ответствии с ним по мере увеличения адсорбции кислорода на се-
ребре образуется поверхностный оксид — сначала Ag2 О, а затем Ag2 О2
и менее устойчивый Ag2O3, которые образуют одну поверхностную
фазу переменного состава. При этом серебро в этой фазе оказыва-
ется одновременно как одновалентным (Ag2O), так и трехвалент-
ным (Ag2O3), т. е. (Ag2O2) или (Ag\4gmO2). Предполагается, что имен-
но этот оксид серебра, адсорбированный на поверхности, участвует
как в реакции 8.15, так и в реакции 8.16.
Исходя из этих представлений, предполагается следующий ме-
ханизм:
Ag2Ofc + С2Я4 —Ag2Oadc + С2Н4О 8.18
Ag2O^ + С2Н4 Ag2OC2H4Oadc 8.19
Ag2O^ + С2Н4 Ag2Oadc + СНОСНО 8.20
Глава 8. Производство стирола и оксидов олефинов
325
Образование продуктов полного окисления происходит за счет
окисления ацетальдегида
CH3CHO+5Ag2O^ —к-^2СО2 + 2H2O + 5Ag2Oadc 8.21
Ag2Oadc + О2 -^Ag2O^ 8.22
Ag2Oadc + 2Ag2O2dc 8.23
Ag2OC2H4O^^±Ag2Oadc + C2H4O 8.24
Ag2O^ + C2H4O^=>Ag2O2C2H4Oark 8.25
A5
Ag2Of + H2OTT=^Ag2O2H2O^ 8.26
A6
Ag2O2adc + CO2 ^=±Ag2O2CO^ 8.27
A7
В данном случае ?lg2Oadc представляет собой промежуточную ча-
стицу поверхностного соединения и соответствует вакантному ме-
сту на поверхности катализатора.
Стадия 8.20 сложная и на самом деле состоит из нескольких
быстрых стадий. Последние четыре стадии описывают равновесие
между продуктами в паровой фазе и адсорбированными на поверх-
ности. В адсорбированном состоянии они могут закрывать катали-
тически активные центры и тормозить целевую реакцию. В соот-
ветствии с механизмом реакции 8.18—8.27 скорость основной
реакции 8.15 описывается как
Для побочной 8.16
где
Л - - —(1+ ^4/’сгя4о)+(1 + + K6pH^0 + K-jpCOi j. 8.30
2/сз Ра,
При низких концентрациях этилена (ниже нижнего предела
взрываемости)
к]Рс2н4
ж =------——
^ + кРс2Н4О
8.31
326
Часть 2. Технология крупнотоннажных производств ...
Наоборот, при высоких (выше верхнего предела взрываемости)
концентрациях этилена
ТУ 1 — .
1 + К^Р^ТЦО
Таким образом, в зависимости от условий проведения скорость
реакции может иметь первый порядок по этилену и нулевой по кис-
лороду 8.31 или первый по кислороду и нулевой по этилену 8.32.
В целом можно говорить о некотором общем виде уравнения,
описывающего скорость реакции окисления этилена
м> = к Pc^Pq /Т\ + к РСг1цо), 8.33
где кажущиеся порядки по исходным реагентам составляют от 0 до 1 (по
экспериментальным данным = 0-0,45, п2 = 0,55-1).
Значительный вклад в исследование процесса получения оки-
си этилена на серебряных катализаторах внесли М.И. Темкин,
А. К. Аветисов, Б. Б. Чесноков.
Российскими исследователями в НИИ «Синтез» совместно
с Институтом катализа СО РАН разработана технология приготов-
ления высокоэффективного катализатора парциального окисления
этилена. Как правило, селективность серебра без добавок не пре-
вышает 45—50 %, в то же время она зависит в основном от наличия
на поверхности электроотрицательных (хлор, сера, селен) и элект-
роположительных (цезий, рубидий, калий) элементов. При исполь-
зовании аминного метода приготовления серебряных катализато-
ров удалось добиться равномерного осаждения на поверхность пор
носителя мелкодисперсных кристаллов серебра (0,8—1,5тыс. А),
содержащих промотирующие и структурообразующие добавки.
Влияние такого рода добавок отражено на рис. 8.11—8.12.
Так как селективность существенно зависит от присутствия С1
на поверхности и его постоянного уноса, в ходе эксплуатации ка-
тализатора требуется постоянная подпитка исходной смеси микро-
количествами хлора. Его источником могут служить дихлорэтан или
винилхлорид.
Готовый катализатор содержит 11—13 % мае. серебра и обеспе-
чивает при 2 МПа и объемной скорости 5—7 тыс.час"1 в воздушном
(5,0% С2Я4; 5,5% О2) и кислородном (15,0% С2Н^, 6,5% О2) вари-
антах организации высокую селективность (80—82%) и произво-
дительность (концентрация С2Я4О на выходе из реактора 1 % и
1,5 % об., соответственно). Разработанный катализатор «НПП Ок-
Глава 8. Производство стирола и оксидов олефинов
327
Рис. 8.11. Зависимость селективности катализаторов на носителях
различной пористой структуры от содержания цезия
Рис. 8.12. Зависимость скорости реакции IV и селективности S от темпе-
ратуры для серебряных катализаторов с добавками Cs и Cl (1), Cs (2), Cl (3)
и без промотирующих добавок (4)
сид-Этокс» выпускается катализаторной фабрикой Казанского АО
«Органический синтез».
Статистические исследования процесса позволили рекомендо-
вать для его проведения трубчатый реактор. При этом в качестве
хладагента целесообразно использовать кипящую под давлением
5,5 МПа воду, что обеспечивает более равномерный теплоотвод по
сравнению с использованием высококипящих промежуточных хла-
дагентов. Рекомендуется использовать трубки диаметром 32 мм
с длиной слоя катализатора 6,5—7 м для воздушного и 27 мм и 7,5—
8 м для кислородного процессов.
Селективность в рассмотренных вариантах достигает соответ-
ственно 78—80 % и 80—81 %. Срок службы катализатора от 2 до 5 лет.
За рубежом в основном применяются катализаторы фирмы
Shell с содержанием серебра 12—15 % вес. Катализаторы обладают
достаточной стабильностью. За 4—5 лет их селективность снижа-
ется на 7—8 %.
Чрезвычайно важное значение для эффективного проведе-
ния процесса имеет температурный режим и степень конверсии
этилена. При постоянной степени конверсии этилена селектив-
ность падает с повышением температуры и степени конверсии
этилена, см. рис. 8.13.
328
Часть 2. Технология крупнотоннажных произвоаств ...
Температура, °C Степень конверсии, %
Рис. 8.13. Зависимость
селективности образова-
ния оксида этилена от
температуры (а) и степени
конверсии (б)
Это связано с последовательно-параллельным характером об-
разования продуктов полного окисления
Сн2 = ~^СЯ2СЯ2О-^->СО2 + Н2О
СН2=СН2-^СО2+Н2О
Выражение для дифференциальной селективности по оксиду
олефина имеет вид
<Р=~—-
r1 + r3
При допущении о равных порядках скоростей реакций парци-
ального и полного окисления получим:
, Рс^О *2
К2 п 1 . '
р=-------—з Рс2тц (8 34)
кх + &2 1 + Л3 / кх
Отсюда очевидно, что подавление побочной реакции полного
окисления за счет изменения концентраций исходных реагентов
невозможно. Однако концентрацией целевого продукта можно эф-
фективно контролировать скорость последовательного полного
окисления. Действительно, промышленные процессы при получе-
нии оксида этилена обеспечивают ее концентрацию в реакцион-
ных газах на уровне 0,7-1,5 %, что позволяет практически исклю-
чить последовательное окисление.
Подавление параллельной реакции полного окисления возмож-
но при снижении температуры процесса. Это связано с тем, что
энергия активации реакции полного окисления на 21—24 кДж/моль
выше, чем для целевого процесса. Следовательно, при снижении
Глава 8. Производство стирола и оксидов олефинов
329
температуры к3/кх уменьшается, а дифференциальная селектив-
ность растет.
Таким образом, в промышленности процесс окисления этиле-
на с получением оксида этилена проводят на серебряном катализа-
торе, промотированном, как правило, хлором, серой, цезием. Окис-
ление ведут в кожухотрубных реакторах со стационарным слоем
катализатора, обеспечивая конверсию этилена за один проход 15—
25 % и концентрацию оксида этилена на выходе 0,7—1,5 %. (Темпе-
ратура 230—250 °C, давление 0,3—3,5 МПа.)
Технология производства оксида этилена
ПАРЦИАЛЬНЫМ ОКИСЛЕНИЕМ ЭТИЛЕНА
Существует два подхода к организации технологического про-
цесса, которые отличаются типом используемого окислителя — воз-
дух или технический кислород.
Первая установка мощностью 7 000 т/год была пущена в США
в 1937 г. фирмой Карбайд энд Карбон. В 1956 г. при создании тако-
го производства фирма Шелл использовала чистый кислород. В на-
стоящее время, несмотря на одновременное сосуществование обеих
технологий, все крупные установки мощностью 50—200 тыс. т/год ис-
пользуют в качестве окислителя кислород.
Главные фирмы-разработчики процесса — Шелл, Юнион Кар-
байд, Сайентифик Дизайн, БАСФ, Ниппон Секубай, НИИ «Синтез».
Несмотря на разнообразие фирм-разработчиков принципиаль-
ные технологические схемы процесса практически не отличаются
друг от друга.
Рассмотрим сначала технологическую схему получения оксида
этилена с использованием в качестве окислителя технического кис-
лорода (рис. 8.14).
Свежий этилен, содержащий промотирующую добавку (С2Я4С/2),
предварительно очищенный от ацетилена (< 0,001 % об.), сернистых
соединений (0,0001 % об.), высших непредельных углеводородов
(< 0,1 % об.), смешивается с рециркуляционным потоком при дав-
лении 2,0 МПа, затем в парогазовую смесь вводится кислород. Смесь
подогревается отходящими реакционными газами в теплообменни-
ке 2. Затем эта смесь с составом С2Я4 — 20—30 % об.; О2 — 7—8 % об.;
СО2 — 4—5 % об.; остальное — инерты поступает при температуре
210—230°С в кожухотрубный реактор 1. Температуру 250—270°С
в реакторе поддерживают циркулирующим в межтрубном простран-
стве высококипящим органическим теплоносителем (обычно дифе-
330
Часть 2. Технология крупнотоннажных произволств ...
Рис. 8.14. Технологическая схема получения оксид этилена по кислород-
ному варианту:
1 — реактор; 2 — рекуперативные теплообменники; 3 — котел-утилизатор; 4 — хо-
лодильник; 5 — циркуляционный компрессор; 6,11 — абсорберы оксида этилена;
7 — абсорбер СО2; 8 — десорбер; 9 — отпарная колонна; 10,12 — ректификационные
колонны; 13 — дроссельный вентиль; 14 — насос; I — этан; II — кислород; III — во-
дяной конденсат; IV — пар; V — фузельная вода; VI — СО2; VII — дифенильная смесь;
VIII — этиленоксид; IX — раствор Х^СО3; X — раствор КНСО2, XI — фузельная вода
на очистку от смол и тяжелых побочных продуктов
нильная смесь). Во внешнем котле-утилизаторе 3 за счет тепла ди-
фенильной смеси вырабатывается пар с давлением 4,5 —5,0 МПа. Ре-
актор, трубопроводы и арматура должны быть изготовлены из леги-
рованной стали, так как обычная сталь сильно корродирует в среде
влажного углекислого газа (Н2О и СО2 — продукты полного окисле-
ния). Кроме того, оксиды железа являются катализаторами полного
окисления, в связи с чем некоторые первые промышленные уста-
новки имели даже реакторы с посеребренными трубками. Реакторы
Глава 8. Производство стирола и оксидов олефинов
331
с псевдоожиженным слоем не нашли применения в данном процес-
се из-за сильного истирания катализатора, трудности его улавлива-
ния и отделения от продуктов.
Выходящий из реактора 1 поток имеет состав: этилен 13—
19,5% об.; кислород 3,5—5,0% об.; оксид этиленадо 1,5 % об.; СО2 -
10—12 % об.; инертные газы (азот, аргон) 62—72 % об. Реакционные
газы охлаждаются исходной смесью в теплообменнике 2, а затем
в водяном холодильнике 4. После этого смесь поступает в абсор-
бер 6. Так как оксид этилена смешивается с водой в любых соотно-
шениях, то в качестве абсорбента используется охлажденная фу-
зельная вода из аппаратов 9 и 11. Раствор оксида этилена из
абсорбера 6 после дросселирования Нагревается фузельной водой
в теплообменнике 2 и поступает в отгонную колонну 9, обогревае-
мую острым паром. Смесь оксида этилена, углекислого газа и не-
большого количества паров воды поступает на ректификацию в ко-
лонну 10. Трудность разделения низко кипящих СО2 и оксида
этилена, а также лабильность оксида этилена приводит к тому, что
эффективность колонны Юне может быть большой. Поэтому в ней
осуществляется фракционирование этой смеси. Дистиллят колон-
ны обогащен углекислым газом, но в нем присутствует и некото-
рое количество оксида этилена. Кубовый продукт — высококонцен-
трированный раствор оксида этилена в воде (с продуктами
окисления) поступает на ректификацию в колонну 12, где в каче-
стве дистиллята выделяют товарный оксид этилена. Кубовый про-
дукт колонны 12 представляет собой фузельную воду, загрязненную
смолообразными продуктами, и отводится на очистку.
Парогазовый поток из верха абсорбера 6 направляется на кар-
бонатную очистку от СО2 в абсорбер 7. При этом протекает реакция
К2СО2 + СО2 + Н2О <=> 1КНСО. 8.35
и углекислый газ связывается в гидрокарбонат. Раствор гидрокар-
боната подогревается в теплообменнике и направляется на десорб-
цию в аппарат 8. Для более эффективной десорбции, как правило,
снижают давление до 0,2—0,3 МПа. Раствор карбоната калия из куба
десорбера охлаждают и возвращают насосом (не показан) на ста-
дию абсорбции в аппарат 7.
Таким образом, рассмотренная технология обеспечивает посто-
янство содержания инертных примесей в циркулирующем газе
в основном за счет очистки его от СО2. Практически разница в со-
ставах выходящего из реактора парогазового потока и потока из
332
Часть 2. Технология крупнотоннажных производств ...
верхней части абсорбера 7 обусловлена отсутствием в нем оксида
олефина и снижением концентрации СО2 приблизительно в 2 раза.
Существующая технология может быть несколько модифици-
рована с целью повышения ее эффективности.
Во-первых, это относится к замене охлаждения реактора 1 ди-
фенильной смесью на кипящую воду, что, как показано в работах
специалистов НИИ «Синтез», существенно снижает вероятность
местного перегрева и теплового срыва реактора.
Во-вторых, целесообразно использовать в колонне 12 обогрев
не острым паром, а глухим паром в циркуляционных кипятильни-
ках, что позволит снизить количество отходящих сточных вод.
Более старая технология окисления этилена воздухом не поз-
воляет достичь той же эффективности, что кислородный процесс,
и обеспечивает общий выход оксида этилена 60 % по этилену при
средней селективности 65 % и суммарной конверсии этилена 90 %.
В отличие от кислородного варианта, где необходимые концентра-
ции реагентов под держиваются в основном за счет хемосорбции СО2
и циркулирующих газов, большое количество инертов, поступаю-
щих с воздухом на стадию окисления, делает этот прием экономи-
чески неэффективным. Простая сдувка при одностадийном окис-
лении приводит к значительным потерям этилена, а если отводить
эту смесь на разделение — к большим энергозатратам на низкотем-
пературную ректификацию. Поэтому для полного использования
этилена в «воздушной» технологии применен метод многоступен-
чатого окисления при все более и более жестких условиях (рис. 8.15).
Свежие этилен и воздух смешиваются с рециркуляционными
газами (давление 0,3—3 МПа, обычно 1—2 МПа). Избыточное давле-
ние позволяет уменьшить габаритные размеры технологического
оборудования. Смесь, поступающая в реактор 1, содержит 4—
6% (об.) этилена, 6—8% (об.) кислорода, 8—10% (об.) СО2, осталь-
ное — азот, аргон, инертные примеси этилена. В реакторе 1 поддер-
живают конверсию этилена на уровне 30—40%. При этом выходя-
щий из реактора 1 парогазовый поток содержит около 1,5 % оксида
этилена. Тепло реакции используют для подогрева циркуляцион-
ного потока и исходного сырья в теплообменнике 2, а затем паро-
газовую смесь направляют в абсорбер 3, орошаемый охлажденной
фузельной водой для отмывки оксида этилена от рециркуляцион-
ных газов. Постоянное накопление инертов в рецикле, охватываю-
щем аппараты 1—3—2, делает необходимым отвод части газового по-
тока. Поэтому часть газов из абсорбера 3 дожимают в компрессо-
Глава 8. Производство стиром и оксидов олефинов
333
Рис. 8.15. Реакторная подсистема технологии окисления этилена возду-
хом с получением оксида этилена:
1 — реактор первой ступени; 2 — теплоообменники; 3 — абсорберы окиси этилена;
4 — реактор второй ступени; 5 — компрессор; I — этилен; II — воздух; III — водяной
конденсат; IV — пар; V — охлажденная фузельная вода со стадии ректификации;
VI — раствор оксида этилена на ректификацию; VII — сбросовые газы
ре 5 до рабочего давления и направляют на вторую стадию окисле-
ния в реактор 4 после подогрева отходящими газами. В реакторе 4
процесс ведут при высоких конверсиях этилена, несмотря на то,
что селективность по целевому продукту падает. Это связано с тем,
что после окисления и отмывки оксида этилена в абсорбере 3 газы
сбрасываются в атмосферу. При больших мощностях производства
становятся выгодными даже установки с тремя ступенями окисле-
ния. Технологический приём многоступенчатого окисления дает
возможность довести выход оксида этилена до 65 %.
Как уже отмечалось, наиболее перспективным в настоящее вре-
мя является «кислородный» процесс. Это связано с:
Ф более высокой эффективностью (выход оксида этилена выше
на 10-15%);
Ф более низкими затратами на создание реакторной подсистемы;
Ф снижением потерь этилена за счет газов сдувки и неселектив-
ного окисления.
Принципы в технологии производства
ОКСИДА ЭТИЛЕНА ОКИСЛЕНИЕМ ЭТИЛЕНА
Технология относится к непрерывным, одностадийным и исполь-
зует дешевое и доступное сырье — этилен и технический кислород.
Процесс при невысоких конверсиях обеспечивает относительно
высокую—до 81—82% — селективность (кислородный процесс).
334
Часть 2. Технология крупнотоннажных производств ...
Температурные условия в реакторе позволяют получать пар с вы-
соким энергетическим потенциалом (давление 4,5—5 МПа), ко-
торый в дальнейшем может применяться на других стадиях тех-
нологии, например, при разделении продуктов. Таким образом,
обеспечивается высокая эффективность использования тепла хи-
мической реакции.
Рециркуляция непрореагировавшего сырья позволяет, несмотря
на низкие конверсии (20—30%) олефина за один проход, обеспе-
чить полное его использование. Относительно невысокими оказы-
ваются затраты на выделение целевого продукта из циркуляцион-
ного потока абсорбцией. Эффективная система хемосорбции СО2
из рециркуляционного потока (кислородный вариант) существен-
но снижает количество газов сдувки и, тем самым, потери исход-
ного сырья. Технология обеспечивает невысокие потребности в
воде, так как имеет по ней внутренний цикл. Оптимальным для
данной технологии является применение аппаратов средней мощ-
ности, поскольку именно кожухотрубные реакторы обеспечивают
минимальные локальные перегревы реакционной смеси, что поз-
воляет повысить дифференциальную селективность по целевому
продукту. Таким образом, возможно создание линий большой еди-
ничной мощности, включающих в себя несколько параллельно ра-
ботающих реакторов.
Глава 9. Производство фенола и ацетона
ИЗ ИЗОПРОПИЛБЕНЗОЛА
S Теоретические основы процесса.
S Технология совместного производства
фенола и ацетона из изопропилбензола.
S Совместное получение фенола, ацетона
и пропиленоксида из изопропилбензола.
® Принципы в технологии производства
фенола и ацетона из изопропилбензола.
В настоящее время используются различные методы получе-
ния фенола:
О каталитическое окисление толуола;
© прямое окисление бензола;
© кумольный метод;
О окисление циклогексана с последующим дегидрированием
циклогексанола до фенола;
© хлорбензольный метод;
® окислительное хлорирование бензола (метод Рашига);
О сульфонатный метод.
Из перечисленных методов в промышленности используются
четыре: каталитическое окисление толуола, прямое окисление бен-
зола, метод Рашига и кумольный метод. Основное количество фе-
нола (более 90 %) получают кумольным методом. Суммарная мощ-
ность установок, производящих фенол кумольным методом,
составляет около 5 млн т в год. Доля кумольного метода в общем
производстве фенола составляет в США 98 %, в ФРГ— 95,3 %, в Япо-
нии — 100 %. Особенно привлекателен кумольный метод производ-
ства фенола тем, что одновременно позволяет получать другой цен-
ный продукт — ацетон. Кумольный способ производства фенола и
ацетона является ярким примером реализации химического прин-
ципа применения «сопряженных» методов в технологии органиче-
ского синтеза (см. гл. 6).
Разработка комплексного кумольного метода, который позволяет
получать не только фенол и ацетон, но и пропиленоксид, показала,
что получение пропиленоксида эпоксидированием пропилена гид-
336
Часть 2. Технология крупнотоннажных производств ...
ропероксидными соединениями является наиболее эффективным
методом синтеза этого вещества.
Кумольный метод получения фенола и ацетона разработан со-
ветскими учеными П.Г. Сергеевым, Б.Д. Кружаловым, Р.Ю. Удрисом
и внедрен в 1944 г. За рубежом аналогичные производства появились
позднее: в Канаде и во Франции — в 1953 г, в США и ФРГ — в 1954 г.
Процесс производства фенола и ацетона кумольным методом
состоит из 7 стадий: алкилирование бензола, окисление изопро-
пилбензола, выделение гидропероксида, разложение гидроперок-
сида, нейтрализация гидропероксида, выделение фенола, выделение
ацетона (рис. 9.1).
Стадия алкилирования достаточно подробно была рассмотрена
в гл. 7. Поэтому в этой главе мы рассмотрим остальные стадии.
Рис. 9.1. Блок-схема совместного получения фенола и ацетона
Глава 9. Производство фенола и auetoha...
337
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПРОЦЕССА
Окисление изопропилбензола
Реакция окисления изопропилбензола:
С6Н6(СН3)СН-^^С6Н5(СН3)СООН 9.1
протекает по механизму сложных цепных реакций с вырожденным
разветвлением цепи. Получить 100%-ную селективность по гид-
ропероксиду в реакции окисления изопропилбензола невозмож-
но, так как параллельно с основным образуются такие побочные
продукты, как диметилфенилкарбинол, ацетофенон, муравьиная
кислота, в незначительной степени пероксидные продукты типа
дикумилпероксида.
В промышленных условиях в настоящее время селективность
стадии окисления изопропилбензола по гидропероксиду состав-
ляет 91—95% (мол.). Такая селективность обеспечивается кон-
структивным оформлением реактора, использованием оптималь-
ных концентраций гидропероксида в реакционной массе (15—
25%), оптимальной температуры (100—120°С) и наиболее ак-
тивного катализатора.
Окисление можно проводить как в жидкой, так и паровой фазе
на разных катализаторах. Наиболее широко в качестве катализато-
ров процесса, проходящего в жидкой фазе при температурах выше
100°C (100—120°C), применяются резинаты и нафтенаты кобальта
и марганца. Используют и инициаторы, например сами гидропе-
роксиды, которые добавляют в шихту в количестве 2,5—3,5%.
Образующийся гидропероксид изопропилбензола частично
подвергается термическому разложению. С повышением темпера-
туры скорость распада гидропероксида возрастает. Основными про-
дуктами распада гидропероксида изопропилбензола являются ди-
метилфенилкарбинол, ацетофенон и метиловый спирт:
CbHs(CH3)2COOH-^C6H5(CH3)2COH 9.2
С6Я5(СЯ3)2 СООН —> СЬН3СОСН3 + СН3ОН 9.3
Образующийся метанол окисляется в формальдегид и муравьи-
ную кислоту, являющуюся ингибитором процесса окисления изо-
пропилбензола.
Как уже отмечалось, на выход гидропероксида влияют тем-
пература и продолжительность окисления (рис. 9.2). Однако чрез-
338
Часть 2. Технология крупнотоннажных производств ...
мерное понижение температуры уменьшает скорость реакции. Так,
за 1 час при t = 120 °C выход гидропероксида составляет 8-10, а при
/= 100°C — 2—3 % (мае.).
Рис. 9.2. Зависимость содержания
гидропероксида в реакционной массе
от продолжительности окисления при
различной температуре
Распад гидропероксида начинает заметно протекать при его кон-
центрации в реакционной массе 18% и выше. При повышенных тем-
пературах его распад сопровождается взрывом. Даже при оптималь-
ной концентрации пероксида в оксидате содержится от 0,5 до 5%
продуктов распада. Процессу окисления благоприятствует щелочная
среда (рЯ=7,5), так как нейтрализуются кислоты-ингибиторы, об-
разующиеся в процессе окисления. В этом случае осуществляется
совмещенный процесс, так как параллельные реакции нейтрализа-
ции позволяют ускорять основную реакцию. В связи с этим окисле-
ние иногда ведут кислородом воздуха в водно-щелочной эмульсии
(1 %-ный раствор Na2CO3) при интенсивном перемешивании и в при-
сутствии поверхностно-активных веществ.
Таким образом, процесс окисления чаще всего проводят при
120— 130°С, Р=0,5—1 МПа, pH = 8,5—10,5. В этих условиях конеч-
ное содержание гидропероксида составляет около 25 %.
Для проведения процесса окисления применяются следующие
реакторы (рис. 9.3): колонного типа; с перемешивающим уст-
ройством (каскад реакторов); эрлифтового типа.
В колонных аппаратах для отвода тепла устанавливаются змее-
вики (отводится 1967 кДж на 1 кг превращенного изопропилбен-
зола). Реактор колонного типа является компактным. Каскад ап-
паратов с перемешивающими устройствами или каскад реакторов
эрлифтового типа требуют использования большого количества ар-
матуры. Управлять процессом в таких реакторах сложно.
Учитывая то, что в оксидате содержится около 25 % пероксида,
а на дальнейшую переработку должен подаваться концентри-
Глава 9. Производство фенола и ацетона...
339
рованный раствор, проводят его
концентрирование в мягких усло-
виях (в вакууме, при низких тем-
пературах). Наиболее широко для
этой цели используют вакуумную
ректификацию (чаще всего на
двухколонной установке). Получа-
емый технический гидропероксид
имеет следующий состав (в %): ги-
дропероксид изопропилбензола —
90—91; диметилфенилкарбинол —
5-7; ацетофенон — 1,0—1,5; дику-
милпероксид — 0,4—0,6; муравьи-
ная кислота — 0,01—0,04.
В дальнейшем в зависимости
от целей процесса (получают
только фенол и ацетон или фе-
нол, ацетон и пропиленокеид)
пероксид направляется на разло-
жение или на эпоксидирование
пропилена.
Разложение гидропероксида
ИЗОПРОПИЛБЕНЗОЛА
Технический гидропероксид
изопропилбензола направляют на
сернокислотное разложение, в ре-
зультате которого образуются фе-
Отработанный.
^воздух
^^Изопропил-
бензол
Продукты.
окисления
f Воздух (О2)
а
Отработанный^
Г^воздух
^Р°^Укть1^.
окисления^"
бензол i к Воздух (OJ
б
Отработанный^
-1- воздух
Продукты^
окисления
Воздух (О2)^~^----
Изопропилбензол
Рис. 9.3. Реакторы окисления:
а — колонного типа: б — с переме-
шивающим устройством; в — эр-
лифтового типа
в
нол и ацетон, а также побочные продукты: а-метилстирол, кумол-
фенол, димеры а-метилстирола и смолы:
С6Я5 (СЯ3 )2 СООН СьНрн + СН.СОСН, 9.4
Веществом, ответственным за образование 80—85% побочных
продуктов, является присутствующий в техническом гидроперокси-
де изопропилбензола диметилфенилкарбинол. Ацетофенон в условиях
окисления практически не превращается в другие продукты, в то вре-
мя как 30—40% диметилфенилкарбинола превращается в а-метилсти-
рол, последний выделяют в виде товарного продукта или в виде угле-
водородной фракции совместно с изопропилбензолом.
340
Часть 2. Технология крупнотоннажных производств ...
Механизм разложения гидропероксида может быть представлен
следующим образом:
1) образование оксониевого иона и его дегидратация:
/СНз
С6Н5-С—ООН + н+
СНз
/СНз /СНз
с6н5—с-оон2 с6н5—с—о+ + н2о
СНз СНз
9.5
2) перегруппировка образовавшегося иона с миграцией фениль-
ной группы к кислородному атому:
/СНз
С6Н5-с^-О+
СН3
СНз
СбН5О-С+
СНз
9.6
3) взаимодействие иона карбония с молекулой гидропероксида:
СНз /СНз /СНз /СНз
С6Н5—+С + С6н5—С—ООН —► с6н5о—с-он + с6н5-с—0+
СНз снз снз снз
С6Н5ОН + СНз —СО—СНз
9.7
Разложение гидропероксида проводят в присутствии раствора
серной кислоты в ацетоне. Разложение в присутствии слабых кис-
лот (щавелевая, метафосфорная и др.) протекает при высоких тем-
пературах (100—120 °C) и с низкими выходами фенола и ацетона.
Максимальные выходы фенола и ацетона достигаются при концен-
трации H2SOV равной 0,07—0,1% от массы гидропероксида.
Выходы целевых продуктов зависят также от температуры. Так,
при повышении температуры процесса разложения с 50 °C до 80 °C
выход ацетона снижается с 98—99 % до 89 % (что составляет = 10%),
а фенола — с 98 до 80—82 %. Вместе с тем при низких температурах
(=30 °C) резко возрастает продолжительность процесса и в реакци-
онной массе остается неразложившийся гидропероксид. Поэтому
оптимальной для процесса разложения является температура 50—
Глава 9. Производство фенола и auetoha...
341
60 °C. На разложение чаще все-
го подают разбавленный (в том
числе и продуктами реакции)
гидропероксид, чтобы избежать
взрыва.
Разложение проводят в ре-
акторах трех типов, отличаю-
щихся способом отвода тепла
реакции. Так, в адиабатических
реакторах (рис. 9.4,а) тепло от-
водится за счет циркуляции
реакционной массы. В проточ-
но-циркуляционной установке
(рис. 9.4,6) тепло отводят, охлаж-
дая водой трубчатый реактор.
При этом часть реакционной
смеси отводится на дальнейшую
переработку, а остальная часть —
на рециркуляцию. В этом случае
рециркуляция повышает выход
побочных веществ.
Более совершенным явля-
ется изотермический реактор
(рис. 9.4,в), в котором тепло от-
водится за счет испарения из-
бытка ацетона. Такой реактор
можно секционировать попе-
речными перегородками, что
снижает выход побочных про-
Тахничаский
гидроперокси^
Раствор
H2SO4
Вода
Реакционная
V
масса на
переработку
Реакционная масса^
на переработку
А Технический
гидропвроксид
Раствор
H2SOt
Реакционная
масса на
переработку
Технический
гидропероксид в
Рис. 9.4. Реакторные узлы
для разложения гидропероксида
изопропилбензола
а
б
дуктов за счет уменьшения времени контакта. Выход фенола
и ацетона в этом реакторе может достигать 98 % от теоретического.
ТЕХНОЛОГИЯ СОВМЕСТНОГО ПРОИЗВОДСТВА
ФЕНОЛА И АЦЕТОНА ИЗ ИЗОПРОПИЛБЕНЗОЛА
Технологическая схема производства фенола и ацетона кумоль-
ным методом представлена на рис. 9.5.
Свежий изопропилбензол смешивают с возвратным изопропил-
бензолом и гидропероксидом изопропилбензола (6 % от массы ших-
ты) в смесителе 7. Шихту насосом 6 прокачивают через теплооб-
342
Часть 2. Технология крупнотоннажных производств ...
Рис. 9.5. Технологическая схема производства фенола и ацетона кумоль-
ным методом:
1 — подогреватель воздуха; 2 — окислительная колонна; 3 — теплообменник; 4, 9,
11 — конденсаторы; 5 — отстойник-нейтрализатор; 6 — насос; 7 — сборник-смеси-
тель; 8 — колонна концентрирования гидропероксида; 10 — реактор разложения ги-
дропероксида; 12 - нейтрализатор; 13—17 — ректификационные колонны; I — воз-
дух; II — отработанные газы; III — раствор соды (слабой щелочи); IV — раствор
солей; V — свежий изопропилбензол; VI — 6%-ный раствор гидропероксида; VII —
серная кислота; VIII — ацетон; IX — а-метилстирольная фракция; X, XIII — смо-
лы; XI — углеводороды; XII — фенол
менник 3 и подают в верхнюю часть колонны окисления 2. В теп-
лообменнике шихта подогревается за счет тепла оксидата до темпе-
ратуры ПО °C. В нижнюю часть колонны подают воздух, предва-
рительно подогретый водяным паром также до температуры 110 °C
в подогревателе 1. На схеме показана полая окислительная колон-
на со встроенными змеевиками для отвода тепла. Также может ис-
пользоваться более эффективная тарельчатая колонна, в которой
осуществляется прямоток между шихтой и воздухом. В этом случае
оксидат выводится из верхней части колонны. Отработанный воз-
дух вместе с парами изопропилбензола, кислот и других примесей
Глава 9. Производство фенола и auetoha ...
343
проходит вначале теплообменник 3 и конденсаторы 4, а затем от-
стойник-нейтрализатор 5, в котором содой или щелочью нейтра-
лизуются кислоты. Отработанный воздух выводится из системы,
а очищенный от кислот изопропилбензол с примесями возвраща-
ется в смеситель 7. Соли из нейтрализатора 5 также выводят из
системы д ля утилизации.
Оксидат из нижней части окислительной колонны 2 через теп-
лообменник 3, где он охлаждается шихтой до температуры 60 °C,
направляется в колонну 8 для концентрирования гидропероксида
изопропилбензола.
В связи с тем что гидропероксид при высоких температурах под-
вергается быстрому разложению со взрывом, концентрирование про-
водят при глубоком вакууме (остаточное давление в кубе колонны
0,79 кПа). Поэтому температура в кубе не должна превышать 100 °C.
Дистиллят колонны 8 (изопропилбензол с примесями кислот и уг-
леводородов) поступает в нейтрализатор 5, а кубовый продукт (кон-
центрированный гидропероксид изопропилбензола) — в реактор раз-
ложения 10. Туда же подается серная кислота в ацетоне. Однако
несмотря на большие энергетические и капитальные затраты часто
для концентрирования используют «двойную» ректификацию
(рис. 9.6), т. е. ректификацию в двух колоннах. В этом случае про-
цесс концентрирования протекает в более безопасных условиях и не
требуется очень глубокий вакуум. Такой вариант еще более предпо-
чтителен, при процессе совместного производства фенола, ацетона
и пропиленоксида, так как на эпоксидирование может направлять-
ся разбавленный гидропероксид (30—35 %), а концентрация гидро-
пероксида в дистилляте второй колонны составляет 35—45 %. Разло-
жение проводят при температуре 60 °C. При этом тепло отводится за
счет испарения ацетона. Пары ацетона конденсируются в конденса-
Рис. 9.6. Двухколонная установка
концентрирования гидропероксида
изопропилбензола
I, III, IV, V — растворы гидропероксида
кумола в изопропилбензоле 30—35 %,
75—80 %, 34—45 %, 95—96 % соответст-
венно; II — изопропилбензол
344
Часть 2. Технология крупнотоннажных производств ...
торе 77, и ацетон возвращается в реактор. В продуктах разложения
остается серная кислота, поэтому перед разделением их пускают че-
рез скруббер 12, заполненный анионитом АН-1.
Для разделения продуктов разложения может быть предложено
несколько вариантов схем. На рис. 9.5 приведена схема, в которой
на первой колонне при остаточном давлении около 5,3 кПа про-
исходит разделение продуктов разложения на ацетоновую и феноль-
ную фракции. Это обусловлено тем, что эти фракции в дальнейшем
разделяют при разных давлениях. В ректификационной колонне 13
в виде дистиллята отделяются ацетон, а-метилстирол и другие лег-
колетучие примеси. Дистиллят колонны 13 поступает в ректифика-
ционную колонну 14, в которой при атмосферном давлении выде-
ляется в виде дистиллята продуктовый ацетон. Кубовый продукт этой
колонны — а-метилстирольная фракция — направляется на дальней-
шее разделение с целью выделения продуктового а-метилстирола
и других продуктов (на схеме не указано). Кубовый продукт колон-
ны 13 направляется в ректификационную колонну 75 для отделения
всех летучих веществ от смолы. Эта и последующие колонны рабо-
тают при остаточном давлении 9,5—13,3 кПа. Дистиллят колонны 75
поступает в ректификационную колонну 16, в которой отделяются
углеводороды от фенола. В колонне 7 7 отделяется продуктовый фе-
нол в виде дистиллята от смол.
Таким образом, совместное производство фенола и ацетона из
изопропилбензола представляет сложную систему с прямыми и об-
ратными связями. Основные рециклы в этой схеме организованы
по изопропилбензолу. Это обусловлено, с одной стороны, тем, что
в колонне окисления концентрация гидропероксида изопропилбен-
зола вследствие его взрывоопасности не должна превышать 30%.
Поэтому почти 70 % изопропилбензола находится в рецикле, обра-
зованном двумя частями: одна часть изопропилбензола, уносимая
отработанным воздухом, после конденсации возвращается в реак-
тор, а вторая часть возвращается туда же после концентрирования
гидропероксида изопропилбензола.
Другой рецикл, содержащий ацетон, обусловлен отводом теп-
ла в реакторе разложения. Испаряемый ацетон конденсируется
и возвращается в реактор. Рециклы требуют значительных затрат
энергии. Уменьшить их величину можно за счет: 1) создания усло-
вий, в которых будет получаться более концентрированный гидро-
пероксид (т. е. увеличения конверсии изопропилбензола); 2) ис-
пользования другого способа отвода тепла в реакторе 10 (например,
Глава 9. Производство фенола и auetoha ...
345
через встроенные в реактор трубы, подавая в них воздух, направля-
емый в колонну окисления).
В технологическую схему разделения можно также внести изме-
нения, направленные на сокращение энергетических затрат. В част-
ности, можно применить две ректификационные колонны вместо
трех: в первой колонне отделить углеводороды, а во второй — про-
дуктовый фенол от смол. В этом случае фенол будет испаряться
и конденсироваться только один раз вместо двух (в рассмотренной
схеме испарение и конденсация фенола происходят дважды).
В данной схеме не рассмотрена также возможность исполь-
зования тепла потоков, поскольку она является принципиальной
технологической схемой, на которой показаны только принципи-
альные технологические решения.
С экологической точки зрения при реализации кумольного ме-
тода производства фенола и ацетона возникают следующие задачи:
очистка отработанного воздуха, утилизация солей, утилизация смол,
получаемых в процессе ректификации и, наконец, утилизация вы-
водимой серной кислоты и анионита. Все эти задачи могут быть
решены, а часть уже решена в промышленности.
СОВМЕСТНОЕ ПОЛУЧЕНИЕ ФЕНОЛА, АЦЕТОНА
И ПРОПИЛЕНОКСИДА ИЗ ИЗОПРОПИЛБЕНЗОЛА
В настоящее время наиболее эффективным методом получения
пропиленоксида признан процесс эпоксидирования пропилена ги-
дропероксидными соединениями. Этим методом фирма «Oxirance»
(США) производит 1,1 млн т в год пропиленоксида, что составляет
более 30 % его мирового производства. Но в связи с увеличением
потребности в пропиленоксиде в последние годы разрабатывается
метод совместного получения фенола, ацетона и пропиленоксида.
В данном случае реализован также химический принцип «сопря-
женного» получения нескольких целевых продуктов в ходе одного
технологического процесса В этом методе часть гидропероксида
изопропилбензола (ГП) направляется на разложение с получением
фенола и ацетона, а остальная часть поступает на эпоксидирова-
ние пропилена:
С6Я5СЯ(СЯз)-2?-► С67/5СОО7/(СЯ3)2 ^СНг = СНСН^ с^снщсн^ + Н2с -'СНСЩ
| - I
Л2
9.8
346
Часть 2. Технология крупнотоннажных производств ...
Создание такого кооперированного производства фенола, аце-
тона и пропиленоксида стало возможным благодаря решению двух
основных проблем.
Во-первых, была предложена новая каталитическая система,
в которой используется модифицированный электронодонорными
лигандами (азотсодержащие соединения, спирты) пропандиолат
молибденила. Эпоксидирование гидропероксида изопропилбензо-
ла проводят в следующих условиях: температура — 115—120 °C; моль-
ное соотношение пропилен: гидропероксид изопропилбензола рав-
но 5:1; концентрации: молибденового катализатора — = 610'4 моль
на 1 моль гидропероксида, промотора — 2 моль на 1 моль катали-
затора; пропанола-2 — до 10% (мае.); продолжительность — до
90 мин. Селективность образования оксида пропилена в расчете на
прореагировавший гидропероксид изопропилбензола составляет
88—90 % (мол.), в расчете на пропилен — >98 % (мол.). Конверсия
гидропероксида изопропилбензола достигает при этом 99,5 %. В от-
сутствие промотора и пропанола-2 процесс эпоксидирования про-
пилена гидропероксидом изопропилбензола протекает с худшими
показателями.
Во-вторых, в совместном способе получения фенола, ацетона
и пропиленоксида осуществляется полная переработка побочных
продуктов эпоксидирования (диметилфенилкарбинола и ацетофе-
нона) гидрированием их до изопропилбензола и этилбензола. Изо-
пропилбензол направляется на получение фенола, ацетона и про-
пиленоксида кумольным методом, а этилбензол — на получение
стирола и пропиленоксида.
Необходимо отметить, что окисление изопропилбензола про-
текает значительно легче, чем окисление этилбензола. Поэтому
метод кооперированного производства фенола, ацетона и про-
пиленоксида должен получить достаточно широкое распростра-
нение.
Блок-схема совместного получения фенола, ацетона и про-
пиленоксида представлена на рис. 9.7. В этом процессе наиболее
полно используется сырье, изопропилбензол (ИПБ) и пропилен —
для получения целевых продуктов (фенола, ацетона и пропиленок-
сида); промежуточные побочные продукты — диметилфенилкарби-
нол (ДМФК) и ацетофенон (АФ), превращаются в изопропилбен-
зол (исходный реагент) и целевой продукт — этилбензол, который
может быть направлен на получение стирола.
Рис. 9.7. Блок-схема технологии совместного получения фенола, ацетона и пропиленоксида
Глава 9. Производство фенола и auetoha... 347
348
Часть 2. Технология крупнотоннажных производств ...
ПРИНЦИПЫ В ТЕХНОЛОГИИ ПРОИЗВОДСТВА
ФЕНОЛА И АЦЕТОНА ИЗ ИЗОПРОПИЛБЕНЗОЛА
Рассматриваемая технология относится к малостадийным
и включает два химических процесса, протекающих с высокой се-
лективностью, — окисление изопропилбензола с выходом гидропе-
роксида 91—95 % и разложение гидропероксида с выходом целевых
продуктов ~99 %. Высокая эффективность обеспечивается не толь-
ко выбором оптимальных параметров протекания химических ре-
акций (температура, давление, кислотность среды), но и использо-
ванием катализаторов и инициаторов процесса. В производстве
используется доступное и относительно дешевое сырье — изопро-
пилбензол, вырабатываемое процессами алкилирования. Данная
технология является ярчайшим примером применения сопряжен-
ных технологических процессов, позволяя одновременно получать
фенол и ацетон как два целевых продукта. Кроме того, использо-
вание при разработке принципа полноты выделения продуктов из
реакционной смеси дает возможность получать в качестве товарного
продукта а-метилстирол, который как мономер по некоторым по-
казателям превосходит широко используемый стирол.
Достижение высоких конверсий за один проход при окисле-
нии изопропилбензола невозможно из-за взрывоопасности высо-
коконцентрированных растворов гидропероксидов при повышен-
ных температурах, а также увеличения выхода продуктов ее
разложения диметилфенилкарбинола, ацетофенона, муравьиной
кислоты. Высокие степени конверсии изопропилбензола в целом
достигаются в технологии за счет применения рециркуляционного
потока по жидкой фазе реактора окисления (аппараты 2—3—4—5—
7—6—3—2 рис. 9.5), направленного со стадии концентрирования
гидропероксида на стадию окисления. Одновременно с повыше-
нием суммарной конверсии рециркуляционный поток по паровой фазе
реактора окисления обеспечивает дополнительный отвод тепла ре-
акции (аппараты 2—3—8—5—7—6—3—2 рис. 9.5). Рециркуляция аце-
тона на стадии разложения гидропероксида (аппараты 10—11—10
рис. 9.5) позволяет эффективно отводить тепло химической реак-
ции и обеспечивает оптимальные условия ее протекания. Отно-
сительно невысокие температуры потоков, охлаждающих агентов
реакторов, не дают возможности использовать их непосредствен-
но как теплоносители на стадии разделения. В то же время при-
менение для охлаждения реакторов водного конденсата позволя-
Глава 9. Производство фенола и auetoha... 349
ет в дальнейшем использовать его как питание водогрейных кот-
лов и котлов-утилизаторов и, тем самым, утилизировать низко-
потенциальное тепло.
Таким образом, при реализации технологии получения фенола
и ацетона кумольным методом нашли применение целый ряд хи-
мических и технологических принципов, что и обеспечивает высо-
кую эффективность и конкурентоспособность этого технологичес-
кого процесса.
Глава 10. Технология производства
метанола
Е Теоретические основы процесса.
Е Технологическое оформление процесса
синтеза метанола.
Б Принципы в технологии производства
метанола.
Метанол является одним из важнейших продуктов органиче-
ского синтеза. Он находит широкое применение в качестве рас-
творителя, полупродукта при производстве многих других продук-
тов (формальдегида, диметилтерефталата, метилметакрилата,
метиламина, уксусной кислоты, карбамидных смол и др.). Только
на производство формальдегида расходуется 40—50 % общего объ-
ема производства метанола. Кроме того, в последнее время мета-
нол начали широко использовать в качестве сырья для микробио-
логического синтеза белка, в качестве источника энергии, а также
для синтеза компонента моторных топлив — метилтрет-бутилового
эфира — эффективного антидетонатора. Его мировое производст-
во в 1990 г. составило =25 млн т/год.
В настоящее время производство метанола по объему занимает
7—8-е место среди остальных производств органических продуктов.
Впервые метанол был получен при сухой перегонке древесины.
В 1923 г. в Германии было пущено первое производство по синтезу
метанола из СО и Нг Синтез метанола проводили на цинкхромовом
катализаторе при температуре 400 °C и давлении 10 МПа. Аналогич-
ное производство было пущено в США в 1927 г. и в СССР в 1934 г.
Длительное время структура потребления метанола была ста-
бильна: 50 % расходовалось на производство формальдегида, по
10% — на производство диметилтерефталата и в качестве раство-
рителя, 30 % — на синтез других продуктов. Стабильный годовой
темп прироста его производства составлял 7—12 %. В последнее вре-
мя значение метанола резко возросло. Оказалось, что он может по-
мочь в решении многих острых и актуальных проблем энергетики,
экологии, обеспечения продуктами питания и т. д., так как являет-
ся универсальным энергоносителем, компонентом и сырьем для по-
лучения моторных топлив, высокооктановых добавок, источником
Глава 10. Технология произволства метанола
351
углерода для микробиологического синтеза белков, а синтез само-
го метанола является рациональным путем утилизации отходов про-
мышленности и жизнедеятельности.
В нашей стране большинство заводов (=70 %) по производству
метанола базировалось на природном газе. Пока практика показы-
вает, что он является эффективным сырьем для синтеза метанола.
Так как в настоящее время наибольшее количество метанола про-
изводится из СО и Н2, то именно этот метод мы и рассмотрим.
Все промышленные методы синтеза метанола базируются на
простой реакции
СО + 2Нг СН,ОН, - = 90,84 кДж/моль. 10.1
и различаются используемыми катализаторами и условиями про-
ведения процесса. Причем примерно до 1965 г. применяли только
процессы, протекающие при высоком давлении (25—32 МПа
и выше) на оксидных катализаторах ZnO—Cr2O2 и температуре 350—
400 °C. В настоящее время около 80% мирового производства ме-
танола осуществляется на установках, базирующихся на процессах,
которые протекают при среднем давлении (4—6 МПа) на катализа-
торах CuO—ZnO—А12О3(Сг2О3) при температуре 230—260°C. Такой
процесс имеет ряд преимуществ. В частности, обеспечивает более
высокую концентрацию метанола в метаноле-сырце — 99,6—99,8 %
(при высоком давлении - не более 93-95 %).
Промышленный синтез метанола относится к числу наиболее
отработанных гетерогенно-каталитических процессов, характе-
ризующихся достаточно высокой селективностью, технологичностью
и производительностью. В настоящее время единичные мощности
агрегатов по производству метанола доведены до 0,7—0,8 млн т/г Со-
оружаются установки мощностью 1,6 млн т/г и проектируются уста-
новки с единичной мощностью свыше 30 млн т/г.
Таким образом, производство метанола в наибольшей степени
приближено к требованиям безотходных или, по крайней мере, мало-
отходных производств, так как оно отвечает основным их принципам.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПРОЦЕССА
Реакция образования метанола из СО и Н2 является наиболее
характерным примером направленного гидрирования монооксида
углерода с сохранением связи С—Она типичных оксидных катали-
заторах. Она протекает с выделением тепла и уменьшением объе-
352
Часть 2. Технология крупнотоннажных производств ...
ма. Поэтому протеканию реакции благоприятствуют низкие тем-
пературы и высокие давления. Следовательно, равновесная кон-
центрация метанола в реакционной смеси зависит от температуры,
давления и состава газа (соотношения СО и Н2).
Кроме того, метанол образуется также по экзотермической ре-
акции
10.3
СО2з^>Н2<=>СН2ОН+Н2О, -ДЯ2°98 =49,57 кДж/моль. 10.2
Равновесный выход метанола, получаемого по реакции 10.1,
можно рассчитать по уравнению
Тсн-.ОН „ rfifco'fllz
Тсо'Тн2 Тсн-.он
где у — молярная концентрация компонентов; Р — общее давление:/— коэффици-
енты активности.
Для расчета термодинамической константы равновесия реакции
10.1 различными авторами предложен ряд уравнений. Мы в каче-
стве примера приводим уравнение Темкина и Чередниченко:
IgXp =3971/7-7,492-lgT+0,00177-T-0,311-T2 +9,218. 10.4
Константу равновесия реакции 10.2 можно рассчитать по фор-
муле X, = где Кх — константа равновесия реакции 10.1; —
константа равновесия конверсии СО.
Таблица 10.1. Влияние температуры и давления на равновесный выход
метанола
Давление, Содержание метанола в паровой фазе, % (об.)
мПа при температуре, °C
240 280 300 340 380 400
5 26.0 13.9 8,7 2,9 0.9 06
10 31.7 25.7 20.4 9,9 3.9 2.4
> 32.8 30.1 27.0 173 8.8 5.6
20 33.1 31,8 30.1 23.0 133 9 9
30 33.3 328 32.1 286 214 17.0
Значения ДЯи Кр при различных температурах для обеих реак-
ций получения метанола (значения К рассчитаны по уравнению
10.4) приведены ниже:
Глава 10. Технология производства метанола
353
25 °C 200 °C 300 °C 400 °C
Для реакции
СО + 2Н2 "----- CIhOH-.
—ДН, кДж/моль 90,03 96,55 99,23 101,32
3.44-104 2,58-10^ 3,14-Ю4 1,24-10 =
Для реакции
СОг + ЗНг СН20Н + Н20‘.
—ДН, кДж/моль 48,94 56,51 60,15 63,20
Кр 2,18-Ю1 8,89-Ю'5 6,70-106 9,79-Ю7
Данные о влиянии температуры и давления на равновесный
выход метанола приведены в табл. 10.1. С повышением температуры
в интервале 200—400 °C при давлениях 5,0—30,0 МПа равновесная
концентрация метанола и соответственно конверсия СО уменьша-
ются. Увеличение давления при постоянной температуре приводит
к росту равновесной концентрации метанола, особенно при тем-
пературах 280—400 °C.
Зависимость равновесной концентрации метанола при разной
температуре от давления представлена на рис. 10.1. С повышением
температуры равновесная концентрация метанола значительно пони-
жается, особенно резко при давлениях до 20 МПа. С повышением дав-
ления концентрация метанола растет. Следовательно, для достиже-
ния одной и той же концентрации метанола в реакционной смеси по
мере повышения температуры требуется все более высокое давление.
Равновесное содержание метанола в смеси зависит также от со-
отношения Н2: СО (рис. 10.2). С ростом этого соотношения равно-
весная концентрация метанола снижается, особенно заметно при
высоких давлениях. Необходимо также отметить, что теплота реак-
С, %(об.)
Рис. 10.1. Зависимость равно-
весного содержания метанола
в газовой смеси от давления
при разной температуре (моль-
ное соотношение Н2. СО в ис-
ходном газе 4:1)
9,8 18,6 Р, МПа
19 а.а
354
Часть 2. Технология крупнотоннажных производств ...
Рис. 10.2. Зависимость равно-
весного содержания метанола
в газовой смеси от мольного
соотношения Н2 : СО при раз-
ном давлении
ции увеличивается с ростом давления, особенно заметно в интер-
вале 10—30 МПа, достигая 112,86—114,95 кДж/ моль при давлении
30-35 МПа и температуре 275-325 °C. С повышением соотноше-
ния Н2. СО от 2:1 до 14:1 конверсия СО при 390 °C и давлении
30 МПа возрастает от 44,5 до 68 %. При этом равновесная концент-
рация метанола снижается с 17,25 до 5,4% (об.). Равновесная кон-
центрация метанола возрастает пропорционально парциальному
давлению СО в реакционной смеси. Следовательно, наличие зна-
чительных количеств инертных газов (азот, метан и др.) снижает
парциальное давление СО и, соответственно, равновесную
концентрацию метанола.
В качестве катализаторов процесса в промышленности широкое
распространение получили таблетированные цинк-хромовые ката-
лизаторы общего химического состава (1—4) ZnO- ZnCr2O4. Такие
катализаторы активны при высоких давлениях (20—30 МПа) и тем-
пературах (340—400°C). Видно, что рабочие условия каталитичес-
ких систем лежат в области температур неблагоприятных для про-
текания реакции с термодинамической точки зрения. Поэтому
процесс проводят при высоких давлениях. Невосстановленные ка-
тализаторы содержат 50—60 % ZnO, 25—30 % Сг2О3, 1—17 % графита
и 8—10% воды. В качестве промоторов используются оксиды А1,
Th, Zr, Та, V, Fe, Са, Mg. По типу действия промоторы делятся на
внутрикристаллические (входящие в кристаллическую решетку
ZnO, например, Fe, Са, Mg) и межкристаллические (например,
Сг2О3). Производительность промышленных катализаторов по ме-
танолу составляет 1—2 кг/л ч.
Устойчивость и срок службы катализаторов в значительной сте-
пени зависят от соотношения Н2.СО. Так как срок службы цинк-
хромовых катализаторов составляет 4—6 мес. при соотношении
Н2: СО=(3— 4): 1 и от одного года до двух лет при Н2: СО=(Ю—12): 1.
Глава 10. Технология производства метанола
355
В последние годы широкое распространение получили низко-
температурные катализаторы. К их числу относятся медьцинкхро-
мовые (СиО, ZnO и Сг2О3) и медьцинкалюминиевыс (СиО, ZnO,
А12О2) катализаторы. Типичные современные катализаторы такого
типа содержат 25—90 % Си и 8—60 % Zn или 30—80 % Си и 10—50 %
Zn. В качестве промотирующих добавок используют Cr, Al, Мп, V,
Ag. Медьцинковые катализаторы работают при давлении 5-10 МПа
и температуре 220—270 °C. В России для синтеза метанола исполь-
зуют катализатор СНМ-1 состава 52—54% СиО, 26—28 % ZnOw 5—
6 % Д/2О3 (до восстановления), который активен при давлении 4—
6 МПа и температуре 220—280 °C. Очень высокой активностью
обладают образцы низкотемпературного катализатора следующего
состава: СиО— 71,0%, ZnO— 25,8% и Сг2О3 —3,2%; наиболее акти-
вен такой катализатор при давлении 3—4 МПа.
Выбор давления в указанных диапазонах определяется тем-
пературой, составом синтез-газа и заданной производитель-
ностью, а температуры — активностью катализатора и конструк-
цией реактора.
Избыток водорода по сравнению со стехиометрическим по-
зволяет повысить скорость реакции, улучшить качество метанола-
сырца и ограничить содержание инертных компонентов.
Конверсия синтез-газа за один проход через реактор состав-
ляет 15—50 % и обусловливается равновесием реакции образования
метанола в выбранных условиях, продолжительностью контакта
и допустимым перепадом температуры по слою катализатора, при
адиабатическом режиме процесса. Для определения коэффици-
ента рециркуляции М.М. Караваевым предложена следующая
формула:
“cm = “F (1 + Ф)/[1 + Ф(1-%)Со]- Ю-5
где Ф - коэффициент рециркуляции; ист - суммарная конверсия СО,
uF- конверсия СО за один проход; с0, ^-концентрации СО во входящем
и отходящем газе после конденсации метанола и воды, % (мол.).
Рециркуляция выгодна с точки зрения экономики процесса, а
также позволяет регулировать тепловой режим реактора и состав
синтез-газа.
До 1975 г. считалось, что реакция образования метанола из син-
тез-газа на оксидных катализаторах протекает через стадию обра-
зования поверхностного формиатного комплекса:
356
Часть 2. Технология крупнотоннажных производств ...
zno н-с---до----н нг
со+н2 ----► \ / ----► СН3ОН
Znb—о
т. е. непосредственно из СО (см. реакцию 10.1).
Однако учеными Института нефтехимического синтеза РАН
им. А. В. Топчиева в 1973—75 гг. был предложен и экспериментально
доказан различными методами принципиально новый механизм
синтеза метанола из оксидов углерода и водорода. Согласно ему на
оксидных катализаторах метанол образуется только из диоксида уг-
лерода и водорода. Диоксид углерода может присутствовать в ис-
ходной газовой смеси или образовываться при конверсии оксида
углерода водяным паром. Поэтому протекают две реакции:
конверсия СО СО+**-_> СО2 + Н2 10.6
к3
синтез метанола СО2 + ЗН2 < ^ > СН20Н + Н2О 10.7
*4
При этом наблюдается рецикл по воде: вода образуется во вто-
рой реакции и расходуется в первой. Поэтому синтез метанола из
СО и Н2 трактуется как циклическая реакция, аналогичная цепным
реакциям, отдельные микростадии которой представляют гетеро-
генно-цепные процессы.
Следовательно, совокупность этих реакций может быть пред-
ставлена схемой:
Н1° >СО2< ЪИ- >СН.ОН 10.8
2' н2о 3
Главными особенностями данной схемы являются окислитель-
но-восстановительный характер синтеза метанола и его цик-
личность: процесс протекает благодаря переносу кислорода мо-
лекулами Н2О между СО2 и СО. Вода, образующаяся по реакции
10.7, потребляется на стадии конверсии СО по реакции 10.6. Сле-
довательно, образование метанола из СО и Н2 происходит только
через промежуточную стадию конверсии водяным паром СО в СО2.
Вместе с тем схема 10.8 не является универсальной и, по-ви-
димому, не реализуется на металлических (Со, Ni, Fe, Rh, Ru, Pd, Pt
и др.) катализаторах.
Кинетические исследования показали, что вторая стадия — вос-
становление СО2 — сильно тормозится водой, в результате чего по-
рядок реакции по водяному пару приближается к минус единице.
Глава 10. Технология производства метанола
357
Установление нового механизма получения метанола из СО и
Н2 через промежуточное образование СО2 позволило предложить и
новый механизм получения метанола из СО2 и Н2. В этом случае
также протекают две реакции:
----^СН3ОН+Н2О
+зн2
СО2 ---
10.9
+н2
—^СО+Н2О
Таким образом, для наиболее важных промышленных медь-
содержащих катализаторов и для газовых смесей Н2, СО, СО2 само-
го разного состава (от смеси, в которой преобладает СО, до смеси,
не содержащей СО) доказано, что синтез метанола протекает по од-
ному и тому же макроскопическому механизму путем восстановле-
ния СО2 и сопровождается реакцией конверсии СО водяным па-
ром. Поэтому газовые смеси СО, СО2 и Н2 самого разного состава
могут быть использованы как сырье для производства метанола.
Основное различие в эффективности процессов синтеза мета-
нола из газовых смесей разного состава и на различных катализа-
торах обусловлено только кинетическими факторами. Полная ки-
нетическая модель процесса, осуществляемого при давлениях
5—10 МПа, имеет достаточно громоздкий вид. Но она может быть
аппроксимирована с хорошей точностью достаточно простыми вы-
ражениями:
для реакции 10.6:
W1 = ^1 ’ ^СО ’ Рн2О /(?«, + ^3 ' Рц2О +^1 Ло, ’^Н2о}’ 10.10
для реакции 10.7:
W2 = &2 ’ ?Н2 ’ /(-^СОг + *3 ’ ?H2O + ^4 ’ ^СО2 ’ ^Н2О )' 10.11
где w, - скорость реакции 10.6; w2 - скорость реакции 10.7; Р- парциаль-
ное давление.
Из установленных кинетических закономерностей вытекает
возможность существенного повышения производительности за
счет выбора условий, диктуемых кинетическими уравнениями (вы-
сокие концентрации Н2 и СО2) и подбора оптимальных условий ра-
боты катализатора на различных отрезках времени.
358
Часть 2. Технология крупнотоннажных производств ...
Исходя из термодинамики и кинетики процесса выбирают ус-
ловия его проведения на соответствующих катализаторах.
Так, в промышленных условиях на цинкхромовых катализаторах
процесс ведут под давлением 25—70 МПа, при температуре 370—
420°С, объемной скорости подачи газовой смеси 10000—35000 час-1
и мольном соотношении Н2: СО= (1,5—2,5): 1. Обычно исходный
газ содержит 10—15 % инертных примесей. В связи с этим требует-
ся непрерывный вывод части рецикла газовой смеси (~ 10 %) из си-
стемы. В этих условиях конверсия СО за один проход составляет
5—20 % при выходе метанола 85—87 % от стехиометрического. Не-
превращенный газ возвращается в реактор после конденсации ме-
танола и воды. Одновременно с метанолом образуется ряд побоч-
ных продуктов: диметиловый эфир, высшие спирты и др.
При работе на низкотемпературных медьсодержащих ката-
лизаторах давление поддерживается в пределах 3—5 МПа, тем-
пература — 230—280°С, объемная скорость 8000—12000 час1, моль-
ное соотношение Н2: СО—(5—7): 1. Обязательным условием
успешной работы низкотемпературных катализаторов является
присутствие в газовой смеси 4—5 % (об.) диоксида углерода. Он
необходим для поддержания активности таких катализаторов.
Срок службы катализатора при выполнении этого условия дости-
гает 3—4 лет.
Рассматривается возможность осуществления синтеза метанола
в гомогенном варианте в мягких условиях и с высокой селективно-
стью. В частности, по аналогии с оксосинтезом можно проводить
гидрирование СО в присутствии карбонилов кобальта при темпе-
ратуре 200 °C и давлении 30 МПа. Новый процесс получения мета-
нола из СО и Н2, базирующийся на карбонилах родия, протекает
при давлении 0,1—2 МПа и температуре 150—220 °C. В качестве ка-
тализатора могут также использоваться Pt и 1г, а также их карбо-
нильные кластеры, нанесенные на основные оксиды (MgO, СаО,
ZnO и др.).
Используя /^-катализаторы, полученные нанесением комп-
лексов общей формулы M2PdCl^ (М— щелочной металл или NH^
на SiO2, А12О2, алюмосиликат или цеолит Nal, можно проводить
селективный синтез метанола из СО и Н2 при давлениях ниже
атмосферного. Применение таких катализаторов дает возмож-
ность снизить температуру процесса, что в свою очередь умень-
шает энергетические затраты, а также повышает селективность
процесса.
Глава 10. Технология производства метанола
359
ТЕХНОЛОГИЧЕСКОЕ ОФОРМЛЕНИЕ ПРОЦЕССА
СИНТЕЗА МЕТАНОЛА
Исходный газ, используемый для синтеза метанола, очищают от
масла, серы, карбонилов железа и других примесей. Для осуществ-
ления синтеза метанола используют реакторы разной конструкции.
Так, реакторы высокого давления представляют собой цельнокова-
ные аппараты колонного типа, в которых катализатор размещается
на полках (5—6 шт.). Причем оптимальным режимом считается изо-
термический. Достижение такого режима зависит от конструкции
насадки колонны. Тем не менее, общим недостатком всех использо-
ванных насадок является то, что реальный режим отличается от изо-
термического. В связи с этим используют комбинированный вари-
ант реактора: сочетание полочной насадки с дополнительным
отводом тепла в верхней части колонны с помощью двойных трубок
(трубок Фильда). Этот вариант реактора обеспечивает режим, наи-
более приближающийся к изотермическому.
При синтезе метанола в аппаратах колонного типа при низ-
ких давлениях температурный режим поддерживают, главным об-
разом, подачей холодного газа. Таким образом, отвод тепла про-
изводится не только с помощью рециркуляционных газов, но и
с помощью выносных и встроенных теплообменников. Для пуска
используется встроенный электрообогреватель. Следовательно,
в реакторах низкого давления может использоваться тот же прин-
цип размещения катализатора и отвода тепла, что и в реакторах
высоких давлений.
Фирмой «Lurgi» (ФРГ) разработан реактор трубчатого типа,
в трубках которого располагается катализатор и идет процесс, а
в межтрубное пространство подается паровой конденсат для отво-
да тепла. При этом образуется пар давлением до 4 МПа. В таком
реакторе температура синтез-газа в трубном пространстве выше
температуры конденсата на 10—12 °C в начале зоны реакции и на
3—5 °C — в конце зоны реакции. В полочных реакторах этот пере-
пад составляет 30—35 °C, т. е. наблюдается большее отклонение от
изотермического режима. По технологии фирмы «Lurgi» метанол
производят также под давлением 5 МПа и температуре 250—280 °C.
В настоящее время создаются установки по производству ме-
танола больших единичных мощностей (1500—2000 т/сутки) на ос-
нове энерготехнологического принципа, позволяющего мак-
симально использовать как тепло реакции, так и энергию потоков.
360
Часть 2. Технология крупнотоннажных производств ...
Действующие установки, работающие по методам различных
фирм, отличаются составом исходного сырья, катализаторами,
а также использованием тепла реакций. В способе фирмы 1CI (Ан-
глия) процесс проводится при давлении 5—10 МПа и применяет-
ся синтез-газ, в котором Я2: СО близко к стехиометрическому.
Единичная мощность установки доходит до 1800 т/сутки. Эконо-
мическая эффективность достигается за счет не только низкого
давления, но и утилизации тепла отходящих газов (с получением
технологического пара) и исключением установки очистки син-
тез-газа от СО2. При этом получается товарный метанол концент-
рации 99,85 %. В качестве примесей в нем содержатся главным об-
разом этанол и ацетон.
В последнее время японскими фирмами разработаны и ис-
пользуются установки, в которых метанол получают при средних
давлениях 10—15 МПа. Данная технология характеризуется высо-
кой степенью утилизации тепла, легкостью поддержания темпера-
туры в реакторе и равномерным распределением теплового потока
по слою катализатора в радиальном и аксиальном направлениях.
Синтез проводят с использованием медьцинкхромовых катализа-
торов при температуре 240—310 °C и синтез-газа, в котором соот-
ношение Н2: (СО+ С(?2) = 2,4—2,7:1.
В качестве сырья для производства синтез-газа используют при-
родный газ, нефтезаводские газы, сжиженный газ, нафту.
Рассмотрим несколько принципиальных технологических схем
производства метанола, отличающихся типом реактора.
Схема синтеза метанола с выносным холодильником в колон-
не применяется, если создаются установки малой и средней еди-
ничной мощности (рис. 10.3). Исходный газ, очищенный от кар-
бонилов железа и масла, а также осушенный, смешивается
с циркуляционным газом и поступает в реактор 4. При этом ос-
новная часть исходного газа (80—85 %) поступает в нижнюю часть
колонны синтеза для охлаждения корпуса и предотвращения во-
дородной и карбонильной коррозии. Затем этот поток нагревает-
ся в теплообменнике 5 до температуры реакции (=300—330 °C) ре-
акторной парогазовой смесью и далее поступает в реактор, пройдя
электроподогреватель 6. Остальная часть исходного газа (20—25 %)
вводится между слоями катализатора в верхнюю часть колонны
для поддержания постоянной температуры в слоях катализатора
в 300-330 °C.
Глава 10. Технология произволства метанола
361
Рис. 10.3. Технологическая схема получения метанола с выносным
холодильником:
1,2 — фильтры: 3 — компрессор; 4 — реактор; 5 — кожухотрубный теплообменник;
6 — электроподогреватель; 7 — конденсатор; 8,9— сепараторы; 10 — сборник;
I— исходный газ; II — метанол-сырец; III — отдувочные газы; IV—газы;
V — вода
Реакторная парогазовая смесь после охлаждения в теплооб-
меннике 5 до температуры 120—140 °C поступает в холодильник-
конденсатор 7, где она охлаждается до температуры 30—40 °C. Из
охлажденной парогазовой смеси конденсируется часть компонен-
тов. Газожидкостная смесь далее поступает в сепаратор 8, где ос-
новная часть жидкости отделяется от газа. Оставшаяся часть жид-
кости отделяется от газа в сепараторе 9. Конденсат из сепараторов 8
и 9 собирается в сборнике 10, из которого отводятся также раство-
ренные газы. Несконденсированные газы вновь компрессором 3 на-
правляются в реактор 4. Часть этих газов (III) выводится из систе-
мы, чтобы в ней не накапливались инертные газы. Основной
недостаток этой схемы заключается в том, что в ней плохо исполь-
зуется тепло реакции и потоков.
Схема синтеза метанола в реакторе колонного типа приведена
на рис. 10.4. В этом случае в реакторе предусмотрено совмещение,
а именно, катализатор, теплообменник и электроподогреватель на-
ходятся в одной упаковке. При этом циркулирующий газ обдувает
корпус колонны и поступает в теплообменник, расположенный в
нижней части колонны. Электронагреватель вмонтирован в цент-
ральную трубку насадки колонны. Заданный температурный режим
поддерживается с помощью холодного газа. Однако отвод тепла мо-
жет осуществляться и посторонним теплоносителем с получением
водяного пара в котле-утилизаторе. Такой вариант более предпо-
чтителен с точки зрения создания безотходных производств.
362
Часть 2. Технология крупнотоннажных производств ...
Рис. 10.4. Технологическая схема синтеза метанола в реакторе колонного
типа:
1,2 — фильтры; 3 — реактор; 4 — конденсатор; 5, 6 — сепараторы; 7 — компрессор;
8 — сборник; I — исходный газ; II — метанол-сырец; III — отдувочные газы; IV — га-
зы; V - пар.
Рис. 10.5. Технологическая схема синтеза метанола с использованием
котла-утилизатора:
1,9 — компрессор; 2 — реактор; 3, 5 — рекуперационные теплообменники; 4 — ко-
тел-утилизатор; 6 — воздушный холодильник; 7 — сепаратор; 8 — сборник; I — ис-
ходный газ; II — метанол — сырец; III — отдувочные газы; IV — газы; V — пар
В крупных агрегатах синтеза метанола температуру в слое ка-
тализатора обычно регулируют посторонним теплоносителем.
В этом случае можно использовать большое количество низкопо-
тенциального тепла, установив теплообменники (котлы-ути-
лизаторы) между газовым теплообменником колонны и конден-
сатором. Примером такого решения является технология фирмы
BASF (ФРГ), схема которой представлена на рис. 10.5. В ней ис-
пользуются единичные агрегаты мощностью до 240 тыс. т в год, а в
качестве сырья — легкий бензин. В данную технологическую схему
введен котел-утилизатор для получения пара за счет тепла реак-
торных газов, выходящих из реактора 2 после теплообменника 3.
Следовательно, газ проходит три ступени теплообмена и поступает
в воздушные холодильники-конденсаторы 6.
В последнее время широкое распространение получила тех-
нология, базирующаяся на низкотемпературных катализаторах
и осуществляемая при пониженных давлениях (5—10 МПа). Общие
подходы к созданию технологии в этом случае в целом сохраняют-
ся. Технология является компактной и высокоэффективной
(рис. 10.6). Особенностью является необходимость тщательной очи-
стки исходного газа от каталитических ядов (серы, хлора и др.). Для
регулирования соотношения реагирующих компонентов в синтез-
газ добавляется в необходимых количествах газ с высоким содер-
жанием водорода. Данную технологию можно использовать для
Глава 10. Технология производства метанола
363
Рис. 10.6. Технологическая схема производства метанола при низком
давлении (с использованием реактора колонного типа):
1,11 — компрессоры; 2 — фильтр; 3 — сепаратор; 4 — сборник; 5, 6 - воздушные
холодильники-конденсаторы; 7, 8 — теплообменники; 9 — электроподогреватель;
10 — реактор; I — исходный газ; II — метанол-сырец; III — продувные газы; IV — газы
получения метанола и из природного газа, предварительно очис-
тив его от каталитических ядов. Вместе с тем в данном случае сла-
бо реализуется принцип использования энергии потоков. В част-
ности, воздушные холодильники не позволяют использовать тепло
охлаждаемых потоков. Оно расходуется на нагрев воздуха.
При использовании в этой схеме трубчатых реакторов об-
легчается не только отвод теплоты реакции, но и за счет этой теп-
лоты получается технологический пар, так как реактор од-
новременно является котлом-утилизатором. Однако такие реакторы
большой единичной мощности создавать трудно (рис. 10.7).
Удельный расход природного газа в разных вариантах технологии
мало отличается. Основное различие — степень очистки газа. Перевод
Рис. 10.7. Технологическая схема
синтеза метанола при низком
давлении (с использованием
трубчатого реактора):
1,7 — компрессоры; 2 — теплообмен-
ник; 3 — реактор; 4 - паросборник;
5 — холодильник; 6 — газосепаратор;
I — исходный газ; II — метанол-сырец;
III — продувные газы; IV — вода;
V - пар
364
Часть 2. Технология крупнотоннажных производств ...
производства метанола на низкотемпературные катализаторы позво-
лил снизить давление в 4—8 раз. Однако при этом значительно увели-
чивается объем реактора. Экономически целесообразно комбиниро-
вать производство метанола с другими производствами, например
производством аммиака. При переходе к теплоэнергетическим схе-
мам себестоимость метанола-ректификата снижается в 1,5 раза. С уве-
личением единичной мощности агрегатов от 40 до 750 тыс. т в год се-
бестоимость метанола-ректификата снижается на 38,2 %. Приведенные
затраты в разных схемах отличаются в пределах 30 %. Одним из путей
повышения технико-экономических показателей производств мета-
нола большой единичной мощности может быть создание техноло-
гии с использованием высокотемпературной конверсии метана при
давлении 5—15 МПа на низкотемпературных катализаторах.
В метаноле-сырце главными примесями являются диметиловый
эфир и вода, в целом же в нем обнаружено около 50 органических
кислородсодержащих соединений разных классов. Общее содержа-
ние микропримесей обычно меньше 1 % (мае.) в основном это спир-
ты С2— С6. К метанолу-ректификату предъявляются высокие регла-
ментируемые требования. Высший сорт Первый сорт
Внешний вид Бесцветная прозрачная жидкость без
взвесей
Плотность с/д20 Интервал температур: 0,791 -0,792
кипения, °C 64,0 -65,5
перегонки продукта, °C <0,8 <1,0
Испытание с КМпОд (перманганатная проба), мин Содержание, % (мае.): >60 >30
воды <0,05 <0,08
свободных кислот (в пересчете <0,0015 <0,0015
на муравьиную кислоту) альдегидов и кетонов (в пересчете на ацетон) <0,003 <0,008
то же (на формальдегид) Не нормируется <0,005
летучих соединений железа (в пересчете на <0,00001 <0,0005
железо)
аммиака и аминосоединений (в пересчете на <0,00001 Не нормируется
аммиак) хлора <0,00001 Должен выдерживать
серы <0,00001 качественный анализ
нелетучего остатка <0,001 0,002
этанола <0,01 Не нормируется
Удельная электрическая проводимость, Ом-’см-1 <3-10-7 Не нормируется
Смешиваемость с водой
Смешивается с водой без следов
помутнения и опалесценции
Глава 10. Технология производства метанола
365
Исходя из этих требований разрабатывается технология разде-
ления метанола-сырца. В ней используется не только ректифика-
ция, но и химическая доочистка метанола от непредельных соеди-
нений и даже адсорбция. Наиболее распространенной является че-
тырехколонная технологическая схема ректификации метанола-
сырца (рис. 10.8). В метаноле-сырце содержится от 2 до 6% (мае.)
диметилового эфира, поэтому последний может быть выделен как
товарный продукт. Сам диметиловый эфир в настоящее время ис-
пользуется только в парфюмерной промышленности как замени-
тель азоноразрушающих фреонов в аэрозольных упаковках. Одна-
ко в 1995 г. группа известных нефтеперерабатывающих и газопере-
рабатывающих компаний Amoco Со., Haldor Topsoe A/S, AVL
Powertrain Engineering, Inc., Navistar International Transportation Co. на
Рис. 10.8. Технологическая схема ректификации метанола-сырца:
1—5 — ректификационные колонны; I — метанол-сырец; II - раствор щелочи;
III — диметиловый эфир; IV — вода; V — промежуточная фракция; VI — КМпО*,
VII — метанол-ректификат; VIII — кубовый остаток; IX — спирты
366
Часть 2. Технология крупнотоннажных производств ...
международном конгрессе и выставке в Детройте анонсировала
новое экологически чистое дизельное топливо — диметиловый
эфир. Уже в 1996 г. диметиловый эфир упоминался в зарубежной
печати не иначе, как дизельное топливо XXI века. Использова-
ние его в дизельных двигателях приводит к понижению эмиссии
оксидов азота NO*, практически безсажевому горению и сниже-
нию шума двигателя.
В соответствии с современными разработками получение ди-
метилового эфира реализуется в реакционных аппаратах близких по
конструкционному оформлению к аппаратам синтеза метанола,
с использованием модифицированных каталитических систем.
Практически существующая технология получения метанола может
быть переориентирована на целевое производство диметилового
эфира. Так же как и при производстве метанола основным факто-
ром, ограничивающим конверсию исходного сырья за один проход,
является высокий тепловой эффект реакции. Существенным обра-
зом должны отличаться подсистемы выделения продуктов из цир-
куляционных газов, поскольку метанол и вода могут быть достаточно
просто отделены от газов конденсацией. В случае ориентации про-
цесса на получение диметилового эфира это может оказаться затруд-
нительным из-за высокой летучести последнего и большого разбав-
ления конденсируемых продуктов инертными газами.
В метаноле-сырце содержатся также кислоты, поэтому предва-
рительно его обрабатывают 7—8 %-ным раствором NaOH для нейт-
рализации органических кислот.
Диметиловый эфир выделяется в колонне 1, имеющей 40 таре-
лок, в качестве дистиллята. Метанол-сырец в колонну 1 подается
на 13—17-ю тарелку. Процесс выделения диметилового эфира ве-
дется под давлением 0,7—1,2 МПа (такое давление определяется
температурой конденсации эфира и возможностью использования
оборотной воды для этой цели). Флегмовое число в колонне 1 ко-
леблется от 6 до 8. Одновременно с эфиром в этой колонне отделя-
ются растворенные газы и частично пентакарбонил железа. В ко-
лонне 2 происходит отделение компонентов или азеотропных
смесей, имеющих температуры кипения ниже, чем метанол, и
в колонну 2, имеющую 65 тарелок, исходная смесь подается на 39
тарелку. Для того чтобы легче отделить примеси в виде азеотропов
с водой, исходная смесь подается в верхнюю часть колонны 2 (на
61 тарелку). В виде дистиллята отгоняется так называемый «пред-
гон» в количестве 0,40—0,85 % (мае.) от питания колонны.
Глава 10. Технология производства метанола
367
Кубовая жидкость колонны 2 перед подачей в следующую ко-
лонну предварительно обрабатывается водным раствором перман-
ганата калия для окисления легкоокисляемых примесей. После это-
го смесь подается на 19—20-ю тарелку колонны 3, которая имеет
75 тарелок. Метанол-ректификат отбирается несколько ниже,
а верхний поток, содержащий легколетучие примеси, направляет-
ся на перманганатную обработку, так как кроме метанола содер-
жит непредельные углеводороды. В нижней части колонны 3 (на
5—10 тарелках) скапливаются спирты С2— С6, поэтому с одной из
тарелок отбирается фракция, которая подается в колонну 4. Из куба
колонны 3 отводятся тяжелокипящие примеси. В колонне 4 про-
исходит отделение метанола-ректификата в виде верхнего продук-
та. Общее число тарелок в колонне 4 — 65, флегмовое число — 4—6,
исходная смесь подается на 20 тарелку. Кроме того, с тарелок 7—10
отбирается гетерогенная смесь, состоящая в основном из воды
и спиртов С2—С6. Эта смесь разделяется в сосуде 5: верхний
слой (преимущественно спирты С2—С6) выводится из сосуда, а ниж-
ний (водный слой) возвращается в колонну 4 примерно на 19 та-
релку. Из куба колонны 4, так же как и из колонны 3, выводятся
тяжелокипящие примеси.
ПРИНЦИПЫ В ТЕХНОЛОГИИ ПРОИЗВОДСТВА
МЕТАНОЛА
Процесс имеет одну химическую стадию, в качестве исходного
сырья используется доступное и дешевое сырье — синтез-газ, обла-
дает достаточно высокой эффективностью (выход метанола 85—87 %
от стехиометрического). Высокая конверсия за один проход не мо-
жет быть достигнута из-за термодинамических ограничений и вы-
сокого теплового эффекта реакции. Практически конверсия СО за
один проход составляет 15—20 %.
Обеспечение высокой суммарной конверсии достигается за счет
рециркуляции исходных компонентов в непрерывном процессе. От пра-
вильно выбранной величины рецикла зависят качество получаемого
метанола, а также энергетические и капитальные затраты, так как
процесс проводится при высоких давлениях и температурах. Одно-
временно рецикловые потоки служат и промежуточными хладаген-
тами. Высокие температура и тепловой эффект позволяют прибли-
зить процесс к энерготехнологическим и, использовав практически
полностью энергию системы, реализовать его не только как процесс
368
Часть 2. Технология крупнотоннажных производств ...
с низким энергопотреблением, но и как процесс, обеспечивающий
выработку энергии. Отсутствие в технологическом решении про-
мывных абсорберов и использование воды только в замкнутом цик-
ле обеспечивает минимальный ее расход. Интенсивно применяется
энергия отходящих потоков высокого давления (газы сдувки рецик-
ла). На этой линии целесообразно устанавливать турбодетандеры
или использовать энергию газов для привода компрессоров. Зна-
чительно экономят энергию паровые турбокомпрессоры для цир-
куляции газа и отказ от компрессии исходного синтез-газа за счет
его получения и очистки при давлении, необходимом для синтеза
метанола. Наконец, процесс производства метанола является наи-
более выраженным примером реализации технологий и аппаратов
большой единичной мощности. Применяются аппараты и технологи-
ческие линии большой единичной мощности (уже действуют до
2,6 млн т/год, проектируются до 30 млн т/год).
Таким образом, в существующих технологических установках
по производству метанола из СО, СО2 и Н2 уже реализованы мно-
гие принципы создания безотходных производств.
Глава 11. Производство кислородсодержащих
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
МЕТОДОМ ОКСОСИНТЕЗА
Б Теоретические основы
процесса оксосинтеза.
Б Технологическое оформление процесса.
Б Принципы в технологии оксосинтеза.
В отрасли основного органического и нефтехимического синте-
за мировое производство кислородсодержащих соединений дости-
гает нескольких миллионов тонн в год. Большую роль в производ-
стве этих продуктов в последние четыре десятилетия играет процесс
оксосинтеза. Он основан на реакции взаимодействия ненасыщен-
ных углеводородов, в частности, олефинов с оксидом углерода
и водородом с образованием альдегидов, имеющих на один атом
углерода больше, чем в исходном олефине:
R-CH-CH3
R—CH^CHi+CO+Hi—r СНО п !
r-ch2-ch2cho
В 1929 г. Д. Смитом было обнаружено при изучении реакции
Фишера—Тропша, что добавка этилена к смеси СО и Н2 увеличивает
выход кислородсодержащих соединений. Реакция гидроформили-
рования была открыта О. Роеленом в 1938 г. Первая же в мире про-
мышленная установка по оксосинтезу была пущена в 1952 г. Бур-
ное промышленное развитие этот процесс получил в 1960-е годы.
Уже к концу 1963 г. мировое производство продуктов оксосинтеза
составило 540—560 тыс. т/год, а к 1974 г. мощности установок воз-
росли почти до 5 млн т/год. В СССР промышленное производство
было организовано в 1965 г., а уже к 1975 г. их производство воз-
росло в 1,6 раза и в последующие годы непрерывно наращивалось.
Большой вклад в создание технологии оксосинтеза в нашей стране
внесли сотрудники ВНИИНефтехима под руководством Д. М. Руд-
ковского.
Основными промышленными продуктами, вырабатываемыми
по этому методу, являются бутанолы и масляные альдегиды, из ко-
370
Часть 2. Технология крупнотоннажных производств ...
торых получают 2-этил гексанол (более 1,5 млн т/год; он применя-
ется для получения пластификаторов), высшие алифатические
спирты — изооктиловый, нониловый, изодециловый, тридецило-
вый, а также смеси спиртов С7— С8 и С6— С10 (1,3—1,4 млн т/год; по-
следние используются для получения поверхностно-активных ве-
ществ, синтетических мсющих средств, эмульгаторов, присадок
к маслам, парфюмерных препаратов и т.д.). Причем такие поверх-
ностно-активные вещества (алкилсульфаты и этоксилаты) быстро
разлагаются биохимически в сточных водах. Кроме того, методом
оксосинтеза получают пропионовый альдегид (из этилена
и синтез-газа), который широко используется для производства
«-пропилового спирта, пропионовой кислоты и других продуктов
органического синтеза.
Таким образом, процесс оксосинтеза в настоящее время стал
основным методом получения кислородсодержащих соединений
(альдегиды, спирты, кислоты, эфиры и др.). Быстрые темпы роста
выпуска продуктов оксосинтеза обусловлены следующими основ-
ными факторами:
❖ универсальностью (при одинаковой организации процесса
можно получать различные альдегиды или спирты с длиной
углеводородной цепи от С3 до CIS);
<$> доступностью сырья (наряду с синтез-газом можно использо-
вать этилен, пропилен, бутилен, димеры, тримеры и тетраме-
ры пропилена, а-олефины, сополимеры пропилена и бутиле-
на и др.);
❖ технико-экономические показатели процесса более благопри-
ятны, чем при использовании других методов производства
аналогичных продуктов.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПРОЦЕССА ОКСОСИНТЕЗА
Промышленный процесс оксосинтеза, как правило, включает
пять основных технологических стадий:
О Получение активной формы катализатора. В случае ко-
бальтовых катализаторов - кобальтизация — образование ката-
лизатора (карбонила кобальта) из металлического кобальта или
его солей.
© Гидроформилирование — взаимодействие ненасыщенных угле-
водородов (например, олефинов) с СО и Я,.
Глава 11. Производство кислородсодержащих соединений ... 371
© Разложение катализатора до металлической или другой фор-
мы. В случае кобальтовых катализаторов — декобальтизация —
разложение карбонилов кобальта и регенерация кобальта.
О Разделение продуктов оксосинтеза с целью выделения целевых
альдегидов и спиртов. Эта стадия может предшествовать ста-
дии дегидрирования, если целевыми продуктами являются аль-
дегиды, или последует за ней, если целевыми продуктами яв-
ляются спирты.
© Гидрирование альдегидов в спирты (при необходимости).
Важнейшей и ключевой стадией процесса оксосинтеза является
стадия гидроформилирования, которая протекает на карбонилах
металлов (кобальта, родия, иридия, рутения, железа, марганца)
и определяет основные технико-экономические показатели различ-
ных технологических схем его осуществления.
Особенностью гидроформилирования олефинов (за исключе-
нием этилена) является образование продуктов как нормального,
так и изостроения. Следовательно, реакция протекает как по пра-
вилу Марковникова, так и против него.
В условиях как гомогенного, так и гетерогенного катализа ре-
акция гидроформилирования протекает с участием «/-электронной
оболочки переходных металлов. В частности, карбонильные ком-
плексы переходных металлов представляют собой богатые энерги-
ей соединения с лабильными электронными связями.
За время существования процесса оксосинтеза было предложено
множество различных вариантов его механизма. Однако механизм
взаимодействия субстрата (карбонилируемого соединения) с ката-
лизатором (гидридами комплексов переходных металлов) оказался
сложным и до сих пор точно не установленным. Более того, неясно,
является ли он диссоциативным или ассоциативным. Вместе с тем
установлено, что:
❖ комплексные катализаторы обладают электронно-акцепторны-
ми свойствами;
❖ каталитическая реакция на них может протекать либо по дис-
социативному (стадийному), либо по ассоциативному (слит-
ному) механизму;
< $> каталитический акт может начинаться с образованием л- или
сг-связи между металлом комплекса и субстратом.
Механизм реакции гидроформилирования на родиевых ката-
лизаторах в интерпретации Уилкинсона и сотрудников представ-
372
Часть 2. Технология крупнотоннажных производств ...
V
Rh
Ph/
w
н
R
CO II
CO
VI
Н
VII
co co
H
Ph/ | CO Ph/ Ph/ | CO
Rh'' "*—
Ph/| 4 CO
Ph/
XIII
Rh'
Ph/' 4 CO
IV
,R
H Xl
Ph/ р СО
СО
Ph/ СН£Н/
'Rhx
co' 'co
I w
Ph/
ph/ I снрн/
'Rh''
co' 'co
VIII
III
Hs 71/
Rh'
Ph/ '
-HCI fl
H
Ph/ I H
Rh
Ph/ pCI
CO
H x"
Ph/ I H
Rh
рьзР Гсоснрн/
- СОСН2СН/ CO
Ph/ CO
'Rhx
Ph/ ''Cl
IX
H2 Ph/ COCH2CH/
' 'Rh''
CO' ' Ph/
|+co
Ph/ X
Ph/ I COCHjChy
'Rhx
co' 'co
Рис. 11.1. Механизм реакции оксосинтеза, катализируемый фосфиновы-
ми комплексами родия. Указан только маршрут, ведущий к неразветвлен-
ным альдегидам
лен на рис. 11.1. Он включает в себя ассоциативный (комплекс!
IV—XI—VIII) и диссоциативный (комплексы V—VI—VII—VIII) мар
шрут. Вклад каждого из них зависит от равновесия между соеди
нениями XIII, IV, V. При избытке трифенилфосфина равновеси
между комплексами V и IV сдвинуто в стороны последнего и пре
обладает ассоциативный механизм. Он обеспечивает высокую се
лекгивность по отношению к альдегидам неразветвленного стро
ения. Это происходит из-за стерических затруднений, вызываемы
трифенилфосфильными лигандами. Экспериментальные данны
об экстремальной зависимости скорости реакции от концентраци
Глава 11. Производство кислородсодержащих соединений ... 373
PPh3 в растворе (с повышением концентрации PPh3 скорость про-
ходит через максимум) хорошо соответствуют механизму, включа-
ющему в себя каталитически неактивный комплекс XIII. Олефи-
новые комплексы VI и IX быстро превращаются в алкильные VII
и VIII. Вслед за этим происходит стадия внедрения СО. Затем об-
разовавшийся плоский квадратный комплекс IX претерпевает окис-
лительное присоединение Н2 с образованием координационно-на-
сыщенного комплекса XII. Последними стадиями являются
перенос еще одного атома водорода к углеродному атому ацильной
группы в XII и восстановительное элиминирование с выделением
альдегида и регенерацией комплекса III. Иногда наблюдаемое при
избытке СО ингибирование реакции связано с образованием ком-
плекса X.
Механизм гидроформилирования на кобальтовых катализато-
рах исследован в меньшей степени, но очевидно, что эти механиз-
мы сходны (рис. 11.2). В статических условиях кривая накопления
СО R
СОч I ||
Со^
со' | СО
н
со
со I
'со^
со' | СО
н
+ RCHCHO
I
СНз
соч I
4 Со^
со' | СО
CH3CHR
со
соч I
Со^
со' | СО
COCHR
I
СНз
СО
СО I
'со^
со' | СО
СН-РНД
| со
со
соч I
Со^
со' I со
COCHPHjR
| н2
со
соч I
Со^
со' | СО
н
+ нсоснрну*
Рис. 11.2. Механизм оксосинтеза, катализируемого немодифицирован-
ными карбонильными комплексами кобальта
374
Часть 2. Технология крупнотоннажных производств ...
альдегидов в реакционной массе имеет индукционный период, что
связано с процессами накопления и разрушения алкильных и
ацильных комплексов в реакционной массе (рис. 11.3).
Рис. 11.3. Кинетические кривые реакции стехиометрического гидрофор-
милирования и-гексена (температура — 10°С; парциальное давление СО -
0,11 МПа; исходная концентрация н-гексена — 3,5 ммоль/г, растворитель -
гептан):
1 - НСо(СО)А; 2 - алкилкарбонилы; 3 - ацилкарбонилы; 4 - альдегиды; 5 - сум-
марное количество кобальтсодержащих соединений
Факторы, ускоряющие реакцию (понижение парциального дав-
ления СО, повышение температуры и парциального давления
Н2), способствуют увеличению выхода альдегидов изостроения.
Факторы, замедляющие реакцию (повышение парциального дав-
ления СО и понижение температуры), напротив, способствуют уве-
личению выхода альдегидов «-строения.
Побочные продукты реакции гидроформилирования образуют-
ся из альдегидов. В первую очередь это спирты, образующиеся
в результате гидрирования альдегидов (реакция 11.2). Альдегиды
также могут вступать в реакцию кротоновой конденсации или аце-
тализации (реакции 11.3, 11.4); а также сложноэфирной кон-
денсации (реакция 11.5):
RCHO + Я2 -> RCH2 ОН 11.2
RCHO+ R'CH2CHO-> RCH=C(R')CHO + Н2О 11.3
RCHO + 2RCH2OH-> RCH(OCH2R)2 + H2O 11.4
2RCHO -> RCOOCH2R 11.5
Глава 11. Производство кислородсодержащих соединений ... 375
Кроме того, могут образовываться продукты уплотнения аль-
дегидов. Обычно выход побочных продуктов не превышает 10—20 %.
Практически все процессы переработки синтез-газа протекают
в присутствии катализаторов на основе переходных металлов, спо-
собных активировать инертные молекулы СО и Нг
Как уже отмечалось, в промышленности используется три типа
гомогенных катализаторов на основе переходных металлов: карбо-
нилкобальтовый без модификаторов; карбонилкобальтовый, моди-
фицированный фосфинами; карбонилродиевый, модифицирован-
ный фосфинами. Немодифицированные родиевые катализаторы не
нашли промышленного применения из-за трудности их отделения,
так как они используются в малых количествах. В результате работ
Н.С. Имянитова и Д. М. Рудковского установлено, что каталитичес-
кая активность карбонилов металлов VIII группы в реакции гидро-
формилирования изменяется следующим образом (в скобках указа-
на относительная активность, а стрелки указывают направление
увеличения активности).
Fe ------► Со ◄----- Ni
(КГ6) (1) (0)
1 I I
Ru ------► Rh •«---- Pd
(К)’2) (Ю3) (-)
t t t
Os ------► lr ------ Pt
(IO3) (101) (-)
Хотя эти данные относительны, а модифицирование карбони-
лов, например фосфинами, позволяет повысить активность и се-
лективность карбонильных комплексов, экспериментальные дан-
ные по активности различных переходных металлов в реакциях
гидроформилирования подтверждают значительно более высокие
активности Со и Rh. Активность переходных металлов в этой реак-
ции уменьшается в ряду:
Rh > Со > Ru > Мп > Fe > Cr,Mo,W,Ni
104 1 IO’2 КГ* КГ*
376
Часть 2. Технология крупнотоннажных производств ...
Как уже отмечалось, каталитические свойства в реакции гид-
роформилирования карбонильные комплексы проявляют в виде
гидридов карбонилов переходных металлов, которые в случае кар-
бонилов кобальта образуются по реакции
2Со + 8СО^±Со2(СО\^=±2НСо(СО)4 11.6
Гидрид карбонила кобальта — белое кристаллическое вещество,
которое плавится при температуре 26 °C. Выше этой температуры
он довольно быстро разлагается и чрезвычайно токсичен. Следо-
вательно, основной недостаток гидридов карбонильных комплек-
сов переходных металлов (в том числе кобальта) — их низкая ста-
бильность. Гидрид карбонила кобальта в растворе сохраняется при
температуре 200 °C (режим гидроформилирования) лишь при дав-
лении 10 МПа. При более низком парциальном давлении СО он
разлагается.
Гидроформилирование — гомогенно-каталитический процесс,
основная реакция которого протекает в присутствии соединений
кобальта или родия — дикобальтоктакарбонила Со2(СО)8 или гид-
рида тетракарбонила кобальта НСо(СО\. В литературе по оксо-
синтезу приняты названия карбонил кобальта и гидрокарбонил
кобальта.
Эти комплексы являются нестабильными. В отсутствие оксида
углерода дикобальтоктакарбонил разлагается при температуре выше
51 °C, а гидрокарбонил кобальта — при температуре ниже 0°С. Их
стабильность при повышенных температурах может быть обеспе-
чена только при высоком парциальном давлении оксида углерода.
Вместе с тем к преимуществам карбонилкобальтовогб ката-
лизатора можно отнести простоту его получения, доступность ис-
ходного сырья, достаточно высокую активность и суммарную се-
лективность по альдегидам; к недостаткам — недостаточную
термическую стабильность, невысокую селективность по альде-
гидам нормального строения.
Кроме того, если проводить гидроформилирование на немо-
дифицированных карбонилах кобальта, то гидрирование альдегидов
в спирты приходится осуществлять в виде самостоятельной стадии
в присутствии подходящего катализатора гидрирования.
Модифицированные же, например фосфинами, карбонилы ко-
бальта являются весьма активными катализаторами в реакции гид-
рирования. Поэтому они позволяют в одном аппарате осуществ-
лять реакции гидроформилирования и гидрирования:
Глава 11. Производство кислородсодержащих соединений ... 377
RCH = СН2 + СО+2Н2О /ICo,co>^h^^> >RCH1CH1CH1OH 11.7
(где Л - С6-С13).
Кроме того, эти катализаторы позволяют получать продукты
с более высоким соотношением и/изо-альдегидов (8:1) по срав-
нению с ^модифицированными катализаторами. Повышение се-
лективности по отношению к продуктам нормального строения
объясняют стерическим эффектом объемного фосфинового лиган-
да, проявляющимся в переходном состоянии.
Стабильность модифицированных кобальтовых катализаторов
также упрощает их извлечение из продуктов реакции и повторный
возврат в реакционную зону, например простой отгонкой альдеги-
дов и спиртов.
Введение в гидридный комплекс лигандов (фосфинов, фосфи-
тов, арсинов, стибнинов и др.) значительно повышает его стабиль-
ность. Это обусловлено тем, что замена СО, например на фосфи-
новый лиганд, обладающий меньшей ^-акцепторной способностью,
приводит к увеличению электронной плотности на металле и, сле-
довательно, к упрочнению связей между металлом и оставшимися
группами СО. При этом активность модифицированного катали-
затора, в том числе и кобальтового, в реакции гидроформилирова-
ния снижается, но усиливается его гидрирующая способность к вос-
становлению альдегидов до спиртов.
Поиски селективных катализаторов реакции гидроформили-
рования продолжаются в трех направлениях:
О увеличение суммарного выхода целевых продуктов (альдеги-
дов или спиртов);
© увеличение выхода продуктов нормального строения;
© понижение температуры и давления процесса.
Эти цели могут быть достигнуты в результате модификации ка-
тализатора гидроформилирования, при которой происходит заме-
щение части групп СО на соответствующий лиганд:
Со2 (С0\ +nL^> Со2 (C0)g_n nL + пСО
или 1/2Со2(СО)8_л nL + \/2H2 ^НСо(СО\_п/1 -n/2L. 11.8
Скелет лиганда имеет общую формулу АВ3, где А — фосфор, мы-
шьяк и сурьма, а В — алкил или арил.
По сравнению с традиционным кобальтовым катализатором
модифицированные катализаторы имеют следующие преимуще-
378
Часть 2. Технология крупнотоннажных производств ...
ства: позволяют увеличить суммарный выход целевых продуктов
и одновременно продуктов неразветвленного строения; процесс
протекает при более низком давлении; обладают повышенной гид-
рирующей способностью. Доля реакции гидрирования на модифи-
цированных катализаторах составляет от 5 до 16 %, при этом не об-
разуются ацетали, что объясняется более слабыми кислыми
свойствами этих катализаторов по сравнению с немодифицирован-
ными. Наблюдается значительное снижение скорости гидрофор-
милирования: для системы карбонилы кобальта + трибутил фосфин
скорость примерно в 175—250 раз ниже, чем на ^модифицирован-
ном катализаторе. Поэтому, несмотря на повышение температуры
процесса со 110—140 до 180—200 °C, скорость будет в 5—6 раз ниже,
чем на немодифицированном катализаторе.
Вместе с тем модифицированные кобальтовые катализаторы
обладают рядом недостатков: при их использовании значительная
часть (10—15%) олефина гидрируется в соответствующий алкан;
в реакции гидроформилирования наблюдается более низкая актив-
ность, чем на немодифицированных кобальтовых катализаторах; так
в присутствии НСо(СО\ при температуре 145 °C гидроформилиро-
вание идет в 5 раз быстрее, чем на HCotCOj^RPhJ при 180 °C.
Большей активностью обладают модифицированные родиевые
катализаторы, например катализатор HRh(CO)(PR3\ активен при
комнатной температуре. В его присутствии наиболее легко гидро-
формилируются а-олефины нормального строения.
Существенным недостатком гомогенных катализаторов гид-
роформилирования как модифицированных, так и немодифици-
рованных является чувствительность к повышению температуры
выше экстремальной и сложность отделения от продуктов реакции
и регенерации.
Что касается родиевых катализаторов, то при всех их пре-
имуществах существенным недостатком является их высокая стои-
мость, так как родий дороже золота и примерно в 1000 раз дороже
кобальта. Поэтому потеря металла в 1 мг на 1 кг оксопродукта, допу-
стимая для кобальта, уже недопустима для родия (особенно, учиты-
вая отсутствие ресурсов родия). Одним из путей решения этой про-
блемы (сохранения катализатора) является их иммобилизация:
химическое связывание комплекса переходного металла на поверх-
ности нерастворимого носителя. Гидроформилирование в этом слу-
чае можно проводить в реакторах со стационарным слоем катализа-
тора. При этом активность и селективность катализатора практически
Глава 11. Произволство кислородсодержаших соединений ... 379
сохраняются на том же уровне, что и в случае гомогенных систем.
Наиболее изученными носителями для подобных катализаторов яв-
ляются оксид алюминия, силикагель и перекрестносшитые полисти-
рольные смолы, содержащие фосфиновые группы.
Как и в обычных гетерогенных катализаторах, в этих системах
лимитирующей стадией процесса чаще всего является диффузия ре-
агентов к катализатору и в нем, а также продуктов реакции из него
и от него. Необходимо иметь в виду, что катализаторы на полисти-
рольных подложках нередко подвержены набуханию за счет проник-
новения растворителя в полимерную матрицу. Однако это явление
может оказаться весьма полезным, так как приводит к повышению
скорости диффузии реагентов и продуктов. Но оно может вызвать
и разрушение гранул иммобилизованного катализатора.
При использовании оксидных носителей такого набухания не
наблюдается, а диффузия протекает в пористой структуре носителя.
Поэтому силикагель и оксид алюминия более перспективны.
Металлокомплексные катализаторы для гидроформилирования
могут иметь и гетерогенную структуру. В этом случае катализатор-
ные комплексы переходных металлов закрепляются на поверхнос-
ти твердых носителей. В качестве носителя, как было отмечено, ис-
пользуются различные типы глинозема, цеолита типа CoNaA,
силикагель, полистирол и др. Такая гетерогенизация гомогенных
каталитических комплексов имеет определенные преимущества:
О упрощает отделение продуктов реакции от катализатора;
© позволяет широко варьировать лигандный состав комплекса
независимо от растворимости лигандов;
© приводит к увеличению концентрации активных центров на
поверхности носителя за счет исключения химических реак-
ций между комплексными соединениями в растворе.
К тому же такие катализаторы обладают большой селектив-
ностью (однородность активных центров) и высоким КПД (высокая
насыщенность поверхности действующими активными центрами)
по сравнению с обычными твердофазными катализаторами. Для
процесса гидроформилирования гетерогенный катализатор полу-
чают химически — взаимодействием силикагеля с полистиролом,
связанным через фосфиновые лиганды с родиевым комплексом.
Эффективность этих катализаторов зависит от следующих фак-
торов: характера связи металл—лиганд; вида связи металл—субст-
рат (иногда лиганд—субстрат); электростатического взаимодейст-
вия комплекса переходного металла с субстратом и носителем (если
380
Часть 2. Технология крупнотоннажных произволств ...
последний имеется); легкости образования промежуточного ката-
литического комплекса; стехиометрического взаимодействия ком-
плекс — субстрат.
Наконец, необходимо отметить, что установлены высокие ак-
тивность и селективность катализаторов, полученных при взаи-
модействии PtCl1L1 (L — третичный фосфин) с SnCl2. Предполага-
ется, что в такой системе активным катализатором является гид-
рид карбонила платины (II) - HPt(SnCl3)(CO) (R3P), активность ко-
торого в 5 раз выше активности модифицированного кобальтового
катализатора. Но этот катализатор пока не нашел широкого
применения.
Реакция гидроформилирования может протекать практически
при атмосферном давлении, однако процесс проводят при повы-
шении давления. Это обусловлено необходимостью не только ста-
билизировать катализатор, но и повысить скорость образования
альдегидов, увеличить выход альдегидов нормального строения.
Вместе с тем повышение парциального давления оксида углерода
увеличивает скорость реакции гидроформилирования лишь до
определенного значения. В то же самое время, дальнейшее повы-
шение влечет за собой не только снижение скорости реакции, но и
скорости образования гидрокарбонила кобальта. Снижение скоро-
сти реакции гидроформилирования при повышении парциального
давления СО сверх необходимого для устойчивости карбонила
и гидрокарбонила кобальта объясняется уменьшением скорости ре-
акции НСо(СО\ .... НСо(СО)3 + СО и увеличением скорости
реакции Со2(СО)1 + СО Со2(СО\.
Повышение парциального давления водорода всегда приводит
к увеличению скорости реакции гидроформилирования. При ра-
боте на синтез-газе, содержащем равные объемы СО и Н2, в широ-
ком интервале давления скорость реакции гидроформилирования
не зависит от общего давления.
Повышение давления увеличивает выход альдегидов нор-
мального строения до определенного значения; имеется макси-
мальное значение давления (определяемое главным образом тем-
пературой процесса), до которого растет выход альдегидов
нормального строения. Дальнейшее повышение давления вызывает
снижение выхода продуктов с прямой цепью (рис. 11.4,а).
Минимальная температура реакции гидроформилирования —
50—60 °C. По мере повышения температуры скорость реакции быс-
тро возрастает: в интервале 90—140 °C — в 100 раз.
Глава 11. Производство кислородсодержащих соединений ... 381
Причем до 180 °C температурный коэффициент в уравнении
Аррениуса остается постоянным, а при температурах выше 180 °C —
уменьшается.
Для кобальтового катализатора наблюдаемая энергия активации
при температуре 110—165 °C и давлении, достигающем 15 МПа, равна
96,4 кДж/моль, а для родиевых катализаторов — 28,5 кДж/моль. Вме-
сте с тем повышение температуры приводит к интенсификации по-
бочных реакций: гидрирования исходного олефина, кротонизации и
альдолизации и др., а также к увеличению выхода продуктов изостро-
ения (рис. 11.4,6). Поэтому при использовании обычных кобальтовых
катализаторов стремятся работать в интервале температур 120—150 °C.
Р, 141а
Рис. 11.4. Зависимость соотношения выходов продуктов нормального
и изостроения от давления (а) и температуры (б)
Таким образом, соотношение альдегидов нормального и изо-
строения изменяется в зависимости от условий проведения реакции:
факторы, замедляющие реакцию гидроформилирования (повыше-
ние парциального давления СО и понижение температуры), спо-
собствуют росту этого соотношения, а факторы, ускоряющие реак-
цию (повышение температуры и парциального давления Н2),
способствуют его снижению.
В качестве растворителя в процессе оксосинтеза могут ис-
пользоваться алифатические и ароматические углеводороды, спир-
ты, а также образующиеся в ходе процесса высококипящие побоч-
ные кислородсодержащие продукты. Также пытались использовать
алифатические эфиры, нитрилы, ангидриды органических кислот,
кетоны, сложные эфиры, лактаны, лактамы и др. Однако при этом
были получены разноречивые результаты. Так, было установлено,
что скорости гидроформилирования пропилена в толуоле и в кубо-
382
Часть 2. Технология крупнотоннажных производств ...
вом остатке (т. е. в высококипящих кислородсодержащих вещест-
вах) близки между собой. Растворитель не только изменяет ско-
рость химической реакции, но и влияет на фазовое равновесие
в системе, гидродинамику и массоперенос. Поэтому выбирать рас-
творитель необходимо не только с учетом изменения скорости хи-
мической реакции, но и возможности последующего его отделе-
ния от продуктов реакции. Достаточно точно известно, что
в полярных растворителях скорость гидроформилирования выше,
чем в углеводородах. Кроме того, добавка воды к растворителям
подавляет конденсацию альдегидов, но при этом уменьшает ско-
рость основной реакции. Последний факт необходимо учитывать
при разработке технологии разделения продуктов гидроформи-
лирования пропилена,
Растворители улучшают условия протекания основной реакции
и транспортировку катализатора. Поэтому растворитель, отвечая
всем требованиям по отношению к основной реакции, не должен
взаимодействовать с продуктами синтеза и образовывать азеотро-
пы с ними, так как иначе значительно усложнится разделение про-
дуктов синтеза. Поэтому лучше выбирать в качестве растворителей
вещества, присутствующие в продуктах синтеза.
В процессе оксосинтеза чаще всего используют исходный газ
с соотношением СО.Н2, равным 1:1. Содержание инертов в газе
может быть до 10%. Примеси же окислительного свойства (кис-
лород, пероксиды), а также СО2 и вода разрушают катализатор.
Аммиак в небольших количествах ускоряет реакцию, а при кон-
центрациях выше 0,5—0,8 % конверсия олефина резко падает.
Ингибирующее действие оказывают диеновые и ацетиленовые уг-
леводороды, поэтому исходный газ предварительно очищают от
этих примесей.
ТЕХНОЛОГИЧЕСКОЕ ОФОРМЛЕНИЕ ПРОЦЕССА
В процессе оксосинтеза с получением альдегидов независимо
от применяемого катализатора существуют три стадии:
О приготовление активной формы катализатора;
© образование альдегидов — гидроформилирование;
© отделение продуктов синтеза от катализатора или его регене-
рация.
Основной стадией является вторая стадия, так как именно
здесь образуются целевые продукты. Однако, как в любом жид-
Глава 11. Производство кислородсодержащих соединений ... 383
кофазном процессе, самой трудной является третья стадия. Имен-
но она имеет наибольшее разнообразие в технологическом оформ-
лении и чаще всего определяет всю технологическую схему оксо-
синтеза. Эти стадии не всегда проводят в разных аппаратах.
Имеются технологические схемы, в которых две стадии объеди-
нены в одном аппарате.
Возможность такого объединения зависит от исходного со-
стояния катализатора, его устойчивости при высоких температурах,
качества олефина и других факторов.
В настоящее время существует три основных типа оформления
процесса оксосинтеза, отличающихся применяемыми катализа-
торами:
О Классический оксосинтез, в котором гидроформилирование
протекает в присутствии карбонилов кобальта при температу-
рах 140-180°C и давлении 20-35 МПа. Эта технология исполь-
зуется фирмами «Ruhrchemic» (ФРГ) и «BASF» (ФРГ), а также
в нашей стране.
© Процесс, протекающий в присутствии модифицированных ко-
бальтовых катализаторов при температурах 150—200 °C и дав-
лении 5—10 МПа, Такая технология используется фирмами
«Shell» (США) и «Mitsubishi» (Япония).
© Процесс, протекающий на модифицированных родиевых ка-
тализаторах. В этом случае основная реакция протекает при
температуре 100 °C и давлении 0,7-2,5 МПа. Такая схема ис-
пользуется фирмой «Union Carbide» (США).
Технологические схемы оксосинтеза отличаются, главным об-
разом, способами получения активной формы катализатора и его
возврата в реактор гидроформилирования после отделения от про-
дуктов синтеза.
На рис. 11.5 представлены технологические схемы реакторных
узлов процесса оксосинтеза при использовании различных катали-
заторов. Так, на рис. 11.5,а представлена триадная схема. При ор-
ганизации процесса по такой схеме каждая стадия протекает в сво-
ем аппарате: в аппарате 1 (катализере) получается активная форма
катализатора, в аппарате 2 (реакторе) проводится реакция гидро-
формилирования, в аппарате 3 (декатализере) происходит разложе-
ние гидрокарбонила кобальта до металлического Со. Все аппараты
работают при одинаковом большом (20—35 МПа) давлении. Две ко-
лонны (катализер и декатализер) заполнены стационарной насад-
384
Часть 2. Технология крупнотоннажных произволств ...
Рис. 11.5. Технологические схемы реакторных узлов процесса оксосинтеза:
а — триадная схема (7 - катализер; 2 — реактор; 3 - декатализер); б — экстракцион-
но-солевая схема (7 — карбонилообразователь; 2 —реактор; 3 — окислительно-
экстракционный узел); в — испарительно-солевая схема (/ — карбонилообразователь;
2 — реактор; 3 — окислительная колонна; 4 - испарительная колонна); г — испари-
тельная схема (1 — реактор; 2 — испарительная колонна)
кой (пемзой), а реактор — пустотелая барботажная колонна, снаб-
женная охлаждающим устройством. По мере исчерпания кобаль-
та катализер заменяется на декатализер и наоборот. Основными
недостатками триадной схемы являются: большие капитальные за-
траты и необходимость переключения аппаратов, а следователь-
но, и потоков. На основе триадной схемы можно создать схемы,
в которых катализер объединяется с реактором. Такие варианты
позволяют сократить энергетические затраты, но при этом труд-
но подобрать оптимальные условия проведения кобальтизации
и гидроформилирования.
Глава 11. Производство кислородсодержащих соединений ... 385
На рис. 11.5,5 представлена принципиальная технологическая
схема, получившая название «солевой», в которой гидрокарбонил
кобальта превращается в соли кобальта. Примером такой схемы мо-
жет служить нафтенатная схема. Из жидкой реакционной массы
экстрагируют водным раствором пероксида водорода и серной кис-
лоты кобальт, который переходит в водный слой в виде сульфата.
Далее водный слой обрабатывают солью нафтеновой кислоты и по-
лучают нафтенат кобальта
Со+ Н2О2 + H2SO, -> CoSO, Co(OOCR)2 . 11.9
Нафтенат кобальта отделяют от водного раствора и направляют
в катализер. Серную и нафтеновую кислоты можно заменить на ук-
сусную кислоту и получать карбонилы кобальта из ацетата кобальта.
Имеется и другая разновидность солевой схемы — испаритель-
но-солевая (рис. 11.5,в). В этом случае реакционная масса окисля-
ется воздухом при температуре 40—70 °C и давлении 0,2—0,4 МПа
в отсутствие кислот. При этом часть альдегида окисляется до пер-
кислоты, которая в свою очередь окисляет кобальт в соль соответ-
ствующей кислоты. Эта соль является практически нелетучей и рас-
творимой в тяжелокипящих побочных продуктах или специальных
растворителях. Поэтому продукты синтеза относительно легко от-
гоняются от раствора соли кобальта. Последний возвращается в ко-
бальтизер для получения гидрокарбонила кобальта. Эта схема при-
обретает все большее значение при получении относительно
легколетучих альдегидов и спиртов.
Испарительная схема особенно предпочтительна при исполь-
зовании достаточно стабильных к разложению модифицированных
кобальтовых и особенно родиевых катализаторов (рис. 11.5,г). В этом
случае схема значительно упрощается, так как не требуется приме-
нение специальных методов стабилизации катализатора. При сни-
жении давления отгоняются продукты оксосинтеза, а катализатор-
ный раствор возвращается для проведения гидроформилирования.
Технологические схемы классического оксосинтеза отличаются в ос-
новном стадией декобальтизации. Наибольшее распространение име-
ют схемы оксосинтеза с термической декобальтизацией. Вместе с тем
эта технология характеризуется сложностью и трудоемкостью по
приготовлению, восстановлению, транспортировке и регенерации
катализатора, цикличностью и сравнительно невысокой произво-
дительностью в расчете на объем реакционного пространства аппа-
ратуры высокого давления.
13 я-б
386
Часть 2. Технология крупнотоннажных производств ...
Существуют следующие основные варианты технологии ок-
сосинтеза с термической декобальтизацией:
1. Технология со стационарным катализатором. К этой техно-
логии относится диадная схема, в которой в первом реакторе про-
исходит образование гидрокарбонила кобальта из металлического
кобальта, нанесенного на пемзу, и процесс гидроформилирования,
а во втором реакторе, также заполненном пемзой, происходит де-
кобальтизация. По мере исчерпания кобальта в первом реакторе ка-
тализер и декатализер меняются своими функциями. В триадной
схеме, как уже отмечалось, каждая из операций протекает
в отдельном реакторе. В этом случае аппарат, в котором образуется
гидрокарбонил кобальта, и аппарат, в котором происходит разло-
жение гидрокарбонила кобальта по мере исчерпания кобальта в пер-
вом аппарате, также меняются своими функциями. И наконец, су-
ществуют технологические схемы, в которых используется раствор
катализатора с малым содержанием Со (менее 0,02 %) в сырье.
В этом случае отпадает необходимость в регенерации кобальта, так
как потеря кобальта не оказывает сильного влияния на себестои-
мость целевого продукта. (При такой концентрации кобальта на его
долю приходится 5 % от себестоимости готовой продукции). В этом
случае значительно упрощается технология оксосинтеза. Однако
и в этой схеме предусматривается декобальтизация, так как в про-
тивном случае продукты оксосинтеза будут загрязнены кобальтом.
2. Технология с движущимся носителем (кизельгуром). В этой тех-
нологии кобальт вводится в реактор в виде суспензии. Такая схема
называется схемой с суспензированным катализатором. В этом слу-
чае кобальт, осажденный на кизельгуре, отделяется от жидких про-
дуктов в магнитном сепараторе и возвращается в первый реактор.
Основным недостатком этой технологии является сильная эрозия
аппаратуры и запорной арматуры. Чтобы избежать этого, предло-
жено вводить металлический кобальт в виде суспензии тонкодис-
персного порошка в растворителе.
3. Солевые схемы. В данной технологии оксосинтеза кобальт
вводят в реактор в виде раствора или суспензии солей жирных или
нафтеновых кислот в воде или органическом растворителе. Выде-
ление катализатора проводят обработкой жидких продуктов реак-
ции в декобальтизере окислителем в присутствии кислот.
По технологии фирм «BASF» (ФРГ) и «Ruhrchemic» (ФРГ) ко-
бальт вводят в реактор в виде раствора ацетата кобальта, а извлече-
ние кобальта из продуктов реакции осуществляют с использовани-
Глава 11. Производство кислородсодержащих соединений ... 387
ем муравьиной или уксусной кислот. В процессе фирмы «Mitsubishi»
(Япония) кобальт вводят в виде соли лауриновой кислоты, а для
декобальтизации используют водный раствор азотной кислоты. От-
личительной особенностью технологии фирмы «Kuhlmann» (Фран-
ция) является использование соды для перевода гидрокарбонила
кобальта в водорастворимую соль при декобальтизации.
4. Испарительные и смешанные схемы. В этой технологии оксо-
синтеза продукты реакции отгоняют от нелетучего Со2(СО)8, солей
органических кислот или трифенилфосфинового комплекса.
Более перспективной является технология оксосинтеза, сов-
мещающая принципы солевых и испарительных схем. Такая тех-
нология по нафтенатно-испарительной схеме используется фирмой
«Shell» (США) с модифицированным кобальтовым катализатором.
Карбонилы кобальта переходят в термостабильную нелетучую фор-
му и после отгонки продуктов реакции возвращаются в реактор гид-
роформилирования .
По аналогичной схеме осуществлен процесс оксосинтеза фир-
мой «Union Carbide» (США) с использованием модифицированного
родиевого катализатора.
Однако испарительные схемы целесообразно использовать при
получении низкотемпературных продуктов синтеза, так как испа-
рение требует больших затрат. Кроме того, желательно подбирать
растворитель, который бы не переводился в паровую фазу.
Технико-экономические показатели основных процессов ок-
сосинтеза приведены в табл. 11.1.
Как уже отмечалось, технологическая схема узла, включающего
получение активной формы катализатора, гидроформилирование и
регенерацию катализатора, зависит от типа катализатора и общей ле-
тучести продуктов оксосинтеза. Структура технологической схемы
разделения продуктов оксосинтеза зависит от свойств всех исходных
компонентов (в том числе и растворителя) и продуктов оксосинтеза.
Мы рассмотрим вопросы разделения только на примерах разделе-
ния продуктов оксосинтеза пропилена, направленного на получе-
ние как масляных альдегидов, так и бутиловых спиртов.
Разделение в значительной степени зависит от двух факторов:
1) выхода изомерных альдегидов и спиртов, 2) наличия различных
растворителей и реакционной активности компонентов (альдегидов
и спиртов), а следовательно, присутствия продуктов уплотнения
(продуктов альдольной конденсации и других реакций). В качестве
растворителя рекомендуется использовать толуол, бутиловые спир-
388
Часть 2. Технология крупнотоннажных производств ...
Таблица 11.1. Технико-экономические показатели основных промышленных
процессов оксосинтеза
Показатели С немодифицированным Со-катализатором Фирмы
ВНИИНефте- хим ВНИИНефте- хим (с рециклом) "Shelf "Union Car- bide"
Катализатор нстсоу. НЩСО)! НСо(СО),. Я&Н) HRh(COi , Р[РЬ}ч
Температура. ’С 120-160 120-130 160-200 60-120
Давление, МПа Концентрация катализатора, 20-35 20-35 5-10 0.7-2,5
% (мае.) 0,1-0,5 0,1-0,3 0,6 001-0,10
Продукты реакции Соотношение продуктов Альдегиды и спирты Альдегиды Спирты Альдегиды
н/изо Выход продуктов на 1 т пропилена, кг: масляный альдегид+ 80:20 80:20 88:12 92:8
бутиловый спирт 1185 1310 1390 1330
изобутиловый спирт Селективность процесса, %: от теоретического в расчете на выход 305 320 150 140
продуктов н-строения суммарный выход ШШшЯ
целевых продуктов 87 96 90 86
ты, продукты уплотнения и др. Ниже приведены свойства компо-
нентов, входящих в продукты оксосинтеза, подлежащие разделению:
Компоненты Температура кипения, °C Растворимость в воде (20°C), г/100 гНгО
Изомасляный альдегид 64,2 6,72
н-Масляный альдегид 74,4 7,50
Изобутиловый спирт 108,0 9,00
н-Бутиловый спирт 117,5 7,90
Толуол 110,6 0,045
Вода 100,0 —
Глава 11. Производство кислородсодержаших соединений ... 389
Необходимо отметить, что применение бутиловых спиртов в
качестве растворителя может привести к увеличению количества
продуктов уплотнения вследствие их взаимодействия с альдегида-
ми, но упрощает разделение, так как бутиловые спирты присутст-
вуют в исходной смеси. При использовании продуктов уплотнения
в качестве растворителя при разделении может также увеличивать-
ся их количество за счет взаимодействия продуктов оксосинтеза при
высоких температурах в кубах колонн. Применение же толуола
в качестве растворителя значительно осложняет разделение продук-
тов оксосинтеза вследствие образования азеотропов толуола с бу-
тиловыми спиртами (табл. 11.2).
Таблица 11.2. Азеотропные смеси в продуктах оксосинтеза пропилена
Система Температура кипения, °C Состав азеотропа, % (мае.)
1 2
Изомасляный альдегид (1) — вода (2) 60,2 89,1 10,9
н-Масляный альдегид (1) вода (2) 68 4 94 4 56
Изобутиловый спирт (1) вода (2) 89,8 67,0 33 0
н-Бути ловый спирт (1) вода (2) 92.7 57 5 42 5
Толуол (1) вода'2) 84.1 604 19,6
Изобутиловый спирт (1) — толуол (2) 100,5 44,5 55 5
я- Бутиловый спирт (1J толуол 12) 105,3- 32,0. 68 0
Рассмотрим технологии разделения продуктов оксосинтеза с
различными растворителями.
Растворитель — толуол. В.Ю. Ганкиным и Т.Г. Гуревичем рас-
смотрена технология разделения по нафтеновой схеме с раствори-
телем — толуолом. Принципиальная технологическая схема ректи-
фикации альдегид содержащего продукта представлена на рис. 11.6.
В колонне 1 из продуктов гидроформилирования выделяются
масляные альдегиды в виде дистиллята. Они могут быть направле-
ны на гидрирование. Однако нафтенатно-испарительная схема эф-
фективна в тех случаях, когда установка оксосинтеза работает
в комплексе с установкой по производству 2-этилгексанола из мас-
ляного альдегида. Поэтому смесь альдегидов направляется в колон-
ну 2 для разделения альдегидов. Кубовый продукт колонны 1, со-
держащий толуол, нафтенат кобальта и образовавшиеся на стадии
гидроформилирования кислородсодержащие продукты, включая
390
Часть 2. Технология крупнотоннажных производств ...
Рис. 11.6. Технологическая схема ректификации альдегидсодержащего
продукта:
1—6 — ректификационные колонны; I — изо-масляный альдегид; II - н-масляный
альдегид; III — газы; IV — бутиловые спирты; V — спирто-толуольная смесь; VI — рас-
твор нафтенатов кобальта; VII — высококипящие кислородсодержащие соединения;
VIII — толуол; IX — смесь изо-бутилового спирта и толуола; X - исходная смесь
бутиловые спирты, направляется в колонну 3. В качестве дистил-
лята этой колонны выводится смесь бутиловых спиртов и толуола
(так называемая «спирто-толуольная головка»), а в виде бокового
погона выводится толуол. Спирто-толуольная головка делится в ко-
лонне 4 на азеотропную смесь изобутилового спирта и толуола (от-
бирается через верх колонны), а сырые бутиловые спирты отбира-
ются в виде кубовой жидкости колонны 4. Сырые бутиловые спирты
смешиваются с изомасляным альдегидом и направляются на гид-
Глава 11. Производство кислородсодержащих соединений ... 391
рирование. Такая суммарная переработка облегчает получение бу-
тиловых спиртов высокого качества.
Толуол, выделяемый в колонне 3, дополнительно очищается
в колонне 6 от примесей бутиловых спиртов. Выделяемые при
этом бутиловые спирты возвращаются на стадию гидроформили-
рования в качестве растворителя. Кубовый продукт колонны 3 по-
ступает в колонну 5, в которой в виде дистиллята отбираются ос-
татки бутиловых спиртов и толуола, подаваемого в линию питания
колонны 3. В качестве бокового погона из колонны 5 отбираются
высококипящие побочные кислородсодержащие продукты гидро-
формилирования, которые могут быть подвергнуты дальнейшей
переработке с целью извлечения содержащихся в них ценных про-
дуктов, например октиловых спиртов, или направлены на сжига-
ние. Из куба колонны 5 выводится раствор нафтената кобальта
в высококипящих побочных продуктах, который возвращается на
стадию образования карбонилов кобальта. Таким образом осуще-
ствляется рецикл кобальтового катализатора в нафтенатно-испа-
рительной схеме. Для предотвращения накапливания в цикле цир-
куляции кобальта смолообразных высококипящих продуктов часть
раствора нафтената кобальта, выводимого из колонны 5, отводится
на регенерацию.
Основные рециклы (из колонны 5 в колонну 3 и из колонны 6
в колонну 4) обусловлены наличием различных азеотропов толуо-
ла с бутиловыми спиртами (см. рис. 11.6 и табл. 11.2). Наличие этих
рециклов приводит к значительным дополнительным затратам
энергии на транспортировку, нагрев и т. д. Рециклы ведут к увели-
чению диаметров колонн, в которые они направлены. Наличие азе-
отропов не позволяет разделить всю смесь на чистые компоненты
и из системы выводятся различные смеси в больших объемах.
В частности, из колонны 4 выводятся смеси (спирто-толуольная го-
ловка и сырые бутиловые спирты) как в виде дистиллята, так и часть
в виде кубового продукта. Из системы выводится также нафтенат
кобальта в виде раствора в высококипящих кислородсодержащих
продуктах, которые не могут постоянно находиться в рецикле.
Следовательно, рассмотренный вариант осуществления про-
цесса оксосинтеза при создании технологии для безотходного (ма-
лоотходного) производства неприемлем. Тем более толуол не дает
особых преимуществ в осуществлении процесса гидроформили-
рования по сравнению с другими растворителями. В предложен-
ной схеме не показан вывод воды (как получаемой в результате
392
Часть 2. Технология крупнотоннажных производств ...
реакций, так и содержащейся в исходном сырье). Кроме того, мас-
ляные альдегиды отделяются от остальных компонентов и делят-
ся в отдельной колонне. Разделение смеси альдегидов требует вы-
сокой эффективности колонны (преальн = 100 при R=10), что не
только требует больших энергетических затрат, но и приводит
к потерям альдегидов за счет их поликонденсации, более того,
н-масляный альдегид требуемой чистоты не может быть выделен
в виде кубового продукта.
При использовании бутиловых спиртов в качестве раствори-
теля при разделении продуктов оксосинтеза увеличивается ско-
рость гидроформилирования, так как в полярных растворителях
эта реакция протекает быстрее, чем в углеводородах. Но в этом
случае более вероятно и образование высококипящих кислород-
содержащих продуктов вследствие взаимодействия спиртов с аль-
дегидами. Однако такие количественные данные об их образова-
нии отсутствуют.
При разделении продуктов оксосинтеза с применением бути-
ловых спиртов в качестве растворителя технологическая схема упро-
щается, так как основные компоненты не образуют азеотропные
смеси (кроме азеотропов с водой (см. табл. 11.2)). В этом случае
в исходной смеси содержатся изомасляный и н-масляный альдеги-
ды, изобутиловый и н-бутиловый спирты, вода и продукты уплот-
нения. Соотношение этих компонентов зависит не только от рас-
творителя, но и от применяемого катализатора.
Если растворитель (бутиловые спирты) влияет, главным об-
разом, на концентрации бутиловых спиртов, так как они не толь-
ко циркулируют в системе (в качестве растворителя), но и обра-
зуются в результате гидрирования масляных альдегидов, то
катализатор влияет в значительной степени на соотношение н/изо
как альдегидов, так и спиртов. Такое изменение состава будет вли-
ять на параметры аппаратов, прежде всего ректификационных ко-
лонн (флегмовые числа и число тарелок), но не будет вызывать
изменения технологической схемы. Поэтому мы рассмотрим раз-
личные варианты технологических схем (наиболее реальные) и для
определенного состава исходной смеси рассмотрим параметры
колонн для качественной их оценки и сопоставления технологи-
ческих схем.
Реакционная смесь, получающаяся в процессе производства
масляных альдегидов при использовании в качестве растворителя
мзо-бутилового спирта, после удаления катализатора, легоколету-
Глава 11. Производство кислородсодержащих соединений ... 393
чих продуктов и продуктов уплотнения имеет примерно следую-
щий состав (в %):
изомасляный альдегид 13,9
н-бутиловый спирт 1,0
н-масляный альдегид 34,9
вода 5,5
изобутиловый спирт 44,7
В этом случае, как показано авторами настоящего пособия, раз-
деление этой многокомпонентной смеси можно осуществить, ис-
пользуя различные технологические схемы. Совокупность вариан-
тов схем, технологически приемлемых для разделения рассматрива-
емой пятикомпонентной смеси, можно определить методом термо-
динамико-топологического анализа. На рис. 11.7 приведен
концентрационный пентатоп этой смеси. Все пространство концен-
траций пентатопа разделено трехмерной гиперповерхностью
Az1(92,7°C)-Az2(60,2°C)-Az3(68,4°C)-Az4(89,8°C) на две области
перегонки. Устойчивыми узлами здесь являются вершина пентато-
па, соответствующая воде, и вершина пентатопа, соответствующая
н-бутиловому спирту (н-БС). Неустойчивым узлом является точка,
соответствующая гетероазеотропу, образованному изомасляным
альдегидом (изо-МА) и водой (Az/60,2 °C)). Остальные особые точ-
ки являются седлами разных порядков. Таким образом, траектории
перегонки и траектории ректификации при бесконечном флегмо-
вом числе собраны в два пучка. Оба пучка траекторий начинаются
в неустойчивом узле AZj(60,2 °C) и заканчиваются в устойчивых уз-
лах, соответствующих воде (100°С) и н-бутиловому спирту (117,5°С).
Рис. 11.7. Диаграмма перегонки пятикомпонентной смеси
продуктов оксосинтеза
394
Часть 2. Технология крупнотоннажных производств ...
Учитывая расположение бинодальных гиперповерхностей, любые
два равновесных состава жидкость—жидкость будут располагаться
в разных областях перегонки и ректификации. Последнее следует
из того, что бинодальные гиперповерхности охватывают с двух сто-
рон разделяющую гиперповерхность. Учитывая это, может быть с
успехом применен принцип перераспределения полей концентра-
ций между областями ректификации за счет расслоения жидкости
на две фазы. Этот принцип и положен в основу синтеза различных
вариантов технологических схем разделения расслаивающейся сме-
си оксосинтеза.
Наиболее простой схемой выделения масляных альдегидов яв-
ляется схема с предварительным обезвоживанием исходной смеси
(рис. 11.8). В двухколонном агрегате (колонны 1 и 2) происходит
Рис. 11.8. Технологическая схема выделения масляных альдегидов
с предварительным обезвоживанием исходной смеси:
1—5 ректификационные колонны; I — исходная смесь; II — фузельная вода;
III — газы; IV — мзо-масляный альдегид; V — н-масляный альдегид; VI — бутило-
вые спирты на оксосинтез; VII — продукты уплотнения
Глава 11. Производство кислородсодержаших соединений ... 395
обезвоживание исходной смеси. В кубе колонны 1 получается обез-
воженная смесь альдегидов и спиртов, а в кубе колонны 2 — фузель-
ная вода. Кубовая жидкость колонны 1 далее поступает в колон-
ну 3, в которой выделяется изомасляный альдегид. В колонне 4
происходит выделение нормального масляного альдегида. Раство-
ритель (изобутиловый спирт) с примесями нормального бутилово-
го спирта отделяется от высококипящих продуктов уплотнения
в колонне 5 и возвращается в процесс оксосинтеза. Основные па-
раметры и температурные режимы ректификационных колонн
представлены ниже (содержание веществ дано в % (мол.)):
№ колонны 1 2 3 4
Количество теоретических тарелок 15 5 50 27
Минимальное флегмовое число 4,0 1,0 10,0 2,0
Температура,0 С: верха колонны 63-64 63-64 59-60 74-75
куба 89-90 100-101 95-96 107-110
Условия разделения. Содержание % (мол.): в колонне 1 — воды в кубе 0,4;
в колонне 2- альдегидов в фузельной воде 0,01; в колонне 3 — и-масля-
ного альдегида в изомасляном альдегиде 0,2, изомасляного альдегида
в кубе 0,2; в колонне 4 — изобутилового спирта в и-масляном альдегиде
0,2; и-масляного альдегида в кубе 0,2. Во всех колоннах коэффициент
избытка флегмы равен 1,5.
Как показали исследования, наиболее сложным узлом тех-
нологической схемы является выделение изомасляного альдегида.
Кроме того, реализация этой схемы осложняется химическими
превращениями альдегидов в процессе выделения (конденсация,
образование ацеталей и др.), которые приводят к значительным по-
терям продуктов (до 30 %).
Однако можно снизить потери альдегидов, ограничив их кон-
денсацию за счет проведения ректификации в более мягких усло-
виях, т. е. при пониженном давлении (53,2 кПа). Такое снижение
давления, правда, не влияет на относительную летучесть альдеги-
дов (при атмосферном давлении а = 1,42, при Р=53,2 кПа, а— 1,46),
но и не предотвращает образование ацеталей.
Все эти трудности, как показано авторами пособия, в известной
мере можно исключить, если проводить ректификацию с добавкой
воды. Добавление воды позволяет несколько снизить температуру в
колоннах, так как все компоненты исходной смеси образуют азеот-
396
Часть 2. Технология крупнотоннажных производств ...
ропы с минимумом температуры кипения (см. табл. 11.2). Кроме
того, добавление воды предотвращает образование ацеталей при
ректификации. В то же время при проведении процесса разделения
с добавкой воды нельзя ожидать существенного изменения отно-
сительной летучести альдегидов, так как последние образуют прак-
тически идеальную смесь и, следовательно, добавление других ком-
понентов к этой смеси будет в одинаковой степени влиять на их
летучесть. Таким образом, действие воды сводится в основном к сни-
жению температуры процесса ректификации и гидролизу ацеталей
(по лабораторным данным при разделении масляных альдегидов
в присутствии воды их потери составляют 3—4 %).
Можно рекомендовать следующую технологическую схему раз-
деления с добавлением воды (рис. 11.9), которая в известной мере
Рис. 11.9. Технологическая схема выделения масляных альдегидов
с добавлением воды:
1—7 — ректификационные колонны; I — исходная смесь; II — изо-масляный альде-
гид; III — газы; IV — и-масляный альдегид; V — фузельная вода; VI — бутиловые
спирты на оксосинтез; VII — продукты уплотнения
Глава 11. Производство кислородсодержаших соединений ... 397
является оптимальной. В колонне 1 происходит выделение водно-
го изомасляного альдегида (3-4 % воды). Обводненный изомасля-
ный альдегид направляется в колонну 2, где происходит отделение
воды в виде гетероазеотропа с изомасляным альдегидом. Кубовая
жидкость колонны 1 подается в колонну 3 для выделения водного
н-масляного альдегида (3—4 % воды), который обезвоживается в ко-
лонне 4. Кубовая жидкость колонны 3 после охлаждения (до 20 °C)
направляется во флорентийский сосуд. Водный слой с низа фло-
рентийского сосуда подается в колонну 1, а верхний слой - в двух-
колонный агрегат (колонны 5 и 6) на обезвоживание. Изобутило-
вый спирт с примесями н-бутилового спирта отделяется от
продуктов уплотнения в колонне 7 и направляется в процесс оксо-
синтеза.
В тех случаях, когда н-масляные альдегиды могут использо-
ваться с примесями воды (3—4%), колонны 2 и 4 из техноло-
гической схемы исключаются. При содержании воды в изобути-
ловом спирте (до насыщения) в процессе оксосинтеза значительно
увеличивается выход альдегидов. В этом случае колонна 6 также
является лишней, так как верхний слой флорентийского сосуда
колонны 3 представляет собой практически изобутиловый спирт,
насыщенный водой.
Основные параметры и температурные режимы колонн тех-
нологической схемы с добавлением воды представлены ниже:
№ колонны 1 2 3 4 5 6
Количество теоретических тарелок 52 11 20 22 48 34
Минимальное флегмовое число 10 2,7 2,1 10,1 1,6 0,8
Температура, °C:
верха колонны 59-60 59-60 68-69 68-69 89-90 89-90
куба 78-80 64-66 90-92 74-76 108-110 100-110
Условия разделения. Содержание % (мол.): в колонне 1 — н-масляного аль-
дегида в изомасляном альдегиде 0,2; изомасляного альдегида в кубе 0,2;
в колонне 2 - воды в изомасляном альдегиде 0,4; в колонне 3 - изобути-
лового спирта в н-масляном альдегиде 0,2, н-масляного альдегида в кубе
0,2; в колонне 4 — воды в н-масляном альдегиде 0,4; в колонне 5 - воды
в кубе 0,2; в колонне 6 — спирта в фузельной воде 0,01. Во всех колоннах
коэффициент избытка флегмы равен 1,5.
Параметры рассмотренной технологической схемы с добав-
лением воды в принципе сопоставимы с технологическими пара-
метрами других схем.
398
Часть 2. Технология крупнотоннажных производств ...
ПРИНЦИПЫ В ТЕХНОЛОГИИ ОКСОСИНТЕЗА
В процессе оксосинтеза реализуются различные принципы соз-
дания безотходных производств.
Химические принципы:
О при получении альдегидов реализован принцип одностадий-
ности, так как в одну стадию получаются альдегиды из соот-
ветствующих олефинов и синтез-газа;
® при использовании модифицированных катализаторов одно-
временно с реакцией гидроформилирования протекает реак-
ция гидрирования с образованием соответствующих спиртов,
следовательно, одновременно получается несколько целевых
продуктов (альдегиды и спирты);
® достигается достаточно высокая селективность и общая кон-
версия сырья.
Технологические принципы:
О широко используется рециркуляция (циркуляция реагентов —
олефина и синтез-газа, растворов исходных веществ для полу-
чения активных форм катализатора или растворов катализато-
ров, растворителей);
® делается попытка использовать теплоту реакции для получе-
ния технологического пара во встроенных в реактор теплооб-
менных конструкциях, например в виде трубок Фильда
(рис. 11.10);
® применяются аппараты и технологические линии большой еди-
ничной мощности, но пока не оценены их оптимальные раз-
меры;
® все производство базируется на непрерывном режиме;
® высокая степень автоматизации, позволяющая не только под-
держивать необходимый режим параметров, но и переключать
потоки при изменении функций катализера и декатализера;
® в ряде случаев побочные продукты (продукты уплотнения) ис-
пользуются в качестве растворителя и сокращается их вывод
из системы.
Вместе с тем процесс оксосинтеза с точки зрения создания без-
отходных или малоотходных производств можно совершенствовать.
В частности, пока плохо используются давление и тепло потоков
для регенерации энергии.
Применение даже модифицированных родиевых катализаторов
не исключает возможность использования тепла потоков, так как
Глава 11. Производство кислородсодержащих соединений ... 399
Рис. 11.10. Схема отвода
тепла с помощью трубок
Фильда
в этом случае процесс будет проводиться при повышенных темпе-
ратурах (150—200 °C).
При организации процесса в присутствии жидкого катализатора
(раствора катализатора) наблюдается конкурентная ситуация. Даже
при наличии встроенных теплообменных устройств часть тепла от-
водится за счет испарения растворителя и продуктов синтеза. Од-
нако при таком простом отводе тепла не полностью используется
теплота реакции.
При переводе же процесса на гетерогенный парофазный про-
цесс этот недостаток можно устранить, но тогда потребуется пред-
варительно испарять олефин (если он является жидким в обычных
условиях) и затрачивать на это дополнительную энергию. Однако
в этом случае значительно легче отделяются продукты синтеза от
катализатора.
Кроме того, повышение температуры приводит к увеличению
скорости основной реакции, т. е. к повышению производитель-
ности. Но при этом увеличивается выход альдегидов и спиртов
изостроения, продуктов уплотнения и разлагается катализатор.
Следовательно, при наличии конкурентных ситуаций необходима
оптимизация, позволяющая подобрать условия, при которых бу-
дет возможно получение дешевых продуктов без загрязнения ок-
ружающей среды.
Глава 12. Производство этилового
и ИЗОПРОПИЛОВОГО СПИРТОВ
S Сернокислотная гидратация олефинов.
S Прямая гидратация низших олефинов.
S Принципы в технологии гидратации
низших олефинов в спирты.
Этиловый и изопропиловый спирты находят широкое примене-
ние в народном хозяйстве в качестве растворителей. Этиловый
спирт применяется также в производстве бутадиена, в пищевой и
медицинской промышленности, в качестве горючего для ракетных
двигателей, антифриза и т.д. Он является важным промежуточным
продуктом органического синтеза (в производстве сложных эфи-
ров, ацетальдегида, уксусной кислоты, хлороформа, хлораля, диэ-
тилового эфира и других продуктов). Изопропиловый спирт ис-
пользуется для получения сложных эфиров, ацетона и др.
Таким образом, низкомолекулярные спирты относятся к числу
многотоннажных продуктов основного органического и неф-
техимического синтеза. Мировое производство этилового спирта
составляет свыше 2,5 млн т/год, а изопропилового около 2 млн т/
год. Поэтому выбор наиболее экономичного способа получения
данных спиртов с учетом экологических ограничений имеет боль-
шое значение.
СЕРНОКИСЛОТНАЯ ГИДРАТАЦИЯ ОЛЕФИНОВ
Теоретические основы процесса сернокислотной
ГИДРАТАЦИИ НИЗШИХ ОЛЕФИНОВ
Существуют два промышленных процесса синтеза спиртов из
низших олефинов: сернокислотная жидкофазная гидратация и ге-
терогенно-каталитическая (прямая) гидратация.
В обоих процессах в реакции участвует промежуточный карб-
катион — продукт присоединения электрофильной частицы (про-
тона) к олефину. Такое присоединение к а-олефинам всегда проте-
кает по правилу Марковникова, поэтому в результате всегда
образуются только вторичные и третичные спирты (исключение со-
Глава 12. Произволство этилового и изопропилового ...
401
ставляет гидратация этилена, в результате которой образуется пер-
вичный спирт — этанол).
Как известно, сила протонных кислот, т. е. их способность про-
тонировать основания (в данном случае олефины) растет с увели-
чением концентрации кислот. В разбавленных растворах кислот
[в случае H2SO^ - ниже 80 % (мае.)] протонирующим агентом яв-
ляется ион HfO или другие гидраты протона, например HfO2
В растворах с низким содержанием воды в качестве протони-
рующего агента выступает кислота в недиссоциированной форме
(Я25О4) или катион, получающийся в результате реакции автопро-
толиза:
2Я25О4 HfSO4 + HSO4 12.1
В растворах, содержащих HfO, кислота выступает в качестве
катализатора реакции гидратации олефина:
RCH = CH2+H3O+ RCHCH3 + Н2О 12.2
RCHCH, + Н2О RCH(OH2)CH3 12.3
RCH(OH2)CH3 + Н2О RCH(OH)CH3 + HfO 12.4
В концентрированных кислотах, в условиях отсутствия сво-
бодной воды, серная кислота выступает и как реагент (реакции 12.1,
12.5, 12.6), и как катализатор реакции образования алкилсульфата
(реакции 12.5, 12.7, 12.8):
RCH = СН2 + HfSO4 <=> RCHCH3 + H2SO4 12.5
RCHCH3 + HSO; -> RCH(QSO3H)CH3 12.6
RCHCH3 + H2SO4 ?=> RCH(HOSO3H)CH3 12.7
RCH(HOSO3H}CH3 + H2SO4 <=> RCH(OSO3H)CH3 + HfSO4 12.8
В этом случае для получения спирта необходимо отдельно про-
водить гидролиз алкилсульфатов.
В случае гидратации таких олефинов, как, например этилен,
являющихся очень слабыми основаниями, в системе H2SO^ — Н2О
мы сталкиваемся с важным внутренним противоречием этой реак-
ции, которое заключается в том, что при концентрации кислоты,
402
Часть 2. Технология крупнотоннажных производств ...
способной протонирорать этилей, практически отсутствует свобод-
ная вода, которая могла бы присоединиться к карбкатиону с обра-
зованием спирта. Поэтому в системе с достаточным для прямой гид-
ратации содержанием воды реакция гидратации может идти только
при высоких температурах (и соответственно, давлениях). Такой ва-
риант и реализуется в процессе прямой гидратации этилена на ге-
терогенных кислотных катализаторах.
Высокая реакционная способность карбкатионов приводит
к протеканию ряда побочных реакций:
RCHCH3 + RCH(OH)CH3 ?=>(RCHCH3)2ОН 12.9
(RCHCH3)2 ОН+Н2О^± (RCHCH3)2 О+HfO 12.10
RCHCH3 + RCH(OSO3H)CH3 + Н2О (RCHCH3)2SO4 + HfO 12.11
RCHCH3 + RCHCH2 ->HCH(CHf)-CH2 — CHR RCHCH2 >ПОЛИМЕР
12.12
Кроме этих продуктов в небольших количествах образуются
продукты окисления. Процесс сернокислотной гидратации олефи-
нов обратимый и, как мы уже отмечали, протекает в две стадии по
следующим стехиометрическим уравнениям:
RCH = СН2 + H2SO4 ?=> RCH(OSO3H)CH3 12.13
RCH(QSO3H)CH3 + Н2О<=± RCH(OH)CH3 + H2SO4 12.14
Образование моно- и диалкилсульфатов — процессы экзо-
термические, протекающие с уменьшением объема реакционной
смеси (вследствие абсорбции газообразных олефинов) Следо-
вательно, смещению равновесия этих процессов в сторону об-
разования алкилсульфатов должно способствовать повышение пар-
циального давления олефина и понижение температуры.
Реакционная способность олефинов в реакциях с протонными
кислотами определяется, главным образом, основностью олефина,
которая резко возрастает по мере увеличения числа заместителей
и роста их электронодонорных свойств у атомов углерода двойной
связи. Этилен в ряду а-олефинов является наиболее слабым осно-
ванием. Константа равновесия протонизации олефина (25 °C) при
переходе от этилена к пропилену увеличивается в 105 раз. Различие
в реакционной способности олефинов отчетливо проявляется в зна-
Глава 12. Производство этилового и изопропилового ...
403
чениях скорости поглощения олефинов 80 %-ной серной кислотой
(при одинаковых температуре и парциальном давлении олефина):
(СЯ3)2 сн = сн2 > СН£Н2СН = сн2 > сн.сн = сн2 > сн2 = сн2
1600 1000 500 1
Эта закономерность находится в хорошем соответствии с усло-
виями поглощения олефинов, используемыми в промышленности
(табл. 12.1).
Таблица 12.1. Условия поглощения олефинов серной кислотой
Олефин Концентрация H2SO4, % Температура, °C Парциальное давле- ние олефина, кПа
Этилен 96-98 80-90 1013,2-1519.8
Пропилен 85 25-35 607,9—810.6
Пропилен 75-80 50-60 607,9-810,6
н-Бутилены 75-80 20-30 303,9 405.3
Изобутилен 55-85 10-20 202,6-303.9
Аналогичная закономерность прослеживается и в отношении ре-
акционной способности олефинов к полимеризации, которая умень-
шается в той же последовательности. Образование полимеров ин-
тенсифицируется при повышении концентрации кислоты и темпе-
ратуры. Этот побочный процесс приводит не только к снижению вы-
хода целевого продукта — спирта, но и к значительным потерям
серной кислоты при ее концентрировании, а также к выделению ди-
оксида серы и, следовательно, к загрязнению окружающей среды.
При концентрировании отработанной серной кислоты в аппаратах
типа «Леми/со» горячим потоком топочного газа содержащиеся в кис-
лоте полимеры окисляются до СО2 и Н2О кислородом, выделяю-
щимся при распаде H2SOA. На окисление каждого звена —СН— по-
лимера затрачивается три атома кислорода (столько же расходуется
молекул H2SO^\
H2SO^H2O + SO2 + O 12.15
-СН2 - + Ю^>С02+ Н2О 12.15а
На одну массовую часть полимера потери кислоты составят:
3-98/14 =21 мае. ч. (Здесь 98 —мол. масса H2SO4; 14 —мол. масса
404
Часть 2. Технология крупнотоннажных произволств ...
звена полимера.) При этом выделится 3-64/14 = 13,7 мае. ч диок-
сида серы (где 64 - мол. масса SO2).
Образование диалкилсульфатов также является побочным про-
цессом, так как помимо гидролиза в целевые продукты — спирты,
они частично реагируют с получаемыми спиртами, увеличивая вы-
ход простых эфиров:
RiSO,+2ROH^2ROR + H2SO, 12.16
Образованию диалкилсульфатов способствует повышение дав-
ления и концентрации кислоты, а также увеличение соотношения
олефин: кислота.
Взаимодействие олефинов с серной кислотой — процесс ге-
терогенный, протекающий в системах газ — жидкость (хемосорб-
ция этилена, пропилена) или жидкость — жидкость (хемоэкстрак-
ция высших олефинов). Процессы такого рода протекают
в диффузионной или переходной областях и описываются урав-
нением первого порядка по поглощаемому олефину:
dG/dt = K-FPf(c), 12.17
где G- количество поглощаемого олефина; t- время; К- коэффициент,
зависящий от интенсивности диффузии и, следовательно, от интенсив-
ности контакта реагентов (барботаж, перемешивание и т.п.); F— поверх-
ность контакта реагентов; Р — парциальное давление олефина;/(с) — мно-
житель, зависящий от концентрации серной кислоты.
Следовательно, повышение давления Рне только сдвигает рав-
новесие в благоприятную сторону, но и увеличивает скорость про-
цесса.
Протеканию процесса способствует и развитие поверхности
контакта F, что может быть обеспечено перемешиванием реагентов.
Интенсификация перемешивания, кроме того, ведет и к увеличе-
нию коэффициента К, что повышает скорость процесса.
Скорость поглощения олефинов также увеличивается, если ис-
ходная серная кислота вводится в процесс не в чистом виде, а с не-
которым содержанием алкилсульфатов, которые, обладая свойства-
ми эмульгаторов, увеличивают поверхность контакта вследствие
ценообразования и тем самым способствуют более быстрому и пол-
ному растворению олефинов. Обычно степень насыщения серной
кислоты олефинами составляет 1,2—1,4 моль олефина/1 моль H2SOV
Вторая стадия процесса — гидролиз алкилсульфатов — также
обратима. Для обеспечения его протекания необходимы избыток
Глава 12. Произволство этилового и изопропилового ...
405
воды и быстрое удаление спирта из зоны реакции. Способность
алкилсульфатов к гидролизу изменяется в той же последователь-
ности, что и в реакции олефинов с серной кислотой:
C2H5OSO3< С^ОЗО^С^ОЗО^т.л.
При расчете избытка воды следует иметь в виду конкурент-
ную ситуацию: чрезмерный избыток воды ведет к сильному раз-
бавлению отработанной серной кислоты и, следовательно, к удо-
рожанию процесса ее концентрирования, а при недостатке воды
(особенно при нагревании, необходимом для ускорения процес-
са гидролиза) усиливаются следующие нежелательные побочные
процессы:
Ф повышенное образование простых эфиров вследствие взаимо-
действия с получаемым спиртом не только диалкилсульфата,
но и моноалкилсульфата:
ROSO2OH + ROH -> H.SO, + ROR 12.18
Ф обратное разложение алкилсульфатов на кислоту и олефин, ко-
торый в этом случае получается уже в виде не мономера, а по-
лимера:
xCnH2nl2OSO2OH->xH2SO, + (СпН2п)х 12.19
Таким образом, на основе приведенной краткой физико-хи-
мической характеристики протекающих процессов можно сфор-
мулировать некоторые основные положения для разработки рацио-
нальной технологической схемы:
Ф для каждого олефина должны быть выбраны свои оптималь-
ные условия взаимодействия с серной кислотой: концентрация
кислоты, температура, парциальное давление олефина и т.д.;
Ф для предотвращения побочного процесса полимеризации не-
обходимо обеспечить:
а) отсутствие в исходной смеси гидратируемого олефина при-
месей высших олефинов (кроме инертных углеводородов,
например, парафинов), которые при взаимодействии с сер-
ной кислотой в условиях, принятых для гидратируемого оле-
фина, образуют главным образом полимеры;
б) наиболее полное извлечение полимеров из отработанной
серной кислоты до ее концентрирования;
в) проведение концентрирования в условиях, исключающих
разложение серной кислоты;
406
Часть 2. Технология крупнотоннажных производств ...
Ф для надлежащей скорости поглощения олефинов серной кис-
лотой (первая стадия процесса) следует:
а) максимально использовать давление исходной олефинсо-
держащей газовой смеси, получаемой на предшествующих
установках разделения;
б) обеспечить максимально возможное перемешивание реаген-
тов и развитие поверхности контакта, а также максималь-
ную растворимость олефина в реакционной смеси, исполь-
зуя, в частности, рециркуляцию получаемых алкилсульфатов.
Максимальная полнота гидролиза обеспечивается непре-
рывным отводом получающегося спирта в виде смеси его паров
с водяным паром. Наиболее эффективно это может быть реали-
зовано в колонном аппарате в виде совмещенного (реакционно-
отгонного) процесса.
Технология сернокислотной гидратации этилена
Поглощение (хемосорбция) этилена серной кислотой — про-
цесс обратимый, экзотермический, протекающий с уменьшени-
ем объема.
СН2 = СНг2 + H2SO~ <=> C2H5OSO2HX, 12.20
ДЯ = -50,232 кДж/моль.
В реакционной смеси наряду с моноэтилсульфатом и свободной
серной кислотой содержится также и диэтилсульфат (рис. 12.1).
Скорость абсорбции этилена описывается уравнением, 12.17 и за-
висит от концентрации исходной серной кислоты, т. е. от множи-
Рис. 12.1. Содержание серной
кислоты в продуктах абсорб-
ции в зависимости от мольно-
го соотношения C1HJH2SOi
(концентрация кислоты 98 %,
температура 80°C):
1 — свободная серная кислота: 2 —
серная кислота, связанная в виде
моноэтилсульфата; 3 — серная
кислота, связанная в виде диэтил-
сульфата
Глава 12. Производство этилового и изопропилового ...
407
теля /(с). Так, абсорбция этилена 93 %-ной кислотой протекает при
прочих равных условиях в 5 раз медленнее, чем при концентрации
кислоты 95%, и в 10 раз медленнее, чем при ее концентрации
в 97,5 %. Однако применение для абсорбции этилена, например оле-
ума, нецелесообразно, так как при этом снижается выход этанола
из-за образования побочных продуктов — сульфосоединений и по-
вышенного образования полимеров.
Получающийся при реакции этилена с олеумом карбилсульфат
при дальнейшем гидролизе образует не целевой продукт — этанол,
а нежелательные примеси — этионовую и изоэтионовую кислоты:
СН2 2SO3 H2c-oso2\o и2О н2с—oso^jh н2с-он
^Н2 - н2с—oso2z * н2с—oso£H - н2с— oso/зн 12 21
КАРБИЛСУЛЬФАТ ЭТИОНОВАЯ КИСЛОТА ИЗОЭТИОНОВАЯ
КИСЛОТА
При прочих равных условиях скорость абсорбции этилена уве-
личивается с повышением температуры и парциального давления,
однако при температуре выше 90 °C начинается интенсивное обра-
зование полимеров. Увеличение парциального давления этилена
выше 2,0 МПа становится тоже малоэффективным. Факторами, ус-
коряющими процесс абсорбции, являются наличие в исходной сер-
ной кислоте этил сульфатов, а также обеспечение лучшего контак-
та реагентов благодаря развитию поверхности и перемешиванию.
В настоящее время в промышленных установках приняты сле-
дующие условия абсорбции этилена: концентрация серной кисло-
ты 97—98 %; температура 80—85°C; парциальное давление этилена
на входе в абсорбер 1,0—1,5 МПа; содержание пропилена и выс-
ших олефинов в исходной этилен-этановой фракции <0,1 % (мол.).
На рис. 12.2 приведена принципиальная технологическая схе-
ма промышленного процесса гидратации этилена. Этилен-этано-
вая фракция с содержанием этилена 40—50 % под давлением 2,5—
3,0 МПа поступает в нижнюю часть абсорбера 7, имеющего обычно
20 колпачковых тарелок. На каждой тарелке с высотой барботаж-
ного слоя 0,6—0,7 м расположены охлаждающие змеевики для от-
вода теплоты реакции. Таким образом, суммарный барботажный
слой составляет около 12—14 м. Исходная серная кислота (97—98 %),
поступающая на верхнюю тарелку абсорбера 7, предварительно сме-
шивается в трубопроводе с реакционной смесью, частично отбира-
емой насосом с восьмой тарелки (от низа колонны). Количество
такой рециркулируемой реакционной смеси рассчитывается так,
408
Часть 2. Технология крупнотоннажных производств ...
Рис. 12.2. Технологическая схема сернокислотной гидратации этилена:
1 — абсорбер (реактор газ—жидкость); 2 — скруббер промывки водой; 3 — скруббер
промывки слабой щелочью; 4 — гидролизе^; 5 — гидролизная (реакционно-отгон-
ная) колонна; 6 — скруббер промывки паров этанола-сырца горячей щелочью;
7 — конденсатор паров этанола-сырца; 8 — приемник этанола-сырца; 9 — сепара-
тор жидкость—жидкость (флорентийский сосуд); 10 — промежуточные емкости;
11 — ректификационная колонна отгонки легколетучих от этанола; 12 — приемник
отогнанных фракций; 13 — основная колонна с дефлегматором для ректификации
этанола; 14 — приемник этанола-продукта; 15 — конденсатор отгоняемых фракций;
16 — колонна экстракции этанола; 17 — теплообменник жидкость—жидкость;
18 — холодильник фузельной воды; 19 — колонна ректификация эфира; I — этилен-
этановая фракция; II — отходящий газ (на пиролиз или в топливную сеть); III — хи-
мически загрязненные стоки в канализацию; IV — «зеленое масло»; V, VI — охлажда-
ющая вода; VII — серная кислота (97—98 %); VIII — экстракт «зеленого масла» (на
сжигание); IX — отработанная серная кислота; X — технический этиловый эфир;
XI — тяжелолетучие углеводороды (на сжигание); XII — острый пар; XIII — товар-
ный этанол; XIV — вода; XV — щелочь
Глава 12. Производство этилового и изопропилового ...
409
чтобы поступающая в абсорбер кислота содержала не менее 0,5—
0,6 моль поглощенного С2Н4 на 1 моль H2SO4.
Отходящий из верхней части абсорбера этан с содержанием 2—
6 % этилена после дросселирования до давления около 0,8 МПа про-
ходит промывные скрубберы 2 и 3, орошаемые соответственно во-
дой и слабым раствором щелочи, и направляется либо на установку
пиролиза, либо в тепловую сеть.
Насыщенная реакционная смесь из нижней части абсорбера 1
направляется в гидролизер 4, в который поступает горячая фузель-
ная вода. Из гидролизера смесь направляется в отгонную колон-
ну 5, где протекает совмещенный процесс: завершается гидролиз
алкилсульфатов и одновременно отгоняются с помощью острого
водяного пара продукты гидролиза: этанол, диэтиловый эфир и др.
Отводимые из верхней части колонны пары уносят в виде брызг
незначительное количество серной кислоты, для нейтрализации
которой служит скруббер 6, орошаемый горячим слабым раство-
ром щелочи. Нейтрализованные пары из верхней части скруббе-
ра 6 направляются в конденсатор 7. Водно-спиртовой конденсат, со-
держащий до 40—45 % (мае.) этанола, 3—4 % (мае.) этилового эфира
и незначительные примеси легкокипящих полимеров, собирается
в приемнике 8.
В куб колонны 5 подается «зеленое масло» (один из продук-
тов нефтепереработки) для экстракции полимеров из отработан-
ной серной кислоты, которая отводится в сепаратор 9. Отсюда
верхний слой — экстракт «зеленого масла» — выводится на утили-
зацию (сжигание), а нижний слой (45—50%-ная серная кислота с
минимальным содержанием полимеров) отводится на установку
концентрирования. Во избежание коррозии кипятильников от со-
прикосновения с разбавленной серной кислотой колонна 5 обо-
гревается острым водяным паром.
Из приемника 8 спирт-сырец направляется в агрегат разделе-
ния, состоящий из трех ректификационных и одной экстрак-
ционной колонны. Через теплообменник 1 /подогретый спирт-сы-
рец поступает в ректификационную колонну И для отгонки
этилового эфира, легколетучей фракции полимеров, а также неко-
торого количества этанола и воды. Для повышения температуры
конденсации до 70 °C, что позволяет охлаждать дефлегматор водой,
в колонне 11 поддерживается небольшое давление (до 0,16 МПа).
Отгон колонны, представляющий собой широкую фракцию, содер-
жащую кроме эфира и полимеров этанол и некоторое количество
410
Часть 2. Технология крупнотоннажных производств ...
воды, собирается в приемнике 12. Кубовая жидкость из колонны 11
(за счет разности давлений) поступает в основную ректификаци-
онную колонну 13, из верхней части которой отбирается в прием-
ник 14 товарный продукт, содержащий до 95 % этанола. В случае
накопления в колонне 13 среднелетучей фракции полимеров пре-
дусматривается отбор их с некоторых тарелок, расположенных меж-
ду тарелкой питания и кубом, в виде пара, направляемого в кон-
денсатор 15, конденсат из которого поступает в приемник 12.
Из приемника 12 полученная широкая фракция для отделения
от нее этанола поступает в экстракционную противоточную колон-
ну 16, куда сверху подается предварительно охлажденная в тепло-
обменнике 7 и холодильнике 18 фузельная вода из колонны 13. Из
колонны 16 отводятся: сверху — отмытый от этанола диэтиловый
эфир с примесью полимеров; снизу — промывная вода, содержа-
щая этанол с примесью эфира. Промывная вода рециркулирует
в ректификационную колонну 77, а верхний продукт колонны 16
поступает в ректификационную колонну 19, где в качестве дистил-
лята отбирается товарный продукт, так называемый технический
эфир; из куба колонны 19 отводится значительная часть загрязня-
ющих товарный эфир полимеров. В целях использования воды
в качестве дешевого хладагента для охлаждения дефлегматоров
в колонне 79поддерживается давление до 13,6 кПа.
Концентрирование отработанной 45—50%-ной Я25О4 до 88—90%
осуществляется в отдельном цехе в аппаратах «Хемико» потоком го-
рячего топочного газа с температурой 800—1000 °C, который про-
ходит противотоком над кислотой, охлаждаясь до 100—120 °C, и уда-
ляется через электрофильтр (для улавливания мелких капелек
и тумана серной кислоты) в атмосферу. Дальнейшее повышение
концентрации кислоты до 98 % производится добавлением олеума.
Следует отметить, что степень концентрирования отработанной
кислоты горячими топочными газами даже в более совершенной
аппаратуре, чем «Хемико», будет неизбежно ограничена определен-
ным содержанием в исходном газовом потоке паров воды, посколь-
ку они являются одним из основных продуктов сгорания топлива.
Основные недостатки технологии сернокислотной
ГИДРАТАЦИИ ЭТИЛЕНА И ПУТИ ИХ УСТРАНЕНИЯ
Главным преимуществом сернокислотной гидратации по срав-
нению с прямой является возможность применения неконцент-
рированных олефинов: этилена, пропилена и др., так как их кон-
Глава 12. Производство этилового и изопропилового ...
411
центрирование связано с большими капитальными и эксплуатаци-
онными затратами. Именно этим можно объяснить применение
данного метода наряду с методом прямой гидратации в США.
Однако метод сернокислотной гидратации имеет и недостат-
ки, устранение которых привело бы к существенному усовер-
шенствованию технологического процесса. Среди них можно от-
метить следующие.
Сложная и громоздкая конструкция тарельчатого абсор-
бера. Абсорбер изготовляют из многих различающихся физи-
ческими свойствами материалов, таких как сталь обычная (корпус
аппарата), свинец и кислотоупорная плитка (футеровка), чугун
(подставки под тарелки), прессованный графит — игурит (тарелки),
легированная сталь (охлаждающие элементы) и др. Охлаждающие
элементы труднодоступны для осмотра. Все это осложняет эксплу-
атацию аппарата, приводит к частым его остановкам и ремонтам.
Однако те же трубы из легированной стали при другом кон-
структивном решении могут выполнять две функции: охлаждение
и обеспечение поверхности контакта газ—жидкость. Например, из
этих труб могут быть изготовлены тарелки провального типа, че-
рез которые будет циркулировать охлаждающая вода. Из них же
могут быть изготовлены трубчатые реакторы барботажного или
пленочного типа с подачей охлаждающей воды в межтрубное про-
странство и т. п.
Если названные конструкции требуют еще разработки и про-
верки, то следующее, уже найденное и проверенное, весьма про-
стое решение рекомендуется для использования в промыш-
ленности. Речь идет о применении барботажного абсорбера
с циркуляцией реакционной смеси через выносной холодильник.
Способ опробован на опытной установке и в условиях абсорбции
этилена и пропилена.
Малая эффективность однократного экстрагирования полиме-
ров «зеленым маслом». При принятом методе экстрагирования
в экстракт переходит 70—75% полимеров. Значит до 30% полимеров
остается в разбавленной кислоте и «проскакивает» в аппараты кон-
центрирования, где в условиях высокой температуры взаимодейст-
вуют с кислородом серной кислоты с выделением SO2 в атмосферу
и соответствующими потерями серной кислоты, о чем уже упоми-
налось выше. Для увеличения полноты экстрагирования целесооб-
разно применять непрерывную противоточную экстракцию в ко-
лонне (как в колонне 76для отмывки этанола, см. рис. 12.2).
412
Часть 2. Технология крупнотоннажных производств ...
Рис. 12.3. Диаграмма фазового
равновесия жидкость—пар би-
нарной смеси Н2О - H1SOi при
атмосферном давлении
Концентрирование отработанной серной кислоты в аппаратах
«Хемико». Эта часть технологического процесса является самым сла-
бым звеном во всем методе сернокислотной гидратации. Во-пер-
вых, концентрировать кислоту удается лишь до 88—90 %, а во-вто-
рых, такой процесс концентрирования из-за высокой температуры
топочных газов приводит к ощутимым потерям серной кислоты от
раскисления, сопровождающегося выбросом вредного диоксида
серы в атмосферу.
Какие же реальные возможности имеются в настоящее время
для устранения этого главного недостатка? Решение следует искать
в создании мягких условий процесса концентрирования, исключа-
ющих вредный процесс разложения серной кислоты. Могут быть
рассмотрены по крайней мере три возможных варианта создания
мягких условий, необходимых для концентрирования кислоты.
Непрерывная противоточная перегонка в вакууме. Диаграмма фа-
зового равновесия жидкость-пар бинарной смеси H2O—H2SO4
представлена на рис. 12.3. Из этой диаграммы видно, что вода
и серная кислота образуют азеотропную смесь с максимальной тем-
пературой кипения 336,6 °C при атмосферном давлении, содержа-
щую 98,3 % (мае.) H2SO4. Безводная серная кислота кипит при ат-
мосферном давлении при температуре 296,2 °C, выделяя пары SO2
и превращаясь при этом также в 98,3 %-ный водный раствор. Вод-
ные растворы, содержащие менее 70 % (мае.) H2SO4, при нагрева-
нии образуют пар, практически не содержащий серной кислоты.
Ниже приведены температуры кипения 98 %-ной кислоты при раз-
личных остаточных давлениях:
Температура, °C 230 175 160 130
Остаточное давление, кПа 13,3 1,6 1,3 0,5
Глава 12. Производство этилового и изопропилового ...
413
Мольная теплота испарения Z серной кислоты составляет
460 54 кДж/моль, что представляет несколько большую величину,
чем Z воды (41868 кДж/моль). Поэтому при перегонке в вакууме,
согласно правилам Вревского, азеотропная смесь будет изменять
свой состав в направлении еще большего обогащения кислотой. Та-
ким образом, все приведенные данные свидетельствуют о принци-
пиальной возможности полного концентрирования кислоты в от-
гонной вакуумной колонне при умеренных температурах, исклю-
чающих разложение кислоты. Кипятильник в такой колонне мо-
жет быть выполнен из обычной углеродистой стали, так как
находящаяся в кубе и кипятильнике высококонцентрированная
кислота не будет вызывать коррозии. Отгонная колонна и особен-
но ее верхняя часть должны быть надежно защищены от коррозии
разбавленной кислотой. Можно рекомендовать примерно следую-
щие параметры работы такой противоточной вакуумной колонны:
температура конденсации отгоняемых водяных паров 40—45 °C (что-
бы обеспечить охлаждение конденсаторов дешевой производствен-
ной водой). Эта температура соответствует давлению 9,2—9,9 кПа;
при таком давлении температура кипения 98 %-ной серной кисло-
ты будет равна 210—215 °C и обогрев кипятильников может быть
осуществлен водяным паром (Р= 3,99—4,6 кПа, /=235-240°C).
Перегонка в токе инертного газа. Газ, отводимый из абсорбера,
практически не содержит влаги и представляет собой этан с при-
месью 2—6 % непрореагировавшего этилена. Такой газ может быть
использован в качестве агента для непрерывной противоточной от-
гонки воды от разбавленной кислоты. Давление этого газового по-
тока составляет не менее 2,5—3,0 МПа, в то время как давление,
при котором реализуется процесс перегонки, не превышает 0,2—
0,3 МПа. Поэтому следует максимально использовать энергию сжа-
тия при таком значительном (не менее чем в 10 раз) снижении дав-
ления (например, применяя детандер в сочетании с дросселирова-
нием и другими приемами).
Приведем оценочный расчет количества воды, которое может
быть отогнано от разбавленной кислоты с помощью отходящего из
абсорбера инертного газа (этана). По экспериментальным данным,
расход 100 %-ного этилена составляет 0,75 т на 1 т этанола. Пола-
гая, что исходная этилен-этановая фракция содержит 50 % (об.) эти-
лена и 50 % (об.) этана (не учитывая примеси), количество отходя-
щего этана будет составлять 0,75—30/28 = 0,8 т на 1 т этанола (где
30 и 28 — мол. массы этана и этилена).
414
Часть 2. Технология крупнотоннажных производств ...
На 1 т 100 %-ного этилена подается 2 т 100 %-ной Я25О4, на 1 т
этанола подается 2-0,75 = 1,5 т кислоты. Следовательно, 50 %-ной
кислоты на перегонку будет поступать 1,5/0,5 = 3 т на 1 т этанола.
При концентрировании кислоты до 98 %-ной следует отогнать
воды 3—1,5/0,98=3—1,53=1,47 т на 1 т этанола. Используем урав-
нение уноса:
9 = <p[p/(7’-Jp)](Mv0/22,4), 12.22
где Р— общее давление, кПа; —количество перегоняемого вещества
(воды), кг; (р - коэффициент насыщения инертного газа перегоняемым ве-
ществом (водой); р — парциальное давление паров перегоняемого вещест-
ва (воды), кПа; М— мол. масса перегоняемого вещества (Мн^0 = 18); v0 —
объем инертного газа при нормальных условиях, м3.
В данном случае v0 = (800/30)- 22,4= 600 м3 (где 800 — количество
этана в кг на 1 кг этанола).
Принимая ориентировочно температуру перегонки 165°С,
(ф=0,8, общее давление Р=304 кПа), получим количество отгоняе-
мой воды: 9=0,8-253,3/(303,9-253,3)/( 18/22,4)-600= 1930 кг «1,9 т на 1
т этанола, что больше, чем требуемое количество отгоняемой воды
(1,47 т/т этанола). Здесь 253,3 кПа — парциальное давление паров
воды при 165°С над 60%-ной серной кислотой, стекающей с тарел-
ки питания (при подаче исходной отработанной 50%-ной кислоты).
Этот (хотя и ориентировочный) расчет указывает на возмож-
ность полного концентрирования кислоты перегонкой в токе от-
ходящего инертного этана в мягких условиях. Такая перегонка мо-
жет быть реализована также в отгонной колонне непрерывного
противотока с подачей тепла для испарения воды в кипятильник и
по высоте колонны.
Гетероазеотропная перегонка, т. е. перегонка в присутствии ве-
щества, не смешивающегося ни с водой, ни с серной кислотой, ни
с водными растворами серной кислоты. Разумеется, что вещество
должно быть стабильным в условиях проведения процесса. В каче-
стве такого инертного вещества могут быть рекомендованы, напри-
мер, насыщенные фторуглероды (перфторуглероды) общей форму-
лы С F2n+2, например — перфторнонан с температурой кипения
125 °C при атмосферном давлении. Процесс может быть реализо-
ван также в противоточной отгонной колонне непрерывного дей-
ствия по схеме, представленной на рис. 12.4.
Так, даже при атмосферном давлении (без применения вакуума)
температура в верхней части колонны будет менее 100 °C, т. е. мень-
Глава 12. Производство этилового и изопропилового ...
415
Рис. 12.4. Схема гетероазеотроп -
ной перегонки разбавленной кис-
лоты с перфторнонаном:
1 — отгонная колонна; 2 — кипятиль-
ник; 3 — конденсатор; 4 — холодиль-
ник; 5 — сепараторы жидкость—жид-
кость; 6 — сборник концентрирован-
ной кислоты; 7 — сборник отогнанной
воды; 8 — сборник гетероазеотропно-
го агента (перфторнонана); I — отра-
ботанная кислота; II — гетероазеот-
ропный агент; III — водяной конден-
сат; IV — концентрированная серная
кислота
ше температуры кипения присутствующего легколетучего компо-
нента, в данном случае воды, а внизу колонны менее 125 °C, т.е.
также меньше температуры кипения перфторнонана, присутству-
ющего в качестве легколетучего компонента.
Разумеется, рассмотренные три варианта отгонки воды, а так-
же возможные их комбинации не ограничивают применения лю-
бых иных более рациональных методов концентрирования отрабо-
танной кислоты.
Неиспользованные возможности экономии энергетических средств
в агрегате разделения. Основанием для выявления возможностей
экономии энергии выступает большой объем производства синте-
тического этанола. Например, отдельные установки по производ-
ству этанола достигают мощности 250—500 тыс. т в год (30—50 и бо-
лее тонн в 1 час), следовательно, и экономия энергии здесь может
оказаться весьма значительной.
Следует обратить внимание на то, что пары этанола-сырца мож-
но подавать в ректификационную колонну без предварительной их
конденсации. Определим возможную экономию энергии (тепла
и холода) на примере ректификации этанола-сырца. Из реакцион-
но-отгонной колонны насыщенные пары этанола-сырца после про-
мывки их слабым горячим раствором щелочи (см. рис. 12.2) посту-
пают на ректификацию с содержанием этанола xz=24,2% (мол.),
или =45 % (мае.). Содержание этанола в дистилляте составляет х =
89,2 % (мол.) или =95 % (мае.). Содержание этанола в нижнем про-
416
Часть 2. Технология крупнотоннажных производств ...
дукте xw= 0,006 % (мол.), или =0,015 % (мае.). Сравним расходы теп-
ла на испарение флегмы и дистиллята, т. е. расход тепла в кипятиль-
нике при подаче исходной смеси непосредственно в виде насыщен-
ного пара и при подаче в виде предварительно сконденсированной
кипящей жидкости. Коэффициент избытка флегмы во всех расчетах
примем равным 1,2.
По кривой фазового равновесия этанол—вода (рис. 12.5) нахо-
дим у = 53,4 % (мол.), xz'=3,8 % (мол.). Определяем значения f 7?жтп,
7?Ппип:
f= (хр - xw)/(xf - xw) = (89,2 - 0,006)/(24,2 - 0,006) = 3,68, 12.23
^min = <XP - y)/(yf- x) = (89,2 - 53,4)/(53,4 - 24,2) = 1,226, 12.24
= (^-^/<5- V) = <89’2 “ 24,2)/(24,2 - 3,8) = 3,17. 12.25
Расход тепла в кипятильнике при подаче исходной смеси в виде
кипящей жидкости составит на 1 кг-моль дистиллята:
(R + 1)Х = (1,2-1,226 + 1)Х = 2,475Х,
где X - молярная теплота испарения; X = 41868 кДж/(кг-моль).
То же при подаче исходной смеси в виде насыщенного пара:
СК" 4-1 -»-Х = (1,2-3,17 + 1-3,68)1= 1,12Х.
Таким образом, при подаче смеси в виде пара расход тепла бу-
дет примерно в 2,2 раза (или 2,475Х—1,12Х = 1,355ХкДж на
1 кг-моль этанола) меньше, чем при ее подаче в виде предварительно
сконденсированной жидкости. На столько же, т. е. на 1,355X кДж
на 1 кг-моль этанола будет меньше и расход холода. В пересчете на
1 т 100 %-ного этанола получим:
экономия тепла: 1,355-41868/(46-0,892) = 1382,6 кДж;
экономия охлаждающей воды: 1382,6/4,186-(45 — 25) = 16,5 м3,
где 0,892 - мольная доля этанола в товарном продукте; 46 - мол. масса
этанола; (45-25) - перепад температур охлаждающей воды, °C.
При подаче исходной смеси в виде пара схема узла разделения
(см. рис. 12.2) должна быть несколько изменена, а именно:
Ф пары этанола-сырца, минуя конденсатор 7, направляются пря-
мо в основную ректификационную колонну 13, где в каче-
стве дистиллята будет отводиться этанол-сырец вместе с лег-
колетучими примесями, а в качестве нижнего продукта — фу-
зельная вода. Боковой отбор среднелетучей фракции поли-
Глава 12. Производство этилового и изопропилового...
417
меров остается без изменений (мо-
жет изменяться только уровень от-
бора);
Ф дистиллят этанола-сырца направля-
ется в ректификационную колон-
ну 11, где в качестве верхнего про-
дукта в приемник 72 отводится фрак-
ция, содержащая этиловый эфир и
легколетучие полимеры с примеся-
ми этанола и воды; в качестве ниж-
него продукта отводится товарный
этанол;
ф соответствующие изменения должны
Рис. 12.5. Кривая фазово-
го равновесия бинарной
смеси этанол—вода
быть сделаны и в обвязке вспомогательной аппаратуры.
В конструкции основной колонны, очевидно, необходимо так-
же учесть иные количества и соотношения парового и жидкостного
потоков по отгонной и укрепляющей частям колонны, чем при по-
даче исходной смеси в виде жидкости.
Следует также использовать принцип теплоинтеграции в мно-
гокорпусных установках ректификации. На рис. 12.6 приведена
принципиальная схема трехкорпусной ректификации, при этом
Рис. 12.6. Технологическая схема трехкорпусной ректификационной
установки:
1,2,3 — ректификационные колонны; 4 — теплообменник; 5 — дефлегматор; 6 — ки-
пятильник-дефлегматор; 7 — кипятильник; 8 — промежуточная емкость; 9 - холо-
дильник; 10 — сборник этилового спирта-ректификата; I — исходная смесь; II — эти-
ловый спирт-ректификат; III — фузельная вода
418
Часть 2. Технология крупнотоннажных производств ...
ректификационные колонны 1,2 и 3 предназначены для разделе-
ния одной и той же смеси и расположены параллельно друг другу.
В колоннах используется различное рабочее давление. В каждом
из аппаратов давление выбирают таким образом, чтобы дефлегма-
тор последующей колонны мог служить кипятильником предыду-
щей. Как видно, кипятильник колонны 1 служит дефлегматором
колонны 2 и, следовательно, обогревается паром, отходящим из
верхней части колонны 2. В свою очередь кипятильник колонны 2
обогревается паром, поступающим из верхней части колонны 3,
и служит ее дефлегматором. И только кипятильник колонны 3 рас-
ходует тепловую энергию, поступающую извне, а дефлегматор ко-
лонны 1 — поступающий извне хладагент.
В случае применения такой трехкорпусной установки исход-
ная смесь делится на три почти равные части (чтобы компенси-
ровать тепловые потери и уменьшение теплоты испарения с повы-
шением давления: во вторую колонну смеси подается несколько
больше, чем в первую, а в третью — несколько больше, чем во вто-
рую). Каждая такая часть подается в соответствующую колонну че-
рез теплообменник (теплообменник может быть и общим), где ис-
ходная смесь нагревается за счет тепла отходящего нижнего
продукта. В трехкорпусной установке будет расходоваться только
35—40 % тепла, расходуемого в обычной однокорпусной ректифи-
кационной установке.
Внедрение этой технологической схемы тормозилось отсут-
ствием достаточно надежных средств автоматизации управления
процессом. В настоящее время такие средства уже разработаны.
Кроме того, если раньше считалось рациональным снабжение
заводских ректификационных установок греющим водяным паром
сравнительно низких параметров (не более 1 МПа), то сейчас, при
столь стремительном укрупнении мощностей химических произ-
водств, более экономичным становится использование водяного
пара значительно более высоких параметров (не менее 1,4 МПа),
что существенно снижает затраты на паропроводы.
Наконец, ограничением применения трехкорпусной схемы мо-
жет служить низкая стабильность веществ, ректифицируемых в ус-
ловиях повышенных давлений и температуры. Однако в данном слу-
чае этанол-сырец с примесями представляет собой вполне стабиль-
ную смесь, которая может быть ректифицирована в таких условиях.
Например, если принять, что колонна 1 работает при атмо-
сферном давлении (или при некотором разряжении) и что грею-
Глава 12. Производство этилового и изопропилового...
419
щий водяной пар поступает под давлением 2,0 МПа и при темпе-
ратуре 215 °C, то в качестве одного из вариантов условий работы
колонн может быть выбран следующий. Температура в кубе колон-
ны высокого давления 3 (Р=1,4 МПа) 195 °C, в верху колонны
170°С; в кубе колонны среднего давления 2 (Р=0,5 МПа) 150°С,
вверху 125 °C; в кубе колонны 1 (атмосферного давления) 105 °C,
вверху 80 °C. Очевидно, что при таких условиях, т. е. при максималь-
ной температуре 200 °C, ни этанол, ни его примеси не будут пре-
терпевать каких-либо превращений.
Условия работы колонн могут быть более мягкими. Так, если
принять температуру конденсации паров этанола в дефлегматоре
колонны 1 ~ 50 °C (а это позволит проводить охлаждение обычной
дешевой производственной водой), то давление в этой колонне со-
ставит 30—35 кПа при температуре в кубе колонны =75 °C. При пе-
репаде температур в кипятильнике этой колонны 20 °C, температу-
ра в верху колонны 2 должна быть 95 °C, что соответствует давлению
около 0,2 МПа при температуре в кубе 120 °C. И наконец, при том
же перепаде температур 20 °C в кипятильнике колонны 2 темпера-
тура в верху колонны (высокого давления) 3 должна быть 140 °C,
что соответствует давлению =0,7 МПа при температуре в кубе
= 165 °C. В этом случае для обогрева кипятильника колонны 3 мо-
жет быть использован водяной пар, имеющий давление 1,2—
1,3 МПа и температуру 185—190°С.
Технология сернокислотной гидратации пропилена
Как уже отмечалось, обе стадии процесса сернокислотной ги-
дратации пропилена протекают при прочих равных условиях зна-
чительно интенсивнее, чем гидратация этилена. Это особенно за-
метно на первой стадии, где реакционная способность пропилена
при абсорбции его серной кислотой оценивается в 500 раз выше,
чем этилена. Поэтому первая стадия гидратации пропилена отли-
чается более мягкими условиями его поглощения: в этом случае
концентрация серной кислоты 80—90%; температура 15—35 °C;
парциальное давление пропилена 0,3—0,8 МПа. Абсорбция про-
пилена может проводиться в полых или насадочных аппаратах ко-
лонного типа.
Технологическая схема такая же, как и при гидратации эти-
лена. Выход спирта составляет 93—95 %, выход эфира — 5—7 %. Все
предложенные способы совершенствования процесса гидратации
этилена применимы к процессу гидратации пропилена. Допол-
420
Часть 2. Технология крупнотоннажных производств ...
нительно можно предложить следующий. В настоящее время про-
пилен-пропановая фракция подается в абсорбер в парообразном
состоянии. Целесообразнее подавать эту фракцию в абсорбер в
жидком виде. Это, во-первых, значительно снижает теплоту по-
глощения пропилена, составляющую при подаче пропилена
в парообразном состоянии 50241 кДж/моль, а при подаче жидко-
го пропилена на 16747 кДж/моль меньше, что заметно облегчает
отвод теплоты абсорбции. Во-вторых, испарение пропана,
присутствующего в пропилене, в еще большей мере облегчает от-
вод теплоты абсорбции. В-третьих, из схемы исключаются испа-
ритель и связанный с этим расход тепла на испарение пропилен-
пропановой фракции.
Рассмотрим новые разработки технологии сернокислотной гид-
ратации пропилена, в которых из технологической схемы исклю-
чен узел концентрирования отработанной серной кислоты.
Технологическая схема сернокислотной гидратации пропилена
70%-ной серной кислотой приведена на рис. 12.7. Исходная про-
пилен-пропановая фракция, содержащая 20—25 % пропилена, под
Рис. 12.7. Технологическая схема сернокислотной гидратации пропилена
70 %-ной серной кислотой:
1 - испаритель; 2 — абсорбер; 3 — емкость для реакционной смеси; 4 - скруббер
промывки пропана щелочью; 5 - конденсатор пропана; 6 - насос; 7 — колонна за-
вершения гидролиза и отгонки ИПС-сырца; 8 - скруббер промывки паров ИПС-
сырца; 9 - конденсатор ИПС-сырца; 10 - приемник; 11 — пароэжекционный
генератор вакуума; 12 — кипятильник; I — пропилен-пропановая фракция; II — сер-
ная кислота; III — раствор щелочи; IV — ИПС-сырец; V — раствор солей; VI — вода;
VII — пар
Глава 12. Производство этилового и изопропилового ...
421
давлением 2,5 МПа подается в испаритель 1, после чего пары на-
правляются в абсорбер 2, где пропилен поглощается 70 %-ной сер-
ной кислотой при температуре 65 °C. При таком значительном со-
держании в серной кислоте воды (30 %) изопропиловый спирт
(ИПС) образуется уже непосредственно в абсорбере. Реакционная
смесь содержит незначительное количество диизопропилсульфа-
та, что благоприятно сказывается на протекании процесса, так как
ведет к снижению образования диизопропилового эфира (ДИПЭ)
по реакции
R2SO4 + 2ROH <=> H2SO4 + 2ROR 12.26
Абсорбция пропилена протекает с достаточной скоростью при
температуре 65 °C и начальном парциальном давлении пропилена
0,5—0,6 МПа. Из верхней части абсорбера 2 отводится пропан (с ос-
таточным содержанием пропилена не более 1 %), который промы-
вается в скруббере 4 слабым раствором щелочи, конденсируется
в конденсаторе 5, охлаждаемом водой.
Реакционная смесь через промежуточную емкость 3 отводится
в колонну 7 для завершения гидролиза и отгонки изопропанола-
сырца. Перед вводом в колонну 7к реакционной смеси добавляется
некоторое количество воды. Колонна 7работает под вакуумом, что
благоприятно сказывается на протекании процесса, так как увели-
чивается скорость отгонки образовавшихся паров ИПС, следова-
тельно, увеличивается полнота гидролиза и уменьшается образова-
ние ДИПЭ. В свою очередь, снижение температуры процесса
обусловливает значительное уменьшение коррозии колонны и осо-
бенно кипятильника 12. Из верхней части колонны 7 отводятся
пары 85 %-ного ИПС-сырца, которые промываются в скруббере 8
горячим раствором слабой щелочи и конденсируются в конденса-
торе 9. Жидкий ИПС-сырец из приемника 10 откачивается на ус-
тановку ректификации. Из нижней части колонны 7 отводится
70 %-ная серная кислота, которую возвращают в абсорбер 2.
Вакуум в колонне 7 можно заменить подачей в нее так называ-
емого отдувочного газа (т. е. происходит концентрирование серной
кислоты в токе инертного газа, о чем уже упоминалось выше при
рассмотрении гидратации этилена). Однако при гидратации про-
пилена отгонка воды в токе инертного газа весьма рационально сов-
мещается в одном аппарате (с завершением гидролиза, а также од-
новременной отгонкой изопропилового спирта и побочных
продуктов (ДИПЭ и др.)).
422
Часть 2. Технология крупнотоннажных производств ...
Технология совместного получения этилового
и изопропилового спиртов сернокислотной гидратацией
Еще в 1930-е годы с целью резкого удешевления процесса
сернокислотной гидратации олефинов были предприняты попыт-
ки разработать технологию последовательного ступенчатого их
поглощения серной кислотой с возрастающей от ступени к ступе-
ни концентрацией при различных парциальных давлениях и темпе-
ратурах. Это позволило бы обойтись без весьма дорогостоящего
предварительного разделения исходного пирогаза не только на чи-
стые компоненты (как это требуется для прямой гидратации), но
даже и на фракции.
Предполагалось, например, что сжатый пирогаз после от-
деления углеводородов >С5 направляется в первый абсорбер, оро-
шаемый 60 %-ной H2SO4, где в мягких условиях четко абсорбируется
только изобутилен, во втором абсорбере, орошаемом 70 %-ной
H2SOV в несколько более жестких условиях четко поглощаются н-
бутилен, в третьем, орошаемом 80—90 %-ной H2SOV в еще более же-
стких условиях четко поглощается пропилен и, наконец, в четвер-
том, орошаемом 98 %-ной H2SOV в наиболее жестких условиях
поглощается этилен. Однако эти попытки не привели к положи-
тельным результатам. Во-первых, не удалось добиться четкого по-
глощения каждого олефина в предназначенном для него абсорбе-
ре, а во-вторых, «проскочившие» в следующий абсорбер олефины
превращались, главным образом, в полимеры.
В настоящее время, когда установлено как соотносятся ре-
акционные способности олефинов (изо-С4: С3: С, = 1000:500:1),
становятся вполне объяснимыми отрицательные результаты пред-
принятых попыток: слишком мало отличаются реакционные спо-
собности олефинов С4 и С3. Однако из этого соотношения следует,
что пропилен и этилен (500:1) вполне могут быть разделены мето-
дом последовательной абсорбции.
Таким образом, если из пирогаза предварительно выделить уг-
леводороды >С4, то сжатый пирогаз без дальнейшего разделения
может быть направлен на двухступенчатую установку последова-
тельной абсорбции, где в первом по ходу газа абсорбере будет в бо-
лее мягких условиях четко поглощаться пропилен, а во втором —
в значительно более жестких условиях — этилен. Оставшиеся не-
поглощенными водород, метан, этан и пропан могут быть направ-
лены сразу на пиролиз в топливную сеть или предварительно ис-
пользованы для концентрирования отработанной кислоты в токе
Глава 12. Производство этилового и изопропилового ...
423
инертного газа. Проведенные в масштабе пилотной установки опы-
ты подтвердили полную возможность реализации такой двухступен-
чатой последовательной абсорбции. Полученные при этом этиловый
и изопропиловый спирты вполне удовлетворяют техническим усло-
виям. Предварительные технике-экономические расчеты показыва-
ют, что себестоимость этанола и изопропанола при последователь-
ной абсорбции и концентрировании отработанной кислоты в токе
инертного газа резко снижается.
Итак, на базе рассмотренных вполне реальных возможностей
совершенствования процесса сернокислотной гидратации низших
олефинов (этилена и пропилена) можно предложить несколько ва-
риантов технологических схем, состоящих из тех или иных комби-
наций реакторных узлов с узлами разделения.
На рис. 12.8 приведен один из возможных вариантов усовер-
шенствованной технологической схемы, в которой реализованы:
О простые барботажные реакторы с рециркуляцией реакционной
смеси через выносные холодильники;
® последовательное поглощение в различных условиях пропилена
и этилена из компремированного пирогаза, предварительно ос-
вобожденного от углеводородов > С4;
© более глубокая очистка отработанной серной кислоты от по-
лимеров в противоточной экстракционной колонне;
О концентрирование отработанной серной кислоты в мягких ус-
ловиях отгонки воды в вакуумной колонне;
© непосредственная подача паров этанола-сырца из реакторно-
го узла (из реакционно-отгонной колонны) в узел разделения
(в основную колонну ректификации этанола от воды).
Отметим особенности этого технологического процесса:
® Освобожденный от углеводородов >С4 сжатый до =4,0 МПа пи-
рогаз после селективного извлечения из него в соответствую-
щих условиях пропилена (например, по схеме, приведенной на
рис. 12.7) поступает в барботажный реактор 1, где поглощается
этилен. Охлаждение рециркулирующей реакционной смеси про-
изводится в холодильнике 2. Отработанный пирогаз промыва-
ется в скруббере 21 слабым раствором щелочи и через турбоде-
тандер (на схеме не показан), где регенерируется энергия сжатия,
направляется на использование (на пиролиз или в топливную
сеть). При ином варианте технологической схемы отработанный
пирогаз может быть использован в качестве инертного газа для
концентрирования отработанной серной кислоты.
424
Часть 2. Технология крупнотоннажных произволств ...
Рис. 12.8. Усовершенствованная технологическая схема сернокислотной
гидратации этилена и пропилена:
1 — абсорбер (реактор) поглощения этилена; 2 — выносной холодильник; 3 — гид-
ролизер (сборник) этилсульфатов; 4 — гидролизная (реакционно-отгонная) колон-
на; 5 — скруббер промывки паров этанола-сырца горячим слабым раствором ще-
лочи; 6 — конденсатор этанола-сырца (аварийный); 7 - сборник этанола-сырца
(аварийный); 8 — противоточная колонна экстракции полимеров «зеленым мас-
лом»; 9 — вакуумная отгонная колонна концентрирования серной кислоты;
10 — сборник водяного конденсата; И - сборник концентрированной 97—98%-ной
серной кислоты; 12 — пароэжекционное вакуумное устройство; 13 — основная ко-
лонна ректификации этанола с дефлегматором; 14 — промежуточная емкость фу-
зельной воды; 15 — ректификационная колонна отгонки легколетучих веществ от
концентрированного этанола-сырца; 16 - сборник товарного этанола; 17 — ко-
лонна экстракции этанола из легколетучих фракций; 18 — сборник фракции эфира
и полимеров; 19 — колонна ректификации эфира; 20 — конденсатор легколету-
чих фракций и гетероазеотропов; 21 — скруббер промывки пирогаза слабым рас-
твором щелочи; 22—24 — теплообменники; I — концентрированная 98%-ная сер-
ная кислота; II — компремированный пирогаз после извлечения пропилена; III —
отработанный пирогаз (на пиролиз или в топливную сеть); IV — «зеленое масло»
(на экстракцию полимеров); V — водяной конденсат; VI — концентрированная
серная кислота; VII — полимеры в «зеленом масле» (на сжигание); VIII — избы-
точная фузельная вода; IX — товарный этанол; X — технический эфир; XI — по-
лимеры (на сжигание): XII — слабый раствор щелочи; XIII — отработанный рас-
твор щелочи
Глава 12. Производство этилового и изопропилового...
425
® Пары этанола-сырца после промывки горячим раствором ще-
лочи в скруббере 5 направляются в ректификационную ко-
лонну 13, минуя конденсатор 6. Последний вместе со сборни-
ком 7 и насосом устанавливаются как компенсационная
система, которая работает в периоды пуска или при наруше-
нии технологического режима. В отличие от традиционной схе-
мы, приведенной на рис. 12.2, основная ректификационная ко-
лонна 13 для отгонки этанола-сырца от воды устанавливается
первой в узле разделения, второй устанавливается ректифика-
ционная колонна 15 для отгонки легколетучих компонентов
от этанола-сырца.
® Вместо несовершенного однократного экстрагирования поли-
меров «зеленым маслом» устанавливается противоточная экс-
тракционная колонна 8, обеспечивающая наиболее полное уда-
ление полимеров из отработанной серной кислоты.
® В данном варианте предусматривается концентрирование кис-
лоты в отгонной вакуумной колонне 9, причем ее кипятиль-
ник, а также холодильник и приемник 11 могут быть изготов-
лены из обычной стали, так как в них поступает концентриро-
ванная кислота. Можно рекомендовать следующий режим ра-
боты колонны 9\ остаточное давление в верхней части колонны
1 кПа, температура =45 °C (это позволит охлаждать конденса-
тор наиболее дешевым хладагентом - водой); температура
в кубе колонны 210-215 °C (это позволит использовать в каче-
стве теплоносителя насыщенный водяной пар с давлением
=3 МПа и температурой 230—235 °C).
ПРЯМАЯ ГИДРАТАЦИЯ НИЗШИХ ОЛЕФИНОВ
Теоретические основы прямой
ГИДРАТАЦИИ НИЗШИХ ОЛЕФИНОВ
Как уже отмечалось, процесс гетерогенно-каталитической ги-
дратации олефинов во многом аналогичен процессам, про-
текающим в растворах кислот.
1. На фосфорно-кислотных катализаторах, которые сейчас яв-
ляются основными в промышленных крупнотоннажных уста-
новках, в результате протонизации олефина на поверхности ката-
лизатора образуется карбкатион, который при повышенных
температурах синтеза реагирует с водой и превращается в спирт.
426
Часть 2. Технология крупнотоннажных производств ...
Так же, как и в растворах, взаимодействие карбкатиона со спир-
том приводит к образованию простых эфиров, а взаимодействие
с олефинами — к образованию полимеров.
2. Реакционная способность олефинов в процессе прямой ги-
дратации меняется в той же последовательности, что и в процессе
сернокислотной гидратации: растет по мере увеличения основно-
сти олефина. Так, гидратация изобутилена протекает примерно
в 8 000 раз быстрее гидратации пропилена, а пропилен гидратиру-
ется в 8 000 раз быстрее этилена. В том же порядке меняется реак-
ционная способность олефинов к полимеризации.
Как мы уже отмечали, катализаторами прямой гидратации мо-
гут служить и разбавленные (10—30%) растворы серной или фос-
форной кислот в условиях высоких температур и давлений, т. е.
в условиях, в которых эти кислоты являются весьма агрессивными
средами. Но в настоящее время благодаря большим достижениям
в борьбе с коррозией этот способ гидратации, несомненно, заслу-
живает внимания и специальных исследований.
Твердые катализаторы — это обычно фосфорная кислота и ее
соли (простые и сложные фосфаты) на таких носителях, как алю-
мосиликаты, силикагели, пемза и т.д.; значительная часть фос-
форной кислоты (до 35 %) находится в свободном состоянии. Не-
достатками процесса гидратации на фосфорно-кислотных
катализаторах являются сильная коррозия аппаратов и унос кис-
лоты в парообразном состоянии потоком реакционной газовой
смеси. Для проведения процесса применяются и нелетучие ката-
лизаторы на основе оксидов металлов (например, Л12О2, №2О2, TiO2
и др.), активированных различными добавками. Для гидратации
высших олефинов (например изобутилена) применяют ионооб-
менные смолы.
При прочих равных условиях в присутствии твердых ката-
лизаторов процесс протекает значительно медленнее, чем в при-
сутствии жидких, но зато значительно уменьшается или даже ис-
ключается коррозия. Снижение скорости можно компенсировать
повышением температуры, но в этом случае снижается выход
спирта и повышается выход побочных продуктов (эфиров, поли-
меров и др.).
Наиболее разработанным применительно к имеющимся про-
мышленным установкам в настоящее время является процесс газо-
фазной гидратации:
СН2=СН™+Н2От^С2Н5ОН™, ДЯ=-41868кДж/моль. 12.27
Глава 12. Производство этилового и изопропилового ...
427
Этот экзотермический процесс протекает с уменьшением объ-
ема и, следовательно, снижение температуры и повышение давле-
ния способствуют увеличению равновесного выхода этанола.
В табл. 12.2 приведены равновесные выходы этанола при раз-
личных температурах и давлениях для эквимолярной смеси этиле-
на и водяного пара. При атмосферном или близком к нему давле-
нии равновесный выход этанола очень низкий. Например, при
Таблица 12.2. Равновесный выход этанола для эквимолярной смеси этилена
и водяного пара
Температура, °C Равновесный выход этанола, %
0,5 МПа 0,8 МПа 1,0 МПа 1,5 МПа
150 53.0 65,0 67.0 74,0
200 30,5 38,7 45,0 54,0
250 14.1 21.4 20.0 35,0
270 — 16,3 — —
300 6.7 10.3 12,5 18.3
350 3,5 5,6 7,0 12,2
атмосферном давлении и температуре 150 °C выход этанола дости-
гает всего лцшь 0,4%. При этих условиях и скорость процесса
в присутствии фосфорно-кислотного катализатора настолько низ-
ка, что оказывается совершенно неприемлемой для промышлен-
ных установок.
Следует обратить внимание на два физико-химических фак-
тора, которые определяют основные технологические параметры
процесса. Прежде всего это активность катализатора, которая име-
ет решающее значение для определения температуры процесса.
Активность широко применяемого в настоящее время фосфорно-
кислотного катализатора является, как известно, невысокой. Толь-
ко при температуре 280-300 °C ее можно считать приемлемой для
промышленных условий. При более же высокой температуре в зна-
чительной мере развиваются побочные процессы: полимеризация
этилена, усиленное образование эфира и др.
Другим отправным фактором именно в этом парофазном про-
цессе выступает весьма низкая по сравнению с этиленом летучесть
воды, которая имеет решающее значение для определения давле-
ния процесса. Последнее при прочих равных условиях зависит от
парциального давления паров воды, т. е. тоже от температуры.
428
Часть 2. Технология крупнотоннажных произволств ...
Таким образом, температура становится важнейшим пара-
метром, определяющим не только скорость, но и общее давление
процесса, а значит и конверсию этилена и другие показатели. Так,
в соответствии со стехиометрическим уравнением реакции, для
эквимолярной смеси этилена и паров воды, парциальное давле-
ние последних должно составлять примерно половину от общего
давления.
Например, при температуре 280 °C давление насыщенного во-
дяного пара составляет -6,5 МПа и, следовательно, предельно воз-
можное общее давление будет равно 6,5-2=13,0 МПа. Однако с це-
лью предотвращения конденсации водяного пара в самом реакторе
(что парализует действие катализатора) парциальное давление па-
ров воды, а значит, и общее давление должно быть несколько ниже.
И действительно, в промышленности применяют общее давление
в пределах 8,0—10,0 МПа.
Имеются и другие пути, предотвращающие появление водяного
конденсата. Во-первых, это повышение температуры. Однако в силу
экзотермичности процесса этот путь принципиально непригоден,
так как приводит к снижению конверсии этилена и интенсифика-
ции побочных процессов. Во-вторых, это снижение парциального
давления водяного пара за счет повышения парциального давле-
ния этилена. Однако этот путь тоже непригоден. Он также приво-
дит к снижению выхода этанола, так как оптимальным соотноше-
нием между реагирующими компонентами является эквимолярное.
Действительно, по закону действующих масс и в соответствии
со стехиометрическим уравнением реакции
рснрно/рснон=к> 12.28
где А" — константа равновесия, величина постоянная при данных услови-
ях; Р - парциальные давления водяного пара, этилена и этанола, пропор-
циональные их мольным долям в реакционной смеси.
При постоянном значении А"максимальное значение знаменате-
ля PC1Hi0H (определяющего выход этанола) будет при максимальном
значении числителя, т.е. произведения РС1Н(РНг0- Следовательно,
нужно определить максимальное значение функции:
f(x) = (A-x)x = Ах-х2, 12.29
где А — общее число молей этилена и водяного пара в реагирующей сме-
си; х - число молей водяного пара в реагирующей смеси; (А — х) — то же,
для этилена.
Глава 12. Производство этилового и изопропилового...
429
Первая производная этой функции
f\x)=A — 2x 12.30
при нулевом значении f\x) получим х = А/2.
Отрицательное значение второй производной f\x)= —2 под-
тверждает, что максимальный выход этанола при прочих равных
условиях возможен только в случае эквимолярной смеси этилена
и водяного пара, т. е. при одинаковых значениях их парциальных
давлений.
В настоящее время процесс гидратации этилена реализуется в
промышленности обычно при следующих условиях: /=280—300 °C;
Р=8,0мПа; мольное соотношение пары воды:этилен = 0,7-0,8;
катализатор — фосфорная кислота и фосфаты на алюмосиликате
или силикагеле при содержании Н3РОА до 35 % в свободном состо-
янии, объемная скорость циркулирующего газа 1800-2000 ч1, что
соответствует продолжительности контакта 18—20 с и производи-
тельности 180—200 кг этанола с 1 м3 катализатора в 1 час.
При этих условиях этилен расходуется примерно следующим
образом: 95 % — на образование этанола; 2—3 % — этилового эфи-
ра; 1—2 % — ацетальдегида; 1—2 % - полимеров и других продуктов.
Из табл. 12.2 и приведенных условий гидратации следует, что
максимальный выход (равновесный) за один проход может соста-
вить только =10%. Практически он достигает =5%, что приводит
к необходимости многократной циркуляции реакционной газовой
смеси через слой катализатора.
Столь малая конверсия этилена и низкая производительность
катализатора обусловили необходимость работы не с разбавлен-
ным (как в сернокислотной гидратации) этиленом, а с концентри-
рованным 98—99 %-ным этиленом. Даже при таком концентриро-
ванном этилене, т. е. при содержании в нем до 2% инертных
примесей (этан, метан, водород и др.), они накапливаются в ре-
циркулирующем газе, что приводит к снижению содержания эти-
лена. Нижний предел концентрации этилена принят в настоящее
время =85%, т. е. соответствует содержанию инертных примесей
=15%. Поэтому необходим отвод последних с частью рециркули-
рующего газа (отдувка на установку газоразделения), которая со-
ставит 2-100/15 = 13 % от подачи свежего 98 %-ного этилена.
Из рециркулирующей реакционной газовой смеси необходим
непрерывный отвод получаемого этанола, что при современном
уровне развития технологии разделения газовых смесей не может
430
Часть 2. Технология крупнотоннажных производств ...
быть осуществлено с должной селективностью, например через
полупроницаемые мембраны. —_
Практически удаление этанола производится обычным мето-
дом конденсации, при этом вода как менее летучий компонент
конденсируется с большей полнотой. Это приводит к огромным
затратам тепла (учитывая крупнотоннажность производства эта-
нола) на получение водяного пара, из которого только около 5 %
расходуется на конденсацию этанола, а остальные 95 % — на кон-
денсацию воды. Поэтому возникает острая необходимость в обес-
печении возможно более полной утилизации тепла непрореаги-
ровавшего водяного пара путем эффективного теплообмена меж-
ду потоками, выходящими из реактора и входящими в него газо-
выми смесями, а также путем генерации вторичного водяного пара
в котлах-утилизаторах.
Относительно низкий температурный потенциал тепла (250—
300 °C), а также невысокие значения коэффициентов теплопере-
дачи, определяемые малоэффективной теплоотдачей от газа, при-
водят на практике к громоздкой системе теплообмена.
Однако положительным фактором здесь является то, что ин-
тенсивная циркуляция реакционной газовой смеси, кратность ко-
торой (при выходе этанола около 5 %) достигает 20, и сравнительно
невысокая теплота реакции позволяют весьма просто реализовать
процесс в адиабатическом реакторе колонного типа. Выделяющая-
ся теплота реакции повышает температуру реагирующего газового
потока всего лишь на 15—20 °C, что допустимо.
Несмотря на весьма малую летучесть фосфорной кислоты,
унос ее в виде паров при такой значительной рециркуляции ре-
акционной газовой смеси и высокой температуре достигает 0,4—
0,5 кг/час с 1 м3 катализатора, что может вызывать коррозию ап-
паратуры и ограничивает длительность нормальной работы ката-
лизатора до 500—600 час. В связи с этим была разработана техно-
логия непрерывной подачи свободной фосфорной кислоты
в реакционную газовую смесь на входе в реактор, нейтрализации
ее щелочью на выходе из реактора и регенерации фосфорной кис-
лоты из полученных при нейтрализации солей. Это позволило уве-
личить длительность работы катализатора до 1500 час, заметно со-
кратить расход фосфорной кислоты и значительно уменьшить
коррозию оборудования. Такой процесс можно проводить в сталь-
ной аппаратуре (только основной аппарат — стальной реактор —
обкладывать внутри медными листами).
Глава 12. Производство этилового и изопропилового ...
431
Технология прямой гидратации низших олефинов
Из приведенной физико-химической характеристики процес-
са можно вывести основные положения, которые были приняты
при разработке существующей технологической схемы:
О Необходимо построить технологическую схему по принципу
многократной циркуляции реагирующей газовой смеси через
реактор с отводом целевого продукта (этанола) посредством
конденсации.
© В качестве исходного продукта следует применять чистый эти-
лен с минимальным содержанием инертных примесей, кото-
рые накапливаются в реакционной смеси и частично отводят-
ся с рециркулирующей газовой смесью в виде «отдувки».
© Повышение давления процесса ограничено из-за опасности
конденсации воды, снижающей активность катализатора.
О Процесс необходимо проводить при эквимолярном или близ-
ком к нему соотношении этилен/водяной пар.
© Необходимо наиболее полно регенерировать тепло, расхо-
дуемое, главным образом, на получение водяного пара.
® Возможно применение адиабатического реактора простейшей
конструкции.
О Целесообразно «подпитывать» поступающую в реактор газо-
вую смесь свежей фосфорной кислотой. Необходима нейтра-
лизация паров фосфорной кислоты на выходе из реактора,
включая регенерацию ее из выпавших солей (фосфатов).
Технологическая схема процесса прямой гидратации этилена
приведена на рис. 12.9. С помощью компрессора свежий этилен по-
дается во всасывающую линию циркуляционного компрессора 2, из
которого рециркулирующая газовая смесь через теплообменники 3
и 4 направляется в инжектор 5 на смешение с водяным паром высо-
кого давления (Z=450°C; Р=8,0 МПа), поступающим обычно с ТЭЦ.
После инжектора 5реакционная газовая смесь при температуре
280-300 °C смешивается с подаваемой фосфорной кислотой («под-
питка» реактора) и поступает на верх колонного реактора б, запол-
ненного высоким (до 8—9 м) слоем катализатора. На выходе, в ниж-
ней части реактора, газовый поток смешивается с подаваемым
раствором щелочи для нейтрализации уносимой из реактора фос-
форной кислоты и через солеотделитель 7 направляется в систему
теплообмена с целью максимальной регенерации тепла (аппара-
ты 4,8,9 и 3). Из теплообменника 3 газовый поток направляется
432
Часть 2. Технология крупнотоннажных производств ...
Рис. 12.9. Технологическая схема прямой гидратации этилена:
1 — компрессор свежего этилена; 2 — компрессор газовой смеси: 3 — теплообмен-
ник газ—конденсирующий пар; 4 — теплообменник газ—газ; 5 — паровой инжек-
тор; 6 — реактор; 7 — солеотделитель; 8,9 — котлы-утилизаторы; 10 — конденсатор-
холодильник: 11 — сепаратор высокого давления; 12 — дроссельный вентиль; 13 —
сепаратор низкого давления; 14 — сборник этанола-сырца; I — свежий этилен;
II — рециркулирующий газ; III — отдувка «инертных»; IV — конденсат водяного пара;
V-водяной пар (ДГ=150°С, Р=0,5МПа); VI - водяной пар (ДГ=125“С, Р=
0,25 МПа); VII — водяной пар (ДГ=450°С, Р=8МПа); VIII - подпитка Я3Р(?4;
IX — раствор щелочи NaOH', X — этанол-сырец на ректификацию
в холодильник 10, где завершается конденсация паров воды и эта-
нола. Далее газожидкостная смесь сепарируется в аппарате 11, газ
рециркулирует в компрессор 2, причем часть его отводится («от-
дувка» инертных) на установку разделения для регенерации эти-
лена. Из аппарата 11 через дроссельный вентиль 12 конденсат на-
правляется в сепаратор низкого давления 13, где из него выделяется
растворенный под давлением газ, который отводится для выделе-
ния этилена. Конденсат (этанол-сырец) собирается в приемник 14,
откуда откачивается на ректификацию.
Возможные пути совершенствования этого технологического
процесса следующие:
® В приведенной технологической схеме исходная реагирующая
смесь получается прямым смешением в инжекторе дорого-
стоящего перегретого водяного пара высокого давления и ре-
циркулирующего этилена. Последующая утилизация тепла про-
Глава 12. Производство этилового и изопропилового...
433
реагировавшей смеси производится в сложной и весьма гро-
моздкой системе теплообмена, включающей котлы-утилиза-
торы. Но возможны и другие более простые решения. Напри-
мер, насыщение потока этилена парами воды в скруббере,
орошаемом горячей водой (сатурационная башня). Для этой
цели может быть использована горячая (фузельная) вода, ре-
циркулирующая с установки ректификации этилена. Необхо-
димый перегрев приготовленной таким путем смеси может
быть осуществлен в печи с огневым нагревом. На рис. 12.10
представлена принципиальная технологическая схема такого
процесса. Преимущества этой схемы:
а) уменьшается громоздкость установки за счет исключения
котлов-утилизаторов и некоторых других теплообменников;
б) исключается расход дорогостоящего перегретого водяного
пара высокого давления;
в) весьма существенно уменьшается сброс фузельной воды
в связи с рециркуляцией ее в процесс гидратации. Возмож-
Рис. 12.10. Технологическая схема прямой гидратации этилена с приго-
товлением исходной смеси путем сатурации и перегрева:
1 — компрессор свежего этилена; 2 — компрессор газовой смеси; 3 — сатурацион-
ная колонна; 4 — печь для перегрева смеси; 5 — реактор; 6 — теплообменник газ-
вода; 7 — конденсатор этанола-сырца; 8 — сепаратор высокого давления; 9 — дрос-
сельный вентиль; 10 — сепаратор низкого давления; 11 - сборник этанола-сырца;
I — свежий этилен; II — фузельная вода (горячая) с установки ректификации;
III — инертные газы; IV — отдувочные газы низкого давления
434
Часть 2. Технология крупнотоннажных производств ...
ны и другие более простые и экономичные, чем рас-
смотренный, варианты приготовления исходной для
гидратации смеси этилена и водяного пара.
® Поиск и применение более активных (лучше нейтральных) ка-
тализаторов. Однако здесь нужно иметь в виду, что снижение
температуры процесса (вследствие большей активности ката-
лизатора) должно обязательно сопровождаться и снижением
парциального давления паров воды для предотвращения их
конденсации. Если при этом соблюдать эквимолярное или
близкое к нему соотношение этилен / водяной пар, то, оче-
видно, и общее давление должно быть соответственно сниже-
но. Так, в США пущен завод по производству этанола мощно-
стью 250 тыс. т/год, на котором применяется новый нейтраль-
ный оксидный катализатор (TiO2 на ZnO) повышенной актив-
ности и селективности. Процесс протекает при температуре
220°С и давлении =5,0 МПа. Конверсия этилена при работе
с указанным катализатором составляет = 10%.
Применение нового катализатора позволяет резко сократить
(= в 2 раза) циркуляцию газовых потоков, сделать менее гро-
моздкой систему теплообмена, исключить всю технологию
«подпитки», нейтрализации и регенерации фосфорной кисло-
ты и т. д. Высокая селективность процесса позволит упростить
установку разделения, сведя ее, по сути, к одной колонне рек-
тификации этанола.
И все же следует подчеркнуть принципиальную недостаточ-
ность этого способа, а именно: снижение температуры процесса
обусловливает снижение давления, что является неблагоприят-
ным фактором для процесса.
® Кардинальный путь совершенствования процесса—это разра-
ботка жидкофазного варианта, т. е. процесса гидратации эти-
лена жидкой водой. Здесь могут быть реализованы два ва-
рианта.
В первом варианте процесс протекает по реакции:
С2Я4газ +НгОж ^±С2Н,ОНга\ ДЯ=-2093,4 кДж/моль. 12.31
Здесь следует дать физико-химическую характеристику этого
процесса.
Теплота реакции очень мала, поэтому конверсия почти не за-
висит от температуры. Следовательно, с целью достижения прием-
лемой скорости процесс можно проводить и при повышенной
Глава 12. Производство этилового и изопропилового ...
435
температуре, не опасаясь большого снижения конверсии. Однако
диапазон рабочих температур здесь резко ограничен значениями
критических температур воды -374 °C и этанола -243 °C. Только в
этом узком интервале температур (243—374 °C) термодинамически
могут сосуществовать газообразный этанол и жидкая вода. Чтобы
вода не испарялась, давление должно быть, очевидно, выше кри-
тического давления воды, которое при /=374°С составляет
21,7 МПа. Критическая температура этилена 9,7 °C значительно
меньше и не определяет рабочей температуры процесса.
Казалось бы, конверсия не должна зависеть от давления, так
как реакция идет без изменения объема. Однако, как показали уточ-
ненные термодинамические расчеты, конверсия увеличивается
с повышением давления. Это связано с изменением в благоприят-
ном направлении соотношений летучестей и коэффициентов ак-
тивности реагентов при изменении давления. Так, при температу-
ре 250°C и давлении 30 МПа теоретически возможный выход
этанола за один проход составляет =60 %. Практический выход со-
ставит, вероятно, =30—40 %. Кроме того, повышение давления уве-
личивает растворимость этилена в воде, что способствует диффу-
зии его через воду к поверхности катализатора, т. е. ускоряет
процесс.
Учитывая малую теплоту реакции, отвод тепла даже при столь
большой конверсии, по-видимому, не составит затруднений и смо-
жет быть осуществлен за счет испарения некоторого количества
воды. Наиболее простым и экономичным технологическим реше-
нием представляется проведение такого процесса в реакторе-колон-
не, как совмещенного с ректификацией в присутствии какого-либо
твердого катализатора, сформованного в виде насадки, пригодной
для проведения одновременно и ректификации, например в виде
колец Рашига. Основная проблема заключается в поиске подходя-
щих катализаторов.
Во втором варианте процесс протекает по уравнению:
СгН™+Н.рж <=> С2Н5ОНЖ, ДЯ = -41868 кДж/моль. 12.32
Эта реакция идет с большим выделением тепла, и, следова-
тельно, с повышением температуры выход этанола уменьшается.
Однако реакция протекает с уменьшением объема, поэтому факто-
ром, смягчающим отрицательное влияние повышенной темпера-
туры, является давление. Тем более, что увеличение давления не
имеет видимых ограничений, так как критическая температура
436
Часть 2. Технология крупнотоннажных производств ...
единственного газообразного реагента — этилена, равная 9,7 °C,
практически всегда будет ниже рабочей температуры процесса.
Исследования такого жидкофазного процесса проводились
в проточном реакторе в присутствии оксида вольфрама W<,03, ак-
тивированного оксидом цинка ZnO на носителе — силикагеле при
t = 250 °C и Р= 30 МПа. При подаче на верх такого реактора этиле-
на и воды снизу отводился 20 %-ный водный раствор этанола. Про-
цесс характеризуется весьма низкой производительностью, кото-
рая составляет примерно 1 л этанола с 1 л катализатора в сутки.
Аналогичные результаты были получены и при использовании в
качестве катализатора нейтральных ионообменных смол.
Применение в качестве катализатора раствора серной кислоты
концентрацией примерно 1—10% показало, что при температуре
= 200—250 °C и давлении =10 МПа конверсия этилена за один про-
ход достигает 90 %.
Таким образом, широкий поиск активных катализаторов (твер-
дых или жидких), а также антикоррозионных материалов для осу-
ществления жидкофазного процесса в том или ином варианте яв-
ляется в настоящее время главной задачей, решение которой
позволит кардинально усовершенствовать процесс прямой гидра-
тации этилена и ликвидировать все недостатки, присущие паро-
фазному процессу.
В промышленности изопропиловый спирт получают главным
образом методом сернокислотной гидратации, однако ведутся ра-
боты и по осуществлению прямой гидратации пропилена.
Например, в нашей стране еще в 1956 г. были проведены такие
исследования на твердом фосфорно-кислотном катализаторе (си-
ликагель, пропитанный фосфорной кислотой). При температуре
170°С, давлении 0,7—0,9 МПа и мольном соотношении водяной
пар/пропилен 0,7-1,0 конверсия пропилена за один проход дости-
гала 6 %, выход спирта - 95 %, выход спирта с 1 м3 катализатора —
80 кг/ч при концентрации спиртоводного конденсата 20 %.
Более усовершенствованный вариант этого процесса, отра-
ботанный на опытной установке, имеет следующие условия и ос-
новные показатели при исходном концентрированном 97—99 %-ном
пропилене: температура 170—190°С, давление 1,7—1,9 МПа, моль-
ное соотношение водяной пар/пропилен 0,4—0,5, объемная ско-
рость 1300 час1. Прореагировавший пропилен расходовался: 98,5 %
на образование спирта, 1,4 % — диизопропилового эфира и 0,1 % —
полимеров. Длительность работы катализатора без снижения ак-
Глава 12. Производство этилового и изопропилового ...
437
тивности составляла 2000 час вследствие малого уноса фосфорной
кислоты, оказавшимся в среднем примерно в 50 раз меньше, чем
при гидратации этилена.
Следует подчеркнуть, что приведенные данные подтвержда-
ют отмеченное ранее (при рассмотрении процесса прямой гид-
ратации этилена) определяющее значение температуры не только
в отношении конверсии пропилена и скорости (произво-
дительности) процесса, но и в отношении давления. Здесь также
проявляется закономерность: чем ниже температура процесса, тем
ниже давление при прочих равных условиях (во избежание кон-
денсации водяного пара).
Принципиальные технологические схемы прямой гидратации
пропилена с участием фосфорно-кислотного катализатора в ос-
новном будут, очевидно, аналогичны таковым для прямой гидра-
тации этилена.
Необходимо упомянуть о применении нейтральных вольфрам-
содержащих катализаторов, работающих при высоких температу-
рах 230—320 °C и давлениях 8—25 МПа. Например, на твердом ка-
тализаторе, содержащем 22% 1F2O3 и 5% ZnO, при мольном соот-
ношении водяной пар/пропилен 10, температуре 230—240 °C и дав-
лении 20—25 МПа конверсия пропилена достигает 50%, а выход
спирта — 95 %. В конденсате содержится 20 % спирта; выход спир-
та с 1 м3 катализатора составляет 15—30 кг/час.
Однако если приведенные данные проанализировать с точки
зрения упомянутого выше определяющего влияния температуры
процесса на его давление, то обнаруживается явное несоответствие
между ними. Так, верхнему пределу температуры 240 °C соответст-
вует давление насыщенного водяного пара 3,4 МПа. В то же время
при мольном соотношении водяной пар/пропилен 10 даже при
нижнем пределе общего давления 8 МПа парциальное давление
воды должно составить 80 х 10/11 = 7,3 МПа, что явно невыполни-
мо. По-видимому, в этом случае протекает жидкофазный процесс,
а не газофазный.
Описан жидкофазный процесс прямой гидратации пропилена
с участием твердого катализатора — катионообменной смолы в ка-
честве катализатора с использованием исходного 92 %-ного про-
пилена при мольном соотношении Я20(ж.): С3Н( = 12,5—15,0. При
температуре 130-150 °C и давлении 6—10 МПа конверсия пропи-
лена достигает 75% при весьма незначительном образовании по-
бочных продуктов, т. е. высоком выходе спирта.
438
Часть 2. Технология крупнотоннажных производств ...
Сопоставление этих двух процессов прямой гидратации про-
пилена по основным условиям проведения (температура, давление)
и основным результатам (конверсия пропилена, выход спирта) под-
тверждает вывод о том, что и первый процесс является не газофаз-
ным, а жидкофазным.
ПРИНЦИПЫ В ТЕХНОЛОГИИ ГИДРАТАЦИИ
НИЗШИХ ОЛЕФИНОВ В СПИРТЫ
Технологии сернокислотной и прямой гидратации олефинов
имеют принципиальные различия. Тем не менее с точки зрения реа-
лизации принципов химической технологии они имеют и некото-
рые общие черты. В частности, технологии относятся к непрерывным
и малостадийным — технология прямой гидратации одностадийна по
химической составляющей так же, как и технология сернокислот-
ной гидратации пропилена, а технология сернокислотной гидрата-
ции этилена имеет две стадии (без учета подсистемы концентриро-
вания серной кислоты, которую можно рассматривать как регенера-
цию катализатора). В обоих технологических решениях интенсивно
используется принцип рециркуляции.
При прямой гидратации он направлен на полное использова-
ние исходного сырья (этилена), обеспечивая высокую суммарную
его конверсию при низкой степени превращения за один проход.
При сернокислотной гидратации рециркуляция направлена на мно-
гократное использование серной кислоты катализатора процесса.
Общим для технологических решений является рецикл, связываю-
щий подсистемы разделения и реакционную. Он дает возможность
не только полностью использовать воду как химический реагент,
но и реализовать принцип реализации технологии с минимальным рас-
ходованием воды и использованием ее кругооборота.
В обеих технологиях используется доступное и дешевое сырье —
этилен, они имеют высокую (95—98 %) селективность по целевому
продукту. Оба технологических решения можно рассматривать как
сопряженные технологии, поскольку образующийся технический
эфир (диэтиловый или изопропиловый) выделяется в качестве то-
варного продукта. Однородная структура подсистемы разделения
продуктов гидратации олефинов также характеризуется единством
используемых принципов. В частности, обеспечивает полноту вы-
деления продуктов из реакционной смеси (этиловый или изопропи-
ловый спирты, соответствующие простые эфиры и вода).
Глава 12. Производство этилового и изопропилового ...
439
В то же время технологические решения, имеющие различные
реакционные подсистемы, обладают и отличиями в реализации
принципов. Например, технологию совместного получения этанола
и изопропанола в большей степени, чем остальные способы, рас-
смотренные в настоящей главе, можно отнести к сопряженным (из
одного сырья этан-этилен-пропан-пропиленовой фракции получа-
ется четыре продукта: этанол, изопропанол и соответствующие эфи-
ры). Сернокислотная гидратация в отличие от прямой является тех-
нологией, обеспечивающей высокие конверсии за один проход. В тех-
нологии сернокислотной гидратации этилена целесообразно исполь-
зовать организационный принцип кооперирования и комбинирования
различных производств, так как это дает возможность за счет прода-
жи разбавленной серной кислоты предприятиям-производителям
минеральных удобрений избежать энергоемкого и экологически не-
безопасного процесса концентрирования H2SOV
Кроме того, при прямой гидратации удается более полно исполь-
зовать энергию системы, поскольку пар, вырабатываемый
в процессе, имеет более высокие энергетические параметры. В этом
случае легче за счет более простого реакторного оборудования мо-
жет быть реализован принцип применения аппаратов и технологиче-
ских линий большой единичной мощности.
Глава 13. Производство ацетальдегида
В Получение ацетальдегида из ацетилена
на ртутных катализаторах.
В Получение ацетальдегида из ацетилена
на нертутном катализаторе.
В Получение ацетальдегида из ацетилена
двухстадийным методом.
В Получение ацетальдегида из этилена.
Ацетальдегид широко используется в химической промышлен-
ности в качестве полупродукта: из него получают уксусную кисло-
ту, уксусный ангидрид, этилацетат, бутанол и 2-этилгексанол, на
долю которых расходуется 95 % производимого ацетальдегида. Од-
нако в последние годы структура его потребления меняется. Еще
сильнее она изменится в будущем, так как большую часть бутанола
и 2-этил гексанол а будут получать на базе оксосинтеза, а уксусную
кислоту — преимущественно карбонилированием метанола и дру-
гими методами. Тем не менее ацетальдегид по-прежнему является
многотоннажным продуктом органического синтеза, а его произ-
водство интересно потому, что он получается в промышленности
разными методами. Причем каждый из методов отражает разные
принципы создания безотходных производств.
Для ацетальдегида характерны все реакции, присущие альде-
гидам. В присутствии кислот он образует жидкий циклический три-
мер, называемый паральдегидом 128°С, tm= —12,6°C):
Н
ЗСНзСНО^
Ж
СН3НС СНСН3
О. ,0
СН
СН3
а также кристаллический метальдегид, состоящий из четырех мо-
лекул ацетальдегида. При нагревании в присутствии серной кис-
лоты эти полимеры разлагаются до мономерного ацетальдегида. Это
свойство иногда используется для транспортировки ацетальдегида.
Более того, полимеры иногда применяются в синтезах вместо мо-
номерного ацетальдегида.
Глава 13. Производство auetальдегида
441
Ацетальдегид в промышленности получают:
О из ацетилена по реакции Кучерова с использованием ртутного
катализатора (жидкофазный процесс) и на нертутном кадмий-
кальцийфосфатном катализаторе Горина (гетерогенный про-
цесс);
© из этанола (каталитическим дегидрированием и окислитель-
ным дегидрированием);
© из этилена (жидкофазный процесс) на палладиевых катализа-
торах в одну и две стадии.
Рассмотрим более подробно технологию производства ацеталь-
дегида из ацетилена и этилена.
ПОЛУЧЕНИЕ АЦЕТАЛЬДЕГИДА ИЗ АЦЕТИЛЕНА
НА РТУТНЫХ КАТАЛИЗАТОРАХ
Теоретические основы процесса
Реакция гидратации ацетилена на ртутных катализаторах была
открыта М.Г. Кучеровым в 1881 г. и использовалась в промышлен-
ности с целью получения ацетальдегида более 60 лет:
СН = СН + Н,0 HgS°<’”g0 уСН.СНО, ДЯ®=-150,1 кДж/моль. 13.1
Реакция сильно экзотермична. До 300 °C она практически нео-
братима, но с дальнейшим ростом температуры равновесие смеща-
ется в сторону разложения ацетальдегида. Она протекает в нужном
направлении с приемлемой скоростью в присутствии катализатор-
ного раствора (10—20 %-ная H2SOV содержащая 0,5—0,6% HgO
в виде HgSO^. Реакция протекает через промежуточное образова-
ние комплекса ацетилена с Hg+\ Дальнейшее его разложение при-
водит к образованию ацетальдегида:
CH +Hg2+ сн +н2о + +Н+
III |||^Hg2+ Hg+CH=CHOH2+
сн сн
13.2
+н+
Hg2++ СН2=СНОН2+—► Hg2+ + СН3-СНО + н+.
Скорость реакции увеличивается с повышением концентрации
H2SO^ и температуры процесса, однако при этом возрастает и вы-
442
Часть 2. Технология крупнотоннажных производств ...
ход побочных продуктов, прежде всего за счет кротоновой конден-
сации с образованием кротонового альдегида
2СН£Н0^СН£Н = СНСН0 + Щ0 13.3
и альдольной конденсации с образованием смол (в том числе и с пос-
ледующей полимеризацией кротонового альдегида).
С целью сокращения образования побочных продуктов в реак-
ционную зону подается избыток ацетилена (2,5:1), с которым по-
лучающийся ацетальдегид уносится из зоны реакции. Это приво-
дит и к увеличению производительности установки. Вместе с тем
подача в избытке ацетилена приводит к уменьшению выхода аце-
тальдегида за один проход через катализаторный раствор и увели-
чению рециркуляционных потоков. Конверсия ацетилена в ацеталь-
дегид за один проход составляет 30—50 %.
Ацетальдегид является сильным восстановителем. В данном
случае в его присутствии Hg2+ вначале восстанавливается до Hg+,
а затем до металлической ртути:
СНОСНО + Я?? + Я,О -> СН.СООН + 2Hg2+ + 2Я+
, 13.4
Hg2+ + Н2О+СНОСНО -> 2Hg +я+ + сн.соон
в результате образуется ртутный шлам. Восстановителями также
могут выступать H2S, РН3 и др. Этот процесс является крайне
нежелательным, поскольку металлическая ртуть имеет высокое
давление насыщенных паров, которые уносятся с реакционными
газами, дезактивируя катализатор и загрязняя окружающую сре-
ду. Для предотвращения восстановления ртути в катализаторный
раствор добавляют соли трехвалентного железа (в избытке по срав-
нению с солями ртути). Этим обеспечивается протекание реак-
ции (Fei+ + Hg+ —> Ле2+ + Hg2+), поддерживающей ртуть в макси-
мальной степени окисления.
В присутствии Ле3+ катализаторный раствор может работать до-
статочно долго, но так как ионы Fe2+ накапливаются, часть его
необходимо непрерывно отводить для регенерации (окислением
азотной кислотой). Тем не менее потери ртути значительны и сос-
тавляют 1,0—1,5 кг на 1 т ацетальдегида.
В промышленности процесс проводят при /=75—100 °C, про-
пуская ацетилен через водный катализаторный раствор. При 50 %
конверсии ацетилена выход альдегида составляет 92—93 % от про-
Глава 13. Производство аиетальдегида
443
реагировавшего ацетилена. Производительность процесса состав-
ляет 160 г ацетальдегида с 1 л катализатора за 1 ч. Основную реак-
цию осуществляют в полой футерованной колонне, заполненной
катализаторным раствором и имеющей расширение в верхней час-
ти (заполненной насадкой).
Технологическое оформление процесса
Технологическая схема процесса получения ацетальдегида из
ацетилена на ртутных катализаторах приведена на рис. 13.1. Очи-
щенный от примесей (H2S. РН3, NH3, AsH3 и др.) свежий ацетилен
смешивается с возвратным ацетиленом и водяным паром в смеси-
теле 1. Затем парогазовая смесь подается в нижнюю часть гидрата-
тора 2 при Р=0,22—0,23 МПа, где протекают реакции. Водяной пар
в данном случае играет роль реагента и теплоносителя.
Рис. 13.1. Технологическая схема производства ацетальдегида из ацетиле-
на на ртутных катализаторах:
1 — смеситель; 2 — реактор; 3 — сепаратор; 4,5 — холодильники; 6,7,13 — скруббе-
ры; 8 - сборник; 9 — теплообменник; 10-12 - ректификационные колонны;
I — свежий ацетилен; 1а — рециркулирующий ацетилен; 16— ацетилен на очистку;
II — водяной пар; III — металлическая ртуть; IIIа — катализаторный раствор после
регенерации; IIIб— катализаторный раствор на регенерацию; IV- кротоновая
фракция; V — товарный ацетальдегид; VI — водный конденсат
Отработанный катализаторный раствор непрерывно частично
отводится с верхней части реактора и направляется на регенера-
цию. После регенерации он возвращается в нижнюю часть реак-
тора. Туда добавляется металлическая ртуть с целью компенсации
ее потерь.
Продукты реакций, непрореагировавшие ацетилен и водяной
пар отделяются вначале в расширителе реактора, а затем в сепара-
444
Часть 2. Технология крупнотоннажных производств ...
торе 3 от капель катализаторной жидкости и проходят последова-
тельно холодильники-конденсаторы 4 и 5. В холодильнике-конден-
саторе Сконденсируются преимущественно пары воды, и конденсат
возвращается в реактор. А в холодильнике-конденсаторе 5 конден-
сируется остальная часть водяных паров, ацетальдегид и кротоно-
вый альдегид. Этот конденсат направляется в сборник 8, а нескон-
денсированная парогазовая смесь — в нижнюю часть скруббера 6.
Таким образом, отвод тепла в реакторе 2 осуществляется
за счет испарения продуктов реакций и воды.
В скрубберах 6 и 7 происходит извлечение ацетальдегида. При-
чем скруббер /орошается водным конденсатом, а скруббер 6 — сла-
бым раствором ацетальдегида. Конденсат из скруббера 6 направля-
ется в сборник 8, в котором собирается водный раствор, содержащий
ацетальдегид (7-10%), кротоновый альдегид и примеси уксусной
кислоты. Несконденсированные продукты (главным образом ацети-
лен) из верхней части скруббера /направляются в смеситель 7. Око-
ло 10 % этого газового потока непрерывно выводится из системы для
отделения от инертных примесей. Конденсат из сборника 8 после
предварительного подогрева в теплообменнике 9 за счет водного кон-
денсата, выходящего из куба колонны 10, до температуры 60-65 °C
направляется в отгонную колонну 10, которая обогревается «острым
паром». Верхний продукт колонны 10направляется в колонну 77 для
отделения от тяжелых примесей (кротонового альдегида, уксусной
кислоты и др.) ацетальдегида и растворенного ацетилена. Верхний
продукт колонны 77 поступает в колонну 72 для отделения ацетиле-
на от ацетальдегида. Так как вместе с ацетиленом уносится некото-
рое количество ацетальдегида, то ацетилен подается в скруббер 13
для отмывки ацетальдегида водой. Водный раствор из скруббера 13
направляется в сборник 8, а ацетилен — в смеситель 7.
Процесс протекает при низких температурах с высокой се-
лективностью и производительностью. Кротоновый альдегид так-
же может быть выделен как целевой продукт (в этом случае селек-
тивность процесса по сумме продуктов увеличится). Отвод тепла
осуществляется простейшим способом (за счет испарения продук-
тов синтеза и воды), при этом продукты реакций отделяются от ка-
тализаторного раствора, т. е. осуществляется совмещенный процесс.
Более быстрому удалению ацетальдегида из зоны реакций способ-
ствует наличие избытка ацетилена.
Вместе с тем описанный выше метод обладает рядом сущест-
венных недостатков:
Глава 13. Производство auetальдегида
445
О в качестве катализатора применяются токсичные вещества
(ртуть и ее соли), причем наблюдаются большие потери ртути;
© катализаторный раствор создает сильно агрессивную среду
(водный раствор серной кислоты);
© регенерация катализатора проводится в присутствии азотной
кислоты.
Можно отметить и некоторые другие недостатки, которые воз-
никают при рассмотрении процесса с точки зрения принципов соз-
дания безотходных производств.
В частности, в жидкофазных процессах тепло реакций часто от-
водится за счет испарения продуктов и сырья. В данном случае за
счет совмещения тепло используется в основном для отделения про-
дуктов синтеза (ацетальдегида и кротонового альдегида) и только ча-
стично для испарения реагента (воды), который после конденсации
возвращается в реактор. Избыточный ацетилен, возвращаемый в виде
рецикла в реактор, способствует быстрому удалению продуктов син-
теза (ацетальдегида и кротонового альдегида) из реакционной зоны.
В результате в меньшей степени протекает их дальнейшее превра-
щение, т. е. реализуется еще один принцип — повышение селектив-
ности процесса. Кроме того, использование «острого пара» в колон-
не 10 сокращает его расход, но увеличивает количество загрязненного
конденсата, требующего дополнительной очистки. Получается так-
же кротоновая фракция, содержащая 10% кротонового альдегида,
которую необходимо перерабатывать с целью выделения продукто-
вого кротонового альдегида.
Принципы в технологии получения
АЦЕТАЛЬДЕГИДА ГИДРАТАЦИЕЙ АЦЕТИЛЕНА
С точки зрения общих принципов создания технология про-
цесса получения ацетальдегида из ацетилена на ртутных катализа-
торах имеет следующие недостатки:
Ф используется токсичная каталитическая система;
® ацетальдегид как продукт выделяется в кубе колонны 12, поэто-
му в нем содержатся тяжелокипящие или нелетучие примеси;
® растворенный ацетилен выделяется только в конце схемы,
предпочтительнее это делать раньше.
Основным недостатком этого способа является неприемлемая
каталитическая система, поэтому она не может быть использована
в промышленности. Остальные недостатки не являются существен-
446
Часть 2. Технология крупнотоннажных произволств ...
ными и могут быть устранены. Вместе с тем этот способ обладает
многими преимуществами, которые могут быть успешно реализова-
ны в других технологиях. В частности, этот процесс является одно-
стадийным, обладает хорошей селективностью, может обеспечить
одновременное получение двух целевых продуктов (ацетальдегид и
кротоновый альдегид). Кроме того, реактор обеспечивает не только
проведение собственно реакции, но и отделение продуктов от ката-
лизаторного раствора. Эффективное применение рециркуляции как
по воде, так и ацетилену обеспечивает не только полное использо-
вание сырья, но и служит для подавления побочных реакций, повы-
шая выход целевого продукта. Все это делает процесс достаточно при-
влекательным, однако высокотоксичная каталитическая система
делает его бесперспективным.
ПОЛУЧЕНИЕ АЦЕТАЛЬДЕГИДА ИЗ АЦЕТИЛЕНА
НА НЕРТУТНОМ КАТАЛИЗАТОРЕ
Для этого процесса в качестве катализатора предлагались раз-
личные оксиды металлов и соли, в том числе фосфаты, вольфрама-
ты, ванадаты, молибдаты, хроматы. Наибольшую активность и ста-
бильность показал кадмийкальцийфосфатный катализатор,
разработанный Ю.А. Гориным и С. М. Момозоном, состава
CdHPO^- Са3(РОА)2, обладающий кислотными свойствами. Этот ка-
тализатор активен при 350—400 °C, регенерируется воздухом и во-
дяным паром при 400-450 °C.
Для осуществления такого процесса предложен колонный аппа-
рат с несколькими слоями катализатора (рис. 13.2), которые разде-
Ацетилен
реакции
лены колпачковыми тарелками, препятствую-
щими попаданию брызг влаги в последующие
слои катализатора. Отвод тепла осуществля-
ется за счет испарения водного конденсата,
вбрызгиваемого между слоями катализатора.
Это устраняет местные перегревы и уменьша-
ет кротоновую конденсацию ацетальдегида
(чему способствует и избыток водяного пара
и ацетилена), а также обусловливает увеличе-
Рис. 13.2. Колонный аппарат с несколькими слоя-
ми катализатора для получения ацетальдегида
Глава 13. Производство аиетальдегида
447
ние скорости целевой реакции — гидратации ацетилена. Процесс
проводят при объемном соотношении водяного пара и ацетилена,
равном 7—10:1 и 45—50 %-ной конверсии ацетилена. При этом вы-
ход ацетальдегида составляет 89 %, кротонового альдегида — 6—7 %,
образуются уксусная кислота (0,5—1,0 %), ацетон (0,3 %) и примеси.
Активность катализатора снижается вследствие образования
смолистых продуктов и зауглероживания. Поэтому к концу цикла
(через 70—100 час) температуру увеличивают до 400—410 °C, после
чего катализатор подвергают регенерации. Общая продолжитель-
ность службы катализатора =2500 час. Производительность ката-
лизатора по ацетальдегиду 140—216 кг/(м3 кат-час).
Непрореагировавший ацетилен возвращается на синтез, 15—
20% ацетилена отводят для очистки от инертных газов. Продукты,
выходящие из реактора, конденсируют, отгоняют от воды и под-
вергают ректификации. В итоге получается 99,5%-ный ацетальде-
гид и 85 %-ный кротоновый альдегид в виде азеотропа с водой.
Вместе с тем этот процесс не нашел широкого распростране-
ния из-за небольшого срока службы катализатора без регенерации,
его низкой механической прочности, токсичности (из-за наличия
кадмия). С точки зрения принципов создания безотходных произ-
водств в нем плохо используется тепло реакции.
ПОЛУЧЕНИЕ АЦЕТАЛЬДЕГИДА
ИЗ АЦЕТИЛЕНА ДВУХСТАДИЙНЫМ МЕТОДОМ
Как уже отмечалось, производство ацетальдегида из ацетилена
жидкофазным (метод Кучерова на ртутном катализаторе)
и парофазным (на катализаторах Горина) в настоящее время пре-
кращено или прекращается. Вместе с тем применение ацетилена
в качестве исходного сырья в производстве ацетальдегида в ряде
районов нашей страны целесообразно вследствие его доступнос-
ти. Кроме того, цена ацетилена в существенно меньшей степени
зависит от стоимости нефти, нежели этилена. Следовательно, его
стоимость как сырья меньше подвержена колебаниям цен на ми-
ровом рынке. Поэтому необходима разработка новых способов по-
лучения ацетальдегида на базе ацетилена, позволяющих создать эко-
логически приемлемое производство.
Эта задача может быть решена за счет использования метода,
базирующегося на промежуточном образовании винилбутилового
эфира из ацетилена и //-бутанола:
448
Часть 2. Технология крупнотоннажных производств ...
С2Н2 + СН2СН2СН2СН2ОН СН2 = СНОСН2СН2СН2СН2 13.5
В этом варианте бутанол постоянно находится в рецикле (до-
бавляется только такое его количество, которое теряется в произ-
водстве), а на получение ацетальдегида расходуется только ацетилен.
Технология двухстадийного способа
производства ацетальдегида из ацетилена
Винилбутиловый эфир (ВБЭ) в этом методе получается при ви-
нилировании н-бутанола ацетиленом в присутствии щелочных ка-
тализаторов. Винилирование можно проводить в присутствии гид-
роксида калия. Кроме того, как будет показано ниже, интервал
температур, при которых протекает процесс, является крайне уз-
ким. Это объясняется тем, что в соответствии с уравнением Арре-
ниуса при увеличении температуры возрастает константа скорости
реакции, а парциальное давление ацетилена (по закону Дальтона)
снижается. Причем при низких температурах доминирует первое,
а при высоких — второе. Процесс можно проводить в кожухотруб-
ном колонном одно- или трехсекционном реакторе. При этом про-
цесс протекает в кинетической области.
Недостатком односекционного реактора является значитель-
ное снижение температуры в верхней зоне колонной части, вслед-
ствие чего в этой зоне реакция идет очень медленно (в результате
излишне большой высоты колонной части). Поэтому для изуче-
ния изотермичности в новом реакторе высота трубчаток и колон-
ных частей была уменьшена, а для создания нужного объема он
скомплектован из трех секций (рис. 13.3).
Ацетилен из расположенной ниже сек-
ции попадает в расположенную выше сек-
цию по двум наружным трубам. Температу-
ра по секциям регулируется подачей пара
в межтрубное пространство трубчаток. Раз-
ность температур в нижней и верхней зонах
колонных частей составляет 1—7 °C. В таком
совмещенном варианте конверсия ацетиле-
на составляет =90% и выше. Необходимо
также отметить, что присутствие воды силь-
Рис. 13.3. Секционный реактор винилирования
бутанола
Глава 13. Производство аиетальдегида
449
но тормозит процесс (ее содержание до 1 % снижает скорость реак-
ции в 2 раза).
Так как винилбутиловый эфир применяется не только как по-
лупродукт при производстве ацетальдегида, но и как целевой про-
дукт — мономер, то требования по его чистоте достаточно высокие
(не ниже 99,5 % по содержанию основного продукта).
Ниже представлены технологические условия и основные по-
казатели промышленного способа винилирования н-бутанола (Aj),
с применением насадочного аппарата и циркуляции (А^,), односек-
ционного кожухотрубно-колонного реактора (Ар и трехсекцион-
ного кожухотрубного колонного реактора (А4):
Температура, К Ai 400-443 Аг 398-106 Аз 393-408 Ад 42-430
Давление ацетилена на входе, МПа 0,45-0,50 0,10-0,15 0,14-0,15 0,15
Содержание гидроксида калия. 13.0-14.5 9 0-11,5 7,4-14.4 13.2-13.9
Скорость подачи ацетилена, л/с 5.0-5.5 7.0-12.5 10-16 14.6-15.0
Конверсия ацетилена, % 60-85 50-60 55-60 -90
Удельная производительность по ВБЭ, г/(м3-с) 25,2 12,5 19,4 35-40
Расходный коэффициент ацетилена на 1 т ВБЭ, кг 504 425 390
При производстве винилбутилового эфира при P~Q,5 МПа
в пустотелом барботажном реакторе ацетилен разбавляется азо-
том до 35 %. Тепло отводится за счет испарения (как и во всех жид-
кофазных процессах). Состав исходной смеси (% мае.): ВБЭ — Уб-
79 %, бутанол — 19—20 %, вода — 0,4—0,8 %, легкая фракция —
0,07-0,08%.
Технологическая схема разделения продуктов синтеза винил-
бутилового эфира (ВБЭ) ректификацией приведена на рис. 13.4.
В колонне 1 при R=3 отделяется целевой винилбутиловый эфир
с содержанием целевого продукта 93—95 %. В ректификационной
колонне 2 отделяются остальные примеси ВБЭ. Эта фракция воз-
вращается в ректификационную колонну 1. Наконец, в ректифи-
кационной, а точнее в дистилляционной колонне 3 отделяется не-
прореагировавший бутанол-1, который направляется в реактор
на винилирование.
450
Часть 2. Технология крупнотоннажных производств ...
Рис. 13.4. Технологическая схема разделения продуктов синтеза винилбу-
тилового эфира ректификацией:
1—3 — ректификационные колонны; I — исходная смесь; II — винилбутиловый эфир;
III — и-бутанол; IV — и-бутанол, дибутилацетатная смола; V — смолы
Необходимо отметить, что при таком варианте разделения труд-
но выделить ВБЭ в чистом виде (=99,5 %), так как он образует азе-
отроп с бутанолом-1 (табл. 13.1). Наличие азеотропов приводит так-
же к значительному рециклу (дистиллята колонны 3).
В связи с этим целесообразно использовать на первом этапе
другой метод разделения (экстракция, экстрактивная ректифи-
кация), реализации которого не препятствует наличие азеотропов.
Технологическая схема разделения продуктов синтеза ВБЭ экс-
тракцией приведена на рис. 13.5. В экстракционной колонне 1 эти-
ленгликолем поглощается, главным образом, бутанол (частично—
Рис. 13.5. Технологическая схема разделения продуктов синтеза ВБЭ
экстракцией и ректификацией:
1 — экстрактор; 2—3 — ректификационные колонны; I — этиленгликоль; Па — ви-
нилбутиловый эфир-сырец; Пб - винилбутиловый эфир; III — гетероазеотроп
и-бутанола с водой
Глава 13. Производство аиетальдегида
451
ВБЭ и вода). Соотношение этиленгликоль: ВБЭ-сырец 0,5:1,0. Ра-
финат — винилбугиловый эфир содержит определенное количест-
во этиленгликоля. В связи с этим в ректификационной колонне 2
из экстракта отгоняется бутанол-1 от этиленгликоля. Вместе
с бутанолом-1 отгоняется вся вода в виде гетероазеотропа. Кубо-
вый продукт колонны 2, содержащий в основном этиленгликоль,
возвращается в экстракционную колонну 7. Рафинат экстракцион-
ной колонны 7 направляется в ректификационную колонну 3 для
выделения продуктового ВБЭ. Кубовый продукт ректификацион-
ной колонны 3, содержащий в основном этиленгликоль, также на-
правляется в экстракционную колонну 7.
Вариант технологической схемы разделения, предусматри-
вающий использование экстрактивной ректификации, представлен
на рис. 13.6. В качестве экстрактивного агента в этой технологии
Рис. 13.6. Технологическая схема разделения продуктов синтеза ВБЭ
ректификацией:
1-3 — ректификационные колонны; I — этиленгликоль; Па - винилбутиловый
эфир-сырец; 115 — винилбутиловый эфир; III — «-бутанол; IV — смолы
также применяется этиленгликоль. В колонне 7 происходит отделе-
ние ВБЭ от бутанола-1. Соотношение этиленгликоля и сырца со-
ставляет 1:1. В ректификационной колонне 2 отделяется бутанол-1.
И наконец, в ректификационной (дистилляционной) колонне 3 эти-
ленгликоль отделяется от смолы. Недостатком данной схемы явля-
ется испарение большого количества высокотемпературного экстрак-
тивного агента — этиленгликоля при отгонке от смолы, что требует
больших энергетических затрат.
Точное сопоставление рассмотренных трех схем разделения
провести очень сложно, так как отсутствуют полные данные о флег-
мовых числах и числе тарелок.
452
Часть 2. Технология крупнотоннажных производств ...
Вторая стадия процесса получения ацетальдегида из ацетилена
двухстадийным методом — гидролиз винилбутилового эфира. Для
ее реализации необходимо разработать непрерывный совмещенный
реакционно-ректификационный процесс гидролиза винилбутило-
вого эфира с высокой селективностью и выходом ацетальдегида.
Для этого необходимо располагать данными о структуре диаграм-
мы фазового равновесия жидкость—пар в системе ацетальдегид—
винилбутиловый эфир—вода—бутанол-1, т.е. информацией о тем-
пературах кипения чистых компонентов и азеотропов, а также
о составах азеотропов (см. табл. 13.1) и типах всех особых точек.
Таблица 13.1. Характеристика особых точек диаграммы фазового равновесия
Наименование точки Состав, % (мол.) Температура кипения, °C Тип особой точки
1 2
Ацеталвдегид (1) 100.0 — 20.8 N
Винилбутиловый эфир (1) 100.0 - 93.8 /V*
Вода (1) 100.0 100,0 Ш1|1И1
Бутанол-1 (1) 100.0 - 117.4 ГТ
Винилбутиловыи эфир (1 )— бутанол-1 (2) 73.7 26,3 ИВИ
Винилбутиловый эфир (1)—вода (2) 42.0 58.0 77.5 а-
Вода-бутанол-1 (2) 89.8 10.2 93.3 |||М1111
Винилбутиловый эфир (1)- вода (2) -бутанол-1 (3‘) 40,9 56,5 - Сз~
* Содержание воды в азеотропе равно 2,6% (мол.).
Структура диаграммы фазового равновесия жидкость—жид-
кость—пар приведена на рис. 13.7.
В концентрационном тетраэдре выделены три области ди-
стилляции и шесть областей ректификации. В одной из областей
дистилляции направленность процесса ректификации совпадает
с направленностью реакционного процесса, в которой можно обес-
печить полное превращение винилбутилового эфира и воды соот-
ветственно в ацетальдегид и бутанол-1:
СЯ2 = СЯО(СЯ2)3СЯ3 + Я2О <-> 2СЯ3СЯО+СЯ3(СЯ2)3ОЯ 13.6
Эта реакция протекает в парожидкостной среде при темпе-
ратуре, близкой к температуре кипения смеси, в присутствии фор-
Гмва 13. Производство аиетальдегим
453
Рис. 13.7. Развертка граничной
поверхности тетраэдра четырех-
компонентной смеси:
---------— следы бимодальной
поверхности;-------► - гранич-
ные линии, разделяющие области
дистилляции; 1 - ацетальдегид; 2 —
винилбутиловый эфир; 3 — вода; 4 -
«-бутанол-1; 2-3, 2-4, 3-4 - бинарные
азеотропы; 2-3-4 — тройной азеотроп
мованного катионообменного
катализатора КУ-2ФПП. На-
ряду с основной реакцией про-
текают и побочные реакции с образованием бутилацетата, крото-
нового альдегида (за счет реакций ацетализации двух типов
и частично полимеризации винилбутилового эфира). Для непре-
рывного совмещенного реакционно-ректификационного процес-
са с локализованной реакционной зоной структура диаграммы оп-
ределяет предельные стационарные состояния и принципиальную
протяженность реакционной зоны в зависимости от состава исход-
ной смеси и от вида разделения. С этой целью проводится анализ
статики процесса на основе термодинамико-топологического ана-
лиза структур фазовых диаграмм смесей, получаемых при протека-
нии основной и побочной реакции.
Так, при осуществлении реакции гидролиза винилбутилового
эфира образуется система винилбутиловый эфир—бутанол-1—дибу-
тилацеталь. В этой системе имеется два положительных азеотропа:
винилбутиловый эфир—бутанол и винилбутиловый эфир—бутила-
цеталь. Для такой системы практический интерес представляет вто-
рое заданное разделение (Р/Ж=0), так как при этом прогнозиру-
ется количественное превращение обоих реагентов с выходом
одного нижнего потока (дибутилацеталя). Кроме того, реакцион-
ная зона имеет принципиальную конечную протяженность в на-
правлении отбираемого потока (нижнего продукта). В связи с этим
целесообразно располагать реакционную зону до самых верхних се-
чений, что с точки зрения кинетики наиболее благоприятно для
осуществления реакции (рис. 13.8,6).
При проведении реакции ацетализации бутанола ацетальдеги-
дом получается система ацетальдегид—вода—бутанол—дибутилаце-
таль, которая характеризуется наличием двух бинарных положи-
тельных-азеотропов: вода—бутанол, вода—дибутилацеталь.
454
Часть 2. Технология крупнотоннажных производств ...
ВБЭ
Вода
а
Дибутил-
ацетат,
бутанол
Рис. 13.8. Схемы получения ацетальдегида (а) и дибутилацеталя (б)
Анализ статики процесса показал, что конверсия реагентов бу-
дет количественной при P/W=P3. Реакционная зона должна быть
распространена до верхних сечений колонны с замыканием верх-
него потока. Такая организация НСРРП ацетализации будет спо-
собствовать селективному протеканию реакции (см. рис. 13.8,6).
Анализ статики основной реакции гидролиза винилбутилового
эфира позволил выделить наиболее устойчивый статический вари-
ант, в котором осуществляется разделение из узла в узел. В этом слу-
чае в качестве верхнего продукта получается ацетальдегид, а в каче-
стве нижнего — бутанол, конверсия винилбутилового эфира составит
100%. Этому варианту соответствует тройственная структура аппа-
рата, схема которой представлена на рис. 13.8,а.
Так как организация процесса, представленная на рис. 13.8,а, ка-
чественно отличается от таковой, представленной на рис. 13.8,6 (для
получения дибутилацеталя), то при организации процесса по перво-
му варианту (см. рис. 13.8,о) условия окажутся неблагоприятными для
протекания побочных реакций. Следовательно, при такой организа-
ции процесса будет подавляться образование побочных продуктов ре-
акции, что позволит повысить селективность основной реакции.
ПОЛУЧЕНИЕ АЦЕТАЛЬДЕГИДА ИЗ ЭТИЛЕНА
Теоретические основы процесса
В последнее время большое распространение получил способ
получения ацетальдегида на базе этилена. Образование ацетальде-
гида при взаимодействии этилена с водным раствором хлорида пал-
ладия (PdCty впервые было описано еще в 1894 г. При взаимодей-
Глава 13. Производство аиетальдегида
455
ствии палладиевого комплекса с водой происходит окисление ак-
тивированного олефина с образованием ацетальдегида и выделе-
нием Pdn НС1 (см. 13.13). Непрерывный процесс получения аце-
тальдегида, в котором восстановление до металлического Pd сов-
мещается с непрерывным его окислением кислородом воздуха, был
предложен в 1959 г. Я.К. Сыркиным, И. И. Моисеевым и М.Н. Вар-
гафтиком. Этот процесс может протекать в одну стадию (в одном
аппарате происходит как окисление этилена, так и выделяющегося
палладия) или в две стадии: окисление (карбонилирование) оле-
фина через стадию образования активного комплекса и восстанов-
ление Pd протекает в одном аппарате, а окисление металлического
Pd—в другом:
СН2 = СН2 + PdCl2 + Н2О -> СН3СНО + Pd + 2НС1 13.7
Pd + 2HCl + Q,5O2 —> PdCl2 + H2O 13.8
В первом (одностадийном) варианте условия процесса и соот-
ношение реагентов должны быть такими, чтобы скорости окисле-
ния этилена и Pt/были одинаковыми (или последняя выше). Вмес-
те с тем скорость второй реакции значительно ниже, чем первой,
поэтому активность катализатора в таком варианте процесса быст-
ро падает.
Для повышения скорости окисления Pd были предложены про-
моторы (это главное достижение в промышленной реализации дан-
ного процесса) — соли меди или железа в среде хлороводородной
кислоты, играющие роль переносчиков кислорода (окисляя палла-
дий, медь или железо восстанавливаются по реакциям):
Pd + 2HCl + 0,5O2- >PdCl2 + H2O 13.9
Cu2Cl2+2HCl + Q,5O2 -+2CuCl2+H2O 13.10
tuinPd + 2FeCl3—^- -> PdCl2 + 2FeCl2 13.11
2FeCl2+2HCl + 0,5O2 -+2FeCl3 + H2O 13.12
Соли Си2С12 и FeCl2 легко окисляются кислородом воздуха, при
этом металл переходит в свое исходное высшее валентное со-
стояние. Следовательно, совмещение реакций 13.7 с 13.9 и 13.10
или 13.7 с 13.11 и 13.12 создает предпосылки для осуществления
456
Часть 2. Технология крупнотоннажных производств ...
в промышленном масштабе получения ацетальдегида прямым окис-
лением этилена молекулярным кислородом.
сг
СГ—Pd — СГ
СН2 к
II =
сн2
сг
сг
X СН2
сг—Pd — ||
/ сн2
сг
сг
X СН2
сг—Pd — ||
X сн2
он2
сг
X сн2
сг—Pd — ||
X сн2
ОН-
Н2О
Н2О
сг
X СН2
сг—Pd — II + ci
X сн2
сг
сг
X СН2
сг—Pd— II + СГ
X сн2
он2
сг
/ сн
сг—Pd — ||
ОН-
w/?-CH2
сг—Pd- - II
/ .СН2
ОН--"
к2
К3
2
+ Нзо+
СН2 13.13
к
СГ
2+х.-сн2 н20
сг—Pd - - II
/' ,сн2
ОН--"
сг
сг—р/—сн2сн2он
он2
к2
СГ
СГ— Pd*— СН2СН2ОН
он2
к3
Pd +2СГ+Н3О++СН3СНО
При этом, если процесс осуществляется в одном аппарате, то
во избежание разбавления непрореагировавшего этилена окисле-
ние необходимо проводить чистым кислородом. Избыток же эти-
лена вводится как с целью быстрого вывода ацетальдегида из зоны
реакции, так и для создания соотношения компонентов за преде-
лами взрывоопасных концентраций.
Глава 13. Производство анетальдегида
457
В случае двухстадийного процесса (когда реакции получения
ацетальдегида и окисления Pd проходят в одном аппарате, а окис-
ление Си2С12 или FeCl2 — в другом) можно использовать кислород
воздуха, так как подача этилена и воздуха разделена. Механизм про-
цесса, предложенный И.И. Моисеевым, М.Н. Варгафтиком и др.,
предусматривает промежуточное образование палладиевого ком-
плекса и выражается схемой 13.13.
Окисление всегда протекает по наименее гидрогенизированно-
му атому углерода у двойной связи, вследствие чего только из эти-
лена образуется ацетальдегид, а из других непредельных углеводо-
родов — кетоны. Реакционная способность олефинов в этой
реакции изменяется в последовательности, характерной для ката-
лиза комплексами металлов:
СН2 = СН2 > СИ, -СИ = СН2 > СИ, -СН2 -СИ = СН2
1,00 0,33 0,25
Суммарная реакция образования ацетальдегида сопровождается
выделением значительного количества тепла:
СН2 =СН2 + 0,5О2 -+СН3СНО, АЯ = -221,5 кДж/моль. 13.14
Скорость отдельных реакций и, соответственно, скорость об-
разования побочных продуктов зависит от условий проведения
процесса. На скорость суммарной реакции, селективность про-
цесса и выход ацетальдегида существенно влияет состав катали-
заторного раствора (содержание PdClv СиС12 и FeCl2), кислотность
среды, давление, температура, соотношение этилена и окис-
ляющего агента.
О Соотношение между общим суммарным содержанием металлов
окислительно-восстановительной системы {Си, Fe или смеси)
и Pd должно быть не меньше 15:1. На практике используется
соотношение (25 :1)—(50:1). Такой избыток меди или железа
обусловливается высокой стоимостью Pd.
© Конверсия олефина зависит также от мольного соотношения
в катализаторе меди (железа) и галогена; оно поддерживается
в узком диапазоне (1:1,4—1:1,8). Поэтому добавляемый в ходе
процесса галоген в виде хлорида или этилхлорида должен до-
зироваться достаточно точно, так как при соотношении мень-
шем, чем 1 : 1, снижается конверсия этилена, а при со-
отношении 1; 2 и выше реакция замедляется. В этом случае
добавляют ацетат меди.
458
Часть 2. Технология крупнотоннажных производств ...
© Процесс следует проводить в кислой (рЯ=0,8—3,0) или нейт-
ральной среде (рЯ=6,0—7,5), так как при повышении pH из
катализаторного раствора будет выпадать хлорид меди (I), что
приводит к снижению выхода ацетальдегида и забивки отвер-
стий газораспределительного устройства. Растворимость хло-
рида См(1) можно повысить добавлением в катализаторный рас-
твор муравьиной, уксусной, а лучше — трихлоруксусной
кислоты. Однако их следует добавлять в незначительном
количестве (особенно уксусную кислоту), так как карбоновые
кислоты образуют с Си малоактивные соли. Кроме того, ук-
сусная кислота растворяет продукты синтеза, что приводит
к образованию побочных хлорированных продуктов.
© Растворимость солей в воде ограничена, поэтому образуются
разбавленные растворы катализатора, что приводит к его низ-
кой удельной производительности. В связи с этим выгоднее
работать с катализатором, находящимся в виде суспензии в воде
или в разбавленной уксусной кислоте (шламовый катализатор).
Применение шламового катализатора позволяет сочетать вы-
сокую концентрацию катализатора с хорошим отводом тепла;
образовывать стабильную пену, что в свою очередь приводит
к хорошему диспергированию газа.
© В качестве сырья можно использовать как концентрированный
этилен, так и этан-этиленовую фракцию. Наличие малых коли-
честв водорода, оксида и диоксида углерода, предельных угле-
водородов не мешает протеканию процесса. Содержание непре-
дельных углеводородов и серы должно быть незначительным
(ацетилена <0,005 %, высших олефинов <0,03 %, серы <0,001 %)
йо избежание образования побочных продуктов.
© Превращение этилена в ацетальдегид при 20 °C протекает с низ-
кой скоростью. Реакция проходит сравнительно интенсивно
при 100-130 °C.
® Для поддержания реакционной массы в жидком состоянии при
такой температуре требуется повышенное давление (0,3—
1,1 МПа), которое способствует и ускорению процесса за счет
улучшения растворимости газов. Для повышения раство-
римости олефина и кислорода в водных растворах рекоменду-
ется применять реакционные устройства, в которых осуществ-
ляется турбулизация жидкости и обеспечивается максимальная
поверхность контакта фаз.
Глава 13. Производство аиеталвлегила
459
© Для полного окисления олефинов в соответствующие аль-
дегиды или кетоны мольное соотношение олефины: кислород
должно составлять 2:1. С целью безопасности работают обыч-
но с недостатком кислорода (соотношение олефин: кислород
от 2,5:1 до 4:1).
© Во избежание побочных реакций (конденсации и хлори-
рования) предусматривается непрерывный отвод ацетальдеги-
да из зоны реакции по мере его образования.
Выход ацетальдегида в зависимости от условий проведения ре-
акций и состава катализатора колеблется в пределах 84—98%. При
этом в качестве побочных продуктов образуются уксусная и му-
равьиная кислоты, хлорсодержащие вещества (метилхлорид,
этилхлорид, хлорацетальдегид), кротоновый альдегид, диоксид уг-
лерода и др.
Процесс прямого окисления этилена в ацетальдегид может осу-
ществляться как с использованием жидкого катализаторного рас-
твора (гомогенно-каталитический процесс), так и на твердом ката-
лизаторе (гетерогенно-каталитический процесс). При гомогенном
процессе хорошие результаты получаются при использовании вод-
ного раствора, содержащего 0,3—0,5 % PdCl2, 12—33 % СиС12 Н2О, 2—
3 % Си(СН3СОО)2 Н2О. В небольших количествах иногда добавля-
ется уксусная кислота.
Гетерогенный процесс может проводиться на катализаторе,
представляющем смесь хлоридов Pd и Си на носителе (оксид алю-
миния, силикагель, пемза, активированный уголь), например мо-
жет использоваться катализатор следующего состава: 2 % PdCl2
и 10% СиС12, нанесенные на активированный уголь. Гетерогенно-
каталитический процесс может осуществляться как на катализаторе
с неподвижным слоем (в трубчатом аппарате и в колонном аппарате
с катализатором на полках), так и на катализаторе в псевдоожижен-
ном состоянии. Гетерогенно-каталитический процесс сопряжен
с трудностями, связанными с отводом теплоты реакции, но они мо-
гут быть устранены. В частности, одним из вариантов может быть
отвод тепла за счет испарения впрыскиваемого между слоями ката-
лизатора водного конденсата (см. производство ацетальдегида из аце-
тилена парофазным методом). Однако это дает дополнительное
количество загрязненной воды, требующей очистки. Поэтому луч-
ше отводить тепло в обычном трубчатом аппарате, выполняющем
одновременно роль котла-утилизатора.
460
Часть 2. Технология крупнотоннажных производств ...
К недостаткам гетерогенно-каталитического процесса отно-
сится также сложность точной дозировки кислорода и этилена.
В жидкофазном процессе тепло отводится за счет испарения про-
дуктов синтеза и воды в токе газа. При этом из зоны реакции вы-
водится ацетальдегид. Таким образом, в одностадийном способе
процесс проводится при /=90—100 °C и Р=1 МПа, а в двухстадий-
ном — окисление этилена проводится при /=100—120°С и Р=0,8—
1,3 МПа. Конверсия этилена в одностадийном способе за один
проход составляет 30—50% (остальное возвращается в реактор
в виде рецикла), выход ацетальдегида на пропущенный этилен в
двухстадийном способе составляет 95 % (дополнительно образу-
ется 1,0—1,5% уксусной кислоты и 1,0—1,3% хлорпроизводных).
Основное различие двух вариантов процесса состоит в том, что
конверсия этилена за один проход при двухстадийном способе со-
ставляет около 100% и, следовательно, не требуется его рецирку-
ляция. В двухстадийном варианте может использоваться менее чи-
стый этилен, чем в одностадийном. В первом случае требования по
технике безопасности менее жесткие, однако двухстадийный спо-
соб требует больших капитальных затрат.
Технологическое оформление процесса
В двухстадийном процессе окисление этилена катализаторным
раствором и регенерацию последнего воздухом проводят в разных
аппаратах. Реакционными аппаратами в данном случае являются
барботажные колонны, которые с целью интенсификации массо-
переноса иногда заполняют насадкой. Из-за сильнокорродирую-
щей катализаторной среды колонны выполняются из титана или
других кислотостойких материалов.
Технологическая схема производства ацетальдегида из этилена
двухстадийным способом представлена на рис. 13.9. В нижнюю
часть реактора 2 подается этилен (или этан-этиленовая фракция),
который барботирует через регенерированный катализаторный рас-
твор. В этом аппарате реакция проводится до почти полной кон-
версии этилена. Полученный раствор ацетальдегида в катализатор-
ном растворе поступает в сепаратор 3, где после сброса давления
испаряются продукты реакции и частично вода. Катализаторный
раствор из сепаратора 3 насосом 4 перекачивается в колонну-реге-
нератор 1, в нижнюю часть которой подается воздух для окисления
См+ или Fe1" до См2+ или Fei+. Оставшиеся газы выводятся из верх-
Рис. 13.9. Технология двухреакторного окисления этилена в ацетальдегид:
1 — регенератор; 2 — реактор; 3 — сепаратор; 4 — насос; 5 — холодильник-конденсатор; 6,10 — абсорберы; 7 — сборник; 8 — отгонная
колонна; 9,11 — ректификационные колонны; I — воздух (технический кислород); II — этилен (этан-этиленовая фракция);
III — инерты воздуха; IV — этилен на очистку; V — ацетальдегид; VI — азеотроп кротоновый альдегид—вода; VII — фузельная вода
на очистку; VIII — пар; IX — вода
Глава 13. Производство аиетмьдегида 461
462
Часть 2. Технология крупнотоннажных производств ...
ней части колонны 1, а регенерированный катализаторный раствор
возвращается в реактор 2.
Парогазовая смесь из сепаратора 3 поступает в холодильник-
конденсатор 5, где конденсируется главным образом вода, кото-
рая возвращается в сепаратор 3. Парогазовая смесь (в основном
содержащая этилен) из верхней части реактора 2 направляется
в скруббер-абсорбер 6 для отмывки продуктов реакций (главным
образом ацетальдегида) водой. Водный раствор ацетальдегида со-
бирается в сборнике 7, а несконденсированный этилен возвраща-
ется в реактор 2. Чтобы исключить накапливание инертных газов
в системе, часть возвращаемого этилена выводится из системы для
очистки. Несконденсированная парогазовая смесь из холодиль-
ника-конденсатора 5 направляется в ректификационную колон-
ну 8, в которой отгоняется ацетальдегид вместе с растворенным
этиленом от всех тяжелокипящих компонентов. В эту же колонну
подается конденсат из сборника 7. Колонна обогревается «острым
паром». Верхний продукт колонны 8 направляется в колонну 9для
отделения этилена от ацетальдегида. Верхний продукт колонны 9
поступает в скруббер 10 для отмывки ацетальдегида от этилена.
Несконденсированный этилен возвращается в реактор 2, а кон-
денсат — в сборник 7. Кубовый продукт колонны 8 направляется
в ректификационную колонну 11 для отделения кротонового аль-
дегида в виде его гетероазеотропа с водой. Колонна 11 обогрева-
ется «острым паром».
В одностадийном варианте производства ацетальдегида из эти-
лена все реакции проводятся в одном реакторе колонного типа. Тех-
нологическая схема представлена на рис. 13.10. Свежий этилен сме-
шивается с возвратным в смесителе 7 и поступает далее в нижнюю
часть реактора 2. В нижнюю же часть, но на высоту примерно од-
ного метра от низа колонны, подается кислород. Парогазовая смесь
из верхней части реактора 2 поступает в холодильник-конденса-
тор 3, в котором конденсируется главным образом вода, и конден-
сат возвращается в реактор 2. Несконденсированная парогазовая
смесь из холодильника-конденсатора 3 поступает в низ скруббера-
абсорбера 4, в котором при орошении водой происходит абсорб-
ция — конденсация продуктов реакций. Несконденсированные газы
(главным образом этилен) направляются в смеситель 1. Часть это-
го потока выводится из системы для очистки с целью вывода из
системы инертных газов. Конденсат поступает в колонну 7 через
сборник 5. Отгонная колонна 7 снабжена обратным холодильни-
Рис. 13.10. Технология производства ацетальдегида из этилена (однореакторный вариант):
1 — смеситель; 2 — реактор; 3 — холодильник-конденсатор; 4 — абсорбер; 5 — сборник; 6 — парциальный конденсатор; 7 - отгонная
колонна; 8,9 - ректификационные колонны; I - свежий этилен; II — технический кислород; IIIа — катализатор с регенерации;
III б - катализатор на регенерацию; IV - ацетальдегид; V — азеотроп кротоновый альдегид—вода; VI — фузельная вода на очистку;
VII — пар; VIII — вода; IX — этилен на очистку
Гмва 13. Производство анетмьдегим 463
464
Часть 2. Технология крупнотоннажных производств ...
ком 6 и предназначена для отпарки этилена и кислорода «острым
паром». Газы возвращаются в смеситель 1, а кубовый продукт на-
правляется в ректификационную колонну <?для выделения ацеталь-
дегида. Колонна обогревается «острым паром». Кубовый продукт
направляется в ректификационную колонну 9, обогреваемую так-
же «острым паром» и предназначенную для отделения кротоново-
го альдегида в виде его гетероазеотропа с водой.
Этот вариант разделения более предпочтителен, чем тот, кото-
рый представлен в технологической схеме двухстадийного процес-
са. Прежде всего из-за того, что растворенные газы сразу отделя-
ются от продуктов в колонне с обратным конденсатором. Вместе
с тем в этом способе все ректификационные колонны обогревают-
ся «острым паром». С одной стороны, это приемлемо, так как в
смеси содержится вода, но, с другой стороны, исходная смесь по-
степенно разбавляется водой, что затрудняет выделение целевых
продуктов, а также приводит к образованию большого количества
сточных вод, требующих очистки. Однако эти два способа близки
по своим экономическим показателям и успешно эксплуатируют-
ся в промышленности.
Парофазный процесс прямого окисления этилена может быть
только одностадийным, причем так же, как и в случае парофазного
процесса, на основе ацетилена он может быть осуществлен в ко-
лонном аппарате.
Этот метод лишен таких недостатков, как коррозия и ис-
пользование рециклов по катализаторному раствору, но ему при-
сущи недостатки, связанные с отводом тепла.
В табл. 13.2 представлены ориентировочные относительные тех-
нико-экономические показатели производства ацетальдегида различ-
ными методами, которые позволяют еще раз сравнить жидкофазные
и парофазные процессы. Жидкофазные (гомогенные) процессы об-
ладают следующими преимуществами: гомогенный катализатор пол-
ностью растворим и теоретически каждый атом металла может уча-
ствовать в реакции, в отличие от гетерогенного, в котором активны
только поверхностные атомы; гомогенные катализаторы являются
высокоселективными; в гомогенном процессе, как правило, конст-
рукция реактора более проста; отвод тепла производится часто про-
ще, чем в случае гетерогенного процесса, за счет испарения продук-
тов синтеза или исходных реагентов.
Однако гомогенные (жидкофазные) процессы также имеют и су-
щественные недостатки: возникают трудности выделения продуктов
Глава 13. Производство анетальдегида
465
из раствора, содержащего катализатор; необходимы рециклы и реге-
нерация катализатора; нестабильность и повышенная чувствитель-
ность катализатора к отравлению; коррозионная активность ката-
лизаторного раствора.
Таблица 13.2. Технико-экономические показатели производства
ацетальдегида (в %)
Т ехнико-экономические показатели Парофазная гидратация ацетилена Дегидри- рование этанола Прямое окисление этилена
односта- дийное двухста- дийное
65.0 120.0 150,0
115,0 85.0 900
««>
Капитальные затраты на ос-
новное производство (на по-
лучение ацетальдегида) 100
То же,с учетом сырья 100
При использовании гетерогенных катализаторов многие из этих
недостатков отсутствуют. Так, неподвижный слой катализатора ха-
рактеризуется хорошей стабильностью и длительным сроком служ-
бы. Кроме того, имеется возможность более рационально исполь-
зовать теплоту реакций, не возникают проблемы отделения
продуктов реакций и т. д.
В целом предпочтение следует отдать гетерогенным процессам
и решать задачи по устранению их недостатков.
Принципы в технологии окисления этилена
В АЦЕТАЛЬДЕГИД
Технология производства ацетальдегида окислением этилена
является одностадийной (в двухреакторном варианте вторая стадия —
регенерация катализаторного раствора), непрерывной и базируется
на дешевом и доступном сырье (этилен, технический кислород или
воздух). Производство имеет высокую эффективность, обеспечивая
выход ацетальдегида по этилену на уровне 92—95 %. Конверсии за
один проход для двух вариантов, реализованных в промышленном
масштабе, отличаются. Так,если для однореакторного варианта ха-
рактерна конверсия этилена за один проход 30—50 %, то для двух-
реакторного — 100 %. Казалось бы, второй вариант предпочтитель-
нее. Однако высокие конверсии достигаются за счет двух (вместо
466
Часть 2. Технология крупнотоннажных произволств ...
одного) дорогостоящих реакторов. Кроме того, двухреакторный ва-
риант требует обеспечения циркуляции каталитического раство-
ра между реакционными аппаратами, а следовательно, капиталь-
ных затрат на коррозионностойкие насосные устройства,
трубопроводы, запорную арматуру и т. п. Вместе с тем в однореак-
торном варианте используе' ся более дорогой окислитель — техни-
ческий кислород. Все это в совокупности приводит к конкурен-
тоспособности двух рассмотренных технических решений.
В технологии окисления этилена в ацетальдегид применяет-
ся принцип рециркуляции. В целом в обоих случаях рециклы на-
правлены на полное использование исходного сырья. Но если
в однореакторном варианте это просматривается непосредствен-
но — рецикл этилена, то рецикл по катализаторному раствору в
двухреакторном варианте обеспечивает работоспособность реак-
торной подсистемы в целом и, следовательно, именно его приме-
нение позволяет достигать стопроцентной конверсии этилена за
один проход.
Применение принципа полноты выделения продуктов из реак-
ционной смеси в рассматриваемых технологиях реализуется как
получение в виде продуктовой фракции кротонового альдегида
с концентрацией, соответствующей азеотропному составу с во-
дой. Отвод тепла за> счет испарения продуктов реакции и воды
катализаторного раствора не позволяет из-за низкого потенциа-
ла в полной мере использовать его для технологических целей.
Как правило, степень его утилизации составляет не более 30%.
В то же время этот показатель может быть увеличен, если под-
держивать в теплообменниках-конденсаторах по холодной сто-
роне достаточно высокое давление и затем направлять подогре-
тую воду (не пар) на питание котлов утилизаторов других
технологических подсистем.
С точки зрения создания аппаратов и технологических линий
большой единичной мощности можно отметить, что, с одной сторо-
ны, как и для большинства гомогенно-каталитических процессов
создание аппаратов большой единичной мощности затруднено из-
за проблем организации контакта газа и жидкости при больших
диаметрах аппаратов, с другой стороны, создание технологичес-
ких линий большой единичной мощности возможно, поскольку
работающие параллельно реакторы могут питать единую систему
разделения.
Глава 14. Производство винилацетата
В Получение винилацетата из ацетилена
и уксусной кислоты.
В Получение винилацетата окислением
этилена в присутствии уксусной кислоты.
В Сравнение различных методов получения
винилацетата.
Среди кислородсодержащих соединений, получаемых в про-
мышленности основного органического и нефтехимического син-
теза, сложные виниловые эфиры, наиболее важным из которых яв-
ляется винилацетат, занимают одно из первых мест. Широкое
распространение в промышленности винилацетат нашел прежде
всего в качестве мономера. Важнейшим свойством винилацетата
выступает его способность к полимеризации. Полимеризация про-
текает по ионному механизму и катализируется кислотными аген-
тами. Винилацетат способен и к сополимеризации с теми мономе-
рами, для которых характерна полимеризация, протекающая по
свободно-радикальному механизму.
Среди полимерных продуктов, получаемых из винилацетата,
наиболее широкое применение нашли поливинилацетат, поли-
виниловый спирт и поливинилацетали. Причем поливинилацетат
благодаря высоким адгезионным свойствам и эластичности обла-
дает высокой клеящей способностью и применяется для производ-
ства водорастворимых латексных красок, клеев, для аппретирова-
ния тканей и т.д. Кроме того, широко распространены его
сополимеры с винилхлоридом (винилит), этиленом, эфирами ак-
риловой кислоты, стиролом и др.
Еще большее количество винилацетата расходуется на по-
лучение поливинилового спирта и поливинилацеталей. Поливи-
ниловый спирт растворим в воде и используется в качестве эмуль-
гатора и загустителя водных растворов, а также для изготовления
бензо- и маслостойких шлангов, уплотнителей, маслонепроницае-
мой бумаги и, главным образом, волокна, выпускаемого под раз-
ными названиями: «винол», «винал» (США), «куралон», «винилон»
(Япония) и др.
Поливинилацетали обладают высокой адгезией к различным
поверхностям и применяются в клеевых композициях в качестве
468
Часть 2. Технология крупнотоннажных произволств ...
связующих в производстве стеклотекстолита, для электроизоляци-
онных покрытий и т. д. В частности, промышленное значение име-
ют: поливинилформаль — при производстве эмалей (в сочетании
с резольными смолами) для покрытия электропроводов, при изго-
товлении связующих, а также бензостойких пленок и баков для бен-
зина, в которых самопроизвольно затягиваются отверстия, возни-
кающие при повреждениях, и т. д.; поливинилэтилаль — при
производстве высокостойких бесцветных пленок и связующих для
покрытия по дереву; поливинилбутираль (бутвар) — в качестве ма-
териала для прослоек в многослойных автомобильных и самолет-
ных безосколочных стеклах, при производстве клеев, пленок, по-
крытий и т. д.
Винилацетат получают различными методами при использо-
вании в качестве первичного исходного сырья уксусной кислоты
и ацетилена или уксусной кислоты,этилена и кислорода.
О Впервые в промышленности винилацетат был получен в 1938 г.
жидкофазным способом из ацетилена и уксусной кислоты на
Кусковском химзаводе. По этому методу ацетилен пропуска-
ют через уксусную кислоту, в которой растворен катализатор.
В качестве катализатора используются соли ртути в присут-
ствии минеральных и органических кислот (серная, фосфор-
ная, сульфокислоты и др.). Основная реакция протекает при
температуре 60—66 °C. В качестве побочного продукта в зна-
чительных количествах образуется этилидендиацетат. Выход
же винилацетата за один проход составляет всего 3-5%. Та-
кой способ не нашел практического применения главным об-
разом из-за токсичности солей ртути, сильного коррозион-
ного действия каталитической системы и низкого выхода
винилацетата.
© Широко распространен парофазный метод получения винила-
цетата из ацетилена и уксусной кислоты. В качестве катализато-
ров используют ацетаты цинка и/или кадмия, нанесенные на ак-
тивированный уголь, ацетат кадмия,нанесенный на оксид
алюминия, силикагель или пемзу. Процесс реализован в реакто-
рах со стационарным и псевдоожиженным слоем катализатора.
© В 1945 г. был пущен один завод по производству винилацетата
на основе ацетальдегида. Но дальнейшего распространения
этот способ не получил.
© В 1953 г. был осуществлен синтез винилацетата из уксусного
ангидрида и ацетальдегида в жидкой фазе при повышенной
Глава 14. Производство виниланетата
469
температуре в присутствии катализатора. Процесс протекает
через промежуточное образование этилидендиацетата по сле-
дующей схеме:
СН,СНО + (СЯ3СО)2 О -+ СН,СН(ООССН, )2 14.1
СН3СН(ООССН3 )2 СН,СООН + СН2 = СНСООСН, 14.2
Побочным продуктом является уксусная кислота. Если учесть,
что исходные продукты (ацетальдегид и уксусный ангидрид)
получаются из этилена и кислорода, то суммарный процесс по-
лучения винилацетата оказывается многостадийным. Именно
это обстоятельство и послужило препятствием для его широ-
кого распространения.
© В последнее время особенно популярен способ, в котором в ка-
честве сырья используются этилен, уксусная кислота и кисло-
род. В качестве катализатора применяются соли палладия с до-
бавками, образующими редокс-систему, и ацетаты щелочных
металлов. Здесь также возможны жидкофазный и парофазный
процессы. Причем жидкофазный процесс может осуществлять-
ся как по одностадийному, так и по двухстадийному вариантам.
Суммарная реакция такого процесса может быть представлена
следующим образом:
СН2 = СН2 + СН3СООН + 0,5О2 -> СН2 = СНСООСН, 14.3
Рассматривая процессы синтеза винилацетата, можно отметить
следующее обстоятельство. Технология процессов, исполь-
зующих как ацетилен, так и этилен, относится к наиболее ха-
рактерным примерам применения металлокомплексных ка-
тализаторов в гетерогенных процессах, а также гомогенных
процессов в жидкофазных условиях.
ПОЛУЧЕНИЕ ВИНИЛАЦЕТАТА
ИЗ АЦЕТИЛЕНА И УКСУСНОЙ КИСЛОТЫ
Теоретические основы процесса
Для получения винилацетата применяется реакция винилиро-
вания, заключающаяся в присоединении к ацетилену уксусной
кислоты, имеющей подвижный атом водорода:
С2Н™ + СН,СООНа1 «=» СН.СООСН = СН™ 14.4
470
Часть 2. Технология крупнотоннажных производств ...
Реакция экзотермична: АЯ^8 =-98 кДж/моль. Этот типичный
гетерогенно-каталитический процесс заключается в пропускании
паров уксусной кислоты и ацетилена через слой твердого катали-
затора. В качестве катализаторов процесса получили распростра-
нение ацетаты цинка, кадмия или их смеси, нанесенные на раз-
личные носители (активированный уголь, силикагель, оксид
алюминия, пемза и др.). Используемые катализаторы имеют удов-
летворительную производительность при температурах 180—270°С.
В этих условиях реакция обратима. Константа равновесия имеет
следующую зависимость от температуры:
IgXp = 4400/7-7,22-lg7 + 2,47-Ю’3 +11,3, 14.5
где Т — температура, К.
В табл. 14.1 представлена зависимость константы равновесия
и равновесного выхода винилацетата от температуры. Из-за резко-
го понижения выхода с увеличением температуры процесс следует
проводить при возможно более низких температурах. На практике
процесс проводят при температуре 230 °C, что обусловлено кине-
тикой реакции.
Таблица 14.1. Константы равновесия и выход винилацетата
Кинетика рассмотренных выше реакций подробно изучена на
катализаторах трех типов:
1.2л(ОЛс)2/С (f = 180 — 220°С); ', = ^я2 /<Х+ьрсщсоонТ 14.6
2. Z«O//^/2O3 (Z = 230—270°С); г = КРС1НРСН/:ООН-, 14.7
3. Cd(QAC)2/yAl2O, (t=170—230°C); г = КР^Н2РСВ}СООВ/(1+ЬР^зСООВ) .
14.8
Глава 14. Производство винилаиетата
471
Реакция протекает через образование поверхностных я-ком-
плексов ацетилена, превращающихся по следующему механизму:
Cd(OAc)2 + АсОН <=2 H[Cd(OAc)3 ] 14.9
H[Cd(OAc)3] + С2Н2 «=* H[Cd(OAc)3(C2H2)] 14.10
H[Cd(OAc)3(C2H2)]^ H[Cd(OAc)2(CH = СНОАс)] 14.11
H[Cd(OAc)2 (CH = СНОАс)] -> Cd(OAc)2 + CH2 = CHOAc 14.12
В случае применения реакторов со стационарным слоем ката-
лизатора в качестве носителя применяется активированный уголь.
Активность катализатора в значительной степени зависит от типа
применяемого активированного угля. Наибольшей активностью об-
ладают катализаторы, приготовленные на углях, имеющих поры
разного диаметра. Активность катализатора возрастает с повыше-
нием температуры активации угля, но не зависит от времени акти-
вации. С повышением температуры процесса различие в активнос-
тях катализаторов, приготовленных на разных углях, уменьшается.
При применении катализатора в псевдоожиженном состоянии ак-
тивированный уголь сильно истирается из-за его недостаточной
прочности. Поэтому в таких реакторах применяются ацетат кад-
мия и его смесь с ацетатом цинка, нанесенные на более твердые
носители: оксид алюминия или силикагель. Процесс проводят при
температуре 160—220 °C и небольшом избыточном давлении (0,03—
0,04 МПа).
В свежеприготовленном катализаторе содержится до 30 % аце-
тата цинка. Он обладает высокой активностью даже при темпера-
турах 160—180°С. При изменении содержания ацетата цинка от 10
до 30 % активность катализатора меняется мало. При понижении
активности катализатора температуру постепенно повышают до
220—230 °C, и если при этом активность катализатора падает, то его
выгружают и направляют на регенерацию. Дезактивация катализа-
тора происходит вследствие: 1) уноса ацетата цинка; 2) разложения
ацетата цинка по реакции:
Zn(OOCCH3)2 -^ZnO + CO2 + СН3СОСН3 14.13
Образовавшийся оксид цинка в основной реакции неактивен.
Однако в условиях получения винилацетата он (при указанных тем-
пературах) взаимодействует с уксусной кислотой с образованием
ацетата цинка:
472
Часть 2. Технология крупнотоннажных производств ...
ZnO+2CH3COOH ^Zn(00CCH,)2 + H2O 14.14
Таким образом происходит частичная регенерация катализато-
ра. Тем не менее активность катализатора падает, вероятно, вслед-
ствие забивки пор катализатора продуктами конденсации ацетона,
альдегидов и других побочных продуктов. Понижение активности
катализатора и вызывает необходимость повышения температуры
реакции.
Конверсия уксусной кислоты и ацетилена в значительной сте-
пени зависит от их соотношения. В свою очередь, соотношение
между ацетиленом и уксусной кислотой зависит от интенсивности
протекания побочных процессов и от кинетических соотношений.
В процессе винилирования наряду с основной реакцией про-
текают побочные с образованием ацетона, ацетальдегида, крото-
нового альдегида и этилидендиацетата (реакции 14.15—14.18):
2СН3СООН^(СН3)2СО + Н2О + СО2 14.15
С2Н2+Н2О^>СН2СОН 14.16
2С2Н2 + Н2О -> СН2СН = СНСОН 14.17
СН.СООН+СН2СООСН - СН2 СН2СН(ООССН2)2 14.18
При избытке кислоты и недостатке ацетилена уксусная кислота
превращается в ацетон с образованием воды и углекислоты. Далее
реакции ацетилена с водой приводят к образованию ацетальдегида
и кротонового альдегида. Здесь следует заметить, что присутствие
всех этих карбонильных соединений в винилацетате отрицательно
сказывается на его полимеризации. Наконец, последовательная ре-
акция уксусной кислоты с образующимся винилацетатом приво-
дит к образованию этилидендиацетата. Наряду с этими реакциями
в присутствии воды протекает и гидролиз винилацетата:
CHfiOOCH = СН2 + Н2О <-> СНрООН + СН2СОН 14.19
Таким образом, чтобы уменьшить образование побочных про-
дуктов, процесс желательно проводить с избытком ацетилена по
отношению к уксусной кислоте и в отсутствие влаги. Этот вывод
хорошо согласуется и с кинетическими данными, поскольку при
использовании Zn(OAc)2 и Cd(OAc)2 процесс сильно тормозится ук-
сусной кислотой. В связи с этим в промышленности процесс про-
водят при мольном соотношении ацетилена и уксусной кислоты
Глава 14. Производство bhhhaauetata
473
от 3,5:1 до 5:1. С целью уменьшения выхода побочных продуктов
и облегчения разделения продуктов реакции конверсию по уксус-
ной кислоте ограничивают в пределах 60—70%. Вместе с тем она
может достигать больших значений при хорошей селективности
процесса. С учетом всех перечисленных побочных реакций, а так-
же самополимеризации винилацетата выход его достигает 95—99 %
по прореагировавшей уксусной кислоте и 92—95 % — по прореаги-
ровавшему ацетилену.
Технологическое оформление процесса
В промышленности чаще всего применяется трубчатый реак-
тор. Объемная скорость паров в нем составляет 300—400 час *. Од-
нако может применяться и реактор с псевдоожиженным слоем ка-
тализатора.
Применение такого реактора дает значительный эффект:
О благодаря интенсивному перемешиванию можно обеспечить
одинаковую температуру по всему объему реактора;
© развивается большая поверхность контакта катализатора и ис-
ходных реакционных газов, что увеличивает скорость реакции;
© значительно увеличивается производительность реактора бла-
годаря большой линейной скорости реакционной смеси;
О облегчается загрузка и выгрузка катализатора, так как полная
механизация этого процесса позволяет резко улучшить усло-
вия труда;
© появляется возможность создания агрегатов большой единич-
ной мощности.
Основной недостаток такого реактора — значительное истира-
ние катализатора, а следовательно, и потери носителя. Кроме того,
наблюдается сильный унос ацетата цинка, подпитка которого за-
труднена. В связи с этим, в случае использования дорогостоящего
и механически непрочного активированного угля, следует исполь-
зовать реактор со стационарным слоем катализатора. Если же при-
меняется механически прочный носитель, а вместо ацетата цин-
ка менее летучий ацетат кадмия, то использование реактора с
псевдоожиженным слоем катализатора вполне оправдано. Посколь-
ку присутствие воды в исходных ацетилене и уксусной кислоте при-
водит к увеличению выхода побочных продуктов и к более интен-
сивному протеканию гидролиза винилацетата, исходные реагенты
должны быть предварительно осушены. В частности, ацетилен мо-
жет содержать влаги не более 0,000835 кг на 1 кг ацетилена.
17 я-6
474
Часть 2. Технология крупнотоннажных производств ...
Большинство примесей, содержащихся в техническом аце-
тилене, не влияют на первоначальную активность катализатора.
Однако их накопление в результате адсорбции вызывает снижение
активности катализатора и, следовательно, сокращает срок его
службы. Поэтому для удлинения срока службы катализатора аце-
тилен предварительно очищают от таких примесей, как РН3, AsH3,
Я,5идр.
Ввиду высокой экзотермичности реакции винилирования необ-
ходимо отводить из реактора тепло. С этой целью в межтрубное про-
странство (реактор со стационарным слоем катализатора) подается
либо высококипящий теплоноситель, например бифенильная смесь,
который охлаждается в выносном холодильнике, либо водный кон-
денсат. Последний вариант прост: не требуется выносной холодиль-
ник, генерируется водяной пар, который может быть использован
в производстве. В реакторе с псевдоожиженным слоем катализатора
имеется встроенный теплообменник, в трубки которого подается
либо высококипящий теплоноситель, либо водный конденсат.
Выделение винилацетата, непрореагировавшей уксусной кис-
лоты и побочных продуктов из реакторной парогазовой смеси про-
водится двумя путями:
Ф ступенчатой конденсацией, вначале в водном конденсаторе,
а затем в рассольном (при температуре рассола от —15 до — 20°С);
® абсорбцией, с использованием в качестве абсорбента уксусной
кислоты, конденсата реакторной парогазовой смеси или «внеш-
него» абсорбента, например ксилола.
На основании экономических показателей предпочтение сле-
дует отдать второму варианту. В данном случае при охлаждении аб-
сорбента коэффициент теплопередачи выше, чем при ступенчатой
конденсации. Охлаждение же абсорбента необходимо, так как при
абсорбции выделяется тепло, что затрудняет абсорбцию и усилива-
ет десорбцию. В качестве абсорбента целесообразнее применять
конденсат, так как в этом случае винилацетат не будет загрязнять-
ся побочными продуктами и разбавляться уксусной кислотой (при
сильном разбавлении затрудняется выделение винилацетата).
При выделении винилацетата, являющегося активным моно-
мером, необходимо учитывать два обстоятельства:
О требования к чистоте винилацетата определяются влиянием
содержащихся в нем примесей на качество получаемого по-
лимера;
Глава 14. Производство винилаиетата
475
© способность винилацетата к термополимеризации в процессе
его выделения.
В винилацетате могут присутствовать следующие примеси: ук-
сусная кислота, вода, ацетальдегид, кротоновый альдегид и аце-
тон. Было установлено, что 0,005 % кротонового альдегида замед-
ляет полимеризацию винилацетата примерно на 15%, а 0,2% —
на 40 %. По другим данным, при содержании кротонового альдеги-
да 1,3-102 моль на 100 г винилацетата полимеризация полностью
прекращается. Уксусная кислота и вода (до концентрации 5 %) не
оказывают влияния на полимеризацию, а ацетальдегид и ацетон вли-
яют очень слабо. Кротоновый альдегид в условиях получения
винилацетата полимеризуется, дезактивируя катализатор. Кроме
того, ацетальдегид в кислой среде может частично превращаться
в паральдегид с температурой кипения 124 °C (сам ацетальдегид ки-
пит при 20,8 °C).
Все это нужно учитывать при создании технологии выделения
винилацетата и регенерации непрореагировавшей уксусной кисло-
ты. Необходимо также принять во внимание термополимеризацию
винилацетата. Поэтому, несмотря на добавки ингибитора (гидро-
хинона с кислородом), следует прежде всего вывести винилацетат
из зоны высоких температур, т. е. отделить его от уксусной кисло-
ты и примесей, имеющих высокую температуру кипения. В связи
с этим более предпочтительным оказался второй вариант разделе-
ния реакционной смеси.
Схема одного из вариантов технологии получения винилаце-
тата газофазным методом из ацетилена и уксусной кислоты, наи-
более часто встречающегося в промышленности, представлена на
рис. 14.1. Свежая уксусная кислота смешивается с регенерирован-
ной кислотой, поступающей из цеха разделения, и направляется
в трубчатый испаритель 1, обогреваемый водяным паром (0,6 МПа).
Туда же поступает как свежий, так и рециркулируемый ацетилен.
Испарение уксусной кислоты проводится при температуре 70—80 °C
и давлении 0,13—0,14 МПа в токе ацетилена. Далее парогазовая
смесь поступает в сепаратор 2 для отделения капель. В дальнейшем
парогазовая исходная смесь подогревается в теплообменнике газ —
газ 3 парогазовой смесью, поступающей из реактора 5. Затем ис-
ходная парогазовая смесь подогревается до температуры 220—230°C
в подогревателе 4 водяным паром (0,9 МПа) или другим теплоно-
сителем, например дифенильной смесью. Для уменьшения уноса
катализатора парогазовая смесь подается в реактор сверху. Реактор
VIII
Рис. 14.1. Технологическая схема получения винилацетата из ацетилена и уксусной кислоты парофазным методом:
1 — испаритель; 2,10 - сепараторы; 3,6 — теплообменники; 4 — подогреватель; 5 — реактор; 7,14 — водяные холодильники; 8 — труба
Вентури; 9 — расширитель; 11 — скруббер; 12,18,23 — сборники, 13 — насос; 15,16 — рассольные холодильники; 17,19,21,22 — ректи-
фикационные колонны; 20 — дистилляционный куб; I — свежий ацетилен; II — свежая уксусная кислота; III — полимеры;
IV — кротоновая фракция; V — легкая фракция; VI — винилацетат; VII — бифенильная смесь (теплоноситель); VIII — ацетилен на
очистку; IX — скоагулировавшая катализаторная пыль; X — тяжелокипящая фракция (этилидендиацетат, полимеры, ингибитор)
476 Часть 2. Технология крупнотоннажных произволств .
Глава 14. Производство винилаиетата
477
представляет собой трубчатый аппарат, трубки которого заполне-
ны катализатором, а в межтрубное пространство подается тепло-
носитель, с помощью которого вначале (в период пуска) подводится
тепло, а затем отводится тепло реакции. Мощность одного агрега-
та составляет 11 или 22 тыс. т/год винилацетата. Для отвода тепла
можно использовать прямое испарение водяного конденсата с по-
лучением в межтрубном пространстве пара. При необходимости от-
вод тепла можно осуществлять испарением жидкой дифенильной
смеси. Дифенильная смесь охлаждается в теплообменнике 6за счет
испарения водяного конденсата. При этом получается водяной пар,
который может быть использован в этом же производстве.
Реакторный газ выводится из нижней части реактора 5через теп-
лообменник 3 и водяной холодильник 7, который играет роль кот-
ла-утилизатора, и направляется (под небольшим избыточным дав-
лением) на очистку и конденсацию. Улавливание катализаторной
пыли происходит в трубе Вентури 8 с расширителем 9 и в сепарато-
ре 10. При помощи винилацетата-сырца, циркулирующего в аппа-
ратах 8—10, осуществляется коагуляция частичек катализаторной
пыли и их отделение в сепараторе 10 от парогазовой смеси. Осадок
катализаторной пыли выводится из нижней части сепаратора 10
и направляется на регенерацию. Конденсат из сепаратора 10 насо-
сом вновь направляется в трубу Вентури 8. Сырец по мере загрязне-
ния направляется на очистку, а вместо него подается свежий.
Парогазовая смесь далее поступает в нижнюю часть скруб-
бера 11, который орошается охлажденным винилацетатом-сырцом.
Из верхней части скруббера выводится обедненная конденсирую-
щимися компонентами газовая смесь, а конденсат винилацетата-
сырца собирается в сборнике 12. Часть винилацетата-сырца насо-
сом 13 направляется в холодильник 14, где охлаждается водой до
30—35 °C. Охлажденный винилацетат-сырец делится на две части:
одна направляется на орошение скруббера, а другая поступает в хо-
лодильник 75, где охлаждается рассолом до температуры 7°С. Этот
винилацетат-сырец тоже делится на две части: одна из них направ-
ляется на орошение в скруббер, а вторая охлаждается в холодиль-
нике 16 рассолом до температуры -6 °C и направляется в самую
верхнюю часть скруббера на орошение.
Ацетилен, выходящий из скруббера 77 и содержащий незна-
чительное количество несконденсированных органических про-
дуктов, рециркулирует через аппараты 1—4 к реактор 5. С целью пре-
дотвращения накопления в системе кислорода и инертных примесей
478
Часть 2. Технология крупнотоннажных производств ...
часть рециркулирующего ацетилена направляется на установку его
очистки или на факел непрерывного сжигания.
Винилацетат-сырец из емкости 12 направляется в ректифика-
ционную колонну 17 для отделения винилацетата вместе с легколе-
тучими компонентами. Колонна работает при флегмовом чис-
ле R =2—3. Дистиллят колонны 17 поступает в ректификационную
колонну 19 через промежуточную емкость 18 для отделения легко-
летучих компонентов (ацетальдегида, ацетона, метилацетата, гете-
роазеотропа винилацетата с водой) от винилацетата. Эта колонна
работает при флегмовом числе R =50. Для отделения винилацетата
от полимеров и ингибитора может быть использован дистилляци-
онный куб 20, работающий при пониженном давлении (ингибитор
подается во все колонны, где присутствует винилацетат, причем, как
правило, во флегмовый поток). Кубовый продукт колонны 77посту-
пает в ректификационную колонну 21 для отделения кротоновой
фракции от уксусной кислоты. При флегмовом числе 7? = 100 в дис-
тиллят отгоняется фракция, содержащая =80 % уксусной кислоты и
=20% кротонового альдегида. В ректификационной колонне 22 от-
гоняют уксусную кислоту от этилидендиацетата, полимеров и инги-
битора. Через аппараты 23,1— 4уксусная кислота рециркулирует в ре-
актор 5, предварительно смешиваясь со свежей уксусной кислотой.
Технология обеспечивает чистоту винилацетата не менее 99,9 %.
Рассмотренную технологию можно усовершенствовать. Так, узел
испарения уксусной кислоты может быть решен более рационально.
В частности, его можно представить в таком виде (рис. 14.2), когда
колонна 22(рис. 14.1), помимо своего прежнего назначения (отгонка
уксусной кислоты от этилидендиа-
цетата, полимеров и ингибитора),
выполняет еще роль испарителя 7 и
смесителя паров уксусной кислоты
с ацетиленом. Другими словами, в
этой колонне осуществляется про-
цесс перегонки уксусной кислоты в
токе газа — ацетилена. Как видно из
рис. 14.2, свежая уксусная кислота
подается в виде флегмы на самый
Рйс. 14.2. Совмещенный процесс ис-
парения уксусной кислоты, ее отделе-
ния от полимеров и ингибитора, а так-
же смешения с ацетиленом
Паро-газовый ползок
Свежая I (стилен + пары
уксусная г\уксуснои кислоты)
кислота
Возвратная
уксусная
кислота
Свежий
ацетиле!/
Возвратный
ацетилен
Раствор ,
полимеров и ингибиторов
в уксусной кислоте
Глава 14. Производство винилашата
479
верх колонны, несколько ниже в колонну поступает рециркулирую-
щая уксусная кислота и противотоком снизу вводится суммарный по-
ток ацетилена (свежий+рециркулирующий). Снизу также отводятся
высококипящие и нелетучие примеси (этилидендиацетат, полимеры,
ингибитор) с остаточной уксусной кислотой.
Модернизированная технологическая схема представлена на
рис. 14.3, при этом функции испарителя 1 и колонны 22 (рис. 14.1)
выполняет колонна 1. В этом случае смесь паров уксусной кисло-
ты и ацетилена отводится из верхней части колонны 1 и направля-
ется по прежней схеме через сепаратор 2, теплообменник 3,
перегреватель 4 в реактор 5 и т. д. Тепло, расходуемое в колонне 1
на подогрев и испарение кислоты, подводится через кипятильник.
Поскольку поток свежей кислоты используется здесь в виде флег-
мы, надобность в дефлегматоре отпадает и этим обеспечивается оп-
ределенная экономия тепла и холода. Кроме того, исключается
трубчатый испаритель, для изготовления которого используются
дорогостоящие материалы.
Следовательно, в одном аппарате здесь протекают три процесса:
О испарение уксусной кислоты;
® смешение паров уксусной кислоты с ацетиленом;
® отделение уксусной кислоты от полимеров, ингибитора и дру-
гих нелетучих примесей.
Кроме того, отделение примесей кротонового альдегида от ук-
сусной кислоты (колонна 22, рис. 14.1) легче проводить в присутст-
вии воды, так как кротоновый альдегид будет отгоняться в виде его
гетероазеотропа с водой, имеющего температуру кипения 84,0 °C, тог-
да как температура кипения чистого альдегида составляет 102,2 °C.
Разность температур кипения значительно увеличивается (на 18,2°C).
Итак, если учесть все замечания, то процесс получения вини-
лацетата из ацетилена и уксусной кислоты можно рассматривать
как одностадийный процесс с достаточно простым технологичес-
ким оформлением.
Процесс парофазного метода получения винилацетата из аце-
тилена и уксусной кислоты имеет следующие преимущества:
Ф он достаточно прост, протекает в одну стадию;
® исходные реагенты в газовой фазе легко перемешиваются;
® парогазовая реакционная смесь загрязняется, главным обра-
зом, твердыми частицами катализатора, которые достаточно
легко отделяются пылеулавливающими устройствами;
VIII
Рис. 14.3. Усовершенствованная технологическая схема получения винилацетата из ацетилена и уксусной кислоты
парофазным методом:
1 - колонна-испаритель; 2,10,21 — сепараторы; 3,6 — теплообменники; 4 — подогреватель; 5 — реактор; 7,14 — водяные холодиль-
ники; 8 —труба Вентури; 9 — расширитель; 11 —скруббер; 12,22 — сборники, 13 —насосы; 15,16 — рассольные холодильники;
17,18,19 — ректификационные колонны; 20 - дистилляционный куб; I — свежий ацетилен; II — свежая уксусная кислота; III — по-
лимеры и ингибитор; IV — кротоновая фракция; V — легкая фракция; VI — винилацетат; VII — бифенильная смесь (теплоноситель);
VIII — ацетилен на очистку; IX — скоагулировавшая катализаторная пыль; X — тяжелокипящая фракция (этилидендиацетат, поли-
меры, ингибитор); XI — вода
480 Часть 2. Технология крупнотоннажных произволств .
Глава 14. Производство винилацетата
481
® характеризуется незначительными затратами тепла на синтез, на
испарение уксусной кислоты и подогрев реакционной смеси;
® основное оборудование (за исключением испарителя) может
быть изготовлено из углеродистой стали, так как исходные ве-
щества находятся в виде перегретой парогазовой смеси и кор-
розия практически отсутствует.
К недостаткам этого метода можно отнести следующее:
О наличие больших объемов циркулирующего газа (объясняется
особенностями кинетики процесса на катализаторе Zn{QAc)2,
для протекания которого необходим избыток ацетилена по
сравнению с его стехиометрическим количеством). Наличие
больших объемов циркулирующего газа требует больших объ-
емов реакционной и вспомогательной аппаратуры. Кроме того,
увеличение объемов нежелательно также ввиду особой взры-
воопасности ацетилена при повышенной температуре;
О необходимость создания большой поверхности теплообмена
вследствие малоинтенсивной теплопередачи к перегретой па-
рогазовой смеси;
О требуется выделение конденсацией винилацетата-сырца из из-
бытка газообразного ацетилена, т. е. из разбавленных газовых
смесей;
О необходимо выделять и возвращать в процесс значительные ко-
личества уксусной кислоты из-за неполной ее конверсии;
О при повышенных температурах (= 200 °C) образуются побочные
продукты, от которых необходимо отделять винилацетат;
© образуются побочные смолообразные продукты, отравляющие
катализатор;
О для отвода тепла необходимо встраивать теплообменные уст-
ройства, тогда как в жидкофазных процессах тепло отводится,
главным образом, за счет испарения продуктов реакции или
исходных реагентов.
Перечисленные преимущества и недостатки характерны для дру-
гих аналогичных газофазных процессов.
Производство винилацетата из ацетилена и уксусной кислоты
представляет сложную химико-технологическую систему (СХТС).
Полная количественная оценка поведения системы может быть по-
лучена расчетным путем при наличии математического описания
работы всех отдельных элементов (аппаратов или комплексов)
и условий их взаимодействия.
482
Часть 2. Технология крупнотоннажных производств ...
Производство винилацетата является типичным примером
СХТС, в которой проходят последовательно следующие основные
технологические операции: подготовка исходного сырья, химичес-
кое превращение сырья в реакторах со стационарным или псевдо-
ожиженным слоем катализатора, конденсация продуктов реакции
и разделение конденсата. При этом возможны многочисленные ре-
циклы сырья и промежуточных продуктов.
Разработка и оптимизация таких СХТС может быть проведена
на основе системного подхода.
Моделирование суммарной СХТС осуществляют, рассматри-
вая отдельные процессы, для которых предложены математические
модели.
Подготовка реакционной смеси. В рассматриваемой технологии
узел подготовки реакционной смеси состоит из последовательно
соединенных элементов смешения газовых и жидких потоков, ком-
примирования ацетилена, испарения уксусной кислоты, перегрева
исходной реакционной смеси до температуры реакции.
Процессы смешения реагентов или разделения (распределения)
потоков описываются следующими соотношениями:
0“’ = ^“’; <?«> = £/*>; 1420
1=1 1=1
=GW8{*\ y^j =G^8(zkh J=l,...,Nk', z =l,...,nk, 14.21
где G^ - общий расход всех компонентов; G^ - общий расход Л-го ком-
понента; 3 — коэффициент разделения; F - мольный расход; mk, пк - число
входных и выходных потоков; Nk - число компонентов; у^ — технологи-
ческий поток; i,z,j,k- индексы, которыми отмечены входные, выходные
потоки, компоненты и номера элементов СХТС соответственно.
Для каждого k-то элемента справедливы соотношения:
^5^=1; ^5g)=l; /=1,-,^ 14.22
z=l z=l
Под коэффициентами разделения понимают постоянные ве-
личины, являющиеся коэффициентами элементов вычислитель-
ного модуля.
Теплообменные процессы. Задача моделирования теплообмен-
ной аппаратуры заключается в том, чтобы на основе количества
и свойств потока (потоков), участвующего в теплообмене, опре-
делить расход теплоносителя, а также площадь теплообменной по-
Глава 14. Производство винилацетата
483
верхности. В другом варианте необходимо определить, например,
конечные температуры потоков и хладагента, т. е. температуры вы-
ходных потоков, когда заданы поверхности теплопередачи и кон-
струкции аппаратов при известных расходах потоков и свойствах
веществ, входящих в них. Эти вопросы подробно рассмотрены
в литературе и являются общими для любых производств, а сле-
довательно, и СХТС. Аналогичным образом может быть описан
тепловой баланс.
Принципы в технологии
производства винилацетата из ацетилена
1. Системный подход. В существующей технологии он ис-
пользуется недостаточно. В данном случае необходимо найти оп-
тимальную конверсию уксусной кислоты с учетом затрат на разде-
ление реакционной смеси, так как трудности разделения смеси
определяются содержанием в ней кислоты. Более того, как было
показано, могут быть совмещены испарение уксусной кислоты, ее
очистка от тяжелокипящих примесей и смешение с ацетиленом.
2. Использование одностадийного метода.
3. Относительно высокая конверсия по уксусной кислоте.
4. Утилизация и использование теплоты реакции и тепла раз-
личных потоков. В частности, реактор превращается в котел-ути-
лизатор, в котором теплота реакции расходуется на образование во-
дяного пара; тепло реакторных газов используется для подогрева
исходной смеси и т. д.
5. Применение непрерывного процесса.
6. Возможность повышения единичной мощности реакцион-
ного аппарата и всей технологической линии.
7. Совершенствование технологии разделения с целью выде-
ления всех продуктов реакции в чистом виде (например, выделяемая
кротоновая фракция не имеет в таком виде сбыта).
ПОЛУЧЕНИЕ ВИНИЛАЦЕТАТА ОКИСЛЕНИЕМ
ЭТИЛЕНА В ПРИСУТСТВИИ УКСУСНОЙ КИСЛОТЫ
В последние годы в промышленности ацетилен в качестве сы-
рья для получения ацетальдегида, винилхлорида и винилацетата за-
меняют более дешевым этиленом. В реакциях с этиленом про-
исходит прямое окислительное замещение атома водорода
в молекуле этилена группами ОН~, СН^СОО на комплексных ка-
484
Часть 2. Технология крупнотоннажных производств ...
тализаторах, содержащих переходные металлы. В промышленности
таким способом получают ацетальдегид, используя в качестве ка-
тализатора комплексы солей палладия.
Отечественными учеными (Я.К. Сыркин, И.И. Моисеев,
М. Н. Варгафтик) было показано, что при пропускании этилена че-
рез раствор PdCl2 в уксусной кислоте в присутствии ацетата натрия
образуется винилацетат. При этом также образуются ацетальдегид
и этилидендиацетат. В основе процесса лежит следующая реакция:
СН2 = СН2 + 0,5ft + CIPCOOH -> СН2 = CHOOCCIL + Н2О 14.23
Эта реакция ацетоксилирования этилена в присутствии восста-
новленного катализатора, в которой происходит замещение водорода
в этилене группой СН3СОО~ в присутствии кислорода. В качестве
катализатора предложены хлорид и бромид палладия, ацетат палла-
дия, металлический палладий и др. Для сравнения рассмотрим ос-
новные закономерности и технологию получения винилацетата окис-
лением этилена в среде уксусной кислоты как на гомогенном, так и
на гетерогенном катализаторах. В промышленности получили рас-
пространение два принципиально отличных друг от друга способа
получения винилацетата на основе реакции 14.23:
О жидкофазный метод с применением окислительно-восстано-
вительной каталитической системы;
© газофазный метод с гетерогенным катализом на основе солей
палладия или металлического палладия.
В промышленности винилацетат жидкофазным окислением на-
чали получать в 1965 г., а парофазным окислением — в 1970 г.
Теоретические основы
ЖИДКОФАЗНОГО МЕТОДА ПОЛУЧЕНИЯ ВИНИЛАЦЕТАТА
По этому методу промышленное применение получил катали-
затор, содержащий анион хлора и катионы Pd, Си и щелочного ме-
талла в среде уксусной кислоты. Жидкофазный процесс синтеза ви-
нилацетата включает следующие стехиометрические реакции:
СН2 = СН2 + PdCl2 + СН3СООН -> СН2 = СНООСН3 + Pd° +2НС1 14.24
Реакция 14.24 катализируется ацетат-ионом. Металлический пал-
ладий в уксусной кислоте медленно окисляется кислородом (низкая
растворимость кислорода, невысокие константы скорости реакций
окисления), поэтому в систему добавляются катализаторы и промо-
Глава 14. Производство винилаиетата
485
торы для ускорения этой реакции. Такими катализаторами являют-
ся соли меди или железа, n-бензохинон, а промотором — хлорид-ион,
который вводится в виде ЫС1. В системе протекают реакции:
Pd + 2CuCl2^PdCl2+2CuCl 14.25
2CuCl+2HCl+0,5O2 -^2CuCl2 + H2O 14.26
Реакции 14.24 — 14.26 составляют суммарную реакцию процесса
(реакция 14.23). Хлорид-ион, обладающий высокой окислительной
активностью, способствует также растворению металлического пал-
ладия. Кроме уксусной кислоты в качестве растворителя могут при-
меняться эфиры, ангидриды, пиридин, хлороформ и др.
Механизм реакции 14.24 включает промежуточное образование
л-комплексов, изомеризацию в палладийорганические соединения
и гетеролитический распад последнего с образованием металличе-
ского палладия.
Из промежуточно образующегося карбкатиона при отщепле-
нии протона в уксусной кислоте получается винилацетат, а при вза-
имодействии с СН^СООН — этилидендиацетат:
СН3СНОСОСН3
+ сн3соон
СН2=СНОСОСНз+ н+
СН3СН(ОСОСНз)2 + н+
14.27
Схема механизма реакции представлена ниже:
Винилацетат
Ацетат натрия, необходимый для протекания этой реакции,
в случае хлорида палладия является источником ионов ацетата, уча-
ствующих во внутрисферной нуклеофильной атаке в процессе изо-
меризации л-комплекса в металлоорганическое соединение.
Активность палладиевого катализатора синтеза винилацетата
повышается почти в 10 раз при добавлении 2-10 % (мае.) ацетатов
486
Часть 2. Технология крупнотоннажных производств ...
щелочных металлов. Эффективность действия катионов щелочных
металлов убывает в последовательности: Cs+ > Rb+ > К+> Na+ > Li+.
В жидкой фазе в результате длительного контакта винилацета-
та с реакционной водой при каталитическом действии солей ме-
таллов и хлор-иона получается ацетальдегид. Кроме того, при не-
посредственном окислении этилена в присутствии воды по тому
же механизму так же образуется ацетальдегид. В результате в этом
процессе производится регулируемое количество ацетальдегида
(в мольном соотношении ацетальдегид: винилацетат 1:0,3—2,5 в за-
висимости от содержания воды) (рис. 14.4).
Рис. 14.4. Изменение мольного соотношения ацетальдегид : винилацетат (п)
в жидкой фазе в зависимости от содержания воды при температуре процес-
са 100 °C
Повышения содержания воды, температуры, длительности пре-
бывания винилацетата в реакционной зоне, содержания палладия
в растворе катализатора способствуют гидролизу винилацетата
с образованием ацетальдегида.
Для полной компенсации уксусной кислоты, используемой
в синтезе винилацетата, требуется определенное количество аце-
тальдегида. Для этой цели необходимо поддерживать мольное со-
отношение винилацетата и ацетальдегида, равное 1,14. Следователь-
но, для получения винилацетата этим методом можно использовать
необезвоженную свежую уксусную кислоту и не проводить обезво-
живания возвратной уксусной кислоты, что значительно снижает
затраты на разделение реакционной смеси. При этом на 1 моль ви-
нилацетата можно получать 0,3—0,4 моля ацетальдегида.
Кроме того, выход винилацетата и ацетальдегида, конверсия
исходных продуктов, выход побочных продуктов зависят от темпе-
ратуры и давления, при которых протекают реакции, а также от кон-
центрации PdCl2, соотношения Pd и Си, соотношения между эти-
леном, кислородом и уксусной кислотой. Наиболее активно
катализатор работает при температуре 100—130 °C. Температура оп-
Глава 14. Производство винилацетата
487
ределяет, главным образом, скорость процесса, так как в интервале
110—130 °C скорость реакции при подъеме температуры на 10 °C уве-
личивается в 1,3 раза. С ростом температуры усиливается гидролиз
винилацетата, приводящий к повышению выхода ацетальдегида.
Однако влияние концентрации воды на выход ацетальдегида
сказывается сильнее, чем влияние температуры.
Повышение парциальных давлений этилена и кислорода при-
водит к увеличению растворимости и скорости основной реакции.
При этом снижается выход этилидендиацетата. Увеличение парци-
ального давления этилена приблизительно пропорционально уве-
личивает объемную производительность реактора. Например, если
при парциальном давлении этилена 0,98 МПа и общем давлении
2,8 МПа получается 0,58 моль/час винилацетата, то при парциаль-
ном давлении этилена, равном 2,6 МПа, и том же общем давлении
выход винилацетата доходит до 0,88 моль/час. Увеличение общего
давления приводит к сокращению выхода этилидендиацетата и
ацетальдегида при увеличении выхода винилацетата. В частности,
при увеличении давления от 0,1 до 2,5 МПа выход этилидендиаце-
тата уменьшается от 100 г до 16 г, а выход винилацетата увели-
чивается от 0,8 г до 223 г с 1 л катализатора в 1 час. В связи с этим
рекомендуется давление от 0,5 до 10 МПа. Чаще всего процесс про-
водят при 4 МПа, так как дальнейшее повышение давления прак-
тически не оказывает влияния на выход винилацетата.
Большое влияние на выход винилацетата, этилидендиацетата
и ацетальдегида оказывают различные растворители, которые до-
бавляются в уксусную кислоту. Так, при добавлении в уксусную кис-
лоту таких соединений, как мочевина и амиды, образование этили-
дендиацетата значительно снижается. Например, замена 50—60%
уксусной кислоты N, У-диметил бензамидом в одних и тех же усло-
виях реакции приводит к снижению выхода этилидендиацетата
с 23,0 до 0,6 % (считая на прореагировавший этилен). При этом вы-
ход ацетальдегида снижается с 64,0 до 18,2 %, а выход винилацета-
та повышается с 7,6 до 41,4 %. Количество таких добавок может со-
ставлять до 80% от общего содержания уксусной кислоты.
В данном процессе на выход винилацетата, ацетальдегида
и побочных продуктов влияет состав катализаторного раствора. Так,
при увеличении концентрации палладия увеличивается производи-
тельность катализатора по винилацетату и ацетальдегиду. Но при
этом усиливается димеризация этилена в бутены (бутен-1, цис-
и транс-бутен-2). Увеличение же содержания воды в растворе ка-
488
Часть 2. Технология крупнотоннажных производств ...
тализатора уменьшает образование бутенов. Так, при содержании
ионов палладия в растворе катализатора 30—50 мг/л и содержа-
нии воды 5—15 % (мае.) около 5 % этилена превращается в бутены
и их производные. Следовательно, наблюдается конкурентная си-
туация. В данном случае, вероятно, необходимо присутствие воды,
снижающей активность полимеризации этилена, но приводящей
к образованию ацетальдегида, который должен рассматриваться
как целевой продукт.
В отношении концентрации палладия в жидкой фазе существует
два варианта. В одних производствах поддерживают низкую кон-
центрацию PdCl2, равную 0,035—0,35 г/л, что соответствует скоро-
стям образования винилацетата от 100 до 120 г/л-час. В других про-
изводствах предпочитают работать с концентрацией PdCl2 около
2 г/л и достигать высоких скоростей реакции (500 г/л-час). Учиты-
вая высокую стоимость палладия, в первом случае ориентируются
на эффективную работу катализатора, а во втором — на максималь-
но возможное использование объема дорогостоящего реактора. Тем
более, что катализаторный раствор и вся реакционная масса обла-
дают высокой коррозионной способностью.
Таким образом, жидкофазное окисление.этилена проводят при
следующих условиях: температура 100—130 °C; давление 3—4 МПа,
содержание ионов Pd 30—50 мг/л и ионов Си 3—5 г/л; для отгонки
полученных ацетальдегида и винилацетата используется большой
избыток этилена (3—5 молей циркуляционных газов на 1 моль сме-
си ацетальдегида и винилацетата); потери хлорид-ионов компен-
сируются подачей НС1. В этих условиях конверсия уксусной кис-
лоты достигает 20—30 %, а этилена — только 2—3 % за один проход.
Наряду с целевыми продуктами (винилацетатом и ацетальдеги-
дом) образуются следующие побочные продукты: бутены, хлорорга-
нические соединения, щавелевая и муравьиная кислоты, сложные
эфиры, СО2 и др. Необходимо учитывать, что наличие щавелевой
кислоты приводит к выпадению в осадок оксалата палладия.
Технологическое оформление жидкофазного процесса
Принципиальная технологическая схема получения винилаце-
тата жидкофазным методом представлена на рис. 14.5.
Этилен, кислород, уксусную кислоту и катализаторный раствор,
содержащий ацетаты и хлориды палладия, меди и щелочного ме-
талла в среде уксусной кислоты, подают в нижнюю часть реактора,
заполненного катализаторным раствором. Отходящая из реактора 7
Рис. 14.5. Технологическая схема
производства винилацетата жидкофазным
методом:
1 — реактор, 2 - регенератор; 3 — водный кон-
денсатор; 4 — рассольный конденсатор, 5 — се-
паратор; 6 - дроссель; 7,13 — абсорберы;
8—десорбер; 9 — насос; 10,12,14,15,18,20-
ректификационные колонны; 11,16 —холо-
дильники; 17,19 — флорентийские сосуды; I —
этилен; II - кислород; III — уксусная кислота;
IV — углекислый газ; V — ацетальдегид; VI —
винилацетат; VII — тяжелые примеси; VIII —
фузельная вода; IX — газы сдувки на сжигание;
X - вода; XI — раствор карбоната натрия
'лава 14. Производство виниланетата 489
490
Часть 2. Технология крупнотоннажных производств ...
парогазовая смесь проходит последовательно водный 3 и рассоль-
ный 4 конденсаторы, где конденсируются винилацетат, ацетальде-
гид, вода, непрореагировавшая уксусная кислота и другие побоч-
ные продукты. В сепараторе 5 происходит отделение конденсата
от непрореагировавших и несконденсированных этилена, кисло-
рода и инертных примесей, ^асть несконденсированных газов воз-
вращается в реактор 1, а остальные после дросселирования посту-
пают в абсорбер 7 для улавливания СО2. Абсорбер орошается
раствором Na2CO2, который образует NaHCOv последний затем раз-
лагается при нагревании в десорбере 8 с выделением С02. После
очистки газов от С02 они возвращаются в реактор 1, часть их выво-
дится из системы для очистки от инертных газов или направляется
на сжигание. Часть катализаторного раствора выводится непрерыв-
но из реактора на регенерацию (очистку от полимеров, доокисле-
ние выпавшего в осадок палладия и т. д.).
Нижний слой из сепаратора 5 направляется в ректификацион-
ную колонну 10, где все продукты отделяются от непрореагиро-
вавшей уксусной кислоты и полимерных примесей. Эта кислота
рециркулирует в реактор 1. Дистиллят колонны 10 направляется
в ректификационную колонну 12 для выделения ацетальдегида.
Так как вместе с ацетальдегидом отделяются растворенные в кон-
денсате газы, то возникают трудности с конденсацией ацетальде-
гида и он частично уносится газами. В связи с этим несконденси-
рованные газы, содержащие ацетальдегид, направляются в скруб-
бер 13 для отмывки ацетальдегида. Газы возвращаются в реактор 1,
а водный раствор ацетальдегида поступает в ректификационную
колонну 14 для отделения ацетальдегида от воды. Ацетальдегид как
целевой продукт направляется по назначению, а вода после ох-
лаждения возвращается в абсорбер 13.
Кубовый продукт колонны 12 после охлаждения в холодиль-
нике 16 поступает во флорентийский сосуд 17, где он расслаивается.
Нижний водный слой объединяется с нижним слоем флорентий-
ского сосуда 19 и поступает в отгонную колонну 15 для отделения
винилацетата и углеводородов в виде гетероазеотропов (с водой) от
воды. Верхний углеводородный слой также объединяется с верх-
ним слоем флорентийского сосуда 19 и поступает в отгонную ко-
лонну 18 для гетероазеотропной осушки. Безводный винилацетат,
содержащий примеси побочных продуктов и полимеров, направ-
ляется в ректификационную колонну 20 для очистки от примесей.
Основными недостатками рассмотренного способа являются:
Глава 14. Производство винилаиетата
491
О сильная коррозионная способность катализаторного раствора,
что вынуждает изготавливать реактор из дорогостоящего мате-
риала (титана) или применять покрытия;
О низкая конверсия за один проход как уксусной кислоты, так
и этилена. Это приводит к значительным затратам энергии
на циркуляцию, вынуждает применять аппараты больших
объемов и теплообменную аппаратуру с большой поверхнос-
тью; затрудняет конденсацию продуктов из-за сильного их
разбавления этиленом, а также выделение винилацетата из
растворов, разбавленных уксусной кислотой.
К недостаткам технологической системы относится также рецир-
куляция уксусной кислоты без очистки от полимеров непосредст-
венно из куба колонны 10 в реактор 1. Это приводит к загрязнению
полимерами катализаторного раствора и к снижению его активнос-
ти. Если же учесть то обстоятельство, что в колонны ректификации,
где присутствует винилацетат, подается ингибитор полимеризации,
то из колонны 10 вместе с уксусной кислотой в реакторный раствор
должен попадать ингибитор. Это, естественно, может привести к еще
большему снижению активности катализатора.
Теоретические основы
ПАРОФАЗНОГО МЕТОДА ПОЛУЧЕНИЯ ВИНИЛАЦЕТАТА
В парофазном методе окисление этилена с целью получения
винилацетата осуществляется на твердом катализаторе (соли пал-
ладия или металлический палладий на оксиде алюминия или си-
ликагеле). В этом процессе функцию катализаторов окисления
и промоторов выполняет инертный пористый носитель. Вместе
с тем в обоих процессах обязательна добавка катиона щелочного
металла. Поэтому схема механизма основной реакции может быть
представлена следующим образом:
Винилацетат
В парофазном процессе благодаря диспергированию палладия
на поверхности носителя возникает непосредственный контакт кис-
492
Часть 2. Технология крупнотоннажных производств ...
лорода с атомами палладия. Природа активации этилена в жидко-
фазном и парофазном процессах различна.
Механизм действия гетерогенного палладиевого катализатора
пока не установлен, однако есть основания считать, что он анало-
гичен механизму гомогенного процесса и включает стадии образо-
вания и превращения этил< н-палладиевых комплексов.
В парофазном процессе со стационарным слоем катализатора
начальная концентрация палладия на носителе составляет от 1 до
5 % и уменьшается в процессе работы до 0,5 %. При этом скорость
образования винилацетата достигает 200 г/л-ч. При работе катали-
затора в псевдоожиженном слое его производительность удается по-
высить (до 1000 г/л-ч). Однако возможность промышленного
осуществления такого процесса вызывает сомнение из-за значи-
тельного уноса катализатора. Вследствие высокой стоимости пал-
ладия его потери должны быть не более 2,2 г на 1 т винилацетата.
Только тогда затраты на катализатор будут такими же, как и в аце-
тиленовом парофазном процессе.
Так как нижний предел взрывоопасной концентрации при 0,7—
0,8 МПа составляет ~7 % (об.) кислорода, то на входе в реактор па-
рогазовая смесь должна содержать не больше 7 % (об.) кислорода.
За один проход в реакцию вступает 60—70 % кислорода. Тогда со-
держание кислорода в циркулирующем газе составляет =3 % (об.) по
отношению к сухому газу. За один проход конверсия этилена состав-
ляет 10—15% (мае.), а уксусной кислоты — 15—30% (мае.). Однако
суммарный выход винилацетата и ацетальдегида в обоих процессах
практически одинаков.
Парофазный процесс характеризуется меньшим выходом побоч-
ных продуктов и, прежде всего, ацетальдегида и полимеров. Не об-
разуются хлорорганические соединения, что объясняется отсутстви-
ем хлор-ионов в парофазном процессе. Небольшой выход ацеталь-
дегида объясняется малым сроком пребывания винилацетата и воды
на поверхности катализатора и, следовательно, незначительным ги-
дролизом винилацетата. Общие потери этилена в этом процессе со-
ставляют (в %): утечка — 1; сдувка — 2—5; образование СО2 — 5—15;
ацетальдегида — 0,5—2; полимеров — 0,5—2. При этом основной по-
бочной реакцией является полное окисление этилена (14.28):
С2Я4 + ЗО2 -э 2СО2 + 2Я2О 14.28
Выход винилацетата по этилену составляет 91—94%, а по ук-
сусной кислоте — 95—100 %. Общий выход винилацетата достигает
Глава 14. Производство bhhhaauetata
493
91%, С02 — 8%, других примесей — 1%. Процесс проводится при
давлении 0,1—0,7 МПа и температуре 175—200 °C. При этих усло-
виях срок службы катализатора, находящегося в стационарном со-
стоянии, не превышает 2,5 лет.
Технологическое оформление парофазного процесса
Один из вариантов технологической схемы процесса представ-
лен на рис. 14.6. Свежая уксусная кислота смешивается с возврат-
ной уксусной кислотой и поступает в колонну-испаритель 1. В ниж-
нюю часть этой колонны подается смесь свежего этилена и возврат-
ной смеси этилена с кислородом. Следовательно, испарение уксусной
кислоты проводится в токе газа при более низких температурах. При
этом кислота отделяется от нелетучих примесей.
Парогазовая смесь поступает в подогреватель 2, где нагревает-
ся до температуры процесса =200 °C. Кислород вводится после сме-
шения этилена с кислотой (специальное перемешивающее устрой-
ство предотвращает взрыв). После этого парогазовая смесь вводится
сверху в трубчатый вертикальный реактор 3. Трубы реактора запол-
нены катализатором, а в межтрубное пространство подается для от-
вода тепла водный конденсат; получаемый пар используется на вну-
тризаводские нужды. Из реактора продукты реакции поступают
в холодильник, где охлаждаются от 4 до 0 °C. При этом часть про-
дуктов конденсируется. Конденсат отделяется от парогазовой сме-
си в сепараторе 5. Несконденсировавшиеся газы после сжатия ком-
прессором 6 подаются в абсорбер 7. Абсорбция может быть
осуществлена, например, пропиленгликолем или водным раство-
ром уксусной кислоты. Последний случай не требует введения в
систему постороннего вещества и позволяет использовать винила-
цетат-сырец в качестве обезвоживающего агента при получении без-
водной уксусной кислоты-рецикла (очевидно, в данном случае ук-
сусная кислота используется в качестве абсорбента).
Конденсат направляется на разделение в ректификационную
колонну 11. Несконденсированные продукты с некоторым коли-
чеством кислоты и воды (за счет уноса) поступают в абсорбер 8,
орошаемый водой, для улавливания прежде всего кислоты. Водный
раствор кислоты также поступает в ректификационную колонну 11.
Очищенные от кислоты газы направляются на очистку от СО2 в аб-
сорбер 9, орошаемый водой или раствором Na2COy Часть газов от-
водится из системы с целью вывода инертных газов. Очищенные
от СО2 газы (этилен и кислород) возвращаются в колонну 1. Абсор-
Рис. 14.6. Технологическая схема парофазного процесса получения винилацетата из этилена:
1 — колонна-испаритель; 2 — подогреватель; 3 — реактор; 4 — холодильник-конденсатор; 5 — сепаратор; 6 — компрессор; 7—9 — абсор-
беры; 10—десорбер; 11,14—17— ректификационные колонны; 12 — конденсатор; 13 — флорентийский сосуд; I —уксусная кислота;
II — этилен; III — СО2; IV — фузельная вода; V — легкие примеси; VI — винилацетат; VII — тяжелокипящие примеси; VIII — газы отдув-
ки; IX — газы сдувки; X — вода; XI - кислород; XII — раствор карбоната натрия
494 Часть 2. Технология крупнотоннажных производств .
Глава 14. Производство bhhhaauetata
495
бент из абсорбера 9 направляется в десорбер 10, откуда возвраща-
ется в абсорбер 9, а СО2 выводится из системы.
В ректификационной колонне 11 происходит отделение всех
легкокипящих компонентов, в том числе винилацетата с водой
в виде гетероазеотропа, от уксусной кислоты и тяжелокипящих при-
месей. Часть уксусной кислоты из куба колонны 11 направляется
в абсорбер 7, а остальная часть — в колонну-испаритель 1. Пары из
колонны 11, содержащие растворенные газы, поступают в конден-
сатор 12. Далее конденсат поступает во флорентийский сосуд 13,
где он расслаивается. Часть верхнего винилацетатного слоя направ-
ляется в виде орошения в колонну 77, а остальная часть — в отгон-
ную колонну 75 для гетероазеотропного обезвоживания винилаце-
тата и отделения легколетучих примесей. Пары из колонны 75также
поступают в конденсатор 72. Нижний водный слой из флорентий-
ского сосуда направляется в отгонную колонну 14 для отделения
растворенного винилацетата в виде гетероазеотропа с водой и лег-
колетучих примесей, пары из которой поступают в конденсатор 72.
Из куба колонны 14 выводится фузельная вода с содержанием
0,001 % винилацетата, которая направляется на биологическую очи-
стку. В кубе колонны 75 получается винилацетат с содержанием
примесей 0,001%. Из сепаратора перед флорентийским сосудом
производится отдувка в систему рециркулирующего газа.
Винилацетат из куба колонны 75 поступает в колонну 16 для
отделения фракции, содержащей метилацетат и легколетучие при-
меси, далее — в колонну 7 7 для отделения от тяжелокипящих при-
месей. Кубовый поток поступает на утилизацию винилацетата и по-
лимерных продуктов. Дистиллят колонны 7 7 является товарным
винилацетатом, который содержит следующие примеси: 0,005—
0,03 % воды; 0,0025—0,005 % уксусной кислоты; 0,0025—0,0075 % аце-
тальдегида; 0,01 % метилацетата; 0,0025 % этилацетата. Содержание
основного продукта 99,9 % (мае.). Для изготовления реактора при-
меняется хромоникелевая нержавеющая сталь, для ректификаци-
онных колонн, в которых присутствует уксусная кислота, — высо-
колегированная нержавеющая сталь, для сборника ледяной
уксусной кислоты— алюминий, а для остальных аппаратов — обыч-
ная сталь.
Данная технологическая схема имеет следующие недостатки:
О свежая уксусная кислота смешивается с возвратной, со-
держащей тяжелые примеси. Необходимо свежую кислоту по-
давать на верх колонны в качестве флегмы, что будет способст-
496
Часть 2. Технология крупнотоннажных производств ...
вовать отделению уксусной кислоты от тяжелых примесей. Воз-
вратную кислоту необходимо подавать в среднюю часть ко-
лонны;
® ввод воды в реакционную смесь после реактора 3 нецеле-
сообразен, так как это приводит, во-первых, к потере тепла, ко-
торое может быть утилизировано, во-вторых, к усилению гид-
ролиза винилацетата и, в-третьих, к дополнительным затратам
энергии на обезвоживание смеси. «Закалку» и отвод тепла не-
обходимо проводить в конденсаторе 4, который может служить
котлом-утилизатором;
© в трехколонном агрегате в верхних частях колонны и флорен-
тийском сосуде происходит накапливание легколетучих при-
месей, что приводит к затруднению разделения и особенно рас-
слаивания во флорентийском сосуде. Кроме того, сдувка из
флорентийского сосуда будет приводить к потерям винилацета-
та. В связи с этим необходимо предварительно отделить лег-
колетучие примеси, в том числе и ацетальдегид. В качестве та-
кой колонны может быть использована колонна 16, так как
легколетучие примеси будут предварительно отделены.
Принципы в технологии производства винилацетата
ОКИСЛЕНИЕМ ЭТИЛЕНА В ПРИСУТСТВИИ УКСУСНОЙ КИСЛОТЫ
Производства винилацетата окислением этилена в присутствии
уксусной кислоты как для парофазного, так и для жидкофазного
процессов имеют некоторые общие черты с точки зрения реализа-
ции в них принципов создания безотходных (малоотходных) тех-
нологий. Эти технологии характеризуются одностадийностью по
химической составляющей и непрерывностью. Невысокие конвер-
сии исходных реагентов за один проход приводят к необходимости
использования рециркуляции для полного превращения сырья. На-
пример, для жидкофазной технологии рециклы по этилену охва-
тывают аппараты 1—3—4—1; 1—3—4—6—7—1; 1—3(4)—5—9—10—12—
13—1; а по уксусной кислоте 1—3(4)—5—9—10 (рис. 14.5). Исходное
сырье для получения винилацетата доступно, поскольку этилен, тех-
нический кислород и уксусная кислота являются относительно де-
шевыми многотоннажными продуктами. Обе технологии позволя-
ют получать высокие (до 95 %) выходы винилацетата и, следова-
тельно, могут быть отнесены к высокоэффективным процессам,
хотя конверсии реагентов за один проход нельзя считать доста-
точными. В полной мере в рассмотренных технологических реше-
Глава 14. Производство винилацетата
497
ниях реализован принцип полноты выделения продуктов из реакци-
онной смеси, так как в противном случае невозможно организо-
вать рецикловые потоки и достичь высокой суммарной конвер-
сии исходного сырья. Достаточно хорошо использован и принцип
разработки технологий с минимальным расходованием воды, так как
отсутствуют кислые, щелочные и солевые водные стоки, а фузель-
ная вода, пройдя очистку, может вновь использоваться в смежных
цехах и производствах. Реализация принципа применения аппа-
ратов и технологических линий большой единичной мощности для
обоих рассмотренных технологий затруднена, но по разным при-
чинам. Для парофазного процесса это связано с трудностями сов-
мещения большой производительности аппарата и исключения
местных перегревов, а также истирания катализатора. Для жидко-
фазного процесса — с трудностями создания барботажных аппа-
ратов большой единичной мощности.
Кроме того, качественное различие рассмотренных реакцион-
ных подсистем приводит и к некоторым отличиям в реализации
принципов создания технологий. В частности это относится к прин-
ципу полноты использования энергии системы. Он может быть бо-
лее просто и эффективно реализован для парофазной технологии
производства винилацетата, поскольку в этом случае температур-
ные условия в реакторе обеспечивают получение греющего пара,
который в дальнейшем можно использовать как энергоноситель для
ректификации или других химических процессов.
СРАВНЕНИЕ РАЗЛИЧНЫХ МЕТОДОВ
ПОЛУЧЕНИЯ ВИНИЛАЦЕТАТА
Основными преимуществами парофазного метода по сравне-
нию с жидкофазным являются:
Ф простота оформления;
® снижение коррозии;
® повышение конверсии как этилена, так и уксусной кислоты;
® повышение селективности процесса.
Следовательно, возникает необходимость провести сравнение
парофазных процессов получения винилацетата на основе ацети-
лена и этилена.
Если учесть, что парофазные процессы получения винилаце-
тата из этилена и ацетилена по технологическому оформлению
498
Часть 2. Технология крупнотоннажных производств ...
и эксплуатационным характеристикам близки, то при их сравне-
нии необходимо учитывать следующие факторы:
О стоимость кислоты одна и та же, так как расходные ко-
эффициенты по ней практически одинаковы;
® стоимость этилена и кислорода в этиленовом способе должна
быть меньше, чем ацетилена в ацетиленовом способе;
© расходы на аппаратурное оформление в этиленовом способе
выше, чем в ацетиленовом, так как условия безопасности ра-
боты обусловливают необходимость проведения процесса во
взрывобезопасной области, когда конверсии как этилена, так
и кислоты низки;
О необходимость улавливания и удаления С02 в этиленовом ва-
рианте;
© выделение продуктов реакций из разбавленных этиленом
и кислородом парогазовых смесей затруднено;
© при малой конверсии кислоты энергетические затраты на раз-
деление конденсата с целью выделения винилацетата и других
продуктов будут большие в этиленовом способе;
О необходимы дополнительные затраты энергии на обезво-
живание реакционной смеси и отдельных компонентов глав-
ным образом в этиленовом варианте;
© требуется больше затрат энергии на циркуляцию непро-
реагировавшей уксусной кислоты в этиленовом способе.
Таким образом, качественное сравнение методов свидетельству-
ет о больших энергетических и капитальных затратах в этиленовом
способе. Следовательно, определяющими могут стать затраты на
сырье. В настоящее время цены на этилен ниже, чем на ацетилен,
и поэтому предпочтение отдается этиленовому способу. Но так как
цены на этилен все время растут и будут опережать рост цен на
ацетилен (прежде всего «карбидный»), то в дальнейшем предпо-
чтение может быть отдано ацетиленовому методу. Только в 1975—
76 гг. в США цена на этилен увеличилась в среднем на 49—65%,
а к 1990 г. она возросла еще почти в 2 раза.
В этиленовом варианте использованы те же принципы, что и в
процессе получения винилацетата из ацетилена. Вместе с тем пло-
хо реализован один из основных принципов — требование высокой
конверсии. Его выполнение затруднено из-за взрывоопасности ис-
пользуемой парогазовой смеси. Следовательно, в этом направле-
нии и необходимо усовершенствовать процесс.
Глава 15. Производство
ХЛОРОРГАНИЧЕСКИХ ПРОДУКТОВ
Е Производство 1,2-дихлорэтана.
В Производство винилхлорида.
Хлорорганические продукты занимают важное место в народном
хозяйстве. Они широко используются в полимерной промышленности
(мономеры, растворители), сельском хозяйстве (на их основе получа-
ют пестициды), в других отраслях промышленности (растворители,
хладагенты). Их производство исчисляется миллионами тонн в год.
В частности, в США производится около 6,5 млн т/год 1,2-дихлор-
этана, свыше 3 млн т/год винилхлорида и по 200—400 тыс. т/год тет-
рахлорметана, три- и тетрахлорэтилена, 1,1,1-трихлорэтана (метил-
хлороформа), дихлорметана (метиленхлорида).
Необходимо также отметить, что большинство хлорорганичес-
ких продуктов наряду с уникальными свойствами могут оказывать
отрицательное воздействие на природу и человека, так как они об-
ладают повышенной токсичностью. В частности, они влияют на
центральную нервную систему, оказывают угнетающее или нарко-
тическое действие (хлороформ, хлораль), раздражают слизистые
оболочки глаз и дыхательных путей (бензилхлорид, хлорацетон).
Некоторые фреоны оказывают негативное воздействие на защит-
ные слои атмосферы.
Разные хлорорганические вещества получаются по своей уни-
кальной технологии, что важно для иллюстрации технологических
принципов. В связи с этим на примерах производств хлороргани-
ческих продуктов можно проследить как общие технологические
принципы, так и принципы создания безотходных производств.
В данной главе будут рассмотрены технологии производства
1,2-дихлорэтана и винилхлорида, получаемых разными методами.
ПРОИЗВОДСТВО 1,2-ДИХЛОРЭТАНА
1,2-Дихлорэтан находит широкое применение в различных от-
раслях промышленности в качестве растворителя, а также по-
лупродукта в производстве других ценных хлорорганических про-
500
Часть 2. Технология крупнотоннажных производств ...
дуктов, например винилхлорида. Он представляет собой бесцветную
летучую жидкость со сладковатым запахом, кипящую при 83,5°C.
1,2-Дихлорэтан хорошо растворяется в этиловом спирте, диэтило-
вом эфире, углеводородах и плохо растворяется в воде (табл. 15.1),
образует со многими веществами азеотропные смеси (табл. 15.2).
1,2-Дихлорэтан может быть получен разными способами.
О Хлорированием этилена в газовой или жидкой фазе в присут-
ствии катализатора:
СН2 = СН2 + С12 >СН2С1 -СН2С1 15.1
© Хлорированием этана в газовой фазе:
СН}-СН} + 2С12^СН2С1-СН2С1 + 2НС1 15.2
© Окислительным хлорированием этилена в газовой фазе на ка-
тализаторе Дикона:
СН2 = СН2 + 2НС1 + 0,5О2 -> СН2С1 - CH2CL + Н2О 15.3
В промышленности 1,2-дихлорэтан получают двумя методами:
прямым хлорированием этилена в жидкой фазе в присутствии ка-
тализатора (FeCl3) или окислительным хлорированием этилена
в паровой фазе на катализаторе Дикона.
Таблица 15.1. Растворимость 1,2-дихлорэтана в воде и воды
в 1,2-дихлорэтане
Растворимость C2H4CI2 в воде Растворимость воды в С2Н4С/2
t°c % (мае.) t°c % (мае.) t°c % (мае.) t°c % (мае.)
0 0,91 40 0,97 0 0,09 40 0,26
10 0.84 46.5 1.02 10 0,11 50 0,34
20 0,87 56,5 1,13 20 0,16 57 0,35
25 0.86 67.5 1.29 25 0,19 69 0,52
30 0,86 72,5 1,38 30 0,22
Получение 1,2-дихлорэтана прямым хлорированием этилена
Теоретические основы процесса аддитивного хлорирования этилена
Этот способ является наиболее распространенным в промыш-
ленности. Процесс хлорирования этилена относится к ионно-ка-
талитическому галогенированию. Первоначально галогенирование
олефинов и, в частности, этилена проводили в газовой фазе. Про-
Глава 15. Производство хлорорганических продуктов
501
цесс в этих условиях протекает по радикально-цепному механизму.
Однако впоследствии было обнаружено, что с появлением жидкой
фазы процесс резко ускоряется и протекает в растворе. При этом
изменяется и механизм реакции.
Таблица 15.2. Азеотропные смеси CJS4Cl2
Второй компонент Ъмп j °C U азеотропа, °C , % (мае.)
Вода 100 71.6 91,8
Бензол 80.4 80.0 15,0
Метиловый спирт 647 Ж 65,0
Трихлорэтилен 87.0 82,0 61,0
Этиловый спирт 78.0 71,0 63.0
При пропускании исходных реагентов (этилена и хлора) через
жидкую фазу, которой обычно является продукт реакции, легко осу-
ществляется присоединение хлора по двойной связи с получением
1,2-дихлорэтана (15.1). Эта реакция протекает достаточно быстро
даже при низких температурах. Но еще больше она ускоряется ка-
тализаторами типа апротонных кислот (чаще всего FeCty.
При достаточно низких (до 30°С) температурах хлор при-
соединяется почти исключительно по двойной связи, а при более
высоких температурах увеличивается выход продуктов заместитель-
ного хлорирования. Соотношение подаваемых реагентов также вли-
яет на выход продуктов заместительного хлорирования.
При хлорировании в жидкой фазе классический ион карбония,
очевидно, не образуется ц положительный заряд рассредоточива-
ется по молекуле. Механизм процесса следующий: происходит эле-
ктрофильное присоединение с промежуточным образованием
л - и о-комплексов. Определяющей скорость процесса, по-видимо-
му, является стадия превращения л-комплекса. Протеканию про-
цесса аддитивного хлорирования в малополярных средах благопри-
ятствуют кислоты Льюиса. Как уже отмечалось, в данном случае
наиболее часто используется хлорид железа. Механизм его дейст-
вия включает предварительное образование комплекса с хлором
и этиленом по следующей схеме:
СН2 +С12 СН2 +FeCl3 Н2СС1 +FeCl4“ Н2СС1
I I —С1-С1—2 | — | 15.4
СН2 СН2 -ЕеСЦ Н2С+ -F’Clj Н2СС1
502
Часть 2. Технология крупнотоннажных произволств ...
FeCl3 не только ускоряет переход л-комплекса в о-комплекс,
но и образует комплекс [FeCl^CT - Cl. Считается, что все реакции
процесса хлорирования этилена (хлорирование этилена и продук-
тов его хлорирования) представляют сложную систему параллель-
но-последовательных реакций, протекающих в жидкой фазе со
сложной кинетикой.
Каталитическая реакция 15.4 имеет первый порядок по олефи-
ну, С/2 и FeCly побочные процессы имеют по хлору более высокий
порядок.
Дальнейшее замещение водорода с образованием высших хло-
ридов (трихлорэтан и др.) протекает по радикально-цепному меха-
низму. Причем зарождение цепи осуществляется уже при низкой
температуре за счет взаимодействия хлора с олефином:
СЯ2=СЯ2+С/2->СЯ2С/-СЯ2+С/ 15.5
Для подавления этого процесса можно снизить температуру. Но
этот путь не используют, а применяют ингибиторы цепных реакций
наряду с катализаторами апротонного типа. В частности, ингибито-
ром, этого процесса служит кислород. Поэтому используют элект-
ролитический хлор-газ, содержащий кислород. В результате совме-
стного действия катализатора и кислорода выход побочного продукта
замещения при хлорировании этилена снижается с 10 до 0,5—2%.
Технологическое оформление процесса
Учитывая, что основная реакция отличается высокой селектив-
ностью и скоростью, часто реагенты дополнительно не очищают
(за исключением осушки), так как катализатором служит FeCly ко-
торый может гидролизоваться. Процесс осуществляют путем бар-
ботирования газообразных реагентов через жидкий продукт, со-
держащий катализатор (т. е. в жидкой фазе).
Раньше процесс проводили при низкой температуре (30 °C), что-
бы избежать дальнейшего замещения. Производительность реакто-
ра в этом случае лимитировала необходимость интенсивного отвода
тепла. Теперь процесс проводят в присутствии катализатора и инги-
битора при более высоких температурах (70—100 °C).
Катализатор может готовиться отдельно или получаться из спе-
циально уложенных в реакторе чугунных брусочков при воз-
действии хлора. Соотношение этилена и хлора берется близким к
стехиометрическому. Небольшой избыток этилена ( = 5 %) необхо-
дим для обеспечения полного исчерпывания хлора.
Глава 15. Произволство хлорорганических пролуктов
503
Следует отметить, что возможны три варианта оформления ре-
акторного узла (рис. 15.1). В первом случае (рис. 15.1,с) реакция
осуществляется в барботажной колонне, снабженной выносным хо-
лодильником-конденсатором по паровой фазе и циркуляционным
холодильником по жидкой фазе. Таким образом тепло реакции от-
водится как за счет скрытой теплоты парообразования, так и за счет
охлаждения во внешнем циркуляционном контуре. Продукты от-
бираются в жидкой фазе.
Рис. 15.1. Реакторные узлы для ионно-каталитического хлорирования
этилена в жидкой фазе:
а — с выносным охлаждением; б — с отводом тепла за счет испарения; в — с совмеще-
нием хлорирования и ректификации; I - этилен; II - хлор; III - продукт; IV - газы
на очистку; V — вода; VI — полихлориды
Во втором случае (см. рис. 15,6) все тепло реакции отводится за
счет скрытой теплоты испарения 1,2-дихлорэтана. Конденсат из хо-
лодильника-конденсатора разделяется на две части. Одну отбирают
в качестве продукта, вторую возвращают в реактор. В этом случае
катализатор совсем не попадает в продукт, а остается в колонне.
И наконец, предложен совмещенный вариант (рис. 15.1,в), по кото-
рому 1,2-дихлорэтан выводится из колонны, как и во втором вариан-
те, а из куба колонны выводится трихлорэтан вместе с катализатором.
В этом случае тепло реакции используется для разделения продук-
тов. Отходящие газы во всех вариантах оформления реакторного
узла пропускают через воду для улавливания НС1. Жидкие продук-
ты, выводимые из верхней части (вариант 15.1,я) и нижней части (ва-
риант 15.1 ,в), очищают от катализатора и подвергают ректификации.
504
Часть 2. Технология крупнотоннажных произволств ...
В целом же процесс получения 1,2-дихлорэтана прямым хло-
рированием этилена состоит из двух стадий: синтеза 1,2-дихлор-
этана и его очистки.
Как уже отмечалось, в зависимости от способа отвода тепла
процесс проводится с отбором продукта из паровой фазы (отвод
тепла за счет испарения реакционной массы) или из жидкой фазы
(отвод тепла за счет выносных теплообменников). В первом случае
агрегат хлорирования представляет собой комплексный реактор
(рис. 15.2), у которого нижняя реакционная часть является полой
и заполнена 1,2-дихлорэтаном, а верхняя часть может быть тарель-
чатой или заполнена насадкой и выполнять роль
Й, ректификационной колонны. Следовательно,
в этом аппарате протекает совмещенный реак-
1и ционно-массообменный процесс. Исходные ре-
--Г ” агенты (обезвоженные хлор и этилен) подаются
II ( Л Рис. 15.2. Комплексный реактор для получения
~7Д I 1,2-дихлорэтана:
ЛГу I — этилен; II — хлор; III — легкокипящая фракция;
I Vl , IV — 1,2-дихлорэтан; V- газы на очистку; VI — полихлориды
по барботерам в низ реакторной части в соотношении, обеспечива-
ющем избыток этилена 3—10 % (об.). Температура в реакционной ча-
сти поддерживается 90—100 °C. Образующийся 1,2-дихлорэтан вмес-
те с легкокипящими компонентами поступает в ректификационную
часть реактора. Пары, выходящие из ректификационной части ап-
парата, конденсируются в конденсаторе, а неконденсируемые газы
выводятся из системы. Конденсат частично возвращается в виде
флегмы в верхнюю зону, а остальная часть подается в реакционную
зону для снятия избыточной теплоты реакции. Товарный 1,2-дихлор-
этан отбирается с глухой тарелки верха ректификационной части.
Конденсат можно полностью возвращать на орошение в колонну,
а для отвода тепла направлять часть охлажденного 1,2-дихлорэтана в
реакционную зону. Из реакционной зоны постоянно или периоди-
чески выводится небольшое количество реакционной массы для ис-
ключения накопления полихлоридов. Из этой смеси на отдельной
ректификационной колонне может быть выделен 1,2-дихлорэтан.
Другой вариант, приведенный на рис. 15.3, предусматривает от-
вод теплоты реакции за счет встроенного теплообменника. Сухие
Глава 15. Производство хлорорганических продуктов
505
Рис. 15.3. Технологическая схема процесса получения 1,2-дихлорэтана
прямым хлорированием этилена в жидкой фазе:
1 — реактор; 2 — блок очистки; 3,4 — ректификационные колонны; I — хлор;
II — этилен; III — вода; IV — легкокипящая фракция; V — 1,2-дихлорэтан; VI — по-
лихлориды
этилен и хлор подаются через барботеры в нижнюю часть пустоте-
лого реактора 1, заполненного 1,2-дихлорэтаном. Процесс хлори-
рования протекает при 50—60 °C. Выходящий из реактора 1,2-ди-
хлорэтан направляется на трехступенчатую отмывку от солей
(кислотой, щелочью и водой) и затем на осушку в комплекс аппа-
ратов?. Далее 1,2-дихлорэтан направляется в ректификационную
колонну 3 для отделения легкокипящих примесей. Кубовый про-
дукт колонны 3 направляется в ректификационную колонну 4 для
отделения 1,2-дихлорэтана (в виде дистиллята) от полихлоридов.
В целом при прямом хлорировании этилена конверсия хлора
близка к 100 %, а конверсия этилена зависит от его избытка и со-
ставляет 90—97 %. При этом выход дихлорэтана достигает более
99%. При рассмотрении этих двух вариантов прямого хлорирова-
ния этилена предпочтение следует отдать первому (рис. 15.2), так
как в нем теплота реакции используется в колонне для отделения
легкокипящих примесей и 1,2-дихлорэтана от полихлоридов, что
приближает этот процесс к безотходному. Во втором же варианте
(рис. 15.3) тепло отводится водой. При этом получается подогретая
вода, тепло которой может быть использовано с трудом, а при рек-
тификации потребуется подводить тепло.
Принципы в технологии получения 1,2-дихлорэтана хлорированием этилена
Технология относится к одностадийным по химической состав-
ляющей, организована как непрерывный процесс, использует мно-
готоннажные доступные полупродукты — этилен и хлор, имеет вы-
1Я я-6
506
Часть 2. Технология крупнотоннажных производств ...
сокую эффективность, обеспечивая выход 1,2-дихлорэтана до 99 %,
при практически полной конверсии хлора и конверсии этилена
90-97%.
Рассмотрим применение остальных основных принципов со-
здания технологий ОО и НХС на примере использования комплекс-
ного реакционного аппарата (рис. 15.2).
В этом случае реализован процесс, имеющий высокие конверсии
исходных реагентов за один проход. В одном аппарате (в ряде случа-
ев с целью упрощения конструкции используют отдельно стоящие
реактор и ректификационную колонну, связанные потоками пара
и жидкости) совмещены процессы синтеза и разделения. Реактор-ко-
лонна обеспечивает выделение продуктового дихлорэтана в практи-
чески чистом виде и одновременно позволяет отделить тяжело-
и легкокипящие побочные фракции, т. е. реализуется принцип полно-
ты выделения продуктов из реакционной смеси. В технологии эффек-
тивно как и во всех совмещенных реакционно-ректификационных
процессах реализован принцип полноты использования энергии систе-
мы, поскольку теплота реакции непосредственно используется для
разделения реакционной смеси. Экзотермичный характер процесса
дает возможность говорить о низком энергопотреблении, так как про-
цесс разделения обеспечивается теплом реакции. Кроме того, так как
целевой продукт отбирается в паровой фазе, то не требуется его от-
мывка от катализатора. Это позволяет избежать образования соле-
вых стоков и загрязнения окружающей среды. Все это дает возмож-
ность организовать кругооборот воды с минимальным ее использованием
в технологии.
Получение 1,2-дихлорэтана
окислительным хлорированием этилена
Теоретические основы процесса
Причиной разработки процессов оксихлорирования явилась
необходимость утилизации больших объемов отходящего газо-
образного хлорида водорода. Последний образуется в производствах
хлорорганических продуктов во всех процессах заместительного
хлорирования и дегидрохлорирования. Объединение стадий хлори-
рования и оксихлорирования позволяет создавать сбалансирован-
ные по хлору производства.
Основным способом проведения оксихлорирования является
газофазный процесс с использованием гетерогенных катализато-
ров. В качестве катализаторов применяют соединения меди, ще-
Глава 15. Произволство хлорорганических продуктов
507
лочных, редкоземельных и некоторых других металлов (или их
смесь) на пористых носителях разного состава и строения.
Основой для процесса оксихлорирования послужил газофазный
процесс окисления хлорида водорода, протекающий на катализа-
торах, содержащих хлорид меди (процесс Дикона). При совместном
протекании реакций Дикона и хлорирования равновесие реакции
сдвигается за счет расходования хлора, поэтому имеем практически
полное превращение НС1. Все рассмотренные реакции оксихлори-
рования практически необратимы в интересующем нас интервале
температур. При этом хлорид меди остается основным катализато-
ром окисления НС1 и оксихлорирования. Для этого процесса Дико-
ном была предложена следующая схема протекания окисления НСГ.
2СиС12 <=> + С1™ 15.6
Сы2С/2 +0,5О2 ->СиОСиС12 15.7
СиО СиС12 + 2НСГ <=> 2СиС12 + Н2(Уаз 15.8
В дальнейшем был предложен механизм образования 1,2-ди-
хлорэтана при взаимодействии этилена с СиС12, в результате кото-
рого образуется восстановленная форма меди:
2СиС12 + С2Я4 -> С2Н,С12 + Си2С12 15.9
Си2С12 + 2НС1 + 0,5О2 -> 2СиС12 + Н2О 15.10
Таким образом, в случае окислительного хлорирования этилена
при 210—280 °C происходит присоединение хлора по двойной свя-
зи, а не замещение. Причем установлено, что хлорирование осу-
ществляется не хлором, а непосредственно CuClv который регене-
рируется под действием НС1н О2:
СН2 = СН2 + 2НС1 + 0,5О2 -> С1СН2 - СН2С1+ Н2О 15.11
СН2 = СН2 + 2СиС12 -> С1СН2 - СН2С1 + Си2С12 15.12
Си2С12 + 2НС1 + 0,5О2 -> 2СиС12 + Н2О 15.13
При этом, видимо, кислород окисляет Си2С12 в оксохлориды
меди (II), которые в присутствии НС! переходят в СиС12.
В данном случае катализаторы готовят пропиткой носителя
(пемза, корунд, алюмосиликат) солями с последующей сушкой.
Их основным компонентом является хлорид меди (II), к которому
508
Часть 2. Технология крупнотоннажных производств ...
добавляют KI для снижения летучести за счет образования ком-
плексов с СиС12. Добавляются также различные модификаторы,
например соединения редкоземельных элементов.
Очень высокая экзотермичность процесса требует организа-
ции отвода тепла в реакторе. Если используется реактор с псевдо-
ожиженным слоем катализатора, то в него подают холодные реа-
генты, а избыток тепла отводится с помощью внутреннего
теплообменника за счет испарения парового конденсата. В кожу-
хотрубных реакторах со стационарным слоем катализатора тепло
отводится за счет испарения водного конденсата, подаваемого
в межтрубное пространство.
В качестве окислителя используют кислород воздуха (тогда воз-
дух подается при давлении 0,3—1,0 МПа) или чистый кислород, что
позволяет лучше организовать рециркуляцию непрореагировавших
веществ. Кислород для окисления НС1 обычно подается с неболь-
шим избытком (=5 %) по отношению к стехиометрическому. При
этом конверсия НС1 и кислорода достигает 80—90 %, а 2—5 % эти-
лена превращается в СО2.
Технологическое оформление процесса
Процесс получения 1,2-дихлорэтана окислительным хлорирова-
нием этилена состоит из двух основных стадий: синтеза 1,2-дихлор-
этана и его выделения. При этом в реакторе протекают две реакции
15.9 и 15.10, т. е. наблюдается совмещение двух реакций в одном ап-
парате (реакторе). Реакция 15.9 направлена на получение целевого
продукта 1,2-дихлорэтана, а реакция 15.10 позволяет регенерировать
катализатор, а именно превращать неактивную форму Си2С12 в ак-
тивную форму СиС12 в присутствии НС1 и О2.
Суммарный процесс оксихлорирования может проводиться
в реакторе со стационарным слоем катализатора (соли меди, нане-
сенные на оксид алюминия или алюмосиликат) — трубчатом реак-
торе или в реакторе с псевдоожиженным слоем катализатора. В пер-
вом случае тепло отводится за счет испарения водного конденсата,
подаваемого в межтрубное пространство, а во втором случае — так-
же за счет испарения водного конденсата, но подаваемого во встро-
енный теплообменник.
Технологическая схема процесса приведена на рис. 15.4. В реак-
тор 1 (в данном случае с псевдоожиженным слоем катализатора) по-
даются этилен, НС1 и воздух (или кислород) в соотношении, обеспе-
чивающем 3—5 % избыток этилена (по объему). Температура
в реакторе поддерживается 210—260 °C.
Глава 15. Производство хлорорганических продуктов
509
Рис. 15.4. Технологическая схема получения 1,2-дихлорэтана оксихлори-
рованием этилена в паровой фазе:
1 — реактор; 2 — закалочная колонна; 3 — конденсатор; 4 — абсорбер; 5 — сепаратор
жидкость-жидкость; 6 — колонна гетероазеотропной ректификации; 7,8 — колонны
отмывки от хлораля; 9,10 — ректификационные колонны; I — этилен; II — хлорис-
тый водород (а) - газ; (б) — концентрированная соляная кислота; III — воздух (тех-
нический кислород); IV — 1,2-дихлорэтан; V — полихлориды; VI — абгаз; VII — вода;
VIII — раствор щелочи; IX — солевые стоки; X — легколетучие примеси
Выходящие из реактора реакционные газы содержат пары
1,2-дихлорэтана, полихлориды, реакционную воду, хлорид водо-
рода и инертные газы. Они поступают в закалочную колонну 2,
в которой происходит охлаждение парогазовой смеси и удаление
из нее непрореагировавшего хлорида водорода и инертных газов.
При этом пары конденсируются в конденсаторе 3. Хлорид водо-
рода с инертными газами поступает в абсорбер 4, орошаемый во-
дой, для улавливания хлорида водорода. Конденсат поступает во
флорентийский сосуд 5. Водный слой из флорентийского сосуда 5
возвращается частично в закалочную колонну, а остальная часть
направляется на очистку от 1,2-дихлорэтана в колонну гетероазе-
отропной ректификации 6. Из куба этой колонны фузельная вода
направляется на очистку, а пары колонны — в конденсатор 3. Ниж-
ний слой (1,2-дихлорэтан-сырец) флорентийского сосуда 5 про-
мывается раствором щелочи и водой в колоннах отмывки 7 и 8
от хлораля, образовавшегося в процессе оксихлорирования за счет
побочной реакции. Далее 1,2-дихлорэтан поступает в ректифика-
ционную колонну 9 для отгонки легколетучих примесей. И на-
конец, в ректификационной колонне 101,2-дихлорэтан отделяется
от полихлоридов.
В этом процессе конверсия этилена составляет = 95 %, хлорида
водорода —=99%; выход 1,2-дихлорэтана — =97%. Преимущество
этого метода обусловлено тем, что в основном аппарате наблюда-
510
Часть 2. Технология крупнотоннажных произвоаств ...
ется меньшая коррозия за счет проведения процесса в паровой фазе
и регенерируется теплота реакции с получением технического пара.
Вместе с тем образуется много отходов в колоннах отмывки 7 и 8
и закалочной колонне 2, а также получается разбавленная соляная
кислота в абсорбере 4.
Следовательно, с точки зрения создания безотходного про-
изводства этот способ не может конкурировать с прямым хло-
рированием этилена.
Принципы в технологии оксихлорирования этилена
Технология получения 1,2-дихлорэтана оксихлорированием
этилена относится к одностадийным по химической составляющей
процесса и непрерывной. Используется дешевое и доступное сырье.
Важной особенностью этого процесса является то, что в качестве
галогенирующего агента применяется хлороводород, который по-
лучается при термическом пиролизе 1,2-дихлорэтана. Процесс име-
ет достаточно высокую эффективность, хотя и уступает по показа-
телям галогенированию этилена. Высокие конверсии реагентов за
один проход позволяют организовать технологию без рециркуляции
по компонентам и потокам. В полной мере в технологии реализо-
ван принцип полноты выделения продуктов из реакционной смеси.
В первую очередь это связано с высокими требованиями к чистоте
1,2-дихлорэтана (>99,2 %), поступающего на стадию термического
пиролиза с получением винилхлорида. Высококипящая фракция
может подвергаться деструктивному хлорированию с получением
четыреххлористого углерода как товарного продукта. Процесс мож-
но отнести к технологиям с низким энергопотреблением и высокой
полнотой использования энергии системы, поскольку реакционная
стадия продуцирует значительное количество высокопотенциаль-
ного тепла, которое может быть утилизировано за счет использо-
вания в процессах разделения или в других производствах. В на-
стоящее время в производствах винилхлорида сбалансированным
по хлору методом (см. ниже) степень утилизации тепла оксихлори-
рования этилена достигает более 97 %. К сожалению, процесс со-
провождается образованием отходов в колоннах отмывки 7 и 8
и закалочной колонне 2, а также получением разбавленной соля-
ной кислоты в абсорбере 4. Наличие отмывочных колонн не дает
возможности отнести процесс оксихлорирования к технологиям
с минимальным расходом воды. Технология позволяет применять
аппараты и линии большой единичной мощности. В большей степени
этот принцип может быть реализован именно построением линий
Глава 15. Производство хлорорганических продуктов
511
большой единичной мощности, поскольку мощности реакторов
даже при использовании кипящего слоя ограничены возможнос-
тью отвода тепла реакции. Не в полной мере реализован в техноло-
гии оксихлорирования и принцип полноты использования отхо-
дов производства. Как правило, легко и тяжелокипящие фракции
хлорорганических продуктов направляются на сжигание. Раньше
на отдельных промышленных предприятиях тяжелокипящая фрак-
ция использовалась как сырье для получения четыреххлористого
углерода. Сейчас его производство запрещено Монреальской кон-
венцией по защите озонового слоя.
ПРОИЗВОДСТВО ВИНИЛХЛОРИДА
Винилхлорид СН=СНС1в основном применяется для получе-
ния поливинилхлорида.
Винилхлорид можно получить различными способами:
О гидрохлорированием ацетилена в газовой или жидкой фазах
в присутствии катализатора:
сн=сн+на > сн2 = сна 15. и
® дегидрохлорированием 1,2-дихлорэтана (в жидкой фазе) гид-
роксидом натрия в водной или спиртовой среде:
СН2С1 - CH2Cl + NaOH^> СН2 = CHCl + NaCl + Н2О 15.15
© термическим дегидрохлорированием 1,2-дихлорэтана в паровой
фазе в присутствии катализаторов, инициаторов или без них:
СН2С1 - СН2С1 -► СН2 = CHCl + НС1 15.16
О хлорированием этилена в газовой фазе в объеме, либо в при-
сутствии катализатора, например оксида алюминия:
СН2 = СН2 + Cl2 -► СН2 = CHCl + НС1 15.17
Рассмотрим несколько наиболее распространенных промышлен-
ных способов производства винилхлорида из ацетилена и этилена.
Получение винилхлорида из ацетилена
Теоретические основы процесса
Распространенным способом получения винилхлорида является
гидрохлорирование ацетилена. Реакция присоединения хлорида во-
дорода к ацетилену типична для соединений с тройной связью:
512
Часть 2. Технология крупнотоннажных производств ...
НС = СН + НС1^СН2=СНС1, ДЯ°98 =-112,4 кДж/моль 15.18
По своей экзотермичности она почти в два раза превосходит
реакцию гидрохлорирования олефинов.
Реакция гидрохлорирования ацетилена в некоторой степени
обратима. Вместе с тем при умеренных температурах равновесие
почти полностью смещено вправо, так как константы равновесия
равны 8104 при 200 °C и 7102 при 300 °C. Причем присоединение
НС1 к ацетилену протекает последовательно — вначале образуется
винилхлорид, азатем 1,1-дихлорэтан:
СН = С И НС1->СН2 = СНС1—1а>СН,-СНС12 15.19
Следовательно, для получения винилхлорида требуется ис-
пользовать селективные катализаторы, ускоряющие только первую
реакцию. Наиболее приемлемыми для этого оказались соли Я?(П)
и См(1). При использовании сулемы HgCl2 также сильно ускоряется
реакция гидратации ацетилена с получением ацетальдегида (реак-
ция Кучерова). В связи с этим процесс проводят в газовой фазе при
температурах 150—200 °C, используя предварительно осушенные ре-
агенты. При этом образуется небольшое количество ацетальдегида
и 1,1-дихлорэтана (=1 %). Вместе с тем можно рассмотреть возмож-
ность совместного получения ацетальдегида и винилхлорида. В этом
случае необходимо проводить процесс в жидкой фазе.
Для жидкофазного гидрохлорирования более пригодна соль
См(1), так как она слабо дезактивируется и плохо ускоряет взаи-
модействие ацетилена с водой. (Следовательно, этот катализатор
непригоден для совместного получения винилхлорида и ацеталь-
дегида.)
Каталитическая система представляет собой раствор Си2С12
и хлорида алюминия в хлороводородной кислоте. Однако на этом
катализаторе протекает также димеризация ацетилена с образова-
нием винилацетилена:
гсн=сн ^>сн ^с-сн=сн2 15.20
Для подавления этой реакции необходимо использовать кон-
центрированную НС1. В связи с этим в ходе процесса в катализа-
торный раствор непрерывно подается НС1для компенсации его рас-
хода на гидрохлорирование.
Каталитическое действие указанных катализаторов объясняется
образованием координационных комплексов, в которых ацетилен
Глава 15. Производство хлорорганических продуктов
513
активируется и взаимодействует с хлор-анионами. При этом име-
ют место переходные состояния с металл-углеродной связью или
металлоорганические соединения, которые быстро разлагаются кис-
лотой:
сн +м+
сн
сн
+н+ СНС1
----► 15.21
-М+ сн2
Образование винилхлорида в газовой фазе описывается сле-
дующим кинетическим уравнением:
г ~ %' ?с2н2 ’ ^на + ^hci )
5.22
Технологическое оформление процесса
Как было показано ранее, промышленный процесс производ-
ства винилхлорида из ацетилена и хлорида водорода представляет
газофазный гетерогенно-каталитический процесс. Катализатором
в данном случае служит HgCl2 [1,0 % (мае.)], нанесенный на акти-
вированный уголь. Процесс проводят на стационарном катализа-
торе при температуре 160-180 °C в трубчатом реакторе. Смесь
ацетилена и хлорида водорода пропускается через трубки, заполнен-
ные катализатором. При этом хлорид водорода берется в небольшом
избытке (5—10 %) к ацетилену, что увеличивает конверсию послед-
него. Исходные вещества подвергаются предварительной осушке
с целью уменьшения образования ацетальдегида и коррозии аппа-
ратуры. При 160—180 °C происходит унос сулемы (за счет ее лету-
чести), хотя и незначительный. В связи с этим постепенно актив-
ность катализатора снижается, и тогда с целью поддержания его
активности повышают температуру до 200—220 °C.
Технологическая схема рассматриваемого производства пред-
ставлена на рис. 15.5. Очищенный ацетилен проходит огне-
преградитель 1, затем холодильник-конденсатор 2 и колонну 5,
в которых происходит осушка ацетилена. В конденсаторе осушка
осуществляется за счет конденсации влаги рассолом, а в колон-
не — твердым NaOH. Сконденсированная влага отделяется в се-
параторе 3.
Осушенный ацетилен смешивается с сухим хлоридом водорода
в смесителе 4 и поступает в трубное пространство реактора 6. В меж-
трубное пространство подается водный конденсат (для отвода теп-
16
Рис. 15.5. Технологическая схема процесса получения винилхлорида гидрохлорированием ацетилена:
1 — огнепреградитель; 2,11 — рассольные конденсаторы; 3 — сепаратор; 4 — смеситель; 5 — осушительная колонна; 6 — реактор;
7 — холодильник; 8—10 — скрубберы: 12 — компрессор; 13,14 — ректификационные колонны; 15 — дефлегматор; 16 — кипятильник;
1а — хлороводород; I б — соляная кислота; II — водный конденсат; III — раствор NaOH\ IV — рассол; V — тяжелокипящая фракция;
VI — легкокипящая фракция; VII — винилхлорид
514 Часть 2. Технология крупнотоннажных произволств ..
Глава 15. Производство хлорорганических продуктов
515
ла), из которого образуется пар. Для отвода тепла может использо-
ваться и органический теплоноситель.
Конверсия ацетилена составляет 97—98%. Реакционные газы
содержат 93% винилхлорида, 5% НС1, 1,0—2,5% С2Н2 и по 0,3%
ацетальдегида и 1,1-дихлорэтана. Кроме того, в нем содержатся сле-
ды унесенной сулемы. Поэтому газ охлаждается в холодильнике 7,
затем проходит через скрубберы 8—10, в которых он очищается
от НС1 и от сулемы. Скруббер 8 орошается разбавленной хлорово-
дородной кислотой (20 %), скруббер 9 — водой и скруббер 10 — цир-
кулирующей щелочью. После этого газ осушается в рассольном хо-
лодильнике-конденсаторе и сжимается компрессором 12 до 0,7—
0,8 МПа. Далее продукты подвергаются разделению на ректифи-
кационных колоннах 13 и 14.
В колонне 13 отделяется винилхлорид вместе с легкокипящими
компонентами от тяжелой фракции, главным образом от 1,1-дихло-
рэтана. Далее в колонне 14 происходит отделение легколетучих ком-
понентов (ацетилена, ацетальдегида) от винилхлорида. Следователь-
но, в данном случае предложен вариант на основе второго заданного
разделения, имеющий свои преимущества и недостатки. В частнос-
ти, к преимуществам относится то, что в колонне /^температура бу-
дет ниже, чем в аналогичной колонне варианта, основанного на пер-
вом заданном разделении (рис. 15.6). А это приводит к меньшим
потерям винилхлорида за счет термополимеризации.
Вариант, представленный на рис. 15.5, имеет существенные не-
достатки: дважды при определенных флегмовых числах испаряется
винилхлорид (по первому заданному разделению один раз), что
приводит к большим энергетическим затратам. Продуктовый ви-
нилхлорид отбирают из куба, поэтому он загрязнен тяжелыми при-
месями (по первому заданному разделению выводится в виде дис-
тиллята).
Рис. 15.6. Технологическая схема выделе-
ния винилхлорида, основанная на первом
заданном разделении:
1,2 — ректификационные колонны; I — ви-
нилхлорид сырец; II — легкокипящая фрак-
ция; III — винилхлорид; IV - тяжелокипящая
фракция; V — газы
516
Часть 2. Технология крупнотоннажных производств ...
Принципы в технологии гидрохлорирования ацетилена
Технология гидрохлорирования ацетилена с получением винилх-
лорида относится к непрерывным и имеет одну стадию по химичес-
кой составляющей. В качестве исходного сырья используются до-
ступные соединения хлороводорода и ацетилена. Хотя последний и
дороже этилена в настоящее время, однако при благоприятной ко-
нъюнктуре рынка или в регионах с дешевой электроэнергией рас-
сматриваемая технология может быть конкурентоспособной с эти-
леновыми способами производства винилхлорида. Процесс
относится к высокоэффективным, обладая высокими конверсиями за
один проход, селективностью и производительностью. В ряде слу-
чаев, поскольку при тех же условиях при наличии в реакционной
массе воды образуется ацетальдегид, процесс можно направить на
одновременное получение двух товарных продуктов — винилхлори-
да и ацетальдегида. При этом технологию можно рассматривать как
сопряженную. Высокие конверсии реагентов за один проход делают
применение рециркуляции нецелесообразным. Из реакционной смеси
полностью выделяют винилхлорид, легко и тяжелокипящие фрак-
ции, как правило, не утилизируются, а подвергаются огневому обез-
вреживанию или глубокому хлорированию с получением четырех-
хлористого углерода (см. выше). Поэтому технология не обладает
полнотой использования жидких и твердых отходов.
С точки зрения реализации принципов разработки технологии
с низким энергопотреблением и полноты использования энергии систе-
мы технология гидрохлорирования ацетилена достаточно совершен-
на. В рассматриваемом случае в реакционной подсистеме выраба-
тывается высокопотенциальное тепло. Его последующая утилиза-
ция позволяет обеспечить энергоресурсами подсистему ректифика-
ционного разделения или смежные производства. Получение
винилхлорида гидрохлорированием ацетилена нельзя отнести к тех-
нологиям с минимальным расходом воды, поскольку отходящие реак-
ционные газы содержат остаточные количества хлороводорода, что
делает необходимым организацию промывки продуктов водой и рас-
твором щелочи. Это приводит к образованию значительного коли-
чества водно-солевых стоков и разбавленной соляной кислоты. Ис-
пользование реакционных аппаратов большой единичной мощности за-
труднено, так как кожухотрубные реакторы имеют ограничения, свя-
занные с трудностями распределения потока сырья при высоких
производительностях, а применение аппаратов с кипящим слоем не-
возможно из-за высокой токсичности каталитической системы (ис-
Глава 15. Производство хлорорганических продуктов
517
тирание катализатора в кипящем слое приводит к повышенному
уносу токсичной каталитической пыли).
Если рассмотреть в целом предложенный вариант производства
винилхлорида, то он на данном этапе не перспективен вследствие
использования очень токсичного катализатора и дорогостоящего
исходного реагента — ацетилена. Однако, если вклад ацетилена в
себестоимость можно компенсировать технологическими решени-
ями, то катализатор требует принципиальной замены. В настоящее
время группой ученых МИТХТ им. М.В. Ломоносова под руковод-
ством проф. О.Н. Темкина разработан процесс гидрохлорирования
ацетилена с использованием металлокомплексных катализаторов на
основе хлоридов Rh(III) в ТУ-метилпирролидоне. Использование та-
кой каталитической системы позволяет исключить из производст-
ва токсичные соли ртути и, при благоприятных ценах на ацетилен,
реализовать промышленное производство винилхлорида.
Производство винилхлорида из этилена
СБАЛАНСИРОВАННЫМ ПО ХЛОРУ СПОСОБОМ
Теоретические основы процесса
Сбалансированный по хлору способ получения винилхлорида
из этилена базируется на трех основных реакциях:
СН2 = СН2 + С12 -> С1СН2-СН2С1 15.23
2СН2С1-СН2С1-У2СН2 = СНС1 + 2НС1 15.24
СН2 = СН2 + 2НС1 + 0,5О2 -> С1СН2 -СН2С1 + Н2О 15.25
2СН2 = СН2 + С12+0,5О2—>2СН2 = СНС1 + Н20 15.26
Следовательно, он является комбинацией трех процессов: пря-
мого аддитивного хлорирования этилена в 1,2-дихлорэтан, терми-
ческого дегидрохлорирования 1,2-дихлорэтана в винилхлорид
и окислительного хлорирования этилена в 1,2-дихлорэтан с помо-
щью хлороводорода, образовавшегося при дегидрохлорировании.
Оксихлорирование протекает с выделением значительного ко-
личества тепла, тогда как пиролиз протекает с поглощением зна-
чительного количества тепла, а НС1, получаемый при пиролизе,
используется в процессе оксихлорирования. Следовательно, не-
обходимо подобрать условия для проведения этих реакций в од-
ном аппарате, что позволит приблизить процесс к адиабатичес-
кому и обеспечит протекание процесса пиролиза, т. е. реализовать
518
Часть 2. Технология крупнотоннажных производств ...
совмещенно-комбинированный процесс получения 1,2-дихлорэ-
тана и винилхлорида. Этот процесс (15.24) требует больших затрат
энергии. К тому же он имеет низкую селективность. Зависимость
изменения энергии Гиббса этой реакции дегидрохлорирования
представлена на рис. 15.7. Как видно из рис. 15.7, изменение знака
энергии происходит для этой реакции при ~ 500 К, а выше этой тем-
пературы преимущественно протекает отщепление НС1. Реакция
15.24 протекает медленно по молекулярному механизму.
Интерес к термическому дегидрохло-
рированию был вызван возможностью
замены прежнего метода отщепления
НС1 под действием щелочи (15.16).
Этот способ используется также для
получения винилиденхлорида и других
продуктов. Но в этом процессе обра-
зуется много сточных вод (щелочных),
а также отходов соли (он требует боль-
шого расхода щелочи).
Рис. 15.7. Зависимость изменения энер-
гии Гиббса от температуры для реакции
дегидрохлорирования 1,1 -дихлорэтана
Термическое дегидрохлорирование позволило устранить эти не-
достатки: реакция протекает при температуре 500 °C только под воз-
действием температуры или в присутствии небольшого количества
хлора (в качестве инициатора) и гетерогенных контактов. Посколь-
ку процесс эндотермический, его, как правило, осуществляют в труб-
чатых реакторах, обогреваемых топочными газами. Такой способ про-
изводства винилхлорида оказался более экономичным (на 30 %) по
сравнению с щелочным дегидрохлорированием 1,2-дихлорэтана и на
14 % — по сравнению с гидрохлорированием ацетилена.
В этом совмещенном процессе из этилена, хлора и кислорода
получается винилхлорид в отсутствие НС1. При этом и се-
бестоимость получаемого мономера снижается на 25—30 % по срав-
нению с методом, основанным на гидрохлорировании ацетилена.
Технологическое оформление процесса получения винилхлорида
сбалансированным по хлору методом
Технологическая схема процесса получения винилхлорида по
комбинированному методу представлена на рис. 15.8.
Рис. 15.8. Технологическая схема получения винилхлорида по комбинированному методу (сбалансированному
по хлору):
1 — хлоратор; 2 — холодильник-конденсатор; 3,17 — сборники; 4 — смеситель; 5 — реактор оксихлорирования; 6 — дроссель; 7,19 — хо-
лодильники смешения; 8 — теплообменник; 9 — насос; 10 — скруббер; 11 — сепаратор пар—жидкость; 12 — сепаратор жидкость—жид-
кость; 13 — компрессор; 14 —колонна гетероазеотропной осушки; 15 — кипятильник; 16,20,21 — ректификационные колонны;
18 — печь пиролиза дихлорэтана; I — этилен; II — хлор; III — воздух (технический кислород); IVa — соляная кислота; IVб — хлороводо-
род (ж); V — рассол; VI — раствор щелочи; VII — вода на сан. очистку; VIII — газы рецикла; IX — полихлориды; X — винилхлорид
Глава 15. Производство хлорорганических продуктов 519
520
Часть 2. Технология крупнотоннажных производств...
Первой стадией этого комбинированного процесса является
прямое хлорирование этилена до 1,2-дихлорэтана, которая осу-
ществляется в колонном аппарате 1. Хлор и этилен подаются в ниж-
нюю часть хлоратора через соответствующие барботеры.
Хлоратор до определенного уровня заполняют катализатор-
ным раствором (FeCl^ в 1,2-дихлорэтане). Теплота реакции в нем
отводится за счет испарения 1,2-дихлорэтана. Пары 1,2-дихлорэ-
тана конденсируются в холодильнике-конденсаторе 2 и конден-
сат собирается в сборнике 3. Далее часть конденсата в виде ре-
цикла возвращается в хлоратор 1 для отвода тепла и поддержания
определенного уровня. В данном случае наблюдается типичный
жидкофазный процесс, в котором теплота реакции отводится
за счет испарения продукта. Но это тепло не используется. Более
того, образуется большое количество нагретой воды. Следователь-
но, необходимо вводить систему использования теплоты реакции.
Остальная часть конденсата направляется на ректификацию в ко-
лонну 16. Кроме того, в сборнике 3 отделяются растворенные газы,
которые во избежание потерь 1,2-дихлорэтана дополнительно ох-
лаждают рассолом в холодильнике 2, а затем очищают и выводят
из системы.
Процесс оксихлорирования осуществляется в реакторе 5 под
давлением 0,5 МПа и при температуре 200—280 °C. Катализатор
в нем находится в псевдоожиженном слое. Чистый этилен, рецир-
кулирующий газ, воздух и хлорид водорода смешиваются предва-
рительно в смесителе 4. Способ смешения и соотношение компо-
нентов должны быть таковыми, чтобы не образовывались
взрывоопасные смеси.
В реакторе 5 тепло отводится за счет встроенного змеевика,
в котором испаряется водный конденсат. В результате образуется
технический пар, который используется в этом же производстве,
например при ректификации.
Полученная реакционная парогазовая смесь, содержащая не-
прореагировавшие этилен, кислород, хлорид водорода, 1,2-дихло-
рэтан и инертные газы, поступает в нижнюю часть холодильника-
смешения 7. Последний орошается водной смесью 1,2-дихлорэтана,
циркулирующей через теплообменник 8 насосом 9. Часть раствора
хлороводородной кислоты непрерывно отводится из системы. Ес-
тественно, эта кислота загрязнена 1,2-дихлорэтаном и поэтому мо-
жет быть использована при его производстве или должна быть очи-
щена от него для последующего использования.
Глава 15. Произволство хлорорганических пролуктов
521
Охлажденную парогазовую смесь направляют в скруббер 10
для нейтрализации оставшегося НС1. Скруббер орошается раство-
ром NaOH, который подается насосом 9. Часть щелочного раство-
ра непрерывно выводится из системы (этот раствор содержит ще-
лочь, соль и растворенный 1,2-дихлорэтан). Поэтому необходимо
разработать способы очистки и утилизации всех продуктов из это-
го раствора.
В скруббере 10 парогазовая смесь очищается от НС1 и СО2
и окончательно охлаждается в холодильнике-конденсаторе 2. Кон-
денсат отделяется от газов в сепараторе 11 и поступает во флорен-
тийский сосуд 12, в котором более тяжелый 1,2-дихлорэтан отде-
ляется от воды. Эта вода используется для разбавления щелочи.
Циркулирующий газ (смесь этилена, кислорода и инертных ве-
ществ) компрессором 13 возвращается в смеситель 4. Чтобы избе-
жать накопления инертов в системе, часть газа выводится из сис-
темы для очистки от унесенного 1,2-дихлорэтана. Так как 1,2-дих-
лорэтан, выходящий из флорентийского сосуда 12, содержит воду
(по растворимости), то он направляется в колонну 14 для гетеро-
азеотропной осушки. Верхний водный слой флорентийского сосу-
да также может быть использован для приготовления щелочи или
должен быть очищен от 1,2-дихлорэтана гетероазеотропной ректи-
фикацией. При этом 1,2-дихлорэтан будет отделен от воды
в виде гетероазеотропа.
Таким образом, в ректификационную колонну 16 направляют
1,2-дихлорэтан, полученный как хлорированием, так и оксихлори-
рованием этилена. В этой колонне 1,2-дихлорэтан отделяется
от высших хлоридов, которые могут применяться в качестве рас-
творителя. Очищенный же 1,2-дихлорэтан может использоваться в
качестве полупродукта при производстве винилхлорида. В этом слу-
чае он собирается в емкости 17, а из нее компрессором 13 направ-
ляется в печь 18, в которой при давлении 1,5—2,0 МПа и темпера-
туре 500 °C он пиролизуется до винилхлорида и НС1.
После пиролиза реакционная парогазовая смесь проходит хо-
лодильник-смешения 19. Этот холодильник орошается захоложен-
ным в холодильнике 8 1,2-дихлорэтаном. Парогазовая смесь далее
охлаждается в холодильнике-конденсаторе 2 и направляется в рек-
тификационную колонну 20. Эта колонна, работающая под давле-
нием, предназначена для отделения НС1. При этом давлении НС1
конденсируется и может возвращаться в виде флегмы, а нескон-
денсированные газы после сепаратора (главным образом НС1) воз-
522
Часть 2. Технология крупнотоннажных произвоаств ...
вращаются в смеситель 4 дляпроведения оксихлорирования. Кубо-
вый продукт колонны 2U (главным образом винилхлорид и 1,2-ди-
хлорэтан) направляется в ректификационную колонну 21 через дрос-
сельный вентиль 6. В этой колонне в качестве дистиллята выделяется
мономерный винилхлорид (99,9 %-ной чистоты). Кубовый продукт,
главным образом 1,2-дихлорэтан, возвращается в колонну 16.
Принципы в технологии получения винилхлорида
сбалансированным по хлору методом
Технология получения винилхлорида сбалансированным по
хлору методом (комбинация хлорирования и оксихлорирования
этилена с термическим дегидрохлорированием 1,2-дихлорэтана)
выступает одним из наиболее интересных примеров реализации
принципов создания технологий ОО и НХС. Технология является
непрерывной. По химической составляющей ее, несмотря на нали-
чие трех отдельных реакторных подсистем, можно отнести к двух-
стадийной. Это вызвано тем, что каждая из цепей химических пре-
вращений, ведущих к винилхлориду, состоит из двух стадий:
оксихлорирование + термический пиролиз и хлорирование + терми-
ческий пиролиз.
Эти два параллельных процесса связаны, во-первых, рецирку-
ляционным потоком по хлороводороду, что позволяет почти полно-
стью его утилизировать, а во-вторых, общей стадией термического
пиролиза, использующей как дихлорэтан оксихлорирования, так
и дихлорэтан хлорирования этилена. Суммарные потери хлора со-
ставляют всего 11—12 кг, а этилена 23—36 кг на тонну товарного ви-
нилхлорида. Большая доля потерь этилена связана с процессом его
полного окисления на стадии оксихлорирования (около 19 кг на
тонну винилхлорида), а хлора на стадии очистки сточных вод и ок-
сихлорирования (4—6 и 3,4—3,7 кг на тонну винилхлорида соответ-
ственно). Таким образом, комбинирование двух процессов в одной
технологии позволяет с использованием рециркуляции по образую-
щемуся хлороводороду свести потери сырья к минимуму и одно-
временно обеспечить эффективную защиту окружающей среды от
хлора и хлороводорода. В данном случае реализуется принцип орга-
низации рециркуляционных потоков по компонентам. Другой иллюс-
трацией данного принципа служит рецикл по 1,2-дихлорэтану, ох-
ватывающий аппараты 16-21 технологической схемы (рис. 15.8).
Этот поток обеспечивает полную конверсию 1,2-дихлорэтана на
стадии термического пиролиза и используется из-за того, что кон-
версия за один проход на этой стадии не превышает 48—50 %.
Глава 15. Производство хлорорганических продуктов
523
Технология базируется на использовании дешевого и доступного
этилена и хлора. Обладает высокой эффективностью в целом, хотя
отдельные ее составляющие различаются по этому показателю. На-
пример, хлорирование этилена обладает более высокой селективно-
стью по сравнению с оксихлорированием и тем более с термичес-
ким пиролизом. Стадии оксихлорирования и хлорирования имеют
высокие конверсии за один проход. Рециркуляция части реакционных
газов на стадии оксихлорирования связана в основном с необходи-
мостью обеспечения газодинамического и концентрационного ре-
жимов аппарата с кипящим слоем. Более того, в настоящее время
доказано, что введение в исходные реагенты продуктов полного окис-
ления дает возможность повысить селективность оксихлорирования.
Эффективное использование тепла (принципы разработки процес-
сов с низким энергопотреблением полноты использования энергии сис-
темы) в данной технологии достигается не только за счет ее утилиза-
ции в подсистеме ректификационного разделения, но и за счет обес-
печения теплообмена между экзотермичными (хлорирование, оксих-
лорирование) и эндотермичными (пиролиз) стадиями процесса.
Принцип полноты выделения продуктов из реакционной смеси ис-
пользуется достаточно полно, поскольку как целевой продукт, так
и 1,2-дихлорэтан, направляемый на пиролиз, должны иметь высо-
кую чистоту.
В рассматриваемой технологии используется принцип минималь-
ного расходования воды, так как в ней практически отсутствуют про-
мывные скрубберы, а хлороводород выделяют в ректификационной
колонне при повышенном давлении. Использование для хлорирова-
ния этилена совмещенного процесса (рис. 15.2) позволяет по сравне-
нию с традиционными реакторами (рис. 15.1, 15.8) наиболее интен-
сивно применять низкопотенциальное тепло хлорирования для пред-
варительного фракционирования продуктов реакции (снижение
энергозатрат на выделение 1,2-дихлорэтана на 50—70 %). Кроме того,
снижается почти в три раза выход высококипящих полихлоридов.
Важной составляющей технологии является реализация прин-
ципа полноты использования газовых потоков и очистки газовых вы-
бросов. Это связано с высокой токсичностью хлора и его соедине-
ний. В первую очередь технология обеспечивает утилизацию
хлороводорода за счет реакции оксихлорирования этилена. Реак-
ционные аппараты снабжены не только водяными, но и рассоль-
ными конденсаторами, которые дают возможность снизить выбро-
сы хлорорганических продуктов в атмосферу за счет более высокой
524
Часть 2. Технология крупнотоннажных произволств ...
степени их конденсации при пониженных температурах. Выделение
хлороводорода из реакционной массы пиролиза проводится ректи-
фикацией, что дает возможность непосредственно организовать его
рецикл на стадию оксихлорирования, избежать процессов абсорб-
ции его водой и, соответственно, кислотных и солевых стоков. На-
конец, технология позволяем создавать линии большой единичной мощ-
ности. Реакционные подсистемы оксихлорирования и пиролиза
и используемые в них реакционные аппараты дают возможность их
проектирования на любую требуемую производительность. Реали-
зация этого принципа для стадии хлорирования может быть осуще-
ствлена за счет применения параллельно работающих жидкофазных
хлораторов, так чтобы вся технологическая цепочка представляла со-
бой линию большой единичной мощности.
Комбинированный процесс получения
ВИНИЛХЛОРИДА ИЗ АЦЕТИЛЕНА и ЭТИЛЕНА
Экономические показатели процесса можно улучшить и за счет
комбинирования двух других способов производства винилхлорида:
из этилена и ацетилена, когда НС1, выделяющийся при пиролизе
1,2-дихлорэтана, используется для гидрохлорирования ацетилена.
В этом процессе 50 % ацетилена заменяется на этилен, а хло-
рид водорода квалифицированно применяется в этом же процессе,
а следовательно, полностью используется хлор. Комбинированный
процесс позволяет снизить себестоимость винилхлорида на 6—7 %
по сравнению с ацетиленовым процессом.
Как известно, ацетилен и этилен получаются одновременно, на-
пример в процессе элекгрокрекинга. Вместе с тем, винилхлорид мо-
жет быть получен как из этилена, так и из ацетилена. В связи с этим
была предложена технология получения винилхлорида в комбини-
рованном процессе. При этом предусматривается, что на первом эта-
пе получается 1,2-дихлорэтан прямым хлорированием этилена и ги-
дрохлорированием ацетилена с использованием НС1, выделяющегося
при хлорировании этилена. На втором этапе осуществляется дегид-
рохлорирование 1,2-дихлорэтана с получением винилхлорида. По-
лучение 1,2-дихлорэтана хлорированием этилена; процесс гидро-
хлорирования ацетилена с получением винилхлорида и процесс
дегидрохлорирования 1,2-дихлорэтана были рассмотрены ранее. Сле-
довательно, нет необходимости рассматривать полную технологиче-
скую схему, так как она состоит из трех указанных подсистем, ста-
дий очистки и ректификации.
Глава 16. Производство продуктов
ОСНОВНОГО ОРГАНИЧЕСКОГО СИНТЕЗА
ОКИСЛИТЕЛЬНЫМ МЕТИЛИРОВАНИЕМ
Ранее мы рассмотрели производство ряда продуктов (этилбен-
зола, стирола), получаемых последовательно алкилированием и де-
гидрированием на базе бензола и олефинов (в частности, этилена
и пропилена). Вместе с тем для получения этих и других ценных
продуктов основного органического синтеза (крезол, бензол) мо-
гут быть использованы доступные исходные вещества (толуол, ме-
тан и кислород), подвергающиеся окислительному метилированию.
Особенно важно реализовать вовлечение метана в прямой син-
тез ценных продуктов основного органического синтеза. Для этого
необходимо воспользоваться новыми положениями теории цепных
реакций. Они состоят в том, что механизм и направление цепных
реакций определяются не только кинетическими и энергетически-
ми факторами, но и пространственным расположением электро-
нов в молекуле взаимодействующих реагентов. На основе этого
можно сделать следующие практические выводы:
для реализации процесса метилирования необходимо обеспе-
чить эффективное образование метильных радикалов;
в реакцию метилирования могут вступать только молекулы
с электронно-акцепторными функциональными группами;
для протекания реакции метилирования необходимо быстро
выводить атомарный водород из зоны реакции.
Одним из возможных и действенных путей реализации третье-
го условия является разбавление реакционной смеси метаном.
В общем виде процесс окислительного метилирования может
быть представлен следующей схемой:
г-► R— СН2СН3
R—СН3 + СН4 + Ог
R-CH=CH2 + Н2О 16.1
►R-H
где R-CN; -С6Н5; -СН = СН2; -С(СН3) = СН2.
526
Часть 2. Технология крупнотоннажных производств ...
Из природного газа и кислорода на основе указанной реакции
осуществлены следующие синтезы: стирола и этилбензола из толу-
ола и метана, бутилена и бутадиена из пропилена, изопентена
и изопрена из изобутилена, акрилонитрила из ацетонитрила, аце-
тонитрила из синильной кислоты.
Мы рассмотрим только окислительное метилирование толуо-
ла, так как ранее было рассмотрено производство этилбензола
и стирола, и мы можем сравнить эти методы.
В настоящее время в мире около 50 % бензола и 10 % этилена
расходуется на производство стирола. Однако растущая потребность
в стироле уже сдерживается производством бензола. В связи с этим
около 70 % толуола перерабатывается в бензол по реакции гидро-
деалкилирования. Вместе с тем можно получать стирол и другие
ароматические углеводороды из толуола. В этом направлении ве-
дутся интенсивные исследования.
В нашей стране под руководством X. Е. Хчеяна (ОАО «ВНИИОС»)
разработан процесс окислительного метилирования толуола
в стирол и этилбензол. Одновременно с ними в процессе образуются
и другие ценные для народного хозяйства продукты: фенол, крезолы
и бензол. Причем образование этих побочных продуктов не ухудша-
ет, а улучшает экономические показатели процесса.
Поэтому окислительное метилирование толуола следует рас-
сматривать как комплексный процесс получения ряда целевых про-
дуктов:
Г-^СбНзСНзСНз + QH5H =СН2
С6Н5СН3 + СН4 + О2--► С6Н6
16.2
|—►С6Н5ОН +СН3С6Н4ОН
Реакция протекает при 700—750 °C с суммарным выходом це-
левых продуктов более 90 % при конверсии толуола 40—50 % за один
проход.
При возрастании мольного соотношения метан: толуол от 1:1
до 12:1 суммарное содержание этилбензола и стирола уве-
личивается более чем в 4 раза, в то же время содержание бензола
уменьшается в 2,0—2,5 раза. Установлено также, что суммарные
скорости процесса окислительного метилирования толуола име-
ют близкий к нулю порядок по метану. Он оказывает примерно
равное тормозящее действие на образование бензола, фенола и
оксидов углерода. Таким образом, целенаправленному синтезу
Глава 16. Производство продуктов ООС окислительным ... 527
продуктов метилирования способствует сильное разбавление ис-
ходной смеси метаном. При мольном соотношении метан: толу-
ол = (10—20): 1 суммарный выход этилбензола и стирола достига-
ет 50-70%.
При проведении процесса окислительного метилирования с ис-
пользованием природного газа конверсия толуола составляет 30—
40% при температурах на 25—40 °C ниже, чем с чистым метаном.
Максимальное значение скорости наблюдается при конверсии
толуола 30 %, т. е. оно несколько сдвинуто в сторону меньших кон-
версий по сравнению с теоретическим максимумом.
Поскольку скорости отдельных направлений процесса в раз-
личной степени зависят от концентрации компонентов в исходной
смеси, то наиболее простым способом изменения состава продук-
тов реакции является варьирование состава исходной смеси.
Реакция окислительного метилирования, подобно другим ра-
дикально-цепным реакциям, зависит от каталитических свойств
поверхности реакционного сосуда и соотношения площади по-
верхности и объема реактора, т. е. от гетерогенного фактора. Было
показано, что при увеличении диаметра реактора изменяются ха-
рактер кинетических кривых и значение максимальных скоростей
реакции, а именно: происходит рост скорости реакций метили-
рования, парциального окисления и торможение реакций диме-
тилирования. Следовательно, при осуществлении реакций в боль-
шом масштабе селективность по целевым продуктам будет
увеличиваться.
Процесс окислительного метилирования является экзотерми-
ческим: теплота реакции составляет «8 800 кДж на 1 кг про-
реагировавшего толуола. Выделяющееся тепло может быть ис-
пользовано для подогрева исходной смеси и выработки пара. Ниже
приведены средние показатели процесса, полученные на опытной
установке:
Конверсия Выход, %:
толуола, % 40-50
Суммарный выход этилбензола + стирола 45-50
целевых продуктов, % 90-95 бензола 23-28
Содержание стирола фенола 12-14
и этилбензола, % 60 крезолов 6-8
528 Часть 2. Технология крупнотоннажных производств ...
Однако необходимо отметить, что в процессе окислительного
метилирования образуется множество других веществ в небольших
количествах. Это приводит к значительным затруднениям выделе-
ния, например стирола мономерной чистоты. Проводить такое вы-
деление в принципе возможно, но при оценке процесса необходи-
мо этот факт учитывать.
Процесс окислительного метилирования является примером:
получения нескольких продуктов из одного вида сырья и позво-
ляет реализовать принципы создания безотходных производств.
ЗАКЛЮЧЕНИЕ
Многоуровневая система подготовки специалистов, которая на
сегодняшний день внедрена или внедряется в химико-технологи-
ческих вузах, ставит вопрос об определении набора изучаемых спе-
циальных дисциплин и о пределах варьирования их содержания.
Химическая технология основного органического и нефтехими-
ческого синтеза характеризуется довольно высокой степенью обус-
ловленности. Это позволяет эффективно использовать математичес-
кое моделирование и широко внедрять ЭВМ в практику анализа
и проектирования химико-технологических систем. Магистральным
направлением при этом становится синтез энерго- и материалосбе-
регающих экологически чистых технологических производств на ос-
нове принципов. Особенно это относится к подготовке бакалавров,
так как здесь специальные дисциплины носят обобщенный харак-
тер. Среди фундаментальных принципов, которые являются своего
рода транскрипцией фундаментальных законов науки, можно выде-
лить химические, физико-химические, экономические, экологичес-
кие и т. д. Среди организационных принципов можно назвать прин-
ципы организации потоков в химико-технологических системах,
принципы кооперации предприятий и др.
Степень использования различных принципов в структуре дис-
циплины, по мнению авторов, является показателем прогрессив-
ности обучения.
Рассматривая в целом принципы технологии основного орга-
нического и нефтехимического синтеза как ведущей отрасли про-
изводства органических продуктов, нетрудно сделать вывод, что
большинство из них направлены на создание безотходных произ-
водств. В этом смысле безотходность, дополненная ресурсо- и энер-
госбережением на каждой стадии производства, и представляет тот
идеал, к которому должны приближаться все технологические
разработки. Естественно, в настоящее время большинство техно-
530
Заключение
логий переработки органического сырья не удовлетворяют этим
требованиям.
Разработка безотходных ресурсо- и энергосберегающих про-
изводств является комплексной проблемой, при решении кото-
рой нужно учитывать не только современное состояние техноло-
гии этого производства, отрасли и смежных отраслей в целом, но
и ее будущее.
Кроме того, при создании таких производств необходимо кри-
тически относиться к кажущимся «простым и легким» решениям
и принципам. В ряде случаев применение простого решения для
осуществления того или иного принципа усложняет реализацию
других принципов, часто наблюдается конкурентная ситуация: луч-
шее решение в рамках одного принципа не позволяет применить
лучшее решение, вытекающее из других принципов. Поэтому тре-
буется оптимизация, лучшим критерием для которой являются
приведенные затраты или приведенный доход, а ограничением —
отсутствие выбросов вредных продуктов в окружающую среду.
В пособии основное внимание было уделено принципам созда-
ния безотходных, ресурсо- и энергосберегающих технологий. Од-
нако при функционировании производств такого типа появляются
дополнительные аспекты, которые также необходимо учитывать при
подготовке инженеров химиков для предприятий отрасли. В целом
необходимо учитывать все аспекты создания и функционирования
производства: технологические, социально-экономические, эколо-
гические, образовательные, воспитательные, правовые и даже меж-
дународные. Этим обусловливаются и задачи подготовки магист-
ров и инженеров химиков, которые должны уметь разрабатывать,
проектировать и управлять такими производствами. На разных кур-
сах обучения в вузе должны рассматриваться разные стороны об-
щей проблемы, но наиболее важной является технологическая, так
как именно технология лежит в основе создания безотходного про-
изводства. Поэтому наибольшее внимание должно уделяться имен-
но этой составляющей как при подготовке инженера химика, так
и магистра.
Практически во всех специальных курсах должны рассмат-
риваться теория и практика реализации ранее рассмотренных прин-
ципов. С первого курса необходимо объяснять студентам, что про-
дукты основного органического и нефтехимического синтеза должны
в идеале производиться только на безотходных производствах. Для
этого во всех курсах должны быть отражены элементы создания таких
Заключение
531
производств, а также последствия производства продуктов по исполь-
зуемой в настоящее время технологии, позволяющей во многих слу-
чаях только 10 % сырья доводить до готовой продукции, а 90 % сырья
превращать в отходы, загрязняющие окружающую среду.
В гуманитарных дисциплинах, преподаваемых в техническом
вузе, должны, по нашему мнению, отражаться воспитательные, ча-
стично экологические и социально-экономические стороны про-
блемы, в экономических — экономические, социально-экономиче-
ские, частично экологические и правовые. Экологические,
социально-экономические и правовые аспекты рассматриваются
также в курсе «Основы промышленной экологии».
Во всех специальных дисциплинах специальности «Химическая
технология органических веществ» большое внимание уделяется во-
просам реализации принципов создания безотходных ресурсо-
и энергосберегающих технологий. В частности, в курсе «Теорети-
ческие основы реакционных процессов» наибольшее внимание уде-
ляется реализации следующих принципов: созданию малостадий-
ных и в пределе одностадийных химических процессов; разработке
процессов, имеющих высокую избирательность (селективность);
применению методов, позволяющих одновременно получать не-
сколько целевых продуктов; совмещению нескольких реакций, на-
правленных на получение одного и того же продукта; разработке
процессов с малым энергопотреблением. Реализация этих принци-
пов базируется на глубоком изучении термодинамики реакцион-
ных процессов, подборе соответствующих каталитических систем
и выборе оптимальных условий проведения реакций на основе
выявления кинетических закономерностей.
В курсе «Теоретические основы и технологические принципы
совмещенных реакционно-массообменных процессов» рассматри-
вается реализация следующих принципов: разработка методов по-
лучения продуктов, позволяющих более полно использовать сырье;
разработка процессов, имеющих высокую избирательность (селек-
тивность); использование рециркуляции по компонентам, вещест-
вам или потокам; применение совмещенных процессов; разработ-
ка процессов с малым энергопотреблением, полнота использования
энергии системы; разработка технологий с минимальным расходом
воды и использованием ее кругооборота. При осуществлении ре-
акций и массообменных процессов в одном аппарате удается снять
термодинамические ограничения, в частности, за счет отвода про-
дуктов реакции в виде дистиллята или кубового продукта дости-
532
Заключение
гать конверсии до 100%. За счет интенсификации процессов мас-
сообмена можно повышать концентрацию реагентов в зоне реак-
ции, что приводит к увеличению конверсии. При таком совмещении
удается также использовать теплоту реакций для осуществления мас-
сообменных процессов.
В одном из основных курсов «Физико-химические основы
и технологические принципы процессов разделения» рассматрива-
ются подходы реализации следующих принципов:
< $> разработка методов получения продуктов, позволяющих более
полно использовать сырье;
< $> применение рециркуляции по компонентам, веществам или по-
токам;
< $> использование совмещенных процессов;
< $> полнота выделения всех продуктов из реакционной смеси;
< $> разработка процессов с малым энергопотреблением;
< $> полнота использования энергии системы;
< $> разработка технологий с минимальным расходом воды и ис-
пользованием ее кругооборота;
< $> применение непрерывных процессов.
В этом курсе рассматриваются вопросы создания технологии
разделения на основе изучения физико-химических свойств разде-
ляемых смесей, различных подсистем и чистых компонентов; раз-
рабатывается оптимальная технология, на основе которой удается
выделить в чистом виде как все продукты реакций, так и непрореаги-
ровавшее сырье, возвращаемое в реактор, причем, как правило, вы-
бирается та технологическая схема, по которой удается разделить
исходную смесь с минимальными расходами энергии и воды. Вода
в данном случае может использоваться в качестве хладагента,экс-
трагента, экстрактивного агента, а также для других целей, поэто-
му предусматривается ее многократное применение. Как правило,
разрабатывается технология для непрерывного производства, так как
при периодическом способе практически невозможно разделить по-
лиазеотропные смеси на чистые компоненты.
В курсе «Основы проектирования и оборудование заводов ос-
новного органического и нефтехимического синтеза» рассматри-
ваются вопросы выбора и расчета оборудования, необходимого для
реализации всех принципов, в том числе с применением ЭВМ.
Здесь особое внимание уделяется реализации следующих прин-
ципов: применению аппаратов и технологических линий большой
единичной мощности; обеспечению высокой надежности обору-
Заключение
533
дования; использованию рециркуляции по веществам и потокам;
применению совмещенных процессов; разработке процессов с ма-
лым энергопотреблением. При проектировании безотходных про-
изводств с применением ЭВМ предусматривается расчет опти-
мальных параметров работы и размеров аппаратов, а также их
надежности в процессе функционирования.
И наконец, в курсе «Технология основного органического
и нефтехимического синтеза», являющемся обобщающим или син-
тетическим курсом, в котором используются все ранее получен-
ные знания, подробно рассматриваются все принципы создания
безотходных технологий. Применение этих принципов иллюстри-
руется на примерах синтеза технологических схем производства
конкретных продуктов основного органического и нефтехимиче-
ского синтеза (спиртов, мономеров, альдегидов, эфиров и др.) на
базе системного подхода. Предварительно проводится критичес-
кий анализ действующих производств и рассматриваются пути их
совершенствования.
В заключение следует обратить внимание на то, что подавляю-
щее большинство принципов создания безотходных производств
и все теоретические курсы базируются на результатах научных ис-
следований, проводимых на кафедре «Химии и технологии основ-
ного органического синтеза» академии в следующих направлениях:
О теоретические основы каталитических процессов;
© физико-химические основы и технологические принципы про-
цессов разделения;
© физико-химические основы и технологические принципы сов-
мещенных реакционно-массообменных процессов;
О создание систем автоматизированного проектирования произ-
водств основного органического и нефтехимического синтеза.
Таким образом, на кафедре осуществляется единый учебно-на-
учный процесс, в котором научная и учебная работа представляют
единый комплекс. Во всех курсах предусмотрено проведение как ла-
бораторных, так и семинарских занятий, в которых закрепляются
различные аспекты создания безотходных производств. Во всех кур-
сах и особенно на практических занятиях демонстрируется приме-
нение ЭВМ при разработке и выборе оптимального варианта техно-
логической схемы безотходного производства. Завершающим этапом
подготовки специалиста является выполнение магистерских дис-
сертаций дипломных работ или проектов. Во многих дипломных ра-
ботах и проектах обязательно предусматривается создание отдель-
534
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
ных элементов или всей технологической схемы безотходного про-
изводства.
Таким образом, полученная на кафедре «Химия и технология ос-
новного органического и нефтехимического синтеза» подготовка
позволит будущим магистрам решать все основные вопросы по со-
зданию безотходных производств в отрасли, а специалистам проек-
тировать и эксплуатировать эти производства. Выпускники долж-
ны быть убеждены в том, что использование безотходной или даже
малоотходной технологии дает двойную выгоду—такая технология
будет и экономной, и природосберегающей.
Данное пособие является первым опытом в обобщении сложив-
шихся на сегодня принципов технологии основного органическо-
го и нефтехимического синтеза. Этот опыт накоплен авторами
в результате многолетнего чтения лекций студентам различных кур-
сов. Авторы будут считать свою задачу выполненной, если данное
пособие поможет студентам освоить основные принципы техноло-
гии органических веществ и окажет стимулирующее воздействие
на исследователей, занимающихся этими проблемами.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Арис Р. Анализ процессов в химических реакторах: Пер.
с англ./Под ред. И. И. Иоффе.—Л.: Химия, 1967. 328 с.
Астарита Дж. Массопередача с химической реакци-
ей: Пер. с англ./Под. ред. Л.А. Серафимова,—Л.: Химия,
1971. 223 с.
Бояринов А.И., Кафаров В.В. Методы оптимизации в хими-
ческой технологии.—М.: Химия, 1969.406 с.
Бусленко Н.П. Моделирование сложных систем.—М.: Наука,
1978. 399 с.
Васильев М.Г. Химический комплекс России.-М.: ОАО
НИИТЭХИМ, 2002. 362 с.
Вейлас С. Химическая кинетика и расчеты промышленных
реакторов: Пер. с англ./Под ред. П.А. Семенова.-М.: Хи-
мия, 1967.414 с.
Ранкин В.Ю., Гуревич Г. С. Технология оксосинтеза.—Л.: Хи-
мия, 1981. 269 с.
Денисов Е. Т. Кинетика гомогенных химических реакций,—
М.: Высшая школа, 1978. 367 с.
Список РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
535
Жаров В.Т., Серафимов JI. А. Физико-химические основы
дистилляции и ректификации.—Л.: Химия, 1975. 239 с.
Закгейм А. Ю. Введение в моделирование химико-техноло-
гических процессов,—М.: Химия, 1982. 298 с.
Кафаров В. В. Методы кибернетики в химии и химической
технологии.-М.: Химия, 1971. 379 с.
Кафаров В. В. Принципы создания безотходных химических
производств.—М.: Химия, 1982. 288 с.
Лебедев Н.Н. Химия и технология основного органическо-
го синтеза,—М.: Химия, 1988. 582 с.
Левеншпилъ О. Инженерное оформление химических про-
цессов: Пер. с англ./Под ред. М.Г. Слинько.—М.: Химия,
1969. 621 с.
Нечипоренко В. И. Структурный анализ систем.—М.: Совет-
ское радио. 1977. 214 с.
Петлюк Ф.Б., Серафимов Л. А. Многокомпонентная ректи-
фикация: теория и расчет.—М.: Химия, 1983. 303 с.
Реакционно-ректификационные процессы: достижения
в области исследования и практического использования.
Писаренко Ю. А., Кардона К. А., Серафимов Л. А.—М.: Луч,
2001.266 с.
Системный анализ процессов химической технологии. Кафа-
ров В.В., Дорохов И.Н., Кольцова Э.М.—М.: Химия, 1983. 368 с.
Тимофеев В. С. Системные закономерности в технологии ос-
новного органического синтеза.—М.: МИТХТ им. М.В. Ло-
моносова, 1981. 107 с.
СиттигМ. Процессы окисления углеводородного сырья:
Пер. с англ./Под ред. С. Е. Гудкова.—М.: Химия, 1970. 300 с.
Совмещенные процессы в химической технологии. Бала-
шов М.И., Тимофеев В. С., Писаренко Ю.А.—М.: Знание, 1986.
32 с.
Сторонкин А. Б. Термодинамика гетерогенных систем. Ч. 1,2.—
Л.: Изд. ЛГУ, 1967.447 с.
Сторонкин А.В. Термодинамика гетерогенных систем. Ч. 3.—
Л.: Изд. ЛГУ, 1969. 185 с.
Теория технологических процессов основного органичес-
кого синтеза. Лебедев Н. Н., Манаков М. Н, Швец В. Ф.—М.:
Химия, 1975. 477 с.
536
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Термодинамика равновесия жидкость—пар. Морачевский А.Г.,
Смирнова Н.А., Пиотровская E.M.—TL: Химия, 1989. 341 с.
Тимофеев В. С., Львов С. В. Технология основного органиче-
ского синтеза,—М.: МИТХТ им. М.В. Ломоносова, 1981.
94 с.
Технология нефтехимического синтеза. Адельсон С. В., Виш-
някова Т.П., Наумкин Я.М.—М.: Химия, 1985. 607 с.
Технология основного органического синтеза. Совмещен-
ные процессы. Серафимов Л.А., Тимофеев В.С., Писарен-
ко Ю.А., Солохин А.В.—М.: Химия, 1993. 416 с.
Уёмов А. И. Системный подход и общая теория систем.—М.:
Мысль, 1978. 272 с.
Уэйлес С. Фазовые равновесия в химической технологии:
Пер. с англ./Под ред. В. С. Бескова. Ч. 1,2.—М.: Мир, 1989.
Ч. 1. 301 с.; Ч. 2. 361с.
Фалъбе Ю. Синтезы на основе окиси углерода: Пер. с нем./
Под ред. Н. С. Имянитова.—Л.: Химия, 1971. 216 с.
Хайлов В. С., Брандт Б.Б. Введение в технологию основно-
го органического синтеза.—Л.: Химия, 1969. 555 с.
Учебное издание
Тимофеев Владимир Савельевич
Серафимов Леонид Антонович
ПРИНЦИПЫ ТЕХНОЛОГИИ ОСНОВНОГО ОРГАНИЧЕСКОГО
И НЕФТЕХИМИЧЕСКОГО СИНТЕЗА
Редактор Г.А. Шестопал. Художник Вивиан дель Рио.
Художественный редактор З.Е. Анфиногенова.
Технический редактор Л.А. Писаренко. Компьютерная верстка Ю.А. Писаренко.
Лицензия ИД № 06236 от 09.11.01.
Сдано в набор 28.04.02. Подл, в печать 18.11.02. Формат 70х1001/16.
Бум. офсетная № 1. Гарнитура Ньютон. Печать офсетная.
Объем 43,55 усл. печ. л. 44,05 усл. кр.-отт., 31,95 уч.-изд. л.
Тираж 3000 экз. Заказ № Я-6.
ФГУП «Издательство «Высшая школа», 127994, Москва, ГСП-4,
Неглинная ул., 29/14.
Тел.: (095) 200-04-56. E-mail: info@v-shkola.ru http://www.v-shkola.ru
Отдел реализации: (095) 200-07-69, 200-59-39, факс: (095) 200-03-01.
E-mail: sales@v-shkola.ru
Отдел «Книга-почтай»: (095) 200-33-36. E-mail: bookpost@v-shkola.ru
Отпечатано в типографии ГУП ПИК «Идел-Пресс».
420066, г. Казань, ул. Декабристов, д. 2