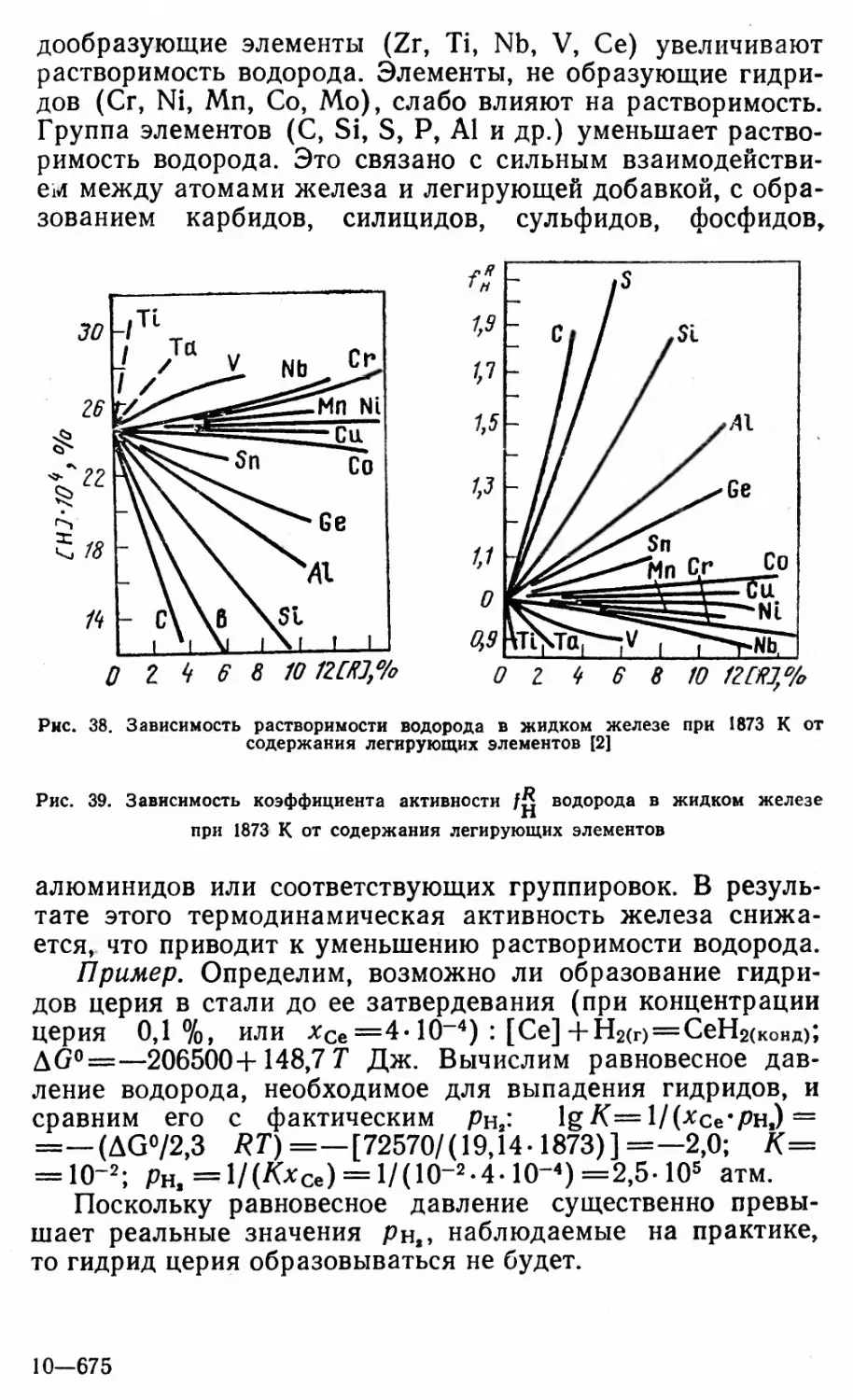
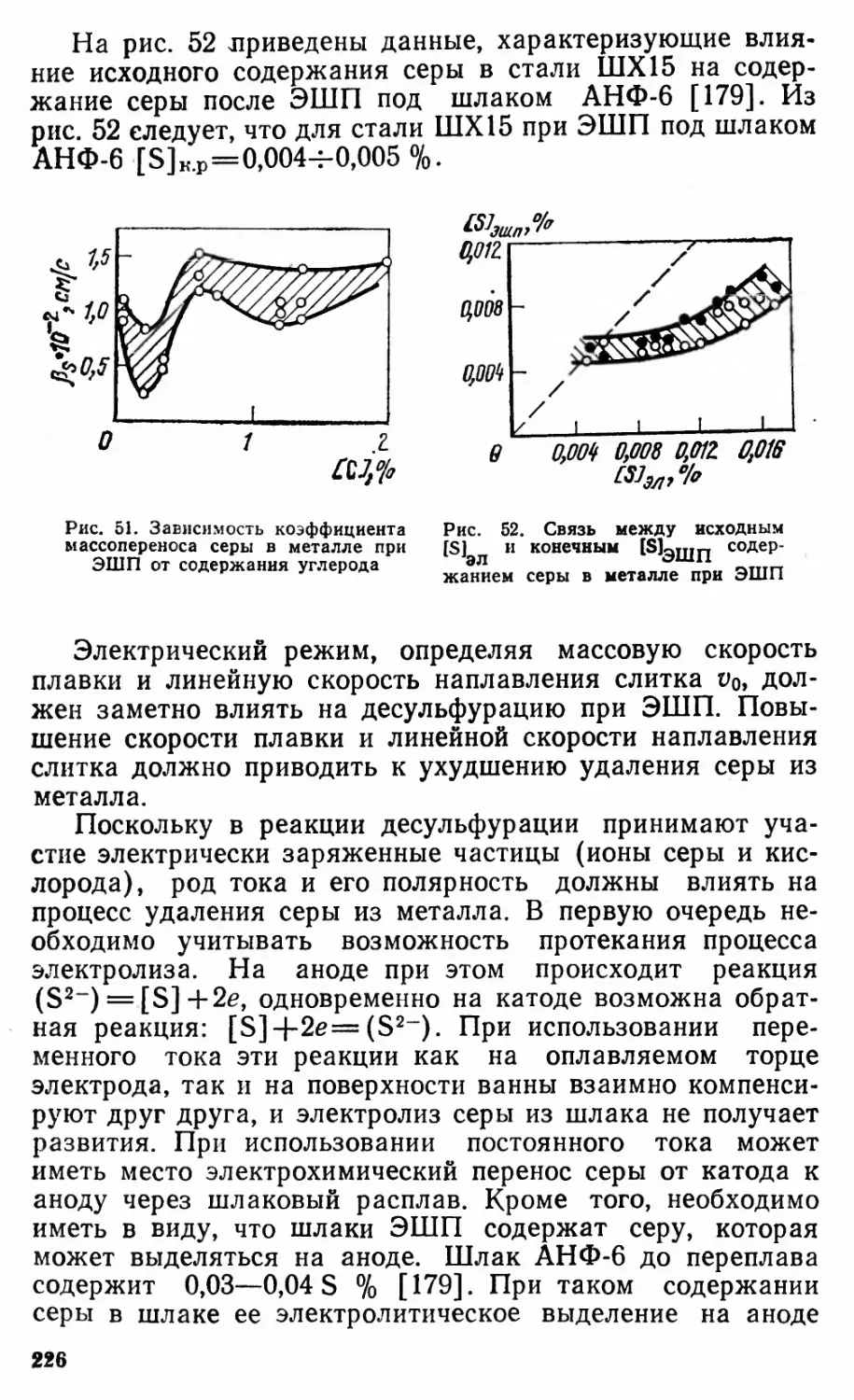
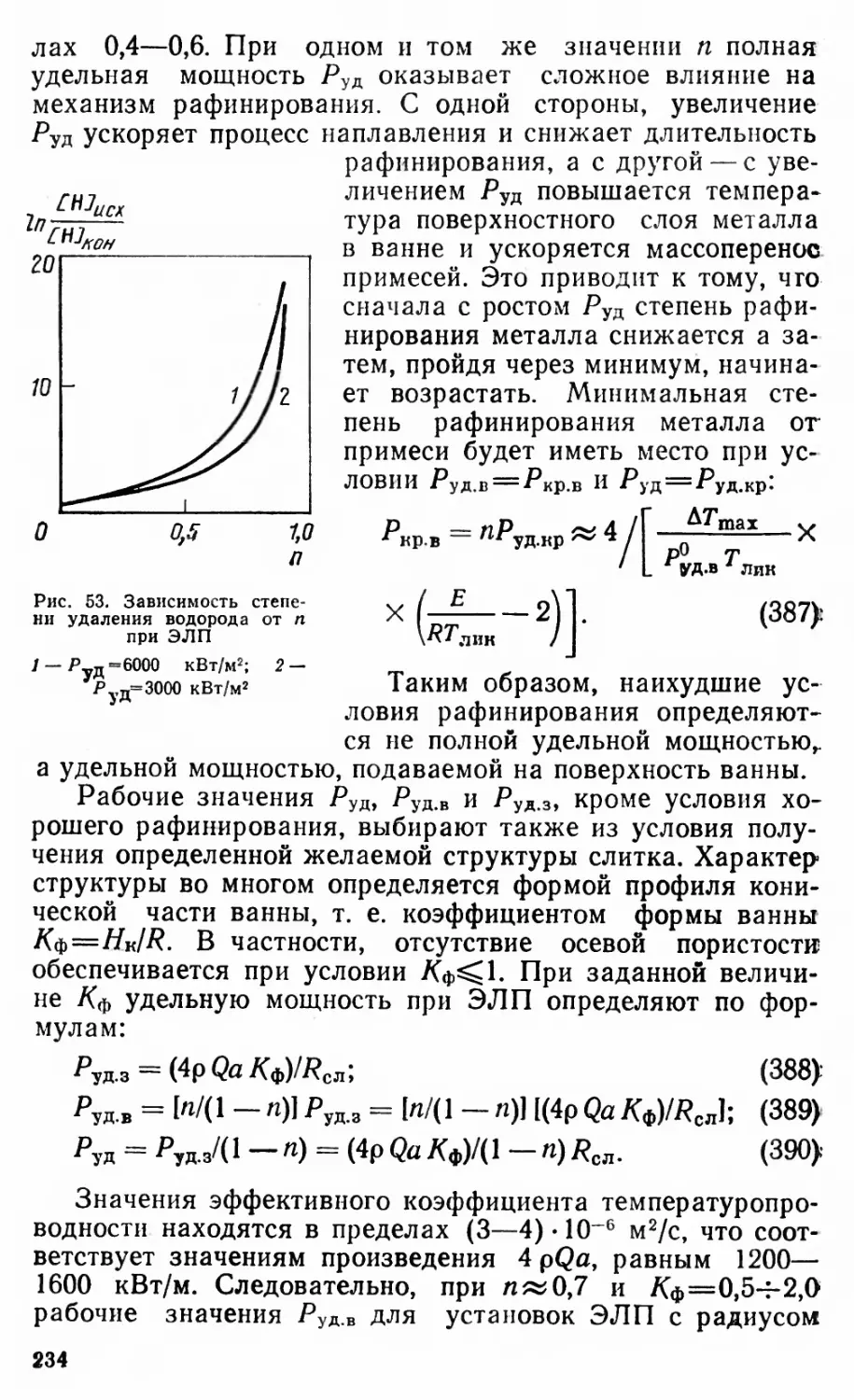
Автор: Григорян В.А Белянчиков Л.Н. Стомахин А.Я.
Теги: металлургия электросталеплавильное производство
Год: 1987
Текст
\
I , " ,
'i 1,
.
,
'{ i ,
\ I
, . i
,
, j" J
, ,
" " " ,[ .'t' "
'. , ,
t . ,<
.
. ,1> ' f .It
' , :1
.' .
'. '.
о
. I
., . .' "
"
'i J. . I
[. \
,. , t I "
., . 't
r .
" ". , "
;: .
... I . ",
о
.' L. , "
I
" t '.... . ,1 , ,
. .
; \ " I
\ , . I
.
, ,
" ,1. .'
\
" I
" . ! ,
'1
,
.
,
J:)
c:t
о
s:
а..
UJ
к:::
1
2
З'
4
5
6
7
.Q
t::t
u:.
а.
1
n
m
N
v
v1
ИI
w1
IX
х
.LJ
ct
s:
о
ж
<с:(
.....
:I:
«
..о
q
s::
о
:I:
:s::
.....
1
.
Пер I1 О Д Jf Ч е с к а я с п с т е м а
JI
r
р
у
.
n
n
ы
ш N
R 2 О з RH4 'НО 2 RH
R 2 0
RO
4 5 б 7
Ве 2S z 2s 2 2 p 1 В 2s 2 2 p 2 С 25 2 2 р 3
БЕРИЛЛИЙ 2 з БОР 4 уrЛЕРОД 5 АЗОТ
9,01218 2 2 10,81 2 12,011 2 14,0057
12 13 14 15
Mg зs 2 З s 'lЗ р 1 Аl 3s 2 3p2 ..Si Зs 2 Зр3 Р
мдrний АЛЮМИНИЙ КРЕМНИИ ФОСФОР
24,3QS 2 2 26,98154 2 28,086 2 30,97376
С 20 " S 21 Т . 22 23
451 1 а 452 2 С Зd'4s 2 2 I Зd 2 45 2 2 V 3d 3 4s 2 2
КАЛИ 1 g КАЛЬЦИЙ СКАНДИЙ ТИТАН 1 ВАНАДИЙ 1
З9,сgе" 40,08 2 44,9559 2 47, QO 2 50,9414 2
29 ЗО 31 32 33
N 1 3d,од s 1 С U 2 3d' as2 Zn з 4S'24p1 G а 4 4S 2 4p2 G е 5 4S 2 4 p 3 As
r 18 МЕДЬ ' ЦИНК 'g rАЛЛИЙ ' rЕРМАНИЙ 1 мышьяк
К 63,546 :: 65,38 2 69,72 2 72,59 2 74,9216
37 1 3 8 2 39 2 40 2 41 1
Rb 5516 Sr 552 8 У Ad 1 S5 2 9 Zr 4d 2 SS 2 10 Nb 4d 4 5S " 2
r РУБИДИЙ 19 СТРОНЦИЙ 19 ИТТРИЙ . 19 ЦИРКОНИЙ ' НИОБИЙ 1
к 85,4678 2 87,62 2 88,9059 2 91,22 2 92,9064 2
\J 1 47 2 48 3 49 4 sa 5 51
N 184d'05s 1 Ag 18 4d 1 0SS 2 Cd 18 5s 2 5p1 I n 18 5S25 2 n 18 5s 2 5p3 S Ь
r 'g СЕРЕБРО ' КАДМИЙ ' ИНДИЙ ' ОЛОВО v 1: CVPbMA
к 2 107,858 2 112,49 2 114,82 2 118,69 ,2 121,75
Р \' 5 1 56 2 57 2 72 2 73 2
2 Cs '.... j S ' 1 Ва бs21 La 5d'бs2, Hf 5d 2 бs 2 , Та 5d3бз21
ЦЕЗИИ 1В. БАРИЙ 1В ЛАНТАН 1: rдФний ' ТАНТАЛ 'g
к 132,9054 2 137,34 2 138,9055 2 i78,4g , 180.9l179 2
g 1 80 1 81 1 82 1 83
32 5d 'О бs 2 Hg 32 бs 2 бр' 11:2 бs 2 б р 2 РЬ 32 б5 2 6 р 3 В i
'g РТУТЬ ' ТАЛЛИЙ ' СВИНЕЦ 1 ВИСМ Т'
к 2 200,59 2 204,37 2 207,1 9 2 208,9804
g 88 89 104 16 105 1f
о 'Ra 75216 Ас бd 1 is 2Н1 Ku бd 2 7s 232 Ns бd37s2 2
N 32 ... ,32 ... 32 ..
м РАДИИ 1 АКТИНИИ 'В К РЧАТОВИИ 'Я НИЛЬСБОРИИ'8
226,0254 2 (227) 2 (260 2 (261) 2
к
1
1-1 1 s'
ВОДОРОД
1,0079
Li 3
2s f
ЛНТИЙ 1
6,941 2
11
М; Na .351
L НАТРИЙ
к 22,9B9 7 j 2
К 19
L
К
N
М
L
К
1 79 Д
32 5d 36s1 U
'g ЗОЛОТО
2 196,9665
87 1
Fr 7S i
ФРАНЦИИ '
(223) 2
р 58 2
С е 4f 1 5d 1 бs 2 ,8
r ЦЕРИИ 'g
к 140,12 2
р 55 2
Т Ь 4f 9 6s 2 2
r ТЕРБИЙ '
к 158,9254 2
90 12
О Т h бd 2 7s 2 18
N ... 32
М ТОРИИ 18
232,0381
g 97
о В к 5f!бd 1 7s 226
N 32
М БЕРКЛИИ 13
k (247) 2
1
59 2
Р r 4f 3 бs 2 2
ПРАЗЕОДИМ 19
140,9077 2
бб 2
D v 4f 1О бs 2 2
ДИСПРОЗИЙ 'g
162,50 2
91
Ра 5f2Бd17s220
... 32
ПРОТАКТИНИИ 'g
231,0359 2
98
С .f 5f'075 226
... 32
КАЛИФОРНИИ '
(251) z
ба 2
Nd 4f4бs2?
НЕОДИМ '
144,24 2
67' 2
Н ' 6
О 4f '1 бs 2 29
.. 18
rольмии 8
164.9304 2
61 2
Pm 4f5бs22
ПРОМЕТИЙ '
(145) 2
68 2
Er 4f '2 65 2 3
ЭРБИЙ 'В
167,26 2
92
u 5f36d 1 7s2 i
УРАН 16
238.029
99
E 5.f117S= !
ЭИНШТЕИНИИ 'В
(254) 2
93
N Р 5f4бd17s222
... 32
нептунии 11
237,0482 2
100 l
Fm 5f12752
32
ФЕРМИИ 'В
(257) 2
\j
R 2 0 s
N
62 2
S m 4f 5 бs 2 2
СДМА?ИЙ 'В
150,4 2
69 2
Тт 4f1 бs2з I
ТУЛИИ 18 i
6 I
168,9342 2 I
94 J 1
Pu 5f 6 75 224 1
... 32 I
ПЛУТОНИИ 'g I
(244) 2
101
М d 5f 13 75 2 3
МЕНДЕЛЕВИЙ ij
(258) 2
.э JI е м е н т о в д. и. М е .1 Д е J] е е в а
э
Е
м
л
YI W
RH 2 RО з RH R 2 0 7
(Н)
в 9
2 s 'Z2 p 4 О 2s 2pS F
е КИСЛОРОД 7 ФТОР
z 15,9994 Z 18,99840
16 17
Зs"З р 4 S Зs 2 З р 5 Сl
СЕРА ХЛОР
2 32,06 2 35,453
24 25
С r Зd'4s ' 1 М n Эd 5 4s 2 2
ХРОМ 1 MAPrAt-IЕц1
51,996 2 54,9360 2
за 35
б 4 s24 p 4 S е 7 4s'Z4 p s В r
1 СЕЛЕН ' БРОМ
2 78,96 2 79,904
42 1 А3' 2
М О 4d 5 S5'13 Те 4d 5 5s 2 ,з
МОЛИБДЕН 1 ТЕХНЕЦИЙ 1В
. 95,94 2 98,9062 2
6 52 7 53
'8 5s 2 5 p 4 Те 18 5s Z 5p5 I
' ТЕЛЛУР ' ЙОД
2 127,60 2 126,9045
74 2 75 2
W 5d 4 бs 2 R е 5d 5 бs 2
ВОЛЬФРАМ 'g РЕНИЙ 1
183,85 2 .186,207 2
11 84 7. 85
32 бs 2 б р 4 Р О l бs 2 б р 5 Д t
' ПОЛОНИЙ 18 АСТАТ
2 (209) (210)
б3 2
Еи 4f7бs22
ЕВРОПИЙ 18
151,95
70 2
У Ь )f'4БS-?
итr r РБИЙ J
173,04
64 2
Gd 4f75d1бs22
rАДОЛИНИЙ 19
157,25 2
71 2
LU4fМsd 1 бs 2 з
ЛЮТЕЦИЙ 19
174,97 2
8
Ат 5f 7 75 225
01 2
АМЕРИЦИИ i
(243) 2
102
No 5f'475232
НОБЕЛИЙ i 2
(255) В
9б 2
С m 5f 7 бd ' 1s 2 2
0# зz
КЮРИИ 1В
(247) 2
103 L
L r-5f '4 бd 1 7s 2 з
ЛОУРЕНСИЙ 12
(256)
Е
н
т
26
Fe Зd б лs 2 2
ЖЕЛЕЗО 1;
55,847 2
о
в
Ш1I
27
С о Зd'4s 2 2
КОБАЛЬТ 1
58,9332 ,
44 1 А5 1
R u Ad 7 ss 1 15 Rh .4d 8 5s 1 16
РУТЕНИЙ 'R РОДИЙ 1
101,07 Z 102,9055 · 2
76 2
05 5d 6 бs 2 j
ОСМИЙ 'g
190,2 2
77 2
I r 5d 7 бs 2
ИРИДИЙ 'g
192,22 2
о
R 04 ........
N 8 28
I 3d 8 4S Z 2
НИКЕЛЬ 1
56,71 2
46 о
Pd 4d 1 0ssO 18
ПДЛЛАДИЙ 'g
106,4 2
78 1
pt 5d 9 бs 1 J
ПЛАТИНА '
195,09 2
Атомный номер
. 26
Fe ЗdеАS Z 2
ЖЕЛЕЗО 1
55,847 2
Атомная масса
2
Н е 1S Z
rЕЛИ и
,QО2БО 2
10
Ne 2s 2 2p:
НЕОН s
20,179 2
16
Ar Зs 2 З р б
APrOH :
З9,Q48 2
...,
К "'с
r Аs2 ;б в
КРИПТОН ,в
8
83,80 2
54 В
Хе 5 S 'Z::lб 16
. КСЕНОН 18
131,30
.
86 l'
R n бs 2 б р б З2
РАДОН 18
(222)
Распределение ЭJ1ектронов
по застраивающимся и по--
сле.пующим 5астроенным
подуровням
Число электронов 8 слоях
1 электронный СЛОЙ К
П " " L
m ,. " м
li .., " N
V " " о
и ,.. ", р
w ... .., Q
иепое число в скобк х массовое
число наийопее УСТСЙЧИ80rо изотопа
ис усственноrо радиоаКТИБноrо элемеНТi.
целое число Dез c oDOK массовое число
наиDолее pacпpOCTpaHeHHoro изотопа
лриродноrо р диоа Тf1вноrо элемент .
В . А. rриrорян, n. Н. &ЕЛЯНЧИКОВ,
А. я. СТОМАХИН
ТЕОРЕТИЧЕСКИЕ
OCHOBbl
ЭЛ Е КТ РОСТ АлЕплАвильныx
ПРОЦЕССОВ
Издание 2..е, переработанное и дополненное
(т)
м о с к в А «МЕТ АJlJlурrИI» 1 9 8 7
УДК 669: 541 (075.8)
р е Ц е н з е н т докт. техн. наук, проф. Б. В. Лuнчевскuй
УДК 669: 541 (075.8)
r р и r о р я н В. А., Б е л я н ч и к о в л. Н., с т о м а х и н А. я.
Теоретические основы ЭJlектростаJlеПJlаВИJlЬНЫХ процессов. М.: Металлур-
rия, 1987, 272 с.
Во втором издании (первое в 1979 r.) изложены физика-химичес-
кие основы процессов, протекающих в электросталеплавильных печах.
Приведены основные понятия химической термодинамики, кинетики ме-
таллурrических процессов, теории шлаков. Описаны методы расчета рав-
новесий в системе металл......... шлак....... rазовая среда. Значительное внима-
ние уделено поверхностным явлениям в сталеплавильных процессах. Рас-
смотрены особенности рафинирования металла при вакуумно-дуrовом,
плазменно-дуrо..вом и электрошлаковом переплавах, а также теория кри-
сталлизации слитков разовоrо формирования и получаемых в водоохлаж
даемых кристаллизаторах. Приведены справочные данные по термодина-
u
мическим, кинетическим, поверхностным и друrим своиствам.
Для научных и инженер но-технических работников. Может быть по-
лезна студентам металлурrических вузов. Ил. 69. Табл. 23. Библиоrр.
список: 234 назв.
r 2602000000 159 29 87
040(OI) 87
@ Издательство «Металлурrия», 1981
оrпАвпЕНИЕ
ПреДИCJIовие . . . . . . . . . . . . . . ·
r '} а в а 1. ОСНОВЫ химической термодинамики
1.1. Энерrия rиббса химической реакции . .
1.2. Направление и полнота химической реакции
1.3. Растворы. Состав. Термодинамические функции'
1.4. Уравнение rиббса........ Дюrема . . . . . · · . ·
1.5. Законы Рауля и fенри ......
1.6. Совершенные растворы. ........
1,7. Идеальные разбавленные растворы . ·
1.8. Активность . ... · · ·
1.9. Экспериментальное определение активности. ..
1.1 о. Реальные растворы . . . .. ......
1.11. Переход от одноrо стандартноrо состояния к друrому · .
1.12. Реrулярные растворы . . .. .....
1.13. Субреrулярные и квазиреrулярные растворы , · , r
1.14. Квазихимическая теория . .. ... -; . .
1.15. Параметры взаимодействия . . . . . . . . .
1.16. Расчет равновесия реакций с участием растворов . . 4
r .ТI а в а 11. Сталеплавильные шлаки . ....
. .
11.1. Технолоrические функции и характеристики шлаков .
11.2. Молекулярная теория шлака . . .. ....
11.3. Теория совершенных ионных растворов . .. '.
11.4. Теория реrулярных ионных растворов . . . . . .
11.5. Термодинамические функции шлака как фазы, имеющей кол-
лективную электронную систему . . . . . . . .
11.6. Распределение ЭJIементов между металлом и шлаком . .
r л а в а 111. Поверхностные явления в сталеплавильных процессах
111.1. Основные понятия . . . . . . . . . . .
.
111.2. Поверхностное натяжение жидких металлов . . . · ·
111.3. Уравнения зависимости nOBepxHocTHoro натяжения расплавов
от состава . .' ....... ..
. .
111.4. Поверхностное натяжение расплавов на основе железа .
111.5. Вычисление концентрации в поверхностном слое .'
111.6. Поверхностное натяжение шлаков . . . . . . ,
111.7. Межфазное натяжение между металлом и шлаком ..
111.8. СМ,ачивание и растекание . . . . fI . .
r л а в а IV. Термодинамические характеристики некоторых рас..
.
плавов на основе железа н никеля . .....
.
.
.
.
.
.
lV.I. КИCJIород в расплавах. ........
lV.2. Уrлерод в расплавах . .. .......
IV.З. Взаимодействие уrлерода и КИCJIорода в расплавах .
1\'.4. Обезуrлероживание хромсодержащих расплавов .'
1\'.5. Сера в расплавах . . . . . . . . .. .
1\'.6. Фосфор в расплавах . . .' ......
1\;.7. Азот в }I{елезе, никеле и их сплавах . ....
1\'.8. Водород в расплавах .. .. ..
r .ТI а в а У. Раскисление стали и сплавов ......
V.I. Влияние элементов раскислителей на активность кислорода в
жидком железе ..........
1*
.
5
6
6
10
12
16
17
19
20
22
26
29
33
34
40
41
49
63
68
69
71
76
77
80
85
90
90
92
93
97
98
100
101
103
.
.
.
.
.
109
109
113
115
120
123
133
135
143
146
146
3
V.2. Анализ кривой раскисления · . . .
V.3 Раскисление железа и ero сплавов .. .. ·
V.4: Комплекс.ные раскислители . · ..
V.5. Раскислительная способность шлака · ·
r JI а в а VI. НеметаJIлические включения. .. ..
VI..l. Образование неметаЛJIических включений. · .
VI.2. Укрупнение неметаЛJIических включений . . .. 't
VI.3. Удаление включений в rравитационном поле . .. . ·
VI.4. Влияние конвекции на удаление неметаллических включений
VI.5. Связь между свойствами поверхностей раздела фаз и скоро-
стью удаления включений .. .'.
VI.6. Переход rраницы раздела металл шлак . .
VI.7. Механизм удаления неметаллических включений .
VI.8. Поведение неметаллических включениЙ в условиях вакуума
r JI а в а VII. Кинетика металлурrических реакций
VII.l. Молекулярная диффузия .
VII.2. Конвективная диффузия . . . . . .
VII.3. Критериальные уравнения в задачах по кинетике . . .
VII.4. Признаки, по которым определяют лимитирующую стадию
reTeporeHHoro процесса . . . . . . . . .
VII.5. Кинетика растворения, плавления . . . . . . .
VII.6. Влияние ПАВ на кинетику reTeporeHHblX процессов . .
VII.7. Кинетика обезуrлероживания . . . . . . . .
VII.8. Образование и удаление rазовых пузырей из жидкой стали
VII.9. Массоперенос компонентов в шлаке . . . . . . .
r JI а в ,а VIII.. Особенности рафинирования металла при пере-
плавных процессах . .. ...... .
.
VIII.1. Общие закономерности рафинирования металла при пере-
плаве . .. ..... ...
VIII.2. Рафинирование металла при ВДП .. ...
VIII.3. Рафинирование металла при ЭШП . .
VIII.4. Рафинирование металла при ЭЛП . . . . . .
r JI а в а IX. Кристаллизация и формирование злектросталепла-
ВИJlьноrо слитка . ,. . . . . .. ....
IX.l. Затвердевание слитка разовоrо формирования . . . .
IX.2. Затвердевание непрерывноrо и полунепрерывноrо слитков
IX.3. Двухфазная область . . . . . .. . . . . .
IX.4. I(онц нтрационное переохлаждение . . . . . . .
IX.5. Дисперсность дендритной структуры, и дендритная ликвация
IX.6. Физическая неоднородность стальноrо слитка . . . .
Библиоrрафический список .....
Предметный указатель . . . .
..........
.
147
149
154
155
156
]57
159
161
163
164
166
169
171
173
173
176
179
180
182
184
186
189
191 .
.
194
195
202
218
231
236
237
241
247
250
252
255
259
267
ПРЕДИСЛОВИЕ
в решениях XXVII съезда КПСС отмечается необходи-
мость существенноrо расширения объема проводимых на..
учных исслеДО,ваний и разработок, а также резкоrо повы-
шения эфф ективности их практическоrо применения.
В СССР и за рубежом опубликовано значительное число
моноrрафий, посвященных теоретическим основам стале..
плавильноrо производства в целом или ero отдельным раз-
делам (rазы в стали, раскисление, неметаллические вклю-
чения и др.). В настоящей книrе коротко изложены Teope
тические закономерности металлурrических процессов,
причем значительное внимание уделено основным физико..
ХIlмически понятиям. Тем не менее книrа по содержанию
существенно отличается от учебников и пособий по физиче-
скоЙ химии, поскольку отобран лишь материал, необходи-
u
мыи для изложения теоретических основ сталеплавильноrо
производства.
В разделе химической термодинамики описаны методы
u u
расчета равновесии при помощи различных моделеи метал-
лических растворов. В rл. 11 излаrаются основы теории
шлаков и рассматриваются термодинамические функции
шлака как фазы, имеющей коллективную электронную
систему. Значительное внимание уделено также физико"хи-
u
Iическим основам поверхностных явлении в сталеП.павиль"
ном производстве, термодинамическим характеристикам не-
!{оторых расплавов на основе железа и никеля, раскисле-
нию, образованию и удалению неметаллических включений,
рафинированию металла при переплавных процессах.
Применение законов физической химии к металлурrиче
ским процессам встречает трудности при проведении коли
чественных расчетов и оценок. С учетом этоrо в !{ниrе при-
водится необходимое число примеров по каждому разделу.
Их цель помочь читателям в освоении расчетных мето-
дов. Для этоrо приведено большое число справочных и таб-
личных данных. В решении ряда задач принимал участие
ю. и. Уточкин.
Во втором издании переработаны некоторые разделы,.
добавлены материалы, делающие изложение более строrим
и последовательным. Приведены новые примеры, которые
ПОЗВоляют читателю лучше понять излаrаемую теорию.
В. А. rриrоряном написаны rлавы 111, V, VI, VII и так...
же разделы IV.7, IV.8, л. Н. Белянчиковым.......... r'лавы VIII
и IX, А. я. Стомахиным .......... rл. 1 и разделы IV.l..........IV.6; rл. 11
написана А. r. Пономаренко.
5
r n а в а 1.
ОСНОВЫ ХИМИЧЕСКОЯ ТЕРМОДИНАМИКИ
При изучении термодинамических характеристик химиче
ских и в том числе металлурrических процессов использу
ют обычно два подхода: феноменолоrический (классическая
термодинамика) и молекулярно статистический (статисти"
ческая термодинамика). Основное внимание в настоящей
u
rлаве уделено классическои термодинамике, которая со..
ставляет основу большинства расчетных методов, приме
няеl\iЫХ на практике. Предполаrается, что основы термоди
намики уже известны читателю из курса физической хи
мии [1]. Основная задача настоящей rлавы состоит в том,
чтобы поМочь читателю в освоении практическоrо при мене..
ния термодинамики для решения задач сталеплавильноrо
,
производства.
1.1. ЭНЕрrия rИ&&СА ХИМИЧЕСКОЙ РЕАКЦИИ
Основной термодинамической характеристикой химической
реаКЦИII является вызываемое ею liзменение энерrии [и б..
бса (до) *1 системы. Для определенности исходные веще
ства и продукты реакции принимают обычно находящими-
ся в их стандартных состояниях. Соответствующую величи..
ну O lIазывают стандартной энерzuей Fllббса химической
реакции 11 обозначают доо (ИЛI1 rGO).
Вещество в стандартном состоянии это обычно чистое
вещество при давлении 1 атм*2 в том arperaTHoM виде, ко-
торый устойчив при данных условиях (если нет специаль-
ной оrоворки). Для меди, например, при 1000 К стандарт..
HbIl\1 состоянием обычно является Си(т), а при 1400 К
Сu(ж). Однако, если это удобно, при 1000 К можно принять
a стандартное состояние и жидкую (переохлажденную)
медь. Возможны и друrие варианты. Например, в справоч
иике [206], при вычислении констант реакции за стандарт..
ное прпнято состояние одноатомноrо rаза (при всех темпе..
ратурах). В теории сталеплавильных процессов за стан..
. *1 В литературе встречаются и друrие названия: свободная энер
rия, изобарно изотермический потенциал. Кроме обозначения а, реко-
мендованноrо АН СССР [3], используют символы Z, Р.
*2 Выбор внесистемной единицы lIзмерения 1 атм== 101325 Па яв..
JIЯСТСЯ В этом случае общепринятым; переход к друrому стандартному
давлеНIIЮ (например, 1 Па) потребовал бы переработки мноrпх спра-
вочников.
6
дартное часто принимают состояние вещества в растворе.
Подробно этот вариант рассмотрен ниже. Стандартные со..
стояния веществ, участвующих в реакции, выбирают про..
извольно, для удобства расчетов. Однако, этот выбор дол..
жен быть четко определен (например, в уравнении реак..
ции), иначе приводимая величина 6,00 не имеет смысла.
Часто фактические (рассматриваемые) состояния peareH..
тов не совпадают со стандартными. Во избежание неточно..
u
стеи в уравнениях следует указывать стандартные состоя..
НИЯ. Например, если рассматривается реакция с участием
кремнезема в шлаке, а за стандартное состояние в расчете
u u
принимается чистыи жидкии кремнезем, то в уравнении
реакции должен быть записан SiО 2 (ж), а не (Si0 2 ).
Значения 6,00 можно найти при помощи таблиц, в кото..
рых приведены данные о стандартных энерrиях rиббса об..
разования веществ из элементов при различных те fпера..
турах [2, 49, 205, 206, 230 и др.]. В последних справочных
издаНIIЯХ [206] приводят иноrда не энерrии rиббса вещесrв
От, а приведенные энерrии rиббса Ф т , которые связаны с
ОТ соотношением:
(D r == {от Но)/Т == 81 (ВТ Но)/Т. (1)
Для определения ilGO необходимо определить суммар..
ную энерrию rиббса образования всех продуктов реакции
(с учетом стехиометрических коэффициентов) и вычесть
из полученноrо значения суммарную энерrию rиббса об-
разования всех исходных веществ. В некоторых справочни"
ках приведены стандартные значения энтальпий ( lfO) и
энтропий ( SO) образования веществ из элементов. Для вы..
числения OO в этом случае используют уравнение:
dGO == ДНО Т ДSО. (2)
Во мноrих практических случаях значения I1HO и LlSo ре..
u
акции в определенном температурном интервале можно
считать не зависящими от температуры. При этом ypaB
нение (2) характеризует зависимость дОО от температуры.
Стандартные энерrии rиббса образования некоторых co
u
единении, имеющих значение для сталеплавильноrо про из..
водства, приведены в табл. 1 в виде коэффициентов урав...
нений типа уравнения (2). Коэффициенты в указанном
температурном интервале приняты постоянными. Для бо...
лее строrих расчетов необходимо учитывать зависимость
HO и SO от температуры, однако необходимость в этом
возникает довольно редко. В качестве примера определим
при помощи табл. 1 значение ao реаКЦИII восстановлеНllЯ
1
Т а б 7I И Ц а 1. Стандартные энерrии rиббса образования некоторых
соединений И3 элементов f1 f G°==:A+BT, ДЖ/МОJlЬ при температурах
сталеплавильных процессов (1800 2000 К)*l
,
Соединение А В Соединение А В
Карбиды
АI,С з ........258000 97 *2 661 00 58
Мn 7 С з
Вс С ........69500 9
Сас. 2 *4 21ЗООО M02C* 66100 110
61
2 MoC* 40600 59
.3
Cr 23С6 380860 37 SiC 123000 38
*3 168000 зо
Cr 7С3 Та2С*2 142ЗОО 5,5
*3 84400 15
Сr З С 2 TaC* 161000 5,5
C 2 H 2 (r) 220000 50 TiC 179000 ,15
CH,(r) 88400 108,5
MgC;2 ZrС*З .......200000 12
9800 102
Нитриды
AIN ззоооо 117 МgзN 2<'\') 855000 504
BN 248000 86 Mo 2 N*2 71550 58
Без N 2 604000 196 Si з N 4 922000 457
Са з N 2 (ж) 918400 490
CeN* 336800 114 TaN* 2 234700 79
Сr2N*З 115000 64 TiN* .........334500 93
СrN*З 113600 73 VN*3 207500 78
NHs(r) 55800 117,6 ZrN* 360200 90
NbN* (600K) 235600 91
Оксиды
A1 2 O(r) 195000 44 *2 1826300 ЗЗ7
Се 2 О з
Аl O(r) 41000 .......58' 1 О
AI0 2 (r) 1 08000 4 .2 1029000 214
СеО 2
АI 2 О з (а) 1681000 324
В2 0 з 1220000 204 СоО(ж) 249700 80
ВаО ........555000 101 Сr20з 1131000 250
ВеО(сх) 619000 104 СuО(ж) 1132000 58,3
CO(r) 118000 83, 77 СU20(ж) 136600 48,5
CO 2 (r) 397000 0,2 FеО6ж) 245000 53
СаО .........790000 194 Fe 2 з 747000 210
CaO(r) .......134000 38,4 Fез О . 992000 247
*. в основном по данным [206] и автоматизированной системы I1BTAHTEPMO
[230]. 3а стандартные фазовые состояния 80 всех случаях, кроме специально
обозначенных, приняты для карбидов, нитридов. оксидов, сульфидов и для эле.
ментов С, В, Cr, Мо. Nb. Та, Ti, W, V. Zr....... твердая фаза; для хлоридов, фто
ридов 11 для элементов N2. 02, 52. Cl 2 , F 2 , Н 2 , Р2. Са. Mg, Na rаз; для осталь
ных элементов жидкость. О вычислении AfGO реакций для веществ в друrом
фаЗОВО:\1 СОСТОЯНIIИ 11 с участием элементов, растворениых в металле, см. с. 66, 67.
8
п родолж. табл. 1
Соединение А В Соединение А В
.
Н2 0 ([') 251070 57,65 SnО2(ж) 560000 197
L З 2 0 з 1784000 278 ТЗ205 1984000 390
MgO 729000 204 TiO( ) 527000 84
MgO(r) 99000 23,9 TiO(r) 28500 .........77
MnO 408400 90 Ti02 936000 176
М П 2 0 з 982000 269 Ti0 2 (r) 344000 3
1\\ПЗ04( ) 1790000 652 Тi20з( ) 1481000 246
МО02 557000 156 ТiзОs(р) 2410000 410
' 002(r ) зоооо .........24 va 406000 73
МООз(r) 370000 65 VO(r) 131000 80
NO(r) 91500 12,72 V 2 О з 1186000 233
N0 2 (r) 35600 61,5 V 204(Ж) 1263000 234
Na20 531 000 250 V0 2 (r) ........251000 8,3
NbO([') 196000 ........84 У 2 О 5 1441000 323
NЬ 2 Оs(ж) 1744000 340 WO(r) 387000 93
NiO 249800 92 W0 2 (r) 20000 22
PO(r) - 99600 11 ,51 wоз(ж) 731000 180
P 2 Os(r) 1235000 331 WОЗ(r) 323000 61
Р 4010(1') 3112000 983 У20з ........1920000 292
SiO(r) 162000 ........46 t 3 ZrO(r) 72000 77 ,3
Si02( ) ........947000 198 Zr02(r) 339000 2
SnO 241000 70 Zr02 1081000 176
СульфuдЬt
АI 2 S з 752000 212 I MnS 276000 63
BaS 527000 110
*3
CS( [') 208500 ........86 , 05 MoS-> 386060 173
...
CS 2 (r) 12300 ......... 5 , 6 NЗ2S*З 555400 240
COS(r) ........204400 8,9
CaS ........691900 190 N. S*3 264300 77
]з 2(r)
CuS; OOI() 113100 82 SiS(r) 20000 47, 1
FеS(ж> 135000 43,2 SiS 2 (r) ........177000 27
SnS(r) 24000 45, 68
Н S(r) 75000 ........15 SO(r) 60000 .......4 , 8
H 2 S(r) 90500 49,2
S02(r) 361 000 72,9
MgS ........535000 187
SОЗ(r) 455100 163
Фторuды
АIF з 12ЗОООО 80 PF& 1646000 300
B2 F 4 14500oo 103 PbF 2 447000 O,l
СаF 2 (ж) ........1312000 210 SF 48200 ........12
CaF 2 ........970000 84 SiF 4 ........1665000 170
FeF 120000 78 SnF 2 500000 2
FeF 2 47З200 ........13 SnF 4 ........1088600 149
MnF 140000 63 ТiF з 1164000 45
MnF 2 592000 0,5 TiF4 ........1566600 134 .
МnF з ........800000 54 ZrF 49600 ........87
NaF 405000 40 ZrF: 3 ........1677500 128
9
п родолж. табл. 1
Соединение
А
в
Соединение
А
в
Хлориды
АIСl з 603000 68 PbCI 1 !ООО ........59
ВС1з 407000 52 PbCl 2 262000 285
СаС1 2 (ж} 89ЗООО 190 PbCI 4 705000 155
FеСIЗ(;I\) 306600 83 SiCl 4 351000 130
МпСI 39000 ......66 SПСl 2 220000 3
MnCI 2 ......305000 .........6 TiCl 4 768500 125
NaCI(}I\) 453000 130 WCI*3 748400 213
NbCl s 688000 17 ZrCI 4 870700 116
PCl 5 4]8100 266
.2 По данным [2].
.3 По данным [49].
О
.4 По данным [234]: 6 f GCaC. == 60250 2б,28 Т.
оксида титана rрафитом до карбида титана: Ti0 2 (T)+
+ЗС(rр)==ТiС(r)+2СО(r). Просуммировав взятые из табл. 1
выражения для 110° реакций образования соответствую-
щих соединений, получим: 110o===2110 o +дG iС G iOJ ==
== [2( ] 19700 8З,О5Т) + ( 185800+14,27T) ] ( 935500+
+ 176,1 ОТ) == 51 0800........З28,2Т Дж.
1.2. НАПРАВЛЕНИЕ И ПОЛНОТА
ХИМИЧЕСКОМ РЕАКЦИИ
COr{IacHo второму закону термодинамики, энерrия rиббса
при необратимых процессах может только убывать. Отсю
да следует, что 1100 является критерие 1 направления и
полноты протекания реакции между веществами, взятыми
в стандартном состоянии. Реакция может протекать толь
ко в том направлении, которое характеризуется отрица
тельным значением OO, т. е. реакция всеrда идет в Ha
правлении уменьшения энерrии rиббса системы. Если
ao===o, то это указывает на равновесие между peareHTa
ми в их стандартных состояниях (реакция не идет). Полно
. I U
та прот кания реакции характеризуется константои paBHO
песня K связанной с 6,00 уравнением изотермы:
.
, ..
L\GO RT lп К. (З)
, I
'.Пользуясь уравнением (3), можно по известному 3Ha
чению АОО определить константу равновесия реакции, и
найти н обходимые для практики равновесные KOHцeHTpa
10
цИИ и друrие характеристики. Например, для реаI{ЦИИ по..
lучения TiC, исходя из уравнения (3) и температурной за..
БИСИМОСТИ tlG , мо)кно получить следующее выражение для
константы равновесия:
800
1 9 К 1 9 (Р ) . т
со 2,303RT
== 510800 + 328,2Т == 26700
+ 17,1.
19,14T 19,14Т Т
Отсюда следует, что при 1873 К равновесное давление СО
в рассматриваемой системе составляет 25 атм.
Величина OO является однозначной характеристикой
u
направления и полноты реакции только при даннои темпе..
ратуре. Для оценки температурной зависимости полноты
реакции удобнее пользоваться теплотой реакции. Непра-
БИЛЬНЫЙ подход может привести к серьезным ошибкам. На-
пример, исходя из температурной зависимости OO peaK
ции окисления уrлерода [C]+[O]==COr, OO=== 22400
39,7 Т Дж [2], делают иноrда заключение, что реакция
должна более полно протекать при высоких температурах,
при которых величина OO более отрицательна. В действи..
тельности реакция идет более полно при пониженной тем..
пературе. Правильный вывод можно сделать при помощи
уравнения изобары Вант-rоффа:
d ln K/dT == Ho/RT2. (4)
Из уравнения (4) видно, что знак температурной зави..
симости константы совпадает со знаком H. В приведен..
ном примере H ::::; 22400 ДЖ, Т. е. меньше нуля, ll, следо-
вательно, при повышении температуры константа умень-
шается, реакция идет менее полно. Такой вывод можно
сделать и используя принцип Ле Шателье. Если температу-
ра повысится, то в системе будет протекать процесс, сопро-
Вождающийся поrлощением тепла. В приведенном приме
ре это соответствует протеканию процесса в обратном Ha
правлении, Т. е. уменьшению полноты реакции. Соrласно
второму закону термодинамики, в 11золированных систеМdХ
Все необратимые процессы сопровождаются увеличением
Энтропии. Таким образом, по значению SO также можно
судить о направлении реакции, но только в ИЗОЛIlрованной
Системе. Реальные объекты обычно нельзя считать изоли..
Рованными системами, поэтому для оценки направлеI-IИЯ и
полноты реакции пользуются значениями 600.
If
1.3. РАСТВОРЫ. СОСТАВ.
ТЕРМОДИНАМИЧЕСКИЕ функции
L{ля описания состава растворов в металлурrии использу
ют обычно массовые доли, выраженные в процентах. В Teo
рии широко пользуются также мольными (атомными) дo
лями и процентами. Связь между различными единицами
выражается формулой:
n.
Х.== J
J
ni + nj + nh + · . ·
Cj/MJ
Ci/Mi + cj/Mj + Ch/Mh + ...
CaT.j
100 '
(5)
.
rде Xj мольная доля компонента /; ni, nj, nk числа MO
v
леи компонентов; Ci, Cj, Ck массовые доли компонен
ТОВ, О/о; Mi, M j , M k молекулярные (атомные) массы;
CaT,j мольная атомная доля компонента j, О/о. Для разбав
ленных растворов, в которых nj, nk... очень малы по cpaB
v
нению с количеством молеи растворителя nЁ можно исполь
зовать упрощенную формулу:
Х j == n j/n i =='(Cj M i /(M j .l 00) == C a1 o.j/ I 00.
.-
(6)
Из формулы (6) видно, что в разбавленном растворе
v
мольная доля пропорциональна массовои концентрации.
Это относится и к друrим способам выражения KOHцeHTpa
ции в разбав.пенных растворах.
L{ля термодинамическоrо описания состояния компонен
та в paCTBOp пользуются парц аЛЬНЫl\fИ мольными xapaK
теристиками gi, под которыми понимают частные производ
ные от соответствующих экстеНСUВНbtх*l свойств раствора
v
по числу молеи данноrо компонента при постоянных темпе
v
ратуре, давлении и числах молеи друrих I{омпонентов:
... ( ag )
gi == '. ·
ani р, T'nJ{i=/=/)
Таким образом, gi представляет собой приращение свой
ства бесконечно болыпоrо количества раствора при добав
ке 1 моля i"Toro компонента. Например, парциальный моль
вый объем компонента в растворе заданноrо состава пока
зывает, на какую величину изменится объем этоrо раствора
(7)
*1 Экстенсивными называют свойства, которые зависят от количе..
ства вещества: V.. Н, S.. G и т .д. Такие свойства, как температура и
давление, не зависящие от количества вещества, называют интен..
сивными.
12
(взятоrо в бесконечно большом количестве) при добавлении
1 моля данноrо компонента. Как видно из определения, пар-
циальные мольные величины являются интенсивными ха-
РЗI{теристиками; они зависят не от количества раствора,
а от ero состава. J{ля определения экстенсивноrо свойства
g раствора необходимо просуммир вать парциальные моль-
ные характеристики компонентов gi, умноженные на соот-
ветствующие числа молей ni. Например для энтальпии
раствора имеем Н === ( ni), или для 1 моля раствора*1
i
Hт== (HiXi)i.
i
В некоторых случаях парциальная мольная характерис-
тика может быть равна соответствующей мольной харак-
теристике чистоrо компонента. Так, если суммарная энер..
rия взаимодействия частиц при образовании раствора из
чистых компонентов не изменяется (такие растворы назы-
вают совершенными), парциальные объемы компонентов и
их парциальные энтальпии будут равны соответствующим
о о
мольным характеристикам: V i == V i ; Hi==Hl. В этом слу-
чае объем и энтальпия раствора аддитивно складываются
из мольных величин: V=== (V ni); H== (H nl). Однако
i i
такие случаи крайне редки. В большинстве растворов пар-
циальные мольные характеристики существенно отличают-
ся от соответствующих мольных характеристик компо-
нентов.
Некоторые свойства (в частности, энтропия и энерrия
rиббса) не являются аддитивныМИ даже в совершенном
растворе. Иноrда в результате сильноrо взаимодействия
компонентов в растворе парциальные мольные характери-
стики .принимают отрицательные значения. Это означает,
ЧТО добавление одноrо из компонентов к раствору приво-
дит не к увеличению, а к уменьшению определенноrо экс-
тенсивноrо свойства. Так, если добавить HeMHoro сульфата
маrния к водному раствору этой соли, объем раствора
уменьшится, поэтому VMgSO. <о. Еще одним примеро МО-
rYT служить разбавленные растворы кремния в расплавах
железа и никеля, в которых парциальные мольные энталь-
пии кремния равны соответственно 41 и 1 1 1 кJ{ж. Эти
величины найдены путем суммирования мольной энтальпии
*1 ПОД молем раствора понимают такое КОJ1ичество раствора, в
котором числа молей компонентов равны их мольным долям (пi==Xi) ,
и следовательно, суммарное число молеи компонентов равно 1. Масса
1 Моля раствора Mт== xIMj==lOO/ (CjIM/).
j j
13
кремния (Hr873, H J, равной 91 кДж [2], и теплот рас...
творения кремния при 1873 К в железе ( 132 кДж) и в
никеле (.........202 кДж). Выделение тепла при взаимодействии
кремния с железом и никелем превышает тот вклад в эн...
тальпию раствора, который вносит добавка 1 моля крем...
ния, HarpeToro до 1873 К, поэтому парциальная мольная
энтальпия кремния в обоих случаях отрицательна. Приве...
v
денныи пример показывает, что парциальная мольная
величина характеризует не только данное растворенное ве...
щество, но и растворитель, точнее состояние данноrо веще...
ства в определенном растворе. Особое место среди парци..
альных мольных величин занимает парциальная мольная
энерrия rиббса, называемая химическим потенциалом ком..
понента:
i === о ; === ( : )p'T'nj(i-i'i). (8) .
Величина fli характеризует стремление компонента по..
кинуть раствор или перейти в Hero из друrой фазы (с боль...
тим значением f..1i). Если химический потенциал компонен..
та fli в растворе выше, чем в паровой фазе (при данном
давлении Pi), то компонент переходит в пар. При повыше..
v
нии давления химическии потенциал компонента в паре
может стать выше, чем в растворе. Это вызовет переход
компонента обратно в раствор.
Наряду с рассмотренными аБСОJIЮТНЫl\1И значениями
......
интеrральных и парциальных характеристик gm И gi В тео..
рии растворов часто пользуются относительными величи..
нами, которые более четко выражают особенности раство..
ров по сравнению с механическими смесями. Относительная
интеrральная характеристика дgпl представляет собой раз..
v v v
ность между gm И соответствующеи величинои, полученнои
путем аддитивноrо сложения характеристик чистых компо..
О ад О Т
нентов gi: дgm==gm gт ==gт glXi. ак, относительная
i
интеrральная мольная энтальпия представляет собой раз...
v v
ность между энтальпиеи моля раствора и суммарнои эн...
v
тальпиеи чистых компонентов, взятых в тех же количест..
вах: H т==Н m......... H Xi, т. е. хараI{теризует интеrральную
i
теплоту образования 1 моля раствора из чистых компонен
тов (интеrральную теплоту смешения). Относительная
парциальная величина gi представляет собой разность
v u v
между парциальнои и соответствующеи мольнам характери...
о
стиками данноrо компонента: gi==gi gi. В качестве при...
J4
rvlepa можно привести относительную парциальную энталь..
о
пию ДНi Нi Нi, которая представляет собой теплоту
растворения 1 моля i"Toro компонента в бесконечно боль-
шОМ количестве раствора.
Наблюдаемые в реальных растворах отклонения от ад-
дитивности, которые характеризуются отно ительными зна-
чениЯМИ термодинамических функций, иноrда MorYT быть
ПОL7'JНОСТЬЮ или частично объяснены теорией' идеальных (на-
пример, совершенных) растворов, поэтому относительные
велИЧИНЫ принято делить на две составляющих идеаль-
ную и избыточную: gт==8g,::+ б; gi== g,?,+дg зб.
Очевидно, что в идеальных растворах избыточные функции
а 5
gmt t1 L1g m t
......
I
'
1 т 0C\J ....
О....
t:))
о Xz 1 х 2 ....... 1
::::sr::
Рис, 1. Связь между интеrральными и парциальными характеристиками в двух-
компонентном растворе:
а абсолютные величины: интеrральные (gm) и парциальные (g i); б относи
те..'1ьные величины. интеrральные ( Ag ==g ДД== gИД+АgИЗб ) и паРЦllаль
. т т т т т
ные ( А' ==i RО==АgИД+АgИзб ) .
l l 1 е I
paBH I нулю. Связь между различными характеристиками
раствора иллюстрируется rрафиками, приведенными на
рИс. 1. На рис. 1, а кривая с точкой М характеризует из-
менение интеrральноrо свойства gm при изменении состава
раствора во всем интервале конструкций. На ординатах
Х2===О и Х2== 1 кривая отсекает мольные характеристики
Компонентов ti и gg. Если в точке М провести касатель-
Ную к кривой, ТО точки пересечения этой касательной с
Ординатами будут соответствовать парциальным характе-
...... ---
РИстикам раствора gl и g2 при концентрациях компонен..
тов, соответствующих точке М. Такой rрафический метод
Определения парциальных характеристик очень удобен для
Лрактических расчетов. Соответствующие аналитические
16
u
выражения имеют следующии вид:
gl === gm + (1 X 1 ) дgт ; (9)
aX l
g2 == gm + (1 Х 2 ) дgт ; (10)
дХ2
.
gm == gl + (1 ....... Х 1 ) (g2 gl ) == X 1 g 1 + x 2 g;. (11)
На рис. 1, 6 кривая с точкой М характеризует относи..
тельные значения Toro же интеrральноrо свойства дgт В
той же бинарной системе }............2. Относительные парциаль..
ные величины gl и g2 (в точке М) MorYT быть определе..
ны по этому rрафику аналоrичным способом............ проведени..
ем касательной. Аналитические выражения для g имеют
тот же вид, что и для g. Пунктирные кривые на рис. 1, а, б
характеризуют значения gm И gm, следующие из теории
совершенных растворов. Такой вид имеют, например, эн..
тропия раствора и взятая с обратным знаком энерrия rиб..
бса. Точки пересечения этих кривых с ординатой точки М
делят величину gm на две составляющие: идеальную и
избыточную. Касательная к пунктирной кривой, проведен..
ная на рис. 1, б, делит на соответствующие части и парци..
альные характеристики 6.g1 и g2.
1.4. УРАВНЕНИЕ rи66сА....... дюrЕМА
Связь между парциальными характеристиками компонен-
тов в бинарном растворе может быть выражена уравне..
ннем:
...... .....
п 1 dg 1 + Il 2 dg 2 =--= О, (12)
которое является одной из форм уравнения rиббса............дю..
reMa. Разделив это уравнение на nl + n2, получим аналоrич...
ное соотношение с мольными долями:
........ .......
Х 1 dg 1 + x 2 dg 2 == О. (13)
Разделив уравнение (13) на dXl с учетом dX1=== dX2, по-
лучим друrую форму уравнения rиббса Дюrема (ДЛЯ по..
стоянных р И Т):
х ( д g 1 ) Х ( ag2 ) ' (14)
1 дХ 1 р,Т 2. дХ2 р,т.
Уравнение rиббса Дюrема имеет большое значение в
термодинамике растворов, так как позволяет рассчитать
парциальные характеристики одноrо компонента раствора
16
по известным характеристикам друrоrо 1. Уравнения (12),.
(13) MorYT быть распространены на мноrокомпонентные
растворы путем добавления членов, соответствующих i===
==3, 4 и Т. Д.
1.5. ЗАКОНЫ РАУЛSl И rЕНРИ
Основой для описания свойств реальных растворов служат
законы Рауля и rенри, определяющие характер зависимо-
сти давления пара компонента над раствором от ero со-
става. Первоначально эти зависи-
мости были установлены эмпириче РСи'
Па
ски, как закономерности, вvыполня 70
ющиеся с довольно высоком точно ба
стью в оrраниченных (для боль
шинства растворов) интервалах 50
концентраций. В дальнейшем были 40
разработаны модели (так называе ЗО
мые идеальные растворы), в KOTO 2.0
рых указанные законы выполняют 10
ся с абсолютной точностью. Эти мо-
дели иrрают большую роль в COBpe О
v
меннои теории растворов, посколь-
ку являются основой для обобще-
ния экспе р иментальноrо мате р иала Рис. 2, Давление пара ме-
v ди над расплавом Fe Cu
И дальнеишеrо развития теории. при 1823 К. (5]
Рассмотрим зависимость давления
пара одноrо из компонентов бинар-
Horo раствора от ero концентрации на примере системы
Fe Cu (рис. 2). Из рис. 2 видно, что давление пара меди
u
над раствором всеrда меньше, чем давление пара чистои
меди, и повышается при увеличении концентрации. Наряду
с кривой А, характеризующей изменение PCu в реальном
растворе Fe Cu, пунктиром проведены две линии 1, 2,
соответствующие двум типам идеальных растворов. Для
идеальноrо раствора первоrо типа справедлив закон Pay
ля (см. рис. 2, кривая 1), соrласно которому давление па-
ра каждоrо из компонентов прямо пропорционально ero
v
Мольнои доле:
P i == p X i ,
/
/
/1
/
/
/
/
/
/
/
I4l o, (46 48 O
Хеи.
(15)
причем коэффициент p в уравнении (15) представляет со-
1 Пример T8Koro расчета приведен на с. 30, 31.
2 675.
17
бой давление пара чистоrо компонента (Pi P при Xi== 1).
", Идеальные растворы первоrо типа называют 'СО8ершеННbl
.м,и. Некоторые из реальных растворов очень близки к co
вершенным. Как правило, такие растворы образуются из
компонентов, мало различающихся своими физико химиче
скими свойствами, например расплавы Fe Mn, Fe Co,
PeO MnO и т. д. Очевидно, что возможность описания pe
альноrо расплава законом Рауля зависит от требуемой
точности: чем она ниже, тем больше растворов можно OT
нести к совершенным. Для идеальноrо раствора BToporo
типа (разбавленноrо раствора) справедлив закон rенри,
соrласно которому давление пара pacTBopeHHoro вещества
прямо пропорционально ero концентрации (рис. 2, кри
вая 2) :
Pi == r i Ci (i =1= 1)*. (16)
ПОСI{ОЛЬКУ В разбав енных растворах между KOHцeH
-трациями, выраженными в различных единицах, существу
.ет приблизит льная прямая пропорциональная зависи
мость (см. с. 12), ТО формула (16) практически справедли
ва при выражении концентрации в любых единицах. Чаще
Bcero используют массовые доли. Коэффициент ri (KOH
.станта rенри) зависит от химической природы компонентов
раствора, а также от выбранных единиц измерения KOHцeH
трации. В общем случае константа rенри не равна
величине РУ', которая служит коэффициентом пропорцио
нальности .Б законе Рауля. Исключение составляют только
совершенные растворы (при условии выражения KOHцeHTpa
дии в мольных долях). Концентрационный интервал, в KO
тором реальные растворы подчиняются закону rенри, KO
леблется от долей процента до нескольких процентов. Как
.видно из рис. 2, давление пара меди над расплавом под
чиняется закону Рауля только в небольшой области KOH
центраций вблизи чистой меди. В остальном концентриро
.ванном диапазоне наблюдаются положительные отклоне
.ния от закона Рауля: реальное давление значительно боль
те теоретическоrо. Отклонения от закона rенри обычно
имеют противоположный характер. В данном случае они
отрицательны.
Характер отклонения от идеальноrо поведения связан с
химической природой компонентов раствора. Если компо
v
ненты проявляют тенденцию к химическому взаимодеист
* ИндеhСОМ i 1 обозначен растворитель
18
вИЮ (например, если при понижении температуры в систе..
ме MorYT образовываться соединения), то раствор харак",
теризуетея отрицательными отклонениями от закона
Рауля. К ЭТОМУ ТИПУ относятся сплавы железа с кремнием,.
алюминием, титаном, ванадием и друrими элементами.
Как видно из фазовых диаrрамм [6 8], в этих сплавах при
охлаждении образуются химические соединения. Если в
растворе проявляется тенденция к отталкиванию молекул,
то отклонения от закона Рауля будут положительными
(как в системе Fe Cu). При сильных положительных от..
клонениях от закона Рауля наблюдается расслоение на две
несмешивающиеся жидкости. Примерами MorYT служить
СlIстемы Fe Ag и Fe Pb [6 8].
1.6. СОВЕРШЕННЫЕ РАСТВОРЫ
Как отмечалось, идеальный совершенный раствор пред"
ставляет собой такую модель, в которой заКОII Рауля выпол",
няется с абсолютной точностью во всем интервале соста...
БОВ. Суммарная энерrия взаимодействия частиц при обра...
зова нии TaKoro раствора из чистых компонентов не
изменяется. Тепловой эффект и изменение объема при об...
разовании совершенноrо раствора равны нулю: Hт==O;
ДНi==О; V т==О; Vi==O. Фактором, который вызывает
самопроизвольное образование совершенноrо раствора из
чистых компонентов, является изменение энтропии. Оно
обусловлено тем, что термодинамическая вероятность рас...
ТБора (в котором каждая из молекул может находиться в
любой части занимаемоrо им объема) выше, чем вероят...
u
ность системы, rде каждыи из компонентов занимает толь
ко свой объем, составляющий лишь часть общеrо объема.
Никакоrо дополнительноrо изменения энтропии, связанно...
ro с упорядочением хаотичноrо расположения молекул,
при образовании совершенноrо раствора не происходит. Оп..
ределение энтропии образования совершенноrо раствора с
использованием формул молекулярной статистики [1] дает
С ТIеДУIощие выражения:
8Sп == R (Xi In Xi); (17)
.
dS i == R]nxi. (18)
Отсюда следует
aт == H'l1 Т Sт == RT Xi In Xi;
i
(19)
2*
19
JlG i == Hi T St == RT)n Х" (20)
t!G i == J.t i == + RT lп x i ' (21)
rде Jl2 химический потенциал компонента в стандартном
состоянии (при- Xi===I). Из приведеНIIЫХ выражений (с уче
том Xi< 1) видно, что образование совершенноrо раствора
всеrда сопровождается увеличением энтропии. При этом
энерrия rиббса системы всеrда уменьшается, так как ее
u u
изменение полностью определяется энтропиинои COCTaB
.JIяющей. Приведенные уравнения показывают также, что
для расчета относительных термодинамических функций
совершенноrо раствора требуется лишь задание состава и
температуры. Для ычисления изменения энтропии ДOCTa
точно знать только состав. Из уравнения (17) следует,
в частно.сти, что в бинарном совершенном растворе I1S m ха..
u u
рактеризуется симметричнои кривои с максимумом в точ
ке Х]-==::Х2 == 0,5, для которой ДSт===5,77 Дж/ (моль- К).
1.7. ИДЕАЛЬНЫЕ РАЗ&АВЛЕННЫЕ РАСТВОРЫ
Экспериментальной основой модели идеальноrб разбавлен..
яоrо раствора является закон rенри. Особенность модели
заключается в том, что она (в отличие от модели совершен
'Horo раствора) не определяет величину энерrии взаимо..
..действия paCTBopeHHoro вещества с растворителем. Для
,упрощения (необходимоrо в любой модели) не учитывает..
u
ея взаимодеиствие молекул pacTBopeHHoro вещества друr
с друrом (в связи с малой их концентрацией). Таким об..
разом, добавление pacTBopeHHoro вещества в разбавленный'
u
.раствор вызывает такое же изменение внутреннеи энерrии
и энтальпии системы, как добавление ero в чистый раство"
ритель (при условии, что раствор и после добавления оста..
,ется разбавленным), т. е. парциальная мольная энтальпия
'pacTBopeHHoro вещества в разбавленном растворе Н 2 ,
а следовательно, и теплота растворения ДН 2 не зависит от
OO 00
концентрации: H2 H2 const, H2 дH2 ===const. Знак
00 означает, что величина относится к начальной области
'I{онцентраций и имеет такое же значение, как в бесконечно
разбаВu1Jенном растворе*.
Изменение энтропии ДS2 при образовании разбавлен
Jloro раствора представляет собой сумму двух величин.
* в литературе иноrда обозначают такие величины тем же индек
СОМ, ЧТU И значения, относящиеся к стандартным состояниям (напри-
мер Ht').
:20
Первая величина связана с изменением состояния молекул
и, следовательно, в области разбавленных растворов не за..
висит от состава. Вторая велична, как и в случае совер..
шенных растворов, обусловлена увеличением объема, пре
доставленноrо молекулам pacTBopeHHoro вещества при пе..
реходе их из индивидуальноrо компонента в раствор. Эта
веТIичина пропорциональна лоrарифму объема раствора,
приходящеrося на единицу количества компоне.нта 2, т. е.
обратно пропорциональна лоrарифму концентрации С2, вы..
раженной в любых единицах. Таким образом, S2===A
R ln С2 (А постоянная величина, не зависящая от со..
става раствора, но зависящая от выбора единиц измере..
IIИЯ С2). Отсюда
a2 === H:; АТ + RT ln С 2 ;
f! == f.13 + H:;.......... АТ + RT In С 2 == '3 -t RT In С 2 .
(22)
(23)
Из уравнения (23) видно, что 'Фg === Jl2 при С2 == 1. OTCIO"
да следует, что велична 'Фg==Jlg+L\Н АТ представляет
собой ХИ lческий потенциал компонента 2 в стандартном
состоянии BToporo типа, т. е. в идеальном разбавленном
растворе с концентрацией С2== 1. Из приведенных формул
видно, что для расчета относительных парциальных харак"
теристик pacTBopeHHoro вещества на основе модели иде..
альноrо разбавленноrо раствора требуется знание пара..
метров, характеризующих взаимодействие. Так, из уравне..
IIИЯ (23) следует, что для расчета L\G 2 при произвольно за..
.данных температуре и составе необходимо не менее двух
u u
экспериментальных определении этои величны при разных
u
температурах, по которым можно наити значения постоян"
IIЫХ Hr и А (если принять, что они не зависят от Т).
В случае, коrда требуется только концентрационная зави..
.симость энерrии rиббса (при данной температуре) можно
оrраничиться одним экспериментальным значением 02,
неоБХОДИ'-1ЫМ для расчета постоянной (при T===const) ве..
\Т}ичины ( H'; AT).
В отличие от pacTBopeHHoro вещества термодинамиче..
Ские функции растворителя в идеальном разбавленном pac
ТБоре MorYT быть вычислены по формулам теории совер..
Шенных растворов. Докажем это при помощи уравнения
rиббса Дюrема. ,Для упрощения примем, что концентра..
ция pacTBopeHHoro вещества выражена в мольных долях
(С 2 ===Х2). Дифференцируя уравнение (23) получим: (aJl2/
/ дХ 2) p,T===RT/X2. Подставляя это выражение в ypaBHeHFe
21
(13), записанное для химических потенциалов, найдем:
Хl ( дf.11 ) == Х 2 ( дJ.t2 ) == Х 2 RT == RT (24)
aXl р,Т дХ2 р.Т Х2 ·
Разделив переменные, получим уравнение dJll ===RT (d ll
/Xl), из KOToporo после интеrрирования получим Jll ===
==RT ln Хl + const. Значение константы в этом выражении
о
можно определить из условия J..tl === J.t 1 при Хl === 1. Получеl-I"
ное в результате выражение J..tl === Jl + RT ln Хl подчиняется
теории совершенных растворов. ИллюстрациеЙ к сКазаНио....
му может служить рис. 2, из KOToporo видно, что в области
u
малых концентрации поведение меди соответствует модели
идеальноrо разбавленноrо раствора (закону rенри); в об....
u
ласти высоких концентрации, коrда медь является раСтво....
рителем, ее поведение соответствует модели совершенноrо
раствора (закону Рауля), поведение железа в первом слу....
чае описывается законом Рауля, во втором законом
rенри.
Интеrральные характеристики для разбавленных pac
творов MorYT быть найдены по известным парциальным Be
личинам при помощи соотношений (9) (11), или rрафи
чески (см. рис. 1).
1.8. АКТИВНОСТЬ '
В реальных растворах способность компонента переходить
в пар или вступать в химическую реакцию, как правило, не
определяется только концентрацией. Это проявляется в от...
клонениях от закона Рауля rенри, а также в том, что
константы реакции с участием растворов, выраженные че...
. u
рез отношения концентрации, не остаются постоянными Прll
переходе от одних концентраций к друrим. Причиной таких
u u
отклонении является взаимодеиствие компонента с осталь
ными веществами, находящимися в растворе. Количествен..
u u u
нои характеристикои, учитывающеи как концентрацию, Tal{
u
И взаимодеиствие компонента с друrими веществами в рас..
творе, является ero активность. В общем виде ПОД актив
ностью понимают отношение парциальноrо давления пара
u
компонента над раствором Pi к аналоrичнои величине для
стандартноrо состояния компонента p T. ОчеВИДIlО, что в
стандартном состоянии активность равна 1. Если рассмат",
ривают отклонения от закона Рауля, то за стандартное co
стояние принимают чистый компонент. В этом случае актив
насть (обозначим ее ai> определяют выражением:
af == pi/p? (25)
22
Связь между определенной таким образом активностью
u u .
И мольнои долеи выражают соотношением:
af == 'V i x l ' (26)
тде 1'; I(оэффициент активности. Если соблюдается закон
Рауля, то как видно из уравнений (15) и (25), ar ==Xi.
В этом случае 1'i=== 1. При отрицательных отклонениях от
IIдеальности 1'i< 1, при положительных отклонениях 1';>.1.
ТаКИl\1 образом, коэффициент активности 1'; количественно
характеризует отличие реальноrо раствора от совершенно
ro при той же концентрации. Из рис. 2 видно, что это отли
чие для системы Fe Cu наиболее сильно проявляется в
разбавленном растворе и постепенно уменьшается по мере
увеличения концентрации. Такая картина наблюдается и
во мноrих друrих растворах, поэтому коэффициент актив
ности в бесконечно разбавленном растворе по отношению
к чистому компоненту, обозначаемый 1' , имеет, как прави..
ло, минимальное или максимальное значение (в зависимо-
сти от знака отклонений от идеальности). С увеличением
концентрации i величина 1'i приближается к 1. Величина
"Y ' характеризующая отклонение закона rенри от закона
Рауля, имеет большое значение в практических расчетах и
Mo eT быть использована для определения активности af
во BCel\f концентрационном интервале соблюдения закона
fенри. Эта величина служит также основой для расчета
u
активностеи компонентов в концентрированных и MHoro
компонентных растворах.
Наряду с рассмотренным способом определения актив
ности существует друrой способ, в котором объектом опи...
сания являются отклонения не от закона Рауля, а от за
I\oHa rенри. Стандартным состоянием компонента в этом
случае является идеальный разбавленный раствор единич",
ной концентрации (при этом обеспечивается равенство 1
активности в стандартном состоянии).
Как отмечалось выше, концентрацию в законе rенри
можно выражать в любых единицах. При использовании
u
мольных долеи стандартным состоянием оказывается rи
патетический разбавленный раствор с концентрацией Х;== 1
(чистый компонент с такими же свойствами, как видеаль...
нам разбавленном растворе). Активность при таком выбо
ре стандартноrо состояния обозначим а[, коэффициент ак..
ТИВНОСТII q>i. В разбавленных растворах (подчиняющих-
r r
ся закону rенри) а; ===Xi, в остальных растворах а, ==
====CPiXi. Если раствор подчиняется закону rенри, то q>(=== i.
23
При отрицательных отклонениях от заКоНа rенри Q)i< 1,
при положительных.......... ер> 1. Заметим, что в этом последнем
случае аТ может быть больше единицы (в отличие от af).
Найдем отношение af/a[, не зависящее от концентрации
[ 220] :
ar 1'; Х; 1'; ( 1'; ) ( , ) "OO (27)
f i Х. o f i .
a r Ч>i Х; Ч>i Ч>i xi o; Q)i l z
i
Соотношение (27) можно использовать для перехода от
одних активностей и коэффицентов активности к друrим.
В большинстве расчетов удобнее выражать массовые
концентрации в процентах. Если рассматривать отклонения
от закона rенри с таким выражением концентраций, то
стандартным состоянием будет 1 О/о ..ный раствор с таl{ИМII
же свойствами, как при бесконечном разбавлении. В неко"
торых случаях, коrда отклонения от закона rенри наблюда..
ются только при концентрациях > 1 О/о, стандартный рас..
твор соответствует реальному 1 О/о -НОМУ раствору. В друrих
случаях стандартное состояние является rипотетическим.
Обозначим активность при таком выборе .стандартноrо со...
стояния a , коэффициент активности fi. По аналоrии с пре-
дыдущим вариантом для идеальноrо разбавленноrо раство",
ра справедливо соотношение a == С, (f'l == 1); при положи..
тельных отклонениях от закона rенри fi> 1, при отрица..
тельных fi< 1. Величина а: (подобно а[) может быть как
больше, так и меньше 1.
Определим соотношение м'ежду а1 и ar, а также связь
fi С Yi. По аналоrии с предыдущим, используя выражение
(6) в виде (Ci/Xi) == (100M i )/M m , rде М т масса моля ос..
HOBHoro сплава (без компонента i), получим:
a
f i с i ____ ( f i С i ) 1 ( С i ) 100М i
1'i xi 1'i xi xi O 1'';' xi x O == 1'';' М т ·
(28)
аР
i
Отсюда
fi === 'Vi .
.
1'
М ; 100
М т
Х.
z
(29)
.
с.
z
Подставляя вместо Xi/Ci выражение, найденное по фОР fуле
(5), которая справедлива для Bcero диапазона концентра...
...
ЦИИ, получим:
24
'\';
"(7'
.
I/M i
Ci/Mi + (100 Ct) М т
1 OOkl i
ciMm+(IOO Ci)Mi ·
lOOM i
М т
.
1'.
f .......... z
i ·
y
Аналоrичное соотношение в форме:
{ 2 == (Y2/Y )[Xl +Х 2 (MJM1}J (30)
было получено (ДЛЯ бинарноrо раствора) К. Люписом
[220J. Оба приведенных выражения отличаются от приме..
няемой обычно в расчетах [221] формулы:
f l == 'Vi/'Vrr. (31)
Однако, уточнение в большинстве случаев ничтожно ма-
ТIO rораздо меньше поrрешности имеющихся значений
коэффициентов активности.
Рассмотрим rрафики, приведенные на рис. 3. В рас..
Л/lаве Fe Si наблюдаются сильные отрицательные откло..
Si,% !1 cu 77
2 о 1 2 J ч
. I
пSi. a s ,-
0,8 V l / "4
'1 / \.1
0,8 I /
2 1у /
0,6
О o, / О
0,4 /
/
(J,'l. О, l /
/
O,OOI1(js7)
/
о О
о Ц2. 0,* 0,6 48 Si О 42. o, 0,6
а 5
РИс. 3. Активности кремния при 1873 К (а) и меди при 1823 К (6) в жидких спла-
вах с железом, выраженные двумя способами: по отношению к чистому компо-
Ненту (на основных rрафиках) и по отношению к 1 %-НОМУ разбавленному рас-
твору (на вставках) (4)
нения от закона Рауля (от лини 1), которые можно харак"
теризовать величиной y ==0,0011. Расплавы Fe Cu
характеризуются положительными отклонениями. В этой си..
стеме для всех составов t'Cu >1 (Ycu ==10,1). Стандарт..
НЫМ состояниям на этих rрафиках соответствуют точки 3;
активности af на rрафиках не показаны. Стандартные со..
Стояния для этоrо варианта определения активности нахо..
25
дятся В точках пересечения кривых закона rенри сордина...
тами Xi=== 1. Вставки на рис. 3 ПОI<азывают в увеличенном
виде части кривых для малых долей кремния и меди. Коор..
динатными осями на этих вставках служат массовая доля
компонента (абсцисса) и активность af (ордината). Пря..
мые линии 2 (см. рис. 3) соответствуют З3I{ОНУ rенри. От..
клонения от закона rенри противоположны по знаку откло
нениям от закона Рауля. В системе Fe Si при 4 о/о Si
a i ==4,6 и, следовательно, fi==I,15 (>1); в расплаве'
Fe Cu при 4 О/О Си a и ==3,6, что соответствует f cu ===0,9
( < 1 ). в системе Fe Si, так же как и во мноrих друrих
случаях, небольшие отклонения от закона rенри обнару...
живаются даже при концентрациях < 1 О/О. При этом в ка..
честве стандартноrо состояния используется rипотетиче...
ский 1 О/О ..ный раствор, обладающий свойствами идеальноrо
разбавленноrо раствора. Это состояние характеризуется'
на rрафиках точками 3' пересечения ординат 1 О/О с ли..
ниями закона rенри.. Очевидно, что в таких растворах ко..
эффициент активности компонента fi в реальном растворе
при 1 О/О ..ной концентрации не равен 1.
В литературе активности ar, а[ и a i часто обозначают
одним и тем же СИМВОЛОl\.1 Ui. Принятые стандартные со..
стояния указывают при этом либо в тексте, либо в выра...
жениях констант равновесия (вводя 'Yf, q>i или fi). В урав...
u
нениях реакции стандартные состояния peareHToB также
обозначают определенным способом. Для кремния, напри
мер, чистому компоненту соответствует запись Si ж (или
Si T ), 1 О/О ..НОМУ раствору [Si] или [Si]l% . Вопрос о выбо
ре стандартноrо состояния решают в каждом конкретном
случае*. Для основных компонентов металла и шлака чаще
u
применяют стандартное состояние «чистыи компонент»..
При рассмотрении систем с оrраниченной растворимостью
(например, растворов rззов в железе) в качестве стандарт..
Horo состояния выбирают обычно 1 О/О ...ный идеальный раз..
бавленный раствор. Такой выбор удобен и для металлов,
коrда рассматриваются расплавы с относительно неболь
u u
шои концентрациеи растворенных компонентов.
1.9. ЭКСПЕРИМЕНТАЛЬНОЕ ОПРЕДЕЛЕНИЕ АКТИВНОСТИ
Различные экспериментальные методы 11 аппаратура Д.,'Iя определеНIIЯ
активностей компонентов в металлурrических расплавах подробно опн
саны в работах [9, 1 О], поэтому оrраничнмся рассмотрением ЛИШЬ не...
* Для удобства расчетов.
26
скольких методов. Наиболее прямым методом определения активности
КО 'lпонента является измерение давления ero пара. Чтобы определить
активность, необходимо измерить давление пара компонента не менее
двух раз: над исследуемым расплавом и над расплавом, принятым a
стандартное состояние. Если таковым служит чистый компонент, то тре.
буемое значение p можно принять по справочным данным. Вычисление
.активности ПРОИЗВОДIIТСЯ в этом случае непосредственно по формуле
(25). Если стандартным состоянием служит 1 О/о ный идеальный разбав-
.. ет б u
лСННЫИ раствор, то для определения Pl тре уется по еньшеи мере од-
но значение давления пара компонента над раствором В области дейст-
.вия закона rенри. Обозначив эту величину р; при [10/0 i]., получим
СТ 1 . 1L
Р Р Р i Р i [ oi] *
. === [ %i ] *; p T == i ; ai == fi [%i] == СТ .
Pl. о [%i]* Pi Pi
На практике в этом случае выполняют серию измерений при различ-
Э ст
.ных концентрациях. то повышает точность опреде.пения Pl ' а также
позволяет найти концентрационный интервал, В котором соблюдается за-
кон rенри. Если растворенное вещество в чистом ВИде при температуре
опыта является rазом, то ero активность в расплаве определяют по раст-
воримости, Некоторое отличие этоrо метода от 'предыдущеrо связано с
те!\!, что молекулы rазов, представляющих наибольший интерес (Н 2 , N 2 ,
02) являются двухатомными и при растворении диссоциируют. Связь
u
между давлением rаза и ero концентрациеи выражается при этом квад.
ратичной зависимостью, которая следует И3 уравнения реакции растворе..
ния. Для азота, например, имеем 1/2 N 2 ==[N]; K==fN[% N]/ V PN!. В обл:
сти, rде раствор ос ается разбавленным, f N === 1 If, следовательно:
I%N] == к JI PN. ·
(32)
Зависимость (32), называемая законом Сuвертса, является формой
закона [енри для случая, коrда растворение сопровождается диссоциа
цией молекул на два атома. В растворах азота и BOДOpOД В железе за
кон Сивертса соблюдается практически для всех концентраций (откло
пения можно ожидать только при сверхвысоких давлениях). Если же
экспериментальные значения растворимости азота [Oio N] не связаны ли..
нейной зависимостью с V PN. (как, например, для растворов азота в хро-
ме), то это указывает на отклонение от идеальности. Характеристикой
этоrо отклонения может служить коэффициент активности азота fN
(стандартное состояние: 1 О/о-ный идеальный разбавленный раствор
азота 'В хроме). Для определения fN необходимо построить по экспери-
ментальным данным rраф к зависимости К' == [%NJ/V PN. от [%:N] и
проэкстраполировать полученную кривую на нулевое значение [О/О I J,
rде fN==l, и, следовательно, К' === К. Пример TaKoro rрафИI<а в полулоrа.
рифмических координатах показан на рис. 4. Экстраполяuия опытных
данных к [% N] ==0 дает 19 К== 1,24. При давлении 1 атм имеем 19 fN ==
-=Ig К ........)g К' === 1,24 0,71 ==0,53, I N ==3,4, что соответствует положитеЛL-
ным отклонениям от закона [енри (Сивертса) . Как отмечалось выше, та.
Кой характер отклонений является обычным для систем с относительно
'Сильным взаимодействием компонентов.
Исследованиями установлено, что при растворении азота и тем бо.
27
u
лее водорода в расплавленнои стали, включая леrированную, заметных.
отклонений от закона Сивертса не наблюдается, В связи с ЭТИ'I иноrда
вызывает удивление тот факт, что при расчете растворимости rаза ис-
пользуют значения коэффициентов активности fN и ' н , существенно от-
личающиеся от еДИНИЦЫ. Это объясняется тем, что при вычислении ко-
эффициентов активности rазов JI.
друrих э.пементов во 1ноrОКО:\IПО-
нентных расплавах за стандартное
состояние часто ПРИНИ lают раз-
" u
uавленныи раствор элемента не в
данном расплаве, а в железе. Рас-
четную формулу для определения
,
коэффициента активности f N co
ответствующеrо такому выбору
стандартноrо СОСТОЯНIIЯ, леrко по-
лучить из следующих paccY)I<..1e
ний. Пусть в равновесии с аЗОТО 1
при данном давлении находятся
два расплава: л<е.пезо и сплав.
Очевидно, что активности азота в
обоих расплавах при одинаковом
"
выооре стандартноrо состояния
,
N]pe ==/ Nсплав [О/О N] сплав. Отсюда, УЧllТЫ--
h 4
r lO
J
-JI
0,0
.
, ..... ..... .... ...... - -- ....1; К
"'-
"
'o t1т/ff!
'-
о
'"
z
6
lNJ, %
Рис. 4. К определению коэффициентов
активности азота в хроме по данным
о растворимости при 2018 К [11]
,
дол)кны быть Р авны: fN [ }/ о
Ре (
,
вая, что f NFe ==1, получим:
,
f N == [%N]Fe/[ %NJспп8В'
сплав
В рассмотренном примере, если выбрать за стандартное состояние
1 О/О ный раствор азота в железе, коэффициент аКТИВНОСТII азота в хроме
,
будет равен: /N==O,045/5,2 O,009. Полученное значение HaMHoro меньше
единицы. Это указывает на то, что азот взаимодействует с хромом зна-
чительно сильнее, чем с железом.
Еще один способ определения активности по данным о равновесии
с rазовой фазой это изучение равновесия химической реакции одноrо
из компонентов со специально выбранной смесью rазов. Примером может
служить реакция C T +C0 2 (r)==2CO(r); 'K==p o/(pco! .а с ). Для определе-
ния активности уrлерода в расплаве ас по отношению к rрафиту нужно
подставить в приведенное уравнение найденное из опыта значение p ol
/ Рео. н вычисленную при помощи таблиц константу реакции С Т + CO 2 (r) ==
== 2CO(r). Если требуется определить коэффициент активности yrJ1epo,.1a по
отношению к идеальному разбавленному раствору, .то н \')1(11 О (как 11 в
предыдущем примере с азотом) проэкстраполировать значеhие К' == Pcok
/(Рео. [О/О С]) к нулевой концентрации уrлерода, а затем найти К и вы...
числить fc из соотношения 'е ==К'/К. Несмотря на значительное число
u
известных методик, определение активностеи в расплавах остается дo
вольно сложным. Существенно облеrчает задачу возможность расчета
активности одноrо из компонентов раствора по данным об активности
друrоrо (или друrих) при помощи уравнении rиббса Дюrема. Пример
TaKoro расчета приведен ниже.
28
(33)
I
1.10. РЕАЛЬНЫЕ РАСТВОРЫ
Уравнения, описывающие поведение компонентов в реаль..
v
ных растворах, можно получить из уравнении для идеаль..
v
ных растворов путем замены концентрации соответствую..
щими значениями активностей. Если за основу выбирают
уравнения, выведенные для совершенноrо раствора, то ис..
пользуют активность по отношению к чистому компоненту_
Выражение для химическоrо потенциала принимает в этом
v
случае следующии вид:
f.Ll == Il + RT]n a l == + RT]n 'V l + RT]n X l - (34)
Изменение энерrии rиббса компонента при изотермиче..
ском переходе из стандартноrо состояния в раствор дан..
Horo состава по уравнению i(ж) ==[i](Xl) составляет:
AG i == RT lnai == RT]n 'Vi + RT ]nxi. (35)
Первое слаrаемое в этой сумме представляет собой И3..
быточную энерrию rиббса растворения:
Аоr зб 7= RT ln 'Vi, (36)
которая может быть обусловлена либо теплотой растворе..
ния ( Hi=l=O), либо отклонением в энтропийном члене
(Т s:эб =1= О), либо и тем и друrим. Выражение для интеr..
ральной энерrии rиббса леrко получить из уравнения (35)
с учетом выражения (11):
Аа т == Х 1 AG 1 + Х 2 a2 ::=.: RT (x1ln Ql + x 2 ln а2). (37)
Можно леrко показать, что активность, введенная нами
в уравнения для совершенных растворов формально, сов..
v v
падает с ранее введеннои активностью, определяемои как
отношение давления пара компонента над раствором к дав..
Jlению пара над чистым компонентом Pl/P . Рассмотрим
раствор, находящийся в равновесии с паром. Очевидно, что
v
химическии потенциал компонента в растворе равен при
этом химическому потенциалу компонента в rазовой фазе:
f..ti(ж) == f..ti(r) == f..t (r) + RT ln Pi.
Аналоrичное уравнение можно написать и для стандарт...
Horo состояния: J..t (ж)==f.t2(r)+RТlnр . Вычитая второе
уравнение из первоrо, получим выражение: f.1 i (ж)............ f.L (ж) :=;
==RT ln (Pilp ) ==RT ln Qi, эквивалентное уравнению [34].
Если за основу для описания реальных растворов выби..
рают уравнение, выведенное для бесконечно разбав.пенно...
ro раствора, то используют активность по отношению к
298
1 О/о -ному раствору, сохраняющему свойства разбавленноrо.
Выражение для химическоrо потенциала при этом имеет
v
следующии вид:
"'1 == 'Ф + RT In a === 'Ф + RT In f l + RT In C l . (38)
Изменение энерrии rиббса при переходе 1 моля компо-
lIента из стандартноrо 1 О/о -Horo раствора в раствор с дан-
ной концентрацией по уравнению [i](l%) ==[i](c.) составляет:
I
t!Gi RT ln a RT ln fi+RT lп Ci.
Отметим, что введение активностей это удобная по-
становка, но еще не решение задачи об описании термоди-
намических свойств реальных растворов. Активности или
коэффициенты активности, как правило, приходится нахо-
дить из опыта. Однако, определив их по данным о каком-
.либо одном свойстве раствора, можно далее рассчитать
ряд друrих ero свойств. Так, измерив парциальное давле..
ние пара компонента над раствором, можно рассчитать ero
равновесные концентрации в различных химических реак-
циях. Определив концентрационную зависимость активно-
сти одноrо компонента рас-
твора, можно при помощи
уравнения rиббса Дюrе-
ма определить то же для
друrоrо компонента. Если
определить два значения ак-
тивности при различных тем-
пературах, то по ним можно
оценить теплоту растворе..
lIИЯ вещества. Измерив теп-
лоту растворения (при по-
мощи калориметра), можно
по одному значению актив-
ности рассчитать ее величи-
u
ну при друrои температуре.
Это уменьшает число опы-
тов, необходимое для полу...
v
чения достаточно полнои
информации об изучаемой
системе. Приведем два при-
мера, показываIощие, как
мо}кно использовать данные об активности компонента в
расплаве для получения дополнительной информации
Прu.мер 1. В работе [12] были экспериментально определены коэф
фициенты активности железа в расплавах с различным содержанием yr
лерода. Эти данные (в сочетании с известной растворимостью уrлерода
,X F' е
.)'с
j2
:1О -
,8
z
б
4
1')
.L
.0
f412
o.08
\ 'J
o,o о
zgfre
,
Рис. "5. rрафическое интеrрирование
уравнения rиббса Дюrема для оп
ределения '\' С (при 1873 К) по данным
о концентрационной зависимости '\' Fe
:30
в железе) были использованы авторами для расчета коэффициентов aK -
ТJlВНОСТИ BToporo компонента уrлерода. Уд бная для таких расчетов
форма уравнения rиббса Дюrема может быть получена из выражениЯ'
[13], если в качестве парциальной характеристики gi взять АG Зб ===
==RTlnVi. В реЗУJlьтате такой подстановки' получим выражение"
xFedln"pe+xcdln,\,c ==0, которое после интеrрирования от x (мольной
доли насыщения) до х С дает следующую формулу:
"Ре
· .f Х х Р с е
Ig 'Ус == Ig 'Ус dlg'Y Fe.
(39)'
.
"Ре
Необходимое для расчетов значение коэффициента активности уrле
.
рода в насыщенном растворе V С можно найти по известной величине'
.
растворимости уrлерода в железе, которая при 1873 К составляет ХС ==
==0,21 (5,4 о/о). Учитывая, что в состоянии насыщения a ==1' X == 1 (как:
. .
у чистоrо rрафита), получим '\' с == l/х с ==4,76. Вычисление входящеrо в'
формулу интеrрала удобно производить rрафическим методом, который.
иллюстрируется рис. 5. На рис. 5 показана в соответствующих координа -
тах часть экспериментальных данных для высоких концентраций уrле
рода. Две заштрихованные площади соответствуют двум значениям ин...
"Ре
J ХРе
теrрала · d 19 'VFe
Хс
.
"Fe
. / .
точками 1 и 2). Пунктиром показано отношение XFe Хс (в насыщенном'
растворе) 81. Построить на одном rрафике всю кривую без ущерба для
точности расчетов трудно (требуется rрафик очень большоrо размера).
В области малых концентраций уrлерода использование TaKoro rрафика.
затрудняется еще и тем, что при хс--+о кривая уходит в бесконечность..
Для ее построения требуется очень высокая точность исходных экспери--
ментальных данных, которая не всеrда может быть достиrнута, поэтому.
в диапазоне малых ХС для определения коэффиnиентов активности про
ще воспользоваться экстраполяцией полученной концентрационной за
висимости активности уrлерода к нулю. Исходные данные и результаты
расчета коэффициентов активности уrлерода описанным методом пред.-
ставлены в табл. 2.
(для растворов, которые характеризуются,
*1 Положение точки О, соответствующей насыщенному раствору,.
определено здесь (как по видимому, и в работе [12]) путем rрафической
экстраполяции кривой до пересечения с пунктирной rОРИЗ0нталью. J{ля
более точных расчетов рекомендуется [222] экстраполировать KOHцeHT
рационную зависимость не 19 VPe' а величины Ig VPe/(1 XFe)2, I{OTO-
рая значительно меньше зависит от концентрации. В рассмотренном
.
примере такая экстраполяция дает для точки О 19 УРе == O,128 (вместо:
O,113).
31'
I а б л и ц а 2. Коэффициенты активности уrлерода в расплавах Fe C
при 1873 К, определенные при помощи уравнения rиббса Дюrема [12]
-- xFe/xC 19VFe 19 "С "С ас
ХС xFe
,
.
, 0.005 0,995 199 О ........
0,0138 0,986 71 o ,003 .......0' 172 0,673 0,0093
0,0270 0,973 36 o , 004 o, 112 0,772 0,0208
О, 0500 0,950 19 .......0 , 006 .......0'012 0,914 0,0486
0,0708 0,929 13, 1 0,012 0,088 1 ,225 0,0867
:0,0920 0,908 9,9 O,019 О, 178 1 , 506 О, 1385
О, 1340 0,866 6,47 ........0 , 044 0,358 2,28 0,306
:0, 1565 0,843 5,4 .......0'069 0,458 2,87 0,452
:0, 1590 0,841 5,3 0,067 0,478 3,00 0,417
. О, 1830 0,817 4,47 o, 086 0,568 3,76 0,677
"0,210 0,79 3,76 ....... 0,678 4,76 1,0
Пример 2. Определим теплоту растворения кремния в железе по двум
известным значениям t коэффициента активности "S1 (17000С) == 0,00162;
'\' (14200С) == 0,00049 [2]. Выражение, необходимое для TaKoro расчета,
.можно получить из уравнения /)"Gi==RTlnai==/!Hi TI1Si, если принять,
что в заданном интервале температур I1Hi и /)"Si можно считать не за-
=ВИСЯЩИМИ от Т. Решая уравнение, получим:
Iп Qi == [I1H i /(RT)] ....... (t1S i /R) , (40)
.ИЛИ
ln ai(T J ) ln a i (T 1 ) == ln 1'i(T 2 ) .......ln 1'i(T 1 ) ==
== (t1H i / R) r (1 /Т 2) ....... (1 /Т 1)] · (41)
Наряду с выражением (41) для определения /!Hi можно воспользо-
:.ваться И дифференциальным уравнением:
d ln ai d ln 1', t1H i
dT dT == RT . ' (42)
которое является результатом дифференцирования выражения (40).
.Чтобы найти среднее (для заданноrо температурноrо интервала) значе-
ннс а.н i можно заменить производную отношением конечных прираще.
u
rнии:
( d 19 1' ) == I1lg,\, ==
dT ер T
....... 2, 79 ....... (....... 3, 31 )
== 0,00186.
1913 ....... 1693
(43)
Подставив найденную величину в уравнение (42), получим
00 2 ( d]g '\' )
6Н SI == 2,303RT cp == 19, 14. 1833 .0, 00186 ==
dT еР
== 120000 Дж.
'32
Знак 00 означает, что величины vr;з и лн';' относятся к области раз
баВ.'Iенных растворов, rде они не зависят от концентрации. Анализ при
веденных уравнений показывает, что в растворах, которые образуются с
выделением тепла (!!Hi<O) и в которых коэффициент активности Vi как
правило, меньше единицы, с повышением температуры ai и "i увеличива
ются. Наблюдаемые в таких растворах отрицательные отклонения от за.
кона Рауля с повышением температуры уменьшаются. В растворах, rде
I1H i > О и V i > 1, активность и коэффициент активности с повышением
температуры уменьшаются, что также приводит к снижению степени от.
клонения от идеальности. Таким образом, при повышении температуры
I'Si' fe
O
0,8
С&I
aSi,a Fe
O
, .'
.'
1St
0.0 1{У}/(
,
1/'13 аО1
J
O/
? '"
"- 0,001
"
П 0,2. f7,4 (1;5 0,8 Х fe О 0,2. 0,4 0,6 0,8 Х Fe
Рис. 6. Зависимость активностей и коэффициентов активностеi\ 8 расплавах
Fe Si от температуры [2]
все растворы приближаются к совершенным. Это обусловлено тем, что
v
упорядочивающая роль энерrии межчастичноrо взаимодеиствия в раство..
ре по отношению к разупорядочивающему действию TeMnepaTypHoro фак
тора с повышением температуры уменьшается. Сказанное иллюстрирует
рис. 6. .
1.11. ПЕРЕХОД ОТ одноrо
СТ AHAAPTHOrO СОСТОЯНИЯ к APyrOMY
в термодинамических расчетах часто возникает необходи
мость перехода от одноrо стандартноrо состояния к друrо
МУ. Например, для определения энерrии rиббса реакции
окисления кремния, paCTBopeHHoro в железе [Si](l%) + 02(r) ===
== Si0 2 (r), требуется из табличноrо значения стандартной
энерrии rиббса реакции чистоrо кремния с кислородом
Si(ж)+О2(r)===SiО 2 (r) вычесть свободную энерrию перехода
Si(ж) ==[Si](l%).
Для вывода расчетной формулы рассмотрим идеальный
З 675 33
разбавленный раствор компонента А в растворителе В. Хи
мический потенциал компонента А в этом растворе можно
выразить двумя способами. Если за стандартное состояние
принять чистый компонент А, то по уравнению (34),
учитывая, что в разбавленном растворе УА ==УА, получим:
....A==.... +RT In(YAxA). Если за стандартное состояние при
пять 1 О/О ..ный разбавленный раствор, то соrласно выраже..
пию (38) с учетом Toro, что в рассматриваемом растворе
fA==l, можно записать: ....А=='Ф +RТlПсА. При выборе в
обоих случаях одноrо и Toro же начальноrо уровня отсчета
энерrии величина J.tA не зависит от способа ее выражения.
Приравнивая правые части полученных уравнений и учи..
тывая, что соrласно выражению (6) в разбавленном рас..
творе XA==(cA.M B )!(M A 8 100), найдем искомое изменение
энерrии rиббса при переходе компонента А из одноrо стан..
дартноrо состояния в друrое А ж ===[А](I%):
о о (1'А ХА) ( 1'А.МВ )
L\G == 'ФА }A.A == RT ln СА == RT ln М А .100 . (44)
Некоторые друrие случаи перехода из одноrо стандартноrо
состояния в друrое (от жидкоrо компонента к твердому И 1]И
rазу) рассмотрены в разделе 1.16.
1.12. РЕrУЛЯРНЫЕ РАСТВОРЫ
Понятие реrулярноrо раствора было впервые введено в
1929 r. rильдебрандом. в предложенной им модели откло..
пение раствора от совершенноrо, т. е. появление избыточной
энерrии rиббса обусловлено только энтальпийным членом:
L\G: б == L\H m ; L\<J;зб == L\H i (45)
Из выражения (45) с учетом уравнения (36) можно вы..
вести важное для практических расчетов соотношение:
H; == RT In Yi, (46)
которое позволяет оценить температурную зависимость !{о..
эффициента активности, если известно хотя бы одно ero
значение. Принимая, что ДН i не зависит от температурыI' ИЗ
выражения (46) можно получить, например:
lп '\'1(T) == (1873/r) In '\'1(1873) · (47)
Предполаrается, что энтропийная составляющая энер..
rии rиббса в реrулярном растворе такая же, как в совер..
теином, и может быть рассчитана, исходя из допущения о
34
по т]ной хаотичности в расположении атомов. Результаты
расчета выражаются уравнениями (17) и (18). Таким обра
ЗОМ, энерrия rиббса в реrулярном растворе определяется
следующими выражениями:
aт === Hт + RT x,ln Xi; (48)
a, == dH i + RT In Xi. (49)
Термин «реrулярные растворы» не связан с существом
рассмотренной модели и был введен rильдебрандом для
обозначения семейства растворов, в которых, как показал
u
эксперимент, сопределеннои реrулярностью изменялось
одно из свойств (растворимость йода или серы). Оказалось,
что предложенная модель удовлетворительно описывает
свойства таких растворов. В результате модель тоже полу-
ЧИ.па название реrулярноrо раствора. Допущение о хаотич
u
ности расположения атомов при определенном взаимодеи-
ствии между ними является rлавным противоречием моде-
ли реrулярноrо раствора, оrраничивающим область ее
применения. Очевидно, что наилучшие результаты модель
реrулярных растворов может дать для систем с относитель
но слабым взаимодействием. В таких системах величина
дН, характеризующая тенденцию к упорядочению (к опре-
деленной rруппировке атомов), должна быть не больше
(или не HaMlIoro больше), чем энерrия тепловоrо движения
атомов RT, определяющая тенденцию кразупорядочению.
С повышением температуры область возможноrо примене-
ния теории реrулярных растворов (ТРР) увеличивается.
Ряд полезных соотношений теории реrулярных раство-
ров может быть получен из статистическоrо анализа моде-
u
ЛИ, предполаrающеи хаотическое расположение атомов по
u u
узлам некоторои решетки, существование которои допус-
кается как в твердом теле, так и в жидкости. Одним из ре-
зультатов TaKoro анализа [1] является следующее выраже
ние для избыточной энерrии rиббса образования одноrо
моля реrулярноrо раствора из чистых компонентов 1 и 2:
лан,;:б == ЛИ m == (Л/2) Р 1 2 == [( zN А л) /2] Х 1 Х 2 .
(50)
rде z число ближайших соседей каждоrо атома; N A
число Авоrадро; энерrия образования двух связей меж-
ду разноименными атомами: ==2B/ 2 8/ 1 e2 2; P/ 2
Число связей 1 2; при хаотическом расположении атомов
р 1 2===zN AXtX2.
Из уравнения (50) видно, что отклонение раствора от
идеальности (знак G б) определяется знаком величи-
3 :
35
ны . При 8==0 dG: б и dH т обращаются в нуль, что со...
ответствует совершенному раствору. Для этоrо не обяза..
тельно, чтобы энерrии связи между всеми атомами в рас..
творе были одинаковыми. Достаточно, если El 2 будет
средним арифметическим энерrией 8/......../ и BJ.....2. Если энер-
rия связи разнородных атомов больше (по абсолютной ве..
личине), чем полусумма энерrий связи атомов одноrо сорта,
то L1<O и, следовательно, Hт<O, Т. е. раствор образуется
с выделением тепла. Парциальные теплоты растворения при
этом также отрицательны, а отсюда следует, соrласно урав..
нению (46), что в таком растворе '\'1 и '\'2 меньше 1. В про..
тивоположном случае, коrда притяжение разноименных
атомов меньше, чем одноименных ( >O), раствор харак"
теризуется положительными отклонениями от идеальности.
Рассмотрим концентрационную зависимость величины
Hт, следующую из уравнения (50). Величну zN A d/2, не
зависящую от состава, обозначим Q (энерzия смешения).
Подставляя, получим: .
&Н т == Q X 1 X 2, (51)
что соответствует параболе с экстремумом 'в точке Xl ===
==Х2===О,5. Экстремальное значение dHm в этой точке рав"
НО 1/4Q. ДЛЯ определения парциальных энтальпий компо..
нентов Hl и dH2 необходимо продифференцировать урав..
нение (51), переписав ero для раствора, содержащеrо nl + n2
молей компонентов, следующим образом:
dH == Hт (nl + п 2 ) == g [(n 1 n 2 )/(n 1 + n 2 )]. (52)
Отсюда получим
2
Hl == д (АН) == g 1z2 == gx == g (1 X 1 )2,
дпl (пl + п2)2
д( H) r\ 2 r\ ( ) 2
dH 2 == == 'Xl === , 1 Х2 .
дn2
Как видно из уравнений (53) и (54), энерrия смешения
Q равна предельному значению Hl (при Xi---+-O). Учитывая
связь между теплотой растворения и коэффициентом актив..
ности по уравнению (46), можно получить следующее, вы..
ражение для зависимости коэффициентов активности ОТ
концентрации:
(53)
(54)
10 1'1 == (Q/ RT) (1 х 1 )2;
101'2 Q/RT)(l х 2 )2.
(55)
(56)
З(;
Из уравнений (55) и (56) следует, что при X2 O коэф-
фициент 1'2 стремится к 1'';==еОЩТ, а '\'1--+1. Таким образом,
в теории реrулярных растворов возможно только прибли..
женное выполнение законов rенри (V2===const) иРауля
(1'1 == 1) в области малых значений Х2, отличных от нуля.
Для иллюстрации расчетных возможностей теории ре-
rулярНЫХ растворов перепишем уравнение (48), (49) для
энерrии rиббса с учетом выражений (51) (54) дЛЯ H_
В результате получаем (для бинарноrо раствора):
Oп" == Qxl Х 2 + RT (Х 1 ]п Х 1 + Х 2 ln Х 2 ); (57)
Ol == Q(1 Xl)2 + RTlnx 1 ; 02 == Q(l X2)2 +
+ RT In Х 2 - (58)
Как видно из уравнений (57), (58) все основные термо-
динамические характеРИСТIIКИ реrулярноrо раствора, вклю-
чая температурную и концентрационную зависимость ак-
тивности, MorYT быть рассчитаны, если известен один пара-
метр энерrия смешения Q. Величину Q, принимаемую 8
u u
простеишем случае не зависящеи от температуры и концен-
трации, мо}кно рассчитать по данным ОДНОТо эксперимента.
Такой расчет может быть выполнеI-I при помощи уравнений
(53), (54) по извеСТI-IОЙ величине i1H i или по уравнениям
(55), (56), если известно одно значение I{оэффициента ак"
тивности "(; (при заданных концентрации и температуре).
Отметим для сравнения, что в теории идеальных разбав-
ленных растворов для вычисления a как функции темпе-
ратуры требуется не менее двух значений "(i при разных Т
( см. с. 21).
Таким образом, теория реrулярных растворов предо-
ставляет довольно широкие возможности для расчета Tep
модинамических характеристик. Однако довольно оrрани
чен Kpyr расплавов, которые MorYT быть описаны этой тео-
u u
риеи с удовлетворительнои степенью точносrи 11 в широком
интервале температур и концентраций. На практике эти
уравнения часто используют в качестве интерполяционных
формул в оrраниченном интервале температур или KOHцeH
траций. При этом величину Q подбирают таким образом
(например при помощи метода наименьших квадратов),
чтобы уравнения соответствовали всей данной совокупно-
сти экспериментальных значений. Далекая экстраполяция
найденных таким способом зависимостей в область пене...
u
следованных температур и концентрации, как правило, не..
допустима. Тем не менее во мноrих случаях теория pery-
лярных растворов может быть использована для обработки
37
экспериментальных данных и практических расчетов. Наи--
лучшие результаты эта теория дает при высоких темпера-
турах и в применении к системам с относительно слабым
взаимодействием (с малым различием свойств I<омпонентов) .
Приведем в качестве примера результаты расчетов, вы..
полненных при помощи формул теории реrулярных раство"
ров для системы Pe Cи. В качестве исходной величины в
этом расчете использован f коэффициент активности
'\' U(1823K) === 1 0,1, полученный в работе [5], что соответству"
ет Q==RT ln ",00===35060 Дж. Большие значения коэффи-
циента активности и энерrии смешения (более чем 2RT)
указывают на то, что система Fe Cu, CTporo rоворя, не
может быть отнесена к системам со слабым взаимодействи..
ем. Исходя из этоrо, можно априори сказать, что в данном
случае при использовании модели реrулярноrо раствора
нельзя ОЖliдать хорошеrо соrласия с экспериментом. По..
смотрим тем не менее, что эта модель может дать. Резуль-
таты расчета приведены в таб ТI. 3 и на рис. 7. Для удобства
т а б .11 И Ц а '3. Пример расчета термодинамических характеристик
раствора Fe Cu при 1823 К при ПОМОЩИ теории реrулярных растворов.
+ .а
::J
U ..Q :Е
--....
с о :Е . ..
..... :Е c::t: Е .. .. CN C\I ,
........ (/) С1 CN ,......., "......
:S :Е . ,......., ,......., :S Q)
r::! <J ::J Q) U (J..
f.... U tL. )ot
xCu %Fe ....... )t I )ot I I
.. I I
f........... :S ..... .....
а:: u Е ...... ..... ........ '--'
........ ........ al al
1 )о( ).( :х:: ..Q а ..Q а ..Q
11 с: CI 1 I1 а 11 а
..... 11
е (1) :S:e Q):E 11 1I
CI') tI.. е e u........ tI.......... :S Q)
<J :t: с.:> :t: :Е :t: :Е u (J..
Е--. + <J <Jc::t: <зt:::{ <зt:::{ р.
о 1,0 О О О 35060 О 10, 1 1,0
О, 1 0,9 4940 3160 1780 28370 335 6,5 1,03
0,2 0,8 7615 5610 2010 22425 1425 4,4 1 , 1
0,3 0,7 9290 7360 1925 17195 3138 3, 1 1,2
0,4 0,6 10210 8410 1800 12635 5605 2,3 1,45
О,5 0,5 10500 8790 ........1715 8785 8785 1,8 1,8
.0,6 0,4 10210 8410 1800 5605 12635 1,45 2,3
0,7 0,3 9290 7360 1925 3138 17195 ' 1,2 3, 1
0,8 0,2 7615 5610 2010 1425 22425 1 , 1 4,4
. 0,9 0,1 4940 3160 1780 335 28370 1,03 6,.5
.1,0 О О О О О 35060 1 ,О 10, 1
· 'Исходные данные: vёu (1823 К) --10,1 [5], следовательно а..АНёи
-с=RТlпV сu ==35060 Дж/моль.
-38
сопоставления с экспериментальными данными, относящи..
мися к 1823 К, расчет выполнен для той же температуры.
Как видно из рис. 7, расхождения между эксперименталь..
нЫМИ и расчетными значениями некоторых характеристик
Ucu
........ -----
......,... ,
. .... \
\\
....\
.'.\
1
00
I'c u 10,1
0,8
,, ---
,
,
" =1 "-
6Cu
u.б
1
Ц
2
о
2 0,4. 0,6 0,8 Х fe
10
1\..;
.
5
...
(J
. ...
'q
.... о
'J
2 5
,
о
0,2
0,*
о,в Х fe
0,6
.
.
I'i
10
8
б
ч
2
о
0,2 0,4 0,6 8 Х Fe
с:::)
'lO
10 :i:.:
Рис. 7. Термодинамические
характеристики расплавов
Fe Cu при 1823 К (сплош
ные линии эксперимен-
тальные данные [5], пуик
тирные результаты расче-
та ПО теории рсrулярных
растворов, точечные ре-
зультаты расчета ПО квази
химической теории)
о
.
не очень велики. Это относится к энтропии, а для концен..
траций <0,2 и >0,8 и к остальным характеристикам.
Для мноrих практических целей полученные расчетные дан..
ные можно считать вполне приемлемыми, несмотря на то,
что модель реrулярноrо раствора была выбрана в данном
случае с явным нарушением установленных rраниц ее при..
мени мости. Вместе с тем в области концентрированных рас..
ТБОрОВ (O,2<.Xi<O,8) заметные отклонения раСЧ ТIIЫХ 311а..
чений dH т от экспериментальных привели к тому, что на
расчетной кривой dG m появились два дополнительных экс"
тремума в точках k и 1. Такая форма кривой Om и соот"
веТСТВУЮlI(ая ей форма расчетной кривой активности аси
39
отвечают расслоению сплава на две неС Iешивающиеся
жидкости. Следующее из расчета расслоение расТВора (не
llаблюдаемое в эксперименте) обуслов..туено не Tel\l, что рас..
чет дает большие отклонения от опытных данных, а свойст"
вами caMoro расплава Fe Cu, который в действите,лыIстии
находится как бы на rрани раССvl0ения. Подтверждением
этоrо являются наблюдаемые в систеl\. е Fe Cu БО..1Jьшие
положительные отклонения от идеальности.
1.13. СУ&РЕrУЛЯРНЫЕ
и КВАЗИРЕrупЯРНЫЕ РАСТВОРЫ
ОТl\1ечая определенную полезность теории реrулярных pac
творов, следует признать, что. большинство реальных сис
тем не может быть описано этой теорией с достаточной точ
ностью и полнотой. Проведенный в работе [13] ана..
лиз имеющихся экспериментальных данных о 175
бинарных металлических системах показал, что только во..
u
семь из них можно удовлетворительно описать теориеи ре..
u
rулярных растворов в ее простеишем варианте.
Одно из наиболее часто встречающихся противоречий
заключается в том, что реальные системы характеризуются
обычно пеСИl\'Iметричными зависимостями термодинамиче
ских характеристик от состава, а теория реrулярных рас..
творов предсказывает симметричные I<ривые (см. рис. 7).
Чтобы )7странить это расхождение теории с экспериментом,
в работе [14] был предложен один из усложненных вариан
тов модели, I{ОТОРЫЙ получил название субре2УЛЯРnО20 рас..
Т80ра. Отличие этоrо раствора от реrУЛЯрlIоrо заключается
в том, что ero энерrия смешения Q не является константой,
а изменяется в зависимости от состава и принимает значе..
НIIЯ от Ql == H'; в чистом компоненте 1 дО Q2== H'f в
.компоненте 2. Это можно записать в виде уравнения:
,Q == QIXl + Q2X2 == !!:tH Хl + Hr' Х2.
(59)
ПОДСТdВ.:1ЯЯ выrпжение (59) в уравнение (51), получим:
Н ОО А н ОО 2
Hт == 2 ..tl Х2 + u 1 Хl .t2.
(60)
Для опреде ТIеIlИЯ парциальных теплот растворения БОС--
J10льзуемся формулой (9):
AH i == !!J.H m + (1 хд д (Ыl т ) .
aXi
40
в результате ПО 1]УЧИМ
Hl == H't' + 2Х 1 (!!!Hr; 2 H't') + xi (5 H'f + 4 H ) +
+ 2x (!!Н 2 H'f); (61)
H2 == H + 2Х 2 ( Hf 2 H'f) + x (5dH 4 H ) +
+ 2x ( Hf H ). (62)
Остальные формулы теории субреrулярных бинарных
растворов следует непосредственно из выражений (46)
(49) :
1п "i == Hi/RT; (63)
Oт == Hт + RT (x 1 ln Х 1 + х 2 1n х 2 ); (64)
!!G i == !!Hr + RT]n Xi. (65)
Значения Hт и Hi в этих формулах определяются
выражениями (60) (62).
Как видно из полученных уравнений, усложнение rvtоде..
.НИ привело к тому, что в расчетные формулы входит
теперь не один параметр (как в теории реrулярных раство-
рОВ), а два: Ql === H<;' и Q2== H . Таким образом, павы..
шеи не точности расчетов достиrается в этом случае в ре..
зультате увеличения количества исходной информации об
объекте. Во мноrих случаях это не только приемлемо, но и
необходимо для лучшеrо соrласования расчетных данных
с практическими. Чтобы найти необходимые для расчетов
два параметра Ql и Q2 В случае, коrда неизвестны значе..
ния Hr; и !1Hf, можно воспользоваться любыми двумя
известными характеристиками: '\'1, Hm, ДН i , aт или 6.0;.
Усложнение расчета сводится при этом к необходимости
u
решения системы двух соответствующих линеиных уравне..
ний.типа (60) (65). ·
В некоторых случаях улучшения соrласования теории
с ЭI{спериментом достиrают введением избыточноrо энтро-
лийноrо члена в формулы для реrулярноrо раствора. Oд
ним из вариантов модели TaKoro типа является раствор, в
котором предполаrается линейная зависимость Q от TeM
пературы. Уравнения, вытекающие из этой модели, и ре...
зультаты расчетов приведены в работе [13], в которой по--
u u
казано, что одновременныи учет концентрационном и тем..
u
пераТУрНQИ зависимости энерrии смешения позволяет уве-
личить число систем, удовлетворительно описываемых тео-
рией, с 8 до 70.
Эффективной является модель квазиреrулярноrо рас..
41
ТБора [16]. В этом случае поправка ВВОДИТСЯ как избыточ"
ная энтропия, связанная с теплотой образования раствора
'простым соотношением
I1Н т == 'f I1s;::б , (66)
или
H, == т s зб . (67)
-
С учетом уравнений (2), (36), (51) и (53) выражение
(66) приводит к важным расчетным Фоrмулам:
l1а:: б == I1Н т (1 7) == lli 1 Х 2 ( 1 -); (68)
l1(flзб == RT In '\'i == I1H i (1 7) == Q(l xд2 (1 7)'
(69)
Из выражения (69), как и из уравнения (46) для pery
лярных растворов, можно получить формулу для расчета
температурной зависимости коэффициента активности по
ero значению при одной температуре. При обычном допу..
щеНИII HiT== Hi(f873) имеем:
1 1873 (1' Т) l
nl' == П'У
. l(T) Т (1:....... 1873) l(1873)'
Из сопоставления выражений (47) и 70) видно, что при
очень больших значениях 't' (по сравнению с Т и 1873 К)
формулы теории квазиреrулярноrо раствора (ТКР) и ТРР
эквивалентны.
Как и' для субреrулярных растворов, в формулы (68),
(69) входят два параметра, в данном случае Q и т, для
определения' которых необходимо не менее двух экспери
ментально полученных значений G;::б, G Зб или Vi. Что
бы определить параметры, как и в предыдущем случае, He
обходимо решить систему двух линейных уравнений типа
(68) или (69). Указанное минимально необходимое коли..
чество исходных данных достаточно для выполнения pac
чета, но, как правило, не обеспечивает высокой точности
получаемых результатов. В связи с этим для определения
параметров используют обычно максимально возможное
I<ОТIичество экспериментальных данных. Вычисления при
этом выполняют меТОДО f наименьших квадратов.
Важным моментом теории квазиреrулярных растворов
является то обстоятельство, что параметр т в первом при
ближении можно считать независящим от индивидуальных
свойств компонентов раствора. Ero можно заранее опреде
(70)
.42
лить для широкоrо Kpyra систем по имеющимся данным о
теплотах и энтропиях образования некоторых из них. Фор..
мально 't' представляет собой температуру, при HarpeBe до
которой раствор приобретает свойства идеальноrо. Это сле-
дует из Toro, что при Т==т формулы теории квазиреrуляр-
ных растворов (68), (69) переходят в выражения для со- ,
вершенноrо раствора. Расчеты [16] показали, например,
что корреляция между Hr: и S (ИЗб) В 90 растворах
(жидких и твердых) на основе целоrо ряда р створителей
(Аи, Cd, Zn, Ag, Bi, Си, Hg и др.) при температуре от 293
до 1426 К удовлетворительно характеризуется одним зна-
чением параметра т, равным 3000 К. Далекая экстраполя-
u
ция зависимостеи, полученных на основе модельных пред-
ставлений, обычно не дает хороших результатов, поэтому
трудно предположить, что найденное в работе [16] значе..
lIие параметра 't' может быть с успехом использовано при
температурах сталеварения (1773 1973 К). Большое раз..
lIообразие сплавов, по которым найдено значение т; также
должно сказываться на ero применимости. Расчеты [-15,
208] 'по данным о 19 расплавах на основе железа и никеля
показали, что значение параметра 't для данной более уз..
кой rpYnnbl растворов составляет 7000 К. Это значение
можно использовать для практических расчетов.
В табл. 4 представлены имеющиеся экспериментальные
данные о разбавленных растворах на основе железа и ни-
келя и результаты расчетов, выполненных по уравнениям
для реrулярноrо и кваsиреrулярноrо раствора. При отборе
для табл. 4 экспериментальных значений t1H'r предпочте-
ние отдавали данным, которые получены калориметриче-
ским методом. Значения коэффициентов активности эле.
мен.тов, растворенных в железе, принимали в основном,
соrласно данным [17]. 3l!ачения 'Уcr в никеле принимали
rлавным образом по данным В. В. Аверина (см. табл. 4)
и работы [24]. Значения H';' ' приведенные в табл. 4 (rpa..
фа 4), рассчитывали по формулам (46) и (69) с учетом
't == 7000 К.
Как видно из табл. 4, экспериментальные значения 6.Но;'
удовлетворительно соrласуются с рассчитанными по Teo
рии квазиреrулярных растворов. Результаты, по ученные
по теории реrулярных растворов, значительно хуже соrла..
суются с экспериментальными данными. В связи с ЭТИМ д.пя
вычисления неизвестных значений H! или У7', а также при
составлении уравнений ДЛЯ вычисления Oc;' в системаХ t
43
:с
:с
CU
е;:
са
'"
tW')
о.
><
z
=-=
:s:
iE
о
4,),......,
:!.е
:с.....
:c-...t
....
..
CII:
ж:..:
::.::=
=
=
2
:t;S(\')
,:CU
:s: t;:
:Е Q,)
Q.=
CUo
... =
y
:ВО
.:c
t=
:r
f.J
c.
с.о
." =
=i-
U
ф
:!с.
::с
.а
t;
t-
=
со>
:Е
==
со>
с
CJ
::111::
m
..
* со
QJ 1:(
== о
==
QJ QJ ,.....
S ь: D ?f!.
g.Ш
:>- QJ,..... .....
5 ос
j; 3
Q):S
*
gf ь: t:t
1:; .....
':2 8:( ....
8...
QJ <,:)
<J
,....,
......
'"-J
1I
f4
о
==
tr
.а
2
........
!Е
t::{
..
8......
:r:
<J
.
f-e
u
QJ
O
O)
:s:.
08......
t:
= Q
t :s:
:J' ==
U Q)
со c:r
Q,c;s
:r::
:S т
t >-
f-4
..а о
1:; :r::
rr)
QJ
Q,
..
:s:
:r::
си
с.
2
f-e
()
c;s
Q,
са
f-e
О
Q)
:а
:r::
:r::
=
8:{
QJ
:r::
..а
с:;
f-4
:з::
QJ
со
Q)
t:
u
::(
(7')
(\1
::!
...
.
........
:s: :::с::
...
::( r.....
c;s со
f-e
:з:: "'-"'"
QJ 8......
e
:s: L'I
.в.'"
.в.j:
(r) (.)
g
r'"
...
\о
c'\s
f--4
44
:а
:с......
:З::f-4
Q):r::
c:l.Q)
О::е
O)
t)
tl.
,-......,
,-......, ii:)
= ........(0 :::G' М
Е............. Е..... * 1'- * 1"-- t-.... f...,.
E.....a e.... f...,.
.. ''; ф J C"I е.... ....... Л 00 ........ ..
.. et5' ci f...,. .. u5 ст> f...,. \с" .. (j) .....; V .. (Q
(j) 00 .. (Q со С со....... .. .. Е--.. со ст> С Ф
I 11 I I ФФ I I ОО М I I
co о I ос I I ..e..,.E--.. С\1ф I
goo oo IC o 1C\1 .......01 1 00
I 108+ggg1 googg
=CO I 1 8 I 8=g """' + зgg
....... со....... l ф l ОО + 1 1"--0C\1
со О .......
00..............
I I
o
о
00 о о
00 00 с о
ОФОО O о о о 00
o O о 00 00 O
I"--фф I 00 00 00 I"--
= I , I о I 1 1 ti5 о I l 1 I I::::c;t
....... o o
8 8 1 8 g 55 С> 8 l l 1 880 l l 8 l I 8 g
cu о (j') LC О \t:> CD ..-4 1..0 10 О
c.oo O\D et:) OO со 0<0
cu \t:> I ct) U") 1....... ..-4
ooll
I
.о
cu
Е-.
о
<:t:)
t::S
........
....... ....... (j)
......., tC f'-... .......
0 ..-4
c\t --"'o
I 1 I 8 8 g I I
001..01..0
C\1 <O..-4
I"--f'-...M.......
I I
,-......, ,-......,
м c"t':) ................
1"--1"--1OI"--LC
"'"""'""..-4..............00........
..... ..... ........ ,..,....
....... ....... ... ....
.......0 С> C"I
I V/\OCOC
Е--.Е--.ООООО
....................c-:> OU")O
о ..-4 C"I О
00 ..-4
8111
О ..-4
.....
........
О
.......
.. 1..0
(j) .......
.......
1 C>°1
000,
о c\t со
OOM
C\tt---
<01
I
OtdI 0I:f( ..........
* ......... ....... * C'I
,....... 00 ..-4 1"-- ....... ........ ф
..-4M ....... *
"""' ........"""
(j)Оt-..''''''''C'f'':) ................М
О юООЬО(QО
О о О .. t--- .. .. .. ... ..
.. ... О О ....... 00 о
00 .......
ф I"e
* * *
C'f)C;;I'-t::
.....................
0C\t .........
О ........ М С
.. c"t':) .. ..
O ......
<о
I I
С>
"I:fI
*
.......
1 00C"l
C"I ......,
........ 00
о ..
LCC"I
00
.......
'"'
........
с\1
.01 t.!') "'Т"'I
* аО *....,&... """
bl) ...... ('\J (1) о 1.-4 ::1 (1) ...... . \"IAJ . s::: С
« UUUUUUС'::;--:r::;:::Е:::Е:
....... ,..... ........
"" "- '"'
00 ---- ........
OfC О с\1
Z а..
tN..... N С\1..а "с
Z a.. а..
а>
......t-.. со
.. e.-..
t--м оо C\l1'- ф
..-. .. с\1 .. .. * c\i ..
....... r-- LO .. Ф о'> Е--. ·
f:-........ .. et:)C\I..... M
J I I I 00 I I
.. о I OOO OO
00 О
a>ooO°t--М I °сУ')
1......01.C00 000
Оct:)ОО t-- OO
81 I I I I I
1"-
I
О 000 О
goooo О
00 &3 8
Офt--С"':) Ф
I ...... I 1110 I I
"""" .......... """" """" ..........
""""""""00000..........0
1 00000 1 0
OO'>OC"l<.O tt:)
00""'..... 00 t-- со
M.....1CU':)C\I с.о
I I I I
....... о'>
t.C .....
о'> ..... ...... t--
..... --." 00 ..
........ o C\lI1:) =..
...... .....
000...... 1 О
00000 О
0.....00 et:)
et:)oog C\I
II..... 1
I
,.......
,......,
..... о'>
C\I .....
........ .......
1 00
00
00et:)
Фа
с\1 00
I I
........ .......
t--,......,................,......,r- C\I
.....ооt--t--о,> ф......
......C\I..........C\lt--*C\I
1 М...... ............ .............. 00 ........
1.CI'-I"-I'-......C"I
О ..... М C\I ..... О .. .....
О ..00 ... ..00
.. C\I .. .. о ..... ...
о 00 О
.......
"'"
........
сп
U5й5Ё=:::» N
..с
::s
1
.о
(о...
::t
Q)
Е-.
с;..)
t::S
Q..
----. tt:)
Lt') ф....... c'f':)
fD ..... со ........ * ....... е fD
* .. * м м * .., ф *
ОО фt--М """11:) E--. .....
"1С --." .... 00 со о'> ......00 .....
.. Е--. м ..... 0'>" .. с\1 10 ..... Е--. .. 00
IЗФС"':) I М I C\I C\I М C\I""' +
О 1 r-: I I I 1.С 1 .... C\I..... 1 tC 1"- <о
oo ggogo+o I+ I ' 81
m 00 1 0 1+8g g8..... + 8
..... ..... ......, c'f':) 00 о со о ("f') 10 ..... t-- О ас
.....00 ' ..... C\I.......... o ..... O.....OC\l
I ..... О I J ..... о ('f') t-- C\I ..... 55 I <о
I ; I C\I I CD I 1 1
......
I
о о с>
О 00011:) О
ФФО О
1"- OOC\l'C\I О 00
1 I III .! i I I с I I I I I з 11 I
.......... ..............................Oo.................................................................................................... ..........
g I 1 g88 I I 10 I 1 I I I g 18 I
о'> ООФC\lф О .....
00 I'-""' 00 00
I I
,......, ......... ,......, ........ ,......,
U':)C\I....... .......LOC\I о'>
.....C\l1.C фl"-.....М.............
........... .....C\lC\I.....................
с....... ......................оМо
8 0° 1 0000......0
..... O OOO OM
мО О oot-.C\lОООс.о
1С О ..... ('f')I.CC\lC\I..........
..... ..........C'f':).....OC\l
I I 1 1 I C\I I
....... ........ ......
ф ........t.O ....... Ф Lt') t-.
,......,..... ......ф......................
М ....... М ........... ............С\1
Mo......oC'1 oo.......
1 ........000............00 8
OMOMOOI.t,)
o tOC\lOOet:).....1O
OM.....1.C.....t--C\lО.....
ф...........C\lО..........C\i<.О
с.о I I 1 C\I...... 1 I I
........
Q со
* ф 5''''''''' C\I : *
l.О*et:) фС\1...... .ф
М ...... * ......tn с\1 I 8:
оооС\1 ф.....I.CО 00
8 8 et:) ёD .. с\1 et:) О О"
.. .. .. .. О .. .... О .....
0000 С\100 ..
О
со
«-
I !::: I
о
о
..
О
........ ф....
*......
фС\1 :b
J * ...... I ...... I.t)
<.000 80
..с.о о"
C\I" .. О
..... О
"""" "....... '"' ,....,
"'" "'" "'" "'" "'"
.......... ...................... ......... ........
C\I c:"'I iN C.:I
.. .. 1.0 aQ ::r: z о Q.. I.Q сп
* 04 * * * с'1 с:: С'1.с C'\I C\J,.... * C\I *
"'" Q) Q).......... 'фо-4 .......... .......... ................ ............... s:::
< UUUU C Z cп
45
...
с)
tt)
()
46
.
1;"""
;
:::.
I::t
IQ ....... ....
в... '1(04
e,:, tJ
Q) <J =
о D:
:s = ...
m
:; о-
Q) ==
i са
Q)
Q.
.с
.......
.
('1)0
:S:'"
.
88...
со g
t =
&:JI =
U cu
(о D'
с.со
:zs =
=
.а о
=
cr) ...
aJ U
c.
.
8...
::х:
<3
а:
=
:z:
8-
2
...
U
(о
Q.
(Q
ё
...
31
=
.а
ф
i
1-
I:(
QI
t:
u
.
8Q
Е
'"
,....
со
IЮ
....
t 8.......
., р....
=
iC:
.в. е
o
=
08
....
=
c.QI
i
t
.
'g.,.
* f..,. ·
f..,.LC е-..
00et:) c.c1O
..00 "1.0 ..
<.о ..О') ..о
C\lo,)..... C\I
I I I ' 1
000 о
00000
-.::ttl"-OOO.....
фet:)et:)C\lС'1
ooooc>
................1t)
1 I I I I
88
0)0 ф
1"- 10 .....
.....0) C"I
I I I I I
........ ........... ........... ........... ........
I I
.....1
I
.....
с.с
.....
I
............. ....................
ф1t)фООО')
...... .... ..... ..... .....
....... ...... ......
880 8
I"- o"'"
(j) ('t) C"I
OOOOO
..... ..... ..... 10 C"I
I I I I I
......
..,0. с.о
.. c'f.)
Фа'" .....
ОО.......С":)
C>C>.....
00.....0
000 ..
.. .. ..
0000 ..
о
10 аС
.
с'а ..... * ....
f--t>>сN
D;IQ
1;
r::{C)
:а
. =
...... ....
:s.....
...
.....:s:
n 1:;
Q.
..с
O
1If
r-...o
00...
.....=
I QJ
f.....:S
....... Q)
е::
..a(r)
...
UD::
0=
=
t:tQ)
=1:;
;Е=
D::I:;
E::
...
и><
==rJ
tJ'...
О
...t:;
==Е::
!ЕС)
>-...
30
..
10=
0=
('I)Q.)
r:{
"'4>
==
U
aJ=
r::t:8;
OrJ
Q.ca
4)0
t:;:f')
I....a
t::
4)0
5
0=
о.
..:=
са::с
OD::
"'0
=...
4)С,)
)10
4)и
t;
0)>-
><0
4>=
u...
=0.
o:
8;1::{
I::{;
...
:SU
Q)
=>-
=:2
0:0
01--
"'0)
u
8
)1><
:s:a
==
... = D::
О. =
r:{ tc
1::{ . 4>
tc 0:...... t:r
:s:......
... = ::с
U Q) (у)
I::{Q)
... CV", '"
· са О ·
:I:
Q.ca
t:c.
.......
....
с
f.....
+
8...
р-
е
....
f.....
Q:'
n
8...
с)
<3
tt')
=
:2!
=
Q)
8;
Q)
r:{
Q)
со
С
о
..а
...
:zs
о
:а
:z:
:z:
са
1::{
::I!
CV
:1:
::с
== IQ
р" О
С t")
,.Q
8.... е::
р- g
v
:s:
n
......
...с
........
....
).t
с)
1::{
s..
......
D::
:=
::с
Q)
со
:а
=
1..
О
:!
><
с.
>-
...
р,.
Q)
t:
:Е
Q)
...
><
==
L..
>.
с.
1::{
8 .... == и
:х:
<J
=
>. t; :<
:с t'O :s
= са ::с
tr' О се
:S: = D::
с:; ... 1:;
с) >.
>. L..
U Q)
. ... р"
>: О ==
са (f)
... 4>
О :2! =
::с
са :с
р,. :5::
-=t :s::
>< с.
= Q) О
= :S:: Q)
!2 ...
>. ... :2
=
... :5:: cv
v t; :5::
. ... v =
at) ж ш :
4) ... .0
! g
с. U :s: а
'" са :.:: t::
= U
>< Q) g; =
:а :д с. ()
:r: се ...
= :с 4)
Q) :18...
:f Q) p-
са = о
== Ё. 1:; :s
со t: со о:
r::: :.с ==
.
.. 8"':i
8... ;:- о
с) ('1) =
<J == ('1)
8; 'с)
== о :Е
:&5
:r::
...
v
aI
са
t")
==
==
...
<J
О 8...:::Е
:& (.:) 2
fi <J ;;
== t'O
са D:: а::
со = ""
('1) :с....... о
aI t:
er
со
=
(f)
с:
О
=
С.
>.
f-o
со
со.
ф
С
:::Е
с)
...
:а
:s ==
:r: а::
= t'O
со =
= I::{:a
е:; f-o
со :I! ==
2 r;
tt') :r:: U
.о ..а са
1; р.
О са
!i;8...
Q):t:
о: <J
=: Q, о
...
:z: U
IQ :'::i
D) ==
о
С с)
== =
8; ::с
(v
::Е
==
:r::
:s:
cl.
r::
v
==
:s:
::с
Q)
r:::
=
са
...
u
О
u
...
о
с>
о
::с
t7'
о
...
са
...
::Е
:s: о 1::{
о. :r:: С)
r:: IQ ::с
о
:r:: ==
и
О :!
IQ
......
'""-
...
D
8Q
.
.
s..
4)
р,.
==
('1')
«s
са
:.::
:5::
:s::
со
О
Q,)
...
со
с.
...
4)
:s
с.
t:
о:
::s::
=
Q)
1;
4)
1:{
о)
о.
t::
О
D::
1;
r:{
:а
а::
со
IQ
О
cf)
..а
8;
О
t:::
U
==
==
t;
:s
о)
:::Е
а>
...
U
==
U
о:
о
=
=
со
r:{
са
. ...
i:<J
U
=:
5,8...
О
IQ
... D::
U =
со
Q.5
о &:t
==
('1)
:::Е
:s
""':'tcO)
O'):r:: :s
с.а :z:
"'-' 1::{ ..а
4) о t::
t::
:::Е о :r::
p.:r:: Q)
о :s
-&... =
:s: с.
о =r
С u
I
IQ
О" w)
0.* ·
О
са
...
........==
\0=
....,.а.
.......0
о)
2'"
:I
:S: С)Ф
:c:S:
CQ:C
со са
с.1Q
>.0
tI)
.. 0.Q
са 'с-=
а::{ 00 о
О с.а r:::
0.0') о) и
. o......:s=
>. о. J;: .. tc
::Е О u ':си
о IQ :S: 4)
:z: , =-= D' ......
,.Q"'" .>'0)
t:; са ..Q U r::: \о
со с:1. ...:s: о.......
... ac:s: U С
= :а о.
:z: t: С) :s:
=: ,.Q c.o:a
о. 1; О r::t ::с :С
ф CQ .:r::ca
t:: 1:{ t -& со са
== Q)8:te-
cr: tl. g. I ..,
U ... О
t ca c
со . <cu
L.. t--: . ....
>CO со := ;.Q
t:: 80004 :Е J;: ::1::
О :r::oU:C
С ':s:c.:=CV
I:{Co.>:D'D'
0).0)
Q.:::E CQ :=
t::: U < D: о t::
... 80 о. t:: i
... о) о)
:S: :Q
:1:
.
......
ф
(J:)
.......
Q)
t:;
>.
:::Е
о.
о
.в.
о '
t::
I
=
О
g,.
О
CQ
...
U
со
со.
><
:zs
==
с.
О:
а:;
>.
а:..
Q)
С.
==
('t)
са
:.:
=
==
о.
о
ф
...
::s
Q)
==
=
со
са
о
tt')
..а
а:;
о
t::
U
==
()
8...
:.t:
<3
Q
==
==
Q)
cr
==
('1')
'0
.. t:::
са О
О ::с
c.
о ...
са :s::
... t7'
и
c.
><
:а1D
==.
Q.
D:.
t::
.
...
ос
е::
о
:.с:
.
:s:
с'з
r:{
I
G>
r:::
Q)
....
са
::с
Q)
:Е
со
:с
(f)
..
(';J
tI'1
о)
r:::
о)
:Е
Q)
IQ
О
=
U
О
=
..
8Q
О
О.
О
C:.Q
...
и
са
р,.
:<
:s
:1:
Q.
D:
е::
>.
L.
Q)
р".
IQ
=0
:s:D.
с. О
O
Q)U
1'4 со
::E
Q)....
:s;.a
====
c.
=0:
08;;
>.
..а""
t:;ф
OQ.
с:с
(.)
:s:ca
IQ
v:IIC
==
:<
са
со
r::
С
U
са
с:.
са
;:=
Q)
1;
4>
...
:s:
t;
u
==
::.::
v
со
I
IQ
О
...
=
4>
:Е
Q)
r:::
(?)
..Q
...
v
О
:z:
IQ
:S:
...
::.::
са
са
...
о
м
со
ПО которым имеются неполные данные, было использовано
уравнение теории квазиреrулярных растворов (69). Из это..
ro можно заключить также, что уравнение (70) лучше про
rнозирует температурную зависимость коэффициентов ак..
тивности, чем выражение (47).
Дальнейшее повышение точности расчетов (применимо-
сти теории для описания реальных систем) может быть
достиrнуто при объединении допущений, принятых в МО-
де&l1ЯХ субреrулярноrо и квззиреrулярноrо растворов.
1.14. КВАЗИХИМИЧЕСКАЯ ТЕОРИЯ
Как уже отмечалось, основное допущение теории реrулярных растворов,
которое заключается в хаотичности расположения частиц, находится в
u
противоречии с тем, что теплота смешения принимается в этан теории
отличной от нуля. В самом деле, если при замене одних связей между
атомами (1 1 и 2 2) на друrие связи (1 2) энерrия системы изменя
стея, естественно предположить, что в растворе будет больше тех свя"
зей, которые энерrетически более выrодны. В квазихимической теории,
разработанной rуrrенхеймом, предполаrается, что число имеЮЩIIХСЯ в
растворе связей каЖдоrо типа обусловлено равновесием реакции
(1.......1) + (2 2) == 2(1 2). (71)
Константу равновесия этой реакции: ==P 1 2)/[pO l)P(2 2)] можно
представить как произведение двух констант Кхаот и Куп соответствую-
щих хаотическому и упорядоченному расположению атомов в растворе.
МОЖНО показать, что Кхаот==4 [1, с. 245], и следовательно, К==4 Куп. Со-
r ласно квазихимической теории, константа Куп по аналоrии с константой
U v
.химическоя реакции определяется энерrиеи упорядочения:
In К УП == (l!1/KT) == (N А l!1/RT) , (72)
ИЛП, учитывая, что Q== 1/2 zN А!1 ,
In К уп == (2Q/zRT). (73)
Формальная аналоrия между уравнением (72) и уравнением изотермьr
химической реакции (3) нашла отражение в термине «квазихимическая
теория растворов». Очевидно, что при Q==O Куп== 1. Все расчетные фор-
мулы должны при этом соответствовать уравнениям для совершенных
растворов. При Q > О К}.п < 1 и, следовательно, К < 4. Это свидетельству..
ет о сдвиrе равновесия реакции (71) влево. При Q < О, наоборот связи
1 2 более энерrетически выrодны равновесие реакции (71) сдвинуто
вправо. Таким образом, квазихимическая теория, учитывающая опред -
лснное упорядочение атомов в растворе, является некоторым уточнением
теории реrулярных растворов. rуrrенхейм называл эти теории соответст..
венно первым и нулевым приближением. Квазихимическую теорию он
именовал также теорией CTporo реrулярных растворов. Вывод основных
уравнений квазихимической теории довольно сложен [38, 39]. Приведем
для краТhОСТИ только конечные результаты, необходимые для практичес-
ких расчетов. Интеrральная теплота образования 1 моля бинарноrо
'"
раствора описывается в квазихимическои теории уравнением:
2
l!1H m == QX 1 Х2. (74)
+l
47
Коэффициент активности компонентов
)кндким вещества 1 имеют следующий вид:
по отношению к ЧИСТЫМ
. { р 1 + 2Xi ' } Z/2
1'1 xi ( + 1) ,
(75)
rде Xi мольные доли компонентов: Q энерrия смешения; z KOOp
динационное число; f3=={1+4xlX2('1)2 1)}1/2, l1==e Q / zRT . Величина 1)
является параметром приведенных уравнений, который должен быть оп
ределен из экспериментальных данных. Этот параметр непосредственно
связан с энерrией смешения и, как будет покаэано ниже, с характери
стиками разбавленных растворов. Соответствующие формулы имеют вид:
l1Н7==Q==zRТIЛll; ,''; ==ll z . Из приведенных формул следует, что в со-
вершенном растворе (при Q==O) 1]== 1 и f3== 1. При бесконечном раэбавле
нии (Xi---+O) также стремится к 1. Координационное число z для жид-
ких растворов, cTporo rоворя, также является параметром теории, по-
скольку кристаллической решетки (в обычном смысле этоrо слова) в
жидкости нет, поэтому величину z иноrда варьируют, добиваясь наилуч-
Шеrо совпадения теоретических и экспериментальных значений (при этом
z может принимать как целые, так и дробные числовые значения). При
ВЫПОJlнении упрощенных расчетов значение z обычно выбирают на осно-
вании данных peHTreHocTpYKTypHoro определения числа ближайших сосе-
дей атома в растворе. Для расплава на основе железа, никеля, и кобаль-
та можно в первом приближении принимать z== 10.
При использовании формулы (75) для вычисления предельноrо значе
ни.я коэффициента активности V'l(B разбавленном растворе) необходимо
иметь в виду, что прямой расчет в этом случае невозможен. Подстанов
ка Xi==O и соответственно == 1 в выражение (75) дает неопределенность
(О/О). Чтобы раскрыть ее, воспользуемся правилом Лопиталя заменим
предел отношения функции пределом отношения их проиэводных. При
этом учтем, что
d === (')2 1)(1 2х.). (76)
d Р 1
В результате получим
Нт {
х .---+0
1
p 1
1 +2Xi
xi ( + 1)
} == 1 im
X. O
l
{3.....1
2
f} (1)2 1)(1 2xi) + 2
2х.
I (1)2 l}(1 2xд+ + I
==Т) 2
и, следовательно, limVi ==" ==1]Ж. Как уже отмечаJIОСЬ, это выражение
x. o
I
очень удобно для определения параметра 1], если известно значение од-
lIoro из предельных коэффициентов активности (rcr). Заметим что IIС-
пользование формулы (75) для расчета Vi при MaJlbIX концентрациях
(xi<0,05) также имеет свои особенности. Вычисления в этом случае
u
следует проводить с повышеннои точностью.
Определив при помощи уравнений (74), (75) значения !!Нт и Vi
MO}l{I10 вычислить по известным фОРМУ.1Jам и остальные характеристики
раствора: ai=='\'iXi; l\Gm==RT(Xllna1+X2)na2); T/1Sm==l\Hт AGm, Для
48
определения парциальных теплот растворения воспользуемся формуло :
d ( Hт)
Ь.Н ; == f1.H m + (1 Xi). (77)
dx.
l
Дифференцируя уравнение (74), с учетом полученноrо ВЫРЗ.>i<сния
дЛЯ df'1/dXi найдем:
d (1Н т ) == п { 1 2Х2 I 2Х 1 Х2 (1)2 1)( 2X 2 l L } .
dxz + 1 т ( + 1)2 (78)
ИЗ ЭТИХ выражений следует, что в разбавленном par:TBope при Х2---+0 (и
соответственно l) теплота растворения H2 стреМIIТСЯ к f1H r; Q. Это
отношение можно использовать для определения параметров теории g
u
и 1), если из эксперимента известно значение однои IIЗ предельных теп-
лот растворения Hi. В табл. 5 приведен пример использования формул
u
квазихимическои теории для расчета термодинамических характеристик
расплавов Fe Cu. В качестве исходной величины, как и в приведенном
выше расчете при помощи теории реrулярных растворов, принято значе-
ние "СU(182ЗК) == 10,1 [5}. Координационное число z принято равным 10.
Результаты расчета приведеllЫ на рис. 7, из KOToporo видно, что полу
ченные данные в цe.ТIoM значительно ближе к экспериментальным, чем
рсзультаты расчета по теории реrулярных растворов (исключение co
ставляет лишь энтропия). Однако достиrнутое уточнение оказалось H(,
достаточным, чтобы полностью ликвидировать переrибы на кривых !!О т
и a. cu , из которых следует ошибочный вывод о расслоении расплава, на
две несмешивающиеся жидкости.
Таким образом, квазихимическая теория является уточнением теории
реrулярных растворов, позволяющим иноrда значительно улучшить co
r ласование между расчетными и экспериментальными данными. Это уточ
нение достиrается практически без введения дополнительных параметров,
так как координационное число z может быть принято для широкоrо
Kpyra расплавов равным 10. Вместе с тем квазихимическая теория не
всеrда обеспечивает удовлетворительное соответствие расчетных значе
IIИЙ экспериментальным. Так же как и теория реrУЛЯРНhlХ растворов, она
Не может описать системы с несимметричными зависимостями термоди
намических характеристик от состава. Для улучшения соответствия Teo
u
рстических и экспериментальных значении в квазихимическую теорию
u .
тоже можно ввести допущения о концентрационнои и температурноя за-
висимости параметра (11 или Q). ДЛЯ этоrо требуются дополнительные
исходные данные (например, второе значение ,, или H, ). Ряд полез
ных формул усложненной квазихимической теории приведен в работах
[13, 40].
1.15. ПАРАМЕТРЫ ВЗАИМОДЕАСТВИЯ
Практическое использование экспериментальных данных
о коэффициентах активности и друrих термодинамических
характеристика.х бинарных расплавов затрудняется тем,
что реальные сплавы одновременно содержат несколько
Примесных или леrирующих элементов. Чтобы учесть вза..
Имяое влияние компонентов раствора на их термодинами..
4 675
49
Т а б л и ц а 5. Пример расчета термодинамических харак еристик
помощи квазихими
АН т . *3 *3 Ай т ,
xCu ХРе ДЖ/МОЛЬ "Ре "'Cu aFe аСи
Дж/моль
......
О 1,0 1,0 О 1 10 1 *2 1 О О
,
О, 1 0,9 1 , 1 3010 1 , 023 5,96 0,921 0,596 1916
0,2 0,8 1,173 5160 1 , 1 3,98 0,88 О" 797 2305
0,3 0,7 1 , 223 6620 1,23 2,88 0,861 0,864 2272
0,4 0,6 1,25 7470 1,43 . 2, 14 0,858 0,857 2335
0,5 0,5 1,26 7760 1,72 1,72 0,859 0,859 2305
0,6 0,4 1,25 7470 2,14 1,43 0,857 0,858 2335
0,7 0,3 1 , 223 6620 2,88 1,23 0,864 0,861 2272
0,8 0,2 1,173 5160 3,98 1 , 1 0,797 0,88 2305
0,9 О, 1 1 , 1 3010 5,96 1 , 023 0,596 О , 921 . 1916
1,0 О 1,0 О 1 О, 1 * 1 О 1 О
п р и м е ч а н и е. Для расчета использовали следующие формулы:
13== V 1 + 4 xCu ХРе (1)1.......1); АН т== 2 nXCu ХРе; "Ре== { ti....... 1+2 xFe } 2/2 :
(3+1 ХРе (j3+1)
. d ( H т> { 1.......2 xCu
+xCu InaCu); ТЛS т == АН т ........ 6а т : ==2 g +
dxCu 1J+1
d (dH т >
==I1H m + (l xCu).
dXCu
*. Исходные данные: 2== 10; v Си (1823К) == 10,1 [5]. Следовательно. '1==
Дж/моль.
*2 О вычислении предельных значений V см. с. 48.
*3 Приведенные значения определены из условия симметрии соответствующих
" ..
'ческие характеристики, пользуются аппаратом парамеТРО8
взаимодействия, который был предложен BarHepOM [41],
а затем развит в работах [16, 42, 43]. Основу метода co
ставляет разложение соответствующей избыточной термо..
динамической функции (ДОi, tJ.H i или ДSi) в ряд Тейлора
'около точки, соответствующей чистому растворителю. Если
u .
за стандартное состояние принять чистыи }{омпонент t, ТО
.для IIзбыточной энерrии rиббса, точнее для ln "(i=== G ЗБIRТ,
получим:
T.p'Xl ).l
n
+
j==2
д ln 1'i
дХj
Xj+
In r i === In "10;'
T,P'Xl 1
1>0
в большинстве случае
требуемая точность позво
ляет оrраничиться членами
ряда нулевой и первой CTe
пени. При этом уравнение
(79) можно представить в
виде: ln '\'2 (Х2; хз; Х4; ...) ==
=== ln Y %1-+1) + In ' + ln [ +
+ ln f +..., который совпа
дает с предложенным Чип
маном [42] выражением:
1'2(%.;х.;%,....) == 1'2(х.;%,==0;х,==0) ' . · ·
Для расчетов повышенной точности (при наличии дo
статочно точных исходных данных) в формулы вводят чле
ны второй степени. Остальными членами ряда пренебреrа
ЮТ. Входящие в уравнение (79) производные (с коэффи"
циентами), взятые при бесконечно малых концентрациях
растворенных элементов (Xl----r 1), называют параметрами
взаимодействия и обозначают соответственно e , P и .k.
С учетом этих обозначений выраJКение (79) преобразуется
следующим образом:
раствора Fe.......Cu при 1823К при
ческой теории*1
1'6S m ,
ДЖ/МОЛЬ
d(AH m ) АНСи'
Дж
dXCu МОЛЬ Cu
..
АН Fe'
Дж
моль Fe
о 35060 35 060 О
4929 25480 25 940 464
7464 17320 19 020 1695
8891 11460 14 650 3180
9807 5607 10 840 5230
10 067 О 7760 7760
9807 5607 5230 1 О 840
8891 11460 3180 14650
7464 17320 1695 19 020
4929 25480 464 25 940
О З5060 О 35 060
ЙFе==VFе xFe: 6G m ==RT (XFe InoFe+
1 xFe xCu (1)' 1) (2 XCи l) }
; АН Cu==
Р (Р+l)1
l/z
("Cu ..1.261 R g"zRТlnТ)==З5060
кривых дпя обоих компонентов (рис. 7).
п
+ +x.
. 2
J==
х
д! ln у,
дx
I
т ,p'%I +1
2
Xj +
n п
+ X
i==2 k==2
i<k
х д ln l' i
дх j дХА
XJXk+...
т 'Р'Х'1.....1
(79)
ппп n
l J 00 + i + i 2 + j,k
n 1', == n 1'i 8l Х} Pl Х} Pi Х} Xk ·
}==2 i==2 1==2 k==2
i<k
4*
(80)
51
Во мноrих случаях удобнее принять за стандартное со..
тояние однопроцентный идеальный разбавленный раствор
компонента i в растворителе 1. При ЭТО I разложение 19 f;===
L\G зб /2,3 RT будет иметь вид:
ппп n
19fi == е:[%л + IrU%jJ2+ I ,{.k[%j)[%k]. (81)
j==2 j==2 j==2 k 2
i<k
хде
ef == д Ig fi
д[ %jJ [%1] ..100
.r == д 2 Jg [; .
I 2 д r % j ] 2 [ % 1 ) 1 СО t
i.k д 2 1gfi I
ri == д[ %j] д[ %k] [%1]--+100'
Свободный член в выражении (81) отсутствует, так Kal{
:в бесконечно разбавленном растворе f't== 1, и, с едователь-
1-10, 19 f;o == о.
Основные соотношения между введенными параметрами
взаимодействия имеют вид [17]:
j l j Mj. М 1 ......... Mj
. Ei == 8j; Ei 230 + ;
М 1 M 1
J М 8. M J 8 М . 82)
е == l ej + l ; (
AJ) 2ЗОМj
230 [ 100M + М. ( М М . ) ] + ( Мl Mj ) 2
p ......... 2 / (" J 1 ]" 2 М r ·
М} 1
(83)
Для определения табличных значений параметров взаи..
модействия используют экспеРИ 1ентальные данные об из..
менении коэффициентов активности элементов в зависимо..
сти от концентрации соответствующих компонентов раство"
ра. Покажем для примера, как определить параметры e r
и r r по данным о влиянии хрома на растворимость азота
в >I{ИДКОМ никеле. Исходные экспериментальные данные
приведены на рис. 8. Поскольку все значения растворимо
сти относятся К одному и тому же давлению, активность
азота во всех расплавах можно считать одинаковой (не за..
висящей от концентрации xpO ta): fN [N] ===const. Отсюда
52
следует
Cr д I g f N I д J g [N I I
eN д [% Cr] [%Cr]==O == д [% Cr] [%Cr]==O ==
-= 0,575 2,824 == 0,112
20 ·
Пара 1етр BToporo порядка, 2,82'1
равный J
1 д tg а I
==28 д[%Сr] [%cr]==O'
Cr I a 2 1g f N
rN .
2 д [%Cr]2 [%Cr]==O 2
,.....,
1 д 2 19 [N[ z
'-....i
== -....-. .
2 д [%Cr) [%Cr]==O I
1
характеризует изменение tg а в
зависимости от [О/О Cr].
Найдем tg а' (в точке, со..
ответствующей 20 О/О Cr) :
tg а' === (0,475 1,209) / (30
.........20) == O,073. В результате
получим:
,f:.{ ==...!... tga' tga O,073 ( 0.112) О 0009
2 [ %Cr] == . 2 .20 ===, 7 ·
Данные работы [17] . о параметрах взаимодействия е{
и , в расплавах на основе железа при 1873 К представле..
lIЫ в табл. 6 8. Для удобства табл. 6 8 воспроизведены
С некоторыми сокращениями, в них не включены некоторые
приведенные в работе [17] значения па раметров для эле..
ментов: Ag, As, Au, Ge, Pd, Pt, Rl1, Sb, Se. Данные о пере..
крестных параметрах r ,k в работе [17] отсутствуют, по..
СI\ОЛЬКУ сведения о них оrраничены и не всеrда достаточно
надежны. Расчет '; при помощи табл. 6 8 (при наличии
в них необходимых пара метров) очень проет. Например, в .
расплаве, содержащем 1,0 О/о С и 1,5 О/О Cr, Ig fc ===e [С] +
+eg r [Cr] r [С]2 + r r[Cr]2 == 0,14.1 +, ( 0,024) .1,5 +
+ 0,0074. 12 + о. 1,52 === 0,1114; f с === 1,29. Для определения
1'с можно воспользоваться формулой (31) и данными
табл. 4. В рассмотренном примере: 1'с == 1' fc ===0,57. 1,29==
====0,74. Однако для мноrих пар элементов табличные зна..
о
10
20
30
[Cr 1,0/0
Рис. 8. Определение парамстроп
взаимодействия по данным о рас-
творимости азота в сплавах Ni
Cr при температуре 1873 К и дав-
пении 1 атм
53
м C'I')
.с со * .......... с"') ..
I .. ф о ..... *
z I I .....
I "--'"
,.. 1"'4 9"4
. * Q') ..... *
00 C"I <.о .. о ,OO t'- t--
Z ..... I
t-- .. .. .. .. о') ..... о .. .. .. ...-4 о') ..
... tC 1"- ..... М C\I I I C"I tr.) Q')
...... I .....
("t') 00 tC t'-
to- 00 ..... ....... м C-I
00 о
.. .. .. .. I .. с") ..
..... с> О О ....... О *' с> О
:s: I ,
с.
с
cu
fW) s:: ..... ..... t:": М t..O C"I
cu :€ I .. I . , .. I .. * .. .. ..
а; ..... о о C\I О с'1 С
cu I I I I I I
!Е
&о
с> О
о') м о ..... о ..... tC ..... ....... C'.J
с :с C"I "I;f4 <D ..... с"':) C"I c"f) C'.J Ф м ..... с.о .....
..... I I I I I I I
.
....... ...
«s о)
:11: tr.) *
1:( ::s ф с.о с"':) о CJ') м 00 00 "I;f4
0= U .. .. .. .. .. .. .. .. .. ..
с. ..... ..... ..... о о ..... C"I C\I О ......
с> .. I I
&:: Ii
.............
f :1
си М C"I CI1 C'I') ...с М
Q с'1 О 00 C'I * О сп * О LQ
.....
са (; .. .. .. .. .. c"f) .. * .. .. ..
с. C'I C'I О ..... О с> ... О М C\I ...... О .....
cu I I I I .. I I I I
&:: с> I
D: ...........
:s: о')
са со с'1 00 с"') ф
.. ..... 00 *
... 8 I I t'- с'1 ..... C'.J
...... .. .. I о
u .. ... I .. о ..
a:s: о о с> ..... О
4u
J:(
Q
:1 .........
:s: t'- t-- C'I t--. t--.
.. .. .. .. ..
fW) u о') о с.с> ф
IQ I I I I I
:в .........
с.
... ..... .... ..... со C"I со ...
4u .. . .. ... .. .. .. *
:1 u о') C'I C'I C'I <.с> с.с> t'- о') ("t') Q') 10 с") <D ...... 00 .......
..... м ..... I I ...... ..... ..... ..... c'f;)
с. I I I
с .
..t О
. 00 * с.с>
со -.::f4 I I м о
.. I.t:) C\I ..... C'I
с") .. I
о')
::f
=
... ... ...
* . *
1.0 М C'.J 00 о ..... tr.) 00
.... о') .. .. ..
< .. .. .. .. ..
r-... ..... C'.J с"':) C'.J М tJ":)
f--t I I I
...
...
=
Q,)
"
Q,)
(g ...... д о .... ::s t: о .с . .... ..с s::
::;: . ....
« со u u u u :r: z z z о а.. VJ (/) fJ)
&4
'1"'4
.... * f'ot с>
* о * C"I О!С
00 tC .. ......
..... c'f') r-.. 1"'-
I I I I .....
&......1
М ::.::'
..
I
t-.
00
r--- .....
О .. =
.....
I с.
. с
,.....
со
о м
. cu
I t:; ..а ..
'" z -.:r е;
се I
...
CJ =
....
.... LC
О с> ::с :3 ..
Q) м <=
..... о') 00 .... u J
... <=
..... \с .. t:;
J I 00 о ....
t:
С о') . ...
t:t .... LC
..
CJ Z о
?Е 1
:.:: ::.::
r={
1-- с.о CI: f-8
-.::r С.
, о .. ==
:::е U о с> cu
(,J I с ::Е
'-"" Q)
м с> (g
'-
C I . с> :"1 О
* ,..... с> .
1с J о') .. м са
LC О ::Е I с.
.. 11
\с ..
со С
1!;) ....
. zz D::
(,J .... .. ::
. . .. u i са
ф t-
(,J 'o:t' (j
......... <:)
..... ... <=> .:
cu I cu
> .. r={
.... 11 ...,. о
... I
1-- :1:
(,J ....
о uZ :s::
:t: ()j c'd
:s: ... ф м
(,J о') .... .. са
:s: <:) (0-4 LC
IЖI О I :!
..
м о С.
U i-
с:: . .
\.t:> о .... .... cu
C'I') c'f':) :з:: Z(0-4 . :&
.....
I I о. . .
8 с.
... ... .
со ..... с
р., х
cu о
.. .
,1:: О ......
.
11 . t-...
м
Q) ........ . r---
Е- U C.D c'\s
. .....
о Q) ...... ::f
.. ..--.. ....... а..
cu . ,
004 ...... ...... ::s::
,.. о>
004
:I: .... t:;
::с ......
...... \о
со ...
r:t ос c'\s
:s 004
::с ..Q f--c
u ::с :з::
............... f-o со :з::
2 со
I:'t &:::t
Q)
о о
..... t: t:
c'i со)
* * *
. 1-4
(--.. fo-4 > N
...
I I t f I I I
со
а.с
t I .. I I I I
с>
I
1'-
I I .. I I
1'- I I
I
-
I I I I I о') I
..
tC
.....
I I .. I I I
(;'1 I
f
I I ...... I I о') I
.. ..
о
CD м
1'- 1'-
I..Q 00 ... .. J .. ..
.. .. * о') с> C\J
с> t-... 00 I f
.....
f"'4 ...
.....
00 со I ..... * C\J
М .. .. C'I I
.. I
с>
Ltj о') ('I'"'J CD
со 1'- c'f':) 00 I..Q
.. I .. I .. .. ..
с> с> с> с> с>
I
м
I I .... I I .. ..
Ltj \с
, I
f"'4
*
О с> I 00 LC
со 00 .. ..
tC> ..... с"':) ...... ..... <.о
I I I I I
C\J
C\J ....
I I .. I о I
..
...... I с>
.
...... C\J О s.... ;:3
U U U U U
....
N
>
....
f...
со
f...
с
с/)
....
с/)
с/)
..а
р..
о
....
z
f-o
:r:
Q)
:Е
cu
;g
<Р:)
55
'"
\с)
:::s
c't:)
о
56
fot
:1:
Q)
:Е
C1.I
....
N
>
....
Е--
(о
f....
с
сп
....
сп
сп
.с
Q.
о
....
z
...
E-t
:z:
Q)
21
Q)
..........
о
111 <011 II tCll
I I I
......."
LC
00 ..... .LC 1'-
I I f I 1 *, о I I
.....
t--- * C
о I I I I 1*1 I
1 1
CD
..LC I
...... ..
I
I 1 I I 1
I I i I 1
I I I 1
... , ",
(J') * о '" 't
..:11 II <.0 1 *11 r-:II ' I 11
I 1 I
.-4
*
11 I I 1
I
C\J
О
I I I а I I
I
('I'"'J
U:II II
о о
......
........C"':)I'-
... ...
...... LC
,
t--<.O
... ......
о .. ..
1 ...... о
t'-
..о
c\t
......
1'- .. 00 ,.,... ... *
I ":' 1 с"':) C .. "' ......'
о 1...... "II:t' (о...... LC
1Q 1'- ('I'"'J 00
00 00 о r--- t-- C'I:) ....
.. .... ....... C\I C\I
C>ii 0111 1
о) c"f':) C'I:)
C\I ......
100' 110' 1....:1
I !
LO 10
..... LC ("fj 00
"':0 1 1 о t--ф";
I I
1'-
('I'"'J с>
о) .... с"':) ......
...... 00 о LC 00
I I I I
...
*
C>cY')1
C\t...... I
1
...
.
00 <О 00
.. ... ..
C\J1O
1 1
<.о LC
.. ...
"II:t' ...... с"':)
I
I I 1
1 I
1 I I
I I
II 11
..... 00 LC
... ...-4 ... .. ф
с\1 ...... М.......
1 I 1 I
10
О
111 о'"
<.о
о) ...... с; 1 1 1
......
1'- СУ') ......
......
I I 1
с> I I
C'I)
cj) * (J')
I CDC\J" 10 1
* .. с...... О ..
...... с> О О 1 с>
I 1
о
I 00 1'- .. 1
..... о') LO
1 1
C'I
*
I I I
1 1
с:: о .с . ,... .... ;::..;:: > . ::.. N 0 .
::r: ::;: z z z о Е: CI) ёI) ci5 ;, r"" ? ....
ЬООО
c-i
U J
]
lc;
.........
;;: J
bI(,О
..
........
. i
z
oc
........... ..
.... с
U
L-.
N ..... 1
......... .
"'" ,.
N ..
::> ,..
.... ..
::J
:>
........... ......
U а;
<:
.
.......
ф
tl)
о '"
......... v':i
.5 J
..
со
tl)
о '"
........ 11)
8 I
.
CJ
.
CJ
-----
о ""':.
""" ..,.
N I
. ...
<u
:s:
Е--
CJ
О
:2
:s:
CJ
:s:
QS
('t')
о
...........
:J I
:r: 00
........ ..
м
Z I
JCS:
О
=
Q.
. --
Е-- С-'> CQ r-..
ro .....
р,. е:; ..............
c;'.5
"''''''
::S E-t ro C'I ....
CIJ E-t
Е-о:.:: ..
:r:
о ;::: с>
* ..., ..
CIJ Q) ..а <=>
:а =:s:!::
:с =::z:: ......
= roro
ro ::r0:; · .
1:{ Q) Q):S: .
==)1= .
О:; ...:s:'->. .
(,) ..... =
foo P.c. . .
Q r::r::o .
Q) ..t:: ·
:Е ::EO · ·
:s: u u &::t: .
... VJ ..
* * * .
.8
.....
.... .
........ .........
......
lенИЯ e ОТСУТСТВУЮТ. В этом случае не следует исключать
неизвестные парзметры (п-ринимать их равными нулю),
лучше попытаться оценить их сравнительным методом,
ПОаТIЬЗУЯСЬ значениями парамеТРОБ для элементов аналоrов
(БIl1И}I<ЗЙШИХ соседей i или j в Периодической системе эле-
ментов д. И. Менделеева). При значительном различии
атомны,Х масс элементов лучше принимать p BeHCTBO пара..
!Уlетров 8, а не е; пересчет можно выполнить при помощи
формул (82). Расплавы на основе никеля и друrих метал..
лов исследованы значительно хуже, чем на основе железа.
Параметры взаимодействия для них менее надежны, а ча..
сто вообще неизвестны. Некоторые имеющиеся сведения по
расплавам на основе никеля приведены в rл. IV. Иноrда
для расчета коэффициентов активности в сплавах на осно-
ве никеля fОЖНО воспользоваться параметрами взаимо-
действия ДЛЯ СП.ТIавов на основе железа (см. с. 63).
Наряду с параметрами взаимодействия, которые пред-
ставляют собой коэффициенты в разложении G Зб IRT,
u u
применяют также энтальпииные и энтропииные параметры,
ЯВ.пяющиеся коэффициентами в аналоrичных разложениях
/1H i и S7Зб. По аналоrии с параметрами 8, е, р, , энталь-
пийные параметры обозначают: 1'), 11, Л, 1, а энтропийные
0', S, п, р. РЯД соотношений между этими параметрами при
веден в работе [43], например
1'J{ == !11; n == 100 (M/M1)h{. (84)
Практическое значение энтальпийных параметров обу
.С.ПQ8лено тем, что они определяют температурную зависи..
масть парамеТрОБ Е{ и е{. Соответствующее выражение
леrко ПОаЛУЧИТЬ ИЗ уравнения rиббса rельмrО"lьца:
д ( а;зб/т) &H i
==-
дТ T
.
(85)
Учитывая уравнение (36), получим выражение:
(д In Yi/aT) ==........ (6.H i IRT2) , которое после дифференциро-
вания по Xj дает
д . дlПl'i 1 . д!!.Н; ; д8УдТ== f)1/(RТ2). (86)
дТ aXj RT2 aXj
Подставляя в уравнение (86) соотношения (82) и (84),
можно получить удобное для практических расчетов Bыpa
.жение
д / дТ ==........ h 1 ( 2,3 RT2) .
(87)
С"....
tJ;
Т а б л и ц а 8. Параметрь: взаимо,в.ействии
Эnемент 1 I I I Mn
АI В С Со Cr Си Мо Nb
Al o, 1. 04 .........
,
в о о
С o, 07 0,74* О О О О О
са 0,07 1,2
Со О
Cr О О О О
Cu 0,01
Н О О О О О О О О О
МП О .........
N О О О О 0,04** О О О О
Ni
О 170 О О О О О О О О
Р 0,08 ' О О
РЬ О О О О О О О
S 0,09 0,74 0,58 О О О О О o 01
,
Si
5п
Ti 0**
V
111 ' ==O.17/T O,OOI1; r ==8.94/Т +0,0026; , i == 1.94/Т 0,0003; , g: ==6.5/Т 0.0055.
.. По Данным (44]: r r ==0.00032; , rt Ni 'C: 0,00008; r i == 0,00007; r r ==
Как уже отмечалось, теплота процесса значите.ПЬНО сла-
бее зависит от температуры, чем изменение энерrии rиббса,
поэтому энтальпийные параметры h{ по сравнеНIIЮ с пара...
метрами взаимодействия е{ в относительно не,большом
температурном интерва.Jlе также' можно считать постоянны-
ми. Это позволяет выражать температурную зависимость
пара метров взаимодействия уравнением e == (А/Т) +В, ко...
торое получается в результате интеrрирования выражения
(87) .
Зависимость пара метров e в железе от температуры
[17] характеризуется следующими выражениями: e I ==
=== (63/Т) +0,011; e l === (1650/T) 0,94; e == (714fT) 0,307;
eg == (158fT) +0,0581; e3r === ( 153/T) +0,062; e 1 == (859/
/T) 0,487; e b === (260/T) +0,0796; e a === (152/T) +0,049;.
e == (350fT) + 0,094; e b == (1720/Т) + 0,503; eg
58
BToporo порядка ,1.100 в железе при 1873 К [171
Элемент J
Ni I Р I s I Si Sп та Ti V W Zr
O,O6
О
о 0,41 0,07* 0,02 0,02 0,01 О ......
О 0,09 ---- .....
........
о 0,25 О О
O,03 ........
О О О О О О О О О
О
0** О О О О О О О О О
О
О О О О О 3, 1 О О (О)
О o, 1 0,1 0,01 ........
О О О О О О
О 0,06 O,O9 0,17 О О 0,01 О 0,01 ........ О , 02
О o 21 * ........ ,
,
О О
** 01
,
o, 06 ......... 0,01
O.OOOI: ' ' NI c: O,OO06; r ! ==0,0005.
== (1750IT) +0,734; e r === (94,2IT) +0,0396; I == (380/
jT) 0,023; e === (34,,5fT) + 0,089; e ! ==....... (13 900fT) + 5,61;
e == (1270/T) +0,33; e 1 == (34 740fT) + 11,95; e 1 ==
== (20 600fT) + 7, 15; e 1 === (162fT) +0,008; е == (233jT)
O,153; e ==(975fT) 0,4; e a ==.......(1960jT) + 0,581; e i==
=== (4070IT) + 1,643. Эти Данные так Же, как и СВЕ;дения о
параметрах взаимодействия BToporo порядка (СМ. табл. 8),
lIемноrочисленны, поэтому при проведении расчетов часто
возникает потребность вычисления пара метров более BЫCO
Koro порядка по параметрам нулевоrо или первоrо поряд
u
ка, а также определения энтальпииных параметров по из
вестным значениям е или В. Соотношения, необходимые для
таких расчетов, можно получить с использованием различ-
IIЫХ теоретических представлений или эмпирически (стати-
стической обработкой большоrо числа экспериментальных.
данных). Примером эмпирическоrо подхода может служить
59
соотношение Чипмана и Корриrана [45]:
h == 4,184. 15000 ei N (1873K) === 62760 е (187ЗК) ,
(88
полученное по экспериментальным данным для растворов
азота в железе, содержащем различные леrирующие З lе...
leHTbI. При помощи этоrо соотношения можно леrко по пу...
чить уравнение для пересчета параметров e на пранз...
вольную температуру. Воспользуемся для этоrо соотноше...
нием между параметрами:
2,3RT (T) === h (T) Tsf(T), (89):
которое следует из уравнения: G зб ===8Нi т srзб. Под..
ставляя выражение (88) и Т=== 1873 К в уравнение (89), по...
лучим: 2,3 RT 1873 e (1873K) ===62760 e (187JK) 1873 S (1873K)'
откуда
N == 14,37d N (1873K). (90)
Подставив уравнение (90) в выра}I{ение (89) и приняв,.
что параметры h и s& в рассматривае 10М интервале Te 1'"
ператур постоянны, получим
2,3RT N(T) == 62760d N (187ЗК) 14,37те{'J(l87ЗК),
или
N(T) == [(3280/T) O,75J;N(1873K). (91)1
При помощи выражения (91) можно вычислить 19 !N(T) В.
сплаве заданноrо состава и далее с учетом уравнений (32,
33) получить выражение для расчета раСТВОрИ IОСТИ азота
u
В нем при заданнои тем пер атуре:
Ig[%NJ 18TM == Ig(K V PN. ) == 1;В 1,25
( 3 80 О,75) (dN(187з)[%jJ).
Это выражение называют уравнение\f Чипмана Корри...
raHa *.
Ряд полезных соотношений между раз.ПИЧНЫМИ пара 1ет-
рами получен в работах [16, 43, 46] на основе 10дельных
представлений. Дифференцируя по Xi уравнения теории ре-
.
( 92);
* Принятая в выражении (92) температурная зависимость paCTBO
римости азота в железе (Ig [N]== 188IT 1,25) несколько отличается.
от результатов последних исследований, однако коэффициеннты в Bыpa
жении (91) были рассчитаны в работе [45] с использованием _ именно.
этоrо выражения. При ero уточнении надо уточнять и уравнение (91)._
60
rуЛЯРНЫХ растворов (53) (56), можно получить следую
fJ1ие вы р ажения. Bi === 21n ,\jOO. P i ==ln ,\,00. ,ni== 2 Hoo.
L1--\ · i ri' i ri ' .'[ i'
Л == Н .
Продифференцировав выражение (47) по [О/О j] с учеТО"'1
формулы (31), получим
d(T) === (1873/Т) (187З). (93)"
Соrласно теории квазиреrулярных растворов из уравнения
(70) с учетом '1'==7000 К получим
(T) == [(2557/Т)........ 0,365] ef(1873) .
(94) :
Из изложенноrо следует, что выражение (94) ближе к дей..
ствительности, чем формула (73). Квазихимическая теория
дает следующие формулы [16,43]:
( i )
00 2 е.
ln '\'1 == 2 ln 1 : ;
8 == Z [1 (,\, )2/Z] -- 21n Yr'
2 (ln '\'i)2;
z
(95)
i 3 ( i ) 2 . i V (1 8 /z)(1 8 /2)
Pi == 81 2 ' 81 == Z 1 (i / ) ·
22 1 В" z. · .
J & J
(96)
11з формулы (96) путем подстановки выражения (95) и
соотношения RT ln y ==Q, полученноrо из уравнения (55),
l\IОЖНО получить выражение:
/ . [ Q . + g J+ Q.. ]
8 == Z 1 ех р 1& 1 I} [46]
l 2RT'
(97).
"
которое позволяет иноrда оценить параметр e приняв
энерrии смешения равными соответствующим предельным.
теплотам растворения (Qli== НЦВl) и Т. д.). Выражение
(97) можно использовать также для вычисления пара мет..
ра в/ при произвольной температуре, если известно ero
значение при 1873 К. Уравнение дл таких расчетов имеет
вид:
[ ( j ) 1873/Т ]
i B i (1873)
8цТ) :-:::: Z 1 1 z ·
(98)'
Приведем некоторые друrие формулы, следующие из..
61
квазихимической теории [16, 43, 46]:
( i ) 2 i
i 8j 8! ( i Z )
Pi == 2z + z ej 2" ;
J,k I ( l j + j k + k i ) i .
Р! ==............ Bj 8k 8k В! 81 8j Bk ,
2
(99)
(100)
11: === 2 HI ехр (2 H?/zRT);
1] == zRT [1 (Bi/ z)] ln [ 1 ------ (8i/ z ) ] .
Как видно из формул (99) (102), применение квази..
u .
химическои теории оrраничено системами, в которых E <
<z. В работах [46, 47] получены соотношения между па..
раметрами для растворов внедрения, в которых атомы i..
Toro компонента располаrаются не в узлах решетки (как
у модели замещения в теории реrулярных растворов
.Н т. п.), а в междоузлиях (порах). PaccMOTpeH I поры акта..
и тетраэдрическоrо типа, для которых атомы, расположен..
liIJIe в ближайших узлах, образуют соответственно октаэдр
:и тетраэдр [47]. Полученные выражения имеют следующий
13 11;1:
(101)
(102)
p == 1/" (е})2 [1 J.t ехр ( 2Q 1/ z RT) "1'];
11 == l)RT [1 (8i/ б) ] In [ 1 (81/ б) ] ,
( 103)
(104)
rде 21j=== flioo; J1., 'Ф и б rеометрические параметры, зна..
чеllИЯ которых для некоторых типов структуры ближнеrо
ПОt)Я .J,I<З приведены в табл. 9.
т а (j л и Ц а 9. Значение параметров ДJlЯ некоторых типов структур
Структура Тип пор
z
JL
б
О. Ц. к. Октаэдрические
Тетраэдрические
r. ц. к. Октаэдрические
Тстраэдрические
8
8
12
12
о
1/2
2/3
3/4
1/2
1/4
1/6
О
2
2
6
4
Как показано в работе [48], применение к растворам
азота в расплавах на основе железа формулы (104) (в ва-
рианте с 6===6) дает выражение, близкое к полуэмпириче..
СКОМУ уравнению Чипмана Корриrана. Аналоrичный ре-
зультат получается также при использовании выражения
(104) в варианте для растворов замещения (с заменой 6-
.б2
числа узлов, окружающих пору, на z............ координационное
число, равное 8 для о. ц. к.-решетки). Дальнейшее развитие
этих работ позволило получить важную формулу для рас..
чета растворимости азота в MHorOKOMnOHeHTHbIX сплавах
[209] :
Мем [ 1 ( j ) ] 6
[%NJ =:= [%NJ Mt М т е 1 6 EN Me"Xj , (105),
rде Ме............ металл..растворитель; Mт== xjM j == 100/ (Cj/
/M j ) мольная масса сплава.
Как показано в работах [210,211], формула (105), He-
смотря на использование только параметров первоrо по-
рядка (e ), обеспечивает довольно высокую точность рас-
чета растворимости азота в расплавах на основе железа и
никеля. Особым достоинством выражения (105) является!
u
то, что за условныи растворитель в расчете можно прини..
aTЬ любой компонент сплава и даже элемент, в нем НЕ
присутствующий вообще. Соrласно теории важно только"
чтобы в этом растворителе при Xt--+ 1 реализовалась модель-
раствора с теми же значениями потенциалов межатомноrо
взаимодействия, которые имеют место в сплаве. Пользуясь.
этой особенностью выражения (105), можно, например,.
преодолеть существенные трудности, связанные с недостат-
u u
I{OM известных значении параметров взаимодеиствия ДЛЯ:
сплавов на основе никеля и друrих. металлов. Как показа-
ли расчеты [211], для расплавов на основе никеля можно.
выбрать в качестве условноrо растворителя железо и вос-
пользоваться при расчете параметрами для сплавов на ero.
основе. Точность оценки растворимости азота при этом.:
оказывается удовлетворительной. Для определения при по-
Мощи выражения (105) [О/О N] при температурах, отличаю-
IЦИХСЯ от 1873 К, в работе [209] рекомендовано для расчета.
E (T) соотношение типа (98) с заменой z на б===6.
....
1.16. РАСЧЕТ РАВНОВЕСИЯ РЕАКЦИЙ
С УЧАСТИЕМ РАСТВОРОВ
Целью расчета, как правило, я'вляется определение равно-,
весной концентрации или paBHOBeCHoro давления одноrо из
peareHTOB по уравнению константы равновесия реакции.
Для остальных peareHToB концентрации или давления
должны быть заданы или приняты с учетом условий проте..
кания реакции, иначе результатом расчета будет не числе,
а уравнение, связывающее неизвестные равновесные XapaI{-
63
теристики. Например, рассчитывая равновесную концентра-
цию кислорода в метаЛ.не при раскислении, необходимо
v v
задаться опреде.неннои концентрациеи раскислителя, в про-
тивном случае можно рассчитать только величину произве-
дения концентраций [R] [О], стоящую в знаменателе J{OI"t..
,станты равновесия реакции:
[R] + [О] == RO(T); К == aRo/!f R [R).fo[O)}.
( 106)
Иноrда целью расчета является определение возможно-
сти (направления) протекания реакции в заданных усло-
виях. Такая задача леrко сводится к первой, так как ответ
можно дать, исходя из сопоставления заданной (фактиче..
екай) концентрации peareHTa с равновесной (реакция
.всеrда идет в направлении их сближения).
Для расчета равновесия реакции, в которой один или
несколько peareHToB находятся в растворе, недостаточно
ЗlIать стандартную энерrию rиббса взаимодействия чистых
веществ. Кроме нее необходимы сведения о коэффициентах
активности peareHTOB в растворе. Если такие данные име-
ются или MorYT быть определены расчетом, то определение
параметров равновесия не представляет больших трудно-
стей. Рассчитаем для ПрИ lера равновесную концентрацию
v
,аЛЮ IИНИЯ в железе в УС ТIовиях вакуум нои плавки в тиrле
'ИЗ оксида алюминия, приняв парциальное давление :кисло-
рода в rазовой фазе РО 1 === 10 6 атм и Т== 1873 К. Прежде
Bcero полезно убедиться в правильности постановки задачи
с точки зрения правила фаз. В данном случае система со..
v
держит три компонента: железо, алюминии и кислород
(К ==3) и три фазы: ЖИДI<УЮ, твердую и rазообразную
(Ф==3). При постоянной температуре число независимых
переменных в такой системе, соrласно правилу фаз, состав..
JIяет С===К Ф+ 1 == 1. Это означает, что при данной тем-
пературе в системе можно выбрать произвольно только
'один параметр, остальные характеристики будут при этом
'определены. В рассматриваемой задаче такой ПРОИЗВО.пьно
выбираемой величиной является давление кислорода. Со..
rласно табл. 1, изменение энерrии rиббса для реакции
,окисления чистоrо жидкоrо алюминия
2АI(ж) + 3/ 2 0 2 (r) == А1 2 О з (т)
(107)
можно вычислить при температурах сталеварения по урав-
нению
dGO ==.......... 1681000 + 324 т Дж.
( 108)
64
В соответствии с уравнением изотермы реакции
ЛУЧIIМ
1 К 1 1 1681000 324T
g g 2 2 3/"2 19, 14Т ·
'YAl xAl РО.
ДЛЯ вычисления искомой концентрации алюминия XAl
остается определить коэффициент активности YAI. Пр ене..
бречь этой величиной в данном случае нельзя (даже при
rрубом расчете), так как раствор алюминия в железе об..
наруживает значительные отклонения от теории совершен..
ных растворов. Полаrая раствор идеальным разбавленным,
воспользуемся ЗIIачением YAl ==0,049 (при Т== 1873 К),
приведенным в табл. 4. Из уравнения (109) получим ХА1 ==
==6,2.10 10 (3.10 8 о/о). Такой результат (малое значение
XAI) не противоречит принятому допущению о разбавлен..
ности раствора и поэтом)' может считаться окончательным.
Если бы расчетная концентрация оказалась за пределами
диапазона, в котором раствор можно считать разбавлен..
ным, ТО расчет следовало бы повторить, воспользовавшись
друrим способом оцеНI{И у Al. Так, при Ро. == 10 17 атм мы
получили бы х Аl == О, 11 (5,3 О/О ). Оценим величину '\' Аl при
такой концентрации при помощи известноrо значения пара-
метра e l ==0,045 (табл. 6, 7). Получим 19 f A1 ==0,045.5,3==
==0,24; f Аl == YAl/"lo;l == 1,74; V Al ==0,049.1,74==0,085. Оче-
u
видно, что Tal{Oe отличие,,\, Al от величины, принятои в рас-
чете, является существенным' И' не может быть допущено.
Для уточнения расчета необходимо подставить в уравнение
(109) вместо коэффициента,,\, Al ero концентрационную за-
висимость. Такую зависимость можно получить, например,
при помощи пара метров взаимодействия, приведенных в
табл. 6 8:
(3) по..
(109)
I g '" I g '\)oo + eAl [%Al] + ,А! [ %Al]2
'AI f Al Al Аl ·
( 11 О)
в первом приближении можно для упрощения расчета
пренебречь квадратичным членом. Однако даже в этом
случае вычисления оказываются rромоздкими, поэтому
Проще воспользоваться методом последовательных прибли-
Жений. Для этоrо нужно повторить два три раза расчет
по уравне1lИЮ (109), подставляя в Hero каждый раз то зна
чение "\'Al, которое соответствует концентрации алюминия,
найденной в предыдущем расчете. Вместо уравнения (11 О)
Можно было бы воспользоваться концентрационной зави
С"мостью коэффициента t'Al, которая следует из каких ли
a75 65
60 модельных представлеlIИЙ: теории реrулярных раСТБQ-
u
ров с ее разновидностями или квазихимическои теории.
В приведенном расчете заданная температура (1873 К)
соответствовала той, дЛЯ которой известны табличные зна-
чения коэффициентов активности и параметров взаимодей-
ствия. При выполнении аналоrичных расчетов для друrих
температур можно воспользоваться данными о темпера-
турной зависи {ости Yl и e приведенными в табл. 4 на
с. 44, 45. При отсутствии необходимых данных следует поль-
зоваться соотношениями (47), (70), (93), (94), которые
следуют из теоретических представлений. Зависимость, аиа.
лоrичную формуле (47), можно использовать и для коэффи-
циентов активности /i. В этом случае величина Hi, входя-
щая в исходное уравнение (46), будет иметь смысл теплоты.
перехода в раствор 1 моля компонента i не из чистоrо ве-
щества i, а из стандартноrо 1 О/о -Horo разбавленноrо рас-
твора. '
-При расчете равновесия между растворенным алюмини-
ем и rазообразным кислородом в качестве стандартноrо
состояния для алюминия был выбран Чf!СТЫЙ компонент.
Если бы нас интересовало взаимодействие pacTBopeHHoro
кислорода с алюминием, то для кислорода такой выбор
стандартноrо состояния был бы неудобен. Для веществ,
которые при температурах сталеварения являются rазами,
в качестве стандартноrо состояния выбирают обычно иде-
альный разбавленный раствор (1 о/о -ной концентрации).
Такой выбор стандартноrо состояния часто применяют и
для остальных peareHTOB. При этом в выражение для кон-
станты равновесия входят процентные концентрации ве-
ществ и коэффициенты активности fi, учитывающие откло-
нения растворов от идеальных разбавленных. В ряде
случаев (при небольших концентрациях) этими коэффици-
ентами можно пренебречь. Рассчитаем для примера равно-
весие реакции:
2 [AI] + 3 [О] == АJ 2 О з (т) . (111)
Очевидно, что OO дЛЯ этой реакции будет отличаться
от ранее приведенноrо OO реакции (107) на величину из-
менения энерrии rиббса при переходе от одноrо стандарт-
Horo состояния к друrому (для алюминия и кислорода).
Чтобы найти выражение для а о реакции ( 111), нужно'
суммировать уравнение (108) и соответствующие уравне-
ния, взятые из табл. 4:
2АI(ж) + З/ 1 О 2 (r) == АI 2 О з (т); ao ==........ 168]000 + 324Т ДЖ,
66
2 [AI] == 2АI(ж); АОО == 2 ( 62800 ....... 23,8Т) Дж
3(0] == 8/ 2 0 2 (r); i!J.Qo == 3 ( 117000 2, 89Т) Дж,
2 [Al] + з [О] == А1 2 О з (т); ao == 1203700 + 376,2Т Дж
Выражение для расчета равновесия имеет вид:
IgK==lg 1 == 1203700+376.2T .(112)
' I [%Al]2 ' [%Аl]3 19,14Т
Определим концентрацию алюминия, которую необходи-
!.IO обеспечить для Tora, чтобы в расплаве содержалось
не более 0,003 О/О кислорода (при 1873 К). Примем fAl ==
===То == 1. Расчет по уравнению (112) дает [Al]===O,0006 о/о. .
Обе концентрации (алюминия и кислорода) оказались, та-
КII I образом, достаточно малыми, чтобы раствор можно
было считать разбавленным. В противном случае (а так-
же при T=i= 18.73 К) уравнение (112) пришлось бы услож..
нить путем введения, как и в предыдущем расчете, концен-
трационных (или температурных) зависимостей коэффици-
ентов fAI н /0. При наличии в расплаве друrих элементов,
кр<?ме железа, алюминия и кислорода, необходимо при по-
v
мощи парамеТРОБ взаимодеиствия учесть и их влияние на
I{оэффициенты fAI и 10.
Если бы в аналоrичном примере требовалось рассчитать
u
равновесную концентрацию не аЛЮМIIНИЯ, а титана, которыи
при 1873 К находится в твердом состоянии, то для опре-
деления ЬаОО реакции Тi ж +О 2 (r)==ТiО 2 (т) потребовалось бы
найти GO перехода Тiж Тiт. Это леrко сделать, если из-
вестны температура и теплота кристаллизации титана.
SKP определяют, исходя из Toro, что в точке плавления пе-
pe oд твердоrо титана в жидкий и наоборот происходит без
I"зменения энерrии rиббса (фазы находятся в равновесии):
дaKP===дHKP T Kp SKP==O. Отсюда
L\SHP == HHP/THP; АО нр == HHP Т (АНнр/Т нр ). '(113)
Приведем некоторые справочные данные [2] для таких рас-
четов:
Элемент I . . . . .
т кр, К . . . . . . .
АНир, КДЖ/МОЛЬ . .
в
,2300
22,2
Cr
2171
20,9
Fe
1809
15,2
Мо
2880
27,6
Nb
2741
(26,4)
. .
Ni
1726
17,6
Ti
1940
15,5
v
2185
( 17 , 6)
Продолжение
W Zr
3650 2123
35,2 16,7
67
Элемент . . . .
т КР, К . . . . .
AHI\p, КДЖ/МОЛЬ
5*
I .
. .
Для оксидов имеем:
Оксид . . . . . .. А1 2 О з СаО SiO j Ti02
(кристобалит)
т ир, К . . . . . .. 2303 2873 1986 2113
!!HI(p, кДж/моль . .. 108,8 79,5 13,0 64,9
Аналоrичный вид имеет уравнение для расчета допол-
нительной энерrии rиббса, которую приобретает жидкость
при переrреве выше ТОЧКИ кипения: I1Gисл==I1Нисп..........
T (I1Н исп/Т кип). Некоторые данные для таких расчетов
приведены ниже [2]:
Элемент . . . . . . .
т КJl.П, К (1 атм) . . . .
Нисп, кДж/моль . . .
Са
1765
150,0
Mg
1390
128,7
s
716
9,62
Р (красн.)
704
30, I
r n а в а 1I
СУ АЛЕПЛАВИЛЬНЫЕ ШЛАКИ
Шлак представляет собой мноrокомпонентный ОКСИДНЫЙ
u
расплав, непосредственно контактирующим с f.iеталлом в
u
сталеплавильном arperaTe и выполняющии Ba}I{Hь e техно..
лоrические функции. Развитие теории шлаков связано с ра..
ботами В. А. Ванюкова, п. rерасименко, r. Шенкз,
М. и. Темкина, л. А. Шварцмана, о. А. ЕСИIlа, В. А. Ко..
жеурова и мноrих друrих отечественных и зарубежных уче..
ных. Первые попытки термодинамическоrо описания шла..
ков бl;>IЛИ основаны на предполо}!<ении о том, что структур..
ными единицами в них являются молекулы оксидов (СаО,
Si0 2 , А1 2 О з и др.), а также силикатов, фосфатов и друrих
соединений. На этой основе бы.па создана так называеfvl3Я
молекулярная или химическая теория шлака, не потеряв..
шая полностью cBoero значения для упрощенных количест..
венных оценок и в настоящее время. Молекулярная модель
не объясняет мноrих физических свойств шлаков, в частно..
u
сти электрическои проводимости и некоторых друrих, хоро..
шо интерпретируемых на основании представления об
u V
электролитическои диссоциации, поэтому дальнеишее раЗВJI"
тие количественной теории было направлено rлавным оБР2"
зом по пути перехода к ионной модели как более совершен..
ной. Обладая большой rибкостью, ионная модель ПОЗВО"lи па
дать качественное объяснение мноrим экспериментальным
фактам и способствовала развитию электрохимии шлаков.
Зна'чительный проrресс в развитии количественной тео..
18
рии шлаков был связан с применением статистической тер-
модинамики. Разработанные на этой основе 1eTOДЫ расче...
та равновесиЙ ПОЗВОJIЯЮТ делать наиболее обоснованные
ЧИСJlенные оценки. Одним из перспективных I-Iаправлений
u
дальнеишеrо развития теории шлаI{ОВ в настоящее время
u
представляется последовательным учет характеристик их
электронноrо строения. На протяжении последних десяти..
летий именно этот путь был связан с наибольшими успеха..
ми физики и химии конденсированноrо состояния, теории
катализа, теории полупроводников. Все химичеСI{ие СВЯЗII
осущеСТВЛЯIОТСЯ посредством э.пеl{ТрО:НОВ, поэтому централь-.
вый вопрос теории шлаков, касаlОЩИЙСЯ особенностей меж.'
u
aToMHoro взаимодеиствия, является в конечном счете во-
просом об их электронном строени . Учет характеристик
электронноrо строения делает !{оличественную теорию бо-
u
лее последовательном и в ряде случаев приводит к качест-
венно новым результатам.
11.1. ТЕхнопоrИЧЕСКИЕ функции
И ХАРАКТЕРИСТИКИ ШЛАКОВ
Важнейшей функцией шлака является сорбция (поrло-
щение) вредных примесей серы, фосфора I1 некоторых
друrих элементов. Сорбционная способность шлака по от-
ношению к примесям зависит от ero состава, температуры .
и степени раскисленности системы металл шлак. Удале
иие примесей требует различных условий. Так, удаление се-
ры полнее протекает к раскисленной системе, удаление фос..
фора в окислительных условиях. Для процессав, проте
кающих в дуrовых печах и друrих открытых arperaTax,
важную роль иrраIОТ защитные (покровные) свойства Ш.па-
ка. Проницаемость Ш.пака по отношению к азоту, водороду
н кислороду, содержащимся в атмосфере, в значительной
мере определяет rззонасыщенность металла и развитие
процессов окисления. Процессы массопереноса в шлаке свя..
заны с диффузионной подвижностью примесей, вязкостью
lU.ПЗI{8, ero составом.
В электросталеП.лавильных процессах существенную
роль MorYT иrрать явления, связанные с тепловым и элеI{'"
Трохимическим действием э.пектрическоrо тока, проходящеrо
Через слой шлака. Например, в процессах ЭШП шлак ВЫ--
ПОлняет функции наrревательноrо элемента, а при исполь...
овании постоянноrо тока значительное развитие получают
электрохимичеёкие эффекты. Шлаки MorYT выполнять ряд
Друrих функций в зависимости от специ(рики конкретныIx
69
процессов: поддержание заданноrо теП&JIовоrо режима, обес..
печение хорошей поверхности слитка, стабилизация электри-
ческих дуr и др. Например, в процессе ВДП используется
добавка очеIIЬ небольшоrо I{ОЛlIчества шлака для ассими-
u
лядин и удаления неметаллических ВКЛlочении.
Важной теХНО.лоrической характеристикой шлака явля..
ется ero основность. Мерой основности служит отношение
u
суммы концентрации основных оксидов к сумме концентра..
ЦИЙ кислотных, в простейше!\f случае (СаО) / (Si0 2 ). В ли-
тературе можно встретить большое число друrих способов
выражения ОСIlОПНОСТИ, которые MorYT быть более удобны..
ми в тех или иных случаях. Однако не существует универ..
сальной шкалы основ насти и В общем случае следует поль..
зоваться по возможности более простыми критериями. Ре..
альные шлаки имеют сложный состав и часто более
u
основ нои шлак в ряду, построенном, например, по десуль..
фурирующей способности, 10жет оказаться менее основ..
ным, еСЛII критерием основности шлака является активность
ионов кислорода [50]. Бо.нее точно завис'имость свойств
Ш&ТIака от состава характеризуют формулы термодинамиче
екой теории растворов, которые будут рассмотрены ниже.
ОСIIОВНОСТЬ широко используется в практической метал
JIурrии в качестве простой обобщающей характеристики.
ВЫСОКООСlIовные шлаки обладают хорошей сорбционной сп.о..
собlfОСТЬЮ по отношению к примесям, жидкоподвижны, ra.."
зопроницаемы, способствуют стабилизации электрических
дуr. Эти шлаки «короткие», Т. е. имеют короткий темпера..
u .
турныи интервал перехода от ЖИДI{оподвижноrо состояния
в твердое. Кислые Ш.паки в тех же УСЛОВIIЯХ более вязки,
обладают хорошими изолирующими свойствами, большим
интерваЛОlYI перехода от жидкоrо к твердому состоянию
( «длинные») (рис. 9).
Важнейшими физическими свойствами сталеплавильных
шлаков ЯВЛЯIОТСЯ пов рхностное натяжение, вязкость, плот..
IIOCTb, электрическая проводимость.
Вязкость шлака существенно влияет на скорость массо..
<>бмена в сталеплавильной ванне, поэтому связана с пока..
зателями Bcero процесса. Обычные значения вязкости элек..
iросталеплавильныIx шлаков при 1600 ос находятся в пре..
делах O,OI O,06 Па. с (вязкость воды при 25 0 С 0,9 l\1Па.с,
стали при 1600 ос 25 мПа. с). Вязкость в значительной сте..
пени зависит от температ)тры (см. рис. 9).
Плотность сталеплавильных шлаков при 1600 ос колеб..
.лется в преде.пах 3,5 2,0 r/CM 3 . Повышенную плотность
Jtl\1e10 r )I{елезистые и l\Iарrаllцовистые шлаки. При прочих
10
равных условиях основные шлаки имеют несколько более
высокую плотность, чем кислые. С повышением температу-
ры П..ТIОТIIОСТЬ расплавленных шлаков уменьшается пример..
НО на 0,2 rjCM 3 на каждые 100 ос.
Электрич ская проводимость шлаков зависит от их co
става. Обычно электрическая проводимость Ш 1аков Прlt
1600 ос находится в пределах
0,000 1...........1 OM l. CM l. Более э..lектро-
проводны основные шлаки. Осо-
бенно сильно увеличиваlОТ электри-
ческую проводимость шлака добав-
ки оксидов щелочных металлов и
rалоrенидов, в частности плавико-
Boro шпата. ЭлеI{тричеСI<ая ПрОБО-
димость, как и жидкоподвижность,
экспоненциально увеличивается при
повышении температуры: %===АХ
Xe E/RT, rде А постоянная ДjIЯ
данноrо шлака; Е энерrия акти-
· v
вации электрическом проводимости.
Приведенные данные следует
рассматривать лишь как ориенти-
ровочные, поскольку лабораторные Рис. 9. Зависимость вязко-
условия, В которых проводятся .из- СТИ кислых (1) 11 основных
(2) Пlлаков от температуры
мерения, не всеrда полностью вос-
производят условия промышленных
arperaToB. Особенно сильно на некоторые свойства шлака
может влиять различие в ОКИСЛlfтельно-восстановительны",
условиях.
q8
0,7
6
0,5
.
(..)
[{З
"")
а2
1
z
0,1
о
167J
1773 187}
Темперот!lРО/1(
11.2. MOпEKyпJlPHASI ТЕОРИЯ ШЛАКА
.
Молекулярная или химическая теория шлака явилась пер-
ВОЙ попыткой научноrо обобщения обширноrо опыта, на-.
копленноrо практической металлурrией. Блаrодаря просто-
и v
те и Har лядности исходных положении этои теории основ-
ные ее принципы широко используются для простых
ориентировочных оценок и в настоящее время. Мноrие по-
и
ложения молекулярнои теории, касающиеся строения шла-
ка, суrубо УСЛQВНЫ, поэтому рассмотрим лишь конечные за-
висимости, применение которых в рамках формальной ко..
личественной теории вполне обоснованно. Как обычно
первым шаrом термодинамическоrо описания равновесия
ЯВ..1Jяется составление уравнения реакции. Например,
[Мп] + (FeO) === (МпО) + [FeJ. (114)
71
На основании уравнения реаl{ЦIIИ прп ПО IОЩИ идеd.льноrо
закона действующих масс (3ДЛ'1) записывается выра>кение
для константы:
Специфика МQлеку.пярной теории ЗЭКЛlочается в способе
подсчета «актипных» или «свободных» !{онцентраций окси
дов, входящих В выражение (115). Рассмотрим первона-
чальный, наиболее полныЙ вариант молекулярной теории,
разработанный r. Шенкоr-л с сотрудниками. Структурными
единицами шлака считаются молекулы оксидов (СаО, FeO,
Si0 2 и др.) И их соединений. Из Bcero мноrообразия возмож-
ных соединений рассматриваются лишь пять: (FeO) 2. Si0 2 ;
.<СаО)з.FезО4; (MnO)2.Si02; CaO.Si0 2 ; (СаО)4.Р20Б. Этот
набор структурных еДlfНИЦ ЯВ ТJяется минимумом, достаточ-
IIblM д.ПЯ передачи основных характерных особенностей шла
ка, определяющих распределение элементов в систе:\rlе Me
Ta ТJ,1 Ш"l а 1<:.
Используя выражения для констант, например фОрI\1УЛУ
(115) [(FeO) II (МпО) «свободные» концентрации, опре
деляеl\lые степенью диссоциаЦИII перечисленных выше пяти
«соединений» J, на основании обширных опытных данных о
распределении элементов -между металло л и шлаком в pe
зультзте l\1ноrочисленных пробных расчетов [. Шенк нашел
численные значения констант распред леНIIЯ 11 диссоциации,
наи&ТIУЧШИМ образом удовлетворяющие экспериментальным
данным. Ниже приводятся значения констант, ВЫЧIlслен
I IbIe [. Шепком для 1873 К:
] D == J (FeO) .(Si02) == 1 77.
g (FeO).. 5i0 2 g «FeO)2' Si0 2 ) "
,
] D === ] (МпО)2. (Si0 2 ) === О 70.
g (МпО).. 5iO! g «МПО)2' Si0 2 ) "
1 D :.=:: 19 (СаО). (Si0 2 ) == О 91'
g СаО.51О 2 (CaO.Si0 2 ) "
L FeO == [FeO] : (FeO) == 0,0149;
] К == I g [Мп]. (FeO) == О 299.
g Мп (МпО) "
] К. ==] [Si]. «FeO) == 1 43.
g 51 g (Si0 2 ) , ,
1 К == 1 9 r p].(FeO):>(CaO)t + O,060 ( P О) == 7,42.
g }J ( P О ) 2 i
...J 2 i
K \n == (МпО)/{(FеО)IЛiп]}.
72
( 115)
( 116)
(11 7)
( 118)
(1 19)
( 120)
(121)
( 122)
Обычно принимают, что феррит кальция диссоциирует
полностыо, а фосфат кальция не диссоциирует COBCel\l. Оче-
вИДНО, что, располаrая этими значеНИЯl\1И KOHCtaI-IТ, по за-
u
данному составу шлака можно с опреде"lеннои степенью
достовеРНОСТ1-I предсказать распреде"ТIение элементов в ус-
,,10ВИЯХ, близких I{ Te f, дЛЯ !{ОТОРЫХ были определены эти
значения. Таким образом, рассмотренная теория суммиру-
u u
ет в терминах условнои lvl0лекулярнои модели определен-
ный практический опыт и ПОЭТО1\1У позволяет делать обосно-
ванные предсказа'ния. Однако следует отметить ИСКЛIОЧИ-
u
тельную rрО?\10ЗДКОСТЬ практических расчетов по этоп схеме.
ДLТIЯ определения «свободной» концентрации какоrо ли-
60 оксида требуется совместное решение большоrо числа
tJ .
уравнении, поскольку концентрации всех оксидов и их со-
единений оказываются взаИl\10связанными. Представление
об образовании соединений между оксидами ОJ{азалось
очень полезным и широко используется при различных ори-
ентировочных оценках. Добавление в шлак О,сновных ОКСИ-
дов должно приводить К связыванию кислотных оксидов
(Si0 2 , Р205 И др.) И способствовать переходу соответствую-
щих элементов из 11ета"Т1ла в шлак. Э"ТIементы, образующие
основные оксиды (МпО, CrO и др.), при этом будут полнее
переходить в металл.
БЫ 10 предложено большое число вариантов этоrо ме-
тода, раэличающихся допущениями относительно вероятно-
ro молекулярноrо состава шлака (состав соединений, харак-
тер их диссоциации). В теории, выдвинутой. Н. /\1. Чуйко,
tJ
наряду с диссоциациеи на оксиды допускается частичная
диссоциация соединений на ионы. п. rерасименко IIСХОДИЛ
tJ U
ИЗ ПО.пнои диссоциации всех соединении на простые и слож-
ные ионы. Подбором соединений и парамеТРОБ их диссоциа..
Il.ИИ исследователям, как правило, удается удовлетворитель-
но описывать имеющиеся экспериментальные данные при
самых различных моделях строения шлака.
Отсутствие пезависимых методов определения фактиче-
cKoro молекулярноrо состава шлака не позволяет предпо-
честь какой либо из указанных вариантов, поэтому ни од-
На из теорий, основанных на подборе молекулярноrо соста-
Ва с последующим ero использованиеl\f в идеальном ЗДМ,
преимущественноrо распространения не получила. Вместе'
с тем общая схема описания равновесий, развитая на ос-
Нове представления о существовании в шлаI{е молекул ОК-
сидов FeO, СаО, АI 2 О з и др., введением активностей кано-
низирована и служит основой термодина fИI{И шлаков.
Введение активностеЙ заключается в простой замене «сво-
73
Ко == a(FeO) .
- ,
lOoo]
К О (1873) =-=. 4,367;
[%Мп] [%0]. I К === 12760 + 5 68
К g Мп Т ,;
МП == а( \по) ,
K Mn (1873) == 0,074;
Й(МпО). 7406 3 36
К........ , 19 K Mn / Fe == т ,4 ;
мn/pe........ а [ О(.Мп ]
(FeO) ltJ
K Мn / Fe (1873) == 3,296. (125)
Для определения aFeO и aMnO по Дllаrрамме рис. 10 и 11
необходимо выразить мольный состав шлака в процентах
(О/О M i ). Находим числа молей (mi) каждоrо из компонен
тов в 100 r шлака, например mСаО О/О СаО/МсаО ==39,94/
/56==0,713. Суммируем найденные 1n; в наше 1 примере
mi=== 1,531. Находим мольные процепты о/о M i == 100(mi/
1 lпi). Например: О/О МсаО ===100. (0,713/1,531) ===46,5 о/о.
бодных концентраций в выражении (115) активностями со..
ответствующих оксидов: КМп == а (Мпо)/(а[мп]й(о) ) .
в настоящее время накоплен значительный объем экс"
периментальных и оцененных теоретически значений актив..
u U
ностеи компонентов rлавнеи..
(Si0 2 )+(PZ 0 5 J ших шлаковых систем. Наиба..
90 10 лее полная сводка таких дан..
ных приводится В справочнике
70 ЗА '[2]. На рис. 10 и 11 приведе..
\ .... с) U
, (\ " ны диаrраммы активностеи
(,.).fO A / 50 МпО и FeO в шлаке по дан..
'" O.5g;5 .ZJ ным Тэр доrана 152, 53].
.. ЗО... ; 0,65 _ 70 П рим.ер. Вычислить содер"
' ( С о . 8 , 9 жание кислорода и марrанца
\.... 90 в металле (железе) , находя
.. дящемся в равновесии со шла..
90' 70 50 JO 10
(CaO\+(MnD)+(M g O' IF о' ком следующеrо состава
'1 ,1 (, '1 е (плавка Е..39 из работы [54],
(сао,+(Nпо)+,МgО),О/О(1'10л.) 1600 0 С): 39,94 % СаО; 15,38 %
Рис. 10. Активность оксида железа S i 02; 10,59 О/О F еО; 1,77 О/О
FeO в шлаке (цифры у кривых Fe о. 5 23 О/ M g O. 1 О 60 О/
значения активности FeO в MO..'Ib 2 3, , 10 , , /0
ных ДОJ1ЯХ) МпО; 16,09 О/о P20s; 0,06 О/О s.
Воспользуемся следующими
выражениями для констант
'[52, 53]:
Ig Ко == (6320/Т) ......... 2,734;
( 123)
( 124 )
14
Мольный состав шлака следующий*, о/о: 46,5 СаО; 16,7 Si0 2 ;
11,0 FеОобщ; 8,5 MgO; 7,4 Р20Б; 9,7 Мпо. Суммируем КОН-
центрации основных и кислых оксидов, соrласно размерно..
СТИ координат диаrрамм: О/О МСаО + о/о MMgO+ О/О ММпО==
::=::64,7 О/о; О/О МсаО + О/О MMgO ===55,0 о/о; о/о MSlo.+
+0/0 М рао . ===24,1 О/О. ПО диаrрзммам находим aFeO ==0,50,
aMnO ==0,260. Содержание кислорода в металле по уравне-
НИЮ (123) составляет [0]02з>==0,50/4,367==0,114 о/о; по
(Si02)+(PzD5)
II
J5
зо
25
2.0
10
15
O
...........
о
ЕО
с)
25 ::..,1
5
1,60
65
25 \ 110
30 \\ "5
з 50
75 70 55 60 55
(CaO}';'(MgO)о (r:1 n O)
(СпD)+(мgОJ, о/о (нол.)
( 5i0 2)+(P2 0 5)
i 40
5 5
t 35
ЗО
")1.
25
.
G;)
'= 2Ь
Рис. 11. Активность оксида
марr8нца MnO в шлаке (циф..
ры у Кривых....... значения актив..
ности МпО, %):
а ,\1 FeO ..0,05:1:0,01; б
МРеО с:О,10 + 0,ОI5; в М РеО ==
8z O,20:tO,02
(5 iDz)+(PzDs>
8 " JO
.,
f
25 5 5
(;),,\ %
zo I /'0 10
/ 15
.J.'5 zo 15
25
10 ЗО
З5
70 65 БО 55 50 70 6 50 55
(сп 0)+ (MgO) (МПО) (CaO)+(MgO) (МпО)
(саD)+(мgо),о/о(мол.) (сnо)+(мgО),0/0(f10Л.)
.
уравнению (124) [O](124) (0,074.0,260)/0,212===0,090 О/о. Со-
держание марrанца по уравнению (124) составляет
[Mn](124)=== (0,074. 0,260) /0,082===0,234 о/о, по уравнению
(125) [МП](125)===0,26/(О,5.З,296) ===0,157 о/о. Отклонения вы..
* FеОобщ в ИСХОДНОМ шлаке ВЫЧИС.ТJяется ПО формуле: О/О FеОобщ==
=== О/О FeO + (72/80) о/о Fе 2 Оз.
75
Iис 1JeHHbIX значений от экспериментальных [О] Эl\СlI === 0,082 о/о,
{Л1.П]ЭRсп==О,212 О/О не превышают 25 о/о. Такое COr.,laCIIe в
u
расчетах равновесии металл........ шлак считается хороши 1.
11.3. ТЕОРИЯ СОВЕРШЕННЫХ ИОННЫХ РАСТВОРОВ
Естественным путем развития КО.1JичественноЙ теории был
переход от Iолекулярной l\10де.ПИ к и()нной как более со-
вершенной. Однако уже первые работы [55, 56] ПОI(азали,
u
.что простая замена концентрации оксидов концентраЦИЯМI:1
ионов в 3ДМ не приводит к заl\1еТIIОМУ улучшен.ию теории
:[57, 58]. ПричноЙ этоrо является оrраниченная при мени-
масть идеальноrо 3ДМ к таким система f, как шлак. Наи-
более обоснованный путь. использования данных о строении
взаимодействующих фаз при расчете равновесий УI{азыва
ет статистическая физика. 3ДМ является частным решени
el\I статистической задачи об энерrии систеl\1Ы ХИl\fически
I1нертных частиц, поэтому он хорошо описывает поведение
rззОВ. Для кондеIfсированных фаз ЗДМ CTporo выполняет
СЯ лишь в некоторых предельных случаях. Частицы, обра
зующие такие фазы, сильно взаимодеЙСТВУIОТ, что приво
дит к новым закономерностям. Первая удачная попытка
v
применения ионнон модели для статистическоrо вычисле
ния термодинамических функций Ш lIака принаД..ТJ:ежит
М. и. Темкину [59]. При статистическом подсчете энтропии
ионноrо раствора М. и. Темкин предположи.ТI, что раствор
полностью ДИССОЦIIирован на ионы, ноны одноrо знаь.а
энерrетичеСI{И эквивалентны, в процессе тепловоrо движе
иия возможны перестановки только между ионами одноrо
знака. Подсчет конфиrурационной (перестановочной) эн
тропии ведется по формуле дS ==R ln w. Вероятность W
(полное ЧИС.,10 вариантов пространственноrо раЗ!\lещения
частиц раствора, возникающих при их взаимных переста
новках) ОI{азывается равной произведению соответствую
щих величин для .катионов 11 анионов: W == W K · W a . При
ЭТОМ в выражении для химических потенциалов I{омпонен
тов шлака, например для CaS, раствореиноrо в шлаке,
tсзs == ,...,gas + HCas ' T SCas;
T SCas == RT In (ХСа. X s )' (126)
rде xs==пs/ lla; xCa===nCa/L1lK; ПСа; nS ЧИСJlа ионов I{a..ab
.ция и серы в расплаве соответственно; }:n а 11 Lnl{ об
щее число анионов и катионов. Величины .ti ПО..1JУЧИЛИ Ha
звание ионных долей по l"емкину. Принимая днi==о, полу
'76
чаем J.lCaS == J.t 8S +RT ln (Х са e X s ), откуда находим оконча.
те.пьное выражение для активности: aCaS ==ХСа е XS.
I<aK показали Л., А. Шварцман и А. М. Самарин [60, 61],
теория совершенных ионных растворов вполне применима
Д/IЯ расчета распределения серы между металлом и силь-
но основным шлаком. Сравнительно небольшие содержания
оксидов кремния, аЛЮlVIИНИЯ 11 фосфора вызывают сущест-
венные расхождения теоретических и экспериментальных
данных. В практических расчетах равновесий теорию со..
вершенных ионных растворов применяют сравнительно ред..
ко, однако ее значение для теории шлаков исключительно
велико. Метод подсчета энтропии, предложенный М. и. Тем..
КИНЫМ, характеризует важную особенность подобных рас..
плавов и используется в более полных статистических тео-
риях, в частности в теории реrулярных ионных растворов
В. А. Кожеурова.
11.4. ТЕОРИSl РЕfупярных ионных РАСТВОРОВ
в отличие от обычной теории реrулярных растворов
(см. rл. 1) энтропия в реrулярном ионном растворе не счи..
тается идеальной, а вычисляется по методу Темкина, как
было описано выше. Вторым важным моментом теории Ко..
жеурова является то, что шлак рассматривается как сис..
тема простейших атомных ионов. Это приводит К важному
результату, заключающемуся в том, что в выражение кон..
станты равновесия концентрации (или активности) распре..
деляющеrося элемента, относящиеся к металлу и шлаку,
входят в одинаковой степени, что более правильно отражает
действительность. Шенк постулировал такое написание KOII..
CTaHTI:!I для фосфора, ссылаясь на опыт. Авторы работы
[62] пытались обосновать одинаковую степень активности
различными предположениями о формах существования
фосфора в контактирующих фазах. '
К наиболее простым зависимостям теория реrулярных
ионных растворов приводит в случае растворов с общим
ионом, какими являются, например, чисто оксидные шла.. .
ки. Единственным анионом в последних оказывается ион
I{ислорода 02 , поэтому конфиrурационная энтропия ани..
Онной подсистемы равна нулю. При этом отличие получае..
мых конечных формул от обыч.ных формул теории реrуляр..
v
ных растворов состоит лишь в замене концентрации, выра..
Женных в атомных долях, концентрациями катионов по
Темкину (Xi). Так, химический потенциал FeO в бинарном
77
,.
расплаве FeO MnO определяется выражением:
J.'PeO == J.L eO + RT In ХРе + X Q Мn..... Fe' ( 127)
rде ХРе==nРе! (nРе + nMn); ХМп == nMn/(nFe + nМп) катионные
доли по Темкину.
Сравнивая выражение (127) с термодинамическим опре-
делением активности:
f.'l == JL + RT In й , == J.L + RT In X,1'(I)' (128)
можно найти выражение для коэффициента активности FeO
в шкале:
RJ' In "(Ре) == Х П Qpe----Mn0 (129)
Кожеуров обобщил теорию для шлака произвольноrо со-
става:
1......1 k k 1 k
RТlnV(Pe) == XiQil + XiQII X,XjQ'j'
1==1 1==1+1 1==1/==1+1
(130)
, Численные значения энерrий смешения Qij, необходи-
мые для вычисления активностей, находятся обратным рас-
четом по имеющимся опытным данным. Так, исходя из экс-
периментальных данных [54], для шлака, состоящеrо из
FeO, МпО, СаО, MgO" Si0 2 , Р 2 0б, В. А. Кожеуров рекомен..
дует следующие значения энерrий смешения (индексы со-
ответствуют номерам оксидов в приведенном порядке запи-
си): Q25== 42 кДж, QЗ5=== Q4s===.........113 кДж, QЗ6==
=== 201 кДж, остальные Qij===O. Из данных [54] получены
значения констант:
К мп == X мn "'(Мп) . 19 К МП == 6700 3 12.
. ,
(Мn] ХРе т ' ,
"(Ре)
2
К р == 1'<Р) К == 2 29. 10.....2 (131)
.
[PJ2 X e 5 , р' .
У (Ре)
(Кр мало изменяется с температурой);
К == аРе == ХРе У(Ре) . I g К == 6320 2 724
о [О) [О]' о т , ·
Подставляя приведенные выше значения QI/ в уравне-
ние (130), ПО-!lУЧИМ выражения для коэффицентов актив-
78
ноСТИ:
IgY(Fe) == (1000/Т) [2,18x Mn x Si + 5,90 (ХСа + XМg) XSI +
+ 10,50x ca Х р ]; (132) .
Igl'(Mn) === 19 '\'(Ре) (2180/Т) X S1 ; (133)
Igl'(p) == 19 l'(Ре) (10500/Т) ХСа. (134)
Пример. Определим содержание кислорода, марrанца и
фосфора в металле по исходным данным предыдущеrо при-
мера. Выражаем состав шлака в числах молей на 100 r
Ш.ТIака, но в отличие от предыдущеrо примера пренебреrаем
содержанием Fе20з в шлаке:
Оксид . . " . . . . FeO l\\nO СаО MgO Р205 5i0 2
Число мопей на 100 r
Ш.1ака . . . . . . . О, 147 О, 149 0,713 0,131 0,113 0,256
Затем подсчитываем общее число молей катионов в
6
100 r шлака*l: v i ii==O,147 +0,149+0,71З+,0,131 +2. О, 113+
1==1
+ 0,256== 1,735 и определяем ионные доли катионов, напри-
l\iep ХРе==О,147/1,735==0,085.
Катион . . . ,. Fe Мп Са Mg 51 Р
Х i . fI . . . .. О, 085 О, 086 О, 41 О О, 076 О, 148 О, 130
Вычисляем коэффициенты активности FeO, МпО, Р 2 О б .
I(оэффициент активности FeO при 1600 ос вычисляем по
уравнению (132)'; 19 ,\,(Ре)== 1,17 · 0,086. 0,148+ 3, 15. 0,410 +
+ 0,076. 0,148+ 5,60. 0,410 0,130===0,540; '\' (Ре)==3,467. Коэф-
фициент активности МпО вычисляем по формуле (133):
19.'V(Мп) ==O,540 1,17. 0,148===0,367; '\' (мп)===2,328. Коэффици-
ент активности Р 2 О б вычисляем по уравнению (134):
19 ,\,(p)==0,540 5,60.0,410== 1,756; ,\,(Р) ===0,018.
Решая уравнения (131) относительно [Mn], [Р], [О] и,
подставляя значения Xi и ,\,1 получам:
[Мп] == 0.086.2.328 ==0 201 % ( 0 212% ) .
3,37.0,085.3,467' , ,
[P) О. 130.0.018 О 324 ( О 111 % ) .
(2,29. 10.......2)1/2. 0,0855/2. 3, 4675/2 , О, о ,
[О) ==- 0.085.3.467 ;::: 0.065% (0.082%).
4,52
*1 Vi число атомов металла i в «молекуле» оксида.
79
в скобках приведены опытные значенпя*!.
Как и метод Шеllка, теория реrулярных ионных раство-
ров является по существу интерполяционным методом. Рас-
чет ведеtся на основании коэффициентов (энерrий смеше-
НИЯ), найденных из Иl\1еющихся экспериментальных данных
по равновесию в рассматриваемой системе. Однако функ-
циональная связь .между составом и термодинамическими
характеристиками в теории реrулярных ионных растворов
устанавливается несколько более обоснованным способом,
v
поэтому точность и наде)Кность предсказании оказывается
выше.
11.5. ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ ШЛАКА
КАК ФАЗЫ, ИМЕЮЩЕЙ КОЛЛЕКТИВНУЮ
ЭЛЕКТРОННУЮ СИСТЕМУ
Традиционный подход I{ описаНИIО равновесий основывает..
ся на представлении о шлаке, как взаимном растворе раз-
личных химических соединений FeO, F е 2 0 з, CaS, CaSiO..
и т. п. Непременным свойством химичеСI{оrо сосдинения,
как индивидуальноrо, так и pacTBopeHHoro в шлаке, считает..
v v
ся определенныи состав, cTporo соответствующии стехио-
метрической формуле и не заВИСЯIЦИЙ от внешних условий.
Записывая выражение закона действующих масс через кон-
центрации (активности) таких соединений, мы, кроме Toro,
постулируем их существование в виде соответствующих 1vIO"
лекул, совершающих самостоятельное тепловое движение
(это следует из статистическоrо вывода ЗДМ). В действи-
тельности конденсированные оксиды не только не содержат
обособленных молекул, но и стехиометрические пропорции
, в них соблюдаются лишь приближенно. Стехиометрические
фазы CTporo ФИI{сированноrо состава являются абстракци-
ей и возможны лишь при абсолютном нуле. Наrревание
u V
приводит К частичнои или полнои дезорrанизации струк-
туры (структурный беспорядок) и способствует нарушению
стехиометрических пропорций (нестехиометрия). Изучение
этих явлений связано с именами крупнейших химиков Бер..
толле, Менделеева, Курнакова, Френкеля, BarHepa, Шот"
тки И др. Однако лишь исследования элеКТРОНIIоrо строения
таких фаз в последние десятилетия позволили более ПОJ1НО
описать закономерности их paBHoBecHoro СУLЦествования и
.1 Экспериментальные данные по фосфору характеризуются павы..
шенным разбросом, поэтому полученное расхо)кдение не следует СЧJI
тать слишком большим.
80
(135)
J10 == J.L(O) . ( 136)
Химический потенциал кислорода в rазовой фазе можно
выразить через парциальные давления различных молеку-
"Т]ярных составляющих rаза:
""0 ' + RT In РО,
u
открыли возможность создания последовательнои тер IОДИ"
намической теории конденсированноrо состояния, об }успе-
u
хаХ которои уже упоминалось.
Оксид МеО х , находящийся в равновесии с окружающей
средой, в общем случае хотя бы в малой степени нестехио-
метричен. Независимо от механизма этоrо явления, ИЗ tе-
u
нения состава окружающеи среды сопровождаются соот-
ветствующими изменениями состава оксида. Из этоrо сле-
дует, что термодинамически он может рассматриваться как
раствор металла и кислорода. Если кристалл MgO находит-
ся в равновесии с собственным паром, то химические потен-
циалы кислорода и маrния в обеих фазах равны:
J.1Mg == JL(Mg);
( 137)
или
f.1 == 1/ 110 + RT In рl/..
о 2 О. О.
Как и большинство друrих оксидов, MgO устойчив в
u
широком диапазоне давлении кислорода, причем изменения
состава во всей области rомоrенности настолько малы, что
обнаруживаются лишь специальными методами и совер..
шенно недоступны для обычных методов аналитической хи..
мии. Однако, как бы малы ни были изменения состава, они
оказываются достаточными для Toro, чтобы поддерживать
равновесие при любых изменениях давления кислорода в
пределах устойчивоrо существования оксида. Если выра..
зить химический потенциал кислорода в оксидной фазе че..
рез активность
J-t(О) == fl o) + RT Ina(O)' (139)
то, приравнивая правые части уравнения (139) и выраже-
ний (137), (138) на основании уравнения (136), можно по..
казать, что активность кислорода в оксиде следует за из..
менениями Ро. и может изменяться в широких преде.лах:
а(о) ==Kopo==Ko.p1J.2. Здесь для постоянных введены обо-
значения
I
( 138)
;" о о
J.10 ....... J.L ( О )
КО == е RT
6 675
1 О О
2 1102 ....... J.L(O)
КО! == е RT
.
( 140)
81
.
,
Изменения активности кислорода в конденсированном
оксиде сопровождаются интенсивными изменениями актив..
ности металлическоrо компонента, в данном случае Mar..
ния. Из уравнения rиббса Дюrема следует, что
dJ.L Mg ==.......... (Хо/ X Mg ) dJ.t(o); Ха! X Mg 1. (141)
Выразив химические потенциалы через соответствующие
парциальные давления можно получить P Mg === Кр оl, т. е.
активности и равновесные парциальные давления компонен.
тов оксидной фазы MorYT изменяться в самых широких пре...
делах при практически неизменном составе фазы. Приве..
денные рассуждения можно повторить для фазы сложноrо
состава и шлаковоrо расплава. Рассмотренный пример ил
люстрирует важную особенность оксидных фаз, заключаю
щ rюся В том, что активности их компонентов, как и мноrие
физические свойства (характер и величина электронной про..
водимости, каталитическая активность, транспортные и ад..
rеэионные характеристики и др.), MorYT изменяться в самых .
широких пределах при практически неизменном составе
оксида (шлака). Состояние оксидной фазы, а значит u весь
1Со.м,nлекс ее фuзuко"хuмuческих свойств не МО2УТ быть пол.
ностью охарактеризованы указанием лишь температуры,
давления и оБЫЧНО20 химичеСКО20 состава. Необходимы до-
полнительные данные, фиксирующие уровень окислuтельно...
восстановuтеЛЬНО20 потенциала.
Удобный критерий окислительно..восстановительноrо по..
тенциала указывает теория электронноrо строения конден",
сированных веществ. Соrласно современным представлени..
ям [63 64], электронные уровни (электронные состояния)
всех атомов, образующих фазу, составляют единую кванто..
механичеСI<УЮ систему. Термодинамически эта система ха..
рактеризуется парциальной энерrией rиббса электронов
(уровнем Ферми) *1, являющейся наиболее общей количе...
v
ственно мерои окислительно..восстановительноrо потенциа...
па. Уровень Ферми J.t имеет простой физический смысл........
это работа, которую нужно затратить, чтобы ввести один
электрон в коллективную систему фазы (или удалить с
обратным знаком). В !{оличественных расчетах будем от-
носить J.1 к молю (6,03.1023) электронов. Уровень Ферми в
общем случае может быть вычислен методами квантовой
статистики на основании данных об энерrетическом (элек-
тронном) спектре KOHKpeTHoro вещества. Оrраничимся вве..
*1 Обозначение J.1 (без индекса) для уровня Ферми (<<уровня хи
мическоrо потенциала») было введено А. Ф. Иоффе [65].
82
'.
дением J1 в термодинамические формулы лишь на чисто
формальном уровне. ЭТО ПОЗВО&7JИТ проследить возможности
метода.
В работе [66] показано, что ПОЛН9е выражение для хн..
мическоrо потенциала компонента*l i оксидной фазы
u
должно содержать член, учитывающии характеристики
о '
элеI{ТРОННОЙ системы фазы: J.ti== .,l+RTlnal+J.ti(J.L); член
RT ln а; определяется лишь номинальным*2 составом фазы
и не зависит от окислительно..восстановительноrо потенциа..
1a системы. Штрих в обозначении ai введен для Toro, что..
бы подчеркнуть, что а; представляет лишь часть полной
активности элемента i. Член J.ti (J..t) В простейшем случае
может быть представлен [66] произведением валентности
элемента i в ОКСИДНОЙ фазе Vi и химическоrо потенциала
электронов:
J1l == J1 + RTlna; + f.1"l. (142)
Ниже будут рассмотрены конкретные приложения этой
формулы. Для этоrо сначала выразим J.t через измеримые в
опыте величины.
Уровень Ферми в оксидных фазах. Очевидно, что rазо-
вая фаза, находящаяся в равновесии с оксидной, всеrда со-
держит кислород, поэтому уровень Ферми удобно выразить
через равновесное парциальное давление кислорода как
величину, доступную для прямых измерений. В условиях
u
равновесия химическии потенциал кислорода в шлаке ра..
вен химическому потенциалу кислорода в rазе: 11(0) ==J.10.
Химический потенциал aToMapHoro кислорода в rазовой фа..
зе JJo==fl +RT ln РО и в шлаке
(o) == " o) + RT In aio) + "(о) . (143)
.
Приравнивая правые части и преобрззуя, получим вы..
ражения для зависимости J.t от давления кислорода:
J1 == J1 0 RT In a /V(o) + RT In P V(O); (J.L O == " o ») .
(144)
Для фазы, мало изменяющей состав в широком диапа..
*1 Компонентами оксидной (как и металлической) фазы здесь 11
далее считаются элементы Периодической системы элементов д. и. MeH
делееВ8.
*2 Т. е. обычным составом, например, по данным химическоrо aH8
лиза.
6*
83
зоне давлений кислорода, a ===const и выполняется соот-
ношение
== A RTlnp 2.
(v(O) == 2; А == const),
( 145)
И&lIИ, используя известную связь между равновесными дав-
лениями РО и Ро. в rазовой фазе, можно J.t выразить через
давление двухатомноrо кислорода:
А I 1/4
f.t == RT про..
Сорбционная способность шлака по отношению 1\, при..
.м.есям. Если rазовая фаза, равновесная со шлаком, содер-
u .
жит малорастворимыи в шлаке rаз t, то, записав условие
равновесия Jl(i)=== f.ti И выр жения для химических потенциа-
лов элемента i в rазе и в шлаке, после преобразований мож..
НО получить выражение растворимости (равновесной кон-
центрации) rаза в шлаке:
К Р P 'V./4
At (1) 1 l d. ·
Если исходить из парциальноrо давления двухатомноrо
rаза, то получим аналоr закона Сивертса для шлаков;
х == К р1/2 p'V f /4
(1) 12 12 i 02 ·
Специфика оксидных фаз проявляется здесь в наличии
\' /4 'v /2
дополнительноrо множителя Po (или а(Ь]).
Этот результат наrлядно иллюстрируется, например,
опытом насыщения шлака азотом. Шлак системы CaO
SiО2 А120з выдерживается
u
при постояннои температуре в
а'Рмосфере с Р N J ===const и из-
ЦООI fJOl 0,1 [DJ Fe (pacт8.)} О/О
(N)
19 p'/Z
N Z
I
"'2.
16
..../5"
19p a
z.
( 146)
(147)
( 148)
2
. -..) о
-....J
t:::J) ...
2 '
......'.,./1
"
1B 1" 1! 10 8 б ZgPO'l.
Рис. 12. Зависимость растворимости азота в шлаке от окислительно восстанови
TeпbHoro потенциала
Рис. 13. Сорбционная способность шлака по отношению к примесям L," (Ofoi)/
/а (%i)/[%i] В различных ОКlIслительно восстановительных условиях (В Bepx
(1]
ней части рисунка дана ориентировочная шкала окисленности железа)
84
меняющимСЯ РО!. В соответствии с обычным законом Си..
вертса в этих условиях следовало бы ожидать постоянства
содержания азота в шлаке. В действительности X(N) ИЗ 1е-
ияется в широких пределах вместе с равновесным давлени-
еМ кислорода в полном соответствии с формулой (148)
(рис. ,12) 167]. Наклон прямых в таких координатах опре..
деляется валентностью примеси, поэтому подобные опыты
v
MorYT использоваться как экспериментальныи метод опре..
u
деления валентности примесеи в шлаках.
Сорбционная способность шлака по отношению к при..
месям зависит и от номинальноrо (аналитическоrо) соста-
ва шлака. Однако один и тот же шлак может изменять
свою сорбционную способность на несколько порядков ве..
.1Jичины в зависимости от окислительно-восстановительноrо
потенциала среды. Очевидно, что зависимость, аналоrичная
выражению (148), получится, если поддерживать постояи..
ной концентрацию (активность) примесноrо элемента в
l(онтаКТИРУlощем со шлаком металле:
Х К а P v./4 К , а а У./2
i - 1 [ i ] Z l [ 1] Z ] ·
О. [О
На рис. 13 приведены кривые зависимости сорбционной
способности шлака 50 О/о СаО, 50 О/о А1 2 О з от РО! при 1550 ос
по отношению к раЗЛИЧНЫ f элементам. Ki вычис.пены по
данным различных авторов, аи] отнесены к активности эле-
. u '
мента t, соответствующем концентрации ero в железе, рав"
ной 1 о/о (стандартное состояние 1 О/о"ный раствор i в же-
лезе) .
( 149)
11.6. РАСПРЕДЕЛЕНИЕ ЭЛЕА ЕНТОВ
МЕЖДУ МЕТАЛЛОМ И ШЛАКОМ
Если две или несколько фаз находятся в равновесии, то все
элементы, образующие данную систему, содержатся в каж..
дой из фаз. При этом для любоrо элемента должно выпол-
няться условие равновесия: J.t(i) == J.L[i]. Химический поте н..
циал элемента i в шлаке, соrласно выражению, (142), равен:
о '
Jl(i) == !l(I)+RT ln a(i) + ,\,i fl. Для металла будем исходить из
о
выражения t[i] === f..t[l] + RT In a[i]. Выполнив преобразования,
получаем выражение для константы распределения эле-
мента i между металлом и шлаком:
, К , ( , /а ) ("iJ.1)/(RT) ( 150)
1 а(о [i] е ·
Чтобы исключить множитель, содержащий неконтроли-
руемую обычным химическим составом величину Jl, возве-
Дем выражение (150) в степень l/Vi и поделим на аналоrич-
85
ное выражение для любоrо друrоrо компонента (i):
K i / i == (aii)/a[i]) 1/"i (a[j]/a;j) )l/VJ. (151)
Полученное выражение характеризует константу рас-
пределения элементов i и j в системе металл.......... шлак. Обыч-
НО выражения констант получаются из рассмотрения тех
или иных реакций и 3ДМ. Написание реакции требует
u
знания конкретных соединении, находящихся в Ш 1аке.
Однако отсутствие такой информации во мноrи случаях
существенно усложняет задачу и вносит элемент неопреде-
ленности. Рассматриваемый путь позволяет избежать этой
трудности.
При описании распределения фосфора в уравнении (151)
вторым элементом (j) может быть любой из присутствую-
ЩИХ в системе, например кислород:
К ( , I ) 1/5 ( ' J ) 1/2
Р/О == а(р) а(р) a(O)/l10J
(i=aO; "о == 2; \'р ==+ 5).
Это соответствуе! К р , полученной из балансовоrо уравне-
ния окисления фосфора, записанноrо в следующем виде:
,
1/ 5 [Р] + I/ [O] === Pt/5 0 1/2. Если j == Ре, то Кр/Ре == (а(р)/
/а[р))1/5 (a[Pe]/a Pe»)1/2 ("Fe ==+2), что соответствует реак-
ции обмена 1/5 [Р]+1/2 (Fe) 1/5 (Р) +1/2 [Fe], ипи 1/5 [Р] +
+1/2 (FeO) :=:1/5 (РО 2 ,5) +1/2 [Fe] и Т. д.
Оценка активностей. Активности элементарных компо..
нентов шлака а; входящие в приведенные выше формулы,
эквивалентны активностям оксидов по Кожеурову а ;i) ==
,
===Xi. 'Vi или по Темкину a(i) ==Xi. Оба эти метода MorYT быть
,
использованы для оценки активностей а! катионных (Yi:>
>0) компонентов шлака. В качестве а; MorYT быть Т8I{же
u
использованы экспериментальные значения активностеи
соответствующих оксидов.
Метод теоретической оценки активностей компонентов
шлака, полностью обеспеченный численными параметрами,
приводится в работе [66]. Соrласно этому методу, актив-
ность компонента шлака выражается формулой a o ==
===X(i>'I'i rде X(i).......... полная аналитическая концентрация эле-
мента i в шлаке, выраженная в атомных долях; 1j)i........... атом-
ный коэффициент активности, равный
А
..1, -. [ х е----- (f!,'J/RT) ] 1 ( 152)
't' i (/) ·
1==1
86
,k полное число компонентов шлака (число сортов ато"
1>10 В ); 8ij энерrия обмена, равная 8ц==1/2 (X /2 x/'2)2;
i, 'Xj.......... атомные пара метры элементов i и j. Значения х
[66] приведены в табл. 10. Формула (152) учитывает лишь
конфиrурационную энтропию смешения, однако, как пока..
за.НИ мноrочисленные расчеты, она дает правильные оценки
u
равновесии в системе металл.......... шлак.
т а б ..тJ И Ц а 10. Энерrетические параметры элементов
Э.1емент Элемент и Элемент х Элемент х
н 448 Мп 251 Cd 280 Ас 117
Li 88 Fe 335 Sп 280 U 88
Ве 218 Со 280 Sb 310 Ри 163
В 197 Ni 464 Те 427 Am 163
С 29 Си 418 1 653 Ст 163
1\ 732 Zn 243 Cs 54 Bk 163
О 1255 Ga 247 Ба 79 Cf 163
F 1544 Ge 385 La 138 Се 138
r\a 79 As 385 Hf 188 Pr 138
\g 146 se 556 Та 113 Nd 163
Al 126 Br 812 W 238 Рт 163
Si 172 Rb 59 05 427 Sm 163
р 205 Sr 96 Ir 427 Eu 163
S 791 У 138 pt 469 Gd 163
CI 992 Zr 226 Au 510 ТЬ 163
К 63 Nb 280 Hg 314 Dy 163
Са 105 Мо 276 Bi 314 Но 163
Sc 163 Ru 385 Ро 385 Er 163
Ti 134 Rb 427 At 469 Tu 163
V 184 Pd 427 Fr 46 УЬ 163
Cr 251 Ag 360 Ra 79 Lu 163
Прuмер. Рассчитаем содержание примесей в металле по
исходным данным примера, paccMOTpeHHoro ранее (с. 79).
Для этоrо сначала выразим состав шлака в атомных долях.
Определяем числа мелей оксидов в 100 r шлака (mi). На-
пример, тСаО == О/о СаО/МсаО ==39,94/56,1 ===0,713. Находим
далее число молей элементов в 100 r шлака (ni), например
ПСа == тсзо === 0,713; nFe == mFeO +2 тРеJО з === 0,147 + 2 Х
Х 0,011 == 0,169; ПО === тСЗО + 2 mSiO J + mFeO + 3 тFРzОз +
+ MgO + 5тР 2 0 а +тмпо ===2,250. Находим сумму всех ni
общее число мелей в 100 r шлаI<а. n===3,894. Вычисляем
атомные доли элементов: X(i)===ni/ n; Х(Ре) ===0,169/3,894==
====0,043. Для вычисления атомных коэффициентов активно-
сти 'Фi сначала оцениваем величины 8il. Например, 8Pe SI ==
87
== 8Si Fe == 1/2 (XVe2 )f 2) Е== 1/2 (3351/2 1721/2) 2 == 13,509 кДж;
8Ca P == EP Ca ===1/2(1051/2 2051/2)2==8,368 кДж; Затем на-
ХОДИМ множители e (eijIRT)1
e........eFe........Si IRT == e---lЗI=jО9/8,31.10 З.187З == е........ О ,8716 == 0,4179,
e eCa pIRT ::::. 8, BIB.31.10 3.1873 == 0,5821.
И, наконец, находим Ч'i. Например,
k
,\1 1 == х . e eFe.......jIRT == х e EF c8 I3L +
I'Fe и) (Са)
j==l
+ х e eFe Si/RT + + х e.......f,F o/RT ==
(Si) ... (О)
== 0,183.0,1218 + 0,066.0,4179 + 0,043.1,000 +
+ 0,034.0,2858 + 0,058.0,6012 + 0,038.0,821 +
+ 0,578 .О,ООО 0,1699. 'ФFе == 1/0,1699 == 5,886.
т а б л и ц а 11. Состав шлак!. и валентность элементов
I ,
Элемент х. ". ,р. Й(l) Элемент х. \1. 1]>. а(о
J 1 1 1 1 1
Са О, 183 2 3, 154 0,577 Р 0,058 5 3 t 139 O, 182
Si 0,066 4 2,919 О t 193 Mn 0,038 2 3,736 O, 142
Fe 0.,043 2 5,886 0,253 О 0,578 ....2 1 , 730 Il , 000
Mg 0,034 2 2,873 0,098
I
При м е 11 а н 11 я. х. выражено D атомных J,OJlJlX.
1
в табл. 11 приведены вычисленные таКИ 1 образом зна..
,
чения 'Фi и a(i) ==X(i)1jH, а также вычисленныЙ элементный
u
состав шлака и типичные для условии сталеварения Ba&lТIeHT..
ности элементов. Значения констант Ki/J MorYT быть взяты
из термодинамических справочников или оценены по I1 tею..
ЩИl\1СЯ данным о распределении э"Т]ементов. Распределение
}{ислорода в соответствии с уравнением (151) описывается
выражением:
а'.....1/2 a 1 / V j ( а 1 /"}, a 1 / V o )
К . == (о) · (/] == [О]. [j] (153)
0// 1 { 2 'l/v. '1/2 '1/v ·
а[о · a(j) } а(о) · a(j) J
В качестве BToporo элемента j в рассматриваемом при
мере f\ orYT быть использованы железо, марrанец и фосфор,
88
поскольку известны концентрации этих элементов в обеих
q)ззах. Учитывая, что а(о) ==1 (СМ. табл. 11), а[о] [О]и
a[Fe]== 1, получим
1/2 1/2
К == а[о]. a(Fe) == ( [О] ) 1/2
О/Ре '1/2 '1/2 ' ·
0(0) .а(Ре) а(Ре)
Константу K O / Fe можно определить, используя, напри-
мер, известные данные о равновесии железа с собственными
оксидами_ Соrласно данным работы r2], [О] 187з==0,23 о/о.
Подставив эти данные в выражение (154), находим /Fe ==
===0,23/1 ===0,23. В раССfvlатриваемом примере [О] ===Kb/Fe.
.a Fe) ===0,23 - 0,253==0,058 о/о. Вычислим кон центрацию кис..
лорода по данным о распределении марrанца:
1 /2 1,2
К Qlo]-а[мп] .}" [O].[Mn]
О/Мп == '1/2 '1/2' \ О/Мп , ·
0(0) · а(мп) а(мn)
Учитывая, что ампо==а;мп) .а;О} ==а;мn), для определения
КО/Мп воспользуемся данными работы [2]:
К 2 == К == !%ОН%Мп]
О/Мп Мп а(мпо) ·
JgK /Mn == ( 127БО/Т) + 5,68;
( 154)
( 155)
(156)
') ,
К К 2 00737 [ OL OO] == КО/1\,\п.а(мп)
1\'\п(1873) == О/Мп ==, ; 1(J
[%Мп]
== 0,0737.0,142 == О 049%
0,212 ' -
При помощи этоrо уравнения, очевидно, можно вычис"
LТ1ИТЬ концентрацию марrанца по заданному содержанию
I\ИСLТIорода в металле:
2 '
[Мп] == КО/мпа(мп) == 0,0737.0,142 =о: О 128%.
1%0] 0,082 '
Рассмотренные примеры ИЛЛIОСТРИРУЮТ основные прин..
ципы всех разработанных в настоящее время практических
методов расчета равновесий. Опыт показывает, что для
большинства массовых технолоrий и методов производства
существующая теория позволяет делать обоснованные
u
предсказания с достаточнои для праl{ТИКИ степенью точ"
Насти.
.1
r n а в а 111
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
В СТАЛЕПЛАВИЛЬНЫХ ПРОЦЕССАХ
Поверхностные явления иrрают оrромную, а во мноrих слу..
чаях решающую роль в процессах производства и обработ...
ки стали и сплавов [69 74]. Непосредственно с поверхно-
стными характеристиками rраницы раздела фаз связаны
процессы зародышеобразования при кипении и деrазации
металла, зарождения, укрупнения и удаления неметалличе-
ских включений. Смачивание и растекание в системе ме-
талл шлак определяют такие важные технолоrические-
характеристики, как прилипаемость, отделение металла от
шлака, их проникновение в капиллярно пористые материа..
лы, пропитку оrнеупоров и др. Способность I( пенообразо-
ванию и устойчивость шлаковой пены связаны с образова-
H el\1 при поверхностном кипении на пузырях СО прочных
адсорбционных пленок.
111.1. ОСНОВНЫЕ ПОНЯТИЯ
IloBepxHocTHoe натяжение. Особенности rраницы раздела
фаз проявляются в том, что свойства фаз вблизи поверхно..
сти существенно отличаются от свойств в объеме. Это отли-
чие связано прежде Bcero с тем, что энерrия молекул на
rранице отличается от энерrии молекул в объеме. Межча..
u
стичные силы, деиствующие на молекулы находящиеся в
объеме, уравновешены, в то время как силовые поля l\10ле..
кул на поверхности несимметричны. Оба типа молекул име..
U.
ют различные координационные числа, различныи характер
тепловоrо движения. Для описания термодинамических
свойств системы с учетом эффектов, связанных с наличием
поверхности раздела фаз, rиббс ввел понятие поверхноет..
HOZO сzущен.uя. Поверхностное сrущение свободной энерrии
характеризует рост свободной энерrии системы при увели..
чении межфазной поверхности на единицу. Известно, что
для Toro, чтобы создать или увеличить поверхность разде-
ла фаз, нужно затратить работу. Величина, численно
равная работе обратимоrо изотермическоrо образования
единицы поверхности, называется коэффициентом поверх-
НОСТНО20 натяжения 1 (J 1. в этом случае поверхностное на-
тяжение имеет размерность работы (джоуль) на единицу
поверхности: I а I ===Дж/м 2 === 103 мДж/м 2 . Часто коэффици-
ент поверхностноrо натяжения определяют как силу, дей..
90
ствующую на единицу длины. В этом случае [о] === Н/М ===
==== Дж/м 2 .
Работа адzезuu. Для Toro чтобы разделить две несме-
шивающиеся жидкости (металл шлак) по поверхности
их соприкосновения, равной, например, 1 см 2 (рис. 14),
нужно затратить работу на со-
здание двух новых поверхно-
стей жидкость rаз по 1 см 2 ,
равную 0"1+02 (rде (1( и <12
поверхностные натяжения обе-
u
их жидкостеи на rранице с
rазом). Однако в результате
r8Koro разобщения фаз ликви-
дируется поверхность их со-
Рис. 14. К вычислению рабо ты aд
прикосновения, в резу.пьтате rеЗИll
чеrо выиrрывается работа, рав"
I-Iая межфазному натяжению
(Jl,2. Работа адrезии (W a ) равна W a ===al +a2 (11,2. Чем боль-
ше работа адrезии между металлом и шлаком, тем сцепле.'
ине двух фаз больше, т. е. тем труднее отделить металл от
шлака. Условием полной смешиваемости двух жидкостей
является Wa===O. В этом случае межчастичные силы каждой
u
пз жидкостеи не препятствуют смешению, так как каждая
u u u u
из жидкостеи притяrивает молекулы друrои с тои же силон,
что И собственные молекулы.
Работа коzезuu. Работой коrезии (W К) называют рабо-
ту разрыва столба жидкости с поперечным сечением в
1 см 2 . В этом случае работа, равная 2аж r, затрачивается
на создание двух новых поверхностей: Wк===2аж r. Сопо-
ставление работы адrезии и коrезии позволяет судить о со-
отношении сил притяжения между частицами различ-
ных фаз.
Аdсорбцuя. Изменение поверхностноrо натяжения l\1e-
А u
таллическоrо или шлаковоrо расплава под деиствием до-
бавки одноrо из компонентов связано с изменением состава
поверхностноrо слоя, который обоrащается i"'TbIM }{омпо-
нентом, характеризующимся более слабым силовым полем.
Рассмотренное явление принято называть адсорбцией r.
Адсорбцию на поверхности раствора обычно вычисляют по
формуле rиббса, моль/см 2 :
. r . ==.......... с i da
1..
RT dCi
Для растворов, которые пе ТIЬЗЯ отнести к классу разбав-
ленных, рекомендуется уравнение rуrенrейма Адама, в
6,
61.l
1
G z
(157 )
91
}{ОТОРОМ В отличие от уравнения (157), rде r1===0 для двух-
I{О 1понентной системы r 1 ===1 2
r i == Qi (l xд . d<J . (158)
RT dai
Прuмер. Вычислить величину адсорбции серы на поверх-
ности жидкоrо железа при 1873 1\ по экспери:ментальным
данным зависимости поверхностноrо атяжения а расплав..
ТIeHIIoro железа от концентрации серы [5]:
[ S] , О/О . . о. о о , 03 О , 09 О, 14 О, 1 7 О, 22 О ,33
а, мД>к/м 2 . .. 1790 1410 1210 1115 1090 1045 980
По этим данным строим rрафик зависимости поверхно-
CTHoro натяжения от состава. Затем ПрОВОДИ 1 kacate-!lЬНbIе
u
К I<РИВОИ и находим TaHreHcbI уrла наклона в задаIIНЫХ точ-
I<ax 1 [S] ==0,05 о/о; 2 [5] ==0,10 о/о; 3 [S] ===0,15 О/о и 4 [S] ==
===0,25 о/о. Они соответственно равны tg аl ===3700; tg а2==
==2100; tg аз== 1400; tg <Х4 == 620. Величина адсорбции в
каждой точке равна r 1 == (0,05. 3700) / (8,31. 103. 1873) ==
=== 1,19. 10 5 моль/м 2 ; r 2 == 1,28.10 5; r з == 1,35.10 5; r 4 ==
==0,99. 10 5 моль/м 2 . Адсорбция rs с увеличением 'концен..
трации серы растет и при неКО10РОМ значении [5] дости"
raeT максимума (r s rnах). С последующим увеличением
[S] численное значение rs снижается. Это связано с тем,
что уменьшение dajdc опережает рост концентрации [S].
Из уравнения (157) следует, что если добавка компонента
к расплаву приводит к снижению nOBepxHocTHoro натяже..
ния, т. е (dafdci) <О, то адсорбция будет положительной
(ri>O). Это означает, что концентрация i"Toro компонента
на поверхности будет больше, чем в объеме. Конечные объ..
емные и поверхностные концентрации определяются равно..
весием между движущей силой диффузии, стремящейся
выравнять концентрацию, и молекулярными силами, стре-
u u .
мящимися создать поверхностныи слои, соответствующии
повышенной свободной энерrии.
111.1. ПОВЕРХНОСТНОЕ НАТJlЖЕНИЕ
ЖИДКИХ МЕТАЛЛОВ
Поверхностное натяжение жидкоrо железа, измеренное
различными методами при 1550 ос, составляет 1800
1880 мДж/м 2 . На aFe существенное влияние оказывают
примеси, особенно поверхностно активные, даже при нич"
тожном их содержании. Значения (J' для некоторых жидких
металлов приведены в табл. 12. Температурная зависимость
!2
поверхностноrо натяжения хорошо описывается уравнением
а == 0'0 + da/dT (Т ......... Т пп), (159)
u
rде о' и 0'0 поверхностные натяжения при искомои темпе..
ратуре Т и температуре плавления Т пл; da/dT темпера-
турный коэффициент nOBepXHoCTHoro натя}кения, da/dT <о.
т а б л и ц а 12. Поверхностное натяжение чистых металлов
Металл daldT '. ос а. Металл d(JldT t, ос (J',
мДж/м 1 МД)J\/N
,
Fe 0,35 1550 1850 Ti 0,26 1720 1330
AI О, 14 700 850 Si 0,09 1550 750
Мп 0,31 1550 1000 СО 0,40 1550 1830
Ni 0,39 1500 1750 Zr 0,20 1880 1330
Cr 0,32 2020 1590 Мо О, 18 2607 2220
V 0,31 1910 1950 W 0,29 3377 2500
I
111.3. УРАВНЕНИЯ ЗАВИСИМОСТИ
nOBEPXHOCTHOrO НАТЯЖЕНИЯ РАСПЛАВОВ
ОТ СОСТАВА
Ltля расчета поверхностноrо наТЯJКения растворов предло
жено большое число уравнений [75]. В большинстве случа-
u
ев эти уравнения применимы лишь для двоиных систем 1I в
более оrраниченном масштабе......... для тройных.
Формула Ш UШКОВСКО20 удовлетворительно описывает
концентрационную зависимость nOBepXHocTHoro натяжения
растворов, для которых выполняется уравнение Ланrмюра:
(J == (11 ........ Z RT In (1 + Ьс), (160)-
rде (1 и 0'1 поверхностные натяжения раствора и чистоrо
растворителя; с.......... концентрация paCTBopeHHoro вещества;
z и Ь -постоянные коэффициенты в уравнении Ланrмюра.
Ltля металлурrических расплавов уравнение (160) мож..
Но применять вплоть до нескольких процентов растворен..
Horo вещества.
Уравнение Шишковскоrо часто записывают следующим
образом:
о' == 01 (RT/ro) In [1 + х (Р ........ 1 )], (161),
rде ю поверхность, занимаемая одним молем растворите..
1Я (мольная поверхность); тоrда: 1/00 число молей на
1 см 2 поверхности; р............ параметр, характеризующий ка..
пиллярную активность paCTBopeHHoro вещества; х rvIОЛЬ"
Ная доля paCTBopeHHoro вещества.
93
п рИм'ер. На основе формулы (160) выведем уравнение,
описывающее поверхностное натяжение расплавов системы
Fe O при 1600 ос, по следующим данным: О'Ре ==
== 1800 мДж/м 2 , площадь, занимаемая одним атомом КИс..
,1Iорода, ы==8,1.10 20 м 2 . Величину z в уравнении (160)
можно определить по формуле: z== 1/00 N а; z== 1/ (8,1.10 20>;
Х6,О2.10 2З ) ==2,05. IO 5 моль/м 2 .
Исходя из экспериментальных данных a==f (с) коэффи"
циент Ь можно вычислить ДВУМЯ способами. При малых с,
раскладывая ln(l+bc) в рЯД, имеем ln(l+b,c) ==Ьс. Тоrда
(J==(Jl zRTbc. Отсюда Ь == (al a) /zRTc. При с[о]==О,ОО5 о/о;
(Jl a==200 мДж/м 2 ; Ь== (200.10 З)/(2,05.10 5.8,3.1873)<
ХО,ОО5) === ]26.
Расчетная формула ДЛЯ а имеет вид а=== 1800 732 19
( 1 + 126 с). Коэффициент Ь lvlОЖНО найти также по уравне-
I-IИЮ Ланrмюра:
r == zbc/(l + Ьс), (162)
r де z........... число адсорбционных мест; уравнение (162) можно
представить в следующем виде: C(Q]/r[Q]==c[O]/Z+ llbz. От-
КТIадывая значение c[O]/r[O] по оси ординат против с[о] по-
лучим прямую линию. Начальная ордината этой прямой
равна l/bz а уrловой коэффициент l/z. Из этих данных
l\10ЖНО вычислить Ь. А. А. Жуховицкий [76] предложил ряд
v
уравнении, при помощи которых можно вычислить поверх-
ностное натяжение растворов в более широкой области !{он-
центраций, чем на основе формулы Шишковскоrо.
Уравнение ЖуховиЦКО20. Поверхностное натяжение би-
HapHoro совершенноrо раствора (а) от состава зависит сле-
дующим образом:
(т == 01 n 1 RT In (1 Х 2 + Х 2 С), (163)
rде al поверхностное натяжение чистоrо nepBoro компо.
нента; Х2 мольная ДОЛЯ BToporo компонента; ,C===eal aJlnlRT
nl число молей nepBoro компонента на 1 см 2 поверхности.,
Из уравнения (163) следует, что при Х2===О a===al, а при
Х2=== 1 а===0'2.
В ряде случаев хорошее совпадение экспериментальных
1I расчетных данных наблюдается при использовании урав..
нения Жуховицкоrо для реальных растворов, в котором
учитывается различие между аI{ТИВНОСТЯМИ компонентов в
объеме и на поверхности [77].
I1puMep. Найти уравнение зависимости поверхностноrо
натяжения ОТ концентрации марrанца в системе Fe n,
<>бразующих совершенный раствор, на основе следующих
94
данных: при t == 1550 ос, аРе == 1850 мДж/м 2 ; ОМп ==
=== 1060 мДж/м 2 ; 'Ре ==0,126 нм; 'Mn===0,130 ИМ. Поско.п:ьку
Fe Mn образует совершенный раствор, то воспользуемся
уравнением (163). Вычислим nFe, приняв, что 'Ре ==
===0,126 им: ...
n ==
Ре
1
ЮРе N А
1
fi eNA
........
1 == 3,3.1 0......5 МОЛЬ/ 12;
3, 14.1 ,26 .10""'!o. 6,02.10 3
С == e«JFe...... (JMn)/пpe RT == е( 185Q.--.I060) 10.......8 /3,3 .10 O. 8.31 .18:23 =:: 4,85;
(J == 1850.10....3.......... 3'3.10.......5.8,31.1823.2'3 Ig (1 Х Мп +
+ 4,85х мп ) ;
о' == 1850 .10.......3 1150 Ig (1 Х Мп + 4,85х мп ) Дж/м2. (164)
На рис. 15 приведены рас-
четные значения (1, вычислен..
ные по уравнению (164).
Уравнение Попеля u Пав--
лова. В отличие от уравнений
(160) и (163). которые для
расчета а раствора требуют
u
знании лишь характеристик
чистых компонентов 0"1 и (1)
уравнение С. И. Попеля и
В. В. Павлова [75] требует
знания большоrо числа пара-
метров. Уравнение имеет вид:
k
у ro %, e(Jrol AII RT == 1,
v
1==1
( 165)
1800
1400
1200
\
1000
О qz 4 0,6 48 ХI1П
Рис. 15. Изотермы поsерхностноrо
натяжения системы Р Мп при
1823 К. вычисленные по уравнению
Жуховицкоrо (1) и Попели Пав-
пова (2)
rде (J поверхностное натяжение раствора; V(J), V моль..
ные объемы раствора в поверхностном слое и в объеме;
Юi парциальная мольная площадь i"Toro компонента; зна-
чение Юi вычисляют по формуле ;i===fiN ЗVi/3. В первом
приближении fi=== 1; i работа выхода моля вещества в
N u u Л' Л О RT 1 л о о о о
оверхностныи слои; U.t===UI a; n Yi, rде UI== f1 ,(J)I. 0i,
(j) .......... поверхностное натяжение и мольная площадь чистых
Компонентов соответственно. Величина сх характеризует до-
95
JIЮ недостаlОЩИХ связей для элементов Fe, Ni, Mn, Cr, V,
Ticx==1/4; для Si, С, Р, На==1/ 6 .
Пример. Вычислим поверхностные натяжения расплавов
по уравнениям Попеля и Павлова при 1550 ос: O'Fe ==
== 1850 мДж/м 2 ; О'Мп === 1060 мДж/м 2 . Расчетная формула
u
Д,ПЯ двухкомпонентнои системы Иl\1еет вид:
ХРе e(HuFe I1F/RT + Х Мп е(J(J)мп l1мп'RТ ==
ХРе У Ре + Х Мп V МI1
(а) .. ro
ХРе V Pe + Х Мп У Мп
.
( 166)
............
ВЫЧIIСЛИМ последова тельно V Fe, V Mn, ЮFе, ЮМп, L1 pe , L\Mn.
1. Посколы<у железо 11 марrанец образуют раствор,
б fJИ3КИЙ по свойствам к совершенному, то V ==0 и V 1 ==
т
== \'1 , Y2==Y (парциальные мо,пьные объемы компонен-
то в равны мольным объемам чистых компонентов). TorAa
V Fe ==Mpe/PFe ==55,85/7,15==7,81 смЗ/моль; У Мп ==54,94/
/6,75===8,29 см 3 /моль.
, ......... 1/3 /3
2. Парциальная мольная площадь ooi==fiN A V l прини-
............
1\faeM fi== 1, тоrда ЮРе ==8,4.107. 8,252/3==3,4.108 см 2 ; ООМп ==
== 8,4. 107 · 8,932/3 == 3,7 · 1 ()8 см 2 .
З. i==fj a RT ln 1'i, так I{aK раствор близок к совер-
шенному, то i==д. ==(J (J) J1Fе == 1850.3,32.10 l ===6,14X
ХIО 7мД)к,6мп==1060.З,45. 104==3,68.107 мДж.
, oroF ...... F /RT 3.32.1040'----6.14.107/1823.8.31.101........
X e == X Fe е е е == \Pe е ........
== xFeA. (167)
aW M А М / RT 3.45.1040.....3.68 .107/1823.8.31.101
X U == Х Мп е n n === X Mn е
== ХМ. В,.
И, наконец, вычислим X e И X n :
х6.) m' /( 6)' + ы' ) . (а).......... ш' /( 6)' + т' )
Fe Х ХРе Х Мп ' Х Мп Х Мп ХРе Х Мп .
Подставив полученные выражения (168) в уравнение
{ 166), ПОЛУЧИ1vI:
/( 8,25AxFe ,
АхРе + ВХ Мв == (8,25x Fe + 8.93х мп ) +
Ax Fe + Bx Mn
8,93Х М8 )
+ ,
МРе + ВХ Мп
( 168)
( 169)
( 170)
96
или окончательно расчетная формула для вычисления име-
еТ ВИД, мДж/м 2 :
781x + 8 29х === О 136х е3,32а/1515 + о 731х e3.45a/1515
, Fe ' Мп ' Fe ' МП ·
(171)
Вычисленные по этой формуле значения о' расплавов
Fe n при различных концентрациях ХМп приведены на
рис. 15.
111.4. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ РАСПЛАВОВ
НА ОСНОВЕ ЖЕЛЕЗА
Все JIеrирующие и примесные элементы (кроме вольфрама)
являются поверхностно активными элементами. Введение
10 О/О (ат.) во,пьфрама увеличивает поверхностное натяже..
ние железа примерно на 150 мДж/м 2 . Сера и кислород об-
ладают наибольшей поверхностной активностью. Поверх-
ностное натяжение чистоrо сульфида (FeS) при 1550"С
равно 550 мДж/м 2 . Поверхностное натяжение FeO при
1450 ос равно 600 мДж/м 2 . Для вычисления повеРХНОСТНОj'Q
натя>кения сплавов на основе железа (исключая растворы
серы и кислорода) с. и. Попель и В. В. Павлов [751 реко-
мендуют пользоваться обобщенным уравнением Шишков...
CKoro (161):
а == а Fe 2000 Ig [1 + (Р i 1) Х l] . (1 72)
При: (0=== 17,4. 103 м 2 множитель, стоящий перед опера-
тором Ig, равен (2,3RT)/ro (2,3.8,31.103.1873)/(17,4 Х
XI0 3 ) ===2000 мДж/м 2 . Для расчетов о' при 160ООС по урав..
нению (172) нужно пользоваться значениями F i [75], ко-
торые приведены ниже:
Элемент . . .. Fe
F i ( Р а с Ч) . . .. 1
Fi(энспер\ . . .. 1
с
2,3
2,0
Si
2,7
2,2
Мп
3,6
5,0
Ni Cr Ti
1,4 2,1 0,12
1,4 2,5 О, 12
. . . .
v
0,19
0,60
Мо
р
1,8
1,5
S
150
500
о
800
1000
Продолжение
Н N
1,0 150,0
Элемент
F i (расч\
F i(экспер)
. . . .
. . . .
0,45
Значения F i при температурах, отличных от 1873 К, можно
Приближенно вычислить по формуле: F T==F g /T. Экспери-
ментальные значения а и расчетные, полученные по фор-
Муле (172), различаются не более чем на 5 о/о. Для оценки
7 675 97
nOBepXHocTHoro натя)Кения 1Кидких сталеи и чуrуна реко-
мендуется следующее уравнение:
(1 == (1Ре 2000 Ig Р, x l ' (173)
.
rде i элементы: Fe, С, Мп, Si, S, Р и др.
Уравнение (173) удовлетворительно описывает экспери-
ментальные данные, если концентрация кислорода и серы
не превышает 0,05 и 0,1 О/О соответственно. Авторы работы
[75] рекомендуют уравнение, в котором для кислорода и
серы используется ю:::::34,8. 10 4 м 2 : а==аРе 2000 19 FiXi
......... 1000 [Ig (1 + F аХа) + 19 (1 +Р sxs)].
Пример. Вычислить а для стали следующеrо состава:
0,15 .o/0 с; 1,16 о/о Mn; 0,54 о/о Si; 17,68 о/о Cr; 8,87 о/о Ni;
0,014 О/о s; 0,0075 о/о О при 1873 К. (Тет == аРе ..........2000 Ig(FFe.
.ХРе + РсХс + РМnХМn + FSixSi + Fcrxcr + FNiXNi + Fsxs +
+ РаХа); а ст ==1800 2000 19(I.0,724+2.0,007+5.0,012+
+ 2,2.0,0126 + 2,5.0,192 + 1,4.0,084 + 1000.0,0003 +, 500 х
ХО,0003) == 1240 мДж/м 2 .
ОцеНка размеров адсорбuрующuхся частиц. Зная мак-
симальную адсорбцию rr ax , можно вычислить площадь Qi
частицы, адсорбированной на поверхности раствора: Qi==
=== 1/ (rr ax N А). Например, размер площади, приходящейся
на один атом серы в поверхностном слое ее расплавов с
железом при r ax==13,I.I0 моль/м 2 , равен Qs==I/(13,lX
ХIО .6,О2.102З) == 12,6.10 20 м 2 .
111.5. ВЫЧИСЛЕНИЕ КОНЦЕНТРАЦИИ
В ПОВЕРХНОСТНОМ СПОЕ
Как известно, адсорбция по rиббсу r 2 (моль/см 2 ) характе...
ризует избыток BToporo компонента в поверхностном слое
по сравнению с ero содержанием в одинаковой порции объ-
eMHoro раствора, т. е. адсорбция по rибб у характеризует
не абсолютную поверхностную концентрацию, а лишь из...
быточную. Воз.никает вопрос какую выбрать толщину
поверхностноrо слоя, чтобы можно было бы сопоставить по..
верхностные и объемные концентрации в одинаковых пор...
циях растворов. rиббс предложил толщину поверхностноrо
u u
слоя отсчитывать от некоторои разделящеи поверхности,.
для которой r 2 ==0. Таким образом, адсорбцию по rиббсу
экспериментально можно определить, измеряя изменение
концентрации объемноrо раствора в результате адсорбции..
Для практических расчетов такой способ определения
nOBepXHOCTHoro слоя связан с рядом IIеудобств.. Существует
98
несколько способов определения поверхностной KOHцeHTpa
ции. Сравнивают содержание BToporo компонента в таких
порциях поверхностноrо и объемноrо раствора, которые
равны по массе, по объему или содержат одинаковое число
молей всех компонентов. Последний способ сравнения по..
лучил наибольшее распространение. В этом случае в раз
бавленном растворе поверхностную концентрацию i"Toro
компонента можно вычислить по уравнению
xr == Х! + ror i , (174)
rде ri адсорбция по rиббсу; xr и Х; мольные доли
i"Toro компонента в поверхностном слое и объеме раствора;
(J) поверхность, занимаемая одним молем раствора, рав"
ная (J)===N;{ V 2 / 3 . ДЛЯ Toro чтобы по формуле (174) вычис..
лить поверхностную концентрацию, необходимо по' экспе..
риментальным данным определить адсорбцию ri.
Пример. Вычислить поверхностные концентрации мар..
танца в сплаве с железом при 3 и 10 О/О [Мп]. По методике,
описанной выше, вычисляем rMn для расплавов указан..
ных концентраций: rMn(3%) ==3,5810 6 моль/м 2 , rMn(lO%) ==
==9,3810 6 моль/м 2 .
Из уравнения (174) имеем:
X n == X Mn + ror Mn; ro == N1J3 VU == N1J3 (MM/P Mn )2/3 .
( 175)
Поскольку атомные массы железа (55,85) и марrанца
(54,94) близки, то мольная доля будет приблизительно рав"
u
на массовом:
х == О 03 + ( 6 02.1023 ) 1/3 [( 54,94.103 )] 3 5.10.....6 ===
Мп(3%)" 6 75. 1 0......3 '
, ,
==0,16 или 16%; XMn(lO%)==O,lO+
+( 6 02.1023 ) 1/3 ( 54,94.103 ) 9 3 .10 б == О 45 или == 45 %
, 6 75. 1 о з' , 8
, \
Таким образом, различают два понятия: адсорбцию
избыток адсорбированноrо компонента на поверхности по
сравнению с объемом и поверхностную концентрацию, co
ответствующую абсолютной величине концентрации на по..
верхности. Если поверхностное натяжение раствора описы..
вается уравнением Шишковскоrо, то поверхностную кон..
центрацию i"Toro компонента (ХТ) можно вычислить по
-формуле:
xr == X l F:l/ Xi Fl8 (176)
7*
99
ПрUм'ер. Вычислим поверхностную концентрацию серы,
если объемная I{онцентрация серы равна 0,05 о/о. ДЛЯ ЭТО...
v
ro определим мольную долю растворенном серы:
"-
х == О ,05/32 =-= О 88 . 10......3.
S 0,05/32 + 99,95/55,85 '
Из приведенных данных для железа /:i== 1, для серы
Fi==500. Тоrда по формуле (176)
x(J) == 0,88.10 З.500 == О З08 или 200З%.
s о , 88. 1 O.......;J 500 + l' ,
111.6. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ ШПАКОВ
Поверхностные свойства расплавов оксидов в эксперимен..
тальном и теоретическом отношениях изучены хуже, чем
поверхностные характеристики чистых металлов и сплавов.
Это связано с тем, что шлак является более сложным объ..
ектом. Строение и структура шлаковых расплавов изучены
в меньшей степеНlf, чем металлических. Ниже приведены
u
значения а для некоторых жидких соединении, важных для
сталеплавильноrо производства.
Соединение . . .
t, ос . . . . .
(1, мДж/м 2 . . .
А1 2 О з
2050
690
FeO
1400 1450
580 670
CaF 2
1400
280
FeS
1200
350
Si0 2
1750 1800
400
Рассматривая поверхностное натяжение расплавов ок"
сидов, следует отметить одну общую закономерность за-
мена одноrо OCHoBHoro оксида друrим, как правило, мало
влияет на а. Значительные изменения наблюдаются лишь
при введении компонентов, являющихся поверхностно ак..
тивными (FeO, FeS, P20s и др.). Значения поверхностноrо
натяжения а различных шлаков приведены ниже, мДж/м 2 .
,
Окислительный электросталеплавильный шлак (35 45 О/О
СаО, 10.......20 СУо Si02, 3-----7 о/о АI 2 О з , 8 30 О/о FeO, 2 8 О/о
Р20б, 4.......10 о/о MnO, 7 15 О/о MgO . . . . . . . .. 250........350
Восстановительный электросталеплавильный шлак (55
60 о/о СаО, 20 о/о Si0 2 , 2 5 О/о АI 2 О з , 8 10 О/о MgO, 4 8 О/о
CaF 2 ) .................... 400.......450
Синтетические известково rлиноземистые шлаки для обра
ботки металла в ковше (55 О/о СаО, 20 40 О/О АI 2 О з , 2 15 о/о
Si0 2 , 2 10 О/О MgO) . . . . . . . . . . . . . . о. 450 O
Синтетические шлаки для разливки стали (10 20 О/о СаО,
2 25 О/о Si0 2 , 1 2 О/О FeO, 5 20 о/о МнО, 30 35 О/О CaF 2 ) 25с........зО
Шлаки Э ШП . . . . . . . . . . . . . . . . .. 300........40
Шлаки индукционных печей (60 о/о СаО, 10 О/о MgO, 30 О/О
Са F 2) . . . . . . . . , . . . . . . . . . .. 350 450
100
111.7. МЕЖФАЗНОЕ НАТSlЖЕНИЕ МЕЖДУ МЕТАЛЛОМ
И ШЛАКОМ
Межфазное натяжение lVlежду металлом и шлаком (ам ш)
u u
тесно связано с природои и характером взаимодеиствия
l.ВУХ фаз. Значение ОМ Ш всеrда меньше наибольшеrо эва..
чения поверхностноrо натяжения металла или шлака. Это
u u
связано с тем, что частицы каждои из ЖИДI{остеи прптяrи..
u u
вают молекулы друrои и тем самым снижают взаимодеист"
u ".,
вие со стороны второи жидкости ее сооственных i\10 1екул.
Межфазное натяжение зависит от химическоrо состпва фаз,
их строения, ориентации молекул и ионов. Чем ближе кон..
тактирующие фазы по свойствам, TelVl межфазное натяже..
ние меньше. Межфазное натяжение на rранице раздела
u u u
)I{идкостеи, характеРИЗУIОЩИХСЯ значительнои взаимнои
u
растворимостью, может достиrать ничтожных значении.
rоворя об изменении crМ Ш в зависимости от состава Ш"ТIакз,
следует отметить следующее. Изменение концентрации, а
точнее замена оксидов Si0 2 , СаО, Аl 2 О з друr на друrа, не
приводит к сколько..нибудь замеТНЫl\1 изменеНИЯ 1 а t ш. Та..
ким образом, если КО Iпонент шлака малорастворим или
практически нераСТБОРИМ в жидкой стали, то lvlежфазное
натяжение велико: как правило, > 1000 мДж/м 2 . При вве..
дении FeO, МпО, FeS и друrих КО lпонентов, которые распре..
де"ТIЯЮТСЯ между металлом и шлаком, наблюдается сущест"
венное снижение ам ш до 200 600 мДжjм 2 . ДобаВ ТIение
3 О/О СаС 2 к восстановительному шлаку электроплавки ени..
)кает ам п! с 1300 до 750 мДж/м 2 , а изменение (FeO) от 0,1
o 95 О/О снижает ам ш с 1250 до 180 мДж/м 2 . Шлаки, содер"
жащие оксиды железа (FeO, Fе20з), характеризуются
большей работой адrезии к жидкому 1еталлу, чем безже
.лезистые шлаI{И. Элементы металлическоrо расплава, В,ПИ
яющие на ам ш можно разделить на три rруппы [75],:
1. Мало влияющие на (J'м ш И практически не переходя..
щие в шлаковую фазу (С, W, Мо, Ni);
2. Характеризующиеся сравнительно низкой капилляр
ной активностью (Si," Мп, Cr, Р и др.), но которые MorYT
быть переведены в ШJlаI< в значительных количествах с об..
разованием соответствующих ОI{СИДОВ. ИЗ формулы W а ===
==01 + a2 al 2 следует, что если под влиянием добавки Ka
коrо..либо компонента в металлическую фазу ом и <1м ш
снижаются па ОДНУ и ту же величину, то работа адrезии
по сравнеНИIО с W а исходноЙ системы не изменится. Однако
в практических условиях так не бывает. Указанные I{ОМПО
ненты (Si, Мп, Cr, Р) характеризуются той особенностью,
101
что они СИ.пьнее ВЛИЯIОТ 11а О'М Ш, чем на ам и это ПРИВОДИТ
I{ увеличению W а;
3. Обладающие очень ВЫСОI{ОЙ поверхностной и меж-
фазной активностью (S, О). Так же, как и в предыдущем
случае, сера и кислород сильнее влияют на а f Ш, чем
на О'М.
Например, в результате насыщения жидкоrо металла
кислородом цри 1550 ос ([ О/О О] ===0,19) поверхностное на-
тяжение в соответствии с формулой (172) снижается в два
раза, а межфазное натяжение снижается более чем в семь
раз. Таким обрЗЗОl\1, сера и кислород способствуют сущест-
. венному )7величению здrезии между металлоrvt и шлаком.
КЗI{ показано выше, W a определяется величина III O'M r, аш r
и О'М Ш. Однако ПОСI{ОЛЬКУ поверхностное наТЯ}l{ение MeTaLТI..
ла больше, чем ШЛ3I<а, то и вклад в межфазную энерrию,
вносимый металлом, больше. Это означает, что поверхност-
ная активность I{О IПОIIента в металле В.нияет на (jм ш, а
следовательно, и на W a В большей степени, чем поверхно-
стная активность этоrо же компонента в шлаке.
rоворя о поверхностных свойствах промышленных ме-
таллических и шлаковых расплавов, следует иметь в виду,
что реа.}lьные стали и шлаки содержат примесные I{омпонен..
ты, концентрации I{OTOPbIX изменяются в широких пределах.
Даже ничтожные изменения концентрации повеРХI-IОСТНО-
активных компонентов MorYT привести к изменению О'м ш,
которое в ряде случаев может быть значительно больше,
чем в.пияние, вызванное изменением OClIoBHoro компонента.
В таБLТI. 13 приведены значения (jм ш для реальных метал..
лурrических систем. В обычных условиях измеряют так на-
зываемое статическОе межфазное натяжение О'мф на rрани-
це раздела двух фаз, находящихся в термодинамическом
равновесии. При протекании межфазной химической peaK
ции или переходе компонента из одной фазы в друrУIО име
ют дело с межфазным натяжением, которое меньше соот"
ветствующеrо статическоrо значения Омф: Межфазное на..
т а б л и ц а 13, Значение О'М Ш дЛЯ реальных метаплурrических
систем [69.......731 '
!\-\еталл
Шлак
(jм ш, МДЖ/М Z
ШХl5
lOX18H9T
и 3 вест к о во r .пи н озем и сты й
Белыlй электропечной
Элсктропечной
АН Ф 6
] 10О IЗОО
1000 1200
900 lOOO
1100
102
тяжение, измеренное при rрадиенте химическоrо потенциала
fl принято называть динамическим или неравновесны,М.
Снижение межфазноrо натяжения a определяется сте..
пенью удаления системы от состояния равновесия. КО.ТIиче..
ственная связь между a и L\J.1 описывается уравнением
[78]: L\<!==M J.1. В результате рассматриваемоrо эффекта
межфазное натяжение при переходе серы из металла в
шлак может быть снижено до 1.........5 мДж/м 2 . В водных рас..
.
творах (J удается снизить ДО такои степени, чте прои.сходит
автоэмульrирование. Изменение межфазноrо натяжения
u
при химическом взаимодеиствии или переходе компонентов
из одной фазы в друrую в определенных условиях приводит
К увеличению поверхности раздела двух фаз. Наибо Т}ее Ha
rлядно это наблюдается в системах, rде одна из взаимодей-
ствующих фаз находится в эмульrированном состоя..
нии [79].
111.8. СМАЧИВАНИЕ И РАСТЕКАНИЕ
Если каплю жидкоrо расплава, например металла или шла..
ка, поместить на твердую подложку (rрафит, оrнеупоры
и др.), ТО В случае оrраниченноrо смачивания наблюдается
картина, изображенная на рис. 16. По периметру капли со..
6r...r
.J
б жs --- r
а
5
Рис. 16. Условия равновесия сил nOBepXHOCTHoro натяжеНIIЯ в различных систе-
мах:
а твердое тело жидкость rаз; б две lIесмешиваЮЩIfССЯ ЖIIДКОСТil rаз;
1 rаз; 2 ЖИДКОСТЬ; 3 твердое тело
прикасаются три фазы: жидкость, rаз и твердое те,,10. На
поверхности раздела каждых двух фаз действуют СИЛЫ
поверхностноrо натяжения, которые стремятся сократить
эти поверхности. К единице ДЛИНЫ окружности кап.пи при
Iожены три силы, которые численно равны коэффициентам
nOBepXHocTHoro натяжения (JT r, aT )f<, (}'ж r. В состоянии
равновесия эти три силы связаны уравнением:
(J"T r ......... (J"т ж == (J"ж r COS е, (177)
103
rде 8 краевой yrOJI смачивания. Если жидкость смачива..
ет твердую подложку, то она будет натекать на твердое
u u
тело до тех пор, пока не установится равновесныи краевои
уrол. Процесс натекания жидкости связан с затратой рабо..
ты на создание новой межфазной поверхности мея<ду твер..
ДЫМ телом и жидкостью. При создании единицы поверхно..
сти (1 C 12) затрачиваемая работа равна aT )K. Однако при
этом ликвидируется поверхность раздела твердое тело
rаз, и это приводит К выиrрышу энерrии, равной (jT r. OTCIO"
да следует, что количественные характеристики растекания
опредеv'IЯЮТСЯ соотношением величин (jT r, ат ж и О"ж r. Та..
ким образом, в момент соприкосновения жидкости с твер..
ДЫl'r1 те..10М создается некоторая неустойчивая систеl\1а. По
rраницам раздела фаз действуют три силы (jT r, O"T )K, О'ж r
И конечное равновесное поло)кение капли опреде..1яется од..
u
ни из двух условии.
1. Ес,ни
O'T........r < О"Т.......ж + О'ж r '
( 1 78)
то смачиванию соответствует затрата работы (увеличение
свободной энерrии капли), т. е. энерrетические затраты,
u
связанiIыIe с созданием навои поверхности, превалируют
над выиrрышем от ликвидации поверхности твердое те..
ло rаз и ЖИДl{ость rаз, поэтому условию (178) соответ"
ствует стяrивание капли до HeKoToporo paBHoBecHoro со..
стояния, описываемоrо уравнение (177).
2. Если
а T r > о" Т......ж + (J ж......r '
(179)
u
то жидкость растекается, пока не ПОI<роет всем поверхности
твердоrо тела. Этот случай соответствует полному смачи..
ванию (8==0). Из уравнения (177) имеем
cose == (ат r ат ж)/(Jж r. (180)
Подставляя в уравнение (180) разность О'т r (Jт ж ИЗ
уравнения W а === ат r+(Jж r (Jт ж, получим
w ........ (1 . ....... r W I
cos е == а )1" ; cos е =-= 8 1. ( 181 )
<1 )I\ r <1 ж ....... r
,
Поскольку величина аж r, стоящая в знаменателе урав..
нения (181), хар ктеризует коrезию, то краевоЙ УI.ОЛ сма..
чивания (cos 8) определяется работой адrезии и коrезии.
В первом случае W а характеризует силы сцепления между
u u
жидкостью и твердаи подложкои, во втором силы сцеп..
.ления между частицами жидкости. Если Wа>аж r, то
104
cos 8>0 и 8<90°; если Wа<аж r, то cos 8.:<0 и 8>90r .
Если имеем систему из двух неСl\1ешивающихся )I{идкостей
)!\А и Жв, то условием равновесия сил поверхностноrо па-
тяжени (см. рис. 166) является (J)I-\Б r==О'ЖА ЖБ.СОS В+
О'ЖА r.СЬS а. Вместе с тем аЖА r .sin а==аЖА jКБ .sin . IIз
двух последних уравнений И lеем расчеТНУIО форму.пу для
вычисления межфазноrо натяжения а}КА ЖБДЛЯ с.пучая, по-
казанноrо на рис. 166:
О'ЖА ЖБ == V O' A + <J Б 2<JЖА(JЖБсоsа. (182)
Различные характеристики смачивания в систеl\1е твер..
дое тело жидкость приведены на рис. 17. В большинстве
8=0
В< 90 ri
//,
о
е> 90 о
8
8==180 о
...... I ........
/////////
Q
2
РJlС. 17. Характеристики смачивания в системе твердое тело )i{IIДКОСТЬ:
а полное смачивание; 6 хорошее смачивание; о плохое смачивание; а
полное несмачивание
случаев с повышением температуры уrол смачивания
) меньшается и жидкость растекается олее полно.
Смачивание оксидов жидкими металлами. Приведенные
соотношения характеризуют процесс смачивания лишь с
точки зрения сил поверхностноrо натяжения. В. Н. Еремеи..
ко и ю. В. Найдич [80] показали, что процесс смачивания
u v
в значительнои мере определяется химическим взаимодеи-
v
ствием между смачивающеи жидкостью и материаЛОi\I под-
ложки. Если жидкий металл (Ме) контактирует с оксидом
(МеО), то полнота химическоrо взаимодействия между ни..
ми Ме+Ме'О==Ме' +МеО определяется степенью химиче..
CKoro сродства соответствующих металлов к кислороду.
Если химическое сродство смачивающеrо металла к кисло
роду :\!епьше, чем fеталла оксида подложки, то химическое
взаимодействие протекает слабо и этому соответствует TY
пой краевоЙ уrол (8)90°). Так, например, же.пезо имеет
u
i\lеньшее химическое сродство к кислороду, че ! маrнии,
u u
аJIЮМИНИИ, ка.ПЬЦИИ, поэтому жидкое железо на оксидах
нз MgO, А1 2 О з , СвО образует краевой уrол 140 145°.
С уменыIениемM различия химическоrо сродства I( кислоро..
ду l<раевоЙ уrол уменьшается. В чаСТIIОСТИ, при смзчива..
нии ЖИДКИМ железом кремнезема 8== 126°. Рассмотрим, как
105
влияют различные компоненты (С, Si, Mn и др.), содержа-
u
щиеся в жидком железе, на краевон уrол при смачивании
оксидов. Характеристики смачивания определяются хими-
ческим вз имодействием не только OCHoBHoro металла (Fe),
но и леrирующих компонентов с оксидом. Очевидно, что
компоненты, характеризующиеся высоким химическим
сродством к кислороду (Si, Ti, AI), в результате взаимо..
действия обеспечат существенное снижение 8.
На рис. 18 [75] приведены данные, показывающие влия-
ние компонентов, растворенных в жидком железе, на сма..
чиваемость 8 к А1 2 О з . Фор-
Ni,Mo мально характер влияния
w р Toro или иноrо компонента
описывается уравнением
( 181), из KOToporo СJlедует,
v
что краевои уrол определя
ется показателями адrезии
и коrезии. Наименьшее вли-
яние на е оказывают слабо
поверхностно активные ком-
поненты никель и молибден.
OHIi практически не изме-
няют ни коrезию, ни адrе..
Рис. 18. Влияние компонентов, раСТ80- зию И в Р амках ур авнения
ренных в жидком железе. на r rол сма-
чивания (6) к А120з [7 (181) l\1ало влияют на 8.
, Остальные элементы (Si,
Mn, С и др.) умеренно уменьшают коrеЗИIО (сравнитеJIЫIО
слабо снижают поверхностное натяжение железа) и силь..
нее влияют на адrезию. Это приводит к уменьшению 8 с
ростом концентрации элементов. Увеличение концентра..
ции кислорода в жидком железе улучшает смачивае 10СТЬ
(8 уменьшается, адrезия между металлом и оксидом уве..
личивается). Нераскисленный металл лучше смачивает фу..
u
теровку, чем раскисленныи.
С.Аtачuвание ерафита жидки".,t железо;.! Ц lllлаком. rpa-
фИТ хорошо смачивается жидким железоуrлеродистым рас-
плавом. Образующиеся уrлы смачивания имеют значе.
ния: а==32+З5 0 , ==40+450 (см. рис. 16). Значение аж r
для расплава, насыщенноrо уrлеродом, составляет 1470
f\fДж/м 2 ; сх'Т Ж== 1200 1400 мДж/м 2 ; W a ==3000 мДж/м 2
[81]. Краевой уrол смачивания rрафита жидким никелем
составляет 600. Характеристики смачивания сильно зави..
сят от кристаллоrрафических плоскостей, которые облада-
ют различными значениями aT r. Приведенные выше дан..
liые относятся к поликристаллическому rрафиту, OT r кота..
е С
с
lJO
Cr
1Z0
110
вО
lJO
5
О
О, 1J,8J S
I I
ЦО25" 4075 О
120
90
100
о
9 8 lZ 18 20
Атомная ООЛfl /(OMпbHeHтoB %
106
poro оценивается в 2500 мДя{/м 2 . ШлаI{овые расплавы
плохо смачивают rрафит. Оксидный расплав системы
СаО SiО2 АI20з на rрафите дает уrол 125°. При длитель-
ной выдержке вследствие образования СаС 2 в Ш,,1аке уrол
.смачивания снижается до 100°.
Растекание ;иетаЛJzа и шлака. Если каплю жидкоrо шла..
ка ПОЛО}l{ИТЬ на поверхность металлическоrо расплава, ТО
она может либо растечься, либо остаться в' виде нерасте-
кающейся капли. Это однозначно определяется поверхност-
ными натяжениями обеих жидкостей и ?\1ежфаЗНЫl\1 натя-
жением. Сказанное справедливо и для случая, если ниж-
ней фазой является твердое тело (rрафит, оrнеупор и др.).
Характеристики растекания обычно находят по разности
работ адrезии и коrезии. В. д. Харкинс эту разность на-
звал коэффициентом растекания:
S === W а ........... W R == (JM r + О"ш.......r ам ш 20"ш.......r ;
S == aM r аш r О"М.......ш. (183)
Ес Т}и коэффициент растекания положителен (S>O, т. е.
W"a>W K ), то шлак растекается по металлу. Ес"ТfИ S<O и
W а соответственно меньше W к, то шлак на поверхности
образует линзу.
П рИм'ер. Вычислим коэффициент растекаНQЯ для систе-
мы шлак металл со следующими поверхностными харак-
теристиками: поверхностное натяжение стали aM r===
== 1400 мДж/м 2 и шлака аш r 400 мДж/м 2 . Межфззное
натяжение ам ш 900 мДж/м 2 . На основании этих данных
получим S == О"м r О"ш r О"м ш === 1400 400 900 === 100
мДж/м 2 . Поскольку S>O, то шлак будет растекаться по
металлу. Таким образом, растекание происходит при усло-
вии О\I r>аш r+ам ш. Это возможно В том случае, ко.rда.
шлак одержит поверхностно-активные компонентыI (FeO,
FeS и др.). К таким системам относятся, в частности, окис-
J1ительные сталеплавильные шлаки с высоким содержани-
ем оксидов железа. Отметим, что в уравнение (183) мы
подставили значение работы коrеЗИИ t равное 20"ш r и полу...
чили I{оэффициент растекания S шлака по металлу. Оче..
видно, что в уравнение, (183) можно подставить значение
I\оrезии, равное 2aM r. В этом случае получим коэффици",
ент растекания металла по шлаку: S' ===aM r+ аш r ам ш
2ам r===аш r ам r ()'м ш. В случае растекания }КИДКОСТИ
по поверхности твердоrо тела имеем следующее' СООТНй"
тенне:
w а === о' T r + о' ж.......r а Т....ж '
( 184 )
107
Подставляя значение разности ат r ат ж из уравнения
(177) в уравнение (184) имеем: S==Wа Wк===аж r+
+аж r cos е 2аж r; S==аж r(СОS e I). Видно, что если
е==о, то cos 6==} и 8==0.
П рониlсновенuе J,tетаЛ.ла u Ulлака в капU.ллярно порuс..
тые J1taTepUQAbl. Оrнеупорные материалы в процессе CLТIY}K..
бы на значитеJIЬНУЮ rлубину пропитываются шлаком, ме..
таЛ"Т}О!\1 и ero оксида IИ. Так, например, в зоне шлаковоrо
u u
пояса в основнои электродуrовои печи шлак проникает в
оrнеупорную кладку на 50 100 мм. Подина печи пропи
тывается оксидами жеLТIеза на rлубину до 150 ММ. Футеров..
ка тиrля ИНДУКЦИОННОЙ печи на 1/3 ТОЛЩИНЫ пропитывает..
ся оксидами железа и леrко ОКИСЛЯЮЩflХСЯ элементов, co
держащихся в стали. Мноrочисленные исследования по
изучению скорости проникновения металла и шлака в Ka
пи,п,пя р HO пор истые оrнеупор ные м а тер иаLl"I ы показывают,
что r,,"Iубина проникновения 1 в зависиrvIОСТИ от времени т
)'ДОВLТIетворительно описывается параболической кривой:
l2 == (<1 COS 6 R't)/21l,
( 185)
rде а поверхностное натяжение ПРОНИI<ающеrо расплава;
е yro l смачивания на поверхности расплав твердое те..
ло; R радиус капилляра; 1') вязкость расплава.
Во мноrих случаях капиллярная пропитка футеровки
протекает ПрИ наличии rрадиента температуры в направ"
лении пропитки. В этом случае для ко,,'!ичественных расче..
тов скорости или rлубины пропитки следует учесть измене..
иие вязкости раСП,ТIава с изменением температуры. Помимо
проникновения ш,пака в оrнеупоры, для практики представ..
ляет интерес опредеLТIение радиуса R пор в оrнеупорах, в ко..
торые жидкая cTaLТIb проникнуть не мо}кет вследствие по..
BepXHocTHoro натяжения. Формула имеет следующий виJ :
R===(2acos8)/p. Поверхностное натяжение стали в зависи
мости от состава изменяется в пределах 1200 1700 мДж/м 2
(нижний. предел для нераскис.пенной стали).
Пример. Вычислим радиус пор в оrнеупорной кладке
u
ванны сталеплаВИLТIЬНОИ печи, в которые жидкая сталь не
I\10жет проникнуть ((Т=== 1450 мДж/м 2 ). rJlубина сталепла
вильной ванны 0,6 м. Уrол смачивания металлом orHeynop..
IlОЙ ]{ладки составляет 8=== 120°. Ферростатическое давле..
ние на rлубине 0,6 м составляет 0,6/1,42===0,42 атм==4,12Х
Х 104 Па. Если а=== 1,45 Дж/м 2 , то R== (2.1,45 cos 1200)/
/(4,12-104) ==0,35-10 4 м ==0,035 мм.
fn8B81V
ТЕРМОДИНАМИЧЕСКИЕ ХАРАКТЕРИСТИКИ
НЕКОТОРЫХ РАСПЛАВОВ
НА ОСНОВЕ ЖЕЛЕЗА И НИКЕЛЯ
в обобщенном виде основные термодинамические свойства
бинарных раСllлавов на основе железа и никеля приведены в
rл. 1 (см. табл. 4). Настоящая rлава посвящена бол е
подробному рассмотрению характеристик отдельных pac
плавов, имеющих большое значение для практики электро
сталеплавильноrо производства.
IV.1. КИСЛОРОД В РАСПЛАВАХ
Прямое экспериментаLТlьное ИССLТlедование взаимодействия
КИСL10рода с расплавленным }келезом затруднено тем, что
равновесное давление rаза в условиях опыта имеет очень
маL1iУЮ трудноизмеримую величину (10 8 атм), поэтому в
опытах вместо чистоrо КИСLТlорода используют обычно rазо..
вую смесь, например Н 2 + Н 2 О, дЛЯ которой равновесное
значение Р О 2' LТlerKo рассчитать, воспользовавшись таблич..
нои веLТlИЧИНОЙ OO реакции
H 1 (r) + 1/,.02(r) == H 2 0(r); f1GO == 252000 +
+ 58,36Т ДЖ [2]. (186)
Искомое значение Р О 2 опреде.пяют из выражения для
константы равновесия реакции (186):
.
19 К == Ig (PH 2 0 I PH 2 ) (1/ V ) == f1GOj2,3RT,
( 187)
зная состав равновесной смеси (PHJol Рн 2 ). Как показывают
резульrаты экспериментов, представленные на рис. 19, рав..
новесная концентрация кислорода в железе при относитель
но небольших ero содержаниях линейно зависит от квад..
paTHoro корня из давления кислорода в rазовой фазе. Эта
заВИСИl\10СТЬ, которую принято называть законом Сивертса,
соrласуется с выражением для константы равновесия ре..
акции: 1/ 2 0 2 (r)==[OJ; K==fo[OJ/V P 0 2 ' откуда при /0===1
следует [O]==K / Ро,, - Это соrласование свидетельствует о
том, что процесс растворения протекает в соответствии с
u u u
написаннои реакциеи, т. е. сопровождается диссоциациеи
молекул на атомы (или друrие одноатомные частицы: ио.,
вы, FeO и др.) В области повышенных содержаний кисло
109
рода наблюдаются отклонения экспериментальных точек
от пунктирных прямых, иллюстрирующих закон Сивертса
Эти отклонения можно количественно выразить концен..
трационной зависимостью I{оэффициента активности
19'o === O,2[O/o О], найденной в работе [82] при помощи
метода, приведенноrо на с. 27. Для мноrОКОМllонеитных
расплавов значения f о можно определить при помощи па-
раметров взаимодействия (см. 1.15).
Увеличение равновесной концентрации кислорода в рас-
ПLТIаве при возрастании ро. оrраничено образованием плен-
I{И оксида. При помощи правила фаз леrко показать, что
u
при постояннои температуре
появление третьей фазы в
u
двухкомпонентнои системе e
лает ее НОIIвариантной. Число
степеней свободы при ЭТО f об
ращается в нуль: С===К Ф+
+1==2 3+1==O. На рис. 19
такое состояние системы xa
рактеризуется точками 3, по
ложение которых определяет
ся только температурой. Если в
равновесной трехфазной систе
Ni,187JK ме повысить давление кислоро
да, то ero концентрация в pa
сплаве не изменится (это по
казано rоризонталями). COCTO
яние, которое возникает при
этом, будет неравновесным
система вернется к пре}{{не IУ
(paBIIoBeCHOl\1Y) состоянию
вследствие связывания избыт
ка кислорода в оксид.
Чтобы отличить раствори
мость кислорода (в двухфаз
ной области) от концентрации
ero в равновесии с оксидом, после,.QНЮЮ называют преде...
лом растворимости (или растворu.ЛlОСТЬЮ оксида). Такнм
образом, растворимость и предел растворимости представ...
ляют собой совершенно различныIe понятия, которые xa
рактеризуют разные состояния равновесия. Недооценка
этоrо различия и неточность формулировок приводят иноr...
да к серьезным ошибкам.
Обобщенной количественноЙ Хdрактеристикой ВЗ3И"IО-
действия расплавленноrо же.пеза с КИСЛОрОДОl\1 rазовоЙ фа-
[О], О/О
0,24
420
61
rзl
03
415
о, 12.
/
ЦО8
Fe,1973
0,09
{)
2 4 8 8
-105 атм ' / 2
ro '
2
Рис. 19. Зависимость растворимости
кислорода в железе [68, 82] и ни-
келе [341 от V' РО. rаЗ080Й фазы:
1, 2 экспериментальные значения
растворимости при 1823 К по дан-
ным (68] и [82]; 3 пределы pac
творимости
110
31>1 слу)кит следующая температурная зависимость I1GO
реаI<ЦИИ:
1/2 0 '2{r) === [О](l%ВРе); ao == 117200 == 2,89Т ДЖ [2].
( 188)
Отсюда
IgK == 19 (fo[OJ/t/ ) == (6120/Т) + 0,151, (189)
тде [О] растворимость кислорода в )келезе прп дaHHO '
РО" о/о.
Как видно из приведенных уравнений и рис. 19, раство"
рение rазообразноrо кислорода в железе сопровождается
СИLТIЬНЫМ тепловыде,пением ( Hoo== 117 200 Дж/моль) и,
u
следовательно, отрицательнои зависимостью раствори..
\10СТИ от температуры.
Комбинируя уравнение (188) с выра)кением для 6.00
реакции образования FeO из ЭJlе 1ентов [2], МО}I{НО полу..
чить хараI{теристики равновесия:
FехО(ж) == хFе(ж) + [0](1%); f1GO == 121000........ 52,38 Т Дж.
( 190)
IОтсюда следует, еСLТlИ принять XFe== 1,
19 К == Ig.(1 О [% О]) === ( 6372/Т) + 2,73;
19 [%0.] ==: ( 6320/Т) + 2,735 [4], (191)
r де [О] предел растворимости, о/о.
Как показывает уравнение (190) процесс растворения
кислорода в железе из ОI{СИДНОЙ фазы сопровождается
поrлощеIIие 1 тепла, поэтому предел растворимости кисло..
рода (в отличие от растворимости) с повышением темпе..
ратуры увеличивается. Ил,пюстрацией этоrо может слу..
жить рис. 19. Значения пределов растворимости при 1923
и 1973 ,К на рис. 19 не показаны; соrласно уравнению (191),
эти значения равны соответственно 0,28 и 0,34 о/о.
ОтмеТIIМ, что полученные расчетом данные о пределах
'растворимости кислорода в железе подтверждаются как
прямыми наблюдениями за образованием оксидной плен..
I\И при определенном значении РН 2 0/РН ! [83], так и специ..
альными опытами [84] по изучению равновесия расплава
со шлаком из FeO (в индукционной печи с вращающимся
тиrлем, исключающим' контакт шлака с оrнеупорами).
Никель обладает значительно меньшим химическим сродством к кис
Л0рОДУ, чем железо, поэтому как видно из рис. 19, раствоrимость КИС
.пОрода в никелевом ,расплаве (при данном РО2) lIa !1I0rO ниже, чем в же
111
,
лезном. Равновесное давление кислорода (при данной ero концентрации)
у никелевоrо расплава, наоборот, значительно выше. При определенны)!
u
условиях оно может достиrать значении, превышающих остаточное дав-
ление rазов в промышленных вакуумных индукционных печа
(rOOJ 133 мПа). Так, в работе [85] показано, что при вакуумной плавке НII"
келя, содержащеrо более 0,2 О/О кислорода, последний может выделяться
из расплава в виде молекул 02 (без участия уrлерода). Ilри вакуумной
плавке железа, даже если оно насыщено кислородоы (0,23 О/О при
1600 ОС), такое выделение невозможно, поскольку равновесное давление
в этом случае составляет 665 мкПа.
Термодинамической характеристикой взаимодействия жидкоrо нике..
ля с rазообразным кислородом может служить уравнение
1/ 2 0 2 {r) == [OJ(I%BNI); OOO == 71600 + 1,84Т ДЖ [34). (192)
Отсюда
Ig К ==Ig(f o [%0] / '/ )==(3740/T) 0,0961. (193)
Коэффициент f о в никеле, по данным [34], может бытu принят равным
1 в довольно широком диапазоне концентраций. Для мноrокомпонент-
ных расплавов на никелевой основе значения 10 можно найти при по-
МОIЦИ параметроп взаимодействия [86], приведенных в таБJ1. 14.
т а б л и ц а 14. Парамеrры взаимодействия в сплавах на основе
никеля Ni O j
Эле- Концент- j . Эле- Концент- . r i
r J е ]
мент j рация % о о мент j рация % о о
Cr 0 11 O,231 0,009 V 0 5 0,394 0,037
МО 0 19 o ,024 О Si 0 0,35 5,38 9,32
W 0 20 ........0 , 004 О Ti 0 5 0,51 0,036
мn 0 14 ........0 ,072 О А1 O 2 1 06 0,27
,
Fe 0 25 ........0 , 025 О С 0 0,05 ......... 2 1 6 111,8
,
СО 0 55 o ,004 О Р 0 2 О О
Си O 58 o ,0099 0,0001 S 0 5 o , 089 О
Комбинируя уравнение (192) с выражением дЛЯ I1GO реакции обра..
зования NiO T из элементов [2], получим
NiO(T) == Ni ж + [0](1% в Ni); 600 == 181100 92,82 Т Дж. (194)
Отсюда следует, что предел раСТБОрИМОС1И КИС..10rо;J.З в никеле оп
ределяется уравнением
19 ([ % О] · XNI) == (........ 9460/Т) + 4,847 . (195)
Допущение XNI==l по аналоrии с уравнением (191) здесь нежелатеJIыI..
поскольку значения пределов растворимости кислорода в никеле, опре-
деленные по формуле (195), существенно выше, чем в железе. Так, прИ
1600 ос [0]==0,64 010. Прямые измерения растворимости NiO(T), обзор KO
ropbIx приведеп в работе [87}, ДЗIОТ Сlце болсс высокис значения [О]
ОI{ОЛО 1 О/о'
112
IV.l. уrЯЕРОД в РАСПЛАВАХ
При растворении уrлерода (rрафита) в расплавал )I{е lеза
и НИI<еля по дости}кении равновесия образуются HaCbIIJLeH
вые растворы, состав которых соответствует фазовым ,:"{иа..
rpaMMaM и характеризуется уравнениями:
19x c == ( 560fT) 0,375 [88], (196)
Д"Т]Я нике.ПЯ
]gx c == ( 1820/T) + 0,097[88].
( 197)
в области температур сталеплавильных процессов l\IОЖ"
но при {енять более простые соотношения:
[ % C]Fe == 1,34 + 2,54. 10.....3 tOC; [% С] N i == -------- 3,04 +
+ 3,8.10 3tOC. (198)
в Р,аботе [94] приведены несколько иные данные о рас..
творимосrи уrлерода в нике,lIе. Сведения о В,ТIиянии «TpeTЬ
их» элементов на растворимость уrлерода в железе и
никеле приведены работах [2, 94]. Очевидно, что актив..
ность уrлерода по отношению к чистому rрафиту в Hacы
щенном растворе равна 1. Коэффициенты активности 'Ус
MorYT быть найдены при этом как ве.ПИЧИНЫ, обратные рас..
творимостям rрафита ХС (СМ. с. 31). Для определения ак"
u
тивностеи уrлерода в ненасыщенных растворах пользуют..
ся обычно методом, основанным на изучении равновесия
расплавов с rазовыми смесяси СО+С0 2 или Н 2 + СН 4 . При
этом активности ac==fc [0/0 С] (по отношению к 1 О/о"ному
идеальному рззбавлеННОlvlУ раствору) находят из выраже..
u U
нии для констант равновесия реакции:
[С) + CO 2 (r) == 2CO(r); К == p o/(PC02 ас);
. [С] + 2H 2 (r) == CH 4 (f); К == РеНа/ (P 2 ас).
,( 1 99)
(200)
Значения К определяют из экспериментальных даНIIьrх
по аналоrин с примером, приведенным на с. 28. Темпера..
u
турная и концентрационная зависимость пзидеНIIЫХ таким
образом коэффициентов fc в СПс;1Jавах на основе же 1Jеза
характеризуется значениями параметров, приведенных в
табл. 6 8 и на с. 54 56, 58, 59.
Если по значениям констант реакций (199), (200) IIай
ти значения соответствующих OO и сопоставить их с таб
.ПИЧНЫМИ значениями D.GO анзлоrичных реЗI{ЦИЙ с участи..
ем rрафита, ТО можно определить изменение энерrИII rиб
B 675
113
uca при переходе
[C](rp) == [C](l% в Fe); /),аё == 22600 42,3 Т Дж [2]. (201)
Первый член в полученном выражении представляет
собой теплоту растворения rрафита в железе с образова-
нием бесконечно разбавленноrо раствора ( Hc). Значение
АН'С ===22 600 Дж подтверждено прямыми калориметриче-
скими измерениями (CM табл. 4). По данным ряда авторов
[89], с ростом концентрации уrлерода величина H с уве..
JIlIчивается. Одно из предложенных уравнений имеет
вид: Hc===22 600+ 24330 (l x e) Дж [2]. Используя BЫ
ражение (155) и соотношение
OC == RT ln ас == 2,3RT Jg УС XC(l%) ==
2 3RT ( l g 00 + 1 Ч12 ) ( 202 )
, 'Ус g l/i2+99/55,85 '
1\10ЖНО найти, что коэффициент активности уrлерода в бес-
конечно разбавленном растворе по отношению к чистому
rрафиту при 1873 К равен '\' (BFe) ===0,5'7. Умножив эту ве-
личину на соответствующее значение fc можно определить
1'с при любой концентрации. Значения коэффициентов ак-
тивности уrлерода в жидком железе были определены еще
одним способом измерением скорости испарения железа
из уrлеродсодержащих расплавов в вакууме [12]*. Полу
ченные результаты удовлетворительно соrласуются с дан-
u
выми друrих исследовании.
Этот же метод был использован для определения активностей уrле
рода в раСП.ТJавах на основе никеля. Авторы работы [30] приводят сле..
дующее уравнение для расчета коэффициентов активности уrлерода " С
в жидком никеле при температуре ,-.., 1823 K
Ig УС ==....... 0,5 + llx c . (203)
Из уравнения (203) следует, что" C(BNl) == 0,32. Используя ypaBHe
Ене (203) в сочетании с данными о теплоте растворения rрафита в жид
ком никеле, полученными калориметрическим методом (см. табл. 4),
можно получить выражение дЛЯ t!G перехода rрафита в раствор:
C{rp) == [C](l% в Ni); f1G C == 41000....... 47.94 Т Дж. (204)
Результаты сравнения активностей уrлерода в расплавах }I{елеза JI
-никеля представлены на рис. 20. Как видно из рис. 20 при концентраци
ях > 1,5 О/О активность уrлерода в никеле существенно выше, чем в желе
зе. При малых содержаниях уrлерода наблюдается обратное соотношr
нне: в никеле v ==0,32, а в железе 'Y ==0,57. В работе [90] показано, что
знакопеременные отклонения кривой активности ас (по отношению к
rp
* Пример расчета ас по этим данным приведен на с. 30.
J14
rрафиту) от кривой 1 ДЛЯ совершенноrо раствора не связаны с J{aKlIM
.1и60 принципиальным изменением свойств раствора. Если выбрать за
стандартное состояние вместо твердоrо rрафита cro rlfпотстичеСКIIЙ пере
ОХ0l1ажденный раСП.ТIав*, который, очевидно, ближе по свойствам J{ paCT
воренному уrлероду, то кривая 2 для совершенноrо раствора оказывается
выше .,1ИНИИ активности ас . Это соответствует отрицательным отклопе..
ж
IIИЯМ от идеальности (при всех возможных концентрациях раствора
вплоть до насыщения rрафитом).
а с (zp)
1,0
2
ОС (ж)
0,01
Рис. 20. Активность уrлерода 8 pac
плавах железа J{ никеля при 1873 К 110 0,5'
данным [2. 951:
а по отношеНlflО к rрафиту;
<;'р
а по отношению '( rllпотетнчсс
С Ж
кому жидкому уrлероду; 1, 2 ас
rp
и а С в соответствующих COBep '
ж О
тенных растворах; 3, 4 в разбавлен
ных растворах (n железе н никеле)
"
. а С (ж)
0,1
о
0,2
Ас
I .
ч [CJ) О/О
о
1
2 J
IV.]. ВЗАИМОДЕЙСТВИЕ уrЛЕРОДА
и КИСЛОРОДА В РАСПЛАВАХ
1.ермодинамические характеристики реакции
ICJ(l%) + [0](1%) ==- CO(r)
(205)
в железе и никеле можно получить из вышеприведенных
данных о растворении кислорода и уrлерода в соответст-
вующих расплавах, комбинируя уравнения (188), (192),
(201), (204) с выражением ДЛЯ дОО реакции
C rp + 1/ 2 0 2 (r) == CO(r); 8а} == 118000 84,4 Т Дж [2J.
(206)
* При построснии шкалы aC}I( принято, что температура П.1аВ.1е
НИЯ rрафита составляет 4020 К, а теплота 125 600 Дж/мо.ль [91, 92].
\a плаВJlения rрафита при 1873 К найдена по уравнению (113). В pe
эультате для раствора на основе )1(С.пеза получено V С ОС == 0,008. Цена
)1\
де.Т1ения для IUKa.ilbJ ас принята большеЙ, чем для шкалы GCr p '
, ж
D V /"(00 ==0,57/0,008==71 раз.
rp Сж
8*
115
Получ енные таким способом уравнения температурной
зависимости OO и 19 К реакции (205) в железе хорошо
соr,ТIасуются с экспериментальными данными, которые име-
u
ЮТ .следующии вид:
.f1GO == 22400 39,7 Т Дж;
=== (1 1 68/Т) + 2,07 [2J.
Для никеля расчет дает
ao == 87500 38,3Т Дж; Ig К == (4570/Т) + 2,0. (208)
РеЗУ lьтаты расчета по уравнению (208) (рис. 21, кри-
Бая 1) сопоставлены с экспериментальными данными [95]
(рис. 21, кривая 2). Для сравнения приведены данные о
равновесии кислорода с кремни [01, О/О
ем в нике.не (рис. 21, !<ривая 3) 0,16
И кислорода с уrлередом в }келе..
зе (рис. 21, I<ривая 4). Как видно Цl
ИЗ рис. 21, расчетные KOHцeHTpa
0,12
19 К == Ig (Pco/f С [Сl f о [О]) ==
(207)
L ЙJ, lJ
405"
0,02
Ol
0,005 , 2
3'
'
0,10
',4
.........
................
0,08
/JIJб
0,002
0,001
0;0005'
О
0,04
{),02
0,05 10 f5' 420
[CJ; fstJ 0/0
о 0,2 44 D,B B O
[С4 r"
.
Рис. 21. Сопоставление расчетных данных о взаимодействии [C]+[O]==CO r в НИ
келе (при 1798 К и р со == 1 атм) с экспериментальными
Рис. 22. Зависимость концентрации кислорода в металле от содержания уrлерода:
I ...... равновесная кривая, соответствующая уравнению (207): 2 фактические KOH
центрации для дуrовых печей вместимостью 40 и 100 т (96): 3 то же, для Map
теновских печей [62]: 4 равновесные концентрации с фактическими MapTeHOB
СКИМИ шлаками [62]
ции кислорода в никеле несколько ниже опытных. ЭТО MO
)J{eT быть связано как с поrрешностями расчета, так и с экс
периментальными ошиБI<ЗМИ при определении очень малых
l{онцентраций кислорода (см. с. 120). Как видно из рис. 21,
в никеле равновесные с уrлеродом концентрации кислоро-
да значите.пыIo меньше, чем в железе. Уrлерод по своей
11 G
раскислительной способности в никеле близок к кремнию
или да}I{е ero превосходит.
Из уравнений (207), (208) видно, что окисление уrле-
рода pacTBOpeHHbIl\f кислородом сопровождается выделени-
u
ем теПLТIа и поэтому ПОL1Jнее протекает при пониженнои тем-
пературе. В расплавах на основе }I{елеза температурная
зависимость константы выражена довольно слабо, так как
значение HO здесь невелико. Однако экзотермический ха-
рактер реакции (205) в железе установлен достаточно точ-
но. Ero часто ИСПОLТIЬЗУЮТ на практике, добиваясь, напри-
мер, более полноrо раскисления металла уrлеродом при
u u
вакуум нои индукционнои плавке в рез)'льтате «ПDДСТУЖИ-
-ва ния».
В связи с этим возникает вопрос: почему в некоторых
случаях В.пияние температ}?ры на процесс ОI{исления уrле-
рода оказывается противоположныrvl. Так, в дуrовых пе-
чах после расплавления металла кипение практически не
происходит (даже при введении окислителя руды) до
тех пор, пока ванна не HarpeTa. Казалось бы, что противо-
речит экзотермическому характеру реакции (205), однако
в действительности никакоrо противоречия нет. При кипе-
нии металла в печи окисление уrлерода определяется не
TOL1JbKO протеканием реакции (205), но и поступлением
u
.кислорода из шлака в соответствии с эндотермическои ре-
акциеЙ (190). Суммарный процесс (РехО) +[С] ==x[Fe] +
+CO r ; OO===98600 92,08 т Дж также является эндотер-
I\-Iическим и при повышении температуры протекает более
ПО,r} но. С,педует добавить, что наряду с термодинамическим
фактором существенное влияние lla интенсивность кипения
ванны оказывают кинетические факторы. С повышение i
температуры скорость окисления уrлерода увеличивается.
Из выражения (207) следует, что при постоянных Т и
u
Рео произведение асао в расплаве является константои.
В о.бласти сравнительно небольших содержаний уrлерода
и кислорода, rде произведение коэффициентов fcfo близко
к 1, произведение равновесных концентраций [С][О]==т
также можно считать постоянным, равным при 1873 К
0,002 (О/о) 2 [2J. rрафически такая связь между равновес-
ными концентраI.(ИЯМИ уrлерода и кислорода выражается
rиперболой (рис. 22, кривая 1). Для точных расчетов и
вне указанноrо на rрафике диапазона концентраций вели-
чину т нельзя считать постоянной. Расчеты с.педует вы-
полнять в этом случае по уравнению (207), определяя
I{оэффициенты активности при помощи парамеТРОБ взаИ ,10
действия. В реальных сталеплавильных процессах значе-
117
ние т в конце окислительноrо рафинирования l\iетаЛ ТIа
также примерно одинаково. Это обусловлено, с одной СТО..
роны, слабой температурной заВИСИ IОСТЬЮ константы ре--.
акции (205) (в связи с малым ее тепловым эффектом), а с
друrо'й......... характером выделения со (в виде пузырей). Ус....
ловием выделения со в пузырь является неравеIIСТВО
Рсо > Рат + Р м gh M + Р Ш gh ш + (2(J/r). (209)
В выражении (209) Рсо означает равновесное давление
со, определяемое выражением (207), а правая часть пред..
ставляет собой сумму действующих на пузырь внешних
сил: атмосферноrо давления, rидростатическоrо давленик
метаЛ.па и Ш.пака и капиллярноrо давления. При кипении
ванны без введения окислителей (<<чистый кип») В резуль
u
тате снижения концентрации уrлерода и кислорода значе..
нне Рсо постепенно уменьшается. В конце периода чис...
Toro кипа Рсо приближается к некоторому пределу, I{O"
торый определяется правой частью неравенства (209).
Предельное значение Рсо в различных сталеплавильных
arperaTax (за исключением вакуумных) прибll'Iизительно
одинаково HeMHoro более 1 атм, поэтому конечные зна...
чения т в различных arperaTax и на разных плавках (пе...
ред раСКИСJlением ванны) довольно близки. Они HecKo ТIЬ"
ко превышают равновесное значение т при Рсо === 1 aT I
и не зависят от содержания со в rазовой фазе.
Концентрации уrлерода и кислорода в металле после
кипа сопоставлены с равновесными на рис. 22. Kal{ ви/п,НО
из рис. 22, реальные содержания кислорода в металле за...
нимают промежуточное положение между двумя равновес...
u
нымн концентрациями, которые определяются, с однои сто...
u u
роны, взаимодеиствием с yr леродом, а с друrои перехо...
дом кислорода из шлака. Высокий окислительный
потенциал шлака (или при продувке......... струи rаза) обес-
печивает при кипении ванны постоянное поступление в ме-
талл кислорода, rде он расходуется на образование со.
Степень переокисления ванны (по отношению к кривой 1)
u
определяется соотношением скоростеи поступления и рас-
ходования кислорода. В конце периода, коrда введение
u
окислителеи прекращают, ванна самораскисляется со-
держание кислорода понижается, приближаясь к paBHOBec
НОМУ. Как видно из рис. 22, в дуrовых печах такое прибли..
жение лучше, чем в мартеновских. Это связано с тем, что
технолоrия электроплавки преДУС lатривает более BЫCO
кую температуру металла в конце окислительноrо перио
да, необходимую для обеспечения скачивания шлака и про
118
ведения вос тановительноrо периода. При повышенной
температуре реакция (205) идет быстрее и ближе подхо-
дит к равновесию.
Ана ТIIIЗ уравнения (207) показывает, что уменьшение
рео ДО ТIжно приводить к пропорциональному снижению
paBHoBeCHoro значения произведения [С]. [О]. На практике
это используется в вакуумных процессах и при обработке
металла инертными rазами. В результате снижения равно-
BecHoro значения Рео Bcero до 0,1 атм резко повышается
раскислительная способность уrлерода, а также обеспечи
вается r..Т]убокое обезуrлероживание расплава без пере-
ОКИС..1Jения.
Как следует из законов термодинамики, при снижении
Рео m==[CJ.[O] До..1JЖНО уменьшаться неоrраниченно, дo
стиrая очень малых значений. Например, для Рсо ==
== 10 5 атм, которое можно леrко обеспечить при вакуум-
u u
нои индукционнои плавке, равновесное значение пl со...
ставляет 1"./ 10 8 (О/о) 2. Реально наблюдаемые концентра...
u
ции уrлерода и кислорода в железе вакуумнои плавки зн.а-
чительно выше: т не уменьшается обычно ниже lO 4 (О/о) 2,
соответствующеrо Рео ==0,1 0,01 атм. Как показали
А. М. Самарин и Р. А. Карасев [223], одной из основных
причин TaKoro несоответствия являются кинетические труд..
ности протекания реакции (205), связанные с условием
(209). При малых значениях Рео силы rидростатическоrо
и капиллярноrо давления делают невозможным кипение
металл , а беспузырьковое выделение СО (через поверх..
ность ванны) является очень медленным процессом, KOTO
рый в крупных промышленных аrреrзтах обычно не дает
ощутимы?, результатов. Не отрицая правильности этоrо
объяснения, следует однако заметить, что оно не подходит
для опытов с малыми массами металла (lO 50 r) II в осо-
бенности для экспериментов с висящей каплей (1,5 r)*.
Пр уменьшении массы металла ero удельная поверхность
значите ТIЬНО возрастает и, как показывают кинетические
расчеты, оказывается в большинстве опытов достаточной
для протекания реакции (205) почти до равновесия даже
в беспузырьковом режиме. Несмотря на это, конечная ве-
личина т не снижалась в таких опытах ниже 10 . ДJI5 f
объяснения причин указанноrо несоответствия теории с
результатами даже лабораторных опытов было выдвинуто
Ilесколько rипотез. Соrласно одной из них все объяснялось
поступлением кислорода из тиrля. Для проверки были про-
* в обобщенном виде эти данные приведены в работе r93).
119
ведены опыты с применением бестиrе.ПЬНОЙ плавки (во ВЭБе...
шенном состоянии и в медном водоохлаждае 10 Л кристаJI-
лизат<?ре с электронно-лучевым HarpeBOM). Результаты
оказались практически такими же.
Правильной оказалась друrая rипотеза. Как показала
проверка, вь!полненная в работе [93], I'rеПО.пное протекание
реакции (205) в лабораторных опытах часто является ка...
u
жущимся, И связано оно с недостаточнои чувствительностью
анализа металла на содержание уr"ТIерода и кислорода.
Определение малых содержаний [О] и [С] сильно осложне-
но поверхностным заrрязнением образцов. Применение спе
циальных методов анализа позволило зафиксировать [93}
в железе после БО-мин выдержки в вакууме (при 1acce ме-
талла 20 50 r) произведение [С]. [0]=== 1,З.IО lО (0/0)2. По-- .
лученное значение близко к теоретической величине т, со-
u
ответствующем давлению в печи при проведении плавок
(б,6.10 8 атм). Характерно, что наблюдаемая величина т
систематически понижалась ПQ мере перехода I{ более чув--
ствительным методам анализа. Поступление кислорода из
тиrля влияло на конечное значение [О], но праизведение
[С]. [О] при этом оставалось близким 1< теоретичеСКО IУ,
вследствие соответствующеrо уменьшения [С] соrласно
уравнению (207). Обнаруженная принципнальная возмо)к-
пасть практически полноrо протекания реакции (205) в
rлубоком вакууме (которая в последние rоды иноrда ста-
вилась под сомнение) имеет большое практичеСI\ое значе...
ние и определяет перспективность попыток активизации
массообменных процессов в условиях промышленных arpe...
raToB (например, при электроннолучевой плавке) с целыо
u
получения сталеи и сплавов со сверхнизким содержанием
уrлерода и кислорода.
IV.4. О&ЕзуrЛЕРОЖИВАНИЕ
ХРОМСОДЕРЖАЩИХ РАСПЛАВОВ
Окисление уrлерода в расплавах с высоким содержанием
хрома является важной проблемой при выплавке KOppO
u u
ЗИОННОСТОИI{ИХ, жаропрочных и друrих сталеи и сплавов.
При обычных (для друrих сталей) условиях плавки ХРОМ
в таких расплавах обладает более высоким химичеС!{И!\1
сродством к кислороду, чем уrлерод, поэтому обезуr,,'1еро
живание в обычных условиях сопровождается большими
потерями хрома. Для решения проблемы нужно создать та...
кие условия плавки, которые способствоваLТIИ бы преИ IУ'"
щественному окислению уrлерО,да. Качественный выбор не...
120
u
обходимых условии ложно сделать, ИСХОДЯ из различия
сВОЙСТВ оксидов хрома 1I уrлерода. Как видно из табл. 1,
образование Сr20з сопровождается значительно б6ЛЬШИ 1
выделением тепла, чем образование СО (приблизитеЛЫ-IО в
три раза, если отнести значения HO к 1 молю кислорода).
В соответствии с изоба рой Вант.. rоффа (см. с. 11) отсюда
С,'1едует, что термодинамическая устойчивость Сr20з с по..
выIение tt температуры понижается значительно быстрее,
че 1 устойчивость СО, поэтому одним из условий эффек"
ТИВlIоrо обезуrлероживания металла в ПРИСУТСТВИИ хрома
ЯВ.1яется повышение температуры. Вторым существенным
различием между оксидами уrлерода и хрома является то
обстоятельство, что СО в условиях плавки представляет
собой rаз, а оксиды ХРОf\ла твердые вещества. Соrласно
принципу Ле..Шателье, образованию, rазообразноrо оксида
должно способствовать понижение давления.
При' количественной оценке необходимых условий обез..
уrлероживания хромсодержащих расплавов следует учи..
тывать, что хром, во..первых, существенно понижает I(ОЭф"
фициенты активности уrлерода и кислорода (см. табл. 6)
И, во-вторых, оrраничивает концентрацию КИСЛОРОД,а в ie...
та,1ле вследствие образования твердых оксидов: FeO. Сr 2 Оз
И.НИ СrЗ04 [2]. В результате уменьшения коэффициентов
fc и 10 произведение [Cj.[OJ, достиrаеrvIое при обезуrлеро..
)I{ивании хромсодержащих расплавов, всеrда выше, чем в
)I{е.пезе. Равновесные значения 'n можно рассчитать по
уравнению (207) при помощи пара метров взаимодействия.
Например, для расплава, содержащеrо 18 О/О Cr и 10 О/о Ni
при 1873 К и р== I атм получим 19 т===lg Рсо 1g fc
1 9 f ........... ( 1168 j T ) 2 07 eCr · 18 e Ni · 1 О....... е Cr · 18.........
о ' с с о
e 1 · 10 2,693. Подставляя в это выражение значения е!
из табл. 6 8, находим, что m===О,ОI9. Коэффициенты { ,
fg, '18 и 18 в этом расчете не учтены, поскольку при малых
,[С] и [О] они близки к 1.
Предельные концентрации уrлерода, которые MorYT быть
достиrнуты при обезуrлероживании хромсодержащих рас..
ПLllавов, опредеЛЯIОТСЯ равновесием с соответствующими
оксидами. Экспериментальные данные для расплавов на
Основе железа выражаются следующими уравнениями [2].
При 9 О/о Cr:
FеО.Сr 2 О з (т) + 4 [С] == [Fel + 2[Cr] + 4CO(r); (210)
6.00 == 830 000 541Т Дж; (211)
19 кl/4 == Ig ([0]1/2 Pco/fc [С) == ( l0830/T) + 7,06. (212)
121
При >9 О/о Cr:
Сr з О4(Т) + 4 [С] == 3 rCr] + 4CO(r); (213)
ao == 882500 585Т Дж. (214)
19 К1/4 === Ig ([Сr]З/4. Pco/f С [С) == ( 11520/Т + 7,64). (215)
Активности оксидов хрома в этих уравнениях приняты
равными 1 в связи с тем, что как в лабораторных, так и в
производственных условиях обезуrлероживание высокохро..
мистых расплавов сопровожда..
ется образованием вязких (re...
TeporeHHbIX) шлаков, насыщен..
ных оксидами хрома. Резуль...
таты расчетов по приведенным
уравнениям, как правило, УДО...
влетворитеJ1ЬНО соr,,lасуются с
данными опытов и производст
венных плавок. Используя)
уравнения (210) (215), IO
жно определить, какие УС..l0'"
вия треБУIОТСЯ для достиже..
ния необходимой степени обез..
уrлероживания расплава при
заданном содержании хрома.
При таких расчетах удобно
пользоваться параметро
[Cr ]j'[C]. Зависимость этоrо
параметра от температуры,
давления СО и состава сплава,
рассчитанная по уравнеНИIО
(215) с использованием данных табл. 6, 7 и уравнения
(47) *, представлена на рис. 23.
Из рис. 23 видно, что в обычных условиях (при Рсо ==
== 1 атм) для достижения необходимоrо значения [Cr]/[C]==
== 10/0,05===200 (которое примерно соответствует концу обез--
уrлероживания в случае выплавки стали типа 12Х18НI0Т)
требуется температура "-/ 1850 ос. Для HarpeBa расплава до'
такой температуры применяют rазообразный кислород.
При обезуrлероживании в вакууме или в условиях про
дувки инертным rазом эффективность процесса значитель
но повышается. Достиrаемые при этом результаты соответ..
ствуют обычно значениям Рео ==O,l O,Ol атм. В таких ус..
ловиях даже при температурах 1700 ос можно обеспечить
pco=[JOlaтl1 pco=qfaтl1
[Cr] 2
[С] 1
1200
1
Z
800
"о
lJoo
'
о
1873
2073 22.71 т,к
1800 2000 t, ос
1000
Рис. 23. Равновесные значсния
[Crl/[Cl для расплавов Fe
18 °k Cr (1). Fe 18 % Cr
10 % Ni (2); Fe IO % Cr
10 % Ni (3)
* Об использовании (47) для расчета !i(T) СМ. с. 66.
122
очень высокие значения tCrJ/[CJ( 1000), необходимые,
в чаСТНОСТII, для выплавки цизкоуrлеродистых коррозион..
носrОЙКIIХ сталей, содержащих <0,03 О/О с.
Как видно из рис. 23, условия обезуrлероживания за..
метио улучшаются в присутствии никеля. Это связано с
Te tf, что нике&lfJЬ увеличивает коэффициент активности уrле..
рОIIЗ (СМ. табл. 7) и, следовательно, облеrчает ero взаИ 10"
.
деиствие с кислородом.
'V.5. СЕРА В РАСПЛАВАХ
{)aBHoBeclloe давление паров серы над расплавами желе..
за и никеля очень мало, поэтому при исследовании таких
расплавов, так же как и при изучении растворов кислоро..
да, ИСПОЛЬЗУIОТ соответствующие rазовые смеси, обычно
Н 2 + H 2 S. Например, в работах [35, 224, 225] теплоты рас-
творения серы в железе и I-Iикеле ( H s) определяли по
температурным зависимостям константы реакции
1/ 2 S 2 (f) == [5] (216)
при ПОМОЩИ уравнения изобары Вант..[оффа (4). Было про-
ведено таI{же определение теплот растворения серы в же..
.,1езе и нике,не калориметрическим методом [97]. При ЭТО!\1
серу вводили в расплавы в виде соответствующих сульфи-
дов: FeS и Ni з S 2 . Для никеля значение 6.Н s == 123,5 кДж,
определенное калориметрическим методом, практически
совпало с результатами равновесных опытов: 117,9 кД>к
[227] И 118,6 кДж [35]. Для железа различие оказалось
значитеJIЬНЫМ: калориметрическим методом было получе..
но I1Hs == 72 кДж, а в равновесных опытах Hs ==
=== 131,9 кДж [2]. Калориметрический метод является наи-
более .надежным для определеIIИЯ тепловых эффектов, по
этому полученное с ero ПОf..l0ЩЬЮ значение теПЛОТI?I раство"
рения серы в железе можно считать, по"видимому, более
правильным, оно лучше соrласуется с данными [226] обо..
u
лее высоком растворимости серы в никеле по сравнению с
железом (при том же значении PHzS/PHz. Кроме этоrо, из
табл. 4 следует, что все элементы (за исключением уrле..
рода, азота и кислорода элементов BToporo периода Пе..
риодической системы элементов Д. и. Менделеева) раство..
ряются в никеле более экзотермично, чем в железе. По"ви"
ДИМОМУ сера не отличается в этом от остальных элементов
TpeTbero периода: алюминия, кремния и фосфора.
Приняв за ОСНОВУ полученные калориметрическим ме..
"ТОДОМ значения теплоты реакции (216) и определенные в
123
равновесных опытах значения I1Goo этой реакции Прlf
1873 К [2, 35J, ПОЛУЧИl\1 следующие выражения те fпера-.
турной зависимости OOO реакции (211) в железе 11 ни-
келе:
G(Fe) -== 72000 9,92 Т Дж;
== 3760 + 0518.
т "
l fs [%5]
g V
PS2
(21 7)
23500 2Т Д 1 ts [%S]
L1G{NI) == 1 + 17,7 ж; g 1,r
J PS2
== 6450 О 926
т ,.
(218)
Влияние различных элементов на коэффициент актив..
ности серы в железе характеризуется параметра IИ взаИ\IО-
действия, приведенными в табл. 6 8. Следует отметить
значитеJlьное увеличение коэффициента активности серы
под влиянием добавок уrлерода, кремния и фосфора. Это
является причиной Toro, что в чуrуне коэффициент аI\ТИВ,"
ности в несколько раз выше, чем в железе. Удаление серы
u
из чуrуна, а также из высокоуrлеродистои или высококрем..
нистой стали протекает значительно лучше, чеl\1 из обыч..
Horo низкоуrлеродистоrо металла. В никеле В rJияние доба
вок на коэффициент активности серы характеризуется еле..
дующими значениями параметров (1848 К) [35]:
Элемент j .... S Fe Gr . '10 Ti Al
Параметр e . .. а,ОЗ5 0,005 0,030 0,053 0,160 0,133
Для лучшеrо ПОНИ 1аIIИЯ поведения серы в сталеП lа..
вильных процессах представляет интерес рассмотрение тер...
u
модинамических характеристик взаимодеиствия paCTBopeH
ной в металле серы со шлаКО f, с rазовой фазой и с 'су.ль...
фидообраэующими элементами.
Взаимодействие серы со ШJtаКО'л'l. Как показали ОПЫТhf
[99, 100], сорбц онная (поrлотительная) способность шла..
u
ков по отношению к сере в значительнои степени зависит
от окислительноrо потенциала. Из рис. 24, А видно, что за...
метное растворение серы в шлаI<е наблюдается в двух об..
ластях значений paBHoBeCHoro авления кислорода: < IO 6 1-1
> 1(r4 атм. Это соответствует двум различным валентнос
тям, которые может проявлять сера в шлаке: 2 (сульфид-
ная) и +6 (сульфатная). В соответствии с ио:нной моделью
124
шлака можно написать две реакции растворения серы в
сульфидной и сульфатной форме:
1/2 S2(r) + (02.......) ::;: 1/ 2 0 2 (r) + (52......);
( a52 )
К I
( ao2 )
р ) 1/2
О.
.
t
Р
51 /
(219)
1f 2 S 2 (r) + З/ 2 О 2 (r) + (02 ) == (SO );
( aSO ) 1
К п == (a02 ) pl/2. p 3 / 2 .
51 02
Если учесть, что для данноrо шлака при небольших кон..
центрациях серы ее коэффициент активност'И 11 значение
а о !.... .......... практически не зависят от (О/о S), то выражения
(219) 1 (220) можно преобразовать с.педующим образом:
К' === ( %5 ) (Р / Р ) 1/2. (221 ) '
, 1 01 5. '
К' == (%5) [ 1/ ( pl/2. p 3 / 2 )] . (222)
11 52 О J
(220)'
Полученные константы называют соответственно су ль..
фuдной И сульфатной емкостью шлака. Из рис. 24, Б видно,
u
что эти характеристики деиствительно не зависят от Ps. и
РО2' но каждая в своей области: I(;I при малых значениях
РО. коrда реальный процесс описывается реакцией (219), а,
K;I при больших РО., коrда процесс описывается реакци"
ей (220).
При помощи выражений (221), (222) леrко объяснить.
почему в различных диапазонах изменения РО. ero значение'
по"разному влияет на растворимость серы. Влияние теl\1пе..
ратуры также имеет ПРОТИВОПО.пожный характер (см. рис.
24, А): Это соrласуется с различными знаками теплот реак"
о
ций [99] : CaO(T)+:1/ 2 5 2 (r)== CaS(T)+ 1/2 0 2(r); Н1700 2fXЮК:=:
=== 100,5 кДж; . CaO(T)+1/2S2(r)+3/202(r)==CaS04(T)
H;70o...-2000K == 816,5 кДж.
Для условий взаимодействия шлака с расплавом стали.
при Ро. < 10 8 атм первостепенное значение Иl\lеет суль"
фидная емкость шлака к; (обозначаемая обыч.но G s ). Не..
которые из имеющихся экспериментальных значений C s ,
Для различных шлаковых расплавов предстаВ,,'Iены на
рис. 25. Из рис. 25 видно, что сорбционная способность
шлаков по отношению к сере резко возрастает с повыше..
нием температуры и основности. Последнее соrласуется с
Вытекающим из уравнения (219) увеличением сульфидной
125
IКОСТИ шлака при повышении активности анионов кис...
лорода (напомним, что rлавными донорами ионов 02 В
шлаке являются основные оксиды). Замена СаО на MnO
и Si0 2 на АI 2 О з приводит К увеличению С s. Однако более
высокая сульфидная емкость шлаков системы MnO Si02
....1
1 [OJ Fe , О/О
I
А
(;)'
Z
о 159В /(
х 1773 1(
о 1823 1(
;}
10
8 б
" 2 О
19PD'l
б
0,01
2
а
0,1 {OJ Fe , О/О
\>:
'х\
O
'\
\
х8
12
...
O
.......С)
C\J
«::> E
..... ч
х 1
82
З
0'1
10 с;)- ris
<:) N
C\I
8
о Шлак 2
tr
\ . Шлак 1
'- ...... ........._
.....10
8 8
6
It 2 О
IgPo2
Рис. 2.1. Растворимость серы 8 шлаках, содержащих 37 % СаО+27 % АI 2 О з +
+Зti % Si02 (шлак J) и 41 % СаО+52 % А1 2 О з +7 % 5i02 (шлак 2), в условиях
равновесия с rазовой смесью 502+Н 2 +С0 2 +50 % N2 при различных РО. и PS.
[99] :
А опыты со шпаком J при 1 % 502 В rазе (изrиб линий связан с непостоянст-
ВОМ р 52); Б опыты при 1773 К; а область Р О,' при KOTOpЫ кислород
-находится в растворе (не образует оксидов); 6 область малой точности анали-
за; J шлак J, 1 % 502; 2 шлак 1, 2 % 502; 3 шлак 2. 1 % 502; 4 шлак
2, 2 % 502
.(а также основных мартеновских шлаков) не обеспечивает
им более высокой десульфурирующей способности по срав-
нению со Ш,,1]аками системы CaO Si02. Это объясняется
тем, что величина C s включает равновесное давление кис-
.лорода ро., а значение роzдля области, в которой MorYT су-
ществовать шлаки с высоким содержанием MnO или FeO
довольно велико.
126
Для расчета сульфидной емкости шлаков, отличающих...
ся по составу от изученных, можно воспользоваться реко--
мендациями rл. 11. Задача сводится к ВЫЧИС 1Jению актив..
ности кислорода [а (O ""')' а(СаО) или а(О)] и коэффициента
активности серы в двух шлаках: в заданном и в одном из
пзученных (с наиболее близким составом к заданному).
Дальнейший расчет В IПОЛ"
няется при помощи выра..
жения (219). Подставив в
Hero вычисленные характе..
ристики изученноrо шлака и
известное значение C s на...
9
1
-,::. (:) C\,I
;::.. N
r::a...
t:I
з
"
q
к.Н.8
2'
( s), о/о
Fs[% SJ
100
z
10
А
5 18
.8
з' "
/t
O
1
0;01 О, 1
O 10
(fe O 0/0-
о
42 Ц4 Ц8 48 х оси
Рис. 25. Сульфидная емкость С 8 различных шлаков в заВИСIIМОСТИ от мольноi1
доли OCHOBHoro оксида Х осв и температуры [100]:
1<
Номер Шлак Т, К Номер Шлак Т, I<
РИБОЙ . кривой
J СаО =1= 510. 1773 МпО + AIJOs 1923
D
/' СаО 810 1923 б СаО + AIJOs + CaF. 1773
2 СаО + AI.3. 1773 (Х AI.O. : x CaF . == 1,3: 1)
2' СвО t A1t? 1923 1773
3' MgO 51. 1923 7 СаО + CaF 1
4 МпО + 510. 1773 8 СаОт 1923
4' МпО + 510. 1923 9 FeO 1823
........ промышленные шлаки: о.м......... основной мартеновскиЙ (1923 К): К.М. КИС
лый мартеновский (1923 К); О,Д. ОСНОВJlОЙ доменныi\ (1773 К)
РВС. 26. Зависимость коэффициента распределения серы при 1823 197З К от co
держания РеО дпя шлаков с долей свободных оснований R, равноЙ 0,22 (J);
0,15 (2) н 0,10 (3) (21:
А доменные шлаки; Б восстановительные шлаки электросталеплаВIfЛЬJJоrо,
процесса; В окислительные шпаки
127
ходят константу К!, а затем обратным расчетом ВЫЧИслq.
ЮТ СВ дЛЯ заданиоrо шлака (с друrими значениями актив...
ности кислорода и коэффициента активности серы).
Зная сульфидную ejvIKocTb шлака, можно оценить тер-
модинамичеСI{ИЙ коэффициент распределения серы между
шлаком и металлом Ls ==(%S)j[%S]. Для такой оценки
величину C s IIY)I{HO снача ТIа преобразовать при помощи
выражений (189) и (217) в коэффициент Ls o ==
=== (О/О S) [%0] /[% SJ, который представляет собой видоиз-
менную константу равновесия реакции
[5] + (02 ) == (52.....) t- [О]; К == as2 [%0]/[ %S). (223)
:(при заданных значениях ао,.... и коэффициента активности
серы). Для нахождения Ls требуется определить содер-
жание в металле pacTBopeHHoro кислорода. Очевидно, что
при данном значении C s десульфурация металла будет
проходить тем лучше, чем полнее он раСКИСJIен. Реакция
(223) идет с поr,,10щением теП"ТIа (1 OO 200 кДж). Это С.не..
, yeT из температурной зависимости C s (см. рис. 25) и
уравнений (188) и (217). Исследования влияния темпера-
iypbi на Ls o дают аналоrичные результаты. Рассчитаем
и:оэффициент распределения серы между железом и извест
u
ково...rлинозе lИСТЫМ шлаком для условии, ИСС.педованных в
работе [101]. Из сопоставления выражений ДJIЯ C S И Ls o
С/lедует
Ig L o == Ig C s + Jg ([O]/V ) Jg ([S]/V ). (224)
Соrласно рис. 25, значение IgC s для шлака, содержа..
щеrо 53 ,о/о СаО и 47 О/О Аl 2 О з (Хсао ==0,6'73), при 1873 К
,состаВ lяет примерно 2, 4. С учетом выражений (189) и
(217), считая fo==fs== 1 ПО.пучим IgLs o=== 2,4 + 3,42.......
2,53 == 1 ,51 ; Ls o == 0,03. Для перехода к Ls оценим
концентрацию кислорода в металле по содержанию алю..
МПНIIЯ, использовав rрафик раскислителыIйй способности
Э.пементов [2]. Результаты расчетов и экспериментов при
Be;l,eHbI в табл. 15. Сопоставление показывает, что расчет
т а б л и ц а 15. Расчетные и экспериментаJlьные значения L s
[1-\1], % [0], % L* 1 [Аl], % [0], % Ls
S I
0,02
0,03
0,00034
0,00026
90/35
115/70
0,05
О, 1
0,00019
0,00012
160/150
250/500
* в числителе расчеТllые значения. в знаменатепе экспериментальные [101,
102].
128
вые значения MorYT служить 1JИШЬ дЛЯ ориентировочной
оценки L5.
Экспериментальные значения коэффициента распределе..
иия серы для различных шлаков приведены на рис. 26 [2].
Мерой основности шлаков, представленных на рис. 26, слу..
жит R доля «свободных» оснований, которая вычисля"
еТС>l по следующим формула {: для восстановительных ус..
повИЙ электроплавки и доменной плавки R===ncao +
+2/ з nМgO..........пsiО.==nАl.0. (nl число молей оксидов в
100 r шлака), для условий окислительноrо рафинирования
металл а R == nеао + пMgO + nMnO......... 2n S I О. ..........4пр.о,.
Взаu.модеЙСТ8uе серы с zаЗО80Й фазой. Переход серы из
металла в rазовую фазу наблюдается rлавным образом при
окислительном рафинировании расплавов. Он происходит
u
также в некоторых процессах вакуумнои металлурrии, од-
нако, широкоrо практическоrо применения десульфурация
в вакууме не имеет. Термодинамические характеристики ре-
u
акции; сопровождающихся переходом серы из металла в
rа:;()вую фазу, можно найти при помощи табл. 14. Приве..
дем выражения для констант равновесия некоторых реак"
ций TaKoro типа (табл. 16).
Расчетные давления различных серосодержащих rазов
над расплавами железа с заданными значениями активнос..
ти серы приведены на рис. 27, из KOToporo видно, что зна..
чительное давление чистой rазообразной серы, превышаю..
т а б п и Ц а 16*. КОЭффllциенты в уравнении IgK==A/T+B
Реакция
А
в
IS] == 1/2 S2(r)
(S] + 1/2 H 2 (r) HS(r)
[S] + [Н] == HS(r)
IS] + H 2 {r) == H 2 S(r)
[S] + 2[Н] == H (r)
[S] + [С] == CS(r)
2[S] + (С] == CS 2 (r)
(S) + [С] + [0]== COS(r)
[S] + (О] == S20(r)
IS] + (О] == SO(r)
(S) + 2[0] == S02(r)
(S] + 3(0] == SОз(r)
(S] + [Si] == SiS(r)
2[S] + (Si] == Si (r)
......3670
7718
........ 5812
973
4786
........13672
......5714
2003
--4731
6803
2662
1528
.......12908
8113
O,518
0,283
1 ,874
......3' 12
0,066
1 ,845
....... 3 , 002
........ 2 , 397
4,510
o ,426
4 , 563
........ 9 t 450
2,735
........1 ,873
· Расчеты выполнены А. В. Боrд,аIlОВЫМ по данным [4, 206].
9 675
129
u
щее остаточное давление при вакуумнои индукционной
плавке (""0,1 Па), наблюдается лишь при высокой актив-
ности серы в расплаве. Такое значение активности можно
ожидать только в чуrуне (при высоком содержании серы,
а также уrлерода, кремния, фосфора, повышающих величи-
ну '5). В этих условиях возможно также удаление серы в
виде cos, H 2 S, Н5, 502, CS, SiS.
Приведем для примера расчет удаления серы из рас-
плава, содержащеrо 0,02 % S; 0,1 О/О с; 0,002 О/О О, в случае
р, 1 атм
Р; , Па
10
[S], О/О
O
10"}
1
I
10"'6
IJ5
10 :1
42
10""
10"11
0,1
.
10 $
405
45 О, 75 lO 1,5 2,0 2,5 O '+j) 5,D
[Мп] , О/О
10 15
OOI OI
1 f5![SJ,%
Рис. 27. Равновесное Д8ВJJение серосодержащих rазов (р.) (СМ. табл. 16) ДЛ"
I
сплавов на основе железа при 1873 К при различных условиях расчета:
2, 4..... Р н ."1 8ТМ: 3, 5 [Н]-О,ООl %; 6, 7...... [C)"O,I %: В....... [С]-=О,l %; [0]-
-0,23 % (условно....... на поверхности металла); 8,....... [C]-=zО.l %. [O]z=O.022 %; 9....
12....... [0]"0,23 %: 9' J2' [0]-=0.022 %: 13, 14....... [51]==0,1 %
Рис. 28. Зависнмость растворимости сульфида lIарrаНЦ8 в чуrуне от СОДержани.
марrаНЦ8 и температуры [4]
пропускания над ним водорода со скоростью 1 М 3 /МИН (при
1873 К и Рн. === 101,325 кПа=== 1 атм). Результаты определе-
ния (при помощи приведенных на с. 129 уравнений) содер-
жания серы в удаляемом rазе приведены в табл. 17.
Максимально возможная скорость удаления серы из
расплава равна 5,3288. 10---5 (З2. 1 ОЗj22,4).== 0,076 r серы на
1 мз водорода, иди 0,076 r Iмин.
Взаuмодействuе серы с сульфuдообразующuмu эле:мен"
Та.м.и. Иноrда для десульфурации расплавов используют
высокое химическое сродство некоторых металлов к сере,
130
Т а б л и ц а 17. Содержание серы в УАaJJяемом rазе
rаз
Равновесное
Д8ВJ1ение rаза
Р, .1()5, атм
{S} .105,
моль S
моль Н.
rаз
Р8Вновесное
давление rаза
Р, · 1 ()5, аl'М
{S} .tOS,
IIOJIbS
IIOJJb Н.
H 2 S 5,018 5,018 О t 0004 0,0008
HS 0,2905 0,2905 О , 0007 0,0007
COS 0,0188 0,0188
При м е ч а н и е. {S} 1: --5,3288.10-1.
.l
сопоставимое с химическим сродством к кислороду или да-
же более высокое (Na, К). При введении таких элементов-
Аесульфураторов в металл удаление серы происходит ана- '
лоrично процессу rлубинноrо раскисления. Имеющиеся еве-
.цення об устойчивости некоторых наиболее прочных
сульфидов пред ставлены ниже в виде значений ao реакций
их образования [2], кДж/моль:
Сульфид . . .. АI 2 S з Вas
.......6.0298 . . . .. 275 464
G187З . . .. Нет СВ.
Cas
513
340
CeS
5З3
401
( K S
З 7
Нет СВ.
Сульфид r . . .
d 0298 . I , .
..........d 01873 . . . .
LЗ2Sа
455
Нет св.
MgS
389
184
MnS
248
140
п родОA3lCенuе
Na2.S TiS
400 254
Нет СВ.
При использовании относительно слабых десульфурато-
ров, например марrанца, заметное удаление серы может
быть достиrнуто только в условиях пониженной температу-
ры. Результаты одноrо из Ifсследований десульфурации чу-
rYHa .(соrласующиеся с данными термодинамическоrо рас-
чета при fs ==576) представлены на рис. 28, из KOToporo
ВИДНО, что несмотря на большое (по сравнению со сталью)
значение коэффициента аl{ТИВНОСТI{ серы в чуrуне и более
высокие концентрации марrанца (,,-,1 о/о) и серы ( O,l о/о),
заметная десульфурация расплава может иметь место толь..
Ко при < 1600 К. Такие условия реализуются в миксерах и .
ковшах, в которых и наблюдается некоторое удаление се-
ры в виде сульфида марrанца, всплывающеrо в шлак. При
выплавке стали марrанец не может служить десульфура..
тором. Ослабление вредноrо действия серы, которое дости"
rается в присутствии марrанца, связано с образованием
MnS при охлаждении слитка. Замена, даже частичная,
g*
131
вредных леrкоплавких сернистых соединений (СУЛЬфИДОВ
и оксисульфидов JКелеза) на значительно более туrоплав-
{{ий GУЛЬФид марrанца обеспечивает СНИJКение краснолом-
кости стали и друrие положительные последствия. Анало-
rичным образом взаимодействует с серой алюминий и не-
которые друrие элементы. Для удаления серы из стали за
счет образования сульфидов применяют более сильные де-
сульфураторы кальций, РЗМ (Се, La) и др. Эффектив-
ными десульфураторами являются и соединения сульфид-
образующих элементов: карбид и ЦIIанамид кальция (СаС 2 ,
CaCN 2 ), сода (Nа 2 СО з ) и др. Термодинамические характе-
ристики реакций вэаимодействия десульфураторов с рас-
плавами MorYT быть определены при помощи справочных
таблиц. Рассчитаем для при мера минимальную концентра-
цию серы, которую можно получить при обработке стали
карбидом кальция. При помощи табл. 1,4 найдем:
Ca (T) == Ca(r) + 2G(rp); I!!(JO == 213000 61,05Т Дж.
[8] == 1/ 2 S 2 (f); АQO == 72000 + 9,92Т ДЖ
Ca(I') + 1/ I S 2 (r) == CaS(T); ЛGО == 702500 + 193,3Т ДЖ
. 2Cr p == 2[CJ; ao == 45200 ........ 84,6Т ДЖ
Ca (T) + [S] == CaS(T) + 2 [С]; ao == 313100 +
+ 57,61T ДЖ (225)
Отсюда при 1873 К:
. 2 2
Ig К == Ig [С] fc aeas == 264 000 == 1 352. (226)
[5] fs аеас. 19.14.1873 '
Если принять, что СаС 2 и CaS находятся в самостоятельных
фазах, то их активности можно считать равными 1. Коэф-
фициенты активности fc и 1s при небольших [С] и [51
также можно приравнять 1. В результате получим:
[С] 2/US] ===2,25. 107, откуда следует, что равновесная кон-
центрация серы в расплаве для рассмотренных условий
очень низка (при 1 %C 4.I<r8 о/о). Таким образом, рас..
чет показывает, что термодинамические оrраничения для
процесса десульфурации стали в результате обработки кар..
бидом кальция (например, вдувания порошка) практически
отсутствуют.
IV.6. ФОСФОР В РАСПЛАВАХ
Фосфор имеет высокое ХИl\1ическое сродство к железу и ни-
I{елю, которое проявляется, например, в большом тепловом
эффекте образования соотвеТСТВУЮЩIIХ растворов. Ка,лори..
метрическими измерениями [204] энтальпий растворения
фосфида никеля в железном 11 IIIII{елевом расплавах полу
чены следующие значения H реаI{ЦИИ 1/ 2 P2(r)== [Р]:
- H (Pe) ==--...-а 140 + 35 кДж; Hr;(Ni) ==........ 252 : 30 кДж.
(227)
Полученное значение 8Нр в железе хорошо соr.пасуется
с результатами равновесных измерений ( 123 кДж) [2].
Если рассчитать температурную зависимость дОоо реакции
{227), приняв за основу !{алориметрическое значение Ho;.
и величину L\G 73' по данным ;[2], то уравнение будет
иметь следующий вид: дOoo== 140 OOO 9,6 Т Д>к. Д Я
никеля в связи с отсутствием равновесных данных значение
D.Goo реакции (227) определить нельзя.
Растворы фосфора в железе характеризуются значитель...
вымя положительными отклонениями от закона rенри, что
...
соrласуется с данными о сильном химическом взаимодеист-
вии компонентов. Коэффициент активности фосфора в БIi-
парном растворе может быть определен из выражения
Igfp==O,062[%P]. Влияние друrих присутствующих в рас-
плаве элементов на fp можно учесть при помощи парамет-
ров взаимодействия, приведенных в табл. 6 8.
Удаление из стали фосфора производят путем ero окис..
ления и перевода в шлак. Для понижения активности про-
дуктов реакции в шлак добавляют известь. Соrласно пред-
ставлениям молекулярной теории шлака, процесс дефосфо
рации металла можно описать уравнение I
2 [Р] + 5 [РеО] + 4 (СаО) == (4СаО .Р205) + 5Fe. (228)
ЭкспеРИl\1ентальные данные о paBHOBeCIIII реакции
(228), полученные Уинклером 11 Чипманом, И lеют следу-
ЮЩИЙ.ВИД [54]:
I g К == J g Х(4СаО. Р 10&)
2 5 4
[Р] Х(реО) .Х(СаО')
== 40 067 ....... 15 06
т ,.
(229)
Величина Х(СаО') представляет собой мольную долю
«свободной» СаО (не связанной в соединения с кислотны"
МИ оксидами) : Х (СаО') == Х(СаО) 2X(SiO a ) .......... 4Х(Р2 0 ъ) ............
133
............2x(Al s 0 a ). rрафическая интерпретация результатов рабо-
ты [54] представлена на рис. 29. При этом [JP==X(4CaO.P z O,)!
/[0/0 р J2; В=== [(СаО) + (MgO) + (МпО)] /[ (Si0 2 ) +2 (P20s) +
+ 1/2 (F е 2 0 з) + 1/2 (АI 2 О з )] О/о (мол).
I(aK видно из приведенных данных, ДЛЯ дефосфорации
металла требуются пониженная температура и шлак с до-
статочно высоким содержанием FeO и СаО. Практическ)тю
40 а 40 5
<::)
Lp=500 .
20 20
(:)
QJ Lp=Z:
O О
5 2,0 2,5 J,O В 5 2,0 2,5 J.fl. 6
'1
Рис. 29. ЗаВИСIIМОСТЬ коэффициента распределения фосфора L р от основности
шлака В, содержания (FeO) п температуры [54):
а 1873 К; 6 Lp ==100
оценку необходимых условий дефосфорации можно cдe ТIaTЬ
на основе упрощенноrо rрафика, приведенноrо на рис. 30
или при помощи эмпирическоrо уравнения: 19 (О/О Р) /
j [ о/о Р] == (22350/ Т) ............16'0 + 2,51 g ( О/О F е о бщ) + 0,08 ( о/о С а О ) :1::
=1::0,4, предложенноrо в работе [105] для шлаков (СаО) +
-+ (FeO) + (Si0 2 ) с нормальным содержанием (MgO),
(МпО) и (АI 2 О з ).
В пос.педние rоды рядом исследований показано, что фосфор подоб
' HO сере мол{ет переходить в шлак не только в окисленноЙ (фосфатной)
..форме, но 11 В восстановленной (фосфидной). Это имеет бо.пьшое значе
'ИИе в связи с необходимостью разработки процесса дефосфорации выео-
колеrированных расплавов без окисления содержащеrося в них хрома
и друrих элементов. Экспериментальные данные о влиянии окислитель..
Horo потенциала на коэффициент распределеН iЯ фосфора между шлаком
JI металлом приведены на рис. 31. Три левые линии на рис. 31 относятся
к восстановительным условиям (расплав Fe }\l........P, шлак СаО : АI 2 О з ==
== 1 : 1), правая линня К окислительным условиям [54} (расплав I c P,
шлак ОСIIОВНОСТЬЮ CaOjSi0 2 3). При построении rрафика равновесные
значения РО2 определя.}lИ при помощи термодинамических хараI<терпстн{{
[2] следующих реакций:
в восстановительных УСЛОВIIЯХ
2 [Al] + 3/2 O:!(r) == (AI2 0 з); 19 РО. == + [lg
Q(AI 2 0 I )
.)
а[ AI]
82000 ]
т + 13,9 ;
134
в окислительных УС 1]ОВJlЯХ
[ 12500 ]
(Fe] + 1/2 02(r) == (FeO); Ig Ро, == 2 Ig Й(FеО) ...... т + 2,6 ·
Активность А1 2 О з В шлаке определяли по экспериментальным данным
[2], активность FeO по формуле В. А. Кожеурова (СМ. rл. 11). Как вид...
но JlЗ рис. 31, дефосфорация в восстаповите.1ьныIx ус.rzовиях требует ВЫсо.
кой температуры и очень СИ.ТIьной раскисленности Iеталла и шлака. По.
сравнению с кривыми для серы (СМ. рис. 24) кривые для фосфора су...
щественно сдвинуты в область более НIIЗКИХ значений POJ. ДЛЯ обеспе..
19lp
5
-t
:1
2
1
О
Z g J!!1
[Р]
2
1
1
187]
О 1773 '" '!(73
..1 '\ 1
...2и ..,19 -18 ...17 :-16 10 ...$ ---8
1/1'11.
8 12. 18 20 24
(Feo),o/II
,
Рнс. эо. Зависимость коэффициента распределения фосфора Lp ..(%PJO,)/[p]2 ОТ
основностн Н степеНIf окиt..J1еНIIОСТII шлака при 1873 К [1051 [цифры у кривых.......
основность (CaO)/[(Si02) + (P 2 0s)]
Рис. ЗJ. Зависимость коэффициента распредепения фосфора между шлаком 11
металлом от окислитепьноrо потенциала (106]
чеНIIЯ необходимой раСКllсленности системы требуется присадка значи..
тельноrо количества элементов, обладающих высоким химическим срод"
СТВОМ К кислороду. При использовании алюминия (как в опытах, представ...
.1JeHHblX на рис. 31) ero концентрация достиrает 1 O 20 о/о. Это затрудня..
ет применение процесса в сталеплавильной технолоrИII. Значительно
.1учшие результаты достиrаются при использовании расплава Ca CaF2,.
которыЙ обеспечивает хорошее раскисление системы без существенноrо
перехода КЗJ1ЬЦИЯ в Ьfетзлл [202]. Необходимо отметить, что пока можно
rОБОрИТЬ лишь о принципиальной ВОЗМО)l{НОСТИ восстановительной дефос--
(рормации металла в условиях сталеплавильноrо ПрОIlЗБDдства. Практи-
ческая реализация процесса связана с РЯДО f трудпостей, которые пока
Не преодолены.
IV.7. АЗОТ В ЖЕЛЕЗЕ, НИКЕЛЕ И их СПЛАВАХ
Растворимость азота в железе подчиняется закону Сиверт..
са (заКОJJУ квадратноrо ко рня ):
1/2 N 2 ==INJ; [NJ == KN I PN a ' (230)
13&
r) e [N] растворимость азота в железе при даННО I пар.. .
циаL1JЬНОМ давлеНИli PN J ; K.rv константа, численное зна-
чение которой зависит от температуры и способов выраже-
u U
нии концентрации и давления.
Выполнимость закона Сивертса
указывает на идеальность обра..
зующеrося раствора. Результаты
u
измерении растворимости азота
в жидком железе, выполненные
различными методами разными
авторами, хорошо соrласуются
II07 111]. Авторы работы [112]
Рис. 32. Зависимость раствори- реКОl\1еНДУIОТ следующее уравне..
МОСТII азота в железе от тем- u
лературы ине температурнои заВИСИfr10СТИ
растворимости азота в жидком
}келезе до 2550 ос:
Ig [%NJ == ( 850iТ) O,905 + 1/2 IgpN.. (231)
11з уравнения (231) c ТIeдyeT, что при 1873 К и PN J ==
== 1 атм растворимость азота в жидком железе составляет
0,044 о/о. Температурный коэффициент растворимости азота
равен 1,0. 10 5 О/о/К. Зависимость растворимости азота в
железе от температуры приведена на ри 32. Энтальпия
растворения азота в }I(ИДКОМ железе AHN представляет
разность двух противоположных по знаку величин: энталь..
пии диссоциаЦИII молекулярноrо азоТа на атомы (6.Н дlfс ) и
энтальпии растворения aTOMapHoro азота в жидком желе..
зе (6.Н р ). Первый процесс является эндотермическим, вто"
u
рОН экзотермическим.
Поскольку H;J.lIc>8Hp, то и суммарный процесс, опи..
сываемый уравнением (230), протекает с поrлощением теп..
ла ( HN === 16280 Дж/моль (см. табл. 4).
Ана ТIИЗ 47 ИСС ТIедованиЙ, выполненных различными ав"
торами методами Сивертса и отбора проб показывает, ДО'
статочно хорошее совпадение растворимости азота в желе..
зе при 1873 К [N] == 0,044 + 0,002 О/О. в то же время энта,,1JЬ"
пия растворения обнаруживает значите.пьный разброс
Результаты статистической обработки массива из 513 экс"
периментальных точек можно описать двумя уравнениями
[98]: при < 1973 К Ig [О/О N] == 560/T 1,06; при > 1973 К
19 [ о/о N] ==:.......11 ОО/Т О, 79. Таким образом энта ьпия рас-
творения азота в жидком металле до 1973 К HN == 10700
Д>!</моль, а выше 1973 К дН ===21000 Дж/моль. А. М. Са-
1\!арllН [161], первый обративший внимание на . это, связыI.
[Нl, O
0.05'
'2
fе лr
4 0]
i' fe
! fe
0,0/
, I
.
.
1073 127} 1 7} 1573 7;К
136
вал изменение HN при изменении температуры со струк"
турными превращениями в ЖИДКОМ СОСТОЯНИИ [233]. Извест"
но, что при растворении кислорода в )КIIДКОМ железе ОКСИД"
ная фаза появляется при очень низком парциаЛЫIОМ давле..
нии кислорода в rаЗОБОЙ фазе (РО! == 10 8 атм). В отличие
от этоrо при растворении азота в жидком )келезе даже при
давлениях Р N J > 1 атм самостоятельная нитридная фаза не
образуется. Это означает, что в условиях открытой плавки
азот с жидким железом образует истинный раствор.
Образование нитридов типа Fe2N и Fe4N имеет место
лишь в твердом 1еталле в температурном интервале суще..
[N]) 0/0
V /Nb
418
Cr
.
I
I
!
I
I
j
J
I
I
.
I
I
.
f,:
6
5'
4
J
Z
1
0,7
0,5
0/1
0,3
0,2
0,1
О 2
с
St
1Z
То.
о
2
Мо
\V,S е
Sn
Co,Ni. Cu
51.
8 10 н, О/О
6 8 10 к, О/О
qo
6
Рис. зз. Зависимость растворимости азота [Nl в жидком железе при 1873 К и
Р н! с: 1 атм [2] от содержания леrирующих элементов [R] [2]
Рис. 34. Зависимость коэффициента активности азота f N в жидком железе при
. 1873 К 11 P N == I атм ОТ содержания леrирующих элементов [п] [2]
J ......
ствования аустенита. Реальные стаJ1И и промышленны
сплавы содержат леrирующие элементы, которые оказыва..
ют существенное влияние на термодина fическое поведение
азота. Присутствие нитридообразующих элементов значи..
тельно упрочняет силы связи с азотом и может привести
к образованию нитридов в раСПL7Jаве в виде самостоятельной
фазы. Влияние леrирующих эле fентов на растворимость
азота в сплавах н:а основе железа показано на рис. 33. По
характеру влияния на растворимость азота элементы мож-
НО разделить на следующие rруппы:
1. Титан, цирконий, ванадий, ниобий и друrие элемеlI..
137
ты, образующие с азотом прочные нитриды. С увеличением
концентрации этих элементов растворимость азота в жид..
ком железе возрастает.
2. Хром, марr.анец и молибден, характеризующиеся
ббльшим химическим сродством I{ азоту, чем железо. При
PN J === 1 атм ЭТII элементы в жидком же.,11езе при KOHцeHTpa
.циях, встречающихся в стали, нитридов не образуют, одна-
ко заметно увеличивают растворимость азота в ЖИДI{ОМ
расплаве.
3. Уrлерод, фосфор, никель, медь, снижающие раствори..
:мость азота в сплавах с железом.
4. Кремний и алюминий, являющиеся нитридообразую-
щими элементами. Первый снижает, а второй не изменяет
растворимости азота в железе.
5. Кислород 11 сера, мало влияющие на растворимость
азота в железе. являясь СИ.пьно поверхностно-активными,
они оказывают существенное влияние на кинетику поrло-
Illения азота.
'Коэффициент активности, описывающий влияние леrи-
рующеrо элемента [R] на термодинамическое поведение
азота, выражается формулой (33). На рис. 34 показано
влияние леrирующих элементов I-Ia коэффициент активнос"
ти азота в ЖIlДКОМ железе при 1873 К. При помощи урав-
нения (33) МО}I<НО выIислитьь растворимость азота в сплаве
любоrо состава. Для этоrо пролоrарифмируем уравнение
(33), а коэффициент активности fN, выразим через пара-
метры взаимодействия. При наличии нескольких леrирую..
щих элементов уравнение имеет вид:
Jg[%N]спл == Ig[%N]Fe e [%R]. (232)
Прuмер. Вычислить растворимость азота [О/о N] сил в I{OP"
розионностойкой стали 12Х18Н8 при 1600 ос и PN J == 1 атм.
ВВIIДУ 1\1алых содержанпй уrлерода, кремния и марrанца
их влиянием rvlОЖНО пренебречь. В соотвеТСТВIIИ с уравне-
нием (232) имеем: 19[%N]спл==lg[%N]Fе е r[%Сr]
e ' [%Ni]; Ig[О/оN]спл === IgO,044+0,047.18 0,010.8==
O,39; [0/оN]спл==0,25 о/о.
Прпменение параметров взаимодействия первоrо поряд-
ка в большинстве случаев обеспечивает необходимую точ"
ность расчета. Однако в ряде случаев нужно учесть также
параметры взаимодействия BToporo порядка. Это улучша-
ет совпадение расчетных данных с экспеРИl\1ентальными.
Для рассматриваемой задачи r r ==4. 10 4; r 1 ==0. В этом
случае 19[ % N] спл == 19[% N]Fe e2r[% Cr] e 1 [%Ni]
138
, r [O/OCr]2; Ig[%N]cn;r == IgO,044 + O,047.18 0,Ol.8.......
4.10 4.182== O,683; [О/оN спл ] ==0,207. В работе [210] на
основе анализа экспериментальных данных по 43 сплавам
на основе железа показано, что при расчете растворимости
азота с использование 1 парамет..
u
ров взаимодеиствия ТО.пько пер- NЛОlЛ1
Boro порядка поrрешность co О/О I
ставила 28 О/о. При учете пара..
метров BToporo порядка средняя
поrрешность снижается до 8 о/о.
Расчет по формуле (105) дает
поrрешность 5 О/о. Растворимость
азота при температурах, отлич- Рис. 35. Зависимость количест-
НЫХ от 1873 К, можно вычислить, ва поrпощенноrо азота N поrn
пользуясь данными по темпера- от :
., ОА растворимость азота в
турнои зависимости пара tетров жидком железе; 08 J{ OE pac-
.
взаимодеиствия или при помощи творимость азота в присутст-
Ч К вни нитридообразvющеrо эле-
уравнения ипмана орриrа.. мента [R'] н [R,r]. [R"]>[R']:
н а (см. с. 60 ) . BCD суммарное копичество
поrпощенноrо азота в растворе
Условия нuтридооб разованuя. и НИТРllде: Е н В точки ПИТ-.
ДЛЯ описания фазовоrо равно- ридообразовання .
весия в системе Fe.........R N при некоторой постоянной.
температуре Т рассмотрим зависимос ть количества азота
поrлощенноrо раСПJlавом (N поrл ) от 1/ РNJ(РИС' 35). Прямая
ОА характеризует изменение растворимости азота в жид..
ком железе в зависимости от V PN. , В соответствии с зако"
нам Сивертса. Ранее указывалось, что нитриды железа при
этом не образуются, поэтому имеет место линейное увеличе..
вие концентрации растворимоrо азота с ростом ero парци..
альноrо давления. Введение в жидкое железо элементов
[R], обладающих ббльшим химическим сродством к азоту,
чем железо, изменяет ход изотермы на рис. 35. В этом слу..
чае увеличение растворимости азота в расплаве Fe R с
V РN, наблюдают лишь до определенноrо предела. В точках
В и Е из расплава выделяются нитриды и равновесие в
трехфазной системе определяется реакцией
с
,,
В/
11
о I
[R] + [N] == RN нонд .
(233)
Таким образом, линии ОВ и ОБ соответствуют равнове..
сию pacTBopeHHoro азота с rазовой формой в расплавах
Fe R. С увеличением концентрации леrирующеrо элемен..
та образование нитридов происходит при меньшем парци..
альном давлении азота. С 'Iедовательно, 1JИIIИЯ ОБ соответ"
139
ствует расплаву с бб ТIьшей концентрацией леrирующеrо
элемента, чем ОВ. Точки В и Е соответствуют трехфазно-
му равновесию в систе lе (rаз, расплав, НИТрIIД). При по..
стояннам значении PN. (линия 1 1) с увеличением кон..
центрации леrllрующеrо элемента растворимость азота
возрастает ВС lедствие упрочнения связи R..........N, так как ко..
эффициент активности азота уменьшается. Отсюда следует,
что с увеличением концентрации леrирующеrо элемента yr..
ловой коэффициент прямых ОА и ОБ будет возрастать.
Рассмотрим ход кривой на рис. 35 за точкой В. Если
Жидкое железо содержит небольшое количество [R], то
зависимость N поrл OT' ! PN. изменяется по кривой ВС. На
этом участке нитридообразующий элемент в реЗУJlьтате
взаимодействия с азотом по реакции (233) полностью пе..
рейдет в нитрид. Таким образом, на участке CD расплав
не содержит нитридообразующеrо элемента и концентрации
paCTBopeHHoro азота будут возрастать по тому же закону,
что и по липии ОА, т. е. с тем же уrловым коэффициентом.
Выпадение нитридной фазы при PN. == 1 атм и 1873 К по
расчету наблюдается при следующих концентрациях нитри"
дообразующих элементов: титана 0,29 о/о, алюминия 0,82 О/о;
циркония 0,093 О/О.
с учетом фаЗОБоrо равновесия условия нитридообразо..
вания можно описать при помощи трех независимых пере..
менных: температуры, PN. и концентрации леrирующеrо
Э r}емента [R]. Вместо давления PN. можно задать связан..
ную с ним равновесную концентрацию азота в расплаве
[О/О N]. ЕСCl1JИ В рассматриваемой системе образуется нитрид,
то число фаз возрастает до 3, число степеней свободы
уменьшается до 2. Это означает, что из трех указанных
независимых переменных достаточно задать две для Toro,
чтобы определить состояние системы. Третья переменная в
этом случае зависит от двух друrих.' Следовательно, д я
Toro, чтобы определить УСЛ(JВИЯ существования IIИТРИДНОЙ
фазы, достаточно записать уравнение, связывающее меж..
ду собой три указанные переI\.1енные. Такая задача, в част..
IIОСТИ, была решена в работе [113].
П I 1Juмер. Определить минимальную концентрацию тита..
на, при которой образуются нитриды титана (TiN) в pac
плаве Fe Ti.........N при 1873 К и PN. === 1 атм. Коэффициент
активности титана в разбавленном растворе железа при
1600 ос равен 1'ТI ==0,037 (стандартное состояние ЧIIСТЫЙ
ЖИДКИЙ титан). Запишем уравнение реакции образоваНIIЯ
IIIIтрида титана:
140
Тi ж + 1/ 2 N 2 (r) ==: TiN(T); L\G?S73 ==: 135140 Дж;
Ig К == Ig 1 dGo 135140
== 3,76;
1'n. N Ti · pM.:l 19,15. 1873 19,15.1873
Jg Х Т. == Jg К Jg '\'П Jg p :;
Igx Ti == 3,76......... JgO,037; X Ti == 3. 10----3; [Ti] == 0,29%.
Прu:мер. Определить концентраЦIIЮ циркония, при КОТО..
рой образуются нитриды циркония при 1873 К и PN. == 1 атм.
Zr(T) + 1/ 2N 2(r) == ZrN(T); !!ОО ==:........ 351800 + 91 ,29Т;
Zr(ж) == Zr(T); ao === 16736 + 7,883Т;
[Zr](l%) == Zr(ж); дао == 80330 + 34,9Т.
[Zr](l%) + 1/ 2 N 2 (r) == ZrN(T); !!ao 288206 + 134,073Т
Ig 1( == Ig 1 == 15057 7,004.
[%Zr] .fzr-VPN. т
При 1873 К IgK==1,03fzr ==1, PN.==l, тоrда 19[%Zr]==
==:.......lg К == 1,03; [Zr] ===0,093 о/о.
Растворимость азота 8 никеле. Никель является основой
мноrих жаропрочных сплавов и входит в состав мноrих
коррозионностойких и конструкционных сталей. Темпера..
турная зависимость растворимости азота в жидком никеле
описывается следующим уравнением [33]:
.
,
1/.N 2 == [NJ Ni ; !!(]О == 69000 + 18,62Т; .
19 [%NJ Ni == ( 3610/T) 0,973 + O,5IgPN.8
(234)
(235)
Из ур внения (235) следует, что при PN. == 1 атм и
1873 К растворимость азота составляет 0,0015 о/о. Ббльшая
теплота растворения азота в никеле (69000 ДЖ/МОЛЬ), чем
в железе (16280 Дж/моль) свидетельствует о более силь..
Ной температурной зависимости растворимости. Вместе с
тем это указывает на то, что растворение азота в никеле
энерrетически затруднено в ббльшей мере, чем в железе.
Химическое сродство никеля к азоту fеньше, чем }келеза.
В связи с этим влияние леrирующих элеl'лентов на paCTBO
"
римость азота в сплавах на никелевои основе проявляется
Ilесколько сильнее, чем в сплавах на железной основе. Нп..
u .
Же приведены значения параметров взаимодеиствия e в
141
сплавах на основе никеля при 1873 К, определенные в раз-
ных работах:
J · · · · · Al се Ti Zr V Nb
. 0,23 O.13 O,O74
1 О ......0 , 53 .......0'21
'N (1873) · .
п родОАжеНА.
. . . . . . Та Cr Мо W Fe со
1/ 0,065 .......0' 1 О .......0'038 .......0'022 ......0'018 О t 0054
tN (1873) · ·
Для перехода к друrим температурам рекомендуется
}'равнение
eiN(T) == [(2440/Т) 0,З05] e'N(1873). (236)
Пара метры взаимодействия BToporo порядка для нике..
левых сплавов, как правило, отсутствуют, Ilсключая , r ==
===0,00103 [207]. СопоставлеНI-Iе экспериментальных дан-
ных по растворимости азота в
20 никелевых сплавах с ре..
зультатами расчета по пара..
u
метрам взаимодеиствия пока..
зывают, что средняя поrреш..
ность составляет 48 О/О [211].
Более высокая поrрешность,
чем для расплавов на OCHOB
железа, связана не ТО.пько с
недостатком данных по пара..
u
метрам взаимодеиствия и их
"
меньшеи надежностью, но еще
Рис. 36. Активность азота в ж ид- И большими абсолютными зна..
ком хроме при 2018 К [4] чениями коэффициентов ак..
тивности.
Азот 8 хроме. Поведение раствора азота в xpolwie
отклоняется от закона Сивертса (рис. 36). На правой оси
ординат отложено значение РМ;. Линейная зависимость
между [%N] и РМ; наблюдается лишь ДО 1 О/О N. Таким об-
разом, закон Сивертса соблюдается лишь при концентра..
ЦИЯХ, не превышающих 1 о/о. При более высоких концентра-
циях наблюдаются положительные отклонения от закона
rенри, связанные с уменьшением межчаСТИЧfIОЙ связи меж-
ду азотом и хромом. При PN 1 == 1 атм, 2018 К в жидком
хроме растворяется 5,2 О/О N. Это позволяет получить в про-
мышленных условиях азотирован:ный феррохром с содер-
жанием азота до 6 О/О. Термодинамическое поведение азота
в жидком хроме характеризуется той особенностью, что
ан
Zч
1,?
16
8
ЛиНlJ1I Зl1кона
reHpll
8
"
1 О
О 1 2 3 f [NJ, О/О
142
процесс растворения сопровождается сильным химическим
u
взаимодеиствием и протекает с выделением значительноrо
КО ТIичества тепла, поэтому с повышением температуры ра-
створимость азота уменьшается. Тем не менее нитриды хро-
ма в виде самостоятельной фазы даже при столь больших
концентрациях азота не образуются. Расчеты показывают,
QTO при 1873 1( CrN выпадает лишь при PN. ==20,5 атм.
Растворимость азота в жидких сплавах Fe Cr с повыше-
нием концентрации хрома увеличивается. Температурный
коэффициент растворимости азота в жидком железе при
уве.п:ичении концентрации хрома изменяет знак. В сплавах
Fe Cr при концентрации хрома <2,3 О/О с повышением
температуры растворимость азота растет. В сплавах, со..
держащих >2,3 О/О Cr, с повышением температуры раство"
римость уменьшается. Очевидно, что в сплаве, содержащем
""' 2,3 о/о Cr, растворимост азота в жидком железе от тем..
пературы не зависит (6.H N ==0). Растворимость азота в
сплавах Fe Ni с увеличением концентрации никеля сни-
жается. Таким образом, термодинамическое поведение аза..
та в ра плавах Fe..........Cr..........Ni определяется равнодействующей
"
двух взаимопротивоположных влиянии, оказываемых нике-
лем (снижает растворимость) и хромом (повышает раствс>"
римость).
Iv.a. ВОДОРОД В РАСПЛАВАХ
Растворимость водорода в жидком железе подчиняется
закону Сивертса:
1/ 2 H 2 (r) == [HJ; Кн == [%HJ/ Y РН.. (237)
Соrласно работе [115],
19 (%HJ Fe === ( 1900/Т) 1,577. (238)
Величина Кн, как следует из уравнения (237), числен-
110 равна растворимости водорода при РН 1 == 1 атм и задан-
ной температуре. При 1873 К и рн. == 1 атм [t1] ===
===0,0027 О/О *. Эитальпия растворения водорода ДНИ ==
===32100 Дж/моль. Растворимость водорода в ЖI-lДКОМ ни..
}(eLТIe описывается уравнением [116]:
Ig [%HJ Ni == ( 924/T) 1,88. (239)
Зависимость растворимости водорода в железе от тем..
пературы приведена на рис. 37, из KOToporo ВИДНО, что при
* 29 смЗjlОО r 1 или 27 ррт, 1 ррт== lO 40/o.
143
температуре кристаллизации наблюдается скачкообразное
изменение растворимости водорода от 28 до 8 смЗ/IОО r.
u
Это имеет большое значение для металлурrическои прак-
тики. В процессе I<ристаллизации водород выделяется из
раствора и это позволяет получать литой металл (слитки
или непреРЫВl!УЮ заrотовку)
u u
С меньшеи концентрациеи рас-
TBopeHHoro водорода. Раство-
римость водорода в аустените
выше, чем в 6-Fe. Это означа-
ет, что стали, кристаллизую-
щиеся в форме V-Fe и имею';'
щие аустенитную структуру,
О MorYT содержать больше БОДО-
873 1073 1273 1473 lС7З т,1( рода в твердом растворе, по-
Рис. 37. Зависимость растворимо- этому такие стали менее ПОД"
сти водорода в железе от темпе- ве р жены по р истости. У р авне...
ратуры
иие (237) приrодно для расче-
та растворимости в жидком
железе, находящемся в равновесии с rазовой фазой, содер-
жащей молекулярный .водород. Однако в реальных усповм-
ях парциональное давление молекулярноrо водорода в печ-
ной атмосфере ничтожно мало, а содержание водорода в
металле определяется парциальным давлением паров во-
ды и влажностью шихтовых и шлакообразующих материа..
лов. Влияние леrирующеrо элемента на растворимость ко..
личественно описывается коэффициентом активности f
(рис. 38, 39). Зная параметры взаимодействия (e ) и pac
творимость водорода в железе ([ О/о Н] Ре)' МОЖНО вычис-
лить растворимость водорода в сплаве данноrо состава
u
при заданном температуре:
Ig [%НJ спп == Ig[ %HJFe e [%RJ. (240)
Коэффициент активности водорода при любой темпе..
ратуре Т для сплава заданноrо состава можно вычислить'
на основе приближения Чипмана и Корриrана по следую-
щей формуле:
19 f (T) == [(6945/Т) 2,48] е (187З) [%R).
{HJ, CI1:!jI002
зо
fе ж
20
d' Fe
6' Fe
10
cx--Fe
(241)
Количественные изменения растворимости водорода в
жидком железе в присутствии TpeTbero элемента опреде-
u
ляются соотношением сил химическоrо взанмодеиствия
между частицами растворителя (железа), paCTBopeHHoro
вещества (водорода) и леrирующей добавки (R). rидри-
144
дообразующие элементы (Zr, Ti, Nb, V, Се) увеличивают
растворимость водорода. Элементы, не образующие rидри..
дов (Cr, Ni, Мп, Со, Мо), слабо влияют на растворимость.
rруппа элементов (С, Si, S, Р, Al и др.) уменьшает раство-
римость водорода. Это связано с сильным взаимодействи-
eid между атомами >I{елеза и леrирующей добавкой, с обра..
зованием карбидов, силицидов, сульфидов, фосфидов
(:)
... 22
.
'
18
f:
9 5i.
Cr 1,7
1,5 Al
о 2 " 8 8 10 12[/(},0/0
1,3
1
t1 Со
О u
Ni
нь
9 10 12 [HJ, %
Рис. 38. Зависимость растворимости водорода в жидком железе при 1873 К от
содержания леrнрующих элементов [2]
Рис. 39. Зависимость коэффициента активности I водорода в жидком железе
при 1873 К от содержания пеrирующих элементов
алюминидов или соответствующих rруппировок. В резуль-
тате этоrо термодинамическая активность железа снижа..
ется, что приводит К уменьшению растворимости водорода.
П рим,ер. Определим, возможно ли образование rидри-
дов церия в стали до ее затвердевания (при концентрации
церия 0,1 о/о, или ХСе ===4.10 4) : [Се] +Н 2 (r)===СеН 2 (конд);
дGО===.........206500+ 148,7 Т Дж. Вычислим равновесное дав..
ление водорода, необходимое для выпадения rидридов, и
сравним ero с фактическим Рн 2 : 19 К === 1/ (ХСе- PH 1 ) :::::
== ( Go/2,3 RT) === [72570/(19,14.1873)] == 2,O; К===
== 10 2; РН 1 == 1/ (КХсе) === 1/ (10 2. 4. 10 4) ===2,5.105 атм.
Поскольку равновесное давление существенно превы"
шает реальные значения PH 1 , наблюдаемые на практике,
то rидрид цери образовываться не будет.
lO 675
rпa8a v
РАСКИСЛЕНИЕ СТАЯИ И СПЛАВОВ
Раскисление является заключительной операцией перед
u u .
разливкои, которая в значительнои мере определяет СБОИ-
стаа rOToBoro металла. Задачами раскисления являются:
1) снижение растворимости кислорода присадками эле-
ментов раскислителей, характеризующихся большим хими-
ческим сродством к кислороду, чем железо, до уровня,
обеспечивающеrо получение плотноrо металла; 2) созда-
ние условий для возможно полноrо удаления образующих-
си продуктов раскисления из жидкой стали. Термодинами-
ческие характеристики раскисления ХОрОllJО изучены и до-
статочно полно изложены в работах [118 121].
V.t. ВJlИЯНИЕ ЭЛЕМЕНТОВ-РАСКИСЛИТЕЛЕА
НА АКТИВНОСТЬ КИСЛОРОДА В ЖИДКОМ ЖЕЛЕЗЕ
На рис. 21 представлена зависимость концентрации кисло..
рода от V РО. . Наклонные линии соответствуют равнове-
сию paCTBopeHHoro в металле кислорода с rазовой фазой.
Точки переrиба отвечают давлениям РО. , при которых
образуются оксиды данных металлов, и нонвариантному
равновесию трех фаз: rазовой, металлической и оксидной.
Уrлы наклона прямых характеризуют константы равнове..
сия реакции растворения rазообразноrо кислорода в соот"
ветствующем металле -1/2 02(r)=== [О]. При заданном значе..
нии РО. дЛЯ металла с большим химическим сродством к
кислороду характерна более высокая концентрация раство-
peHHoro кислорода. Вместе с тем, чем больше химическое
сродство данноrо металла к кислороду, тем при более низ..
КИл парциальных давлениях происходит образование ОК-
сидной фазы. Если к исходному металлу Ме добавить не..
которое количество раскислителя R, то линии [О] ==f(V !)
будет соответствовать больший уrловой коэффициент.
В этом случае оксидная фаза появится при более низком
давлении кислорода. Равенству парциальных давлений
кислорода соответствует равенство активности кислорода
в исходном металле Ме и в сплаве, содержащем pac
кислитель (Ме R): аО(Ме) == aO(Me R); [О/о О] Mef[o] (Ме) ===
== [О/О О] (A1e R)f[o] (Me R). Поскольку для Ме выполняется
закон Сивертса, то '[О](Ме) === 1. Коэффициент ffo] == '[Ь](ме>
характеризует влияние раскислителя на коэффициент ак-
J46
тивности кис..тIорода, pacTBopeHHoro в сплаве Me R. Сле-
;:I.OBaTe"lbHo, flb] == [0/0 О] Ме/[ О/о О] ("1c R).
Экспериментальные данные по изменению коэффициен-
ТОВ активности кислорода в жидких сплавах на основе же-
lеза обычно представляют в координатах Ig f [% R].
Уrловые коэффициенты прямых характеризуют параметры
взаимодействия первоrо порядка (e ). Чем сильнее рас-
кислитель, тем в бо.пьшей мере он уменьшает коэффициент
активности кислорода.
У.2. АНАЛИЗ КРивой РАСКИСЛЕНИЯ
Результаты экспериментов по определению раскислите.JlЬ"
ной способности элементов во мноrих случаях представля-
ют rрафически в виде зависимости активности растворен-
Horo кислорода а[О] от аКТИВНGСТИ элемента..раскислителя
a[R]. При ЭТОМ монотонному снижению а[О] соответствует
увеличение a[R]. Если по оси ординат откладывать не ак..
тивность, а концеl-Iтрацию paCTBO
peHHoro кислорода, а по оси абс..
цисс остаточную концентра-
цию элемента-раскислителя, то
v
на кривои растворимости кисло-
рода для большинства раскисли..
телей наблюдают минимум. На
рис. 40 такие данные приведены
для раскисления жидкоrо железа
хромом. Видно, что с увеличени-
ем содержания хрома до 8 о/о кон-
центрация pacTBopeHHoro кисло-
рода уменьшается до минималь-
Horo значения (0,03 о/о), а с даLТУЬ
нейшим ростом [0/0 Cr] значение
[0/0 О] возрастает, в то время как
а(О] непрерывно снижается. Физические причины TaKoro
изменения [0/0 О] связаны с уменьшением коэффициента
активности кислорода с увеличением [О/О R]. Увеличение
концентрации кислорода после точки минимума некоторые
исследователи связывают с растворением продуктов peaK
ции раскисления в жидком железе. Проанализируем зако
номерности, приводящие к минимуму на кривой раствори-
мости кислорода. Рассмотрим реакцию раскисления
RОконд== [R] + [О]. Примем, что отклонения раствора ОТ
идеальности связаны с поведением кислорода а[о] =t= [0/0 О].
В этом случае l( == [% R] a lO ] === [% R][ % ОН{Ъ]. ПО опре-
10*
9,l
0,1
0,08
o,o
t:::s o,Ol
· .... а пl
'JV
.... 0,006
с aoo
'" 0,002
0,001
0,1
1
10
[Crl, %
Рис. 40. Зависимость содержа-
ния кислорода н ero aKTIIBHO.
СТИ в распnавах Fe Cr пр}!
1873 К от коnичества ВВОДимо.
ro хрома (4)
147
u R R[%R]
деLlению параметра взаимодеиствия {[О] ==е о тоrда
K==[%R)[%O] e eg [%RJ; [%0] == K/g[%RJ /[%RJ. (242)
Из формулы (242) следует, что зависимость [0/0 О] от
[О/О R] носит сложный характер. В реальных условиях при
небольших концентрациях [R] роль знаменателя проявля-
ется сильнее, и концентрация кислорода с увеличением
[0/0 R] убывает. С дальнейшим увеличением [R] (после
точки минимума) роль экспоненты возрастает и это при-
водит к увеличению концентрации paCTBopeHHoro кислоро-
да. Из данных, приведенных на рис. 40, следует, что увели-
чение концентрации 1Келеза (правая ветвь кривой) приво-
дит К снижению концентрации кислорода. Однако отсюда
нельзя сделать вывод, что 'железо может быть раскислите-
лем для жидкоrо хрома. На самом деле с увеличением
концентрации железа активность pacTBopeHHoro кислорода
увеличивается, что СВ.идетельствует о повышении окисли
тельноrо потенциала расплава.
В работе [120] установлена связь между параметром
взаимодействия e и концентрацией раскислителя XR, ко-
u
торыи соответствует минимальная концентрация кисло-
рода:
e == (тln)(l/xR)' (243)
rде XR Iольная доля раскислителя; т и n число ато-
мов R и О в молекуле RO.
При помощи уравнения (243) на основе эксперимен-
тальной кривой [0/0 О] ==ср (хн) можно вычислить e . Если
продукты раскисления имеют сложный состав (FeO. RxOy) ,
то равновесная концентрация кислорода будет описывать
ся уравнением [103]:
1 %0] === (e X R )/[ (Ь bX R + X R ) К 2 ], (244)
rде Ь==К 1 /К 2 (K 1 и К 2 константы равновесия реакции
ОКI-Iсления железа 1-1 раскислителя) . _
в этом случае в точке минимума кривой растворимости
кислорода имеем
х == ( l/e R ) [Ь/(l b)]. (245)
R m1n О
Анализ }<ривой раскисления показывает, что она может
И 1еть не только минимум, но и быть замкнутой [232]. Ми-
хайлов r. r. сделал полезное обобщение и систематизацию
литературных и собственных данных в виде диаrрамм со..
148
стояния, устанавливающих связь между составами жидко..
ro металла и равновесных неметаллических фаз. Состав
paBHoBecHoro металла определен на поверхности раство"
римости компонентов в жидком металле.
. v.э. РАскиспЕНИЕ ЖЕЛЕЗА и Ero СПЛАВОВ
По увеличению раскислительной способности элементы
можно расположить в следующей последовательности: Ni,
Fe, Mn, Si, Al. В этом ряду каждый. послеДУЮIЦИЙ элемент
является раскислителем по отношению к предыдущему.
Существуют различные способы оценки раскислительной
способности элементов, которые выражают одну и ту же
термодинамическую сущность. В частности с увеличением
раскислительной способности равновесная остаточная ак-
тивность кислорода, соответствующая одинаковым оста..
u
точным активностям элементов..раскислителеи, уменьша-
ется. Если продуктом раскисления является чистый оксид
RmOn, то ero активность aR о === 1. В общем случае следу-
m n
ет учитывать сложность образующеrося оксида FeO)<'
XRmOn. Чем выше раскислительная способность, T M при
меньших концентрациях элемента..раскислителя образуют..
ся С,,1Jожные продукты раскисления типа F O.RmOп. Место
u
уrлерода в ряду раскислителеи определяется давлением
Рсо. При Рсо === 1 атм уrлерод располаrается между эле..
ментами Мп и Si. При низких значениях Рсо уrлерод мо"
жет быть более сильным раскислителем, чем например,
u
алюминии.
Раскисление марzанцем
Марrанец является сравнительно слабым раскислителем.
При' 1600°С и концентрациях марrанца 0,2 и 0,8 О/О жидкое
железо содержит 0,15 и 0,1 О/О кислорода. При этой же тем..
пературе под шлаками из чистых оксидов железа [о]нас===
=== 0,23 о/о. При введении марrанца в сталь образуются про..
дукты раскисления, состоящие из FeO и МпО. Концентра..
ция МпО зависит от содержания марrанца в металле и
температуры. В соответствии с диаrраммой состояния
PeO MnO продукты раскисления в зависимости от содер-
.iкания марrанца образуют жидкие или твердые растворы
[ 122] :
[Mn] + (FeO) == (МпО) + Pe}l ; ao ==......... 123260 +
+ 56,46Т. (246)
149
Оксиды FeO и МпО образуют практически совеРшен_
ныIй р€J.СТБОр. Тоrда
K Mn == X(MnO)/X(FeO). [%Мп1; Jg К Мп == (6440/Т) 2,95.
(247)
Справедливость соотношения (247) подтверждается
линейной зависимостью Х(мпО)/Х(РеО) от [0/0 Мп] или По-
стоянством КМп при заданной температуре. Процесс рас-
кисления жидкоrо железа марrанцем изучен сравнительно
полно. Результаты различных авторов достаточно хорошо
соrласуются. Во мноrих случаях реакцию раскислен'ия 1ap-
rанцем записывают в следующем виде:
[Мп) + [о) == (МпО); К п == а(мпо) La[o] .а[мп], (248)
Выражение (248) можно получить сложением уравне-
ний (246) и (190). В этом случае
Jg K == (12770/Т) 5,69. (249)
П ри.мер. Определить состав продуктов раскисления ста-
,,1И при 1600°С и 0,50/0 [Мп] в жидком металле. Из урав-
нения (247) следует, что мольная доля (ХМпО) при ПОСТQ-
u .
янном температуре определяется концентрациеи марrанца.
Принимаем, что образующиеся продукты раскисления об..
разуют совершенный раствор Х (FeO) + Х(МпО) === 1. Констан..
та равновесия реакции (247) при 1600°С равна Ig KMn ==
=== (6440/Т) 2,95===O,48; 3,02===X(MnO)/X(FeO). [0/0 Мп]. От..
сюда при [Мn] ===0,5 О/О образующиеся продукты раскисле..
иия имеют следующий состав: (МпО) ===60 о/о, (FeO) ===
=== 40 0/0.
Раскисление кремнием
Кремний более сильный раскислитель, чем марrанец.
Терм динамические характеристики реакции раскисления
стали кремнием выражаются следующим уравнением
[ 126] :
Si0 2 (T) == [Si] + 2 [О]; !!"аО == 596785 ........ 231,21 Т; (250)
JgK 51 == ( 31180/T) + 12,08; KSI == a[s,]afo] ==
== 1 %SiJ [%012 1[51] ftO] == [% SiJ[ %0)2. (251)
Мlfоrочисленные исследования показывают, что произ..
ведение растворимости [0/0 Si] [о/о О] 2 остается постоянным
при изменении концентрации кремния вплоть до 20/0. Это
Связано с тем, что с увеличением концентрации кремния
в расплаве '[51] увеличивается, а '[о] уменьшается. Ука..
150
зан ные изменения ПРОИСХОДЯТ так, что их произведение
f(SiJftOJ == 1. При малых содержа иях кремния в стали и
высоком содержании кислорода продуктом раскисления
ЯВLТIяется не чистый кремнезем, а силикаты (FeO) х.
. (Si02) различноrо состава. Количественные соотношенич
между Х(РеО) И X(SiO.) можно вычислить на основе кон-
станты равновесия уравнения: 2 (FeO) + [Si] == (S i0 2) +
+2Fе(ж); OO=== 354470+ 126,32 т полученноrо комбина-
цией уравнений (249) и (250):
Ig К == X(Si02/X FeO). [%SiJ == (185201Т) 6.6. (252)
Расчеты по уравнению (252) показывают, что при 0,1
и 0,3 О/О Si содержание FeO в продуктах раскисления со-
ставляет 10 и 4 О/о соответственно. Переход от одних про-
дуктов раскисления (железистых силикатов) к друrим
(чистый кремнезем) по мере увеличения концентрации
I<:ремния в жидком железе происходит непрерывно.
При.мер. Вычислим концентрацию кремния, соответст-
.. .
вующую минимальнои концентрации кислорода при
1600 ос.
В соответствии с уравнением (251) имеем:
)п [%0) == Ч In KSi 1/" ln [%SiJ ц" In fr i] In f ]. .
(253)
Чтобы найти экстремум функции, продиффундируем
уравнение (253) по концентрации кремния и приравняем
нулю:
d 10 (%0) == J... . 1 J.... d 10 tF iJ d 10 tfJ] . (254)
d (% 51] 2 [%Si) 2 d [%Si] d [% Si]
Используя данные по параметрам взаимодействия
(e : ===0,11; eg i == O,131) и решая уравнение (254) отно-
сительно [О/о Si] при минимальной концентрации кислоро-
да, имеем [0/0 Si] ==2,86 о/о. По формуле (251) вычисляем
[О] mln ===4,19. 1 O 3 о/о.
.
РаС1\,uслеНllе алюминием
АLТIЮМИНИЙ является очень сильным раскислителем и в свя-
зи с этим широко применяется для раскисления стали.
РаСI{ислительная способность алюминия экспериментально
определялась мноrими исследователями. Трудности экспе
риментальноrо изучения раскислительной способности алю..
Миния связаны со сравнительно большой поrрешностью
u u
определении малых концентрации кислорода и раскисли-
151
теJIЯ в расплаве, а также низкоrо окислительноrо потенци_
ала (Ро.) в rззовой фазе. Например, при остаточной Кон-
центрации алюминия 0,001 О/о содержание pacTBopeHHoro
кислорода составляет 0,001 о/о, что приближается к преде-
лу определения кислорода. При малых добавках алюминия
образуются сложные включения, состоящие из шпинели
FеО.А1 2 О з (rерценита) или раствора оксидов А1 2 О з И РеО.
При избытке алюминия [О/О AI]/[% O] 25 образуется чи-
стый А1 2 О з . Д ТIЯ большинства сталеплавильных процессов
ЭТО условие выполняется:
Аl 2 О з == 2 [Al] + 3 [О]; ao == 124220 394,85Т. (255)
На основе обобщения результатов различных исследо-
ваний авторы работы [119] рекомендуют следующее вы-
u
ражение для температурнои зависимости константы рав-
новесия реакции (255):
Jg К А) ==; IgafAl].a O] == ( 64900/T) + 20,63. (256)
Для большинства практических расчетов можно при-
нять, что а[АI]==[О/о Аl] и a[o]==[% О].
ДРУ2ие раСКUСЛIlтелu
Цирконии. Относится к одному из наиболее сильных рас-
кислителей. Продуктом раскисления является Zr02:
.
Zr0 2 (T) === [Zr] + 2 [О]; ao == 790700 230,69Т. (257)
19 K zr == Ig [%Zr][ %0]2; Ig K zr == ( 41370/T) +
+ 12,07[119]. (258)
Бор. Температурная зависимость константы равновесия
реакции раскисления бором
В 2 О З == 2 [8] + 3 [О]; dGo == 855460 295,33Т (259)
выражается уравнением
]gK B == Ig[%В]2[%О]З == ( 44695/T) + 15,43[119]. (260)
Ванадий сравнительно слабый раскислитель. При
1600 0 С и <0,2 о/о V образуется 'шпинель FeO. V 2 О з . При
> 0,2 о/о образуется оксид V 20з:
V 2 О З == 2 [У] + 3 [О]; &00 == 877340...... 336,О2Т (261)
Ig Ку == Jg [% У]2 [%0]3; ffo] == ( 44793/T) +
+ 17,556 [ 121]. (262)
Малые добавки ванадия вводят в металл не для рас-
152
кисления, а для реrулирования размера зерна и связыва
ПИЯ азота с целью предотвращения старения.
Титан. При изучении раскислительной способности ти-
тана наибольшие трудности связаны с И,,1.{ентификацией
продуктов раскисления. При <0,2 О/О [Ti] образуется
ТiзОs [124, 125]:
ТiЗОf) == 3 (Ti] + 5 [О]; АQO == 793735 65,О7Т; (263)
Ig КТ! == Ig [% Тi]З [%0]1 === ( 414 70fT) + 3,4. (264)
Кальций и Jrtаzнuй являются очень сильными раСКИСtllИ
теляМИ. Трудности использования этих раскислителей для
обработки жидкой стали связаны с тем, что при темпера
турах сталеварения оба элемента находятся в rазообраз
u
НОМ состоянии И характеризуются очень низкои раствори-
мостью в жидком железе. Растворимость I(альция при
1600 ос и РСа === 1 атм равна O,02 O,03 о/о, а 1аrНия...... ТЬ(-
сячные ДОЛИ процеНТ8. Раскислительная способность Mar.
ния, .по данным [119], определяется уравнением:
MgO c " == Mg(r) + [О]; АQO == 622050 201,35 Т; (265)
19pMg'[%OJ == ( 32500/T) + 10,52, (266)
Раскислительная способность кальция, соответствую-
щая СаО(т)== [Са] + [О], определена при 1600°С в мзrие-
[01, о/о
10....1
.
10 ;;
с
7. n
. Lz'.JJ
" . Тi,>О з /
. /
/
/
10
1[} "
10 .}
10 2
10 1
1
1(1
СК],%
Рис. 41. Раскиспитепьная способность зпементов в жидком
железе при 1873 К 11211
153
зитовом тиrле. Получено следующее значение произведе...
ния: [О/О Са] · [О/О О] === 1,2. 1 O 5. В реальных условиях Mar-
u
нии используют для раскисления металла в Вllде лиrаТУРt
а кальций в виде сплавов с кремнием и алюминием. Очень
сильными раскислителями являются лантан:оиды (лантан,
церий и др.), которые в последнее время широко применя:
ются в сталеплавильном производстве [119, 121]. Раскис..
..тIите,,1ьная способность Э.пементов в жидком железе при
1873 К приведена на рис. 41.
V.4. КОМПЛЕКСНЫЕ РАскиспИТЕЛИ
в практике сталеварения широко лрименяют комплексные
раскислители, представляющие собой сплавы двух или не-
скольких компонентов (силикомарrанец, СII.пикокальций,
сплав кремния, марrанца и алюминия и др.). Преимуще-
ства, связанные с применением !{омплексных раСКИСЛIlте-
лей, обусловлены двумя обстоятельствами: существенным
улучшением термодинамических условий раскисления и бо-
лее блаrоприятными кинетичеСКИ 1И условиями зарожде-
u
ния, укрупнения и удаления неметаллических включении.
Например при 1600 ос в жидком железе с 0,2 О/О Si наха..
ДИТСЯ в равновесии 0,012 010 pacTBopeHHoro кислорода. B1\le..
сте с тем при добавке 0,5 О/о Мп содержанию 0,2 о/о Si соот"
ветствует более низкая равновесная концентрация кисло-
рода: 0,008 о/о. Таким образом, добавка марrанца приводит
к повышению раскислительной способности кремния. Мар-
u
rанец и кремнии раздельно и совместно повышают раскис-
лительную способность алюминия. Рассматриваемый эф-
фект увеличения раскислительной способности под влия-
нием BToporo компонента объясняется уменьшением
термодинамической активности обрвзующеrося оксида в
сложных продуктах раскисления, которые существенно
отличаются от продуктов при раздельном раскислении.
Если сталь одновременно раскислить кремнием, MapraH-
цем, то продуктами раскисления являются железомарrан-
цовистые силикаты. Состав силикатноrо раствора и ero
u
arperaTHoe состояние определяется температурои, а также
концентрацией кремния и марr нца в железе. В этом слу-
чае реакцию раскисления кремнием следует записать C.1Je-
дующим образом:
[Si] + 2 [О] == (SiOJ. (267)
в рассматриваемых условиях (Si0 2 ) образует раствор
с (MnO). Константа равновесия реакции (267) в отличие
154
от (251) имеет вид:
К == a(Si0 2 ) /( a[SI] а со ]). (268)
В уравнении (268) активность кремнезема aSIO. мень-
ше единицы. Поскольку константа равновесия при данной
те пературе постоянна, то У fеньшение aSIO. приводит к
снижению произведения растворимости Й[SI] . а: о ) , а сле-
довательно, к уменьшению концентрации остаточноrо кис..
лорода в жидкой стали. Таким образом, в присутствии бо-
лее слабоrо раскислителя (марrанца) раскислительная
способность кремния повышается. Активности компонентов
в бинарных и тройных оксидных системах приведены в ра-
ботах [2, 123]. Если продуктом раскисления является
шлак, насыщенный кремнеземом (aslo. === 1) или чистый
Si0 2 (aSIO. === 1), то марrанец не влияет на раскислитель..
ную способность кремния. Марrанец увеличивает раскис..
ТIите-!IЬНУЮ способность алюминия лишь в том случае, Kor..
v
да жидкии l.Iеталл находится в равновесии со шлаком и
шпинельными растворами. В области, rде металл находит-
ся в равновесии с твердым корундом, содержание [О/О О]
.
определяется только концентрациеи алюминия.
V.5. РАскиспИТЕЛЬНАЯ СПОСО&НОСТЬ ШПАКА
Для оценки раскислительной способности восстановитель-
ных шлаков необходимо сопоставить фактическую актив-
ность кислорода а[ОJф в металле под шлаком данноrо со..
става с равновесным значение f a[OJ p . Если аrо]ф>аrо]р,
то Ш.1ак оказывает раскисляющее действие. Исследования,
проведенные Ф. п. Еднералом, А. М. Левиным, д. я. По-
во.Т}оц им, А. и. Холодовы м И ДР., показали, что диффузи-
онное раскисление стали иrрает сравнительно малую роль
в снижении концентрации кислорода в средне.. и высоко-
уrлеродистых сталях. В-первой половине восстановитель-
Horo периода активность кислорода в этих сталях опреде-
.1Jяется уrлеродом и в большинстве случаев ниже активно-
сти I{ислорода, равновесной со шлаком. Так, например,
если в металле имеется 0,7 О/О [С], то равновесная с уrле..
родом а[О] == [о/о О] O,003. Этой концентрации кислорода
соответствует равновесная активность FeO в шлаке:
a(FeO) [О/о 0]/[ О/О О] Hac O,003/0,23 O,013, ИЛII 1,5 о/о
(FeO). Вместе с тем в пеРВУIО половину восстановительно-
ro периода содержание (FeO) > 1,5 о/о. Такой шлак по от-
u
Ношению к металлу не ПРОЯВ.1Jяет раскисляющеrо деиствия.
155
Активность кислорода в металле для низкоуrлеродистых
сталей в большинстве случаев превосходит paBHoBeCHYI().
активность со шлаком. Однако и в этом случае при диф-
фузионном раскислении уrлеродом содержание кислорода
в металле не уменьшится ниже paBHoBecHoro с уrлеродом.
Для обеих rрупп сталей существенное уменьшение содер..
жания кислорода в металле при раскислении шлака ПО..
рошком ферросилиция наблюдается лишь при одновремен-
ном повышении концентрации кремния в металле. В ре..
альных условиях равновесие между расплавом и rазовой
фазой, как правило, не достиrается, а rлубинное раскисле-
ние имеет то преимущества, что заданная степень раскис-
ления достиrается за более короткое время. Восстанови-
u
тельным период протекает в условиях постоянноrо попол-
нения ванны I{ИСЛОРОДОМ. По данным А. М. Левина, в этот
период из воздуха в ванну поступает до 0,3 О/О кислорода
от массы металла. Это в 5.........10 раз больше концентрации
кислорода в металле в начале восстановительноrо периода.
В этом смысле восстановительный шлак обладает защит-
u
ными своиствами.
Таким образом, диффузионное раскисление металла яв"
ляется малоэффективным процессом. Концентрация кисло..
u
рода в металле в восстановительныи перио плавки опре-
деляется не законом распределения кислорода и не
степенью развития реакции раскисления в шпаке и на rpa..
нице раздела металл шлак, а в основном процессами rлу
бинноrо раскисления.
r пав а VI
НЕМЕТ АЛЛИЧЕСКИЕ ВКЛЮЧЕНИЯ
Получение стали, чистой от неметаллнческнх включений, является важ.
ноЙ и. актуальной задачей современной метаЛJIурrии. Повышение требова-
ний к качеству металла определяет поиск способов снижения количества
неметаллических включений и ослабления их вредноrо влияния. На осно-
вании большоrо числа исследований [129 135] можно заключи.ть, ЧТО
экзоrенные включения достаточно полно удаляются из жидкой стали, а
основная масса неметаллических включений, встречающихся в твердоА
стал,и, принадлежит к классу эндоrенных, .образующихся в результате
сложных физико-химических процессов в жидком, затвердевающем и
твердом металле. Это прежде Bcero изменение растворимости кислорода,
более полное протекание реакций раскисления, НИТРИДQобразования при
понижении температуры. Чтобы разпичить эндоrенные включения, обра-
зующиеся в различные периоды ппавки и при затвердевании металла,
В. и. ЯВОЙСКИЙ С сотрудниками [136] предложил следующую кпассифи-
]56
кацию неметалпнческих включений: 1) предкристаллизационные: перВIIЧ-
ные, образующиеся при раскислении стали, и вторичные, обраЗУЮll:иеся
при охлаждении жидкоrо металла до температуры, соответствующеи ли-
нии ликвидуса; 2) кристаллизационные: третичные, образующиеся в зат...
вердевающей стали в температурном интервале между линиями JIИКВИ-
дуса и солидуса; 3) по лекристаллизационные: четвертичные, образую:
щиеся в затвердевающеи стали при охлаждении металла до комнатнои
теl пературы.
VI.1. О&РАЗОIАНИЕ
НЕМЕТАЛЛИЧЕСКИХ ВКЛЮЧЕНИй
Закономерности зарождениSl неметаллических включений в ЖИДКО I )Ie-
тзлле изучены в недостаточной степени. Объясняется это тем, что да)ке
для более простых объектов количественные расчеты интенсивности за-
родышеобразования связаны со мноrими трудностями. Сложности эти
существенно возрастают при переходе к техническим объектам стаЛЯh-1
11 чуrунам. Основной моделью, используемой большинством исследова-
телей, является образование новой фазы в рамках классической теории
rиббса ......... Фол' мера. Соrласно этой теории система может находиться в
метастабильном сост янии :(переохлажденном, перен сыщенном и ДI>..)
сколь..уrодно долrо, если внешние условия остаются неизменными. rиббс
первым указал на то, что возникновение зародыша и ero рост до критн-
ческоrо размера связаны с увеличением свободной энерrии. l{ля случая
кристаллизации рост свободной энерrии обусловлен затратой работы на
образование новой поверхности между зародышем и матрицей. Исходя из
теории флуктуации, допускающей такой процесс, Фо,льмер показал, что
скорость образования / числа зародышей в еДинице объема за 1 с опн...
сывается уравнением:
J == А ехр ( a* / kT), (269):
r де Й* изменение свободной энерrии при образовании зародыша кря-
тическоrо размера: k......... постоянная Больцмана;
!J.G. == (16пЙ: вv2)/[ 3 (kT)2 (1п а)2] t (270)-
O'M B межфазное натяжение на, rранице метЦJlЛ ........ включение; V ..........
мопьный объем образующейся фазы; а......... степень пересыщения.
При образовании продуктов раскисления под степенью nересbtщения
Понимают отношение произведений растворимости фактических концепт...
раций элемента раскиспителя и кислорода [О/о R .[% О]Ф К равновесным.
Предэкспоненциальный множитель характеризует частотный фактор..
Уравнения (269) и (270) устанавливают связь между степенью пересы...
щения, значением aM B и интенсивностью зародышеобр зования. При по...
Мощи уравнений (269) и (270) можно установить относнтел,ьную вели...
чину вклада, вносимоrо aM B и а для спонтанноrо образования зароды-
ша критическоrо радиуса. Приведенные формулы применнмы лишь для
расчета скорости зарождения новой фазы в однокомпонентных системах,
в частности, для процессов кристаллизации, конденсации и др. Те!.! не
менее эти закономерности используют и для оценки скорости зарожде-
ния неметаплнческих включений. В связи с этим расчеты являются при..
ближеннымн и в ряде случаев носят полуколичественный характер.
Из уравнения (270) следует, что чем больше степень пересыщеНIIЯ.
Тем леrче пронсходит процесс эародышеобразоваНIlЯ. ПО данным,
157"
с. и. Попеля, FeO и MnO (aM B== 180 мДж/м 2 ) из окисленноrо металпа
!.forYT выделяться самопроизвольно прн сравните.аьно небольшоЙ стеПе-
ни пересыщения. При этом ДHa .1eTp зародыша составляет OKOJ10 четырс:х
параметров решетки. С увеличением (1M B требуется существенно ббль-
шая степень пересыщения. С повышением межфазноrо натяжения до
500 (расплавы FeO MnO Si02) и 700 мДж/м 2 интенсивность зароды..
wеобразования близка к нулю даже при трех- и десятикратном пересы-
щениях соответственно. Необходимость пересыщения для зародышеоб-
разования подтверждается не только расчетом. но и экспериментами.
В работе [137] пересыщения расплава, содержащеrо алюминий и кисло-
род, достиrали быстрым охлаждением жидкоrо железа на 350 ос. После
3Toro расплав выдерживали 20 мин и затем быстро охлаждали до кри-
сталлизации. Было показано, что при выдержке образуются включения
АI 2 О з . В тех случаях, коrда пересыщение отсутствовало, включения ко-
рунда не образовывались вплоть до температуры затвердевания.
Ряд исследователей, исходя из предложения о существенном раз-
личии между (J'T r И (1ж r. ззкл'ючают, что образование твердых включе-
ниii оксидов при введении сильных раскислителей в соответствии с фор-
МУ.тtой (270) может происходить лишь при значительном пересыщении.
Однако это не так. Основанием для TaKoro утверждения является ббль-
шее значение межфазноrо натяжения в системе твердыЙ, ОКСИ;Д жид-
КИЙ металл по сравнению с межфазным натяжением жидких продуктов
раскисления на rранице с жидкой сталью, При прочих равных УСЛОВИflХ
этот фа"кт имеет значение, но переоценивать ero не следует. Известно, что
поверхностные натяжения веществ в твердом и жидком состояниях сра,В-
нительно близки и различаются в большинстве случаев не более чем на
10 20 о/о. В этом смысле arperaTHoe состояние вещества не иrрает ре-
шающей роли. Картина изменяется, если в продуктах раскисления име-
ются компоненты (например, FeO), которые существенно снижают меж-
q)азное натяжение. Это приводит к уменьшению необходимоЙ степени пе-
ресыщения для образования зародышей критическоrо радиуса r*. Расче-
u
-ты показывают, что при одинаковои скорости зарождения включения
Аl 2 О з требуют rораздо большей степени пересыщения, чем включения
Si0 2 и.'1и силикаты (FeO) % (Si0 2 ) 71. На этом основании, казалось бы,
.
!w{ожно сделать заключение, что rOMoreHHoe зарождение включении ко-
рунда затруднено в большей степени, чем зарождение включений сили-
I<:атоIЗ. Однако в рассматриваемом случае важна не только степень, но и
концентрация пересыщения [138]. Например, при содержании элементов.
раскислителей 0,03 и 0,1 о/о концентрация кислорода в пересыщеННО 1
растворе должна составлять соответственно 0,037 и 0,013 О/о при образо-
ваНIIИ А1 2 О з и 79 о/о: (т .е. больше предела растворимости кислорода)
при образовании Si0 2 . Исходя IIЗ этоrо, можно заключить, что rлинозем
образуется rOMoreHHo, а кремнезеl\{ reTeporeHHo на посторонних приме-
сях.
Известно, что наличие rOToBblX поверхностей существенно облеrчает
процесс зародышеобразования. В соответствии с этим степень пересыще..
ния, необходимая для reTeporeHHoro образования зародышей, всеrда
!еньше, чем для rOMoreHHoro. Это обстоятельство иrрает очень важную
роль в практике раскисления. Промышленные раскислители содер}кат не-
r.lеталлические включения. устоЙчивые при температурах сталеварения,
которые являются ПОДЛОJкками для reTeporeHHoro зародышеобразования
продуктов раскисления. Вместе с тем эти раскислители содержат при-
месные концентрации 'более сильных элементов-раскислителей, которые
обеспечивают ,образование соответствующих подложек облеrчающих
да.1ыlйшееe образование неметаллических 'включений. Нап'ример при рас-
кислении стали алюминием и кремнисм вначале образуются включения
158
rлинозема, на поверхности которых формируются обра"зования СИЛИI{атов.
fOMoreHHoe образование зародышей Si0 2 может иметь место в процессе
кристаллизации металла, при котороЙ достиrаются требуемые концент-
рации критических пересыщений. При. содержании в стали азота нитри..
ды титана, как правило, образуются на подложках включений оксидов
титана. После образования зародыша критическоrо размера ero рост но-
сит молекулярный характер и связан с диффузией растворенных приме-
ce:i (кислорода и раскислителя) в жидкой стали с последующим выделе-
нием новоЙ фазы на имеющуюся ПОДЛО}l{КУ. Наличие зародыша снижает
степень пересыщения, однако вследствие обеднения ванны кислородом
этот процесс сравнительно быстро заканчивается. Дальнейший рост за..
U ь
родыша связан с коаrуляциеи частиц, движущихся под деиствием пото"
ка или силовоrо поля. В ряде случаев первичные продукты раскисления
в стали образуются в результате расслоения исходноrо расплава при
введении раскислителя*.
Мноrочисленные даннЫе показывают, что основные трудности полу-
чения чистой стали связаны с укрупнением и удалением включений. По
данным ряда исследователей, продолжительность процесса образования-
и удаления леrко коалесцирующих включениЙ составляет O,5 2 мин.
Процесс удаления мелких включений (rv 5 мкм) более медленный. Уда.
Т}ение последней сотой доли кислорода занимает основное время рафини-
u
рования и не зависит от начальнои концентрации кислорода.
VI.2. УКРУПНЕНИЕ
НЕМЕТАппИЧЕСКИХ вкпЮЧЕНИJit
Укрупнение частиц возможно при их столкновении. Это может произоij.
U u
ти В результате естественнои миrраЦИIl частиц или под воздеиствием на-
правленных сил. Различают два типа коаrуляции: Ilерuкuнетuческ.ую и
ортокuнетuческую (термины введены Виrнером). Под перикинетической
коаrуляцией понимают укрупнение частиц размером ,....., 1 мкм, движу"
щихся по законам случайных блуждений (например, броуновскоrо дви-
жения). Под ортокинетической коаrуляцией понимают укрупнение частиц
.
в жидком металле, коrда частицы находятся под воздеиствием силовоrо
поля: rравитационноrо (всплывание), электричеСКОI"О (электрофорез),
концентрационноrо (движение под действием адсорбционных сил). Кор..
.
токинетическои коаrуляции относится также укрупнение неметаплических
включений в результате столкновени й движущихся с потоком жидкости.
u V
частиц в условиях естественнои и принудительнои конвекции.
Расчеты показывают, что для частиц диаметром >0,1 мкм ор-
токинетическая коаrуляция имеет преобладающее значение [139]. Роль
двух типов коаrуляции одинакова для очень мелких частиц ( 1 МКМ).
Скорость слияния двух капель одннаковоrо радиуса v прямо пропор-
циональна межфаэному натяжению О'М....В и обратно пропорциональна
вязкости 1): V==К(f1и.....В/fJ). По данным работы [147] скорость слия-
ния составляет 15-------17 м/с. В реальных условиях для различных вк. ю-
чений аМ.....В изменяется в 10 15 раз, а вязкость в lОЗ lО5 раз,.
поэтому вязкость может оказать б6льшее влияние на скорость слия-
ния, чем межфазное натяжение на rранице металп включение. Распро..
странено мнение, что более эффективно укрупняются включения, ха-
· Менделев В. А. Термодинамический анализ 11 эксперименталь-
Ное изучение условий выделения неметаллической: фазы при раСКИСJlе.
нии и леrировании сплавов на основе железа. Автореф. К8НД. Дис. М.,
1 981. '
159
рактеризующиеся высоким z..iежфазным натяжением, поскольку этому
С.'1УЧ310 соответствует значительное снижение свободной энерrии. Это
u
подтверждается результатами сравнения жидких включении, КОТОРЫе
различаются значениями aM B при прочих равных условиях. Дейст-
вительно, предпочтительнее будут сливаться включения, имеющие БОJIее
высокие значения aM B. СЛИЯНИIО двух жидких неметаллическнх Ча-
стиц предшествует образование металлическоrо перешейка. Зависимость
u
радиуса перешеика а от времени т при слиянии двух соприкасающихся
вязких капель радиусом r описывается формулой Френкеля:
а 2 == з /2 [(af't) /(n1J)],
(271)
r де а радиус кривизны; (J поверхностное натяжение; f) вязкость.
При раЗJlИЧНЫХ радиусах кривизны капель скорость их слияния
определяется скоростью слияния капель с меньшим радиусом, а при
..
различных вязкостях скоростью слияния капель с меньшеи вязко-
стью [147]. Уравнение (271) хорошо передает соответствие опытных
и расчетных данных при 11>0,7 Па.с. При меньших значениях вязко-
u
сти, коrда сопротивление носит инерционныи характер, следует пользо-
ваться формулой:
а 2 == К V (ar't) /1] . (272)
Опытные данные, а также расчеты по формулам (271) и (272)
IIоказывают, что капли из неметаллических фаз различноrо состава
(СаО, А120з, CaF 2 , Si0 2 , MgO) С вязкостью от 0,005 до 0,26 Па. с сли-
ваются со скоростями увеличения площади перешейка d(1ta 2 )/d't от
единицы до десятков квадратных сантиметров в секунду. Особенно
важны закономерности укрупнения твердых включений. Во мноrих
случаях наблюдаемые в стали крупные включения rлинозема ( 3 мм)
состоят из множества мелких частиц размером в несколько микромет-
ров. Моделированием и математическими расчетами показано, что ча-
СТИЦЫ в этих скоплениях удерживаются силами поверхностноrо натя-
>h.ения, возникающими вследствие уменьшения межфазной поверхности
u
металл включение при выдавливании манжеты жидкои стали между
частицами. Расчеты показывают, что две соединяющиеся частицы раз-
мером 5 мкм MorYT быть разорваны потоком движущеrося металла,
ес.'1И скорость потока относительно частиц => 1,4 м/с.
Образование Сl(:оплений возыжноo при условии самопроизвольноrо
установления контакта между включениями. Этому предшествует ста-
дия, связанная с появлением манжеты из жидкоrо металла. Дальней-
v u
шее поведение этих включении в существеннои степени определяется
капиллярными силами. Удержание неметаллических включений при
v
помощи капиллярных сил связано с адrезиеи жидкоrо металла к соеди-
няемым поверхностям. ЭТОТ вопрос достаточно полно рассмотрен в
работах ю. В. Найдича, с. и. Попеля, А. А. Дерябина. Жидкая aH-
жета MO)l{eT быть удалена лишь при отрllцательном значении измене..
ния свободной энерrии этоrо процесса: дG==2(ав r-----аll В) <О, ИЛИ
/1G==2(JN r cos 8<0 .<8 краевой уrол смачивания металлом поверх-
ности включения).
Таким образом, смачиваемость является важнейшей характеристИ
кой прочности образования сложных конrломератов. Если 8>900, то
образование скоплений возможно; если {)<90 0 , то процесс термоди
намически невозможен. Расчеты, выполненные в работе [140], показа
,ЛИ, что при в> 1000 силы, действующие в турбулентном потоке, не MO
rYT разорвать связи и разобщить скопления включений.
При турбулентных пульсациях в струе металла (v 10 м/с) вклю-
.J60
qеНIIЯ крупных размеров (r== 10 мкм) будут отрываться друr от друrа,
если их вязкость превышает 0,04 Па. с, а маленькие частицы (r ==
=== 1 мкм) при 1l 5.109 Па. с, <1== 1000 мДж/м 2 [141].
v..]. УДАЛЕНИЕ ВКЛЮЧЕНИЙ
В rРАВИТАЦИОННОМ ПОЛЕ
Перенос неметаллических включений в жидкой стали к межфазной
поверхности раздела металл шлак и металл Футеровка осуществля
ется либо движением частицы относительно самой среды (всплывание,
броуновская диффузия, инерционное смещение и др.), либо конвектив
ными потоками металла. Всплыванию частиц в вязкой жидкости под
деiiствием rравитационных сил посвящено большое число теоретических
11 экспериментальных исследований. Для количественной оценки ско-
pOCTII всплывания v сферическоrо твердоrо включения радиусом , ши-
роко используют формулу Стокса, выведенную при условии равенства
СИ.'! сопротивления движению шара в вязкой среде (F==6п'l1V) и Ap
ХlIмеда р' == "/з'JtrЗg (pM PB):
v === 2/ 9gr2 [(Рм ........ Рв) /1)] . (273)
Формула (273) cTporo выполняется, коrда критерий Рейнольдса
<0,6". Если при Re 0,6 вычислить предельные размеры включений, то
получится, что формула Стокса приrодна лишь для расчета скоростей
всплывания твердых включений диаметром < 100 мкм. Однако практика
показывает, что эксперимента.1ьные данные хорошо соrласуются с рас..
четными для включений размером < 10 МКМ. Д. я. ПО8QЛОДКИЙ [118]
показал, что при раскислении стали кремнием экспериментальные зна
чения скорости удаления ВК..rIIочений размером от 2 до 10 мкм хорошо
соr.FJасуются с рассчитанными по формуле Стокса (от 0,5 мм/мин при
выдержке 2 ч до 6 мм/мин при выдержке 13 мин). Для включениЙ
большоrо размера формула (273) дает завышенные результаты. Для
T8Koro типа включений можно пользоваться формулой, которая леrко
выводится, если силу F' приравнять силе сопротивления по закону
Ньютона (F2==Kr211v2). Тоrда
v 2 == gr (4п/3К)[(РМ........ Рв)/11] , (274)
rде К == 24/Re коэффициент, зависяЩИЙ от критерия Рейнольдса, Re.
Скорости всплывания }lП1ДКИХ ВКЛlочений вследствие движения }I{ИД..
u
кости В капле и различных rраничных условии отличаются от скорости
движения твердых частиц TaKoro же размера, поэтому для количествен
. u
нои оценки СI{ОРОСТИ всплывания жидких включении нужно пользо-
ваться не уравнениями (273) и (274), а формулой Рыбчинскоrо
Адам ара:
V < == 2/ з g r 2 (PhI PB)/f)l\l] [(f):\[ + 11в)/(2'11\[ + 31)8)J, (275)
rде 11в Динамическая вязкость жидкоrо включения, Kr/ (м. с).
Сравнивая уравнения (273) и (275), имеем:
Vж/Vт == 3 (11м + 1)B)/(2Y)M: + 31lB) > 1. (276)
Таким образом, при одинаковом размере частиц скорость BCnJIbIBa
НИЯ жидкоrо включения БО.пьше скорости всплывания твердоrо ВКЛIО
чеllliЯ. При 11n llM формула (275) переходит в формулу (273), поэто
МУ для очень вязких жидких включений (11)0,2 Па.с) можно пользо
ваться формулой Стокса. РаЗ.ПIIЧИЯ расчетных и опытных значений v
MorYT быть вызваны не только размером, но 11 формой всплывающих
11 675
161
включений. Для включений корунда действительно скорость Всплывания
даже для малых частиц меньше, чем по формуле Стокеа [118]. ЭТО
учитывается фактором формы х==rэ/rс (r э Эк8ивалентный радиус
шара, объем KOToporo равен объему включения; 'с радиус шара ПО
Стоксу с той же плотностью и скоростью движения). Фактор формы х
для различных моделей варьируется в пределах 2 5. С учетом хеко...
рость всплывания можно вычислить по формуле:
v == 2/9 gr 2 (Рм Рв) / (11м х) · (277)
Включения АI 2 О з ВСПJlываlОТ в четыре восемь раз медленнее,
чем равные по размерам включения СlIликатов. Это связано с непра-
вильной формой АI 2 О з , а так}ке изменением ориентации ВК.ТIIочений rли...
назема во время всплывания, приводящим к изменению х [118]. Анализ
работ по удалению неметаллических включений позволяет заключить,
что закон Стоксз удовлетворительно описывает удаление включениЙ в
спокойной ванне. В условиях реальной плавки достаточно крупные
включения (> 15 мкм) сравнительно быстро всплывают из жидкой
стали в течение первых минут ПОСJlе введения раскислителей. ВС.,1ед-
u
ствие развитых конвективных потоков в жидкои стали для Ме"lКИХ
включений непременимы законы Стокса и Рыбчинскоrо Адамара.
Пример. Рассчитаем скорости всплывания неметаллических частиц
в жидкой стали в rравитационном поле при 1600 ос. Покажем, в каком
интервале скоростей движения для включений радиусом 50 мкм В спо-
коЙном металле выпОлняется фОРМУ.'1а (273):
Re == (vdРи)/1Jм 1, (278)
rде d харзкте истический размер, в данном случае равный диаметру
частицы: v< (Re-1')M)/(PM-d) == (1-6.10 З)/(2.5-10 5 7,15.103) == О,ВХ
Х 10 2 м/с==О,8 см/с. По формуле (27'3) вычислим скорость подъема
частицы rлинозема радиусом 10 мкм: v==2/9.9,81[(7,1 3,97) .103/6.10 З]
(1 0 5/2) == 30 мкм/с.
т а б л и ц а 18. Скорости всплывания различных включений
Скорость всплывания Скорость всплывания
1()5 (м/с) включений 105 (М/ с) ВКJJючеНJJЙ
Тип включения диаметром, МКМ Тип вкл Юllения диаметром, мим
10 20 50 10 I 20 I 50
Аl 2 О з 3 12 75 AIN 4 16 100
Si0 2 5 20 125 TiN 2 8 50
Полученное значение скорости удовwТ]етворяет УСЛОВИIО Re< 1_ Сле-
довательно, для частиц тзкоrо размера можно применять формулу
Стокса. Скорости всплывания частиц размером 20 и 50 мкм соответст-
венно равны 120 и 750 мкм/с. Для вычисления скорости всплываНIIЯ
жидкоrо силикатноrо включения воспользуемся формулой (275):
2 (7'15......... 2,5) 6.1(}----З + 5-10 1 9,81-10----5
v==-. · ·
3 6 - 1 о з 2 · 6. 1 о..... з + З. 10......1 2
== 40 мкм/с
Для частиц радиусом 20 и 50 мкм соответственно имеем скорость
всплывания 160 и 1000 МКМ/С. ДЛЯ вязкой частицы СИЛIII<атов (118 11м)
162
поправочный множитель в уравнении Рыбчинскоrо-------Адамара ПрИ\iерно
авен 1/3. Таким образом жидкие силикатные включения в спокойно\{
еталле всплывают несколько быстрее твердых частиц rлинозема тако-
ro }ке размера. Значения скоростей всплывания включений приведены
в таб 'I. 18.
VI.4. ВЛИЯНИЕ КОНВЕКЦИИ НА УДАЛЕНИЕ
НЕМЕТАЛЛИЧЕСКИХ ВКЛЮЧЕНИА
Лабораторными и промышленными экспериментами показано, что кон-
вективные потоки в жидком металле улучшают условия для удаления
неметаллических включений. С ростом интенсивности конвективноrо
.
перемешивания увеличивается частота столкновении между включения-
ми, приводящая к укрупнению частиц, растет вероятность выхода вклю-
u
чеНlIИ к поверхности раздела металл шлак, увеличивается частота
при.'1ипания включений к футеровке и т. д. Этот процесс протекает осо-
бенно интенсивно в период кипения жидкой ванны. Скорость конвек-
тивных потоков (м/с) в различных металлурrических arperaT8x пр иве-
дена ниже:
\артеновская печь О 1 1 Индукционная печь З 8
,
КИС.ТIородный КОН- эшп . . . . . о , 05........0' 1 О
вертер . . . . . 1........2 ВДП, ПДП, ЭЛП O,O ,20
Дуrовая электро Ковш . . . . . 0,O5 O,50
net1b . . . . . о 5........1 Изложница . 10 3 IO
, . .
I(оличественная сторона вопроса о влиянии перемешивания на yдa
.ТIение включениii изучена недостаточно. Это D первую очередь связано
с 1e f, что сталеплавильная ванна относится к числу rидродинамически
неопределенных задач. Закономерности распределения скоростей пото-
коп }f идкоrо металла и шлака в сталеплавильноЙ ванне в большинстве
случаев неизвестны. Они сло}кны, и их трудно количественно описать.
Имеющиеся в литературе ) равнения носят эмпирический или полуэмпи-
рический характер. Например, учет конвективноrо переноса для верти-
v u
ка ТIЬНОИ составляющеи скорости приводит к появлению поправочноrо
c.'laraeMOro VM COS V В уравнении (273) (VM скорость движения ме-
Ta.тI1I1a; 17 уrол ме>I{ДУ вертикалью 11 направлением вектора скорости
движения металла). По расчетам авторов работы [142] для включений
размерами 10 70 мкм конвективное слаrаемое превалирует над сток-
СОБСКИМ, если VM COS ,\,>O,046 2,27 мм/с. Принимая во внимание ско-
рости движения, наблюдаемые на практике, следует отметить, что про-
цессы удаления включений будут в основном определяться конвектив
НЫМ I\faCCOnepeHocoM. Однако положительное влияние турбулизации име-
ет предел, превышеНllе KOToporo вызывает повторное вовлечение вклю-
... ...
чении в жидкиlf металл.
Практика показывает, что при кипении ванны и обильном rазовы-
u
де.;Iении происходит интенсивное удаление неметаЛJlических включении
u Р
[143]. Это связано с улучшением условии укрупнения включеНИlf u 1I их
доставки на rраницу раздела металл шлак вследствие развитои кон-
векции, а rлавное удаления флотацией. Включения прилипают к
ВСП.ТIываЮЩИ f пузырям и выносятся на поверхность. При расчете pa
боты прилипания включений к пузырям rаза W нужно учитывать раз
Мер включений. Неметаллические включения малых размеров леrче
прилипают, чем крупные. Существенное влияние на величину W оказы-
вает 6. При небольших краевых уrлах смачивания необходимо затра
11*
163
тить меньшую работу [144]. Авторы работы [145] рассматриваЮI три
возможных механизма прилипания неметаллических включений к ПО-
верхности всплывающих пузырей со: инерция, зацепление и миrрация
включений. Расчеты показывают, что для мелких включений (, 1 мкм)
преобладающим механизмом осаждения является диффузия из турбу-
лентноrо потока, для частиц радиусом , 10 мкм зацепление и для
более крупных инерционное отклон ние от линии тока.
VI.5. СВЯЗЬ МЕЖДУ СВОЯСТВАМИ
ПОВЕРХНОСТЕй РАЗДЕЛА ФАЗ
И СКОРОСТЬЮ УДАЛЕНИЯ ВКЛЮЧЕНИЯ
Связь :между скоростью движения включений и :межфаЗНblАt наТЯОlCенuеАf
па 2ранице металл включение. Сопротивление, которое испытывает
недефОРl.iируемая частица при ДВИ}l{ении в вязкой жидкости, не зави-
сит от природы тела и характера ero поверхности. Высказывается пред-
положение, что с увеличеним работы адrезии (или уменьшением aM B)
скорость движе ия должна снижаться. Некоторые исследователи пы-
таются установить количественную связь между скоростью всплывания
и поверхностными характеристиками, вводя в формулу Стокеа попра-
вочный множитель, учитывающий влияние a.м B. Однако точка зрения
u
о существовании связи между скоростью всплывания включении и
межфазным натяжением, между ВК.7Iючением и металлом является
ошибочной. Наблюдаемые на практике различия скоростей ДВИ}l{ения
при изменении межфазноrо натяжения следует объяснить друrими при-
чинами. Например этот эффект мо}кет быть связан снеконтролируемым
rазовыделением на поверхности движущеrося объекта и др. Вопрос о
возникновении скольжения между жидкостью и движущимся объектом
в случае отсутствия смачивания рассмотрен Б. В. Деряrиным [146],
который показал, что эффект скольжения в жидкостях, не смачивающих
твердое тело, имеет место лишь в очень узких зазорах ( 1 мкм). Та-
ким образом, различия в поверхностных характеристиках в системе
включение расплав MorYT проявиться лишь в поrраничных слоях тол-
щиной 1 мм, что существенно меньше обычно наБЛIодаемых неметал-
лических включений [147]. Для определения скорости движения твер-
доrо шара в жидкости с учетом скольжения на rранице раздела фаз мо-
жет быть использовано уравнение, предложенное Ламбом:
v == v C 1' (31) + kr)j(2f) + kr), (279)
rде k......... коэффициент трения скольжения; V CT скорость движения
по формуле Стокса. Расчеты по уравнению (279), выполненные для
двух типов включений Аl 2 О з и Si0 2 показывают, что поправочный MHO
)I{ИТель к стоксовой скорости для включений радиусом 0,01; 0,1; 1 и
] О мкм составляет примерно 0'76......... 0,84; 0,93 0,97; 0,99; 1,0 [148]..
Следовательно, скольжение на rранице металл включение мо)кет
влиять на сопротивление движению лишь для очень мелких немета.ПЛИ-
ческих включений (0'01........ 0,001 мкм). Для более крупных включений
(> 1 мкм) поправочный множитель близок к 1. Таким образом, лучшее
удаление включений, характеризующихся меньшей смачиваемостью
(АI 2 О з и др.), чем силикаты, связано не с эффектом скольжения, а с
особенностями перехода межфазноЙ rраницы.
Адсорбционное торlttоженuе. Присутствие в жидком метаЛJlе no
Dерхностно активных компонентов (серы, кислорода и др.) приводит к
адсорбции этих компонентов на поверхности неметаллических частиц
и существенному снижению ме)кфазноrо натяжения на rранице Me
164
Ta 1..1 В!{.'1ючение. .. . Н. Фрумкин показал, что ПРИСутствие поверХIIО"
C1ho-аКТIIВНЫХ веществ (ПАВ) может вызывать торможение ДВII}I\ущей
ся частицы в результате перемещения молекул адсорбционноrо вещества
с лобовой части включений в кормовую. Это приводит К снижеНIIЮ
ловерхностноrо натяжения в кормовой части. При rрадиенте меL{{фазно
ro натяжения возникает сила, тормозящая ДВИ}l{ение }{ЗПЛII 1I тем самым
предотвращающая наl<опление ПАВ в кормовой части. Расчеты пока
зывают, что эффект адсорбционноrо торможения заметно В.lияет на
скорость перемещения для включений размером 1 МКМ.
Движение неметаллuttесlCUХ вКЛ/О'lенuu в полях дUффУЗU!1 ПАВ.
В жидком металле существуют локальные области, характеризуюшиесн
rрадиентом концентрации ПАВ. Такие области появляются в резуль
тате введения в жидкий металл раскислителей, леrИРУЮЩIIХ добавок
11 др. ПРIlСУТСТВlIе неоднородных концентрационных полей (полей диф-
фузии) приводит к неравномерной адсорбции вдоль поверхности части-
цы. ВозникающиЙ rрадиент nOBepXHocTHoro натяжения обусловливает
v
возникновение силы, вызывающеи движение неметаллическоrо включе-
ния [149]. Расчеты показывают, что для оксидных частиц сложноrо co
става (АI20з СаО SiО2 FеО) даже при незначительном rрадиенте
концентрации поверхностно активноrо кислорода (10 2o/O/M) в рзсплав
.,1енном }келезе реализация адсорбционноrо механизма ДВИ)l{ения вместо
rравитационноrо приводит J{ увеличению скорости частиц размером
3 8 мкм в пять десять раз, а частиц раЗМСрО 1 I O 20 мкм В пол--
тора три раза. Лабораторными опытами показано, что полнота уда-
ления ОКСИДНЫХ включений зависит от rрадиента концентрации. Скоро-
сти всплывания продуктов раскисления в полях диффузии кремния и
v
марrанца превышают скорости всплывания под деиствием rравитаЦIlОН-
ных си..'] в ЗО 50 JI 10 15 раз соответственно. Больший эффект для
кремния связан с тем, что он является более капиллярно активным по
отношению к железу, чем марrанец. По рассмотренному r.tеханизму
происходит укрупнение включений в основном в локальных объемах
металла. у дзление включений IIЗ объема металла происходит под дей
ствием rравитационных сил и конвективных потоков.
П pu,,'fep. Рассчитаем скорость движения )кидкоЙ немета.ТIлической
частицы размером 20 мкм, содержащей до 40 О/О Аl 2 О з в жидком ме-
таЛ..fJе в поле диффузии ПАВ. Действием выталкивающей силы 10ЖНО
пренебречь. Концентрацпя кислорода в металле равна 0,015 О/о, дли
тзкоrо содеР)l{8НИЯ кислорода rRТ ЗОО мДж/м 2 (r адсорбция кис-
..10рода на поверхности неметаллическоrо включения; R универса.?lЬ"
ная rазовая постоянная; Т........ абсолютная температура). Значсние r RT
получено расчетом из зависимости межфазноrо натяжения на rранице
включение металл от содержания кислорода в последнем. Среднее
значение rраднентз концентрации кислорода в окреСТНОСТII немета.ПЛИ-
ческоrо включения dcJdx==O,5 .10 1 о/о/м. Вязкость металла 1) ==0,5 Па. с..
Выраженне Д"f}Я СИ.'Iы, вызывающей перемещение частицы в поле Дllф'"
<РУЗИII, описывается формулоЙ:
Р' == S grad 0'.
В соответствии с уравнением rлббса:
grad (J == r grad f!.
В СБОЮ очередь
дJ1 дс
grad Jl. == ·
дс дх
(280)
(281 )
RT
.
дс
,
дх
(282)
с
r де с l<онuеНТРЗUIIЯ вещее [на.
165
Подстав.ТIЯЯ уравнения (281) 11 (282) в выражение (280), получим
F == S r RT . dc . (283)
с dx
Выражение для скорости дви)кения ВК.1Jючения ПО.l ЧIIМ, если силу F
приравняем силе СОПРОТИВ.lения среды:
F 4w 2 rRT (dc/dx) 2 rrRT
v== == ..
6 ч 3
Подставляя значения величин в уравнение (284), получим: v==
==2.10 5.300.10 З.О,5.10 1/3.1,5.IО 2.5.IО З 1,4.10 3 м/с == 1,4 мм/с.
Для сравнения укажем, что СКОрОСТЬ всплывания неметаллическоrо
вк.тJючения TaKoro )ке размера в rравитаЦИОННОЪf ПО.ТIе равна 0,4 мм/с.
dc
.
(284)
VI.6. ПЕРЕХОД rРАННЦЫ РАЗДЕЛА МЕТАлп шпАК
Тер.модUНQАtutlеСlCое УСДО8ие YCTOU t lll80CTU нелtетаЛЛllчесlCUХ включений.
ДЛЯ ТОАО, чтобы ответить на вопрос, останется неметаллическое включе..
нне в жидко1i стали или перейдет в шлаковую фазу (без учета кине.
тики процесса), нсобходимо сформулировать общее термодинамическое
условие устойчивости включениЙ в жидком металле. Условия самопроиз
u
BOJlbHOrO перехода неметалличеСКIIХ включении через rраницу раздела
меТЗJIЛ шлак обычно записывают в виде соотношения:
(О"М......В+ (J'М ш) > (J'ш.....В' (285)
или в виде эквивалснтноrо выра}кения O'== (JШ n О':'I В О'М Ш. Переход
rраницы раздела может осуществ..'IЯТЬСЯ при УСЛОВИII L\a<O. Для боль.
шинства оксидных систем O'<O If, следовате.ТIЬНО, частицы MorYT пе..
реходить rраницу раздела. Соотношение (285) ЯR.1Jяется приближенным,
тем не менее им часто ПОЛЬ3УIОТСЯ для праКТIIЧССI\ИХ расчетов.
КраевоЙ уrол смачивания 11 работа адrеЗИII в системе жидкиЙ ме.
u
TaJJ.тI неметаллические включеНIIЯ для некоторых ста.неи и СПJlаВQВ
nРIlведены в таб.п. 19 [69 74]. Значения Iежфазноrо натяжения и
т а б л и ц а 19. Значения KpaeBoro уrла смачивания и работы
адrеЗIIИ W а В системе жидкий металл неметаллические включения
ВКЛJоче
ине
)1(ндкнй
метал.'!
е, rpaA
Включе-
ние
ж ИДКIIЙ
металл
в, rрад
\\7 а '
мДж/м 2
А1 2 О з Железо 130 AIN ШХl5 110 960
Аl 2 О з Fe 4 % с 120 В!\ ШХ15 114 875
Si0 2 Железо 110 TiN ШХ15 110 1007
Сr20з » 88 AIN 12Xl8H9 125
СаО » 132 АI 2 О з 12XIBH9T 570
TiO'l » 84 А1 2 О з Никель 130
...
KpaeBoro yr,Ja на rранице раздела жидкое }келсзо АI 2 О з приведеllЫ
в табл. 20. Ю. А. Минаев, А. yI. Русанов [150] на основе термодинамн-
ческоrо рассмотрения условий устоЙчивости ВКЛЮЧСНIIЙ В заданной фазе
nреДЛОЖII.1I1 следующую ФОР IУЛУ, при ПОМОLЦII которой можно прсд
'66
ТаБJIица 20. Межфазное натяжение (aM B) и краевой У ОЛ (8)
на rранице раздела жидкое же '1езо АI 2 О з
Металл е, rрад I (J H.........r · a { r . (J 1\1......B '
мДжjм 2 мДжjм 2 МДж/М2
)Келезо . · . . . 140 900 1850 2280
Fe + 4 % с . . . 133 900 1730 2080
Fe+O,OO2%S. 140 900 1390 1965
сказать переход немсталл.пческоrо включения из металла на поверхность
:\lетал.П Il1лак IIЛII металл.......... rаз:
К == О'М......В O'M......r == 1/2 (1 + cos 8 М ....... В ) О, 3а B r . (286)
Расчеты по формуле (286) покззывают, что твердые включения
АI 2 О з образуют наименее устоЙчивую взвесь 11 лучше удаЛ5IIОТСЯ из ме..
талла, чем друrие твердые ВК.Пlочения (Si0 2 , MgO и др.). Стабильность
эмульсий, образованных }J{ИДI{ИМИ продуктами раскисления, TaKjl{e
уменьшается с увеличением содержания АI 2 О з . Например при 1560 ос
пдавильным и рафинировочным шлаком с высоким содержанием АI 2 О з
K== 1380, дЛЯ 75 О/О АI 2 О з 11 25 о/о Si0 2 1(== 740; для Si0 2 K== 450
(расчетные значения). Все металлурrические взвеси (твердые включе..
ния) и ЭМУЛЬСИИ (я{идкие вк.пючения) характеризуются отрицательными
значениями К. Это означает, что при отсутствии химических процессов
растворения 11 изменения условий адсорбции в процессе выхода на
rраницу раздела фаз включения являются неустойчивыми дисперсными
системами. Следовательно, при К <О возможен самопроизвольный пере-
ход частиц из металла в шлак. Если рассматривать устойчивость вклю-
чений в условиях, коrда ЖИДКИЙ металл покрыт шлаком (все продукты
раскисления растворяются в шлаках, а на rранице раздела включение
шлак ав ш О), то приближенно коэффициент К можно определить по
формуле:
к aB........r aM r'
(287)
Расчеты по формулам (286) и (2871) показывают, что по "Iepe снп"
;,кения содеР}I{ания АI 2 О з в жидких продуктах раскисления стабиль..
ность образованных им эмульсий возрастает. Под белым электростаlllе..
плаВИЛЬНЫ 1 и рафинировочным шлаком с высоким содержанием А1 2 О з
и СаО неметаллические включения менее устойчивы, чем под карбидным..
ПОД карбидными шлаками сталь получается более заrрязненной по двум
причинам: включения в металле более устойчивы; карбидный шлак
имеет большую склонность к запутыванию в металле вследствие повы"
тенноЙ работы адrезии. Таким образом, металлурrические спстемы ха..
рактеризуются той особенностью, что неметаллические включения в жид..
кой стали образуют термодинамически неустойчивую систему. Переходу
включений IIЗ металла в шлак соответствует снижение свободной энер-
rИН. К числу факторов, снижающих термодинамическую устойчивость He
металлических включений в )I{ИДКОМ металле и способствующих пере
ходу rраницы раздела мета.1'IЛ шлак, металл rаз, относятся: 1) BЫ
сокое межфазное натяжение на rранице металл включение (jl\I B;
2) высокое поверхностное натяжение жидкоrо металла (JM r; 3) низкое
поверхностное натя ,,{еНJlе неметаллическоrо включения (1B r.
Образование устойчивых пленок Jrtеталла на 2раНllце разде,,7а фаз.
167
в предыдущем разде lе при оценке УСТОЙЧИВОСТII неметаллическнх
ПКЛlочениЙ не учитывалась возможность образования смачивающих
пленок MeTaJlJla на поверхности чаСТI1НЫ. Вместе с тем закономерности
перехода частиц из MeTaJ1.1Ja в Ш.ilак Сlllедует оценивать с учетом этих
II.1'JeHOK. Образованпе устоЙчивоЙ П"lеНКII ыжетT привести к ПОЯВ.lеНIIЮ
энерrетическоrо 6а рьера при переходе rраницы раздела фаз, 11cc..leдo
ваНИЯ ПI показзно, что туrОП.lавкне неметаЛJlические включения (наПрll
мер, f\1 2 О з ) у дзляются из металла более эффективно, чем )КlIдкне BK.тIIO
чеНlIЯ силикатов. Это связано с различными условиями преОДО..lения
TOIIKOii пленки металла на rранице раздела металл шдак и метал.Н
rаз ВКЛlочениями раЗ.ТIIIЧНЫХ типов. Например выходу СНЛИI{атных ВК.пю
чений на rраницу мета.П..l rаз прсдшествует деформация тонкоЙ пленки
металла. В. В. Хлынов С сотрудниками экспериментально установи-
7]I1, что В месте выхода включения Si02 на поверхность метаЛJlа появ.ля-
..fJacb выпуклость, которая сопровождалась оттеканием металла с по-
верХНОС1И ОКСllда под действием поверхностных сил. В случае уда.пrНIIЯ
включениЙ типа Аl 2 О з разделите.ТIЬН3Я П.1енка металла «прокалыва.Т!JСЬ»
без предварпте..ТIьноil деформации, з поверхность расплава при этом не
нска)1<3,,13СЬ (рис. 42). Бы..l0 показано, что наблюдаемые явления не СI3Я
.............. ...........
............... ...........................................................
...... """' 1 :::-
з
.
1 2
.............. .........
4
............... .......
2
...
Рис. 42. Переход частицами корунда (1) и СИЛlIкатов (2) rраницы раздела шtl1а
КО80А (3) 11 металлическоЙ (4) фаз
Рис. 43. Схеыа ВОЗIIИКIIОI3СННЯ раСКЛИНИВ8ющеrо давления:
1 шлак; 2 мста,,1.1; 3 неметаллическне 8К.'ЮЧ НiIЯ; 4 пленка
заны с адсорБЦИОНIIО l(lIнетическим эффектом ( "\зранrони), так как при
iеД..Т]енном растяжеНIIИ поверхности leTa..JI.тIa диффузия успевает обес
nечItть раВIIОЕесную концентрацию ПАВ на межфазной поверхности.
Устойчивость пленок связана с раСl\"luн,uвающu,, t давленuеlrt, Епер
вые обнаруженным Б. В. ДеряrllllЫМ. Первоначальное понятие paCl{JIlI
IIивающеrо давления было применено к случаю TOHKoro слоя жидкости,
разделяющеrо поверхности двух твердых тел. Расклинивающее даВ.:'Jение
TOHKoro плоскопараллельноrо С.ПОЯ )I{ИДКОСТИ, разделяющеrо два тверды",
u
1'ела, равно даВЛСlIlIlО р, с которым деиствует в состоянии равновесия
..
слон жидкости на оrраничивающие ero. тела, стремясь их раздвинуть
или С)l(ать (еС:ПI рп <О). Расклинивающее давление появляется по сле-
дующеЙ причинс. При утончении жидкости до плеНI 1I (рис. 43) поверх-
ностные слои жидкости сбли}каются до такой степени, что начинает
u
проявляться потенциальная энерrия их взаимодеиствия, которую lIель
зя отнести ни к одной из rраничных поверхностсЙ. Это BbIJbIBaeT появле
u
ние расклинивающеrо давления рл, которое для даННОll системы зависит
только от толщины пленки ХН. Формулы для расчета рп сложны. ОНII
включают ряд характеристик, которые для металлических систем (жид-
кий метаЛ.l неметаллические включения) неизвестны. Для низкотем-
пературных )1<Ilдкостеil Рп наЧlIнаст проявляться при Хп == О, I -+- 1 мм и
168
ДОСТllrает 1 О кПа. [аким образом, переход не ета.1.ТIическим Вк.rIЮЧС
нием rраницы разде.1а фаз (метал.'I rаз, :мета"Т]..11 шлак) связан с
преодолением тонкоЙ пленки металла. Расклинивающее давление иrра
u
ет также существенную pO ТJb при укрупнении включении в результате
их столкновения.
Рассмотрим термодинамическую устоЙчивость П.lеIlКИ при смачива
ннн включениЙ жидкими раСП.7JаваМII. Д,,'Iя :мета.1"lурrllческих систем
представляет интерес случаЙ, коrда О'М>О'В. Такая ситуация реализуется
при контакте )I{идкоrо металла с большинством оксидов, нитридов, суль
(}Н1ДОВ Н др. При оценке устойчивости немета,,1.1ических включений He
uGходимо учесть работу образования пленки. В это случае уравнение
(286) принимает вид:
К == aM r[1/2 (1 cos eB M) + Р П х п ], (288)
rде ХП толщина П. lенки; Рп расклиниваIощее давленис, равное
д
Рп == д (O'B r+ crM r)' (289)
Х П
ПОСКО.,llЬКУ OM r Bcer да ПО.,110)!\lIтельно, то при К == О можно ПО.,lУЧИТЬ
прибли:;кенную оценку отрицательноrо значения Рп для равновесной
пленки. П,,1енка устойчива, еС.7JИ любое изменение хп приведет к уве.
личению натя)кения. В работе [151] разработан экспериментальный
I ,.
метод оцеНКII УСТОllЧИВОСТИ пленок, Ifспользование KOToporo позволяет
иллюстрировать В.lияние жидких П.,lСНОК на процесс перехода HeMeTaJI
.ПilчеСКИМlI ВК.lючениями rраницы разде,па фаз.
При 01lСIIке В.ТJияния раСК..11ННlIваlощеrо дав.Т]еIlИЯ на переход вклю
чеНlIЯМИ ['раllНЦЫ раздела фаз отмечается, что наибольшую устойчивость
имеют n.leHKII на жидких включеНIIЯХ FeO [148]. В процессе раскис.ае
ния MeTa.7I..'Ia кремнием устойчивость пленок снижается (обраЗУIОТСЯ-
силикаты) 11 совершенно исчезает при 1 О/О Si. При выходе на поверх
насть продуктов раскисления Сllликомарrанцем также образуются
u
устоичивые П",lенки металла, хорошо смачивающие не IетаЛЛllческие.
включения. При подходе к поверхности раздела продуктов раскисления
Ti0 2 , MgO, Аl 2 О з пленки не образуются и частицы Ja ничтожно малое
время (IО 4 IО б с) самопроизвольно выходят на rраНIIЦУ раздела
фаз, не испытывая барьерноrо деЙСТВl'IЯ.
VI.7. МЕХАНИЗМ УДАЛЕНИЯ
НЕМЕТАЛЛИЧЕСКИХ ВКЛЮЧЕНИЙ
Длительное время считали, что порядок раскисдения жидкой стаЛIl дол..
jкеи быть таков, чтобы первоначально обеспечить получение }!<IIДКИХ
u
lIеме1аллических включении, применяя предварительное раскисление
стали марrанцем и кремнием с добавками очень малых количеств алю
миния. При этом исходили из Toro, что, поскольку преобладаlощая
часть включений удаляется по закону Стокса, соrласно которому CKO
рость удаления пропорциональна квадрату радиуса, нужно добиваться
формирования включений, способных к быстрому укрупнеНИIО иудале..
нию. Этим требованиям соответствуют жидкие продукты раскисления:
анн леrко коалесцируют, в результате чеrо увеличиваются размеры ча
стиц, и быстро всплывают D rравитационном поле; хорошо аССИМIIЛИРУ
IOT твердые включения (типа АI 2 О з ), которые образуются на второй
стадии раскисления при введении сильных раскислителей. Такая точка
зрения на процесс раскисления II механизм уда",1СНIНI пеметал.rrических
169
включениlr широко распространена и в наСТОЯlцее время. Последующие
исследования поверхностных свойств на ме}l{фазных rраницах мета.пл
неметаллическое ВКЛIочение Ш.7Jак rазовая фаза [152, 153] показали,
что особенности удаления продуктов раскисления связаны rwfJaBHbIM об.
разом Не с раЗl\Iером, а с ТИПО f включениЙ. Было показано, что проДук.
ты раскисления сильными раскислителями (АI 2 О з ) удаляются из жидкой
ста.'1И быстрее, чем силикаты. Быстрое удаление вкдючений корунда
объясняли высоким межфазным натяжением АI 2 О з (aB ъ(==2000 мДж/м 2 )
и явлением сколь)кения. Наряду с этим БЫJIО наказано, что силикаты,
u
характериэующисся хорошеи смачиваемостью и меНЬШIIМ значением
(jB ?\1==600+800 мДж/м 2 , при тех )I{e самых размерах уда.fJЯIОТСЯ зна.
чительно медленнее.
Истинная причина более быстроrо уда.ТIения IIЗ стали включениЙ
r.rlинозема связана не с тем, что метаЛ.1J выта.,1кивает немета.ТI.flичеСКIIС
БК.lючеНIIЯ rЛИIlозема на поверхность, а с особенностями перехода rpa.
llИЦЫ раздела фаз, которые существенно раЗ.ТJичаIОТСЯ для разных про-
дуктов раскисления. Эксперименты, проведенные .ТIИlllЬ в условиях rpa.
и
Битзционноrо поля, П9казали, что скорость всплывания включении
u u
rJIинозема в спокоинои ванне в пять десять раз меньше скорости
всплывания силикатов Toro же размера.
На основе исследований, проведенных в послс нс вреМя в JIaUO-
раторных 1I промышленных условиях по изучению поверхностных НС-
и
металлических включении, мехаНlIЗМ удаления ВК.1JIочения можно пред.
ставить слеДУIОЩИМ образом. После введения раСКlIслителеЙ в жидкой
стали образуются неметаллические включения, размеры которых прибли.
женно :можно описать кривой нормальноrо распределения. Процесс
u
удаления из ста.ТJИ неметалличеСКIIХ включении включает ДВе стадии:
1) перенос ВКЛlочениii на межфаЗНУIО поверхность металл шлак,
металл rаз, мета,,1Л футеровка; 2) переход rраницы раздела фаз.
Крупные включения (10 20 мкм 11 более) достаточно полно удаляются
U u
нз металла под деиствием выталкивающеll силы и конвективноrо пере.
носа в течение первых минут после введения раСКИС.ТIителей. ДЗJl{е с
ни;,кних rоризонтов сталеплаВИJIЬНЫХ печей включения размером 100 мкм
БСП.ТIывают за 1 мин, а включения размером ЗО Ь-IКМ за 10 мин.
Д.fJЯ частиц размером < 1 О мкм действие выталкиваю.щей СИЛbI подав.
ляется конвекциеii. Переное мелких включений на rраницу раздела
u
метаЛ"l шлак осуществляется в основном движущеllСЯ жидкостью,
причем с увеличением интенсивности перемешивания (до HeKoToporo пре.
дела) частота столкновений и «ПРllлипания» К rранице возрастает. Кон-
векция способствует так)ке укрупнению включений. После Toro как
DК.fJючение подведено к ме}кфазно]U[ поверхности, начинается вторая ста-
дия переход rраницы.
Существуют различные мнения о том, I{акая JlЗ двух указанных
стадий является лимитирующсй. ПОД переходом rраницы раздела фаJ
понимают преодоление плеНКII ЖIIДl(оrо металла между включением 11
шлаковым расплавом. При этом еС.тlII пленка преодолена инеметалли.
чеСI<ое включение коснулось шлака, то в большинстве случаев созда.
IОТСЯ условия, обеспечиваЮlцие дальнеЙшее ИЗВ ТIеченнс включения из
стали. Неметаллические включения (rлинозем, СИЛlIкаты 11 др.) из числа
тех, KOTophle остаЛllСЬ после всплывания крупных частиц, к rранице раз.
дела фаз доставляются конвективными потоками металла со скоростью
ДВlfжущсrося расплава. При этом плохо смачиваемые ВКЛIочения (АI 2 О з ,
Zr02 и др.) разделительную пленку металла проходят беспрепятственно.
Следовательно, для этих типов включений процесс удаления лимитирует.
ся доставкой их на rраницу раздела фаз. ВключеНIISl (FeO, МпО, Si0 2 ).
хорошо смаЧlIваlОЩllесн металлом, разделитеЛЬНУIО пленку преодолева
170
JOT во времени. Включения TaKoro типа Moryr накапливаться на ме)к-
фазной rранице, и вероятность их уноса Br лубь металла существенно
больше, чем в первом случае. Для этих типов включений в большинстве
случаев реализуются условия, при которых процесс удаления ЛИМИТII-
руется переходом rраницы раздела фаз.
Таким образом, на первоЙ стадии размер ВК 1юченпй в основном
ОПРСДС lяет способ доставки к межфазноЙ rранице. Крупные включения
ВСП.,1ывают сами, "fе..1кие переносятся конвективными потоками жидко-
сти. На этой стадии роль поверхностных свойств в основном проявля-
ется в таких процессах, как укрупнение (слияние, слипание, аrреrация),
адсорбционное тормо)кение, движение включений в концентрационном
лоле и др. На второЙ стадии удаления включениЙ, связанном с перехо-
дом rраницы, поверхностные свойства системы (aM B' аМ ШI аШ 8) и
характеристики смачиваемости, определяют термодинамические и ки-
нетические закономерности перехода. РаЗ fеры ВК 7Jючений в этом случае
иrрают меньшую роль. Рассмотренная схема носит общий характер и
не 1\fожет отразить 'Iноrообразия частных случаев, которые имеют место
u
при выплавке отде8l1ЬНЫХ rрупп ста lIеи и сплавов, характеризующихся
образованием ВКoIl10ченпЙ различных типов.
VI.B. ПОВЕДЕНИЕ НЕМЕТ АЛЛИЧЕСКИХ ВКЛЮЧЕНИй '
В усповиях ВАКУУМА
При использовании вакуума создаются дополнительные термодинамиче
..
ские и кинетические ВОЗМОЖНОСТII для удалеНIIЯ из жидкои стали не-
металлических включений. К ним относятся: 1) термическая диссо-
циация неметаллических включений (оксидов, нитридов, сульфидов)
при высокой температуре 11 малом остаточном давлении; 2) Dосстановле-
u
иие оксидных неметаллических ВК.1Iючении растворенным в металле yr
леродом и последующее удаление со; 3) удаление неметаллических
u
включении в реЗУ.lьтате интенсивноrо перемеШlJвания жидкоrо Me
талла и прилипания включений к пузырям при обезуrлероживании 11
удалении растворенных rазов; 4) удаление КIIС.:10рода В результате
испарения субоксидов.
При внепечной вакуумной обработке из )I{ИДКОЙ стали уда.пяются.
неметалличеСI{ие ВКЛIочения rлавным образом ВС.1Jедствие их переноса
на rраницу фаз движущимся потоком расплава JI всплывающими пузы .
рями rаза. При этом в зависимости от состава металла, степеНII ero
раскисления н rазонасыщеННОСТJI удаляется ДО 30 О/О включений. ПрJi
плавке металла в rлубоком вакууме (O,133 0,013 Па) степень удаления
возрастает до 50 60 о/о. В тех случаях, коrда металл затвердевает в
водоохлаждаемых кристаллизатороах, наряду с удалением существен
но изменяются форма, размер и XapaI{Tep расположения оставшихся
включений. Они, как правило, дробятся 11 распредедяются более рав-
номерно. Рассмотрим возможность уда 1JСНIJЯ кислорода из )КIf,J.I<ОЙ стали
u
В результате термическои диссоциации оксидов:
МехОу == х [Ме] + у [О]. (290)
ПолучающиЙся по реакции (290) растворенный кислород ДИФФУН-
дирует к поверхности раздела металл rаз и десорбllруется в rаЗОВУIО
фазу в виде 02. Таким образом, суммарныЙ процесс связан с осуществ-
лением реакции:
Л1ех Оу == х [Ме] + у/20 2 . (291)
С уменьшенисм остаточноrо давления в системе рсаКIlIIЯ (291) про-
171
текает бо..lее Полно. Однако этот процесс может ПО.I1УЧИТЬ развитие лишь
в том случае, коrда давление диссоциации Ро,' !vIe:;Oy оксида больше
парциальноrо дав..lеllИЯ КIIслорода р :T в вакуумноЙ камере с задан-
ныь! значением остаточноrо давления рОСТ. Значения давлениЙ диссо-
циаций оксидов (СаО, MgO, Аl 2 О з , FeO и др.) настолько мады
« 1 ,3 lkПа), что в условиях вакуумной плавки (рОСТ== 1,3+ 1,3-1 0 2 Па)
следует скорее ожидать поступления кислорода в расплав из атмосферы,
чем ero удалеНIIЯ в rазовую фазу. Вместе с тем расчеты показывают,
что из расплава )IПiдкоrо никеля уже при 24 Па и 1600 ос возмо)кна
прямая десорбция кислорода в rазовую фазу [85]. Присутствие yrJlepo-
да существенно IIзменяет картину:
Мех Оу + у [С] == х [Ме] + у со. (292)
С уменьшением остаточноrо давления реакция (292) протекает бо-
JIee полно. В некоторых работах показано соответствие между коли-
и
eCTBOM удаляемых включении и снижением концентрации уrnерода.
Одна]{о в ряде случаев TaKoro соответствия не наблюдают, что можно
бъяснить очень малыми изменениями концентраций уrлерода
(........0,005 о/о), которые MorYT остаться незамечеННЫМII. О возмо}{{ности
и
восстановления включении свидетельствуют присутствие моноокtида
уrлерода со в отходящих rазах, а также уrлеродный конденсат на
водоохлаждаемых стенках кристаллизатора, ПОкрытых возrонаМI[ Map
санца и железа, которые являются хорошими' катализаторами реакции
разложения СО (реакции Белла).
Взаимодействие оксида с уrлеродом может происходить по двум
схемам. В первом случае реакции (292) предшествуют диссоциация
оксида, диффузия yr лерода и кислорода к поверхности раздела фаз
и последующая реакция между ними. Во втором случае восстаНОВ..1еllие
()I{сида связывается с образованием зародыша СО на поверхности вклю-
чений, а последующий рост пузыря с диффузией уrлерода. В этом
случае характеристики восстановления оксидов зависят от их смачивае-
мости (на А1 2 О з зародышу леrче образоваться, так как он хуже сма-
чивается), соответствия пузыря СО размеру неметаллическоrо вклю-
чения и др. В рассматриваемых условиях MorYT получить развитие
u
также процессы всплывания неметаллических включении, увлекаемые
rазовыми позырями на поверхность жидкоrо металла. Возможность
восстановления взвешенных частиц растворенным yr леродом зависит
()т температуры, остаточноrо давления и состава металла, rлубины зале-
тания включения. Расчеты показывают, что при 1600 ос частично MorYT
восстановиться включениям Si0 2 и достаточно полно МпО, Сr20з. Воз
можность восстановления неметаЛ lJических включений с образованием
rазообразных субоксидов связано с протеканием, lIаПрlI Н р, слеДУIОЩИХ
и
реакции:
А1 2 О з (т) + 2 [С] == A1 2 0(r) ! 2СО; OO == 287 800 110,31T;
А]20з(т) + [С) :=: 2/\10(1') со: i\QO == 375150 113, 70Т;
Si0 2 (T) + [С] == SiO(r) со; ao == 156 040 68, 99Т _
Расчеты показывают, что еС.,lИ содер}{ анис yr лерода составляет
0,1 О/о, указанные реакции при 1600 ос получают развитие при РОСТ,
равном 21,32 и 87 Па. Несмотря на термодинамическую возможность
..
восстаНОВ.1ения ВКJlIочении yr леродом, тем не менее указанные реакции
v
вследствие раЗ. Т lIIЧНЫХ кинетических трудностеll получают оrраниченное
разВитие. Доля удаленных ВКЛIочений в результате восстановления yr-
'1epOДOM не I1peBbIulaeT 20 о/о. В частности, наличие оксидной ПЛСНК!I
172
на поверхности жидкоrо металла при ВИП, влп и ЭЛП также указы-
u u
вает на ТО, что процессы диссоциации включении 11 взаи\tодеllСТВИЯ с
u
уrлеродом доминирующеи pOJ1H не IIrpalOT.
r n а в а VII.
КИНЕТИКА МЕТ АллурrИЧЕСКИХ РЕАКЦИИ
Мета.ллурrические реакции в большинстве случаев явля..
u
ются сложными мноrостадииными процессами, протекаю-
ЩИМИ на rранице мета ТJЛ шлак rазовая фаза. Изуче
u
ине кинетики reTeporeHHbIX реакции сводится, как правило,
к последовательному решению двух задач: установлению
лимитирующеrо звена и определению количественных ха..
рактеристик этоrо звена (константы скорости процесса, ко-
эффициента массопередачи, влияния температуры и др.).
Реакции сталеплавильноrо производства характеризуются
тем, что их скорость в большинстве случаев лимитируется
процессами переноса веществ. Различают внешнюю и вну"
треннюю массопередачу. В реакциях между текучими фа..
зами с твердым телом или между жидкостью и rазом при
u
сравнительно малых скоростях потока rаза лимитирующем
тадией является внешняя диффузия, удельной количест-
венной характеристикой которой является коэффициент
массопередачu. Данные термодинамики не оrраничены
l\lасштабными факторами, в то время как кинетические
данные существенно зависят от rеометрических характе-
ристик системы, поэтому скорости металлурrических ре-
акций, леrко измеряемые в лабораторных условиях, дают
информацию, которую в большинстве случаев нельзя пе-
ренести на ПРО lышленные условия. Во мноrих случаях ре..
шенне подобных задач связано с использованием теории
подобия и критериальных уравнений.
VII.1. МОЛЕКУЛЯРНАЯ диффузия
Количественные характеристики диффузии описываются
двумя уравнениями Фика. Если количество вещества dm
продиффундировало в единицу времени d't через площадь
S при rрадиенте концентрации dc/dx, то первый заl(ОН, Фи..
ка выражается следующим уравнением:
dm/dl1 === DS (dc/dx), (293)
rде D коэффициент диффузии, м 2 /с. Если s== 1 м 2 , а
173
dc/dx== 1 моль/м 4 , то D=== dm/dT. Таким образом, I{ОЭф-
фициент диффузии равен скорости диффузии через единич-
ную поверхность при rрадиенте I\онцентрации, paBHorvf 1.
Минус указывает, что диффузия происходит в направле-
нии уменьшения концентрации. Под диффузионном пото-
ком П понимают количество вещества (в rpaMMax, молях
и др.), которое диффундирует через единицу площади
(1 м 2 ) за единицу времени (с). Уравнение (293) мало при-
rодно для определения D, так как диффузионный поток n
моль/ (м 2 · с) нужно измерять в условиях постоянноrо rpa-
диента, что экспериментально трудно осуществить. Значи-
тельно проще проследить за распределением концентрации
диффундирующеrо элемента вдоль направления диффузии
u
за определенныи промежуток времени или измерить И3!\.Iе..
нение концентрации во времени в определенной точке. Для
вычисления коэффициента диффузии по эксперименталь-
ным данным ИСПО.пьзуют второй закон Фuка, который для
u
одномернои задачи выражается уравнением:
дс/д,; == D (д 2 с/дх 2 ). (294)
Интеrрируя выражение (294) при заданных нача ТIЬНЫХ
.,
и rраничных условиях, которые определяются конкретнои
u
постановкои задачи, можно получи:rь выражение для ско-
рости диффузии [154; 155]. Для приближенных расчетов
представляет интерес уравнение х 2 ===2D't. При помощи это-
ro уравнения зная значение D можно вычислить путь диф...
фузии х за заданное время, или время, необходимое для
Toro, чтобы фронт диффузии переместился на величину х.
Приведем еще одно полезное соотношение: q===kv:t. Про..
порциональность количества продиффундировавшеrо веще-
ства q квадратному корню из времени является убедитель..
ным доказательством диФФузионноrо характера исследуе-
Moro процесса. Значения коэффициентов дифq'У3ИJI в
твердых телах составляют lO 12 ]O 16 жидкостях lO 8..........
10 lO И rазах 10 5..........10 4 м 2 /с.
В табл. 21. приведены значения коэффициентов диффу..
зии некоторых элементов в ЖИДI{ОМ железе. Зависимость
коэффициента диффузии от температуры выражается урав-
нением D===Do e E/RT, rде Е энерrия активации диффу-
зии, Дж/моль. Величину Е экспериментально определяют
из уrловоrо коэффициента прямой в координатах 19 D..........
1/Т. Энерrия активации диффузии в rазовой фазе, как
это следует на I{инетической теории rазов, равна приблизи-
тельно RT/2. Таким образом, при температурах металлур..
rическоrо производства энерrия активации диффузии в ra..
174
Т а б л и ц а 2]. Значения коэффициента диффузии D компонентов и
энеРr)fЯ активации (Е) в ЖИдком железе
Диффундя -
рующий
э.,емент
Т. I(
D. 109,
MI/C
Е,
КДЖ/МОЛЬ
Диффунди-
рующий
элемент
Т, К
D .10',
MI,C
Е.
КДЖ/МОЛЬ
N
Н
О
S
р
1873
1873
1873
1873
1823
5.0
300.0
12
4.5
4,7
38,6
16,8
21,0
42,0
33,6
с
Si
Мп
Cr
W
1863
1833
1953
1843
]873
7,2
3.8
0.61
0,4
1,2
50.4
37,8
67.1
29,4
100,7
зах составляет 8,0 КДЖ/МОЛЬ. Для диффузии компонен-
тов в жидкой стали энерrия активации диффузии
варьируется в пределах 20 80 кДж/моль. Увеличение ко-
эффициента диффузии с тем пературой связано с уменьше-
u
нием JJЯ3КОСТИ 1'), температурная зависимость которои опр -
де ТIяется соотношением: 11 ==f}oeEt')/RT, rде ЕТ) энерrия ак-
тивации вязкоrо течения жидкости.
В табл. 22 приведены значения динамической вязкости
Д.ля некоторых жидкостей. Зависимость коэффициента диф-
ф)'зии JJ от вязкости 11 для частицы радиусом , определя-
ется формулой Стокса Эйнштейна:
D == RT/6nr!)N А, (295)
rде N A число Авоrадро.
Значения коэффициентов диффузии, вычисленные по фор-
муле (295), удовлетворительно соrласуются с эксперимен-
та ТIЬНЫМИ дпнными. По формуле (295) решают и обратную
задачу....... по заданному значению D определяют радиус
диффундирующей частицы. Однако, поrрешности, связан..
ные с применением формулы (295), существенны и MorYT
достиrать одноrо порядка.
т а б л и ц а 22. Значения динамической вязкости 11 для некоторых
.
жидкостеи
Жидкость Т, К 1'), Жидкость Т, К 1').
кПа . с кПа . с
Вода . . . . . 298 0,89 )Кидкий чуrун . . 1673 1 ,5
r Лllцерин . . . 298 500 )I(идкии шлак . 1873 2,0
.
Касторовое MaCJlO 298 800 Средний шлак . . 1873 20,()
)l(идкое железо . 1873 4,5 rустой шлак . . 1873 >200
)I(идкая сталь . . 1873 2,5
175
VII.1. КОНВЕКТИВНАЯ диффузия
в lvIеталлурrических процеrсах с участием ЖИДI{ИХ и rз-
зообраЗI-IЫХ фаз молекулярная диффузия в чистом виде
встречается сравнительно редко. На самом деле имеет
место конвективная диффузия, }{оrда на молекулярную
диффУЗIIЮ накладывается перенос вещества потоком. В тео-
рии конвективной диффузии различают два поrраничных
слоя: 2LlдродuнамuчеС1\,llй б r и дuфузuонный Б Д 8 Под rид-
родинамическим поrраничным CtТIoeM понимают толщину
жидкостп или rаза на rранице с конденсированной фазой,
в которой скорость ПО10ка жидкости изменяется от а===О
.
1
(.)
,
"*
()(
с(
!/
с
х
Рис. 44. Схема rидродинамическоrо l)r JI диффузионноrо 6 д поrраничных слоев
при набеrании жидкости со скоростью а на ПЛОСКУIО пластину
Рис. 45. Изменение концентрации в поrраНIfЧНОМ слое (с. концентрации JI асы...
щения. вблизи тверд.ой фазы; с концентрация вещества в объеме ЖИДКОСТ}I):
1 твердая фаза; 2 жидкость
(на поверхности) до значения а в ядре потока. ТаКИlvf об-
разом, вследствие трения скорость }Кидкости на поверхно-
сти равна О, а на некотором расстоянии от повеРХНОСТII она
равна скорости течения в объеме. Если на плоскую плас-
тину набеrает поток жидкости со скоростью а, то распре-
деление скоростей вблизи твердоrо тела на расстоянии у
от точки набеrания струи имеет вид, показанный на рис. 44.
В этом случае толщина rидродинамическоrо слоя опреде-
ляется уравне нием :
б r === 5,2 V('Vy)/a (296)
rде 'V кинематическая вязкость. В кинетических задачах
интересуются в основном не распределением скоростей,
а распределением концентрации вблизи межфазной по..
верхности. Толщину слоя жидкости, в которой наблюдают
rрадиент концентрации компонента, называют дuффузuон-
НЫ,М, поzраНliЧНЫм. слоем (6 д ). Если изучается растворение
твердоrо тела в жидкости и процесс лимитируется массо..
176
u
передачеи атомов paCTBopeHHoro вещества, то к поверхности
u u
твердоrо тела ПрИ ТIеrает слои жидкости, в !{оторои КОН-
центрация соответствует насыщению (рис. 45). На некото-
ром расстоянии от поверхности концентрация вещества со-
ответствует концентрации с в объеме. Толщину слоя, в пре-
делах которой наблюдают ИЗ lенение концентрации от с*
до с называют диффУЗИОННЫ!\1 поrраничным слоем. При
данных значениях у и а толщина rидродинамическоrо слоя
в соответствии с формулой (296) определяется вязкостью ",
а толщина диффузионноrо С&lIОЯ коэффициентом диффу-
зии D. Во мноrих случаях количественная связь между тол..
щинами rидродинамическоrо и диффузионноrо поrранично-
ro слоев удовлетворительно описывается уравнением:
fJд/fJ r == (D/V)1/3. (297)
Коэффициент диффузии }{омпонентов в жидкой стали D
1 O 9 M 2 JC, а кинематическая вязкость жидкой стали ,,
10 6 м 2 /с. Тоrда D/'V=== IO 3 11 В соответствии с уравнениеtl
(297) t)д О,l t)r. Таким образом, в рассматриваемых ус...
ловиях толщина дифФузионноrо слоя составляет Bcero
10 О/о от толщины rидродинамическоrо слоя. В общем ви"
де t)д==t)r/Рr 1 / З . Для rазов критерий Праl-lДТЛЯ Pr=== 1, по..
этому t)д === t)r.
Коэффициент массопередачu
При изучении reTeporeHHbIx fеталлурrических реакций в
большинстве случаев истинная толщина поrраничноrо диф..
фузионноrо слоя неизвестна. Для практических расчетов
пользуются коэффициентом массопередачи . В этом слу-
чае формулу для определения диффузионноrо потока П за
писывают в следующем виде:
.
п == D (дс/дх) == D ( c/fJ) == c, (298)
rде D/t).
Распределение концентрации вещества вблизи поверх-
ности твердоrо тела показано на рис. 45. Поток вещества
через плоскость x o определяется уравнением:
П == D (дсlдх)х===о. (299)
Если сложное распределение концентрации в пределах
истинной толщины диффузионноrо слоя б д заменить линеЙ..
ным распределением, то
(дс/дх)х===о === (с* с)/б, (300)
12 675
177
rде б эффективная ТО lщина поrраничноrо диффузион..
Horo слоя.
Величну б можно опреде,ТIИТЬ по отрезку, который отсе-
кает касательная к кривой в точке С(Х==О) на оси абсцисс.
Подставив значение производной из уравнения (300) в
уравнение (299), ПОЛУЧИl\f:
П == (D /6)( с* с) === (с* ......... с). (30 1 )
Под эффективной толщиной пО2раНUЧНО20 дuффузuон
НО20 слоя понимают значение 6, которое обеспечивает Ta
v
кую же величину потока, что и деиствительное значение
б д при переносе BeLЦecTBa в результате чисто молекуляр-
ной диффузии.
Поскольку диффузионный поток выражает количество
вещества на единицу поверхности за единицу времени, то
ИI\1еет размерность скорости (М/С), а концентрация Bыpa
жается в I<r/cM 3 . Если массовая концентрация выражена в
процентах, то р имеет размерность Kr/ (м 2 . с. о/о). От Mac
cOBoro содержания, выраженноrо в процентах, к размерно-
сти Kr/M 3 можно перейти при помощи выражения с===
=== (О/О) (р/l00), rде р плотность среды, Kr/M 3 . Однако, в ря-
де случаев рассчитывают не по величине потока на 1 м 2
поверхности, а на 1 м 3 объема пористоrо или зернистоrо
материала. В этом случае поток имеет размерность
кr/(мЗ.с), а .........l/c. Уравнение (301) широко применяют
при изучении кинетики reTeporeHHbIx металлурrических 'ре-
акций. Если измеряют изменение концентрации реаrирую-
щеrо компонента, то уравнение (301) записывают следую-
щим обра30 1:
dc/dt == ( DS/БV)(с с*), (302)
rде V объем; DS/(fJV) === . Рассмотрим температурную
зависимость . Поскольку ==D/б, а 6 в соответствии с
формулой (296) пропорциональна вязкости fJ 1)1/2, то
Ef3==ED+ 1/2 E V. Таким образом, энерrия активации массо-
передачи Ef3 имеет сложный физический смысл и отражает
те fпературную зависимость коэффициента диффузии и вяз-
I{OCT и.
При внешней диффузии количественные закономерно..
сти переноса вещества в направлении координаты х опи-
сываются уравнением конвективной диффузии:
П ==:. D (дс/дх) + а. х С. (303)
Первое слаrаемое правой части уравнения (303) характе-
риз}ет перенос вещества в результате молекулярной диф-
178
фузии, второй перенос вещества ПОТОКОМ. Анализ урав-
нения (303) показывает, что в ЖИДI{ОСТЯХ перенос вещест-
ва осуществляется потоком. Даже в условиях естественной
u
}{онвекции не имеет места чисто молекулярныи перенос.
Слаrаемым конвективноrо переноса можно пренебречь "ТIИШЬ
при малых значениях критерия Пекле (Pe===PrRe). Такие
условия реализуются, в частности, при: массопередаче в ra-
зовой фазе [157]. Уравнение конвективной диффузии !\IОЖ-
но решить только для rlIдродина lически определенных за-
дач, т. е. для задач, в которых известны распределение ско-
ростей и концентрации. B IecTe с тем большинство
еталлурrических задач являются rидродинамически неоп-
реде,,1енными. Закономерности движения жидкоrо расп"Т}а-
ва в сталеплавильной печи и в ковше сло)кпы и в БОЛЬШllН-
стве случаев неизвестны, С ЭТИ I обстояте"ТIЬСТВОМ связаны
трудности решения уравнения конвективной диффузии Д.пя
\Iноrих задач металлурrическоrо производства. Точные ре-
шения конвективной диффузии получены лишь для orpaHII-
ченноrо числа задач, в частности, для набеrания пото}{а
на плос}{ую пластину и на поверхность вращающеrося
диска.
VII.3. КРИТЕРИАЛЬНЫЕ УРАВНЕНИЯ
В ЗАДАЧАХ ПО КИНЕТИКЕ
Коэффициент массопередачи, как праВI-IЛО, определяют э}{с-
периментально и устанавливают связь между значением
и различными параметрами. Например, если переход серы
из металла в шлак лимитируется массопереносом в шлако-
вой фазе, то нужно знать зависимость от интенсивности
перемешивания шлака, вязкости, характеристических раз-
меров системы, температуры и друrих величин. Количествен-
ную связь между и соответствующими параметрами срав-
нительно просто можно устанавливать' на основе теории по-
добия [156 160]. ЗIlачение коэффициента массопередачи
определяется критерием Нусселыа Nu== d/D (d харак-
теристический размер, м; D коэффициент диффузии,
м 2 /с). Иноrда диффузионный критерий Нуссельта называ-
ют критерlfем Шервуда и обозначают Sh. 'Критерий Нус-
u
сельта характеризует перенос вещества в неподвижнои сре-
де или ламинарном потоке. Для случая, коrда поток жид-
кости или rаза обтекает тело (например, растворение куска
ферросплава в сталеплавильной ванне), критерий Нуссель-
та имеет постоянное значение и зависит лишь от rеОl\1етри"
ческой формы тела. В частности, при обтекании шара по-
12*
179
"OKO 1 Nu===2. При ламинаРНО I течении жидкости или ra-
за критерий Nu также имеет постоянное значение.
Например, Д 1JЯ труб Nu===3,66. Количественные характе-
ристики между и соответствующими параметрами вязко-
стью ", скоростью течения а, характеристическими разме-
рами (d и др.) сравнительно просто можно устаlIОВИТЬ на
основе критериальных уравнений Nu==bRenpr т . Количест-
венную связь между критериями Nu, Re и Pr обычно на-
ХОДЯТ по экспериментальным данным. Пользуясь изложен-
u u
нои методикои, можно написать критериальные уравнения,
I{OTOpbIe описывают зависимость коэффициента массопере-
дачи от парметров опыта:
Bd/D == Ь (ad/v)т ('V/D)n;
А т п.........т
== а "
.
(304)
Если показатель степени т изменяется в пределах 0'4...........
0,6, то это указывает на диффузионную природу процесса.
При помощи критериальных уравнений типа (304) в лите-
ратуре описана кинетика перехода серы из металла в шлак,
обезуrлероживания, растворения твердых тел, восстанов-
ления оксидов и др. [156 159].
VH.'. ПРИЗНАКИ,
ПО КОТОРЫМ ОПРЕДЕЛЯЮТ
ЛИМИТИРУЮЩУЮ СТАДИЮ
rETEPOrEHHOro ПРОЦЕССА
Наиболее распространенные признаки, по которым можно
выявить лимитирующее зве о, рассмотрены ниже.
1. Влияние перемешивания или изменение скорости по-
тока rаза или жидкости на кинетику изучаемоrо процесса.
Если изменение скорости потока а или интенсивности пере-
мешивания не приводит к изменению скорости процесса в
цe ТIoM, это значит, что внешняя диффузия не является ли-
митирующей стадией. В этом случае процесс контролиру-
ется либо внутренней диффузией, либо химико-адсорбци-
онным звеном. Зависимость скорости реакции от интенсив-
ности перемешивания в большинстве случаев наиболее убе-
дительно свидетельствует в пользу внешн й диффузии.
2. Отсутствие rрадиентов концентрации взаимодейст-
вующих компонентов в фазах, прилеrающих к межфазной
rранице, указывает на то, что реакция на поверхности раз-
дe ТIa фаз протекает в кинетичеСI{ОМ режиме. rрадиент кон..
центрации в одной из фаз указывает на диффузионный ха..
180
рактер процесса. В ЭТО f случае Иl\lеет место термодинами..
v
ческое равновесие реакции, протекающеи на rранице
раздела фаз.
3. Вид кинетической кривой. Во мноrих случаях харак"
u u
тер режима определяют по виду кинетическои кривои или
соответствию экспериментальных данных определенным ре..
шением кинетических уравнений. Рассмотрим кинетику по..
u
rлощения азота жидким железом, которыи включает три
стадии: внешнюю диффузию......... массоперенос азота в rазо..
вой фазе к поверхност.И жидкоrо металла; химико..адсорб..
ционное звено, включающее процессы диссоциации моле..
кулярноrо азота, адсорбции, десорбции и др.; внутреннюю
диффузию массоперенос азота в жидком расплаве.
Эксперименты показывают, что первая стадия, как пра..
ВИ&1IО, осуществляется довольно быстро и не является лими"
тирующей. Если лимитирующей является вторая стадия, то
u u
прежде Bcero нужно установить, какои частныи процесс
контро,пирует адсорбцию в целом. Допустим, что такой ста..
u
диеи является диссоциация молекул азота на атомы и ад..
сорбция последних на поврехности расплавов. В этом слу..
чае
d [N]/d't == К 1 PN 1 К 2 [N]2,
rде KtPN 1 ......... характеризует скорость прямоrо процесса;
К2 [N] 2 ......... скорость обратноrо процесса.
Поскольку PN 1 ==[N];/ KN и В СОСТОЯНIIИ равновесия
l(1PN 2 ==K2[N]2, откуда Kl/K2==KN, то
d[NJ/d1i == (Kl/KN)([N] [{\J]2).
Интеrрируя уравнение (З06)
't[N], получим
In [N]p+ [N] . [N]p [N]o == 2 :1 [NJ p 1:.
(N]p [N] [N]p + [N]o N
Если лимитирующей стадиеЙ является внутренняя диффу..
зия, то
(305)
(З06)
в пределах О и [N]o и
(307)
d [NJ/d-r == ж ([NJ p [N])
и после интеrрирования получим
In [N] р [N]o ==: ж 1:.
[N]p [N]
ДЛЯ определения ЛИl\fитирующей стадии эксперимен..
тальные результаты обрабатывают при помощи уравнений
(3О7) и (309) и полученные данные представляют rpa..
(308)
(309)
181
фически. [рафик, на котором получена линейная заВIIСИ-
мость, указывает на то, что данная стадия являе'tся ТIИ fII-
тирующей. Из приведенных уравнений следует, что при
т'-"+О скорость адсорбции пропорциональна PN. (процесс
лимитируется второй стадией) и 2 (процесс лимитиру-
ется третьей стадией). Однако рассмотренные признаl{И в
некоторых случаях 1Ie дают однозначноrо ответа. В частно-
сти, решение для первой стадии будет таКИ 1 }ке, как и ДеЛЯ
u
втором.
4. Температурная зависиftIОСТЬ скорости реакции. По-
скольку энерrия аткивации химической реакции Ех боль-
те энерrии активации диффузии Е д , то обычно при низких
температурах процесс лимитируется актом химичеСI{оrо
u
взаимодеиствия, при высоких теl\1пературах массопе..
реИОСОl\..t. Таким образом, с повышением температуры кине..
тические оrраничения устраняются и процесс, как правило,
реализуется в диффузионном режиме.
5. Пропорциональность количества прореаrировавшеrо
вещества !{вадратному корню из времени (q==k V '[) ЯВ-
ляется доказательством Toro, что процесс ЛИМИТIlруется
диффузией.
6. Если добавки ПАВ в ТIИЯЮТ на CI\OpOCTb процесса, то
в большинстве случаев это указывает, что реакция проте-
!{ает в кинетическом режиме.
7. Порядок реакции, определяемый экспериментаvlЬНО.
Если на основе опытных данных YCTaHoB ТIeHO, что реакция
u
имеет первыи порядок, то па основе этоrо нельзя сде.пать
u
однозначноrо вывода о .ПИ!\Iитирующеи стадии, ПОСКО..,1ЬКУ
скорость диффузии также описывается реаI{цией первоrо
порядка. Дробный И.J1И второй порядок реакции в БО.J1Ь--
шинстве случаев указывает, что диффузионное сопротив-
ление либо устранено, либо существенно У fеньшено.
Если реакция по реаrирующему компоненту имеет ну-
u
левои порядок, то это указывает, что скорость реакции не
зависит ОТ концентрации, которая во времени изменяется
u
1 И 11 е и н о.
VII.5. КИНЕТИКА РАСТВОРЕНИSl, ПЛАВЛЕНИSl
Растворение твердоrо тела в жидкости включает две ста-
дии: 1) разрушение кристаллической решетки 11 переход
атомов твердоrо тела в жидкий раствор (кинетическая ста..
дия); 2) массопередачу растворенных атомов из поrранич-
Horo слоя в объем раствора (диффузионная стадия). Рас-
182
смотрим кинетический реЖИ 1 растворения. В ЭТОl\1 с.пучае
dc/dt === (K 1 Sпo/V)(l С/Спас)' (310)
u
rде ПО число атомов на единичнои поверхности.
Интеrрируя уравнение (310) при условии, что при '{===о,
с===о, И приняв, что (KlnOS)/V==K получим
с === Спас (1 е КТ/Спас) . (311)
Если процесс реализуется в кинетической области, то
зависимость концентрации от времени выражается экспо
ненциальной зависимостью. В этом случае константу pac
творения можно определить rрафически по уrловому коэф
фициенту прямой в координатах 19 C T [162]. Если ско-
u
рость растворения лимитируется массопередачеи, то к
u
поверхности твердоrо тела прилеrает слои жидкости толщи
ной б д (СМ. рис. 45), в котором концентрация растворенио-
ro вещества изменяется от Спас на rранице с твердым те-
лом дО С, рзвноrо концентрации paCTBopeHHoro вещества
вда ТIИ от поверхности Соб. rрадиент концентрации (CHac
C) /6 определяет размер диффузионноrо потока
dc/d't == DS [(Свае с)/БJ. (312)
Интеrрирование уравнения (312) при ус.ловии, что при' т==О
с===о, дает
С === СпаJ 1 е : Т). (313)
Из уравнения (313) следует, что при диффузионном pe
жиме растворения также наблюдается экспоненциальная
зависимость концентрации от времени, поэтому только по
v u
виду кинетическои кривои нельзя сделать вывод олимити..
рующей стадии, поскольку для обоих режимов характерна
одинаковая зависимость концентрации от времени. В про-
меЖУТОЧ:НО 1 режиме растворения С==С нас (l eK"t), rде К ==
==k / (k+ ). При k получаем уравнение, соответствую-
щее кинетическому режиму, при <k диффузионному ре..
жиму. Если в -жидкости растворяется монокристалл, то
скорость растворения cYLЦecTBeHHo зависит от кристалло-
rрафической плоскости. Большие скорости растворения со-
ответствуют rраням, которые характеризуются б6льшим
значением поверхностноrо натяжения. Обычно рассматри-
вают два случая растворения твердых тел в жидкостях.
В первом случае твердое тело имеет более низкую темпе..
ратуру плавления, чем жидкость (например, растворение
а&ТIIО fИНИЯ в жидкой стали). При этом твердое вещество пе-
183
реходит в )КIIдкое состояние, а пос Т]едующее распреде..lение
по объему связано с диф(рузией И..1]И конвективным l\laCCO-
переНОСО!\1. Во втором' случае теrdпература плавления твер-
доrо тела выше температуры расплава и растворение свя-
зано с химическим взаимодействием, диффузией компонен-
тов, проникновением жидкоrо расплава в поры твердоrо
тела и др.
В последние rоды широкое распространение получи..ТIа
дИФФУЗllонная теория плавления твердых тел. Эта теория,
в частности, описывает плавление ТIoMa в ЖlfДКОМ чуrуне.
Растворенный в жидком расплаве уrлерод диффундирует к
u
поверхности скрапа и насыщает до некоторои KOHцeHTpa
ции, что ПРИВDДИТ К снижению температуры плавления в со-
ответствии с диаrраммой системы Fe C 11 переходу TBep
дой фазы в жидкую. Таким образом, поверхностная KOH
центрация уrлерода определяется соотношением двух
потоков уrлерода: внешнедифФузионноrо, к rранице разде
ла фаз и внутридиффузионноrо, связанноrо с переходом
уrлерода внутрь твердой фазы. Наряду с указанным Iexa-
низмом существенную роль иrрает межкристаллитное про-
u u
никновение жидкоrо расплава, которыи под деиствие f ка-
пиллярных си.П располаrается по rраницам зерен или в раз
витых порах, что приводит К распаду твердоrо тела на
отдельные куски. По такому механизму происходит плавле
вне шлакообразующих, растворение извести и др. Если на
rранице раздела фаз между жидкостью и твердым те.НОМ
имеет место взаимодействие с образованием химических co
единений (растворение железа в алюминии), то ПОДВИЖ
1IOCTb компонентов описывается законами реактивной диф-
фузии [164]. В большинстве случаев растворение добавок
в жидких металлах и шлаках проходит по диффУЗИОННО tУ
механизму, поэтому для ускорения растворения необходи-
ло перемешивание расплава.
VII.6. ВЛИЯНИЕ ПАВ НА КИНЕТИКУ
rETEPOrEHHblX ПРОЦЕССОВ
Влияние ПАВ на скорость reTeporeHHoro процесса в боль-
шинстве случаев наблюдают, если суммарная скорость ли
1итируется химико-адсорбционной стадией. Если процесс
реализуется в области внешней и внутренней диффузии, то
на rранице раздела фаз имеется тер 'lодинамическое рав-
новесие и любые изменения состояния rраницы (наПрИ:Vtер,
в результате добавок ПАВ) не MorYT быть замечены и вли-
ять на скорость реакции [165]. Однако, ес ТIИ добавки ПАВ
-184
Te r или иным спосоБОl\i влияют на rидродинамические }ТС"
.ПОВИЯ В поrраНИЧНО 1 слое, даже в диффузионном ре)КИNlе
f\10}I{HO наблюдать изменение скорости под действием ПАВ.
Бл:ияние ПАВ на скорость reTeporeHHbIX реакций количест..
венио учитывается введением в кинетическое уравнение ве..
ТIИЧИНЫ 6, которая характеризует число занятых мест. Так,
например, скорость реакции обезуrлероживания Vc rазо..
образным КИС.ПОРОДОМ в присутствии ПАВ можно описать
уравнением: Vc ===К 1 (l e) [CJpo., rде множитель (1 8)
характеризует число мест, незанятых ПАВ. В большинстве
случаев удовлетворительное
соответствие эксперимен"
Ta.ТIЬHЫX и расчетных дан..
ных наблюдают в pa IKax 8
u 't-or
ланrмюровскии кинетики. I / А
rОБОрЯ о влиянии ПАВ на 0,5 j .ff:t:
кинетику rетероrенной pe3K r о-
ЦИИ, обычно имеIОТ в виду 0,4 I
б. I IOКИрОВКУ rраницы разде 0.2 I
7Ia фаз, т. е. Уl\1еньшение ак.. 1 О
тивной поверхности. Однако
eCLТIII процесс протекает в
диффузионом режиме, то ДО"
бавки ПАВ вследствие
уменьшения поверхности
"
взаИ?\fодеиствия MorYT смес..
тить реакцию в кинетичес..
!<:ую область. На рис. 46 по..
I(азано влияние серы и фас..
фора на кннеТIIКУ обезуr леро}кивания )!{ПДI{оrо железа в
УСLТIОВИЯХ элеI{трокаПИL'1лярноrо движения металла в ШL1Jа-
ке. 11з рис. 46 следует, что обезуrлероживаlIие развивается
в ДИФФУ3ИОННО 1 режиме, TaI{ как ускорение движения l\1e..
та.плической капли приводит I{ увеличеНИIО значения Kl.
В рамках диФфузионноrо режима небольшие добавки ПАВ
не изменяют характера процесса. Однако чем в, БО Т"lьшеЙ
мере устранено диффузионное сопротивление, тем меньшие
концентраЦИII ПАВ нужны ДЛЯ перевода процесса в I{HHe..
тическую оБЛаСТЬ, которая соответствует линии АВ (Cl\1.
рис. 46). При достаточной скорости движения капли про..
цесс развивается в н:инеТllчеСI{Оl\I ре)киме. Известно, что
скорость абсорбции азота, протекаЮIцая обычно в диффу..
зионном режиме, в присутствии раствореиноrо в метаЛ/Iе
КИСаiJорода по причинам, указанным выше, лимитируется
кинетическим звеном. Во мноrих СЛУIIаях ПАВ пrрают pOLТIb
1.0 х
I
)
х
x и.........
1
I
0,1
f
0,3
s
5
С} с/л
0. ::>
,
Рис. 46. Зависимость константы CKO
рости обезуrпероживания от концент.
рации поверхностно аКТlIВНЫХ веществ
и скорости перемешивания:
J добавки серы, v п -=2,5 м/с: 2 5 дo
баВКJI фосфора при соответственно paB
ноН 2.5; 1,6; 1 и 0,75 м/с
185
не примесных добавок, а Cal\11I ЯВL1ЯЮТСЯ участниками ре..
31{ЦИИ.
Очевидно, что если реаI{цИЯ протекает на rранице раз..
дела фаз, то поверхностные концентрации этих компонен
ТОВ существенно отличаются от объе IНЫХ и кинетика рас..
С 1атриваемых реакций имеет ряд особенностей. PaCC loT"
.
рим реакцию окисления серы, раствореннои в l\1еталле 11.11 н:
шлаке rазообразным кис,лородом. В этом сл)тчае вкинети..
чеСI<ое уравнение следует представлять не объемную, а по-
верхностную !{онцентраЦИIО серы. В рамках модели Ланr...
мюра И 1еем:
dcs/dL == КРО . [(zbcs)/(l + bc s )]. (314)
После интеrрирования ПОЛУЧИ'-1:
]п (cslc ) + ь (c s ) == KP02ZbT,
О
rде Cs............ исходная концентрация серы в расплаве; Р О 2........
парциальное давление кислорода. При малых значениях C
.
]п (cs/c ) + ь (c s c ) == ln C s + bc s .
Линейная зависимость ме:tI{ДУ In Cs + bcs от 't указы-
вает на выполнимость уравнения (314). Если окисление се..
ры происходит в режиме максимальной адсорбции и при
этом диффузионные оrраничения устранены, Т. е. достав..
ка частиц серы из объема на rраницу разде 1а фаз и кис-
лорода не лимитируют процесса в целом, то реакция бу..
дет протекать с постоянной скоростью. При заданном зна..
u
чении Ро, этому соответствует НУ.,1евои порядок реаКЦИll по
сере. Это выполняется, если bcs 1 и правая часть фор..
мулы (314) является ПОСТОЯIIНОЙ величиной. С уменьшени..
ем объемной концентрации до Cs, при котором bcs < 1, на..
блюдается изменение концентрации серы по экспоненци..
альному закону: C s == lPge...... KP o 2 . Таким образом, большие
скорости взаимодействия на rранице раздела фаз ме:tКДУ
компонентами, один из которых является поверхностно..ак"
ТИВIIЫМ, наблюдаются лишь в том случае, коrда диффузи..
онное торможение 1Jибо устранено, либо существенно умень"
шено. В присутствии ПАВ распределение кислорода l\le:tK..
ду различными компонентами определяется химическим
сродством и поверхностной концентрацией [11].
VII.7. КИНЕТ КА О&ЕэуrЛЕРОЖИВАНИА
В практике электросталеплавильноrо производства для
окисления примесей существует два способа подвода окис..
лите,пя. В первом случае }{ислород поступает из шлака,
186
в котором высокая активность кислорода а(РеО) поддержи..
вается добавками }келезной рУДЫ, аrломерата и друrих
u
ОКIIС.J1ителеи, при этом скорость окисления уrлерода состав..
ляет O,5 1,O О/О Сjч; во втором расплав продувают rазо..
образным кис..l0рОДОМ, что обеспечивает Vc==273 О/О С/ч.
l(инетические закономерности обезуrлероживания связаны
с особенностями этой реакции, являющейся мноrостадий-
ной. Лабораторные и промышленные плавк"и свидетельст"
вуют о существовании температурноrо пороrа (1450
1500 ':>С), ниже KOToporo скорость окисления уrлерода рез..
!{о снижается и наблюдается интенсивное окисление железа
расплав переокисляется) . По данным М. я. МеД}I{ибож-
CKoro, соотношение кислорода, расходуемоrо на ОКИС ТIение
уrлерода и железа при 1250 1280°C, составляет 1 : 1, при
1400 ос 4: 1 и при БО 1Jее высокой температуре более
10 : 1. Снижение скорости окисления с понижением темпе-
ратуры связано с уменьшением диффузионноrо потока кис..
1I0poдa (ПО), вследствие уменьшения коэффициента мас..
сопередачи ( o) и уменьшения rрадиента концентрации
([О/О О]пов [О/о 0]06):
ПО == o ([?60]лов [%0)06 == O(La(FeO) [%ОJоб). (315)
Переход кислорода из шлака в металл является эндо
термическим процессом и с понижением температуры по,'1
нота перехода РеО уменьшается, "а следовательно, снижа
ется [0/0 0JnoB, соответствующая равновесию L==[O/o о]пов/
I а(РеО).
Температурный пороr обезуrлероживания наблюдают и
при продувке :Vlеталла rазообрззным кислородом. В от.ПИ
чие от paCCMoTpeHHoro случая здесь растворение I{ИС ТIорода
1/202==[0] является процессом экзотермичеСКИIvr, ПОЭТО!\1У
снижение те 1пературы будет приводить к увеличению
[О/О О]П В, а следовательно, росту rрадиента I{онцентраций.
Одинаковый характер кинетических закономерностей окис..
1Jения уrлерода в обоих случаях позволяет заключить, что
в рассматриваемых УС.:10ВИЯХ коэффициент массопередачи
оказывает более сильное сни}кающее действие на поток
по. Мржно допустить также, что окисление уrлерода в OT
личие от кремния, марrанца, фосфора и друrих шлакооб-
раз)'ющих элементов осуществляется в результате взаимо"
действия с кислородом не Ш 1Jаковой фазы, а pacTBOpeHlIbIl\1
в f\1еталле [95]. Это также объясняет одинаковые заJ{ОНО
мерности окисления при двух способах подвода ОКИС,1И
теля.
Большая скорость обезуr ТIероживания rазообразным
187
кислородом связана с существенным увеличение 1 поверх...
IIocTHoro раздела мета ТItJ1 шлак, так как на поверхности
пузырей образуется пленка (FeO), что объясняет кипение
не только на rранице раздела металл футеровка, но и во
всем объеме.
Важны:t\l вопросом кинетики обезуrлероживания яв Т]я'"
ется установление лимитирующей стадии. Ряд исследовате-
,лей формулируют крайние точки зрения на природу .}lИl\IИ...
тирующей стадии (или диффузия, или химическое звено!).
Вместе с тем закономерности окисления 'СJIедует paCCl\IaT-
ривать в заданных I{OHKpeTHbIX УС.повиях. Достаточно хоро-
шо объясняет эксперимента ТIьные данные теория критиче-
ских концентраций, разработанная с. И. ФИ ТIипповым [167].
При высоких концентрациях уrлерода ([ О/О с] > [О/О С] КР)
процесс обезуrлероживания ЛИ!\'Iитируется диффузией окис-
лителя. При этом наблюдается поверхностное (беспузырь-
ковое) обезуrлероживание. Скорость окисления уrлерода
не зависит от I(онцентрации уrлерода и состава :t\fетаtJ1",lиче-
cKoro расплава. Обезуrлероживание протекает при избыт-
ке реаrирующеrо уrлерода и недостатке кис.порода. ОПЫТ-
u
ные данные хорошо аппроксИ:t\1ИРУЮТСЯ уравнением прямои
линии:
......... d [C]/d't == (llV)(llWPo,) ,
(316)
rде V объем металлической ванны; 1') .......... коэффициент ис-
пользования ОI{ислителя; w скорость потока окислителя;
Ро, парциальное давление кислорода.
С уменьшением концентрации paCTBopeHHoro уrлерода
до значений, меньших, чем [С]кр, закономеР110СТИ ОКИС r}е-
иия существенно изменяется. В этих условиях макроскопи-
u
ческая скорость окисления определяется концентрациеи yr..
"Т"Iepoдa: .
d [C]/dT == К [%С]. (317)
Этот период характеризуется меньшими скоростями
окисления уrлерода, превышением концентрации КИС lОрО"
да в метаЛ ТJе, существенным развитием процесса окисления
же.,1еза. Ниже критической концентрации уrлерода полу-
чает развитие процесс объемноrо обезуrлероживания. Тео..
u
рия критических концентрации ВПО.пне удовлетворительно
описывает и промышленные плавки. Вместе с тем изложен-
ная теория полностью ИСI(лючает стадию химическоrо вза-
u
имодеиствия, в то время как в определенных условиях эта
стадия является лимитирующей [163, 168]. Показано, что
u
роль стадии химичеСI{оrо взаимодеиствия возрастает с
188
у:t\1еньшением концентрации уrлерода, увеличением скоро..
сти подвода окислителя, снижением температуры и добав-
}{ой ПАВ.
VII.8. О&РАЗОВАНИЕ и УДАЛЕНИЕ
r АЗОВЫХ ПУЗЫРЕМ ИЗ ЖИДКОМ СУ ЛИ
в сталеплавильном производстве важную роль иrрают про-
цессы, связанные с образованием, ростом и удаление 1 из
u
жидкоrо металла rазовых пузыреи во время rазовыделения,
обезуrлероживания, продувки жидкоrо металла в печи и в.
ковше и др. Эти процессы получают особое развитие при
вакуумной плавке и обработке жидкоrо металла. Для об-
разования пузыря необходимо соблюдение условия, описы-
BaeMoro формулой (209), из которой следует, что равновес-
u
ныи радиус пузыря
':,> 2а/(Рат + gPM h M +gPm h m ). (31В}
Таким образом, чем больше поверхностное натяжение,
тем больше радиус пузыря при одном и том же равновес-
ном давлении. Известно, что спонтанное rомоrепное за-
u
рождение rазовых пузыреи связано с существенным пере-
сыщением. Развитые соображения лежат в основе общепри-
нятоrо положения, что пузыри rаза MorYT образовываться
по reTeporeHHoMY механизму лишь на rранице разде-
ла фаз. Для пузыря данноrо объема краевой уrол смачи-
вания 8 оцределяет радиус рзвновесноrо зародыша, а сле-
довательно, и раВН'овесное давление внутри пузыря
(рис. 47). Рассмотрим два случая. Если расплав плохо сма-
чивает контактную поверхность (e o), то центрами зарож-
дения пузырей rаза MorYT быть трещины, уrлубления, поры,.
заполнеJjные rазом. Эти полости являются центрами обра-
зования пузырей rаза при обезуrлероживании и деrазации.
Очевидно, что равновесное давление Рсо зависит не ТО"Т]ЬКО
ОТ 8, но и от формы уrлубления. Для радиуса основания
конусообразной трещины R возможные варианты приведе-
ны на рис. 47 [128], из KOToporo следует, что если 8<900,
то пузырь может расти, так как r в процессе увеличения.
объема остается большим r>R/sin 8. В этом случае (при
заданном значении 8) наименьший радиус пузыря опреде-
ляется соотношением r==R/sin е. На с. 108 приведен пример
определения значений R и 8, при которых металл не запол..
няет rазовую полость в футеровке. Если R больше расчет...
Horo, значения, то для Toro, чтобы такие полости моrли
быть постоянными источниками пузырей, необходимо, что ,
189=
бы уrол в вершине конуса при 8<900 не был острый, а за-
кр)rr 1Jенный. Рассмотрим условия роста пузырей. Мини-
Iальное давление внутри пузыря, необходимое для ero су-
ществования, можно найти из услови я p== pgr+ (20/r):
dp/dr ::::; pg (2a/r 2 ) == о; 'min == V2a/pg. (319)
Минимальное даВ"lение PCO(min) В пузыре, образующем-
ся в вакуумной камере непо средственно под зеркалом ме-
та,ТIла, равно Рео == 2 V 20pg. Для стали а== 1400 мДж/м 2 ,
при этом PCO(min) ==0,01 атм, что обеспечивается концентра-
цией кислорода, равной 0,01 О/О при 0,02 О/О [С]. ДЛЯ пузы-
8<900
....... -...
/ OO
.........
... ...........
...............
r= H/sinfl
8>900
к
r> SiпS 4
...............
----- ............... .........
...............................
....................... ..............
............ ................................................
...............
'/ '"
r>R
r=!?
r)H
РIfС. 47. Схема образования пузыреЙ на rранице разде.1Jа жидкость твердое
тело
u
реи азота и водорода соответствующие равновесные кон-
центрации равны 0,04 о/о [N] и 0,0025 О/О [Н]. При равновес-
I1bIX давлениях 0,01 атм радиус пузыря равен 6 ММ. ДЛЯ
Toro чтобы обеспечить интенсивное кипение или rазовыде-
ление, PCO(mln) должно быть бол:ьше. Скорость подъема ra-
v
3080ro пузыря зависит от rидродинамических условии жид..
I{ОЙ ванны, формы пузыря, l\1ассооб Iена между пузырем и
жидкой ванной и др. Мноrие исследователи упрощают кар-
тину, ПрИНИl\1ая, что форма п)тзырей остается шарообраз-
ноЙ, или вводят различные поправки с учетом rрибовидной
формы. Для шарообразных пузырей в жидкой стали, ради..
ус !{ОТОРЫХ превышает 1 l\1M Д.пя ск орост и подъеi\1а V MO}l{..
но пользоваться выражением: V;::::: V4/зrg .
Переход ПУЗЫРЯМli rраницы раздела фаз, например l\1e-
та,7J,l шлаI{, происходит по ДBY 1: механизмам [169]. В пер..
190
ваМ случае переход осуществляется в среду с l\fеньшим зна..
чением О'мф. Такой тип перехода правилен для любых раз-
\1еров частиц (rазовых пузырей). По BTOpOl\1Y механизму
u u
существует некоторыи критическим размер частиц, меньше
KOToporo переход не осуществляется, TaI{ как увеличение
u
поверхностнои энерrии не КО lпенсируется уменьшением
потенциальной энерrии частиц. В сталеплавильной прак"
тике различают поверхностное и донное кипение. В первом
случае пузыри зарождаются на rранице Футеровка мета,,1JЛ
и при своем движении растут как в результате уменьшения
ферростатическоrо давления, так и вследствие реакции,.
протекающей на rранице пузырь металл. При дости)ке-
нии ими поверхности шлак rаз в атмосферу выбрасыва..
ется значительное число металлических корольков. В слу..
чае nOBepXHocTHoro кипения rазовые пузыри, образующиеся
на межфазной rранице 1lетаЛ rJа со шлаКО I, имеют зна..
чительно меньшие размеры. Такой тип кипения не приво..
дит к выносу корольков. Наряду с этим рассмотрим за ко..
номерности, исходя из двух механизмов перехода rраницы
раздела фаз. Пузыри rаза, образующиеся на подине и под-
ходящие к rранице металл шлак с объемом менее КРИТJI"
u u
ческоrо, не MorYT ее переити из..за метаЛЛIiческои пленки
на поверхности. Пузыри с пленкой MorYT перейти только по
второму механизму. Они останавливаются на rранице до
тех пор, пока их объем не достиrнет критическоrо значения.
Это может произойти .В результате протекания реакции на
u
поверхности пузыреи, укрупнения их при слиянии, а также'
вследствие слипания с образованием комплекса ячеистой
структуры.
В случае поверхностноrо кипения вследствие возникно..
u
вения rазовои полости непосредственно на rранице ме..
талл шлак возможно образование пузырей без плеНКII.
Переход таких пузырей соответствует уменьшению свобод"
ной энерrии системы для частиц любоrо размера.
VII.9. МАССОПЕРЕНОС' КОМПОНЕНТОВ В ШЛАКЕ
Соrласно закону Фика, диффузионный поток примеСII B
шлаке определяется ero rрадиентом концентрации. Одна..
КО в реальных условиях (СМ. rл. 11) поведение примеСJI в.
шлаке определяется не только rрадиентом концентрации,
но и rрадиентом окисленности расплава оксидов. Суммар..
u .
ныи поток l-Toro компонента опреде 7Jяется соотошение f
( dlnci "; dlnpo ) 3
П, == КВ, RTc, dx + 4 + dx. ' ( 20)
191
тде Bi подвижность диффундирующих частиц; 'Vi ва-
лентность.
Из уравнения (320) МО}I{НО леrко получить два предель..
ных с.пучая. Первый соответствует равномерной окислен..
НОСТИ (d lnpos/dx==O) И ПРИВОДИТ J{ закону Фика. BTOPO
случай рассмотрим на примере переноса азота через слои
раСП&lТIавленноrо шлака. Пусть два rазовых объема разде..
лены пленкой шлака ТО lIЩИНОЙ tlq== 1. В rазовых объемах
u
поддерживаются постоянныи перепад парциальных давле-
НIIЙ азота PN. ==const (например при разбавлении инерт-
ным rазом) и одинаковое давление I{ислорода. Перепишем
u
-уравнение Фика, за lенив ПрОIIЗ80ДНУЮ конечнои разнос-
.-тью:
П(N) == DN /).C N == DN (C c ). (321)
Но соrласно уравнению (148), C(N) зависит от Ро.: C(N) ==
К 1/2 "N/4 С П ........ D /4 1,2 Та
PN. РО.. ледовате.ПЬНО, (N)........ (N) РО. PN. · ..
:КИr\1 образом, если при L\pN1==const изменять РО. (сохра..
.няя ero одинаковым в обоих объемах), будет также изме..
няться проницаемость шлаковоrо слоя по отношению к азоту.
Так, в условиях сталеплавильных процессов проницае..
мость слоев шлака, омываемых печной атмосферой (Ро.
1 1 атм) в 106 раз ниже, чем слоев, контактирующих с
l\1еталлом (p 10 9 атм), поэтому диффузионное сопротив-
&ТIение оказывается сосредоточенным в тонком поверхноет..
HOl\1 слое шлака. Ана 10rичные ВЫВОДЫ можно сделать и по
отношению к друrим Э.пементам. При этом характер влия-
ния РО. на проницаемость шлака определяется значением
11 знаком валентности раССlvlатриваеrvfоrо элемента 'Vi поэто-
.МУ, например, для водорода (VH==<+l) наблюдается обрат-
ная картина: перенос лимитируют слои, прилеrающие к ме..
таллу.
Для сталеплавильной праI{ТИКИ важное значение Иl\;lе-
'ет взаимодействие потоков компонентов в шлаке, обус..
..ТI08.1eHHoe rрадиентами концентрации и окисленности. На-
u
ПрlI fер, в УСLТIОВИЯХ открытои плавки существует непре-
рывный поток !{ислорода из атмосферы к rранице раздела
u
1еталл шлак, которыи с)тществепно влияет на поведе..
ние примесей в шлаI<е. IСПОJIЬЗУЯ методы термодинамики
необратимых процессав, заПIIше t выражения для потоков
кислорода ПО и азота П N в расплаве оксидов: ПО ===
===Ll,ldJ.1o+Ll,2dJlN; ПN===L2,ldllо L2,2dJlN, rде JlO и J!N
rрадиенты химических потенциалов кислорода и азота.
П)ТСТЬ шлак вначале равномерно насыщен азотом, Т. е.
'192
df.1o ==0. Тоrда при наличии потока кислорода возникает по-
ТОК азота П N == (L2,t/Lt,t) по. Этот поток приведет к воз-
никновению rрадиента химичеСI{оrо потенциала азота, ко-
торый противодействует породившему ero потоку nN. При
некотором предельном значении d поток азота прекра...
тится (ПN==О) И будет достиrнуто стационарное состоя..
вне. Таким образом, если в шлаке существуют только два
потока азота и кислорода, выполняется соотношение
ПN/ПО=== 3/2; dJ.to/dJ!N ===3/2. Из этих соотношений следу-
ет, что поток азота направлен навстречу инициирующему
u
ero потоку кислорода, а создаваемыи при этом rрадиент
химическоrо потенциала азота совпадает по знаку с rpa-
диентом химическоrо потенциала кислорода. Следователь-
но, система работает как насос, создавая перепад хими-
ческоrо потенциала азота. Обобщая эти результаты, мож-
но записать:
пt/п о == 'Vl/'V O ; dJ10/d(!i == 'Vi/V o . (322)
Из соотношений (322) следует, что направление пото-
ка примеси и знак возникающих при этом rрадиентов J,.ti
определяются законом валентности. Например, поток во-
дорода (VH ==.+ 1) в отличие от потока азота совпадает по
направлеНИIО с потоком кислорода. Рассмотрим действие
азотноrо «насоса» на конкретном примере. Известно, что
шлак, контактирующий с ,печной атмосферой (р==
== 10132,5 Па) практически не растворяет азота. Находя-
щиеся в контакте с металлом слои шлака раскислены
([O] O,l О/о; POa 10,13.10 Па) и растворяют заметное ко...
личество азота.
При конвективном движении отдельные порции шлака
попеременно оказываются с областях с пониженной и по-
вышенной окисленностью, поrлощая азот вблизи металла
и выбрасывая ero в атмосферу. Перемешивание шлака иr-
рает активную роль в работе азотноrо «насоса», резко по-
вышая ero производительность. Однако II в отсутствие пе-
ремешивания эффект «накачки» должен существовать и
подчиняться тем же закономерностям Из. сказанноrо сле..
дует, что фактическая стационарная концентрация азота в
u
металле всеrда ниже, а водорода выше равновеснои с печ..
ной атмосферой. В пределе это отклонение может дости"
raTb значительных величин:
INJ max == [NJ p (p . 7P !) == [NJ p -10----6;
[Н]mах == (Н]р (10 9/10 1)1/4 == [Н]р-l0 2 .
(323)
(324)
13 675
193
Рассмотренные закономерности подтверждаются прак...
тикой содержание водорода в металле открытых печей
либо близко к равновесию, либо превышает ero. Содержа...
ние азота более чем в 10 раз ниже paBHoBecHoro даже в ду...
rOBbIx электропечах, rде происходит интенсивное насыще...
ние металла азотом в области дуr. В процессе выдержки
под шлаком содержание водорода в металле уве.пичивает...
ся, а содержание азота снижается. Перемешивание резко
ускоряет поступление водорода и удаление азота.
r n а в а VIII
ОСО&ЕННОСТИ РАФИНИРОВАНИЯ МЕТАЛЛА
ПРИ ПЕРЕПЛАВНЫХ ПРОЦЕССАХ
еталл oTBeTCTBeHHoro назначения после выплавки и раз
ливки подверrается еще одному металлурrическому пере-
делу переплаву в специальных плавильных arperaT8x.
В настоящее время в промышленных масштабах применя-
u ..
ются следующие методы переплава: вакуумныи дуrовои
(ВДП), электрошлаковый (ЭШП), электроннолучевой
(ЭЛП) и плазменно-дуrовой (ПДП). Разрабатывается и ос-
ваивается вакуумно-плазменно-дуrовой переплав (БПДП).
ОСНОВНОЙ задачей каждоrо из этих процессов является по-
выIениеe качества металла, улучшение ero служебных ха-
ра!<теристик. Для этоrо необходимо выполнение следующих
требований: 1) удаление из металла вредных или нежела..
тельных примесей в результате создания развитой контаК1
НОЙ поверхности металла с рафинирующей средой (разре-
женный rаз, инертный rаз, шлак); в некоторых случаях, Ha
пример при ПДП, наряду с удалением примесей возможно
леrирование металла компонентами рафинирующей среды
(например, азотом); 2) создание блаrоприятных' условий
для кристаллизации металла при ero наплавлении в мед-
ном водоохлаждаемом кристаллизаторе. Процессы рафИНl'f-
рования наряду с особенностями, характерными для каж..
Доrо метода переплава, имеlОТ ряд общих закономерностей,
связанных, в частности, с кинетикой рафинирования.
VIII.t. О&ЩИЕ ЗАКОНОМЕРНОСТИ
РАФИНИРОВАНИJl МЕТАЛЛА ПРИ ПЕРЕПЛАВЕ
Кинетическим закономерностям процесса рафинирования
металла при переплавных процессах посвящен ряд работ
[171 173, 229]. Характерной чертой всех переплавных про..
цессов является мноrостадийность процессов рафинирова..
u
ния, которые происходят на торце оплавляемои эаrотовки,
в каплях металла, проходящих рафинирующую фазу, и в
ванне металла. При анализе процессов рафинирования
удобно использовать в качестве характеристик режима мас..
u
совую скорость плавки g линеиные скорости оплавления
электрода v э и наплавления слитка vo. Между этими ве..
личинами имеют место следующие соотношения:
V o == g/(FcJJP) == g/(nR p); v з == g/(Fэр) ==
== g/(nr p); V o == (d2.v э )fD2 t (325)
r де F СЛ, F э ........ площади поперечных сечений слитка и элек..
трода; RCJI' 'э радиусы слитка и электрода; D, d диа...
метры слитка и электрода; р ........... плотность металла.
Площадь поверхности рафинирования на стадии элек..
трода (8) может ОТЛliчаться от площади F э в связи с тем,
что поверхность торца электрода может иметь форму ко..
нуса, полусферы и т. п. В этом случае S>F з , и можно при..
нять S===mF э , rде m l. Кроме мноrостадийности, пере..
u
плавные процессы характеризуются существеннои неизо..
термичностью. Во первых, MorYT значительно различаться
по температуре различные стадии процесса. BO BTOPыx, в
пределах одной стадии обычно IIMeeT место неравномерный
переrрев поверхности рафинирования. Имеются участки
локальноrо BblcoKoro переrрева (фокальные и электродные
пятна). В связи с этим все расчеты для определенной 'ста...
дии процесса проводят обычно для какой"то средней ха..
рактерной температуры. В"третьих, как правило, наблюда...
ется cYLЦecTBeHHoe различие температур поверхности вза-
имодействия металла с рафинирующей фазой и самой
рафинирующей фазы. Все это необходимо учитывать при
pac eTax. Анализ процесса удаления примесей полезно про-
водить на основании балансовых уравнений на каждой ста-
дии переплавноrо процесса. При этом необходимо учиты..
вать порядок реакции лимитирующеrо звена. Удаление ис-
паряющихся цветных примесей лимитируется в любом
случае реакцией первоrо порядка (стадиями BHYTpeHHero
массопереноса, испарения или внешнеrо массопереноса) .
13.
195
Вместе с тем в общем случае процесс удаления rазооб-
разных примесей (азота и водорода) может ЛI-Iмитировать-
ся реакциями как nepBoro так и BToporo порядков. Балан-
совое уравнение на i-той стадии процесса в этом общем
случае имеет вид:
dc.
M i l == gCOi -....... gCi
d1:
(a i К 1 К 2 pSi) с;л
+
Кl + К 2 С iп
rде k1 i масса жидкоrо металла; С О; исходное содер-
жание примеси на данной стадии; С; текущее (конечное)
u
содержание примеси на даннои стадии; Сiп содержание
примеси на поверхности металла, равновесное с рафини-
рующей фазой; r.J.,i ДОЛЯ площади поверхности металла,
незаблокированная fIAB; Кl, К2 константы скорости
процесс а реакции nepBoro и BToporo. порядка. При Kl :
K2Ci процесс лимитируется реакцией nepBoro порядка,
при K2Ci Kl реакцией BToporo порядка, то есть при
. прочих равных условиях вопрос о лимитирующем зве
1Ie определяется содержанием примеси в металле на дaH
ной стадии. При этом, если условия в среднем соответству-
ют некоторому переходному состоянию, коrда Кl K2Ci, ТО
u u
не исключено, что при переходе от одном стадии к друrои
порядок реакции изменится с первоrо на второй. Измене
ние произойдет при Ci==KI/K 2 , и это содержание является
критической массовой долей примеси. В. В. Авериным
[107] для азота установлена при 1873 К зависимость [N]KP
ОТ PN J И показано, что в вакууме npI! PN z ---+0 В железе
[N]KP O,05 о/о. Хотя определенное в работе [230] значение
(N]KP и представляется слишком высоким из за принятоrо
в ра четах очень BbIcoKoro ,значения коэффициента Macco
переноса ==KI ==3,5.10 4 м/с, однако роль химическоrо
звена при удалении азота в вакууме может быть сущест"
венноЙ. ОсобеНIIО это относится к металлу с повышенной
чистотой по азоту (выплавленному в ВИП и подверrаемо-
МУ ВДП 11 ЭЛП И Т. п.). Решение уравнения (326) в об..
щем Биде достаточно сложно для наrлядноrо анализа, и
к нему следует прибеrать только для условий переходноrо
режима. Если известен преобладающий характер реакции,
то для установившеrося режима переплава при dCi/d't==O
можно пользоваться упрощенными выражениями. Обозна
u
чая линеиную скорость оплавления или наплавления на
u
даВIIОИ стадии через Vi, получим: для реакции nepBoro по..
(a i К 1 К 2 pSi) C i
К 1 + К 2 с i
+
t
(326)
196
рядка, коrда Kl K2Ci
С; ==(COi+ miК iаiСiП )/(l+ m i : 1 a i ). (327)
Д.ПЯ реаКЦИII BToporo порядка, коrда K2Ci Kl
/ 2
1 Vi + Vi Coi + 2 Vi
с. С ·
1 4т2 К 2 ,..,2 т. К 2 а. iп 2т. К 2 а.
l 2 \Ni 1 1 1 1
Наиболее часто используют трехстадийные переплав-
ные процессы, включающие стадии: 1) жидкая пленка на
торце оплавляемой заrотовки (элеI{трода); 2) падающие
капли; 3) ванна жидкоrо металла. Возможны процессы с
большим числом стадий и с использованием промежуточ-
ных емкостей, холодноrо пода и т. п. При раСС 10трении
всех этих процессов для упрощения анализа необходимо
исключить из рассмотрения вторую стадию (падающих Ka
пель) вследствие незначительност степени рафинирова
u
ния металла на этои стадии.
Для примера рассмотрим простейший случай, коrда
, U
процесс лимитирует реакция первоrо порядка, а величинои
Сiп можно пренебречь. Тоrда на стадии капли имеем для
установившеrося режима:
C.iO == Ci g+ Kl Р; рс, ИЛИ Ci == cio/[l +(Kl Р; Р)/ g], (329)
rде Р; суммарная поверхность всех одновременно суще-
ствующих и падающих капель, число которых будет n.
,При радиусе капли RK имеем Р; ===4nnR . При про-
должительности падения t'пад С высоты L всеrда одновре-
менно существует n капель:
n == (g'tпаJ/(4/зпR Р) === [(3g)/(4nR p)J V2Llg o ,
rде go ускорение свободноrо пад ения.
Отсюда C l == сiO/Р + (3K 1 /R K ) V 2LlgJ, а степень рафи-
нирования (.0/0):
ro === (Cio........ С,) .100 == 100 /[ 1 + ( Rп ) .. / ео ] .
O ЗК 1 V 2L
Оценим радиус капли. Примем, что в момент ее отрыва
радиус шейки равен среднему радиусу капли RK. Отрыв
происходит, коrда сила тяжести капли превышает силы
межфазноrо натяжения в шейке 11 выталкивания капли из
u
окружающеи среды:
4/ззtR gо(р Рср);, 2пR И О'Мфt
(328)
(330)
(331 )
(332)
197
rJte Рср плотность окружающей среды; О'мф межфазное
натяжение на rранице капли с окружающей средой (для
вакуума О"мф совпадает с поверхностным натяжением Me
талла). Отсюда
RR> V3cr м ф/[2g 0 (р Рср)l. (333)
в условиях вакуума для железа при (Jмф=== ],7 Дж/м 2
и р===6900 Kr/M 3 получаем RK 6 мм. При этом значении
RK и L===2 см, а К 1 ==O,Ol O,1 мм/с получим (й===O,03
o,3 о/о, т. е. стадией капель при расчетах можно пренебречь.
Тоrда для лимитирующей реакции первоrо порядка с уче
том стадии пленки и ванны, 'считая для ванны m=== 1, име
ем:
Св ==
СО + [тК пл а пл спл.п)/uэл + (КВ а в Св.п)/U о . (334)
( 1 + тКпла пл )( 1 + Ква в ) ( 1 + Ква в )
V эл V o V o ,
Индексы «пл» и «в» относятся соответственно к пленке
на торце электрода и к ванне, а индекс «п» относится К
процессам на поверхности металла. В практических расче
тах часто пренебреrают величинами Сп .п и с в . п . Кроме TO
ro, как правило, (mКпл fXпл)/v эл < 1 и KB(:J.,B/VO< 1. В этом
случае можно воспользоваться подстановкой l.+x ex при
х< 1, и получить выражение:
In со/св == (1/v o )[K B а в + К пл а пл т (d 2 /D2)]. (335)
Выражением (335) часто пользуются в литературе, объ-
единяя для простоты выражение в скобках в одну KOHCTaH
ту. Наряду с этим используется и упрощенный вариант
формулы (334):
Св со j[ (1 + тК::ла пл )( 1 + кво: в )]. (336)
в этом случае степень рафинирования металла от при-
меси не зависит от ее исходной массовой доли со, о/о: .
ro == ( СО Св ) о 100 == { 1
[( 1 + тК::ла пл )( 1 + К:;В )] 1 }о100.
Независимость о) от со является в данном случае приз
IIаком первоrо порядка реакции лимитирующеrо звена. Аб-
u
солютное снижение массовои доли примеси в этом случае
198
тк :лаПJI )( 1 + К::в )] 1} .
(337)
Т. е. при построении зависимости tlC от со вида c Kco
для реакции первоrо порядка всеrда К < 1. Если процесс
u
ТIимитируется реакциеи BToporo порядка, также существу..
ют упрощенные выражения для расчетов. Допустим, что
u
для каждои стадии различие между величинами со и с не..
велико, а величиной Cin можно пренебречь. Тоrда для не..
установившеrося процесса балансовое уравнение примет
вид:
M i (dci/a't) ai K i Si PC .
имеет вид:
fj,c == CO CB == GJ {1 [( 1 +
(338)
Интеrрируя от 't O дО 't 't И от со до С пл , получим, счи..
тая Мпл/Sп;лР't Vэ;лlm:
1 1 тК ил апл .
,
Спл
СО
V эл
С пл == СО /( 1 + тК:::ПJIС О ).
(339)
Аналоrично для стадии ванны
1 1 КВ а в
.
,
.св Спл V o
Отсюда в конечном результате
1 1 == тКппа пл + Ква в
.св Со V эл Vo
v (Кв а в +тКпла пл : );
СВ . СО /[1 + (КВ а в + тКпла пл : со )/V o ].
В этом случае
C == (аС6)1 (1 + аСа)'
rде а=== (l/vo) [Квсхв+Кплm СХпл (d 2 /D2)].
При aco l имеем ДC ас6, а при асо> 1 имеем C
co (l/a), т. е. если зависимость c от СО в определен..
ном интервале значений со описывается выражением c===
===К (Co C'), rде К 1, то это свидетельствует о том, что
процесс лимитируется реакцией BToporo порядка. Наличие
в этом выражении члена с' === l/а не следует рассматривать
как некое блокирование реакционной поверхности. По при..
......
св == С пл / (1 +
КВ а в Спп
Vo
) . (340)
(341 )
(342)
(343)
199
u
роде своеи, как следует из приведенных выше расчетов,
этот член не связан с содержанием примеси в поверхност..
ных СJ10ЯХ lеталла. Степень рафинирования при лимити..
u
рующеи реакции BToporo порядка существенно зависит от
исходной массовой доли примеси О/о:
(о == (dC/C o ) .100 == [(асо)/(l + aQo)] .100. (344)
Таким образом, характер зависимости 6.с и (J) от СО оп..
и
ределенныи экспериментально, позволяет судить опоряд..
ке лимитирующей реакции. Во всех упрощенных расчетах
веЛIIЧИНОЙ Сiп пренебреrали. Однако в процессах, в кото..
рых имеет место дуrовой разряд (ВДП, ПДП, I3ПДП), He
обходимо учитывать наличие на поверхности металла так
называемых особых зон возможноrо контакта металла с
плазмой дуrовоrо разряда. Если локальное поверхностное
содержание примеси в особой зоне составляет C , а вне
" ' 11
ЗОНЫ Сп, то расчетное значение сп==nсп +..(I n)сп (n дo..
", ,
ля площади особой зоны). Обычно Сп<С п и СП nсп.
Особенностью процессов, идущих с использованием ду..
rOBoro разряда, является высокая степень их I-Iеизотермич..
ности. Степень диссоциации двухатомных rазов в этих про..
цессах, а следовательно, и состав rазовой атмосферы оп..
ределяется температурой столба дуrи. Процесс поrлоще..
ния (или выделения) rаза из мета 1ла идет при температу..
ре металла, которая существенноо ниже температуры стол..
ба дуrи. При ПДП температура плазмы в столбе .сущест"
венно выше даже температур катодноrо и анодноrо пятен
на поверхности металла. При ВДП дуrа rорит в парах ме..
и
талла, и температура ионов и неитральных частиц в уело..
u
виях вакуума определяется тем.пературои испаряющих по..
u и
верхностеи, т. е. температуром катодных и анодных пятен
(Т к и Т а). Для железа и никеля ориентировочно MO)l(HO при..
нимать при ВДП Т к ==Т л +175Ки Т а ==Т л +400К (Тл тем"
пература ликвидуса). Соответствующие температуры име..
ЮТ место в прикатодных и прианодных частях столба дуrо..
Boro разряда. Состав rазовой фазы, !{онтактирующей непос..
редственно с металлом, определяется на основании оценки
критерия Дамкелера: Ое === К/ (р2[)2) ==Тх/Т д , rде р дaB
ление; б расстояние, которое ДОJIЖНЫ пройти частицы
rаза; 'СХ продолжительность химичеСI{оrо акта рекомби..
нации атомов в молекулу; Т д продолжительность про..
,хождения расстояния 6; К коэффицие т, равный 108 Х
ХПаЗ.м2(lО 3 атм З .см 2 ).
При Oe 1 атомарные rз.'3Ы достиrают поверхности ме..
200
талла, не успевая рекомбинировать. В случае ПДП при
р== 1 атм (0,1 МПа) и 6===2 см, De===2,5. 10 4 1, в случае
ВДП при р=== 1 Па и 6===2 см, Dе===2,5. 1011 1.
Исходя из оценки значения Ое при ПДП В. и. Лаком
ский [173] считает наиболее вероятным контакт металла
при ПДП не с атомами азота, а с ero возбужденными !vIO
.
лекулами N 2. Дополнительная энерrия возбуждения этих
.
молекул G в по ,оценке В. I. Лакомскоrо состаВ.Jlяет
898 кДж/моль: {N; }=={N 2 }, aO== 898 кДж/моль. Отсю
.
да для реакции 1/2 {N 2 }==[N]п в железе имеем
IgK ==]g {fN [% NlП/(Р 2)1/2} === (2264/Т) + 1,16. (345)
Для ВДП De 1 и металл контактирует с rазовой фа..
зой, имеющей состав плазмы столба. В зоне катодных и
u
анодноrо пятен процесс взаимодеиствия металла и rаза
при ВДП протекает при равенстве их те lператур. Неизо..
термичность возможна Прll различии температур особых
u u
зон и остаЛЬНОII реаrирующеи поверхности.
В связи с этим в зонах катодных и анодноrо пятен
[0/0 r]== (Kr/fr) V , rде Kr и fr определяются при темпе..
ратуре соответствующеrо пятна. Однако площадь сечения
столба дуrи в вакууме значительно больше площади анод..
Horo пятна и общей площади мноrочисленных катодных
пятен. Отсюда при De 1 имеет место вероятность подхо..
да rаза плазмы к холодному металлу вне площади элек..
ТРОДНЫХ пятен. В этом случае процесс поrлощения (И,,11И
удаления) rаза неизотермичен. Водород и азот в rазовой
фазе диссоциирует по реакциям: {Н2}===2{Н}, OO==434080
98,OT Дж/моль; {N 2 } == 2{N},dGO === 946000 115,OT Д>.('
. /MOilb. Константа диссоциации Ка ===P;/Pr ' для водорода
J
1 g Ка ( 22700/T) + 5, 11, для азота 19 Ка === ( 49400/T) ;...
+ 6,00. При общем давлении aTOMapHoro и молеКУJIЯРНОI о
rазов PJ:.r. === Pr+Pr J И' степе ни ДIIССQциации а имеем:
а =-= lfV 1 + ( 4P :r.r./ K a) ; (346)
Pr. == [P:r.r.(l a)]/(l + а); Pr =-= (2P:r.r. a)/(l +а). (347)
парциалыIеe давл ение aToMapHo ro rаза составляет:
Pr =- 2P:r.r.f[ 1 + 1/ 1 + (4P1:r/ Ка) ·
При Т===2000 К для водорода Ka==5,76.10 7 aTl\I, Д.tlя
азота Ka==2,0.10 19 атм. При p Ha===1 Ila (1.1(r5 атм) и
Р N2===О,1+1,ОПа (1.10 e I.10 5aT I) имеем 4p'J:,r 2 /Ka l.
-
201
в ЭТИХ УСЛОВИЯХР r V KaP1:.r. V KaPr. · Тоrда п о peaK
ции {r}==[r] имеем [%rJ == (Kr/f r ) Pr (Kr!f r ) V KaP r .,
rде Kr и fr определяются при температуре металла, а
Ка ......... при температуре соответствующей зоны сто ба ,nуrи,
7. е. при Т к для катода и Та для анода. Для железа 19K н==
19 (fH[O/o Н]/РН) == (9750/T) 4,28; 19 KN ==lg(fN[%N]/
/PN) == (24155IT) 4,065. Для никеля 19 Кн== (10380/T)
4,45; 19 KN (21000/Т) 3,960. При Т мет == 1773 К и
Т плаз ==2000 К, рн.==2,5 Па (2,5.10 5 атм) и PN.== 1 Па (lX
Х 10 5aTM) в ЧИСТQМ железе имеем [О/оН]п==6,2.10 5 о/о;
{0/оN]п==0,017 о/о. Соответственно в никеле [О/оН]п==l,ОХ
Х lO 4 о/о; [0/оN]п==I,3.10 4 о/о. Такие значения [r]п MorYT
оказывать определенное влияние на кинетику процесса
при существенных значениях доли площади контакта n.
Величина п при одной и той же линейной плотности тока
j==I/D уменьшается с ростом D так как п-==//(iF), rде
i плотность тока в столбе дуrи; F площадь поверхности
металла на соответствующей стадии процесса. На промыш"
JIeHHbIX установках влиянием Сiп в кинетических расчетах
можно пренебречь.
Однако местные, локальные перенасыщения металла
азотом при содержании в металле нитридообразующих
элементов M9rYT приводить к образованию нитридных пле..
иок на поверхности металла в особой зоне. Если эта плен..
ка при перемеlЦении особой зоны по поверхности металла
не успевает диссоциировать, она может вместе с каплями
.металла перейти в ванну и, достиrнув фронта кристалли..
,зации, стать причиной образования нитридных скоплений
1J металле.
VIII.2. РАФИНИРОВАНИЕ МЕТАлпА ПРИ ВДП
Температурный режим процесса вдп
ля оценки среднеrо переrрева металла пленки на торце
электрода над температурой ликсидуса ( ТЭ) можно ис
пользовать следующее выражеНlfе:
АТ э -----:= (Т лин 273) 6v э 1 + 1 /1 + 16<10 ВИР а (Т oJI T ) "
2а C p dv 2 ( Т......... Т )
э с ол с т
rде Т лик , Т сол температуры ликсидуса и солидуса; б
средняя толщина жидкой пленки; а коэффициент темпе..
-202
ратуропроводности металла; С удельная теплоемкость
метаЛlла при Т соп ; р плотность металла при т еол ; Впр.......
приведенная степень черноты в системе электрод стенка
кристаллизатора (корона слитка); Тет температура стен-
ки кристаллизатора (короны слитка); 0'0 постоянная Сте..
фана Больцмана. Величину б можно оценить по фор..
муле:
б == V O'M/(6pgo), (348)
rде р плотность жидкоrо металла; а м поверхностное
натяжение металла при Т лик; go ускорение свободноrо
падения. Среднее значение {, составляет I,O I,5 мм, а зна..
чения дТ э находятся в пределах 20 50 К в зависимости
от режима процесса.
В зонах каплеобразования толщина пленки примерно в
два раза больше б, а температура переrрева также в два
раза больше ТЗ. Средняя скорость течения металла в
пленке и==36 v э . Ч исло центров каплеобразования n==
==n[raV / (pgo)/(24crM) 1]. Коэффициент массопереноса при..
меси в пленке определяется по формуле:
пл === ,/ D i vэ ,/- r э .. / - pgo .
r э 2п бом
(349)
Коэффициент массопереноса примеси в зоне каплеобразо..
вания составляет:
А .. I D i V Э pgo ]1 ' брgо
t'R. rэ V ·
ом n ом
Для поверхности зеркала жидкой ванны среднюю сте..
u
лень переrрева над температурои ликвидуса можно оце-
нить п'о формуле:
T ПОII == Tlnax [1 (а bD + CD2)/ [],
(350)
(351 )
тде дТ тах теоретически максltмально возможная сте..
пень переrрева металла: 1 ток переплава.
Величины T тах, а, Ь, с являются функциями свойств
переплавляемоrо металла, величин d, D и длины межэлек-
'Тродноrо промежутка L. ДЛЯ сталей при L 20 мм, D ==
== 100+ 1000 мм и d/D==O,7+0,85 можно принимать
дТ mах==485 К, а== 1000 А, Ь==2500 А/м, с== 15100 А/м 2 .
Степень neperpeBa металла cyrцecTBeHHo зависит ОТ OTHO
шения d/D. При малых отношениях d/D ве&lIИКИ потери теп..
203
ла на и:злучение и испарение с поверхности ванны, при
больших значениях d/D эти потери снижаlОТСЯ, но паяв..
ляется утечка тока на стенку кристаллизатора, поэтому су..
lЦecTByeT определенное значение djD, при котором темпе
ратура ванны при данном токе максимальна. Температу
ра снижается при удалении от поверхности в rлубь ванны
[174] (рис. 48, с. 216). При отсутствии электромаrнитных
u
полеи средняя скорость движения металла в ванне, вызван
Horo падением в ванну капель мета,,1Jла, составляет u==
8а/Rсл (а эффективная температуропроводность ме..
талла). Коэффициент массопереноса примеси в ванне прР'
центральном пад ении ка пель составляет:
Рв == (4/R cп ) V(2аD,)/л:. (352)
При падении капель на расст оянии r от центра ванны
Рв == (4/R cп ) [1 + (2r/R cп )1 V(2аD i )/л:. (353)
Удаление водорода
При оптимальных режимах процесса вдп наблюдается
значительное удаJiение водорода из металла. При перепла..
ве сплавов на никелевой основе удаляется 80 90 о/о, а при
переплаве коррозионностойких сталей 70 80o/0 водорода.
При реакции BToporo порядка константа скорости процее..
са удале.ния водорода опр еделяется по формуле, м/ (с. о/о Н) :
К [1013f .I(pK .)] V Ми. 1(2:rr.RT), (354)
rде Кн. ......... константа в формуле [%Н] == ( К 1 , ) V р при
Н. н Н.
РН., атм; Р плотность жидкоrо металла.
Оценим критическую концентрацию водорода в чистом
железе и в стали типа 12Х18НI0Т дЛЯ условий пле ки и
зоны каплеобразования на электроде при Т== 1773 К При
р===7 rjcM 3 имеем для железа К==217 Mj(c.O/o), а для
стали 12Х18НI0Т K 176 М! (с. о/о). в железе пл ==
81 ,4 мкм/с в каплях при d==20 см и 'n===9 I\===O,33 M1vf/C.
Соответственно в стали 12X18HI0T пл==О,325 мм/с и
H=== 1,31 мм/с. Отсюда в железе [Н]}(р===З,8.10 7 1,5Х
ХI0 БО/0, или 4,2.10 З 1,7.10 2 см З /I00 r. В стали
12Х1810Т соответственно '[Н]КР== 1,85. 10 6 7,5. 10 6 о/о,
или 2,1. lO 2 8,4. 10 2 см З /I00 r. Из этоrо следует, что ли..
митирующим звеном при реально существующих концент..
рациях водорода должен быть внутренний массоперенос.
Для небольших лабораторных и полупромыш.пенных
установок необходимо учитывать влияние на кинетику
, u
процесса поверхностных концентрации водорода в особых
204
зонах. В работе [175] установлена экстремальная зависи
масть степени удаления водорода от отношения d/D для
коррозионностойких сталей при D 125+ 150 ММ. Прll ма..
ЛЫХ значениях d/D<О,б велики потери тепла ванной в
результате излучения и испарения, малы степень переrре..
ва зеркала ванны и константа. скорости процесса. При
d/D>O,6 мала пропускная способность зазора между элек
тродом и кристаллизатором, водород плохо откачивается
u
ИЗ зоны плавления, в неи растут Рн. и поверхностные мас-
совые ДОЛИ [Н] плоп, ТН] воп. Это должно ухудшать условия
рафинирования. Однако на крупных промышленных печах
проведение процесса при d/D O,8070,83 обеспеЧIIвает
хорошее удаление водорода. Это объясняется тем, что роль
процесса откачки на малых и крупных печах различна.
Поток удаляемой примеси (rаза) при лимитирующей ре..
u
акции BToporo порядка для мноrостадииноrо процесса co
ставляет:
i k l k
П == ар KiFici ap КiFiС;пn;'
i 1 i l
Величина Сiп определяется по формуле:Сiп == K ri 1/ Kai Pr J ,
rде Рr.===(ПVр,РОТ)/(М('J-S:rJ-298); Vр, молярный объ
еТ\1; Ро атмосферное давление; М ('1 молекулярная Mac
са; Sr. скорость откачки rаза [2 из зоны плавки. Таким
образом величина Сiп является функцией П как и П явля"
ется функцией Сiп. Отсюда
i==k
aS r2 K i F i с;п
i==1
i==k
S + aV м Ро рТ К о F к 2 о К n
. r 2 Mr 2 .298 t i rt аЕ t
i==1
(355)
п==
.
(356)
Характер зависимости П от S ('. зависит от соотношения
ме)кду S r 2 И величиной
l==k
А == (aVp.popT)/(M r . .298) KEPEк:.EKaEn;'
i==1
При плавке у устья кристаллизатора (ЭЛП, конечная CTa
l k
дия ВДП) S.r2 A И П а KiFiCi, т. е. не зависит от Sr.8
i==1
При плавке в rлубине кристаллизатора (ВДП) соотно"
205
шение между S r И А зависит от пi. На малых печах при
· I==k
Sr.<A в rлубине кристаллизатораП (a.Sr/A) K i F i с;.
1==1
Поскольку n; уменьшается с увеличением D, то зависи..
мость П от п; на печах с диаметром кристаллизатора
D>200 мм практически отсутствует. В. связи с этим пред...
ставляет интерес определение значения Pr. В различных
участках зоны плавления. При этом определении необхо..
v
димо учитывать rаэопоrлотительное деиствие паровоrо
конденсата на стенках кристаллизатора. В обuцем случае
S + UнрUпSо
НОН S
U нр 8 0 +U п о+UнрU п
80 Икр U П 80
+
U пр UПР(UНРuП+URР80........uп80)
rде 50 быстрота действия BaKYYMHoro насоса; SKOH
быстрота поrлощения rаза [ 2 конденсатом; ИИ, U пр про
пускная способность вакуумной системы печи, зазора ме)к...
ду кристаллизатором и электродом и подэлектродноrо про..
.
межутка.
Вопрос о влиянии Sr. на давление в зоне плавления из
всех переплавных процессов актуален только дЛЯ ВДП
Tal{ как при ЭЛП отсутствует дуrовой разряд, а при
ВПДП, как при ЭЛП, процесс идет у устья кристалли
затора. По аналоrии с испарительно rеттерными Hacoca!vtlf
Sr ==
J
1+
,
(357)
SROH == зtq> V (RT)/(2nM r2 ) DhнoH'
rде h ион высота конденсата; коэффициент прилипа..
ния. В reTTepHbIx насосах коэффициент прилипания харак'"
u
теризует вероятность захвата молеI{УЛЫ rаза пленкои reT
тера при соударении. По смыслу (j) 1. В условиях плавки
в медном водоохлаждаемом кристаллизаторе при темпе
ратуре конденсата 500 К для азота <р N. 0,38, для СО
(f)co 0,59, для водорода q> Н. """ 0,02, т. е. поr лощением BO
дорода можно пренебречь.
Обычно величины So и И П велики по сравнению с oc
тальными и не лимитируют процесса. Если торец электро
да имеет вид конуса (полусферы), то И пр также не лими
тирует процесса. Тоrда для водорода Sи. и пр , а ДJJЯ
азота S NI UКР+SКОИ. ДЛЯ плоскоrо торца SH. (Ul<pUnp)1
/ (UI<P+ U пр); S N. [и пр (UI\Р+SI\ОИ) ] / (U нр +SI\ОИ+ U пр ).
Для молекулярноrо режима течения rаза
206
и НР == 1/3 V( nRТ)/(2M r .) (D/ L) [1 (d/D)J [1 (d 2 /D2)]; (358)
U пр == 32/з V (пRТ)/(2М r .) [(l2 x)/(d 2х)], (359)
rде х расстояние от оси электрода до точки замера; l
расстояние между торцом электрода и зеркалом ванны.
Распределение давления rаза в подэлектродном про--
v
межутке при условии ero paBHoMepHoro выделения по Bcelf
поверхности ТОЕца электрода и зеркала находится из усло--
вия dр==............dП/u пр . При интенсивности rазовыделения
q(Па.м/с, л.атм/с.см 2 ) имеем
р == Рзаз + (3q/16l 2 ) V(2nM r .)/(RT) [(d/2) х]2,
rде Рзаз ......... давление в зазоре между электродом и кристал--
лизатором на уровне зоны плавки.
Удаление азота
Степень удаления азота при ВДП меньше степени удале...
v u
ния водорода и существенно зависит от исходнои массовои
доли азота. Ориентировочно из металла удаляется 20
40 О/О азота. А. Б. CepreeBbIM для ряда сталей и сплавов
установлена зависимость [N] ==K[N]o [N]/), rде К 1..
Это свидетельствует о том, что процесс лимитируется в
основном реакцией BToporo порядка. По видимому, диффу...
зионно..десорбционное звено (реакция первоrо порядка):
лимитирует процесс удаления азота только при ВДП CTa
лей и сплавов с очень высоким (0,04.........0'06 О/о) содержанием'
азота. При массовой доле азота 0,02 0,04 О/о) имеет место-
смешанный режим. При более низкой массовой доле азота
лимитирующая стадия имеет второй порядок реакции. Су--
щественную роль иrрают также условия rидродинамики на
данной стадии процесса. Например, расчеты показывают,.
что для стали 08Xl8HI0T при d==0,4 м и D==O,5 м при
температуре на торце электрода 1773 К и на поверхности
ванны 1873 К в пленке [N]RP==O,06 о/о, в каплях [N]ир==
===0,25 О/о, в ванне {N]l(p===O,0077 о/о.
Константа скорости процесса в данном случае сущест",
венно зависит от активности аЗОТа в металле. Как и вслу..
чае водорода для реакции BToporo порядка константа CKO
рости составляет м/ (с. о/о) :
К == [(1013f )/(pK .)] V MN./(2nRT) , (360)1
rде К N. константа равновесия процеса 1/2 {N 2 }== [N].
Чем ниже значение fN, тем выше роль химико..десорбцион-
Horo звена. Особенно это относится к сплавам на никеле..
207
вой основе, в которых массовая доля титана достиrает He
скольких процентов. При расчетах необходимо учитывать
также блокировку поверхности раздела металл rаз по.,
верхностно-активными веществами и вводить коэффициент
а, показывающий долю площади адсорбционных центров
на поверхности металла, на которых идет химическая peaK .
ция, от общей площади поверхности раздела металл rаз.
Величина а должна зависеть от содержания в метал-
ле поверхностно-активных веществ (кислорода и серы).
При оценке значения а необходимо учитывать содер-
жание в металле не только ПАВ, но и элементов, влияю..
щих на активность ПАВ. Зависимость К от f приводит
тому, что при введении в металл элементов, понижающих
активность азота (в частности, титана) резко возрастает
кажущаяся энерrия активации процесса. Это заметно
В.пияет на характер зависимости степени удаления азота
от электрическоrо режима переплава, определяющейся
критериями Стэнтона Stэ==Клл/vэ и StB==KB/VO. В пределах
используемых значений j==I/D (11 25 кА/м) в сталях без
титана величины Кл л и Кв растут с увеличением тока мед..
леннее, чем Vэ и Vo. Критерии St э и St B при этом уменьша..
ются, и удаление азота ухудшается. Если }I{e в результате
введения нитрообразующих Э&l1ементов значение Кв растет
быстрее, чем vo, то при уменьшении St э критерий St n может
расти. При ЭТОl\l отмечается либо улучшение удаления
,азота при повышении тока, либо независимость степени
,рафинирования от режима переплава.
В литературе отмечается возможность улучшения уда..
.ления азота при введении в металл титана, что связывают
"[229] с всплыванием нитридов титаI-Iа в ванне. Вместе с
Tel\1 данные работы [231] показывают, что даже при высо-
кой массовой доле титана (до 3 О/о) в никелевых сплавах
практически все нитриды титана диссоциированы уже на
стадии пленки на торце электрода. Появление пленки нит..
u
ридов титана на поверхности жидкон ванны связано не с
всплыванием нитридов, а с образованием их в месте кон..
v
такта метаЛла с плазмои дуrи вне анодноrо Пятна.
Одной из причин улучшения удаления азота при введе-
нии в металл титана может быть понижение активности
ПАВ, rлавным образом, серы.
Нитридные пленки MorYT возникать и на торце электро-
да по реакции
[Ti] + {N} == TiN T :
aTIN
КТ i N . -== ........
f T1 [% Ti) PN
:208
QTIN
fT11%Ti] VKaPN 1
Для сплавов на основе железа 19 К TIN == (39497/Т)
9,704), для никелевых 19 KTI N (33497/T) 8,802. Отсюда
при aTIN == 1 образование нитридной пленки возможно при
условии PN.>prJ:, rде
rJ: == (Ка IqIN пl [% Тi]) l, (362)
rде Ка определяется при температуре катодноrо пятна
(для торца электрода) или анодноrо пятна (для зеркала
ванны), а К TIN И f т' для температуры поверхности метал..
u
ла на соответствующеи стадии.
Дуrа непрерывно перемещается в подэлектродном про..
межутке, и образующаяся пленка по выходе из особой
зоны растворяется в мета lле. Если пленки возникают в
раЙоне каплеобразования, они вместе с каплями перено..
сятся в ванну к фронту кристаллизации. Капля, проходя
u U
жидкии металл, превращается во вращающиися тор с
уменьшающимся по мере опускания радиусом KpyroBoro
сечения. В результате этоrо в металле образуются спира..
леВlIдные скопления нитридов титана (дефект «улитка»).
Такие же капли, отброшенные электродинамическими си..
v
ламп на стенку кирсталлизатора в раионе короны слитка
приносят пленки нитридов в корону. Опадение таких уча..
стков короны в ванну также может привести к фиксации
u
в металле нитридных СКОПtJ1ении, но уже не спиралевидных
(дефект «корона»). Оба дефекта имеют общую первопри..
чин:у, и для их предотвращения необходимы следующие
условия: 1) уменьшение вероятности перекрытия зон кап..
леобразования и rорения дуrи; 2) перемещение зоны кап..
леобразования в район наилучших условий откачки (на
периферию торца электрода); 3) уменьшение активности
титана в пределах возможных колебаний марочноrо соста..
Ба; 4) понижение [N]o при выплавке ИСХОДIlоrо металла.
Периферийное каплеобразование при d 240 мм (D>
>320 мм) обеспечивается поддержанием KopoTKoro под..
электродноrо промежутка и плотной короны слитка, обес..
печивающей хороший ЛУЧIIСТЫЙ теплообмен с боковой
поверхностью торца электрода. Это обеспечивает форми..
рование «куполообразноrо» торца с периферийным капле..
образованием и преимущественно подэлектродным rope-
нием дуrи.
При нарушении этих УС ТIовий и формирования плоскоrо
.
(361)
14 675
209
торца капли образуются в районе центра тяжести участ-
}{ов металлосбора, т. е. на расстоянии примерно d/ з от
оси электрода. В ЭТО 1 же районе располаrается в данном
случае и зона наиболее вероятноrо rорения дуrи, что резко
увеличивает опасность брака по «улитке» (<<короне»). Прll
D, 180 мм (d 150 мм) электроды плавятся, имея кони-
ческий торец с центральным каплеобразованием и дуrой,
rорящей преимущественно на середине образующей !{ОНУ-
са. Наряду с хорошей ОТI<ачкой азота при такой форме
торца это приводит К тому, что соответств}тющие дефекты
в этих случаях, как правило, не возникают. При D==
==200+280 мм (d== 1607200 мм) имеет место переход от
одноцентренноrо каплеобразования к мноrоцентренному и
от коническоrо торца к плоскому. В этих переходных усло-
виях наиболее трудно развести в пространстве зоны наи-
более вероятноrо каплеобрзэования и rорения дуrи, поэто-
му в слитках TBKoro размера возможно появление дефекта
«улитка» (<<корона»).
Для каждоrо сплава можно оценить максимально до-
пустимое значение [N]o, превышение KOToporo при данном
расположении З0Н каплеобразования вызывает опасность
появления дефектов «улитка» 11 «корона». Дефекты отсут-
ствуют при Р t: KT p . Для периферийноrо каплеобраэо-
факт пер
вания на промышленных печах P.N. === PN. :
ПV.. Р О т g [%N]V. 1 Р О Т
Р пер ,......... ....
N ........
· м н . SN.. 298 M N, (иl(р + SROP) 29800
еа [ %N] V J& РО Т
M N1 (UJ(P + SИОР) (1 + а (%NoJ) 29800 ·
При подэлектродном каплеобразовании на раССТОЯНIIИ
х от центра торца P КТ ==PN == P + PNI'
PN. == (A/l2) [( d../2) ......... х ]2,
........
........
(363)
rде
rде А == [(Y ТРО р)/16] .10..... 4 (аК пл [%N пn ]2 +
+ аК в [%N B ]2) V2n/ (RTMN.)
[(V Ji Ро ga)/(4D2)] V 2Т/(п RMN.) [%N] .10----4.
При подэлектродном I<аплеобразоваНИII значение tNJHP
меньше, чем при периферийном.
Прuмер. При ВДП хромоникелевоrо сплава в Крl1стал
лизаторе диаметром D==400 мм содержание азота [N]o по-
210
низилось С 0,01 до 0,0056 о/о. Определить конечное содержа-
ние азота в этом же сплаве при переплаве ero в кристалли-
заторедиаметром D===500 ММ. Массовую скорость перепла-
ва считаем прямо пропорциональной D. Определим коэф-
фициент а == ([0/0 N]o [% N]ион) / ([0/0 N]o[% N]коп) === .<0,01 .........
O,0056) / (0,01.0,0056) === 78,51/%.
,При переходе к друrому типоразмеру, считая I/D ==
==const и температурные условия на всех стадиях БЛИ3КII-
", 2 2
МИ, примем al/a2 VO/VO==(g2Dl)/(gl/D2)==Dl/D2. ОТ-
сюда а2===аl (D 2 /D 1 ) :=::78,5 (500/400) ==98,0.
В новом кристаллизаторе [N]кои===0,Оl/.(1+98,О.0,Оl) ==
.=== 0,0051 о/о.
Прuмер. Определим паРЦIIальное давление азота в зо-
не П ТIавки, при котором на поверхности катода образуется
нитрид итана при получении никелевоrо сплава методом
вдп.
Исходные данные: температура плазмы 1830 К, темпе-
ратура катода 1675 К, титана в сплаве 2,6 о/о, 19 'ТI ==
=== ( 4488/Т) 0,518. Определяем константу диссоциации
азота в плазме: 19 Ка' (........49400/1830) +6,00 == 21;
Kr:x' == 10 21. Константа нитридообразования на поверхности
металла составляет: 19 KTfN == (33497/1675)........8'802== 11,22;
KTIN == 1,66.1011. Коэффициент активности титана на по-
верхности металла определяем из выражения: 19 'ТI ==
== (4488/1675) ........0'518==2' 16; 'ТI == 145. Критическое давле-
ние азота составляет: p ==(Ka KilN fil[%Ti]) 1==(1<r21X
х 1,662 · 1022. 1452. 2,62) 1 == 2,6. 1 O 6 атм'=== 0,26 Па.
ПрUм'ер. Определить максимально допустимую массо-
вую долю азота в хромоникелевом сплаве, rарантирующую
отсутствие дефекта «улитка» (<<корона») при периферий-
нам и подэлектродном каплеобразовании. Критическое
парциальное давление азота составляет 0,26 Па. Исходные
данные: D==38 см; d==30 см; g==5,5 r/c; суммарная быст-
рота откачки насосами и конденсатом у периферии элект-
рода 5,5 м 3 /с, коэффициент a==62 1 jO/o. При подэлектрод
НО!\I l<аплеобрззоваНIIИ [==2 C I. Те fпература плазмы 1830 К.
Определим давление азота на периферии подэлектродноrо
промежутка :
5,5. 1 О..... · 62 · 22 , 4. 105 · 1830 [ % N ] 6
рпе р
N J 298.28.5,5.100 (1 + 62 [%N]o)
== 3 05.103 [%N]б .
, 1+62[%N]o
14*
211
Прli подэлектродном каплеобразовании примем х==
==d/3===O,1 М. Тоrда перепад дав ления 6.PN J равен:
11 == 22,4.10&.5,5. l()--"З.62 .. / 2.1830 [% NJ5==
PN J 4.104.0,38 .2 .10----4 V п.81830.28
== 1,2.104 [% NJ 6.
J!авление азота в зоне подэлектродноrо каплеобразова-
ния составляет: р N ===P P+ PN ===3,05.10 3 {[О/о r 0]2/(14..
2 J J
,)
+62 [0/0 N]0)}+1,2.10 4 [0/0 N]o. В случае периферийноrо
каплеобразования при условии PN e ; ==PN имеем: (3,О5х
хl0 З [0/0 N]5)пе р (1 + 62 [0/0 N]o) == 0,26; [0/0 N]5 5,2x
х I(r--З [0/0 N]0 8,4.10 5==O. Отсюда [0/0 N]o==O,0121 о/о.
При подэлектродном каплеобразовании уравнение отно-
сительно [О/О N]o является кубическим. Поскольку 6.р N 2 >
> p ;, то пренебреrаем величиной р p. т or да 1,2. 104 Х
х[о/о N] ===O,26 Па, отсюда [0/0 N]o 4,6.10 3 о/о. Подставим
ЭТО значение в знаменатель формулы для р :p : {(3,ОБХ
ХIО З [0/0 N] /(1+62.4,6.10 2)}+1,2.104 [0/0 N]5==O,26 Па,
отсюда [о/о N]0==4,2.10 З о/о.
Удаление оксидных включенuii, при вдп
Снижение в металле кислорода и, соответственно, оксид-
ных включений при ВДП может достиrать 50 70 о/о. Ко-
нечное содержание оксидов при этом является результатом
u
ряда процессов, каждыи из которых по"своему зависит от
режима переплава, диаметра электрода, кристаллизатора и
состава металла. От этих же факторов зависит и относи-
тельная роль каждоrо процесса. К таким процессам ОТНО-
, . u
сятся всплывание включении в ванне и взаимодеиствие ра-
cTBopeHHoro кислорода с уrлеродом на стадиях торца и
ванны, диссоциация и ассоциация включений. Взаимодейст-
вие уrлерода с недиссоциироваННЫМII оксидами при вдп
заметноrо развити,Я не получает.
r. Кнюппель [119], исследуя процесс обезуrлероживания
в вакууме при отсутствии кипения (что характерно для
ВДП), установил в области массовых долей кислорода
O,012 O,53 О/О зависимость константы скорости процесса
от содержания paCTBopeHHoro кислорода в металле: К ==
== (l+c [0/0 О]), rде P KOHCTaHTa скорости диффузион-
ной ступени. При этом зависимость К от [0/0 О] довольно су-
щественна. При 1873 К K (1,44.10 З)/(1+174 [0/0 О]) м/с.
е учетом этой зависимости К от массовой доли растворен..
Horo кислорода получено приб.ТIиженное выражение для
212
конечноrо содер)l ания ОКСIIДОВ в метаЛ,,1Jе, о/о:
[%НВJ ион == [%HBJ o { 1 [ хэ +
1 + (KB/v O ) 1 + (Кэ/V э )
+ х и (1 Хэ)] + [(1 хэ)(1 XB) /(1 + :0 )J).
rде Кэ, КВ соответственно константы скорости уrлерод..
Horo раСКJ'lсления на стадии торца 11 ванны; Хэ, хв степень
диссоциации оксидов На стадии образования пленки на тор..
це электрода и на стаДlI1I ванны; W CKOpOCTb всплывания
оксидов в ванне.
ФОР I:ула верна для э/Vэ> 1 и B/VO> 1, ЧТО оБЫЧl О
имеет место. Для устойчивых, неДИССОЦИИРУIОЩIIХ включе..
ний, при )(э==хв==Q (о/о НВ]ион==[О/о HB]o/[1 + (w/vo)]. Для
друrоrр предельноrо случая, коrда ВКЛIочения полностью
диссоциированы уже в пленке, при %э==Хп== 1 имеем:
[%НВ]НОН == [%НВ] [} + (Кэ/vэ)] l [1 + (Kn/vo)l l. (364)
В первом случае удаление ВI<лючений определяется про..
цессами их всплывания, Ба втором раскислением метал-
ла уrлеродом. Для шаровидноrо включения х=== l (r/
/ro) 3 (ro исходный радиус включения; r текущий ра..
диус). Величины r и )( MorYT быть оценены на основаНIIИ
решения дифференциальноrо уравнения процесса раство-
рения шаровидноrо включения. Без учета конвеI{ТИВНОЙ
диффузи:и примем, что за вре 1Я dт; растворяется слой окси"
да ТОЛЩИНОЙ dr. Отсюда:
4:nr 2 '\' dr ::- ( 4nD/I00) {[ %О]П [%ОJ об } Р' dT, (365)
rде у плотность кислорода в оксиде, Kr/M2; р плотность
жидкоrо металла; D КОЭффlIциент диффузии I{ислорода
в меТ8лле, 112/с; [0/0 О]п массовая доля КlIслорода в ме..
талле на rранице с оксидом, равновесная с ОКСIlДОМ при
данной температуре; О/о; [0/0 О] об массовая ДОJfЯ кислоро..
да в объеме металла, о/о.
В свою очередь [0/0 О]об==Х[О/о O] , rде [0/0 О];Е об
щее содержание в металле кислорода, связанноrо в оксиды.
В пределе равновесная при данной температуре степень
диссоциации составляет: ..
Х р8вн == [%О]П/[ %О]}: === 1 (, I<OH/,0)3. (366)
Следовательно, конечный радиус включения 'кон сущест..
венно зависит от общеrо содержания кис.порода в метал...
ле, связанноrо в ОI{СИДЫ. Чем больше количество оксидов
в меТЗ.пле, тем онн }<рупнее. '
213
Таким образом содер;,кание ОКСIlДОВ в lIСХОДНО 1 мета.Т}-
ле обусловливает интенсивность протекания процессов yr-
JIеродноrо раСКIIС"fJения и ВСП.1Ь1вания. Че 1 rрязнее исход..
ный металл, Te 1 БО.ilЬШУЮ роль иrрают npOI(€'CCbI всп.пыва..
НIIЯ, 11 наоборот. ПрИНИ Iая, что величина [О/о 01 л является
u u
Р авновесном, опреде ТIяемои ПО, реакции ДIlссоциации ОI{СИ..
. 1/
да: 1/ п Ме т О п :р: т /'1 [Ме] + [О], получим [О] л ===К[ aM тonl
.1 (f o aAleп]. Следовательно, на характер механизма удалени
оксидов в,пияет и массовая ДО.11Я элемента Ме в MeTa"l"le 11
активность ОКСllда Ме п1 О п . Если не учитывать ВЛИЯНllе ве-
личины [О/О Ме] на состав оксидов, то повышение вел}-[чины
[О/О AIe] Уl\Iеньшает х I1 повышает роль процесса ВСПJlыва..
ния до появления минимума [О/О О] на кривой раСКИСIl1е..
ния. Роль всплывания повышается при содержании оксида
МетО?) в СЛО2КНОМ КО lплеКСНО 1 оксиде, что понижает
a.t'Ie,пOn. НаПрП!\1ер, для СИЛЛИI\1аНита АI 2 О з +SiО 2 == A120. Х
Х Si0 2 ; ao === 188550 1,25T Дж/моль; 19 K1873 === 5,24;
aSi0 2 ==аАlsО з == K I/J == 0,0024, ДJ1Я андалузита Аl 2 О з + Si0 2 ===
==1\.l2 0 з-SiО 2 ; L1Go=== 158000 1,95 Д>I{/МОЛЬ; 19 К187З===
==4,82; aSi0 2 == aAI20J==K 1/2==0,0039. При 1873 К Д,НЯ СИ,,1Н"
ката кальцпя CaO.Si0 2 QSio.==0,056, Д,,'1Я силиката 2СаОх
XSi0 2 aSi0 2 ==0,072 для СИ,,1Jиката MgO.Si0 2 aSiO. ==0,29,
ДIl1JЯ СIl.ТIпката 2MgO.Si0 2 aSiO. ==0,224.
TaKII I образом термодинамическая устойчивость Si0 2
существенно повыIенаa в силикатах ка.ТIЬЦИЯ и маrния, НО
особенно резко повышена в алюмосиликатах. Для а"ТIЮ:VIО-
силикатов характерно и реЗI{ое снижение активности r,пи..
назема. Д ТIЯ шпинели типа СаО. А1 2 О з II IeeM: СаО+
+А1 2 О з ==СаО.А1 2 О з ; дaO== 15420+23,4 т ДЖ/МОЛЬ, Т. е.
при T 660 К эта шпинель неустоЙчива !I разлаrается.
Также неустойчивы и друrие аЛlоминаты кальция.
Укрупнение СЛИТI{а, уве,,1]I1чивая пребывание мета"lла в
}I{II)JJ{01I состоянии И повышая %, способствует раЗВИТIIIО
процессов уrлеродноrо раскисления и сни}кению роли про
цессов Всплыпанин. Повышение степени диссоциации с
pOCTO 1 дпаметра кристаллизатора (ИЛII с повышением то..
ка при ТО\1 же п) приводит I{ росту ДОJ1И ВКJlючений, ВТО"
рИчно образовавшихся по реакции [Ме]+п[О] ==Me,nO'I.
Размеры таких «ВТОРПЧIlЫХ» ВКЛIочеНlIlUI не зависят от
u
,размеров ИСХОДНЫХ ВКJIючении и опреде"ТIЯЮТСЯ только ус..
JIОВИЯМИ кристаллизации с,нитка ВДП. Всплывание частиц
ОКСИДОВ в ванне возмо}кно в результате действия трех ос..
НОБНЫХ 1еханизмов: конвективных потоков, закона Сток..
са, ДВИJ+ еНIIЯ в ПО.lе ПАВ. Хотя скорость конвективных
214
ПОТОI{ОВ метаЛ.Jlа превышает скорость частиц по двум дpy
rИl\.f механизмам, конвективные потоки являются циркуля--
ционными; они MorYT YBII1eKaTb включение на поверхность
ИJ1И в rлубь металла. Два друrих Iеханизма являются не..
циркуляционными, а следовательно, опредеЛЯЮЩИl\IИ про...
цесс всплывания включений. В диффузионном ПО ТIе ПАВ
ВИ:Cllючения движутся со скоростыо: w=== (2r/3f)) (rRT/c) х
х (dcjdx). Поскольку rRT/c== d(JM n/dc (aM B - межфаз..
ное наТЯ}l{ение на rpaHllue включения с метаЛЛО1\I), ТО
w == (2r/311) (d(JJd B/dx) == (2r/3f)) (daM.....B/dT) (dT/dx).
(367)
с учетом выражения aM B == aB aM cos8 получим
dO M ...... B das
dT dT
da ltl е ...L · е d8 :: d<1 { COS 8.
cos а SlП
dT j 1\1 dT dT
(368)
Значения d(JM/dT по данным различных авторов суще-
ственно раЗ,,1}ичаются для одноrо и Toro же металла. TaK
ДЛЯ железа daM/dT равно ........3,5.} O 4 Дж/ (м 2 . К) (CM. табп. 12)
и........5.IО ' Д}I</(м 2 .К) [177]. Для никеля daM/dT равно
3,9. IO Дж/ (м 2 . К) (СМ. табл. 12) и 2. 1 o Д)к! (м 2 . К)'
l177J. Посколы у dGM/dT <о, то всплывание включений в
направлеНIIИ повышения температуры (dT/dx>o) ВО3МОЖ"
но только, если cos 8<0, т. е. если 8>:л/2 (90°). Д,ТIЯ SiOl.
В жидком железе 8== 1260 для MgO, СаО, АI 2 О з 8== 140+
+ 145°. Компоненты сплава, имеющие BbICOI{Oe химическое
средство к КИСJIОРОДУ (Al, Ti) резко понижают 8 1I cos8.
Так, в сплавах на основе железа С 2,5 З О/О Ti Д.,1JЯ Аl 2 О з
е уменьшается до 90°, а cos 8 до о.
Всплывание частиц в направлении повышения темпе
ратуры связано с увеличением в этом направлении степе
u
ни диссоциации оксидов и ростом массовои ДОЛИ paCTBO
peHHoro кислорода. Средний температурный rрадиент П
объе 1У )I{ИДКОЙ ванны можно приближено оценить из вы...
ражения: dT /dx (tц/R) (J1r/12) [1 (J.ti/4)] [1 + 3/8 (R2/H )]..
тде ' ц температура в центре зеркала ванны; R
.)
радиус СЛIlТI<а; Н К rлубина конической части ванны; tl
I<оэффициент, определяемый условиями теплообмена и теп...
лофизичеСI{ИМИ свойствами металла. Соотношение CKopOCTeii
всплывания частиц по закону Стокса 1I в дпффузионном
поле КИСJ10рода в условиях ВДП составляет:
215
WCT 4g o (Рм (эв) r я R
,
G'ПАВ dcr M .) ( . !J.i " ( 3 R2 )
dT COS О!1! ( ц \ 1 4 ) 1 + 8 H
.rде go S'скоренпе с ободноrо падения; R радиус СJlитка.
Принимая go==9,8 M 2 fc; d(JM!dT== 4.10 Дж! (м 2 . К) cos 0=:
==0,7; J.1i==1+2; R/HK==I; p I==7 r/CM 3 ; рв==3 r/CM 3 , по.пуча-
ем Wст/WПАВ === (2,573,3) .105 ' в R, rде 'в и R выраже140
в метрах.
Если выразить R в ?\leTpaX, а 'в в tИКрОl\1етрах) ТО ра-
венство скоростей IIмеет место при условии 'в == (374) /R МКМ.
Прп меньшем значении 'в ВI{лючения всплывают под деft.
ствием поверхностных СИ t
при болыuем по закону
Стокса. Для R===20 см части-
цы с ,в::::; 15720 мкм всплыва
ют rлавным образом в поле
кислорода. Температурный
rрадиент в ванне резко колеб-
лется по ее высоте. Анализ
кривых рис. 48 показывает, что
dT /dx у поверхности зеркала
ванны в 10 90 раз превыша
ет значение dT /dx у фронта
кристаллизации. Отсюда и
ро.пь механизмов всплывания
должны быть различноЙ по вы-
соте ванны. В rLllубине ванны,
у фронта кристаллизации МО-
)кет преобладать всплывание
по закону СТОКС8, в то время
!<ак в поверхностных слоях ванны преобладает всплывание
в диффузионном поле кислорода.
Сравним теперь скорости процесов ВСП 1ывания и уrле-
,
родноrо раскисления. Учитывая, что обычно в металле
ВДП общее содержание кислорода < 0,0 1 о/о, а содер)кание
paCTBopeHHoro кислорода еще меньшс, ПрПNlем по r. Кнюп-
пелю при 1873К дЛЯ IолеI\УЛ СО в }келезе ===14,4Y
Х lО З м/с. Для среднеrо по объему ванны значения теr.,1пе
paTypHoro rрадиента, прннятых выше значениях парамет
ров процесса и физических величин и считая 1) ==4 r/ (м. с),
имеем WПАВ (6,5+8,5)r B /R I/C. ОТСIода в/WПАВ === (1,7 :.
2,2) · R/rn.l O '. Считая, что в среднем в ванну с каплями
ПРИХОДЯТ ОI{СIlДЫ с 'B 2 I\fK I, получим fJB/w R.I02. Это
tOC
'J
1700
1500
I
х
11
11
\,
\.,,
\ ,
,o
t .........-.....;:
'J7 и If .......... """"'-= ........
....... ;.:ar ..
.......... -
I
.1
Х2
З
6.4
05
1600
1'100
о
4
8
12
lJ см
Рис. 48. Распределение те:\1 ператур
по rлубине жидкой ванны 1 при
ВДП стаJlИ ШХ15 в кристаллиз то
ре диаметром 280 мм при токе
6,0 (/). 5,6 (2), 5,0 (,1). 4,2 (4) и
3,3 кА (5)
216
(369)
означает,ЧТО практически для всех кристаллизаторов вос-
становительные процесы быстрее процессов всплывания.
Скорости обоих процессов MorYT быть сравнимы только
ДЛЯ случая всплывания крупных (r 8 ;>10 мкм) оксидов В
малых (R<5 см) лабораторных криста.п 1Jизаторах.
Изменение хuМ,uчеСКО20 состава при ВДП
Как правило, в процессе ВДП не наб.ТIюдается значитель-
Horo изменения химическоrо состава металла. Только ле-
тучие КО 1поненты, такие как марrанец, MorYT удаляться
из металла в заметных КО ТIичествах. Поведение марrанца
имеет при вдп особое значение, так !<ак ero концентра-
. v
ция в некоторых конструкционных ]1 КОРРОЗИОННОСТОИI{ИХ
сталях достиrает нескольких процентов, а снижение кон-
центрации марrанца после вдп состаВ.пяет 25 30 %1,
Удаление марrанца лимитируется rлаВНЫ 1 образом внут-
ренней диффузией. В работе [174] показано, что связь
между исходной и конечной концентрацией марrанца ха.
рактериэуется следующей формулой:
]п IМп]oI[Мп]п == ( Mn/Vo) [1 (d 2 /D2)J. (370)
Формула (370) показывает, что марrанец испаряется
u
преимущественно снезаэкранированнои э.пектродом части
поверхности жидкой ванны. Кажущееся неучастие виспа..
v
рении остаЛЬНОli 'поверхности ванны и торца электрода свя-
зано, по видимому, с тем, что под электродом испарение
марrанца .лимитируется внешним массопереносом. Кроме
Toro, некоторую роль может иrрать частичная конденса..
ция паров марrанца на отдельных участках торца электро-
да вследствие значительноrо различия температур близко
расположенных поверхностей электрода и ванны. Констан-
Та скорости испарения марrанца MH по данным работы
[ 174], составляет 0,6 мкм/с для спокойной ванны I1
""" 1,2 мкм/с для ванны, вращае110Й электромаrнитным по-
ле1\1: соленоида.
Особый интерес в смысле поведения марrанца пред-
ставляют участки слитков, наП.1Jзвленные в нестационаr..
нам режиме (нижняя и верхняя зоны). Нижняя часть
слитка наплавляется, как правило, npl1 повышенном токе,
что способствует сохранеИПIО Iнарrанца. В верхней часrи
слитка, коrда требуется понижать скорость плавления для
v
выведения усадочнои paKOBIIHbl, потери марrанца резко
возрастают. В тех случаях, коrда в стали orOBopeH нижний
предел по марrанцу, приходится либо cOBce 1 отказывать-
ся от выведения усадочной рЗ'КОВИНЫ, либо ПрОБОДИТЬ этот
217
процесс в аТ!vl0сфере инертноrо rаза для понижения CKOpO
CTfI испарения MapraHua.
Прuмер. ОпредеJIИМ конечное содержание rvlарrанца в
конструкционной стали Прl! ВДП В кристал.пизаторе диа
метром 500 M I при токе 9 }<А. Исходные данные: g==
==90 r/c; d==0,4 м; (МП]о== 1,5 О/о; р==7 r/cM 3 ; .\\n==6X
ХI0 З см/с. 1). vo==(4g)/(nD2 p ) == (4-90)/(3,14.502.7)==
==6,7.10 З см/с; 2). ln[Mn]o/[Mn]K ==( л\п/vо)[1 (d2/D2)]==
==[(6.10 3)/(6,7.10 З)](1 0,82)==0,32; 3) [Mn]o/[Mn]K==
==e o ,32==1,38; 4). [Mn]K== [Мп]о/1,38== 1,5/1,38== 1,09 О/о.
Из цветных металлов, присутствующих в виде примеси
в конструкционных сталях, подверrаемых ВДП, в небо.пь
ших концентрациях присутствует медь, содержание кото-
рой составляет 0,1 0,3 О/о. В результате ВДП содержание
меди понижается на 10 ЗО о/о. По данным работы [174],
u u
испарение меди подчиняется зависимости, аналоrичнои тои,
что ПОlllучена для марrанца [формула (342)]. Для крис"
Т8J1ЛИЗ8тора диаметром 320 мм при ВДП стали 50Х2НМ
при токе 5,5 кА веЛIlЧIlна cи составляла 4,0 .1О З см/с, а
при 6,5 кА Веи ==8,8 .10 З см/с. Более сильная, чем у мар..
танца, З8ВИСIIМОСТЬ от температуры вызвана, ПО"ВИДИl\10"
му, тем, что IIспарение rvlеди в б6льшей степени, чем испа..
рение Iарrанца, лимитируется стадией десорбции атомов
с поверхности раСПJIава. Это предположение подтвержда..
u
ется повышеннои активностью меди в расплавах )l{е ТIеза.
VIII.3. РАФИНИРОВАНИЕ МЕТАЛЛА ПРИ ЭШП
ТемпературныЙ реЖUАt процесса ЭШП
Измерение температуры шлака и металла при ЭШП сви-
детельствует о неравномерном распределении температ ""
ры по объеrvlУ шлаковой ванны и по поверхности ванны rvle..
талла. Максимальные температуры (1750 1900 ОС) соот"
ве ствуют подэлектродной зоне. Темпер тура Ш ТIака в
u
кольцевом зазоре между ЭJlектродом и степкои !{рllста.п.пи..
затора достиrает 1675 1725 ос. Температура открытой по..
u
верхности шлаковои ванны 11 слоя шлака, прилеrающеrо к
метаЛJ1У, на 100 I50 ос ниже температуры Ш1Jа'ка в коль..
цеВОl\I зазоре. Теl\1пература шлака и l\1ета.пла при ЭШП за..
ВIIСIIТ от двух qJaKTopoB: электрическоrо режима перепла-
u u
ва и электрическои проводимостп ШлаI\а, опреде ТIяющеи
размер \1е}l{электродноrо промежутка.
Для определения эффективной температуры, характер-
I-IОЙ дЛЯ процессов рафинирования при ЭШП, может быть
IIСПОЛЬ30вана заВИСИ IОСТЬ, аналоrичная ВДП:
218
т == Т пИК + T mах [1 (P д/P уд)]' (371)
rде Р' уд удельная мощность, выдеlяе lая в Ш.паковой
ванне; p д удельная мощность, при которой neperpeB
мета..lла практически отсутствует.
Величина Руд определяется IIЗ выражения Р уд ===
===Р/ (HmD) (Р ПО.пная мощность, выде..lяе lая в шлаке;
D ........... диаметр криста..ТJлизатора; Н ш ........... расстояние между
торцом электрода 11 поверхностыо 1ета..l..lической ванны)_
Прuмер. Определим эффективную температуру при
ЭШП стали ШХ15 в криста.плизаторе диамеТрО?\f 400 мм
при TOI<e 10 l<.A, напряжении на Ш..1аКQВОЙ ванне 60 В и
rлубине шлаковой ванны нш=== 150 h1 f. 11сходные данные:
iJ]Jlli== 1460 ос; 7.1]111\=== 1733 К; P д===400 Вт/см; 6.Т тах ===
===5001(. 1) Р уд === (U/)/(HIIID) === (60-10000)/(15.40) ===
===1000 Вт/см; 2) T===1733+500[1 (400!1000)]==2033 к
( 1760 ОС) .
Удаление неJ,f,еталлuческu.х ВК..lючен'UЙ при ЭШ П
Вопросам рафинирования мета..ТIла при ЭШП посвящен
ряд работ. Из них наиqолее JlIlтереСНЫ 1И являются работы
[179...........185]. Значительное внимание во всех работах уделе--
но вопросу удаления ВК&lТJючений. При ЭШП удаление не..
металлических включений может достпrать 65 75 ,О/о. При
u
этом rлавную роль в процессе уда..7Jения включении при
ЭШП иrрает рафliнирование lета lла Ш..lаком. Удаление
u
включении из металла может сопрово)кдаться вторичным
заrрязнением металла включениями вследствие окисления
u
электрода кислородом воздуха, перехода раскис ителеи из
шлака в металл и Т. п. При переП,,1Jаве под Ш.п:аками, co
держащими rлинозеJ.f, ВОЗ!\10ЖIIО заrрязнение металла
А]20з по следующим cxe laM: 1) 2 (АIЗ+) + 2 (02 ) + [О] +
+ [FeJ == АI 2 О з (т) + (Ре 2 +); 2) 2 (A13+) + 2 (02 ) + [О] +
+ [Мn]===АI 2 О з (т)+(Мп 2 +); 3) 2(A13+)+9/2(02 )+3[O]+
.+3/2[Si]===А'120З(Т)+З/2(Si05 ). Растворенный кислород в
металле появляется в резу.пьтате раЗLТ"lожения оксидов
I<ремния и марrанца, а малая }<онцентрация в ШЛВI\е катио...
нов железа и марrанца и кремнекислородных комплексов
способствует сдвиrу этих реакций в сторону раскисления
мета..lIла алюминием шлака. Появление в шлаке I<атионов
u
железа и марrанца, Т. е. мета..1JЛОВ с переменнон валентно..
СТЬЮ, в СБОЮ очередь способствует своеобразной «перекач..
ке»' кислорода из rазовой атмосферы в металл. На поверх..
ности шлаковой ванны происходит адсорбция к слорода
1/ 2 {О2} (О) аде. Адсорбция сопровождается ионизацией
219
aTO 10B кислорода 11 ОКИС ТIение?\f присутствующих в шлаке
u u
катионов низшем до l{aTIIOHOB высшем валентности:
(О)а,цс + 2 (Ме 2 +) + 3 (O:! ) 2 (M ). (372)
Металлом Ме с переменной валентностыо MorYT быть
например, же,пезо, марrанец, титан. Анионы FeO;, МПО2'
Ti02 диффундируют через шлаl{ к металлу. Конвективные
потоки в металле значительно ускоряют подход анионов
к металлу. На rранице шлак металл анионы трехвалент..
ных металлов восстанавливаются до двухвалентных:
2 (МеО2") + [FeJ 2 (Ме 2 +) + (Fe 2 +) + 4 (02 ). (373)
С учетом перехода кислорода из шлака в металл по
реакции (Fe 2 +) + (02 ) == [Fe] +'[0] суммарный процесс
«перекачки» кислорода имеет вид: 1/ 2 {02} == [О].
Возможна также транспортировка I{ислорода из rазо
вой фаЗbI в металл в реЗУLТIьтате растворения в шлаке BO
дяных паров:
{Н 2 О} + (02 ) === 2 (ОН......);
2 (ОН......) + (Fe 2 +) == [Fe] + 2 [О] + 2 [Н];
(Н 2 О) + (Fe 2 +) + (02......) == lFe] +2 [О] + 2 [Н]. (374)
При этом в металл поступает не только кислород, но и
водород. Таким образом, всеrда имеются источники появ
ления в металле (даже предварIIтельно раСКИСLТIенном)
u U
pacTBopeHHoro кислорода, которыи может стать причинои
образования вторичных rлиноземистых включений. Кроме
железа, марrанца и кремния, вторичному заrрязпению ме..
талла rлиноземом при ЭШП заметно способствует уrлерод
в металле. Поскольку rлинозем в шлаке диссоциирован по
реакции (АI 2 О з ) (AI02) + (AI3+) + (02 ), то «перекачка»
!{пслорода из атмосферы в металл анионами (AI0 2 ) в при:-
сутствии уrлерода происходит по схеме: З/ 2 {О2} + 2 (АI0 2 ) +
.+2fC] ==А120з(т)+2(О2 ) +2{СО}.
Обработка экспериментальных данных по ЭШП уrле
u
родистых сталеи дает следующее выра}кение для мини
l\1a ТIbHoro содержания rлинозема внеметаллических вклю...
чеIIИЯХ nplf ЭШП ПОД шлаком AI-I Ф..6: [010 АI 2 О з ] mln ===
==0,0029+9. 10 4a +2,6. 10 За 2 rде 0,0029 ,О/о I{О 7]ичест
во rлинозема, образующеrося в результате раскис,пения
металла аЛЮМИIIпеl\f, ВОССТ3ПОВ"Т"IеИIlЫМ из ШL7IаI<а )J{еL1Jезом
и: марrанцем. С учетом Toro факта, что в металле всеrда
после ЭШП ПРllсутствует определенное МИНI-IмаЛЫlое ко-
r
220
,
личество rлинозема, характерное для данноrо шлака и
данноrо металла, формула для оценки степени удаления
оксидов при ЭШП принимает вид:
[%НВ]НОН == [%НВ) + [(тwпл)/v э ] [%АI 2 О з]mln +
[1 + {тwпл)/vэ] [1 + (WB/V O )]
+ (WB/VO) [%АI 2 О з]mtn ,
[1 + (WB/VO)
u U
rде Wпп, W s линеиные скорости перехода включении из
металла в шлак на стадии пленки и ванны. Для включе-
ний, самопроизвольно переХОДЯll ИХ rраницу раздела фаз
(А1 2 О з , MgO, Ti0 2 ) , лимитирующей является скорость
подвода включений к rранице раздела. Для силикатов
(при < 1,% Si), оксидов марrанца и железа, преодолева-
ющих npfI межфазном переходе расклинивающее давле-
ние, процесс лимитируется стадией перехода. Принимая в
первом случае, что включения перемещаются в диффузи-
онном поле ПАВ, имеем nplf самопроизвольном переходе
критерий Стэнтона:
5t == Wi/Vi == [(2, в)/(311а)] (dar,r/dT) (Т ; .......... то) cos 8, (375)
rде T i .......... температура поверхности металла на COOTBeTCT
u
вующеи стадии.
Как следует из выражения (375) при таком переходе
лучше удаляются более крупные частицы. Повышение
подводимой мощности, увеличивая T i и тем самым умень-
шая 'в сложным образом влияет на конечное содержание
включений [О/о НВ] кон. Для включений систеlvlЫ
FeO MnO Si02 решающую роль при переходе rраницы
иrрают поверхностные свойства системы. Размеры вклю-
чений иrрают здесь меньшую роль. Однако, поскольку
малому включению леrче преодолеть расклинивающее дaB
ление, в данном случае лучше должны удаляться включе
ния с меньшим 'в, так как значения W пл и W B В этом слу
чае. слабо связаны со скоростью переплава, критерии
Wi/Vi с увеличением Vo уменьшаются, и рафинирование от
этих включений должно при этом ухудшаться. Для xopo
шей экстракции включений шлаком при ЭШП кроме
указанных кинетических условий необходимо: 1) хорошее
смачивание неметаллических включений шлаком; фторид
ные расплавы пре}(почтительнее оксидных в качестве ОСIIО
вы дЛЯ ШЛЗI{ОВ ЭШП, так как обладают лучшей смачивае
мQстью; 2) плохое смачивание неметаллических включений
металлом; 3) оптимальное значение поверхностноrо натя
жения металла; веЛIfчина <1 м в условиях ЭШП зависит
221
rлавным образом от химическоrо состава металла и в сис-
теме Fe C в присутствии paCTBopeHHoro кислорода имеет
максимум при'" 0,2 О/о [С].
На рис. 49 приведена заВИСИ1.IОСТЬ степени удаления не..
u u
металлических включении от fассовои доли уrлерода в
СIl1ИТI<ах диаметром 100 M ! при
1== 1,5 кА ПОД шлаком АНФ 6.
Как видно из рис. 49, наиба..
.,'Iee эффективный процесс уда-
u
ления включении должен Иl\1еть
место при ЭШП среднеуr.перо-
дистых сталей (0,3 0,5 О/О С).
п рИм'ер. Определить !<онеч-
u
2 ное содержание включении
lCJ}% rлинозема после ЭШП стали
ПОД шлаком АНФ 6 при их ис-
Рис. 49. Зависимость степени уда- ХОДНОМ содержании 0,009 о/о;
пения ОКСИДНЫХ включений 'Ф при D== 40 СМ . , d == 20 см . . g === 90 r/
ЭШП от содержания уrлерода в
стали /с. в стали содержится 1,0 О/О с
о И 0,2 О/О Si. Средний радиус
включении ,в==5 МКМ. т з == 1783 К; Т в ===2033 К; Т о ===З00 К;
а=== 1,5.10 5 м 2 /с, fJ ==0,025 Па. С, коэффициент m==2.
1. Определим [% А1 2 О З ]Шln: 19 fc ===eg[% С] +e I[% Si] =
==0,14.1,0+0,08.0,2===0,156; 19 fSi==e 1 [% С] +e [Si] ==
==0,18.1,0+0,11.0,2==0,202; 'С == 1,43; f51 === 1,6; ас == 1,43;
aSI ==0,32; [о/о АI 2 О з ] mln == 0,0029 + 9. 1 o . 1 432 + 2 6. 1 O 3 У
Х 0,323/2 == 0,0052. ' , ,
2. Примем для железа d(JмldТ=== З,5.10 4Дж/(м2.К)
и cos e==cas 1300== 0,765.
40
50
о
ЗО
20:
О
1
3. т S t O == 2 · 2 · 5. 10----8. 3 ,5. 10---- t
з.2,5.1О----!.l,5.1О !I (1783 300).O,765 == 7,0.
4. St == 2.5.10----8.3'5.10.....& ( 2033........ 300 ) .0 765 === 4 1
в з . 2 ,5. 1 о.....!. 1 .5. 1 o...... " ·
5 [ % АI О ] :== 0,009 + 7 · 0,0052 +
· 2 3 НОВ 8 .5, 1
+ 4, 1 · 0,0052 == О 0053 %
5 ' О.
, 1
Из друrих процессов, происходяIЦИХ в ванне и имею-
щих отношение к неметаллическим включениям, необходп..
МО отметить процессы укрупнения включений. Те включе..
ния, которые не были экстраrированы в шлак и не успели
222
диссоциировать в области высоких температур, попадая в
низкотемпературную зону ванны, становятся центрами
формирования новых включений по реакции: х[Ме] +
+y[O] MexOy. Процесс осаждения продукта МехО у на
поверхность включения ПОДЛОЖКИ лимитируется диффу..
зней paCTBopeHHoro кислорода. Поток П (r/c) вещества
МехО у на частицу равен: П ==4 rcrBDo С[О] (М/16), rде Do......
коэффициент диффузии кислорода; С[О]....... концентрация
I{ИСLТIорода в расплаве, r/cM 3 ; М молекулярная масса
МехО у ; 16............ атомная масса кислорода.
Скорость увеличения размера включения drB/d't при
этом составит: drB/d't==Do cM/(16pBr B ), rде PB плотность
ВКLТIючения. Таким образом, сохранившиеся в металле мел..
I{ие включения укрупняются быстрее, чем более крупные.
Этот процесс наряду с явлением более интенсивной экстра..
u
ПОL1JЯЦИИ мелких включении в шлак приводит к тому, что
одним из результатов ЭШП ЯВJlяется относительно более
резкое снижение содержания мелких неметаллических
v
ВI{LТIючении по сравнению с крупными.
Поведение серы
Обычно целью ЭШП является понижение содержания се..
ры в металле. Степень удаления серы при ЭШП, как пра..
.вил:о, составляет 50 75 О/О и зависит от содержания серы
в IIСХОДНОМ металле, состава шлака и атмосферы над
шлаком, режима переплава, рода и полярности тока.
При использовании высокоосновных шлаков с большим
содержанием СаО, имеющих в своем составе карбид каль..
ция СаС 2 , содержание серы в металле может быть сниже-
но ДО 0,0025 о/о. Обычное содержание серы в металле после
ЭШП составляет 0,006 0,010 о/о. Наиболее существеНН9е
влияние на степень десульфурации при ЭШП оказывает
.
состав шлака.
. При эшп на фторидных шлаках содержание серы в
отработанном шлаке, как правило, не только не повыша..
ется, а даже за 1етно снижается, если процесс идет в атмо"
сфере, содержащей кислород.
Данное явление связано с тем, что существует два типа
u
реакции, управляющих содержанием серы в процессе
ЭШП между шлаком и металлом (1) и между rазом и
шлаком (2): 1) [5] + (02 ) == (S2 ) + [О]; 2) (S2 )-t.
+З/ 2 {О2} == {S02} + (02.....). Суммарная реакция процесса де..
сульфурации в данном случае имеет вид:
[S] + 3/1 {О2} === {50:!} + [О].
(376)
223
Таким образом, процесс десульфурации при ЭШП Cu"
стоит из следующих стадий: 1) диффузии серы из объема
металла к поверХНОСТI-I раздела металл шлак; 2) пере-
'Хода серы из металла в шлак; 3) переноса серы от по-
верхности раздела металл Ш.Jlак к поверхности раздела
шлак атмосфера; 4) окисления серы на rранице шлака
с атмосферой; 5) отвода продуктов окисления серы от rpa-
ницы раздела шлак атмосфера.
Равновесное с данной атмосферой содеР}l{ание серы в
металле равно: [S]p== ([ОН olKfs) (р sO. /р :). rде K KOH-
станта равновесия реакции (376); р 50 , парциальное
давление S02 в атмосфере над шлаКО 1; р О, ......... парциаль-
ное давление кислорода в атмосфере над шлаком; 10, fs.......
коэффициенты активности кислорода и серы (по rенри).
Таким образом, равновесное
содержание серы в меТ8.Jlле
должно зависеть только от
степени раскисленности метал-
ла и состава rззовой фазы.
Установлено [179], что пре..
кращение доступа воздуха к
u
шлаковом ванне, достиrаемое
u
подачеи в кристаллизатор ар-
rOHa, тормозит процесс десуль..
фурации (рис. 50) и ведет к
Рис. 50. Зависимость степени JI накоплению се р ы во Ф то р ид-
десульфурации металла при ЭШП
от введения aproH8 (пунктирная НОМ шлаке. Содержание серы
линия исходное содержание се- В исхо д ном шлаке АНФ lП
ры, 1 с расстояние от низа слит
ка): составляет 0,018; в шлаке пос-
J......c aproHoM; 2 без aproH8 ле ЭШП на воздухе 0,015, пас-
,,1Je ЭШП в атмосфере aprOH3
0,100 о/о. Зависимость CTeneHII десульфурации от состава
шлака связана с тем, что состав шлака влияет на степень
достижения равновесия на rранице раздела металл.........
шлак.
Чем больше в шлаке анионов 02 , тем леrче и ПО 1нее
осуществляется анионный обмен между серой и кислоро-
дом на rранице металл шлак 1I тем ближе концентрация
серы в поверх остном слое метаЛ.па на rранице этоrо раз:'
дела приближается к равновесной с данной атмосферой.
Наибольшее приближение к равновесию достиrается при
использовании шлаков с высоким содержанием СаО, наи-
меньшее при использовании силикатных шлаков. Следо-
вательно, в реальных процессах содержание серы в метал-
ле на ero rранице со шлаком по отнощению к атмосфере
.
[91, %
0,0"
0,02
2
,
,
.
о
20 40
lC1 ММ
- 50
224
является не paBHOBecHbI l, а квззиравновеСIlЫМ l S J Н.р.
Квазиравновесной эту величину можно считать потому,
что для каждоrо состава шлаI<а эти величины, очевидно,
должны быть постоянной характеристикой и влиять на
скорость перехода серы из металла в шлак. При данном
составе rззовой атмосферы скорость этоrо перехода может
лимитироваться диффузией серы ,,1и60 в шлаI<е, либо в ме-
талле. В условиях ЭШП с использованием жидкоподвиж-
ных фторидных И известково rлиноземистых шлаков наи-
более вероятным лимитирующим звеном является диффу-
зия серы в металле.
Считая, что условия массопереноса серы в металле на
торце электрода и на поверхности ванны примерно одина..
ковы, поведение серы при ЭШП 10ЖНО описать ypaBHe
нием:
ln (s]исх....... [S]И.Р == s ( 1 + т d 2 ) (377)
[S]ИОН [5]п.р Vo D2 '
ИЛИ
[5] :::; [S)исх....... [S]I(OH == ( 1......... (5]я.р ) [ 1 ........... e Ps /о о (1+т d!/DI)] ,
(S]исх [S]исх [5]нов
rде s......... средний коэффициент 1vlacconepeHoca серы на тор"
це электрода и на поверхности ванны; .rS]H.P......... концентра..
ция серы в диффузионном слое, квазиравновесном с дан-
ным составом шлака и атмосферы.
Нами установлено, что Прl! ЭШП под шлаком АНФ 6
металла, содержащеrо 0,03 2,O о/о С, 0'22........1'47 О/О Мп,
O,2 O,95 О/О Si и 0,51 О/О Al величина [S]И.Р не зависит от
состава металла и режима переплава и равна 0,002:1:0,001.
Коэффициент массопереноса серы sзависит rлаВНЫ 1
образом от концентрации уrлерода в металле. Какой либо
заметной зависимости s от содержания в металле lap"
,rанца, кремния и алюминия (в исследованнык пределах)
IIe обнаружено. Зависимость s от содержания уrлерода
приведена на рис. 51. Величина s имеет максимум ПрII
0,2 О/о С, что соответствует максимуму nOBepXHocTHoro натя-
жения в системе Fe C. Для сталей с> 0,5 О/о С величина
s от содержания уrлерода практически не зависит. Оче..
ВИДНО, что понижение содержания серы в металле npll
ЭШП возможно только до величины .rS]H.P и только, ес ТIИ
исходное содержание серы [S]исх превышает [S]H.P. ЕСЛJI
[S]H.P> [S]исх, то удаления серы из металла не происхо..
дит, И даже может иметь место ззrрязнение металла серой
шлака.
15 675
225
На рис. 52 ,nриведены данные, характеризующие влия-
ние исходноrо содержания серы в стали ШХ15 на содер-
жание серы после ЭШП под шлаком АНФ-6 [179]. Из
рис. 52 следует, что для стали ШХ15 при ЭШП ПОД шлаком
АНФ-6 '[S]H.p===O,00470,005 о/о.
c.l 5
... 1.0
I J
.
o,5
[SJ.1шп10/"
4012.
0,009
/
/
/ . ....
/ r' .,.. .
. t.N.\!t .
.
0,008
о
1
.2-
[C %
0,00'1 0,008 D,01Z 4016
lSJ эд , 0/"
f}
Рис. 51. 3аВI1СJlМОСТЬ коэффициента
ыcconepeHocaa серы в металле при
ЭШП от содержания yr.'1epoAa
Рис. 52. Связь между ИСХОДНЫМ
(S]эп и конечным [S]ЭШП coдep
жаннем серы в метап.пе при ЭШП
Электрический режим, определяя массовую скорость
u
плавки и линеиную скорость наплавления слитка Vo, дол-
жен заметно влиять на десульфурацию при эшп. Повы-
шение скорости плавки и линейной скорости наплавления
слитка должно приводить К ухудшению удаления серы из
металла.
Поскольку в реакции десульфурации принимают уча-
стие электрически заряженные частицы (ионы серы и кис-
лорода), род тока и ero полярность должны влиять на
процесс удаления серы из металла. В первую очередь не-
обходимо учитывать возможность протекания процесса
электролиза. На аноде при этом происходит реакция
(S2 ) === [5] +2е, одновременно на катоде возможна обрат-
ная реакция: [5] +2е== (S2 ). При использовании пере-
MeHHoro тока эти реакции как на оплавляемом торце
электрода, так 11 на поверхности ванны взаимно компенси-
руют друr друrа, и электролиз серы из шлака не получает
развития. При использовании постоянноrо тока может
u
IIMeTb l\1eCTO электрохимическии перенос серы от катода к
аноду через шлаковый расплав. Кроме Toro, необходимо
иметь в виду, что шлаки ЭШП содержат серу, которая
может выделяться на аноде. Шлак АНФ-6 дО переплава
содержит O,03 O,04 S О/О [179]. При таком содержании
серы в шлаке ее элеКТРОЛИТIIческое выделение на аноде
2!6
может существенно влиять на процесс удаления серы ИЗ:
металла.
Кроме электролизных явлений на электродах, исполь-
зование постоянноrо тока прlIВОДIIТ к ВО3НИК!lовению в.
шлаковой фазе направленноrо потока анионов серы (от
}{атода к аноду). Поскольку в процессе десульфурации npJI
ЭШП большую роль иrрает окисление серы на rранице
шлака с rазовой фазой, условия транспортировки серы к
v
этои rранице должны существенно В 71ИЯТЬ на ход процесса.
При переменном токе, коrда направленный элеКТРОХII-
v
мическии перенос серы в шлаке отсутствует, сера перено-
IIТСЯ к rранице с rазовой фазой rлавным образом блаrо-
даря конвективным потокам в шлаке. При наличип интеН8а
сивных потоков в шлаке этот процесс не ЛИ iитирует общеrо
процесса десульфурации, который в данном случае
,пимитируется диффузией серы в металле. При постоянных
о
токе и полярности электрод анод электрохимическои
перенос серы от ванны I{ электроду способствует транспор-
тировке анионов серы к rранице с rазовой фазой. В случае
v
противоположноя полярности электрод............ катод электрохи-
v
мическии перенос препятствует поступлению серы в rазо...
вую фазу, что должно привести к ухудшению условий де-
сульфурации в целом.
В табл. 23 приведены данные работы [179] о влпянии
рода тока и полярности на десульфурацию среДI-Iеуrлеро...
диетой стали (0,4 о/о С, 0,3 О/О Si, 0,69 О/о Mn, 0,032 о/о S,
0,017 О/О Р) при ЭШП под различными шлаками. НаИЛУЧ 8а
шие результаты по десульфурации достиrаются при IIC"
пользовании nepeMeHHoro тока. При постоянном токе и по-
лярности электрод............ анод степень десульфурации несколь..
!{О снижается. Ухудшение десульфурации связано с
электролитичеСКlfМ выделением на аноде серы, содерЖЗ 8а
т а б л и ц а 23, Влияние рода тока на деСУJlьфурацию при эшп [1791
РОД "ока
Полярность
Содержание серы после ЭШП
ПОД шлаками. %
АНФ-l I АНФ- 6 1 АНФ- 9 1 АНФ-7
0,017 0,013 0,009 0,006
0,032 0,036 0,039 0,034
0,018 0,015 0,011 0,015
Переменный
»
, Постоянный
Электрод катод
Электрод анод
n р п м е ч а н и е. Исходное содержание серы в металле 0.032 %. Состав шла-
ков: АИФ-l 95 % CaF 2 ; АНФ.6 70 0 ю СаF 2 +ЗО % А1 2 О з ; АНФ-9 80 % CaF +
+20 % M O; АНФ 7 80 % СаР2+20 % СаО.
]5*
227
щейся в шлаке. Однако этот процесс в значительной степе..
ни скомпенсирован интенсификацией транспортировки се..
ры с rраницы с rазовой фазой. При полярности элект..
u
pOД KaTOД условия такои транспортировки резко ухудшены
и электролиз серы на аноде ванне не только приоста..
навливает процесс десульфурации, но и пирводит К неко"
u
торому насыщению метаЛLТIа серои из шл.ака.
Поведение азота
Поведение азота при ЭШП зависит от мноrих факторов,
в чаСТIIОСТИ от исходноrо ero содержания в металле и
формы, в которой он в нем присутствует, от состава шлака,
режима переплава и т. д. При ЭШП сталей, не содержа-
щих нитридообразующих элементов, степень удаления азо..
та тем выше, чем больше ero исходное содержание. l1ри
ЭШП сталей, содержащих такие нитридообразующиЕ'
элементы, как титан, ниобий, азот из металла почти не
удаляются. Имеют место даже случаи HeKoToporo повыше..
ния азота в металле после ЭШП таких сталей. Определя..
ЮЩИМ моментом в данном случае является способность
шлака адсорбировать нитридные включения. Фторидные
шлаки типа АНФ..IП и АНФ..6 обладают слабой адсорби..
рующей способностью по отношеНИIО к нитридам ниобия и
титана.
На поведение азота при ЭШП влияет состав шлака.
Шлаки ЭШП являются безжелезистыми, а такие шлаки
оБL1Jадают повышенной способностью растворять азот. IIри
u
переплаве уrлеродистых сталеи под шлаками систем
А1 2 О з ........СаО; с а F 2 ........Al20з; А1 2 О з ........СаО возможны образо..
вание в шлаке ионов CN и перенос ими азота из rазовой
фазы в мета.ПЛ. Введение в шлак Si0 2 снижает раствори..
мость азота в шлаке и улучшает удаление азота из металла
при эшп. Поведение pacTBopeHHoro азота при ЭШП MO
жет быть описано уравнением:
In [N]исх........ [N]P8BH == PN ( 1 + т d 2 ) (378)
(N]f(OH ....... [N] равн V o D t
Т. е. L7IIIМИТИРУЮЩИМ звеном удаления азота является вну"
тренняя диффузия азота в металле к rраницам раздела
металл ш Т]аI{о Таким образом, предельное нижнее со..
держание азота после ЭШП определяется ero равновесной
u
концентрацпеи на rранице металла и шлака, т. е. величи..
ной [N]рзвно
Для слу,чая ЭШП среднеуrлеродистых сталей под шла..
I\:OM АНФ..6 равновесная между металлом и шлаком кон..
228
центрация азота [N]рзвн==о,006+0,03[0/0 N]ш, rде [0/0 N]ш
концентрация азота в шлаке. Коэффициент Iассопереноса
азота в металле в условиях эшп N (5,7::1:: 1) .10 5 м/с.
Прli содержании уrлерода в металле r-..I 0,2 О/О веЛIIчина N
понижается до (4::1:: 1) · 1 0 5 м/с. Это явление tvlожет быть
связано как с влиянием caMoro уrлерода на Nt так Ii
с тем, что при содержании в стали 0,2 О/О С ухудшаются
условия удаления из металла серы и IIеметаллическItх
вк.пючений, а по данным работы [187], повышение серы If
кислорода в металле ПОНIlжает N.
Такое значение N соответствует эффективной темпера
туре процесса на поверхности раздела металл шлак
tзф=== 1750 ос. Влияние электрическоrо режима на значения
-[N]рзвн и N обнаружено не было. Режим переплава ока-
зывает сложное влияние на поведение азота при эшп.
Поскольку N практически не зависит от режима, т. е.
v v
ОТ скорости переflлава, повышение линеинои скорости на-
плавления слитка Vo должно приводить К ухудшению ра-
финирования металла от азота. Вместе с тем, режим
переплава влияет на величину заrлубления оплавляемоrо
конца электрода в шлак и на проrрев электрода. При плав-
лении лектрода вблизи поверхности шлаковой ванны мо-
жет происходить не только усиленное окисление металла,
но п поrлощение им азота llЗ атмосферы воздуха. Таким
образом, режим переплава может влиять на величину
[N] иех. .
Если _ вести ЭШП при неизменных значения силы тока
и Jlапряженпя на источнике питания, то к концу плаВI{И в
v
связи с нарастанием напряжения на шлаковои ванне за..
rлуб.лепие электрода в шлак уменьшается li возможно по..
вышение содержания азота в верхней части слитка L 188].
Для предотвращения этоrо явления переплав необходимо
вестн на дифференцированном режиме, постепенно пони..
жая силу тока li напряжение на источнике питания по ходу
П,лавки.
На удаление азота при ЭШП может влиять процесс
восстановления алюминия из шлака. В работе [179] в ре-
зультате ЭШП стали зохrСНА содержание азота повыси-
лось при увеличении остаточноrо алюминия до 0,3 U/ O . При
u
дальнеише I повышении содержания алюминия содержа-
ние азота в металле после ЭШП ПОНIIжалось. Влияние
TliTaHa аналоrично влиянию алюминия. Удовлетворитель-
ное объяснение этоrо явления пока не найдено.
Таким образом, содержание азота в металле ЭШП
можно реrулировать подбором шлака и режима перепла-
229
ва. Степень удаления азота при ЭШП стаLlIей, в которых
азот находится в растворенном состоянии, находится в
пределах 15 30 о/о, Т. е. неСI{ОЛЫ{О хуже, чем при способе
ВДП.
Поведение водорода
Поведение водорода при ЭШП подчиняется тем }I{е кинети-
ческим закономерностям, что 11 поведение азота:
]n [%H]lJcx [%H]paBH, == H ( l+m d: ) , (379)
[%H]ROII......... [%Н]равн V o D
rде Рн коэффициент 1\1aCCOnepeHoca водорода в металле.
При 1750 ос н== (3,3::1:0,2) · 10 2 см/с.
При таком высоком значеНIIИ I{оэффициента массопе-
реноса поведение водорода определяется rлавным обра-
зом величиной [О/О Н]равн концентрацией водорода, рав-
v
новеенои со шлаком.
Удаление водорода из металла nplI ЭШП ВО3 fОЖНО
только, еСЛII [О/О Н]равн< [О/О Н]:исх, иначе будет иметь fe-
сто насыщение металла водородом. Поскольку содержа-
ние водорода в шлаках может достиrать 20 млjlОО r,
очень ва>кна специальна подrотовка шлаI{ОВ ЭШП (про-
ДУВI<а aproHoM во время выплавки Ш.пака, прокаливание
шлака перед ЭШП).
Концентрация водорода в шлаке в процессе ЭШП опре-
деляется не только исходным содержание 1 водорода, НО и
водородом, попадающим в Ш.пак из атмосферы, по реак-
ции: {Н 2 О} + (02 ) ==2 (OH ). С повышением содержания
v v
водяных паров над шлаковом ванон в металле увеличива-
ется содержание водорода. Это увеличение значительно
Прl! использовании известковистых шлаков I-f чистоrо фто"
рида кальция. НаИЛУЧШИМlI защитными свойствами обла-
дают Фторидно-rлиноземистые Ш 7Jаки типа АНФ..6 и сили-
катные типа АН-В. Защита поверхности шлака aprOHoM
позволяет понизить содержание водорода в металле. Для
шлаков системы CaF2 CaO (АНФ-7) и СаF2 АI20з"""'"
CaO.........MgO (АН-291) обычной выплаВКII при ЭШП без
защитной атмосферы связь между [О/О Н]равн и содержани-
ем водорода в шлаке (Н) имеет вид: [0/0 Н]равн==3,6Х
Х IO 5 (Н) * о/о; для шлака АНФ-6: [О/О Н]равн===2,ОХ
Х 10 5 (Н)* 0/0; для чистоrо фторида кальция: [0/0 Н]равн===
===2,5. 10 5 (Н) * о/о. При ЭШП в атмосфере aproH3
'Ic (Н) в мл/lОО r.
230
величина [0/0 Н]рзвн пони}кается в 1,7 1,8 раза. Содержа-
ние водорода в металле изменяется по мере наплавления
слитка. Очень часто металл самой нижней части слитка
имеет наибольшую концентрацию водорода, так как при
u
наплавлении этан части из шлака недостаточно удален
водород. По мере наплавления ПРОИСХОДИТ некоторое ра-
финирование шлака ОТ водорода и в системе атмосфера
шлак............ металл устанавливается равновесие. По степени
удаления водорода процесс ЭШП уступает вдп. В зави-
СИМОСТИ от качества подrОТОВI{И шлаков и режима перепла..
ва степень удаления водорода колеблется в пределах
о зо о/о. При использовании плохо подrотовленных, сырых
шлаков может иметь место насыщение металла водородом.
VIII.4. РАФИНИРОВАНИЕ МЕТАЛЛА ПРИ ЭЛП
ЭЛП по сравнению с вдп по условиям рафинирования
мета.:1JЛ3 имеет следующие особенности:
1. Меньшую толщину жидкой пленки на торце заrотов-
КИ, составляющую при ЭЛП "" О, 1 мм, что связано с осо-
бенностями стекания мета.Н.па с I{оническоrо или скошен-
Horo торца. Отсюда большая скорость движения металла
в П8l1Jенке и в 3 4 раза больший коэффициент массопере-
носа. для коничеСI{оrо торца средний коэффициент мас-
сопереноса равен:
==
4 (1 + 1/2") D i sin ср/2 V 3 / ео cos rp/2 3/
V 3 1 V Э ,
1t 2 'а v
(380)
rде <р уrол при вершине конуса;" кинематическая
вязкость. В зоне каплеобразования величина f} определя-
ется по фОРl\1уле (350) при 11== 1. .
2. Более высокую эффеКТИВНУIО температуру процесса
на поверхности ванны.
3. Возможность более длительной выдержки металла в
вакууме, так как процессы плавления эаrотовки и подоrре-
ва ванны npll ЭЛП MorYT осуществляться раздельными нс..
точниками тепла независимо друr от друrа. Это позволяет
наплавлять слиток и проводить рафинирование металла
v
в ванне пр" сколь уrодно малои скорости плавки.
4. Большую удельную поверхность металла на кониче-
ском или скошенном торце по сравнеНИIО с плоским торцом
при вдп.
231
Температурный режим процесса ЭЛ П
TaI{ же, как при ВДП и ЭШП, те fпература металла на
поверхности ванны при ЭЛП распределяется HepaBHo Iep-
но. Она максимальна в центре и минимальна на перифе-
рин. Перепад температур между центром 11 периферией
достиrает IOO 200 К. Управление разверткой электронно-
ro луча, дающее возможность дополнительно nporpeBaTb
периферийные зоны, позволяет снижать этот перепад до
50 К. Подробно вопрос о температуре металла при JIП
рассмотрен в работе :[ 189]. Средняя эффективная темпера..
тура поверхности ванны при ЭЛП является Функuией
v v
удельнои мощности, поступающеи на поверхность ванны:
Руд.в==Рв/Р (Р В общая мощность электронных лучей, обо-
rревающих ванну; F площадь поверхности ванны). Для
оцеНI{И эффектпвной температуры Т зФ при PYД.B 1,2 KBT/C 12
может быть использована формула:
Т ЭФ === Т пИК T шах [Руд.в/(Руд.в + P Д.B)]' (381)
rде Т лИJt ............ температура ликвидуса, К; 6.Т шах максималь..
но возможный переrрев К. Для железа T шах 580 К;
P Д.B постоянная величина. Для сталей Р Д.B
4600 кВт/м 2 . Обычно плавки проводят при Руд.в== 10007
76000 кВт/м2, что соответствует neperpeBY ванны на
lOO 330 К.
Удаление растворенных 2азов и летучих nримесей
При ЭЛП происходит значительное удаление из металла
.
азота, водорода, неметалличеСI{ИХ включении и цветных
примесей [189 191]. Из работ, посвященных механизму
удаления примесей из металла при ЭЛП, необходимо от-
метить [187, 192, 193]. Если удаление примеси при ЭЛП
лимитируется внутренней диффузией, то кинетика процес..
са описывается выражением:
ln Со/С НОН == (l/v o ) [Рв + т пл (d 2 /D2)J. (382)
Равновесной поверхностной концентрацией примеси
здесь можно пренебречь, так как в условиях IIИЗКИХ оста-
точных давлений (P <O,1 Па)Сiп Сi, поэтому, если удале..
v
нне примеси лимитируется реакциеи nepBoro порядка, что
характерно в частности для процесса испарения, то для
расчетов следует пользоваться выражениями (334), (335)
и (337). Если же процесс лимитируется реакцией BToporo
порядка (удаление азота), то рекомендуется ПОJIьзовать-
ся формулами (342) и (343). При этом величины Кпл опре..
232
деляются при температуре пленки Т пл === Т лик + (1 2) 1(,
а Кв при Тэф. Отличите.ПЬНОЙ особенностью ЭЛП ЯВ ТIяеrся
управляемое распределение общей мощности Р между за
rотовкой (Р З ) И ванной (Р В ). Поскольку Р===РЭ+РВ, то
соответственно относя удельные мощности к площади зер- .
кала ванны, имеем Руд===Руд.з==Р).д.в. Если обозначить
Ре! Р==Руд.в/Руд через п, то
Т эФ == fпик + L\Tmax[(nPYA)/(nPYA + д.B)]' (383)
Видно, что при малых значениях Руд увеличение п СИЛЬ
нее сказывается на росте температуры, чем при большой
Р}.д. Если принять, что массовая скорость плавки при ЭJIП
g== (Рз/Q) , rде Q.......... количество тепла, необходимое для
наrревз, расплавления и HeKoToporo (на 1 2K) neperpeBa
металла, то
V g
о
nR2 р
Р З
Qрп R2
р }"д.:1
Qp
Руд ( 1 п)
Qp
.
(384 )
Отсюда для процесса испарения примесей, считая К ==
=== Koe E/HT получим:
I п .Е!.== QpK o (е Е/RТил+е Е/RТэф). (385)
с Руд (1 ...... п) .
Для процессов удаления растворенных rазов справеД lИ
во выражение:
t!.c == Со /[ С о + Руд (1 n) (e E/RT ил + е Е/RТ8Ф) ] . (386)
со Qp Ко
Из приведенных ФОР fУ.п видно, что степень рафиниро-
вания металла при ЭЛП определяется такими факторами
электрическоrо режима I<aK полная удельная мощность
Руд 11 доля мощности, поступающей в в.анну n.
На рис. 53 показана зависимость степени удаления BO
дорода от оп дЛЯ различных значений Руд. Из рис. 53 ВИД
но, что степень рафинирования непрерывно увеличивается
с ростом n. Наиболее реЗI{ое )'веЛIIчение степени рафини
рования наб r]юдается при п>О,7 7 О,75. Это ПОIl1Jо)кенпе
справедливо для всех случаев рафинирования метаЛLТIа при
ЭЛП от растворенных rазов и ТIетучих примесей. Если пе
u
реплавляется металл, не содержащии летучих составляю
щих (например, марrанца), потери которых IIежелателыI,'
величину п следует выбирать в пределах O,75 O,85, обес
печивая хорошее удаление водорода, азота II вредных лету
чих примесей. В противном случае п выбирается в преде
233
лах O,4 O,6. При одном 11 TO ! же значении п полная
удеЛЫ1ая МОЩНОСТЬ Руд оказывает С,,10жное влияние на
механизм рафинирования. С ОДНОЙ стороны, увеличение
Руд ускоряет процесс наплавления и СНIIжает длительность
рафинирования, а с др)тrой с YBe
[Нl личением Руд повышается те lпера--
Zn lICX тура поверхностноrо слоя металла
Z [НJI(OH в ванне и ускоряется массоперенос
О примесей. Это ПРИВОДIIТ к тому, чrо
сначала с pOCTO 1 Руд степень рафи-
нирования металла снижается а за-
u .
тем, проидя через минимум, начина-
ет возрастать. МИНИ lальная сте-
пень рафинирования металла от'
примеси будет иметь f\,leCTO при ус-
ЛОВIlИ РУД.В===Р КР . В 11 p)'д PYД.KP:
р p.]) == пР уд.нр 4 /[ оА.Т шах Х
р ,,"Д.В Т ЛЯК
10
1
2
о
0.5
'1
O
л
Рис. 53. Зависимость степе
НII удаления водорода от п
при ЭЛП
1 Руд ==6000 кВт/м 2 ; 2
Р }' Д 3000 кВт/м2
Х ( Е 2 )]
RT Л1JН ·
(387
Таким образом, наихудшие ус.-
ловия рафинирования определяют
. u
ся не полнои удельном МОЩНОСТЬЮt-
U u
а удельнои мощностью, подаваемои на поверхность ванны.
Рабочие значения Руд, РУД.В И РуJJ..З, кроме УСЛОВIIЯ xo
рошеrо рафинирования, выбирают также из условия полу-
чения определенной желаемой структуры слитка. Характера
структуры 80 MHoroM определяется формой профиля кони
ческой части ванны, т. е. коэффициентом формы ванны
КФ===Нн/R. В частности, отсутствие осевой пористости
обеспечивается при условии Кф l. При заданной величи-
не К Ф удельную МОЩНОСТЬ при ЭЛП определяют по фор-
fулам:
Р-уд.з === (4р Qa Кф)/R сл ;
Р уд . в == [n/(l.........п)] Р уд . з == [n/(l ........п)] [(4рQаКф)/R сп J;
Р iД === Руд.з/(I .........п) == (4р Qa Кф)/(l n)Rcп.
(388}
(389)
(390)
Значения эффективноrо I{оэффициента температуропро-
водности находятся в пределах (3 4). 10 6 м 2 /с, что соот-
ветствует значениям произведения 4 pQa, равным 1200...........
1600 кВт/м. Следовательно, при п 0,7 11 Кф О,5+2,О
рабочие значения Руд.в для установок ЭЛП с радиусом
234
слитка >5 см, как правило, ниже значений Р КР . В . В этих
случаях понижение Р уд . В , а следовательно, при дaHHO 1 п
понижение Р УД . В И Руд должно приводить К улучшению ра-
фlIнирования. Вместе с тем в ряде случаев бывает необхо-
ДIIМО вести процесс так, чтобы сохранять ценные леrиру..
ющие, например, хром. В этом случае необходимо, чтобы
РУД.В==Р НР . В , а между радиусом слитка и величиной n име-
&110 место соотношение:
n== [ 1 + А mахраQКф ( R: 2) ] 1. (391)
Р УД.В Т ПЛ RClI пл
Таким образом, при увеличении радиуса слитка и при
неизменном коэффициенте формы ванны для обеспечения
минимальных потерь летучих леrирующих, необходимо по..
вышать долю МОЩНОСТИ, подаваемой па ванну. Если же
u
эта ДОЛЯ остается постояннои, то для сохранения мини..
мальных потерь необходимо увеличение коэффициента
формы ванны. В целом ЭЛП позволяет удалять из метал..
ла до 85 95 О/О водорода, 70 90 О/О азота, 80 о/о меди, 90
95 О/О сурьмы, 98 99 о/о свинца. Потери марrанца в сталях
MorYT достиrать 60 80 О/о, а в никелевых сплавах состав..
ляют 30.........50 о/о. Вместе с тем потери при оптимальных с
ТОЧI{И зрения этих потерь ре>кимах переплава MorYT не пре
вышать 20 О/О. Содержание кремния, серы и фосфора ПОС 1Jе
ЭЛП практически не изменяется. Общие потери металла
на испарение при ЭЛП составляют 4 5 О/о.
Удаление неJ1tетаЛЛllttескuх включений
3аI{ономерности удаления неметаллических ВI{лючений при
ЭЛП аналоrичны тем, которые имеют место при ВДП при
ана&1JоrИЧIIЫХ температурных режимах. Вместе с тем при
ЭЛП в области фокальноrо пятна, rде температура превы"
тает среднюю эффективную, может иметь место активное
испарение некоторых субоксидов, имеIОЩИХ высокое дав-
7Iение насыщенноrо пара (NbO, ВО, ZrO, SiO, AIO), обра-
зующихся по реакциям:
МехОу(т,ж) == х{МеО} + (у х) [О];
Л1е х О у (т,ж) + (у х) [С] == х {МеО} + (у х) {СО}.
(392)
(393)
.Общее снижение содеР}I<ания не1\iеталлических включе..
ний при ЭЛП составляет от 50 до 90 О/О в зависимости от
хараI\:тера включений 11 режима переплава. Более нЙзкие
остаточные давления в зоне плавки, чем при вдп, более
быстрый массоперенос в п,,'!енке на торце заrотовки, БО&11ее
235
длительная выдержка металла в жидком состоянии и воз-
можность более BbICOI{oro neperpeBa создают при ЭЛП
блаrоприятные условия Д Я восстановления неметалличе-
ских включений уrлероДом. При этом возникает возмож-
ность rлубокоrо BaKYYMHoro обезуrлеРО)l{ивания особониз-
}{oyr леродистых стаiIей [194].
r n а в а 'Х
ИРИСУ АЛЛИЗАЦИЯ И ФОРМИРОВАНИЕ
ЭЛЕКТРОСТ АЛЕПЛАвильноrо СЛИТКА
в настоящее время распространены различные методы по-
лучения слитков. Основную часть слитков все еще получа-
ют при разливке металла в изложницы. Однако с каждым
rодом все большее распространение получают машины не-
прерывноrо литья заrотовок (МНЛ3) и машины полуне-
npepbIBHoro литья заrотовок (МПНЛЗ), а также методы
специальной электрометаллурrии. Во всех этих случаях
металл затвердевает в медных водоохлаждае 1ЫХ кристал-
лизаторах. Закономерности формирования слитков во всех
u
перечисленных случаях имеют, с однои стороны, MHoro
общеrо, а с друrой характеризуются рядом особеннос-
тей. Например, при разливке металла в изложницы фор-
мирование слитка практичеСI{И llзчинается ПОС.ТIе Toro, как
вся изложница заполнена металлом. Поступл:ения новых
u
ПОРЦИIl металла в изложницу в процессе затвердевания
слитка не происходит. По аналоrии с терминолоrией "ТIJI-
тейноrо производства, rде отливка, получаемая в подобных
условиях, называется отливкой рззовоrо формирования,
u
.такои слиток можно характеризовать как слито1\, разовоzо
формирования (Срф). в слитках же, получаемых на
.i\'lНJlIЗ, МПНЛЗ и в переплавных процессах, затвердевание
. металла сопровождается непрерывным поступлением в
кристаллизатор новых порций жидкоrо металла. При этом
u
В зависимости от конкретных условии массовая скорость
затвердевания может быть равна массовой скорости по-
ступления жидкоrо металла, может быть меньше ее 1I, на-
конец, может ее превышать.
В случае равенства этих скоростей имеет место так на..
зываемый квазистационарный процесс формирования слит-
ка. В случае их неравенства процесс формирования слитка
нестационарен. Квазuстацuонарный процесс И fеет место
при получении слитков на МНЛЗ и при разных видах про-
236
u
цессов переплава при малои скорости наплавления СЛIIТ-
КОВ. Слитки, полученные в этих условиях, можно характе-
ризовать как слитки непрерывноrо формирования. СЛИТКJI,
полученные МПНЛЗ, а также при переплаве с повышенной
скоростью наплавления, формируются внестационарных
условиях затвердевания. Такие слитки можно отнести к
слиткам полунепрерывноrо формирования. Одной из важ-
u
неиших задач, стоящих перед 1\1 таллурrами, является по-
лучение слитков с максимальной ХИМIIческой и q)изической
однородностью металла.
IX.1. ЗАТВЕРДЕВАНИЕ СЛИТКА
РАзовоrо ФОРМИРОВАНИЯ
Слиток разовоrо формирования, отлитый в изложницу, ха..
рактеризуется тем, что основная часть ero тела кристаЛ ifJI"
зуется при радиальном отводе тепла к стенкам изложницы.
Вертикальная составляющая скорости кристаллизации nplI
этом практически отсутствует. Точка на фронте !<ристаЛЛ11-
зации движется rоризонтально, и вектор ее CKOpOCTII по
величине и направлению совпадает с вектором CKOpOCTJI
u
утолщения твердои корочки металла в данном rОрИЗ0Н"
тальном сечении слитка. Обычно для определения ТОЛЩJI-
ны корочки затвердевшеrо мета ла , образующейся npll
кристаллизации стальноrо слитка, пользуются так назы-
ваемой формулой квадраТНОёО корня: KV 't (-r вре..
мя; К постоянный коэффициент, подобранный эмпири-
чески). К, по данным различных авторов, колеблется 8
зависимости от марки стали в пределах 1,7 2,7 см/мин о ,5
,(O,220 O,362 см/с о ,5). Однако практика показываеt', ЧТО
закон квадратноrо корня выполняется не всеrда. Достаточ-
но хорошо описывая начальную стадию затвердевания пе-
риферийной зоны слитка, этот закон дa T отклонения от
эксперимента при рассмотрении затвердевания централь..
u
нои зоны.
Кроме Toro, значения коэффициента К, подобранные
эмпирически, не MorYT полностью отразить влияние таких
факторов, как теплофизические свойства затвердевающей
стали и условий разливки, в частности температуру раз-
ливаемоrо металла.
Для вывода зависимости между величинами 6 и 't В
работе! были сделаны следующие допущения: 1) теплоем..
J Белянчиков л. Н. Формирование слитка спокойной стали (раз
де..1 курса «Производство стали и ферросплавов». Курс лекций). 1.,
МИСиС, 1975. 143 с. с ил.
2;37
I{OCTb И теплопроводность ft.fетаЛLТIа не ависят от темпера..
туры и фазовоrо состоян ия 1ета,П 1а; 2) температура в
u u
затвердевшеи корке IIзменяется по линеиному закону.
С учетом принятых доп}?щений решение уравнения тепло-
Boro баланса имеет С"lедующиЙ ВIIД:
( , ) 2.......... . + 2С ( tRP + t!t) ( ) 3 +
R сл 3 + с ( tRP + Ы) R сл
+ С(Ы,ф+Ы) ( ) 4
:Е + с ( tRP + t!t) · R сл .........
2Bi · А t с....... и т
p[I+C(MHP+M»)R ·
(394)
('де скрытая удельная теплота кристаллизации; С
удельная теплоемкость жидкоrо металла; tRP темпера..
турный интервал кристаллизации; /).t............. переrрев MeTaJ1Jla
Ilад температурой ликвидуса; л......... коэффициент теплопро-
водности твердоrо металла; tс и......... перепад температур
между СЛИТКОМ и изложницей, в среднем l1tс и==275 К;
-р плотность металла; 't' вреl\1:Я; Bi критерий Био.
За исключением последнеrо момента, коrда в центре
'СLТIитка затвердевает двухфазная зона, затвердевание слит-
ка (отливки) протекает при постоянном значении крите-
рия Био [195]. Обработка экспериментальных данных пока..
зывает, что для стальных СЛИТI{ОВ, отлитых в изложницу,
можно принять Bi==O,74. Длительность полноrо затверде-
вания СЛИТl<а обознаЧIf 1 через т 11 определим из условия
-r=='t при s==Rcп:
Т1; == pR [ + 2С (L\t KP + Ы)]/(6лL\t пВi).
(395)
:V!звестиа эмпирическая формула В. М. TareeBa, об06-
.щившеrо мноrочисленные экспериментальные данные по
u u
затвердеванию СПОI<ОИНОИ стали в изложнице: 'C ==
2
==0,112 Rcп, rде '{ ПРОДО"ТIжительность затвердевания
'СIlТIитка, мин; Rсл радиус слитка, см. Проведем сравне-
Hlie результатов, получаемых по формуле (395) и по фор..
MYLТIe В. М. TareeBa, на примере ста&ТlИ ШХI5. Примем для
этой стали следующие значения теПL10физических констант:
== 270 КДЖ/I<r; л == 34 Вт/ (1\[. 1<); с === 645 Дж/ (Kr. К),
,L\t Kp === 120 К; р==6950 Kr/f.f 1 3. Переrрев t:,.t принимаем рап-
HbIl\I 0 50 К. ПОЛУЧИ f Т == (0,107...;-..0,123) R2 мин. При
дt==20 К результат совпадает с данными В. М. TareeBa.
В безраЗ fерных координатах /R 't/T уравнение затвер-
'238
девания слитка принимает вид:
( ) 2 2 :Е + 2С (М"р + At) ( ) 3 +
R cп .......... з. + с (L\t ир + L\t). R сл
+ С (Аt ир + At) ( ) 4
+ с (МИР + At) R сл
+ 2С (6t яр + At) 't
.
3 [ + с (bl ир + At)] ,
На рис. 54 показана зависимость / RC.i от Т/Т ;I.J1Я
стали ШХ15 ПрИ различном neperpeBe мета l1ла над те!\У..
.
(396)
t/R
O
/R
O
5" f
/i 8
/к а
/ ,
......--5 /
Ц5 . / / O
/ (,8
/1
/,/
//
/;"
61
ol
.з
..... ..... "
0,5
'.
о
0,5
O
:L
'&1:
о
0,5
go
ViЁ
Рис. 54. Расчетное изменение толщины твердой коронки в процессе затвердева-
ния слитка разовоrо формирования сталн ШХ15 при переrpеве О (1), 20 (.2), 70
(8), 120 К (4) и теоретическая заВJIСИМОСТЬ, соответствующая закону КВ8дратното
корня (5)
Рис. 55. Сравнение экспериментальных (1 8) и расчетных (4. 5) данных об из-
менении толщины твердой корочки в процессе затвердевания спитка разовоrо
формирования диаметром 125 (1), 200 (2) и 400 (3) мм:
4 закон KB8ApaTHoro корня; 5.... расчет по формуле (256)
пературой ликвидуса при разливке. Наряду с результата-
ми, полученными по формуле (396), на рис. 54 приведен
rрафик, соответствующий закону квадратноrо корня. За-
кон квадратноrо корня тем лучше описывает процесс за..
твердевания слитка, чем выше переrрев металла, шире ИН-
тервал кристаллизации, больше удельная теплоемкость
металла и меньше скрытая удельная теплота кристаллиза-
ции. На рис. 55 приведены экспериментальные данные, по..
лученные Н. и. Хвориновым [19В] в сравнении с расчетными
кривыми. Расчеты выполнены по формуле (396). Сов...
падение расчетных данных с экспериментом удовлетвори..
239
тельное. Полученная зависимость ТОЛЩИНЫ затвердевшей
корочки от времени позволяет определить скорость продви
}кения фронта кристаллизации в слитке разовоrо формиро-
вания. Если слиток имеет форму цилиндра, то вектор ско..
pOCTII продвижения фронта кристаллизации по величине и
направлению совпадает с вектором скорости затвердева-
ния. В этом случае
d
v==
d,;
I + 2С ( tRP + /) R ClI
.
6 [I + с (L\t ир + А/)] '{1,:
[ + 2С (А/ир + /) 2С (А/ир + L\t) ( ) 2 ]
R сл l }.: + с (Мир + М) R сл + + с (Аt ир + М) R сл
На рис. 56 показано изменение безразмерной скорости
l{ристаЛЛlIзации по сечению слитка стали ШХ15 при раз..
lIIIЧНЫХ степенях переrрева металла. Под безразмерной
скоростью кристаллизации подразумевается величина
Vt' I Rсл. Как видно из рис. 56, скорость кристаллизации
в начальный момент затвердевания слитка бесконечно Be
лика. Затем по мере нараста..
u
ния твердои корочки скорость
кристаллизации снижается.
При малых значениях переrре..
ва скорость кристаллизации
проходит через минимум при
определенном значении /Rсл,
а затем начинает возрастать.
При больших степенях пере..
rpeBa CI{OPOCTb кристаллиза..
1.0 ции от периферии к центру
,
/R слитка убывает монотонно.
Условие появления минимума
u
на кривои скорости кри та l1"
лизации определяется выраже..
нием Llt+ tl\p< /3C, т. е. по
явление минимума значения v
Tel\I вероятнее, чем меньше степень переrрева металла, уже
ero интервал I<ристаллизации, меньше удеJlьная теплоем..
I<ОСТЬ и больше скрытая )тдельная теплота кристаЛ ТIизации.
Интерес для современной специальной металлурrии пред
.стаВ&ТIяет процесс получения полых слитков (трубных за..
rOTOBOK) в медных водоохлаждаемых кристаллизаторах.
В этом процессе затвердевание слитка проходит как по на..
иr /K
2.5
"
1&
2,0
"
1 2 3 4
\\' .J
\ I
..........
...
I
5
O
O
о
[},5
Рис. 56. Изменение скорости кри-
сталлизации по сечению слитка pa
зовоrо формирования при neperpe-
nе О ( 1 ) . 20 (2), 70 (8) и 120 К ( 4 )
.240
праВ ТIению от наружных слоев к внутренним, так и от BHYT
ренних слоев к внешним. При этом, если в первом случае
площадь поверхности затвердевания постоянно уменьша..
ется, то во втором случае она возрастает. Изменение TO ТI"
u
ЩИНЫ затвердевающеи КОРОЧКИ при затвердевании, идущем
от периферии в rлубь заrотовки, описывается уже извест..
ной формулой (396). Для корочки, образующейся при за..
u
твердевании внутреннем полости заrотовки, эта зависимость
несколько видоизменяется:
( J.. ) ! + . + 2С (M 11P + Ы) ( J.. ) З
r 3 + с ( tI(P + t).J r
С (L\tI(P + At) r ( ) 4 2 Bi 'Л tС""'R -r \
2 ( + с (Af ир + М)] · Ro r 7 == р [ + с (Аt ир + Ы)] r '
rде r радиус внутренней цилиндрической полости; Ro
радиус окружности, на которой встречаются фронт затвер..
девания, идущий от периферии к центру, с фронтом, иду..
ЩИМ от центра к периферии.
IX.1. ЗАТВЕРДЕВАНИЕ НЕПРЕрывноrо
и ПОЛУНЕПРЕРывноrо слитков
Затвердевание слитков, получаемых на МНЛЗ и МПНЛЗ,
u
характеризуется тем, что передачеи тепла в осевом направ"
1]ении можно пренебречь, поскольку длина слитка в десят-
ки (для МПНЛЗ) и даже сотни (для МНЛЗ) раз превы"
тает ero радиус. Для слитков, полученных переплавом, при
Д ТIине их, в 2,5 3 раза превышающей радиус, осевым от..
ВОДОl\1 тепла также можно пренебречь. Ванна жидкоrо ме..
талла в непрерывных и полунепрерывных слитках в общем
случае состоит из двух частей. Верхняя часть, в которой
u
ЖИДI(НИ .металл непосредственно прилеrает к стенке кри"
СТИЛ 1изатора или rарнисажу из паров и" брызr, образую..
u
ще fУСЯ на стенке, называется цилиндрическои частью.
В этой части ванны металл, отдавая тепло переrрева, еще
не кристаллизуется. r лубину этой части ванны обозначим
Н ц (рис. 57). Нижняя часть ванны, условно называемая
u
коническои, соответствует участку затвердевания металла.
Здесь жидкий металл контактирует с корочкой затвердева
ющеrо металла. rлубину этой части ванны обозначим Ни
(см. рис. 57).
Для квазистационарных условий в непрерывном слитке
HH===g/ (4'Лра), или Нн. R л ио/4а, rде g массовая CKO
рость подачи металла в кристаллизатор, Kr/c, кr/мин, r/c;
16 675
241
Vo линейная скорость наплавления слитка; а эффек"
тивный коэффициент температуропроводности. Массу }{ОНИ"
u
ческаи части ванны при квазистационарном режиме мож-
но определить из выражения: GCT.K==gR;n /8а; Ост.к===
===1tR iпpvo/8a. Зависимость величины G CT . 1 \ от массовой
скорости плавки на приме-
Р е слитков вдп показаl-iа G
ст.к,К2
на рис. 58. При нестационар- 180
нам процессе в полунепре..
20
о 1
xZ
8З
у
8' /
\ I
\ /
8 ()( А , h I
.I . I
.I&, . с' /
А С о' 1J
.
140
100
60
о r (
R
1 2. з." 5 8 7 8
g, К2/НИН
Рис. 57. Фронт кристаллизации в непрерывном слитке
Рвс. 58. Зависимость массы конической части слитка ВДП от массовой СКОРОСТ8
плавки при квазистационарном режиме для разных сталей н сплавов (Dap-
..380 ММ):
1 ХН77ТЮР; 12Х21Н5Т; 3 08Xl8HI0T
рЫБНОМ слитке
R 2 2
а н == g c:.n ....1
( п2 R 2 )
8а ....i + 2L
( 2 )
1 + 'ИР 1: l' 111
23'
пJ.tэф t СОJ1 лLJ 0(""1) ,
(397)
rде gкp массовая скорость кристаллизации; L ----- длина
накристаллизовавшеrося слитка; t cOlI ............ температура соли-
дуса; ).11......... коэффициент, 'зависящий от теплофизических
свойств металла и условий теплообмена между слитком и
2 2 2'
кристаллизатором: ).1 зф :::::: J.L 1 + (n 2 R cп/ 4L2 ). Коэффициент
).11 зависит от критерия Био и является первым корнем
уравнения: J O ().1)/J 1 (J.t) ==J.L/Bi, rде Jo(p,) и 11 (п) ........цилиН..
дрические функции nepBoro рода нулевоrо и первоrо по..
рядка соответственно. Изменение общей массы жидкой
242
ванны G подчиняется следующему закону:
dG + п. 2 Аар (f1I+ n: ) LG
dL ,! I [ 1 10 t max f1I ]
t п . с t сол 8е соп J о (111)
п 2 R рл ( f1i + п. 2 ) ( 10 tmax ....i )
== 4L t coп 8 + nR' Р.
в1":, [ 1 10 t mаж f1I ]
t п . с t coп 8t coп J 0(111)
rде t ma %. максимальная температура поверхности ванны
при данном режиме переплава; t п . с средняя температура
поверхности ванны.
На рис. 59 61 приведены примеры изменения величин
О, ОП и Оц (масса цилиндрической части ванны) при вдп
.......
.......
С Е , не G/(,KZ
. . 11,8 /( А
300 .. 10,0
'1,8кА 200 о 8,1
Z50 А 7,1
1f10
о р 6,2
8,1
2.00 150 х 5,0
150 . 'J,61<A
7,1 100
100 6,2
5,O
. )l.
" ' ,6 ' .
50 50 1"7 "!#
3,5 кА
...
О 25 50 75 100 L,CN О
25 50 75 L, см
Рис. 59. Изменение общей массы жидкой ванны по мере наппавпения с.аитка
БДП СП.'1ава ХН77ТЮР (цифры у точек ток переплава)
Рис. 60. Изменение массы конической части ванны по мере наплавпения слитка
ВДП СП.13В8 ХН77ЮР (цифры У точек ток переплава)
коррозионностойких сталей. Аналоrичная закономерность
имеет место и при друrих видах переплава (ЭШП, ЭЛП,
ПДП) с той только разницей, что в этих процессах получа-
ет большое развитие цилиндрическая часть ванны. Это свя"
заНQ с тем, что при ЭШП, ЭЛП и ПДП доля тепла, ПОСТУ-
пающеrо в ванну путем HarpeBa, больше, чем при ВДП.
16*
243
При ВДП основная ДОЛЯ тепла поступает в ванну с !<зп-
J1ЯМИ жидкоrо металла.
Такой вид зависимости G от L связан с изменением
тепловых потерь ванны по мере наплавления слитка Поте-
ри тепла через поддон при этом уменьшаются. Через боко-
вую поверхность слитка потери тепла сначала возрастают
Сц,Кё !lJ(p,zjc
Z5D 1 8HA 1
»
25
200 А 10,0
I
о 8,1
20
6.7,1
150 .
о В;2
15
х 5,0
'8-..... . 6KA 10
/
Р А.
5 jI -6--
.......
75' 100 L J cl1
о
1 l J "L/R
Рис. 61. Изменение м ассы цилиндрической части ванны по мере раСП.:IаВ."JеНИJl
слитка вдп сплава ХН77ТЮР (цифры у точек...... ток переПJlава)
Рис. 62. Изменение массовой скорости кристаллизации по мере напла,в..1еНИJl
слитка вдп сплава ХН56ВМКЮ (D ир "105 ММ):
J...... 1,2 кА; б,З r/c; 2...... 1,6 кА, 10,5 r/c; 3...... 2 кА, 15,2 r/c; 4 2,4 кА, 17,8 r/c
пропорционально L, а затем их рост замедляется, так I<aK
нижние (более холодные) части слитка имеют меньшую
теплоотдачу, чем верхние. Общие потери в .единицу време-
ни при этом минимальны при определенном значении L, а
затем возрастают, ассимтотически приближаясь к некото-
рому стабильному значению. При малой общей rлубине
ванны (плавка на относительно малых токах) затухание
роста потерь через боковую поверхность начинается рано,
и общие потери монотонно (без минимума) уменьшаются
по мере наплавления слитка. Соответственно общая масса
ванны либо имеет максимум (при повышенных токах) t
либо монотонно возрастает, стремясь к некоторому стабиль-
ному значению. Коэффициент а зависит от условий охлаж-
дения слитка, а следовательно, и от ero диаметра (радиу-
са). Ориентировочно можно принимать, что 19 a==lg ao
............1,8 R сл, r де ао коэффициент температуропроводности I (:'-
Т алл а пр и t сол; R ел ............ радиус сл итка, М.
При наплавлении слитка в вакууме критерий Био мож"
244
но оценить из BToporo выражения, связывающеrо
2R CJl (х + а о Е пv т ол)
,
nл {t caп [1 + J о (Jll)] ЗОО}
111 И Bi:
Bi ==
(398)
r де €np приведенная степень черноты €пр 0,56; ао по
стоянная Стефана Больцмана; %==1260 (1570 tсол),.
Вт Jft12.
Наличие систе 1Ы двух уравнений, связывающих 111 и
Bi, позволяет определить значения этих величин в I<аждом
конкретном случае.
На рис. 62 приведен пример изменения массовой CKOpO
сти кристаллизации по мере наплавления слитка в HeCTa
ционарном режиме. Под профилем жидкой ванны метал..
7Ja обычно понимают профи.пь конической части ванны. От..
ношение HH/R называется l(оэффuцuентоJ,1, фОрМЫ ванны..
Найти уравнение профиля конической части МО)КНО из ypaB
нения (396). Пусть фронт кристал.пизации продвиrается
вверх вдоль оси С lитка со скоростью VO. На ОСII слитка век...
тор продвижения фронта кристаллизации по величине и по
направлению совпадает с вектором скорости продвижения
тверДОll фазы в осевом направлении.
Коническая часть ЖИДI{ОЙ ванны полностью закристал...
,,7Jизуется при этом за время T ==HI(/vo, которое соответ...
ствует длите.ПЬНОСТИ продвижения твердой фазы от края
слитка до ero оси. Если на фронте кристаллизации выбрать
точку D (см. рис. 57) с координатами, и у, то твердая I{O'"
рачка толщиной S нарастает за время, пока точка D пере...
мещается по вертикали на величину Ни У, Т. е. за время
L==HK Y/vo, Отсюда 't/'t == 1 (у/ НН).
Профиль конической части жидкой ванны удобнее вы...
ражать не в координатах /R y/HI\' а в координата'{
r/R y/HH. в этих координатах уравнение профиля жид
u
кои ванны имеет вид:
у == 1 ......... з [ + с ( tRP + L\t)] ( 1 ' ) 2 +
Ни + 2С (dt ир + dt) R сл
+ 2 ( 1........... ' ) 3........ ЗС (МИР + dt) ( 1.......... ' ) 4
R CJ1 + 2С (l\tJ(P + t) R сл .
Если учесть, что С ( tl\p+ t) < , то эту формулу МО"
жно существенно УПРОСТIIТЬ:
у/Н к (1 + n) (r2/R л) n (rЗ/R ), (399,
rде п колеблется от О до 2. Профиль конической части ван..
НЫ, рассчитанный по уравнению (399) для п=== 1, ПQказан,
на рис. 63.
245
Непрерывные и полунепрерывные С.нитки непрерывно
наращиваются в кристаллизаторах. Твердая фаза в этом
случае продвиrается не только от периферии к центру, но
и ВДОЛЬ ОСИ С.питка. Осевая составляющая скорости про..
движения фронта кристаЛ.,lизации влияет на процесс за..
твердеваНIIЯ непрерывноrо 11 полунепрерывноrо СЛIIТКОВ
.
I
1 ' У/Н/(
,
/2
, ./
-----,
r/R
1
о
r/R
1
5
о
0,5
O
r/R
Рис. БЗ. Профиль конической частil ванны в непрерЫВНО 1 СДl1тке
Рис. G4. IlзмеllСllие скорости кристаЛ.'Iизации по сечению иепреРЫ8ноrо СЛllтка
( I\ф == /1 ' R == 1)
ПОД СI{ОРОСТЬЮ В даННО:\'1 с.lучае с.lед}'ет понимать ли..
нейную CI{OPOCTb продвижения фиксированной точки на
фронте кристаллизации в направ..lении, перпендикулярном
поверхности фронта. TaKII 1 образом, эта ТQЧI{а движется
одновременно и по вертика.,1I1, и по rоризонта Т}и.
При ЭТОМ радиа.пьная и вертикальная составляющие
вектора скорости криста.плизации не совпадают по вели...
u .
чине с радиальнои и вертикальнои скоростями ПРОДВlIже..
ния твердой фазы в данном rоризонтаЛЬНО 1 IiЛИ веРТИI{аль..
IIO!\-1 сечении.
РаСС 10ТрИМ схему на рис. 57. На He 1 представлены в
вертика..1ЬНО 1 разрезе два положения поверхности фронта
кристаллизации. Пусть их разделяет во времени 1 с. Тоrда
путь, пройдеlIНЫЙ любой точкой от первой поверхности до
u u
второи, раБеl! скорости этон ТОЧКИ В даННО!\1 направлении.
Возьмем на первой поверхности точку А. За 1 с она пе..
реl'vtестится па вторую поверхность в точку А'. Скорость
перемещения точки А, нормальная к поверхности фронта
I<РIIстаЛ.ПIlзации (V n ) ЧIIсленно равна отрезку АА'. В ра-
диальном направлении изменение координаты точки А опи..
шется отрезком АС, а в вертика Т'IЬНОМ отрезком АВ. 8ме..
246
сте с тем твердая фаза за ЭТО вре 1Я переместилась в ра-
диальном направлеНIIII на расстояние А С'. Этот отрезок
ЧИС.пенно равен скорости переrvlещения твердой фазы в ра..
диальном направлении V r . В вертика&ilЬНОМ направлении
твердая фаза переместилась па расстояние АВ', численно
равное скорости продвижения твердой фазы вдоль ОСВ слит..
ка vo.
ПОСКОJ1ЬКУ при I{вазистационарном процессе фронт кри"
сталлизации переместится параллельно самому себе, то ве..
личина Vo постоянна по всему сечению слитка. НеТРУДIIО
заметить, что АВ<АВ' и АС <АС'. Таким образом, ско-
рость перемещения точки на фронте кристаллизации в ра-
диа.ПЬНОМ и rоризонтальном направлениях меньше скорости
продвижения твердой фазы в этих направлениях.
В этом существенное отличие ус,повий затвердевания не-
u
прерывноrо и полунепрерывноrо слитков от условии за-
твердевания слитков рззовоrо фОР fирования.
B leCTe с тем скорость оттеснения примесей фронтом
u
кристаллизаЦIIИ определяется веЛИЧИIlОИ и напраВ.пением
......
вектора V 1 1. (Т. е. отрезком АА'). Следовательно ЭТОТ век-
тор и ero состаВ&i1яющие АВ и АС являются определяющи-
ми СI{ОРОСТЯМИ при кристаллизации в непрерЫВНОl'v1 и
полунепрерывном слитках. Проведем KaCaTe lIbII)TIO к поверх-
ности фронта кристаллизации в точке А. Пусть она обра-
зует с rоризонталью уrол а. Тоrда очевидно, что АА' =='
AB' cos а, т. е. Vn==VO COS а. Если профиль фронта кри"
стал,пизации описывается у равнени ем у=== у (Ни, r / Rc:r), то
tga==y', отсюда v ==vo/VI + (у')2.
На рис. 64 показано изменение величины V 71 /VO по се-
чению слитка, коrда профиль фронта кристаллизации (про.-
филь конической части ванны) описывается уравнением
(399) для различных значений n. Если п>О, то скорость
ПРОДВИ}I{ения фронта кристаллизации имеет минимум в се-
чении слитка, а на периферии и на оси слитка она совпа-
......
дает по направлению и величине с вектором vo.
ЕСЛII n О, то величина v n максимальна на оси слитка,
rде она совпадает с Vo, а от оси к периферии монотонно
уменьшается.
IХ.Э. ДВУХФАЗНАЯ О&ЛАСТЬ
При затвердевании чистых lета ТУлов или эвтектических
плавов в слитке образуется пере:\IещаЮI1tllЙСЯ фронт кри"
247
u u
ста.ПЛlIзации, отделяюu ии твердыи l\Iета lЛ от жидкоrо.
В сплавах, кристаллизующихся в интерва.не температур,
u u
затвердевание происходит в переходнои, TaI{ называе IОИ
двухфазной об ТIасти. Ширина двухфазной области 'Ф зави
сит от интервала кристаллизации tRP===t;rlrn tcO!I 11 TeM
u
пературных rрадиентов в раионе изотер 1 ТУИI\Вllдуса 11 co
лиду са (\7 :1111\ и \7 CO.ТI) .
Доля твердоrо l\lеталла в двухфазной об Т}асти IIЗl\fеIIЯ
ется ОТ О при t:I IП \ до 100 О/О при t co .!. При эrО!\.1 достаточно
U u
прочныи скелет из сросшихся осе и развивающихся ден-
дритов фОРМIJруется при образовании в жидкости пример-
110 20 О/О твердой фазы. Этому состоянию соответствует тем-
пература, I{OTOPYIO обозначим t O ,2.
Двухфазную область в интервале температур t.сол tо.
назовем твердо жидкой зоной (об.пастью), а область в ИН-
d l'
A
. ' !.+--.
II . 1:.. . --=.....
. ............ f'O-J
""I . d "t:::s
".1.-.
............
,.._. ............ ..........
ж
R
"'T
0,5
о
45
O
r/R
Рис. 65. Cxe 1 а распределения фаз D затвердеiНlIем слитке
Рис. 66. уlзменение протяженности двухфазной облаСТII в непрерывном С.1I1тке
(КФ =:%H/R== 1)
тервале температур tOI2 t:I1rn назовем жидко твердоЙ 30"
110Й (областью). Наибольшее число различных дефектов
ВОЗНИI{ает в слитке при ero ОХJlаждении в двухфазной об-
ласти. РаССМОТРИ 1 процесс кристаллизации металла в ча-
ти слитка высотой dl (рис. 65).
Пусть на расстоянии r от оси слитка rрадпент темпе-
ратуры равен \7, а па расстоянии r+dr rрадиент равен
V +dV. Поско.пьку жидкий металл в двухфазной области
пронизап растущими кристаллами и не принимает участия
U u
В циркуляции, то конвективнои передачеи тепла здесь мо-
жно пренебречь 1I считать, что теплопередача в этой области
осущеСТВ ТIяется только теп ТIОПрОВОДНОСТЬЮ. Решение Д.ТIЯ
248
этоrо с,пучая дано Л\. И.' 1\lусатовым 1. КО,1ичество теп,пз,
проходящеrо за время dT через ЦИ.J1ИНf рические поверхно-
сти радиусом r и r+dr, обознаЧИ!\1 соответственно dQl Ii
dQ2. Тоrда dQl === 2n'Ar\ldldT; dQ2== 2nл(r+dr) (vr +
+dV') dld't. За время d,; во всей двухфазной зоне заl{РИ...
ста,iIлизуется мета&ТlЛ l\lассой dM. В рассматриваемом эле..
MeHTapHO 1 !{ольцевом объеме толщиной dr выделится ко..
личество тепла, пропорциона,,1ЫIое изменению доли закри-
сталлизовавшеrося в данном !{ОL1ьце металла. Обозначим
это количество тепла через dQ3. Тоrда dQз== dМdN (
СI<:рытая удельная теплота I{ристаллизации; dN измене...
иие ДОЛИ закристаллизовавшеrося металла в элементарном
кольце за время dT). Это количество тепла пройдет через
цилиндрическую поверхность, оrраничивающую область со
стороны полностью затвердевшеrо металла и имеющую ра..
диус (Rc.ТI ). Обозначим }{ОL'1ичество прошедшеrо через
эту поверхность тепла через dQ4: dQ4 === ..........2Jtл (R сл
) vr солdNdldт, rде \7 сол rрадиент температур на rpa..
нице двухфазной области с ПО"ТIность затвердевшим метал-
лом, Т. е. rрадиент температур при температуре солидуса..
Очевидно, что dQз=== dQ4. Тепловой баланс в рассматри"
ваемом элементарном объеме двухфазной области можно
представить в виде LТJюбоrо из двух следующих уравнений:
dQ2 dQl dQ4; (400)
dQ2 dQl === dQз. (401)
Применительно к слитку разовоrо формирования с не-
стационаРНрI!\1 температурным полем удобнее воспользо",
ваться уравнением (400), так как в величину dQ4 входит
rрадиент V сол, величина KOToporo для СЛИТI{а разовоrо
формирования леrко определяется. Для наплавляеr..10rо
слитка, теl\Iпературное поле KOToporo квазистационаРНО t
удобнее ПО,;1ьзоваться уравнением (401). Как уже rовори
лось выше, для слитка разовоrо формирования можно
u
принять линеиное распределение температуры в корочке пол..
ностью затвердевающеrо металла. Тоrда V сол== (tсол
tпов) /6, rде t пов температура боковой поверхности слит..
ка. Но, как показано в работе [197], tпов==tсол/(l+Вi)",
Следовательно,
== вi . c?п О 425 f coп . (402)
V сМ 1 + вi s , s
1 lycaTOB М. и. Некоторые металлурrичеекие основы дуrовой'
плавки титана с расходуемым э.Т]ектродом. Автореф. I<анд. дне. М,,
1961.
249
Решение уравнения (400) для слитка разовоrо форми-
рования дает следующие результаты:
'Ф -:::: s 1 +.Bi . Мир ; 'Фт ж ==:' 4 'Ф; 'Фж т ===
В! t co .! 4 + пl
т
4 + т 'Ф.
( 403)
u
rде т отношение перепадов концентрации ме}кду изотер-
мами ликвидуса и солидуса при температурах ликвидуса
и солидуса д я даиноrо состава сплава.
ПОСКОЛЬКУ дЛЯ большинства бинарных СПLТJавов жеLТIеза
т==0,2....;-.О,5, то велиична 'ФТ Ж составляет в этих сплавах
90 95 О/О от ф. Решение уравнения (401) ДL1JЯ непрерывных
слитков проведено в работе 1 . Протяженность двухфазной
области в данном случае равна:
'Ф {4HI/[ ti V 1 + (у')2]). ( tирltсол). (404)
Из выражения (404) следует, что величина Ф в непре-
рывных и полунепрерывных слитках изменяется по более
сложному закону, чеl'Y1 в слитке разовоrо формирования.
На рис. 66 показано изменение безразмерной протяженно-
сти двухфазной области cp/1I'0 ( 'O........ протяженность двух-
фазной области на оси слитка) по сечению непрерывноrо
слитка. Принято, что профиль жидкой ванны описывается
уравнением (399). Из рис. 66 следует, что в сечении слит-
ка имеет 1\1eCTO минимум ширины двухфазной области в на-
правлении, нормальном к фронту кристаллизации. Положе-
ние этоrо минимума соответствует условию у" ==0. При
этом неравномерность протяженности двухфазной области
увеличивается с ростом относительной r&ТIубины жидкой
ванны. TO,,1JbKO при n==о протяженность двухфазной области
максимальная в центре слитка и монотонно убывает от
центра !{ периqJерии.
IX.4. КОНЦЕНТРАЦИОННОЕ ПЕРЕОХЛАЖДЕНИЕ
в сплавах перед фронтом растущих кристаллов имеет Mec
u
то концентрационное УПL10тнение, Т. е. С"ТIои с повышенным
содержанием примеси. Допустим, что теl\1пература ликви
дуса представляет собой прямую .пинию с TaHreHcoM уrла
наклона т. Тоrда на расстоянии х от фронта I<ристалли..
зации температура ликвидуса t..ТlIП( должна быть равна:
t лlIи (х) == tо mсж (х), rде t o температура П..ТIавления чис-
1 БеЛЯIIЧIIКОВ л. Н. Закономерности кристаллизации наП.ТIЗВ,,'Iяемоrо
слитка. М., МИСпС, 1981. 108 с. с ил.
250
Toro растворителя; С ж (х) ........... концентрация примеСII в точ-
!{е х.
Концентрация примеси изменяется в концентрационном
УП.потнении вдоль оси ..\: по следующему З31\ОНУ:
С Ж (х) ==С ж (1 + 1 К е VХIDж). (405)
rде v скорость продвижения фронта кристаллизации;
К ........... эффективный I\оэффициент распределения примеси;
D ж коэффициент диффузии примеси в жидкой фазе;
С Н { ........... концентрация примеси при "t большем, чем толщина
дифузионноrо слоя б, т. е. при .х б. Тоrда
t лlIи (х) == t o С ж {l + [( 1 К)/ Кl е vХ/Dж} . (406)
Поскольку С ж (х) уменьшается с увеличением х, равно..
весная температура t лик (х) ДОЛ}I{на при этом увеЛИЧIIвать...
ся. Однако реальное распределение температуры в жидкой
фазе 1)1\ (х) не обязательно должно совпадать сравновес..
НЫМ. В простейшем случае распределение температуры мо"
жно записать I ж (х) tж (О) + v' жх, rде t ж (О) ........... температу..
ра на фронте Криста lли3ации; v' ж температурный rpa..
диент в ЖИДI\ОЙ фазе. Величину t ж (О) можно опреде Т]ить
из формулы (406) при условии х===О: tiI{(O) ===tлин(О) =='
=== tо mсж ( 1/ К). Отсюда
t ж (х) == tо тсж/К 4 vжх. (407)
Очевидно, что если в KaKOM TO объеме жидкости буде'f
соблюдаться соотношение t ж (х) <t ЛIIН (х), то жидкость в
этом объеме оказывается переох.пажденной по отношению
к равновесной температуре ликвидуса. Это явление полу
чило название концентраЦllОННО20 перео.хлажденuя в OT
1Jичие от переохлажденuя термнчеСКО20. В районе, приле..
rающем к Q)POHTY кристаллизации, при ..t===O условие соз
дания концентрационноrо переОХ 7Iаждения принимает вид
dt;и (х ) I < dt ЛИR (х) I . (408)
dx х===о dx х==о
Продифференцировав выражения (406) и (407) по х
по.ПУЧИМ на основании уравнения (408) условие существо..
u
вания концентрационноrо переОХ"lаждения в раионе изо..
термы ликвидуса:
V лин/ v < (пzс ж / D ж ) [( 1 ........... К)/ К] . (409)
И, наборат, I{онцептоаuионное переохлаждение ДО ТIЖI-IО
отсутствовать при УСЛОВl1П
vлин 1v > (Inс ж ID)J.() [(1 K)/KJ. (410
251
'Х.5. ДИСПЕРСНОСТЬ ДЕНДРИТНОй СТРУКТУРЫ
И ДЕНДРИТНАЯ пИКВАЦИЯ
в черной металлурrии ПРИХОДИТСЯ иметь де.ПО со сталями
u
и сплавами, у КОТОРЫХ концентрации примесеи .пеrирую..
щих элементов T8I{ велики, что в реальных С ТIитках плас..
кий и ячеистый фронт кристаллизации существуют малое
время. Структура таких слитков формируется как дендрит..
ная структура. Важным вопросом при рассмотрении про..
u
цесса дендритнои кристаллизации является вопрос о раз..
мерах дендритов, расстоянии 1ежду ИХ rлавными ОСЯl\fИ
.х I и осями BToporo порядка X II . Концентрация примеси на
:оси дендрита соответствует ее концентрации в вершине
u
дрендрита, крнсталлизующеися в nepBYIO очередь идолж..
жна быть минимальной. Обозначим эту концентрацию
Cmln. БаJlанс примеси в концентрационном УП.потнении, при..
ведепноЙ в работе [198], дает с.педующее выражение для
Cmln:
'С т1П == К [(v ЛиН D;I{/mv) + C iH ]. (411)
,Отношение Сmln/СЖ назовем эффеКТUВНblJ11, КОЭффllцuен--
ТОМ nерерасnределеflUЯ и обозначим Кэф, т. е. Кэф==Сmil1/ С Ж.
Тоrда
КэФ == К [1 + (v Лии Dж/тС}1{ v)]. (412)
Эффективный коэффициент распределения К ЭФ , как впер..
вые было показано в работе [199], связан с равновесным
коэффициентом распределения Ко следующим образом:
КэФ == Ко/[Ко + (1 Ко) ехр ( vб/DiR)l. (413)
После Toro как дендрит выбросил ось BToporo порядка,
вершина rлаВIIОЙ оси продолжает расти. Концентрация
u
примеси в }I{ИДКОМ металле вдоль rлавнои оси по мере уда..
ления от оси BToporo порядка меняется в соответствии с
формулой (405). Коrда концентрация CiI\{X) достиrпет зва..
чения Cmln/ К, дендрит выбросит следующую вторичную ось.
Приравнивая выражение для С иt (х) И Cmln, получим
", II == (Dж/v II ) In [(1 К)/(КэФ К)], (414)
rде v II скорость утолщения осей BToporo порядка.
ОбознаЧИ 1 скорость роста осей первоrо порядка че
рез v I .
А. Е. Волков показал, что соотношение между V II и v I
подчиняется закономерности: v1Ijv I ==: (Кэф К) / (l K).
Отсюда, подстав ТIЯЯ это выра}кение в фОрl\IУЛУ (413) и рас..
252
крывая значение Кэф, получаем:
X II == тсж ( 1 Ко ) e.......6v/DH{ In [ тсж v (1 ........... Ко) е БVID}I< ] (415)
V:lIIM Ко V ЛIIН D)R Ко ·
I(онкретный вид ФУНКЦИI1 X II (v) во MHOrOM определяе'I"
ся ВИДОМ функции V лин (v) и V ЛIlН/V. в слитке разовоrо
формирования при линейном распределении температуры
в твердой корочке имеем V лш\ V сол == (t сол / s ) [Bij ( 1 +
:+Bi)] и с учетом выражения Д ТIя v получим:
Vлии == pt coп ( + с (L\t ир + М)] [ 1 + 2С (L\t ир + 6t) Х
v А6t с .... и (1 + Bi) 1: + с (L\t ир + dt)
х + 2С (,мир + ,м) . 2 ] .
R cп + с ( tир + Ы) R"J.
сл
На рис. 67 показано изменение V ЛИ1\/V по сечению слит..
ка стаJIИ ШХl5 при раз ТIИЧНОЙ степени neperpeBa. От пери..
х 1IjR
ЦОlч
z
-&
1'
1
t>
ЦОО7
.
8.1
I
6.2
0.3
Q
5
tO
;/К
о
0,1 0,2 0,3 0,4
't,.R, С/12/ с '
,
Рис. 67. Изменение отношения \1 JIИИ/V по сечению слитка разовоrо формирова-
вив стали ШХ15 при переrреве О (/), 70 (.2), 120 (3) и 150 (4) К
Рис. 68. Зависимость степени дисперсности дендритной структуры при кристал-
лизации. сплава ХН77ТЮР (/) и стапи типа 12X18HI0T (//) в кристаллизаторе
диаметром 380 (1), 320 (2) Jf 500 (3) мм
ферии к центру величина V JlJtШ/V практически всеrда моно-
тонно убывает, хотя ПрИ условии t ( /2C) tKP она
может ПРОХОДИТЬ через МИНИМУМ.
ДЛЯ HenpepbIBHor o слитк а имеем
.V пик == ( i t пик /4Н к ) V 1 + (у')2; VпикZvп == (4 iаtпик)L
V(v R ),
rде а эффективный коэффициент температуропроводно"
CTI1. Совместный анализ выражений дЛЯ X II , V лик И V в СЛ}'.
чае слитка разовоrо формирования показывает, что при
253
прочих равных условиях величина X II прямо пропорцио-
нальна радиусу слитка, поэтому удобно рассматривать
связь безразмерных величин хII/Rсл и /Rсл. От перифе..
рии к центру слитка величина хII/Rсл изменяется в общем
случае сложным образом, проходя через максимум. В ра-
боте* показано, что этот максимум имеет мест о при
I+С(Мир+Аt) (1 + V2.1O tир).
R cп + 2С (6tJ(p + dt)
в непрерывных слитках
11 теж v п R л (1 ........ ко) ...... v /D Х
Х == е п ж
4J1I аt лин Ко
I тсжv R (I Ко) V /D
Х n е п ж .
4,..,i D ж аt пип ко)
Максимум значения xII/R при этом имеет место при ско-
рости продвижения фронта кристаллизации v п , равной ко-
эффициенту массопереноса леrирующих примесей р==Dж/fJ,
Т. е. при vп== ==Dж/fJ. При малых скоростях кристаллиза-
ции, коrда Vп< , условие сж(х) ==Стln/К обеспечивается
при малых значениях x II , блаrодаря малому значению ко-
эффициента распределения К. При больших скоростях кри-
сталлизации, коrда Vп> , блаrодаря чему в концентраци-
онном уплотнении резко возрастает rрадиент концентра-
ции примеси, условие С ж (х) ===С т ln/ К при малых значениях
x II обеспечивается вследствие роста Сж. Выше [см. форму-
лу (352)] было показано, что в наплавляемом слитке ко-
эффициент массопереноса примеси обратно пропорциона-
лен радиусу слитка, Т. е. (fJvп)/D ж === (vRсл)/А, rде А
.
для даннои примеси в данном металле есть величина по-
u
стоянная при даннаи температуре, Т. е. применительно к ус-
ловиям фронта кристаллизации при температуре ликвиду-
са. Отсюда следует, что для данноrо сплава безразмерная
величина хII/Rсл является функцией произведения VпR. На
рис. 68 покззана зависимость между пара fетрами XII/Rc!l
и RслVп для никелевоrо сплаВа и коррозионностойко
стали.
Рассматривая случай диффузии примеси с конечной
скоростью в твердой фазе при неоrраниченной скорости
диффузии в жидкой фазе, и. Н. rаликов [201] получил
· Белянчиков л. Н. Формирование слитка спокойной стали (раздел
курса сПроизводство стали и ферросплавов::.. Курс лекций). М.: МИСиС,
1975. 143 с.
254
С ТIедующее выражение для степени дендритной ликва..
ЦliИ 1):
'1 == (С шах Cmtn)!C o == Ко [ ( :I :I + 1 Y K' 1 ]. (416)
rде со концентрация примеси в ковшовой пробе; Стах
концентрация примеси в межосном объеме; Сшln.......... концен"
трация примеси в оси дендрита; КО равновесный коэф-
фициент распределения. В реальных условиях коэффици..
ент КО должен быть заменен эффективным коэффициен-
TOl\f К, определяемым для условий затвердевания между
осяr.IИ BToporo порядка при v == V II . В этих условиях К Ко
и фОРМУ"ТJа (416) применима и при оrраниченной диффузии
в жидкой фазе.
Отсюда следует, что степень дендритной ликвации опре..
де ТIяется rлаВНЫ 1 образом I фактором VIIX II . В непрерыI"
ном слитке
2 ')
vIl хН == п. 'п mс ж v П R ( 1 Ко ) е.......tJfJп/Dж ( 417 )
Ж? К ·
411i D ж аt лин о
Это выражение имеет максимум при vn==2 , Т. е. оди..
наковая степень дендритной ликвации может быть получе-
H как при малых, так и при больших скоростях кристал-
лизации.
'Х.6. ФИЗИЧЕСКАЯ НЕОДНОРОДНОСТЬ
СТАяьноrо СЛИТКА
у садочная раковина
Понижение теf\1пературы жидкой стали, а также ее затвер-
девание сопровождаются уменьшением объема металла.
Различие между объемом, занимаемым ранее жидким ме..
таллом" и объемом твердоrо металла приводит к возник
новению в С.1Jитке усадочной раковины. Располаrается уса..
u
дочная раковина в раионе так называемоrо 'тепловоrо цен..
u u u
тра, т. е. Б самом rорячеи зоне слитка, затвердевающеи в
последнюю очередь. Особенностью наплавляемых слитков
является возможность путем снижения по определенному
u
закону мощности, подаваемои в зону плавления, практи-
чески полностью вывести усадочную раковину из тела
слитка. При этом в rоловной части слитка создаются ус-
ловия кристаллизации, близкие к нормальным. Если при
u
этом не происходит подпитки rоловнои части слитка оплав..
ляющимся электродом, а только rреется поверхность ван-
255
ВЫ, что возможно при элп и ПДП, то длительность вы-
ведения раковины определяется по формуле: Тр===R л j4a.
В случае ВДП 11 ЭШП при снижении мощности элек-
трод продолжает оплавляться, и металл продолжает посту-
пать в кристаллизатор, что уве 7Jичивает длитеЛЬfIОСТЬ вы-
ведения раковины. В работе (см. сноску на с. 250) ПОI<аэz-
но, что в этом случае
rr == ( R ) 1 + 4a p / [ 1 ео ]
р 4а ,....i лt соЛ J о (1.1.1) 2л,.... i лt соп J о (""'1) L о ·
( 418)
rде go ----- массовая скорость плавки до начала выведения
раковины; Lo высота слитка до начала выведения рако-
вины.
В течение Tl ===R /4a (О,55+0,60)тр производят сни-
жение мощности, а при T2=='t'p 't'1 (0,40 0,45)Tp произ-
водят выдержку при постоянной мощности. При этом пе-
риоды Тl И Т2 MorYT быть разделены на несколько стадий.
П ример. Определим длительность выведения усадочной
раковины в слитке стали 12Х18НI0Т при ВДП в кристалли-
заторе диаметром 0,5 М. Исходные данные: а===4,2 10 б м 2 /
jc; ===2,78.105 Дж/кr; л==зо ВТ/(М.К); р===7400 Kr/M 3 ;
t сQл ==1390 0 С; J..tl==1,36; go===O,09 Kr/c; L o ===2,5 М. ПО табли-
цам цилиндрических функций находим JO(f,.tI) ===/0(1,36) ==
===0,588. TI ===R /4а == 0,252/ (4.4,2. 1 6) ==3720 с==62 мин===
== 1 ч 02 мин.
ft == 3720 ( 1 + 4.4,2.10 8.2, 78.106.7400 )/( 1........
р 1,86.30.1390.0,588
0,09.2,78.105 ) == 6708 с == 11 1,8 МИН
6,28.1,86.30.1390.0,588.2,5
1 ч 42 мин; Т 2 == '[р q-l == 40 МИН.
Осевая nористость
В реальных условиях затвердевающеrо стальноrо слитка
имеет место двухфазная область, в которой температура
изменяется от ликвидуса до солидуса. Вблизи температу-
ры солидуса кристаллы срастаются, и это ПрИБОДИТ к ра-
зобщению ячеек, заключающих в себе остатки жидкой фа..
зы. Поскольку затвердевание таких ячеек происходит без
подпитки жидки { металлом, в I<аждой из них образуется
небольшая усадочная раковина. Множество таких раковин
в совокупности образуют пористость. .
256
В слитке особенность этоrо процесса состоит. в том, что
u
до момента полноrо срастания кристаллов часть жидкои
фазы успевает профильтроваться через ceTI<Y кристаллов из
осевой зоны в перифеРИЙНУIО, rде I\1еталл имеет более низ..
кую температуру. В результате периферийные ячейки по..
лучают некоторое питание от осевых. Осевые ячейки TaKoro
u
питания lIe имеют, поэтому в осевон части слитка металл
получается более рыхлым. Дефект этот получил название
осевой nористости. Пористость, развивающаяся в осевой
u u
части слитка непосредственно под зонои усадочнои paKoBll..
НЫ, называют усадОЧНОll рыхлостью. Ширина пористой зо..
ны 'Фпор определяется шириной двухфазной области в ",10-
мент достижения фронтом ликвидуса центра слитка. В этом
момент имеет место условие 'Ф==='Фпор== (R 'Фпор)[(l+Вi)/
/Bi] (!1tKp/t KP ). Отсюда мо)кно найти
"'пор == ( 1 + Bi . tRP )/( 1 + 1 + Bi .
R cп Bi t сол Bi
( 6.tRP )/( 0,425 + А/ир ) ,
t СОJI t СОll
u
Т. е. относительная ширина лористои зоны В слитке раза..
Boro формирования не зависит от радиуса слитка, а зави..
сит только от интервала кристал-
лизации и температуры солиду"
са. Поскольку повышение содер"
жания уrлерода в стали расти..
ряет интервал кристаллизации,
то сталь с повышенным уrлеро..
ДОМ проявляет большую склон..
ность К осевой рыхлости. В не..
прерывных и полунепрерывных .
слитк х условия подпитки за..
твердевающих ячеек жидким ме..
таллом значительно лучше, чем в
слитках разовоrо формирования.
Здесь над фронтом двухфаз..
ной области всеrда имеется ван..
u
на жидкоrо металла, которыи по
капиллярам, образуемым зазора..
ми между растущими дендрита..
ми, проникает в rлубь двухфаз..
ной области. Однако в центральной части слитка процесс
фильтрации жидкоrо металла затрудняется. На рис. 69
представлен разрез ванны жидкоrо металла в непрерывном
слитке. Видно, что дендриты, СХОДЯlциеся своими вершина..
17 675
!!t lcp )
tсо;л
( 419)
I
I
f
2 I
ФпО Р
Ф ло
R
R
Рис. 69. Ширина пористоА зоны
в непрерывном слитке:
J линия IJЗОЛlIквидуса; 2 JJИ-
ния изосолидуса
257
МИ В центре фронта ликвидуса, как бы отсекают некоторую
область в центре слитка, условия подпитки которой хуже,
чем у остальных участков двухфазной области. Очевидно,
что эта зона будет в наибольшей степени поражена усадоч-
ной ористостью. Ширина пористой зоны 'Фпор в данном
с,ТУучае !ожет быть определена следующим образом. С од-
ной стороны, из рис. 69 видно, что
'Фпор == '1'0 cos а .sin а == 'Фо {у' /[ 1 + (у')2]}. (420)
С друrой стороны, значение производной у' == dy/dr в
точке А ожно найти из формулы (399) при r=='i'пор и n===
==0. Отсюда в условиях затрудн енной подпитки имеем:
r
1Vпор == 1 / 2 . М R2 .
RCJ! J.1I t сол 4Н к
При этом осевая пористость в непрерывном СЛИТI{е бу-
дет отсутствов ать при у словии:
.. f 2
Ни -< V ""1 . t сол .
R cп 8 tRP
Прuмер. Определим максимально допустимое с точки
зрения осевой рыхлости значение коэффициента формы
ванны' при ВДП стали 12XI8HIOT. Исходные данные:
L\t ир ==56 ОС ; t сол ==1390 0 С; p,i==I,86. Отсюда
HK/R cn -< У(1,86/8) (1390/50) == 2,54.
(421)
(422)
&и&лиоrРАФИЧЕСКИЯ СПИСОК
1. Жуховицкий А. А., Шварц.!ttан Л. А. Физическая химия. М.: Me
таллурrия, 1976. 544 с.
2. ЭЛЛUОТ Д. Ф., r лейзер М., Ра.!ttакрuшна В. Термохимия стаJlепnа..
вильных процессов. М.: Металлурrия, 1969. 252 с.
3. Термодинамика. Выл. 85, 97, 103 (Комитет научно техническоrl
терминолоrии АН СССР. !\\.: Наука, 1973; 1980; 1984.
4. Производство стали в электропечах. Пер. с анrл. (Под ред. rри-
rоряна В. А. М.: Металлурrия, 1965. 424 с.
5. Morris 1. Р., Zellars о. R. J. 1\'\etals, 1956, v. 8, NQ 8, р. 1086........
1090.
6. Хансен М., Андерко К. Структуры двойных сплавов: Справочник.
Т. 1, 11. М.: Металлурrизда т, 1962. 1488 с.
7. ЭЛЛUОТ Р. п. Структуры двойных сплавов: Справочник. Т. 1, 2. М.:
Металлурrия, 1970. 454; 472 с.
8. ШаflК, Ф. А. Структуры двойных сплавов: Справочник. М.: Мета.,...
лурrия, 1973. 760 с.
9. Лuнчевскuй Б. В. Техника металлурrичеСh.оrо эксперимента. !vi.:
Металлурrия, 1967. 344 с.
1 о. ФНЗНКО Хlfмические методы исследования металлурrических процес-
сов/Филиппов с. Н., Арсентьев п. п., Яковлев В. В., Крашенинни-
ков М. F. М.: Металлурrия, 1968. 552 с.
11. У мбер д., Эллиот д. ф........ Проблемы современной металлурrИII,
1961, N2 1 (55), с. 3........23.
12. Сюй Цзен..цзи, Поляков А. ю., Самарин А. М. Изв. вузов. Чер-
ная металлурrия, 1959, N2 11, с. 3 12.
13. Срывалuн Н. Т., Есин О. А., Ватолufl, Н. А. 11 др. ЖФХ, 1968t
т. 42, N2 3, с. 717........722.
14. Н ardi Н. К........ Acta Met., 1953, v. 1, . 202 209.
15. Островскuй о. Н., Стомахин А. Я., Fрuzорян В. А. Изв. АН
СССР. Металлы, 1977, N2 1, с. 81 85.
16. Lupis с. Н. Р., Elliott J. Р. Acta 1\\et., 1967, v. 15, N2 2, р. 265........
276.
17. Sigworth а. К., Elliott J. р......... l\\etal Science, 1974, v. 8, р. 298........
310.
18. Ямаучи Т., Ичuзе Э., Мори Т. В кн.: Процессы раскисления JI
образования неметаллических включений в стали. М.: Наука, 1977t
с. 147 160.
19. Дюбанов В. r., Сто.махин А. Я., Филuппов А. Ф.......... Изв. вузов.
Черная металлурrия, 1975, N2 3, с. 5 7.
20. Wolley F., Elliott J. Р. Trans. Met. Soc. AIME, 1967, v. 239,
Q. 1872........1883. .
21. Fruehan R. Met. Trans., 1970, v. 1, р. 2083 2088.
22. Есин Ю. о., Баев В. М., Петрушевскuй М. с., rельд п. в
Изв. АН СССР. Металлы, 1975, N2 4, с. 82 86; 1974, N2 4, с. 73 76.
23. Sponseller D. L., Flinn R. А., Trans, Met. Soc. AIME, 1964,
v. 230, р. 876 887. .
24. Selected Values of the Thermodinamic Properties of Blnnary АНо-
ys./Hultgren R.I Desai Р. D., Hawkins D. Т., а. о. ASM, Metals
Park, Ohio, 1973. 1435 р.
25. Есип Ю. о., ЗавЬЯЛОВ В. К., П етрушевскuй М. с. и др......... Изв.
. вузов. Черная металлурrия, 1973, N2 12, с. 23 27.
.26. Явойскuй В. Н., Свяжuн А. r., Вuшкарев А. Ф., Чурсин r. М.
В кн.: Взаимодействие rазов с металлами. М.: Наука, 1973, с. 98
108.
17*
259
27. Tozaki У., Jguchi Y. 1 Ban ja 8., Fuwa Т. Int. Sympos. Met. СЬеm.
Appl. Ferrous Met., Sheffield, 1971, р. 2 7.
28. Wagner 8., Pierre а. R. Met. Trans., 1972, v. 3, р. 2873 2878.
29. Furukawa 1'1 KQto Е. Tetsu to Hagane, 1975, v. 61, N2 15, р. 3050
3059.
30. Цуnынин F. П., Сюй Цзен цзи, Поляков А. Ю., Самарин А. М........
Металлурrия, }Iеталловедение, физико-химические исследования:
Науч. тр. ИМет. им. А. А. Байкова. М.: Наука, 1962, Ng 1 О, с. 155.........
162.
31. \fleinstein 1\;1., Elliott J. F. Trans. Met. Soc. AIME, 1963, v. 227,
. 285 286.
32. Есин ю. О., Баев В. М., rельд п. В., Петрушевский М. С.......... ИЗВ.
АН СССР. Металлы, 1974, N!! 4, с. 73 77.
33. СтомаХllН А. Я., Байер П., Поляков А. ю. Изв. АН СССР. Ме-
таллы, 1965, N!! 4, с. 37 45.
34. Аверин В. В., Поляков А. Ю., Ca,1,tapuH А. М.......... Изв. АН СССР.
ОТН, 1957, N2 8, с. 120 122.
35. \'eпal W. V. 1 Geiger а. Н. Met. Trans., 1973, v. 4, р. 2567
2573.
36. Триполитов А. Н., КРlочков о. Н., СТо.махин А. Я., Филип
nов А. Ф. Изв. вузов. Черная металлурrия, 1969, Ng 5, с. 57 61.
37. Margrave J. L. Collog. Int. CNRS. 1972, N2 205, р. 71 77.
38. Guggenheiт Е. А. Mixtures. Oxford, 1952, 270 с.
39. ШахnаРОНО8 М. и. Введение в молекулярную теорию растворов.
М.: rостехтеориздат, 1956, 507 с.
40. Бурылев Б. п. ЖФХ, 1967, т. 41, с. 676 680.
41. Ваенер К. Термодинамика сплавов.: Пер. с анrл. М.: Металлурr-
издат, 1957. 179 с.
42. Chipтan J. J. Iron and Steel Inst., 1955, N2 180, р. 97.
43. Lupis с. Н. Р., Elliott J. F. Acta Met., 1966, v. 14, р. 529, 1019.
44. Wada Н., Pehlke R. D.......... Met. Trans., Ser. 1977, v. 8 В, р. 443.........
450.
45. ChipmQn J., Corrigan D. А. Trans. Met. Soc. AIME, 1965, v. 233,
N2 7, р. 1249 1252.
46. Большов л. А., Fрuzорян В. А., CTO,1,taxUH А. Я........ Изв. вузов.
Черная 1.IетаЛ.1Jурrия, 1973, Ng 1, с. 53 55.
47. Большов л. А., rрuzорян В. А., СТО,1,!ахин А. я. ...... ФММ, 1972, Т. 34,
вып. 6, с. 1139 1144.
48. Большов л. А., Трuzорян В. А., CTOJ,taxUH А. Я........ Изв. вузов. Чер..
ная металлурrия, 1972, Ng 11, с. 60 62.
49. Stиll D. R., Prophet Н. JANAF Thermochemical Tables., 2 d ed.,
US NBS, \Vash., 1971, 1141 р.; Suppl.: J. Phys. and СЬеm. Rev.
Data, 1974, v. 3, р. 3 II 480; 1975, v. 4, р. 1 175; 1978, v. 7, р. 793
940; 1982, v. 11, р. 695 940.
50. ШваРЦJtlйН Л. А., Томилuн Н. А......... Успехи химии, 1957, Ng 26,
с. 554.
51. Пономаренко А. Т......... ЖФХ, 1972, Т. 46, N2 8, с. 1950 1958.
52. TurkdogQn Е. Т., Pearson J. J. Iron and Steel Inst., 1953, v. 173,
N2 3, р. 217 223.
53. Turkdogan Е. T. J Pearson J. J. Iron and Steel Inst., 1953, v. 173,
N2 12, р. 393 398.
54. Winkler Т. В., Chipnlan J. Trans AI 'lE, 1946, v. 167, р. 111.
55. Herasymenko Р. Transactions of the Faraday Soc., 1938, N2 34,
р. 1245.
56. Herasyтeпko Р., Speit а. Е.......... J. Iron and Steel Inst., 1950, v. 166,
р. 169.
260
57. Есин О. А. ЭлеКТРО ТIитическая природа жидких шлаков. CBepд
ловск: ДОМ техники Уральскоrо индустриальноrо ин та ИМ. С. М.
Кирова, t 946, 4 t с.
58. Кожеуров В. А. Термодинамика металлурrических шлаков. CBepд
.ТIOBCK: Металлурrиздат, 1955, 163 с.
59. Te.JlKUH М. И. ЖФХ, 1946, т. 20, с. 105.
60. Са"иарuн А. М., ШваРЦ tан л. А. Изв. АН СССР, ОТН., 1948,
N2 9, с. 1457. .
61. Са"иарuн А. М., Ш Bapl{ taH л. А.......... Успехи химии, 1954, N2 1,
с. 24.
62. Явойскuй В. И. Теория процессов производства стали. М.: Метал
лурrия, 1967. 518 с.
63. Ормонт Б. Ф. Введение в физическую химию икристаллохимию
полупроводников. М.: Высшая школа, 1973. 655 с.
64. Киреев п. с. Физика полупроводников. М.: Высшая школа, 1975,
584 с. .
65. Иоффе 'А. Ф. ПОЛУПРОВОДНИКII в современной физике. М. Л.: АН
СССР, 1954. 356 с.
66. Пономаренко А. Т. ЖФХ, 1974, т. 48, N2 7, с. 1668 1671.
67. ПОНОJfаренко А. Т., Козлов ю. Е., Морозов А. Н.......... Изв. АН
СССР. Металлы, 1974, N2 3, с. 64 69.
68. Gokcen N. J. of Metals, 1956, v. 8, N2 11, р. 1558 1567.
69. Поверхностные явления в металлурrических процессах: Труды
межвузовской конференции. М.: Металлурrиздат, 1963, 267 с.
70. Поверхностные явления в расплава"{ и возникающих из них TBep
дых фазах. Нальчик: Кабардино Балкарское книжное изд во, 1965,
652 с.
71. Поверхностные явления в расплавах. Киев: Наукова думка, 1968,
488 с.
72. Смачиваемость и поверхностные свойства расплавов и твердых
тел. Киев: Наукава думка, 1972, 347 с.
73. Адrезия расплавов. Киев: Наукова думка, 1974,222 с.
74. Физическая химия конденсированных фаз сверхтвердых материа-
лов и lIХ rраниц раздела. Киев: Наукова думка, 1975, 231 с.
75. Попель С. И. Теория металлурrических процессов. М.: ВИНИТИ,
1971, 131 с.
76. Жуховuцкuй А. А....... ЖФХ, 1944, т. 18, N2 5 6, с. 113........120.
77. Хабашu Ф. Основы прикладной металлурrии. Т. 1. М.: Метал
J!урrия, 1975, 231 с.
78. ЖУХО8UЦКUЙ А. А., rРИ20РЯн, В. А., Мuхалuк Е. ....... ДАН СССР, 1964,
Т. 155, N 2, с. 392 394.
79. rрU20рЯН В. А., Минаев ю. А......... В кн.: Физико-химические основы
ЩJоизводства стали. М.: Наука, 1971, с. 582.
80. EpeAfeflKo В. М., Найдuч ю. В......... ЖФХ, 1959, т. 33, ]\fg 6, с. 1238
1245.
81. Нuженко В. Н., Флока Л. и. в кн.: Поверхностные явления в
расплавах. I(иев: Наукава думка, 1968, с. 130 138.
82. Floridis Т. Р., Chipman J. Trans. Met. Soc. AIME, 1958, v. 212,
р. 549.
83. Аверин В. В" Поляков А, Ю., Ca,1fapun А. }л......... Изв. АН СССР.
ОТН, 1955, N 3, с. 90 1 07.
84. Т ау/о, с. R., CJlipman J. Trans. AIME, 1943, v. 154, р. 228.
85. Линчевскиtl Б. В. ИЗБ. АН СССР. Металлы, 1971, М2 4, с. 79 83.
86. Janke D., Fischer W. А. Arch. Eisenhfittenwesen, 1975, Bd. 46,
X 5, s. 297 302.
261
87. Tankjпs Е. С., Gokcen N. А., Belton а. R. Trans. Met. Soc. АIЛ\Е,
1964, v. 230, р. 820 827.
88. Turkdogan Е. Т., Hancock R. А., Herlitz S. J. J. Iron and Steel
Inst., 1956, v. 182, pt. 3, р. 274.
89. Schurпzann Е., Riпlkus Н. J. Giessereiforschung, 1974, Bd. 26,
N2 4, S. 175 179.
90. FрU20РЯн В. А., Жуховицкuй А. А. IIзв. АН СССР, Мета.1ЛЫ,
1969, N2 5, С. 61 66.
91. Bundy Р. D. J. Chem. Phys., 1963, N2 38, р. 618 630.
92. Leider R., Krikorian о. Н., УОUnе D. А. Carbon t 1973t 1\2 11,
р. 555 563.
93. Кочетов А. Н., Сто"иахuн А. Я., Fрll20рЯН В. А., Натансон К. Ю.
Iзв. ВУЗОВ. Черная металлурrия, 1976, N2 1, с. 65 71.
94. ScJzenck Н., Frohberg М. а., Steinmetz Е. Arch. Eisenhiittenursen,
1963, Bd. 34, N2 1, S. 37 42.
95. поляков А. Ю. Теоретические основы рафинирования ста.пеП.па-
вильной ванны. 1\'\.: Наука, 1975, 207 с.
96. Электрометаллурrия стали и ферросплавов/Поволоцкuй д. Я., Ро..
Il ИН В. Е., Рысс М. А. и др. М.: Металлурrия, 1984. 568 с.
97. ВаЙсбурд С. Е., Дю6анов В. Т., Зедина Н. Н. и др. Изв. вузов.
Черная металлурrия, 1972, N2 1, с. 53 55.
98. Юрин В. В., Котельнuков Т. Н., CTOAtaXUH А. Я., rрuzорян В. А.........
ИЗБ. вузов. Черная металлурrия, 1986, N2 11, с. 40 45
99. ФuнчеА.t С., Ричардсон Ф. Пробw1емы современной метаЛ.lурrllll,
1955, N2 1, с. 24.
100. Ric/lardson Р. D., Physical Chemistry of Лlеlts in Metallt1rgy, v, 1,
2, L N. У, 1974 Acad. Press, 537 p.
101. Сазонов М. Л' I Шалимов А. Т., Меркулов Ю. Л1. и др. Теория fe-
таллурrических процессов: Науч. тр./ЦНИИЧМ. М.: МетаЛ lурrIlЯ,
1967, N2 50, с. 14 22.
102. Рафинирование стали синтетическими Ш lаками /ВОИНОВ С. Т., Ша-
лимов А. Т., Косой Л. Ф., Калинников Е. С. 1\'\.: МетаЛJ1урrня,
1970. 464 с.
103. ЖУХОВUЦКUЙ А. А., FРUZОРЯft В. А. Iзв. АН СССР. MeTawl.lbJ,
1970, N2 4, с. 27 33.
104. Сталеплавильное производство: Справочник. Т. lt 2/По.i. ред.
А. М. Самарина. М.: Металлурrия, 1964, 527; 1039 с.
105. Healy О. W. J. Iron and Steel Inst., 1970, N2 7, р. 664 668.
106. Петрухuн С. Н., rрU20рЯН В. А., CroJttaXUH А. Я. и др. I1зв. ву-
зов. Черная металлурrпя, 1975, N2 3, с. 76 80.
107. Азот в металлах/Аверин В. B' I Ревякин А. В., Федорченко В. 11"
Козина Л. Н. М.: Металлурrия, 1976, 221 с.
108. Морозов А. Н. Водород и азот в стаwТ]и. М.: Металлурrия, 1968,
281 с.
109. Взаимодействие rазов с металлами В кн.: Труды 111 советско-
японскоrо симпозиума по физика-химическим основам металлурrи-
ческих процессов. М.: Наука, 1973, 215 с.
110. Взаимодействие металлов и rазов в сталеплавильных процессах:
Науч. тр./МИСиС. М.: Металлурrия, 1.973, N2 79, 292 с.
111. Pehlke R. D., Elliott J. F.......... Trans. Met. Soc. AIME, 1963, v. 227,
N2 5, р. 849 855.
112. Свяжuн А. r., Чурсин r. М., Вuшкарев А. Ф., Явойскuii В. и..........
Металлы, 1974, N2 5, с. 24 35.
113. Сто.махин А. Я., Поляков А. Ю. Изв. вузов. Черная металлур-
rия, 1967, N2 3, с. 116 121.
262
114. Проблемы деrазаЦНII металлов/Кунuн л. л., rOAOBU1f, А. М., Cypo
вой ю. Н., ХОХРUН В. М. М.: Наука, 1972, 324 с.
115. Бан.-я Ш., Фува Т. В КИ.: ФИ3l1ко химические основы металлур-
rических процессов. \.: Наука, 1973, с. 225 235.
116. Lange К. \\7., SC/lenk Н. z. Metallkunde, 1969, Bd. 60, N2 8,
s. 638.
117. Явойскuй В. И., ЛУЗZllн' В. П., Вuшкарев А. Ф. Окисленность ста-
ли и методы ее контроля. М.: Металw,урrия, 1970,285 с.
118. ПОВDЛОЦк.uй д. Я. Раскисление стали. М.: Металлурrия, 1972,
207 с.
119. Кнюnпель Т. Раскисление и вакуумная обработка стали: Пер. с
нем. М.: Металлурrия, 1973, 311 с.
120. Аверин В. В., Самарин А. М. ИЗБ. АН СССР. Металлурrия и
топливо, 1961, Ng 5, с. 3 10.
121. Куликов И. с. Раскисление металлов. М.: Металлурrия, 1975,
504 с.
122. Fischer w. А., Fleisclzer Н. J. Archiv Eisenhi.ittenwesen, 1961,
Bd. 1, s. 1 10.
123. МUЯШUта Н., Нuшuкава К., Немото х........... В КН.: Взаимодействие
rазов с мета.,1лами. М.: Наука, 1973, с. 50 59.
124. Chino Н. Tetsu to Hagane, 1966, v. 52, р. 559 966.
125. Segawa К., Tsunetolni Trans. Iron and Steel Inst. Japan, 1969,
N 9, р. 89 95.
126. Suzuki Kenichiro, Sanbollgi Koji J. Iron and Steel Inst. Japan,
1972, v. 58, N2 12, р. 1594.
127. Metallurgical Chemistry of Iron and Steel. Symposium. July, 1971,
Sheffield; Iron and Steel Inst., 1973, 425 р.
128. Фаст Дж. Д. Взаимодействие металлов с rазами. Т. 2. М.: Метал-
лурrия, 1958, 351 с.
129. Сталь, 1973, N 7, с. 590 616.
130. Шульте ю. А. Неметаллические включения в электростали. !\\.:
Металлурrия, 1964, 207 с.
131. Виносрад М. Н., rpOAtOBa r. п. Включения в леrированных ста-
лях и сплавах. М.: Металлурrия, 1972,214 с.
132. Кuслuнz Р., Ланzе Н. Неметаллические включения в стали: Пер.
с анrл. М.: Металлурrия, 1968, 121 с.
133. Нарита Н. Кристаллическая структура неметаллических включе-
ний в стали: Пер. с яп. М.: Металлурrия, 1969, 191 с.
134. ЛиТВUНова Т. Н., Пuрожкова В. П., Петров А. К. Петроrрафия не-
;металлических включений. М.: Металлурrия, 1972, 184 с.
135. Шпuс х. и. Поведение неметаллических включений в сrали при
кристаллизации и деформации: Пер. с нем. М.: Металлурrия, 1971,
126 с.
136. ЯвойскuЙ В. Н., БЛUЗН10ков с. А., ropoxoB Л. с., Вuшкарев А. Ф.
В кн.:. Рафинирование 11 кристаллизация стали. ч. 1. М.: Наука,
1974, с. 1 15.
137. Turpin М. L., Elliot J. F. Iron and Steel Inst., 1966, У. 204, лr2 3,
р. 217.
138. МчедЛUШВllЛU В. А., rонzадзе r. А., CaAtapUH А. М. Изв. АН
СССР. Металлы, 1972, N2 5, с. 10 19.
139. Поппель С. и. В ки. Физико химические основы производства
стали. М.: Наука, 1964, с. 15 18.
140. БаnТUЭJ1fанскuй В. Н., БаХАfйН Н. К., Дмитриев ю. В.......... ИЗБ. ву-
зов. Черная металлурrия, 1969, N2 3, с. 42 45.
141. ХЛblНОВ В. В., Сорокин ю. В., Торновой В. А.......... В КН.: Физиче..
263
екая ХИ\IНЯ ПО5СРХНОСТIIЫл ЯI3лений в раеП..:Jавах. Киев: НЗУI(ова
думка, 1971, с. 234 237.
142, CTpozaHoB А. Н., Дробы.шевский А. С., Поволоцкий Д. Я. I1зв.
вузов. Черная металлурrllЯ, 1972, NQ 2, с. 64 66.
143. Обработка металла инерТНЫ IИ rазамиjОйкс Т. Н., Степанов А. В.,
Мелехов П. И. и др. 1\1.: l\1.ета.7Jлурrия, 1969, 112 с.
144. Хуснояров К. Б., Власов Н. И. ПРОIIЗВОДСТВО стаЛI1 Науч. тр.!
/НИИМ. М.: Металлурrия, 1972, NQ 16, с. 11 18.
145. Еланекий F. Н., Кудрин В. А., Azeee Е. Е., Бабич В. К. 11зв.
вузов. Черная металлурrия, 1974, NQ 5, с. 44 48.
146. ДерЯ211Н Б. В. Что такое трение? М.: АН СССР, 1963, 227 с.
147. Попель с. Н., ХЛblflов В. В., Дерябин А. А. В кн.: ФИЗИКО ХИМII"
ческие основы металлурrических процессов. /\1..: Наука, 1973, З08 с.
148. Х лыlовв В. В., Сорокин Ю. В., Стратоновuч В. и.......... в КИ.: Физико..
ХlI IIlческие исследования металлурrических процессов. Сверд..
ловек: УПИ, 1973, с. 114........126.
149. Л111наеа ю. А. )КФХ, 1969, т. 23, N2 9, с. 2379 2383.
150. А1uнаев ю. А., Русанов А. И. Изв. АН СССР. Металлы, 1971,
NQ 5, с. 59 66.
151. А1uнаев ю. А" УТОЧКllН Ю. 11., Fрuсорян В. А, ИЗБ. АН СССР.
Мет ал.ТIЫ, 1971, .N 6, с. 15.
152. ПлеКUflzер Е" Вальстер М. Проблемы современной металлур...
rии, 1960, .N2 6 (54), с. 82 1 07.
153. Plockinger Е. J. Iron and Steel Inst., 1963, У. 201, N2 7, р. 576.
154. Лепuнскuх Б. М., Кайбычев А. В., Савельев ю. А. Диффузия эле..
ментов в жидких металлах rpYnnbl железа. М.: Наука, 1974,
с. 191.
155. Бокштейfl Б. С., Бокштейн с. З., Жуховuцкuй А. А. Кинетика диф..
фузии в твердых телах. М.: Металлурrия, 1974, 280 с.
156. Астарита Дж. Массопередача с химической реакцией. л.: ХИМИЯ,
1971, 329 с.
157. Левuч В. Т. Физнко химичеекая rидродинамика. М.: Физматrиз,
1959, 659 с.
158. Эккерт Э. Р., Дрейк Р. М. Теория теnло- и массообмена и перено-
са. М. л.: rосэнерrоиздат, 1961, 680 с.
159. Франк Ка.Аtенецкuй д. А. Диффузия и теплопередача в химической
кинетике. М.: Наука, 1967, 491 с.
160. Физико-химические основы металлурrических пр оцессов/Жу.ховu[{..
КUЙ А. А., БелащеflКО д. К., Бокштеuн Б. с., FриеОРЯfl В. А.,
fpuzopbeo Т. А., Fуzля В. Т.: Мета.YJлурrия, 1973, 391 с.
161. Самарин А. М......... В КН.: Физико-химические основы металлурrиче-
ских процессов/Труды l-ro советско-японскоrо СИМПОЗНУ!\lа. М.:.
HaYI{a, 1969, с. 128 145.
162. Виzдорчu1С Е. М., Шеинин А. Б. Мате lаТlIческое моделирование
непрерывных процессов растворения. л.: Химия, 1971.246 с.
163. Попель с. Н., ПавЛов В. В.......... Журнал Всесоюзноrо химичеСI{оrо
общества ИМ. д. и. Менделеева, 1971, т. XVI, N2 5, с. 523 528.
164. Процессы взаимной диффузии в сплавах/Под ред. rYPoBa К. п.
М.: Наука, 1973. 359 с.
165. Fриzорян В. А. Журнал Всесоюзноrо химическоrо общества
ИМ. д. И. Менделеева, 1971, т. XVI N2 5, с. 535 541.
166. FРU20РЯfl В. А., Алеев Р. А. В К1I.: С1\ ачиваемость и поверхност..
ные свойства расплавов и твердых тел. Киев: Наукова думка,
1972, с. 1 89 192.
167. Филиппов С. и. Теория металлурrических процессов. 1\1.: Л1етал..
лурrия, ] 967, 279 с.
264
168. Травин о. В., Мокрова В. П., Паршин С. и. Теория метаЛ.ТIурrи
ческих процессов: Науч. тр./ЦНИИЧМ. М.: Металлурrия, 1971,
с. 33 З7.
169. FрU20рЯн. В. А., ШвuндлеР/llан л. С., Алеев Р. А........ ИЗБ. вузов.
Черная металлурrия, 1968, N2 5, с. 1 1 17.
170. \'(Iahlster М. Proceeding of tllC IV International conference оп
vacuum metal1urgy, Tokyo, Jиne 4 8, 1973, The Iron and Steel
Inst. of Japan, Tokyo, 1973, р. 56 61.
171. Патон Б. Е., Тu.хОНО8СКUЙ А. л. в КИ.: Рафинирующие пере
П.1Jавы. Киев: Н аукова думка, 1974, с. 150 162. .
172. ТtlХОНОВСКUЙ А. л. В ки.: Раq)ин рующие переплавы. Киев: Hay
кова думка, 1974, с. 167 179.
173. Лако.мскuй В. 1/. Плазменно дуrовой переплав. Киев: Техника,
1974, 335 с.
174. Сер2еев А. Е., Швед Ф. J{., Т УЛИН Н. А. Вакуумный дуrовой пере-
плав конструкционной стали. М.: Металлурrия, 1974, 191 с. о
175. Серебрuйс1СUЙ З. И., ПОЛИН и. В. Металлурrия. л.: Судпромrиз,
1959, N2 2, с. 22 32.
176. Есин о. А., Тельд п. В. Физическая химИя пирометаллурrических
процессов. ч. 1. М.: МетаJl.пурrиздат, 1962, 703 с.
177. Еременко В. Н........... УкраИНСI ИЙ химический }!{урнал, 1962, т. X VI 1 1,
вып. 4, с. 427 449.
178. БеЛЯНЧU1Сов л. Н.......... ИЗВ. вузов. Черная металлурrия, 1965, N2 7,
с. 74 76.
179. Латаш Ю. Во, Медовар Б. и. Электрошлаковый переплав. М.: Me
таллурrия, 1970, 239 с.
180. Клюев М. Мо, Каблуковскuй А. Ф. Металлурrия электрошлаково
ro переплава. М.: Металлурrия, 1969, 256 с.
181. Волков с. Ео В ки.: Спецнальная электрометаллурrпяо Киев:
Наукова думка, 1972. ч. 1, с. 9 1 7.
182. Кей А В КН.: Специальная электрометаллурrия. Киев: Наукова
думка, 1972. ч. 2, с. 47.........63.
183. Медовар Б. Н., Емельяненко ю. Т., тихонов В. А........... В ки. Рафи
нирующие переплавы. Киев: Наукова думка, 1975, с. 73 81.
184. Kojiтa У., Kato М., Toyoda Т., /nоиуе М. Tnanso Iron. and Steel
Inst. of Japan, 1975, Vo 15, Ng 8, р. 397 406.
185. ВЫЧУZО8 Т. А., ХЛblнов В. В., Хасин Т. А. CTatl'Ib, 1967, Х2 6,
с. 514 516.
186. Абрамов о. В. Кристаллизация металлов в ультразвуковом поле.
1\-\.: Металлурrпя, 1972, 320 с.
187. /lеЛlпuцкuй В. В., Окороков r. Н., БОЯРШUНО8 В. А.......... Сталь,
1972, Ng 3, с. 224 229.
188. КаЛJенскuй ю. М., Сухотин Б. Н., Я 80ЙСКUй В. и.......... Автоматиче
ская сварка, 1965, N2 1 О, с. 69 71.
189. СЛtелянскuй ;\1. Я., 1'r1аЛblшев С. А., TKafleB л. Т., rYTTeplttaH К. д.
Электротермия, 1964, N2 39, с. 18 20.
190. Заборонок Т. Ф., Зеленов Т. Н., РОНЖUfl А. С., Соколов Б. Т.........
Эпектронная П.ТIавка. М.: Металлурrия, 1966, 291 с.
191. Антропов о. ф" УСТИft К. п. Электротермия, 1969, NQ 87, с. 21
22.
192. П атон Б. Е., Мовчап Б. А., Тихоновский А. л. в кн.: Рафини
рующие переплавы. I(иев: Наукова YMKa, 1974, с. 179 195.
193. Тuхоновскuй А. л. в КИ.: РафИНИРУIощие переплавы. Киев: Hay
КОБЗ думка, 1975, с. 125 13 1.
194. Дю6анов В. Т., Ло.мберz Б. С., repacuMoaa Т. д. и др. Изв. ву..
зов. Черная металлурrия, 1975, с. 63 66.
265
195. Литейное производствоjПод ред. Куманина и. Б. 1\\.: Машина...
строение, 1971, 319 с.
196. Хворинов Н. Jf. КристаЛ.ТIIlзаЦIIЯ 11 неоднородность стали. 1\\.: Маш-
rи з, 1958, 392 с.
197. Вейник, А. и. Теория особых ВИДОВ .:'IИТЬЯ. М.: \ашrIlЗ, 1958.
300 с.
198. Fleпzings М. S. Modern Castil1gs, 1964, v. 46, Л 1, р. 31 36.
199. Бартон, При},! и Слuхтер. В КИ.: rерманий, М.: IIЛ, 1955, с. 74
81.
200. Белянчиков л. Н., Савченко Т. Т., ТРU20РЛН В. А. ИЗВ. вузов.
Черная металлурrия, 1975, N2 7, с. 71 74.
201. rоликов и. Н. Дендритная ликвация в стали. М.: l\1.еталлурrиздат,.
1958, 206 с.
202. Петрухин с. Н., FрU20РЯfl В. А., Стомахин А. я. 11 ДР. Изв. ву...
зов. Черная металлурrия, 1977, N2 5, с. 65 67.
203. ПОНОJ,tаренко А. F., Козлов ю. с. ИЗВ. вузов. Черная MeTaIl1011YP
rия, 1975, N2 5, с. 20 24.
204. Островский о. Н., Вайсбурд с. Е., Fр1l20РЯfl В. А. 11 др. 11зв.
ВУЗОВ. Черная металлурrия, 1976, N2 3, с. 55 58.
205. Термические константы веществ/Медведев В. А., БеР2ман Т. А.,.
Fурвuч л. В. и ДР.: СправочиикjОтв. ред. В. п. rлушка. М.:
ВИНvIТvI, 1965 1981. Вып. 1 10.
206. Термодинамические свойства индивидуальных веществ/Тур..
ВUЧ л. В., Вейц и. В., Медведев В. А.. и др.: Справочное издание.
Т. 1 4/0TB. ред. В. п. r лушко. М.: Наука, 1978 1982.
207. Суровой ю. Н., Окороков Т. Н., Нефедерова с. А., Кузнецов А. А..........
В кн.: Теория металлурrllческих процессов. M : l\lеталлурrия, 1972,.
с. 29 З8.
208. Stoтakhin А. Уа., Grigoryan V. А. The Eighth Japan USSR Joint
Symposium оп Physical Chemistry of Metallurgical Processes. June
16 18, 1981. Tokyo, Japan. р. 129 14З.
209. Большов Л. А. Изв. вузов. Черная металлурrия, 1982, N2 1.
с. 8 1 о.
210. Соколов В. М., БОЛЬШО8 л. А........ ИЗБ. ВУЗОВ. Черная металлурrНЯt-
1982, H 9, с. 5 8.
211. Большов л. А., Сто.махин А. Я., СОКОЛОВ В. М., Тетерuн В. F.........
Изв. АН СССР. Металлы, 1984, Ng 5, с. 60 62.
212. Elliott J. F. Ellectric Furnace Steel Conf. Proc. v. 32, AIME, 1975
р. 62 74.
213. AzeeB ю. А., Арчуzов С. А. Изв. АН СССР. Металлы, 1984, N2 З.
с. 78 80.
214. Рысс Т. М., CTpozaflOB А. Н., ECliH ю. О., rельд п. В........ ЖФХ.
1976, Т. 50, Н2 3, с. 771 772.
215. Kubaschewski О., Geiger К........Н., Hack К. ----- z. Metallkunde, 1977,
v. 68, N 5, р. 337 341.
216. Верт.ман А. А., Самарин А. 1. Свойства расплавов железа. М.:
Наука, 1969, 280 с.
217. Есип ю. о., Баев В. М., Л10розов с. Н. Физические свойства ме..
таллов и сплавов: Науч. тр.jУПИ. Свердловск: 'ПИ, 1976, Н!! 1,
с. 66 72.
218. Баталuн F. Н., Стукало В. ..4., Нещu.менко Н. я. 11 др. ИЗБ. АН
СССР. Металлы, 1977, X 6, с. 44 45.
219. Baп ya S., Maruyallla Л/., Kawase У. Tetsu to Hagane, ]984
v. 70, р. 65 72.
220. Lupis с. Н. Р. Chemical Thernl0dynamics of \aterials. N. У.:
Elscvier Sci. Publ. Со., Jnc., 1983,581 р.
266
221. rрuzорлн В. А., БеЛЯН,Чllков л. Н., CToJ.faxun А. я. Теоретические
основы ЭJlектросталеппаВIIЛЬНЫХ процессов. 1 e изд-е. М.: l\\eTan-
лурrия, 1979. 256 с.
222. Даркен л. с., Fyppu Р. В. Физическая химия металлов. Пер. с
анrл./Под ред. акад. Н. Н. Сироты. М.: Металлурrиздат, 1960,
582 с.
223. Сажарuн' А. ..\1., Карасев Р. A. ДAH СССР, 1958, Т. 119, N25,
с. 990 992.
224. Sherтan С. W., Elwander Н. 1'1 Chipтan J. Trans AIME, 1950,
,Т. 188, р. 334.
225. Ban ya S., Chipman 1. Trans. Met. Soc. AIME, 1968, v. 242,
р. 942.
226. Alcock с. 8., Cheng [. L. J. Iron and Steel Inst., 1960, У. 195,
pt. 2, N2 6, р. 169 173.
227. Cordier J. А., C/lipтan J. J. Metals, 1955, v. 7, Н2 8, р. 905,
228. J'точ1СUН ю. Н., Менделев В. А., Fриzорян В. А., Вестфаль с. В.
ИЗБ. вузов. Черная метаЛ.1урrня, 1983, N2 7, с. 5 9.
229. РаФИНИРУЮlцие переплавы стали и сплавов в вакууме/Боярши-
нов В. А., Шалuмов Ал. Т., Щербаков А. и. н др. Под ред.
В. А. Бояршинова. М.: Металпурrия, 1979. 304 с.
230. rурвич л. В. Вестник АН СССР, 1983, N2 3, с. 54.
231. Доронин r. И., Fуэенков В. А., БеЛЯНЧUКО8 л. Н. ИЗБ. вузов.
Черная металлурrня, 1982, N 7, с. 152.
232. "'1енделев В. А., УТОЧ1СUН ю. И., rрU20РЯн, В. А. ИЗБ. ВУЗОВ.
Черная метаплурrия, 1980, Х!! 7, с. 40 44.
233. Изв. вузов. Черная метаппурrия, 1986, Н2 9, с. 132 141.
234. ТУР1СдО2ан Е. Т. Физическая химия высокотемпературных процес
СОВ. Пер. с анrл./Под ред. В. А. rрнrоряна. М.: Метаплурrия, 19815,
344 с.
ПРЕДМЕТНЫй УКАЗАТЕЛЬ
А
Аверина зависимость 196
Апоrадро число 36
Аптоэ ульrирование 103
Адсорбция 9]
Азот в расплавах 135 J43
Азотопроницаемость шлака 69
Активность кислорода в жидком
l\{eTa.1J 1e 146, ] 56
fwfежфаэная 102
методы определения 26 28
поверхностная 102
racTBopoB 22 26
ЧlIстоrо оксида 149
элементов раСКIIСЛRтелей 149
155 .
ApXII leдa фОРМУ.1а 161
Б
Белла реакция ]72
Бно I{ритерий 238
Быстрота действия naKYYMHOrG
насоса 206
поrлощения J аза 206
в
BaI-lT rоффа уравнение 11
Водород в расплавах 14З 145
Водородопроницаемость шпаков 69
Вязкость динамическая 175
I{инематическая ] 75
шлаков 70
Взаимодейстпие серы с rазовой
фазоЙ 129, 130
с сульфидообразующими Э.ТIе.
ментами 130 132
r
rазопоrлотительное действие парJ
Boro конденсата 206
rаЗОПРОllиuаемость шлака 69
rенри 3t;1KOHbI 17 19, 20, 22
константа 18
rерuенит 152
rиббса формула 91
rиббса энерrия 6
избыточная 50
образования соединениЙ 8
10
приведенная 7
267
свободная 6
стандартная 6, 7
rиб6са rельмrольца уравнеНIIС
57
rllб(jса Дюrема уравнение 16, 17,
21, 28, 30, 31
rиббса Фольмера теория 157
rll.аьдебранда понятие реrу.ТIЯРНО-
ro раствора 34, 35
fуrrенхейма теория 47 .
rуrеllrейма Адама уравнение 91,
92
rрафический метод определения
парцнальных характеристик 15, lf
Д
Давлени.е раСl{линиваlощее 168
Дамкелера критерий 200
Десульфурация при ЭШП 223
229
Дефекты слитка БДП 209, 210
Дефосфорация металла 133 135
Диффузия конвективная 176 179
молекулярная 173 175
ДОJIИ компонента атомные 12
массовые 12
молекулярные 12
мольные 12
Е
Емкость шлаliа сульфатная ]25
""'7"" сульфидная 12 129
Ж
ЖИДКОПОДВИЖlIОСТЬ Ш.71аков 70
ЖУХОВlIцкоrо уравнение 94
3
Закон действующих масс идеаль
ныЙ 12, 13, 76
квадратноrо корня 135
Зародышеобразование reTeporeH-
ное 158
rOMoreHHoe 159
И
Избыточная энерrия rиббса 34,35
Изобарно изотермический потеn-
циа,,1 6
Интенсивность зародышеобразова-
ния 157
К
КIIСЛОрОД в расплавах 1 09 112
взаимодействие с уrлеродом
115 120
КИСЛОРОДОПРОllицаемость шлака
69
Кнюппеля зависимость 212
Коаrуляция ортокинетическая 159
перикинетическая 159
KO)f{eYPoBa теория 77, 78
268
формула 78
Константа равновесия реаКЦИIl 64
СI{ОРОСТИ процесса у ,J.а.1Jениq
азота 207
водорода 204
Концентрация равновесная 6-1
Коэффициент активности 3. 28
водорода 144
серы 124
диффузии 173, 175, 177
.......... массопередаЧII 1 73, 177 179
массопереноса серы 225
перераспределенин эффеКТtlR
ный 252
поверхностноrо натяжения 90.,
91
распределения серы 127 129
.......... фосфора 134, 135
растворимости азота 136
растекания 107
........ темпераТУРОПРОВОДНОСТII 203,
253
"'""- формы ванны 24S
Краевой уrол смачивания 104, 106,
166
Критическая концеН1'рация води-
рода 204
л
Ла\lба уравнение 164
Ланrмюра уравнение 93, 9.t, 186
Ле Шателье принцип 11
Ликвация дендритная 252 255
Лимитирующа51 стадия rетероrеч-
Horo процесса 180 182
Лопиталя правило 48
Люписа соотношение 25
М
Массоперенос компонентов в шла-
ке 191 194
Машина непрерывноrо литья заr')-
товок 236
полунепрерывноrо литья заrо-
товок 236
Межфазное натяжение между ме-
та лом и шлаком 101 103
динамическое 102. 103
неравновесное 103
статическое 102
eTOД калориметрический 123
определения термодинамичt;с-
них функций Ш.пака 76 78
теоретической оценки активно-
стей компонентов 86
еханизм образования пузырrй
189 191
у да,,1JСIПI я в К.fJючениЙ 169 171
в условиях вакуума 171
173
Моль 13
масса 13
МО 7]ьная доля насыщения 31
Н
Направление химическоii реаКПltн
1 1
Насосы испарительно rетероrенные
206
Неметаллические вклК'чения 156-
]73
классификация 157
Нитрндообразование 139, 140
.......... условия 139
Нуссельта критерий 179
О
Обезуrлероживание 120, 185 ]89
.......... температурный ПОрОI' 187
Основность шлаков 70
Отклонение от законов Рау.пя п
rенри 22
.......... отрицательное 23, 24
.......... .......... .................... положительное 24, 27
Отливка разовоrо формирования
236
П
Параметры взаимодействия Э..че.
\leHTOB 49 63
....... BToporo порядка 58, 59
.......... nepBoro порядка 54 56
энтальпийные 57
........ энтропийные 57
Пекле критерий 119
Перемешивание шлака 193
Переокиспевне расппава 187
Переохлаждение концентрацион-
ное 250, 251
термическое 25]
Плотность шпака 70, 71
Поведение элементов при ЭШП:
азота 228, 229
водорода 229........231
серы 223........228
Поверхностно активные вещества
] 65, 184.......186
Поверхностное натяжение жидки
металлов 90 92
........ коэффициент 90, 9]
................. чистых металлов 93
................. шлаков 100
Поверхностное сrущение 90
Подвижность примесей диффузи-
онная 69
Полнота протекания реакции 1 О,
11
Попеля Павлова уравнение 95
96
Пористость осевая 256, 257
Поток азота 192, 193
диффузионный 174, 177
кислорода 192, 193
Правило фаз 64
Предел растворимости 110
Продолжительность полноrо за-
твердевания слитка 238
Процесс rетероrенный 180 J82
184.......186
....... квазистационарный 236
....... переплава трехстадийныЙ ] 97
Р
Работа адrезни 91
........ коrезии 91
....... разрыва стодба жидкости 91
Равновесие химических реаКЦИR
63 68
Радиус капли 197, 198
пузыря равновесныЙ 189
Раковина усадочная 255, 256
Раскисление металла 146 156
rлубинное 156
диффузионное 155, 156
Раскислите..ТIlI комплексные 15 t,
155
Раскислительная способность эл -
ментов 149 155
........ шлака 155, 156
Распределение элементов Jtiежду
металлом и шлаком 85 89
........ константа 85, 86
Растворимость азота в железе 136,
137
............... в никеле 141, 142
........ в хрОМЕ; 142, 143
водорода в железе 143 145
кислорода в железе 11 О, 111
в никеле ] 11, 112
оксида 110
серы в шлаках 126
Растворы 12........16
активность 22 26
бесконечно разбавленные 29:.
30
идеальные 17........22
....... квазиреrулярные 41, 42
....... насыщенные 31
разбавленные 18, 20 22
......... реальные 22........26, 29 33
реrулярные 3 40
свойства интенсивные 13
экстенсивные 12
........ совершенные 13, 18 20
26t
состав 12
субреrУJ]ярные 40, 41
Растекание 107, 108
коэффициент 107
мета.7Jла и Illлака 108
Рау.1Я законы 17 19, 22
Рафинирование металла при пере
плавных IJроцессах 194 236
......... ......... при В Д П 202......... 218
........ nplI ЭЛП 2Зl 2З6
при ЭШП 218.........231
Реакция раскисления 147
........ химическая, направление 1 О,
11
........... полнота протекания 11
РеЖИ 1 температурный процесс
ЭЛП 232
......... ЭШП 218,219
........... Э.1еl\трическиЙ процесса ЭШIl
226,227
РыБЧlIнскоrо Лдамара формула
161, 162
РЫХ.10СТЬ усадочная 257
С
Свободная энерrия 6
CBoiicTBa раствора интенсивные 13
.................. эк сте н с 11 В Н Ы е 12
Ш.fJаков защитные 69
CepreeBa зависимость 207
Сера в расплавах 123 132
......... взаимодеЙствие с rазовоЙ cpe
дой 129
'.................... с СУJ]ьфидообразующими эле
tleHTaMII ] 30.........132
......... со шлаком 124, 125
Сивертса заl<ОН 27, ] 09, 135, ] 3')
Скорость ВСПЛЫDания ВК.'1ючениii
161 I63
......... диффузии ] 74
н:онвеКТIIВНЫХ потоков 163
С.'Iптки нелрерывноrо фОрМllрО13а
ния 237
......... no.ТIYHenpepbIBHoro фОрМИровз"
ния 236
полые 240
......... раЗОБоrо формирования 236,
237
С.ТIой поrраничный rидродинамиче
скнЙ 176
......... диффузионный 177
Смачивание 1 03 1 08
rрафllта }иелезом и шлаКОl\f
1 06, 1 07
............ ОКСИДОВ ЖИДI{ИМИ металла III
1 05, 1 06
Сорбция 69
270
Способ подвода окислителей 186,
187
Способность шлака десульфурир}-
ющая 126
сорбционная 69, 84, 85, 12!
Стадия диффузионная 182, 183
кинетическая 182, 183
Стандартная энерrия rиббса ofi-
разования соединений 8 10:
карбидов 8
нитридов 8
оксидов 8, 9
сульфидов 9
фторидов 9
Х.ТIоридов 1 О
Стандартное состояние веществ
6, 7
компонентов 22
Степень дендритной ликвации 255
переrрева над т мпературой
ЛИКВIIдуса 202, 203
пересыщения 157
рафинирования 197, 198, 200
удаления азота 207
......... водорода 205
Стефана Больцмана ПОСТОЯНdая
203
Стокса формула 161
Стокса ЭйнштеЙна формула 175
Стэнтона критерий 208
т
TareeBa формула 238
'Темкнна метод 76 78
Те:\lпература ..YJиквндуса 202
СОЛlfдуса 202
Температурный коэффициент 110-
BepXHOCTHoro натя}Кения 93
Теория квазиреrулярных раство-
ров 42,
квазихимическая 47
плавления твердых тел диффу-
зионная 184
реrу ТIЯРНЫХ ионных растворов
77 80
рсrулярных растворов 35 40
совершенных ионных растворов
76,77
cTporo реrулярных растворов
47
субреrулярных растворов 41
......... Ш.1аI<ОВ ионная 68
молекулярная 68, 69, 71 7?
элсктронноrо строения кондеd-
сированных веществ 82
Термодинамическое условие УСТ0Й-
ЧIIDОСТИ DК.пючений 166
Толщина поrраничноrо дпффузи-
OHHoro слоя эффективная 178
Торможение адсорбционное 164,
165
У
Уrлерод в расплавах 113 115
.................. взаимодействие с кислоро-
дом 11 120
Удаление при ЭЛП включениЙ
235, 236
........ rазов и летучих ПрИ lесеii
232 235
Уинклера Чипмана формула 133
Уравнение конвективной диффу
зии 178
Уровень Ферми 82
......... в оксидных фазах 83
......... химическоrо потеНllиала 82
Устойчивость пленок l.fеталла на
rраннце раздела фаз 167 169
Ф
Фаза рафинирующая 195
Ферми уровень 82
Фика второй закон 174
первый закон 173
Филиппова теория 188
Формула квадратноrо корня 237
Фосфор в расплавах 133 135
Френкеля формула 160
Фронт кристаллизации в непре-
рывном слитке 242
Функции шлаков термодинамиче-
ские 80 85
.......... технолоrические 69
Х
Характеристики мольные IIHTer
ральные 14, 15
.................. относите.lьные 14, 15
.................. парциальные 13, 15
шлака технолоrические 70
Химический потенциал KO lnOHelI
та 14, 30
.................. ки сл О р од а 81, 83
.................. м а r н и я 8 1
.................. электронов 83
, Ч
Чипмана I<орриrана соотношение
59,60
......... уравнение 60, 61
Чуйко теория 73
ш
Шенка значения констант распре-
деления и диссоциации 72
......... теория 72
UПервуда критерий 179
Шишковскоrо формула 93, 97
Шлаки сталеплавильные 68 69
......... высокоосновные 70
......... кислые 70
(рторидные 223, 228
Э
Электрическая ПрОВОДИМQСТЬ шла-
ка 70, 71
Элементы rидридообразующие 144,
145
диффундирующие 174, 175
нитридообразующие 137, 138,
140
поверхностно активные 97
ЭлемеllТЫ десупьфураторы 131
Элементы раскиспители 146 156:
алюминий 151, 152
бор 152
ванадий 152
кальций 153
кремний 150, 151
маrний ] 53
марrанец 149, 150.
титан 153
цирконий 152
Энерrетические параметры эле-
ментов 87
Энерrия активации массопередаЧJI
178
обмена 87
смешения 36
Энтальпия мольная ннтеrраЛЬН1Ч
14
парциальная 14
Энтропия образования разбав ен-
ных растворов 20, 21
.................. совершенных растворов 19
......... смешения 87
Эффективная толщина поrрЗНIJlI-
Horo диффузионноrо слоя 178
Я
Явления электролизные на Э"lект-
родах 227
Явойскоrо классификация неме-
таЛJJических включений 156, 157
271
НАVЧНОЕ ИЗДАНИЕ
Вули Аршакович fриrорян
Лев Николаевич БЕЛЯНЧИКОВ
Александр Яковлевич СТОМАХИН
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ
ЭЛЕКТРОСТАЛЕПЛАВИЛЬНЫХ ПРОЦЕССОВ
Редактор издательства Е. К. Полторацкая
Художественный редактор Ю. и. С.м.урыzин
Технический редактор М. и. Воскобойникова
Корректор В. М. rpUaHeBa
ИВ Н2 2802
Сдано в набор 03,10.86. Подписано в печать 13.04.87. Т 11З21. Формат бумаrи
84Х 108 t /32. Бумаrа Тllпоrрафская N2 ]. rарнитура литературная. Печать высокая.
Уел. леч. л. 14,28. Усл. Kp. OTT. 14.49. УЧ. IIЗД. л. ]6.48. Тираж 4600 экз.
Заказ 675. Цена 2 р. 90 к. Ilзд. 1\2 1113
Ордена Трудовоrо KpacHoro Знамени издательство с еталлурrия»
] 19857. rсп, OCKBa, r З4, 2 A Обыденский пер., д. 14
Владимирская ТJlпоrрафия Союзполиrрафпрома при rосударствеllНОМ
комитете СССР по делам издательств, ПОЛllrрафии 11 книжной t'орrовли
600000. Т. Владимир, Октябрьский проспект, д. 7
J:)
c:t
о
s:
а..
UJ
к:::
1 1
2 n
з' m
4
5
6
7 Х
.LJ
ct
s:
о
ж
<с:(
.....
:I:
«
..о
q
s::
о
:I:
:s::
.....
:о
t::t
u:.
а.
1
Пер )1 О Д Jf Ч е с к а я с п с т е м а
JI
R 2 0
RO
456 7
Ве 2S z 2s 2 2 p 1 В 2s 2 2 p 2 С 2s 2 2 p 3
БЕРИЛЛИЙ 2 з БОР 4 уrЛЕРОД 5 АЗОТ
9,01218 2 2 10,81 2 12,011 2 14,0057
12 13 14 15
Mg зs 2 З s 'lЗ р 1 Аl 3s 2 3p2 Si Зs 2 Зр3 Р
мдrний АЛЮМИНИЙ КРЕМНИЙ ФОСФОР
24,3QS 2 2 26,98154 2 28,086 2 30,97376
С 20 " S 21 Т . 22 23
4S1 1 а 452 2 С Зd'4s 2 2 I Зd 2 45 2 2 V 3d 3 4s 2 2
КАЛИ 1 g КАЛЬЦИИ СКАНДИЙ ТИТАН 1 ВАНАДИЙ 1
З9,сgе" 40,08 2 44,9559 2 47, QO 2 50,9414 2
29 ЗО 31 32 33
N 1 3d' Од 51 С U 2 3d' as2 Zn з 4S'24p1 G а 4 4S 2 4p2 G е 5 4S 2 4 p 3 As
r 18 МЕДЬ ' ЦИНК 'g rАЛЛИЙ ' rЕРМАНИЙ 1 мышьяк
К 63,546 :: 65,38 2 69,72 2 72,59 2 74,9216
37 1 3 8 2 39 2 40 2 41 1
Rb 5516 Sr 552 8 У Ad 1 S5 2 9 Zr 4d 2 SS 2 10 Nb 4d 4 5S " 2
r РУБИДИЙ 19 СТРОНЦИЙ 19 ИТТРИЙ . 19 ЦИРКОНИЙ 1 НИОБИЙ 1
к 85,4678 2 87,62 2 88,9059 2 91,22 2 92,9064 2
\J 1 47 2 48 3 49 4 sa 5 51
N 184d'OSS1 Ag 18 4d 1 0SS 2 Cd 18 5s 2 5p1 I n 18 5S25 2 n 18 5s 2 5p3 S Ь
r 'g СЕРЕБРО ' КАДМИЙ ' ИНДИЙ ' ОЛОВО v ': CVPbMA
к 2 107,858 2 112,49 2 114,82 2 118,69 ,2 121,75
Р \' 5 1 56 2 57 2 72 2 73 2
2 Cs '.... j S ' 1 Ва БS 2 1g La 5d'б521 Hf 5d 2 бs 2 , Та 5d 3 В3 Z И
ЦЕЗИИ 18. БАРИЙ 19 ЛАНТАН 1: rдФний ' ТАНТАЛ 'g
к 132,9054 2 137,34 2 138,9055 2 i78,4g , 180.9l179 2
g 1 80 1 81 1 82 1 83
32 5d 1О бs 2 Hg 32 бs 2 бр' 11:2 бs 2 б р 2 РЬ 32 б5 2 6 р 3 В i
'g РТУТЬ ' ТАЛЛИЙ ' СВИНЕЦ 1 ВИСМ Т'
к 2 200,59 2 204,37 2 207,1 9 2 208,9804
g 88 89 104 15 105 1f
о 'Ra 75216 Ас бd 1 is 2Н1 Ku бd 2 7s 232 Ns бd37s2 2
N 32 ... ,32 ... 32 ..
м РАДИИ 19 АКТИНИИ 'В КУРЧАТОВИИ 'Я НИЛЬСБОРИИ'8
226,0254 2 (227) 2 (260 2 (261) 2
к
1
Н 15'
ВОДОРОД
1,0079
Li 3
N
2s f
ЛНТИЙ 1
6,941 2
11
М; Na .351
L НДТРИЙ
к 22,9B9 7 j 2
К 19
L
К
N
М
L
К
v
v1
ИI
IX
, 79 Д
32 5d 3651 U
19 ЗОЛОТО
2 196,9665
87 1
Fr 7S i
Фрднции 1
(223) 2
р 58 2
С е 4f 1 5d 1 бs 2 18
r ЦЕРИЙ 19
к 140,12 2
р 55 2
Т Ь 4f 9 6s 2 2
r ТЕРБИЙ 19
к 158,9254 2
90 12
Th бd 2 7s 218
... 32
ТОРИИ 18
232,0381
р 97
в к 5f!бd1 s2
М БЕРКЛИИ 13
k (247) 2
59 2
Pr 4f 3 бs 2 2
ПРАЗЕОДИМ 19
140,9077 2
бб 2
D v 4f 10 65 2 2
ДИСПРОЗИЙ 'g
162,50 2
r
р
ш N
R 2 О з RH4 'НО 2 RH
ба 2
N d 4f4бs2?
НЕОДИМ 1
144,24 2
67' 2
Н ' 8
О 4f 11 бs 2 29
.. 18
rольмии 8
164.9304 2
61 2
Pm 4f5бs22
ПРОМ ЕТИЙ '
(145) 2
68 2
Er 4f'2бs2з
ЭРБИЙ 19
167,26 2
92 9
U 5f36d ' 7s2 i
УРАН 16
238.029
99
E 5.f1'75= !
ЭИНШТЕИНИИ 1В
(254) 2
93 9
N Р 5f4бd'7s222
_ 32
нептунии 11
237,0482 2
100
Fm 5f'275 23
- 32
ФЕРМИИ 1В
(257) 2
n
n
ы
\j
R 2 0 s
N
62 2
S m 4f 5 65 2 2
СДМА?ИЙ 'В
150,4 2
69 2
Тт 4f' бs2з I
ТУЛИИ 18 i
6 I
168,9342 2 I
94 I
Pu 5f 6 75 224
... 32 I
ПЛУТОНИИ 'g I
(244) 2
101
М d 5f 13 75 2 3
МЕНДЕЛЕВИЙ ij
(258) 2
.э JI е м е н т о в д. и. М е .1 Д е J] е е в а
э
Е
м
л
YI W
RH 2 RО з RH R 2 0 7
(Н)
в 9
2 s 'Z2 p 4 О 2s 2pS F
е КИСЛОРОД 7 ФТОР
z 15,9994 Z 18,99840
16 17
Зs"З р 4 S Зs 2 З р 5 Сl
СЕРА ХЛОР
2 32,06 2 35,453
24 25
С r Зd'4s ' 1 М n Эd 5 4s 2 2
ХРОМ 1 MAPrAt-IЕц1
51,996 2 54,9360 2
за 35
б 4s 2 4 p 4 S е 7 4S'Z4 p s В r
1 СЕЛЕН 18 БРОМ
2 78,96 79,904
42 1 А3' 2
М О 4d 5 S5'13 Те 4d 5 5s 2 ,з
МОЛИБДЕН 1 ТЕХНЕЦИЙ 1:
95,94 2 98,9062 2
6 52 7 53
'8 5s 2 5 p 4 Те 18 5s Z 5p5 I
' ТЕЛЛУР ' ЙОД
2 127,60 2 126,9045
74 2 75 2
W 5d 4 бs 2 R е 5d 5 бs 2
ВОЛЬФРАМ 'g РЕНИЙ 1
183,85 2 .186,207 2
11 84 7. 85
32 бs 2 б р 4 Р О l 6s 2 б р 5 Д t
' ПОЛОНИЙ 18 АСТАТ
2 (209) (210)
б3 2 64 2
Еи 4f7б522 Gd 4f75d1бs22
ЕВРОПИЙ 18 rддолиний 19
151,95 157,25 2
70 2 71 2
У Ь )f'4БS-? LU4f 14 5d 1 бs 2 з
итr r РБИЙ J ЛЮТЕЦИЙ 19
173,04 174,97 2
8
Ат 5f 7 75 225
01 2
АМЕРИЦИИ i
(243) 2
102
No 5f'475232
НОБЕЛИЙ i 2
(255) В
9б 2
С m 5f 7 бd ' 1s 2 2
0# зz
КЮРИИ 1В
(247) 2
103 '
L r-5f '4 бd 1 7s 2 з
ЛОУРЕНСИЙ 12
( 256)
Е
в
Ш1I
н
т
о
R 04 ........
F 26 С 27 N · 28
е Зd б лs 2 2 О Зd'4s 2 2 I 3d 8 4S Z 2
ЖЕЛЕЗО 1; КОБАЛЬТ 1 НИКЕЛЬ 1
55,847 2 58,9332, 56,71 2
44 1 А5 1 46 о
R u Ad 7 ss 1 15 Rh .4d 8 5s 1 16 Pd 4d 1 0ssO 18
РУТЕНИЙ 'R РОДИЙ 1 ПДЛЛАДИЙ 'g
101,07 Z 102,9055 · 2 106,4 2
О 76 11 77 2 78,1
5 5d 6 бs 2 32 I r 5d 7 бs 2 pt 5d9бs1:
ОСМИЙ 'g ИРИДИЙ 'g ПЛАТИНА '
190,2 2 192,22 2 195,09 2
Атомный номер
. 26
Fe ЗdеАS Z 2
ЖЕЛЕЗО 1
55,847 2
Атомная масса
о
2
Н е 1S Z
. rЕЛИЙ
-',00260 2
10
Ne 2s 2 2 p E'
НЕОН s
20,179 2
16
Ar Зs 2 З р б
APrOH :
З9,Q48 2
К "'с
r Аs2 ;б в
КРИПТОН ,в
8
83,80 2
54 В
Хе 5 S 'Z::lб 16
. КСЕНОН 18
131,30
86 11
R n бs 2 б р б З2
РАДОН 18
(222)
Распределение ЭJ1ектронов
по застраивающимся и по--
сле.пующим 5астроенным
подуровням
Число электронов 8 слоях
1 электронный СЛОЙ К I
П " " L
m ,. " м
li .., " N
V " " о
и ,.. ", р
w ... .., Q
иепое число в скобк х массовое
число наийопее УСТСЙЧИ80rо изотопа
ис усственноrо радиоаКТИБноrо элемеНТi.
целое число Dез c oDOK массовое число
наиDолее pacпpOCTpaHeHHoro изотопа
лриродноrо р диоа Тf1вноrо элемент .
\
. , ,
I t'lit, , .... , ;f I ," \
\1 I . ' 1, , '" i '.
,, . , I , r !' ,
. \ ,1 .: · . ' , . 110/
'.. , .. I 1 ' ' I .'
. .. " , , "' l'
!\. /. , i " . : ' \ r ,. ',1
'k,:" \ ' .) ,' о ' A \'1' :.: ,. ',О ,\
· \ ! 1, ' ',' ':' t ,,:., \' " 'I 1 ! f,' .... .'
о
t , ) " · , .. " ...у I ' 1 , . '
(.,: / \ , ') !' ' · ." l' t '. , " ,,1' ; \\
' , ' 1....' ., " I ,4. , . ,: . . I ' ).
r ,. r . ,.. , \"'" '\ . I .
\ ''\о .' '1 J · , " " 1, ) ' . t ., I ., Ir. 1. <,:'.. ' '.' . : ,..
'; : I ':U, t t <, .." '\ \ t',: " · · \ '" . I i'
' .''' ,. , 'i !II.:" \ I , , . ,'" '. , '.'
о \, ,', . , 1 " 1: "'" '1 "f. '1\! '
'\ ',. 'r ,. ( : , ,, :'} \ >1 . I , }.
& . l' t .:.:.t" t . , . , I "" , ' , " ):t 1, "1 , ) . I , ,,'
:!I :Iif' , , .' i ''1, (. ( '1 , '.' ,( " . .
' ,, , ' · , ' Ili' " IJ. I ' "!, 1' '1 " 10. ": ' ) ', t I
... '. .,I:ii: .1., 0;:- л' 4 " r. \ '1 'i' , ':"':ф, ". ' , 4'
1 '" i\I.. ) , '. . '. I'r 'и" ". ,
\ " '" \ \ \ t , " '. . , I , . " "
I .. '" . '" . J ' " I I
\'1' !I. "." \ '1 ': .. 1', \ , ' о-о " ;, О"", "1. > ,!-' .
' ' 1 1i\ I ",' ' \ , :... I l' ,_ \, ' " ') " ) ' .
J , ( · \.., ' ... " " f .. , , . . , k J " ,
,jRI"1: \ ,.,} \ ' "(., ., 1', r ' '\ I I д. '\, t.
,it.:" :h 1" \,. .: , . '" :I. ' , " .
\: :: . : ' : \ \.;" : i;': (,: . f ;' ," \.,: ) ' ' , %"'.
' 1 .:: о!-. \ " " " ", · А $" t' I \ ,-', ...
' ..,,' ,''\J:' ) ) \ ,1'1 ,4i '''(,' <.... j r,\: ,. .t
",! ; ,,\. f",.... "'\ l · \,\ ('t' ' . ,1 \" ,* : '"
' ri. f" r I ' , "! ,)li,
}. "' " \'(" 1: 1', ; ",' · " !' " , 'ч . ' : ., 'i!' ... I
· \ ' {, ',оД., I ,) \'.1; · :" "', . o!t' t h ,. '1 :,. r' .\' I '';'\
' ,1, , ... ' 1" . ;, \ . .. ; , . ." , , .
\ ,, · o :' 1 \ " . '.. !").."
'1 i'_ ,,' \ n .. о, i О '1 , <1' \ ' .. о .,1', 1, , ,
1'f'\ , h ., ' ..' " " "\ . . , 't I < .., \ \ .
'\, :f \ I 1, .\ "о 1.. t '. I , l' . , '
\ \\ ',. Ч · "!о I о' t, r ,., 1! ,,' " . , , '." (, , , .
' ;. \:.. " '.. 1. ,..',. ,,' I , . ., I
,O " II"', \. h \'1" . '.: . 1.', , С. '...
, )l« 1b'" 011: l' , ';: , 1 Ч\ . \1 ' ., Ia . ),,, j ' ,
. C1 , .. 1 I ,'l'l т. ! b ....' ',-: ''\ 4 " о , , " ., ,
j "'j. it '\ \. ,' '\'. . с '\,1, 1;."
r. '"!о." '.\), 1 I \ ..0( "' t. 1",. i'" \ '
.!\. · :' , : :'> и" :' l'.. ' .t iЩ' ', ! . , , l' " : '1 ' '\ :'\ \ ' \
'hl' , .... I' ','!:' '''\\. , 1, , .
' '1) ' ' ; ,)', '; I !', i . . ч : , \,' ,,+ '\ ,,' I \, '" '
'>: . ..} \ I t . \ l ., ''Jo\ :' , \ ' l' . '
' , · ,. "". \ :.., I о' Ч ,\ \ I' <1, ,. "
· · '. ,;. ..,., '" I I,'IS " to!o' , ..' . . . '!, ( .
!,.с J " ;:r., , Ч : '\" l' ', \ '.}. . I "
аН, \ '- I .. . / . I t ). " , \...:): , ". \
' ,tJt . .' .\ · '". '" "t , [ ' . "..
\ .. I ' ,. ',1 " ; \... '1}- , ,'!) :- It \.
. · '): . , . "I \ , t
"i::, ' :;.\t! \ \ ,1.' / ':'Ч f ., "
" · i 1 , '. I ! , r- ",1,' I
, " \ 1\} " I ., '. . " l
'"... ., , '< \ I ,
oi · t' ;'). щ\,', 1'\' '\;< . 1" t . I " t 1
1. I о. " . itr- . ; '" (.
" ,. .., , " " f
..
, " \
1
I
.' \
. .
1
, '1
"
,\"
'''1 { t:
(
rr t .
. .
(. .. ... .'
о
,.
1 1.
1'1' "
'.:\. ) '
.' "'.. ., \ '
t tl
.' .\ t "
. \ ':
' ' ,!-!.
} .
. ,1
".. ,
&.
\' · с
1,'
, .'
t \1 : 1,.
f :'. } ( . ..
(.
, ,
\о
1., J
.
\,
.' '\
.," l' I о
. "", f ..1
, .
\
о; "{ .':1 )' .
111'.' r ., ;
. _ . I ,t', '
:{ '" ) " .t {'
1\ .1 ot\ ,'\
.. ......, .
t".J ..
, .. '
at о
'
.. 1
.. '
,
f..
.
"
, \'
'\ <
&.
o\i,
. ,
"
i
'\ I
.
, . .
11 \1;;" '\
\..
f
) t
1(.
"
t
,\
\.'
,
(;
t
, ) f ' ,
". i,t 11
.1
.
, j .. "
, о
1
\
,
. ,
{ t
'" \;
\,t
. '.
1i
I
't
"
N
')
\O
I. о
'1\
'i1.
.'.
\
,
..\
t
, .
\-
,.
\