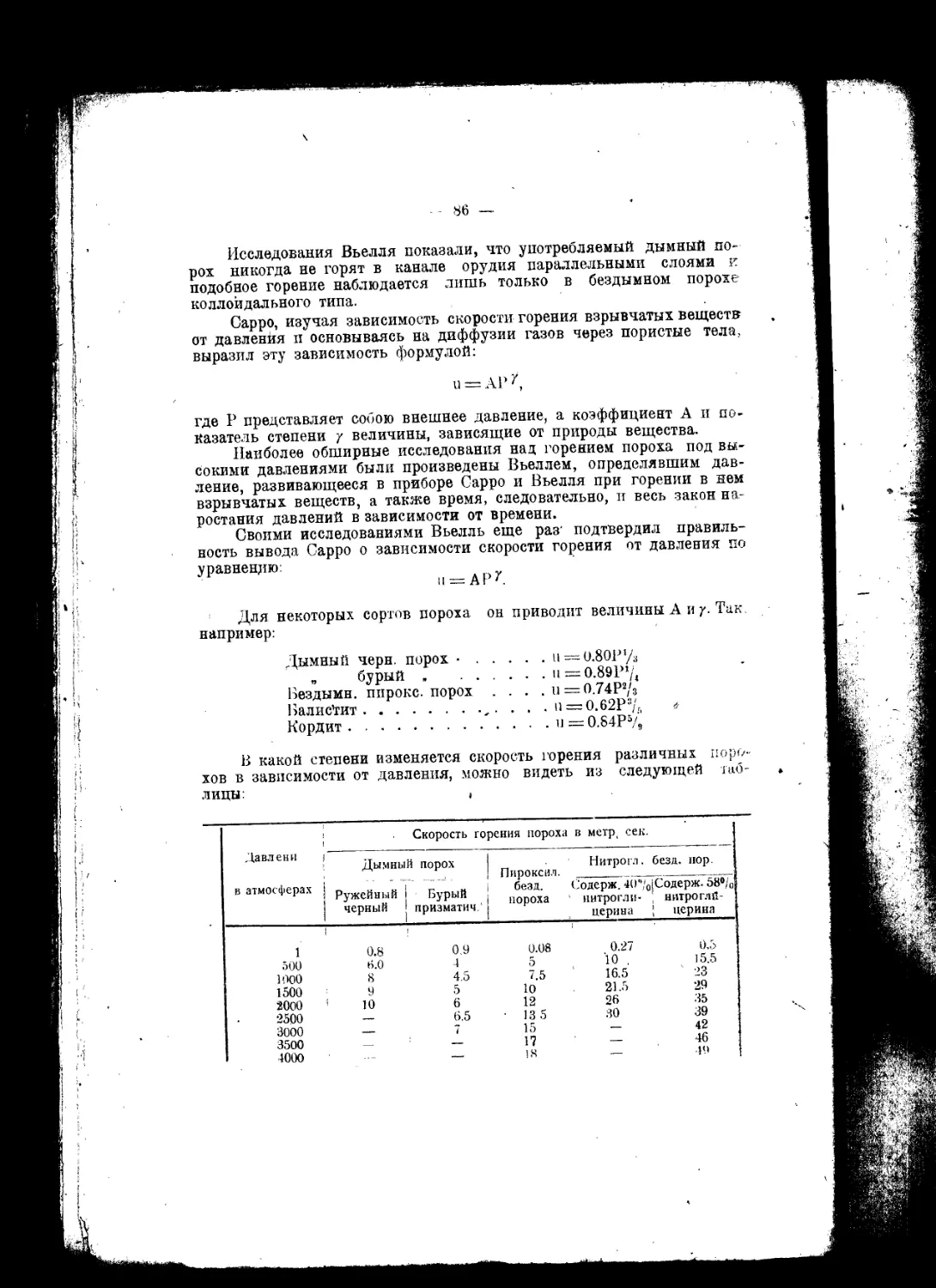
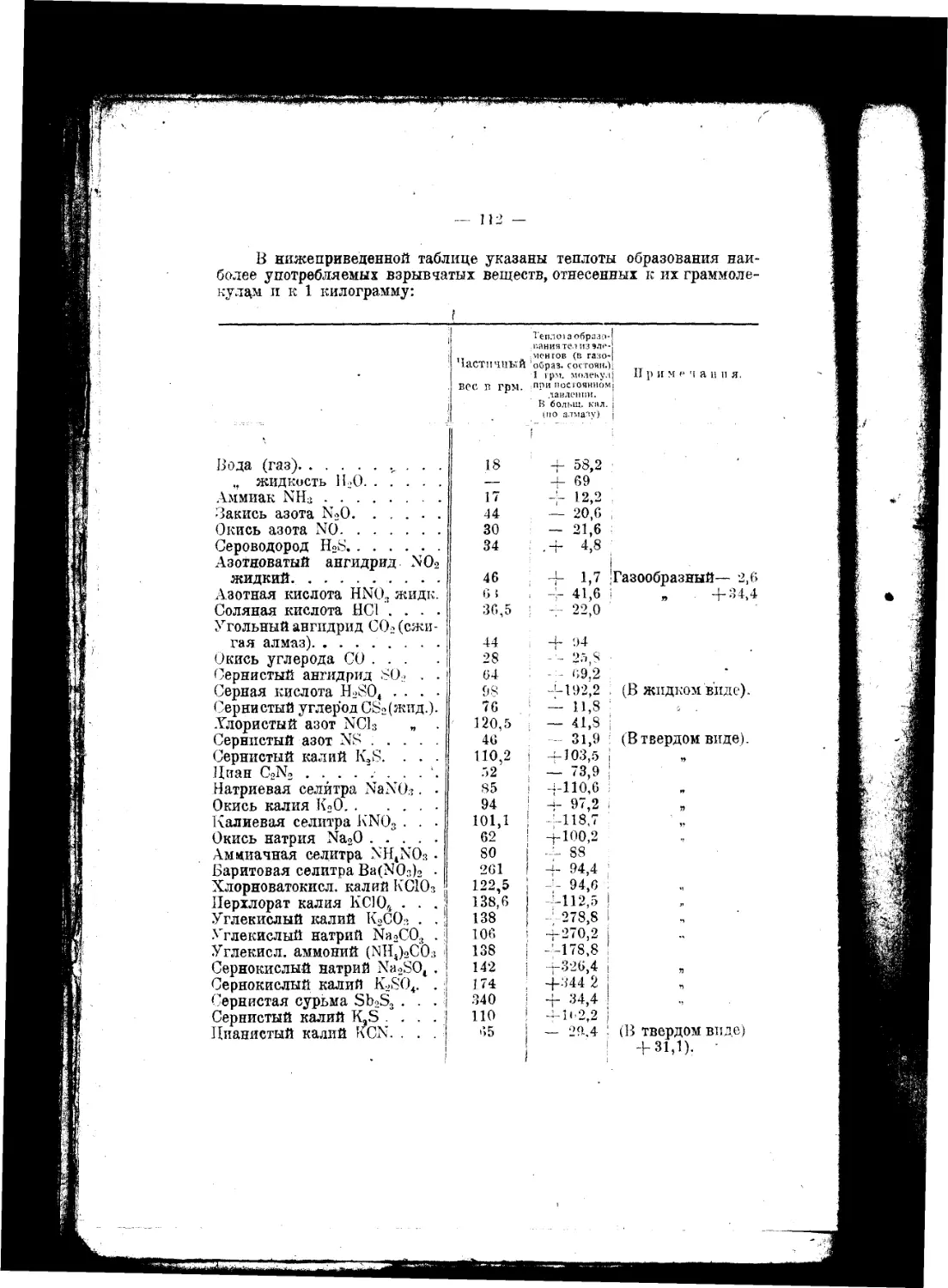
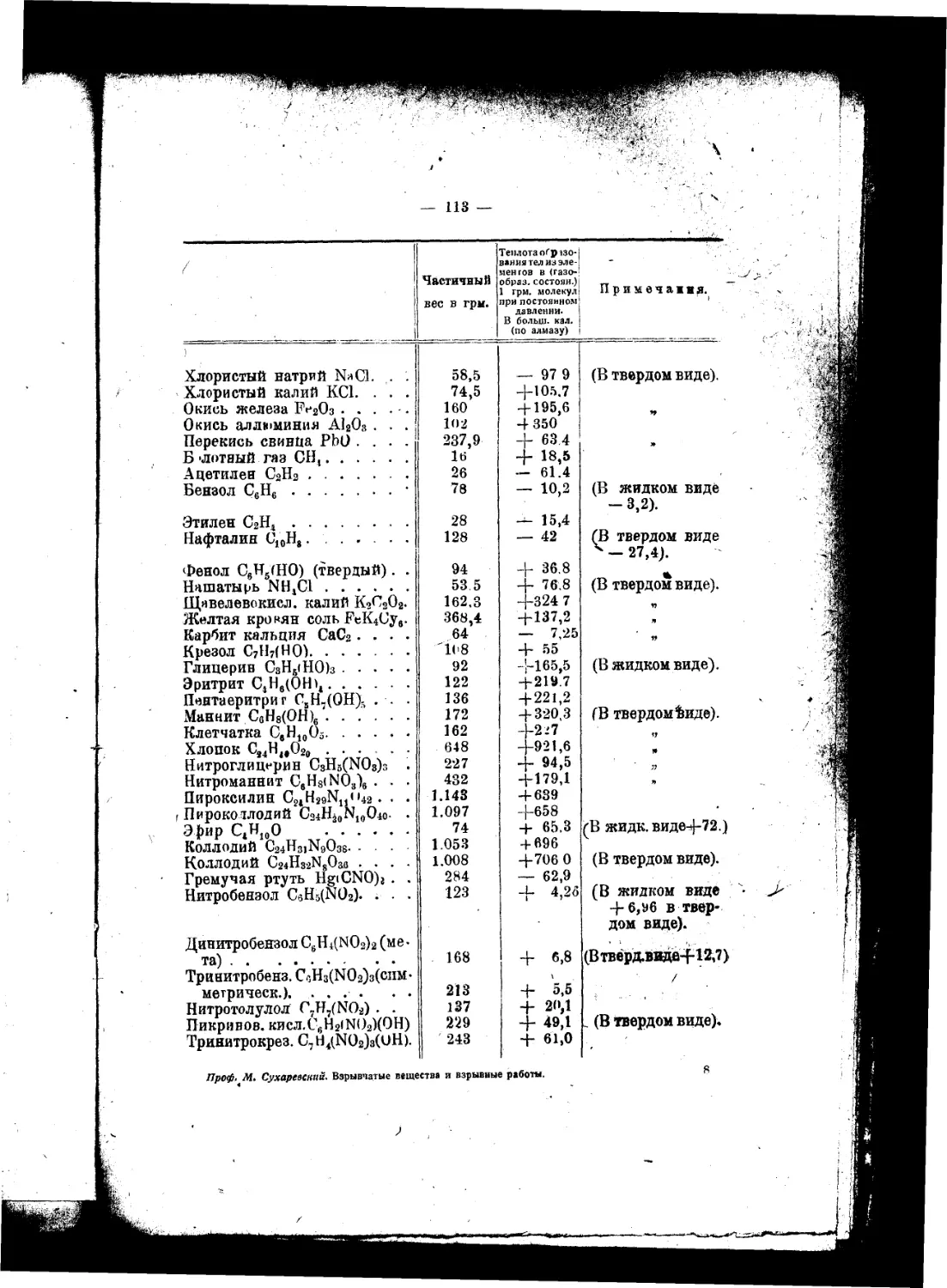
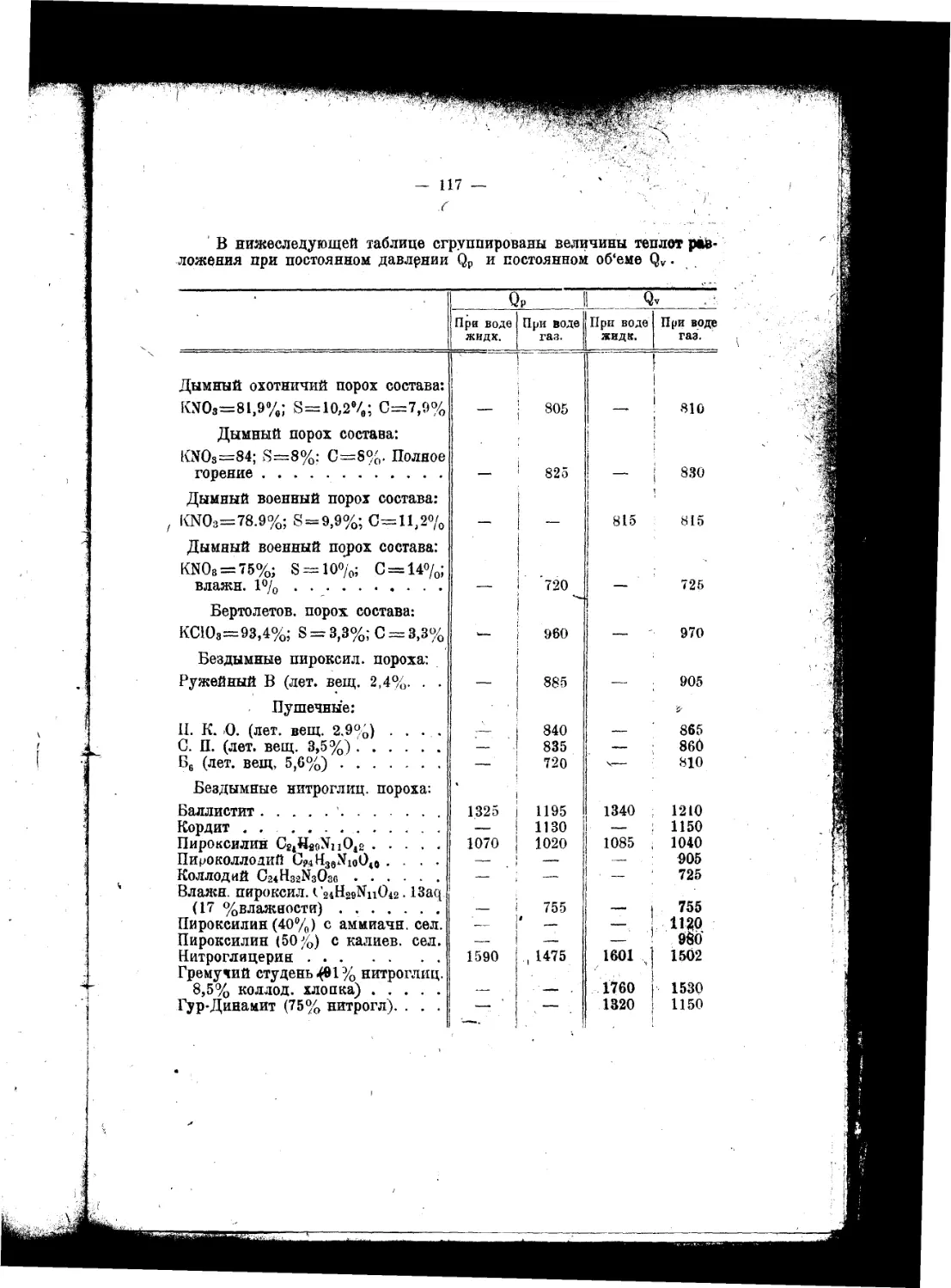
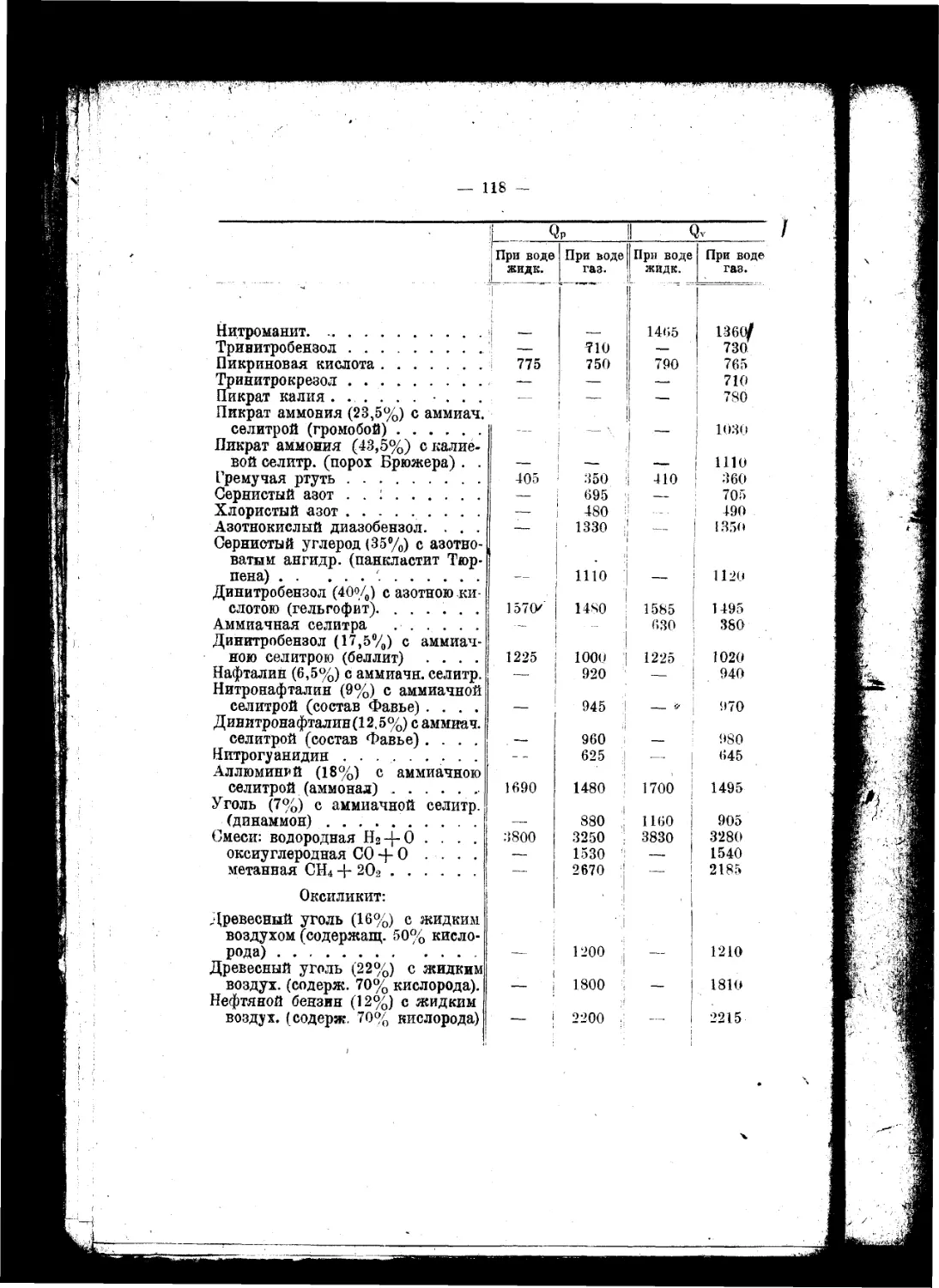
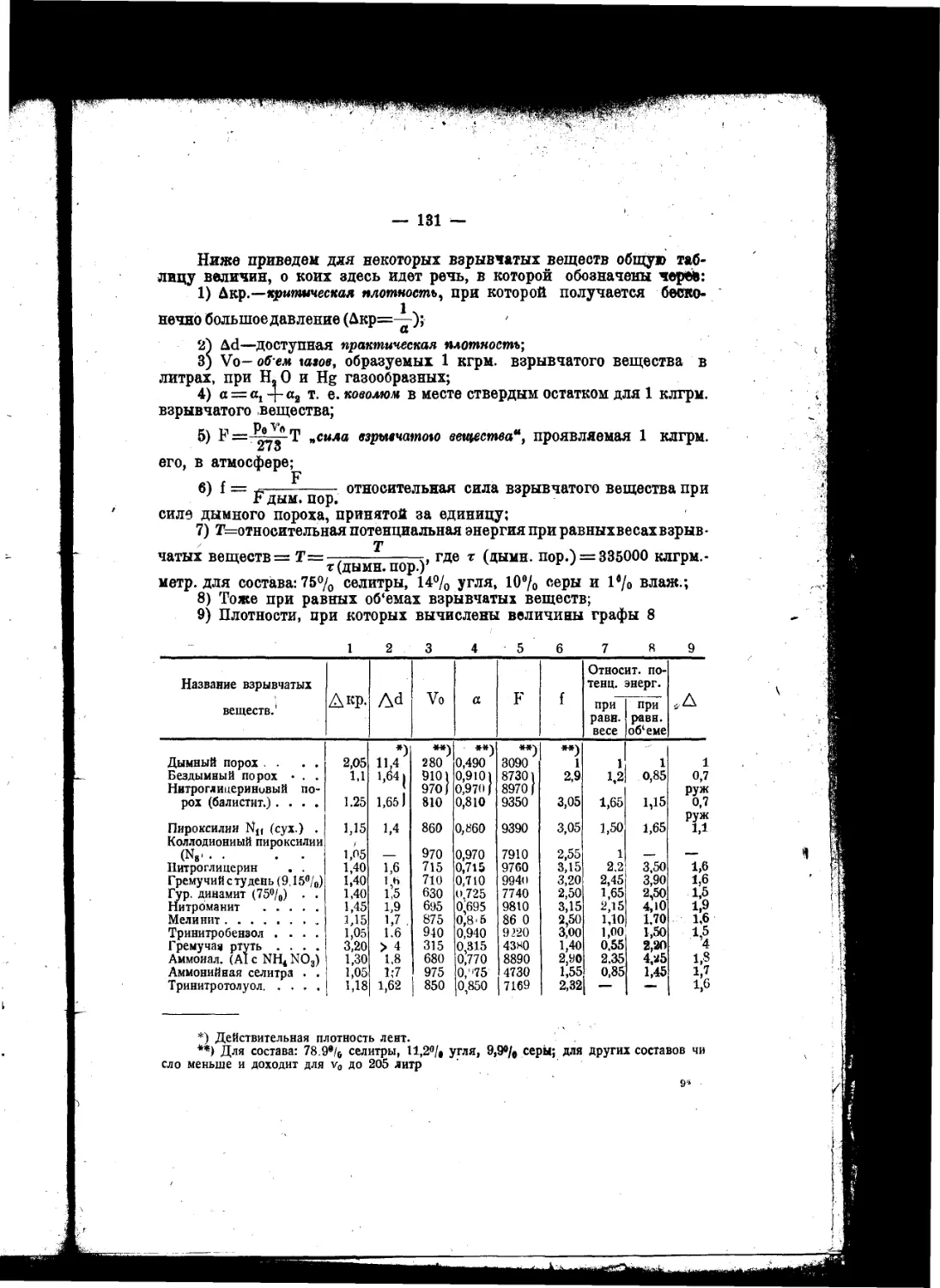
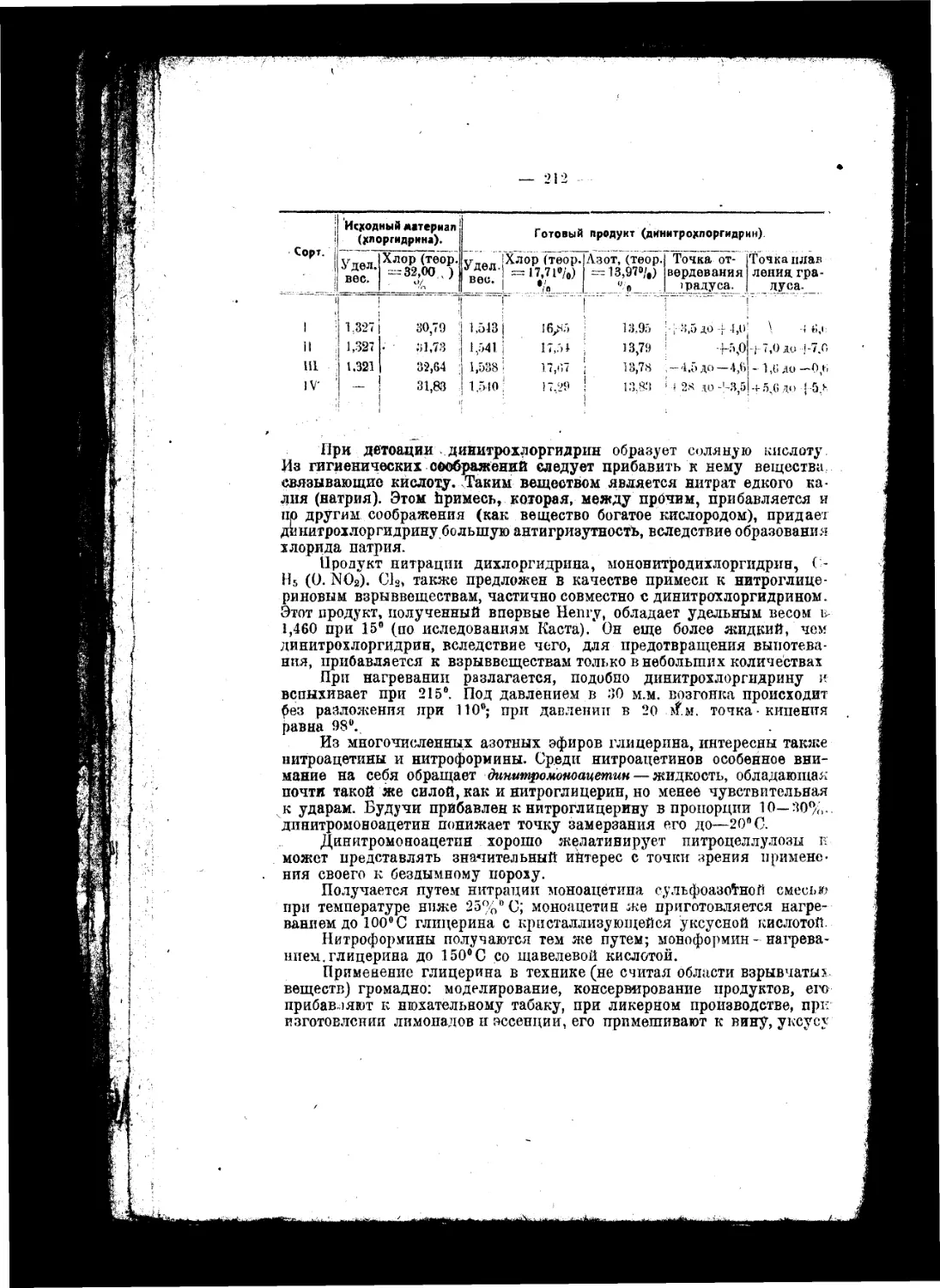
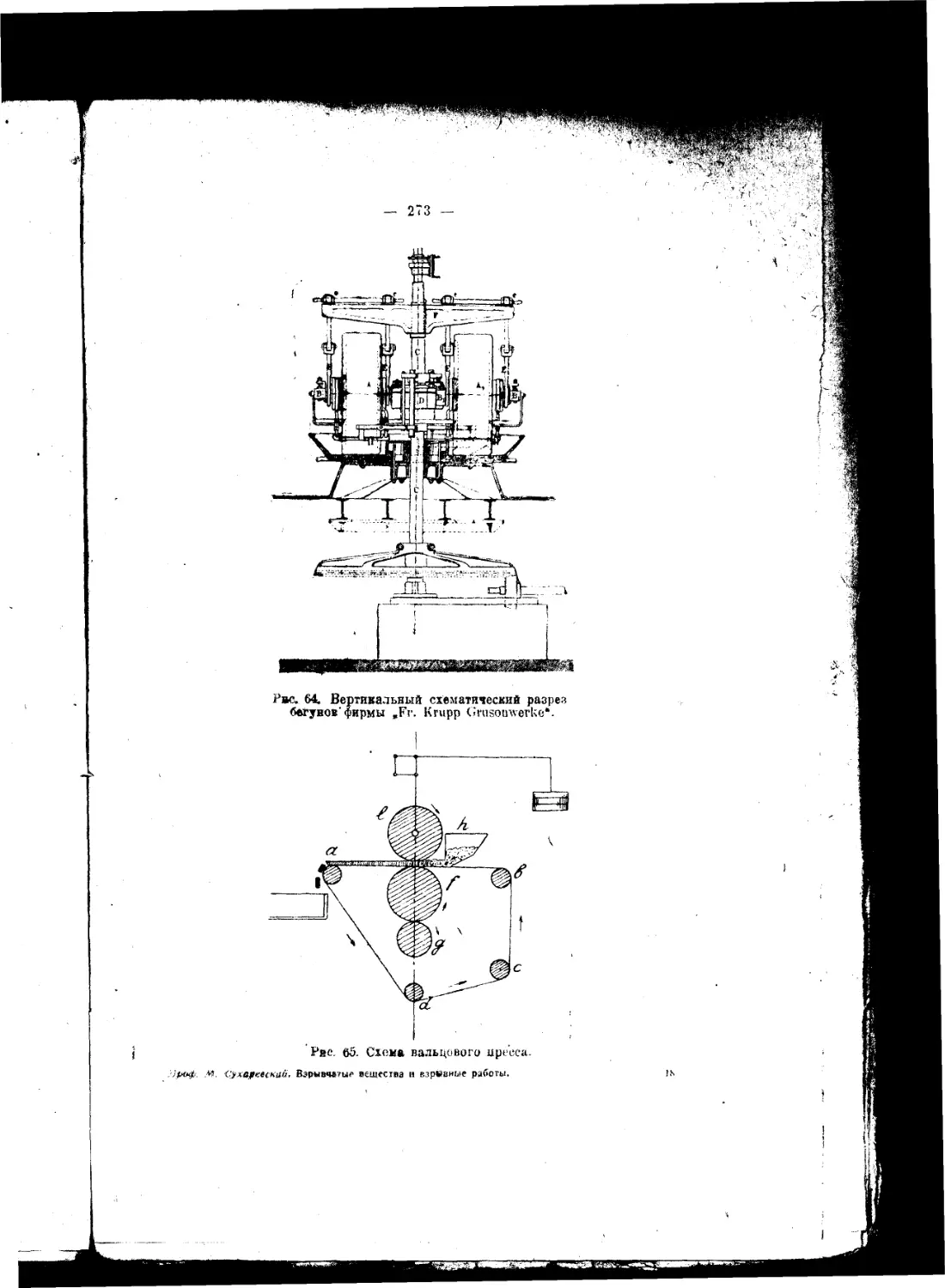
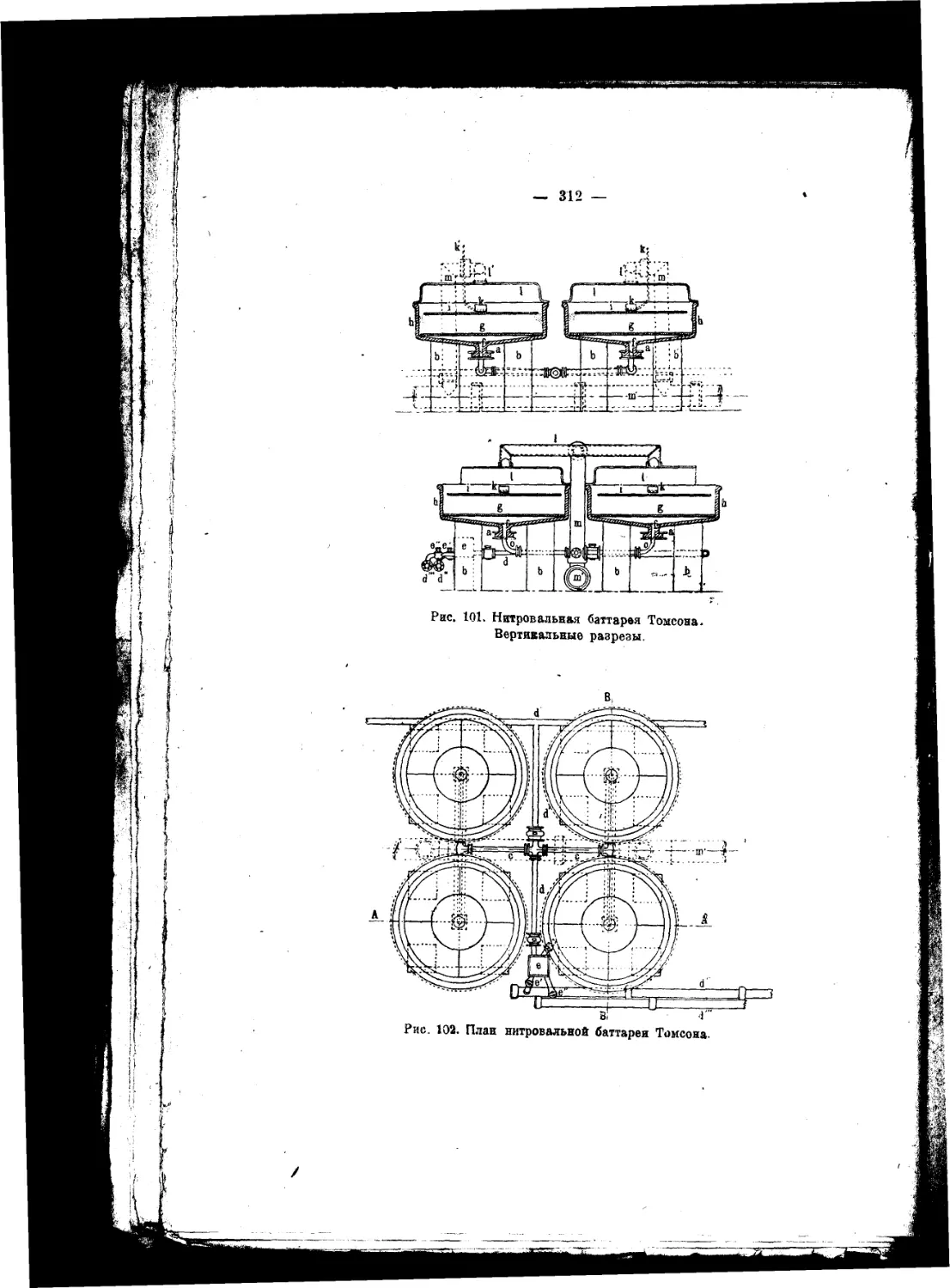
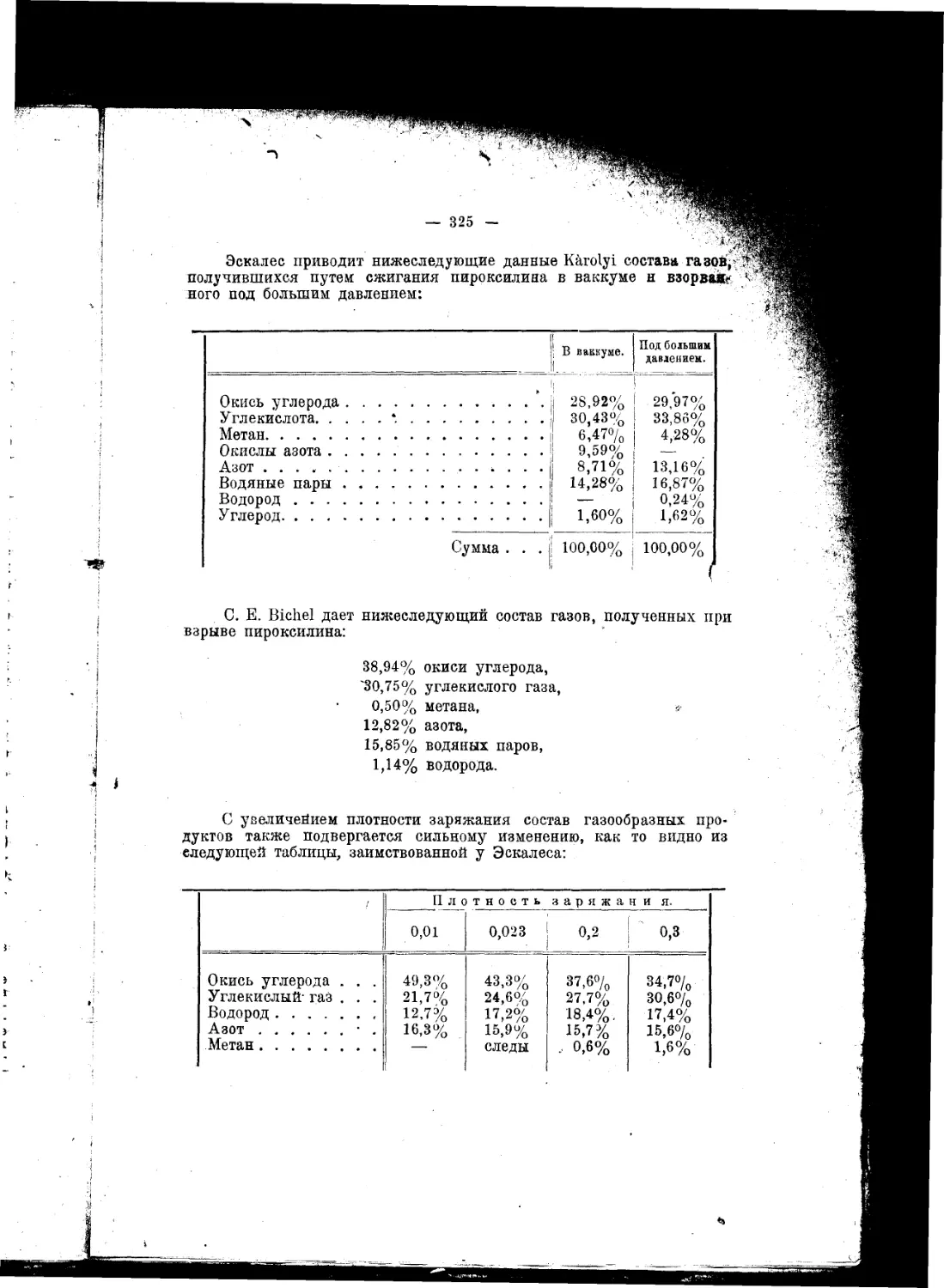
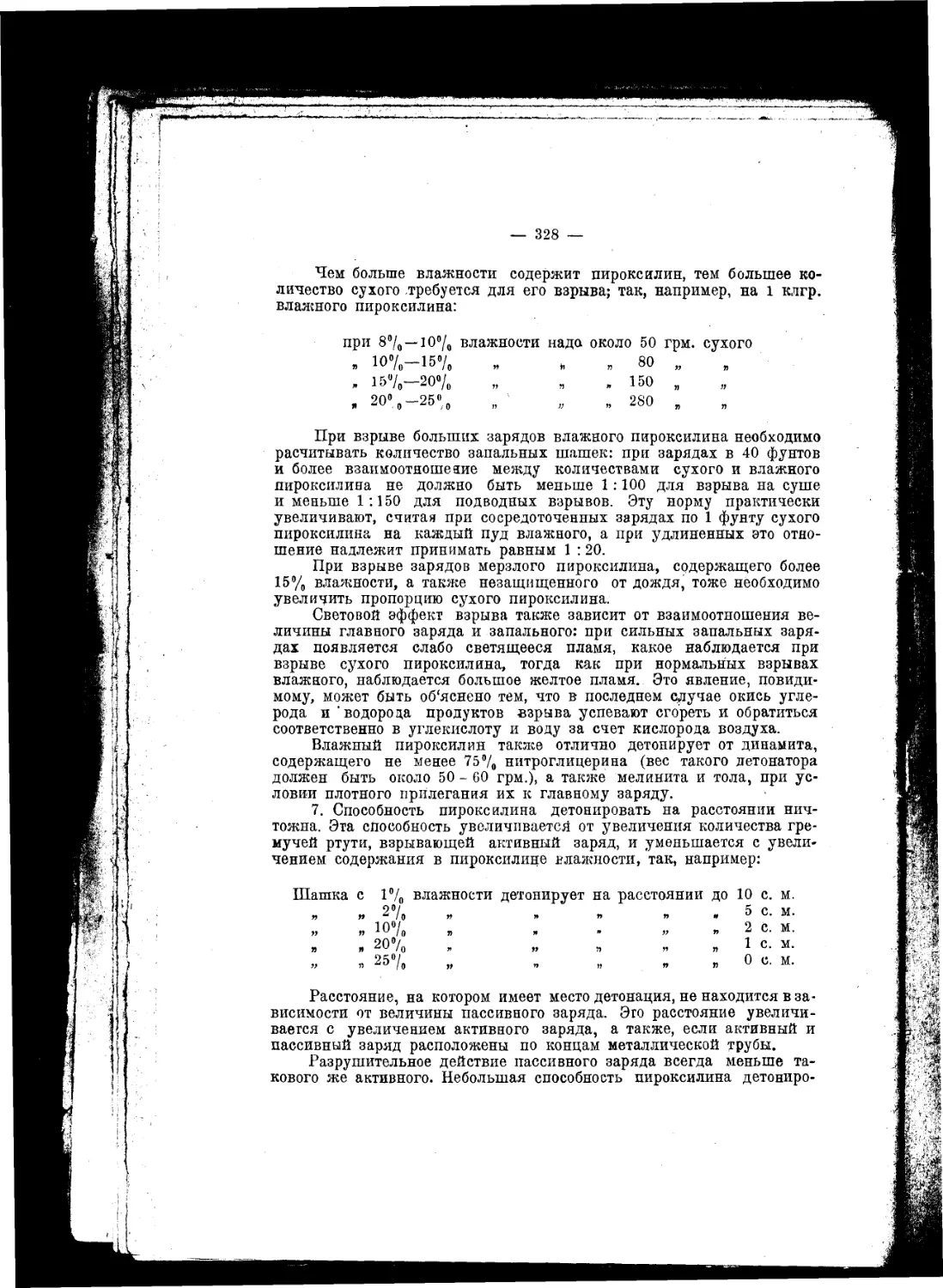
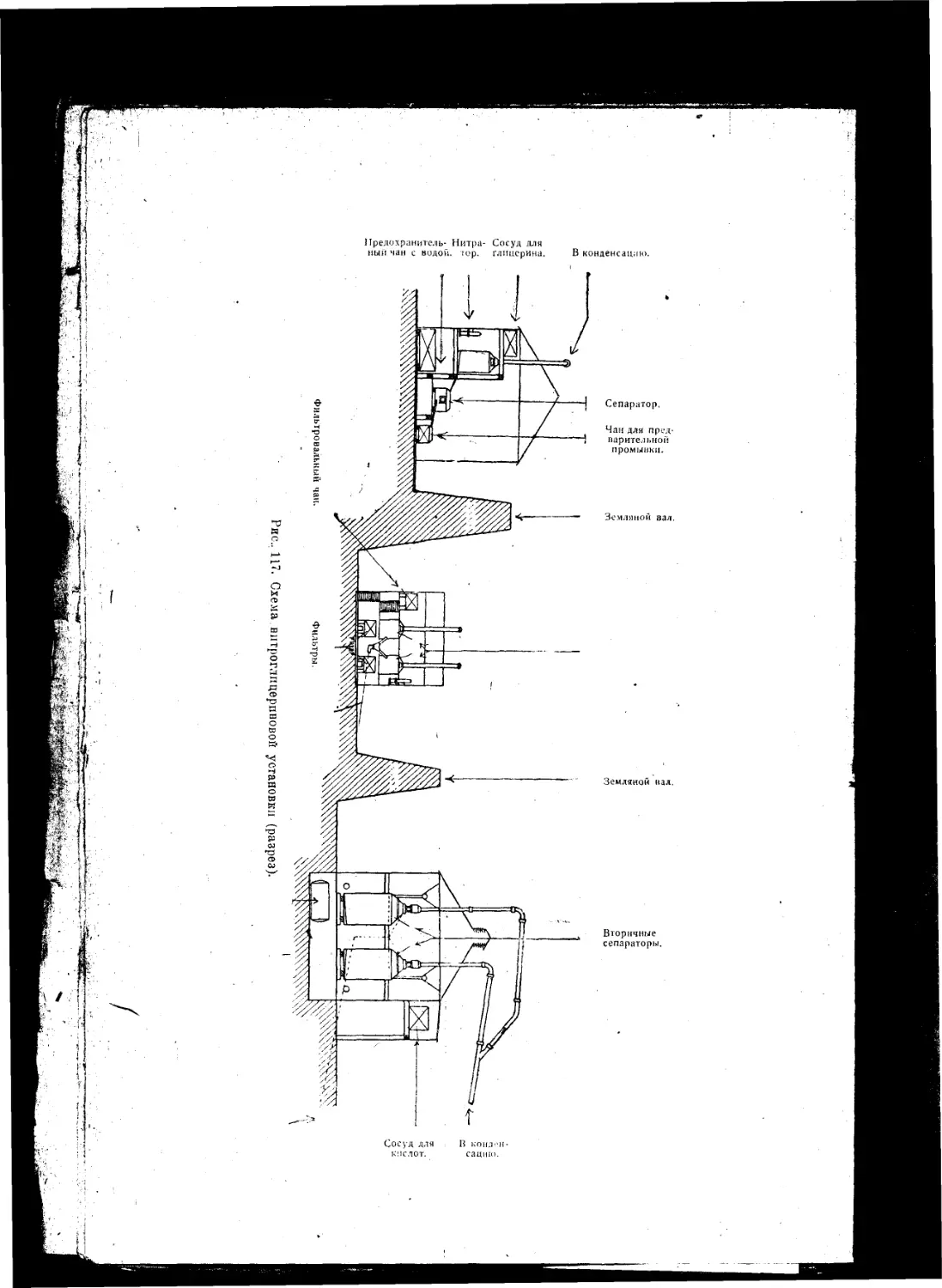
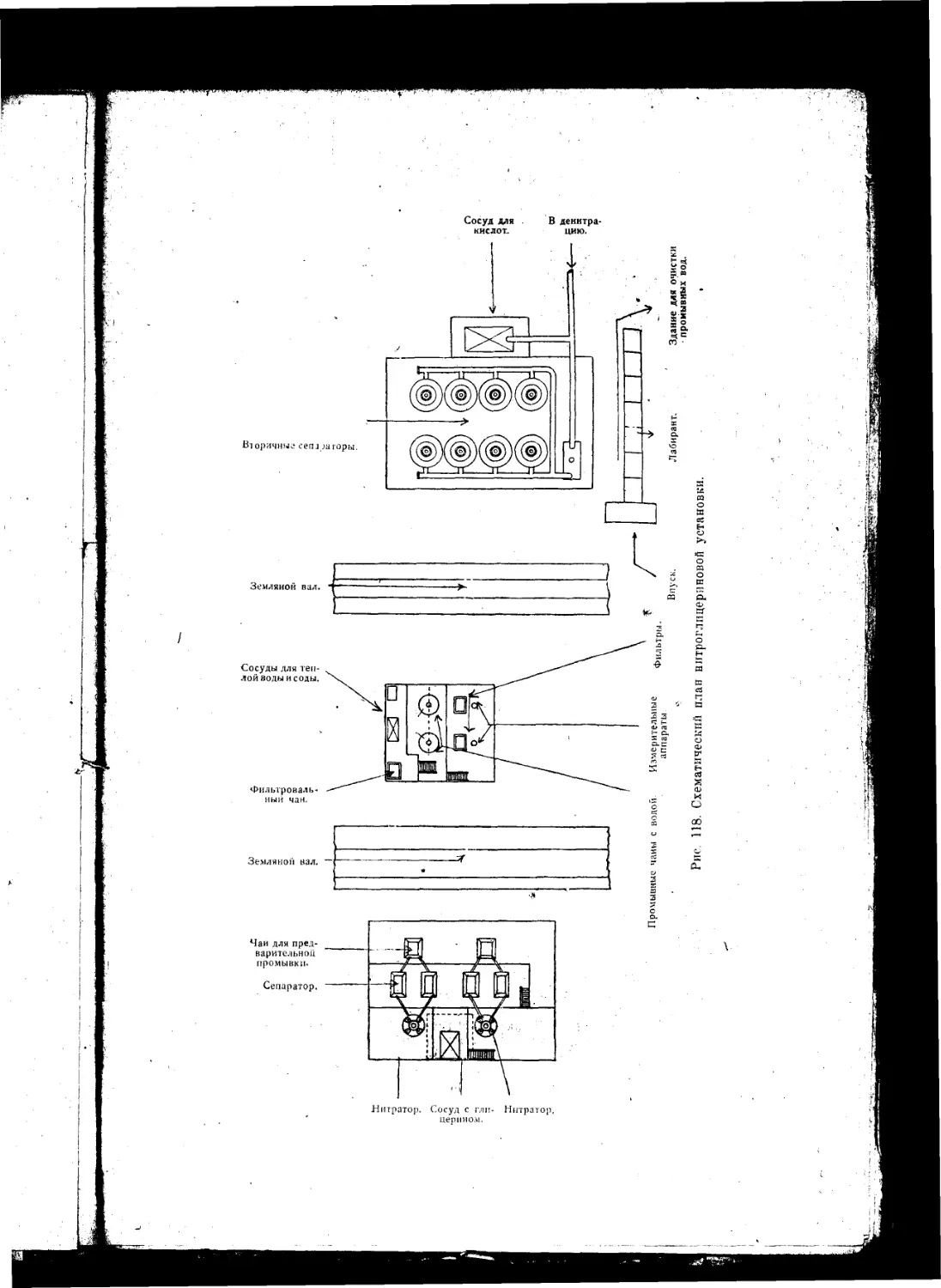
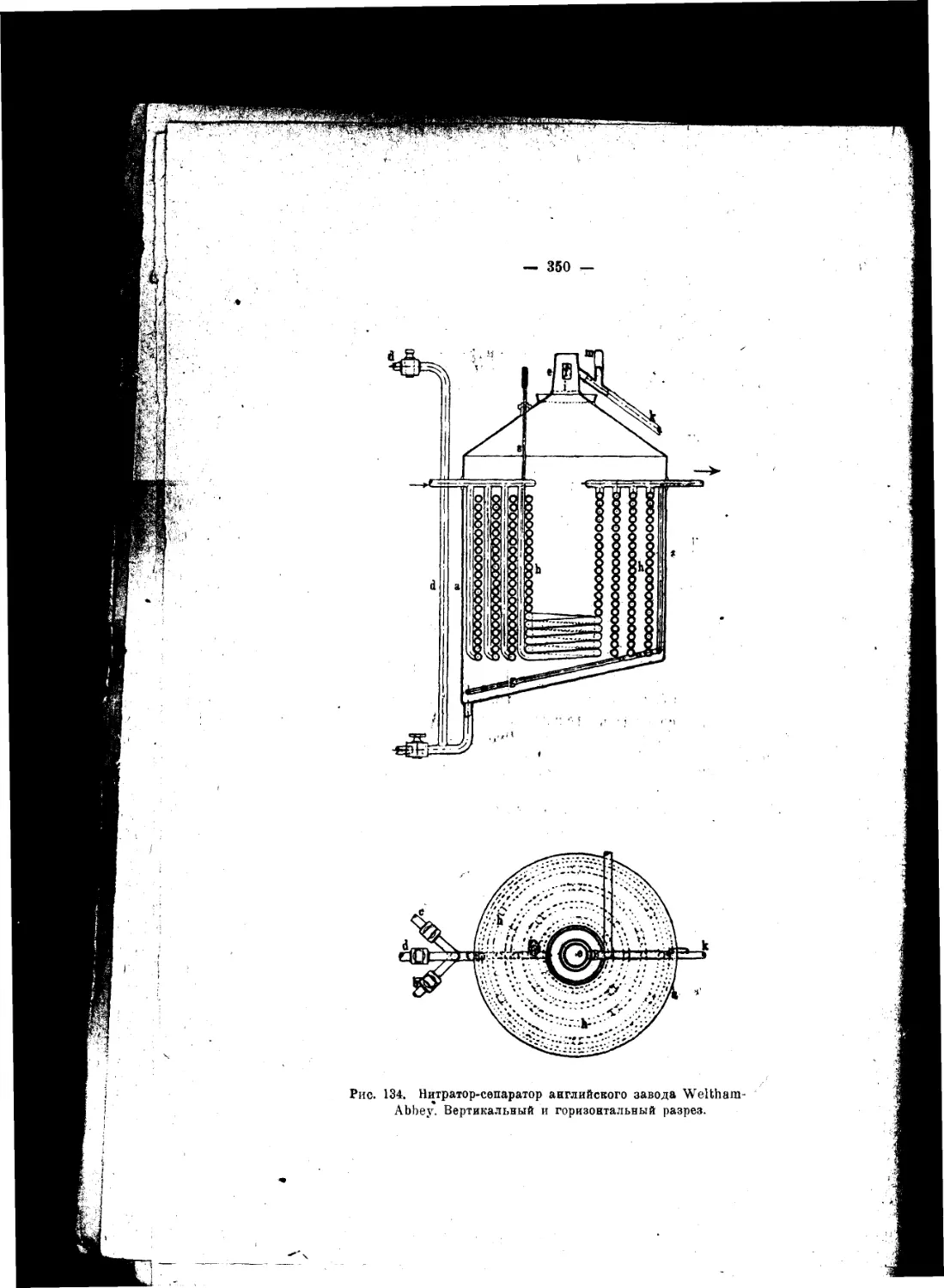
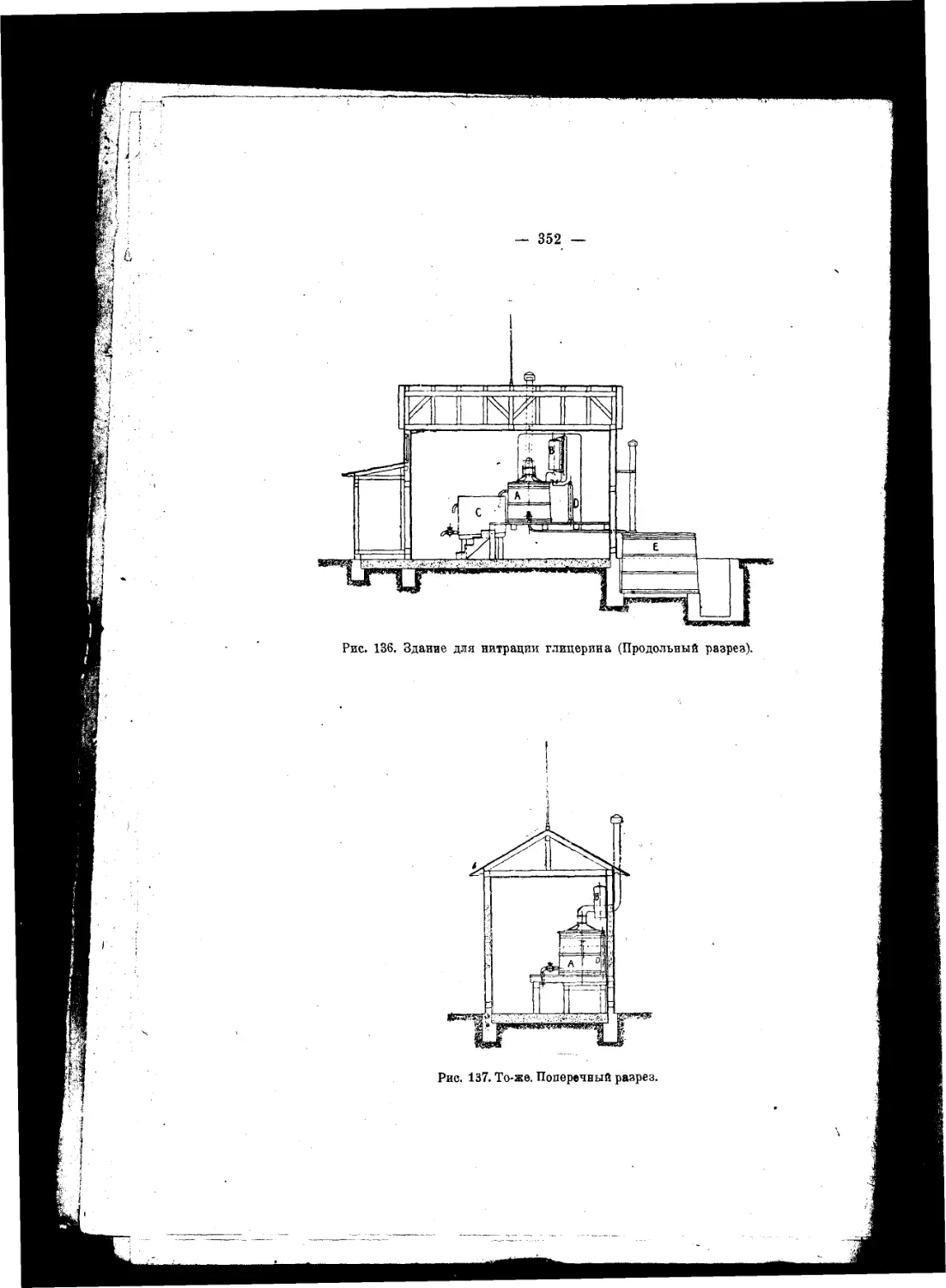
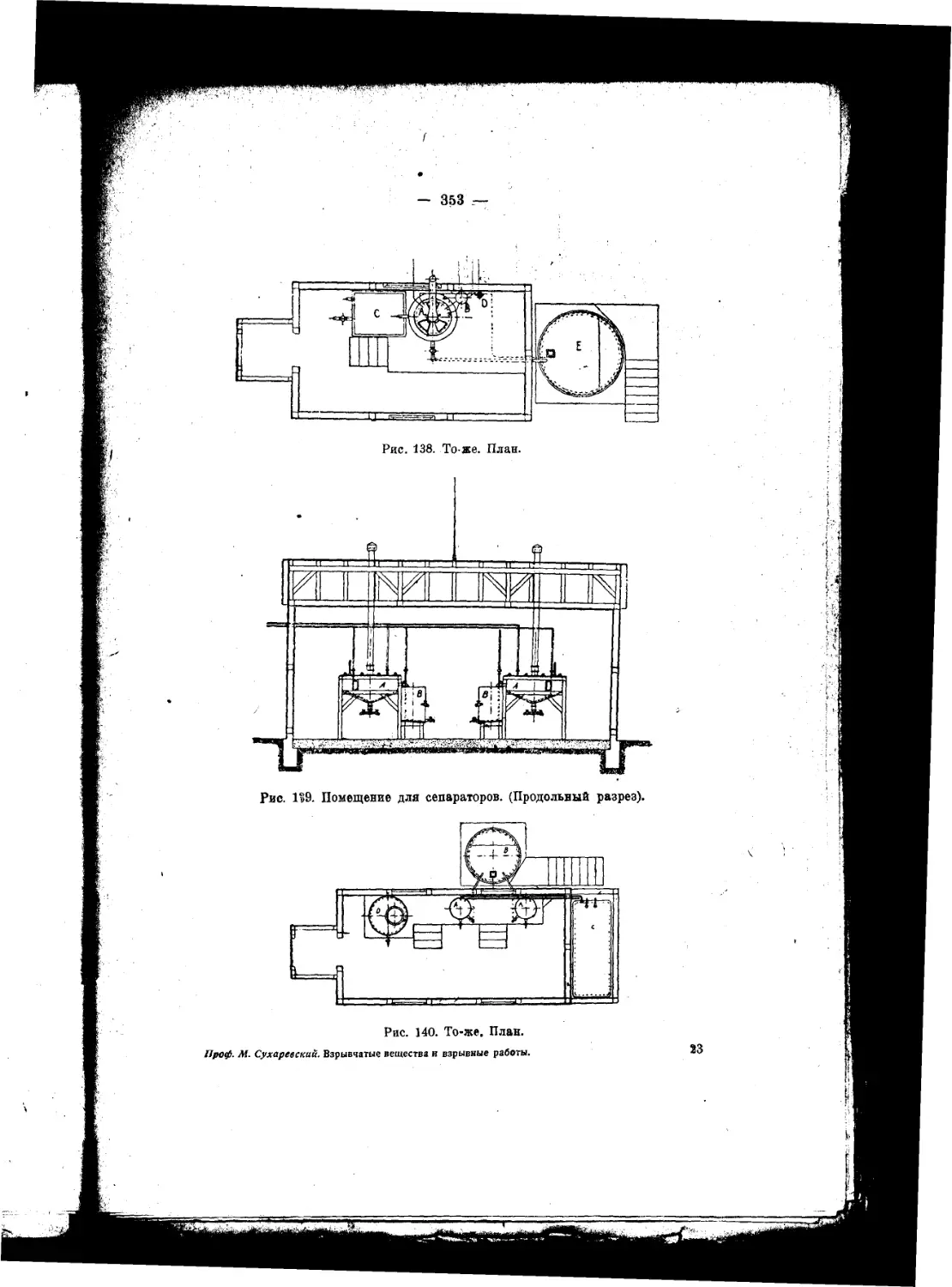
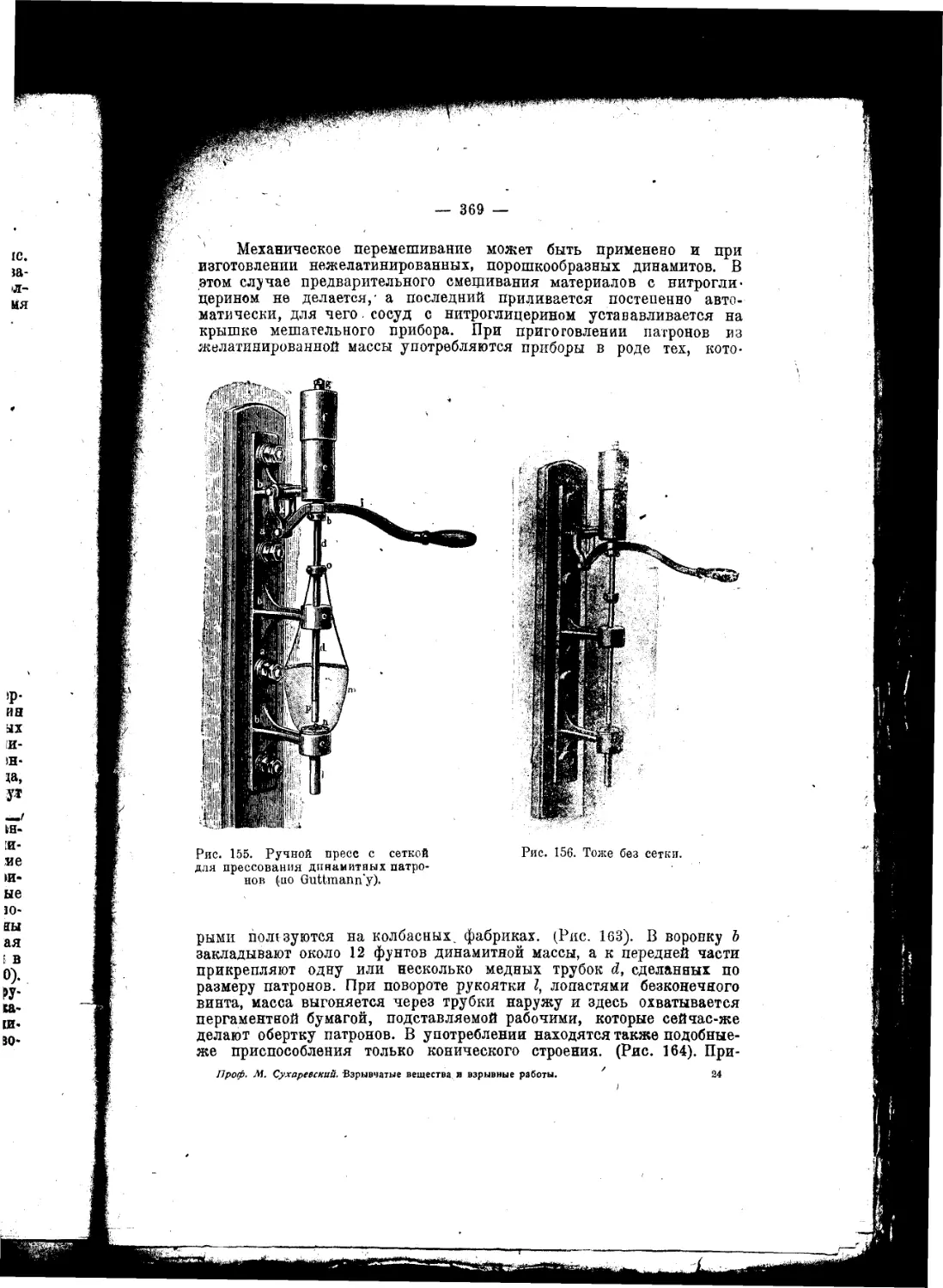
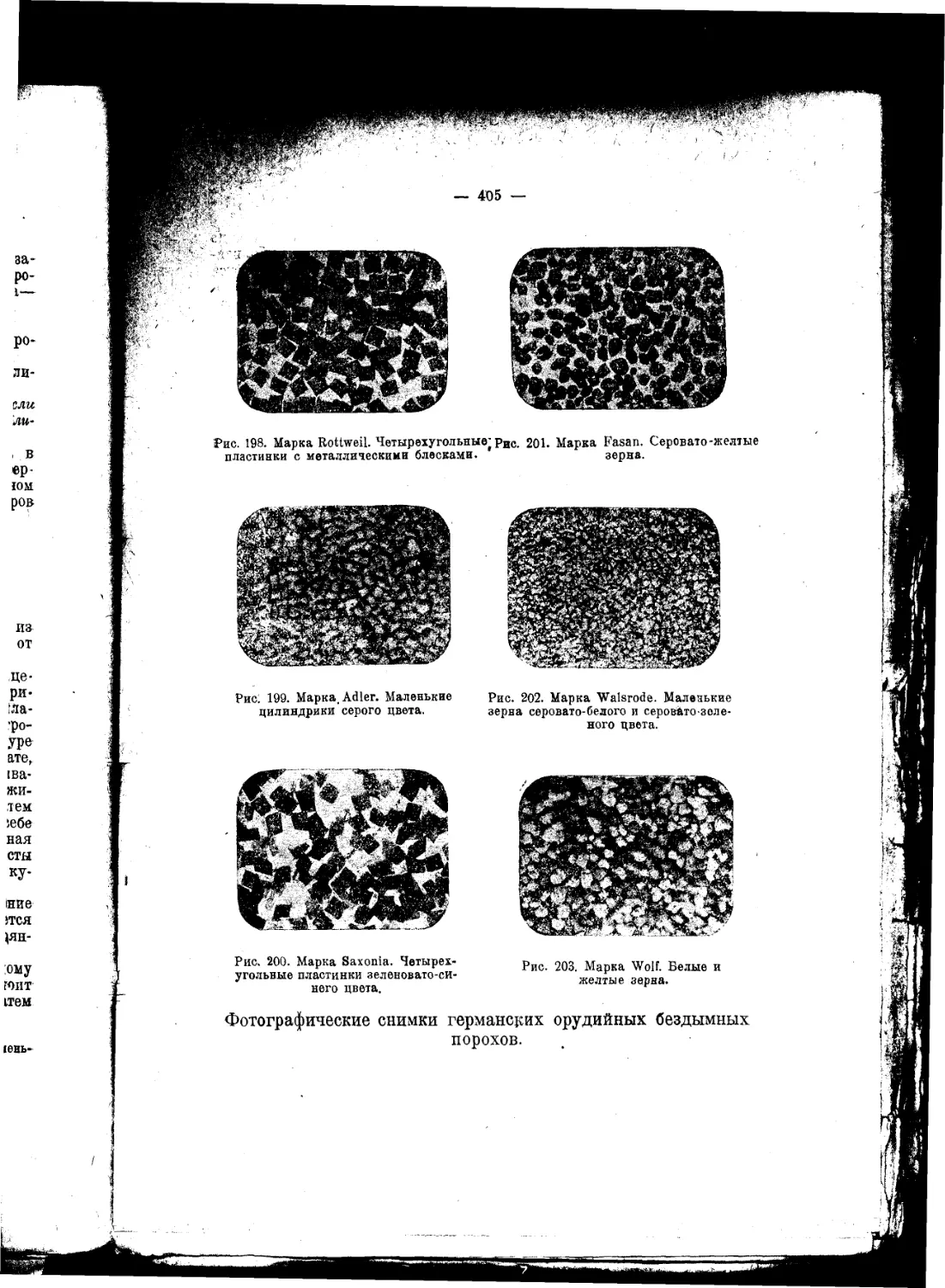
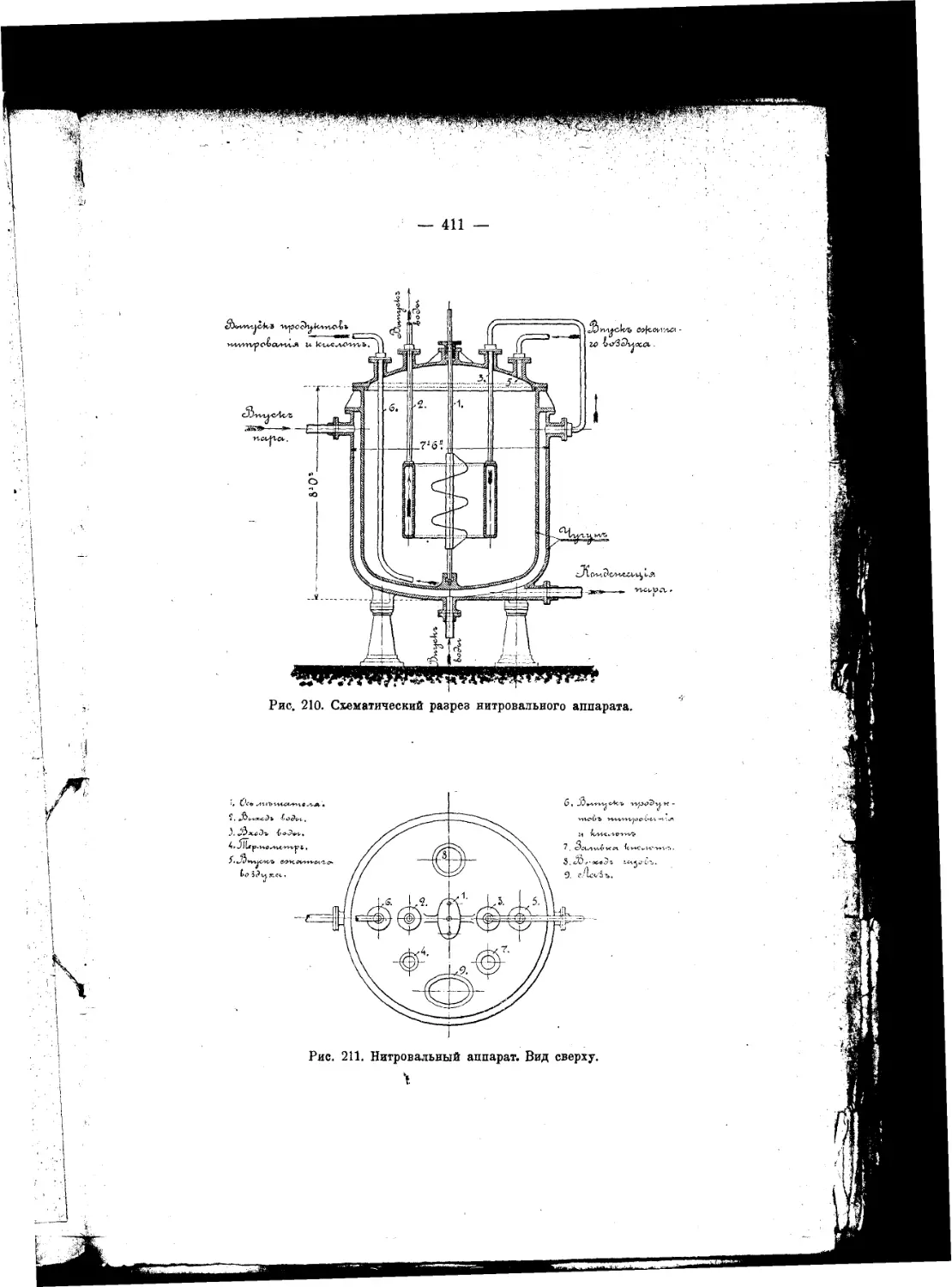
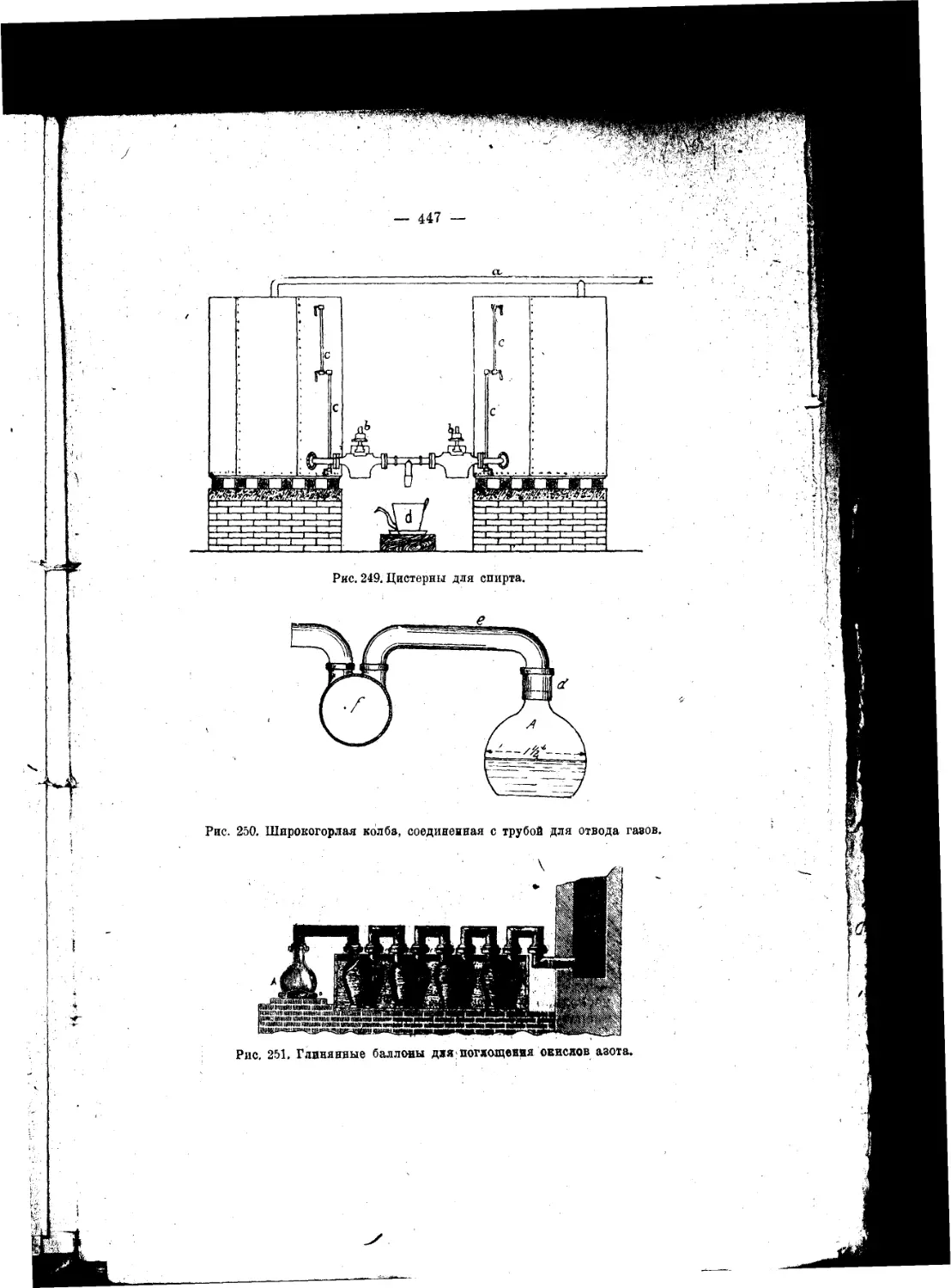
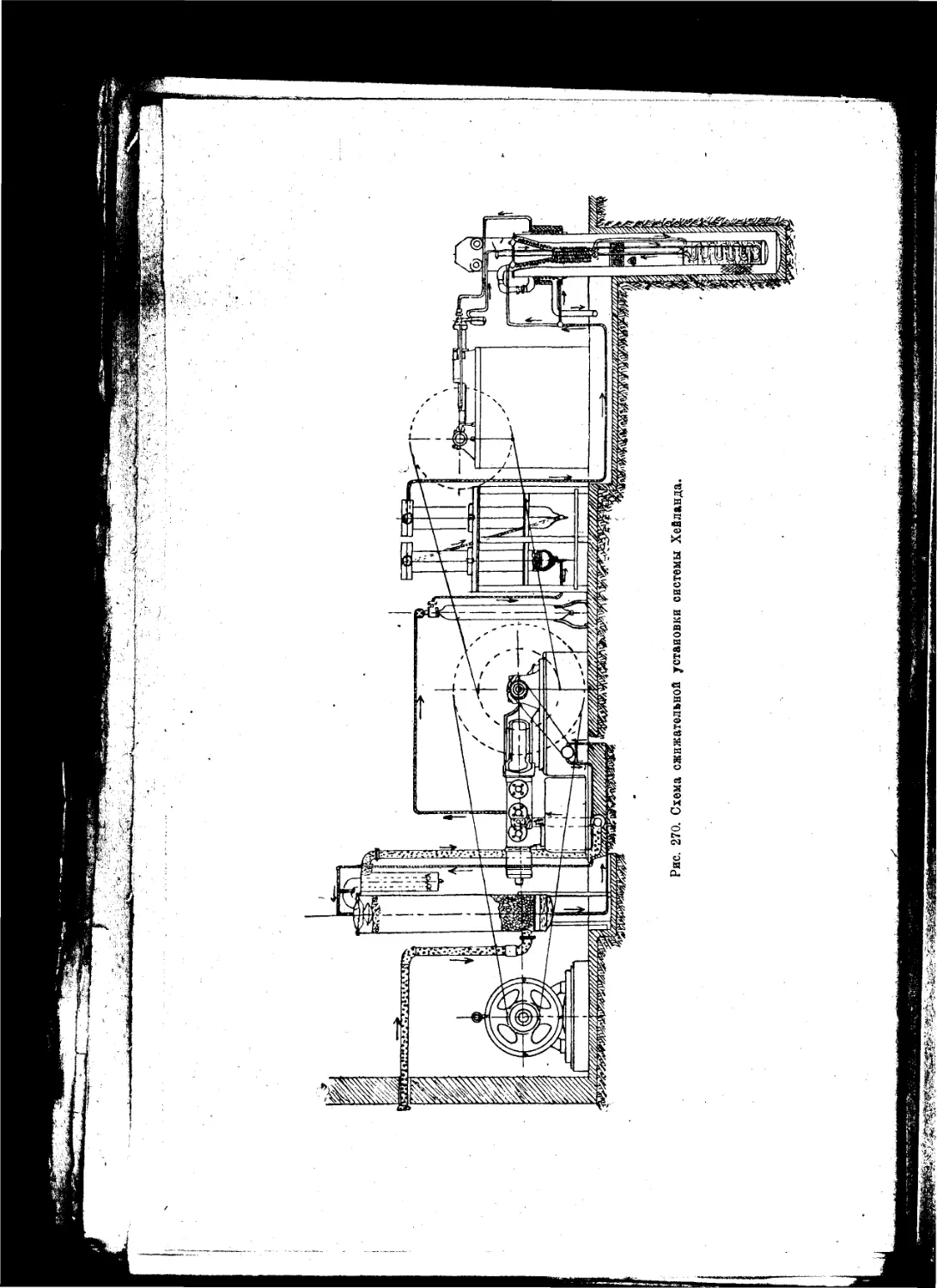
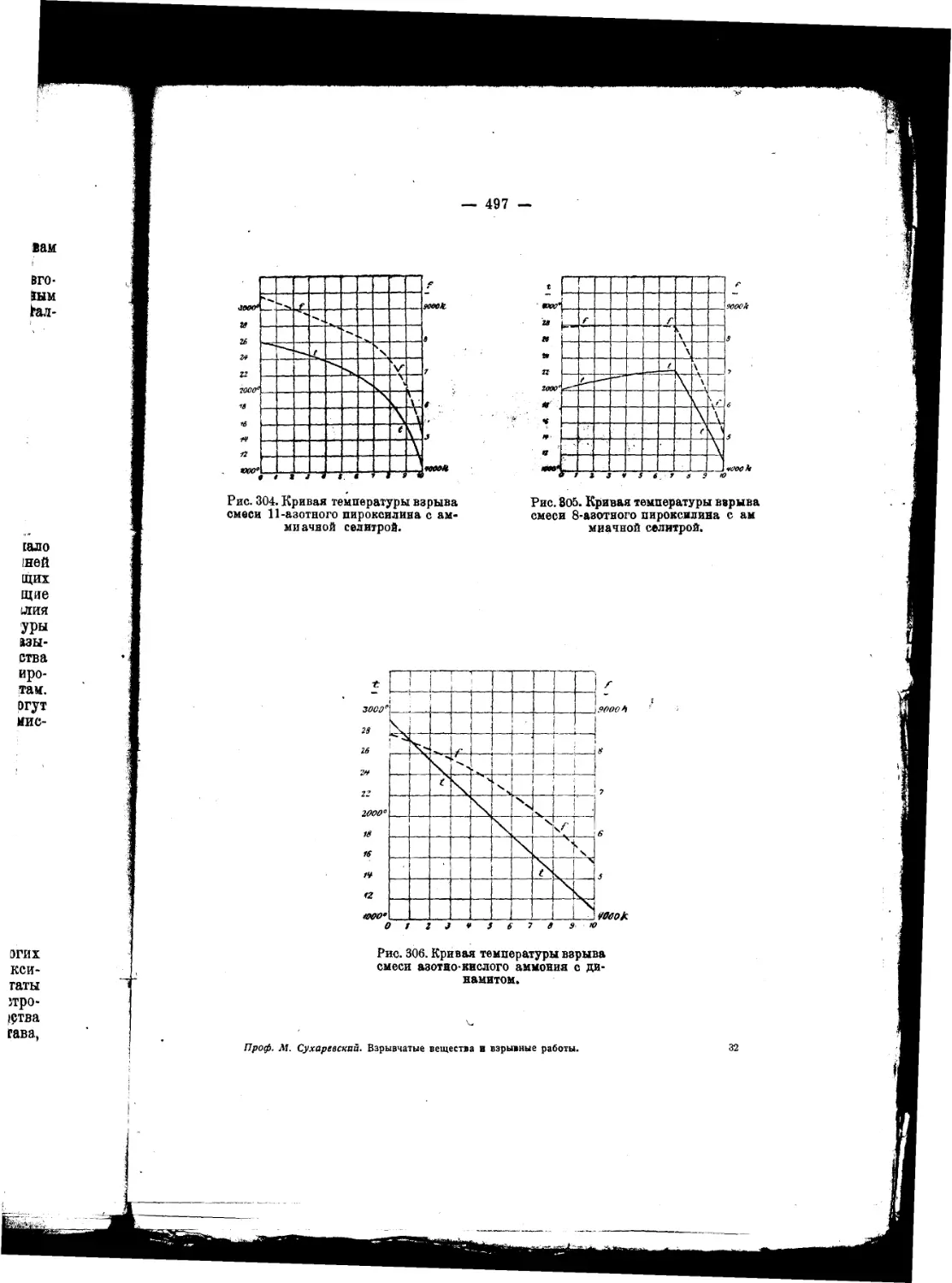
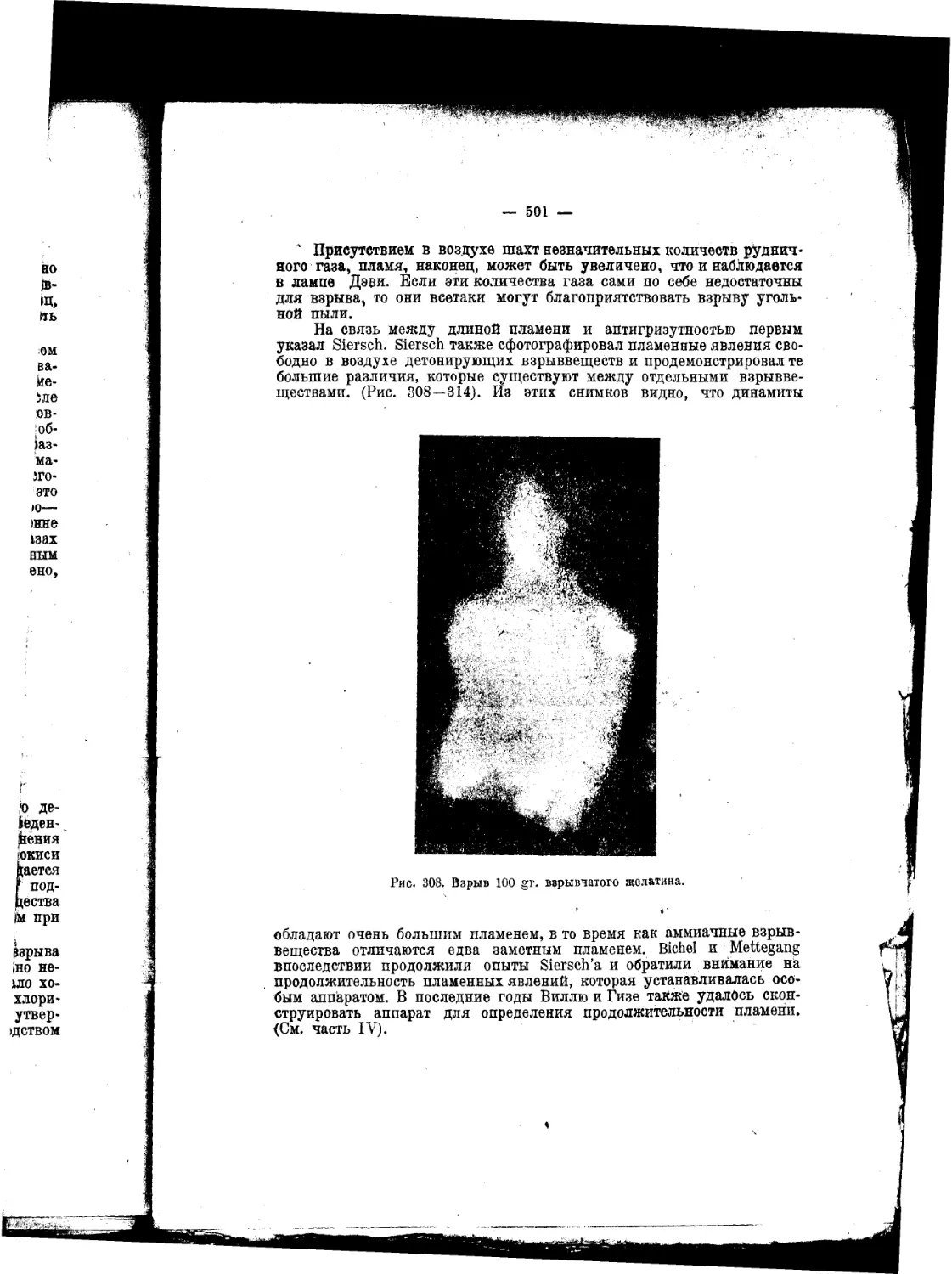
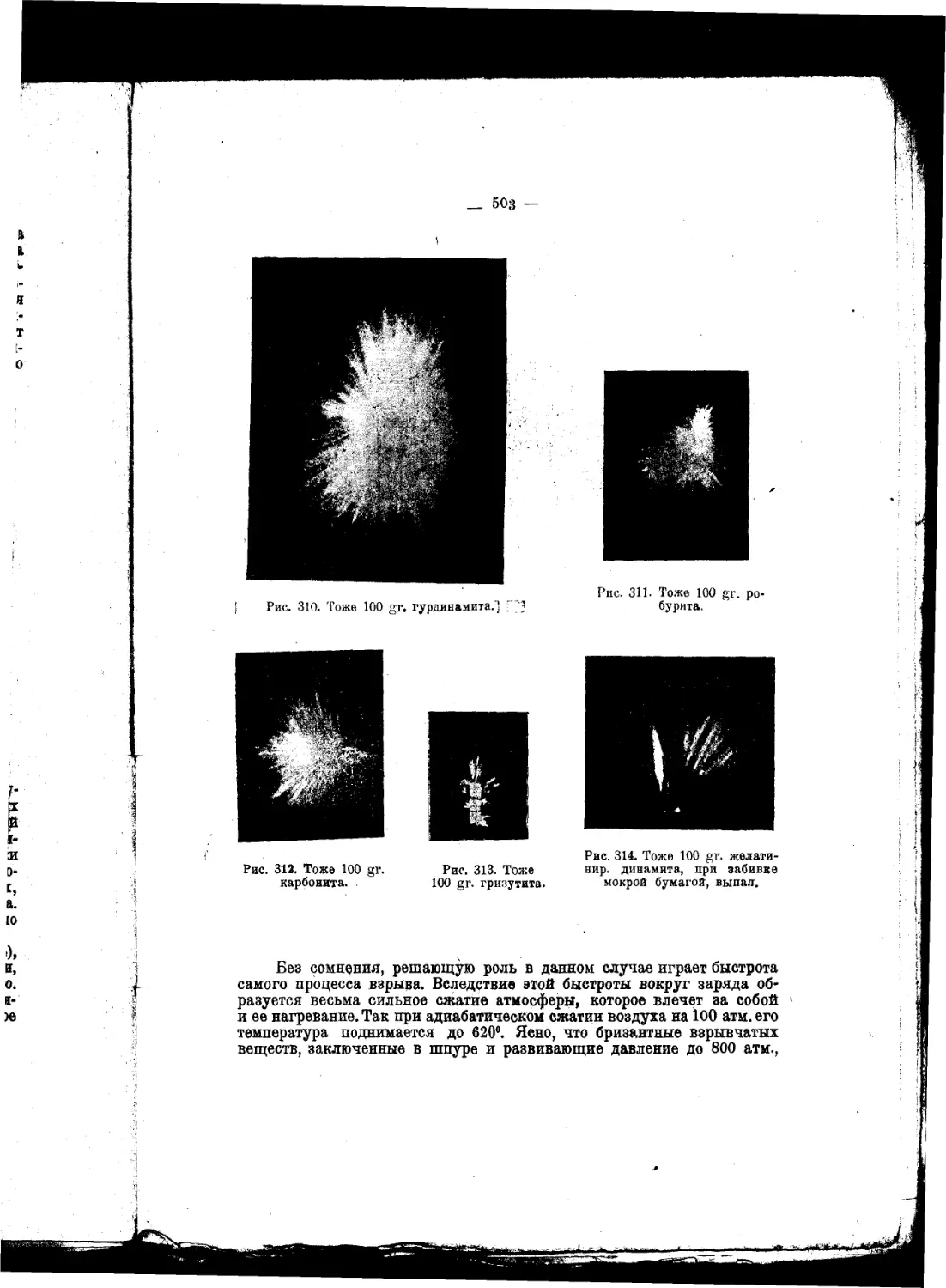
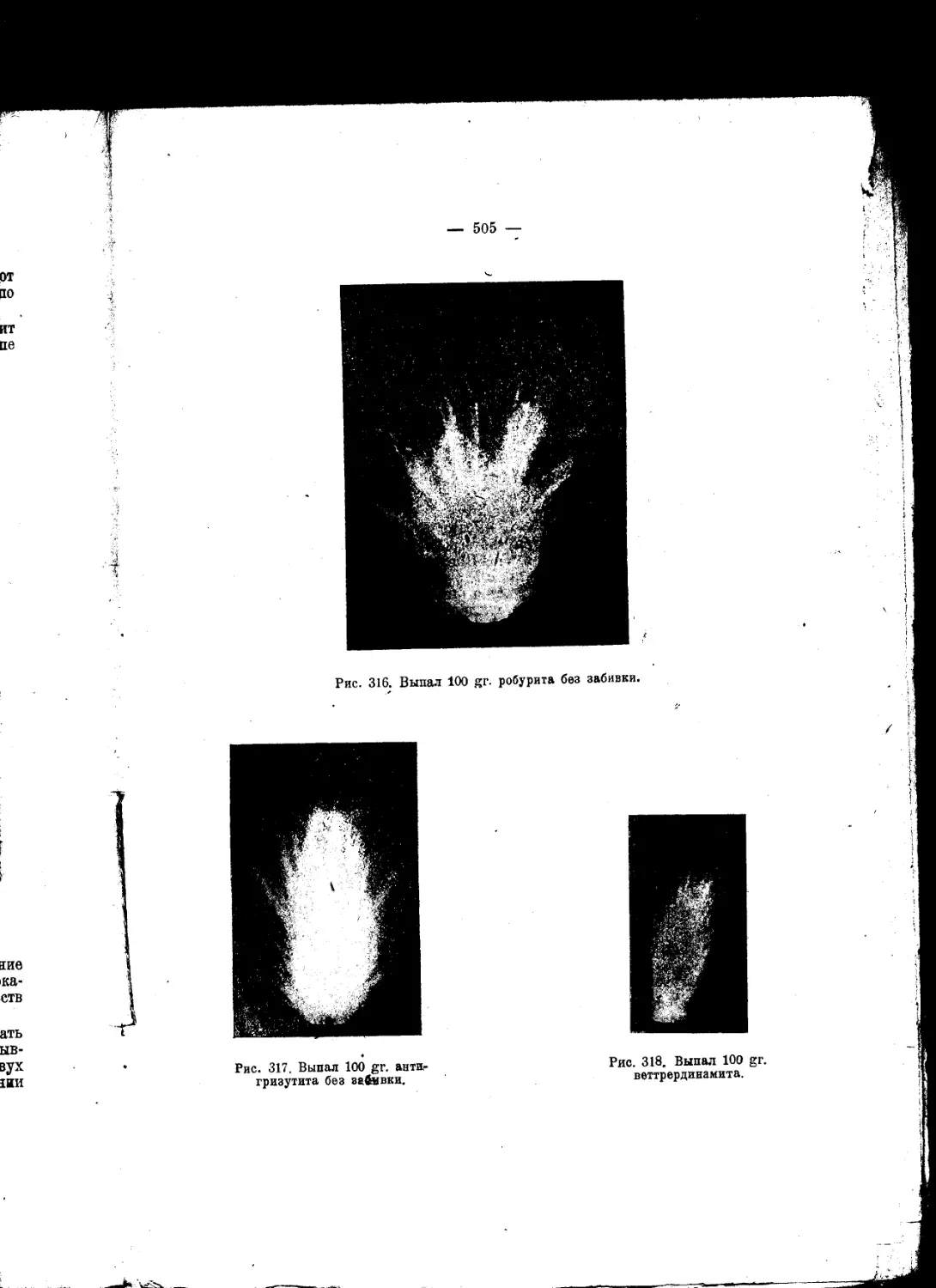
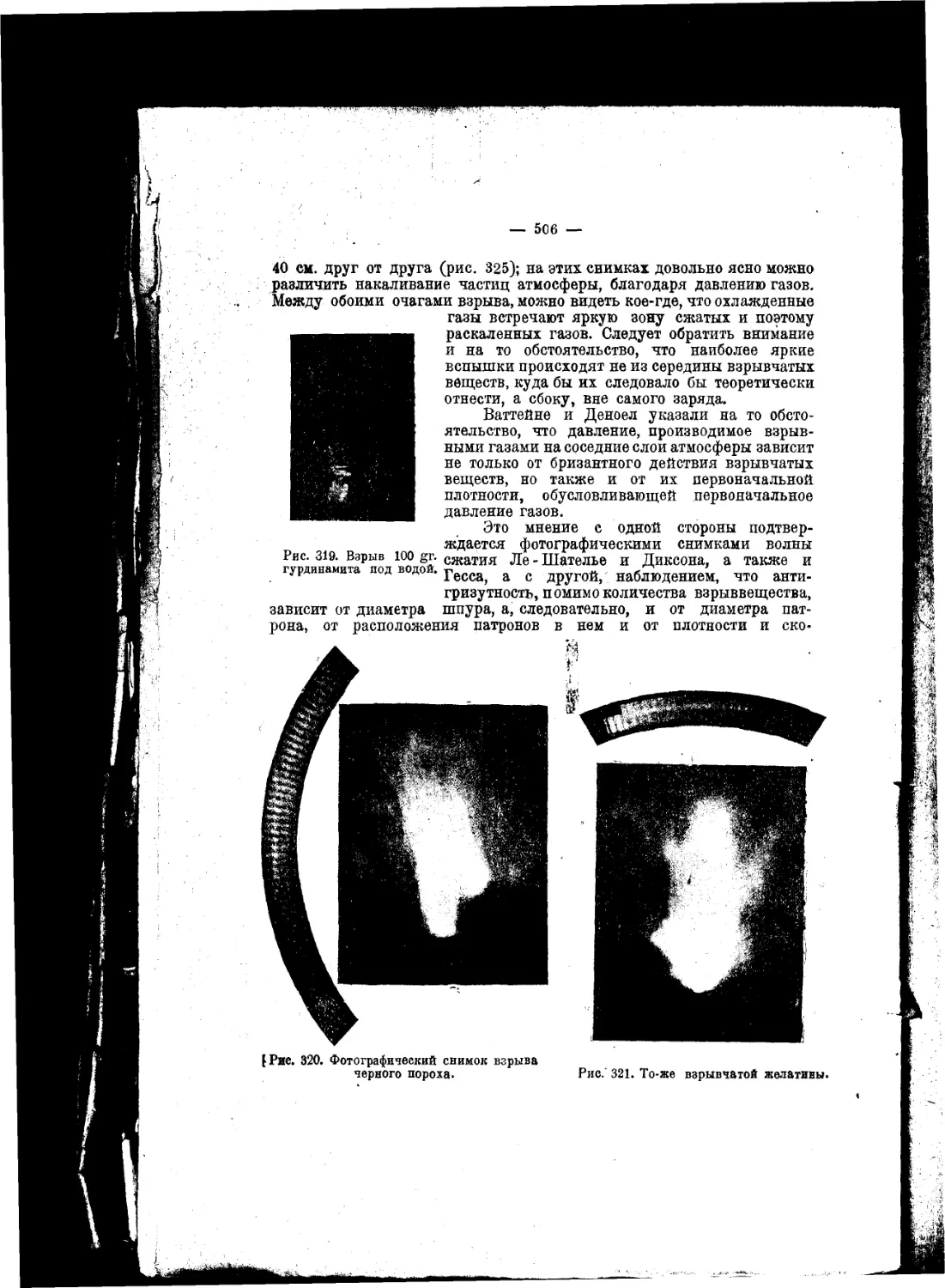
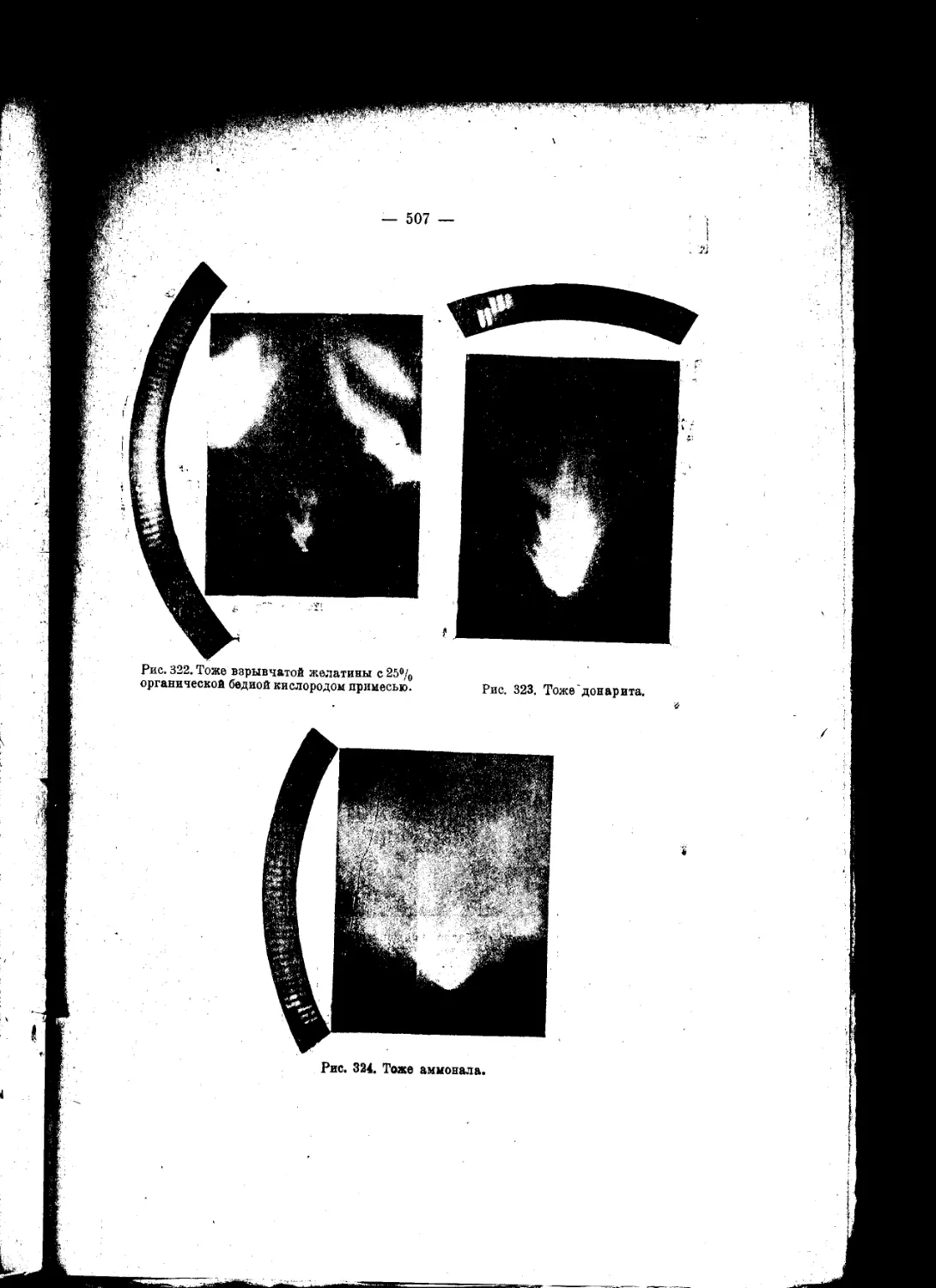
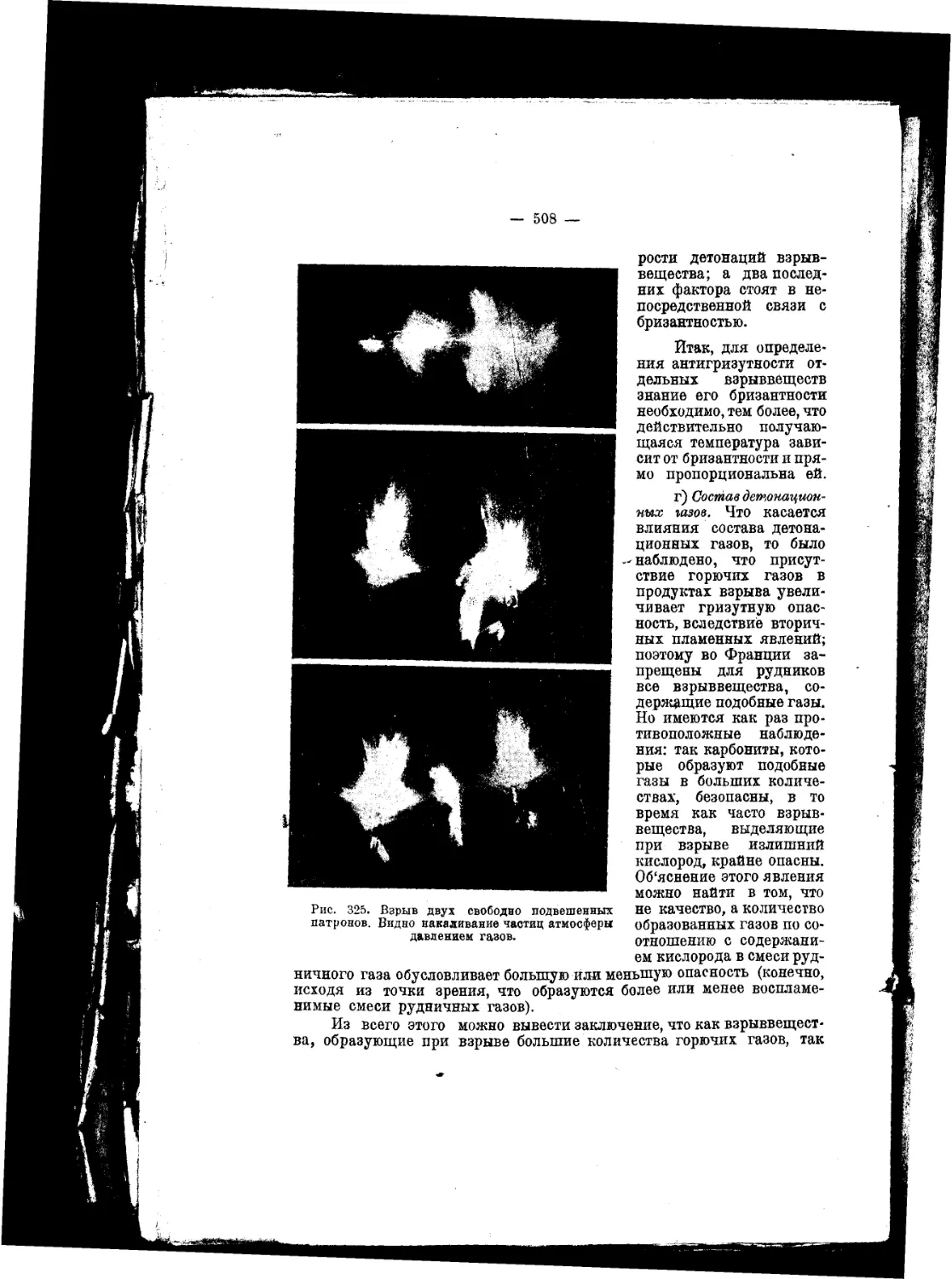
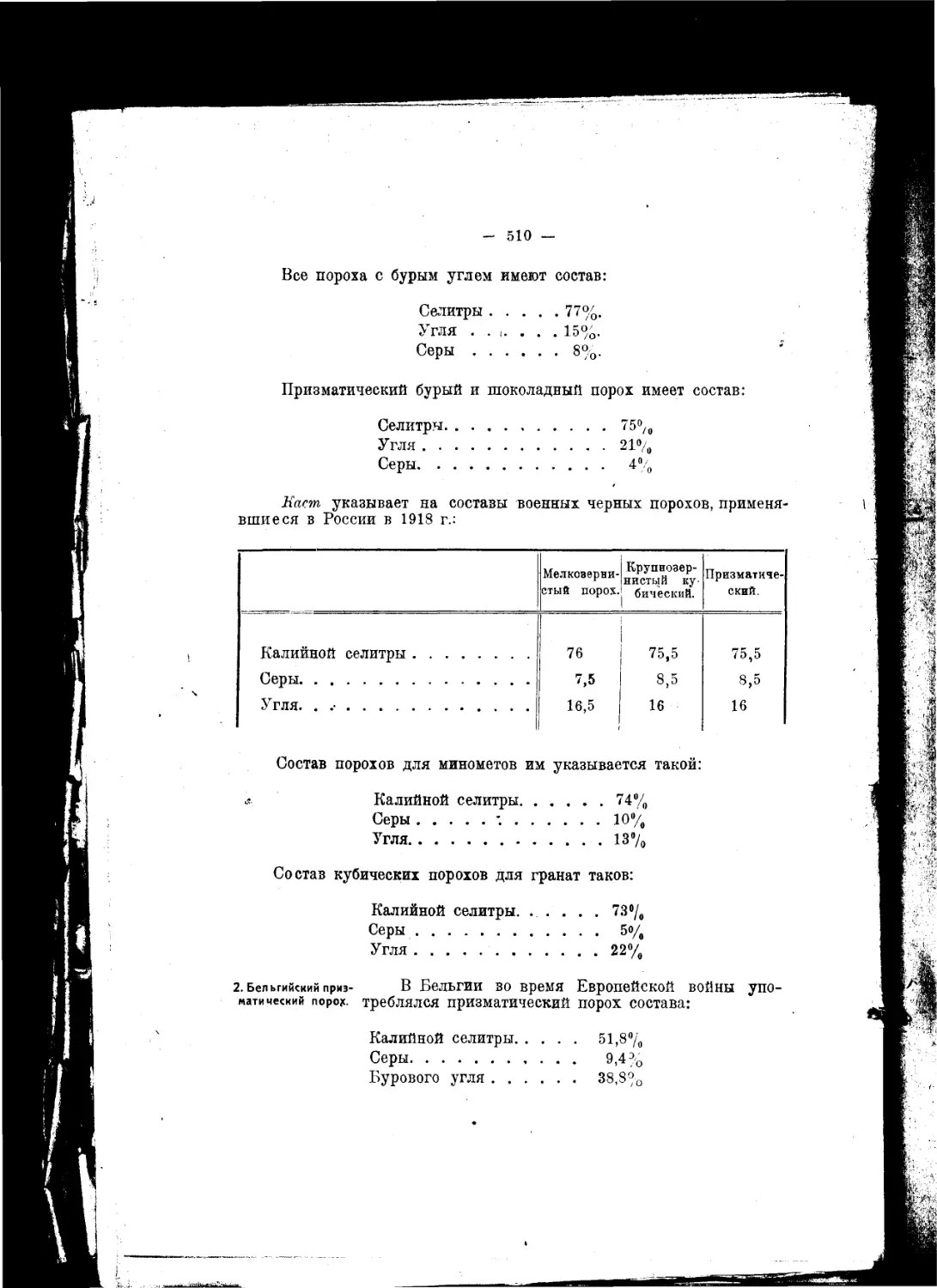
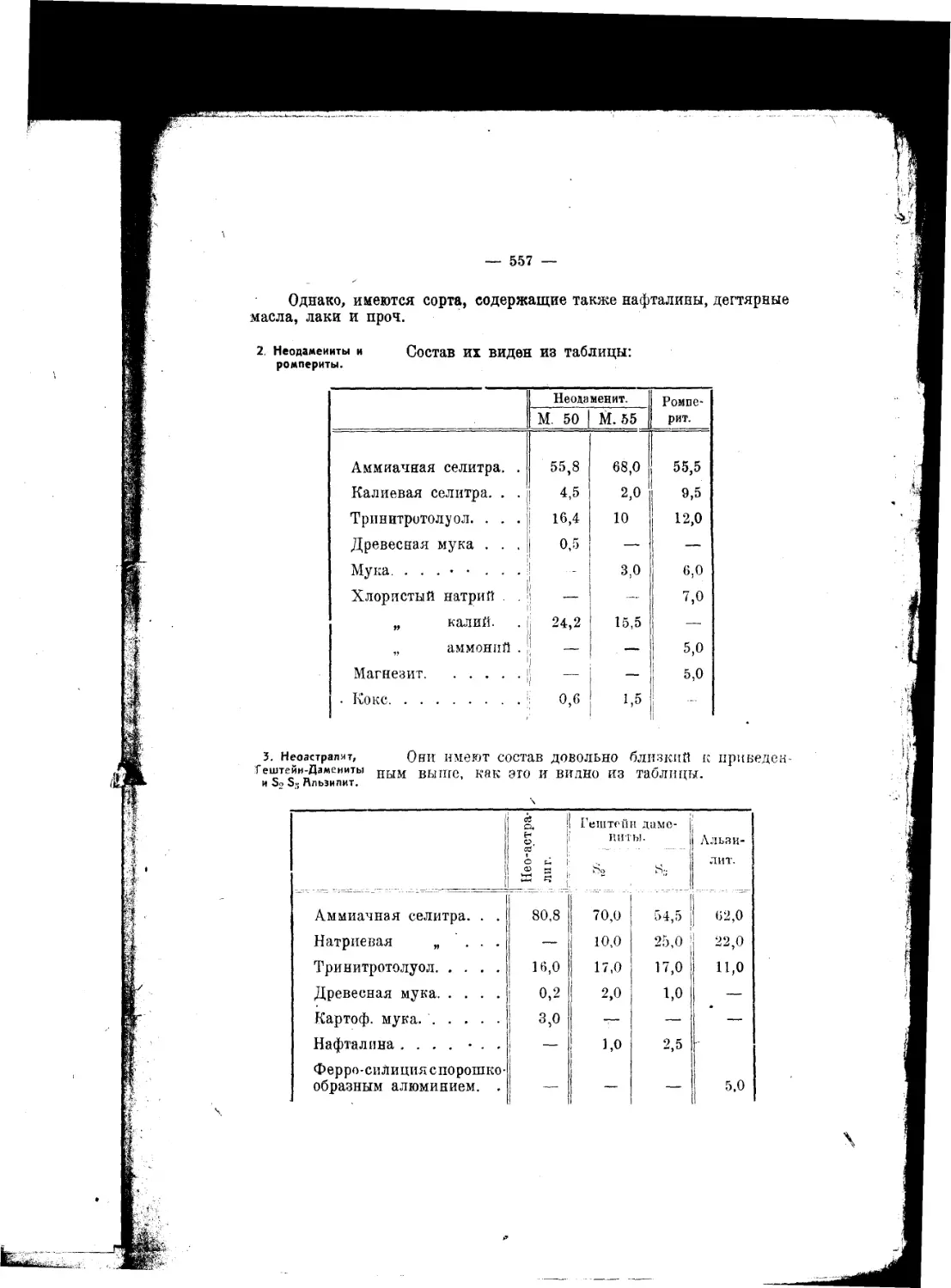
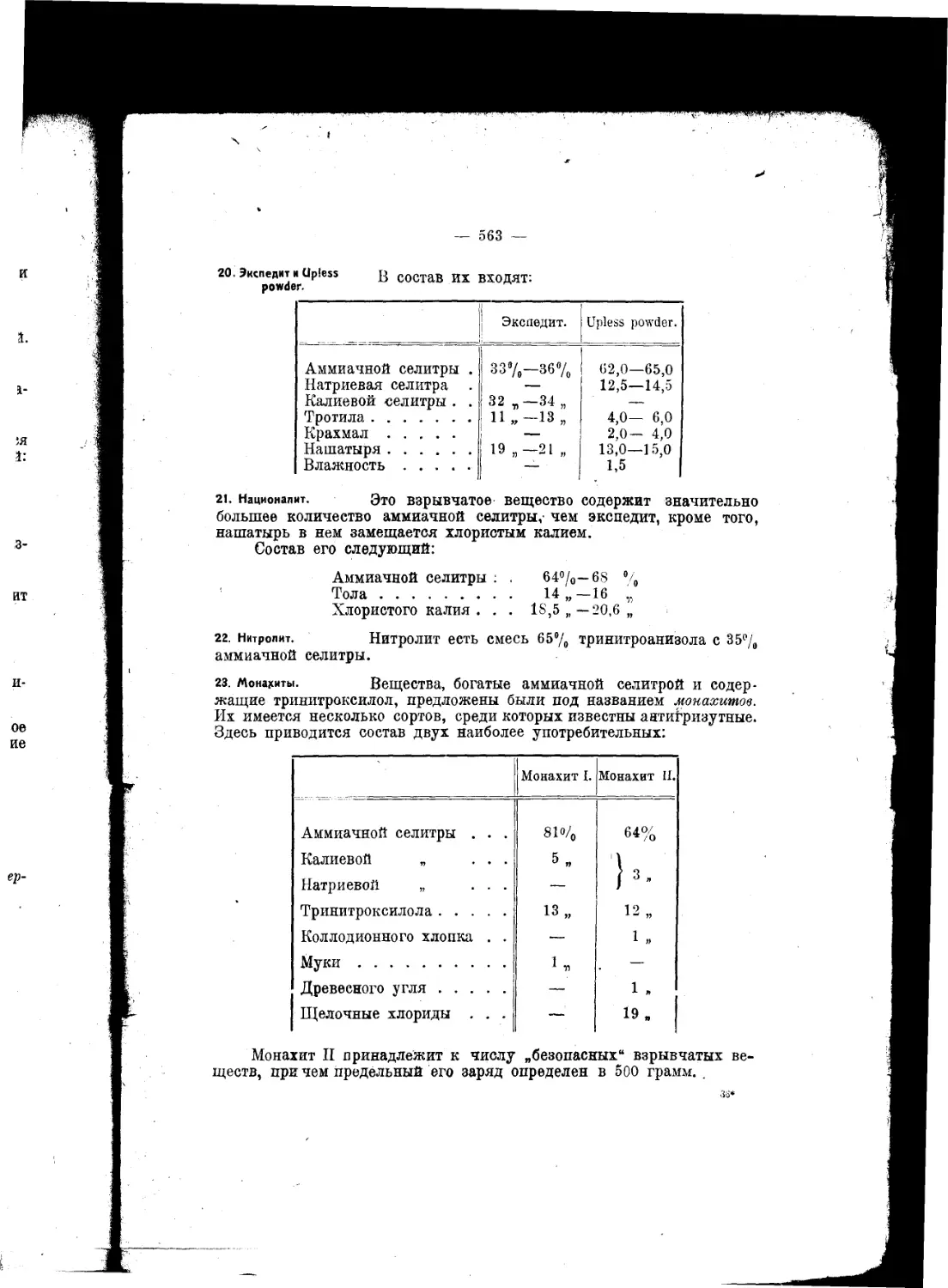
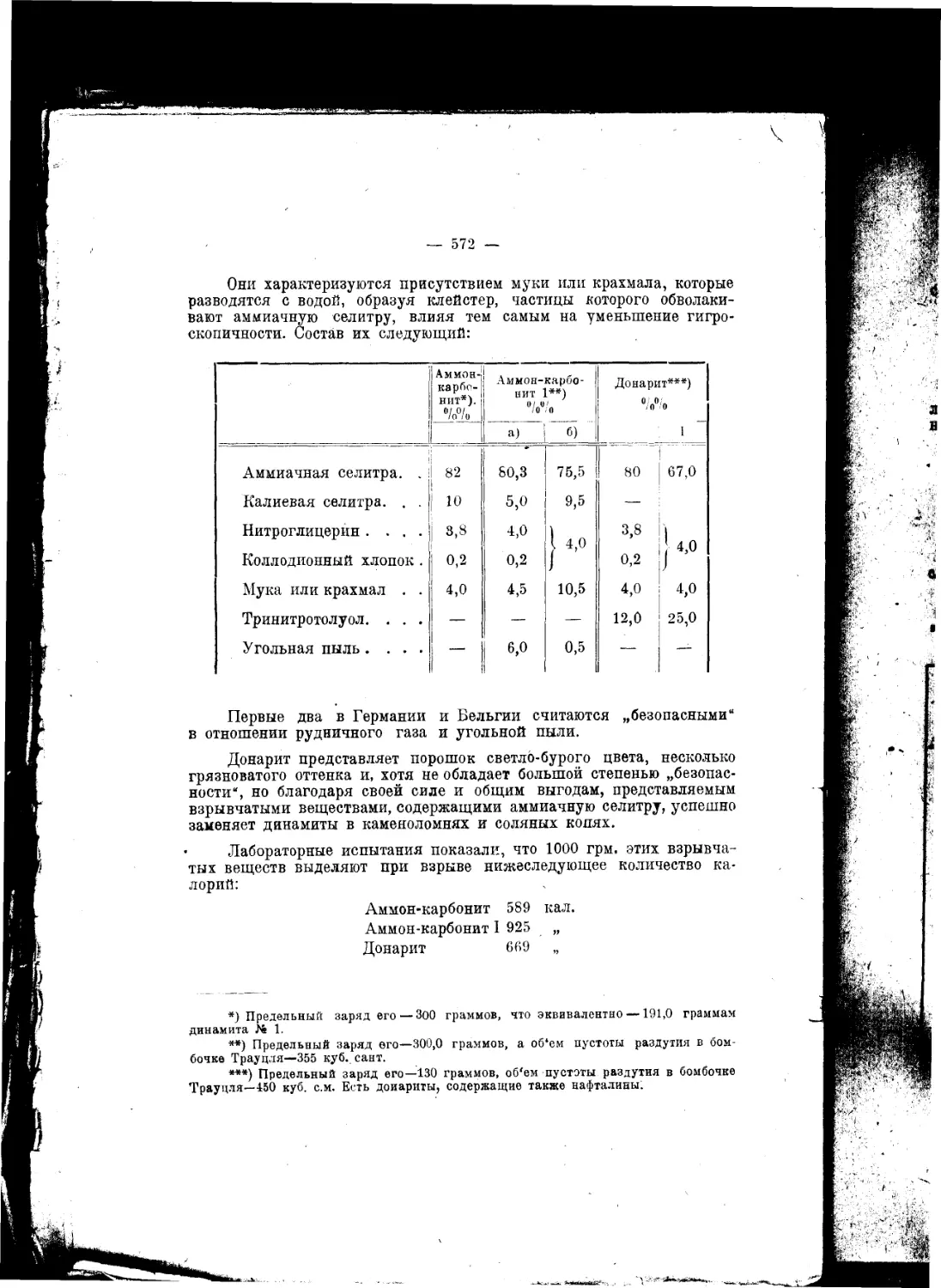
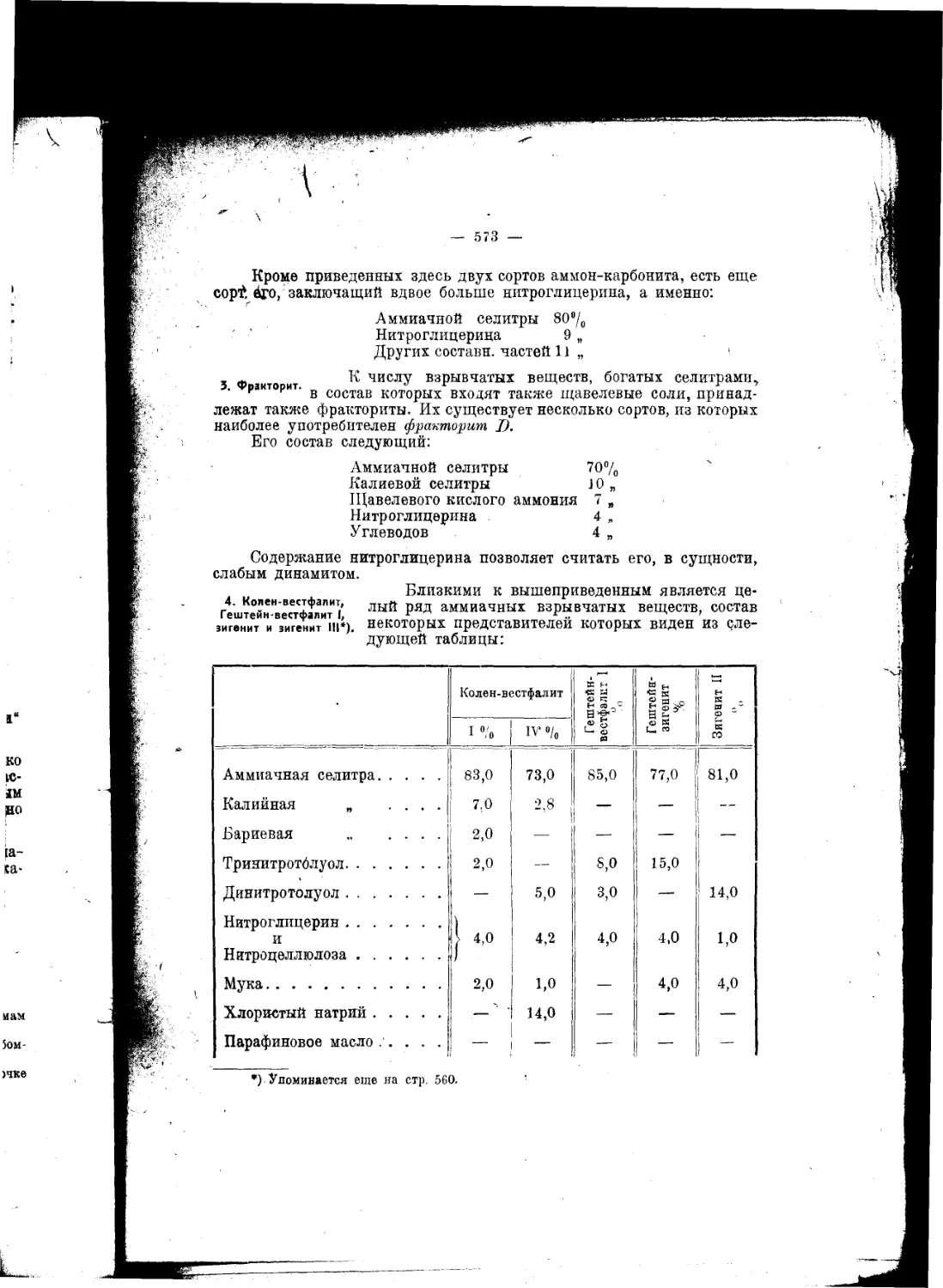
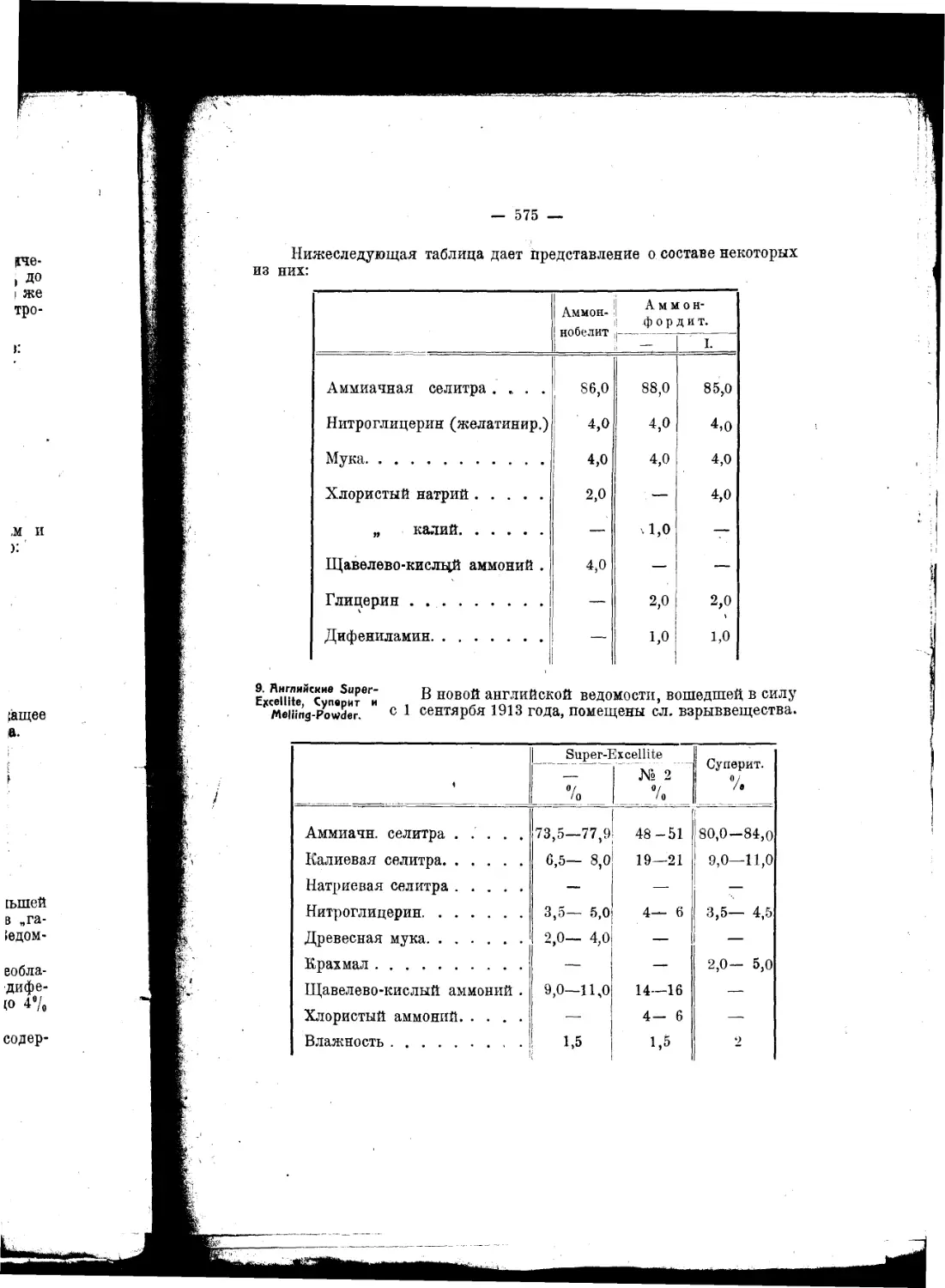
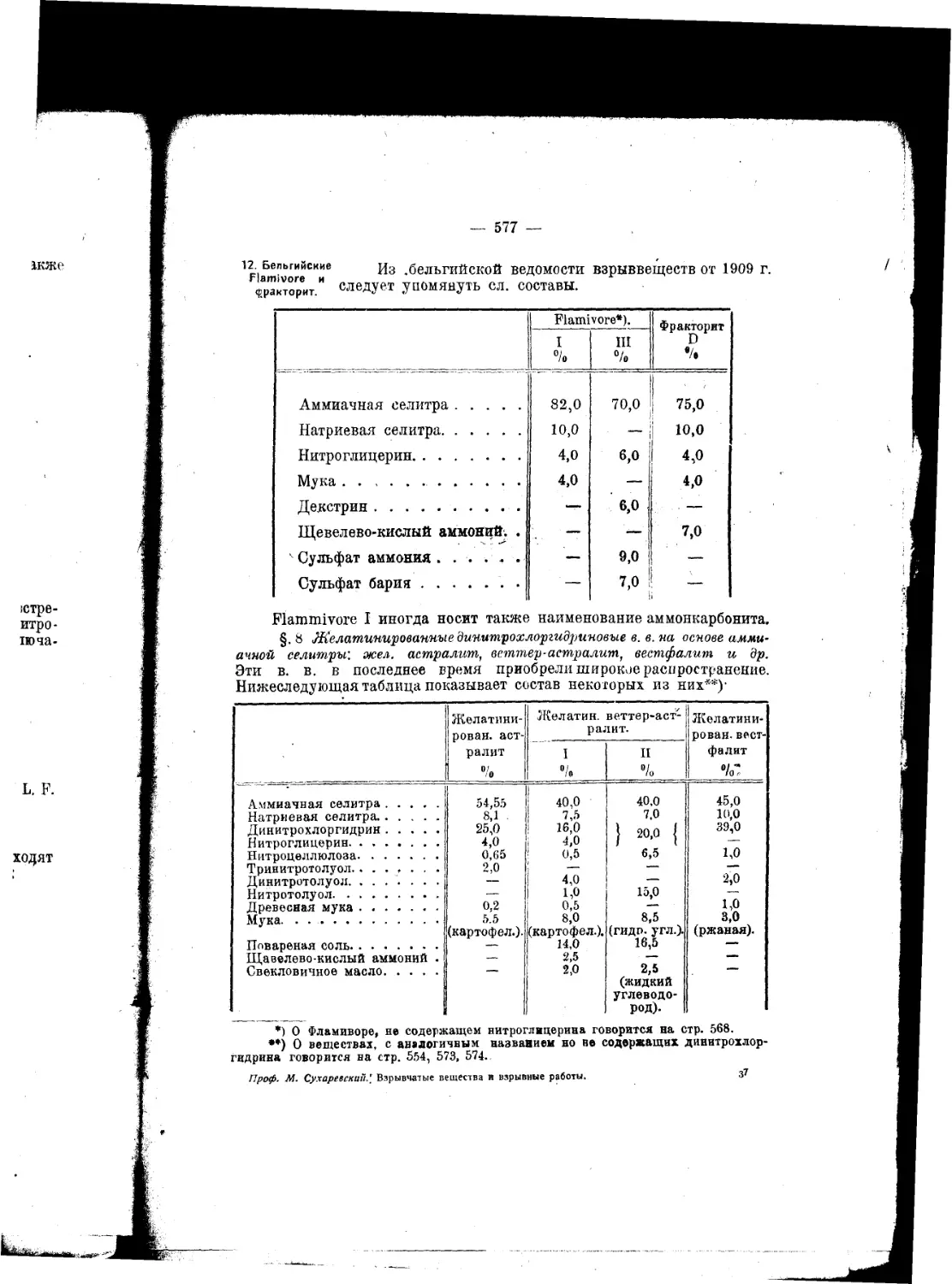
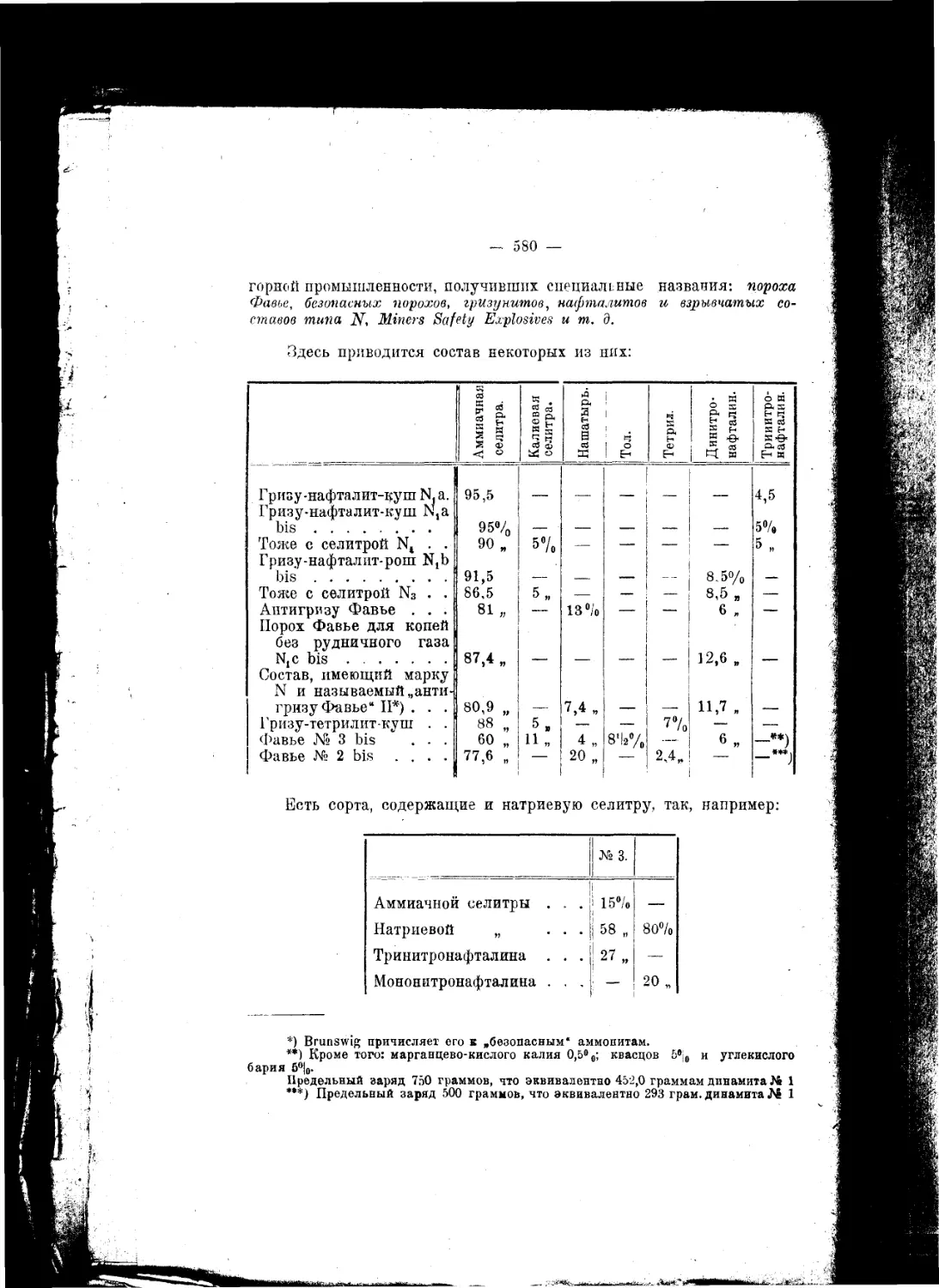
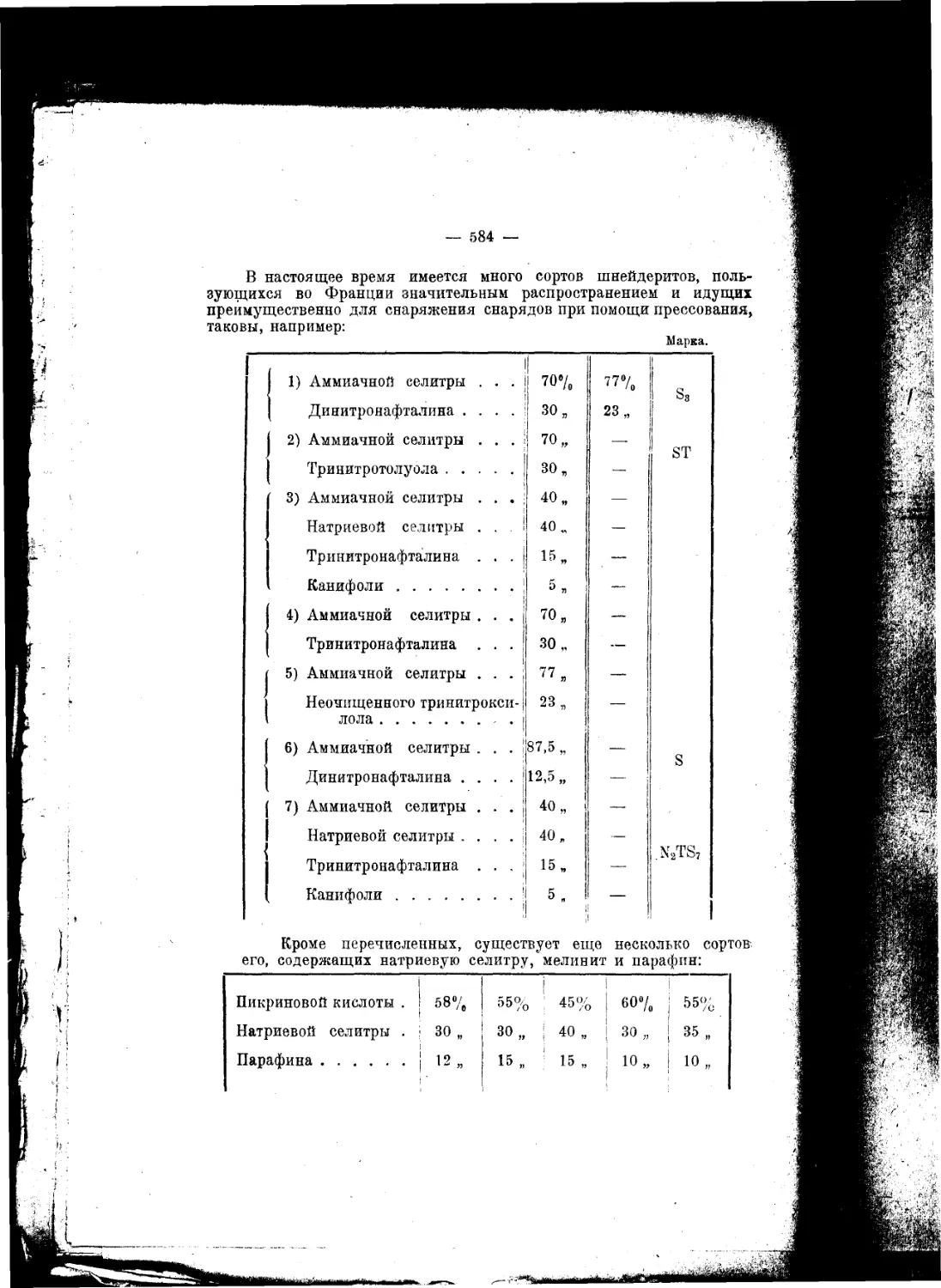
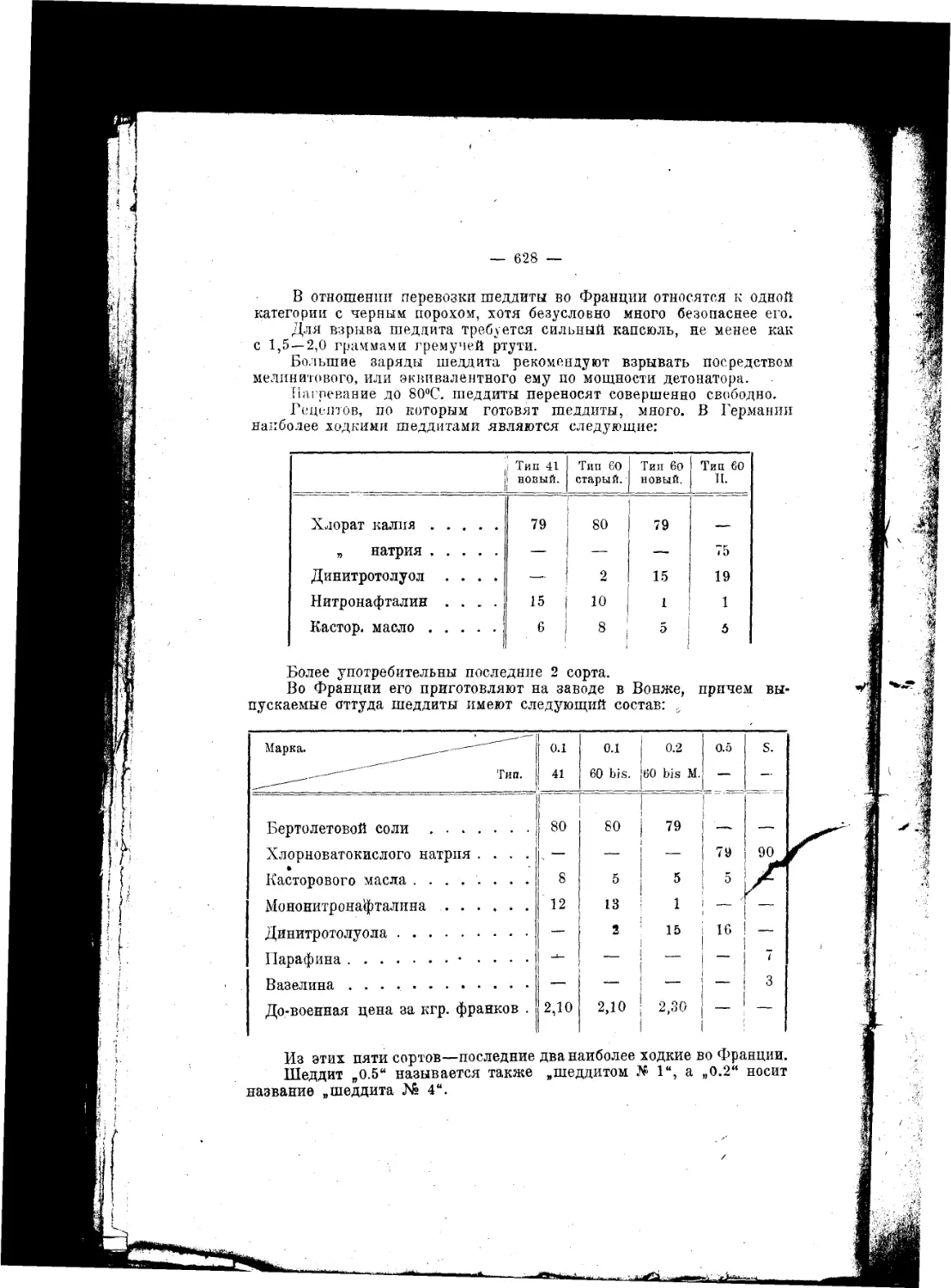
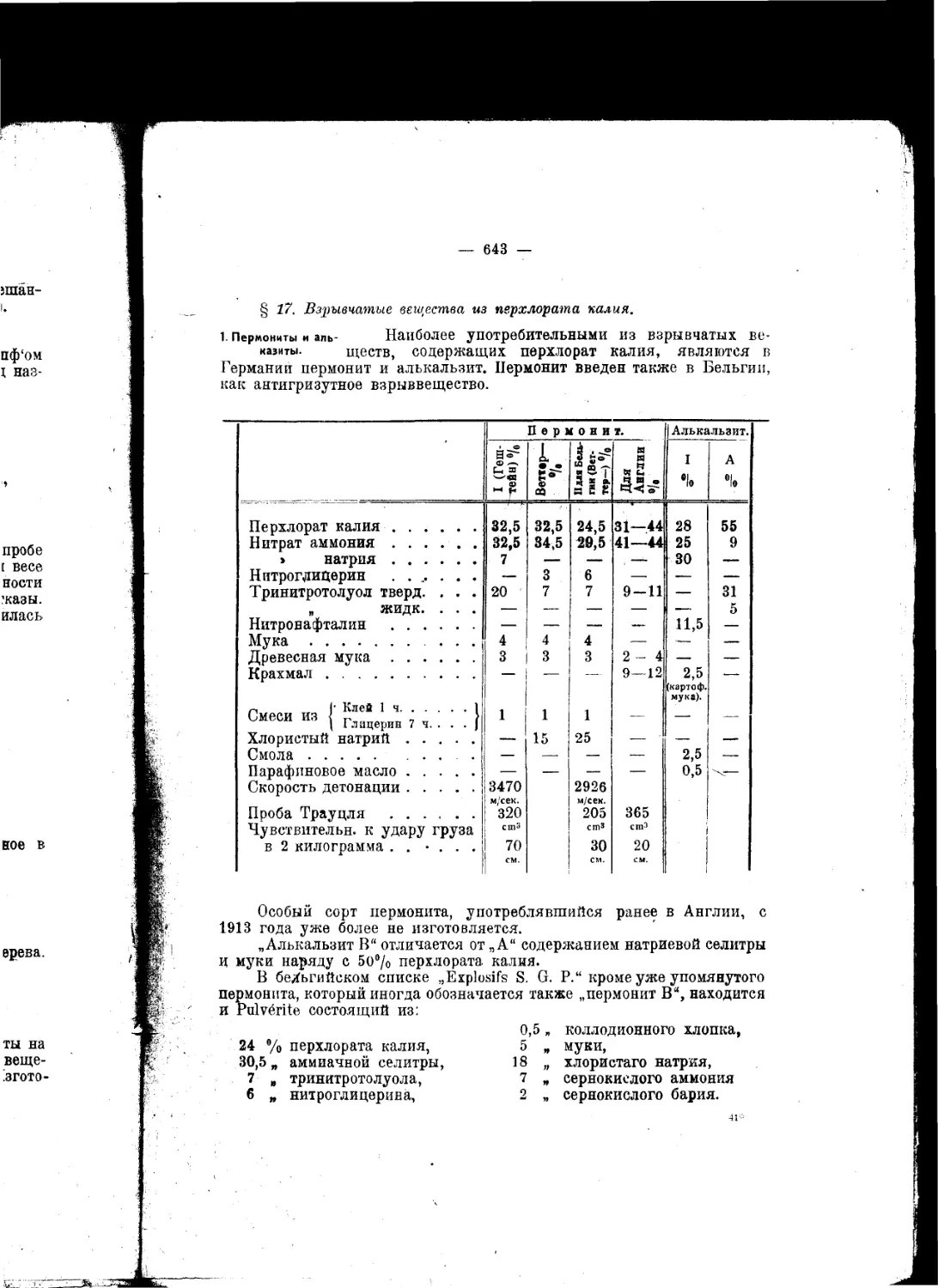
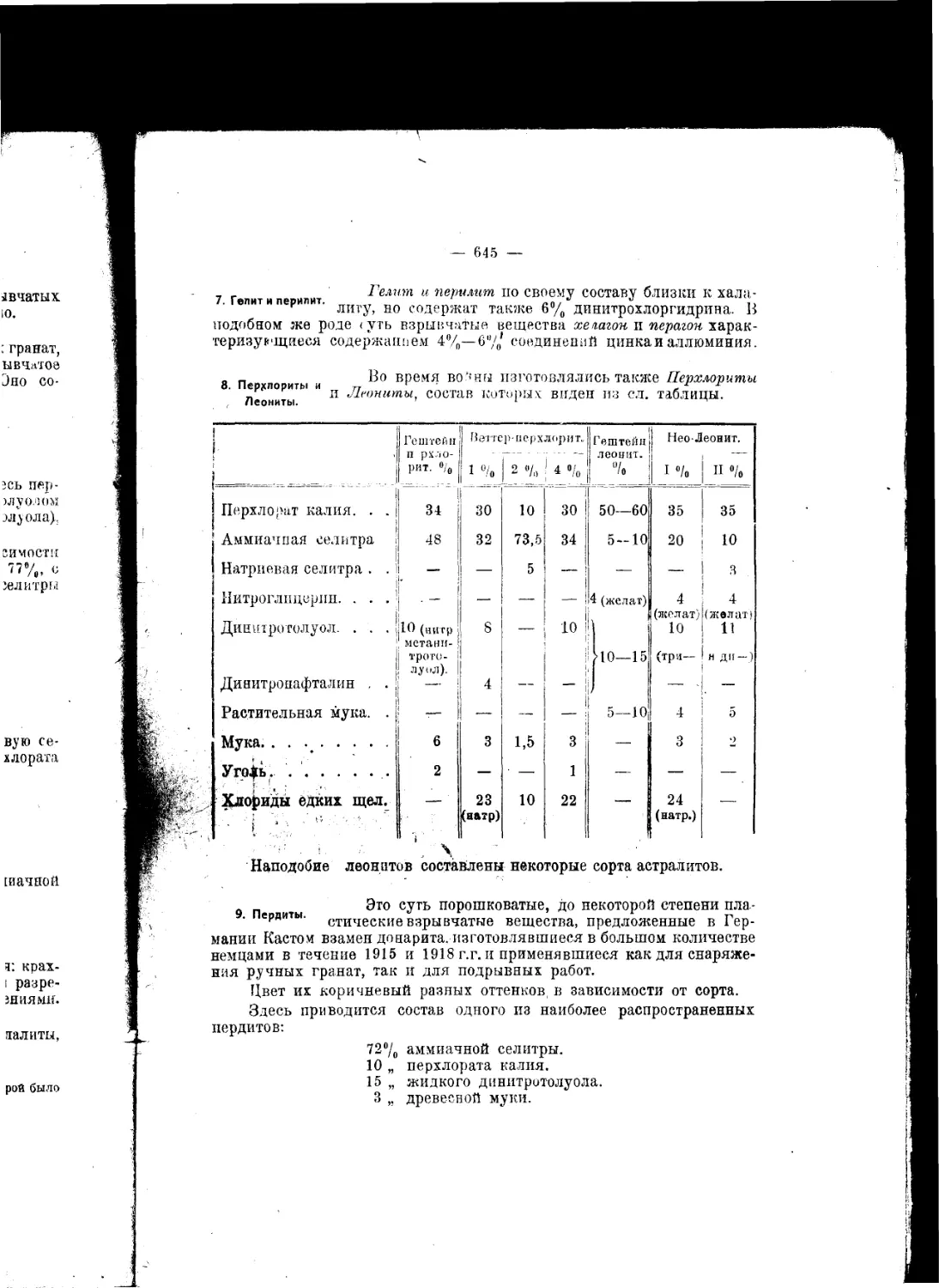
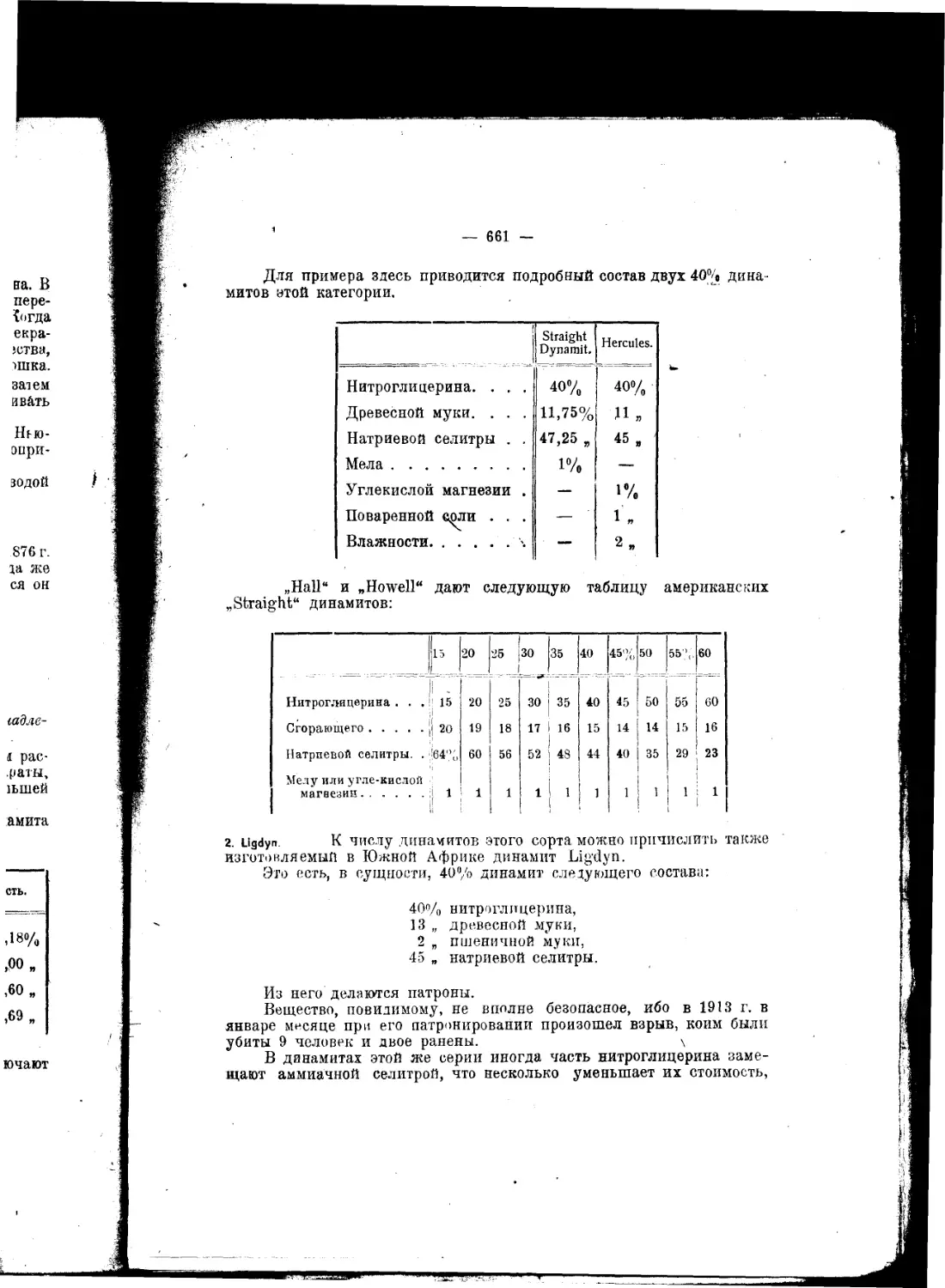
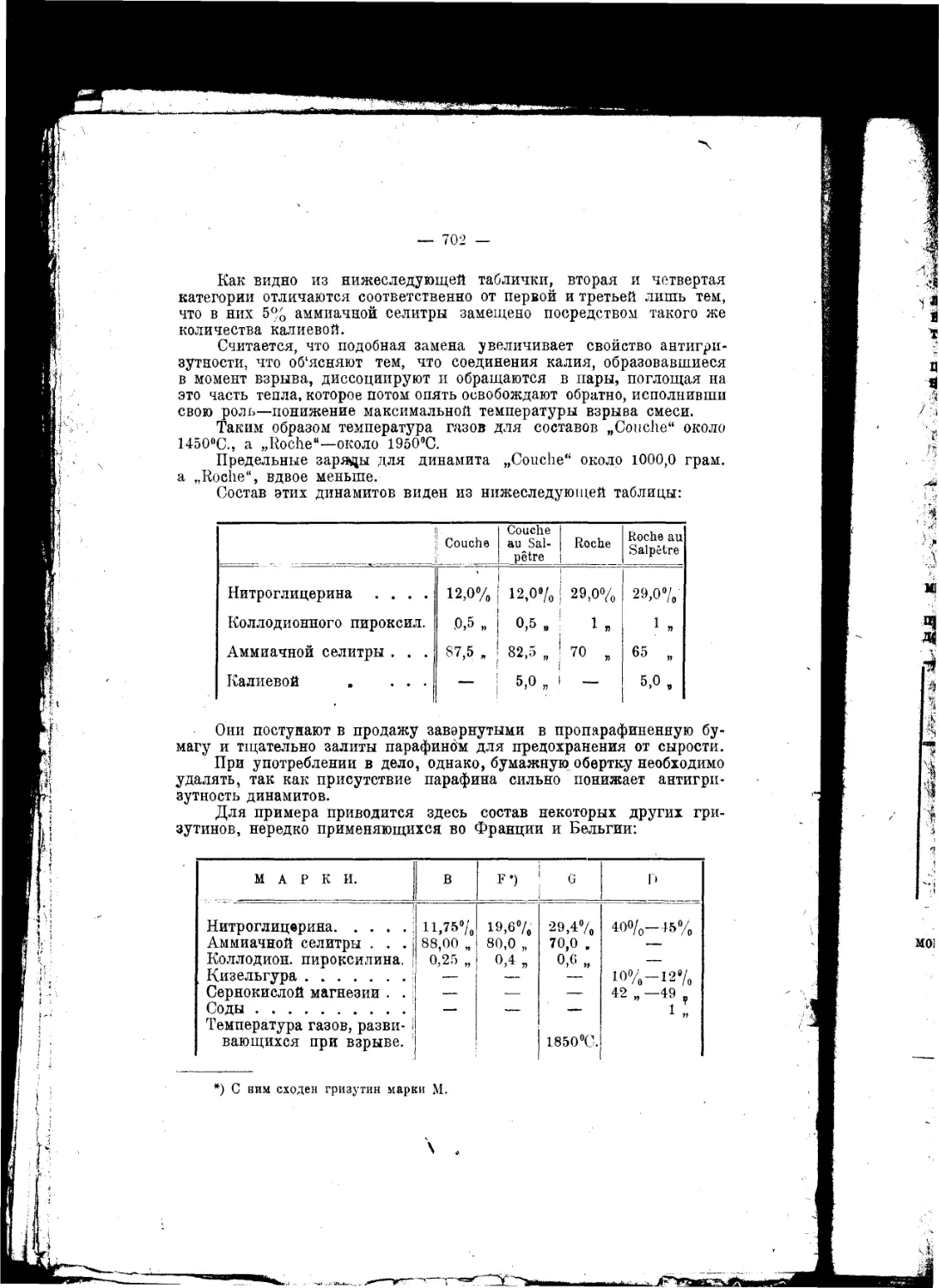
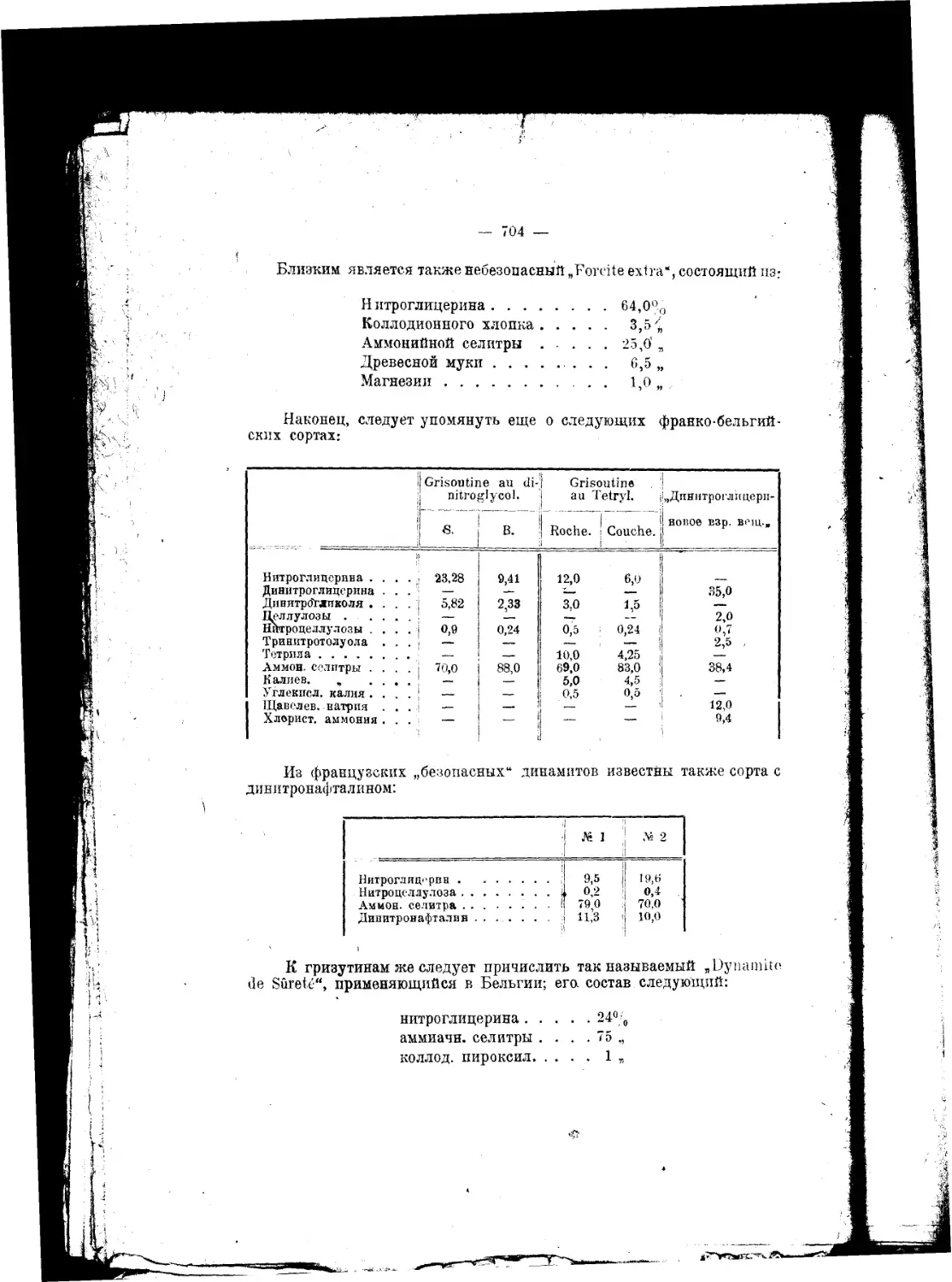
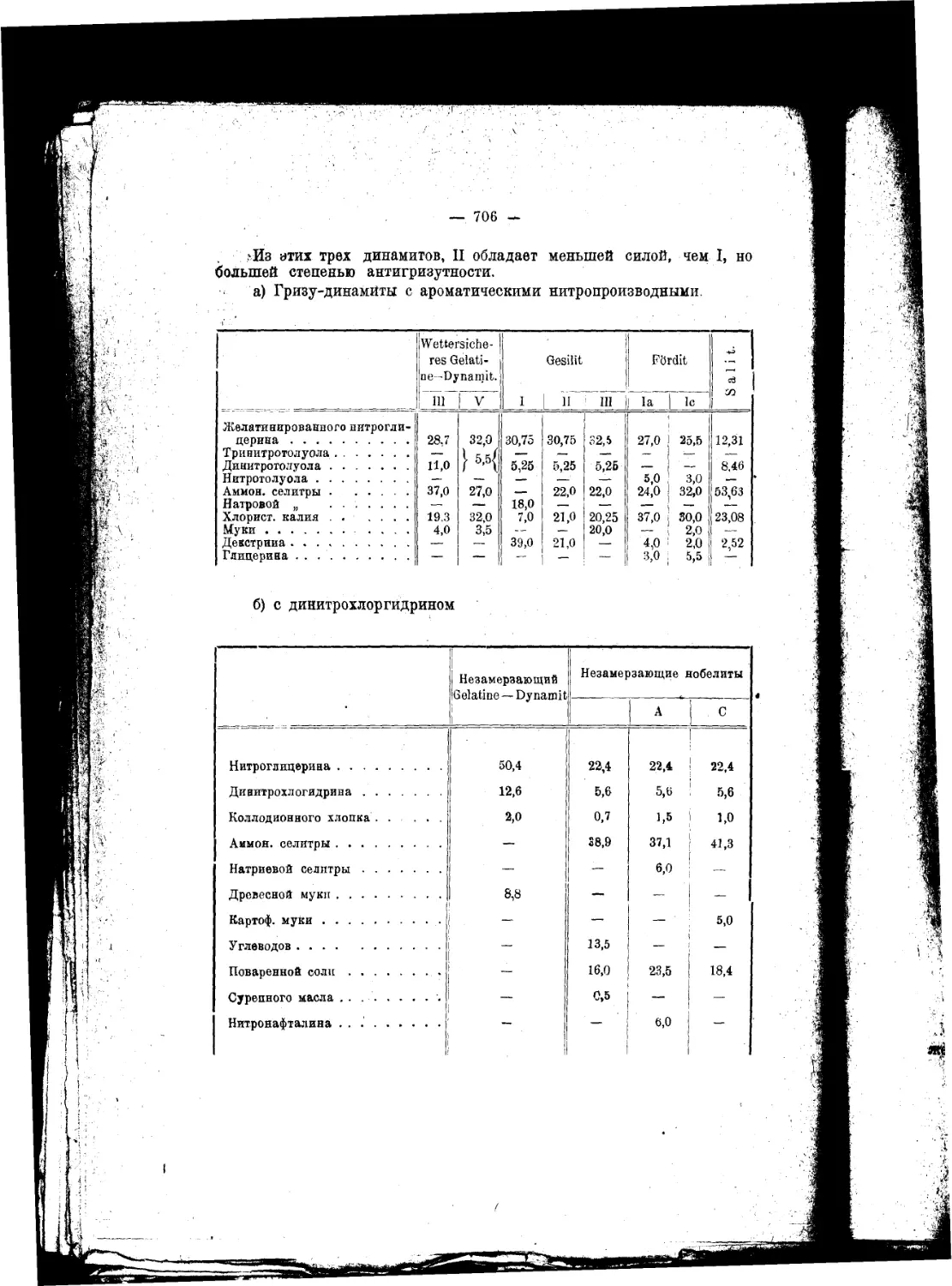
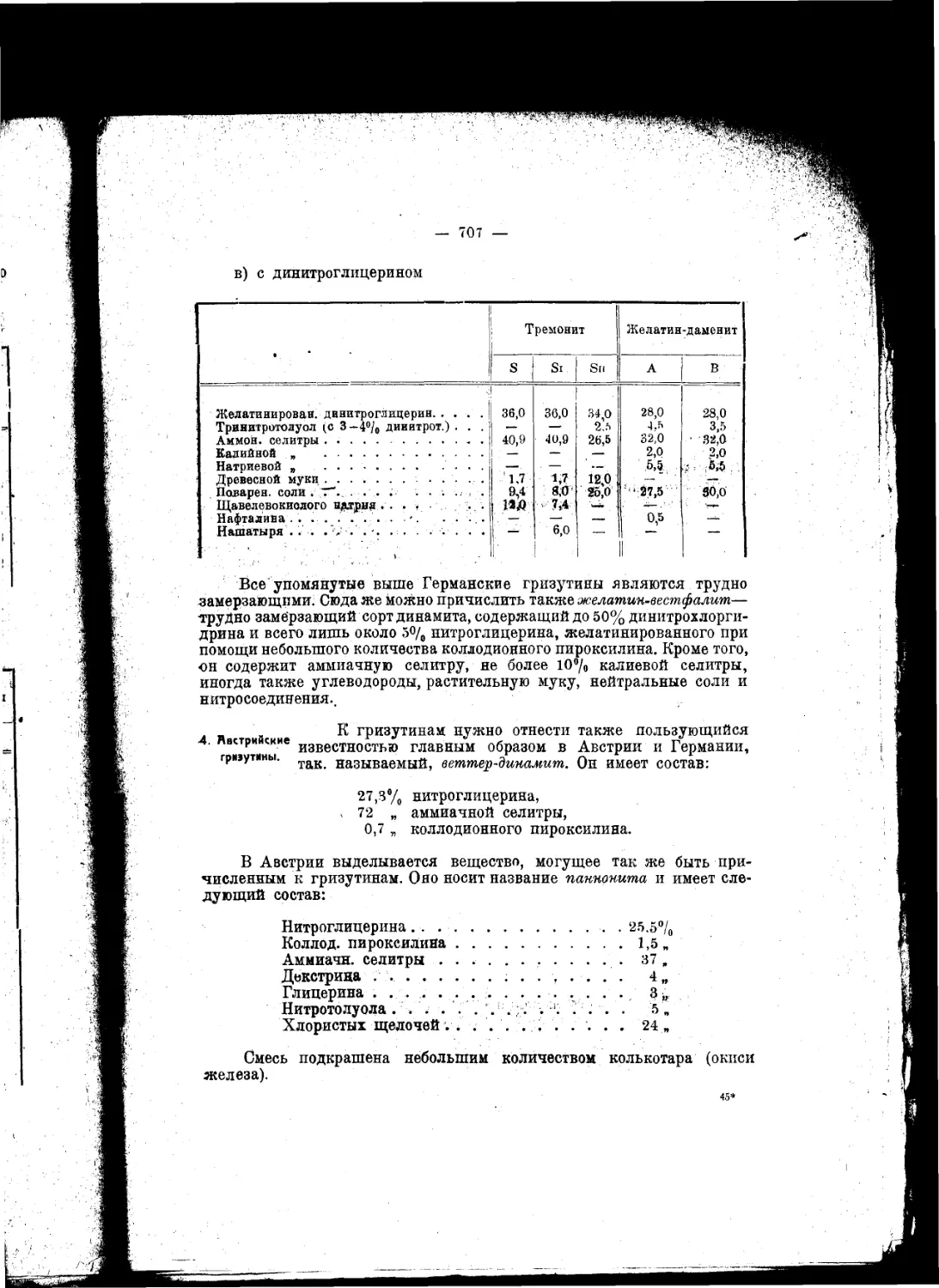
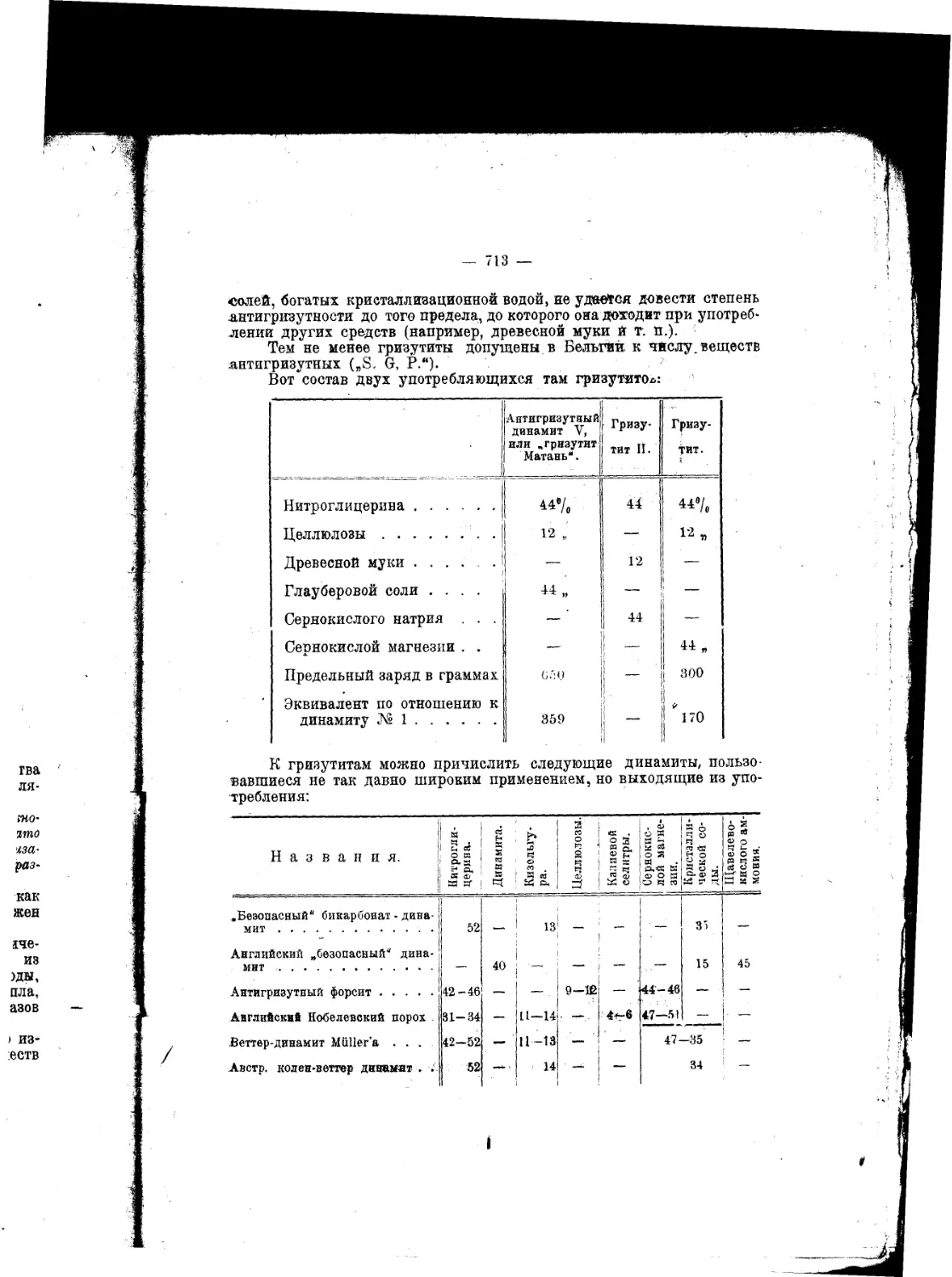
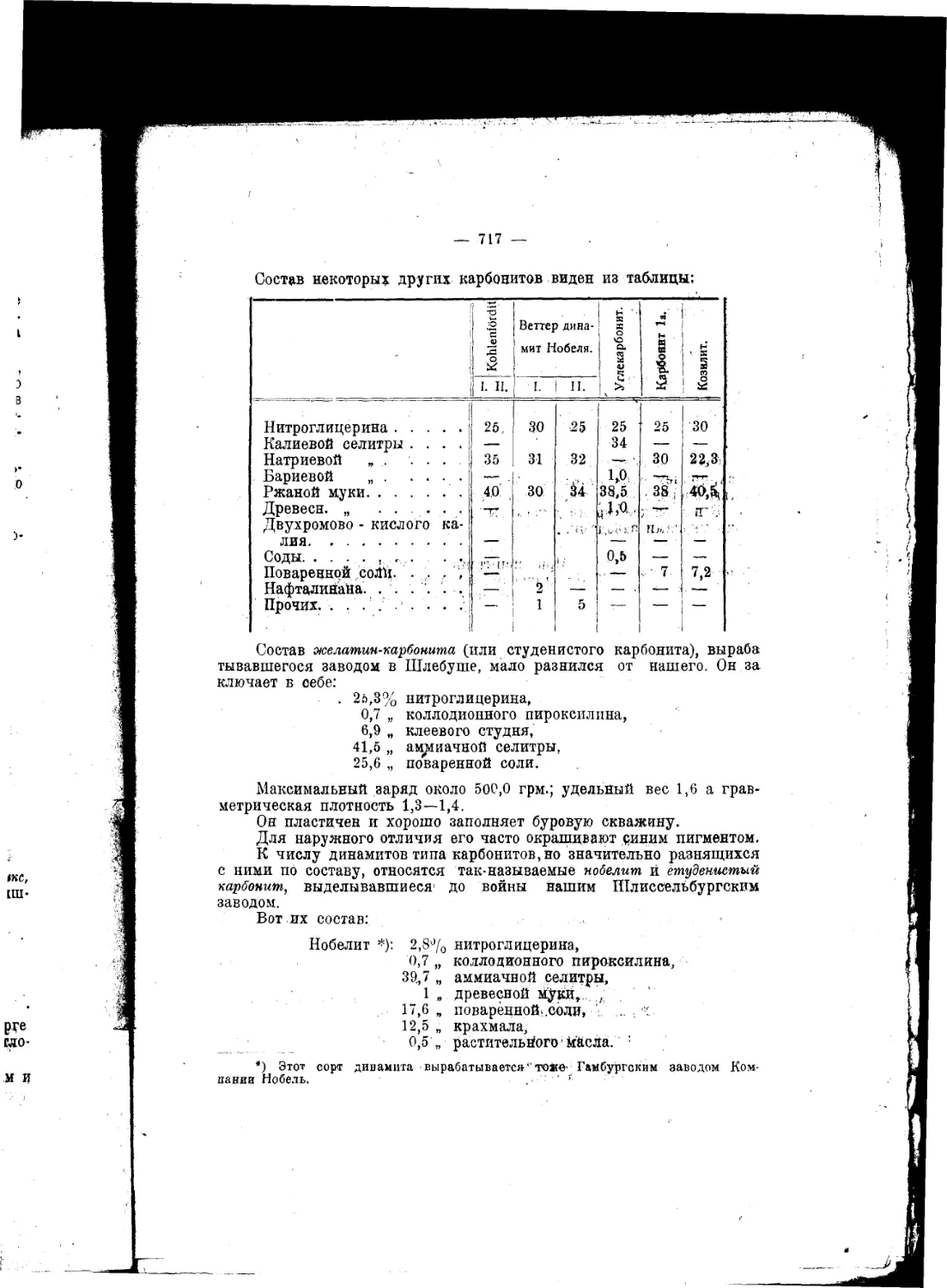
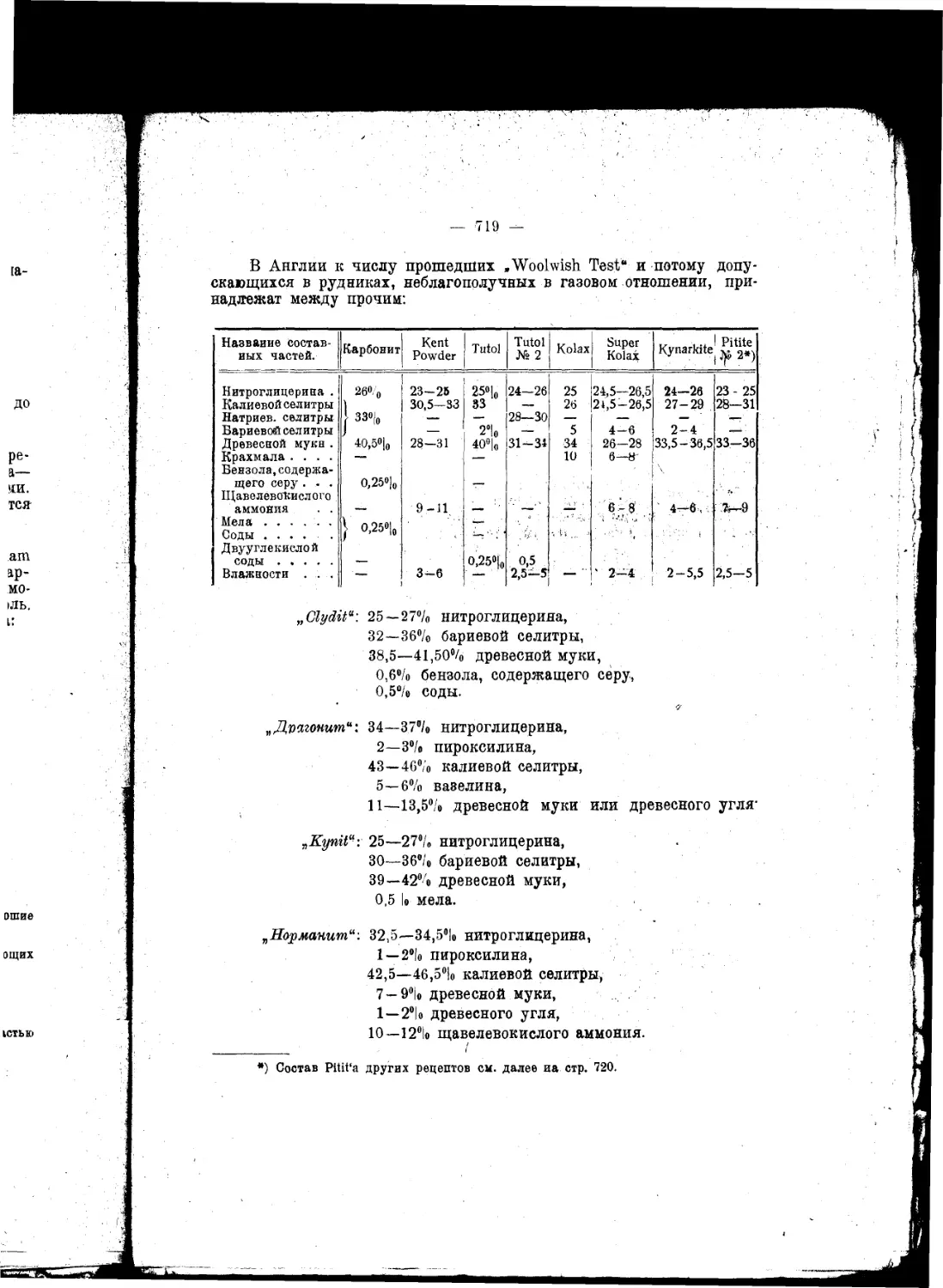
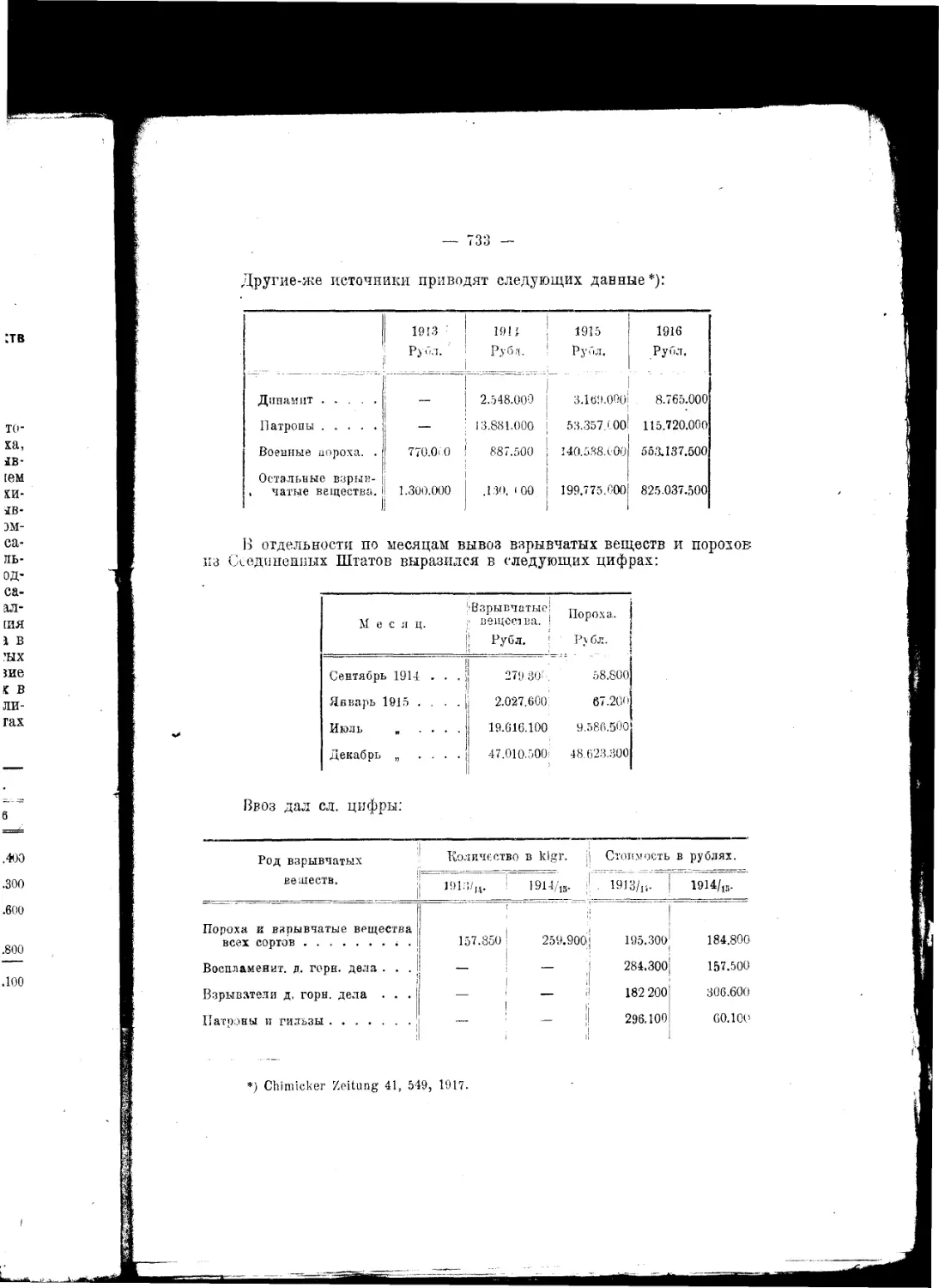
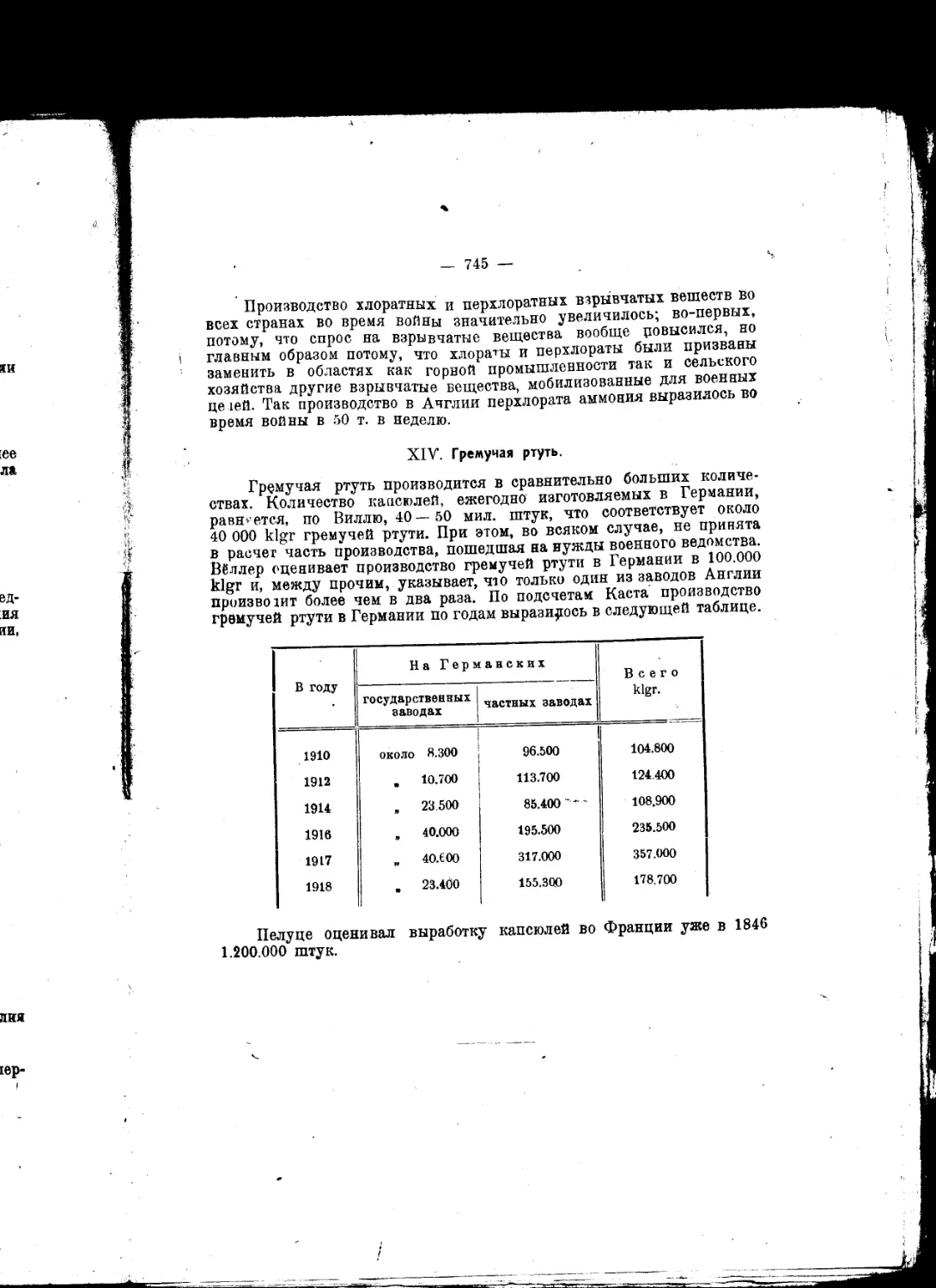
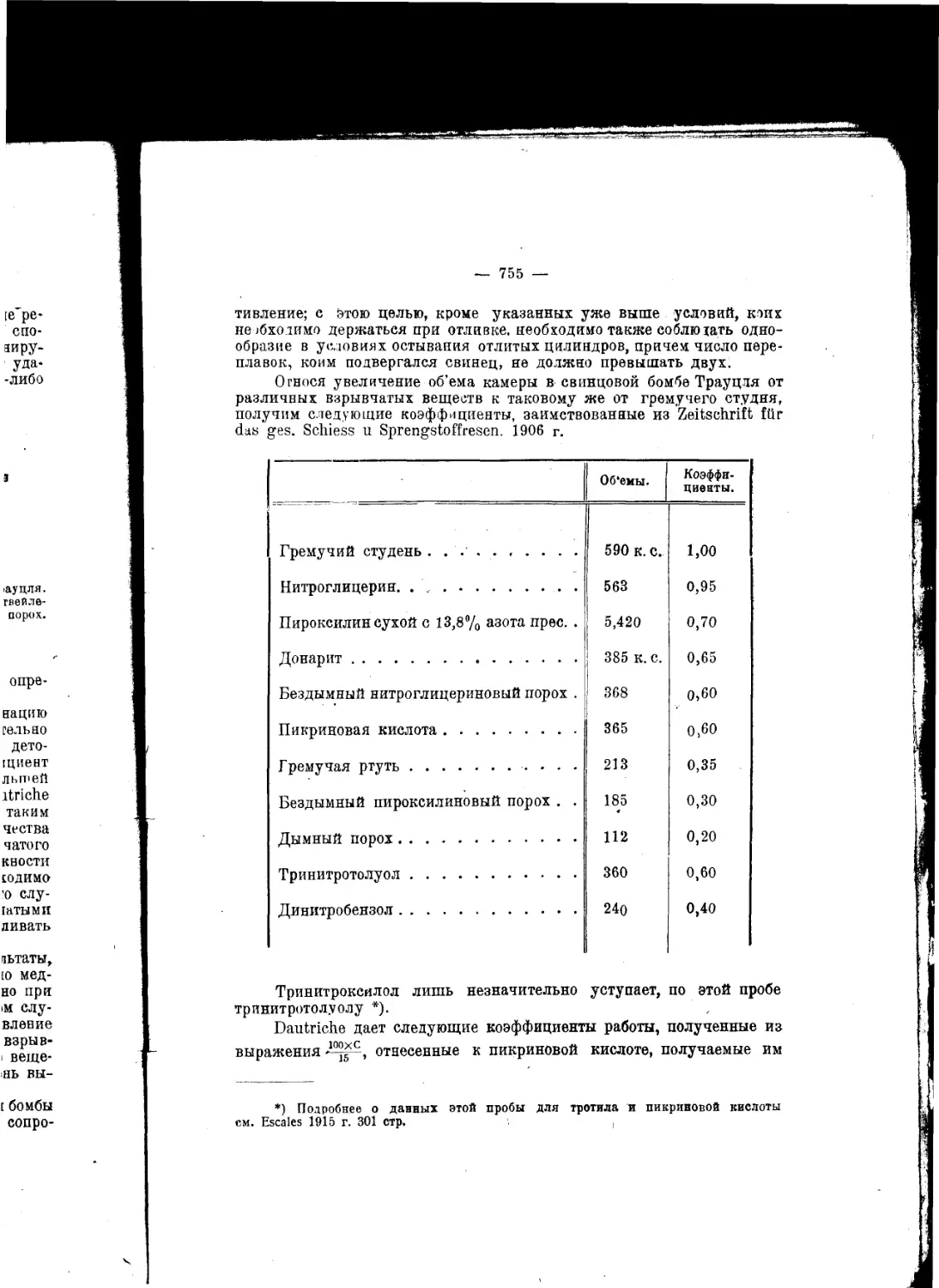
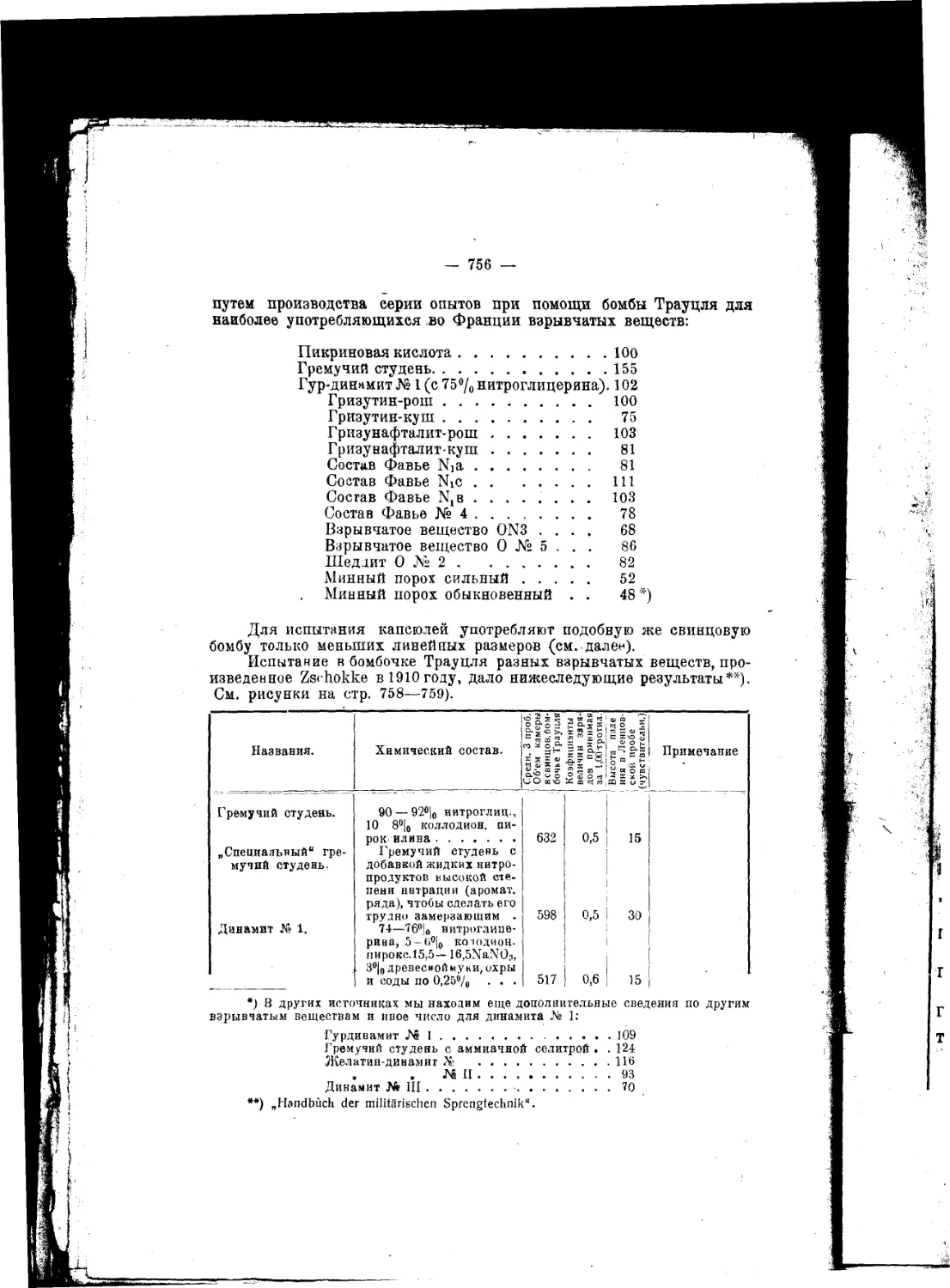
Текст
Пролетарин всех стран, соединяйтесь!
Р. С Ф. С. Р.
НАУЧНО-ТЕХНИЧЕСКИЙ ОТДЕЛ ВОНХ
Г. СЕРИЯ 3. ИНЖЕНЕРНО-ПРОМЫШЛЕННАЯ БИБЛИОТЕКА N2 VII- 3
СУХАРЕВСКИМ, И.
ВЗРЫВЧАТЫЕ ВЕЩЕСТВА
м
СЛРИВОЧНВЕ РУКОВОДСТВО ДЛЯ HI-
женеров, техника» и студентов
Том I.
Сост- при сотрудничает»** t Черника и ассист. Н. Соколова)
16^
xu'l:c;nc / л / рис.
.Я -
/V
.!
ГОСУДАРСТВЕННОЕ ТЕХНИЧЕСКОЕ ИЗДАТЕЛЬСТВО
МОСКВА- 1923.
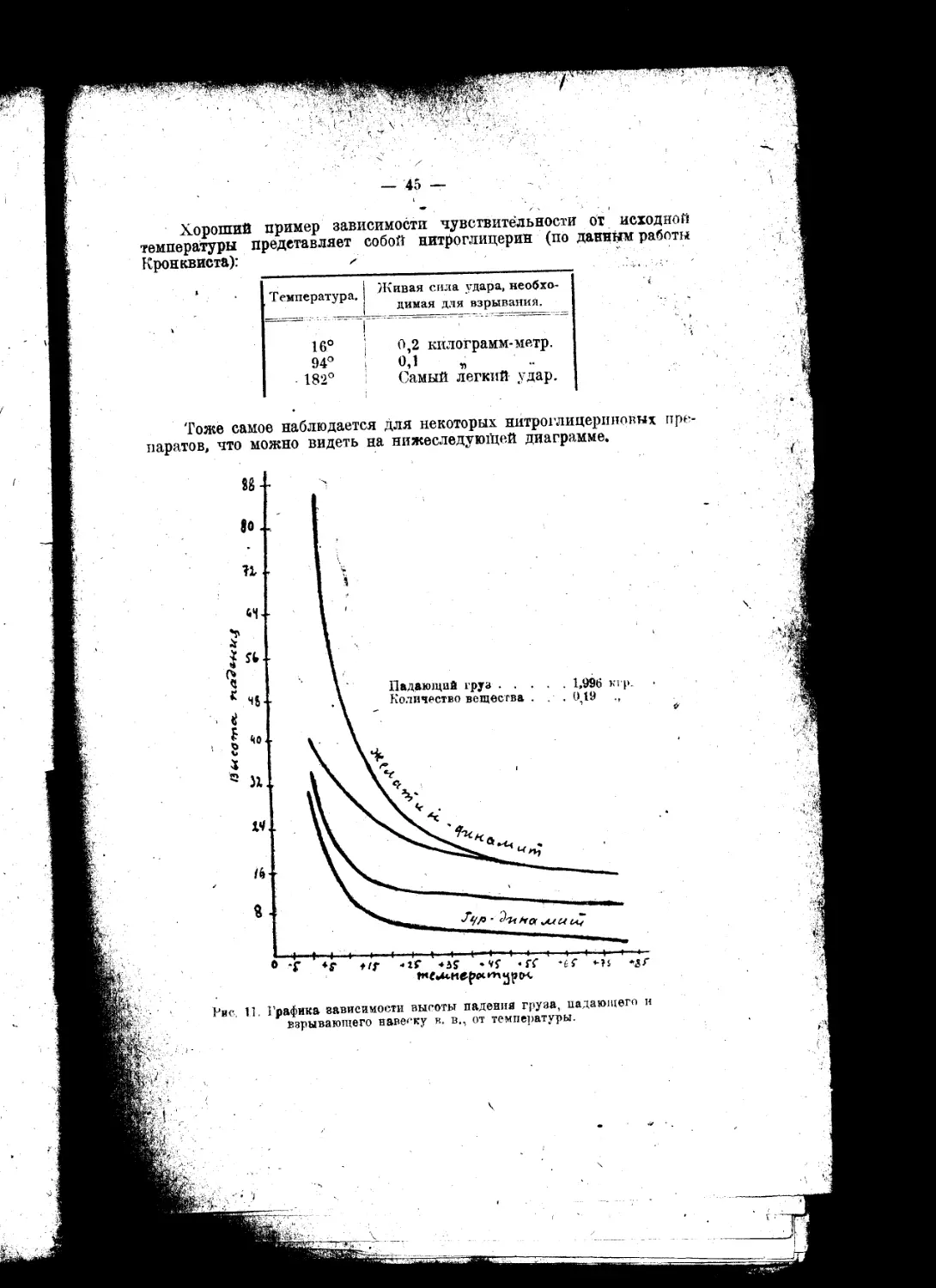
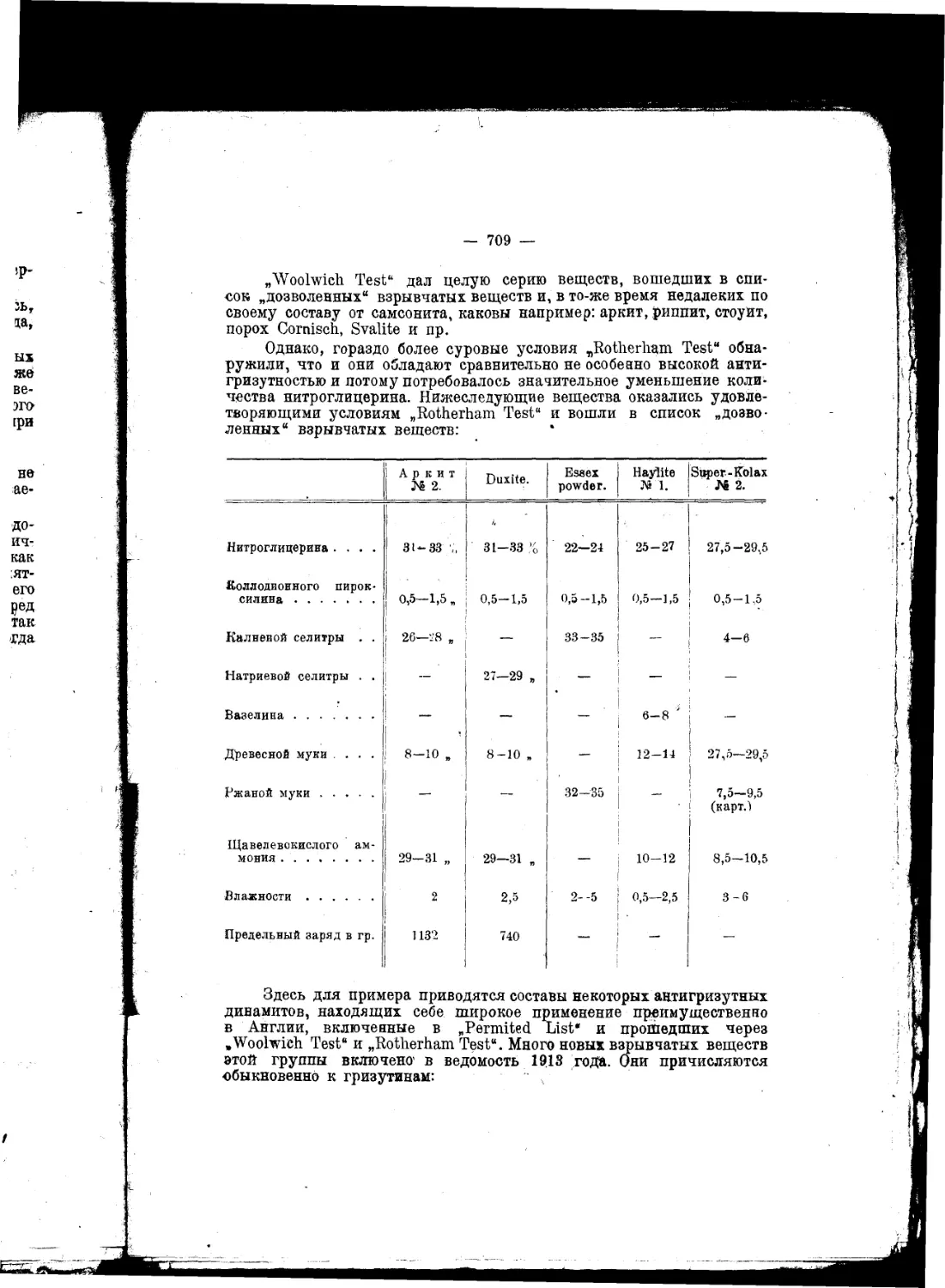
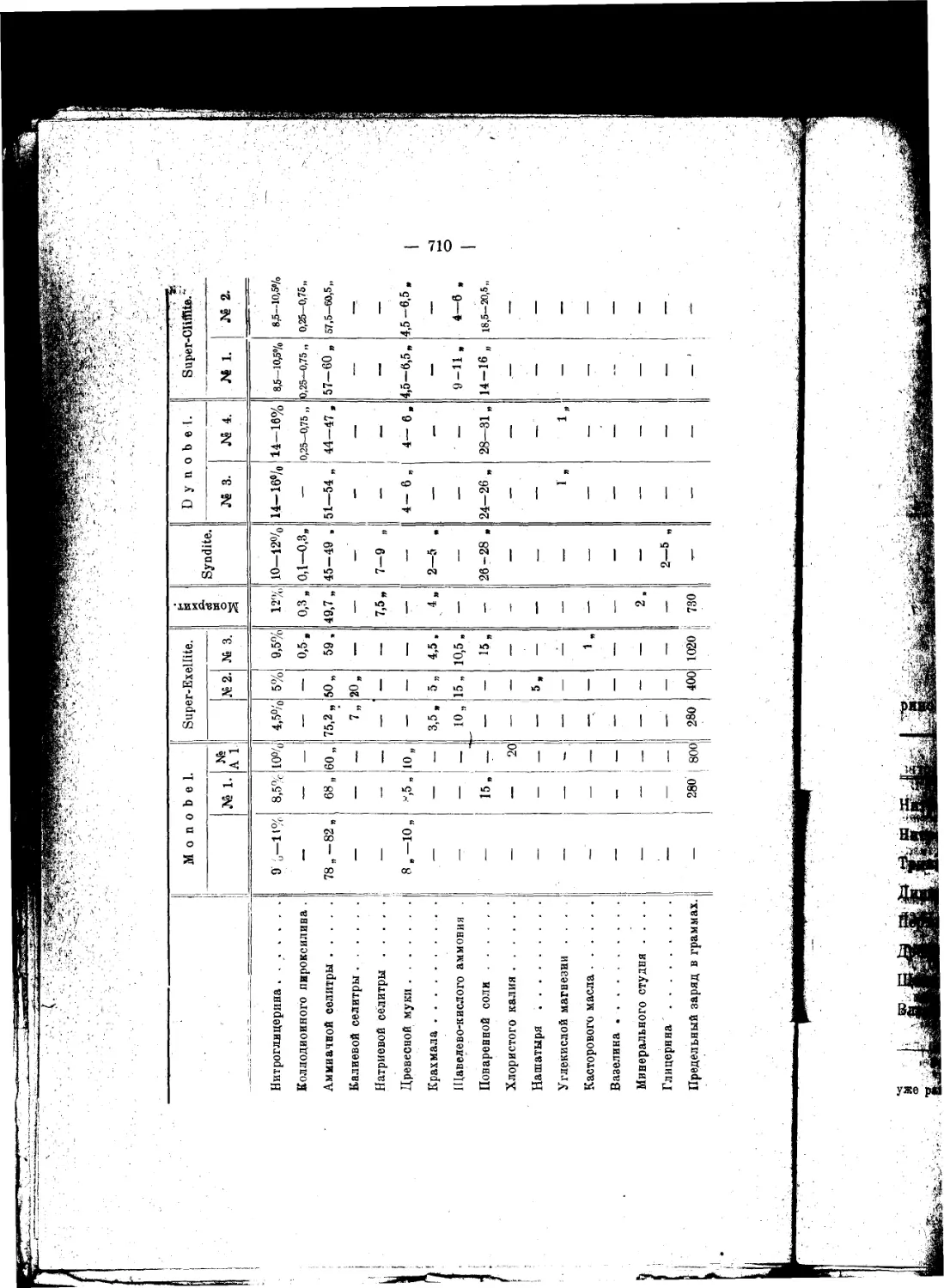
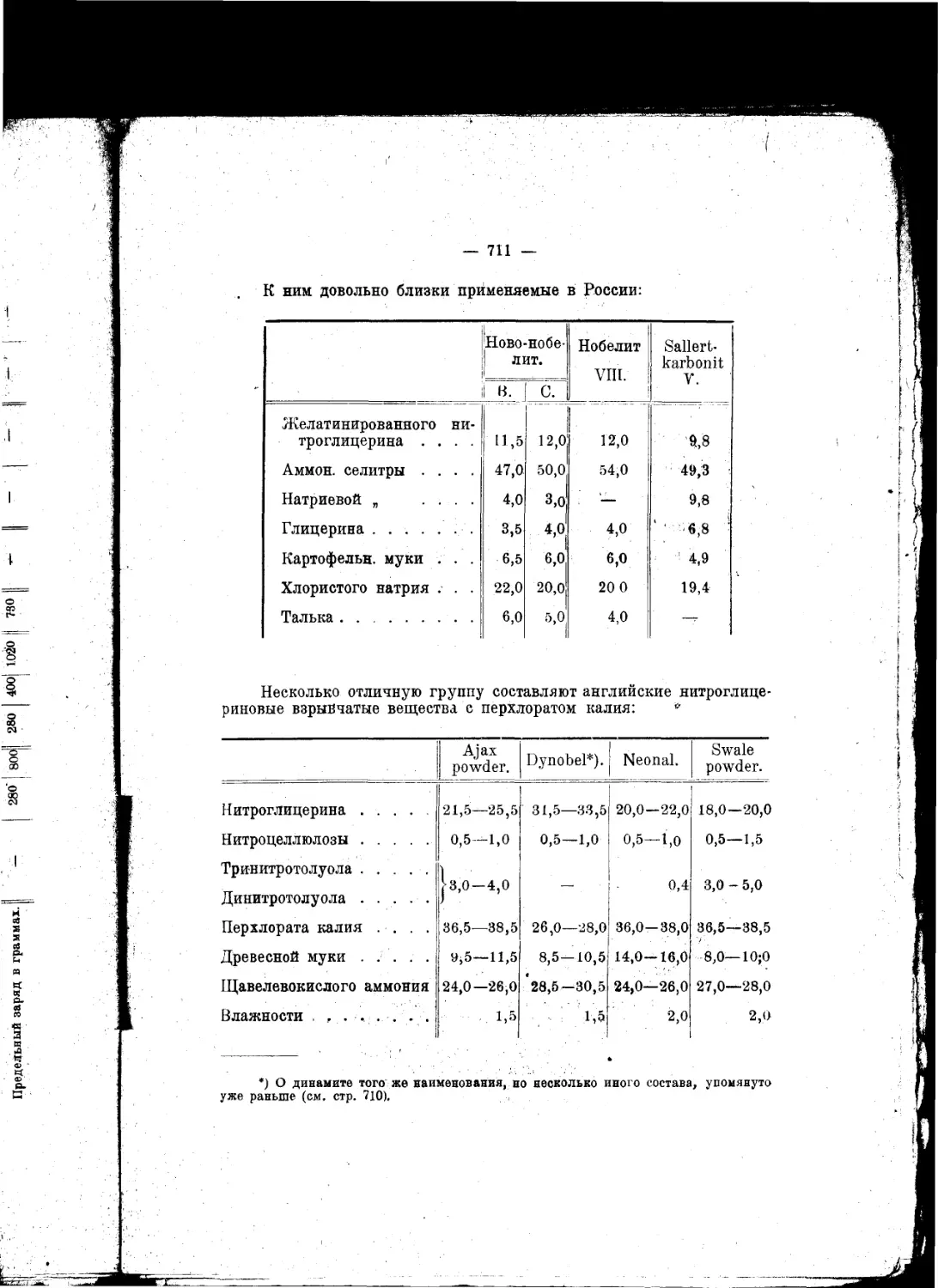
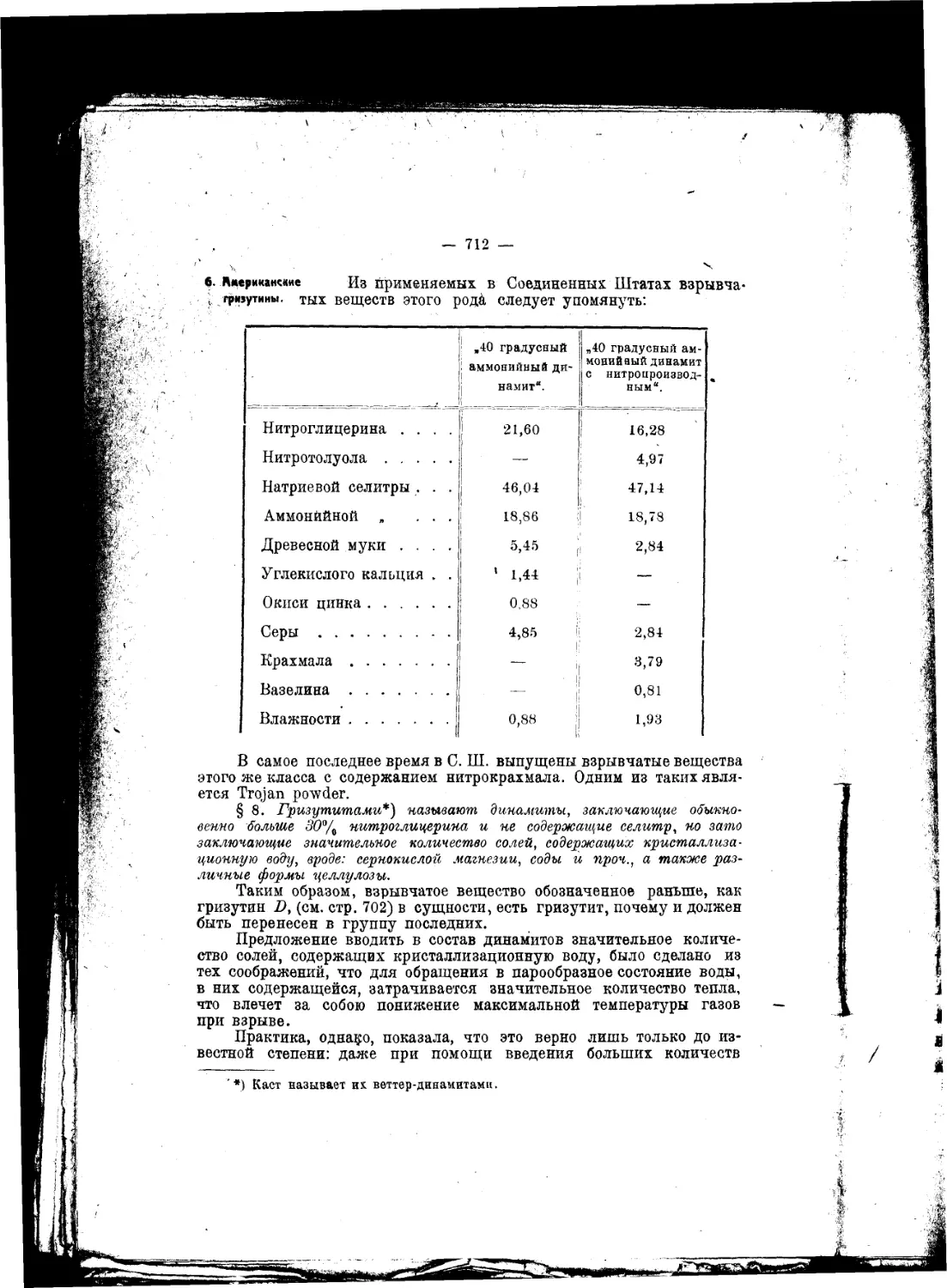
.„.„Внимание к взрывчатым веществам, вероятно, год от года будет не умаляться^
а возрастать, ибо в новой области этого предмета предвидится множество самосто-
ятельных и глубоко важных для науки вопросов"...
.„.„Чем дальше будут стрелять ружья и пушки, тем, без всякого сомнения, войны
будут реже, а когда, что ныне уже очень близко по времени, ружья будут бить на
расстояниях, при которых не видно стрелка и не слышно выстрела, тогда с одвой
стороны каждому будет виднее, чем доныне, лотерейность войн, а с другой стороны
станет нагляднее выступать в этом деле значение знания, разумности, предусмо-
трительности и гуманности, которые прекратят войны".
*Эти соображения ведут к тому заключению, что изучение взрывчатых веществ
п усовершенствование силы огнестрельного оружия—одни из лучших и верных
путей к достижению общего мира"...
. .„Я, не обннуясь, говорю, что изучение взрывчатых веществ имеет, между
прочим, целью—упрочение всеобщего мира^^что охота воевать обратно пропорци-
ональна. по крайней мере квадрату (если не кубу илн еще высшей оепеыи) рассто-
яний или дальности боя оружия, что Закономерно управляя скоростью горения
взрывчатых веществ, увеличивая начальную" скорость выкидываемых снарядов,
современность содействует высшнм сторонам просвещения и прогресса и что разра-
ботка знания взрывчатых веществ отвечает как прямым, так и косвенным целям
мирных успехов науки и промышленности
Д. Менделеев.
асЛ'^'Жеином
о
нжвне.
(Din с^етип
Jlouста нт ин
анаьиги
Л) е лигно
иьаоюения носЬяи^аелн
книги
МОСКВА.
Октябрь 1922 г.
ПРЕДИСЛОВИЕ.
t
Широкие круги специалистов давно уже ощущают острый недо-
статок в подробном справочнике по взрывчатым веществам и их при-
менению. Еще в 1918 году у автора этих строк зародилась мысль о
необходимости издания такого справочника. Совместно с В. К. Кочмер-
жевским мною было приступлено к пересмотру части технологии в. в.
Но оторванность наша от Западной Европы, отсутствие новейшей
литературы в значительной степени тормазили осуществление этой
идеи. И только к концу 1921 года, когда была получена из-за гра-
ницы литература и мне удалось детально с ней ознакомиться—вы-
яснилась возможность составления настоящего труда в соответствии
с новейшими литературными данными. Материалами для составления
настоящей книги послужили нижеследующие источники, из кото-
рых часто приходилось заимствовать целые страницы*). Графи-
ческий материал, вследствие современных условий, дороговизны и ,
трудности получения, также большею частью заимствован из указанных
ниже источников. Книга безусловно имеет много недостатков и погре-
шностей и автор заранее принимает все справедливые упреки и заме-
чания своих коллег. Но—„лучшее есть враг хорошего", а мне больше,
чем кому другому, известен тот острый голод, который ощущается в
настоящее время у специалистов, работающих в области взрывчатых
веществ и их применения, так долго оторванных от общения с западом.
Поэтому я считаю возможным выпустить книгу в свет в настоящем
ее виде, значительно пополнив прежние сведения по технологии взрывч.
веществ последними литературными данными. Считаю долгом принести
благодарность Г. II. Чернику, принимавшему деятельное участие в соста-
влении книги, моим ассистентам Н. Соколову и С. Ельцу, оказавшим
большую помощь в работе, Инженерному Комитету, который содейст-
вовал выпуску книги в свет, и В. Гакель, помогавшему мне при частых
переводах из немецкой литературы. Я буду считать себя удовлетворен-
ным, если настоящая книга в какой либо степени будет оценена моими
коллегами по специальности, как необходимое пособие при работе. „Feci
rjuoci potui faciant meliora potentes".
М. Сухаревский.
Москва. Октябрь 1922 г.
В. К. Кочмержевский. Взрывчатые вещества. Литографированные записки, ч. 1 и 2.
(1912 г.).
Наставление для инженерных войск по специальному образованию. Подрывные ра-
боты (1911 г.).
Eskales. Das Schwarzpulver und ahnliche Mischungeii. 1904.
Сапожников. „Взрывчатые вещества”. Записки.
Забудский. „Взрывч. вещ/. 1898 г.
Его-же. „Приготовление бездымных пироксилиновых порохов. Записки. 1903 г.
Инструкция на прием, хранение и отпуск порохов. 1917.
Сухаревский. „Взрывчатые вещества и смесн, их составы и свойства".
Его-же. „Жидкий воздух и его техническое и эконом, значение.
М. Р. Corbin. Conference sur les explosifs Chlorates ot perchlorates. (1915 т.).
S. J. von Romocki. Geschichte der Explosivstoft'e (1896 r.).
0. Guttmann. Zwanzig Jahre Eortschritte in Explosivstoften (1909 r.).
B. Zsehokke. Handbuch der militarischen Sprengtechnik (1911 r.).
J. Daniel. Les explosifs industriels (1893 r.).
F. Salvatt Vocabulario di polveri ed esplosivi (1893 r.).
R. Escales. Die Schiessbaum-wolle, (1905 r.).
L. Venin et G. Chesneau. Les poudres et explosifs (1914 r.).
L. Chalon. Matieres explosives (1893 r.).
von Heise. Sprengstotte. (1904 r.).
A. Marschal. Explosives. (1917 r.).
Mahler u Esehenbacher. Die Sprengtechnik (1881 r.).
0. Guttmann. Die Industrie der Explosivstotfe (1895 r.).
F. Chalon. Le tirage des mines par lelec trici to (1888 r.).
H Brunswig. Die Explosifstoftb (1907 r.).
F. Chalon. „Les explosives modernes“.
M. Eissler. „Handbook of Modern* Explosives”.
0. Guttmann. „Schiess und Sprengmittel”.
Escales. „InitialcxplosivstotTe" 1917.
„ „Nitroglycerin und Dynamite".
„ „Nitrosprengstoft’e*.
„ „Ammonsalpeterspengstofle".
„ „Chlorat-sprengstofle".
Zei tach rift fur Schiess und Sprengsiott'ewesen
L Gody. „Matters Explosives**. (1893 r.).
Kast. „Ziind u Sprengstohe (1921 r).
Bidermann. „Die Chemie der Sprengstoffe (1917 r.).
F6rg. Ammonal-
Hebenstreit. „Sprengmittei u Sprengarbeiten" (1921 r.).
О. Г. Филиппов. Курс взрывчатых веществ (1916 г.).
А. А. Солонина. Гремучая ртуть. Литографированные записки. 1909.
Его-же. Лабораторное приготовление и испытание взрывчатых веществ. Литографи-
рованные записки в двух частях (1901 г.).
П. Паутов. Горные работы со взрывчатыми веществами (1907 г.).
Краткий исторический обзор взрывча
гых веществ.
Jf. Cr.v.'-rf t';'£ \ а',. 1ы>; вещества и р,зр h;j аьк' оа'огы.
Взрывчатые вещества и прогресс культуры.
§ 1. Если не считать искусственного приготовления огня в до-
исторический период, то можно - смело сказать, что ни одно изобрете-
ние, основанное на химических процессах, не оказало большего влияния
на развитие человечества, чем взрывчатые вещества. Изобретение
черного пороха и, использование его взрывной силы для метания сна-
рядов знаменует собой новую эру в истории человечества. До того
времени разница в вооружении и способах ведения войны между
цивилизованными нациями и варварами была слишком незначительна,
и победа оставалась всегда на стороне грубой физической силы.
Вследствие этого Римская • Империя, стоявшая на высоте культуры и
обладавшая стройной государственной организацией, должна была
склониться перед германцами, имевшими в своём распоряжении одну
только грубую физическую силу. Вследствие этого фанатичные поклон-
ники Ислама покорили персидскую и византийскую империй, а дикие
орды монголов распространили свое владычество на Среднюю Азию и
часть восточной Европы, вплоть до Польши. Все эти события на долгие
столетия остановили прогресс культуры и снова ввергли человечество
в дикое варварство.
§ 2. Но подобные нападения менее культурных рас на своих
более культурных соседей становятся совершенно невозможными, лишь
только последние начинают- применять взрыввещества для военных
целей. Порох и все более совершенствуемое огнестрельное оружие
обеспечили европейской культуре победы почти над всем земным
шаром.
Но нации, обладавшие порохом, и огнестрельным оружием, должны
были трудиться над их усовершенствованием, дабы их господствующее
положение и самостоятельность не подверглись-бы новой опасности.
Средства же к такому постоянному усовершенствованию могла дать
только наука, т. к. умение использовать вещества и силы природы
зависит от теоретических познаний, которые в свою очередь приобре-
таются изучением природы. Развитие физики и химии, как и вообще
в технике, дает себя чувствовать особенно в технике взрывного дела.
§ 3. Но не только употребление взрыввеществ для военных целей
и для дела разрушения побуждают ученых к более глубокому их
изучению, но и мирные цели, приносящие благо всему человечеству.
В лице черного пороха, динамита и т. д. человечество обладает колос-
1*
сальной силой, которую по желанию можно употребить на благо или
.во вред своим ближним. С помощью этой силы в настоящее время
из недр земли добываются такие необходимые для человеческого оби-
хода предметы как уголь, руда, соли, разные металлы; благодаря ей
устраняются подводные камни, угрожающие судоходству, высокие
крутые горы уже не могут препятствовать сношениям людей и их
торговле, и наконец эта сила, облегчает труд земледельца заменяя его
мускульную энергию.
Как-бы в благодарность за те указания, которые теоретические
иследования дали технике, последняя поелужила чистой науке им-
пульсом и возможностью к проведению исследований, расширивших
и углубивших познание законов природы. .
Именно исследование взрыввеществ навело, как физику, так и
химию, на такие области, которые до того времени совершенно не
затрагивались опытной наукой: и здесь удалось наблюдать материю
во взаимоотношениях к давлению, температуре, движению. Последние
при этом достигают таких величин, которые далеко выходят за пре-
делы границ, в которых обычно происходят явления химического или
физического обмена веществ. На самом деле, в то время как хими-
ческие реакции происходят при давлении в одну атмосферу и при
температуре в несколько десятков градусов, при чем газы развивают
сравнительно небольшую деятельность, реакции взрыввеществ вызы-
вают давления, измеряемые в тысячах атмосфер, при этом освобож-
даются такие количества тепла, которые придают молекулам скорость
в тысячи метров в секунду.
Изследование таких явлений значительно раздвигает границы
познания природы и распространяет их далеко за обычные пределы.
ГЛАВА II.
Дымный П О р О
> ...
§ 1. Нельзя с точностью определить время изобретения черного
пороха и первого применения его в смысле использования его мощной
энергии. Уже в очень ранние периоды у различных народов можно
найти указания на горящие метательные снаряды. Вначале приме-
ненные лучины были вскоре заменены сажей, селитрой, смолой, т.-е.
такими веществами, которые легко воспламенить и трудно загасить.
Но тем не менее их легко было обезвредить охлаждением или лише-
нием их воздуха Сам же снаряд не должен был обладать значитель-
ной скоростью, чт( бы не погаснуть от охлаждающего влияния воздуха.
Все эти недостатки зажигательных снарядов были устранены в
знаменитом греческом огне (около 673 г.). Секрет его изготовления и упо-
требления в начале был известен только в пределах Византийской
Империи. Появление огня произвело на всех современников колос-
сальное впечатление. Утверждали даже, что все предметы, зажженные
греческим огнем, не могут быть потушены. Успех греческого огня
надо отнести к открытию селитры и ее качествам.
rt
•'«
-<
л
'У
Г '
I
>
r
' г
4':-
?
‘ A*
7t-.it
Еж j- л
ИкЛ^тЯ’ •
*
ft.
Ai.'A'i .
;.:
Bfee"
$
Й •
ж
.'lyw*!
Гг<х?’
4:
>
.л
Яг Я’Л д-
ж
V"
1,'"*,..''К,',Л
• -"iWiV -.1 - .<.••»• W • ...............
Л
.,..'!ft.<'Y.'l'A ;
?.'^'V r\_. '
;'£ '
- *t ...
V j "
1*ьйу ^'•"•?
?»
; w
1 $ •• . : ,' • Г ,, . '
, ®......Д .\АУ
: m* ;.;* s' m
*’ .'U“ tWWW*
' ' " \ ' 0* - i :
.
Mr',.'!>
'} . . ; !1 5 ' ‘ '
1 v
.. т , i-^
/'Ж- .< j
Ji
Mis
и: •
.i/l.
4
'Ж,:"
,г,^ '
ЛГ'-"
I
¥
,; л -M.
Нл
7.
Из рукописи Вальтера Миллимета,
\ „De officii® Regum“ (1325 г.)
Внизу изображена первобытная пушка ввиде бутылки,
выпускающей стрелу; человек прикладывает огонь к
отверстию (по Marschall*#)..
J
; $
МКГ
.!
. .^'.^
$J5w’
(Oki-JW
&
Л
' *L - .f *
ж
,ЛЛ
t^t'..;
J
'^.УгЙ’й1
\ Л .• t 4^': .tMeiaii
ДОХОДОМ»
♦ zu
ж8
w
r-Г >Ч‘/
' \ ‘:'/4
vy..\
Л
Ж
Игл
та
’.Ч
$
:П-
^’‘гг-'жй
rwil
'"Й
«й.
W
'&'
fe-1 ,. J
Е л
&; • - •• -i
H"
1л/
r-
?• '
It **.. '
><
Г.
: ' Л'
к
К
У •
№'
EtgjjtaAy
МЕк*-
|И; "
яр-
Й'." ' ’
ж
\
Уже в старину были известны выветривания осадков
дых растворов, образующихся в почве многих сухйх местно
Так описанный Диоскоридом и Илиниусом „камень города
(город в Мизии), по всей вероятности, не что иное, как селитра^
нитрат, калия. То же можно сказать и о составе, известном под|
званием „китайского снега". В арабских рукописях можно найти у
зания на соль, похожую по своим свойствам на селитру и именуй
мую там „Barud".
В начале селитру употребляли в медицине, как обеззаражива-
ющее и охлаждающее средство при нарывах и ранах. Возможно, что
случайно открыли, что, будучи брошена на горячие угли, селитра
горит ярким пламенем.
Так, китайцы употребляли селитру для добывания огня, для фейер-
верков и т. д., на ,что указывают названия: „китайская соль" и „китай-
ский снег", коими арабские писатели обычно обозначали селитру.
Однако, совершенно невозможно более или менее точно определить
время ее открытия. Возможно, что употребление горючих составов с
селитрой для военных целей было введено в Китае не раньше, чем в
Европе. По этому поводу Бертелло (Mati£res explosives t. II, 354) при-
водит несколько данных, найденых иезуитскими миссионерами в древне-
китайских рукописях. Они гласят: „В 969 году по христианскому
летоисчислению и во второй год царствования Тай-Тсу, основателя
династии Зонгов, этому Императору был представлен состав, который
зажигал стрелы и кидал их на большое расстояние. Около ,1002 года,
в царствование его наследника Тжин-Тсонг, были в употреблении
особые трубки, которые бросали зажженные стрелы и бомбы на расто-
яние от 700—1000 шагов".
! При этом нельзя забывать, что речь идет здесь о ракетах,
нб ни в коем случае не о пушках, > а также не о черном порохе.
На осаду города Кай-фунг-фу указывают, как на первйй случай
применения пушек, т.-е. употребления черного пороха. Однако,
автор этого сообщения Петр Гаубил оговаривается, что употре-
бленная с обеих сторон машина, под названием Хо-пао, по всей
вероятности, не была пушкой, а простым метательным орудием,
которое бросало сосуды, наполненные горючим составом, на до-
вольно значительные растояния. Подобно этому, употребленные
около 1271 года при осаде города Сшнг-ианг машины были по-
строены инженерами — иностранцами, итальянцами и персами,
как о том повествует и Марко Поло в соответствии с китайскими
историками.
По этим и другим источникам можно с несомненностью
установить, что китайцы в эго время еще не были знакомы(С
употреблением черного пороха. Даже в 1621 году, пушки были
им совершенно не известны; du Halde уверяет, что мандарины 3
были Повержены в крайнее изумление при пробной стрельбе Ий;<j"
пушек, которые город Макао преподнес в подарок китайскр!^^
. .императору. I
Все же считают, что честь открытия селитры тфинадлежаю^1Я^^
тайцам, которые смешивали ее с горючими веществами, во< " , 11 .г
с серой и углем, и употребляли эти составы для фейерверков»
к
л А
Л
л-
’>
' >4;
ц..
ггД"'
'X-
У Ь'7’'
-7
Гй/irj ^аЛ^ЗЯй-^*
.ч
г ',
£
О
»Л- --'Л'”' .ijfe Л '
K*L«j
Л
— 6 —
t
открыли также, что при сожжении этих составов получается толкаю-
щая-сила, которую и использовали для военных целей в виде ракет,
однако не ранее 10 столетия, т.-е. в то время, когда это открытие
было сделано и на Западе. Но китайцам не принадлежит честь от-
крытия взрывной силы газов, образующихся при сожжении в закры-
тых сосудах селитровых смесей, следовательно, они не знали черный
порох в современном смысле этого слова. С упоминанием о „грече-
ском огне", как о изобретении некоего Каллиникоса из Геллиополиса,
мы впервые встречаемся в 673 году. Благодаря греческому огню был
уничтожен флот арабов, осаждавший Константинополь, и с тех пор
в течение долгих столетий греческий огонь был страшным орудием
в руках византийцев, в особенности же в морских битвах. Император
Лев-философ в своих, военных трудах говорит, что греческий огонь
выбрасывается с ужасающим грохотом из особых труб и что его неу-
гасимое пламя уничтожает неприятельские корабли. Использована-ли
здесь и в какой степени толкающая сила горящих газов—установить
трудно. Но зато с несомненностью установлено, что селитра входила
в этот состав.
Обычно греческий огонь помещался в выдолбленные камни или
в железные сосуды, снабженные отверстиями; выбрасывался он мета-
тельными машинами. Византийцы употребляли также и такие сосуды
(под названием: „тирозифонов"), которые бросались в неприятеля ру-
ками— т. е. нечто подобное современным ручным гранатам.
§ 2. Изготовление и способ употребления греческого огня был
долгое время известен только одним грекам. Недаром Византийский
Император назначил самые ужасные наказания за разглашение этого
секрета. Но понемногу секрет все таки распространился и, наконец,
стал достоянием и врагов. Ведь не через Китай, а через Константино-
поль магометане познакомились с греческим огнем, который они ^ак
ужасно использовали во- время Крестовых походов. По описанию
Joinvilles . (Histoire du roy Sainct—Loys) можно судить, какой ужас
распространяли неприятельские огненные машины среди войска
Людовика Святого.
Однако, точный состав греческого огня греки тщательно скры-
вали. Они Называют горючие составные части сажу, нефть, серу, но
о самой важной части, о селитре, они не говорят ни слова. Менее
скрытны арабские писатели. В одном арабском манускрипте, переве-
денном Remand u Fove (Du feu gregorois et des origines de la poudre
a canon, 1845) указываются несколько смесей селитры с различными
горючими веществами.
Много рецептов селитровых горючих смесей мы находим в знаме-
нитой книге Марка, Грека: „Liber ignium ad comburendum bostes“.
Время появления этого труда точно не установлено; приблизительно
можно назвать промежуток между XI и ХШ столетиями. Гуттман
(Industrie der Explosivstoffe) полагает, что этот труд не мог быть на-
писан ранее 1229 года, так как арабы до этого года не употребляли
селитру для горючих смесей, а автор главным образом пользовался
арабскими источниками. Среди рецептов мы находим составы, которые
шень близки теперешнему черному пороху, так, напр.: 2 фун. серы,
2 ф. липового угля и 6 ф. селитры. Но так же как и арабские источ-
Jl7:
•Ж;
IT
WT«W^«W!WW4Mr*P^-
-
г
V"
/Мики, Марк Грек говорит лишь о том, что назначение смеси
ство пожара. Он описываете даже и ракету, но употребления 1
смесей, как толкающей силы в пушках, он ещё не знает. Но все-тй
ракета, также отчасти использовала толкающую силу. Марк Грек^
называет ракету ignis volatilis или tunica ad volandum. Селитровый
состав обычно помещался в трубу, закрытый или суженный конец
которой нагревался. Воспламененная масса выбрасывала содержимое
в горящем виде наружу. Следует обратить внимание и на то, что
тогдашняя селитра представляла из себя весьма не чистый нитрат
калия. Если-бы вышеуказанная смесь состояла из чистой селитры,
то она при воспламенении дала-бы взрыв, а не горела-бы как ракета.
У Марка Грека мы находим также и описания „tunica tonitrum
faciens*. Но и здесь речь идет не а моментальном взрыве. Наполнен-
ная наполовину горячей смесью гильза разрывалась с грохотом, как
только газы приобретали достаточную упругость. Цель ея—устрашать
врагов своим грохотом.
В трудах знаменитых алхимиков Альбертуса Магнуса (1193—
1280) и Рожера Бэкона (открытие пороха которому приписывают
англичане) (1214 —1292) мы находим довольно фантастические со-
общения о селитровых горючих смесях „ignis volans", „tunica ad
volandum" и о „ad faciendum tonitruum". Но в сущности ничего нового
здесь нет, и Марк Греку в данном случае является первоисто-
. чником.
§ 3. Следовательно в конце XIII столетия были известны селитро-
вые смеси, близкие по составу с черным порохом, которые легко
воспламенялись и легко воспламеняли горящие предметы и которые
можно было бросать в виде ракет на известное расстояние. Последнее
дало толчок к использованию толкающей силы пороха. В трубу стали
помещать не только горючую смесь, но и снаряд, который выбра-
сывался газами. Это открытие и, следовательно, открытие черного
пороха, очевидно^ сделано арабами. В одной арабской рукописи, хра-
нящейся в Петербургской Библиотеке, описывается смесь, состоящая
из 10 драхм селитры, 2 драхм угля и 1% драхм серы. Этой смесью,
растертой в мелкий порощок, наполняли на одну треть „медфу”, а
затем воспламеняли. „Медфа“—выдолбленная часть. Этимологически
она имеет значение: „propulsorium, projecto rium“. Лишь впоследствии
она в арабском языке принимает значение пушки (Упманн: „Das
Schiesspulver“
Здесь в первый раз приходится иметь дело с баллистическим
действием пороха. От стреляющей трубы „медфы" до пушки оста-
вался теперь только один шаг и, по сообщениям Либри, уже в 1326 г.
во Флоренции отливаются металлические пушки. Однако сообщения
этого автора не совсем бесспорны. В 1339 году француз Варфоломей
, Драх представил, по сообщению одного существующего и ныне доку-
мента, счетной палате доклад: „Pour avoir fondre et autres choses
necessaires aux canons'*. При защите Камбрэ (1339) были в употреб-
лении 10 пушек, а в битве при Кресси англичане пользовались
(1346/3 пушками, из которых они стреляли маленькими железцыми
бомбами.
/'
5 ;
я
В Германии открытие черного пороха обычно связывается с име-
нем Бертольда Шварц. Предание гласит, что Шварц, францисканский
монах- из Фрейбурга в ^аварии, случайно, при алхимических опы-
тах, открыл черный порох и его действие. В XV и XVI столетиях его
все считали изобретателем черного пороха. Более точных данных об
этом монахе и о времени, в котором он жил, до настоящего времени
все еще не получено. Бели откинуть все многочисленные анекдоты о
нем и основываться на достоверных сообщениях немецких, итальян-
ских, голландских и других источников XV-ro и XVI столетий, то можно
с уверенностью сказать, что какой-то монах Бертольд Шварц дей-
ствительно существовал и сделал самостоятельно, независимо от раз-
личных, главным образом, арабских рукописей и преданий, открытие
черного пороха; однйкО, это открытие падает на середину XIV столетия
(обычно называют даже 1380 год), т. е. время, когда в Германии упо-
требление черного пороха было уже известно. Так, напр., мы знаем,
что в 1340 году в Страсбурге, в 1344 в Спандау, в 1348 году в Лиг-
нице существовали пороховые заводы. В 1360 году пожар в Любеке,
уничтоживший ратушу, произошел, как говорят, от взрыва пороха.
Иоган Роже в своей „Тюрингской хронике" говорит, что при осаде
Фридрихом, маркграфом Мейсеенским, (в 1365 г.). Ейнбека, защитни-
ком последнего, герцогом Генрихом браншвейгским, в первый раз
было применено огнестрельное оружие.
В Испании упоминаются метаемые огнем бомбы в связи с осадой
горАда Аликанты; Россия в 1389 году, Швеция в 1400 году обзаво-
дятся артиллерией. Очевидно употребление пушек распространилось
очень быстро; но с другой стороны вооружение пехоты пиками дер-
жалось еще долго, во Франции даже до времен Людовика XIV; также
и английская армия, в свое время прославившаяся стрелками, сра-
жалась еще в 1627 г. при осаде острова Рэ с луками и стрелами.
Греческий огонь, с развитием употребления черного пороха, по-
немногу исчезает йз числа военных средств. •
В России порох начал изготовляться только в XV веке, но боль-
шие фабрики его сооружены были только лишь в царствование Импе-
ратора Петра 1-го: Охтенский, Сестрорецкий и Петербургский порохо-
вые заводы. Йз этих заводов поныне функционирует только один
Охтенский, остальные же два впоследствии были ликвидированы:
Сестрорецкий в 1735 году, а Петербургский в 1801 году. Вскоре
после смерти Петра Великого был основан Шостенский пороховой за-
вод, работающий и до настоящего времени.
Следующим нововведением было то, что вместо каменных или
железных сплошных снарядов стали употреблять полые. Эта мысль
заимствована, очевидно, от огненных бомб (горшков), но назначение
новых снарядов не ограничивалось устройством пожаров. Стенки
гильз стали делаться толще, а внутренность заполняться порохом,
который взрывался позже, чем употребленный для выстрела снаряда.
Так образовалась бомба, действие которой усиливалось происходящим
на некотором расстояний взрывом ея содержимого. Бомбы появились
в XVI столетии, в XVII столетии они уже приобрели большое значение,
а в наши дни они настолько усовершенствованы, что первый бомбы
кажутся безобидными игрушками.
Si
относится по видимому уже к более позднему времени, и М141Я^Нн|е
видим применение пороха в этой области только в 1487 гддЯ|Ии,
осаде замка Серецанелла. Однако, первые шаги пороха на этоЛЩ
прище не были вполне удачны. С какого времени стал применяп1И|
порох для подземных взрывов в России—в точности еще неизвесиЯИ
но установлен, однако, тот факт, что во времена осады Казани порой
уже числился в числе вспомогательных'средств. атаки.
Указания на применение пороха для подземных фугасов отно-
сятся ко временам осады Негропонте в 1472 году; ручные гранаты
появились только около 1524 года, а петарды — при осаде Кагора
Генрихом IV в 1577 году. Восемь лет спустя, а именно в 1585 году,
инженер Дженибалли применил порох при осаде Антверпена, снаря-
жая им мины, спускавшиеся по течению. Казалось бы, после этого
следующим непосредственным шагом было бы применение пороха для
снаряжения оборонительных подводных мин, в действительности же
указания на таковые мы имеем впервые лишь в начале девятнадца-
того столетия (Кронштадт 1807 г.), введение же в употребление дон-
ных мин относится ко временам Датской войны, при чем таковые при-
менены были впервые в 1848 году в Киле.
Первое применение пороха в горном деле было сделано при
подрывных работах (для уничтожения подводных камней на реке
Немане) в 1548 году. В 1527 году тиролец Каспар Вейндель первый
применил взрывчатые вещества в рудниках в Венгрии, в 1632 г. они
уже появляются при рудничных работах в Клаустале, а в 1645 году
во Фрейберг, с 1670 г. вводятся и в других государствах.
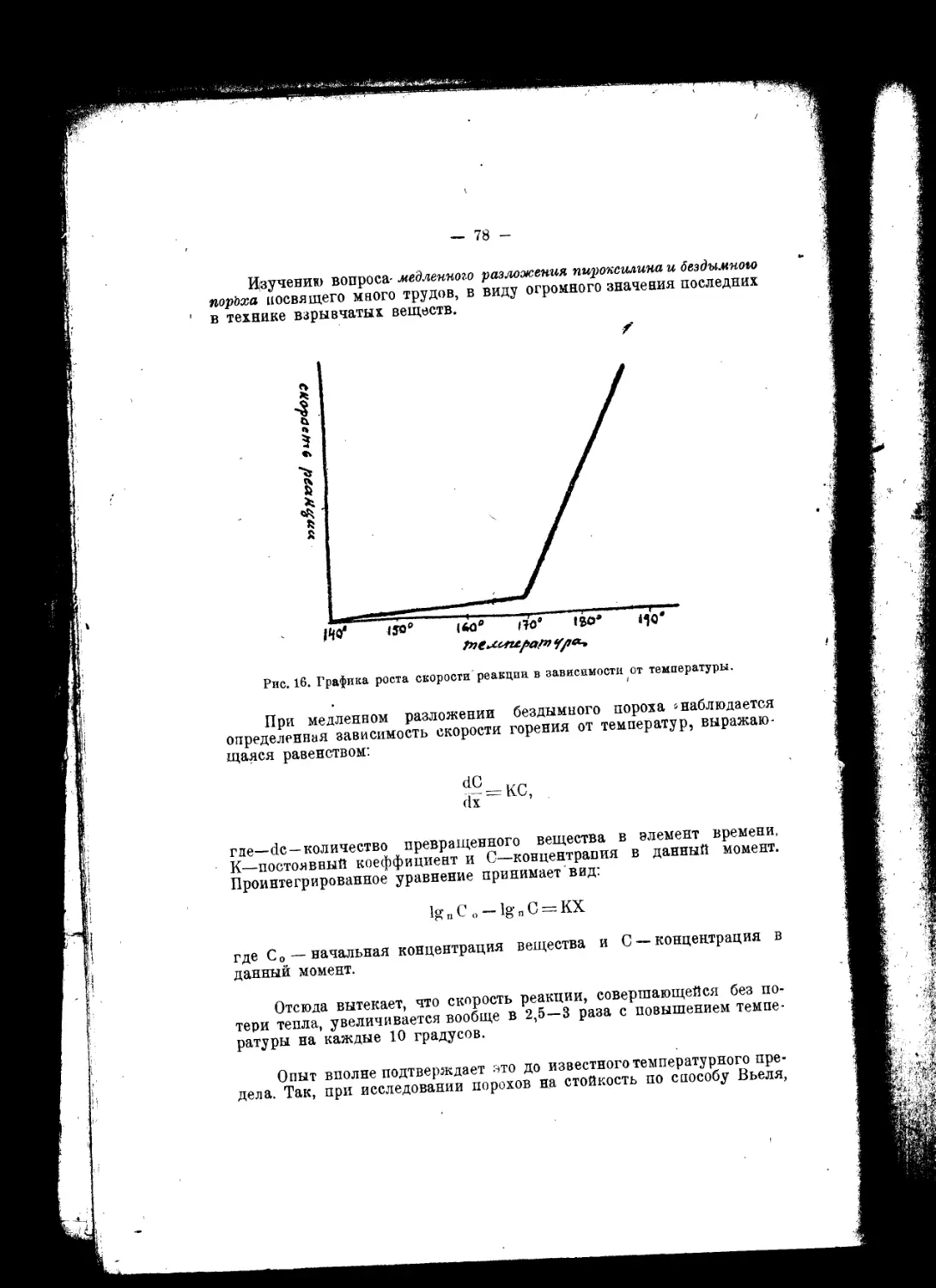
§ 5. Дальнейшая’ история дымного пороха вплоть до наших дней
сводится к детальному изучению зависимости его свойств rfr свойств
его составных -частей и способов приготовления. Изучение последнего
имело 1 своим результатом значительные улучшения в самой технике
производства и поставило последнюю на современную высоту. - Из-
учение первого вызвало целый ряд предложений, сводящихся к замене
основных элементов состава черного пороха другими веществами, в
той или иной степени, по мнению авторов предложений, улучшающих
качество дымного пороха или удешевляющих его. Так в 1756 году
Le-Blond предложил порох с уменьшенным количеством селитры и
совсем без нее, а в 1786 году Бертоле заменил в порохе селитру
хлорновато-калиевой солью. Первые практические-применения амми-
ачной селцтры с той же. целью относятся к эпохе французской "рево-
люции. В 1799 году предложено было к пороху примешать пикриновую
кислоту, а в 1809 году Дюлонг предложил уменьшить количество
порохового дыма Введением в состав пороха пикратов. \
Вариантов взрывчатых веществ, сходных с черным порохом, было
предложено множество и, в этом отношении, их особенное изобилие
появилось в шестидесятых годах прошлого столетия. Так например
в 1861 году Ньютон предложил свой порох, в этом же году появился
порох Сколанда, в 1862 году — Саксифрагин, порох Бенетта и Келлова,
в 1863 году — Шеффера и Буленберга, в 1864 году—порох Фильда,
Галлоксилин п Даввея, в 1865 году—порох Шампи и Эргардта, в
1866 году—порох Неймейрра и Ерафта, в 1868 году—порох Ревелей, в
начале семидесятых годов предложен был порох: аммидожен,
лёцерит и порох Виол тта, наконец в 1877 году—порох Шварца.
К рассматриваемому промежутку времени относятся также по-
пытки применения в состав пороха бертолетовой соли (порох Гана,
Каллю, Ожандра и т. п.). В настоящее время все эти составы пред-
ставляют интерес исключительно исторический.
С изобретением бездымного пороха, производство дымных, есте-
ственно, должно было сократиться и, в действительности, оно сошло
до минимума. Дымный порох находит себе небольшое применение
в некоторых воспламенителях и в снарядах, в пиротехнике и еще
требуется, по большей части, старыми охотниками, предпочитающими
этот порох новому.
Предложенный уже давно порох с натриевой селитрой, благодаря
своей дешевизне, стал применяться под названием взрывчатой, или
гремучей селитры в частной промышленности, особенно в Америке, и
в настоящее время один из употребительнейших сортов ее содержит
приблизительно: 75% натриевой селитры, 15 частей бурого угля и
10 частей серы.
Преследуя цель удешевления стоимости пороха, предложена
была смесь, принадлежащая к группе порохов с натриевой селитрой,
названная петрокластитом, заключающая в себе каменноугольную
смолу и двухромовокалиеву соль. Фабрика в Дартфорде предложила
в качестве „безопасного взрывчатого вещества11 пороховую смесь, в
состав которой входит значительное количество древесных опилок и
серно-кислая закись железа, по составу почти тождественную с карбо-
азотином или Safety Blasting Powder и названную Кагюцитом (Cahuecit).
Взрывчатое вещество это выделывалось в Германии, но постоянного
состава не имело (примерно заключая’в себе около 70% натровой се-
литры, 8% ламповой копоти, 12% серного цвета и 10% целлюлозы с
малым количеством сернокислого железа.)
Эти все смеси обладали общим свойством, сравнительно медлен-
но протекающей реакции взрывчатого разложения, и свойством колоть
камень, не дробя его. Наиболее родственными дымному пороху, как
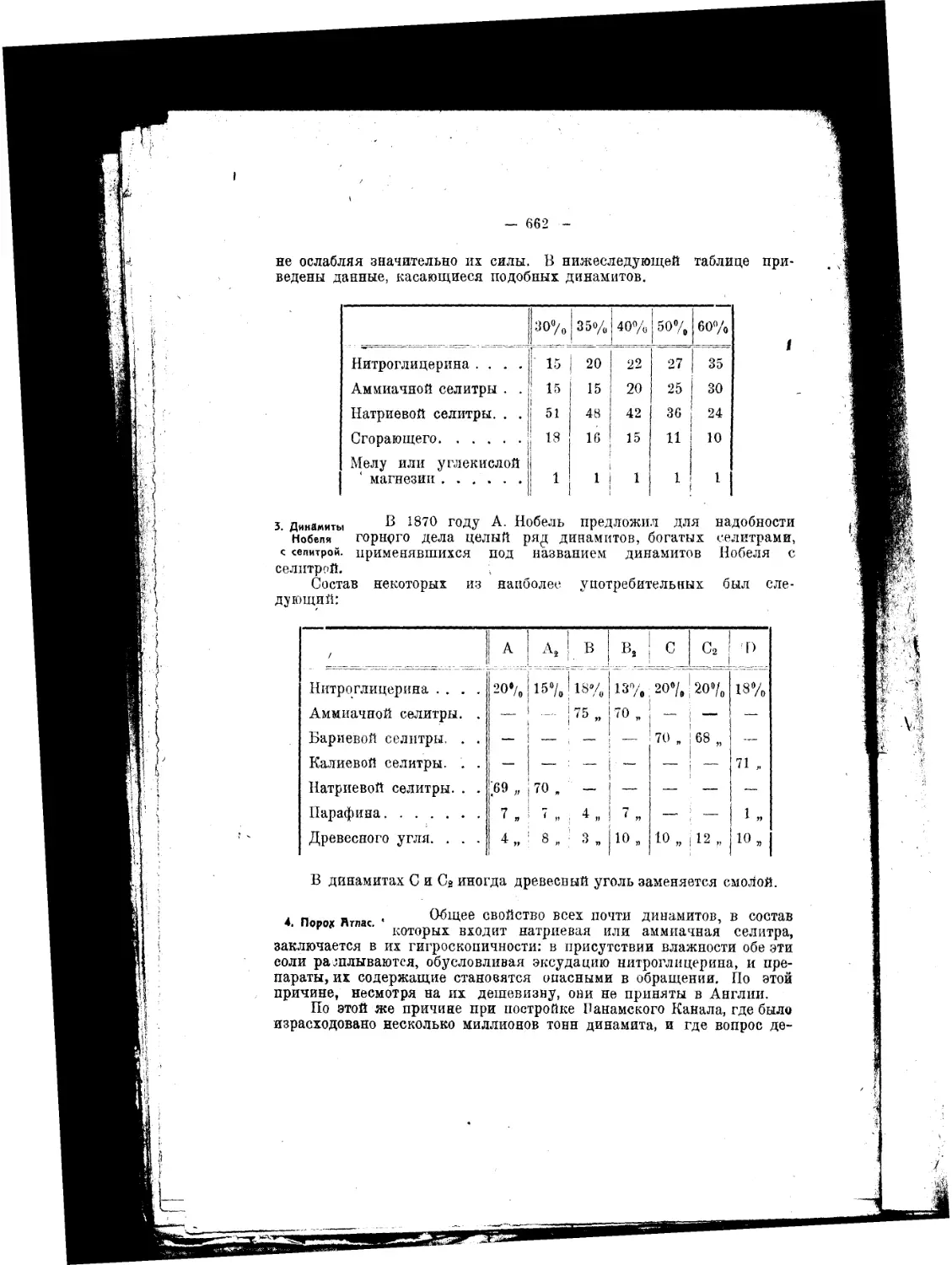
по своему составу, так и, так сказать, исторически, являются вещест-
ва с аммиачной селитрой, о которых мы скажем в отдельной главе.
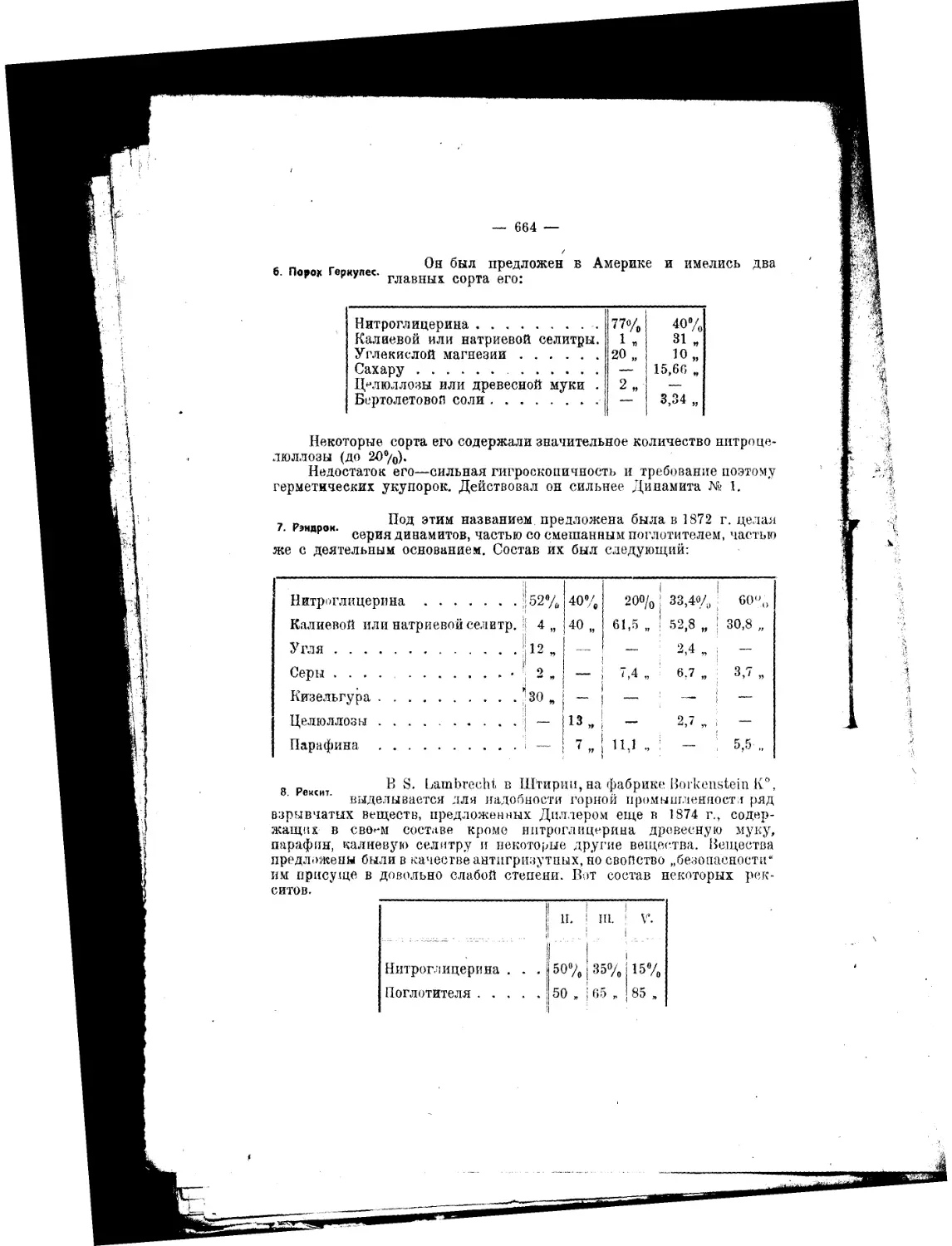
ГЛАВА '111.
Пироксилин и бездымный пороге.
В течение долгих столетий черный или дымный порох был един-
ственным в области взрывных работ. Только в XIX столетии появля-
ются новые взрывчатые вещества постепенно вытеснившие дымвый
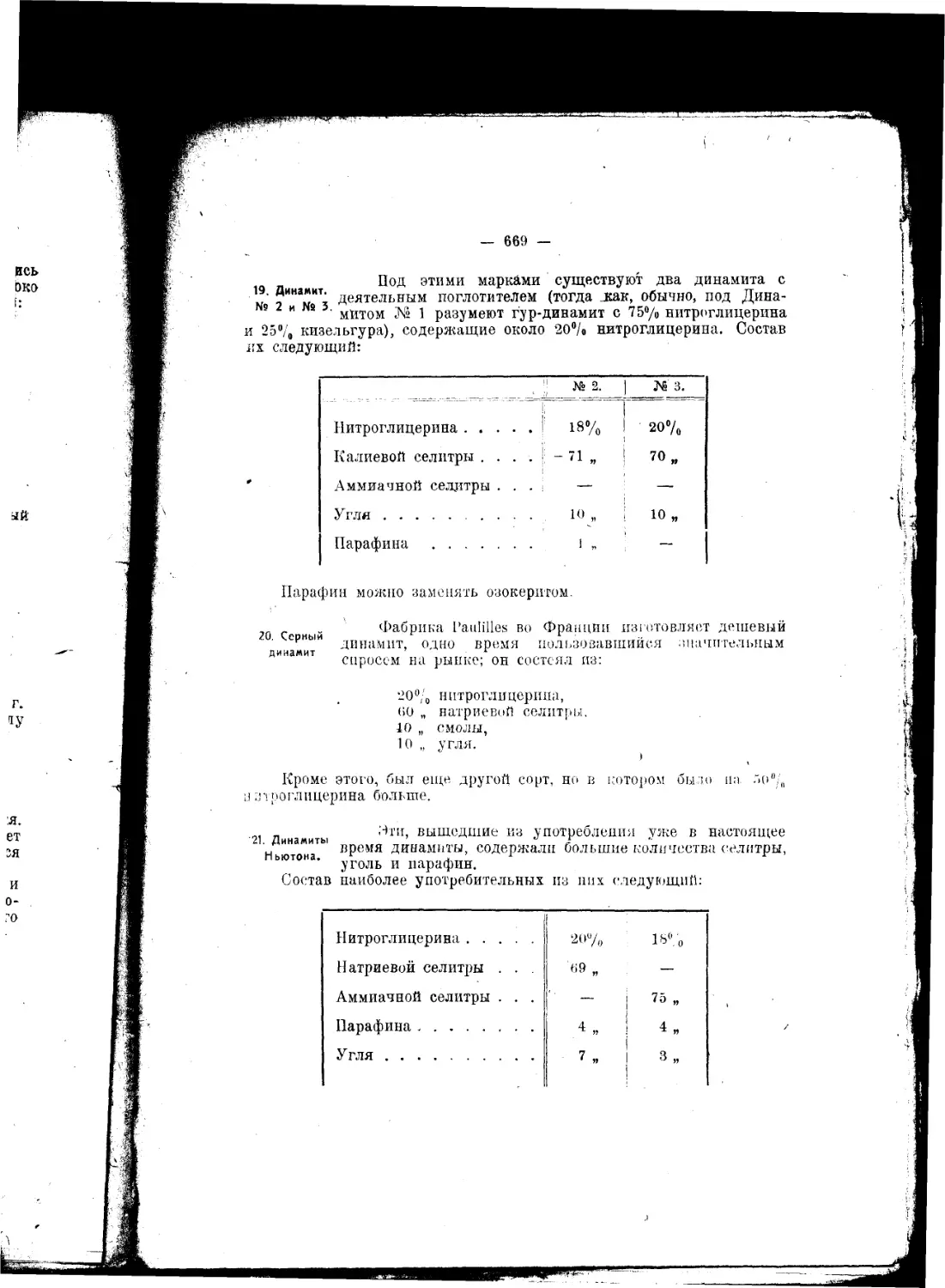
порох. В 1832 году Браконо нашел, что от действия азотной кислоты
на древесные волокна, крахмал и т. д. получаетя легко воспламеня-
ющиеся вещества, которые он назвал ксилоидин (Xyloidin). Полуз, в
1834 г., доказал что ксилоидин при температуре 180’С воспламеняет-
ся, а при сильном ударе взрывается. Дюма для получения подобных
бумагой, которую он назвал нитроамида
вбществ пользовался ।
все эти вещества отличались непостоянством действия и недо
ной стойкотью, и честь получения более или менее стойкого продув
&
принадлежит лишь профессору Базельского Университета ХристиайЕЯ
Шенбейну, который в 1845 г. впервые получил его действием азот**
ной кислоты на вату Шенбейн, который впоследствие назвал это веще-
ство пироксилином, держал свое изобретение строжайшем секрете;
таким образом получилось что в 1846'году Р. Bottger из Франкфурта-
на Майне сделал аналогическое открытие. Оба изобретателя об'едияи-
лись и совместно предложили свое изобретение Немецкому Союзу. Им
была обещана награда от имени всей нации в случае, если пироксилин
вполне сможет заменить для огнестрельных оружии черный порох.
Между тем Отто в Брауншвейге удалой. также получить взрыв-
чатый хлопок и он впервые гласно об‘явил о своем открытии в
1846 году статьей в „Augsburger Allgenmeiner Zeitung“.
, Сейчас же после .этого был произведен целый ряд опытов, в
' которых вместо хлопка действию азотной кислоты подвергались по-
добные же вещества, вроде льна, опилок и т. д.; самый способ ра-
бот был также видоизменен. Кармаш и Геерен в Ганновере и Кноп
в Лейпциге доказали, что смесь концентрированной азотной и серной
кислоты гораздо выгоднее, чем азотная кислота в отдельности, так
как получающаяся от действия азотной кислоты на хлопок вода по-
глощается серной кислотой и тем самым не допускает разжижения
азотной кислоты и уменьшения силы ее действия. Миллон и Гаудин
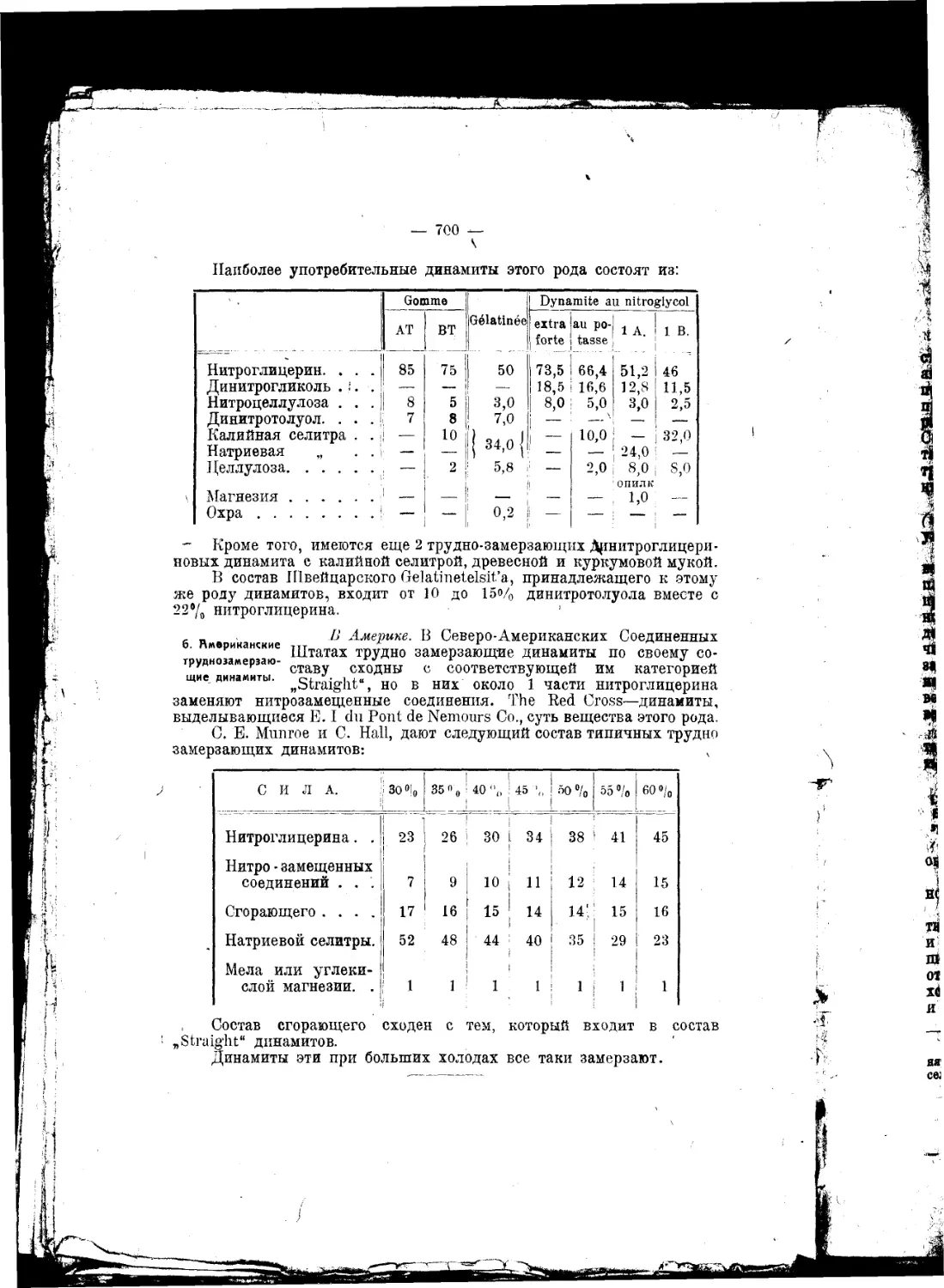
рекомендуют употреблять свежую смесь из селитры и азотной кисло-
ты, чем устраняется необходимость особого приготовления азотной
кислоты.
Открытие Шенбейна вызвало большой интерес к новому взрывча-
тому веществу и везде были поставлены опыты по его испытанию и^
устроены были небольшие заводы для его приготовления. Однако,
ряд взрывов, имевших место вскоре после его изобретения в разных
государствах, заставили всюду отказаться от продолжения опытов с
ними и только в Австрии они продолжались под руководством баро-
на Ленка. Благодаря тщательности фабрикации получался продукт
более высокого качества и опыты с ним давали настолько хорошие
результаты, что решено было из него приготовлять бездымный по-
рох, с каковой целью для опыта приказано было сформировать не-
сколько опытных батарей.
В 1868 г. пироксилин употреблялся для разрушения упразднен-
ных фортификационных сооружений гор. Вены, а в 1859 г. он при-
менялся для снаряжения подводных мин при обороне Венеции; в
1862 же году, пироксилиновыми подрывными патронами, снабжены
были в Австрии инженерные войска.’
Однако, около 1865 г. произошел без всяких видимых причин,
ряд взрывов пироксилина, при чем австрийское правительство рас-
порядилось закрыть немедленно фабрику его в Хиртенберге и опыты
с ним решено было прекратить. .
Но результат австрийских опытов даром не пропал. В 1862 п в
Англии была образована комиссия по1 производству опытов с ним в
С/Гоумаркетте, и устроен был завод для приготовления, его. В 1865 г.
Ж’-
W'.
/Ж
директор Вульвичской химической лаборатории проф. Абель устано-
вил факт, что причина саморазложения пироксилина заключается в
его неудовлетворительной промывке и ввел в фабрикацию его важ-
ное усовершенствование—превращение его для лучшей промывки в
мезгу, которая затем прессовалась. Результат этого усовершенствова-
ния был блестящий: получился очень стойкий продукт, подорвать
доверие к которому не мог даже ряд взрывов происшедших в 1871 г.
в Стоумаркетте, так как доказана было фактически, наличность
злого умысла в виде злостной порчи пироксилина при помощи сер-
ной кислоты.
С тех пор пироксилин снова вводится в разных государствах:
в 1877 г. было построено во Франции (в Бретани), в местечке
Moulin- Rouge, около Бреста, завод, в 1881 г. пироксилином в Гер-
мании 'снабжена была каваллерия и инженерные войска, а также
устроен был в Силезии завод Круппа • Мюле, в Австрии построен
был завод для приготовления пироксилина около Фиуме; в 1875 г.
пироксилин был принят нашим Морским Ведомством для снаря-
жения мин, а в 1876 г. и нашим Военным Ведомством. Дальнейшая
история пироксилина, как такового, вплоть до наших дней сводится
к различным улучшениям в технике производства его.
§ 2. В середине восьмидесятых годов -Виелль применил пирокси-
лин для изготовления бездымного пороха коллоидального типа, а
несколько позже появился и нитроглицериновый порох, и препа-
раты, содержащие пироксилин. Они были предложены Нобелем.
В 1892 г. Менделеевым было указано на особый сорт пирокси-
лина, раствор имаго в смеси спирта и эфира, дающаго с этой смесью
плотную массу, названную им пироколмдием, пригодную для изгото-
вления бездымного Пороха. о
В настоящее время} пироксилин признается наряду с толом и
мелинитом, одним из лучших взрывчатых веществ, находя себе са-
мое обширное применение во всех государствах.
Применяется он как в чистом виде,1, так и в виде смесей с дру-
гими веществами.
Так, во Франции в 1890 г. была призйана в качестве взрыв-
чатого вещества с низкой температурой газов развивающихся при
взрыве, смесь его с 90,5°/0 и 80® „ аммиачной селитры. Первая была названа
взрывчатым веществом типа Р, и допущена была для работ в рудниках
опасных в смысле рудничного газа и угольной пыли, а вторая в
прочих рудниках. Они не получили более широкого распространения
почти исключительно благодаря сравнительной своей дороговизне.
Последнее обстоятельство в связи с бездымностью пироксилина
заставило далее работать по пути удешевления подобных смесей. Так
Сарро и Вьелль изучали смесь пироксилина с 59% аммиачной се-
литры, дающую полное сгорание и развивающую силу по меньшей
мере равную чистому пироксилину.
Ими же изучен потентат (смесь равных количеств пироксилина
и селитры)—вещество значительно более дешевое, но еще достаточно
сильное, а также предложенный в Бельгии и сходный с ним по составу,
тонит (ВхНем большая часть калиевой селитры замещена баритовой),
принадлежащий уже, в сущности, к классу антигризутных веществ.
4 '
*#,
V4
A
/Л
>. ф.у^
ft
'4
': <
' - i':
'. *
’• '1
ч
ft±W>
мШЖ
ШО
1О
''./"> .-л„
’ > к * ' \ 41 '
"‘i'Sfo. '
Ж-
•'Л -l '-J 'Л
d'-’W.
> *
«'. Л ‘>’
^л|;
<<
ч<г
I ;
ь-
V, . 'I:,.-*''
«Ь'Л.1;.
'.".’'Ж
. . •, Л Ч
э& •
.:"лЖ
*\*R*A- Jtv-
м.; йж
“У*' к
‘n
Ml
s-4v' *
г '.' J,*-*'
$?'>' '
АЛ.’ r£A .
— 13 —
gg
ж-»
l;;¥M 5
Из других смесей пироксилина подвергавшихся
мя (в самом начале восьмидесятых годов) более или
менее ’
ному изучению, можно указать на пропарафиниро ванный пмрМ
Результаты получились в общем удовлетворительные, хотя прй
было, что парафин флегматизирует пироксилин в большей стёй
чем то, даже было бы желательно, ибо подобный пироксилин у|
несколько мало чувствителен к калек лю и требует вспомогательно
детонатора1 в виде обыкновенного пироксилина, или эквивалентного^
ему другого мощного детойатора, что -Конечно делает пропарафиниро-
ванный пироксилин значительно менее удобным в употреблении.
Высокая цена хлопка вызвала многочисленные попытки найти
вещество более дешевое, могущее его заменить и, с этой целью, испы-
таны были, как ряд волокнистых веществ, так и тел богатых целюл-
лозой. Работы эти пока не увенчались успехом и такого, эквивалент-
ного хлопчатой бумаге вещества, пока не найдено. Лучшим оказался
все-таки лен; имеют также практическое применение, изредка, нитро-
ванные древесные'опилки. Во время войны 1914—1919 г. в Германии;
применяли нитроцеллюллозу.
Было-бы несправедливо умолчать про выдающуюся работу Лео
Виньона с оксицелюллозой и гидроцелюллозой, опубликованную им
в Лондоне в 1898 г.
§ 3. Важные неудобства, проистекающие из наличности у поро-
ха обильного дыма, давно уже заставили лиц работающих в области '
взрывчатых веществ, разыскивать бездымные и малодымные пороха.
Нельзя сказать, чтобы работы эти бы ли-бы совершенно безрезультатны:
от времени до времени появлялись разные препараты, преимуществен-
но малодымные, страдавшие, однако, одним общим недостатком - не
вполне достаточной для практического употребления безопасности ю.
Открытие Шенбейном пироксилина выдвинуло вопрос о бездым-
ных порохах в число очередных вопросов, настоятельно требовавших
разрешения. Действительно, на следующий-же год (в 1847 г.) доктор
Гартиг опубликовал в Брауншвейге интересную брошюру, в которой .
описывались его исследования над пироксилином, указывалось жела-
тинирующее действие уксусного эфира на нитрованный хлопок, а
также на то, что белого цвета порошковатое тело, получающееся из
студня, из которого испарился у> сусный эфир, обладает несколько
иными свойствами, чем пироксилин до его растворения.
В том-же году во Франции в Commission du Pyroxyle, пробовали
измельчать пироксилин, смешивать его с декстрином и зернить для
применения в огнестрельном оружии, но он оказался слишком сильно-
действующим.
Затем этим вопросом усердно и долго занимался в Австрии
Барон-фон Ленк, испытывавший применение пироксилина для стрель-
бы из орудий. ’
В 1865 г. германской службы Капитан Эдуард Шульце издал
брошюру „Neues chemisches Schiesspulver“, в которой он указывает
на способ приготовления бездымного пороха из нитроцелюллозы (шиф-
рованных древе-ных опилок). В том-же году, способ приготовления '
- бездымного пороха из пироксилина опатентовал проф. Абель. Нови-
1
• - - w-
димому, как Абель, так и Шульце работали совершенно друг от
друга независимо.
Между тем способ Э. Шульце также был опатентован в Австрии
и фирма Н. Pemice и К0 стала изготовлять бездымный порох Шульце,
выпуская его под названием нитрокеилина.
В 1872—1875 г. г. вырабатывался порох названный колЛодином,
предложенйый в 1870 г. Фридрихом Фолькманом.
В 1882 г. Walter F. Reid предложил зерненную нитроцелюллозу
покрывать с йоверхности с целью уплотнения ее спирто-эфирной
смесью, а в следующем в 1883 г. Оскар Вольф и Макс фон-Феретер •
предложили метод приготовления из пироксилина небольших куби-
ков, покрывая поверхность их растворителями. Действие пороха
F. Reid’ существовавшего под маркой Е. С., на военное огнестрель-
ное оружие признавалось черезчур сильным, но он оказался хорошим
в качестве охотничьего пороха.
§ 4. Все эти попытки, однако, совершенно затмило открытие
Вьслля, сделавшего в 1886 г, предложение полностью желатинировать
нптроцелкллозу и делать Из полученной массы ленты, кои затем разре-
зывать на полоски или маленькие квадратики. Во всяком случае,
именно Вьелль, с его блестящим французским остроумием, принадле-
жит заслуга в разрешении этой задачи во всей ее полноте. Своим
открытием Вьелль, так сказать, указал путь, по которому надлежало
идти тем, кто хотел пользоваться нитроцелюллозами для приготовления >
бездымных порохов.
Как и следовало ожидать, тотчас-же откликнулся другой талант-
ливый, неутомимый работник в области взрывчатых веществ, Аль-
фред Нобель, предл.оживший в 1888 г. нитроглицериновые пороха
(типа кордита)—в частности баллистит. Он употребил для изготов-
ления баллистита растворимый пироксилин, желатинировав его
нитроглицерином и прибавил камфары (которая впоследствии была
оставлена). Теперь камфара заменена анилином и прибавляют вазе-
лин и дифениламин. Кстати здесь можно упомянуть про то, что в
последнее время в Америке стали снова заниматься вопросом о нитро-
крахмале, в смысле применения его в бездымных порохах. До сих
пор вопрос по применению никрокрахмала в качестве взрывчатого
вещества не выходил из рамок лабораторного изучения в силу того,
что не умели готовить продукта с высоким содержавием азота и что
получающийся продукт не обладал достаточной стойкостью. Ныне в
Америке предложен способ получения октонитрокрахмала С12Н12 (NOs)g
с содержанием 16,5% азота и достигли уже препарата, обладающего
повидимому, достаточной стойкостью и возможно, что подобный окто-
нитрокрахмал найдет себе применение в бездымных порохах.
Таковы главные моменты в истории бездымних порохов. Даль-
нейшие работы в этой области уже касаются техники производства их.
подбора растворителей и сортов пироксилина для приготовления их,
о чем, ввиду краткости настоящей справки, мы распространяться не
можем.
В к
что
осв
г *
Г v
ЯЗЫ(
кон
вво’
кла
Bblfj
ОРИ
про.;
объ-
нас/
Доб|
00Г1
комп
расг|
допс|
HayL*
СЛО>Н
ЯЗЫВ
ПОЛЬ|
указ. ?
класс j
г-
Осво^
как б •
ввод. J
ИСКЛ1
1
Йене-
шаб; ;
эфф( 1
— 16 —
приготовления нитроглицерина, если и не заводским путем, то во
всяком случая в большом количестве.
При приготовлении его держались такого порядка.
Стеклянные банки устанавливались в деревянные баки,
в которых была помещена охлаждающая смесь, состоящая из
льда, посыпанного поваренной солью. В банки наливалось сперва
20 фунтов концентрированной азотной кислоты и затем к ней
тонкой струей, при постоянном перемешивании стеклянными
палочками, приливали вдвое большее по весу количество крепкой
серной кислоты. При этом следили за тем, чтобы температура
смеси не поднималась выше 30°С. После прилития всей н)жной
порции кислоты, смеси давали постоять, пока она не принимала
температуру 0* и только тогда начинали процес нитрации.
Последняя велась таким образом. Отвешенное количество
глицерина (на вышеупомянутую порцию кислот бралось 10 фунтов
глицерина) приливалось очень тонкой струйкой или же частыми
каплями кислотной смеси, при непрерывном перемешивании жид-
кости стеклянными палочкамй. Глицерин помещался в жестяных
сосудах с медными кранами подвешенными над баками. Во время
этой операции строго наблюдалось, чтобы температура смеси
не поднималась выше 6*0. и если это случалось, то приливание
глицерина немедленно останавливалось и смеси давалось охла-
дится снова до 0* и только после этого, принимались за даль-
нейшее прилитие глицерина.
Когда нитрация была закончена, то жидкости давалось
отстояться и всплывший на поверхность нитроглицерин сливался
в деревянные чаны, где и промывался, после чего готовый
продукт сливался в стеклянные бутыли вмещавшие его 2 пуда,
при чем сверху его наливалось немного воды.
Бутыли с нитроглицерином были тщательно упакованы
в корзины с соломой и перевезены в Кронштадт на батарею
»Ден“. .
В 1867 году, во время летних практических занятий в лагерях
Сводной Саперной бригады, было изготовлено еще 15 пудов нитро-
глицерина.
За промежуток времени с 1863 по 1868 год в Кронштадте и
Петергофе произведен был ряд опытов подрывания при помощи
нитроглицерина рельсов и других железных частей и простых кон-
струкций; мостов, палисадов, ряжей, плотов, камней и т. п., а также
испытывалось применение нитроглицерина для снаряжения подвод-
ных мин.
Опыты с подводными минами состояли в выяснении передачи
действия мин, снаряженных нитроглицерином, через воду на двойные
и одиночные нища броненосных судов.
Кронштадтские и Петергофские опыты вполне наглядно обнару-
жили громадное превосходство действия нитроглицерина перед черным
порохом.
В самом же начале опытов, еще в 1863 году, ввиду обнаружив-
шихся на первых же порах явных превосходств нитроглицерина над
ророхом, заказано было 300 кольцеобразных медных сосудов, вмести-
фунтов нитроглицерина в каждый, для--*;
действий подводных мин.
ПО 25
местью
В то время еще, способа взрывания нитроглицерина при ^Й
гремучей ртути, не было известно и взрыв нитроглицерина дости
воспламенением запального заряда черного пороха, бравшей^ИЦ
тройном количестве по весу против веса нитроглицерина, или жеэдЗ
помощи какого-либо, более или менее, остроумного приспособления^
Эти же опыты обнаружили, что при действии против мин<
ных галлерей булевыми колодцами, а также под водой, нитро*
глицерин действует по меньшей мере вчетверо сильнее пороха,
что же касается до минных горнов, то воронки образуемые нитро-
глицерином уступают по размерам воронкам пороховым. Это и
понятно: обладая чрезвычайной быстротой взрывчатого разложе-
ния, нитроглицерин большую' часть своей энергии тратит на
раздробление, сжатие и т. и. ближайших к заряду частей грунта
и не успевает сообщить поступательной скорости более отдален-
ным частицам земли, в противоположность черному пороху, обла-
дающему сравнительно гораздо более слабым, местным действием.
В 1866 году в Саперном лагере под Петергофом, от неизвестных
причину взорвался погреб с 34'/2 п. нитроглицерина, при чем работав-
шие около него четверо нижних чинов были убиты. Они занимались
промывкой нитроглицерина, для чего и выносили его- из погреба.
Комиссия, назначенная для расследования причин взрыва, при-
шла к выводу, что таковой должно приписать непосредственному
взрыву самого нитроглицерина, совершенно независимо от хранивше-
гося вместе с ним на складе черного пороха.
Еще в 1863 г. Шведский инженер Альфред Нобель, ознакомив-
шись с .работами Зинина, и способом приготовления нитроглицерина
ваял ,сдерва ;вр франции, а потом в Швеции патент
на приготовление* этой взрывчатой жидкости, а затем и на смачивание
ед> обыкновенного черного пороха. Им были устроены две фабрики
для приготовления нитроглицерина: одна в Стокгольме, а другая в
Гамбурге. /•
§ 3. В начале 1863 года Альфреду Нобелю удалось сделать важ-
ное открытие, что нитроглицерин отлично детонирует от весьма не-
большого количества гремучей ртути, что сразу значительно упро-
щало применение его на практике.
В следующем же 1866 году тем же Нобелем обнаружено было,
что, растворяя нитроглицерин в 15 частях метилового спирта, его
можно совершенно безопасно перевозить, так как в таком виде он
относится совершенно пассивно даже к сильным толчкам; для выде-
ления же его из подобного раствора, стоит только его разбавить рав-
ным количеством воды, сильно поболтать в течение некоторого вре-
мени и дать отстояться, после чего нитроглицерин сядет на дно.
Наблюдения, однако, показали, что этот способ практически не
совсем удобен, так как с течением времени древесный спирт испаряет-
ся или слабеет и в конце концов может освободить нитроглицерин,
причем, конечно, безопасность уже нарушится.
§ 4. В том же 1866 году А. Нобель совершенно случайно открыл,
динамит: бутыли, в которых нитроглицерин был предназначен-к дере-
Г
Прбф. М. Сухаревский. ; 2
а<
де
ч,
»&й£Й
1
[у*. . <
\ :> Р
1
jf
' 111
п
ля
О
BI
К|
б»
fh
k
=&
|Г:|
к’С/
к
о<
КС
ВС
KJ'
вь
, К
КМ
Г
18 —
на.
До
ОС
КОГ
рас
дог
На\
ели;
ЯЗЬ 5
пол
ука:
КЛЭ(
Осв'.
как I
ввод
искл
Исп(
шаб
эфф
Ъ'-
г •
(.1
н
f /
•Vi.
о.
Ий
возке, были уложены в кремнистую землю (кизельгур), при чем-одна
из бутылей дала течь, часть нитроглицерина вытекла и была погло-
щена кремнистой землей. Нобель обратил внимание на то обстоятель-
CTBoj что полученный, смоченный нитроглицерином кизельгур, не выде-
ляет его даже при сильном давлении, а между тем под влиянием
капсюля дремучей ртути, взрывает с силой, только немного уступаю-
щей чистому нитроглицерину, взятому в количестве, поглощенном
кремнистой землей. •
Это наблюдение Нобеля оказалось чрезвычайно важным: оно давало
возможность отказаться совершенно от употребления нитроглицерина в
жидком виде, застивляя напитывать им порошковатые поглотители, в
каковом виде он делается значительно более безопасным в обращении.
Порошковатые вещества, поглотившие нитроглицерин, названы
были динамитами, и в 1867 году А. Нобель взял патент на пригото-
вление так называемого кизельгур-динамшпа или иначе гур-динамита,
содержащего от 30 до 70% нитроглицерина.
В 1867 году А. Нобель предложил динамит для снаряжения
артиллерийских снарядов, но специальная комиссия, назначенная для
испытания этого предложения, пришла к выводу, что для этой цели
динамит не пригоден, так как не обеспечивает в достаточной степени
безопасности.
Опыты с нитроглицерином в России велись до 1868 года, а затем
продолжались уже с динамитами до тех пор, пока Инженерное Ведом-
ство в 1880 году не решило принять прессованный пироксилин.
Едва ли не первые попытки применения нитроглицерина в част-
ной промышленности относятся к 1867 году, когда на работы по раз-
работке золотоносных россыпей Перемыкина, в Якутской Области, была
послана туда партия нитроглицерина и командирован был в качестве
специалиста от „Технического Гальванического заведения*" капитан
Черниловский-Сокол.
Независимо от результатов этих опытов, они не могли иметь
существенного практического значения уже по той простой причине,
что к этому же времени относится появление на мировом рынке дина-
митов, которые должны были немедленно совершенно вытеснить из
употребления чистый нитроглицерин.
В 1868 году полковник Петрушевский предложил свой порошко-
образный магнезиальный динамит, состоявший из 75% нитроглицерина
и 25% углекислой магнезии, в качестве поглотителя. В том же году
в Кронштадте было приготовлено 18 пудов такого динамита, давшего
при испытании его хорошие результаты.
§ 5. В частной промышленности Нобель вйел динамиты в 1869 году,
и уже в 1871 году у нас в Западном крае они применялись при
добывании цинковых руд и каменного угля.
В 1872 г. другой шведский инженер, а именно Лиандер, пред-
ложил взрывчатое вещество, содержащее 37% нитроглицерина, 40%
калиевой селитры, 10% бертолетовой соли, 12% древесного угля и
!•/• прочих частей, назвавши его нитрометаллином.
Наше военное ведомство решило его испытать в Кронштадте,
Керчи и Варшаве, а для получения его устроить небольшой завод
нитрометаллина около Севастополя.
#
Опыты эти показали, что нитрометаллин не обладаетЗв^^Иигибо
. преимуществами перед динамитами, благодаря же прис^ря|^^И|ик
летовой соли, более них опасен в обращении, а потому
Ведомство ^высказалось относительно принятия его отрицподИ^^В
В 1875—1879 г.г. у нас производились опыты в
литом Трауцля. Опыты велись в Усть-Ижоре и в Варшаве й]МВЙИ^Н
ных бригадах. Динамит этот состоял из 70% нитроглицерина
тельного поглотителя, состоявшего из 29,5%.древесно-бумажной м1отВ
и 0,5% соды. -
В 1876 году наша кавалерия и Инженерные войска были снаб-
жены патронами из целлюлозе-динамита. Кавалерийские патроны были
заключены в цилиндрическую картонную гильзу, покрытую лаком сна-
ружи и выложенную свинцовой бумагой внутри.
Этот сорт динамита принят был в войну в 1877—1878 годах и
широко использовался для разрушения железных и разработки горных
.дорог на Европейском театре военных действий, а также для снаря-
жения подводных мин, поставленных в Черном море и на Дунае.
После окончания войны около 90 пудов этого динамита употре-
блено было при ликвидации крепости 13иддин.
При отправке остального динамита обратно в Россию 212 пудов
его взорвались на станции Фратешти от неизвестной причины.
В 1875 году А. Нобель открыл способ желатинизации нитрогли-
церина и предложил гремучие студни (вернее желатинированные
динамиты).
В 1880 году у нас испытывалась взрывчатая желатина, состоя-
щая. из 89% нитроглицерина, 7% коллодионного пироксилина и 4% кам-
фары. Препарат этот оказался имеющим важное преимущество перед
целлюлозе-динамитом Трау цля в том отношении,что невыдел яет нитрогли-
церина ни в воде, ни при сильном давленци, не взрывал от удара
ружейной пули и с трудом детонирует через влияние, по силе же
превосходил другие динамиты. Впоследствии, однако, обнаружилось,
что этот сорт динамита не обладает достаточным постоянством и не-
сколько склонен к самор <зложению (вероятно по причине неудовле-
творительной промывки нитроглицерина).
Во время Франко-Прусской компании в 1870—1871 г.г. немцами,
для снаряжения подводных мин употреблялся дуалин, состоявший И8
50% Нитроглицерина, 30% нитрованной древесины и 20% калиевой,
селитры, в качестве же подрывных патронов, немецкие инженерное
войска были снабжены так называемым литофрактором—особым видом
динамита, заключающим 52%—70% нитроглицерина, 30%—25% киаель-
ура и небольшое количество каменного угля, селитры и серы,
В ту же войну динамиты введены были и во французских войсках,
цри чем в 1870—1871 г.г. выстроены ^были во Франции две казенных
и одна частная динамитные фабрики.
В 1871 году динамитом были снабжены также и австрийские
инженерные войска.
В 1878 г. Lanfrey предложил сильный динамит, в котором погло-
тителем служит нитрованная солома. Он назван был палеином.
О нитроглицериновом бездымном порохе бы4о сказано выше.
— 20 —
/
♦
Все работы за последующие годы были направлены к получению
нитроглицериновых препаратов, обладающих максимумом стойкости-
или лучшим образом отвечающий тем или иным практическим потреб-
ностям. Поэтому было предложено множество вариантов основного
состава нобелевского динамита и множество различных дополнитель-
ных компонентов последнего. Сказанное привело к тому, что в настоящее
время число различных торговых и технических марок динамитов
исчисляется сотнями и упоминать о них в этой краткой исторической
справке было бы лишним. .
ГЛАВА V.
Вещества с преобладающим содержанием аммонийной селитры
и т.-наз. безопасные. .
§ 1. Первые попытки в применении аммиачной селитры сделаны
были еще в XVIII столетии во Франции, но. практическое введение
ее в практику взрывчатых веществ следует приписать фабрике Кб1п-
Rottweiler, выпустившей так называемый амидпорох.
В Австрии также интересовались вопросом ее применения, и
Майер в Феликсдорфе усердно работал в этой области. Следствием
исследований этого ученого явилось „безопасное*' взрывчатое веще-
ство, приготовлявшееся австрийским правительством под названием
веттер-динаммона (около 94% аммиачной и 2% калиевой селитры с
4% древесного угля). '
В Швеции вопросом о применении во взрывной технике ам-
миачной селитры занимались Ольсон и Норрбин, которые впервые
установили, что аммиачная селитра в смеси с углем дает силь-
ное взрывчатое вещество. В результате чего ими в 1869 году был
предложен т. наз. аммиачный порох..Ими же был приложен к ам-
миачным веществам принцип Но 5 ел я взрывания посредством капсюля.
Вообще в этом-же периоде принялись основательно за изучение во-
проса о „безопасных" взрывчатых веществах.
Появляется масса подобного рода взрывчатых веществ специаль-
ного назначения, из которых можно упомянуть следующие: нитро-
глицерин—содержащие препараты: саксонит, монобель—порох;’ карбо-
ниты, аркит, риппит, стоуит и т. п., боббинит—смесь, подобная' чер-
ному пороху, аммонит, робурит, весфалит, беллит, Fawersham-Powder,
аммоналы и другие, более или менее богатые аммиачной селитрой, ве-
щества.
Здесь приводится таблица, заимствованная у О. Гуттмана о по-
треблении некоторых взрывчатых веществ в 1907 году:
Саксонит....................22,18%
Боббинит....................13,69%
МоноИель-порох...............9,17%
Аммонит................... 7,25 %
Карбониты.................. . 7,11 %
Робуриты' . ... . . . . . . . . .6.57% ,
'Аркит . . . . . . . . . . . 5.64%
Вестфалит . . . . ............ .5,22% WHMli£ •- •
Беллит .......................4,78 •/• '
. Ринпит........................3,95%
Fawersham-Powder,............. ..2,88 °/°
Стоуит.........................2,32%
Аммонал............... . 1,48®/®- ’’ W
V-
Из всех этих взрывчатых веществ безусловно боббинит наделах
наибольшую сенсацию. Потребление его прогрессировало с года
на год и оно выражалось уже миллионами фунтов, когда воз-
ник вопрос, насколько он действительно' удовлетворяет требова-
ниям „безопасности", которые ‘пред’являются к группе таковых взрыв-
чатых веществ. В результате статистика показала, что число несчаст-
ных случаев с боббинитом было около 1,83%, а с другими „безопас-
ными" Взрывчатыми веществами всего лишь 0,94%. Стало ясно, что
необыкновенно широкое применение боббинита в частной промышлен-
ности, в частности же при условиях „опасной" рудничной атмосферы
не является обосновленным его действительно высокой степенью „бе-
зопасности", а просто есть следствие его хороших качеств, как ве-
щества, подобно дымному пороху, не дробящего породы, отчасти же
как результат широкой рекламы после чего он стал постепенно выво-
диться из употребления.
§ 2. В средине ^девятидесятых годов прошлого столетия много
шуму также, наделало сообщение майора Гейлиха и доктора Пана-
ови^а о том,' что несчастные случаи с пороховыми смесями происхо-
дят большей частью, благодаря содержанию в селитрах хлорноватых
солей и перхлоратов, от которых селитры не свободны. Хотя это
оказалось вообще верным, но доказано также было, что йримеси этих
солей там, где они есть, выражаются вторыми десятичными доляМй %,
в каковых количествах они не могут оказать никакого практического
влияния на увеличение опасности обращения с пороком и что та-
ковая может возникнуть лишь благодаря только случайной концен-
трации их в сколько-нибудь значительных количествах в каком-ни-
будь месте смеси.
§ 3. Около 1888 г. Champan предложил применять в детонаторах
металлический магний, а Вейфенбах в Мюнхене в 1898 г. — порошкова-
тый аллюминцй в пиротехнике; в следующем же в 1899 г. Мюнхенский-*
же химик Рихард Эскалэс — металлический аллюминий для пригото-
вления аммонала. С тех пор появляется целая серия взрывчатых сме-
сей, существующих под этим названием, обладающих прекрасным'
фугасным эффектом. Все они принадлежат к групйе взрывчатых
веществ, богатых аммиачной селитрой. .
Применяющиеся в настоящее время аммоналы имеют раянообраз*
ный сослав; они заключают кроме всегда преобладающего количества
аммиачной селитры: тол, тринитроксилол, роданистый аммоний, уголь,
-стеариновую кислоту и т. п., при чем металлический аллюминий в
.настоящее время в состав их иногда и не вводится.
• . ‘ я Л
В эту же группу часто включают и недавно появившиеся во
Франции вещества, носящие марку A. R. В состав их, кроме 80—
85° о аммиачной селитры, входит 10 — 15% реальгара и 5% парафина.
• Сравнительно высокая стоимость порошковатого аллюминия и
склонность его к окисляемости в соприкосновении с аммиачной селит-
рой, естественно повлекли стремление искать веществ, могущих его
заменить.Были испробованы металлические порошки железа, кремния,
углеродистого кремния, цинка'и его сплавов, меди и т.п., но остано-
вились на двух: на ферросилиции и кремнистом кальцгш. Применяя
первый — получили сикрит, эхо и другие смеси, кремнистый же каль-
ций вошел в состав сабу литов.
§ 4. В 1885 г. в Бельгии предложено было Фавье несколько
взрывчатых веществ, сходных по составу и очень богатых аммиачной
селитрой, содержащие нафталин в разных степеням нитрации. Они
получили название составов Фавье, гризунитов, безопасных порохов,
нафталитов и т. д. (сюда-же причисляется также и шнейдерит) и во
Франции носят марку № 1. Они характеризуются хорошим фугасным
действием, но не совсем достаточным дробящим эффектом, а также
сравнительно невысокой температурой газов, получающихся при
взрыве. Они, несмотря на важный недостаток в виде гигроскопич-
ности, широко применяются в частной промышленности.
35. С развитием во всем свете фабрично-заводской промыш-
ленности сильно, стала возрастать потребность в каменном угле,
а в соответствии с таковой, увеличилось и число несчастных
случаев в каменноугольных шахтах от взрыва рудничного газа
и угольной пыли.
Таким образом, явилась необходимость в органах, на обязан-
ности которых было бы принимать меры к возможному уменьше-
нию числа несчастных случаев путем изучения причин их вызы-
вающих, для принятия соответствующих мер предосторожности.
Почин в этом отношении принадлежит Англии, которая йервая
назначила Антигризутную Комиссию, затем такие же комиссии
возникли в Германии, Фрайции, 'Саксонии и Австрии, но ни одна
из этих комиссий до второй половины 1885 г. не занималась
испытанием взрывчатых веществ на антигризутность и едва ли
не первой, которая поставила себе задачей (в 1886 г.) выяснить
степень антигризутности различных взрывчатых веществ—была
Германская в Нейбибельсберге, основателем и директором которой
состоял известный специалист но в. в. проф. В. Билль. По
распоряжению Правительства была устроена с этой целью опытная
галлерея в Найкирхене, открывшая свои действия в сентябре
1885 г. Впоследствие были построены подобные же опытные гал-
лереи и в других государствах.
Россия, как и обыкновенно, и в этом отношении сильно
отстала: антигризутная комиссия была учреждена у нас лишь
z незадолго до Европейской войны, но никакими, сколько-нибудь
выдающимися работами, себя не проявила.
Германн Шпренгель
Хлоратные взрыввещества и мелинит.
§ 1. Одним из заслуживающих внимания событий в И0мВН|
взрывчатых веществ, является практическое применение* бертол^дИ
соли, в частности изобретения шеддитов.
Как известно, первые попытки применения бертолетовой сошгмр
взрывчатым веществам были сделаны еще в 1788 году Бертоллеж
Лавуазье, пытавшихся приготовить новый порох. Попытка эта, кото-
рая стоила жизни двум присутствующим людям, само собой разу-
меется, не привела к практическим результатам, но идея не была
брошена й, от времени до времени продолжали появляться предло-
жения веществ, содержащих бертолетовую соль. Вещества эти, однако,
оказывались всегда страдающими недостаточной безопасностью в обра-
щении, почему ни одно из них в практике не было принято, пока не обра-
тились к применению флегматизаторов. Так, еще в 1867 году Ф. Ган
пробовал вводить в качестве такового спермацет, затем было предло-
жено применять каменноугольную смолу и углеводороды, в 1888 г.
парафин и нафталин, в 1891 г. — льняное масло и, наконец, Street в
1896 г. разрешил вопрос практически, употребив в качестве флегма-
тизатора касторовое масло, и назвал свое взрывчатое вещество шедди-
том, в честь небольшого городка Chedd в Швейцарии, где оно было
впервые приготовлено.
Позже в 1908 г. в Англии предложено было взрывчатое вещество,
сходное по составу с шеддитом и названное Steelit’oM Colliery. Оно
содержит 74% бертолетовой соли, 25% окисленной смолы и 1% рици-
нового масла.
Тогда же обратили серьезное внимание на перхлораты, т.-е. соли
хлорной кислоты. *
Появляется целая серия взрывчатых веществ, имеющих основой
перхлораты, особенно их много было предложено в Бельгии и во
Франции: ионскиты стали готовиться в Бельгии, E.I86-, Е. Р.; шеддит;
0.1901.10 во Франции, пермонтит—Германской фабрикой .Карбонит"
в Шлебуше и т. п.
В 1884 г. появляется в Америке интересное взрывчатое веще-
ство Rackarock (реккерокк), приготовляющееся, вообще говоря, в мо-
мент надобности, пользовавшееся довольно широким применением
в Америке и Восточной Азии и не утратившее свое практическое
значение и доньще.
Оно заключает в качестве существенных составных частей бер-
толетовую соль с небольшой примесью окиси железа и мононитробен-
зол (мирбановое масло).
Оно послужило родоначальником целого ряда взрывчатых ве-
ществ этого же рода каковы, например: прометей, самсон и медзянкит
(в последнем менонитробензол заменяется керосином, нефтью и т. п.,
и. т. д.)
§ 2. Теперь скажу несколько слов еще об одном важном пре-
парате, получившем широкое применение во всех государствах—
пикриновой кислоте.
Препарат этот был открыт еще в 1788 г. Гаусманом, но о его
взрывчатых свойствах не подозревали почти что в течение целого
столетия. Первые попытки практического использования пикриновой
кислоты в области взрывчатых веществ (не считая, конечно, пикра-
тов), относятся к 1871 г., когда Шпренгель предложил применять
в своих составах в качестве сгорающего, однако только 1886 г. Евге-
ний Тюрпэн доказал воочию- бе выдающиеся взрывчатые качества.
Выдающиеся качества пикриновой кислоты обратили на нее вни-
мание всех государств и многие тотчас же ввели ее у себя, хотя и
под разными названиями: лиддита (в Англии), мелинита (во Фран-
х С
ции), gg
(в Германии), шимозе (в Японии), пертита, пикринита и т.п.
Однако, при всех своих достоинствах она обладает одним недостатком,
несколько затрудняющим ее применение в артиллерии для снаряже-
ния снарядов при помощи заливки, а именно, сравнительно, высокой
точкой плавления (122,5*С), поэтому ученые направили свои иссле-
дования в сторону изыскания Способов понижения этой температуры,
вводя в ее состав другие вещества неслишком ослабляющие ее силу.
В этом отношении заслуживает особое внимание работа Жирара.
Отсутствие в мелините свойств пластичности заставило делать
попытки придать пикриновой кислоте это свойство путем смешива-
ния с соответствующими веществами. Составы, явившиеся резуль-
татом этих попыток, большого практического значения, однако, не по-
лучили.
Но это не единственные недостатки ее: химическое действие ее
на большинство металлов ведет за собой образование чувстви-
тельных к механическим влияниям и, потому опасных в обращении
пикратов, для избежания каковых оболочки в которых должна содер-
жаться сколько-нибудь продолжительное время пикриновая кислота,
должны быть предохранены от ее раз‘едающего действия тем или иным
путем; кроме того вдыхание ее пыли вредно отзывается на здоровья
рабочих; чрезвычайно горький вкус этой пыли также дает себя чув •
ствовать работающему с нею и вдобавок она сильно пачкает, окраши-
вая кожу в желтый цвет. Сказанное послужило причиной значитель-
ного сокращения потребления пикриновой кислоты, и она была отне-
сена, так сказать, к резервным в. в. Именно такую роль она несла
у нас в 1914—19 гг. вследствие обнаруживавшегося недостатка тола.
§ 3. Как только выяснились некоторые недостатки мелинита,
во Франции предложено было вещество почти эквивалентное ему по
своим взрывчатым качествам—это тринитрокрезол, в Австрии же,
смесь из пикриновой кислоты и мононитронафталина, названная зкра-
зитом. Чистый тринитрокрезол применяют, однако, на практике реже
нежели смесь его с 40% мелинита. Такая смесь носит название во
Франции крезилита и имеет марку 60/40.
Экразит также превосходное взрывчатое вещество, почти экви-
валентное мелиниту. В последнее время к нему стали добавлять около
2% тола.
Вильгельм Билль.
Топ, тетрил и другие современные взрывчатые вещества.
§ 1. В 1900 г. Вильбранд впервые указал на выдающиеся взрыв-
чатые свойства тринитротолуола.
Случилось тоже, что и при открытии мелинита: всюду стали
изучать свойства тринитротолуола и он быстро введен был в боль-
шинстве государств: французы его назвали толитом, испанцы — три-
литом, Карбонитовая же фабрика в Шлебуше — тротилом, завод в
Шенебеке— тринолом и т. д. У нас в Артиллерийском Ведомстве со-
хранилось за ним его немецкое название тротила, в Инженерном же
Ведомстве он существует под названием тола.
Вместе с тем начали изыскивать способы увеличить его удель-
ный вес. Стали превращать в пластичную массу смесь его с бертоле-
товой солью при помощи желатинированной динитротолуодом нитро-
целлулозы. Вводя иногда.сюда еще и терпентин—получили пластичную
массу, названную пластротилом, смешивая же тол с азотно-кислым
свинцом и нитроцеллуЛозой, желатинированной динитротолуолом—
трипластит.
Желая увеличить бризантные свойства тринитротолуола, пред-
ложено было к нему примешивать около 72% азотнокислого свинца.
Такие смеси изготовлялись в Бельгии под названием макаритов. Глав-
ным потребителям их являлось Военное Ведомство.
Смеси дола с аммиачной селитрой обладают хорошим фугасным
эффектом и, хотя и слабее чистого тола, но много дешевле его. Сме-
си тола, содержащие 40% аммиачной селитры дано название амотола.
В Германии амотол ностит марку Fp 60/40, в Англии — называется
амотолом 40/60, иногда же 87/13, 70/30 и т. д.
После обнаружения взрывчатых свойств тринитробензола и три-
нитротолуола, совершенно естественным является предложение ка-
честве взрывчатого вещества тринитроксилола или ксилита. Хотя по
свойствам своим он близок к толу, но обладая, между прочим, не
сколько меньшею чувствительностью к капсюлю, пока имеет, значи-
тельно меньше тола, практическое значение.
§ 2. К числу взрывчатых веществ, выдающихся по своим каче-
ствам, из числа предложенных уже в этом столетии, заслуживает
упоминание гексанит или гексанитродифениламин. Он был предложен
Аустёном и приготовляется в Германии на заводе Круппа-Мюлле. По
бризантности своей гексанит превосходит тол, пироксилин и мелинит,
по-фугасному же действию он несколько превосходит мелинит и тол,
уступая несколько в этом отношении пироксилину. Пока особенного
распространения не получил, но возможно, что в будущем им еще
займутся.
К современникам тола можно причислить также тетрил или-
тетранитрометиланилин — первоклассный детонатор, открытый гол-
ланцем Ромбергом. Будучи одним из наилучших возбудителей взры-
ва тетрил'вместе с тем одно из наиболее могучих взрывчатых ве-
— 26 —
ществ, далёко оставляющее позади себя лучшие взрывчатые вещества:
тол, пироксилин и мелинит; однако, значительная его чувствитель-
ность к механическим влияниям и, сравнительно высокая стоимость,
пока ограничивают его практическое применение, если не считать
его применение в капсюлях-детонаторах.
ГЛАВА VIII.
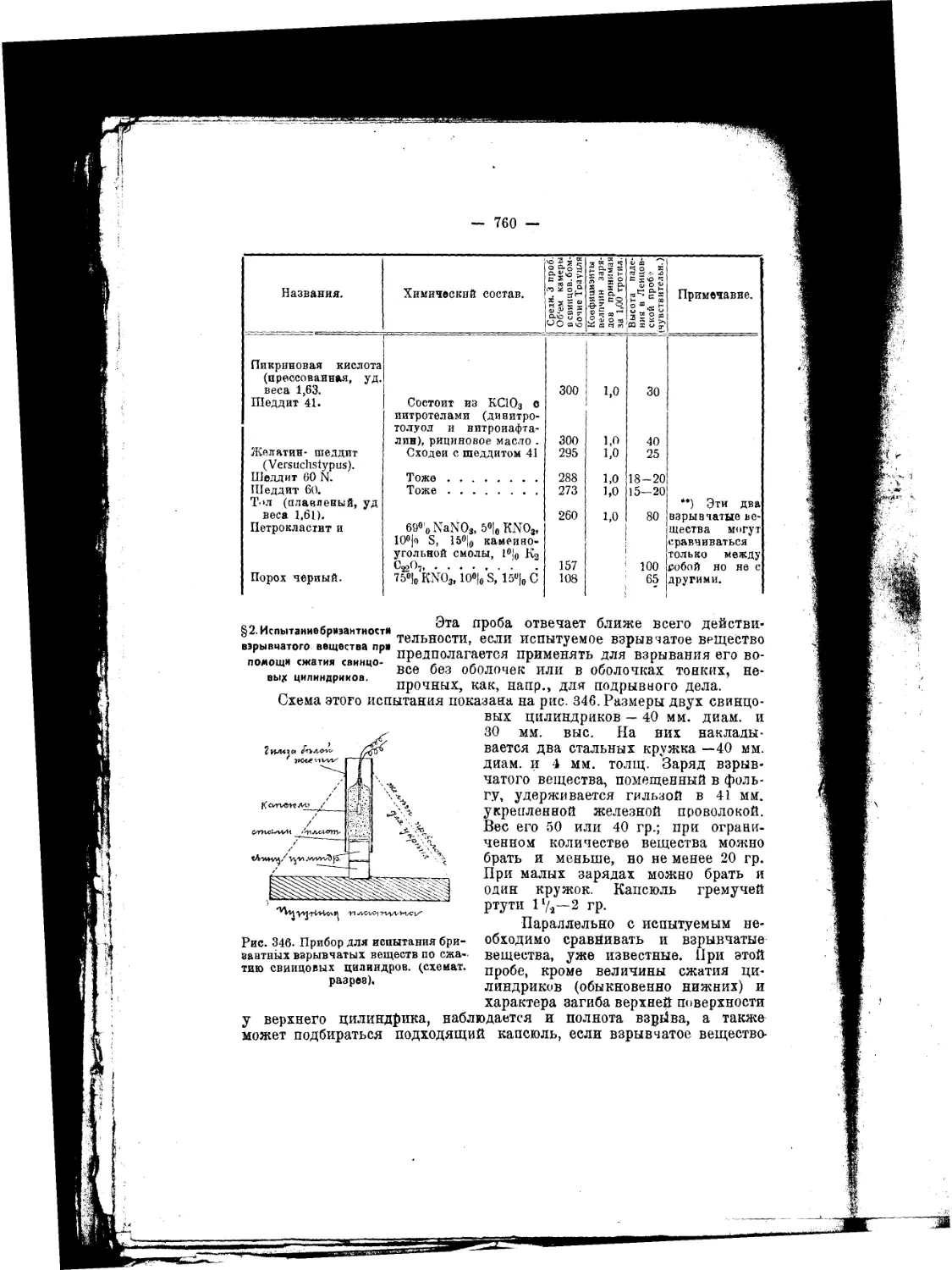
Гремучая ртуть, азиды, быстрогорящие и детонирующие шнуры,
§ 1. Как известно гремучая ртуть была впервые получена в 1800 г.
Говардом, в 181.5 же Году впервые применена для изготовления каш
сюлей Durs EggO’m. С тех пор около трех четвертей столетия, как в
отношении гремучей ртути, так и капсюльных составов, не было сде-
лано ничего такого, что заслуживало бы быть особенно отмечен-
ным в качестве выдающегося; только под конец XIX столетия вновь
пробуждается интерес к гремучим составам и являются предложения
применять к последним металлический аллюминий, особенно в со-
ставы, предназначенные для воспламенения бездымного пороха;
тогда же явились первые попытки выделки комбинированы! под-
рывных капсюлей: мелинитовых и толовых.
§ 2. В 1890 г. химиком Куртиусом получена была впервые азо-
тиетоводородная кислота или азоимид. Соли этой кислоты названы были
азидами. Как сама кислота, так и ее соли, обладают взрывчатыми свой-
ствами и, благодаря работам Бертоле (в 1894 г.), Куртиуса и Риссона
(в 1898 г.), а также и других, мы теперь достаточно ознакомлены со
взрывчатыми свойствами этих интересных соединений. Лучше других
изучены в отношении их практического применения: азид свинца,
меди, ртути и серебра, а в качестве исходного продукта — азид натрия,
Практическое применив уже имеет азид свинца (N3)2 Pb, мо-
гущий заменить гремучую ртуть, хотя возможным ему конкуррентом
в будущем может быть и азид серебра.
Невозможность всегда применить гальванический способ воспла-
менения группы зарядов, естественно привела к изысканию способов
бдновременйого сообщения огня зарядам без применения электричес-
кого тока. Таковая возможность была найдена, используя с этой целью
огромную скорость детонации некоторых взрывчатых веществ, изго-
товляя так называемые детонирующие шнуры.
§ 3. С самого начала пытались исходить из типа шнура бикфорда,
заменяя пороховой состав его зерненным пироксилином (шнур Мэссена);
скорость передачи взрыва при помощи таких шнуров доходила до
2500—гЗООО метров в секунду. Однако для однообразия действия подоб-
ных шнуров требовалось совершенно равномерное уплотнение пиро-
ксилиновой массы по всей длине шнура, что было очень трудно
достижимо'.
Это обстоятельство заставило отказаться от зерненного пирокси-
лина и заменить его тонким порошком того же пироксилина, но
приготовленным из гидроцеллулозы Жирара, применяя
в качестве оболочки, свинцовые трубки. ;'пЯ|ж.
Получился ццгур, действующий очень однообразно, но«чйЙИ|
в сильной степени ломким. Тогда заменили, свинцовую трубЛу^5ЙИ|
ной, что дало отличные результаты, причем, скорость ДетОЯИ
удалось поднять до 4000 метров в секунду. Однако такие
благодаря оловянной трубочке, обходились очень дорого, а потому
стали пробовать изготовлять детонирующие шнуры с гибкой оболочкой.
. v Генералом австрийской службы Гессом предложено было изго-
товлять детонирующие шнуры из гремучей ртути, которую для,безо-
пасности флегматизировать 20% парафина (в 1903 г.). Эти шнуры
нашли себе применение в частной промышленности, особенно в газо-
вых рудниках. \
В настоящее время дл’я приготовления детонирующих шнуров
пироксилин более не употребляют, а применяют мелинит (с 1900 г.),
тол и тетрил, были опыты (в Австрии) применения с этою же целью
также ритроманнита.
ГЛАВА IX.
Составы Шпренгеля, Панкластиты Тюрпена, Оксипиквит.
§ 1. В 1875 г. Шпренгель сделал выдающееся открытие: он
предложил в качестве взрывчатых веществ употреблять смеси крепкой
азотной кислоты с углеводородами и легко окисляющимися веществами
как-то: нафталином, бензолом, сероуглеродом и т. п. Открытие это
представляло очень большой научный интерес, но, по всем понятным
причинам—неудобству обращения с едкими и легко летучими жид-
костями, не могло иметь серьезного практического значения.
§ 2. В 1878 г. французский химик Тюрпэн предложил взрывчатые
вещества типа 1 составов Шпренгеля, названные им панкластитами,
представляющими смеси азотноватой кислоты с жирными маслами,
продуктами перегонки нефти и каменного угля, с сероуглеродом
и т. п.
Несмотря на свою колоссальную силу, панкластиты так-же, как и
составы Шпренгеля серьезного практического . значения иметь не
могли.
§ 3. В последнее время получили значительное распространение,
в особенности в горном деле, препараты жидкого взрывчатого воздуха
(оксиликвит). Впервые его применил Линде при постройке Симплон-
ского туннеля. Но первый опыт был неудачен, так как техника того
времени не знала еще способов стабилизации этого нового взрывчатого
вещества. Однако за последнее двадцатилетие целым рядом исследо-
ваний и изобретений удалось эти недостатки сгладить я приготовить
препарат, достаточно отвечающий запросам взрывной техники.
Здесь следует упомянуть Ковача и Балдуса, которым впервые
удалось достичь удовлетворительных практических результатов. Вели-
кая Европейская война и связанный с ней недостаток гражд. взр. веществ
послужили могучим импульсом к развитию взрывных работ с жидким
воздухом в Германии. И техника как приготовления оксиликвита, так
и самих работ с ним была там поставлена так высоко, что почти по-
ловина рудников Германии работала им. >
Более подробно о жидком воздухе будет сказано в дальнейшем.
Огромная механическая работа, которую способно произвести
' взрывчатое вещество при взрыве, естественно привело к попыт-
кам применения взрывчатых веществ в качестве двигающей силы
машин. Действительно небольшая модель подобной машины,
действующей под влиянием взрыва небольших количеств дена-
мита, была построена в Вене в 1878 г.; известны также предло-
жения применить в качестве двигателя машин бездымный порох,
но пока все эти предложения никакого практического приложе-
ния не получили.
В последнее время взрывчатые вещества за границей—осо-
бенно в Америке,—получили довольно широкое применение в
мелиорации, о чем будет сказано далее.
х Чтобы закончить с исторической справкой, надо еще упо-
мянуть о применении взрывчатых веществ в частной промышлен-
ности, в тех случаях, когда в них используются не их взрыв-
чатые свойства.
На приготовление целюллоида идет огромное количество ни-
трованной целулозы, выражающееся по меньшей мере 25.000 тонн
в год, на искусственный шелк потребляется ее свыше 5.000 тонн.
Если к этому прибавить то количество нитроцелулозы,
которое идет на приготовление лаков для кожи, водоупорные
составы, коллодий для медицинских целей и газокалильрых кол-
пачков, фотографических целей и т. п., то станет ясным, какое
огромное количество нитроцелулозы потребляется ежегодно во
всем свете.
Но ни одна нитроцелуллоза играет видную роль в промы-
шленности мирной жизни народов. Припомним, например, что
пикриновая кислота и ее производные представляют важные
красящие вещества, азо-соединения и их производные также
имеют немалое значение в красильном деле.
Основные понятия о взрыве, взрывчатом веществе, элементах
взрыва и источниках взрывного разложения.
Горение, как это имеет место для многих хими-
§ 1. взрыв и взрыв- ческих реакций, может совершаться с большею или
чатое вещество. меньпгею интенсивностью. Если количество тепла,
выделяющегося участвующими в процессе горения веществами, не ве-
лико, или если отделение теплоты производится медленно, постепен-
но, или же, наконец, если много тепла теряется, благодаря сильной
теплопроводности тела, либо утрачивается в виде лучистой теплоты,
то температура не в состоянии повыситься до того предела, при ко-
тором наступает явление свечения. К подобному частному случаю
название „горение" не применяют и просто считают, что имеется на
, лицо экзотермическая реакция, сопровождающаяся выделением ббль-
шего и меньшего количества тепла, причем, если дело идет о соеди-
нении тела с кислородом, будь таковой в свободном илр связанном
состоянии, говорят, что происходит окисление. Если при реакции ко-
личество выделяющегося тепла достаточно для воспроизведения сла-
бого светового эффекта, причем сама реакция протекает сравнительно
медленно, то подобному процессу дают название тления. С возраста-
нием количества отделяющегося при реакции тепла и с возрастанием
быстроты, с которой она протекает, наблюдается более или менее ин-
тенсивное горение, причем отделяющиеся при реакции горючие газы
воспламеняются или, как говорят, горение совершается с отделением
пламени. Подобную сущность имеет процесс, известный в общежитии
под наименованием горения.
Есть вещества, у которых процесс горения протекает с чрезвы-
чайной быстротой, причем отделяется весьма большое количество
_ тепла, быстро нагревающего до очень высокой температуры газо-
образные продукты сгорания, которые поэтому приобретают огромную
упругость, благодаря которой они могут производить весьма большую
механическую работу. Подобного рода реакции носят название взрыв-
чатого разложения или просто называются взрывом.
Таким образом, взрывом называется такая экзотермическая реакция,
при которой вещество с чрезвычайной быстротой обращается (полностью
или почти) в газообразные продукты, имеющие очень высокую темпера-
муру, отчего возникает сильное давление газов, которое и производит
внешнюю работу взрыва', а потому 'взрывчатыми веществами являются
лишь те, которые, заключая в себе большой запас химической энергии,
способны чрезвычайно быстро разлагаться с образованием большого коли-
чества газов, с превращением хвоей химической энергии в тепловую.
Работа взрыва выражается в метании близь лежащих предметов,
или в раскалывании, раздроблении и вообще деформировании их,
причем в окружающую взрывчатое вещество среду ударом газов по-
сылается звуковая волна.
Таким образом, с увеличением скоростей горения и быстроты
сгорания зарядов, а также величины массы взрывчатого вещества, мы
можем наблюдать следующие градации, в сущности одного и того
же явления: тление, медленнее горение, вспышка и взрыв, причем вспыш-
кой буДем называть весьма слабый взрыв, в котором отсутствуют силь-
ное механическое действие и характерный 'Звук взрыва.
Q Явление взрыва сводится к трем факторам: 1) на-
6 ' лементы личности газов, 2) влиянию высокой температуры и 3) бы-
взрыва. СТрОте образования газообразных продуктов взрыва.
. 1) Образование при взрыве большого количества газов есть не-
пременное условие, при неисполнении которого не может иметь место
само явление взрыва, так как только тогда они, благодаря очень вы-
соким температурам, развиваемым реакциями взрывчатого разложения,
приобретают необыкновенную упругость, благодаря которой они спо-
собны производить огромную механическую работу. Нет газов—нет и
явления взрыва, независимо от того, как не поднималась бы высоко
температура. Всем известен способ Гольдсмита, применяющийся для
восстановиваия трудноплавкйх металлов и употребляющийся для
термической сварки разных металлов: берется смесь какого-либо ме-
таллического окисла, например, в так называемом „термите**, приме-
няющемся для термической сварки металлов, этим окисло^ служит
окись железа, которая берется в пропорции 72%—78% и смешивается
с порошковатым аллюминием (28%—.22% в термите) в пропорции, вы-
числяемой из формулы:
Al2 + Fe2O3—Al2O3 + Fe2 + 15O болып. калор.
и, при помощи специальной смеси, (40 ч. ВаО2; 7ч. КС1О3; 10 ч. А1),
воспламенятся. Происходит в высщей степени энергичная реакция
с выделением огромного количества тепла, поднимающего темпера-
туру до 3000°. Реакция протекает спокойно, без взрыва, единственно
потому, что образующиеся в качестве продуктов реакции глинозем и
металлическое железо тела не газообразные. ,
2) Влияние температуры в явлении взрыва сказывается в том,
что под действием ея газообразные продукты взрывчатого разложения
занимают гораздо больший об1 ем, чем они заняли бы при обыкновен-
ной температуре, или иначе, температура сильно повышает упругость
газов и, 'значит, способность их производить механическую работу.
На практике во взрывчатые составы нередко вводят вещества,
предназначенные исключительно для повышения температуры, каковы,
например, порошкообразный аллюминий. Этой прибавкой количество
газов не увеличивают, но сильно повышают их упругость, а следо-
вательно повышается сила взрывчатого вещества. Такую же роль
м^ввенного элемента взрыва, понятно без специальных пояснеМИЙр
«шдому теоретически, как общее положение, вещества прй$
роющиеся при взрыве в газообразные продукты, т. е. не дающие'
Каких твердых Остатков, (в том числе и дыма) должны быть най-
ме сильными *)•
3) Быстрота, с которой протекает взрывчатое разложение, имеет
ujr* '
й также самое существенное влияние на характер действия взрывчатого
вещества. При сравнительно более медленной реакции, отделяющаяся
Деплота, благодаря лучеиспусканию, теплопроводности и иным при-
чинам и привходящим обстоятельствам, будет успевать рассеиваться
и только частью пойдет на возвышение температуры газообразных
' продуктов взрыва, увеличивая их упругость. При таких условиях мы
будем иметь просто более или менее быстрое сгорание—так называ-
’ емую вспышку. ' .
Весьма характерным примером подобного рода явления может
служить сгорание небольшого количества черного пороха, зажжен-
, ного открыто на воздухе. >
Типичным примером взрывчатых веществ, обладающих весьма
большими скоростями сгорания, являются так называемые гремучие
соли, в частности—гремучая ртуть.
Вещество это обладает, даже среди взрывчатых веществ, исклю-
чительной быстротой взрывчатого разложения. Выделяя при взрыве
небольшое количество газов, гремучая ртуть не принадлежит к
I’ числу наиболее могучих взрывчатых веществ, но местное ея действие
Г громадно,, единственно по причине совершенно исключительной быст-
УЛАгтт л л. а к a ажа sr ‘гъг'Ж-г ««ъгг а нч а а чЧ а кч тг a ttY.1 А тттт а АТТА ТТППГГЛ тГТТПС1*Т1'Л
Ь • -
в? к числу взрывчатых веществ, обладающих самым высоким
роты, с которой совершается взрывчатое, разложение, она принадлежит
, тате назы-
ваемым бризантным эффектом.
Теоретически рассуждая, взрывчатыми реакциями могут бытв-
реакции соединения, разложения и замещения, но на практике с
последним Видом мы не встречаемся, так как при этих реакциях
либо совсем не образуются газообразные продукты, либо реакции те-
кут слишком медленно и то лишь в водных растворах, кроме того,
по самому механизму этих реакций, они требуют довольно большого
>
времени для своего окончания.
Существует много попыток дать теоретическую характеристику
взрывчатых веществ и теоретическое об‘яснение явления взрыва, но
достигнуть в этом отношении каких-либо общих положений пока еще
не удалось. По отношению к однородным взрывчатым веществам
| можно принять представление о них, как о системах, находящихся в
состоянии неустойчивого равновесия. Эти взгляды, справедливые в
ft значительной мере по отношению к однородным системам,- вызывают
В .............
fc;../,, *) Как мы увидим дальше, это правило имеет и исключения. К числу та
К|Ьоаых принадлежит например меллинит-одно из самых могучих взрывчатых
ИиШ&еств, но при взрыве он дает некоторое количество твердого остатка, в виде
черного дыма.
Af. Сухаремжнн. Взрывные нгшегтвз и взрывные работы.. °
существенные возражения в случае применения их к неоднородным
системам, каковыми является большая часть употребляющихся в тех-
нике взрывчатых веществ. Дело в,том, что в таких системах совер-
шенно не приходится говорить об их однородности, так как составные
части соприкасаются между собой лишь по поверхностям, на которых
только и возможно развитие. химического взаимодействия их. Не-
смотря на такие неблагоприятные условия, все же имеется на лицо
колоссальная скорость взрывчатого'разложения. Как нй кратковре-
менно явление взрыва, все же возможно, допущение, что отдельные
части таких неоднородных систем успевают перейти отчасти в жидкое
или газообразное состояние, образуя в этом случае однородные,
смеси, т. к. только этим обстоятельством возможно об‘яснить быстрое/
и достаточно полное превращение реагирующих веществ.
Суммируя вышеизложенное замечаем, что дать точно теоретическую ,
характеристику взрывчатых систем мы не имеем еще возможности вслед-/7
ствие малой изученности этого вопроса,' но общие условия, необхо-
димые для получения явления взрыва, можно характеризовать уже
достаточно точно, а именно:
А) Химическая реакция, лежащая в основе взрывчатого превра-
щения, должна сопровождаться выделением достаточного количества
тепла, т. е. быть экзотермической.
В) Начальная исходная система должна обладать в той или
другой степени чувствительностью к внешнему воздействию, которое
направлено к тому, чтобы вызвать в ней взрывчатое превращение.
- С) Система должна быть подвергнута в начале превращения не-
которому внешнему импульсу достаточной интенсивности и такого*
характера, чтобы система была выведена из состояния своего равно-
весия и получила возможность к превращению в строго определенном
направлении. .
/, в Как бы мелро не было распыляемо вАцество или
* . зрывчатые ПуЛьверИЗИр0валась ЖИдкость, мы всегда будем полу-
смеси газов. чать частицы' вещества физические, т. е. обладающие
всеми тремя измерениями, между тем как реакция происходит между
молекулами. .
Иным образом представляется вопрос по отношению к-газам:при
смешивании двух газов происходит перемешивание самых молекул,
при чем таковое может совершаться частью искусственным путем,
главнейшим же образом происходит естественным образом, благодаря
свойству газов легко диффундировать.
Таким образом, как бы ни была мала физическая частица тела,
, но в виду того, что она имеет все три измерения — процесс сгорания
ее протекает не моментально, соединение же между собой газообраз-
ных тел', сгораемого и сжигающего, происходит мгновенно.
Послб этой предпосылки станет понятным, что все горючие газы
в смеси с кислородом или с воздухом дают взрывчатые смеси, при
зажигании взрывающие. К таким относятся: ,
а) Газообразные смеси:
Н2 + С1, образует 2HCI, освобождая 44 болып.
21L + О, .. 2Н„О. . 58
калории
образует
” »
1»
2СО,, освобождав
2Н2О + 2СО2
2Н.0 + СО2.
68
болып. калшш
СН4 + 202
б) См» си углерода с кислородом:
С + О образует СО, освобождая
С + О2 „ СО2, „
Чем больше состав смеси отступает
29
97
ОТ
больш. калорий
»» »
этих уравнений
a
А’.
* ’pt
V * • • м \ .....ЦИ'. •
в смысле
увеличения или уменьшения одного из действующих компонентов,
'(или если примешивается посторонний инертный газ), тем более осла-
бевает сила взрыва и, в конце концов, смесь утрачивает свойство
взрываться. Подобное явление находит себе об‘яснение в том, что
газ, не принимающий участия в реакции, заставляет взрывающуюся
смесь распределяться в большом об'еме и отнимает часть тепловой
энергии реакции. Если мы обратимся к вышеприведенной таблице,
то увидим, что при соединении углерода с кислородом, взятым в
количестве, достаточном -для образования углекислого газа, выде-
ляется 97 больших калорий тепла (это относится к грамм молекуле),
тогда как при неполном сгораний того же углерода выделяется всего
лишь 29 б. калорий. Эти цифры, относящиеся к термическому эффекту,
раз'ясняют нам то обстоятельство, что в состав всех применяющихся
на практике взрывчатых веществ входит в качестве сгорающего именно
углерод. Здесь, однако, следует сделать существенную оговорку. Так
как цифры эти относятся к грамм-молекулам, то следовательно 97
больших калорий являются результатом сжигания 12 грамм углерода
(ибо атомный вес углерода 12), тогда как, при таких же условиях,
2 грамма Н2 при сгорании дают 58 больших калорий.
Таким образом, 1 (один) грамм углерода, сгорая в углекислоту,
97
освобождает ~ = 8 больших калорий, тогда как 1 грамм водорода,
12 • >
58
сгорая в воду, освобождает '0 ••= 29 больших калорий, т. е. количе-
ство энергии, освобождающейся при образовании воды, значительно
больше, нежели при образовании углекислого газа (если исходить из
равных весовых и* количественных соотношений реагирующих тел).
В практическом же отношении все выгоды, конечно, на стороне
углерода; он, в виде угля, является твердым телом, а поэтому зани-
мая гораздо меньше места, аккумулирует скрытно значительно боль-
шее количество химической энергии в несравненно меньшем об'еме.
При Тех реакциях взрывчатого разложения,
о которых говорилось до сих пор, предполага-
лось, что потребный для процесса кислород на-
ходится в свободном состоянии или, смешанный
с азотом (одна часть кислорода на четыре части
§ 4. вещества с конден-
сированным содержанием
кислорода, связанного, но
легко освобождаемого.
азота), входит в состав воздуха. В химии, однако, известен целый ряд
соединений, богатый кислородом, который они очень легко уступают—
в них кислород находится как бы в аккумулированном состоянии.
К таковым веществам принадлежат между прочим: селитры—калиевая
(KNO3\, натриевая (NaNOs), аммиачная (NH4NO3), бариевая \Ba(NO^2],
стронциевая [бХМЛзМ и другие нитраты, не применяющиеся на прак-
тике вследствие своей дороговизны, марганцево-кислый калий (KMnOi).
двух-хромокалиевая соль (XsCr2O,) и аналогичные ей хроматы, хро-
мовый ангидрит (ООз), не применяемый в технике взрывчатых ве-
ществ по причине слишком легкой отдачи им своего кислорода,
хлорноватые соли, преимущественно калиевая (КОЮз), называемая
чаще бертолетовой солью, соли щелочных металлов хлорной кислоты
или перхлораты—калия (KClOi), натрия {NaClO^ и аммония (NHiClOi)
и т. д.
Из подобных же аккумуляторов кислорода, но жидких, чаще
других применяется азотная кислота.
Здесь же следует упомянуть о.том, зто сам ожиженный кисло-
род, за счет которого различные вещества, в роде угля, ваты.и т. п.,
сгорают чрезвычайно быстро с выделением огромного количества тепла,
образует с ним и сильно взрывчатые смеси.
Само собой понятно, что неудобства, обращения с жидкостями
вообще, а с такими едкими, как азотная кислота, или летучими—
вроде жидкого кислорода, или воздуха, обусловливают то, что жидкие
сжигающие в практику долго не входили.
Смешивая какое-либо сгорающее с одним из этих веществ (или
же с несколькими), у нас будут налицо условия, благоприятные для
получения быстрого горения и в частности, взрыва, так как такие
вещества занимая до взрыва небольшой об’ем, между тем, образуют
при реакции большое количество газов, нагретых до весьма высокой
температуры, а потому обладающих большой упругостью. Но так как
процесс и здесь сводится ко взаимодействию между молекулами, то
понятно, что чем тоньше измельчены и лучше перемешаны будут
составные части, тем энергичнее будет итти реакция взрывчатого раз-
ложения. Само собой понятно также, что пропорция составных частей
должна быть подобрана наивыгоднейшим образом: всякий избыток
какой-либо составной части над ее действительной потребностью, бу-
дет . уже вредным, а количество инертных, не участвующих в реакции
веществ, должно быть минимальным.
Однако, смешивание сгорающего с одной из перечисленных выше
солей недостаточно, чтобы получить взрыв. Для него необходим какой-
либо внешний импульс (нагревание, удар, трение и т. п.), которые
вызвали бы предварительно разложение солей и освобождение кисло-
рода, который уже, под влиянием возвышенной температуры, вошел
бы в химическое соединение со сгорающим, при чем освободится
тепло, которое разложит новое количество соли и освободит новое ко-
личество кислорода, за счет которого вступит в реакцию новое коли-
чество сгорающего и т. д. Таковы отдельные фазы явления взрывча-
того разложения смесей сгорающего с веществом богатым кислоро-
дом. Некоторые из перечисленных, выше солей сами по себе взрыв-
чатые вещества, как нап ример: бертолетовая соль, аммиачная селитра
и др., но для своего взрыва они требуют очень могучего импульса
в виде сильного удара, трения и других, в высшей степени* интен-
сивных, механических влияний. Несмотря на это, возможность взрыва
в
йа
я
а-
6-
в-
ра
са
J
i, У-.: *
' V"
37 —
Шйг «нцеств
установлена горьким опытом практически й’Ч
:ении с ними
вцодящиу в СО'
стдв молекулы взрыв-
•’’V's.-wtwx веществ.
необходимо соблюдать большую осторож»
Углерод, водород и другие сгорающие*
дящие в состав молекулы взрывчатых В
при распадании ее, соединяются с кислородом"^!,
таким образом, играют роль горючего материал»;'/
Практически огромное значение имеет именно угле*
«й^род, дающий громадное количество соединений (преимущественно так
Называемых органических), образуя весьма сложные молекулы, содер-
жащие большое число атомов, как самого углерода, так и других
элементов. Это дает возможность иметь взрывчатые вещества органи-
ческого происхождения, обладающие самыми разнообразными свой-
ствами.
Азот играет двоякую роль: активную и пассивную.
Пассивная роль его заключается в удержании в молекуле эле-
ментов, обладающих склонностью жадно соединяться друг с другом,
и, разделяя их собою, препятствовать им вступать непосредственно
в химическое взаимодействие.
Азот принято считать элементом недеятельным, но это справед-
ливо только условно. Азот, как элемент, как простое вещество, является
по отношению ко многим веществам малоактивным по той причине,
что оба атома азота в его молекуле Ns весьма прочно связаны между
собою—атомы азота обладают сильным сродством друг к другу, так
сказать, взаимно насыщают друг друга, почему с другими элементами
подобный азот соединяется менее жадно. (
Поэтому то чаще' всего в продуктах взрывчатого разложения
азот присутствует именно в свободном состоянии, комбинируясь в моу
лекулы N2 с выделением тепла. Если судить по количеству хими<
ческих соединений, в состав’ коих входит азот, то его едвали можно
причислить к элементам пассивным. Стоит только вспомнить массу
соединений его с кислородом, водородом, галоидами, металлами и,
особенно, с углеродом (амины, амиды, белковые вещества, нитросое-
динения, азотнокислые эфиры, азиды, нитрозо-соединения, алкаллоиды
и т. д.), чтобы притти ic заключению, Что понятие о пассивности
азота—чисто условное.
Влияние нагревания при реакциях взрывчатого разложения выра-
жается в том, что оно обусловливает распад молекул составных ча-
стей смеси, или, по меньшей мере, ослабляет связь между атомами,
составляющими молекулу, причем последние комбинируются уже в
бойее простые экзотермические соединения, освобождающие столько
% тепла, что его оказывается достаточным для нагревания следующих
слоев смеси — причина почему вся смесь, нагретая лишь в одном
£|фсте, сгорает вся. Аналогичное влияние нагревания и в случае
^|^лйчия, вместо взрывчатой смеси, такового же химического соеди-
нения. В этом случае высокая температура, ослабляя связь между
||$ *) в Англии в Ст. Хэллен произошел, ужасный по своим последствиям,
рыв магазина с 158 тоннами бертолетовой соли. Аммиачная селитря в сухом
|рояиии требует также осторожного обращения с ней, особенно, если пред-
йгается хотя бы случайное присутствие в ней горючих веществ.
-J> л-
атомами в молекуле взрывчатого химического соединения, позволяет
этим атомам соединяться с целью образовать иные, уже более про -
стые молекулы, почему энергия и освобождается. Другая роль нагре-
вания—увеличение скорости реакции, а так как под’ем температуры
при взрывах достигает тысяч градусов, то понятно, что и скорости
взрывчатых разложений достигают колоссальных размеров.
§13. Проявление взрыв-
чатьцс свойств другими
веществами.
Физическое состояние вещества имеет огром-
ное значение в отношении проявления телами взрыв-
чатых свойств. Всем известно, например, что уголь
(каменный, древесный и т. д.), хотя и горюч, но ,
взрывчатыми свойствами не' обладает, однако, стоит его привести в
состояние тончайшей пыли и смешать с воздухом, чтобы получилась
смесь, обладающая сильно 'взрывчатыми свойствами. Лабораторным
путем нетрудно воспроизвести подобное же явление с серой, крах-
малом и многими другими веществами, преимущественно органиче-
ского происхождения.
Некоторые распыленные металлы в воздухе сгорают очень
быстро, но вообще говоря без взрыва, так как здесь нет одного
из факторов присущих этому явлению — отсутствует образование
газообразных веществ по причине не летучести получающихся
металлических окислов.
Изложению следующей главы является необходимым пред-
послать краткое пояснение некоторых терминов, с которыми в
дальнейшем придется оперировать. Сюда относятся понятия „ за-
ряда " и „плотности заряжания".
Определенное весовое количество взрывчатых веществ, зани-
мающего общий об’ем, называют зарядом, который в силу такого
определения может быть либосплошным, либо состоять из отдель-
ных частей той или другой формы и размера. Эти части, из
которых заряд составляется, могут быть зерна (как, например,
в черном порохе), ленты, трубки, нити и пр. (в бездымном поро-
хе), шашки и параллелепипеды (пироксилин, тол; мелинит) и т. п *).
Говоря о зарядах, необходимо кстати указать на так назы
ваемую плотность заряжания. Под этим термином разумеют от-
ношение веса заряда взрывчатого вещества (W) к весу воды,
заполняющей весь об‘ем (V'), в который помещается заряд.
. Л W
где d все единицы об‘ема воды, а т. к. он принимается за еди-
ницу, то формула принимает более простой вид.
_ W (в грм.)
- ~ У'(вкуб.с.м.)
Подобным образом трактованная „плотность заряжания" оказы-
вается тождественнй с т. наз. гравиметрической плотностью взр.
вещ., т. к. последняя также определяется для всего об‘ема, за-
) Филиппов. — Курс взрывчатых веществ.
\. . -
,м-.,нятого зарядом, т.-е. для всей совокупности частиц пл^.аерен .
'д, в. и промежутков между ними. Поэтому плотность за|цвЙания
или-гравиметрическая плотность всегда меньше действитйяЦвй
плотности в. в. определяемой для сплошной массы вепВДЙ*
КГ? . W '
/. формуле: Д = практически выгоднее давать выражение:
JT., , » «'• •
л J__ W __ W/W __ 1
А — у/ — V'/w ~ V'/W
1
v, т.-е. определяя ее отношением еди-
ницы веса к соответствующей части об'ема. Детально о плотности
в. в. будет говориться особо.
ГЛАВА II.
Процесс сгорания взрывчаты^ веществ.
_ Всякое взрывчатое вещество’ сгорает не
* и мгновенно, но теория и лабораторная практика
н .. поз воляют разбить Процесс сгорания его на не-
веществ. сколько фаз, продолжительность которых и зави-
симость их от внешних и внутренних факторов, являются крайне
существенными для теоретической трактовки процесса сгорания. В
этом отношении наиболее подходящим об'ектом для изучения явля-
ется порох, как взрывчатое вещество, горящее крайне медленно.
Предварительно заметим, что надо различать скорость горения
зерна (толщина сгоревшего слоя зерна в единицу времени) быст-
роту сгорания всего заряда в совокупности, при чем эта последняя,
будучи отнесена к зарядам одинакового веса, характеризуется време-
нем, в течение которого сгорает весь заряд.
Как бы не была мала величина зерен взрывчатого вещества и
как бы не была велика скорость горения его, взрыв заряда является
рядом последовательных явлений. Чтобы нагляднее проследить эти
явления, рассмотрим случай обыкновенного горения, протекающего
более медленно и потому легче поддающегося анализированию. Застав-
ляя гореть дрова, мы сначала зажигаем их, то-есть вызываем горение
их в одной хотя бы небольшой части поверхности дров. Пламя, воз-
никнув в том месте, быстро распространяется по всей поверхности
дров—происходит воспламенение и уже после этого горение начинает
проникать от поверхности вглубь древесины. Это последнее и является
собственно горением, при чем оно протекает гораздо медленнее, чем
«воспламенение, так как твердые, жидкие горючие тела и газы, не
будучи предварительно смешаны с воздухом, охватываются им по
ружной поверхности, только по которой и' происходит горение.
При взрывчатых веществах значение внешней неверности устра-
ется, но все указанные только что явления — зажжение, воспламе-
ие и горенйе — имеют место. И здесь обыкновенно воспламенение
текает с большей быстротой, нежели собственно горение, так как
горячее пламя, охватывая свободно поверхность сразу на большое
расстояние, зажигает и следующие участки поверхности; проникно-
»вение же тепла вовнутрь может происходить, в твердом веществе,
толькЬ теплопроводностью и отчасти через посредство пор, избежать
которых в твердом веществе почти невозможно. При взрыве эти три
явления как бы сливаются в одно, маскируются и чем больше скорость
взрыва, тем труднее различить их. Йр их самостоятельное значение
всегда можно подчеркнуть, даже при гремучей ртути, которая обыкно-
венно всегда взрывает Так, например, гремучая ртуть, будучи поме-
щена в пустоте, дает от прикосновения накаленной проволоки слабый
взрыв только частиц непосредственно соприкасающихся с проволокой
и, так как скорость воспламенения и горения в данных условиях;
очень замедлены, то образующиеся при взрыве частиц газы разбра-
сывают остальные частицы ранее, чем наступит их разложение.
Представляется восможным искусственно затруднять эти явления
и отчасти даже разделять их: обливая полено водой, мы сильно замед-
ляем воспламенение (распространение пламени по поверхности):, по-
крывая поверхность зерен взрывчатого вещества каким-либо закупо-
ривающим его поры и неровности недеятельным веществом, мы можем
затруднить зажигание его. Наконец, восможно замедлить и воспламе-
нение и горение взрывчатого вещества, что успешно достигается при
приготовлении бездымного пороха; желатинизируя пористую массу
пироксилина, даже и прессованного, получают почти однородную бес-
пористую плотную массу. Лента бездымного пороха горит только с
зажженного конца, при чем горение происходит сравнительно медленно
поперечными слоями, совершенно не распространяясь по поверхности
ленты. Достигаемое замедление горения настолько значительно, что
скорость сгорания, например, русского бездымного пороха #ля 3 дм.
скорострельной пушки на открытом воздухе равна 4,5—5 мм. в секунду.
Отметим, что лента обращенная зажженным концом вниз сгорает в
10—20 раз быстрёе, нежели та же самая обращенная горящим концом
вверх; по этому факту можем судить, что охватывание пламенем является
значительным фактором в скорости процессов воспламенения и горения.
Таким образом, имея с точки зрения химии дело только с одним
явлением—горениём, мы для удобства, изучения внутренней балли-
стики взрывчатого вещества выявляем три последовательных элемента
>того явления: 1) зажжение заряда взрывчатого вещества, т.-е. воз-
буждение посредством внешней энергии (пламени, накаленного тела,
удара., трения и т. п.) горения в какой-либо частице его, 2) воспла-
менение, т.-в. самостоятельная передача зажжения но всей поверхности
зерен заряда и 3) собственно горение, т.-е. распространение горения
от поверхности заряда вглубь его;
Скорость воспламенения и горенйя взрывчатого вещества зави-
сит от природы его, но под влиянием различных физических усло-
вий, эта скорость может изменяться в большj ю или меныпую сторону
даже для одного и того же взрывчатого вещества. Так скорость вос-
пламенения можно уменьшить:
а) уменьшением давления, так как в этом случае пламя свобод-
нее расходится в стороны, в противоположность воспламенению в замк-
У
Мек
tu1
$
to
1.4 '•
f
[<
*
— 41
V'
; А' Ч
&S..
й
нутом пространстве, когда газы, будучи не в состояний це-
ликом обращаются на само вещество; '
б) более гладкой, тщательно полированной поверхность^^/
• в) увеличением плотности взрывчатого вещества:
г) уменьшением величины сечения слоя зерен, насыпанн
рожкой, так как, чем тоньше слой, тем отдача теплоты в стер
больше;
д) покрыванием или пропитыванием зерен с поверхности, инерт-,
ными веществами. Так, например, действует на ружейный бездымный,
порох графитойание. '
Все эти условия сводятся, собственно, fs. двум причинам: во-пер-
вых/к уходу теплоты в сторону от поверхности взрывчатого веще-
ства, Во-вторых, качеству самой поверхности, способствующей пла-
мени более легко скользить по ней, отчего теплота также, проносясь
мимо, распределяется на больший об‘ем, поэтому температура Полу-
чается в данном месте меныпая.
Скорость, собственно, горения уменьшается при:
а) уменьшении давления, по той же причине, как я в случае
(Воспламенения;
б) при большей плотности взрывчатых веществ;
в) при добавлении инертных примесей и
г) при увеличении теплопроводности и теплоотдачи, что наблю-
дается в непереходящем в горение тлении зажженной пироксилино-
вой нити, обвитой вокруг железного прута, бцстро поглощающего
отделяющую пироксилином теплоту (этим же обгоняется и неспособ-
ность горения на воздухе металла в куске). >
В то время как качество поверхности взрывчатых веществ (а так-
же поверхности зерен) не влияет на скорость, собственно, горения,
плотност ь взрывчатых веществ сохраняет свое влияние на цее, также
как й на скорость воспламенения. Это можно об‘яснить тем, что уве-
личение плотности того же самого вещества, приводя к уменьшению
числа пор, затрудняет проникновевие пламени через них внутрь, го-
рящая поверхность постоянно сохраняет подобие -первоначальной по-
верхности зерна и все явление приближается к горению концентри-
ческими слоями. Наоборот при малой плотности того же самого ве-
щества имеем большее количество пор, через которые пламя быстро
проходит внутрь зерна, скорость сгорания его увеличивается и про-
текает так же; как. если бы зерно это было не сплошное, а состоял^
из мелких зерен в волокон.
Остается выявить влияние величины зерен на скорость сгорания.
Уменьшение величины зерен приводит к повышению давления (даже
на открытом воздухе), а последнее уже и увеличивает скорости,
собственно, сгорания; таким образом быстрота сгорания- заряда тем
больше, чем мельче зерно. При обыкновенном давлении масса пороха,
представляя собой одно сплошное зерно больших размеров, сгорит
в наибольшее время; та же масса в виде мякоти—в кратчайшее время;
ррохсо средней величиной зерен сгорит в течение времени, вели-
Ина которого будет заключаться между этими двумя крайними пред-
Жгами. Вместе с тем при уменьшении величины зерен все большее
Лшйество пороха приходится на долю воспламенения, атак каково
газы, будучи не в состояний j:
л. "„
Ля>Мг
h 11 If®#
-4.
ire Л,
' Ч'
. '$
у1л
..йЬж
<О
ы,ЛTU
. "SU,
.
г' ' t^'l
i
•'. i
?и
AiiJlJ
•-4М
?
♦5
А
•?%
••< W-]
- J ,:
происходит с большей скоростью, чем горение, то и время сгорания
заряда сокращается еще более.
Иными словами: заряд измельченного взрывчатого вещества
является как бы одним зерном его, но с огромной поверхностью,
равной сумме поверхностей всех зерен. к
Именно поэтому от дымного пороха в виде пороховой мякоти, с
целью замедления сгорания заряда, перешли к зернению его. Ленты
же бездымных порохов делаются тем толще, чем больше требуется
времени для сгорания пороха, чтобы с увеличением длины канала
орудия и времени движения снаряда, образование новых количеств
газов было бы обеспечено; в противном случае, по сгорании всего за-
ряда, давление на снаряд будет быстро падать, вследствие увеличения
заснарядного пространства.
Итак, с увеличением скорости горения, уменьшается время его
рания заряда, потому что время сгорания всего заряда приблизитель-
но равно таковому же для отдельного зерна, при увеличении же быст-
роты сгорания, например при уменьшении величины зерен, увеличи-
вается и скорость горения и, особенно, воспламенения, потому Что при
ртом возрастает давление, а с увеличением давления возрастает ско-
вость горения и воспламенения.
Влияние давления на скорость горения легко об‘ясняется тем,
что под действием высоких давлений, доходящих до сотен тысяч ат-
мосфер, пламя начинает проникать в микроскопически малые поры
пороховых зерен, отчего даже весьма плотные зерна пороха уподобля-
ются при таких условиях пористому, даже зернистому веществу, по
которому горение распространяется не только теплопроводностью и не-
посредственным зажиганием одного слоя от другого, но и в силу про-
никновения пламени по порам вглубь вещества заряда. Таким обра-
зом, здесь роль давления диаметрально противоположна тому, чего
мы достигаем увеличением плотности пороха.
§ 2. Взрывчатое разложение и Взрывчатое разложение для своего воз-
чувствительность в. в. ко взрыву, никновения всегда требует некоторой за-
траты внешней энергии в виде механических факторов или повышения
температуры, но в дальнейшем, вследствие своей экзотермичности, эта
реакция протекает сама собой, и вся задача внешнего импульса сво-
дится лишь к тому, чтобы хотя в одном месте или в небольшой части
данной системы,/довести скорость разложения до того предела, который
соответствует явлению взрыва. Возбуждение взрывчатого разложения
производится различными способами, а именно соприкосновением с
накаленным телом или огнем, быстрым поднятием температуры, дей-
ствием некоторых химических веществ, ударом, трением и взрывом
некоторых /Взрывчатых веществ, как то: гремучей рту^и и других де-
тонаторов.
Различие чувствительности равнообразных взрывчатых веществ
к упомянутым выше возбудителям об ясняется причинами химического
и физического характера. Важнейшим химическим фактором, влияю-
щим на чувствительность, является непрочное, шаткое строение мо-
леку л. Байер, изучая взрывчатые свойства ацетилена и.е^яроизвод-
ных, указал, как на одну из причин взрывчатости этих 'Ымт^едий
на тройную связь углеродных атомов С = С. *.
Вант-Гофф высказал взгляд, что обилие взрывчатых вещШ^Н'
классе органических углеродистых соединений объясняется тем, ‘Як
атомы водорода, азота,, кислорода и углерода находятся в естесщ^й^й
ной непрочной группировке, и при малейшем внешнем импульсе сой
вершается перегруппировка их в более прочные и естественные соче*.
тания, причем обычно образуется углекислый газ, вода и свободный
азот, а в случае недостатка кислорода окись углерода, водород, и азот.
Характерным признаком малой устойчивости молекул могут служить'
следующие типичные группировки элементов:
О — О В озоне и некоторых перекисях. ,
О — CI В хлорноватых и хлорнокислых соединениях и перхло-'
ратых.
N — С1 или вообще галлонды. В хлористом азоте NC1,.
N == 0. В органических и неорганических производных азотной
и азотистой кислот, в нитро-производных и т. д.
N -- N. В диазосоединениях, в азотисто-водородной кислоте и ее
производных.
N~C. В гремучих солях и циане.
Сн=С. В ацетилене и его производных.
Нахождение в молекуле кислорода, водорода пли углерода, рядЪм
с упомянутыми выше нестойкими комплексами, еще более увеличивает
способность к перегруппировкам. Вследствие этого делается понятным,
что в азотных эфирах, вроде нитроглицерина или пироксилина, чув-
ствительность к внешним импульсам сильно повышается по мере уве-
личения в них числа нитрогрупп. Это можно видеть из примера ни-
тропроизводаых фенола:
C6’I4<0u2 . не взрывает от капсюля в 2 грм. гремучей ртути.
<ЗвНз<0д 2 . . взрывает от капсюля в 1 грам. „ я
C€H2 <*)3 . . взрывает от капсюля в 0,3 грм. гремучей ртути.
На основании подобного же рода рассуждений Вертело пришел
к общему заключению, что чувствительность взрывчатых веществ, при
прочих равных условиях, возрастает по мере увеличения теплоты
разложения. Опытные данные вполне подтверждают это, а именно:
эндотермические соединения выделяют вообще большие количества
тепла при разложении, чем экзотермические и вместе с тем они осо-
бенно чувствительны. Так, соединения^азота с хлором, бромом и ио-
дом являются наиболее чувствительными из всех известных взрыв-
чатых реществ, а так как по мере увеличения атомных весов галоидов
эти соединения становятся все более эндотермичными, то параллельно
с этим увеличивается и чувствительность их к внешним импульсам.
Диазосоединения, металлические производные ацетилена, гремучие
соли, адиды и т. ц. также являются прекрасным доказательством
правильности взглядов Вертело. Необходимо, однако, при этом ука-
зать на-то, что иногда при большом сходстве в отношении термохи-
мического характера образования двух веществ, они резко отличаются
друг от друга по своей чувствительности. Так, например, азид ртути
(Ns)a Hg имеет теплоту образования — 61,3. калории, а гремучая ртуть
(CNO)2 Hg—62 калории и, следовательно, можно было бы /ожидать
существование у них одинаковой чувствительности, а между тем пер-
вое из них отличается своей исключительной чувствительностью в
отношении удара и трения, тогда как другое значительно более инерт-
но и нашло себе большое применение в технике взрывчатых веществ.
Большая часть практически применяемых взрывчатых веществ
относится к числу экзотермических соединений (нитроглицерин, пи-
роксилин, нитропроизводные ароматического ряда и др ) и, вместе с
тем, они обладают значительно меньшей чувствительностью по срав-
нению с упомянутыми выше эндотермическими взрывчатыми веще-
ствами.
Наряду с этим химическим фактором’, в виду малой устойчивости
молекул, а также большого теплового эффекта разложения взрывчатых
веществ, огромное влияние на чувствительность имеет также и целый
ряд физических условий: как то температура, при которой находится
взрывчатое вещество перед моментом своего разложения, структура
вещества, его плотность, твердость, теплоемкость и т. п.
Влияние этих факторов нередко может иметь полное преоблада-
ние над влиянием химических свойств вещества.
Рассмотрим влияние • некоторых из упомянутых выше факторов
более подробно. •
1) Температура. Чувствительность данного, взрывчатого вещества
тем больше, чем выше температура, при которой оно Находится. Это
вытекает из того, что чем выше начальная температура взрывчатого
вещества, тей меньше энергии, потребной для воспламенения идет
на нагревание всего вещества или части его до той температуры,
которая обусловливает начало взрывчатого разложения. Кроме того,
с повышением температуры увеличивается и скорость распростране-
ния реакции. Начавшееся разложение выделяет тепло, которое идет
на нагревание соседних слоев до температуры взрывчатого разложе-
ния и т. д. и чем выше начальная температура, тем меньше будет
теряться тепла на лучеиспускание и, следовательно, данным его коли-
чеством больше вещества будет нагрето до предельной температуры.
Характерным примером в этом отношении является целлулоид,
представляющий твердый роговидный материал, приготовляемый из
нитроклетчатки, камфоры и различных посторонних примесей, при-
бавляемых для придания массе вида слоновой кости, черепахи и
т. п. Заженный целлулоид сгорает совершенно спокойно. При обык-
новенных температурах совершенно не чувствителен к ударам, но,
нагретый до температуры близкой к температуре воспламенения ве-
щества (160—180°), делается очень чувствительным и разлагается при
ударе со взрывом.
Хороший пример зависимости чувствительности от исходной
температуры представляет собой нитроглицерин (по данным работы
Кронквиста): z л.
Температура. Живая сила удара» необхо’ димая для взрывания.
16° 94° - 182° 1 0,2 килограмм-метр. 0,1 ,,, Самый легкий удар.
<
Тоже самое наблюдается для некоторых нитроглицериновых пре-
паратов, что можно видеть на нижеследующей диаграмме.
' '
ГЖ Л. • , • *
1 Рис. 11. Графика зависимости высоты падения груза, падающего и
взрывающего навеску в. в., от температуры.
— 46 —
' *
о
Вообще все взрывчатые вещества становятся особенно чувстви-
тельными ко взрыву при температуре начинающегося медленного
разложения их.
Если будем-брать равные массы различных веществ, то чувст-
вительность их будет зависеть от соответствующих температур на-
чала разложения. Например, температура разложения бертолетовой
соли (350°) значительно ниже, чем азотнокислых солей (выше 450°),
чем и об‘ясняется большая чувствительность к взрыву пороха с
бертолетовой солью.
2) Структура вещества оказывает большое влияние на измене-
ние чувствительности, так как чем плотнее вещество, тем лучше бу-
дет его теплопроводность, а, следовательно, и тем больше придется
затратить энергии извне для возбуждения взрывчатого разложения.
Этим обгоняется, например, значительно меньшая чувствительность
прессованного пироксилина по сравнению с рыхлым.
Практически чувствительность взрывчатых веществ ко взрыва-
нию определяется 2-мя способами: чувствительностью к удару и к
температуре зажигания.
1) Для испытания взрывчатых веществ в отношении механиче-
ской стойкости (чувствительность к ударам) применяются следующие
методы:
а) Удар молотком на наковальнях различной твердости, выбо-
ром которых можно установить некоторую последовательность в из-
менении чувствительности взрывчатых веществ.
б) Трение в шероховатой ступке грубым пестиком или между
двумя шероховатыми поверхностями, покрытыми песком или стеклян-
ной бумагой. ''
в) Падение взрывчатого вещества (в упаковке или без нее) на
твердую подкладку.
г) Стрельба по взрывчатому веществу с различных расстояний.
д) Наиболее распространенным и точным методом можно счи-
тать испытание на специальном копре, где при данном весе падаю-
щего . ударника мерою чувствительности служит минимальная высота
падения, при которой взрывчатое вещество способно подвергаться
взрывчатому у разложению.
Этот способ можно считать наиболее пригодным для определе-
ния чувствительности к удару и весь вопрос заключается лишь в
том, чтобы точно установить условия его применения для точных и
сравнимых между, собою результатов (вес ударника, материал и
устройство наковальни, количество взрывчатого вещества, его уплот-
нение и т. п.).
В следующей таблице приводятся данные испытания некоторых
взрывчатых веществ при падении груза в 2 кгр. на 0,10 грм. подсу-
шенного при 40“ взрывчатого вещества:
'ч
шкрат
>1
1
' и
. Взрывчатое вещество
Высота п>- Классн^ика
дения в см. терм
рчая ртуть......
роглицерин (сухой)
ат
5
свинца.
серебра,
железа,
меди. .
i
х
->
. $ h
Динитроглицерин (сухой)
Рурдинамит пластическ.
^Гремучий студень пластический.
Г -
;|Гремучий студень замерзший. .
[Желатин-динамит пластичный. .
ВГурдинамит замерзший. ....
^Гремучий студень из динитрогли
К церина,......................
Гур динам ат из динитроглицёрина.
’Кубический порох..............
г.
Класс 1.
Высота падания
7см.
Откапсюля—детона
тора и аналогия
ных по чувств»
тельности воспла
‘ менителей взрыва-
ют.
К перевозке по же -
лезным дорогам не
допускается.
Класс 2.
Высота паден ия 7 -25
см.
Признаются опасны-
ми по возможности
взрыва.
Тринитрокрезол
Шеддит тип 60.
У:-* >
ШРотвейльский порох № 1.172.
ОБдодымный охотничий порох.
ЦЦйластинчатый порох. . . . .
Е|Пикри новая кислота*) ... . . .
Шеддит тип 41..............
Овксанитро-дифениламин. . -
Гринитробензол.. ........
%транитро-метиланилин’) . .
тринитротолуол*)
12
12—15
20
2Э
26—30
30
32
30—45
30—54
35—95
36
40
40—50
40—65
57—90
(и ДО 180)
..
Класс 3.
Высота падения 26 -
100 см.
/
) В различных условиях опыта: вещество подсушено или нет; в порошке или
>вано, без оболочки или в станиоле, без ударника или с ним.
<АУ';
Взрывчатое вещество.
Пикрат цинка..................
Черный порох, оленья марка 4. .
Пикрат аммония. . . . . . ... ,
Пикрат натрия. ...............I
Пороховая мякоть к... . . . . . .. I
Прессованный пироксилин с 15%
влажности. ... . . . '. . . .
Тринитро-диметиланилин. . . . . ;
Коллодионный пироксилин прес- }
со ванный с 15% влажности . . I
Черный порох (крупнозернистый), j
Робурит 1а. . . . . . . . . . . j
Аммонкарбонит . . . ... . . .
Астралит..................
!
I
i
Доварит . . . . . . . . . . j
Динитробензол. ......... j
Взрывчатое вещество Ротвейлеров-;
ской фабрики ...... 4 !
Динитрофенол. ........
6
Петрокластит................- •
Тринитроксилол ..... . . .
Тринитронафталин..............1
Фульменит. ........" . . . . . .
Высота па- Классификация и харак-
дения в см. теристика.
60
• 70
/• 80
• 80
85
85 .
05
100
100
105
ПО
по
но
120
135
150
150
170
175
более 180
Высота падения 26—
100 см.
* *
/
| Класс 4.
Высота 100—200 см.
Нитроклетчаткас со-
держанием более
20в/в влажности не
чувствительна к
удару,зажигатель-
ным шнуром не за
жигается, опас-
ность взрыва .не
исключена
- и
й'
Безопасные в обра-
щении вещества;
мало чувствитель-
ны к удару, трудно
I воспламеняются и
от зажигательного
шнура не горят;
опасность взрыва
исключена.
I Ароматические ни-
тросоединевия ма-
ло чувствительны
к удару,тру дно вос-
пламеняются и от
зажигательн. шну
ра не горят; опас-
ность взрыва ис-
ключена.
г
I
^^ВЭрывчатбе вещество.
-I
более 180
более 1SO
приведем
. . 0,4
я
»
is
180
180
180
. 0,5
. 0,8
. 0,9
. 0.9
»>
>>
к
фульменит. . .
^леровский минный порох
йиский безопасный порох .
^йилин с 20е/, влажности
данные, полученные
кислоты и пикратов
0,3 кил. мет. ')
I
’М
рдионный пироксилин с содер-
яием более 2О’/о влажности .
Дополнение к этой таблице
Забудским по взрываемости пикриновой
Пикраты: РЬ
Ро.
.•£
i
1
Высота па- Классификация и тара-
деиия в см. ктери стика.
lift.
AS
Пикриновой К-ТЫ.....................1,1
Ж; _
g; Сравнивая данные этих двух Таблиц мы находим следующее:
^гремучая ртуть и по отношению к высокой температуре и к удару
Яяется наиболее чувствительной из всех приведенных, да и на
|<ктике в действительности она является одной из самых опасных
Обращении; 2) обе Таблицы показывают значительную разницу в
ЙЙТвительности пикриновой кислоты и ее пикратов, а так как мы
Жда ве можем быть уверены, что от соприкосновения мелинита с
Валами и их окислами, несмотря на изолировку, не получится пи-
£а, то это обстоятельство послужило главной причиной оставле-
мелинита и перехода к тротилу; 3) бездымный порох (и пирокси-
||Являются гораздо чувствительнее, чем дымные; 4) инертные при-
(в динамитах) и влажность (в пироксилине) делают вещество
Be чувствительным и к-температуре и к удару; 5) также действует
чение плотности, по крайней мере по отношению к удару, т. к.
|Г УДаР воспринимается большей массой вещества и, значит, на
[ую частицу Приходится меньшая механическая энергия и, кроме
(^увеличивается теплопроводность (порошкообразные, кристалли-
jk прессованные и плавленные пикриновая кислота, тротил и
11
••< е^нг*.
Досмотрим теперь более подробно взрываемость различных взрыв-
“рвществот нагревания.
Ж
J
4
1о исследованиям проф. А. А. Солонины чувствительность азида-свинца, за-
дгчфупности кристаллов его и др. обстоятельств, можно считать в порядке
вил.-метр. ? т. е. гремучая ртуть чувствительнее его в 2—3 раза.
1. г
QfxapeacKaii. Взрывчатые вещества н взрывные работы. 4
I
f'
г.
йЯ
is
i
(
I
Обыкновенно для возбуждения разложения взрывчатых веществ
путем нагревавия, вещество должно быть нагрето до определенной
температуры, которая называется температурой воспламенения. ’)
Для более точного уяснения зависимости взрывчатого разложе-
ния от нагревания, рассмотрим отдельно эту способность различных
взрывчатых веществ вообще и у порохов и газовых смесей в част-
ности:
а) при однообразно быстром нагревании (в парафиновой ванне)
для различных взрывчатых веществ различают следующие темпера-
туры воспламенения: (данные Виллем 2).
Дымный порох около.......................... 300* ц.
। _ ( одиннадцати азотный . 183’—186*
Пироксилин: I десяти азотный .... 186*-ЦК)’
Нитроглицерин...................... 160*—220°
Кремнистый динамит с 75°/0 нитрогли-
церина ....................... 180*—200*
Гремучий студень . . . ... 180*—200°
Бездымный пироксилиновый мелкий по-
рох ........... ............... 173*—176*
Тоже крупный....................... 168’ 172*
Нитроманнит........................ 160*—170®
Нитрокрахмал....................... 170*-175°
Бездымный нитроглицериновый порох
(с 40’/, нитроглицерина) .... 170*—180°
Пикриновая кислота—взрывается очень
трудно при Нагревании даже до крас
ного каления.
Пикраты..................................... 260’*—360’ 3)
Гремучая ртуть.................. 160’—165’
б) Температура и скорость воспламенения порохов от нагревания
зависит как от химических, так и от физических свойств их. При
быстром нагревании, температура воспламенения дымного пороха лежит
Ь Очень медленное приращение температуры при определении температуры
зажигзни i м »жет не дать истинных показаний, т. к. многие вещества при этом мед-
ленно разлагаю си без взрыва или взятые в сравнительно большом количестве мо-
гут окончить свое разложение взрывом, хотя внешвяя температура далеко не дохо-
дит до температуры зажигания. Эго потому, что самим веществом, вследствие ре*
акций разложения (Экзо), производится разогревание до этой температуры. Так, по
исследованиям пр<-ф А А Солонины, взмывание гремучей ртути происходит ок. 160°;
при она совершенно не изменяется, от \9° приблизительно» начинается ее мед-
ленное риз южение вплоть до температуры взрывания (ок. IbO% при чем при малых
навесках они не оканчивается взрывом; но при большой навеске ^0,8 гр.), в толстом
слое, взрывает уже при наружной температуре в 100—991ЛГ
21 ОД грм. Взрывчат, вещества бросают в пробирку, когда температура = 100°
и под‘нм температуры регулируется так, чтобы каждую минуту она поднималась на 5°*
*0 Пикрат СВИНЦ1 имеет температуру воспламенения 260»
железа я я я ЗОН»
меди Я я я 310’
п цин^а W » я 315’
л алл ю миния „ „ я 3 0’
,, Кил ИЯ ю * г> 335»
я бария » н я 340»
й олова я Я » 360»
не про-
300°
нагревании его воспламенение не про-
114°—120* начинает плавиться, зерна
а при медленном
т совсем, ибо сера при
»тся, а при дальнейшем повышении температуры сера испаряется
»0°), и порох вспыхивает без взрыва. Вообще температура вос-
:ения дымного пороха тем выше: 1) чем тщательнее смешаны
у собою составные части, 2) чем больше плотность его и 3) чем
» обожженный уголь входит в его состав.
Скорость воспламенения ленточного бездымного пороха на от-
эм воздухе равна скорости его горения, т. к. ленты его горят па
атом воздухе вполне" спокойно и медленно, при чем сгорание
сходит лишь поперечными слоями, 'не распространяясь вспышкою
всей поверхности.
в) Температура воспламенения газообразных взрывчатых смесей
ьма высока и различается существенно для разных смесей. Еще
1И показал, что тонкая железная проволока (0,65 мм. толщиной)
спламеняет водороднокислородный гремучий газ при темно-красном
лении; смесь окиси углерода с кислородом—при красном калении,
рудничный газ не всегда воспламеняется и при белом калении про-
волоки.
J Ле Шателье и Малляр произвели систематические наблюдения
вад температурой воспламенения газовых смесей, при чем получили
•следующие данные:
смеси.
Температура и вос-
пламенения. (
об
об
Г2
л 2
F.. U
$$06. СЕЦ4
fej2 06.СН4-Н8
об. О
об. О,
об.
об.
об.
об.
или 4 об. воздуха .
или 4 об. воздуха . .
воздуха.
530° С
550»—570°
f55O°—660*
6900—710°
630°—650"
650°—750“
О
1
О . .
Из этих чисел
видно, что температура воспламенения мало из-
|ется даже от большой примеси посторонних газов, за исключе-
К влияния примеси углекислоты к смесям, содержащим окись
фода. Гремучие смеси, заключающие окись углерода, взрывают
: значительно высшей температуре 630° — 650°, чем водородные
•Ч 530—570°.
Необходимо заметить, что на воспламеняемость газов оказывает
те контактное действие
ствие пористости угля,
адной смеси понижается
тел и еще другие обстоятельства. Так,
температура воспламенения гремучей
в присутствии его до 350°. Указанные
4*
выше числа Ле-Шателье и Малляра, относятся до закрытых фарфо-
ровых сосудов. В стеклянных сосудах температура воспламенения во-
дородной смеси будет несколько выше (около 600°). Присутствие влаж-
ности может также иметь значение. По опытам Диксона, хорошо вы-
сушеная (над фосфорным ангидридом) смесь окиси углерода с кисло-,
родом совсем не взрывает ни от искры, ни от накаленной платиновой
проволоки. Между тем при следах влажности взрывание, совершается
при to =650°—660°, что можно об’яснить образованием при этом из
воды перекиси водорода Н2О2, содействующей ходу таких реакций.
Относительно воспламеняемости газообразных взрывчатых смесей
наблюдения показывают, что довольно значительные уклонения в
смесях от наивыгоднейшей пропорции кислорода не уничтожают
взрывчатости системы. При этом, однако, состав продуктов меняется;
в них появляется или свободный углерод или продукты неполного-
Горения углерода.
ГЛАВА III.
Детонация и взрыв через влияние;
Подобно тому, как горение в различных случаях
1. Детонация. "может протекать с различной скоростью, доводя в пре-
деле до вспышки и взрыва, взрыв может отличаться по скорости про-
текания процесса. В пределе скорость эта может быть настолько боль-
шой, т. е. взрыв происходит в такой короткий промежуток времени,
что практически, оперируя с небольшими об’емами взрывчатых ве-
ществ, этим промежутком времени можно пренебречь и считать, что
взрыв происходит мгновенно, что вещество мгновенно обращается в
газы, которые в первый момент занимают об‘ем, равный об'ему веще-
ства ДО взрыва. Такой взрыв, протекающий в минимальный промежуток
времени, называется детонацией или взрывом 1-го рода в отличие от
обыкновенного взрыва, именуемого взрывом 2-го рода. В течение этого
весьма короткого промежутка времени развивающаяся теплота не
- успевает уйти ни непосредственной передачей, ни лучеиспусканием,
что обусловливает огромную упругость газов, образующихся в первый
момент детонации и наивысшую температуру. Вследствие этого дето-
нация дает наибольшую силу разрушительного действия и наибольшее
количество газов, об’ем которых увеличивается с температурой, а
также отчасти вследствие более полного разложения и отчасти вслед-
ствие диссоциации. В то время, как образуемые При обыкновенном
взрыве и при детонации количества теплоты являются близкими, раз-
рушительное действие весьма различно. Сводя опыты Ру и Сарро
по измерению разрушительного действия, получаем следующую инте-
ресную таблицу, в которой сила разрушительного действия ружейного*
лшмного пороха, воспламеняемого обыкновенным способом, ярянмта за
вДЯНИЦу:
1 ? Теплота горения. ' - Разрушительн.
Обыкнов. взрыв. Детонация. Обыкнов. взрыв. ДетоййШ * *
1 Руж. дымн. пор. 1 730 730 1 ' *
Пикриновая кислота ... 830 870 _ о 5,5 -
Пироксилин ....... 1055 1060 3 6,5
Нитроглицерин ...... 1720 г 1775 4,8 10,0
Наглядным примером разницы, существующей между обыкно-
венным взрывом и детонацией, может служить следующий опыт: если
возьмем два куска железнодорожного рельса, положим их концами
на прочные подставки таким образом, чтобы они имели совершенно
•одинаковые пролеты, на середине рельсов, на верхней площадке го-
ловки, укрепим открыто, по одинаковому (достаточной величины)
заряду взрывчатого вещества, могущего давать по <желанию взрыв
1-го и 2-го рода, и произведем взрывы, то увидим, что тот рельс, на
котором имел место взрыв 2-го рода, останется целым, между тем как
другой взрывом 1-го рода будет разбит, деформирован, словом, будет
носить следы необыкновенной силы Удара,. которому он подвергался.
Впервые явление детонации было открыто Нобелем в 1864 г. на
нитроглицерине, при взрывании его капсюлем гремучей ртути. Нитро-
глицерин, побужденный к разложению накаленным телом или пла-
менем, сгорает на открытом воздухе либо совершенно спокойно, либо
дает слабый взрыв, от капсюля же гремучей ртути онЩаже на от-
крытом воздухе всегда взрывается необыкновенно быстро, производя
механическое действие, во много раз превышающее таковое в первом
случае.
Спустя четыре года, Абель заметил эту способность у пирокси-
лина и тщательно изучил этот вопрос; им было обнаружено, что:
1) Сухой прессованный пироксилин легко взрывается с громад-
ной скоростью от капсюля гремучей ртути, при чем скорость детонации
-его колеблется, в зависимости от плотности прессованной массы, от
5300 до 6100 метров в секунду.
2) Не только сухой, но и влажный пироксилин способен к дето-
нации, при чем эта способность ко взрыву от гремучей ртути посте-
пенно ослабевает с увеличением в пироксилине влажности; так при
,5°/0 влаги пироксилин уже не всегда взрывает от 1—2 грамм гремучей
ртути, при 17 /0 необходим уже капсюль с 15 грамм, ее, а при 30*/а
Пироксилин совсем уже становится нечувствительным к гремучей
!ртути; на влажный пироксилин хорошо действует запал сухого пиро-
ксилина, взрываемого в свою очередь гремучей ртутью; по опытам
Абеля 140 грамм сухого пироксилина способны взорвать какое угодно
^количество влажного с любым процентным содержанием влаги.
3) Рыхлый пироксилин от гремучей ртути дает только частичную
детонацию, а большая часть его разбрасывается в несгоревшем состоянии.
4) Гремучая ртуть вызывает детонацию в пироксилине не только
при непосредственном соприкосновении, но даже и на некотором рас-
стоянии, даже в случае отделения его от заряда небольшим слоем
воды или твердою перегородкою; так, напр., капсюль в 2’/, грамма
гремучей ртути, будучи отделен от поверхности пироксилинового
заряда медным экраном и находясь на расстоянии 30 м.м. от заряда,
все таки вызывает детонацию его.
5) Количество гремучей ртути, необходимое для взрыва сухого
пироксилина, зависит от толщины и плотности капсюльной гильзы;
при плотно вставленных в прессованный пироксилин капсюлях, при
латунной гильзе достаточно всего лишь 0,3 грамма гремучей ртути,
тогда как, при бумажной гильзе ее требуется один грамм, если же
латунный капсюль вставлен свободно, то для обеспечения действия
необходим капсюль не менее 2-х грамм.
6) Гремучее серебро дает такие же результаты при взрывании,
как и гремучая ртуть; хлористого азота требуется для взрывания в
10—15 раз больше по сравнению с гремучей ртутью; йодистый азот
ни в каких количествах детонации пироксилина не вызывает; нитро-
глицерин в количестве не менее 60 rpajiM, также может служить
детонатором для пироксилина; смесь гремучей ртути с бертолетовой
солью, в несколько больших количествах, чем чистая гремучая ртуть,
также способна детонировать. Эти данные указывают на то, что причина
детонации пироксилина заключается не в одном только количестве
тепла, выделяемом детонатором при сгорании, так как, например,
состав из 80’/# грамм гремучей ртути и 15’/0 бертолетовой соли выде-
ляет на единицу веса на 10°/# больше количество тепла, чем чистая
гремучая ртуть, а между тем он действует хуже ее.
На основании своих опытов, для об‘яснения явления детонации
Абель предложил' свою теорию синхронических колебаний, которую мы
рассмотрим несколько дальше.
Дальнейшими исследованиями различных ученых явление дето-
нации было рассмотрено по отношению ко всем взрывчатым веществам,
при чем выяснилось, что оно распространяется далеко не на все
вещества; для детонирования многих из них лучше брать не гремучую
ртуть, а какие либо другие детонаторы, так, по данным Ру и Сарро,
для того, чтобы вызвать детонацию черного пороха лучше применять
нитроглицерин, в свою очередь взрываемый капсюлем гремучей ртути.
Плавленный тол и мелинит лучше всего детонирует от запальных
патронов, спрессованных из тех же самых веществ в порошкообразном
виде, в свою очередь взорванных гремучей ртутью, от чистой же
гремучей ртути очень часто эти вещества дают отказы.
Различный внешний эффект между взрывом и детонацией побу-
дил произвести более детальные исследования этого явления, и Абель
в 1868 г. опредилил опытами, что: 1) лучшим детонатором для пиро-
ксилина является гремучая ртуть*), 2) для влажного пироксилина
*) В настоящее время это уже не совсем так: имеются детонаторы вроде тетрила
лучше вызывающие детонацию даже нежели гремучая ртуть.
...ЛМ'
-.М
га ' л'
Ж:*'-
Ж?; 1
употреблять „запальные" шашки
из сухого,—детонирование
фого произвести тоже гремучей ртутью; 3) скорость распроотране-
детонации сухого пироксилина, в зависимости от плотности
£
^1,1—1,2), изменяется от 5300—6100 (5—6 верст). Эта скорости
/близка к скорости распространения звука в таких твердых средах, как
/ сталь, стекло и пр. (ок. 5200 -- -) и в 15—18 раз оольше скорости
р; в сек.
звука в воздухе (333 при 0е и 760 мм. давления).
- § 2. Скорость детона-'' Вертело и Вьелль в 80-х годах прошлого
\ цжг газообразны* взрыв-столетия произвели обширные эксперименталь-
Г чаты* веществ. ные исследования по вопросу о распространении
£ детонации во взрывчатых, газообразных смесях и зависимости ее от
| различных внешних условий как-то: расположения трубки с газом,
материала ее, длины и диаметра, значения открытых и закрытых кон-
g нов трубки, детонатора, начального давления газовой смеси и состава
/ смеси. '
В этих опытах испытывавшиеся газовые смеси заключались в
'"длинные трубки (40 метр, длины и 5 м.м в диаметре) с кранами на
обоих концах.
Около одного из кранов в трубке имелся боковой канал, в ко-
торый вставлялся, изолированный от трубки, электрический провод
для получения искры, служащей для воспламенения. В двух местах
трубки, с целью определения скорости распространения детонации,
помещались особые прерыватели, которые, в момент прохождения
взрыва через данные сечения, вызывали размыкание электрического
тока, что сейчас же отмечалось на хронографе Ле-Буланже.
Опыт показал, что на скорость детонации никакого влияния не
оказывают: положение трубки в пространстве (горизонтальное,4 верти-
кальное или загнутое), материал трубки, длина трубки, начальное
давление до 3-х атмосфер, закрывание и открывание концов, что об-
меняется громадными скоростями детонации, при которой газы не
успевают быть выброшенными из трубки при открытых ее концах,
г присутствие в трубке маленьких детонаторов и диаметр трубки, на-
чиная с 5 м/м. и выше; значительное же уменьшение диаметра труб-
ки понижает скорость детонации.
Большое влияние на скорость детонации оказывает изменение
состава смеси. Этот вопрос в отношении присутствия водяных паров
е; бйл более подробно изучен Диксоном, исследовавшим кроме этого
[^шияние температуры и давления.
По его исследованиям оказалось, что изменения начальной тем-
фатуры в пределах от 10* до 100° несколько понижает скорость де-
янии, что видно из следующих данных:
Температура в градусах
Цельсия.
10*
100°
t i
КС
Скорость
детонации
2821 — 8 метр.
2790 — 12 „
2581 — 2 метр.
2538 — 8 „
Изменение давления в пределах от 200 м/м. до 1500 м/м. оказы-
вает небольшое влияние на изменение, скоростей; так, для гремуле-
во дородной смеси:
Давление в м.м. 200 300 500 760 1100 1500
Скорость детонации 2627 2705 2775 2821 2856 2872 мет.веек.
В оксеуглеродных смесях (2С0 + Оз) скорость детонации нахо-
дится в довольно большой зависимости от присутствия водяных па-
ров и, возникающих в их присутствии, побочных реакций:
Количество влажности в % 0 1.2 2.3 3.7 5.6 9.э 15.6 38.4
Скорость детон. в метр. исек. 1305 1678 1703 1713 1738 1693 1666 1266
из этих данных мы видим, что сначала, при увеличении % содержания
водяных паров, скорость детонации возрастает и при 5,6% достигает сво-
его максимума, дальнейшие прибавки уже будут влиять отрицательно.
Ле-Шателье, занимавшийся вопросом о влиянии относительной про-
порции составных частей взрывчатых газовых смесей на скорости детона-
ции, показал, что подобно обыкновенному взрыву и здесь существует про-
порция с максимальной скоростью детонации и при уклонении от нее
в обе стороны происходит значительное уменьшение этих скоростей.
Примешивание инертных газов азота или воздуха—значительно
уменьшает скорость детонации, что видно из нижеследующих данных:
Состав смеси
Скорость распространения
детонации
2 обН+ 1 об. 0%2 об. N;
2 об Н + 4,7 об. воздуха;
2 об Н + 6,6 об. „
2 обН + 7,2 об.
2120 метр.
1440 ,
1210 „
детонации нет
Причина постоянства скоростей распространения детонации и
зависимость их главным образом от состава смеси, об'ясняется тем
обстоятельством, что эти скорости оказываются почти равными ско-
ростям движения газообразных частиц при тех температурах, какие
развиваются при взрыве, и следовательно скорость распространения
взрывной волны не может быть больше скорости поступательного
движения частиц. Так, по Бертелло, величины скоростей частиц и
величины детонации нижеследующие: ,
Состав смеси Скорость газовых частиц Скорость распрост- ранен. детонации
. .. .... %— • —-»м •*- п
} н2+0 * СО +О С2 Н2 + 50 С2 Hi + 60 СгН8 + 70 СН4+4О С. No+40 2850 метр, в сек. 1950 2650 2500 2450 2 50 2500 2800 метр, в сек. 1100 2500 2200 2350 2300 - 2200
||$фресть' дето-
if.’ жидкщс взрыв
‘гЙ»тых веществ.
жидких взрывчатых ве-
азотнокислого метила, нй-
Скврость детонации
ществ, главным образом,
троглицерина и панкластита, были детально- изу-
чены Вертело, Брюно и Вьеллем методом, приме-
нявшимся для исследования этого вопроса при газовых взрывчатых
(^ЙЬрях. Вещество ’помещалось в длинные трубки из различных ма-
териалов и различного диаметра, а .возбудителем взрыва служил
Йапсюль гремучей ртути. Опыты над азотнокислым метилом (Вертело
;<Ж Брюно), разлагающимся по одному, или сразу по двум нижесле-
) дующим уравнениям:
К 2СЫ:1ОХО
2
2CH.ONO, - СО, + СО + N„ + ЗН.,0
й • ** - ' • •• * к •
.доказали, что скорость детонации его находится в зависимости от
материала трубок и толщины их стенок, а именно, скорости убывают
по мере уменьшения прочности последних; так, при взрыве в каучу-
ковых трубках, внутреннего диаметра 5 м/м. и внешнего 12 м/м.,
скорость достигает всего лишь 1600 метров в секунду, в то время,
как в стеклянных трубках, при внутреннем диаметре 3 м/м и тол-
щине стенок в 1^ м/м, скорость равна уже 1900 метр., при том же
диаметре и толщине в 2 м/м., она равна 2200 метров в секунду, Д при
толщине 4’j, м/м, скорость достигает уже 2500 метров в секунду.
Нитроглицерин (по Вертело и Вьеллю) при температурах 12°—
14°С и узких трубках (с диаметром менее 3 м/м), трудно поддается
детонации, что обгоняется большой вязкостью нитроглицерина при
этой температур'е; при 18—20° скорость детонации становится нор-
мальной, достигающей 1300—1380 метр, в секунду.
Скорость детонации иланкластита, состоящего из сернистого уг-
лерода и двуокиси азота, достигает (в свинцовых трубках диаметром
3 м/м.) 6000 метров в секунду, приближаясь в этом отношении к пи-
роксилину. .
Этот вопрос изучался детально многими;- сне-
§ 4. Скорость деюна- циалистами и, между прочим, Вертело, Вьелем,
ЦИИ т"|х₽веществ.ЫВЧа Бихелем, Дотришем, Меттегангом и др. Эти изсле
дователи применяли различные методы; так, напри-
мер, Вертело и Вьель пользовались длинными трубками, Бихель—
укладывал открыто на воздухе длинный ряд патронов с испытуемым
веществом и, при помоши хронографа Ле-Буланже отмечал время
прохождения детонации через два сечения находящиеся друг от
друга на расстоянии 30—35 метров. Совершенно иным методом поль-
зовался Дотриш, беря две ветви детонирующего шнура (он пользо-
вался мелинитовым шнуром, обладающим чрезвычайно равномерной
скоростью детонации в 6880 метров в секунду), одни концы которых
были вставлены в муфтообразный капсюль — детонатор, другие же
укладывались на свинцовой пластинке, толщиной 25 м/м. на встречу
один другому, вплотную по прямому направлению. ।
При воспламенении капсюля, детонация распространяется одно-
временно по обоим ветвям до встречи в каком нибудь пункте; вслед-
ствие одинаковой скорости распространении детонации точка встречи
будет одинаково удалена от места воспламенения, по протяжению обоих
шнуров, но если же мы в одну из этих ветвей введем трубку опреде-
ленной длины с испытуемым взрывчатым веществом, то точка встречи
переместится в какой-либо другой пункт, если только скорость дето-
нации испытуемого взрывчатого вещества будет отличаться от ско-
рости детонации шнура.
По величине этого перемещения можно судить о скорости дето-
нации введенного добавочного взрывчатого вещества.
Меттеганг, занимавшийся этим же вопросом, сконструировал
весьма совершенней аппарат, позволяющий производить измерение
скоростей на очень коротком ряде патронов.
Результатом этих исследований явилась возможность выяснения
зависимости скорости распространения детонации в твердых взрыв-
чатых веществах от различного рода причин. Так, например, оказа-
лось, что скорость ее зависит: от плотности заряжания, *) (Рис. 12,13 и 14)
М/Sec W9 — Черный порох.
им ш ю m m ш on ы > сю
3836 — Всстфалит.
3900 Гремучая ртуть..
4173 Доварит.
4825 -- Мона хит 1.
^ВЦИННИННВИВВИЯВЗИНЕННННВВ^,
- Аммонал 2.
Рис. 12. Графика зависимости скорости детонации от
плотности.
’ (По Вейс Гебентренту).
*) С увеличением плотности заряжания, скорость распространения детонации
возрастает; так например: у пироксилина плотность заряжания 0,7, скорость дето-
нации определена только в 4000 метров в сек,, тогда как при 1,1 — 1.2 она доходит
до 6000 метров в секунду.
от гравиметрической плотности, по мере увеличения которой скорость
детонации сперва возрастает до некоторой максимальной величины и
затем начинает опять уменьшаться, и'наконец, от величины диа-
метра патронов.*)
— Пикриновая кислота
-- Трипитролуол.
- Пироксилин.
Аммонал II,
Аммонал I.
Моняхнт.
Допарит.
Рис. 13. Кривые роста скорости детонации различных
взрыввеществ в зависимости от их плотности.
(По Вемс-Гебенстрейтур
-- Плотность.
Рис. 14. Кривая роста скорости детонации Шеддита
в зависимости от плотности.
(По Детриту).
> ——* ~
*) Зависимость эта существует лишь до известного диаметра патронов; так, на-
пример, для пироксилина максимальная скорость детонации наблюдается при пат-
ронах диаметром 30 м.м., для патронов же с аммиачной селитрой такая максималь-*
пая скорость соответствует диаметру патронов в 50 м.м.
В нижеприведенной таблице сделана Брунсвиком частичная
сводка цифровых данных исследований, произведенных в этом отно-
шении выше упомянутыми авторами, а равно Ле-Шателье и Хейсе.
Название взрывчатых
веществ.
Состав (химическ, фор-
мула).
Скорость
детонации
в м.|еек
Твердые вещества.
Гремучая ртуть HgCjNA 6,45 мм. — 3920 м.с.
Нитроманнит CGHS(OHO,)6 1 <4 1 <4 Г1 * >7 *А.ос 6900- 7100 ; 77СО
Пироксилин сухой. . . . . 2 0,67—6,73 3700 -3800
» W * • ' * <4 0,9 ! 39)"
ад . г .... / » ч 9 1,17 48i'O
W ’? * 1 i <4 1.2 1 4300
,> и .... w 3,15 1,27 5400
J» >» • 1 ” 4 14 4800-62 0
Пироксилин влажный (30°/( 1 5900 - 61(10
влажности) . . 1 ’ « 31
Нитрогидроцеллюлоза. . . ! ' 1 << 1 <5,5 —“ 4900 6100
Нитрокрахмал n 1 <4 1,1-1,2 5000
и \ I) t <4 1,35 5500
Пикриновая кислота. . . . C6H2(HO,)3OH 30 1.55 7700-8200
Тринитротолуол. ..... CeH2(NO,)3CH;) 30 1,55 7200
Дымный порох 75%KNO3; 13%C; 12’/0S 30 1,04 300
Гурдинамит 75% нитроглицерина 3 2300—2890
6 —— 1900-3200
• 31 5900—660 •
tl • * • • • » 30 1,58 6800
г? ад **•••*• 20 1,62 6800
Гремуч, студень c 93 нитроглицерина 30 1,63 77'0
Аммонкарбонит Же л ати н-дин ам ит (С ту де* 820/oNHj NOSv10%KN03 63,5% нитроглицерина; 30 1,19 ' 310"
нистый динамит.) . - . . 30 1,67 700"
1,5% раствор, пирокснл.
27°/0 натриевой селитры.
8% древесной муки.
Kohlenkarbonit 25% нитроглицерина. 39% калиевой селитры. 1% балиевой селптры. > 30 1,42 2700
1 38,5% ржаной муки. 1,0% дубовой коры. | UV
0,5% соды.
До нариты. . 80%аммиачной селитры.
12% тротила. 4% ржаной муки. 1 30 1,31 4100
4% желатинированного 1
нитроглицерина. J
ад ••••••• 87% аммиачной селитры. 6% сериикисл. аммония. > 40 1-1,2 2900
7% динитробевзола. 3300
ь я 50 ; 1—1.2 и
Название взрывчатых Состав*"(химическ. фор*
веществ..
Шеддит................
Жидкие взрывчатые веще-
ства.
Нитроглицерин .
Метилнитрат . .
Иаикластит. . .
С3
CH3NO;*
Г - а з о в ы е смеси.
‘Jllq-pOj......................... х •
H^-j-N^O...................
Hj+Cljj ......... .........
2СО+ С2 ........................
ЗСН^-^ЗО^ ’ ...........................
• .........................
2С,Н*+50а..............................
сД+о„............ ..............I
........ ....................
e2Nrb2NO . ..........................
i!
П
I
92% аммиачной селитры.!
8° о нафталина. |
80°'0 бертолетовой соли,
рицинового масла.
13%моионитроиафталина
2° о дивитротолуоа. :
10
<10
< 10
< 10
<10
<10
< 10
: 10
< 10
< 10
Скорость
детонации
в м./сек.
2900
3300
3700
2550
2900
1000-1600
2100
6600—6600
2820
3300
> 1730
16‘0
, 2320
2360
2390
2730
2580
<2850
g Сильная детонация порождает в окружающей среде
§ . Взрыв через механичесКуЮ волну бОЛЫНОЙ МОЩНОСТИ, Движущуюся
влияние. в 3T0g среде со скоростью превышающей скорость
звука и потому отличной от звуковой волны. При двух зарядах
взрывчатого вещества, расположенных достаточно близко друг от
друга, но все же разделенных какою-нибудь инертною средой (во-
дою, металлом, воздухом) при детонации одного заряда называемого
активным такая волна встречая другой заряд, называемый пассив-
ным, производит по нему удар и при достаточной силе этого удара
вызывает детонацию пассивного заряда. Это явление называют взры-
вом через влияние. '
Если же удар механической волны не будет достаточно силен,
то будет иметь место только обыкновенный взрыв или даже обыкно-
венное горение. Поэтому увеличение веса! активного заряда и свя-
занной с ним силы • детонации увеличивает расстояние, на, котором
взрыв через влияние еще может иметь место. Чем больше этЬ рассто-
яние пассивного заряда от активного, тем труднее вызвать детонацию
первого, так как преодолевая расстояние, волна теряет свою
мощность.
Природа среды, по которой передается ударная волна, имеет
существенное влияние на дальность передачи взрыва через влияние.
При двух зарядах расположенных на общей подкладке, дальность
эта тем больше, чем жестче и плотнее подкладка. Например, при за-
рядах положенных на земле она больше, нежели при зарядах подве-
шенных в воздухе (обычно путем привязывания к шестам), при за-
рядах, положенных на рельс, она еще больше; лучше же всего взрыв
через влияние передается под водой: при весе активного и пассив-
ного заряда динамита в 100 клг. каждый, это расстояние достигает
18 метров, уменьшаясь на земле в 4 раза и в воздухе раз в 8.
Вследствие своей большой чувствительности к удару динамит осо-
бенно способен взрываться на расстоянии; поэтому динамит не при-
меняют для снаряжения подводных мин, так к*к совокупность чув-
ствительности динамита и увеличения в воде дальности передачи
взрыва может привести от взрыва одной мины к взрыву соседних,
что устраняется при применении менее чувствительных к удару
взрывчатых веществ влажного-пироксилина, и тротила.
Помимо природы среды на дальность передачи взрыва влияет
также присутствие оболочек и материал их. Так снабжение обоих
зарядов металлическими оболочками вдвое увеличивает дальность
передачи по сравнению с зарядами без оболочек, деревянные же обо-
лочки (толщиною в 2—27г см.) оказывают обратное действие, почти
вдвое уменьшая эту дальность.
Количественная зависимость между наибольшей дистанцией
(D) передачи взрыва через влияние и весом активного заряда (Р)
может быть выражена следующей формулой: D = К j/где констан-
та (К) зависит от единиц меры для D и Р, от свойств взрывчатого
вещества активного и пассивного заряда, оболочки (последней в осо-
бенности по отношению к пассивному заряду) и,'наконец, от природы
среды, по которой передается ударная волна.
Вообще расстояние, на которое взрыв через влияние может
происходить невелико, но учитывая огромные количества взрывчатых
веществ, хранящихся на складах и погребах, а равно находящихся
в помещениях их фабрикации, необходимо считаться при постройке
или выборе их. с явлением взрыва через влияние, соответственно
рассчитывая расстояния между такими постройками. При этом по-
мимо расстояния передачи в<рыва через влйяние приходится учи-
тывать также и разрушительное действие взрывной волны, произво-
дящей различные разрушения в зависимости от своей мощности и
расстояния: на близком расстоянии это действие настолько сильно,
что от постройки ничего не остается; дальше следует зона сильного
разру । ения, за ней—зона значительных повреждений и, наконец, зона
более легких повреждений, выражающихся лишь в выбивании окон-
ных стекол*). Эго последнее может иметь место даже на несколько
верст, как, например, при взрыве тротиловой мастерской, происшедше-
го в 8 ч. 15 м. вечера 16 а феля 1915 года, когда разбитие стекол
*) Такое разрушительное действие взрывной волны еще раз подтверждает
правильность об'яснения сущности взрыва иа расстоянии ударом по взрывчатому
веществу, вызывающим взрыв последнего.
•^;д||Й»далось в Петрограде — на расстоянии 7 верст от места взрыва.
^^Ивктерно отметить, что происшедший одновременно взрыв грему-
^^И|И.риутя в удаленных на 1 версту от тротиловой мастерской двух
^ЯрМньнях об‘ясняют тем, что осколки стекол вызвали взрыв такого
чувствительного к удару взрывчатого вещества, как гремучая ртуть.
^фсВвнедствие этого приходится оберегать не только помещения для
Ввзрывчатого вещества, но и жилые и технические постройки. При
| < расчетах пользуются приведенной выше формулой (1)=КрФ), одна-
ко значительно увеличивая величину К до пределов, вытекающих
ф из определения последствий крупных взрывов и характера разру-
j шений в различном расстоянии от фокуса взрыва.
t „Инструкция к определению предельного максимального коли-
L чества взрывчатого вещества" (1909 года) устанавливает величину
I К (при Г)—в саженях и Р—в пудах) для случаев самых сильных
К взрывчатых веществ, как нитроглицерина и его препаратов с содер-
L жанием первого в 30 и более •/#, в 31,5, а при наличии защитного
Г' вала в 5,5.
Рис. 15. Мастерская с железобетонным валом.
(Системы О. Гутмана)*
( Защитный вал, таким образом, сокращает величину опасной
й зоны приблизительно в 5,5 раз, что подчеркивает их значение. Роль
| защитных валов собственно двоякая: защита здания от действия
I взрыва соседних хранилищ и защита окружающих построек. Ха-
I ' рактерно, что указа- ные выше сушильни с гремучей ртутью, имели
|’ защитительные валы со стороны ближайших построек, но не были
к защищены валом со стороны тротиловой мастерской и окнами своей
В открытой стороны смотрели в ее направлении. Защитные валы обычно
В . делаются земляными, иногда железо-бетонными, при чем последние
г занимают меньше места. Их высота не должна быть ниже высоты
к защищаемого здания.
.' 1 VJ •.'•• ." ''• 1
— 64 —
Подрывное дело исполыовывает взрывы через влияние, распо-
лагая группу зарядов на расстоянии друг от друга несколько мень-
шем наименьшего расстояния передачи взрыва и взрывая капсюлем
только один из этих зарядов. Помимо экономии времени, преимуще-
1 ство этого способа заключается еще в том, что производимая взры-
вом работа количественно увеличивается в силу одновременности
действия нескольких зарядов, а это позволяет для достижения одного
и! того яге эффекта расходовать меньшее количество взрывчатого
вещества. Чтобы, увеличить чувствительность пассивных зарядов к
влиянию взрыва на расстоянии их снабжают капсюлями, вставлен-
ными со стороны активного заряда. Практически при применении
взрывов на расстоянии необходимо проявлять, однако, большую осто-
рожность, учитывая все обстоятельства, могущие влиять, на умень-
шение расстояния передачи взрыва, так как при малейшем упуще-
нии легко может произойти отказ. Ввиду этого при ответственных
взрывах редко пользуются взрывом через йлияние.
Явление ударной волны еще не вполне изучено и оно, вероятно,
является более сложным' нежели его изображает приведенная фор-
мула I ' ; К V Р, справедливая лишь для некоторых средних зна-
чений Р; для больших величин его приходится уменьшать величину
К, для меныпих, наоборот увеличивать, притом весьма значительно.
Несомненно одно— ударная взрывная волна отлична от звуковой вол-
, ны, так как присущая ей строго определенная скорость распространения
зависит не от источника, а от физического состояния среды, в ко-
торой происходит распространение. >
Имеется несколько попыток об‘яснения явления дето-
§ б. еория нациИ( но из них мы рассмотрим подробнее только две
детонации. синхронических колебаний Абеля и теорию взрывной'
волны Бертело. Теория Абеля интересна, как первая по времени по-
пытка объяснения этого явления, теория же Вертело, как наиболее
- просто и ясно об'ясняющая его.
Теория синхронических колебаний: Абель допускает, что взрывча-
тые вещества, способные к детонации, чувствительны к звуковым
волнам определенного числа колебаний, под влиянием которых не-
стойкие частицы их распадаются в кратчайший промежуток времени.
При своем распаде эти частицы служат источником особых колеба-
ний, подобных звуковым, которые, распространяясь в окружающей
среде, способны вызывать явления детонации в других взрывчатых
веществах, находящихся на Небольшом расстоянии, т. е. по Абелю
явление детонации подобно физическому явлению звучания струн в
унисон.
Однако, в скором времени, благодаря работам Бертело и других
исследователей, эта теория была оставлена, так как ею не могли быть
об'яснены многие факты. Так, например, нитроглицерин только в
количествах не более 60 грамм способен, и то слабо, вызывать дето-
нацию пироксилина, тогда как минимальные количества последнего
прекрасно детонируют нитроглицерин. Это явление совершенно не
может быть объяснено теорией Абеля, так как по таковой совершенно
безразлично, какое вещество служит источником энергии, лишь бы
л
'ед
— 65 —
! оно вызывало появление в окружающей среде соответствующих коле-
< баний. С целью выяснения вопроса о влиянии звуковых волн на хи-
S мические превращения, Вертело произвел ряд опытов: так, испытуе-
I? мое вещество он подвергал действию сильных звуковых колебаний,
I для чего оно помещалось в сосуд, прикрепленный к одной из ветвей
j камертона, приводимого в движение электрическим прерывателем и
L, делающего около 100 простых колебаний в секунду. В другом ряде
I опытов вещества помещались в закрытую стеклянную трубку (длин.
£ . 60 см. с диаметр, в 3 м/м.), в которой вызывались продольные коле-
|>аЛанйя путем трения колеса, покрытого мокрым войлоком; число ко-
|: лебаний доходило до 7200, и, однако, как в том, так и в другом сду-
I. чае не замечалось никакого изменения в состоянии испытуемых Be-
lt ществ, откуда Вертело м»г заключить, что химические превращения
Ц не ускоряются и не возбуждаются звуковыми колебаниями.
Некоторое подтверждение теории синхронических колебаний
/ Шампион и Пелле находили в результатах своих опытов, в которых
они прикрепляли кусочки йодистого азота к струнам контрабаса; в
тот момент, когда начинают звучать струны другого контрабаса, на-
ходящегося на некотором расстоянии, взрываются лишь те кусочки,
которые подвергаются не менее 60 колебаниям в секунду. Кроме того,
эти исследователи производили опыты с двумя параболическими зер-
калами, находящимися на расстоянии 2,5 метров и закопченными са-
/ жей для устранения влияния отражения тепла: на линии фокусов
зеркал помещали в различных точках капли нитроглицерина и кусоч-
g ки йодистого азота (1 гр ). Когда в одном из фокусов взрывали кап-
лю нитроглицерина, то взрывались сами собой и порции его, поме-
щенные в фокусе другого зеркала, но не взрывались находящиеся в
других точках. • *
Однако, эти опыты мало прибавляют данных к подтверждению
i теории Абеля: они показывают, что взрывы веществ далеко не про-
f исходят всегда на таких расстояниях, на которых звуковые колебания
| передаются еще очень хорошо. К тому же подобные опыты совсем не
устанавливают необходимости некоторых предельных тонов, а указы-
вают лишь на то, что ниже известного предела взрывающее действие
колебаний прекращается, высокие же тона действуют безразлично на
всякие мало прочные вещества.
Теория взрывной волны Вертело ставит в связь явления детона-
ции от механического действия — удара: не только сильный взрыв,
капсюля гремучей ртути, производит детонацию некоторых
рывчатых веществ, но и сильное механическое действие — удар.
|(кя каждого вещества требуется определенная минимальная сила
Цара для получения детонации, меньше которой вещество будет да-
так наз. „неполный взрыв", когда часть вещества разбрасываетг
,.ф сгорев, или сгорает более медленно: при еще более слабом
|ре вовсе не получается ни взрыва, ни горения. Такое взрывание
фом—об'я сияют переходом механической энергии, при остановке
&ейия, в тепловую, отчего мгновенно повышается температура.
^При взрыве капсюля гремучей ртути или др. вещества для дето-
ания данного получается также сильный удар, и его механиче-
(энергия, будучи установлена следующими слоями вещества,
М. Сухаревский. Взрывчатые вещества и взрывные работы. ‘5
31
-<
1
обращается в тепловую с резким повышением температуры, вследствие
чего происходит химическое явление — взрцвчатое разложение ве-
щества со всеми последствиями и удар газов, обладающих большой
упругостью, о следующие слои вещества. Этот удар повторяет тот же
цикл явлений по отношению соседних слоев и т. д. Такое чередова-
ние явлений: механических, тепловых и химических от слоя к слою,
в кратчайшее время, и составляет основное допущение теори взрывной
волны, которым и стремятся об‘яснить явление детонации, т. е. обра-
щение вещества в газообразные продукты в столь короткое время,
что им мы можем пренебр-чь и считать разложение данной массы
вещества мгновенным. Все условия, препятствующие перечисленному
ходу явлений, составляющих взрывную волну, уменьшают скорость
детонации, а затем и вовсе прекращают возможность ее получения.
К ним относятся:
1) Различные причины, мешающие механической энергии в
'кратчайшее время обращаться в тепловую. Так, при получении дето-
нации ударом, чем толще слой взрываемого вещества, тем требуется
большее механическое усилие, т. к. в первые моменты часть механи-
ческой энергии идет на сжатие вещества и его деформацию. По этой
причине рыхлый пироксилин (мезга) совсем не детонирует, а только
частью сгорая, разбрасывается. Поэтому при испытаниях чувствитель-
ности твердых взрывчатых веществ к удару на копре берут очень
тонкие лепешечки, обыкновенно цилиндрики 5 мм. диам и только
% мм. высотой, вещества порошкообразные берут в прессованном
состоянии в количестве всего около 0,05 гр.
Но это относится только к сравнительно небольшим количествам
взрываемого вещества. Большие количества взрываемого вещества, не
переносящего сильных ударов, даже при обыкновенном зажжении
заканчивают свое горение взрывом или даже детонацией. Это объяс-
няется тем, что при таком большом количестве вещества значитель-
ная масса его успеет нагреться до температуры, требующейся для
возникновения взрывчатого разложения или детонации.
2) Сюда же относятся все обстоятельства, мешающие тому же
самому количеству- тепловой энергии порождать наиболее высокую
температуру, а) Так действует увеличение об‘ема, на который распро-
страняется теплота, напр., когда берем вещество с меньшей плотностью.
Поэтому, „напр., чем плотность пироксилина больше, тем он действует
сильнее и больше вероятность получить детонацию (без отказа). По-
следнее время, благодаря применению почти кипящей воды при
прессовании, плотность пироксилиновых шашек удалось повысить до
1,28—1,34 (при 2,5% влажности), вместо прежних 1,15—1,20. б) Также
действует увеличение влажности, т. к. вода отнимает часть энергии
на парообразование, с) Температура до взрыва играет тоже немало-
важную рол1: чем более предварительно подогрето вещество, тем оно
чувствительнее к детонации.
3) Примесь инертных тел, неоднородность строения и несплош-
ное расгределение вещества являются тоже тормозящими факторами.
Так уже при 40% окиси углерода ее смесь с О2 не детонирует, тогда
Шкдаже при 2О°/о ея, такая смесь еще может гореть*). Кислород,
^кабыточествующий в данном примере, является инертной примесью,
которая, значит, действует по отношению к детонации более сильно,
чем по отношению к горению.
Теория взрывной волны встречает,, однако, целый ряд серьезных
возражений, вытекающих из свойств болееновых взрывчатых веществ,
как, например, тола, появившегося уже после ее со «дания. Сущность
теории волны сводится к допущению чередования явлений механи-
ческих, тепловых и химич(ских от слоя к слою, в кратчайшее время,
чем и обгоняется столь быстрая передача детонации. Но так как
толщина слоя и время в этом допущении не определяются точно,
то фактически оно вовсе не указьпает порядка скоростей детонации
в раз 'ичных взрывчатых веществах и не всегда выясняет явление.
06‘яснение причины больших скоростей детонации может'быть
отчасти сделано и без допущения указанного чередования трех явле-
ний. Так, мы видели, что скорость горения взрывчатого вещества
увеличивается весьма бы- тро с увеличением давления и температуры.
А так как при детонации развиваются дав тения и температуры мак-
симальные, то отсюда становится понятной та огромная, предельная
для каждого взрывчатого вещества быстрота химического разложения
его. которая достигается при этом явлении, почему вообще взрыв-
веществ, заключенных в оболочки из жестких металлов, происходит
с большой скоростью, чем без оболочек или в оболочках слабых, так
как давления в первом случае достигаются сразу большие, а с ними
и темнера)уры. К тому же можно заметить, что отдача теплоты одним
только лучеиспусканием пропорциональна времени и поверхности
излу 'ения, завися в то же время и от температуры. Здесь время
весьма мало, поэтому и потеря на лучеиспускание близка к нулю.
Вообще вызвать детонацию накаливанием взрывчатого вещества
гораздо труднее, чем ударом, а для таких взрывчатых веществ)4как
мелинит, особенно же тротил, это часто даже вовсе не. удается, ибо
при этом происходит сперва плавление, а затем и горение. Между
тем теория взрывной волны не только не об'ясняет этого обстоятель-
ства, но по ней йыходит безразлично, каким бы путем мы воспламе-
няли бы взрывчатое вещество, а в том числе и накаливанием, так
как эта теория стремится явление удара свести к явлениям, преиму-
щественно тепловым, не видя в данном случае в механических воз-
действиях главной причины возникновения химических реакций.
Между тем известно много реакций, происходящих под действием
ударов и трения.
Этот недостаток теории взрывной волны становится понятным,
если заметить, что ова возникла еще тогда, когда не было известно
таких взрывчатых веществ, как тротил, а появилась для об‘яснения
детонации, основываясь, главным образом, на детонации нитроглице-
рина и пироксилина, легьо взрываемых и накаливанием.
Тем не менее, теория взрывной волны сделала шаг вперед в
том отношении, что в то время, как объяснить большие скорости
Наивыгоднейшая пропорция компонентов в смеси СО и Og вытекает из формулы
ICO 4- Оа = 2СО2, каковой соответствует 66,66°/0СО.
детонации нельзя было одною теплопроводностью, как имеющею срав-
нительно небольшую скорость, введение в понятие о взрывной волне
понятия механического удара дало возможность обойти объяснение
бол» ших скоростей одною теплопроводностью. Таким образом, в отно-
шении скоростей передачи детонации, важнейшим элементом взрывной
волны надо считать удар, скорость передачи которого как раз того же
порядка, какой мы имеем для скоростей детонации.
Что передача детонации не успевает происходить исключительно
теплопроводностью показывает, между прочим, тот факт, что при
детонации, например, пироксилина, дерево, которое обращается им в
щепы, нисколько не обугливается. Таким образом» очевидно, что дей-
ствие даже всей массы газов настолько кратковременно, что теплота
не успевает быть воспринята телом.
Все обстоятельства, способствующие распространению удара по
взрывчатому веществу, увеличивают скорость детонации. В этом отно-
шении большую роль играет увеличение упругости, однородности и
сплошности вещества. '
Все вышеперечисленное указывает, что передача детонации (в том
числе и чрез инертную среду) происходит не только теплопроводностью,
как при горении, но и ударом.
При детонации само взрывчатое вещество уподобляется той
инертной среде, которая передает удар от активного заряда й пассив-
ному. Отличие взрывчатого вещества от инертной среды, в этом
отношении, только то, что передав удар, оно и само взрывает.
Бертл'о, введением в теорию взрывной волны элемента механи-
ческого воздействия—удара, сделал первый шаг к выяснению сущности
детонации. Строго рассуждая введение принципа ударной волны есть
да 1ьнейшее развитие вытекающих из его теории следствий. Ведение
термина ударной волны сводит детонацию к явлению взрыва через
влияние с тем лишь отличием, что взамен инертной среды мы рас-
сматриваем среду взрывчатую. А, что удар в такой среде может
вызвать взрыв, есть факт общеизвестный: от достаточно сильного
удара все взрывчатые вещества взрывают.
Между прочим теория Бертло не Об‘ясняет, почему наибольшая
скорость детонации в газообразных взрывчатых веществах почти равна
скорости молекулярного движения, отвечающего температуре взрыва.
По кинетической теории вещества, теплота об'ясняется движением
молекул в различных направлениях. Поэтому в ударной волне, пере-
дающей детонацию в газообразном взрывчатом веществе, как имеющей
определённое направление, движение молекул уже не безпорядочное,
а более или менее упорядоченное, так как все они движутся в ней
почти по направлениям ее распространения, а в пределе, при макси-
мальной скорости, волна состоит из молекул, движущихся в ее напра-
влениях и с той же скоростью.
Таким образом, с некоторой степенью вероятности можно пред-
положить, что в расщеплении молекул, совершающемся под влиянием
температуаы,—видную, а иногда и доминирующую роль играет также
и удар, что является совершенно естественным, если припомнить, что
понятие о теплоте сводится к движению молекул, т. е. к их взаимным
ударам. Тогда в явлении передачи, детонации взрывчатыми веществами,
№
- X'l
A '.
1
i.
t-ti*
У?*’
&
ЯдИболее существенными элементами, на ряду с химическими, станут
механические и тепловые, причем в некоторых случаях механические
могут дажё доминировать.
g Детонированием будем называть совокупность
<Э . детонирование и де- тех ^ецстви^^ посредством которых мы вызываем
тонаторы. . детонацию в каком нибудь взрывчатом веществе*).
Мы уже видели, что, при зажигании взрывчатого вещества пла-
менем, накаленным телом и пр., большею частью, получается плавное
горение. Напротив, детонирование взрывчатого вещества лучше всего
производится ударом.
Самое явление детонации впервые изучалось на нитроглицерине
и пироксилине при действии капсюля гремучей ртути, которое также
^сводится к удару. Такой удар является очень выгодным, как в отно-
гпении силы, направлении действия, так и простоте его вызывания,
/Для чего гремучую ртуть достаточно зажечь, если она в прессованном
«состоянии и заключена в оболочку.
I. Детонатором называется взрывчатое вещество обыкновенно заклю-
'• фнное в какую нибудь оболочку, употребляемое для детонирования другою.
мдо должно дать столь сильный импульс, чтобы он мог быть доста-
точно энергичным началом для ударной волны в детонируемом веществе,
способной вызвать его взрыв, поэтому оно само должно давать дето-
увацию и притом без отказа. Гремучая ртуть почти всегда дает детонацию,
дарываем ли мы ее ударом, трением или нагреванием. Только при
Ойгревании, не доходящем до 100’, в малом количестве, она разлагается
* “'степенно и, потому, разложение не кончается взрывом, или насы-
"йдя открыто в небольшом количестве, при зажжении, дает только
ку, Ввиду этого гремучая ртуть служит надежным детонатором
аогих взрывчатых веществ, в том числе для нитроглицерина,
'„Пироксилина, порошкообразной пикриновой кислоты и т. п.,
достаточно сравнительно небольшого ее количества, (обыкно-
е более 2 гр.), для детонирования любого количества этих
•хДця детонирования же других взрывчатых веществ гремучая
имется не всегда достаточно удовлетворительной.
“ ^детонирования влажного пироксилина у потребляется
Мща для мелинита—порошкообразная пикриновая кис-
мдоронЫ исвесгны взрывчатые вещества довольствую-
‘|вШ 4Я®бими детонаторами; так например, для дето-
'запала из дымного, пороха.
W*'*,
ги к детонации всех взрывчатых
.jiQM гремучая ртуть и дает всегда
выйтйфляет выгоду, но количество
Цшг >ррдоДДтеЛьиб невелики, что
Название вещества. Колич. тепла в каллориях (при пост, давлении) на 1 кил. вещества при (Н,О жидкой). Относительная величина потен- циальной энергии, которая для дыми, прохода прии. за . единицу.
Аммонал 1600 2,35
Сухой Пироксилин . . . 1070 1,5
Пикриновая кислота . . 77э 1,1
Дымный порох. . . . 720 1
Гремучая ртуть . . . 405 0,55
Ввиду указанного, способы детонирования приходится усложнять,
вводя, независимо от гремучей ртути, которая уже играет роль
ударного вещества, собственно детонатор: из сухого пироксилина—для
влажного, из порошкообразной пикриновой кислоты-для плавленной,,
тетрил—для тротила и т. п.
Легкое детонирование аммонала одним запалом из дымного,
пороха, об'ясняется огромной температурой и энергией, развиваемыми
этой смесью, вследствие чего она, так сказать, сама себя детонирует,
если взята в достаточном количестве, а потому требует только заж-
жения. для чего достаточно и дымного пороха.
Капсюль гремучей ртути с бикфордовым шнуром является простей-
шим приспособлением для детонировмния. В военно подрывном деле эта
система называется зажигательной трубкой. Более сложные по устрой-
ству, или действию называются взрывателями.
Всякое другое взрывчат е вещество, обладающее теми же выгод-
ными свойствами, как а гремучая ртуть, но имеющее новые преиму-
щества, может с у пехом заменить ее, или, по крайней мере, может
быть применено вместо вея в отдельных случаях. Таким веществом
оказался, например, азид свинца.
Детонатор, -заключенный в прочные металлические оболочки,
особенно из жестких металлов, детонирует значительно лучше, вслед-
ствие более резкого удара.
Это и составляет причину, почему капсюли всегда имеют метал- •
лические гильзы.
Иногда бывает необходимо для достижения вполне обеспеченного
взрыва прибегать к применению двух и даже трех промежуточных
детонаторов. Как пример этому, можно привести следующий факт:
В начале Европейской воины в тот период, когда у нас стал
ощущаться недостаток во взрывчатых веществах, вам пришлось приме-
нять между прочим динитробензол; Однако, предварительные опыты
обнаружили его недостаточную чувствительность к детонатору из
тетрила, но в то же время констатирован был тот факт, что он взрывает
без отказа при помощи плавленного тротила. Таким образом, для
уверенности получить обеспеченный взрыв, пришлось ввести еще проме-
жуточный детонатор, при чем следовате 1ьно получалась такая последо-
вательность детонирования динитробензола: ьзрыв гремучей ртути вызы-
вал детонацию тетрила, которым детонировался плавленный тротил,
возбуждавший уже в свою очередь детонацию в заряде динитробгнзола.
К веществам, требующим промежуточных детонаторов, принадле-
жат между прочим некоторые составы, содержащие перхлораты и т. п.
ГЛАВА IV.
Плотность взрывчаты* веществ.
§1.Плотностьмрыв- Кроме уже рассмотренных ранее факторов: коли-
натогв вецестм. чества и температуры газов, развивающихся при ч
взрыве и скорости, с которой протекает взрывчатое
-разложеаие, существенное значение имеет также плот-
ности взрывчатого вещества. Одно и то же вещество в различных
случаях действует не одинаково.
Чем больше плотность данного взрывчатого вещества, тем большее
веерное количество его помещается в данном обеме, а потому, при
одинаковой силе двух веществ (относительно веса), выгоднее будет
ур, которое плотнее, так как в том же-бб'еме будет заключена большая
•^вргяя.- При равном же весе таких взрывчатых веществ, энергия
SStoaee плотного из них, та же по величине, Обрушится на меньшую
|ЙЙутреннюю поверхность об‘ема и, значит, произведет большее рэзру-
‘Нгение. Отсюда ясно, что т. к. одно и то же взрывчатое вещество
• 'Может быть различной плотности, то выгоднее всего оперировать со
взрывчатыми веществами, максимальной, допустимей практикой, плот-
ности, для чего многие вещества подвергают прессованию, или же
увеличения плотности достигают другими приемами (плавлением,
вещества, не плавкие цементируют сплавлением с легкоплавкими
взрывчатыми веществами и пр.).
Из этого ясно, почему газовые взрывчатые смеси, а также рас:
пыленные жидкие и твердые горючие вещества, не употребляются
в качестве военных взрывчатых веществ, так как они, занимая уже
до лзрыва слишком большой об‘ем, т. е. имея малую плотность, не-
смотря на большое количество выделяемой ими теплоты, не могут
проявить той силы, которую развивают жидкие и твердые тела боль-
шой плотности. Но зато горючие газы и жидкости (в распыленном
состоявии) находят себе широкое применение для двигателей внутрен-
него сгорания. s
В нижеследующей табличке приведены практически доступные
наибольшие плотности некоторых взрывчатых веществ и плотности
нормальные.
Название взрывчатых веществ. Плотности.
Дымн.порох, зерненый и призм, (гравиметр.) „ „ „ (действительн.) Пироксилин—мезга „ прессованный . . . • • • . . Самих волокон пироксилина (абсолютная) Бездымн. пироксилиновый порох в лентах (действит.) ( Бездымн. ружейный (гравиметрии.) „ граритованный (тоже) „ нитроглицериновый: Балистит „ „ Кордит. Нитроглицерин 1,0 —(1.4) 1,60—1,87 0,2 —0,3 1,2 —1.4 1,68 1,57—1,64 ок. 0,65 0,78—0,81 1,64—1,65 1,58 1,6
• Название взрывчатых веществ.
Гремучий студень.............................
Гур-Динамит.............................
Тротил (Тол).................................
Мелинит .....................................
Аммиачная селитра........................• .
Тетрил порошкообразный и прессованный........
Гексанитро-дифениламин прессованный..........
Аммонал........... ..........................
Гремучая ртуть (абсолютный уд. в. 4,394) прессов
Азид свинца (абсолютный уд. в '4,797) прессов. • . .
I Плотности.
1,5 —1,6
1,4 -1,5
1,55-1,61
1,6 —1,7
1,6
1 —1,63
1,58—1,67
1,8
ок. 4
> 4
Сравнивая некоторые числа этой таблицы мы видим, что иногда1
искусственно можно придать значительно большую плотность веществу.
Так, при пироксилине в виде мезги с плотностью 0,2—0,3 прессова-
нием мы достигаем плотности до 1,4; а посредством желатинизации
его, при получении бездымного пороха получаем массу, плотность
которой доходит до 1,64; дальше идти уже нельзя, т. к. уд. вес
самого вещества пироксилина около 1,68. Не следует забывать, при
этом, разницы между плотностями', действительной и гравиметрической.
Действительная—определяется для сплошной массы вещества (самого
зерна'), а гравиметрическая—для совокупности зерен, лент или волокон
с промежутками между ними. Поэтому гравиметрическая плотность
всегда меньше действительной. Так для дымного пороха действитель-
ная плотность около 1,75—1,85, а гравиметрическая ок. 1 и, лишь
в исключительных случаях (например, в некотором призматическом
порохе укладываемом правильно, почти без промежутков), можно
достигнуть плотности 1,4.
Из всего этого следует, что при сравнении двух взрывчатых веществ
между собою, надо обращать внимание не столько на количество теплоты,
отделяемой равными весовыми количествами их, сколько равными их
об*емами, т.-е. включать сюда и их плотность. Переход же этот, от
равного веса к равному об'ему, делается очень легко. Напр., если
мы имели, для одного и того же вещества, сперва плотность 1,1, а
потом достигли плотности его=1,4 (пироксилин), то в один и тот же
об‘ем (напр., 1 литр), при второй плотности поместится вещества
1,4 килогр, , . z г> « /
в -г—-------= 1,27 раза более. Во столько же раз больше (при
1,1 килогр. 1 г г 4
том же веществе), будет заключаться в равных об'емах и энергии.
Гремучая ртуть в состоянии прессованном (особенно прессованная
в прочные оболочки) менее опасна в обращении, совершенно безо-
пасно и легко переносит перевозку и сотрясения, потому что в этом
случае она составляет одно целое с тем телом, в которое впресована;
внешние удары и толчки воспринимаются при этом сперва оболочкой.
Вещества в прессованном и, особенно, в плавленном состояниях ме-
нее чувствительны к удару. Например, пикриновая кислота прессо-
ванная требует более чем вдвое сильного удара (1,5 к. м.), чем кри- ,
сталлическая—(0,7 к. м. *).
Чем более спрессован пироксилин, тем он менее чувствителен if мв*
ханическим влияниям и взрыванию. Это можно об'яснить тем.-что -во-
лоски пироксилина являются теплопроводными, тогда как воздух, за-
ключенный и между ними, очень дурной проводник тепла. Поэтому
чем сильнее спрессован пироксилин, тем он(вобщей своей массе) тепло-
проводнее, а потому при местном ли его нагревании, или при теп-
лоте, полученной при механических действиях (удара, трения), по-
следняя успевает распространяться по его массе, но труднее достигает
температуры, необходимой для возникновения взрывчатого разложения.
Иногда, наоборот, приходится умышленно повышать чувстви-
тельность взрывчатого вещества, к взрыванию; и в таком случае также
руководствуются только что указанными соображениями. Так, напри-
мер, взрывчатые смеси с хлоратами (КСЮ,), напр., шеддиты, с пер-
хлоратом аммония (NH4C1O3), при очень больших плотностях могут
давать отказы. Тоже происходит и с другими взрывчатыми веще-
ствами, когда они при продолжительном хранении слеживаются, умень-
шаясь в своем об‘еме; поэтому их употребляют в слабо запрессован-
ном состоянии, или даже вовсе без прессования, а слежавшиеся раз-
минают между пальцами. Также точно в качестве детонаторов, вместо
тетрила можно употреблять и менее чувствительные к взрыванию
веществ, напр., пикриновую кислоту тринитротолуол, но тогда они
обязательно должны быть взяты порошкообразными, так как иначе
могут быть отказы; полнота же взрыва при этом обеспечивается
прочной оболочкой взрывателя, непозволяж щей происходить разбра-
сыванию вещества, еще неуспевшего взорваться.
Если будем зажигать пироксилин пламенем, или накаленным
твердым телом, то происходит следующее: тогда как рыхлый пирок-
силин даст вспышку почти мгновенную, шашка прессованного пирок-
силина (в том же количестве) будет гореть более плавно. Этцщотому,
что с увеличением плотности уменьшается как скорость воспламе-
нения, так и скорость горения. Условия же воспламенения здесь
в обоих случаях различные; в то время как рыхлый пироксилин охва-
тывается пламенем не только на наружной поверхности насыпанной
кучки, но и в глубину каждой отдельной цастицы его, так как между
ними имеются достаточные для этого промежутки, прессованный пи-
роксилин горит слоями, так как условия проникновения пламени во-
внутрь затруднены тем в большей степени, чем более плотность и,
значит, тем сильнее произведено прессование.
Желатинизацией пирок- илина, при получении бездымного пороха
и прессованием пороховой массы для образования из нее лент и валь-
цовкой лент, после удаления части растворителя, достигается не
только большая плотность (собственно говоря—того же) пироксилина,
*) Поэтому образование, напр, в снарядах порошкообразной пикриновой ки-
слоты нужно считать даже более опасным, чем образование пикратов, так как обра-
зование пикратов можно избежать различными средствами, от получения же пыли
пнкриной кислоты избавиться трудно.
но почти устраняется его пористость и получается сплошная, более
или менее однородная масса, отчего горение еще более замедляется
и пироксилин, вещество весьма быстро горящее, такими приемами,
обращается в вещество, способное развивать прогрессивные давления,
присущи® веществам метательным, то-есть становится порохом.
С увеличением плотности условия детонации, напротив, обыкно-
венные облегчаются. Тогда как прессованный сухой пироксилин
отлично взрывается от капсюля гремучей ртути, рыхлый пироксилин
(мезга) при этом только разбрасывается, т.-е. с увеличением плотно-
сти для того же вещества увеличивается полнота взрыва и облег-
чается детонация. Эго может быть об'яснено улучшением условий
для восприятия веществом ударной волны. Подобно тому, как звуко-
вая волна плохо передается через тела, имеющие не однородное, рых-
лое строение (тела порошкообразные пух, сено, пробка), тогда как
легко передается в газах и вообще упругих телах, так и ударная
волна лучше и с большей скоростью передается в сплошных, одно-
родных и упругих средах. Вот почему рыхлый пироксилин не под-
дается детонированию, тогда как газовые взрывчатые смеси гораздо
меньшей плотности, легко дают детонацию от капсюля гремучей
ртути. Этот пример показывает, что тут роль играет не столько сама
по себе плотность, как упругость и строение вещества, так как тело
с увеличением плотности, обыкновенно, делается и более однород-
ным. Увеличение упругости с увеличением плотности, заметно хотя бы
из того, что плогно спрессованную шашку пироксилина можно отли-
чить от шашки плохо спрессованной, или растрескавшейся по осо-
бенному, характерному звуку, слышащемуся при легком постукива-
нии по ней твердым предметом. Это столь характерное явление, что
по одному этому, при некотором навыке, можно приблизительно су-
дить о плотности шашек (при одинаковой влажности, а при одинако-
вой плотности можно этим путем оценивать приблизительно” влаж-
ность) !
Исключение из только что сказанного сделана Детришем его
наблюдениями над скоростью детонации гурдинамита различных плот-
ностей (с 25% кизельгура) и шеддита состава: 80% КСЮ , 13%
мононитронафталина, 5% касторового масла и 2% динигротолуола.
Опыты производились в цинковых трубках 20 м. диам. Результаты
получились следующие.
*
Для шеддита.
Плотность 0,7 0,8 0,9 1,0 1,1 1,2 1,3 1,38 1,52
Скор» детон. м. в сек. . 2100 2248 2430 2504 максим 2550 2510 2360 2166 отказ.
Число опытов 5 5 4 4 4 4 4 1 1
Сред, отклонений. . . • 20 52 14 19 31 37 42 — ' —
— 75 —
Для Гур-Динамита:
Плотность. . . . . . . 0,63 0,79 0,85 1,34 1,54 1,62 1,69 1,71 1,74
Скорость детонации . . 1991 2397 2563 3670 5230 максим 6794 4207 2460 отказ.
‘ Такое исключение обгоняется, вероятно, понижением чувстви-
тельности к удару, на что указывают отказы при дальнейшем увели-
чении плотности. Поэтому можно ожидать, что при усилении капсюля
отказов не получалось бы.
Итак, роль плотности двоякая: с увеличением ее для того же
Самого взрывчатого вещества, не только увеличивается количество
энергии в том же обеуе, но и изменяются по нашему произволу мно-
гие взрывчатые свойства, к числу каковых принадлежит: чувстви-
тельность к взрыванию, продолжительность горения и усиление дето-
нации.
§ 3. Гравиметрическая плотность. До сих пор мы говорили, имея
в виду тот случай, когда взрывчатое вещество целиком заполняет
об‘ем, в которым содержится, т.-е. когда в этом об‘еме заключается
максимальное количество энергии этого вещества. Но чаще, особенно
для пороха, приходится иметь дело с об'емом, только частью зани-
маемым взрывчатым веществом. Тогда вводят понятие о „плотности
заряжания*. Под этим названием разумеют отношение веса заряда взрыв-
чатого вещества (со) к весу воды, заполняющей ве‘ь об'ем (V), в который
мы помещали заряд, т.-е. это есть величина отвлеченная. Поэтому плот-
ность заряжения (Д) выражается следующей формулой:
Л = —$ где rf—вес единицы об'ема воды, а так как, по метрической
системе, она принимается за единицу, то при этой системе единиц:
Л — -ъ- , где со в грм или клгр, а V будет выражена соответственно.
Но при вычислениях удобнее плотность заряжания относить
к единице веса взрывчатого вещества, относя не весь об'ему ко всему
весу со взрывчатого вещества, а только к единице веса соответствен-
ш, со*
ную часть (v) об‘ема камеры V. Тогда Л — —
*1
v=— есть об‘ем, приходящийся на единицу веса взрывчатого вещества.
Если наоборот нам известна плотность заряжания то об'ем, приходя-
1
щийся на единицу веса заряда, определится как v= —р т.-е. v есть
величина обратная Л.
Если вещество целиком заполняет об'ем, то плотность заряжания
Л будет равна плотности d самого вещества, потому что тогда
dV
со — dV и Л = = d.
" V
Ясно, что чем больше плотность заряжания, тем Дольше давление
И тем быстрее скорость сгорания, так как с увеличением давления,
эта скорость быстро возрастает и тем, значит, сильнее действие взрыв-
чатого вещества. Напротив, с уменьшением плотности заряжания
(в пределе—до нуля, т.-е. когда ш=0, пли заряда не имеется) давле-
ния меньше и скорости разложения убывают, и такие взрывчатые
вещества, как, например, порох, более постепенно развивают, в неизме-
няющемся об'еме, наибольшее давление, которое получается к тому
моменту, когда сгорают уже последние частицы вещества. Тогда
плотность газов будет равняться плотности заряжания.
Из нижеследующей таблицы видна наглядно зависимость давле-
ния развиваемого газами (выраженного в атмосферах на 1 кв. с. м.)
от плотностей заряжания, или от отношения веса заряда в граммах
к пространству, в котором вмещается заряд в кубических сантиметрах.
Таблицаэта заимствована у Н. Brunswiga. „Die Explosivstoffe. 1907“.
Плотность заряж. _ V Черн. порох. Нитро- глицер. Пиро- ксилин. Пикри- новая кисл. Амми- ачная селит. Грему- чая ртуть.
0,1 1 336 1098 1061 983 542 468
. 0,2 708 2351 2343 2174 1217 966
0,3 . I 1123 3847 3921 3650 2077 1501
0,4 ; 1587 5640 5912 5523 3211 2072
0,5 i 2U2 7829 8502 7981 4779 2686
0,6 | 2708 10560 12000 11350 7032 3347
0,7 ! 3393 14060 17020 16240 10800 4068
0,8 i 4201 21520 24510 24030 17870 4952
0,9 5126 25270 38500 38310 36250 5683
1,0 6236 35010 ***— —— —— 6602
1,2 ! 9255 * —— -— 8726
1,4 । 14130 — — — - - 1320
1,6 i 29340 —1 — 14560
1,8 1 i — — ♦ 18790
2,0 1 — 11,111 • 1 ' 24350
2,4 1 — —* — 43970
1
— 77
ГЛАВА V.
Скорость реакций взрывчаты^ веществ.
_ Изучение этого вопроса представляет
§1. Скорость разложения твердых громадныц теоретический и практический
и ЖИДКИХ взрывчатых веществ. интереС) так как лишь после ОСНОВателЬНОГО
выяснения зависимости скорости разложения взрывчатых веществ от
внешних и внутренних причин мы в со стоянии будем судить о при-
годности испытуемого вещества для той или иной цели.
При изучении этого вопроса приходится различать два рода
скоростей:
1) скорость реакции или так называемую Частичную скорость
взрывчатого разложения и 2) скорость распространения взрывчатого
разложения.
Под первой подразумевают отношение количества разложенного в
единицу времени вещества ко всей его массе, а под второй—простран-
ственное распространение реакции в единицу времени.
' Определение скорости реакции взрывчатого разложения веществ
крайне затруднительно, в виду чрезвычайной ее кратковременности,
а также трудности условия наблюдения только ее одной, так как для
этого необходимо, чтобы вся масса испытуемого вещества была по-
ставлена в условия одновременного взрывчатого распада, что практи-
чески почти невозможно, и поэтому обычно взрывчатый распад веще-
ства обусловливается обоими скоростями одновременно- и, следова-
тельно, представляет собою распространение реакции от слоя к слою;
однако, с достаточной точностью скорость реакций разложения взрыв-
чатых веществ может быть изучена при температу| ах ниже точки
воспламенения, что имеет отношение к выяснению стойкости взрывча-
тых веществ с точки зрения безопасности их хранения. 4
А. Определение частичной скорости разложения взрывчатых веществ
при температурах ниже точки воспламенения.
Нам известно, что всякое вещество, способное к химическим
превращениям при высоких температурах, претерпевает их уже и при
обыкновенных условиях, и все различие заключается исключительно
лишь в скорости реакции.
.Так, Вант-Гофф, занимаясь изучением зависимости разложения
хлористого азота от температуры, нашел, что реакция распада его
Следует довольно близко известному уравнению константы скорости
реакции:
1 , начальн. колич.
К —— log-------------------
t ° остающееся кол.
Еще более интересны исследования Голтеема над разложением
ивелевокислого серебра (см. диаграмму Рис. 16);
7 На этой диаграмме обращает на себя внимание точка, лежащая
Ло 170°, до’нее реакция разложения идет медленно, при переходе же
18 эту точку скорость реакции быстро увеличивается вплоть до
[д&меВения и взрыва.
Изучению вопроса' медленного разложения пироксилина и бездымною
пор'оха иосвящего много трудов, в виду огромного значения последних
в технике взрывчатых веществ.
Рис. 16. Графика роста скорости' реакции в зависимости от температуры.
I
При медленном разложении бездымного пороха * наблюдается
определенная зависимость скорости горения от температур, выражаю-
щаяся равенством:
dC
dx
= КС,
где—de—количество превращенного вещества в элемент времени,
К—постоянный коеффициент и С—концентрапия в данный момент.
Проинтегрированное уравнение принимает вид:
lgnCo-lgnC = KX
где Со — начальная концентрация вещества и С — концентрация в
данный момент.
Отсюда вытекает, что скорость реакции, совершающейся без по-
тери тепла, увеличивается вообще в 2,5—3 раза с повышением темпе-
ратуры на каждые 10 градусов.
Опыт вполне подтверждает ото до известного температурного пре-
дела. Так, при исследовании порохов на стойкость по способу Вьеля,
оказывается, что если порох при 75®С выдерживает нагревание в про-
должение d суток, то при 85°С время уменьшается примерно в 3 раза,
при 95*—в 4 раза, при 105° в 27 раз и т. д.
Вьель, занимавшийся вопросом разложения нитроклетчатки в за-
висимости от степени нитрации и влияния температуры, выразил эту
последнюю уравнением:
log N — а + Ь. 0,99321,
где—количество азота, отделяемого в единицу времени, а и b постоянный
коэффициент и 1=температура.
Митагош, также занимавшийся этим вопросом, обратил внимание
на то, что при подобном разложении мы встречаемся с одним из
случаев аутокатализа, в котором катализаторами служат сами про-
дукты распада нитроклетчатки.
Наиболее полное детальное исследование было произведено
проф А. В. Сапожниковым, для чего при разложении нитроклетчаток
измерялись об'ем и состав газов, выделяющихся в определенные про-,
межутки времени.
При всех подобного рода измерениях обнаружилось, что разло-
жение нитроклетчаток носит сложный характер при температуре ниже
точки их воспламенения, но что возможно выразить зависимость ско-
рости реакций от температур для некоторых участков ее. Так. разло-
жение нерастворимого пироксилина, состава С24Н2а (ONOS)U О9, при
температурах от 120» до 150' резко разграничивается на две зоны:
первая от 120* до 135*, другая от 135° до 150°, при чем скорость раз-
ложения в каждом пределе идет по одному общему уравнению:
Лх
— а —|-bt
где левая часть есть отношение приращения об’ема газов dv к про-
межутку времени dx, а и b постоянные коеффициенты.
При температурах от 120° до 150* это уравнение принимает вид:
-г-= — 2.22 -4- 0,01921
zlx
При температурах от 135* до 150°:
=—64.22-4-O.48t
dx
Зависимость частичных реакций от давления резко сказывается
газов при отсутствии потери тепла, в то время как для жидких
Нетвердых тел она крайне незначительна; кроме того, эта скорость
№Вйсит еще от относительных количеств составных частей, причем
Цдй постоянной температуре скорость реакции увеличивается от из-
Йка той или другой участвующей в ней составной части системы,
Имюеь же инертного газа замедляет ее.
^ИЙЧто касается нитроглицерина, то и для него приходится отме-
^НиШуществование предельной температуры, лежащей около 145*,
— 80 —
ниже которой разложение идет сравнительно медленно, выше этой
точки—значительно ускоряется, а в пределах от J90°—195* реакция
разложения происходит всего лишь в несколько секунд, но никогда
не оканчивается взрывом.
Для пикриновой кислоты, тола и прочих нитросоединений этот во-
прос изучен крайне мало и, по имеющимся данным, можно только сказать,
что эти вещества отличаются большей стойкостью, чем азотные эфиры.
Уже упомянуто выше на практике при разложении взрывчатых
веществ нам пр. ходится считаться не только с частичными скоро-
стями рузложения, но и со скоростью распространения его.
Скорость распространения разложений находится под влиянием
многих факторов, как то: давления теплопроводности, внешнего им-
пульса и др.
«) Давление. Насколько важным является этот фактор, можно
видеть из того, что горение большинства взрывчатых веществ в пу-
стоте, от воспламенения накаленной проволоки происходит так медленно,
что заметно лишь в темноте, по появляющемуся зеленоватому свету.
При давлении */s0 атмосф. появляется небольшое желтоватое пламя,
а при Vio—пламя делается блестящим. Гремучая ртуть, хотя в пустоте,
всегда взрывается от прикосновения с накаленной проволокой, но при
этом взрыв не передается всем частям, а лишь непосредственно сопри-
касающимся с проволокой.
Относительно дымного пороха уже в XVIII веке было замечено,
что на вершинах гор он сгорает значительно медленнее, чем у подошвы
их. Сен-Робер, наблюдая горение на различных высотах порохового
состава, запрес.сованного в свинцовых трубках, выразил зависимость
скорости горения и от давления Р уравнением: U = AP. *
Результаты его опытов приводятся в нижеследующей таблице:
Давление в мм. ртути, столба.___||740 <25 I 720 | 695 | (519 | Щ | 5,59 | 529
Время горения в секундах ..... i| 35 I 35 | 35 ( 36 | 39 | 39 I 42 | 44
Влияние давления на скорость разложения взрывчатых веществ
об1ясняется тем, что по мере уменьшения внешнего давления, газообразные
продукты разложения успевают быстрее распространяться в окружающей
среде, вследствие чего уменьшается и количество тепла, какое они
могли бы передать соседним, не сгоревшим еще частям заряда; кроме
того, в связи с давлением изменяется и скорость химических реакций,
имекицих место при взрывчатом разложении.
б) Теплопроводность. Теплопроводность является одним из гла-
вных факторов, оказывающих большое влияние на скорость рас-
пространения взрывчатого разложения, что можно видеть на пиро-
ксилине. Зажженный рыхлый пироксилин сгорает крайне быстро,
тогда как скорость горения прессованного крайне незначительна.
Такая разница обгоняется тем, что тепло в прессованном заряде,
вследствие большей теплопроводности волокон, тесно соприкасающихся,
в этом случае между собою, будет распространяться с большой легкостью,
благодоря чему температура не будет так быстро достигать предела,
необходимого для передачи воспламенения от слоя к слою. Насколько
это справедливо, можно судить по тому, что если рыхлым пирокси-
лином, скученным в нити обмотать железный стержень и пытаться
его зажечь, то вместо обычного горения мы будем наблюдать лишь
тление его, вследствие того, что большая часть тепла будет отдаваться
железу— хорошему проводнику его.
’ Скорость взрывчатого разложения и распространение
иешижй qro находится в большой зависимости, кроме упомянутых
импульс. выше факторов, еще от внешнего импульса.
Насколько значительно влияние этого фактора можно видеть на
пироксилине: если пироксилиновые шашки, уложенные в ряд, дли-
ною в 1 метр, детонировать с одного конца капсюлем гремучей ртути,
то для сгорания' их потребуется время не более 0,0002 сек., что со-
ответствует скорости разложения 5000—6000 метров в секунду; если
же воспламенение производить при помощи пламени, то скорость
распространения взрыва будет достигать всего лишь нескольких сот
метров в секунду и то лишь при условии нахождения заряда в за-
крытом помещении. При этих же условиях бездымный порох сгорает
всего лишь со скоростью 10—15 метров в секунду. Эта разница об-
ясняется тем. что внешний импульс дает толчок для разложения не
всей массе вещества, а лишь некоторой его доле, которая при своем
разложении выделяет тепло, идущее на нагревание соседних слоев, и
чем больше количество частиц будет доведено внешним импульсом
до состояния разложения, тем большее количество тепла будет пере-
дано соседним слоям, а, следовательно, тем энергичнее пойдет даль-
нейшее разложение вещества; кроме того, громаднейшая скорость
’разложения, в случае применения в качестве внешнего импульса де-
тонатора об‘ясняется тем, что при этих условиях передача энергии
от импульса совершается в условиях, близких к адиабатическому
• процессу, так как потеря тепла при этом ничтожно мала по сравне-
нию со всем количеством его, выделяемым детонатором. В случае же
применения внешнего импульса в виде нагревания или искры, вос-
пламенение происходит не мгновенно, а требует некоторого конечного
времени, вследствие большой утечки тепла в окружающую среду; чем
интенсивнее будет передача тепла взрывчатой системе, тем быстрее
достигается та предельная температура, при которой начинается
взрывчатое разложение. Скорость нагревания какой-нибудь части
данной системы находится под влиянием двух противоположных про-
цессов: притока тепла извне и расхода его путем распространения,
как в самой массе вещества, так и путем излучения.
'Влияние температуры на скорость воспламенения изучалось,
главным образом, в применении к газовым взрывчатым смесям, по
отношению же к твердым и жидким веществам, изучение этого вопро-
са затрудняется следующими обстоятельствами: реакция взрывчатого
Ьфадожения многих веществ, пр мере изменения температуры, сильно
том резкими’ скачками изменяется в отношении образующихся
ИЦрудеюв взрыва и поэтому получаются несравнимые условия разло-
Единственный вывод, какой можно получить из опытных дан-
^ндоодится к тому/ что за некоторым пределом температуры ско-
^^Еимакции распада всех взрывчатых веществ становится настоль-
^ИЬиительной, что воспламенение их происходит почти мгновенно.
практике чаще всего определяют температуру воспламенения
веществ при одинаковых условиях поселенного нагрева-
;tyxape&CHiiii. Взрывчатые вещества и взрывные работы. 6.
ния, для чего определенную навеску, помещенную в толстостенный
стеклянный цилиндр, нагревают на маслянной или парафиновой бане,
начиная с 100°, при чем нагревание ведут с такой скоростью, чтобы
температура равномерно подымалась со скоростью 5° в минуту; нагре-
вание производят до вспышки вещества. В нижеследующей таблице
приведены температуры воспламенения некоторых взрывчатых веществ:
Пироксилин с 13% азота............ 183 — 186* С.
Коллодионный хлопок (12% №) . . .186-190° „
Пироксилиновый бездымный порох . . 168—172* г
Нитроглицерин....................160 - 220° „
Гремучий студень............ . . .. 180'—200® ,
Нитроглиц порох (40% нитроглицер.) 170—180° „
Динамит (75% нитроглицерина) . . . 180—200* ..
Пикриновая кислота ......... > 220° „
Нитроманнит....................... 160 — 170* ,,
Нитрокрахмал..............«... 170—175® ,.
Гремучая ртуть.................... 160—165* я
Черный порох ..................... > 225* „
S 2. Скорость горения га-
зовых взрывчатых смесей
при обыкновенном взры-
ве.
Вопрос о скорости распространения взрывчатого разложения в
газовых смесях в виду большого теоретического и практического ин-
тереса будет рассмотрен подробно отдельно.
Обыкновенный взрыв отличается от детона-
ции тем, что реакция распространяется во взрыв
чатом веществе, благодаря простому обмену теп-
лоты путем теплопроводности между сгоревшими
и не сгоревшими слоями. Для газовых смесей,
вследствии удаленности частиц друг от друга, эта скорость довольно
незначительна, благодаря чему, вопрос о скоростях их горения был
изучен довольно подробно.
Первым исследователем, произведшим экспериментальное иссле-
дование этого вопроса, является Бунзен, который пользовался сле-
дующим Приемом: взрывчатая смесь, заключенная в сосуд, выпуска-
лась через тонкое отверстие и зажигалась, при чем определялась та
скорость выхода газа, при которой пламя горящего газа держалось у
отверстия, не проскакивая во внутрь. Принимая скорость горения в
этом случае равной скорости выхода газа из отверстия, можно легко
определить ее по уравнению:
где F — площадь поперечного сечения отверстия в квадратных сан-
тиметрах, a v — число кубич. см. в секунду выходящего газа.
Для водородной гремучей смеси эта скорость, по Бунзену, ока-
залась равной 34 метрам, а для окиси углеродной (СО 4-0)—одному
метру в секунду.
Дальнейшими работами Малляра и Ле-Шателье и др. были под-
тверждены наблюдения Бунзена. При этих опытах измерялась ско-
рость. перемещения пламени в трубке, заполненной испытуемой гррю-
чею смесью, при чем в работах Михельсона ход процесса горения за-
писывался прямо на фотографической пластинке. Кроме того опытам?
Михельсона была еще выяснена зависимость скорости горения газо-
вых смесей'от относительной пропорций их состава. Если бы резуль-
таты опытов Михельсона выразить графически, построивши соответ- )
-сменные диаграммы, то мы увидели-бы, что во всех кривых ясно на-
мечается точка, соответствующая наибольшей скорости горения, при
чем в пропорции этих смесей всегда имеется небольшой избыток
(около 10®/в горючего газа.
При изменении пропорции в ту или иную сторону от этой макси-
мальной точки, скорость горения понижается и в конце концов ста-
новится настолько незначительной, что устраняется всякая возмож-
ность взрывчатого разложения и смеси становятся не горючими. В
нижеследующей таблице приводятся примеры сохранения горючести
для различных га-ювых взрывчатых смесей при воспламенении их
электрической искрой средней длины:
Пределы сохранения в газовых смесях
взрывчатых свойств.
Водород (Н) . . . 9.5 — 66.5 по об‘ему
Окись углерода (СО) 16.5 — 75.0
Водяной газ (На-[-0) 12?5 — 66.5
Болотный газ (СН<) ь — 13
Светильный газ 8 — 12
Ацетилен (С2Н./). . 3.5 — 52.5
Этилен (С2Н4) . . 4 — 14.5
Эфир этиловый . . 27 — 7.7
Ацетон (С, Н60) . . 5 — 12
Спирт, винный 90°/и. 4 — 13.7
Бензол (С6 Н6) . . . -2.7 — 6.3
Бензин...........2.4 — 4.9
Пейтан (С5 Н1а) . . 2.5 — 4.6
Хлористый метил (Из CI) 10—15
Значение пределов воспламенения газовых смесей имеет боль-
опой практический интерес, так как позволяет устранять иногда
-могущие произойти в рудниках взрывы выделяющихся из земли
стазов,
j . V
На пределы сохранения газовыми смесями взрывчатых свойств
^«оказывает большое влияние температура, с повышением которой пре-
ьМёлы горения расширяются.
К, Аналогично температуре оказывает большое влияние и давление
Кфичем с уменьшением давления пределы постепенно суживаются и
НжКОНце концов, все газовые смеси становятся совершенно не горю
far при некоторой определенной малой величине давления.
84 —
Малляр и Ле-шателье опытами с гремуче-водородной смесью по-
лучили следующие цифры
Состав смеси
Скорость распространения
в 1 сек.
2 об. И. -+- 1 об. о .
2 <>б. Н. -1- 1,5 об. О . . •
2,5 об. II. 1 об. О . . .
2 Об. Н. Ч- 2 об. О . . .
20 метров
17
1"
1 г>
2 Об.-4Н. -4- 1 об. О
Эти данные вполне согласуются с работой Михельсона, причем
здесь заметно влияние теплопроводности составных частей смеси на
скорость ее горения. Так смесь, состоящая из 3 об'емов водорода-!-
1 об'ема кислорода, имеет скорость горения 12 метров, в то время,
как смесь из 2 об. водорода-{-2 об. кислорода имеет скорость всего
лишь 10 метров. Эта разница об'ясняется тем, что теплопроводность
водорода (0,000383) значительно лучше кислорода, а также' воздуха
(0.00057), азота (0,000052) и углекислоты (0.000022),
Почти одинаковой теплопроводностью кислорода и азота можно
об'яснить то, что в смесях метана замена избытка кислорода азотом,
не изменяет скорости распространения горения, примешивание же
углекислоты понижает ее.
На газовые смеси очень часто оказывают каталитическое влияние
некоторые посторонние примеси. Так, в случае присутствия в окси-
углеродной смеси незначительных количеств водяного пара,4 скорости
заметно вырастают, что видно из нижеследующего:
Процентное содержание водяного пара
Скорость горения
о*/с....................................... 119 метр в сек.
1.2’4 об'ема............................. 175
5-6*4 „ 244
2О.О’/о „ ...................... • 317
Точно также оказывают каталитиче ское влияние и многие водо-
родистые соединения, как вапр.
H3S; NH3: HCl; C2Ht и др.
Влияние их можно об'яснить побочными реакциями, как, напр.г
с присутствием водяного пара в оксиуглеродной смеси, наряду с
обыкновенной реакцией горения окиси углорода.
2 CO-2-On = 2 С Оз,
.могут иметь место и две другие:
СО -=- Н2 О = СО, + 1Ь.
. 211, + О2 = 2 Н2О;
вследствие невозможности этик реакций в гремучей водородаой сме-
сщнрисутствие паров воды совершенно не указывает каталитического
' влияния.
Все эти опытные данные относятся к спокойному состоянию сме-
сей, но, повидимому, скорости распространения значительно возра-
стают при колебаниях газообразной массы, подвергающейся горению.
По опытам Малл яра и Ле-Шателье, скорость распространения горения
рудничного газа равна 0.6 метра в сек., и если бы она оставалась
таковой, то взрыв этого газа никогда не имел бы тех ужасных пос-
ледствий, каковые известны на практике, и рабочие могли бы спа-
саться при появлении пламени.
Точных опытных данных по этому вопросу совершенно не имеется,
только при горении болотного газа в неспокойном состоянии в труб-
ках при лабораторных испытаниях найдены наибольшие скорости, до-
«стйгающие 20 метров, а в крайних пределах практики возможно до-
пущение скорости в несколько сот метров.
При изучении явления горения в трубках наблюдалось следую-
щее. 1) сначала происходило спокойное распространение пламени, 2)
горение смеси при неспокойном ее состоянии и в 3) горение посте-
пенно ускорялось вплоть до скоростей, отвечающих взрывной волной.
В Особенности второй и третий периоды имели место при воспламе-
нении смеси с закрытого конца трубки.
На практике при взрыве рудничного газа в галлереях возможны,
как и в трубках, два рода воспламенения:
1) в случае вспышки газа у входа в галлерею, распространение
пламени внутрь совершается более или менее спокойно (происходив
обжигание, удушение) и 2) при воспламенении газа у глухого конца
галлереи—происходит сильный взрыв.
§ 5. Горение взрывча- Вопрос горения взрывчатых веществ под
ты* веществ вообще под большим давлением, в виду его громаднейшего
большим давлением, в практического интереса в применении их для
^частности порогов стрельбы из огнестрельных орудий, подвергся
всестороннему исследованию. Подробное рассмотрение этого вопроса
’Относится к предмету внутренней балистике. а мы отмечаем здесь
«лишь важнейшие заключения, какие можно сделать на основании
s пйтных данных.
Ъ начале существовал взгляд, что зерна дымного пороха сго-
>т в, канале орудия так же, как и в воздухе—параллельными (кон-
трическими) слоями, и что давление совершенно не оказывает
яния на скорость горения.
Позднейшими исследованиями Сен-Робера, Костана, Сарро и
I это мнение было совершенно опровергнуто; так по исследова-
остана, в орудиях больших калибров средняя скорость состав-
лю менее 30 см. в сек., а наибольшая доходит до 150—200 см.
цельно, в 150—200 раз превосходит скорость горения на
воздухе.
86 —
Исследования Вьелля показали, что употребляемый дымный по-
рох никогда не горят в канале орудия параллельными слоями к
подобное горение наблюдается лишь только в бездымном порохе
коллоидального типа.
Сарро, изучая зависимость скорости горения взрывчатых веществ
от давления п' основываясь на диффузии газов через пористые тела,
выразил эту зависимость формулой:
п = АР <
где Р представляет собою внешнее давление, а коэффициент А и по-
казатель степени / величины, зависящие от природы вещества.
Наиболее обширные исследования над горением пороха под вы-
сокими давлениями были произведены Вьеллем, определявшим дав-
ление, развивающееся в приборе Сарро и Вьелля при горении в нем
взрывчатых веществ, а также время, следовательно, и весь закон на-
ростания давлений в зависимости от времени.
Своими исследованиями Вьелль еще раз’ подтвердил правиль-
ность вывода Сарро о зависимости скорости горения от давления по
уравнению:
11 = АР Л
Для некоторых сортов пороха он приводит величины А и/. Так.
например:
Дымный черн. порох •
бурый .
Бездымн. пирокс. порох
БалисТит ..........
Кордит ............
. и = 0.80Р*/3
. н — O.89P‘/t
. и — О.74Р2/з
. и = О.62Р8/,,
. и = 0.84Р%
В какой степени изменяется скорость горения различных поро-
хов в зависимости от давления, можно видеть из следующей таб-
лицы: ,
111 '1 11 IJ11 III I I « i I III I I 1*1—i 11
Скорость горения пороха в метр( сек.
Давлени ।
Дымный порох
в атмосферах Ружейный черный Бурый призматич?
1 0.8 0.9
□00 0.0 4
1000 8 4.5
1500 ; 9 5
2000 1 10 6
2500 — 6.5
3000 i
3500 ‘ ——
4000 — 11
Пироксил. безд. пороха Нитрогл. безд. пор.
Содерж. 40 "д 1 нитрогли- церина 3| Содерж. 58®/q . нитроглй- [ церина
0.08 0.27 0,5
1- 0 10 . 15.5
7.5 16.5 23
10 21.5 29
12 26 35
• 13 5 30 39
15 — 42
17 —— 46 '
18 — 49
§ 4. Стойкость взрыв-
чатого вещества.
Как видно из этой таблицы, давление оказывает значительно
большое влияние на бездымный, чем на дымный порох, кроме того,
скорость горения нитроглицериновых порохов выше чем пироксили-
нового, хотя первые подвергаются значительно меньшей зависимости
от давления.
Затем Вьдллю удалось окончательно доказать, что горение дым-
ного цороха под высоким давлением никогда не происходит по
параллельным или концентрическим слоям и что такое горение свой-
ственно лишь бездымным порохам.
Позднейшие исследования различных авторов вполне подтверж-
дают выводы Вьелля, хотя у некоторых встречаются попытки выра-
зить зависимость скорости горения от давления другими функциями.
При рассмотрении вопроса о чувствительности
взрывчатого вещества к взрыванию мы не говорили
о значении времени. Но, многие взрывчатые веще-
ства, при более или менее продолжительном времени хранения, изме-
няют не только чувствительность к взрыванию, но й различные свои
взрывчатые свойства в ту или другую сторону. Так пироксилин, из-
готовлявшийся прежним способом, не выдерживал долгого хранения
и иногда его саморазложение доходило до самовоспламенения. Ко-
нечно, изменение свойств вещества производится не самим временем,
а различными деятелями, действие которых выражается в функции
от времени.
Свойство взрывчатого вещества сохранять в течение времени свои
качества, нормальную чувствительность к взрыванию и, вообще, все свои
взрывчатые свойства, назв. стойкостью, взрывчатого вещества или их по-
стоянством. Нестойкими взрывчатыми веществами называются те, ко-
торые с течением времени более или менее меняют свои свойства.
Причины, делающие взрывчатые вещества нестойкими, при хранении,
могут быть двух родов: химические и физические. й"
К химическим причинам относятся, напр., непрочность самих
химических соединений, образующих взрывчатое вещество, вследствие
их эндотермической природы, присутствие различных химических
агентов, как-то: неотмытых кислот, щелочей и пр., обе эти причины
значительно усугубляются при действии более высокой температуры', и хотя
она является деятелем физическим, но она вызывает ускорение хими-
процессов и, значительно увеличивает скорость разложения ве-
'КрймЬтого, непостоянство вещества может происходить и оттого,
м.
5ет большую способность к реакциям соединения (или
дгоуающими телами. Так пикриновая кислота легко
на стойкость веществ, кроме
>ивяот. вместе с химическими,
мвв1 вмжаомых частей данного
~ллялмл
о®*.
/ЛйЕ$'
_ ..,_ , _цли1,......, .....Ж веществ, мак дымный
. физических причин,
так хек- имйшаяяг вДажвосСЬ/дейсхвуЯрастворяющим образом на
еёлитру, вначале расстраивает достигнутую до некоторой степени одно-
родность состава, а Затем и совершенно приводит порох в негодность;
сотрясения при перевозках, вследствие перетирания зерен, нарушают
полировку наружной поверхности корки зерен и вызывают образо-
вание. мякоти; от ударов происходит раскалывание зерен, чему спо-
собствует хрупкость, очень сильно выраженная у него, сравнительно
.с бездымным порохом. Итак дымный порох в некоторых условиях
может являться нестойким в физическом отношении, в химическом
же он является очень стойким, так как все его составные части
(уголь, сера и селитра) являются очень стойкими.
В бездымном пироксилиновом порохе происходит улетучивание
остаточного растворителя и может увеличиваться содержание воды,
В нитроглицер. порохе, особенно при повышенной температуре, про-
исходит испарение нитроглицерина. При низких же температурах,
вследствие изменения об’ема нитроглицерина от замерзания, может
также происходить нарушение строения пороха. Гремучая ртуть и
азиды при действии света, постепенно разлагаясь, теряют свои взрыв-
чатые свойства. Нитросоединения под действием света меняют окраску
(пикриновая кислота—становится ярко-желтой, тринитротолуол—бу-
реет, а нитробензол- зеленеет). Но изменение взрывчатых свойств при
этом не замечено, вероятно в виду незначительных количеств изме-
няющегося только с поверхности вещества.
Из этого мы видим, что, помимо двух родов причин, вызываю-
щих нестойкость взрывчатых веществ, необходимо еще различать для
самого вещества: стойкость в химическом отношении и стойкость в
отношении физическом, так как одна и та же причина может изме-
нят!> илп химические либо физические свойства. Наше внимание мы
обратим главным образом на химическую стойкость. Постоянство же
вообще взрывчатых свойств, в том числе и балистических, склады-
вается, обыкновенно, из этих двух видов обстоятельств.
Здесь, как и при вопросе о чувствительности, заметим, что
вообще нитросоединенпя являются не только более прочными в отно-
шении чувствительности к взрыванию, но и более стойкими при хра-
нении, чем азотнокислые эфиры, так как группа нитро (—Л’<Г) является
более прочной, чем группа азотной кислоты (—О2\гОа).
Однако, стойкость взрывчатого вещества есть свойство относи-
тельное, и одно и то же вещество, в различных условиях хранения,
проявляет различную стойкость. Эго зависит от удаления или смягче-
ния вреддого действия тех причин, которые мы перечисляли. Поэтому
на практике при фабрикации, хранении и перевозке взрывчатого ве-
щества стараются создать условия, наиболие благоприятствующие
проявлению стойкости в высшей мере. Так стараются приготовить
вещество возможно более чистым, обеспечивают его от сырости, если
оно ег боится, некоторые, как, например, гремучую ртуть, хранят
в темноте, вещества, содержащие летучие части, хранятся в герметй-
ческой укупорке, (например, бездымный порох) при перевозках ста-
раются избежать значительных ударов и сотрясений, стараются не
подвергать взрывчатое вещество продолжительвому действию повы-
шенной температуры и солнечных лучей и т. д. Ясно, что, чем менее
стойко данное взрывчатое вещество, тем больше требуется предосто-
рожностей при продолжительном его хранении.
— 89 —
Но иногда, несмотря на все подобные предосторожности,, веще-
ство по самой своей природе является нестойким или, как пирокси-
лин, не может быть вполне абсолютно отмыто от кислот (по крайней
мере при заводском его изготовлении), которые его разрушают. Тогда,
гораздо проще решается вопрос об увеличении стойкости (если не
самого вещества, то фабриката из него) посредством введения в его,
состав некоторых веществ, парализующих разлагающее действие вред-
ных примесей.
Напротив, желая проверить стойкость какого-нибудь взрывчатого
вещества и сравнить его по стойкости с известным, подвергают хра-
нению небольшое его количество нарочно в самых неблагоприятных
условиях, но таких, с которыми иногда действительно придется иметь
дело при его хранении. Это так называемый медленный способ, так
как он часто требует многие годы; между тем, иногда требуется не-
медленный ответ на вопрос, годится ли данное взрывчатое вещество
в отношении стойкости, не будет ли оно легко разлагаться в условиях
хранения и не является ли оно поэтому даже опасным в обращении.
Кроме того, этот способ совсем не годится, когда желают сравнить
два образчика того же взрывчатого вещества, но различного приго-
товления, или только разных партий, если немедленно одну из них
надо пустить в дело, как, например, пироксилин на фабрикацию по-
роха. Без испытания же порохового пироксилина в этом отношении
мы не можем ручаться и за стойкость пороха, приготовленного из него.
Поэтому для сравнения взрывчатого вещества но стойкости упо-
требляется так называемый скорый способ, состоящий в держании
взрывчатых веществ при температуре, значительно высшей обыкно-
венной, а затем они могут сравниваться или но чувствительности
к взрыванию, или по отношению к химическим реактивам, по потере
в весе, появлению на глаз продуктов разложения (окислов азота) рли
другими приемами. Так как с увеличением температуры увеличи-
вается скорость разложения взрывчатого вещества (как и вообще хи-
мических реакций), то при таком скором способе то, что при медлен-
ном совершается весьма долго, пред нами в термостате происходит
быстро, и годы сокращаются в часы и даже в минуты. Таким образом,
можно полагать, что образчик, оказавшийся более стойким при уско-
ренном способе, будет более стойким и при медленном, а также ока-
жется более стойким и на практите. В виду того, что пироксилин, и,
в особенности, бездымный порох являлись особенно капризными в
•отношении стойкости, то для них выработано много испытаний, По-
следние и будут описаны в соответствующей части настоящей книги.
?(од реакций разложения взрывчаты^ веществ.
§ 1. Различный характер В зависимости от характера внешнего импуль-
ра'зпожений взрывчатых са и давления большинство взрывчатых веществ
веществ. способно разлагаться с различной скоростью и по
различным уравнениям.
Типичным примером в этом отношении является аммиачная
селитра NH, NO3, разлагающаяся в завибимости от условий по 5-ти
- различным уравнениям, то с поглощением, то с выделением тепла,,
что видно из нижеследующего:
Реакция разложения.
Количество
тепла в ка-
। лориях.
Условия реакции.
1) NH. NO, = HN03 + NHS.
2) NH, NO, = N.O-j-2HSO. .
3) NH. NOs = O,5N.-J- NO-J
-|-2H2O.....................
4) NH, NO, = 0,75 N/ 4- 0,5
NO-J-2H2U.................
5) N H, X 0.. = N. I- 0,50 > +
...................
— 41,3 При слабом нагревании.
4 10,2 I При слабом нагревании
4 до плавления и несколько
+ J выше, примерно до 200°.
.,0 - 1 При быстром и сильном
" ’’ нагревании (400 — 500°),
о а 7 разложение со взрывом.
Вообще замечено, что чем слабее первоначальный импульс, вызывающий
начало взрывчатого разложения, тем сложнее получаются продукты рас-
пада и тем медленнее течет сама реакция, а, следовательно, здесь не
могут иметь места большие давления. Чем сильнее становится импульс,
'тем получаются все более и более простые, а вместе с тем и более стойкие
продукты распада, а сама реакция, благодаря возникающему здесь большому
давлению, протекает в самый короткий срок. То же самое наблюдается
и у других взрывчатых веществ, ибо нам известно, что большинство
взрывчатых веществ, как-то: пироксилин, нитроглицерин и т. и., спо-
собны при слабом нагревании их или при воспламенении под малыми давле-
ниями, подвергаться особому роду разложения с образованием окислов азота
и окиси углерода, независимо от содержания в частице кислорода, иногда
вполне или даже болев чем достаточного для сгорания углерода и водорода
в углекислый газ и воду.
С подобного рода разложением приходится сталкиваться при
испытании химической стойкости взрывчатых веществ, а также при
неудачных, не полных взрывах и при холостой стрельбе ’).
Если взрывчатое вещество будет подвергаться воздействию крайне
энергичного импульса, то взрыв дает продукты простые, наиболее
прочные, п все разложение можно выразить одним уравнением, так
*) На практике с реакцией медленного разложения аммиачной селитры по
уравнению 1-му, приходится сильно считаться: при хранении именно она и
имеет место, при чем аммиак, вследствие сильной ‘летучести своей, тотчас же
удаляется, азотная же кислота действует сильно раз‘одающим образом на ме-
таллы, находящиеся по соседству с ней.
что для этих случаев можно, не прибегая к анализу, предсказать-
направление реакции и определить количество и состав продуктов-
взрыва.
Предсказать реакции разложения для взрыва наиболее совер-
шенно можно, лишь руководствуясь следующими положениями:
А) если в частице взрывчатого вещества имеется большой запас
кислорода, то весь углерод и водород сгорят в углекислый газ и воду,,
а азот выделится в свободном состоянии, в каковом выделяется и
избыток кислорода, если таковой остается к концу реакции.
В) вещества с недостаточным количеством кислорода не подчи-
няются столь простым правилам распада, так кат: на ход его оказы-
вает большое влияние плотность заряжения и максимальное давление взрыва,
В зависимости от природы составных частей продуктов разложения вы-
деляющиеся при взрыве газы могут быть более или менее ядовиты.
На это Главное влияние оказывает содержание в них окиси углерода.
§ 2. Разложение взрывчаты; веществ Рассмотрим на некоторых приме-
с количеством кислорода, достаточным рях оба рОДВ взрывчатых разложений.
для полного окисления. Разложение взрывчатых веществ,
относящихся к этой группе, при полном взрыве, соответствует началу
наибольшего выделения тепла, что возможно только в том случае, когда
весь углерод и водород сгорят в углекислоту и воду, а азот выделится в
свободном состоянии: при всяком другом превращении отделялось-бы
меньшее количество тепла. ।
Действительно, однородные химические соединения с большим
содержанием кислорода в частице, как-то: нитроглицерин и нитроман-
нит при полном взрыве всегда следуют упомянутым выше теорети-
ческим предположениям и дают лишь продукты полного окисления,
так, например, теоретически нитроглицерин разлагается по- формуле:
2C3H5(ONO2)3 == 6СО2 Ь 5Н2О ' 3N. ' 0.50, 1590 калорий*).
&
Нитроманит-же: 1
C.H.(0N0A = 6(.’О, 4Н„О 3N. 0, 4-1465 калорий.
U Q ' и J J д I > J Ж I X
Как видно из этих уравнений, количество заключающегося в
этих взрывчатых составах кислорода больше того, которое требуется
для полного сгорания, и часть его освобождается не использованной.
Взрывчатые вещества с недостаточным количеством кислорода в
частице для полного сгорания, будучи смешаны с аммйачной селит-
рой, также следуют принципу наибольшего выделения тепла; так,
например, смесь из 40% пироксилина состава С24Н29ХИ<% и 60% ам-
миачной селитры, разлагается по уравнению:
С24Н20 Nn 0и J-20,5NHtN()g = 24С02 55.5Н,0 26N, Ц-1290 калорий,
,т.-е. теоретически выделяя тепла на 1 кгр. 1290 кал. (для смеси 40’
пироксилина и 60% NH4NO..), тогда как наблюдение дает 1275 ка-
дорий из других веществ подобного рода укажем на следующие:
Беллит (динитробензола 17,5% и аммиачной селитры 82,5°/,)
||L V C0H4(NO2), + H0NHtN03 = 6СО,4 22Н4О + 1 IN,;
ИвЬ% *) По Филиппову; иные наблюдатели для теплоты разложений нитроглицерина
^мЬывжют несколько отличные числа.
Громовой (пикрата аммония—27,5% и аммиачной селитры 72,5%)—
CeH2(NO,),ON% 4- 8NH4NO3 = 6СО2 4- 19Н3О 4-10%.
Панкластит Тюрпена (мононитробензола 30% и двуокиси
азота 70% — '
2C.H.NO. 4- 12,5NO» — 12(10,, -|- 5Н.0 ' - 7.25%.
Гремучий студень (нитроглицерина 91,5" „ и . колодионного
хлопка S,5%—
51C8H5(0N0a)a4- C„H3J%OS8 = 17700,4143%04- 31%
Что же касается до распада смесей, содержащих в своем со-
ставе KNO^NaNOs/BafNOsj-j, а также и бертолетовую соль, то они
обычно уклоняются от наивыгоднейших, в отношении выделения
тепла, реакций, что об’ясняется возможностью образования вторичных
реакций, идущих среди продуктов распада. Так, например, смесь
58% пероксилина состава с 42% калиевой селитры в
первый момент взрыва распадается по реакции:
5C%Ha<>Nn 0.44- 41 KN(»3 = 20,5К„С0з 4- 99,500-.. 4- 72,5Н3( > -г 48%,
что соответствует выделению на 1 кгр. вещества—980 калорий. Однако,
возможно допущение, что при охлаждении будет образовываться кис-
лый углекислый калий и если бы это совершилось вполне реакция
‘будет протекать по следующему уравнению; ,
5CS4H39N11O43 4- 41KNO3 41KHC0.-J 4- 7900., 4.5211,0 4- 48%,
при'чем,/вместо 980* калорий, их освободилось бы 1120.
При опытах Сарре и Бьеля со смесью 50% пироксилина if 50%
KNOa (т.-е. с некоторым избытком окислителя), наблюдалось выде-
ление 960 кал. на 1 кгр., т.-е. на 15% меньше теоретического, со-
ответствующего первой реакции, а, следовательно, возможно допу-
щение и других реакций распада.
В© всяком схучае, из сопоставления этих цифр мы видим, что
хотя вторичные реакции и имеют место, но, вследствие крайне бы-
строго охлаждения продуктов взрыва, они не идут до конца и до-
вольно незначительно влияют на конечный итог распада, так что для
приближенных расчетов можно пользоваться уравнениями, соответ-
ствующими полному сгоранию.
§ 3. Разложение при недостаточном ,£»ЗрЬ4вЧСЮТШ' вещества с недости-
количестве кислорода. точным количеством кислорода для пол-
ного сгорания углерода и водорода в углекислый газ и воду не следуют при
своем распаде правилу наибольшего выделения тепла, а уклоняются от
него в ту или другую сторону.
Состав и количество продуктов распада подобных взрывчатых
веществ сильно колеблются в зависимости от наличия кислорода, ко-
торого может быть или только достаточно для образования окиси
углерода, или даже меньше, или больше, чем нужно для окисления
всего углерода в СО.
Рассмотрим оба случая отдельно.
а) Кислорода во взрывчатом веществе не больше, чем нужно для1
образования окиси углерода.
При взрывчатом разложении веществ этой группы, наблюдается
всегда соединение, всего кислорода с углеродом в окись углерода, а
остальные элементы выделяются в свободном состоянии, в каковом
виде при недостатке кислорода, выделяете т и углерод.
Для простоты рассмотрим реакции распада наиболее характер-'
> вых представителей, как-то гремучей ртути Hg(CNO)., и-азотнокислого-
диазобензола OJI5N2NOS.
Гремучая ртуть. Исходя из принципа наибольшего выделения
тепла, возможно было бы ожидать разложения гремучей ртути по
следующему уравнению:
Hg(CNO)2 Hg4- СО» + € 4- N» -г калорий,
в действительности же ее распад совершается иначе;
Hg(CN( >)i e Hg 4- 2СО 4- Na + 114,9 калорий*)-
Возможное дальнейшее превращение окиси углерода в углекислый газ.,
по уравнению:
2СО = СО-2 4- С 4~ 42,3 калорий
встречает препятствие в виду: высокой прочности СО ^сравнительно
с СО8 и огромной скорости разложения гремучей ртути, по окончании
какового наступает быстрое охлаждение, при чем, вследствие малой
теплоемкости продуктов взрыва, а также малого количества выде-
ляющегося при этом тепла (по сравнению с другими взрывчатыми
веществами), исключается всякая возможность подобного рода пре-
вращения.
Азотнокислый диазобеяэол CnHeN2NOs является типичным пред-
ставителем взрывчатых веществ с содержанием кислорода недоста-
точным даже для превращения всего углерода в окись.
Распад частицы совершается по уравнению:
2QeH5N2NO3 =s 6СО 4* 6С 4- 5Н» 4 3N2 + 403,2 калорий. •
Благодаря присутствию свободного водорода, возможно ожидать-
появления вторичной реакции:
’СО 4 2Нй = СО4 + СН4,
но таковая не происходит вследствие тех же причин, затрудняющих,
реакцию 2СО - СО4 -I- С при гремучей ртути. Однако, ио исследова-
ниям Вертело и Вьеля, разложение азотнокислого диазобензола со-
провождается образованием до 9% побочных продуктов, не вошедших
в уравнение, а именно: метана СН4 (2,15%), цианистого водорода
HCN (3,2%), аммиака NH, и др. соединений углерода, водорода и
азота. Образование подобных соединений возможно об’яснить синтезом,
этих соединений. , .
•) Ио Филиппову выделяется 101 калория.
в) Кислорода во взрывчатом веществ больше, чем нужно для образо-
вания окиси углерода. При взрывчатом разложении веществ, относящихся
к этой группе, мы наблюдаем значительно более сложную картину рас*
пада, и. вывести какую-либо строгую закономерность в образовании
конечных продуктов не удается, вследствие того, что наряду с пер-
вичными реакциями, имеют место и реакции вторичные, количественная
сторона которых зависит от давления, развивающегося при взрыве,
В общем при взрыве мы наблюдаем здесь примерно следующую
последовательность: кислород в начале распределяется между углеро-
дом и водородом, вследствие чего наблюдается появлёние окиси угле-
рода и паров воды, которые тотчас же вступают между собой во взаимо-
действие по реакции:
Н2О + СО;-= СО,;-!-Н2-10 калорий;
в свою очередь водород вступает в реакцию с окисью углерода:
2Н, 2СО = СО, -|- СН4 4" 60,2 калории.
и действительно при взрывчатом разложении веществ, относящихся
к этой группе, мы всегда наблюдаем, кроме окиси углерода, паров воды,
и свободного азота, Присутствие углекислого газа и метана, причем %
содержания их наз-одится в прямой зависимости от плотности заряжа-
ния, что видно из следующих опытных данных работ Сарро и Вьелля:
Наименование испыту
емого вещества.
Пироксилин . .
(Воспламенение на-
каленным телом) *).
Пикриновая кислота.
со,
Н2
N2
СН4
!|Состав газо-!
образных [
: продуктов 1
; взрыва. :
со
со.
Плот п о с т ь заряжания.
0,01 0,023 I 0,20 । . 0,30
49,3% 37,6 34,7
21,7 12,7 i , 27>7 л 18,4 * t 30,6 > 17,4
16,3 ! 15,7 15,6
0,0 0,6 1,5
об‘ем газов об‘ем газов
на 1 к. грм. I на 1 кгр.
658 — ’ 682 —
61,6 | 54,3 48,8
—— ~ 7,6 , 15,4 20.5
* 12,5 1 6,3 3.1
17,1 ; 18,2 19,8
— 1,2 ; 5,8 7,8
1 1. об‘емы газов на 1 kgr.
— * 830 ! 765 । 725
этих данных мы замечаем, что с увеилчением
, содержания СО, и СН4 быстро увеличивается,
при больших давлениях имеют также большее место
При рассмотрении i
плотности заряжания %
а следовательно,
вторичные реакции взаимодействия с парами воды и водородом.
*) При детонации состав продуктов почти одинаков с этим.
Уменьшение количества водорода при разложении пикриновой
кислоты с увеличением плотности заряжания об'ясняется тем, ЧТО
водород при таком малом содержании кислорода, проявляет способ-
ность брать углерод из СО для образования метана. Это обстоятель-
ство следует об'яснять не только экзотермичностыо взаимодействия
2СО 4- 2HS — С0.2 -|- СН4 (что отвечает стремлению системы прибли-
жаться к правилу наибольшего выделения тепла), но также и про-
исходящим при взаимодействии сжатием (из 4 об. образуется лишь 2).
Исходя из упомянутых выше данных анализа, реакции разложе-
ния пироксилина при различных плотностях заряжания, принебрегая
образованием' СН4, можно выразить уравнениями:
Плотность
заряжания.
0.010
0,023
0,200
0,300
1 Мехавиче- |
I ское давле-!
ние в атмо- <
сферах. |
! .....
100
250
: 2300
: 3950
Реакция разложения пироксилина
C2i Н09 N(i О49
16,5СО4-7Л5 СО8 + 4Н2Ч 5,5 N24~1O,5 Н2О'
15 СО+Й СО,4-5,5 Н2-|-5,5 N2-t-9 Н2О
13,5 СО 4- 10,5 СО. 4- 7 Н<> 4- 5.5 N2 4 7,5 Н2О
13 СО+ 11 СОг4"7‘5 Н^ + 5.5 1+4-7 Н20
Следовательно реакцию разложения пироксилина при плотности
газо? 1.00 можно выразить следующим уравнением:
С24 Н29 Nii Oi2 12 СО + 12 С02 4“ 8,5 Н2 4~ 5.5 N2 4~ ® Н20 4“ 1140 кал-
лорий. Неполнота сгорания и здесь характеризуется присутствием
окиси углерода и свободного водорода.
Для пикриновой кислоты:
Плотность
заряжания. |
1
Максималь-'
ное давле- <
ние в атмо- г
сферах. |
Реакция разложения пикриновой кислоты.
16 Се Н2 (NO2)3 (ОН).
0,100 |
0,200 ।
0,300 j
890 11 СО» -4-84 СО 4-24 N, + СН4 + 16 Но +- 6 Н20
3400 [ 20 СОа + 69 СО + 24 N, + 7 СН4 + 7 М ^Н2О
4420 ! 25С02 + 61 СО+ 24N« + 9,5 CHj + 4Ho + H, 0 + 0,5С
Реакция разложения при плотности газов 1,00 выразится следу-
ющим уравнением:
16 Ce Н2 (NO2)s(OH) - 28 СО. + 56 СО + 24 N2 11 СН4 + 1,5'Н2 + С*)
Образование свободного углерода зависит, по всей * вероятности, от
проявления при высоком давлении 5000—6000 атмосфер, процесса
диссоциации окиси углерода по реакции:
2 СО ==С02 +С+42,3 калории.
Количество теплоты, развивающейся при разложении взрывчатых
веществ, находится в некоторой зависимости от плотности заряжания,
вследствие изменения состава продуктов, но все же никогда но'Достя-
гается предел соответствующий максимальному ее выделению, каковое
бы наблюдалось при разложении пироксилина по уравнению:
С24 Н29 Nii О42 = 21 СО» + 55 N, + 8.5 Н2 + 3 СН4 + 1405 колорий.
*) Но Филиппову 2 НО. СсН» (NO2)3=3 N2-JC04~ll С0+На0+2 На+-350 калорий
На бездымном порохе ясно заметен тот же характер влияния
плотности заряжания на ход разложения, что видно из следующей
таблицы:
Испытуемое вещество.
)
Пироксилиновые i
составы. f
С'24 Н:% О.л,3 Nj0 |;
I
об'ем газов на 1 кгр/
Состав | Плотность за ряхе а ни я.
газов»_'________________
со ! 48,5% 1 44 94 i 44,6%
со» ! IV „ | 21,0 „ I 22,5,,
н. 18,6 .. : 14,7 „ 20,1 ..
у “ \ я 14,0,. ; 13,9 „ ' 13,8 .,
он, 0,2 „ i 0,5 , ' 1,0 г,
705 710 7 J 5
Те же результаты, пренебрегая лишь образованием болотной
газа, можно выразить следующим рядом уравнений:
Плотность
заряжания.
0,02
0,10
0,20
Макеималь- j
ное давле- I Реакция разложения бездымного пороха,
ние. I
— 6,5 СО3 + 17,5 СО + 7 Н, + 5 N. + И Н2 О
920 7,5 С0> + 16,5 СО + 8 Н> + 5 X» + 10 Н« О
2100 8 СО» + 16 СО 4 8 Н, + 5 No + 9.5 И» О
Нитроглицериновые пороха, заключая в своем составе большие срав-
тельяо количества нитроглицерина, дают реакцию взрывчатого разло-
жения более приближающуюся к условиям полного горения;
СО» СО CH. Н2 X. (по об’ему)
36% 35,4% <>,3% 10,1 % 20,9%
Тринитробензол разлагается по формуле: »
2C,.HS (NO2)s--- 3N, 4-12С0 3HS 4- 311 калорий
а тринитротолуол:
2CSH, (CH.,) (N02)8 =••= 3N» 4- 12С0 % Зиг % 2С.
Как видно из последней формулы, выделяется при взрывчатом
разложении тела свободный углерод—это и есть тот густой черный
дым, который сопровождает взрыв тротила. В данном случае он не
служит указателем на неполноту взрыва, так как почти во всех
нитросоединенпях таковая характеризуема окраской дыма окислами
азота в желтый цвет.
Тетрил при взрыве, при небольших плотностях заряжания, раз-
лагается по формуле:
2С,Н, (NO2)sNNO,CH3 = 5Х, -+ 11С0 -% 2СО» -L Н»О СН,( % 2В.;
’ (C-f-NH3)
Формула эта показывает, что при взрыве тетрила также отделя-
ется свободный углерод (дым и копоть) и небольшое количество ам-
миака.
Азиды разлагаются с выделением свободного азота, например:
Ph \-_-i\4 3 %.
Механические смеси, с точки зрения однород-
> . азпож.ение mejca- ноети состава? значительно уступают другим
НИМ^€1СЙЖ И# Тъ А *»» A a- rt\Tl Л " ш- - * ' Г *< ‘*Г .
чатым веществам. , * Л
В механических смесях, в силу чисто технических условий,
никогда не может быть достигвута полная однородность состава, сле-
довательно, является разнообразие в продуктах разложения и реакция
распада не может быть выражена одним уравнением. Так распад се-
литре-серо-угольного пороха возможен по следующим реакциям:
(1) 2K\os s
(2) „
(3) ,
(4) »
(5) ,
г 3C = K2S+3CO2-bN2-’-775 калорий *).
„ = К2СО3 + СО2 4- СО + N2 + S 4- 620 калор.
„ К2СО3 -Ь1,5С()2 4- N2 4- S 4- 0,50 4- 700 кал.
„ = К2804 4- 2С0 4- Nz + С 4- 730 калор.
„ = K2SO4 4- С02 4' N2 4- 2С 4- 780 ,
Ио принципу наибольшего выделения тепла, мы в праве были
бы ожидать распад этого пороха по (1) и (5) уравнениям, но в дей-
ствительности при горении пороха выделяется меньшее количество
тепла, и, по опытам Нобеля и Абеля, образчик английского крупно-
зернистого пороха дает всего лишь 715 калорий.
Состав газообразных продуктов'горения в общем мало изменяет-
ся с изменением плотности заряжания, причем содержание угле-
кислоты колеблется в обе стороны и лишь % содержание окиси угле-
рода незначительно убывает.
Хотя, как уже было упомянуто, распад механических смесей те-
чет сразу по нескольким уравнениям, все же одно из них является
доминирующим, которое на практике и принимают для приближен-
ных расчетов. Так, для черного пушечного пороха состава 77,2%
KNO.,; IO,7°/OS и 12,1%С, эта реакция может быть выражена следующим
уравнением:
SKNO3 4- 3,5S 4-10,5С =. 6,5С02-;- 1,5СО 4~ 4\ + 2,5К„СО4* 0,5K2S044
-i-K2s3
причем на 1 кгр. смеси получается об'ем газов 265 литр, и при реакции
выделяется тепла 700 кал.
Если в дымном порохе количество серы недостаточно для обра-
зования H2S или ее вовсе нет, то вместо сернокислого калия обра-
зуется поташ, весьма прочное соединение, и реакция протекает по
формулам:
2KN0.-4 4С — К2СО3 4-ЗСО + Ng, или
4KN0' 4- 50 = 2К2СО. 4- 300. 4- 2N2
Напротив, при недостатке или полном отсутствии угля и из-
бытке кислорода получается сернокислый калий и сернистый газ:
2KN0. 4- 2S = k2SOj 4- SO, 4- N2.
О’ 'X I Л ’
_ . _ ..... # '
’) Эта формула соответствует теоретическому составу пороха: 78,4% калиевой
селитры, 13,4% серы и 11,8% угля. Филиппов определил число калорий, выделяю-
щихся при этой реакции, в 209 вместо 775.
Проф. Л1. Сухарсясыпп Взрывчатые вещества и взрывные работы.
98 —
, _ При составлении уравнения взрывчатого рас-
S 5 j]ii£гftitUJ1114Я ГД30* х х
ъ >. Ни«<.«цИ.цн « пада веществ мы пользовались лишь опытными
образны? продуктов данными анали3а охлажденных продуктов взрыва,
взрыва. совершенно игнорируя вопрос о влиянии диссо-
циации их при тех высоких температурах, каковые имеют место при
явлении взрыва. В самом деле, в продуктах распада большинства
взрывчатых веществ мы всегда замечаем: присутствие довольно боль-
ших количеств, легко подвергающихся диссоциации, углекислого га-
за, окиси углерода и паров воды, а потому возникает вопрос, быть
может, составленные нами уравнения распада совсем не отвечают
действительности в Самый момент взрыва, а, следовательно, и все
наши предыдущие термохимические расчеты будут сведены к нулю?
Углекислый газ и пары воды начинают диссоциировать, при
обыкновенном давлении, при температурах выше 1000°, по уравне-
ниям:
200, 200 ’ О2
2Н„О^2Н, + 02,
йричем степень диссоциации находится в прямой зависимости от
температуры.
Так по Ирвингу:
Температура (абсо-
лютная')
К о э ф ф и ц и е н т ы. д и с с о ц и а ц и и
Воды.
Углекислого газа.
1500°
2 000*
2500”
3000°
0,0002
0,0051»
0,034
0Д10
0,0004
0,0085
0,156
0,485
однако, благодаря работам Малляра. /1е-Шателье,
что степень диссоциации
Оказывается
Нернста и др., что степень диссоциации зависит не только от темпе-
ратуры, но и давления, причем с увеличением этого последнего степень
диссоциации быстро падает и, при весьма высоких давлениях, стре-
мится к нулю.
Таким образом, во всех случаях взрывчатого разложения, сопро-
вождающихся развитием высоких давлений (не-<100 атмосфер) с
явлением диссоциации совершенно считаться не приходится, что, ко-
нечно, значительно упрощает все расчеты.
Изучение об'ема, а также качественного и ко-
личественного состав^ газообразных продуктов взрыв-
чатого разложения веществ в самый момент взрыва
представляет большой теоретический интерес, так
как в этом случае мы смогли бы дать точную характеристику взрыв-
чатых систем и уяснить себе весь ход этих мгновенно совершающихся
реакций; но, к сожалению, практически это оказывается невозможным,
и нам приходится производить наблюдения над продуктами распада
лишь только спустя некоторое время после взрыва и то при нормаль-
§ 6. Об‘ем и состав
газообразны^ про-
дуктов взрыва.
I
ных условиях, т. е. при обыкновенном давлении и температуре,: и уже
по этим данным судить о тех химических превращениях; каковые
могут иметь место в моменты взрыва, т. е. при громадном давлении
и высокой температуре.
Практически нам удается лишь исследовать постоянные газооб-
разные продукты, как то: СО2; СО; Н2; Na’, О2 и пр., что же касается,
жидких продуктов взрыва (воды, ртути и т. п.) то, хотя таковые в мо-
мент взрыва и находятся в парообразном состоянии, но к моменту
анализа снова превращаются в жидкости и вследствие этого, говоря
об об'еме, нам приходится различать его величину при воде жидкой
и парообразной.
Определение об‘ема газообразных продуктов может быть произ-
ведено: 1) путем непосредственного измерения; 2) вычислением, на
основании известной уже реакции взрывчатого разложения.
а _ _ В зависимости от поставленных перед нами задач,
§ . пытное измере- взрывчатое разложение нам приходится вести либо
ние и исспелованис л *
при давлениях, близких к атмосферному, либо при
продуктов взрыва. * * r v г
' . 7 к условиях обычного разложения взрывчатых веществ.
Первый случай соответствует встречающейся иногда в Практике,
обычно вследствие порчи капсюля, так называемой осечке детонации,
когда, вместо взрыва происходит лишь медленное горение заряда
при небольших давлениях с выделением большого количества окиси
углерода и окислов азота.
Для практического исследования испытуемое вещество помещается
в маленькую трубочку 15 сайт, длины (и 4 мм. диаметр., сообщаю-
щуюся с каучуковым шаром. При воспламенении заряда разложение
течет медленно, и, благодаря эластичности каучукового шара, давле-
ние все время держится близким к атмосферному.
При исследовании продуктов взрыва под большими давлениями
разложение ведут в калориметрической или манометрической бомбе
и образовавшиеся газообразные продукты, по охлаждении, собирают
в специальный ртутный газометр, в котором измеряется их об‘ем, а
затем они поступают в приборы для химического анализа. Количе-
ство воды определяется либо путем непосредственного ее измерения,
либо как разность между весом испытуемого вещества и весом газо-
образных продуктов его распада. Образующийся твердый осадок со-
бирается и анализируется отдельно.
Одним из лучших ртутных газометров, употребляемых для выше-
указанных целей, является газометр Вьелля, состоящий из прочного
чугунного сосуда, рис. 17, заполненного ртутью; для уменьшения ко-
личества ртути, сосуд имеет двойные стенки с кольцеобразным кана-
лом, в котором помещается стеклянный колокол с осевым каналом,
в который входит стержень. Газы собираются в пространстве.под ко-
локолом над ртутью, куда они проводятся по специальной трубке.
Для измерения об‘ема собранных газов, над подвижным стеклян-
ным колоколом имеется еще неподвижней колокол, герметически
скрепленный с нижним основанием газометра и заполняемый через
особую воронку водой; при перемещении подвижного стеклянного
колокола, по мере того как он заполняется газами, он вытесняет из
неподвижного стеклянного колокола равный об'ем воды, которая вы-
текает через боковую трубку и собирается во взвешенный сосуд.
Пользуясь практически таким газометром, из него предварительно
выпускают заполняющий его газ или воздух и посредством разряжаю-
щего насоса поднимают ртуть по вышеуказанной специальной трубке
Рис. 17, Ртутный газометр Вьелля.
,до появления ее у крана, который после, этого закрывают. В непод-
вижный стеклянный колокол наливают воды в таком количестве.,
чтобы уровень ее был на высоте боковой трубки для стока воды. Бомбу
с продуктами взрыва присоединяют при помощи каучуковой трубки,
к входному крану специальной трубки, причем в эту соединительную
трубку вводится еще небольшой ртутный манометр, при помощи
которого можно следить за давлением газов при их впуске в газо-
метр, а также за давлением газов, собранных уже в нем. Открывши
кран специальной трубки, осторожно открывают кран бомбы, причем
газы собираются в газометр, вытесняя соответственное количество
воды, которая по окончании опыта взвешивается. Зная вес вышед-
шей воды и ее температуру, а также барометрическое давление и по-
казание манометра, приводят об'ем газов к нормальным условиям и
вычисляют величину его на 1 килогр. взрывчатого вещества.
Для того, чтобы взять пробу газов для химического анализа,
нажимают при помощи стержня осевого канала вниз и, открыв
кран специальной трубки, выпускают необходимое количество газов.
— 101
Обр&ЭОВаВ-
§ 8. Анализ газов и
доставление реакций
разложения взрывча-
тых веществ.
определения об'ема газов,
взрывчатом разложении, приступают к
$
*1
После
шихся при
химическому анализу их, для чего газы пропускают .
в газовую бюретку для точного измерения об'ема
анализируемой порции, а затем в газовые пипетки,
наполненные соответствующими растворами, способными поглощать
одну из составных частей анализируемой смеси. Так, напр., для по-
глащения С02 пользуются крепкими растворами КНО, для СО—полу-
хлористой медью Си2 С12, для кислорода—щелочным раствором пиро-
галлола, для NO—раствором железного купороса. После каждого про-
пускания газа через один из упомянутых поглотителей газ снова
поступает в газовую бюретку для определения сокращения об'ема,
по которому и производят вычисление.
Определение количеств водорода и болотного газа, вследствие
отсутствия для них соответствующих поглотителей, производится путем
сжигания их в присутствии кислорода в углекислый газ и воду, ана-
лизируемые затем обычным путем, после чего судят о количестве
свободного азота, не поглощаемого никакими растворами.
Выражая результаты анализа в об‘емных процентах, не трудно
составить реакцию взрывчатого разложения, а именно-. об‘ем газооб-
разных продуктов взрыва, соответствующий одной граммолекуле ве-
щества, умножается на процентное содержание каждого газа и на вес
единицы его об1ема; полученный вес каждого газа в отдельности де-
лится на его молекулярной вес, причем и получается число молекул
его в уравнении разложения.
> 9. Вычисление
об'ема газов по
реакции взрывча-
того разложения.
».ИМ
' Н.Ч1
0-1
• ’<%
;ЧпЯ
-41
В тех случаях, когда известна уже реакция
взрывчатого разложения вещества, нет надобности для
определений об‘ема подучающихся газов прибегать к
упомянутому выше способу определения, а таковой
можно точно высчитать по реакции, исходя из закона
Авогадро, согласно которого в равных об'емах газов, при одинаковых
температуре и давлении, заключается одинаковое число молекул,
причем для граммолекул при 0° и 760 м/м. давления этот об‘ем рав-
няется 22,35 метра, а при других температурах
Таким образом, имея уравнение взрывчатого разложения одной \
граммолекулы (М) вещества, разлагающегося по уравнению:
М= iiiWi BoWg-;...............)
где wiW”....— частичные веса, a щщз...... числа частиц), мы jrtprKO
определим об'ем газообразных продуктов его распада:
760 м/м давления),
одинаковы и равны
v —22,35 (illПо-}-Пз-Ь....) литров (при 0е и
г. к. при этих условиях об'емы частиц Wj; w*;....
22,35 литр.
Для одного же килограмма:
1000 V 22.35 , , , '
$
t
ъ
t-
— 102 —
Так, для нитроглицерина, распадающегося но уравнению:
2С3Н5 ((ЖОДз = 6СО2 + 5Н2О + 3N2 + О,5О2,
об'ем продуктов, при воде парообразной, равняется:
1000 у 22,35 .„ , г
V ==----- 4-7“-- (6~- ' ’ 3 ‘ %>) — * 13 ЛИТрОВ,
х О ТГ 14
а при воде жидкой:
1000 Х_22,35
454 ...
(6 3 - /0,5) = 467 литр.
В нижеследующей таблице приводятся величины об'ема газо-
образных продуктов разложения разных взрывчатых веществ, отнесен-
ные к 1 кгр., при парообразной воде:
Vo в
литрах.
Дымный порох состава KNO3 = 84%; S = 8%; С= 8%;
Полное горение . ‘ ...........................205
Дымный охотничий порох состава KNOs — 81,9%; S = 10,2%;
С = 7,9о/о . .................. '............23?
Дымный военный порох состава' KNOs = 78,9о/о; S=9,9%
С =11,2%......................................2SO
Дымный военный порох состава 75% селитры; 1О«/о серы;
14% угля; 1% влажности .... ... 4 ... . 280
Бертолетовый порох КСЮ3 = 82,4%; S = С = 8,8% . . 225
Бездымные пироксилиновые пороха:
Ружейный В (лет. вещ. 2, 4%).................. 9io
Пушечные:
П. К. О. (лет. вещ. 2,9 %)....................92о
С. II. (лет. вещ. 3,5%).......................930
Бв (лет. вещ. 5,6%) . . ......................970
Бездымные нитроглицериновые пороха:
‘ Баллистит..................................... 810
Кордит....................................... 860
Сухой пироксилин одиннадцатцазотный.............. ... 860
Пироколлодий десятиазотный..........................895
Коллодий восьмиазотный............................. 975
Влажный пироксилин (с 17% влажноспД . 925
с 15% „ ........ 910
Пироксилин (40%) с аммиачн. селитрой................860
э (50 „) с калиевой „ 470
Нитроглицерин ... 715
Гремучий студень (ЭР/г’/о нпгрогл. 8%% коллодионного пи-
роксилина) ...................., . ............До
Гур-динамит (75% нитроглицерина) ............. 630
Нитроманнит ..................................... 695
Тринитробензол......................................940
Пикриновая кислота............................. ... 875
Пикрат аммония.................................. . 995 <
„ калия ................................... .... 550
„ аммония (23%%) с аммиачной селитрой (громобой, ,
маисит)......................................880
Пикрат аммония (43%%) с калиевой силитрой (порох
Брюжера).........................................430
Гремучая ртуть...............•................ 315
Сернистый азот...............•......................... 245--
Хлористый азот.........................................370
Азотнокислый диазобензол...............................930
Сернистый углерод (35%) с азотноватым ангидридом (пан-
кластит Тюрпена).................• . •.....470
Динитробензол (40%) с азотною кислотою (гельгофит) . . . 690
Аммиачная селитра.................. ...................975
Динитробензол (17%%) с аммиачной селитрой (беллит) . . 900
Нафталин (6%°/0) с аммиачной селитрой (состав Фавье) . 935
Нитронафталин (9%) с аммиачн. селитр. „ „ . . 925
Динитронафталин (12%%) с аммиачной селитрой............910
Нитрогуанидин ...............................". . 1075
Аллюминий (18%) с аммиачной селитрой (аммонал) .... 680
Уголь (7%) с аммиачной селитрой (динамон) ....... 905
Смеси:
Водородная Н2 Д- 0 . . . . ................1295
Оксиуглеродная СО 4-203 . . . ...................510
Метанная СЩ 4- 2 Н20 ..................... . 835
Оксиликит:
Древесный уголь (16%) с жидким воздухом содерж.
50% кислорода ..................... . . . . 620
Древесный уголь (22%) с жидким воздухом (содерж. *
70% кислорода) ............................. 560
Нефтяной бензин (12%) с жидким воздухом (содерж.
70% кислорода)............................ 770
ГЛАВА VII.
Теплота образования взрывчатого разложения веществ.
Изучение тепловых явлений при образовании взрывчатых веществ
иди при их взрывчатом разложении представляет большой теорети-
ческий и практический интерес. Основанием для теоретического изу-
чения взрывчатых -веществ в этом отношении служат общие положения
термохимии, а для практического—методы калориметрических изме-
рений.
§ 1. Основные нача- На основании первого начала Термодинамики,
ла термохимии, связь между изменением энергии материальной систе-
мы простых или сложных тел, переходящей из одного состояния в
другое, количеством теплоты и внешней работой выражается равен-
ством:
Q = Ui — lb + AW (А)
где Q — теплота превращения, щ им2— величины энергии системы в
начальном и конечном состояниях, выраженные в калориях, А— теп-
ловой эквивалент работы, равный’/i2j большой калории, W—внешняя
работа, считающаяся положительной, когда система получает ее из-
вне—и отрицательной, когда сама система производит эту работу.
Работа внешних сил W определяется уравнением:
W = I р'7\. при давлении р и об'еме г.
1£огда переход системы из одного состояния в другое совершает-
ся при неизменном об‘еме, то W=O и уравнение (А) принимает вид
Q = u,—и2 (В).
В том случае, если превращение совершается при постоянном
давлении, Что представляется случаем, чаще встречающимся, работа
W будет:
- I
V, ' . V,
где г2— первоначальный, а г, —конечный об‘ем газов. Количество
тепла потребного на эту работу будет:
Е ’
эквивалент тепла = 425 килограмметров, а
(>1 *’ (W vi >
где Е = механический
следовательно,
Так как 1 граммолекула какого угодно газа (т.-е. напр. 2 грм.
водорода, 28 грм. азота, 28 грм. окиси углерода и пр.) при О’ и
760 м/м. давления, занимает об‘ем 22,4 литра, то об’ем >\ смеси газов
при этих условиях будет равен числу граммолекул (п), умноженному
1
на 22,4, а^при температуре 1°об‘ем у, = п>< 22,4(1 -i «!.), где <: =
ей 4 -
есть коэффициент расширения. Если мы имеем дело со взрывчатым
веществом, то очевидно об‘ем vt (начальный об'ем или об‘ем взрыв-
чатого вещества) будет ничтожный сравнительно с г,2 (т.-е. с об'емом
газов, получившихся при взрыве) и им можно пренебречь, и тогда
получим:
01 -Р' 22лМдецим- ^ „
J ~ 425 к. м. ‘ V ' 273/,
Подставляя сюда вместо р — давление атмосферы —10333 килотр.на
кв. метр и выражая jbсе в килогр. и метр., получим: ч:
10333
()i—. 1м’2
/ t \
. п. (1 ) = 0,54 п: +0,002 n. t;
так как второй член сравнительно с первым очень мал, то им можно
пренебречь, и тогда
О1 = 0,54. 11.
Если через Qv обозначить количество теплоты, определяемое при
постоянном об‘еме, и через Qp обозначить количество теплоты,
определяемое при постоянном давлении, то мы имеем Qv^Op-f-Q1,
тогда зная Qp, мы определим Q, и наоборот.
Подставляя полученное нами выше выражение для работы;
W—р (\о - v,), в формулу Q—и,—Uo-j-AW, получим:
о = Hi — u2 -;-Ар (v._, — у,) (С).
Из уравнений (В) и (С) вытекает выраженное Гессом начало
чрезвычайной важности, а именно, что при всех превращениях системы,
происходящих при постоянном давлении или постоянном объеме, коли-
чество выделенной теплоты зависит только от начального и конечного
состояния системы и не зависит от характера и порядка промежу-
точных превращений.
Из этого начала, можно сделать несколько очень важных^ вы-
водов:
1) Если цикл превращений какой либо системы заканчивается
приходом ее в исходное положение, то сумма всех теплот равна нулю.
Qo.l 'Г Q|,2 " I Гк’.3“Г .... Г Qn l.n + Qn,0 = 0.
2) Количество теплоты, отделяемое при каком-либо превращении,
равно количеству теплоты, поглощаемому реакцией противоположного
направления:
Q2.1— Ql.2>
гак как в этом случае система проходит замкнутый ЦИКЛ, ’а следо-
вательно и сумма теплот превращений должна быть рдвна нулю:
01,2 И' 02,1 = 0.
3) Из п.п. 1 и 2 можно вывести, что количество теплоты, выде-
ляемое при непосредственном переходе системы из одного состояния
в другое, равно сумме теплот, отделяемых при каждом последова-
тельном превращении между теми же пределами, т.-е. что
Vo,n = Qo,i + Qi,2 +......+ Qn i,»;
о
4) Теплота, выделяемая при переходе какой-либо системы в
другую, содержащую те же тела, только иначе соединенные, равна
разности теплоты образования начальных и окончательных тел.
Если система простых тел, обозначенная через о, может перейти
или прямо в систему 2-ю или ко второй через 1-ю, то для такого
превращения сумма теплот выразится равенством:
Qo.i + Qi,2 -г Q2,(> = 0, или Q1.2 =— Qi,о — Qo,i;
атак как —Q2,o = Qo,2, то Qi,2 = Qo,2 —Qo.i; i
Этот вывод чрезвычайно важен для теории взрывчатых ве-
ществ, т. к. позволяет вычислять теплоты их образования и горения.
5) Очень часто для решения термохимических вопросов по от-
ношению к веществам, с недостатком кислорода для полного сгорания
углерода и водорода в углекислый газ и воду, приходится прибегать
к сожжению их в кислороде.
Пусть взрывчатому веществу А необходима для полного горения
прибавка В количества кислорода; обозначим систему свободных эле-
ментов через О, систему взрывчатого вещества через 1 и продукты
горения—2, тогда имеем: ‘
4* Qi.4 — Qo,3> или Он,) = О0,3 — Qj„;
если О0,1,—-искомая теплота образования из элементов, то Qo,а?—извест-
ные теплоты сгорания этих элементов в полные продукты окисления,
а Qj ,2—теплота сгорания определяемые калориметрически.
Начало наиболь- Рассмотренные нами первое начало термодинамики
шей работы. и некоторые выводы из него дают возможность ре-
шения очень многих вопросов относительно теплот образования и
разложения взрывчатых веществ, но совершенно не касаются вопроса
о наиболее вероятном направлении реакции взрывчатого разложения.
Вертело, изучая вопрос о максимуме работ реакции, подметил
после целого ряда калориметрических наблюдений зависимость на-
правления реакций от тепловой энергии, причем формулировал ее
в начале так: всякое химическое превращение, совершающееся без участия
посторонней энергии, стремится к образованию системы прочных тел, вы-
деляющих при своем образовании наибольшее количество тепла, т. е. вна-
чале взрывчатого разложения присутствующие элементы комбинируются
во всевозможные сочетания, и по истечении некоторого короткого
промежутка времени получается смесь соединений, относительные
пропорции которых будут зависить от скороетей реакций, и если по-
лученные соединения не способны реагировать друг с другом, вслед-
, ствие наступившего быстрого охлаждения, то все они и останутся
существовать в общей смеси продуктов взрыва. Если же получаю-
— 107 —
щиеся соединения будут находиться достаточное время прйвысо-
кой температуре в тесном соприкосновении друг с другом, tog они
вступят между собою в такое взаимодействие, при котором образуется
система прочных тел, отвечающих наибольшему выделению тепла.
Но дальнейший опыт показал, что начало Вертело справедливо
лишь для ограниченного класса взрывчатых веществ, богатых кисло-
родом и, следовательно, дающих продукты полного горения. Действи-
тельно, при данной формулировке выходит, что при таком превраще-
нии должна бы уменьшиться вся энергия системы, а между тем по
данным второго начала термодинамики, должна уменьшиться только
свободная энергия u=ST, где Т—постоянная температура системы,
a S—энтропия, и только в том случае получаются одинаковые результаты
по обоим началам, когда член ST крайне невелик по сравнению с вели-
чиной энергии. Впоследствии Вертело сам формулировал свое начало
несколько иначе, а именно: всякое химическое превращение, совершающееся
при постоянной температуре без участия посторонней энергии, стремится
к образованию системы прочных тел, выделяющих при своем -образовании
наибольшее количество тепла, но при условии уменьшения разности (Q—
теплот образования из элементов систем начальной и окончательной на
разность энтропий (q—q,) этих систем, т. е. что в формуле (Q—С\) хи-
мически утилизируется лишь разность (Q—Qi)— (q— qt).
2. Методы калоримет- Экспериментальное определение теплот обра-
ричёскик измерений. зования и разложения взрывчатых веществ про-
изводится в настоящее время с большой точностью и простотой в
особом аппарате, известном под названием калориметрической бомбы
Вертело (рис. 18). Прибор этот, кроме теплоты образования горючих и
взрывчатых веществ и теплоты газов, развиваю-
щихся при разложении этих-же веществ, позволяет
также определять об'ем газов, а также качественный
и количественный состав их. Он состоит из проч-
ного стального стакана, который с наружной сто-
роны никкелирован, а с внутренней одет довольно
толстым слоем платины, во избежание сгорания
стенок бомбы, что, помимо изнашивания может
существенно влиять на количество измеряемой
теплоты. Бомба закрывается конической стальной
крышкой, с внутренней стороны тоже одетой пла-
тиной, причем она снабжена необходимой арматурой.
В цилиндрическом стержне имеется кран Реньо,
необходимый для впуска и выпуска газов; затем на
стержне подвешена платиновая чашечка, в которую
помещается навеска сжигаемого вещества. Воспла-
менение заряда производится при помощи железной
или платиновой проволочки, которая накаливается рве> jg. Калориметриче-
электрическим током, проводимым через тело бомбы свая бомба Вертело,
и стержень с одной стороны и через изолирован-
ный стержень с другой стороны. Закрепление крышки в бомбе дости-
гается при помощи специального кольца, которое навинчивает гя на
бомбу и сжимает крышку по ее конической поверхности.
— 108 —
Обыкновенная емкость бомбы около 300 куб. сантиметров; наи-
большая плотность заряжания 0,02.
Когда бомба применяется для определения теплоты образования
по полному горению в кислороде, то после полного снаряжения ее че-
рез кран, в нее вводится сжатый кисдород до давления 25 атм. (из
резервуара, содержащего кислород под давлением 150—160 атмосфер
или посредством нагнетательного насоса) причем удается достигнуть
сгорание находящегося в бомбе вещества в несколько секунд. При
определении же теплот взрывчатого разложения из бомбы предвари-
тельно совершенно удаляется весь воздух и вместо него вводится ней-
тральный газ — азот.
Для производства калориметрического измерения, кроме бомбы,
которая служит камерой для сжигания, необходим соответственный
калориметр с мешалкой, предложенные Вертело (рис? 19). Собственно
калориметр представляет латунный сосуд, в
который свободно устанавливается бомба и
наливается точно известное количество
воды; сам же калориметр помещается в
двухстенный сосуд, который тоже и запол-
нен водой и служит экраном для защиты ка-
лориметра от случайных колебаний. Ме-
шалка состоит из системы пластинок гели-
коидальной формы, причем достаточно про-
стого поворачивания ее то в одну, то в дру-
гую стороны, воды чтобы жидкость калори-
метра подверглась полному равномерному
размешиванию. Конечно, необходимой ча-
стью калометрического аппарата является
еще точный, чувствительный термометр,
при помощи которого прямо на гла'з можно
измерять температуру с точностью до
0,01°—0,02-».
Для всей системы бомбы и калори-
метра заране необходимо установить тем
или другим путем водяной эквивалент, т. е.
теплоемкость ее, выраженную эквивалент-
ным количеством воды в граммах. При
самом производстве опыта собирают бомбу
п весь калориметрический аппарат, как
указано выше, наливают в калориметр до-
статочное количество воды, чтобы ею была
закрыта калориметрическая бомба, пускают
в ход мешалку и прежде всего дают уста-
новиться равномерной тем пературе во всех
/
Рис. 19. Калориметрическая бомба480™1 аппарата, на что требуется минут
ьи (Вертело с калориметром. 20—30. Затем делают отсчет температуры
каждую минуту, причем это измерение
распадается на три периода.
а) Предварительный период состоит в точном установлении тепло-
вого обмена калориметрической системы и окружающей среды, что
выражается, в зависимости от условий опыта, трояко: — темпёратура
остается все время без перемен, температура может каждую мйнуту
понижаться на одну и ту же величину (около 0,005° — 0,61 °) или,
наконец, температура равномерно повышается на такую же долю»
градуса в минуту. В конце этого периода (5—10 минут) производится
воспламенение вещества и тогда начинается второй период.
Ь) — горения вещества, в течение которого температура сперва
быстро поднимается, проходит через максимум и затем начинает
падать — сперва неравномерно, скачками, а с течением времени со-
вершенно правильно, на одну и ту же долю градуса в минуту, что-
приводит к. третьему, последнему периоду.
с) — когда устанавливается опять точный обмен теила между
системой калориметра и внешней средой.
По окончании опыта чертят систему координат и по оси абсцисс
откладывают времена наблюдения в минутах, а по оси ординат соот-
ветственные температуры.
В пределах предварительного и последующего периода, все
температуры располагаются на прямых, период-же горения протекает
весьма короткий промежуток времени, который принимается при
постройке температурной линии за 1 минуту. Для определения на-
чальной температуры принимают, что тепловой обмен калориметри-
ческой системы и среды идет еще по закону, выраженному темпера-
турной прямой первого периода и потому, продолжая ее до пересече-
ния с ординатой, соответствующей концу, горения, получаем искомую
температуру. Точно также поступают для. определения конечной,,
максимальной температуры, для чего продолжают прямую последу-
ющего периода до пересечения ее с соответственной ординатой, ко-
торая и даст действительную, максимальную температуру оп^та
Следовательно, повышение температуры определится разностью
ординат.
Количество теплоты в данном опыте (Q) найдется из уравнения
О = © (Р - Р’)]
где 0 — повышение температуры, Р—количество воды в калориметре
и Р* водяной эквивалент бомбы и калориметрической системы, выра-
женной весом воды в граммах.
Найденное количество теплоты необходимо “^ще подвергнуть не-
которым поправкам:
1) На теплоту горения проволочки, служащей для воспламе-
нения.
2) На теплоту горения вспомогательного запала, часто приме-
няемого для воспламенения некоторых веществ.
3) На теплоту образования азотной кислоты, в случае сжигания
в кислороде азотистых веществ. Количество же образовавшейся азот-
ной кислоты определяется в остатках горения обычным путем.
По окончании опыта, калориметрическая бомба тщательно обти-
рается; открывая кран, из нее выпускают газообразные продукты
прямо на воздух или, в случаенеобходиМОсти исследования их, в
специальный газометр,—й затем уже бомбу разбирают и приводят
в порядок. z
Основанием для вычисления теплоты образования
§ з. Теплота обра- взрывчатых веществ служит термохимический закон
веществ. сумм lecca, самое же определение возможно осуще-
ствить тремя различными методами: 1) по реакции
образования взрывчатого вещества, 2) по реакции его разложения и
3) по теплоте полного сжигания его в кислороде. Этот последний
практически наиболее применим.
Рассмотрим все три метода на некоторых примерах:
а) Определение no реакциям образования.
Нам уже Известно одно из важных следствий начала Гесса, а
именно, что если система простых тел (О) переходит в систему (2)
проходя через (1), то сумма теплот выражается равенством:
Q»,i -г Qi >i 1 Q. >о
или Q0,, = Q0)1
(А)
При образовании какого-нибудь взрывчатого нитро-вещества В
действием азотной кислоты на тело А, мы как раз имеем такую си-
стему и, следовательно, вышеприведенным уравнением можно восполь-
зоваться для расчета теплоты образования.
Вычислим, для примера, теплоту образования нитроглицерина,
который, как известно, образуется действием крепкой азотной кислоты
на глицерин:
<\HS (ОН):14- 3HNO,=С3Н5 (0ХО2)3 -U ЗН,0
Здесь согласно урванения (А) имеем:
Qo.,—теплота образования глицерина и азотной кислоты из «лементов:
(ЗС : 811 -1-30) 4- 3 (II 4- N 4- 30)1 -- С„Па (НО), -4- 3HNO3 4- 287,4 калор.
0114 — теплота взаимодействия глицерина и азотной кислоты:
С3н; (Н0)3 4- 311ХО.. = (’3Uj (0Х0,)3 ' 311,0 4-14.1 калор.,
откуда:
Q0,a выражается суммой Q„t —301,5 кал.
Для определения теплоты образования одной,граммолекулы нитро-
глицерина остается вычесть из полученной величины теплоту образо-
вания трех молекул воды, т. е. 3 X № = 207 кал.:
301,5 — 207—94,5 кал.
б) Определение по реакции разложения.
Определение этим путем возможно лишь в тех случаях, когда
при разложении вещества получаются без прибавки кислорода про-
дукты полного сгорания. В таком случае, зная теплоту разложения
1 >
— Ill -
взрывчатого вещества. и состав продукта горения, можно вычислить
теплоту образования:
Мои - ~ Оша ~~ Qi
Для нитроглицерина имеем:
2. CSHS (ON02), = бССН- 5Н3 03N2 + 0,5O2;
В этом случае: Qo t — искомая теплота образования нитроглице-
рина; Qo,a — сумма теплот сгорания элементов (Ca + H5-i-J?3-}-09) в
продукты горения 1/2 (6СО2 + 5Н20 -|- -j-0,502) = 455,4; Qt,2 — опре-
деляемая калориметрическим путем теплота взрывчатого разложения
нитроглицерина — равная 360,9 кал. на одну граммолекулу.
Подставляя эти величины в уравнение, имеем: *
Qn,। = 455,4 — 360,9 — 94,5 кал.
в) Определение по теплоте горения в кислороде.
Определение теплоты образования по теплоте разложения не мо-
жет быть применено для взрывчатых веществ, дающих, вследствие
недостаточного количества кислорода в частице, продукты неполного
сгорания. В этом случае вещество сжигается в калориметрической
бомбе в сжатом кислороде в углекислый газ и воду.
Вычисления ведутся по известной формуле:
I" Qir-—
где теплота горения Qi,s определяется опытным путем. Так, для не-
растворимого пироксилина (13‘,‘>5%) полное горение выражается равен-
ством: *
С24 Н2„к Кн,- Оа1-,34-10,75 4 = 24 СО? 4 14,65 11,04-5,35 N2;
Величина Q1)2 = 2632 кал.
Qo,2—теплота образования СО2, HSO и Х2 находится по термохимиче-
ским данным:
24СО2..................... 24X 94,3 = 2260 кал.
14,65 Н2О (жидк.).........14,65/469 = 1010 кал.
5,35 N,............................... О кал.
Сумма 4,2 = 3270 калорий.
Подставляя эти данные в уравнение, найдем:
Qo>1 =4,г —Qn2 = 3270 —2632 = 638 кал.
Теплота образования нитроклетчатки, содержащей п нитро-
групп, может быть определена по эмпирической формуле, вырабо-
танной в Научно-Технической Лаборатории Морского Ведомства:
Q = 921,5 — 26,5 п. '
В нижеприведенной таблице указаны теплоты образования наи-
более употребляемых взрывчатых веществ, отнесенных к их граммоле-
кулдм и к 1 килограмму:
! Частичный
вес в грм.
I
Теп.юлаобразо-
.вания тел из эле-
ментов (в газо-|
’образ, состояв.)!
1 грм. молекул
при постоянном
; давлении.
В больш. кил. |
(по алмазу) j
И р и м е ч а ц п я.
Вода (газ)...............
„ жидкость 1БО..........
Аммиак NH3................
Закись азота N20..........
Окись азота NO............
Сероводород H2S...........
Азотноватый ангидрид NO2
жидкий.............
Азотная кислота HNO,. жидк.
Соляная кислота НС1 ....
Угольный ангидрид СО2 (сжи-
гая алмаз)...........
Окись углерода СО . . .
Сернистый ангидрид S0:> . .
Серная кислота H2S04 ....
Сернистый углерод СЙ2(жид.).
Хлористый азот NC13 „ .
Сернистый азот NS.........
Сернистый калий К,Н. . . .
Циан C2N2 . . . . . . . . \
Натриевая селитра NaNO,?. -
Окись калия К20...........
Калиевая селитра KN03 . . •
Окись натрия Na20.........
Аммиачная селитра NH4NO3 •
Баритовая селитра Ba(NO2)2 •
Хлорноватокисл, калий КС103 i
Перхлорат калия КС104 . . .
Углекислый калий К2С03 . .;
Углекислый натрий Na2C03 . i
Углекисл, аммоний (NH4)2C03 !
Сернокислый натрий
Сернокислый калий K2SO4. .;
Серн истая сурьма Sb2S3 . . .
Сернистый калий KaS . . . .
Цианистый калий KCN. . . .
44
28
64
98
76
120,5
46
110,2
52
85
94
101,1
62
80
261
122,5
138,6
138
106
138
142
174
340
110
65
18 -j- 58,2
— Ч- 69
17 12,2
44 — 20,6
30 — 21,6
34 .4- 4,8
46 — 1,7 Газообразный— 2,6
6i - 41,6 „ +34,4
36,5 | -г 22,0
- - •
: - - 69,2 :
—192,2 : (В жидком виде).
! — 11,8 : : .
: — 41,8 !
- 31,9 : (В твердом виде).
i +103,5 । „
; - 73,9 !
i +110,6 I
! + 97,2 i
: -изд
! 4-100,2
88
+ 94,4 ;
; 94,6 ;
±112,5 I
.278,8 I
i ±270 2 i
i -’-178,8 ।
i +326,4 i
+344 2 i
i + 34,4 !
! +1<-2,2 I
i — 29,4 ! (В твердом виде)
* ' ' л
/ Теплота образо- вания тел из эле- 4 1
Частичный вес в грм. менгов в (газо- обрзз. состоял.) 1 грм, молекул при постоянном давлении. В больш. кал. (по алмазу) Примечажня. ” ।
Хлористый натрий NaCl. .
Хлористый калий КС1. . .
Окись железа Ре20з . ...
Окись аллюминия А12Оз . •
Перекись свинца РЬО . . •
Б «лотный газ ОН,.......
Ацетилен С2Н2...........
Бензол С6Н6.............
Этилен С2Н,.............
Нафталин С10Н8......
Фенол СвН6ШО) (твердый).
Нашатырь NH8C1..........
Щавелевокисл, калий КоС202
Желтая кро вян соль FeK4Uye
Карбит кальция СаС2. . .
Крезол С7Н7(НО).........
Глицерин С3Н8(Н0)з ....
Эритрит СЩдОН),.........
Пентаеритри г С8Н,(0Н)5 . .
Маннит СвН8(ОН)6........
Клетчатка С,Н10О5.......
Хлопок Cs4H4tO2e........
Нитроглицерин CsHsfNOeJs
Нитроманнит CeHs(NO3)6 . .
Пироксилин CnH2eNu<’4a.
г Пироколлодий CaiH^NjoOio-
Эфир СЩ10О ..............
Коллодий C24H31N9O38. - . .
Коллодий C24H82N80ae • .
Гремучая ртуть HgiCNO)j .
Нитробензол СвНз^Ог). . •
Динитробензол C6H4(N02)2 (ме-
та) ......................
Тринитробенз. СоН3(МОз)з(сим-
мегрическ.). ....
Нитротолулол C7H7(NO2). .
Пикринов. кисл.СвН21МО2)(ОН)
Тринитрокрез. C7H4(NO2)s(UH).
58,5
74,5
160
102
237,9
16
26
78
28
128
94
53 5
162,3
368,4
64
'108
92
122
136
172
162
648
227
432
1.143
1.097
74
1.053
1.008
284
123
168
213
137
229
243
— 97 9
4-105.7
+ 195,6
4 350
— 63 4
-- 18,5
— 61.4
— 10,2
— 15,4
— 42
+ 36.8
4- 76.8
4~3247
+137,2
— 7,25
+ 55
-’-165,5
+ 219.7
+ 221,2
-320,3
—217
—921,6
— 94,5
—179,1
+ 639
—j—658
+ 65.3
+ 696
+706 О
— 62,9
+ 4,26
+ 6,8
+ 5,5
— 20,1
— 49,1
+ 61,0
Проф. М> Сухаревский. Взрывчатые вещества и взрывные работы.
(В твердом виде).
я»
(В жидком виде
- 3,2).
(В твердом виде
4 — 27,4).
(В твердом виде),
я
(В жидком виде).
(В твердом Ниде),
н
7/'
я
Л
(В жидк. виде+72.)
(В твердом виде).
(В жидком виде
+ 6,96 в твер-
дом виде).
(Втверд.виде+12,7)
. (В твердом виде).
4
— 114 —
1 i Частичный J вес в грм. j 1 ' Теплота образо-t вз ния тел изэле-1 ментов (в газ©-' образ, состояв.) 1 грм. молекул при постоянном давлении. В больш. кал. । (по алмазу) Примечания.
Пикрат калия CeH2(NO2WOK). 267 +117,5
Пикр. аммон. C6H2(N02)3(0NHt). : 246 ! + 80,1 (В твердом виде ».
Азотнокислый диазобензол.
C6H5N2NO8. а 167 j — 45.6 1
Нитронафталин СюНт^Оз). j 173 — 14.7
Динитронафталин CJeHe(N02)2- 218 - 5,7
Тринитронафтал. CloH5(N02)s. 263 + 33
Нитрогуанидин CH3N2(NO2). . 1.32 + 22,0 • Я
Терпентин С10Н1(, ...... ' 136 + 8,6 В жидком виде—17.
Антрацен СиН10 . 178 — 42,4 W
Спирт метиловый CHtO . . . 32 — 53.6 (В жидк. виде+62).
,, этиловыйГ.С2Н6О, . . . 1 46 1 i f + 60,7 „ +70).
I -
, . _ Определение количества теплоты, выделяю-
s 4. Теплота взрывчатого „ * 5
' щейся при взрывчатом разложении, произво-
разпоже ия. ДИтся либо путем теоретических вычислений
но реакциям разложения, либо непосредственным измерением в кало-
риметрической бомбе. •
а) Определение теплоты взрывчатого разложения калориметриче-
ским путем.
Для определения теплоты взрывчатого разложения вещество
сжигают в калориметрической бомбе в атмосфере азота.
б) Теплота взрывчатого разложения по реакциям его.
Переходя к вычислениям последней, заметим, что здесь осо-
бенно нужно различать Q при постоянном об‘еме и Q при постоян-
ном давлении, вводя в случае необходимости соответствующую по-
правку. Как уже было сказано выше, взаимоотношение между этими
двумя величинами определяется уравнением:
Qv — Qp + 0,54п 0,002щ (, и т. д.
последний член численно крайне незначителен, мы можем принять:
Qv —— Qp + о,54п,
Применяя этот способ вычисления поправки к нитроглицерину, раз-
лагающемуся согласно уравнения:
2C3H5(ONOa)8 — 6СО2 Ч 5Н2О + 3\2 + 0,50,,
т. е. при я —6 + 5-|-3-f-0,5 = 9,5, находим поправку для 1 клграмма:
0,54.9,5.1000
454
= 11,3 кал.
— 115 —
Расчет теплоты, выделяющейся при взрывчатом разложении ве-
щества, производится на основании закона сумм Гесса по ура’внению:
Qo,t >+ — Оо>2‘
Рассмотрим это на примере разложения нитроглицерина, совер-
шающегося в замкнутом сосуде по уравнению:
2C3H5(ONOa)3 = «СО, Н- 5Н,0 + 3N, -j- 0,50,.
*
Вычислим теплоту взрывчатого разложения, считая, что про-
дукты разложения приведены снова изначальной температуре 4-15®С.
Обозначая через Qv2 искомую ве тчину, через Qoq — теплоту
образования нитроглццярпна из элементов и через Qo,2 — сумму теплот
образования всех продуктов взрыва из элементов, тогда будем иметь:
)
>21,2 “= Оо’-
Qe,, находим по термохимическим данным:
Теплота образования продуктов: /
бСОа==?Х9М=^ 565,8 калорий
5Н2О (жидкой) == 5X 69 =345 калорий
N и О ==б калорий .
следовательно 0^,2 == 910,8 калорий.
Теплота образования нитроглицерина, т.-е. Qen для двух граммоле-
кул — 2 X 94,5 = 189 кал.
Следовательно, теплота, освобожденная двумя молекулами, будет:
Q(,2 —910,8 —189 = 721,8 калорий.
на две граммолекулы нитроглицерина (т.-е. на 454 грм.), а на одну
721 8
о’ =360,9 калор. (при постоянном давлении). Число газообразных
6 ~ 3 I 0 5
молекул продуктов взрыва будет п 9 ’ =4,75.
На 1 молекулу нитроглицерина (вода предполагается жидкой),
следовательно, эквивалент работы сжатия будет 0,54 X 4,75 = 2,565 кал.
Прибавляя это число к 360,9, мы получим в итоге полную теплоту
363,465 кал., а для одного килограмма (при постоянном об'еме и
воде жидкой): ,
Qv = 363,465X S = 1601,16 кдл.,
116 —
а для ролы газообразной— 1502,5 кал., так как теплота образования
воды в парообразном состоянии равна -J- 58,2 кал. (вместо 69 калор-
при жидкой).
Зная Qv мы легко определяем Qp на основании существующего
между ними соотношения или вычислением:
9p = Qv —0,54л или 0Р=Л21~ . 1589,86.
J i
Определим также количество единиц тепла, выделяющихся при
взрыве гремучей ртути.
Как известно, формула ее взрывчатого разложения следующая:
Hg(CNO), = Hg 4- 2СО J- N, + QP калорий;
где Qp требуется определить.
Подставляя сюда вместо СО... -j'2*’ калорий, а вместо левой
части равенства — 62 9 калорий (Nj и Hg, как простые тела теплот
не выделяет) и решая уравнение, получим Qp= 114,9 калорий, т.-е.
что 1 граммолекдла (284 грм) гремучей ртути дает 114,9 калорий,
следовательно, 1 килограмм даст
114.9 X 1000
284
= 405 калорий.
Отсюда правило: чтобы определить теплоту взрывчатого разложения
данного взрывчатого вещества теоретически, надо: написать для получаю-
щихся продуктов разложения сумму теплот образования из простых
тел и вычесть алгебраическое значение для теплоты Ъ /разевания самого
взрывчатого вещества {из простых тел).
В заключение заметим, чго плотность заряжания (см. дал.) ока-
зывает влияние на численную величину Qv и Qp, но точных опыт-
ных данных по этому вопросу почти не имеется, так что вывести
какое нибудь определенное заключение не представляется пока воз-
можным. По Нобелю, при разложении пироксилина, влияние плот-
ности заряжания сказывается довольно значительно, а именно:
Плотность заряжания . . 0,05 0,15 0.30 0 50
Теплота взрыв, разлож. . 820 825 900 1010 кал.
Из данных же работ проф. А. Сапожникова Совершенно не за-
мечается этого влияния.
Пироксилин. .. Нездымныи ib>p« х.
П.тотв за ряж. Тепл. взр. Плоти заряж. Тепл, взр
0,017 0,025 0,.00 1060 кал. ; 1058 „ I 1059 „ | 0,017 0,100 0,200 Г 977 кал. 973 „ 966 „
- 117 —
В нижеследующей таблице сгруппированы величины теплот ров
ложения при постоянном давлении Qp и постоянном об’еме Qv.
1 Qp ; Qv :
При воде жидх. При воде газ. При воде жидк. При воде газ.
Дымный охотничий порох состава: I
KNOa=8l,9%; S=10,2%; С=7,9% 805 810
Дымный порох состава: 1 i }
KNO3=84; S=8%; С=8%. Полное горение ' 825 4 1 i 830
Дымный военный порох состава: i 1 i т
KNO3=78.9%; S = 9,9%; C=ll,2<>/0 — ; — 815 815
Дымный военный порох состава: KNOS = 75%; 8 = 10%; С = 14%; влажн. 1% — i 720 । — 725
Бертолетов, порох состава: КС1Оа=93,4%; S = 3,3%; С = 3,3% W-— j i 960 “— 970
Бездымные пироксил. пороха: Ружейный В (лет. вещ. 2,4%. . . 1 885 - — 905
Пушечные:
II. К. 0. (лет. вещ. 2.9%) .... 840 865
С. П. (лет. вещ. 3,5%) — 835 »' 1 860
Б6 (лет. вещ, 5,6%) 720 810
Бездымные нитроглиц. пороха:
Баллистит 1325 1195 1340 1210
Кордит «М 1 изо г____ 1150
Пироксилин 1070 1020 1085 1040
Пироколлодий C?4H39NioOto .... — 905
Коллодий C24H32N3O3G — 1 —— 725
Влажн. пироксил. С21Н29№пО42 • 13aq (17 %влажности) — 755 755
Пироксилин (40%) с аммиачн. сел. 1 1 W.
Пироксилин (50%) с калиев. сел. — " 9$0
Нитроглицерин 1590 1475 1601 1 1502
Гремучий студень >(01 % нитроглиц. 8,5% коллод. хлопка) ..... — II 1760 1530
Гур-Динамит (75% нитрогл). . . . 1 ч 4 1320 t 1150
— 118
QP I__________ Qv
При воде При воде При воде При воде
J жидк. газ. жидк. газ.
Л Нитроканит. Т”' i 1 — 1465 I860/
Тринитробензол 710 — 730
Пикриновая кислота 775 750 790 765
Тринитрокрезол . . — — й 1 710 Г
Пикрат калия ...... ... — 1 f i —• 780
Пикрат аммония (23,5%) с аммиач. : i
селитрой (громобой) — , ч 4 . — — 1030
Пикрат аммония (43,5%) с калие- t ! )
вой селитр, (порох Брюжера). . — 1 1110
Гремучая ртуть 405 i 350 ; 410 ! 360
Сернистый азот . . : i 695 1 1 705
Хлористый азот — 480 ! 490
Азотнокислый диазобензол. . . . 1330 ; 1350
Сернистый углерод (35%) с азотно- 1,
ватым ангидр. (панкластит Тюр-
пена) — 1110 - 1120
Динитробензол (40%) с азотною ки- :i
слотою (гельгофит). ...... 1570/ 14S0 ; 1585 1495
Аммиачная селитра . . . . . . — . i 630 380
Динитробензол (17,5%) с аммиач-
ною селитрою (беллит) .... 1225 1000 1 1225 1020
Нафталин (6,5%) с аммиачн. селитр. 1 920 — 940
Нитронафталин (9%) с аммиачной
селитрой (состав Фавье) .... 945 1 — о . 970
Динитрона фтал ин (12,5 %) с аммиач. i i
селитрой (состав Фавье).... —— 960 i —— 980
Нитрогуанидин . . — — 625 ~— 1 645
Аллюминий (18%) с аммиачною i
селитрой (аммонал) . . . . . . 1690 1480 ; 1700 ; 1495
Уголь (7%) с аммиачной селитр. 'i i
(динаммон) ........ . . — 880 ; 1 1160 905
Смеси: водородная Нз0 . . . . 3800 3250 ; 3830 3280
оксиуглеродная СО + 0 .... 1530 1540
метанная СЩ + 2О2 2670 2185
Оксиликит: ’ :i 1
Древесный уголь (16%) с жидким '' i s ।
воздухом (содержащ. 50% кисло- 11
рода) 1 1200 ; —- . Г21О
Древесный уголь (22%) с жидким I
воздух, (содерж. 70% кислорода). — ! 1800 — 1810
Нефтяной бензин (12%) с жидким
воздух, (содерж. 70% кислорода) / ' 1 2200 J 1 2215
1
ГЛАВА VIII.
•т. ; , i
Температура взрывчатого разложения.
§ 1. Принципы
определений.
Изучение вопроса о максимальной температуре
взрывчатого разложения веществ представляет большой
теоретический интерес, так как оно тесно связано с
вопросом о давлениях газов при взрыве.
Определение температур производится лишь путем теоретических
вычислений, т. к. практически не удается осуществить непосредствен-
ное измерение ее, вследствие необычайной краткости явления взрыва
и тех высоких температур (часто достигающих 3000°—4000°;, каковые
имеют место при подобного рода явлениях.
Теоретически температура горения взрывчатых веществ расчи-
тывается по теплоте разложения или количеству калорий тепловой
энергии, выделяющейся при взрыве, каковая измеряется практиче-
скими путями; зная же среднюю теплоемкость продуктов взрыва (с),
не трудно определить и температуру (t) по уравнению:
Q = Ct, ИЛИ t
Q
с ’
где у — количество калорйй тепловой энергии, выделяемой при взры-
ве, а с—теплоемкость продуктов взрыва.
Оказывается, однако, что определение величины с представляет
довольно большие затруднения, так как для многих газообразных тел
существует зависимость теплоемкости от температуры, вследствие че-
го было не мало попыток со стороны многих исследователей к уста-
новлению точной величины ее. О вычислении температуры взрывча-
того разложения будет сказано дальше.
$ 2. Теплоемкость про-
дуктов взрывчатого
разложения.
Зависимость теплоемкости негазообразных про-
дуктов взрыва от температуры настолько мала, что
ее обычно принимают за постоянную величину
равную для граммолекул:
KgCOs — 30,0 калорий.
Ха2СО, — 29,0
' KgSO4 — 33,2
K,S—17.8
КС1—12,9 „ .
NH4C1 — 20
v KOI—10,5 „ x -
AI2O8 -22,4 „ ' ' ,
310.-11.4
Аморфный углерод С— 2,9 „ (атомная)
>
Что же касается до теплоемкости газообразных продуктов, то в
этом случае приходится различать теплоемкость при постоянном дав-
лении Cf от теплоемкости при постоянном об'еме— G, , при чем эти
величины связаны между собою уравнением:
где г — внешняя работа расширения газа, находящегося при постоян-
ном давлении, при нагревании его ва 1°, при чем для всех газов эта
величина отнесенная к граммолекуле, равна 2, т. е.
Ср — Су 4- 2.
Рассматривая теплоемкость газов с простыми одноатомными мо-
лекулами (пары ртути, аргон, гелий и др.), замечаем, что она не за-
висит ог температуры и что, по кинетической теории, для одной грам-
молекулы газа равна:
Ср—5 и Ст = 3.
Для газов же со сложными многоатомными молекулами вопрос
о теплоемкости их значительно усложняется Тем, что при нагревании
таких газов нужно ^читаться не только с изменением кинетического
состояния самых молекул их, но также и с изменением кинетического
состояния атомов, при движении их в пределах молекул. Обозначая
количество'тепла, необходимое для изменения кинетического состояния
атомов, буквою — а, мы получим для граммолекулярных количеств газов:
С, = 34-а и Ср = 54-а.
Величина а находится в зависимости от степени сложности молекул
и увеличивается с увеличением числа атомов, а также с повышением
температуры, вследствие чего теплоемкость подобного рода газов со
сложными молекулами находится в зависимости от температуры и с
увеличением ее увеличивается. Насколько значительна эта зависи-
мость, можно видеть из того, что если вычислять температуру взрыв-
чатого разложения пироксилина и нитроглицерина по формуле;
то для первого 1 = около 5000°—6000° С, вместо 2700° С, а для вто-
рого около 70и0°—800о° С, вместо 3450° С.
По опытам Малляра и Ле-Шателье зависимость теплоемкости га-
зов со сложными молекулами выражается уравнением:
С = а 4- М.
где а и Ь постоянные для каждого таза величины, устанавливаемые
опытом.
. — 121 — '
Установление зависимости теплоемкости при постбяппомУЙАШвУв*
от температуры было произведено вначале вышеупомянутымиучИйа-
ми для температур до 2500° С, при чем эта зависимость выражается Дйкг
Углекислого газа СО». . . . С» = 6,25 + 0.0037 t
Водяного пара Н2О.........Cv =5,60 + 0,0033 t
Для газов с двухатомными мо-
лекулами .............Cv = 4,80 + 0,0006 1
Исследователи полагали, что эти равенства останутся справед-
ливыми и для более высоких температур; отнако, опыт показал, что
это не так и что для температур выше 250о* необходимо пользоваться
данными раб<‘т Бертелло и Вьелля, произведших обширное^ исследо-
вание до 4500* С. Полученные ими результаты выражаются следую-
щими уравнениями:
Углекислый газ СО» .... . Су =16,1 + 0,0015 t
Водяной пар Н»0 . .... . Cv = 12,4 + 0,0019 t
Газы с двухатомн. мол. СО, На, Xs, О» Gr= 3,5+.0,и0161
Теплоемкость при постоянном давлении Ср легко определяется по
формуле: >
следовательно:
По Малляру 'и Ле-Шателье.
для COg— Ср =8.25 + 0,0037 t
„ Н»9 — С₽ =7,60 + 0,0033 t
и C0,H2,N2,02 —Ср = 6,80 +0,0006 t
По Вертело и Вьеллю.
СР = 18,1+ 0.0015 t
Ср = 14.4 + 0,0019 t
Ср= 5,5 +0,0016 t
При температурах не превышающих 2500° С уравнения Малляра
и Ле-Шателье оказываются более справедливыми, а от 2500° С и выше
необходимо пользоваться данными Бертело и Вьелля.
§ 5. Вычисление тем- УСТВНОВИВ Величину Коэффициентов й И Ь В
пературы взрывчатого приведенном выше выражении Малляра и Ле-Ша-
разложения. телье:
Cv = a+bt,
I ' - -w •
мы легко вычисляем температуру взрывчатого разложения по фор-
муле: 4+
t = — или Q = Ct;
с
— 122 —
подставив в него вместо С его выражения (а + Ы), имеем:
Q = at + bt2
решаем это квадратное уравнение относительно t:
_ — а 4- |/а*+ 4bQ.
, ' 2b
В этом выражении Q представляет собой теплоту взрывчатого
разложения исследуемого вещества в количестве одной граммолекулы,
коэффициенты же а и Ъ определяются, в зависимости от состава га-
зообразных продуктов взрыьа, следующим путем:
Пусть одна граммолекула вещества разлагается при взрыве на а
молекул углекислого газа, 0 молекул водяного пара и у молекул газов с
двухатомным молекулярным составом. По Малляру и Ле-Шеталье,
теплоемкости этих газов выражаются следующими уравнениями:
для СО2 . . . . ’...........C'v = 6,25/. + 0,0037xt
„ Н,0 . . . ...............С'\ = 5,60/? + 0,0033/91
„ двуатомн. газов . . . С'" v = 4,80/ + 0,0006/t
Общая теплоемкость всех этих газов равна: С\ + С", 4- О'", =
= 6,25х + 5,60/9 + 4,80/ + 0 0037zt 4- 0,0033/9t + O,0006/t.
Сравнивая эти уравнения с уравнением С/= a -f- bt, легко заме-
тить, что
а = 6,25 а + 5,60/9 + 4,80г
b = 0,0037 & 4- 0,0033/94-0,0006/
Применим эти рассуждения для определения температуры взрыв-
чатого разложения нитроглицерина, распадающегося, как известно,
по уравнению:
2C3H5(ONO2)s == 6СО2 4 5Н2О 4- 3N«. +О,5О2.
Теплота взрывчатого разложения двух граммолекул нитроглице-
рина равна 667,8 кал., а величина а и b определяется по выше-
указанному:
а = 6,26 . 6 4- 5.60 . 5 4- 4,8 . 3,5 = 82.4
b = 0,0037 . 6 + 0,0033 . 5 + 0,0006 . 3,5 = 0,0408
следовательно температура взрывчатого разложения будет равна:
4 . 0,0408 . 667800 „1лл0
ГГбЛ40¥--------= 3160
Температура
разложения.
— 123 -
Наименование взрывчатых веществ.
3350°С
2400
3550
Zschokkc
\
г
2750
3900
23^0
2300
2200
а Н- ht
Дымный порох состава 84% KNOS; 8% S; 8% С
(полное горение) .............................
Дымный военный порох состава 78,9%KNOs; 9,9*/0S;
Бертолетов, порох состава 82.4°/eKC103; 8,8°/0S; 8,8% С’
Бездымные пироксилиновые пороха:
Ружейный В (лет. вещ. 2,4%) ........
Пушечные:
!<Г
О Для черного пороха заключающего 75% селитры и 13 % угля
дает число 2537 °C.
2) Для прессованного пироксилина В, Zschokke дает число 2380 °C.
3) Для гремучего студня, заключающего 92% нитроглицерина, В. Zschokke,
даст число 321fi °C.
УдиЬ'.' -
й-
с > Сарро допускает, что сов
§ 4. Вычисление температуры ,,лттл
* г 7Г молекулы которых заключают в ceotw
взрывчатого разложения по т()же имеюр одау —
упрощенным формулам для молекулярную теплоту, а следовательно
теплоемкостей. ла ,а и ft из формулы:
будут одними и теми-же для газов, содержащих одно и тоже число-
атомов в молекуле.
Так для двухатомных а = 4,8 и b = 0,001; для трехатомных
а = 6,2 и Ь = 0,0025.
Такое допущение значительно упрощает расчеты, лишь довольно
незначительно уклоняющиеся от действительности.
Приводим таблицу температур, развивающихся при разложении
разных взрывчатых веществ.
С. П. (лет. вещ. 3,5%)....................
Бб (лет. вещ. 5,6%).......................
Бездымные нитроглицериновые пороха:
Баллистит...................................
Кордит . .................................
Пироксилин состава ........ . . .
Пироколлодийный C2iH3ONlt<Xo.................
Коллодий C2iH32N8O,6 .......................
Влажный пироксилин высшей нитрации (17°/0 влж.)
Пироксилин (40%) с аммиачн. селирой..........
Пироксилин (60%) с калиевой селитрой.........
Нитроглицерин ...............................
Гремучий студень (91,50/о нитроглицер. 28,5%
коллодионного пироксилина)..................
2850
2800
2700
2450
1950
1900
2550
3150
3450
—“ 124 —
Наименование взрывчатых веществ.
Гур-Динамит (75% нитроглицерна).........,
Нигроманнит................................
Тринитробензол ................... . . . .
Пикриновая кислота ............. ........
Тринитрокрезол.............................
Тринитротолуол.............................
Пикрат аммония.............................
. Пикрат калия .......... \................
Пикрат аммония (23%%) с аммиачною селитрою
(громобой мансит).........................
Пикрат аммония (43'/2%) с калиевой селитрой
(порох Брюжера)...................
Гремучая ртуть.............................
Сернистый азот.............................
Хлористый азот.............................
Азотнокислый диазобенюл....................
Сернистый углерод (35%) с азотноватым ангиридом
(Панкластит Тюрпена)............
,Д и нитробензол (40%) с азотной кислотой (гель-
гофит)....................................
Аммиачная селитра.................
Динитробензол (1 < %%) с аммиачной селитрой
(беллит) .................................
Нафта тин (6%-%) с аммиачной селитрой (сост.
Флвье)...................................
' Температура
разложения.
3150 *)
3450°С
2400
2450 ’)
2350
2142
1800
2800
2350
3250
3550
3750
3550
2050
3950
3550
1150
2300
2100
2200
Нигронафталин (9%) с аммиачной селитрой (сост.
Фавье) ...................................
Динитронафталин (12%) с аммиачной селитрой
(сост. Фавье).............................
Нитрогуанидин..............................
Алюминий (i8 ) с аммиачной селитрой (аммонал)
Уголь (7%) с аммиачной селитрой (динаммон) .
Смеси: водородная 2Н2 + О2..................
оксиуглеродная 2СО + О2 ..................
метанная CHt + 202 .......................
Оксиликиты: 1) Древесный уголь (16%) с жидким
воздухом содержащим 50% кислорода . . . .
2) Древесный уголь (22%) с жидким воз-
духом содержащим 70% кислорода ....
3) Не (утяной бензин (12%) с жидким воз-
духом, содержащим 70% кислорода........
2250
1750
I 3300
2350
3750
4150
3750
3650
4600
j 4100
А) Для этого динамита В. Zschokke даст число 2999 °C-
-) Для пикриновой кислоты В. Zschokke даст число 249МС
§ 5. Определение
температуры взрыв-
чатого разложения
по опытным наблю-
дениям давлений.
Исходя из ’ формулы
Р = ^7-, (см. след. главу)
1—а£л
где: Д= плотность заряжания,
а = коволюм газа
п ч Pev0T
для вычисления
где р0 =з 1,033 кгрм. на 1 кв. с/м; и =?об‘ему газов, отделяемых*дним*
киллогряммом взрывчатого вещества при о°С и давлении 760 м/м-
и Т=обеолюгной температуре взрывчатого разложения.
Решая это уравнение относительно Т имеем:
1.033. v0
а т. к. сила F определяется опытным путем, а об'ем газов теорети-
чески или тоже опытом, то сразу, путем простого расчета, опреде-
лится и температура.
В нижеследующей таблице приведены для сравнения, температуры
разложения некоторых взрывчатых веществ, расчитанные по этому
способу и по способу ранее описанному:
4 Наименование веществ, 1 Температуры | высчитанные । по формуле Температуры высчитанные по теплоем-
| давлений. кости.
2750°С.
Дымный военный порох состава 78,9%
КХО3; 9,9%S; 11,2°/о С. ......
Аммиацная се титра ..... ...
Пироксилин (Сз4 Н29 Nn 0и) ....
Пикриновая кислота.......
2900°С.
1250 „
2650 „
2300 „
1150
2700
2450
ГЛАВА IX.
Сила и потенциальная энергия взрывчатого вещества.
§ 1. Наибольшее да-
вление при взрыве
и сила взрывчатиго
вещества.
Общее уравнение для состояния газа выражается,,
как известно, следующей функцией между р, v и t:
pv =povo
где рл—начальное давление, обыкновенно принимаемое равным 1 атм.;
у0—об‘ем газов при давлении р0 и температуре О” ;$•—температура,
a p и v давление и об‘ем при температуре t6. Выражая эту зависи-
мость в абсолютной температуре Т = 273 4- имеем:
Dv ₽°' о /073 j t0') — P° V°T
P'“ 273 ^'d tJ“ 273 r
Так как v0 для данного количества газа есть величина постоян-
ная, а принимаем равном нормальному давлению атмосферы, т.-е.
оно есть величина тоже постоянная, то, обозначая это постоянное
отношение ^ерез R, получаем уравнение Клапейрона:
А ( V
pv = RT,
которое говорит, что произведение об'ема газа на ею давление пропорци
опально абсолютной температуре. Но это справедливо только для
„идеальных" газов, так как общее уравнение состояния газа, из
которого мы его получаем, выведено из законов Бойля - Мариотта
jpv =povo] и Гей-Люссака [v = vp (1 + t0)]. справедливых только для -
„идеального" состояния газов и тем менее точных, чем газ больше
сжат, так как тогда молекулы газа сближаются на такие расстояния,
когда начинают проявляться молекулярные притяжения (подобно тем,
кои существуют в жидкостях), и газ все более теряет свои индиви-
дуальные свойства приближаясь в этом отношении к свойствам
жидкостей, особенно с понижением температуры, так как тогда умень-
шаются скорости молекул и они легче группируются для образования
молекул жидкости. Кроме того, при большом сжатии газа, нельзя
пренебрегать и суммой об'емов самих молекул, которые предполагают
несжимаемыми, так как об‘ем каждой молекулы, хотя и Очень мал, но
представляет конечную величину, число же молекул в единице об'ема
газа—огромное. Поэтому при больших давлениях выходит, что газ
заключен не в об‘еме, предоставленном ему. (г), а в меньшем, на вели-
чину (а) суммы об'емов самих молекул, сжатых до-сближения, т.-е.
в об'еме:
Эта-то величина х названа коволюмом. Поэтому уравнение Клапейрона
обращается в следующее, более точное:
позволяющее определить
давление Р, развиваемое взрывчатым веще-
ством, по данным:
РьБ,
273
; 7—абсолютной температуре:
»•—предоста-
вленному (для единицы веса газа) об‘ему и а—коволюму образующихся
.4^
127 —
газов. Вводя сюда вместо я
зависимости
его
вырая^яие
в
следующую формулу:
г
1 — ай *
ай
у
273 0
тогда
(В)
1 —аД'
t
Л'.
!
:\
ай
(Г
II :
‘ .Л.
Ге
называется силой взрывчатого вещества. Это же видно из
мулы, так как F = P при
дят: г'о—об‘ем газов, образуемых единицей веса вещества, и Т—абсолютная
температура взрыва этого вещества суть величины независящие от условий
заряжания и ко волю ма, с другой же стороны, характерные для каждого
вещества и характеризующие ею силу, а потому величина F==RT-^y^T
самой фор-
плотности заряжания: Д=— получаем
RT _ ВТД _ р0 ve
1 ~ 1 — аД ~ 273
— — а
Это есть формула, определяющая наибольшее давление взрывчатого
вещества, при плотности заряжания Л, если коволюм вещества есй> «,
а так кай в выражение F==J^-v0T, кроме постоянных р0 и 273, вхо-
li этик выражениях v0 представляет об‘ем газов, образуемых
1 кил. данного взрывчатого вещества при О’ и 760 м.м. давления,
то-есть, вообще говоря, является переменной величиной, постоянной
только для д <нного вещества (и то при одинаковых условиях горения);
Т~абсолютная температура горения взрывчатого вещества; Л -плот-
ность заряжания; «—коволюм всей смеси газов, образуемых единицей
веса вещества. Обозначим:
тле. P=F, или сила взрывчатого вещества Fда-
влением Р, которое бы мы получили, если бы вар лн единицу веса
вещества в об‘еме v, равном (l-f’а), т.-е. в едмчйце еб'ема увеличен-
ном на коволюм. .Имей такоЬ анаяЙМчмЙЙайфаЛеИие F, мы легко
могли бы сравнивать различию вярнвчвям»вещества по силе. Но
проведение таких одытов в большинстве олучаев немыслимо, так как
н
i
i
।
ч
— 128 —
давлений, получающихся при этих условиях не выдержат никакие
оболочки.
Пример:
Найти наибольшее давление Р, если дано:
1) V—об‘ем замкнутой оболочки в литрах,
21 to—вес заряда взрывчатого вещества в килогр.
3) - об‘ем газов и паров, образуемый 1 килогр. взрывчатого
вещества,
4) а—коволюм газов и паров, выделяемых 1 килогр. взрывча-
того ветнества,
•5) Т— температура взрыва данного вещества.
Подставим все эти данные в формулу (А).
Однако, так как она относится к единице веса вещества, кото-
рого по условию у нас со килограммов, то вместо у0 подставим авю
(так как об'ем газов будет в со раз бол: шиmj, также а заменится по-
средством аю и V посредством v, тогда получим:
Р = Ро va> Т
273 V — асо
Разделив числителя и знаменателя на V имеем.
О?
р р(Л(Д v __________ р
273 1—асо 1—аД
Если взрывчатое вещество дает твердый или жидкий остаток,
об'ем которого а3, а коволюм газов то вместо а надо подставить
а = ах + «2
Формула (В) имеет весьма важное значение, так как ею решается
масса различных вопросов. Например, сделав два опыта определения
р при ризных значениях А. помощью ее мы легко определим F и а,
самые характерные величины для взрывчатого вещества, для чего
стоит только решить два уравнения с двумя неизвестными. А тогда,
по этой же формуле, (теоретически) будем знать Р при любых плот-
ностях заряжания Л. Заметим при этом, что для нахождения F и а
таким способом не требуется определения, ни об ема газов, ни тем-
пературы. ни количества тепла.
Величина коволюма а для различных газов колеблется между
0,00086 — 0,00136 частями от об'ема этих газов при 0“ и 760 м.м. да-
вления. Вообще при вычислениях можно принять, вместо этих чисел,
0,001, следовательно
а = А
1000 ’
тем более, что обыкновенно имеем дело со смесью разных газов и
точность других чисел меньше, чем ошибка, которую мы делаем этим
округлением. Таким образом, зная реакцию разложения вещецтв*
определив об'ем газов v0. мы будем знать и коволюм at.
Поясним это примером. ~:Л-.
Пусть требуется определить об'ем газов и коволюм по реакции
разложения для нитроглицерина. Эти величины определяются для ’ЯВ
1 кгрм. вещества. Реакция разложения нитроглицерина протекает,
как известно, по уравнению:
2 Сз Нз (NOO2)8 = 3 N2 -J- 6 С02 + 5 Н2 О + 0,502.
Воду здесь надо считать газообразной, поэтому 2 грамма нитрогли*
церина (2 X 227 грм.) дадут
з _|_ 6 4-5 + 0,5 = 14,5.
граммолекул газов, или 14,5X22,4 литр., а 1 кгрм. даст об'ем
газов =— ох/.,о7-----= 715 литр. Коволюм же будет = 0,715, так как
твердых и жидких продуктов здесь нет. Эти числа получаются и при
непосредственном опыте.
1
Уравнение (В) показывает, что, при 1— а Д = О, или Д = —,Р = со,
ос
т. е. получается бесконечно большое давление, это значит, что при
плотности заряжания обратной коволюму, давление будет бесконечно
болипее, которое не выдержат никакие стенки. Так как Д = —,
то выражение Д = — дает —=— или v = а, т. е. иначе говоря, Дав-
ление бесконечно велико (т. е. Р = со) при взрывании взрывчатого
вещества в об’еме, равном его коволюму; это также сразу видно и из
уравнения (А), так как в нем Р= оо при о — <х = О или v = a. При
плотностях заряжения Д>—-сосуд будет наполняться несжимаемым
веществом, об'ем которого превышает вместимость сосуда, и потому его
стенки неминуемо должны разорваться. Вычис ляя для различных взры-
вчатых веществ эту, так сказать „критическую" плотность заряЛеания
1
(Д = —) нам станет понятным, почему большинство взрывчатых ве-
ществ разрывают оболочки любой прочности, когда они взрываются в
об'еме, целиком ими занимаемом Ниже приводятся эти
критической плотности заряжания в общей таблице.
„ „ Д
P = F——v-можно выразить еще уравнением:
величины
Формулу
=F + «Р, которое показывает, что отношение -г- есть
линейная
функция от Р, т. е. величины F и а постоянны для данного в. в. По-
этому эта функция выражается прямой с угловым коэфицинетом а и
начальной Ординатой F.
Преф. М. Сухаревский. Взрывчатые вещества а взрывные работу. °
— 130 —
§ 2. Потенцилпьнля Всякая работа получается на счет какой-ни-
энергия взрывчатого ве- будь энергии, направляемой в сторону сопро*
щества. тивлений, оказываемых при совершении
- этой работы. Так как во взрывчатом веществе (из работоспособных)
заключается только химическая энергия, то, очевидно, что—механи-
ческая работа, производимая ими, есть следствие перехода только
потенциальной энергии в кинетическую в виде тепла. Выделяемые при
этом газы служат только средством, благодаря которому эта энергия
(тепловая) может произвести механическую работу, так как нагрева-
ние твердых тел, не вызывая сильного расширения их, не может
дать механической работы так легко, как нагревание газов.
Отсюда понятно, что наибольшее количество механической ра-
боты, какое только может дать данное взрывчатое вещество, разсуждая
теоретически, можно измерять той химической (потенциальной') энергией,
которая в нем заключена, вернее не вся, а которая освобождается при
взрыве в виде теплоты, таковая же определяется легко опы ным путем
и теоретически. Переход же от этого количества тепловой энергии
Qp к эквивалентному количеству возможной механической работы
совершается очень легко умножением Qp на механический эквива-
лент тепла Е = 425 кгрм.-метр, то есть, эта работа будет
T=EQP
а, так как это лишь теоретически возможная энергия, получаемая из
потенциальной (химической) энергии взрывчатого вещества, то она и
называется потенциальной механической энергией, или просто потенциаль-
ной энергией взрывчатого вещества.
Действительная же (полезная) работа взрывчатого вещества обык-
новенно не превосходит половины этой величины, тай как часть теп-
ла отдается стенкам, большая же его часть уходит вместе с раска-
ленными газами при освобождении их; наконец, газы при взрыве рас-
ширяются только до уравновешивания их давления давлением окру-
жающей среды, т. е. давление их далеко не достигает нуля, хотя бы
потому, что окружающий воздух имеет давление ок. 760 м.м. ртут-
ного столба; почему и берется Qp, а не Qv.
Но работоспособность взрывчатого вещества для практических
целей нельзя определять одной только потенциальной энергией их,
и мы видели, что важную роль играют газы*) так что, например,
вещество термит (смесь порошкообразных AI и Fe2O3) хотя и выделяет
при горении огромное количество тепла, т. е. обладает огромной потен-
циальной энергией, но, не давая газов, не обладает взрывчатой силой,
и потому и не может считаться взрывчатым веществом. Кроме того,
при производстве подрывных работ, ‘раздроблении снарядов и пр.,
как уже знаем, важную роль играет коволюм и плотность заряжания,
а значит и плотность самого вещества. Поэтому, наравне с потен-
циальной энергией взрывчатого вещества, все эти обстоятельства
нельзя упускать ив виду.
*) Значение которых нам станет еще более ясным, если вспомним, что при темпе-
ратуре выше критической, они не сжимаемы в жидкость.
— 131 —
Ниже приведем для некоторых взрывчатых веществ общую таб-
лицу величин, о коих здесь идет речь, в которой обозначены черев:
1) Акр.—критическая плотность, при которой получается беско-
нечно большое давление (Дкр=-%
2) Ad—доступная практическая плотность;
3) Vo— об-ем юзов, образуемых 1 кгрм. взрывчатого вещества в
литрах, при Н, О и Hg газообразных;
4) а=«4 ая т. е. коволюм в месте ствердым остатком для 1 клгрм.
взрывчатого .вещества;
5) — пСила взрывчатою вещества", проявляемая 1 клгрм.
его, в атмосфере;
F
6) f = ------ относительная сила взрывчатого вещества при
F дым. пор.
силе дымного пороха, принятой за единицу;
7) Т=относительная потенциальная энергия при равныхвесахвзрыв-
У Т
чатых веществ = g^pj* **) где т (^ымн. пор.) = 335000 клгрм.-
метр, для состава: 75% селитры, 14% угля, 10% серы и 1% влаж.;
8) Тоже при равных об'емах взрывчатых веществ;
9) Плотности, при которых вычислены величины графы 8
1 2 3 4 5 6 7 8 9
Относит, по-
Название взрывчатых тенц. энерг.
веществ.’ Акр. Ad Vo а ji* f при равн. при равн.
весе объеме
») **) **)
Дымный порох . . 2,05 11,4 280 0,490 3090 1 1 1
Бездымный порох • . . 1,1 1,641 9101 0,9101 87301 2,9 1,2 0,85 0,7
Нитроглицериновый по- 970/ 0,970 / 8970 / руж
рох (балистит.).... 1.25 1,65 J 810 0,810 9350 3,05 1,65 1,15 0,7
руж
Пироксилин NIf (сух.) . 1,15 1,4 860 0,860 9390 3,05 1,50 1,65 1,1
Коллодионный пироксилии
(Ne 1,05 — 970 0,970 7910 2,55 1
Нитроглицерин • . 1,40 1,6 i715 0,715 9760 3,15 2.2 3,50 1,6
Гремучий с ту день (9,15%) 1,40 1,6 710 0,710 9940 3,20 2,45 3,90 1,6
Гур. динамит (75%) . . 1,40 1’5 630 0.725 7740 2,50 1,65 2,50 1,5
Нитроманит 1,45 1,9 695 0^695 9810 3,15 2,15 4,10 1,9
Мелинит 1,15 1,7 . 875 0,8'5 86 0 2,50 1,10 1,70 1,6
Тринитробензол .... 1,05 1.6 940 0,940 9220 3,00 1,00 1,50 •Ч
Гремучая ртуть .... 3,20 > 4 315 0,315 43Н0 1,40 0.55 2,20 4
Аммонал. (Ale NH4NO3) 1,30 1,8 680 0,770 8890 2,90 2,35 4,25 1,8
Аммонийная селитра . . 1,05 1:7 975 0,"75 4730 1,55 0,85 1,45 ч
Тринитротолуол 1,18 1,62 850 0850 7 7169 2,32 Ж 1,6
*) Действительная плотность лент.
**) Для состава: 78,9% селитры, 11,2% угля, 9,9% серы; для других составов чи
ело меньше и доходит для v0 до 205 литр
— 132 —
Из этой таблицы видим, что тогда как дымный порох даже при
максимальных плотностях заряжания никогда не достигнет критиче*
ской плотности заряжания (2.05)—^для бездымных порохов это легко
достигается. Кроме того, так как с увеличением плотности заряжания
увеличивается скорость горения и при больших плотностях заряжания
горение бездымного пороха обращается в детонацию, то поэтому при
стрел! бе из орудий (метательном действии) плотность заряжания для
бездымных порохов обыкновенно берут не больше 0,5. Для ружей, в
виду очень малой поперечной нагрузки пули, сравнител) но со сна-
рядом и небольшого заряда, детонации опасаться не приходится, а
потому для винтовок допущена плотность больше 0,5, а именно почти
равная гравиметрической плотности винтовочного порохи.
В заключение здесь приводится таблица статического давления
и сила удара для некоторых взрывчатых веществ, заимствованная
у В. „Zchokke. Handbuch der Militar. Sprengtechnik 1911“ и таблица
работы газон, развивающихся при взрывчаты> разложениях некоторых
взрывчатых веществ заимствованная у Н. Brunswig’a:
Наименование взрывчатых веществ. Числа кало- рий освобо- ждающихся при взрыве. 4 Работа газов в килогр.- метрах. Коэффи- циенты.
93% гремучий студень 1640 700.000 1,00
Нитроглицерин 1580 670.000 0,96
Нитроманнит. . . 1520 645.000 0,92
Гур-Динамит № 1 (75°/0) 1290 55U.000 0,79
Нитроглицериновый порох (4О°/о). . . . 1290 550.000 0,79
Пироксилин (с 13°/0 азота). ....... 1100 465000 0 66
Пироксилиновый порох 900 380.000 0,54
Коллодионный пироксилин (с 12"/о азота). 730 310000 0,44
Смесь 9О°/о аммиачной силитры и 10%,
нитронафталина. . 930 385.000 0,58
Пикриновая кислота. 810 345.000 0,49
Черный порох 685 290.000 0,41
Аммиачная селитра 630 265 000 0,38
Гремучая ртуть 410 175.000 1,25
Об опытных определениях об'ема газов, теплоты и давления при
взрыве и соответствующих приборах будет сказано в одной из следу-
ющих частей настоящей книги.
Название взрывча- того вещества. ; <s i 3 Состав его. ! л 3 6 | И Температура развивающ. при взрыве испи- ленная в граду- сах Цельзия. Скор, детон 1 вметр.всек. Статическое давление в килогр. (С. м 2) Ps = Ро 4* 273)
Черный порох Гремучий студень. 175% калиевой селитры. 1 04 1 । 3% угля ! 112% серы. . . (92% нитроглиц. . 1.63 1 8% коллод. хл. . ! 1 2537 3216 300| 409. 770011393. о-э А . 3216А V 1 273 J = 4209 =17803
Гурдинамит № 1 175% нитроглицерина.! 1.58 125 /0 кизельгура . . 1 2999 к 6818 1055. А 2999\ V г 273 / =12694
Прессован, пжрокс. C1JHu(N02)6 1.25 2380 6383 1 1145. А , 2Я8О\ V ! 273J = 11127
Пикриновая кисл. С6Н2 (NO2)3 (НО) '1.55 . 2498 8183 1298. / 2438\ 273 J = 13175
Тринитротолуол. . СтНДЯОД 1.55 2142 7618 1400. VT 273) =12384
Сила удара
_. mv2
Pd = —
&
в килограммометрах-
секундах.
1 X 7700»
2Х 9,81
1 X 6818»
2Х 9.81
1 X 6383»
2Х 9,81
= 3021916
= 2369272
= 2076589
= 3412920
2Х 9,81
2Х;о'м = 2957896
ЧАСТЬ II.
Описание материалов, идущих на изго-
товление взрывчатых веществ, как обла-
дающих взрывчатыми свойствами, так
и необладающих ими.
При прогрессирующем увеличении количества самых различных
взрывчатых ве ществ, находящих себ^ спрос, как в военном деле,
так и гражданской практике, естественным явилось и значительное
увеличение исходных материалов, идущие на их изготовление, по-
этому для систематического курса взрывчатых веществ нам кажется
рациональным предпослать части, излагающей собственно технологию °
взрывчатых веществ, описание главнейших свойств некоторых тел,
идущих на изготовление взрывчатый веществ, как обладающих взрыв-
чатыми свойствами, так и не обладающих ими, выделив это описание
в виде отдельной части.
По той же причине и в целях естественной систематизации ма-
териала, мы разделили настоящую часть на два отдела: отдел пер-
вый—неорганические соединения, отдел второй—органические соеди-
нении, каждый же отдел, в свою очередь, разделен нами на под'от-
делы, главы и §§, соответствующие естественной группировке со-
единений.
Неорганические соединения.
ПОД'ОТДЕЛ I.
Металлоиды и ир соединения.
ГЛАВА I.
Углерод и кремний и ил соединения.
углерод
В технологии взрывчатых веществ чистый
§ 1. Уголь, находит себе применение лишь как основная доминирующая
часть различных углей, идущих при фабрикации взрыв-
чатых веществ. Из различных углей чаще всего применяют обыкно-
венный черный древесный уголь, реже—бурый, а еще реже лигнит
и каменный уголь. Для минных порохов бурый уголь не годен. Из
всех сортов древесного угля черный отличается наибольшим посто-
янством. Бурый уголь применяется в некоторых охотничьих порохах,
а также в шоколадном порохе, употреблявшемся прежде в орудиях
большого калибра.
Ретортный уголь изредка применяется для электрических запа-
лов, предназначенных для токов средней силы.
„Коасный" уголь составляет специальный сорт бурого угля
и употребляется при фабрикации динаммона, веттер—динамита и не-
большого числа других взрывчатых веществ.
Лигнит применяется в некоторых сортах аммонала.
„ у «) Сода (Na2CO3-\- представляет безцветные мо-
5 2 ХИЫе ноклинические призматические кристаллы, содержащие
10 частиц кристаллизационной воды. Удельный вес ••
1,45; 100 частей воды, при 0° растворяют 21,33 части соды, а прй -
100°С—420 частей ее. Водные растворы соды имеют сильно щелоч-
ную реакцию. В спирту сода не растворима. '
При нагревай и до 100* сода теряет всю воду и распадается 1 но*
рошок—так называемый кальцинированную соду.
Как известно, сода бывает 1) натуральная; 2) получающаяся ИЗ
золы некоторых растений (водорослей, свекловицы и садовых расте-
ний) и 3) приготовленная химическим путем, переработкой некого-
рых, встреча» шихся в природе в больших количествах, соединений
натрия, как, например, поваренная и глауберова соль, чилийская
селитра, криолит и т. п. При химической обработке этих веществ по-
лучаются побочные продукты производства, находящие себе обеспе-
ченный сбыт в промышленности, как-то: соляная кислота, белильная
известь, сера, хлористый аммоний, калиевая селитра, квасцы, серно-
кислый глинозем, гиппосульфит, алюминат натрия й т. п.
В технике взрывчатых веществ сода применяется, как в каче-
стве нейтрализатора свободных кислот (например, в некоторых дина-
митах), так и для понижения температуры пламени при взрыве.
Существуют несколько способов приготовления соды химическим
путем, но пользуются широким применением только два—классический
способ Леблана (предложен в 1793 г.*) и позднейший—аммиачный**).
С целью очистки соды, продажный препарат несколько раз пере-
кристаллизовывают; полученные кристаллы высушивают и сохраняют
в плотно-закупоренных склянках, иначе на воздухе она легко выве-
тривается.
В тех случаях, когда чистота соды имеет большое значение, как,
например, в технологии взрывчатых веществ следует произвести со-
ответствующее испы ание. Для этого берут 20 грм. соды и растворяют
в 80 куб. с/м. воды; должен Получиться совершенно бесцветный и
прозрачный раствор. Из посторонних веществ в ней чаще других при-
сутствуют: кремнезем, серная кислота, хлористые соединения, мышьяк,
тяжелые металлы, фосфорная кислота, .едкие ще ючи, двууглекислый
натрий, сернистый натрий, гиппосульфит. Присутствие кремневой
кислоты обнаруживается так:
20 грм. соды растворяют в избытке разведенной соляной кислоты;
раствор выпаривается досуха и сухой остаток нагревается до 100°, после
че о растворяется в 150 куб. с|м. воды, подкисленной небольшим ко-
личеством соляной кислоты. Если кремневой кислоты нет, то полу-
чится совершенно прозрачный раствор, в противном случае в растворе
будут плавать хлопья кремнезема. »
Для испытания на серную кислоту 10 грм. соды растворяют
в 150 куб. с/м. воды; жидкость слегка подкисляется соляной кислотой
и нагревается до кипения, затем приливается немного раствора хло-
ристого бария; после 12-ти часового стояния не должно получиться ни
мути, ни осадка.
Для обнаружения присутствия хлористых солей 5 грм. соды
растворяют в 50 куб. с/м. воды; жидкость, подкисляемая разведенной
*) Процесс Леблана — процесс превращения сернонатровой соли в соду состоит
в сильном прокаливании смеси первой соли с углем и услеизвестковой солью, при
этой происходит сл. реакция:сперва сернонятровая соль а углем раскисляв гея, образуя
сернистый натрий и углекислый газ, что может быть выражено уравнением NaaSO44-
4-2С—Na2S+2COa Полученный сернистый нятрий NagS вступает в дв йное разложе-
ние со взятою углеизвестковою солью и дает сернистый кальций и соду. Na^S+CaCOy <==
Na2rO3-pCaS При этом сверх того от действия жара часть избытка yi леизвв'-тко-
вой сот разлагается, образуя известь и углекислый газ Са( 03е= СаО+COj, а угле-
кислый газ с избытком у<ля дает оьнсь углерода. Таким образом в результате из
массы, содержавшей N^SOj получается масса заключающая Na2CO3, CaS, СаО, но в
ней не остается сернистого натрия, или только, некоторая часть его. Тогда всю ре-
акцию можно выразить так 2Na2SO44-3CaCO34-9C = 2Na?cO34-CaO+2CaS-hl0CO. Эту
смесь прокаливают, охлаждают и потом подвер ают методическому выщелачиванию.
**) Аммиачной способ, разработанный Шлезингом, состоит в том, что прямо
в природный насыщенный и вевыпаренвый растворNaCl вводят NH3 и избыток Сор-
осам дается NaHCO3 (часть NaCl и NaH’*03 остается в растворе), а в растворе полу-
чается NH|G1. Из него получают опять NH3, а при прокаливании NaH( О3 — соду.
азотной кислотой, не должна изменяться при прилитии раствора
ляписа (AgN 'a). ' ?
Для испытания на мышьяк, берут 30 грм. соды и, растворившее
в небольшом количестве воды, прибавляют разведенной чистой сеШЙк
кислоты. Дальнейшее испытание ведете» на приборе Марша,причем.ДЛЯ
выделения водорода берут 10 грм. цинка и разведенную -серную кие?
лоту (1:3). Выделяющийся водород пропускается через прибор в тече-
ние % часа, причем в реляционной трубке не должно быть налета.
Для производства пробы на присутствие тяжелых металлов бе-
рут 20 грм. <оды и растворяют в 60 куб. с/м. воды; к раствору при-
ливают избыток разведенной соляной кислоты и пропускают серово-
дород. Последний не должен давать никакого осадка сернистых ме-
таллов сероводородной группы. Можно тоже прилить аммиака и сер-
нистого аммония, при этом не должно быть ни мути, ни осадка.
В случае, если есть основание предпо ага:ь возм ожность при-
сутствия фосфорной кислоты, растворяют 5 грм соды в 50 куб. с|м.
воды, раствор сильно подкисляют азотвой кислотой и полученную
жидкость испытывают азотнокислым раствором молибденовокис юго
аммония. Если по истечении двух часов стояния в теплом месте жид-
кость останется прозрачной и не будет осадка—это покажет отсутствие
фосфорной кислоты.
Присутствие едких щелочей обнаруживается при помощи реак-
тива Доббина *).
В оучае присутствия двууглекислого натрия, при нагревании
сухой соды до 150е С происходит потеря в весе от потери ею части
углекислоты; в присутствии же последней можно убедиться, пропу-
ская выделяющийся газ через баритовую воду. Сода, не содержащая
двууглекислого натрия, не должна терять в весе и выделять углекис-
лого газа при температуре 150°С.
Е ли есть в соде примесь сернистого натрия, то от прибавления
к раствору ее серной кислоты — выделяется сероводород.
Присутствие гиппосутьфита обнаруживается так: к разбавлен-
ной сервой кислоте прибавляют несколько капель раствора хамелеона
или хромокислого калия и затем вводят в полученную жидкость
немного испытываемой соды, но так, чтобы жидкость сохраняла кислую
реакцию. Если жидкость обесцвечивается или принимает зеленоватое
окрашивание, то эго будет служить указанием на присутствие серно-
кислого или серяоватистокислого натрия.
В хорошем техническом продукте обыкновенно допускается: не
более 0,5% воды, около 0,1% нерастворимых в соляной кислот® при-
месей и не более 0,02% окиси железа. В соде, полученной по »1ши>
ачному < пособу, обыкновенно содержится меньше 0.1% сернокислых
солей и от 0,5 % до 2,5% поваренной соли; хорошая же леблановская
сода заключает в себе от 0,5% до 1% сернокислых содей н от0,25%
до о.5°/0 поваренной соли. I >
•) Оя готовится нижеследующим образом: к водному раствору йодистого
калия (5 грм.) приливают раствор сулемы до тех пор, пока образуется постоянный
осадок. Жидкость фильтруют, к ней прибавляют 1 грм. нашатыря и слабого раствора
едкого натрия до тех пор, пока будет образоваться постоянный осадок. Тогда жид-
кость вновь фильтруют и разбавляют до об‘ема в 1 литр.
— 142 —
количественное определение углекислого натрия производится
титрованием горячего раствора 5 грм. соды в 50 куб. с/м. воды в при-
сутствии лакмусовой тинктуры, нормальным раствором соляной-кислоты.
1 куб. сайт, кислотьгсоответствует 0.053 безводной соды или 0,1427 десяти-
водного ее гидрата. В качестве индикатора можно брать метилоранж,
который именно и употребляется с этой целью ма содовых заводах.
Как было упомянуто выше, сода применяется иногда в антигри-
зутных веществах для понижения температуры пламени.
б) Углекислый кальций (СаСО&) изредка применяется в форме мела,
линегура и др. (ресвит, кайнит, белый динамит; в небольших коли-
чествах вводится в некоторые сорта пироксилина и пр.). Удельный
вес около 2,7.
Химическое исследование мела одинаково с анализом известня-
ков вообще и потому ход исследований можно найти в любом руко-
водстве к техническому анализу. Здесь только вкратце приводится
перечень необх<димых определений.
1. Определение влажности.
2. „ гидратвой воды.
3. „ углекислоты
4 „ остатка, нерастворимого в соляной кислоте.
5. „ веществ, пере педших в солянокислый раствор
(могущих частью перейти в раствор: кремневая кислота, глинозем,
железо, марганец, фосфорная кислота и щелочи. Другие примеси на-
ходятся реже перечисленных).
6. Определение извести и магнезии.
7. „ кремнезема, растворимого в щелочах.
8. „ органических веществ
В) Углекислая магнезия МдСОъ известный белый об'емистый поро-
шок удельного веса 2,9— 3,1 В чистой воде не растворим, но не-
сколько растворяется в воде, содержащей углекислый газ.
В технике взрывчатых веществ применяется довольно редко (в
динамитах, взрывчатых веществ типа Прометей и пр.).
г) В некоторых безопасных взрывчатых веществах изготовляемых
Кельн-Роттвейлеровской фабрикой, применяются также кислый углекис-
лый аммоний Н (HNt) GOS. Это есть бесцветная кристаллическая соль
без запаха, растворяющаяся в 6 частях холодной воды и разлагаю-
щаяся в горячей. В спирте нерастворима. Иногда в тех же взрывча-
тых веществах она заменяется соответствующей бариевой солью *).
§ 5. Кремний и его В практике взрывчатых веществ нередко поль-
соедйнения. зуюся кремнеземом SiO2; его применяют исключи-
тельно в виде тонкого порошка. Искусственный или чистый природный
кремнезем представляет собой порошок белого цвета, удельного веса
2,2, нерастворимый в воде и кислотах (кроме плавиковой). Из сортов
природного кремнезема наибольшим применением пользует -я земли-
стое вещество, называемое кизельгуром или инфузорной землей, встре-
чающееся в значительных количествах во многих местах, между
*) Другие соединения углерода, имеющие значение в технологии взрыв-
чатых веществ описываются в специальном отделе настоящей части.
Г Ганновере, у Оберлое. Он представляется в виде порошка
цвета различных оттенков от зеленоватого до красноватого, и со*
|ЗадИГГ>давным Образом М9 кремнистых панцирей микроскопических диато-
^^1, обладает большой поглотительной способностью по отношении к НИ*
троглицёрину (поглощая еГодо'4-х частей по весу и плотно удерживая).
Г Здесь приводится химический состав некоторых сортов кизельгура.
У?
Авторы анализов и не- Анализ Gody. Sanford. Hagen.
сторождение. Из Оберлое (Ган- Прока- ленный*
Названия новер). Сухой.
составные частей. . — 1 - - - - 1 , — —. I. II.
Кремнезем...........................
Углекислая известь..................
Известь............................
Магнезия............................
Окись железа............'...........
Глинозем ...........................
Органическ. вещества.............. .
Влажность...........................
0,73
0,13
2,28
8,43
74,48
0,34
0,39
| 24,42
94,3 96,34
— 1,64
2Д -
1,3 0,6
— 1,5
0,4 -
1,9
Анализ бледно-розового, кизельгура из Ardeer
Powder, выполненный в 1884 г. Дюпрэ, дал:
Растворимого кремнезема и окиси железа 95,69%
Нерастворимого кремнезема, песку и пр. . . 2,0о%
Потери от прокаливания . ..............0,60%
Влажности......................... 1,71%>>
Сумма . 100,00%
Кизельгур применяется в динамитах с недеятельным основанием
в качестве поглотителя (кизельгур—динамит или гурдинамит, кизель-
гур—гельгофит и пр.)
Известный полировальный порошок трепел имеет состав одина-
ковый с инфузорной землей и применяется также в динамитах в ка-
честве отличного поглотителя. Динамиты его содержащие, окрашены
в красный цвет
Реже применяется в качестве поглотителя овернский ранданнт
и искусственный кремнезем (в динамитах прежнего изготовления).
Кизельгур является также часто применяемым поглотителем в
оксиликвите.
Де али попытки заменять кремнистый поглотитель в динамитах
каолином, углекислой магнезией, золой богхедского угля и т. п. ве-
ществами.
Из сплавов кремния два—с железом и кальцием, в настоящее '
время также применяются в технике взрывчатых веществ.
Ферросилиций применяется в сикрите и „французском эхо“, а
' Кремнистый кальций в сабулитах и силацие.
Технический ферросилиций далеко не чист: в нем заключаются
примеси: маранца, фосфора, углерода, серы и аллюминия. Имеется
два сорта обыкновенного технического продукта: „богатый кремнеземом"
и „нормальный**. Вот их приблизительный состав:
Si Fe Мп Р С Al S
„богатого": 45-47°/» 43—50% 1’» 9,1% 0,3% 1% —
„нормального**: 10—12% — 1—2% до 0,18% — 0,05
Хотя при взрыве и тот и другой сорта его выделяют большое
количество тепла, однако, ни тот ни другой, негодны к введению их
во взрывчатые вещества, ибо обуславливают чувствительность их к
удару ружейной пули. Чтобы этого не было, ферросилиций должен
содержать 90—95’1» кремния (так как даже при 75% кремния он еще
сохраняет чувствительность к удару ружейной пули).
Значительные технические трудности, с которым сопряжено по-
лучение подобного высокопроцентного продукта, в связи с большой
твердостью ферросилиция и связанной с этим трудности получения
из него тонкого порошка, также как и угловатая, с острыми краями,
форма частиц, представляют его отрицательные качества, препятству-
ющие его широкому применению.
Также точно, невидимому, химическая стойкость смесей, содер-
жащих кремнистый кальций, оставляет желать пока много лучшего.
ГЛАВА II.
Дзот и его соединения.
§ 1. Из пятой группы элементов не только по богатству соеди-
нений, но и обилию случаев применения во взрывной технике наи-
большее значение имеет азот. Мы рассмотрим сначала кислородные
соединения азота и их производные, а затем некислородные.
„ _ _ Окись азота NO постоянный бесцветный газ, мало
а растворимый в воде (%0 объема при обыкновенной тем-
пературе); при нагревании он разлагается, отделяя кислород, почему
некоторые зажженные тела (как, напр., фосфор), в нем продолжают го-
реть. Получается действием разведенной азотной кислоты (удельного
веса 1,18) на металлическую медь по уравнению:
8HNO3 + 3Cu = 3Cu(N03)2 + 2N0 + 4Н20.
От капсюля с гремучей ртутью он взрывается.
„ , _ , Аютистый анги^рпт N2O3 и соответствующий
0 ему гидрат—азотистая кислота HNO^ неизвестны
арит и его произвол- " г
r г в совершенно чистом состоянии, хотя азотистая
ные. с м _ о
кислота имеет целый ряд хорошо изученных солеи,
обладающих большой устойчивостью. Однако, каждый раз, как только
пробуют выделить азотистую кислоту из ее солей, последняя распа-
вГ
и двуокись
познания о
:v.
I'rfe1,
ia-ангидрит и воду, а первый—на окись азота NO
О». Насколько простираются наши современные
дехВеществах, азотистый ангидрит есть газ буроватого цвета,
И^Иш&ном охлаждении сгущающийся в синюю жидкость. Азотистый
обладает способностью поддерживать горение.
^МРСвабодная азотистая кислота и азотистый ангидрит выделяют
йодистого калия, каковым свойством и пользуются для откры-
их присутствия в солях.
Азотистые соли обладают, подобно селитрам, свойством легко
пааать свой кислород. Азотистый ангидрит обладает большой окис-
ИКЙельной способностью; он легко поглащается азотной кислотой и,
Итаком виде, кислота эта применяется в панкластитах.
К; Из солей t азотистой кислоты наибольшей известностью поль-
РКуКиЪя: азотисто калиевая сом и азотисто-натриевая.
' а) Азотисто-калиевая соль KNOt получается путем сплавления ка-
S/лиевой > селитры с окисью свинца и обработки сплавленной массы во-
£ дой. Из полученной жидкости легко выкристаллизовывается избыток
,' селитры, азотисто-же калиевая соль остается в растворе. Есть и дру-
|^ие способы ее приготовления (прокаливанием калиевой селитры с
«Йшеничным крахмалом или сплавлением' сернисто-кислого калия
‘ K^SOs с калиевой селитрой). .
Раствор азотистокалиевой соли имеет щелочную реакцию. Чистый
Технический продукт (Kalium nitrosum purissimum) содержит 80—90*/»
| азотисто-калиевой соли, остальное же составляют: свободные щелочи,
'Карбонаты, хлориды, сульфаты и нитраты. Соль гигроскопична и
должна храниться в герметических стеклянных банках оранжевого
[отекла.
fcV- ' б) Азотистокислый натр NaNOz получается подобно калиевой
В&ЛИ, носит название „нитрита" и имеет значительное применение в
ЕвЬомышленности, ибо реагирует с амидами диазо-красящих веществ,
Кеюразуя краски на тканях.
К,-'--'- в) Азотистый аммоний NOt—бесцветное кристаллическое тё-
wj обладающее взрывчатыми свойствами. В холодной воде он раство-
Йм, в горячей же разлагается. При быстром нагревании до 70°—80°,
□также при сильном ударе разлагается со взрывом. Гигроскопичен
Иредос^аточно устойчив для практического употребления. Приго-
Иидяется большей частью путем двойного разложения азотисто-бари-
Мш/.соли с сернокислым аммонием. -
Мнщ* Азотноватый ангидрид NzOk, а двуокись
^Ьр*отиовать,й ангид’ азота N02,различаются между собой также, как
и Му0***1* азота- 030Н отличается от кислорода, при чем азотноватый
^Ийгдрид переходя в двуокись азота, поглощает тепло.
^^Аэотная кислота, действуя на олово и некоторые органические
вроде крахмала, дает бурые пары окислов азота, состоящие
азотноватого ангидрида и двуокиси азота. Более чистая
азота получается путем разложения азотнокислогр свинца,
^^^НнирЩегося по уравнению: Pb(NO3)2 — 2NO2 -f- О + РЬО. Получаю-
этом двуокись азота в сильно охлажденном приемнике
сгущена в бурую жидкость, кипящую при 4-22*0.
Сухаревский. Взрывчатые вещества и взрывные работы. Ю.
Чистый азотноватый ангидрид—есть бесцветное кристаллическое
тело, плавящееся при—10°0 в бесцветную же жидкость. При Темпе-
ратуре выше—10°С- кристаллы плавятся, образуя красно-желтую жид-
кость, похожую на ту, которая получаемся путем разложения азотно-
кислого свинца.
Пары азотноватного ангидрида имеют характерный запах и бурый
цвет, ослабевающий при низких температурах и значительно усили-
вающийся при нагревании.
Азотноватый ангидрид в жидком виде кипит при 22»—26°С и
при 15°С имеет удельный вес 1,474. Азотноватый ангидрид с водой
Дает при низких температурах (напр., со льдом) смесь азотной и азо-
тистой кислот, а с теплой водой только одну азотную кислоту.
Двуокись азота во многих Случаях действует окислительно.
Оба ожиженые газа сами по себе не взрывчаты, но в смеси с
горючими веществами способны детонировать с огромной силой, бу-
дучи взорваны капсюлем с гремучей ртутью, почему и применяются
в панкластитах.
„ _ • , Окислу NoOr соответствует азотная кисло-
§5. Нэотный андигрид и та_^0^0 иъли HNOt. Эго бесцветная при
его производные. обыкновенной температуре, едкая жидкость с
удушливым запахом удельного веса 1,526, ипящая при 86°О. Нор-
мальный гидрат, отвечающий обычным солям есть одноосновная кис-
лота. Она является сильным окислителем, действующим разруши-
тельно на многие растительные и животные ткани. В технике изго-
товления взрывчатых веществ применяется почти исключительно креп-
кая кислота, по мере надобности разводимая водой. Нормальный гид-
рат с содержанием 98,7°/0 азотной кислоты не применяется на прак-
тике по причине своего непостоянства при переменах температуры.-
Если в кислоте будет меньше 25*/0 воды, то, испаряя на «воздухе га-
зообразную азотную кислоту, она дымит. Такая кислота носит наз-
вание дымящейся—азотной кислоты.
' Последняя не только от действия органических веществ воздуха,
но даже от небольшего нагревания, легко теряет часть кислорода,
образуя нисшие степени окисления азота, сообщающий ей краснобурый
цвет (Менделеев).
а) Существует несколько фабричных способов приготовления
азотной кислоты.
Самый старый, так сказать классический, основан на действии
серной кислоты при нагревании на чилийскую селитру. При этом во-
дород серной кислоты становится на место натрия, образуя смотря
по количеству взятой селитры кислую или среднюю соль серно-кислого
натрия. Таким образом, реакция следует по уравнениям:
' NaNoa + HgSO. = HNOs-f-NaHSO,;
2NaNOs Н-H2SO< = 2HNO3 + Na2SO4.
На эти операции тратится много времени и лишнего тепла; кроме
того, разложение селитры приходится вести при 300°, отчего страдают
реторты и получается много других окислов азота. Все это делает
более выгодным способ Валентинера непрерывной перегонки азотной
кислоты, под уменьшенным давлением. По этому способу вместо «ре-
торты употребляется котел (рис. 19), в котором на дне имеется кран
дЛЯ выпуска горячего сульфата и лаз для загрузки селитры и сер-
ной кислоты. Вся эта система котла с поглотительными бутылями
(соединена с водяным насосом и разложение происходит под умень-
шенным давлением, вследствие чего, температура при разложении
доходит самое большее до 180°. На рис. 20 показана установка Ва-
лентитра полностью.
Рис. 19. Котел Валентинера.
Цо способу Юбеля разложение NaN03 серной кислотой до обра-
зования NaHS0« происходит в одной паре реторт при сравнительно
невысокой температуре, а в третьей реторте селитра разлагается по-
лисульфатом состава NaHSOiH2SO1. Отгонка кислоты ведется непре-
V
Зй?.'
ЫЙ К
рывно.
, , Гутман заменил обыкновенные глинянные баллоны для сгущения
фаров азотной кислоты системой тонкостенных вертикальных глиня-
труб, сообщающиеся между собой поочередно вверху .и внизу;
йЖАнарнцх соединительны^ труб идут -жмяюнную трубу.
^^гог(о дня устранения азотновмо&окяйГОН добрасывает в трубу,
МОДЙШДОЙ'" - --- - - -
<под давлением в 4 ат-
ЩМсление большей части
ЭД» Выделяющиеся пары
приемнике.
*
Рис. 20. Общая схема установка Валентинера.
Теоретически для до-
бывания азотной кислоты
из чилийской селитры
надо взять 98 частей сер-
ной кислоты и 85 частей
. селитры, на практике же
оказывается, что при та-
кой пропорции азотная
кислота не вытесняется
• из селитры серной кисло-
той нацело, а потому про-
порцию* сейитры умень-
шают и берут ее лишь
80 частей.
В виду того, что опе-
рация добывания азотной
кислоты (технической) ве-
дется по этому способу’
в чугунных котлах (хотя
и слабо, но все таки под-
вергающихся действию,
как серной, так и азотной
кислот), получаемая кис-
лота иногда содержит не-
которое количество же-
леза.
Кроме того, при добы-
вании азотной кислоты
по этому способу, масса
пенится и потому в дисти-
лят попадают брызги сер-
ной кислоты. Затем азотная
кислота под влиянием
серной, частично раала-
гается с образованием
низших степеней окисле-
ния азота, которые также
растворяются в азотной
кислоте, и переходят вме-
сте с ней в приемник.
Так как чилийская се-
- литра всегда содержит
поваренную соль, дающую
под влиянием серной кис-
лоты хлористый водород,
то в технической азотной
кислоте почти всегда за-
ключается и некоторое
количество соляной кис-
лоты.
— 149 -
Попадается а ней иногда под и мышьяк. Таким образом техни-
ческий продукт, полученный по этому способу, далеко не чист и не-
обходимы его очистка концентрация.
1 . Рис. 21. Аппарат Гутмана для сгущения паров азогной кислоты.
О
в
А . • ':
ЛЪ'- 'У
Существует несколько способов получения чистой азотной кис-
4оты: . '„/У / > > <
ггI) Продаэкная кислота, удельного веса 1,31, нагревается й стек-
.«.«?< jgg*“EL 1К°1°
I дщу1Ц|мвт в идла/кдсн"
................................................., 'Жбка В верхней
Йры. В это время
ййствора ля писа.
приемник и
___________ _____ w р’ пока в реторте оотанется лишь
небольшоеко¥иче^вожидкбо^|г.'ь
у
— 150 -
2) К продажной кислоте* прибавляется раствор азотнокислого
свинца, а затем хромово-калиевая соль.
Первая прибавка освобождает ее от серной и соляной кислот,
в случае, если они в ней4 находятся, а вторая обусловливает осво-
бождение кислорода, окисляющего нисшие соединения азота в азотную
кислоту. Полученную жидкость перегоняют, при чем первую и послед-
нюю порции погона отбрасывают.’
3) К продажной азотной кислоте, удельного веса 1,38, приба-
вляют 0,4 части воды (по весу) и по каплям приливают раствора
ляписа до тех пор, пока образуется еще муть.
После отстаивания жидкость сливается в стеклянную реторту,
туда прибавляется калиевая селитра; несодержащая хлора, и погон
собирают в охлажденном приемнике.
4) Если является необходимым лишь освобождение азотной кис-
лоты от двуокиси азота, последнее достигается при помощи пропуска-
ния через нее, при умеренном нагревании, тока воздуха или же угле-
кислого газа. Растворенные в азотной кислоте окисли азота можно
также удалить при помощи ее нагревания в течение некоторого вре-
мени с небольшим количеством чистого угля. Получающийся при
этом углекислый газ уносит с собой нисшие степени окисления азота.
После этого оставшуюся жидкость надо перегнать и дистилят собрать
в охлажденный приемник.
Полное освобождение азотной кислоты от нисших окислов,
узнается тем, что, после разбавления водой, она не дает окрашивания
от прибавления крахмала, содержащего иодистый калий.
Очень крепкую, (но все-таки не абсолютную) азотную кислоту >
можно получить, подвергая перегонке смесь равных об‘емов серной
и азотной кислот. Беря на одну часть азотной 5 частей серной кис-
лоты, получают дистилят, содержащий 90% взятой азотной кислоты
и уже не изменяющийся при новой перегонке с крепкой серной
кислотой.
Путем перегонки невозможно крепость кислоты довести более
чём до 98,7%, абсолютная же, 100% кислота, получается дробным вы-
мораживанием при температуре ниже—41е С в смеси жидкой угле-
• кислоты с эфиром.
В таком виде это есть снегоподобная масса, которая обращается
снова в желтоватую жидкость и, отчасти разлагаясь, образует кислоту
с содержанием 98,1% чистой азотной кислоты.
б) Вопрос о синтетическом получении азотной кислоты из воздуха
уже давно интересовал химиков всего света, но потребовалось со
времени знаменитого наблюдения Кавендиша (1781 год) более ста лет,
чтобы вопрос получил практическое разрешение.
Как известно, этот английский физик первый заметил, что при
пропускании электрической искры через воздух получается азотная
кислота. #
Известно, что при высокой температуре кислород соединяется
непосредственно с азотом, образуя окись азота но уравнению:
N2+ Оз 2 NO.
151
Реакция эта эндотермическая и обратимая, т. е. сопровождается
поглощением тепла и соединение азота с кислородом не полное:
реакция протекает до тех пор, пока между количеством окиси, азота,
кислорода и азотом не установится определенное количественное со-
отношение, что для данной температуры представляется величиной
постоянной, доказывающей наличность в этом случае химического
равновесия. Эти два обстоятельства крайне неблагоприятны для тех-
нического получения азота из воздуха.
Так в случае нагревания до 1811’ С количество образующейся
окиси азота равно 0,37% общего об'ема обоих газов. При 3000” только
3,57% смесь соединяется в окись азота, в действительности же выход
ее меньше, так как при охлаждении часть окиси азота снова раз-
лагается на элементы.
Таким образом, техническими трудностями являются: достиже-
ние и поддержание очень высокой температуры и быстрое охлаждение
реакционной смеси для предупреждения распада окиси азота. Раз
эти трудности превзойдены—получение из окиси азота азотной кис-
лоты, уже дело довольно простое: в присутствии воздуха окись азота
легко и полностью окисляется в двуокись, а последняя в присутствии
воды дает азотную кислоту, (а также азотистую), в присутствии же
окисей щелочных и щелочно-земельных металлов образует соответ-
ствующие селитры. Американец Бредлей и Лявежот впервые приме-
нили этот принцип, основав близ Ниагарского водопада в 1902 году
фабрику. Однако, .она просуществовала всего только два года.
Вторая попытка была произведена норвежцами Биркеландом
и Эйде.
В основе принят был тот же принцип, разница только была
в конструкции, электрических приспособлений, при помощи ко-
торых достигалась необходимая высокая температура. *
• Последнее время по способу Биркеланда и Эйде в Норвегии
готовилось много основной азотно-кальциевой соли известной
под названием воздушной селитры.
Так, например, еще год до войны оттуда вывезено 400.000 п.
воздушной селитры. Следует также упомянуть, что на том же
принципе основаны печи предложенные Шенгерром, Генсберюм,
Паулитом, Горбовым и Миткевичем.
Возможность неубыточно выделывать селитру по способу
Биркеланда и Эйде обусловливается наличностью дешевой водяной
силы.
в)' Другой принцип, на котором может быть основано получение
азотной кислоты из воздуха, состоит в том, что азот при высокой
температуре легко соединяется с металлами и металлическими кар-
бидами, и полученные соединения, под влиянием воды и водяного
цара, разлагаются с выделением аммиака, который так или иначе
0 окисляется в азотную кислоту.
В Германии Франк и Карро употребляли карбид кальция,
с которым азот при температуре 1000®С образует очень постоян-
U-.ЙЫЙ промежуточный продукт —цианамид кальция Са CN2, могу-
152 —
щий с одной стороны прямо итти на удобрение, с другой же-
лающий под действием водяного пара аммиак:
CaCN2 + С + 4H20 = 2NH8 + Са(НО)2 + 2 СО;
' г - t
на этом принципе в 1902 году была основана в Италии фабрика,
которая вырабатывала 800000 пудов кальция цианамида в год.
Третий принцип, позволяющий фиксировать атмосферный
азот в виде аммиака состоит в приготовлений нитритов, т.-е.
соединений металлов с азотом; Из нитритов для технического
образования аммиака имеет значение пока только алюминиевый
нитрит.
Последний получается путем нагревания смеси алюминия
с углем в атмосфере азота; получаемый продукт при кипячении
с водою отделяет весь связанный в нем азот в виде аммиака.
Первая фабрика, основанная на применении этого принципа, была
построена в Мюльгаузене в 1909 году, затем их построено было
довольно много в разных местах Южной Франции и Норвегии.
Все эти способы основаны на действии высокой темпера-
туры, наконец, Габер в Германии предложил метод прямого
соединения азота с воздухом, при котором Наличность очень вы-
сокой температуры не обязательна, а потому этот метод может
быть применен в местностях, не располагающих дешевой водяной
силой.
Реакция образования аммиака в данном случае также обра-
тима, но экзотермическая. Если при синтезе окиси азота хими-
ческое равновесие участвующих в реакции веществ, только при
очень высоких температурах устанавливается в Пользу азота
около 3% (при 3,000° С), то при образовании аммиака имеет
место совершенно обратное: при 1020° С—оно всего липй> 0,012%,
при 327’ С—2,72%, а при 27° С—98,51%. Казалось бы, что дан-
ные эти в высшей степени благоприятны для технического по-
лучения аммиака. Однако, на деле происходит нечто другое: при
низких температурах протекает реакция чрезвычайно медленно
и можно ускорить ее только путем нагревания, но само собой
понятно, что тогда реакция изменится не в пользу увеличения
выхода аммиака. Применяя в качестве катализаторов осмий, ру-
тений и уран и одновременно нагревая смесь газов до 650’—700° С,
можно значительно ускорить синтез. Однако, при этих условиях
предельный выход все же не более 0,2%, что следует признать
недостаточным, так как выходы аммиака повышаются с увели-
чением давления, техника утилизировала эту зависимость и в
1912 году в Германии основана была первая фабрика производ-
ства аммиака по способу Габера, выделывающая около 3.500.000 п.
сернокислого аммония. Полученный тем или иным путем аммиак
может быть превращен ,в азотную кислоту при помощи окисле-
ния его атмосферным воздухом в присутствии платины, играю-
щей здесь роль катализатора; схематически • реакция идет по
уравнению:
NH3 + 40 = HNO3Н2 О.
В сущности на этом деле не ограничивается: при более продол-
жительном соприкосновении газовой смеси с платиной наступает раа-
ложение азотной кислоты с образованием воды и выделением свобод-
ного азота.
Чтобы избежать этого, время контакта газовой смеси с платиной
ограничивают 0,01 секунды. Самая кислота (53%) получается охла-
ждением реакционной смеси в особых камерах. Попытки заменить
платину другими более дешевыми катализаторами (перекисью мар-
ганца, перекисью свинца, ор ислам и железа и серебра и т. п.) пока
не привели к практическим результатам.
г) При приготовлении пироксилина применяется обыкновенно
азотная кислота крепостью 48,1’,—48,5° Вё, содержащая 94,09%—97,5%
гидрата азотной кислоты.
Удельный вес такой кислоты 1,498—1,508, причем наибольшее
содержание в ней азотноватого ангидрита допускается 1,5%.
В технике взрывчатых веществ применяется иногда красная дымя-
щаяся азотная кислота; это — обыкновенно крепкая азотная кислота,
содержащая окислы азота: N2O3, N2O4 и NO. Она обладает чрезвы-
чайно 'сильно развитыми окислительными свойствами, воспламеняет
РН3, H2S, HJ. Органические вещества, подобные соломе, опилкам и
т. д. под ее влиянием также воспламеняются. Гигроскопична и дымит
на воздухе. А
Если к кислоте мало-по-маду прибавлять воду, то она принимает
сперва зеленоватое окрашивание, переходящее при дальнейшем при-
бавлении воды затем в голубоватое и, наконец, при дальнейшем раз-
бавлении водой жидкость обесцвечивается. Концентрированная серная
кислота также обесцвечивает красную дымящуюся азотную кислоту.
Существуют несколько способов приготовления дымящейся азот-
ной кислоты, при чем чаще всего в лабораториях ее готовят перегоняя
в реторте смесь 1001 частей азотной кислоты, З1/? частей крахмала и
100 частей концентрированной серной кислоты. Смесь должна запол-
нять не более третьей части реторты.
Содержание дымящей азотной кислотах определяется при помощи
титрирования хамелеоном (КМ-п О,).
Продолжительное пропускание через кислоту углекислого газа
освобождает ее полностью от растворенных в ней окислов азота.
Крепкая красная дымящаяся азотная кислота имеет удельный вес
1,56. Химическое действие ее резко и сильно, несколько отличаясь
от действия обыкновенной.
Сама кислота взрывчатыми свойствами не обладает^ но непосред-
ственно входит в составы Шпренгеля.
д) Водные растворы азотной кислоты и ее солей обесцвечивают
при нагревании (или окрашивают в желтый цвет) раствор индиго-
кармина.
Азотная кислота в присутствии серной дает от кристалика желез-
ЖрГб купороса темнобурое кольцо.
Если в азотную кислоту опустить несколько шариков металли-
WSplib®. ртути или медных опилок или проволоки, а затем прилить
ЛИЙ^ЙНТрированной серной кислоты, то при подогревании развиваются
Мрасщо-бурые пары окрашивающие в синевато-фиолетовый или пур-
пурно-красный цвет бумажку, напитанную крахмалом и смоченную
раствором йодистого калия. Бруцин в присутствии серной кислоты
окрашивает азотную кислоту в оранжево-красный цвет. Азотная кис-
лота/ в Присутствии серной окрашивается раствором серно-кислого
анилива в сине-фиолетовый цвет. Дифениламин» растворенный в соля-
ной кислоте, окрашивав азотную кислоту в присутствии серной в
синий цвет. Фенол, растворенной в крепкой серной кислоте, после
разбавления полученной жидкости двумя об'емами воды, в соприкос-
новении с кристаликом азотно-кислой соли, дает буро-красные окра-
шивания. ' ,
Чистая азотная кислота должна быть безцветна и не оставлять
никакого твердого остатка при выпаривании ее на платиновой пла-
стинке. Азотная кислота сильно разбавленная водой, не должна
мутиться при прилитии раствора ляписа или хлористого бария (отсут-
ствие хлора и серной кислоты); отсутствие азотной кислоты узнается
по неизменяемости цвета раствора марганцево-кислого калия и отсут-
ствию окрашивания иодо-цинкового крахмального клейстера (реактив
Тромсдорфа). Присутствие железа в ней может быть обнаружено
i
Рис. 22. Получение калийной селитры в Индии.
посредством роданистого калия. Для обнаруживания иода склянку
наполовину наполняют испытываемой кислотой, насыщают содой, при-
бавляют к жидкости немного серной кислоты и дымящейся азотной,
а у самой поверхности прикрепляют крахмальную бумажку. В присут-
ствии иода последняя, спустя некоторое время, окрашивается в синий
цвет.
При количественном анализе азотной кислоты берут ее 10 куби-
ческих сантиметров и вливают в холодную воду, доводя об'емжид-
кости, до 100 куб, сантиметров; от этой жидкости берут определенный
об'ем ее и титруют щелочью в присутствии лакмуса, как индикатора.
Существуют между прочим другие весовые способы анализа, осно-
ванные на дозировании Сернокислого бария, но об‘емный метод
проще.
е) Из солей азотной кислоты селитры или соли щелочных и
щелочно-земельных металлов имеют самое широкое применение в
деле приготовления взрывчатых веществ и пиротехнических составов,
играя роль сжигающего вещества. Азотнокислые соли тяжелых метал-
лов (свинца, меди, ртути и пр.), хотя тоже иногда применяются в
рассматриваемой нами области, но гораздо реже, играя роли веществ
второстепенного значения.
. _ I. KNOs встречается в природе довольно
1. Мзотнокалиевая «оль или r г
редко ив малых количествах, входя в состав почв,
” из которых она в прежнее’время местами и добы- .
валась (Индия). (Рис. 22).
Состав натуральной чилийской и индийской селитр, по Marchall'ro,
таков:
7 В 100 частях селитры содержится: Чилийская селитра. Индийская селитра.
Сырая. Очищенная. Промытая #
Азотно-кислого натрия.. . . 94 20 — 1
Азотно-кислого калия .... 1,51 68,40 90,70 94,91
Хлористого натрия .... 1,06 17,98 5,40 3,12
Йодистого натрия 0,01 1 ——
Хлористого калия . . . . • • 0,26 —— > -
Сернокислой магнезии . . . 0.26 — — * < -
Хлористого магния ..... 0,32 —
Сернокислого кальция . . . 0.07 — * 1
Нерастворимых веществ . . . 0,1$ 1.70 0,30 0,20
Воды .... 2,15 3.80 1 ’ ' ——*
Азотнокислого кальция . 2 60 — — ч
АзотнокисЛ®®*ыагния . . . 2,12 " —
Сернокислого натрия .... 3 40 0,91 0,03
100,00 100,00
В настоящее время KN03 получается почти исключительно искус-
’ ственно. С этой же целью еще не так давно пользовались так называемыми
селитряницами, которые в настоящее время уже почти совсем оста-
влены, уступив место заводскому способу приготовления этой соли
из чилийской селитры при помощи процесса двойного разложения
последней с поташом или хлористым каЛием по уравнению:
Na^Oa+KCi = KNOs + NaCl*). ‘
• i
♦) Хлористый калий поступает на рынок преимущественно из Стасфуртских соля-
ных месторождений, частью же из Мюльгаузена.
Небольшое количество калиевой селитры добывается также из богатых
калиевыми солями, отбросов свеклосахарного производства.
Добытый тем или иным путем сырой продукт очищают при помощи
повторной Кристаллизации, доводя технический продукт до содержа-
ния в нем 95% KNO».
/и о
Для калиевой селитры перекристаллизация сильно облегчается
-большой разницей растворимости этой соли в воде при разных темпе-
ратурах*). В спирту калиевая селитра нерастворима. Чистая кали-
евая селитра практически не гигроскопична примесь же хлоридов и
других нитратов оказывает в этом отношении вредное влияние. После
двухкратной очистки перекристаллизацией из насыщенного раствора
количество примесей уменьшается до 1%. Однако, для целей приме-
нения селитры в процессах приготовления взрывчатых веществ, тре-
буется селитры горазда более высокой степени чистоты: содержание в
них хлористого натрия должно быть меньше 1:10.000, Кроме того ка-
лиевая селитра, заключающая перхлораты и хлористый калий, при-
обретает сильно повышенную чувствительность к ударам и потому во
•Франции требуют, например, чтобы калиевая селитра, идущая на изго-
товление черного пороха, не содержала бы больше 0,001 перхлоратов
•и 0,0001 хлористого калия. Такая высокая степень чистоты продукта
достигается при помощи рафинирования селитры. Процесс этот основан
также на кристаллизации насыщенного раствора, отличаясь только
деталями и некоторыми операциями вспомогательного назначения
(добавление клея, снятие пены, отстаивание и пр.).
Калиевая селитра кристаллизуется в безводных длинных, . по
бокам бороздчатых, ромбических 6-ти гранных призмах, заканчива-
ющихся такими же пирамидами. Соль бесцветная, характерного про-
• &
*) В нижеследующей табличке заключаются данные, касающиеся степени ра-
створимости в воде хлористых солей и нитратов калия и натрия.
* *
100 весовых частей воды растворяют
весовых частей солей:
При 10°С. При 100°С. При 115°С.
КС1 32 57
Na (Т Й5,7 39,6
Va NO3 78 178 205
KNO3 22 246 332
I) В нижеследующей таблице показаны количества влажности (в процентах,),
поглащаемой различными нитратами при нахождении их в течение 120 часов под
стеклянным колпаком в насыщенной парами воды атмосфере:
KNO3 Поглотила 0,02% Н2О.
Ba(NO3)2 „ 0,04„ я
Na NO. „ 0,30 „ „
Pb (NO3)2 . 3,51 „ „
Sr (NO.,), , 14,27, „
NH,NO3 „ 38,3 , ,
Ca (NOg), , 81,7 „ .
II) Технически чистый продукт содержит обыкновенно от 3—5°/0 хлористого
натрия я небольшое количество хлористого калия.
МШого вкуса. При нагревании до 339°С., она плавится в
МЙйо бесцветную жидкость. При обыкновенной температуре в
Ерйвиде мало деятельна, при возвышенной же, наоборот, дей-
Цткак весьма сильный окислитель, легко отдавая свой кислород.
Ийенная на расколенный уголь, селитра вызывает его быстрое
Йние:
4 KNO3 + 50 = 2 К2СО3 3 С02 + 2 N2.
- г »
Подобное же явление имеет место при натревании калиевой селитры
с серой до температуры 432°С.:
2 KNOS + 2S - K2SO4 4- N2 + S02.
ч
На этих двух реакциях основано применение селитры для изготовления
черного пороха.
Растворение калиевой селитры в воде сопровождается сильным
поглощением тепла, отчего ее применяют также в охладительных
смесях. Так, например, при растворении в 100 весовых частях воды
16 весовых частей калиевой селитры производят понижение темпера-
туры с 4-13,2’0. до 4"3°С.; еще большее понижение температуры
наблюдается при растворении смесей калиевой селитры с аммиачной,
роданистым—и аммонием и калием*).
Лабораторным путем калиевая селитра чаще всего получается
посредством нейтрализации азотной кислоты поташом. /
В продажной чаще других встречаются примеси известковых и
магнезиальных солей (конечно, не считая натриевых); их можно уда-
лить путем прибавления углекалиевой соли. Дальнейшую очистку
производят кристаллизацией маточных растворов. *
Растворы калиевой селитры не должны обнаруживать никаких
видных изменений от прилития аммиака, щавелевокислого и серно-
кислого аммония, а также при пропускании сероводородного газа в
подкисленную соляной кислотой жидкость. Ни Сероуглерод, ни хлор-
ная вода не должны вызывать в растворе калиевой селитры никакого
окрашивания. /
Калиевая селитра входит в состав очень многих, как взрывча-
тых веществ, так и пиротехнических смесей.
2. п.пОз или натро- Азотйстые вещества, медленно окисляясь в почве
вая (чилийская) се- в присутствии щелочей, образуют селитру — таким
литра. путем образовалась и натриевая (чилийская) или куби-
ческая селитра. Почти вся натриевая селитра, поступающая на миро-
вой рынок, доставляется провинцией Тарапака в Чили.
•) Например, при растворении 22 частей калиевой селитры и 98 частей рода
нистого аммония в 100 частях воды температура падает с + 25®С до — 13,8°С, а при
посыпании 100 частей снега смесью 2 частей калиевой селитры и 112 частей рода-
нистого калия, температура понижается до — 34,1°С.
Технический продукт, поступающий в продажу, после высуши-
вания его при 100° С, имеет в среднем нижеследующий химический
состав:
* II *
NaNOs— 94,290%
NaCl — 1,990%
Н2О— 1,993%
K2SO4— 0,239%
KN03— 0,426%
Mg(NO3)2— 0,858%
Остатка*) — 0,303%
„ Хотя разность в степени растворимости натриевой селитры в
холодной и горячей воде также весьма значительна**), но некоторые
примеси удерживаются ею довольно упорно, а потому стоимость
очистки натриевой селитры значительно дороже, чем калиевой. В
частности, получение ее в столь высокой степени чистоты, какая
требуется от калиевой селитры при применении ея в фабрикации
взрывчатых веществ, и не стараются достичь, ибо даже ее высокая
очистка от примесей не устранит главного недостатка, присущего
натриевой селитре—гигроскопичности.
Если бы натриевая селитра не обладала этим вредным недостат-
ком—несомненно, она в большинстве случаев с выгодой заменила бы
калиевую: при равных весах, в натриевой селитре на % кислорода .
больше нежели в калиевой, стоимость же ее много ниже, чем калие-
вой селитры, количество же каллорий, освобожденных обоими препа-
ратами1, почти одинаково. Таким образом, при равных весах, напри-
мер, порох с натриевой селитрой даст большее количество газов
нагретых До более высокой температуры, чем соответствующий порох
с калиевой селитрой, а потому был бы выгоднее последней.
Развитое до высокой степени 'свойство гигроскопичности натрие-
вой селитры вынуждает, в случае ее применения, прибегать к раз-
ным способам устранения доступа к ней воздуха: герметической уку-
порке, упаковке патронов в непроницаемую для воздуха бумагу
(восковую, пропарафиненную, иногда пергаментную и т. п.) с тща-
тельной заливкой подобных оболочек парафином, воском и другими
веществами, преграждающими доступ воздуха, и, наконец, к вве-
дению в состав^ взрывчатых веществ специальных обволакивающих
средств, препятствующих доступу воздуха к частичкам соли.
Пробовали ослабить вредное влияние гигроскопичности добав-
лением к натриевой селитре обезвоженной глауберовой соли, тако-
вой же магнезии, поваренной соли и проч., но без особого успеха.
В тех случаях, когда ее употребляют на практике, ее тщательно
измельчают, просеивают и сушат в железных сосудах, причем она
теряет от 10 до 14% своего веса, после чего все-таки сохраняет около
4% влажности.
*) Гипс, иодистая соль, землистые вещества и пр.
*•) В спирту натриевая селитра ие растворима-
применение в технике, осо-
VtVCH»
1
•ш
Я
7''
в 100 частях воды в зависимости от температуры последней
54 + 0,611;
в градусах Цельсия.
селитра имеет обширное
Pt; приготовления азотной кислоты и калиевой селитры.
ДОйытании технического продукта, обыкновенно ограничи-
1) определением влажности, 2) процентного содержания не-
цМмых веществ, 3) количества хлора—при помощи титрован-
рмягвора азотно-серебряной соли и 4) наконец, серной кислоты
Цдством хлористого бария. Остаток принимают обыкновенно за
натриевую селитру.
шачиая се-
литра.
NHjNO3 получается насыщением аммиака приба-
вляемой по каплям азотной кислотой или растворени-
ем в последней углекислого аммония. Получаемый
(створ, выпаривается до 33° Вё, после чего кристаллизуется и отде-
ляется от маточного раствора.
Аммиачная селитра принадлежит к числу солей, не содержащих
(Йсталлизационной воды; она безцветна, без запаха и имеет особый
Лфохладительный вкус. Эга соль весьма растворима в воде*), так,
(йщример, в 100 частях холодной воды растворяется 200 частей
Цммиачной селитры, в горячей же гораздо больше; в спирту она так-
if, растворима, но значительно меньше, чем в воде, а именно — одна
Цйеть соли растворяется в 20 частях спирта. Растворение аммиачной
|ЙКвтры в воде сопровождается сильным поглощением тепла и, следо-
отельно; падением температуры (до--13,6"С.); в смеси ее со снегом
риометр падает до—16,7ь°; при растворении в воде смеси аммиачной
литры с роданистым калием или аммонием, можно достичь—30°С.
Холода. .
г’ При 160° С. аммиачная селитра плавится, а при 180° С. наступает
|яке ее разложение. При нагревании смеси аммиачной селитры с сер-
кислотой до 100° С. выделяется азотная кислота и в растворе
случается сернокислый аммоний, при 160° 0. происходит выделение
жиси азота. Таким образом в первом случае серная кислота отни-
St аммиак, во втором же воду. Под влиянием щелочи раствор
миачной селитры выделяет аммиак.
^Чистый азотно-кислый аммоний должен обладать следующими
1ствами: 1) при нагревании, на платиновой пластинке должен
Ностью улетучиваться, не оставляя никакого остатка. 2) Раствор
будучи подкислен соляной кислотой, не должен давать никакого
даже мути с хлористым барием и, в присутствии азотной
не изменяться под действием раствора ляписа. 3) При при-
K раствору аммиачной селитры магензиальной смеси и ам-
। должно появляться осадка, даже при продолжительном
створа. 4) Раствор аммиачной селитры не должен претер-
кого видимого изменения под действием серо-водорода,
нистого и щавелевокислого аммония. 5) При выпарива-
ЮЙ бане одного грамма аммиачной селитры с несколь-
азотной кислоты, осадок должен сохранят^ свой белый
&
;#j
?'Л'- • 1>. ’’ Г . '* ’?•'•' • ”7 • . *" .'
— 160 —
/
цвет, не получая никакого цветного оттенка. Преобладающей и наи-
более обыкновенной примесью является серная кислота.
Сама по себе соль представляет уже взрывчатое вещество, но
вызвать ее детонацию могут только или весьма быстрое нагревание
•до 230°С., или очень сильный удар. При нагревании до 180°С. амми-
ачная селитра разлагается и выделяет закись азота (Na0), что же
касается явления взрыва, то в этом случае разложение идет различ-
ными путями и, в зависимости от обстоятельств, могут получаться:
азот,' кислород, двуокись азота (NO,) и окись азота (NO). Вопросом
этим много занимался Бертело, который показал, что разложение
аммиачной селитры может следовать по четырем формулам.
При взрыве мы, главным образом, имеем:
NH4NOs - N,.+ 0 + 2Н20;
причем отделяется 30,7 единиц тепла.
Теоретические взрывчатые’ данные для аммиачной селитры вы-
ражаются нижеследующими числами:
f = 4§94 килогр.
v0 = 916 литров
t° = 1051° С.
а = 0,9761*)
Из обыкновенных взрывчатых веществ аммиачная селитра раз-
вивает, таким образом, самую низкую температуру при взрыве (в этом
отношении ее превосходит только нитрогуанидин, для которого эта
данная равна 907° С., что имеет большое значение для веществ анти-
гризутных (называемых тоже „предохранительными" ^или „безопас-
ными"), при изготовлении коих она находит себе большое применение.
В отношении своих сжигательных способностей. аммиачная се-
литра обладает очень выгодными свойствами:. содержа 6О°/о кислоро-
да, она допускает возможность вводить болыпде количество сгораю-
щего начала, превращаясь нацело в газообразные продукты взрыва,
образуя большое количество газов, не содержащих окиси углерода
(что очень важно в применении ее в рудниках).
Наряду с этими важными преимуществами, соль эта обладает
крупными недостатками, ограничивающими часто на практике ее при-
менение, а именно:
*) В последующем изложении будут обозначаться через:
f = теоретическая сила взрывч. вещ. т. е. то давление, которое развивает
один килограмм взрывчатого вещества в об*еме одного литра, считая, что газ сле-
дует законам Мариотта и Гей-Люсака.
v0 = об‘ем газов, развивающихся при взрыве, приведенный к 0 градусов и
760 мм. давления.
р = температура газов при взрыве.
«с = Коэффициент равный
р — работа.
а потому
укупорки.
от капсюля;
4) цена ее-ср:
В качестве?^
\ 1) Как уже говорилось, она- сильно гигроскопична,
препараты, ее содержащие, требуют или герметической
или применения воска, парафина и других изолирующих от сырости
веществ, или введения в состав взрывчатого вещества специальных
обволакивающих; ч <
2) при хранении она медленно разлагается, выделяя свободную
азотную кислоту, что не совсем безопаснов” смесях, в которых содер-
жатся нитропроизводйые, д род?- .цйт^ц^ериш или пироксилина;
3) она сравнительно сWRMk полностью детонирует
от капсюля; ' •' - .
ВЖ-•
вещества не приме*
_____... ...... .взрывчатых веществ:
„предохранительных* (антигризутных) дйнамитов, смесей типа-соста-
йрвАфЙЙ и Других антиЕризутных взрйвчатых составов, смесей
нитропроизводных' ароматического ряда с нитроцелуллозами, мукой,
пикратами, креэилатами, нитроглицерином, нафталином и его про-
изводными и т. п.
Метод анализа аммиачной селитры одинаков с анализом других
аммиачных солей: выделяют аммиак при помощи едкого калия, погло-
щают газ при помощи избытка титрованной кислоты, после чего сво-
бодную оставшуюся кислоту дозируют обратным титрованием. Способ
этот разработан Моором Фрезениусом.
Бариевая селитра есть безцветная кристалличе-
4.Бариевая селитра. ская соль> содержащая четыре частицы криетализа-
ционной воды. Химическая формула ее Ba (NO3) 2 + 4Н2О. На воздухе
не изменяется — практически она не гигроскопична. В холодной воде
.растворяется .весьма мало; так, например, 100 частей воды при 0°@
растворяют всего лишь 5,2части бариевой селитры, при 100° значи-
тельно больше, а именно34,8 частей. В спирту соль эта нерастворима.
Раствор бариевой селитры не должен мутиться при прибавлении
раствора ляписа, должен быть совершенно нейтральным, не давать
осадка с сероводородом и сернистым аммонием. Серная кислота дол-
ЙЙк нз него количественно осаждать весь барий и отфильтрованная
|Вшкос£ь, после выпаривания на платиновой пластинке, должна уле-
ШНймвдя без. остатка.
^МНвЫ^Й^ и&калена, сперва растрескивается, а затем разлагается,
^^В^КмКкгёрбд: азот л азотистые пары, оставляя, наконец, твердый
J*
И ;
> V j /_? \
W?Si
jgag 4-i(Wv v- *<> ч^ /1-Ж| j
Jr t L. * * \'H JSy 1 6 %
ся при помощи двойного разложения
давбрОМ селитры или обработкой кон-
jMifW. n^M растворения
кислоте.
|Ц^Ц^|^4£г' Т^ёов0му определению
ржекислой соли
to. сернокислой
V:' ' \
' ’'А- '
препарате встречается
а
В
I * Проф. М. Сухаревский. Взрывчатые вещества и взрывные работы.
И
Так как азотно-бариевая соль имеет сравнительно с селитрами
щелочных металлов больший вес молекулы, то применение ее не
так выгодно, ибо, при равных весах, приготовленный из нее порох
• дает меньший об'ем газов, имеющих к тому же более низкую темпе-
ратуру. Недостатки эти отчасти компенсируются тем обстоятельством,
что разложение ее при взрыве совершается хотя более медленно,
но очень правильно и хотя она и дает много нагару, но мало пор-
тит оружие. По этим то причинам ее иногда применяют в порохе и
взрывчатых веществах. Свойство бариевых соединений окрашивать
пламя в зеленый цвет обусловливает применение ее в пиротехнике.
5 С н ев я се- з)а + 422^0 или стронциевая селитра'
тронциевая се- СХОдНа с бариевой по наружному виду и кристалли-
пит₽а" зуется, также как и она, с четырьмя частицами воды.
Метод ее получения—путем действия азотной кислоты на угле-
кислый стронции (таким же образом может быть получена и бари-
евая селитра) или растворением хлористого стронция в азотной кис-
лоте. 100 частей воды растворяют при 0е 40 частей азотно-кислого
стронция; горячая же вода,его растворяет много больше, так, на-
пример, насыщенный раствор ее при 108° С. содержит 103 части
стронциевой селитры. В спирту она не растворима.
Азотно стронциевая соль сильно гигроскопична, обладая этим
свойством в гораздо более сильной степени нежели даже натриевая,
но уступая известковой.
При накаливании азотно-кислого стронция получается в ре-
зультате окись стронция. Чистота стронциевой селитры обыкновенно
узнается путем прибавления к раствору ее кремнефтористоводородной
кислоты, причем не должно быть помутнение жидкости. Так же
точно жидкость после выделения из нее обыкновенном путем азотно-
кислого стронция не должна давать осадка с аммиаком и углекис-
лым аммонием
В применении к выделке из нее взрывчатых веществ, благо-
даря еще более высокому молекулярному весу, чем бариевая се-
литра—стронциевая селитра имеет следовательно те же недостатки,
проистекающие из высокого частичного веса, но реакция ее разло-
жения при взрыве протекает постепенно и столь же правильно, как
у бариевой.
Сравнительно небольшие запасы соединений стронция в при-
роде в том виде, в каком они могут быть использованы для надоб-
ностей техники, составляют также причину редкого ее применения
для Приготовления взрывчатых веществ1)
Чаще пользуются ее свойством окрашивать пламя в ярко-крас-
ный цвет и потому/ она себе находит широкое применение в пиро-
технии, входя в состав красного огня (д этом отношении она, однако,
уступает солям лития),
6. Кальциевая 6. Если бы не чрезвычайная гигроскопичность,
селитра. • то по причине своей дешевизны кальциевая селитра
Са (NOs)2 нашла бы себе во многих случаях применение в технике
») Все таки она входит в качестве сжигающего в так называемом денсите.
расплываться на
приготовления взрывчатых смесей, но ее
всякую возможность ее
.'и ’WAv1 .ч _.
свойство
использовать с этой целью.
7. Азотнокислый евимец РЬ бесцветная, кри-
сталлическая соль, удельного веса 4,58. Получается пря-
мым растворением металла или глета в азотной кислоте.
ЙвЙг сильном нагревании она разлагается, выделяя двуокись азота
'^^Йсдород, превращаясь в глет. В 100 частях холодной воды раство-
"'ЫгетсЯ при 10°С. 48 частей ее, в кипящей же воде (при 100°С.)—139
^Йстей соли. Азотнокислый свинец растворяется также в щелочах.'
Способен детонировать и применяется во взрывной технике,
входя в состав бельгийских макаритов. При взрыве дает большое
количество газов. Применяется также в составах вспомогательного
назначения. Главный недостаток — гигроскопичность.
6. Нитрат олова и
азотно-кислая амми- Здесь можно упомянуть также о нитрате олоса
ачная медь. w азотнокислой аммиачной меди.
Первый взрывает от сильного толчка и быстрого нагревания,
образуя большое количество газов; практического применения не
имеет, но случайное образование этой соли при соприкосновении
луженых металлов с некоторыми азотнокислыми солями, разложение
которых может дать место выделению паров азотной кислоты, в при-
сутствии значительной влажности, может представить'опасность воз
(кновения случайного взрыва.
Аммиачный нитрат меди не чувствителен к толчкам, но дето-
^яирует от капсюля гремучей ртути. Теоретически вычисленная тем-
пература взрыва этой соли довольно низка, потому казалось бы она
могла бы быть применена в связи с аммиачной селитрой в анти
гризутных составах, но сильно ядовитые продукты взрыва, исклю-
чают возможность подобного применения ее.
• Азотнокислые соли вообще сравнительно легко отдают свой
Кислород и потому некоторые из них, как, например, Ляпис и азот-
-покиелая медь с выгодой могли бы применяться для изготовления
взрывчатых веществ, но первый дорог, а вторая, как сказано, обра-
зует при взрыве очень ядовитые газы.
Как сказано было выше, азот, помимо своих
й|г:6. Азотистая сера, кислородных соединений, имеет некоторые другие
fc производные, представляющие интерес для техно-
яшчш взрывчатых веществ. Так действуя сухим аммиаком на хло-
ЯЙЙую серу:
О,к
Gj
®йа получил кристаллическое вещество желтого цвета, сильно
ажающее обоняние и глаза, имеющее состав N2S2 и названное
серой. При растирании ее с твердыми телами она сильно
Ййт, при накаливании сперва плавится без разложения, а при
Йдает взрыв. По характеру взрыва азотистая сера напоминает
M© ртуть, хотя несколько слабее последней.
|д&Тистая сера не растворима в воде, мало растворима в спирте,
' Юуглероде. Действуя хлороформовым раствором’хлористой
41*3
— 164 —
серы на азотистую серу, получают желтый, кристаллический продукт
ее замещения, обладающий сильно взрывчатыми свойствами^
Азотистый селен обладает свойствами, сходными с соответст-
вующим соединением серы. ' Л
„ , _ 1. Хлористый азот N6I3. Это есть продукт мета-
* к лепсии в аммиаке водорода хлором. Он открыт Дю-
изводные азота. лонгои и представляет маслянистую жидкость желтого
цвета, удельного веса 1,65, кипящую при 71 °C. и разлагающуюся при
97® на свои компоненты. Соприкосновение с фосфором, терпентинным
маслом, резиной и т. п. дает взрыв столь иногда сильный, что от
малой капли хлористого азота пробиваются толстые доски. По иссле-
дованиям Девилля и Готфейля, при взрывчатом разложении хлори-
стого азота выделяется 38.Q00 калорий.
Безопасно можно демонстрировать получение этого взрывчатого
вещества, разлагая гальваническим током слабо-нагретый раствор на-
шатыря; при этом хлористый азот получается на положительном
электроде в виде маленьких шариков, которые подымаются вверх.
Если на поверхность нашатыря налить немноТо терпентинного масла,
то капельки хлористого азота, придя в соприкосновение со скипида-
ром, тотчас же взрываются.
Для приготовления хлористого азота в .чашку, наполненную на-
шатырным спиртом, подогретым до ЗО°С, опрокидывают горлом вниз
стеклянную колбу, наполненную хлорным газом. Тотчас происходит
поглощение хлора1 аммиаком и образование хлористого азота в виде
маслянистой жидкости, которую лучше всего собирать в свинцовую
чашечку. . . •
Еще лучше, в смысле безопасности, поступать следующим обра-
зом: горло воронки опускают в чашку со ртутью, Й. в самую воронку
сперва ’наливают насыщенный раствор поваренной соли, а, поверх
последнего, раствор нашатыря в 9 частях воды. После этого пропус-
кают хлор. Образующиеся в нашатыре капельки хлористого азота
тотчас же са^и опускаются в раствор хлористого натрия. Hentschel
получал раствор хлористого азота в бензоле следующим образом:
раствор белильной извести СаС1аО2, осторожно смешивается с таким
количеством соляной кислоты, чтобы раствор нашатыря не давал га-
зов, и тогда прибавляют растворы нашатыря и бензола—при осторож-
ном взбалтывании; при этом образуется хлористый азот, который
тотчас же и растворяется в бензоле, причем этот раствор всплывает
на поверхность. В таком виде он безопасно сохраняется (Менделеев).
Из всех взрывчатых веществ это бесспорно самое опасное в обра-
щении: при сотрясении и легком соприкосновении с некоторыми телами,
а иногда без всякой видимой причины, хлористый азот взрывает с боль-
шой силой.
2. Йодистый азот UHJ8. Это есть тоже продукт металепсии ам-
миака, как и хлористый азот. Он представляет твердое тело темно-
коричневого цвета, чрезвычайно взрывчатое. Может быть получен
лабораторным путем, обливая измельченный порошок иода аммиаком,
или ate вливая в аммиак спиртовый раствор иода. В обоих случаях
получается темно-коричневый осадок йодистого азота, причем реакция
. следует уравнению:
'' 3NH3+2J2=2NH.1J4-NHJ2
.V.
Если его собирать на фильтр, промыть водою и, разодравши
фильтр на части,- высушить, то при малейшем прикосновении каким-
либо твердым телом (хотя бы бородкой пера) к иодистому азоту, по-
следний взрывает с большой силой.
Силою взрыва он не уступает хлористому азоту и почти столь же
опасен в обращении, как и последний. '
Состав йодистого азота не постоянен, при избытке воды полу-
чается повидимому также и NJg. (Менделеев).
Азотистоводородная кислота HNS представляет бес-
§ 8. Пютистово- цветную, прозрачную, пахучую жидкость, обладающую
тМщ/и азиды* ядовитыми свойствами. Она смешивается с водой и спир-
z том, кипит при 37°С., а при прикосновении с накален-
ны» телом взрывается. Она открыта в 1890 г. Т. Куртиусом и полу-
чена вводного из производных бензола, а именно C0H5CONS.
f;. Соли этой кислоты называются азидами-, многие из них обла-
гает сильно-взрывчатыми свойствами, напомйная гремучую ртуть.
Ймты приготовления из некоторых из них капсюлей дали очень хо-
^Ййие результаты и возможно, что они войдут в технику взрывча-
то, веществ в качестве первоклассных возбудителей взрыва. Они бу-
Йт. более подробно рассмотрены далее.
£
жЛ.
fe'" /
aKfciPM' *
Фосфор, мышьяк и кислород.
технологии
и мышьяк
Из металлоидов 5-й группы, помимо азота, в
_ давчатых веществ имеют некоторое значение фосфор
ЦЙЙдедний в виде мышьяковистого водорода). Из металлоидов же
группы все большее значение приобретает кислород, вследствие
^дочжгольного роста применения так называемых оксилитовых пре-
• 'Ф *оо В технике взрывчатых веществ имеет применение только
о«рор. краеный фосфор, да и то весьма ограниченное. Это есть
аснобурое, порошковатое, непрозрачное вещество, удельного веса
^jga воздухе не окисляется ,и не ядовит, от трения не воспла-
гается. Плавится при температуре около 630°. В сероуглероде не
кЩрИмен^ется в спичечном производстве и для дымовых смесей.
ННмг электрических запалов, предназначенных для токов малого
применяют иногда полуфосфорнокислую медь Cu8POt.
^ИвКвйДородистый фосфор РН8—довольно постоянный, бесцвет-
|ИИм&Счайно ядовитый газ, с чесночным запахом, мало раство-
римый в воде. При большом охлаждении он сжижается. Получается
путем нагревания крепкого раствора щелочи с 'фосфором. Трехводо-
родистый фосфор взрывается от капсюля с гремучей ртутью.
Применялся германцами в Европейскую войну в химических
• снарядах.
$ з Мышьякови- Мышьяковистый водород AsHg—горючий, бесцвет-
* ' ‘ “ * ный газ> с чесночным запахом, при 50° сгущающийся
стыи в д р д. в подвижную жидкость. Он мало растворим в воде
и так же, как и PH,, в высшей степени ядовит.
Получается действием воды на сплав мышьяка с натрием.
Он применялся в Европейскую войну германцами также в хими-
ческих снарядах, действовавших „эманацией". Подобно трехводоро-
дистому фосфору, взрывает от капсюля с гремучей ртутью.
4 Ки л о Кислород в чистом виде имеет применение лишь в спа-
э . ислород. сдельных аппаратах для отравленных газами.
Жидкий воздух, не обогащенный кислородом, представляет из
себя жидкость, несколько более легкую, нежели вода, но обогащенный
кислородом, как то имеет, например, место после некоторого улетучи-
вания азоТа, делается несколько-тяжелее воДы, приобретая голубова-
тый цвет.
Порошковатые: древесный уголь, вата, лигнит, кизельгур, смо-
ченный керосином и т. д., обмокнутые в жидкий воздух, делаются
сильно взрывчатыми.
Озон Оз. Этот газ представляет особое аллотропическое состоя-
ние кислорода—специальное его, более энергичное, химическое со-
стояние. При быстром сдавливании и нагревании он взрывает, пре-
вращаясь в кислород, тоже имеет место у ожиженново озона при
резком уменьшении давления или при нагревании.
Озон по’лучается при помощи специальных приборов—озонизато-
ров, вырабатывающих его посредством тихих электрических разря-
дов.
Озон представляет газ с характерным запахом, отчасти напоми-
нающим запах раков. По своим свойствам Озон во многих отношениях
существенно отличается от кислорода. Он обесцвечивает индиго, лак-
мус и другие краски, окисляя их. Серебро он окисляет при обыкно-
венной температуре (оно чернеет). Сильно поглощается ртутью, пере-
ходящей при этом в окись; многие низсшие степени окисления пе-
реходят в высшие (напр. сернистая кислота обращается в серную, за-
кись азота—в окись, мышьяковистая кислота As20a в мышьяковую
AsjOs, аммиак тоже им окисляется; озон, будучи пропущен чрез раст-
вор едкого калия, выделяет иод. Последним свойством и пользуются
на практике для открытия озона, причем реакция настолько чувстви-
тельна, что позволяет констатировать присутствие даже следов озона.
С некоторыми органическими телами (например, с бензолом, гу-
таперчей и т. д.^образует взрывчатые тела, называемые озонидами.
Нитроглицерин и иодистый азот в соприкосновении с озоном
также взрывают.
— 167 —
ГЛАВА IV.
Сера и ее соединения.
. _ Почти вся сера, потребляемая в Европе, идет из Сици-
' ера‘ лии, где она добывается, смотря по содержанию серы в
исходном материале, либо проплавкой*), или перегонкой. Реже добы-
вают серу из сернистых руд при помощи перегретого водяного пара.
Сицилийская сырая сера, получаемая выплавкой (рис. 23), пред-
ставляет продукт далеко не чистый; в ней обыкновенно заключаются:
Серы от 88,7° io до 96,2°1о
(растворимой в сероугле-
роде).
Углистых веществ от
0,5% ДО 1,1%.
Серы от О, до 2,1%
(нерастворимой в серо-
углероде).
Песку от 1,5%до5,5%.
Известняку (иногда
и целестина) от 1,8% до
4. io,
/г
Такая сера носит на-
звание комовой", для даль-
нейшей очистки полу-
ченного продукта его пе-
регоняют в особых цечах,
сообщающихся с каме-
С
Рис. 23- Разрез сицилийской калькароны для
выплавки серы.
рами, на стенках которых,
в первые стадии процесса,
конденсируются пары, или образуя макрокристаллический налет, так
^называемого серного цвета**), затем же, когда камера достаточно про-
греемся, на дае ее начинает собираться более или менее чистый жидкий
~отливаемый по мере накопления в формы палочек. Это уже
Ш^ЙМмЁВаак&я мереяковаяили литрованная сера—более чистый ры-
ienH ^мовая сера. (Рис. 24).
ожено было также много других ве-
.5'
докаливании без доступа возду-
остатки, богатые сер-'
^иййа; 'б»етиАьного газа, гипс
©ОВ СКОЛЬКО-
&
gw?
*) В Сицилиия&^йлв^;
особых печей, в ко:
плавится остальная масса
И< : 7 5 .
<
, - называемых калькаронов
особых печей, в котор#X засчет отделяющейся при этом теплоты,
плавится остальная масса еДЙМ
**) В серном цвете всегда находят некоторое количество окислов серы, а также
другие примеси*/"
В России большие залежи серы имеются В Дагестане (Черкей
Черката Кхиут), около Петровска в Каракумской степи Закасрийского
края, да Камчатке и т. д. ,
Как известно, сера диморфна и имеет несколько модйфикаций,
(аллотропия), обнаруживающих каждая самостоятельные физические
свойства. . х
Обыкновенная сера обладает лимонно-желтым цветом, который
бледнеет с понижением температуры (при—50® она почти безцветна).
Она очень хрупка, в воде нерастворима, но хорошо растворима в
сернистом углероде CS2 (при 0е насыщенный раствор содержит 24% се-
ры, а при 50е—37 частей ее, при 55° —137 частей), причем при ра-
створении ее происходит значительное понижение температуры. В
бензоле сера мало растворима (немного меньше 1%), в хлороформе
немного более 1%; кроме этого, она несколько растворима в горячем
феноле и некоторых маслообразных жидкостях.
Рис, 24. Установка для очищения cepii перегонкой.
а—чугунная цилиндрическая реторта для перегонки серы; d—топка;
f —котел для плавки серы; g—дымовая труба; h—труба для стока рас-
плавлеяяой серы из котла ,f“ в реторту „а“; р—штанга, запирающая
. t выход из камеры; m—серная камера.
Удельный вес плавленной серы (октаэдрической) 2,015 -2,Об,
Призматическая сера имеет удельный'вес 1,93 и плавится при 119,3°.
тогда как октаэдрическая имеет точку плавления при 114°.
Прй 160°-220° расплавленная сера становится очень густой и
приобретает темный цвет, при дальнейшем нагревании снова делайся
жидкой и подвижной, но первоначального цвета при этом не приоб-
ретает вновь, при 300е она начинает возгоняться, а при 448° она ки-
пит. Выливая в холодную воду расплавленную серу, нагретую до
850°, мы получаем ее в мягком и очень тягучем виде, упругостью
напоминающей каучук, но в таком виде она остается недолго, пе-
реходяхзатем в обыкновенную желтую октаэдрическую серу. При 300°
сера загорается на воздухе; один грм. ее, сгорая в воздухе, выделяет
2250 калорий, причем развивается температура в 1974° С (вычислен-
ная теоретически). Сера соединяется поч^и со всеми простыми тела-
ми, но для этого необходимо, чтобы она была предварительно выве-
дена из состояния твердого вещества путем расплавления или пре-
вращения в парообразное состояние.
Из соединений серы, имеющих отношение ко взрывчатым веще-
ствам, и продукты их разложения мцжно упомянуть: сернистый ангид-
рид 8— газы, серную кислоту H2S0, и сульфаты щелочных метал-
лов Me’t 504, где Ме' = К, Na, (NH<), реальгар As3S2, сернистые ще-
лочи (например К2 8), сернистую сурьму или антимоний 8в283 и т.п.
Как сама сера, так и ее кислоты и соли имеют огромное применение
в технике. В смеси со многими телами сера дает взрывчатые смеси,
на каковом свойстве и основано ее применение в порохах.
В смеси с бертолетовой солью применяется в воспламенителях.
В буром порохе с бертолетовой солью присутствие серы значительно
повышает чувствительность их к ударам и трению и может повести
о самопроизвольному взрыву.
Серный цвет в порохе не употребляется вовсе, в пиротехниче^
ских смесях же также избегается, ибо он подвержен окислению на
воздухе, ,в смесях же с углем бывают даже случаи его самовозгора-
ния, почему такие смеси должны сохраняться обеспеченными от до-
ступа воздуха. Смесь серного Цвета с порошком сернистой сурьмы,
при соблюдении известной пропорции, может дать место для под'ема
температуры настолько значительного, что может произойти самовоз-
горание смеси. Этим же свойством серного цвета обгоняются случаи
самовозгорания бенгальских огней.
§ 2. Сериал а) Первый технический метод добывания этого важ-
кислота. нейщеГо химического продукта, называемый камерным
процессом, общеизвестен. Однако, не вдаваясь в детальное описание
самой техники процесса, напомним лишь химизм происходящих
реакций.
В камерах происходит окисление сернистого газа. Окисли-
телем, по мнению Берцелиуса, являются азотистый ангидрид,
при чем реакция протекает так:
ifc.,
Ж,.
Кк
ШунГе, принимая, что главным деятелем является NO2, при-
Кчто N20s участвует только в качестве компонента при са-
мом начале камерного процесса, при образовании нитрозилсер-
ной кислоты:
28О3 4- N2O3 + О2 + Н2О = 2SO5NH, которая при действии воды
разлагается на H2SO4 и окислы азота:
2SO5 NH-j-H2O = 2H2SO4 + NO4-NO2, но. что этот процесс
не есть главный процесс в камерах, как думали раньше. В Гло-
веровой же башне происходит реакция.
й
2SO5 NH + S02 -}- 2Н2О = 3H2SO4 + 2N0.
По теории Рашича (1905 г.) первым продуктам окисления
SO» является нитрозосульфоновая кислота, до сих пор, правда,
неполученная: S02-р HONO = ON. SO3H.
В момент образования эта кислота соединяется еще с одной
частицей азотистой кислоты и дает продукт синего цвета, что часто
наблюдается и при работах с нитрометром. Этому новому про-
дукту Рашич приписывает следующую структурную формулу:
ОН — S02 — N<
ОН
О
Это нитрозилсульфоновая кислота, которую. Лунге называет
сульфонитроновой. Она разлагается, по Рашичу, в камерах также,
как и в нитрометре, таким образом: ;
ОН — SO2 — N qH = SO2 2н + N0; 2N0 + 0 =» N20,,
получающийся при этом азотистый ангидрит гидратИзируется и
вновь вступает в круг реакций. По Лунге ate NO окисляется не-
посредственно в азотноватую окись NO2, а К2О^, как таковой,
вовсе не существует при t* камер. По Лунге, судьфонитроновая
кислота окисляется избытком кислорода в нитрозиДсерную кис-
лоту, которая передает свой кислород восстановившей при опы-
тах в нитрометре, или в камерах сернистому ангидриду, и воз-
становляется опять в сульфонитроновую кислоту. Таким образом,
эти реакции идут до тех'пор, пока есть свободный кислород, а
затем уже нитрозилсерная кислота разлагается на H2SO4 и NO.
Из сказанного ясно, что нитрозилсерная или нитросульфоновая
кислота является катализатором, передатчиком кислорода. Пря-
мыми опытами доказано соединение в нитрометре SO2 с кисло-
родом при посредстве нитросульфоновой кислоты.
Таким образам, можно по Лунге и Рашичу, все реакции
получения серной кислоты камерным способом свести к следую-
щим главнейшим:
1. 2SO5 + NO + N02 + Оя + Н20 = 2SOsNH.
2. 2SOf,NH -b SO2 + 2Н2О = 2S05NH2 4- H,SO
3. 2SO5NH3-t-O = 2SO5NH + H,O
Реакции 2-ая и 3-ая главные и идут до тех пор, пока не
. наступит гидролиз и разложение нитрозилсерной кислоты ,по
• реакции четвертой:
4. 2SO5NH + Н20 = 2H2SO4 + NO + NO2
Затем вновь образуется сульфонитроновая кислота и из нее
нитрозилсерная кислота^
5. SO2+NO2+H2O=SO5NH2,
а затем опять реакция третья.
6. 2SO5 NHt+O2 = 2SO5NH + H2O.
С другой сторЪны происходят такие реакции:
7. 2SO5NHa + NO2 = 2SOsNH + NO + H20.
8. 2NO + O2 = 2NO2.
В нижних слоях Гдоверовой башни возможна реакция Рашича:
9) ОН — S02^ qH = SO2 < од + NO,
т.-е. непосредственное образование H2S04 из нитрозилсульфоно-
вой или сульфонитроновой кислоты без перехода через кислоту ни-
трозилсерную. Таков, в кратких словах, химизм камерного про- •
цесса.
Рис. 25. Печь для сжигания S в SO2.
Далее мы кратко коснемся фабричного способа приготовления
серной кислоты, который в основных чертах, как общеизвестно со-. •
стоит в том, что сера сжигается в двуокись серы (рис. 25), к которой
S’ - /затем прибавляется необходимое для образования серной кислоты '
количество воздуха и водяного papa; последняя реакция ускоряется
< прибавлением окиси азота.
В настоящее время двуокись серы лишь в незначительном
количестве изготовляется из самой серы; для этой цели, главным
№№одузКат серные соединения железа; последние в специаль-
,П0Чах. сжигаются в окись железа, которая осаждается, идву-
' * серы, которая улетучивается. Кроме того, большие кодичестзд
— 172 —
серной кислоты получаются из других руд, содержащих серу. Горя-
чая смесь двуокиси серы и воздуха пропускается сначала через
Рис. 26. Гей-Люсакова башня для поглощения окислов Ъвота, уходящих из камер
пустую камеру, в которой осаждаются мелкие, заваривающие ее
частицы,
Ь..'
!^V
hr *
к'
!V.
'
Лг '
<.
м> ।
т .
'
ГЖ:<
$
А
ЕШ’':-
После этого газы поступают,сйизу в так называемую Гловерову
башню (рис. 27). Башня зад камнями, не чувствительными
к действию кислот. Навстре
серная
-М'
?!$
-.> V
!
s
;,^эам капает разжиженная
••«.хХт7.' 1v
щ
Рис.
27.
Гловерова башвя, служащая для очищения Н2 S04
от окислов азота и передачи их в камеры.
При этом достигается охлаждение горячих газов тем,
to
••' 4"’(3i' •••
(®р'>ида»/'Чйй>
кислота.
• они испаряют воду из разжиженной серной кислоты; последняя
ЧТО
следовательно, концентрируется. Одновременно чабть газовой смеси
переводится в серную кислоту, окись азота (см. ниже) отделяется от
кислоты и идет снова в переработку. Таким образом уменьшается
потеря вышеуказанных, сравнительно дорогих, веществ; кроме того
серная кислота освобождается от примеси, которая вредно отрази-
лась бы при ее дальнейшей переработке, а также при ее употреблении.
Из Гловеровой башни газы поступают в большие свинцовые
камеры. В камеры вдуваются пары воды и окись азота, благодаря
чему окисление в серную кислоту завершается и последняя мелким
дождем Осаждается на дйо камер.
Из камер вместе с азотом отработанного воздуха улетучиваются
также и окиси азота,посколько они не успели быть поглощены раз-
жиженной кислотой, образующейся в камерах или т. н. камерной
кислотой. Чтобы использовать и их, окиси азота пропускаются через
вторую которой им навстречу
капает конце£^н|>р1мяйяя, верная кислота'; Последняя легко раство-
ряет их в сЙ04 Дтщ)сфё|)рый. адот уходит.;$ большую трубу, поддер-
живающую тиру через весь ряд аппаратов. ,|Сенцентрированная серная
кислота с окисями азота снова направляетсяв ГЛоверову башню,,
где снова испаряет окиси азота. . ! '
Рве. 28. Платиновый аппарат для выпаривания HgSO,.
А—платиновый сосуд; В—шлем; а—платиновая -трубка с воронкой для
приливания кислоты в котел; С—короткое плечо платинового сифона;
О—трубка с поплавком, показывающим уровень кислоты в кубе,
Ь— трубка с гидравлическим запором для вытекания кислоты, если куб
переполнен; f—дымоход.
Камерная кислота обычно вырабатывается крепостью от 50 до 51вБ*).
Такая кислота годится уже для многих производств, напр., для пригото-
вления суперфосфатов, сернокислого глинозема, купороса. Для большин-
ства же других целей требуется более крепкая кислота. Поэтому ее
выпаривают в особых платиновых сосудах (рис. 28) до 65у2—66° Б.
В настоящее время все большее значение приобретает про-
изводство серной кислоты по контактному способу. Начало кон-
тактному способу приготовления H2S0« положил Филипс в 1831 г.,
взявший патент на соединение сернистого газа с кислородом
при пропускании их смеси через накаленную платину. Клеменс
*) Кислота, вытекающая из Гловеровой башни, обыкновенно, бывает кре-
постью в 60—62° В.
1875 году предложил заменить платину платинирован-
^—.Жбёстом, отчего значительно увеличивается площадь кон-'
Дбо платина, выделенная из соединения, осаждается на
|КшЬкнах рыхлого азбеста в мелкораздробленном виде. А так как
i^OMa очень дорога, то лишь после применения платинированного
“ зэбсета стало возможным фабричное производство, но его долго
преследовали неудачи, потому что способ этот был недостаточно
разработан. Контакты часто переставали работать вследствие за-
сорения веществами, которые механически увлекались пиритными
. газами, проходящими через контакт. Кроме того затрата на
самые контакты ложилась большой тяжестью на устройство за-
, водов. Заслуга устранения всех этих недостатков (путем промы-
вания Газов, регулирования температуры, т. к. реакция SO2 +
4-0 <__ 80s обратима в сравнительно узких пределах темпера-
туры) всецело принадлежит Кничу.
Работа в аппарате с платиновыми контактами происходит
таким образом: через камеру пропускают горячив дымовые газы,
которые накаляют контакты до требуемой температуры (t° около
400®С); затем через особую трубку впускают пиритные газы; в
смеси с воздухом они входят в пространство, окружающее кон-
такты; последние находятся в трубках. Газы; внизу входят в
трубку, поднимаются вверх через слой контакта, здесь происходит
окисление SO, в 80s, а последний выходит через отводную трубку
для дальнейшего получения из него H2SO4. Во время реакции
выделяется тепло, так что контакты приходится охлаждать.
Регулирование t°, как сказано, является самым главным при ра-
боте контактов; реакция SO2 + O = SOs дает 32,3 калории.
В 1899 г. были взяты патенты на замену платинового кон-
такта свежеобожженными пиритными огарками; это так называе-
мый мангеймский способ! В основе бго лежало давно известное
наблюдение, что в пиритных газах Всегда имеется уже незначи-
тельное количество SO3 В настоящее время контактное получе-
ние крепкой кислоты обходится дешевле камерного способа, но
слабая камерная кислота дешева потому, что все существующие
свинцовые камеры давным давно уже амортизованы.
При работе с пиритными огарками, нет специальных поме-
щений для контактов, а существует лишь печь особого устрой-
ства. В ней на колосниках происходит горение колчедана. Воздух,
высушенный в особой колонне, проходит по трубам в рабочее
•пространство, где и поддерживает горение колчедана; затем газы
’спускаются вниз, через толщу колчедана, и через трубу вытя-
^гйваются наружу.
Таким образом, горение происходит в верхних слоях колче-
по мере выгорания последнего, забрасывают новую порцию
Ийчедана, а часть пиритных огарков, находящихся в нижних
Моях, выбрасывают через раздвижные колосники. Мы ви-
Ш, что газы от сгоревшего колчедана проходят через только
НК'Йожженные пиритные огарки, что очень важно для даль-
окисления, ибо Они имеют контактные свойства только
6—7 часов после обжига, а затем их теряют. Газы,
поступающие в контакт, должны быть совершенно лишены па-
ров воды, присутствие которых препятствует правильной работе.
В России в настоящее время (до 1917 г.) по контактному способу
работает не менее 3-х заводов.
в) Химику, имеющему дело со в. в., вряд ли понадобится самому
приготовлять серную кислоту, однако, знание методов очищения про-
дажного продукта необходимо. '
.. ;В лаборатории применяются: 1) продажная крепкая так называе-
мая'английская серная к., дымящая серная к., 3) химически-чистая
концентрированная и 4) разведенная серная к. (1 ч. HaS04 и 5Н2О по
об'ему.
В настоящее время дымящуюся или нордгаузенскую серную кис-
лоту или oleum готовят, пропуская летучие продукты разложения
железного купороса в крепкую серную кислоту, приготовляемую тем
или иным способом. Сернистый газ в ней не растворяется, а серный
ангидрид поглощается. Его можно готовить не только накаливанием
FeSOi или Na2S2O7, но также и при накаливании смеси последней
соли с MgS04 (Вольтере), п. ч. тогда остается прочная двойная соль
MgNa2(S04)2, ^тли прямым соединением 80а с О при действии губчатой
платины или азбеста, покрытого платиновой чернью. Нордjayзенская
серная кислота, легко'выделяя серный ангидрид, на воздухе дымит,
почему и называется дымящей; дым этот есть не что иное, как пары
серного ангидрида, соединяющиеся на воздухе с влажностью и пре-
вращающиеся тогда в нелетучую серную кислоту (гидрат). В дымя-
щей серной кислоте содержится особое соединение SO3 с H2SO4 или
пиросерная кислота, т.' е. неполный ангидрид серной кислоты HaSaO7,
аналогичный по составу с Na2S2O7, К2Сг2О7 и относящийся к H2SO4,
как пирофосфорная кислота относится к Н3РО4. Связь* которая скреп-
ляет H2SO4’с SO3, однако, непрочна, как видно из того, что S03 можно
легко выделить из такого соединения легким назреванием. Чтобы
получить определенное соединение нордгаузенскую кислоту охлаждают
до 5°С, и еще лучше—сперва перегоняют часть ея, чтобы в дистил-
лат перешел весь SO3 и некоторое, количество Н2804, тогда и при
обыкновенной температуре дистиллат застывает, потому что соединение
H2SO4SO3 плавится при-)-35°. Хотя с водой, основаниями и т. п. это
тело реагирует, как смесь S03 и H2SO4, но так как определенное со-
единение H2S2O7 существует в отдельности, дает соли и свой хлоран-
гидрид S2O5C12, то должно признать особую пиросернук» кислоту, по
существу подобную с пиро-фосфорной, с тем.различием, что эта по-
следняя отличается гораздо большим постоянством и даже с водой
не переходит прямо в полный гидрат. Соли же M2S2Or, растворенные
в воде реагируют, как кислые соли MHSO4, а для фосфорной кислоты
неполные гидраты (например, РНО3, Н3Р2О7) имеют самостоятельные
реакции даже в водяном растворе, отличающие их и их соли от пол-
ных гидратов. Температура плавления олеума колеблется в зависи-
мости от содержания свободного SO3 от—11,2 до+ 40, а удельный вес
от,1,8186 до 1,9772.
Oleum находит самбе широкое применение в технологии взрыв-
чатых веществ и сделал доступным, вследствие своей дешевизны,
приготовление многих взрывчатых веществ.
целях использование отработанных кислот
вменении его в
Йо в конце настоящей главы.
ogee часто встречающимися примесями в технической сер-
е являются: азотная и азотистая кислоты, железо, свинец
^Йк, сернистая кислота, селен и титан.
Химически чистая концентрированная серная кислота получается
ующим образом.
! 1000 частей продажной английской серной кислоты нагревают
од сильной тягой в фарфоровой или платиновой чашке с тремя ча-
Р.'отями сернокислого аммония до тех пор, пока не начнут выделяться в
^'большом количестве удушливые кислые пары. При этой операции
уделяются из нее окислы азота, если только они присутствовали.
К охлажденной жидкости прибавляют 4—5 частей крупно измель-
ченной перекиси марганца, и смесь снова нагревают при постоянном
помешивании стеклянной палочкой. Вели в кислоте имеется мышья-
Кцвйстая кислота, то при этой операции она переходит в мышьяко-
вую. После этого жидкости дают охладиться и сливают ее в реторту,
подобранную таким образом, чтобы жидкость занимала не более п*о-
^вины ее вместимости. Затем содержимое реторты подвергают пере-
g гонке, конденсируя дистилят в охлажденном приемнике. После того
" как в приемнике собралось первые 10—15 частей дистилята, приемник
^заменяют другим и в него собирают дистилят до тех пор, пока пе-
регонится туда до .’/< жидкости, заключающейся в реторте.
Способ тот можно изменить: так, например, продажная кислота
Может быть освобождена от окислов азота нагреванием ее с углем;
равным образом, примесь мышьяка может быть Удалена посредством
сернистого натрия или серноватисто-кислым натрием. ,
Второй способ очищения продажной кислоты основан на дей-
ствии сероводорода: одна часть английской серной кислоты, смеши-
вается с 4-мя частями воды. Полученную жидкость нагревают до 70’С
и пропускают сернистый водород, после чего ей дают стоять в покое
несколько дней; прозрачную жидкость сливают с осадка в реторту и
перегоняют.
Серная кислота есть маслянистая, безцветная, очень едкая, не
детучая при обыкновенной температуре жидкость без запаха. Она
^вшивается с водой во всех пропорциях, причем происходит выде-
ВНие большого количества тепла и уменьшение об’ема. Кипит при
ЦЙФЙС, причем она может перегоняться, отчасти при этом разлагаясь;
Цингой содержит кислоту крепостью 98,7%.
Нормальный гидрат на практике применения не имеет и полу-
фется исключительно лабораторным путем.
Уже при сорока градусах он отделяет заметный дым серного
|йддрида, пока не вберет в себя 1,5% влажности. В таком виде пред-
ается самая крепкая кислота, встречающаяся в продаже, имею-
удельный вес около 1,84. Она имеет сильную склонность погло-
отнимать от других веществ воду, на чем, между прочим,
|р применение ее ври фабрикации некоторых взрывчатых ве- ’
роксилина, нитроглицерина и проч.).
|£редственно в состав взрывчатых веществ не входит, хотя
( в так называемых Власовских трубках.
'^р^еский. Взрывчатые вещества и взрывные «работы.
Л
4
12
1
178 —
Буроватый цвет, наблюдающийся иногда в крепкой кислоте, ука-
зывает на присутствие в ней обугленных ею, случайно попавших с
пылью, органических частиц, каковое обстоятельство большей
частью не мешает ее применению.
Как известно из аналитической химии, реактивами на серную
кислоту служат: едкий, хлористый и азотно-кислый барий, а также
уксуснокислый свинец.'
Чистая серная кислота при нагревании на платиновой пластинке
должна улетучиваться, не оставляя ни малейшего твердого остатка,
не давать мути при прибавлении раствора ляписа и не окрашиваться
в синий цвет от прибавления дифениламина.
Свинец- может быть обнаружен, прибавляя к испытуемой кислоте
пятерной об^ем абсолютного спирта; если она свободна от свинца, то
даже после долгого стояния в ней не будет мути.
Пршзум&вдолегко обнаруживается действием на пред-
варительно ,в^^р(вдЙввЫ1иу1>^йодоту сернистого и щавелевокислого
аммония', а'также пропусканйе^ИЕ'серно водсродного газа.
Мышьяк констатируется прй йе^фщи прибора Марша, аммиак-
реактивом Нейслера, действуй йй ИЙ’Ж^^оетп» полученную нейтра-
лизацией кислоты. ‘
, , а) Из сернскйслых солей изредко приме-
s “ няется (между прочим, в некоторых гризутитах)
сернокислая магнезия MgSOt (горькая, эпсомская или английская соль).
Она встречается в Стасфурских соляных месторождениях, составляя
минерал кизерит MgSO4H2O. Соль обладает слабительными свойствами
и потому находит себе также применение в медицине. Это есть без-
цветное кристаллическое тело, удельного веса 1,69, содержащее обык-
новенно 7 частиц кристаллизационной воды. В холодной воде раство-
римо в количестве 25,8%, а в горячей 71,43%’’’ Кроме гризутитов,
применена между прочим в Нобелевском порохе и некоторых других
взрывчатых веществах.
б) Сернокислый аммоний (NH4^SO4 есть безцветная кристалли-
ческая соль, удельного веса 1,77, растворимая в количестве 76,8% в
холодной и 97,8% в кипящей воде: в спирту же вовсе нерастворима.
При 14о'« она плавится.
Чаще всего приготовляется путем насыщения углекислого аммо-
ния слабой серной кислотой, или последней —газообразным аммиаком.
Чистая соль должна нацело растворяться в воде, не давая ни-
какой мути, а при нагревании на платиновой пластинке, улетучи-
ваться без остатка. Иногда в ней примешаны хлористые и родани-
стые соли, фосфорные и мышьяковые кислоты, реже металлические
окислы. Распознаются эти примеси по общему правилу; хлор—раство-
ром ляписа в подкисленной азотной кислотой жидкости; роданистые
соединения—помощью раствора солей окиси железа, металлы—по-
мощью сероводорода и сернистого аммония.
Входит в состав немногих взрывчатых веществ между прочим:
(робуритов, боббинитов и проч.
I в) Калиевые квасцы KAl(SO4)t. 12 До О— безцветная кристалличе-
ская соль сернокислого глинозема и сернокислого калия, имеющая
сладко-вяжущий вкус и удельный вес 1,73. Растворимость калиевых
179
в горячей—
кристаллиза-
квасцов в 100 частях воды: в холодной—9,5 частей,
J5,7 частей. При нагревании квасцы плавятся в своей
ционной воде, а затем разлагаются. ’
Раствор квасцов показывает кислую реакцию. Наиболее обычной
и, вместе с тем, вредной примесью к ним является железо (проба
желтой кровяной солью или роданистым калием).
В технике пользуются очень широким применением, но во. взрыв-
чатых веществах употребляются редко (входят й состав динамитов
Горслея). ’
Хромовые, квасцы KCr(SOp>.,. 12Я3() есть, также кристаллическая
•<5рль/|ю темно-фиолетового цвета, содержащая 12 частиц воды. При-’
мбдаиЙёячредко, вдодя/в состав так называемых хромоаммонптов.
д) Из сернистых металлов применяется изредка
верм^тьон^ШрЙШВ$рь HgS. Эго есть красный кристаллический
нерастворимый в воде.
сигнальных огней, которым придает
XsbjS». есть кристаллическое
Удельный вес его —
плавится. В тех-
дяется, но при-
ЙбЙ в Бельгии, а
рйайиЬщйхся во Франции.
|^#ШйЭЙтся спларлением мышьяка
даваемой формулой; заводским же способом
интенсивн
/: Искусствённым п
е серой р пропорции,
его готовят, перегоняя смесь мышьякового и серного колчедана.
Растворим в сернистом калие и едком к’алие. С селитрой дает
вспышку с отделением яркого белого пламени.
в) Сернистая сурьма Sb«S..t —кристаллическое тело темного серо-
стального цвета, удельного веса 4,62'2. В воде нерастворима, по
легко растворяется даже в слабых растворах Ха»8. При нагревании
не плавится.
Сернистая сурьма встречается в природе, образуя минерал анти-
монит или сурьмянный блеск, составляющий едва-ли не главную
РУДУ» служащую для выплавки металла. Продажный препарат чаще
всего содержит железо, медь, мышьяк и свинец.
В смеси с бертолетовой солью может с выгодой заменить серу
в воспламенителях, где часто и применяется, особенно в терочных.
Прежде употреблялась в некоторых порохах (яапр. в порохе Ганац
Хлор и ег0 соединения.
J , в R I
/
§ 1. Чистый хлор в технологии взрывчатых веществ значения
не имеет, хотя и были некоторые попытки его применения, как, на-
пример, в химических воспламенителях системы Шварца. Произвол-
ьные же его, особенно, кислородные, находят довольно большее при-
1 г
/
менение, и интерес к ним за последнее время значительно увели-
чился.
§ 2. Окись jcnopa или
хлорноватистый ан-
гидрид.
С12О есть газ, сгущающийся при + 20° С в крас-
ную жидкость, которая в безводном виде легко взры-
вает, при чем выделяется около 15.000 единиц тепла.
Взрыв происходит как от резкого изменения давле-
ния, так и от
сотрясений, а равно
нагревания; это же явление имеет
Рис. 31. Аппарат
Вельд она для получения хлора с регенерацией перекиси марганца
место в присутствии серы и органических веществ. Водные растворы
взрывчатыми свойствами не обладают, ибо окись хлора тогда пере-
стает существовать, превратившись в хлорноватистую кислоту по-
уравнению:
С120 +Н2О = 2'НСЮ.
:ij Е—каменные хлоровыделители» остатки из которых спускаются в колодец
Е где они нейтрализуются мелом. Отсюда остатки поднимаются по чугунной трубке
насосом g в отстойные чаны Несделанные из железа отстоявшаяся жидкость
с аукается по трубам в 2 окислительные железные башни 0; сюда поступает извест
новое молоко» приготовляемое в I и К, оно поднимается насосом L в сосуд М, из
котораго уже распределяется в обе башни. В башни вдугается воздух посредством
воздуховдувной машины Р. По окончании окисления, жидкость вместе с осадком
спускается в резевуар S, откуда, после отстаивается, прозрачная жидкость (раствор ,
СаС12) сливается, а осадок, состоящий из Мп Qg и извести ввиде жидкой кашицы/
опять поступает, в смеси с свежен перекисью, марганца,, в хлоровыделитель Е.
— 181
Окись хлора в лабораториях готовится обыкновенно действием
«сухого хлора на охлажденную окись ртути.
этого берут 100,0 грм. серной
_ 010-2 есть газ при 10° сгущающийся в жидкость.
§ • двуокись в газообразном; состоянии, так и в жидком виде, он
* 0₽а" очень легко взрывает в присутствии органических и по-
рбшковатых тел при нагревании С.
Двуокись хлора прйготбвййб^Ж^осторожным, действием серной
кислоты на бертолетовую соль,
кислоты, которую охлажд^т
в кислоту вводят 15,0 грм
после чего осторожно пе_
отделяющиеся пары в прие
-.'j j&W ?
Истертой в порошок,
ДО. 20—40е С и сгущая
^РЗИ^ДИтельной смеси.
е
Л. >.
|«иО^|!ЭД^И05ОДЯТ'ВЗрЫВЫ.
и хлора нагревали Ъ про-
ге, нагреваемой до 7 О’С, смесь щавелевой кислоты
ертолетовой солью. Реакция следовала уравнению:
2 КСЮз н- з С3Но04.2 Н20 = 2 С.2НКО4 + 2 СО. + 2 СЮ. + 8 Н2О.
По их словам, операция вполне безопасна. Она несколько облегчается
от прибавки небольшого количества серной Кислоты.
Воспламенение смеси бертолетовой соли с сахаром от капли
крепкой серной кислоты, невидимому, обязан^ образованию двуокиси
хлора (на этом свойстве основано устройство, так называемых Власов-
ских трубок).
Если в воду бросить несколько кусочков фосфора и затем не-
много кристалликов бертолетовой соли, а на них через длинную во-
ронку налить немного серной кислоты, то фосфор загорится и горит
-за счет образования двуокиси хлора.
Только что описанные газообразные кислородные соединения
' хлора, как таковые, в технике взрывчатых веществ'не применяются,
но для последней является существенным возможность образования
их при тех или иных реакциях.
Следующей категорией кислородных производных хлора, коими
пользуются уже с давних пор для изготовления взрывчатой смеси,
являются соли хлорноватой кислоты, а в последнее время' также и
соли хлорной кислоты, носящие обыкновенно название перхлоратов.
§ 4. Хлорноватая кис- Она получается путем прибавления серной
лота нею 7НО кислоты к раствору хлорноватокислого бария. От-
3' 2 деленный от осадка сернокислого бария раствор
сгущают под колоколом воздушного насоса. Крепкая кислота дей-
ствует вкачестве чрезвычайно энергичного окислителя: органиче-
ские вещества, приведенные с нею в соприкосновение, воспламеняются
и т. п. Она уже разлагается при нагревании выше 40° С с образова-
нием хлорной кислоты по уравнению:
4 НС-Юл — 2 НСЮч + Н2О + С12 + Оз.
Из ее солей, во взрывной технике имеют значение соли К, Na, ХИ,,.
На, Sr, Са.
а) Хлорнаватокалиевая или бертолетовая соль К(ЯО% представляет
бесцветные,пластинчатые кристаллы всем известного солоновато-прохла-
дительного вкуса, имеющие удельный вес 2,326; мало гигроскопична.
Рис. 32. Продольный разрез камеры для получения хлора
по Лунге.
Ледяная вода ее растворяет только в количестве 3.33%, в кипящей
же она растворяется в количестве около 60%. В спирту она раство-
ряется очень мало (100 частей спирта растворяют 0,885 части берто-
летовой соли).
При 335—376° соль плавится и разлагается, выделяя кислород
и превращаясь в хлористый калий; реакция значительно облегчается
в присутствии небольшого количества перекиси марганца, чем и
пользуются при лабораторной добыче кислорода. Сильное перегревание
расплавленной соли может вызвать взрыв. Соляная и крепкая серная
кислоты разлагают бертолетовую соль, причем реакция сопровождается
выделением двуокиси хлора С1О2, отличающейся, как сказано выше
сильно-взрывчатыми свойствами.
— 183 —
-. Будучи брошена
металлами и органическими
Рис. 33. Поперечный разрез камеры
, для получения хлора по Лунге.
на накаленный уголь, она дает вспышку, а в
смеси с серой, некоторыми сернистыми
веществами, она делается очень чув-
.ствительнбй к ударам и трению.
Смеси ее с углеводами и некоторыми
органическими веществами, под влия-
нием капли крепкой серной кислоты
загораются, при чем реакция их еще
более усиливается прибавкой желтой
кровяной соли. Смесь бертолетовой
соли с серой взрывает от удара; обла-
дает также взрывчатыми свойствами
смесь двух частей бертолетовой соли
с одной частью сахара и одной частью
желтой кровяной соли.
Хлорноватокалиевая соль может
получаться, пропусканием струи хлор-
ного газа в насыщенный раствор по-
таша и последующей кристаллизацией
из предварительно выпаренного раст-
вора. В лабораториях ее лучше готовить
пропусканием втеплый раствор белиль-
ной извести струи хлора и прибавле-
нием затем хлористого калия. Технический продукт готовится, насыще-
нием хлором известкового молока, предварительно подогретого до
50 60° С, при чем образовываются: хлорновато-кислая известь Са(СЮз)2
и хлористый кальций СаС12. Жидкость упаривается и к ней прибав-
ляется хлористый калий (в горячем растворе), затем продолжают
выпаривание и, наконец, подвергают кристаллизации. Полученная соль
промывается небольшим количеством воды, переводится снова в раствор
при помощи горячей воды и снова кристаллизуется *).
Для испытания бертолетовой соли готовят из нее 5% раствдр,
который испытывается: 1) на металлы—сернистым водородом, 2) на
содержание извести — щавелевокислым аммонием, 3) на содержание
хлористых солей—раствором ляписа (допускается появление при этом
едва заметной мути, но бтнюдь не осадка). При накаливании берто-
летовой соли в закрытом тигле, должен получиться остаток чисто
белого цвета (розоватое окрашивание его указывает на присутствие
соединений марганца). Раствор бертолетовой соли должен иметь
\ среднюю реакцию.
*) Прим. Вышеописанный способ получения КСЮ31 предложенный Либихом,
теперь все более вытесняется электролитическим, как более дешевым. В основе
последнего лежат следующие реакции: КНО + СЬ ® КСЮ + HCI; КСЮ + 4 Ci +
аИ^О^КСЮз+ЧНС!; НС1 4-КСЮ = КС1 + НС10; НСП-НСЮ^2С1 + Н20. Все
эти реакции происходят при электролизе водного раствора КС1 без диафрагмы.
Температура от самонагревания повышается до 45°, т. ч. без особого подогревания
КСЮ# тут же осаждается на дне сосуда. Из вышеприведенного видно, как это
и цоказ^в^ет йрактика, что весьма полезно прибавлять в ванну до начала
электролиза некоторое количество КОН (около 2%), Впервые электролизом была
получена во Франции Галлом и Монтлором.
В лабораториях и технике, бертолетовая соль- применяется в ка-
честве весьма энергичного окислителя; при анализе органических
соединений—употребляется для их разрушения; при элементарном
органическим анализе—для определения углерода, серы и проч.
В продаже нередко встречается довольно чистый препарат.
В подрывной технике применяется довольно часто: в шеддитах,
в составах с жидким сгорающим типа рэкка-рокк и других взрывчатых
веществах, ударных, капсюльных, терочных и дымных составах (шашки
дымовой завесы), в воспламенителях, пиротехнических смесях, спичеч-
ном производстве и проч.
Были попытки применять ее в порохах, в смеси с нитроглице-
рином.
б) Хлорноватокислый натрий NaClO» по наружному виду своему
сходен с бертолетовой солью, но в воде гораздо более" ее растворим:
холодная вода растворяет равное по весу количество .этой соли, а
горячая в 3;33 раза больше. В спирту эта соль также растворима.
Хлорноватокислый натрий сильно гигроскопичен и взрывает много
легче бертолетовой соли. При накаливании разлагается.
От хорошего технического продукта требуется содержание в нем
не меньше 99,5% Na СЮн; из наиболее частых примесей в нем на-
блюдается поваренная соль.
Количество последней может быть определено следующим
образом: берут 120 грамм хлороватонатриевой соли и раство-
ряют в литре воды. Из получившейся жидкости берут 25 куб.
•сайт, и титруют раствором ляписа (1:100 норм.) в присутствии
нескольких капель раствора хромовокислого калия К2СгО4, Слу-
жащего индикатором, до появления красноватого оттенка,
вследствие начала осаждения хромосеребряной соли после того,
как весь хлор выделится в виде хлористого серебра.
Результат перечисляют на хлористый натрий, количество
п/ - к- 2.34Ш л
последнего в % оудет: А =------где m число кубических сайт.
израсходованного титра, п навеска хлороватонатриевой соли
в грм.
. Чтобы узнать, не содержит ли испытуемая соль веществ,
- способных выделять иод из йодистого калия, производится два
испытания:одно в нейтральном, а другое в кислом растворе.
Для этого 10 грм. хлорноватокислого натрия» растворяют в 100
куб. сайт, воды и из полученного раствора отбирают две отдель-
ные пробы по 20 куб. сайт, каждая. К одной из них прибавля-
ется один куб. сайт. 10%’ раствора йодистого калии и один куб.
сайт, раствора крахмала, при чем не должно наблюдаться немед-
ленной окраски в синий цвет жидкости. К другой порции при-
бавляется, кроме тех же реактивов, еще несколько куб. сайт,
слабой (5%) серной кислоты.
Анализ же хлорноватонатриевой соли, в смысле определе-
ния % содержания в ней чистой соли, производится следующим
образом:
4 грм. соли растворяют в литре воды и 10 куб. сант. по-
лученной жидкости вливают в баллон, снабженный клапаном к
— 185 — ,
воронкойс. краном. Затем приготовляют раствор 30 грм. кри-
сталлов Железного-купороса в 900 куб. сайт, воды/переливает • в
•литровую колбу) я дотерты доливают концентрированной £ерйой
кислотой. Полученная жидкость, раньше ее применения в дело,
• титрует^Йевдщормальным раствором марганцевокалиевой соли.
Вцтеедф|^’В<мДух - из баллона при помощи углекислого газад
ввод^жу|^.50 куб. сант. приготовленного вышеописанным спо-
- соб^тмйЙюрд- железного купороса, после чего содержимое
.кипйтится в течение 10 минут, затем охлаждается и
; :р^^|вДйегся водой. Далее растворяют в одном литре воды:
1ШЙ5Й/«0рнокислого марганца MnSOt + 5Н2О, 138 грм. фосфор.
колоты, удельного веса 1,7, и 130 грм. серной киелрты,
. 1,82. Десять куб. ,сант. последней жидкости вводят в '
и излишек сераожелезной соли титруют децинормальным .
^.j^-Wp’popoM марганцевокислого калия.
' ь Расчет производится следующим образом:
X-n 17. 75 (nV—т") , , .
> : количество NaC103B%=- > где: in'= число куб. ‘
сант. раствора марганцовокислого калия, израсходованного на
, титрование 50 куб. сант. раствора железного купороса; ш"=
- число куб. сант. раствора марганцевокислого калия, израсхо-
дованного на титрование избытка раствора железного купороса,
употребленного для восстановления хлората; и = навеска хлор
новатокислого натрия в граммах.
Применяется во взрывчатых смесях значительно реже бертоле-
товой соли, но входит в состав некоторых взрывчатых веществ типа
шеддитов и пр.
в) Хлорноватокислый аммоний ЛПДСЮз есть бесцветная кристал-
оичесг?ая соль, весьма растворимая,' как в холодной, так и в горячей
• лде; й спирту же растворима мало. Вещество весьма опасное в оораще-
: вам разлагающееся с сильным взрывом при сравнительно небольшом нагрг-
нании (до 1OS°C.) или ударе.
технике взрывчатых веществ не употребляется, ио при продол-
жительном соприкосновении хлорноватокислым солей калия и натрия г
Р^^Лоратом аммония он может все-таки образоваться. Это необходимо
иметь в виду, не допуская никогда смешения составов, в которые
вкройДРЯ хлорноватые соли с составами, заключающими перхлораты аммо-
/ни^ например, шедитов е составами пЕ“, „Ри,
„2?*, н т. п.
>,,ц,Г1Хлорноватые соли: бария Ва^СЮ»)* и стронция 8г(С10$\, а
тамоленаходят себе применение в пиротехнии.
Д): Хлорноватокислый кальций. Са(СЮ.3\ испытывался для зажига-
'телАй безопасных лампочек, употребляющихся в рудниках с руд-
- ничвййх .разом, но оказался недостаточно обеспечивающим надежность
воспламенения.
При нагревании разлагается, на воздухе расплывается, потому,
несмотря Bta сравнительную дешевизну, для приготовления взрыв-
чатых смесей не применяется.
Сама по себе хлорная кислота Н<'10±— бесцвет-
§ 5. Опорная кисло- ная, довольно постоянная при обыкновенной тен-
та нею, и ея сопи, пературе жидкость, очень едкая и дымящая на
воздухе. Удельный вес ее 1,78. Будучи нагрета до
1 Ю?С она взрывается; также бывали случаи ее саморазложения при
хранении сопровождающиеся сильным взрывом, без всяких видимых
причин. С углем она дает сильный взрыв, который имеет место также
и в присутствии дерева, бумаги и других органических веществ.
В воде растворяется во всех пропорциях, при чем получающиеся
жидкости отличаются своим постоянством. Соли ее, хотя и содержат
больше кислорода, нежели хлорноватые, но по большой части зна-
чительно труднее его выделяют. Так, например, брошенные на го-
рящий уголь, дают более слабую вспышку, нежели хлорноватые соли,
а) Перхлорат калия— КСЮ^ из перхлората наиболее постоянная
соль. Это — бесцветное кристаллическое вещество, удельного веса
2,54, сравнительно плохо растворимое в воде: в холодной оно раст-
ворило в количестве 1,68%, а » горячей —18,18%. В спирту не ра-
створяется. КСЮ1 гигроскопичен. При нагревании разлагается.
Образование перхлората калия имеет место при нагревании
бертолетовой соли: когда расплавленная масса, выделивши часть
своего кислорода, начинает пучиться и затвердевать, то сплавленная
масса, как показывает нижеследующее уравнение, содержит перхло-
рат калия и хлористой калии
2 KG1O:; — KCIO.S I KOI 4 О2.
Так как она плавится труднее бертолетовой соли, то образо-
вание перхлората калия проявляется, при добывании кислорода из
бертолетовой соли появлением в массе твердых крупинок.
Перхлорат калия получается также электролизом бертолетовой
соли, а также под влиянием азотной и серной кислот-. Перхлорат
калия легко поддается очистке, благодаря своей трудной раствори-
мости в воде.
Он обладает взрывчатыми свойствами, особенно будучи смешан
со сгорающими веществами, но, благодаря тому, что слишком мало
чувствителен к капсюлю, в технике взрывчатых веществ применя-
ется сравнительно редко. Фабричный способ приготовления — путем
электролиза бертолетовой соли. Из взрывчатых веществ, в составе
которых он является одним из компонентов, можно назвать: пиро-
диалин, цермантит и взрывчатые вещества Жирара.
б) Перхлорат натрия NaClOi представляет из себя гигроскопич-
ную, расплывающуюся в воде массу, имеющую те же свойства, как
и перхлорат калия, но отличающуюся меньшим, сравнительно с ним,
постоянством. В отношении некоторых тел (напр., закиси железа)
действует, как окислитель, в отношении же других—наоборот, как
раскислитель (напр., перхлорат калия под его влиянием превращается
в хлористый калий). В природе встречается в небольшом количестве
в виде примеси к чилийской селитре.
Г
v — 187 — • . ; t> \
< , ’J
В) Перхлорат аммония NH4OIO* — бесцветная, кристаллИЧОСКМ
соль, растворимая в 5 частях холодной вода. Более гигроскопична
соответствующей калиевой соли. Получается путем двойного разло-
жения аммиачной селитры и-перхлората натрия; соединение довольно
постоянное. Перхлорат аммония значительно более чувствителен к
капсюлю, чем перхлорат калия, но сравнительно плохо передает де-
тонацию. к тому же при взрыве его получается значительное коли-
чество хлористого водорода, что ограничивает многие возможности
его применения (напр., в подземных работах).
В соприкосновении с пламенем горит, но плохо распространяет
пламя на соседние с горящими места. Температура отделяющихся
при взрыве газов сравнительно не высока, почему NH^CJO-t приме-
няется для изготовления антигризутных составов как-то; ионскит.
1 пс*. 34. Чугунные ретор1*ы для перегонки
соляной кислоты.
составы „У<)/10“, „Е“ и т. д. Примесь селитры увеличивает гигроско-
пичность перхлората аммония.
Следует помнить правило: никогда не смешивать перхлората
аммония с хлорноватыми солями, или веществ'ами их содержащими,
т. к. вследствие обменной реакции, может образоваться хлорновато-
кислый аммоний—чрезвычайно опасное взрывчатое вещество. Также
надлежит избегать его смешивания с селитрами, ибо, вследствие
обменной реакции, может образоваться гигроскопичная аммиачная
селитра. Следует также всемерно избегать возможности образования
случайных смесей даже пыли хлорноватых солей и перхлоратов с
древесными опилками, углем, сахаром, мукой и, особенно, крахмалом
и серой, так как, представляя сильно взрывчатые вещества, смеси
эти вместе с тем, очень чувствительны к трению и ударам, взры-
ваясь иногда уже при 120— 150°С.
§ 6. Соляная кислота Хотя соляная кислота лишь в виде своих седей
м ее соли. находит некоторое, крайне незначительное, применение
в технологии взрывчатых веществ, но так как при лабораторией и
заводской практике ею постоянно приходится пользоваться, напомним
о некоторых ея свойствах. НС1—газ, легко растворимый в воде: 1 гр.
воды растворяет 0,825 гр. НС1. Водный, насыщенный раствор содер-,
жит при 0° температуры 45,1°/» НС1 и имеет удельный вес 1,226; при
• нагревании выделяется НС1 и кислота становится слабее. Когда же
-t® достигнет 111®, то целиком перегоняется раствор, содержащий около
19,5% HCI и близкий к формуле НС1 + 8 Н2О. (Рис 34).
Соляная кислота получается в технике как побочный продукт
при переработке NaCl, Na2 SOa. Добывается также из каменной
соли. Разложение NaCl производится Н2 в особых, предложен-
ных Лебланом, муфельных сульфатных печах или в. механических
сульфатных печах системна Джонса. Выделяющийся ПС1 улавливается
в целом ряде поглотительных баллонов и, наконец, пропускается
через Госседжеву поглотительную башню.
Для получений соляной кислоты пользуются иногда также спо-
собом Гаргривса разложения NaCl сернистой кислотой.
Из солей НС1—кислоты упомянем 6 двух: NaCl и NHt Cl.
а) Хлористый натрий или поваренная соль NaCl — всем известное
вещество повседневного обихода. Удельный вес ее 2,13; растворяется
в 100 частях холодной воды в количестве 35%, в-горячей же лишь
несколько более, а именно 39,5%. Гигроскопична. Входит в состав
сравнительно немногих взрывчатых смесей (фульминит, гелизит и пр.).
Хлористый аммоний иногда вводится в состав взрывчатых веществ,
преимущественно антигризутных, затем - веществ типа составов Фавье,
а также в шашки дымовой завесы белого дыма. >
В лабораториях его готовят, или нейтрализуя аммиак посред-
ством соляной кислоты, или возгонкой смеси сернистого аммония и
хлористого .натрия. Торговый нашатырь очищают возгонкой.
б) Полученный путем выгона нашатырь NHt Cl <, представляет
бесцветную, ’остро-соленого вкуса, волокнистую массу, из водных же
растворов выкристаллизовывается обыкновенно в виде кубических
или октаэдрических кристаллов, располагающихся подобно бородке
пера. При нагревании до 100® почти не изменяется, при более повы-
шенной температуре—улетучивается, не плавясь. При нагревании
нашатыря с известковым молоком происходит выделение аммиака.
Удельный вес нашатыря 1,52; соль легко растворима в воде и трудно
в спирту: при 0® 100 частей воды растворяют .28,4 частей этой соли
кипящая же вода—72,80 частей его. Растворы хлористого аммония
показывают нейтральную реакцию; при нагревании освобождают не-
сколько аммиака и тогда начинают показывать реакцию кислую.
Металлы и соединения.
Магннй.Каиьций,
-' § 1М«
ярдим, айтитащгйм v св
летучего окисла—магнезии,
Аммоний, Свинец и ик соединения.
Поменяется почти исключительно в по-
0Н представляет собой сере-
;слегка 'Кристал-
Шлоизменяется на
,:Г'18йй^;;'ЯёскОлько''
_________________ ’*» ,-ШЙй белым,
nt ’ белого ненязвкего; и не-
при этой (на 24 весовые
Mg. Несмотря на
освобождая
части) около 140,000 единиц тепла.
Кислоты растворяют металлический
магний соединяясь с данным количеством кислорода, выделяет больше
то, что
тепла, нежели аллюминий, применение металлического магния во
взрывчатых веществах, по. причине значительно более легкой его
окисляёмости, более ограничено. Широко им пользуются в фотогра-
фической практике для так называемых магниевых вспышек.
Здесь приводятся два рецепта по которым иногда изготовлются
составы для фотохимических вспышек:
1 часть порошка магния
1 „ бертолетовой соли
1 ,, перхлората калия
или
1 . „ порошка магния и ,
I я двухромокйслого калия.
Технический магний далеко не чист; он содержит обыкновенно
примеси: железа—от 0,1% до 5,7°/0; углерода—от 0,1% до 0,2%;
кремния—от 1,9% до 2,4%, иногда же йллюминия (от 0 до 0,4%) и
цинка (от 0 до 3,1%).
§ 2. Кальций. Из соединений последнего некоторое значение в тех-
нике взрывчатых веществ имеет окись кальция СаО, всем известное
белое некристаллическое тело, удельного веса 3,08, жадно притягива-
ющее влагу и постепенно переходящее в одноводный гидрат, имеющий
вид белого об'емистого порошка (как говорят известь гасится). В воде
очень мало растворима, при чем в холодной воде растворяется в боль-
ших количествах чем в горячей.
Непосредственно в технике взрывчатых веществ имеет лишь
вспомогательное применение (как, напр., в химических запалах системы
Штейнау и Яролинек), но при фабрикации, в частности, пироксилина,.
содержание в воде извести оказывает часто существеннее влияние
на качество получаемого продукта. (См. далее).
§ з. Металлический Металлический алюминий применяется в технике
. алюминий. взрывчатых веществ как в порошке, так и в струж-
ках. Удельный вес металла 2,6 — 2,7; он тверже олова, но мягче
цинка и меди, при чем в отношении твердости -ближе всего подходит
к серебру. Звучен, но. не очень гибок, излом неровный—мелко-зазуб-
ренный. Довольно ковок, но в листах несколько ломок, тверд и мало
эластичен. Может плющиться в тонкие листочки и, хотя с трудом,
но вытягивается в проволоку.
В сплошном вице металл в технике взрывчатых веществ вовсе
не применяется. Цветом он напоминает олово, синеватым же оттенком
своим приближается к цинку. В соляной кислоте растворяется, азот-
ная же ни на холоду, ни при Нагревании не действует; слабая серная
кислота действует медленно, крепкая же сравнительно легко раство-
ряет его при нагревании. Довольно легко растворяется в щелочах.
На воздухе с поверхности алюминий медленно окисляется,
покрываясь белым налетом глинозема. Температура плавления алю-
миния около 700°, порошок его будучи сильно накален, - загорается,
испуская сильный белый свет и переходя в неплавкую и не летучую
окись AIJ).,, при чем на один пай образовавшегося глинозема (т.-е. на
103 грм.) выделяется около 250.000 единиц тепла. Последнее свойство
привело к применению металлического алюминия в технологии
взрывчатых веществ с целью повышения термического эффекта взрыва
и увеличения упругости развивающихся при этом газов, а следова
тельно, для увеличения фугасного эффекта взрывчатого вещества.
Преимущественно его прибавляют во взрывчатые смеси, содер- •
жащие аммиачную селитру и носящие название аммоналов. Уже
прибавка 3% 'алюминия оказывает видное действие на эффект взрыва
Прибавка его повышает также способность к детонации.
Металлический алюминий предложили Вводить также в гремучую
ртуть или запрессовывать его в капсюли поверх последней для обес-
печения взрывания бездымного пороха обыкновенными капсюлями.
Находясь в непосредственном соприкосновении с некоторыми
металлическими солями, порошковатый алюминий подвергается с
течением времени окислению, теряя мало-по малу способность сгорать
прй взрыве и обращаясь в индиферентное соединение, ослабляющее
действие взрывчатого вещества, вместо того, чтобы повышать по-
следнее.
Примечание. Наиболее обыкновенными примесями к тех-
ническому продукту является кремний и железо, иногда же в
нем находятся: сера, фосфор, хлор и ,мышьяк.
Для определения содержания кремния 2—4 грм. алюмини-
евых стружек обрабатывают в об'емистой платиновой чашке
13—25 грм. чистого едкого калия и 25 куб. сайт, горячей воды;
чашка сверху прикрывается крышкой для избежания потерь
разбрызгиванием и под конец несколько подогревается. По охла-
ждении, брызги на крышке смывают горячей кислотой, которую
затем нейтрализуют и раствор выпаривают досуха при непрерыв-
tном помешивании. Прокаленный и взвешенный остаток цреб^т'
обычным способом фтористоводородной кислотой на кремни#*.;;*^'
Для определения железа 3,00 грм. алюминиевых струяйк
обрабатываются в полулитровой колбе 50 куб. сант. 40% раствора
едкого калия, при чем к концу реакции колбу подогревают; к
раствору приливают 200 куб. сайт, чистой разведенной серной
кислоты (удельного веса 1,16) и кипятят до тех пор, пока жид-
кость не сделается совершенно прозрачной. Но охлаждении,
титруют железо хамелеоном.
Обрабатывая металл раствором едкого натрия или соляной
кислотой, пробуют выделяющийся водород при прмощи бумажки,
опитавщой,раствор ом ляписа. Если на последней не появится
ни желтого пятна—это укажет на отсутствие мышь-
^Шрж^фосфора. Хлор можно обнаружить раствором ляписа,
мЯЬ^Чфибавляют к жидкости, полученной путем обработки
•НнЧЦВух грамм металлического алюминия едким натром, и
РпМЙйзацией полученной жидкости азотной кислотой.
пречисленных здесь примесей, в продажном. а^юм и-
^'встречаются также следы углерода, водорода и окись алю-
Йня/ натрий, бор и медь. >
? Чистый алюминий заключает 98—99,75% металла, обыкно-
йный же—только 92—98%
Процессов добывания алюминия заводским путем предло
жено было несколько. Они сводятся к 2-м категориям: получению
алюмйния сухим путем и электрометаллургическим.
К числу способов получения алюминия сухим путем отно-
сятся: а) способ Вблера, разлагавшего хлористый алюминий при
посредстве металлического калия; б) Девилля — применявшего
с этой же целью хлориды алюминия и натрия, разлагавшиеся
им в расплавленном виде посредством металлического натрия;
в) Нетто — предлагавшего пользоваться в качестве руды криоли-
том и, наконец, г) Грабау— добывание алюминия из фтористого
алюминия. Бекетов предложил металлический натрий заменить
металлическим магнием.
Все эти способы были в общем дороги, так как требовали
металлического натрия, поэтому техника продолжала изыскивать
более дешевые методы. Сделаны были попытки в о останов лять
алюминий при помощи гальванического тока из смеси глины с
углем, но неудачно — получался металл, содержавший много
углерода и негодный для технического употребления. Тогда
обратились к электрометаллургическому методу — электролизу
расплавленных безводных соединений глинозема токами высокого
ампеража. Исходным материалом могут служить: глина (боксит
А1203), фтористый алюминий A12F6 и сернистый алюминий A12S3.
’ Из глин он готовится по способам: Heroult и Байера; из криолита
По методу Мине и Грабау и, наконец, применяя сернистый алю-
миний, работает завод Алюминево-Промышленного о-ва в Нейгау-
зене.
.Другие металлы в мелко раздробленном состоянии освобождают
Ыэдрании также большое количество тепла и потому должны
действовать подобно алюминию и магнию, но главное затруднение их
применения зависит от трудности получения их в порошковатом,
мелкораздробленном состоянии.
Так, например, были произведены опыты применения железа,
цинка и его сплавов, меди*), металлов редких земель и карбида
кремния, пока, однако, не приведшие к практическим результатам.
„ 4 Окиси Из соединений свинца применяются (преимуществ
s . киси свинца-венно в пиротехнике и спичечном производстве) пере-
киси свинца РЬО2 или иначе двуокись свинца и сурик РЬ3О4 извест-
ная оранжевая краска. .
Заводским способом сурик готовится слабым прокаливанием мас-
сикота при доступе воздуха в особых печах. Формула сурика РЬзО*
лишь приблизительная, ибо состав его не постоянен. Цвет оранжево-
красный. Двуокись свинца(неправильно называемая перекисью) полу-
чается путем обработки сурика слабой азотной кислотой. Двуокись
свинца — мелкий темнобурый порошок, сопротивляющийся действию
кислот. Двуокись свинца может поглощать сернистый газ, а при рас-
тирании в ступке с серой дает вспышку. (О некоторых свинцовых,
солях см. далее).
Г Л А В А II.
С г, Mnj'Fe и их соединения,
u f
Из металлов 6 группы ;лишь хром дает соединения, имеющие
значение во взрывной технике. Сюда относятся: К2СГ2О7, (ХЩДСг-О;
и PbCrsOi, на рассмотрении которых мы и остановимся.
.. , _ ' а) Двухромокйслый калий h'2Cr>От есть кристал-
к лическая соль оранжево-красного цвета удельного
веса 1,98, растворимая в количестве 4,С частей в 100 частях холод-
ной воды (при 0°) и|94,1 частей в 10Q частях кипящей. В спирте и
эфире она не растворима. Водные растворы показывают кислую реак-
цию. При краснокалильном жаре она плавится, при очень высокой
температуре выделяет 3 частицы кислорода, превращаясь в среднюю
соль и давая окись хрома. Друхромокислый калий ядовит и дейст-
вует, как сильный окислитель, сравнительно легко отдающий свой
кислород. Изредка применяется во взрывчатых веществах (даменит,
углекарбониты, французский охотничий порох и пр.). Двухромокислый
калий должен всецело растворяться в теплой воде и давать совер-
шенно прозрачную жидкость, которая, будучи подкислена азотной
кислотой, не должна давать мути или-осадка от прибавки раствора
ляписа и хлористого бария (отсутствие извести).
Для лабораторного приготовления двухромокислого калия, раст-
вор хромовокалиевой соли КгСгО* разлагают посредством азотной или
серной кислот.
.. *
*) Тонкий порошок металлической меди применяется изредка в электрических
запалах для токов среднего напряжения.
производстве хромпика,
хромистый железняк
перемешивании. Измельченная
лодском
зя с мелом при частом
ивается затем с горячей водой и к смеси прибавляют сер-
ты до слабокислой реакции. Этим путем хромокальциевая
ходит в двухромокальциевую. Для получения самого хром-
лвуют на двухромокальциевую соль раствором поташа, при
—««дает из жидкости карбонат кальция, в растворе же остается
ВМОкалиевая соль, которую оттуда и выкристаллизовывают.
Двухромокислый аммоний (NH^ Сг >0- представляет кристал-
жую соль желтого цвета удельного веса 2,37, легко растворимую,
к холодной, так и в горячей воде. Эго весьма энергичный окис-
почему иногда применяется в технике взрывчатых веществ в
«гве материала, за счет, кислорода которого протекает реакция
«чалого разложения. В общем реагирует также как аммиачная
fepa 'или перхлорат аммония, но действует несколько слабее их.
Магревании и взрыве разлагается с образованием свободного
а. Температура газов при взрыве 1300° С.; об'ем их небольшой.
? Применяется во французском ружейном порохе и некоторых
ЙфЦзутных веществах. Соль действует на металлы, а пыль ее
Йо раздражает слизистые оболочки.
. в) Существуют три хромосвинцовые соли: средняя РЬС^О^ извест-
цод названием желтого крона, хромовой желти или хромгельба
Требляющаяся в качестве краски; основная PbC^Ch + РЬ(НО)2,
чествующая под названием хромрот (киноварно-красного цвета) и,
Онец, так называемая хроморанж, которая представляет, в сущ-
ик, смесь первых двух солей. ,
,В технике взрывчатых веществ применяется только средняя
т.-е. желтый крон (он входит в состав пороха „Корнпль").
Соль эта получается взаимодействием растворов хромокалиевой
де: какой-либо из солей свинца, чаще всего уксуснокислого свинца.
Ней крон нерастворим ни в воде, ни в уксусной кислоте, но
юряется в едком кали; при накаливании же разлагается. В
Оде хромосвинцовая соль встречается в виде минерала, назнвае-
Красной свинцовой рудой.
Сведине ния
h'V
Мдганца.
..
' ц но растворяется в крепкой соляной кислоте. При накалива-
[' отдает свой кислород. В природе находится в значительном
Я?ве, образуя минерал, называемый пиролюзитом.
даровая ценность перекиси марганца обусловливается содержа-
щей кйслорода сверх того количества его, которое требуется
»лй формулой закиси марганца или количеством хлора, кото-
:ет выделить, а также количеством растворимых в кисло-
«й (преимущественно углекальцевой и углебариевой солей,
Ией железа). Также точно важно в практическом отношении
QQEH хлора, чтобы содержание в
Г'.Дозможно меньше.
ycttDttCKuii. Взрывчатые вещества в взрывные работы
а) Перекись марганца МпОъ — всем известное порош-
коватое тело черного цвета, удельного веса 4,7—5,02.
Этот окисел не растворим в воде и крепкой азотной
ней гидрата окиси мар-
13
Количественные способы определения перекиси марганца разра-
ботал Люнге, у которого интересующиеся могут их найти (Lunge.
Chemisch technische (Jntersuchungsmethoden.
Имеет в общей технике весьма большое применение, во взрыв-
чатых же веществах употребляется сравнительно редко (во взрывча-
тых веществах типа Прометея и в небольшом количестве других).
б) Марганцевокалиевая соль или минеральный хамелион (КМпО^).
Это темно-фиолетовые кристаллы с зеленоватым отливом, просвечива-
ющие красным цветом, имеющие удельный вес 2,71. В 100 частях
холодной воды растворяется около 6,5% соли, в горячей же она
весьма растворима.
При накаливании соль разлагается, выделяя кислород и оставляя
низшие окислы марганца.
Марганцевокислый калий, как в сухом виде, так и в виде ра-
створа) не представляет прочного соединения, причем водный раствор
его изменяется даже под действием света'. Соль сохраняют в банках
с притертой пробкой.
Растворы марганцевокалиевой соли имеют столь характерный и
резкий, интенсивный красный цвет, что даже при громадном разбав-
лении водой, он еще хорошо заметен. Множество веществ восста-
новляют марганцевокалиевую соль в двуокись марганца, причем крас-
ный цвет раствора пропадает (необходимо иметь в виду, что резина
и каучук также действуют разлагающим образом на раствор хаме-
леона). Особенно в этом отношении легко действуют вещества орга-
нические, которые эта соль окисляет. В присутствии кислот марган-
цевокалиевая соль действует как окислитель.
Сернистый ангидрид и его соли, а также соли закиси железа
обесцвечивают растворы марганцевокалиевой ооли; на последнем свой-
стве основано применение минерального хамелеона для титрования
железа. \
Смесь марганцевокислого калия с серой и фосфором воспламе-
няется от трения и при ударе, смесь же с углем воспламеняется
только при нагревании. В общем марганцевокислый калий—энергич-
ный окислитель.
Есть несколько способов заводского приготовления марган-
цевокалиевой соли. По первому способу половина тонны раство-
ра едкого калия крепостью 45° Вё. (удельного веса 1,44) выпа-
ривают с 105 килограммами бертолетовой соли и при выпари-
вании прибавляют при постоянном помешивании 180 килогр.
измельченной перекиси марганца; выпаренная масса нагревается
’ до спокойного сплавления и перемешивается до остывания. По-
лученная масса измельчается в порошок и нагревается в желез-
ных котлах до краснокалильного жара, затем охлаждается, раз-
бивается на куски, нагревается в котле с избытком воды и от-
стаивается. Прозрачный раствор слитый с осевшего гидрата пе-
рекиси марганца выпаривается до кристаллизации. Штедлер не-
сколько изменил этот способ, предложивши превращать марган-
цовистокалиевую соль в марганцевокислую при помощи хлора.
При замене хлора—бромом, в качестве побочного продукта полу-
чается бромистый калий, имеющий высокую торговую ценность.
Превращение соли марганцовистой кислоты в марганцевую можно
достичь также путем электролитическим; последний способ на-
шел применение в заводском методе приготовления марганцево-
г калиевой соли.
При кипячении раствора марганцовистокислого калия или
при пропускании углекислого газа через такой раствор также
получается марганцовокислый калий. Полученную жидкость ели- '
вают с осадка, выпаривает до 25° по Вё. и кристаллизуют. В
случае сомнения в чистоте марганцевокалпевой соли, ее обык-
новенно испытывают на содержание в ней хлора и серной кислоты.
ДдИ этого 0,5 грм. соли растворяют в 125 куб. сант. воды,
в которые добавляют два куб. сант. спирта; раствор нагревают
до кипеиия;он доажен дать бесцветную жидкость. Ее подкисляют
аза?нойКИСдотоД В получившемся растворе ни ляпис, ни азотно-
не должны давать осадка (хотя небольшая муть
допускается).
® горячему раствору 0,5 грм. испытуемой соли в 5
воды прибавить щавелевой кислоты до полного обес-
раствора и взяв ‘2 куб. сант. полученной жидкости,
/к ней смесь 2 куб. сант. серной кислоты и 1 куб.
в|М|мук' железного купороса, то в месте соприкосновения не должно
НЙ^Йлюдаться окрашенного кольца. Присутствие последнего ука-
^Е^^Жет на -то. что испытуемая соль содержит азотистые соединения.
Количественное определение марганцовокислого калия со-
К^тоит в титровании раствором его 2:1000 раствором (39,2:1000)
железисто аммиачной соли Fe (NHt)2(SO4)a к которому прибавлено
немного разведенной серной кислоты.-Берут 10 куб. сант. послед-
него раствора и приливают раствор хамелеона до остающейся
окраски. Для этой же цели вместо железа можно взять щаве-
левую кислоту.
Применяется в некоторых взрывчатых веществах типа Прометей,
робуритах и проч.
Марганцовокислый аммоний NHtMnO4 имеет состав, аналогичный
«соответствующей калиевой соли; взрывчат; своими свойствами напо-
минает бихромат аммония, но дороже его; пока делались только пб-
яЫТки его применения.
Из металлов 8 группы периодической системы эле-
№g*‘ оединения ментов имеет значение в технологии взрывчаты^ веществ
Кг;*?пем’ лишь железо в виде некоторых солей производимой от
К&дои .его железистосинеродистой кислоты и в виде своей окиси.
№ а) Железистосинеродистый калий или желтая кровяная соль,
Нм желтое синь-кали есть кристаллическое тело светло-желтого цве-
Нйдельного веса 1,83, вкус ее горький; эта соль не ядовита. При
ИКС Теряет кристаллизационную воду и белеет. Растворяется в хо-
ЩйЬфводе в количестве 28%, горячая же вода растворяет почти
^Ню^-по. весу количество ее; в спирту нерастворима.
Шше \ Желтая кровяная соль получается заводским путем из так
ЯНшг Называемой ламинговой массы, служащей на газовых заводах для
Цр,«чистки светильного газа и состоящей из сернокислой закиси же-
леза, извести и опилок, или что теперь встречается чаще—про-
сто из смоченной водой .окиси железа; после продолжительного
употребления масса, эта теряет свою способность очищать газ,
так как окись железа от действия цианистых соединений газа
превращается в соли железистосинеродистой кислоты. Массу обра-
батывают крепким раствором щелочи (едким калием), причем
она сразу меняет свой черноватый цвет на красный; затем вы-
щелачивается железисто-синеродистый калий, который и пере-
кристаллизовывается.
В прежнее время она готовилась заводским способом спе-
циально: в железных тиглях или сковородах сплавлялись обуг-
ленные азотистые отбросы (кровь, рога, копыта, обрезки кожи,
шерцть и т. п.) с железным ломом или опилками и поташем.
При выщелачивании сплавленной массы водой происходит об-
менное взаимодействие между образовавшимися при сплавлении;
сернистым железом и цианистым калием. Полученная жидкость
фильтруется и подвергается кристаллизации путем упаривания
В лабораториях железисто-синеродистый калий приготовля-
ется нагреванием водного раствора цианистого калия с желез-
ными опилками или с порошком сернистого железа, либо дей-
ствуя цианистым калием на железный купорос. Чаще же всего,
просто продажный препарат перекристаллизовывается.
В продажном препарате чаще других встречаются примеси
серной кислоты, хлористого калия и натриевых солей. Серная
кислота обнаруживается подкислением жйдкости соляной кисло-
той и прибавкой хлористого бария—не должно быть при этом ни
. осадка, ни мути. Сплавляют 0,5 грм. испйтуемой соли с 1 грм.
чистой селитры в фарфоровом тигле, массу выщелачивают водой,
подкисляют азотной кислотой и пробуют раствором ляписа—от-
сутствие при этом осадка или мути покажет отсутствие хлорис-
того калия. Для пробы на присутствие солей натрия раствор
испытуемой соли подкисляют соляной кислотой и приливают
избыток хлорного железа, затем фильтруют и к полученной жид-
кости приливают аммиака, вновь фильтруют и раствор пробуют
ппросурмянойислым калием.
Анализ желтой кровяной соли сводится чаще всего к опре-
делению в ней чистой соли, и последнее основано на опреде-
ленйи отношений подкисленного соляной кислотой испытуемого
раствора к хамелеону.
Применяется в нескольких взрывчатых веществах, где иногда
заменяет серу, или же самостоятельно, как например в нитроферрите,
зеленом порохе if пр.
б) Железистосинеродистый свинец Pb2Fe(CN)s. Технический про-
дукт, применяемый в электрических запалах, есть тонкий белый с
желтоватым оттенком порошок, получающийся путем взаимодействия
растворов желтой кровяной соли и уксуснокислого свинца. Реакция
его образования протекает по следующей формуле: »
K.Fe(CN)e4-2Pb(CsH3O2)2 = PbiFe(CN)6-HCH3CO.OH.
Г'
/
*
"7 *-
л
— 197 —
зажигательной смеси электрических запалов его
етовой солью и графитом.
fycucb железа Ре^Ог есть всем известный бурый порошковатый
состава Fe»O3, удельного веса 5,2, нерастворимый в воде. В
ЯКе взрывчатых веществ употребляется в качестве несуществен-
составной части некоторых из них (взрывчатые вещества типа
ta-рокк).
? X Л-
ТТ ЧЛ1’’- '
। .fi •' ‘15 «<.
смешивают’ :
О
части некоторых из них (взрывчатые вещества типа
а
1
L
*'ft
Органические соединения.
В технологии взрывчатых веществ находят себе применение пред-
ставители почти всех гомологических рядов и классов органических
соединений. Степень Важности их для технологии взрывчатых ве-
ществ весьма различна, поэтому мы Преимущественно останавливаем-
ся на тех из них, которые имеют преимущественное значение, при-
держиваясь при описании общепринятой систематизации отдельных
соединений и групп.
II О Д‘О Т Д Е .1 I.
Соединения жирного «ряда.
Г .1 А ,В А I.
Углеводороды.
§1. Па- Углеводороды Сп + Н2ц-+-2, называемые насыщенными или
раффины. предельными углеводородами или параффинами, характери-
зуются неспособностью к дальнейшему присоединению к своей малекуле
атомов водорода и.своей инертностью к химический превращениям. По-
добно первому члену этого ряда-метану, они трудно поддаются окис-
лению, не изменяются от действия концентрированной Н2 УСЬ и легко
заменяют водород галлоидами. Низшие члены этого класса—газы,
средние—жидкие тела, высшие—твердые тела. Сырая американская
нефть состоит из смеси многих из этих соединений, разделяемых
фракционированной перегонкой. В технологии взрывчатых веществ на-
ходят применение: 1) нефть, 2) керосин, являющийся погоном нефти,
перегоняющимся между 150—300° С, 3) вазелин, представляющий оста-
ток после испарения американской нефти на воздухе—при обыкновен-
ной температуре полужидкая масса, в очищенном виде белого ’цвета,
4) лараффин, состоящий из смеси высших членов ряда С„ Н?„ 4-
(С22 Н46, С24 Н-.о, С2,; Hr,4, C2s и в значительном количестве встреча-
ющийся в некоторых сортах яванской нефти.
i
— 199 —
6', '
арахнологии взрывчатых веществ используется богатство С пер-
вторые же два применяются преимущественно, как стаби-
нц* Члены этого гомологического ряда представляют без-
й. цветные жидкости, эфирного запаха; даже низшие из них
растворяются в воде. Перегоняются без разложения. Эмпири-
формула их Сп H2n +1—N02 определяет их, как соединения,
жащие нитрогруппу NO„ азот которой непосредственно связан
___Деродом. .
Чрезвычайная важность для технологии в. в. как нитротел, так
^сложных эфиров неорганических кислот заставляет несколько оста-
;овмться на существенном вопросе различия между, ними.
. у . Еще В. Мейер при попытке получить азотистые эфиры действием
Йодистого алкила на азотистосеребряную соль получил два соеди-
?иения одной и той же эмпирической формулы: CnH2n + iNOs, но
•различных, как по химическим, так и физическим свойствам. Так
как разница в точках кипения позволяла сравнительно легко их
фракционировать, они были подвергнуты обстоятельному изучению,
Обнаружившему следующие между $щми различия:
1) Нижекипящие соединения при действий едких щелочей раз-
лагаются на спирт и азотную кислоту, поэтому их следует признать
за эфиры аротистой кислоты; цх образование выражается уравнением:
СпНгп-Н J + AgONO = Сп Н2п + 1 ON0 + AgJ. При тех же условиях вы-
щекипящие соединения—нитротела—не образуют ни спирта, ни ки-
слоты (или соли). ,
2) При действии водорода в момент выделения на сложные эфи-
ры неорганических кислот конечными продуктами являются спирт
и аммиак. "•
При тех условиях -нитротела дают амины:
Сп Нгп + ,Х02 »>-> Сп Н2п -н NH2, следовательно, азот в этих те-
лах 'должен быть непосредственно связан с углеродом. Атомы же кис-
лорода с своей стороны могут быть связаны только с азотом, т. к.
рбсстановление в амины происходит уже при обыкновенной темпера-
?ре, а при этих условиях, атомы кислорода, если бы они были не-
18федственно связаны с углеродом, не могли бы быть отняты.
С Сравнение формул поясняет сказанное:
ki
NO — 0 — СП., СНз
Азотистоэтиловый эфир
NO,
нитроэтан.
овательно в первых соединениях азот трехвалентел, а во вторых—
валентен.
Я) Нитротела-обладают целым рядом реакций, отличающих их от
Ных эфиров. Сюда относятся:
а) способность первичных и вторичных нитропараффинов заме-
§.водород при углеродном атоме, связанном с нитрогруппой, ще-
НИЙ,металлами, особенно натрием, образуя мелко-кристалличе-
р5едце осадки, трудная растворимость которых в абсолютном
йШслужит для отделения нитропараффинов от других веществ;
б), отношение их щелочного раствора к сернокислому раствору
' азотистонатрйевой соли.
При этом: 1) первичные нитросоединения дают алкилнитроловые
кислоты (см. далее), растворяющиеся в щелочах С кровавокрасным
окрашиванием, образуя металлические производные, 2) вторичныел
нйтросоединения дают бесцветные твердые псевдонитрилы, при пере-
ходе в жидкое состояние принимающие интенсивную синюю окраску.
Нитропараффины взрываются с трудом, но металлические произ-
водные их являются, сильно взрывчатыми. Так натровая соль
нитроловой кислоты взрывает от малейщего удара. Эта соль
СП.; МЮJVa cHgCIa дает гремучую ртуть.
Охлоренные производные нитропараффинов составляют интерес-
ную группу взрывчатых веществ, например: хлородинитрометан-жел-
тые кристаллы, взрывающиеся около 145<>С, тринитрохлорметан и
т. д. . ''
Нолинитрованные производные параффины также дают со ще-
лочными гидратами взрывчатые соли, напр. тринитрометан СН(Д’О..)з
или нитроферм, взрывающийся при нагревании; аммониевая соль его
более постоянна и взрывает при 200»С.
§ 5, Олефины. Си нап Ненасыщенные углеводороды ряда этилена в
и hjc нитропроизводные, технологии взрывчатых веществ Имеют некоторое,
главным образом, научное значение только своими нитропроизводными,
сравнительно легко получаемыми при помощи непосредственного дей-
ствия дымящейся азотной кислоты. Так, например, нитрокаприлен
получающийся при помощи кипячения каприлена, добываемого из
Кавказской нефти с азотной кислотой удельного веса 1,38 и т. д.
Эти нитропроизводные изомерны соответствующими азотистыми
эфирами, отличаясь,, однако, от последних большой стойкостью и не-
которыми характерными реакциями. Имею!, как сказано, значение
лишь научное, Практического же применения не получили.
§ 4. Ненасыщенные уте- ® рассматриваемом гомологическом ряду в
водороды группы ацети- технологии взрывчатых веществ имеют значение
пена Си Hsn—„ ацетилен и его металлические производные.
Ацетилен ядовитый газ, характеризующийся своим противным
запахом, горящий очень ярким пламенем. При 18«С и под давлением
83 атмосфер он ожижается, образуя бесцветную жидкость, хорошо
растворим в ацетоне (25% об'емов), в воде растворим в количестве
50"я по об'ему.
Находясь под обыкновенным давлением, он взрывает под влия-
нием капсюля с гремучей ртутью, а также от сильных ударов и
электрической искры. Способен также детонировать от соседнего
взрыва. При небольшом сжатии (до 2 атм.) взрыв происходит также
при соприкосновении с накаленной проволокой. Смеси ацетилена с
воздухом взрывают с ужасной силой при соприкосновении с пламе-
нем.
В жидком виде он очень опасен, взрывая с большой рилой от
пламени и искры. ’ -
На практике ацетилен добывается действием воды на карбид
кальция СаС> Структурная формула ацетилена Н ( —Н. В химиче-
ском отношении он характеризуется своими способностями как к ре-
акциям присоединения, так И конденсирования и, что весьма важяот
образованием металлических соединений. Так с аммиачными раство-
рами о днохлори^той меди. «Ц;4- 4
(у меди—красный, у ceppopi^ij
Красный осадок под влфйки ‘" *'
зуются в лабораториях
§ 5. Кислоты жирного
RCOOH и их нитропромэ-
. BonHb(e-v^
манита, веттерДи
которую пытались
лучены в свой
дающие соли Ki
Азотно —и
пункты получения
торых имеются И В8^
ше.нии совершеиНр н^д^
торые из эфиром’Вч
стые пары, получаю
и потому предлоЯН
мер, действуют.«
нением котор
; 6. Ямины, айилЙ|)^|
TponpoXJ/
свойствам,.с
иод деМфтПвЙ!
о
i 8 > Н
в ляписа он производит осадок
который при ударе взрывается,
.выделяет ацетилен, чем и ноль-
|$мкияЧистого ацетилена.
^рёНия технологии взрывчатых ве-
't жирного ряда и их соли не пред-
“jefei? Из 'последних имеет некоторое
“ ДгО, входящая в состав нор-
соль — KNaC+HjCMHijO,
’И^тропроизводные не по-
.>JHepHk эфиры последних,
фдШходит , группа NO2-
^йЙЙ^щвдяют исходные
«ЙСДвнений, среди ко-
этом отно-
эвметять, что неко-
хвом поглощать азоти-
ЙДожеаии азотных эфиров
И||ВД^Йй5нДизаторов. Так, напри-
тДрийовый глицериды, с приме-
дтересНых опытов.
^Жирного ряда, общая формула ко-
в технологии в. в,
jepCCHbi толькосвоими нитропроизводными по
1,<<;р^ррпараффи^ЙМй. Вторичные основные^ амины
, ~ Кислоты дают азотисто-производные типа
-»NO,’ кой моЬут примсиятьсЯ в качестве стабилизаторов.
АмйдЬь, Общая формула которых K.CO.NH, и амидины.
играют роль оснований и с азотной кислотой образуют малопостоян-
ные сол^т. Среди амидов особенного внимания заслуживают: карбамид^
или мочевина и гуанидин
с их нитропроизводными.
• ГЛАВА II.
< 1 Общие ммеианйя /Обще можно определить спирты, рак
” ' ’ от углеводородов путем
замещения в них ;гидроксилом—ОН. По
числу водных с wTb едио-Двухгтрех— и вообще
многоатомные; по положен^ ЯОДЙЫХ'вС1атков--первичные, вторичные
и третичные; Максимальное Чиело вб'днШ остатков, которое содер-
жится в спирте, не может йреяыШКТь Чисй Углеродных атомов, обра-
зующих цепь. . / ' ' \
Йлг'; Спирты от С, — С4 — подвижные бесцветные жидкости, от
С*—Си—маслянисты, от С)? и выше—твердые тела.
Многие сложные эфиры спиртов являются взрывчатыми веще-
ствами, находящими широкое применение в технике. Рассмотрение
последних мы произведем по группам спиртов.
Так как для технологии взрывчатых веществ наибольшее значе-
ние имеют сложные/эфиры различных классов спиртов, мы, переходя
к разсмотрению последних, вновь напоминаем то, что уже говорилось
ранее при нитропараффинах, о существенно важном для технологии
в. в. различии между сложными эфирами спиртов и изомерными им
нитротелами — нитрованными спиртами.
Нитрованные спирты представляют научный интерес, но не имеют
применения на практике, главным образом вследствие трудности до-
стичь замещения в цепи спиртовых радикалов, что не позволяет
прямо получать соответствующие производные. Так, например, нитро-
этил овый спирт CoHjNOoOH получается, как нитрогидрин гликоля,
действуя на монохлоргликоль ляписом. Серия сложных эфиров го-
раздо важнее с практической точки зрения и отличается общими ре-
акциями омыливания и восстановления. Из них азотистые эфиры не
принадлежат к числу могущественных взрывчатых веществ и мало-
стойки, а потому представляют интерес лишь ,.с точки зрения хими-
ческой; получаются они прямым действием азотистой кислоты на
спирты. Нитриды этила и амила образуются в продуктах медленного
разложения бездымнаго пороха коллоидального типа, при. приготов-
лении коих соответствующие спирты входят в качестве растворителей.
Практика пользуется исключительно только азотными эфирами в
качестве взрывчатых веществ. Они вообще образуются по формуле:
СпН„,(ОН),1 + ПНОШ, = С„Н,„ (ONO,)„ + „.НОН.
В виду омыляющего действия воды на готовый z эфир необходимо
почти всегда связать выделяющуюся воду, что достигается приме-
нением при нитрации крепкой серной кислоты, составляющей с азот-
ной кислотой так называемую сульфоазотную смесь.
„ . _ В химическом отношении характеризуются
§ . Одноатомные спирты 0^щесПИрТ0ВЫМИ реакциями типичного водорода
и ид азотнокислые эфиры. ГИДрОКСИЛЬНОй группы, как, например, образо-
вание алкоголятов, сложных эфиров, окислением в альдегиды и ке-
тоны и дальше—в кислоты.
Среди азотных эфиров одноатомных спиртов едва-ли не первое
место по взрывчатости принадлежит азотнокислому метилу: СНз — ONOa,
жидкости, очень сильно взрывающей от удара, кипящей при 66°, пары
которой при 150° дают также очень сильный взрыв. Она получается
непосредственным действием серной кислоты на смесь метилового
спирта и калиевой селитры прд температуре 1Г>ос.
Взрывчатые константы характиризугощие этот препарат следующие У
f = 10,511 килогр.
v°= 869 литр,
t -= 2.809°
: , Р = 603 Т0НН0
метр,
а = 0,869 литр.
С азотнокислым метилом сходен азотнокислый этил: СПз — СЩ — ONO2P
который представляет также жидкость, кипящую при 85°, пары ко-
торой при 140° дают сильный взрыв.- Получается непосредственным
действием чистой концентрированной азотной кислоты на этиловый
спирт и последующей дисцилляцией. При этом прибавляют небольшое
количество азотнокислой мочевины (100 грм. на 6 килогр. эфира) для
уничтожения азотистой кислоты, с целью поглощения образовавшегося
соответствующего ей эфира.
Азотнокислый амил—: бесцветная, маслообразная жидкость, кипя-
щая при 148°, получается нагреванием амилового спирта с сульфо-
азотной смесью в присутствии мочевины.
Азотные эфиры высших одноатомных спиртов также взрывчаты,
но мощность их постепенно убывает.
Пока на практике применений не получили.
„ „ _ Гликоли представляют собой, в большинстве
8 у н случаев, густые бесцветные жидкости сладкова-
того вкуса. Их точка кипения и удельный вес
э<*жрь|‘ значительно выше, чем у одноатомных спиртов
с тем же числом угдеродвых атомов. Так, например, гликоль ^ипит
при 197,5°, а этиловый спирт при 78°; удельный вес гликоля при
ОоС—1,128, этилового спирта 0,806. Гидроксилы гликолей имеют та-
кой же характер, как и гидроксилы одноатомных спиртов: способны
замещаться галоидами, образуют простые и сложные эфиры, дают
алкоголяты и окисляются в альдегид и кислоту (если гидроксилы
• находятся при первичных углеродах). Реакции гликолей могут распро-
странятся, как на одни, так и на два гидроксила.
Как известно гликоль есть двухатомный спирт состава:
СН.ОН
А
СНзОН
Замещая в нем гидроксил ОН посредством группы 0N02 мы
получим эфир — бинитрат гликоля или динитрин: CH0ONO2—CHjONOj
в виде желтой, маслообразной жидкости, нерастворимой в воде, взры-
.. Шаюшей при ударе и нагревании, вещество очень ядовитое.
--v Приготовляют его вливая тонкой струей гликоль в охлажденных» '
, вульфоазотную смесь. Способ этот общий для всех азотных эфиров
’многоатомных спиртов.
J ti и Необходимо заботиться, чтобы температура отнюдь не повыша-
лась 'во избежание получения продуктов окисления.
S!/
КХ. :
Взрывчатое разложение протекает по формуле:
' .(CH2ONO2)2 = 2СО2 + 2HJ) + N3,
т.-е. разложение полное с образованием газообразных продуктов.
Взрывчатые константы, характиризующие динитрин таковы:
1 == 9.676 килогр.
v, «и 734 литраТ
t — 3.196е
Р = 672 Т°НН°
метр.
а — 0,73 литра
Как видно, это также одно из могущественных взрывчатых
веществ, приближающееся к нитроглицерину, обладающее низкой
точкой замерзания (около —20%), цочёму и применяющееся в некото-
рых трудно замерзающих сортах динамитов. 1
Удобство его совместного применения с нитроглицерином уве-
личивается еще тем обстоятельством, что оба спирта могут нитриро-
ваться в смеси друг с другом, отнюдь нФ мешая один другому*)
Подобными же свойствами и еще более трудной замерзаемостью
обладает динитрат пропиленгликоля: CHa.CH0N0>. CH20N0it также
маслообразная, сильно взрывчатая жидкость. При взрывчатом ее раз-
ложении получается окись углерода,^ вместо углекислого газа.
Кроме перечисленных здесь двух представителей нитрованных
двухатомных • спиртов, существует целая серия других^ происходя-
щих из многочисленных изомеров и производных гликоля; очень
многие из них обладают взрывчатыми свойствами, но пока в прак-
тике приложения не имеют.
§ 4. Тре^атомные спирты. а) Глицерин. Исходным продуктом для полу-
чения всех только что рассмотренных азотно-кислых эфиров служит
глицерин СзНо(ОН)з. Это есть всем известная прозрачная, маслянистая
сладкая на вкус жидкость удельного веса, 1,262 (при 15°~С). Он должен
быть бесцветный, но часто торговый продукт окрашен в несколько
желтоватый цвет. В химическом смысле это есть трехатомный спирт.
Структурная формула глицерина: СИ,ОНСНОНС11,О11 о Правд ы-
вайся тем соображением, что при осторожном окислении глицерина
последовательно получаются глицериновая и тартроновая кислоты—
следовательно, в молекуле глицерина имеются 2 группы СН20Н, а
так как последняя кислота обладает еще и спиртовыми свойствами,
находящаяся в ней группа СН2О должна иметь строение — СЛОИ.
Фрвдемо и Сильве удалось осуществить синтез глицерина непосред-
ственно из элементов. Они исходили из уксусной кислоты (которая
может быть получена из элементов по различным методам) и вели
*) Во время минувшей войны германские заводы вследствие недостатка гли-
церина широко применяли вместо него в динамитах гликоль; целый ряд научных
дссдедовании доказал полную практическую возможность этой замены.
процесс в такой последовательности: укс. кислота -> ацетон -> изо-
пропиловый спирт > пропилен ->хлористый пропилен-►трихлоргид-
рин > глицерин. . ; v . <
Из. различных реакций глиц^рИД^ являются характерными: 1) полу-
чение аллипового спирта, 2) -цбаЙ^ого аллила, 3) акролеина, 4) подп-
етого изопропила, 5) »дгрЙ.^Йи|ЙЙРЯО1Р»
Но для технологии
ние имеют лцшц cflft$t
сколько далее поговр{|й
Глицерин нахо
твердых и /жидаИ
честив ...irHlfyp'
НЙДШ
tL
.7?^
0^.
I&.
ГЦеществ исключительное значе-
<£дицерина, о последних мы не-
Льных эфиров (триглицеридов)
большей части жиров в коли-
ж лй|р$боткой жиров основа-
ВЙМ1П*ром и просто, Перегретой
“разуется при спиртовом
И—И1ИИ, м^ Шеале в Швеции при
обращено
^иКВОМ^Й подучаться в
WMjWW** :W стеарино-
етмыловарения. .
-.беиипинство глицерина, находящегося
jT**глицерином/ получающийся обработкой пальмового масла.
* ’ Заводские методы приготовления глицерина сводятся большей
частью к концентрации и очищению глицерина, получаемого при
Омылении жиров известью под давлением. Глицерин, после выд-4-,
выТ'получав^Рмг _
существует, однако, особый сорт его, называемый гол-
ления нерастворимого известкового мыла, остается в водцом растворе;
раствор этот, имеющий крепость 5—6° по Вё, называется глицери-
новой водой. На тех заводах, где разложение жиров производится
При помощи перегретого пара, глицерин составляет вместе «с жир-
ными кислотами продукт перегонки и получается непосредственно
в довольно чистом виде, если только температура не превышает
310*0, иначе часть его разлагается и в нем появится примесь акро-
леина. Температура кипения глицерина 290° С.
Глицерин, обесцвеченный в случае надобности костяным углем,
но все-таки еще слабый, не может быть сгущен путем выпаривания
в открытых сосудах до нужной консистенции, ибо от выпаривания
он снова окрашивается. Поэтому его переводят в ваккум-аппарат и
уваривают без доступа воздуха, Тем не менее, однако, случается,
что его приходится вторично нагревать с костяным углем и фильтро-
вать. На динамитные заводы требуется глицерин, несодержащий хлора,
который поэтому осаждается раствором ляписа (вводимая в глицерин
азотная кислота при подобном осаждении ве вредит последующему
процессу нитрации).
Очищение глицерина перегонкой по способу Вильсона и Рейне
(предложенному в 1885» году) составляет один из самых важных
процессов фабрикации. Глицерин, почти совершенно отделенный от
жирных кислот, перегоняют без доступа воздуха перегретым водяным
паром, служащим вместе с тем и для отгонки летучих примесей.
Для этого сгущают глицерин при возможно низкой температуре до
удельного веса 1,15 и затем пропускают несколько часов через сит-
чатую трубку пар, имеющий температуру 100—110° С, пока перегон
перестанет давать кислую реакцию. Далее, пропуская пар, глицерин
нагревают до 170—180° С (но не выше 200° С), при чем он перего-
..няется вместе с водяными парами (если нужно, то он этим же путем
снова ректификуется).
Для того чтобы из дисциляционного аппарата получался глице-
рин, содержащий возможно мало воды, пар пропускают через ряд
холодильных аппаратов, окруженных дурными проводниками frenna;
в первом сгущается почти безводный глицерин, в третьем почти
чистая вода, а во втором промежуточный продукт—смесь глицерина
с водой,при чем вода сильно преобладает. (Рис. 35).
Дальше мы несколько подробнее остановимся на весьма распро-
страненом в Западной Европе аппарате Гекмана для дистилядизации
глицерина (рис. 36, 37). Особенно широкое применение он находит
себе при фабрикапии глицерина для динамитов. Сырой глицерин
в сосуде А нагревается перегретым паром до t° 130—180®. Испаряясь
глицериновые пары по трубе В проходят через сборный чан С, тем-
пература которого' около 90*, (D — паровое отопление) в ряд камер
Е. Проходя слои глицерина, осадившиеся на дно камер, пары посте-
пенно отдают свой глицерин, так что в охладитель F поступают почти
чистые пары воды лишь с весьма незнччительным остатком глицерина,
который сдесь отделяется и уходит в камеры Е. Иногда в аппарат
включают еще вторичный конденсатор К, где L трубка для отвода
глицерина. Чистые пары воды охлаждаются в змеевике М а затем
уже в виде воды поступают через измерительное приспособление N
в сборные чаны 0. Глицерина получается в 95—100%. Потери при
дистйляции крайне не значительны.
Рис. 35. Общий* вид установки для дистиляции глицерина фирмы Джорж
Скотт и С-я в Лондоне. Впереди видны баттареи для кондерсации гли-
церина состоящие иа вертикальных металических трубок, охлаждаемых
воздухом; сзади них дистиляционныё колбы, где на основании раз-
личных точек кипения отделяются примеси загрязняющие глицерин.
' й
I
•Л
«Г'
— 207 —
я
1
,• Химически-чистый глицерин имеет удельный вес 1,2653, нагре-
ло 150° он воспламеняется и горит синим несветящимся пламё-
ем (Вагнер-Фишер „Химическая технология*). При низких темпе-
атурах он кристаллизуется. Температура кипения чистого глице-
рина 299° С.
7 , 6) Как сказано выше, для технологии в. в. наибольшее значение
Имеют сложные эфиры глицерина, в частности, азотные. Последних
^ля, глицерина известно три, а именно: моно ди и тринитроглицерины.
Тринитроглицерин обыкновенно зовется просто нитройицерином*).
Мононитроглицерин—жидкость желтого цвета, растворимая в воде,
получающаяся действием разведенной азотной кислоты на глице-
рин, Он от удара не взрывает и в качестве взрывчатого вещества
представляется интересным.
Динитроглицерин уже предстайляет значительный технический
®$рес, так как начинает применяться с целью понижения
мерзация нитроглицерина.
'Подучают его, вливая одну часть глицерина в 3% части
' I»!
' 'X1S
’ЙЖ
J-Vi* - л
&
подниматься
маслянистой
*) Названий, как и многие другие, скорее техническое, но не научное: нитро-
глицерин есть полный азотно-кислый эфир глицерина, а не нитротело, так как
2 нем атомы N связаны с атомами С не непосредственно» что было бы характерно
для нитротел, а через атомы 0, что характерно для сложных эфиров»
Рис. 36. Аппарат для дистиляции глицерина Гекмана.
жидкости, которую промывают также'как и обыкновенный нитрогли-
церин, но, так как он несколько растворим в воде (100 частей воды
точки
креп-
fbft азотПой кислоты (94%), несодержащей окислов азота и охла-
до 0°. Вливание надо производить довольно быстро, чтобы
ра. несколько поднялась (но не выше 20° С) и затем дать
в разделительной воронке, не позволяя, однако, тем-
. Образовавшийся динитроглицерин остается
^Продукта, жидкость разбавляют водой и
’ “ 7 не давая температуре
ерин образует слой
11
' ,т-
1 ' J
s,. $3
I-iiH
$
>»
t
*
V-
w***’
-Ч'.
г\.
"I. «Лп ' .
208 —
ж
i1
растворяют около 5‘/а частей динитроглицерина), промывку ведут,
утилизируя промывные воды, уже насыщенным„ динитроглицерином.
Выход продукта, около 155 частей на 100 частей глицерина.
Если нитрация не полная, то образуется мононитроглицерин,
растворимый в воде, который и уменьшает выхбд продукта.
Технический динитроглицерин представляет собой смесь двух
изомеров:
'$
CH2NO3 —СНОН —CHiNOs
и CHgNOs — CHNO3 - СН,ОН.
Ь
у
Л
I '•'/
I 7
Первый из этих изомеров—твердое вещество, но он находится
в смеси в очень малом количестве, второй—жидкость, преобладает.
Свойства динитроглицерина следующие: он значительно менее чув-
ствителен к ударам, чем тринитроглицерин, и фабрикация его гораздо
более безопасна. Точка плавления его лежит около 50° С, при чем
в смеси с тринитроглицерином он сильно понижает точку замер-
зания последнего.
I:
Г;
г
1 г: ’
ii-
Рис. 37. To-же новейшей конструкции. <
ь:
7
Затем его примесь к нитроглицерину несколько уменьшает сте-
пень бризантности последнего, и совместное употребление их имеет
то преимущество, что избыток кислорода в тринитроглицерине сжигает
избыток углерода в динитроглицерине. Он еще легче нитроглицерина
f-
чи*
№
!
., i
Л
-
Л
К
-Г 4» "
<
— 209
Вдтйиирует нитроцеллулозы: без всякого добавочного растворителя
ВОжет растворить до 75% своего веса коллодионного хлопка. По-
By то динитроглицерин возбуждает к себе большой интерес в
Еше применения его к производству незамерзающие .динамитов и
рё бездымных порохов. '
О нитроглицерине будет говориться подробно дальше. Здесь мы
|кем_лишь, что выход нитроглицерина сильно зависит от свойств
pro глицерина и На практике, для испытания глицерина, идущего
/фабрикацию динамита, лучше всего сделать пробное приготовление
Йитро®одукта, что производится очень удобно в приборе Брунедя.
прокую стеклянную трубку вводят 50 грм. сульфоазотной
ти азотной кислоты креностьк»..'Й% и 5 частей серной
рСТЬЮ §6%) —- •
ш.
^^^^^^^^^^^^ИИКфОгаверх.
^^^^^^^^^^^^МНрдоделёния, так
глицерина.
i минут, тогда
^^^^^^МШЯедЫить' до получаса.
^^^^ВНИшйя клочковатых частиц..
^^ИКдат'В градуированнуЮ трубку,
ИИИРдакончании операции нагревания
Н^НИВ^М^/? .•
^рж8т£’-.!' «•
эдЙвненйю:
^^^ШННКм№П;<?7 г"л- < * ' '
&•+• з НО . NOi = CSH5 (0N02)s + з Н20.
f
'&
ИНмЙКииз 92 частей глицерина должно было бы получиться
КчНСТОЙ нитроглицерина, т.-е. 246,7%, с расходом на это 205%
ЙЙ кислоты. Заводским же путем получается не более 210—230%
«йглицерина. Причина потерь—присутствие примесей в глицерине,
j&HHo жирных кислот и высших гомологов глицерина (полпглице-
Йов)^ кои легче окисляются под влиянием азотной кислоты с обра-
ДОИем щавелевой и др. кислот; также здесь имеют место образо-
|ие: сульфоглицериновой кислоты и даже потеря нитроглицерина,
Йдствие его растворимости в воде.
>. Для нитрации необходима крепкая азотная кислота (48° по Вё),
Цержащая не свыше 1% низших окислов азота, иначе при нитрации
разуются нестойкие азотистые эфиры; серная кислота должна быть
Йщовенная, крепость!» 66° по Вё. Дымящая серная кислота служит
Р концентрации кислот, остающихся после процесса нитрации. Обе
ряые кислоты должны быть по возможности совершенно свободны
железа, свинца и не должны заключать более 0,1% мышьяка.
в) Заметим, что неполвые азотнокислые эфиры глицерина, как,
пример, моно—и ди-эфиры глицерина, могут далее путем заме-
Проф. М. Сухаревский. Взрывчатые вещества н взрывные работы.
14
— 210 -
щения ; одного или двух свободных спиртовых радикалов давать раз-
личные производные. Подобные продукты замещения были испытаны
на предмет использования их взрывчатых свойств и по меньшей
мере один из них, а именно динитромонохлорогидрин диссиметрический:
CHoNOs — CHNO3 — CHaCl в настоящее время представляет уже прак-
тический интерес.
Динитрохлоргидрин (СзН5) С1 (0ХО2)^, впервые был предложен
Непту; формула его следующая:
СП, 01
СИ. О. NO..
ОН,. О. NO..
Как примесь к вйрывЧатым веществам, он был предложен Волней, в
качестве вещества, 'идущего на изготовление незамерзающих дина-
митов—„Deutsche Sprengetoff A. G.“.
Динитрохлоргидрин получается нитрацией монохлоргидрина в
отдельности или в смеси с тринитроглицерином. В воде он не ра-
створим. ' ,
Дииятрохлоргидрин в чистом виде представляется в виде проз-
рачной жидкости, более жидкой, чем нитроглицерин. Технический ди-
нитрохлоргидрин окрашен в желтоватый цвет. Обладает слабым эфир-
ным запахом; физиологическое действие подобно нитроглицерину.
Растворяется в органических растворителях, зато не растворим в
воде и кислотах; смешивается с нитроглицерином и желатинирует
колодибнный хлопок, подобно последнему. *
При медленном нагревании в пробирке начинает разлагаться
при 140—145° с образованием бурых паров, при 160—170’ начинает
возгоняться, а при 190 до 205° дает вспышку, подобно нитроглицерину.
При воспламенении це детонирует, так что даже большее партий его,
упакованные в обитые железом ящики, сгорают без взрыва. В этом
отношении резко отличается от нитроглицерина, и это свойство его
послужило основание^ к допущению его к перевозкам по железным
дорогам (Германия). По опытам Каст‘а возгонка под давлением в
60 т.т. происходит при 145о, при чем наблюдается разложение; при
давлении в 20 т.т. возгонка происходит при 131°, а при давлении
в 16 т.т.—при около 100°, хотя и в данном случае наблюдаются слабые
признаки разложения.
Удельный вес при 15°, смотря по чистоте продукта, колеблется
между 1,53 s и 1,543 (Каст).
К удару менее чувствителен, чем нитроглицерин; к, тому же,
вследствие своей текучести, легко растекается тонким слоем, чем
ослабляется сила удара. Ниже приведем таблицу для сравнения чув-
ствительности к удару нитроглицерина и дпнитрохлоргидрина, заим-
ствованную у Каста. ,
* »
г1 d¥:i- . А-*Г
ИЕ*^ •'
№’
Шг
-
&
"Л
лицерин (жидкий).................
(отвердев.).............
зитрохлоргидрин (жидкий)............
динамит (75 '<,) из нитроглиц.....
, (75 <) „ динитрохлоргииа . .
1 Взрыв происходит. ’
При падении навески в
; 2 клгр. i Ю ’клгр.
I с высоты
4-10
10-20
8
15—30
с сильным
в CM
8—10
2
треском,
В то время, как нитроглицерин детонирует
динитрохлоргидрине наблюдается лишь местная детонация с сла-
«<Шм потрескиванием. Также и гурдинамит из динитрохлоргидрина взры-
гораздо более слабым треском, чем таковой из нитроглицерина.
7 испытании чувствительности к удару было установлено, что
трохлоргидрин гораздо более чувствителен к падению
tX навесок.
:тания в свинцовой бомбочке показали, что:
нитроглицериновый гурдиномит даст вспучивание в . .
» . » » ® • *
Технический динитрохлоргидрин имет два изомера: .
JtkV-.
о/
мо
Динитрохлоргидриновый
MP,*
Динитро—а—хлоргидрин.
/ CHj. CI
/ CH. 0. Nbo
CH. 0. NO,
более
300
235
Дпнитро—/?—хлоргидрин.
СНг. 0. NO»
СН. С1
СН»
2-
тя-
СП1
Кл
./ Динитрохлоргидрин более трудно замерзает, чем'нитроглицерин
циклически, в смеси с последним, может быть обозначен незамер-
ВДОИ* Каст произвел ряд опытов для выяснения степени влияния
||$Н' динйтрохлоргидрина на понижение точки замерзания нитро-
Й&рина (взят был сравнительно чистый динитро—а—хлоргидрин с
|®?отвердевания в +1,6°), причем оказалось, что примесь 10 — 12%
(Йрпхлоргидрина понижает точку замерзания на 4—6», примесь в
^Йа 10—12°. При больших примесях смесь сохраняла тестообраз-
Ькрн^ияатенцию и полное отвердевание наблюдалось лишь при
Кельном понижении температуры.
Ммхболее чистый динитро—а—хлоргидрин, полученный Каслом,
ИЬудельным весом в 1,541 и точкой отвердевания b -J-50. В дру-
ИЬчаях точка отвердевания опускалось до —4,51
^Мш&Ным таблицы, однако, точка отвердевания наболее чистого
^^Кжт-хлоргидрина, в соответствии с высшей точкой плавлейия,
находится выше+7,1 °.
г Сорт. Исходный материал (хлоргидрина). Готовый продукт (динитрохлоргидрин)
Удел, вес. Хлор (теор. --32,00 J Удел, вес. Хлор (теор. = 17,71%) •/о Азот, (теор. -13,97%) % Точка от- вердевания градуса. Точка плав ленид гра- дуса.
- . । г ...
1 1 : 1.327 30,79 1,543 16^85 13,95 <•3,5 до 4 1,0 • » 6,0
II 1,327 31,73 j 1,541 17,51 \ 13J9 ! +5,0 5 t ,0 до
И1 1.321 32,64 ; 1,538 17,67 ; 13,78 , - 4,5 до — 4, Ь - 1,6 до —
IV ’ 31,83 1 1.540 1 17,29 ’ 13.83 1 ’ 4 28 до -4-5,6 до | 5?
i
При детоации динитрохлоргидрин образует соляную кислоту
Из гигиенических сопряжений следует прибавить к нему вещества
связывающие кислоту. Таким веществом является нитрат едкого ка-
дия (натрия). Этом Ьримесь, которая, между прочим, прибавляется и
пр другим соображения (как вещество богатое кислородом), придает
динитрохлоргидрину большую антигризутность, вследствие образования
хлорида патрия.
Продукт нитрации дихлоргидрина, мононитродихлоргидрин, ( -
Hs (О. NO2). С13, также предложен в качестве примеси к нитроглице-
риновым взрыввеществам, частично совместно с динитрохлоргидрином.
Этот продукт, полученный впервые Henry, обладает удельным весом в-
1,460 при 15° (по иследованиям Каста). Он еще более жидкий, чем
динитрохлоргидрин, вследствие чего, для предотвращения выпотева-
ния, прибавляется к взрыввеществам только в небольших количествах
При нагревании разлагается, подобно динитрохлоргидрину и
вспыхивает при 215°. Под давлением в 30 м.м. возгонка происходит
без разложения при 110е; при давлении в 20 »Г.м. точка кипения
равна 98°.,
Из многочисленных азотных эфиров глицерина, интересны также
нитроацетины и нитроформины. Среди нитроацетинов особенное вни-
мание на себя обращает динитромоноацетин— жидкость, обладающая
почти такой же силой, как и нитроглицерин, но менее чувствительная
к ударам. Будучи прибавлен к нитроглицерину в пропорции 10— 30%..
динитромоноацетин понижает точку замерзания его до—20" С.
Динитромоноацетин хорошо желатинирует питроцеллулозы к-
может представлять значительный интерес с точки зрения примене-
ния своего к бездымному пороху.
Получается путем нитрации моноацётина сулъфоазо^ной смесью
при температуре ниже 25%° С; моноацетин же приготовляется нагре-
ванием до 100° С глицерина с кристаллизующейся уксусной кислотой.
Нитроформины получаются тем же путем; моноформин - нагрева-
нием. глицерина до 150° С со щавелевой кислотой.
Применение глицерина в технике (не считая области взрывчатых
веществ) громадно: моделирование, консервирование продуктов, его
прибавляют к нюхательному табаку, при ликерном производстве, при
изготовлении лимонадов и эссенции, его примешивают к вину, уксусу
— 213 —
Лпеелизация), им смазывают часовые механизмы,
^йя копировальных чернил, его употребляют в
Ж Он прекрасно растворяет красящие вещества, приготовляемые
гноугольной смолы (анилиновую синь, цианинфанилин-фиолет
, (и ализарин). Затем идет также на приготовление глицери-
шлихты, на пропитывание приводных ремней, его прибавляют
КШде газоизмерительных аппаратов, чтобы сделать их трудно замер-
Д&ющими зимой, он идет на изготовление гектографических масс, из
он идет, для
косметике и
W-Wepo приготовляют искусственное горчичное масло (сульфоцианаллил),
И>с глетом он дает быстро твердеющие замаски. Глицерин растворяет
.И -значительное количество мышьяковистой кислоты, при чем этот ра-
. створ употребляется при печатании синими красками на ситцах.
5. Четыре^атом-
«ые спирты и hjc
' эфиры.
^с большой силой при ударе и нагревании. Сам по себе на практике
? н® употребляется, однако, один из высших гомологов эритрита, а
.дйаденно — пентаэритрит, СНзСДФ, (0Н)4, будучи нитрован сульфоазотной
СйЙвЬ^О, образует твердое тело тетранитропентаэритрит, плавящееся
при ,143• и представляющее очень устойчивое тело, взрывающееся
-с огромной силой.. Теплота его образованная + 115,5 калорий. Его
Предложили принять в бездымном порохе, но главнейший его недо-
.статок—высокая стоимость пока не дает возможность его использовать-
на практике. Самый исходный материал, из которого он готовится,
т.-е. пентаэритрит, может быть получен синтетически при помощи кон-
денсации водного раствора смеси формалина с ацетальдегидом в при-
<сутствии извести; 4-НСОН -ф СЩСОН -ф Н20 = НСО2Н -ф СН3С4Н<ОН)4
; § $..? ГШтиатомные
;-спирты или пенто-
ды и И£ эфиры.
^врабит, получающийся из арабинозы. Все эти изомеры при помощи
Сульфоазотной смеси (содержащей 2 части азотной кислоты и 5 частей
фШтйой кислоты) дают взрывчатый 5 азотный эфир—С5Н7 (ONOS)5. При
50’С последний уже начинает разлагаться, а при 120—140®С взрывает.
ЙГорячая вода и .слабые щелочи его легко омыливают. Практического
значения не имеет.
1-ф.
7. Шестиатомные
►ты или гексолы
и иа
ф
J> J
'4
<ф
>',J <
Г
fv г
f
н
f -,
<?v
>»***.
ч5^-’
► Ь
; .и1
Наиболее известный из четырехатомных спиртов
есть эритрит С< H0(OH)t. Эфир наивысшей степени ни-
трации эритрита есть тетранитроэритрит (ONOS\.
Это твердое тело, плавящееся при 61® С, взрывающееся
Общая формула этих спиртов Сл Н2« _з (0Н)5.
Наиболее известные из этих спиртов суть: пиннит—
.сладкое вещество, извлекаемое из выделений коры
некоторых хвойных, кверцит, получающийся из желудей
Наиболее известные шестиатомные спирты суть
дульцит, сорбит и маннит СВН8(ОН)8. Последний чаще
других встречается в природе и приготовляется
искусственно при помощи амальгамы натрия из глю-
и помощи сульфоазотной смеси все они дают шестиазотные
Дитроманнит Св Н8 (ONOs)e представляет чрезвычайно могу-
Вое взрывчатое вещество, очень чувствительное к удару (зна-
.более чувствительное, чем нитроглицерин), и потому очень
обращении. Он значительно больше растворяется в горячем
вк в холодном, и этим пользуются для его очищения путем
перекристаллизации и последующей промывки водой готового про-
дукта. Он представляет тонкие игольчатые кристаллы, плавящиеся
при 112° С и взрывающие при 210° С. Он медленно разлагается "на
свету. Взрывчатое разложение его следует по формуле:
С,Нк(ОМО2)0 = 6СО2 + 4Н20 + 3N, + 02.
Как видно, в нем имеется, избыток кислорода.
Взрывчатые константы его характеризующие суть:
f = 9247 килограмм,
у0 =691 литр,
t = 3247е С, /
Р = 616 -Т—-
метр.
Как видно, он почти эквивалентен нитроглицерину.
Скорость детонационной волны 6900—77'00 «етр. в секунду. что
делает его очень выгодным для применения при приготовлении дето-
нирующих шнуров, и действительно такие шнуры изготовлялись
в Австрии. Нитроманнит в расплавленном виде растворяет коллодион- ,
ный хлопок, но свойство это не может быть практически использовано
в силу того, что он сам при этой температуре не обладает достаточной
стойкостью.
Маннит может давать, кроме шестиазотного, также и пятиазотный
эфир—твердое вещество, плавящееся при 82еС и разлагающееся при
температуре около 125° С. Под действием нагревания маннит пере-
ходит в так называемый манитан С6НК(ОН)4, который в свою очередь,
при помощи нитрации на холоду, дает соответствующий эфир, обла-
дающий также сильно взрывчатым свойством и чувствительный к
ударам.
б) Дульцит дает такие же эфиры, как и маннит, которые обла-
дают теми же свойствами.
Азотные эфиры охлорейных производных этих спиртов также
обладают сильно взрывчатыми свойствами.
Г Л А В А Г11.
Углеводы.
$ л. Общие замечания. Как известно, общая их формула ]1С6Н10О5—(п — 1)
Н20. Те, в которых п==1 число атомов С=С обыкновенно разделяются на
альдозы и' кетозы, первые характеризуются наличием в их молекуле
Н
альдегидной группы —C^q, вторые кетогруппы — СО—. Поэтому и
в своих реакциях они проявляют характерные различия. Так, обмы-
лив нитрилы тех и других и заменив спиртовые водные остатки
ооэ
гос.ъчи л..* »-. i
Wi*-
'Ck
X-.
Ш
'.; X -: J‘.V
215 —
- 7
V*
./г;
J"-
(
,„ Мы из альдозы получим нормальную жирную кислоту, а
— йзокислоту.
^ГШвисимости от числа атомов углерода, составляющих цепь,
Иф?: диозами (напр., гликолевый альдегид), триозами (напр.
НДОза), тетрозами, пентозами (напр., арабиноза, ксилоза и т. п.),
ДОЛми (напр., глюкоза и ее изомеры) и т. д. Последние, т.-е. гек-
Sh- С6 Н1о О,, составляют наиболее значительную группу, являясь
вводными изомерных спиртов: маннитов (манноза, фруктоза), сер-
(глюкоза) и дульцита (галактоза), они заключаются в большом
ЭЙИЧеетве органических веществ, нося название сахаров. Из них
||ЙС03а пользуется наибольшим распространением; она легко полу-
имя действием разведенной серной кислоты на картофель.
ВаГлюкоза есть альдоза, которая подобно спиртам может быть
Ия^уно обезвожена, давая соответствующий ангидрид-глюкозану.
К$ущертвует в природе большое число соединений происходящих
готически от соединения альдозы со спиртом. В производных ше-
мйгрмного ряда их' зовут глюкозидами или полиглюкозидами, если
|ийх сгруппированы более основных молекул.
И;;Между этими телами те, кои содержат соединения двух молекул'
ДОрзы с отнятием одной частицы воды, называются дисахаридами
|и, сахаробинозами Ста Н2з Оц, типом коих может служить тростнико-
вой свекловичной сахар. Резведенная серная кислота при кипяче-
Й расщепляет сахарозу на глюкозу и левулозу; нагревание же—
Мцинляет ее на' глюкозу и глюкозану; Отнятие большего числа
$$гиЦ воды от глюкозидов обращает их в декстрины, общая фор-
0«та' коих отвечает полимерам глюкозаны.
ш.; Наконец, крахмал, клей и целлулозы, суть высшие комплексы,
Втветотвующйе той же формуле (Сс Н)о О.) и их причисляют* обы-
й^нной к полисахаридам. При помощи гидролиза крахмал расщеп-
на декстрин и глтркозу. Большая часть полисахаридов гидро-
К^ется подобным же образом, хотя впрочем в отношении целлулозы
Ьйдиз совершенно оказывается беспомощным.
|ф)С точки зрения своего химического состава углеводы суть наи-
МЙе исследованные соединения, часть из них к тому же (как, напр.,
jjgMaj,; целлулоза и др.) имеют неопределенную органическую фор-
EoL НТО делает химическое исследование их особенно трудным.
Е|й»огпюкозы и Глюкозы способны нитроваться сульфоазотной
Ьдоодарозы. смесью, давая пятиазотный спирт глюкозы. Эта выс-
Й степень нитрации глюкозы имеет вид белого порошка плавяще-
Ьпри + 10’С и разлагающегося со взрывом при 135°С. Билль его
кил, растворяя при 0’ глюкозу в азотной кислоте удельного веса
^ИЗри медленном Прилитии серной кислоты нитрованный продукт
ИЙется В виде маслянистой массы, которая после охлаждения
Ииащается в твердое тело белого цвета; после охлаждения его
Мнвают.
^В&рдчая' вода его .разлагает, производя, подобно щелочам, омыли-
^ШЗйтроглюкбза—взрывчатое вещество посредственной силы.
^Ивергая подобному же процессу нитрации д и сахариды, полу-
^^|Ь£йиаэотные эфиры их, твердые т&ча плавящиеся при различных
^ИМгурах смотря по происхождению (так, напр., для продукта.
1
I
W
'-aft
^5
' b,
4'!
;Л;
' '*&
-л
fc
7
•j:.
go;
— 21G —
полученного. на. тростникового сахара точка плавления равна 28*0, а
для того, который приготовлен из мальтозы 163*0). Все они взрыв-
чаты и чувствительны к ударам, малоустойчивы при нагревании, так
что начинают уже разлагаться при температурах около 50*0; точка
воспламенения большинства из них около 135*0.
\ Нитросахар—густое вещество напоминающее клей, при высуши-
вании обращается в твердое хрупкое вещество белого цвета, раство-
римое в спирту и эфире. При осторожном нагревании он разлагается,
при быстром же, также как и при ударе, сильно взрывает. Не обла-
дает достаточным постоянством. Были попытки его применения в
качестве взрывчатого вещества (петражит), но он не получил распро-
странения, благодаря отсутствию достаточного постоянства.
Лактоза также способна нитроваться давая нитролактозу—сильно
взрывчатый продукт. Кристаллизуется она из спирта и эфира в виде
перламутровых пластинок; также не обладает достаточным посто-
янством. •
• Подобными же свойствами обладает продукт нитрации клея —
нитрогумми. '
Раффиноза, трисахарид дает эфир, представляющий липкую
массу, плавящуюся при 55*—65*0, мало устойчивую. Для получения
нитрорафинозы обрабатывают сахар-рафинад в охлажденной сульфо -
азотной смеси (2:1), затем полученное вещество промывают водой,
растворяют в спирте и снова осаждают из этого раствора водой.
Желая практически использовать, это взрывчатое вещество, предло-
жили его делать из нитромелассы (меласса—продукт свеклосахарного
производства),, но в виду изменчивого состава самой мелассы—оче-
видно, и продукт ее нитрации не будет всегда иметь одинаковые
свойства.
' Полисахариды: декстрин, клей, крахмал, целу-
? з. Крахмал и нитро- лоза дают также азотные эфиры обладающие взрыв-
i крахмал. qaTHMH свойствами
Их пробовали применять, ввод^ в состав некоторых взрывчатых
веществ, неполучивших • распространения вследствие непостоянства
' состава их.
Из них наибольший интерес представляют для технологии взрыв-
чатые вещества нитропроизводные крахмала и клетчатки. Крахмал—
(С6 Н1в Or.) х — представляет одно из наиболее распространенных
веществ растительного мира. Крахмал не растворим в воде; но если
его нагреть с водой, то оболочки разрываются, а содержимое их раз-
бухает—образуется клейстер. При нагревании со слабыми кислотами,
также под действием диастаза крахмал гидролизируется и дает маль-
тозу и декстрин; мальтоза же в свою очередь гидролитически распа-
дается и доставляет d —глюкозу. Крахмал не дает реакций, характерных
для моноз. < ’ иодом дает характерное синего цвета растворимое в воде
соединение.
Обрабатывая крахмал десятью частями дымящейся азотной кис-
лоты и поглащая образующуюся при реакции воду, получают моно-
натрокрахмал, или ксилои дин» предложенный еще в 1832 году Враконо
в качестве взрывчатого вещества, и два динитрокрахмала.
Ксилоидин имеет вид белой творожистой массы, нерастворимой
в воде, но растворимой в -эфире, он гигроскопичен, Взрывает, дри
175*0;’не обладает достаточным постоянством, обнаруживая наклонность
к саморазложению. Ксилоидин предложен был Ухациусом для при-
менения при приготовлении пороха, но, благодаря непостоянству
состава и недостаточной стойкости, не мог войти в употребление.
- Если азотнокислый раствор крахмала обработать не водой, а
сульфоазотной смесью на холоду, то получится два четырехазотных
эфира крахмала: [С,2 Н16 Oe (0N02)Jn.
Тетранитрокрахмал—гораздо более сильное взрывчатое вещество,
чем ксилоидин, и в настоящее время заняты изучением его с целью
применения к бездымному пороху, однако, еще не достигли достаточ-
ной его стойкости.
Билль еще указывает на шестиазотный эфир в виде белого по-
рошка, который после очистки его спиртом он считает достаточно
стойким. Температура взрыва этого вещества около 194°С. Наконец
Arthur Hough получил заводским путем восьмиазотный эфир крах-
мала, содержащий 1С,5о/0 азота, применяя для нитрации сульфоазот-
ную смесь, содержащую дымящуюся серную кислоту.
Кроме перечисленных нитропроизводных крахмала, известны
еще: динитрокрахмал, представляющий интерес ^исключительно на-
учный; гексанитрокрахмал, — белый порошок, после ^перекристаллиза-
ции, невидимому, обладающий достаточным постоянством; он взры-
вает при нагревании до 190°, и, наконец, октонитрокрахмал—еще. не-
достаточно хорошо изученное химическое соединение.
Как уже замечено было раньше, в ряде нитро-
§ 4. клетчатка или цеп- .глюкозидов, нитроцеллулозы представляю®, соеди-
пулоза и ее нитропро- нения наиболее комплексные.
изводные. Нитроцеллулозы получаются путем нитрации *
веществ богатых клетчаткой (СвНюСЪ)^ среди ко-
торых первое место занимает хлопок, для целуллрзы которого при-
нимают формулу: CoiHigOao- Из продуктов нитрации клетчатки на-
ибольшее значение имеют различные сорта пироксилина. Процесс
получения этих нитроцеллулоз будет описан в следующем отделе
книги, здесь мы упомянем: лишь о "некоторых химических свойствах
клетчатки. Образцом почти чистой клетчатки может служит тонкая
фильтровальная шведская бумага. После обработки такой бумаги ед-
ким кали, соляной кислотой,’ водой, спиртом и эфиром, клетчатка по-
лучается в виде белого порошка, нерастворимого ни в одном из
обычных растворителей. Р1е, однакож, можно растворить в аммиач-
ном растворе окиси меди (Швейцеров реактив). Из такого раствора,
'-клетчатка осаждается кислотами и солями в виде студенистого
йеадка, высыхающего в аморфный порошок. При нагревании с кисло-
ИВИи, клетчатка гидролизируется; при этом в зависимости, от того,
МЙбй клетчаткой пользовались, получается та или другая моноза-
ЙГреакцией устанавливается углеводная природа клетчатки. При
^Ип|ии на нее ангидридом уксусной кислоты получается восьми-
^^Мкое производное, которое при обработке едким кали дает особую
^^Мк^аким путем подтверждается присутствие в клетчатке водных
считая военных ведомств, потребляющих пироксилйп и
коллодионный хлопок, растворимая нитроклетчатка имеет громадн.-е
применение и в повседневной нашей жизни. Достаточно указать на
то, что целлулоид, на изготовление которого идет растворимый пи-
'роксилин, потребляется ежегодно в количестве свыше 25.000 тонн,
искуственного же шелка выделывается более 5.000 тонн в год, Коже-
венные и другие лаки, водоупорные составы и связующие вещества,
употребляемые при фабрикации колпачков газокалильного света, еще
далеко не исчерпывают список производств, потребляющих нитро-
целлулозу.
Дорогой хлопок пробовали заменить другими веществами, бога-
тыми клетчаткой: джутом, коноплей, льном, соломой, древесными
опилками, мукой и т. п. Из них наилучшие результаты дали лен
и конопля, затем древесная мука, но все они дают нитропродукты
значительно нисшего качества, чем хлопок.
ГЛАВА IV.
Производные угольной кислоты.
Из органических производных угольной кислоты для технологии
в. в. имеют значение ее амидопроизводные, из которых мы рассмот-
рим мочевину и гуанидин, впервые синтетически полученные Веле-
ром (1828 Г/). -
NHa,
§ 1. Мочевина имеет формулу СО:^ кристаллизуется в приз-
NH.,,
мах, легко растворимых в воде и спирте. Плавится при 132° и при-
дальнейшем нагревании дает биурет, переходящий при дальнейшем
нагревании в циануровую кислоту. На этом свойстве мочевиды осно-
ван способ получения из нее циановых соединений. Как вещество
основного характера, мочевина с кислотами образует соли (однако
лишь одно кислые), как, например, CO(NH2),HCI, COfNH,^, NO.iH и т. д.
Известны также продукты замещения водорода амидо-груйп моче
. вины, как, например, нитро и нитрозопроизвбдные.
Нитромочевина
NO,
получается действием концентрированной серной кислоты на азотно-
кислую мочевину или образуется прямым взаимодействием мочевины.
и двуокиси, азота. Характер имеет кислотный," почему примёйЬ>й£
нитроМочевины в качестве стабилизатора азотных эфиров не совсем
безопасно, несмотря на легкость поглощения ею азотистых паров,
т. ,j6. благодаря своим кислотным свойствам может усилить разло-
жение азотнокислых эфиров, вместо того, чтобы замедлить его.
. .С целью выяснения возможности применения в качестве стаби-
лизаторов замещенных производных мочевины, произведен был ряд
опытов, показавших, что некоторые из них, невидимому, могут дать
ХОрдШие результаты. К числу таковых относится например: диметил-
Ши^мылмочевина (центр алит), которая в действительности и прИме-
. ЙЯЙЬЯ в качестве стабилизатор^. в бездымном порохе.
t - /
. § 2. Гуанидин. Q=NH.
. NH2,
по строению своему представляет амид имидоугольной кислоты, т. е.
отличается от мочевины тем, что кислород карбонила замощен ими-
догруппой. Гуанидин кристалличен и легко растворим. Дает взрыв-
чатые производные. Он готовится или из цианамида кальция, либо
из сульфоцианата, нагревая сульфоцианат аммония (способ Фоль-
гарда). Гуанидин — сильное основание, образует однокислотные соли,
в том числе характерную углекислую соль, и нитропроизводные.
Азотнокислый гуанидин — белые пластинки очень мало раство-
римые в холодной воде и взрывающие от сильного капсюля гремучей
ртути.
Теоретический подсчет дает следующей величины его взрывча-
тых констант:
f =5834 килогр.
v„ = 12SO литр.
> ‘ 1
, Гуанидин образует между прочим многочисленные производные
> ' и в том числе нитрогуанидин'.
U” >
образующийся действием серной кислоты на азотнокислый гуанидин
Mil Nil.
по реакции: NH = C<^ _-ЩО •= NH = (X Н
• NIL.’HI.M) ’ N<
NO.
вди действием сульфоазотной смеси на углекислую, хлористую и
сульфоцианистую соли гуанидина. 1
Нитрогуанидин CNJItО- кристаллизуется в игольчатых кристал-
ликах, почти не растворимых в холодной воде' и плавящихся при
230°, и обладает слабокислыми свойствами. Он значительно легче
взрывается, чем азотнокислый гуанидин, но очень мало чувствителен
• к ударам; взрывается от капсюля в 1,5 грм. гремучей ртути. Как
взрывчатое вещество, он замечателен исключительно низкой темпе-
ратурой газов, образующихся при взрыве, а именно, всего лишь
907°С, и характеризуется нижеследующими взрывчатыми константами.
I -4790 килогр.
v# — 1073 литра
t = 907’
Нарывчатое его разложение следует в формуле:
CNJI4O2 = СО Н- II. О Но f 2No.
• &
Нитрогуанидин был предложен, и не без успеха, для понижения
температуры газов в аитигризутяых веществах, а также нитрогли-
цериновом порохе, но его высокая стоимость и ядовитые продукты
взрыва пока препятствуют его применению на практике.
Заслуживает внимания также пикрат гуанидина, благодаря не-
которым интересным своим взрывчатым свойствам, которые и обу-
словливают попытки его применения на практике.
' Из нитропроизводных гуанидина заслуживает также быть отме-
ченным нитрозогуанидин — вещество, взрывающее при 160".
Гуанидин и его соли предположено применять также в качестве
стабилизаторов азотных эфиров, но против применения их с этой
целью можно сделать те же возражения, как и в отношении мочевивы.
ГЛАВА V.
Производные циана С Д,
§ 1. Циан и гре-
мучая кислота.
Кроме, перечисленных из соединений алифатиче-
ских в технологии взрывчатых веществ, весьма важное
значение имеют производные циана.
нитрил щаве-
*ЧЛ**-
*7
$*) Тремучее Сребро получено было также в 1800 году.
*) Профессором А. А. Солонина в 1909 году предложены несколько иные
лы для гремучей кислоты:
N - СП
С NH II -C^N~()
л А' $'
. -г-Л
Ов^ы‘;. М
кД « 4 Я*-' V/ yvwini«4 MMlilU |
TgOiY’C. При сгорании дает
. . лмЛд-' *гъ _
х.^-
г
Циан, химически определяемый как нитрил щаве
G=N, физически' характеризуется, как без-
\газ с резким запахом, сгущаемый в жидкость, кипящую
пламя, окруженное пурпурной
Реакция образования циана эндотермическая. Многие произ-
рего обладают резко выраженными взрывчатыми свойствами.
В, этом отношении наиболее важными для нас являются фу ли-
шили гремучие соли—соли весьма непостоянной летучей, гре-
бки С лоты, напоминающей своим запахом синильную кислоту и
ющей весьма ядовитыми свойствами.
Строение гремучей кислоты, по всей вероятности, С Х.ОИ, т. е.
ла ее допускает двухвалентный углеродный атом; по крайней
, при действии хлористого ацетила на гремучую ртуть образу-
соединение СНз.СО(СКО); с другой стороны, при обработке со-
кислотой она присоединяет воду, вследствие чего образуются
Ксйламин и муравьиная кислота. Действие брома на гремучую
приводит к соединению Вг.СоЛаО-а, со структурой
N —О
Л
Дре фульминаты обладают взрывчатыми свойствами и из них тяже-
бных—метпутлов в особенности. Гремучая ртуть есть типичный детона-
тор, и до сих пор в смысле практического своего применения она
может иметь конкурентом разве только азид свинца*)- •
Ввиду важности практического применения этого
* 2- дремучая вещества во взрывчатой технике, на ней надлежит оста-
ртуть. новйться несколько подробнее. „
Желая получить хлористую ртуть, английской химик Е. Ho-
ward в 1800 году случайно получил серый порошок (C=^NO)4Hg,
обладавший сильными взрывчатыми свойствами; названный гремучей
ртутью **).
В. Howard, исследуя открытую им гремучую ртуть, пришел к за-
[в ключению, что в ней заключается около 64,7% ртути, 21,3% щаве-
1 левой кислоты и 14% этилнитрита, что, однако, оспаривал Бертоле,
$ также принявшийся за ее изучение. По мнению последнего, в со-
став гремучей ртути входят: сильно окисленная ртуть, аммиак и ка-
кое-то органическое вещество, но не щавелевая кислота.
Дальнейшие исследования Фиркруа и Тенара Доказали, что в
;.йависимости от условий ведения процесса приготовления гремучей
ути получается, продукт, содержащий щавелевую кислоту, или
К»’
лишенный ее и что в этом отношении и Говард и. Бертоле были
правы каждый по своему.
Классические работы Либиха и Гей-Люссака с гремучими солями
ртути и серебра, производившиеся ими|вб вторую половину первой
четверти XIX-го столетия, установили, 4Tq как гремучая ртуть, так и
гремучее серебро, суть соли одной и той же кислоты.
Далее ею много занимались Кекуле, Шишков и другие химики.
Около 80 годов XIX-го столетия изучением взрывчатых свойств
гремучей ртути занялись Бертело и Вьелль. При помощи взрывов
в бомбочке, они установили, что взрывчатое разложение ее следует
уравнению: .
02К»0 Hu=2CO-+X4-Hg
и что 1,00 грамм ее при этом выделяет 403,5 калорий откуда они
вычислили, чтотемпература взрыва гремучей ртути достигает 4000°.
Ими же установлвво,'^то давление газов, развивающихся при
взрыве, сильно завися от плотности заряжания, в тоже время для
гремучей ртути' значительно меньше, чем для пироксилина:
Давление в килограммах.
Плоти. заряжания.
Для трем.
ртути.
Для пирок-
силина.
0,1
0,2
0,3
0,4
1085
3120
5575
8 (45
Они пришли к выводу, что на месте соприкосновения гремучей
ртути со стендами бомбочки, развивается колоссальное Явление—не
меньше 4S.000 атмосфер.
Существующие методы получения гремучей ртути можно разде-
лить в сущности на две категории. К первой относят способы ее по-
лучения действием раствора металлической ртути в азотной кислоте
на органические соединения, содержащие несколько атомов углерода
в частице, а также углерод и кислород:' ко второму же—основан-
ные на действии сулемы или азотнокислой ртути Hg (NO3)jL на орга-
нические вещества, содержащие лишь 1 атом углерода в чаЬтице.
Второй способ по своей дороговизне и малому выходу имеет
лишь научное значение. К не^у принадлежат методы: а) Метод Шолля,
основанный на действии сперва едкого натрия на мбнохлорформоксищ
а затем сулемы; б) действие сулемы на натрий—нитрометан при на-
гревании (способ Nef’a) и в) способ Вилянда, основанный на нагре-
вании смеси метилнитроловой кислоты, воды, азотной кислоты и азотно-
кислой ртути.
К первой категории относятся методы получения гремучей ртути
действием раствора ртути в азотной кислоте на винный спирт, кото-
рый могут заменять: лигнон, диметилацеталь, диетилацеталь, ацеталь-
дегид, паральдегид, метальдегид малоновая кислота и т. и.; в технике
пользуются с.
этой целью вйнным спиртом.
спирта, можно поступать
в кислоте к спирту, или обратно.
•Л
дочительно
[Ю при помощи винного
ибавлять раствор ртути
кивании к спирту раствора ртути в кислоте основан способ -
I, несколько измененный Бекманом, по которому, однако, в на-
_^е" время уже не работают в заводском масштабе.
й'Э Карсяуе на заводе Deutsche Waffen und Munitions Fabriken
Цучая ртуть (серая) получается таким образом:
400,0 грам. метал, ртути растворяются в 4,20 килограмм, азотной
лоты, крепостью 4О°/о и полученная жидкость приливается к 4 лит-
г 96% спирта; перед смешиванием спирт нагревается до 40°С, .а
>твор дэтути—до 50—55°С. На одну весовую часть металлической
ти приходится 10,5 частей азотной кислоты и 8,118 частей спирта
весу).
На Охтенском заводе 1 ф. ртути растворяют в 11 ф. азотной ки-
Ооты крепостью 40’ по Вё и Йолученную жидкость приливают к 10 ф.
ВО зол. 961///,, спирта, причем иногда производят подогревание ра-
створа ртути. .
оВесовые отношения такие' на одну часть ртути приходится И
частей- азотной кислоты и 10,625 частей спирта.
Белая гремучая ртуть готовится на заводе в Рейнсдорфе близ
Виттенберга. По способу этого же завода Вырабатывают ее и на нашем
Охтенском заводе. Берут, 500,0 грамм ,ртути и растворяют в 4,50 килогр.
азотной кислоты крепостью 40» ио Вё; к полученной жидкости при-
бавляют 5 куб. сант. соляной кислоты крепостью в 15° по Вё и 5/1 грм.
красной меди. Ртутный раствор приливается к 5,0 литрам винного-
•спирта крепостью 92° — 95°. Температура, при которой должна проте-
кать реакция, равна 20° С.
Весовые отношения здесь следующие: на 1 часть ртути, 9 частей
азотной кислоты и 8,3 — 8,16 частей спирта. Venin u Chesneau (Boudres
.fet explosives 1914), дают в общих чертах способ приготовления гре-
мучей ртути, основанный на приливании спирта к раствору ртути в
азотной кислоте. Очищенная метцллйчеЦкая ртуть в количестве 300
грам. растворяется в 3 килогр. азотной кислоты и к этой жидкости
йриливают 3 литра этилового спирта, крепостью 95°. Возникающая
реакция поднимает температуры смеси до 50°—60°С и ее умеряют при-
бавлением нового количества спирта, как .только появятся бурые па-
ры окислов азота. При этом происходят побочные реакции,—в част-
ности образование альдегидов, этилнитрата и этилнитрита, выделя-
ются пары спирта, альдегида и т. п., кои и отводятся в-соответствую-
щие конденсационные аппараты.
Через 3/4—1 час реакцию можно считать уже почти законченной,
и гремучая ртуть оказывается уже выделившейся в виде оче’нц Мел-
ких кристалликов. После этого все переносят в большой сосуд и
дают стоять до следующего дня. Затем осадок промывается, утили-
зируя промывные воды, так как гремучая ртуть несколько раствори-
ма, в'воде.
А > Сушку производят в малых эбонитовых ящиках или на дере-
вянных рамках, по которым натянуто полотно. Сушить однако грему-
чую ртуть надо только перед самым употреблением, ибо для безо-
пасности ее следует, всегда хранить залитою водою.
Гремучая ртуть' взрывает уже при самых слабых ударах, а так
же при нагревании до температуры около 160°С.
Под водой ее можно безопасно растирать в порошок и, в таком
виде, она значительно менее чувствительна к ударам, нежели в бо-
лее или менее в крупных кристаллах. При содержании 20% воды гре-
мучая ртуть практически перестает быть чувствительной к ударам. К
присутствии влажности она медленно разлагается в соприкосновении
с металлами—в частности с медью, а потому медные капсюльные
гильзы должны быть тщательно никкелированы или покрыты надеж
ным слоем лака, ибо замечено, что гремучая ртуть ни на никкели
ровку, ни на лак не действует.
Можно было бы внутренность капсюльных гильз и лудить, так
ка# чиста# Гремуч## ртуть с оловом не реагирует, но в ней часто
имеется небольшая примесь металлической ртути (особенно в серой;
и тогда полуда может оказаться ненадежной, вследствие образования
амальгаммы. -
Растворы едких щелочей- и сернокислого железа разрушают гре-
мучую ртуть, а потому эти растворы позволяют уничтожать следы ее
в промывных водах и отбросах производства, в Тряпках, гильзах
и т. д.
Гремучая ртуть самостоятельно или в смеси с селитрами, хло
ратами, сернистой сурьмой и другими веществами служит для при-
готовления капсюлей и других детонаторов.
Гремучая ртуть—соединение эндотермическое и теплота ее обра-
зования—62,9 калор.
Ее взрывчатое разложение следует формуле:
Hg (С — М))2 = 2 СО + N. + Hg.
Взрывчатые константы ее таковы:
f = 4576 килогр.
v0 = 314 литров.
t = 3453°
1> =174,7
метр.
а 0,31 литр.
Как видно—гремучая ртуть далеко не принадлежит к наиболее могу-
щественным взрывчатым веществам, своим же дробящим действием
целиком обязана исключительной быстроте совершающейся реакции
взрывчатого разложения. Удельный вес ее 4,48.
§ з. Гремучее Химическая формула С (АО2) (CN) Ag2.
серебро. Как по химическому своему составу, так и по не-
обыкновенной бризантности, к гремучей ртути очень близко стоит
гремучее серебро Берлинети. Его готовят, прибавляя раствор одной ча-
сти серебра в 20 весовых частях азотной кислоты удельного веса
1,36—1,38 к 27 частям спирта крепостью 85»/о— 90°/,, и нагревая смесь
до кипения. После этого прибавляют еще 27 частей спирта и дают
охладиться.
1чеё серебро также можно получить, введя в спиртовый 1
Ьйса азотистую кислоту, приготовленную действием азотной
а порошок крахмала, или кипятя гремучую ртуть в воде с
Ми и платиновыми пластинками.
учее серебро представляется в виде мелких белых непроз-
-Игольчатых кристалликов, едва растворимых в холодной и
to заметно в кипящей воде.
акция его образования протекает по уравнению:
Получившийся тем или иным путем продукт осторожно сливается
цльтр, тщательно промывается на нем до тех пор, пока промыв-
Вб'ды перестанут давать кислую реакцию; затем мокрый, разор-
Зй на полреки фильтр сушится в эксикаторе на пропускной бу-
~ По причине крайней чувствительности гремучего серебра куда-
^причем оно взрывает даже под водой, при приготовлении- его
Йуат соблюдать величайшую осторожность и при работе стеклян-
ki палочки должны заменяться деревянными, Если его необходимо
ельчить, последнее допускается только путем растирания его меж-
пальцами, или при помощи пробки в фарфоровой ступочке, one-
>уя с самыми малыми количествами вещества. Особенную осто-
шесть необходимо соблюдать при фильтровании и промывке гбто-
э продукта, а также при сушке его.
Сухое Гремучее серебро сохраняется в небольших количествах в
Тонных ящичках. Чувствительность его к механическим влияниям
ЙителЬно больше, чем у гремучей ртути, и потому в обращении с
i надо соблюдать еще’ большую осторожность; брать его нельзя*’'
аче, как бумажными совочками.
' Гремучее серебро сильно ядовито; в кипящей- воде оно раство-
Мо весьма заметно: одна'часть гремучего серебра требует для свое-
растворения 36 частей кипящей воды, в холодной же его раство-
мость незначительна. Лйгкий удар двух твердых тел достаточен
я его взрыва даже под водой. Сильный взрыв его происходит так-
е в соприкосновении с накаленным телом в присутствии хлора и ,
? капли серной кислоты. Нагревание до 130°С. гремучее серебро вы-
держивает без взрыва. В сильно разреженном пространстве способ-
ЯёстЬ детонации невидимому утрачивается—происходит лишь сгора-
|$ие, сопровождающееся только слабым световым эффектом.
L Чрезмерная чувствительность гремучего серебра к трению исклю-
чает возможность его применения в капсюлях, и Оно употребляемся
дзючти исключительно при изготовлении елочных хлопушек,, в> пога-
ных Небольшое количество гремучего серебра наклеено на подоску из .
Пергамента, к которой приклеена такая же полоска с шероховатой
Поверхностью, производящая при смещении своем трение, гот которого
Йв взрывается гремучее серебро. К гремучему серебру в этих хлопуш-
ках также прибавляют немного песку или толченого стекла.
\ Другой препарат, по свойствам своим очень сходный с гремучим
серебром Берлинети, но еще более его -чувствительный
Проф. М. Сухаревский. Взрывчатые вещества в взрывные работы.
4
механиче-
15
едим влияниям, носят название бертолетовою гремучею серебра. Послед-
нее получают, действуя в течение 24 часов крепким аммиаком на
свежую осажденную окись серебра. При этом часть. окиси переходит
в раствор, часть же превращается в гремучую соль. Полученный кри-
сталлический порошок черного цвета осторожно сушится на про-
пускной бумаге. Его вероятный состав Ag?N,Ag,HN. Оно легко ра-
створимо в KCN.
Бертолетевое гремучее серебро, по причине своей исключитель-
< 1.Н?»
ной чувствительности к трению, никакого практического применения
не имеет.
Насколько оно опасно в обращении доказывают факты его взры-
wo^> ' iifyjr рп время промывки его, под влиянием падении ка-
При обработце кийяще^о раствора гремучего серебра хлористым
калием осаждается хлористое серебро и, пр выпаривании раствора,
выделяется двойная соль состава Ca^O^gK в виде серебристых че-
шуек, сильно взрывающих при нагревании.
§ 4. Гремучие соли Гремучее золото*) представляет вещество весьма
других металлов, сходное с гремучим серебром; сравнительно мало на-
следовано и, по причине своей дороговизны практического значения
иметь не может в ближайшем будущем,
Из гремучих солей других металлов больше других исследованы
гремучий цинк C^NjOaZn и гремучая медь C2N2O2CU.
Ни то ни другое соединение не применяются на практике, но
гремучая медь представляет значительный интерес по той причине,
что она случайно может образоваться на стенках капсюльных гильз
при хранении капсюлей в сырых помещения», если конечно внутрен-
няя поверхность не будет совершенно защищена от влияния гремучей
ртути лакировкой или никкелированием.
Гремучая медь, как то показал несчастный случай, происшедший
во время работ с Нею профессора. А. А. Солонины, при лабораторной
обстановке, значительно чувствительнее гремучей ртути к механичи-
ским влияниям и способна давать сильный взрыв даже под водой
Возможно, что появлению этого опасного соединения мы иногда обя-
заны преждевременныйи разрывами артиллерийских снарядов в тех
случаях, когда нет основания предполагать неисправность дистанцион-
ных и ударных трубок.
Гремучий цинк взрывает с силой, мало уступающей гремучей
ртути (А. Солонина).
S 5. Другие произ- Среди производных циана мы имеем не мало обла-
водные циана, дающих врывчатыми свойствами. Такова например
группа оксимов — в частности нитроформоксим или метилнитрововая
кислота:
. NO?
^NOH-
*) У помаваете* в трудах Базилиуса Валентина (в 17 веке).
J Тоже относится и к
тринитроацетонюпрчл:
груме нитронов, среда которых интересен
zKQ2
p/NO2
g\NO2
\CN '
вещество сильно взрывающее при нагревании до 220°, но нечувстви-
тельное к толчкам. Получают его, обрабатывая на холоду, изоциануро-
вую или фульминуровую кислоту, Или одну из ее солей, сульфоазот-
. НОЙ смесью. ‘
Сама по себе избциацуродая ^кйслоШад^рталгщет. слабое взрыв-
чатое вещество, щелошфШ которой‘^шйучайтобрабатывая гре-
мучую ртуть при кипячении раствором «^ри«?рй Щедрин. ,
Можно еще упомянуть Про ^'^Mfuidpo^caMoeyio Kucj&ny.
; _NH0 ' '.z ’..''V':
! HlcOH
продуктом окисления метиламина. Ртутная соль ее
Hg < q 5 CH
I
являющуюся
взрывчата и, по свойствам своим, очень близка' к гремучей ртути.
»
ПОД* ОТДЕЛ П.
г
Циклические соединения.
А. Класс ароматически^ соединений.
ГЛАВА I. •
Бензол, толуол, ксилол и нитропроизводные /
•; 1. общие зме- Как известно, существует значительное количество
чаиия. углеродистых соединений, которые сравнительно е
составом жирных тел богаче углеродом. Соединения эти легко всту-
пают в реакции замещения и лишь в редких случаях дают продукты
присоединения, не принадлежащие, однако, к классу жирных Тел..
Эти-то богатые углеродом соединения распадаются опять такйДЩ/рЦс-
колько подразделений, но все они обладают общим свойство^, .именно,
они все могут быть произведены от одной центральной срущвн, на-
иболее других исследованной и носящей название <фожаййт$<ясов, так
как многие вещества, к ней относящиеся, входят в состав бальзамов,
смол и др. пахучих веществ. Вое такие соединения содержат по край-
ней мере одну группу из шести паев углерода. ,
Простейшим представителем этой группы «МЩется беняол G6H0.
Соединения ароматического ряда дают ЦМую серию нитропроиз-
водных, чрезвычайно важных в смысле применения их в качестве
взрывчатых веществ, но еще большие количества их широко исполь-
зуются в промышленности, будучи преимущественно исходными ма-
териалами для изготовления красящих веществ.
Под действием концентрированной азотной кислоты они обна-
руживают склонность к образованию продуктов замещения, в которых
группа NO» заменяет один или несколько атомов водорода, образуя
вещество с кислой реакцией.
Группа R.OH, соответствующая спиртам жирного ряда, в при-
менений к ароматическому ряду, получает название фенола и играет
роль кислоты, нб ойа уже не дает, подобно спиртам, азотных эфиров,
способных К ом^Диванию; эти-то азотные производные углеводородов
и фенолой-г^Йбблее важные взрывчатые вещества ароматического
ряда.'
При помощи восстановляющих средств они обращаются в амины
и амиды, а последние' под влиянием азотистой кислоты образуют
азо-соединения.
Помимо этого, для нитро&рризводных ароматического ряда ха-
рактерно существование многочисленных изомеров, образующихся при
одной и той же реакции;- это обстоятельство сильно затрудняет их
изучение.
Бензол и его нитропроизврдные.
§ 2, Бензол (ЛИ**) начинает ряд ароматических соединений.
Это бесцветная, подвижная, сильно лучепр&гомляющаяся жидкость, ки-
пящая при 80,5s ° С и при 0° застывающая в бесцветную кристалли-
ческую массу, плавящуюся при 6° С. Удельный вес его при + О’ равен
0.899, а при 20° равен 0,878. Он обладает приятным ароматическим
запахом, легко^'воспламеняется'й''Горит ярким* коптящим пламенем.
В воде нерастворим, но легко растворяется в спирте и эфире, сам
же служит хорошим растворителем для смол, жиров и других, орга-
нических тел. Бензол летуч, пары его тяжелы и в смеси с воздухом
дают сильно взрывчатый газ.
Может быть получен синтетически, но на практике его добы-
вают из легкого каменноугольного масла, для чего последнее обраба-
тывают серной кислотой и подвергают фракционированной перегонке,
собирая дистиллят, кипящий между 80—85° С. В таком продукте есть
лишь небольшая примесь параффинов, олефинов и углеводородов аце-
тиленового ряда. Удалить эти примеси возможно, замораживая бен-
зол в охладительной смеси и отжимая затем жидкие части.
Очень чистый бензол получается путем перегонки одной части
бензойной кислоты с тремя частями гашеной извести:
C.HsCOOH = СеНв + СО».
сн
сн^сн
•» Или трукгупнс I
CH. JCH
'4
— 229 —
I
4
i
Ж$г“
MflHf
Z :
Л
ь
f •:
3
i" л /;У^; ,
/X
Под влиянием озона бензол окисляется, образуя продукт присоеди-
нения—озобензол, белого цвета масса, взрывающаяся при 50° С под
влиянием малейшего трения. Это вещество принадлежит к азонидам
и отличается сильно бризантными свойствами, однако, на практике
пока не употребляется*). Бензол образует три нитропроизводных про-
дуктов замещения: моно-ди и тринитробензол.
а) Подвергая бензол действию сульфоазотной смеси, (состоящей
из равных частей азотной кислоты крепостью 40* Вё и серной, кисло-
ты крепостью 66* Вё), получается мононитробвнзол'. CeHsNOj. Это есть
желтоватая жидкость, кипящая при 22‘0®, ядовитая, имеющая жгуче-
сладковатый вкус и пахнущая горьким миндалем (почему и употреб-
производстве, существуя в
зврго масла). Взрывчатыми
^шй^х веществ не-,
М’фёдка-рокк, гельго-
ь- J ч г ;
_Й^Вй1Ы^смесью С подогреванием,
кислотой, то получается
^$i^W’iPp©X изомеров: мета-орто-па-
количество последних двух изомеров не-
ft
щйи кипенияэтих изомеров суть:
метадинитробензола 90е С,
ортодинитробензола 116* С,
парадинитробензола 172,1* С.
&
Е Метадинитробензол представляет твердое вещество, нер.аствори-
' мое в воде, но растворяющееся в спирту, и» которого он выкристал-
лизовывается в виде длинных, блестящих, бесцветных игол. Он обла-
дает взрывчатыми свойствами, но слабыми, детонирует только от силь-
ного капсюля гремучей ртути.
О чистоте продукта судят по температуре плавления. Во взрыв-
ной технике применяется нередко, входя в состав робуритов/ бел-
литов, секюритов, тонитов, составов Шпренгеля и т. п.
в) Тринитробензол или бензит СвНз^(О,)з образуется в небольшом
количестве одновременно с динитробензолом, но может быть приго-
товлен и в отдельности путем нитрации динитробензола,' при нагре-
вании до 150*—200®, безводной сульфоазотной смесью (содержащей
дымящуюся серную кислоту), но эта операция небезопасна. Безопас-
ное его получение—окисление раствора тринитротолуола в серной
i кислоте посредством двухромовокалиевой соли. При этой операции по-
лучается тринитробензойная кислота, которую кипящая вода превра- -
щает в тринитробензол. Образующиеся при этом хромовые квасцы
остаются в растворе и выкристаллизовываются при выпаривании, при-
чем снова могут быть переведены в бихромат калия. К сожалению,
операция эта очень дорогая. Тринитробензол—твердое тело, плавя-
Л
1
' i-Ж
*) Хотя не исключена в будущем возможность его применения как чрезвычайно
сильного взрывчатого вещества, реакция горении которого наиболее близка к идеалу»
J/
к
'М^здат-
!-Л
.<7
Брана d. Кислотная смесь же поступает в колонну сверху при Ь и
опускается, благодаря большему удельному весу, в распылен-
ном состоянии вниз. В это время происходит между бензолом и кис-
лотами желательная реакция. Обработанные кислоты собираются внизу
колонны и тяжестью стоящей над ними жидкости перегоняются в
резервуар С, в то время как нитробензол Переходит в колонну II.
В колонне II нитробензол, несущий в себе остатки кислот, промывается
Здесь снова применяется принцип противотоков и, благодаря большему
II Ы1 IIMR
I. г1 < I
Рис. 40. Аппарат длд получв«г-|^т|юбввзояацо Kubiersky.
удельному весу, нитробензол собир®0Т<8яЙНизу аппарата, “откуда
переходит д дистилляционную колонн|!эд» г^е: дистиллируется водяны-
ми парами, поступающими в колонну при р. После конденсации в сосу-
дах Е и F и охлаждения в у, чистый нитробензол вытекает постоян-
ной струей из выпускного крана К.
Для приготовлениядиццтррбеивола (С,. Н4 (NOj}) берут две
части HN0„ плотност^ю Дж54, .и к?ней приливают одну часть бензола,
который растворяете# н^щийал^; после охлаждения смеси, к ней
прибавляют еще три оо‘емв,<№^0» и кипятят; наконец, к смеси при-
бавляют избыток воды и тогда в осадке получают творожистую массу
двунитробензола, состоящего, главными образом, из мета—ди нитробензо-
ла; его промывают в воде, и для отделения изомеров, растворяют в горячем
спирте, из которого выкристаллизовывают бесцветные кристаллы чи-
i Ь и
рхен*
кис-
иизу
ся в
У II.
втся.
цему
Рис. 41. Деталь колон-
гны I предыдущего ри-
суйка.
стого двунитробензбла, плавящегося при 91*. Температура тййиёнйя
орто = 118’, пара - 172° (обыкновенный продажный продукт^ ittiW
точку плавления ниже 91°). * '
Для приготовления тринитробензола, С« Н,
(NO2)s подвергают обработке динитросоеди-
нения смесью дымящих—азотной и серной кис-
лот, при чем, как при получении тетранитро-
нафталина, серную кислоту насыщают (до 5О’/о)
ангидридом SOs-
Тринитробензол может быть также получен
путем обработки других нитросоединений, на-
пример, тринитротолуола.
„ „ _ а) Следующим выСШим го-
s г мологом бензола служит толуол:
иитропроиэводные. ртт р П _ г п *-> пни п
ънз Veils — Ъу-Пб ) или метил-
бензол. Это есть бесцветная жидкость удельного
веса 0,88, обладающая эфирным запахом. Он
дает нитропроизводные сходные с таковыми для
бензола. ,
Заводским путем толуол получается одно-
временно с бензолом, от которого отделяется
фракционированной перегонкой, составляя часть,
кипящую около 120°С., при чем дистилляцию
ведут под уменьшенным давлением.
Известны три степени нитрации толуола:
мононитротолуол, динитротолуол и тринитрото-
луол.
б) Менонитротолуол образует три изомера:
1,2 ортонитротолуол — желтого цвета жидкость,
кипящая при 230° С.; 1,3 метанитротолуол—
твердое тело, плавящееся при+16° С., полу-
чающееся из параацетотолуола; 1,4 паранитро-
толоуол—твердое тело, плавящееся при+ 54* С.
Орто и паранитротолуолы получаются одновременно при нитрации на
холоду толуола и служат для приготовления тринитротолуола, а также
употребляются в качестве красящего вещества; они отделяются охлаж-
дением до—10° С.
в) Динитротолуолы. Существует пять изомеров. Главным обра-
зом получают смесь изомеров 1, 2, 4 и 1, 2, 6, нитруя толуол’ кон-
центрированной сульфоазотной смесью (на 20 килогр. толуола берут
145 килогр. серной кислоты и 30 килогр. азотной, разбавляя' Смесь
20 килогр. воды).
Толуол вливают тонкой струей при непрерывно,м пропускании
воздуха, который увлекает окислы азота, являющиеся следствием
гда
щ-
су-
Ш- (
1ве
Да,
ЮЙ
•и-
«у
ао-
ем
СИ
сн^\с.сн3
*) Или структурно |
СН1 >СН
побочных реакций, особенно по причине окисления менее стойких
изомеров. При этом надо избегать образования смеси паров окислов
азота с парами толуола, обладающей свойствами сильно взрывать при
нагревании. Динитротолуол—твердое тело, кристаллизующееся из
спирта в виде длинных игол, плавящееся при 71» С. Действуя азотной
'кислотой на метанитротолуол, получают изомер, кристаллизующийся
в длинных желтых иглах и плавящийся при 60,5 С.
Смесь изомеров имеет измененную пониженную температуру
плавления, что вредит, как получению его заводскими способами,
так и практическому его использованию, поэтому смесь орто—и пара
динитротолуола, имеющую температуру плавления 70’—71’С., отде-
ляют, остальное же служит для приготовления тринитротолуола.
Динитротолуол 2, 4, применяется при изготовлении многих
взрывчатых веществ, особенно шеддитов, а также в некоторых специаль-
ных взрывателях.
Динитротолуол при взрыве разлагается по уравнению:
С,'Нв (х\О2), = 4 СО + 3 Н2Х2 + 3 С.
Как видно—в ней много свободного углерода и потому выгодно
динЩгротолуол смешивать с веществами богатыми кислородами: сели-
трами, хлоратами и проч. -
г) Тринитротолуол (Тротил, тол, тринол, толит и npi). Это веще-
ство есть результат максимальной нитрации толуола. Химическая его
формула С7 Н5 (NOj>)3 *). Известны три изомера тринитротолуола, плавя-
щееся между 72’С и 82* С, получающиеся одновременно при нитрации,
при чем, однако, изомер 1, 2, 4, 6 преобладает. . „
Тринитротолуол можно получить тремя способами: *
а) путем нитрования динитротолуола—процес, употребляющийся
при утилизации остатков от фабрикации 1, 2, 4 динитротолуола;
б) вторично нитруя мононитропродукт;
в) троекратным нитрованием толуола./
Последний процесс требует применения сульфоазотных смесей,
особенно концентрированных, что и достигается применением дымя-
щейся серной кислоты.
Ввиду важности тринитротолуола в деле взрывчатых веществ, о
нем будет говориться далее особо, тогда же и коснемся вопроса его
фабрикации и свойств.
а) Ксилол бесцветная жидкость с особенным
эфирйым запахом, отличным от бензола и толуола.
Он получается также из той части каменноугольного
масла, которая кипит при 137*—142*0. .
Ксилол—есть смесь трех изомеров, немогущих быть разделен-
ными в силу близости точек их кипения, а именно: метилтолуол^ 1, 4,
§ 5. Ксипоп СвН4
(<Нз)2 и др. дери-
ваты бензола.
•) Или структурно: C.CHt
NO*C/\CNO.,
днмвтилбензод илм параксилол, присутствующий в незначительном ко-
личестве в ксилоле и представляющий бесцветную жидкость, кипящую
при 420®G с характерным запахом, ненапоминающим бензол; при 15’С
он застывает в кристаллическою массу; затем 1, 3, диметилбензол или
изо (мета) ксилол — преобладающая часть ксилола из каменноуголь-
ного масла. Это тоже бесцветная жидкость, запахом своим сходная
с метилтолуолом и кипящая при 138°. Наконец, ортоксилол или 2, 2
диметилбензол представляет бесцветную жидкость с неприятным запахом,
кипящую при 140° С. От других кислолов отличается тем, что труднее
образует твердые нитросоединения.
Ксилол дает также моно-ди-тринитроксилолы и нитропроизводные.
Тринитрокислол симметрический плавится при 176—177’С, при чем
теплота его образования около + 18,3 калорий. Формула тринитро-
кислола С6 Н (NO2)s (СН3)2. Это — кристаллический порошок, светло-
коричневого цвета, способный прессоваться в плотную массу и мо-
гущий плавиться. Он менее чувствительнее к удавам нежели тол, по
силе взрыва в общем одинаков с тринитротолуолом.
' Применяется преимущественно в смеси с селитрами в аммонолах.
б) Кумол или пропилбензо# C6H5(C8HJ— дистилят каменноуголь-
ного масла, кипящий около 166’0. Он также образует нитрокумолы
и нитропроизводные, но последние, в практике взрывчатых веществ
пока еще не применяются.
в) Фенилацетилен CgH3 — С ОН приближается по свойствам к
ацетилену и дает подобно ему с аммиачными растворами металличе-
ских окислов (например, меди и других) опасные взрывчатые соеди-
нения.
\ .............................
ГЛАВА II.
&
Фенолы и и]с нитропроизводные.
о, . а) Фенолы дают нитропроизводные, из которых
1 . о ыкновенныи некоторые имеют чрезвычайно важное значение в
фенол и его нитро- " t
г смысле их применения.
производные. Как ИЗвеств0> фенолы составлены по общей фор-
муле К—ОН, сходной с формулой спиртов жирного ряда, но характе-
ризуются кислой реакцией и соединяясь с основаниями, дают соли. '
Эфиров, однако, они не образуют, чем существенно отличаюся от
спиртов.
Первым членом фенолов являются: фенол С6Н5 (ОН) *), производ-
ные бензола, и крезол СН8 — С8 Н4 (ОН), производные толуола; следую-
щие высшие гомологи, не применяются вовсе в технике взрывчатых
веществ.
•) Или структурно: СН
Все фенолы дают продукты замещения водородных атомов ядра
остатком азотной кислоты—N02, причем это замещение совершается
легче, чем у углеводородов, т.-е. происходит при посредстве менее
крепких кислот, а реакции их с азотной кислотой совершается более
энергично. Нитрофенолы реагируют Даже со щелочными карбонатами,
тогда как фенолы соединяются ТОЛЬКО со свободными щелочами.
Бурное течение реакции цИтрации при помощи азотной кислоты
делает практически затруднительным ведение нитрации непосред-
ственным путем, поэтому, как общее правило, операция сводится
к предварительному приготовлению сульфосмесей, которые с фено-
лами, хотя и легко реагируют, но не столь бурно, как чистые кислоты.
Способ приготовления пикриновой кислоты может служить типом
методов нитрации фенолов, а потому только он один и отмечается
несколько подробнее.
б) Фенол CG Н-(ОН), образует три изомерных мононитрофенолов,
не обладающих взрывчатыми свойствами, но соли которых предста-
вляют важные красящие вещества. Их можно получить действием/
очень слабой азотной кислоты на фенол.
в) Также точно известны три изомерных динитрофенолов, которые
могут быть получены путем нитрования фенола азотной кислотой
удельного веса 1,37, причем фенол должен быть предварительно ра-
створен в воде. Соли динитрофенолов — слабые взрывчатые вещества;
свинцовые и серебряные соли их очень легко, однако, взрывают от
удара и нагревания.
г) Тринитрофенол **) представляет также три изомера, из коих
d (1, 2, 4, 6) плавятся при 122,5” С и представляет так называемую
пикриновую кислоту, изомеры же /9 и у плавятся соответственно при
60* и 118° С.
Их можно получить путем непосредственного действия сульфо-
азотной смеси на фенол, умеряя реакцию усиленным охлаждением и
растворяя предварительно фенол в каком-нибудь углеводороде, или,
что предпочтительнее, приготовляя предварительно сульфопроизводное
растворение фенола в серной кислоте и разлагая затем этот промежу-
точный продукт азотной кислотой. Этот метод и употребляется в за-
водском производстве, ибо он более безопасен и дает более однообраз-
ный продукт, но непосредственная нитрация, хорошо выполненная,
также может дать хороший выход продукта.
Нитруя динитрофенол 1, 3, 5 посредством концентрированной
сульфоазотной смеси получают пентанитрофенол. Из нитрованных
фенолов подробнее Остановимся на пикриновой кислоте.
Пикриновая кислота или тринитрофенол представляет очень могу-
щественное взрывчатое вещество, которым широко пользуются военные
ведомства всех государств, применяя его иод названием: мелинита
**) Или структурно: С. NO,
NOjC/XCNO,
(Франция и Россия), .»иддита (Англия), шимозе (Япония), С] 88 (Гер-
манйя) и т. п.
' Представляя мелкий кристаллический порошок, пикриновая кис-
лота в таком виде несколько чувствительна к сильным ударам, но
В сплошном виде, полученная путем плавки, она настолько делается
малочувствительной к толчкам и ударам, что снаряженные ею сна-
ряды безопасно выдерживают удар пороховых газов при смещении
снаряда в канале орудия.
Касательно заводского способа ее приготовления будет сказано
далее. ' .
Пикриновая кислота представляет, собою золотисто-желтый по-
рошок, состоящий из мелких чешуек, весьма горького вкуса, при чем
горечь эта продолжительное время остается на языке. Пикриновая
кислота является важным красящим веществом. Чистый. препарат
плавится при 122° С; при 15° С он сравнительно мало растворим в.воде
(1,16 частей пикриновой кислоты растворяется в 100 частях воды),
в горячей-же воде ,он растворим значительно больше и в кипящей
воде растворяется уже в количестве 5%. Серная кислота ее раство-
ряет в количестве 9%. Кроме того, пикриновая кислота растворима
в спирте, эфире, хлороформе, бензине, керосине и т. д. и потому все
эти вещества могут служить для ее очистки.
Пикриновая кислота принадлежит к числу сильных кислот, спо-
собных разлагать мало-по-малу нитраты й хлораты в присутствии влаж-
ности, поэтому то смеси этих веществ, предложенные в качестве
пороха, должны быть признаны небезопасными, т. к. при сушке такого
пороха могут образоваться пикраты, гораздо более чувствительные
к механическим влияниям, чем сам тринитрофенол, особенно в том
случае, если смесь де содержит специальных веществ, поддержцрающих
ее пластичность, могущую уменьшить чувствительность ее к толчкам
и ударам.
В чистом виде тринитрофенол безусловно постоянен при хране-
нии его в обыкновенных условиях температуры; при помощи осто-
рожного нагревания, можно достичь улетучивания небольших коли-
честв пикриновой кислоты бдз разложения. Пикриновая кислота не
гигроскопична.
\ Едкими щелочами она разлагается, в свою очередь разлагая щелоч-
ные карбонаты с образованием соответствующих. пикратов. Восстано-
вители переводят пикриновую каслоту в пикрамиковую кислоту (амидо-
динитрофеноловую), тоже взрывчатое вещество, которое Тюрпен даже
пытался ввести в употребление, о чем также будет еще речь Впереди.
В дальнейшей стадии восстановления получается иитродиамидофенол—
также взрывчатое, но малоустойчивое тело, и, наконец, триамидо-
фенол.
Кристаллическая или порошков атая пикриновая кислота детони-
рует под влиянием сильного удара tom капсюля гремучей ртути,
причем подогретая (даже солнечными лучами) она делается значи-
тельно более чувствительной к удару. Если же она очень сильно
спрессована или сплавлена, то становится настолько малочувстви-
тельной к ударам, что детонирует только от'очень сильного, детона-
тора (вторичного), взорванного в свою очередь капсюлем гремучей
ртути. Как общее Правило, подобным промежуточным детонатором,
может служить тот же мелинит, но, в порощковатом виде.
Взрывчатое, разложение пйкриноври; йрлоты может следовать
по трем уравнениям: t /
2C6H2(NO2)3(OH) = ЖЮ + 3Ha + 3N2 + C. ' • . - (О
2СвН3(КО2)з(ОН)=ПОО+С^+ЩО + 2Н24-ЗК2 , . .(2)
2С6Н3(ЛтОа)3(ОН) =Й 12СО 4-2H20 + Hs + 3N2 . . . (3)
Повидимому. разложение по формуле (3) самое совершенное и имеет
место при максимальных давлениях, но в большинстве случаев взрыв
мелинита сопровождается отделением обильного черного дыма, ука-
зывающего на присутствие в продуктах взрыва значительных коли-
честв несгоревшего углерода (смотри уравнение (1)). Помимо итого,
по исследованиям Сарро, Вьелля и Бертло, в них присутствуют
также и метан.
Взрывчатые константы мелинита (по формулам (1) и (2)) сле-
дующие:
""(1) (2).
f “9780 килогр. 9682 килогр.
. v,= 828 литр. 877 литр.
t“ = 2832°C 2634°
371 363 '
метр. метр.
а= 0,837 литр. 0,877 литр.
Теплота образования молекулы пикриновой кислоты — +5,0,2 ка-
лорий.
Бризантный эффект тринитрофенола, главным образом, зависит
от огромной скорости детонации, доходящей иногда до 7000 метр,
в сек. (в детонирующих шнурах), которая в патронах прессованного
мелинита понижается до 5000 метров в секунду (для удельного веса
1,56); Для мелинита удельного веса 1,?4 Дотриш получил макси-
мальную цифру:—7645 метр, в секунду при очень сильном детонаторе
в 8о грм. динамита № 1, взорванным в свою очередь капсюлем
в о,5 грм. гремучей ртути.
Во Франции так же, как ив большинстве государств, являю-
щихся потребителями- тринптрофёнола, последний имеется двух сор-
тов: более чистый, содержащий, по меньшей мере,'98% химической
чйстой пикриновой кислоты и Применяющийся для подрызных патро-
нов, детонаторов, детонирующих Шнуров и т. п., и несколько менее
чистый, применяющийся для снаряжения снарядов (во Франции боль-
шей частью с примесью крезёлита).
Испытание пикриновой кислоты на пригодность ее для целей
подрывной техники состоит в определении точки плавления, которая
не должна быть ниже 121* С (чаще при испытании пользуются образ-
цовым эталоном), определяют содержание влажности, веществ, раство-
римых в кипящей воде и эфире (остаток, нерастворимый в эфире,
содержит преимущественно нитраты и пикраты), определяют содер-
от обработки эфиром), пробуют на серную
Ч1'
1
4
золы (в остатке от обработки эфиром), пробуют на серную
г.ю и щавелевую кислоты. Затем определяют также содержание
I. пикриновой кислоты, ийи переводя ее в пикрат калия, или
Зуясь' нерастворимостью пикратов алкалоидов, применяя чаще
) в качестве реактива серно-кислый цинхонин, имеющий то пре-
цество, что он дает соответствующий пикрат, весящий вдвое
,ше, чем вступившая в соединение пикриновая кислота. Наконец
^гда определяют общее содержание азота по способу Kjeldahl-
МЬапёг’а, которое должно быть близко к 18,34%.
д) Как сказано выше, пикриновая кислота, приходя в контакт
металлами, действует химически на большинство из них, давая
зртйШ,- носящие название пикратов, более или менее чувствительные
^толчкам и ударам. Среди них в этом отношении на первой месте
^а^жеН' быть бесспорно поставлен - пикрат свинца, который настолько
^^вствителен к ударам, что были попытки его применения в капсю-
взамен гремучей ртути. Попытки эти, однако, не привели к прак-
тическим результатам, в виду чрезмерно повышенной чувствитель-
ности этого препарата. Несколько меньшей чувствительностью к ударам
и толчкам отличается пикрат железа, затем пикрат мвдп и аллюми-
. • -кия. Чистое олово совсем не подвергается действию пикриновой
^кислоты, поэтому оловянные трубки и применяются в качестве обо-
лочек для детонирующих мелинитовых шнуров и оловом лудят сна-
I фяды, начиняемые мелинитом. Надо, однако, зорко следить за тем.
чтобы внутренность снарядов, предназначенных для заполнения мели-
нитом, была безукоризненно хорошо вылужена или же покрыта
толстым слоем лака, дабы сделать совершенно невозможным сопри-
косновение мелинита с железом и тем устранить возможность образо-
вания пикратов.
Пикраты кальция также опасны, и потому соприкосновение
мелинита с известью надо безусловно устранять. Влияние извести
' на мелинит особенно сказывается при пожарах: падение штукатурки
на горящий мелинит зачастую ведет к сильнейшим взрывам его
(М. Gody).
. е) Пикрат ''калия. Химическая формула его С6Нз(ХО2)зОК. Он
/ получается кипячением пикриновой кислоты с поташем и очищением
;: последовательными кристаллизациями полученного продукта. Соль
эта очень мало растворима в воде (при 15® последняя растворяет
лишь 0,38% пикрата калия). Это вещество обладает сильными бри-
зантными свойствами, дает резкую вспышку при соприкосновении
с пламенем и настолько чувствительно к ударам, что -обращение
с ним далеко небезопасно.
Состав продуктов взрывчатого разложения-его, по, исследова-
ниям Сарро и Вьелля, сильно зависит от плотности заряжания. При
плотности заряжания 0,5 они нашли следующий состав продукта
взрыва:
- 1бСвН2(КОа)зОК = 4KCN -j- 6К2СО3 + 21СО2 f 52СО Ц- 22Na Ц- 6СН4 +
iь И здесь, как ив других взрывчатых веществах этогорода,
&\>»₽ыв сопровождается выделением: густого черного Дйма, вследствие
значительного количества несгоревшего углерода. Теоретические кон-
станты, характеризующие это взрывчатое вещество, суть следующие:
±‘ = 6352 килогр.
Vo= 549 литров,
to = 27790 С
' метр,
а = 0,658 литров.
Присутствие в продуктах взрыва значительного количества сво-
бодного углерода обусловливает выгодность достижения более пол-
ного сгорания путем смешивдиия пикрата калия с веществами, бога-
тыми -кислородом, в роде селитр и хлоратов, но все попытки до сих
пор в этом направлении не привели к реальным результатам, потому -
что получающиеся продукты очень чувствительны к механическим
влияниям и небезопасны в обращении. Здесь заметим, что к числу
таковых принадлежит, между прочим, порох Дезиньеля (смесь пикрата
калия с селитрой и углем), оставленный после знаменитого ужасного
шц^ыва на площади Сорбонны (см. далее).
ж) Пикрат аммония. Эта соль приготовляется так же, как и
предыдущая, и представляет оранжево-желтые призматические кри-
сталлики, довольно значительно растворимые в воде. Будучи зажжена,
она медленно сгорает коптящим пламенем и очень трудно детони-
рует даже под влиянием сильного удара, чем существенно разнится
от других пикратов.
Формула ее взрывчатого разложения под большим давлением
представляется в виде следующего уравнения:
2CeH2(NO2)3ONH4 = СО2 + HsO +11С0 4-5Н2 + 4N2.
В действительности взрывчатое разложение, повидимому, сопро-
вождается также и другими побочными реакциями, так как при
взрыве всегда получается остаток,, содержащий свободный уголь.
Об’ем газов, получающихся при взрыве, равен 998 литрам. Про-
бовали также и этот препарат смешивать с селитрами и хлоратами,
получая. Л о лее или менее удачные результаты. \
К числу производных п/гкрата аммония принадлежит также так
называемый изопурпуровый калий CgHaNsOeK, взрывчатое вещество,
получающееся взаимодействие^ горячих растворов цианистого калия
и пикрата \ аммония. Он детонирует от удара, но практического зна-
чения noKi не имеет.
з) Органические производные пикратов. Это суть также взр'ывчатые
вещества, содержащие большой избыток углерода, которые пока прак-
тического значения не имеют, главным образом вследствие трудности
приготовления, представляя интерес пока исключительно научный.
Среди них заслуживают быть отмеченными: пикриновые эфиры, пик-
риновые амины и амидины, пикриновые производные некоторых угле-
водородов ароматического ряда (бензола, нафталина и т. п.), а также
а
t пикраты алкалоидов (например, употребляемые в качестве
^пикраты цинхонина, акридина и т. п.) и проч.
лныефенолы, а) Резорцин СбН4(0Н)з, как известно, есть двух-
фенол, дающий с азотной кислотой мононитропродукт, а
, б-азотйой смесью — тринитрорезорцищ или оке ипипри новую
^CtH(N02>3(0H)s, которая так же, как и ее соли, сильно взрыв-
ячество. Теплота ее образования: 4-109,3 калории. В самое
ве время в Германии был взят ряд патентов, практически уже
вленных, на приготовление состава для капсюлей—детонаторов
свинцовой соли тринитрорезорцина Изомеры резорцина—орто*
„пирокатехин и гидрохинон,—нитруются только частично, окис-
„ при нитрации с образованием преимущественно щавелевой кис*
^подобно орто и паракрезолам. Метиловые и этиловые произвол-
Гидрохинона более стойки и дают моно, ди-и тринитропродукты,
^б) Флероглюцин СбНз(0Н)2, трехвалентный фенол, нитруясь с
жфо-азотной смесью, дает тринитрофлероглюцин С6(Ы02)з(0Нз)—
ИШчатое вещество. Оно взрывает при 158** С. Это соединение дает
Йвтствующие кислоты и три серии солей, обладающих взрывча-
№ свойствами, но не имеющих пока приложения па практике. 1
.Крезолы И « нитро- ЧаСТЦ ЕаМв“НЛУГ0ЛЬ«?п. ДвГГЯ’ ПеРеГ0НЯЮ‘
’’щиеся между 185е и 210е, содержат крезол
₽ в С7Н,(ОН) в виде трех изомеров:
СИ
СН/\ССНз
, Или структурно: I i
СН\/СН
С (ОН)
паракрезола, плавящегося при Зб«С
ортокрезола, „ „ 31 °C
метакрезола, „ „ жидк.
; Практически крезол получается из
теозота, причем пропорция полученных
фговый крезол содержит примеси: фенола, толуола и 'нафталина.
Крезол имеет те же стадии нитрации, как и фенол, но взрывная
|вдика. пользуется только тринитрокрёзолом.
•. .Все три изомера относятся к процессу нитрации далеко не оди-
цково, причем орто —и паракрезолы при этой операции в значи-
доьной степени опыляются, вместо того, чтобы нитроваться, превра-
(дась частью в щавелевую кислоту; они дают только динитропроио-
Йные.
Только метакрезол дает тринитрокрезол, взрывчатое вещество,
мыса сходное по свойству с пикриновой кислотой, плавящееся при
&*т- Ю6°С. и представляющее в свою очередь смесь изомеров. Ка-
“ТИМ продажного крезила, в смысле содержания в нем метакрезола,
Двержено значительным колебаниям, чго имеет огромное значение
|М еаводеком приготовлении триншрокрезола: вместо теретического
S'Wes*. М, Сухаревский. Взрывчатые вещества и взрывные работы 16
t1'
л
и
кипящего
при 202 °C
, 185°С
„ 201°С
г
99
*>
неочищенного фенола или
изомеров очень различна.
99
Ь..' .
выхода в 200% тринитропродукта из 100 частей крезола, иногда лишь
получается только 90% нужною тринитропродукта и вдобавок таковой
продукт плавится уже около 100#С., причем не обладает достаточной
пластичностью и однообразием.
В настоящее время при помощи фракционированной перегонки
добывают почти чистый метакрезол, кипящий при 200° — 201,5"С.,
Можно также употреблять и другой метод, отделение паракрезола,
обрабатывая крезол дымящейся сегной кислотой: метакрезол остается
в растворе, тогда как пара крезол дает кристаллизующееся соединение,
которое и может быть отделено центрофугой; однако этот способ дает
значительно менее чистый метакрезол, чем первый спосэб (фракциони-
рованной перегонки).
Поэтому при приемке крезола для целей нитрации крайне не-
обходимо тщательное предварительное его лабораторное испытание,
производящееся в’общем по той же сюме, по которой производится
добыча нитропродукта, при'чем преследуют главную цель — опреде-
ление выхода.
Заводское производство тоинитрокрезола охотно с фабрикацией
пикриновой кислоты. Он применяется преимущественно во Франции, для
снаряжение снарядов; он несколько слабее мелинита и сгорает также
чМенее полно, образуя в продуктах взрывчатою разложения бол!ше
свободного водорода и Углерода. Трпнитрокрез"Л с большой выгодой
применяется совместно с другими взрывчатыми веществами, об|а4уя
смеси, обладающие свойствами, сходными с мелинитом.
Теплота образования его+54,1 ьалор. Химические свойства весьма
сходны со свойствами пикриновой кислоты.
, ____________________________ ' #
ГЛАВА III.
Производные спиртов, апдегидов, кетонов и кнспст ароматического
ряда.
Спирты, алдегиды, кетоны и кислоты ароматического ряда, также
как и соотве1ствующие соединения жирного ряда, могут давать питропро-
изводные; применяя п> следние главным образом (как, например, mj-
нонитроортобензолдегид) в красочном деле (для приготовления искус-
ственного индию.
В качес ве типа подобных кислот можно назвать бензойную кис-
лоту СвШСООН, которая нитруется сульфоазотпой смесью. Разбавляя
затем жидкость водой, получают мснонптробензопную кислоту—твердое
тело, плавящееся про + 127*С. Теплота ее образования+ 96,1 калорий,
а теплота разложения доходит до + з772 калорий (на килогр.).
Соли этих кислот сильные взрывчатые вещества. Трудно расчи-
тывать, чтобы мвогочисд еапые нитропроизводпые этого класса веществ
могли когда-нибудь быть использованы в качестве взрывчатых веществ,
но срнди них нашлись бы такие, которые могли бы служить для по-
глощения окислов азота NO и NO.,, т -е. в качестве стабилизаторов
бездымного пороха и других азотных эфиров.
I:
ГЛАВА IV.
i г'' '
и амиды
Ц* Эти соединения
ароматического ряда и иу производные..
заслуживают особого внимания, принимая в
Лают1 ту важную роль, которую они играют в технике вообще и та-
ВВОЙ-же взрывчатых веществ в частности.
Среди них прежде всего необходимо указать на анилин CeH5NH9
л
с
СН/ХСН
или структурно: I |
сн\/сн
он
я егб нптропроизводные.
й а) Как известно анилин был впервые по-
§ . нипин н его НИТР°’ЛуЧга в 1826 году Унфердербеном из продуктов пе-
проиаводные. регонки индиго, ав 18,3 году из продуктов перегон-
ки каменного угля, н > свое название получил в 1841 году от Фридше,
много работавшего с ним. Много занимался им также наш соотече-
ственник проф. Зинин, который в 1812 г. указал путь его заводского
получения — восстановлением нитробензола посредством водорода в
Яомент его выделения. Многочисленными исследованиями свойства
анилина и его производных были заняты Эрдман и А. В. Гофман.
Хотя нитробензол восставовляется сероводородом в анилин, но
последний заводским путем предпочитают готовить из того-же нитро*
бензола при помощи восстановления железными опилками й уксусной
кислотой (способ Васйащр). Позже уксусная кислота была совершенно
вытеснена соляной кислотой, причем реакция образования анилина
следует уравнению: * \
CeH5NO2 + ЗРе + 6НС1 = CeHsNH2 + 2 Н2О + 3FeCl2.
' По окончании реакции прибавляется водная известь и анилин
отгоняется ври помощи струи пара.
Все продажные сорта анилина содержат 98% — 98%% аминов,
углеводородов ароматического ряда.
Из числа примесей, сопровождающих продажные сорта анилина,
можно назвать: воду, бензол, нитробензол, аммиак и небольшие ко-
личества ближе неисследованных веществ, содержащих серу и
характеризующихся неприятным запахом. Общее содержание этих при-
месей (не считая воды) обыкновенно не превышает 0,5%.
Обыкновенно в продаже имеется 4 сорта анилина, или как его
часто зовут—инплинового масла: более или менее чистый амидобензол,
предназначенный для изготовления синей краски, затем смесь обоих
толуидинов (так называемый „чистый толуидин") и две смеси анилина
с толуидином в различных пропорциях (с содержанием обыкновенно
нескольких % ксилидина и др. веществ).
214 —
Чистый продажный анилин имеет удельный вес 1,0245 (ирг
15 JC ), причем содержит не более 1% толуидина и вполне растворим
в слабой кислоте с образованием вполне прозрачной жидкости. Он
идет преимущественно на изготовление дифениламина, фуксиновой
сини и метиланилина, а также для анилиновой черни.
В толуидине преобладает то ортотолуидин, то паратолуидин. Про-
цент примесей в толуидине приблизительно таков же, как и в’гнетом
продажном амидобензоле.
Важно отметить, что главная масса изготовляемого анилина смесь
анилина с обоими толуидинами; этот продукт существует под . назва-
нием „анилина для красной краски в нем имеется небольшая при
месь ксилидина. Удельный вес этого сорта анилина 1,004 — 1,006 (при
10* *—12’С.). причем он заключает приблизительно 20% анилина.
40% паратолуидииа и 40% ортотолуидина.
Главное применение анилина в красочном производстве.
б) Азотная кислота, настолько энергично, действует на анилина
что реакцию приходится умерять, выполняя нитрацию при помощи
предварительной сульфонизации.
Тринитроанилин или пикрамид, CJl^NCh^NHa, представляет очень
могущественное взрывчатое вещество, схожее с пикриновой кислотой.
Теплота его образования 15,2 кал.; под действием натриевой щелоча
он переходит в пикриновую кислоту.
Тетронитроанилин представляет еще более сильное взрывчатое
вещество, нежели предыдущее. Он содержит 25,6° 0 азота и представ-
ляет желтое кристаллическое тело. Получается действием сульфо-
азотной смеси на метанитроанилин. Реакция идет всего лишь ни-
сколько минут, при чем требуется нагревание до 8ottC.: выход про-
дукта 130%—148%. Это вещество очень стойкое н^ожет имен, зна-
чение в будущем.
Метиланилин, получающийся нагреванием хлористоводородно-
кислого анилина с метиловым спиртом, дает целую серию нитропро-
изводных— в частности же образует тетранитрометиланилин *) иле
тетрил CeH1(NOJ'’3NNGsCHs, содержащий 24,4% азота.
Он представляет превосходнейшее взрывчатое вещество в смысл»-
мощности, сильно превосходящее мелинит, пироксилин и тротил (по
взрывчатой силе он впрочем несколько уступает тетронитроанилину),
применяющийся в широком масштабе в качестве первоклассного де-
тонатора, для изготовления детонирующих шнуров, а также разных
взрывателей и т. п.
Эго вещество эндотермическое и теплота его образования — 40/
калорий. Его готовят, действуя сульфоазотной смесью на сернокислый
метиланилин.
ХО2 - N сн,
.\02С /\CNOS
*) Ила структурно: I !
СН\/СН
cno4
Если тетрил не пользуется более широким применением, то при-
чиной тому служит, главным образом, его сравнительно высокая
стоимость. О нем будет еще говорится далее.
ч Продукт этот получается нагреванием анилина с
* . дифениламин. соляно.кислым анилином, при чем реакция следует
уравнению:
<Н„ : <V.= р*й5^;nh+nh4ci.
V/j. П5/
Амляы ароматического ряда характеризуются гораздо более слабой
основностью, чем амины жирного ряда, и той легкостью, с которой
они дают азотисто—и азотио-производные. Эти то их свойства позво-
ляют их использовать с большой выгодой в качестве стабилизаторов
бездымного пороха. Сверх того, некоторые из производных их пред-
ставляют важные взрывчатые вещества.
Дифениламин или фениланилин образует целую серию нитро-
производных. де гексан итродифенила мина., или гексанита [C6H2(NO)g|2NH
включительно. Последний представляет тонкий очень маркий иоро
шок желтого цвета, способный хорошо прессоваться. Он получен лишь
недавно Ауетеном. Обладает сильно бризантными свойствами, прево-
сходя в этом отношении пироксилин, тол и мелинит, несколько усту-
пая по силе тетранитроанилину.
В промышленности применяется также вВ качестве красящего
вещества, носящего название ауранции или им^раторской желти, но
но были опыты применения его и в взрывной технике, давшие отл ип
ные результаты. Ro время минувшей войны в Германии достаточно
Щироко применяли гексанит для снаряжения снаряпов. О нем также
будет говориться еще дальше.
Соединения‘Эти, как. и у аминов жирного ряда, полу
* Нитро- ЧаЮтся непосредственным действием азотистых паров илйг
,амины, азотистой кислоты па основные вторичные амины и обра-
зуются в качестве первых продуктов поглощения при употре-
блении этих аминов в качестве стабилизаторов. Так, например, в слу-
чае присутствия небольших количеств (1 %—2%) дифениламина в без-
дымном порохе коллоидального типа. прежде, всего образуется мопо-
и ди-витрозфениламины, затем следующей стадией являются нитро-
мнитродифениламин и, наконец, нитродифениламины— до тринитро-
тпфенидамина включительно.
Постепенное образование, этих продуктов, указывающих на со-
вершающийся в нитроцеллулозе процесс медленного саморазложения,
может быть обнаружен при помощи специальных реакций. В част-
ности. можно, например, указать на красное окрашивание, появляю-
щееся после кипячения спиртового раствора а—нафталина в при
сутствин нитрозодифениламина,, на характерное красное окрашивание
спиртового раствора едкого натрия в прйсутствии динитродифенил-
амина и на красное окрашивание цианистого калия, которое дает только
гринигро дифениламин.
246
Соединения эти дают многочисленные производные,
§ 4. Фенил к числу таковых принадлежит, например, тетранитродифе-
««иды. нилмочевина. Вообще фенилмочевипы заслуживают упо-
минания в виду своего свойства желатинировать нитроцеллулозы;
между ними наибольшей известностью в области взрывчатых веществ
пользуется диметилдифенилмочевина, применяющаяся под названием
централита для поверхностной желатинизации зерен бездымного ру-
жейного пороха, что дает возможность значительно увеличить на-
чальную скорость пуль 6-ти и 7-ми миллиметрового калибра.
Умеренное восстановление витрофенолов дает ами-
Нитроами- дофенолы, которые в свою очередь способны нитроваться,
дофенолы. как наПрИмер, соединение подобного типа можно назвать
амидодинитрофенол или пикрамиковую кислоту. Это взрывчатое веще-
ство получается действием сернистого аммония на спиртовой раствор
пикриновой кислоты; выпаривая жидкость на водяной баве, получают
пикрамат аммония, который разлагают при помощи азотной кислоты,
Пикрамиковая кислота и ее соли были предложены Тюрпеном
для применения в различных взрывчатых смесях.
Г Л А В А V.
Азо и Диазосоединения.
В жирном ряду восстановление нитросоединений при-
§ 1. Нз»сое .водит непосредственно к аминам; при окиелении жирных
динения. аминов отщепляются алкильные группы (этиламин, напр.,
дает уксусную кислоту и аммиак). Напротив, в ароматическом ряду
известны промежуточные продукты, которые могут быть получены,
как при восстановлении нитросоединений, так и отчасти при окисле-
нии ароматических аминов. Из этих соединений особо важными явля-
ются те, которые представляют собой производные нитробензола и
анилина. В то время, как восстановление нитросоединений в кислых
растворах приводит к аминам, при применении щелочных восстано-
вителей получаются соединения, образовавшиеся сочетанием двух
остатков нитробензола.
Азосоединения сильно отличаются по составу от рассмотренных,
выше соединений.
Все они построены по схеме:
Таков, например, азобензол;
C.H.- N — NС..Н.„
как все азбсоединения, довольно устойчивое тело, кристаллизующееся
в краснооранжевых кристаллах. Температура плавления его + 68'0,
кипения + 295«С. При дальнейшем возстановлении дает анилин.
’ ; s- Открыты Гриссом в 1860 г. В то время, как в жирном
tЙ.Д«иосо- ряду переход от аминосоединений к диазосоединениям удя-
лось осуществить лишь с определенной группой аминов,
1 ароматическом ряду для всех первичных аминов является харак
терньщ способность диазотироваться. По Ганчу все диазосоединения
Делятся на 2 группы: 1. Соединения со структурной формулой:
ArN.X Это соли диазония, имеющие ха-
III
N рактер аммониевых солей, и
2. Соединения со структурной формулой:
Ar Я — N . X; диазосоединения, по характеру
подобные азосоединениям. Многочисленные превращения диазосоеди-
нений можно характеризовать двумя родами реакций: происходящих
с выделением N2 — группы или с сохранением, ее.
Самый диазобензол в свободном состоянии не получен, а изве-
стен в виде своих солей, как, например, хлористый диазобензол
< (LH,-—N —С1
V а
N
Известны также три-и тетра-азосоединения.
В то время, как азосоединения, вообще говоря, тела довольно
устойчивые, этого нельзя сказать про ряд нитрованных диазосоеди-
ненпй, большая часть которых представляет собою взрывчатые веще
ства большой силы, легко разлагающиеся при нагревании от удара.
Они представляют также важную серию красящих веществ.
Не перечисляя свойств диазосоединеаий, можно лишь заметить,
что они образуют нитро-и нитрозопроизводные, обладающие малой
устойчпвошью и, по большей части, имеющие взрывчатые свойства.
В них ясно выражены основные свойства, так как с крепкими ки-
слотами они дают соли—в частности азотнокислые, кои все взрыв-
чаты.
Диазобензол С,Н5Я2 представляет тело, взрывчатые свойства ко-
торого изучены более нежели какого-либо другого из соединений
этого ряда. Соли его получаются по общему способу действием азоти-
стой кислоты на. соль анилина:
С;НДКН.,).НС1 + HNOa-СеН5 - NCI I 2Н,0
* hi
111
N
Эта операция опасна но причине малой стойкости диазосоедиие
ний. Изучены были также взрывчатые свойства хлористого, броми-
стого, азотнокислого, сернокислого, хромового и пикрата диазобензола
и, новидимому, они могли бы. получить практическое применение
в качестве возбудителей взрыва, но этому мешает слишком повышен-
ная их чувствительность к ударам и трению, к тому же они не обла-
дают достаточной стойкостью.
Как тип приготовления этих соединений, здесь в общих чертах
указываегся на ход получения азотнокислого диазобензола CSIL,N2NO3,
разработанный Бертло и Вьеллем: азотнокислый анилин тщательно
стирают с водой, чтобы образовать довольно густую массу, которую
вливают в охлажденную трубку, затем на дно ее вводят медленно
азотистую кислоту до выделения пузырьков азота; масса при этом
окрашивается в красный цвет, но затем частично обесцвечивается.
Тогда к жидкости прибавляют равный об'ем спирта и затем эфира,
который осаждает азотнЛсислый диазобензол. Его промывают эфиром
и сушат без нагревания.
Под влиянием влажности азотнокислый диазобензол разлагается,
образуя фенот; свет его также разлагает, хотя и медленно
Под влиянием удара и трения он взрывает подобно гремучей
ртути. Также действуем и нагревание до 90’С. (тогда как гремучая
ртуть выдерживает нагревание по меньшей мере до 150*)
Формула его взрывчатого разложения следующая:
CJI5N„NOs -ЗСО + 2.КН, т
а взрывчатые константы, его характеризующие суть.
f - 8240 килогр.
v® = 935 литров,
t® -- 2054®
Р -- 327,8
’ метр.
а — 1,08 литр.
Теплота его образования — 47,4 калории.
Диазоамианобензол более стоек, нежели диазобензол; он взрывает
только при 200®. Получается непосредственным соединением диазо-
бензола и анилина, или при осторожном восстановлении анилина
Замещенные анилины и их гомологи дают тем же путем целый
ряд продуктов замещения.
249 —
ГЛАВА VI.
i
Соединения с конденсированными бензольными кольцами
Ъ Нафталин и его
"роиэнодные.
a) Нафталин <Л*! ls
е с
нс j ск
нс I .Л J сн
% „ С \
с с
а н
np'vv' ..iv.ri летучую часть каменноугольного масла, перегоняющую^
чри ишиературе около 200° С.
<>го -белые чешуйки, плавящиеся при 78—79* и кипящие при
21*' 219“ С. Нафталин очищается возгонкой. При всех температурах
он имеет особенный, своеобразный запах.
Технический нафталин, считающийся практически достаточно чис-
тым для целей изготовления красок (для получения из него .а— наф-
талина). должен удовлетворять следующим условиям: температура
плавления 79" V, а кипения 216*—217° С. Небольшой цилиндрик, от-
литый на испытуемого нафталина, будучи поставлен на стеклянную
пластинку на открытом воздухе, в несколько дней должен улету-
читься без остатка, оставаясь до самого конца белым. При нагревании
1,00 грамм нафталина с- чистой крепкой серной кислотой, не должно
быть никакого красного окрашивания (может быть допущено в край-
ности изменение цвета на сероватый17
Количество изомеров в его производных весьма большое, что и
явствует из «го структурной формулы. Так у него известны два нитро-
нафталина. I 1 динитронафталинов и т. в.
о) Млитшпронафталин C1PH;(NO1). Ou приготовляется так:
В глиняный чан, подобный нитрационному кубу для нитрации
фенола, помещают 12% пуд. азотной кислоты в 34J Вё, а затем вы-
сылают 2 иуда 7 ф. нафталина, и размешивают деревянной, лопатой
до тех пор, пока не •растворится весь нафталин. Помешивание про-
должают в течение 10 часов. В ото время происходит нитрация наф-
талина. при чем она совершается очень спокойно, без заметного вы-
деления азотистых паров. Продукт оставляют стоять до другого дня,
образовавшуюся твердую к р истаялическую массу моыонитронафталина
разбивают и снова перемешивают; затем жидкость сливают сифоном
до тех пор. пока ве стечет смачивающая кристаллы жидкость. .
Далее мононитропафталия прмытт холодной водой, для чего
заставляют через него протекать холодную воду в течение 1 часа.
Промытый монояитронафталин иэмельча-имп в мельнице, после чего ею
помещают в центрофугу и, закрыв нижнее отверстие последней, вто-
рично промывают водой.—на атот раз нагретой до 30е, в течение 2-х
часов. '
Затем пускают в ход- центрофугу и в продолжение б—8 часов
производят отжимку до тех пор. пока мононитронафталигг не будет
(.»<ЬЖЮЖ Д1-1! ОТ воды
250
В центрофугу закладывают около 3-х пудов продукта, причем в
начале прибавляют около 2’Д ведер воды небольшими порциями.
После обработки в центрофуге, мояонигронафталин снова измель-
чают в мельницах для того, чтобы получить его в виде более мел
кого порошка.
Количество полученного продукта 23/» пуда, что составляет вы-
ход: 1,3 части на 1 ч, нафталина.
Существуют два изомера мононитро нафталина, а именно а и Д
Первый (торговый продукт) представляет желтые призмы, плавящиеся
при 4-58® С; изомер плавится при 79n С. Реакция мононптронафга-
лина нейтральная; он нерастворим в воде, по растворяется в эфире,
в спирте, бензоле, сероуглероде, керосине и т. п. Торговый продукт
обыкновенно плавится Ьри 55°— 56° С.
Взрывчатыми свойствами мононптронафталин обладает в слабой
степени, но применяется в некоторых шеддптах в качестве сгораю-
щего начала и для придания веществу пластичности.
Он дает интересные сплавы с пикриновой кислотой, обладающие
хорошими взрывчатыми качествами, которые Street предложил в ка-
честве взрывчатых веществ (типа ММН).
в) Динитронафталин CHHe(NO»)j раньше добывали, подвергая
мононитронафталин вторичной нитрации, при помощи крепкой азот
ной кислоты, в настоящее же время его готовят непосредственно из
нафталина, ирдвергая его нитрации сульфоазотной смесью, но более
концентрированной, чем таковая требуется для получения монопитр»-
нафталина. Способ получения одинаков с таковым для мононитро-
продукта, но для регулирования крепости смеси приходится приме-
нять дымящуюся азотную кислоту. Заводским способом получается
обыкновенно смесь трех изомеров, а именно:
изомер с точкой плавления 217®
изомер с точкой плавления 167°
144*
W » rt
Динитронафталин входит в состав большого количества взрывчатых
веществ (найр., составов Фавье) и при обыкновенной температуре
представляет, подобно нафталину, твердое вещество, жирноватое на
ощупь (если оно только не вполне чисто). В нем большой избыток
углерода и он гораздо слабее динитробензола, но зато гораздо легче
применяется на практике я имеет преимущество малой чувствитель
пости к толчкам.
г) Тринитронафталин Ct#H5(N02).4 обыкновенно получают три-
нитрояафталин из моно пли динитронродукта.
Для приготовления тринитронафталина смешивают сперва 7, по -
лученного при предыдущей операции мононитронафталина (28 фу я.)
с 2 пуд. 12 фун. натровой селитры и получают, следовательно, 3 пуда
смеси. Эту смесь протирают через сито и опускают всю сразу в нит-
рационный куб (А) (рис. 42) с 6 пудами серной кислоты, плотностью
65 -66* Вё и определенной температуры.
— 251 -----
Куб помещают в деревянный чан В. Между стенками куба и чана
находится вода, которая может быть нагреваема паром; тут же распо-
ложен змеевик «, по которому циркулирует воздух, нагреваемый тем
же паром.
Смотря по крепости серной кислоты, налитой в нитрационный
куб, является необходимость несколько остудить или назреть ее. Так,
серная кислота крепостью 65,5’ Вё, остужается водой до 8°С.,—кре-
постью 65,1* Вё, нагревается паром до 24’С.
Ряс 42, Прибор для получения тринптронафталяна (схемат. раярпз).
После опускания смеси, куб закрывают крышкой (на чертеже не
показано), в кот. рэй имеются отверстия: для сообщения с приборами,
поглощающими азотистые пары, для трубки, приводящей нагретый
воздух, и для вставления мешалки. Затем начинают пропускать во-
дяной пар, а содержимое куба перемешивают деревянной мешалкой в
течение 10 минут—пока не появляются красно-бурые пары. Тогда,
отверстие для мешалки закрывается, а водяной пар продолжают про-
пускать еще в течение 2 часов, при чем температура поднимается де
100’—105’0. Воздух вдувают во все время операции, а также и после
прекращения впуска пара, всего в течение около 7 часов,—до тех
пор, пока температура не упадет до 85—80’.
П ^Сле этого, не снимая крышки, наливают в чан воды и снова
перемешивают содержимое куба, чтобы удалить из жидкости остав-
шиеся окисли азота. По снятии крышки, доливают воды почти до
краев куба и оставляют стоять до другого дня.
На другой день жидкость сливают сифоном, а полученный три
нитронафталин перекладывают в чан с диафрагмой чтобы жидкость
могла с него стечь. Далее тринитронафталин промывают холодной
водой, в каменных чанах, заставляя его стоять с водой в течение 2-х
часов, потом, удалив воду, выбирают из чанов и измельчают в мель
нице, состоящей из-двух цилиндрических каменных вальцев. Полу-
ценный порошок тривигроаафталина вторично промывается теплой
водой (при 30°) в течение 2-х часов,а затем следует отжимка в центр—
футе в течение 4—5 часов,-пока из нее не станет выходить пыль
тринитронафталина.
Последней операцией является плавка тринитронафталина Д ,!f
адого употребляются медные луженые, тигли. В каждый тигель номе
щают около 5 фун. тривитронафталина; плавка производится в масля
ной ванне и продолжается 2—-3 часа,—до тех пор, пока не выделятся
асе находящиеся в нем газы.
По окончании плавки, тигли с расплавленным тринитронаф;а-
лияоч вынимают посредством блоков из масляной ванны, переносят
к дырчатому котлу С вставленному в другой (В) с. г оря чей водой, вы-
ливают в него жидкий тринитронафталин в течение 3—4 минут, все время
перемешивая лопаткой (рис. '43). Здесь тринитронафталин затвердеем»
Ги'-. ГЧ Прибор для получения твердого тринитронафталина (схемах, разрез.
и обращается в зерна; затем дырчатый котел С вынимается из котла
В. после того как стечет вода, тринитронафталин выбрасывают в ко-
тел с холодной водой. Здесь он остается 3 — 4 минуты, при чем «го
все время размешивают; наконец, его перекладывают в особый чан
для того, чтобы с него стекла вода.
Полученный таким образом, тринитронафталин измельчают в
мельнице и сушат при t около 56"С.
Получающийся тем или иным путем тринитронафталин - есть
смесь трех изомеров, плавящихся при 122», 214® и 247». Торговый про
дукт представляет смесь всех трех изомеров и носит название иафти-
mat (современные названия ди и тринитронафталине Dinal и Ti’inaJ)
он.плавится при ПО’С. Его центрофугуют и плавят в медных сосу-
дах до полного прекращения выделения из него газов. Готовая масса
затем вливается в воду, измельчается, цецтрофугируется и сушится.
Тринитронафталин—твердое тело светло-желтого цвета, мало ра
створимое в воде, но разтворимоев уксусной кислоте и хлороформ,?.
Мало чувствителен к удару.
Он применяется во многих взрывчатых веществах (например, в
гризупафталитах): его вводят изредка в бездымный порох в качестве
-стабилизатора.
253
д) Тетронитронафталин. Химическая формула его C^H^NO^. Его
получают, нитруя снова динитронафталин сульфоазотвой смесью, со-
держащей избыток дымящейся серн< й кислоты. Операция ведется при
температуре около 120"С в течение одного часа. После удаления кис
лоты и промывки, получают продукт, неимеющий постоянного состава,
который очищается кристаллизацией из раст, ора в ледяной уксусной
кислоте. Перекристаллизованный продукт, имеющий вид тонких иголь-
чатых кристалликов, плавящихся при 220°С, и есть смесь двух изо-
меров с точками плавления—269° и 2()ОоС.
Он очень мало чувствителен к толчкам и детонирует только от
сильного детонатора.
Все нитронафталины, будучи зажжены, сгорают коптящим пла-
менем без взрыва.
Нитронафталины, применяемые на практике, в сущности пред
ставляют продукты различных степеней нитрации и взрывчатая их
сила обыкновенно оценивается общим содержанием азота, получаю
щегося при взрыве в манометрической бомбе. При плотности 0,3 нит-
ронафталина разные степени нитрации дают следующие величины
давления:
Моно нитрона фтал ин 1208 килогр. с.м?
Динитронафталин . 2355 „ „
Тринитронафталин . 3275 „ „
Тетронитронафталин 3745 ,
Формула взрывчатого разложения тетрон и трош; ф талина будет
такова:
С5 Н4 (NO2)4 - 6 СО + 2HS 0 + 2N,.
Как видно, сгорание хотя и не полное, но все-таки более полное чем
у тола, а потому, повидимому, применение тетронитропродукт а в не-
которых случаях могло бы быть выгодным, если бы найден был спо-
соб получения достаточно однородного продукта, а в фабрикации вве-
дены некоторые усовершенствования.
е) Галлоидные производные нитронафталинов. Это суть также
взрывчатые вещества, но в качества таковых ближайшим образом не
изучены.
ж) Производные нафтолов. Нитропроизводные нафтолов могут
появляться в виде примесей при фабрикации нитрофенолов. Практи-
ческого применения пока не имеют.
§ 2. Производные аитра- Вместе с парафином, в продуктах сухой пе
цена. регонки каменного угля находятся углеводороды
еще более, сложного состава нежели нафталин; к числу таковых при
надлежат между прочим антраце.н Сн Нц, инден и т. д. Все они на-
ходятся в неочищенном нафталине и нитруются одновременно с ним,
влияя своим присутствием, как на отклонения точки плавления от
нормы, так и на пластичность полученного нитропродукта.
ГЛАВА VII
Смолы и терпены,
§ и. Смолы. Состав их до сих пор еще недостаточно установлен,
невидимому, опи должны быть несколько приближающимися к т>-рне-
н»м, так как последние в соприкосновении с воздухом осмоляются.
Одной из известнейших смол является канифоль, представляющая со»
бой остаток от отгопкп терпевтинпою масла. Во всяком случае это
есть вещество весьма сложного сооава, содержащее преимуществен^
но кислые продукты. Новейшие работы В. И. Вузнпкова подтвердили
крайнюю сложность состава, как русских, так и иностранных сор*
тов продажной канифоли и вместе с тем сделали возможным проло-
жить ее в качестве флегматизатора пороха и для получения беспла-
менных порохов.
Обрабатывая на водяя< й бане истертую в порошок смолу азотпой
кислотой крепостью 1,45, получают твердое вещество ям»у»осло.>у, ко-
торую применяли в различных взрывчатых веществах. Так, например,
Шульце еще в 1886 году се употреблял для приготовления особого
сорта периксилинового охотничьего пороха.
§2. Терпены. Среди терпенов Ci0Hie интересен пинен, хлористое со-
единение которого обладает свойством поглощать азотистые пары, а
жотому испытывалось в качестве стабилизатора азотных эфиров. Борнеол,
CsIIieCHOII или борнейская камфора принадлежит к группе производ-
ных полициклических терпенов и характризуется, как спирт. Он
образует также эфиры, при чем нитрат борнеола представляется ве-
ществом взрывчатым.
Камфора обыкновенная СаШвСО представляет собой ненасыщенный
кетон. Она образует нитро — и нитрозопроизводные продукты замеще-
ния. Известно, чго камфора в спиртовом растворе представляет раст-
воритель для некоторых нитроце ыулоз (образуя так называемый
целлулоид)-, значительное количество производных смол и камфоры
обладают аналогичными же свойствами.
Камфора и борнеол применяются для того, чтобы умерить быст-
роту сгорания некоторых бездымных порохов и, до известной степени,
могут играть роль также стабилизаторов. Камфора вводится в не-
которые взрывчатые вещества (напр., в гремучие студни) в качестве
фле1матизанюра для уменьшения их чувствительности к механическим
влияниям/
Умеряющее действие камфоры на скорость сгорания подробно
исследовались Бертело.
S Класс гетероциклически# соединении.
ГЛАВА L
Тиофен и его нитропроизводные.
Тиофен*
НС —СН,
НС ОН
являющийся вредной примесью к углеводородам, идущим для нужд
взрывной техники, образует с азотной кислотой производные, сводные
е производными углеводородов, сообщая последним неприятный запах
и желтоватую или красноватую окраску.
Присутствие нитрогиофепов во взрывчатых веществах аромати-
ческого ряда понижает их точку плавления it уменьшает стойкость,
сообщая, как уже сказано, же гговатую или красноватую окраску.
Характерной реакцией яа прчгутспмие тиофена сложит окраши-
вание в синий цвет индофенива Соответствующие нитропроизводные,
превращенные в амины, принимают характерную красную окраску,
благодаря амидотиофепу, если только они содержат эту примесь.
ЧАСТЬ III.
ч
Основные понятия о технологии
главнейших взрывчатых веществ
и смесей.
Проф. М* Сухаревский. Взрывчатые вещества и взрывные работы.
В виду самых разнообразных задач, которые
Обще* замечание, современная техника пред‘являет ко взрывчатым ве-
ществам, само собой понятно, что ни одно взрывча-
тое вещество не может быть универсальным, и потому существует
очень много их, при чем каждое обладает каким либо отличительным
свойством, заставляющим на практике отдавать ему преимущество
в данном частном случае. Расположение взрывчатых веществ по из-
вестной системе зависит от той точки зрения, с которой вопрос этот
рассматривается.
С точки зрения применения взрывчатых веществ они могут быть
разделены на четыре группы:
1) Предназначенные для производства разрушений путем исполь-
зования живой силы резкого удара газов, — это будут вещества бри-
зантные или дробящие, характеризующиеся протеканием в них
реакций взрывчатого разложения с колоссальной быстротой, следст-
вием чего является крайне резкий удар газов.
2) Вещества, реакция взрывчатого разложения коих протекает
сравнительно медленно, у которых поэтому давления нарастают по-
степенно. Эго суть вещества, обладающие хорошими баллистическими
(метательными) .свойствами и потому получившие название, метатель -
пых или пороха.
3) Вещества, служащие для передачи огня или производства 'де-
тонации.
4) Вещества, служащие для дачи сигналов, преимущественно све-
товых.
В последние две группы войдет часть веществ и из первых
двух групп.
Вещества, входящие в состав первых двух групп, иногда делят
также на:
1. взрывчатые вещества, применяющиеся в военном ведомстве
(порох, а также бризантные составы и вещества).
2. Взрывчатые вещества, пр именяющиеся в промышленности-, сюда
войдут частью взрывчатые вещества, применяющиеся в военном ве-
домстве, а также и другие, мало пригодные для военного дела, но.
с выгодой могущие применяться в промышленности. Среди последних
выделится специальная группа „безопасных" или антигризутных
взрывчатых вейщств для работ в рудниках с угольной пылью и руд-
ничным газом.
С точки зрения состава.
По своему составу взрывчатые . вещества • разделяются-) на
3 группы: "
I. Механические смеси, в которых составные части перемешаны
между собой механически и могут быть снова тем или иным путем
извлечены. (Типичным представителем таких веществ является обык-
новенный черный порох). Они могут быть:
а) газообразными,
б) жидкими,
в) твердыми.
II. Химические соединения, в’которых части химически соедине-
ны между собой и не могут быть выделены без разложения всей
системы. (Типичным представителем их является, например, пикри-
новая кислота). Сюда входят:
1) Экзотермические соединения:
А) Сложные эфиры азотной кислоты:
а) мнбгоатомных алкоголей (например, нитроглицерин);
в) углеводов (например, нитрокрахмал).
В) Нитросоединения (например, пикриновая кислота);
2) Эндотермические соединения.
А) Гремучие соли (например, гремучая ртуть).
В) Диазосоединения и разные азотистые взрывчатые вещества
(например, азотнокислый диазобензол).
3) Соединения, не содержащие углерода (например, азиды).
III. Смешанные составы представляют смесь каких-либо взрывча-
тых химических веществ с другими веществами—дзрывчатыми или
невзрывчатыми (характерным представителем является многочислен-
ная группа динамитов).
С точки зрения химической:
А. Неорганические.
а) Содержащие хлор (например, бертолетовая соль).
б) Содержащие азот (например, азиды).
в) Нитраты (например, аммонийная селитра).
г) Двухромокислые соли (напр., двух ром окйслый аммоний).
д) Сложные соединения перекиси марганца (напр., марганцево-
кислый калий).
е) Соединения металло-органические (т. е. соединения- мине-
ральных веществ с органическими радикалами).
В. Органические соединения. ,
1) Жирный ряд.
а) производные замещения углеводородов (напр. нитропарафины);
б) нитропроизводные спиртов (напр., нитроглицерин);
в) нитропроизводные альдегидов и кетонов (например, нитро-
целюллюлозы);
г) нитропроизводные кислот жирного ряда, простых и сложных.
(Например, нитроуксусный эфир);
д) нитропроизводные аминов и амидов (например, нитрогуанидин).
2) Ароматический ряд.
а) Нитропроизводные углеводородов (например, тринитротолуол).
б) Нитропроизводные фенолов (например, пикриновая кислота).
в) Нитропроизводные спиртов; альдегидов, кетонов и кислот
ароматического ряда (например, соли тринитробензольной кислоты).
г) Нитропроизводные анилинов ароматического ряда (например,
нитроанилин).
3) Производные смол и камфар. (Например, нитрованная смола).
4) Азо и диазо соединения и их производные (например, азотно-
кислый диазобензол).
5) Производные цианистых соединений (например, гремучая ртуть).
Современная техника приготовления взрывчатых веществ, достиг-
нув большого совершенства, вместе с тем является в своих деталях
настолько сложной, что чисто—книжное изучение ее не может дать
каких-либо практически ценных результатов.
Поэтому здесь мы старались дать лишь основные понятия о со-
временном приготовлении взрывчатых веществ, выбрав из последних
несколько наиболее важных, не задерживаясь слишком долго на раз-
личных. деталях производств; последние часто варьируются, общие
же черты производства являются более постояни^мид: характерными.
В равной мере, рамки настоящего труда не' позволяют охватить
всего разнообразия современных взрывчатых веществ, поэтому в опи-
сательной половине настоящей части мы приводим лишь те из них,
которые имели уже известное историческое прошлое или и в настоящее
время являются наиболее распространенными и интересными с точки
.зрения своих качеств и свойств.
Основные понятия о технологии главней-
ших взрывчатых веществ и свойства
последних,
ч.
Черный дымный пороге.
§ 1. Хотя черный порох в наши дни уже не имеет такого подавляю-
щего значения, которое он имел раньше,"однако, историческое его зна-
чение и наглядность многих стадий его производства для характе-
ристики приготовления механических смесей являются основаниям,
для описания производства и некоторых свойств его в первую очередь.
Как уже говорилось ранее, обыкновенный черный или дымный
(селитро-серно-угольный) порох есть механическая смесь селитры,
серы и угля". Теоретический состав его, от которого различные сор-
та пороха более или менее отклоняются (о чем подробнее будет ска-
зано далее), по Вертело, таков.
Калиевой селитры — S4"0
Серы.................8*/о
Угля................8®/()
§ 2. Технология черного пороха в общих чертах состоит в сле-
дующем.
Продажная сера, если только она не вполне чиста, подвергается
переплавке или возгонке.
Селитра. На лучшие сорта пороха (в том числе и не военные)
идет исключительно калиевая, причем она должна быть очень чистая.
Готовится обыкновенно из хлористого калия при помощи обмен-
ного разложения в водном растворе с натриевой селитрой и подвер-
гается затем процессу нитрования. Нерастворимых в воде примесей
в ней абсолютно не допускается.
Из всех трех составных частей дымного пороха наибольшие труд-
ности изготовления выпадают на долю угля. Для достижения возможно
большего однообразия в качестве угля, берут дерево одного и того-же
сорта и возраста и обугливают его при одной и той-же температуре
по возможности в совершенно одинаковых условиях. Обжиг ведут в
железных ретортах в течение около 5 часов, причем для получения
черного угля нагревают реторты до 350°, для бурого-же угля нагре-
вание требуется меньшее.
Хороший черный уголь должен иметь черный цвет с синеватым
отливом, в порошке же чисто черный. Он должен быть тверд, хрупок
и'легко разламываться, при ударе-же издавать отчетливый звук. Гореть
должен или вовсе без пламени, либо с коротким, бледно-синеватого
цвета пламенем.
Черный уголь хотя и гигроскопичен, но обладает этим свойством
в меньшей степени, чем бурый. Последний ‘труднее измельчается,
но легче сгорает, причем порох, его содержащий, действует сильнее
черного.
§ 3. Центр тяжести при приготовлении черного пороха заключается
в наилучшем измельчении отдельных составных частей, их перемеши-
вании и придании смеси прессованием, большой плотности, так как
взрывчатое разложение пороха будет тем быстрее, чем ближе сопри-
касаются друг с другом частицы угля, серы и селитры.
Измельчение, смешивание и прессование производилось раньше
одновременно. Для этой цели употреблялись механические ступки.
(Рис. 45). Конструкция подобной ступки весьма проста. Она состоит из
Рис. 45. Механическая ступка.
ряда пестов „а“, которые поднимаются и опускаются шипами „с“, наса-
женными на вал „А“. Самые ступки (рис. 46) сферичны с воронкообразный
расширением наверху. Вес песта обычно колеблется между 20—30 klgr.
Высота его падения 0,432 mt; каждая ступка вмещает 8 klgr смеси.
Все три составные части пороха, в соответствующих составу пороха
количествах, одновременно помещались в стуики, смачивались водой
и обрабатывались в течение от 6—24 часов, смотря по сорту пороха.
1) Измельчение составные частей.
В настоящее время составные части сначала измельчаются в
отдельности, причем, однако, уголь и сера обычно измельчаются
Рис. 46. Деталь рис. 46. Ступка с
пестом. (Вертикальный разрез).
совместно. Измельчение происходит или в барабанах, или-же под
бегунами. Подобный барабан обычно (Рис. 47, 48, 49) помещается
Рис. 47. Барабан для измельчения составных частей '
пороха.
в кожух, не пропускающий угольной пыли. На внутренней стене
барабана прикреплены поперечные бруски, которые совместно с желез-
ными или бронзовыми пулями способствуют лучшему измельчению
серо-угольной смеси. По окончании измельчения пороховая мякоть
по кожаным воронкам просеивается в бочки.
Бегуны—чугунные (рис. 50, 51) или бронзовые цилиндры А, А,
весом около 3000 klgr. каждый. Они катятся по бронзовому лежню
с закраинами. Оба цилиндра отстоят от вертикальной оси В на не-
одинаковом расстоянии и приспособлены таким образом, что могут
независимо друг от друга подниматься вверх. Воронка Е служит для
насыпания материалов.
Рис. 48. Французский барабан для из-
мельчения составных частей пороха.
Селитра обычно не требует предварительного измельчения, так
как поступает на завод в виде мелкой кристаллической муки. В про-
тивном случае она измельчается в особых барабанах или мельницах.
Рис. 52, 53, 54 показывают различные конструкции таких барабанов,
принцип устройства и действия которых сходен с такими же для
серо-угольной смеси. С успехом применяются также и мельницы
„Excelsior" и „Perplex® (рис. 55, 56), которые снабжены, как видно
на рис., предварительным измельчителем, состоящим из двух вальцов,
и воронки. Во особенно удачные результаты получаются при приме-
нении мельницы системы Пфейфер (рис. 57, 58) с воздушным отсеива-
телем, принцип устройства которого состоит в том, что струя воздуха
различной силы к состоянии увлекать частицы различного веса. Это
устройство позволяет получать совершенно однородно-измельченную се-
литру. Рис. 59.показывает схемат. разрез мельницы Пфейфера, из кото-
рого можно видеть, что измельченная селитра, ковшами на бесконеч-
ной цепи е поддается наверх Н воздушный просеиватель, который на
рис. 60, 61, 62 показан в отдельности в последовательном усовершен-
ствовании. Кроме того, применяется еще целый ряд других машин,
наиболее характерные из которых показаны в прилагаемых рисунках.
266 —
2. Предварительное смешивание.
В Англии, Гермааии и др. странах, где смешивание составных
пастей пороха происходит под бегунами, обычно производится пред-
варительное смешивание в особых медных барабанах, диаметр которых
равен 820 мм. (в Англии), а ширина 450 сант. Через барабан пропу-
щена ось, на которой прикреплены восемь рядов бронзовых вилко-
образных стержней. Барабан вертится в обратном направлении по
Рл«. 49. Германский барабан для измельчения
составных частей пороха.
отношению к мешалке, причем первый делает 40 оборотов, а послед-
няя 80 в минуту. После 5 минут движения, барабан опоражнивается
а смесь просеивается вручную сквозь сита для удаления случайно
попавших, посторонних предметов.
3. Смешивание тройного состава.
Смешивание производится двояко: в барабанах или под бегунами.
Ввиду опасности работы с селитрой барабаны делаются из кожи, а
все металлические части из бронзы. Бегуны уже, описаны выше и
здесь мы коснемся только некоторых усовершенствованных типов. Так,
на заводе Gruson в Германии употребляются бегуны, которые подве-
шены на приводном валу F (рис. 63, 64) таким: образом, что не касаются
лежня, чем значительно уменьшается опасность взрыва от падения
бегуна на лежень с крупных кусков смеси.
4. Прессование пороговой мякоти.
Прессование пороховой мякоти происходит в винтовых, вальцовых
или гидравлических прессах. Но прежде, чем попасть под пресс, по-
роховая лепешка разбивается дере-
вянными молотками на мелкие куски,
а затем пропускается через вальцовую
дробильную машину^ Последняя со-
стоит из двух пар бронзовых вальцов.
Измельченные пороховые лепешки на-
сыпаются на бесконечное полотно,
которое подводит их к первой паре
вальцов, откуда они попадают под
вторую пару, чтобы оттуда выйти уже
ввиде муки, которая через воронки
поступает в ящики. Иногда эта мани-
пуляция повторяется несколько раз.
Собственно прессование производится Рис. 50. Схематический разрез
в прессах. Раньше в употреблении бегунов.
были винтовые прессы. Позднее в
Германии были в ходу заимствованные из Франции вальцовые прессы
т. н. „laminoirs", которые отчасти сохранились и до настоящего
Рис. 51. Бегуны.
времени. Они состоят (рис. 65, 66) из литого вальца С, который
трением приводит в движение большой картонный вал В, а этот в
свою очередь давильный вал А из твердой литой стали. Бесконечное
полотно D проходит под воронкой Е, а затем между картонным и да-
вильным валами.
52. Барабан для измельчения селитры фирмы „Krupp Grusonwerke".
Рис
F Рычаг, устройство которого видно из рисунка, давит на вал А,
который и прессует бегущую по бесконечному полотну пороховую
муку. При выходе из машины пороховая масса проходит через перед-
вижные ножи F, которые обрезают ее с боков.
Рис. 53. Испан-
ский барабан для
измельчения се-
литры с диаго-
нальной осью фир-
мы „в arcarena".
В последнее время вальцовые прессы все больше
и больше вытесняются гидравлическими прессами,
принцип устройства которых сходен с обыкновен-
ными гидравлическими прессами (рис. 67 и 68). На
четырехколесный вагончик, который по рельсам может
вкатываться на поршень пресса, накладывается по-
роховая масса, прослоенная медными или эбонито-
выми пластинами. Происходит это сл. образом. На
вагончик сначала кладется пластинка; на нее де-
ревянная рама, которая немного выше первой; в раму
насыпается пороховая мякоть, уравнивается линей-
кой и затем на нее кладется вторая пластинка, рама
поднимается и т. д. пока не образуется слой доста-
точной высоты. Тогда раму удаляют, а вагончик
пускают под пресс. В настоящее время ввиду электрических свойств
эбонитовых пластинок последние заменены пластинками из вулкани-
зированной фибры. Прессование продолжается 30 — 40 минут, при
чем давление достигает 25 — 30 klgr. на квадр. сайт, поверхности
пластины. Рекомендуется прессование производить медленно и повто-
рять несколько раз, чтобы получить значительное спрессОвание, не
прибегая к большим давлениям. Края лепешки из под пресса выхо-
— 269
Рис. 54. Барабан для измельчения селитры фирмы „Riedinger".
Рис. 55. Мельница „Excelsior" фирмы
„Golzern" для измельчения селитры.
дят менее спрессованными, чем середина, поэтому 2 — 3 ст. с края
всегда срезаются.
_ 970 —
5. Зернение.
В России способ зернения пороховой массы находится в зависи-
мости от сорта приготовляемого пороха. Порох крупнозернистый при-
готовляется посредством дробильной машины, а порох мелкозерни-
стый—посредством грохотов и крутильни.
„ Рис. 56. Мельница „Perplex* для измельчения селитры.
Дробильная машина (рис. 69) состоит' из двух зубчатых бронзовых
вальцев А и В, вращающихся навстречу один другому; пороховые
лепешки закладываются в имеющуюся над вальцами воронку С, откуда
падают в промежуток между ними и тотчас же дробятся в зерна,
размеры которых можно ограничивать, изменяя расстояние между-
вальцами. Получаемые принтом зерна неоднородны и поэтому они про
свиваются через сита М, N, 0, на которых и разделяются на несколько
сортов, освобождаясь вместе с тем от пороховой мякоти. Непрошедшие
через верхнее сито, крупные зерна подаются элеватором ЕЕ, при по-
мощи черпаков К, опять в воронку и подвергаются вторичному зер-
нению.
Грохоты представляют собой круглые сита с двойным, иногда
тройным дном; верхнее дно делается из кожи и имеет отверстия,
которые соответствуют по размерам наибольшему поперечному сече-
Рис, 57. Мельница для измельчения селитры системы „Pfeifer"
г '
Рис. Вертикальный
разрез мельницы „Pfei-
fer1" (-схема)..
Рис, 58. Жернов мельзицы юРге^Г‘,
Рис. 60. Воздушный про
сеиватель „Pfeifer14, Еоа
сгрукция 1888 г.
— 272 —
Рис. 61. Воздушный просеи-
ватель „Pfeifer’a*. Конструк-
ция 1895 г.
Рис. 62. Воздушный просеиватель „Pfeifer’a".
Конструкция 1909 г.
Рис. 63. Наружный вид бегунов фирмы ttFr. Krupp
Grusonwerke*.
Рве. 64. Вертикальный схематический разрез
бегунов’фирмы жЕг. Krupp Grusonwerkc*.
Ряс. 65. Схема вальцового пресса.
Л?, Сулареесый. Взрывчатые вещества и взрывные работы.
Рис, 66. Вальцовый пресс для прессования пороха.
i
Рис 67. Схематический разрез
гидравлического пресса.
Рис. 68О Гидравлический пресс.
275
нию зерен приготовляемого пороха, а другие донья металлические»
имеют более мелкие отверстия. Пороховые лепешки закладываются
в грохоты вместе с несколькими свинцовыми шариками; затем они
закрываются крышками и устанавливаются на особый прибор, наш*
Рис. 09. Вертикальный схематический разрез дробильной
машины.
ваемый крутильней, (рис. 70). Крутильня представляет собой горизон-
тальный стол R. N, укрепленный на качающихся стержнях mm; на нее
Рис. 70. Вертикатьвый разрез и план крутильной
машины для мелкозернистого пороха.
устанавливается целый ряд грохотов, а затем механическим путем
она приводится в колебательное движение. Пороховые лепешки
276
дробятся ударами свинцовых шариков и тотчас же просеиваются
через дырчатые донья, разделяясь на несколько сортов; образующаяся
при этом пороховая мякоть, просеивается через сита, и собирается в
ящике К, поставленном под крутильней.
В Германии для этой цели служит машина Lefebure. Ьна состоит
из деревянной рамы, установленной на подвижных шарнирных брусьях,
которые коленчатым валом приводятся в эксцентрическое движение.
В раме сделаны 12 отверстий, над которыми столько же дубовых сит,
т.-е. грохотов. Каждое сито состоит из трех, находящихся один над
другим, меньших сит. Размельченный спрессованный порох через
медные воронки попадает на верхнее сито, где тяжелым диском про-
сирается сквозь него. Пороховая пыль падает через воронку в яшяк
в то время как хорошие зерна через другую воронку ссыпаются
во второе сито. Более широким распространением пользуются ма-
шины Congreve (рис. 71). Три или четыре пары вальцов укреплены
Рве. 71. Машина для зернения пороха ..Congrrve*.
i
Рве. 72. Машина для дернения пороха фирмы .(Dust Remover*.
на крепкой чугунной подставке. Две нижние пары вальцов гладкие,
следующая пара снабжена зубьями, отстоящими на 6 мил. друг от
друга; у верхней пары зубья отстоят на 12 мил. Подача пороховой
массы к верхней паре вальцов происходит бесконечным полотном.
' _ ?
Рис. 73 Машина для зернения пороха фирмы „А. G < iclzeni-Grimma*.
Под каждой парой вальцов, исключая нижний, находится сито, кото-
рое составляет соединение одной пары вальцов с другой. Кроме того,
два длинных сита наклонно прикреплены под всей машиной на рас-
стоянии 15 cm. друг от друга. Верхнее сито имеет 10 отверстий
в англ, дюйме, нижнее—20. Все сита приводятся в дрожащее дви-
жение. Из нижнего сита зерна сыпятся в ящики. В особые ящики
ссыпается и пороховая пыль. Способ действия этой машины понятен
и поэтому останавливаться на нем не будем. Укажем только, что
вальцы делают 25 оборотов в минуту, а сита 130—150 ударов.
6. Отделение пороговой пыли, предварительная сушка и полировка.
Дальнейшая обработка пороха в разных странах весьма различна
и зависит, главным образом, от примененного способа зернения.
В Англии порох сейчас же полируется. Полировка преследует
цель сгладить острые углы и выступы и замазать поры, чтобы порох
труднее впитывал влажность. Эта операция производится в бараба-
нах, которые отличаются от метательные тем, что в них нет попе-
278
/
речных брусьев. В барабан закладывается 200 klgr. пороху; он вра-
щается со скоростью постепенно возрастающей до 16 оборотов в
минуту. Продолжительность операции—до 20 часов, смотря по сорту
пороха.
Предварительная сушка производится на рамах, обтянутых по-
лотном и помещенных в шкаф, через который продувается нагретый
воздух.
Отделение пороховой пыли состоит в том, что порох всыпают
в небольшие длинные мешки, которые приводятся в такое движение,
что порох пересыпается с одного конца мешка в другой и затем
обратно. При этом пыль просеивается сквозь мешок. Иногда для
придания пороху глянца прибавляется немного графиту.
На наших казенных заводах после сортировки производится
чистка пороха. Для машинной чистки было устроено сл. приспо-
собление (рис. 74). Три деревянных круга ('^ надеты ня ось а;
Гис. 74. Приспособление для чистки пороха.
в кругах, по окружности, проделаны отверстия, к которым прикре-
плены мешки. В каждый мешок всыпали около 15 фунтов пороха,
закрывали отверстия втулками b и завязывали под ними мешки.
Порох при вращении оси пересыпался от одного конца мешка к дру-
гому, что продолжалось около 2 часов, при чем зерна очищались от
мякоти, проходящей через холст и собиравшейся в подставленные
книзу ящики,
7) Окончательная сушка мешка и укупорка
Окончательная сушка нроизводится в тех же аппаратах, как и
предварительная и имеет целью уменьшить содержание влажности
Г(О О,5»/о.
После сушки порох различного времени изготовления перемеши-
вается я укупоривается в боченкн со вложенными в них равендуч-
ными мешками или в герметически закрывающиеся металлические
ящики
§ 4. Прнгетевйеиие при»- В I860 году американский генерал Родман
татичесиого порога, предложил спрессованный в виде призмы порох
с просверленными в нем: отверстиями с целью придания ему большей
равномерности горения и уменьшения первоначального давления на
канал орудия.
В 1879 году нроф. Вишнеградским был сконструирован^пресе
для призматического пороха, который отчасти сохранился’ до на-
стоящего времени. (Рис. 75). Он состоит из трех частей: верхней,
Рис. 75. Механический пресс Вишнеградского
для призматического пороха.
средней и нижней. Верхняя и нижняя части соединены рычагами и
приводят в движение верхнюю и нижнюю траверсы при помощи
эксцентриков и зубчатых колес таким образом, что обе траверсы
сближаются на известное расстояние, а затем движутся снизу вверх.
На каждой траверсе прикреплено по G пестов, внутри которых про
буравлено по 7 каналов. В средней части находятся стальные фор-
мочки, в которых прессуется порох. На нижней траверсе прикрои
лены 7 стальных игл. оканчивающихся коническим остреем. Диаметр
их равен 5 инн. Эти иглы проходят через каналы нижиих тестов и
достигают до средней части. Порох насыпается в медный ящик,
который скользит ио средней части туда и обратно и снабжен
сосудами для отмеривания пороха. Этот ящик двигается совместно
сю всей машиной и как только он остановится над формочкой, порох
из мерок падает вниз, а сам ящик продолжает свое движение. Оба
песта тогда начинают сближаться и, благодаря соответствующему
устройству эксцентриков, нижний пест начинает двигаться вверх,
Рис. 70. Механический пресс для прнзмати >
скоро пороха фирмы „А. G. Krupp Grusonwcrkv*
как только верхний достигнет своего нижнего расположения. Верхняя
траверса вращением большого эксцентрика быстро поднимается вверх,
нижние песты выталкивают готовую призму, а вновь возвращающийся
ящик сталкивает ее навстречу рабочим.
13 настоящее время призматический порох обычно выделывается
на гидравлических прессах (рис. 77 и 78), которые в основных чер-
тах действуют так же, как и механические.
Примечание. Существует порох, где уголь заменен дру-
гим веществом вроде каменного угля, древесных опилок, клея,
декстрина, крахмала, резины, винного камня и т. д и т. д,
'Гаковы, например: Петралит, жанит, карбоазотин и амидоген.
Производство их отличается некоторыми особенностями.
Отдельные составные части в течение 15 мин. основательно
fir
А?-
та
я?
— 281 -
смешиваются в барабанах, затем смесь
(рис. 79), в котором она вываривается. В
бавляют большое количество воды.
помещается в
котел
обычно
котел .
при-
Риг. 77. Гидравлический пресс для
призматического пороха.
С/ '(\iifcj
5
Порох, изготовленный подобным образом, никогда не обла-
дает безупречной однородностью, так как селитра при выкри-
сталлизовании образует большие кристаллы, которые легко отде-
ляются от остальной массы.
fl
2Я2
Й
и
&
й - л
*^r.ol№
Я
i'uc, 7S Гидравлический пресс лля призматического
пороха фирмы „Л- G. GoVzern-Grimma".
у
i
i
Рис. 7 ч Котел для вываривания карбоазотина.
а- открытый котел; В—сосуд для пара; G—мешалка;
С—впуск пара.
я
t
'.-ЦК'Л
j: v
?Г
X-
§ 5. Состав черного пороха главнейших государств следующий
ij Селитра. I JL J Сера. Угол*.,
а) Винтовочный порох: h •* 1' ।
Австро-Венгрия, Китай, Франция, Англия, >
Испания, Россия, Швеция, Турция, Соедн-
ненные Штаты . . . . . ;{ 75 10 ! 15
Бельгия г ~ - - г «о,;? ; 12 i 12,5
Испания, Персия 75 в , 12,5 12,5
Германия . 1] л " i 4 10 hi
Голландия ;1 70 .j 14 ’ 1 ()
Португалия ... . !i 75,7 ; 10,7 I
Швейцария . . . 1 — г I !! ♦ 5 11 ' II
б) Пушечный поро.г: Австро Венгрия, Германия i:' '1 ’ i; 74 ; 10 1 b
Франция, Англия, Швеция ii 75 1 , i : 10 ! 15
i в) Охотничий порох i!
Австро-Венгрия ; 7 6 9,4 14,n
Франция, Германия ;! 78 ' 10 1 2
Англия 7 5 ; и - * JO 15
Швейцария J 78 ; < 1 0 . 12
г) Минный порох: 1
Австро-Венгрия i 60,2 > 18.4 : 21,4
Франция < "2 13 , 15
Германия 70 ‘ , 1 d 14 16
Англия ii 75 i 10 15
Италия . . : 7o 18 12
РОССИЯ . ....... 1 66,6 I* . ‘ 16,7 16,7
Бурый призматический c :.7s - si f Д» z*le 19 20“U
В ружейном военном порохе больше селитры и меньше уг.ы,
ь охотничьем—количество селитры еще больше, а в минном наобо-
рот— значительно меньше.
'I
- 234 —
В нижеследующей таблице приведен состав еще некоторых фран-
цузских черных порохов:
! Селитра. 1 ! Сера, V ЛГ016.
Охотничий ’ Т ч <> ' i * / о г ! ю% ! 12% уголь бурый
i специальный.
Вурый военный „Г. В.“ . . . ! -Г» ! 19е/ | 1 /о
Военный 1 i % ® •' ' < / 0 ’ 1 / 0 ; 12,5% уголь черн.,
i i ! F ' специальн..
Минный, сильный . I 72 75"- •„! 13 10°. 15“/.
Минный, обыкновенный . . . . ! <52% i 20° 18%.
Пороховая мякоть 62% : 20« 18’1» уголь черный,
i обыкновенный.
Минный порох, медленно горящий; 40* р :!0%,
Как видно отсюда, охотнички пороха и военные, наиболее богаты
селитрой, порох же минного типа для рудничных работ и сравни-
тельно не твердой скалы заключает ее наименьший процент; чем
тверже горная порода, тем выгоднее применять порох с большим
количеством селитры. В вязком, нетрещиноватом камне и соответствую-
щих качеств угольных пластах все преимущества будут на стороне
прессованного пороха, сделанного из лучших, богатых селитрой, сортов.
Черный порох с содержанием 65—70% селитры дает больший
об’ем газов, но последние имеют температуру ниже тех, которые
получаются при порохе с 75е;» селитры, который поэтому развивает
большее давление.
При уменьшенном количестве селитры, в продуктах взрыва полу-
чается значительно больше окиси углерода, нежели в порохе с
большим количеством селитры, уде количество окиси углерода умень-
шается за счет возрастания количества углекислоты.
Увеличение количества селитры вместе с тем увеличивает и силу
пороха, а также выгодно в смысле уменьшения нагара; увеличение
количества серы придает зернам пороха большую прочность, способ-
ствует увеличению количества отделяющегося при взрыве тепла,
уменьшает гигроскопичность и облегчает воспламенение, но зато уве-
личивает количество нагара, несколько уменьшая в то же время силу
пороха. Увеличение количества угля до известного предела выгодно,
ибо уголь способствует образованию большего количества газов, но
зато делает зерна менее твердыми и более гигроскопичными. Степень
обжига угля сильно влияет как на силу пороха, так и на воспламеняе-
мость. Древесные породы, доставляющие лучший уголь следующие:
черемуха, крушина, бук, береза и ива.
Вообще состав черного пороха довольно сильно разнится в за-
висимости от цели его применения.
— 285 —
По величине зерен военные пороха разделяется на:
а) пушечный или артиллерийский с зернами около 1,5 м. м.
б) ружейный , „ „ „ „ 1 м. м/')
в) крупнозерн. „ „ „ „ „ 5—10 м. м
г) призматический—шашки высотою 25 м. м. диам. 40 м. м.
д) бурый призматический.
Сорт в) мало, а г) и д) вовсе не пригодны для ( минной войны
и подрывных работ.
Зерна пороха должны быть ровные, темно сизого цвета, на ощупь
сухие и настолько тверды, что не должны раздавливаться между
пальцами. Для придания пороху блеска при полировке, прибавляют
от 0,1 до 1,5% графита или серы в порошке. Так называемый алмазный
порох получается путем смешивания пороха различной степени
полировки.
Удельный вес отдельных зерен пороха 1,45 — 1,97, а в зарядах
(гравиметрическая плотность) от 0,9 до 1,0, прессованного же 1,55—1,85.
Вес одного кубич. фута пороха около 26% килограм. В нем не должно
быть больше 0,1 % пороховой мякоти и он не должен пачкать бумагу,
будучи на нее насыпан.
Если быстро довести какую-нибудь частичку пороха до темпе-
ратуры 2500—3 10° (в зависимости от сорта пороха, чаще всего до 265»),
то порох взрывается. Поэтому все механические влияння, как-то:
удар, трение и проч., способные возвысить температуру до этого пре-
дела, вызывают взрыв пороха**) Непосредственное пламя легко вос-
пламеняет порох только в том случае, если оно обладает достаточной
плотностью: пламя спирта и бумаги с трудом зажигают порох. Искра,
происходящая от удара железа и стали о камень, легко взрывает по-
рох, искра-же электричества, (как статистического, так и динамиче-
ского, а также индуктивных приборов), не особенно высокого напря-
жения, не зажигает пороха, но молния его взрывает всегда.
Удар ружейной пули по большей части взрывает порох» но удар
медного предмета о камень почти никогда не вызывает взрыва..
При взрыве пороха 43,6% по весу его обращается в газообразные
продукты, а 56,4% составляют твердый остаток, причем температура
газов при взрыве доходит до 2200°, а упругость их до 6000 атмосфер
*) Число зерен в 1 грам. французского пороха приблизительно следующее:
а) в военном порохе (идущем на запалы для бездымных порохов и снаряж-
шрапнели (от 900 до 1200);
б) в охотничьих сортах: № О от 650 до 950; № 1 от 2000 до 3000; 2 oi
4000 до 6000; № 3 от 8000 до 12000 и № 4 от 20000 до 30000. .
*’) При медленном нагревании пороха при температуре около 100°С, плавится
сера,затем селитра и может выделиться кислород раньше,нежели воспламенится уголь,
так что такое разложение может протечь и без взрыва.
Заслуживает внимания тот факт, что порох, в состав которого входит утоп-
ия куркумы, почти не чувствителен к механическим влияниям.
При взрыве одного килогр. черного пороха, содержащего 75е/,
•селитры, получается:
122 литра углекислого газа (приведенные к температ. 15*С.)
87 „ окиси углерода
87 , азота 1
364 грам. твердого остатка.
Общий об'ем газообразных продуктов равен 296 литров.
Реакция взрывчатого разложения дымного пороха зависит от ею
состава. В частности для того, который состоит из 75% калиевой се-
литры, 13°/0 угля и 127» серы, она протекает главным образом по
следующему уравнению:
20KNOS*+ ЗОС + 10S = 6К2С03 + K9S04 + 3K2Ss + 14СО, + 1000 + 10N,.
Сарро для взрывчатого разложения французского военного дым-
ного пороха, дает следующее уравнение:
IOKNO3 + 4S + I2C = 8С0, + ЗСО + 5xN» + K2CO3 + 2K,SO42K,S.
и взрывчатые константы, его характеризующие, будут, следовательно
Т = 310о килогр.
v0 == 279 литров
t° = 2660*
Р== 272 22^
метр,
а —0,488 литров.
Venin и Chesneau замечают, что данная Сарро формула взрыв
пятого разложения скорее отвечает сортам охотничьего пороха чем
военного.
1 килогр. пороха, будучи зажжен на воздухе, сгорает в 0,01 се-
кунды, при чем скорость сгорания возрастает с увеличением давления.
Сила и потенциал черного пороха весьма различны, так же кик
и скорпсю сгорания: охотничий сгорает в минимальное время, военный
должен сгорать jo раз до более постепенно, минный же в некоторых
случаях должен сгорать еще медленнее, чтобы не дробить каменные
п->р |ды. Увели юние размера зерен и их плотности желает порох мед-
леннее горящим. Угловатый порох горит со скоростью, равной сфе
рпческим порошинкам, имеющим диаметр,, равный наименьшему раз-
меру уг оват ах частил его. Плотность заряжения угловатого пороха
будет также больше. До некоторой степени скорость с>орания умень-
шатся с увеличением поверхностной плотности зерен при помощи
полировки. Этим увеличивается пр-грессивность действия пороха.
Чем больше калибр орудия, тем порох должен сгорать медленнее, и
потому для таких орудий употреблялись призматические и крупно
287 —
.зернистые пороха. Чтобы замедлить сгорание пороха в его состав
вводят также парафин, что одновременно делает подобные пороха
меннее гигроскопичными.
Пороха с бурым, мало прокаленным углем, употребляются для
пушек большего калибра, давая значительное увеличение начальных
скоростей, не увеличивая в то же время в значительной степени мак*
сималъного давления. Бурый порох дает гораздо меньше дыму, чем
черный, но зато он более гигроскопичен. Воспламеняется он также
труднее черного, при чем последний служит обыкновенно для него
во спл ам ен и телем.
В нижеследующей таблице приведены некоторые данные о срав-
нительных баллистических качествах некоторых французских черных
и бурых, а также бездымных порохов.
Калибр пушек, сорт по- рох,! и марка 00 м/м Безд В. С Стар. Черн. 138 м/м. Бур. Р. в8 155м/м Черн с. Pj 240 м/м 270м/м Бур- P. в. ЗО5ы/м Беед, 1В
Безд. В. Мо и Безд В. М- Черн. 30/40
Вес снаряда в кнлограм. 8 ь 30 30 40 170 144 216 340
Вес заряда в килогр. . 0,72 1/0 7,13 12.3 8J 76 Зо 70 123
Начальн. скор, в мет. в сек. 450 45“ 755 585 450 920 450 514 83d
Наибольш. давл. в килогр. 16Ю 23UO 2000 2300 2200, 2500 2100 2400 2500
При воспламенении пороха сперва загорается уголь, за ним пла-
вится селитра и наступает ее разложение с освобождением кислоре*
да, за счет которого и идет дальнейшая реакция взрыва.
Порох легко отсыревает; в нем не должно заключаться более
1,1% влажности; при большом содержании влажности зерна начинают
терять блеск и свойственный им сизый цвет, делаясь матово чер-
ными, затем же слипаются в комья; Если порох натянул не более
З’/о—4% влажности, то по просушке поверхность зерен будет иметь
однообразный цвет, и такой порох еще годен к употреблению. При
5% влажности на поверхности пороховых зерен, после просушки их,
выступает белый налет от выкристаллизовавшейся селитры. Такой
/ пооох действует уже слабее обыкновенного. Если в порохе от 7% до
14% влажности, то замечается разбухание зерен и, по просушке era,
помимо налета селитры па зернах, он слипается в твердые комья,
трудно раздавливаемые рукой. В таком виде порох не годен к упо-
треблению.
Порох, подмоченный морской водой, также делается негодным.
Если порох в замкнутом пространстве (в прочной оболочке или пр»
хорошей забивке) воспламенить капсюлем с гремучей ртутью, то он
действует сильнее, увеличивается разрушительное действие, но ве
изменяется метательное. Дробящее действие пороха незначительно.
При взрыве больших пороховых зарядов (например, больше 10
пудов) и наличности хорошей забивкй, фугасное действие пороха
можно усилить, заставляя его детонировать от запального заряда пи-
роксилина или динамита.
Пироксилин и нитроцеллюлоза.
£ 1. Мы здесь не будем излагать истории пироксилина - этого
классического бризантного взрывчатого вещества, так как коснулись
уже в общих чертах последней в исторической справке, и перейдем
прямо к описанию свойств и состава пироксилина и его фабрика-
ции.
Хлопок, из которого приготовляется пироксилин, состоит, как уже
было сказано главным образом, из целлюлозы (клетчатки). Последняя
с химической точки зрения есть углеводород (Сх, (НзО)у)п. Так как
чаще всего специально для хлопковой целлюлозы принимают х —(>;
у “5;п = 4, то целлюлозе хлопка, из которого готовят пироксилин,
обычно дают химическую формулу:
(- 24 Н40 О»!
Анализ наиболее чистых природных целлюлоз хлопка показывает
присутствие в них некоторого количества жиров, азотистых веществ,
воды, а также минеральных веществ. Здесь приводится анализ одной
из таких целлюлоз.
Жиров и воскоподобных тел . о,4°/« — 0,5%
Азотистых тел.............0,5% — 0,7%
Воды......................5,2% — 8,0%
Целлюлозы...................87% 91%
Золы. . . • 0,1%—0,13%
Хлопчатник (gossypium), дающий хлопок, принадлежит к се-
мейству Malvaceen. Этот род растений очень богат видами, ра-
стет в жарких странах Старого и Нового Света, особенно—ate
много его культивируется в южных штатах Северной Америки.
У нас он разводится в Хиве и Бухаре и других местах Турке-
стана, а также в небольшом количестве в Закавказье.
Это небольшой кустик с 3—5 лопатными листьями и боль-
шими белыми, желтыми или красноватыми цветами, устроен-
ными также,как у мальвы. Плод—яйцевидная,3—5 створная ко-
робочка, величиной приблизительно с грецкий орех, открываю-
щаяся тремя клапанами; она содержит многочисленные яйце-
видные семена темного цвета величиной в горошину, покрытые с
поверхности длинными волосками, которые служат для распро-
странения ее ветром, так как ко времени созревания плода во
доски делаются эластичными, коробочка трескается и вата вы-
лезает из коробочки, со временем же и семена выскакивают ив
коробочки. Эти то волоски представляют собою, сильно вытяну
той формы, тонкостенные клеточки длиной 10—50 м.м. В сече-
нии отдельный волосок представляет сплюснутое кольцо, либо
форма его напоминает слегка желобок, при чем обе прозрачные
стенки подобной вытянутой клеточки очень близки между собою,
образуя внутренний каналец. Ширина , волоска меняется от
0,012 до 0,042 м.м. и обычно эти отдельные волоски скручены
винтообразно, или имеют вид кривого желобка. Стенки клеточки
не одинаковой толщины, почему внутренний каналец является
то более узкий, то уширяется. В незрелом состоянии в волоске
внутреннего канальца нет. (Рис. 80 и 81).
Рис. 81, Хлопковые волокна
Риг. 80, Хлопковые клето'ю.
Для очистки ваты*) от семян существует специальная маши-
на. Очищенная от семян вата прессуется в кипы, которые я по-
ступают в продажу.
§ 2. Под действием смеси концентрированных серной и
азотной кислот, хлопчатая бумага, не претерпевая никаких ви-
димых изменений в своем наружном виде, превращается в азот-
ный эфир клетчатки или нитроцеллюлозу, что выражается тем,
что некоторое число атомов водорода целлюлозы замещается со-
ответствующим числом частиц азотноватого ангидрида, причем
число таковых замещаемых частиц водорода не может быть боль-
ше 12, обыкновенно же, практически, не превосходит одиннадцати.
Реакция при нитрации хлопка протекает по нижеследующему
уравнению
Н.,<( 0*гЬ НЫ03 — Си Н40. г, — (N0«) г» Ч- и. Нг о.
В виду этого формула одиннадцати азотной клетчатки (или еддекани-
троцеллюлозы) или обыкновенного пироксилина будет:
См Н» О» (NO,)i> ~ Си Наэ (0N02>! О9 = С;< lk-n O»-n (ONOt)n.
*) Цвет волосков ваты в обшей массе либо белый, либо желтоватый (послед-
ний преимущественно у ьи.айскою хлопка).
Преф, Xf, Сухаревский. Взрывчатые вещества и взрывные работы.
290 —
Однако, попутно при фабрикации пироксилина получаются про-
дукты низшей нитрации (в количестве 5—10%), а незначительная
часть хлопка даже остается неизмененной (0,5—г, ).
Двсятиазотная клетчатка или Ьирокмлодай (деканитроцеллюлоза)
по наружному виду не отличается от одиннадцати-азотной, но обла-
дает характерным свойством растворяться в смеси спирта с эфиром
и имеет состав:
Си Ню Ow (NО2Jio - С»* Hm (ONI >in.
Девяти—и восьми азотные клетчатки (эннеа—и октонитроцелюл-
лозы):
Он Ня 02o(NOs)9 - Си Hai (ONO»)b Од;
Ся Нз, О,0 (NO,)i=С,4 н;!., (ONOA о1г;
во Франции носят название пироксилина .Л* 2 или растворимого пирок-
силина.
Семиазотная клетчатка, или гептанитроцеллюлоза CCiHsaOjjfNO;?,-
во Франции носит название низшего сорта коллодионного хлопка.
Шести, пяти и четырехазотная клетчатки (гекса-пента и тетра-
нитроцеллюлозы):
С24 Из40з 4(NOs)t.:
C^H^CMNOsk, •
С21Н,1}О,6(КО:04;
составляют продукты низшей степени нитрации целлюлозы и во
Франции носят название „рыхлого хлопка".
Двенадцатиазотная клетчатка (додеканитроцеллюлоза) Вьелем не
могла быть получена; с другой стороны Lunge приготовлена динитро -
целлюлоза, но тринитроцеллюлоза до сих пор так и осталась неиз-
вестной.
В нижеследующей таблице помещены данные, касающиеся со
держания азота и NO в различных сортах нитроцеллюлозы:
Количество азота в Количество NO в куб. с.м.
12-ти азотная клетчатка . . . 14,14 226,27
11 -ти 13,47 215,17
Ю-ти 12,75 203,35
9-ТИ 11,96 190.75
8-ми 11,11 177,19
7-МИ 10,18 162,36
e-ти „ 9,15 145,93
5-ти 8,02 127.91
4-Х 6,76 107.81
По наружному виду все эти азотные эфиры хлопчатой бумаг
не разнятся между собою, но зато отличаются различным отноше-
нием к растворителям, так например:
а) обыкновенный пироксилин, или во Франции—пироксилин Л? 1 (Т. е.
одиннадцатиазотная клетчатка, носящая во Франции названия: cotou,—
poudre de guerre, fulmi coton, pyroxyle и марку C. Pi), растворим И
ацетоне и уксусно этиловом эфире. В смеси спирта с эфиром он, во-
обще говоря, не растворим, хотя эта жидкость извлекает из техни-
ческого продукта 1О°/о—-15% растворимого в ней нитрованного хлоп-
ка. *)
Этот сорт пироксилина, наиболее могущественный из азотно-
кислых эфиров целлюлозы, употребляется в подрывном деле в ка-
честве первоклассного бризантного вещества, идет также и на изго-
товление бездымного пороха коллоидального типа В не с полным
растворением; в таком порохе он остается неизменным. Порох этот
употреблялся в Великую войну Россией, Францией, Румынией и
частью Австрией.
Этот же сорт пироксилина идет на изготовление бездымного по-
роха коллоидального типа с полным растворением, при чем перево-
дится в раствор при помощи ацетона, реже—уксуснокислого амила,
или уксусно-этилового эфира.
Применяется также и в нитроглицериновом порохе типа бал-
листитов, вместе с пироксилином № 2. Для переведения его в ра-
створ требуется применение вспомогательного растворителя. Этот же
сорт глицерина применяется также в нитроглицериновом порохе
без пироксилина № 2, при чем также переводят его в раствор при
помощи вспомогательного растворителя.
Ь) Десятиазотный пироксилин, или пироколлодий (деканитро-
целлюлоза) или pyrocollodion растворим в спирто-эфирной смеси и в
нитроглицерине. Этот сорт пироксилина готовится двух видов: один
вполне растворимый в эфире, а другой почти не растворим в 56’
эфира,—Растворимая разновидность применяется при фабрикации
бездымного пороха коллоидального типа В с полным растворением,
выделывавшегося раньше в России и Соединенных Штатах Америки.
с) Девяти и восьмиазотная клетчатки составляют так называ-
емый коллодионный хлопок, или растворимый пироксилин (coton—poudre
soluble, coton — collodion superieur, coton azotique). Во Франции он
зовется также пироксилином № 2 и носит марку С. Рг **)
Десятиазотная клетчатка растворима в эфире крепостью 56° и
в смеси спирта эфира, в ацетоне, уксусно-этиловом эфире и нитро-
глицерине, также и в метиловом спирту.
*) Ни спирт, пи эфир в отдельности не растворяют этот сорт нитроцеллюлозы.
Ацетон, уксусный эфир, бензол и нитробензол растворяют вообще нитроцеллюлозы:
в нитроглицерине пироксилин высшей степени нитрации сам по себе ве растворим,
но можно получить раствор его в нитроглицерине при помощи предварительного
его растворения в ацетоне.
Едкий калий, особенно при нагревании до 60° С. растворяет также пирокси-
лин; растворим он также н в сульфоазотной смеси, но при этом уже имеет место
разложение продукта с выделением окнслов азота. Также действует и подогретая
до 40й—60° С азотйая кислота. В концентрированной серной кислоте пироксилин при
обыкновенной температуре растворим с трудом.
•*) Так называемые растворимые нитроцеллюлозы (коллодионный хлопок)
частью растворимы в нитроглицерине при обыкновенной температуре, при 50° С же
растворяются в нем даже сравнительно легко, чем Нобель и воспользовался для
приготовления гремучего студня и баллиститов.
19*
*
Этот сорт пироксилина иногда также идет на изготовление без-
дымного пороха коллоидального типа В с неполным растворением
Будучи переведен в раствор при помощи спирто-эфирной смеси
образует желатинообразную массу, служащую обволакивающим на-
чалом для частиц неизмененного пироксилина высшей нитрации -
пироксилина № 1, Входит в состав тоже и некоторых баллиститов.
В Германии, Соединенных Штатах и Испании он идет на изго
товление бездымного пороха коллоидального типа с полным раство-
рением. Раньше его также употребляли в значительных количествах
на изготовление бездымного пороха нитроглицеринового типа с иол
ным растворением—прежних кордита и баллистита (с повышенным
водержанием нитроглицерина, сравнительно с современным поро
хом этого типа).
Эти сорта применяются в значительных количествах и в насте
ящее время, вместе с пироксилином Ns 1, при выделке нитроглице-
ринового пороха со вспомогательным растворителем, каковы, напри
мер, некоторые итальянские баллиститы.
д) Ссмиааотный пироксилин, или так называемый низший аорт
коллодионного хлопка (cotons—collodions inferieurs), характеризуется
способностью растворяться в 95% спирту, а также в спиртовом ра-
створе камфары. Этот и сорта еще с меньшим содержанием азота в
технике порохов и взрывчатых веществ уже не употребляются, со-
ставляя вредные примеси, но находят себе, однако, обширное приме
нение в деле изготовления целлюлоида, лаков из нитроцеллюлозы
и т. и. *»
е) Пироксилины более низких степеней нитрации, называемые
во Франции Cotons friables (начиная с гексанитроцеллголозы). уж*
не растворимы нацело в растворителях пироксилинов высших <-тече
ней.
Как бы тщательно ни велась операция нитрации хлопка, но по-
лучить продукт вполне однородный—дело почти невозможное. Так.
например, при приготовлении одиннадцатиазотного пироксилина за-
водским путем, несмотря на соблюдение всех требуемых условий, по-
лучается, как было сказано, продукт, содержащий 5—10% боле*,
низких степеней нитрации пироксилина, что ясно обнаруживается
частичною растворимостью получаемого продукта в спирто-эфирной
смеси, а О,5%—1,0% хлопка остаются вовсе неизменными. Присут-
ствие в одиннадцатиазотном пироксилине азотных эфиров низших
степеней нитрации ясно также видно под микроскопом в поляризо-
ванном свете: пироксилин высшей питрапии окрашен в синий цвет,
коллодионный хлопок кажется окрашенным в желтые цвета, а вовсе-
неизменный имеет иризованные цвета: голубоватые, зеленоватые и
темно-желтые.
*) При фабрикации искусственного шелка нитрованный хлопок, после тща-
тельной отмывки кислот, высушивается и растворяется в сиирто-эфирной смеси, при
чей Chardonnet нашел, что нитроцеллюлоза, содержащая 25% воды, растворяется в
смеси из 40% спирта и 60% эфира значительно более легко, нежели сухая; Douge
же считает, чти максимум ее растворимости в спирто-эфирной смеси соответствует
нитроцеллюлозе, содержащей 6—1О<7о ьоды; Duqucsnay рекомендует применение
качестве растворителя смеси ацетона, уксусной кислоты и амилового спирта.
Другой способ распознавания в пироксилине неизменного хлопка4
(»скован на действии иода и серной кислоты. При этом целлюлоза
окрашивается в синий цвет, остающийся в ней при последующе^
промывке, тогда как нитроцеллюлоза, не окрашиваясь сама, окраши-
вает лишь самый раствор, а потому, после последующей промывки
голой, снова принимает первоначальный свой белый цвет.^
Совершенно иное отношение к раствору иода в иодистом калии:
только при пироксилине высшей нитрации нет остающегося синего
окрашивания, низшие же степени нитрации хлопка, даже после про-
мывки, не теряют своей синей окраски, интенсивность которой зави-
сит от степени нитрации. Количество неизмененного хлопка можно
определить, обрабатывая нитроцеллюлозу спиртовым раствором эти-
лата натрия в присутствии ацетона.
Причина трудности получения при нитрации вполне однородного
продукта заключается в том, что выход определенного какого-либо
азотного эфира целлюлозы, зависит от выполнения целого ряда условий,
среди которых одно из главных мест занимает определенная кон-
центрация кислот и возможность немедленного удаления от нитру-
емой целлюлозы воды, получающейся от реакции нитрации. Уже
одно вполне однообразное удаление воды из всей массы нитруемого
хлопка, чрезвычайно затруднительно, а между тем одной этой при-
чины уже достаточно, чтобы вызвать неодинаковость концентрации
кислотной смеси во всех местах нитруемой порции хлопка, а следо-
дательно, создать благоприятные условия для получения целлюлоз
различных степеней нитрации.
Несмотря на все попытки заменить хлопок для изготовления
пироксилина другими видами целлюлозы: льном, коноплей и другими
волокнистыти веществами, древесной мукой, соломой и т. п., резуль-
таты получались всегда определенно отрицательные: получался
непременно продукт более низких качеств, нежели тот, который дает
Во время Европейской войны Германия, будучи совершенно ли-
шена подвоза хлопка, вынуждена была готовить свою нитроцеллюлозу,
необходимую ей для фабрикации бездымного пороха, из древесной
массы, но, несмотря на все старания, качество получавшегося пороха
всегда уступало тому, какой приготовлен был из ваты.
Причина безуспешности попыток в этом направлении заклю-
чается, главным образом, в том, что, во-первых, вата есть самый чистый
вид клетчатки, во-вторых, что, в переименованных выше суррогатах
содержится преимущественно особый вид целлюлозы—лигноза, которая
относится к нитрации несколько иначе, к тому же присутствие в
отих веществах большего количества минеральных примесей и посто-
ронних органических веществ, обусловливает возникновение, наряду
с нитрацией, целого ряда других побочных реакций, главным обра-
зом, окисления и, в результате, в окончательном продукте получается
целый ряд соединений, чрезвычайно трудно удаляемых из готового
фабриката и составляющих для пироксилина вредную примесь,
сильно влияющую на уменьшение его стойкости при хранении.
— 294 —
Льняная кудель и конопля, невидимому, служат все-таки лучший
ми суррогатами хлопка для приготовления пироксилина, за ними
следует древесная масса, служащая для изготовления бумаги.
1. Для фабричного приготовления нирокси
§ 5. Фабричное произ лина, употребляется хлопчатая бумага, получа-
водство пироксилина, ющаяся кипами, либо, что предпочтительнее, так.
называемые хлопчато-бумажные концы, идущие на
ткацких фабриках в отброс, так как состоят преимущественно из за-
путавшейся пряжи со шпулек, концов основ и т. п. Концы должны
быть чисты и хорошо отбелены; они предпочитаются хлопку, вслед-
ствие своей дешевизны и отсутствия в них загрязняющих хлопок
примесей (семян, скорлуп и т. п.).
Присутствие в концах примесей, в роде кусков дерева, железа
цветных волокон, шнурков, веревок, узлов и т. п., вредно влияет на
качество получаемого из них пироксилина, уменьшая его химическую
стойкость. Большое количество подобных примесей, обесценивает этот
исходный продукт, и. если в нем больше 4% подобного браку, те
концы на выделку пироксилина вовсе не принимаются. Из загрязня-
ющих концы примесей, кроме поименованных выше, еще следует
назвать жировые и смолистые вещества, так как при процесс»
нитрации они окисляются, давая место образованию продуктов, так-
же сильно понижающих стойкость пироксилина. Поэтому концы, со-
держащие более 1% веществ, растворимых в эфире, также совер-
шенно не идут на фабрикацию пироксилина. Является очевидным,
что концы должны иметь нейтральную реакцию.
Случается, что концы имеют значительное количество очень ко-
ротких волоконцев хлопка, так называемой хлопковой пыли. Ее при
сутствие в больших количествах (свыше 2%) йе допускается, так
как она вызывает непроизводительную трату кислот па свою нитра-
цию, т. к. при последующих за нитрацией промывках она все рас-э<
уносится водой.
Значительное количество минеральных примесей (золы) «вредно
отзывается на. качестве пироксилина, а потому концы, дающие больше
0,75% золы, также не принимаются. Среди минеральных нримесег
особенно не желательны хлористый кальций, магнезия и соединения
железа.
Количество влажности в концах не должно превосходит]. 10%.
Азотная кислота, употребляющаяся для получения пироксилина
высшей степени нитрации, должна быть обязательно самая чистая к
крепкая, удельного веса около 1,50 (48°—48,5” по Бомб); в контакт»
с воздухом подобная кислота обычно дымится. Она должна быть, или
совсем бесцветной, или лишь слабо окрашенной. В ней допускается
не свыше 1,5% окислов азота (N2O4). Вполне годная для получения
пироксилина высшей степени нитрации кислота должна содержать
не менее 90% моногидрата.
Вопрос об укупорке азотной кислоты имеет существенно»
значение в смысле безопасности от пожара. Крепкая азотная
кислота, попавшая на солому и другие органические вещества
может вызвать их воспламенение, а, потому эту кислоту сохра
ияют в глиняных или стеклянных бутылях, неплотно закрытых
— 295 —
стеклянными или глиняными пробками и обернутые затем со-
ломой они устанавливаются в плетеные (из хвороста) корзины.
Для того, чтобы избежать самовозгорания соломы от слу-
чайно треснувшей бутыли с кислотой, материал корзины и со-
’ лома пропитываются раствором хлористого цинка или хлористо-
го кальция.
Серная кислота в сущности не принимает непосредственно уча-
стия в реакции нитрации, но роль ее чрезвычайно важна: ее назна-
чение—немедленно, связывать образующуюся при нитрации воду, без
чего образование продукта высшей нитрации было бы невозможно,,
вследствие изменяющейся концентрации азотной кислоты.
Серная кислота, потребляющаяся для изготовления пироксилина
высшей нитрации, должна быть совершенно прозрачна; она должна
быть бесцветна или в крайности допускается кислота, имеющая лишь
слегка буроватый оттенок, обусловливаемый случайно попавшими'в
нее из воздуха частицами пыли.
Одним из существенных требований, пред'являемых к серной
кислоте является отсутствие в ней органических веществ, так как
последние способствуют возникновению при нитрации побочных про-
цессов окисления.
При заводском способе приготовления пироксилина высшей ни-
трации (одиннадцати азотная клетчатка, содержащая 5%-10% кол-
лодионного хлопка) берется приблизительно на 1 весовую часть азот-
ной кислоты удельного веса 48*Вё около 3 весовых частей аздхдой
кислоты 6б*Вё.
В сущности, пропорция отдельных компонентов сульфоазотной
смеси меняется в зависимости от способа, по которому ведется ни-
трация.
Так, например, в процессе Абеля, для получения одиннадцати
азотной клетчатки сульфоазотная смесь содержит:
от 15% до 19% HNO;i
„ 74% » ‘1% H2S(U
.. ю% „ «% н,.о
„ О,59о .. 1% NOl-
При нитровании ио способу Нобеля, где количество смеси в
Во раз по весу более, чем вес взятого хлопка и при 12 часовой ни-
трации мы имеем:
75% H2SU4
15,75% HNO3
7,95% Н2О
1.3% NO,
2 36
В процессе Selwig’a, при количестве кислот в 50—55 раз большем
навески хлопка и ведения нитрации в течение 30—40 минут:
«8.4% 1%S04
22.1% HNO'.
8,5% %0
».:<% no
При применении метода Томсона, при котором общее количестве
сульфоазотной смеси в 32—36 раз более навески хлопка, а реакция
ИИТраЦИИ ДЛИТСЯ 2—2’% Часа:
от 68% до 70% H.SO,
. 21% ,. 23% HNO::
/ „
11 ри приготовлении десятиазотной клетчатки, растворимой в сашрчо-
эфирной смеси плотности 56°, Менделеев советует количество кислот
вычислять по формуле:
2IIN0, • x(lLSO.) 4 (х ; 2Ш,О
причем х=,— 4 до 5 (Сапожников).
zT
В по ше пригодно е атой целью смесь:
«1% H2SOa
. 25% UNO
14% II О
iipii фабрикации девятиазотной клетчатки, применяющейся для
фабрикации гремучих студней, берут небеленый хлопок .и нитруют
его при низкой температуре сульфоазотной смесью, содержащей в
своем составе:
ОТ -’О11 ДО /о HN0,
ч 61% • г ««% H.SO
157., 17% II-0
•>> 0.4" V , -Г f J , - 0.6%. NO.
Семи и восьмиазотные клетчатки получаются еще более слабыми
сульфоазотными смесями, каковы, например, следующие:
187,, 71 /д ») % Ь ; >-V * / 0 НЛО
59% .. «C/е H£SO
18% - 20% Н4)
0,4% NO-
.^едя операцию при значительном нагревании (до 80*4%
— 297 —
2. UpuwnweMHui- нирм-илта на наших заводах состоит из ни-
жеследующих" операций:
I. Приготовке хлопка или бумажных очищенных концов.
' Эта операция состоит в сортировке, сушке, ческе и отвеши-
вании необходимых для нитрации навесок.
2. Приготовление сульфоазотной смеси. Эта операция состоит из
отвешивания кислот, их смешивания и охлаждении.,
J. Нитрации хлопка: а) погружение хлопка на короткое время
в кислотную смесь и б) выдерживании напитанной ки6л->той хлоп-
ковой массы в особых сосудах, поставленных в бассейны с холодной
водой, в течение продолжительного времени.
4. Отжатии отнитровавшегося пироксилина от избытка кислот
я центрофугах
5. Промывке пироксилина в холодных и горячих водах и по-
следующем отжатии его в центрофугах.
6. Превращении пироксилина при помощи измельчания в мезгу.
7. Промывке и мешке мезги.
ь Просеивании готовой мезги
Детальное описание всех этих операций не входит к программу
настоящего труда, почему здесь мы ограничиваемся лишь описанием
этих производств в общих чертах постольку, поскольку это требуется
лл неясного понимания хода процесса фабрикации.
a) llwt»>n,wna хлопкк. состоит в тщательной ручной разборке его.
при чем все механические примеси из него удаляют. Само собой, что
эта операция представляется крайне медленной.
Очищенный в ручную хлопок поступает в ческу. Эта операция
состоит в расчесывании спутанных комков прямей, а также в отде-
лении как грубых, так и слишком мелких волокон. После чески хло-
пок приобретает вид пушистой массы. Операция производится на
трепальных машинах различного устройства, на рис. 82 схематически
доказано устройство одной из таких машин.
И;с, 52. Схематическое устройство трона.н/ной машины-
Хлопковые концы кладутся сперва на бесконечное полотно, за-
тем они попадают между рифленными вальцами виси далее в не-
подвижный барабан d. где они разрываются острыми зубцами, име*>-
щимися на нижней стенке барабана и на концах трех крыльев, на-
саженных на вращающуюся ось. По выходе из барабана d, хлопковые
концы захватываются вращающимися решетчатыми барабанами < и /,
при чем очень мелкие частицы хлопка и пыль высасываются (на черт,
не показано) внутрь барабанов, а главная масса хлопка проходит через
вальцы у и Л и подается на движущееся плотно I, откуда попадает
в подставляемые корзины ’)•
д) Сушка хлопка. Расчесанный хлопок подвергается сушке. В нем
может заключаться до 10®/в влажности, которая должна быть удалена
возможно полнее перед обработкой хлопка кислотами, так х«ак при-
сутствие ее ослабляет действие смеси азотной и серной кислот.
Обыкновенно доводят уменьшение влажности до предела 1,0 — 1,5 */0.
Хлопчатобумажные концы высушиваются для нитрования при
температуре 90 - ЮО’С. Для этой цели обыкновенно служат сушиль-
ный цилиндры. В сушильном цилиндре (рис. S3) нагретый воздух
Рис. 83. Схематический разрез сушильного цилиндра. >
9 На некоторых заводах расчесанный хлопок свертываеюя вокруг деревне*
ноте, валька ч большие цилиндрические свертки.
— 299 —
поступает по трубке' В—в пространство А, между двойными стенками,
и внутрь цилиндра,—через отверстия внутреннего дна С и централь-
ной трубки д. Цилиндр закрывается крышкою D; дно F — откидное
на шарнире. В цилиндр помещаются несколько свертков хлопка, всего
весом около 8 пуд., которые насаживаются на трубку с отверстиями.
По окончании сушки (через G--8 часов), откидывается днище цилин-
дра, и хлопок выгружается в так называемые охладники (рис. 841
t
Рис. 84. Схематический разрез через крышку охладника.
т.-е. плотно закрываемые крышкой аа (при помощи болтов d), цилин-
дрические железные сосуды; в них концы охлаждаются и хранятся
до развешивания.
Сушка бумажных концов представляет операцию опасную в по-
жарном отношении. Возможны случаи самовозгорания хлопка.
В настоящее время сушильные цилиндры выводятся из употре-
бления и заменяются более совершенными сушильным- аппаратами.
Сушильные аппараты бывают весьма разных систем. Рис. 85 по-
казывает аппарат фирмы Фридрих Гаас в Лейпциге. Он состоит из
' Уис. 85. Сушильный аппарат фирмы Фридрих .Гале в Лейпциге.
300 —
ряда отдельных сушильных камер, в которых друг под другом рас-
положены выдвижные сита с хлопком, и стольких же нагревающих
камер. Оба рода камер расположены таким образом, что воздух,
вытягиваемый очень сильным вентилятором, проходит поочередно
оба вида камер, т. е. последовательно проходит через сушильную
камеру, затем через нагревающую, затем снова через сушильную
и т д. Внутри нагревающих камер находятся батареи для нагревания
воздуха. Наверху аппарата помещаются краны, регулирующие цирку-
ляцию воздуха. Каждая камера снабжена термометром. Нагретый воз-
дух проходит сушильные камеры снизу вверх и притом так, что осо-
бое приспособление позволяет самый горячий воздух направлять
в камеру с наиболее сырым хлопком.
Фирма Бенно Шильде строит сушильные аппараты иной ком
струкции, основанной на принципе противотоков и притом таким об-
разом, что нагретый в каллорифере воздух прогоняется сильными
вентиляторами через сита снизу наверх, в то время как сами сиза
передвигаются сверху вниз, т. е. навстречу течению воздуха. Пере-
движение сит, как внутри аппарата, так и снаружи его, происходят
механическим путем, так что рабочая человеческая сила нужна только
для наполнения и опоражнивания сит. Высушенный хлопок выни-
мается снизу из аппарата, затем сито вновь наполняется свежим
хлопком, после чего особым приспособлением оно поднимается наверх
и снова вводится в аппарат. Подобный сушильный аппарат показан
яа рис. 86ли 87. По сушильным шахтам « и в сита механически пе-
Внешний вид сушильного камерного
аппарата фирмы Бемо Шетяьде,
РйС, 86,
— 301 —
редвигаются по направлению, указанному более толстыми стрелками,
при нем пастью в горизонтальном, частью в вертикальном направле-
ниях,* через дверь „ди сита выхолят из аппарата и попадают на подъ-
емный механизм где опаражниваются, а затем снова заполняются
Ри< 87. Схематический разрез сушильного аппарата фирмы Бенно Шн и,;
хлопком. д, i, k, I—автоматически закрывающиеся двери. Ход воз-
духа обозначен тонкими стрелками. ,Более интенсивную производи-
тельность, как количественн >, так и качественно, ддютт. н. „Siebbandt-
rockner“ той же фирмы. Рис. 89 и 90 дают некоторое понятие об
этих аппаратах. Они бывают разных размеров, но даже самый боль-
шой из них не требует больше одного рабочего для присмотра за
собой. Подобный аппарат работает непрерывно и состоит из бесконеч-
ных сит, расположенных н-сколькими рядами друг над другом и при-
водимыми в движение валами. Сига двигаются в противоположном
друг другу направлении. Просушивающийся хлопок поднимается осо-
бым элеватором и высыпается на верхнее сито аппарата. Так как сито
находится в движении, то оно подхватывает хлопок и доносит его
до конца аппарата, где хлопок падает вниз и находящимся внизу
ситом увлекается уже в противоположную сторону, и так до тех пор,
пока хлопок не пройдет весь аппарат и не будет выброшен внизу из
аппарата. Таким образом, при каждой перемене сита хлопок пере-
вертывается, что способствует более интенсивной сушке. Сушильный
аппарат, показанный ва рис. 88, снабжен 2 бесконечными, подвиж-
ными ситами, аппарат на рис. 89—7 или 9 ситами
I
Охлажденный хлопок развешивается перед самым нитрованием
на отдельные навески. При способе нитрования, заключающемся в
обработке кислотною смесью в ваннах *) и затем в горшках, навески
Сие. Еезпрерывно действующий сушильный аппарат фирм Бенно
ТПильде с 2 безконечнымв подвижными ситами.
хлопка берутся небольшие (650 грамм). Каждая навеска помещается
в жестяной цилиндр, плотно закрываемый крышкой.
в) Приготовление смеси азотной и серной кислот-. На состав готового
пироксилина влияют следующие условия кислотной обработки: кре
пость кислот, относительные количества их и хлопка, продолжительность
обработки и температура; из этих условий имеют главное значение
состав и относительное количество кислотной смеси.
Исследования Абеля и Ленка показали, что при употреблении
кислот наибольшей плотности, при прочих равных условиях, наиболь-
шая степень нитрации пироксилина получается в том случае, когда
смесь составлена из 1 вес. ч. азотной и 3 вес. ч. серной кислот. При
избытке серной кислоты может происходить разложение образую-
щегося пироксилина. По опытам Абеля, увеличение количества кислотной
смеси относительно хлопка благоприятствует образованию наиболее
взрывчатого продукта. Это происходит оттого, что при малом количе-
стве кислот выделяющаяся при реакции вода значительно ослабляет
их концентрацию, а это влечет за собою образование низких эфиров.
) Если нитрация производится в центрифугах, .тогда 'навески хтопка
берутся больше.
Относительно продолжительности обработки опытами Абеля выяс-
нилось, что последняя должна длиться около 24 часов.
• Повышение температуры кислотной смеси способствует в значи-
тельной степени быстроте превращения хлопка в пироксилин. Однако,
в заводской практике избегают повышенной температуры, потому что
Рис. 8’Л Беспрерывво действующий сушильный аппарат фирм Бенно
1Т1иль:;е <• 7—9 безкон очными подвижными ситами*
при этом может начаться окисление массы с выделением бурых
окислов азота и образование различных органических кислот, при чем
нитруемая масса может воспламениться.
Смешивание кислот производится в приборах разного устройства.
Чаще всего употребляются метательные приборы или смесители,
устройство которых показано на рис. 90. Такие приборы приняты на
нашем Охтенском заводе.
Мешатели расположены в верхнем этаже здания, куда под'емни-
ками подаются сосуды со взвешанными кислотами. Закладка одного
мешателя—около 18 пуд. Для наливания азотной ‘кислоты из глиня-
ного сосуда в мешатель пользуются сифоном, от которого идет каучу-
ковая трубка в одно из отверстий крышки прибора. Серная же кис-
лота переливается обыкновенно без сифона, прямо из бутыли через
свинцовую воронку, вставленную в отверстие крышки. Перемешивание
кислот производится вручную и продолжается минут 5.
На некоторых заводах мешка кислот производится в чанах И
(рис. 91) при помощи сжатого воздуха, вдуваемого по трубке С.
Охлаждение й хранение кислотной смеси. Приготовленная 'смесь
выпускается для охлаждения и хранения до употребления в храни-
тели. представляющие собою чаще всего циллиндрические сосуды.
Рис. 90. Схематический разрез кисю1тосме> ител>:
Охтеаского порохового завода.
емкостью на 125 п. смеси; они располагаются в особом помещении;
рядом с помещением для смешивания кислот. Сосуды эти распола
гаются ниже мешателей и кислоты пускают в них самотеком. Распо-
ложение хранителей относительно нитрационных ванн также при-
меняется такое, чтобы кислотная смесь направлялась в ванну само-
теком по трубам.
Выпускаемая из смесителей кислотная смесь имеет температуру
в среднем около 28° С зимой п до 40* С летом.
г) Нитрование .хлопка. Способы Абеля и Нобеля. На наших заводах
изготовляются два сорта пироксилина: № I, так называемый нераство-
римый пироксилин, и № 2—растворимый пироксилин. Состав кислотных,
смесей для получения одного и того же сорта пироксилина прихо-
дится изменять в зависимости не только от времени года *)- но И’О’!
*) Летом азотная кислота легко испаряется.
Рис. 91. Схематический раз-
рез чана для смешивания
кислот сжатым воздухом.
сорта употребляемых концов. В среднем состав кислотных смесей на
наших заводах в расходных ваннах можно принять: а) для нераство-
римого пироксилина: 21,5% HNOs; 70,6% H2SO4;
0,6% N2O4) и b) для растворимого пироксилина:
H2SO4; 14% Н2О (и около 0,5% Я2О4).
Ванны для нитрования бываютразличного
устройства. На Охтенском заводе ванны имеют
устройство, показанное на рис. 92. Количе-
ство кислотной смеси, налитой в ванну
(14 пудов), в 350 раз превосходит вес хлопка.
- В ящике А с проточной водой помещается
7 ванн, из которых средняя служит расход-
ной; в эту ванну из хранителей по трубе
поступает смесь кислот, которая ковшами
добавляется по мере необходимости в 6 ни-
трационных рабочих ванн. Охлаждающая
проточная вода поступает по трубе f и вы-
текает через отверстие д в задней стенке
ящика. Ванны прикрыты сверху навесами,
из-под которых отводятся едкие кислотные
пары в вентиляционные трубы. Навеска хлопка
(около Р/2 ф.), погружаемая в кислотную
смесь и содержащая 1,5 — 2,5% влажности,
держится в ванне при получении нераство-
римого пироксилина 5—6 минут, а при по-
лучении растворимого — несколько дольше,
должна быть 15—20° С.
7,9% Н20 (и около
17,8% HNO3; 68,2%
Температура в ваннах
Рис. 92. Нитровальиая ванна Охтенского порохового завода.
Вымоченный хлопок отжимается на решетке а при помощи ры-
чага D, на которую рабочий наваливается своим весом или навеши-
вается свинцовый груз, подымаемый при помощи парового цилиндра.
Проф, М. Сухаревский. Взрывчатые вещества и взрывные работы. 20.
На 1 часть хлопка при получении нерастворимого пироксилина
приходится 10,5 — 12 частей кислот. (При получении растворимого
17—19 част.). Обработанная закладка хлопка выкладывается вилкой
на столик с воронкой и проталкивается в подставляемый глиняный
горшок. Горшки отвозятся и устанавливаются в бассейны с водой.
Нитрование в горшках. Для окончания
Рис. 93. Нитровальный
горшок.
При устройстве
нитрования продукта, получаемого в ваннах,
употребляются глиняные горшки (рис. 93),
с глиняной или аллюминиевой крышкой (вы-
сота их около 31 М.М., дням. ОКОЛО 230 М.М.).
Бассейн, в котором устанавливаются
горшки, устраивается в том же здании, где
установлены ванны. Для охлаждения горшков
вода пускается весьма слабым течением и
только по дну горшков.
Процесс нитрования в горшках продол-
жается (на Охтенском заводе): для нераство-
римого пироксилина не менее 10 часов, а для
растворимого пироксилина не менее 6 часов,
вентиляции в помещении для бассейнов с гор-
шками приходится считаться с тем, что иногда горшки трескаются,
и тогда все помещение наполняется тяжелыми удушливыми газами.
д) Отжатие пироксилина от кислот в центрофугах. При полу-
чении пироксилина обработкой в ваннах и горшках отделение нитро-
ванного продукта от избытка кислот производится в так называемых
кислотных центрофугах. Обыкновенное устройство центрофуги видно
из рис. 9Ф. Она представляет собою дыочатый цилиндр А со сплош-
Ряс. 94. Кислотная центрофуга.
ным дном, вращающийся очень быстро на вертикальной оси С. Ци-
линдр этот, диаметром около 0,92 метра, помещается в другом сплош-
ном цилиндре — кожухе В. Из кожуха идут трубы: одна к верхней
части .(на черт, не показана)— для отвода газов, Другая d внизу для
отвода отжимаемых кислот. Вращение производится при помощи при-
водного ремня. Для остановки центрофуги служит особый тормаз.
Скорость вращения центрофуги 600—800 обор, в минуту. В центро-
фугу обыкновенно закладывают содержимое 5 горшков. Отжимкапро-
должается 5-10 минут, так что вся работа с нагрузкой и выгрузкой
требует 7* часа. Отжимается примерно около 75v/t кислоты, пропи-
тывающей закладку.
Отжатый пироксилин перекладывается в аллюминиевые сосуды
цилиндрической формы, называемые тушильниками, и сейчас, же Идет
на холодную промывку в чаны, расположенные рядом с центрофу-
гами. Для отвода удушливых газов центрофуга окружена деревянным
кожухом, сообщающимся с вентиляционными трубами. Отжатые кис-
лоты направляются в баки, расположенные в небольшом здании ря-
дом с кислотной мастерской.
Отжатые кислоты употребляются на приготовление растворимого
пироксилина и на приготовление азотной кислоты (см.—использов.
отраб. кислот).
е) В настоящее же время нитрование хлопка в ваннах почти
везде оставлено и заменено нитрованием в особых центрофугах (рис.
95, 96, 97*), которые одновременно служат и для отжатия кислот.
Рис. 95. Нитровальная центрофуга.
Внутри центрофуги d имеется дырчатый барабан с таким же (дырча-
тым) конусом с. Крышка снабжена откидным ЯЬтвором а для загрузки
хлопка и вытяжным отверстием о для удаления газов. Кислоты по-
•) Способ Selwiga и Lange, весьма распространенный во Франции и Германии.
20»
— 308 —
ступают в междустенное пространство, проникают под конус и при
медленном вращении центрофуги пронизывают хлопок; далее, гчерез
I
Рис. 96. Тоже. Общий вид установки.
Рис. 97. Тоже. Вид сверху.
отверстия в барабане, они снова уходят в междустенное пространство.
Загрузка центрофуги в средней 5>/а килогр. хлопка и 450 килогр
П° о?он’ани® нитрации (% часа) выпускают кисло-
ты и приводят центрофугу в быстрое вращение в продолжение 3 ми-
- 309 —
нут для отжатия. Подобные центрофуги бывают различных, размеров;
для пироксилина предпочитают неболктпие размеры. • Ёмкость малых
центрофуг колеблется от 6,5 — 20 клгр. хлопка. Кроме указанной,
имеются^центрофуги и других систем. Рис. 98 и 99.
Рис. 98. Вращающаяся центрофуга с циркуляцией кислот.
Отнитрованный хлопок затем поступает в гидравлический транс-
портер, по которому и увлекается в промывные чаны. (Способ Selwig’a
гораздо дешевле и быстрее способов Абеля и Нобеля.
Кроме только что описанных методов нитрования, существуют
и другие представляющие комбинацию способов Абеля и Нобеля с
одной стороны и Selwig’a с другой. Их предложено было несколько,
но они особых преимуществ не дают, а потому большего распростра-
нения не получили. В числе таких заслуживает упоминания способ,
предложенный динамитным заводом Нобеля в Вене, в котором нит-
рация производится в особом приборе при уменьшенном давлении.
ж) Нитрование по способу Томсона. Этот способ, впервые приме-
ненный в 1905 году на английском казенном заводе в Уоальтам Аббе
и широко использующийся во Франции и Италии, основан на сле-
дующем наблюдении. Если^осторожно приливать воду.на поверхность
нитрующегося хлопка и в то же время дать кислотам .возможность
медленно стекать внизу, то вода совершенно вытеснит их из проме-
жутков между волокнами пироксилина; при этом температура не
подымается выше допустимой, а крепость кислот понижается лишь
незначительно. Вследствие этого почти вся отработанная кислота
полу- ается в годном. для дальнейшего нитрования состоянии, а для
предварительной пгюмыккч пчршддшинд, требуется виды гораздо
• менее, чем при доугот чг.ччиад нд'лпнар-ш...
Рис. 99. Нитдовалытая центрофуга новейшей кон-
струкции. 1—кран для впуска кислот. Д—кран для
выпуска кислот, в—вытяжная труба для кислотных
паров, р—лав для загрузки хлопка, а—крышка аппа-
рата.
Приборы для нитрования (рис. 100, 101, 102) представляют собой
каменные цилиндро-конические сосуды /г, диаметр. 1,0—1,10 метров
и 0,25—0,40 метров глубиной, помещающиеся на кирпичных устоях.
Внизу каждого сосуда имеется выпускное отверстие а, поверх кото-
рого наложено малое сито /; выше этого сита положено другое боль-
шое сито д и, наконец, еще выше решетка i с отверстиями несколько
более 1 см. и состоящая из отдельных сегментов; к решетке подхо-
дит трубка Ъ с отверстиями (душ) для воды, поступающей по труб-
ке/Г. Сосуд покрывается легко снимающимся колпаком I, от кото-
рого идет вытяжная труба Л.
<
ЛА'Йс'
ш
4
.рй
ч
Смесь кислот .поступает через нижнее отверстие, хлопок заклады-
вается малыми порциями (всего 8,6 килогр.), прчием он помещаете^ W
сито д и прикладывается сегментами решетки i; вода, поступающая
через душ к, располагается тонким слоем (около 1 с.м.) поверх решет-
ки. Нитрование продолжается 2% часа. По прошествии этого времени
открывают сточный кран, и стекание кислот регулируют таким обра-
зом, чтобы каждую минуту вытекало определенное количество (7,7
1
.-I
:3
Я
I
:----------------------
Рис. 100. Нитровальный сосуд Томсона.
Вертикальный разрез.
ттгттп i И1Г111111 ш 111 >
килогр.) кислоты. Первую часть сточной кислоты направляют в
зервуар для нитрующей смеси*), а вторую часть в мастерскую
разделения, промывные воды спускаются в отводной канал. Промывка
продолжается до прекращения следов кислотной реакции.
Выгоды способа Томсона заключаются в простоте, экономичности
и почти полной безвредности для рабочих**).
Процесс Томсона вместе с тем и очень нежный и при маломаль-
ской неосторожности, в зоне соприкосновения воды с отработанными
кислотами, может произойти повышение температуры и денитрация
пироксилина. Слой хлопка должен быть очень однородный без узел-
ков и частей, могущих вызвать повышение температуры во время
нитрации. Трудность соблюдения этих условий и легкая склонность
к денитрации обусловливает то, что количество азота в получаемом
по этому методу пироксилине несколько меньше, чем по способу цент-
рофугирования, хотя разница не превышает 1%, что практически не
существенно.
ре-
для
*) Обычно эти обработанные кислоты заключают 17% —19% азотной кислоты
62‘с—64% серной кислоты и 17%—20% воды.
** ) Delpy утверждает, что способ Томсона поглощает в два раза больше
нитрующей кислотной смеси чем любой иа старых способов»
»’
Hr
г;
V
I 7 4
П • V
И'.!
e'
Л-
d d
Рис. 101. Нитровальн&я баттарая Томсона
Вертикальные разрезы.
Рис. 102. План нитровальной баттареи Томсона.
—313 -
е) Промывка пироксилина. В настоящее время на пироксилиновых
заводах производится ряд промывок, представляющих соединение
кратковременной холодной промывки с продолжительною горячею
промывкою (рис. 103).
Рис. 103. Деревянные ванны для промывки пироксилина.
На наших заводах холодная промывка делается проточной водой
в деревянных прямоугольных ваннах или ящиках с тремя сообщающи-
мися друг с другом отделениями. Одну закладку центрофуги—содер-
жимое 5 горшков—бросают сначала в отделение А ящика и мешают
ее граблями. Затем переносят пироксилин в отделение В, а далее в
отделение С с чистой водою, поступающей по трубе а. Перегородки Ъ
доходят до дна, но нижние части их решетчатые. Промывка продол-
жается около % часа. Из ванны масса перекладывается для отжатия
и потом дальнейшей холодной промывки в центрофуги; в них поме-
щают содержимое 10 нитрационных горшков.
В пироксилине после хо-
лодной промывки заключается
0,1—О,2°/о кислот.
После холодной промывки
пироксилин поступает в деревян-
ные сборные чаны с водой (емкость
Bl 500 в.). В чане помещается
70—80 пудов пироксилина, кото-
рый и остается в нем несколько
суток; причем вода в чане ме-
няется два раза в сутки. Горячая
промывка ведется с употребле-
нием щелочных прибавок (соды*).
Чаны для горячей промывки
имеют устройство, представленное
на рис. 104. Закладка около 4 У, пу-
дов пироксилина (6 ушатов), счи-
тая на сухой. После нагрузки
пускают в чан чистую (Е) или ще-
лочную воду (D) в таком количе-
Рис. 104. Чан для горячей промывки
пироксилина.
стве, чтобы она стояла над пиро-
ксилином. Чистая вода поступает холодною, а щелочная—нагретою до
70—80 С. Впуская в чан, по трубе Ъ пар,—доводят жидкость до кипения.
*) Для целей стабилизации пироксилина.
Продолжительность каждой промывки, при кипении, определяется
в 2 часа.-Всех промывок производится 8, из них: 1-я и две послед-
них делаются чистою водою, а 5 средних промывок—щелочною. Вся
продолжительность горячей промывки около 2о часов-'). Щелочная
вода заготовляется в больших баках, расположенных в верхнем этаже
здания.
ж) Измельчение пироксилина в мезгу. Измельчение пироксилина в
мезгу является необходимым как для окончательной промывки пи-
роксилина, так и для получения мелкой порошкообразной массы.
Опыт показывает, что волокнистый пироксилин, промытый горя-
чей промывкой до достижения вполне удовлетворительной химической
стойкости по пробе Абеля, содержит нередко еще до 0,3% неотмытых
кислот внутри волокон.
На наших заводах для измельчения пироксилиновой массы упот-
ребляется так называемые голландеры**) рис. 105,106,107). Эго чугунные
Рис. 105. Голландер для измельчания пироксилина.
Схематический вертикальный разрез.
•••• >45^ ...
Рис. 106. Наружный вид голландера.
*) Вообще продолжительность промывки непостоянная и зависит от применяемых
методов нитрации и иногда деталей ведения промывок.
*♦) Размеры голландера; длина 4 м,, ширина 2 м.. глубина 0,5 м.
ванны, разделенные на две части продольной перегородкой. С одной сто-
роны в голландере имеется горизонтальный барабан А, на поверхности
которого располагаются стальные ножи d. Дно голландеров под бара-
баном приподнято и в одном месте в нем тоже вставлена группа но-
жей I. Режущие ножи в барабане расположены группами по 4 в
каждом, всего групп 16—18; число неподвижных ножей—9. Проме-
жутки между ножами заполнены буковыми прокладками. При работе
ножи сильно истачиваются.
Рис. 107. Голландер фирмы „Friedrich Krupp A, G. Grusonwerke".
Закладка в голландер—около 15 пудов пироксилина (15 ушатов)
Пироксилин закладывается малыми порциями, причем предварительно
он подвергается еще переработке в особых аппаратах, которые отби-
рают из пироксилина посторонние случайные предметы; растрепывают
также при этом, и комья, образующиеся иногда во время'промывок.
Это достигается пропусканием мезги через узкую щель т. н. узло-
уловителя. (Рис. 108).
Рис. 108. „Узлоуловитель"—аппарат для предварительной подготовки
пироксилина к измельчанию.
Когда идет измельчение, то, чтобы масса не садилась на дно,
рабочий перемешивает ее веслом или для этой цели приспосабливается
особое колесо. Вода с содержанием 0,3% соды, во время измельчения
вообще говоря, не меняется, но имеются машины, в которых есть осо-
бый промывательный барабан (tambour loveur), который удаляет часть
промывных вод, которые тотчас же заменяются новыми порциями
фильтрованной воды; такое приспособление делает промывку и уда-
ление вредных примесей гораздо более совершенным. Время обработ-
ки в среднем—около 8 час. Скорость вращения барабана—220 оборо-
тов в 1 минуту.
з) Промывка и мешка мезги, (см. схему расположения приборов
(рис. 109). После измельчания следует промывка мезги, которая сопро-
Рис. 109. Схема расположения приборов для промывки н мешки пироксилина.
А—голландер для измельчания пироксилина, В—лавер, С—мутитель, D—прибор
для просейки, Е—отстойная яма.
вождается меткой пироксилина различного времени выделки. Так
как Промывкой мезги заканчиваются главные работы по приготовле-
нию пироксилина, то При промывке производятся разные испытания
на химическую стойкость и на состав продукта.
Для промывки употребляются большие промывочные ванны*) сход-
ные с голландерами, называемые лазерами. В них вместо барабана с
кожами устроено колесо с лопатками; для сливания воды из лавера
служит сифон. Закладка значительная — из 6 голландеров; при про-
мывке ее приходится воды приблизительно в 10 раз больше (по весу),
чем мезги. Промывка продолжается в среднем 36 час. и производит-
ся в следующем порядке: 4 горячих промывки по 2 часа каждая, за-
тем 2 холодных по 2 часа и, наконец, 2 холодных по 12 час.
*) Размер ванн: длина 5,5 мм., ширина 2,5 м., глубина 1,25 м.
- 317 —
а) Нросейка мезги и отжатие от воды. Ца. наших заводах промы-
тая пироксилиновая мезга подвергается во влажном состоянии про-
сейке, — собственно прожиманию через сито для очистки от случайно
попавших в нее посторонних примесей и недостаточно измельченных
волокон пироксилина.
Перед просейкой масса, направляющаяся по желобу а,' прохо-
дит еще в „мутитель* Р, представляющий собой бак из оцинкованного
железа и расположенный несколько выше очистителя. В этом баке
вращается вал Р с винтовыми лопастями. Пироксилиновая мезга
взмучивается и вследствие этого не оседает на дно. Из мутителя мез-
га по трубе видет уже в прибор для просейки (рис. 110), который со-
Рис. 110. Мутитель (Р) и прибор для просейки пироксилина (В).
стоит из плоского металлического сита Н, подвешенного с одной
стороны на ремнях Е; с другой стороны сито может вращаться'около
точки К. Сито снабжено узкими и длинными отверстиями, шириной
внизу около 1 мм. и расширяющимися кверху. Чтобы частички
пироксилина не задерживались в щелях сита, оно приводится _л1в час-
тое дрожание храповниками М. " .
Под ситом находятся два вала N и ,N' с продольными узкими
лопастями, приводимые в движение зубчатыми колесами В и В,.
Вращающиеся валы с лопастями не дают пироксилину оседать
на стенках прибора и заставляют его вместе с водою проходить сквозь
ситчг снизу вверх. В продолжение 2 час. на этом приборе можно
очистить одну закладку лавера (около 90 пуд.). Отсеянный таким
образом пироксилин увлекается водою и отводится желобом Q из
оцинкованного железа в ямы для отстаивания. В желоб ставятся же-
лезные пластины, составляющие как бы гребенку, и, для возможно
полного удаления частиц железа, — магнита.
Отстойная яма представляет собой каменное, обделанное цементом
помещение*), с кирпичным решетчатым полом. Стенки. бассейна и
дно покрываются двойным слоем холста.
Отстойная яма служит для нагрузки пироксилина из одного
лавера. Пироксилиновая мезга выдерживается в бассейне около 6 ча-
сов; отстоявшийся пироксилин имеет вид плотной влажной массы.
Из бассейна мезга выбирается лопатами и поступает для послед-
него отжатия в центрофуги того же устройства, что и употребляемые
при холодной промывке, но так как пироксилиновая мезга очень
мелка, то она отжимается сквозь холст, которым обятута внутренняя
поверхность центрофуги. Остается в отжатой мезге влажности 25—ЗО’/0.
(Рис. 111).
Рис. 111. Центрофуга для окончательного отжатия
пироксилина. Общий вид.
Выход пироксилина. Теоретически, на 100 ч. клетчатки должно
получиться 183,5 ч. пироксилина наивысшей нитрации (12-ти азот-
ной клечатки). Но при валовой фабрикации этого выхода далеко не
достигают, даже если производство ведется на нерастворимый пирок-
силин. Меньший выход зависит оттого, что в пироксилине получают-
ся всегда низшие продукты нитрации и ненитрованный хлопок, а
*) Размер его 2 X 2 X 3 метра-
также происходят потери пироксилина при различных операциях. Обыч-
ный выход нерастворимого пироксилина, на 100 част, высушенного
хлопка, 160—165 ч. Выход растворимого пироксилина-—немного меньше.
н) Прессование пироксилина. Для приготовления подрывных пирок-
силиновых шашек, пироксилиновая мезга прессуется в гидравлическом
прессе под давлением около 600 атмосфер.
Обыкновенно мезгу предварительно формуют, при помощи особых
добавочных прессов, под малым давлением.
Для этого вводят отвешанное количество пироксилина в медную
воронку В (рис. 112), расположённую рядом с прессом, поливают
I
Рис. 112. СхематическийТразрез аппарата для предварительного
формования пироксилина.
массу водой, и рычагом проталкивают ее в форму D, вделанную в
крыло. Поворачиванием крыла около оси (болта) ЕЕ форму подводят
под пресс. После прессования пироксилиновые шашки имеют высоту
около 150 мм., т.-е. втрое большую нормальной. Такие шашки по-
ступают далее под большой пресс (рис. 113) для окончательного прес-
сования. Каждая шашка вкладывается в гнездо стальной матрицы
Jf и подвергается давлению такого же пуансона П. Для упора вверху,
между матрицей и верхней связью пресса О, вдвигается стальная
тележка Т, передвигаемая на рельсах. Вытесняемая вода и воздух
уходят через отверстия се. Прессование продолжается 1х/а минуты.
По окончании прессования тележка убирается и шашки выталкивают-
ся наружу.
Вследствие трения пуансона о стенки матрицы»при прессовании
и трения пироксилина о те же стенки при выталкивании шашек эта
операция является не безопасной и потому производится в отдельном
Рис. 113. Пресс для выделки пироксилиновых шашек.
помещении, за толстыми стенами, при чем рабочий, действующий
прессом, находится за особой прочной переборкой и наблюдает за вы-
ходом шашек при помощи зеркала.
Сверление отверстий в шашках производится на заводах при по-
мощи токарного станка. На таком же станке производится, если нуж-
но, и обточка шашек.
1. Пироксилин, полученныйл&бораторным путем,
наружному виду очень мало от ди чается от хлопка,
которого он приготовлен: он только более жесток
упруг. Полученный же фабричным' путем пиро-
§ X Свойства пиро-
ксилина.
по
из
и не столь гибок и
ксилин имеет вид полу-белой бумажной массы.
Действительный удельный вес его = 1,65, а влажного, получен-
ного путем прессования под давлением 1600 клгр. на 1 кв. см., = 1,25.
В зависимости от степени спрессования удельный вес меняется от
1,00 до 1,40 *).
Пироксилин не имеет ни запаха, ни вкуса; хорошо приготовлен-
ный препарат ни на воздухе, ни в воде, как в холодной, так и в го-
рячей, не изменяется.
Пироксилин обладает способностью впитывать в себя значи-
тельное количество воды. Продукт, заключающий в себе не свыше
3-х */• влажности, называется сухим, при большем же содержании
воды он зовется влажным. Чем меньше спрессован пироксилин, тем
большее количество воды в себя ой может впитать; так, например,
пироксилин, спрессованный до удельного веса 1,15, может впитать
до ЗО°/о воды, тогда как имеющий плотность 1,4 не может в себя
впитать более 2О°/о влажности. Находясь на открытом воздухе, влаж-
ный пироксилин постепенно-теряет воду, до тех пор, пока влажность
в нем не достигает, наконец, 2%; уменьшить содержание в нем воды
против этого предела можно лишь при помощи дальнейшего высу-
шивания его в сушильных аппаратах, но подобный, искусственно
высушенный пироксилин, будучи оставлен на воздухе, снова погло-
щает из него влагу, пока количество таковой не достигнет в нем 2-х ®/о-
Во влажной атмосфере пироксилин может поглотить до 5% воды
и даже больше, почему его надо считать до известной степени гигро-
скопичным **)•
Присутствие в пироксилине воды безусловно ослабляет взрыв-
чатую его силу, но в столь незначительной степени, что практически
это не имеет никакого значения, а так как влажный пироксилин
несравненно безопаснее сухого, то это взрывчатое вещество всегда
хранится в виде влажного пироксилина, в сухом же состоянии со-
держат его в минимальных количествах (запальные шашки).
Шашка сухого пироксилина, или содержащего малое количество
(около 5%) воды, детонирует непосредственно от капсюля № 8 (с 2 мя грм.)
гремучей ртути, или же соответствующей мощности тетрилового или
комбинированного капсюля; если же содержание воды в пироксилине
больше, то для взрыва его необходим вспомогательный детонатор,
*) Удельный вес порошковатого пироксилина 0,3, а в виде ваты—0,1.
Для определения удельного веса пироксилиновых шашек весьма удобно
пользоваться ртутными весами Бодэ, изготовляемыми R. НаЬп’ом в Касселе.
*•) Билль произвел целую серию определений содержания воды и азота
в пироксилинах, изготовленных из хлопка различного происхождения, и нашел,
чт.о сумма процентного содержания азота и влажности печти постоянна и
близка к 14,6°/0.
Проф. М, Сухаревская Взрывчатые вещества и взрывные работы 21
в качестве какового обычно употребляют шашку сухого пироксилина,
взрываемую в свою очередь соответствующим капсюлем.
Вообще говоря, чем больше влажности в пироксилине, тем боль-
шее количество сухого требуется взять, чтобы вызвать детонацию
всего заряда.
2. При температурах 180°—200°, в зависимости от степени ни-
трации, наступает воспламенение пироксилина *), при чем реакция
разложения его, т.-е. превращение его в газообразные продукты,
будет протекать сравнительно не столь быстро—он просто сгорает;
однако, может произойти и взрыв его, если нагревать его быстро,
или опыт вести под большим давлением. Последнее оказывает также
существенное влияние на химический состав газообразных продуктов
разложения пироксилина. Пироксилин, взорванный в замкнутой проч-
ной оболочке, дает преимущественно: окись углерода, углекислоту,
водяные пары и свободный азот; если же пироксилин взорвать на
открытом воздухе, то всегда получится также некоторое количество
окислов азота, обуславливающих буроватый оттенок газообразных
продуктов взрыва.
При взрыве, а также при горении пироксилина, он почти что на-
цело превращается в газообразные продукты, при чем количество
твердого остатка бурого цвета не превосходит 0,5%—1°/0.
Обладая вполне удовлетворительной стойкостью при обыкновенной
температуре, даже очень тщательно приготовленный пироксилин ока-
зывается довольно чувствительным уже к небольшому нагреванию:
при повышении температуры до 50’—60’, спустя, некоторое время,
уже наступают первые признаки разложения его. Замечено, что чем
выше качество пироксилина, тем при данной температуре, медленнее
наступает разложение, поэтому промежуток времени дб наступления
разложения может служить, так сказать, показателем стойкости
пироксилина.
3. Разные лица на определении этого времени базировали пред-
ложенные ими методы определения стойкости пироксилина, причем
предлагали вести опыт при различных температурах, а именно:
Абель — при 65’0, Гуттман—80° 0, Вьель—106,5°, Бергман и Юнк—
при 135’0, Билль—при 135’0 и Обермюллер—140°С, и, наконец, в
самое последнее время в Германии остановились на 75’0, полагая
что такая температура является наиболее близкой к естественным
условиям хранения.'
В сухом виде пироксилин довольно чувствителен к механиче-
ским влияниям, к ударам и трению. Так,’например, сухой пироксилин,
положенный тонким слоем на железную наковальню, взрывает от удара
железного груза весом 50 клгрм, падающего с высоты 30 см., но
при этом детонирует только та часть взрывчатого вещества, по которой
пришелся удар; соседние же с ней чаще всего просто разбрасы-
ваются, иногда же, воспламеняясь, сгорают без. взрыва, т.-е. получается
то, что называют местным взрывом.
*) Температура воспламенения пироксилина сильно зависит также от по-
становки опыта, так, например, при медленном возвышении температуры (на-
пример, медленнее чем на 5’ в минуту), взрыв его может наступить значительно
раньше, в благоприятном случае даже при 165° С.
Для испытания чувствительности пироксилина на удар, обыкно-
венно берут 0,10 грм/ его, запрессовывают в плотный медный капсюль .
диаметром 10 м/м. и высотой 1 м/м.
В толстом слое пироксилин оказывается пассивным даже в от-
ношении весьма сильных ударов.
При трении сухой пироксилин электризуется; этого свойства,
однако, лишен влажный. При энергичном трении сухой пироксилин
воспламеняется, содержащий же меньше 1% влажности при этом
может даже взорваться. Предварительное подогревание сухого пиро-
ксилина сильно облегчает воспламенение сухого порошковатого пиро-
ксилина от трения. Наблюдались случаи воспламенения подобного
пироксилина даже от трения об войлок.
Шашка сухого пироксилина, будучи помещена на рельс железной
дороги, всегда загорается под паровозом, иногда то же имеет место
при прохождении над ней вагона.
Удар ружейной пули обыкновенно воспламеняет сухой пирокси-
лин; если же он предварительно подогрет, то может последовать также
и взрыв его. То же случается с пироксилином, содержащим меньше
1 % влажности.
Влажный пироксилин к падению в него ружейной пули относится
совершенно пассивно, он при этом только раздробляется, к трению
не чувствителен, ударов таких, какие встречаются обыкновенно на
практике—не боится.
Из изложенного явствует, что сухой пироксилин несколько более
чувствителен к механическим влияниям, чем это было бы желательно.
Его можно флегматизировать, пропитывая параффином; от этого его
сила значительно уменьшается, а также он дает много дыма.;
Лучший способ сделать пироксилин вполне безопасным—дер-
жать его постоянно влажным. Как уже замечено было раньше, вода
его нисколько не портит и не изменяет, а между тем' во влажном
состоянии он не боится ни толчков, ни ударов, ни трения, • причем
влажные шашки совершенно безопасно можно сверлить.
Получаемый на заводе в качестве окончательного продукта
производства порошковатый пироксилин носит название мезги, которая «
прессуется в различной формы шашки, причем тому, который при-
меняется в подрывном деле, придают форму, чаще всего, шестигран-
ных призм со скошенными боковыми ребрами или цилиндриков,
реже—кубиков и параллелепипедов (см. часть взрывных работ).
4. Пироксилиновые шашки имеются двух размеров большие или
саперные, имеющие диаметр описанной кругом основания окружности
81 мм. и высоту 50 мм. и кавалерийские или малые, имеющие диаметр
описанной окружности 54 мм. и высоту 45 мм. Большая шашка
весит около 250 грм., а кавалерийская около 110 грм.
Шашечный пироксилин цилиндрической формы называется бу-
ровым. Буровая шашка имеет диаметр 30 мм., а высоту 80 мм.,
весит же около 50 грм.
В случае, если шашки эти должны служить запальными, в них
оставляется при фабрикации или же высверливается в момент надоб-
ности цилиндрическое отверстие диаметром 8,3 мм. для капсюля.
4
Сухая пироксилиновая шашка, будучи погружена в воду, напиты-
вается ею до отказа в 15—20 минут*).
Мороз не оказывает никакого влияния на безопасность пирокси-
лина, что же касается способности пироксилина взрываться, то в
сухом пироксилине она на морозе остается без изменения, что же
касается влажного, то в замерзшем способность взрываться у послед-
него несколько понижается, что, однако, практического значения
не имеет.
Солнечный свет на прессованный пироксилин не оказывает ни-
какого влияния, порошковатый же, подвергнувшийся продолжительное
время непосредственному действию солнечных лучей, становится не-
сколько более восприимчивым ко внешним влияниям.
Электрический ток достаточной силы лишь зажигает сухой пиро-
ксилин, но не взрывает его.
Будучи зажжен в сравнительно небольшом количестве, сухой
пироксилин сгорает быстро, но без взрыва, давая довольно яркое
пламя желто-оранжевого цвета. Что же касается влажного, то он
загорается только/ по мере высыхания и горит медленно и всегда
без взрыва. Способность влажного пироксилина воспламеняться нахо-
дится >в тесной зависимости от содержания в нем влажности. Это
ясно видно из отношения влажного пироксилина к накаленному
железу: при 7% влажности пироксилин загорается; при 9%—он
тлеет в течение того времени, пока он находится в соприкосновении
с железом, а при 12#/0 выделяются только пары воды, но пироксилин
не загорается вовсе.
Сухой пироксилин в сравнительно небольших количествах (при-
мерно до 275 клгрм.) может быть безопасно сжигаем на открытом
воздухе при условии размещения его нетолстым слоем (во избежание
возможности прогревания массы пироксилина до опасного предела,
за которым может последовать взрыв).
5. Температура воспламенил хорошего пироксилина не должна
быть ниже 180°С. Как уже замечено было раньше, реакция сгорания
пироксилина (понимая и взрыв его, как частичный случай сгорания)
протекает различным образом в зависимости от давления, под кото-
рым он находится. Вообще говоря, в нем меньше кислорода, чем то
требуется для сгорания всего углерода в углекислый газ и воду**).
*) Через 1 минуту лежания в воде опа вбирает в себя 5—8% воды, через
5 минут 15—18э/о, через Ц,—% часа—25—30% воды.
Казалось-бы, что взрывчатое вещество, развивающее при взрыве полное
горение, должно было быть вместе с тем и самым сильным, однако практика
показывает, что в отношении многих взрывчатых веществ, такое положение непри-
менимо; наиболее могучие взрывчатые вещества, как, например, мелинит, пиро-
ксилин, нитроглицерин н др.', как раз подобной картины не дают: в пироксилине
и мелините недостаточно кислорода для полного сгорания, .оттого в продуктах
взрыва получается ядовитая окись углерода, взрыв же мелинита сверх сего харак-
теризуется обильным черным дымом от несгоревших частиц углерода, в некото-
рых же наоборот—избыток кислорода, освобождающегося при взрыве и т. п.
Эскалес приводит нижеследующие данные Karolyi состава газов,
получившихся путем сжигания пироксилина в ваккуме н взорвав
ного под большим давлением:
1 ! В ваккуме. Под большим давлением.
Окись углерода . . * 28,92% г 29,97%
Углекислота. . . . * 30,43% 33,86%
Метан 6,47% | 4,28%
Окислы азота . . . 9,59%
Азот ....... 8,71% 13,16%
Водяные пары . . 14,28% 16,87%
Водород 0,24%
Углерод 1 | 1,60% 1,62%
Сумма . . Л 100,00% j 100,00%
С. Е. Bichel дает нижеследующий состав газов, полученных при
взрыве пироксилина:
38,94% окиси углерода,
'30,75% углекислого газа,
0,50% метана,
12,82% азота,
15,85% водяных паров,
1,14% водорода.
С увеличейием плотности заряжания состав газообразных про-
дуктов также подвергается сильному изменению, как то видно из
следующей таблицы, заимствованной у Эскалеса:
Плотность заряжай и я.
0,01 0,023 0,2 0,3
Окись углерода . . . 49,3% 43,3% 37,6% 34,7%
Углекислый- газ . . . 21,7% 24,6% 27,7% 30,6%
Водород 12,7% 17,2% 18,4%. 17,4%
Азот * , 16,3% 15,9% 15,7% 15,6%
Метан 1 следы , 0,6% 1,6%
i
Вертело считает, что реакцию взрывчатого разложения пирокси-
лина при малых плотностях заряжания можно выразить формулой:
CatH»9(NO.)11O„ = 15CO+eCOs-|-5,5Hi+9H,O+5,5N.);
а при больших:.
C24H29(NO3)tlO2e=12CO-F12CO2+8,5H3+6H20+5,5N2.
По С. Е. Bichel, об‘ем газообразных продуктов, получающихся
при взрыве 1 килограмма пироксилина, равен 887 литрам, из которых
около ’Д —пары воды, остальные же приходятся на прочие газо-
образные вещества, причем по его определению при взрыве 1 кило-
грамма пироксилина освобождается 898 больших калорий тепла (по
Sarrau и Viell’ro 1071 калория), причем теоретически температура
взрыва доходит до 2380°С. Теоретически работа, развиваемая взры-
вом 1 килограмма пироксилина вычислена Вертело и оказалась рав-
ной 45.5.000 килограммо-метров (из расчета 1074 тепловых калорий).
В этом отношении пироксилин, по сравнению с другими взрывчатыми
веществами, как это видно из таблички, заимствованной у R. Escales’a
занимает среднее место.
1 килогр. вещества. Калорий. Работа ки- лограммо- метры.
Нитроглицерин 1570 667.000
Гремучий студень. . 1530 650.000
Пироксилин. • 1074 456.000
Черный порох 520 220.000
Гремучая ртуть. 403 170.000
Проба в бомбочке Трауцля (при заряде 10,0 грм. пироксилина)
дала об'ем пустоты раздутия 420 куб. с;/м.
6. Сила взрыва пироксилина—больше нежели нитроглицерина,
но потенциал его меньше; сравнительно с черным порохом, он дей-
ствует в 3—4 раза сильнее.
Для взрыва сухого пироксилина требуется капсюль, содержа-
щий не менее 1 грм. гремучей ртути; более слабые капсюля дают
взрывы случайные. На практике для взрыва пироксилина применяют
капсюля, содержащие 2 грм. гремучей ртути (№ 8). Применять по-
добные капсюля вместо граммовых рекомендуется в силу того, между
прочим, соображения, что на практике в сухом пироксилине может
оказаться содержание несколько больше 3% влажности и при грам-
мовом капсюле взрыв не был бы вполне обеспечен *).
• Пироксилин меньшей плотности требует более сильных капсю-
лей; так, например, для взрыва пироксилина, имеющего плотность 0,8,
необходим четырех-граммовый капсюль, тогда как пироксилин спрес-
сованный до максимальной плотности = 1,4, может быть взорван кап-
сюлем с 0,5 грм. гремучей ртути.
Месторасположение в заряде капсюля вовсе не безразлично:
эффект взрыва получается наибольшим при расположении капсюля
в стороне, противоположной той, в которой находится об'ект действия
заряда. Между капсюлем и детонирующим от него: зарядом не должно
быть промежуточной среды, как, например, дерева,бумаги, рога и пр.,
но тонкие металлические оболочки капсюлей вовсе не препятствуют
взрыву.
Если сила капсюля не достаточна для того,, чтобыпроизвести
взрыв пироксилина, последний лишь разбрасывается й^^агорается.
Разложение пироксилина при взрыве происходи®? настолько бы-
стро, что если положить на. толстую железную плитку листочек и на
него пироксилиновую шашку, то после взрыва получитодна плитке
выпуклый отпечаток листочка. , /
На морозе влажный пироксилин замерзает и в таком виде для
своего взрыва требует усиленных запальных зарядов eyXWo пирокси-
лина, сухой же пироксилин к морозу нечувствителен
Влажный пироксилин может быть взорван и 'бёй..;.^эт^0д6тва за-
. пальных зарядов сухого пироксилина, прямо помоцйуэл усиленных
' капсюлей. Так, например, пироксилин с 6—10%требует
для своего взрыва капсюля с 2,5 граммами гремучййС р^р?й,. а при
10% влажности и более потребовался бы капсюль Чне^Й0Неё, как
с 7 граммами гремучей ртути. ,/'’
Таким образом, влажный пироксилин более врегО.д^шцно взры-
вать при помощи запальных шашек сухого пироксилина, что на
практике и делается. ,
При составлении зарядов надо наблюдать, чтобы зазор между
запальной шашкой и влажным пироксилином не превосходил 2 м.м.,
включая сюда и оболочки запальной шашки и заряда; лучше же
всего, чтобы заряд и запальная шашка непосредственно соприкаса-
лись между собою.
Скорость распространения взрыва в заряде очень велика; Bichel
ее определил равной 6383 метров в секунду; она значительно умень-
шается при наличии между шашками промежутков.
1) Капсюльная гильза обязательно должна быть металлическая, причем тол-
щина стенок ее не должна превышать 0,2 мм. Лучший материал для капсюльной
гильзы—красная медь. При бумажных гильзочках, или если вместилище для грему-
чей ртути сделать из гусиного пера, количество гремучей ртутй надо увеличить
Чем больше влажности содержит пироксилин, тем большее ко-
личество сухого .требуется для его взрыва; так, например, на 1 клгр.
влажного пироксилина:
при 8% —10% влажности надо около 50 грм. сухого
» 107. —15% „ „ „ 80 „
я 15% -20% „ „ , 150 ,
я 20% -25% „ ' „ „ 280 в
При взрыве больших зарядов влажного пироксилина необходимо
расчитывать количество запальных шашек: при зарядах в 40 фунтов
и более взаимоотношение между количествами сухого и влажного
пироксилина не должно быть меньше 1:100 для взрыва на суше
и меньше 1:150 для подводных взрывов. Эту норму практически
увеличивают, считая при сосредоточенных зарядах по 1 фунту сухого
пироксилина на каждый пуд влажного, а при удлиненных это отно-
шение надлежит принимать равным 1 :20.
При взрыве зарядов мерзлого пироксилина, содержащего более
15% влажности, а также незащищенного от дождя, тоже необходимо
увеличить пропорцию сухого пироксилина.
Световой эффект взрыва также зависит от взаимоотношения ве-
личины главного заряда и запального: при сильных запальных заря-
дах появляется слабо светящееся пламя, какое наблюдается при
взрыве сухого пироксилина, тогда как при нормальных взрывах
влажного, наблюдается большое желтое пламя. Это явление, невиди-
мому, может быть объяснено тем, что в последнем случае окись угле-
рода и ’водорода продуктов взрыва успевают сгореть и обратиться
соответственно в углекислоту и воду за счет кислорода воздуха.
Влажный пироксилин также отлично детонирует от динамита,
содержащего не менее 75% нитроглицерина (вес такого детонатора
должен быть около 50 - 60 грм.), а также мелинита и тола, при ус-
ловии плотного прилегания их к главному заряду.
7. Способность пироксилина детонировать на расстоянии нич-
тожна. Эта способность увеличивается от увеличения количества гре-
мучей ртути, взрывающей активный заряд, и уменьшается с увели-
чением содержания в пироксилине влажности, так, например:
Шашка с 1% влажности детонирует на расстоянии до 10 с. м.
Я 2% Я я я я V 5 с. м.
ю% я я я 2 с. м.
» я 20% л л 1 с. м.
я я 25% V п » я 0 с. м.
Расстояние, на котором имеет место детонация, не находится в за-
висимости от величины пассивного заряда. Эго расстояние увеличи-
вается с увеличением активного заряда, а также, если активный и
пассивный заряд расположены по концам металлической трубы.
Разрушительное действие пассивного заряда всегда меньше та-
кового же активного. Небольшая способность пироксилина детониро-
вать может быть значительно увеличена введением в пассивный за-
ряд капсюля с гремучей ртутью.
В нижеследующей таблице показаны расстояния, на которых де-
тонирует при благоприятных обстоятельствах (сухая погода, безве-
трие и пр.) пассивные заряды, капсюля которых обращены своими
отверстиями к активному заряду:
при величине заряда в 410 грм. максимальное расстояние 1,30 метр.
. и Я п я 820 99 99 99 1,60 99
» п п » 1,65 клгрм. 99 Я 1,70 99
99 я м 2,9 » Я 99 2 п
п Я п я 4,10 п Я И * 2‘45 W
99 Я W 8,25 н 7) Я 2,90
п 99 16,40 я Я я 3,60 Я
Свойства подставок, на которых находятся детонируемые заряды также
оказывают некоторое влияние на дальность детонации, но в меньшей
степени, чем у динамитов.
Под водою детонация также возможна, но на расстояниях гораздо
меньших.
Напитывание пироксилина растворами бертолетовой соли, селитры
и хлористого калия, значительно повышает способность пироксилина
детонировать.
8. Надлежаще приготовленный пироксилин предоставляет, прак-
тически, достаточно стойкое вещество. Дурная фабрикация его с не-
полной отмывкой кислот, соприкосновение с жирами и кислотами, а
также нерациональное хранение его вызывают его саморазложение*).
Последнее обнаруживается при помощи лакмусовой и иодкрах-
мальной бумажек (могущих констатировать, его кислотность).
Плесень и пятна—не вредят ему, если они лишь с поверхности.
Пироксилин действует на металлы при продолжительном сопри-
косновении с ними. Более других подвергается раз'еданию бронза,
железо и сталь, менее других—медь, свинец и цинк.
Порошковатый пироксилин или мезга с виду похожи на измель-
ченный хлопок. Удельный его вес 0,1. Порошковатый пироксилин,
положенный на наковальню тонким слоем, взрывается от удара. От
трения металлическим предметом он может загореться (от возвышения
температуры). Порошковатый пироксилин взрывается при быстром его
нагревании до 1100—140°С.
Небольшим количеством гремучей ртути, рыхлый пироксилин
только разбрасывается, а не взрывается.
*) Постепенное саморазложение в нитроцеллюлозе по Биллю представляют
следующую картину: в пироксилине обнаруживается с самого начала кислая реакция,
при чем. начинают выделяться азотистые пары, далее вещество теряет свойственную
ему структуру и постепенно превращается в клееобразную массу, которая затем
приобретает свойство растворяться в воде. Полученный раствор имеет сильно кислую
реакцию и содержит кроме углекислоты и окислов азота также муравьиную и ща-
велевую кислоты, а также соединения, природа которых еще не установлена, глю-
козу, сахарную кислоту и г. п.
Применение пироксилина у нас в военном деле самое разнообраз-
ное. Наряду с толом он у нас признается лучшим взрывчатым ве-
ществом для подрывных работ и снаряжения им хбомб, мин и снаря-
дов. К сожалению, в нем у нас постоянно чувствуется недостаток.
Об особых видах пироксилина и'веществах, сходных с ним (кол-
лодион. хлопок, целлулоид, нитродревесина и др.) будет сказано
далее.
•ГЛАВА III.
Нитроглицерин и динамит.
Н. Нитроглицерин.
С точки зрения техно-химической нитроглицерин уже был оха-
рактеризован ранее. Здесь мы рассмотрим фабрикацию его и пополним
наши сведения о тех его качествах, которые преимущественно важны
во взрывной технике.
ч 1 л л ика ия и- а) Большая часть сведений, касающихся основ-
ь ' а Рикаци* ни' ных материалов, идущих на фабрикацию нитроглице-
трогпицерин . рИна как_т0: глицерина, азотной и серной кислот,
также дана уже было раньше, поэтому здесь же мы лишь ограни-
чимся указаниями на главные специальные условия, коим должны
удовлетворять технические продукты, требующиеся для этого произ-
водства.
Кислоты должны быть наивысшей концентрации, при чем содержание
в серной кислоте моногидрата не допускается меньше 94%, азотная же
должна содержать его по меньшей мере 93%.
Присутствие в последней азотноватой окиси N2O4 в количествах
превышающих 2% не допускается, в виду того, что последняя обус-
ловливает возникновение наряду с процессом нитрации глицерина,
опасных реакции его окисления.
Глицерин СэН5(ОН)3, как известно представляет бесцветную си-
ропообразной консистенции, липкую жидкость сладкого вкуса удель-
ного веса 1,27; запаха не имеет никакого; с водой смешивается во
всех пропорциях. При сильном холоде застывает в бесцветную, кри-
сталлическую массу, обладающую сильным лучепреломлением, снова
плавящуюся при4-7°С. При посредственно низких температурах (на-
пример, при 40°С.), он еще не кристаллизуется, но становится не-
сколько студенистым. При быстром нагревании около 280°С., глицерин
перегоняется, но уже при этом отчасти разлагается; в ваккуме же
перегоняется без разложения.
Глицерин гигроскопичен и, при благоприятных условиях, может
впитать из воздуха до 50% влажности.
Хороший технический продукт должен легко растворяться в воде,
в спирте, в смеси спирта с эфиром, но нерастворим в эфире, серни-
стом углероде, бензоле и хлороформе.
331 —
В свою очередь глицерин может растворять 1 значительное коли-
чество едких щелочей и многих других веществ, -
Глицерин, предназначенный для приготовления из него нитро-
глицерина, не должен содержать более двух—трех процентов влаж-
ности и имеет удельный вес по меньшей мере 1,26 (при 15°С.).
Температура кипения чистого глицерина 290°С.
Кроме содержания минимального количества влажности, глицерин,
идущий на фабрикацию нитроглицерина, должен иметь совершенно
нейтральную реакцию иобязательно быть свободным от примесей извести,
серной кислоты, мышьяка и хлора. Содержание в нем жирных кислот
в количестве более 0,1—0,2% не допускается в виду того, что при-
сутствие их обусловливает возникновение крайне опасных реакций
окисления и не позволяет хорошо промыть готовый фабрикат. Макси-
мальное количество золы, допускаемое в глицерине есть 0,1%.
Теоретически для приготовления ста весовых частей нитрогли-
церина необходимо взять 40,5 частей глицерина и 83,3 части азотной
кислоты. На практике, однако, приходится брать значительно больше
азотной кислоты, а для того чтобы связать, выделяющуюся при про-
цессе нитрации воду, мешающую процессу—вводится также большое
количество крепкой серной кислоты. В настоящее время чаще всего
нитрующую смесь составляют из 3 х частей<азотной и 5 частей серной
кислоты.
Что же касается пропорции глицерина относительно сульфоазот-
ной смеси, то она изменяется в зависимости от качества глицерина
и крепости кислот. Чаще всего приходится брать на одну часть гли-
церина не менее восьми частей кислотной смеси*).Последнюю приготовля-
ют в общем так же, как и для нитрации хлопка, вливая серную кислоту
тонкой струей, при непрерывном и сильном помешивания, в охла-
жденную азотную кислоту, не позволяя температуре смеси подниматься
сколько-нибудь значительно**).
б) Самая фабрикация нитроглицерина слагается из нижеследу-
ющих главнейших операций: 1) нитрации глицерина; 2) отделения нитро-
глицерина от кислот; 3) промывки его; 4) фильтрования готового продукта
и 5) выделения его из промывных вод и отработанных кислот.
Схема процесса видна из рис. 116, 117, 118, 119, отдельные же
операции состоят из следующих:
7) Нитрация глицерина. Последняя производится в чугунном
(в^Америке) или чаще—в свинцовом сосуде d цилиндрической формы,
(рис. 120, 121) вставленном в деревянный чай сс. Сосуд снабжен
крышкой конической формы, сквозь которую проходят: а) от двух до шести
трубочек п, по которым в аппарат вдувается сжатый воздух, долженству-
ющий перемешивать массу во время нитрации и охлаждать ее; б) несколь-
*) На нитроглицериновом заводе Waltham-Abbey в Англии, где фабрикация
ведется при всех усовершенствованиях, отношение количества глицерина к коли-
честву смеси = 1: 6,13, причем выход получается около 229%.
*•) Улучшение готового фабриката достигнуто применением концентрирован-
ных кислот и более сильным охлаждением (15° вместо 20—28°).
Благодаря этому выход нитроглицерина, смотря по' чистоте исходного
продукта, достигает 230 ", по Hochwimmer даже 235%, в то время как старые спо-
собы давали не более 215 ',; теоретический выход = 246,7%. В среднем при фабрич-
ном произаод-тве выход нитроглицерина можно принять равным 225—2281,.
— 332 —
ко . (обыкновенно 2 или 3) отдельных змеевиков q, предназначенных дчя
циркуляции по ним воды, имеющей целью охлаждать кислотную смесь
во время нитрации; в) двух термометров т, из которых один имеет
Рис. 114. Внешний вид нитроглицеринового завода (Америка).
шарик близь дна нитрационного сосуда, другой же, предназначенный
для указания температуры слоев жидкости, ближайших к поверхности
Рис. 115. Внешний вид нитроглицеринового завода.
ее, не доходит до дна: г) из трубки t, сквозь которую вводят внутрь
аппарата кислотную смесь; д) из воронки о, сквозь которую по специ-
. альной трубке е с краном, приливают глицерин, предназначенный для
нитрации; е) из трубки h, предназначенной для отвода выделяющихся
при нитрации газов. Трубка эта имеет стеклянную часть i для того,
чтобы можно было судить по цвету паров о ходе реакции внутри
прибора.
В самой крышке же нитрационного аппарата (или так называе-
мого нитратора), имеется также несколько отверстий со вставленными
в них стеклами для того, чтобы можно было следить за процессом
нитрации, совершающимся вйутри прибора. В дне нитратора имеется
Рис. 116. Схема нитроглицериновой установки,
а—сосуд с глицерином, b—витровальный аппарат,
с — резервуар для кислот, d — разделительный
аппарат, её—промывные чаны, i—фильтр, к—эбо-
нитовая кружка, 1—бассейн с водой.
кран, предназначенный для опоражнивания аппарата, при чем нитро-
глицерин может быть или выпущен в аппарат для промывки, или
же, в случае, если бы реакция приняла опасное течение, быстро уда-
лен в специальный приемник, содержащий большое количество воды
(примерно в 10 раз больше кислотной смеси в нитраторе). Интересное
усовершенствование нитратора было предложено в 1902 году Эверсом.
Последний для перемешивания нитрующейся смеси применил особый
Предохранитель- Нитра- Сосуд для
ный чан с водой, тор. глицерина. В конденсацию.
Сосуд для
кислот.
В денитра-
цию.
Лабирант. Здание для очистки
Земляной вал. "
Сосуды для теп-
лой воды и соды.
Фильтроваль-
ный чан.
Земляной вал.
Чаи для пред-
варительной
промывки.
Сепаратор.
Ни.тратор. Сосуд с гл и- Нитратор,
церином.
распылитель, работающий кислотами, поступающими в него под из-
вестным давлением. Преимущества его аппарата состоят в достижении
большей однородности получаемого продукта и в значительном уско-
рении процесса—при одновременном впуске компонентов. (Рис. 122,123).
Предохранит,
чан с водой.
Горизонт.
Рис. 119. Схема нитроглицериновой установки.
Глицерин, предназначенный для нитрации, находится в специ-
альном аппарате, из котораго поступает в воронку нитратора под давле-
нием сжатого воздуха.
Аппарат этот (рис. 124) состоит из металлического цилиндриче-
ского, герметрически закрывающегося сосуда с покатым к середине
дном. В середине крышки расположена воронка с краном, сквозь ко-
торую входит внутрь прибора глицерин;* в крышке закреплена также
и трубка, через которую'вжутрь цилиндра нагнетают воздух. От нижней
точки дна отходит трубка с краном, сквозь которую глицерин под
напором сжатого воздуха поступает.в нитратор. Сбоку цилиндра для
определения уровня жидкости внутри сосуда есть приспособление
того же типа, как и водомерное стекло.
Обыкновенно нитратор расчитывается для возможности произ-
водства в нем одновременной нитрации 150 килогр. глицерина*).
*) По существующим узаконениям в Германии воспргщено нитрование более
260 klgr. глицерина в одной партии; в Англии при старых способах более 230klgr-,
при новом более 453 klgr. По данным Macnab последняя цифра увеличивается
до 675 klgr.
Глицерин, поступающий в прибор для нитрации, обычно имеет
температуру 20° С или несколько выше, так как иначе он слишком
густ и плохо нитруется. В начале Нитрации температура кислотной
смеси должна быть 15* С; по мере приливания глицерина она иачи-
Рис. 120. Аппарат для нитрации глицерина.
нает повышаться. Поднятие температуры, однако, вредно влияет на
процесс нитрации, обусловливая возникновение опасных реакций
окисления, а потому, практически, температуре не дают достигать
25°С., особенно остерегаясь доводить ее до 30°С., иначе, при дальней-
шем прибавлении глицерина* температура быстро доходит до 50е С.
при которой начинается крайне опасное разложение нитроглицерина"
Повышение температуры умеряют уменьшением притока глицерина
и усиленным пропусканием через нитрующуюся смесь воздуха. Если
бы, несмотря на эти средства, температура достигла опасного предела,
Проф. М. Сухаревский. Взрывчатые вещества в взрывные работы. 92
— 338 —
то* немедленно выпускают содержимое нитратора в специальный чан,
содержащий большое количество воды.
Ввиду того, • что усиленное продувание воздуха служит одним
из главных средств предупреждения катастрофы, могущей иметь ме-
сто "‘вследствие перегревания нитрующейся смеси, то на большинстве
заводов, на случай внезапной порчи воздуходувных приспособлений,
имеются наготове цилиндры со сжатым воздухом.
Рис. 121. Аппарат для нитрации глицерина
по способу Нобеля (с механической
мешалкой). Схема.
Что (касается рабочего давления струи сжатого воздуха, вы-
пускаемого для перемешивания нитрующейся смеси и для ее охлаж-
дения, то таковое обычно ограничивают двумя атмосферами, ибо при
большей скорости вдуваемого воздуха происходит значительное уле-
тучивание азотной кислоты, влияющее на уменьшение выхода фабри-
ката.
— 339 —
Рис. 122. У совершенствованный нитрационный аппарат Эверса, а — свинцовый
нитрациожиый куб; b — шлем; с — вытяжная труба; i — распылитель»
Ряс. 123. Распылитель фверса. (Деталь). 1 —впуск глицерина; h— впуск нитрующих
кислот; 0,0 — распылители глицерина; п — распылители кислот.
Попадание в нитратор посторонних предметов, как-то: масла, кус-
ком дерева и проч., ни в каком случае не должно быть допускаемо,
так как присутствие их при процессе нитрации может вызвать крайне
опасный процесс саморазложения нитроглицерина.
Операция нитрации, вместе со вспомогательными работами, в
роде наполнения сосудов кислотами и впуском нитроглицерина, тре-
Рис. 124. Сосуд для глицерина.
бует 1—1*4 часа, при чем самый процесс нитрации длится всего лишь
25—45 минут, в зависимости от внешней температуры (в теплое время
года значительно дольше нежели зимой).
Та легкость, с которой происходит в процессе нитрации глице-
рина под’ем температуры до опасного предела, обусловливает то, что
при этой операции требуется иметь самый строгий надзор за ходом
реакции. Малейшее упущение в этом отношении может повлечь за
собой несчастие, или, во всяком случае, потерю всей нитруюй^жу.
порции фабриката; последнее заставило французов Бутми и Фб1ш|Ж
1876 г. предложить особый способ нитрации, основанный на
пипе замедления процесса нитрации и устранения этим цодняЙ!^
температуры до опасного предела.
Они предложили приготовлять две отдельные смеси: глицерин©-?
серную (из одной части глицерина и трех частей серной кислоты), а
другую сульфоазотную смесь специального состава (равное количе-
ство серной и азотной кислот). Обе смеси охлаждались и затем при-
водились в соприкосновение.
Теоретическое основание этого способа весьма просто: глицерин
под влиянием серной кислоты превращается в серно-глицериновый
эфир CjHgfOH^HSOi, который под влиянием сульфоазотной смеси,
превращается в свою очередь в нитроглицерин, причем реакция по-
добного превращения протекает очень медленно (от 12 до 24 часов).
Теория эта практикой, однако, не оправдалась: способ этот в
смысле безопасности не представляет каких-либо особых преимуществ
и потому в настоящее время почти вышел из употребления.
2) Отделение нитроглицерина от кислот основано на том, что го-
товый фабрикат, имея удельный вес 1,6, всплывает на поверхности
отработавшей кислотной жидкости, имеющей удельный вес почти
равный 1,7.
Невзирая на подобную сравнительно малую разницу в удельных
весах обеих жидкостей, разделение их совершается довольно быстро,
если только в нитрационную смесь не попало постороннее вещество
(например, жир, сернокислый свинец и т. п.). Операция эта происхо-
дит в специальных аппаратах, называемых сепараторами.
Схема такого прибора представлена на рис. 125. Он состоит из
деревянного сосуда той, либо другой формы, выложенного внутри
свинцом, либо заключающего в себе внутренний свинцовый сосуд с
дном покатым к средине. В боковых стенках аппарата и его крышке
сделаны вырезы, забранные стеклом, для того, чтобы можно было сле-
дить за тем, что делается внутри прибора. Сквозь крышку также пре-
ходит трубка для впуска внутрь прибора сжатого воздуха, доходящая
до самой низкой точки дна аппарата,/а также другая, для удаления
отработаннаго воздуха. Сквозь крышку цроходит внутрь прибора
термометр.
Приток смеси нитроглицерина с кислотами обычно производится
той же самой трубкой, по которой поступает в прибор сжатый воз-
дух. Последний пропускается внутрь аппарата только тогда, когда
замечается разогревание жидкости. '
Для отвода газов служит пристроенная по середине крышки
труба, имеющая стеклянное окошечко для того, чтобы можно было
бы наблюдать цвет газов, удаляющихся по этой трубе из сепаратора.
От нижней части дна отходит короткая вертикальная трубка со стек-
лянным окошечком и тремя кранами под Йим: нижним, по большей
части пролетным, предназначенным для быстрого опоражнивания се-
паратора от жидкости в случае чрезмерного разогревания ее, могу-
щего оыть не безопасным; другие два служат для впуска кислот.
I
Всплывший на поверхность кислотной смеси нитроглицерин впу-
скается через специальный кран, находящийся в одной из боковых
стенок сепаратора, и поступает в промывной чан. Операция отделения
готового нитроглицерина от кислот, вообще говоря, требует около полу-
часа времени.
Когда замечают, что нитроглицерин уже полностью выделился
из кислотной смеси, то при помощи крана в боковой стенке сепара-
тора выпускают большую часть его малыми порциями -ъ промывной
Рис. 125. Схематический разрез сепаратора.
чан, после чего боковой кран закрывают й, открывши один из кра-
нов, служащих для спуска кислот, выпускают последние до тех пор,
пока в окошечке спускной трубы покажется нитроглицерин. Тогда
этот кран закрывают и по третьему крану спускают остаток жидкости
в особый приёмник.
3) Отделенный от кислот нитроглицерин немедленно поступает
в свинцовый чан, с покатым в одну сторону дном, где и подвергается
предварительной промывке. Таковая производится пропусканием через
жидкость сжатого воздуха, который и перемешивает ее. Для провода
его служит трубка, проходящая через крышку аппарата и доходящая
до дна. Через крышку же проходят трубки, отводящие отработанный
воздух.
Для выпуска жидкости из аппарата имеются в боковых стенках
его два крана: верхний служит для выпуска промывных вод, а ниж-
ний—для удаления из прибора нитроглицерина.
Промывка должна вестись при температуре 15* С., или немногим
выше, при чем не должна ни в какдм случае подниматься вышеЗО’С.
По причине значительной разности удельных весов нитроглице-
рина и промывных вод, отстаивание жидкостй после окончания опе-
рации происходит довольно быстро.
Рис. 126. Чаны для промывки и нитрализации нитроглице-
рина по старому способу Нобеля. Нитроглицерин находится
в чанах А, А', А"; вода поступает в иих снизу через
трубы Д, Д', Д".
4) Для дальнейшей промывки глицерина он поступает в специаль-
ные промывочные чаны. Последние устроены в общем также, как и
чаны для предварительной промывки. Схематический разрез промы-
вочного чана показан на рис. 127,
Как видно, он состоит из сосуда с наклонным дном, при чем в
одной из боковых стенок его, в самой низкой части, имеется кран
для выпуска нитроглицерина. Для удаления промывных вод служит
другой кран, соединенный с воронкой особого устройства, могущий
перемещаться ввверх и вниз и соединенный с выходным отверстием
при посредстве каучуковой трубки. Самое перемешивание жидкости
производится преимущественно посредством пропускания через нее
сжатого воздуха, входящего в прибор при помощи особого трубопро-
вода. Иногда промывка достигается при помощи механических ме-
шалок.
Промывку ведут обыкновенно тройным об‘емом воды, при чем
делают семь или восемь промывок, пропуская воздух каждый раз в
течение четверти часа. ;
Для некоторых из последних промывок берут однопроцентный
раствор соды, остальные же ведутся при помощи чистой воды, при-
чем считают наиболее благоприятной температурой ее 25е—30® С., на
некоторых же заводах даже и выше (например, на Шлиссельбургском
— 344 —
температура ^доводится до 40—60° С). Полнота промывки испыты-
вается пробой Абеля на стойкость, при чем, если проба дала резуль-
тат отрицательный, то промывку продолжают далее; в таком случае
рекомендуется также применять пропускание несколько подогретого
воздуха.
Рис. 127. Чан для удаления промывных вод из нитроглицерина.
Рис. 128. Внутренний вид помещения для промывки нитро-
глицерина с аппаратами.
5) Фильтрование нитроглицерина имеет целью удаление случайно
попавших твердых частиц, а также пены. Обычно процесс этот сов-
мещают также с обезвоживанием нитроглицерина. Достигают этого при
помощи фильтрования сквозь слой смеси поваренной соли и хлори-
стого магния, ‘ заключенной между двумя фланелевыми прокладками.
На рис. 129 показан схематический разрез фильтровального ап-
парата.
Рис. 129. Схематический разрез фильтрованного чана для обезвоживания
нитроглицерина.
Как видно, он представляет деревянный чан выложенный внутри
свинцом, причем дно его покато в одну сторону. Через верхнюю крыш-
ку вставляют свинцовый цилиндр, сверху открытый, снизу же имею-
щий дно из проволочной сетки. Поверх последней между двумя фла-
нелевыми прокладками располагается слой смеси поваренной соли д
хлористым магнием. Чтобы воспрепятствовать верхней прокладке
всплывать на поверхность вливаемого нитроглицерина, она удержи-
вается на месте свинцовым решетчатым грузом.
Однократное фильтрование, несмотря даже на высокую степень
гигроскопичности хлористого магния, не вполне обезвоживает нитро-
глицерин. Если требуется получить совершенно безводный- продукт,
то нитроглицерин оставляют стоять в чане еще 24—48 часов в поме-
щении имеющем температуру 25—ЗО°С. При этом остальная вода испа-
ряется. '
Вполне готовый продукт разливается в большие эбОЙитовые кув-
шины с крышками, в которых и хранится. . ' •
6) Выделение нитроглицерина из отработанных кислот ti промывных
вод.
Кислотная смесь, по удалении ее из сепаратора, еще не совсем
свободна от нитроглицерина и потому в таком виде не может идти в
переработку с целью извлечения из нее снова азотной и серной ки-
слот; кроме того, в жидкости могут образоваться и низшие нитропро-
дукты глицерина (моно—и динитроглицерин), которые вследствие
своей малой стойкости могут разлагаться, поэтому ее предвари-
тельно подвергают очистке. Последнее совершается в больших баках,
(см. рис. 130) снабженных змеевиками для охлаждения содержимого и
трубками для вдувания сжатого воздуха на случай возрастания тем-
пературы от начавшегося саморазложения нитроглицерина.
Рис. 130. Схематический разрез аппарата для выделения
нитроглицерина из отработан, кислот и промывных вод.
Сквозь крышку сосуда проходят два термометра и труба, через
которую в прибор поступает кислотная смесь.
Последняя, поступив в прибор, остается в нем несколько часов,
по истечении которых нитроглицерин всплывает на поверхность при-
чем, если кислотная смесь заполняет весь прибор и частью даже
входит в среднюю стеклянную трубку, то отделившийся при этом
нитроглицерин может быть выпущен при помощи особого крана.
Отработанные кислоты, идущие на переработку, содержат в сред-
нем около 10 /0 азотной и 70% серной кислоты, остальные же 20%
составляет вода.
Нельзя сказать, чтобы промывные воды были безусловно свобод-
ны от нитроглицерина. Они его содержат всегда и потому, не столь-
ко с целью использовать его, сколько для того, чтобы случайно ско-
пившийся в каком-нибудь месте взрывчатый продукт не мог послу-
жить причиной несчастного случая, промывные воды подвергают про-
цессу очистки, систематически пропуская их или через систему свин-
цовых ящиков с кранами как то показано на рис. 131, либо через
специальные аппараты ящичной формы снабженные перегородками
и имеющими продольный и поперечный уклон дна (см. рис. 132).
Получившийся нитроглицерин должен быть особенно тщательно
промыт, так как в нем скопляются часто вредные низщие про-
дукты и потому зачастую такие остатки нитроглицерина попросту
сжигаются.
Теоретически 100 частей глицерина должны давать 247 частей
нитроглицерина, на практике же его не получают более 210 — 220 ча-
Рис. 131. Система свинцовых ящиков с кранами для очистки нитроглицерина
от промыва, вод.
I
стей. Происходит подобная потеря вследствие той причины, что при
нитрации, количество азотной кислоты все более и более уменьшается
и поступающие в нитратор новые порции глицерина уже значительно
. .____________________________________ &
Рис. 132. Ящичный аппарат
для очистки нитроглицерина от промывных вод.
менее полно подвергаются нитрации, все более и более растворяясь
в серной кислоте.
Кроме этого явления, на понижение выхода нитроглицерина
влияет возникновение второстепенных реакций: образование азотно-
глицеринового эфира С, Н5 (НО), (ONO,) и окисление глицерина в гли-
— 348 —
цериновую кислоту СО. ОН. СН2 (ОН)з. Максимальные выходы продукта
имеют место зимой при применении кислот наивысшей степени кон-
центрации.
Присутствие в азотной кислоте низших степеней окисления азота
также отражается вредно на качестве фабриката и на его количестве:
они действуют разлагающим образом на нитроглицерин и окисляют
глицерин, вместо того, чтобы его нитровать.
Применяя безводную серную кислоту, выход продукта можно по-
высить до 229 частей.
Как известно, нитроглицерин весьма чувствителен к трению,
а между тем только что описанный способ фабрикации его во многом
грешит в этом отношении, хотя бы необходимостью пропускать нитро-
глицерин через большое количество кранов.
Этот недостаток в значительной мере ослаблен на правительствен-
ной фабрике нитроглицерина в Weltham - Abbey в Англии.
Существенной особенностью фабрикации нитроглицерина на этом
заводе является производство нитрации и отделения готового нитро-
глицерина от кислот в одном и том же аппарате, нитраторе-сепараторе.
Этот прибор представлен схематически на рис. 134.
Рис. 133. Нитратор - сепаратор английск. завода Weltham-Abbey (схема).
Поступившая в аппарат кислотная смесь охлаждается змееви-
ком h, после чего производится впуск глицерина и нитрация его при
постоянном перемешивании жидкости сжатым воздухом, выходящего
из отверстий в донной воздуходувной трубке д. Цря наблюдения
за температурой служит термометр 8.
Когда нитрация закончена, то через трубку d впускают в аппа-
рат отработан ну кислотную смесь, которая поднимает уровень жид-
кости в аппарате до тех пор, пока поверхность всплывшего на верх
нитроглицерина*) не покажется в окошечке /. В это время он авто-
матически начнет'переливаться через трубку К в бак для предвари-
тельной промывки. Так будет продолжаться до тех пор, пока весь
нитроглицерин не будет вытеснен из нитратора-сепаратора. Таким
образом подобная температура совершенно исключает необходимость
иметь по пути движения нитроглицерина краны и представляет не-
сомненно важное преимущество в смысле безопасности.
Также точно и баки, как для предварительной промывки, так
и промывные — не имеют кранов, а снабжены гибкими резиновыми
рукавами с концами, заделанными в свинец. Преимущество подобных
приспособлений слишком очевидно, чтобы требовать специальных
пояснений.
Схема расположения нитратора-сепаратора и баков для про-
мывки представлена на рис. 133.
Формулируя в нескольких словах, преимущество аппаратуры
на фабрике Weltham-Abbey, можно сказать, что выгоды, представляе-
мые ею, те, что нитроглицерин не проходит здесь через краны
и находится более короткое время в соприкосновении с кислотной
смесью.
Хороший технический продукт должен содержать в себе мини-
мальное количество влажности, что узнается высушиванием навески
его в эксикаторе с хлористым кальцием (но отнюдь не над серной
кислотой, во избежание случайного взрыва).
Реакция в нем должна быть обязательно нейтральная.
Он должен содержать 18,35%—18,45% азота (теоретически
18,50*/°). Химическая стойкость зайодского продукта проверяется при
помощи пробы Абеля в навеске в 3 грм. нагреванием ее до 65° С.,
при чем окрашивание подокрахмальной бумажки не должно насту-
пать ранее 15 минут.
Либерт предложил несколько иной способ фабрикации нитро-
глицерина, отличающийся большей безопасностью: во время нитрации
глицерина он прибавляет в кислотную смесь смесь солей сернокис-
лого аммония и аммиачной селитры.
Большое значение для безопасности производства имеет
рациональное устройство фабричных зданий. В нижеследующих
рисунках показаны фабричные здания постройки инженера Эккелт
в Берлине, отличающиеся своей простотой и удобным располо-
жением аппаратов. Каждый отдельный процесс производства
происходит в особом здании.
4 Медленное выделение нитроглицерина, задерживающее весь ход фабри-
кацни его, в последнее время пытались устранить прибавлением различных при*
иесей. Особенно действительными в этом отношении оказались флуориды (иапр.
0,002% флуорида натрия). Предложены %также силикаты и жидкие углеводороды
(напр. 0,5—2 /о парафина). Последней примеси, однако, приписывают возникновение
нескольких катастроф.
Рис. 134. Нитратор-сепаратор английского завода Weltham-
Abbey. Вертикальный и горизонтальный разрез.
— 351 —
Рис. 136, 137, 138 показывают здание для нитрации тли*
церина. А —нитрационный аппарат из толстого свинца, заклю-
ченный в деревянный сосуд; В—резервуар для глицерина с
указателем высоты стояния жидкости и шкалой; D — сосуд с
жидкой углекислотой для охлаждения нитрующейся смесив
случае опасности; С — собирательный чан для нитроглице-
рина; Е— предохранительный бак с водой.
Свинцовый Чан для К предварител.
стержень, предварит. чану с водой,
промывки.
Рис. 135. Схема заводской установки нитраторов-сепараторов.
На нижеследующих рисунках 139, 140, 141 показано поме-
щение для сепараторов. А— сепараторы; В — чаны для предва-
рительной промывки; С — предохранительный бак с водой. '
И, наконец, рис. 142, 143 дают, представление о помещении
для окончательной промывки и фильтрации нитроглицерина,
где А — промывные чаны из толстого свинца, в которых нитро-
глицерин промывается водой и сжатым воздухом. В—предо-
хранительный бак с водой, который одновременно служит от-
стойником для увлеченных промывным’и водами частиц нитро-
— 352 —
Рис. 136. Здание для нитрации глицерина (Продольный разрез).
Рис. 137. To-же. Поперечный разрез.
353 r-
Рис. 138. То-же. План.
Рис. 139. Помещение для сепараторов. (Продольный разрез).
*
Рис. 140. То’Же. План.
Преф, М. Сухаревский. Взрывчатые вещества и взрывные работы.
23
4
Ж
В j
— 354 —
мм
I
;! &
-,з
глицерина (промывные воды пропускаются через предохрани-
тельный бак Б); С —резервуар для воды; Б—фильтр для про-
мытого и нейтрализованного содой нитроглицерина.
Рис. 141. Тоже. (Поперечный разрез).
П" "И -ГТ
Fj ’ТГ— И Н "П
1
г
<3
- <
i < с
4 3
t £
! ? i
J
Рис. 142. Помещение для окончательной промывки нитро-
глицерина. (Продольный разрез).
Рис. 143. Тоже. План.
Использование отработанны^ кислот при фабрикации нитроглицерина.
Отработанные кислоты, кроме серной кислоты, содержат
также значительное количество неиспользованной азотной кис-
лоты, почему представляют из себя очень ценный отброс,
которой может быть утилизирован несколькими способами.
На тех заводах, изготовляющих взрывчатые вещества, на
которых имеются соответствующие оборудования для пригото-
вления азотной кислоты, таковая получается, применяя, вместо
серной кислоты, отработанную сульфо-азотную смесь, причем
заключающаяся в ней азотная кислота, присоединяясь к выде-
ляющейся из чилийской селитры, соответственно увеличит вы-
ход продукта. Второй способ Hilaire’a и Chardonnet основан на
нагревании смеси до 170°, причем перегоняется почти чистая
азотная кислота; остающаяся серная кислота, все еще содер-
жащая азотную, вторично нагревается до 200—210°, причем
перегоняется остальная азотная кислота, но уже более слабая.
Применение специальных аппаратов—денитрификаторов, высо-
ких цилиндров наполненных пемзой, в которые вдувается смесь
воздуха и водяного пара, позволяет также по >у ^ать азотную
кислоту удельного веса 1,33 и серную удельного веса 1,64.
Существуют и изменения этого способа.
Способ денитрирования, опатентованный Evers’oM, дает воз-
можность получать азотную кислоту крепостью 38—40° Вё, а
серную кислоту не менее 60* Вё и чрезвычайно экономичен. На
рис, 144 дана схема установки Эверса.
Отработанные кислоты разлагаются в башне, наполненной
пемзой и нагреваемой снизу паром. При этом просачивающаяся
сверху, по принципу противотоков, смесь кислот приходит в
тесное соприкосновение с паром. Жидкая серная кислота выте-
кает снизу из башни, в то время как газообразная азотная
кислота уходит через верх башни в конденсационную баттарею
где и конденсируется.
Рис. 144. Схема аппаратуры Эверса для регенерации отработанных кислот-
а — башця-денитрификатор, заполненная пемзой; b — охладительная батта-
рея; с — конденсаторы JJ' — инжектора для воды и пара; dрезервуар для
отработанных кислот.
Аппарат почти не требует присмотра так как инжектора
башни работают автоматически, а циркуляция кислот регули-
руется автоматическим давлением, благодаря чему стекающие
жидкие кислоты автоматически-же поднимаются снова на верх
башни, что происходит до тех пор, пока не получится кислота
достаточной крепости.
Ниже мы даем отдельный рисунок такого автоматического
кислотного элеватора, сконструированного Керстнером. (Рис. 145).
Вследствие своей тяжести кислоты из резервуара А переходят
в элеватор В. Как только В наполнится, кислоты поднимут
поплавок Y, который посредством стержня С закроет клапан
для выпуска воздуха и одновременно откроет другой клапан
и впустит в В сжатый воздух. Последний закроет клапан М т.-е
прекратит впуск кислот, а находящуюся в элеваторе кислоту
поднимет по трубе Т на верх башни. Но вместе с кислотами
уходит и часть сжатого воздуха, давление падает и клапаны
принимают исходное положение.
Применение олеума дает возможность применять отработан-
ную кислотную смесь для нитрации новой порции глицерина,
-.4
— 357 —
> ч
добавляя вычисленное количество свежих азотной кислоты и" олеу-
ма. Операция эта у французов носит название rejeunissement*).
Как ведется вычисление—яснее всего видно из частного примера.
Рис. 145. Автоматический кислотный элеватор Керстнера.
1
J
!
Допустим, что для нитрования 100 килограмм глицерина (по
способу Nathana) надо приготовить 515 килограмм сульфо-азот-
ной смеси, утилизируя с этой целью часть отработанных кислот,
состав которых ^звестен. >
*) В переводе на русский язык это значит „омолаживание*.
— 358 —
Для приготовления 515 килограмм сульфо-азотной смеси
из кислот нормальной концентрации необходимо взять:
274 килограмма серной кислоты (53%)
241 „ азотной „ (47%)
Назовем через ЛГ общий вес потребной сульфо-азстной
смеси, т.-е. в данном случае = 515 килогр.; через а—процентное
содержание в готовой смеси азотной кислоты нормальной кре-
пости (т.:е. 48о Вё, содержащей 93% моногидрата), т.-е. в дан-
ном случае а = 47%; через Ъ — процентное содержание в гото-
вой смеси серной кислоты нормальной крепости (т.-е. 66° Вё),
а, следовательно, в данном случае b = 53%.
Заключающийся в олеуме серный ангидрид может, отнявши
от отработанных кислот появившуюся в них от реакции нитро-
вания воду, образовать моногидрат серной кислоты, который и
повысит ея крепость. Так, например, j 00 частиц воды, содержа-
щей 70%30з, могут, связавши 15 частиц воды, образовать таким
образом 115 частиц H2SO4 воды, или дать, так сказать, 115%
серной кислоты.
Назовем через а количеетво в процентах моногидрата, за-
ключающегося в азотной кислоте нормальной крепости (т.-е.
48° Вё), а, следовательно, в данном случае а = 93%, а через
общее количество его в олеуме, т.-е. в данном случае £=115%.
Наконец пусть а' и Ь' выражают процентное содержание в
отработанной сульфо-азотной смеси соответственно азотной и
серной кислот. При нитрации глицерина по способу Nathan’a,
отработанные кислоты, как известно, содержат:
75,5% серной кислоты
9% азотной
14,5% воды.
В таком случае, следовательно, для величин а' и Ь' будем
иметь: а'=9%; Ъ’=75,5%.
Если через х, у и z назовем соответственно искомые веса
отработанной сульфо-азотной смеси, олеума и азотной кислоты,
то мы можем составить следующие уравнения:
M = x + y+z;
aM = a'x-|-az;
bM = b'x+Py.
Из этих уравнений мы получим:
.__а __ Ь_
a
ЬМ — Ь'х:
аМ — а'х
z =-----------
а
Подставляя в них соответствующие
. получим:
численные величины,
_47_ 53
93 П5
х = 515---g---= 72,5 клгрм.
93 115
= 189,75 клгрм.
93
= 253,2 клгрм.
Итак надо будет, для составления 515 килограмм сульфо-
азотной смеси, употребить:
72,5 клгрм. отработанных кислот
189,5 „ олеума
253,2 „ азотной кислоты.
При процессе Nathan’a получают из 515 килограмм сульфо-
азотной смеси, употребленных Иа нитрацию, около 359 кило-
грамм отработанных кислот, а значит из них для новой нитрации
можно использовать приблизительно пятую часть их.
§ 2. Свойства нитро- а) Нитроглицерин представляет собой безцвет-
глицерина. ную, или слегка желтоватую жидкость, маслообраз-
ной консистенции, почти лишенную запаха и обладающую сладким
вкусом. Удельный вес ее 1,6.
При температуре около+ 8°С. нитроглицерин превращается в
белую, кристаллическую массу, или, как говорят, замерзает. Подобная
затвердевшая масса нитроглицерина снова превращается в жидкость
при температуре + 11°С и при том очень медленно. Температура при
которой замерзает нитроглицерин находится в большой зависимости
от его чистоты: чем чище продукт, тем точка замерзания его ниже;
так например, химически чистый, безводный нитроглицерин затвер-
девает только при температуре — 18°С. При замерзании об’ем нитро-
глицерина уменьшается. При обыкновенной температуре нитроглицерин
мало летуч, но при температуре + 40°С., испарение его становятся уже
заметным, причем ощущается его своеобразный запах. .
При температуре 4- 60°С. он начинает проявлять следы своего
разложения, а при 105°С. уже заметно выделение из него бурых
окислов азота.
При быстром нагревании технического нитроглицерина до 180°С.
он взрывает. Совершенно чистый нитроглицерин обладает значитель-
но более высокой температурой взрыва, а именно 217°С.
Будучи зажжен, в сравнительно небольшом количестве, на воз-
духе, нитроглицерин сгорает голубоватым пламенем с небольшим
треском и вспышками, без дыма, распространяя запах окислов азота.
При горении значительных количеств нитроглицерина, таковое может
легко завершиться взрывом, если только температура его возвысится
до 18О°С. раньше, чем он успеет сгореть. Быстрое превращение в пар
капли воды, случайно попавшей в горящий нитроглицерин, зачастую
оказывается досхаточным, чтобы вызвать взрыв всей горящей мас-
сы его.
Раскаленное железо вызывает взрыв нитроглицерина в том слу-
чае, когда он предварительно подогрет.
Действие электричества—подобно теплоте: наступает местное раз-
ложение, вызывающее нагревание и дело может даже окончиться
взрывом. Удар молнии всегда взрывает нитроглицерин.
б) Нитроглицерин очень чувствителен ко всем вообще механи-
ческим влияниям. Тонкий слой нитроглицерина, налитый на желез-
ную наковальню, взрывается при падении груза весом в 2 килогр. с
высоты 4 с. м. В подобном случае, однако, взрыв по большей части
местный и ограничивается только частью, подвергшейся удару и не
распространяется на соседние части. Особенно чувствителен к ударам,
предварительно подогретый нитроглицерин. <
Трение между двумя твердыми предметами, легко вызывает взрыв
нитроглицерина.
Для взрывания нитроглицерина достаточно капсюля с 0,25 грм.
гремучей ртути, замерзший же значительно менее чувствителен к кап-
сюлю: в этом случае для взрыва нитроглицерина требуется капсюль
по меньшей мере с 2-я граммами гремучей ртути.
Вообще нитроглицерин в замерзшем виде менее чувствителен к
ударам, чем в жидком, но подобный затвердевший нитроглицерин совер-
шенно не выносит раскалыванья, скобления, сверления, стругания, разламы-
вания и проч., почему при обращении с замерзшим нитроглицерином необ-
ходимо соблюдать величайшую осторожность.
К трению замерзший нитроглицерин столь же восприимчив, как
как и в жидком виде.
Введение в нитроглицерин некоторых специальных веществ может
сильно понизить температуру его замерзания. Это обстоятельство очень
важно в смысле безопасности обращения с нитроглицериновыми препа-
ратами при низких температурах. Такими веществами могут быть
следующие: нитробензол, динитрогликоль, динитротолуол, а также ди-
нитроглицерин и другие. Нитробензол едва-ли не первый в хроноло-
гическом порядке среди веществ, понижающих точку замерзания
нитроглицерина, но в настоящее время с этой целью он употребляет-
ся редко. Динитроглицерин дорог и гигроскопичен, отчего его приме-
нение также очень ограниченное. С большим успехом пытались при-
менять динитродихлоргидрин диссиметрический, а также мононитро-
дихлоргидрин (см. выше).
Нитруя смесь глицерина с его полимерами, получается тринитро-
глицерин в смеси с динитроглицерином и тетранитроглицерином,
также обладающие более низкой точкой замерзания, нежели сам
нитроглицерин.
Кроме этих веществ, испытывался целый ряд других препаратов,
как, например, динитроацетин, динитроформин и другие, но пока тех-
— 361 —
ника ни на одном из этих препаратов еще окончательно не оста-
новилась.
Будучи подвернут продолжительному действию солнечных лу-
чей, нитроглицерин становится более чувствительным к сотрясениям.
Нитроглицерин не гигроскопичен; в воде растворим очень мало:
одна часть нитроглицерина для своего растворения требует 800 час-
тей воды. Он растворим в целом ряде жидкостей, как'например: в
эфире, бензине, нитробензоле, толуоле, феноле, ацетоне, прованском
масле, древесном спирте и проч. В этиловом (винном) ,спирте на хо-
лоду нитроглицерин значительно менее растворим, нежели в древес-
ном спирте, при нагревании же этилового спирта до 50°С., раствори-
мость в нем нитроглицерина заметно повышается.
в) Крепкие минеральные кислоты, как серная и азотная, также
растворяют нитроглицерин, при чем растворение его в азотной кислоте
идет медленно.
Сам нитроглицерин служит растворителем для многих смол, кам-
форы и т. и., но нэ действует совершенно на каучук. z '
Коллодионный хлопок, растворяясь в нитроглицерине, желати-
нирует его.
Неотмытые кислоты вызывают саморазложение нитроглицерина,
при чем он делается значительно более чувствительным к механичес-
ким влияниям и весьма опасным в обращении. Нитроглицеринв ко-
тором уже начался процесс разложения, принимает зеленоватый от-
тенок. Подобный продукт во избежание несчастного случая, тотчас
же необходимо уничтожить, Самой вредной и опасной примесью к
нитроглицерину являются дурно отмытые кислоты, а потому основным
условием, которому должен удовлетворять нитроглицерин, является
нейтральная реакция. Нитроглицерин в малых дозах имеет примене-
ние в медицине при лечении преимущественно сердечных болезней,
в более же значительных же количествах он для организма t ядовит.
Смертельная доза его при приеме во внутрь около 10 -граммов, про-
тивоядием же ему служат: хлороформ, антипирин, кофе и сщв неко-
торые другие вещества. Токсические свойства нитроглицерина про-
являются не только при приеме его во внутрь, но и в том случае
если он приходит в соприкосновение с кожей, или же если даже ню-
хать препараты его содержащие. Болезненные явления в таких слу-
чаях проявляются головной болью, пульсацией артерий в ^висках и
тошнотой. В виду подобных обстоятельств, рабочим динамитных фабрик,
коим приходится перемешивать в ручную нитроглицерин: с поглоти-
телем, вменяется в обязанность производить эту операцию в Каучу-
ковых перчатках.
Организм человека, однако, очень скоро привыкает, к нитрогли- .
церину и он перестает в скором времени вызывать вышеописанные
болезненные явления, так что постоянные рабочие динамцтных фаб-
рик от надевания каучуковых перчаток, почти все отказываются.
г) Как уже было замечено раньше, реакция взрывчатого разло-
жения нитроглицерина следует уравнению:
2C3Hfi(NO2)3 = 6СО2 + 5Н2О + 3Ns + О
при чем получается:
58% углекислого газа,
20% паров воды,
18,5% азота и
3,5% свободного кислорода.
Как видно отсюда—окись углерода среди продуктов взрыва ни-
троглицерина, отсутствует совершенно и потому газы не ядовиты.
Из этого же уравнения явствует, что нитроглицерин содержит
кислорода более, нежели того требуется для полного сгорания—часть
сжигающего остается неиспользованной.
Теоретические константы, характеризующие взрывчатые свойства
нитроглицерина суть следующие:
f=9200 килогр.
ve = 712,8 литров,
t° = 3145°
|’= 620™““°
метр.
а = 0,71 литр.
Во взрывчатых препаратах вроде динамитов, иногда случаются
неполные взрывы. При таких обстоятельствах среди газообразных про-
дуктов взрыва может также появляться окись углерода и даже не-
сколько окислов азота и метан. Избыток кислорода в нитроглицерине
делает выгодным смешивание его со сгорающими, особенно с нитро-
целлюлозами, чем на практике и широко пользуется преимущественно
в желатинйрованвых динамитах.
д) Первоначально до изобретения динамитов делались много-
численные попытки к практическому применению чистого нитрогли-
церина, как взрывчатого вещества. И в этом отношении наиболее
приемлемыми оказывались предложения Нобеля. Для взрывания ни-
троглицерина в качестве детонатора он употреблял черный порох.
Суть его предложений видна из нижеследующих рисунков*).
Здесь можно упомянуть про так называемое гре-
гремучее масло. Мучее масло, предложенное Леманом для замены ни-
троглицерина. Нексторые недостатки, присущие нитроглицерину в
нем несколько, ослаблены. Оно представляет с химической точки зрения,,
ни что иное, как азотный эфир глицерина.
Это есть желтовато-бурая маслообразная жидкость, несколько ра-
створимая в холодной и, довольно легко в теплой воде, а также в
обычных растворителях нитроглицерина. Оно имеет удельный вес 1,52
*) В Соединенных Штатах нитроглицерин, по сообщению Munroe и Kibler, пе-
ревозится в незамерзшем состоянии свободно в больших количествах и употребля-
ется для добывания нефти взрывным способом.
Для большей безопасности при перевозках нитроглицерин иногда смешивается .
с ацетоном. Для последующего отделения нитроглиц* рина от этой примеси, его раз-
лагают водой, затем отделяют ее, делают несколько промывок водой и наконец
фильтрует его сквозь азбест.
*
V t
) *
I •
¥
л
Рис. 146. аа—шпур, в ко-
торый до погружения в
нитроглицерин вводился
деревянный воспламени-
тель с пороховой каме-
рой F и пробкой „п“. По-
рох зажигался восплам.
шнуром, выходящим на-
ружу.
сс — поверхность нитро-
глицерина, 1—забивка.
— 363 —
Рис. 147. Налитый
в шпур нитрогли-
церин закрыт проб-
кой. над которой
находится забив-
ка; через послед-
ние проходит зажи-
гательный шнур с
подвешенным па-
тентованным вос-
пламенителем.
--MW > Ж JlflW .1 и*ИУ
&
^\\\
Рис. 148. В шпурвведеи
патрон с нитроглицери-
ном, закрытый пробкой,
и второй патрон с поро-
хом, который воспламе-
няется зажигательным
шнуром, выпущенным
наружу.
— 364 —
> з
•W
Рис. 149. В шпур введен
патрон с нитроглицери-
ном, закрытый пробкой,
куда вставлен воспламе-
нитель. Последний имеет
камеру F с порохом, за-
жигаемого огнепровод-
ным шнуром, выпущен-
ным наружу,
нитрации
Рис. 150. Патрон с нитро-
глицерином имеет в кон-
це особую камеру с по-
рохом. Камера отделена
от нитроглицерина дном
и слоем мела. Огнепро-
вод проходит через весь
патрон
в пороховую ка-
меру.
Рис. 151. Взрывание
нитроглицерина под
водой.
Последний наливает-
ся через трубку «о
и воронку <d>.
кислоты или ее соли
глицериндисерной
одной азотной кислотой. Продукт ни-
и получается путем
сульфоазотной смесью или же
трации выделяется путем нейтрализации кислоты известью, либо из-
влекается эфиром.
Гремучее масло легко желатинируется коллодионным хлопком, в
особенности при нагревании, и замерзает только лишь при—24° С.
Оно в общем обладает теми же свойствами, как и нитрогли-
церин, при чем, как уже сказано, некоторые недостатки присущие
последнему, в нем значительно ослаблены.
В. Динамит.
§ 1. Смеси нитроглицерина с порошковатыми веществами, имеющими свой-
ства ею впитывать и прочно удерживать, вообще называют динамитами.
Однако, эго определение- не обобщает всех динамитов: существуют
вещества, которые, растворяясь в нитроглицерине, превращают его
в студенистую массу, которая прочно удерживает нитроглицерин от
эксудирования. Это также суть динамиты, но в отличие от первых
их зовут желатинированными динамитами.
По своему наружному виду динамиты, следовательно, студени-
стые или тестообразные, пластичные (иногда даже несколько сухо-
ватые) вещества, прочно удерживающие в себе нитроглицерин и, зна-
чительно более безопасные в обращении, чем чистый нитроглицерин.
Существует множество динамитов, при чем состав их отличается
крайним разнообразием, почему сколько-нибудь точная классификация
их чрезвычайно затруднительна.
В качестве поглотителя может быть. какое-либо инертное тело,
непринимающее участие в реакции взрыва, например, естественный
или искусственный кремнезем, углекислая магнезия, мел, квасцы и т. д.;
могут также быть и вещества горючие, принимающие участие в
реакции взрыва и даже взрывчатые составы. Первая категория дина-
митов с инертными поглотителями носит название динамитов с не-
деятельным основанием, вторая же категория называется динамитами с
деятельным основанием.
Хотя динамиты с недеятельным основанием и употребляются до
настоящего времени, но они постепенно выводятся из употребления,
вытесняясь динамитами с деятельным основанием.
Желатинированные динамиты в сущности принадлежат к послед-
ней категории динамитов, но чаще их выделяют в особую категорию
желатинированных динамитов.
Горная промышленность, являющаяся в мирное время одним из
наиболее крупных потребителей взрывчатых веществ прёд'являет к
ним также и специальные требования, а именно чтобы применяемые
в рудниках взрывчатые вещества не могли вызвать взрыВа рудничь-
ного газа и угольной пыли, т.-е. были бы в этом отношении безопас?
ными. Таким образом, явилась новая группа взрывчатых веществ,
среди которых много также и динамитов. Подобного рода динамиты
носят название антифризу тных, ^предохранительных^ или „безопасных,.
Таким образом, практически все динамитымогу тбыть разделены так:
/
к . (
[1. Гурдинамиты.......................
U и I
§ аз । 2. Динамиты с деятельным основанием,
Й § I но без коллодионного хлопка . . . .
О
«3
*
3. Взрывчатые желатины, состоящие из
90—93°/0 нитроглицерина и 10 — 7%
коллодионного хлопка...............
4. Студенистые динамиты, состоящие из
45 - 65% студенистого нитроглицери-
на (97% нитроглицерина с 3% кол-
лодионного хлопка) и 55—35% по-
рошкообразного основания...........
С недеятельным
основанием.
С деятельным
основанием.
Промышленность, деля динамиты на „обыкновенные" и „безо-
пасные" (со значительным % NH4 NO3 и др. вещ.), делит последние
на Гризутины, гризутиты, карбониты, желатины.
Здесь мы рассмотрим приготовление динамитов, описание же их
многочисленных сортов отнесем к концу настоящей части.
При* приготовлении динамитов следует различать приготовление
нежелатинированных и желатинированных динамитов.
а) Приготовление нежелатинированных динамитов.
В качестве примера рассмотрим вкратце приготовление гурди-
намита. Как уже было указано, основанием кизель гур—динамита слу-
жит особая кремнистая земля кизельгур, (рис. 152, 153). В сухом со-
Рис. 152. Строение кизельгура под микроскопом.
стоянии кизельгур представляет собой легко рассыпающуюся в по-
рошок массу, имеющую цвет от белого до серого и зеленого; он со-
стоит из остатков мелких раковин или окаменелых водорослей, вслед-
ствие чего заключает в себе множество прочных клеточек; эти кле-
точки образуют своего рода резервуары лля нитроглицерина, который
они удерживают в себе действием волосности и тем предохраняют
его от внешних влияний. Кизельгур состоит, главным образом, из
кремневой кислоты; затем в нем содержится некоторое количество
магнезии, окиси железа, глинозема и воды органических веществ. Для
удаления двух последних составных частей кизельгур прокаливают, что
делается или на открытом огне или лучше в особых муффельных
печах, располагаемых в 2—4 этажа; в них обжигаемая масса после-
довательно перемещается из верхнего этажа в нижний. Прокаленный
кизельгур*) охлаждается в железных сосудах, затем подвергается
измельчанию между вальцами, наконец просеивается. Перед смеши-
ванием к порошку прибавляется сода и для окрашивания охра,
умбра и т. п.
Рис. 153. Тоже.
Смешивание поглотителя с нитроглицерином производится в
деревянных, выложенных свинцом ящиках, с помощью деревянных
лопаток или просто руками. Для достижения большей однор >дности,
смесь ’Дважды протирается сквозь сита. Для облегчения заряжания
буровых скважин, готовый динамит обычно npeccyeicfl в цилиндри-
ческие патроны, диаметр которых колеблется от 19 до 26 mm. Патро-
ны заворачиваются в пергаментную или пропараффиненную бумагу.
Для патронирования динамита существуют два рода прессов: такие,
которые впрессовывают сразу целый патрон в пергаментную оболочку
и такие, которые выпрессовывают длинную колбасу соответствующего
диаметра, которая время от времени отрезается и заворачивается
в бумагу. Пресс первого рода показан на рис. 154. Пергаментная бу-
мага обертывается вокруг трубки „В“ и удерживается одной рукой
рабочего; другой рукой рабочий, действуя прибойником С, .^вгоняет
массу в трубку и потом выталкивает, ее наружу, в пергаментную
•) В прокаленном кизельгуре находится: 96,3% SiO«; 1,84% CaO; 1,5% AI3OJ
и О,5°/0 F2O3.
оболочку. Пресс второго рода действует при помощи рычага i (рис.
155, 156, 157), укрепленного на шарнире В сетку т накладыва-
ется динамит; из трубки „Iй- динамит выходит в виде длинной кол-
басы, каждые 10 см. которой обламываются рабочим и тут же двумя
другими рабочими заворачиваются в пергаментную бумагу.
Рис. 154. Пресс для выделки динамитных патронов. (Вертикальный и гори-
зонтальный схемат. разрезы).
4
б) Приготовление желатинированных динамитов.
Для приготовления взрывчатого желатина в метательную мастер-
скую доставляются уже развешанные материалы, т. е. нитроглицерин
и коллодионный хлопок, предварительно просушенный на особых
лотцах при температуре в 35—50°С. Оба исходных продукта смеши-
ваются просто руками в деревянных, двустенных ящиках, выложен-
ных внутри медью.- Между стенками яшика пропускается теплая вода,
при температуре не выше 50°С. Перемешивание продолжается минут
10, после чего смеси дают отстояться около 2 часов. _____t
Для приготовления антигризутвых составов из желатинирован-
ного нитроглицерина, когда требуется особо тщательное перемеши-
вание для придания однородности массе, применяются механические
метательные приборы. При этом предварительно смешанные матери-
алы, в количестве около 6 пуд. помещаются в особые двустенные
ящики (шириной 2 фута, длиной 3 ф>та). внутри которых располо-
жены две оси q с лопастями г, движущимися в разные стороны
(рис. 158,159, 160). В междустенном пространстве у циркулирует теплая
вода, поддерживаюшая температуру в 40-45°С. Оси приводятся в
движение электрическим приводом, действующим на вал т (рис. 160).
Рукоятка h служит для поднятия чана i, пока лопасти не погру-
зятся в него на достаточную глубину. На рис. 159, наглядно пока-
зано расположение лопастей и их взаимодействие. Так как механи-
ческое перемешивание представляет опасность, то работа произво-
дится автоматически, в отсутствии рабочих.
' Механическое перемешивание может быть применено и при
изготовлении нежелатинированных, порошкообразных динамитов. В
этом случае предварительного смешивания материалов с нитрогли-
церином не делается/ а последний приливается постепенно авто-
матически, для чего. сосуд с нитроглицерином устанавливается на
крышке метательного прибора. При приготовлении патронов из
желатинированной массы употребляются приборы в роде тех, кото-
Рис. 155. Ручной пресс с сеткой
для прессования динамитных патро-
нов (по Guttmann'y).
Рис. 156. Тоже без сетки.
рыми пользуются на колбасных, фабриках. (Рис. 163). В воронку Ъ
закладывают около 12 фунтов динамитной массы, а к передней части
прикрепляют одну или несколько медных трубок d, сделанных по
размеру патронов. При повороте рукоятки I, лопастями безконечяого
винта, масса выгоняется через трубки наружу и здесь охватывается
пергаментной бумагой, подставляемой рабочими, которые сейчас-же
делают обертку патронов. В употреблении находятся также подобные-
же приспособления только конического строения. (Рис. 164). При-
Проф. AJ. Сухаревский. Взрывчатые вещества и взрывные работы.
24
Рис. 157. Патронирование динамита.
Рис. 158. Мшательный прибор
для приготовления предохра-
нительных динамитов.
Рис. 151*. Тоже. Вид сверху, по-
казывающий расположение ло-
пастей и их взаимодейстзи'3.
— 371 —
\
боры по одному или по два располагаются в отдельных помещениях,
окруженных валами. Температура этих помещений не должна быть
ниже + 12®С. В Соединенных Штатах в настоящее время перемеши-
Ряс. 160. Тоже. Общий вид всего прибора.
ванне отдельных составных частей -производится йод деревянными
бегунами. Диаметр лежня равняется 3 mt, диаметр бегунов—2% mt;
катящиеся плоскости бегунов отделаны твердой резиной (Hartgummi).
Рис. 161. Общий вид метательного прибора, служащего ДЛ^ приготовления наиболее
чувствительных сортов динамита. Особенность его заключается в том, что приводное
колесо значительно удалено от мешателя, а оси лопастей мешателя могут двигаться
r вертикальном направлении, что способствует уменьшению трения между смесью
и осями мешателя.
372 -
Рис. 162. Тоже. Собственно мешатель.
Американские аппараты для патронирования также разнятся от
европейских. Они делаются из дерева; приводятся в действие пневма-
тически; требуют двух человек прислуги, состоят из вращающегося
Рис. 163. Аппарат для выделки патронов из желатинированного динамита.»
стержня с 4 крыльями, каждый вместимостью в 24 патрона. На кры-
ло в горизонтальном положении накладываются пустые оболочки пат-
ронов; затем крыло поворачивается на */< оборота и динамит впрес-
совывается в оболочки через продольную воронку. При дальнейшем
Рис. 164. Тоже. Конической формы.
повороте на */, круга набитые и закрытые патроны снова приходят
в вертикальное положение; их снимают и упаковывают в ящики. По-
добным аппаратом можно изготовить в одно и тоже время несрав-
ненно большее количество динамитных патронов, чем употребляющи-
мися в Европе машинами.
г § з. Общие свойства Свойства динамитов желатинированных не-
динамитов. сколько отличаются от свойств нежелатинирован-
ных, а посему обе эти группы должны быть рассмотрены особо,
сейчас же мы коснемся в общих чертах свойств динамитов нежела-
тинированных.
а) Свойства динамитов нежелатинированных. 1) По наружному
своему виду динамиты представляют, большей частью, пластичную,
тестообразную, или вообще более или менее мягкую массу, в боль-
шинстве случаев несколько жирную на ощупь.
Цвет динамитов различен. Неподкрашенный искусственно, он
обыкновенно принимает цвет, заключающегося в нем поглотителя, а
следовательно, в большинстве случаев динамиты окрашены в разные
оттенки, серого, красновато-бурого, грязно-зеленого и черного цветов.
Замерзшие динамиты делаются значительно светлее, принимая, по
большей части, грязновато-серы# тона и, в таком случае, наружные
различия между сортами, теряются еще больше. По этой причине
динамиты нередко окрашиваются искусственно различными индифе-
рентными пигментами в разные цвета.
Удельный вес динамитов также различен, чаще он заключается
в пределах между 1,4 и 1,7.
2) В отношении удара и трения динамиты менее чувствительны,
чем чистый нитроглицерин. При других одинаковых условиях дина-
миты с большим содержанием нитроглицерина чувствительнее к
удару динамитов, более бедных нитроглицерином. Чувствительность
к ударам находится также в зависимости от природы поглотителя и
твердости тех тел, между которыми происходит удар.
На чувствительность динамитов к удару и- трению оказывает
также существенное влияние та температура, до которой нагрет дина-
мит; с повышением температуры повыпщется также и чувствитель-
ность динамита к удару и трению.
Если динамит находится тонким слоем на камне, то при ударе
молотком он часто взрывается, если же его расположить на железной
или стальной плите, то при ударе молотком по тонкому слою его
взрыв происходит всегда.
Талый и замерзший динамит реагируют на удар несколько раз-
лично: замерзший менее чувствителен к удару, чем мягкий; полу-
замерзший же более чувствителен к удару, чем талый или замерзший.
Здесь следует указать на то обстоятельство, что динамит чув- .
ствителен к толчкам и ударам (тем, которые обыкновенно встречаются
на практике), только в том случае, если он разложен тонким слоем;
в массе же его чувствительность значительно меньше. Так, напри-
мер, боченок с динамитом, брошенный даже с большой высоты, не
взрывается. Однако, особенно сильные удары не переносят динамиты
даже и в массе; так, например, он совершенно не пригоден для сна-
ряжения артиллерийских снарядов, коим сообщаются большие на-
чальные скорости.
Большинство динамитов при сжатии их между листами бумаги
несколько выделяют нитроглицерин, оставляющий на бумаге жирные
пятна.,
Подобная пропитанная нитроглицерином бумага под ударом
молотка взрывается. Это обстоятельство необходимо твердо помнить
во избежание несчастных случаев.
Динамитные патроны, положенные на головку рельса при про-
ходе паровоза, под ним взрываются.
Большинство динамитов под ударом ружейной пули, попавшей
в них даже с далеких дистанций, дает взрыв, поэтому в некоторые
сорта динамитов, применяющихся в военном деле, вводят так назы-
ваемые </)леглштмзаторы, с целью ослабить восприимчивость дина-
митов к попаданию ружейной пули. Так называемые „военные дина-
миты" суть гремучие студни, флегматизированные камфорой; они
уже к попаданию в них ружейной пули относятся пассивно.
3) Взрывание динамитов. Все динамиты детонируют от капсюля,
с гремучей ртутью или иного, эквивалентного последним капсюля,
причем, чем динамиты более богаты нитроглицерином, тем меньшей
величины капсюль требуется для их взрывания.
Так, например: *
Динамиты с 45—50’о нитроглицерина требуют капсюля с 1 грм. гремучей ртути.
» Ч О Я Я * » „ У) „
п » 70 75 о „ » п п 0,25 „ п „
Данные эти относятся к динамитам с недеятельным основанием,
что же касается динамитов с деятельным основанием, то они значи-
тельно более чувствительны к капсюлю; так, например, известны
динамиты с деятельным основанием, содержащие 45*/0 нитроглицерина,
столь же чувствительные к капсюлю, как и динамит № 1,
Практически—при взрыве гурдинамита № 1 берут обыкновенно
капсюль с 1—1,5 грм. гремучей ртути (№№ 6 и 7), а для гурдина-
митов № 2 и № 3, капсюля № 8 (с 2 грм. гремучей ртути).
Гремучая ртуть однако не есть единственный детонатор для
динамита; последний детонирует от целого ряда взрывчатых веществ;
что же касается черного пороха, то он взрывает динамит только в
случае очень прочной забивки, хотя в подобном случае динамиты не
развивают полной своей силы; в случае же недостаточной забивки,
взрывом пороха, динамит только разбрасывается.
Замерзшие динамиты значительно менее чувствительны к кап-
сюлям, так что даже капсюля № 8 (с 2 грм. гремучей ртути), не
всегда дают полные взрывы. При взрыве замерзших динамитов в
продуктах взрыва появляются ядовитые газы, которых не имеется в
случае взрыва талого динамита.
Вообще избегают взрывать динамит в замерзшем виде и, если
это требуется,, то необходимо брать запальные патроны из талого
динамита.
4) Под влиянием воды большинство динамитов выделяют нитро-
глицерин; отсыревшие динамиты не теряют способности взрываться
при известном содержании влажности; так, например, при содержании
влажности -40°^ еще возможен взрыв.
Лучше других сопротивляются эксудации нитроглицерина под
влиянием воды желатинированные динамиты (например, гремучие
студни): растворенный в нитроглицерине пироксилин покрывает дина-
мит водоупорной пленкой, препятствующей дальнейшей эксудации
из динамита нитроглицерина. Как общее правило, при употреблении
динамитов для подводных взрывов необходимо заряды заключать в
непроницаемые для воды оболочки, если только неизвестно наверно,
что данный сорт динамита безусловно водоупорный.
Однако, не только непосредственное соприкосновение с водой
вызывает' эксудирование нитроглицерина из динамитов. Этот же
процесс совершается вообще под влиянием влажности, а потому
хранить динамиты в сырых помещениях нельзя.
Само собой разумеется, что динамиты с эксудировавшим из них
нитроглицерином, делаются почти столь же опасными в обращении,
как и чистый нитроглицерин.
5) Влияние низких температур. Так же, как и чистый нитрогли-
церин, динамиты при понижении температуры затвердевают, теряя
свою пластичность, или, как говорят—замерзают. Температура эта
для разных динамитов различна, но у большинства потеря пластич-
ности наблюдается в' пределах +4’—|-12’С. Процесс замерзания
обыкновенно сопровождается изменением цвета и появлением грязно-
белых оттенков. Замерзание начинается с поверхности и распростра-
няется внутрь массы с тем большей скоростью, чем богаче динамит
нитроглицерином.
Замерзший динамит нельзя ломать, раскалывать, скоблить, резать,
сверлишь и т. п., так как при этих операциях легко может последо-
вать взрыв. Таким образом, замерзший динамит гораздо опаснее в
обращении, чем талый, но еще большую опасность представляет
полузамерзший.
— 376 —
Оттаивание динамитов происходит чрезвычайно медленно: за-
мерзшие патроны становятся мягкими иногда только по истечении
1—2-х суток. Это обстоятельство очень важно помнить, так как
патрон, кажущийся с поверхности оттаявшим, внутри может быть
замерзшим и послужить причиной крупного несчастного случая.
Будучи зажжен, замерзший динамит горит сравнительно мед-
ленно—по мере оттаивания, но случается нередко, что горение за-
мерзшего динамита завершается взрывом.
Для ускорения оттаивания замерзших динамитов служат особые'
аппараты. В общем это бсть прибор (см. рис. 165, 166), состоящий
Рис. 165. Прибор
для оттаивания
динамитов нагре-
, той водой.
Рис. 166. To-же с.хемат. продольный раз-
рез. (Видны воронка для наливания
воды и термометр).
из двух металлических сосудов, вставленных один в другой, причем
они снабжены обыкновенно общей крышкой. В наружный сосуд на-
ливается горячая вода, имеющая температуру не выше 600С., а во
внутренний помещают динамит, подлежащий оттаиванию.
Само собой понятно, что при приборе должен быть и термометр.
Для оттаивания значительного количества динамита (примерно
до 50 килогр.) существуют также аппараты, имеющие форму ящиков
на ножках. Иногда в них вода нагревается при помощи электрического
тока, причем температура поддерживается не выше 40° С. (Рис. 167,7168).
Надо, однако, не упускать из виду, что большинство динамитов
при оттаивании вообще, особенно же при нагревании до 30°—40° С
склонны эксудировать нитроглицерин, а потому лучше всего не допускать
вовсе динамит до замерзания.
Этого достигают, сохраняя данную порцию динамита, предназна-
ченную для употребления, в особых приборах, могущих долго сохра-
нять тепло, в- так называемых термоферах.
Конструкция этих приборов весьма разнообразна. Один из инте-
реснейших приборов этого рода конструирован на том принципе, что
расплавленный уксусно-кислый натрий при своей кристаллизации
выделяет значительное количество тепла.
Практически—горнорабочие часто сохраняют динамит в талом
виде, помещая патроны у себя в карманах. Ясно и без доказательств
вся ненормальность подобного способа: выделяющийся нитроглицерин
— 377 —
Рис. 167. Электрический прибор для оттаивания
динамитов (в собранном виде).
Рис. 168. То же. В разобранном виде.
пропитывает понемногу материю карманов, к тому же рабочие легко
могут случайно, даже без всякого злого умысла, заносить патроны
динамитов к себе домой, где они легко могут послужить причиной
крупного несчастья.
— 37S —
Недостатки, присущие замерзшим динамитам, относятся в боль-
шей или меньшей степени ко всем препаратам, содержащим нитро-
глицерин, а потому совершенно понятны попытки возможно более
понизить точку замерзания нитроглицерина.
Как уже упомянуто раньше, с этой целью вводят некоторые
вещества, понижающие точку замерзания нитроглицерина (нитрогли-
коли, нитротолуолы, динитроглицерин, производные глицериновых
эфиров, нитрохлоргидрин, формины, ацетины и проч.).
Динитрогликоль, в количестве 10—20% употребляется с этой
целью во Франции едва ли не чаще других веществ этого рода. Он
есть также взрывчатое вещество, лишь немного уступающее нитро-
глицерину по своей силе и, в то же время, значительно менее чув-
ствительное к ударам. Главный его недостаток—дороговизна, но в на-
стоящее время техника серьезно занята изысканием дешевых методов
его получения в значительных количествах.
Хороших результатов, повидимому, достигают при применении
также и динитротолуола. За ними следуют динитроглицерин и др.
6) Влияние нагревания. Как уже было замечено раньше, нагревание
некоторых динамитов до 30—40° С вызывают уже начало эксудации
нитроглицерина. Большинство динамитов выносят неособенно продол-
жительное нагревание до 60° С без разложения, но при 70° С последнее
уже обнаруживается более или менее рельефно.
При быстром нагревании до 180° С большинство динамитов
взрывается.
При постепенном нагревании, при температуре 182° С динамиты
воспламеняются, при чем зажженный в небольшом количестве, он сго-
рает быстро красновато-желтым пламенем с отделением окислов азота;
будучи же зажжен в замкнутом пространстве, или же в большем
количестве (примерно более 15 кйлогр.), он сперва загорается, а затем
в большинстве случаев взрывает.
Спокойно горящий динамит можно тушить водой.
Динамитный патрон, брошенный в горящий костер, обыкновенно
сгорает в нем быстро, но без взрыва; исключение представляет тот
случай, когда костер разложен на каменистым грунте. В этом случае
может произойти также взрыв. Последний также имеет место в том
случае, если динамит заключен в металлическую гильзу, хотя бы
имеющую небольшое отверстие; в подобном случае газы, выделяемые
быстрогорящим динамитом, не успевают удаляться и поднимают вну-
треннее давление, влекущее за собою взрыв.
7) Влияние солнечною света. Действие солнечного света на дина-
миты одинаково с влиянием его на нитроглицерин: при продолжи-
тельном действии солнечных лучей динамиты делаются более чувстви-
тельными к сотрясениям и ударам, а разогревание солнечными лучами
обусловливает в большинстве случаев эксудацию и.з них нитрогли-
церина.
8) Температура газов при взрыве различная и вообще говоря чем
выше, тем больше в динамите нитроглицерина.
Во многих случаях уменьшение этой температуры составляет
предмет особенной заботы техники, каковое обстоятельство имеет место,
например, в веществах антигризутных („безопасных** или „предохра-
витальных"), назначенных для работы в рудниках- с рудничным газом
и каменноугольной пылью.
Понижение этой температуры достигается путем введения раз-
личных веществ, часто растительного происхождения (мука древесная,
а также хлебные злаки) или минеральных (сода, содержащая кри-
сталлизационную воду). При помощи этих средств удается понизить
температуру газов, развивающихся при взрыве, ниже 2000® и даже у
некоторых она падает до 1350°.
9) Действие электричества. Динамиты вообще говоря, менее чув-
ствительны к действию электричества, чем чистый нитроглицерин.
Электрическая искра неособенно высокого напряжения не взры-
вает динамита: происходит лишь местное нагревание, иногда только
сгорание, или частичный слабый взрыв. То же явление происходит
при накаливании тонкой железной проволоки, помещенной внутрь
динамита.
Удар молнии всегда взрывает динамит.
10) Влияние продолжительною хранения. Хранение динамита про-
должительное время (например, более 5 лет), даже при самых благо-
приятных условиях, оказывает влияние на качество продукта, так
как вследствие летучести нитроглицерина, процентное содержание1
его постепенно уменьшается. Это особенно дает себя чувствовать
в жарких странах, где запасы динамитов поэтому освежаются не реже,
как каждые 3—5 лет.
При неблагоприятных условиях хранения динамит может под-
вергнуться процессу саморазложения, вследствие чего может быть
воспламенение и взрыв всей его массы. Большей частью причиной
его возникновения служит недостаточная отмывка его от кислот, или
же загрязнение примесями. Процесс этот, сначала протекающий очень
медленно и непредставляющий в начале опасности, узнается по кислой
реакции лакмусовой бумажки.
Динамит, обнаруживший признаки саморазложения, необходимо
немедленно израсходовать, если же этого сделать нельзя, то он
уничтожается сжиганием по одному патрону в открытом костре на
мягком грунте.
И) Физиологические действия динамитов на человеческий организм
те же, что и нитроглицерина, если только в составе поглотителя нет
каких-либо веществ, действующих7 специально.
12) Взрыв через влияние. Взрыв активного динамитного заряда
сравнительно легко производит детонацию пассивного заряда.
Предельное расстояние взрыва через влияние находится в тесной
зависимости от величины активного заряда, изменяясь с изменением
величины этого заряда довольно закономерно. Также точно это пре-
дельное расстояние -зависит заметным образом и от свойств той под-
ставки, на которой расположены оба заряда, и от того, находятся ли
они открытыми в металлических оболочках.
При расположении обоих зарядов, находящихся в металлических
оболочках, на твердой стали, предельное расстояние, на котором воз-
можен взрыв через влияние, определяется формулой:
1 = 4 С.
где 1 — расстояние в футах, а О'—вес заряда динамита в фунтах. ,
При отсутствии у зарядов металлических оболочек, это предель-
. ное расстояние уменьшается вдвое, а при мягком грунте 1 = 0.
Способность активного динамитного заряда передавать взрыв
пассивному зависит также от пропорции нитроглицерина, заключаю-
щегося в динамите.
Влияние оболочки зарядов, весьма существевное для заряда
пассивного почти не имеет никакого значения для заряда активного.
Замечено, что предельное расстояние, на котором возможен взрыв
через влияние, тем больше, чем тоньше и тверже оболочка пассив-
ного заряда. Пассивному заряду, свободно подвешенному на воздухе,
взрыв через влияние передается только на минимальном расстоянии.
Под землей вызвать детонацию пассивного заряда взрывом актив-
ного, значительно труднее чем на воздухе. Так, например, два заряда,
весом по 4 килогр. динамита каждый, взрываются одновременно лишь
в том случае, если предельное их расстояние не превышает 2*/а фу-
тов (т.-е. в таком случае 1 = 1/аС).
Еще труднее, чем под землей, происходит передача взрыва под
водой. При больших зарядах динамита (бдлыпих 5 пудов), пассивные
заряды могут детонировать на расстояниях, выражающихся уже са-
женями.
б) Свойства динамитов желатинированных. Динамиты желатини-
рованные в отношении некоторых своих свойств, существенно разнят-
ся от динамитов нежелатинированных, только что рассмотренных.
1) По наружному виду они напоминают полузастывшую клеевую
массу или желе, они тягучи, вязки, пластичны, упруги и обладают
бдлыпой или меньшей степенью прозрачности. Цвет их различный —
от бесцветных до буровато-желтых разных оттенков, те же, которые
содержат в ’своем составе муку, селитры и др. вещества, в большей
или меньшей степени зернисты. Большая часть желатинированых
динамитов на ощупь несколько жирны.
Желатинирование димамиты содержащие значительное количе-
ство солей, муки, и т. д., мало пластичны и упруги, а также обла-
дают малой тягучестью и меньше просвечивают. (Рис. 169—172).
Удельный вес желатинированных динамитов различен в зависи-
мости от природы содержащихся в них веществ, при чем наименьшие
величины удельных весов приходятся на долю гремучих студней
(около 1,55), а наибольшие относятся к веществам богатыми селит-
рами (около 1,7).
2) Эксудация нитроглицерина. Желатинированные динамиты не
выделяют нитроглицерина ни под влиянием сдавливания, ни под
действием воды, если, конечно, в них нет поглотителя, растворяю-
щегося в воде. Под влиянием тепла (50°—60® С.) они несколько раз-
мягчаются, но жирными при этом делаться не должны; если же
нагревание превосходит известный предел, то наблюдается эксудация
нитроглицерина. При оттаивании замерзших желатинированных дина-
митов, часто также замечается эксудация нитроглицерина.
3) Отношение к механическим влияниям. Желатинированные дина-
миты в незамерзшем состоянии, вообще говоря, менее чувствительны
к ударам и трению, чем динамиты нежелатинированные, в замерзшем
же виде наоборот—значительно превосходят их в этом отношении.
Гремучие студни, будучи флегматизированы камфорой, становят-
ся нечувствительными к попаданию в них ружейной пули. .Как уже-
Рис. 169. Фотографический снимок взрывчатого желатина (в отраженном свете).
(По Marschall’io).
о
т
е
й
к
ь
i-
[г
е
й
>
:е
Д
>-
Ь
>е
я
1-
Рис. 170. Фотографический снимок взрывчатого желатина (в проходящем свете).
(По Marschall’io)
сказано раньше, желатинированные динамиты при сдавливании не
выделяют нитроглицерина.
4) Взрывание желатинированных динамитов. Параллельно с пони-
жением чувствительности незамерзших желатинированных динами-
тов к механическим влияниям, в них также является сильно пони
женной чувствительность к капсюлю. В этом отношении они не толь
Ряс. 171. Фотографический снимок взрывчатого желатина. (По Маг>сйа1Гюл
Рис. 172 Фотографический снимок взрывчатого желатина. (По Marschalhoч
ко сильно уступают чистому нитроглицерину, но даже очень многим
нежелатинпрованным динамитам. Так, например, для взрыва не фдег-
матйзированных гремучих студней с наивысшим содержанием нитро-
глицерина, требуется капсюль не слабее № У т.-е. с 0,8 грм. гремуч.
— 383 —
ртути, на практике же для надежности взр,ыва берут капсюль № 7 с
1,5 грм. гремучей ртути.
В общем желатинированные динамиты, содержащие селитру,
значительно более чувствительны к капсюлю, нежели те, в которые
она не входит, так что для некоторых таких динамитов достаточен
даже капсюль № 3 (с 0,54 грм. гремучей ртути).
В замерзшем же состоянии — наоборот, желатинированны^йи-
намиты значительно более чувствительны к капсюлю, чем пезамер^Ое.
Надежнее всего гремучие студни взрывать при помощи запаль-
ных патронов студенистого динамита.
5) Влияние, воды и влажности на желатинированные динамиты
несколько иное, чем на остальные. Водой из них нитроглицерин
удаляется лишь с поверхности, при чем освобождающаяся нитро-
целлюлоза облегает массу желатинированного динамита, образуя водо-.
непроницаемую пленку, препятствующую проникновению воды внутрь
массы динамита.
Само собой разумеется, что это относится к желатинированным
динамитам, незаключающим в себе растворимого в воде поглотителя.
Равным образом и сырость воздуха не вызывает § типичных
желатинированных динамитах (без растворимого в воде поглотителя)
так легко эксудации нитроглицерина.
6) Влияние низких температур. При температурах, близких к 0е,
желатинированные динамиты замерзают, образуя твердую, беловатую
массу и в таком виде утрачивают безопасность в обращении в боль-
шей мере, чем динамиты нежелатинированные.
Также, как и последние, их нельзя ни ломать, ни царапать, ни
скоблить, ни строгать, нщраскалывать, ни сверлить, словом, нельзя с ни-
ми производить никаких работ, при которых могли бы отделяться от
общей массы какой бы то ни было величины частицы, так как при этом
они очень легко взрываются*). > ;
Меры предохранения против замерзания их и оттаивания совер-
шенно одинаковы с теми, которые указаны для нежелатинированных.
7) Влияние нагревания, солнечного света и электричества совершен-
но те же что и на динамиты нежелатинированные.
Будучи зажжены на открытом воздухе не в особенно большом
количестве, незамерзшие желатинированные динамиты быстро сгорают
без дыма синеватым пламенем, при чем состав продуктов сгорания
их зависит от того, представляют ли они чистые гремучие студни,
нли же содержат какие-либо другие вещества (селитры, соли,, муку
и т. п.). В первом случае продукты взрыва заключают лишь углекис-
лоту, воду, а также свободные азот и кислород. Окиси углерода при
полном взрыве их среди продуктов взрыва вовсе не имеется. Темпе-
< ратура взрыва газов, развивающихся при взрыве, очень высока, до-
ходя теоретически до 3200°С., но она сильно может понижаться при
помощи введения в состав этих динамитов специальных веществ
(муки, соли, содержащие кристаллизационную воду и т. п.).
*) Наблюдапись ззрывы динамитных патронов при их разворачивании и сня-
тии бумажных оберток, почему и эта операция с замёрзшими патронами не допускается.
Температура, при которой при быстром нагревании наступает
взрыв, определена около\.240°С.
Динамиты этой категории, содержащие селитру, муку и проч.,
при взрыве дают по большей части дым и твердый остаток, количе-
ство которого может доходить до 16%.
Среди-, динамитов, принадлежащих к типу желатинированных,
имеется довольно „много антигризутных („безопасных11, или „предо-
хранительных“), температура газов при взрыве коих сильно понижена
искусственным образом.
8) В отношении продолжительности хранения желатинированные
динамиты сходны с нежелатинированными. Ввиду меньшей легкости,
с которой сорта, несодержащиё растворимых в воде частей, эксуди-
руют в присутствии влажности нитроглицерин, при подыскании для
их хранения сухих помещений можно выставлять несколько менее
суровые требования.
9) Физиологическое действие на организм человека желатинирован-
ных динамитов то же самое, как и нежелатинированных, если только
содержание посторонних веществ не вызывает каких-л^бо специаль-
ных действий.
10) Сказанное относительно взрыва через влияние нежелатиниро-
ванных динамитов в общем применимо и к желатинированным, при-
чем, вследствие их несколько более пониженной чувствительности к
капсюлю, максимальные дистанции, на которых еще могут быть взры-
вы через влияние, следовало бы несколько сократить. Для гремучих
же студней это требуется во всяком случае, если они флегматизированы
камфорой. Принимая же во внимание большую силу гремучих студ-
ней сравнительно с остальными динамитами, для них обыкновенно
считают те же предельные дистанции для взрыва через влияние,
которые определяются и для динамитов нежелатинированного типа.
ГЛ АВ А III.
Бездымный пороге
§ 1. Способность пироксилина не давать при взрыве твердых
остатков вызвала стремление, во Франции в 1846 г. и в Австрии
в 1852 г., заменить им селитро-серо-угольный порох, выделяющий
при взрыве всего 40% газов по весу. Попытки в этом направлении
долго не имели успеха: при стрельбе из ружей рыхлый пироксилин
действовал не однообразно и, кроме того, влиял разрушительно на
оружие. Давление образующихся газов, обусловливаемое чрезвычайною
быстротою его горения, было настолько велико, что пироксилин не
мог употребляться без особых приспособлений. Для уменьшения его
разрушительного действия употреблялись полые или состоящие из
нескольких слоев заряды, к пироксилину прибавлялся хлопок и
проч.
В 1864 г. прусский капитан Шульце для стрельбы предложил
ревесный порох, состоящий из смеси нитрованной древесины и
— 385 —
селитры. Этот порох действовал неравномерно, вследствие неодина-
ковой степени нитрования; при выстреле давал легкий дым.
В 1869 г. во Франции появился пикриновый порох.
В конце семидесятых годов во Франции, Англии и Германии
вновь обратились к пироксилину, приготовляя порох/ состоящий из
смеси зерненного пироксилина с селитрами (бариевой и калиевой).
Пироксилино-селитряный порох фабриковался теми же маши-
нами и приборами, которые употреблялись при приготовлении черного
пороха. Смесь пироксилина (60 ) с бариевою (30%) и калиевою (10%)
селитрами обрабатывалась под бегунами, затем лепешки зернились
и сушились при t°=40°C.
Этот порох давал мало дыма и нагара, но на практике оказался
непостоянным, в отношении баллистических свойств, и гигроско-
пичным.
На французском заводе Pont de Buis изготовлялся охотничий
порох, в состав которого входили: растворимый пироксилин (28%),
нерастворимый пироксилин (37 ), бариевая селитра (29.°/<) и калие-
вая селитра (6«0). '
К малодымному пороху относится порох, предложенный в 1884 г.
Руктешелем, известный под названием „еилотвор". Он представлял
собою нитро-клетчатку, приготовленную из древесной бумажной массы,
какая употребляется для фабрикации писчей бумаги.
До 1884 г. ни один из типов известного малодымного пороха не мог
считаться достаточно удовлетворительным. В 1884 г. французский
инженер Виелль, заведывающий химической лабораторией артилле-
рийского ведомства, предложил новый бездымный пироксилиновый
порох, состоящий из пироксилина разных степеней нитрации, гак на-
зываемого коллоидального типа. ’
Пироксилин высшей нитрации, как известно, не растворим в
смеси спирта и эфира; сорта же пироксилина менее нитрованные
растворяются в этой смеси. При обработке спирто-эфиром пироксилина
разных степеней нитрации, частицы нерастворенного пироксилина
обволакиваются слоем коллодия и вся смесь представляет собою тесто-
образную массу; из последней особыми прессами выдавливаются труб-
ки, ленты, или нити определенных размеров и плотности, которые
после резки и просушки, имеют вид твердых, упругих, чуть прозрач-
ных пластинок темножелтого или коричневого цвета, напоминающих
рог или клей.
Так обработанный пироксилин горит гораздо медленнее и про-
грессивнее, благодаря чему он оказался в состоянии давать начальную
скорость около 640 метр, в секунду при давлении, не превышающем
2400 мм. на 1 кв. см., т.-е.—безопасном дл^ оружия.
Увеличение начальной скорости против прежней (500 м.) имело
особое значение ввиду перехода к малокалиберному ружью: живая
сила снаряда, пропорциональная массе его и квадрату скорости, умень-
шилась, в, ледсгвие уменьшения массы снаряда, и необходимо было
увеличить начальную скорость, то есть увеличить метательную силу
пороха.
Кроме пироксилинового бездымного пороха, несколько позднее
(1887 г.) появился пироксилиново-нитроглицериновый порох, предло-
Проф. М. Сухаревский. Взрывчатые вещества и взрывные работы. 25
— 386 —
женный Нобелем; в нем растворителем служит нитроглицерин или
ацетон.
Сначала к новому пороху относились очень недоверчиво, но
после 1890 г. хорошие свойства его уже достаточно выяснились и на-
чало уже устанавливаться заводское приготовление его. Производство
же прежнего селитро-серо-угольного пороха сильне сократилось.
Пироксилиновый порох принят был во Франции и в России,
а пироксилиново-нитроглицериновый (двух типов)—в других странах.
У нас заводское приготовление бездымного пороха начато было
в 1891 г. на Охтенском пороховом заводе, затем производство устано-
вилось и на других казенных заводах—Казанском и Шостенском.
R. Пироксилиновый бездымный порор.
„ . п Приготовление последнего требует установки про-
беэдымнопГпирок0- изводства пироксилина и этилового эфира. Спирт
сипинового порога, приобретается покупкой.
В отделении собствевно бездымного пороха производятся следую-
щие операции: обезвоживание пироксилина, желатинизация, Прессо-
вание, провяливание, резка и сушка.
а) Приготовление пироксилина производится Порядком, указанным
ранее. Отметим только следующее:
Кислотная смесь для нерастворимого пироксилина, содержащего
5—8% коллодионного хлоПка, состоит из:
21,5% азотной кислоты,
70,6% серной „
7,9°/о воды,
для растворимого, содержащего 92—98% коллодионного хлоПка, из:
17,8% азотной кислоты,
68,2% серной „
14 % воды. '
После нитрования хлопка в ваннах, для получения растворимого
пироксилина, навески не отжимаются; нитрование в горшках произ-
водится меньшее время—6 часов.
Закладку нитрованного хлопка в голландеры делают таким обра-
зом, чтобы при самом измельчании получалась смесь нерастворимого
и растворимого пироксилина такого состава, который требуется для
массы, поступающей на желатинизацию,. Дзота в общей массе пи-
роксилина должно содержаться около 12,8%; количество растворимого
пироксилина при этом достигает 40% (для пушечного пороха, для ру-
жейного—несколько меньше).
Менделеевым в 1890 г. предложен для фабрикации бездымного по-
роха пироксилин, отвечающий составу С24 Н,10 Oi0(N03)1o, т. наз. пи-
роколлодий. Это предложение нашло практич. осуществление в Аме-
рике и у нас на Шлиссельбургском заводе, начавшем выпускагь т. н.
пироколлодионный порох. Отличие пироколлодия или т. н. пирокол-
лодионного пироксилина от обычно применяемого для фабрикации
бездымн. пороха пироксилина состоит в том, что оц отличаясь боль-
шой растворимостью—до 87 ± 5°/0, в то же время содержит большой
% азота—12,92 ± О,05*/о.
После измельчения следует промывка мезги, которая сопровож-
дается мешкой пироксилина выделки разного времени. При этом про-
изводятся испытания на химическую стойкость и на состав пирокси-
линовой массы.
Для нейтрализации кислот прибавляют к воде соду. Оконча-
тельный же продукт не должен содержать щелочей.
б) Приготовление лфира. Так как в частной промышленности эфир
в больших количествах не производится, то пороховым заводам при-
ходится самим дрбывать этот продукт.
Материалы, идущие на приготовление эфира, суть: спирт, сер-
ная кислота и едкий натр.
Спирт—должен иметь крепость 90° (по Траллесу). Сивушного
масла допускается не более О,1»/о.
Серная кислота—должна иметь крепость не менее 65,5° (по Боме),
что составляет около 93% гидрата На 80ц она не должна заключать в
себе следов окислов азота и примесей железа и мышьяка.
Едкий натр—должен заключать в себе чистого Na ОН нё менее
72%; остальное может быть—сода и некоторые другие примеси.
Процесс получения эфира заключается: 1) в получении т. наз.
сырого эфира, т. е, —смеси, состоящей из эфира (55%), спирта (30%)
и воды и 2) в „ректификации" сырого эфира с целью разделения его
на составные части.
Получение сырого эфира производится в приборе, называемом
„этерификатором'1' (рис. 173). Это железный цилиндр высотою 7 фт. и
диаметром около 6 фт., выложенный внутри свинцом, а снаружи об-
шитый деревом. В крыше прибора имеется лаз и 5 патрубков; из них
средний назначается для трубы, отводящей пары сырого эфира. На-
значение других видно из дальнейшего.
Через лаз Ъ в прибор вливается серная кислота (150 пуд.), а по
трубе а пускается из бака спирт*) (85 пуд.), который входит в цилиндр
тонкими струйками через отверстия трубы. Смесь спирта и кислоты
нагревается при помощи вертикального змеевика с с значительным
числом оборотов, в котором циркулирует водяной пар. Температура
жидкости поддерживается до 125—130°С. и измеряется термометром.
Образующиеся при процессе пары эфира направляются в другой
прибор „сатюратор" или „нейтрализатор" В, т. е.—обшитый деревом
медный цилиндр, назначение которого состоит в возможно полном
выделении кислотных примесей из эфирных паров при помощи едко-
го натра. Внутри цилиндра имеются пять перегородок, образующих
своими закраинами как бы тарелки D (рис. 174), накрываемые кол-
пачками т с зубчатыми краями. Тарелки наполняются 4% раствором
едкого натра, который поступает в нейтрализатор по трубке и попа-
*) Другие растворители для порохового пироксилина—ацетон и уксусный
эфир—не вошли у нас в практику.
— 388
дает сперва на верхнюю тарелку, потом переливается через трубочки
п с одной тарелки на другую. Пары неочищенного эфира проникают
под колпачки через отверстия е е и, чтобы выйти из под них, долж-
ны пройти через-раствор едкого натра и, таким образом, отдать ему
кислотные примеси.
Рис. 173. Аппаратура для приготовления сырого
эфира. (Схема).
Рис. 174. Схематическая
деталь нейтрализатора.
Нейтрализованные пары сырого эфира сгущаются в змеевике
охладника Е; охлаждение производится водою, поступающею по тру-
бе р. Эфир собирается в сборном баке F, причем он протекает через
контрольный стакан д, в котором поверяется ареометром его плотность.
Отработавший раствор едкого натра, содержащий в небольшом коли-
честве сгущенные пары эфира, выпускается по трубе q в особый хо-
лодильник L, откуда идет в общий сборный бак сырого эфира, прой-
дя через контрольный стакан И. Эта жидкость, содержащая еще ще-
лочь, окончательно нейтрализует кислотные примеси, если таковые
остались в эфире.
Эфир поступает затем в ректификационную колонну (рис. 175).
Колонна представляет собою медный высокий цилиндр (высотой
17 фут.), обшитый деревом. В верхней части колонны (2) находится
28 перегородок с тарелками и отверстиями. Очищаемый эфир входит
Рис. 175. Ректификационная колонна. (Схема).
в колонну по трубке S. Для нагревания жидкости, в нижнюю часть
колонны В поступает водяной пар через кольцевидную трубку Ъ. Тем-
пература жидкости поддерживается около 60°С. При испарении жид-
кости, так как температура кверху понижается, происходит конден-
санция спирта и воды, которые и переливаются с одной тарелки на
другую; между тем пары эфира, кипящего при 35°С, увлекая с собой
немного спирта, направляется по трубке С в сосуд D. (дефлегматор),
связанный непосредственно с холодильником. Дефлегматор и холо-
дильник представляют собою медные цилиндры, снабженные внутри
трубками d, d, через которые снизу вверх проходит охлаждающая
вода, и перегородками f, f и g, g. Скопляющийся в дефлегматоре
эфир по трубке i стекает обратно в колонну, а пары эфира и часть
жидкости переходят по трубке й в холодильник. Из него уже по трубке
h чистый эфир, охлажденный до температуры 20—25’С., поступает в
сборный бак.
— 390 —
Спирт, вода и другие примеси, выделенные из сырого эфира,
собираются внизу ректификационной колонны и по трубе и направ-
ляются в другую колонну („рекуперационную"), расположенную ря-
дом, где происходит отделение спирта от воды. Операция эта в общем
сходна с ректификацией эфира.
Этиловый эфир, называемый также серным, С4Н10 О, имеет вид без-
цветной прозрачной жидкости, с своеобразным запахом; горит светящим
пламенем; смесь паров его с воздухом легко воспламеняется со взрывом;
кипит при 35°С; смешивается со спиртом во всех пропорциях; вды-
хание паров серного эфира вредно, так как действует подобно хлоро-
форму; уд. вес 0,7 (при 15°С.).
в) Обезвоживание пироксилина. Пироксилиновая мезга доставляется
на пороховой завод с содержанием до 30% влажности и, прежде чем
приступить к дальнейшей обработке ее, необходимо получить ее в
более или менее сухом виде. В прежнее время это достигалось сушкой
пироксилина. Неудобство работы с совершенно сухим порошкообраз-
ным пироксилином и ряд взрывов пироксилиновых сушилен заставили
отказаться от сушки пироксилина и заменить ее более безопасной
операцией обезвоживания винным спиртом. С этой целью влажный
пироксилин обрабатывается в особых аппаратах, называемых диффу-
зорами, винным спиртом крепостью в 95,3°; при этом почти вся влага
растворяется в спирте и вместе с ним уходит из пироксилина.
На Охтенском заводе диффузоры имеют вид, показанный на рис.
176. Сосуд закрывается герметически крышкой при помоши каучуко-
вой прокладки а и зажимных гаек. Мешок
А с обрабатываемой мезгой, открытый сверху,
лежит на медном круге С с большим числом
f отверстий. Такой же круг d кладется поверх
мешка, и через отверстия этого круга проте-
кает спирт, поступающий из бака или из со-
седнего сосуда. Приток спирта совершается
по трубке /, которая служит также и для
нагнетания сжатого воздуха, Через трубку у
выпускается воздух из диффузора при напол-
нении последнего крепким спиртом. Ко дну
сосуда присоединена изогнутая трубка г, ко-
торая другим концом входит в верхнюю часть
следующего диффузора. В дне сосуда еще
имеется трубка k с краном для выпуска
жидкости из сосуда.
Операция обезвоживания производится
Рис. 176. Схематический последовательно в трех сосудах. Спирт пере-
разрез диффузора. гоняется из одного сосуда в другой давлением
сжатого воздуха.
По окончании операции обезвоживания, пироксилин отжимается
в особом гидравлическом прессе или в центрофугах, с таким расче-
том, чтобы на 1 часть его оставалось еще около его веса винного
спирта, что не мешает дальнейшей работе, так как этот спирт является
одной из составных частей растворителя пороховой массы. Обыкно-
венно отжимают несколько сильнее, а потом недостающую часть спирта
добавляют.
На казенных заводах Германии применяется тот же способ в
несколько технически усовершенствованном виде. Пироксилин при
помощи подвижного компрессора А впрессовывается в диффузоры В
(рис. 177). Затем в закрытые диффузоры впрессовывается под давле-
ние. 177. Установка дяя обезвоживания пироксилина.
нием в 7 атм. спирт, поступающий из резервуаров С. Спирт гонит
воду вниз; затем открывают выпускной кран и* выпускают воду и
спирт. Удельный вес стекающей жидкости контролируется при
помощи ареометра. После этого пироксилин вынимается из диффу-
зоров и отжимается в гидравлических прессах для удаления избы-
точного спирта. Подобный гидравлический пресс показан на рис. 178
и 179. Пресс снабжен двумя горшками вращающимися вокруг вер-
тикальной колонны, куда, между двумя дырчатами пластинами закла-
дывается пироксилин. В то время как один горшок наполняется
другой находится под прессом. Выжатый спирт стекает через отверстия
поршня. Пресс обычно развивает давление в 100—200 атм.
В самое последнее время избыточный спирт отжимается сжатым
воздухом уже при процессе обезвоживания. Требующееся для этого
давление, около 12 атм.
Более быстро, чем в диффузорах, происходит обезвоживание пи-
роксилина в особых центрофугах (рис. 180), которые устроены таким
образом, что спирт впрыскивается во время вращения барабана. Для
избежания потери спирта, крышки закрываются герметически.
- г) Желатинизация. Обезвоженный и смоченный спиртом пирокси-
лин поступает на операцию желатинизации, посредством которой ему
и сообщается коллоидальное состояние, свойственное бездымному по-
Г— 392 —
poxy. Тут-же прибавляется необходимое количество эфира, так-что
соотношение эфира к спирту выразится отношением 4:3. Эфир обыч-
но прибавляется в несколько приемов. В разных странах соотношение
эфира и спирта различно: так во Франции оно равно отношению 9:5,
в соединенных штатах 3:1, в других 2:1.
Рис. 178. Гидравлический пресс для отжатия избы-
точного спирта. Общий вид всей установки.
В этот момент прибавляются и остальные примеси (неоргани-
ческие соли, стабилизаторы и т. д.); если они растворимы в эфире,
их предварительно растворяют в нем. Нерастворимые соли присыпа-
ются во время мешки. Последняя происходит в особых мешателях*).
(Рис. 181—184). Мешатель, показанный на рис. 181, состоит из проч-
ного чугунного цилиндра А с откидной стенкой в и отверстием
сверху, которое может быть герметически закрыто крышкой а; через зад-
нюю стенку его проходит стержень 1), снабженный на конце стальной
мешалкой d, причем посредством особого механизма этот стержень
может быть приведен одновременно в поступательное и вращательное
движение, и вследствие этого мешалка совершает плавное, винтовое
движение, двигаясь то вперед, то назад.
*) Называются также ямалаксерами“.
— 393 —
Рис| 179. To-же. Вид одного пресса в отдельности.
Рис. 180. Центрофуга для обезвоживания пироксилина.
Пироксилин, содержащий по весу около 50% спирта, загружается
в мешатель через верхнее отверстие в количестве около 3 пудов,
к нему приливают этилового эфира в количестве, вдвое большем
Рис. 181. Аппарат для желатинизации пироксилина (схема).
Рпс 182. Усовершенствованный мешатель для желатинизации^пироксилина.
Общий вид.
по отношению к содержанию спирта, и затем, герметически закрывши
аппарат, пускают в ход мешалку. Обработка продолжается 2—3 часа.
Для увеличения стойкости пороха, т. е. способности выдержи-
вать продолжительно хранение, к нему прибавляется 1% дифени-
— 395 —
Ряс. 183. Тот-же метатель. Приоткрытом ящике.
Рис. 184. Метатель с крышкой системы Werner—Pfleiderer.
— 396 —
ламина — CeH5NHCeH5 — (по расчету на чистый пироксилин); это ве-
щество вводится в мешатель вместе с эфиром, в котором оно пред-
варительно растворяется.
вниз (рис. 185).
Рис. 185. Схемат.
пресса для выдавай вания
пороховых лент Охтеа-
ского порохового завода.
д) Прессование. Из приготовленной тестообразной массы выделы-
вается уже самый порох выдавливанием через отверстия при помощи
особых гидравлических прессов, которые могут быть различного
устройства. На Охтенском пороховом заводе установлен пресс, в ко-
тором масса выдавливается из матрицы в вертикальном направлении
ссовый цилиндр расположен на такой высоте ,
чтобы под ним оставалось достаточное про-
странство для помещения выдавливаемых лент.
Чтобы работа шла непрерывно, пресс устроен
с двумя цилиндрами, поворачивающимися около
одной из вертикальных колонн пресса, подобно
тому, как это сделано в прессах для предва-
рительного прессования пироксилиновых шашек;
таким образом, когда в одном из цилиндров
идет прессование, в другой закладывается по-
роховая масса.
Число отверстий в матрице различно,
смотря по толщине лент: например, для пороха,
предназначенного для береговых орудий и
имеющего толщину лент более 2 м.м.—в матрице
делается одно отверстие, а для ружейного пороха
(тол1циною около 0,4-х м.м.) — несколько сот
отверстий.
В пресс обыкновенно закладывается 2,5 пу-
да тестообразной массы. Перед выдавливанием
масса предварительно прессуется под давлением до 250 атм.;
Выходящие из пресса ленты или при изготовлении ружейного
пороха—пучки нитей режутся на куски длиною до 2 метр, и ве-
шаются на горизонтальные деревянные палки. В таком положении
ленты или пучки помещаются в особые шкафы для „улавливания"
выделяющихся паров растворителя. На рис. 186 показан общий вид
такого пресса, сконструированного подобно гидравлическому прессу
для обезвоживания пироксилина (см. выше). Выходящие из пресса
ленты автоматически режутся на куски в 2—3 метра длиной, затем
подхватываются безконечным полотном, откуда они соскальзывают на
подставку, где автоматически же подвешиваются.
разрез
е) Провяливание. Вышедший из шкафов порох содержит еще
20—30% растворителя. Для дальнейшего выделения растворителя,
порох „провяливают11 в помещениях при обыкновенной температуре
или при нагревании до 35—40°С в продолжение 1—4 суток. При
этом выделяется еще 5—10% растворителя. В таком полумягком
виде ленты вальцуются, чтобы выровнять их толщину и режутся
на пластинки требуемых размеров. Эти операции, большею частью,
производятся одновременно, на одном и том же станке.
Для резки пушечного пороха употребляются разного рода
станки. Простейшие срстоят из двух пар вальцов первая пара
I
J
I
i
5
J
У
i
I-
— 397
" w®i
'' ;\;LVrWSOn¥,-V’<
Общий вид установки для прессования пороховых
- - , A.—G. Grusonverke.
Рис. 186. <__,
лент герм, фирмы F. Krupp
Рис. 187. Машина для ватьцовшия бездыин ого пороха
— 398 —
Рис. 188. Машина для дополнительной, более тонкой, вальцовки
бездымного пороха.
Рис. 189. Машина для резки бездымного пороха,
старой конструкция (по Guttmann'y).
— 399 —
'их назначается-для подачи лент, а вторая—собственно для резки;
в этой последней верхний валек снабжен одним или несколькими
ножами, которые и отрезывают, с каждым поворотом вальцев, куски
ленты.
Рис. 190. Аналогичная машина с открытым механизмом.
Для зернения ружейного пороха применяются станки, напоми-
нающие по устройству машины для крошки табаку. В этих станках
сразу целый дучек нитей подается автоматически с каждым пово-
ротом колеса на известную длину вперед и затем обрезается сталь-
ным ножом, давая мелкие квадратные зерна. Рис. 191 дает снимок
машины для резки пороха новейшей конструкции. Сзади машины
установлен длинный стол с двумя отделениями, куда могут вклады-
ватся пороховые ленты до 3 mt. длиной. Две пары вальцов, устано-
вленные у конца стола захватывают ленты и подвигают их к ножам
Оси верхние пары вальцов подвижные, так что могут быть установ-
лены в зависимости от толщины режущихся лент.
Аналогичную конструкцию мы находим и у машин для резки
трубочного пороха. (Рис. 192).
Нарезанный уже ружейный порох подвергается затем сортировке.
в особой машине для получения более однообразных по размерам
зерен. Пушечный порох сортируется в ручную.
ж) Сушка. Предварительная сушка бездымного пороха умыш-
ленно не доводится до конца, и потому только что нарезанный по-
— 400 —
рох содержит еще значительное количество растворителя, большая
часть которого удаляется затем окончательной сушкой. Эта операция
Рис. 191, Машина для резки пластинчатого пороха.
имеет большое значение в фабрикации бездымного пороха и успех
ее оказывает большое влияние на все качества пороха*).
Рис. 192. Машина для резки трубочного пороха,'
Сушка бездымного пороха производится в особых сушильнях,
где он раскладывается тонким слоем на лотка^, состоящих из дере-
вянных рам, обтянутых холстом, и помещается в особых шкафах,
в которых проходит струя воздуха, нагретого до 40»—45*. В зависи-
мости от толщины пороха, сушка его продолжается от 1—2 недель и
до несколько месяцев**), при чем в конечном результате в порохе оста-
ется от 1,5 до 5% летучих веществ, состоящих отчасти из остаточ-
ного растворителя, а отчасти из влажности. На рис. 193 показана ва-
*) Для более успешной сушки, порох предварительно вымачивают в воде.
**) По последним сведениям, в Америке удалось сократить время сушки До
5 дней, так что весь процесс производства занимает не более 21 дня.
куум-сушильная Установка фирмы Emil Passburg в Берлине а на рибг
194 вакуум-сушильный шкаф в отдельности. На последнем рис. видны
внутреннее устройство и двустенные сушильные полки. При сушильне
обычно устраивается приспособление для „улавливания" испаряющих-
ся растворителей (спирт, ацетон и т.*д.). Кроме того шкафы снабжены
предохранителями для автоматического открывания дверей при опас-
ности взрыва.
Рис. 193. Ваккум—сушильня для бездымного пороха
фирмы Emil Passburg.
При сушке размер зерен или пластинок по толщине уменьша-
ется почти на половину.
з) Ружейный и револьверный порох подвергается еще: а) пуль-
веризации спиртовым, раствором (1О°/о) камфоры, для уменьшения в
начале скорости горения зерен и б) графитованию.
Для графитования готовый порошек всыпают в барабаны (рис. 195)
вместе с графитовым порошком, которого берется О,5°/в по отношению
к весу пороха. Барабаны приводятся во вращение, вследствие чего
пороховые зерна полируются и острые края их сглаживаются. Благо-
даря этому гравиметрическая плотность пороха увеличивается до
0,8; кроме того, увеличивается его сыпучесть (текучесть) и улучша-
ются баллистические качества.
В дополнение к сказанному о приготовлении бездымного пороха
следует отметить, что техника пороходелия продолжает еще разви-
ваться. Так, например, для флегматизиции пороха взамен камфоры
предложены ныне более действительные вещества „централиты", кани-
фоль. „Централиты", представляющие дифенильные производные диме-
тил или диэтилмочевины, были предложены в Германии уже довольно
давно, но не находили применения вследствие своей дороговизны.
Проф. М. Сухаревский. Взрывчатые вещества и взрывные работы.
26
Канифоль в качестве флегматизатора была предложена в России
В. И. Бузниковым, указавшим, после подробного изучения русской
канифоли, на одну из составных частей ее— именно, воскообразное,
желтого цвета, вещество С, обладающее весьма слабыми кислотны-
ми свойствами и большим молекулярным весом и находящееся в
русской канифоли в количестве до 68%,—как на один из лучших
флегматизаторов для пороха. Поэтому он предложил для флегмати-
зации последнего вводить до 2,6% названного вещества С.
Рис. 194. Ваккум—сушильный шкаф.
Рис. 195. Барабан для полировки
ружейного пороха.
Для уменьшения пламени при выстреле к пороху прибавляются
мыла, растительные масла или вещества, содержащие углекислоту и
большое количество кристаллизационной воды. Примеси эти понижают
температуру газов.
Можно также уменьшить пламя в ущерб бездымности, рас-
полагая в орудии в переди заряда мешечек с КМпО4, или дру-
I гими, богатыми кислородом веществами.
£
Для того, чтобы по наружному виду можно было бы судить о
состоянии пороха, к нему прибавляют еще какой нибудь индикатор—
вещество, изменяющее цвет пороха под действием продуктов разло-
жения его. Таким индикатором может служить дифенил-мочевина,
некоторые анилиновые краски и проч.
а) Винтовочный порох представляет собою
§ 4. Свойства пирокси- мелкие квадратные пластинки. Удельный вес его—
линового пороха. около 1,6; гравиметрическая плотность 0,65. Пу-
шечный порох имеет вид лент или трубчатых
стержней разных размеров.
Если рассматривать порох невооруженным глазом, то он по-
кажется довольно однородным; под микроскопом же в полу-прозрач-
ной массе затвердевшего коллодиума (растворенного хлопка) можно
легко различить частицы нерастворимого пироксилина.
Рис. 196. Микрофотографиче-
ский снимок пироксилинового
бездымного пороха (среди мас-
сы видны вкрапления нераство-
рившагося пироксилина.
Рис. 197. Микрофотографи-
ческий снимок пироколло-
диоиного пороха.
б) Кроме двух сортов пироксилина, порох содержит в себе еще
некоторое количество органических летучих веществ, входивших в состав
растворителя, и влажность. Присутствие остаточного растворителя
существенно необходимо, т. к. при полном улетучивании eVo порох
потеряет свое коллоидальное состояние и превратится в порошкообраз-
ную массу пироксилина.
Для сбережения растворителя порох хранят в герметической
укупорке.
в) Порох не боится подмочки водой, так как подсушенный он
снова становится годным для стрельбы. Подсушка, однако, должна
производиться медленно и осторожно, что уменьшит неизбежную при
этом потерю растворителя.
г) Высокая температура, а также резкие колебания ее вредно
-отзываются на порохе, т. к. нарушают его состав и понижают хими-
ческую стойкость.
д) Бездымный порох воспламеняется значительно труднее, чем
прежний селитро-серо-угольный. Поэтому ружейные капсюли ныне
усилены *). Заряды артиллерийских орудий воспламеняются запаль-
ными зарядами из дымного ружейного пороха. Подрывные заряды
лучше взрывать обыкновенными капсюлями с 2 гр. гремучей ртути.
е) Продукты взрывчатого разложения пороха состоят из:
CO,CO„H2,N2,HaO
и небольшого количества болотного газа (СН4).
-) Капсюльный состав: 50% бертол. соли, 25°/0 сернист, сурьмы и 25% серой
гремучей ртути.
При ружейном порохе в продуктах разложения более всего за-
ключается окиси углерода—около 49%, двуокиси углерода и водоро-
да почти поровну—около 18%, азота—около 14%, болотного газа—
меньше 0,2%. .
Температура разложения—2340° G.
ж) Сила пироксилинового пороха превосходит силу селитро-серо-
угольного приблизительно в 2%—3 раза.
Давление в канале орудия, между прочим, зависит от коли-
чества азота в порохе.
При употреблении пироксилинового пороха в подрывном деле, если
заряды не помещаются в замкнутых оболочках,—действие их прибли-
жается к действию обыкновенного черного пороха.
3) При стрельбе пироксилиновым порохом никакого нагара в
канале оружия не получается, чем не менее канал легко подвер-
гается ржавчине и скорее изнашивается, чем при прежнем дымном
порохе. Это обгоняется присутствием в продуктах разложения паров
воды и высокой температурой газов.
Б. Нитроглицериновый бездымный поро;<.
§ 1. Нитроглицериновые бездымные пороха приготовляются из
смеси нитроглицерина и нитроклетчатки, при чем в зависимости от
состава они бывают двух важнейших типов — баллистит и кордит.
Баллистит, предложенный Нобелем, состоит из 5О°/о нитроглице-
рина C3H5(ONOa)3 и 50% коллодионного хлопка C29H3i(ONO2)9Oh, при-
чем для увеличения его стойкости прибавляется 1%—2% дифенила-
мина*). Для приготовления этого пороха 6—8 весовых частей нитро-
глиеринац смешивают по возможности при, низкой температуре
(6—8° С) с 1 весовой частью коллодионного хлопка в особом аппарате,
из которого выкачивается воздух для лучшего сближения смешива-
емых веществ. После этого смесь подвергается прессованию или отжи-
мается в центрофуге для удаления избытка нитроглицерина, затем
нагревается до 60°—90’ С; при этом нитроглицерин растворяет в себе
коллодионный хлопок и получается однородная желатинообразная
масса. Эта масса раскатывается посредством нагретых вальцев в листы
соответственной толщины и затем режется в виде пластинок или ку-
биков различного размера.
Таким образом, в баллистите совершенно избегается применение
какого-либо постороннего растворителя и желатинизация достигается
на счет его нитроглицерина, что делает этот порох весьма постоян-
ным в отношении баллистических качеств.
В новейшее время баллистит изготовляется по патентованному
способу Lundholm и Sayers’a, который в основных чертах состоит
в следующем. Коллодионный хлопок пропитывается водой, а затем
/
♦) В последнее время к этому пороху стали прибавлять уголь для умень-
шения t газов и для увеличения их объема.
— 405 —
Рис. 198. Марка Rottweil. Четырехугольные;рис. 201. Марка Fasan. Серовато-желтые
пластинки с металлическими блесками. зерна.
Рис. 202. Марка Walsrode. Маленькие
зерна серовато-белого и серовато-зеле-
ного цвета.
Рис: 199. Марка, Adler. Маленькие
цилиндрики серого цвета.
Рис. 200. Марка Saxonia. Четырех-
угольные пластинки зеленовато-си-
него цвета.
Рис. 203. Марка Wolf. Белые и
желтые зерна.
Фотографические снимки германских орудийных бездымных
порохов.
— 406 —
при посредстве сжатого воздуха смешивается с нитроглицерином до
полного насыщения им. Вода отжимается затем в прессах приблизи-
тельно до 33°/о- Полученные спрессованные лепешки раздробляются
в деревянных ч^нах с целью их измельчения и смешивания различ-
ных партий производства. В самое последнее время эта трудная
ручная работа заменена машиной системы Velten—Dr. Meister, по-
строенной на подобие коксоизмельчателей с той только разницей, что
вся машина в данном случае изготовляется из дерева (рис. 204, 205).
Рис. 204. Машина системы Velten Dr, Meister.
(Продольный разрез).
Рис. 205. To-же вид сверху.
Затем масса протирается сквозь редкие сита и после I1/.,—2-часового
промешивания в машинах Werner Pfleiderer (рис. 206) (здесь же при-
бавляются необходимые примеси) провальцовывается между нагретыми
вал1цами до почти полного испарения (до 1%) воды и до образо-
вания вполне гомогенной массы.
§ 2. Кбрдит, изготовленный впервые английскими химиками
Абелем и Дьюаром, имеет следующий состав:
58 вес. частей нитроглицерина,
37 „ „ пироксилина,
5 „ „ вазелина.
Рис. 206. Мешатель системы Werner Pfleiderer
для баллиститов и динамитов.
Применяемый в этом случае нерастворимый пироксилин в нитро-
глицерине не растворяется и потому для желатинизации его при-
ходится прибегать к особому растворителю — ацетону, количество
которого берется равным 7& части веса общей массы пироксилина и
нитроглицерина.
Для приготовления кордита отвешивают соответственные коли-
чества нитроглицерина и высушенного пироксилина и затем смешивают
их прямо руками; затем смесь переносится в особый мешатель, к ней
прибавляется ацетон, и она обрабатывается механическим уже способом
около 37, часов. После этого к массе прибавляют вазелин и продол-
жают обработку еще 3‘/2 часа. Пироксилин и нитроглицерин посте-
— 408 —
пенно растворяются в ацетоне и образуют густую, тестообразную
массу коричневого цвета, которая посредством прессования (рис. 207—209),
превращается в цилиндрические струны или нити различного диа-
Рис. 207. Пресс для нитроглицерино-
вого пороха (продольный разрез), ста-
рой конструкции по (Guttmann'y)*).
Рис. 208. Пресс для нитроглицер.
порохов. (Боковой разрез).
*) В основание А ставлены две колонны В. В, скрепленные наверху перекла-
диной С. Вдоль этих колонн скользит поршень D. В основание вделана форма Е,
которая закреплена зажимами F. На нижнем конце формы В навинчена крышка G
с мундштуком Н, диаметр которого соответствует диаметру прессуемых нитей. В
цилиндр J накладывается прессуемая масса. М—прессующий поршень. Приспосо-
бление Т с тремя рычагами регулирует движение поршня вверх и вниз. Верхний
гидравлический цилиндр Р с предохранительным клапаном S служит для регулиро-
вания давления.
метра; полученный таким образом порох наматывается на цилиндри-
ческие барабаны и затем для удаления избытка ацетона подвер-
гается сушке.
Вазелин, примешиваемый к кордиту, служит, главным образом,
для замедления горения пороха и для предохранения его от сырости.
§ 3. Особенности нитроглицериновою пороха.
а) Этот порох более силен, чем пироксилиновый.
Рис. 209. Гидравлический пресс для кордита.
б) Температура газов его более высока (2800® С), вследствие чего
стенки оружия сильнее нагреваются и скорее изнашиваются.
в) Количество СОз более, чем в пироксилиновом порохе. Про-
дукты разложения в круглых цифрах:
22 СО» 4- 16 СО 4- 20 Н20 4- 7 4- 11 N2.
г) Содержание влажности и других летучих веществ—незначи-
тельное (около 0,5%).
д) При повышении t° (более 40° С) возможно улетучивание нитро-
глицерина, а при низкой (ниже + 8 С)—затвердевание его; при обыкно-
венной t° нитроглицериновые пороха весьма постоянны.
е) Порох типа кордита имеет меньшую плотность и более мягок,
чем баллистит и пироксилиновый порох.
ГЛАВА IV.
Т о л и Т е т р и л.
Я. Тол.
§ 1. Приготовление тола или тринитротолуола состоит из сле-
дующих операций: нитрования, промывки, гранулирования, отжимки,
сушки, кристаллизации, и окончательной сушки.
Нитрация толуола производится последовательно: сначала полу-
чается моно, потом—ди—и, наконец,—тринитротолуол. Аппарат для
нитрации—чугунный, циллиндрический, с двойными стенками, вмещаю-
щий в себя до 250 пудов материалов фабрикации. Аппарат' устано-
влен вертикально на особом помосте, так что большая часть его
находится ниже помоста и, следовательно, имеется доступ в верхней
и нижней части сосуда (рис. 210).
Внутри чугунного сосуда находится пустотелый кольцеобразный
цилиндр, диаметром и высотою около 3 фут. с двойными стенками,
подвешенный к крышке сосуда при помощи двух чугунных труб, (2,3)
сообщающихся с внутренним кольцеобразным пространством цилиндра.
По этим трубам внутрь цилиндра пускается, смотря по надобности
холодная вода или пар,—Одна из этих труб (3) имеет сообщение с между -
стенным пространством нитровального аппарата, а другая (2) служит
для отвода воды.
Внутри сосуда для перемешивания жидкостей имеется чугунная
мешалка с винтовыми лопастями. Лопасти приходятся внутри кольце-
образного цилиндра, о котором было сказано выше, и лишь немного
не доходят до стенок его. Скорость вращения мешалки 180 оборотов
в 1 минуту.
Для загрузки сосуда, на крышке его имеются два отверстия: (рис. 211)
более широкое (лаз) для вливания толуола и узкое—для вливания
кислот. Кроме того, на крышке имеются: широкое отверстие для аллю-
миниевой вытяжной трубы, отводящей выделяющиеся при нитрации
окислы азота, отверстие для свинцовой трубы, доходящей до дна
сосуда и служащей для перегонки сжатым воздухом содержимого
сосуда в другие приборы, отверстие для трубки, приводящей сжатый
воздух, наконец, небольшое отверстие для термометра.
Кислоты накачиваются предварительно в особые мерные ци-
линдры, определенной емкости, установленные на весовой платформе
около нитровального аппарата; отсюда кислоты переливаются в аппарат
самотеком.
гч>
JL...
^JvvHzu.c4v3 'Wp-oc^A/wvo-^b
------------------------миж
-r.'WM -
-г—'
Рис. 210. Схематический разрез нитровального аппарата.
паял -
Рис. 211. Нитровальный аппарат. Вид сверху.
»**>*••
Л
j
f
*
На некоторых же заводах подобное приспособление сделано для
толуола, а кислотная смесь приготовляется и навешивается в отдель-
ной мастерской, откуда готовая навеска гонится сжатым воздухом по
трубам прямо в аппарат.
Рис. 212. Наружный вид нитро-
вального аппарата.
Рис. 213. Тот же аппарат в разрезе.
В подготовленный к работе аппарат заливают 1000 килограмм
(61 пуд.) толуола.
По заливке толуола начинают впускать кислотную смесь,—всего
2820 кил. (177 пуд.). Навеска смеси составлена следующим образом:
на 1 часть тола берется:
1,67 частей серной кислоты в 66»—Вё (98%)
0,25 „ азотной „ „ 48°—Вё (92%)
0,90 „ „ „ 38°—Вё (53%)
При нитровании толуола выделяется значительное количество
тепла. В виду этого кислотную смесь вливают в аппарат медленно,—
тонкой струей, с рассчетом залить всю навеску в течение 8—16 часов,
а в междустенное пространство его пускают холодную воду.
За ходом нитрации следят по термометру, усиливая или ослабляя
ток воды и регулируя таким образом охлаждение; возрастание темпе-
ратуры в аппарате держат в границах: первые 4 часа 15*—30°С, по-
следующие 30’—40° С.
Во время прилива кислот работает мешатель; он устанавливает
наилучшее соприкосновение между нитрующей и нитруемой жидко-
стями. Цилиндр, окружающий мешатель, способствует лучшему раз-
мешиванию: лопасти мешателя выгоняют жидкость изнутри цилиндра
наружу, взамен ее под лопасти попадает жидкость, бывшая вне
цилиндра.
Рис. 214. Разрез нитровального аппарата с патентованной полой мешалкой,
в которой циркулирует холодная вода.
Когда приливание кислотной смеси закончено, охлаждение стен
аппарата прекращают, и, пуская во внутристенное пространство пар,
подымают температуру в аппарате до 65° С, причем поддерживают
ее на этом уровне в течение */, часа. Все это время продолжает ра-
ботать мешатель. Нагрев и размешивание способствуют завершению
процесса нитрования, возбуждая взаимодействие между нитруемым
веществом и ослабевающей нитрующей смесью.
Затем прекращают нагрев и мешку и делают пробу, контроли-
рующую законченность процесса нитрования.
— 414 —
По окончании процесса нитрования в аппарате будет находиться
горячая смесь жидкого—мононитротолуола и отработанных кислот.
При охлаждении и спокойном состоянии, обе жидкости быстро раз-
деляются по удельному весу—первая всплывает наверх, вторая остается
внизу.
Запасный трубопровод.
Мешалка.
Холодная вода.
Термометр.
Впуск нитру-
емого вещества.
Впуск сжатого
воздуха.
Холодная вода
для охлаждения —
мешалки.
Вытяжная
труба для
паров.
Впуск
кислот.
____ Резервуар
~ для кислот.
Рис. 215. Верхняя крышка нитровального аппарата с полной арматурой.
(В аппарате всегда оказывается некоторое количество грязи, обра-
зующейся отчасти разрушением кислотами труб и аппаратов, частью
заносимой толуолом и кислотами).
Значительное повышение выхода нитро и динитротолуота полу-
чается при помощи турбо-нитраторов (рис. 216) Неймана. Последний
состоит из двустенного нитровального сосуда А с вращающейся полой
внутренней частью В, почти такого же размера как и сосуд А. Кислоты
и нитруемый продукт поступают различными трубопроводами в ни-
тровальвый сосуд снизу, а по окончании нитрации вытекают через
кран С. Для лучшего перемешивания на наружной части сосуда В
устроены выступы а, которые заходят в впадины Ъ нитровального со-
*
суда А. Охлаждение аппарата производится пропусканием воды через
Мйждуствнное пространство сосуда А или В. Преимущество аппарата
заключается в большей безопасности в смысле последствий повышения
температуры, так как его емкость не превышает 180 литров.
Полученный мононитротолуол представляет жидкость красновато-
коричневого цвета и содержит в себе все три изомера:
20—25% пара, 73—79% орто и 1—2% метамононитротолуола:
Первый—твердое вещество, имеющее точку плавления 54°С, и
точку кипения 238°С, второй и третий жидкие вещества, имеющие
точки кипения 223°С и 230°С.
Чем крепче кислота и выше температура, тем более получается
„пара“—соединения и менее „орто“; содержание же „мета“ всегда не
превосходит 2—5%.
При 4Оо/о „пара" мононитротолуол остается еще жидким.
Контрольная проба на полноту нитрования заключается в том,
что образчик жидкого мононитротолуола 100 куб. сант. подвергают мед-
ленному нагреву до 200’С. Получающийся перегон собирают в калиб-
рованный стаканчик и измеряют. Он будет состоять из непронитро-
вавшегося толуола (точка кипения толуола около 110°С, мононитро-
толуола—выше 220°С).
Процесс нитрования считается законченным, если перегона ока-
жется не более х/2%.
Когда нитрование закончено, содержимое аппарата сжатым воз-
духом выгоняют по свинцовым трубам в разделительный цилиндр
(„сепаратор"). Он представляет собой цилиндрический чугунный или
железный сосуд с коническим дном, обитый внутри свинцом. На око-
нечности конуса имеется выпускной кран (рис. 217).
Рис. 216. Схематический разрез турбо-
натратора Неймана.
Рис. 217.
Сепаратор (схема).
— 416 —
I
Мононитротолуол и кислоты при охлаждении и при несколько—
часовом спокойном отстаивании разделяются по удельному весу. Затем ’
кислоты сливаются в бутыли, а нитротолуол перегоняется сжатым воз
духом обратно в нитрационный куб для дальнейшей обработки.
Отработанная смесь кислот, получающаяся после первого нитро-
вания, содержит:
H2SOt — 70%, HNOa-W,.
Выход мононитрртолуола: на 1 ч. толуола получается около 1,4 ч.
мононитротолуола.
§ 2. Второе нитрование ведется в тех же аппаратах, что и первое.
Дня нитрования в аппаратах заливают 850 кило (около 52 пуд.)
мононитротолуола. Затем начинают впуск кислотной смеси в количе-
стве 2010 кил. (около 122 пуд.):
1400 кило серной кислоты в 66°Вё (96—98%)
380 „ азотной „ „ 48°Вё (92%)
250 „ „ „ 36’Вё (53 >/0)
Кислотную смесь вливают в течение 21/2 — 5 часов. Стены аппа-
рата во время переливания кислот подвергаются непрерывному охла-
ждению; к концу нитрования, । температуру в аппарате постепенно до-
водят до 80°С.
По окончании заливки смеси охлаждение сменяют нагревом,
пуская во внутреннее пространство пар. Температуру в аппарате от
80°С—постепенно в продолжение часа—доводят до 110°С; в это время
продолжает работать мешатель.
11о истечении часа мешку и нагрев прекращают. Содержимое
аппарата охлаждают до 60°—80°С.—Нитрование будет достаточно полно,
если отработанная смесь кислот будет содержать не более 2,5% моно-
гидрата.
Динитротолуол, как уже говорилось—представляет собою тело с
точкой плавления 54°—бб°С.—Он также содержит несколько изомеров,
по состоит, главным образом, из твердых веществ—„орто-пара11 и
„орто-ортоа *) соединений, содержащихся в отношении 3: 2, и незначи-
тельного количества мета-динитротолуолов в общей сумме не превы-
шающих 1—1Х/2°/о-
Смесь „орто-пара" и „орто орто" имеют пониженную, в сравнении
с каждым из составляющих (70,5° и 61 °C), точку-плавления. При рав-
ных количествах их эта смесь плавится при 38°С.
Содержимое аппарата после второго нитрования в жидком виде
сжатым воздухом перегоняют вместе с кислотами в сепаратор, отли-
*) Структурно
СН3 СНз
/\NO2 NO2/\NO2
чающийся от указанного выше тем, что внутри его проходит свинцо-
вый паровой змеевик или в особый, выложенный свинцом, приемник.
В сепараторе динитротолуол, находящийся при 60—80’С в рас-
плавленном состоянии, разделяется по удельному весу of кислот,
всплывая наверх. Когда жидкости разделились, кислотную смесь вы-
пускают в подземные баки, откуда она впоследствии поступит в при-
боры Для денитрации.
Отработанная кислотная смесь содержит: динитротолуола около
2,3%. Полученная слабая азотная кислота идет в дело на составление
нитрующих смесей.
Выход динитротолуола: одна часть мононитротолуола дает 1,2 ча-
сти динитротолуола. • .
§ 3. Третье нитрование. Полученный вторым нитрованием про-
дукт нитруют дальше в тринитротолуол, предварительно переводя его
в сульфоеоединение.
Сульфирование и нитрация ведутся в том же аппарате, который
служил и для предшертвоваших нитраций.
Динитротолуол подается к аппарату по трубам в жидком виде
из сепаратора, где расплавляется помошью парового змеевика, или
переносится в ушатах.
В аппараты заливают 600 кило (около 36 пуд.) расплавленного
динитротолуола, имеющего температуру около 60°С.
Затем подают в междустенное пространство пар и начинают за-
ливку 3000 кило (около 183 пуд.) серной кислоты крепостью 66°Вё. Ее
льют широкой струей в течение 1—17а часа. В продолжение^ заливки
кислоты в аппарате поддерживают температуру 80°С, и содержимое
его размешивают мешателем. По окончании заливки еще около % часа’1’
продолжают мешку.
Затем нагрев сменяют охлаждением до 60°С и начинают заливку
азотной кислоты,.которой берется 570 кил.*) (около 35 пуд).
Кислоту льют медленной струей в течение 1 часа. В продол-
жение этого времени температуре в аппарате не дают подняться
выше 70 °C.
Когда закончена заливка азотной кислоты, охлаждение прекра-
щают и вновь прибегают к нагреву, чтобы способствовать завершению
нитрации. Температуру плавно подымают до 115°С, затем процесс
становится настолько энергичным, что температура самостоятельно
начинает расти; ей, однако, не дают подняться выше 140».
Описанная операция занимает около трех с небольшим часов
времени (от начала заливки серной кислоты). По прошествии этого
времени нитрация завершается достаточно полно.
Понизив температуру до 90—100®С, содержимое аппарата, кото-
рое все будет жидко при этих температурах, по трубам перегоняют
в железные, выложенные свинцом, отстойные чаны.
Тринитротолуол собирается сверху в виде густой массы; жидкость
спускается через краны в подставленные ведра. Отделенная азотная
кислота идет снова в дело.
*) ИЗО к. 48° В и 240 к. 38° В.
Проф. М. Сухаревский. Взрывчатые вещества и взрывные работы.
27
Тринитротолуол, полученный третьим нитрованием, содержит три
изомера, главную массу составляет симметрический изомер а, имею-
। щий точку плавления 80,5°. Несимметрические изомеры*) находятся
в незначительных количествах.
Отработанная смесь кислот содержит еще 3—5% тринитротолуола.
Газы, выделяющиеся при нитрации толуола, уходят через вы-
тяжную аллюминиевую трубу, проходят через ряд глинянных бал-
лонов, сгущаются в них в жидкость и, наконец, через небольшую
колонну, наполненную коксом, выходят наружу. Сконденсированная
кислота имеет крепость около 37%.
§ 4. Промывка. Приготовленный тринитротолуол промывается го-
рячей водой для удаления излишка кислот. Для этого тринитротолуол
выбирается из отстойных чанов аллюминиевыми черпаками, перекла-
дывается в деревянные ушаты и доставляется к промывным чанам
(рис. 218). Эти чаны деревянные, выложенны свинцом; внутри их у
дна имеется два змеевика, входящие один в другой: один из них
служит для пропуска пара, нагревающего воду, а другой для про-
пуска сжатого воздуха, служащего для перемешивания. Над чанами
установлены колпаки, соединенные с вытяжными трубами. В чаны
помещается около 65 пуд. тола. Промывка производится горячей во-
дой 5—6 раз, каждый раз по %—1 часу, пока не будет удалена вся
свободная кислота, что узнается пробой на лакмусовую бумажку.
Затем тринитротолуол, находящийся в жидком состоянии внизу
промывного чана, выпускается через кран в большую деревянную
г ванну с водой; при этом навстречу ему пускают струю холодной
воды, тол быстро твердеет и принимает форму зерен величиной с
дробинку. Отсюда он выбирается ковшами и отправляется к центро-
фугам (рис. 819), где он отжимается от влажности в продолжении
z 20 минут, до содержания влажности около 15%.
Рас. 218. Промывной чаа (схема).
Точки плавления их: ft —112*, у — 104°.
Рис. 219. Цептрофуга для отжатия
тола.
Промывные воды спускаются в особые бассейны, с поперечными
перегородками, где тол, бывший в растворе, оседает.
§ 5. а) Сушка. Она производится горячим воздухом в деревян-
ных* сушильных шкафах с полками, на которые устанавливаются лот-
ки с тринитротолуолом, насыпанным тонким слоем или на стелажах
особой сушильни. Сушка продолжается 6—8 часов. Тринитротолуол
выходит с содержанием около 0,1% влаги.
б) Кристаллизация. Как было сказано, технический тринитротолуол,
кроме симметрического соединения, составляющего главную его часть,
содержит еще несимметрические его изомеры; затем недонитрованный
динитро-и даже мононитротолуол, продукты нитрования примесей то-
луола и прочие.
Все эти соединения, примешанные к симметрическому тринитро-
толуола, содержатся в значительных количествах. Однако, присутствие
их обнаруживает точка плавления технического тринитротолуола 77°—
80"С, отличная от таковой у симмерического изомера тринитротолуола
81,&°С.
Чтобы удалить все сопровождающие примеси, полученный три-
нитротолуол подвергают кристаллизации из этилового спирта (алкоголя).
Он легко растворим в горячем спирте и очень трудно в холодном.
Растворение тринитротолуола производят в больших железных
котлах. Котел имеет форму лежачего цилиндра, нижняя половина ко-
торого одета паровой рубашкой. По оси установлен мешатель, рабо-
тающий от привода (рис. 220). Для операции заливают котел спиртом
Рис. 220. Котел с метателем для растворевия тринитротолуола (схема).
крепостью 93°—95°, к которому прибавляют ‘/о, часть толуола *); за-
тем загружают тринитротолуолом. Количество последнего не более Vs ч.
растворителя, что дает раствор, близкий к насыщенному. По загруз-
ке приводится в действие мешатель и в паровую рубашку пускают
пар, помощью которого спирт разогревается до кипения. Через два
часа растворение будет закончено.
*) Примесь эта способствует лучшему растворению.
*
i:-
я
i;
— 420
&
fl
Г'/
'W ,
№
С котлом соединены трубами кристаллизаторы, вертикальные же-
лезные или чугунные цилиндры с двойными стенками и метателем
по оси (рис. 221).
i
Рис. 221. Кристаллизатор (схема).
Полученный в котле раствор пропускают через фильтр, при чем
он освобождается от нерастворившихся примесей, после чего отводят
его в кристаллизатор.
Стенки кристаллизатора охлаждаются холодной водой; раствор,
размешиваемый мешателем, постепенно стынет и кристаллизуется.
По прошествии 24 часов содержимое кристаллизатора, размешан-
ное мешателем, выпускают по трубам в центрофугу для отжатия
спирта.
Центрофуга — обычного устройства, делающая около 2000 оборо-
тов в минуту. Отжимание продолжается 20—30 минут. Оставшийся
в центрофуге продукт содержит еще около 45°/0 спирта.
На рис. 222 и 223 показано расположение приборов на одном из
заводов. Тринитротолуол (рис. 2S3) в жидком состоянии подается
трубопроводом или лучше (в целях безопасности) в нагреваемых
паром подвижных котлах А. Из котла А он стекает в котел для рас-
*
&
ж
О
'й
v
' "Л
. i'.':
$
•a?
/ASM
АшЯ
/Я!
<As
"' '. /А
-" /А.
AM
У А
" Л=!
; мн
• 4
'•q
-
'
4
ива
- ад
y'S
Аж
лЖ
' '.<?
' -Сх
Ч-. ;Т
•;Н‘
'-ft
— 421 — <
! I ’ , г
- t
творения В, снабженный охладителем Д, где и растворяется спиртом,
поступающим из резервуара С. Смесь сжатым воздухом перегоняется
через фильтр G в кристаллизатор Н, который имеет двойные стенки
И смотря по надобности может охлаждаться водой или нагреваться
паром. Кроме того из кристаллизатора может быть выкачан воздух,
Рис. 222. Схема расположения приборов при кристаллизации тринитротолуола.
что делается с целью усилить испарение спирта и для более силь-
ного охлаждения. Пары спирта осаждаются в конденсаторе О, откуда
автоматическим приспособлением Р перегоняются в ректификатор.
Образовавшаяся в кристаллизаторе Н тестообразная кристаллическая
масса спускается в т. н. нутч J, где происходит отделение маточного
раствора и сушка кристаллов. Не осадившиеся в конденсаторе О Пары
спирта увлекаются насосом S в вторичный конденсатор R. Резервуар
N служит для нагревания воды, которой в свою очередь нагреваются
кристаллизатор и нутч. М—насос, для перегонки теплой воды.
Спирт, отделившийся от кристаллизированной массы содержит,
наряду с продуктами неполной нитрации, около 2°/0 тринитротолуола.
Поэтому фракцинированной дистиляцией испаряют % его об‘ема,
после чего его охлаждают. Эта манипуляция влечет за собой выде«
ление новых количеств нечистого тринитротолуола (точка отверде-
вания 74° С). Этот тринитротолуол промывается спиртом и просуши-
— 422 —
вается и из него выпаривается весь остаточный спирт, после чего
получается более или менее жидкая масса, состоящая из слабо нитро-
ванного толуола и других нитрованных побочных продуктов т. н.
„жидкий тринитротолуол". .
Установка для выпаривания спирта и вторичного выделения
тринитротолуола показана на рис. 224.
Система состоит из двух котлов А и В, каждый вместимостью
в 5000 литров маточного раствора. Оба котла снабжены двойными
стенками, между которыми пропускается, смотря по необходимости
пар или холодная вода. Наполнение котлов происходит по трубопро-
воду „с“, на котором устроены предохранительные клапаны. После
наполнения котла, пускается горячий пар, чем достигается испа-
рение маточного раствора на Уз об'ема. Испаряющийся спирт через
трубопровод d отводится в конденсатор D, где он, по охлаждении
Рис. 224. Аппаратура для получения жидкого тринитротолуола.
холодной водой, осаждается. Увлеченный ввиде пыли раствор задер-
живается в отсекателе С, откуда трубопроводом „с“ отводится снова
в котел. Сконденсированный спирт из конденсатора D трубопрово-
дом „g“ отводится через сосуд для под'ема жидкостей Е к сборному
сосуду. Не^конденсированные газы увлекаются воздушным насосом F
и через трубопровод Г накачиваются во вторичный конденсатор G.
После того, как содержимое котла испарилось на */з своего об'ема
и охлаждено, открывают краны f и выпускают содержимое в ва-
куум—нутч*) N. По трубопроводу 0 высушенный маточный раствор
под действием нутчевого насоса Н сбегает в т. н. монж L. Для этой цели
кран р открывается, а кран q запирается. Отделяющиеся при этом
газы охлаждаются в конденсаторе J и спирт осаждается на дно
конденсатора. Несконденсированные газы снова накачиваются во вто-
ричный конденсатор G, где и осаждаются. Когда вторая партия бу-
дет в нутче освобождена от маточного раствора, она промывается
,*) Прибор, аналогичный употребляемому на сахарных заводах для обезвожи-
вания сахарных голов.
— 424 —
чистым спиртом; после удаления последнего вентиль р закрывается,
a q открывается и нутч превращается в вакуум сушильню. (Рис. 225).
Образующиеся пары спирта осаждаются в конденсаторе J, в то время как
воздушный насос Н выкачивает из путча воздух.
Рис. 225. „Вакуум—нутч“ для сушки тринитротолуола.
в) Вторая сушка. Для окончательного удаления спирта тринитро-
толуол сушится в особых сушильнях при температуре 35—40° С.
Сушка производится на небольших деревянных лотках со стеклян-
ным дном, установленных на стелажах, как и при производстве мели-
нита. . *
г) Последней операцией является просейка тринитротолуола через
медные сита для отделения могущих попасть посторонних тел. (Рис. 226).
д) Выход тринитротолуола. На 1 ч. толуола получается 1,25 ч.
окончательного продукта.
Готовый продукт хранится в обыкновенных деревянных ящиках
по 3 пуда в каждом.
Порошкообразный тринитротолуол, будучи спрессован в патроны,
уже может быть употребляем для подрывных целей. Но если мы
имеем в виду заливать этим веществом оболочки для подрывных
патронов, то его приходится плавить, что может быть сделано и в
обыкновенных чугунных котлах с кипящей водой.
Ч- • ' . - 425
I 1 , ' I
\ I '
На заводах плавку производят в чугунных дзухстенных цилиндри-
ческих котлах, нагревая пространство между стенками паром и
производя помешивание (рис. 227—229).
Рис. 226- Аппарат для просейки тринитротоулола.
Заливка гильз и снарядов делается полузастывшей массой, а
стенки их подогревают.
е) Контрольное испытание. Готовый тринитротолуол в настоящее
время испытывают на заводах только на температуру застывания.
Считают, что эта .точка — чувствительный показатель чистоты про-
дукта.
Фабрикация тола почти не оказывает вредного влияния на здо-
ровье рабочих.
Стоимость тринитротолуола в России в 1914 г. составляла около
25 руб. за пуд.
Примечание. Взрыввещества большей плотности имеют
то преимущество, что они менее чувствительны к удару и трению,
что имеет большое значение, если они предназначаются к за-
ливке в снаряды. В 1910 году Bichel были сконструированны
аппараты для придания большей плотности плавящимся нитроте-
лам, в частности, тринитротолуолу. (Рис. 233 и 234).
Увеличение плотности достигается одновременным приме-
нением давления и быстрого охлаждения, которое получают про-
пусканием охлаждающей жидкости через междустенное простран-
ство аппарата. Рис. 235 показывает несколько измененный тип
подобного аппарата, позволяющий верхнюю часть держать в рас-
плавленном состоянии, в то время как главная масса уже отвер-
дела. (DRP № 2440 34). См. Escales „Nitrosprengstoffe"
—— 4:26
§ 6 Свойств т л а) В непрессованном виде тол*) имеет вид порошка
§ . воиства тола. еветло.желтого цвета, кристаллического строения;
удельный вес его около 1. Прессованием, под давлением 1000 атмо-
Впуск пара
Снаряд.
Вращающейся
круг. $
Узкоколейная
вагонетка.
Выпуск воды.
Рис. 227. Котел для заливки снарядов трииитротолуолом (схем, разрез).
Рис. 228. Котел для плавки тринитротолуола.
сфер, ему не трудно придать плотность 1,5; плотность же плавленного
тола: крупно-кристаллического 1,55, мелко-кристаллического 1,59.
*) Также „тротил", „тринол". Впервые был получен германским химиком
Вильбраидом в 1900 г.
— 427 —
Плавленный тол имеет в изломе вид сахара-рэ финала, но цвет
его светло-коричневый. Прессованный тол имеет светло-серый цвет.
Рис. 229. Патентованный прибор для плавки тринитротолуола
(DRP № 249978).
Состоит из двух котлов: одного для плавки, другого для сливания сплавленной
массы. Верхний котел имет покатое дно и наклонные стенки, чем достигается боль-
шая равномерность плавления. Кран для выпуска плавленной массы особым при-
способлением охраняется от засорения.
Оба эти сорта способны крошиться, в особенности прессованный.
(Рис. 230—232).
В отличие от мелинита, тол имеет значительно менее горький
вкус, не действует вредно на слизистые оболочки и кожу, почти не-
растворим в воде, не имеет кислотного характера и красящих свойств.
Тол на-чисто растворяется в бензоле, остаются в осадке только
минеральные и некоторые органические примеси.
В химическом отношении тол очень стойкое вещество; при на-
гревании при 65* впродолжение нескольких часов он совершенно не
изменяется. При 79°—81,5° он плавится, при дальнейшем повышении
температуры медленно улетучивается; при быстром нагревании—заго-
рается, но не взрывает. Положенный на раскаленное железо он также
быстро сгорает без взрыва. Температура взрыва 242—244*0; темпера-
тура газов при взрыве, по исследованию Сарро—2410*0.
— 42S —
Рис. 232. Тоже плавленного тола.
: -^1 :
•. -Г-. r - р IIAJ,.,
л
Рис. 230. Микрофотографический
снимок кристаллического тола.
ИС.
231. Тоже прессованного
тола.
Рис. 233. Аппарат для
увеличения плотности
тринитротолуола.
Рис. 234. Аппарат для
увеличения плотности
плавящихся нитротел.
Рис. 235. Аппарат для
увеличения плотности
плавящихся нитротел.* .
' От огня тол сперва с поверхности плавится, потом загорается и
горит желтым, сильно коптящим пламенем.
JK удару и трению тол мало чувствителен. В этом отношении он
соответствует влажному пироксилину с содержанием влажности свыше
15’/в и, следовательно, значительно более безопасен в обращении, чем ме-
линит и сухой пироксилин. При ударе стальной бабы весом в 50 ки-
лограмм, падающей с высоты 30 см. по тонкому слою тола, положен-
ному на стальную наковальню, было 5% взрывов, тогда как мелинит
при тех же условиях давал 20% взрывов, а пироксилин почти 100%-
При меньшей высоте падения тол совсем не взрывается.
При ударе ружейной пули, выпущенной с 20 шагов, как по-
рошкооброзный прессованный, так и плавленный тол не взрывается
и не загорается.
Растирание небольшого количества тола, положенного на же-
лезную плиту, напильником не вызывает взрыва.
К недостаткам тола следует отнести недостаточную чувствитель-
ность его к обыкновенному капсюлю, содержащему 2 грамма гремучей
ртути. Плавленный тол от такого капсюля совсем не взрывается, а
порошкообразный прессованный взрывается не всегда: чем он более
спрессован, тем труднее взрывается. Для обеспечения детонации кап-
сюли пришлось бы делать усиленными, то-есть содержащими большее
количество гремучей ртути. Вместо этого употребляют капсюли с те-
трилом, о котором будет сказано ниже. Капсюли с тетрилом содержат
1—1, 2 грамма этого взрывчатого вещества и 0, 5 — 0,8 грамма гре-
мучей ртути с 10% бертолетовой соли. Гремучая ртуть запрессовы-
вается поверх тетрила. Эти капсюли взрывают порошкообразный прес-
сованный тол без отказа, но не всегда плавленный тол. Таким образом,
при ответственных взрывах, при пользовании плавленным толом нельзя
полагаться на одни капсюли с тетрилом: нужны запальные патроны
из порошкообразного слабо-прессованного тола или, еще лучше, из
того же тетрила. Этот последний может быть взорван обыкновенным
капсюлем.
При взрывании 10-тн грамм порошкообразного тола в свинцовой
бомбе получилось расширение в 360 кб. см. При взрывании в таких же
условиях мелинита, расширение получалось, как сказано, в 378 кб. см.,
а при взрыве пироксилина—420 кб. см. Это показывает, что фугасное
действие тола уступает таковому же мелинита и пироксилина.
При взрывании 50 грамм порошкообразного тола на свинцовом
столбике обнаружилось сжатие на 15 м.м., т.-е. меньше, чем при
взрыве мелинита в тех же условиях (18 м.м.) и почти равное тако-
вому же при взрыве пироксилина (16 м.м.).
При практических взрывах, значительной разницы в действии
между толом и пироксилином не замечено. Вообще же можно допу-
стить, что тол, благодаря своей большей плотности действует иногда,—
например против железных частей, — лучше пироксилина (примерно
на 10%).
При взрывании камней тол действует так же, как пироксилин,
но менее дробит породу (получаются более крупные куски).
Способность тола взрываться от детонации через расстояние—не
велика. Так, например, шашка из порошкообразного прессованного
при умень-
тола, расположенная на деревянном бревне, взорванная тетриловым „
капсюлем, не передала взрыва толовой шашке, находящейся на рас-
стоянии 1% фута; передача взрыва последовала только
шенйи расстояния до 1/2 фута (вес шашки 1 ф.).
Тол. сохраняет способность взрываться под водой.
Б. Тетрил.
Приготовление тетрила состоит из
операций: 1) приготовления сульфо-смеси,
следующих
2) нитрации,
3) промывки, 4) перекристаллизации из ацетона, 5)сушки
§ 1. Приготовление
тетрила.
и 6) просейки.
а) Сулъфо-смесь или сульфо-кислота готовится из диметилани-
лина и серной кислоты в цилиндрическом железном аппарате А
(рис. 236), диаметром и высотою около 1 м., снабженном вертикальным
мешателем. Аппарат установлен в деревянном чане, наполняемом
водой.
На 50 килогр. (около 3 п.) диметиланилина берется 500 килогр.
серной кислоты с содержанием 96% моногидрата (66°Вё). Сперва ап-
парат загружается кислотой, а затем из жестяного цилиндрического
мерника Б в нее вливается тонкой струей диметиланилин.
Операция продолжается 1 час, при чем работает мешатель, а котел
охлаждается водой.
Готовая сульфокислота сжатым воздухом перегоняется в железный
бак В для хранения.
б) Нитрация производится крепкой азотной кислотой в цилиндри-
ческих железных, выложенных внутри свинцом, аппаратах Г (диа-
метром % м., высотою 1 м.). Стенки их двойные, по оси проходит
вертикальный аллюминиевый мешатель; внизу отверстие с краном для
спуска содержимого в центрофугу; от крышки идет железная труба
к вентилятору, высасывающему газы. Над каждым аппаратом уста-
новлен свинцовый мерник D (диаметром 0,35 м., высотою 0,7 м.),
снабженный мерным стеклом и трубой с краном для соединения с
нитровальным аппаратом.' Сульфокислота наливается в мерники по
трубам из бака В.
В нитровальный аппарат помещают 50 килогр. (около 3 пуд.)
крепкой азотной кислоты (90%). Сульфокислоту в количестве 100 ки-
лограмм вливают медленно,—в продолжение одного часа,—при по-
мешивании, наблюдая, чтобы t° не подымалась выше 50—55°, для чего
в междустенное пространство вливается вода.
Отделяющиеся при нитрации газы, вытягиваемые вентилятором,
попадают в колонный аппарат (6 колонн, высотою 5 м., диам. 0,6 м.),
где окислы азота конденсируются водой. Колонна расположена сна-
ружи здания.
При нитрации происходит следующая реакция*).
СеВДСНД + 10HN03 =
CeH4(N02)3N(N02)CH34- 8Н2О + 6NO2 + СО2
*) Теоретически, на 1 об'ем диметиланилина достаточно взять 5,2 об‘ема чистой
азотной кислоты или 6 об1емов с содержанием 86%.
в) Отжимка. По окончании нитрации содержимое' аппаратов
спускается в Центрофугу Е., заключенную в железный кожух; этот
последний соединен трубой4с отстойными ящиками, расположенцыми
вне мастерской. Жидкость в центрофугах процеживается через про»
нитрованную ткань (канву). Скорость вращения центрофуги и время
отжатия—обычные.
Рис. 238. Аппарат для приготовления сульфосмеси (схема).
Отстойные ящики деревянные, выложенные свинцом. Один из
ящиков (последний) представляет собой фильтр: он снабжен перего-
родками, не доходящими, по очереди, до верху и до дна; между ними
положен известковый камень (для нейтрализации и фильтрования).
г) Промывка. Из центрофуг тетрил переносится в промывные де-
ревянные, выложенные свинцом, чаны 3 (рис. 237). Внутри их имеется
Рис. 237. Прибор для промывки и кристаллизации тетрила (схема).
свинцовая труба для нагревания воды паром и аллюминиевый меша-
тель. Всего производится до 10 промывок, по одному часу каждая;
первые три промывки делаются холодной, остальные горячей водой.
Промытая масса поступает в воронку-фильтр И. Промывная вода
направляется в отстойные ящики, о которых сказано выше.
После промывки тетрил снова отжимается в центрофуиах и су-
шится при t не более 6О°С.
д) Перекристаллизация производится в специальных приборах,
похожих на таковые же для кристаллизации тола.
Растворителем служит ацетон, которого берется около 3 частей
на одну часть тетрила. В приборе К растворитель подогревают паром
почти до кипения; затем раствор перегоняют через фильтр Л в при-
бор Т (кристаллизатор), в междустенное пространство которого вы-
пускается вода, вследствие чего тетрил осаждается. Пары ацетона
отводятся железной трубой в такой же холодильник с медным змее-
виком.
Охлажденный раствор выпускают в воронку с матерчатым филь-
тром, на котором и собираются кристаллы тетрила.
Отработанный ацетон перегоняется в перегонном кубе Н, обык-
новенного устройства.
е) Сушка тетрила производится в сушильнях, на деревянных
лотках, положенных на такие же стелажи при t не более 60°С. Воздух
в сушильне нагревается калорифером.
ж) Просейка, являющаяся последней операцией, сходна с таковой же
при изготовлении тола и других подобных веществ.
Выход тетрила: на 1 ч. диметиланилина получается около 2 ч.
тетрила.
§ 2. Свойства тетрила. Тетранитрометиланилин *) или тетрил был
получен впервые,—сравнительно недавно,—химиком Ромбергом в Гол-
ландии, действием азотной и серной кислот на моно-и-диметиланилин.
Эти материалы представляют собою бесцветные, пахучие и горючие
жидкости.
а) В чистом' виде тетрил представляет собою порошок из ромби-
ческих кристаллов желто-зеленоватого цвета, без запаха, несколько
соленого вкуса, почти не растворимый в воде и очень мало в холо-
дном спирте. В обыкновенном состоянии тетрил содержит не более
6,08% влажности. Количество серной кислоты — не более 0,005%.
Количество посторонних примесей не более 0,15%- Плотность прессо-
ванного тетрила может быть доведена до 1,7.
б) Температура застывания тетрила 128°, но в плавленном виде
это вещество не применяется, т. к. при указанной температуре тетрил
теряет свою химическую и физическую стойкость—разлагается и от-
части улетучивается **). Нагревание же при низших температурах
тетрил выдерживает очень хорошо. От пламени и вообще при повы-
шении температуры до 205° загорается и быстро горит.
*) Волее точно его следовало бы назвать: 2, 4, 6 тринитрофенплметил—ни-
трамин.
**) Поэтому в Морском Ведомстве к порошкообразному тетрилу добавляют 1/3
по весу порошкообразного тринитротолуола и, после тщательного смешения, смесь
нагревается в той же гильзе, в которую ее надо ввести, при помощи водяной бани.
При этом тротил, как более легкоплавкий, расплавляется и цементирует неплавя-
щийся еще тетрил в сплошную массу, менее чувствительную к удару и трению, чем
порошкообразный тетрил, и хотя труднее взрываемую, но лучше детонирующую
при достаточно сильном удаие.
—— 433
Тетрил более чувствителен к удару и трению, чем мелинит и тол,
во мене» чувствителен, чем сухой пироксилин.
При ударе падающего груза в 50 килограмм по тонкому слою
тетрила, при высоте падения в 30 см., получается около С0% взрывов.
• в) Тетрил по своей чувствительности к взрыву капсюля с гре-
мучей ртутью приближается к нитроглицерину: он может быть взорван
капсюлем, содержащим 0,5 грамма гремучей ртути. Сам же он является
прекрасным детонатором для прочих взрывчатых веществ. Поэтому
в Германии уже давно стали применять тетрил для приготовления
взрывных капсюлей, в которых большая часть (1,2 гр.) прессованный
тетрил, а меньшая (0,8 гр.) гремучая ртуть. Приготовляются также
капсюли с меньшим еще содержанием этих взрывчатых веществ
(всего—1,3 гр.).
г) Хорошо отмытый от кислот тетрил не обнаруживает действия
на металлы. Замечено, впрочем, некоторое действие на железо, что
может быть об'яснено присутствием следов серной кислоты, уничто-
жить которые весьма трудно.
Вследствие большого количества соединений азота (24, 75°/в) и
большой скорости взрыва, тетрил представляет собою весьма сильное
взрывчатое вещество, превосходящее сухой пироксилин и мелинит.
д) При опытах по сдавливанию свинцовых цилиндров получилось
уменьшение их длины на 25 мм., а при опытах по образованию камер
в свинцовых бомбах получалось расширение в 480 куб. сантим.
При взрывах в стальной бомбе Сарро и Вьеля, где газами
сжимаются маленькие медные цилиндрики, обнаружено давление,
превышающее на 21’/о давление газов мелинита.
Из изложенного видно, что тетрил — превосходное взрывчатое
вещество, но применению его в больших количествах в подрывном
деле мешает его дороговизна (80 руб. за пуд. в 1914 г.). Он может
быть употреблен в качестве возбудителя взрыва для тола,—в запаль-
ных шашках, вес которых может быть 15—20 грамм (около 4 золоти.)
или в особых капсюлях *).
Для больших толовых зарядов, например, минных, запальный
заряд из тетрила должен быть 100—500 грамм.
Гексанит.
Гексанит (CuHt (NOz\ NH), действительное название которого
должно быть: гексонитродифениламин был получен несколько лет тому
назад химиком Аустеном из пикрил-нитроанилина. Ныне он изгото-
вляется на германских заводах в Грисгейме и в Круппа-Мюле. При-
готовленные последним заводом гексанитовые шашки, имеющие форму
пироксилиновых саперных, испытывались в 1909 году в Военной
Электротехнической Школе.
В химическом отношении гексанит может быть представлен в
виде соединения двух рядов нитро-групп NOz. Таким образом, нитро-
*) Капсюли для снарядов содержат 1,5 гр. тетрила, 0,8 гр. гремучей ртути и
0,25 гр. „прусского" состава, спрессованных каждый отдельно.
Пр оф, И. Сухаревский. Взрывчатые вещества и взрывные работы. 28
— 431 —
группа N02 входит в гексанит 6 раз. Количество азота в нем дости-
гает 22,3%, тогда как в мелините азота 18,3%, а в толе—18,5%.
Свойства гексанита. Гексанит представляет собою тонкий желтый
порошок. В спрессованном состоянии имеет вид твердой однородной
массы, трудно раскалываемой ножом. Удельный вес гексанита, прес-
сованного под давлением 3.000 килогр. на 1 кв, м.м, —1,65. Однако
края шашек, не имеющих оболочек, способны выкрашиваться.
Для придания большей прочности шашкам, гексанит смешивают
с небольшим количеством тола и подогревают, для сплавления тола
с поверхности.
Порошок гексанита весьма маркий; руки, запачканные гексанитом,
нельзя смыть в продолжение нескольких дней.
Гексанит, подобно мелиниту и толу, загорается от пламени с
трудом и горит, плавясь, желтым коптящим пламенем.
Гексанит плавится при 238°. При обыкновенной температуре и
при нагревании до 100° не разлагается и не изменяется. При темпе-
ратуре около 160° заметно отделение бурых паров—признак разложения.
Температура взрыва около 300°.
Относительно чувствительности гексанита к трению и удару сле-
дует заметить, что это взрывчатое вещество приближается к мели-
ниту, т.-е. стоит посредине между сухим пироксилином и толом.
При опытах удара бабой в 50 килограмм весом по тонкому слою
гексанита, запрессованному в пистоны, на стальной наковальне, с
высоты 30 см., получилось более 60 о взрыва; выше этого процента
дает, как сказано, сухой пироксилин.
Ружейная пуля 3-х лин. винтовки, выпущенная с расстояния в
20 шаг. по гексанитовым патронам, расположенным на железной под-
становке, толщиною % дм., не вызывает ни взрыва, ни загорания
гексанита.
Для взрывания гексанита можно пользоваться капсюлями в 2 гр.
гремучей ртути. Однако, нельзя быть уверенным в каждом взрыве:
иногда бывают отказы и это обстоятельство надо отнести к недостаткам
гексанита.
Гексанитовые шашки, помещенные в воду, могут быть также
взорваны капсюлем, но в этом случае отказы бывают чаще, чем при
взрывах на воздухе.
Дробящая, ударная сила гексанита больше, чем у тола, пирок-
силина и мелинита. На опытах по сдавливанию свинцовых цилиндриков
заряд в 50 грам. порошкообразного гексанита произвел сжатие ци-
линдриков на 20 м.м.
Практические взрывы, произведенные в В. Э. Школе, также ука-
зали на превосходство дробящего действия гексанита, сравнительное
пироксилином, в некоторых случаях даже на 20—30%.
Фугасное же действие гексанита, обнаруживаемое расширением
камеры в свинцовом цилиндре (380 куб. см.), уступает таковому же
сухого пироксилина (420 куб. см.), но имеет некоторое преимущество
сравнительно с мелинитом и толом.
Детонирующая способность гексанита не велика и лишь немного
превосходит таковую же пироксилина: 2-х фунтовый заряд гексанита,
расположенный на железной подставке, передает взрыв отдельной гек-
санитовой шашке без оболочки, аа расстоянии всего 15 дм.
Гексанит почти не гигроскопичен; шашка, выставленная в сырую
погоду на ночь на воздух, не изменила своего веса. Растворимость в
воде ничтожная, но вода окрашивается в красно-желтйй цвет.
На металлы гексанит, невидимому, не действует, но совершенно
безразличным к ним его считать нельзя: шашка, смоченная водой и
положенная на 2 суток между цинковой и медной пластинкой, вызвала
появление на них пятен; на цинковой были красноватые пятна, на
медной—темные.
Стоимость гексанита около 60 рублей за пуд (1914 г.).
Приготовление гексанита. Фабричным способом гексанит может
быть получен из дифениламина или метилдифениламина действием
азотной кислоты.
Метилдифениламин смешивают с азотной кислотой в операцион-
ном кубе и подогревают паром. Когда реакция, начицй7' ИТ?й оцень
энергично, нагревание прекращают, а затем, дагррв^иие продолжают
до полного прекращения выделения ^асно-бурых^арой ‘окислов азота.
Далее, смесь выливают в холодную воду, промывают горячей
водой и выкристаллизовывают из уксусной кислоты.
Таким образом, операция может быть ведена без вспомогатель-
ного действия серной кислоты, что представляет большое преимущество,
так как окончательный продукт может быть легче и полнее промыт,
, а это имеет значение в отношении стойкости этого взрывчатого ве-
щества и неизменяемости его при хранении.
Можно также приготовить гексанит, получив сперва динитроди-
фениламин из других нитросоединенйй и анилина, а потом донитро-
вывая его далее при помощи азотной кислоты. При этом динитроди-
фениламин смешивают сперва с слабой азотной кислотой (32ф), а
потом нагревают с более крепкой (46°Б). Полученный продукт про-
мывают спиртом и водой.
Вообще приготовление гексанита в чистом виде облегчается, бла-
годаря весьма малой растворимости его в чистой или содержащей
кислоты воде. ,
ГЛАВА VI.
Пикриновая кислота и пикраты.
§ 1. Приготовление пикриновой кислоты, из которой путем пере-
плавки получается мелинит, производится следующим образом.
а) Пикриновая кислота, как уже говорилось выше, получается
из фенола (карболовая кислота),*) CeHsОН, действием на него крепкой
-- ’ . с
*) Во время последней войны большой спрос на пикриновую кислоту заставил
прибегнуть к получению ее из бензола, переводя его, действием хлора в хлор-бевзол
CeHsCl. При нитрований последнего, получают сперва динитрохлорбензол, а затем
действием щелочей—дийитрофенол, который далее донитровывается азотной кислотой,
при нагревавии.
Латкой кислотой, однако, вследствие получающейся при этом высокой
; температуры, предпочитают смешивать предварительно с серной кис-
лотой (66* Вё); полученную затем сульфофеноловую кислоту обраба-
тывают азотной кислотой, плотностью 37® Вё.
Примечание: Азотная кислота получается смешением?в
< каменных сосудах 5*/4 пудов азотной кислоты плотностью 40° Вё
' с 3‘/а пуд., отработанных кислот меньшей плотности (30—34° Вё).
Наливание кислот производится посредством сифона, перемеши-
вание—сжатым воздухом.
Для приготовления сульфофеноловой смеси, фенол, хранящийся
обыкновенно в жестяных цилиндрах, плавят в чугунном эмалиро-
ванном котле, нагреваемом паром, наблюдая при этом, чтобы темпе-
ратура фенола не подымалась выше 70° С. Расплавленный фенол до-
ставляется в жестяных закрытых ведрах к каменным сосудам (рис. 238),
помещенным в деревянные чаны с бетонным дном; между стенками
помещается песок. В сосуды наливается сперва 5’/2 пуд. серной кис-
лоты и 1 п. 9 фунт, фенола. При ртой операции температура повышается
до 100* С. Несколько охлажденный сульфофенол, но не ниже 50® С,
разливают в глиняные цилиндрические сосуды, емкостью около 1 пуда,
с краном внизу, и отправляют в отделение для нитрации.
б) Нитрация производится в больших глиняных нитрационных
кубах (рис. 239) с крышкой, лежащей на закраинах и имеющей от-
Рис. 238. Схематический разрез ка-
менного сосуда для получения суль-
фофеноловой смеси.
Рис. 239. Схематический разрез ку-
ба для нитрования сульфофенола.
верстия для вливания сульфофенола, для перемешивания и для
отвода газов. Эти кубы также помещаются в деревянные чаны с дном,
выложенным бетоном. Каждый куб) соединен посредством изогнутой
гончарной трубы с серией подобных же сосудов, называемых охлаД-
никами (рис. 240) и служащими для конденсации окислов азот»;
Охладники наливаются до половины водой.
Для производства операции в куб наливают 9 п. 6 ф. азотной
кислоты и делают соединение с охладниками. Рядом, на особой полке,
устанавливается сосуд с сульфофенолом и затем начинается вливание
его тонкой струей через глиняную воронку. Всего вливается 6 п. 29 ф.
сульфофенола, т.-е. все приготовленное количество его, при чем опе-
рация продолжается около 1*/2 часа.
По окончании вливания сульфофенола, содержимое нитрацион-
ного куба перемешивают сжатым до 6 атмосфер воздухом. Для этого
через отверстие крышки опускают до дна куба стеклянную трубку,
соединенную с воздуходувным аппаратом. Перемешивание продол-
жается 8Д—1 час.
При реакции получается пикриновая кислота и освобождается
серная кислота и вода. Попутно выделяется большое количество
окислов азота, которые сгущаются, как сказано, в охладниках. Далее
газы поступают в „колонный аппарат" (рис. 241), составленный из
Рис. 240. Охладники для конденсации
окислов азота.
Рис. 241. Схематический вид колонного
аппарата.
керамиковых цилиндров, образующих несколько колонн, и, наконец,
выходят наружу. Каждый цилиндр снабжается дырчатым дном и
заполняется большим числом мал;ых глиняных цилиндров (рис. 242).
В колонны пускается вода, которая разливается nd всем малым ци-
линдрам, поглощает окисли азота и выливается через нижние трубки
в особые приемники.
--.135
Ч
_ Вместо малых глиняных цилиндров колонны могут быть напол-
нены кусками кокса. '
, в) На другой день после нитрации снимают крышки с нитра-
ционных кубов и удаляют сифоном кислоту, для чего приходится
прокалывать об‘емистый слой кристаллов пикриновой кислоты, нахо-
дящийся на верху. Затем пикриновую кислоту перекладывают, при
помощи эбонитовых черпаков, в большие цилиндрические чаны, уста-
новленные на тележках (рис. 243).
Рис. 242. Глиня-
ный цилиндр.
Рис. 243. Подвижной цилиндри-
ческий чан.
Через несколько часов спускают через кран остатки серной кис-
лоты, а пикриновую кислоту доставляют, для промывки, к деревянным
промывным чанам (рис. 244), с промежуточным решетчатым дном и
краном. В каждый чан помещают около 16 пуд. пикриновой кислоты.
Промывка производится холодной водой много раз, пока количество
серной кислоты не будет менее 0,02%. Каждый раз берется 20 ведер
воды, перемешивание производится 3 часа, после чего воду спускают
и наливают свежую воду. В общем промывка занимает около 2 суток.
После промывки пикриновую кислоту, содержащую 15 — 20%
влажности, перекладывают деревянными лопатами в бочки или ушаты
и в них переносят к центрофугам для отжатия воды.
Центрофуги в общем такие же, какие употребляются при пиро-
ксилиновом производстве. Они вмещают окодо 3 пудов пикриновой
кислоты и вращаются со скоростью 1.200 оборотов в минуту.
/• Отжатие продолжается 5 минут после чего пикриновая кислота
имеет уже 5 — 6% влажности.
После отжатия воды, пикриновая кислота переносится в ушатах
в сушильню, где досушивается нагретым до 60<>С воздухом в .про-
должение 16 часов,—до содержания влажности 0,25%.
Сушка производится на лотках (рис. 245) со стеклянным дном,
размещаемых на стелажах, сделанных из углового железа.
Последней операцией с пикриновой кислотой является просейка,
производимая в ситах с медным сетчатым дном (рис. 246). От сит
1
439 —
спускаются рукава в подставленные деревянные ящики, а сверху
сита закрываются крышками с кожаным верхом. Сита приводятся в
движение машинами, или вручную. Просейка 18 пудов занимает
4—5 часов.
Рис. 244. Деревянный промывной
чан (схема).
Рис. 245. Лоток для сушки пикрино-
вой кислоты.
Рис. 246. Сито для просейки пикри-
новой кислоты (схема).
Пикриновая кислота, содержащаяся в промывных водах, осаж-
дается в 6 особых деревянных отстойных чанах, соединенных рукавами
друг с другом (рис. 247).
Рис. 247. Отстойный чан для осаждения пикриновой кислоты из промывных вод.
(Вертикальный разрез)*
В самое последнее время дорогие глинянные нитрационные кубы
постепенно заменяются железными нитрационными котлами. Это ново-
Айедёние позволяет производить одновременную нитрацию крупных
Партий фенола примерно в 1000—2000 klgr.
Согласно этого способа берут 94 част, фенола и смешивают
при непрерывном помешивании с 400 част. 2О°/о олеума. Для образо-
вания дисульфофеноловой кислоты смесь нагревается в продолжение
5 часов до 90—100°. Последнюю разбавляют 200 част, серной кислоты
(1,84) при температуре ниже 50е, при чем сначала приливают 80 част,
серной кислоты (1,46), затем еще раз 80 част, при t° 60—80° и, на-
конец, еще 100 част, при t® свыше 80°. Пикриновая кислота выде-
ляется в виде желтых кристаллов. Если в пробе при приливании
серной кислоты будет наблюдаться дальнейшее выделение пикриновой
кислоты, нитрацию продолжают. Этим способом достигается также
большой выход продукта (200—205% вместо 186% при старых способах;
теоретический выход—243,5%).
Marquerol и Loriette предполагают, что сравнительно незначи-
тельный выход пикриновой кислоты при старых способах об’ясняется
не окислением, как предполагалось раньше, а растворимостью динитро-
сульфосмеси в маточных растворах. Для увеличения выхода они реко-
мендуют после нитрации нагревать продукт до 110—112°.
Во Франции и до наших дней сохранился способ Келера, в ко-
тором при нитрации вместо азотной кислоты употребляют чилийскую
селитру и серную кислоту.
г) Для получения собственно мелинита пикриновую кислоту пла-
вят. Плавка мелинита производится в медных, вылуженных чистым
оловом, ведрах, вмещающих 3 пуда пикриновой кислоты. Эти ведра
опускают в медные котлы с глицерином, нагреваемые особыми пе-
чами. Плавка производится при температуре не более 170® в продол-
жение 1*, 2 часа. Затем ведра вынимают из котлов и оставляют Стоять
до следующего дня. Для выбрасывания мелинитовых болванок ведра
снова немного подогревают, опуская в горячий глицерин, затем их
опрокидывают. Болванки очищают медными стамесками сверху и снизу
от осевших или всплывших наверх примесей. Далее болванку разби-
вают на куски и укладывают в боченки.
Для заливки снарядов или оболочек для патронов, плавку про-
изводят вторично. Металлические оболочки для мелинита должны
быть лакированы. Заливку снарядов производят под давлением сжа-
того воздуха (до 250 фунт, на 1 кв. дюйм). Вообще при заливке надо
принимать меры, чтобы в мелините не образовалось бы пустот.
При плавке мелинита отделяются газы, вредные для здоровья
(расстройство дыхательных и пищеварительных органов).
Для приготовления патронов из порошкообразного мелинита, плав-
ленный мелинит измельчают в мельницах с медными лужеными жер-
новами.
Полученный мелкий порошок просеивают через медные сита,
затем сушат, пока будет не более 0,1% влажности, и запрессовывают
гидравлическим прессом в гильзы. Для прессования гильзы помещают
в стальные матрицы. Давление доводится до 400 атмосфер.
Для помещения капсюля, в прессованной шашке высверливается
на горизонтальном станке отверстие ц, после того патрон снабжается
крышкой и запаивается.
Мелинитовые подрывные патроны делаются также состоящими
из плавленного и порошкообразного пироксилина вместе; оболочка
заливается вся плавленным мелинитом и потом в затвердевшем ме-
лините высверливается гнездо для помещения детонатора из порошко-
образного мелинита или оболочка заливается на а,з, а верхняя часть
ее заполняется порошкообразным прессованным мелинитом.
Материалом для оболочек может служить латунь и жесть.
Стоимость пикриновой кислоты, не обращенной в патроны—22 р.
за пуд (в 1914 г.). х
а) Мелинит представляет собою твердое тело
§ 2. Свойства мели- кристаллического строения, желтого цвета; на вкус
ии та‘ очень горек. Плотность плавленного мелинита—1,6;
плотность порошкообразного прессованного—1,4.
Мелинит немного растворим в холодной воде (1:90); в горячей
же воде растворимость его гораздо более (1:20). Еще лучше мелинит
растворяется в спирте, бензоле и эфире. Растворы его сильно окрашивают
в желтый цвет кожу и ткани животного происхождения, как, напри-
мер, сукно, шерсть, шелк и проч.
Мелинит способен крошиться; пыль его сильно раздражает ды-
хательные пути, вследствие этого, его необходимо помещать в оболочки.
Температура плавления мелинита 122,5’С.
Быстрое повышение температуры до 300°С. вызывает взрыв ме-
линита подобно обыкновенному черному пороху.
От пламени мелинит загорается и горит медленно сильно коп-
тящим пламенем; горение ‘ мелинита в малых количествах опасности
не представляет.
б) Для взрывания плавленного мелинита необходим усиленный
капсюль,—с количеством гремучей ртути более 3 грамм, цри запальный
патрон, состоящий из 20 грамм порошкообразного прессованного мели-
нита, взрываемого обыкновенным капсюлем. Для взрывания плавлен-
ного мелинита пригоден также сухой пироксилин. Однако при всех
этих способах иногда случаются неполные взрывы (до 1О°/о всех
взрывов)* *).
Удар ружейной пули из трех-линейной винтовки с расстояния
в 20 шагов не вызывает взрыва мелинита; но иногда он загорается,—
например, в том случае, когда пуля не рронизывает насквозь ящика,
в котором он находится, а пробивает только одну стенку.
Удар и трение, случающиеся при обыкновенных условиях, не
вызывают ни взрыЬа, ни загорания мелинита, а потому он может
считаться довольно безопасным в обращении веществом. Однако, со-
вершенно безопасным его назвать нельзя. Были случаи взрыва мели-
нита не только в сушильнях и складах, но и при фабрикации (на-
пример 25-го апреля 1901 г. на химическом заводе Griesheim —
в Германии). <
> - f • ? .
; • V
*) Во влажном состоянии при 5°|в содержания воды прессованная пикриновая
кислота взрывается от капсюля с 1-грм. гремучей ртути. При 6°|0 содержания воды
наблюдаются уже отказы, а при 1О°|о воды требуется уже капсюль с 2 и более грм.
гремучей ртутн. При примеси 2°;0 вазелина требуется капсюль с 1,5 грм. гремучей
ртути, при 3^10 вазелина—2 грм. гремучей ртути, а при 5°'й—3 грм. гремучей ртути.
Удар бабы весом, в 50 килограмм, с высоты 30 см. по пистонам,
заключавшим в себе 0,1 грамма мелинита, вызывал взрыв их в 2-х
случаях из 10 (20 7в).
Пироксилин при этих условиях почти всегда взрывается.
в) Мелинит способен передавать взрыв от одного заряда к дру-
гому на некотором расстоянии. Это расстояние при благоприятных
условиях достигает:
при заряде весом 2 фунта 1 фут.
л « я 10 я 5 ,,
я я ?? 15 п L5 „
я » я 30 я 15 „
Однако, детонация через указанные расстояния не всегда удава-
лась, а потому воспользоваться этим свойством мелинита при рас-
положении зарядов на железных мостах, не прибегая к вставлению
капсюлей в пассивные заряды — нельзя. Тем не менее указанная
способность мелинита должна быть отнесена к достоинствам его, так
как позволяет не заботиться о плотном соприкосновении частей за-
ряда между собой, что иногда бывает затруднительно при П—образных
и Т—образных поясах ферм.
г) Подрывная сила мелинита, если судить по результатам взры-
вов, весьма близка к силе сухого пироксилина, имеющего плотность
1,2 и содержащего около 13’/0 азота. В некоторых случаях, например,
при взрывании железа и при известном соотношении между толщи-
ной плиты и размерами зарядов по высоте и ширине, мелинитовые
заряды действовали несколько лучше пироксилиновых.
Взрыв 50 грамм порошкообразного, прессованного в ручную, ме-
линита на свинцовом столбике, состоящем из двух цилиндриков, по
верх которых положена стальная накладка, вызывает сжатия их на
18 мм. Пироксилин при этих условиях дает сжатие в 16 мм.
При взрывании 10 грамм порошкообразного мелинита в свинцо-
вой бомбе Трауцля обнаруживается расширение камеры в 378 куб.
см.; такое же количество сухого пироксилина производит в бомбе
рассширение до 420 куб. см.
При взрыве мелинитовых зарядов отделяется большое количест-
во ядовитых газов, вследствие значительного содержания окцси угле-
рода в продуктах разложения.
д) Пикриновая кислота и пикраты, такие соединения, в которых
кислорода недостаточно, для образования полных продуктов окисленгя
углерода и водорода — углекислоты СО2 и воды Н2О Поэтому для них
ход разложения при взрыве не так прост, как, напр., для нитроглицерина
С.Нз(М03)2, который заключает достаточное количество кислорода для
полного сжигания горючих элементов. Сравнительно с нерастворимым
пироксилином для пикриновой кислоты продукты горения в общем
сложнее, а именно, сказывается это главным образом в образовании
при больших плотностях газов относительно большого процентною
содержания болотною газа — СЩ (метана).
Из исследований Сарро и Виелля над составом продуктов горе-
ния пикриновой кислоты при различных плотностях заряжания, для
— 443 —
плотности J = 0,50, отвечающей давлению, газов в 7,400 атмосфер
имеем следующий состав на 100 об'емов постоянных газов следова-
тельно без воды:
углекислоты . . . . 2О,5°/о,
окиси углерода. . . 48,8°/0,
азота............................. . 19,8%,
водорода...........3,1%,
болотного газа. . . . 7,8%,
Об’ем постоянных газов на 1 кгр. пикриновой кислоты (при 0* и
давлении 760 мм.) —725 куб. метров. Эти результаты выражаются
довольно сложными уравнениями. Но для практических целей, при
вычислениях, производимых; для вывода формулы давлений, развивае-
мых пикриновой кислотой в замкнутом пространстве, можно пренебречь
образованием болотного газа и принять такое приближенное уравнение
реакции при взрыве-
2C6H2(N02)30H = СО2 4-Н2О + 11С0 + 2Н2+3No
Для такого уравнения вычисляются следующие характеристики
взрывчатого действия для пикриновой кислоты, которыми пользуются
при вычислениях давлений: об'ем газов, образуемым 1 кгр. пикриновой
кислоты при взрыве V° = 877 литров (при 0° и давлении 760 мм.),
количество тепла 767 калорий (единиц тепла), температура при взры-
ве t° = 2,430* Ц., коэффициент f, так называемая сила взрывчатого ве-
щества = 8,960.
Те же величины, напр.: для дымного военного пороха V* = 280
литр., t° = 2,750*, f = 3,190; для пироксилина V° = 860 литр., t° — 2,710?,
I' = 9,700. '
При недостаточности в пикриновой кислоте и пикратах кисло-
рода для полного окисления углерода и водорода, выгодно смешивать
эти взрывчатые химические соединения с селитрами или другими со-
жигающими деятелями, чтобы получалось при горении большее коли-
чество углекислоты и водяного пара.
При производстве подрывных работ и для действия разрывных
снарядов имеет значение достижение возможно большого давления
на оболочку при взрыве.
На скорость взрывчатого разложения (детонации) оказывает су-
щественное влияние строение самцх взрывчатых веществ. Кристалличе-
ское однообразное состояние пикриновой кислоты благоприятствует быст-
рой передаче детонаций. Для нея скорость детонации 6, б00 метров в
секунду. Для нитроглицерина эта скорость 1,300 метр., для динами-
та—2,700 метр., для пироксилина при плотности его О,7— около 4,000
метр., а при плотности от 1,1 до 1,2 —около 6,000 метр.
Из опытов Ру и Сарро вад разрыванием чугунных бомбочек
оказалось, что при воспламенении накаленным, телом пикриновая кис-
лота в этих снарядах взрывается, но с силой в .2% раза меньшей,
нежели при взрыве с помощью детонатора.
Wit' ’ 4o/eo Это есть смесь 40% мелинита и 60% тринитро-
Г v . ?е,н-пнт ' ’ метакрезола. Применяется преимущественно в военном
'деле. Крезилит 40/60 получается сплавляя под водой компоненты,
при чем точка плавления сплава равна 85°С; смесь обладает при
65’ — 70’С большей пластичностью, благодаря каковому свойству она
чрезвычайно удобна для снаряжения артиллерийских снарядов. После
сплавления составных частей, массу в горячем виде фильтруют, вы-
ливают на стол, измельчают и зернят, затем просеивают сквозь сито
и сушат при 45°С. Нагретая до 70°С смесь эта превосходно прессуется.
Нитропроводные крезолов обладают взрывчатыми свойствами, сход-
ными с крезолом, но пока практического применения не получили.
Соли пикриновой кислоты и нитрокрезолов суть также взрывча-
тые вещества по большей части более чувствительные к механичесщтм
влияниям нежели соответствующие им кислоты и уступают им по
своей мощности.
Крезилаты — соли тринитрометакрезола имеют свойства сходные
с пикратами и из них только крезилат аммония обладает достаточною
безопасностью в обращении для практического использования. Он
применяется в Австрии*) и обладает прекрасными взрывчатыми каче-
ствами, а также употребляется там как для снаряжения снарядов, так
и в виде подрывных патронов. К попаданию ружейной пули он относится
пассивно; он сильнее динамита № 1 (гурдинамит с 75% нитроглице-
рина), но несколько слабее не только мелинита, но и крезилита.
Были сделаны многочисленные попытки использовать практически
аммиачные крезилаты путем смеси их с селитрами, преимущественно
с аммиачной, и одно время они выделывались во Франции под наз-
ванием взрывчатых веществ типа С, но оказались менее выгодными
сравнительно с веществами с нитронафталинами и потому фабрикация
их была приостановлена.
§ 4. Пиираты. • Мелинит обладает свойством кислоты и способен заме-
щать свой гидроксильный водород металлом, образуя пикраты. По-
следние могут также образоваться при хранении пикриновой кислоты
в металлических оболочках (кроме оловянных, вследствие чего об-
разование пикратов может быть отчасти предупреждено тщательным
лужением оболочек).
Пикраты могут быть приготовляемы различными 'способами: пре-
имущественно взаимодействием пикриновой кислоты с углекислыми
солями металлов, так могут быть приготовлены пикраты: калия, натрия,
аммония, бария, стронция, кальция, магния, марганца и некоторые дру-
гие; они получаются при взаимодействиях пикриновой кислоты с
углекислыми солями металлов. Пикраты железа, ртути, цинка, свинца,
меди, аллюминия, нпккеля приготовляются при посредстве пикрата бария.
Пикраты олова, сурьмы готовятся иными, особыми для них способами.
а) Пикрат калия. С6Н2(МОя)зОК получается таким образом. Налив
в чашку воды (20 ч. на 1 ч. пикр. кислоты), доводят ее до кипения,
и затем в ней растворяют пикриновую кислоту. В горячий раствор,
прибавляют небольшими порциями поташ К2СОз (82 ч. на 100 ч. пикр.
кислоты). Нагревание продолжается до тех пор, пока не прекратится
*) Иногда ошибочно называется экразитом.
— 445 —
выделение углекислоты. По охлаждении раствора кристаллизуется
пикрат, который высушивается (при 50—60®С.). Растворимость пикра-
та калия в воде слабее, нежели пикриновой кислоты: 1 ч. его раст-
воряется в 260 и. воды при 15°С. и в 14 ч. при кипячении.
Кристаллы пикрата калия—длинные золотистожелтые призмы с
несколько металлическим отливом. При осторожном нагревании пи-
крат окрашивается, в краснооранжевый цвет, но при охлаждении при-
нимает свой прежней цвет. '
Пикрат бария приготовляется таким образом. Пикриновая кислота
растворяется при кипении в таком же относительном количестве во-
ды, как и для получения пикрата калия и к этому насыщенному
раствору, при постоянном перемешивании, прибавляется небольшими
порциями углебариевая соль ВаСО3 в пайном отношении к пикрино-
вой кислоте (42—45 ч. на 100 ч. пикриновой кислоты). Ее необходимо
прибавлять понемногу, потому что происходит энергичное выделение
углекислоты. Кристаллы пикрата бария после высушивания (50—60°),
содержат кристаллизационную воду, а икенно 11, 2%, так что эта
соль выходит состава [CeH2(NO2)3O]2. Ва-]-5На0. Пикрат теряет боль-
шую часть кристаллизационной воды (10, 5%) при температуре от
100 до 12О°С.
Пикрат бария кристаллизуется в виде призматических косых
призм четыреугольного сечения цвета золотисто — желтого с шелковис-
тым отливом. Пикрат хорошо растворим в воде.
Подобно пикрату бария, .приготовляются пикраты стронция, каль-
ция и магния, а также никкеля и марганца.
б) Приготовление пикратов железа, цинка, меди-и ртути произво-
дится посредством пикрата бария. Принтом следует брать для взаимо-
действия такие соли металлов, чтобы получилась нерастворимая ба-
риевая соль, лучше всего сернобариевая соль В a 80±, которую уда-
лить легко из смеси фильтрацией. Для получения пикратов к нагре-
тому раствору пикрата бария прибавляют соль данного металла в пай-
ном количестве. Так, напр., на 100 ч. пикрата бария требуется 42 ч.
железного купороса Fe SO, + 7 Н2О, 43 ч. цинкового купороса
Zn 5 04-{-7Н20, 38 ч. медного купороса CuS04H-5H20, 44 ч. серно-
ртутной соли HgSO* для получения пикратов закиси железа, цинка,
меди и ртути. Образующиеся пикраты содержат кристаллизационную
воду.
в) Свойства пикратов. 1) Пикраты, как сказано, более опасны в
обращении, чем пикриновая кислота’(наиболее чувствителен к удару
пикрат свинца).
2) Взрываются от воспламенения огнем или от капсюля с 1 грам.
гремучей ртути (в последнем случае действие пикратов более сильное).
- 3) Пыль некоторых пикратов, воспламеняясь от огня, способна
вызвать взрыв во всей массе пикрата.
4) Температура взрыва различных пикратов различна, и колеб-
лется в пределах 258—360°. ; . <
5) Сила взрыва не одинаковая:’ от вильнода) взрыва (пикраты
свинца, бария, калия) до слабой вспышки (пикраты—железа, никке-
ля, аллюминия). ' _
Гремучая ртуть и азиды.
R. Гремучая ртуть.
1. Приготовление гремучей ртути. Способ получения гремучей
ртути Говарда не давал хорошего выхода ее. Позднее целесообразные
способы были выработаны Либихом, Шанделоном и др.
На Охгенском заводе взрывчатых веществ гремучую ртуть гото-
вляли следующим способом:
а) Растворение ртути в азотной кислоте. Предварительно ртуть
протирается через полотно, затем она отвешивается в стеклянных
банках, ровно по 1 фунту. О чистоте ртути судят; между прочим, по
способности ее легко перекатываться в мелкие шарики.
Отвешенное количество (1 ф.) ртути вливается
т—j- в длинные узкогорлые колбы (рис. 248), которые
ставятся под навесом с тягой в ванну с водой,
подогреваемой паром. Температура воды поддержи-
вается в 35—40 градусов С.
Азотная кислота — плотностью 40°Вё отвеши-
вается в стеклянные стаканы по 11 ф. в каждом,
J I и содержимое 1 стакана вливается в колбу со ртутью.
У Растворение продолжается около 1 часа.
/ \ Получаемая на заводе азотная кислота иссле-
дуется на присутствие серной кислоты при помощи
; -О6'* ' / хлористого бария: осадка не должно быть, а также
\_на присутствие хлора при помощи азотно-кислого
серебра: при действии на раствор кислоты (1:70)
Рис. 248. Колба допускается появление лишь легкой мути.
для ртути. б) Обработка раствора спиртом. Получаемый
спирт имеет крепость 90°; он поступает в особые
цистерны (рис. 249), имеющие каждая — 2 наружные мерные трубки
(с.с.). Для выпуска спирта открываются краны вв. Отмеренные коли-
чества спирта, около И фунтов (10 ф. 60 з.) из сосуда d с боковым
горлом переливается в другие цинковые кувшины, которые относятся
в мастерскую для получения гремучей ртути.
В мастерской на особом помосте установлены в два ряда 12 стек-
лянных, широкогорлых колб А (рис. 250)—диаметром около 1 фута с
кранами. В эти колбы вливается из кувшинов спирт. Колбы при по-
мощи глиняных (керамиковых) муфт— d и таких же колен е—соеди-
нены с продольной трубой служащей для отвода газов. Эта труба,
в свою очередь, сообщается с рядом глиняных балонов с (рис. 251),
поставленных в наполненный водой чан, и служащих для поглощения
окислов азота. Прошедшие через баллоны газы направляются в вы-
тяжную трубу, в которой тяга усиливается паром, или в конденсан-
ционную колонну. (Рис. 252).
В эту же мастерскую приносятся и узкогорлые колбы с раство-
ром азотно-кислой ртути и устанавливаются по одному у каждого, со-
— 447 —
CL
Рис. 249. Цистерны для спирта.
Рис. 250. Шнрокогорлая колба, соединенная с трубой для отвода газов.
Рис. 251. Глинянные баллоны джя ногяощевня овисдовазота.
МММ*
_ ... .„i.ujui ин—мш ..
3SEJ—
— 448 —
суда со спиртом. По приказанию мастера рабочие одновременно при-
ступают к.заливке ртутного раствора в указанные сосуды со спиртом.
Опорожненные колбы относятся опять под навес, где снова в них
приготовляется раствор ртути в кислоте.
Рис. 252. Установка реторт с
конденсационной башней (боковой вид).
Рис. 253. Тоже (вид сверху).
Через несколько минут по вливании раствора в спирт начинается
реакция; температура мало-по малу повышается до кипения жидко-
сти (58—81°С), при чем все сильнее и сильнее начинают выделяться
белые пары азотно-этилового эфира- Через полчаса реакция ослабе-
Рис. 254. Охладянк.
гремучую ртуть про-
вает (температура 50—45°С); под конец выделяются одни окисли
азота и кипение делается все спокойнее. Образовавшейся гремучей
ртути дают некоторое время отстояться, так что вся операция зани-
мает 4 часа. На некоторых заводах промывку начинают, как только
колба станет проясняться. Повышение температуры в начале процес-
са не представляет опасности и сосуды не должны охлаждаться во
избежании получения в продукте сравнительно большого процента
металлической ртути.
в) Промывание гремучей ртути. Сняв каменные колена широко-
горлых колб и слив осторожно жидкость й глинянные сосуды, так
называемые охладники (рис. 254), вытряхивают
гремучую ртуть в глинянные тазы; затем спо-
ласкивают колбу 2 раза, при чем в первый
раз воду сливают в таз, а второй раз в охлад-
ник. В один таз собирают ртуть с 6 колб.
После этого таз относят в отдельные по-
мещения, где производится отмывка гремучей
ртути от кислот. Первоначально в таз нали-
вают 2 кружки воды и гремучую ртуть пере-
мешивают руками (в резиновых рукавицах) в
продолжение */< часа; затем вода сливается и
промывка продолжается свежей водой. Таких
промывок должно быть не менее восьми, пока
промывные воды не перестанут показывать
кислотность на лакмусовую бумажку. Наконец,
свивают в тазу с водой через сито.
Выход гремучей ртути: На 1 часть металлической ртути 2,25
части (теоретический выход - 1,42 ч.).
Рис. 255. Общий вид мастерской гремучей ртути.
Ироф. AL Сухаревский. Взрывчатые вещества и взрывные работы.
29
После промывки гремучая ртуть во влажном состоянии уклады-
• вается по 10 фунтов в стеклянные банки.
Для очистки гремучей ртути может быть применен раствор ци-
анистого калия, с выделением ее из раствора азотной кислотой или
пиридин (CJ1-N), из которого гремучая ртуть осаждается водой. Пос-
ледний способ лучше, так как при нем не выделяется вредных газов.
г) Слитые кислоты, вместе с водой от ополаскивания колб, от-
стаиваются в течение суток, после чего кислоту сливают, а остаток—
гремучая ртуть от нескольких партий производства за день, доходя-
Щий до 8—10 ф., поступает в тазы для промывки, при чем его до-
бавляют к промываемой в то время партии гремучей ртути.
Слитые кислоты, а равно и промывные воды выливаются в на-
ходящийся по близости колодец с сеткой, прикрытой навесом. Про-
изводство гремучей ртути ведется обыкновенно один летний месяц.
В день приготовляют несколько партий—в общей сложности не бо-
лее одного пуда гремучей ртути.
§ 2. Приготовление белой гремучей ртути. Если приготовлять грему-
чую ртуть по старым способам из ртути, азотной кислоты, и спирта, без
прибавлений каких-либо примесей, то всегда будет получаться более
или менее серый продукт, который даже в самых светлых своих ню-
ансах будет отливать сероватым или желтым оттенком. Lobry de Brun
полагает, что серый цвет происходит от того, что реакция не вполне
доведена до конца; другие химики об'ясняют это загрязнением мел-
кими частицами жидкой ртути, а Бертелло и Вьель на основании анали-
зов гремучей ртути утверждают, что фульминаты гремучей ртути
должны содержать металлическую ртуть. Теоретически содержание
ртути в гремучей ртути равно 70,42% (по определению Вертело и
Вьеля 71%). Предположение, что всякая, даже совершенно чистая
гремучая ртуть загрязнена очень незначительным */о содержания ме-
таллической ртути, было опровергнуто А. Солонина. По новейшим,
улучшенным методам анализа как серой, так и белой гремучей ртути
получаются результаты, близкие к теоретическим. Даже при испыта-
нии^а золотых пластинках и под микроскопом ни в серой, ни в бе-
лой гремучей ртути не удалось найти ни малейшей примеси метал-
лической ртути. Правда, гремучая ртуть, приготовленная заводским
путем, часто загрязнена ртутью, что легко можно различить под
сильным микроскопом. Ниже мы приводим несколько ^икро-фотогра-
фических снимков чистой и содержащей металлическую ртуть грему-
чей ртути. Рис. 256 дает при 150 кратном увеличении ёнимок с пробы
гремучей ртути заводского приготовления, где даже невооруженным
глазом можно различить капельки ртути. Рис. 257 изображает
кристаллы серой, рис. 258, белой гремучей ртути полученной
прибавлением меди и соляной кислоты. Па этих снимках можно от-
четливо различить большие кристаллы серой и красивые, правильные
очертания белой гремучей ртути. Но в то же время одними исследо-
ваниями под микроскопом никогда нельзя решить вопрос о загрязне-
нии гремучей ртути присутствием ртути, так как не исключена воз-
можность, что ртуть содержится в кристаллах гремучей ртути в раст-
воренном состоянии или заполняет пустоты последних. В самое по-
следнее время аналитическими исследованиями Филиппа предполо-
— 451
жение, что белая гремучая ртуть является наиболее чистым продуктом,
было поставлено под сомнение.
Чтобы получить совершенно белую гремучую ртуть надо к ра-
створу ртути в азотной кислоте прибавить меди и соляной кислоты,
(опыты Л. Велера) или полухлористую медь (опыты А. Солонина).
Рис. 256. Проба гремучей
ртути заводского приготовления.
Рис. 257. Кристаллы серой гремучей ртути. (Escales).
У Каста в его труде „ Spreng und Ztlndstoffe“ мы находим иное
об'яснение различной окраски гремучей ртути, почему для сравнения
приводим его целиком.
Так называемая „белаяа гремучая ртуть имеет почти чисто-белый
цвет и состоит не из отдельных кристаллов, а из сросшихся в про-
дольном направлении кристаллических систем. Вследствие своего
сращивания, кристаллы не прозрачны и сильно отбрасывают лучи,
почему они и кажутся белыми. Белая гремучая ртут менее чиста,
чем серая и содержит 99,3 — 99,4°/0 растворимых в соляной кислоте
солей ртути; в водном аммиаке растворяется с образованием незначи-
тельного осадка. Нерастворимый в соляной кислоте остаток на фильтре
с аммиаком окрашивается в немного более темный цвет, чем остаток
серой гремучей ртути. Предположение, что „белая" гремучая ртуть,
грязнее „серой", впоследствии было подтверждено ФилиШом.
Рис. 258. Кристаллы .белой' гремучей ртути. (Escales).
На основании последних исследований, вряд-ли приходится
сомневаться в том, что различная окраска гремучей ртути зависит
главным образом от физических явлении т. е. об'яеняется более или
менее сильным преломлением света. Предположение, что серый цвет
происходит от мелких частиц металлической ртути или от загрязнения
органическими частицами так же мало выдерживает критики, как и
таковое, что белая ртуть окрашена присутствием посторонних вещесгв.
Подтверждение этой гипотезы отчасти можно видеть в том, что
при растирании „серых" кристаллов под водой получается почти
белый продукт, с другой-же стороны в том, что окраска зависит от
величины кристаллов. При очень быстрой реакции по способу Велера
(альдегид вместо спирта) можно и без прибавления соляной кислоты
получить почти белый, мелко-кристаллический порошек. *
Причину сращивания отдельных кристаллов следует искать в
нарушенной кристаллизации вследствие присутствия загрязняющих
— 453 —
примесей, а в случае присутствия меди
«следствие каталитических воздействий.
и в ускоренной реакции
Рис. 259. Кристаллы .серой” гремучей
ртути. (Hast). '
Рис. 261. Кристалл „серой* гремучей
ртути. (Kast).
Рис. 260. Кристалл .белой” гремучей
ртути. (Kast),
Рис. 262.Кристаллы „белой* гремучей
ртути. (Kast).
На Охтенском заводе взрывчатых веществ для получения вбелой“
гремучей ртути растворяют 1 ф. 21 зол. ртути в 11 ф. азотной кисло-
ты, затем к раствору прибавляют 5 грамм электролитной меди и
5 куб. сантиметров химической чистой соляной кислоты; спирта бе-
рется 9 ф. 71 зол.
§ 3. "Свойства гремучей ртути. Гремучая ртуть в сухом состоянии
имеет вид светло-серого порошка, кристаллического строения, в форме
октаэдров. Удельный вес ее велик и прессованием можно довести
плотность ее 4,42.
Гремучая ртуть имеет металлический сладковатый вкус и по-
добно всем ртутным соединениям ядовита. В холодной воде она очень
трудно растворима; в горячей—несколько растворима: одна часть ее
растворяется в 130 ч. воды. Сухая гремучая ртуть способна втягивать
в себя сырость.
Гремучая ртуть является довольно стойким взрывчатым веще-
ством: она выдерживает хранение даже при температуре в 50® С не
выделяя газов и вообще не изменяясь. Влажная гремучая ртуть при
соприкосновении с латунью и медью образует „фульминат" меди, а
потому медные капсюльные гильзы должны быть хорошо лакированы
или, лучше, должны быть никкелированы, так как никкель на гре-
мучую ртуть не действует. Образование фульминатов потому неже-
лательно, что они сами по себе опасны, а взрывчатую силу капсюлей
с течением времени уменьшают. Сухая гремучая ртуть очень чув-
ствительна к удару и трению. Железный груз в 600 грамм, падающий
с высоты 7—9 сантиметров уже производит взрыв ее. Взрывы про-
исходят тем легче, чем крупнее кристаллы. Царапание острым желез-
ным предметом или растирание между двумя железными поверхно-
стями вызывают взрыв гремучей ртути. Менее легко гремучая ртуть
взрывается между мраморными плитками, трудно—между свинцовыми
или деревянными поверхностями'.
Прессованная гремучая ртуть значительно менее опасна в обра-
щении, чем непрессованная.
Во влажном состоянии гремучая' ртуть/ достаточно безопасна.
Так, уже при содержании 5°/0 влажности удар железным молотком по
гремучей ртути, насыпанной тонким слоем на железной поверхности,
вызывает лишь частичный взрыв, т.-е. нераспространяющийся на все
насыпанное количество ее; при полном насыщении гремучей ртути
водой (Зо’/О) при ударе не происходит и частичного взрыва. Влажную
гремучую ртуть можно взорвать при помощи небольшого количества
сухой гремучей ртути. Сухая гремучая ртуть легко взрывается от
искры и пламени. При нагревании ее до 160—19о° С. она также
взрывается, вообще температура взрыва тем выше, чем выше темпе-
ратура начала нагревания. Взрывчатое разложение гремучей ртути
может быть представлено уравнением:
HgC2N,O, --= Hg + 2С0 + N2
По быстроте своего разложения, при наличности большой плот-
ности, гремучая ртуть резко отличается от других взрывчатых веществ
и до последнего времени являлась единственным, применяемым на
практике, детонатором.
Гремучая ртуть исключительно дробящее вещество, развивающее
давление до 48 тысяч атмосфер; количество же выделяемых при взрыве
газов незначительно: 314 литров на 1 килограмм.
Б. Азиды,
§ 1. Азиды —соли азотистоводородной кислоты (азоимида) N3H,
полученной в 1890 г. химиком Т. Куртиусом из органического со-
единения C6H8CON3, одного из производных бензола. Впоследствии
Куртиус и многие другие получали указанную кислоту из иных
соединений.
Азотисто-водородная кислота—прозрачная, подвижная, пахучая,
ядовитая жидкость; точка кипения ее—37°; она легко смешивается с
водой и спиртом; при соприкосновении с накаленным телом—взрывает.
В 1894 г. исследованиями Бертло и других ученых впервые выяснены
взрывчатые свойства аммониевой соли азотисто-водородной кислоты.
В 1898'г, Куртиус и Риссон опубликовали свои способы получения
этой и других солей HN3, а также и их свойства.
О взрывчатой силе азида аммония (порошкообразное вещество)
до некоторой степени можно судить по следующим данным:
1 килограмм NHiNs выделяет при горении 1633 калорий тепла и
дает работу в 694 тыс. килограммометров, тогда как такое же коли-
чество пироксилина выделяет 1070 калорий и дает работу в 455 тыс.
кгр. метр.
Температура горения для NH4N3 не высока—около 1400 ' (горение
пироксилина 2700°).
При взрыве NH4N3 разлагается по уравнению:
2 ИНД, = 3 N» -к Н2 4- 2 NH..
Количество образующихся при этом газов на 1 килограмм—
1148 литров,—брлее, чем для пироксилина (859 литр.).
Азид аммония, как взрывчатое вещество, не применим, т. к. он
летуч даже при обыкновенной температуре. Плавится при 160°.
Азидов цинка, марганца, никкеля и кобальта, а также аллюминия
не удалось получить. Азиды железа можно получить лишь в растворе.
§ 2. Азид натрия. На фабриках Германии и Франции с 1909 г.
стали изготовлять в больших, сравнительно, количествах азид натрия,
как исходный продукт, для получения взрывчатых азидов— свицца
и друг. (см. далее) *). „
По одному из способов натрий-азид получается действием закиси
азота на амид натрия. Лабораторным способом амид натрия NaH2N,
получается в никкелевой чашке—диам. 13 см., высотою 8 см., вста-
вляемой на подставке в железный ящик, в крышке которого имеется
отверстие для введения аммиака, а в одной из стенок—отверстие для
отвода газа. Пиккелевая трубка для введения аммиака должна дохо-
дить почти до дна никкелевой чашки.
В чашку помещают 100 гр. металлического натрия, нагревают
ящик и пропускают через расплавленный натрий аммиак. Темпера-
туру внутри ящика держать не ниже 250® и не выше 350® С. При
реакции выделяется водород.
2 Na 4-2 NH3 = 2 NaNH2 4-Н2.
Через 5—7 часов реакция кончается и прибор охлаждают до ком-
натной температуры.
Азид натрия получается в том же приборе; для чего через натрий-
амид, находящийся в никкелевой чашке, при нагревании до 190°
•) Азиды натрия, калия, кальция и стронция не взрываются от огня.
— 456 —
пропускают закись азота. Операция продолжается около 5 час.; конец
реакции легко определить, так как в течении ее выделяется аммиак:
2 NaNH2 + N20 = NaN3 + NaHO + NH3.
Закись азота продолжают пропускать и при охлаждении полу-
ченного раствора; едкий натр нейтрализуется слабой азотной кисло-
той (1:10).
На заводе взрывчатых веществ в Тройсдорфе, близ Кельна,
для получения амида натрия пользовались никкелевыми чашками а
(рис. 263), диам. 55 см., вышиною 30 см., в которые помещалось около
2 килограмм натрия. Аммиак впускался при помощи воронки е.
Рио. 263. Схематический разрез аппарата для получения амида натрия.
Для получения азида применялся другой прибор (рис. 264), при
посредстве которого сразу обрабатывался 20 килограмм Н-амида.
Части прибора следующие: а—медная, никкелированная внутри труба с,
расширением Ъ, служащим для впуска закиси азота; с—трубка для
выпуска газа; трубка для закладывания Н-амида; с—отверстие для
выпуска Н-амида; /—никкелированная ось с никкелевыми крыльями
для перемешивания Н-амида во время пропускания закиси азота.
По окончании операции к остывшему раствору Н-азида прили-
вается понемногу вода, затем раствор выливается и нейтрализуется.
— 457 —
Исследованием азидов занимался,,главным образом, профессор
Политехнического Института в г. Карлсруэ—Л. Велер (Lothar Wohler)
Рис: 264. Аппарат для получения азида натрия.
и его помощник Мартин (пострадавший при взрыве). В лаборатории
Велера работали также русские химики: Максимов, Крупко и А. Со-
лонина.
Работами последнего в значительной мере выяснены^ свойства
азидов свинца, меди, ртути и серебра.
rv
Примечание: Амида натрия для приготовления азида,
' берут каждый раз лишь ч. того, что было получено, т. к. азид
натрия легко ползет из чашки.
Ряс. 265. Аппарат для измерения чувствительности азидов.
Азиды свинца и серебра.
§ 3. а) Азид свинца, PbN6, впервые был получен Картиусом
в 1891 г. действием уксусносвинцовой соли на натрий-азид. Это бе-
лый или слегка розовый, блестящий порошок, нерастворимый в хо-
лодной воде и мало растворимый в кипятке (1: 2000); нерастворим
также в крепком нашатырном спирте; легко растворяется в подогре-
той уксусной кислоте.
При сохранении азида под водой, при обыкновенной температуре,
он не теряет своих взрывчатых свойств.
На воздухе сухой порошок азида втягивает не более 0,01%
влажности.
Удельный вес азида свинца несколько более, удельного веса
гремучей ртути — около 4,8.
Азид свинца, как возбудитель взрыва, способен заменять грему-
чую ртуть и на применение его с этой целью взяты патенты* **)). Кап-
сюльные гильзы могут быть медные, лакированные внутри, т. к. азид
свинца действует на медь; действие это, однако, незначительно"*).
Азид свинца не пригоден для приготовления ружейных капсюлей,
служащих для воспламенения бездымного пороха, т. к. вследствие
большой скорости взрывчатого разложения он не успевает зажечь
пороха.
Высушивание при 94°С в течение 12 часов сырого азида безопас-
но; при этом состав его не изменяется. При^нагревании при t° выше
100° азид начинает терять свой азот.
Температура взрыва азида находится в пределах от 295 до 345°.
Эта температура определена была погружением азида в сплав Вуда,
при определенной температуре, на 6 секунд.
С пбнижением to взрыва азида увеличивается чувствительность
его к удару. Так, например, азид, имеющий t° взрыва—325°С взрывается
при падении груза в 600 грамм с высоты 19 см., а имеющий to взры-
ва— 345°С взрывается при падении того же груза с высоты 25 см.
Вообще же азид свинца имеет чувствительность к удару большую,
чем пикрат свинца и меньшую, чем гремучая ртуть (последняя взры-
вается при падении указанного выше груза с высоты 7—9 см.).
Определение чувствительности азидов к ударам произведено
А. А. Солониной на приборе Велера. Устройство прибора показано
на рис. 265. Удары производятся при помощи молотка а, вращающе-
гося на оси е; вес молотка 600 грамм. Перед опытом молоток устана-
вливается на определенную высоту падения при помощи задержки
б, привинчиваемой к латунной дуге с делениями (ж) при помощи
винта з. Взрывчатое вещество кладется под стальной стержень в,
который и принимает удары мрлотка.
Для испытания—вещество прессовалось в латунные пистоны, ди-
аметр. 5 мм., высотою 2 мм.; поверх вещества накладывался тонкий
кружок красной меди.
*) Л. Велером в Германии, Ирони кусом—во Франции и Англии.
**) Во время минувшей войны в Германии в целях экономии металлической
ртути и спирта снаряжали капсюли—детонаторы преимущественно азидом свинца.
— 459 —
Азид свинца приготовлялся на указанном выше заводе в Тройс-
дорфе, где установка производства не обошлась без жертв; в сентябре
1909 г. произошел взрыв 150 гр. азида свинца, которым был смер-
тельно ранен лаборант.
Во Франции азид свинца готовится на одной из динамитных
фабрик (Montigny), где для получения азида берется не уксусно-кис-
лый, а аЗотно-кислый свинец.
Лабораторным путем азид свинца можно получить приливая
постепенно, при помешивании, 1 об‘ем раствора азида натрия (1.: 6),
нагретого до 75°С., к 4 об'емам раствора азотно-кислого свинца (1:11).
Раствор перед смешиванием фильтруется. Полученный осадок, после
отстаивания, отсасывается от жидкости на фарфоровой воронке Бюх-
нера, промывается сперва водой, потом спиртом и эфиром, наконец,
высушивается: 1) на водяной бане в продолжение 15 минут, при to
около 100°С. и 2) в эксикаторе, над хлористым кальцием, причем из
эксикатора предварительно выкачивается воздух.
Lenze на основании Собственных опытов утверждает, что под
действием света азид свинца в короткий промежуток времени окра-
шивается в желтый цвет? последнее явление на его взрывчатое свой-
ство не влияет, так как наружный окрашенный слой защищает
внутренность кристаллов от дальнейшего проникновения света.
Перекристаллизация азида свинца водой с незначительной при-
месью уксусно-кислого аммония небезопасна, так как азид при вы-
кристаллизации может взорваться без всякой причины. (Lenze). Поэтому
азид свинца в перекристаллизованном виде не употребляется. При
продолжительном нагревании до 50° наблюдается незначительное
уменьшение его взрывчатых свойств. При нагревании до 200° разло-
жение происходит в короткий промежуток времени, зато азид свинца
совершенно теряет свои взрывчатые свойства. ,
Температура вспышки по Велеру=345°, по Мартину=327о, а По
Hitsch=36°.
К удару азид свинца по Ленце менее чувствителен, по Велеру
значительно менее чувствителен чем гремучая ртуть.
б) Основной азид свинца. Кроме азида PbNe, взрывчатыми свой-
ствами обладает и „основной* азид PbOPbN, Скорость взрывчатого
разложения его и чувствительность к удару менее, чем у чистого
азида свинца.
Основной азид свинца может быть получен нагреванием гидрата
окиси свинца с обыкновенным азидом, в присутствии воды:
Pb(OH)2 + PbNe = PbO. PbN, + Н2О
Нагревание должно продолжаться около 24 часов. Операция может
производиться в обыкновенной узкогорлой колбе.
с . _ Си N, и Си N,. а) Окисный азид меди Си N. мо-
ъ жет быть получен при взаимодействии растворов азида
натрия и медного купороса:
CuSO4 4- 2NaN, = CuN6 -f-Na, SO,
или непосредственным действием азотисто-водородной кислоты на медь.
/ /1' / ,г
ч • #
i*'
<F ' ®:
Окисный азид меди Си N6 желто-бурая кристаллическая соль,
трудно растворимая в воде (цвет раствора зеленовато-желтый), с те-
чением времени от действия воды разлагающаяся. Этот азид сильно
взрывчат и весьма опасен в обращении*), т. к. легко озрывает от тре-
ния, удара и нагревания. Чувствительность к удару значительно пре-
восходит таковую же гремучей ртути.
б) Закисный азид Си N3 был получен действием раствора азида
натрия на смесь растворов: медного купороса и кислой сернисто-на-
триевой соли. Эго — серое кристаллическое вещество, взрывающееся
от накаливания, но значительно менее чувствительное к удару, чем
окисный азид и гремучая ртуть: высота падения груза (в приборе
Велера), при которой закисный азид взрывался—около 20 см.
а б Нзипы dtvtm HgN6 11 HgN3. а) Окисный ртутный азид HgNs
3 ' и ' впервые был получен Бертло и Виелем растворением
свеже-осажденной окиси ртути в азотисто-водородной кислоте:
HgO + 2HN3^HgN64-H2O.
Окисный ртутный азид представляет собою бесцветный кристал-
лический порошок, плохо растворимый в холодной и легко в горячей
воде. Имеет сходство с гремучей ртутью: одинаковый вес молекулы,
почти одинаковую плотность и одинаковое содержание ртути, но чув-
ствительность к удару и трению большую, чем у гремучей ртути. Этот
азид почти также опасен в обращении, как окисный медный азид.
б) Закисный азид ртути, HgN3, впервые был получен Куртиусом.
Получается приливанием азотнокислой закиси ртути к раствору азида
натрия и аммония. Это мелкий белый порошок, мало растворимый в
воде. От действия прямых солнечных лучей способен разлагаться.
От удара и огня взрывает, давая пламя синего цвета. Высота падения
грчза в приборе Велера, при которой происходит взрыв, около 23 см.,
следовательно этот азид гораздо менее чувствителен, чем гремучая
ртуть.
AgN3—также был впервые получен Куртиусом.
s ' зид се₽е ₽а' Для приготовления его приливают раствор азида на-
трия к раствору ляписа, при этом первый раствор содержит 1,3 гр.
азида на 10 ч. воды, второй—двухнормальный. Растворы берутся в
равных об'емах.
Азид серебра—мелкий белый порошок, плавящийся' при 250°,
нерастворимый в воде и разведенных минеральных кислотах; легко
растворяется в нашатырном спирте. От действия света медленно раз-
лагается. Температура взрыва азида серебра 280—300’.
Азид серебра хотя и был причиной несчастного случая при его
приготовлении,—следует считать менее чувствительным к удару, чем
все другие азиды (высоты падения груза в приборе Велера, при ко-
торой получается взрыв, не менее 29 см.).
•) Опасен даже в сыром виде.
Из всего изложенного видно, что только
§ . равнение азидов с окисные азиды Меди и ртути более чувствительны
гремуче ртутью. к уДару, чем гремучая ртуть.
Присутствие воды в азидах свинца и ртути мало изменяет чув-
ствительность их к удару, тогда как присутствие воды в гремучей
ртути оказывает большее влияние; тем не менее, сырая гремучая ртуть
оказывается более чувствительной, чем сухой мелкокристаллический—
азид свинца. Большие же сухие кристаллы азида свинца почти также
чувствительны к удару, как сырая гремучая ртуть.
Взрывчатая сила азидов более, чем у гремучей ртути: это было
видно по действию их на стенки пистонов и нижнюю поверхность
стержней в вышеупомянутом приборе Велера.
Все азиды, не исключая самых чувствительных к ударам, имеют
t* взрыва высшую, чем гремучая ртуть.
Для большинства азидов понижении t° взрыва соответствует увели-
чению чувствительности их к удару.
По опытам Велера, чтобы вызвать в капсюлях взрыв 1 гр. прес-
сованного тринитротолуола необходимо 0,3 гр. гремучей ртути; для
той же цели достаточно взять 0,5 грам. азида серебра.
Солонина, в дополнение к указанным опытам, определял способность
других азидов к передаче взрыва тринитротолуолу. При этом, он при-
готовлял капсюль диаметр. 7 мм.*) длиною 44 мм. Капсюли заклю-
в себе 1 грамм тринитротолуола, прессованного под давлением около
2000 килогр. на 1 кв. см. Азид или гремучая ртуть в прессовались
сверху под давлением несколько более 1300 кил., причем поверх ве-
щества накладывалась латунная чашечка с отверстием по средине.
Взрывание производилось при помощи шнура Бикфорда. Пол-
нота взрыва поверялась пробиванием свинцовой пластинки толщиною
5 мм. Пластинка подставлялась под капсюль, установленный верти-
кально, на столе с отверстием; ось капсюля проходила через центр
отверстия стола.
Из опытов выяснилось, что для взрыва 1 гр. тринитротолуола
необходимо и достаточно 0,1 гр. азида свинца. При этом свинцовая
пластинка пробивается и от места пробоины идут характерные лучи.
Тот же результат получается от взрыва тринитротолуола при помощи
0,3 гр. гремучей ртути.
Для получения таких же результатов при помощи закисных
азидов меди или ртути CuN3 и HgN3 необходимо было взять по 0,15 гр.
этих веществ.
На заводе в Тройсдорфе сравнивали капсюли, содержащие 0,85 гр.
тетрила и 0,4 гр. гремучей ртути (с 20% бертол. соли) с капсюлями,
содержащими 1 гр. тетрила и 0,15 гр. азида свинца. При помощи
таких капсюлей взрывались, в больших свинцовых бомбах, заряды
*) Интересные исследования различных новых фильминатов и азидов мы на-
ходим у Л. Велера и Мартина (Bericht der Deutschen Chemischen Gesellschaft, 50,
586—696, 1917) В главе о фульминатах, между прочим, помещены исследования о
гремуче-кислом кадмии (Cd (CNO)a), гремуче-кислом таллие (T1CNO), гремуче-кислой
меди (CuCNO). Среди азидов мы находим исследования азидов никкеля (NiNeH2O),
кобальта (С0ХбН20), марганцы (MnN6), железа и хлора.
— 462 —
1
тетрада и пикриновой кислоты, флегматизированной 5 или 10% ка-
сторового масла. О результатах судили по расширению камер. И те и
«Ьугие капсюли действовали в общем одинаково.
> » Таким образом, азид свинца вероятно найдет себе применение в
Чигнике подрывного дела, как более сильный, мало гигроскопичный
‘ мало чувствительный к удару детонатор.
X Некоторые преимущества азида серебра не имеют значения в
' .виду его дороговизны и способности подвергаться изменениям при
продолжительном действии света.
О гремучем серебре, неимеющем существенного знания во взрыв-
ной технике, было уже достаточно сказано ранее.
ГЛАВА VIII.
Взрывчатые смеси на основе жидкого воздуха*).
В виду исключительного внимания уделенного в последнее время
препаратам жидкого воздуха, той солидной роли, которую они сыграли
в Германии за последнее время и тем перспективам, которые откры-
ваются для применения их у нас в России, мы остановимся несколько
детальнее на особенностях последнего.
й , т Для получения жидкого воздуха сырым ма-
1 териалом является атмосферный воздух, пред-
жидкого воздуха, ставляющий собой механическую смесь газообраз-
ных элементов и соединений. Для конечных целей—получения взрыв-
чатого жидкого воздух из всех составных частей атмосферного воз-
духа, главное значение имеют кислород и азот: получение наиболее
обогащенного кислородом воздуха и возможно полное удаление азота—
одна из главных задач при производстве взрывчатого жидкого воз-
духа.
В настоящее время, количество различного рода типов сжижа-
тельных машин исчисляется десятками. Практически все они могут
быть разбиты на 2 класса: к первому следует отнести те, в которых
весь сжижаемый воздух поступает в конце процесса в собственно-
сжижатель (ЛияЭе), ко второму—построенные по принципу .Клода, в
' которых, сжатый в начале процесса, воздух подвергается разделению,
' при чем приблизительно одна половина его сразу направляется для
сжижения, а вторая, поступающая в рабочий цилиндр, во первых,
понижая свое давление до нормального, совершает некоторую внешнюю
работу, используемую в сжижательных же установках, и, во вторых,
приобретенною ею низкой температурой охлаждает сжижаемую часть
воздуха или поддерживает низкую температуру некоторых отдельных
предварительных жидких охладителей.
' *) См. Проф. М. Сухаревский. „Жидкий воздух и его современное техническое
и экономическое значение во взрывной технике". Москва, 1922 г. Издание ГВИУ.
Рассмотрим в качестве примеров наиболее усовершенствованную
установку системы Линде (рис. 266) параллельно с рассмотрением си-
стемы Хейланда.
Рис. 266. Установка для сжижения воздуха по способу Линде (схема).
Сжижательный аппарат работает следующим образом: воздух по-
ступает через всасывающий трубопровод „аи сначала в очиститель „в“,
в котором по принципу встречного течения обрабатывается распы-
ленным раствором едкого кали или едкого натра. Этот очиститель
состоит из цилиндра, наполненного коксом или стальными опилками,
и двух входных и выходных вентилей, служащих для впуска и вы-
пуска из него раствора едкого калия. Кругообращение едкого калия
(или натрия) поддерживается маленьким центрофуговым насосом, при-
водимым в движение валом компрессора. Возобновление растворов
едкого калия или .натрия рекомендуется производить один раз в не-
делю. Лишившись в названном очистителе гв“ почти всей заключаю-
щейся в нем пыли и углекислоты, воздух поступает в цилиндр для
поглощения влажности „с“, служащий, кроме того, для улавливания
щелочного раствора. / '
Пройдя этот цилиндр, построенный по тому же принципу, как и
цилиндр „в“, воздух попадает в компрессор „е“, в котором происходит
первая основная операция—сжатие воздуха до давления в 200—220
атмосфер.
Продя последовательно через все цилиндры компрессора и под-
вергаясь при переходе из первого во второй и из .второго в третий
охлаждению в змейковых охладителях, воздух покидает окончательно
компррессор при температуре в 15—20 градусов Цельсия. Направ-
ляясь затем через трубопровод </» в сушильную батарею, воздух по
пути в последнюю проходит через предварительный охладитель <#>,
— 464 —
где он. охлаждается поступающим через трубку «о» из аппарата для
сжижения <т> холодным азотом. Это предварительное охлаждение
производится по принципу Сименса, для увеличения в дальнейшем
эффекта Томсон-Жюль. В предварительном охладителе также дости-
гается охлаждение возможных следов влажности. На пути из предва-
рительного охладителя в сушильную батарею, воздух пропускается
через улавливатель масел <Л», а иногда, при неисправности трубо-
провода, вследствие значительного осаждения на стенках последнего
льда, через особый оттаиватель «Ь. Спресованный до 220—200 атмо-
сфер и охлажденный воздух, попав в сушильную батарею, оконча-
тельно освобождается от последних остатков выделившейся при сжатии
воды и возможно оставшейся углекислоты. Батарея состоит из 4-х
подвешенных на металлической стойке бутылей кованного железа,
наполненных едким калием. В дальнейшем, движение сжатого воздуха
в аппаратах Линде и Хейланда различно. Мы проследим сначала дви-
жение сжатого воздуха у Линде.
Пройдя, сушильную батарею, высушенный и очищенный воздух
направляется через клапан <£» в так называемый глубокий охладитель
<Ь, где он искусственным образом охлаждается до 20 градусов Цельсия.
Для достижения такого охлаждения у Линде употребляется аммиачный
или углекислотный компрессор «р», откуда охлажденное вещество
под высоким давлением попадает в глубокий охладитель, после пред-
варительного сгущения в конденсаторе «Q», проходя при этом через
регулирующее приспособление «г> с манометрами. Охлаждение кон-
денсатора производится проточной водой. Охлаждение воздуха в глу-
боком охладителе,, представляющем также, как и предварительный
охладитель, систему двойных труб, совершается по принцип^ встреч-
ного течения -сжатого воздуха и охлаждающего состава. Из глубокого
охладителя охлажденный до температуры 20 градусов Цельсия воздух
поступает уже в аппарат для сжижения.
В аппарате для сжижения воздух не только сжижается, но и
подвергается разложению на кислород и азот. Аппарат (см. рис. 267)
состоит из системы концентрических труб „а“, разрежательного кла-
пана „Ь“ и колонки для ректификации „с“. Система концентрических
труб построена таким образом: внутри трубы проходит под высоким
давлением охлажденный воздух; через наружную трубу, в противо-
положном направлении, идет освободившийся холодный азот, отдавая
сжатому воздуху свой холод (согласно принципу встречного течения)
и понижает таким образом его температуру до—170 градусов Цельсия.
Затем сжатый воздух пропускается через змейковую трубку „d*, ко-
торая помещена в ванне с жидким кислородом. Здесь воздух сжи-
мается в еще большей степени и подходит к разрежательному кла-
пану „Ь“, где, благодаря быстрому падению давления, получается
необходимая для сжижения низкая температура.
Жидкий воздух просачивается пока еще с примесью атмосфер-
ного азота через ректификационную колонку „с“ в ванну, располо-
женную под ним. За этот промежуток времени он очищается от азота
настолько, что в ванну поступает как совершенно чистый кислород.
Последнее происходит следующим образом. Проходя через змейковую
трубу (см. выше;, сжатый воздух обладает немного более высокой
температурой, чем кислородная ванна; эта разница в температурах
вполне достаточна для того, чтобы вызвать образование в ванне ки-
слородных паров, которые подымаются вверх по ректификационной
колонке', следовательно, в направлении обратном просачивающемуся
воздуху. А так как пары кислорода имеют более высокую температу-
Рис. 267. Аппарат для сжижения воздуха (схема).
i
ру, чем жидкий воздух, то онщ“ нагревая его, вызывают испарение
азота; сами же они охлаждаются и стекают вместе с жидким возду-
хом вниз. Таким образом, получают на верху пары азота, а внизу—
почти чистый кислород. Азот выпускают наружу, предварительно за-
ставив его быть охладителем в некоторых отдельных частях сжижа-
тельной системы. Жидкий кислород стекает через кран в специаль-
ные баллоны.
Особая водомерная трубка при этом показывает количество со-
бранного сжижательным аппаратом жидкого воздуха. Посредством треть-
ей трубки, которая соединена с ванной для кислорода, можно получить
также кислород и в газообразном состоянии. Это приспособление, правда,
устраивается лишь в тех случаях, когда кроме получения жидкого
кислорода имеется в виду употребление газообразного кислорода для
технических или санитарных целей. На рис. 268 детально показан
аппарат Линде для сжижения в разрезе и в виде сбоку... Вся уста-
новка сделана из меди и бронзы, вследствие высокой вязкости этих
металлов даже при низки! температурах. Для уменьшения потери
холода весь аппарат помещен в дерёвяйный ящик, а свободные про-
странства заполнены изолирующим веществом: овечьей шерстью или
обрезками шелка. Для получения конечных продуктов аппарат Линде
требует промежуток времени от 7* до % часа, в зависимости от на-
Пр оф. М. Сухаревский. Взрывчатые вещества и взрывные работы. 30
ружной температуры и стецени изоляции всех частей аппарата.
Для обслуживания такой установки требуется один—два рабочих.
Небольшая установка, примерно, с выработкой в 20 литров в час тре-
бует мотор в 60 лош. сил. Рисунок 2б9 показываем подробно всю схе-
му установки сжижательной установки системы Линде.
Рис. 268. Внешний вид и разрез сжижательного аппарата.
Сжижательный .аппарат системы Хейланда, раньше всего отли-
чается от аппарата системы Линде тем, что в сжижательную машину
поступает не весь переработанный компрессором воздух, а лишь часть
его, в среднем 50%.
Кроме, того отличие системы Хейланда от системы Линде сво-
дится к следующему: во-первых, отсутствует предварительный охла-
дитель, во-вторых, в сжижательной машине охлаждение и ректифи-
кация происходят на несколько иных принципах взаимодействия воз-
духа, поступившего непосредственно через разрежательный клапан и
из парораспределительного цилиндра, в-третьих, в небольших отличиях
в устройстве ректификационной колонки и испарителя. На рис. 270
изображена схема сжижательной установки системы Хейланда.
Движение воздуха в системе Хейланда протекает следующим
образом: спрессованный до 220 атмосфер воздух под высоким давле-
— 467 —
нием направляется через трубопровод $ сушильную батарею, пройдя
которую и сохранив еще давление в 200 дтмосфер, направляется к
трехходовому парораспределительному клйпану, откуда часть его
(40—50%) идет непосредственно к сжижательной машине, а осталь-
ная часть (60—50%) к рабочему цилиндру. В Последнем поступившая
часть воздуха подвергается разрежению с 200 атмосфер до 1,3 атмос-
феры, с выделением внешней энергии, которая - приводным ремнем
передается на вал компрессора. Охлажденный разрежением почти до
30*
Рис. 270. Схема сжижательной установки системы Хейланда.
своей критической температуры, воздух поступает в уловитель жиров,
а затем, подвергшись охлаждению, направляется в воздухосжижатель-
ную машину для участия в ректификации,
Для ясного представления дальнейшего движения воздуха в ма-
шине Хейланда, следует разбить последнее на 2 течения: течение .
первое—-идущее непосредственно в сжижательный аппарат, и течение
второе—идущее из рабочего Цилиндра. Течение первое вступает свер-
ху в сжижательный аппарат и опускается пЬ трубам, свернутым сна-
чала в виде конуса, а затем в виде спирали. На этом пути оно все
время окружено уходящими наверх парами холодного азота, благо-
даря чему воздух названного течения охлаждается почти до своей
критической температуры. Затем через вертикальную трубу воздух
опускается, а затем снова поднимается (при чем часть его уже сжи-
жена) до верхнего края ректификатора, где устроен разрежательный
вентиль (см. рис. 271). Разреженный в разрежательном вентиле воздух
(почти уже сжиженный без остатка) равномерно распределяется по
ректификационной колонке, в которой происходит обогащение возду-
ха кислородом. Пройдя колонку и сильно обогатившись кислородом,
воздух попадает в испаритель. Испаритель состоит из сообщающихся
сосудов с высокими краями, помещенных по винтообразной линии
друг над другом. (Процесс ректификации здесь происходит в виде
фракционировочного испарения). Затем сжиженный воздух, содержа-
щий приблизительно 85°/0 кислорода, собирается на дне испарителя
и, наконец, направляется из сжижательного аппарата для разлива-
ния в баллоны.
Охлажденный разрежением в рабочем цилиндре почти до своей
критической температуры воздух течения второго (рис. 272) вступает
в сжижательную машину, где охлаждается еще в большей степени в
аппарате по теплообмену, который проводится им по змеевидной трубе,
и, наконец, выливается из нескольких отверстий в нижнем конце
ректификатора. Здесь он служит для обогащения кислородом первого
течения путем замены своим кислородом азота первого течения, что
основывается на принципе использования различия температур кипе-
ния названных двух газов. Наконец, азот этого течения, как и течения
первого, выпускается наружу.
§ 2. Свойства жид Теперь мы должны дать некоторые сведения, так
иого воздуха, сказать, i охарактеризовать полученный конечный про-
дукт с качественной (физико-химической) стороны.
Вес одного литра жидкого воздуха—около 1 килограмма. Для
получения 1 литра жидкого воздуха необходимо сгустить около
780 литров газообразного. При наливании в воду жидкий воздух
сначала плавает по ней, а затем, вследствие испарения азота и обо-
гащения более тяжелым кислородом, тонет. Нормальный цвет жидко-
го воздуха голубой, зависящий от свойственного жидкому кислороду
синего цвета (жидкий азот бесцветен); по мере обогащения кислоро-
дом, названная окраска Жидкого воздуха становится яснее. Жидкий
воздух, а в особенности жидкий кислород, даже в тонком слое дают
отлично видимые иреЬщё чер^к спектра поглощения, отвечающие
спектру кислорода. Вследствие его крайне низкой температуры ки-
пения—191° Цельсия,—он не может быть сохраняем в закрытых сосу-
— 470 —
дах, которые бы разрывались. Для хранения жидкого воздуха упо-
требляют сосуды, построенные по принципу Дьюара, с 2 стенками и
безвоздушным пространством между ними (подробно в § о баллонах).
Pj с. 271. Движение .течения первого" в сжижательном аппарате (схема).
В жидком воздухе быстро замерзает не только вода, но и угле-
кислота, спирт водный и безводный, причем последний проявляет
изменение свойств: он не загорается,
но взрывается от удара. Эфир кри-
сталлизуется, частично сжижается
светильный газ, метан обращается
в жидкость. Свойства твердых тел
также подвергаются резким изме-
нениям. Ртуть в жидком воздухе
затвердевает (температура ее замер-
зания—39 градусов С.) и ее можно
ковать,‘как свинец.
Явление у пру гостй сйЛьнб Из-
меняется: каучук становится хруп-
ким, а упругость и сопротивление
разрыву увеличивается у металлов,
исключая цинк, висмут и сурьму,
которые делаются более хрупкими,
серебро же и медь делаются более
мягкими.
§ 3. Баллоны для тран-
спортирования жидкого
воздуха и насыщения пат-
ронов.
(схема).
Рис. 272. Движение .течения второго"
в сжижательном аппарате
Первона-
чальные пред-
ложения в
этом направ-
лении, несмо-
тря на многочисленность, вовсе не
решали вопроса, так как • примене-
ние самых разнообразных матери-
алов для постройки баллонов ока-
зало малое влияние на понижение
степени испаряемости, вследствие
все-таки значительной степени те-
плопроводности взятых материалов.
Изложенное явилось причиной того
внимания, которое было уделено
предложенному в 1893 году профес-
сором Лондонского Королевского
Института Дьюаром баллону для
хранения и транзита сжиженных
газов и вообще жидкостей низкой
температуры, в котором в качестве
изолирующей среды была раци-
онально использована абсолютная
нетеплопроводность пустоты. Бал-
лон Дьюара был сделан (выдут) из
стекла и представлял сплошные две
стенки, между которые .имелась
пустота (воздух выкачан). Для
еще большего отражения тепловых лучей внутренняя
ность наружного сосуда и внешняя внутреннего были
поверх-
посере-
брены. Сжиженный газ, помещенный в подобный баллон, может
сохраняться сравнительно долго, так как необходимая для его испа-
рения теплота (скрытая теплота испарения) может лишь крайне мед-
ленно проникать через междустенную пустоту. Дальнейшие улучше-
ния были направлены в сторону получения наиболее идеальной пу-
стоты в междустенном пространстве и придания баллону большей
стойкости в отношении механических влияний. Последнее достига-
лось помещением сосуда в более или менее прочную обшивку (дере-
вянную, металлическую или иную), первое же—введением в между-
стенное пространство разного рода поглотителей, адсорбирующих
остатки неуловленного вследствие прилипания к стенкам воздуха.
Таких поглотителей было предложено и применяется достаточное ко-
личество, но безусловное предпочтение нужно отдать только угле-
вому поглотителю.
Современные баллоны для транзита, хранения и пользования
жидким воздухом, при всем своем видимом конструктивном разно-
образии, построены все по принципу Дьюара. Исходными материалами
для всех видов баллонов являются стекло, металл и, в самое последнее
время, фарфор. В зависимости от своего непосредственного назначе-
ния баллоны разделяются на таковые для транзита, хранения и по-
гружения патронов при насыщении последних жидким воздухом.
Из применяемых в настоящее время в Германии баллонов типо-
выми можно считать баллоны, построенные Хейландом по принципу
Дьюара. Так, баллон для транзита состоит из двойного шарообразного
резервуара, имеющего длинное горлышко с узким выходным отвер-
стием см. рис. 273 и 274. Своеобразной особенностью названного бал-
Рис. 273. Баллон Хей-
ланда для перевозки
жидкого воздуха.
Рис. 274. To-же (разрез).
лона является то, что внутренний сосуд обладает до некоторой степени
подвижностью, являясь как бы подвешенным в наружном, что дости-
гается особым патентованным способом соединения сосудов. Обыкно-
венно, названные баллоны дополнительно помещаются в жестяной
цилиндр и промежуток между ним и стенками цилиндра заполняется
худыми проводниками тепла (см. рис. 275, 276). Типичный баллон для
погружения, построенный по тому же принципу Дьюара, имеет большей
частью цилиндрическую форму и диаметр горлышка достаточный для
свободного опускания в сосуд одного или нескольких патронов, т.-е.,
примерно, от 40 до 100 и более милиметров. В остальном, кроме своих
Рис. 275. Внешний .вид и разрез современного баллона для перевозки
жидкого воздуха.
размеров, он мало отличается от баллона для перевозки, что и видно
из помещенных рис. 277, 278 в конце главы рисунков.
§ 4. Поглотители Идея практического применения жидкого воздуха
патроны для жид- для взрывных целей, вследствие богатства последнего
кого воздуха, кислородом, крайне проста: поглотитель, богатый угле-
родом, так или иначе пропитывается или вообще помещается в бли-
жайшем контакте с жидким воздухом, и подобная механическая смесь,
богатая всеми необходимыми элементами для получения весьма высо-
кой температуры, взрывается.
По вопросу о наивыгоднейшем °/0 содержании кислорода в жид-
ком воздухе наиболее распространенным мнением считается признание
85% вполне достаточным количеством кислорода для взрывания пат-
ронов в нормальных условиях. В о'снову выбора этой цифры ложится
соображение, что промежуток времени между насыщением патрона и
производством взрыва служит для обогащения жидкого воздуха кис-
лородом, что происходит вследствие того, что азот испаряется гораздо
скорее и, благодаря этой самостоятельной фракционированной дисти-
ляции, содержание кислорода в жидком воздухе быстро увеличивается,
легко достигая 90 и даже более %• Простая по своей сущности
реакция горения, предполагает наличие двух взаимодействующих
веществ кислорода и углерода. Кислород мы имеем в жидком воздухе,
углерод должен быть доставлен и притом в количестве, соответ-
ствующем типовой реакции горения. Поэтому с самого начала была
сделана масса предложений различных богатых углеродом веществ
в качестве поглотителей для жидкого воздуха. В дальнейшем было
Рис. 278. Баллон для
Рис. 276. Tb-же другой конструкции. погружения в разрезе.
обращено внимание на возможность частичной или полной замены
углеродистых веществ некоторыми металлами и, таким образом, в на-
стоящее время все применяемые поглотители могут быть разбиты на
следующие три группы:
1) Поглотители, в состав которых входит значительный % ме‘
таллов в том или ином состоянии, а % углеродистых веществ сравни-
тельно незначителен;
2) Поглотители, в состав которых входит углерод в количестве,
приблизительно равном 5О°/о, остальные же 50°состоят из иных
легко сгорающих веществ или металлических прийесей;
• 3) Поглотители, содержащие углерода до 95 — 99о/о, вовсе без
посторонних примесей.
Применение металлических поглотителей всегда в основе своей
имеет реакцию, построенную по принципу так. наз. термитов, анало-
гичную со всем известной •реакцией Гольдшмидта, т.-е. в данном случае
используется легкая окисляемость некоторых металлов, горящих в
струе кислорода с огромным выделением тепла.
— 475 —
Применение металлов в порошке или коллоидальных смесей
особенно желательно в тех горных разработках, где недопустимо обра-
зование СО, а необходимо полное сгорание. Своеобразной особенностью
этих поглотителей является то, что в продуктах горения вовсе отсут-
ствует углекислота, и взрывной эффект достигается в данном случае,
главным образом, лишь крайне высокой температурой и давлением
расширившегося под влиянием этой температуры остаточного жидкого
воздуха, не вошедшего в реакцию.
Ко второму классу поглотителей следует отнести: мох, торф,
древесные и пробковые опилки, употребляемые в отдельности или во
взаимной смеси или в смеси с металлическими поглотителями.
Применение мха имеет практическое оправдание в использовании
его всасывательных в отношении жидкого воздуха способностей, а не
заключенного в нем углерода. Поэтому мох всегда предварительно
насыщается богатыми углеродом жидкими углеводородами, керосином
а затем уже жидким воздухом. Что касается торфа, то для роли по-
глотителя годятся лишь зрелые сорта его (например, смолистый торф).
Полезной особенностью мха и торфа, как поглотителей, служит то об-
стоятельство, что, после всасывания жидких углеводов и жидкого
воздуха, они сохраняют всю свою гибкость, допускающую наиболее
плотную забивку ими патрона. Древесные опилки, со средним содер-
жанием углерода от 48,2 до 51,8°/0 представляют довольно удобный
и давно принятый на практике поглотитель. Употребляются они или
в отдельности или в смеси с другими углеродосодержащими веще-
ствами, а также металлическими порошками. Пробковые опилки, хи-
мически и физически близкие к древесным, имеют перед последними
то преимущество, что обладают способностью всасывать очень боль-
шое количество жидкого кислорода (в 6 раз больше обыкновенного),
при взрыве же, наоборот, требуют очень мало' кислорода.
Кроме того, пробковые опилки находят широкое применение при
изготовлении так называемых безопасных от влияния рудничного
воздуха патронов.
Попытки изготовить такие патроны продолжаются до настоящих
дней и заключаются, главным образом, в прибавлении к поглоща-
ющим составам различных солей. А так как эти прибавления зани-
мают значительную весовую часть всего состава, приблизительно до
80% его,. необходимым является применение крайне мощных погло-
тителей, которые могли бы, несмотря на свой незначительный об'ем,
впитать столько жидкого воздуха, сколько нужно для сгорания всего
патрона.
Переходными к третьей группе поглотителей являются составные
поглотители, в которых деятельною частью являются жидкие углево-
дороды, главным образом, керосин, а собственно поглотителем служит
инфузорная земля (кизельгур), при чем обыкновенно берут 40% ке-
росина и 60°/0 кизельгура.
К этому классу поглотителей очень часто добавляются иные лег-
ко сгорающие и дающие газообразные продукты вещества, как, напри-
мер, тонко измельченная сера.
Третий класс. поглотителей характеризуется весьма высоким
содержанием углерода в последних^ большой теплопроводной способ-
: их—до 8.000 и значительно более калорий, большой всасыва-
WgbBOtt (поглотительной) способностью и стильным взрывным эффек-
Этими качествами обладают, как древесный уголь, так и некото-
рые сорта каменных углей,' дающие большие выходы кокса, и, конечно,
. как таковой, и, наконец, в особенности, сажа. Все эти поглоти-
Л'применяются ц возможно более размельченном виде, чем дости-
большая поверхность поглощения, с качественной же стороны
; основным требованием, пред‘являемым к ним, является возможно
’ -большая пористость (пустотелость). Многочисленные опыты показали,
что наиболее пригодным поглотителем из этой группы является сажа,
как вещество, во-первых, могущее содержать до 99% углерода, и, во
вторых, обладающее исключительной всасывательной способностью.
Применяют несколько сортов сажи, различающихся по своей стоимости
в зависимости от степени очистки. Сажа добывается, обыкновенно, из
дешевых углеводородов, преимущественно из отбросов, получаемых
при перегоне смол, в роде сырого нафталина или антраценового
масла. Большей поглотительной способностью обладает, так называе-
. мая мелко-зернистая сажа, Изготовляемая обыкновенно заводским
путем. Этот сорт свободно впитывает и удерживает довольно продол-
жительное время в четыре—пять раз увеличенный собственный вес
жидкого воздуха. По свидетельству немецких авторов, патроны из
подобного рода сажи могут быть воспламеняемы одним зажигательным
Бикфордовым шнуром без капсюля и при сгорании почти не образуют
дыма.
Патрон или оболочка для помещения поглотительной смеси,
несмотря на большое разнообразие, в некоторых деталях, в общем
отличается крайней простотой конструкции.
Так напр. патрон Sieder’a состоит-нз двух оболочек: внутренней, про-
пускающей жидкий воздух и его пары и наружной—не пропускающей
последние. Этим до некоторой степени было выражено намерение,
давая жидкому воздуху свободный доступ в патрон, заставлять его
при испарении обтекать вокруг патрона под наружной оболочкой и
тем задерживать испарение. Первоначально сконструированный анало-
гичный патрон Messer'а состоял из внутренней, пропускающей жидкий
воздух оболочки, на которую спирально накатана наружная, не пропуска-
ющая пары оболочка, при чем эта изолировочная оболочка покрывает
внутреннюю не целиком, а лишь частично. Это нововведение, позволяв-
шее весьма быстро вести насыщение патрона, в то же время впервые осу-
ществляло спиральное обтекание испаряющегося жидкого воздуха
вокруг патрона, чем достигалась большая продолжительность сохра-
нения низкой температуры последнего, а, следовательно большая
жизненность патрона. Затем тем же Messer'ом были введены дальней-
шие улучшения в конструкции его патрона, и в настоящее время
патентованный иатрон Messer'а, показанный на рис. 279, 280,
- -состоит из следующих частей: патрон имеет наружную бумажную
/-оболочку «а», непроницаемую, как для жидкого воздуха, так и для
; его паров. В эту оболочку помещена вторая оболочка <s», изготовлен-
ная из бумаги, хорошо впитывающей жидкий воздух и пропускающей
иго пары. Пары жидкого воздуха для более целесообразного исполь-
зования их холода обтекают спиралью патрон. Это достигается тем,
— 477 —
a
m
VJ
3
a
a
t ~
Рис. 28L Патров
Messer'a упрохцен-
; ной конструкции,
что в изолирующую о&ш&де^у <«» закатываемся г(или";навивается по-
верх ее) непроницаемая' дйд/naj[j6»' жидкого воздуха^ бумажная обо-
того W ii
. нйж oSjM
нения сажей. Наполнение па-
тронов поглотителем происхо-
дит машинным способом. Ниж-
ний конец патрона <е* оклеен
тканью/ проницаемой для жид-
кого воздуха и его паров,
верхний же конец «f», в кото-
рый вставлен дополнительный
картонный кружок <Л>, закрыт
герметически плотно. Наверх-
нем конце прикреплена веревка
или проволока <^», позволяю-
щая работать с патроном, • не
подвергая свои руки ожогам.
Нормальное насыщение
патронов жидким воздухом в
баллонах для наполнения про-
изводится следующим образом:
в баллон наливается сначала
незначительное количество
жидкого воздуха (на самое дно
лишь), а затем подвешиваются
в баллон патроны. Испаря-
ющийся жидкий воздух крайне
охлаждает патроны и тем по-
вышает их поглотительную
способность. После этого в
баллон наливается все необхо-
димое для насыщения патронов
количество жидкого воздуха,
при чем на практике высоту
наливания жидкого воздуха в
баллон определяют в зависи-
мости от высоты патронов — в
среднем она должна превышать
на 5 сантиметров высоту па-
трона.
Когда последний налит,
в него погружаются приве-
шенные на особых веревках
или проволоках патроны. Сна-
чала патроны плавают на по-
верхности жидкого воздухз, а затем, по
На дно. Весь процесс насыщения длится
co
Ф
p.
to
Рис. 28О-Ь. To-же (по-
перечный разрез).
3
№
И
rt
И
о
и
ь
о
и
ф
г
cn>
CM
w
мере насыщения, опускаются
в среднем от 5 до 25 минут,.
— 478 —
в. зависимости от "качеств ^поглотителя и материала патронной обо-
лочки.
В некоторых горнопромышленных предприятиях Германии на-
полнение патронов поглотителем происходит в особых машинах. На-
полнительный состав попадает через воронку <а> в сосуд <Ь», откуда
зубчатым валом передвигается к стеклянной воронке <<?» (см. рис. 282).
Рис. 282. Машина для патронирования патронов для жидкого
воздуха. (Схематический разрез).
Падая вдоль по ней, он попадает в патронодержатель «е>, который,
по введению в него патрона, закрывается снизу клапаном «Д. На ползуне
<g», который поднимается и опускается коленчатым валом «Л», укреплен
зажим <й. Этим зажимом поднимается попускается пресс «&>. Когда
ся, он ударяет в контактную кнопку <Ь. Вследствие
теСким или механическим способами, открывается кла-
пресс по
этого, эд
Пан «/>/$*Й|ййфНется контакт <я»>. От разрыва контакта «»»> оста-
навлийЯётсяВал«м>, на котором укреплен зубчатый вал «о, и подача
поглопйпЙ1ДёГО состава прекращается. Изготовление более тонких или
боляд щ^юких патронов регулируется патронодержателем «е>. Закры-
клапана </.зажим <?» и контакт «»»» приводятся электриче-
скийспособом снова в движение. Коленчатый вал <h» и вал «п> при-
водятся в движение приводными ремнями. Большей частью строят
несйолъКо таких аппаратов рядом друг с другом (см. рис 283). б от-
г
Рио. 283. Установка, состоящая из нескольких приборов, показанных на рис. 285/
( I . -X. 1
, - -г : '
деШШъкх аппаратах можно выделывать патроны различных величин
наполнения. Аппарат работает следующим образом: после
Того, как патронная оболочка вставлена в патронодержатель ,,е“ и
клапан ,,f“ закрыт, зубчатый вал начинает подавать поглощающий
состав. Состав падает в патронную оболочку и спрессовывается опу-
стившимся прессом; степень прессования можно регулировать, уве-
личивая или уменьшая вес пресса. После этого пресс останавлива-
емся, в то время как ползун и зажим опускаются. При обратном
поднятии ползуна зажим поднимает за робой и пресс. Это продол-
жается до тех пор, пока патрон не наполнится. В это время пресс
достигает наивысшего своего положения и ударяется об контактную
кнопку „Iй, благодаря чему открывается клапан „f“, зубчатый вал
останавливается, вследствие разрыва контакта „т“, и зажим „г“ осво-
бождает пресс, который падает вниз и выталкивает патрон. В этом
положении пресс остается до закрытия клапана. Закрытием клапана
после введения новой патронной оболочки в патронодержатель, зажим
и контакт снова приходят в движение до следующего наполнения
патрона.
Новый способ механического насыщения патронов жидким воз-
духом доводит до минимума непроизводительную потерю последнего.
По этому способу поглотитель помещается в непроницаемую для
жидкого воздуха оболочку; один конец оболочки делается проница-
емым для жидкого воздуха, т. е. в нем помещается просверленная в
нескольких местах крышка. Этим концом оболочка, заполненная
поглотительным составом, вводится в особое наполняющее механи-
чески приспособление. Через трубочку, проходящую через это приспо-
собление, в поглотитель накачивается жидкий воздух в необходимом
количестве и под известным давлением. Для ускорения процесса на-
сыщения в поглотитель вводится трубочка, снабженная дырками;
тогда жидкий • воздух из наполняющего приспособления попадает
сначала в трубочку, а оттуда через ее отверстия проникает и в погло-
тительный состав. Количество подаваемого жидкого воздуха точно
регулируется. На рис. 284 показана непроницаемая для жидкого воз-
духа оболочка „а“, состоящая из особо обработанной бумаги, картона
и т. п. материала, закрытая снизу просверленной крышкой „Ъи. В
оболочке помещен богатый углеродом поглотитель „с“. Для насыще-
ния жидким воздухом патрон вводится в плотно к нему прилегаю-
щее наполнительное приспособление „е“. Через трубку „с?“поступает
жидкий воздух и насыщает патрон снизу—наверх. Подымающиеся
наверх холодные газы способствуют предварительному охлаждению
поглотителя.
По своей идее весьма близким к этому способу механического
наполнения стоит имеющий в настоящее время лишь историческое
значение патентованный способ Ковач—Балдус. Способ Ковач—Балдус
патента 1912 г. так называемый, „способ заполнения шпура", заклю-
чался в том, что первоначально в скважину вводился патрон с погло-
тителем, не насыщенным жидким воздухом, вместе с зажигательным
шнуром. Через патрон проходят 2 трубочки (см. рис. №№ 285—287).
Первая трубочка служит для накачивания жидкого воздуха в погло-
тительный состав патрона из особых баллонов, построенных по прин-
ципу Дьюара. Вторая трубочка служит для выведения наружу обра-
зующихся продуктов испарения, которые при неблагоприятных обсто-
ятельствах могли бы выбросить назад весь заряд. Этот способ имеет
то особое преимущество, что патрон приобретает свою взрывную спо-
собность лишь в шнуре, таким образом, здесь безусловно большая
гарантия безопасности работы. Но получив впервые свое практиче-
ское применение в 1913 г., он почти тотчас же был оставлен, вслед-
Рис. 285. Патрон с 2 трубками для на- i>
пол нения и испарения жидкого воздуха. !;
Игла. п
Рис. 284. Прибор для меха-
нического насыщения па-
тронов жидким воздухом
(схема).
Рис. 286. Специальный баллон
для нагнетания жидкого возду-
ха в шпур.
Рис. 287. Насыщение патронов жидким воздухом по способу
Ковач и Балдуса.
ствие массы чисто технических недочетов, главным из которых явля-
ется то обстоятельство, что при недоступности патрона мы совершен-
но не можем регулировать степень насыщения и, таким образом,
здесь возможны 2 отрицательных явления—или пересыщение патрона
Проф. М. Сухаревский. Взрывчатые вещества и взрывные работы. 31
жидким воздухом и, следовательно, непроизводительная трата его,
или неполное насыщение, что может иметь следствием отказы и ча-
стичные неполные взрывы, не дающие необходимого эффекта.
Наполнение патронов, конечно, следует производить в сравнитель-
ной близости от места работы и по окончании приготовления шпуров,
кои надлежит зарядить патронами с взрывчатым воздухом.
В самое последнее время было предложено для целей изоляции
патронов от нагревания стенками шпура, погружать патрон в раствор
некоторых солей перед введением его в шпур. Это погружение вызы-
вает образование на патроне сплошной ледяной поверхности, несколько
понижающей скорость испарения жидкого воздуха, вследствие нагре-
вания стенками шпура.
Патроны вводятся в шпур при помощи особых щипцов или же
особых жестяных лопаточек (к шпурам патроны подносятся на особых
деревянных дощечках, на которые выкладываются после вынимания
из баллонов для погружении). Все операции с патронами не допускают
прикосновения к ним голыми руками, так как жидкий воздух произ-
водит ожоги, трудно залечимые и крайне болезненные. Забивка сква-
жины обыкновенно производится глиной, песком, осколками породы
и т. д., по возможности не плотно, дабы дать выход испаряющемуся
жидкому воздуху.
§ 5. Воспламенение Воспламенение патронов с жидким воздухом мо-
патронов с жидким жет быть произведено тремя способами: во первых',
воздухом. одним Бикфордовым зажигательным шнуром, во-вторых,
Бикфордовым зажигательным шнуром с капсюлем (пистоном), в третьих,
электрическим способом. Применение того или; иного способа всецело
зависит от качества взятого патронного наполнителя и также от
местных условий работы.
Взрывание патронов одним Бикфордовым зажигательным шну-
ром может быть практически выполнено лишь при патронах, в кото-
рых в качестве наполнителей взяты кизельгур и керосин, и если под-
вергаемые разработке породы не являются слишком плотными (песчанник
и сходные с ним). Возможность применения такого упрощенного вос-
пламенителя в данном случае обгоняется особыми физико-химиче-
скими свойствами смеси: керосин-инфузорная земля-жидкий воздух,
требующей для своей детонации лишь достаточно плотной искры
огня. В большинстве других случаев приходится пользоваться для
воспламенения исключительно капсюлем-детонатором, взрываемым по-
средством Бикфордова зажигательного шнура, путем обыкновенного
зажигания последнего или электрическим путем.
Воспламенение патронов посредством Бикфордова зажигательного
шнура с капсюлем производится следующим образом: (рис. 288) пистон
прикрепляется к зажигательному шнуру так, что боковая сторона
шнура образует небольшой выступ, острием какого-нибудь железного
предмета прокалывается отверстие в бумажной пластинке «/г» патрона
и капсюль вводится в патрон. Следует при этом избегать нажатия на
шнур. В приготовленном таким образом патроне капсюль, вследствие
упомянутого выступа зажигательного шнура, держится достаточно
.крепко, и патрон может быть насыщаем жидким воздухом обычным
путем. В тем случае, когда находят лучшим ввести воспламенитель-
— 483 —
ное приспособление уже после насыщения поступают несколько иначе:
во-первых, отверстие в бумажной пластинке «А» делается несколько
больше, во-вторых, шнур, в части своей, непосредственно прилегающей
к капсюлю, одевается немного коническим деревянным пробуравлен-
ным цилиндриком, диаметром соответственно равным отверстию <h».
Воспламенитель, (капсюль детонатор) в котором утилизируется
жидкий воздух в конструктивном отношении мало отличается от при-
веденного выше (см. рис. 289). Верхний конец патрона из бумаги и
сажи состоит из круглого несгорающего бруска «и», просверленного
в середине. В это отверстие укреплен воспламенитель <Ь-крепкая бу-
мажная гильза, снабженная на конце отверстием «£». В другой ее
конец вклеена коническая просверленная колодка <^> с полостью. Диа-
метр просверленного отверстия в самой узкой части гильзы весьма
мал. Воспламенитель <г» также как и ввоь.патрон, заполнен сажей,
в то время как в полости конической колодки «/» помещено немного
легко воспламеняемой шерсти, служащей дйя передачи огня зажи-
гательного шнура на содержимое воспламенителя. Для удержания
зажигательного шнура служит особое приспособление из тонкой жести,
прикрепленное на конце патрона и состоящее из нескольких
острых Зубьев, При насыщении патрона жидкий воздух или кислород
проникает через маленькое отверстие «Ъ в воспламенитель <г» и про-
питывает находящуюся в нем сажу. При зажигании, вследствие
твердости стенок и незначительности отверстия <&» в воспламенителе
быстро увеличивается давление, которое переходит во взрыв, след-
ствием чего является взрыв-детонация всего запального патрона, а
следовательно и всего помещенного в шпур заряда.
§ 6. Электрическое * Опытным путем было установлено, что для воспла-
воспламенение. менения патрона с жидким воздухом, в большинстве
случаев, вполне пригоден обыкновенный электрический (платиновый)
запал, лишь с несколько увеличенным содержанием воспламенительного
состава для улучшения действия. Электрические запалы, делятся
на 2 класса: во-первых, электрические запалы для одновременного
зажигания и, во-вторых, электрические запалы для разновременного
зажигания. Из первой группы наиболее распространенными являются
германские запалы системы „Wulkan*, „Sirius* и др., вообще отлича-
ющиеся лишь деталями своего устройства.
Для моментального взрыва нормального патрона, большей частью
служит так называемый „Специальный моментальный воспламенитель"
(см. рис. 290) представляющий собой электрозапал „Wulkan* с особым
(патентованным) воспламенительным составом и с приспособлением,
препятствующим выпадению последнего из гильзы. Это достигается
пробкой, закрывающей входное отверстие. При воспламенении элек-
трический ток зажигает воспламенительный состав, который дает
очень плотную искру, достаточную для воспламенения всего патрона.
Названный запал также ценен тем, что может быть свободно перево-
зимым, без принятия особых мер предосторожности, так как по суще-
. ству своему совершенно безопасен для хранения и перевозки. То же
самое можно сказать и в отношении так называемого безопасного
электрозапала, изображенного на рис. 291,. Особенностью этого запала
31*
является то, что обе составные его части, собственно электрозапал и
капсюль детонатор, доставляются отдельно друг от друга и соеди-
няются лишь перед употреблением. При электрическом зажигании
было обращено серьезное внимание на введение запалов с такими
капсюлями, действие которых зависило бы в большей или меньшей
степени от пропитывания жидким воздухом. К таким электрозапалам
относятся „Sprengluftcapsel" и „Specielie Sprengluftcapsel“. Первый
(см. рис. 292, 293)—состоит из заостренной с одного конца металли-
ческой трубочки с продольными разрезами, наполненной поглотителем,
близким по составу к патронному поглотителю, лишь с добавлением
некоторых солей. Как и всякий другой запал, воздушный электро-
запал глубоко вводится в патрон. При погружении патрона в жидкий
воздух кислороде проникает через продольныразрезы в богатый он
углероддм поглотительный состав запала. Таким образом, до насы-
щения жидким воздухом, запал совершенно безопасен, после же на-
сыщения представляет собой уже запал—капсюль детонатор весьма
большой бризантной силы, поэтому при отказах, по истечении 30 минут,
т.-е. срока, достаточного для испарения из запала всего жидкого воз-
духа, запал становится совершенно безопасным. Рис. 294 показывает
патрон с воздушным электрозапалом в буровой скважине. В тех слу-
чаях, когда так называемый „безопасный электрозапал** недостаточно
силен, а употребление взрывного воздушного запала невозможнв по
тем или иным причинам, рекомендуется употреблять, несколько иначе
сконструированный, воздушный запал „Specieller Sprenglilftkapsel",
который отличается особым составом, вполне удовлетворительным для
работ с жидким воздухом и весьма мало чувствительным к резкому
колебанию температуры и действию сырости. Относительно влияния
последней необходимо особенно подчеркнуть, что почти все сорта
употребляемых запалов чувствительны к ней, а потому нуждаются
для своего хранения в достаточно сухом помещении.
Для одновременного взрыва большого количества зарядов, в на-
стоящее время, обычно употребляются деревянные колодки „а* с про-
резью по середине для помещения запала „5“ (см. рис. 295). Такая
колодка с запалом — капсюлем обыкновенно вводится в самый конец
шпура, затем соединяются провода и только после этого приступают
к наполнению шпура патронами и к забивке его.
В некоторых случаях применения патронов с жидким воздухом,
особенно в горных разработках, обязательным является последова-
тельность взрывов. В настоящее время разновременность взрыва дости-
гают, исходя из простого принципа различной длины зажигательного
шнура. Для разновременного зажигания употребляют самые обыкно-
венные электрические платиновые запалы. Между самим запалом и
капсюлем укрепляется кусок зажигательного шнура, той или иной
длины (см. рис. 296). При одновременном зажигании нескольких
заключенных в цепь запалов, платиновые проволочки их одновре-
менно накаливаются и зажигают шнур. В более коротком шнуре искра
скорее доходит до капсюля, который взорвется первым. Различной
длиной шнура можно получить точно регулированную последователь-
ность взрывов. Для воспламенения обыкновенно пользуются подрыв-
ной машинкой. Как раньше уже говорилось, было сделано м ного
мймь
Рис. 288. Патрон Meicepa. а, Ъ, с—оболочки; d—поглотитель; через отверстие в передней стенке h введен капсюль с
зажигательным шнуром.
Рис. 289. Патрон с капсюлем, активируемым жидким воздухом.
00
СИ
Рис. 290. Специальный моментальный
воспламенитель.
Рис. 291. Безопасный электрозапал.
I
— 486 —
L -uhl:'- • Wh^t/Z;' i r^1 •il!₽i>rti'^4**:^««!₽’ 'v. >nt*ji**M*i|i»**'j|l||,l|j **jt *и"’“'• ~ ‘♦wrf* lI ~**ri
5*4vi11 mi at M* i h« iV///// ****
Рис. 292. Взрывной воздушный электрозапал
(Sprengluftkapsel).
Рис. 293. Патрон с введенным в него
воздушным электрозапалом.
Рис. 291. Патрон с воздушным электрозапалом
п шпуре.
Рис- 295. Расположение патронов в шпуре.
попыток к воспламенению патронов без применения капсюлей одним
Бикфордовым шнуром, и при электрическом зажигании последнего
в этом направлении было произведено много вполне удачных опытов.
В данном случае является необходимым получение более сильной
искры, для чего поступают следующим образом. Шнур сгибают на
расстоянии от конца, приблизительно равном IQ-ти сайт., (см. рис. 297)
и делают на этом месте надрезы, а затем уже вводят в таком виде
в патрон. Если теперь искра дойдет до пороховой сердцевины до места
сгиба, то зажигательный шнур начинает гореть с возрастающей
живостью и без отказа взрывает патрон. Того же самго результата
можно достигнуть, надрезав Бикфордов шнур на том же расстоянии
от конца в нескольких местах и протянув его через патрон, вместе
с тем, завязав один конец его узлом для воспрепятствования вытя-
гиванию шнура из патрона (см. рис. 298). Вообще и при электриче-
ском зажигании следует следить за тем, чтобы зажигательный шнур,
посколысо он проходит через патрон, был бы окружен для предохра-
нения от действия паров жидкого воздуха особой оболочкой азбесто-
вой или иной. Такая оболочка, весьма простая по конструкции, но
вполне предохраняющая зажигательный шнур и служащая для укре-
Рис. 296. Электрозапал с Бикфордовым
шнуром и капсюлем.
Рис. 297. Патрон с введенным внутрь согнутым
/и расщемленным иа сгибе Бикфордовым шнуром.
Рис! 298. Йатрон $ протянутым через него, рас-
щепленным по середине Бикфордовым шнуром.
Рис. 299. Бикфордов шнур с изолированной
оболочкой, введенный в патрон.
пленил капсюля изображена на рис. 299. Для предохранения выпа-
дения воспламенителя из патрона, в головной части последнего
помещается особая картонная пластинка, звездообразной формы с отвер-
стием для Бикфордова шнура по середине. В заключение следует
—— 488 —
казать, что от правильного выбора воспламенителя в значительной
степени зависит весь успех работы с жидким воздухом и поэтому для
работы с ними необходима предварительная выучка взрывников.
§ 1. Сравнение жид- Параллельно с решением практических вопросов
кого воздуха с про- применения окислитовых препаратов во взрывной тех-
чияи взрывчатыми нике шло и теоретическое обоснование рациональности
веществами. ведения взрывных работ с ними.
Отрицательной чертой, характерной для большинства современных
взрывчатых веществ, является то обстоятельство что количество вы-
деляемой при взрыве энергии, определяющее эффект взрыва, меньше
теоретически расчитанного, так как большинство современных твердых
взрывчатых веществ является веществами, образованными из простых
тел с потерей, иногда весьма значительной, определенного %-та энергии.
Выделение ими все же больших количеств последней следует об'яснить
тем, что, в отношении запаса энергии, эти вещества являются промежу-
точными между продуктами их взрыва и простыми веществами, из кото-
рых они образованы; энергию же выделяют на счет сгорания в самой
молекуле, обыкновенно, С и Н с кислородом (Филиппов). Так, для нитро-
глицерина, пикриновой кислоты и гремучей ртути мы имеем уменьшение
энергии в среднем на 20% против теоретически расчитанного для пол-
ного сгорания содержащихся в них С и Н с кислородом. Помимо того,
избыток кислорода в первом, углерода—во втором, наличие азота явля-
ются балластом, понижающим общий тепловой эффект. Еще в большей
мере сказанное относится к тринитротолуолу (Stettbacher): 1000 грамм
толуола дают при 3130 граммах кислорода 9994 калории; 7175 граммов
тринитротолуола, при том же молекулярном содержании кислорода,
дают только 5255 калории, что составляет 48% потери энергии.
Приведенные примеры показывают, что, во-первых, азотная кис-
лота является' фактором, понижающим энергию взрыва, во-вторых,
для получения наивысшего калорийного эффекта при взрыве наи-
лучшей системой должна была бы явиться система: углерод-кислород.
Последнее и достигается в оксилитовых препаратах, дающих, по ка-
лориметрическим и теоретическим определениям, на 1 килограмм
2000—2500 калорий при взрыве.
Действительно, взяв для примера 1 из средних по даваемому
тепловому эффекту оксилитовых препаратов, именно, систему сажа-
нафталин необходимое количество кислорода, мы можем теоретически
вычислить: предположим, что жидкий воздух содержит 85% кисло-
рода, а поглотитель составлен таким образом: 80% сажи и 20% сы-
рого нафталина. Вычислим количество потребного для вышеуказанной
смеси поглотителей жидкого кислорода:
G 4- О2 = GO’
12 32
1 2,67
I | 4-120»= 10СО24-4Н2О
128
384
Отсюда находим, что вышеуказанная смесь требует жидкого кис-
лорода в -—2—£-----2— = 2,74 раза больше веса самой смеси, но так
как в нашем распоряжении имеется не жидкий кислород, а лишь
содержащий 85°/0 последнего жидкий воздух, нам необходимо будет
, 100.2,74 „„„
взять жидкого воздуха несколько более, именно, в—— = 3,22 раза
больше веса смеси поглотителей. При таком соотношении получается
максимальная сила взрыва, при чем 1 килограмм смеси сгорая должен
дать следующее количество калорий:
0,8 килограмм сажи — 0,8.8080—6464 калории,
0,2 „ нафт. —0,2.9702 —1940
1 килограмм смеси........... 8404 калорий.
Если прибавить к этому еще 3220 грамм жидкого воздуха, то
смесь из сажи, сырого нафталина и жидкого воздуха, весящая 4,22 ки-
лограмма образует 8,404 калорий, т.-е. теоретически:
/ 1 килограмм дает 2000 калорий,
следовательно, на 25°/ф больше, чем сильнейшее из известных до на-
стоящего времени взрывчатых веществ—нитроглицирина и взрывчатой
желатины. Таким образом, при удачном взрыве оксилитового патрона
должен получиться взрыв колоссальной силы, тем более что по но-
вейшим данным для иных, более удачно составленных, смесей с жид-
ким воздухом калорийный эффект найден значительно большим и его
в среднем надо считать равным: 2300—2500 больший калорий на каж-
дый килограмм взятой смеси.
О поразительной силе оксилитовых препаратов свидетельствуют
между прочим следующие практические опытные данные (М. Enderli):
На 2 одинаковых железных бруска (Рис. 300), изогнутых в виде
латинской буквд U, тодщинЬ которых достигала 5 милиметров, были
положены: патрон желатинного динамида весом в 75 грамм и патрон
сырого нафталина весом в15 грамм,-насыщенный учетверенным количе-
ствомжидкого воздуха. Затем о ба’патрона были взорваны. Силой взрыва
динамита боковая стенка бруска былавзорвана, остальные же части
были только слабо изогнуты; препарат жидкого воздуха вырвал не
только боковую стенку, но и нижнюю часть, так что уцелела только
узенькая полоска, да и та-была сильно искривлена. Кроме того, земля
от взрыва оксилитового патрона была вскопана на глубину, по крайней
мере в 2 раза большую, чем при взрыве динамитного патрона. Второй
опыт с 65-ю граммами альдорфита и приблизительно таким же патро-
ном жидкого воздуха дал еще более поразительные результаты в пользу
жидкого воздуха. Конечно, в условиях практической работы, достичь
максимальных опытных данных, большей частью, не удается, что
однако, не уменьшает значение вышесказанного.
Попыток установления точных взрывчатых констант, определяющих
в принятой в теории взрывчатых веществ единицах, качественные
свойства оксилитовых препаратов было сравнительно немного и, так
Рио. 300. Железные бруски, взорванные одина-
ковыми весовыми зарядами жидкого воздуха и
желатинированного динамита (справа — жидкий
воздух, слева — желатинированный динамит.
(Опыт Enderli).
как они производились с препаратами, значительно между собою от-
личающимися по составу, и при практически разных условиях, то
страдают сравнительной разноречивостью. Приводя ниже некоторые
из этих констант, мы взяли те из них, точность вычисления которых
нами считается наибольшей, а для сравнения привели те же данные для
дымного пороха и динамита (кремнистого динамита и гремучего студня):
КОНСТАНТЫ. Оксилитовые смеси. Динамит. Дымный порох.
I. Сила взрывчатого вещества, являемая одним килограммом в атмосферах, определенная формуле: 273 про- его, по f 1 1 1 8764—9420 7740—9940 3090
КОНСТАНТЫ. Оксилитовые смеси. Динамит. |дымный порох.
II. Относительная сила взрывчатого г
вещества при силе дымного по- роха равной единице: f = l.. . . 2,84—3,09 25 - 3,2 1
III. Потенциальная энергия, изме- ренная для одного килограмма взрывчатого вещества по фор- муле: Т= 425. Qp клгр. — метр. от 935000 л от 552750 335000
IV. Относительная потенциальная энергия для одного килограмма взрывчатого вещества, считая t для дымного пороха равным еди нице до 10625000 2,79—3,17 до 820750 1,65—2,45
К Доступная практическая плот- ность 1,5 1,5—1,6 1,14
VI. Об*ем газов, образуемый одним килограммом взрывчатого веще- ства при температуре взрыва, отнесенный к О градус и 760 мид- лимет. давления 505-550 if 630—710 1 280
Приведенные константы позволяют считать оксилитовые смеси
равноценными по качествам лучшим сортам динамитов, особенно в
отношении их метательного действия. Хотя бризантность их, зави-
сящая от количества даваемых при взрыве газов, должна считаться,
по сравнении с динамитами, несколько пониженной, однако, это имеет
на практике иногда даже некоторое преимущество, тем более, что по
остальным сврим качествам оксилитовые препараты могут оказаться
даже более выгодными, чем динамиты.
В заключение укажем, что еще. большого эффекта и работоспособ-
ности можно ожидать при утилизации озона: германской науке в Этом
направлении удалось достичь весьма ценных результатов: полученные
в недавнем прошлом этиленозонид и бензолтриозонид или озобензол,
представляющие химически однородные тела, но своему дробящему
действию и скорости разложения, по мнению специалистов, должны
превозойти, все современные взрывчатые вещества, если практическое
применение их будет возможно.
Состав и свойства взрывчаты^ веществ
и смесей.
Количество известных в настоящее время взрывчатых веществ и
смесей исчисляется тысячами. Причиной этого является, как достиг-
нутый значительный прогресс в технике производства взрывчатых
веществ, так и исключительные успехи в теории взрывчатых веществ
и смесей, могущей предугадать качества и дать рецептуру для со-
ставления многочисленных вариаций известных в. в. и смесей. Им-
пульсом к такому значительному увеличению количества в. в. и
смесей явилось, главным образом, значительное расширение сферы
применения взр. вещ.: пришлось количества в. в. и смесей согласо-
вывать с целями и условиями той работы, для котррой они требова-
лись. И ’ в этом отношении наиболее требовательным потребителем
является во всех странах (не считая Военного Ведомства) — горно-
рудничная промышленность.
Условия работы в рудничной атмосфере действительно ’ предпо-
лагают многие исключительные качества от применяемых в. в. и сме-
сей) именно те качества, которые определяют т.-наз. безопасность или
антигр изутность их.
К сожалению, почти до конца прошлого столетия техника приго •
товления безопасных взрывчатых веществ не имела под собой хотя
какого-либо научно построенного базиса, в результате — выпускалась
масса взрывчатых веществ, предназначенных для потребностей горного
ведомства и рекламируемых, как безопасные, в то время, как вскоре
практика давала самые ужасные доказательства противоположного.
Поэтому предпринятые в. конце прошлого столетия попытки на-
учного обоснования антигризутности взрывчатых веществ должны
быть рассматриваемы, как новый этап на пути рационального исполь-
зования потенциальной энергии взрывчатых веществ и смесей огор-
ном деле.
Исходя из изложенного, мы предпосылаем настоящему отделу,—
описанию взрывчатых веществ и смесей — главу, в которой вкратце
постараемся изложить современные взгляды на антигризутность взрыв •
чатых веществ и смесей.
ГЛАВА I.
Вопросы антигризутности взрывчаты^ веществ и смесей.
§ 1. Импульсом к исследованиям явлений выделения пламени при
взрыве послужило то наблюдение, что некоторые взрыввещества (черный
порох, динамит) способны воспламенять своим большим, нередко
вырывающимся из шпура, пламенем взрывчатый рудничный газ и
смесь угольной пыли с воздухом. А так как*,последнее может повести
к страшным катастрофам, то стремление избежать их имеет с социаль-
ной тбчки зрения огромное значение для всей взрывной промышлен-
ности. Поэтому во всех странах были назначены комиссии для иссле-
дования причин подобных взрывов и издан целый ряд постановлений,
ограничивающих пользование взрыввеществами в угольных шахтах.
Ясно, что среди причин, вызывающих взрывы рудничного газа, как
пламя взрыва, так и пользование открытым огнем стоят на первом
месте и должно даже казаться странным, что воспламенение проис-
ходит сравнительно редко, так как температура взрыва смеси мета-
на с воздухом находится при 650—750», в то время, как температура
взрыва взрыввеществ зачастую превосходит на много!0 в loo О»*).
Наиболее легко воспламенимой является смесь метана с возду-
хом при содержании 9,5% метана.
Смеси с содержанием метана свыше 14% не взрывчаты, но
могут стать таковыми при доступе воздуха. Поэтому наибольший
интерес и значение имеет определение нижней границы взрывной спо-
собности смесей рудничного газа. По Паркеру, она равняется 5,8%.
Нижняя граница (частичной) сгораемости лежит еще ниже, а именно
при 2% метана.
Билуховский и Лакоцинский определяют границы взрывной спо-
собности метана от 3,7 до 9,0%. Присутствие угольной пыли пони-
жает взрывную границу для метана до 3 — 4% и увеличивает скорость
распространения взрыва. Присутствие тяжелых углеводородов также
увеличивает воспламеняемость.
При смесях угольной пыли воспламеняемость в значительной
степени зависит от химического строения пыли, размеров отдельных
пылинок и содержания в ней летучих веществ.
Малляр и Ле-Шателье, однако, доказали, что воспламенение сме-
сей при температуре воспламенения происходит крайне медленно и
что почти всегда наблюдается замедление, которое может достигнуть
10 сек. От присутствия инертных газов замедление увеличивается, но
с повышением температуры уменьшается. При 1000° оно равняется
1 сек., при 2200° доказать его уже не представляется возможным.
Эта температура, поэтому, и расматривается. Малляром и Ле-Шателье
как критическая для возможности взрыва рудничного газа.
Если предположить, считаясь с этими обстоятельствами, что
условия для воспламенения рудничного газа при его узких взрыв-
ных границах воспламенения имеются на лицо довольно редко и что
*) Kast .Spreng й Ziindstoffe® 1921 г.
наступлению этих условий можно противодействовать хорошей венти-
ляцией и другими техническими мероприятиями, то все таки опыт
показал, чтоизбежать воспламенения удается далеко не всегда. Для уяс-
нения необходимых и достаточных для взрыва рудничного газа факторов
были произведены наряду с работами антигризутных комиссий много-
численные исследования, которые во многих отношениях способство-
вали уяснению этого вопроса. Результаты этих исследований таковы.
§ 2. а) Температура пламени. По вышеизложенному можно пред-
положить, что при известных обстоятельствах воспламенение смеси
наблюдаться не будет, а именно, если будут приняты меры к тому,
чтобы температура выбивающегося из шпура пламени, т.-е. попада-
ющих в рудничный газ раскаленных продуктов взрыва, будет по воз-
можности понижена. Этого можно достигнуть тем, что:
1) будут употребляться взрывчатые вещества, которые сами по
себе имеют невысокую температуру взрыва.
2) не будут употреблены слишком большие количества взрывве-
ществ.
3) к взрыввеществам будут прибавлены вещества, которые при
взрыве поглощают теплоту.
4) теплота, образующаяся при взрыве, будет обращена, по воз-
можности полностью уже в самом шпуре в механическую работу.
Первому условию удовлетворяют аммиачно-селитровые взрывве-
щества, температура взрыва которых весьма низка, как вследствие
освобождающихся больших количеств азота (в аммиачной селитре
последние составляют 35%), которые требуют дополнительного нагрева,
так и вследствие высокой, удельной теплоты паров воды, так же об-
разующихся в большом количестве. К сожалению, эта соль, вследствие
малой способности к детонации, не может применяться, как взрыв-
чатое вещество; обыкновенно к ней прибавляют органические веще-
ства, которые и производят полное сгорание за счет излишнего кис-
лорода. Но при этом, опять-таки повышается температура взрывай
тем болыце, чем больше кислорода содержит в себе сама примесь.
Поэтому понизить темпёратуру взрыва аммиачных взрыввещессв ниже
] 500° вряд-ли возможно, оно и не практично, так как способность к
детонации и взрывной эффект зависят также от температуры.
С этой точки зрения и на основании вышеуказанных исследо-
ваний Малляра и Ле-Щателье, а также опытов, произведенных в 1888 го-
ду по поручению * Comission des substances explosives", предельная тем-
пература взрыва каковой может достигнуть взрыввещество (на основа-
нии удельных теплот) было теоретически определена во Франции и
России для рудничных копей в 1900°, а для угольных копей в 1500°.
Что-же касается второго условия, то надо сказать, что с увели-
чением (количества взрыв вещества) заряда увеличивается и становится
более горячим и пламя, так как отдача тепла наружу сравнительно
уменьшается с увеличением количества взрыввещества. Но так как
величина пламени зависит от состава взрыввещества, то допустимое
количество различно для каждого взрыввещества в отдельности. Это
допустимое количество носит название „предельного заряда". Послед-
ний обычно устанавливается практически-опытным путем в т. н. испы-
тательных штреках; здесь мы даем описание Опытного штрека в Гель-
зепкирхене. (Рис. 303). Опытный штрек по возможности приноровлен
к условиямподземных галлерей. Длина его достигает 34 mt; поперечный
разрез его имеет форму эллипса, площадь которого равна 2 квадр. метрам,
высота ровна 1.85 mt, ширина 1.35 mt. Тройные стенки сделаны из
особой породы американской пихты (по возможности без сучков). Об-
щая толщина стенок равняется 60 mm. Каждые 400—600 mm. штрека
обхвачены крепкими обручами из двутаврового железа. Один конец
штрека открыт, другим-же концом он входит в каменный массив,
3,5 mt. высотой, 3 mt. шириной и 3 mt. Длиной, при том таким обра-
зом, что ближайшая к массиву часть штрека (на расстоянии приблиз.
в 1 метр.) как снаружи, так и внутри сцементирована. Для большей
сопротивляемости, штрек по самые окна зарыт в землю Сторона
штрека, не имеющая окон, засыпана землей. Чтобы заглушить
звуковые явления взрыва, открытый конец штрека окружен полукруг-
лым валом. В каменном массиве сделаны два углубления, в которые
вставлены два искусственных шпура из литой стали. При опытах
с гризутными смесями на шипы железного круга, надевается сплош-
ной лист картона, который затем укрепляется вторым кругом. Таким
образом в штреке отделяется камера, об,ем которой в точности равен
10 mt. Для удаления газов из штрека после взрыва служит чугунная
труба, диаметом в 400^mm., Трубазапирается точно пригнанной кониче-
ской пробкой, укрепленной на стержень, благодаря чему можно откры-
вать и запирать трубу не входя в штрек. Перед трубой установлен венти-
лятор. Для удаления газов при работе винтилятора требуется не более
7 минут. Наблюдения за всем происходящим внутри штрека ведутся
через окна, коих 15 шт. Воспламенение производится электрическим
способом. Однако, вследствие зависимости полученных данных от
Рис. 301. Опытный штрек в Шлебуше. На первом плане английский, на заднем
германский опытные штреки. В последнем виден взрыв рудничного газа.
метода опыта/ результаты нельзя рассматривать, как окончательные,
а только как относительные. Этот способ практикуется во всех стра-
нах. В Бельгии, как и во Франции вместе с тем обращается особое
внимание й на температуру взрыву.
На практике предельный заряд варьируется, согласно свойствам
и составу рудничного газа и угольной пыли.
Третье условие касается материалов, применяющихся для изго-
товления антигризутных взрыввеществ. В начале к обыкновенным
динамитам примешивали неорганические соли, содержавшие кристал-
Рис. 302, Горизонтальный и вертикальный разрезы опытного
штрека в Гельзенкирхене.
лизационную воду; однако, подобные взрыввещества оказались мало
пригодными, так что производство их в настоящее время, по крайней
мере в Германии, совершенно прекращено. Позднее, вместо содержащих
кристализационную воду солей, стали употреблять соли, не содержащие
ее, в особенности хлориды щелочных металлов бикарбонаты калия
и щавелевокислый калий, которые вызывают понижение температуры
взрыва отчасти испарением, отчасти своим разложением. Эти соли оказы-
вают благоприятное влияние на антигрибутность данного взрыввещества
не только в больших количествах, как это наблюдается при желатиниро-
ванных динамитах, но и одним своим присутствием, подобно карбонитам.
Весьма показательной и интересной иллюстрацией к изложенномумогут
служить графики, разработанные французской антигризутной комис-
сией. (Рис. 285).
Рис. 303. Поперечный разрез опытного штрека в Гельзенкирхене.
Путем вычислений, была определена температура взрыва многих
составов, но работы коснулись главным образом смесей азотнокси-
лого аммония с динамитом, пироксилином и пироколлодием. Результаты
их представлены графически в виде двух линий. Эти линии постро-
ены таким образом, что по оси абсцисс откладывались количества
азотнокислого аммония, выраженные в десятых долях всего состава,
— 497 —
Рис. 304. Кривая температуры взрыва
смеси 11-азотного пироксилина с ам-
миачной селитрой.
Рис. 805. Кривая температуры взрыва
смеси 8-азотного пироксилина с ам
миачной селитрой.
5
Рис. 306. Кривая температуры взрыва
смеси азотно'Кислого аммония с ди-
намитом.
Проф. М. Сухаревский. Взрывчатые вещества в взрывные работы.
32
(
— 498 —
а по оси ординат для кривой tt отмечались соответственные темпера-
туре взрыва ff величины удельного давления. Удельным давлением
называется такое, какое в единице об'ема пространства развивают
газы, полученные в момент взрыва из единицы веса испытуемого
вещества. Указываемая величина в известной степени служит выра-
зителем силы взрывчатого материала. Обе кривые наглядно предста-
вляют зависимость температуры пламени при взрыве и удельного
давления от химического состава испытуемого материала. Опыты про-
Рис. 307. Опытный штрек в Ней-Бабельсберге.
изводились с патронами в 50 гр., которые свободно подвешивались
в камерах или испытательных штреках, где их взрывали пистонами
с 1,5 гр. гремучей ртути. Щтреки наполняли различными гремучими
смесями и при этом заметили, что если вычисленная температура
пламени бризантных составов лежит ниже 2200°С., то взрыва грему-
чих смесей не происходило. Что же касается пороховых зарядов, то
они его производили всегда даже тогда, когда были заключёны в водя-
ном патроне.
Так как все примеси уменьшают взрывной эффект взрыввещества,
то неоднократно делались предложения и опыты применить их в ка-
честве забивки. В этом случае их назначение—потушить пламя.
К всему вышесказанному можно еще прибавить, что в самое по-
следнее время неоднократно испытывался способ ограничить район
распространения взрыва угольной пыли тем, что в определенных
местах галлереи насыпалась несгораемая рудничная пыль, которая
силой взрыва распылялась; другой способ состоял в устройстве во
время взрыва в галлереях предохранительных мокрых зон, водяных
завес и пр.
Четвертое условие, возможно полный перевод образовавшейся
теплоты в механическую работу, практически не всегда выполнимо.
При быстро детонирующих, бризантных взрыввеществах вполне мыс-
лимо, чтобы газы, только по совершении известной работы, т. е. уже
В охлажденном состоянии, выходили-бы наружу, однако возможность
подобного быстрого и полного превращения теплоты в работу зависит
от различных внешних обстоятельств, которые не всегда одинаковы.
Сюда следует отнести форму, а в особенности диаметр шпура (следо-
вательно и диаметр патрона), направление его, свойства и крепость
породы и забивки. Во всяком случае при твердой и тщательной
забивке опасность взрыва значительно уменьшается. Поэтому высота
забивки для угольных шахт обычно декретирована. Но твердой уверен-
ности не может дать даже идеальная забивка, так как порода может
изобиловать трещинами и щелями, которые предоставят горячим газам
безпрепятственный выход.
Температура взрыва данного взрыввещества, следовательно,
играет выдающуюся роль для определения степени опасности его ко
взрывам рудничного газа, так как от нее в первую очередь зависит
возможность понизить температуру выделяемых в воздух газов до
предельной границы воспламенения рудничных газов. Опыт, однако,
показал, что не одна температура имеет решающее значение. Ведь влече-
ние последнего времени были предложены взрыввещества, которые,
несмотря на их высокую температуру взрыва, сравнительно антигри-
зутны, и, наоборот, существуют взрыввещества, которые, несмотря на
низкую температуру взрыва, не всегда гарантируют невозможность
последнего.
б) Продолжительность и длина пламени*'). Длина пламени, связь
которой с антигризутностью и зависимость которой от заряда были
уже упомянуты выше, и продолжительность пламенного явления
стоят в тесной связи с его температурой. Чем выше температура,
тем больше потребуется времени для охлаждения частиц газа ниже
их температуры раскаливания и, следовательно, тем дольше вся мас-
са газа будет находиться в раскаленном состоянии. Состав взрывных
газов также влияет на продолжительность пламени. Во многих слу-
чаях следует допустить, что после взрыва, во время остывания, меж-
ду продуктами взрыва цроисходят вторичные реакции, которые пре-
пятствуют резкому понижйию температуры, следствием чего являет-
ся медленное угасание пламени. Эти вторичные реакции могут быть
ускорены присутствием, в продуктах взрыва веществ, способных дей-
ствовать каталитически. Этим предположением, например, обгоняется
благоприятное влияние незначительных количеств неорганических
примесей на антигризутность.
Поэтому быстрая и по возможности полная реакция разложения
взрыввещества, а, следовательно, также хорошая детонационная спо-
собность и достаточно полное воспламенение влияют благоприятно на
антигризутность. Черный порох, который, благодаря сравнительно
медленной реакции, дает большое, продолжительное пламя, поэтому
повсюду запрещен к употреблению в угольных шахтах. Далее, на
r) Kast „Spreng und Ztindstoffe*.
основании практического опыта установлено, что от недостаточно
основательного перемешивания составных частей бризантных взрыв-
веществ или от неполной детонации последних (выпал) и, наконец,
от дотлевающих частиц взрыввещества или его оболочки, опасность
взрыва рудничных газов значительно увеличивается.
При взрыввеществах, не обладающих достаточным количеством
кислорода для полного сгорания, где в продуктах взрыва, следова-
тельно, имеются на лицо горючие газы (окись углерода, водород, ме-
тан и т. д.), может прибавиться еще то явление, что эти газы после
смешивания с воздухом снова воспламенятся и этим увеличат основ-
ное пламя взрыва. На эти вторичные пламенные явления первая об-
ратила внимание „Comission des substances explosives11, которая из раз-
ницы теоретически вычисленных и практически полученных в ма-
леньком опытном штреке количеств теплот установила степень сго-
раемости взрывных газов. Позднее, Билль и Гизе подтвердили это
фотографическими снимками, а Каст нашел, что при взрыве нитро—
взрыввеществ (пикриновая кислота или тринитротолуол) соотношение
окиси и двуокиси углерода в смешанных с воздухом взрывных газах
меняется, смотря по тому, детонируют-ли взрыввещества под сильным
давлением (в гранатах) или на открытом воздухе. Так было найдено,
что при взрыве:
270 gr
270 gr
270 gr
*
270 gr
1000 gr
пикриновой кислоты
тринитротолуола
я
под давлением:
СО_55
С02 —45
без п _45 ” ~ 55
под п -а70 ” — 30
без п __40 " — 60
_ 30
» « ” —'7п
я
я
Существующая разница находит себе об‘яснение в том, что де-
тонационные газы при взрыве под давлением, вследствие произведен-
ной работы быстро охлаждаются ниже температуры воспламенения
своей смеси с воздухом, так что последующее превращение окиси
углерода в двуокись уже не могло иметь место, как это наблюдается
при взрыве на открытом воздухе. Это об'яснение находит себе под-
тверждение еще в том, что при больших количествах взрыввещества
количество фиксированной двуокиси углерода было больше, чем при
незначительных.
Вторичные пламенные явления тесно связаны с опасностью взрыва
рудничных газов. Их стараются избежать, добавляя сравнительно не-
большие количества неорганических солей, что на практике дало хо-
рошие результаты. Что же касается, в частности, добавления хлори-
стого натрия, то Бейлинг, на основании собственных опытов, утвер-
ждает, что хлористый натрий является предохранительным средством
только от угольной пыли, а не от рудничного газа.
— 501 —
НО
(в*
Щ,
(ТЬ
ом
ва-
йе-
зле
ов-
‘об-
)аз-
ма-
5го-
это
•о—
1нне
1зах
ным
ено,
' Присутствием в воздухе шахт незначительных количеств руднич-
ного газа, пламя, наконец, может быть увеличено, что и наблюдается
в лампе Дэви. Если эти количества газа сами по себе недостаточны
для взрыва, то они всетаки могут благоприятствовать взрыву уголь-
ной пыли.
На связь между длиной пламени и антигризутностью первым
указал Siersch. Siersch также сфотографировал пламенные явления сво-
бодно в воздухе детонирующих взрыввеществ и продемонстрировал те
большие различия, которые существуют между отдельными взрывве-
ществами. (Рис. 308—314). Из этих снимков видно, что динамиты
,*о Де-
кеден-
*йения
-окиси
гается
* под-
дества
IM при
Взрыва
,но ве-
то хо-
хл ори-
утвер-
>дством
Рис. 308. Взрыв 100 gr. взрывчатого желатина.
обладают очень большим пламенем, в то время как аммиачные взрыв-
вещества отличаются едва заметным пламенем. Bichel и Mettegang
впоследствии продолжили опыты Siersch’a и обратили внимание на
продолжительность пламенных явлений, которая устанавливалась осо-
бым аппаратом. В последние годы Виляю и Гизе также удалось скон-
струировать аппарат для определения продолжительности пламени.
(См. часть IV).
— 502 —
Относительно снимков Siersch'a надо заметить, что если сила
пламени робурита при выпалах в сравнении с пламенем гурдинамита
кажется большой, в то время как при свободном расположении пат-
рона в пространстве она оказывается маленькой, то это обстоятель-
ство имеет, наверно, ту причину, что робурит в шпуре разлагается
гораздо лучше, чем в воздухе. Вследствие этого при подобных сним-
ках надо всегда помнить, что может быть разложение происходит
не вполне так полно, как оно происходило бы в шпуре (ведь сним-
ки производятся в свободно подвешенном состоянии). ‘Кроме того
Рис. 309. Тоже 100 gr. желатинированного динамита.
надо помнить и то, что эти фотографии не могут безоговорочно слу-
жить масштабом для суждения о температуре пламени взрывчатых
веществ., так как пластинка передает только химическое действие лучей
на нее. А химически сильно действующие лучи не являются одновремен-
но обладающими наибольшей теплотой. С другой стороны, снимки
наглядно показывают, присутствие раскаленных газов, безразлично—по-
лучились ли они из раскаленных газов взрыва, или же из сжатых,
благодаря механической работе, газов и раскаленных частиц воздуха.
Очень возможно, что если этот метод исследования будет достаточно
улучшен, он даст весьма ценные данные.
Некоторые снимки Билля приводятся нами ниже (рис. 320—324),
причем большой снимок передает в масштабе форму и длину пламени,
а узкая полоса сбоку своею светлой частью—продолжительность его.
в) Бризантное действие. Из остальных факторов, имеющих влия-
ние на антигризутность, важным было признано также и бризантное
действие взрыввещества.
Рис. 310. Тоже 100 gr. гурдинамита.] О
Рис. 312. Тоже 100 gr.
карбонита. ,
Рис. 313. Тоже
100 gr. гризутита.
Рис. 311. Тоже 100 gr. ро-
бурита.
Рис, 314. Тоже 100 gr. желати-
иир. динамита, при забивке
мокрой бумагой, выпал.
Без сомнения, решающую роль в данном случае играет быстрота
самого процесса взрыва. Вследствие этой быстроты вокруг заряда об-
разуется весьма сильное сжатие атмосферы, которое влечет за собой
и ее нагревание. Так при адиабатическом сжатии воздуха на 100 атм. его
температура поднимается до 620°. Ясно, что бризантные взрывчатых
веществ, заключенные в шпуре и развивающие давление до 800 атм.,
легко произведут в ближайших слоях атмосферы сжатие в несколько сот
атмосфер, т.-е. теплота, получаемая как следствие этого сжатия, сама по
себе вполне достаточна для воспламенения рудничного газа.
От быстроты процесса взрыва и силы взрывчатых веществ зависит
количество энергии, освобождающейся в единицу времени. Чем выше
Рис. 315. Выпал 100 gr. гурдииамита бее забивки.
бризантное действие, тем выше и действие взрывных газов на соседние
гризутные слои атмосферы. И, действительно, опыты в Германии пока-
зали, что с уменьшением бризантного действия взрывчатых веществ
безопасность их в гризутном отношении увеличивается.
Австрийский генерал Гельф весьма остроумно сумел сделать
видимым действие, которое производит механическая работа взрыв-
ных газов. Он сфотографировал ночью одновременный взрыв двух
взрывных патронов, свободно подвешенных в воздухе, на расстоянии
*
аие
»ка-
етв
ать
ыв-
вух
1ИИ
505 —
-Г
*
Рис. 316. Выпал 100 gr. робурита без забивки.
?
от
по
ИТ
не
* w/?
Рис. 317. Выпал 100 gr. антиг
гризутита без забивки.
Рис. 313. Выпал 100 gr.
веттрердинамита.
f
i'j
fl
— 506 —
40 см. друг от друга (рис. 325); на этих снимках довольно ясно можно
различить накаливание частиц атмосферы, благодаря давлению газов.
Между обоими очагами взрыва, можно видеть кое-где, что охлажденные
Рис. 319. Взрыв 100 gr.
гурдинамита под водой.
газы встречают яркую зону сжатых и поэтому
раскаленных газов. Следует обратить внимание
и на то обстоятельство, что наиболее яркие
вспышки происходят не из середины взрывчатых
веществ, куда бы их следовало бы теоретически
отнести, а сбоку, вне самого заряда.
Ваттейне и Деноел указали на то обсто-
ятельство, что давление, производимое взрыв-
ными газами на соседние слои атмосферы зависит
не только от бризантного действия взрывчатых
веществ, но также и от их первоначальной
плотности, обусловливающей первоначальное
давление газов.
Это мнение с одной стороны подтвер-
ждается фотографическими снимками волны
сжатия Ле - Шателье и Диксона, а также и
Гесса, а с другой, наблюдением, что анти-
гризутность, помимо количества взрыввещества,
зависит от диаметра шпура, а, следовательно, и от диаметра пат-
рона, от расположения патронов в нем и от плотности и ско-
[Рие. 320. Фотографический снимок взрыва
черного пороха.
Рис.' 321. То-же взрывчатой желатины.
— 507 —
Рис. 322. Тоже взрывчатой желатины с 25°/0
органической бедной кислородом примесью.
Рис. 323. Тоже'донарита.
Рис. 324. Тоже аммонала.
— 508 —
Рис. 325. Взрыв двух свободно подвешенных
патронов. Видно накаливание частиц атмосферы
давлением газов.
рости детонаций взрыв-
вещества; а два послед-
них фактора стоят в не-
посредственной связи с
бризантностью.
Итак, для определе-
ния антигризутности от-
дельных взрыввёществ
знание его бризантности
необходимо, тем более, что
действительно получаю-
щаяся температура зави-
сит от бризантности и пря-
мо пропорциональна ей.
г) Состав детонацион-
ных газов. Что касается
влияния состава детона-
ционных газов, то было
' наблюдено, что присут-
ствие горючих газов в
продуктах взрыва увели-
чивает гризутную опас-
ность, вследствие вторич-
ных пламенных явлений;
поэтому во Франции за-
прещены для рудников
все взрыввещества, со-
держащие подобные газы.
Но имеются как раз про-
тивоположные наблюде-
ния: так карбониты, кото-
рые образуют подобные
газы в больших количе-
ствах, безопасны, в то
время как часто взрыв-
вещества, выделяющие
при взрыве излишний
кислород, крайне опасны.
06‘яснение этого явления
можно найти в том, что
не качество, а количество
образованных газов по со-
отношению с содержани-
ем кислорода в смеси руд-
ничного газа обусловливает большую или меньшую опасность (конечно,
исходя из точки зрения, что образуются более или менее воспламе-
нимые смеси рудничных газов).
Из всего этого можно вывести заключение, что как взрыввещест-
ва, образующие при взрыве большие количества горючих газов, так
и выделяющие избыточный кислород, на практике не однообразны
по безопасности.
д) Другие факторы. Кроме уже вышеуказанных факторов, увели-
чивающих гризутную опасность, здесь следует упомянуть также и
йрсокую температуру и давление воздуха, влажность его и т.-д. Но
при этом следует подчеркнуть, что всем этим факторам нельзя при-
давать одностороннего значения. Так, например, низкое давление
воздуха благоприятствует истечению рудничных газов из пород.
Таковы современные предпосылки об антигризутности взрывчатых
веществ. Резюмируя их можно сказать, что этот вопрос, поставленный,
видимо, на путь правильного решения ожидает еще много новых как
опытных поверок изложенных предпосылок, так и нового возможно
полного освещения, как теоретического, так и практического.
ГЛАВА II.
§ 1. Производство черных порохов было описано выше. Здесь
мы лишь кратко скажем о некоторых, применяемых в настоящее
время сортах его, у нас и за границей.
Военный дымный порох имеется у нас следующих
1. Русские военные СОрТОВ:
дымные породе. q черным углем.
Охотничий — крупный, зерна 0,76 mm. 0,38 mm. и мелкий 0,38 mm.
0,12 mm.
Ружейный — зерна от 1,27 mm. до 0,76 mm. расходуется теперь
на снаряжение шрапнелей или применяется для воспламенителей
и т. п.
Артиллерийский — зерна величиной от 1,27 mm. до 2,03 mm.; при-
менялся раньше для стрельбы из гладкоствольных орудий, а теперь
идет на снаряжение снарядов.
Крупнозернистый — зерна величиною от 5 mm. до 10 mm. непра-
вильной угловатой формы; употребляется для боевых зарядов в поле-
вой и для уменьшенных зарядов в осадной и крепостной артиллериях.
Призматический черный—в виде шестигранных призм, с 7-ю ци-
линдрическими каналами; будучи назначен для осадной и береговой
артиллерии, он был впоследствии заменен в береговой артиллерии—
бурым призматическим и бездымным, в осадной и крепостной—крупно-
зернистым и бездымным.
Б. С бурым и шоколадным углем.
Охотничий — крупный (зерна 1,27 mm.—2,03 mm.) и мелкий (зер-
на 0,38 mm.— 0,51 mm.). /
Трубочный — для кольцевого состава в дистанционных трубк ах;
по размеру зерен сходен с мелким охотничьим, но имеет менып ую
плотность.
Ружейный — зерна от 0,89 mm. до 0,51 mm. Им снаряжены п ат-
роны в берданках; в настоящее время он идет также на снаряжение
шрапнелей.
510 —
Все пороха с бурым углем имеют состав:
Селитры . .
Угля . .
Серы . . .
Призматический бурый и шоколадный порох имеет состав:
Селитры..................75°/0
Угля.......................21%
Серы...................... 4 %
Наст указывает на составы военных черных порохов, применя-
вшиеся в России в 1918 г.:
Мелкозерни- стый порох. Крупнозер- нистый ку- бический. Призматиче- ский.
75.5
76
75,5
Калийной селитры
Серы.........
Угля. ......
16,5
)
16
16
Состав порохов для минометов им указывается такой:
Калийной селитры........74%
Серы........*.............10%
Угля......................13%
Состав кубических порохов для гранат таков:
Калийной селитры. ... . . 73%
Серы........................ 5<>/0
Угля...........................22%
2. Бельгийский приз-
матический пороге.
В Бельгии во время
треблялся призматический
Европейской войны упо-
порох состава:
Калийной селитры....... 51,8%
Серы.................... 9,4%
Бурового угля............ 38,8%
— 511 —
Охотничий гре-
мучий порох*
Каст считает его состоящим из:
Калийной селитры........ 75%
Серы.....................10%
Угля.....................15%
4. Взрывчатый Весьма распространенный взрывчатый порох имеет
порок. состав:
Калийной селитры . . . 60—78%
Серы................18,5—10%
Угля................21,5-12%
Употребительным германским сортом является состоящий из:
Калийной селитры .
Серы. ...........
Угля.............
65,76%
• 15,10%
. 20-14%
5. Французскиедым- Во Франции распространены следующие сорта:
ные порога.
Сильный порох. Обыкновен- Слабый по- ный порох Гкпугл (кругл. илиР^ \Руг? угловатый). и У в")’
Кругл, или угловатый. МС.
Калийной селитры . .
Серы................
У гля...............
75 75 62 52
10 12,5 20 30
15 12,5 18 18
Второй сорт представляет состав старых французских военных
порохов.
Для целей горного промысла готовят черный порох
6. Пороу для специальной формы при помощи прессования (еще в
горные работ, сыром виде), в виде шашек и столбиков с каналом по
'середине, назначенным для нанизывания их на зажи-
гательный шнур, а также для удобства переноски нанизанными на
обыкновенную бичевку. Внутренний канал их по оси, без сомнения,
способствует скорейшему распространению пламени. В шашках канал
делают цилиндрическим и конец фитиля или бичевки завязывают
узлом, в столбиках же внутренний канал делают слегка конической
формы и шнур подгибают под себя.
Такой прессованный порох представляет много удобств при за-
ряжании и забивки шпуров. Удельный вес такого прессованного’по-
роха доходит до 1,85. .'г. ;'
В вязких и вполне слитных породах, где газы в состоянии"пол-
ностью развится в шпуре и тем достичь своей максимальной упру-
гости, следует отдать предпочтение применению прессованного по-
роха, но для него надо бурить глубокие шпуры, обеспечивающие
хорошую забивку. WMfe
§ 2. Для дальнейшего описания различных сортов дымных по-
рохов практически является удобным разбить их на группы в зави-
симости от характера изменений основного типового состава смеси
или усложнения ея. В первую очередь мы остановимся на порохах,
в которых калийная селитра подверглась полной или частичной за-
мене натриевой, а остальные компоненты, либо остались без изме-
нения или подверглись частичной замене.
Вследствие большой дороговизны калиевой селитры, сравни-
тельно с натриевой, а также меньшего содержания в ней кислорода*),
и желания уменьшить до минимума количество твердых продуктов
взрыва, пришли к попыткам применить, вместо калиевой селитры или
части ее, натриевую и аммиачную (иногда бариевую**) и стронциевую
селитру), а для уменьшения же гигроскопичности—начали заменять
уголь, целиком или частью, иными веществами, и даже вовсе отка-
зались от серы.
В общем пороха с натриевой селитрой дешевле, сильнее, но
гигроскопичнее порохов с калиевой селитрой, с аммониевой—дороже и
гигроскопичнее, но такие пороха действуют значительно сильнее и
дают меньше нагару. Препараты с баритовой селитрой труднее вос-
пламеняются, медленнее горят и менее портят огнестрельное оружие, и
нежели пороха с калиевой селитрой. Препараты с натриевой селитрой
с выгодой применяются между прочим при разработке каменной соли.
Уменьшение скорости сгорания пороха может быть также достигнуто
путем замены древесного угля отрубями, опилками, дубильной кис-
лотой и т. п. В настоящее время все эти суррогаты древесного угля
употребляются сравнительно редко, за исключением разве лигнита,
который еще кое-когда применяется в дешевых порохах с натриевой
селитрой.
Переходя к пороховым смесям с натр!евой силитрой,
1. Взрывчатая необходимо, прежде всего, упомянуть про взрывчатую или
селитра. гремучую селитру. Состав ее непостоянен, но в общем бли-
зок к следующему:
натриевой селитры . . .75%,
серы . . . .............Ю%,
бурого угля . . . . . .15%.
Следовательно, в сущности, это есть тот же дымный порох.
Будучи сравнительно очень дешева, она пользуется значительным
•) Калиевая селитра содержит 47% кислорода, натриевая же—56% его.
•*) Бариевая селитра дает мало дыма и развивает значительную энергию.
,..4.<.'>.*а4<.,<«ий»5*^
op ох.
ьным
кис-
угля
1ита,
16В0Й
ктов
или
Шую
аять
>тка-
или
бли-
8 НИ-
П0-
1ВИ-
10СИ
хах,
за-
зме-
за-
'по-
I»,.
1ОЛ-
ФУ’
по-
цие
но
ке и
ее и
вов-
не, и
трой
юли.
ию.
** '
— 513
. «!*
»
угля
натриевой селитры,
калиевой
серы,
древесного
каменного
33
и
применением в частной промышленности. Ее много употребляют в
Стасфурских соляных месторождениях, где она оказывается горазд
выгоднее черного пороха.
Важные ее достоинства, помимо дешевизны,— отсутствие в про-
дуктах взрыва ядовитых газов. Особенно хорошо ее применять при
разработке залежей карналита; в более твердых породах Стасфурских
месторождений работают, комбинируя заряды динамита со взрыв-
чатой селитрой.
Йроме только что приведеного состава так называемой „взрыв-
чатой селитры" есть еще несколько сортов с другой пропорцией тех
же составных частей, например:
70 \> натриевой селитры,
15’о серы,
15 о древесного угля.
Есть сорта с бурым углем, содержащие калиевую и натриевую
селитру вместе.
Известен также сорт „взрывчатой селитры", содержащей каменный
уголь:
56 о
20'о
10 п
10 о
Взрывчатая селитра
Взрывчатая селитра зерниста, как обыкновенный порох; не
полируется, или же прессуется в патроны; цвет ее буровато-серый.
Взрывчатая селитра, будучи зажжена на открытом воздухе, сго-
рает сравнительно медленно, без вспышки. Из других пороховых
смесей весьма близких к составу взрывчатой селитры и черного
пороха, но не столь широко применявшихся, можно назвать следующие:
Натриевой селитры. 76 о 74,8 <>
Серы . 10<> 10,1 о
Угля i 1 ( 14 15, Го
Большую гигроскопичность смесей, содержащих натриевую се-
литру, стараются по возможности уменьшить, применяя тщательно
; залитые парафином бумажные обертки из пропитанной парафином-же
бумаги и возможно скорее употребляя подобные пороха в дело.
Здесь заметим, что в Америке также весьма распространен
близкий к перечисленым по составу порох, содержащий:
Натриевой селитры 73’.,
Серы . - . - . . 11 ’<>
УГЛЯ . . . . . . 16'о
Проф. Л1. Сухаревский. Взрывчатые вещества и взрывные работы.
/
514 —
2. Пиронон и
Пиронон.
В 1815 году De-Tret предложил дешевую порохо-
вую смесь специально для горного промысла, названную
им пирономом (она же и пиронон). Состав ее следующий:
Натриевой селитры.
Серы.............
Древесного угля. .
52,5 'о
20,0 ’<>
27,5"/о
71,4 '<>
13,5
15,1 <>
В некоторых сортах древесный уголь заменен танином.
В 1860 году Окслейд в Англии предложил деше-
з. Пороу Окслейда, вый порох, содержащий также одну натриевую сели-
тру. Состав его следующий:
Натриевой селитры. 61
Серы.............12’.,
Древесного угля. . 13 ,
Каменного угля . . 14
К этим порохам весьма близка по составу смесь,
4. Минные.порога применяющаяся в одном из государств в качестве мин-
ного военного пороха. В ее состав входят:
Натриевой селитры. 74,22
Серы...........10,03
Угля ...... . 15,01 ’>
Влажности.......0,74 У
Гравиметрическая плотность смеси 1,771—1,765.
Есть также минный порох (военный) с таким же количеством
калиевой селитры и с 10 частями угля. Состав его следующий:
Калиевой селитры. 74,80 о
Серы................14,56'.,
Угля.................10,01 >
Влажности.............0,63 А
Гравиметрическая плотность его 1,681 — 1,693.
>хо-
вую
зше-
;ели-
месь,
.<мин-
ством
г
.'1
5. Порох Шварца.
Он состоит из:
I. II.
Калиевой селитры. 46,6 56,2’о
Натриевой „ 26,5 18,1 ‘о
Серы ; 9,2 'о 9,6 о
Угля 14,7 .'-о 15,0 о
Влажности. . . ... Го 1%
_ м Миллер предложив пороховую смесь, состоящую
® op<4t ипп^а' из двух частей, в отдельности невзрывчатых и приобре-
тающих свойство это лишь тогда, когда они смешаны вместе в извест-
ной пропорции.
Часть
Часть
Берут
I СОСТОИТ ИЗ:
II:
:^.'г ' ।
Натриевой селитры. 58 .
Калиевой „ 38 .
Крахмала..........4
Двухромокалиевой
соли. И о
... 46
Угля .
71 часть № I и 29 частей У» II.
7. порох Шеффера Шеффер и Бюденберг предложили порох, в кото-
и Бюденберга. ром натриевая селитра является преобладающей. Его
состав:
30 . - 38
40
18 о
калиевой селитры,
натриевой „
серы,
угля,
лигнита,
двойной виннокалиерой и виннонатриевой соли.
33*
!
•1
516 —
й;
&
1
Он значительно сильнее
обыкновенного
черного пороха.
4
1
а
-И
я
' 3
**
"*(
л
&
Л
Л
А.
"j
V
73 ’о селитры,
10 о серы,
8 древесного угля,
8 ’о крахмала или отрубей,
сернокислой магнезии.
И
'Й
С предыдущим сходен предложенный Гемпёрле
У» ПМИД0Ж6Н.
амиооэк-ен:
; *J
из
,-,{Й
Вй!
ОГI lit JMTtlL
I '1
_ „ ’ „ . Пороха Неймейера имелось несколько сортов, из
8. Поро^ Неимеиера. которы£ главнейшие ТРИ:
Селитры.. . 72 о 72 ’и 75
Серы. . . 10 , 10 ; 6,25
Угля. . . . 12.1 18 .. 18,75 %
Лигнита. . . 8 — —
.vjfl
i
8гл1
Оба эти пороха не дробят породы и потому очень охотно упот-
реблялись при разработках каменного угля.
Приготовление их таково: селитра с сернокислой магнезией
кипятится; в жидкость всыпаются при постоянном помешивании
остальные составные части; нагревание продолжают, доводя темпера-
туру до 140°С.> при чем масса принимает кашицеобразную конси-
стенцию.
Из полученной массы прессуют цилиндрики, которые и сушатся.
В восьмидесятых годах прошлого столетия R. Са-
. агюцит. предложил пороховую смесь, которая стала выра-
батываться в Дартфорде под названием Cahuecit (кагюцит) или Safety
Blasting Powder. Одно время смесь эта пользовалась довольно широ-
ким применением в частной промышленности, особенно в Англии и
Германии, отчасти также и в Америке. Состав кагюцита был . сле-
дующий:
Английский Германский
Селитры . 64% не более 70%
Серы 12% 8—12% серного цвета
Ламповой копоти . . 7% ЯО/ и немного желез-
- Целлюлозы * ' 1 1 7°' J < . 0 ^1 ного куппороса.
Lr
г ’ .^W1
i?®
517 —
ле-
Дот-
1ией
,НИИ
ера-
нси-
атся.
I
£ Са-
зыра-
Jafety
пиро-
ии и
, еле-
о цвета
) желез-
юроса.
и. Пороге Heusschen'a. Предложен был $ Германии в 1880 году.
Состав его следующий:
№ № 1 । 2 3 4 5 | 6 ф « 17 8 9
Селитра . . . 63,53 . 63,04 ,(1 62,58 62,12 61,69 , 61,29 : 60,52 о 59,80 ; 57,23 1,
Сера . . . . 11,72/ 11,46 , ; п,2о . 10 95 10,73, 10,49 ; 10,07 9,68 7,37
Сажа .... 2,93 Т 2,87 ; i 2,8° • 2,76 . 2,68 ( 2,63 о ' 2,52 : ?,4? / . • Ь 1,84’,',
Танин .... 19.54 / 19,09 18,67 , . 118,26 , (17,87 С 17,50 о 16,78% 16,14’;, 15,36
Жел. купорос -1,37 е, 2,66'. 3,89 '< 5,07 . 6,21/,. 7,29 с 9,34 Ч, 11,22 „ 17,07;,,
Глицерин . . 0,91 / 0,88 ., 0,86 '. i • 0,84 \ i 0,82 ,, 0,80 0,77 < 0J4 1,13 о i ‘ <
В свое время в значительном количестве применялся в Герма-
нии и Англии. Поступал в продажу вч виде патронов разной вели-
чины.
12, Азотин.
15. Пороге Фрей-
берга и Вецлара.
Азотин есть смесь натриевой селитры, серы, угля
и нефтяных остатков.
В состав его входят:
11атриевой селитры . ..
Серы.........
Угля.... ............
Танина...............
14. Диоррексин
известны следующие:
Вецлара
64,04
17 82
18.14
66 68
11,77
18,71'
Есть несколько сортов этого взрывчатого веще-
ства, предложенного W. Рапсега, из которых наиболее
А в
Калиевой селитры 1 Натриевой селитры J 75 60о 42,78% 23,16
Серы * . • . • 12’о 12 13,4'о
Древесного угля ** z (1 7,49
Опилок букового дерева 13 10/ 10,97
Пикриновой кислоты — 1,5 1,65 „
Bit а ж во с т и - д , 7,5 ‘ 0,55 % .
. f ',
15. Порох Meuriing‘a принадлежит к военным порохам и предложен
и Норденфельда. ОКОЛО 1885 года.
По составу это черный порох, но с приготовленным особым спо-
собом углем, что обусловливает значительно более высокие балли-
стические качества его, сравнительно с обыкновенным дымным по-
рохом.
Для приготовления угля для него бралась целлюлоза и обраба-
тывалась раствором серной кислоты. После окончания обугливания,
масса промывалась сперва холодной водой, затем слабым раствором
щелочи.
Брали также гидроцеллюлозу, которая обрабатывалась кипящим
раствором сернокислой щелочи, подкисленным серной кислотой. По-
лученная масса смешивалась с серой и обрабатывалась сероуглеро-
дом, растворитель отгонялся и после высушивания полученная масса
измельчалась, а затем смешивалась с насыщенным раствором селитры.
Далее все сушилось, зернилось и графитовалост^ как обыкновенно.
Удельный вес полученного пороха .1,839, состав же его был сле-
дующий:
Селитры ..... 75,80®/0
Угля . . • . -. 16t54°/0
Серы.............7,66%.
16. Порок Винанта Эти ПОрОха заключают в себе:
и von кир а. 1
1 i i J Винанта. von Kup’a.
Калиевой селитры . . 2 ММ <. J I 1— 66%
Бариевая селитра. . . 76 С 80 . — 80’.-
Натриевой „ . . — '**"”* i —
Серы i ' 7 9 I 10
У гля ! 22 ", 13 . 16.. 10 1
17. Пудролит. Од
Langollen’6. Он состоит
был предложен в
из:
1872 году и выделывался в
Калиевой селитры . 68
Натриевой „ . 3 л
Серы...............12 >
Древесного угля. . 6
Бариевой селитры . 3 \>
Древесных опилок. 5
Танина............. 3 '<>
Он принадлежит к порохам с медленным сгоранием; в настоящее
время совершенно вышел из употребления.
18. Пороге Judson. Эю взрывчатое вещество применяется нередко
в Америке; сорт, существует под маркой С. М., заключает в своем
составе: . .
64'о натриевой селитры, ’
16'<> серы,
15 ‘о специального угля и
4 о нитроглицерина.
Как видно, он уже представляет переход к динамитам*).
Для разработки не особенно твердых каменных пород предложен
5ыл также сравнительно недорогой порох состоящий из:
65 калиевой селитры,
4’о натриевой „
12 <> серы,
19 <> угля.
Несмотря на содержание гигроскопической натриевой селитры,
получается продукт, не обладающий особенно сильной гигроскопич-
ностью, благодаря тому, что при прессовании из него лепешек, он
допускает нагревание состава несколько выше температуры плавления
серы, которая цементируя частицы смеси и, в тоже время обвалаки-
вает их, препятствуя доступу влажности.
19. Пороге Тонкина. Это есть обыкновенный зерненый поро?, лишь
содержащий пироксилин.
Состав его следующий:
• «
Калиевой, или натриевой селитры 56!.о
Древесного угля.............. 26 •<>
Серы....................... 15 о
Пироксилина................. . 3\>
20. Пороге Burton’a. . Это взрывчатое вещество также состоит из обыкно-
венного черного пороха с прибавкой к нему пироксилина, иногда
тоже обыкновенного или желатинированного нитроглицерина.
Тестообразная консистенция этого взрывчатого вещества дости-
гается прибавлением раствора гумми-лака.
21. Боббинит. Мало есть взрывчатых веществ, которым так посчаст-
ливилось в применении в частной промышленности, как боббиниту.
В сущности это есть черный порох, заключающий сернокислые соли
аммония и меди, или же крахмал, или парафин. Он считался в числе
„безопасных" взрывчатых веществ и в широком масштабе применя-
*) Другой сорт его заключает в 5 раз больше нитроглицерина, т.-е. 20
что же касается других составных частей, то количество селитры в нем 53,90 ,
серы 13,50 Д, и угля 12,60 Х,-
ется в рудниках неблагополучных, как в газовом отношении, так и
в отношении угольной пыли. В 1914 г. его употреблено было свыше
миллиона фунтов в одной Англии. Впоследствии он всетаки признан
был небезопасным и исключен из числа „дозволенных" взрывчатых
веществ для употребления в „газовой*' атмосфере и в „пыльных" руд-
никах. Состав его, по Маршалю, следующий.
„Первый* „Второй*
Калиевая селитра • от 62,0 до 65,0 от 63,0 до 66,0 65,.'; 1
Древесный уголь k . . . „ 17,0 . 19,0 „ 18,5 , 20,5 19.52
Сера . „ 1,5 , 2,5’ 15 2 5 2.63
Сернокисл, аммоний |
„ 13,0 „ П,0 ' ' \-
Сернокислая медь | 1
Рисового или кукурузы, крахмала — » 7,0 . 9,0 i 8,73
Парафин — „ 2,5 . 3,5 3.35
Влажность 0 „ 2,5 , 0 „ 3,0 0,46
§ >. Нижеследующие пороховые смеси представляют дальпейту ю
вариацию основные' составных частей черного пороха и не содержат серы.
1. Литофрактор*}. Так называемый литофрактор совершенно>не содер-
жит серы. В нем 77% баритовой селитры, 2% канифоли и 21% угля.
Он предложен был Ньютоном. Как саксифрагин, так и литофрактор
обладают общим свойством довольно трудно воспламеняться.
2. Саксифрагин. Виннандтом предложено было взрывчатое веще-
ство, не содержащее серы, названное им саксифрагином. В состав его
входит баритовая селитра и небольшое количество‘калиевой: •
76.1—77баритовой селитры.
22’.—21 угля,
2Д> калиевой селитры.
В саксифрагине бариевая селитра может быть заменена строн-
циевой или нитратом свинца.
з. Нашенский порох. К числу черных порохов, не содержащих серы,
надо причислить также Аахенский порох, состоящий из натриевой
селитры и каменного угля. Пропорция составных частей различна в
зависимости от цели его применения.
*) Этот литофрактор не следует смешивать с одноименным с ним динамитом.
4. Пороге Фора. С. А. Фор и Е. French предложили минный по-
рох с баритовой селитрой и нитроцеллюлозой следующего состава:
Бариевой селитры 89
Нитроцеллюлозы 5,5’<<
Древесного угля 5,5 ’<>
5. Галпоксилин Бпэк- г_ _ . „ „ -г»
мана. Предложен был в 1866 году Блэкманом; Различные
сорта его заключали. '
от
»
т>
я
75 ' • до 85 > калиевой селитры
9 , целлюлозы (опилок)
1 > желтой кровяной соли
5 > древесного угля
W
я
И
Он применялся довольно часто в Австрии; сильнее черного по-
роха и безопаснее его в обращении.
6. Порох Boitona. В 1868 году Bplton предложил пороховую смесь,
основанную на том же принципе изготовления ее из двух самих по
себе невзрывчатых частей, как и порох Миллера.
Состав этих частей следующий:
Часть А:
А
Натриевой селитры ••••••406 частей,
Поташа • • .................. 522 „
Соды- - • ...................23
Древесного угля -•••••-.. 17 „
Углекислой меди .•••••. 9 „
Г р а ф и т а................... 6 „
Других составных частей .-..17
Часть В:
Желтой кровяной соли . . . . . 417 частей
Сахару............•......... 486
Древесного угля 21 „
Графита 7 „
Других составных‘частей . . 69 „
Для составления пороха, перед самым употреблением его берут
545 частей смеси А и 455 частей смеси В, иногда йге поровну обоих
в зависимости от цели применения.
_ _ Это взрывчатое вещество делается также, как и
орох a urs а. ПредЫдущее> лишь в момент надобности и состоит из
двух смесей. В смесь А входит калиевая или натриевая селитры с
прибавлением или без* сернокислого аммония, аммиачной селитры,
нашатыря, сернокислой магнезии и сажи или угля; смесь В состав-
ляется из нитратов или хлоронитратов бензола, толуола или нафта*
лина, с прибавкой, или без таковой, других веществ в этом же роде.
Взаимная пропорция этих смесей зависит от цели, для которой
это взрывчатое вещество приготовляется.
8. Пэрапит. Под этим названием выпущен был крупно-зернистый
порох, в котором сера заменена была сернистой сурьмой. Его состав
был:
Селитры 64
Древесн. угля . • . 30
Сернистой сурьмы • . 6 \
Он. действовал сильнее обыкновенного черного дымного пороха.
9. Карбоазотин. В таком же роде был и карбоазотин:
50 — 60 „ натриевой селитры.
13 —1(!' сажи.
4 5 > железного купороса.
14 —16 , танина.
9 —18°/о сала.
Он причислялся к „безопасным" порохам.
4. Трудность получения надлежащих качеств и всегда однообраз-
ного угля, вызвала ряд попыток заменять его иными вещеетвами. Однако,
большая часть последних затрудняет воспламенение, хотя некоторые и
дают большее колггчество газов.
К числу таких веществ принадлежат: кокс, каменный уголь»
разные специальные угли, дубильная кора, катеху, сахар, опилки,
декстрин, крахмальный клейстер, гумми, красная и желтая кровяная
соли, винный камень, сегнетова соль, уксуснокислый натр и т. п.
Из взрывчатых веществ подобного рода можно упомянуть сле-
дующие.
1. Белый гремучий,
пороге.
Под этим названием «была предложена смесь:
Се титры . . .
Серы ......
Кремортартора
2. Петрокпастит или ЭТО
галлоиластит. СМёСЬ:
взрывчатое вещество представляет из себя
10% серы,
69% натриевой селитры,
5% калиевой селитры,
15% каменноугольной смолы, или вообще смоли-
стых веществ,
1% двухромокалиевой соли.
Были сорта его содержащие древесный уголь. Он менее гигро-
скопичен, нежели можно бы было ожидать, благодаря большому ко-
личеству входящей в его состав натриевой селитры. Действовал
сильнее черного пороха и был безопасан в обращении.
. . Здесь необходимо еще упомянуть про так назы-
. umisc pu ver. ваемый Zuniischpulver. Под этим названием обозначают
легко горючие смеси, служащие вместе с тем полготителями. Так как
они, главным образом, входят в состав взрывчатых веществ, применя-
ющихся в рудниках, то их составные части подбираются таким образом,
чтобы при сгорании получить по возможности только углекислый газ
и воду. В общем состав их напоминает несколько состав пороха, почему
мы и относим их к группе порохов. При описании динамитов приводится
в частных случаях солгав соответствующего Zumischpulver, служащего
поглотителем, здесь же достаточно заметить, что в состав их входят
селитры (преимущественно аммиачная) и органические вещества, как
то: мука хлебных злаков и древесная, каменный и древесный уголь и
другие, при чем часто к ним примешивают соду, редко — серу.
Смесь эта должна полностью сгорать и обладать хорошей способ-
ностью поглощать нитроглицерин; для этого уголь должен быть из-
мельчен весьма тонко, древесная же мука не должна быть слишком
мелка.
Так, например, применяются иногда состав:
52,5% натриевой селитры,
20% серы,
27,5% муки из ивовой коры.
4. Геракл ин. Это есть смесь:
33% калиевой селитры,
33% натриевой селитры,
14°/о серы,
20% древесных опилок.
Древесные опилки для гераклина обрабатываются предварительно
раствором равных частей калиевой селитры и пикриновой кислоты и
затем сушатся. Готовые опилки содержат около 3% пикриновой кис-
лоты и столько же селитры.
5. Порога Маттена, Эти дешевые пороховые смеси содержали:
пиролит.
/ 50.5%—67,5°1о калиевой селитры,
0%—16% натриевой селитры,
20% серы (серный цвет),
. 11%—12%% самых мелких древесных опилок,
1,5% угольной пыли.
Один из наиболее употребительных сортов, очень экономичный,
заключает в себе:
47% натриевой селитры,
18 „ калиевой селитры,
17 „ серы,
12 „ древесных опилок,
6 „ углекислого, или сернокислого натрия.
6. Литофрактор-ди- К числу взрывчатых веществ, содержащих сели-
намитол или белый тру и употреблявшихся в прежнее время, но теперь
порок Lannoy. уже почти вышедших из употребления, принадлежит
литофрактор-динамитол, или белый порох Lannoy. Он состоит из:
65% натриевой селитры,
13 „ серы,
22 „ нитрованной древесной муки или отрубей.
Силою своей он превосходит черный порох, обладая хорошим
фугасным эффектом, но загорается с трудом. Зловонный дым, который
он дает при взрыве, и сравнительно высокая стоимость его составляют
причины, почему он не получил большого распространения.
_ _ Это дешевая пороховая смесь, предложена была
. итотрит. Antheuniss'oM в Бельгии. Литотрит представляет мед-
ленно горящий, очень экономичный порох, дающий хорошие резуль-
таты в рудниках. Он заключал в себе:
Ч I,
Древесных опилок ................ 8%
Калиевой селитры.................50 „
Натриевой селитры . ............ 16 „
Серы возогнанной ....... 18 „
Древесного угля................1,50 „
Желтой кровяной соли.......... 3 „
Углекислого аммония...........3,50 „
8. Препозит. Это черный порох с 18% серы, уголь которого в
количестве 5% вамещен гиппозином.
э.Поро}<Браидэйля Это порох, в котором уголь заменен сахаром.
Состав его следующий:
Селитры............. . 76,19%
Серы .................9,52 ,,
Сахару................14,29 „
0 В 1875 году Espir предложил пороховую смесь в
ю. порок Espir. атом Ж0 рОде> применявшуюся затем некоторое время
в Плимуте, хотя скоро, впрочем, оставленную. Она состояла из:
Натриевой селитры . . . 60%
Серы ............... 14 „
Древесных опилок . . • 26 „ Л
_ Это порох с натриевой селитрой; в нем древесный
орох дарвея. уГ0ЛЬ заменен крахмалом, мукой, отрубями и проч.
Массу еще влажной прессуют и зернят.
12 Пет алит Петролит (Прохаска). Он состоит из селитры, серы,
етралит. древеснод муки и коксового порошка. Зерна его поли-
рованы графитом.
13 ф К числу порохов, не содержащих угля, необхо-
орсит' димо причислить также бельгийский форсит (не смеши-
вать его с одноименным динамитом). Он состоит из:
76% калиевой селитры *), ' ь
20 „ древесной смолы,
3 „ серы и
1 „ древесной муки.
Большей частью этот форсит применяется в качестве поглоти-
теля для динамитов.
• 14. Минные пороха В 1871 году De-Terre предложил несколько сортов
De-Terr. минных порохов, оказавшихся очень ЭКОНОМИЧНЫМИ для
скальных работ; состав их здесь приводится, при чем первый предна-
значен для работ в твердых породах наподобие гранита, а второй в
брлее мягких, как, например, известняки, долмиты и проч.
Селитры калиевой . . . .
Серы...................
Опилок ................
Натриевой селитры . . .
Каменного угля ......
67,5%
20,0;
12,5 ,'
51,5%
20,0 „
11,0 „
16,0 „
1,5,,
§ о. Здесь приводится состав нескольких порохов со значительным
уклонением от типового состава, а также упоминается о пикриновых
дымных и малодымных порохах.
*) В некоторых сортах вместо калиевой селитры входит натриевая. Также
существует иная пропорция составных частей.
— 526 —
_ Он представляет оригинальное взрывчатое веще-
. орох иопетта- ство> предложенное Виолеттом для рудничных работ.
Это есть смесь уксуснокислого натрия с натриевой селитрой,
взрывающая при 350°. Реакция взрывчатого разложения следует
уравнению:
10 (СНз. CO2Na. 3 Н20) +16 NaNOs = 13 Na2COs + 7 С02 + 45 Н20 + 8 N2.
Иногда прибавляют до 10% серы.
Большой недостаток—сильная гигроскопичность.
Изредка применяется в пиротехнике.
2. Рашит-
Состав одного из новейших сортов рашита:
65% натриевой селитры и
35 „ крезолсульфокислого натрия.
5. Пикриный порох Это есть смесь пикриновой кислоты, свинцового
«свинцовымглетом глета, -серы и угля. Существует несколько сортов его
с различной пропорцией составных частей в зависимости от назна-
чения.
4. Порох Moritz- Состав этого пороха, предложенный для работы в
Koepei№2. относительно не твердом грунте:
Калиевой селитры . . . 42,0°/о
Нитриевой „ ... 22,0 „
Серы.................12,5 „
Древесного угля ... 7,0 „
Древесной муки . . . . 10,0 „
Сернокислого натрия . 5,0 ,,
Пикриновой кислоты . 1,5 „
5 По о Нобля Учитывая многие преимущества бариевой селитры,
орох о еля. цобель, в КОНце so-х годов прошлого, столетия, предло-
жил сперва ею заменять в обыкновенном порохе калиевую селитру,
затем же перешел к следующим пороховым смесям:
Обыкновенного пороха...........66,6% — 80%
Пороха из бариевой селитры ... — 80% —
Пикрата аммония................20,1 „ 12 я —
Бариевой селитры...............13,3 „ 8 „ 20 „
Последний сорт его был цредложен много раньше, а именно еще
в 1865 г. для пушек большого калибра, требовавших порохов, сравни-
тельно более медленно сгорающих.
%
,'ф.
"’У?
$
Для пороха
Брюжера.
441 метр, в сек.
1700 килогр.
1.1 ' „
•W:,-. * *
I
%Л
'
" >
Более или менее удачной попыткой применения
6. Порог Брюжера и
малодымные порога, пикрата аммония следует признать смесь его с калие-
вой селитрой, в частности порох Брюжера.
Смесь этих двух компонентов дающая место полному сгоранию
(43,2% пикрата аммония и 56,8% калиевой селитры), имеет следующие
константы, характеризующие взрывчатые свойства этой смеси:
Давление............... 5698 килогр.
Об’ем газов........... 431 литр.
Температура их. . . . 3217°
Работа........? . . . 432 тонн
метр.
а = 0,605 литров.
Смесь эта под влиянием даже сильного удара взрывает лишь
частично, зажженная же на открытом воздухе сгорает без взрыва;
в обращении безопаснее черного пороха, но обладает значительною ги-
гроскопичностью, вероятно по причине образования аммиачной селитры.
Подмеченные высокие баллистические качества смесей пикрата-
аммония и калиевой селитры, побудили генерала Брюжера предло-
жить их применять для изготовления малодымных порохов. Предло-
женный им порох представлял из себя смесь 54% пикрата аммония
и 46% калиевой селитры. Смесь эта сильнее черного пороха и менее
его чувствительна к механическим влияниям, обладая в то же время
свойством выделять мало дыма, характеризуется хорошими балли-
стическими качествами, не портя в то же время особенно сильно кана-
ла орудия, но боится сырости.
На выдающиеся баллистические качества порохов Брюжера обра-
щено было когда-то серьезное внимание и, весьма возможнб, что они
в отношении орудий большого калибра вытеснили бы черные пороха, но
изобретение Вьеллем пироксилиновых порохов коллоидального типа
положило конец производившимся уже в большом масштабе с ними
испытаниям вследствие явного превосходства во всех отношениях поро-
хов коллоидального типа.
Здесь приводятся интересные данные, характеризующие сравни-
тельные баллистические качества этих порохов в
пушкам калибра в 90 миллиметров:
Для черного
пороха С,-
450 метр. "В сек.
2360 килогр.
1,9 „
Л' - '
KV
'U&.'
s;s.
!д
>5?
Л ’
%
*5Г
применении их к
Для пороха Вьелля
типа ВС-
446 метр, в сек.
1500 килогв.
0,72 я
Нач. скор. снар.
Наиболып. давл.
.'Заряд ....
Отрицательной стороной бездымных порохов, содержащих нитро-
целлюлозу, как известно, служит неполная их стойкость даже при
Применении лучших стабилизаторов и, кто знает, не придется ли еще
в будущем обратиться снова к нитропроизводным ароматического ряда,
Обнаруживающим в отношении баллистических качеств результаты,
сзддЦимые с теми, кои дают в настоящее время бездымные пороха
коллоидального типа.
.
ГЛАВА III.
b
Аммиачные взрывчатые вещества.
§ 1. Производство а) Способность к экзотермическим реакциям и к
аммивчно-селитро- превращению без остатка в газообразные продукты, а
Bbl!t взр' вещ‘ также химическая стойкость при низких температурах,
безопасность в обращении и антигризутность готовых фабрикатов
делают аммиачную селитру весьма подходящим исходным продуктом
для взрывчатых веществ.
По Вертело взрывчатое разложение аммиачной селитры наблю-
дается лишь при нагревании ее свыше 300°С; при более низких
температурах наблюдается более или менее сильное разложение.
В меЛко-измельченном, сухом и рыхлом состоянии аммиачная
селитра взрывается от капсюля. При пробе Трауцля дает об‘ем камеры
раздутия в 165 см3. Детонирует с трудом; в слабо - прессованном или
влажном состоянии совсем не детонирует. От прибавления незна-
чительных количеств органических веществ, которые при взрыве
сгорают за счет выделившегося излишнего кислорода, детонационная
способность увеличиваются. От прибавления угля и других горючих
веществ увеличивается воспламеняемость*).
К недостаткам аммиачной селитры принадлежит ее большая
гигроскопичность. Величина ее кристаллов имеет значение не только
для гигроскопичности, но и для плотности и детонационной способно-
сти готовых фабрикатов.
Слишком мелкая селитра затрудняет производство взрыввеществ
из нее, так как она легко, особенно при сушке, слеживается, что
вредно отражается на детонационной способности.
В настоящее время предпочитают производить аммиачную селит-
ру на завода? взрывчатых веществ, так как это производство позво-
ляет достаточно полно использовать полученную при денитрации
разложенную азотную кислоту.
Разжиженная азотная кислота насыщается или аммиачной водой,
или газообразным аммиаком. При массовом производстве аммиачная
селитра получается обменной реакцией из солей аммиака и натрие-
вой или известковой селитры, которая получается электролизом, или-
же изготовляется из натриевой селитры и хлористого кальция, или
же, наконец, по способу, аналогичному с производством аммиачной соды.
В последнее время аммиачную селитру добывают из азота воздуха.
Выпаривание раствора нитрата аммония производится или на
открытых сковородах, или-же в вакууме.
Подобный вакуум-аппарат фирмы Эмиль Пассбург в Берлине по-
казан на рис. 326. Способ выпаривания имеет большое влияние на
степ»
в вам
или1|
*) В 1921 году, на заводе взрывчатых веществ в Kriewald’e (Верхняя Силезия)
от невыясненной причины взорвалось пять вагонов аммиачной селитры, стоявших
у разгрузочной рампы.
ная
ниеь
ваю!
раба
чер«
Риф
мый
бым
автс
тер!
нип
она
I
(i. t
ff
4
1 >
[ к
i a
ai,
fOB
POM
w-
ШХ
рая
зры
йли
*на-
ыве
лая
чих
шая
рько
бно-
;еств
что
шит-
рзво-
рции
г
рдой,
счная
грие-
или-
: ИЛИ
соды,
ха.
[и на
ie по-
де на
степень крупности кристаллов аммиачной селитры. Так выпаривание
в вакуум аппарате дает очень мелкий, открытое выпаривание — более
или менее грубый продукт.
Рис. 326. Вакуум аппарат для, выпаривания растворов аммиачной селитры.
.илезия)
оявших
б) Производство аммиачно - селитровых взрывчатых веществ в
своих основных чертах не отличается от производства других взрыв-
чатых веществ.
Особой предварительной обработки (подготовки) требует аммиач-
ная селитра, легко впитывающая влагу. Незадолго перед употребле-
нием она высушивается в особых сушильнях, снабженных перемеши-
вающими лопастями. Селитра подается в аппарат элеваторами.
Иногда сушка вместо сушилен производится в сушильных ба-
рабанах. Нагретый в калорифере воздух прогоняется вентиляторами
через аппарат.
Из барабана селитра выходит уже в высушенном состоянии.
Рис. 327—329 изображают подобный сушильный барабан, изготовляе-
мый Petry и. Heking в Дортмунде. Аппарат обычно снабжается осо-
бым приспособлением, позволяющим регулировать температуру, и
автоматической воронкой, регулирующей равномерную подачу ма-
териала.
После сушки аммиачная селитра поступает в вальцовые мель-
НЯцы для измельчения, так как во время нахождения в барабане
'она слеживается.
Проф. М, Сухаревский. Взрывчатые вещества и взрывные’ работы. 34
— 530 —
Рис. 327. Аппарат для предварительной сушки селитры для
производства аммиачных взрыввеществ.
Мотор. Выход селитры.
Рис. 328. Сушильный барабан фирмы „Petry и Hecking" для сушки
селитры (продольный разрез).
С этой операцией может быть совмещено смешивание селитры
с порошкообразными, безопасными составными частями взрывчатого
вещества.
Ароматические нитросоединения, если только они не находятся
уже в жидком состоянии, обычно плавятся, а затем к ним, также в
531
нагретом состоянии, прибавляются остальные составные части. Эта
операция происходит на т. н. тарелочных аппаратах, т. е. на нагревае-
мых паром сковородах, имеющих вид тарелок.
Рис. 329. Сушительный барабан фирмы .Petry и Hecking" для
сушки селитры (вид сверху).
Диаметр сковороды равен 2 м. По сковородам катятся жернова,
на подобие бегунов, или вальцы (рис. 330 и 331).
Рис. 330. „Тарелочный" аппарат для смешивания составных частей
аммиачных взрыввеществ (показано внутреннее устройство).
Для смешивания и просеивания порошковатых и зернистых ве-
ществ очень удобны барабанные мешалки, внизу которых имеется
34»
I
— 532 —
приспособление для просейки. (Рис. 332) дает такую барабанную ме-
шалку в исполнении фирмы Karl Seemann в Берлине.
Рис. 331. „Тарелочный" аппарат другой конструкции (по Kast'y).
Не детонирующими не плавящиеся вещества, богатые углеродом,
требуют особенно основательного смешивания с аммиачной селитрой,
иначе детонационная способность всего взрывчатого вещества будет зна-
чительно ослаблена. Если вышеназванные примеси растворимы в ор-
ганических растворителях, в роде смолы, то их прибавление к селитре
может быть произведено в жидком состоянии на тарелочных аппара-
тах, в противном-же случае возможны следующие два выхода: или
смешивание происходит сухим путем, именно, длительной обработкой
под бегунами, или-же применяются способы смешивания, практикую-
щиеся при производстве рашита и аммиачного пороха: аммиачная
селитра в виде концентрированного раствора в воде смешивается с
углем и т. д. в тестообразную массу, которую затем пропускают
через горячие вальцы или же распыляют в особых нагретых распы-
лителях.
Опасные составные части, в роде нитроглицерина и т-д., обычно
добавляются в конце производства в мешалках системы, „Werner-Pflei-
derer“, которые в целях безопасности устанавливаются в удаленных
особых зданиях, окруженных Баллами При прибавлении небольших
количеств (5—10%) опасных солей эти меры предосторожности являют-
ся излишними, при условии прибавления этой соли до смешивания
аммиачной селитры с органическими веществами.
Патронирование аммиачно-селитровых взрыввеществ происходит
механическим путем в особых аппарат. На рис. 333 изображена по-
добный аппарат фирмы системы Karl Seemann, отличается точ-
ностью работы и отсутствием пыли; плотность впрессования массы
в патронную оболочку может быть регулируема. Обслуживание ма-
шины весьма просто и заключается во вкладывании патронной обо-
лочки в воровку и пуска машины в ход нажатием ногой на рычаг,
после чего машина уже самостоятельно набивает массу, в оболочку
и Выбрасывает патрон, как только последний наполнен соответству-
ющим количеством взрывчатой массы. Взвешивания патронов уже
«больше не требуется и патроны могут тут-же запечатываться. Отдель-
ные части машины, которые на упомянутом рис. находятся наружи,
Рис. 332. Барабанная мешалка фирмы „К. Seemannu в Берлине.
в действительности заключены в предохранительный кожух, но тем
не менее легко доступны для чистки. Машина обычно изготовляется
с двумя воронками, которые, однако, работают вполне независимо
друг от друга.
Следует упомянуть также об автоматическом прессе (рис. 334),
изготовляемом Magdesprunger Eisenhuttenwerke. Смешанный порошок
насыпается в воронку, откуда высыпается в дырья подвижной мерки.
Мерка высыпает строго определенные количества смеси в пустые
стальные матрицы, после чего уходит назад, где снова наполняется.
В это время верхние и нижние пресса опускаются и поднимаются и
прессуют порошок в маленькие цилиндрики, Желаемой величины,
в середине которых одновременно выделывается отверстие для зажига-
тельного шнура. Готовые цилиндрики нижним прессом выталкива-
ются и принимаются рабочим. Подобный пресс прессует в минуту
от 24 до 96 патронов, Некоторый интерес представляет также при-
бор, изображенный на рис. 335.
— 534 —
Рис. 333. Аппарат для патрониро-
вания аммиачных вврыввеществ
фирмы „К. Sceniann".
Рис. 334. Автоматический пресс для прес-
сования патронов из аммийчных взрыввеществ
фирмы Magdesprunger — Eisenhuttenwerke.
Рйс. 335. Схема аппарата для патронирования аммиачных взрыввеществ. А—воронка.
В—мерка. Н—ручка ручного привода. С—патронная оболочка (по Eskales’y).
Готовые патроны для предохранения от влажности помещаются
во вторую бумажную оболочку, покрытую смесью парафина и кани-
-фоли, которую перед закладыванием патрона в шпур следует удалять.
Затем патроны пачками в 2'/2 кгр, заворачиваются в бумагу, и опу-
скаются в раствор парафина с канифолью, а затем упаковываются
в ящики.
На прилагаемых рисунках изображены два парафинирующих
аппарата, причем рис. 336 показывает аппарат для патронов, а рис.
337 для пакетов.
Рис. зЗб. Аппарат для парафинирования патронов.
§ 2. Смеси, состоящие из неорганических компонентов с или без
добавления невзрывчатых органических производных.
Сюда относятся:
1, Прдир-Нобелев-
ский пороге.
Он состоит из:
Аммиачной селитры . . .
Кизельгура ............
Сернокислой магнезии . .
Натриевой селитры . .,.
. 31 %—34%.
. 11 , -14 ,
• 47 ,-51 „
— 536 —
Ряс. 337. Аппарат для парафинирования пакетов с аммиачными взрывчатыми веще
ствами (по Kasfy).
2. Аэролит. В Дании выделывается взрывчатое вещество, в состав
которого входит сера. Оно названо аэролитом.
Его состав следующий:
Аммиачной селитры..........78, 1а/0.
Калиевой селитры...........7’ 5
Серы.......................8Д5 ”
Говяжьего сала ............2 5^
Саговой муки...............1’25 ”
Перекиси марганца..........1*25 ”
Смолы .....................(\ 6 ”
I
Сера, сало, смола и перекись марганца сплавляются вместе,
после чего туда прибавляются мука и калиевая селитра, затем массе
дают охладиться и превращают ее в порошкообразное состояние.
Вслед за этим прибавляют аммиачной селитры, перемешивают и вто-
рично плавят. Далее охлаждают и снова превращают в порошок.
По силе оно несколько уступает аммоналу.
з. Яммон-Рашит IV. Состав его крайне простой:
Аммиачной селитры . . . 85,0%.
Куркумы.............. 15,0 „
4. Бритонит. Это есть смесь:
Аммиачной селитры . . . . 21% —25°/0.
Калиевой селитры около . . 31 „,
Древесной муки . . . . . .42 39 „
Соды........... О „ — 5 „
5. Взрывчатое вещество . Во время Европейской ВОЙНЫ ВО ФраНЦИИ
с реальгаром HR. применено было взрывчатое вещество, богатое
содержанием аммиачной селитры, заключавшее
также реальгар и парафин. Состав двух его
сортов был следующий:
Аммиачной селитры.........
Реальгара (As S)..........
.Парафина..................
80%
15 .
Оно носило марку А. К.
Оба сорта дают обильный белый дым, хорошо заметный издали.
Применялись в снарядах среднего и большого калибра.
6. взрывчатое ве- Необходимо здесь упомянуть об интересном
щество с азотно-ам- взрывчатом составе, содержащем CufNOab 4NHg. Оно
миачной медью. имеет довольно низкую температуру взрыва (1750°) и
• очень маленькое пламя при взрыве, а потому могло
бы иметь некоторое значение среди антигризутных веществ, если бы
не ядовитые продукты взрыва й повышенная чувствительность к
механическим влияниям.
Состав его следующий:
Азотно-аммиачной меди .
Аммиачной селитры . •
100 частей, 20 частей.
167 „ 80 „
— 53S —
Первая соль легко получается, если к раствору азотнокислой
меди прилить избыток аммиака и выпарить жидкость при умеренной
температуре. Соль получается в виде синих кристаллов.
7. Пммид порога или Они были предложены в середине восьмиде-
Chii«orth special сятых годов прошлого столетия и представляют-
powder. собой смесь калревой и аммиачной селитр со смо-
листыми веществами или углем. Изготовлялись, между
прочим, Кельн-Роттвейлеровской фабрикой. Один из употребительней-
ших порохов этого рода имел состав:
8. Элеитронит.
4О'\> калиевой селитры,
38 „ аммониевой „
22 „ древесного угля.
Состав его:
Аммиачной селитры 71 V — 75 .
Баритовой „ 1S „—20 „
\ Древесной муки . . 7„—10 „
9. Лфозит и Вирит. Предложены'в Англии в 1912 г.
Они состоят из:
• Aphosit. Virit.
Аммиачной селитры . 58'. — 62% 35—40?о
Калиевой „ 28,-31 „ 33—38 „
Древесного угля. . . 3,5 „ - 4,5 „ 10 5—12,5
Древесной муки . . . 3,5, ^4,5 „
Щевелевокисл. аммон. — 9—12 ’о
Серы 1 2-3,0 „ 4 — 5 „
io. Венедит. Это бсть взрывчатое вещество, содержащее смолу.
Состав его:
Аммиачной селитры . 92 . —95 л
Смолы, точка плавле-
ния которой лежит
не выше 74,7’С. . . 5 — 7 „
.-Эти взрывчатые вещества принадлежат к числу „дозволенных"
в Англии.
11. Slcfierheitssprengpul-
ver. (,Бе»опасный“ взрыв-
чатые подо).
pulver („Безопасный"
Кельн - Роттвейлеровская фабрика взрыв-
чатых веществ изготовляет несколько .безопас-
ных" взрывчатых веществ. К числу таковых
принадлежит так называемый Sicherheitsspreng-
взрывчатый порох). Состав его следующий:
Аммиачной селитры . 93,0%
Льняного масла ... 4,9 „
Серы........... 1,2 „
Баритовой селитры . 0,9 „
Формула его взрывчатого разложения выражается следующим
уравнением:
337N2H4O8 +-3.35СгзН360,+118+ВаЫ,06=7бСО,+734Н2О+338Х2+65О,4-
+ 11SO, + ВаСОз.
В других сортах „безопасных" взрывчатых веществ, выпускаемых
этой же фабрикой, по составу своему напоминающих выше приве-
денное, вводятся и другие растительные масла, двууглекислый аммо-
ний и проч. Есть сорта, в которых сера вовсе отсутствует.
Для приготовления этих взрывчатых веществ, составные части
их смешиваются и затем масса зернится, причем из нее изготовляются
патроны, предохраненные от сырости при помощи обертывания их в
оловянную фольгу. Они взрываются капсюлем № 8. Об‘ем полости
раздутия при испытании в свинцовой бомбочке Трауцля—342 куб. сайт.,
развивающихся при взрыве, 1774°С.
В 1902—1903 г.г. той же фабрикой были
выпущены два состава: один причисляемый к
.безопасным", а другой же, для употребления
в рудниках в отсутствии „газовой" атмосферы
и угольной пыли. Первый из них состоит из:
а температура газов,
12. Kohlen-ftnagonspreng-
pulver и Q£stein-Rnagon-
sprengpulver. (Янагоновые
взрывчатые пороха).
Аммиачной селитры . 78,5%
Калиевой „ . 17,5 „
Растительного масла. 2,5 „
Алюминия.......... 1,0 „
Баритовой селитры . О 5 „
Оя получил название «угольного анагонового взрывчатого по-
роха" {Kohlen-Anagonsprengpulw'r}. При содержании 8 ’о рудничного газа,
допускается употребление его в зарядах, непревышающих 400—500,
грамм.
Второй состав предназначен преимущественно для скальных работ,
почему и получил название гештейн-анагонового взрывчатого пороха
( Gestein-Anagonsp rengpulver).
В состав его входят:
Аммиачной селитры . 84,5%
Калиевой „ . 1,5 „
Древесного угля . . 8 „
Алюминия ..... 5,5 „
Бариевой селитры . . 0,5 „
По действию своему он подходит к динамитам. Введение в его
состав металлического алюминия, значительно повышает температуру
газов и силу его. Он не принадлежит-к числу „безопасных" взрыв-
чатых веществ. Каст аналогичный состав называет „нео-анагоном“.
Н. Brunswig причисляет его к числу аммоналов.
Как угольный анагоновый, так и гештейн анагоновый взрывча-
тые пороха—суть мелкозернистые пороха серого цвета и заделыва-
ются в такие же патроны, как и их прототип Sicherheitssprengpulver.
13. Вестфалит- Вестфальско-Ангальтское Акционерное О-во производ-
ства взрывчатых веществ в Берлине приготовляет взрыв-
чатый состав, пользующийся большим спросом и до на
стоящего времени употребляющийся иногда в каменноугольных и
соляных копях. Оно названо вестфалитом.
Это белый, необыкновенно тонкий порошок с желтовато-бурым
оттенком. В сухом виде он пылит и даже спрессованный в патроны
остается рыхлым. При хранении несколько слеживается, обращаясь в
ноздреватую массу. Гигроскопичен, поэтому патроны вестфалита упа-
ковываются в две парафинированные бумажные обертки. С выгодой
применяется в каменноугольных и соляных копях, причем не дает
копоти. '
Реакция его взрывчатого разложения следует по формуле:
687NH4NO3+24KNO34-10C20HJ0O2 = I88CO2 + 1524Н2О+Ю8О2-|-699Х2 +
+ 12К2СОз + 749 калорий.
Механическая работа взрыва 318.325 килограмметров. Он дает
930 литров, газов приведенных к 0°, и 760 миллиметров давления.
Его состав следующий:
I. III*).
Аммиачной селитры . . . л 95% 91%
Калиевой „ ... 4»
Смолы . . . 5°/о 5 ,
Вестфалит представляет и до сих пор одно из взрывчатых ве-
ществ с довольно высокой степенью антигризутности и применяется
в каменноугольных копях, неблагополучных в отношении рудничного
газа и изобилующих угольной пылью**).
*) Н. Brunswig причисляет этот вестфалит также к „безопасным11 в.в.
**) Вестфалит III допущен в России для применения в рудниках, небла-
гополучных в отношении рудничного газа статьей У: 2589 „Собрание Узако-
нений и Распоряжений Правительства11 за 1900 г. № 118.
— 541 —
Температура газов, образующихся при взрыве вестфалита 1806°С,
об'ем пустоты раздутия при взрыве в свинцовой бомбочке Трауцля: 10
грам. вещества—389 кубических сантиметров. О вестфалите содержа-
щем толь будет сказано дальше.
м. американские В Америке и Англии в настоящее время широко
Deton'b Masurite распространены относящиеся к тому же классу:
a) Detonite special, .
б) Hecla N2,
в) Masurite М. L. F. („low freesing"), '
г) Titanite N3—Р, 7—Р, 8—Р. ;
Невзрывчатые составные части, подобно вестфалиту, содержит
также: Kanite А. , -
15. Динаммон и вет- Правительственная фабрика в Австрии вырабаты-
тердинаммон. вает так называемый динаммон*). Есть два. сорта его,
один называется просто динаммон**), а другой носит название вет-
тердинаммона. ;
Первый состоит из: . : ,
87?о—88 о аммиачной селитры,
13 „—12,, „красного* угля.
Гравиметрическая плотность его 0,9. <
Второй из: ,л
94% аммиачной селитры,
3„ калиевой селитры и
4 „ „красного“ угля. , .
Гравиметрическая плотность его 0,85. ,
Оба поступают в продажу в виде патронов, завернутых в про-
парафиненную бумагу и оловянную фо'льгу для предохранения от
сырости. Они имеют вид тонкого порошка, причем динаммон, темно-
бурого, а веттердинаммон, хотя того-же цвета, но значительно светлее.
Динаммон требует капсюля № 6 (т.-е. с одним грам. гремучей
ртути), а веттердинаммон—№ 8 (т.-е. с двумя грам. грейучей ртути).
В смысле безопасности употребления в копях с рудйичным газом,
допускается к применению лишь веттердинаммон. ;
п Несколько меньшей „безопасностью", чем антигри-
рогрессит. Зутные СОрТа вестфалита, обладает сходный с ним по
действию, но совершенно отличный по составу npotpeccum. Это есть
смесь:
94% аммиачной селитры,
6 „ соляно-кислого анилина.
*) Существует также сорт динамита, носящий название динаммон^. со-
стоящий из 45% нитроглицерина, 47,2% аммиачной селитры и 7,8% бурого угля.
Им в Австрии снаряжают иногда минометные бомбы.
**) Н. Brunswig причисляет его к аммонитам.
§ з. Аммоналы и Эти взрывчатые вещества в основных своих сор-
сабулиты. тах являются крайне близкими к описанным в пре-
дыдущем §, т. к. также состоят лишь из неорганических компонентов.
Но т. к. в других своих сортах они имеют компонентами ароматиче-
ские нитропроизводные—их явилось необходимым выделить в особую
группу.
в. Аммоналы. Это смеси, предложенные в 1900 году Риттером
фон-Дамент, изготовлявшиеся сперва на фабрике Майера и Го'М в
Феликсдорфе, пользующиеся в настоящее время весьма широким при-
менением, преимущественно для снаряжения разного рода разрывных
снарядов. В качестве главной составной части они содержат аммиач-
ную селитру, из других же составных частей можно назвать: метал-
лический алюминий, бурый и черный древесный уголь, стеариновую
кислоту, роданистый аммоний, тринитротолуол, тринитроксилол и т. п.
Аммоналы—суть взрывчатые вещества, обладающие большой си-
лой. Скорость детонации в них доходит до 3.450 метров в секунду.
Алюминий не должен быть в состоянии слишком тонкого порошка.
Гравиметрическая их плотность равна единице или немногим более.
Аммонал Фурера, применяющийся в Австрии в качестве разрыв-
ного заряда для артиллерийских снарядов (так называемый „аммо-
нал № 2“), состоит из:
72% аммиачной селитры,
23,5% порошковатого алюминия,
4,5% древесного угля.
Уголь для этого аммонала готовится особым способом, путем об-
работки в течение 12 часов древесных опилок перегретым паром с
5® о серной кислоты в закрытом сосуде.
Цвет аммоналов различный, в зависимости от сорта: английский
и вообще сорта с алюминием—серые порошки с блестками, не содер-
жащие алюминия—порошковатые тела светло-желтовато-коричневого
цвета разных оттенков, а содержащие уголь имеют оттенок несколько
более темный.
По своим свойствам (взрывчатым) аммонал приближается к ме-
линиту и толу.
Удельный вес прессованного аммонала 1,4—1,5, при чем он взры-
вается капсюлем с 2-мя грам. гремучей ртути. От сгорания металли-
ческого алюминия за счет кислорода аммиачной селитры, отделяется
громадное количество тепла, но количество газов развивается при
взрыве сравнительно небольшое (ввиду того, что в продуктах горения
имеется очень много твердой окиси алюминия).
Дробящее действие аммонала на железо и бетон значительно
меньше, чем у мелинита, а метательное—больше; фугасный эффект
очень высокий. К удару и трению, практически, ацмопал мало чув
ствителен, от огня сгорает спокойно.
Аммонал—порошковатое вещество, легко прессующееся.
Иногда вводят в состав аммоналов тол, который, плавясь, может
цементировать массу (аматолы). z
)М
ро
ме-
жет
ьно
>ект
1ув-
:ий
ер-
ого
ько
IB-
10-
об-
: с
е-
'Ю
Ж
ры-
ли-
тся
при
НИЯ
in-
ly-
са.
и-
JX
г-:
543 —
£
>=
В нижеследующей табличке помещены некоторые константы ам-
моналов, а также (для сравнения) пикриновой кислоты и тола, полу-
ченные при одинаковых условиях.
7 / Аммонал № 1 с90,5”самм. селитры. Аммонал М2 с 72°'о а мм. сел. Пикриновая кислота Тол.
Скорость распростран. детонации )
метр в - ... 3380 1 i 3450 8183 7618
сек
Температура газов при взрыве в
градус. С 4 1710 ! 3915 2498 ; 2142
Количество газов из 1 кил. взр. j
вещ. в литрах 977 594 768 850
Освобождается при взрыве 1 кил.
больших калорий . * . . . 727 1600 : 117 599
Об'ем пустоты в бомбочке Трауц- 1
ля в кубич. сантиметр. . . . 250 329 ! 29.3 286
Тоже с песком * — 445 . — 330
Гравиметрическая плотность . . . / 0,865 0,900 ! - > —
Вычисленное давление в кил. на 1
квадраты, сантиметр .... 6338 9425 ! 1 — —*
Примечание: высокая температура, развиваемая горением
металлического алюминия, делает пробу Трауцля неприменимой
к подобного рода взрывчатым веществам, так как, кроме меха-
нической работы, на об‘ем пустоты влияет факт сплавления сте-
нок камеры, и результаты получаются ошибочные.
1. Яммонапы №№ f и 2. Продукты взрыва аммонала содержат:
« | Аммонал № 1 Аммонал № 2
1 н °' °-' и о о- В 0.0- 1
Углекислого газа .... ! 13,14 7,0
Воды . . .' j 49,6 14,14
Свободного кислорода . . 2,6 *— —
Азота . 34,66 28,47
Окиси углерода """ 4,57
Метана 1 0,25
Водорода ........ 1 1,1Я
Глинозема . .' ! f . ) 44,38 |
Несмотря на огромную температуру взрыва аммонала № 2, до-
ходящую почти до 4000е С, об'ем газов- сильно уменьшается, благодаря
— 544 —
тому, что масса тепла расходуется на нагревание 44,38’3 твердого
остатка.
Аммонал, примененный в пробных оболочках (например, снаря-
дах), дает прекрасный фугасный эффект при сравнительно не очень
высоких температурах газов.
Воронки, образовавшиеся от взрыва аммонала № 2, однако, не-
сколько больше тех, которые получаются от аммонала № 1.
Главный недостаток аммоналов—их гигроскопичность и окисляе-
мость металлического алюминия в присутствии влажности, а потому
аммоналы с алюминием должны храниться обязательно в герметиче-
ской укупорке. ,
Вполне надежный детонатор для прессованного аммонала—по-
рошковатый аммонал, взорванный капсюлем' № 8; в полубронебойных
же снарядах детонатором может служить даже черный порох.
Если аммонал идет на снаряжение артиллерийских снарядов,
назначенных для действия на большие дистанции, то его обыкновенно
помещают в жестянке с двойными стенками, между которыми про-
странство заполняется дымной смесью (так как, даже не взирая на
значительное содержание алюминия, сам по себе он дает не доста-
точно хорошо заметный с больших дистанций дым), состоящей из:
80-о металлической сурьмы в порошке,
20 „ красного фосфора.
Другой сорт аммонала (№ 1) *), допускающий простое воспламе-
нение, но несколько уступающий аммоналам с алюминием по силе,
состоит из: .
95,5’3 аммиачной селитры,
4,5 „ бурого древесного угля.
Он опатентован в Англии. Состав прессуется в виде патронов,
которые покрываются графитом. Для предохранения от сырости, их
завертывают в пропараффиненную бумагу,
_ Во Франции аммоналы пользуются в настоящее
ммонап . . . Время также большим распространением. Так, например,
сорт его содержащий:
86 о аммиачной селитры,
8 „ алюминия (в порошке или опилках),
6 „ стеариновой кислоты (последняя—для придачи пла-
стичности),
применяется для снаряжения артиллерийских снарядов больших
калибров при помощи спрессования. Он носит марку „А. М. S.“.
A. Marchall в „Explosives11 (1917 г.) проводит следующие данные, касаю-
щиеся состава употребительных аммоналов:
*) A. Marshall, „Explosives" (1917 г.) его обозначает как динаммон.
— 545 —
дого
3. Аммонал В.
Аммонал В:
аря-
чень
;ляе-
тому
гиче-
—по-
лных
ядов,
jchho
про-
Я На
,оста-
1 из:
Аммиачной селитры . . . 93%—95,5%
t Алюминия................2,5 „ — 3,5 „
Древесного угля.........2 „ — 3 „
4. Kipping Ammonai:
Аммиачной селитры . . 84%—87%,
Алюминия.............7 „ — 9 „,
Древесного угля. . . . 2 „ — 3 „,
Двухромокислого кал. . 3 „ — 4 „,
5. S. Deiens Powder:
Аммиачной селитры . . 92%—95%, '
Алюминия.............2 „ — 3 „ ,
Тротила. . . . . . . . 3 „ — 5 „,
6. Явстрийске аммо- Аммоналы, выделывающиеся в Феликсдорфе в Австрии
нопы. на завОде д, Roth. A. G., имеют состав:
ламе-
силе,
Аммиачной селитры. . 80,75% 90% 88% 80%
Алюминия 1 15 „ 4„ 8„ 18 п
Древесного угля . . . 1 4,25 „ 6 „ 4 „ О -* 0
ронов,
ги, их
У A. Marschall'H мы находим указание еще на два употребитель-
ных аммонала:
оящее
ример,
i пла-
Аммиачной селитры. 72%! 47% I i
Алюминия 25 я 22 „
Древесного угля. . 3 „ 1 „
Тротила — 30 „ 1
лылих
И. S.“.
касаю-
7. Яммонал Ландриэна: Другой тип аммонала, а именно, с роданис-
тым аммонием испытывался для снаряжения снарядов при помощи
заливки. Состав его следующий.
76,4% Аммиачной селитры,
10,8 „ Роданистого аммония,
12,8 „ Алюминия в порошке.
Нооф. М. Сухаревский. Взрывчатые вещества и взрывные работы.
Точка плавления этой смеси около 130°. Состав этот носит наз-
вание аммонала Ландриэна. Применяется он также для снаряжения
артиллерийских снарядов больших калибров при помощи прессования.
1 Кроме перечисленных сортов аммонала, существует еще много
его разновидностей, содержащих между прочим тол и ксилит. К числу
таковых принадлежат:
8. Английский аммонал. Это ОСТЬ СМвСЬ:
14% тола,
66 „ аммиачной селитры,
17 „ порошка аллюминия,
3 „ угля.
Он идет на снаряжение минометных снарядов и обладает отлич-
ным фугасным действием.
Об'ем камеры раздутия в свинцовой бомбочке Трауцля 400 куб.
сант. Дробящее его действие удовлетворительно.
Подрывные патроны английского аммонала (в их оригинальной
укупорке) Roburite and Ammonal L td, завернуты в пропарафиненную
бумагу, имеют цилиндрическую форму (диаметром около 42 м.м.) и
весят 8 англ, унцов.
Состав аммонала Коммиссии по применению взрывчатых веществ,
существующий под названием английского, следующий:
65% аммиачной селитры,
15 „ тринитротолуола,
1,7 „ алюминия,
3 „ угля.
Как явствует отсюда, он почти не отличается от состава настоя-
щего английского аммон ла.
Было предложено несколько смесей аммиачной селитры с три-
нитроксилолом, коим даны также названия аммоналов; из них известны
следующие:
9. Русские Аммоналы. Аммонал J\s 3t состоящий из:
18% тринитроксилола,
82 „ аммиачной селитры
Аммонал Л? 4,
82°/0 аммиачной селитры,
12 „ тринитроксилола,
6 „ алюминия в порошке.
Первый состав значительно уступает второму по фугасному дей-
ствию: аммонал № 3 дал об'ем камеры раздутия при пробе в свинцо-
вой бомбочке Трауцля 480 куб. сант., тогда как второй лишь 435 куб.
сант. Последний сорт применяется в Военно-Инженерном Ведомстве.
аммонала № 2 Комиссии по применению взрывчатых
.
78,5% аммиачной селитры,
%г 21,5 , тринитроксилола.
: ' <;’А - :
Алмонала-же № 1 той же Комиссии:
’ -по.
73% аммиачной селитры,
20 , три нитроксилола,
1 . 7 „ алюминия.
>•*
Аммоналы № 1 и № 2 в настоящее время употребляются уже
редко.
Кроме снарядов артиллерийских и минометных, аммоналом во
время войны снаряжались также и ручные гранаты.
Аммонал, коим снаряжали наши артиллерийские снаряды, со-
стоял из:
60% тринитротолуола,
40 „ аммиачной селитры.
Вещество это по взрывчатой своей силе весьма близко к толу;
ему дано название—амотола.
Согласно техническим условиям на прием в Военно-Инженерное
Ведомство амотола, последний должен состоять из 70% аммиачной
селитры и ЗО°/о тринитротолуола. Предложен был нам также в свое
время амотол, содержащий вместо аммиачной селитры такое же коли-
чество (70%) бариевой, требовавший для своего взрыва капсюль № 6,
но принят он не был. Предложение исходило от Бельгийского О-ва
Фавье.
Наши 6-дюймовые стальные фугасные бомбы содержат 21 фунт
• амотола, имеющего состав:
50% тротила,
50 „ аммиачной селитры.
Введение тола в состав аммоналов усиливает их действие и во-
обще повышает их качество. Однако, это не есть единственная при-
чина совместного применение тротила с аммиачной селитрой. Предпо-
лагалось, что достигая обволакивания частиц аммиачной селитры
тринитротолуолом, мы сильно понижаем свойство гигроскопичности
смеси. Практика, между тем, показала, что при продолжительном хра-
нении снаряды, снаряженные амотолом „текут", т.-е., что аммиачная
селитра с течецием времени не только отсыревает, но и расплывается.
Таким образом амотол не оправдал возлагавшихся на него на-
дежд в смысле уменьшения гигроскопичности.
'_ _ й Эти взрывчатые вещества пользуются значительным
ь. а улиты. расПр0СТранением в Англии и Франции, являются смесями
" сн"а,,и • аммиачной селитры с кремнистым кальцием или с каким-
нибудь нитропроизводным (например, тринитротолуолом, динитро-
нафталином и т. п.), либо с вазелином, параффином, или стеарино-
вой кислотой. Сабулиты в большей или меньшей степени гигроско-
пичны. Они могут применяться и для подрывных работ. С сабули-
тами сходен так называемый силаций.
Несмотря на то, что испытание этих составов дало хорошие ре-
зультаты, они мало пока применимы, ибо, благодаря заключающе-
муся в них кремнистому кальцию — веществу сравнительно еще мало
изученному, вопрос о их достаточной стойкости при хранении пока
еще остается не вполне выясненным.
1. Ннглийские Из числа английских сабулитов можно указать на
сабулиты. два более известные сорта, а именно:
Аммиачной селитры .
Кремнистого кальция
Тринитротолуола . . .
80%
| 20 „
78*/»
14 „
8„
Сабулиты — порошкообразные вещества с металлическими блест-
ками. Они безопасны в обращении и, практически, от удара не взры-
ваются. Газы, развивающиеся при взрыве, ядовитыми свойствами не
обладают; к морозу сабулиты не чувствительны.
2 Французские Во Франции применяются для снаряжения бомб и
сабулиты. • гранат при помощи прессования три сорта сабулитов:
1) 86% аммиачной селитры,
8„ кремнистого кальция,
6 „ стеарина.
Этот сорт носит марку ,,S“.
2) 84% аммиачной селитры,
10 „ кремнистого кальция,
6 „ стеарина.
Этот сорт недавно только стал применяться.
3) 65% аммиачной селитры,
25 „ кремнистого кадьция,
10 „ тринитротолуола.
Этот сорт носит марку Т. _
3. Бельгийские
сабулиты.
В Бельгии применяется, в числе „безопасных" взрыв-
чатых веществ, так называемый антигризутный сабулит А.
Его состав следующий:
Аммиачной селитры 54%.
Калиевой селитры 22 „
Кремнистого кальция 5 „
Тринитротолуола 6 „
Нашатыря 13 „
— 549 -
f
)OCKO-
,були-
ie ре-
ающе-
> мало
: пока
ггь на
Его предельный заряд 900 граммов, что эквивалентно 596,0 грам.
динамита № 1.
Сабулиты дают, благодаря сгоранию кремнистого кальция, обиль-
ный белый дым, хорошо видимый издали.
§ 4. В состав взрывчатых веществ с аммиачной селитрой, иногда
вводят бензол, получая таким образом ряд препаратов, каковы например:
беллиты, предложенные инженером Ламм в 1885 году в Швеции и
робуриты, появившиеся в Германии в следующем году (предложены были
Ротом ).
1 Беллиты Беллиты, суть смеси аммиачной селитры с динитро-
бензолом; среди них есть составы, богатые поваренной
солью. Все они причисляются к ,безопасным11 взрывчатым веще-
ствам. Существует четыре наиболее употребительных сорта беллита'
а именно:
; блест-
ie взры-
ами не
бомб и
[итов:
I
I
1
i
•I
1
Аммиачной селитры . . .
Динитробензола (мета). .
Поваренной соли . . . .
№ 1.
82%-85% 61%
18 15 „ 12 „
— 27 «
I
I
I
№ 3, j № 4.
92%—95% 66%
5#-8„ 14 „
— 20,
№ № 2 и 4—антигризутные вещества, при чем предельный заряд
№ 2—900 грамм, а № 4—500 грамм.
Каст дает несколько иной состав беллитов:
* ! № 2. f Ai? 3. № 4.
Аммиачной селитры . . i 59,5— 67— 64—
! 62,5 70 68
Дийитробензола . . . ! 11—13 1 1 12—14 13—15
Хлористого натрия . . i 25,5- 17— 19—
! 28,5 19 21
Влажности ! °,75 1,5 1
а' взрыв-
абулит А.
Есть беллиты, содержащие вместо метадинитробензола тринитро-
нафталин.
По внешнему виду беллит представляет зернистую пластичную
массу желтовато-белого цвета; удельный вес в уплотненном состоя-
нии 1,2.
Разложение беллита при взрыве следует уравнению:
С6Н4 (NO2) 2 + 10NH4NOs = 6C02 + 22Н2О 4- 11N2
Беллит изготовляется в виде цилиндрических патронов, весом
15 золотников, длиною 5 дм., диаметр. 1 дм.; для вкладывания кап-
сюля в патронах сделаны отверстия. Для взрывания беллита нужен
капсюль в 1—1'/2 грамма гремучей ртути.
Динитробензол, идущий на изготовление беллита, должен быть
хорошо отмыт от азотной кислоты, так как ее присутствие, в незна-
чительных даже количествах, может вызвать самовоспламенение
беллита.
У нас опыты с беллитом были произведены в 1887 г., главным
образом в гор. Кюмени.
Беллит обладает следующими свойствами: мало чувствителен к
ударам и трению но значительно менее чем динамит.
Не взрывается от удара ружейной пули.
Мороз не имеет влияния на свойства беллита и его можно
взорвать во время мороза теми же капсюлями, как при обыкновенной
температуре.
При взрыве не дает ни пламени ни дыма.
Будучи нагрет в открытом сосуде до 90°(\, начинает разла-
гаться.
От прикосновения огня беллит с трудом загорается и горит,
как жир, коптящим пламенем.
Детонирующая способность беллита ничтожна. Взрыв белли-
тового патрона не передается таковому иге патрону даже на расстоя-
нии 8Д.—1 дюйм. Удлиненные беллитовые заряды часто дают непол-
ные взрывы.
Беллит может быть взорван сухим пироксилином.
Опыты, произведенные в кр. Кюмени — показали, что бел-
лит по своей взрывчатой силе не имеет преимуществ перед пирок-
силином или динамитом: беллитовые заряды, при одном и том же
весе с динамитными, не пробивали насквозь каменные своды и стены,
как динамитные заряды, а образовывали в кладке одне лишь выбоины.
При расположении зарядов в буровых скважинах, беллит дейст-
вовал подобно обыкновенному черному пороху и не дробил так мелко
породу, как динамит.
Вследствие малой чувствительности беллита к ударам, толчкам
и трению, состав этот пробовали применять для снаряжения бомб. Ио
опытам в Швеции, фугасное действие беллитовых бомб значительно
превосходит таковое же действие пороховых. Однако случается, что от
действия капсюля и запального патрона не взрывается весь заряд, а
часть его разбрасывается; это явление в особенности часто замечается,
если сильно уплотнить беллитовый заряд.
Случающиеся неполные взрывы и способность сильно втягивать
влажность, делают употребление беллита мало пригодным для воен-
ных целей.
К его недостаткам следует причислить гигроскопичность—в воде
он разла, ается; Беллитовые патроны пробовали покрывать коллодиу-
мом, препятствующим беллиту поглощать влагу, но эта мера оказа-
лась на практике неудобной. Для предохранения от сырости патроны
обертываются в двойные пергаментные оболочки.
Детонирует с трудом и обнаруживает некоторую наклонность да-»
вать неполные взрывы.
Как уже упомянуто раньше, содержащийся в нем динитробензол
а-
IT,
1И-
)Я-
эл-
ел-
юк-
же
ны,
ны.
1CT-
лко
кам
. По
[ЬНО
о от
Д, а
ггся,
вать
$оен-
воде
>диу-
каза-
роны
ъ да-«
ензол
— 551 —
обязательно должен быть безукоризненно отмыт от всяких следов
свободной азотной кислоты, иначе можно ожидать самовозгорания
этого взрывчатого вещества.
Церечисленные недостатки беллита значительно ограничивают
применение его, впрочем его употребляют очень охотно при порохо-
стрельных работах в сухой скале. Беллитом пробовали снаряжать
бомбы, но благодаря значительному числу неполных взрывов, особенно
при сильно уплотненных зарядах, он был признан мало соответствую-
щим этой цели.
Тот же Ламм в 1891 году предложил взрыввещество, подобное
беллиту и состоявшее из:
90% нитрата амммония и
10 „ динитробензола.
Но вследствие происшедших при его применении на практике
отравлений, от него пришлось отказаться.
* * . .
Впоследствии инженер Ламм несколько видоиз-
ео- елпит. менил пропорцию составных частей беллита, применив
для его приготовления не только аммиачную, но и друтие селитры—
калиевую, натриевую и бариевую.
В нижеследующей табличке помещены данные относительно реко-
мендуемых
им пропорций:
Денитробензола . 34.48 51.00 1 44.64 55.25
Аммиачн. селит. . 65.52 —
Калиевой „ — 49.00 1 _
Бариевой „ —— — 55.36 —
Натриевой „ — - ' —- j 44.75
3 Отличается от типичных беллитов тем, что часть
епит‘ динитробензола заменена толом. Состав одного из них,
по Касту: ам. селитры —66,0—70,0%; тола—5,5—7,5%; динйтробен-
зола—5,5—7,5%; хлористого натрия---16,5 —18,5%; влажности—1%.
_ 6 Эти взрывчатые вещества б'ыли предложены в
о уриты. 1386 году доктором Ротом в Германии и выделываются
на фабрике взрывчатых веществ в Руре.
Существует много сортов этого взрывчатого вещества, пользую-
щегося значительным спросом в частной промышленности в Германии
и Англии. Это вещество большей частью буровато-желтого цвета*),
*) Существуют робуриты и других цветов, как например грязно-белого и т. и
поступающее в продажу, как в порошковатом и зерненном виде, так
и в виде цилиндрических шашек диаметром от 22 м.м. до 45 м.м. и
высотой до 60 м.м. Порошковатый состав несколько напоминает дре-
весную муку. Удельный вес прессованного робурита 1,2—1,6 темпера-
тура же газов, развивающихся при взрыве его —1616°С.
Робуриты, изготовлявшиеся прежде, несколько разнятся от выде-
лывающихся в настоящее время.
В нижеследующей табличке приводится состав нескольких робу-
ритов, изготовлявшихся раньше:
* № 1. № 2.
1 Аммиачной селитры 90 38,5 41,6
Калиевой „ ...... 30,7% 25,0%
Динитробензола • ! 7,7 „ J
Хлористого динитробензола . . . 10 г ' —*
Нитробензола 7,7%
Хлористого динитрофенола . . . - ' 15,4 „ —»
Пикриновой кислоты 16,7%
Хлористого тринитронафталина . 1 1 i f - 16,7 „
Состав робуритов, изготовляющихся в настоящее время, различен
в зависимости от цели применения этих взрывчатых веществ. Так.
например, робурит № 1—(Н. Brunswig- причисляет его к числу „безо-
пасных" аммонитов) имеет следующий состав: 5
Аммиачной селитры . 87,5%
Динитробензола ... 7,0 „
Сернокислого аммония . 5,0 „
Марганц.-калиевой соли. 0,5 „
Это взрывчатое вещество имеет вид порошка грязно-белого цвета,
который при хранении несколько слеживается. Взрывается он капсю-
лем № 8 (с двумя грам. гремучей ртути); гигроскопичен, но не в
особенно высокой степени. Формула его взрывчатого разложения
нижеследующая:
431 (NH.) NO. -+- 16,4CeH0N2O4 4-КМпО4 4-15 (NH4)2S04=98C0.>4-895H20-h.
134024-447N24-KMn044-15 (NH4)2SO4
Теоретическая температура взрыва 1616°С, причем один килограмм
робурита освобождает 612 калорий тепла, что соответствует механи-
— 553 —
ческой работе в 2.601.000 килограмметров. Об'ем газов, приведенных
к О* и 760 м.м. давления, 891 литр; упругость их в об‘еме одного
литра—6370 килограммов; плотность заряжения—0,86.
Как показывает формула его взрывчатого разложения, при взрыве
робурита получается много свободного кислорода.
Кроме этих сортов, имеются еще другие сорта его, содержащие
калиевую селитру, назначение которой увеличение • „безопасности**
при применении робуритов в рудниках; некоторое сорта их содержат
также и тол.
Вот состав некоторых из подобных робуритов:
Робурит А.
Аммиачной селитры . . . 82,50%
Калиевой селитры. ... 5,о „
Динитробензола . • . . . 7,0 „
Сернокислого аммония. . 5,0 „
Марганцево-кислого калия 0,5 „
Робурит I С.
Аммиачной селитры. . . 72,3%
Калиевой селитры. . . . 10,0 „
Динитробензола..........12,0 „
Сернокислого аммония. . 5,0 „
Марганцево-кислого калия 0,5 „
Из робуритов, несколько реже встречающихся в частной про
мышленности, можно назвать еще три:
Робурит обыкновенный'.
Аммиачной селитры. . . 92,5о/о
Динитробензола......... 7,0 „
Марганцево-кислого калия 0,5 „
Робурит 1с:
Аммиачной селитры. . . 77,5%
Динитробензола..........12, „
Марганцево-кислого калия 0,5 „
Калиевой селитры. . . . 10,0
Робурит № 3.
Аммиачной селитры . . 86%—89%
Динитробензола. . . . . 9 „ —13 „
Сернокислого аммония . 0%—2 „
Специально для порохострельных работ в каменноломнях и для
употребления в рудниках без руднинного газа (не в каменноугольных,
копях), существует еще один сорт робурита, так незываемый гештейн-
робурит, заключающий в себе:
Аммиачной селитры. . 82,5%
Динитробензола. . . .17,5,,
— 554 —
H. Brunswig причисляет его также к „безопасным* аммонитам.
По силе он близко подходит к динамиту, но безусловно безопас-
нее его.
Кроме перечисленных, существует еше много сортов этого взрыв-
чатого вещества, пользующегося в Германии и Англии значительным
распространением. Все сорта робурита одерживают хорошо продол-
жительное хранение, не теряя своих взрывчатых качеств.
Одно время в Англии предполагали заменить пироксилин робури-
том, но опыты, произведенные там в 1890 году, не показали никаких
преимуществ робурита перед пироксилином, почему вопрос этот и был
оставлен.
В Англии предпочитают в робуритах хлорированный диншро
бензол, в Германии-же обыкновенный. Сначала вместо динитрсбензола
в состав робурита вводили продукты нитрации нафталина, прибавляя
даже и бертолетовую соль; в качестве витропроизводных также при-
меняли продукты нитрации каменно-угольного масла и т. д.. Вообще
состав робуритов много раз подвергался коренным изменениям и по-
зднейшие сорта его имеют мало общего со своими прототипами.
О робуритах, содержащих тол, будет речь впереди.
5. Секюриты. К числу „безопасных" взрывчатых веществ, бо-
гатых аммиачной селитрой и содержащих динитро-
бензол, принадлежать секюрипгы, или, как их назы-
вают в Англии, Flameless Securites.
Их имеется несколько сортов, из коих наиболее употребительны
следующие:
Аммиачной селитры. . . . , . 75 78 74 -: — 90
Динитробензола. ..... 25 п 19 „ 26„ ; 26 10
Щавелевокислого аммония. f . I з„ — > 74 ’ * п
Эти сорта пользуются довольно широким применением в частной
промышленности в Англии*). Н Brunswig их относит также к ам-
монитам.
Фабрикация их довольно простая: аммиачная селитра и щавелево-
кислый аммоний (иногда щавелевокислый калий) растворяются в ми-
нимальном количестве воды, раствор выпаривается, остаток сушится
при 80°С, и затем к нему прибавляется нитробензол.
С секюритом сходен порох Denaby. В него вводится еще древес-
ная мука.
*) Есть сорта, содержащие также и калиевую селитру, а также не содержа-
щие оксалатов; в некоторых содержатся нитро.безол и нитроцеллулоза; наконец,
в состав некоторых входит динитротолуол, моно-и-динитронафталин и т.-д. Во-
обще состав секюритов довольно разнообразен.
6. Триторит.
Это взрывчатое вещество было предложено в
Бельгии. О?о состоит из:
Аммиачной селитры . 70 о
Ди нитробензол а......18 „
Калиевой селитры. . . . 11 „
Угля ... .........1,
Температура взрыва его 2276’С. Оно не принадлежит к числу
„безопасных" взрывчатых веществ.
и. <сг ь я Имеется несколько сортов этого взрывчатого
. пюкауф ( uc аи ). вещества, весьма популярного в Германии. Он при-
надлежит к числу антигризутных веществ и, кроме
преобладающего количества аммиачной селитры, заключает в себе до-
вольно разнообразные сгорающие: муку, сахар, крахмал, смолы, жир-
ные масла, нитробензол и т. п. В него вводят иногда калиевую и на-
триевую селитры, а также щавелевые соли.
Здесь приводится состав двух, едва-ли не наиболее употребитель-
нейших сортов его:
Аммиачная селитра. .
Калиевая селитра. . .
Динитробензол . . . .
Древесная мука. . . .
Щавелевокислая медь.
Другие вещества . . .
70,4%
10,0 г, I
1,0 J
м»,
5,0 „
7 2
82,7%
1,0%
11,5В
4,8 я
Предельный заряд для сорта А 1 — 400 грамм, а для А .111—450
грамм*); об‘ем-же камеры раздутия при пробе в свинцовой бомбочке
Трауцля, соответственно: 312 и 341 куб. сайт.
8 Лмвис Эго вещество предложено в Англии и заключает
М8ИС' значительное количество аммиачной селитры в качестве
ссщественной составной части:
Аммиачной селитры.....................88%—91%
Древесной муки..........................4 „ — 6Я
Динитробенаола или охлоренного нафталина 4 „ — 6 „
*) У нас в Горном Ведомстве допускается предельный заряд обоих в 350,0 грам.
556
9. Гештейн-даменит. Это один из распространенных сортов даменита.
Он имеет состав:
Аммиачной селитры . . 84.5%
Куркумы...............12,0 „
Метадинитробензола . 1,0 „
Двухромокислого калия. 2,5 „
§ 5. Аммиачные в. в. с взрывчатыми нитропроизводными толуола
в качестве компонентов (преимущественно). Сюда относится целый ряд
взрывчатых веществ.
к Гештейн-вест- Так называемые гештейн вестфалиты содержат дини-
Фалит и телыит. тробензол и динитротолуол, существуя в продаже под
марками В. и С.. В состав первого входит смесь аммиачной селитры
с динитротолуолом и металлическим алюминием, а второй содержит
динитробензол.
В Швейцарии гештейн-вестфалит С выделывается под торговым
названием тельзита А.
Сделано наблюдение, что некоторые, признававшиеся совершено
„безопасными" (в смысле употребления в копях с рудничным 1*азом
и угольной пылью) взрывчатые вещества делаются „опасными" в при-
сутствии парафина (даже пропарафиненной бумаги). Поэтому па-
троны вестфалита имеют двойную обертку: наружную-из пропара-
финенной бумаги, удаляемую непосредственно перед употреблением,
предохраняющую состав от доступа влажности и внутреннюю-без па-
рафина, в которой заряд вводится в буровую скважину. В случае
отсутствия рудничного газа в копях, патроны могут употребляться
без предварительного удаления пропарафиченной оболочки; к этому
же в силу необходимости приходится прибегать при мокрых буровых
скажинах, причем присутствие здесь воды оказывает благотворное,
влияние на понижение температуры взрыва, уменьшая тем самым
вредное влияние парафина обложки. В сухих скважинах и в при-
сутствии рудничного газа, наружную оболочку необходимо удалят»
Состав германского гештейн-вестфалита таков:
Аммиачной селитры . . 84,5%
Динитротолуола. . . . 12,0„
Алюминия...............5, „
Кроме приведенных наиболее употребительных, существует еще
несколько сортов вестфалита. Так, например, одно время охотно
применялись вестфалиты следующего состава:
Аммиачной селитры. . . ;
Калиевой селитры. . . . ।
Тола...............j
Нашатыря............
Канифоли............
Двухромокалиевой соли.
58%-61%
13„ -15„
— 557 —
Однако, имеются сорта, содержащие также нафталины, дегтярные
масла, лаки и проч.
2. Неодамеииты и
ромпериты.
Состав их виден из таблицы:
Неодаменит. Ромпе-
М. 50 М. 55 рит.
Аммиачная селитра. . 55,8 68,0 55,5
Калиевая селитра. . . 4,5 2,0 9,5
Тринитротолуол. . . . i 16,4 10 12,0
Древесная мука . . . 0,5 1 —
Мука. . . . • • . . . 1 i 3,0 6,0
Хлористый натрий . . 1 — 7,0
„ калий. 24,2 15,5 —
,, аммоний . 1 5,0
Магнезит I —— 5,0
. Кокс ’ 0,6 1,5 ! i ।
5. Неоастралит, Они имеют состав довольно близкий к приведен-
Тештейн-Даменнты ным вЫШС, КВ К ЭГО И ВИДНО ИЗ Таблицы.
И So S- НлЬЗИЛИТ,
ft
Нео-астра- лит. i _ Ге штейн даме- ниты. Альзи- лит.
So S;;
Аммиачная селитра. . . 80,8 70,0 1) 4,3 | 62,0
Натриевая „ . . . 10,0 25,0 22,0
Тринитротолуол 16,0 17,0 17,0 11,0
Древесная мука 0,2 2,0 1,0
Картоф. мука. 3,0 —7— — -
Нафталина .... • . . 1,0 2,5
Ферро-сиЛиция спорошко- образным алюминием. . 6 —-—. 1 - — 5,0
4. Динаммон 1 и Эти взрывчатые вещества преимущественно упо-
Динаммон м. требляются в Австрии. Состав их соответственно:
Аммиачной селитры. . 82,3% 86,0%
Угля................2,9 „ 4,0 „
Тринитротолуола . . . 14,8 „ 10,0 „ (из них 5% моно).
Уголь, для этих взрывчатых веществ, приготовляется сл. образом:
Расщепленная древесина, (щепы ели) величиною 1—4 мм. нагре-
вается в течении 12 — 20 часов (смотря по желательному содержанию
углерода) перегретым паром в автоклавах при 350°С. После промывки
щепа просушивается в особых печах. Содержание углерода обычно
равняется 64’/».
Во Франции с 18£)0 года, на основании опытов Малляра и Ле-
Шателье, немногие сорта простых по своему составу аммиачных взрыв-
веществ допущении в копях, неблагополучных в смысле рудничного
газа („poudres de surete").
В Бельгии предложены были составы, в которых
5. Денсит. аммиачная селитра частью замещена калиевой и строн-
циевой селитрами. Они названы были денситами. Их
имеется несколько сортов, из которых наиболее употребительными
являются следующие три:
Аммиачной селитры . . j
Калиевой , . . I
Натриевой . j
Стронциевой э . J
Тринитротолуола . . . . ;
Нашатыря.............
!
18% i 74% ' 49,8%
45,5 „ ; - : -
_ 99 __
— п
Первый из этих составов носит марку № 4, а второй № 3.
Температура газов, развивающихся при взрыве денсита доходи!
до 2117е.
Предельный заряд первых двух соответственно; 850,0 грамм, и
700 граммов, что эквивалентно 549,0 и 310,0 граммам дина-
мита № 1.
Относительно смесей тола с селитрами следует заметить, что в
обращении они значительно более безопасны, чем динамиты, по силе
же соответствуют таковым же со средним содержанием нитроглицерина.
К недостаткам их следует отнести большую или меньшую гигро-
скопичность, особенно составов, содержащих поваренную соль.
Во время войны они применялись для снаряжения английских
снарядов и ручных гранат.
— 559 —
6. Баленит. Фэвэр-
шэм-'Лаудер (Faver-
sham Powder) иНиг-
ро паудер (Negro-
Powder).
В Бельгии же был предложен состав несколько
сходный с амотолом с довольно низкой температурой
газов, развивающихся при взрыве (1992°), названный
баленитом.
Он представляет весьма простую смесь 85%
аммиачной селитры и 15% тола. Предложенный же в Англии несколько
более сложный, но сходный с ним состав, в котором часть тола за-
менена была поваренной солью и нашатырем, назван был Faversham-
Powder (Фэвэршэм-паудер).
Состав его следующий:
ft
84%—86% аммиачной селитры,
. 10 „ —12 „ тола,
1 „ — 2 „ нашатыря;
О,— 3, поваренной соли.
Другой сорт его (№ 2) содержит:
47,5% аммиачной селитры,
24,0 „ калиевой „
18,5 „ нашатыря,
10,0 „ тола.
Эти взрывчатые вещества принадлежат к числу „дозволенных*
для употребления в рудниках Англии; недостаток их—гигроскопич-
ность.
Предельный заряд 675 грам.
Сюда же можно причислить также несколько сходный по со-
ставу, применяющийся в Англии в качестве „дозволенного11 взрыв-
чатого вещества, так называемый Нигро-паудер (Negro-Powder).
Состав носящего марку № 2 следующий:
Аммиачной-селитры от 55°/в до 58%
Тротила ... „ 14 „ „ 16 „
Поваренной соли или
хлористого калия „ 26 ., „ 29 „
Графита............„ 0,5 „ „ 1,0 „
Предельный заряд его 675 грамм.
Заводом Виннера на ст. Саблино изготовлялся
7. Зигенит. состав, в котором тол заменен был динитротолуолом.
Он заключал в себе:
84,5% аммиачной селитры,
14,5 „ динитротолуола,
1,0 „ клетчатки.
Эта взрывчатая смесь названа была зигенитом.
— 560 —
Температура газов, развивающихся при взрыве его, достигает
2596®. Состав германского зигенита таков:
Аммиачной селитры . 82,0®/0
Динитротолуола . . . 14,0 „
Муки............... 4 „
К числу веществ, изготовляющихся в Германии и богатых содер-
жанием аммиачной селитры, можно причислить также следующие:
8. Дорфит 1 и IL
Это взрывчатое вещество изготовляется нескольких
сортов, из которых два пользуются едва ли не наи-
большей известностью. Состав их следующий:
ГЛ О/
01 /о
Аммиачной селитры .
Калиевой
Тола ......
Муки ржаной. . .
Поваренной соли . .।
I:
Оба они принадлежат к числу „безопасных" взрывчатых веществ,
причем предельные заряды допускаются соответственно—532 грамма и
300 грамм, об'ем же камеры раздутия при пробе в свинцовой бомбочке
Трауцля для № 1-172 куб. см., а для № 11 — 219 куб. см.
9. Гештейн-дорфит Кроме этих двух сортов дорфита, выделывается
или дорфит hi. еще один сорт, це причисляемый к разряду антигризу-
тных. Он получил название гештейн-дорфита. Состав его следующий.
Аммиачной селитры 66 %
Калиевой „ 5 „
Тринитротолуола . 15 „
Поваренной соли . 10 „
Ржаной муки ... 4 „
10. Альдорфит.
Это есть смесь 8; ®/0
тола и 2 , ржаной муки.
аммиачной селитры,
I
17 %
11. Робуриты № 4, С успехом применяются в Англии и Германии и
н и hi. причислены к веществам аатигризутным, сорта робу-
рита, содержащие тротил.
— 561 —
Состав его следующий:
Аммиачной селитры . .
Тротила ..............
Поваренной соли ....
Калиевой селитры . . .
Марганцево-калиевой соли
Муки..................
Нашатыря..............
Магнезита.............
Робурит № III.
I!
Робурит № 4, Робурит №11.
__ . .... г__ ________
610/ 10 71,5% . 55%
16 „ 12 12 „
23 „ 5 „ 7 „
— 5 „ 9,5 „
— 0,5 „ ’ 0,5 „
6 „ 6 „
5 я
— 5 я
Предельный заряд № 4 — 500 граммов, № 11 — 350 граммов, а для
№ III—650 грам., причем об‘ем камеры раздутия в бомбочке Трауцля
'у № II—325 куб. сайт., у № III—275 куб. сайт.
Есть робуриты, в состав которых, вместо калиевой селитры, вво*
дится натриевая.
Сорта робуритов, содержащие тол, готовятся на заводе Кранц и К°
в Саксонии.
12. Drednought Это взрывчатое вещество английского происхожде-
Powder. ния содержит:
Аммиачной селитры . 73%—
Натриевой „ . 14 „ — 17 „
Тола ................ 3 , — 5 _
Нашатыря............. 4 „ — 6 »
13. Бауценский бе- Это богатое, селитрами (преимущественно амми-
зопасный пороге, ачной) взрывчатое вещество, содержащее до 15% тола.
В нем около 10% аммиачной селитры земещено бариевой.
14 йммон кагюцит*) g СМвСЬ ИЗ:
и Тцендерит.
Аммон-ка- гюцит. Тцендерит.
Аммиачной селитры . . .
Тринитротолуола.......
Муки . ...............
Поваренной соли ......
82% 92%
16 „
1 »
0,5 „
В Америке он довольно распространен в частной промышлен-
ности и мелиорации.
*) Аммон-Кагюцит не следует смешивать с кагюцитом, о котором упоминалась
уже раньше.
Проф. М. Сухаревский, Взрывчатые вещества и взрывные работы.
36
- 562 —
15. Н а н с и т.
Состав
Это взрывчатое вещество обладает антигризутными
свойствами в довольно высокой степени.
его следующий:
Аммиачной
Калиевой
селитры 6S частей.
4
11 11
Динитротолуола
Муки . . . .
частей.
11
Максимальный заряд его, при употреблении в рудниках
зовой атмосферой", определен в 600 грм.
с „га-
Это также антигризутное вещество, применяющееся
еовестфапит. преимущественно -
Германии. Его состав
следующий:
Аммиачной селитры . 70,3 я/,
Динитротолуола . . . 10,9 „
Муки..........
Поваренной соли
16,8 „
Предельный заряд его равен 140 граммам, об‘ем же
дутия в свинцовой бомбочке Трауцля—309 куб. сантиметров.
камеры раз-
17. Вельтерин I.
Это бельгийское взрывчатое вещество. Он состоит
из:
Аммиачной селитры .... 78\>
Тринитрокрезилата аммония. 22 „
Температура взрыва его 2190°С; к числу „безопасных" он не при-
числяется.
18. Кэн тит. Это взрывчатое вещество содержит почти одинаковое
количество калиевой и аммиачной селитры и также весьма близкие
между собой количества тола и нашатыря. Состав его следующий:
Аммиачной селитры .
Калиевой „
Тротила ...........
Нашатыря...........
"* Я V V
14 „—16
16 „—18
11
19. Супперкуртисит От кэнтита по составу своему
№ 5- куртиеит № 3 Он состоит из:
не далек суппер-
Супперкурти-
: СИТ № 3.
Аммиачной селитры
Калиевой
Тола............
Нашатыря . . . .
Влажности . . . .
%—40”/,
„-31 „
____1)
» 1 1 Я
—23
Я “ ’ »
в
я
20. Экспедит и Upless 3 СОСТЯВ ИХ ВХОДЯТ:
powder.
Экспедит. Upless powder.
Аммиачной селитры . зз7.-зб’/0 62,0—65,0
Натриевая селитра 12,5—14,5
Калиевой селитры . . 32 „ -34 „
Тротила 11 „ —13 я 4,0— 6,0
Крахмал 1 — 2,0— 4,0
Нашатыря 19 21 1 я 1 п 13,0—15,0
Влажность 1 — 1,5 | ♦
21. Националит. Это взрывчатое вещество содержит значительно
большее количество аммиачной селитры,- чем экспедит, кроме того,
нашатырь в нем замещается хлористым калием.
Состав его следующий:
Аммиачной селитры : . 64°/0— 68 ’/.
Тола.................. 14 „ -16 „
Хлористого калия . . . 1S,5 „ —20,6 „
22. Нитролит. Нитролит есть смесь 65°/0 тринитроанизола с 35%
аммиачной селитры.
23. Моназиты. Вещества, богатые аммиачной селитрой и содер-
жащие тринитроксилол, предложены были под названием монахитов.
Их имеется несколько сортов, среди которых известны аати^ризутные.
Здесь приводится состав двух наиболее употребительных:
Монахит I. Монахит II.
селитры . .
81%
64%
г
к
п
»
Аммиачной
Калиевой
Натриевой
Тринитроксилола .......
Коллодионного хлопка . .
Муки...................
Древесного угля........
Щелочные хлориды . . .
13 „
»
я
19 .
Монахит II принадлежит к числу „безопасных" взрывчатых ве-
ществ, при чем предельный его заряд определен в 500 грамм. .
Из других сортов рашита, заслуживают упоми-
т нания также те, кои носят марки I и И, они состоят
шит и ’’ из аммиачной селитры и мононитрокрезол—сульфокис-
лого аммония (84:16) или крезолсульфокислого натрия (87:13), и,
кроме того, могут содержать до 30% сульфата натрия. (См. также стр.).
Так, аммон-рашит III состоит из:
60% аммиачной селитры.
10 „ крезолсульфокислого натрия,
30 „ сульфата натрия.
Распространенным сортом французских аммиачно-
• кр osi ). селиТр0ВЫХ взрывчатых веществ является тип „С“. Он
соответствует вельтерину, предложен Roux и состоит из аммиачной
селитры и аммиачного тринитрокрезилата. До 1906 года он изготов-
лялся в трех сортах, из которых один уже был упомянут выше.
№ 1 а. 0 0 Е х р 1 о s i f С. №°2
№ 1 b. •о № 1 bis °/о
Нитрат аммония . . . Аммиачн. тринитрокре- 93 78 50 75
зилат ’•ч 7 22 50 25
Тип „1а“ и до настоящего времени носит в Бельгии свое основ-
ное названиё „вельтерин № 1“.
Под тем же названием известна другая смесь, именно, аммиач-
ной селитры с пикратом аммония, готовящаяся во Франции заводским
путем. Константы ея таковы:
1' =8544 клгр.
у„= 881 литр.
t = 2273° С.
Р =434,7 МеТ^
сек.
а = 0,881 литр.
Взрывчатое разложение ея протекает по уравнению:
NHj.CjHo (N0?),0 + 8NH4NO3 = 6C0s % 19Щ0 % 10%
Сравнительно дорога.
26. Громовой,
ной степени.
Это есть смесь 72,5% аммиачной селитры с 27,5%
пикрата аммония. Он гигроскопичен в довольно силь-
*) Аммон-Рашит I и Ш и Exlosif С помещены - здесь по ошибке и должны
быть напечатаны в конце главы об аммиачно-селитровых взрывчатых веществ.
— 565 —
_ Под этим названием' предложен был в конце
. мензиты и g.0 х годов ряд взрывчатых веществ, представляющих
эмензины. смесь пикриновой кислоты с аммиачной селитрой в
разных пропорциях.
Процесс их приготовления совершенно прост: в азотную кислоту
крепостью бО’Вё вводят пикриновую кислоту и выпаривают, причем
образуется вещество желтого цвета.
Далее берут равные части полученного вещества и аммиачной
селитры, сплавляют их между собой и из полученной массы делают
патроны.
При сплавлении компонентов температуру отнюдь нельзя дово-
дить до 200° С, ибо при таком нагревании наступает уже взрыв
эмензита. । •
По наружному виду—кристаллическая масса желтого цвета без
запаха, очень горького вкуса.
При взрыве они не дают ядовитых газов, могут плавиться без
разложения и отливаться в формы; будучи зажжены, загораются и
сгорают спокойным пламенем без отделения дыма. При помощи вве-
дения в расплавленный эмензит специальных солей можно окраши-
вать пламя в различный цвет, оставляя его бездымным. Он может
быть применен, как в виде порошка, так и в зерненном и плавлен-
ном виде. Удельный вес его 1,47—1,8
Позже изобретатель дал несколько другой состав эмензита, реко-
мендуя его делать из равных частей пикриновой кислоты, натриевой
и аммиачной селитр, (по 33 у3% каждой), причем процесс приготов-
ления вести так: пикриновую кислоту нагревают в фарфоровом' сосуде
до 97°С, пока она не превратится в полужидкую массу. Затем туда
вводят натриевую селитру и малыми порциями, при постоянном поме-
шивании, аммиачную селитру, пока вся масса не станёт однородного
цвета (желтого).
Она постепенно густеет и, наконец, становится кристаллической
и плотной, после этого ее превращают в порошок.
В общем имеется более 5 сортов эмензита, различающихся по
своей силе.
Давление, развиваемое им на единицу площади, приблизительно
на 100/в превосходит то, которое дает нитроглицерин.
Примечание. Были попытки заменять в смесях селитры
с толом аммиачную селитру как бариевой, так и стронциевой.
Таковы, например, взрывчатые вещества, предложенные Бель-
гийским Обществом Фавье. Одно, почти аналогичное амотолу,
заключает в себе:
70% баритовой селитры.
30 „ тринитротолуола.
В Бельгии пользуются иногда взрывчатыми веще-
Z8. маиариты. ствами, в коюрых селитра заменена азотнокислым
свинцом, в качестве же горючего входит какое нибудь нитропроиз-
водное (например тринитротолуол или тринитронафталин). Такие смеси
называются макаритами. Они предложены были в 1899 году.
Бельгийские макариты состоят из:
71,9% азотнокислого свинца,
28,1 „ тринитротолуола
Французские же имеют состав:
а) 75,2°/о азотнокислого свинца,
24,8 „ тринитронафталина.
б) 57,6 „ азотнокислого свинца,
42,4 „ тринитронафталина.
Они обозначены маркою „Т. М. N“.
в) 50% азотнокислого свинца,
50 „ тринитротолуола-
г) 70 „ азотнокислого свинца.
30 „ тринитротолуола.
Они носят марку „N. Р. Т.“
§ 6. Существует серия аммиачных взрывчатых веществ с нитро-
производными целлулозы в качестве сгорающего.
Сюда относится целый ряд достаточно распространенных взрывчатых
веществ, как, нарример:
1. Взрывчатая смесь
Русского Общества’
для выделки порога.
Недавно Русское Общество для выделки ,пороха
предложило взрывчатую смесь (которой не присвоено
было, невидимому, специального названия), содержа-
щую, кроме тола, также и пироксилин.
Состав ее следующий:
62% аммиачной селитры.
16 „ тринитротолуола или тринитроксилола.
20 „ пироксилина.
2 „ гиппозина. *)
Состав этот безопасен в обращении, не взрывается от ружейной
пули и пригоден также для подрывных работ.
Он содержит преобладающее количество аммйач-
. дромаммонит. ной селиТрЫ, которую в количестве не свыше 15% за-
мещает калиевая. В нем заключается также до 9% коллодионного
пироксилина, хромовые квасцы и до 0,5% вазелина.
3 - Под этим названием существуют два вещества:
’ ’ °‘ одно предложено в Бельгии, другое-же во Франции.
•) Гиппозин—специальным способом обработанный конский помет, предназна-
ченный для придания препарату пористости и облегчения детонации.
Бельгийское „Эхо“ состоит из:
60% аммиачной селитры.
30 „ лигнита.
10 „ моно нитронафталина.
Состав обладает слабым бризантным эффектом.
Французское „Эхо“, предложенное Твено, имеет состав:
79% аммиачной селитры.
8 „ ферро-силиция.
7 „ гиппозина.
3„ алюминия.
Существует и другой сорт этого-же взрывчатого вещества, обла-
дающий бризантными свойствами в значительно большей степени, чем
предыдущий:
Состав его следующий:
80% аммиачной селитры.
6 „ алюминия.
6 „ ферро-силиция. .
5 „ пироксилина и
3 „ ржаной или древесной муки.
Метательное действие этого пироксилин—содержащего Эхо “ более
чем мелийита, ио силе-же он несколько слабее сикрита, более приб-
лижаясь к шеддитам, по свойствам-же близок к аммоналам.
Ферро-силиций должен быть также, как и в сикрите, с высоким
содержанием кремния.
Составом „Эхо“ этого сорта в количестве около 0,95 фунтов сна-
ряжались метательные снаряды для бомбометов „Эксцельзиор" к 9
сантиметровому бомбомету Аазена, а первым—ручные гранаты Аазена
и аэропланные бомбы, в применении к которым эти составы давали
хорошие результаты.
Имеется сорт „Эхо", в состав которого входит ферро-силиций,
но не содержащий алюминия.
Аммиачной селитры . . 82%.
Пироксилина.........2,5 „
Ферро-силиция около . 9 „
Гиппозина...........6,5 „
Этот состав еще недостаточно изучен относительно стойкости
его при хранении. Он боится не только подмочки, но и влажности
вообще, ибо под ее влиянием возможно разложение ферро-силиция с
отделением самовоспламеняющегося кремнистого водорода.
— 568 —
Он выпущен был
Й.
Глинозема
Это
взрывчатое
вещество состоит
из:
именно 1525°С.,
&
6. Флямивор.
9
5. Смесь пирокси-
лина с аммиачной
селитрой и толом.
м
аммиачной селитры,
нитроцелюллозы.
тротила.
гиппозина.
88,91
8,09
3,00
сущее
аммиН
следу}
62%
20 „
16%
.62%.
16 „
• 20 „
2„
92,88 85,13
4,85 1,61
2,27 2,70
ч ’
70%
3 ,,
4. Состав Na 7 Наш завод Виннера в 1916 году предложил также
завода Виннера. СОСТЯВ СХОДНЫЙ С „ЭхоД ИМ6НН0:
Ферро-силиций:
87,89
7,30
4,80
Аммиачной селитры .
Тола . . ; .......
Пироксилина . . . .
Гиппозина.........
1
„ Состав Л? 7“ и обладал дей-
под названием
ствием, приближающимся к амотолу.
Об‘ем пустоты, произведенной им в бомбочке Трауцля—388 куб.
сайт., а сжатие свинцовых цилиндриков 13,5 мил. К попаданию ру-
жейной пули относится пассивно.
Для надежности взрыва, вещество должно быть несколько
спрессовано; при недостаточном же спрессовании заряда и неплотном
соприкосновении патронов—могут быть неполные взрывы.
Вещество выпускается с завода, в патронах спресованных до
плотности 1,2. Детонирует от тетрила или от того-же состава, но
сильнее спрессованного.
Профессор А. А. Солонина, для сортов „Эхо“ употребляющихся
у нас, дает следующий состав их:
Аммиачной селитры .
Пироксилина.......
Алюминия .....
( кремния
Ферросилиц.ч железа
I кальция
. 81,75 82, 0 84,90 82,00
. 2,23 2,84 2,82 2,70
. 2,24 3,13 2,06 1,92
. 7,36 3,25 8,61 4,35
. 0,67 0,27 0,45 0,59
. 0,25 0,18 0,24 0,14
. 5,00 8,31 4,25 8,30
Низкую температуру взрыва, а
имеет предложенное в Бельгии, взрывчатое вещество,
названное „флямивор*. Два из наиболее употребительнейших его сор-
тов состоят из:
Аммиачной селитры . . . 85%
Нитроцелуллозы.........10 „
Сернокислого аммония
Сернокислого бария.
Углеводородов. . . .
1
— 569 —
7. Взрывчатое ве- Несколько более высокую температуру, развиваю-
щество Лебо и щую при взрыве (1б2б») — имеет вещество, предложен.
Касто. ное бельгийцами Лебо и Касто, состоящее из:
Аммиачной селитры 900/0.
Нитро декстрина . . 10 „
8. Поро^ Севран- Существует два главных сорта этих порохов, зна-
Ливри. чительно разнящихся по своему составу:
№ 1. • Минный. J : :
Аммиачной селитры. . . . . . 8О’/о 1 93%
Коллодионного хлопка 20 „ 1
Крезилата аммония 1 — ; 7»/ 1,
9. Фульменит и Фульменит представляет собою препарат содер
Веттер-фульменит. жащий пироксилин и тол. Он состоит из:
Аммиачной селитры 86,5%, f 1 1 85,0%,-
Пироксилина 4 « ; 5 п
Тола । 5,5 „ ' 11,9 „
Парафинового масла 2,5 „ , 0,1 „
Древесного угля 1.5 „ i
Муки i ; ! 2,5 „ j
Подобный же состав имеет так называемый сеттер—фульменит,
существенно отличающийся от предыдущего меньшим содержанием
аммиачной селитры и наличностью поваренной соли. Состав его
следующий:
Аммиачной селитры 76,5%, 76,0%,
Пироксилина 4 ” । 0,5 „
Тротила . . . ' 5,5 , И,8 „
Парафинового масла . .... 1 2,5 , 0,2 „
Древесного угля . . . . . . . ’ 1,5 „ 1,5 „
Поваренной соли . ...... ю „ 10,0 „
Альдорфит и фульменит не допускаются к применению в рудни-
ках, неблагополучных в „газовом1* отношении, что же касается дор-
фита и веттер-фульменита, то они причисляются к антригризутным
веществам.
Смеси нитроцелюллозы с аммиачной селитрой были
io. „Ejcpiosif Р.“ изучены во Франции с целью получить достаточно мо-
гучее взрывчатое вещество с низкой температурой га-
зов, развивающихся при взрыве. Опыты Comission des Substances
Explosifes в этом направлении привели к предложению в 1890 г. сле-
дующих двух смесей:
I 90,5 % аммиачной селитры,
Л» 1 (Couch е) \
' 4 ' I 9,э „ нитроцелюллозы;
Л? 2 (Roche)
80 »/0 аммиачной селитры,
20 „ нитроцеллюлозы.
В качестве нитроцеллюлозы применали пироксилин с п=8, со-
держащий около 12’4 влажности. Его смешивают осторожно в особых
аппаратах с селитрой, заключающей 2%—3% влажности в течении
1 часа, после чего масса зернится, осторожно сушится и просеивается.
По действию они напоминали гризутины; отсыревши, однако,
детонировали с трудом. Главная причина малого распространения
этих взрывчатых веществ заключалось в их сравнительно высокой
стоимости.
§ 7. Существует целая серия аммиачных взрывчатых веществ
с нитроглицерином, в качестве сгорающего и, таким образом, все ниже-
перечисленные взрывчатые вещества по многим своим качествам предста-
вляют родственную группу.
1 и к и т Он сравнительно недавно предложен Норвежским
и к р и т. дКцИ0НерНЫМ Обществом. В его состав входит ферро-си-
лиций,—вещество, освобождающее при сгорании огромное количество
тепла. Химический состав одного из очень употребительных сортов
следующий:
68,5о/0 аммиачной селитры,
10,0 „ нитроглицерина,
8,0 „ тола (или продуктов его нитрации),
13,5 „ ферро-силиция.
Есть сикриты, имеющие также и другой состав.
Сикрит безопасен в обращении и годен для подрывных работ,
нЪ при условии высокого содержания (93%—95*/о) кремния в ферро-
силицие, иначе, цри содержании железа в нем около 25%, он делается
настолько чувствительным к ударам, что взрывается от попадания
ружейной пули.
Сикрит—порошкообразное вещество темно-серого цвета с блест-
ками, слегка жирноватое на ощупь, способное при небольшом нажатии
рукой спрессовываться в полупластичную массу плотностью 1,2; машин-
ным прессованием его moJkho довести до 1,4—1,5, но делать это из-
бегают в силу того, что с увеличением плотности сикрита, его чувст-
вительность к капсюлю сильно понижается.
Присутствие в нем ферро-силиция значительно повышает коли-
чество отделяющегося при взрыве тепла, а наличие жидких масло-
образных продуктов нитрации тринитротолуола, обволакивающих ча-
стички гигроскопичной аммиачной селитры, несколько уменьшают
чувствительность препарата к сырости и отчасти действуют в каче-
стве флегматизатора. Растирание небольшого количества сикрита
между двумя железными пластинками, а также в форфоровой ступке
не вызывает взрыва сикрита, в общем, к удару он почти столь же
чувствителен, как и тол, но попадание ружейной пули с расстояния
меньше 75 шагов может вызвать взрыв его; однако, при опытах в этом
направлении, производившихся зимой, и стрельбой с дальних дистан-
ций взрывов не наблюдалось.
От огня он загорается с трудом и при удалении пламени обыкно-
венно скоро гаснет.
Нагревание до 80°С в продолжениие получаса он переносит без
видимых изменений.
Сикрит взрывает от обыкновенного толового и тетрилового кап-
сюлей, или капсюля с двумя граммами гремучей ртути (№ 8), при
чем даже несколько отсыревший не утрачивает этой способности.
Передача взрыва от одного патрона к другому происходит вполне
надежно, даже еслиимежду ними соприкосновение не вполне плотное.
По силе взрыва он почти нисколько не уступает пироксилину и толу.
Согласно действующих в Инженерном Ведомстве правил, общее
сжатие свинцовых цилиндриков при пробе на бризантность, не
должно быть меньше 16 миллиметров [при заряде 45,0 грам. сикрита,
взорванного толовым капсюлем], а 10,0 грам. сикрита, взорванного
в бомбочке Трауцля, не должны давать об‘ем камеры раздутия мень-
ший 380 куб. сантиметров.
Сикрит применяется в тех же случаях, как пироксилин и тол, при
чем заряды его расчитываются по Тем же формулам.
При хранений сикрит слеживается и в таком виде делается менее
чувствительным. к капсюлю, давая даже отказы. Чтобы избежать по-
следних, состав несколько разминают между пальцами.
К числу недостатков сикрита принадлежит также и то, что во
время значительных морозов замечаются иногда отказы. Происходит-ли
это вследствие замерзания в нем нитроглицерина, или по какой-либо
другой причине—пока не выяснено.
Нельзя также не упомянуть того, что ферро-силиций при извест-
ных неблагоприятных условиях может разлагаться, что имеет место,
например, в присутствии некоторых крепких кислот.
Практика показала также, что сикрит, заготовленный Военным
Инженерным Ведомством во время Европейской войны, при продол-
жительном хранении несколько утрачивает свою стойкость.
2. Аммон-карбонит,
аммон-карбонит 1
и донарит.
Карбонитной фабрикой в Шлебуше изготовляются,
между прочим: аммон-карбонит и аммон-карбонит 1.
)
Они характеризуются присутствием муки или крахмала, которые
разводятся с водой, образуя клейстер, частицы которого обволаки-
вают аммиачную селитру, влияя тем самым на уменьшение гигро-
скопичности. Состав их следующий:
Аммон-
карбо-
нит*).
Аммон-карбо-
нит 1**)
V/o
а) । б)
Донарит***)
Vo
Аммиачная селитра. ,
Калиевая селитра. . .
Нитроглицерин. . . .
Коллодионный хлопок.
Мука или крахмал . .
Тринитротолуол. . . .
Угольная пыль. . . .
10
0,2
4,0
80,3
5,0
4,0
0,2
6,0
75,5 I!
10,5
0,5
80
0,2
4,0
67,0
i 4,0
25,0
J
! 4>°
Первые два в Германии и Бельгии считаются „ безопасными “
в отношении рудничного газа и угольной пыли.
Донарит представляет порошок светло-бурого цвета, несколько
грязноватого оттенка и, хотя не обладает большой степенью „безопас-
ности", но благодаря своей силе и общим выгодам, представляемым
взрывчатыми веществами, содержащими аммиачную селитру, успешно
заменяет динамиты в каменоломнях и соляных копях.
Лабораторные испытания показали, что 1000 грм. этих взрывча-
тых веществ выделяют при взрыве нижеследующее количество ка-
лорий:
Аммон-карбонит 589 кал.
Аммон-карбонит I 925 „
Донарит 669 „
♦ ) Предельный заряд его — ЗоО граммов, что эквивалентно —191,0 граммам
динамита № 1.
* *) Предельный заряд его—300,0 граммов, а об'ем пустоты раздутия в бом-
бочке Трауцля—355 куб., сайт.
* **) Предельный заряд его—130 граммов, об'ем пустоты раздутия в бомбочке
Трауцля—450 куб. с.м. Есть доиариты, содержащие также нафталины.
— 573 —
Кроме приведенных здесь двух сортов аммон-карбонита, есть еще
copt ёго,: заключащий вдвое больше нитроглицерина, а именно:
Аммиачной селитры 8О°/0
' ’ Нитроглицерина 9 „
Других составн. частей 11 „ 1
К числу взрывчатых веществ, богатых селитрами,
в состав которых входят также щавелевые соли, принад-
5. Фракторит.
лежат также фракториты. Их существует несколько сортов, из которых
наиболее употребителен фракторит D.
Его состав следующий:
Аммиачной селитры 70%
Калиевой селитры J0 „
Щавелевого кислого аммония 7 „
Нитроглицерина . 4 „
Углеводов 4 _
Содержание нитроглицерина позволяет считать его, в сущности,
слабым динамитом.
4. Колен-вестфалит,
Гештейнвестфалит I,
зигенит и зигенит III*).
Близкими к вышеприведенным является це-
лый ряд аммиачных взрывчатых веществ, состав
некоторых представителей которых виден из сле-
дующей таблицы:
• Колен-вестфалит Гештейн- вестфалит I о . о Гештейн- зигенит % Зигенит II о о
Т о/ 1 1 о IV %
Аммиачная селитра 83,0 73,0 85,0 77,0 81,0
Калийная „ .... 7,0 2,8 •** —
Бариевая „ .... 2,0 ’ —— 1 1 —
Тринитротолуол 2,0 —- 8,0 15,0
Динитротолуол — 5,0 3,0 14,0
Нитроглицерин J 4,0
И 4,2 4,0 4,0 1,0
Нитроцеллюлоза ...... 1
Мука 2,0 1,о 4,0 4,0
Хлористый натрий - 14,0 —
Парафиновое масло ..... 1 — —
•) Упоминается еще на стр. 560.
— 574
_ _ Это взрывчатое вещество, наряду с большим количе-
страпиг.. ством аммиачноц селитры (74,5%), заключает от 7% до
150/° тола или мононитронафталина,'1’/о древесного угля, столько же
древесной муки, около 21/2% парафинового масла, и до 4% нитро-
глицерина.
Состав другого из современных германских астралитов таков:
Аммиачной селитры 80,0%,
Тринитротолуола 1,9 „
Нитроглицерина 1
Нитроцеллюлозы I "
Муки 2,5 „
Древесной муки 0,5 „
Каменного угля 1,0 „
Парафинового масла 0,1 „
6. Веттер-астрапит.
Принадлежит к антигризутным веществам и
имеет состав сходный, с предыдущим, а именно:
Аммиачной селитры _74,5%
Поваренной соли 10 „
Тола 7 „
Нитроглицерина 4 „
Древесной муки 1 „
Древесного угля 1 „
Парафина 2,5 „
Н вит Эт0 также „безопасное" взрывчатое вещество, содержащее
‘ овит' небольшое количество желатинированного нитроглицерина.
Состав его следующий.
Аммиачной селитры..............78°/0
Калиевой селитры.................5 „
Желатинированного нитроглицерина 4 „
Поваренной соли..................8 „
Растительной муки,...............5 „
Повит обладает антигризутными свойствами в несколько большей
степени, чем сходный с ним нансит, и максимальный его заряд в „га-
зовой" рудничной атмосфере допускается по правилам Горного Ведом-
ства в 700,0 грм.
В состав этих взрывчатых веществ, кроме преобла-
в.Мммонфердити даЮщего количества- аммиачной селитры, входят: дифе-
ммон-но епит. ниламИН) МуКа, глицерин, бертолетовая соль и до 4%
нитроглицерина.
Таким образом, это, в сущности, динамиты с небольшим содер-
жанием нитроглицерина.
— 575 —
Нижеследующая таблица дает представление о составе некоторых
из них:
Аммон- ,i
1
нобелит ,1-
А м мон-
фор д и т.
Аммиачная селитра. , . .
Нитроглицерин (желатинир.)
Мука...................
Хлористый натрий.......
„ калий...........
Щавелево-кислцй аммоний .
Глицерин . . ..........
Дифениламин............
86,0 88,0 85,0
4,0 4,0 4,0
4,0 4,0 4,0
2,0 1 4,0
V 1,0
4,0 ——
2,0 2,0
- 1,0 1,0
В новой английской ведомости, вошедшей в силу
с 1 сентярбя 1913 года, помещены сл. взрыввещества.
Я Английские Super-
Ejccellite, Суперйт и
Melting-Powder.
1 Suner-Excellite Суперйт. %
°/ /о № 2 °/ /о
Аммиачн. селитра ..... 73,5—77,9 48-51 80,0—84,0
Калиевая селитра 6,5— 8,0 19—21 9,0—11,0
Натриевая селитра '—II —
Нитроглицерин — 5,0 4— 6 3,5— 4,5
Древесная мука 2,0— 4,0 1
Крахмал — 2,0— 5,0
Щавелево-кислый аммоний . 9,0—11,0 14—16 •—.——.
Хлористый аммоний — 4— 6 —
Влажность 1,5 1 1,5 9 «0
Состав сортов „Melling-Powder* отличается наличием в них также
ароматических нитропроизводных:
1 Аммиачная селитра ! 51—55
Калиевая селитра -
Натриевая селитра i 11 — 13
Нитроглицерин 4— 6
Тринитротолуол [ 5— 7
Древесная мука j 3— 5
Щевелево-кислый аммоний . i t 1 18—20
Влажность 1 2.
10. Американские
Aetna и др.
Среди американских взрывчатых веществ встре-
чается также целый ряд составов, содержащих нитро -
соединения и нитроглицерин, а иногда и не заключа-
ющих последнего.
К подобным взрыввеществам принадлежат:
Aetna coal powder А. А.
Bental coal powder № 2.
Bituminite № 5 и № 7.
Coalite № 3.
Coal special № 4.
Collier powder № 5, Ла 3, № 5 special и ЛЬ 5 L. F.
(Low freesing).
MonoBcl ЛЬ 1, № 2, ЛЬ 3.
H. Французские По своему составу они наиболее близко подходят
гризутины. к немецким аммиачно-селитровым взрыввеществам:
- GrisoutineA •/о GrisoutineB %
Аммиачная селитра. . . 90,45 94,00
Нитроглицерин 4,85 5,98
Нитроцеллюлоза 0,15 i 0,12
Смола i 4,55 ) —
акже
12. Бельгийские
Flamivore и
^ракторит.
Из .бельгийской ведомости взрыввеществ от 1909 г.
следует упомянуть сл. составы.
Flamivore*).
Фракторит
D
%
Аммиачная селитра........
Натриевая селитра........
Нитро глицерин...........
Мука.....................
Декстрин......... ... .
Щевелево-кислый аммоний. .
Сульфат аммония . • • . . .
Сульфат бария.........
82,0
10,0
4,0
4,0
6,0
9,0
7,0 !
75,0
10,0
4,0
4,0
7,0
ютре-
итро-
1юча-
наименование аммонкарбонита
Flammivore I иногда носит также
§. 8 Желатинированные динитр ох лор гидри новые в. в. на основе амми-
ачной селитры; жел. астралгт, веттер-астралит, вестфалит и др.
Эти в. в. в последнее время приобрели широкое распространение.
Нижеследующая таблица показывает состав некоторых из них**)1
L. F.
ходят
Желатини- рован. аст- ралит °/о Желатин, веттер-аст- ралит. Желатини- рован. вест- фалит %7
I ’/о II 0/ /0
40,0
54,55
Аммиачная селитра .......
Натриевая селитра........
Динитрохлоргидрин .......
Нитроглицерин. .......
Нитроцеллюлоза...........
Тринитротолуол.
Динитротолуол. .......
Нитротолуол. ............
Древесная мука...........
Мука. . .................
Повареная соль...........
Щавелево-кислый аммоний .
Свекловичное масло.......
25,0
4,0
0,65
2,0
16,0
4,0
0,5
40.0
7.0
20,0
6,5
10,0
39,0
ДО
0,2
(картофел.).
1,0
0,5
8,0
(картофел.).
14,0
15.0
(гидр. угл.>
16,5
1,0
3,0
(ржаная).
2,0
(жидкий
углеводо-
род).
*) О Фламиворе, не содержащем нитроглицерина говорится на стр. 568.
**) О веществах, с аналогичным названием но не содержащих динитрохлор-
гидрина говорится на стр. 554, 573, 574.
Пр оф. М. Сухаревский/ Взрывчатые вещества и взрывные работы, 3?
578 —
1. в. в. Валсродера; Из других ДИНИТроХЛОрГИДриЦОВЫХ В. В. Нвоб-
лагпозит, пфальцит. ХОДИМО упомянуть:
Безопасное взрывчатое вещество Валсродера. По своему составу сход-
но с фульменитом. Аммон и гештейнзелзагитп с гепггейнзигенитом, вет-
тергелингерит с дорфитом I; с последним сходны также лигнозит и
пфальцит. Последние два содержат также и коллодионный хлопок
(!•/•), Лигнозит в качестве индеферентной примеси содержит боксит, а
в пфальците калиевая селитра заменена натриевой.
2. Титанит, Шлезит, Различные сорта титанита содержат кроме
Глюкауф1,тевтонит. аммиачной селитры также и тринитротолуол и уголь
куркума.
Шлезиты подобны веттерастралитам и содержат частично и пер-
хлорат калия (2*0)
Гмокауф I содежит натриевую селитру, щавелево-кислый ам-
моний, поваренную соль и азотно-аммиачную медь.
Тевпюнит подобен гештейн стремониту, однако, вместо динитро-
глицерина содержит динитрохлоргидрин.
з. Жепатин-донарит Желатинированный донарит и туннелит пред-
туннелит. ставляют из себя желатинированные, динитрохлор-
гидриновые взрыввещества.
Детонит состоит из аммиачной селитры, древесной муки, угля,
4°/» нитроглицерина и частью из моно и ди нитросоединений.
§ 9. Существует довольно много взрывчатых веществ с нитропроиз-
водными нафталина (« нафталином) в качестве сгорающего.
Среди них заслуживают упоминания следующие.
1. м»нол»т(обыкновен- Это взрывчатое вещество предложено было
ный и антисризутный). в Бельгии и оказалось обладающим хорошим фу-
гасным эффектом.
Его существует нескольку сортов, из коих наиболее употреби-
тельные следующие два:
Аммиачной селитры . . .
Натриевой „ . . .
Муки...................
Динитронафталина . . . .
Тринитронафталина . . .
80% ' 87%
Температура газов, развивающихся при взрыве, 1916»С.
Кроме этого сорта, в Бельгии же применяется минолит анти-
гризутный, который имеет следующий состав:
Аммиачной селитры . . 72% Тринитронафталина . . 2%
Натриевой „ . . 23 „ Тола..................... 3 „
— 579 —
Предельный заряд его 400 грамм, что эквивалетно 236 грам. ди-
намита № 1.
Это взрывчатое вещество предложено было в
. итроферрит. iggy году в Бельгии инженером Корниль.
Это есть порошок, получающийся путем смешивания измельчённых,
каждая в отдельности, составных частей. Им наполняются бумажные
гильзы, которые затем парафинируются; цвет его серовато-желтый;
взрывается капсюлем с 1.5 грам. гремучей ртути. Практически, к ударам
не чувствителен; в соприкосновении с раскаленным железом горит как
бы с небольшим шипением, напоминающим горение жирных веществ,
но гаснет по удалению раскаленного железа; дыма дает мало.
Не замерзает; в общем напоминает составы Фавье.
Выделывался у нас на заводе близ ет, Харцысская и находил
себе значительное применение в горном деле.
Существует несколько сортов его; в общем в его состав входят:
а) селитры (преимущественно аммиачной, иногда же и другие),
б) моно-ди и тринитронафталин (преимущественно' последний), в) на-
шатырь, и д) древесные опилки.
Один из наиболее употребительных сортов, а именно № 1, имеет
нижеследующий состав:
Аммиачной селитры.............9з,5°/0
Тринитронафталина................. 2 „
Железисто-синеродистого калия. 2 „
Сахара.......................... 2,5 ,
Температура газов, развивающихся при взрыве, 155800.*
с ф Эти чрезвычайно распространенные в настоящее
. оставь, авье. Время взрЫВЧатые вещества предложены были в
Бельгии в 1884 году и готовились там па заводе в Вильворде.
В основании их находится аммиачная селитра, в качестве же
сгорающего—нитропроизводные нафталина. Применение последних,
помимо их дешевизны, вызвано было и следующим соображением:
при взрыве они дают довольно большое количество газообразных про-
дуктов, причем температура их поднимается сравнительно невысоко
(например, в бельгийском аптигризу № 8 и французском гризу—наф-
талите куш она может дойти всего лишь до 1400°С), во вторых же,
производные нафталина обладают некоторой пластичностью и потому,
будучи смешаны с селитрой, сообщают это свойство отчасти и ей,
что очень важно на практике.
Один из предложенных Фавье с самаго начала составов был:
90,86% аммиачной селитры,
9,14 „ мононитронафталина.
Состав этот при взрыве теоретически дает полное сгорание с образо-
ванием воды, углекислого газа и освобождая азот. Никаких горючих
газов при реакции взрывчатого разложения не получается.
Франция и Бельгия в настоящее время выделывают целую серию
составов Фавье, исключительно шедших в мирное время на нужды
37»
580 —
горной промышленности, получивших специальные названия: пороха
Фавье, безопасных порохов, гризунитов, нафталитов и взрывчатых со-
ставов типа N, Miners Safety Explosives и т. д.
Здесь приводится состав некоторых из них:
Аммиачная селитра. Калиевая селитра. Нашатырь. 1 ГЗ 1 ° 1 | Тетрил. Динитро- нафталин. Трииитро- нафталин.
Гризу-нафталит-куш N, а. Гризу-нафталит-куш N,a 95,5 ' — 4,5
bis 95% ‘ ' 5%
Тоже с селитрой N, . . Гризу-нафталит-рош Ntb 90 и 57. — ' - 5 „
bis 91,5 - 8.5%
Тоже с селитрой N3 . . 86,5 5„ — 8,5 я
Антигризу Фавье . . . Порох Фавье для копей 81 „ 13% 1 * **) *•*) — - 6 „ —
без рудничного газа N, с bis 87,4 „ 12,6 „
Состав, имеющий марку
N и называемый „анти- гризу Фавье“ II*) . . . 80,9 „ — 7,4 „ —1 11,7 ,
Гризу-тетрилит куш . . 88 „ 5, — 7% —
Фавье № 3 bis . . . во „ П „ 8'12% 6 „
Фавье № 2 bis . . . . 77,6 „ 1 — 20 „ ' — 2 Д,,
Есть сорта, содержащие и натриевую
селитру, так,
например:
№ 3.
Аммиачной селитры . .
Натриевой „ . .
Тринитронафталина . .
Мононитронафталина . .
15%
80%
W
20 „
*) Brunswig причисляет его к ^безопасным* аммонитам.
**) Кроме того: марганцево-кислого калия 0,5° 0; квасцов 5°j0 и углекислого
бария 5°|0.
Предельный заряд 750 граммов, что эквивалентно 452,0 граммам динамита № 1
*•*) Предельный заряд 500 граммов, что эквивалентно 293 грам. динамита № 1
F
— 581 —
-Ж
роха
I co-
If.
b
r,
ll
о w
n
#♦*
кер:
екислого
иита№ 1
шта^ 1
Lk
При приготовлении этих взрывчатых веществ смесь размалывается
между жерновами, раздробляется в барабанах, просеивается и, на-
конец, просушивается. Способ патронирования зависит'©г смеси. „N,a“
и „Njb" патронируются в машинках, при помощи нискольких дви-
жущихся винтов ,Njc“ и „Ntd“ спрессовываются из смеси верен и
порошка, при чем взрыв достигается воспламенением слабо спрессо-
ванного вещества, которое помещается в патрон. z
Составы Фавье в Европейской войне пользовааись довольно ши-
роким применением; они шли на снаряжение аэропланных бомб, ручных
гранат и из них делали даже подрывные патроны (правду сказать—в
большинстве случаев оказывавшиеся чрезвычайно слабыми), хотя
областью их лучшего применения следует считать все-таки горную
промышленность.
Для более наглядного различия по наружному виду составов
Фавье, мало различающихся между собою в отношении цвета.,, они
окрашиваются искусственно в разные цвета. Так, например, Nja и
окрашиваются в зеленый метиловой зеленью, N,b—розалиномв розовый
a NiC в светло-желтый цвет. ,
Натуральный же цвет их серый, или чаще, желтоватый различных
оттенков.
Сорта, носящие марки N, и N3, содержат натриевую селитру, по-
чему сильно гигроскопичны, вследствие чего значительным спросом
не пользуются, несмотря на дешевизну.
В России в 1890 г. испытывался наиболее сильный из составов
Фавье, а именно NjC, содержащий небольшое количество смолы, для
вязкости и, попутно, для уменьшения гигроскопичности. ч '
Этот состав в буровых скважинах оказался действующим^ почти
одинаково с динамитом № I.
На складах взрывчатых веществ Военно-Инженерного Ведомства
имеется-также в значительном количестве состав Фавье с 85% аймй-
ачной селитры и 15% динитронафталина; преобладающим-же в нашем
Военном Ведомстве всетаки является сорт NjC.
Составы Фавье дают хороший фугасный эффект, но обладают
не вполне удовлетворительным дрожащим действием: хотя-сиой пре-
восходит порох, но значительно уступает мелиниту, пироксилину и
толу, которые много сильнее; о обенно слабо бризантное действие
составов Фавье в отношении железа. ? -
Составы Фавье совершенно безопасны в обращений, Чрезвычайно
мало чувствительны к ударам и трению; к удару ружейной пули
относятся пассивно.
Сравнительная малая чувствительность этих составов к капсюлю
и наклонность их давать неполные взрывы принадлежат к числу
недостатков этих взрывчатых смесей. Для взрыва их необходимо упот-
реблять капсюль с 0,75 гр. при куб. плотности в 1,0 и в 2 гр. грем.
ртути— при плотности в 1,25.
Следует заметить, что плотность, до которой спрессован состав
фавье, имеет существенное влияние на способность его детонировать
f
£
4
от капсюля: сильно спрессованные составы не взрываются зачастую
даже от капсюля с двумя граммами гремучей ртути. В этом отноше-
нии они обнаруживают сходство со шнейдеритами. Для возможно боль-
шего обеспечения надежного получения полного взрыва и полной
детонации, необходимо поэтому избегать сил1ного уплотнения массы
взрывчатого вещества и потому патроны делаются либо из смеси
слабо уплотненных порошковатого и зе, венного составов, либо, упот-
ребляют запальные патроны из умеренно спрессованной смеси, имею-
щие по оси своей цилиндрический канал, заполняемый пор шковатой,
мало уплотненной смесью, играющей в данном случае роль промежу-
точного детонатора, подобно тому, как это же самое имеет место при
взрыве мелинита. Во всяком случае составы Фавье спрессовывать до
наибольшей плотности отнюдь нельзя*).
Патроны, имеющие по своей оси канал, заполненный псрошкова-
той смесью, служат запальными для патронов, приготовленных из
прессованного состава.
Запальные патроны весят около 50 граммов и взрываются при
помощи капсюля, содержащего 1 грамм гремучей ртути. Патроны из
прессованного состава Фавье без промежуточного детонатора дают
отказы даже иногда при двухграммовом капсюле.
Обыкновенные патроны имеют вид сплошных шашек, состоящих
из прессованного состава и весят 100 грамм; из них обыкновенно
и составляется самый заряд, взрываемый при помощи запального
патрона.
Оболочками патронов служат или деревянные, трубчатые, тонко-
стенные цилиндры или бумажная обертка. Хотя первые обходятся
несколько дороже бумажных оберток и картонных гильз, но представ-
ляют то существенное преимущество, что заряд в них лучше предо-
хранен от доступа влажности и, к тому-же, состав может в них
запрессовываться непосредственно. Чаще-же, однако, патроны состава
Фавье имеют обертку из пропарафиненной бумаги, в каковом виде
погружаются в расплавленный парафин; после охлаждения вынутого
из него патрона, последний снова заворачивается в бумагу, которая
при употреблении удаляется прочь.
Для составов Фавье, как порошковатых, так и прессованных,
отличным детонатором служит пироксилин или динамит.
Мороз не оказывает на составы Фавье никакого влияния.
При температуре около 150°С большинство из них плавится, а
при быстром нагревании до 400°С они могут взрываться. Температура
газов при взрыве 2200*, причем пламя, отделяющееся при взрыве не-
большое. Патроны состава Фавье можно безопасно бросать в костер—
они лишь быстро сгорают без взрыва.
•) .Окончательная плотность’ есть та, до которой способно быть уплотнено
вещество и она обыкновенно сильно разнится для порошковатых взрывчатых веществ
от так-называемой „предельной плотности", т. е. такой, при которой обеспечен
полный йврыв. С „предельными плотностями" приходится на практике сильно счи-
таться при снаряжении прессованием порошковатыми веществами снарядов, имею-
щих большие начальные скорости, ибо при вылете из орудия, сила инерции снаряда
может обусловить увеличение плотности разрывного заряда настолько, Что она прев-
зойдет „предельную", и, как результат—явится неполный взрыв.
- 583 —
Способность детонировать на разстоянии—слабая. Скорость рас-
пространения детонационной волны состава NiC—3635 метров в се-
кунду для слегка спрессованного и 4100 метров в сек.—для порошко-
ватого.
Достоинством состава Фавье следует считать его сравнительную
дешевизну, недостатками же, как уже замечено раньше, гигроскопич-
ность и недостаточную чувствительность к капсюлю. В случае, при-
менения срставов Фавье в минной войне, коэффициент следует умень-
шать 1,5 раза.
Многие составы Фавье могут со значительной степенью безопас-
ности' применяться в копях с рудничным газом и угольной пылью,
но надо иметь в виду, что присутствие парафина в оболочке, зна-
чительно влияет на уменьшение этой „безопасности". К тому-же,
вследствие присутствия парафина в продуктах взрыва, появляется
также ядовитая окись углерода.
Нашатырь, вхо дящий в состав антигризу—Фавье %, имеет целью
понизить температуру газов, образующихся при взрыве, но pro при-
сутствие оказывается невыгодным в том отношении, что в продуктах
взрыва появляется соляная кислота, делающая дым трудно переноси-
мым рабочими, хотя нашатырь, увеличивая об‘ем газов в то-же
время усиливает действие состава.
4 Лммо иты К составам Фавье иногда относятся также близкие
ммониты. им аммониты, в основных своих сортах также содер-
жащие нитропроизводные нафталина.
Это суть взрывчатые вещества различного состава, из которых
наиболее часто применяющиеся заключают в себе:
№ 1.
Аммиачной селитры . 75%
Тротила............ 5%
Нашатыря..........20%
№ 2.
71—75 88%
Хлористого калия . . —
„ натрия —
Динитронафталина. . —
Предельный заряд . 675 гр.
16 — 18 —
7—8 —
2— 3 12%
87 %-89»/0
13 %-11%
73о/,— 77%
4%- 6%
19,57,-21,5%
5 Qi х Первые образцы шнейдерита были ни чем иным,
не дерит. как составом ^jjC фавЬе, т. е. смесью 87,4% аммиачной
селитры и 12,6% динитронафталина, к которой для уменьшения
гигроскопичности прибавлялось лишь немного парафина. *) Смесь
эта в мирное время применялась в горном деле, а в военное—стала
употребляться на снаряжение артиллерийских снарядов, преимуще-
ственно малых калибров, а также ручных гранат, при помощи прес-
сования.
Шнейдерит имеет вид довольно тонкого порошка светло- коричне-
вато-желтого цвета.
•) Он у нас в Артиллерийском Ведомстве существует под названием .фран-
цузского". (А. А. Солонина).
В настоящее время имеется много сортов шнейдеритов, поль-
зующихся во Франции значительным распространением и идущих
преимущественно для снаряжения снарядов при помощи прессования,
таковы, например:
Марка.
11) Аммиачной селитры . . .
Динитронафталина ....
j 2) Аммиачной селитры . . .
| Тринитротолуола..........
3) Аммиачной селитры . . . ;
Натриевой селитры . . !
Тринитронафталина . . . j
Канифоли ............ ]
14) Аммиачной селитры . . .
Тринитронафталина . . .
5) Аммиачной селитры . . . j
I
Неочищенного тринитрокси-1
лола.................
6) Аммиачной селитры . .
Динитронафталина . . .
7) Аммиачной селитры . .
Натриевой селитры . . .
Тринитронафталина . .
Канифоли ..............
70’
30 я
70 „
30 я
40 „
40 „
70 я
30 ..
<87,5 „
12,5 „
40 „
i 40,
i 15„
77%
ST
»
77 „
7Э
п
S
Кроме перечисленных, существует еще несколько сортов
его, содержащих натриевую селитру, мелинит и парафин:
Пикриновой кислоты . 58% 55% 45% 60% 00 /с Г
Натриевой селитры . 30 „ 30 „ 40 „ зо „ 35 „
Парафина 12 „ 15 „ 15 „ 10 „ ю „
Наша Комиссия по применению Взрывчатых Веществ приняла
шнейдерит, состоящий из 78% аммиачной селитры и 22% динитро-
нафталина.
Для взрыва шнейдерита в качестве промежуточного детонатора
часто применяют тол. При взрыве получается дым, содержащий много
водяного пара, а потому степень заметности его издали находится в
большой зависимости от гигрометрического состояния воздуха. В
виду этого снаряды, предназначенные для действия на большие ди-
станции, должны обязательно снабжаться дымными составами. Для
этой цели чаще всего применяется смесь красного фосфора с метал-
лической супьмой. к которым для придания пластичности прибавляют
около 15% парафина и заключают полученную смесь в металлическую
оболочку, чтобы предохранить ее от соприкосновения с разрывным
зарядом во избежание образования химических соединений, чувстви-
тельных к удару и трении». Для 75 м. м. снарядов количество в 20—
25 граммов красного фосфора дает уже хорошие результаты.
Введение этой дымной смеси в снаряды с заливкой несколько
затруднительно, ибо вызывает необходимость высверливания для нее
канала, который затем должен быть вновь заделан.
Красный Фосфор не оказывает влияния на взрывчатые нитро-
производные углеводородов, а потому в разрывные заряды последних,
если это, конечно, только тр-буется, вводят красный фосфор непо-
средственно в з рненном виде: благодаря большому удельному весу
он при заливке садится на дно, то есть занимает как раз надлежащее
место.
Шнейдерит выделывается либо в виде порошка, коим снаря-
жаются а ‘тиллерийские снаряды и ручные гранаты при помощи прес-
сования, или же в зерненном. В последнем случае зерненный шней-
дерит сцементовываетш расплавленным толом в сплошной мелко зер-
нистый конгломерат. Он применяется для снаряжения снарядов в
105 мил.' и 293 мил. калибров. В подобном случае в качестве проме-
жуто iHoro детонатора применяют тротил.
Иногда применяют для снаряжения снарядов оба сорта шнейде-
рита—порошковатый и зерненный, вводя их слоями и подвергая за-
тем прессованию. Такой способ практикуется между прочим на Гавр-
ских заводах Шнейдера.
Шнейдерит вообще не особенно выгодно применять для снаря-
жения снарядов больших калибров, ибо при выстреле иногда наблю-
дается смещение разрывы го заряда от изменившейся вследствие
инерции плотности состава, в смысле уплотнения его, а потому ста-
раются заменить его аммоналами.
Надо заметить, что вообще взрывчатые смеси в снарядах не пред-
ставляют таких гарантий в смысле надежности взрыва, как взрыв-
чатые химические соединения.
В отношении состава Фавье—вообще и шнейдерита—в частности
надо заметить, что способность детонировать, завися Прежде всего от
природы и силы детонатора, в большой степени зависит также, как
мы уже упомянули раньше, от плотности заряда, а также прочности
заключающей разрывной заряд оболочки. Так, например, шнейдерит
на открытом воздухе дает надежный взрыв только в том случае, если
его плотность не превосходит 1,1, в снарядах же то же явление имеет
место даже при плотностях, доходящих до 1, 3—1, 4. Впрочем это
явление не является общим правилом для всех взрывчатых веществ—
иногда наблюдается явление совершенно обратное.
Вообще вопрос о том, каким образом вводить порошковатые
взрывчатые вещества внутрь снаряда, не так прост, как кажется на
первый взгляд. С одной стороны, плотность для полного обеспечения
взрыва не может превосходить известных величин, с другой же сто-
роны, сила инерции при смещении снаряда во время выстрела, может
вызвать дальнейшее уплотнение массы и разрывной заряд уже не
будет плотно заполнять всю внутреннюю полость снаряда, что также
недопустимо. Введение разрывного заряда внутрь снаряда в расплав-
ленном виде более обеспечивает неподвижность состава (конечно, при
условии возможности устранения образования или уничтожения уса-
дочных раковин, воздушных полостей и крупных образований кристал-
лов; трудность выполнения всех этих условий, в связи с большой
плотностью сплавленной массы, иногда вынуждает вовсе отказаться
от заливки), но это не всегда возможно, даже при наличии веществ,
способ ых плавиться, по причине сравнительно высокой температуры
плавления их, могущей вызвать нарушение химического состава са-
мого взрывчатого вещества.
Иногда взрывчатое вещество, в готовом уже виде, плавят и.
превративши вслед затем в порошкообразное состояние размалыва-
нием, применяют в дело уже в порошковатом виде.
В некоторых случаях возможно расплавить одну из составных
частей и постепенно вводить туда другие составные части с тем, чтобы
далее применять полученную смесь, либо в сплавленном виде, либо
предварительно измельчив ее в порошок.
6 Бава ит Это СУТЬ взрывчатые вещества, содержащие нитро-
вариты. нафталины и древесный уголь, в качестве же сжигающего
в них заключается около 9О°/о аммиачной селитры. Иногда в состав
баваритов вводят нитрокумол и другие нитро-производные углеводо-
родов.
Баварит иногда называют также вигоршпом. однако последний не
следует смешивать с одноименным динамитом.
, п Дортмундская фабрика „безопасных взрывчатых ве-
амениты. ществ« Castroper Sicherheitssprengstoff— Action Gesellschaft
приготовляет состав, названный ею даменитом;*).
Сорт его, обозначенный лит. А, имеет вид порошка шафранно-
желтого цвета; из него приготовляют патроны при помощи не особенно
сильного прессования, которые завертываются в пропарафинирован-
ные гильзы.
Он имеет сильный запах нафталина. Для взрывания его служит
• капсюль № 8; температура газов при взрыве—2064°Q, причем 10 грам-
мов его, азорванных в свинцовой бомбочке Трауцля, образуют камеру
раздутия в 440 куб. сантиметров.
*) О даменитах, но совсем иного состава, упоминается на «тр. 557.
Состав некоторых его сортов следующий:
Аммиачной селитры. . . • .
Нафталина...............
Двухромокислого калия . . .
Калиевой селитры........
Куркума ................
91,Ов/о
6,5 „
91,7%
6,5 „
В 1898 году в Рейыско-Вестфальском каменноугольном округе
даменит А был один из самых распространенных взрывчатых веществ,
содержащих аммиачную селитру.
Среди продуктов взрыва даменитов находится много водяного
пара. К сотрясениям и ударам они практически не чувствительны.
От искры и пламени не взрывают, если только около них нет капсю-
лей или других детонаторов; хотя при соприкосновении с пламенем
они загораются, но большей частью горение прекращается с удалением
пламени. Насколько они безопасны во время пожаров доказывает тот
факт, что при пожаре фабрики в Castrop’e сгорело без взрыва около
2500 кил. даменита А.
Мороз на них не оказывает никакого влияния.
Все они в большей или меньшей степени гигроскопичны; от-
сыревшие сперва действуют слабее и труднее взрываются, а затем и
вовсе утрачивают это свойство. К числу их недостатков также при-
надлежит не совсем достаточная чувствительность их к капсюлю.
Сила их различна в зависимости от состава, но в общем одина-
кова с динамитами средней силы.
По степени „безопасности" они значительно уступают карбонитам.
Прототипом даменита А служило вещество, носившее название
просто даменита.
Это была смесь аммиачной и калиевой селитры с парафином,
но не содержащая двухромокислого калия.
Фабрикой выпускается довольно много сортов, как даменитов,
так и гештейн—даменитов, причем последние носят также названия
перфектив—даменитов.
Вообще состав даменитов не отличается постоянством: кроме пре-
обладающего количества аммиачной селитры, разные сорта их заклю-
чают: твердые углеводороды и их нитропроизводные (входящие в ко-
личестве обыкновенно не превосходящем 17%), тол, динитробензол,
нитронафталины и нитро-производные толуола, калиевую селитру
{чаще всего в количестве не более 15%), натровую селитру, нашатырь,
щелочные хроматы (обыкновенно не более 3%), иногда щавелевые
соли, фосфорные соли, желтую кровяную соль, порошок корня кур-
кумы и проч.
На даменит А по своему действию весьма по-
0₽0|t икт°рия- хож порох Виктория. Он имеет вид зернистого пороха,
несколько напоминающего охотничий: также гигроскопичен, как и
даменит, соответствуя ему также и по степени „безопасности".
9. Stanford powder.
Состав этого, принятого в Англии, взрывча-
того вещества таков:
Аммиачной селитры—68,0 —72,0
Натриевой „ 21,0,,—23,0 „
Тринитронафталина 3.0 4,0 „
Хлористого аммония 3,5 „— 4,5 „
Влажности 1 „
ю. Белый порох Кор- Эти взрывчатые вещества, принадлежащие к
нипя №1 bis и фрак- числу „безопасных", были предложены в Бельгии.
т°рит* Состав их следующий: (См. также стр. 573).
Порох Корниля Фракторит
Аммиачной' селитры. . . . . ;
i
Калиевой селитры.........i
Хромовокислого свинца • • • j
Динитронафталина.........J
!
Нашатыря.................;
Щавелевокислого аммония. .
77%
1 „
75°/о
18 „
Одно время он применялся довольно часто в Бельгии в каче-
стве антигризутного. Предельный заряд его 500 граммов, что экви-
валентно 305,0 граммам динамита 1.
Последняя война доставила нам в числе трофейного
1. уропит. П0ДрЫВН0Г0 имущества довольно много взрывчатых ве-
ществ, изготовленных заграницей уже во время войны. Кроме этого,
также и у нас по инициативе отдельных фронтов заготовлялись взрыв-
чатые вещества неустановленных типов. К числу таковых принад-
лежит между прочим куролит—вещество, заготовленное непосредствен-
(О-
га,
и
ным распоряжением Северного фронта. Состав его очень сложный, а
именно, он содержит в себе приблизительно:
за-
1 > .
Аммиачной селитры.....................50%,
Калиевой селитры.......................15 „ ,
Перекиси марганца................... 8 „ ,
Марганцево калиевой соли................3 „ ,
Парафина................................4 „ ,
Нафталина...................... около 2 „ ,
Канифоля ............................ 2 „ ,
Серы ............. .. „ 2п ,
Талька.......................... „ 2 , ,
Поваренной соли................. * 2„,
Саговой муки .-................. „ 2 „ ,
каче-
экви-
йного
х ве-
это гоу
зрыв-
инад-
зтвен-
&
Это очень темного оттенка порошок, несколько жирный на ощупь,
способный прессоваться.
Фугасное его действие сходно с аммоналами, а следовательно,
вполне удовлетворительно. Бризантным же своим эффектом оно сильно
уступает не только пироксилину, мелиниту и толу, сикриту, но даже
шеддитам и перхлоратам.
В linnHOM деле можно им пользоваться так же, как и составами
Фавье.
Существенные его недостатки заключаются в большой сложности
состава, почему может легко произойти нарушение однородности его,
к тому-же, он довольно дорог и обладает способностью взрываться
от огня, подо<но черному пороху.
В последнее время вводятся в употребление вещества, богатые
аммиачно • селитрой и содержащие различные органические вещества,
в роде: моно крезол-сульфоната, крезол-сульфоната-натрия, остатков
от производства древесной целюллозы и т. п.
Они получили название Rachit, Racing и т. п. и получаются
путем растворения в воде компонентов и быстрого выпаривания полу-
ченной жидкости в особых аппаратах.
§ 10. Плавленные аммиачно-селитровые взрыввещества. Недостаток
аммиачно селитровых взрыввеществ, заключающийся в том, что они не
поддаются плавке, увеличивает их гигроскопичность и делает их трудно
применимыми в военном деле для снаряжения снарядов. Пытались
придать им некоторую пластичность, нагревая их в особых аппаратах,
причем некоторые из их составных частей плавились (ароматические
витротела). Так поступают, например, при изготовлении некоторых
шнейдеритов.
Однако, для некоторых взрывчатых веществ продолжительное на-
гревание до температур, лежащих значительно выше 100°С, невозможно,
так как аммиачная селитра, даже самая чистая, начинает разлагаться
при 140°, т.-е. значительно ниже своей точки плавления (166—170°).
Благодаря каталитическим влияниям разложение быстро ускоряется,
так что продолжительное нагревание больших масс до температур
выше НО* становится опасным. .
— 590 —
Поэтому плавление аммиачных взрывчатых веществ возможно лишь
в том случае, если температура плавления будет понижена, по край-
ней мере до 110°. Это можно было-бы легче всего достигнуть, прибавляя
незначительное количество воды (2—4%), но этот способ, по очевид-
ным причинам, совершенно непригоден.
Гораздо лучше понизить точку плавления прибавлением некото-
рых неорганических или, что еще лучше (вследствие большей спо-
собности к детонации) органических солей. Для этой цели Girard
предложил примесь азотнокислого гуанидина в эквимолекуляр-
ных количествах. Позднее были с той же целью предложены
многие другие вещества, как-то: мочевина, гидразин, этилендиамид.
Все они вследствие благоприятных условий, созданных мировой
войной, были испытаны на практике. Недостатки подобных смесей за-
ключаются в том, что с понижением точки плавления увеличивается
гигроскопичность и в большей способности аммиачной селитры к хими-
ческим реакциям в расплавленном состоянии.
Из всех этих смесей наилучшими оказались те, которые содер-
жат от 10 — 20% натриевой селитры вместе с 5% других примесей,
вроде хлоридов, ацетатов, смолы, дициандиамида и т. д. Так, немцы
во время войны снаряжали снаряды следующими двумя смесями, из
коих первая была предложена A. G. Dynamit vorm. Alfred Nobel,
вторая—Кастом:
Аммиачная селитра. . . .
Натриевая селитра. . . .
Дициандиамид..........
Натриевый ацетат . . . .
Тринитротолуол . . . • .
. . 65—60% 67—65%
10, 10—12,
5, - „
- • - з„
. . 20—25 „ 20 _
Точка плавления этих смесей находится при 105—110°С. Смеши-
вание должно производиться таким образом, чтобы смесь возможно
меньше подвергалась бы нагреванию. Поэтому сначала плавят трини-
тротуол, а затем прибавляют натриевую и столько аммиачной селитры,
чтобы получить еще жидкую массу, азатем быстро прибавить осталь-
ные части смеси и остаток аммиачной селитры. Натриевый ацетат
можно применять, как в кристаллическом, так и в кальцинированном
виде. С первой из названных солей можно получить, ввиду присут-
ствия воды, большее понижение точки плавления, чем с последней.
Хлоратные и перхлоратные взрыввещества.
§ 1. Хлор*} в соединениях кислорода с хлором играет ту-же
роль, что и азот в соединениях азота с кислородом. В про-
тивоположность к азоту хлор может быть использован в двух
видах, а именно: как остаток хлорноватой кислоты — О —
остаток хлорной кислоты — 0 — С1|=о Остаток хлорноватой кислоты
и как
*) Kast, Spreng und Ziindstoffe (1921 г.).
соответствует остатку азотной кислоты. Хлораты калия и ватрия отли-
чаются от соответствующих нитратов большим молекулярным весом и
большей плотностью, меньшей теплотой образования и большей — раз-
ложения. Но главное различие заключено в способности к экзотерми-
ческому преобразованию:
2КС1О. = 2КС1 + 30„ + 23,8 кал.
а, следовательно, и в меньшей связанности атомов, для раз‘еди-
нения которых требуется меньший импульс, чем для азотных соеди-
нений. Поэтому хлораты, в отличие от нитратов, уже при одном только
нагревании выделяют все свое содержание кислорода.
Разница особенно ярко выступает при сравнении солей аммония:
в то время как хлорат аммония разлагается уже при нормальной
температуре, а при t® 100—110®, также как при ударе и трении, раз-
ложение переходит во взрыв, нитрат аммония, который разлагается
тоже экзотермически, являет признаки медленного разложения только
при температуре около 100®, а взрывчатого—лишь при t® выше 300«;
(разложения, как следствия механического воздействия, достичь весьма
трудно). Поэтому хлорат аммонйя не только не может быть исполь-
зован для технических целей, но даже его образование при приме-
нении хлоратов в качестве составных частей взрывчатых веществ,
должно быть безусловно устранено.
По вышеуказанным причинам, чувствительность хлоратных взрыв-
чатых веществ к механическому воздействию гораздо больше, чем
таковая у смесей азотно-кислых солей, и задача производства хлорат-
ных взрывчатых веществ наших дней заключается именно^ в том, чтобы
найти вещество, которое превращалось бы само без остатка в газы
и придавало бы взрывчатому веществу пластичные свойства, т.-е.
обволакивало бы хлоратные частицы 1'аким образом, чтобы смесь стала
бы менее чувствительна к ударам и трению.
Остаток хлорной кислоты более устойчив, чем таковой хлорноватой
кислоты. Он представляет из себя наиболее постоянную степень окис-
ления хлора. Реакция 2KCIO3 J- 0а — 2КС101 34 кал.,, при одновремен-
ном обогащении кислородом молекул, экзотер*ична. При сравнении
с хлоратом мы, следовательно, наблюдаем потерю энергии, которая в
соответствующих взрывчатых веществах сказывается в том отношении,
что последние менее чувствительны К химическому и тепловому воз-
действию а также требуют для своей детонации более сильного им-
пульса, чем хлоратные взрывчатые вещества.
Если снова сравнить соли аммония, то можно также констати-
ровать, что перхлорат аммония не так легко разлагается, но зато и менее
чувствителен к детонации, чем аммиачная селитра.
Состав и свойства. Главный недостаток, как уже быЛо сказано
выше, всех хлоратных и перхлоратных взрывчатых веществ заключается
в чувствительности к тепловым и механическим воздействиям. Поэтому
при производстве их внимание было в, первую, очередь направлено на
возможное ослабление этого недостатка. Это удается лучше всего
при дополнительном введении именно таких компонентов, которые:
1) мало способны к реакциям, 2) совершенно, или маловзрывчаты,
3) не вступают в реакцию с основным веществом, даже при продол-
жительном хранении, 4) делают взрыввеще' твч мягкими и пластиче-
скими тем, что обволакивают хлоратные частицы, 5) при хранении и
перевозках взрыввещества не отделяются выветриванием или выкри-
сталлизацией.
Первому требованию не удовлетворяли употреблявшиеся ранее
вещества, в роде серы, угля, сахара, железо-синеродистого калия и
т. д., представители которых входили в опасные для обращения
хлоратные пороха. Так, порох Вертело, а также „белый" или „гер-
манский" порох („Teutonit") Ожандра состояли из 2 част, хлората
калия, 1 части сахара и 1 части желтой кровяной соли. Это требова-
ние осталось неудовлетворенным даже при замене серы в порохах
Бертелло ее соединениями, а в порохе Ожандра при замене сахара
крахмалом, опилками, разными целлю озными веществами, а также
при употреблении, по предложению D> signolle и Castellage, пикратов
калия и при частичной замене хлората калия бихромагом калия и
азотно-кислыми солями. Это удалось лишь тогда, когда вместо выше-
указанных веществ стали применять пластические вещества: Hall и
Wells употребляли каучук, Halm—спермацевт, Oliver — воск, сало и
смолу.
Шпренгель первым указал на пригодность жидких ароматических
нитросоединений. Позднее их применял Валенберг и Чирнер.
Вигорит Воркмана содержал органические нитраты, кинетит
Петри и Фалленштейна—нитробензол, нитронеллулозу, и пр.
Чирнер указал на пригодность дегтя, который позже в пиродиа-
лите Тюрпэн'а явился компонентом смеси, пригодной как взрывчатое
вещество.
Ылепгё вновь’ввел парафин, которым ран*е пользовались Гимли
и Трютшлер фон Фалькенштегн. Кроме парафина, употреблялись
стеариновая кислота и декстрин, наряду с углекислым натрием. Все
указанные предложения относятся к взрывчатым веществам, которые
не взрываются от соприкосновения с огнем. Но все взрывчат е веще-
ства с по лобными примесями, сравнительно не сильны. Поэтому пред-
ложение Street’oM смесей с низкой Точкой плавления из аромате ческих
нитросоединений, означало собой большой шаг вперед; и действи-
тельно ему удалось получить сильные и достаточно безопасные взрыв-
вещества. Взрывчатые вещества Street’a, вошедшие в практику, в
качестве флегматизаторов содержат рицивоное масло. В настоящее
время, по месту своего производства в Шедде в Верхней Савойе, они
носят название Шеддитов. Это наименование впервые приобрело права
гражданства в Англии.
Вместо употребленных Street’oM смесей масел с простыми и слож-
ными нитросоединениями (пикронитронафталин, пикроазобензол),
Бонне, Жирар и другие предложили много иных более или менее
практически удовлетворительных флегматизаторов.
Большим недостатком этих пластических хлоратных взрыввеществ
является то обстоятельство, что, вследствие химического изменения
масел и жиров, затем выкристаллизации некоторых составных частей
и других причин, эти взрывчатые вещества теряют с течением време-
ни свою пластичность, слеживаются, что влечет за собой ослабление
способности детонировать. Особенно сильное слеживание можно наблю-
дать в составах, содержащих легко плавящиеся или жирные примеси
(нитросоединения, парафин и т. д.) или же в аммиачных перхлоратных
взрывчатых веществах, к которым подмешаны гигроскопичные соли
(натриевая селитра). Для устранения этого недостатка были, между
прочим, предложены пробковая мука и кизельгур.
Были сделаны попытки увеличить детонационную способность при-
бавлением известных примесей (возбудителей); в качестве подобных
примесей следует упомянуть окислы металлов, марганцево-кислый
калий и другие.
Слеживание ослабляется в хлоратных вэрыввеществах превра-
щением их в зерненное состояние, одновременно с обработкой их вме-
сте с вяжущими веществами. Этот способ изготовления хлоратных
взрыввеществ испытывался неоднократно, причем Tschirnег при зерне-
нии употреблял смолу, Гимли и Трютшлер фон Фалькенштейн и Хан-
нан, парафин, каучук, асфальт, смолу, и др. вещества, Lyte и Леваль,
а также и Шнебелин крахмал, von Brauk воск, смолу, разные виды
каучука. Эти предложения были практически использованы в употре-
блявшемся в Соединенных Штатах порохе „Комета" и в вошедших
в последнее время в употребление в Германии и Англии взрывчатых
•веществах Steel'а. Порох „Комета" состоял из 2/3 хлоратов калия
и у, еловой смолы, а при приготовлении взрыввещества Steel'a, на-
зываемого в Германии порохом „Силезия", а в Англии „Colliery Steelite"
употреблялась обработанная азотной кислотой смесь из смолы и крах-
мала. Пиродиалит, недавно предложенный как совершенно не чув-
ствительный к огню, содержит между прочим хлорат калия и смолу,
находящихся в отношении 85 :15.
Вообще. было испытано, как во Франции, так и в других госу-
дарствах большое количество смесей содержащих хлорноватые соли
и перхлораты, основанных на том же принципе, как и шеддиты.
Таковы например взрывчатые вещества М. Lheure (напр. О № 4),
содержащие сало, и динитробензол или нитротолуол (сэбомиты), с
керосином, вазелином и парафином (минилит или взрывчатое веще-
ство 0 № 6), со стеалитом и нитрованной смесью крахмала и кани-
фоли, с различными нитропроизводными или азосоединениями с
подходящей точкой плавления (взрывчатых веществ Жирард)и большое
количество рецептов, еще более сложных.
Среди хлоратных и перхлоратных взрывчатых веществ имеются
антигрпзутные сорта. Для получения этих сортов особенно подходящим
является перхлорат калия, так как, вследствие своей малой способ-
ности к реакциям, может употребляться в смесях с аммиачной се-
литрой. Первым антигризутным перхлоратом, содержавшим перхлорат
калия, был пермонит.
По предложению Шпренгеля, опасность при обращении с хло-
ратными взрыввеществами пытаются обойти тем, что смешивают со-
ставные части перед самым употреблением. Этот способ употреблялся
при взрывных работах при постройке Нью-Йоркского порта, прове-
денных с помощью взрыввещества рэккарокк (смесь нитробензола с
хлоратом калия), а также в так называемых: Прометее, медзянките и т. п.
Проф. М. Сухаревский. Взрывчатые вещества и взрывные работы.
8
§ 2. Производство хлоратных взрывчатых веществ. Производство
хлоратных взрывчатых веществ отличается большой простотой, так
как вследствие их особенностей, тщательное смешение составных ча-
стей, как это имеет место при производстве черного пороха, совер-
шенно излишне. Прибавлением ослабляющих примесей (флегматиза-
торов) уменьшается детонационная способность, вследствие чего про-
изводство этих взрывчатых веществ становится значительно более
безопасным при условии, что составные части смешиваются во влажном
состояниии, а обработка веществ, способных к самовоспламенению,
ведется отдельно. Ввиду изложенного, хлоратные взрыввчатые веще-
ства имеют много преимуществ по сравнении с нитроглицериновыми
и черным порохом. Кроме того, вследствие простоты производства и
дешевизны исходных материалов, цена их довольно низкая.
Измельчение хлоратов происходит в быстровращающихся мельни-
цах системы „Excelsior** „Perplex" „Matador" и т. д. На рис. 338 показан
внешний вид подобной мельницы системы „Matador"; на рис. 339 она
дана в открытом виде. Но при этом лишь надо следить, чтобы с хло-
ратами не смешивались частицы органических веществ, так как в
таком случае возможен взрыв.
Рас. 338. Мельница „Мата-
дор“ для измельчения хло-
рата калия (внешний вид).
Рис. 339. To-же (внутренний вид).
*
Сушка хлоратов и перхлоратов обычно производится в тех же
аппаратах, какие употребляются при сушке аммиачных взрыввеществ.
г
у
и
h
[СТВО
: так
: ча-
эвер-
тиза-
про-
5олее
жном
знию,
веще-
выми
гва и
аьни-
казан
9 она
i хло-
как в
В?.
тех же
зществ.
При этой операции следует держатся тех же мер предосторожности,
как и при размельчении (удаление органических веществ).
При пластических взрывчатых веществах (шеддитах) смешива-
ние ароматических нитротел с маслами, жировыми веществами и т. д.
производится в нагретых двухстенных сосудах из эмалированного чу-
гуна, при чем температуру нагревания иногда, смотря по обстоятель-
ствам, поднимают до точки плавления нитротел. В полученную смесь или
жидкую массу сначала прибавляют необходимые прймеси, а потом
размельченные и просеенные хлораты. Эта смесь промешивается до
тех пор, пока мелкие,- белые частицы хлората совершенно исчезнут.
После этого масса раскладывается на широких столах и несколько
раз прокатывается деревянными вальками. При этой операций масса (
скатывается в более или менее круглые зерна, причем мелких зерен'
больше, чем крупных. Мелкие зерна отсеиваются, а крупные прибав-
ляются в небольшом количестве к следующей партий. Весовое соот-
ношений испытывается несколько раз до и'после вальцовки.
При * производстве калийно-перхдоратных взрывчатых веществ
смешивание сухих составных частей, как перхлорат, аммиачная
селитра, антигризутные примеси и т. д., производится на „тарелочных"
аппаратах (см. производство аммиачных взрывчатых веществ), в то
время как нитротела, как более опасные, смешиваются в механиче-
ских мешалках системы „Werner Pfleiderer" с соблюдением соответ-
ствующих предосторожностей (в отдельных обнесенных валами
зданиях и т. д.).
Зерцение состоит в том, что полученная масса несколько раз
протирается в подогретом состоянии (30—35») через сита.
Перед патронированием пластических взрывчатых веществ смеси
дают 48 часов постоять, чтобы нитротела успели снова отвердеть.
Самое патронирование при шеддитах происходит в ’деревянных
формах с отверстием, соответствующим диаметру патронов, при помо-
щи деревянного прибойника. Но такие сравнительно безопасные
взрывчатые вещества, как шеддиты, можно также патронировать в
машинах, служащих для патронирования динамитов, при чем не
следует слишком спрессовывать состав, т. к. это могло бы вредно
отразится на способностях смеси детонировать.
Пиродиалит Тюрпена, содержащий бертолетовую соль и смолы, из-
готовляется патентованным Способом, который заключается в обработке
смеси 2‘Д % спирта в особых барабанах со стеклянными шарами. Зерне-
ние пороха „Силезия" состоит в том, что порошкообразная смесь, разло-
женная тонким пластом, орошается спиртом или иным, нерастворяю-
щим хлорат, веществом при легком перемешивании. Зернение другим
способом, как и вальцовка порошкообразного взрывчатого вещества,
увлажнение водой, повторение вальцовки с добавочным подмешй-
ванием порошкообразных веществ и т. д., как это практиковалось
раньше во Франции, имеет для хлоратных взрывчатых веществах
тот недостаток, что при высыхании увлажненной части образуются
на стенках аппаратов корки, удаление которых представляет опасность.
При изготовлении хлоратных смесей следует избегать прямого
смешивания хлората с легковоспламеняющимися составными .частями.
Далее, так как чувствительность к механическим воздействиям зави-
а '
4
1
i
t
1
i
I
' Л
38
I
сит от содержания хлората в смеси, следует строго придерживаться
рецептуры, а самое смешивание производить достаточно тщательно.
При этом надо соблюдать большую осторожность. Чтобы контролиро-
вать достаточность поремешивания смеси, применяется искуственное
окрашивание смеси нейтральными красящими пигментами в различные
яркие цвета. Все аппараты должны содержаться в чистоте. Следует обра-
тить внимание и на то обстоятельство, что одежда рабочих, метлы и дере-
вянные части аппаратов, вследствие впитывания хлоратной пыли,
становятся очень опасными в пожарном отношении. Особенно легко
впитывается вследствие своей гигроскопичности пыль натриевого
хлората. Поэтому необходимо, время от времени, основательно про-
мывать все аппараты. Производство перхлоратных в. в. не отличается
в общем от описанного; о деталях производства хлоратных и перхло-
ратных взрывчатых веществ будет еще несколько сказано при описа-
нии отдельных взрывчатых веществ.
§ 3. Обращаясь к механизму взрыва элементарной хлоратной
смрси, мы видим, что взрывчатое разложение ее теоретически сле-
дует уравнению:
2КС1О3 + 2С + 3S = 2KC1 +2СО2 + S02 * *)
Хотя потенциал и сила этой взрывчатой смеси оказались зна-
чительно превосходящими эти же данные для черного пороха, но
степень безопасности смеси для возможности ее практического исполь-
зования оказалось совершенно неудовлетворительной. Причина послед-
него, главным образом, заключается в присутствии серы, которая, по-
мимо уже того, что .чрезвычайно повышает своим присутствием чув-
ствительность смеси к механическим влияниям, оказывается прямо
таки вредной, так как под влиянием влажности воздуха подвержена
окислению, что влечет за собою повышение температуры,— последнее
же при неблагоприятных условиях может повлечь за собою самовоз-
горание состава.
Не обладай сера подобными свойствами, явилось бы возможным
получать сильные взрывчатые вещества путем смешивания бертоле-
товой соли с одной серой, не вводя в смесь даже вовсе угля. Дей-
ствительно, теоретически, смесь:
71,9°/0 бертолетовой соли,
28,1 „ серы,
дает взрывчатое разложение, следующее уравнению:
2КС1О3 + 3S = 2КС1 4- 3SO2.
*) Для подобной же смеси, содержащей компоненты в несколько иной про-
порции, а именно:
78,28% бертолетовой соли,
11,50» серы,
10,22 „ угля,
реакция взрывчатого разложения будет, теоретически, идти по следующему уранению.
2ксю3 + зс + s = k2s + зсо2;+ С12
Присутствие в смеси серы, однако, также не является безусловной
необходимостью: обыкновенная смерь бертолетовой соли о углем или
вообще с углерод-содержащими веществами также обладает взрывча-
тыми свойствами и, теоретически, равным образом может, дать пол-
ное сгорание.
В самом деле, взрывчатое разложение смеси: '
87,20% бертолетовой соли,
, 12,80 „ угля ,
следует уравнению: С
2КС10, + ЗС = 2КС1 + ЗСО2.
давая, как видно, также полное сгорание.
Не' только углерод в своем свободном состоянии в смеси с берто-
летовой солью, но и многие его соединения, будучи смешаны с берто-
летовой солью, дают взрывчатые вещества большой силы.
К числу таковых, едва-ли не самых старых, принадлежит смесь
бертолетовой соли с сахаром. Подобная смесь значительно более
опасна в обращении, чем простая смесь этого хлората с углем, но,
вместе с тем, значительно превосходит последнюю и по силе..
Так, например, смесь *
74,2% бертолетовой соли,
25,8 „ сахару
представляет сильно бризантное вещество, весьма опасное в обра-
щении. . • /
Реакция взрывчатого разложения смеси бертолетовой соли с са-
харом, теоретически, следует уравнению:
8КСЮ3 4- ClsH220n = 12С0г + ПН20 + 8КС1;
Как видно—в данном случае также имеет место полное сгорание.
Количество взрывчатых веществ, содержащих бертолетовую соль,
настолько велико, что привести состав всех их совершенно не позво-
ляет обсем настоящего труда, а потому мы ограничиваемся указанием
составов главнейших из них.
При перечислении их мы будем придерживаться, вообще говоря,
классификации их по роду преобладающих составных частей, хотя в
исключительных случаях придется делать от подобного порядка также
и отступления.
В прежнее время часто применяли смеси бертолетовой соли с
селитрами, в настоящее же время эти два сжигающие совместно во
взрывчатые смеси предпочитают не вводить, равно как и не приме-
няют при бертолетовой соли ни серы, ни сернистых металлов.
§ 4. Из смесей бертолетовой соли с серой и сернистыми метал-
лами (иногда содержащими и другие составные части), можно назвать
минный порох, Домэрга, взрывчатое вещество Нарона, порох Шлезингера,
взрывчатые смеси Spoon а и др.
1. Взрывчатое ве-
щество Домэрга.
2. Взрывчатое ве-
щество Нарона.
3. Порох Шлезин-
гера.
Оно представляет смесь бертолетовой соли с се-
рой в различных пропорциях.
Предложено было в качестве минного пороха.
Эта была смесь бертолетовой соли с серо-углеро-
дом. (CS2).
Предлагалось для снаряжения артиллерийских
снарядов.
Он предложен был в качестве метательного пороха
для пушек малого калибра.
Состав его следующий:
42,9% бертолетовой соли,
42,9 „ сернистой сурьмы,
14,2 „ серного цвета.
4. Взрывчатые смеси
Spoon'a.
Это смеси, предложенные Spoon'oM для снаря-
жения электрических.запалов.
Он дал несколько рецептов подобных смесей,
из которых заслуживают упоминания следующие:
а) смесь бертолетовой соли с сернистой сурьмой и прибавкой
порошка угля или вовсе без последнего.
б) Смесь бертолетовой соли с сернистой сурьмой и полуфосфо-
ристой медью.
в) Смесь бертолетовой соли с полуфосфористой и полусернистой
медью.
г) Смесь бертолетовой соли, пироксилина и порошка из черниль-
ного орешка?)
г держащих, кроме бертолетовой соли, также
пигмент (ASjSs).
Состав его следующий:
Он принадлежит к числу бинарных порохов, со-
еще аури-
70% бертолетовой соли,
30 „ аурипигмента.
С предыдущим порохом Gallon очень
. орох о era. Cotter'а, представляющий то различие,
аурипигмент заменен реальгаром (AsaS2).
Касательно третьего взрывчатого вещества, в состав
сходен по-
что в нем
коего вхо-
дит также много реальгара,—а именно пороха Мельвилля, мы упомя-
нем в дальнейшем.
_ _ , Едва-ли не единственную, в смысле своей ори-
7 гинальности, взрывчатую смесь, предложили A. Berg
п°род. и parjs—Mauhaud.
Она состояла из:
50% бертолетовой соли и
50 „ серноватисто-бариевой соли.
с се-
I.
iepo-
;ских
>ром
Ими же предложено и другое взрывчатое вещество, в состав
которого вместо бертолетовой соли входит Хлорноватисто-натриевая,
з вместо серноватисто-бариевой соли—сиропообразный гиппофосфит
натрия (ХаГ(ОН)2!.
Давно уже сделанное наблюдение, что берто-
8. порох Перкинса летовая соль в с^всй с фосфором дает сильно
взрывчатые вещества, естественно дривело к предложению подобных
смесей. - . ’ ’ ,1-
iapn*
всей,
1ВКОЙ
эсфо-
1СТОЙ
йиль-
!, CO-
аурп-
смешанных воспламенителей, имею
всего заключают: бертолетовую, ©
нистую сурьму, хотя последней'
нистых металлов, иногда же^
также заменялась Каляеве
По причине срвмеф^
или сернистыхметадд^"-'
подобные ему по со
хранению, вслрДств
Это составляет причфЦ
практического пример
§ 5. Теперь пере#
летовой солью и сернщ
сахар и вообще угле
К числу так
Мунделя и ПертюйсС^
Goetz'a и ГарриссоШ^.
1. Порох Кастро.
В ;
промысла. ;
Перкинс предложил применять ^д^.смеси для изготовления
щчный состав. Они чаще
фосфор, а также ёер-
йёнялась одним из сер-
Щдь целиком или частично
бертолетовой солью серы
*'Йво так же, как и все
_Йм К продолжительному
^разводного разложения *).
торы Перкинса не получили
if, содержащим наравне с берто-.
частности серой, также
ценить: пороха Кастро, Коллера,
ем^тво Kitchen, Силезит, пороха
Латое вещество предложено было
ЕЙЙфЙкё для надобностей горного
й соли,
н по-
з нем
вхо-
помя-
: ори-
Berg
Из всех трех компа
прессуется в патроны; кбтр|
дажу, завернутыми в пропарафв
„ _ ик Состав, его
2. Пород Кёллера.
. •. V » ’
70% бертолетовой соли,
20 „ серы, ’
10 „ угля.
ШёХСЯ густое тесто, которое
сдается и поступают в про-
*) Замечено, что химически чистая бертолетовая соль й таковая же сера или
сернистый металл даже при длительном хранении не среагируют друг на друга, ио
самые незначительные примеси к ним, особенно присутствие свободных минераль-
ных кислот, уже вызывают реакцию, по всей , вероятности вследствие окисления серы
с образованием серной квслоты, которая крайне энергично реагирует с хлорвовато-
калиевой солью.
3. Порох Мунделя.
4. Взрывчатое веще-
ство Kitchen.
5, Поро/с Гана.
— 600 —
Его предложение было готовить по нижеследую-
щему рецепту.
63,4% бертолетовой соли.
31,6 „ серы,
4,3 „ порошка кассии,
0,7 „ животного угля.
К нему очень близок порох Пертюиссэ.
Состоит из смеси бертолетовой соли, серы, угля,
содержит также и смолу.
Он был предложен в 1867 году и имел следующий
состав:
61,25°/0 бертолетовой соли,
28,08 „ трехсернистой сурьмы,
3 „ угля
46 „ спермацета.
Спермацет здесь играет роль флегматизатора.
Это взрывчатое вещество предложено было в 1887 г.
. илезит. в двстрИИ—Петровичем и Зибертом, давшими следующий
рецепт, по которому оно должно изготовляться:
60% бертолетовой соли,
10 „ сернистой сурьмы,
30 „ сахару.
К числу взрывчатых веществ в этом же роде, но
. opojt ое z а. уЖе g0Jfee сложного состава, заключающих также фос-
фор и пикрат свинца, можно прйчислить порох Goetz’a. Он также бо-
гат сахаром (СсН12О6—виноградный сахар).
Состав его следующий:
34,5% бертолетовой соли,
34,5 „ сахарного сиропа,
10,4 „ угля,
6,8 „ серы,
3,4 „ аморфного фосфора,
10,4 я пикрата свинца.
Будучи зажжен на открытом воздухе, состав сгорает блестящим
пламенем без взрыва.
8. Порох Гаррисона.
Существуют два типа этих порохов. Под № 1
значится минный, а под № 2—ружейный.
Бертолетовой соли ..........
Крахмала....................
Древесного угля.............
Серы. ......................
Ликоподия...................
Каменного угля..............
Сажи........................
№1
70%
Ю „
ю „
10 „
№ 2
65,67%
5,97 ,
5,97 .
11,94 „
1,49 „
5,97 „
2,99 ,,
§ 6. Нижеследующие вещества содержат в преобладающем количе-
стве бертолетовую соль в смеси с различными органическими веществами.
К числу таковых принадлежат пороха: Рорелея, Бенгалин, Корнэ,
Байонский, Брэнка, взрывчатое вещество Брэнка, порох Марэшаля,
Sleepers powder, порох Роджэрса, порох Ринкера, и Спэнса и друг.
1. Порох Горслея.
Это есть зернистый порох, предложенный в 1872 г.
Состав его следующий:
75% бертолетовой соли,
25 „ измельченного чернильного орешка.
Взрывает при 220°С.
о „ с . Это очень простая смесь; была предложена
2. Порох Бенгалин. ~ /ч f *
в 1882 году. Она же существовала под названием
взрывчатого вещества Medail.
Состав ее следующий:
40% бертолетовой соли,
60 отрубей.
Способ приготовления несложный: отруби смешиваются с концен-
трированным раствором бертолетовой соли в воде в тестообразную
массу, которую затем прессуют в патроны.
Будучи зажжена на воздухе—сгорает блестящим пламенем в роде
бенгальского огня, не взрываясь; детонирует от капсюля с гремучей
ртутью.
_ „ . Он представляет смесь бертолетовой соли с от-
г рубями, превращенную в тестообразную массу при
помощи слабого раствора гуммиарабика. Из полученной массы прес-
суются цилиндрические патроны, или оно зернится.
4. Порох Корнэ-
Это взрывчатое вещество в сущности сходно с обо-
ими предыдущими; вместо отрубей оно содержит дру-
гое сгорающее—смолу.
I
— 602 —
Состав пороха Корнэ следующий:
75% бертолетовой соли,
25 „ смолы.
В Англии он причисляется к О. 1‘. 8. Safety compounds („безо-
пасным* взрывчатым веществам).
5. Пород Брзнна.
По составу он весьма близок к предыдущему.
В него входят:
s7% бертолетовой соли и
13 „ американской смолы.
Смесь превращается в тестообразную массу путем смачивания
раствором какой-либо камеди в воде или уксусе и зернится.
6. Взрывчатое веще-
ство Брэнка.
Тем же автором предложена была другая смесь,
в которой смола заменена льняным маслом, но при-
бавлено еще небольшое количество окиси свинца.
Состав его следующий:
70,67’о бертолетовой соли,
28,27 „ льняного масла,
1,06 „ окиси свинца.
«
Это взрывчатое вещество называется Shooting powder
_ „ „ Это взрывчатое вещество также имеет очень
7. Порох Маоэшаля. ..
к к простой состав, а именно:
84'о бертолетовой соли,
16 „ стеариновой кислоты (С17Н35СО2Н).
Действует этот порох значительно сильнее черного.
Пороховая смесь, состоящая из бертолетовой
eeper s pow er. соли, сахара и угля.
„ „ „ Это уже несколько более сложная смесь, co-
д. порох Роджэрса. стоящая
38,50% бертолетовой соли,
15,40 „ измельченной древесной коры,
23,05 „ глинозема,
23,05 „ гуттаперчи.
Гуттаперча растворяется в сероуглероде, бензине или другом
каком-либо летучем растворителе, после чего туда вводят остальные
составные части, образуя тестообразную массу, из которой прессуют
патроны. 1 ,
Глинозем—инертное вещество, ‘Назначаемое для замедления и
регулирования реакции взрывчатого разложения ‘ смеси.
ю Поопха Риикепа Взрывчатых веществ, существующих под этим
и к ’ наименованием, предложено, было не менее десяти,
причем они отличаются большим разнообразием состава.
Так, например, помимо бертолетовой соли, они заключают одно
или несколько из нижепоименованных веществ: древесный уголь,
каменный уголь, древесные опилки, муку хлебных злаков, двуугле-
кислую соду, измельченное корье и другие органические вещества,
даже селитры и азотнокислый свинец.
Бертолетовая соль растворяется в воде и в полученный раствор
Вводятся остальные составные части, затем все переносится на водя-
ную баню.
II. Пороха Спэнса.
и для ручного
бертолетовой соли, преобладающие количества: угля, опилок или муки
в состав некоторых введено даже небольшое количество селитры:
Наиболее известны следующие смеси:
Спэнс совместно с Риккером предложили не-
сколько баллистических порохов, как пушечных, так
огнестрельного оружия. Все они содержат помимо
?
« 1 Артиллерий ск. | пороха. ; Ружейные пороха.
Бертолетовой соли . . . . 58,83 ’о 1 54,79?о . 1 62,50/о 62,50%
Каменного угля 5,88,, 4,П „ 6,25 „ 7,81 „
Двууглекислой соды . . .: ! 8,82,, 16,43 „ । "— 4,69 ,
Древесной муки 20,59 „ 1 19,19 „ j — -—
Древесного угля . . f. . . 5,88 „ 5,48 „ ; i 18,75 „ 7,81 „
Пшеничной муки ! i 12,50,, 15,63 „
Селитры 1 i 1 1 1,56 „
Составные части с водой замешиваются в тестообразную массу,
которая высушивается на водяной бане и зернится, как обыкновенно.
Изобретатели полагают, что силу взрывчатого вещества можно
регулировать в известных пределах, заменяя часть двууглекислой
соды—вещества, не принимающего участия в реакции взрыва, по-
средством калиевой селитры или азотнокислым свинцом).
12. Порога с бертопето- Смеси бертолетовой соли с углем и смоли-
аОй сопью для скальных ОТЫМИ Веществами уже давно применяются В гор-
работ. ной промышленности, преимущественно в камено-
ломнях.
В качестве сгорающего обыкновенно берут: смолы, канифоль,
деготь, вазелин, парафин, спермацет, нафталин и другие углеводо-
роды.
Надо однако не забывать, что все эти смеси очень чувствительны
к ударам и трению.
Быть может чаще других применяется для скальных работ
смесь:
80 ’<> бертолетовой соли,
13 „ угля,
1 „ углекислой магнезии,
6 ,, смолистых веществ.
и по о а Симен Эти взРывчатые вещества, кроме бертолетовой
роха именса. соли, содерЖат в себе какой-либо углеводород, как,
например, парафин, асфальт, смолы, гуттаперчу и т. д., распущенный
в каком-нибудь летучем растворителе — преимущественно состоящем
из другого жидкого углеводорода.
Тестообразную массу прессуют в патроны и сушат. Можно пред-
варительно ее зернить и затем прессовать в виде патронов в готовые
оболочки. Это суть все пороха для горного промысла.
14. Минные порога
Михайловского.
их
Они были предложены в 1905 году, причем в состав
входили:
50° 0 бертолетовой соли,
5 „ перекиси марганца,
45 „ порошковатого органическ. вещества.
В качестве последнего рекомендовались следующие вещества:
древесные опилки, отруби, танин и т. п.
Для приготовления его, бертолетовая соль обливалась водой и
остальные части вмешивались в полученную жидкость для образова-
ния тестообразной массы.
_ В Германии находят себе применение смеси бертолето-
. илезия. вой соди с неокисленной смолой, и те, которые содержат
значительное количество поваренной соли, причисляются к „безопас-
ным" взрывчатым веществам, таковы, например: Силезия IV22 и Силе-
зия 4.
Силезия ZTСилезия -I
Бертолетовой соли..........70% 80°/,,
Смолы.....................8 „ 20 „
Поваренной соли...........22 „ —
Вследствие большого избытка бертолетовой соли при взрыве их
получается значительное количество свободного кислорода, доходящее
до 14,2%.
К числу взрывчатых веществ того же порядка как
. цементит. п силезия 4 принадлежит также, предложенный во время
Европейской войны Шпитальским, цементит.
Он состоит из:
86% бертолетовой соли,
12 „ углеродистых веществ.
В качестве углеродистых веществ Шпитальским испробованы:
вазелин, парафин, канифоль и другие.
Смесь должна быть уплотнена до удельного веса не превышаю-
щего 1,2, иначе состав делается не достаточно чувствительным к кап-
сюлю.
Пока это взрывчатое вещество фабричным путем не выделыва-
лось. Подобные взрывчатые вещества еще раньше предлагались во
Франции.
В Австрии изготовляются, между прочим, взрывча-
. длоратины. тые вещества> содержащие бертолетовую соль, коим при-
своено название хлоратинов.
Состав одного из них:
Хлората калия...................88°/0
Антраценового масла ............ 12 „
•
Смешивание составных частей производится ручным способом.
Они допускаются для работ в рудниках. При взрыве их, однако, по-
лучаются труднопереносимые газы и большинство из них гигроско-
пичны.
Необходимо твердо помнить, что совместное применение хлорно-
ватых солейр аммиачными совершенно не допускается, вследствие возмож-
ности образования при посредстве обменного разложения, крайне опасной
хлорновато-аммониевой соли, точно также нельзя употреблять одновремен-
но хлоратов с пикриновой кислотой и нитрокрезолом, в виду того, что
получаются смеси слишком чувствительные к механическим влияниям.
Необходимо также самым тщательным образом избегать всякой
возможности образования смеси пыли хлорноватых солей и перхло-
ратов с превращенными в пыль: древесными опилками, углем, саха-
ром, и другими органическими веществами особенно же крахмалом,
а также серой, так как подобные смесиобладают весьма сильно взрыв-
чатыми свойствами, давая взрыв уже при температуре не превосходя-
щей 120—150° С.
§ 7. Как в пороховых смесях с селитрами синеродистые соединения
(в частности—желтая кровяная соль) играют известную роль, также
точно и в смесях с бертолетовой солью важное значение имеют соли
синильной кислоты—преимущественно та же самая желтая кровяная
соль.
606 —
Из группы хлоратных смесей, содержащих цианистые соединения,
следует упомянуть про нижеследующие: пороха Мельвилля, Белые пороха,
пороха Багоп- Cauvet, Динажолеен, взрывчатая бумага, Graham's powder,
порох Нобеля, порох Willams'a, порох Нелье, порох Haifa, порох Gomes,
масса для стопина Миллса и Гомеза.
п а Мель илля Это очеиь простое взрывчатое вещество приго-
. срока ельаилля. ТОВЛЯЮТ) смешивая поровну бертолетовую соль с
цианистым калием.
Само собою разумеется, что подобное взрывчатое вещество может
представлять интерес, чисто научный, а отнюдь не практический.
Тем же автором предложен был другой вариант подобной смеси,
содержащей также и мышьяк:
62% бертолетовой соли,
25 „ реальгара (As, %),
13 „ синеродистого калия.
Имеется также рецепт бинарной взрывчатой смеси, предло-
женный тем-же Мельвиллем, состоящей лишь из бертолетовой
соли и реальгара, а именно:‘
66% бертолетовой соли,
34 „ реальгара.
Пороха Мельвилля предлагались, как в качестве баллисти-
ческих, так и минных пороха.
_ Б Под этим названием существует довольно много
епые пороха. ВЗрЫвчатых веществ, отличающихся подчас очень суще-
ственно не только пропорциями составных частей, но и природой их.
Так, например, порох Ожандра, Lannoy, Шульце, Ухациуса и др.—
зовут белыми порохами, но здесь мы под этим названием будем разуметь
только хлоратные смеси почти совершенно тождественного состава,
а именно:
X» 1 № 2. № 3.
Бертолетовой соли . . . 48% 50% 1,7 /О
Желтой кровяной соли 29 „ 25 „ -° w
Сахару 23 „ 25 „ 23 „
Смесь № 1 называется порохом Reveley или белым английским
порохом-, № 2 носит название белого американского пороха или пороха
Ожандра и смесь № 3—белым германским порохом или пороха Поля.
Изготовляются эти пороха очень просто: компоненты смешиваются,
смесь увлажняется 4—5% воды и зернится.
Они предложены были в средине минувшего столетия.
— 607 —
5. Порох BaronGauvet. К белым порохам по составу близок предложенный в 1882 году порох Baron-Cauvet. Он состоит из:
« 50% бертолетовой соли, 50 „ желтой кровяной соли.
4. Динаможен.
Он предложен Петри в 1882 году и состоит из:
46,98% бертолетовой соли,
23,49 „ едкого калия,
11,91 „ желтой кровяной соли,
10,91 „ древесного угля,
6,71 „ крахмала. ,
. г
, Первоначальным способом ея приготовлений был
следующий: приготовлялась на растворе камеди полу-
жидкая смесь из:
33% бертолетовой соли,
53 „ селитры,
7„ угля,
7 „ древесной муки, твердых пород дерева.
Смесью этой пропитывается плотная, не проклеенная бумага, ко-
торая затем свертывается в цилиндрические патроны и просушивается.
К ударам и трению эти патроны мало чувствительны; рекомен-
довалось их применять в горных работах.
Затем в 1?86 году Beley предложил другой’ рецепт взрывчатой
бумаги. Она приготовлялась следующим образом: растворяют в кипя-
щей воде:
45,5% бертолетовой соли,
11,7 „ желтой кровяной соли,
24,1 ,, раффинированной поваренной соли
и вливают туда взболтанные с водой 7% крахмала, после чего всы-
пают 11,7% древесного угля в виде тончайшей пыли. В эту кипящую
жидкость погружается бумага, которая затем свертывается в цилинд-
рики и высушивается.
6. Grahams
powder.
Это взрывчатое вещество также содержит желтую кро-
вяную соль, кроме того в состав его входит довольно много
сахару и металлических окислов.
Оно содержит в себе следующие вещества:
40% бертолетовой соли,
20 „ сахару,
16 „ желтой кровяной соли,
1,25 „ металлических окислов.
— 608 —
7. Порога
Нобеля.
В 1880 году во Франции испытаны были 8 сортов по-
рохов с бертолетовой солью, предложенных Нобелем. Состав
их был следующий:
Бертолетовой соли ..........
Сахару .....................
Желтой кровяной соли . . . .
Крахмалу....................
Камфары.....................
Серы........................
Бензина ....................
Селитры ....................
Древесн. угля.........• . .
1 2 i о о 4 6 7 8
72,0 71,5 68,5 55,6 71,5 71,4 52,6 53,2
14,4 15,7 16;5 22,2 14,3 14,4 5,3 8,0
11,5 12,8 15,0 8,9 5,7 8,4 8,5
0,7 2.2 1,4 1,4 1,0 0,5
1,4^ 2,2 1,4 1,4 1,0 0,5
1 ! — " — 8,9 —
— । — — 11,4 5,7 — —
— 1 — —- -II 26,3 26,6
1 “ 1 5,4 2,7
Испытания этих смесей показали, что, если только они приготовлены
из чистых материалов, они могут безопасно храниться и, до известной
степени, безопасны в обращении и при перевозке. Исключение состав-
ляет смесь № 4 в состав которой входит сера, которая даже в чистом
виде в соприкосновении с воздухом в присутствии влажности оки-
сляется (вероятно, образуя серную кислоту), причем окислы ее всту-
пают во _ взаимодействие с бертолетовой солью, обусловливая при
неблагоприятных обстоятельствах возможность возникновения само-
разложения смеси.
„ „ , К числу порохов с бертолетовой солью, богатых
г содержанием желтой кровяной солью, относится также
порох Willam’sa, в составе своем содержащий двухромокалиевую соль.
Зга смесь заключает в себе:
57,15% бертолетовой соли,
19,05 „ желтой кровяной соли,
2,38 ,, двухромокалиевой соли,
5,95 „ порошка чернильного орешка,
2,38 „ каменного угля,
7,14 „ крахмала,
5,95 „ нефтяного масла.
Пороха эти предложены были во Франции и испытаны
‘ opo!ta Правительственной Комиссией в 1884 году. Состав одного
еппье‘ из них был следующий:
67% бертолетовой соли,
8,5% селитры,
8,5 „ серы,
6,0 „ древесной муки,
10,0 „ экстракта кампешевого дерева.
по-
став
8
Тем-же автором в 1882 году предложены были артиллерийские
п минные пороха, найденные Правительственной Комиссией недоста-
точно безопасными.
Для их изготовления даны были следующие рецепты:
53,2
8,0
8,5
0,5
0,5
26,6
2,7
юны
тной
зав-
етом
оки-
зсту-
при
:амо-
атых
акже
соль.
• 1 1 Мин t н ы е. ! Артиллер,
Бертолетовой соли . | 47% 1 44% ' 40%
Желтой кров, соли . 36 „ 38 „ 15 „
Серного цвета . . . 17 „ 18 ». ю „
Сахару ...... —1 15»
Угля 5 »
Селитры ... • . 1 15 »
10. Порох НаН’я.
Это довольно простая смесь
желтой кровяной солью и серой:
бертолетовой соли с
гганы
дного
52,2'о бертолетовой соли,
42,2 „ желтой кровяной соли,
5,6 „ серы.
Технология производства этого пороха в общих чертах состоит
в следующем: составные части, каждая в отдельности, измельчаются,
затем превращаются в тестообразную массу при помощи чистой, или
подкисленной азотной кислотой, воды. После высушивания, масса
смачивается 10’/» раствором гуттаперчи в сероуплероде и зернится,
как обыкновенно.
По причине летучести паров сероуглерода и чрезвычайной лег-
кости с какой они воспламеняются со взрывом, фабрикация этой смеси
очень опасна; также точно нельзя сказать, чтобы она вообще была
устойчива и при хранении.
В состав этих взрывчатых смесей, кроме пре-
I. пороха Qomezа. обладаЮщего "количества бертолетовой соли и желтой
кровяной соли, а также сахару, входит нитрат свинца, или-же свин-
цовый сахар, -иногда-же также и соли железа.
>2. Маса для стопи- Стопинную пряжу погружают в ЖИДКОСТЬ, со-
на Milis’a и Gomez a. стоящую из этилового спирта, железистосинеродистого
свинца и бертолетовой соли.
§ 8. Желание несколько уменьшить резкость действия препаратов
заключающих в качестве сжигающего бертолетовую соль и, попутно, не
сколько удешевить стоимость их, привело к попыткам частичной замены
Проф. М, Сухаревский. Взрывчатые вещества и взрывные работы, ,39
хлорноватокалиевой соли селитрами, преимущественно щ елочных металлов,
ы в результате было предложено большое количество веществ, заклю-
шпощих одновременно бертолетовую соль и селитры.
Впрочем в настоящее время смесей бертолетовой соли с селит-
трами избегают.
Нижеследующим вещества заключают одновременно бертолетовую
соль и селитры, иногда же серу или сернистые металлы, уголь или
вообще углеродистые вещества-, пороха Nisser’a, Kellow - Short’а, составы
Гехштеттера, Sjohery'a. Ромиты. Frenkel’я, гремучим порог, Петро-
фактор и др.
В 1886 году Nisser’oM была предложена пороховая
. ороца user а. смесь следующего состава:
Бертолетовой соли .... 10,50° 0
Селитры................. 44,50 „
Каменного угля..........19,50 „
Серы.....................19,50 „
Древесных спилок .... 6,50 „
Двухромокалиевой соли • 2,00
Желтой кров, соли .... 1,50 „
В некоторые пороха вместо бертолетовой соли вводился перхлорат
калия, в другие же, вместо калиевой селитры — натровая, наконец,
некоторые содержали древесные опилки, полностью или частью, заме-
ненные отрубями, танином и т. п.
Изобретатель указывает, что желая усилить действие по-
роха, надлежит увеличить пропорцию селитры за счет уменьшения
количества серы и угля.
Пороха эти предложены были в качестве метательных, но при-
няты не были.
В 1870 году этот же автор предложил пороховые смеси совер-
шенно иного и при этом более простого состава, а именно:
Бертолетовой соли . . 55%—45%
Кремортартару .... 44%-54 „
Желтой кровяной соли. 1% —
Серы................ — 1 „
Однако, и эти пороха распространения не получили, опять-таки
вследствие небезопасности в обращении.
Это обстоятельство заставило Nisser‘a последовать примеру других
и предложить взрывчатое вещество, приготовляющееся в момент на-
добности из двух смесей, самих по себе не взрывчатых и совершенно
безопасных, а именно:
а) Калиевой селитры ...... от 6°/о до 37%
Бертолетовой соли V 41 „ „ Э я
б) Сахару V зо „ „ 3 i „
Опилок W 12,. ,. ь „
Серы возогнанной !> и „ 13 .
ллов,
1хлю-
елит-
повую
или
*,тавы
гетро-
ховая
В этих смесях, также как и в порохах Nissera, иногда бертоле-
товая соль заменялась перхлоратом калия, калиевая селитра—натриевой,
а опилки отрубями, или углем.
2. Порода Keiiow Несколько раньше первых порохов Nisser‘a, а имен-
Short, но в 1862 году, был предложен Kellow-Short порох,
состоявший из следующих частей:
• Бертолетовой соли . *. от 6% до 12%
Калиевой селитры . . „ 4 „ „ 8 „
Натриевой „ . . „ 36 „ „ 30 „
Серы.................„ 10 .„ 10
Опилок древесных . . „ 4.4 „ „ 40 » •
хлорат
.конец,
, заме-
:е по-
япения
со при-
совер-
В некоторых сортах опилки заменялись!танином.
Это взрывчатое вещество обладало значительной» Микроскопич-
ностью и было далеко небезопасно в обращении; фабрикация его
также была сопряжена со значительным риском возможности взрыва,
а потому оно не йолучило сколько-нибудь значительного распростра-
нения.
з. Составы Гвхштот- Они имеют довольно разнообразный состав, но
тара. в общем представляют вещества богатые бертолетовой
солью, калиевой селитрой, серой и углем. В некоторых сортах бертблето-
вую соль заменяют соединения свинца, в других вместо калиевой, входит
натриевая селитра, вместо серы — сернистые металлы.
4. Взрывчатые веще- Это суть взрывчатые вещества богатые бертолето-
ства Sjoderg'a, вою солью и содержащие в своем составе или аммиачную
селитру или же щавелево-кислый аммоний. Из прочих „компонентов в
состав их входят: углекислый аммоний, а также углеводороды как
твердые, так и жидкие. В качестве жидких углеводородов указы-
вается на вещества, принадлежащие к группе нефтяных масел, из
твердых же те, которые принадлежат к группе нафталинов. Здесь
.приводятся рецепты нескольких составов этого рода:
1ть-таки
fдругих
лент на-
вршенно
я i; А. / — — * , •- 1 - Г — ..- —. Г * - • • — 1 в. i |_. ...
1; Бертолетовой соли ; 46,15% •50%
Аммиачной селитры 23.OS „
Щавелево-кислого аммония .Л — 25 „
!| Жидких углеводородов . . . . 115.39 „ 16.66 „
Твердых углеводородов .... 7.69 „ 8.34 „
Углекислого аммония 1 7.69 ) 1 -
Приведенные здесь пропорции отдельных составных частей под-
вержены сильным колебаниям, причем в отдельных сортах они Заклю-
чаются между следующими пределами:
Бертолетовой соли ... от 16.13% до 28%
Аммиачной селитры . . 48.39 „ „ 48 „
Жидких углеводородов . „ 10.13 „ „ 16
Твердых „ . „ 3.22 „ . 8 „
Углекислого аммония . „ 16.13 „ „ —
Вещества Sjoberg‘a развивают в полной мере свою силу только®
прочных оболочках и при хорошей забивке; они детонируют от заряда
динамита.
5. Взрывчатое веще- Оно было предложено в 1876 г. и имело следующий
ство Вяпемберга. состав:
Бертолетовой соли............. 31.25’/,—40%
Аммиачной селитры............. 6.25 „ —45 „
Нитропроизводных углеводородов . 62.50,, —15 „
В аммиачную селитру прибавлялось небольшое количество па-
рафина.
В качестве нитропроизводных автор предлагал применять: моно-
нитротолуол, динитротолуол, тринитротолуол, мононитронафталин,
динитронафталин, тринитронафталин, мононитрокумол, динитрокумол
и тринитрокумол, мононитробензол и динитробензол.
В сущности это взрывчатое вещество принадлежит к одному
классу с составами Шпренгеля.
6. Взрывчатая смесь Это довольно простая смесь бертолетовой соли
Гимли. с калиевой селитрой и каменноугольной смолой. Состав
ее следующий:
45% бертолетовой соли,
35калиевой селитры,
20 „ каменноугольной смолы.
Под названием вигерина было предложено в 1875 году
. Бисерин, е д Bjorkmann’oM в&рывчатое вещество, содержащее нитро-
сахар. Было его несколько сортов, различающихся пропорцией состав-
ных частей. В общем вигерин содержал:
От 15,38% до 20,01% бертолетовой соли,
„ ^8,46,, .. 33,33,, нитролина*),
,, 23,08 „ » 23,33 „ селитры,
23,08 „ „ 23,33 „ целлюлозы.
*) Этот нитролин не следует смешивать с одноименным препаратом предло-
женным инженером С. LamnfoM и представляющим специальный поглотшель,
напитанный особой жидкостью, представляющий собою продукт действия сульфо-
азотной смеси на смесь глицерина с бензолом. К жидкости, полученной при помощи
такого способа прибавляют от 1% до 6°/,, коллодионного хлопка^ который ее и же-
латинирует.
Тем же втором предложен был еще особый сорт вигерина, ко-
торый он назвал американским. Он состоял из:
20в/о бертолетовой соли,
20 „ калиевой селитры,
10 „ нитрованной муки,
10 „ не нитрованной муки,
10 „ древесных опилок,
30 „ нитролина.
Под именем нитролина мы подразумеваем в общем нитросахар,
причем нитролин, идущий на выделку вигерина Bjorkmann’a, или
„вигорита"**), принятого в Англии, есть продукт нитрации глюкозы,
сахарозы, мелассы и т. п. сахаристых веществ; тот же, который
употреблялся для выделки американского вигорита, получался дей-
ствием смеси 80 частей азотной и 170 частей серной кислоты на смесь
15 частей сиропа с 15 частями стеарина.
8 Ромиты Под ЭТИМ названием существует ряд взрывчатых веществ,
‘ м содержащих, наряду с бертолетовой солью, различные коли-
чества ^ммиачной селитры, нафталина, или продуктов его нитрации.
Большинство из них хранятся в виде отдельных составных частей и
готовяТв(Я лишь к моменту употребления.
9. Пороха двч3-
кого действия
Тюрпэна.
Желание ослабить, по возможности, чувствитель-
ность бертолетовой соли к механическим влияниям,
привело Тюрпэна к предложению своих порохов двойного
действия.
В них он применил в равных пропорциях, как хлорнов&го-калие-
вую соль, так и калиевую селитру, а также перекись марганца, в
качестве же сгорающего—смолистые вещества, способные давать массе,
до известной степени, свойства пластичности.
- Тюрпэн заметил, что подобного рода смеси могут просто зажи-
гаться, давая в подобных случаях явления, аналогичные с черным
порохом, с другой же стороны под действием капсюля с гремучей
ртутью, получался взрыв чисто бризантных свойств—откуда и само
название пороха двойного действия. В сущности современные шед-
диты суть производные этого прототипа.
ю По ф Он представляет смесь бертолетовой соли с селит-
орох рэн- рами, азотнокислым свинцом, (иногда — аммиачной
кепя’ селитрой).
Составные части превращаются в тесто-образную массу при по-
мощи сплавления с каким-либо твердым углеводородом.
« г м ц « Под этим названием предложены были очень
ремучии порох, быстрогорящие смеси, состоящие из перхлората
s **) в виду того, что название вигорита присвоено особому виду динамита, то
чтобы не путаться в названиях, будем все взрывчатые вещества с нитролином,
предложенные Е. A. Bjorkmann’oM называть вигоринамд.
— 614 —
калия с селитрой, с серой и легко загорающимися органическими
веществами, каковым например: порошок ликоподия, мельчай-
ший порошок древесной муки и т. п. Вот один из таких их
составов:
45% перхлората калия,
25 „ селитры,
15 серы,
7,5 древесной муки,
7,5 ликоподия.
Одновременное присутствие серы с перхлоратом калия орга-
нических, легко горючих веществ, обусловило крайнюю опасность
в обращении с подобными взрывчатыми веществами, а потому
предложенный гремучий порох не вошел в употребление.
Позже во Франции на место ^той
составы той-же категории:
смеси явились следующие
Бертолетовой соли . . 33,3% 40%
Сернистой сурьмы . . 66,7 „ 25° ' 20 „
Гремучей ртути . . . 50 „
Селитры — 25 „
Сурику 30%
Аморфного фосфора . 1О„
минный
' Sand оу предложил
12. Пироном Sandoy. J. r
r 1 присвоено название пиронома.
По составу он отличается от пиронома De-Tret,
заключается:
порох, которому
а именно в нем
. 64.5°;
Калиевой селитры
У гля..........
Серы...........
Металлической сурьмы.
Бертолетовой соли. . .
Муки.................
Хромовокислого калия.
8,5
к 5 „
5,0 „
4,0 „
1 „
13. Петрофаитор.
Он представляет из себя взрывчатое вещество, со-
держащее нитроглицерин, хотя и в небольшом, сравни-
тельно, количестве, а потому, в сущности, есть род динамита с дея-
тельным поглотителем, напоминающим собою пороховые смеси, бога-
тые бертолетовой солью.
Состав его следующий:
67% бертолетовой соли,
20 „ селитры,
10 „ нитроглицерина,
3 „ пятисернистой сурьмы,
мьММйМЙйнмМыйшМЙМ
....-* ,J—-jf—f|'J)ljfj
— 615 —
Одновременное присутствие бертолетовой соли и пятисернистой
сурьмы обусловливает опасность, представляемую петрофактором при
хранении, так как при совместном влиянии влажности и воздуха
возможно разложение пятисернистой сурьмы и потому могут создатьоя
благоприятные условия для возникновения саморазложения взрывча-
того вещества.
„ Нитроглицерина......... 36,78%
Калиевой селитры .... 40,49 „
Бертолетовой соли. . . . 9,26
Древесного бурого угля . 12,30
Песка и золы........., 1,21
Цвет его темно-серый; отсыревший не взрывает, толчки и уда-
ры выдерживает лишь небольшие. «Горит >4ез взрыва. .
Нитрометаллин действует сильнее пороха, но не превосходит
действием своим динамиты; однако благодаря содержанию бертолето-
вою, соли, в обращений опаснее их, почему и не получил распро-
странения.
§ 9. Теперь переходим ко взрывчатым веществам, богатым бертоле-
товой солью и селитрами, содержащим цианистые соединения—в частности,
желтую кровяную, соль.
Непроклеенную бумагу опускают в кипящую,
. Бумажный порох. СИрОПообразной консистенции, смесь нижеследующих
веществ в воде:
Бертолетовой соли . . . 45 "д
Калиевой селитры ... 23 „
Желтой кровяной соли . 16,5 ,,
Поташа . • .,..........15 .,
Крахмала.............0,20 .,
Двухромокалиевой соли. 0,30 „
Бумага затем свертывается в цилиндрики и сушится при тем
пературе 100°С.
Для предохранения от сырости патроны покрываются лаком,
состоящим из раствора одной части ксилоидина в трех частях уксус-
ной кислоты.
Хлоратный пороге
Darvey.
Было предложено два сорта этого
вещества, а именно:
взрывчатого
Бертолетовой соли . . . 30 70 37
Калиевой селитры ... 25 „ 18 3/4 „
Желтой кровяной соли . 10 „ 25 „
Двухромокалиевой соли. 10 „ —
Сернистой сурьмы . . . 25 „ 18 34°/0
11 U Я* < I .. < •r- w,,*,i
; " ' ' I
— 61G —
, п в иля Это пороховая смесь, богатая бертолетовой солью
. opt»t риля. и селитрой, содержащая также желтую кровянуй соль,
Здесь приводятся рецепты мета-
уголь, парафин и другие вещества,
тельного и минного порохов Вриля:
Метательный. Минный.
Бертолетовой соли . . . 48,0° „ 50,0%
Селитры 24,3 25,0 „
Желтой кровяной соли. 9,1 „ 4,5 „
Древесного угля . . . И,6 „ 12,5 „
Парафина 6,5 „ 6,0 „
Соединений железа . . 0,5 „ 2,0 „
§ 10. Известно несколько веществ, богатых бертолетовой солью и се-
литрами, которые также содержат никриновую кислоту и пикраты.
Таковы, например, зеленый порох, пороха Фонтэна: Tseliirner'a, Викторит
и пр,
Хл та тины Это Д°вольно обширная группа смесей пикратов с
. длорокат «тины. одним или несколькими хлоратами.
2 Ф ан зек й Взрывчатое вещество, носящее это название, не
ранцузскии СОдерЖИТ вовсе селитры и состоит из смеси бертолетовой
зеленый порол. соли с пикриновой кислотой и желтой кровяной солью.
Состав его следующий:
66,7% бертолетовой соли,
19% пикриновой кислоты,
14.3% желтой кровяной соли.
Он состоит из бертолетовой соли и пикриново-ки-
. оро> онгэна. сдого калия> смешанных в равных пропорциях.Обладает
огромной силой, но по чувствительности к механическим влияниям
мало уступает гремучей ртути; по этой причине не мог войти в
употребление.
4 Пород Он пРеДставляет простую смесь:
Tschirner а. 40,96% бертолетовой соли,
54,28% пикриновой кислоты,
4,79% смолы.
Для приготовления его порошок смолы растворяется в бензине
или другом каком-либо подходящем растворителе; этим раствором
смачивают остальные составные части для образования пластичного
теста, из коего и выделывают цилиндрики.
_ _ По составу своему это взрывчатое
икторит. ПОрОХОМ Tschirner’a.
В состав его входят:
вещество сходно,с
39% бертолетовой соли,
53,7% пикриновой кислоты,
4,9% калиевой селитры,
2,4% угля.
Й
L
if.'
Есть сорта виксорита, содержащие натриевую и баритовую се-
литры. В общем—это зерненные пороха желтовато-серого цвета.
ete-
\Ы.
'т
5 С
не
юй
х
fc
В':
|U
6. Порох К числу порохов, содержащих натриевую селитру, сле-
Борпинетти. дует также отнести порох Борлинетти.
Он предложен был в 1867 г. и оригинален в том отношении, что в
нем применена едва ли не впервые пикриновая кислота.
Состав этого пороха следующий:
Пикриновой кислоты . . . 35,1 /9.
Натриевой селитры .... 35,1 „
Хромовокислого калия . . 29,8 я
f \
7. Порох Он предложен в 1883 г. для надобностей горного дела.
Moritz-Koepei. Известны два главных сорта его.
ки-
ает
сям
I в
ине
ром
:ого
о с
№ 1. № 2.
Калиевой селитры ... . 35,00%. 42,00%
Натриевой селитры . . . 19,00 „ 22,00 „
Серы 11,00 ,. 12,50 „
Древесной муки ..... 9,50 10,00 „
Бертолетовой соли .... 9,50 п
Древесного угля 6,00 „ 7,00 и
Сернокислого натрия . . 4.25 „ 5,00 „
Желтой кровяной соли. . 2,25 „
Сахару 2,25 „
Пикриновой кислоты. . . 1/25 г 1,50 „
Л? 1 предназначен для твердой скалы, а № 2 для более мягких
пород.
8. Впит. Его состав:
около 70 частей калиевой селитры,
» 2 серы,
я 18 „ угля или лигнита,
„ 0,4 „ пикриновой кислоты,
„ 0,4 я бертолетовой соли.
„ 0,3 „ кальцинированной соды.
По наружному виду — довольно крупные зерна шоколадного
цвета; в горной промышленности он был испытан и им остались
довольны.
Есть сорта его, содержащие несколько иные пропорции со-
ставных частей и даже, заключающие другие составные части,
а именно:
Калиевой селитры ОТ 72 до 75 частей.
Пикрата натрия я з,з 99 8 99
Каменного угля или лигнита . я 11,2 99 15 М
Серы. . . м П,2 99 10 М
Бертолетовой соли 99 2.3 W 0 М
§ 11. Детонаторы. Смеси содержащие хлорноватые соли имеют
оо золъно резко выраженные свойства детонаторов, а потому нередко и,
используют в качестве таковых.
1. Детонатор
Winiwarmer'a.
Им предложено три типа детонаторов:
i X"* 1 I 1. L Л» 2. Л? 3.
1 Гремучей ртути . . . . i 15,88% ——
Бертолетовой соли. . . 15,25 „ 1.23%
Сернистой сурьмы. . .' 1 16,52 „ 15 -
Угля ; 0,64 „ — 1,18%
Селитры 2,54 „ 4,59 „
Желтой кровяной соли . П,22 „ 0,31 , —
Перекиси свинца. . . . 0,32 „ 4,60 „ 24,62 „
Этероксилина 47,64 „ 68,71 , 40,7/
Гремучего цинка. . . . —— 23,01 „ —
Аморфного фосфора . . j — » 28,85 ,
Этероксплином автор называет раствор, состоящий из: 66,65° О
эфира и 33,35% нитроцеллюлозы, т.-е. род колодия, при помощи
которого смеси дается тестообразная консистенция.
2. Детонатор для ружейных
патронов к винтовке Мау-
зера.
45,45% бертолетовой соли,
39,39 „ сернистой сурьмы,
9,10 „ гремучей ртути,
3,03 „ серы,
3.03 пороховой мякоти.
Этот детонатор приготовляется так: на мраморном столе деревян-
ным пестиком растирают бертолетовую соль, прибавляя понемногу
раствор адраганта в спирту. Затем каждые 15 минут вводят посте-
пенно остальные составные части: сернистую сурьму, серу и, наконец,
пороховую мякоть; гремучую ртуть прибавляют последней. В течение
всей операции не прекращают перемешивания смеси.
Хлорновато-калиевая соль широко используется в капсюльных со-
ставах. В нижеследующей таблице помещен состав некоторых взрывчатых
смесей этого рода.
Бертолетов, соль. ; ; Сернистая i сурьма. 11 Сера. Об £ • J3 1 и g ° § S a о x jl н о О д ,i Гуммиара- !i! бик. (раст- ;; вор). •i Красный ji фосфор. l! Уголь. ' j Окись свинца. 1 1 - ji Смола. сё tx в § О ex cd X и C3 CL 1 1 — 1) Пороховая i! мякоть./ l Фосфор ! аморфный. il v ij Канифоль» j i Желтая
т Капе. сост. для игольч. руж. . . . 1 я » я я я • • • Я мп М Я • • „ „ „ руж. Генри Мортини . ; „ „ „ пушек в Англии. . . „ в Швейцарии для патрон. . . . в „ „ для пушек . , . „ для гранатных капе n да Норденфсльд. пуш Сост. для ударник, артиллер. снар. Капе, состав да да да .. • да „ н л да да » да • • . • Я да да да • да да да » ружейн я Я п **'*•*•• я да я да да х да .. ...... я да я • да да да да да да W и я • Детские пистоны я я да да Детонатор Мильбанка Я W ' 4 5; 55’ 2,25 i.5o; 75' 75 1 41 3 45( 1 5' ’ 4 1 1' ' 1 1 15 ч 3 52 30 50 12 9 |38.71 (78.26 ! 67 ! 64 1 00 ’ф Л- О О СМ HQ СМ г-1 о? ОС гх 00 И 1 ~ 1 * 1 1 1 1 1 1 1 1 1 1 1 1 1 2 1 1 {*4 0.25 13,75' “ 1 10 1 1 4 15.14 9.24 9.06 i 29 ; 23 1 14.5 j 02.5 i “ ' 2.17 Г 1 — ~- i । — j 2.25 3 600 eos 3! 21 i 2.5’ __ 0.5 0.5 52. 2 43.77 62. 5 7.0 66.7 100 62.5 100 100 109 ; loo i i i i ri i i i i i i i i i i-1 i i 11 i i i । i _gg i iiii 1111i3111111 i 1111111111 i 111 i 11111 ! 4 1 i II 1 1 1 1 1 ; 1 H I- 1 1 1 - 1 1 1 1 il 1 1 1 1 1 1 1 _ 3.7 f ( 10 1*) i 1 — I 1 1 1 1 30 i r-4 ,1 l г 1 i:i 1 I i 1 1 i 1 I 1 i 1 1 I 1 1 I 1 i 1 i 1 1 I i"S 1 । । I Ю i i 111 -11111111.11111 11111111111111 111 фк г-1 Ci iobftrfxw । e11 gi i •w=-be111“xgsi г11111111111111111 СП СЛ W f 1 1 1 1 1 1 1 1 1 1 1 II 1 1 1 1 ” 1 II 11 111 1 1 l\l 1 1 11 1 I 1 1 1 1 1 1 1 1 1 1 1 1 1 " 1 1 1 1 1 1 1 1 1 1 1Ss1 1 1 1 1 1 1 1 1 1 1 1 1 I ) 1 .1 i 1 I 1 I I 1 1 1 f 1 1 I 1 1 1 1 I 1 1 1 1 г|й ’ j — 3.22
*) Уголь смочен клеевой водой с сахаром прибавлением
несколько капель азотной кислоты.
..«иждд, wa»
— 620 —
1 \
Существует довольно много рецептов, служащих для изготовления
детонаторов и зажигательных смесей электрических запалов.
Смесь, которой был снаряжен запал Дрейера, состояла из 52%
хлорновато-калиевой соли, 42% сернистой сурьмы (антимонил) и к ней
прибавлялось для проводимости 6% тонко измельченного порошка гра-
фита. Смесь эта была очень чувствительна к механическим влияниям
и потому подвинчивание винтиков, регулирующих сопротивление за-
пала, было строго запрещено.
Платиновые запалы, принятые в Военно-Инженерном Ведомстве,
снаряжались смесью равных количеств железисто-синеродистого свинца
и бертолетовой соли. Однако подобный состав был слишком чув-
ствителен к трению, а потому для флегматизации его, ввели в него
графит ввиде мелкого порошка и таким образом получился детонатор
состоящий из:
35% бертолетовой соли,
35 „ железисто-синеродистого свинца,
30 „ порошковатого графита.
Железисто-синеродистый свинец получается простым смешива-
нием водных растворов 37 весовых частей желтой кровяной соли и
65 частей свинцового сахару:
K4Fe(CN)e -j- 2Pb(C2H302)2 = Pb2Fe(CN)6 % 4СН3С00К.
Полученный железо-синеродистый свинец имеет вид тонкого тя-
желого осадка бледно-желтого цвета. После промывки, его сушат при
температуре не свыше 50°С.
Каждая составная часть отдельно измельчается и просеивается*),
смешивайие же производится очень осторожно на листе бумаги
(лучше—глянцевой) роговым шпателем или таковою же ложечкой и
в заключении просеивается сквозь шелковое сито. Готовая смесь хра-
нится в стеклянных банках с корковой пробкой, при чем наблюдают,
чтобы при закупоривании банки между нею и пробкой не попадал бы
состав.
Отсутствие на рынке свинцового сахару вынудило Военно-Инже-
нерное Ведомство отказаться от этой смеси и допустить для приго-
• *) При растирании бертолетовой соли надо соблюдать осторожность, не допуская
ударов и просеивать ее сквозь шелковое сито.
товления запалов другую смесь, могущую быть причисленную к пикри-
новым порохам. Оно состоит из:
50% бертолетовой соли..
26 „ желтой кровяной соли.
24 „ сахара-рафинада.
На открытом воздухе она легко дает вспышку с образованием
большого пламени и обильного дыма, при прикосновении с пламенем
в металлической гильзочке, закрытой обыкновенной пробочкой —
детонирует. <
В сравнении со смесью, содержащею железисто-синеродистый: сви-
нец, она оказалась несколько чувствительнее последней к механическим
влияниям, но разница настолько мала, что практического значения
она не имеет.
Смесь эта имеет вид белого пороха с еле заметным желтоватым
оттенком и по своему составу более всего приближается к пороху.
Haffeneger’a. ' г
В запале, также как и предыдущая, воспламеняется от пирок-
силиновой ваты, обмотанной кругом платийового мостика.
Из других смесей, служащих детонаторами в электрических
запалах, можно указать на некоторые, помещённые в нижеследующей
таблице:
(См. таблицу на стр. 622).
§ 12. В особую группу надлежит выделить смеси бертолетовой
соли с жидкими нитротелами и вообще углеводородами. таких сме-
сей наиболее интересной является рэкка-рокк.
„ Это взрывчатое вещество было предложено в Аме-
' рике R. Divine в начале 80-х годов, причем одно время
(. экна-рокк/ пользовалось большим распространением и значительно
применялось в Европейскую войну*).
Нами же оно было широко использовано также в течение Рус-
ско-Я понской войны.
Существует несколько рецептов, по которым оно изготовляется.
Вот некоторые из наиболее употребительных:
Бертолетовой соли . . z : s3,4°/0
Мононитробензола . . % 8,3 „
Нефтяного масла . . . . 8,3 „
Скипидара............—
*) В сущности рэкка-рокк принадлежит к тому же классу взрывчатых веществ,
как и составы Шпренгеля. представляя лишь частный случай, в котором жидкое
сжигающее заменено твердой—хлорноватой солью.
li i Бертолетова соль. / Калиевая селитра. Гремучая ртуть. Сернистая сурьма М од иод енов ы л блеск. Ретортный уголь. Медные опилки. Полу сернистая медь. Полуфо сфористая медь. j Сера. Графит. Пироксилин. I Желтая кроняная соль. 1 i 1 Сахар. । I Серноватиетокис- | 1 лыЙ евив_ец._ _ ! Двухромокалп свая соль. —_—.— —— Стеклян. порошок. Умбра. d о о о
Эбнера для тока высокого напряжения . 44 j 44 12 ! । 1 5 1 ( 1 ! j -
(44 J0 1 /44 1 1
71ля токов средней силы 147 16 W7 6 [ —— 5 - * ~ 1 —..
Ожандра „ „ 41.66 * — - * 12.5 1 — — —- — — ;25 20.84 — "
50 50 —- J > —— । ' ‘ * * *— — *Ь|-- - -
Dow и'а „ „ — 25 — — 75 1 __ — —— 1 = — — * 1 *
44 — 44 — 6 — 6 — —- — —- i 1 1 » —— 1
Для токов малого напряжения 22 - — 64 14 — 1 — — — — 1 1
56 I. ! 15 38 — 1 — i —. i — *- - -Ч.
Я " W W Абеля „ „ 16 — — — - — —— 28 56 — ' — 1 1 — г -—— — — - —
Для искровых запалов Эбнера 73.33 1 г. — 6.67 * — ** ! — j — -—-» 20 1 : —— • — — 1 —
Абеля 1 3 —*- 9 — — i — " - ~ ' — +
, / ’•37.5 — 37.5 25 — — 1 * 1 _ 1 —— ' — 1
42.86 — 128.57 28.57 1 - — — <— : — 1 1 о 1 1 i
Английские детонаторы { <46.15 I . л — — 46.15 » — — г 3.85 — I ж 1 3.8.5 —— : — —
1 48 — — — —- 48 I । — 4 i 1 — ! 1 ” " —--I 1 "
\ ,',44.44 *— 44 44 1 ~ *— """ — 3.70 —— I — 1 — с 1 3.70 * । —'
Для платиновых запалов ........ —*" — — 1 10 — 1 — 190 1 1" * — . —
Абеля 87 — *" — 13 — * —— — 1 i • —" —
Английский детонатор > 6 *— : 4 4 * —— — ; —- •, **' * — — i —> — — —
Детонатор Гана (64.51 — । 3.23 *— — — 1. ' “* ——- 16.13**) — — « 116.13 1 >11
Детонатор СапоиП'я (35.46 - — - — — : — 28.37*) * . 35.46 : 0.4
Состав для фрикционных трубок . . . . ;33 — 67 ' — — 1 — — *- 1 - — • — 1 i — —
Терочный воспламенитель 1^560 1 1 1 ' 15 *— > . 10 — i — - (175 50 7 о 20 45.25
Для вытяжных трубок f ! , -- - 28 — 11 — 1 t i J 1 ; * .... - “——
*) Двойной роданистой соли железа и свинца.
**) Пикриновой кислоты.
— 623
Состав рэкка-рокка употреблявшийся нами в Японскую войну
был следующий:
75% бертолетовой соли, содержащей 3,5% окиси
железа,
25 „ мононитробензола.
гда
В готовом виде рэкка-рокк представляет пластичную массу крас-
новато-бурого цвета. Обе действующие составные части, каждая в
отдельности (т. е. бертолетовая соль и мирбановое масло), безопасны
в обращении и при перевозке, но смес^ их уже делается настолько
чувствительной к толчкам и ударам,неблагоприятных усло-
виях не исключается возм^кность вцр^ва, £ потому по нашим прави-
лам она приготовляется только в анаАобности, причем не-
израсходованная часть, должна (быт^^Й^ояЙна в тот же день*).
Бертолетовая: .соль с ркищ>ю «^^ спрессовывается в патроны,
завернутые в бумажную .вбертжу. да употребления, бумагу
снимают и ца||«0 n^pp^z^ow«a»T B нитробензол на время от нес-
кольких минут до полуцасаг**), цока они не впитают в себя нужное
количество жидкости, причем -следует иметь в виду, что излишнее
количество мононитробензола вредит делу, уменьшая взрывчатую силу
вещества.
Лучше всего поэтому напитывать патроны отмеренным заранее
количеством мирбанового масла.
Необходимо иметь в виду, что при напитывании бертолетовой
соли нитробензолом, выделяются вредные газы, почему эту операцию
следует производить либо под тягой, или же на открытом воздухе.
По силе взрыва рэкка-рокк уступает пироксилину, толу и меле-
ниту, а также большинству динамитов; взрывается -от капсюля с
0,5—0,1 грам. гремучей ртути, а также от сильного удара железного
или стального предмета и сильного трения между твердыми поверх-
ностями. При взрыве дает обильный белый дым.
Будучи зажжен на воздухе, горит ярким пламенем, напоминая
бенгальский огонь.
Случается, что будучи взорван на открытом воздухе — не дает
полного взрыва, но в прочной оболочке или при хорошей забивке
он развивает полную свою силу без отказа.
К морозу относится безразлично и мало гигроскопичен.
Причина, почему в готовом виде он не может храниться про-
должительное время, заключается в том, что из него улетучивается
мононитробензол.
Он сравнительно не дорог; 1 пуд готового рэкка-рокка до войны
обходился около 25 рублей.
*) В Австрии рэкка-рокком снаряжена была часть ручных гранат и снарядов
s. к траншейным орудиям, причем они перевозились и, насколько известно, взрывов
их, под влиянием толчков и ударов не было.
*♦) Подобная разница во времени зависит, главным образом, от температуры,
так как с понижением ее мпрбановое масло густеет и поглощается бертолетовой
солью, в таком виде, очень медленно.
— 624 —
В 1885 году при уничтожении подводных рифов Flood Воск в
Hell' Gate в Ныо-Иорке генералом Newton’oM израсходовано было
240.399 фунт, рэкка-рокка и 42.331 фунт динамита, причем состав
того сорта рэкка-рокка, которым пользовались при этих работах, был
следующий: 1
Бертолетовой соли...........23,5°/,,
< Нитробензола.....................76,5 „.
Такой состав • рэкка-рокка представляется исключительным*),
чаще же применяющиеся на практике сорта содержат одну часть
мононитробензола на 3—4 весовых частей бертолетовой соли, иногда
же эта пропорция определяется в 1: (4—5).
В состав некоторых сортов рэкка-рокка входит немного серы, а
также марганцево-кислого калия.
Известны сорта рэкка-рокка, содержащие на 3,54 частей берто-
летовой соли 1 часть сероуглерода (21 о по В‘), иногда же в состав их
входит и каменноугольное масло.
Рэкка-рокк представляет некоторое сходство с порохами двойного
действия, предложенным Тюрпеном в 1886 году, о коих уже упоми-
налось раньше.
2 Саме Взрывчатое вещество, сходное по составу с рэкка-
мсои' рокком.
_ „ , , Медзяикат очень похож на рэкка-рокк и
’ г к часто применяется у нас в каменоломнях из-за
простоты * состава.
Это бинарная смесь:
90% бертолетовой соли,
10 „ керосина.
Керосин может быть заменен нефтью.
Он также приготовляется непосредственно перед употреблением
в дело; породы не дробит.
Барбауит по своему составу похож на медзянкит. В Германии
разрешен для провоза по железным дорогам лишь с известными огра-
ничениями. Он состоит из: 90—92% хлората калия, 10—8% особых
сортов керосина с высокой точкой кипения.
4. Взрывчатый кпорат.
Состав в том же роде представляет „взрывчатый
хлорат1'. Состав его следующий:
66° 0 хлората калия,
22 „ веществ богатых углеродом,
12 „ связывающих веществ (цемент).
Последняя группа прибавляется в виде водного раствора, который
затем отвердевает. Смешивание, поэтому, достаточно безопасно. „Взрыв-
•) Он заимствован из „Vocabulario di polveri ed explosivi*' F. Salvati.
чатый хлорат" употребляется как в зерненном, так и в спрессованном
виде.
Еще в 1871 г. Шпренгелем указан был взрывчатый
состав, в. котором сжигающим веществом служит бертоле-
сгорающим-же служит смесь
нитробензола, скипидара и
или 60:15:25. Напитывание
перед самым употреблением.
’ _ Почтя одновременно с рэкка-рокком, Виннером бы-
. елыи поре? ло ПредЛожено взрывчатое вещество, получившее назва-
инн ₽ ’ ние белого пороха Виннера.
По составу оно близко подходит к рэкка-рокку, представляя из
себя также смесь мононитробензола с бертолетовой солью. Последняя
спрессовывается в цилиндрические патроны диаметром 0,875 и высо-
тою 3,5 дюйма, весящие около 12 золотников. Патроны предназначен-
ные для взрыва в сухих местах, обертываются в бумагу, а те, кото-
рые предназначены для взрывов в воде — заключаются в жестяные
коробки с отверстием для капсюля. -
Перед употреблением их в дело, патроны пропитываются нитро-
бензолом при помощи* простого погружения их в эту жидкость, где
они оставляются не меньше 3-х часов, так как, благодаря большой
плотности спрессованной бертолетовой соли, проникновение внутрь
патрона мирбанового масла весьма медленно.
В промышленности белый порох Виннера применяется преимуще-
ственно при порохостре'льных работах в' скале и дает хорошие резуль-
таты. В продаже на каждые 32 фунт, патронов, полагается 8 фунт,
нитробензола.
6. Прометей.
товая соль (в количестве от 80 до 95%) в смеси с 5—z0% перекиси
марганца
нефтяного масла в пропорции 50:20:30,
предполагалось делать непосредственно
Состав этот назван Прометеем.
Прометей во Франции существует
вещества с маркой „О № 3й.
Патроны с сухой смесью поглощают, при погружении их в жид-
кое сгорающее, от 8% до 13% его. Эта-то неодинаковость впитывания
жидкого сгорающего готовым к. употреблению препаратом составляет
их главнейший недостаток, обусловливающий различие взрывчатого
эффекта.
Употребление прометен в России предложено было в 1896 году
'Степановым. Поглотителем у него фигурирует тоже бертолетовая соль,
с примесью перекиси марганца, жидкостью-же служит смесь 2Оо/°
нитробензола, 30% скипидара и 50% нефти. Изобретателем жидкость
эта названа „вулканическим маслом".
Бертолетовая соль спрессована в патроны диаметром от 1 до
1,5 дюйма. Патроны до напитывания их не горючи, жидкость-же
хотя от огня и загорается, но сама по себе не взрывчата.
В течение получаса или 40 минут патроны, будучи погружены
в жидкость, напитывают ее в себя около 10% своего веса.
, Избыток жидкости сверх этой нормы уменьшает силу взрывчатого,
вещества, потому обыкновенно патроны, помещенные в сосуде, обли-
ваются отмеренным заранее количеством жидкой смеси.
На воздухе Прометей даже при капсюле с 2 граммами гремучей
ртути по большей части дает только неполные взрывы, в шпурах же
Проф. 7И. Сухаревский, Взрывчатые вещества и взрывные работы. 40
под названием взрывчатою
626 —
при хорошей забивке—взрывы полные и сильные, сходные с дина-
митными, К удару и трению он чувствителен в меньшей степени, чем
рэкка-рокк и белый порох Виннера. При морозе патроны его не за-
мерзают, но в сильно охлажденном виде он еще менее чувствителен
к трению и удару. Мало гигроскопичен; подмокшие патроны можно
просушивать.
Температура газов, развивающихся при взрыве, выше точки
воспламенения рудничного газа, почему в копях с таковым его при-
менять не следует. С выгодой применяется в каменноломнях, ибо
мало дробит породу. Довольно дешев.
Для надежного взрыва Прометея изобретатель рекомендует за-
менять обыкновенные капсюля с гремучей ртутью специальными
составами:
а) Особыми капсюлями, состоящими из 40% бертолетовой соли,
40% смеси пикратов калия и свинца и 20% целлоидина, (вещества,
сходного с целюллоидом).
б) Запальными пластинками, содержащими бертолетовую соль,
пикраты и около 40% пироксилина.
Предложенные изобретателем капсюля оказались действующими
надежно только в тех случаях, когда заряды находились в буровых
скважинах при хорошей забивке; пластинки же действовали хуже, не
всегда давая полные взрывы.
7. Усовершенство- В 1899 году Кирсановым было предложено взрыв-
ванный лрометвй. чатое вещество, сходное по составу и одинаковое по-
Действию с Прометеем. Оно им названо усовершенствованным Про-
метеем. В составе его, вместо перекиси марганца, введено 20% мар-
ганцовокислого калия, а в жидкости не заключается нефти, за счет
которой увеличено количество нитробензола. Состав последней сле-
дующий:
70% нитробензола,
зо „ скипидара.
8 Цвет Офицером болгарской службы Величковым была предло-
’ жена смесь бертолетовой соли с нитро производными, обладающая
большим метательным действием, хотя по силе значительно уступающая
пироксилину. Она оказалась удобной для порохострельных работ, так ,
как мало дробит породу. Состав ее следующий:
80% бертолетовой соли,
12 „ динитротолуола,
3 г нитробензола,
3 „ нитронафталина,
2 „ терпинтина.
Помимо этого, существуют еще три варианта „1Хвета“:
№ 2. 80% бертолетовой соли; '•
16 „ нитробензола,
3 „ густого венецианского скипидара,
1 „ пикриновой кислоты.
Подогретый скипидар смешивают с нитробензолом и затем
прибавляют бертолетовую соль: -
*
Бертолетовой соли
Динитротолуола ;
Нитробензола
/ 1 ” i у
Пикриновой
•*
№ з
80%
№ 4
80%
5Я
л
ЛЬ'
15 „
...
•4*
i. Горячий дини^рото^Д ®
всыпают бертолет0вую:.ео^^^|
жения ручных ‘т^ДвиИр^*9^
§ 15. Шздднты.%^4
толетовая соль,,,
Во Франции
заключающие
хлорной кислоты
Щеддиты
Е: A. Street’oit
полу чили., от' имени’'
тым нитробензолом и
И Кз 4 для снаря-
элеё распространенные взрыв-
тех, в состав которых входит бер-
Ы: шеддитов разумеют все вещества,
щелочных металлов и щелочные соли
^до^аты. < .
}Цы сравнительно недавно—около 1906 года
Ж Corbin et C-ie. Название свое шеддиты
ЙолЁшоГЬ Городка Chedd в Haute Savoie.
_ вавДЯЮт собой порошковатые, мелкозернистого
'Строения вещей^ жевтого цвета, обладающие некоторою пластич-
жостью;'-;.Р^%с?ч;;'.:-:.'.'
НеКОт^й®да|Ы1пщДДитов для более наглядного различия окра-
шиваютоДувйй^ЙН^енно В черный, синий, лиловый и другие цвета*),
щеддитов имеет очень важное значение в смысле
влияния её на скорость детонации. Эта скорость возрастает с увели-
^^чениём,Й£0ТнЬсти, только до известного предела, после которого она
^стро падает. Таким образом, та Плотность, до которой спрессован
ш№Шт, Дайеко не безразлична в отношении эффекта его взрыва.
т£ толчкам и ударам шеддиты практически довольно мало чув-
ствительны, причем, если последние достигают иногда опасных пре-
делов, то шеддит дает только местный взрыв, не распространяющийся
на соседние части, чаще же всего при этом происходит только воспла-
менений (например, под влиянием удара ружейной пули).
'••*) Это главным образом относится к „шеддитам", изготовляющимся во Франции
й представляющим в сущности уже перхлораты. Дело в том, что замечено, что при
ярко окрашенном шеддите частички сжигающего, дурно покрытые обволакивающим,
ясно выделяются на общем фоне своим белым цветом. Подобные частицы, обладая,
сравнительно с остальной массой смеси, значительно более повышенной чувстви-
тельностью к механическим влияниям, могут легко послужить причиной несчастного
случая. Таким образом ровный яркий цвет исскуственно-окрашенных шеддитов служит
одним из положительных признаков их доброкачественности.
40*
В отношении перевозки шеддиты во Франции относятся к одной
категории с черным порохом, хотя безусловно много безопаснее его.
Для взрыва шеддита требуется сильный капсюль, не менее как
с 1,5 —2,0 граммами гремучей ртути.
Большие заряды шеддита рекомендуют взрывать посредством
мелинитового, или эквивалентного ему по мощности детонатора.
Нагревание до 80°С. шеддиты переносят совершенно свободно.
Рецептов, по которым готовят шеддиты, много. В Германии
наиболее ходкими шеддитами являются следующие:
I i Тип 41 1 новый. Тип 60 старый. Тип 6о новый. Тип 60 II.
Хлорат калия 79 1 80 79
„ натрия — — — - 75
Динитротолуол .... - 2 15 19
Нитронафталин .... 15 10 1 1
Кастор, масло 1 6 8 ! i и* а 5
Более употребительны последние 2 сорта.
Во Франции его приготовляют на заводе в Вонже,
пускаемые оттуда шеддиты имеют следующий состав: ..
причем вы-
Бертолетовой соли ............
Хлорноватокислого натрия . . . .
Касторового масла ........
Мононитронафталина............
Динитротолуола................
Парафина.............• . . . .
Вазелина .... ................
До-военная цена за кгр. франков .
0.1 41 0.1 60 bis. 0.2 60 bis М. 0.5 S.
80 80 79
79 90
8 5 5 Jf
12 13 1 / Ч I"** —
— 2 15 16 i
"
— - —— 3
2,10 2,10 2,30 1 1 —
Из этих пяти сортов—последние два наиболее ходкие во Франции.
Шеддит „0.5“ называется также „шеддитом № 1“, а „0.2“ носит
название „шеддита № 4“.
Шеддит „0.1“ (тип 41) действует на породу преимущественно
раскалывающим образом, „0.2“ гораздо сильнее, а „0.5“ наиболее сильно.
Действие последних двух сортов напоминает уже взрыв динамита № 1.
Скорость детонации шеддита „0.1“ была определена Lheur’oM и
оказалось равной 3175 метров в секунду, т.-е. почти «вдвое меньше,
чем мелинита, гремучего студня и других, а сорта „0.2“ 2750 метров
в секунду.
Шеддиты, содержащие вместо бертолетовой соли хлорноватокислый
натрий, довольно сильно гигроскопичны, но зато дешевле; применение,
однако, к ним хорошо пропарафинированных оболочек делает натриевые
шеддиты практически также применимыми для надобности горнопро-
мышленности.
Все шеддиты не принадлежат к антигризутным веществам.
Во время Европейской войны шеддиты применялись немцами для
. снаряжения артиллерийских снарядов, но в таком случае в них вводился
добавочный флегматизатор. Взрыв таких снарядов .характеризовался
зеленовато-белым дымом.
Еще до войны во Франции пробовали ив шеддитов приготовлять
шашки для подрывных работ, но произведенные с. ними опыты не
показали превосходства этого взрывчатого вещества перед нитропро-
изводными ароматического ряда, за исключением отсутствия в про-
дуктах взрыва шеддитов ядовитых газов, к тому же они все-таки до
известной степени чувствительны к попаданию ружейной пули, почему
эти опыты были оставлены.
В минувшую Европейскую войну шеддиты применялись в до-
вольно обширном размере для снаряжения артиллерийских снарядов,
в аэропланных бомбах, ручных гранатах, а также в подрывном деле.
б) Технология шеддитов заключается в общих чертах в сле-
дующем:
Нитропроизводные растворяются при нагревании до 80°С. в ка-
сторовом масле и в полученную жидкость вносят измельченную и
просеянную бертолетовую соль, предварительно высушенную и подо-
гретую приблизительно до той же температуры. В течение всего вре-
мени прибавки бертолетовой соли не перестают мешать массу деревян-
ными лопаточками; таким образом, смешивание производится в течение
10 минут, причем; количество массы, находящейся в работе, обыкно-
венно не превосходит 25 килограммов.
Далее готовая смесь переносится в другое полухолодное здание,
где в течение следующих 10 минут охлаждается и принимает зерни-
стое строение. При этом наблюдается, чтобы не было в ней частиц
бертолетовой соли, не покрытых маслянной смесью. Затем шеддит
просеивается и смешивается с порциями предыдущих заготовок и
затем патронируется.
Размер патронов различный, часто из него делают цилиндриче-
ские патроны диаметром 2,5 см. и высотой в 22 см., причем пат-
роны шеддита „0.2“ весят около 135 граммов. Они заключены, в обо-
лочку из простой, чаще же пропарафинированнрй бумаги; есть также
патроны в металлических гильзах, причем иногда бывают патроны
не цилиндрической формы (например, полуфунтовые подрывные пат-
роны в четырехугольны! жестянках и пр.)
— 630 —
В горных работах шеддиты выгодно применять при не особенна
твердых породах, где действие их лучше такового же мелинита почти
'на 15%, но в твердых породах они действуют процентов на 20 слабее
мелинита.
При подрывных работах открытыми зарядами, шеддиты заметно
уступают по силе пироксилину, мелиниту и толу.
С течением времени при хранении, шеддиты несколько слежи-
ваются и чувствительность их к капсюлю несколько понижается.
, _ .. Во Франции под названием шеддитов так же
применяются вещества, носящие марку „0.4 , со-
стоящие из 90% бертолетовой соли и 10% парафина. Они предложены
были Lheur’oM и носят иногда, название взрывчатых,
ее ществ Lheur а.
так называемые
вещества, содер-
также: керосин,
о м К шеддитам, очень близки
2. Менелиты или взрыв- Щ * 1
л-иг менелиты. Ото суть взрывчатые
* ” жащие, кроме бертолетовой если,
вазелин, парафин, иногда смолы и т. п. Они приготовляются во Фран-
ции на заводе в Вонже и существуют под названием взрывчатых
веществ „0.6®. Вот состав некоторых*из них:
Бертолетовой соли ..... :
i
Тяжелых нефтяных масел. . !
Вазелина.................
Парафина. ...............
Вару.....................
907.,
3
Во взрывчатых веществах типа шеддитов, вазелин и парафин
играют ту же роль, как и касторовое масло: они придают веществу
пластичность и одновременно с тем служат флегматизаторами.
Эти вещества, предложенные Тюрпэном, имеют
3. Пиродиалиты. еходный с менеЛитами состав.
__ К числу взрывчатых веществ, богатых берто-
. о югу ее i е. летовой солью и содержащих в качестве обволакиваю-
щих (флегматизаторов) не касторовое масло, можно причислить так
называемые Colliery—Steelit’H. Имеется несколько сортов этих взрывча-
тых веществ, характеризующихся присутствием в них окисленной
смолы, служащей обволакивающим для частичек бертолетовой соли.
Эти взрывчатые вещества состоят из:
/ . № 3 i № 5
Бертолетовой соли „Окисленной смолы" .... Косторового масла ..... Аллюминия \ Ч, 1 от 72,5% до 75,5%- „ 23,5 , „ 26,5 „ ’ п 0,5 „ ч 1,0 „ . 75% 25 „ 79,2% 15,8 „ 5 „
„Окисленная смола" приготовляется таким образом: 9 частей ис-
тертой в порошок канифоли смешивается с одной частью крахмала,
полученная смесь нитруется азотной кислотой удельного веса 1,41
в присутствии серной кислоты при обыкновенной температуре. По
окончании процесса получается желтая аморфная масса, плавающая
над кислотой. Она вынимается, измельчается и промывается, затем
сушится без нагревания. Она не взрывчата и загорается с трудом.
Это вещество смешивается с бертолетовой солью в барабанах
с деревянными шариками.
Готовая масса выкладывается порциями в 1—5 килограмм на
цинковые листы, смачивается и'перемешивается особыми присшсоб-
лениями в роде грабель, пока не обратится в тесто, которое оставляют
высыхать на деревянных подкладках. ;
Colliery—Steelite в Англии принадлежит к числу „дозволенных"
веществ для употребления в горном деле „в газовой атмосфере
5 Это суть взрывчатые вещества, в которых на ряду
. э омиты. с преобладающим количеством бертолетовой соли, содер-
жатся: сало, динитробензол и нитропроизводные толуола.
. _ Жирар предложил ряд взрывчатых смесей,
’тшГжи1* а*Щв состоящих 113 бертолетовой соли с различными
ства ирара. нитропроизводными и азо-соединениями, имею-
щими подходящую температуру плавления.
Для увеличения детонационной способности хлорат-
ных взрыввеществ к ним иногда подмешивают нитро-
глицерин и нитроцеллулозу, в особенности при применении
слабо нитрованных ароматических соединений. Так, Альбиты (альбит,
веттеральбит, коленальбит) состоят из: .
7. Нльбит и
Кивит.
64—68% хлората калия
2—13 „ моно-и динитронафталина,
3— 4 „ опилок (древесной муки),
3 „ нитроглицерина, наряду с нафталином и антигри-
зутными примесями.
— 632 —
Кивит состоит из подобных-же веществ, только вместо нитро-
глицерина берется 4°/о пироксилина.
8. Коронит и
Фаворит.
Коронит и Фаворит по своему составу подобны пред-
идущим, и также содержат и нитроглицерин. Кроме
того в продаже существуют еще корониты (гештейнкоронит
X, Хк и 7бв), содержащие хлораты калия и натрия в различных со-
отношениях (вместе от 65 до 80%), причем при наличии хлората
калия, также и нитроглицерин (1 — 5%). Количество последнего
будет тем больше, чем больше хлората калия и чем меньше хлората
натрия входит в смесь.
Нижеследующая таблица показывает составы некоторых из них:
1 j Колен коронит. J Веттер I коронит.1 Гештейн- коронит. Бал- ДУрит Фаворит.
I IV j V 1 " 1 XI 16 i S * 1 19 <> 1 1 ®/о А °/о в °/о с 1 % д °/о
Хлорат калия . . . 3. 64 66,5 62 60 — - 78 65 65 65,5 67
„ натрия . . . 31 —' — i 85 j 80 —. 11 —- — ——-
Нитроглицерин . . . 1 4 (жел.) 4 ' — ———- 4 желет 3 1 и —
Динитротолуол . . . ! i 7,5 j 1 7 i 8 * > 1 1 । 5 10 нитр. ,ме- ; танит!ро-! толуоил 1 :}11 3 4
Динитронафталин .| i Нитронафталин . . . 1 1 7 г 1 i 3 •i J ? ( " 1 ! । 1 |10 * |‘>э 5 3,5
Нафталин . . . * . —~ 4 1 1 1 5 : сырой антра- цен — 1 1 — 1 1 } — —
Древесная мука . . \ 1 4 3,5 1 4 4 "—- Г I 4 1 э 4-
Растительная мука . Уголь i 1 " '* i “ 1 1 3,5 1 5 ! ) 3 — ! 1 1 1 ( j 1 — j j
Парафин 3,5 2,5 2,5 —« 5 i 5 I 0.5 ! 0,5 । j
Дегтярное масло . . — 1,5 1,5 1 —* 1 '— ’ ’ — , I ! ——- ! । —* 1
Жировые вещества , — 1 1 1 у i . i 1 I > — ! ___ 0,5 — i 0,5 1 * 1 0,5 1
Хлористые щелочи . 26 ; 16 повар. ! соль 1 16 1 23 камеи соль 24,5 I I i I 1 20 1 1 21 i t i j 20 натрий хло- } РИД. 21 калий хло- рид.
~ „ Несколько особо стоят взрывчатые смеси, состоя-
щества содержащие Щие из бертолетовом соли или калиевои селитры
бертолетовую сопь о ксимтоъеио&окислым *килием.
с ксантогеновокис- Как известно, ксантогеновокислые щелочи до-
пым капнем. вольно легко получаются совместным действием не-
которых спиртов и эфиров при помощи смеси едких щелочей с серо-
углеродом—веществ дешевых. Сравнительная дешевизна продуктов,
из которых они таким образом готовятся, и сильно взрывчатые свой-
ства подобных смесей навели на мысль прйменения их в качестве
порохов. Т
В свое время Шварцом предложено было несколько таких порохов,
а именно:
Калиевой селитры . . . ।.
КсантогеновокислогО калия
Хлорноватокислого калия.
Угля..................* .
68,5%
27,4'
68,7%
64,20%
33,9
3,92
й
75 „
Все эти смеси гораздо сильнее черного пороха, но не получили
распространения, благодаря слишком большой чувствительности к
механическим влияниям. Как в этом отношении, так и в отношении
мощности, последний сорт сильно выдается перед остальными тремя.
Примечание. Большинство смесей бертолетовой соли или
калиевой селитры с феноле — и бензоло-моно — и — ди-су'Льфово-ки-
слыми щелочами и аммонием представляют из себя сильно взрыв-
чатые вещества, к сожалению, очень чувствительные к механи-
ческим влияниям, почему до сих пор практического применения
не получившие.
§ 15. Теперь обратимся к другой категории „шеддитов", содер-
жащих по преимуществу перхлораты, т. е. щелочные соли хлорной
кислоты, называемые перхлоратами. По своим свойствам они довольно
близко стоят к веществам, содержащим бертолетовую соль.
На применение перхлоратов к баллистическим порохам Нобель
еще в 1885 году взял,патент. Содержа еще большее количество ки-
слорода, чем хлорноватые соли, перхлораты способны давать еще
больший об'ем газов при взрыве, но обладают общим недостатком —
недостаточной чувствительностью к капсюлю и склонностью к непол-
ным взрывам.
Во Франции смеси, содержащие перхлораты, пробовали приме-
нять между прочим для снаряжения артиллерийских снарядов орудий
дальнего боя, но они так же, как и смеси с бертолетовой солью, без
введения в них специальных флегматизаторов, не признаны были
для этой цели в достаточной мере безопасными; впрочем ими иногда
— 634 ——
снаряжались, также как и обыкновенными шеддитами, снаряды ору-
дий ближнего боя (минометные, бомбометные и проч.).
Из перхлоратов наибольший интерес представляет перхлорат
аммония, более других чувствительный к капсюлю и дающий весьма
большой об‘ем газов. Его недостаток—образование при взрыве значи-
тельного количества соляной кислоты, что делает его неудобным
для применения в рудниках, если не принимать специальных мер
к переводу выделяющейся соляной кислоты в какое-либо твердое,
непахучее соединение.
Перхлорат аммония сам по себе представляет взрывчатое веще-
ство, но он детонирует с трудом и, обыкновенно, частично. При
обыкновенной температуре он постоянен, а при 150°, разлагается
по уравнению:
ХН4 . C1O4=C1+O3+N + 2H2O.
Реакция повидимому автокаталитическая.
Настоятельно необходимо, чтобы перхлорат аммония ни в каком
случае не соприкасался с хлорноватыми солями калия и натрия, во
избежание крайне опасного двойного разложения его с образованием
хлорноватокислого аммония.
Перхлорат аммония почти столь-же и чувствителен к ударам,
как и пикриновая кислота.
С увеличением плотности, скорость детонации сперва возра-
стает, но только до известного предела, после которого она быстро
падает.
К веществам, содержащим перхлораты, принадлежат: некоторые
специальные карбониты*), ионскиты, альматрит и много других.
Из перхлоратов, в 1906—1907 гг. были исследованы Французской
, Правительственной Комиссией между прочим:
„Тип 1-й“.
82% перхлората аммония,
13% динитротолуола,
5% рицинового масла.
„Тип П-йи.
50 ч перхлората аммония,
30 о натриевой селитры,
15% динйтротолуола,
5®/о касторового масла.
В смысле безопасности фабрикации и хранения, они одинаковы
с прочими шеддитами, но при взрыве дают большое количество газо-
образного хлористого водорода (особенно „Тип 1-й“, который при
взрыве одного килограмма вещества дает 150 литров этого газа, между
тем как „Тип П-й“—лишь 16 литров газообразного хлористого водорода.
*) Venin A. Chesneau. Explosifs. (1914 г.), Р. 361. В сущности же это пермониты.
. —. 635 - -
При хранении они твердеют легче обыкновенных шеддитов и,
затвердев, обнаруживают наклонность давать неполные взрывы. С целью
уменьшить вероятность таковых, патроны их так же, как и шеддита,
рекомендуется перед употреблением несколько разминать пальцами,
если это представляется только возможным. При таких предосторо-
жностях вероятность получения неполного взрыва значительно ослаб-,
ляется, особенно для „Типа 1-го“, в отношении же „Типа П-го“ это
достигает цели несколько реже.
„Тип 1-й“ по силе близок к гремучему студню, а „Тип 2-й“—
почти одинаков с «Фениксом».
Скорость распространения детонационной волны достигает для
этих типов соответственно: 4.020 метров в сек. для „Типа 1-го“ И
3361 метр—для „Типа 11-го“, сильно уменьшаясь с увеличением плот-
ности. . ’
„Предельная плотность" не должна превосходить 1,33—1,38, ибо
при уплотнении и отвердевании при хранении, эти шеддиты'легко
переступают этот предел. При плотностях, близких к „предельным"
чувствительность к; капсюлю этих шеддитов , сильно понижается, а
потому является бблыпая вероятность получения неполных взрывов.
Эти-то недостаткй ограничивают применение подобных взрывча-
тых веществ на практике, не взирая даже на их большую силу.
б) Во время Европейской войны, ввиду недостатка во Франции
азотной и серной кислот, в состав шеддитов редко вводили нитро-
производные в качестве сгорающего, заменяя их чаще вазелином и
парафином. Так, например, для снаряжения бомб системы генерала
Дюмезиля, применяли состав „Ch", или „86/14", содержащий:*)
8б°/о перхлората аммония,
14% параффина.
Инженерное ведомство во Франции применяет для минных и
подрывных работ, а также для снаряжения ручных гранат, аэроплан-
ных бомб и снарядов орудий ближнего боя, взрывчатое вещество
марки „0. Л» 6 В“; состоящее из:
90% бертолетовой соли,
7% парафина,
3% вазелина.
Кроме этого приготовляются следующие составы:
/ * Перхлората аммония. Парафина. Вазелина. Натриевой селитры.
! Взрывч. вещ. „90/10“ i Е“ i » » »-LJ . P“ 1 » ” 5»1 S" 1 3? » ” 1 90% 92% 61,5% 90%*) 10% 8% 8,5%. 70/ * /о . 3% “ Ч “ J 11 30%
*) М. Р. Corbin. Explosifs chlorates et perchlorates. 1915. 2-e Edition.
♦) Хлорновато-кислый натрий.
В этих шеддитах, равно как и во всех препаратах этого сорта,
однородность смеси, т.-е. полное обволакивание частиц сжигающего
сгорающим флегматизатором, играет первенствующую роль в смысле
безопасности обращения со смесью, почему они и окрашиваются в
темные цвета, так как при этом неполная однородность смеси обна-
руживается существованием более светло окрашенных мест и пятен.
Точка воспламенения этих шеддитов лежит между 250°—300°С.
Весьма близкими с ними по составу являются:
III е д д и т ы.
Тип В. Тип С.
Перхлорат аммония
Нитрат натрия . .
Динитротолуол
Касторовое масло .
50
30
15
5
Шеддиты „86/14“, 90/10 и „Е“ сгорают весьма быстро и легко
воспламеняются, а „Р“, „О. № 6 В“ и ,,S“ почти вовсе не горят и
трудно воспламеняются. Если даже их с большим трудом и удается
иногда зажечь спичкой, то они тотчас же гаснут по удалении пламени.
Все таки из последних сравнительно легче воспламеняется „0. № 6 В“.
Если эти вещества заключены в прочные оболочки, то получа-
ются иные данные. Здесь; как и везде, замечается большая зависимость
быстроты сгорания от давления. Под достаточным давлением взрыв-
чатое вещество, не загорающееся при обыкновенных условиях, будучи
нагрето до надлежащей температуры, может развить очень быстрое
сгорание. Это может иметь место, например, в снарядах, если взры-
ватель недостаточно силен для того, чтобы вызвать полную детонацию
всего заряда; в таком случае он вызывает только его частичное
сгорание.
При подобных условиях тип «8» может дать место полному сго-
ранию невзорвавшейся части, хотя сравнительно медленное, с обра-
зованием обильного белого дыма. Также точно, если предварительно
подогреть всю массу взрывчатого вещества, то даже трудно загора-
ющаяся смесь, воспламенившаяся в одном месте, гораздо легче заго-
рается во всей своей массе.
Скорость сгорания на открытом воздухе также сильно зависит
от массы воспламенившегося взрывчатого вещества и его плотности:
вещества „86/14“, „90/10“ и ,Е“, будучи сильно спрессованы в виде
цилиндриков, горят медленно, если они зажжены извне; это же явле-
ние совершается значительно с большой быстротой и даже может за-
вершиться взрывом, если горение началось со средины массы. Во вся-
ком случае все работы с этими шеддитами должны вестись вдали от
всякого пламени, чтобы была совершенно исключена возможность по-
явления искры.
е
в
t В отношении чувствительности к толчкам и ударам эти взрыв-
чатые вещества располагаются в нижеследующем порядке:* *)
1-
я.
J.
Тол 100 см.
Мелинит . . . 40 „
„90/10“ . . . 27 „
Е “ . . „и . зо „
„86/14“ . . . 38 „
„0. № 6 В“ . . 45 „
„Р“ 50 „
,,S“ ..... 60 „
'КО
’ и
гея
1И.
В“.
ча-
сть
ыв-
гчи
рое
ры-
1ИЮ
ное
Вго-
5ра-
[ЬНО
ора-
аго-
гсит
ictii:
шде
Вле-
? за-
вся-
и от
> по-
Ружейная пуля, попавшая с расстояния 10 метров, первый раз не
вызывает взрыва, вторичное же попадание ее в одно и тоже место
может повлечь за собой взрыв. Последний же может иметь место и
при первом же попадании ружейной пули в состав, заключенный в
прочную оболочку *).
Свойства детонировать на расстоянии незначительно. Взрыв 77 мм,
бризантного снаряда не вызвал взрыва в двух таких же снарядах, на-
ходящихся с ним в соприкосновении и снаряженных составами „86/14“
и „Р“ (но, конечно, в них не было взрывателей), хотя самые снаряды
были разбиты и отброшены на расстоянии 10 метров; с другой сто-
роны, взрыв бомбы Дюмезиля, снаряженной 6-ю килогр. „86/14“, прои-
сшедший по близости другой такой же бомбы, в разстоянии 25—30
с/м. взорвал и ее.
Во Франции вещества эти считаются безопасными применении
их к снарядам орудий, необладающих большими начальными скоро-
стями (например, аэропланных бомб, ручных гранат и пр.). Для сна-
рядов траншейных орудий составы „86/14“—„90/10“, „Е“, „Р“ и ,,S“, ока-
зались также вполне применимыми, в нарезных же „86/14“ и „Р“.
дали результаты отрицательные.
Способность детонировать, или степень легкости взрывания кап-
сюлем и детонаторами в них сильно зависит, как от плотности заря-
дов, так и от давления, а также от формы заряда.
„Предельная плотность'' (т.-е., та плотность, превзойдя которую
заряд не даст полного взрыва) для этих веществ следующая:
„86/14“ 0,91 „Е“ 1,08
„90/10“ 0,95 „О № 6 В“ 1,15
„Р“ 1,00 ,,S“ 1,35
• *) Цифры эти получены из опыта падения стальной бабы весом в 5 килгр.
При этой пробе за высоту падения принимается та, при которой при 10 испытаниях
не получается ни одного взрыва. Другие принимают за высоту ту, которая соответ-
ствует 5 взрывам и 5 отказам.
*) Явления эти могут быть об'яснены тем, что в первом случав пуля, при
первом своем попадании, обнажает частички перхлората от обвалакивающего, делая
их уже чувствительными к ударам, во-втором же случае—влиянием нагревания
пули при прохождении сквозь прочную оболочку.
Скорости распространения детонационной волны при „предель-
ных плотностях" этих взрывчатых смесей выражаются так:
„Е“ 3200 метров в секунду.
„90/10“ 3400 я я
„86'14“ 3700 я я я
Р“ тч J- 2500 11 V
0 Л» 6 В“ 3200 я я я
3700 11 1?
При взрыве в неизменяемом пространстве (например, в артилле-
рийских снарядах), получаются совершенно другие данные: с увели-
чением давления—скорости детонации возрастают, также относятся ве-
личины „предельных плотностей". Таким образом, но скорости рас-
пространения детонационной волны в воздухе, еще нельзя судить о
той же данной при взрыве в неизменяемом пространстве; Действи-
тельно; смесь „Р“ в последнем случае дает лучшие результаты, чем
„86/14“, тогда как на воздухе наблюдается совершенно обратное.
Некоторые из этих шеддитов для своего взрыва требуют вспомо-
гательных детонаторов, например, порошковатого тола и мелинита, а
вещество „Р“ надежнее всего взрывает от 2-х промежуточных дето-
наторов: меньшего—порошковатого мелинита и большего---порошко-
ватого тола; такой двойной детонатор (25 грм. мелинита и 75 грм.
тола), без отказа взрывает 725 грм. „Р“, имеющего плотность 1,67.
Мина Дюме шля, снаряженная шеддитом „86/14“ имеет также двой-
ной детонатор: один—из порошковатого плавленного мелинита, кото-
рый совместно с другим из плавленного—не порошковатого, действует
отлично в качестве возбудителя взрыва.
„Окончательные плотности" (т.-е. наибольшие плотности, кото-
рые можно сообщить данному веществу), значительно разнятся для
этих шеддитов от „предельных плотностей", так, например:
(„Предельная’
I плотность*.
„Окончательная
плотность*. '
„86/14“.
„90/10“
„Р“ и „Е“
0,95
1,0—1,08
1,15
1,69
1,75
1,91
2,05
В отношении бризантности, подвергнутые пробе Hesse на сжатие
свинцовых цилиндриков при взрыве заряда в 45,00 грм. капсюлем
№ 8, вещества эти располагаются в нижеследующем порядке:
На открытом воздухе, при плотностях близких к „предельным":
Мелинит............ . . . 1,0.
„86/14“, „90/10" и „Е“ . . 0,9.
„Р“..................0,8.
„О № 6 В“ и ,,S“ .... 0,7. , .
В снарядах и вообще в прочных оболочках:
Мелинит, „90/10“ и „Е“ . 1,0;
„Р“.....................0,7..
„86/14®. . . •.. . ... , . 0,5. Л .
„О № 6 В“ И „.< . . . .0,4. Л/
В смысле фугасного эффекта в земле вещества, взорванные без
прочных оболочек, располагаются в нижеследующем порядке:
4 I .1
Мелинит . . . . . .1.0.
Тол. . . ... . . . 1,0.
„86/14“ . ..........1,10.
„О № 6 В“............1,15.
„S. . ............ 1,20.
„Р“, „90/10“ и „Е“. . 1,30.
При бомбах же Дюмезиля, величина образуемых ими воронок,
относится между собою как:
„86/14“
Р“. .
„А.
1,00.
1.30.
1.05.
Газы от взрыва переносятся легко у „0. Л? 6 В“, „Р“ и „3“.
Составы „90/10 и „Е“ дают в составе газов много хлористого
водорода и переносятся с большим трудом.
Составы „90/10“, „Е“ и 86/14“ дают меньше всего дыма и он
менее всего заметен; „0. № 6 В® и ,,S“ дают больше дыму и он
заметнее.
Эти сорта шеддитов выдерживают нагревание без изменения до
50°С., начиная же с 52»С., парафин плавится и вещество прини-
мает тестообразную консистенцию. В таком виде оно менее чувстви-
тельно к детонаторам, но опаснее в обращении не делается. В подоб-
ных случаях придется прибегать к вспомогательным детонаторам в
роде порошкообразных мелинита или тола.
Влажности сорта „3“ и „Р“ боятся вследствие поглощения ее
содержащимися в них натриевыми солями, остальные боятся ее в
значительно меньшей степени. Отсыревши, эти шеддиты обладают
значительно более пониженной чувствительностью к детонаторам.
При цбдводных взрывах они требуют обязательно водоупорных
оболочек. При хранении затвердевают и потому перед (употреблением
— 640 —
подобные шеддиты полезно разминать между пальцами. Также точно
надо всячески избегать распыления' этих взрывчатых смесей, ибо их
пыль сильно взрывает от огня. Надлежит избегать деревянных полов
и линолеума,—
В обращении с ними, особенно при снаряжении снарядов этими
шеддитами, надлежит всячески стараться избегать скользящих уда-
ров, особенно при сортах: „86 14“, „90/10“ и ,.Е“.
При употреблении их для порохострельных работ в скале сле-
дует применять песчаную забивку. Длина ее должна быть от 0,5 до
0,66 длины заряда, однако, не менее 20 с. м., иначе она будет вы-
бита обратно.
Нельзя смешивать ни одною из веществ группы-. „86 14“, „90/10",
,,Е“ и ГР“ ни с одним веществом группы „8“ и „О. Л? 6 В".
Взрывчатое разложение этих смесей следует уравнениям:
а) Вещество „86/14"
731,8NH4C1O4 + 875СЩ = 87500, + 1177,2Н30 + 731,8МН4С1 + 572,8Н2.
Об‘ем газов (1 килограмм вещества, приведенный к 0° и 760 м. м.
давления) = 586,0 литров.
б) Вещество „90/10“
766NH4C1O4 + 625СН4 = 376HC14-390NH4Cl + 625СО, + 1814Н20 Д- 188N2.
Об'ем газов = 670,2 литра.
в) Вещество „Е“
817,7NH, . (Ж + 500СН4 = 817,7НС1 4 ’500ОО2 + 2226,5Н»О + 22,1 О-з +
Д- 408,8N2.
Об‘ем газов = 887,2 литра.
г) Вещество „Р“
523ХН4. СЮ4 + 353NaNOs + 531,2СН4 = 353NaCl 4- 170,4НС1 -J- 531,200, +
4- 2024Н20 4- 33,103 4* 438,2Е2.
06‘ем газов = 713,5 литров.
д) Вещество „0. № 6 В“
734,6КС1О3 4- 625СН4 = 734,6КС1 4- 62500,4- 953,8Н,О 4- 296,2Н2.
06‘ем газов = 418,5 литров.
е) Вещество „S“
845NaC103 + 625СН4 = 845NaCl -J- 625С0, 4- 125ОН,О 4- 17,5O2.
Об'ем газов = 422,5 литров *).
Известно, что формула парафина и вазелина соответствует общему выраже-
нию CrtHj/i-f- s, где п = 24 или 25, но для простоты расчетов взято СН4, т. е. п = 1.
Практически — это не имеет особого значения, ибо ошибка через это допущение не
лревосходит 4°/о.
— 641 —
1 Ионскиты § 76- Н°д этим названием предложен в Бельгии ряд
окениты. взрывчат. веществ, содержащих перхлорат аммония, селит-
ры и тол. Состав их разнообразный. Среди них есть антигризутные
и бризантные. Приводим состав некоторых, чаще других употребляю-
щихся на практике.
10 bis. 13 II
Перхлората аммония . . 22% 20% 15 %
Аммиачной селитры . . 30 „ 27 * п ^17,5 „
Натриевой селитры . . 15 „ 27» 30 „
Бариевой селитры . . . 6 „ 10 „
Тола 10 „ 20 „ 22 5
Поваренной соли .... 20 „ —
Сорт „10 bis.“, — антигризутный, — причем предельный его заряд
определен равным 900 граммам, Ч1О эквивалентно 540 грм. динамита
,¥ 1, сорт же „13“ бризантный.
Ионскиты были изучены французской Commission des Substances
Explosives и, по заключению ее, не представляют каких-либо заметных
преимуществ перед шеддитами.
Каст при испытании ионскита „ 13 'определит об’ем камеры разду-
тия при пробе Трауцля в 285 ст.3, а тля ионскита II—245 ст.3, в то
время как „шеддит тип 60 новый" дает—250 ст.3.
Нпь т ит В России под названием альматрита, во время войны,
пьматрит. щаитальским предложена была смесь перхлората аммо-
ния с разными углеродистыми веществами, как то: парафином, вазе-
лином, канифолью и проч., т. е. того самого рода, как и шеддиты —
„86/14“ „90/Ю“, „Е“ и „Р“.
Углеродистые вещества, вводимые им в состав, изобретатель на-
звал „цементом".
В некоторых сортах альматрита добавляется до 5% алюминия.
По силе альматрит уступает толу; фабричным путем пока не изготов-
лялся.
Бл тин Это есть BenJecTB0> почти белого ввета с еле заметным
' "atT н" желтоватым оттенком, мелко-зерниспл о строения, подобное
шеддитам, обладающее некоторой пластичностью. В состав его
Проф. М. Сухаревский. Взрывчатые вещества и взрывные работы. 41
9
в!одят перхлорат аммония (6О*/0) и натриевая селитра (22%), смешан-
ные со сгорающими: тринитротолуолом (1 l’/о) и парафином (7%).
4 Те ит В Швеции выпущено на рынок, предложенное Нау копф’ом
р₽ит' пластическое аммиачно-перхлоратное взрыввещество под наз-
ванием „террит", состоящее из:
43 % перхлората аммония,
28 „ нитрата натрия,
27,8 „ „жидкого* три—или динитротолуола,
1,2 „ коллодионного хлопка.
Это взрывчатое вещество, по наблюдениям Каста, при пробе
Трауцля дает об’ем камеры раздутия в 340 ст3 и при кубическом весе
1,67 скорость детонации в 4700 mt./c. Вследствие своей пластичности
и большой плотности (max. = 2,15) дает на воздухе частые отказы.
Поэтому был введен в его состав нитроглицерин, так что получилась
следующая смесь:
35 — 45 ч. перхлората аммония,
25 — 35 „ нитрата натрия,
10 — 20 „ нитроглицерина,
10 — 20 „ нитротолуола,
О— 5 „ нитробензола,
0,5 — 2,5 „ нитроцеллулозы,
О— 5 „ опилок.
Бельгийское взрыввещество амазит, разрешенное в
. мазит. днглии для работ в угольных копях, состоит из:
32 — 36 ч. перхлората аммония,
29 — 33 „ нитрата натрия,
30 — 36 „ плодов (сушеных) миробаланового дерева.
0,15— 0,5 „ " агар-агара,
О— 3,5 „ влажности.
6. Плавленные ам-
миачно перхлорат-
ные в. 8.
вление их, без
В Германии во время войны взяты патенты на
плавленные аммиачно - перхлоратные взрывчатые веще-
ства, которые, однако, в употребление не вошли. Изгото-
сомнения, опасно.
— 643 —
§ 17. Взрывчатые вещества из перхлората калия.
1. Пермониты и аль- Наиболее употребительными из взрывчатых ве-
казиты. щеетв, содержащих перхлорат калия, являются в
Германии пермонит и алькальзит. Пермонит введен также в Бельгии,
как антигризутное взрыввещество.
П е р м о н и Т. Алькальзит.
Г * - ° 9® Ф 1 • о Бель- Вет- >•/. Я Я I А
Ф НН <3 S X 1 я S S Для Анг »/. •1. •1.
Перхлорат калия -г 32,5 32,5 24,5 31—44 28 55
Нитрат аммония ..... . 32,5 34,5 29,5 41—44 25 9
> натрия 7 "ММ 30
Нитроглицерин ....... •— 3 6 — ' 1—
Тринитротолуол тверд. . . . 20 7 7 9-11 31
„ жид к. . . . — 5
Нитронафталин 1 11,5
Мука 4 4 4 lta —
Древесная мука 3 3 3 2-4
Крахмал —— 9—12 2,5 (картоф. мука). —
Смеси из { г } 1 Глицерин 7 ч.. . . J 1 1 1 — —
Хлористый натрий 15 25 —
Смола ... — " 2,5
Парафиновое масло Скорость детонации Проба Трауцля Чувствительн. к удару груза в 2 килограмма . . • . . . 3470 м/сек. 320 ст3 70 СМ. 2926 м/сек. 205 СП)3 30 см. 365 era3 20 CM. 0,5
Особый сорт пермонита, употреблявшийся ранее в Англии, с
1913 года уже более не изготовляется.
„Алькальзит В" отличается от„А“ содержанием натриевой селитры
И муки наряду с 5о°/о перхлората калия.
В бельгийском списке „Explosifs S. G. Р.“ кроме уже упомянутого
пермонита, который иногда обозначается также „пермонит В“, находится
и Pulverite состоящий из:
24 % перхлората калия,
30,5 „ аммиачной селитры,
7 „ тринитротолуола,
6 „ нитроглицерина,
0,5 „ коллодионного хлопка,
5 „ муки,
18 „ хлористаго натрия,
7 „ сернокислого аммония
2 „ сернокислого бария.
644 —
В английском „Permitted list", кроме уже упомянутых взрывчатых
веществ, иных перхлоратных взрывчатых веществ не включено.
присвоено название „Mischpulver*. Оно со-
2 Misdtpuiver* ® качестве разрывного снаряда для ручных гранат,
р ‘ в Германии в минувшую войну употреблялось взрывчатое
вещество, которому было
сюяло из:
12% перхлората калия,
5 п алюминиевого порошка,
83 я черного пороха.
Это взрывчатое вещество представляет смесь пер-
хлората калия с аммиачной селитрой, тринитротолуолом
иногда соответствующим количеством ди нитротолуола).
3. Персалит.
(заменяемом
мукой и т. п.
Пропорция отдельных составных частей изменяется в зависимости
от сорта, причем количество перхлората калия нсиревосхолиг 77%, с
другой же стороны наименьшее содержание в них амииачний селитры
4% количество ди—или тринитротолуола. 10%.
4. Веттер-пер^алит.
В епт ер • п epcaduni—со стоит и з:
35% перхлорат калия.
25 „ ароматических нитросоединений.
б „ нитро гл в це р и и а.
Кроме этих составных частей он содержит: муку. натриевую се-
литру и др. вещества. Есть сорта с меньшим содержанием перхлората
калия.
В Германии применяются также.
5. Ромиты I, II, III-
Ромиты 7, 77, III - состоящие из:
34-60,8
24
20—25
В 2— 4
частей перхлората калия.
„ кал пений, натриевой
селитр.
„ тринитротолуола.
„ хлопка.
и аммиачной
Кроме перечисленных составных частей в них заключаются: крах-
мал, вазелин, касторовое масло и нафталин. Они в Германии разре-
шены к перевозке по железным дорогам, с известными ограничениями.
Халалтг,— веттер,— колен — и гештейнхалалиты,
' ^алалить’- имеют состав сходный с персалитом.
*) Его не смешивать со смесью содержащей натриевую сплитру, о которой было
уже сказано раньше.
— 645 —
_ Гелит и перилит по своему составу близки к хала-
епит и перипит. литу? но содержат также 6% динитрохлоргидрина. В
подобном же роде «уть взрывчатые вещества хеаагон и перагон харак-
теризующиеся содержанием 4%—670* соединений цинкаи аллюминия.
8. Пергслориты и
Леониты.
Во время вО'<ны изготовлялись также Перхлориты
и Леониты, состав которых виден из ел. таблицы.
J,
i
Перхлорат калия. . .
Аммиачная селитра
Натриевая селитра . .
Нитроглицерин. . . .
Динитротолуол. . . .
Динитронафталин . .
Растительная мука. .
Мука. . . ..........
* 4 : «'•
Угр|ь...............
Хлориды едких щел.
* ; у-.. / ./ , < . "
* Ч *
Гештейн » П рХЛО- рит. % Berrep'iiepx лор и к I 4 0/ Гештейн леонит, о/ /o Нео-Леонит.
1 °/о 2 % I °/o п 7o
34 30 10 30 50—60 35 35
I 48 32 73,5 34 5-10 20 10
!- — 5 t — —- 3
’ • - — —- 1 4 (желат) 4 4
1 ((желат) (желат)
U1O (нитр 8 10 10 11
| метани- 1
трою- >10—15 (три— н ди — )
луол). I I 1
1 ( 4 — /
1 II — i — 1 5—10 4 э
6 3 1,5 3 1 3 9
2 1 1 —1
II-*** 23 10 22 24 * ——
i . (натр) * ((натр.)
Наподобие леонитов составлены некоторые сорта астралитов.
Это суть порошковатые, до некоторой степени пла-
. ердиты. стичеекие взрывчатые вещества, предложенные в Гер-
мании Кастом взамен донарита. изготовлявшиеся в большом количестве
немцами в течение 1915 и 1918 г.г. и применявшиеся как для снаряже-
ния ручных гранат, так и для подрывных работ.
Цвет их коричневый разных оттенков в зависимости от сорта.
Здесь приводится состав одного из наиболее распространенных
пердитов:
72°/0 аммиачной селитры.
10 „ перхлората калия.
15 „ жидкого динитротолуола.
3 „ древесной муки.
Есть сорта пердита, издающие сильный запах нитробензола.
Пердиты выдаются своим хорошим фугасным действием (об’ем пу-
стоты при пробе Трауцля определен был для вышеприведенного сорта
в 350 куб. с. м.), дробящее действие тоже настолько удовлетворительно,
что дает возможность их употреблять для подрывных работ.
Пердиты Отлично действуют в применении их к некоторым спе-
циальным горным работам. В общем они сильнее донаритов для за-
мены коих были предложены, к удару же столь же чувствительны
как и последние.
Гигроскопичны, а потому требуют хорошо пропарафиненых обо-
лочек.
В последнее время обнаружено, что стойкость их оставляет же-
лать много лучшего, так как констатированы были случаи их само-
произвольного взрыва, что конечно ограничивает возможность их даль-
нейшего сколько-нибудь широкого применения.
10. Кроме вышеуказанных существует еще целый ряд веществ, со-
держащих перхлорат калия и по составу близких к пермонитам. В состав
их входит иногда более значительное количество нитроглицерина и
древесной муки; аммиачная селитра в них заменена щавелево-кислым
аммонием, который не гигроскопичен; в некоторых тол заменен
динитротолуолом, что делает их трудно замерзающими.
Состав некоторых из них следующий:
1 2 3 4 5
Перхлората калия. .... 27 37 14 . 37,2 37,5
Нитроглицерина 32,5 21 40 22,5 19
Коллодионного хлопка. . . . 0,7 0,8 2,8 0,8 1
Древесной муки 10,3 16 5 11 10,5
Динитротолуола или трини- тротолуола ' " °,2 3,5 4
Щавелево-кислого аммония . 29,5 25 39 25 28 •
Предельный заряд в грам. . 400 300 550 220 365
и. Порок м в. Существует в Англии еще вещество, содержащее
(Modified Black) и перхлорат калия, но по составу своему сильно отли-
Roslin Giant Pow- чающееся от перечисленных веществ. Это так называе-
der- мый порох М. В {Modified Black). Это черный порох, в
котором часть селитры замещена перхлоратом калия.
Другой близкий ПО составу порох—Roslin Giant Powder.
— 647 —
la.
'ем пу-
> сорта
гельно,
iM спе-
1ля за-
тельны
ях обо-
рот же-
х само-
х даль-
ютв, со-
J состав
эрина и
кислым
заменен
। ч ты в - Это СУТЬ взРывчатые вещества перхлоратные, при зрывчатые ве- чем некотОрЫе из них принадлежат к динамитам. Состав их изменяется в следующих пределах:
№ 1. № 2.
Перхлората калия ... от 0,96% До 2,39% от 7,40'% до 12,49%
Калиевой селитры ... „ 50.73 „ „ 41,83 „ — —
Аммиачной селитры . . „ 38,65 „ „ 31,87 „ — —
Динитронафталина. . . „ 4,83 „ , 3,99, от 37,04 „ до 31,25 „
Смолы „ 4,83 я „ 19,92 „ „ 3,70 „ „ 3,13 „
Нитроглицерина .... — — „ 18,52 „ „ 15,63 „
Коллодионного хлопка. — *— я 22,23 , „ 18,75 ъ
Нитрогидроцелюллозы . — „ 11,12 „ , 18,75 „
. Состав его позволяет относит его также и к ам-
миачным взрыв, веществам содержащим тоже и пер-
хлорат калия./Его состав следующий:
Аммиачной селитры . . 76,0%
Перхлорат калия . . . 4,0 „
Тринитротолуол. . . . 15,0 „
Муки. «................5,0 „
Г,5
)
1
0,5
4
8
№5
(ержащее
ьно отли-
: называе-
порох, в
ГЛАВА V.
Динамиты.
А. Динамиты нежелатинированные.
§ 1. Гурдинамиты и динамиты со смешанным основанием, преиму-
щественно недеятельным.
_ Типичным и вместе с тем классическим пред-
Кизелыур или ур- ставителем динамитов с недеятельным основанием
динамиты 9 2,,. является кизельгур или гур-динамит, о котором
уже несколько говорилось выше.
Существуют три наиболее ходкие сорта гур динамитов, а именно:
с 75%, 35°/о и *^5°/о нитроглицерина; реже требуется сорт, содержа-
щий 50% нитроглицерина. Если не считать 0,5% соды, во всех этих
сортах, остальное, следовательно, приходится на кизельгур.
Из этих сортов динамита первый, т.-е. состоящий из 75% нитро-
глицерина, 24,5% кизельгура и 0,5 соды, носит название Гур-дина-
мита № 1, или чаще Динамита № 1, причем часто сила его прини-
мается за единицу для сравнения силы других динамитов (особенно
антигризутных сортов).
В гурдинамиты, изготовляющиеся в настоящее время, вместо
соды вводят около 1% мела или же углекислую магнезию.
Динамит № I представляет собою пластичную массу, жирную
на ощупь, имеющую удельный вес 1,67. Цвет его зависит от сорта
заключающейся в нем инфузорной земли—часто попадаются сорта
красноватого цвета, но бывают и иных цветов.
Гурдинамиты с меньшим содержанием нитроглицерина обладают
меньшей пластичностью, причем наиболее бедные им даже несколько
суховаты на ощупь.
Позже стали выделывать сорта гурдинамитов, в которых часть
инфузорной земли заменялась сернокислым барием или измельченной
слюдой, та пком, даже содой и т. п. веществами.
Гурдинамит № 1 действует резко и сильно; продукты взрыва,
его не ядовиты; в горной промышленности его выгодно применять
в твердой и вязкой скале. По цене он значительно дешевле гремучих
студней и мелинита, но значительно опаснее их в обращении.
Гурдинамит № 2 выгодно применять в менее, твердых породах,
а также при подрывании льда.
Гурдинамит № 3 преимущественно употребляется при разработке
карьеров, причешу особых преимуществ перед черным порохом, не пред-
ставляет.
В смысле безопасности гурдинамиты значительно уступают
взрывчатым веществам, принятым в Военном Ведомстве, а также
военным порохам, а потому для подрывного дела и, тем более, для сна-
ряжения снарядов, не применяются.
Если принять энергию, развиваемую черным порохом за 1.00, то
энергия, развиваемая гурдин^митом № 1 выразится числом 2,5, а гре-
мучего студня с 92о/о нитроглицерина—3,5.
В Австрии принимается, что полезная работа, развиваемая взры-
вом 1 килогр. этих трех веществ, выразится так:
Черного пороха (с 62°/0 селитры) . . 33.000 килогр.—метров.
Гуртинамита № 1. ............ 75.000 „ „
Гремучего студня (с 92% нитрогл.) . 84.000 „ „
2. Английские гур-
динамиты.
В Англии гурдинамиты готовятся на заводе
Ardeer. Здесь помещены два анализа этих динамитов,
произведенные Dupre и выполненные им в 1901 г.:
Нитроглицерина ....... 73,62% 73,98%
__ ! Кизельгура 25,70 „ 25,00,
чг i Углекислого аммония .... 0,19% 1 0,16 „
Других растворимых частей . о,и „ 0,24 „
Влажности 0,38 7 Я 1 0,62,
1ук>
рта
>рта
ают
ькэ
LCTb
ной
ыва
[ЯТЬ
чих
хах,
)ТКв
ред-
[ают
кже
сна-
), то
гре-
?ры-
Эти динамиты в Англии называются Динамитами № 1 или про-
сто Динамитами В Северной Америке эти ясе динамиты зовут обык-
новенно Giant -powder, что не совсем верно, так как существуют
динамиты, имеющие это же название, но совершенно иной состав.
Прежде в Англии пользовались также значительным спросом
более слабые динамиты X» 2 и %. Они применялись в угольных
копях и каменноломнях.
В состав Динамита № 2 входит всего лишь 18% нитроглице-
рина, 10% древесной муки и 72% селитры, а также небольшое ко-
личество парафина.
Динамит № 3 сильнее: в его состав входят разные количества
гурдинамита и смеси селитры с древесной мукой
В настоящее время эти динамиты спрашиваются очень редко.
Заслуживает быть отмеченным тот факт, что во Франции воспре-
щается перевозить динамиты-, упакованные более, чем за год.
Из динамитов типа гурдинамита и вообще с недеятельным основа-
нием можно упомянуть про следующие:
5. Динамит Ибоса
или Розовый.
которого обязал
Существовали два главных сорта этого динамита,
а именно: с 66% и о 68% нитроглицерина. Остальное
составлял поглотитель, представлявший трепел, цвету
был цвет самого динамита.
Под этим названием выделывался на заводе Ран*
. Белый динамит, в0 франции динамит, содержащий 7о% и 75%
нитроглицерина и 30%—25% естественного кремнезема. ‘
с „ К числу этих динамитов, выделывавшихся в
5. Динамиты типа гурди- lg7o принадлежат следующие сорта его:
намитов, выделывающиеся 1
воде
гтов,
1 гл
на правительственном за-
воде в Вонже во Фран-
ции.
а) 75 % нитроглицерин?!.,
20,8 „ ранданита *),
3,8 „ кремнезема Вьерзона,
0,1 „ углекислой магнезии.
Этот динамит во Франции носил
ранданитового.
название
Динамита № 1 или
б) Динамит с кремнеземом Вьерзона:
50 % нитроглицерина,
48 „ кремнезема Вьерзона,
1,5 „ розовой охры.
Этот сорт динамита носил во Франции название Динамита № 2.
*) Ранданит—кремнистая земля из Ayssat (Puy-de-Dome) во Франции.
650 —
в) Еще более бедные нитроглицерином динамиты имели следу-
ющий состав:
Нитроглицерина 30% 30%
Кремнезема 60 „ 65 „
Мела 1 „ 1 „
Охры желтой 5 „ —
Шлаков доменных печей 4 „ 4 „
г) Кроме этих сортов, готовился динамит еще под маркой .спе-
циальный*. Он состоял из:
90% нитроглицерина,
1 „ ранданита,
8 „ специального кремнезема,
1 „ углекислой магнезии.
д) Динамит Champion а из золы бохгедского угля. Он был пред-
ложен в 1871 году. Были три главных сорта этого динамита:
Нитроглицерина..........60% 55% 62%
Золы бохгедского угля . . 40 „ 45 „ 38 „
Поглотителем этого динамита служила промытая зола битуми-
нозного минерала из Бохгеда. Она состояла преимущественно из гли-
нозема и кремнезема.
Динамит этот оказался не обладающим достаточной безопасностью
в обращении, а потому вскоре был оставлен.
6. Динамит
Hills’a.
К динамитам с искусственным кремнеземом *) надо
причислить изготовлявшийся недолгое время, так называе-
мый, HilVs powder.
7. Слюдяной дина-
мит (Mica powder)-
время попытка
Он был предложен Mowbray в 1874 г. Измель-
чённая в порошок слюда обладает свойством погло-
щать до 110% нитроглицерина и была сдельна одно
выработки динамита с поглотителем из измельченной
слюды:
Нитроглицерина . .
Слюды в порошке .
52% 40%'
48 „ 60 „
Бикарбонат-Вет-
тер динамит.
К числу динамитов, содержащих кизельгур, но
не принадлежащих к типу гурдинамнтов (вследствие
содержания большого количества соды), следуег при-
числить один из антигризутных динамитов (группы гризутитов), в не-
*) Искусственный кремнезем обладает в отношении нитроглицерина поглоти-
тельной способностью в значительно большей степени, нежели естественный.
Искусственный кремнезем Бертелло предложил получать путем разложения
фтористого кремния водой.
-651 -
давнее время применявшийся в довольно обширном размере в горном
промысле, это — бикарбонат-веттер динамит. Он состоит из:
52% нитроглицерина, 85 „ кристаллической соды.
13 „ кизельгура,
О нем будет еще упомянуто дальше .при антигризутных дина-
митах.
9. Динамит Петру-
шевского.
Петрушевский в 1868 г. предложил динамит, в
котором кизельгур заменен углекислой магнезией. Он
содержит:
75% нитроглицерина,
25 „ углекислой магнезии.
Удельный вес его 1,7.
В свое время признавалось, что он обладает хорошими каче-
ствами и был известен в С. Америке, где и применялся под названием
Magnesia powder.
10. Динамит или
нитромагнит или
Ejtfra-Hercules pow-
der.
I!. Spring paste.
Предложен был в Америке Е. Jones’OM еще в
1879 году и состоял из:
Нитроглицерина . . . 75% 40%
Калиевой селитры . . 2,1 „ 31 я
Бертолетовой соли . 1,05 „ 3,3 „
Углекисл, магнезии . 20,8 „ 10 „
Сахара.............1 „ 15,6 „ •
Этот динамит заключает в себе:
72% нитроглицерина,
6 „ мела,
20 „ углекислой магнезии и
2 „ древесных опилок.
12 м таллин- Этот Дйнамит представляет смесь нитроглицерина с
етаплин- каолином Кроме последнего, в состав поглотителя входят
нитролеум. также и меТаллические окислы. Пропорция составных ча-
стей непостоянна и зависит от желаемой силы, которую нужно при-
дать этому динамиту.
Выделывается в Америке.
Он предложен был Biel в 1876 г. Этот динамит гото-
атаэиэт. вился в Швейцарии на фабрике Satigny по нескольким
рецептам, из которых наиболее известны два:
а также:
а) 65% нитроглицерина,
30 „ мела,
5 „ охры,
б) 40% нитроглицерина и
60 _ поглотителя.
fr
В этом последнем сорте в качестве поглотителя была взята
смесь песку, охры, угля, смолистых и других веществ. Начал входить
в употребление, но был оставлен .после ужасного своими последствиями
взрыва в форте -loux в 1878 г. при упаковке 12 ящиков натаян?та.
)4 Черный Состав его сходен с гурдпвамитом, но в него введены.
р и также и углеродистые вещества. Боится сырости.
Под таким же названием „черно; с динамита" существуй;
еще и другая смесь, а. именно:
Нитроглицерина .
Гипса и древесных опилок
Влажности
67,5 %i 56,90%
! i
I 30,11 „ ! 42,13 „
; ।
i 2,39 „ i 0,97 „
I i
I i
15 Динамит Этот динам11Т есть в сущности кизельгур-динамит
м3„,|*ИТ содержащий уголь. В нем заключается 45% нитроглице-
зртелля. рПНа. 0П ПредЛ0Жен был в 1870 году и носил название
..Dynamite noire8, применяясь в войну 1870 — 1871 г.г.
В таком же роде, так называемый, Гур-'динамит № III Ь. Это
ci.1, смесь:
30 % нитроглицерина,
69.5 „ кизельгура, калиевой селитры,
древесных опилок и смолы,
0,5 „ соды.
16. Динамит
Омарка.
В 1878 году Омарк предложил свой динамит с по-
глотителем из кизельгура, но содержащий иптрэманнит.
Состав его был следующий
1 Нитроглицерина . 75% i 73°/ | 72%
Нитроманнита . . i 2 „ 2 И ! 2 „
Кизельгура . . ' 20 „ 22 24
Угля ! 1 3 м ।
Смолы ; 3 г 1 —
1 Парафина . . . . 9 , *
17 Динамит к числу динамитов, содержащих значительное коли-
Круммеля. чество кизельгура, необходимо причислить Динамиты
— 653 —
Круммеля, стоящие, однако, уже довольно далеко от типичных гур-
динамитов. Они состояли из следующих частей:
Нитроглице рина
Кизельгура
Нитрованных древесных опилок . 10 „ | 60 „
Это суть дин&миты частью с деятельным осно-
ванием. частью же со сметанным поглотителем. Они
были предложены около 187и г. Энгельсом.
Литофракторы с деятельным основанием заключают только 3,5%
>.дзельгура, со смешанным же поглотителем имеют до 50% инфу-
.ы-'.'Ной земли.
В Германии выделывалось несколько сортов литофракторов:
Нитроглицерина ........
•Кизельгура или песку . .
Угля...................
Натриевой селитры
Бариевой селитры .
Серы.............
Кроме этих сортов литофрактора был ещ“ один, содержавший
70% нитроглицерина и специальный деятельный поглотитель, со
стоявший из пироксилина, серы, селитры, угля, пороха и бертоле-
товой соли.
Сорт А носил название литофрактора Krebs'а.
Литофрактор в кампанию 1870—1871 г. применялся, как нем-
цами, так и французами, причем—те и другие были им довольны.
К числу недостатков его следует отнести следующие: он боится
воды и сильного нагревания, даже солнцем; при оттаивании эксуди-
рует нитроглицерин и от попадания ружейной пули взрывается.
Пластичный; цвет черный: действие несколько уступает дина-
миту № 1.
— 654 —
Несколько отличающийся по составу литофрактор вырабаты-
вался в Англии. .Он состоял из:
55% нитроглицерина,
36 „ угольного порошка,
3,5 „ кизельгура,
2,5 , бариевой селитры,
2,5 „ бикарбоната натрия,
0,5 „ сернокислой магнезии.
В некоторых сортах древесный уголь заменялся опилками или
отрубями.
Литофрактор, выделывавшийся в Америке, имел нижеследую-
щий состав:
4о°/о нитроглицерина,
40 » калиевой или натриевой селитры,
13 „ целюллозы.
7 „ парафина.
19. Апьсберский
динамит.
С литофрактором сходен по составу так называ-
емым Альсберский динамит, применявшийся в Австрии
в 1883 г. Он заключает в себе:
65% нитроглицерина.
10 „ бариевой селитры,
20 „ кизельгура,
5 „ древесного угля.
„ . Это динамит со смешанным поглотителем:
20. Стонит. **
68°/о нитроглицерина,
20 „ кизельгура,
4 „ древесной муки.
8 „ специальной смеси.
Эта специальная смесь состоит из калиевой и бариевой селитры
углекислой
21. Динамиты
Rhenisch.
магнезии, сажи и других веществ.
Этот динамит был предложен в 1874 г. Gottheil’eM.
Состав его следующий:
I №2
Нитроглицерина
Кизельгура . .
Гипса ....
Тяжелого шпата
Это динамиты, в которых нитроглицерин поглощен
м пка"™ сложной смесью, состоящей из равных частей: золы,
опакау. кремнистой земли, буры и соды, смешанных с количе-
ством сажи, в 2*/2 раза превышающим общий вес этих частей.
Готовая смесь, составляющая поглотитель, предварительно сме-
шивается очищенным керосином и только после этого напитывается
нитроглицерином.
Они состоят из азбеста, черного пороха и нитро-
динамиты из ГЛНцерИНа и следовательно, представляют собой дина-
аз еста. миты со смешанным поглотителем.
Иногда часть азбеста заменяется мелом, кизельгуром и другими
веществами.
К числу динамитов с недеятельным основанием,
.динамит орспея. хотд уЖе совсем не типа гурдинамитов, принадле-
жит Динамит Горвлея. Он состоит из:
73% нитроглицерина
27 „ квасцов.
Большинство перечисленных здесь динамитов уже в настоящее
время вышли из употребления, имея интерес почти исключительно
исторический. Возможно, что не далеко то время, когда и все вообще
динамиты с недеятельным поглотителем постигнет та же участь.
§ 2. Динамиты с деятельным основанием.
Количество динамитов с деятельным основанием значительно
превосходит таковое же количество динамитов с инертным поглотите-
лем и дать хотя бы только рецептуру всех подобных нитроглицери-
новых препаратов не позволяют рамки этого труда, а потому здесь
мы ограничиваемся указанием на главнейшие *).
К числу динамитов простейшего состава можно отнести сле-
дующие:
Динамит Морзе есть смесь нитроглицерина с
. Динамит орзе. какод_либо смолой, предварительно распущенной
в каком-либо летучем растворителе, который затем должен быть уда-
лен. Сухая масса может затем зерниться.
2. Punshon
explosive.
Это есть смесь 70%
кой-либо смолы.
нитроглицерина с 30% ка-
г Это взрывчатое вещество было предложено около
. аварии динамит. г Girard, Millot и Vogt. Существовало несколько
рецептов его, сильно разнящихся между собой. Частью это были дина-
миты с недеятельным поглотителей (глинозем, каолин, трепел и проч.),
часть же с деятельным основанием.
*) Некоторые из помещенных выше динамитов можно было бы также отнести
к этой группе,но практически удобным оказалось упомянуть о них ранее.
Среди последних наиболее известным был тот, который состоял
из смеси:
40% нитроглицерина
60 „ сахару в кусках.
Этот сорт обладал весьма важным недостатком: в присутствии
влажности он оксидировал нитроглицерин.
4. Взрывчатое вещество
Грюнэ.
Эго есть динамит, в состав поглотителя кото-
рого входят животный и растительный уголь.
Стремление использовать в качестве погло-
тителя черный порох и смеси, с ним сходные, заставило предложить
особый ряд динамитов. Одним из первых динамитов этого рода был
так называемый Wolf’s powder, употреблявшийся в Америке и предло-
женный А. Нобелем в 18G3 году. Этот динамит послужил прототипом
для целой серии динамитов в этом же роде. В числе таковых можно
назвать следующие:
5 ВзрыЕч-тое вещество Это есть смесь нитроглицерина с зерненным
Нлизон. черным минным порохом.
r п Это есть минный порох, содержащий от 30 ди
к 35% нитроглицерина. Предложен был в 1870 г. Легко
эксудирует вит| о глицерин, а потому признан не безопасным в обра-
щении. Он также назывался Colonial Krut.
„ с с • Этот динамит имеет в качестве поглотителя также
г черный п< рох. В нем 2э% нитроглицерина. Применялся
французскими войсками в войну 1670—1871 г.г.
в. Австрийский Сходен с предыдущим и состоит из черного пороха
динамит III. с 15% нитроглицерина.
9. Кёльнский пороге.
Есть также черный порох с 30 — 35% нитро-
глицерина.
W. Пороге Нептун.
Сорт динамита, вырабатывавшегося в Северной
Америке. Он состоит из:
35% нитроглицерина,
48 „ натриевой селитры,
7 „ серы,
10 „ древесного угля.
Его сила под водой, сравнительно с динамитом № 1 выражается
числом 0,82.
остояя
И. Вулканит.
Смесь нитроглицерина с пороховой мякотью.
43% нитроглицерина и
57 „ пороховой мякоти.
12. Вулкан - динамит.
тствии
Сходный с ним, предложенный Warren’ом в
1885 г., Вулкан-динамит состоит из:
1 котс-
пь.
погло-
пожить
да был
[редло*
ОТИПОМ
можно
Нитроглицерина
Натриевой селитры
Древесного угля .
Серы. ..........
. . 32,607,
. . 49,50 „
- • 9,6 „
• • 8,3 „
30%
52-5 „
Ю.5 „
7 „
13. Порол Shaem'a. Этот динамит предложен был еще в 1869 году и
состоял из 62,5—90,97, нитроглицерина и 37,5—9,10% пороха Шульце.
С ним сходен порох Юпитер.
1енны м
Взрывчатое вещество, предложенное в 1886 году и
. адмит. имеЮщее в своем составе в качестве поглотителя те же
части, которые входят в состав черного пороха, но с заменой калие-
вой селитры, натриевой и добавлением, древесной муки:
1 30 до
Легко
в обра-
$
207# нитроглицерина,
56 „ чилийской селитры,
10 „ серы,
7 „ угля,
7 „ древесной муки.
: также
:енялся
й»
пороха
Составные части его смешиваются после измельчения и к ним
прибавляется нитроглицерин, после чего масса тщательно перемеши-
вается.
Из тестообразной массы делают патроны, которые укупориваются
герметически, так как, вследствие присутствия натриевой селитры,
смесь обладает сильной гигроскопичностью.
нитро-
Этот динамит выделывается нескольких сортов,
5. ian-ро« ег )'разяящихся> главным образом, количеством нитрогли-
церина (от 20 до 75%). Один из чаще употребляющихся состоит из:
дверной
ч
367» нитроглицерина,
4 „ чилийской или аммиачной селитры,
8 „ серы,
8 „ угля или смолы.
жается
Он обладает сильной гигроскопичностью.
*) Как уже замечено раныпе кизельгур динамит № 1 аовут в Америке так-
зке Giant-powder, что хотя и неправильно, но приходится считаться с совершив-
шимся фактом.
Проф. М, Сухаревский. Взрывчатые вещества и взрывные работы.
42
— 658 —
При подводных взрывах коэффициент его действия, сравнительно
с динамитом № 1 выражается числом 0,83.
Всть сорт Giant-powder, содержащий также и кремнезем;
Нитроглицерина .... 40%
Натриевой селитры . . 40 „
Смолы...............6 „
Серы "..............6 „
Кремнезема ...... 8 „
16 т нит Этот динамит предложен был Энгельсом выделывает-
ятанит. сд в дмерИке и по С0СтаВу своему близко стоит к преды-
дущему. Иногда он называется Titan-powder. Он состоит из:
Нитроглицерина .
Древесной муки . .
Калиевой селитры .
Натриевой селитра
Серы.............
Древесного угля . .
№ 1. № 2.
48% 40%
16 „ 10 „
34 „ 20 „
— 20 „
17 Л гнит Под этим названием известен динамит, предложенный
. игнит. Бялабеном в 1884 году; он состоит из: 80-85% нитроглице-
рина и 20—15% деятельного поглотителя,/состоящего из:
70% селитры,
18 „ парафина и
12 „ серы.
18. Динамит Шульце,
стояло' из:
Эго вещество предложено было в качестве по-
роха. Оно готовилось по нескольким рецептам и со-
33,4—61,21% нитроглицерина,
41,6—24.49 „ бариевой селитры,
16,6—10,20 „ калиевой селитры,
4,2 - 2,05 „ серы,
4,2— 2,05 „ углеводородов.
В качестве последних Шульце рекомендует: канифоль
тернетин -
ное масло и проч.
Им же предложен также и минный порох:
10% нитроглицерина,
75 „ калиевой, натриевой или аммиачной селитры,
15 „ нитропроизводных углеводородов.
В качестве последних им указаны: нитробензол, нитронафталин
нитротолуол и т. п.
— 659 —
,л _ Поглотитель этого динамита представляет
w?°in г1'ав<Тв° 11ОРОХОВУЮ смесь с натриевой селитрой, содержа-
। с е пег а. щую немного крахмала: ,
10% нитроглицерина,
73 „ чилийской селитры, 1
10 „ серы, I пп0/
’ г ’ > 90% поглотителя.
12 „ угля и I
5 „ крахмала. J
__ Он представляет собою динамит с пороховым осно-
орсит ewin. ваниеМ) содержащим декстрин и целюллозу; предложен
был в 1883 году. Его состав следующий:
От 70,65 до 67,00% нитроглицерина,
„ 4,35 „ 3,56 „ уксусно-кислой целюллозы,
„ 3,26 „ 2,67 „ декстрина,
„ 26,77 „ 21,74 „ минного пороха.
Уксусно-кислую целюллозу получают, выдерживая в течение
некоторого времени вату в смеси раствора уксуснокислого натрия и
серной кислоты, а затем тщательно промывая ее. ,
Про другие форситы см. „желатинированные динамиты*.
, Этот!динамит имеет основанием своим обыкновен-
. орок ur on а. черный порох, к которому прибавлен пироксилин.
В эту смесь вводится, или обыкновенный нитроглицерин, или же
желатинированный и все обращается в тестообразную массу при по-
мощи гуммилака.
Вследствие малаго своего содержания нитроглице-
. ju son-pow er. рИНа эт0 взрывчатое вещество может быть причислено к
динамитам только условно. Оно было предложено в С. А. Соединенных
Штатах в 1876 году и довольно широко распространено в Северной
Америке. В некоторых его сортах количество нитроглицерина подни-
майся до 20%.
Состав этих порохов следующий:
Нитроглицерина . .
Натриевой селитры .
Серы . .............
Битуминозного угля .
20%
53,9 „
13,5 „
12,6 „
*) Серы, угля и смолы.
Технология его сложна и фабрикация не совсем безопасна. В
фарфоровом сосуде помешают все твердые части и нагревае т пере-
гретым до температуры 140°С, паром, безпрерывно помешивая. Когда
все превратится в однообразную массу, то ее охлаждают, не прекра-
щая постоянного перемешивания до полного остывания вещества,
причем масса в конце концов оказывается в состоянии тонкого порошка.
Он не должен иметь вид пыли, так как прибавляемый затем
нитроглицерин не должен поглощаться, а только лишь обволакивать
частицы с поверхности.
Вещество это готовится на фабрике в Drakesville в штате Нио-
Джерсей.Он очень экономичен, не взрывает ни от толчков, ни от сопри-
косновения с накаленным телом.
Взрывчатое вещество с маркой С. М. обнаруживает под водой
силу равную 0,44, a 3F . —0,62 силы Динамита Ла 1.
С Judson-powder сходен Champion powder.
25. Coads explosive.
В состав этого динамита, предложено™ с 1876 г.
входит активный поглодитель с селитрой, иногда же
просто минный порох с добавлением древесной муки. Готовится он
по нескольким рецептам:
Нитроглицерина..........
Селитры........... . . .
Древесной муки. . • . . . .
Обыкновенного минного пор.
75% 30% 30%.
5 „ 50 „ —
20 „ 20 „ 10 „
— 60 „
$ 3. К той же группе неокнглатинированних динамитов принадле-
жат еще следующих:
В Северной Америке пользуются особым рас-
1. Лмерииансмие динамиты цростраНвНИеМ ПИТрШ ЛИЦСрпНОВЫе препараты,
с натриевой селитрой. СОдерЖащие натриевую селитру и муку, большей
частью древесную.
Bureau of Explosives lieport дает следующий состав динамита
этого рода:
Катего- рия, Нитроглицерин. Древесная мука. Натриевая селитра. Влажность.
б % 53,5% — 65,1% 14,2в/о-22,О% 16,0% 29,8% 1,16%- 3,18%
50 „ 49,3 „ —50,1 , 11,6 „ -13,4 , 32.6 „ —33,8 „ 1,97 „—2,00 „
40 ., 34,8 „ -41,9 7,7 „ -13,9 „ 0,80 „-3,60 „ 0,80 „ —3,60 „
30 „ 29,7 „ —32,5 „ 7,9 „-10,2 „ 1,09 „—1,69 „ 1,09 „-1,69 „
Кроме перечисленных здесь составных частей, они заключают
еще небольшое количество и других веществ.
1
— 661
Для примера здесь приводится подробный состав двух 40% дина-
митов отой категории.
Straight Dynamit Hercules.
Нитроглицерина. . . . 40% 40%
Древесной муки. . . . И,75% П»
Натриевой селитры . . 47,25 , 45, '
Мела 1% ——
Углекислой магнезии . — ‘%
Поваренной сшги . . . — 1„
Влажности \ 2 »
„На11“ и „Howell" дают следующую таблицу американских
„Straight** динамитов:
г. 20 25 |ЗО 1 35 40 45% 50 55%, 60
Нитроглицерина . . . 1 ' 15 I 20 25 30 » 40 45 50 55 60
Сгорающего j 20 19 18 17 16 15 14 14 15 16
Натриевой селитры. . м% 60 56 52 48 44 40 35 29 23
Мелу или угле-кислой магнезии...... i1 И 1 1 1 ь 1 1 1 1 11 1 1 i 1 ।
2. Ligdyn К числу динамитов этого сорта можно причислить также
изготовляемый в Южной Африке динамит Ligdyn.
Это есть, в сущности, 40% динамит следующего состава:
40% нитроглицерина,
13 „ древесной муки,
2 „ пшеничной муки,
45 „ натриевой селитры.
Из него делаются патроны.
Вещество, невидимому, не вполне безопасное, ибо в 1913 г. в
январе месяце при его патронировании произошел взрыв, коим были
убиты 9 человек и двое ранены. \
В динамитах этой же серии иногда часть нитроглицерина заме-
щают аммиачной селитрой, что несколько уменьшает их стоимость,
1-1 I IIIIW IIIL.JI1U,.....II...
- 662
не ослабляя значительно их силы. В нижеследующей таблице при-
ведены данные, касающиеся подобных динамитов.
30% 35% 40% | 50% 60% 1
Нитроглицерина .... 15 20 22 27 35 д
Аммиачной селитры . . ' I5 15 20 25 30 —
Натриевой селитры. . . i 51 48 42 36 24
Сгорающего 1 13 16 15 П 10
Мелу или углекислой
магнезии ...... 1 1 1 1 1 1
з динамиты В 1870 году А. Нобель предложил для
Нобеля горнцго дела целый ряд динамитов, богатых
с селитрой, применявшихся под названием динамитов
селитрой. ;
Состав некоторых из наиболее употребительных
дующий:
надобности
селитрами,
Нобеля с
был еле-
/ j -Д- । -^2 13 в c C2 D
Нитроглицерина .... 20% 15% 18% 1 w /• 20’/, 20% 18%
Аммиачной селитры. . _ J_—rJ ” I 75 „ 70 „ —
Бариевой селитры. . . ! 70 „ j 68 „ —
Калиевой селитры. . . { j — ! 71 „
Натриевой селитры. . . 69 „ 70 „ — - ' -
Парафина 7 J 7 „ 4 „ * » —- "*
Древесного угля. . . . 4 „ 8 „ 3 „ 10 „ 10 „ j 12 „ 10 „
В динамитах С и С2 иногда древесный уголь заменяется смолой.
4 Порох Птлас • Общее свойство всех почти динамитов, в состав
р ’ которых входит натриевая или аммиачная селитра,
заключается в их гигроскопичности: в присутствии влажности обе эти
соли расплываются, обусловливая эксудацию нитроглицерина, и пре-
параты, их содержащие становятся опасными в обращении. По этой
причине, несмотря на их дешевизну, они не приняты в Англии.
По этой же причине при постройке Панамского Канала, где было
израсходовано несколько миллионов тонн динамита, и где вопрос де-
— 663 —
шевизны взрывчатого вещества мог бы играть первенствующую роль,
от употребления динамитов с этими селитрами Isthmian Canal Commis-
sion отказалась и остановилась на динамите, содержащем калиевую
селитру, Атлас—порохе.
Состав двух сортов его, наиболее применявшихся при этих ра-
ботах, был следующий:
1 в + i
Нитроглицерина . . . 61,1% 45,7%
Древесной муки . . . 14,1 . Ю,5 „
Калиевой селитры . . 21,6 , 40,9 „
Магнезии i 3,0 , — —'
Мелу - 1,9 „
Влажности 0,2 „ 1,0 „
Кроме этих двух сортов, имеются и другие сорта динамита этого
наименования, предложенные в 1883—1884 г.г. Fenias'OM и заключающие
от 15 до 70% нитроглицерина. Рецептов, по которым готовятся эти
динамиты, более дёсяти. Для примера приводится состав двух, имеющих
марки А и В:
Нитроглицерина
50%
Натриевой селитры
Древесной целюллозы
Углекислой магнезии ,
Кроме этих сортов, в Америке употребляются Атлас - пороха с
содержанием нитроглицерина 29,8% и 71,6%. Тогоже наименования
динамит приготовлялся в восьмидесятых годах прошлого столетия в
Германии близ Кёльна. Он был предложен Энгельсом в 1886 г.
5 п а э а и Эти динамиты сходны по составу с Атлас-порохом,
°гв'м Т"а " но с°Де₽жат несколько иную пропорцию составных
вкпа' частей; так, например, в состав Этны входят от 15%
до 65% нитроглицерина, натровая селитра и древесные опилки.
— 664 —
6. Порок Геркулес.
Он был предложен в Америке и имелись два
главных сорта его:
Нитроглицерина 77% 40%
Калиевой или натриевой селитры. 1 „ 31 „
Углекислой магнезии 20 „ 10 „
Сахару III" 15,66 „
Целюллозы или древесной муки . 2„ ——
Бертолетовой соли 3,34 „
Некоторые сорта его содержали значительное количество нитроце-
люллозы (до 20%).
Недостаток его—сильная гигроскопичность и требование поэтому
герметических укупорок. Действовал он сильнее Динамита № 1.
_ Под этим названием, предложена была в 1872 г. целая
эндрок. серИЯ динамитоВ) частью со сметанным поглотителем, частью
же с деятельным основанием. Состав их был следующий:
Нитроглицерина .............
Калиевой или натриевой селитр.
Угля........................
Серы ....................«
Кизельгура .................
Целюллозы...................
Парафина ...................
20% ; 33,40/, 60°,
61,5 „ 52,8 „ 1 30,8 „
2 4 -
6,7 „ зд»
11 ‘ >"
9 7 7» > * —
11,1 : 1 5,5
8 Рексит В S' L«ambrecht. в Штирии, на фабрике Borkenstein К°,
ексит. вь1Делывается ;1ЛЯ надобности горной промышленности ряд
взрывчатых веществ, предложенных Диллером еще в 1874 г., содер-
жащих в своем составе кроме нитроглицерина древесную муку,
парафин, калиевую селитру и некоторые другие вещества. Вещества
предложены были в качестве антигрпзутпых, но свойство „безопасности"
им присуще в довольно слабой степени. Вот состав некоторых рек-
ситов.
Нитроглицерина .
Поглотителя . . .
• II. I III. * V.
I 1 i
....... .. , ... ...
50% 35% 115%
50 „ i 65 „ j 85 „
ь два
>оце-
тому
— 665 —
t '
и
65% 175%
40%
55%
60%
30 •/.
о
JJ
п
V
»
я
1
О
К
рекситу
м
и
1 *
, i
9. Мэганит
следующий:
* п
>5
4,
0,7
64 %—67%
18%
близок
фабрике Шуклера и К“ г
68 я
лэганит, приготовляющийся на
Цурдорфе в Венгрии; Состав его
78 ,
58 „
68 „
: 43 „
П°/о
'о- П
— 0,8
Поглотитель имеет различный состав, но для этих рекситов
употребляется следующий:
74% натриевой селитры,
дубильного корья и
соды.
Рексит представляет мелко-зернистую пластичную массу темно-
коричневого цвета, жирную на ощупь. В . воде выделяет нитрогли-
церин. Применяется преимущественно в горной промышленности, но
нельзя сказать, чтобы был вполне стоек..
Есть сорта рексита и с большим содержанием нитроглицерина,
а именно в 64%—67% и другим составом поглотителя, например:
елая
зтью
Нитроглицерина .
Натриев. селитры.
Древесной гнили
или нитрован-[
ной цёлюллозы. i
Древесн. муки . .
Мела............
Удельный вес . .
яд
•р-
ва
ЕС
Нитроглицерина . . .
Нитролигнозы . . • .
Нитроцелюллозы . . .
Натриевой селитры . .
Древесной муки . . .
Соды................
№ 1. : 1 № 2- № 3. . ———Ч--Т-- ——•-—.
1 г 60” ,! И 38% 7°/
ио „ 6 „ 9
Ю „ .1 6 „ 9 * »
ho, 37,5% 56,75%
12% 18%
! _ 0.5% 0,25%
меганита, существует еще
сортов
Кроме этих трех
его, носящий название Ориазита. Состав его
10. OpnajHi. один с()рт
следующий:
18
56,25
18,0
/о
н
ff
нитроглицерина,
нитроцелюллозы,
натриевой селитры,
соды,
гидроцелюллозы и древесной муки.
f
В 1876 году Sjoeberg предложил динамит, содержащий
етралит. аммиачНуЮ селитру и гидроцелюллозу.
Он готовился По нескольким рецептам; один из его сортов имел
следующий состав:
Нитроглицерина................ 64%
Аммиачной селитры .... 12 „ >
Гидроцелюллозы.......... 23 „
Кислого сернокисл, натрия. . 0,5 „
Мела ..................... 0.25 „
Других веществ.........0,25 „ (большей частью спер-
мацет).
В некоторых сортах его гидроцелюллоза заменялась животным
углем.
Кроме этих сортов, имелись еще сорта с Древесной мукой и со
„специальным углем". Эти сорта испытывались в 1882 году во Франции
в Commission des Substances Explosives.
Один из них имел состав:
60% нитроглицерина,
16 „ натриевой, калиевой или аммониевой селитры,
16 „ специального угля,
6 „ древесной муки,
1 „ мелу,
1 „ (преимущественно) спермацета.
12 Динамит Гин а ® 1881 r(W Гинда предложил динамит, богатый
ин мит инд . уГлем и СОдерЖащИй аммиачную селитру. Состав его
следующий:
64% нитроглицерина,
12 „ аммиачной селитры,
23 „ угля,
0,25 „ мела и
0,5 „ соды.
15. Серанин.
В 1867 году Bjorkman в Швеции предложил динамит,
богатый аммиачной селитрой, названный им серанином.
Он имел следующий состав:
18,1% нитроглицерина,
72,5 „ аммиачной селитры,
8,7 „ древесных опилок или угля,
0,7 „ бензола или крезола.
14. Амидожэн.
‘ »
Эти динамиты с аммиачной селитрой и значительным
количеством древесного угля. Состав их следующий:
Нитроглицерина 75 70
Аммиачной селитры . . . 4 7
Древесного угля ..... 18 13
Парафина 3 10
Неудобства этого динамита заключаются в том, что он эксудирует
легко нитроглицерин, ибо очень гигроскопичен, требуя обязательно
герметической укупорки.
15. Динамит Норрбина и
Ольсона.
К динамитам, содержащим значительное ко-
личество угля, следует причислить динамит Норрбина
и Ольсона; один из его сортов заключал в себе:
60% нитроглицерина,
10%—30 „ древесного или каменного угля,
8 „ —10 „ аммиачной селитры.
Сорт этот обладал большой силой, но был очень гигроскопичен
и не безопасен в обращении, почему широкого распространения не
получил.
Вообще говоря, уголь был бы хорошим поглотителем нитрогли-
церина, но при взрыве по большей части не дает полного сгорания,
образуя много окиси углерода, для избежания чего приходится вводить
большие количества селитры. В 1867 году ими же был предложен еще
один сорт динамита под названием Ammoniak Krut. Он уже принад-
лежит к категории динамитов, богатых аммиачной селитрой. Он заключал
в себе:
10%—20% нитроглицерина,
80 „ аммиачной селитры.
6 „ угля.
При взрыве дает малое пламя, а потому до известной степени
антигризутен.
Главный недостаток—сильная гигроскопичность и наклонность
эксудировать нитроглицерин.
— 668 —
Во Франции в прежнее время угольные динамиты пользовались
значительным распространением. Так, например, довольно широко
пользовались угольными динамитами, имевшими следующий состав:
I. II.
•» Нитроглицерин ! ' 9 9 0 / 1 /о I 1 Н
Калиевой селитры .... । ;бб „ f 72 „
Угля . . . ' 12 10 „
16 Матаньит ® г- был предложен еще один динамит, богатый
атаньит. aMMHa4HOg селитрой. Он назван был матаньитом.
Выделывались два главных сорта его:
Нитроглицерина . . . .
Аммиачной селитры . .
Кизельгура ..........
О
17. Карбодинамит.
Этот динамит был предложен Борландом в 1887 г.
и имеет очень простой состав, принадлежа к числу
угольных динамитов. Он заключает в себе:
90 частей нитроглицерина,
10 „ обугленной пробки.
В состав его вводится тоже 1,5°|о соды и углекислого аммония.
Цвет его темно-серый. Прибавка к нему селитры несколько усиливает
его, но в то же время сильно ослабляет его способность сопротивляться
действию воды.
, Q v „ . . Этот сорт динамита предложен был Нобелем и
18. Угольный дина- , г “
еще богаче предыдущего углем, количество же нитро-
мит’ глицерина в нем уменьшено более, чем в 4 раза. Кго
состав следующий:
Нитроглицерина..........: 2О°/о
Бариевой селитры . . . . : 68 ,,
Древесного угля . . . .12 „
Смолы....................: -
2О°/о
78 „
иск
Ько
Под этими марками существуют два динамита с
ы ? Г? деятельным поглотителем (тогда дсак, обычно, под Дина-
№ 2 и № 5. мИтом ] разумеют гур-динамит с 75% нитроглицерина
и 25°/0 кизельгура), содержащие около 20% нитроглицерина. Состав
их следующий:
ай
" № 2. № з.
Нитроглицерина : 18% 1 1 20%
Калиевой селитры .... - 71 „ i • 70 „
Аммиачной селитры . . . j —
Угля ю, • 10 „
Парафина ( 1 „ —
Парафин можно заменять озокеритом.
20. Серный
динамит
Фабрика Paulilles во Франции изготовляет дешевый
динамит, одно время пользовавшийся значительным
спросом на рынке; он состоял из:
20% нитроглицерина,
60 „ натриевой селитры,
10 „ смолы,
10 „ угля.
)
Кроме этого, был еще другой сорт, но в котором было па. до0/,,
нитроглицерина больше.
динамиты выш<;ДШИе из употребления уже в настоящее
'/ инамиты время динамиты, содержали большие количества селитры,
ьютона. уГ0ЛЬ и парафин.
Состав наиболее употребительных из них следующий:
Нитроглицерина........
Натриевой селитры . . .
Аммиачной селитры . . .
Парафина .............
У гля.................
20% 18%
69 „
— i 75 „
4 1 4
♦
7 „ 3 ..
22 Вз ывчатое Это есть Динамит тоже, содержащий немного нитро-
’ ествТнофег глийеРина и заключающий более половины аммиачной
щ тво ег. селиТрЫ> а также и большее количество глауберовой соли.
Его состав следующий:
Нитроглицерина .............. • 20»/.
Аммиачной селитры.............. 56,25%
Угля древесного................5%
Глауберовой соли...............18,75%
Обладает антигризутными свойствами и очень экономичен.
„ U! . . . В состав этого динамита входит значительный
23. nindes explosive. _ „
к процент лимоннокислого аммония и угля.
Он содержит в себе:
64% нитроглицерина,
23 ,, угля,
12 „ лимоннокислого аммония,
0,25 „ мыла,
0,50 „ соды,
0,25 » других органических веществ.
24. „Имидное" взрывча- Это есть динамит, в котором нитроглицерин
'тое вещество. поглащен пороховой смесью Gaen’a:
Нитроглицерина ................ 68 40
Смеси........................... 32 60
Пороховая смесь Gaena есть смесь 101 части калиевой селитры
80 частей аммиачной селитры и 40 частей древесного угля.
Это суть динамиты различного состава. В
н н некоторых из них поглотителем служит смесь,
содержащая серу, сажу, муку и т. и п., а также калиевую селитру и
железный купорос. В состав других входит динитробензол; такое
взрывчатое вещество носит название Фортисина, наконец, есть также
сорта, содержащие пикриновую кислоту.
В Бельгии под названием „фортис" подразумевают порох
Henschen’a.
26. Порох Castellanos.
Это есть динамит довольно сложного состава,
а именно:
40% нитроглицерина,
25 „ калиевой, натриевой или аммиачной срлитры.
ю „ пикратов калия, натрия и аммония.
5„ серы,
10 „ нерастворимых солей и
10 „ угля.
Кроме этих сортов, имеются еще и другие, в состав которых
входят—нитробензол, целюллоза и порошковатый кремнезем.
В качестве вышеобозначенных „нерастворимых солей" следует
понимать: щавелевокислый кальций, углекислый цинк и силикаты
кальция, магния и цинка.
Динамиты Castell anos’a Характеризуется несколько повышенной
чувствительностью.
_ Этот динамит отличается необычайной сложностью
г своего состава. Вот один из рецептов, по которому он
готовился:
57 % нитроглицерина,
5 „ пироксилина,
8,5 „ нитрокрахмала,
5,0 „ нитроманита,
8,0 » селитры,
0,5 „ нитробензола,
9,0 „ аммония хлористого, азотнокисл, и сернокислого.
15 „ других веществ.
§ 4 В нижеследующих динамитах содержится в большем или мень-
шем количестве бертолетовая соль.
* Этот динамит более нежели на половину со-
1. динамит орспея. ) стоит из бертолетовой соли. Его состав' следующий:
Нитроглицерина 25°/о 25 °/0
Бертолетовой соли . . . 56 „ 56, 2 „
Чернильных орешков . . 19 „ 9,40 J
Древесного угля .... i 9,40 „
Он был предложен в 1872 году шведским инже-
. питрометаллин. нер0М Лиандером, при чем состоял из:
36,78% нитроглицерина,
40 49 „ калиевой селитры
9,26 „ бертолетовой соли,
12,30,, древесного угля,
1,21 „ золы и песку.
*) Про одноименный с ним динамит, содержащий в качестве поглотителя
квасцы, было уже упомянуто раньше.
Удельный вес он имел 1,6% и представлял массу темносерого
цвета, жирную на ощупь. Может гореть без взрыва; выдерживает лишь
незначите п ные толчки и удары. Вообще не безопасен.
В - 1874 году в Москве взорвалась партия нитрометаллина у
Яузского моста.
з. Взрывчатое веще- Этот динамит содержит одновременно бертоле-
ство Gotham. товую соль и селитру:
67 3% нитроглицерина,
19,2 , бертолетовой соли,
3,9 „ калиевой селитры,
9,6 „ дубового корья.
Mil
j;
• и
cei
сад
4. Нитрокрут
Он так же, как и предыдущий, содержит одновре-
менно бертолетовую соль и селитру:
14% -24% нитроглицерина.
14 „—30 „ бертолетовой соли,
72 „—46 „ калиевой лли натриевой селитры.
В некоторых сортах часть нитроглицерина замещена нитропроиз-
в од > ы м и у гл евод ород о в.
К динамитам, содержащим бертолетовую соль, следует отнести и
вышедшие из употребления динамиты Бл^нч-Брена-, они имели раз-
ный сестав: количество нитроглищ рина 40%—50%, поглотители же
были различные, например:
смй
M0I
50% бертолетовой соли.
33.3 „ древесного угля или опилок.
16,7 „ каменного угля;
СОЙ
ДО
сос
или
Смесь равных количеств бертолетовой соли, каменного и древес-
ного угля;
или
33 3% бертолетовой соли
66,7 „ угля или опилок;
или
33,3 „ бертолетовой соли
33,3 „ сахару
33,4 „ древесного угля;
или
Равные части: бертолетовой соли, древесных опилок, угля и ка-
лиевой селитры.
вод
сах
Уголь может быть древесный или каменный; древесные опилки
могут заменяться декстрином или крахмалом.
Эти динамиты были предложены еще в 1875 г.
5 в ывч ты ве Нобель предложил целый ряд взрывчатых веществ
зрывчатые ве- с переменным составом, составленных из смеси нитро-
щества побеля. r z . г
глицерина с солями, богатыми кислородом; как-то: с
селитрами, хлоратами и перхлоратами.
В состав этих динамитов входят также нитроцелюллозы, нитро-
сахарозы и другие вещества, замещающие собою часть нитроглицерина.
Здесь приводятся составы некоторых из предложенных им смесей:
№ 1.
. I Нитроглицерина . . . . v. ’ 25%
' ( Солей богатых кислородом .7,5 „
Q. I Специальных смесей .... 5 „
\ Солей богатых кислородом . 95 „
Эти „специальные смеси" суть смеси нитроглицерина с гидро-
целюллозой, нитроцелюллозой и нитросахорозой. Некоторые из этих
смесей обладают так же баллистическими свойствами и Нобелем реко-
мендованы в качестве порохов.
б В 1872 г. Бекман предложил динамит сложного
е астин. состава> также содержащий селитры и бертолетовую
соль. Для его приготовления было предложено несколько рецептов.
Для примера здесь приводится состав двух динамитов более простого
состава и одного более сложного:
№ 1. № 2.
Нитроглицерина........................78% 68%
Древесного угля или древесных опилок . 14 „ 20 „
Селитры калиевой . . . ............ . 8 „ 12 „
Более сложная смесь состоит из:
50% нитроглицерина,
10 „ бертолетовой соли, калиевой селитры и пик-
рата калия,
10 „ нитроцелюллозы,
15 „ угля,
3 „ двууглекислой соды,
10 „ двуокиси свинца,
2 „ парафина и декстрина.
В других рецептах Бекмана рекомендуется брать жидкие угле-
водороды и твердые нитропроизводные вроде: нитрокрахмала, витро-
сахара и т. п.
Проф. ЛЬ Сухаревс^аи. Взрывчатые вещества и взрывные работы. 43
Наконец, Бекман предложил еще один вариант себастина, заклю-
чающий в себе 68%—78% нитроглицерина, поглощенного смесью
8%—12% серы и 14%—2O°io пористого угля.
- М1 . .. „ Это есть вариант себастина, N _. ., 1876 г. в Швеции Fahneljehnом. предложенный в Состав его сле-
new beuastine. ДуЮЩ£1й:
.V 1. Л- 2.
Нитроглицерина 69 % 55%,
Древесного угля 23 „ О 9
Селитры или бертолетовой соли . 7 „ 19 . >
Соды 1 ,. А * „
В общем же эти динамиты содержали составные части в коли-
чествах близких к следующим пределам:
Нитроглицерина............45%—75%
Древесного угля...........30 „ —15 „
Селитры и бертолетовой соли. 25 „ — 5 „
Вещество очень опасно при приготовлении, если только нитро-
глицерин не вполне отмыт от кислот.
8. Вигорит Нме-
риканский.
Этот динамит был предложен в 1875 г. и выраба-
тывался на специальном заводе в Калифорнии.
Он выделывался по нескольким рецептам, из коих
главнейших два:
Нитроглицерина. . . . 43,75%
Калиевой селитры. . . 18,75 „
Древесных опилок . . 11,25 „
Бертолетовой соли . . 17, 5 „
Гипса.................8,75 „
Натриевой селитры . . —
Угля................. —
30%
60 „
Обнаруживает сильную склонность эксудировать нитроглицерин.
Кроме перечисленных двух рецептов, американский вигорит вы-
делывался еще другого состава, причем пропорция отдельных состав-
ных частей его обыкновенно заключалась между следующими пре-
делами:
Нитроглицерина . .
Калиевой селитры .
Древесных опилок .
Бертолетовой соли .
ОТ 25% до 30%
я 15 я 35 „
я 15,, я 35 я
г» ю „ 30 „
*) Вместе с нитроцеллулозой и нитролигнином.
Витериты приобрели печальную известность по чрезвычайному
сильному взрыву, имевшему место при выделке его Hamilton powder-
Company около станции Stratford в Штате Онтарио.
Это есть смесь нитроглицерина с бертолетовой
. opojc е ера. солью, углем и нитроцелюллозой, смоченных маслом.
Антуан и Гено предложили очень сильный дина-
мит, к сожалению, не обладающий достаточной безо-
пасностью в обращении.
Их препарат состоит из непроклеенной бумаги, вымачивающейся
в растворе селитры, бертолетовой соли и пикрата калия. После про-
сушки она пропитывалась нитроглицерином.
§ 5. Нижеследующие динамиты содержат нитроглицерин в смеси
с различными нитропроизводными.
1. Динамит
Mowbray.
Он имеет очень простой состав. Это есть бинарная
смесь:
Нитроглицерина . 70
Нитротолуола . . 30
2. Салит.
Предложен в 1878 г. Бельгерштромом и представляет
также бинарную смесь:
64,86% нитроглицерина,
35,14 „ нитромочевины.
Нитромочевина СО. NgHt.HNOs сильно взрывает при нагревании
до 150°С. Она может поглотить до 77% нитроглицерина.
Им была предложена целая серия взрывчатых
веществ, в состав которых входил какой-либо угле-
водород, в котором была растворена сера (как, напри-
мер, растительное масло, перегнанное в железной реторте, с 28%—30%
серы в порошке) со сжигающим в роде селитр, хлоратов нитропроиз-
водных углеводородов, нитроглицерином, нитроманнитом и т. п.
. Так, например, им предложено делать смесь, состоящую из:
77% нитроглицерина и
22 п терпентинного масла,
поглощая их кремнеземом
По своей взрывчатой силе подобный динамит не уступал Гур-
Динамиту № 1, но был менее бризантен, менее чувствителен к кап-
сюлю п механическим влияниям. *)
§ 6. Известен ряд динамитов, в которых поглотителем нитрогли-
церина служат разные виды целюллозы. К числу таких динамитов
можно причислить следующие'.
1. Динамит Бур-
стенбендера.
Этот динамит состоит, главным образом, из
20% — 60% нитроглицерина, смешанного с 80°/в —40°/®
специальной целюллозы из пробки. Кроме этих двух
компонентов, входят в состав его и другие вещества.
2. Взрывчатое ве-
щество Claris.
Оно было предложено в Англии еще в 1868 г. и
представляет растительное волокно, пропитанное нитро-
глицерином.
, Этот динамит по составу сходен с предыдущим.
. ульгурит. qh состоит из 60% — 90% нитроглицерина и 40%—10%
муки, растительных злаков и магнезии, причем динамит содержит
90% нитроглицерина представлял из себя жидкость.
. л Оно было предложено М. Rocca в 1884 году и вы-
итокпастит. рабатывалось в Испании.
Литокластит представляет смесь нитроглицерина с углеводоро-
дами типа СтНпОр, где р меньше или равно п. В общем это будут
целлюлозы и вещества родственные им.
М. Rocca предполагал их вводить в состав дйнамита лишь в та-
ком количестве, чтобы при взрыве они сгорали бы нацело. Таким
образом, варьируя природу поглотителя и пропорции составных
частей, можно получать взрывчатое вещество той или другой мощ-
ности.
*) Другие взрывчатые вещества им предложено получать, смешивая ра-
стительное масло с растворенной в нем серой с одним из следующих нитро-
производных:
Нитроглицерином (С3Н5 (NO3)3)
Нитробензолом С6Н5—NOa)
Нитротолуолом СВН4 (NO2).CH3)
Нитрофенолом (C6H4(NQ2) ОН)
Нитрокумолом (С9 HuNO2)
с прибавлением натриевой селитры.
Здесь для примера приводится пример подобного взрывчатого вещества
о нитрокумолом:
Натриевой селитры...............850/0
t Нитрокумола....................... 5 „
Растительного масла с серой .... 10 я
Главное неудобство взрывчатых веществ Бихеля —окисляемость на воз-
духе масла. ,
•%?
кап-
пли-
нтов
из
40%
двух
1 г,-11
итро-
щим.
-10%
ржит
и вы-
доро-
будут
в та-
?аким
1ВНЫХ
мощ-
вая ра-
нитро-
эщества
на воз-
г
Ир*
ir '
&
й'. I
$
— 677 —
5 В 1876 г. у нас, в Военном ведомстве, был вве-
э. целпюлозе-дина- ден целлюлозе.^инамит Трауцля, ИЗГОТОВЛЯВШИЙСЯ НЯ
мит рауцля. заВ0Де Нобеля.
Он заключал в себе:
70 % нитроглицерина
29,5 „ древесно-бумажной'массы,
9,5 „ соды.
Уд. вес его около 1,0. Пластичная масса от темно-бурого до
светло-коричневого цвета.
Кроме этого сорта существовали и другие сорта его, заключавшие:
70 % — 75 °/о нитроглицерина,
24,5 „ —29,5 „ нитрованной древесины,
0,5 „ СОДЫ.
Цвет их был от темносерого до желтоватого, строение мелко-
зернистое и в смысле безопасности в обращении, они приравнивались
к кизельгур-динамитам с соответствующим содержанием нитрогли-
церина.
Известен ряд динамитов, непринадлежащих к разряду желати-
нитро-
числу
нированных, но содержащих большее или меньшее количество
целлюлоз. В состав их иногда входят так же и селитры. К
таковых принадлежат следующие:
Он предложен был в 1871 г. В сущности
пред-
ставляет из себя тип переходный между динамитами
с инертным основанием к динамитам рассматривае-
мой группы.
Он готовился в Штейермарке в Австрии и
желтовато-коричневого цвета, пластичной массы,
Его состав следующий:
6. Белый австрий-
ский динамит Дил-
лера.
имел вид светлый,
жирной на ощупь.
60% — 75% нитроглицерина,
40 „ — 25 „ смеси обожженного мела и
Другие сорта динамита Диллера заключали
Нитроглицерина . .
Мела............ .
Углекислой магнезии
Нитроцеллюлозы . .
Пироксилина ....
63°/
20 „
5
10 „
9
г
нитроцеллюлозы.
в себе:
65%
30 „
Удельный вес 1,3—1,4. По внешнему виду — довольно суховатая
мелкозернистая масса светложелтого или коричневого цвета. При
продолжительном хранении эксудирует нитроглицерин.
ПЛЧ...
К числу динамитов, содержащих нитроцеллюлозу и
. дуалинъ. значительное количество селитры, принадлежит предложен-
ный в Австрии Дитмаром в 1868 году дуалин. Он состоит из:
50% нитроглицерина,
30 „ нитрованных древесных опилок,
20 „ калиевой селитры.
Одно время он применялся для снаряжения подводных мин
(Германией во Франко-Прусскую войну 1870—1871 г.).
Это порошковатое вещество желто-коричневого цвета. Детонирует
от капсюля только в прессованном виде. Воспламеняется довольно
легко, горит без взрыва. На морозе замерзает, но не изменяет при
этом своей структуры, однако, сверлить замерзший динамит нельзя.
Удельный вес 1,2 при взрыве дает много углекислаго газа. Не
достаточно стоек.
8. Абелинили Он предложен в 1867 г. Абелем,
глиоксипин. Он СОСТОИТ ИЗ:
65,5% нитроглицерина,
30,0,, пироксилина,
3,5% с.елитры,
1,0 „ соды.
В Австрии применялась одно время подобная же смесь, но за-
ключавшая в себе лишь 25% нитроглицерина.
• . Этот динамит состоит из 88,4% нитроглицерина,
. eans erosive, пироксилиновой мезги и около 2,8% воды.
Пироксилиновая мезга может быть заменена нитродекстрином.
При приготовлении этого динамита, пироксилиновая мезга или
нитродекстрин сперва смачиваются водой и затем к ним прибавляется
нитроглицерин.
Для получения нитродекстрина, декстрин, или английский клей
смачивается % своего веса азотной кислотой; жидкости дают стоять
на вольном воздухе и окончательно высушивают при 115е С.
10. Фупьминатин.
Под этим названием
динамит состоящий из:
Фукс в 1871 г.
предложил
85в/0 нитроглицерина и 15% нитроцеллюлозы.
Под тем же названием, но иного состава Buffi и Candini гото-
вили так же в ..Милане другой динамит.
11 к ип то Смесь глицерина с крахмалом подвергается нитра-
. сипотодин. цИИ тем же cn0C0g0M> которым получается нитроглице-
рин. Вместо крахмала можно брать целлюлозу, гидроцеллюлозу, ман-
нит, даже бензол и другие вещества.
12. Динамит Этот динамит заключает довольно много селитры. Его
австрийский, состав следующий:
42,85% нитроглицерина,
42,85 „ селитры,
14,30 „ нитроцеллюлозы.
ин
гет
>но
ри
ЗЯ.
Не
Динамит этот требует для своего взрыва специального капсюля,
от обыкновенного же он не детонирует.
Препарат мало чувствителен к удару и холоду, по силе же
своей, мало разнится с другими динамитами. )
S3. Порох Ry\?es’a.
Он готовился нескольких сортов, из
наиболее известны три:
которых
33“
Нитроглицерина . . \ 44,87 43,64 22,65
ГТ ! Пироксилина . . . . . 46,72 45,45 70,75
Касторового масла . . 1,87 1.82 0,94
Углекислой магнезии . 1,87 1,82 0,94
Коллодионного хлопка. 1 4,67 7,27 4,72
. Это пироксилиновые динамиты разного состава, со-
. м ерит . дерЖащИе парафин или гуммилак. Состав их следующий:
на,
юм.
1ЛИ
яся
лей
)ЯТЬ
От 33,33% до 36,36% нитроглицерина
„ 44,45 „ „ 42,73,, пироксилина,
„ 22,22 „ „ 20,91 „ гуммилака или парафина.
15. ЕзрЫвчатое
вещество Ка-
лифорния.
Смесь нитроглицерина с пироксилином, нитратом-
метила или этила и древесным спиртом.
Опасна как при фабрикации, так и при обращении
с ней.,
жил
В 1876 г. Ламм предложил динамит, состоящий из
. «тропит. ННТр0ГЛИцерИна и (5% нитроцеллюлозы. В качестве
последней он предлагал нитрованные: хлопок, солому, крахмал и проч.
Своему составу он дал название нитролит.
'ОТО-
Так назван сильный динамит, предложенный в 1877
апвин. гОДу £anfrey и выделывавшийся одно время бельгийской
фабрикой Arendonc. Состав его весьма прост:
[тра-
нце-
мая-
30%—50% нитроглицерина,
70 „ —50 „ порошкообразной нитрованной соломы.
Солома бралась овсяная и нитровалась как обыкновенно.
— 680 —
При равных весовых количествах он сильнее 75°(0 гурдинамита,
воды мало боится. Удельный вес палеина, содержащего 50% нитро-
глицерина 1.4; цвет его коричневый. Недостаток его—склонность к
эксудации нитроглицерина.
18. Взрывчатое ве-
щество Атланта
Это есть нитроцеллюлоза, поглотившая известное
количество нитроглицерина с небольшим количеством
парафина.
19. Динамит
Трауцля.
дующий:
Он предложен был в 1867 г. и одно время принадле-
жал к лучшим взрывчатым веществам, а потому пользо-
вался значительным распространением. Состав его сле-
73о/0 нитроглицерина,
25 „ пироксилина,
2„ угля.
Он обладал свойством взрываться под водой без картуза и до-
вольно хорошо выдерживал толчки и удары. Довольно хорошо взры-
вался капсюлем гремучей ртути.
20. Экстра-динамит.
Предложен был в 1879 г. А. Нобелем.
Он готовился по нескольким рецептам:
Нитроглицерина .... 23 63 14 55,6
Нитроцеллюлозы .... i 71 24 1 4,8
Аммиачной селитры . . j 2 12 63 35,5
Древесного угля .... ! 4 1 12 ~
В качестве нитроцеллюлозы Нобелем рекомендованы: нитродек-
стрин, нитрокрахмал и т. п., древесный же уголь, можно заменять
частью или полностью: сахаром, крахмалом, декстрином и т. п.
В таком же роде смесь представляет так называемая аммонийная
нитрожелатина. Она заключает в себе:
55% нитроглицерина,
35 „ аммиачной селитры,
2 „ коллодионного пироксилина,
3 „ декстрина,
5 „ древесного угля.
Сперва смешивают между собою нитроглицерин и декстрин, за-
тем прибавляют коллодионный пироксилин и аммиачную селитру и
наконец уголь. Замешивают все в тестообразную массу, которую патро-
нируют в водонепроницаемые гильзы. Вещество гигроскопично, хра-
нится в сухом помещении.
Оно взрывается особыми капсюлями.
21 Яме ик н Это С3ЧЪ динамиты самого разнообразного состава,
ский Фоосит содержащие от 7,9% до 76% нитроглицерина, от 0,1%
т р ’ до 4% нитроцеллюлозы и от 92% до 20% поглотителя.
В качестве последнего служит смесь калиевой с натриевой се-
литры с древесной мукой. Есть сорта этого динамита и с более слож-
ным поглотителем, состоящим из:
84,2% натриевой селитры,
9,5 „ серы,
3,7 я канифоли,
2,6 „ древесного дегтя.
Для приготовления этих динамитов сплавляют: канифоли, серу,
и деготь, затем прибавляют чилийскую селитру, после чего варят до
полного удаления паров воды. После охлаждения массу измельчают
и смешивают с нитроглицерином. Подробнее о них будет сказано
далее.
22 Пик „ Это взрывчатое вещество было предложено в Аме-
икриновыи рИке, ПрИчем существует несколько рецептов, по кото-
динамит. рым оно готовится 0дИН из наиболее известных сортов;
его заключает в себе:
37,5% нитроглицерина,
37,5 „ аммиачной селитры,
25 „ пикрата аммония.
23 _ ин В Гамбурге с 1887 г. выделывалась так называемая
икриновая пикриновая желатина. В ее состав входили: нитрогли-
желатина. церИн, коллодионный пироксилин и пикриновая кислота.
Особого распространения не получила.
24. Взрывчатая
смесь Смоляни-
нова.
Она заключала от 80% до 97% нитроглицерина и
от 20 до 3% специальной жидкости.
Испытывалась в 1887—1888 г. в Америке. Предло-
жена была между прочим для снаряжения снарядов.
__ п Это есть смесь нитроглицерина с нафталином или
25. Пантопопит. v r
динитронафталином.
Одно время она выделывалась на заводе в Опальдене и считалась
экономической,
Б. Желатинированные динамиты.
Хотя А. Нобель еще в 1875 году заметил, что 7%—8% колло-
дионного хлопка, растворяясь в нитроглицерине, желатинирует его,
и в следующем году взял патент на приготовление желатинирован-
ных динамитов, но последнее широкое применение получили не сразу.
Так, начало их выделки в Англии относится только к 1878 г., а на
континенте они стали готовиться только в 1880 г.
Они тогда состояли из:
89% нитроглицерина
7 „ коллодионного пироксилина
4 „ камфары.
Однако, производство развивалось очень медленно, при чем при-
чиной было то обстоятельство, что приготовлявшиеся гремучие студни
эксудировали нитроглицерин и потому не обладали достаточной безо-
пасностью. С этим недостатком справились в Англии только в 1887 г.,
и с тех пор желатинированные динамиты, благодаря огромной своей
силе и безопасности обращения, получают самое широкое распро-
странение.
Наиболее сильные из них, а именно гремучие студни (т.-е. соб-
ственно гремучий студень или его синонимы: нитрожелатин или взрыв-
чатый желатин) с большой выгодой применяют при работах в очень
вязких и твердых породах. Они часто употребляются в особенности
в Америке и Трансваале.
Менее мощные, так называемые студенистые динамиты, характе-
ризующиеся меньшим содержанием нитроглицерина, в частности —
антигризутные сорта желатинированных динамитов с выгодой при-
меняются в горном деле в менее твердых породах, а также там, где
вопрос получения породы в виде крупных кусков представляется
существенным.
§ 1. Гремучие студни представляют динамиты с максимальным
содержанием нитроглицерина, а потому представляют одни из сильнейших
нитроглицериновых препаратов.
В них редко больше 12 */2% коллодионного пироксилина, чаще
его всего 7—8°/о *). В большинстве случаев в составе своем они за-
ключают еще немного мела или углекислой магнезии, а также 1%, или
несколько меньше, вазелина.
Наш Шлиссельбургский пороховой завод выпускает гремучий
студень с максимальным содержанием нитроглицерина под названием
„Гремучий студень Экстра*1**). Он заключает в себе:
93% нитроглицерина и
7 „ коллодионного пироксилина.
*) Так называемый Желатин—форлст заключает в себе 96 нитроглицерина и
4 ,, коллодионного пироксилина. Он в 1,33 раза сильнее динамита № 1.
**) Или просто „Гремучий студень".
Он при взрыве дает полное* сгорание, развивая силу почти е
полутора раза большую, нежели сила динамита № 1.
Тот же состав Нитрожелатина завода Акционерного О-ва Виннер.
1
в
Английский Blasting
Gelatin е.
себе:
Приблизительно такой же состав гремучих студ-
ней в главных Государствах Западной Европы, так
например: английский Blasting Gelatine заключает
93,95% нитроглицерина,
7,5 „ коллодионного пироксилина,
0,2 „ мела и
0,3 „ влажности.
Имеет фабр, марку „№ 1“.
2 Австрийский гремучий
студень,
бургского завода.
Заводы Zamky в Богемии и Прессбурге вы-
рабатывают гремучий студень, идентичный по со-
ставу с гремучим студнем „Экстра“ Шлиссель-
з. Германский Он состоит из 91,5 нитроглицерина, 8% особого
Spenggelatlne сорта КОЛЛОДИОННОГО ХЛОПКИ И 0,5 СОДЫ.
4. Швейцарский грему-
чий студень..
Гремучий студень, вырабатываемый в Швей-
царии, заключает 91°/о нитроглиперина, 9% колло-
дионного хлопка и немного соды.
_ _ Изготовляемый в Италии гремучий студень
. тапьянскии гремучий С0д6рЖИТ несколько меньше нитроглицерина, а
студень. именно 92—93%, кроме того 8—7% коллодионного
пироксилина и 2°/е древесного спирта.
6. Французские гремучие ОНИ ПОДОбны НЯШИМ. Вот состав ТИПИЧНЫХ
студни. трех:
Нитрогли- церин, Коллод. пи роке. Калие- вая се- литра. Натрие- вая се- литра. Древес- ная му- ка.
Dynamite—gomine extra forte । । 92%—83% 1 8%-7% । — —
„ potasse.. . ' 82„-83„ ' 1 6»—5„ . 9%-10%! — II 2% 3%
„ „ soude. ... 82 . -83 „ J J 6»—5. J 9%-Ю% 2 „ -3 „
Коллодионный пироксилин, идущий на изготовление гремучих
студней, должен быть совершенно растворим в смеси спирта с эфиром,
но вместе с тем содержать максимальное количество азота. Хотя гре-
мучие студни взрываются капсюлем № 8, но рекомендуется их за-
ставлять детонировать патроном студенистого динамита или специ-
альным запальным патроном, содержащим во°/о нитроглицерина и
40% нитроцеллюлозы, или, наконец, при помощи взрыва запальной
шашки пироксилина.
Реакция детонации гремучих студней протекает по уравнению:
30,8CeHIO Ng 0, 3 С24 Нз1 Nt» O3g = 209 СО2 —j— 170 Н2О -j- 20з —j— 97Ng,
причем температура взрыва теоретически достигает 3203°С. Из
одного килограмма взрывчатого вещества, об’ем газообразных продук-
тов, приводя их к 0° и 760 м. м. давления будет 708 литров, причем
выделяется 1535 калорий тепла. Упругость газа в об‘еме одного литра
доходит до 9332 килограмм.
7. Гремучки студень
„обыкновенный**.
Под этим названием Шлиссельбургский завод
выпускает фабрикат, промежуточный между грему-
чими студнямй и студенистыми динамитами. Они
содержат в своем составе:
83% нитроглицерина,
5 „ коллодионного пироксилина,
10 „ калиевой селитры,
2„ древесной муки.
_ г _ Так называемый „Гремучий студень" Акционер-
в н ного Общества Виннера отличается от этого динамита
иннера. Шлиссельбургского завода отсутствием древесной
муки, за счет которой увеличено на 2% количество селитры.
Гремучие студни, применяющиеся в частной промышленности,
большею частью патронируются в цилиндрические патроны d = 30 мм.
и длиной около 100 мм., весящие 70—Юо грм. фунтовые патроны за-
ключаются обычно в жестянки четырехугольной формы*
Лучшая обертка патронов—растительный пергамент; при невоз-
можности иметь его допускается бумажная обертка, причем она пред-
варительно должна быть пропитана смесью 20 частями парафина,
30 частей очищенного жира и 60 ч. смолы.
Прежде применяли специальные подрывные патроны в картон-
ных гильзах, заключавших 150 грм. вещества.
Они снабжались входящей внутрь состава гильзочкой, содержа-
щей запальный заряд из 30 грм. прессованного сухого пироксилина.
Эти запальные патроны хранились отдельно.
Гремучие студни с течением времени делаются несколько тверже
свеже-приготовленных. Хороший гремучий студень не должен эксу-
дировать нитроглицерина даже при повторном замерзании и оттаива-
нии*), а также при недельном лежании при температуре 32°С не должно
нисколько изменяться ни физическое, ни химическое состояние.
*) На практике это достигается с трудом и многие гремучие студни эмули-
руют нитроглицерин при повторном замерзании и оттаивании. Это особенно имеет
место в гремучих студнях изготовленных после 1914 года.
Вполне доброкачественные гремучие студни выдерживают пробу
на стойкость в течение 40—60 минут, причем минимальное время для
пробы на стойкость определяется в 10 минут.
Для своего взрыва гремучие студни требуют работы в 3,5 килогр-
метр. Если небольшое количество гремучего студня положить между
бронзовыми плитками, то взрыв происходит при падении груза
в 26,25 килогр. с выс. 3,66 метр.; замерзший же взрывают при тех же
условиях при падении того же груза с высоты всего лишь 6,80 мет-
ров. Студенистые динамиты при таком опыте не дают столь большой
разницы: в них взрыв происходит при высоте падения этого груза
с высоты 2,10—2,40 метров.
Камфарные гремучие студни должны выдерживать в течение
8 дней нагревание до 70°С, не обнаруживая при этом значительного
разложения.
Будучи положены в воду, гремучие студни с поверхности бе-
леют, подвергаясь действию жидкости только снаружи.
Гремучие студни- при медленном нагревании до 204«С. взрывают,
камфарные же при таких условиях только воспламеняются при темпе-
ратуре 350°С. С течением времени сила гремучих студней несколько
слабеет и вместе с тем уменьшается их чувствительность к капсюлю.
Содди нашел, что нитрожелатина, давшая об'ем полости разду-
тия в бомбочке Трауцля 570-гб00 куб. c./м., по истечении года дала
только 340—420 куб. с. м., потребовав для своего взрыва капсюля № 7,
тогда как год тому назад детонировала от капсюля № 6. Под влия-
нием некоторых причин, еще пока в точности не установленных, гре-
мучие студни несколько выделяют нитроглицерин. Чтобы это свойство
не делало их- опасными в обращении, их завертывают в раститель-
ный пергамент, не пропускающий сквозь с’ебя нитроглицерин наружу.
Соприкосновение с гремучими студнями вызывает обычную для
нитроглицерина головную боль.
Военные динамиты.
§ 2. Введение в состав гремучих студней камфары и вазелина
делает их настолько мало чувствительными к механическим влияниям,
что представляет возможным даже применение их в известных слу-
чаях в военном деле. Такие специальные динамиты носят название
военных.
Например, гремучий студень, состоящий из:
95% гремучего студня с содержанием 92,5—
—93,5% нитроглицерина и 7,5%
— 6,5 „ коллодионного, пироксилина
4 „ камфары,
1 „ вазелина.
Не взрывается даже от попадания в него ружейной пули, а потому
может применяться в военном деле для подрывных работ, метатель-
I
ных снарядов, бросаемых от руки и т. п., и называется военным ди-
намитом.
Таким образом, камфара и вазелин служат флегматизаторйми
гремучих студней, причем вазелин в то же время несколько пони-
жает точку замерзания этих динамитов.
I Русские военные Наши военные динамиты имеют вид янтарно-
у е военные желтой, или буроватой полупрозрачной, слегка ма-
дии миты. слянистой на ощупь, упругой массы и обыкновенно
употребляются в виде цилиндрических патронов, завернутые в бумаж-
ную, из растительного пергамента, оболочку с надписью ,,военный
динамит11, причем вес их около 70 грм.*) Заряды его для подрывных
работ обычно расчитываются по тем же формулам, по которым рас-
читываются пироксилиновые.
По существующим в Военно-Инженерном Ведомстве правилам,
заряды до 4 фунтов (т.-е. не свыше 24 патронов) можно взрывать
одним толовым или тетриловым капсюлем № 8, при больших же
зарядах для верности взрыва рекомендуется брать еще промежуточ-
ный детонатор из студенистого динамита, взятого в количестве 2,5%
веса заряда'при сухопутных взрывах и 5% при подводных.
Заряд военного динамита обычно зашивается или завертывается
в непромокаемую ткань; при отсутствии таковой его можно заверты-
вать в холст, жесть или бумагу, но непромокаемая ткань предпочти-
тельнее перед другими.
В Австрии под названием военного динамита
приготовляют смесь: 96% нитрожелатины, состоя-
из 90% нитроглицерина и 10% коллодион-
камфары.
2. Австрийский военный
динамит.
кого пироксилина с 4%
5. Итальянский военный
динамит.
Состоит из 95% нитрожелатины, заключаю-
щей 92% нитроглицерина и 8% коллодионного
пироксилина, а также 5% камфары.
4. Snyders Explosive.
К той же группе камфарных динамитов следует
отнести также „Взрывчатое вещество Snyders'аи, пред-
ложенное в Ныо-1орке.
Этот динамит состоит из 94% нитроглицерина и 6% специаль-
ного поглотителя, состоящего из пироксилина, коллодионного хлопка
и камфары; в качестве растворителя—применен был эфир.
Им пробовали снаряжать гранаты, но он оказался не соответствую-
щим этой цели. Известны камфарные гремучие' студни и с другими
пропорциями составных частей, как например;
88%—89% нитроглицерина
7 , коллодионного пироксилина
5 „ — 4 „ камфары.
*) Фунтовые заряды гремучаго студня (военного динамита) обыкновенно уку-
порены в четыреугольные жестянки, имеющие специальную гильзочку для капсюля.
— 687 —
Удельный вес этих динамитов близок к 1,60. Температура взрыва
около 204»С.
Состав его:
5. Американский кам-
фарный динамит.
§ 5'. Студенистые динамиты
или желатин-динамиты.
нитроглицерина..................86,4%
коллодионного пироксилина .... 9,6„
камфары.........................4,7 „
Гремучие студни для некоторых случаев
в частной промышленности и горного дела
слишком сильны, а потому в состав их вводят-
ся некоторые вещества, умеряющие их черезчур сильное бризантное
действие. Таким образом получаются взрывчатые желатины с несколько
ослабленным действием, называемые студенистыми или желатин-
динамитами, характеризующиеся меньшим, сравнительно с гремучими
студнями, содержанием нитроглицерина и заключающие в себе, кроме
коллодионного пироксилина, также селитру и древесную муку*).
। - t Пропорция нитроглицерина в студенистых
у «кие студенистые динамитах различная, причем она изменяется от
динамиты. д0 g4oyei в России чаще других употребляется
студенистый динамит^ приготовляющийся на Шлиссельбургском заводе
и состоящий из:
62% нитроглицерина, 27% селитры и
3 „ нитроцеллулозы, 8 „ поглотителя.
Нитроцеллулозой служит для него коллодионный хлоиок, а по-
глотителем— смесь селитры и древесной муки.
От этого динамита прекрасно детонируют гремучие студни, чем
и пользуются часто на практике, употребляя этот динамит в качестве
вспомогательного детонатора.
, Во Франции студенистые динамиты носят
раицуэские названия Gelatine A, Gomme и Gelignite. Вот
студенистые динамиты. состав некоторЫХ наиболее распрострайенных во
Франции студенистых динамитов:
Нитро- глиц. Коллбд. хлопок. _ J Кали- евая селитра. Натри- евая, селитра. Древесн. мука. Ржаная мука.
Gelatine А . । 64% 3% 24% 8%
Gelatine В —potasse . . . 57,5% 2,5<% 32% 8%
„ В. sonde .... 57% 3% — 34% 6% —
Gomme Е | 49% 2®/0 36»/, ю% 3%
*) Сюда же можно причислить
близкие к ним по составу.
так называемые желиньиты (Gelignite),весьма
К числу динамитов, по своему составу похожих на студенистые
динамиты, но обладающих свойством трудно замерзать, принадлежит
принятый французской Commission des Substances Explosives, вы делы
ваемый фабрикой Societe Anonyme d’Explosifs et Produits chim ique
динамит из категории „Antigels", состоящий из:
66,4% нитроглицерина,
5% коллодионного пироксилина,
16,6 % нитрогликоля,
10% селитры,
2 „ древесной муки.
В других трудно замерзающих динамитах, во Франции вместо
нитрогликоля вводится динитротолуол.
з г некие ст В Германии студенистые динамиты, употребляе-
ерм1нские студе- мые в горноц промышленности, состоят из 80 частей
нистые динамиты. „ 1 ’
желатинированного пятью процентами коллодионного
пироксилина, гремучего студня и к нему прибавляют 20 частей
„Zumischpulver" *).
Иногда в качестве красящего вещества прибавляют немного
Выделывающийся в Австрии студенистый дина-
мит носит название Динамита I и имеет сходный
состав, заключая в себе:
жженой охры.
4. Австрийские сту-
денистые динамиты
62,5% нитроглицерина, |
2,5 „ колодионного пироксилина j
25,5 „ натриевой селитры, 1
8,75% муки, ’ 35%**)
0,75 „ соды. j
65%
4 По виду этот динамит представляет вязковатую и пластичную
массу. Хотя он и боится воды, но в сырых скважинах применяться
все таки может. При достаточной силе сравнительно дешев, почему
применяется довольно часто. При взрыве не дает вредных газов, по
составляет до 16,6% твердого остатка.
Динамит этот дает об'ем пустоты при пробе в бомбочке Трауцля
556 куб. сантиметров.
Для придания составу большей твердости, иногда увеличивают
пропорцию пироксилина, иногда же берут больше „Zumischpulver’a".
Благодаря содержанию „Zumischpulver’a", состав боится воды,
так как она выщелачивает натриевую селитру, но это происходит не
*) Состав „Zumischpulver" вообще говоря не постоянен, часто же применяется
с этою целью смесь: 74% натриевой селитры, 25% мука й 1% соды. Иногда коли-
чество селитры и муки относятся между собой даже как 4:1.
**) Иногда этот »Zumischpulverrt заключает в себе: 26,25% натриевой селитры,
8,4% муки и 0,35% соды.
}тые
жит
(еды
ique
с такой большой быстротой, чтобы этот динамит нельзя было бы при-
менять при сырых скважинах. В общем по своему наружному виду
немецкий студенистый динамит (или желатин-динамит) очень напоми-
нает хлебное тесто.
Удельный вес его 1,7 и для взрывания достаточно капсюля № 3
(с 0,54% грм. гремучей ртути). '
Детонационное разложение этого студенистого динамита следует
уравнению:
41,3C6H10NeOi8 + O,7C24H31N9O38 + 91,4NaNO3 + 16,2С6Н1вО5 + Na2CO3 =
X = 316СО2 + 298Н2О -Г 2902 + 172Х2 + 47XNaCO3.
есто
дяе-
гтей
1ОГО
;гей
ю го
ина-
ный
Этот динамит дает около 16,6% (относительно веса заряда) твер-
дого остатка. Килограмм этого динамита при взрыве образует 606 лит-
ров газов (приведенных к 0« и 760 м.м. давления), причем упругость
развивающихся газов, имеющих об'ем один литр, равняется 7466 кило-
граммов. При взрыве отделяется 1267 тепловых калорий.
Для него мы имеем следующие взрывчатые константы:
f = 7476 килограммов
ve — 606 литров
to = 2984°С.
Р = 538,5 тонно-метров.
а = 1,5 литра
‘ В Англии студенистые динамиты носят название
. игпииские студч- (}е|ацпе Dynamit’oB. Состав их отличается разнообраз-
нистые динамиты. ной ПрОПОрцИен составных частей, но природа их в
общем та же самая, как и немецких, с той только разницей, что они
заключают вместо натриевой селитры калиевую.
Чаще всего в них 70—76% нитроглицерина. Один из „стандарт-
ных* динамитов этого рода имеет следующий состав:
шую
ться
1ему
!, но
щля
вают
т’а“.
оды,
т не
яется
коли-
итры,
74,5% нитроглицерина,
5,5 „ коллодионного пироксилина,
4 /0 древесной муки,
15,5% кадиевой селитры,
0,2 „ мела,
0,3 •„ влажности.
Древесная мука для этих динамитов не должна быть слишком
мелка, иначе трудно получить полный взрыв; чем мельче прочие со-
ставные части, тем лучше.
Если взрыв полный и с патронов снята бумажная обертка, то
этот стандартный сорт желатин-динамйта почти не дает окиси угле-
рода (ее получается всего лишь около 2%), тогда как, если оставлять
в патроне бумажную обертку, то количество окиси углерода возра-
стает весьма заметно, доходя до 14%.
Проф. Л1. Сухаревский. Взрывчатые вещества и взрывные работы.
44
• В Англии для обертки употребляется преимущественно расти-
тельной пергамент, чего нельзя сказать про патроны, вырабатываю-
щие на континенте; само собой понятно, что пергаментные обертки
во всех отошениях предпочтительнее.
Иногда, кроме бумажной обертки, патроны завертываются еще в
фольгу, последняя предохраняет больше от сырости, не допуская
нитроглицерин, в случае эксудации его, впитываться в бумажную
обертку, но, будучи при взрыве распыляема, дает среди продуктов
взрыва вредные вещества, почему ..особенно рекомендоваться не
может.
6. Прочие сорта студе-.
нистыу динамитов.
Из других студенистых динамитов, менее
распространенных, можно указать на следующие
сорта его:
Нитроглицерина . . . 64,4% г.со/ ас /0 38,8%
Коллодион. пироксил. 2,3 „ 9 1,2 „
Натриевой селитры. . 24,7 „ 28 „ 45 „
Древесной муки . . . 7,6 „ 12 , 15 „
Соды 0,4 „ —
Существуют студенистые динамиты с камфарой (до 6/>/0). Прежде
студенистые' динамиты с содержанием нитроглицерина от 60% до 80%
обозначались № 1, а те, в которых количество нитроглицерина заклю-
чается в пределах между 40% и 50% носили Л6 2. Ныне такая ну-
мерация более уже не употребляется. В замерзшем виде студенистые
динамиты по большей части действуют даже при полных взрывах не-
сколько слабее талых, в то же время выделяя вредные газы.
К студенистым динамитам можно причислить так-называе-
мые желатин-динамиты Нобеля, предложенные им в 1876 г. ч
Их разновременно предложено было Нобелем много сортов, при-
чем наиболее известные суть следующие:
Желатинированного нитроглицерина . 65%
Поглотителя...........'...........35 „
Желатинированный нитроглицерин состоял из 97,5% нитрогли-
церина и 2,5 % коллодионного пироксилина, а поглотитель заключал
в себе:
75% калиевой селитры, .
24 ,, древесной муки, •
1 соды.
Динамит с меньшим содержанием нитроглицерина:
Нитроглицерина........... 63,40 43,85
Коллодионного пироксилина. 1,60 1,15
Селитры..............' . . 26,75 41,25
Древесной муки............8,40 13,20
Соды ..................... 0,35 0,55
Серы........ — —
24,35.
0,65.
56,00.
17,00.
0.75.
1,25.
— 691 —
Они хорошо сопротивляются повышению температуры и влаж-
ности, пластичны и не эксудируют нитроглицерина. Взрывают от
капсюля с гремучей ртутью с большой силрй.
§ 4. Желиньиты (Gelignites) или „желатиндинамиты для экспорта" *)—
суть те же студенистые динамиты, но с несколько иной пропорцией со-
ставных частей. Обычно английские желиньиты содержат от 54% до
80% нитроглицерина, чаще же 54%—63% его, причем он желатини-
рован при помощи 3%—6% коллодионного - пироксилина. Они содер-
жат часто вместо натриевой селитры калиевую (24%36%), сравнитель-
ное небольшое количество муки (6%—9%) и мела (около 0,5%).
Удельный вес 60% желиньита—»1,63. Для фзрывания его тре-
буется капсюль К? 5 (с 0,8 грм. гремучей ртути).
По наружному виду желиньит напоминает немецкие желатин-
динамиты, но несколько плотнее .его и имеет меньшую пластичность.
1. Английские Для примера приводится состав одного из „стандарт-
желиньиты. ных“ сортов английского желиныгта:
Нитроглицерина..........60,5%.
Коллодионного пироксилина. 4,5
Древесной муки............. 7 „
Калиевой селитры.......... 27 „
Мелу......................0,2 „
Влажности.................0,8 „
2. Французские Здесь приводится для примера состав одного фран-
желиньиты. цузского желиньита:
Нитроглицерина............................58%.
Коллодионного пироксилина . 2 „
Калиевой селитры..........28 „ \
Древесной муки..............9 „
Ржаной муки.................3 „
В состав французских желиньитов нередко вводят тоже и ам-
миачную селитру, что с одной стороны увеличивает силу динамита
с другой же делает препарат более гигроскопичным и менее стойким.
(Вот состав еще одного желиньита:
56,50% нитроглицерина,
3,80 „ коллодионного пироксилина,
8,оО „ древесной муки,
32,00 „ калиевой селитры.
По силе он одинаков с динамитом № 1 (по крайней мере под
водой).
*) В Австрии они называются динамитами II.
44
/
692 —
Состав
последнего:
г
. i
)
II
надо
*
3. Австрийские
желиньиты.
натриевой селитры,
муки,
Нитроглицерина .
Нитроцеллюлозы. .
Натриевой селцтры
Сгорающего. . . .
Мела.............
название ди-
намит IIу заключающего в себе: 72% калиевой селитры; 1ь% нитроглицерина и
70%
28 „
45% желатинированного нитроглицерина,
55 „ порошковатого основания.
*) С этим динамитом не
10% древесного угля.
Австрийский динамит II *), тот же желиньит, имею-
щий состав:
н
'3t
г'М
Л..
А
%
„ соды,
„ красящихТвеществ.
Применйемые в Англии, так-называемые 40% динамиты
или „Farmer’s Dynamite* принадлежат уже к более слабым,
но за то, экономическим динамитам.
4. Farmer's
Dynamite.
Они заключают в себе более нежели 39,5% нитроглицерина,^же-
латинированного 0,75%, коллодионного пироксилина и смешанного с
натриевой селитрой, с 16,5% серы, древесной мукой и небольшим ко-
личеством углекислой магнезии.
Применяются они преимущественно для целей’ мелиорации в
тех случаях, когда не требуется взывчатых веществ большей силы,
От соответствующих американских 40% динамитов они отличаются
тем, что входящий в их состав нитроглицерин-желатинированный и
в них настолько значительное количество древесной муки, что почти
исключается всякая вероятность эксудации нитроглицерина, а следо-
вательно, такой динамит вполне безопасен в обращении.
Несколько уменьшая количество нитроглицерина и увеличивая
количество муки, а также вводя аммиачную селитру—мы естественно
переходим к антигризутным динамитам, о которых будет еще речь
впереди.
. Американские
S экономичные
динамиты.
Они там называются „Gelatin's*
Но Holl и Howell, они имеют приблизительно следующий} состав:
I
к
л
i
&
я
В Америке выделывается целый ряд экономичных
динамитов желатинированного типа, характеризующихся
содержанием натриевой селитры.
или „Gelatin-Dynamit'&ti'R'*
30% __J О г 0 / оэ /0 д 40% 50% 55% 60% 70%!
23,0 28,0 33,0 42,0 46,0 50,0 60,0
0,7 0,9 1,0 1,5 1,7 1,9 2,4 J
62,3 58,1 52,0 45,5 42,3 /29,6
13,0 12,0 10,0 10,0. 9,0 9Д 7,0
1.0 1,0 1,0 1,0 1,°. 1,0 1,0
смешивать состав, носящий
тоже
/
i
!
й
— 693 —
В качестве сгорающего при динамитах, содержащих 60%—70%
нитроглицерина, употребляется древесная мука, в остальных же при-
меняется: сера, древесная мука, иногда смолы и другие вещества.
Некоторые заводы заменяют небольшое количество нитроглице-
рина посредством аммиачной селитры, отчего стоимость таких дина-
митов несколько понижается.
Как например динамитов этой категории можно указать на 30%
динамит, анализированный W. С. Соре. В нем он определил:
30,70% нитроглицерина, 3,08% серы,
0,88 „ нитроцеллулозы, 1,02 „ окиси цинка,
54,27 „ натриевой селитры, 0,47 „ влажности.
8,58 „ древесной муки, *
Эти динамиты, вообще говоря, дают при взрыве ядовитые газы
и, для предупреждения образования таковых, Munroe и Hall предложили
в состав их вводить серу.
Хорошие результаты дает также динамит следующего состава:
33°/о нитроглицерина,
1 „ нитроцеллулозы,
54 „ натриевой селитры,
11 % сгорающего,
1» мелу.
Они предложены были Lewin‘ом. Это название иногда,
* . орситы. и ПрИ том соверШенно неправильно, применяется к обыкно-
венным желатинам.
, _ Форситы, применяющиеся в Англии, содержат
• * к • ' разные пропорции нитроглицерина и специального
поглотителя, состоящего из:
76% натриевой селитры,
3 „ серы,
20% древесного дегтя,
1 „ древесной массы.
. В Бельгии форситы вырабатываются в Baleine-
. Бельгийские «рорситы. sur— причем главнейшие сорта состоят из:
МАРКА.
• 1. св к № 1. № 2.
Q- 3 СЛ •
Нитроглицерина .... 1 ! 64 : 64 49 36
Нитроцеллулозы .... 3,5 1 3 2 3
Натриевой селитры . . . — 24 36 35
Аммиачной селитры . . • 25 1 — *—
Древесной муки .... 6,5 8 13 11
Магнезии 1 1 ' *1
Ржаных отрубей .... - — 14
Они выделываются также с калиевой селитрой.
z
К. Форсит готовится в Бельгии, Америке, Испании и поступает
обыкновенно в продажу в патронах, весом около 80 грм., диаметрой
несколько больше 20 мм. и длиной около 120 мм. Он замерзает между
— 2°С. Здесь приводится несколько рецептов форситов, употре-
бляющихся на практике:
Нитроглицерина . . . . 76 “о 50 25
Коллодионного пирокс. • 4 „ 2,6„ Б.3„
Калиевой селитры . . • 16,8„ 40 „ 61,9„
Серы о • “ „ 4,6„ 7,1»
Канифоли . 0,7 „ 1,6„ 2 7 -1 5 • П
Смолы . 0,5., 1,2„ 9 *•
з. Ямерииансиие В Соединенных Штатах имеются в обращении много
форситы. сортов форсита, различающихся главным образом содер-
жанием нитроглицерина. Здесь приводится содержание этого. сгора-
ющего в некоторых из американских форситов:
Л? 1 „Extra Eorsite* 80° о
I
Относительно форсита
упомянуто раньше-в группе
с уксуснокислой целлулозой было уже
динамитов с Пороховым основанием.
4. Hmmonium Весьма мощные динамиты получаются -при помощи
Sprengeiatin. введения в обыкновенный, или предварительно желатини-
рованный нитроглицерин, аммиачной селитры.
Действие подобных динамитов приближается к эффекту взрыва
самых мощных гремучих студней, и они обладают огромными скоро-
стями распространения детонационной волны; дыма они дают сравни-
тельно очень мало, не оставляя почти совсем твердого остатка, однако
они гигроскопичны.
5. Швейцарские Акционерным Обществом А. Нобель в Бонне выраба-
форситы. тываются подобные динамиты. Они имеют различный состав,
но в общем заключают в себе:
40 0 о — 50° о желатинированного нитроглицерина,
46 „ — 55 „ аммиачной селитры,
3,5» — 5 , муки,
0,5 „ соды.
Динамиты эти пользуются также значительным спросом в Австрии
6. Нммон-жела- К этой же группе желатинированных динамитов
тин — динамит, можно причислить также так называемый а.я.ион-
желатин—динамит состоящий из:
1 I
I
f
37,5% нитроглицерина,
2,5,, коллодионого пироксилина,
' 55, „ аммиачной селитры,
5, „ древесного угля.
Цвет его, черный. При хранении его требуется сухое помещение,
так как при гигроскопичности аммиачной селитры, легко может эксу-
дировать нитроглицерин.
Сюда же можно причислить и другой, не содержащий вовсе
угля и состоящий из:
'
57 о нитроглицерина,
3.. коллодионного пироксилина,
40,, аммиачной селитры.
ч динамм н Австрийская Правительственная фабрика вырабаты-
s . динаммон. вает ВЗрЫВчатое вещество подобного же рода, но за-
ключающее, особенным образом приготовленный уголь, носящий
название „Rothe Kohle“ (красный уголь).
Это вещество есть так называемый динаммон*). Он состоит из:
45 ’ ; нитроглицерина,
47,2 „ аммиачной селитры, 4
т 7,8 „ „красного угля“.
$ 8. Динамиты трудно Выделение таких динамитов в специальную
замерзающие. группу чисто условное и основывается исключительно
на искусственном понижении точки замерзания их.
В Англии зимы не отличаются суровостью и цртому применение
там трудно — замерзающих динамитов ограничено, на континенте же
они пользуются в некоторых местах значительным спросом.
В Германии и Швейцарии некоторые „специальные сорта" взрыв-
чатых желатин, с целью понизить точку замерзания нитроглицерина,
содержат жидкие нитропроизводные толуола и некоторых других
соединений тел ароматического ряда. Не считая перечисленных,
ассортимент веществ, понижающих точку замерзания нитроглицерина
и удобо применимых в составе динамитов, в общем не велик; это
суть: динитромицерин, динитрохлоргидрин (о нем говорилось уже выше),
динитроацетин, динитроформин, тетранитродиглицерин, динитрогликоль
нитроизо-бутил-глицериновъш нитрата, еще некоторые эфиры глицерина
Точка плавления чистого нитроглицерина =4-13>3°С.
*) Его не следует смешивать с одноименным с ним взрывчатым веществом н
содержащим нитроглицерина, о котором упомянуто было раньше.
He считая опасности обращения с самим замерзшим нитрогли-
церином, он и препараты его представляют тот большой недостаток,
•что в замерзшем виде они обнаруживают большую склонность давать
неполные взрывы, что при палении шпуров представляет серьезную
опасность в смысле значительного количества, могущих быть несчаст-
ных случаев.
Что касается чувствительности к ударам замерзших динамитов,
то опыты дают подчас противоречивые результаты, хотя в отношении
^гремучих студней установлено, что они безусловно чувствительнее
К ударам, нежели талые.
Во всяком случае насколько опасны в обращении замерзшие
динамиты, доказывает тот факт, что известно не мало случаев, когда
'они взрывались даже при снимании бумажных оболочек с патронов,
почему подобные операции должны быть категорически запрещены.
Одним из первых препаратов, предложенных с целью понижения
точки замерзания нитроглицерина, был нитробензол и нитротолуол,
однако, тот и другой обладают общим недостатком — сильно замедлять
скорость детонации, что очень не выгодно при применении взрывчатых
веществ к твердым породам и вынуждает употреблять для взрыва
сильные капсюли.
Они все таки кое-когда применяются, например, в так называемых
гуммидинамитах, изготовляющихся заводом Д-ра Нансена и К ? в Гам-
бурге и Нитроглицериновой К° в Христиании.
Нитробензол применяется также с этой же целью и в Австрии.
Динитроглицерин имеет склонность соединяться с кристаллиза-
ционной водой и даже до известной степени гигроскопичен, почему
применение его имеет свои отрицательные стороны.
Динитрохлоргидрин удобнее и, сравнительно, он не $ак дорог,
а потому имеет существенное практическое значение. С нитроглице-
рином он смешивается во всех пропорциях и хорошо желатинирует
колодионный пироксилин.
Будучи примешан в количестве около 20% к нитроглицерину,
ослабляет его силу весьма немного.
Динитрохлоргидрин входит в состав следующих взрывчатых
веществ:
Желатин-астралита.
Желатин-вестфалита.
х Желатин-донарита.
Желатин-веттер-астралита.
Он может быть смешан с глицерином при фабрикации нитро-
глицерина и нисколько не мешает процессу нитрации, все время
оставаясь при нитроглицерине.
Практически его можно считать нерастворимым в воде и кислотах;
он не гигроскопичен, но зато при взрыве дает газообразный хлористый
водород, что делает газы от взрыва трудно переносимыми рабочими,
& потому необходимо вводить в динамиты, его содержащие, какие-
либо соли, которые его переводили бы в неорганический хлорид.
Бендель показал, что моноацетин и моноформин способны ни-
троваться и, в смысле способности понижать точку замерзания
нитроглицерина, обладают хорошими свойствами.
Динитроацетин С3 Hs (NOa )2. (С, Hg О2) получается путем нитрации
40 частей ацетина смесью 100 частей азотной кислоты и 25 частей
олеума.
Динитроформин можно получить, нагревая 100 частей глицерина
с 50 частями щавелевой кислоты сперва до 100°С., а затем поднимая
температуру до 140°—150°, после чего полученный продукт подвер-
гается нитрации.
Готовый продукт имеет удельйый вес 1,57 и заключает в себе
15х7% азота, представляя смесь 33% динитроформина и 67% нитро-
глицерина. Он не замерзает и хорошо, если не лучше чем нитро-
глицерин, желатинирует коллодионный пироксилин' /
Как видно, получение его просто и сравнительно • дешево, а
потому возможно, что он имеет будущее.
Тетранитроглицерин. Если от двух частиц глицерина отнять одну
частицу воды, то получим диглицерин: 2C3HgO3 — НаО = (СН2.ОН.
СН.ОН.СН2)2О, последний же при своей нитрации дает тетранитро-
глицерин C6H10N6Oi3, обладает свойством понижать точку замерзания
тринитроглицерина, также точно, как и вещества, о которых только
что говорилось.
Ди1лицерин может бьтвь получен путем нагревания глицерина
до температуры 290° —295° С. в течение 8 часов. При этом получа-
ется около 60% диглицерина и 4%—6% полиглицерина. Примеси
от диглицерина можно отделить путем перегонки его под' давлением
8—10 м.м.
По английскому патенту переход глицерина в диглицерин
лучше всего совершается при нагревании глицерина до температуры
245° —2 50° С. в токе какого либо индиферентного газа, как, напри-
мер, углекислоты. Другой английский патент указывает на более
быстрый процес обращения глицерина в диглицерин, а именно—к
глицерину прибавляют около 0,5% щелочи и нагревают до 275° —280С.
Чистый диглицерин имеет точку кипения 245° —250° С. под
давлением 8 м.м. и представляет безцветную, ирозрачную жидкость,
растворимую в воде. Его удельный вес 1,33. Он обладает значительно
большей липкостью, чем глицерин. Тетранитроглицерин очень похож
на тринитроглицерин. I
Смесь 25% диглицерииа и 75% глицерина нитруется совершенно
тем же способом, по которому приготовляется нитроглицерин, при чем
полученная смесь обладает свойством трудно замерзающей жидкости.
Гурдинамиты с подобным нитроглицерином дают при пробе
Трауцля те же результаты, как'и с обыкновенным нитроглицерином.
Динитрогликоль применяется в довольно широком масштабе во
Франции, где изготовляется фабрикой принадлежащей Society Апо-
nyme d’Explosifs et Produits chimiques.
Сила его теоретически лишь на 4%* превосходит таковую же
нитроглицерина, при испытании же в калорической бомбочке сила
‘T ^jy*--др'-
тадик.,^.
— ’.98 — ’
4
его на S°/о — 20% превосходит силу нитроглицерина в зависимости
от метода испытания его. Проба Трауцля дает для обоих взрывчатых
веществ одинаковые результаты.
Пока нитрогликоль дороже стоит нитроглицерина, но вышепоиме-
нованное Об-во надеется найти способ изготовления его по той же
цене.
Удельный вес его 1,496; он более летуч, чем нитроглицерин
Нитро-изобутил—глицерин—нитрат. Если нитрометан CH3N02 смешать
с 4 частями 40% формина и небольшим количеством поташа, или
кислого углекислого калия, то происходит образование нитро-изобу-
тил-глицерина.
C(CH2.0H)3N02.
Он представляет кристаллическое вещество, довольно легко раство-
римое в воде и спирте, но мало растворимое в эфире, плавящееся
при 158’—159°С.
Полученное вещество перекристаллизовывают и нитруют кислот-
ной смесью; в результате получают тринитрат C(CH2.NOS)8.NO2, жид-
кость удельн. веса 1.68 с очень низкой точкой замерзания.
Пока, благодаря дороговизне, оно не имеет еще практического
значения, но химики заняты приисканием способа его дешевого
изготовления.
. г Из трудно замерзающих динамитов типа желати-
умми динамиГ* НИр0Ванных можно указать на гумми-динамиты, изготов-
ляемые в Христиании Нитроглицериновой Компанией и в Гамбурге
заводом Д - ра Нансена. Они получили свое название благодаря
своеобразной консистенции. В широком масштабе применяются в
Скандинавских Государствах. Они состоят из желатинированного
нитроглицерина, к которому прибавлено несколько процентов нитро-
бензола, а также аммиачной селитры; по наружному виду напоминают
немецкие желатинированные динамиты, но различаются от них по
своему действию.
Удельный вес их 1.49; взрываются от капсюля.
2. Нитробензопьный Еще в 1882 г. Вендинг предложил свой нитро-
Динамит. бензольный динамит, хорошо сопротивляющийся также
значительному нагреванию (до 70"С.), он готовился нескольких
сортов, из коих особенно рекомендовал лишь два:
Нитроглицерина................34,4’/0 21-1%
нитроцеллулозы................2,2 „ . 1,5 „
нитробензола...................7,8 „ 7,0 „
аммиачной селитры.............55,6 „ 70,4 „
Нитробензол с нитроцеллулозой в нем образовал студень. По
ступал в продажу в патронах из пропарафиненной бумаги.
з. Австрийские Динами- В Австрии вырабатываются тоже трудно замер-
ты I, и, in, iin. зающие динамиты содержащие нитробензол.
— 699 —
Два наиболее известные там сорта их суть следующие:
а) ъь'Чц нитроглицерина,
6 „ нитробензола,
4 „ колодионного пироксилина,
25 „ селитры,
19 „ Zumischpulver.
Этот динамит носит название динамита I.
б) 38 % нитроглицерина.
4 „ нитробензола,
3 „ коллодионного пироксилина,
20 „ селитры,
35 „ „Zumischpulver".
Этот динамит носит название Динамита 11.
В состав того и другого динамитов входит желатинированный
нитроглицерин.
Кроме этих двух сортов, в Австрии же вырабатывались сорта,
содержащие вместо нитробензола—нитротолуол. Вот состав двух дина-
митов, содержащих этот „antigel":
Динамит I X Динамит II ?
Нитроглицерина . . .... 55°!„ 38, 5%
Нитроцеллулозы. . • • - 2„ И 5 „
Нитротолуола . . . .... ю „ 8
Древесной муки. . .... 8 „ 4,16 „
Муки ржаной . . . * • 3,12 „
Натриевой селитры ... . . 24 „ 43,6s „
Ламповой копоти . • • « • 0,52 „
Окиси железа . . . • • • • „0,5 „ 0,52
Соды .... 0,5 „ —
Известен также аналогичного состава динамит III. №
4. Германские труд- В Германии трудно-замерзающие динамиты обыч-
но-замерэающие но характеризуются, как состоящие из желатиниро-
динамиты. ванного нитроглицерина с прибавкой к нему большего
или меньшего количества селитры и богатых углеродом соединений,
с частичной заменой нитроглицерина нитрованным хлоргидрином,
динитроглицерином, или сходными с ними веществами. О них сказано
будет далее.
5. Французские Во Франции Societe Anonyme des Explo'sifs et Pro-
трудно-замерэаю- duits chimiques в качестве „antigel" употребляет нитро-
щие динамиты. ГЛИКОЛЬ.
Наиболее употребительные динамиты этого рода состоят из:
i Gomme Gelatinee Dynamite au nitroglycol
АТ ВТ extra forte au po- tasse 1 A. 1 в.
Нитроглицерин. . . . 85 751 1 50 73,5 66,4 51,2 46
Динитрогликоль . . . i *14» I i 1 18,5 16,6 12,8 11,5
Нитроцеллулоза . . . I 8 5 1 3,0 8,0 5,0 3,0 2,5
Динитротолуол. . . . I 7 8 ! 7,0 1 ' —
Калийная селитра . . , i — 10 j 34,0 { 1 — 10,0 32,0
Натриевая „ . . i - — — -- 24,0
Целлулоза 2 5,8 ; 1 1 2,0 8,0 ОПИЛ К 8,0
Магнезия — — : I 1 1,0
Охра i — 0,2 1 1 — — —
- Кроме того, имеются еще 2 трудно-замерзающих Дрнитроглицери-
новых динамита с калийной селитрой, древесной и куркумовой мукой.
В состав Швейцарского Gelatinetelsit’a, принадлежащего к этому
же роду динамитов, входит от 10 до 15о/о динитротолуола вместе с
22% нитроглицерина.
В Америке. В Северо-Американских Соединенных
Штатах трудно замерзающие динамиты по своему со-
ставу сходны с соответствующей им категорией
„Straight", но в них около 1 части нитроглицерина
6. Американские
труднозамерзаю-
щие динамиты.
заменяют нитрозамещенные соединения. The Red Cross—динамиты,
выделывающиеся Е. I du Pont de Nemours Co., суть вещества этого рода.
О. Е. Munroe и С. Hall, дают следующий состав типичных трудно
замерзающих динамитов: ,
СИЛА. ; ! 30% 1 35 " о 40 "о ! 45 1 50 % 55 % 60%
Нитроглицерина. . 23 26 30 34 38 1 41 45
Нитро замещенных i i I
соединений . . . 7 9 10 I 11 12 14 15
Сгорающего .... 17 16 15 14 14'. 15 16
Натриевой селитры. 52 48 44 ' 40 i 35 29 23
Мела или углеки- 1 1
слой магнезии. . 1 i 1 i 1 1 1 1 1 1
, Состав сгорающего сходен с тем,
„Straight" динамитов.
Динамиты эти при больших холодах
который входит в состав
все таки замерзают.
•§ 7. Динамиты с селитрами применяемые преимущественно в
горной промышленности.
В эту категорию динамитов входят смеси, содержащие в каче-
стве сжигающего значительное количество селитры, преимущественно
аммиачной и, кроме того, заключающие в своем составе вещества,
предназначенные для понижения температуры газов, развивающихся
при взрыве, вроде: солей, содержащих, кристаллизационную воду,
различных сортов муки растительных злаков и древесной и т. п.
Сфера применения этих взрывчатых веществ в рудниках и притом
там, где не требуется особенно большой силы, но где доминирует
требование свести до минимума воспламенение при взрыве руднич-
ных газов и угольной пыли*).
Поэтому сейчас пойдет речь преимущественно об антщризутных
(или „безопасных"), или „предохранительных" динамитов. К тому, что
уже было сказано раньше мы вновь добавим следующее:
Строго говоря, в полном смысле „безопасных", в отношении
взрыва рудничного газа, взрывчатых веществ, дающих при взрыве
пламя, нет и все существующие могут рассматриваться в этом на-
правлении лишь относительно друг друга, причем само собой понят-
но—то взрывчатое вещество будет наиболее „безопасным", которое
допускает применение максимального заряда, что определяется исклю-
чительно практически. Степень „безопасности" взрывчатого вещества
зависит от многих причин и менее всего зависит от силы вещества, чему
наглядный пример—черный порох, едва ли не самое слабое взрывчатое
вещество, но в-то же'время едва ли и не самое „опасное" • К этому
вопросу мы еще вернемся далее.
Так же как вообще во взрывчатых веществах, так и в динами-
тах резкой грани между обыкновенными и „безопасными" взрывча-
тыми веществами провести нельзя.
1. Французские и Это СУТЬ динамиты, сравнительно небогатые нитро-
Бепьгийские гри- глицерином /они его заключают от 11*/о д° 30%), при-
зутины или гризу- меняющиеся в широком масштабе во Франции и Бель-
динамиты. гии, а также изготовлявшиеся до войны и у нас. Все
они содержат желатинированный нитроглицерин. '
Во Франции их изготовление разрешено было частным заводам,
но состав их утверждался Правительством.
В 1911 г. la Commissondes Substances Explosives разделила гризу-
тины на 4 категории: первых две, получившие наименование „Couche"
и „Couche ап Salpetre", обладают свойствами антигризутности в боль-
шей мере и допускаются для работ в рудниках опасных в газовом
отношении, а вторые две категории—допускаются для работ при про-
хождении галлерей в скале. Эти две категории носят название „Roche"
и „Roche ап Salp6tre*.
*) Во Франции в копях с каменноугольной пылью разрешено также приме-
нять 92%- -93% гремучего студня, а также 82%—83% гремучие студни с калиевой
селитрой (и составы Фавье). В других государствах это не разрешается.
Как видно из нижеследующей таблички, вторая и четвертая
категории отличаются соответственно от первой и третьей лишь тем,
что в них 5% аммиачной селитры замещено посредством такого же
количества калиевой.
Считается, что подобная замена увеличивает свойство антигри-
зутности, что об‘ясняют тем, что соединения калия, образовавшиеся
в момент взрыва, диссоциируют и обращаются в пары, поглощая на
это часть тепла, которое потом опять освобождают обратно, исполнивши
свою роль—понижение максимальной температуры взрыва смеси.
Таким образом температура газов для составов ,,Conche“ около
1450’С., a „Roche"—около 1950’С.
Предельные заряды для динамита ,,Couche“ около 1000,0 грам.
a „Roche", вдвое меньше.
Состав этих динамитов виден из нижеследующей таблицы:
. „ Л * Couche Couche au Sal- petre Roche Roche au Salpetre
Нитроглицерина .... 12,0% 12,0% 29,0% 29,0%
Коллодионного пироксил. 0,5 „ 0,5 „ 1 я 1 »
Аммиачной селитры . . . 87,5 „ \ 82,5 „ 70 „ 65 „
Калиевой , ... Г ! 5,0 „ 5,0,
Они поступают в продажу завернутыми в пропарафиненную бу-
магу и тщательно залиты парафином для предохранения от сырости.
При употреблении в дело, однако, бумажную обертку необходимо
удалять, так как присутствие парафина сильно понижает антигрп-
зутность динамитов.
Для примера приводится здесь состав некоторых других гри-
зутинов, нередко применяющихся во Франции и Бельгии:
МАРКИ. В F *) G Г»
1 Нитроглицерина ; 11,75% 19,6% 29,4% 40%—45%
Аммиачной селитры . . . 88,00 „ 80,0 „ 70,0 , —
Коллодион. пироксилина. 0.25 „ 0,4 „ 0,6 „ 1
Кизельгура — — ——* 10%-12%
Сернокислой магнезии . . •1 1 ' 42 „ —49 ,
Соды — 11
Температура газов, разви-
вающихся при взрыве. 1850’С.
*) С ним сходен гризутин марки М.
— 703 —
Как видно из таблицы, гризутин D имеет состав совершенно от-
личный от остальных а потому безусловно ошибочно носит это назва-
ние и должен быть из групп гризутинов исключен* **)). Он применяется
также и в Германии.
Сюда же можно причислить также антигризутный Колинит В.
представляющий желиньит с аммиачной селитрой и другими состав-
ными частями, как-то:
/1)
I „
•20
О я
12 „
29 „
м
нитроглицерина,
коллодионного пироксилина,
аммиачной селитры,
перхлората калия,
тротила,
целуллозы или муки,
сернокислой магнезии.
О
Предельный заряд 800 грам.,' что эквивалентно 460 грам. дина-
мита № 1.
Из Бельгийских антигризутных динамитов можно назвать для
примера следующие гризутины, находящиеся в списке ,,S. G. Р.“7
допущенных в рудниках, динамитов.
Составные части. Фракторит. Флямивор III. ! Аммон— ; карбонит?*) j _ _
Нитроглицерина <в/о G°/o 4°/о
Аммиачной селитры 75. 70. 82 „
Калиевой селитры 10.
Натриевой „ 10% -
Щавелево-кислого аммония Д 1 '
Углеводородов 8’/о 4°/о
Сернокислого аммония —- 9„ ——
Сернокислого бария — 7. —
Предельный заряд в граммах 700 6)0 300
Эквивалент по отношению к динамиту № 1 420 382 191
Сюда же могут быть отнесены: Antigel de surete, ingelite и тре-
монит I, состав которого:
Нитроглицерина •...........................25%
Динитротолуола........................ . 15 „
Натриевой селитры........................20 „
Древесной или ржаной муки.................35
Сернокислого аммония.............. . • . 5 „
*) Он принадлежит к груйпе гризутитов.
**) О них уже говорилось раньше.
Близким является также небезопасный „Forcite extra*, состоящий из,-
Нитроглицерина...............64,0%
Коллодионного хлопка........ 3,5^
Аммонийной селитры..........25,0 _
Древесной муки................ 6,5 „
Магнезии...................... 1,о „
Наконец, следует упомянуть еще о следующих франко-бельгий-
ских сортах:
Grisoutine au dP nitroglycol. i i . в. j B. : 1 ; Grisoutine , -I au Tetryl. ^Диинтроглйцери- , К , ! новое взр. веш..я Roche. Couche. l| i 1 II
23,28
6,0
9,41
12,0
I)
Нитроглицерина .
Динитроглицерина
ДинитроТликоля .
Целлулозы .
Нитроцеллулозы .
Тринитротолуола
Тетрила ........
Аммон, селитры .
Калиев. „
Углекисл, калия .
Щавелев, натрия
Хлорист. аммония
5,82
2,33
3,0
35,0
0,9
0,24
0,5
0,24
0,7
70,0
88,0
10,0
69,0
83,0
0,5
38,4
12,0
9,4
Из французских „безопасных"
динитронафталином:
динамитов известны также сорта с
t № 1 № 2
Нитроглицерин —г 1 1 9,5 j 19,6
Нитроцеллулоза ! 0,4
Аммон, селитра 1 79 0 ; 70,0 '
Динитронафталин ........ i 11,3 ' 10,0
4 (
К гризутинам же следует причислить так называемый „Dynamite
de Surete", применяющийся в Бельгии; era состав следующий:
нитроглицерина.........24%
аммиачн. селитры . . . . 75 „
коллод. пироксил.......1 „
705 —
[й из:
Температура газов, развивающаяся при взрыве 1745°С.
2. Русские гри- g России до Европейской войны выделывались
зутины. в значительном количестве гризутины, как Шлиссель-
бургским заводом, так и заводом Акционерного О-ва Виннера у ст.
Саблино Николаевской ж. д. Шлиссельбургским заводом, главным
образом, выделывались 3 марки, пользующиеся наибольшим распро-
странением: At — сильный, Ап—средней силы и Аш—более слабый.
Состав их следующий:
ьгий-
цери-
»ещ.„
Нитроглицерина.......... . . .
Коллодионного пироксилина . .
Аммиачной селитры . . . . . . .
Калиевой селитры ..........
Древесной муки...............
Акционерное О-во Виннера изготовляло две наиболее известных
марки гризутинов, а именно Г и В. Состав их был сходен с гризу-
тинами Шлиссельбургского завода, причем марка Г сходна была
с сортом А, Шлиссельбургского завода, а марка В отличалась от А1П
только меньшим содержанием коллодионного пироксилина (0,24%) и
несколько большим содержанием нитроглицерина (11,75%).
юрта с
*3. Германские гри- Из германских гризутинов можно указать на не-
зутины. сколько пользующихся большим распространением.
Вестфальское Акц. Общество в Германии выделывает несколько
сортов „безопасных* * динамитов, с большим содержанием нитроглице-
рина,—чем-то наблюдается в большинстве антигризутных динамитов.
К числу таковых принадлежит так.-назыв. „безопасный Желатин— ди-
намит Г', „безопасный желатин—динамит Пи и „1ал.
Состав их такой:
namitc
I н 1а
Нитроглицерина ... 40% 29,6% зв;о%
Коллодионного пироксилина . . . 1» 0,4, 1,0,
Аммиачной селитры . .... - 27 „ 32,0 „ 25,0 „
Калиевой селитры 4» 6,0 „ 5,0 ,
Мыла . 12.5, 10,0 . 14.0.
Ржаной муки ю„ 17,0,
Жидких углеводородов .... 3.5 „ 3,0. 4,0,
Древесной муки . . . . .... 2,0. 2,0 „ — —
Щавелевокислых солей i 2,5 „
Зроф. М. Сухаревский. Взрывчатые вещества и взрывные работы.
706
. ?Из атих трех динамитов, II обладает меньшей силой, чем I, но
большей степенью антигризутности.
а) Гризу-динамйты с ароматическими нитропроизводными.
Wettersiche- res Gelati- □е -Dynaimt. I Gesilit Fdrdit S a 1 i t.
Ill 1 11 ! Ill i la 1 Ic
Желатинированного нитрогли- церина 28,7 32,0 30,75 30,75 32,5 27,0 25,5 12,31
Тринитротолуола " } 5,5{ —— ;
Динитротолуола 11,0 5,25 5,25 5,26 *'— —-- 8,46
Нитротолуола — — *— —~ 5,0 3,0 *
Аммон, селитры ...... 37,0 27,0 — 22,0 22,0 24,0 32,0 53,63
Натровой „ . — —- 18,0 -
Хлорист. калия . . .... 19,3 32,0 7,0 21,0 20,25 37,0 30,0 23,08
Муки • 4,0 3,5 — — 20,0 —- 2,0 —
Декстрина * 1 ~ 39,0 21,0 4,0 2,0 2,52
Глицерина — — — — 3,0 5,5 —
б) с динитрохлоргидрином
• 1 1 Незамерзающий Gelatine — Dynamit 1 1 Незамерзающие нобелиты - .. ...
А с
Нитроглицерина 50,4 22,4 22,4 22,4
Динитрохлогидрина 12,6 5,6 5,6 5,6
Коллодионного хлопка ..... 2,0 0,7 1,5 1 1,0
Аммон, селитры — 38,9 37,1 41,3
Натриевой селитры — — 6,0
Древесной муки . 8,8 —'— —
Картоф. муки — — 5,0
Углеводов — 13,5
Поваренной соли . 16,0 23,5 18,4
Сурепного масла . . —- 0,5 —— —
Нитронафталина — 6,0 —
в) с динитроглицерином
« • 1 1 ; Тремонит 1 Желатин-даменит
s 1 Si Sii в
. Желатинирован, ди нитроглицерин. . . . . 36,0 36,0 34,0 28,0 28,0
Тринитротолуол (с 3—4% дииитрот.) . . . — —— 2.5 4,5 3,5
Аммон, селитры . 40,9 40,9 26,5 32,0 32,0
Калийной „ . . ........... — > 2,0 2,0
Натриевой „ . . —. — * —— 5,5
Древесной мука . . . . . . . . . . ... . 1.7 12,0 —-• —•
Поварен, соли . Т*. . . . . . . . .. . 9,4 : ад 26,0 '' -.27,5 •' 80,0
Щавелевокислого ндтрия * • • % . • 12Д - 7,4 - WWI ' . ' г/
Нафталина . ..... —— —- О.5 —-
Нашатыря . . . . . . . . . . / 6,0 —’—
Все’упомянутые выше Германские гризутины являются трудно
замерзающими. Сюда же можно причислить также желатин-вестфалит—
трудно замерзающий сорт динамита, содержащий до 50% динитрохлорги-
дрина и всего лишь около 5% нитроглицерина, желатинированного при
помощи небольшого количества коллодионного пироксилина. Кроме того,
он содержит аммиачную селитру, не более 10% калиевой селитры,
иногда также углеводороды, растительную муку, нейтральные соли и
нитросоединения..
К гризутинам нужно отнести также пользующийся
. встри ские известностью главным образом в Австрии и Германии,
гриэутины. так называемый, веттер-динамит. Он имеет состав:
27,3% нитроглицерина,
>72 „ аммиачной селитры,
0,7 „ коллодионного пироксилина.
В Австрии выделывается вещество, могущее так же быть при-
численным к гризутинам. Оно носит название паннонита и имеет сле-
дующий состав:
Нитроглицерина.................. . 25.5%
Коллод. пироксилина.................1,5 „
Аммиачн. селитры ............ 37 ,
Декстрина . . ..................... 4„
Глицерина . .. .. ,. ... . .... .... . . з
Нитротолуола . . . . . ". \ ;. . ‘. ? ... 5,
Хлористых щелочей......... . . . 24,
Смесь подкрашена небольшим количеством колькотара (окиси
железа).
— 708 —
Патроны обычно снабжены специальными детонаторами, содер-
жащими тринитротолуол.
Прежде применялась в соответствующих случаях другая смесь ,
заключавшая аммиачную селитру, солянокислый анилин и, иногда,
сернокислый аммоний.
Кроме перечисленных, имеется еще целый ряд анти^ризутных
нитроглицериновых препаратов, содержащих калиевую селитру, а также
соли, богатые кристаллизационной водой или же заключающие щаве-
лево-кислый аммоний. Эти вещества замедляют реакцию взрывчатого
разложения и понижают температуру газов, развивающихся при
взрыве.
5. Английские Среди „Permited Explosives" в Англии, едва-ли не
гризутины. наибольшим распространением пользовался, так называе-
мый, саксонит, выделывавшийся „Nobel’s Explosive Со“.
Действительно, его в одной Англии в 1907 году было израсходо-
вано около 1.721.200 фунт.; в 1909 году он был подвергнут вторич-
ному испытанию в опытом штреке на антигризутность и, так как
результаты получены были, сверх ожидания, не вполне благоприят-
ные, то он был вычеркнут из списка „дозволенных веществ® и его
заменил сходней с ним препарат самсонит, представлявший перед
ним ясно выраженные преимущества в смысле антигризутности, так
что уже в 1910 году его расход выразился в 1.071.000 фунтов, тогда
как потребность саксонита упала до 135.600 фунтов.
Вот состав этих двух динамитов:
. Саксонит. Самсонит.
Нитроглицерина ..... 42,5%-62 о/0 57%-60 %
Пироксилина 2,5 п 5 й 3 „ 4 „
Калиевой селитры .... 1 16 „ - 27,5 „ 17 19 „•
Древесной муки 3,5 „ - 8 „ i ?!
Мелу . 0- 0,5 „ - -
Щавелевокислого аммония 9 „ —27 . 12,5 —14,5 „
Влажности 0—1,5»
— 709 —
„Woolwich Test" дал целую серию веществ, вошедших в спи-
сок „дозволенных" взрывчатых веществ и, в то-же время недалеких по
своему составу от самсонита, каковы например: аркит, риппит, стоуит,
порох Cornisch, Svalite и пр.
Однако, гораздо более суровые условия „Rotherham Test" обна-
ружили, что и они обладают сравнительно не особенно высокой анти-
гризутностью и потому потребовалось значительное уменьшение коли-
чества нитроглицерина. Нижеследующие вещества оказались удовле-
творяющими условиям „Rotherham Test" и вошли в список „дозво-
ленных" взрывчатых веществ: •
| Аркит № 2. Duxite. Essex powder. Haylite № 1. Super-Kolax J>6 2.
- -
Нитроглицерина .... 31*-зз 31-33 ‘о 22—24 25-27 27,5-29,5
Коллодионного пирок- силина * 0,5—1,5 „ 0,5—1,5 0,5-1,5 0,5—1,5 0,5-1,5
Каляевой селитры . . 1 ! 26-78 „ 1 -— 33-35 1 4-6
Натриевой селитры . . ! 1 — 1 27—29 „ • —
* Вазелина •— —— 1 6—8 " i i
Древесной муки . . . . ! 8-10 „ 1 8-10 „ — 12-14 27,5—29,5
Ржаной муки । 1 1 1 -—— 32-35 1 i i 7,5—9,5 ! (карт.) r
Щавелевокислого ам- мония . . . 29-31 „ 29—31 „ 10-12 8,5-10,5
Влажности 2 2,5 2--5 0,5—2,5 3-6
Предельный заряд в гр. 1132 740 ““ ——*
Здесь для примера приводятся составы некоторых антигризутных
динамитов, находящих себе широкое применение преимущественно
в Англии, включенные в „Permited List* и прошедших через
„Woolwich Test" и „Rotherham Test". Много новых взрывчатых веществ
этой группы включено' в ведомость 1913 года. Они причисляются
обыкновенно к гризутинам:
1 j М о п о b е 1. I Super-Exellite. Моиархит. Syndite. D у п о b е I. Super- • ' Т5-. Cliffite?
1 № 1. № А 1 №2. № 3. № 3. № 4. № 1. JSS 2.
Нитроглицерина 9' о-1’% 8,5% 10%; 4,5% 5% 9,5% 12% 10—12% 14—16% 14-16% 8,5-10,5% 8,5-10,5в/0
Коллодионного пироксилина . — — —- 0,5, о,з. 0,1-0,3, — 0,25—0,75 „ 0,25—0,75 „ 0,25—0,75,,
Аммиачной селитры 78,-82, , 68 „ 60 „ 75,2 „ 50, 59. 49,7 „ 45-49 » 51—54 „ 44-47 , 57-60 „ 57,5—60,5 „
Калиевой селитры — ——— — 7„ 20, —— — — —
Натриевой селитры ! 1 * ** — —— 7,5, 7-9 „ —
Древесной муки 8 , -10 , “,5 , 10 „ — — — ' - 4-6,1 4- 6, 4,5—6,5 „ 4,5 —6,5 ,
Крахмала . — 3,5, 4,5, 4, 2—5 , ММ ——
Щавелево-кислого аммония ’ — 10 15 „ 10,5 , — —— — 9-И , 4—6 ,
Поваренной соли — 15, — 15, "" 26-28 „ 24—26 , 28—31 „ 14-16 „ 18,5—20,5 „
Хлористого калия — 20 — — •• — — . — ™
Нашатыря __ — — — 5 » — — — ' I» -
Углекислой магнезии . . . . —. — —— Т. 1» —
Касторового масла ...... — — — —- | —111 ' — 1
Вазелина • . — — —— —* — — — 1
Минерального студня .... — — — — — 2. — — — —
Глицерина" — — 1—— — —* — 2-5 „ — —* — »
Предельный заряд в граммах. J 280 800 280 400 1020 j i ' 730 ! т — - '
Предельный заряд в граммах. | — 2®° 800 280 400 780
— 711 —
Несколько отличную группу
г.
f,
t
/
i
I
английские нитроглице-
калия: *
составляют
риновые взрывчатые вещества с перхлоратом
*) О динамите того же наименования, но несколько иного состава, упомянуто
уже раньше (см. стр. 710).
К ним довольно близки применяемые в России:
Ново-нобе- лит. Нобелит VIII. 1 Sallert- karbonit V.
в. С.
Желатинированного ни- троглицерина .... 11,5 12,0 12,0 9,8
Аммон, селитры .... 47,0 50,0 54,0 49,3 •
Натриевой „ .... 4,0 3,0 9,в
Глицерина . . . . . . . 3,5 4,°! 4,0 ' 6,8 ’
Картофельн. муки . . . 6,5 6,0 6,0 4,9
Хлористого натрия . . . 22,0 20,0 20 0 19,4
Талька * 6,0 5,0 4,0
Нитроглицерина..........
Нитроцеллюлозы..........
Тринитротолуола . . . . .
Динитротолуола . . . . .
Перхлората калия . . . .
Древесной муки . . . . .
Щавелевокислого аммония
Влажности , . ......
I Ajax powder. Dynobel*). Neonal. Swale powder.
21,5—25,5 31,5—33,5 20,0—22,0 18,0—20,0
0,5—1,0 0,5—1,0 0,5—l,o 0,5—1,5
j-3,0 — 4,0 "— 0,4 3,0-5,0
36,5—38,5 26,0—28,0 36,0—38,0 36,5—38,5
9,5—11,5 8,5—10,5 14,0—16,0 8,0—10;0
24,0—26,0 *28,5—30,5 24,0—26,0 27,0—28,0
1,5 1,5 * 2,0 2,0
I-
1
t
6. Американские Из применяемых в Соединенных Штатах взрывча-
. гриэутины. тых веществ этого рода следует упомянуть:
I
- ' „40 градусный S аммонийный ди- j намит“. f J „40 градусный ам- монийный динамит с нитропроизвод- ным*.
Нитроглицерина .... 21,60 | 16,28
Нитротолуола — 4,97 1 J
Натриевой селитры . . . 46,04 47,14
Аммонийной . ... i 18,86 : । Г 18,78
Древесной муки .... 5,45 ; 2,84
Углекислого кальция . . ’ 1,44 —i—
Окиси цинка ! 0,88
Серы j 4,85 ' 1 2,84
Крахмала 3,79
Вазелина ! — г ! 0,81
Влажности 0,88 li 1,93
В самое последнее время в С. Ш. выпущены взрывчатые вещества
этого же класса с содержанием нитрокрахмала. Одним из таких явля-
ется Trojan powder.
§ 8. Гризутитами*) называют динамиты, заключающие обыкно-
венно больше 30°/й нитроглицерина и не содержащие селитр, но зато
заключающие значительное количество солей, содержащих кристаллиза-
ционную воду, вроде: сернокислой магнезии, соды и проч., а также раз-
личные формы целлулозы.
Таким образом, взрывчатое вещество обозначенное раньше, как
гризутин D, (см. стр. 702) в сущности, есть гризутит, почему и должен
быть перенесен в группу последних.
Предложение вводить в состав динамитов значительное количе-
ство солей, содержащих кристаллизационную воду, было сделано из
тех соображений, что для обращения в парообразное состояние воды,
в них содержащейся, затрачивается значительное количество тепла,
что влечет за собою понижение максимальной температуры газов
при взрыве.
Практика, однако, показала, что это верно лишь только до из-
вестной степени: даже при помощи введения больших количеств
' *) Каст называет их веттер-динамитамн.
солей, богатых кристаллизационной водой, не удайся довести степень
антигризутности до того предела, до которого она доходит при употреб-
лении других средств (например, древесной муки й т. п.).
Тем не менее гризутиты допущены в Бельгии к числу/веществ
антнгризутных („S. G, Р.“).
Вот состав двух употребляющихся там гризутитоь:
Антигризутяый динамит V, или п г ризу тит Матань". Гризу- тит П. Гризу- тит. $
Нитроглицерина 44% 44 44%
Целлюлозы • • • 1 12 „ — — 12 ъ
Древесной муки ...... 12 j
Глауберовой соли .... 44 „ i — 1
Сернокислого натрия . . . — 44 — -
Сепнокислой магнезии . . л. —— I 44 „
Предельный заряд в граммах О': О — 300 1
Эквивалент по отношению к динамиту № 1 359 ; 1 1 _ t * 170
гва
ля-
то-
то
%за-
раз-
как
жен
1че-
из
да,
пла,
азов
> из-
:еств
К гризутитам можно причислить следующие динамиты, пользо-
вавшиеся не так давно широким применением, но выходящие из упо-
требления:
Названия. Нитрогли- церина. Динамита. Кизельгу- ра. Целлюлозы. Калиевой селитры. I Сернокис- 1 лой магне- 1 ЗИИ. Кристалли- ческой со- | ДЫ. Щавелево- кислого ам- мония.
.Безопасный" бикарбонат - дина- мит . . 52 ——ь 13 1 »* — 35 —-
Английский „безопасный" дина- мит 40 — - — 15 45
Антигризутный форсит 42-46 9—иг л 44-46
Английский Нобелевский порох . 31-34 —— 11—14 47—51 f —
Веттер-динамит МйНег’а ... 42-52 11-13 f ! 47- -Ъ
Австр. колен-ветгер динамит . ; 52 14 34
; К числу динамитов, богатых аммиачной селитрой и глауберовой
СОЛЬЮ можно отнести также взрывчатое вещество Flower.
В настоящее время гризутиты употребляются уже зачительно
реже, понемногу уступая место различным веществам типа промежу-
точного между гризутинами и гризутитами.
Сюда же можно отнести франц, гризутиты состава:
Динам, гри-
зутит Е.
Динамит
№ 2 F.
Нитроглицерина . . 42% 52%
Сернокислой магнезии 46 и
. Кизельгура 12 „ 15 „
Сернокислого бария . 33 в
§ 9. Карбониты. К числу антигривутных динамитов, обладающих
максимальной степенью „безопасности^, принадлежат карбониты, пред-
ложенные Бирелем и Шмидтом еще в 1885 г.
Это суть динамиты, содержащие 25%—30% нитроглицерина и
примерно около же этого—муки, а также 25%—40%'селитр щелоч-
ных металлов и бариевой. В состав некоторых входит и аммиачная
селитра, а также соли не оказывающие влияния на понижение темпе-
ратуры газов; в некоторых имеется около 1°/о коллодионного хлопка
для желатинизации нитроглицерина и немного соды. Некоторые
содержат клеевой студень*).
A.. Marschal („Explosives") дает такой’состав английского карбонита:
25% нитроглицерина,
30,5 „ калиевой селитры,
4 „ бариевой селитры,
40 „ древесной муки,
0,5 „ соды.
Таким образом карбониты, в сущности динамиты, с значительным
количеством „Zumischpulver’a“. Нитроглицерин в них большею частью
желатинированный.
По причине большего избытка имеющегося в них углерода, они
при взрыве не дают полного сгорания, образуя значительное количе-
ство окиси углерода и свободного водорода,
Вообще, газообразные продукты взрыва карбонитов не чужды
присутствия в них горючих газов.
*) Клеевой студень состоит из 3,5—7 частей столярного клея, распущенного
з 1 ч. глицерина.
— 715 —
большинство карбонитов при температурах ниже + 8°С замер-
зают.
Хранение выдерживают хорошо.
Для надежного воспламенения требуют капсюля № 5 .или № 6.
Карбониты не рекомендуется применять в твердых и вязких
породах: в них все преимущества на стороне обыкновенных ди-
намитов.
- Углекарбонит,, приготовляемый заводом в Шле-
. ерманские и буше, представляет несколько пластичную, грязНо-
руссиие кар ониты. сер0.беловатого цвета, легко разламывающуюся при
небольшом давлении массу, которая имеет запах, несколько напоми-
нающий запах хлеба, вследствие значительного содержания муки..
Состав углекарбонита следующий:
25 */о нитроглицерина, . rv; ; •
34 ,, калиевой селитры, 1 < ч -
38,5 „ (муки), считая в том числе 2‘/г/о' влажности в 1%
бариевой селитры, - - .
0,5 „ СОДЫ,
ь - у
Теоретическая температура газов при взрыве 1845°С.
Предельный заряд его 900 грм.
Силы этого динамита и состава Фавье относятся между собой
как 13,6: 18.
Реакция взрывчатого разложения угле-карбонита протекает, глав-
ным образом, по уравнению:
144 С6 Н10 N6 01? + 880 KNOg + 596 С6 Н,о 05 + 36? Н2 0 + 10 Ba N2 О6 + Ва +
+ 12 Na2 СОз = 1648 СО2 + 2342 СО + 1647 Н2 0 + 2416 Н, + 877 N2 + 440 К?
СОз + 10 Ва С03 + 12 Na2 СО3.
Об‘ем пустоты раздутия при пробе Трауцля 206 куб. c/м., а взрыв-
чатые константы, характеризующие углекарбонит, следующие;
f = 6115 килогр.
v0= 763 литра. . •
t=.1845°C. ) '
Р = 263,9
’ тонн.
d = 0,763 литра.
Предельный заряд 900 грм.
*
Вестфальско-Ангальская Компания в Берлине изготовляет в а
своем заводе, так-называемый, виттенбергский веттер-динамит, кото-
рый имеет подобный же состав. Предельный заряд зго допускается
1200—1300 грм. 1 .
Заводом Компании „Карбонит" в Шлебупге изготовляется кроме
вышеозначенного обыкновенного карбонита, еще несколько сортов его.
— 716 —
из которых углекарбонит I и- углекарбонит II, находят себе обширное
применение преимущественно в Германии, в качестве первоклас-
сных антигризунтных динамитов, a Garbonit изготовляется для экспорта
в Англию.
Последний отличается от углекарбонитов, главным образом, тем,
что в состав его входит, вместо натриевой—калиевая селитра и вместо
муки растительных злаков—мука из корья. Сила этих динамитов
также' превосходит английский карбони!, по степени же антигризут-
ности же они почти обладают ею в равной мере, допуская макси-
мальные заряды в 1000—1100 грм.
Считают, что виттенбергский веттер-динамит обладает еще боль-
шей степенью антигризутности, и допускают предельные заряды его до
1200—1300 грм.
Состав главных сортов углекарбонитов, выделывающихся заво-
дом в Шлебуше, следующий:
। Угле-
!! карбонит!.
Угле-
карбонит II.
Нитроглицерина. . . . . .
Натриевой селитры . . .
Пшеничной муки.........
Двухромокислого калия. .
Теоретическая температура
газов при взрыве..........
25.0%
30,5 „
39,5 „
1861°
30 %
24,5 „
40,5 ,,
О в
1821°
Число калорий тепла, отде-
ляют;. при взрыве 1000 грм.
вещества.................
663
К числу динамитов типа карбонитов принадлежит также феникс,
одно время пользовавшийся широким применением в горной промыш-
ленности. Его состав следующий:
30% нитроглицерина,
32 „ натриевой селитры,
38 „ ржаной муки. .
Динамит этот вырабатывается фабрикой Р. Ганзена в Гамбурге
Цвет его в зависимости от сорта изменяется от желтоватого до светло-
бурого; удельный вес 1,44—1,15.
В отношении антигризутности несколько уступает карбонитам и
предельный его заряд определен в 700 грм.
Состав некоторые других карбонитов виден из таблицы;
- - - Kohlenfordit Веттер дина- мит Нобеля. Углекарбонит. Карбонит 1а. Козилит.
I. II. I. 1 II.
Нитроглицерина 25, 80 25 25 25 30
Калиевой селитры . . . . 4 34 —
Натриевой „ . ... 35 31 32 30 22,3
Бариевой „ . .... "ТЫ
Ржаной муки 40 30 34 38,5 , 38,;
Древесн. „ ..... * Д' гг %'
Двухромово - кислого ка- 1. - Н stj. ?‘ s . • Ы * "
ЛИЯ 1 —— —
Соды. . . . . , .... lb. 0,5 —
Поваренной соЛИ. . . , V ' 7 7,2
Нафталинана. . . . ". . . 2 — — "» ** *
Прочих. . . .... . . 1 ' ’ I 1 5 —• ——*
Состав желатин-карбонита (или студенистого карбонита), выраба
тывавшегося заводом в Шлебуше, мало разнился от нашего. Он за
ключает в себе:
. 2а,3% нитроглицерина,
0,7 „ коллодионного пироксилина,
6,9 „ клеевого студня,
41,5 „ аммиачной селитры,
25,6 „ поваренной соли.
Максимальный заряд около 500,0 грм.; удельный вес 1,6 а грав-
метрическая плотность 1,3—1,4.
Он пластичен и хорошо заполняет буровую скважину.
Для наружного отличия его часто окрашивают синим пигментом.
К числу Динамитов типа карбонитов, но значительно разнящихся
с ними по составу, относятся так-называемые нобелит й студенистый
карбонит, выделывавшиеся1 до войны нашим Шлиссельбургским
заводом.
Вот их состав:
Нобелит *): 2,8% нитроглицерина,
0,7 „ коллодионного пироксилина,
39,7 „ аммиачной селитры,
1 „ древесной муки, .
17,6 „ поваренной.соли, \.. Л
12,5 „ крахмала,
0,5 „ растительного масла. :
*) Этот сорт динамита вырабатываете»‘ тоже" Гамбургским заводом Ком-
пании Нобель.
718 —
Последнее прибавляется для придания массе большей пла-
стичности. -
Студенистого карбонита* * ***)):
28% нитроглицерина,
0,6 „ коллодионного пироксилина,
40 „ аммиачной селитры,
24 „ поваренной соли,
7,4 „ клеевого студня (состоящего из 1°/0 глицерина и от 3,5 до
7 частей столярного клея.
Состав карбонитов вообще изменяется в довольно широких пре-
делах, причем одни селитры замещаются другими, а древесная мука—
частью посредством рисового крахмала, частью другими сгорающими.
В настоящее время динамиты типа карбонитов приготовляются
очень многими заводами..
2. Ннглийские карбониты
и близкие к ним.
При испытании карбонитов в „Rotherham
Test“ признано было желательным в состав кар-
бонитов ввести еще 7—10°/0 щавелевокислого аммо-
ния, почему и стали вырабатывать карбониты, содержащие эту соль.
Для примера приводится состав нескольких препаратов этого рода:
Название составных частей. Кэм- брит Super- № 1. -Kolax. № 2. Бритонит № 2 *♦*).
- Нитроглицерина 1 23% 25,50/0 28,50/0 24%
Коллодионного пироксилина . 1%
Калиевой селитры 27% 25,50/0 16,50/0 30%
Бариевой селитры 3,5% ' 5°/0 5% —
Древесной муки .... 38% 300/о 31% 38»/0
Крахмала . . » 8.50/с "
Щавелевокислого аммония . . 8% 7°/0 9,5% 8%
Мела 0,5»/в — —
Максимальный заряд (в грм.) . 850 850 900 675
•) Студенистый карбонит испытывался у нас в 1911 году и дал хорошие
результаты.
*♦) Кэмбрит изготовляется нескольких сортов, большей частью заключающих
в себе:
25—27% нитроглицерина, 39—42% древесной муки,
3,5—4,5% бариевой селитры, 0,5% бензола, содержащего
28—32% калиевбй селитры, 0,5% соды.
***) Бритоииты изготовляются тоже нескольких сортов. В них большей частью
содержится:
25—27% нитроглицерина^ 39-43% древесной муки,
31—34% калиевой селитры, О(5°|0 соды.
В Англии к числу прошедших .Woolwish Test" и потому допу-
скающихся в рудниках, неблагополучных в газовом отношении, при-
надлежат между прочим:
Название состав- ных частей. Карбонит Kent Powder Tutol Tutol № 2 Kolax Super Kolax Kynarkite 1 Pitite |^2* *)
Нитроглицерина . Калиевой селитры Натриев. селитры Бариевой селитры Древесной муки . Крахмала .... Бензола, содержа- щего серу. . . Щавелевокислого аммойия Мела ...... Соды ...... Двууглекислой соды Влажности . . . 26% ! 33°|0 40,5% 0,25% } 0,25% 00 ' - Л ®? —< 1—< ' см . । со —, • • ер । А । । ) । । со О со сх> ‘ оо СЧ со см 1 "S 1 1 Г 1 IStolSS Qi О о О . ° . - О О о О • . СО О ** <П СМ СО СО •'_ ••• 1 Illi 1 1 а а £ > ' 25 26 5 34 10 1. !’ i , . W \ %... ' юмо СО © 00 1 •. • . , СМ СМ Ср СМ х ' Ьо ? ~ Ml I I 1 1 1 1 ( МО МО Фо см -к см v _ СМ СМ - ' - : , 24—26 27—29 2-4 33,5-36,5 \ \ ч 4—6. 2-5,5 23- 25 28—31 33-36 2,5-5
„СИусИ^: 25 — 27% нитроглицерина,
32—36% бариевой селитры,
38,5—41,50% древесной муки,
0,6°/о бензола, содержащего серу,
0,5% соды.
„Дюагокыиг": 34—37% нитроглицерина,
2—3% пироксилина,
43—46% калиевой селитры,
5—6% вазелина,
11—13,5% древесной муки или древесного угля1
„Kynit“: 25—27°/0 нитроглицерина,
30—36% бариевой селитры,
39—42% древесной муки,
0,5 I» мела.
„Норманит“: 32,5—34,5% нитроглицерина,
1—2% пироксилина,
42,5—46,5% калиевой селитры,
7-9% древесной муки,
1—2% древесного угля,
10—12% щавелевокислого аммония.
/
____ f
*) Состав Pitit‘a других рецептов см. далее иа стр. 720.
;• >-Л
25—27% нитроглицерина,
31—35°!о бариевой селитры,
40—43°1о древесной муки,
0,5% соды.
Siv.
’* ?*|
- "-А
„Викторит"; 25—27% нитроглицерина,
32—Зб°|о бариевой селитры,
38,5—41,5 древесной муки,
0,5°1о бензола, содержащего серу,
0,5% соды.
5 z . Из динамитов типа карбонитов, допуска^щи ся
навг'ьгиисние Бельгии для работ в рудниках, опасных в газовом отно
нар ониты. шении и внесенных в список взрывчатых веществ ,,S. G. Рл
можно назвать, между прочим, следующие:
1 j Угле- карбонит. Минит.
Нитроглицерина........
Калиевой селитры . . . .
Бариевой селитры ....
Муки............. ...
Муки из корья .......
Соды .................
Предельный заряд в грм.
Эквивалент к динам. № 1 I
25% 25%
34% 35%
п
38,5% 39,5«|
1%'
О,5«|о 0,5’%
900 750
501 405
Динамит под названием .Antigel de Surete" принадлежит к труд
но замерзающим сортам карбонитов.
К этой же категории карбонитов можно причислить тоже бель
гийские минерит и антигризутные колинит, форсит, сходные по сво-
ему составу с углекарбонитами, а также сэкурофор III, в котором
около 1% древесной муки заменено мукой из корья, причем предель-
ный его заряд определяется в 850 грм., что эквивалентно 548 грм
динамита № 1.
i %
Они отличаются от английских несколько своим
составом. Обычно в них: нитроглицерина—от 30 до 40%
селитры—-от 40—52%, муки—от 13—20%.
nd
же
coi
п?
4. Французские
карбониты.
Они известны под названиями “Dynamite № 2, 6, 7“. Углекарбо
ниту соответствует „Carbonite В“ или „Carbit d’Abion".
ч '
I Vi
*) Состав так наз, Pitite № 2 приведен уже выше на стр. 719.
жел
П1
• Во взрывчатые вещества, богатые аммиачной селитрой, часто
вводят небольшое количество (несколько процентов) нитроглицерина
не столько для их усиления, сколько для того, чтобы сделать их
более чувствительными к детонации, что позволяет им придавать
более высокие плотности, при которых без подобных прибавок, чувстви-
тельность к капсюлю, обычно, значительно понижается.
Г ЛАВА
Бездымные порога *).
Во время войны 1914—1918 г.г. во Франции, Бельгии, России и
в Соединенных Штатах Америки употреблялись почти исключительно
пороха из нитроцеллулозы, в Англии и Италии—нитроглицериновые.
Остальные государства, как напр,, Германия, Австро-Венгрия, Япония,
Швеция и Норвегия употребляли для винтовок и для мелко-калибер-
ных орудий пороха из нитроцеллулозы, а для крупных орудий нитро-
глицериновые пороха.
, л § 1, Порох из нитроцеллюлозы. Французский
1. Французские нитро- в„ (ддя полевых орудий ВС) д£я 0£адных
целпупозные порога. оруднй Bgp, для ВИНТОВок BF и для морских ору-
дий 1Ш) состоит из смеси нитроцеллулозы высшей п низшей степеней
нитрации с примесью 2% (° 1896 г.) или 8°/0 (с 190(5 г.) амилового спирта
(„А. М.“), который в самое последнее время заменен 1,5-—2°1о дифе-
ниламина („!)“). Соотношение между нитроцеллулозами высшей п
низшей степеней нитрации в порохах, предназначенных для морских
орудий, равно 55:45, а при винтовочных порохах 80:20. Раствори-
мость в эфирном спирте достигает при первых 20—30°;о, а в послед-
них до 5O"io. Содержание азота колеблется между 11,5 и ll,9°io. Жела-
тинирующим веществом служит смесь из 9 частей эфира и 3 частей
95° спирта. Подобные пороха изготовляются ввиде листочков пли
полос, связанных в пачки или свернутых в спирали. Новейшие ру-
жейные пороха (ввиде листочков) графитованы, что при прежних
сортах не практиковалось, причем графитование сильнее, чем в
прежних германских порохах.
Не употребляющийся уже более с 1902 г. французский орудий-
ный порох ,,BN“ состоял из:'
41,3 частей растворимой |
29,1 „ нерастворимой / нпчроцеллулозы
19 „ нитрата бария
8 „ „ калия
2 „ углекислого газа.
По всей вероятности недостающий остаток из O,G°io состоял из
желатинирующих веществ и влажности.
) Kast „Spreng tmd Zundstoffe".
Проф. M. Сухаревский. Взрывчатые вещества и взрывные работы.
__ 722 ___
Полосы употребляющихся ныне французских орудийных поро-
хов снабжены продольными разрезами, чтобы облегчить связывание
их в пучки. Для различия они иногда окрашиваются (т. напр. воен-
ный порох в метил-оранжевый цвет).
Германский ружейный и орудийный порох
. ерманские нитро- (ввиде ЛИСТОЧКОВ) [„GeW. Bl. Р.“ И „GeSCll Bl. Р.“]
цеплулозные пороха. перВоначально СОСТОЯЛ ИЗ 95° о ПИрОКСИЛИНа С 12,7°;о
содержания азота и около 5% уксусного эфира. Первый (для винто-
вок 88) имеет форму листочков, величиной в 1,7 кв. м.м. и 0,25 м.м.
толщины и изготовляется желатинизацией 100 частей пироксилина
(12,6—12,8% азота) при помощи 70 частей уксусного эфира, 30 частей
спирта и 2 частей камфоры. Позднее ружейный порох изготовлялся
из 3 частей пироксилина, 1 части коллодионного хлопка с камфорой и
около 2% летучих веществ (эфирный спирт, влажность); орудийный
порох содержал 93% (анологичной) нитроцеллулозы и 7% централита.
Орудийный порох (.ВР“) и ружейный порох („SP") состоял из
той-же нитроцеллулозы, желатинированной эфирным спиртом, с при-
месью дифениламина (1°/о) или централита, акардита (до 70%) и ща-
велевокислого натрия (0,5 до 3,5%); последний иногдазаменялся двувинно-
кислым калием (2%). Листочки S—пороха имеют поверхность около
1,32 к. мм., толщину около 0,3 мм. и содержат О,5°'о дифениламина, а
часто и щавелевокислого натрия (1°1о); они сильно спрессованы и
графитованы.
3. Австрийские и Испанские
нитроцеллулозные порога.
имеют вид пластинок.
Такой же состав мы находим в ружейных
порохах испанского и австрийского происхож-
дения; последние желатинированы ацетоном и
Оба сорта графитованы.
4. Бельгийские нитро-
целпупозные порога.
В Бельгии употребляются пороха, совершенно
подобные французским, из чистой нитроцеллулозы,
содержащие:
40—80% нерастворимой нитроцелуллозы,
60—20 „ растворимой нитроцелуллозы
с 1,5— 5 „ эфирных примесей.
Они иногда графитуются и имеют форму листочков или глад-
ких, спиральных полос. Так, орудийный порох состоит из нитроцеллу-
лозы с 12,6% содержания азота и 65—70% растворимости, плюс 1,5%
централита в качестве стабилизатора. Ружейные и револьверные по-
роха содержат, кроме того, дифениламин. К револьверным иногда при-
бавляется 1,5% нитрата бария. Далее, определенные сорта содержат
до 4,5% динитробензола.
Бельгийские пороха, более старого производства, которые частично
употреблялись еще в 1914 году, были желатинированы уксусным
эфиром. При новейших же для желатинизации употреблялся эфир-
но-спиртовая смесь. Так, подвергшийся тщательной вальцовке и гра-
тованный порох для револьверов системы Browning, по данным поро-
хового завода Caulille, состоит из 97,55 гр. пироксилина, 1,426 гр. дифени-
ламина, 0,012 сублимата, 0,012 гр. мочевины и 1,00 гр. нитрата бария.
5. Русские нитроцеппу- Русский пироколлодионный порох для морских
лозные порока, орудий состоит из растворимой нитроцеллулозы, по-
лученной прямой нитрацией, с 12,44% содержания
азота. Однако, этот порох впоследствии был заменен французским,
„poudre В“, причем употреблялся еще в 1918 году или в виде полос,
шириною в 30 mm. и до 5,5 mm. высотой, или же ввиде трубок, диа-
метр которых достигал до 17 mm. В качестве стабилизатора прибав-
лялся дифениламин.
Русский ружейный порох сходен по своему составу с германским
порохом „S“. Он состоит из нитроцеллулозы 28 о растворимости и 12%
содержания азота и содержит 0,7% дифениламина и 2% камфоры.
Орудийные пороха сходны с французскими порохами (в полос-
ках). В качестве стабилизатора служит амиловый спирт и дифени-
ламин. Нитроцеллулоза содержит 12% азота и растворимость ее дохо-
дит до 40%. Для полевых орудий употребляются также трубочный порох.
В румынской армии употребляются пороха из
. умынские нитро- НИТрОцелЛуЛОЗЫ растворимостью до 20%. В качестве
целлулозные порока. ста5илизат0р0в подмешиваются совместно централит
и дифениламин (4:1); получающийся от прибавления дифениламина
грязный оттенок устранялся прибавлением сажи.
, _ Американский порох для полевых и морских
7. мериканскКе нитро- ОруДИЙ СОСТОИТ ИЗ НИТрОЦвЛЛуЛОЗЫ, ВЫСОКОЙ ра-
целпулозные порока. створимости и желатинированной эфирно-спирто-
вой смесью с 12,6% содержания азота (minimum) и 2—3% летучих
веществ. Он изготовляется в виде цилиндриков, 10 mm. длиной и
4 mm. толщиной, с 7 каналами диаметром в 0,2 mm. Для стабилизации
прибавляется (с 1900 г.) 1% дифениламина. Прежде в него вводилось
незначительное количество Rosanilin’a в качестве индикатора.
Американский ружейный порох, употреблявшийся ранее, как
в сухопутных войсках, так и во флоте, состоял из растворимой и не-
растворимой нитроцеллулозы с прибавлением 15% баритовой и 4%
калиевой селитры и 1% карбоната калия в качестве стабилизатора.
В настоящее время он состоит из желатинированной эфироспиртом
„пироцеллулозы" с 12,4% содержания азота и дифениламина. Порох гра-
фитуется.
Употребляемый в Швейцарии и Дании так
. Швейцарские и Дат- называемый нормальный ПОрОХ* СОСТОИТ ИЗ ПИрОК-
ские нитроцеплулозные силина с примеСЬЮ 2% СМОЛЫ. По ДаННЫМ СтаД-
порока. лин‘а, швейцарский ружейный порох состоит из
целлулозы высшей нитрации, желатинированной ацетоном, которая
после желатинизации провальцовывается и разрезается на тонкие
листочки (1000 на 1 гр.)
4 » 8 2. Нитроглицериновые пороха. Английский Кор-
1. Английские нитро- ,, , с,:(| , „ г
к дит (I) состоит с 1892 года из 3<°/п нитроцеллулозы
глицериновые порога. с 12,5% содержания азота (растворимость колеблется
от 10 до 12%), 58% нитроглицерина и 5% „минерального желе* —
(продукт дестилляции сырого керосина). Желатинизация производится
ацетоном. Изготовляется ввиде прутков и нитей; удельный вес равен
1,53. Ввиду сильного действия на канал орудия он с 1901 года заменен
кордитом, „MD“ (modified), состоящим из 65% подобной же нитро-
целлулозы, Зо% нитроглицерина и 6% вазелина.
В новейшее время ружейный кордит изготовляется ввиде трубо-
чек, длиною 38 mm. Наружный диаметр достигает 1 mm., в то время
как внутренний равен 0,2 mm. Содержание нитроглицерина умень-
шено до 23,5%. Новейшие сорта обозначаются „В. D. В." и „Admiral-
flits—Cordit“, при чем во время Европейской войны 1914—1918 г.,
вследствие недостатка ацетона, для желатинизации кордита марки
,,R. I). В.“ употреблялся эфирный спирт.
Нити и трубочки изготовляются длиною в 28 и 41 mm.; для
винтовок толщина их делается в 1,3 mm, а для орудий, смотря
по калибру, колеблется от 0,82 до 12,4 mm. Одно' время кордит
употрелялся также и в американском флоте.
_ „ . В Австро-Венгрии введен желатинированный
к г ацетоном нитроглицериновым порох типа кордитов,
глицериновые порога. _ „ .АП/Г J г
г 1 содержащий 30—40% нитроглицерина и нитроцел-
лулозу с 13,2—13,4% содержания азота, однако, без примеси вазе-
лина. Для мелкокалиберных орудий он изготовляется ввиде пластинок,
для крупных калибров ввиде колец.
т „ Итальянский Ифилит“ (с 1890 г.) имеет форму
3. Итальянские нитро- _ „ ' , ' ,т , А
г нитей; по составу похож на оаллистит Нобеля. Состав
к г фплита следующим: эО частей коллодионного хлопка
с 11,2—12% содержания азота, 50 частей нитроглицерина. Ранее
прибавлялась 1 часть анилина с камфорой, теперь же—дифениламин.
В Мировой войне он употреблялся также в минометах и шел на
снаряжение снарядов специального назначения.
Введенный с 1894 г. „соленит" по своему составу сходен с кор-
дитом; изготовляется ввиде трубочек и состоит из 66% коллодионного
хлопка, 33% нитроглицерина, 1,1% вазелина. Филит употребляется
в морских и полевых орудиях, а соленит идет для винтовок.
. .. „ Немецкий порох (в кубиках) „WP“ состоит из:
t ерманскии нитро- 6q0 * смешанной нитроцеллулозы С 12,6—12,7% с°-
глицериновым пороу. дерЖания азота (растворимость колеблется ОТ 50 ДО
70%) и 40% нитроглицерина. ч
По новейшим данным, к нему добавляется 0,5—.1,0% централитл;
он имеет форму кубиков, в то время, как другие пороха подобного же
состава изготовляются в виде пластинок или трубочек.
Германский порох, не содержащий растворителей, состоит из 63%
нитроцеллулозы (растворимость около 68%) ЗО°/о нитроглицерина и
7% централита.
— 725 —
5. Норвежский нитрогпи- „ИитрОГЛИЦериНОВЫЙ ТрубОЧНЫЙ ПОрОХ“ СОСТОИТ
• цгриновый пороге. из:25,3—29,3 частей нитроглицерина, 4 — 7 ч. центра-
лита, 0,5 ч. вазелина или щавелево-кислого—аммония, 0,5 ч. бикарбо-
ната натрия, 0,1 ч. графита.
Норвежский баллистит состоит из 50% нитроцеллулозы, 40% ни-
троглицерина, 5 /0 нитронафталина и 5% „жидкого стабилизатора с
высокой точкой кипения".
6. Американский нитрогпи- Ранее употреблявшийся американский ору-
цериновый nopojs. дийный порох Гудзона Максим'а и Schtlpphatls’a
состоял из 81,8% нерастворимой нитроцеллулозы с 13,3% содержания
азота, 8,2% растворимой нитроцеллулозы с 12,0%> содержания азота,
9,0% нитроглицерина и 1 % мочевины. Изготовлялся ввиде пробура-
вленных цилиндров. Вследствие неоднократных случаев разрыва в
каналах о/рудий был оставлен.
§ З.Друпе военные порога. ТрИНИТрОТОЛуОЛОВЫЙ порох, ИЗГ0Т0ВЛЯ6МЫЙ
соединенными пороховыми заводами Coin — Rottweiler, является образ-
чиком порохов, при изготовлении которых летучие растворители не
употребляются. Он состоит из нитроцеллулозы с высоким содержанием
(20—30%) тринитротолуола и имеет вид твердой, глянцевитой, не-
много прозрачной массы. Во время войны в Германии был введен
подобный порох из нптроцеллулозы- с 20% нитроглицерина, 15,25%
тринитротолуола, 3,5% динитротолуола и 0,25% централита. Он имел
форму кубиков.
Незначительные количества нитротел (до 4%), вроде динитробен-
зола и динитр'отолуола, употреблялись уже раньше, как примесь к
военным порохам. Так у нас в России во время мировой войны упот-
реблялся нитроцеллулозный порох в виде графитованных палочек
с тонким продольным каналом длиной в 1,5 мм. и 0,5—0,6 мм. в диа-
метре, содержавший 0,5% дифиниламина и 4% динитротолуола.
Стабилит Гудзона Максимка представляет собой также порох,
без растворителей. Применялся в Соединенных Штатах. Его состав
точно неизвестен. По некоторым предположениям он сходен с пирок-
силином (60 ч.), желатинированным тринитроанизолом (40 ч.) Подоб-
ный порох, вследствие особых свойств тринитроанизола малостоек и
обладает, главным образом, тем недостатком, что из него тринитроани-
зол быстро выветривается.
§4. охотничьи, спортивные От всех, вышеназванных порохов значительно
и маневренные порога, отличаются охотничьи и спортивные пороха, так
как здесь меньше обращают внимания на получение баллистических,
а следовательно и определенных химических свойств. Пороха, пред-
назначенные для спортивных целей и охотничьи пороха для пуле-
вых ружей, обычно совершенно или по крайней мере на половину
желатинированны и поэтому их состав сходен с военными поро-
хами, в то время как для дробовых патронов употребляются более
быстро — сгорающие на половину или вовсе не желатинирован-
ные пороха. Они состоят или из мелкозернистых сортов выше-
указанных военных порохов или из нитроцеллулозы с большей
— 726 —
примесью баритовой и калиевой селитры на подобие французского
пороха ,,BN“. Для внешнего различия они иногда окрашиваются.
Поэтому они по своему составу приближаются к порохоподобным
взрывчатым веществам.
К группе охотничьих порохов близко примыкают учебные и
маневренные пороха.
К этому сорту порохов относятся:
А) /Желатинированные пороха без особых примесей, которые дли
более быстрого сгорания изготовляются ввиде мелких зерен:
1. Нижеследующие пороха, которые вследствие повторной обра-
ботки щелочами и вывариванием сделаны более пористыми и тем
самым превращены в бризантные пороха.
а) Французские: poudre ВС, NL (nitratee et lavhe); „poudres pyro-
xylees T“, и „Tbis", которые отличаются от, „poudre B“ желатинизацией
уксусным эфиром и ацетоном, а также небольшим диаметром зерен
(0,1 мм.); „poudre ЕЕ" для маневренной стрельбы, из хлопка и агар —
агара („gelose*).
б) Германвкие: „Rottweiler Blattchen pulver Rauchlos" и бездымного
„Scheibenpulver Р“, желатинированного уксусным эфиром „Wals-
roder Kornpulver, Marke Sonne'-' с примесью 2°/п мела; „Troisdorfer
Jagdpulver" из желатинированной эфирным спиртом и частично
растворимой питроцеллулозы с примесью баритовой и калиевой се-
литры для облегчения зажигания.
в) Кроме того, к этой—же категории можно причислить: выше-
названный Австрийский пластинчатый порох, который носит название
„Rauchloses Pulver № 1“ и состоит из: 31% нитроцеллулозы, 36°/О
нитроглицерина, 18°/0 баритовой селитры и 10% угля; затем далее
’„Rauchloses Pulver № 2“, состоящий из: 40% питроцеллулозы, 40%
нитроглицерина и 20° 0 баритовой селитры.
Последний сорт графитуется.
г) Английские: Маневренный порох из кордита без вазелина
ввиде пластинок с 32% содержания нитроглицерина и „Ballistit— Ja-
gdpulver" из 62% нитроцеллулозы и 38% нитроглицерина.
д) Бельгийские: „Mullerite I и 11 а также „Saxonia".
е) Американский охотничий порох с баритовой и калиевой се-
литрой и уксусно - кислым амилом в качестве желатинирующего
вещества.
Кроме того, сюда же относятся прессованные пороха Шмидта,
(которые состоят из одного куска, что позволяет производить снаря-
жение патронов не прибегая к отвешиванию).
Б) Наполовину желатинированные пороха с большими примесями.
Изготовляются в форме листочков и зерен:
а) Английские: „ЕС“ (Explosives Company) Рейда и Ионсона.
Состоят из: 54% растворимой и нерастворимой нитроцеллулозы,
взятой почти в равных частях (28: 26), 38% баритовой и калиевой
селитры, 4% целлулозы, 2% камфоры; „амберит", содержащий 20%
баритовой и калиевой селитры и до 10% парафина.
б) Французские: „Poudre pyroxylee J“ Bruneau из 83% нитро-
целлулозы, 17% бихромата аммония или-же(в его измененном составе
позднейшего времени): 83% нитроцеллуозы. 14% бихромата аммония
— 727 —
и 3% бихромата калия; „poudre pyroxylee М“ представляющий смесь,
окрашенную аурамином в желтый цвет и состоящую из 71% нитро-
целлулозы (из них от 15—до 20% растворимой), 20% баритовой селитры,
.5% калиевой селитры, 3% камфоры и 1% агар-агара; .poudre pyroxy-
lee R", который в настоящее время не изготовляется и ко-
торый отличается от „poudre М“ меньшим содержанием нитроцеллулозы
(55%); „poudre pyroxylee S“, состоящий из: 28% растворимой нитро-
целлулозы, 37% нерастворимой, 29% баритовой и 6% калиевой селитры.
в) Бельгийские маневренные пороха из 75% нитроцеллулозы и
25% щелочных нитратов; „Соора1“—порох с баритовой селитрой и
смолой; зерненный порох „Clermonite" также с нитратами.
г) Австрийские бездымные охотничьи и пластинчатые пороха,
содержащие на ряду с нитроцеллулозой нитроглицерин, баритовую
селитру, древесный уголь или вазелин.
Броме того следует упомянуть нижеследующие пороховые смеси по-
верхностно желатинированные.
а) Спиралит, состоящий из нйтроцеллулбзы, приготовленной из бу-
маги и обработанной органическими растворами солей, коллодием и т. д.
б) Изобретенный в 1864 году и употреблявшийся в особенности
в Англии „Schulze — Pulver", состоящий >из 50% очищенной, нитро-
ванной древесины или смешанной нитроцеллулозы различной раство-
римости в качестве основания и с содержанием 13% ненитрованной
целлулозы, 33% баритовой и калиевой селитры и 4% парафина. (О
нем уже говорилось выше).
в) Германский „«Schulze Pulver, Marke Wolf";
г) Английский „Imperial — Schulze — Pulver* состоящий из 82%
нитроцеллулозы, 10% баритовой селитры и 8% вазелина.
д) „Troisdorfer — Jagdpulver" 22,5% баритовой 1,1% калиевой
селитры вместе с пентралитом и дпфениламитом—и, наконец.
е) „Walsroder LDP Wolfmarke" с 10% баритовой селитры, 7%
жировых веществ, 3% агар-агара и 2% клея.
ж) Порох из 7% нитроцеллулозы, 23% баритовой селитры,
2% хромовокислого калия и 5% тринитротолуола.
Хорошо желатинированные пороха имеют преимущество большей
сопротивляемости влиянию погоды и летучести, а, следовательно,
обладают большей баллистической равномерностью.
ГЛАВА VII.
Жидкие взрывчатые смеси.
Это суть почти исключительно вещества, содержащие в качестве
сжигающего, азотную или азотноватую кислоты, в качестве же сго-
рающего—различные углеродистые вещества,—как-то: углеводороды
ароматического ряда и их нитропроизводные (бензол, нафталин и
проч.), пикриновую кислоту, сернистый углерод, масла, прбдукты
перегонки каменного угля и нефти и т. п.
728 —
Жидкие взрывчатые смеси разделяются на 4 категории: составы
Шпренгеля, Гельгофиты^ Панкластгты Тюрпэна и смеси, предложенные
Винандтом, содержащие тетронитрометан.
§ I. Составы
Шпренгеля.
Они были предложены Германом Шпренгелем в
Англии в начале 70-х годов и представляют взрывча-
тые смеси, в которых сгорающее вещество растворено
в жидком сжигающем и потому они имеют жидкую консистенцию*).
В качестве сжигающего Шпренгель употреблял крепкую азотную
кислоту удельного веса 1,5, в качестве же сгорающего могут быть:
бензол, нафталин и их нитропроизводные, пикриновая кислота, сер-
нистый углерод и проч. Вот некоторые рецепты изготовления составов
Шпренгеля:
1 |{ I I
! А В
I :
j ! : <
Азотной кислоты . ji 41,7% : 71,9%
! Пикрин. КИСЛОТЫ. ! 58,3 „ j —
г ; 1
i Нитробензола. .%! — 28,1 „
Динлтробензола. . i;
Составы Шпренгеля под влиянием капсюля гремучей ртути взры-
вают с большой силой. Ни толчков, ни трения не боятся.
s ° Панкпзститы Они предложены были в 1878 г. проф. Тюрпэном.
" а кл“<т ты- jjce онп СоСТСЯТ из чистого безводного азотноватого
ангидрида (NjOi)**) и какого—либо сгорающего. В качестве послед-
него Тюряэя, вместо бензола и нафталина, применявшихся Шпренге-
лем, предложил применять продукты их нитрации, а также масла в
роде: оливкового, льняного и др., или же продукты перегонки камен-
ного угля и нефти и наконец смешивагь с сероуглеродом. Смотря по
природе последнего, паш> астаты делятся на 4 группы:
1-я группа. В качестве сгорающего берется сероуглерод (С82),
причем взаимная пропорция обоих компонентов по об'ему будет:
2 об'ема сероуглерода и 3 об‘ема азотноватого ангидрида.
Этот сорт более других чувствителен к толчкам.
Другие составы в этом же роде заключают в себе.
Сернистого углерода . 35,5%
Двуокиси азота . . . 64,5 „
50%
50 „
*) В качестве сжигающего, кроме азотной кислоты, Шнренгель предложил
также бертолетовую соль, но предложение это практически было осуществлено лишь
несколько лет спустя американцем S. R. Divine, который в 1880 г. предложил так
называемый рэкка-рокк.
**) Азотноватый ангидрид кипит прп4-22°С и замерзает при—12°С; около 7О”С
он уже разлагается.
729 —
Смесь одной части сернистого углерода с 1,8 частями азотнова-
той кислоты, испытывалась в Германии для снаряжения снарядов.
2-я группа. В качестве сгорающего входит один из углеводоро-
дов, представляющих продукт перегонки нефти, например: пентан
(С5Н12), гексан (СсНн) и т. д., либо один пз продуктов перегонки ка-
менного угля, напр. бензол (С6Нв), толуол (С7Н8), ксилол (С8Н10) и т. д.,
они могут входить отдельно или вместе.
К этой группе принадлежат панкластиты следующего состава:
81,6% двуокиси азота.
18,6 „ бензола.
3-я группа. Сгорающим может быть какое—либо тело из группы
кислот жирного ряда, например: оливковое, хлопковое,. касторовое,
льняное, сезамное и т. п. масла, а также масла животного происхож-
дения: костяное, рыбий жир, ворвань, спермацет и т. д., или органи-
ческие жирные кислоты, каковые, например: олеиновая [С3Н5 (С%Нзз02з)]
маргариновая (С1вН33.СО2Н), стеариновая (Ct7H3SCO2H), пальмитиновая
(Ci5H3lCO,H), глицерин (С3Н80,;), жир, сало и т. д.
4-я группа. В качестве сгорающего—какое-либо нитросоединение,
как например: нитробензол (CcHsNOs), нитроксилол (С3Н9НОг) нитро-
анилин [NH2.C8H3 (NOo)o] и т. д.
Панкластиты, применяемые для промышленных целей, состоят
из двух жидкостей, одна в другой растворимых и каждая в отдель-
ности, не взрывчатых.
Панкластиты представляют ту выгоду, что каждая из составных
частей в отдельности совершенно безопасна при хранении и перевозке,
приготовлять их’ можно в любой момент и любой силы, варьируя та-
ковую изменением пропорций составных частей.
Весьма существенной отрицательной стороной панкласгитов яв-
ляется их жидкое состояние, каковое обстоятельство сильно усугуб-
ляется необходимостью иметь в них дело с такими едкими жидко-
стями, как азотная и азотноватая кислоты.
При малейшей оплошности кислая жидкость может проникнуть
к детонатору и послужит причиной несчастного случая; так действи-
тельно и случилось в 1884 году с Punshon’oM.
Помимо своего жидкого состояния, вещества эти представляют
еще другое важное практическое неудобство: они сохраняют свое жид-
кое состояние и полную силу только при плотно закупоренной посуде,
ибо по причине летучести азотноватой кислоты, последняя быстро
испаряется, оставляя в конце концов растворенное в ней вещество
не обладающее взрывчатыми свойствами. Варьируя в известных преде-
лах взаимоотношения составных частей, можно получить взрывчатые
преппараты различной силы и степени чувствительности. Удельный вес
панкластита около 1,0, по силе он превосходит динамиты, содержа-
щие 75 .> нитроглицерина. Взрывается капсюлем с двумя грам. гре-
мучей ртути, будучи же зажжены—горит. Температура газов, разви-
вающихся при взрыве около 3000°.
Панкластиты, несмотря на свою силу, благодаря неудобствам,
связанным с обращением с ними, до войны, практического примене-
ния не имели.
Однако общий недостаток во Франции материала для фабрика-
ции взрывчатых веществ, привел к попыткам вновь попробовать
использовать огромную силу составов Шпренгеля и во время войны,
стали снова применять смеси азотноватой кислоты с сероуглеродом и
керосином для снаряжения аэропланных бомб. В других случаях при-
менение панкластитов в военном деле весьма затруднительно, ввиду
трудности достижения смешивания жидкости в нужный момент.
Панкластиты могут быть поглощены различными веществами,
как и нитроглицерин. Они практически не чувствительны к ударам;
взрывают от капсюля с гремучей ртутью; будучи зажжены на воз-
духе, горят без взрыва, настолько ярким пламенем, что Тюрпэн пред-
ложил даже их употреблять для оптической сигнализации, построивши
для этой цели специальный прибор, в котором обе жидкости прите-
кают к горелке каждая отдельно и смешиваются лишь у самого
устья ее.
К панкластитам можно также отнести так называемый Анилит.
Это есть смесь азотноватой кислоты с сернистым углеродом и
некоторыми растительными маслами в приблизительной пропорции
65% кислоты и 35% остального.
Пробовали целиком применять для снаряжений аэропланных бомб.
Гельгофит предложен в 1881 г. прусским капитаном
& ’ впьго<₽»т- Гельгофом. Это взрывчатое вещество принадлежит к
типу составов Шпренгеля, т. е. составов, содержащих крепкую азот-
ную кислоту и какие—нибудь углеводороды (нафталип, бензол и
проч.), или другие легкоокисляющиеся соединения.
Гельгофит состоит из 40'о динитробензола и 60 о крепкой азот-
ной кислоты. Смешивание (растворение) производится при подогревании
азотной кислоты. Представляет собою красную, прозрачную маслооб-
разную жидкость.
Два наиболее известных его сорта состоят из:
1) 72 ,> азотной кислоты,
28 „ нитробензола.
2) 60 „ азотной кислоты,
40 „ динитробензола.
Будучи зажжен, гельгофит горит спокойно, без взрыва, отделяя
красно-бурые пары; горящий древесный уголь, погруженный в гель-
гофит, тухнет в нем. Не взрывается даже от сильного удара.
Для производства взрыва необходим ка псюль с гремучей ртутью.
Разложение гельгофита при взрыве происходит по следующему
уравнению:
С6Н4 (Ж)2 + 4 HNO3 == 6 С02 + 4 Н20 + ЗН2
По опытам капитана Пампушка (1885 г.) взрывчатая сила гель-
гофита более таковой же нитроглицерина. Гельгофит испытывался на
утью.
гель-
ся на
деляя
гель-
/шт.
)М и
)ЦИИ
— 731 —
)омб.
аном
§ 4. Взрывчатое ве-
щество Винандта.
ЮМ,
вне-
азот-
ами
JIOO6-
130Т-
)Л и
1ка-
вать
1ны,
)М и
дри-
аду
*) Или „карбонит
ваются динамиты, содержащие селитру.
зми,
рам;
воз-
ред-
вши
ите-
иого
практике в рудниках Прийислинского края в 1883 г. Оболочками для
гельгофитных патронов служили картонные гильзы, покрытые раство-
римым стеклом. Патроны снаряжались перед употреблением в дело.
В качестве преимущества гельгофита выставлялись—его большая
взрывчатая сила и безопасность в обращении. К недостаткам гельго-
фита »следует отнести: жидкое состояние, делающее обращение с ним
затруднительным, присутствие едкой, зажигающей некоторые органи-
ческие тела, кислоты, непригодность обыкновенных пергаметных обо-
лочек и потерю взрывчатых свойств в случае, проникания в него воды.
Неудобство, сопряженное с употреблением гельгофита в виде
жидкости навело на мысль превращать это вещество в тестообразную
массу при помощи инфузорной земли. Германский завод в Шлебуше
стал приготовлять так. наз. кизельгур-гельгофит *). Это пластичное
взрывчатое вещество состоит из смеси нитробензола с инфузорной
землей и азотной кислотой. Эта последняя вскоре была заменена
нейтральными богатыми кислородом соединениями.
/Синетит. (1885 г.)—пластичное вещество, состоящее из нитро-
бензола и растворенного в нем коллодионного хлопка, с прибавкой
некоторого количества селитры (или бертолетовой соли) и сернистой
сурьмы.
От огня вспыхивает, как порох, для быстрого взрыва требуется
капсюль в 2 грамма гремучей ртути.
К взрывчатым веществам с жидким сгорающим
принадлежит, между прочим, предложенная Винанд-
том смесь—тетранитрометана с нефтью или иным
углеводородистым сгорающим.
Тетранитро метан ниже 13°С. кристаллизуется, с водой не сме-
шивается. Опыты показали, что эта взрывчатая смесь может приме-
няться в тех же случаях, к которым применимы панкластиты и со-
ставы Шпренгеля.
I/
• Tfjr-
г
Был предложен в 1883 г. в Нью-Йорке М. Эмменсом; есть
§ . нсонит. в СущН0СТИ С0Став Шпренгеля. Он состоит из 42% азотной и
58% пикриновой кислот, с добавлением иногда какого-либо нитрата.
Вещество приготовляется в момент надобности и предназначено для
работ в рудниках.
Об (жсиликвите,
сказано выше в главе
1
который должно отнести к этой же группе, было
о жидком воздухе.
это название неправильно, так как карбонитами пазы-
i
Краткие статистические данные о фабрикации взрывчаты^ веществ
в различны^ страна^*).
I. Общие сведения - ).
Производство взрывчатых веществ до середины прошлого сто-
летия, вследствие ограниченного круга применения черного пороха,
держалось в скромных рамках. Зато с появлением бризантных взрыв-
чатых веществ в шестидесятых годах прошлого столетия, с введением
бездымного пороха в конце восьмидесятых, с мощным развитием хи-
мической промышленности и расширением области применения взрыв-
чатых веществ в конце 'XIX-го столетия (в горном деле, в каменолом-
нях, при постройке туннелей, шоссейных и железных дорог) и в са-
мое последнее время с увеличением взрывных работ в области сель-
ского хозяйства (корчевка пней, глубокая вспашка и пр.)—произвол-
. ство взрывчатых веществ начинает прогрессивно расти. Что каса-
ется военных взрывчатых веществ, то уже в Русско-Японскую и Бал-
канскую войны обозначилось резкое увеличение области применения
взрывчатых веществ; но мировая война 1914—1918 г. превзошла в
атом отношении все ожидания. Производство военных, взрывчатых
веществ, которое уже за последние 10 лет неуклонно росло вследствие
тревожных политических горизонтов, поднялось во всех странах в
несколько сот раз. Для этого поднятия характерным является увели-
чение производства взрывчатых веществ в Соединенных Штатах
Америки. Так вывоз составлял:
4
Род взрывчатых веществ. Количество в klgr. I . _. _ ... "... . z J 1913/14 j 1914/15 ' 1915-16 ' Стоимость в рублях***). 1913/14 : 1914/15 i 1915/16
Динамит i 16.5‘>i.ooo: 3.498.500 9.119.500 1 S <333.700 1.940.400 । 8.177.400
Патроны 1 1 8.396.200/17.199.400 77.874.300
Военные пороха . . . i 448.000 3.486.000-96.535.00(1 518.700 10.693.200 364.345.600
Остальные взрывчатые вещества I 1 1 / ; 1.923.600j27.266.200 529.762.800
Сумма. . 1 ' 1 j r । i i 14.172.200 77.099.200 / ; 980.160.11)0
*) Chemieker Zeitung 41. 191. 1917.
**) К сожалению, данные о производстве русских заводов очень скудны.
**'*) Довоенный рубль приравнен к двум германским маркам.
Пороха в |
всех сор
Воспламени'
И. Л:
Взрывателя
Патроны и 1
ч
*) Chii
Другие-же источники приводят следующих данные*):
1913 ' 19 И 1915 1916
• Pj o.i. г । Руби. Рубл. Рубл.
Динамит ..... 2.548.000 3.169.000 .... 8.765.000
Патроны — 13.881.000 53.357.(00 115.720.000
Военные вороха. . 1 770.000 887.500 140.538.600 553,137.500
Остальные взрыв- чатые вещества. 1 i 1.300.000 ,130. 100 199.775.000 825.037.500
В отдельности по месяцам вывоз взрывчатых веществ и порохов
из Соединенных Штатов выразился в следующих цифрах:
Мес я ц.
[’Взрывчатые!
вещества. !
!; Рубл. '
Сентябрь 1914
Январь 1915 .
Июль „
Декабрь „
i 279 30'-
| 2.027.600
19.616.100
47.010.500
Пороха.
Р\ бл.
L
08.800
67.26"
У.586.500
48.623.300
Ввоз дал сл. цифры:
Род взрывчатых i тг ' Количество в klgr. j Стоимость в рублях.
веществ. г.4.; 1914/13. il . 1913/п. 1914/13.
Пороха и взрывчатые вещества ( ( 184.800
всех сортов . 157.850 ! i 259.900' 195.300
Воспламенит, д, гори, дела . . . 1 'J - lj 284.300 157.500
J Взрыватели д. горн, дела . . . — С 182 200 306.600
Патроны и гильзы ' — ! J 296.100 60.100
*) Chimicker Zeitung 41, 549, 1917.
В общей сложности производство взрывчатых веществ в Соеди-
ненных Штатах равнялось:
В 1899 году около 98.000.000 kigr
„ 1900 г ч 113.400.000
„ 1904 л и 164.000.000 )*!
„ 1905 п 186.520.000 V
„ 1909 212.000.000 W
„ 1912 г> 222.700.000 и
„ 1915 Г 206.000.000 ??
„ 1916 п ч 227.000.000 М
Общая стоимость за последние два года достигла 1,45 милли-
ардов рублей, в то время как другие источники исчисляют стоимость
одного вывоза:
в 1914 году до 14.112.000 рубл.
„ 1915 „ „ 93.321.000 „
„ 1916 „ „ 1.050.434.000
Что касается других стран, то мы, к сожалению, не имеем та-
ких-же точно данных и о производстве приходится здесь судить
по данным ввоза и вывоза.
Так в Германии ввоз взрывчатых веществ, включая сюда снаря-
женные патроны, как ружейные, так и пушечные, капсюля и т. д.,
выразился в сл. цифрах:
В 190S году 480.000 kigr стоимостью в 443.000 рубл.
„ 1910 „ 419.800 „ „ ,, 505.500
„ 1912 „ 432,100 „ „ „ 539.500 „
„ 1913 „ 463.600 „ „ „ 574.000
В первую
половину 1914 „ 232.000 ,, „ „ 258.500
Вывоз:
В 1908 году 8.613.900 kigr СТОИМОСТЬЮ в 10.052.000
„ 1910 я 14.389.500 п 17.805.000
„ 1912 Н 18.315.000 ч . л 30.555.500
„ 1913 Л 18.561,800 п W •п 34.798.000
В первую по-
ловину 1914 г 8.276.100 ч 27.829.500
рубл.
Я .
11
Следовательно, вывоз превосходил ввоз на:
В 1908 году на 8.133.900
i 1910 „ „ 10.396.970
„ 1912 „ „ 17.883.400
„ 1913 „ „ 18.097.700
В первую по-
ловину 1914 „ „ 8.044.100
kigr стоимостью В 9.609.000 руб.
„ „ „ 17.299.500 „
„ „ „ 30.016.000 „
„ г т, 34.224.000 „
я 12.571.000 „
;оеди-
1ИЛЛИ-
амость
эм та-
судить
снаря-
т. д.,
А так как расход взрывчатых веществ в горной промышленности
в, 1913 году выразился в 50000 тонн, а расход военных взрывчатых
веществ в 6000 тонн (нитросоединения и бездымные пороха) то,
следовательно, производство взрывчатых веществ в Германии до вой-
ны можно оценить в 74000 тонн.
На одних 32 соединенных Кбльн—Роттвейлеровских пороховых
заводах в 1911 году было изготовлено 5000 т. разных сортов пороха.
Что же касается увеличения производительности за время
мировой войны, то в Англии средняя месячная производительность
за время сентябрь 1914 г.—июль 1915 г. увеличилась в 3,5 раза, а с
этого месяца по июль 1916 г. в 28 раз т.-е? в течение двух лет в
ПО раз. Для сравнения можно указать на то, что английские госу-
дарственные заводы в 1900/01 г. выпустили взрывчатых веществ
на 3,5 мил. рублей, (порох, пироксилин и кордит), что соответствует
количеству в 1,2 мил. klgr.
Во Франции производительность государственных заводов за
время с 1 августа 1914 г. по 1 февраля 1916 г. увеличилась в 2,8 раз,
а на частных за то-же время в 23,3 раза.
Производство взрывчатых веществ в южной России видно
из следующей таблицы.
1913. : 1914. удов в год. 1915. I 1916. । 11 ц И Наивысшая
j 1917. ; возможная ! выработка.
♦ Динами^ составы Фавье, [ i : ।
пироксилин 28175 ; 34485 19905 75110 182000 200. 000
Мелинит, тротил, шней-
дерит — 42135 496616 674000 1 1.000000
По французским источникам производство взрывчатых веществ
в разных странах представляется в следующих цифрах.
• _ . - — . ' До войны, f t. 1 1915. t. 1916 t.
Германия Австро-Венгрия Бельгия Соединенные Штаты Великобритания . . Франция » . Италия Россия Япония . . 1 60.00 5.000 1.000 8.000 18.000 5.000 3 500 6.000 4.000 360.000 90.000 ? 100.000 120.000 160.000 15.000 60.000 50.000 . 540.000 150.000 1* 160.000 200.000 500.000 45.000 100.000 90.000
К этой таблице следует заметить, что количество, падающее в
1915 и 191(5 г. на Германию, очевидно, преувеличено на 50%, а в
отношении Соединенных Штатов (сравни вышеприведенные данные)
значительно уменьшено.
Билль уже в 1910 году оценивал мировое производство взрыв-
чатых веществ в 300000—400000 тонн.
Что касается размеров производства сырья для ароматических
нитросоединений, то на них указывают следующие цифры.
11. Бензол, толуол и фенол.
Производство сырого бензола выразилось в Германии,
в 1909 году
„ 1916/17
........................... 14.000 t.
....................ОКОЛО -150.000 „
что соответствует мировой выработке бензола в 1912 году (150.000—
160.000 Г) и половине таковой, если были-бы использованы все заво-
ды, занятые выработкой кокса и светильного газа.
В Англии перед войной было, выработано:
в 1913 году 3 мил. галлонов по 4 kigr. или 12.000 t
„1915 „ ...........................ОКОЛО 65.000 „
„1916 .................... • . . . „ 9(5.000 *
Для Соединенных Штатов в 1913 и 1915 г. можно принять ту же
цифру что и для Германии в 1916 году (120.000 t.).
Италия может выработать Г2.000 t. чистого бензола.
Производство толуола выразилось в Германии:
в 1916 году В 2000—3000 t.; в 191(5 году 35.000 t.
„ Соединенных Штатах..............„1916 „ 32.000 „
................ !917 14.000 „
„ Италии....................................... 2.000 „
Мировое производство толуола перед войной можно оценить в
ю.ооо t. в год.
Из фенола в пикриновую кислоту в 1917 году в Германии было
переработано около 24.000 t.
В Соединенных Штатах производство фенола перед войной
равнялось около 75 С, зато расход в:
1913 году выразился в 4.000 t.
191.4 „ ,, „ 5.О0О „ ИЗ НИХ
1915 „ „ „ 8.200 „ „ „
1916 „ (приблизит.) 10.000
3.S00 I. ввезено
6*
Ур;.
— 737 —
цее в
д/ 3, В
шные)
ззрыв-
tecKEix
, Цена на фенол с 35 рубл. за 100, klgr перед войной поднялась
до 700 рубл. за 100 klgr (вторая половина 1915 г.) В Июне 1916 г.
цена снова упала до *275 рубл., из чего можно заключить, что сирое
уменьшился, ввиду поднятия производительности внутри отдельных
• государств.
Синтетического фенола, по данным Molinari в 1917 году во
Франции выработано около 60.000 тонн или 200 тонн в день.
В Италии—4800 тонн или 16 тонн в день, главным образом для
нереработки в пикриновую кислоту. Другие-же источники оцени-
вают годовую производительность Франции в 100.000 тонн, а Соеди-
ненных Штатов в 25.000 тонн.
Нафталина до войны в Германии добывалось около 50.000 t.j, год.
III. Селитры.
Производство чилийской селитры и ввоз ее в отдельные страны
видны из следующей, таблицы.
.ООО—
заво-
TV же
Л
J!
Ч
Год. Произ водство. Вывоз. Ввоз в • 1
в и из t Чили j Германию t. Францию t. Великобри- танию t Сведи н. Штаты t.
1900 1.3БО.ООО — 480.000 1 —
1905 1.550.000 — — 530.000 —
1910 2.300.000 720.000 — — ——
1912 2 5О0.ООО — 813 000 | 300-320.000 130.000
1913 2.700.000 Израсходо- | ванно около J В год.
1914 2.670.000 2 000.000 750—780.000 297.000 550.000
1915 1.908.000 2.200.000 наряду с 35.000 254.000 около 240.000 800.000
1916 3.165.000 3.240.000 Nogesalpetep. 540.000 „ 400.000 1.200.000
1917 —— 1.558.839
Германия для нужд химической промышленности
:ить в
I было
ой пой
Германия для нужд химической промышленности до войны
употребляла 20% всего ввезенного количества, т. е. 150.000—200.000 т.;
Для остальных стран можно принять 10 -15’/0-
По Munroe, в Соединенных Штатах ввезенная селитра распреде-
следующим образом:
Для производства
взрыввеществ.
. 80.306 Т.
. 120.662 „
лялась
в
1900 году
1905 „
Для других
целей.
165.498
231.104
т.
»
НО
Проф, Ж. Сухаревский. Взрывчатые вещества и взрывные работы.
47
Во время войны, наоборот, можно принять, что 10— 2О’/о упо-
треблялось для нужд сельского хозяйства, а остаток целиком шел на
производстве! взрывчатых веществ.
О росте цен на натриевую селитру дает представление следующая
таблица. '
В 1900 году 22 Fr. за тонну.
„ 1907 28 п и Я
„ 1911 п 21 я » Я
„ 1916 34 » я я
в 1917 я 42 я п я
IV. Черный порох.
Из различных сортов черного пороха взрывчатый порох, (Spreng-
pulver) а в особенности его дешевые разновидности пользуются боль-
шим спросом. Вследствие своего не дробящего действия, они
при соляных разработках, в рыхлой породе, в безопасных в отно-
шении рудничного газа угольных копях пользуются полной монопо-
лией и не могут быть заменены бризантными, взрывчатыми вещест-
вами. И это, безусловно, сказывается в громадных количествах еже-
годной фабрикации.
Так на частных заводах Соединенных Штатов изготовлено.
В 1840 г. „ 1890 „ 4.07 43.044 т. п (включая взрывчатый порох).
» 1900 В 56.546 я Я
п 1905 W 97.766 » » 99
» 1909 я 111.738 п 99 9
1912 » . 104.434 9? » » Я
т. е. почти половина производства всех взрывчатых веществ (см. ранее).
В Германии в 1913 году израсходовано около 20.000 t порохо-
подобных взрывчатых вешеств.
Расход черного пороха в Англии выразился:
В 1909 году 7.981.307 kigr. = 58,5%
„ 1911. „ 7.856.500 „ = 55 3 „ всех взрывчатых веществ.
Наряду с черным порохом израсходовано боббинита:
в 1909 году 507 433 kigr. = 13,2%
„1911 „ 544.530 „ = 12,8 - общего количества
всех разрешенных в горном деле взрывчатых веществ или 3%
общего количества взрывчатых веществ. Поэтому боббинит смело
можно поставить на первое место среди норохоподобных взрывчатых
веществ. В указанные цифры ве включен еще вывоз, который в 1906
году достигал почти половины количества, израсходованного внутри
страны т. е. 3.028.400 kigr.
Во Франции в 1905 году произведено 2,788.320 klgr взрывчатого
и 456.333 klgr охотничьего пороха, а вместе, следовательно,
3.244.653 klgr.
V. Нитроцеллулоза.
В то время, как непосредственное употребление нитроцеллулозы
в качестве взрывчатого вещества с течением времени непрерывно
падает, переработка ее в бездымные пороха и динамиты принимает
все большие размеры. В последнее время особенно заметно увеличи-
лась переработка нитроцеллулозы для технических целей, как то: для
приготовления целлулоида, искусственного шелка, фотографических
п 1енок, коллодия, различных лаков и т. д. Так, количество колло-
дионного хлопка, идущего на приготовление целлулоида, в 1909 году
оценивалось Гуттманом в 24 мил. klgr (Германия 15.000 t., Соеди-
ненные Штаты 4.000 t.) а Шварц исчислил в 1909 г. мировую потреб-
ность в искусственном шелке в 1,5 мил. klgr. Другие-же источники
называют даже цифру в 2,8 мил. klgr,
В Соединенных Штатах производство пироксилина (исключая
нитроцеллулозу, добытую для технических целей) равнялось:
В 1900 году 1.355.500 klgr.
„ 1905 „ 2.679.000 „
О количестве хлопка переработанного во время мировой войны
в нитроцеллулозу, можно судить по данным министерства торговли
в Вашингтоне.' Согласно последнему:
В 1915 году 244.033 КИП ПО 500 фун. ИЛИ 55.340.000 klgr.
_ 1916 „ 584.000 „ „ 500 , „ 132.500 000 „
хлопка были переработаны в нитроцеллулозу. Если же считать потерю
при обработке хлопка сырца равной 35°/в. то количество неотбеленного
хлопка переработанных в 1916 году, достигнет 898.016 кип или
203.666.400 klgr или 17.000 t. в месяц, что соответствует 16.000 t.
пороха.
VI. Нитроглицерин.
Производство нитроглицерина в последние годы значительно уве-
личилось. Так в Соединенных Штатах оно выразилось:
в 1902 году
16.100.000 klgr.
Из этого количества 1.640.000 klgr были выпущены на рынок
непосредственно, а остаток был переработан в динамиты.
В 1904 году 23.600.000 klgr.
И я 1909 „ 45.000,000 „
— 740 -
VII. Динамиты.
В настоящее время производство гурдинамита в Германии почти
прекращено. Желатинированный динамит играет теперь первостепен
ную роль во всей группе динамитов.
В Англии расход и ввоз гурдинамита в 1911 году выразился
в 56.000 kigr в то время, как таковые желатинированного динамита в
1.837.000 kigr.
Что касается других сортов динамита, то и тут наблюдается
стремление заменить их другими взрывчатыми веществами и если
производство их пока еще не уменьшилось, то во всяком случае много-
численные работы, где раньше исключительно употреблялся динамит,
выполняются другими взрывчатыми веществами.
На первом месте по производству динамитов, бесспорно, стоят
Соединенные Штаты. Изготовляются почти исключительно смешанные
динамиты. Выпущено на рынок:
в
1900
1904
1909
году
п
я
39.000.000 kigr.
59.000.000 „
80.000.000 „
Вывоз выразился в 1914
я 1918
году В 6.562.000 kigr.
„ „ 8.578.000 „
На втором,месте стоит Германия с производством:
В 1890 году 4.938.000 kigr.
п 1909 я 8.000.000
я 1911 V 11,000 000 м
1913 10.000.000 »
В рудниках и каменоломнях Англии было израсходовано:
В 1909 году 1.732.000 kigr.
„ 1911 „ 1 825.000 „
Общая выработка динамита в Англии для горной промышлен-
ности (исключая количество его израсходованное при постройке же-
лезных и иных дорог) — значительна — и выражается в следующих
цифрах:
В 1909 году 2.991.600 kigr
„ 1911 „ 2.965 300 ,
Во Франции израсходовано динамита:
почти
гепен
.зился
гита в
хается
с если
иного-
щмит,
стоят
:анные
В 1900 году
„ 1905 „
» 1910 „
„ 1912 „
t
1.556.000 kigr.
1.589.000 ,
1.918.000 „
2.405.000 .
К этим цифрам следует еще прибавить вывоз по 600.000—
700.000 kigr в год.
1870 году общая выработка 15 Нобелевских фабрик вырази-
лась лишь в 424.000 kigr.
VIII. Бездымные порога.
О производстве бездымных порохов имеются лишь неточные
данные, так как производство таковых, по большей части сосредото-
чено на государственных заводах, откуда получить точные данные,
по причине военной тайны, очень затруднительно. На германских
государственных заводах производство бездымных порохов выразилось
в следующих приблизительных цифрах.
В году. Пироксилино- вые пороха. Нитроглице- риновые поро- ха.
1905 1.704.900
1910 1.439.650
1913 1.786 800 —
1914 4.941.800 - ' —
1916 13.601.800 36.750
1917 16.440.900 2.596.750
1918 10.934.550 4.536.750
ашлен-
1ке же-
уЮЩИХ
Общее производство бездымных порохов, выразилось в kgr.:
1 В году. Военные пороха. Охотнич. пороха. Общее количест. Вывезено.
Пирокси- линовые пороха. Нитрогли- цериновые пороха.
1905 2.643 900 1.167.150 11.000 3.822.050 559.900
1910 2.064.950 1.946.800 42.900 4.054 650 981.900
1913 3.278.800 3.294.100 103 000 6.675.900 1.456.800
1914 8.330.000 6.285.000 66.900 14.681.900 1.169.800
1916 38.872.650 35.427 050 33.100 74.630.700 790.000
1917 46.880.250 46.871.000 18.000 91.769.250 345.400
1918 41.316.000 59.172.000 1 51.500 100.539400 21.820
Максимальная месячная выработка падает на октябрь 1918 г.—
9.574 t.
— 742 —
i
Ввоз, в сравнении с внутригосударственной выработкой, очень
мал. Так, примерно, в 1912 и 1913 годах он выразился в 30.000 klgr.
В Соединенных Штатах вывоз бездымных порохов выразился
в 19г4 году в 484.790 klgr.
„ 1918 „ я 15.399.500 „
В Англии во время войны производство кордита достигло (1918 г.)
35.000 000 klgr. (2.000 т. в неделю).
1)(. Пикриновая кислота.
Производство пикриновой кислоты в конце прошлого столетия
достигло в Германии цифры в 2—3 мил. k|gr.; с введением тринитро-
толуола оно значительно упало, так что в
1912 году было выработано около 230,000 klgr. ч
а в 1913/14 году не более 180.000 „
Во время Европейской войны производство пикриновой кислоты
снова значительно поднялось, главным образом в Соединенных Шта-
тах. Поско 1ьку об этом можно судить по производству фенола (см.
выше), оно поднялось в 1916 году до 18.600 тонн.
Расход пикриновой кислоты перед войной в Германии выразился
в 1912/13 Г. около 80.000 klgr.
„ 1913/14 м 130.000 п
а во время войны: 1914 п 55 567.350 »
1915 я 55 5.057.000
1916 п « 8.827.400
1917 V) 20 630.450 »
1918 « 25.246.050
В Англии выработка пикриновой кислоты во время войны дости-
гала 1.000 t в неделю.
ft. Тринитротолуол.
Производство тринитротолуола в последние годы перед войной
настолько покнялось, что в одной Германии ежегодно вырабатывалось
около 4,5 мил. klgr. По отдельным годам производство его представля-
ется в сл. цифрах:
в 1905 году 118.000
5? 1910 1.277.000
п 1912 2 530.000
» 1913 » 4.530.000
743 -
Во время войны выработка еще более повысилась, а именно:
В 1914 году ДО 7.330.000
„ 1915 „ „ 34.700.000
„ 1916 „ „ 64.800.000
„ 1917 „ „ 71 950.000 •
„1918 „ „ 49.500.000
Наряду с этим было выработано динитротолуола для горнопро-
мышленных целей: (в качестве одного из компонентов)
В 1905 году 48.000 klgr,
•fl 1910 288.000
1912 740.500 п
» 1913 881.000 1)
1914 » 321.000
В Англии было выработано:
В 1916/17 годах
и к концу 1918 года
21 500.000 klgr.
60.000.000 „
I
По другим данным производство выражалось до 1.000 тонн в
неделю, из коих 500 т. перекристаллизовывались.
XI. Безопасные (антигризутные) взрывчатые вещества.
Спрос на антигризутные взрывчатые вещества за последние 20 лет
увеличился весьма значительно. Если в 1890 г. производство анти-
гризутных составов по данным Билля было весьма незначительно, то
в 1909 году оно равнялось .... Ю.ооо.ооо klgr.
а В 1911 „ „ „ .... 15.000.000 „
В Англии израсходовано „permistted explosives"
В 1909 году................. . . . 3.349.000 klgr.
„ 1911 » ..................... . 3.792.000 „
Во Франции израсходовано в 1905 году 1.033.500 klgr. составов
Фавье (тип N), а в 1909 году то же количество плюс 600.000 klgr.
гризутинов с аммиачной селитрой.
В Соединенных Штатах, где до сравнительно недавнего прошлого,
вследствие незначительной глубины рудников и отсутствия в послед-
них рудничного газа, не существовало вовсе надобности вантигризут-
ных составах до 1901 года не было употреблено ни одного gr.
В 1905 году производство последних было еще весьма незначительно
(467.800 klgr.); но в 1909 году оно уже равнялось 3.967.000 klgr., а
в 1912 ГОДУ 8.379.200 klgr.
XII. Нммиачно-сепитровые взрывчатые вещества.
А
Расход аммиачно-селитровых взрывчатых веществ в Германии
выразился в 1913 году в 20.и00 тонн.
XIII. Хлоратные и перхлоратные взрывчатые вещества.
Увеличение спроса на хлоратные взрывчатые вещества нагляднее
всего можно проследить по увеличению производства шеддита с начала
настоящего столетия. В то время как
в 1901 году производство равнялось 410.000 klgr.
оно поднялось „ 1906 „.........................до 1.200.000 klgr.
„ 1908 „ .......................п 1.700.000 „
За это же время, по данным Girard и Laroche производство шед-
дитов из хлората калия постоянно уменьшалось за счет увеличения
производства последнего из хлората натрия. В Германии, Бельгии,
Греции, Италии, Швейцарии и Тунисе было произведено:
В году • Шеддита из
Хлората калия klgr Хлората натрия klgr
190*4 187.500 62.500
1905 431.500 123.000
1906 222.500 284.400
1908 126.250 650.000
I
Во Франции произведено, шеддита (из хлората калия)
в 1905 году.......................... 200.000 klgr.
„ 1910 „ ..................... 980.450 „
„ 1912 „ ..................... 1.200.000 „
в то время, как расход других взрывчатых веществ из хлората калия
в 1910 году выразился в 50.725 klgr.
В Англии расход взрывчатых веществ на основе хлоратов и пер-
хлоратов '
в 1909 году равнялся............... 130 350 klgr.
„1911 „ ...................89.110 „
Производство хлоратных и перхлоратных взрывчатых веществ во
всех странах во время войны значительно увеличилось; во-первых,
потому, что спрос на взрывчатые вещества вообще повысился, но
главным образом потому, что хлораты и перхлораты были призваны
заменить в областях как горной промышленности так и сельского
хозяйства другие взрывчатые вещества, мобилизованные для военных
це лей. Так производство в Англии перхлората аммония выразилось во
время войны в 50 т. в неделю.
XIV. Гремучая ртуть.
Гремучая ртуть производится в сравнительно больших количе-
ствах. Количество капсюлей, ежегодно изготовляемых в Германии,
равняется, по Биллю, 40— 50 мил. штук, что соответствует около
40 000 kigr гремучей ртути. При этом, во всяком случае, не принята
в расчет часть производства, пошедшая на нужды военного ведомства.
Вёллер оценивает производство гремучей ртути в Германии в 100.000
kigr и, между прочим, указывает, чю только один из заводов Англии
произвотит более чем в два раза. По подсчетам Каста производство
гремучей ртути в Германии по годам выразилось в следующей таблице.
В году • На Германских Всего kigr. ' 7
государственных заводах частных заводах
1910 около 8.300 96.500 104.800
1912 * 10.700 113.700 124.400
1914 23.500 85.400 ~ 108.900
1916 и 40.000 195.500 235.500
1917 40.600 317.000 357.000
1918 * 23.400 155.300 178.700
Пелуце оценивал
1.200.000 штук.
выработку капсюлей во Франции уже в 1846
ЧАСТЬ IV.
Испытания и способы лабораторного
приготовления взрывчатых веществ.
Ой Современное многообразие областей применения
щие замечания. ВЗрЫВчаты1 веществ в военном деле, промышленности,
сельском хозяйстве и пр., вызвало появление на рынке огромного
количества различных сортов специальных взрывчатых веществ,
вместе с тем широко поставило вопрос о достаточно практических
и доступных методах поверки их качеств, порой сильно афиширу-
емых. Предпосылкой к установлению этих методов является твердое
установление перечня тех качеств, которые вообще являются жела-
тельными для каждого взрывчатого вещества.
Ко всякому взрывчатому веществу современная практика пред‘-
являет следующие требования:
1) Оно должно обладать при хранении достаточной стойкостью в
своем химическом составе.
2) Должно соответствовать той цели, для которой оно предназна-
чено (в качестве ли метательного пороха, для порохострельных работ,
к применению в рудниках с рудничным газом, подрывным работам на
открытом воздухе, в качестве-ли детонатора, для приведения в дей-
ствие двигательных машин, снаряжения различных метательных и
артиллерийских снарядов, для минных работ и т. д.)
з) Должно быть удобно и безопасно в обращении, хранении и
перевозке, не боясь ударов и трения.
4) Приготовление его должно быть, возможно, заводским путем и
быть вполне безопасным.
5) Оно должно взрываться без отказа.
6) Оно не должно бояться перемен температуры, не изменяя под
ее влиянием, ни химического состава, ни физического строения,—в
частности не должно замерзать и улетучиваться.
Из менее существенных, но все же также весьма важных усло-
вий, оно должно также в большой или меньшей степени удовлетво-
рять еще следующим:
1) Быть возможно менее гигроскопичным и растворимым в воде.
2) Плотность его должна быть возможно большей.
3) Не должно быть ядовито.
4) Должно быть доступно по цене.
К тем взрывчатым веществам, кои употребляются в военном деле,
к требованиям нечувствительности взрывчатого вещества к обыкно-
венным толчкам и ударам, присоединяют его нечувствительность к
ударам ружейной пули,
Взрывчатых веществ, обладающих всеми псречисленными каче-
ствами, не существует, но перечень их служит тем масштабом, кото-
рым определяются достоинства того или иного взрывчатого вещества.
В настоящее время одним из наиболее совершенвых взрывчатых ве-
ществ специального назначения считается тринитротолуол.
Важность вышеперечисленных качеств вместе с тем ясно опре-
деляет пути и способы опытной поверки взрывчатых веществ. Эта
поверка должна состоять из испытаний как, механических, физиче-
ских так и чисто химических.
Сообразно сказанному мы и разделили настоящую часть на два
отдела, включив в первый—испытания общие для всех взрывчатых ве-
ществ и притом преимущественно механические и физические, и во
второй—техно-химические испытания отдельных классов взрывчатых
веществ, повторив в соответствующих местах, однако, те из нехими-
ческих испытаний, которые имеют исключительное и специальное зна-
чение для того или иного взрывчатою вещества.
В заключение, в виде самостоятельного отдела, мы даем при-
меры лабораторного приготовления взрывчатых веществ, что при си-
стематическом изучении взрывчатых веществ должно быть не только
важным и желательным, но и необходимым.
ОТДЕЛ I
Механические и физические испытания.
ГЛАВА I.
Фугасный и бризантный эффект.
f.
Введение в практику того или иного взрывчатого вещества бази-
руется на степени удовлетворительности испытаний его свойств в тех
преимущественно и Особенно направлениях, в которых намечается его
практическое использование.
Поэтому, помимо испытаний общего характера, приходится про-
делать ряд опытов специальных, предусмотреть которые заранее даже
не представляется возможным, так как они зависят от индивидуаль-
ных свойств вещества и специальных условий его применения.
Равным образом - при изменении условий применения изве тного
уже взрывчатого вещества—приходится также ставить вновь опыты,
учитывая изменившиеся условия его применения.
Среди испытаний, которые являются обязательными для всех
взрывчатых веществ, раньше всего следует назвать определение фу-
гасного и бризантного эффекта взрывчатого- вещества.
Оно основан на производстве взрыва заряда
испытуемого вещества в так называемой бомбочке
Трауцля и сравнении об‘ема получившейся камеры
раздутия с таковою же другого взрывчатого веще-
стса, принятой за единицу сравнения.
Прибор (рис. 340) состоит из точеного массив-
ного цилиндра, отлитого из чистого раффиниро-
§ 1. Определение фугас-
ного эффекта взрывча-
тых веществ по способу
Трауцля*) мни Абеля,
предложившего его одно-
временно с Трауцлем.
ванного свинца- Диаметр его 2< О м/м. при такой же высоте. По оси
своей цилиндр имеет канал 25 м/м. диам. и 25 м/м. глубиной. Все
бомбы, с которыми предположено произвести опыты- одной серии,
должны быть от литы из одной и той же партии свинца в -одно и то
же время и совершенно однообразно, причем могут употребляться в
дело не ранее 48 часов после отливки. На рис. 341 показана форма, в
которой отливаются такие свинцовые цилиндры.
*) L. Vermin et G- Chesneau. Les poudres et explosifis 1914.
Опыт можно поставить двояко: а) брать равные по весу заряды
и определять об'емы образуемых их взрывами пустот и б) подбирать
заряды, производящие одинаювого об'ема пустоты и брать отношение
весов зарядов. Этот второй метод, конечно, точнее первого и потому
должен быть безусловно предпочтен.
*--------— Sotf---------------
-----₽ов------* '
Рис. 340. Бомба Трауцля в плане и разрезе до и после испытания.
Как ни кажется прост способ Трауцля, но для получения дей-
ствительных ценных результатов он требует выполнения испытаний
при совершенно тождественных условиях, малейшее отступление от
коих совершенно обесценивает полученные результаты, делая их не-
сравнимыми. Ввиду этого необходимо соблюдать следующие правила,
применяемые, между прочим во Франции в лаборатории de la Commis-
sion des Substances Explosives (Dautriche. Rapport № 250. Июль 1912 г.).
1) За единицу сравнения берут об'ем пустоты, образующейся при
взрыве 15.000 грм. чистой пикриновой кислоты, считая этот об'ем
соответствующим коэффициенту 100, или такого же количества кизель-
гурдинамита—с 75% нитроглицерина, считая этот об'ем соответствую-
щим коэффициенту 102.
2) Взрывчатое вещество осторожно вводится на дно внутренней
камеры, при чем измеряют толщину слоя его и от дна; в него вво-
дится капсюль с 1,5 грм. гремучей ртути, воспламеняемый электриче-
ством, при чем капсюль входит в кружок из пробки толщиной 5 — 6 м/м.
е легким трением. Капсюль должен быт установлен по оси прибора и
углубляется во взрывчатое вещество не менее как на 25 м/м.
— 753 —
' 3) Забивка состоит из промытого сухого песка, просеянного
сквозь сито в 144 отверстий на 1 квадр. с.м., весящего приблизительно
около 1300 грм. в литре. Насыпается в отверстие совершенно свободно
без уплотнения. Заделка отверстия для
помещения заряда прежде производилась
свинцовой же пробкой (рис. 342).
4) Заряд взрывчатого вещества за-
вертывается в оловяную фольгу, выре-
занную по шаблону (рис'. 344).
5) После взрыва вычищают пустоту,
которая должна иметь грушевидною фор-
му и об‘ем ее измеряют водой. Об'ем
раздутия, сделанного взрывчатым ве-
ществом Д v получается, вычитая из
полученного об'ема пустоты 65 куб. с/м.,
соответствующих об'ему первоначальной
пустоты.
6) Нет никакой надобности в точно-
сти подбирать заряд, дающий такую же
пустоту, как и тот, который принят за
единицу — для этого можно ввести по-
правку, определяемую формулой:
1.4 C. J
откуда =
. ^2
Предполагая, что
Д V. , , „
*—1 = 1 ± Е, отно-
Д v2 ’
шение р,’ будет равно 1 4- 2/3 Е, или
Рис. 341. Схематический разрез
фермы для отливки свинцовых
цилиндров для испытания в
бомбе Трауцля.
1 — 3/4 Е в зависимости от того, будет ли отношение -г-—
меньше единицы*). - V2
Таким образом, раздутие не пропорционально
заряду, а потому метод сравнения об‘емов, произ-
водимых разного веса зарядами, в принципе уже
заключает в себе неправильность.
7) Если взрывчатое вещество содержит из-
быток кислорода, то это обстоятельство надлежит
принять к сведению, так как в таком случае
гремучая ртуть капсюля разлагается по другой
формуле (с образованием СО, вместо СО) производя
также работу, повышающую общий результат опыта.
Этим обстоятельством при пробе Трауцля отнюдь
нельзя пренебрегать по причине сравнительно
небольших навесок заряда (нд практике же, ко-
нечно, действием капсюля пренебрегают).
больше или
Рис 342. Забивка
свинцовой бомбочки
свинцовой пробкой
(прежний способ).
*) Приблизительные величины для полученные при помощи этой формулы в
пределе 0,60 - 1,60 могут отличаться от действительных не более, как на 355 *
Проф. /И. Сухаревский. Взрывчатые вещества и взрывные работы.
48
8) Чтобы получить при помощи пробы Трауцля сравнимые~ре-
зультаты, необходимо, чтобы взрыв был бы очень резкий (т. е., спо-
соб этот применим только к веществам бризантным), т. е., детониру-
ющим, так как иначе часть газов не подействует, так как успеет уда-
литься выбросив забивку. В виду этого, если возникает какое-либо
Рис- 343. Результаты испытания различных взрывчатых веществ в бомбочке Трауцля.
Слева направо: динамит, [обурит, даменит, даменит А, вестфалит, кельн-Роттнейле-
ровский безопасный порох, црогрессит, робурит I, колен карбонит и черный порок.
сомнение в этом отношении, то предварительно надлежит сделать опре-
деление скорости детонации (хотя бы по способу Dautriche’а).
Вещества, не детонирующие идя дающие неполную детонацию
(как, например, черней порох), должны для опыта предварительно
смешаться с соответствующим количеством дето-
г_______. пирующего взрывчатого вещества, коэффициент
_'_°Тд которого уже заранее точно известен. Для большей
Jo I \ точности определений в этом случае, Dautriche
। I________\ рекомендует подбирать взрывчатые вещества таким
”1 I образом, чтобы в них отношение количества
К----130— Ы ’
’ теплоты, отделяющейся при реакции взрывчатого
Рис. 344. Шаблон оло-
вянной фольги.
разложения к давлению, было бы по возможности
ближе друг к другу. Помимо сего необходимо
учитывать возможность возникновения в это слу-
чае побочных реакций между обоими взрывчатыми
веществами. Также точно в подобном случае приходится усиливать
капсюль, что также должно быть принято в соображение.
Метод Трауцля может к тому же давать неверные результаты,
если мы его применим к взрывчатому веществу с сравнительно мед-
ленно протекающей реакцией взрывчатого разложения, если оно при
эт)М выделяет очень большое количество тепла, так как в этом слу-
чае по причине оплавления и размягчения металла, сопротивление
стенок сильно уменьшается.Особенно ярко это сказывается при взрыв-
чатых веществах, содержащих алюминий; подобные взрывчатые веще-
ства дают результаты, сильно преувеличенные по причине очень вы-
соких температур, развиваемых сгоранием алюминия.
Особенное внимание надлежит обратить на то, чтобы стенки бомбы
оказывали при всех опытах одной и той же серии одинаковое сопро-
— 755 —
тивление; с этою целью, кроме указанных уже выше условий, коих
не обходимо держаться при отливке, необходимо также соблюдать одно-
образие в условиях остывания отлитых цилиндров, причем число пере-
плавок, коим подвергался свинец, не должно превышать двух.
Огнося увеличение об’ема камеры в свинцовой бомбе Трауцля от
различных взрывчатых веществ к таковому же от гремучего студня,
получим следующие коэффициенты, заимствованные из Zeitschrift flir
das ges. Schiess u Sprengstoffresen. 1906 r.
- Об‘емы. Коэффи- циенты.
Гремучий студень . . . . . . . . . . 590 К. с. 1,00
Нитроглицерин. . , . 563 0,95
Пироксилин сухой с 13,8% азота прес.. 5,420 0,70
Донарит 385 к. с. 0,65
Бездымный нитроглицериновый порох . • 368 0,60
Пикриновая кислота 365 0,60
Гремучая ртуть 213 0,35
Бездымный пироксилиновый порох . . 185 * 0,30
Дымный порох 112 0,20
Тринитротолуол 360 0,60
Динитробензол 240 0,40
Тринитроксилол лишь незначительно уступает, по этой пробе
тринитротолуолу *).
Dautriche дает следующие коэффициенты работы, полученные из
выражения отнесенные к пикриновой кислоте, получаемые им
*) Подробнее о данных этой пробы для тротила и пикриновой кислоты
см. Escales 1915 г. 301 стр, ।
— 756 —
путем производства серии опытов при помощи бомбы Трауцля для
наиболее употребляющихся во Франции взрывчатых веществ:
Пикриновая кислота................100
Гремучий студень...................155
Гур-динамит № 1 (с 75% нитроглицерина). 102
Гризутин-рош................. 100
Гризутин-куш................. 75
Гризунафталит-рош............ 103
Гризунафталит-куш............ 81
Состав Фавье %а................. 81
Состав Фавье NiC................Ill
Состав Фавье N,b ....... . ЮЗ
Состав Фавье № 4................ 78
Взрывчатое вещество ON3 .... 68
Взрывчатое вещество 0 № 5 . . . 86
Шеддит О № 2................. 82
Минный порох сильный......... 52
Минный порох обыкновенный . . 48 *)
Для испытания капсюлей употребляют подобную же свинцовую
бомбу только меньших линейных размеров (см. далее).
Испытание в бомбочке Трауцля разных взрывчатых веществ, про-
изведенное Zschokke в 1910году, дало нижеследующие результаты**).
См. рисунки на стр. 758—759).
Названия. Химический состав. о. ё" о у ь о- s « ; ч о == S’ s о >> я:2зЙто-°ч „ S 2 О. К S Л щ О и !Е « !Е л> “ ® Е 52 р. „ ® te( cu X х S S и S л, га у J S и Sworn .Q-X wo vU сп чо л а с, м a E и a Примечание
Гремучий студень. „Специальный" гре- мучий студень. Динамит № 1, 90 —92°|0 нитроглиц., 10 8°|0 коллодион. пи- рок илина Гремучий студень с добавкой жидких нитро- продуктов высокой сте- пени нитрации (аромат, ряда), чтобы сделать его трудно замерзающим . 74—76°|0 нитроглице- рина, 5-б0|0 КО1ОДИ0Н- пирокс.15,5— 16,5NaNOa, . 3°|о древесной муки, охры и соды по 0,25% ... 632 598 517 0,5 | 15 1 1 1 1 1 0,5 I 30 i 0,6 15
*) В других источниках мы находим еще дополнительные сведения по другим
взрывчатым веществам и иное число для динамита № 1:
Гурдинамит № 1....................... 109
Гремучий студень с аммиачной селитрой * .124
Желатин-динамит X; ..................116
» » № II..................93
Динамит № III......................... 70
**) „Handbuch der militarischen Sprengtechnik".
— 757 —
л Названия. Химический состав. Средн. 3 проб- Об'ем камеры в свинцов. бом- бочие Трауцля Коэфициэнты величин. заря- дов принимая за 1,00 тролит. Высота паде ння в Ленцов- ской пробе (чувствнтельи.) Примечание. *
Желатинотельзит J. Тяжелый Вестфалит. Желатий-вестфалит. Тельзит А. Желатин Вендер. УсиленныйВестфалит Шеддит С. Бездымн. порох мар- ки Р. С. 88 (руж.). „Специальный* жела- тин-тельзит. Пикриновая кислота плавленад уцельн. веса 1,76. Прессованный пиро- ксилин с 2—2, 5°/0 воды уд. веса 1,12. Гурдинамит. Тол (прессованный, уд. веса 1,50). Пластичное взрывча- тое вещество, содержа* щое NH4No3 и, желати- нированный коллодио- ном пироксилином—ни- троглицерин, флегма- тизированный жидкими нитротелами ароматиче- ского ряда высокой сте- пени нитраций Порошковатое взрыв- чатое вещество, содер- жащее аммиачную се- литру, нитротолуол и по- рошок алюминия . Пластичное взрывча- тое вещество, содержа- щее аммиачную селит- ру, динитрохлогидрин, коллодионный хлопок и нитроглицерин .... Состав сходен с тяже* лым вестфалитом . . . Пластичное взрывча- тое вещество, содержа- щее аммиачную селит- ру, динитроацетин и желатинированный кол- лодионным пироксили- ном нитроглицерин . . Порошкообразное ве- щество, содержащее NH4 NO3, смолу и несколько 0)0 алюминия в порошке Около 80° 0 КС103 с ни- тротелами и касторовым маслом Нитроцеллулозы 82°|0, тола 18°|0 Состав как и желатин- тельзита, но часть NH4 NO3 замещена NaNO3 Тринитрофенол • . . Нитроцеллулоза . . . 70° о нитроглицерина ЗО°|о кизельгура .... 475 442 437 432 *425 425 378 350 340 325 323*) 316 300 0,6 0,7 0,7 0,7 0,7 0,7 0,8 .0,8 1,0 1,0 1,0 1,0 1,0 i 50 55—60 30 70 Более 100 80—85 20 25 Более 100 30 25 20 80 а ♦) Число это относится к вла- жному пирокси- лину с 15% в0’ ды,—для сухо- го же оиа дол- жна быть рав- на 368.
— 758 —
Рис. 345. Результаты испытаний взрывчаты^
бСГкуб. ом. Перед выстре-
лом.
639, куб. см. Гремучий
студень.
598 куб. см. Специаль-
ный гремучий студень.
437 куб. см. Желатин*-
вестфалит.
432 куб. см. Тельзит А.
425^*куб. см. ‘Желатин
Бендер.
340 куб. см. „Специаль-
ный* желатин тельзит
325 куб. см. Пикриновая
кислота плавленная уд.
^вес 1,76.
tl *
323 куб. см. Прессован,
пироксилин.
295. куб. см- Желатин —
шеддит (Versuchstypus).
288. куб.см. Шеддит 60 N*.
273 куб. см. Шеддит 60.
— 759 —
no Zschokke
веществ в бомбочке Трауцля
it*
142
475 куб.
Г1
!
:^Ж
тин
378
куб. см. Шеддит С.
куб. см. Бездымный
1ЛЬ-
ЙНЬ.
куб. см. Тяжелый
Вестфалит.
425 куб. см. Усиленный
вестфалит.
см. Желатино-
тельзит J.
350
порох марки Р. С. 88.
517 куб. см. Динамит
№ 1.
Ой
’г? .?<•.•••
Ш'ДЙ!
шш
J fl:
ван.
&
Й"'Ж
316 куб. см. Гурдинамит.
300 куб. см. Тол [(прес-
сованный). >
300 куб. см.* Шеддит 41.
1 60.
i
г
15Т ку б. см. Петрокла-
стит.
108^куб. см» Черный по-
рох.
Названия. Химический состав. Средн. 3 проб. 06‘ем камеры всвинцов.бом- бочие Трауцля Коефициэнты | величин заря-| дов принимая! за 1,00 тротил.} Высота паде- ния в Ленцов- ской пробе дчувствительн.) Примечавие.
Пикриновая кислота j
(прессованная, уд.
веса 1,63. 300 1,0 30
Шеддит 41. Состоит из КС1О3 в
иитротелами (динитро-
толуол и нитроиафта-
лин), рициновое масло . 300 1,0 40
Желатин- шеддит Сходен с шеддитом 41 295 1,0 25
(Versuchstypus).
Шеддит 60 N. Тоже ........ 288 1,0 18-20
Шеддит 60. Тоже 273 1,0 15-20
Т*»л (плавленый, уд **) Эти два
веса 1,61). 260 1,0 80 взрывчатые ве-
Петрокластит и 69°'о NaN0#, 5«|0 KNOt, щества могут
1О°(о S, 15°|о камеино- сравниваться
угольной смолы, 1°|о К3 только между
^22^7» 157 1 100 £обой но не с
Порох черный. 75°lo KNO3,1О°|0 S, 15«|0 С 108 1 1 65 ж другими.
Эта проба отвечает
всего действи-
ближе
тельности, если испытуемое взрывчатое вещество
предполагается применять для взрывания его во-
все без оболочек или в оболочках тонких, не-
прочных, как, напр., для подрывного дела.
§2. Испытаниебризантности
взрывчатого вещества при
помощи сжатия свинцо-
вых цилиндриков.
Схема этого испытания показана на рис. 346. Размеры двух свинцо-
Рис. 346. Прибор для испытания бри-
зантных взрывчатых веществ по сжа-
тию свинцовых цилиндров, (схеиат.
разрез).
вых цилиндриков — 40 мм. диам. и
30 мм. вне. На них наклады-
вается два стальных кружка —40 мм.
диам. и 4 мм. толщ. Заряд взрыв-
чатого вещества, помещенный в фоль-
гу, удерживается гильзой в 41 мм.
укрепленной железной проволокой.
Вес его 50 или 40 гр.; при ограни-
ченном количестве вещества можно
брать и меньше, но не менее 20 гр.
При малых зарядах можно брать и
один кружок. Капсюль гремучей
ртути 1‘/а—2 гр.
Параллельно с испытуемым не-
обходимо сравнивать и взрывчатые
вещества, уже известные. При этой
пробе, кроме величины сжатия ци-
линдриков (обыкновенно нижних) и
характера загиба верхней поверхности
у верхнего цилиндрика, наблюдается и полнота взрь!ва, а также
может подбираться подходящий капсюль, если взрывчатое вещество-
ji- >Жг . • - ***»< ^* J
— 761 —
мало чувствительно к слабым капсюлям. Если взрывчатое веще-
ство дает всегда без отказов полный взрыв в условиях пробы, оно
тем ботее будет взрываться в толстых и прочных оболочках. Так как
взрывчатые вещества, хотя и сильные, но развивающие свое давление
медленно, не успевают произвести достаточного сжатия цилиндриков,
то эта проба характеризует бризантность взрывчатого вещества или
точнее скорость детонации.
Австрийские опыты с зарядом в 50 гр. с кружками в 4,5 мм.,
при высоте заряда в 30,5 мм. дали сумму сжатия обоих цилиндри-
ков для гур-динамита с 5О°/о нитрогл. в 15 мм., а для австрийского
экразита—в 35 мм.
Во Франции, в других условиях, именно: только в одном цилинд-
рике диам. 67 мм., заряда 40 гр. и капсюле 1,5 гр., получено сжатие:
Для пикриновой кислоты. .................................11 мм.
« состава Ф1вье (12% дияитронафталина и 88% NH.NO») . 8 „
„ нитрогуанидина ......................................7 „
„ гризутина (30% гремучего студня и 70% NHJSIOg . . . 7 „
» » 12» » „ 80 „ . . . 5 „
Во Франции (см. L. Vennin et Ghesneau. Les poudres et explosifs
1914) эта проба делается несколько иначе.
Точеный свинцовый дилиндрик диам. 36 мм. и высотою 72 мм.
ставят на толстую стальную плитку, служащую наковальней. На
верхнее основание цилиндрика укладывают толстый стальной кружок
и затем надеваю г цинковый колпачек с зарядом в 20,00 гр. взрывчатого
вещества, подлежащего испытанию (см. фиг. 348).
Quinan конструировал прибор, дающий возможность в одно и
то же время измерять бризантность и полезную работу взрывчатого
вещества.
Его аппарат (см. рис. 319) состоит из массивной наковальни JE и
стальной толстой плитки В, сквозь которые проходят четыре напра-
вляющие стержня, по коим свободно могут перемещаться в вертикаль-
ном направлении два стальных цилиндра с й d, причем в первом из
них, т-е. с, сделано в верхнем основании по оси углубление служа-
щее камерой, а в верхнем d имеется отверстие, сквозь которое про-
ходят провода к электрическому запалу. Оба стальные цилиндра хорошо
друг к другу пришлифованы основаниями. На схематическом чертеже
верхний показан несколько приподнятым. Под цилиндр е на плитку,
по оси прибора, ставят цилиндр А для сжатия. При взрыве заряда
(1—2 грм.) в камере цилиндра, происходит сплющивание цилинра А
и подбрасывание части d на некоторую высоту. Измеряя последнюю и
определяя сжатие цилиндрика, мы получаем данные для суждения о
величийе работы, произведенной взрывчатым, веществом и о степени
его бризантности. Прибор Quinan’a научного значения, однако, не имеет
и может служить лишь для приблизительных, предварительных ис-
пытаний.
К подобным же аппаратам принадлежит и прибор Гуттмана, пред-
ставленный на рис. 350. Это своего рода манометрическая бомбочка
с центральным расположением заряда, могущим быть воспламененным
— 762 —
при помощи куркового или иного какого-либо, приспособления. Газы
от взрыва заряда, при помощи стальных кружков вдавливают свинцо-
вые цилиндрики в конической формы пустоту. Измерение происходя-
щей при этом деформации цилиндриков даег возможность судить о
развивающихся при взрыве давлениях.
Рис. 347. Испытание взрывчатых веществ ^на
сжатие свинцовых цилиндров.
Рис. 348. Прибор, принятый во Фран-
ции, для испытания бризантности на
сжатие свинцовых^ цилиндриков.
§3. Испытание взрывча- Это испытание в отношении характера взрыва
того вещества (в капсю- взрывчатых веществ явтяется близким преды-
лял) пробиванием с винцо- дущ^му, хотя вовсе уже не носит научного харак-
вы^с пластинок. тера; Здесь взрывчатое вещество характеризуется,
вместо сжатия, пробиванием сравнительно тонкой (4 м.м) квадратной
(45X45 м.м) свинцовой пластинки, положенной на стальное кольцо,
а также лучеобразными следами на ней от \даров кусочков оболочки
разорванного капсюля. Оно является также типичной пробой на бри-
зантность и ею испытываются не только самые взрывчатые вещества,
но и капсюля с ними и, между прочим, капсюля с двумя и тремя
взрывчатыми веществами. Результаты этой пробы являются показа-
тельными тоже только при параллельном испытании с уже извест-
ными взрывчатыми веществами или капсюлями с ними. Преимуществом
этой пробы является, кроме простоты ее и отсутствия сложных при-
боров, весьма малый расход взрычатого вещества, почему можно
получить интересные результаты и при наличности ограниченного
его количества.
763 —
§4. Испытание взрывчатого ве- —По своей задаче определение фугасного
щества на действие в земле. эффекта, несколько приближается к йфобе Трау-
цля и, будучи произведено при благоприятных условиях однообразия,
Рис,349.’Прибор Quinana для одновременного опре-
деления бризантности и полезной работы взрыв-
'чатых веществ. (Схематич. разрез).
150—200£грм. и помещают на глубину
может только служить для
характеризования взрывча-
того вещества, в особенности
применяющегося для мин-
ных работ в земле.
Для ведения опыта вы-
бирают, по возможности,
однородные грунт, представ-
ляющий везде одинаковое
сопротивление, делают в нем
вертикальные отверстия, в
которых помещают на опре-
деленной глубине заряды и
измеряют об'ем образовав-
шихся взрывами эллипсо-
идов по формуле:
v = i/ie*D’H
Измеривши оси, вычис-
ляют и об'ем, вычитая из него
об'ем дыры, в которой нахо-
дился заряд. Сравнивают с
действием черного пороха
или гурдинамита №1 (с 75%
нитроглицерина).
ВоФранции такое опыт-
ное поле находится в Sev-
гап—Livry. Заряды берут в
1 метра, причем подгоняют
Рис. 350. Прибор Гуттмана для определения бризантности в. в. (схем, разрез).
зарязы так, чтобы получить равные объемы. Диаметр дыр, высверли-
ваемых в земле, 29 миллиметр., капсюля берут с 1,5 грм. гремучей ртути.
§ 5. Испытание вврывиа- Dautriche изучал действие зарядов в 5-10
ты, веществ действием ГРМ- Равных взрывчатых веществ на глыбе бе-
на бетон тина в 500 мм. диаметром и такой же высоты,
при чем относительные результаты получаются сход-
ные с теми, которые дает метод Трауцля, но, конечно, они значительно
менее точны. i
о д n Французская Commission des Substanscs Explo-
S 6 Проба взрывчатых • г 1
веществ на прогиб ставь-slves взРывала заряды в 100-200 грм. на сталь-
ных плитках размером 500 мм. х 150 мм. и 25 мм.
НЫХ плиток. - г г
толщиной, покоющихся на двух неподвижных опо-
рах, имеющих длину пролетов к свету 400 мм. Сталь бралась воз-
можно более мягкой и однообразных качеств, причем условия всех
опытов должны быть возможно более идентичными
Подбирают
торую дал тип.
заряд, соответствующий той-же степени прогиба, ко-
К сожалению, эти практические испытания, по
причинам экономического характера, производятся
редко, но во Франции оно всетаки было выполнено
дважды: Антигризутной Комиссией в 1897 г. в руд-
никах d’ Anzin, Blanzy и Firminy и Commission des
§ 7. Практическое
испытание взрывча-
ты^ веществ в руд
никах и карьерах
Substances Explosives, при посредстве инженера Dautriche в карьерах
Enville.
В нижеприведенных двух табличках заключаются некоторые из
получившихся результатов:
♦
Опыты в Anzin (1897 г.).
Название взрывчатого вещества. Теоретиче- ские потен- циалы. Сила по ис- пытанию в бомбочке. Проба Трауцля. ! Результат произвел. | испытания.
Гремучий студень 100 100 100 100
Гурдинамит № 1 (с 75% нитро- глицерина) 75 67 66 67
Студенистый гризутнн (с 70 () нитроглицерина 41 72 66 69
Гризутит В АЫоп (88 %) • • • 37 60 50 53
Фавье № 1с (87,4 о) 65 86 71 65
Черный порох обыкновенный . 43 28 31 31
— 765 —
Опыты в Enville 1910 г.).
о » т
Название взрывчатых Я О Ф о * * и s ь* и ч ьтат вед. ани
“ й О .5 ф ев СТ ч ГО Ь
X ю >» >» х 2
веществ. <=? ь s 3 ? 3 S о св о. л го о В Ф CL Q
О о ю К го ЕН Он н я
Пикриновая кислота 100 100 100 100
Фавье № 1с 90 102 104 111
Шеддит (02) 67 115 88 90
Из этих таблиц видно, что метод Трауцля дает результаты, весьма
близкие к практическим и, так как он наиболее научен из всех, то
его и следует рассматривать как наилучший для испытаний в лабора-
торной обстановке.
В нижеследующей таблице сопоставлены взаимоотношения коэффи-
циентов силы (или вернее давления развиваемого газами) и потен-
циала (т.-е. произведения числа калорий на механический эквива-
лент тепла) некоторых употребляемых во Франции взрывчатых веществ,
принимая за единицу сравнения пиириновую кислоту (коэффициент ее
принят равным 100).
Название взрывчатых Сила. Коэффици- ент ио пробе Трауцля. Потенциал
веществ.
93 Гремучий студень 114 155 205
75 Гурдинамит № 1 . 80 102 159
8/,4 ; сост. Фдвье № 1с 96 111 127 —-
9Г ,5 сост. Фавье № la bis или гризугин-куш 72 81 74
Обыкновеввый черный минный по- рох 36 48 85
Из этой таблипы явствует, что в общем результаты, получаемые
по методу Трауцля, являются промежуточными между вычисленными
манометрически потенциалом и силой.
Примечание. Практические опыты в земле и бомбочке
Трауцля привели к выводу, что уплотнение взрывчатых веществ
в заряде имеет значительное влияние на полезное действие —
обстоятельство, которое нельзя было предусмотреть, руководству-
— 766 —
йй
ясь теоретическими опытами в замкнутом сосуде. Работа взрыв-
чатого вещества, по мере увеличения плотности, сперва возра-
стает, но достигнув некоторого предела, быстро падает и нередко
в подобном случае находят поело взрыва часть вещества не
разложившимся. Подобное обстоятельство может иметь очень
важное значение при работах в гризутных рудниках, сильно по-
вышая возможность взрыва рудничного газа и угольной пыли.
Существует так же зависимость скорости детонации от
плотности. Замечено тоже некоторое ослабление действия взрыв-
чатых веществ с крупным зерном сравнительно с мелкозерни-
стыми сортами его-же, причем в шеддитах разница может до-
стигнуть до 10%. Явление это об'ясняется не полным разложе-
нием зерен, плотность коих превосходит предельную.
Замечено, что если взрывчатое вещество трудно разлагается
при простом сгорании, что имеет место, например, в „безопас-
ных* взрывчатых веществах, то это разложение происходит тем
с большей быстротой и тем полнее, чем больше быстрота дето-
национной волны, причем, максимум полезной работы ei о полу-
чается при максимальной скорости детонации. Вообще скорость
детонации несколько возрастает с увеличением диаметра гильзы
и сопротивления их оболочек и тоже возрастает с увеличением
веса капсюля и большею мелкостью зерен взрывчатого вещества.
Скорость детонации, с увеличением плотности, сперва до-
вольно плавно возрастает, пока не достигает некоторого макси-
мума, перейдя который, она чрезвычайно
На рис 351 видно это явление
Dautrich’eM при опытах с шеддитом №
быстро падает.
данным, полученным
в патронах диаметром
по
60
д
Рис. 351. Графика зависимости скорости
детонации от плотности эаряжавия.
В?
ТО
В1
ра
ап
Бу
тев
скс
наб
ден
дает
точв
дую1
юще
раба
ЩИМ1
расш
30 м/м. Высшая точка кривой и соответствует предельной плот-
ности (densite’ limit-,), за которой детонация перестает быть уже
полной. Определение же этих предельных- плотностей не пред-
ставляет никакого затруднения, если измерить скорость дето-
нации при помощи детонирующих шнуров по способу того же
Dautrich’a. Для того, чтобы по возможности избежать плотностей,
превосходящих предельную, некоторые вещества, подвергшиеся
длительному хранению, (например, шеддиты, сикрит и т. п ), пе-
ред употреблением в дело, разминают между пальцами, хотя
такой паллиатив не всегда оказывается достаточным. При всем
том, однако, не надо забывать итого обстоятельства, что большие
плотности позволяют вводить в скважины данного диаметра
бблылие весовые количества взрывчатых веществ, что может
значительно удешевить работу, почему на практике и стараются
держаться некоторого практического максимума.
/
s 8 0 Скорость распространения детонации, взрывчатых
g . предепение веществ была уже в 1885 году подр 'бно изу-
ск рос™детонации чена рерТелло и Вьелем. Произведенные с тех пор
’ в‘ исследования в сущности не дали много нового, разве
только обогатили уже имевшийся материал. Даже методы определения
в принципе остались такими же, с той только разницей, что благодаря
техническому усовершенствованию аппаратов, результаты стали полу-
чаться более точные. Для определения скорости детонации какого-
нибудь в/в. поступают следующим образом. Длинный брусок соответ-
ветствующего взрывчатого вещества вставляется в металлическую
трубку, длиной в несколько метров. Через брусок пропускаются на
точно измеренных расстояниях две медные проволочки, котор> е, каж-
дая в отдельности, являются частью электрической цепи. Все это
приспособление зарывается в землю. Как только взрывной капсюль
взорвется и вызовет детонацию в/в., первая проволочка разрывается и
ток в первой цепи прекращается. К гда детонация бруска дойдет до
второй проволочки, она разрывает и ее и, тем самым, прекращает ток
и во второй цепи. Само собой разумеется, что металлическая трубка
разрывается на куски. Если теперь каким нибудь чувствительным
аппаратом, вроде аппарата для опретеления скорости полета снарядов
Буланже или искровым индуктором Сименса, определить время, про-
текшее между обоими разрывами цепи, то простое вычисление дает
скорость детонации в одну секунду. Длина бруска бывает различной.
В общем она определяется промежутком времени достаточным для
наблюдения, причем, конечно, при большей длине, ошибки в наблю-
дениях будут меньше.
Изображенный на рис. 352—354 искровый хронограф Сименса
дает настолько точные наблюдения, что позволяет получать вполне
точные результаты при длине бруска в 10 -20 см. Он состоит из сле-
дующих частей: Т — вращающийся барабан, S - с‘емное колесо, име-
ющее столько же делений, сколько миллиметров в окружности ба-
рабана, N —нониус, Н — передвигающиеся санки с проводами, веду-
щими к отдельным искровым остриям, А, до Ав — выключатели для
расположенных сзади искровых индукторов, М —обозначает место для
— 768 —
Рис. 352. Искровой хронограф Сименса (общий вид).
Рис. 353. Деталь верхней части искрового хронографа Сименса.
— 769 —
t
электромотора, который вращает измерительный барабан. Рис. 354 по-
казывает распределительную доску: В — выключатель мотора, F —
электро-акустический из-
мерительный прибор Гарт-
манн - Кемпфа, специаль-
но приспособленный для
определения большого
количества оборотов.
Окружность применяемых
барабанов, обычно, коле-
блется от 45 до 100 см.;
количество оборотов бара-
бана равно 100—162 в
секунду.
Кроме указанного,
следует еще остановиться
на измерительном аппа-
рате Меттеганга.
Аппарат состоит из
четырех основных частей:
1) Из зачерненного
барабана с платиновыми
остриями, зубчатым при-
водом и измерительным
приспособлением;
2) Из электромотора;
Рис. 354. Распределительная доска к искровому
хронографу Сименса.
3) Из измерителя скорости вибраций
4) и из искровых индукторов.
Ток из какого-
нибудь сильного
источника идет —
смотря по количеству
искровых индукто-
ров— через соответ-
ствующее количество
реостатов с десятью
параллельно - соеди-
ненными лампочка-
ми к первичной об-
мотке искровых инду-
кторов, а оттуда об-
ратно к силовому ис-
точнику. Вторичные
обмотки одним полю-
сом присоединены к
Рис. 355. Схема измерительного аппарата Меттеганга. соответствующим
платиновым остриям
перед барабаном, другим к его основанию. Провода, ведущие к пер-
Проф. М. Сухаревский. Взрывчатые вещества и взрывные работы.
49
— 793 —
Названия взрывчатых веществ. Высота падения груза, при которой происходит взрыв.
!—. Ill .. - . Вес груза в килограммах.
0,1 0,25 0,50 1.00 2.00 5.00 20.00
Йодистый азот . ч . . < 5
Гремучая ртуть . . . 5—10 < 5
Нитроглицерин , . . . 5—10 <ft t *
Гурдинамит (75% ни- троглицерина .... 5—10 <5
Студенистый динамит (с 65% нитрогл.} . . 5—10 < 5
Динитроглицерин С, Н3 (N03)2HO ...... 10-15 5—10 <5
Смесь вертолет, соли и серы 15—20 10,-15 5—10 <5
Сухой пироксилин . . 30-40 15—20 5—Ю 5-10 5—10 ' <5
Бездымный порох Вье- ля .»•••<»•• 40—50 20-30 \ 10—15 10—15 10-15 5—10 <5
Пироксилин с 15% вла- жности >200 \ \ 70-80 15-20 0—15 . 10—15; 5-10 <5
Черный порох (с 75% селитры и 10% серы) f >200 190—200 100-110 30-40 5—10 <5
Пикриновая кислота плавленная 1 > 200 190 —200 ! 100—110 50-60 < 5
Пикриновая кислота прессованная .... 1 > 200 140—150 80—90 < 5
Прессованный трини- тротолуол i > 200 150—160 80—90 <5
Аммиачная селитра . f > 200
Смесь 95,5% аммиачн. селитры с 4,5% трини- тронафталина .... 1 >200 140—150 70—80 <5
— 794 —
Класс.
Черны порох.
Нитроцеллулоза.
Нитро-соединеиия.
Динамиты.
Аммиачно - селитро-
вые взрывчатые ве-
щества. I
Хлоратные н перхло-
ротные взрывчатые <
вещества.
Таблица чувствительности взрывчаты^ веществ
ЧУВСТВИТЕЛЬ
При падении
2 klgr. | 5 klgr.
Происходит взрыв при
Черный порох.................
Взрывчатая селитра...........
Пироксилин ..................
Колодиониый хлопок...........
Пикриновая кислота...........
Пикрат свинца (обезвожен.) . . .
Тринитрокрезол..........ч^. -
Трииитрокрезилат свинца ....
Триннтробензол ..............
Динитробензол................
Тринитрохлорбензол...........
Тринитротолуол...............
Тринитроанизол ..............
Гексаннтродифениламин........
Тетранитрометиланнлин
Нитроглицерин...............i
i
Гурдинамит..................j
Взрывчатый желатин..........I
Желатинированный динамит . . . j
Донарит.......................
Аммонкаюцит.................I
Фульменит ...................
Аммонал I....................
Шеддит (тип 60J ............!
Лигнознт 4.............*...)
Тетрит.....................I'
свыше 60
60
35
свыше
40
10
60
60
30
60
30
свыше
60
я
п
»
м
40
40
15
5
10
12
40
50
35
60
30
15
20
8
30
8
30
10
40
60
60
60
60
свыше
40
40
»
я
15
15
8
18
30
28
14
40
40
4
ч
— 705 —
еществ
ЕЛЬ
X они и
klgr,
1ЫВ при
35
:ше
40
5
8
30
30
10
40
иле
40
40
о
40
40
15
15
8
18
30
28
14
к механическим и тепловым воздействиям.
H 0 с T b К У Д HP У. Чувствительность к трению (в фарфоровой ступке). Температура вспыш- ки °C.
грузов 10 klgr. падении с в: | 20 klgr. высоты в:
16 10 не чувствителен < 310-315
свыше 24 10 » 305-315
4 « 2 195—200
5 4 я 205—204
20 ю слабый запах гари 300—310
6 2 взрыв 285—287
24 14 очень слабый запах гари 270—276
6 2 взрыв • 255—257
24 16 очень слабый запах гари вспышки не наблюдается.
свыше 24 свыше 16 не чувствителен ।
24 14 я 395—397
. 24 16 я 295-300
,, 24 свыше 16 » 290—296
10 6 запах гари 248-252
8 4 слабое потрескивание 190—194
3 —— - взрыв 200-205
3 1 запах окиси азота 195—200
5 2 взрыв 202—208
3 1 180-190
12 6 не чувствителен вспышки не наблюдается.
16 10 / я „ г *
ю / очень слабый запах 310-315
8 4 не чувствителен вспышки не наблюдается.
7 5 взрыв 258—265
4 / * » 182—186
< .6 — я 298—305
J
i:
Г. j
J 4
i
А'
е
7
йевие
гком-
вают
1аль- '
^емой
ет на
ОТДЕЛ III.
Примеры лабораторного приготовления
некоторые взрывчаты^ веществ.
ГЛАВА I.
Пироксилин, нитроглицерин, динамиты и др.
„ Для лабораторного получения пироксилина вату
‘ "₽e"cw*H- нитруют азотной кислотой, прибавляя к ней серную;
последняя Предназначена для удаления воды из круга взаимодействия
азотной кислоты на клетчатку; в зависимости от крепости кислот, их
отношения к количеству клетчатки и т. п., получаются пироксилины,
содержащие различное количество азота.
Приняв по Вьелю х=4 т. е. С2< Н40 О20, действие азотной кислоты
можно выразить следующими управлениями:
CnH„O2O +12HNO3 = O„H2gO.( 0N02)12 + 12Н2О,
C2iH4002o+ 11NHO3 = Gt2H2eOe(ONOa)u + 11Н20 и т. д.
Лабораторное приготовление пироксилина можно разбить на следующие
пять операций:
1. Подготовка хлопка (в данном случае ваты),
2. приготовление кислотной смеси (азотной и серной),
3, нитрование хлопка,
4. промывка пироксилина и
5. сушка пироксилина. ;
, _ Вата, которая употребляется для приготовления
л рцхлого пироксилина, тщательно перебирается ру-
ками для отделения случайных примесей. Хорошо брать для этой
цели белую гигроскопическую вату.
Вата сушится непрерывно в продолжение 5-ти часов в сушильном
шкафу при температуре около 100°С ; при сушке вата кладется тонким
слоем в фарфоровую чашку или другой открытый сосуд. Охлаждают
высушенную вату в эксикаторе над серной кислотой.
Во время сушки вдты приготовляют кислотную
) риготовление нис- смесь. расчет ведется на 5 гр. ваты. На Охтенском
лотно смеси. пироксилиновом заводе для получения нерастворимого
пироксилина берут смесь, содержащую моногидрата HNO, —21,5°/0 по
весу, моногидрата H2SOt—70,5% по весу и воды 8°/0 по весу; для
растворимого пироксилина 18% моногидрата HNO3, 68"/0 црногидрата
H‘250t и 14% воды. Смеси же берется на заводе 1 килограмм (при
работе с небольшим количеством хлопка можно брать меньше). Рас-
чет кислот производится после определения удельного веса их при
помощи таблиц Удельный вес кислот обыкновенно быстро определяетя
при помощи весов Mohr — Westphals или, менее точно, при помощи
ареометра. , ’
, „ Разрезанная на мелкие кусочки, навескй. ваты
’ (5 грамм) опускается постепенно в стакан, куда на-
лита охлажденная до комнатной температуры кислотная смесь и затем
перемешивается стеклянной палочкой. Вата, напитанная выше ука-
занным количеством кислот, накрывается затем стеклянной пластинкой
и остается стоять в стаканчике: 12 часов—при приготовлении нера-
створимого и 4 часа при приготовлении растворимого пироксилина.
. п После нитрации пироксилин, насколько воз-
' г можно, отжимается от кислот и уже после этого
л*на' подвергается промывке. Сначала промывают холодной
водой в течение % часа. Для этого пироксилин перемещают в большую
стеклянную чашку или стакан и пускают в сосуд с пироксилином из
под крана, при помощи каучуковой трубки, небольшую струю холодной
воды; вода все время меняется, так как к посуде приспосабливается
сифон. Во время промывки рекомендуется помешивать пироксилин
стеклянной палочкой.
После холодной промывки пироксилин отжимается.и промывается
горячей водой. Для этого в колбе или- лучше в. жестяном цилиндре
нагревают воду до кипения и пар при помощи трубки проводится в
стакан или коническую колбу с пироксилином, в которой раньше при-
лито небольшое количество воды. Горячая промывка употребляется
8 раз; 1-я, 7-я и 8-я без всяких примесей, а при 2 ой, 3-й, 4-й, 5-й
и 6 й промывках прибавляется в коническую колбу, где производится
промывка, по 0,2 грамма (расчет на 5 гр. пироксилина) углекислого
аммония. Пропускание пара продолжается за раз«неменее 1% часов;
затем вода выливается из колбы, насыпается, если нужно, 0,2 гр.
углекисло-аммониевой соли, и опять пропускается нар и т. д.
, „ Вода отжимается, на сколько возможно, ручным
’ г прессом (пироксилин кладется между листами про-
пускной бумаги) и сушится в сушильном ш'кафу при температуре не
выше 50°С. Надо сушить не менее 6—8 часов до/ постоянного веса.
Охлаждается в эксикаторе над серной кислотой и взвешивается. Выход
пироксилина при этом обыкновенно получается такой, что из 5 граммов
ваты получается около 8 граммов пироксилина.
§ 2. Нигрогпицерин. (Расчет на 10 гр. глицерина)
С3НБ(0Н)3 + 3HNO3 C.IVONOa), + ЗЯ20;
а) Глицерин СзН5( )Н)3, употребляющийся для приготовления
нитроглицерина, должен быть свободен, по возможности, от вся-
ких примесей. Отсутствие жирных кислот доказывается отс.1ствием
черного осадка от прилития 10%-ного раствора ляписа, (в количестве
равном общему глицерина: берется глицерина не более 2 к. с.); при
чем раствор ставится в темноту на 10 минут. (Допускается количество
минеральных примесей не более 0,1%).
Кальциевые соли (проба—щавелевоаммиачная соль (NHjlaCaO,),
серная кислота и ея соли (проба—хлористый барий ВаС12) и хлористые
соли (проба ляпись AgNO3) совершенно не допускаются в глицерине.
Удельный вес глицерина должен быть близок к 1,26, при 15в(1,
т.-е. содержание воды не более 2—3%. Если же он менее, вследствие
большего содержания воды, то повышение удельного веса достигается
нагреванием до требуемого удельного веса при температуре 130°.
После поверки удельного веса и чистоты глицерина приготов-
ляется смесь азотн «й и серной кислот. Обыкновенно берется на 3 бе-
совых часта азотной кислоты IINCh (удельного веса 1,50} — 5 весовых
частей серной (уд веса 1,83), при чем на 1 часть глицерина требуется
8 частей кислотной смеси: следовательно, при обработке 10 гр. глице-
рина надо 30 гр. азотной кислоты и 50 гр. серной.
Серная кисл’ота вливается тонкой струей в стакан, где находится
азотная кислота, охлажденная снегом или льдом до О°С.; при чем во
все время приливания серной кислоты производится помешивание
смеси стеклянной палочкой. Когда смесь остыла до О°С., то начинается
приливание отвешенного количе тва глицерина из капельной воронки
в стй.кан, который охлаждается снегом или льдом (лучше еще при-
бавить немного соли): приливать надо глицерин по каплям и все время
наблюдать за термометром, чтобы температура была не выше 5°С.
Если же температура поднимается выше, то перестают капать и
отходят от вы1яжн'то шкафа, где производится приготовление нитро-
глицерина, и предупреждают присутствующих об опасности взрыва.
Во все вр--мя качан я смесь надо помешивать стеклянной палочкой.
Когда кончилось капание, надо до тех пор помешивать палочкой,
пока смесь не примет температуру около О"С. Затем всю смесь из
стакана выливают в сосуд с большим количеством холодной воды и
продувают, для лучшей промывки, воздух через нитроглицерин, опу-
стивш!йся на дно сосуда. Затем, когда нитроглицерин отстоится,
повторяют эту операцию, сливши предварительно большее количество
воды сифоном. Поомывка эта производится около 10 раз (пока синяя
лакмусовая бумажка не перестанет краснеть) Затем окончательно про-
мывают Нитроглицерин 1% раствором соды. Потом опять промывают
чистой водой для удаления соды; красная лакмусовая бумажка не
должна синеть и на разделительной воронке отделяют нитроглицерин,
— 890 —
который затем фильтруют; для высушивания на фильтр кладут по-
рошок, предварительно прокаленной измельченной и остуженной по-
варенной соли. Затем, переливают нитроглицерин в маленький ста-
канчик, ставят его в эксикатор, из которого затем выкачивается воздух.
Нельзя, пользоваться эксикатором с серной кислотой, а обязательно—
эксикатором с клористым кальцием. Все сосуды, где могут остаться
капли нитроглицерина, надо мыть неочищенным древесным (СН3ОН,
метиловым) спиртом. Выход нитроглицерина должен быть около двой-
ного веса взятого глицерина.
Рис. 444. Схема усовершенствованного аппарата Шлегеля для пробной нитрации
глицерина.
б) Шлегель сконструировал специальный аппарат для пробной
нитрации глицерина. Новак усовершенствовал этет аппарат в том
отношении, что промывка нитроглицерина производится в самом аппа-
рате. Оба аппарата изготовляются фирмой Ephraim Greiner in Stiitzerbach.
АппаратШпегеля устроен сл. образом. (Рис. 4441). Стеклянный сосуд
большого размера А, которому придана форма овальной воронки,
служит резервуаром для смеси кислот. Сосуд находится в охлади-
тельном баке С, снабженном кранами f и е для внуска и выпуска
охлаждающей воды. Термометр Ъ служит для измерения температуры
внутри сосуда. Доходящая почти до самого дна трубка, а проводит
сжатый воздух. В резервуаре В помещается отвешенное количество
глицерина, который по стеклянной трубке капает в сосуд А. Трубка
С отводит образующиеся во время нитрации газы.
Сначала впускают в сосуд А смесь кнслот и охлаждают ее до
12—15*С. Затем через трубку а вдувают сжатый воздух, который при-
водит смесь в волнообразное движение. В это время впускают гли-
церин тонкой струйкой, наблюдая, чтобы температура не поднималась
выше ЗО’С. Когда весь глицерин влит, дают смеси охладиться до
- 891 -J-
20—2500., а затем прекращают впуск сжатого воздуха. Самый процесс
нитрации занимает не более 10 минут. Как только глицерин отделится
и всплывает наверх, кислоты выпускаются через кран d. Затем нитро-
глицерин в особом сосуде подвергают промывке сначала холодной
водой, потом теплой (40 50®С.) затем теплым содовым раствором 10’Вё
и, наконец, снова холодной водой. После промывки нитроглицерин пере-
ливается в измерительный цилиндр, который после 24 часов отстаивания
показывает число полученных кубических сентиметров нитроглицерина.
Новак усовершенствовал этот аппарат, благодаря чему промывку
можно производить в самом аппарате. Рис. 444н показывает айпарат во
время нитрации; рис. 444шво время промывки нитроглицерина, для чего
воронка О снимается и заменяется трубкой I; к трубке 5 каучуковой
трубкой прикрепляется трубка Ъ., действующая как сифон и служащая
для отвода промывных вод.
Нитроглицерин, полученный в подобных аппаратах, должен безу-
словно уничтожаться. Для этой цели нитроглицерин тонкой струйкой
выливают на слой опилок, наблюдая, чтобы не было местных его скопле-
ний. Затем массу зажигают спичкой и она быстро и безопасно сгорает.
§ з. Динитроглк- По Mikolajczak’y (Deutsche Patentanmeldung 25176
цвр*/Нпип’/Нз)!вН'1 от 15 Августа 1903 г.), динитроглицерин получается
( ‘ следующим образом: 10 весовых частей глицерина уд.
веса 1,262 при охлаждении, смешиваются с 33 вес. частями азотной
кис юты, уд. веса 1,50; лучше всего медленно приливать азотную
кислоту в глицерин, при непрерывном помешивании; сначала обра-
зуется главным образом, мононитроглицерин:
Сз Н5 (ОН)8 +HNOg = Сз Н5 (ОН)8 (ONO2) + Н2О,
который при стоянии смеси в течение нескольких часов (достаточно
два часа), при температуре около + 10° С., переходит в динитроглицерин:
С3 Н5 (ОН)2 (ONO2) + HN0, = С, Н6 (ОН) (ONO2)2 + Н2О.
После окончания нитрации разбавляют смесь 10 ю весовыми частями
холодной воды, нейтрализуют порошкообразным углекислым кальцием
(лучше всего известковым шпатом) до тех пор, пока жидкость не примет
удельного веса 1,58; тогда динитроглицерин всплывает, его отделяют
при помощи разделительной вор-нки, промывают слабым раствором
соды до щелочной реакции, затем чистой водой до нейтральной
реакции и сушат в эксикаторе над хлористым кальцием.
По другому способу глицерин при 18° — 20° С. нйтруется 4 — 7
весов, частями кислотной смеси, которая в 100 весовых частях содержит
8—12 вес. частей воды, 60—70 вес. частей моногидрата серной кислоты
HjSCh и 15—32 вес. части моногидрата азотной кислоты HNOS.
Но Eskales'y (Die Explosivstoffe, drittes Hef) ди нитроглицерин полу-
чается следующими методами.
Пример: 100 грамм г глицерина постепенно при помешивании,
вливают в 500 гр. смеси: 10% Н20 -|- 22,5% HN03-|- 67,5% H2SO4,
наблюдая, чтобы температура была 18—20° С.; маслянистой жидкости
7“
«7
или совсем не-выделяется, или очень малое количество; в последнем
случае эго исключительно нитроглицерин (тринитроглицерин); по
отделении масла, кислотная смесь, в которой находится динитрогли-
церин, разбавляется водой; воды берется в 10 раз более по об'ему,
чем кислотной смеси; при таком разведения водой, кислоты не
действуют на экстрактирующее вещество.
После разведения водой извлекают динитроглицерин эфиром
и этот экстракт нейтрализуют углекислым кальцием; по‘-ле отгонки
эфира динитроглицерин представляет маслооб азную жидкость светло-
желтого цвета удельного веса около 1,5, лишь со следами тринитро-
глицерина. Можно также поступать иначе, а именно раствор
динигроглицерина нейтрализуют углекистым кальцием; выделившийся
сульфат CaSiU отфильтровывают на фарфоровой вор <нке Бюхнера;
нейтральный раствор извлекают эфиром и перегоняют под умень-
шенным давлением. Выход д нитроглицерина около 60% теоретического
т. е. из расчета по уравнению;
'Сз Н5 (ОН)3 + 2HN0, = С3 Щ (ОН) (ONO2)2 4- 2Н2О
Можно брать и другие количества кислотной смеси, например,
следующего состава (расчет на 100 грамм глицерина): 400 гр. кислотной
смеси состава:
8% Н2 0 + 30,7% HN03 4- 61,3% Н2 S04,
700 гр. кислотной смеси' состава:
12®/0 Н2О 4- 17,6% HN0, + 70,4% H2SO4.
Извлечение двунитроглицерина эфиром можно заменить хлоро-
формом, бензолом или бензином.
Will предложил несколько иной способ получения (1 мая 1904 г.
патент D. R. Р. 175751) динитроглицерина: сначала получается
нитроглицерин (тринитроглицерин)—100 гр. нитроглицерина разме-
шивают с 1000 гр. серной кислоты, содержащей 70% моногидрита
HgSO*. пока не получится прозрачный, или почти прозрачный, раствор.
Процесс раств зрения идет без заметного вы шления продуктов разложе-
ния (без выделения бурых паров). Нераствориншийся три нитроглице-
рин отделяется и прозрачный раствор после достаточного охлаждения
вливается в 4—5 литров холодной воды, затем извлекают эфиром,
нейтрализуют и отгоняют эфир.
'Кроме вышеизложенного Escales и Novak дали очень удобный
способ лабораторного пр шотовления динитроглицерииа: 92 гр. гли-
церина, удегьного веса 1,26, смешиваются с 200 гр. серн'й кислоты
уд. веса 1,84, причем смесь охлаждается до 15 —20® С.; затем, при-
ливается, при охлажтении до 30° С., азотная кислота, удельного веса
1,48 в количестве 150 гр.; по окончании нитрации охтаждают смесь
до 20° и оставляют смесь стоять, пока она, мед ленно нагреваясь, не
примет температуру 30—35*; тогда вливают в воду, взятую в двойном
или тройном об‘еме; из раствора извлекают динитроглицерин эфиром
или другим растворителем (хлороформом, бензолом или бензином)
§ 4. МоноупорДИНИ" гч ту //лхтлч \
троглицерин. vHUlNUgh-
Исходным материалом служит хлоргидрин (монохлоргидрин)
СзН5С1(ОН)2, представляющий не полный сложный эфир глицерина
и соляной кислоты.
Ниже приводятся три способа получения хлоргидрина. Первые
два способа предложенные Deutschen Sprengstoff- Actien Gesellschaft
(D. В P. 180668).
1-й способ 100 гр. глицерина смешиваются при обыкновенной
температуре с 150 гр. соляной кислоты уд. веса 1 80—1.90 и нагрева-
ются в автоклаве (причем дгетаточво 1 атм. давления), в течение
15 часов; полученный продукт фракционируют при уменьшенном
давлении 12—15 мм.; сначала nejеговяется вода вместе с соляной
кислотой, затем, при 130- 150° С., перегоняется монохлоргндрин
и под-конец, при 165 — 180°, неизмененный глицерин; когда моно-
хлорги ;рин применяется для целей техники взрывчатых веществ,
то обыкновенно глицерин не отгоняется (обыкновенно остается глице-
рина 25*/в).
2 й способ: (французский патент 370224) Глицерин при обыкно-
венной температуре смешивается срасчитанным по формулам С,Н2
(0Н)3 и S, С12 количе твоя хлористой серы, которая получается следую-
щим образом: получают обычным способом хлор:
МпО2 + 4НС1 = МпС12 + 2 П2О + С12
и струю хлора, высушенного серной кислотой пропускают в реторту,
в которой нагревается сера, немного выше температуры плавления;
образующееся соединение S2 + Cl2 = S2tl2 при этом перегоняется в
приемнике (шар с двумя тубулусами), который охлаждается водой,
вместе с хлористой серой, при этом перегоняется и часть серы. Если
полученный перегон вновь насытить хлором, то серы не останется,
а получится чистая S2 С12 — хлористая сера, которая представляет
бу ровато желтую жидкость удельного веса 1,4 при 0° и кипяшую при
144® С. Эта жидкость сильно дымит на воздухе (Основы химии
Д. Менделеева стр. 346).
Затем смешивают хлористую серу с глицерином, при чем наблю-
дают, чтобы температура смеси была в пределах 40°—50°С. Этим спо-
собом удается сразу перевести в многохлоргидрин от 80—90% взятого
глиЦ'рина. Далее поступают, как и в первом способе.
3 й способ выработан Westfalisch Anhaltischen Sprengstoff Act. Ges.
Пропускают хлористый вод» род через глицерин, гагретьй от 70 до Ю0°
по окончании (что узнается взвешиванием), перегоняют под умень-
шенным давленьем, как и в первом способе.
При «том способе, главным образом, получается а — монохлор-
гидрин СН2 Cl— CH (OHj—СН2 ОН и небольшое лишь количество
хлоргидрина
СН2 0Н-СНС1-СН2 ОН.^
По F. Boewer’y (Zeitsch far das Schiess und Spengstoffwesen I, S. 22)
монохлоргидрин нитруют смесью азотной и серной кислоты так же,
как при получении тринитроглицерина из глицерина; после нитрации
образующийся монохлординитроглицерин после стояния быстро и хо-
рошо отделяется от кислотной смеси; постоянство продукта легко до-
стигается промывкой слабо щелочной водой.
§ 5. Динамиты. а) Динамиты с недеятельным основанием.
Приготовление кизельгур динамита Нобеля (три сорта). Этот динамит
получается поглощением нитроглицерина кизельгуром.
Надо прежде всего кизельгур прокалить в фарфоровом тигле до
красного калеаия; прокаливание производится до постоянного веса.
Остывший в эксикаторе над серной кислотой кизельгур измель-
чается в фгрф провой ступке и просеивается через сито с отверстием
в 1,5—2 мм. Затем берут чистую соду, прокаливают в тигле до по-
стоянного веса, измельчают в фарфоровой ступке и тоже просеивают
через сито с отверстиями 1,5—2 ми. В ступке насыпают 24,5 гр. ки-
зельгура и 0,5 гр соды, хорошенько перетирают пестиком и посте-
пенно приливают 75 гр. нитроглицерина. Перемешивают стеклянной
палочкой и протирают руками в каучуковых перчатках через оловя-
ное сито с отверстиями в 3 мм. Так получается 1-й сорт;
Надо взять для 2-го сорта:
нитроглицерина .... 50 грм.
кизельгура.....• . 49,5 „
соды .......... 0,5 „
Для 3-го сорта:
нитроглицерина .... 35 грм.
кизельгура.............64,5 „
соды . . . •.......... 0,5 „
б) Динамиты с оеятельным основанием.
«• Пригвтовление Калийная селитра KNOS, измельченная в порошок,
дииамга Нобеля высушивается до постоянного веса при 100°, точно
так же измельченный древесный уголь сушится при
100° С. Затем селитра и уголь отдельно .просеиваются через сито с
1*/2—2 мм. отверстиями; отвешивают калийной селитры 71 гр. и
угля 10 гр ; отвешенные вещества насыпаются в фарфоровую ступку
и тщательно перемешиваются с 1 гр. порошкообразного парафина.
Затем в ступку к смеси постепенно приливается 18 гр. нитроглице-
рина, и все тщательно перемешивается и затем руками, в каучуко-
вых перчатках, протирается через оловянное сито с 3 мм. отверстиями.
2. Пряготовлмяе Отвешивается 9,6 гр. колодионного хлопка, воз-
греиучвго студня. можно лучше измельченного и высушенного сначала
при 40°, а потом над хлористым кальцием или серной кислотой до
постоянного веса (в эксикаторе). В ступку кладут 4 гр. камфоры и
тщательно растирают пестиком хлойок с камфорой затем смесь
кладут в фарфоровую чашку, которую нагревают осторожно на во-
дяной бане до 7О*С. К смеси приливают постепенно 86,4 гр. нитро-
глицерина и при нагревании смеси не выше 70 , размешивают стек-
лянной палочкой, пока смесь не примет однообразный вид, для чего
нужно несколько часов.
Динитро-ацетин С3Н5(ОКО2)а(ОСОСНз).
Исходным продуктом служит моноацетин
Дмнитро*ацетин.
С8Н5(ОН)2 (О.СОСНз), который получается, по Berthelot, нагрева-
нием одинаковых об‘емов ледяной уксусной кислотыи глице-
рина в течение 114 часов, при 100° С. Для отделения от обра-
зующихся диацетина и триацетина обрабатывается смесь рав-
ным об'емом воды и несколько раз взбалтывается с небольшими
количествами бензола; после того, как взбалтыванием с бензолом
удален-триацетин, обрабатывается эфиром; эфирный экстракт вы-
паривается на водяной бане и остаток перегоняется под умень-
шенным давлением; моноацетин перегоняется по Geitel’to при
2—3 мм. давления, при 130—132° С , в виде густой жидкости,
у (ельного веса при 15°С., 1,2212 (Geitel, Journal fiir praktische
Ghemie, (2) 57, 117 и 118).
40 частей моноацетина приливается постепенно к смеси 100
частей азотной кислоты, удельного веса 1,513 и 25 частей серной
кислоты, с содержанием 25% S03; при этом кислотная смесь
охлаждается до 25°; ио окончании нитрации вливают смесь в
ледяную воду и промывают сначала холодной водой и затем
слабым нагретым до 70’ раствором соды. При этом получается
выход около 95% теоретического: '
,СзН5(0Н)2(0С00Нз + 2HNOS =
C8H5(ONO2)8(OCOCH8) + 2Н20.
Динитроформин Динитроформин C3H5(0N02)(0CH0).
динитроформин. Получается по Vender’y (R. Escales, Die Explo
sivstoffe, Drittes Heft, S. 192) способом, аналогичным получению
динитроцетина.
Смесь главных количеств глицерина и безводной щавелевой
кислоты сначала нагревается до 100°, затем, 20 часов при 140—
150° и затем нитруется смесью азотной и серной кислоты (также
приготовленной, как и для нитрования динитроацетина); полу-
ченный продукт промывают водой и затем, слабым раствором соды,
при чем лишь получается 30% динитроформина и 70% трини-
троглицерина.
I
Такая смесь пригодна для технического употребления, как
трудно замерзающая, почти не уступает силе тринитроглицерину,
мало чувствительна к ударам и толчкам.
— 896 —
Тетранитроди гл и церин
Тетранитро-
диглицерин.
i
— - MW**
ПЯКММг*
i
! -1*
h
IT5
8
j ;
►> ;
CSH5(ONO2)2
СзН5(ОМО2)2
• Исходным продуктом служит диглицерин (пироглицерин)
С.Н,(ОН)2. „ л т
л’и пп > О» который был получен из глицерина Lourenzo
G8rj.5((Jn.)2
(Analt-s de chimie et de phisique (3) 67, 300).
Образование его можно проще все о представить следую-
щим уравнением: 2СзН6(ОН)зв Н2О + [С3Н5(0Н)2]20.
Приведем два способа Escales’a:
1-й способ Escales и Novofc'a (немецкий патент 12 мая 19о6 г.)
1 часть глицерина смешивается с %— ’/& весок, ч. воды (или
лучше соляной кислоты, не более ’Д вес. части) и затем, при
нагревании до 100”, пропускается в течение нескольких часов
струя хлористого водорода, пока не будет более поглощ- ния
газа; по прекращении пропускания х юристого водорода приба-
вляется к смеси равная ио весу часть глицерина и все нагре-
вается в колбе с обратным холодильником в течение 20—24 ча-
сов на водяной бане, т.-е при J00®.
2-й способ Escales‘a Глицерин, без разбавления водой при
100° насыщают хлористым водородом (пока взвешивание не ука-
жет больше привеса! и затем на> ревают при 150°. При такой
конденсации всегда, кроме диглицерива и неизменного глице-
рина, получается монохлоргидрин, дихлоргидрин, хлоргидрин,
диглицерин, триглицерин и хлоргидрин Tpi глицерина.
Обыкновенно полученную смесь прямо нитруют, как нитру-
ют чистый глицерин, так как азотные эфиры этих побочных
продуктов, в особенности различные нитрохлоргидрины, облада-
ют низкий температурой замерзания.
Если желают получить чистый диглицерин, то лучше всего,
по Will и Stohrer’y, (Z itsch. f. d. Schiess. und Sprengstoffwesen,
I. S. 231), глицерин нагревают 7—8 часов при 290 295°, причем
нагревание производится так, чтобы вола могла отгоняться, а
высококипящие продукты стекали бы обратно. При этом полу-
чается 6о®/0 диглицерина и, в зависимости от нагревания, 4 6°/ф
триглицерина и др. продуктов конденсации, остальное—неизмен-
ный глицерин.
При перегонке под уменьшенным давлением 8—10 мм., гли-
церин перегоняется при 160—220®, а продукты конденсации при
220—270"; после нескольких перегонок под уменьшенным давле-
нием можно получить чистый диглицерин, который при 8 мм.
давления, перегоняется без разложения при 240—250° С.
j
. i
„ . u Нитромаяит СлН</ОН)в + 6НМОз=
§ б. Нитроманнит. P C6Hg(ON(•,), + 6H,0.
(Рассчет на 10 gr маннита).
Маннит CeHg(OH)t должен быть, по возможности, чистым
что поверяется определением температуры плавления.
л
!<
?'!ih
£
Перед определением точки плавления, измельченный в тонкий
порошок маннит сушится при температуре около 100° в течение
5 часов и остуживается в эксикаторе над серной кислотой.
Химически чистый маннит плавится по Фавру и Ландольту
при 166°. Продажный маннит, с температурой плавления 160—165»,
допускается для приготовления нитроманнита.
Определение температуры плавления производится следую-
щим образом: маннит при помощи маленькой ступки, растирается
в тонкий порошок и насыпается в стеклянный капилляр, при
чем высота слоя насыпанного вещества в трубочке не должна
лать 2 мм. Капилляр прикрепляется (при помощи отрезка
; |ювой проволочки или каучуковой трубки) к термометру
' ^обы середина слоя вещества в капилляре находилась про-
^ередины шарика термометра; в наружную колбу особого при-
\5бра наливается крепкая и чистая серная кислота; термометр с
прикрепленным к нему капилляром, при помощи пробки вста-
вляется во внутреннюю воздушную баню. Нагревается прибор
возможно маленьким пламенем бунзеновой горелки так, чтобы
пламя не касалось стекла прибора.
Если знают приблизительно температуру плавления веще-
ства, напр. для маннита не ниже 160°, то, ве доходя до предпо-
лагаемой температуры градусов на 10, быстрЬ нагревают, а уже
затем—постепенно и наблюдают состояние вещества при каждом
. градусе: для этого, ставя в сторону горелку, дают ртути под-
няться до остановки и т. д. пока вещество не расплавится. Если
вещество не чисто, то начало плавления будет на несколько
градусов ниже окончательного плавления всего вещества. Перед
нагреванием не забывать поворачивать притертую пробку при-
бора так, чтобы растилающийся воздух мог свободно выходить
из колбы. По охлаждении прибора надо завернуть так притертую
пробку, чтобы влажность не могла попадать в колбочку, содер-
жащую серную кислоту.
Кроме вышеописанного прибора, часто пользуются более про-
стыми, в которых нет внутренней пробирки, а прямо термометр
опускается в серную кислоту; в этих приборах можно не при-
креплять капилляр каучуком или" проволокой, а смочивши сер-
ной кислотой, приложить капилляр: он будет держаться от сма-
чивания серной кислотой.
Отвешенное количеетво маннита (10 гр.) растирается в сухой
фарфоровой ступке и затем понемногу приливают 100 гр. охлаж-
денной до 0° чистой азотной кислоты HNOS. удельного веса 1,52.
Во все время приливания растирают пестиком маннит в кислоте;
полученная смесь выливается в стакан, охлажденный льдом или
снегом. Затем ступка ополаскивается 100 граммами охлажденной
до 0°С. серной кислоты H2SO4, удельного веса 1.82 и постепенно
при помешивании стеклянной палочкой выливается в стакан со
смесью маннита и азотной кислоты. Обращать большое внимание
на тщательное охлаждение, так при недостаточном охлаждении,
могут выделяться краснобурые пары окислов азота и, вместо
нитроманнита, получаются продукты его окисления.
Проф. М. Сухаревский. Взрывчатые вещества и взрывные работы, 57
4^; Ч;
к
,л
V
'-.ic
if V
5^74 / ’ ">г-
g?T
- ?
41
I ?
1.1 4
' 1 V
' 1'7
it
i. J
1
<'У:
<
ЗЖ'
898 —
тотчас
по прилитии
Нитроманнит начинает выделяться
серной кислоты в виде творожистой белой массы. После прили-
тия серной кислоты, помешивают смесь стеклянной палочкой до
охлаждения смеси около о» и затем выливают содержимое ста-
кана в сосуд с большим количеством охлажденной до 0* воды;
дают отстояться нитроманниту и сверху, йри помощи сифона,
сливают воду с растворенной в ней кислотной смесью, затем еще
раза три проделывают эту операцию, прибавляя каждый раз све-
жей воды. Затем фильтруют при употреблении водяного насоса
и фарфоровой воронки.
По величине плоского круглого дна фаровой воронки выре -
зывается такой же величины круглый бумажный фильтр, что быт
лишь он прикрывал все те мелкие отверстия, которые имеются
на плоском дне воронки; фильтр предварительно смачивают во-
дой и прижимают; затем наливают жидкость и тубулус кониче-
ской колбы соединяется каучуковым шлангом с водяным насо-
сом. Чтобы фильтр не прорвало, надо следить за тем, чтобы не
было такого момента, когда нет жидкости над фильтром. На во-
ронке нитромавнит промывается раз холодной водой, затем одно-
процентным раствором соды Na2COs и опять водой, пока краевая
лакмусовая бумажка не перестанет синеть.
Выход около 21*/2 грамма. Сырой еще нитроманнит раство-
ряют в возможно малом количестве нагретого почти до кипения
винного спирта С2Н5ОН и оставляют прозрачный раствор охлаж-
/
L
г.
i
i
v
даться. Выделившийся нитроманнит отфильтровывают, пользуясь, Г4’’ V.-
как раньше, фарфоровой воронкой и насосом. Затем кладут в \ 1
фарфоровую чашечку и сушат при 70’ до постоянного веса и \ (
охлаждают в эксикаторе.
Сырой, т.-е. неочищенный нитроманнит плавится около
100’С. Очищенный перекристаллизацией из спирта — плавится
при 112 —ИЗ’С. без малейших признаков разложения. Удельный
вес кристаллического нитроманнита при 0° С. равен 1,604; уд.
вес расплавленного и отвердевшего — около 1,5 [1,446; 1,503 и
1,537] при о’. Прессованием можно увеличить уд. вес до 1,806.
§ 7. Нитрокра^малы.
(Die Schiessbaumwolle, Dr. R. Escales 1905 r.
стр. 270).
1-й способ. 5 гр. тонко измельченного, высу-
шенного при 20°С. крахмала растворяется, при поме-
шивании и при сильном охлаждении (смесью снега с солью), в 60 гр.
крепкой азотной кислоты удельного веса 1,5 и затем прибавляется
40 гр. крепкой серной кислоты уд. веса 1,83. Во время приливания
. серной кислоты надо хорошо размешивать. После охлаждения все вы-
ливается в избыток ледяной воды; отстаивается нитрокрахмал, кото-
рый промывается чистой водой до нейтральной реакции.
Получается 6,61—6,73 гр. нитрокрахмала; полученный продукт-
обрабатывался избытком 96 <> спирта, причем часть не растворяется
и таким образом удается получить два изомера.
Тетранитрокрагсмап.
<nHie(O6ONO2)4.
i *\
V ч
7
m;
4
> ।
¥
— 899 —
2-й способ. 20 гр. высушенного при 100° до постоянного веса крах-
мала вносятся, при помешивании при 20—25е, в 200 гр. азотной кислоты,
уд. веса 1,501 и оставлятюся стоять 50 часов. Полученный желтый прозрач-
ный раствор, в количестве 100 гр., выливается, при помешивании в тече-
ние двух минут, в смесь, состоящую из: 108 гр. азотной кислоты, уд. веса
1,59, 737 гр. серной кислоты, уд. веса 1.829 и 155 гр. воды. После
15 минут все выливается в ледяную воду и в течение у2 часа отстаи-
вается, затем отфильтровывается, промывается чистой водой и высу-
шивается.
5-й способ. 40 грамм высушенного при 100° крахмала, при обык-
новенной температуре растворяется в 400 граммах азотной кислоты,
удельного веса 1,501; несколько дней раствор стоит, затем выливается
в холодную воду, промывается слабым раствором соды и высушивается.
. При всех этих трех способах получения, нитрокрахмал сушится
после промывания чистой водой в эксикаторе над серной кислотой до
постоянного веса; для скорости высушивания лучше выкачивать воздух
из эксикатора.
ГЛАВА II.
Тол, тетрил, пикриновая кислота, пикраты, тринитронафталин.
1-й способ. В плоскодонную колбу, емкостью в
иротолуоп (. on). 2 фунта, навешивалось 150 jp. крепкой серной
кислоты HoS04 и туда же вливалось 100 гр. азотной кислоты, 40°В. Так
как при смешении происходит разогревание, то дают смеси остыть;
затем вводится толуол в количестве 50 грамм, небольшими порциями;
при этом температура содержимого колбы повышается; следует вести,
процесс так, чтобы температура поднималась не выше 80—90®С., после
каждого приливания толуола смесь хорошо взбалтывается.
При вышеупомянутых условиях эта операция требует '/2 часа
времени.
Когда весь толуол прилит, то дают смеси этой стоять в течение
двух часов при температуре 80—90°С., для чего колба нагревается на
водяной бане.
Мононитротолуол собирается в виде масла на поверхности кис-
лотной смеси. Содержимое колбы выливается в воду, которой по об'ему
берется в три раза больше; тогда нитротолуол собирается на дне в
виде густого желтоватого масла, которое отделяется на разделительной
воронке, несколько раз промывается чистой водой и может служить
для дальнейшей переработки в динитросоединение.
Из 50 гр. толуола получалось около 75 гр. мононитротолуола.
Для переработки нитротолуола в динитропроизводное, полученные
75 гр. нитросоединения нагревают в колбе до 65"С., и к нему при-
ливается постепенно смесь 60 гр. крепкой азотной кислоты с 91 ’<>
моногидрата HNO, и 120 гр. крепкой серной кислоты с «5 о моно-
гидрата H2SOt, причем колба все время взбалтывается; когда вся кис-
лотная смесь будет введена, колба нагревается на водяной бане в
течение одного часа при 90°С. и изредка взбалтывается.
57*
По остывании смеси, динитросоединение выкристаллизовывается
на поверхности кислот; твердое тело отжимается от кислот на воронке
Бюхнера и идет на дальнейшую переработку.
Из 75 гр. нитротолуола получается около 100 гр. динитротолуола
с температурой плавления около 67°С. Полученное динитропроизводное
в количестве 100 гр. растворяется при 45—50’0. в 400 гр. крепкой
серной кислоты и затем туда же вливается 200 гр. крепкой азотной
кислоты с 91% моногидрата HNOS; смесь тщательно перемешивается,
при нагревании до 95’0., пока не прекратится выделение бурых паров
окислов азота, для чего требуется около 4 часов времени, после чего
смесь при остывании выделяет на поверхности кристаллический тро-
тил, который отжимается от кислот на воронке Бюхтера, промывается
сначала горячей водой (50 —60’0.) и слабым раствором углекислого
аммония (0,05’С); затем промывают еще холодной водой и высуши-
вают при 60° и до постоянного веса—в эксикаторе. Температура пла-
вления полученного таким способом тротила 72—77’0. Выход тротила
ок. 120 гр.
2-й способ. Этот способ, дает очень хорошие результаты и удобен
как для лабораторного получения, так и для фабрикации в больших
количествах.
Приготовление динитротолуола. Триста грамм серной кислоты с
95% моногидрата, HgSO, смешивается с 200 гр. крепкой азотной кис-
лоты с 91% моногидрата HNO3; при смешении температура подни-
мается и поэтому дают остыть; над сосудом устанавливается стеклянная
воронка с краном, где поме щается сто грамм толуола, который посте-
пенно вливается в смесь г’слот в течение двух часов; при смешении
толуола с кислотами происходит энергичная реакция с повышением
температуры, при чем надо стараться, чтобы температура не была
выше 9о*С.
Когда толуол вводится в смесь кислот, то для перемешивания
туда же продувается воздух, высушенный пропусканием через серную
кислоту.
После окончания вливания толуола в смесь кислот, в течение
одного часа продувают сухой воздух. После охлаждения динитротолуол
кристаллизуется на поверхности кислот; его отжимают и пускают в
дальнейшую переработку.
Выход динитротолуола—около 200 граммов, с температурой плав-
ления около 67°C.
Переработка динитротолуола в тротил-, в тот же сосуд помещают
100 грамм динитротолуола и 400 грамм крепкой серной кислоты с
95°/0 моногидрата H2SO4 и нагревается до 40—50’0.; когда весь ди-
нитротолуол растворится, то приливается 200 гр. азотной кислоты с
91% моногидрата HNO3; затем вся сМесь нагревается до 95’0. и изредка
продувается сухим воздухом для перемешивания.
Когда окончится выделение бурых паров окислов азота, то пе-
рестают нагревать, и, по охлаждении, выкристаллизовывается тротил,
который отжимается от кислот, промывается сначала горячей водой
(60 — 70’0.), затем, слабой щелочью (например, 0,05% углекислого
аммония),—опять водой, но холодной и высушивается до постоянного
веса при 70’0.
хав-
ают
бен
них
сис-
;шь
ная
чте-
нии
ием
ыла
пе-
'ИЛ,
дой
[ОГО
[ОГО
ди-
I С
дка
НИЯ
1ую
ние
уол
тся
нке
f
— 901 —
ола
;ное
кой
ной
гея,
ров
гего
гро-
ггся
юго
СПИ-
гла-
ила
Получается при этом, обыкновенно, тротил с т. плавления 77®С.;
но по данным А. Солонина Федорову удавалось, при вышеуказанных
условиях, иногда получать тротил с температурой плавления и 800.
Вообще же можно поднять температуру с 67® до вХ’/г* для тротила,
выкристаллизовывая его из горячего спирта.
„ „ _ Тетрил был впервые получен в 1883 году Rom-
§ . етранитромети- (Recueil des travaux chim. de Pays Bas
' K 2,108) действием смеси азотной и серной кислот,
как на метиланилин, так и на диметиланилин. Впоследствии появился
еще целый ряд других способов получения тетрила. 20 гр. диме-
тиланилина приливают постепенно, по каплям к 200 гр. серной ки-
слоты удельного веса 1,84, при чем колба охлаждается водой. После
остывания, полученный сулъфодиметиланилин по каплям приливают
к 400 гр. дымящейся азотной кислоты, удельного веса 1,48 при поме-
шивании палочкой и сильном охлаждении смесью льда с солью.
Получается темнокоричневая жидкость, ее оставляют стоять до
следующего дня, затем нагревают до 60° С. на водяной бане до
окончания выделения окислов азота в течение пяти—шести часов.
Когда смесь остынет, то ее выливают в избыток холодной воды
со льдом; полученное твердое тело \ промывают водой и отсасывают
на воронке Бюхнера. Для очищения выкристаллизовывают из ацетона
Температура плавления 127°.
Пикриновая кислота. ‘
С. Н5 (ОН) + 3HNOS = С6 Н2 (NO2), ОН 4- ЗН2О.
Фенол, Св Н5 (ОН), должен быть, по возможности, чис-
тым и не должен быть жидким, так как в последнем случае он
содержит много воды.
Химически чистый фенол плавится при 42,5®—43® С. по Behal‘ю;
кипит при 180—185° по Hamberg‘y. Продажный прозрачный кристал-
лический фенол годится для получения пикриновой кислоты.
К 100 гр. фенола приливают осторожно 100 гр. концентриро-
ванной серной кислоты; смешение производят в сосуде с притертой
пробкой и после прилития серной кислоты взбалтывают несколько
раз смесь и затем дают ей стоять до тех пор, пока проба смеси,
разбавленная водой, не дает осадка фенола, так как фенол раство-
ряется труднее сульфофеноловой кислоты; в колбу наливается 300 гр.
азотной кислоты (уд. в. 1,4) и начинают из капельной воронки по-
немногу капать сульфеноловую смесь и по временам взбалтывают
колбу; при этом нитровании выделяются краснобурые пары окислов
азота, которые отводятся при помощи трубки в отверстие тяги.
Затем смесь нагревают в продолжение 1 — 2 часов на водяной
бане, пока еще заметно действие азотной кислоты. Жидкость теряет
свой первоначальный темный цвет и окрашивается в желтый.4
Если, как это иногда бывает, отдели ется темножелтое масло,
состоящее, главным образом, из динитрофенола, То для окончательного
превращения динитрофенола в пикриновую кислоту, надо выпарить
3. Пикрино-
вая кислота*).
*) Способы лабораторного приготовления взрывчатых веществ заимствованы
главным образом у А, Солонины.
на песочной бане смесь, до 2/з об'ема и вновь заменить дымящейся
азотной кислотой убыль жидкости.
Жидкость опять нагревают на водяной бане до тех пор, пока
проба смеси, будучи разбавлена холодной водой, не выделит желтых
кристаллов, растворяющихся в чистой кипящей воде без мути
и следов масла. Наконец, через еще горячую смесь, продувают
воздух; для этой цели опускают стеклянную трубку в смесь и, соеди-
нивши эту трубку с каучуковым шаром или мехом, продувают воздух
до тех пор, пока перестанут выделяться краснобурые пары окислов
азота. Смесь и» колбы выливается в избыток холодной воды, которую
через некоторое время, когда пикриновая кислота осядет, при помощи
сифона сливают и заменяют свежей.
При помощи фарфоровой воронки и водяного насоса фильтруют
пикриновую кислоту и, растворивши при нагревании в небольшом
количестве воды (20 ч. воды на 1 ч. кислоты), оставляют пикриновую
кислоту выкристаллизовываться.
Выкристаллизовавшуюся пикриновую кислоту фильтруют опять
при помощи фарфоровой воронки и водяного насоса и сушат на
часовом стекле пли в фарфоровой чашке при температуре 35° С. до
постоянного веса. Охлаждают в эксикаторе и затем взвешивают.
о . _ Известно несколько способов получения пикратов;
§ . икраты. мы иа них рассмотрим два главных: 1-й способ—полу-
чение пикратов из пикриновой кислоты и солей металлов, 2-й спо-
соб-получение пикратов из пикратов, полученных по первому спо-
собу и солей металлов.
1-й способ: Получение пикратов калия, натрия, бария, стронция
и магния производится, в сущности, одинаково: в стаканчике дово-
дится вода до кипения и в ней растворяется пикриновая кислота
(на 20 ч. воды—1 ч. пикриновой кислоты по весу). К горячему
раствору прибавляют углекислые соли соответствующих металлов.
Количество углекислых солей расчитывается по теории. На
каждую частицу поташа. K,COS, соды Л7а2СО3 и углекислых: бария
ВаСО3, стронция SrCOa и кальция СаСОз надо по 2 частицы пикри-
новой кислоты; это видно из указания состава пикратов.
. Св Н2 (N0a)3 ОК;
Cs Н2 (N0s)3 ONa; [О, Н2 (NO2)3 0]2 Ва. 5Н2О.
Пикрат бария содержит 5 частиц воды после высушивания до
постоянного веса при 50° и теряет большую часть воды при вы-
сушивании при 100—120°.
[Св Н2 (N02)s 0]2 Sr.5H2 0;
[C6H2(N0,)30]2Ca.5H20;
[C.H2(N01)sO]1Mg.8H1O.
Зная атомные веса элементов (С =12; N = 14; 0=16; Na=23;
Mg = 24; К = 39; Са = 40; Sr=88; Ba = 137), легко вычислить весовые
[ейся
пока
штых
мути
гвают
оеди-
оздух
1СЛОВ
горую
мощи
груют
ЫНОМ
говую
опять
гт на
С. до
ратов;
-полу-
1 спо-
г спо-
юнция
дово-
и'елота
>ячему
юв.
/и. На
бария
пикри-
-отношения; вапр. ва 10 гр. пикривовой кислоты 2С6Н2 (N02)30H
(вес частицы 2.(12.6-}-2-f-46.3-]- 17)=458) надо взять безводной соды
Na2CO„, [вес частицы 23.2+12 + 16.3=106 всего, 4^у°~ок' 2% ГР-
(2.3)].
После прибавления указанного количества углекислых солей,
доводят жидкость до кипения и помешивают стеклянной палочкой;
затем еще прибавляют одну—две крупинки углекислой соли и смотрят,—
выделяется углекислота или нет. В последнем случае фильтруют
горячий раствор при/ помощи воронки и водяною насоса; профиль-
трованный раствор оставляется кристаллизоваться на сутки, или
более,—в зависимости от выпавшего осадка. Затем пикраты отфильтро-
вывают опять при помощи фарфоровой воронки и водяного насоса
и раскладываются после отсасывания насосом маточного раствора, на
часовом стекле или чашечке и сушатся до постоянного веса при
температуре не выше 50°.
Пикрат аммония можно также бы было готовить, исходя из
углекислого аммония, но проше—к раствору в горячей воде пикри-
новой кислоты прибавит нашатырного спирта; прибавляется столько
нашатырного спирта, . чтобы после 10 мин. кипения раствора он еще
выделял бы пары аммиака; проба—красной лакмусовой бумажкой.
Затем раствор фильтруется и т. д., как и раньше.
[ИЯ до
ри вы*
Расчет ведется для пикрата аммония по формуле:
С6 Н2 (NO2)3 ОН + NH3 = С6Н2 (К О2)з 0NH.,
но, конечно, надо предварительно определять крепость нашатырного
спирта ареометром и затем определяют процентное количество амми-
ака по таблицам.
2-й способ: Получение пикратов железа Fe, ртути—Hg, цинка—
Zn и меди - Си.
К раствору пикрата бария (1 ч. безводного в 85 ч. воды), на-
гретого почти до кипения, прибавляется насыщенный при обыкновен-
ной температуре раствор сернокислых солей железа, или цинка, или
ртути, или меди, тоже нагретых почти до кипения. Еще горячий
раствор профильтровывают для удаления осевшего сернокислого
бария при помощи фарфоровой воронки и водяного насоса; при
получении пикрата ртути необходимо особенно быстро фильтровать,
так как в холодной воде пикрлт ртути мало растворим (1 ч. пикрата
ртути растворима лишь всего в 1200 ч. воды на Холоду).
С профильтрованным раствором поступают, как указано раньше
при пикратах калия и т. д.
Ча= 23;
весовые
о - т Тринитрокрезол. C6H(CH3)(NO2)3OH.
§ 5. Тринитрокрезол. СвН4(СН3)ОН+ЗНКОз = СвН(ОНз)(КО2)3ОН+ЗН2О.
Для приготовления тринитрокрезола употребляется продажный
крезол, состоящий из смеси трех изомеров: орто, мета и пара. Этот
крезол представляет жидкость, обыквовенно окрашенную в буроватый
цвет и перегоняется в пределах 190—2ОЗ“С. Получение триниТрокре-
зо да в общем похоже на получение пикриновой кислоты, но суще-
ственная разница в том, что для получения тринитрокрезола надо
затратить гораздо более времени, так как от замедления процесса,
нитрации значительно зависит успех работы.
Сначала надо приготовить сульфокрезоловую смесь: '
СНзС0Н4(ОН)+Н28О4=СН3СвНз(Н8О3)ОН+Н2О.
*
К 100 гр. крезола в склянку с притертой пробкой приливают тонкой
струей 260 гр. серной ыислоты 62—63“ по Боме. Смесь сильно взбал-
тывают несколько раз и оставляют стоять на сутки (до тех пор пока
проба в воде на-цело растворится).
Азотная кислота, в количестве 800 гр. 37’ по Боме, наливается
в реторту, а сульфокрезоловая смесь по каплям выливается из ка-
пельно^ воронки.
Сульфокрезоловуюсмесьвыливаютпо каплям в 5 приемов: 1-ые80 гр.
выливают по каплям в продолжение 30 мин., во все время капания взбал-
тывают реторту. Потом около минуты продувают воздух; для этого,
вынув пр, бку из тубулуса реторты, вставляют стеклянную трубку и,
надев на нее каучуковую трубочку, при помощи каучуковых шаров
или меха, осторожно продувают воздух через азотную кислоту. Затем,
дают стоять: на стояние вместе с продувкой требуется около РДчаса.
Затем, в каждые 1‘/з ч. выливают по каплям всего по 70 гр.,
т.-е. на 280 гр. требуется 6 час. Затем, вторично продувают воздух
до прекращения выделения краснобурых паров окислов азота. Вся
смесь из реторты выливается в сосуд с большим количеством холод-
ной воды, которая после отстаивания тринитрокрезола заменяется но-
вой и т. д. до тех пор, пока лакмусовая бумажка перестанет указы-
вать присутс1вие кислот.
Затем, при помощи фарфоровой воронки и водяного насоса отсасы-
вают твердый тринитрокрезол. Тринитрокрезол помещают из воронки в
стаканчик, куда наливают ввды, приблизительно в 20 раз более, чем
получено тринитрокрезола й, помешивая палочкой, плавят под водой на
водяной бане тринитрокрезол, затем еще сливают тщательно воду, а
тринитрокрезол высушивают при 60° до постоянного веса и охлаждают
в эксикаторе над серной вислотой. Чтобы получить более чистый про-
дукт, надо растворить тринитрокрезол в горячем винном спирте СаЬЦОН)
и выпавшие, по охлаждении спирта кристаллы, отфильтровать и вы-
сушить при 60“С., а потом—в эксикаторе над серной кислотой.
Заводский тринитрокрезол плавится при 82—92°, а выкристалли-
зованный из горячего спирта при 102—104“.
Тринитронафталин, C,„H5(NO2)3.
I. С10Н8 + HNO,=C10H,NO2 + H2O.
II. C10H7NO2 + 2HNO3==C10H5(NO2), + 2Н20.
Для приготовления тринитронафталина сначала приготовляют
мононитронафталин, а уже из него потом готовится тринитронафталин.,
§ 6. Тринитро-
нафталин.
— 905 —i
г
Нафталин, употребляющийся для получения мононитронафта-
лийа, должен быть, по возможности, чистым, что поверяется темпера-
турой плавления, которая для химически чистого нафталина по Mills’y,
равна 8О.О6"С.
По Smith’y поверяют чистоту нафталина тем, что в фарфоровом
тигле, расплавляют Р/а грамма треххлористой сурьмы (темп, плавле-
ния 72°С.) и затем прибавляют, маленькими порциями небольшое ко-
личество нафталина; при не чистом нафталине получают красное
окрашивание.
В стакан помещают 100 гр. тонко измельченного нафталина и
приливают туда 600 гр. азотной кислоты, удельного веса 1,33 и затем
в течение целого дня-производят перемешивание нафталина стеклян-
ной палочкой или лучше лопаточкой, сначала до тех пор, пока он не
растворится, а затем возможно чаще; на ночь оставляют стоять и на
другой день тоже возможно чаще помешивают. Еще дня на два оста-
вляют нитрЬваться и производят в эти дни по временам помешивание.
Когда не мешают, то закрывают тщательно стакан стеклянной пла-
стинкой. Таким образом на нитрацию необходимо не менее 4-х дней.
Затем, промывают получившийся нитропродукт струей холодной
воды из под крана в течение 1 часа, при чем в начале промывки
производят помешивание стеклянной лопаточкой. После этого про-
дукт отсасывают на фарфооовой воронке, пользуясь водяным насосом
и сушат при 40°. После сушки охлаждают и ставят на' сутки в экси-
каторе над серной кислотой. Проба мононитронафталина должна иметь
температуру плавления 55—60°С., что близко к температуре плавле-
ния а—мононитронафталина, который, будучи химически чист, пла-
вится при 58—61°.
' Высушенный мононитронафталин растирается в ступке с 22 гр. высу-
шенной и тонкб измельченной натровой селитрой NaNO3; затем в стакан-
чик наливается 80 гр. серйой кислоты крепостью около 66° по Боме.
В зависимости от крепости серной кислоты, она должна быть
остужена или нагрета; так если серная кислота:
крепостью 65,7° по Боме, то остужается ДО о°с.
65.6 п п л 4„
» 65,5 т> и » я л 8,
я 65,3 я я я 'я 16 ,
и 65,2 » я » я л 20,
п 65,1 я я нагревается и 24 „
я 65,0 я » J » 28 „
В серную кислоту сразу опускается смесь мононитронафталина
с селитрой. Смесь нагревается на водяной бане и производится раз-
мешивается стеклянной палочкой до появления краснобурых паров.
После этого нагревание на водяной бане продолжается еще в течение
2-х часов и в то же время, по возможности, чаще продувают воздух.
После окончания нагревания продувают воздух до тех пор, пока
температура не понизится до 75’0. Затем приливают холодную воду
(возможно более), помешивают палочкой несколько минут и оставляют
стоять до другого дня.
— 906 —
На другой день промывают холодной; водой до тех пор, пока
вода не будет давать кислой реакции на лакмусовую бумажку. Отса-
сывают на фарфоровой воронке и сушат часов 5, — сначала при 60’,
а затем в эксикаторе над серной кислотой до постоянного веса. Точка
плавления полученного продукта 90—170°.
Изследование, произведенное профессором Ипатьевым, показы-
вает, что при заводском получении тринитронафталина в описанных
выше условиях получается тринитронафталин состоящий, главным
образом, из а и /9 изомеров.
§ 8. Нитробенаоп к 150 гр. крепкой серной кислоты, которая нахо-
(по L.Qattermann y). дИТСЯ в колбе, ВМбСТИМрСТЬЮ ОКОЛО */г ЛИТра, ПрИЛИ-
вают постепенно, при взбалтывании, 100 гр. крепкой азотной кислоты
(уд. веса 1,4). После того, как теплая смесь охладится до комнатной
температуры от погружения в холодную воду, прибавляют постепенно,
при частом взбалтывании, к смеси 50 гр. бензола. Если температура
при этом будет стоять выше 50—60°, то погружают при дальнейшем
I вливании бензола сосуд в воду на короткое время. К колбе приспо-
собляют поднимающуюся вверх трубку и нагревают в течение часа,
при взбалтывании на водяной бане при температуре около 60° (тер-
мометр в воде).
После охлаждения отделяют нижний слой, который состоит из
серной и азотной кислот, на разделительной воронке от верхнего слоя,
который содержит нитробензол.
Последний несколько раз взбалтывают в разделительной воронке
с водой, при чем теперь наблюдается то, что нитробензол образует
нижний слой.
После промывания переливают нитробензол в сухую колбу и
нагревают с хлористым кальцием на водяной бане, пока, бывшая сна-
чала молочной, жидкость не сделается ясной. Наконец, его очищают
перегонкой из фракционной колбы с приспособленной к ней удлинен-
ной трубкой.
Точка кипения 206—207°. Выход 60—70 гр.
§ 9. Динитробенэоп
(по LGattermann'y).
C6H5NO2 + HNOs = C«H1(NO2)2 + H2O.
К смеси 25 гр. крепкой серной кислоты и 15 гр. дымящейся
азотной кислоты прибавляют постепенно (под тягой) 10 гр. нитробен-
зола и нагревают, при частом взбалтывании, в открытой колбе */2 часа
на водяной бане. Немного остывшую смесь, при взбалтывании, выли-
вают в холодную воду, затем застывший динитробензол отфильтровы-
вают, промывают водой, растирают на глиняной тарелке и выкристал-
лизовывают из спирта.
Т. плавления 90°, выход 10—12 гр.
Температура плавления показывает, что при таком способе ни-
трации получается метадинитробензол, так как ортодинитробензол
плавится при 118°, а парадинитробензол — при 171°.
Один из практических способов получения гекса-
§ ю. Гексанитроди- нитродифениламина описан в Zeitschrift fur das gesamte
фениламин. gchiess und Sprengstoffwessen 1910 № 1.
й
>а
)М
о-
— 907 —
*
1 весов, часть дифениламина постепенно при размешивании вво-
дится в 10 весов, частей серной кислоты 98“/# и затем размешивается
до растворения.
раствор медленно (в течение 3-х часов) вводится в 10 вес. ча-
стей азотной кислоты уд. веса 1,50. При вливании раствора азотная
кислота должна хорошо охлаждаться и при вливании все время раз-
мешивают. После вливания в течение 1 часа сильно охлаждают.
Всплывающие комки надо немедленно погружать вниз, иначе может
произойти воспламенение.
Затем сосуд, где находится вещество, нагревается на водяной
бане, сначала слабо и когда кончится энергичное выделение бурных
паров, то до кипения, пока не будет более выделяться азотных газов
и охлаждается,
По охлаждении смесь вливается в 60 вес. ч. воды (т.-е. если
вз^то 10 гр. дифениламина, то в 600 куб. сант.), перемешивается и
после полного охлаждения фильтруется и затем еще промывается
сначала холодной, а потом и горячей водой до нейтральной реакции,
опять фильтруется на фарфоровой воронке и высушивается при
50—60’С. 100 ч. дифениламина дают 170 ч. гексанитропродукта.
из
ЭЯ.
нее
ует
;на-
ают
<ен-
ейся
эбен-
часа
5ЫЛИ-
ровы-
ютал-
5в ни-
5ензол
гекса-
esamte
ГЛАВА III.
Гремучие сопи и азиды.
_ , Следует обратить внимание на чистоту ртути
® ’ Ре*Учая ртуть- и киолот. Ртуть Ьчищается пропусканием несколько
раз маленькими капельками через слабую азотную1 киелоту и, затем
фильтрованием через полотно или замшу.
Азотная кислота, употребляемая для нитрации, должна быть
прозрачной, не должна содержать серной кислоты, что поверяется
пробой: с хлористым барием ВаС1а не должно быть осадка от прибавки
этого реактива. По Lobry de Bruyn’y (Berichte dr Deutsch Chem
Gesellschaft, 1886, 1370), 100 rp. 90% спирта наливается в колбу.
Затем в стаканчике растворяется при обыкновенной температуре 10 гр.
ртути в 120 гр. азотной кислоты HN03 уд. веса 1,34. Раствор ртути
в кислоте нагревается до 70° и уже после этого маленькими порция-
ми постепенно приливается к спирту, при непрерывном взбалтывании.
Прибор оставляют стоять и если через ’/в часа не начнется вы-
' деление белых паров, то можно нагреть колбу на водяной бане до
начала кипения, т.-е. до появления пузырьков (обыкновенно обходят-
ся без нагревания).
Когда реакция кончилась, то дают гремучей ртути отстояться в
течение часа и затем выливают содержимое колбы в стакан с. холод-
ной водой, где гремучая ртуть промывается несколько раз холодной
водой до тех пор, пока в промывной воде лакмусовая синяя бумажка
не нерестанеть краснеть.
Затем отсасывают на фарборовой воронке, при помощи водяного
насоса, влажную гремучую ртуть. Сушится при 50“ в течение 6-ти
часов и затем в эксикаторе над хлористым кальцием.
/ Г
Удается, как указывает проф(. А. Солонина хорошее получение
гремучей ртути, если брать на 50 гр. ртути 450 гр. азотной кислоты
уд. веса 1,3*8 и 500 куб. сайт, спирта около 96%; при чем ртутный
раствор не нагревался. Этими способами гремучая ртуть получается
всегда серовато-желтоватой.
Чтобы получить совершенно белую гремучую ртуть, надо при-
бавить меди и соляной кислоты (Berichte 1905, 1348 Lothar Wohler и
К. Theodorovits), монохлористую медь СпС1. *) Для получения белой
гремучей ртути монохлористую медь прибавляют к спирту в коли-
честве 1 до 2 граммов на 50 гр. металлической ртути.
Дтя очистки фабричной гремучей ртути ее растворяют в растворе
цианистого калия (на 1 ч. KCN—3 % части воды; при чем берут на
1 ч. серой гремучей ртути—0,83 ч. цианистого калия), к профильтро-
ванному раствору прибавляется постепенно азотная кислота (на 1 гр.
гремучей ртути—2,3 к. с. азотной кислоты уд. веса 1,38, растворенной
в 8,9 к. с. вош).
Выделившийся белый,» очень мелкий, порошок промывают водой
(раз десять) до тех пор, пока лакмусовая бумажка не перестанет крас-
неть после сохранения гремучей ртути под водой в течение несколь-
ких часов.
Другой способ очищения заключается в растворении гремучей
ртути в пиридине (на один грамм серой гремучей ртути берется 6,9
к. сайт, пиридина).
После фильтрования прибавляется постепенно вода (на 1 гр. се-
рой гремучей ртути 100 к. сайт, воды) и, когда осядет выделившаяся
гремучая ртуть, ее отфильтровывают, промывают холодной водой (на
1 гр. гремучей ртути—20р к. с. промыв, воды) и затем высушиваю*
в эксикаторе над СаС13, из которого выкачивают воздух до тех пор,
пока не исчезнет запах пиридина и затем еще до постоянного веса.
§ 2. Гремучее серебро.
Ag2 С2 N2 О2.
Реакция ведется по Гей Люссаку и Либиху так же, как и для
получения гремучей ртути.
В колбу наливают 27 гр. винного спирта 90% и к нему прили-
вают сразу охлажденный до комнатной температуры раствор: 1 гр.
серебра (химически чистого) в 20 гр. азотной кислот уд. веса 1,36 —
1,38 и нагревают до начала кипения; затем приливают еще 27 гр.
спирта 9о% и оставляют стоять при комнатной температуре.
Дальше поступают так же, как и с гремучей ртутью, но не реко-
мендуется сушить в бане при повышенной температуре, а прямо в
эксикаторе над хлористым кальцием (лучше, если эксикатор из тем-
ного стекла), который надо поставить в темное место.
Не сушить более 1 гр. гремучего серебра, так как оно чрезвы-
чайно чувствительно к слабым механическим влияниям и от удара
даже может взорваться под водою.
Й
из 10ft
при, р»
гую ст
нагрею
*) Опыты А. А. Солонины.
§ 8. Свинцовая соль азотистоводородной кислоты РЬ Нв (Азид свинца).
Исходным продуктом служит обыкновенно натрий азид Na N3, ко-
торый на заводах в настоящее время готовится двумя способами.
1-й способ. Этот способ представляет собственно усовершенство-
ванный Dennis и Broune способ Wislicenus’a (Berichte d. d. chem
Gesellschaft 25, 2084 и Zeitschrift fur anorganischen Chemie 40,68).
Способ этот можно разбить на две фазы:
1) получение натрийамида действием аммиака на натрий и
2) но лучение натрийазида действием закиси азота на натрий-
амид.
Получение натрийамида
Na + NH3 = Na NH2 + H
100 гр. натрия постепенно расплавляются в никелевой чашке с пер-
пендикулярными стенками (диаметр чашкй 13 сайт. и вышина 8 сан.).
Предварительно натрий после разрезания промывается дважды в без-
водном этиловом эфире (перегнанным над натрием). Чашка, еще до
вкладывания натрия, помещается в железный сосуд и воздух из со-
суда вытесняется аммиаком, тщательно высушенным пропусканием
через колонны с едким кали и обрезками натрия. Когда весь натрий
расплавится, то пропускают через натрий аммиак под небольшим
давлением, для чего трубку, из которой выходит сухой аммиак, опу-
скают в расплавленный натрий. При пропускании аммиака температура
должна быть 260—270°. Для контроля прохождения аммиака ставят
промывную склянку с небольшим количеством высококипящего нефтя-
ного масла. Аммиак для этой цели удобнее всего получать нагрева-
нием в медном сосуде хлористого аммония с двойным по весу коли-
чеством гашеной извести; смесь перед накаливанием слегка смачи-
вается. Обратить особенное внимание, чтобы аммиак перед впусканием
в расплавленный натрий хорошо высушивался. Через 4%—7 часов 1
реакция оканчивается. Конец реакции легко узнать испытанием вы-
деляющегося газа, а именно: выделяющийся газ по окончании реак-
ции не должен гореть после промывания водой.
Полученный натрийамид охлаждается до. комнатной температуры
в струе аммиака и три четверти его вынимается из чашки и хранится
в эксикаторе над металлическим натрием.
Получение натрийазида
Na NH2 -J- N2O = Na N3 Д- H2O
Na NHa + H2O — Na HO -f- NH3
2Na NH2 + N20 = Na N3 4-Na HO-j-M
На одну четверть полученного в никелевой чашке натрийамида
из 100 гр. натрия действуют закисью азота при нагревании 190° и
при размешивании. Отклонение от 190“ на три градуса в ту или дру-
гую сторону не имеет значения. Закись азота удобнее всего получать
нагреванием смеси 17 вес. частей натровой селитры NaNO3, 20 вес.
г
частей калийной селитры KNO3 и 19 вес. частей сернокислого аммо-
ния (NH4)2 S04. Закись азота перед высушиванием пропускается через
раствдр железного купороса FeSO,. Высушивание закиси азота должно
быть очень тщательное, что достигается пропусканием через ряд скля-
нок и колонн с серной кислотой и хлористым кальцием. Обыкновенно
реакция кончается через 5 часов. Конец реакции легко узнать, так
как по окончании действия закиси азота уже более не выделяется
аммиак и, следовательно, красная лакмусовая бумажка не будет синеть.
Охлаждается в струе закиси азота. Если реакция доведена до конца,
то проба полученного азида натрия с водой не должна выделять
газов.
Полученная смесь натрий азида и едкого натра растворяете^ в воде
и по охлаждении постепенно при помешивании нейтрализуется слабой
азотной кислотой до слабо щелочной реакции. Такой раствор уже
может применяться для получения азида свинца.
2-ой способ. Этот способ основан на окислении гидразина азоти-
стой кислотой. Для того, чтобы получить хороший выход Stolle (Ве-
richte d. d. Chem. Gesellschaft 41, 2811) брал (до 8O“/o) сернокислый
гидразин, прибавлял к нему этилат натрия (количества взяты по теории)
и в присутствии спирта кипятил всю эту смесь с амилнитритом с об-
обратным холодильником. После окончания реакции сначала отгоняется
спирт, а затем водяным паром производится отгонка образовавшегося
амилового спирта и оставшегося амилнитрита.
Реакция обгоняется тем, что азотистая кислота действует
на гидразин по уравнению:
N2H4 + HNO, = N3H + 2На0.
Если же прямо действовать на гидразин азотистой кислотой, то
хотя и получается N3H, но выход очень мал вследствие действия на
И3Н азотистой кислоты.
Можно вместо амилнитрита взять этилнитрит по Theile (Berichte
d. d. Chem. Gesellschaft 41, 2811) 5 гр. гидрата гидразина смеши*
вается с 37,5 куб. сайт. 4 нормального раствора натрий метилата и за-
тем прибавляется 12,6 куб. сайт, этилнитрита и 50 куб. сайт эфира.
Через 24 часа стояния получается NaN3, который промывается эфиром.
Способ StollO менее удобен, так как полученным раствором нельзя
прямо пользоваться для получения азида свинца, ибо раствор содер-
жит сернокислый натрий, а надо еще этот раствор подкислить слабой
серной кислотой и отгонять N3H; отгон поглощается раствором едкого
натра.
Получается азид свинца PbNe следующим образом:
5 гр. натрийазида растворяется в 50 куб. см. воды (если на-
трийазид продажный, например от Raschig’a, то необходимо раствор
профильтровать). Полученный раствор медленно по каплям при разме-
шивании приливается к раствору 25 гр. азотно-кислого свинца в 250
к. с. воды. После того, как осадок отстоится, его промываю! несколько
раз водой, отсасывают на воронке Бюхнера и еще промывают 2 раза
спиртом и один раз эфиром; высушивается при 100° в течение ’Д часа
и ставится в эксикатор над хлористым кальцием. ,
— 911 —
’ Обращать внимание, чтобы при осаждении азида свинца, как’
раствор натрийазида, так и азотнокислого свинца ;не были бы теп-
лыми. Ни в каком случае не следует заменять азотнокислый свинец
уксуснокислым свинцом. Хранить азид свинца надо в темном месте
или в темном эксикаторе над хлористым кальцием. Уничтожать ос-
татки азида свинца при помощи крепкого раствора едкого натра. При
работе с азидом свинца надевать на глаза проволочную сетку и под
сеткой слюдяные очки.