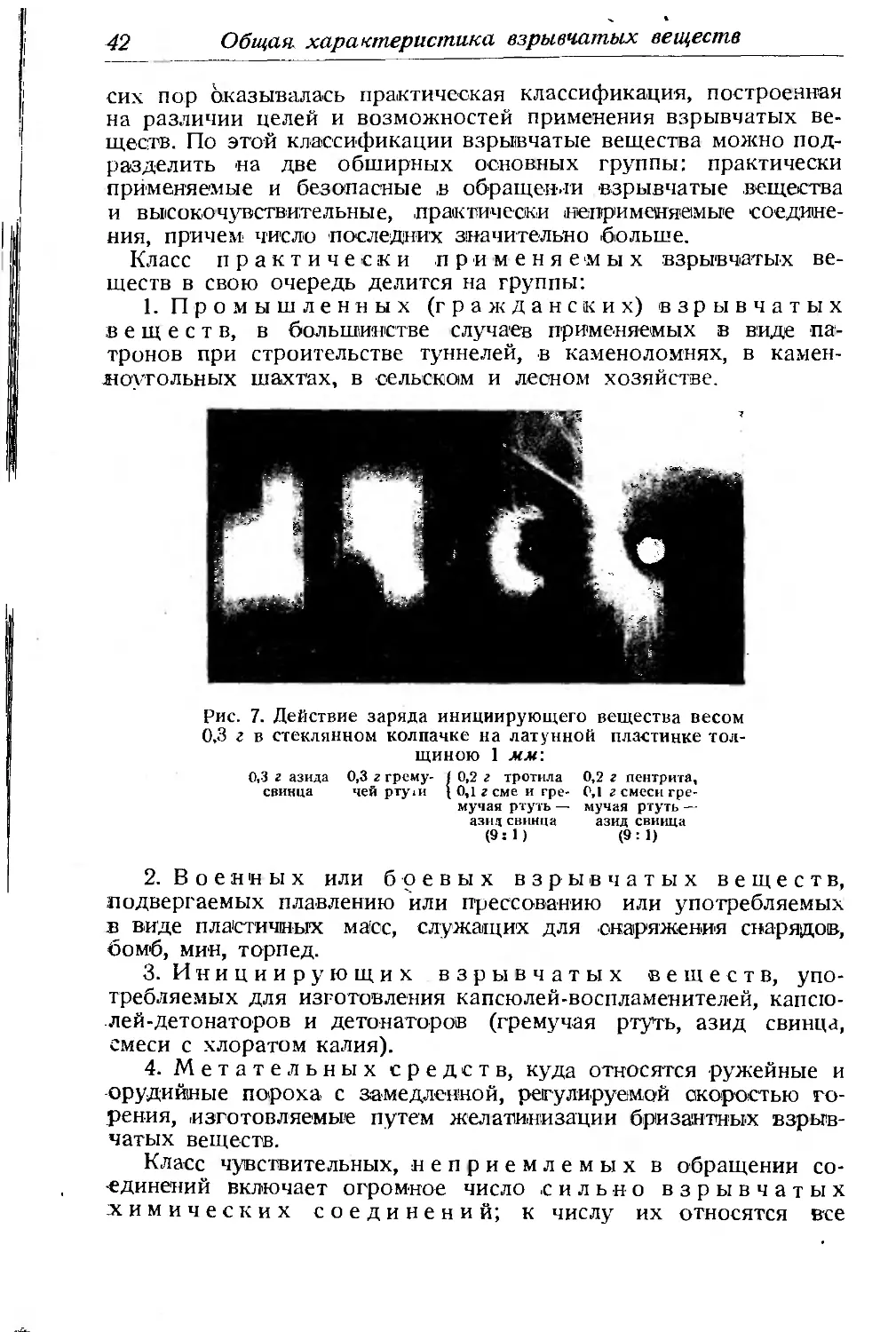
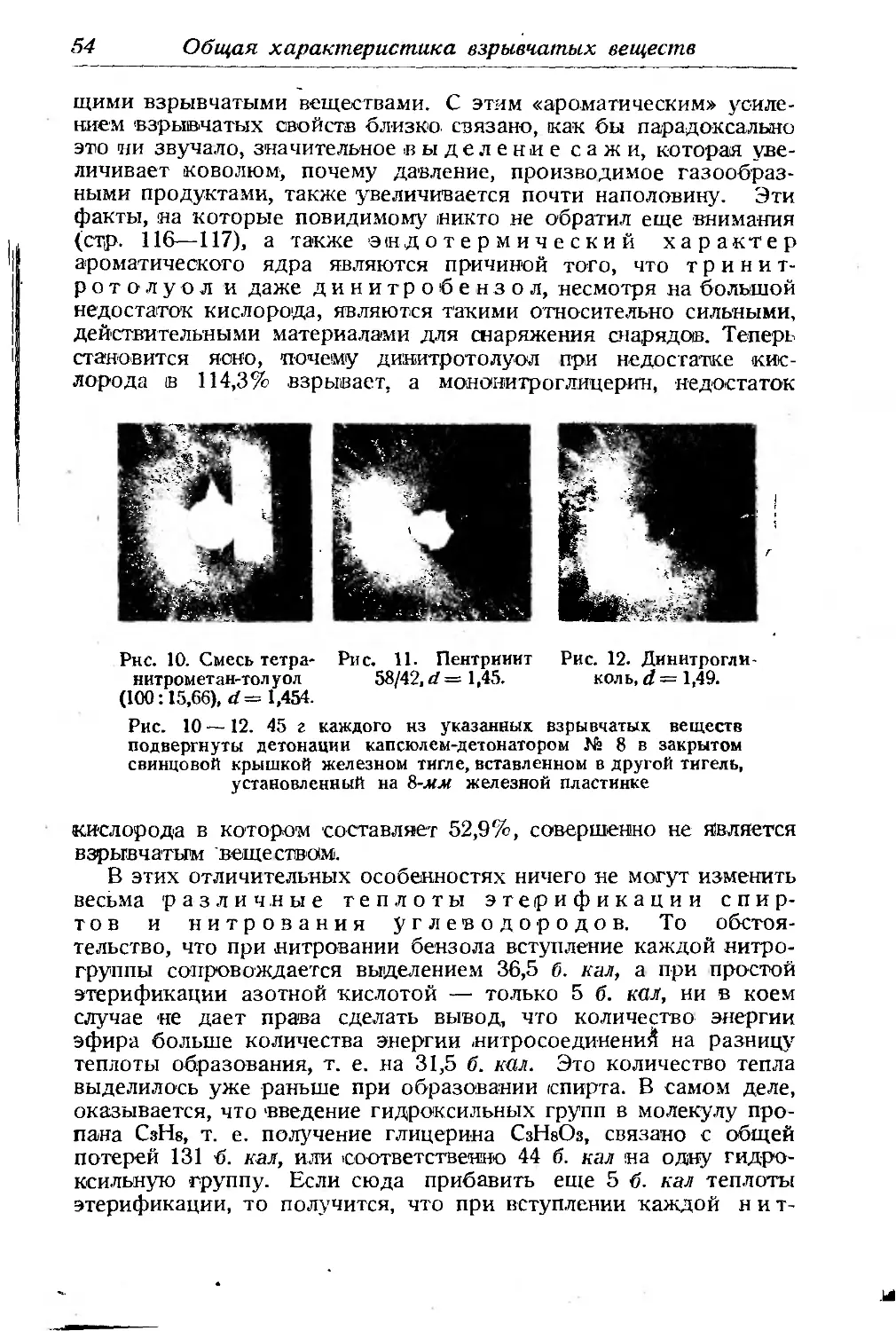
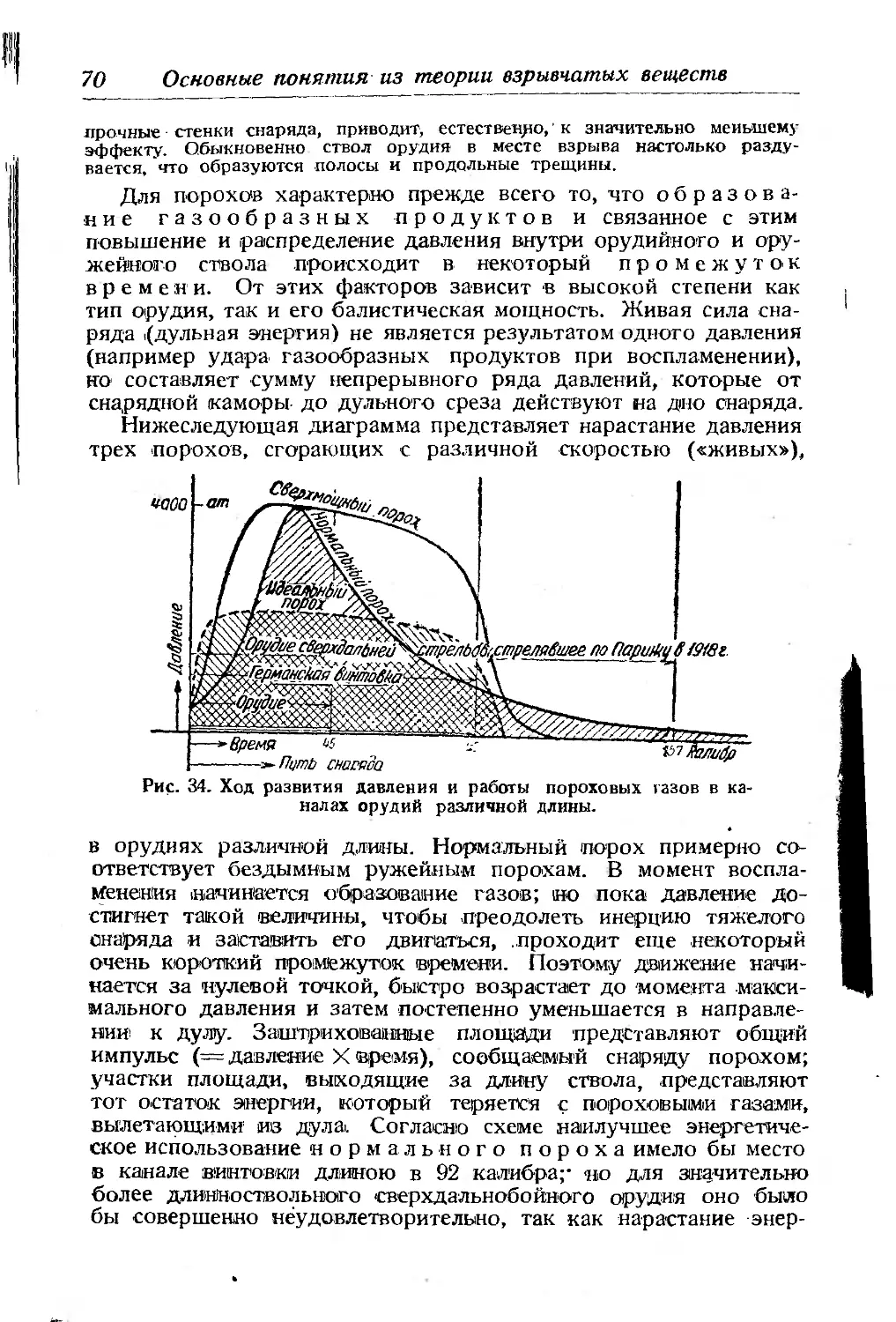
Текст
А. ШТВТВАХЕР
ПОРОХА
й
ВЗРЫВЧАТЫЕ
ВЕЩЕСТВА
ОКТИ • 1436
A. STETTBACHER
DIE SCHIESS-UND
SPRENGSTOFFE
ZWEITE vOllig umgearbeitete auflage
VERLAG VON JOHANN AMBROSIOS BARTH
LEIPZIG 1933
А. ШТЕТБАХЕР
ПОРОХА И ВЗРЫВЧАТЫЕ
ВЕЩЕСТВА
ПЕРЕВОД СО ВТОРОГО СОВЕРШЕННО
ПЕРЕРАБОТАННОГО НЕМЕЦКОГО
ИЗДАНИЯ 1933 г. ПОД РЕДАКЦИЕЙ
проф. А. В. САПОЖНИКОВА
инж. К. М. БЯЛКО
ОНТИ • ГЛАВНАЯ РЕДАКЦИЯ ХИМИЧЕСКОЙ ЛИТЕРАТУРЫ
МОСКВА
1936
ХМ-30-5-3
Книга представляет собою руковод-
ство, посвященное в основном описанию
взрывчатых веществ и порохов и техно-
логических способов их получения, а так-
же описанию применения их в самых раз-
нообразных областях. Помимо того
в книге изложены основные вопросы из
теории взрывчатых веществ и довольно
полно представлены методы испытания
и исследования этого важного класса со-
единений. Большое количество библио-
графических ссылок позволяет в каждом
отдельном случае обратиться к перво-
источнику. Книга рассчитана на студен-
тов старших курсов и специалистов, ра-
ботающих в области взрывчатых ве-
ществ.
Отв. редактор К. М. Бялко. Техредактор П. В. Погудкин.
Сяано в набор 7/П 1935 г. Подписано к печати 14/VII 1936 г.
Формат 62Х941/16. ГРХЛ № 844. Колич. печ. листов 383/4.
Учетно-авторских л. 44,2. Договор № 6020. Колич. бум. л. 193/8.
Уполн. Главлита № В—40652. Тираж 2500. Печ. зн. в 1 бум, л. 97.600. Заказ № 317К
2-я типогр. ОНТИ им. Евгении Соколовой. Ленинград, пр. Красных Командиров, 29.
ОГЛАВЛЕНИЕ
Стр.
Предисловие к русскому изданию................................. 12
Предисловие ко второму немецкому изданию........................15
Введение...................................................... 19
Глава первая. Исторический обзор
1. Дымный (черный) порох.................................. . . 21
II. Открытия в переходную эпоху алхимии...................... - 24
III. Бризантные взрывчатые вещества ............ 27
IV. Бездымные пороха......................................... 34
V. Боевые взрывчатые вещества .... ....... 36
*
Глава вторая. Общая характеристика взрывчатых веществ
I. Введение .... ................................. 41
11. Основные свойства взрывчатых веществ и их действие..........43
III. Пределы развития силы и энергетические возможности взрывчатых
веществ...................................................... .47
IV. Термохимические основы важнейших взрывчатых веществ .... 51
V. Взрывчатые свойства и химическое строение...................58
1. Химически однородные взрывчатые вещества и механические
взрывчатые с.меси..........................'..................—
2. Определенные взрывчатые нитросоединения ароматического ряда . 60
3. Диазосоединения..........................................63
4. Затухание взрывной волны пластичных и желатинообразных
нитроглицериновых взрывчатых веществ .... ... 64
Г лава третья. Основные понятия из теории взрывчатых веществ
I. Взрывчатые и метательные средства . .......................67
1. Снаряд или ракета?...................................... 75
2. Воспламенение или начальный импульс......................77
Взрыв через влияние ..... . . ... —
3. Взрывы на открытом воздухе...............................80
Упругое действие давления ....... . . —
4. Влияние способа воспламенения на детонацию...............81
5. Бризантность и давление бризантности................ . . 83
6. Искусственные сотрясения почвы посредством взрывов ... 88
П. Скорость детонации...........................................89
1. Экспериментальное определение............................91
2. Косвенный способ определения скорости детонации по Д о т р и ш у 95
3. Зависимость скорости детонации от свойств взрывчатого ве-
щества ................................................ . . 97
4 Величина и продолжительность пламени взрыва..............101
i
6
Оглавление
III. Развитие явления взрыва.......................................111
1. Вычисление объема газообразных продуктов по реакции взрыв-
чатого разложения................................................—
2. Объем газообразных продуктов в момент взрыва.............112
3. Давление газообразных продуктов взрыва (давление взрыва) . .113
4. Теплота взрывчатого разложения..............................125
Теплота взрыва (горения) при постоянном давлении и постоян-
ном объеме . . ‘........................................’ . 129
Определение теплоты взрыва в калориметре . . . . .132
Анализ газообразных продуктов, образующихся в стальной
камере после .взрыва в заключенном в ней свинцовом
цилиндре..................................................133
5. Температура взрыва..........................................134
Вычисление температуры взрыва................................135
Температура взрыва гремучего студня..........................137
Вычисление температуры взрыва пентаэритриттетранитрата . . 140
Количество энергии и работоспособность ..................... 148
Г лава четвертая. Дымный (черный) порох
I. Исходные материалы............................................152
1. Калиевая селитра (азотнокислый калий).........................—
2. Древесный уголь.............................................153
3. Сера........................................................155
II. Фабрикация пороха..............................................156
1. Измельчение исходных материалов.............................157
2. Смешение компонентов............. ................... —
3. Уплотнение состава..........................................—
4. Прессование порохового состава........................... 160
5. Зернение......................................................—
6. Придание зерну круглой формы и полировка (сырая или пред-
варительная) ..................................................161
7. Прессованный (призматический) порох....................... 162
8. Сушка и сортировка...........................................—
9. Укупорка и хранение........................................163
10. Свойства дымного пороха.................................
III. Отдельные сорта дымного (черного) пороха и сходные с ним
составы......................................................... • 167
1. Охотничий порох...............................................—
2. Минный порох...............................................168
3. Порох для снаряжения средств воспламенения...................—
4. Пороховые столбики, трубочный порох........................169
5. Составы, сходные с дымным порохом: взрывчатые селитры . . 170
I
Г лава пятая. Кислоты, применяемые для нитрации
1. Азотная кислота............................................172
2. Серная кислота.............................................173
3. Олеум (дымящая серная кислота) ... 174
4. Ядовитость кислот..........................................176
5. Мешка кислот............................................. .177
6. Освежение отработанной кислоты.............................178
7. Перекачивание кислот насосами.............................179
8. Денитрация. Регенерация кислот . 181
9. Металлы и материалы для аппаратуры в производстве взрыв-
чатых веществ ....................................................
Оглавление
7
Глава шестая. Пироксилин (нитроклетчатка)
1. Клетчатка......................................................48
Требования, предъявляемые к очищенному хлопку..............191
11. К теории образования нитроклетчатки...........................192
Высокоазотная нитроклетчатка с содержанием азота до 14% . . 196
111. Производство пироксилина.....................................197
1. Старый способ нитрации в горшках.....................—
2. Нитрация в центрофугах.....................................198
3. Нитрация хлопка в нитраторах по американскому способу . - . 200
4. Английский способ вытеснения (способ Томсона)..............203
5. Мешка кислот............................................. 205
6. Промывка и стабилизация . . *..............................206
7. Обезвоживание нитроклетчатки...............................209
8. Исследование нитроклетчатки................................210
9. Прессованный пироксилин....................................216
IV. Свойства нитроклетчатки......................................217
Глава седьмая. Нитроглицерин
I. Глицерин.....................................................221
1. Получение нитроглицерина в лаборатории. Пробная нитрация . 222
2. Общие соображения о нитрации и выходах нитроглицерина
в прежнее и в настоящее время.................................224
II. Производство нитроглицерина..................................226
1. Кислотная (нитрующая) смесь ...............................228
2. Нитрация.............................................. • • ~
3. Промывка...................................................232
4. Фильтрация.......................... .................233
5. Последующее разделение.....................................—
6. Очистка сточных вод........................................235
7. Непрерывный процесс производства нитроглицерина, предложен-
ный А. Ш м и д о ..............................................—
8. Требования, предъявляемые к нитроглицерину.................240
ЯП. Свойства нитроглицерина.........................................—
1. Физические и химические свойства...........................—
2. Взрывчатые свойства........................................243
(V. Низшие г.тицериннитраты.......................................245
1. Глицериндинитрат..........................................246
2. Глицеринмононитрат........................................247
3. Монохлоргидриндинитрат.....................................—
4. Ацетилдинитроглицерин.................................... 748
5. Диглицеринтетранитрат......................................—
6. Нитроизобутилглицеринтринитрат............................249
V. Прочие взрывчатые эфиры спиртов................................—
2. Пентаэритриттетранитрат, или нитропентаэритрит (пентрит) . . 254
3. Маннитгексанитрат.........................................261
4. Нитросахар и нитрокрахмал.................................263
VI. Другие высокобризантные взрывчатые вещества и смеси .... —
1. Эфиры спиртов и хлорноватой и хлорной кислот................—
2. Циклотриметилентринитрамин, или гексоген ... .... 264
3. Взрывчатые смеси, содержащие двуокись азота...............268
Панкластит..............................................—
4. Смеси тетранитрометана с углеводородами...................271
Глава восьмая. Бездымные пороха
1. Фабрикация бездымных порохов................................275
1. Пироксилиновый порох......................................—
2. Нитроглицериновый порох................................. 283
8
Оглавление
3. Стабилизаторы..............................................
II. Свойства бездымных порохов..................................2ВВ
1. Испытание на стойкость....................................292
2. Метательные средства большой мощности . .................295
Порох для дальнобойных орудий ................................—
III. Действие пороха в оружьи.................................. . 300
1. Энергетический и балистический балансы пороха в оружии . 304
2. Поведение пороха при стрельбе . . . .... . 305
IV. Пули и снаряды и их действие.................................308
1. Пули (дум-дум, расширяющиеся, разрывные, зажигательные и
трассирующие)..................................................—
2. Звук выстрела орудия и звук, производимый снарядом .... 315
3. Унитарные патроны (ружейные и орудийные) .... . . 316
4. Сверхдальнобойное орудие, стрелявшее по Парижу ..... 318
Глава девятая. Нитроглицериновые взрывчатые вещества,
Динамиты
I. Гурдинамиты.................................................325
II. Гремучий студень.......................................... 323
1. Приготовление ..............................................—
2. Свойства...................................................332
3. Применение............................................... 337
4. Трудно замерзающий гремучий студень . 338
5. Военный гремучий студень....................................—
III. Желатиндинамиты........................................... . 339
1. Обыкновенный желатиндинамит и пентринит . ................340
2. «Безопасные» динамиты.....................................348
Г лава десятая. Антигризутные взрывчатые вещества
I. Взрывы рудничного газа................................ . 352
11. Фотографирование пламени ... ................. 356
III. Опытный штрек для испытаний на антигризутность............. 360
Жидкая углекислота как антигризутное в отношении рудничного
газа и угольной пыли взрывчатое вещество (Carbox blasting-
device) ................................................. 365,
Глава одиннадцатая. Взрывчатые нитросоединения ароматического
ряда
I. Исходные и промежуточные продукты ......... 367
1. Бензол................................................. , 368
2. Толуол................................................... —
3. Ксилол.............................................. .... 370
4. Сольвент-нафта................................................
5. Нафталин......................................................
6. Фенол (карболовая кислота)............................. . —
7. Анизол....................................................371
8. Крезол...................................................
9. Анилин........................................... . . .
10. Диметиланилин...........................................
II. Нитропроизводные бензола и его гомологов..................
1. Нитробензол........................................ . .
2. Динитробензол.............................................373
3. Тринитробензол ... ................................375
4. Нитротолуол...............................................376
5. Динитротолуол .................................. .... . __
6. Тринитротолуол (тротил, ТНТ)..............................379
Промывка кислого тринитротолуола...........................384
Очистка....................................................388
Оглавление 9
Ректификация растворителя .................................. 391
Свойства тринитротолуола ................................... 394
Военные требования, предъявляемые к тринитротолуолу . • 398
Применение тринитротолуола ................................ 400
7. Нитроксилолы и тринитроксилол .............................401
8. Нитропроизводные сольвент-нафты............................ 402
III. Нитронафталины..............................................—
1. Мононитронафталин...........................................—
2. Динитронафталин............................................403
3. Тринитронафталин.......................................... 404
4. Тетранитронафталин.........................................405
IV. Нитропроизводные фенолов и их производных...................—
1. Нитрофенол................................................ —
2. Динитрофенол...............................................405
3. Тринитрофенол (пикриновая кислота).........................407
Лабораторный метод получения пикриновой кислоты ............ 408
Свойства............... ... ........... ... 411
Испытание.................................................. 413
Применение.................................................. —
4. Тринитроанизол и тетранитроанизол .........................414
5. Тетранитрофенол и пентанитрофенол ..........................—
6. Тринитрокрезол (крезилит)................................. 415
7. Тринитрорезорцин, или оксипикриновая кислота................-
V. Ароматические нитрамины .... .............416
1. Пикрамид..................................................—
2. Тринитрофенилметилнитрамин (тетранитрометил! (илин, тетрил) . —
3. Тетранитроанилин................................. .... . 4'20
4. Гексанитродифениламин (гексил) .... .............422
5. Гексанитродифенил....................... .................425
6. Гексанитродифенилоксид (2, 4, 6, 3', 4', б'-гексанитродифеииловый
эфир).................................................... .... —
7. Гексанитродифенилсульфид (пикрилсульфид) ... —
8. Гексанитросульфобензид, или гексанитродифени ельфон . . -
Глава двенадцатая. Аммиачноселитренные, или безопасные,
взрывчатые вещества
I. Аммиачная селитра, азотнокислый аммоний.....................427
Вещества, заменяющие аммиачную селитру. Нитрат гуанидина
и нитрогуанидин .......................................431
II. Производство аммиачноселитренных взрывчатых веществ ... —
1. Подготовка аммиачной селитры...............................432
2. Смешение составных частей..................................434
3. Просеивание (зернение), патронирование и 'парафинирование . . 436
III. Свойства аммиачноселитренных взрывчатых веществ .... 439
Глава тринадцатая. Хлоратные взрывчатые вещества (шеддиты)
I. Хлорноватокислый калий и хлорноватокислый натрий............447
II. Перхлораты............................... .................449
III. Производство хлоратных взрывчатых веществ . .............450
Лабораторный способ приготовления шеддита..................
IV. Свойства............................. ......................452
V. Перхлоратные взрывчатые вещества ................. . . 454
Г лава четырнадцатая. Оксиликвитные взрывчатые вещества
(оксиликвиты)
1. Состав окси лик битных взрывчатых веществ . . ..........458
2. Взрывчатое действие.......................................46 ’
3. Применение................................................465
10
Оглавление
Взрывчатые смеси, составленные из щелочных металлов и галоидо-
производных углеводородов ............................... 467
Глава пятнадцатая. Инициирующие взрывчатые вещества
I. Гремучая ртуть .... . ...........................469
1. Исторические сведения, относящиеся к исследованию строения
гремучей ртути ............................................... —
2. Получение гремучей ртути ... ....................470
3. Свойства................................................... 473
II. Азиды................а». . ...................................479
I. Азид натрия............................ ...................480
2. Азид свинца.................................................'81
3. Тринитрорезорцинат свинца (тенерес) . 486
• III. Другие инициирующие взрывчатые вещества.....................487
1. Сернистый азот...............................................—
2. Ацетиленистое серебро.......................................488
3. Хлорнокислый нитрофенилдиазоний . . —
4. Органические перекиси . ................................439
5. Циануртриазид..............................................—
6. Тринитротриазцдобензол......................................491
7. Тетрацен .................................................. 492
Глава шестнадцатая. Ударные составы и капсюли-воспламенители
1. Ударные составы............................................495
2. Ружейные капсюли-воспламенители.............................496
3. Капсюли — воспламенители для снарядов......................498
4. Фрикционные трубки.......................................... —
Глава семнадцатая. Капсюли-детонаторы
1. Гремучертутные капсюли-детонаторы.........................502
2. Безопасные капсюли-детонаторы, применяемые « шахтах, содер-
жащих рудничные газы..........................................504
3. Азидотетриловые и азидопентритовые капсюли-детонаторы . . 505
4. Электродетонаторы и электрозапалы.........................506
5. Детонаторы, промежуточные заряды, инициирующие заряды . .510
6. Испытание капсюлей-детонаторов и детонаторов на инициирую-
щую способность...............................................512
Глава восемнадцатая. Шнуры для воспламенения
1. Обыкновенный медленно горящий шнур.........................516
2. Быстро горящий шнур........................................518
3. Детонирующий шнур...........................................—
Глава девятнадцатая. Практические способы испытания взрывчатых
веществ
I. Проба Трауцля в свинцовых цилиндрах..........................524
II. Проба по обжатию свинцовых цилиндров........................529
Взрывная проба под водою.....................................532
JII. Испытание посредством балистического маятника и балистической
мортирки......................................................533
IV. Испытание на копре.............................................536
V. Температура вспышки (температура воспламенения)..............539
VI. Уничтожение взрывчатых вешеств .... 542
Глава двадцатая. Взрывные работы
I. Техника взрывания...........................................545
II. Горные взрывные работы......................................549
III. Прорытие туннелей...........................................553
Оглавление 11
IV. Действие мин............................................558
V. Применение взрывчатых веществ в сельском и лесном хозяйствах . 362
VI. Подрывы льда............................................567
VII. Подводные взрывы. Торпедирование........................570
Глава двадцать первая. Артиллерийские снаряды, бомбы и мины
1. Бронебойные снаряды и снаряды с наконечником...........577
2. Бризантные и фугасные снаряды.........................579
3. Шрапнель..............................................582
Расход артиллерийских снарядов во время мировой войны . . 5F5'
4. Авиационные бомбы.......................................—
б. Ручные гранаты, бомбометные и минометные снаряды .... 59
6. Торпеды ........................................... .... 59
7. Морские мины ...........................................60
Глава двадцать вторая. Грандиозные взрывы и катастрофы
от взрывов.......................6
Предметный указатель .......................................... 6
ПРЕДИСЛОВИЕ К РУССКОМУ ИЗДАНИЮ
Книга А. Штетбахера «Пороха и взрывчатые вещества»
является вторым изданием книги того же наименования, появив-
шейся в 1919 г., но значительно расширенным и дополненным
новейшими техническими данными и многочисленными прекрасно
выполненными иллюстрациями, которым автор правильно при-
дает большое практическое значение с точки зрения наглядности
изложения фактического материала.
Автор' сам1 отмечает в предисловии, что его книга имеет глав-
ной целью описательную и технологическую стороны в области
порохов и взрывчатых веществ; что же касается теории, то ее
изложение ограничивается самыми необходимыми сведениями,
достаточными лишь для лучшего понимания природы взрывча-
тых веществ и их применения, а также для более ясного пред-
ставления о дальнейшем развитии этой области техники и про-
мышленности.
Практическое значение книги Штетбахера повышается
тем, что в ней для всех важнейших взрывчатых веществ дается
детальное описание заводских технологических процессов,
а также описание методов приготовления взрывчатых веществ
в лаборатории.
Значительный интерес для военных специалистов, и в част-
ности для артиллеристов, представляет приведенное автором
краткое описание важнейших явлений, происходящих в канале
огнестрельного орудия, а также описание некоторых типичных
образцов артиллерийских снарядов и авиабомб и принадлежно-
стей к ним. В виде особого приложения в конце книги дается
описание химических средств борьбы — некоторых отравляющих
веществ и противогазов.
Как видно из оглавления, книга содержит:
1. Исторический обзор.
2. Общую характеристику взрывчатых веществ.
3. Основные понятия из теории взрывчатых веществ.
4. Пороха и взрывчатые вещества.
5. Практические способы испытания взрывчатых веществ.
6. Взрывные работы.
7. Артиллерийские снаряды, бомбы и мины.
8. Грандиозные взрывы и катастрофы от взрывов.
На теоретическую часть приходится всего только 13% объема
книги, на описательную и технологическую — 55%, что в сумме-
Предисловие к русскому изданию 13
с другими частями чисто практического характера дает доста-
точное представление о направлении этой книги.
Теоретическая часть книги по существу дает только изложе-
ние некоторых основных понятий и характеристик без доста-
точно строгой последовательности и системы в распределении
материала. Эта часть книги носит в значительной мере поверх-
ностный характер и ни в коей мере не может считаться доста-
точно точной и исчерпывающей все современные задачи теории
взрывчатых веществ. Достаточно хорошо в ней представлены
важнейшие методы испытания и исследования взрывчатых
веществ и самого явления взрыва в наиболее современном
виде.
В описательную технологическую часть книги входят все из-
вестные взрывчатые вещества, имеющие промышленное или воен-
ное значение. При описании каждого отдельного вещества автор
придерживается одной и той же схемы: исходные материалы,
фабрикация, испытания и практическое применение; в последнем
пункте всюду, где это необходимо1, тщательно отмечается зна-
чение данного взрывчатого вещества в военной технике. В виде
общего замечания по этой части книги нужно указать, что все
сообщаемые в ней сведения исчерпывающим образом отражают
новейшую журнальную литературу, а также более солидные изда-
ния по этой специальности. Нельзя не упрекнуть автора книги
в излишнем увлечении пе.нтаэр|итриттетранитратом (тэн) и так
называемым пентринитом, которым он придает слишком боль-
шое значение и свойствами которых нередко пользуется в изло-
жении как какими-то стандартными; признавая все практическое
значение этих веществ, в частности тэна, в некоторых специаль-
ных случаях применения их, нельзя разделять полностью увлече-
ния автора книги этими взрывчатыми веществами.
В виде общего вывода можно сказать, что если книгу
А. Штетбахера и нельзя рекомендовать в качестве самостоятель-
ного систематического руководства по теории и технологии
взрывчатых веществ, то для всех лиц, работающих в области
порохов и взрывчатых веществ, а также для лиц, желающих
познакомиться с современным состоянием этой специальной
области техники, она может служить прекрасным пособием и
справочной книгой. Приведенные в книге библиографические
указания дают читателю возможность обращаться в нужных слу-
чаях к обширной оригинальной литературе.
Книга снабжена именным и предметным указателями, что зна-
чительно облегчает пользование ею для справок.
Перевод книги выполнили следующие лица:
К. М. Б я л к о — теория взрывчатых веществ, аммиачносе-
Дитренные и хлоратные взрывчатые вещества, артиллерийские
снаряды, бомбы и мины,
М. Г. Зиновьев — нитро соединения,
Э. Ю. Март и н сон — динамиты,
J4 Предисловие к русскому изданию
И. В. Орлова — исторический обзор, кислоты, азотнокис-
лые эфиры, оксиликвиты,
В. В. Хар и з о м е н о в — пороха,
| О. К. Юрвелин | — инициирующие взрывчатые вещества,,
ударные составы, капсюли-детонаторы, шнуры для воспламене-
ния, взрывные работы.
Проф. А. В. Сапожников
Инж. К. М. Бялко
ПРЕДИСЛОВИЕ КО ВТОРОМУ НЕМЕЦКОМУ ИЗДАНИЮ
Соответственно изменившимся запросам и требованиям вре-
мени предлагаемая читателю книга совершенно переработана и
дополнена. Она написана с точки зрения материалистически
мыслящего химика, и вещества с их свойствами рассматриваются
в ней как чисто1 физические субстанции, теория же и отвлечен-
ные вопросы затронуты лишь постольку, поскольку они облег-
чают изучение взаимозависимости между явлениями, дают воз-
можность делать сравнения и позволяют предвидеть будущее.
Поэтому экспериментально-химическая! часть включает только
новейшую, специально сконструированную аппаратуру. Спо-
собы приготовления важнейших основных и инициирующих
взрывчатых веществ с указанием самых сильных по разруши-
тельному действию1 высокобризантных смесей описаны здесь
впервые, причем в1 каждом отдельном случае в основу положены
либо опыт, либо наблюдения автора. Многие способы в отно-
шении их выполнения могут показаться очень простыми; они и
в самом деле таковы, но лишь для тех, кто работает с необхо-
димым вниманием и знает их; сам автор например даже в труд-
нейших случаях нитрации никогда не пользовался мешалкой, и,
несм'отря на это, у него ни разу не произошло вспышки. Но
неопытным лицам и учащимся1 прежде всего настойчиво реко-
мендуется избегать всякого рода несерьезных экспериментов со
взрывчатыми веществами: тот, кто не справляется по крайней
мере с основными химическими операциями, должен отказаться
от подобных развлечений, последствием которых является
увечье.
Во всех разделах книги, в которых по характеру изложения
это оказалось возможным, обращено1 особое внимание на нагляд-
ность изложения; даже в таких глубоко теоретических вопро-
сах, которых прежде избегали касаться, а .именно при рассмотре-
нии давления и температуры взрыва, смутные абстрактные поня-
тия иллюстрируются соответственно подобранными примерами.
Многочисленные фотографические снимки специально поставлен-
ных опытных взрывов дают живую картину разрушительной
мощи гражданских и военных взрывчатых веществ, а некоторые
фотографии, выполненные в темноте, свидетельствуют о жуткой
силе этих наиболее опасных из извесгных нам химических реак-
ций.
16
Предисловие ко сторому немецкому изданию
Равным образом и в прикладной части увеличено число при-
меров из практики; особенно это относится к новому разделу о
подводных взрывах. Опираясь на собственные и на официаль-
ные опыты, удалось разрешить один из важнейших вопросов,
каким является недостаточная восприимчивость динамита к де-
тонации. Особое .внимание уделено также вопросам внутрен-
ней балистики (снаряды и порох) и всем явлениям, связан-
ным с нею; это сделано с целью представить в сжатой форме
командному составу все известное и новое в этой области.
В заключение я выражаю свою благодарность всем предприя-
тиям и официальным учреждениям, оказавшим мне содействие
при составлении настоящего труда — отделению взрывчатых
веществ Государственного химико-технического института'в Бер-
лине, Laboratoire central des Poudres и Laboratoire de la Comission
des Substances explosives в Париже, Bureau of Mines в Вашингтоне,
германским, французским, итальянским, английским, польским,
шведским и американским фирмам, ознакомившим автора с со-
временным состоянием техники, Швейцарскому военному депар-
таменту, а также д-ру К. Рубину, директору Швейцарского акц.
о-ва «Шеддит и динамит» и инж. Э. Шейкеру, директору акц.
о-ва «Лонцаверке», любезности которых обязано помещение
в книге некоторых ценных материалов.
Д-р Альфред Штетбохер
Цюрих, февраль 1933
ПОРОХА И ВЗРЫВЧАТЫЕ
О ВЕЩЕСТВА
u> i
£ СЭ ч
ж
ВВЕДЕНИЕ
Дымный (черный) порох — первый из ставших известными
порохов и взрывчатых .веществ—является поздним достижением
нашей эры. До этого человек не имел понятия о развитии
силы, которое мы в настоящее время так выразительно назы-
ваем словом «взрыв». Непонятным и бессмысленным казался бы
ему тот факт, что1 вещество, внешне ничем не отличающееся от
прочих, от одного простого накола острием булавки или воздей-
ствия маленькой искры могло бы внезапно развить разрушитель-
ную силу. Ни древние греки, ни римляне не знали другого
грома, кроме грома, сопровождающего удар молнии, и спокой-
ствие тех минувших времен нарушалось лишь извержением вул-
кана или падением метеора. Конечно эти явления наблюдались
со страхом:; они даже прерывали обычное течение жизни, но
мысль самопроизвольно вызвать молнию и гром считалась бы
тогда сумасбродной и богопротивной. Поражение противника
с далекого, безопасного расстояния смертоносной пулей или
ядром показалось бы античному воину возмутительной тру-
состью. Однако если бы воины того времени внезапно пере-
неслись в нашу эпоху, то они быстро и основательно освоились
бы с современным оружием, ибо пороха и взрывчатые вещества
являются символом! высшей энергии и готовности к действию и
долго еще останутся таковыми.
С исторических времен оружие и военное дело находятся на
уровне современной им техники. От дубины древнего человека^
отравленной стрелы дикаря, меча античного воина и через сред-
невековый порох развитие средств войны приводит к современ-
ной артиллерии, пользующейся бризантными взрывчатыми веще-
ствами, и наконец к боевым химическим веществам.
Сила искусственного взрыва еще долго не достигнет масшта-
бов разрушительных сил природы, и даже катастрофические
взрывы, например величайший в истории взрывчатых веществ
взрыв в Оппау в 1921 г. лишь в очень слабой степени напоминают
извержения вулканов и обвалы гор.
В Оппау взлетел на воздух склад, в котором хранилось 4500 т.
искусственных удобрений {смесь нитрата и сульфата аммония).
Выделившаяся при этом взрыве энергия исчисляется
в 1143 млн. б. кал, что в пересчете на механическую работу со-
ответствует 485 млрд. кгя. Однако эта работа составляет лишь
2*
20
Введение
немного больше 1/80 работы обвала большой горы, а при сра-
внении с еще более мощным выделением энергии при изверже-
нии вулкана она едва достаточна для того, чтобы нагреть кусок
гранита кубической формы с ребром 10 м до 1000° и подбросить
его на высоту в 1000 м. Если человек когда-нибудь сможет
искусственно воспроизводить силу, равную силе землетрясения
или наводнения, то он, надо полагать, будет употреблять ее ра-
зумно и с чувством ответственности по отношению к себе подоб-
ным.
Маловероятно, чтобы взрывчатые вещества, помимо того ис-
пользования, которое они нашли до настоящего времени, были
применены для особенно крупных целей. Все признаки говорят
за то, что в дальнейшем они не будут играть ведущей роли
в мировом энергетическом хозяйстве. Если взрывчатые вещества
рассматривать с точки зрения абсолютного количества энергии,
то развитие их вскоре достигнет максимума, после чего, начнется
эпоха другой, более совершенной формы энергии, возможно эле-
ктричества, но в иной, доселе еще совершенно неизвестной
форме разряда. Однако еще до этого место снарядов займут
ракеты, обладающие гораздо большей скоростью полета, кото-
рые, подобно метеорам, понесут «газ», «огонь» и «взрыв» во все
уголки земного шара.
ГЛАВА ПЕРВАЯ
ИСТОРИЧЕСКИЙ ОБЗОР
1. Дымный (черный) порох
История пороха теряется во мраке давно минувших веков,
и его изобретение связано с легендами. Не подлежит сомнению,
что порох не был открыт одним лицом; скорее всего, секрет его
состава, еще до того как вообще возникла мысль об использо-
вании движущей силы пороха, за долгое время прошел через
многие руки, пока наконец вследствие какого-нибудь происше-
ствия, может быть случайного, порох стал широко известен.
И с именем человека, который непосредственно столкнулся
с этим случаем или сообщил о нем, стали в дальнейшем связы-
вать факт изобретения пороха.
Так приблизительно можно представить себе «изобретение»
дымного пороха. Ибо ход развития пороха и отсутствие в те
времена химических познаний говорят за то, что подобный
состав ни случайно, ни закономерно не мог быть делом рук
одного человека. Это подтверждают также исторические данные.
Порох происходит вероятно от «греческого огня», который был
изобретен Калли никое ом в 671 г. и состоял невидимому
из серы, соли, смолы, асфальта и жженой извести. Согласно
новейшим исследованиям Фельдгауза такие смеси выбрасы-
вались под давлением из специальных приспособлений и, сопри-
касаясь с водою, разогревались, причем теплота гашения извести
быстро испаряла часть горючих веществ, которые в смеси с воз-
духом взрывали. Византийские императоры хранили тайну этого
огня и употребляли его на протяжении столетий. Всем таким го-
рючим и дымовым смесям нехватало однако существенной со-
ставной части, а именно селитры, благодаря которой возможно
горение внутри смеси без доступа воздуха.
Сведения о селитре и ее свойстве поддерживать интен-
сивное горение появились впервые в VIII столетии. Но вероятно
лишь в XII или XIII столетии пришли к мысли прибавлять к горю-
чим смесям селитру в целях повышения интенсивности их горе-
ния и затруднения тушения; по крайней 1мере из описания войн
XIII столетия можно узнать, что уже в то время применялись
Дефлагрирующие, т. е. самовозгорающиеся омеси.
Так, Марк Грек, грек из Византии, упоминает в своей
22 Исторический обзор
знаменитой книге по пиротехнии «Liber ignium ad comburendos
hostes», написанной около 1250 г., о чем-то вроде картузных за-
рядов и ракет, .которые с большой силой бросали в ряды неприя-
теля, вызывая ужас огнем и производимым ими треском.
В 1279 г. египетский чернокнижник Альмарко ясно говорит
о «факелах, обвязанных шнуром, которые производят шум,
подобный страшной молнии, и извергают огонь, все разбивают,
зажигают и испепеляют». Подобное действие может произво-
дить только смесь, содержащая селитру.
К этому времени, приблизительно около 1300 г., и появилась
невидимому мысль, что громоподобную силу взрыва такого фа»
кела можно использовать для метания его самого; и тот, кому
впервые пришла эта Идея, должен в известной степени считаться
изобретателем пороха.
Одно из первых доказательств применения такого напоминаю-
щего орудие устройства мы находим в английской живописи
1326 г„ между тем как первые достоверные указания о приме-
нении огнестрельного оружия в Германии относятся к 1331 г.
Немецкий бернардинский монах Бертольд по прозванию
Шварц (Черный), который во многих литературных источниках
упоминается как изобретатель пороха,, жил позднее; он распро-
странил сведения о метательных свойствах пороха и работал над
его применением (около 1388 г.,). Равным образом неоднократно
упоминаемый в связи с этим английский доминиканский монах
Роджер Бекон1 хотя и знал еще ранее о существовании по-
роха, но был знаком только со взрывчатыми, а.ие с метатель-
ными свойствами пороха. Он и его современник, ученый Альбер-
тус Магнус, были вероятно первыми западноевропейскими
информаторами по этому вопросу (1257 г.). Правда, несколько
ранее, в 1232 г. —как считают в настоящее время историки — ки-
тайцы будто бы применяли для снаряжения бомб смеси, подоб-
ные дымному пороху, состоявшие из селитры, серы и угля.
«Заводское» производство пороха в то время велось только
вручную. Развитие производства шло медленно и оставалось
вначале секретом оружейных мастеров; пороховые мельницы по-
явились лишь в середине XV столетия. Поэтому сообщения
о том, что уже в 1340 г. в; Аугсбурге и в 1344 г. в Шпандау име-
лись пороховые мельницы, являются ошибочными. Не доказано
также, что англичане первые пользовались артиллерией в битве
при Креси в 1346 г. Однако порох — «дело рук дьявола», как
его называли теологи,—был распространен в Европе уже давно,
и основы военного дела быстро, как бы движимые магической
силой, преображались коренным образом. Неприступные твер-
дыни рыцарства пали под ударами ядер, метавшихся с далеких
расстояний, гордые замки были разрушены, и над развалинами
1 По транскрипции Штетбахера «Roger Васо»; англичане, например
Маршалл (Explosives, т. I, стр. 15, 1917 г.), пишут «Roger Bacon». Мы при-
держиваемся английской транскрипции. Прим. ред.
I. Дымный (черный) порох
23
средневековья занялась заря Возрождения. Сила пороха была
предвестником новой эпохи, оглашаемой грохотом пушек.
В первые столетия своего существования .порох носил назва-
ние Krut или Kraut; это название и по настоящее время употре-
бляется в некоторых странах1. Kraut и Log равнозначащи «по-
роху и свинцу». Современное название «порох» (Pulver) было
тогда неизвестно; впервые стали говорить о порохе, когда
с прогрессом' производства пороха измельчение и перемешивание
составных частей — пульверизация — стали более тонкими. Это
Рис. 1. Воспламенение заряда
в XVIII столетии (по Н а у к-
г о ф у):
1—направляющий шнур; 2—зажига-
тельная трубка; 3—серный фитиль.
4—оболочка фитиля; 5—забойка; 6—по-
рох.
название сохранилось и тогда,
когда с 1525 г. во Франции на-
чали «зернить» порох.
Подобно открытию пороха, его
усовершенствование также длилось
столетия. Многочисленные опыты
привели постепенно к более це-
лесообразному изменению соста-
ва пороха. Попутно с этим шла
и очистка селитры. Позднее, к кон-
цу XVIII столетия, Бертолле
методически занимался изысканием
наилучшего соотношения компо-
нентов и подошел к современному
составу.
Около трех столетий порох
служил исключительно для воен-х-
ных целей. Самое раннее сообще-
ние о, его промышленном приме-
нении, или, как говорят в на-
стоящее время, о применении в ка-
честве «гражданского» взрывчато-
го вещества, относится к 1627 г.,
когда тирольский горняк Каспар
В е й н д л ь произвел первые
опыты взрыва в одном венгерском руднике. Преимущества
такого способа перед тяжелым трудом до того подкупали, что,
несмотря на прерванные вследствие 30-летней войны культурные
сношения, этот способ -стал применяться с 1632 г. в Гарце,
с 1645 г. в’Саксонии и с 1670 г. в Англии. Особенно рано взрыв-
ной метод стал будто бы практиковаться и в Швеции, а именно
в 1635 г. немецкими горнорабочими на серебряных рудниках
в Назафьелле. Вскоре подрывные работы получили широкое
распространение на строительстве дорог и тунне-
л е й, как например во Франции при строительстве туннеля
Мальпа в 1679 г. и особенно в Швейцарии в 1696 г., где древняя
Бергинерская тропа была расширена в Альбульскую дорогу,
Например в Швеции и Голландии. Прим. ред.
24
Исторический обзор
а в 1707 г. был взорван Урнерлох у Сен-Готарда. Очевидные
затруднения представляло воспламенение заряда. Вместо совре-
менного бикфордова шнура в то время пользовались или палоч*
ками, обмазанными пороховым тестом, или запалами в виде вы-
сушенных и свернутых в тонкую трубочку бумажных полосок,,
в которые вводился медленно горящий серный фитиль — хлоп-
чатобумажная нить, пропитанная жидкой серой, служившая для
проводки огня. В тех случаях, когда требовались особые меры
предосторожности при взрыве, фитиль поджигали с помощью
горящей трубки, наполненной серой, селитрой и порохом; такую
трубку опускали к шпуру по шнуру из-за надежного прикрытия.
Уже в 1683 г. появляется нечто вроде буровой машины,
благодаря чему применение пороха было значительно облегчено-
и усовершенствовано. Тогдашние шпуры были однако очень
мелки и имели лишь 15—20 j/ити в диаметре. Дальнейшие усовер-
шенствования техники подрывных работ относятся к XIX столе-
тию: в 1804 г. произведено первое электрическое паление X а-
стелем в Коновице (Австрия). Еще раньше, в 1744 г., сотруд-
нику Берлинской академии Лудольфу удалось воспламенить
серный эфир с помощью электрической искры; в 1831 г. Бик-
форд изобрел столь долгожданный зажигательный шнур,,
а в 1854 г. Брайтон и Бартлет применили для пуска
буровых машин сжатый воздух.
II. Открытия в переходную эпоху алхимии
Из изложенного видно, что дымный порох более 500 лет был
единственным известным порохом и взрывчатым веществом.
Даже алхимики XVII столетия, производившие бесконечные
опыты, не сумели натолкнуться на новую взрывчатую смесь или
взрывчатое соединение. Единственное исключение составляет
впрочем гремучее золото, которое было открыто, воз-
можно, уже в XV столетии и впервые в 1609 г. упоминается в со-
чинениях алхимика Иоганна Тёльде из Франкенгаузена.
Немецкий монах Базилиус Вален тину с, с именем кото-
рого раньше связывали открытие гремучего золота, по послед-
ним исследованиям является мифической личностью; это имя
служило лишь псевдонимом Тёльде, стремившегося придать
своим сочинениям оттенок исторической давности и таинствен-
ного происхождения (Фе ль дг а уз). С этого времени большин-
ство алхимиков занялось гремучим золотом (Aurum tonitruans);
гремучее золото в отличие от дымного пороха уже тогда явля-
лось представителем того класса взрывчатых веществ, которые
в настоящее время называются бризантными. В последующие
века это вещество и способ его приготовления были снова за-
быты.,
Лишь после того, как были разбиты оковы средневековья и
химия как наука постепенно начала выходить из тьмы схола-
стики, благодаря открытию новых взрывчатых веществ исключи-
II. Открытия в переходную эпоху алхимии
25
тельной роли пороха удалось положить конец. В связи с откры-
тием хлора Шееле, Бертолле (1748—1822 гг.) открыл
в 1786 г. хлорную кислоту и ее соли. Вскоре он указал на значе-
ние хлората калия (Muriate suroxigene de Potasse) для за-
мены селитры и совместно с де-Б ю й о н о м приготовил из него
первые взрывчатые вещества. На пороховом заводе в Эссоне
была сделана первая попытка приготовить значительные коли-
чества хлоратного пороха; однако уже в 1788 г. во время осмотра,
завода изобретателем совместно с Лавуазье произошел
взрыв, которым два человека было убито.
В том же году, 24 мая, Бертолле представил Париж-
ской академии наук свое второе сенсационное открытие; это
было черное гремучее серебро, названное его именем
и полученное Бертолле за год до того выпариванием аммиачного-
раствора азотнокислого серебра. С открытием гремучего серебра
мир приобрел в т о р о е взрывчатое вещество, обла-
давшее чрезвычайно опасными, в то время неслыханными свой-
ствами. В том же 1788 г. Гаус май открыл пикрино-
вую кислоту, после того как Вульфе, 'обрабатывая ин-
диго азотной кислотой, еще в 1771 г. получил желтую жидкость,
которая окрашивала полотно и шелк. Г а ус ма н обратил вни-
мание на характерные свойства полученного таким образом ве-
щества, отметил его горький вкус и кислый характер; однако он
не предвидел, что 100 лет спустя эта желтая масса будет служить
для снаряжения снарядов. В 1799 г. Вельтер, обрабатывая
шелк азотной кислотой, впервые получил чистую кристалличе-
скую пикриновую кислоту; он выделил также ее калиевую солы
и отметил, что она дает вспышку при нагревании.
К этим открытиям в области взрывчатых веществ в самом
конце столетия присоединилось неожиданное открытие гре-
мучей ртути, сделанное английским алхимиком Го в а р-
д о м. Задавшись целью приготовить «перекисную хлористую*
соль ртути», он подверг взаимодействию три вещества — ртуть,
азотную кислоту и спирт — и при бурном кипении жидкости по-
лучил тяжелый серый кристаллический порошок, который от
удара и пламени взрывал с ни с чем не сравнимой силой; это*
была гремучая ртуть. С открытием гремучей ртути химия овла-
дела наконец настоящим взрывчатым веществом, во всех отно-
шениях значительно превосходившим дымный порох Ч
Судя по различным сообщениям, очень вероятно, что гре-
1 Штетбахер не указывает источника, из которого он заимствовал выра-
жение «uberoxydiertsalzsaures Quecksilber», буквально переведенное на рус-
ский язык как «перекисная хлористая соль ртути»; выражение непонятно.
Согласно литературным первоисточникам, Philos. Transact, of the Royal Soc. of
London 90, 1, 204 (1800) и др., обстоятельства, при которых была открыта
гремучая ртуть, таковы. Говард хотел получить хлористую ртуть. По по-
нятиям того времени всякая кислота, в том числе и соляная, должна бы со-
держать водород и кислород и на этом основании хлор считался кислород-
ным соединением (простым телом он признан Деви только в 1810 г.); еле-
26 Исторический обзор
мучая ртуть уже значительно раньше (в 1660 г.) была получена
голландским алхимиком по фамилии Дреббель .при приго-
товлении «ртутной эссенции», которая в то время находила себе
применение в качестве важного лекарственного средства против
новой болезни—сифилиса. Дреббель знал также и о грему-
чем золоте, которое К р о л л ь упоминает в своем сочинении
«Basilica chimica» (1608 г.) под названием Aurum fulminans.
Вскоре после открытия Говарда (1799 г.) Б ip у н ь я т е л л и
в 1802 г. получил совершенно таким же путем гремучее се-
ребро, которое по своим опасным свойствам превосходило
ртутное соединение.
Шум, который (произвели эти вещества в ученом мире, по-
дал повод Бертолле также заняться ими. Уже в 1815 г.
изучение гремучей ртути продвинулось настолько, далеко, что
ее смогли применить в качестве ударного состава в капсю-
лях. Не успел утихнуть шум, вызванный открытием Говарда, как
в 1811 г. распространилось известие о новом жутком по своей
силе взрывчатом веществе; открытие стоило изобретателю глаза
и трех пальцев: это было «взрывчатое масло Д ю л о н г а», тяже-
лая жидкость от желтого до коричневого цвета, оказавшаяся
впоследствии хлористым азотом и обогатившая химию
одним из опаснейших соединений. В 1829 г„ Серюлля полу-
чил еще более чувствительный йодистый азот, а в 1837 г.
Субейран открыл сильно взрывчатый, но стойкий сер-
нистый а зот великолепного оранжевого цвета.
Между тем ни попытка применения хлоратного пороха, ни
использование гремучей ртути для воспламенения пороха не сде-
лали нового вклада в технику взрывчатых веществ. Дымный по-
рох неоспоримо господствовал попрежнему; более того, изобре-
тенный Бикфордом в 1831 г. шнур вызвал новый гро-
мадный подъем в (промышленном применении дымного пороха.
Лишь после того, как мощный прогресс, являвшийся результа-
том развития теоретической химии, привел к получению взрыв-
чатых соединений путем непосредственного действия азотной
кислоты на органические вещества, могли появиться новые тех-
нические перспективы.
Первые попытки этого рода принадлежат французскому хи-
довательно из водорода и кислорода через посредство третьего тела можно
было получить соляную кислоту, а'затем хлористую ртуть. На этом основа-
нии Говард взял в качестве водородистого соединения винный спирт, сме-
шал его не со ртутью, как сказано у Штетбахера, а с красной окисью ртути
(кислородсодержащее соединение) и подействовал на эту смесь азотной
кислотой. В результате бурной реакции между указанными веществами
образовалась гремучая ртуть, которую Говард считал соединением «эфир-
ного селитренного газа» (nitrous etherized, современный этилнитрит) со ща-
велевокислой ртутью и кислородом. Бертолле, Biblioth. Britannique 2, 18,
250 (1801) Bulletin des sciences de la Soc. philomath. № 56, на основании своих
исследований, считал, что гремучая ртуть состоит из «сильно окисленной»
ртути, как это имеет место в сублимате аммиака и какого-то органического
вещества, но не щавелевой кислоты. Прим. ред.
III. Бризантные взрывчатые вещества
27
Мику Б рак он но, который в 1832 и 1833 гг. занимался иссле-
дованием действия концентрированной азотной кислоты на крах-
мал, сахар, древесину и пр. и при этом получал легкогорючие
вещества, которые он назвал к с и л о и дин ам и. Пелуз про-
должил те же опыты В' 1838 г. в {Париже, но ни он, ни его пред-
шественник не дали взрывной технике каких-либо практических
результатов.
Тем временем нитрование органических веществ становилось
все более распространенным и общеупотребительным процессом.
В 1834 г. Митче р лих получил нитробензол, в 1835 г. был
получен нитронафталин, а в 1843 г. Лоран впервые синтети-
чески приготовил пикриновую кислоту из фенола и азотной кис-
лоты. Было вполне естественно испытать действие азотной кис-
лоты на всевозможные другие вещества, чтобы таким образом
получить особые соединения, в которых азотная кислота явля-
лась бы уже не механической примесью в форме селитры, как
например в дымном порохе, а вела бы к образованию таких хи-
мически однородных веществ, молекулы которых способны к со-
вершенному внутреннему горению. Так подошел 1846 г.,
когда почти одновременно были открыты два первые мощные
бризантные взрывчатые вещества: нитрогли-
церин и п и р о к с и л и н.
у
III. Бризантные взрывчатые вещества
Нитроглицерин был открыт в'1846 г. итальянцем А скан и о
С о б р е р о (1812—1888 гг.) в Турине. Будучи ассистентом зна-
менитого Пелуза, он занимался нитрованием, а затем в качестве
профессора химии самостоятельно работал в области «гремучих
веществ». Первое сообщение о нитроглицерине, названном им
пироглицерином, помещено в журнале «L’Institut» от
15 февраля 1847 г.; в этом сообщении были уже описаны важ-
нейшие данные о приготовлении нитроглицерина, а также наи-
более важные его свойства. Собреро сознавал значение своего
открытия и не преминул рекомендовать открытую им взрывча-
тую жидкость для применения в технике. Однако трудности и
опасность технического производства считались тогда настолько
серьезными, что изобретатель жидкого нитроглицерина отдал
предпочтение своему открытому несколько лет позднее твердому
н и тр о м аяни ту, не добившись однако и в этом случае прак-
тического результата. Первые 200 г нитроглицерина, полученного
Собреро, до сих пор хранятся как достопримечательность на ста-
рейшем итальянском динамитном заводе в Авильяна, близ Ту-
рина; там же в честь Собреро воздвигнут скромный памятник.
В то время как для скрытой энергии нитроглицерина не уда-
валось найти применения, этим .веществом под названием г л о-
н о и н завладела медицина, и оно вышло в большинство совре-
менных фармакопей в качестве средства от головокружения и
28
Исторический обзор
сердечных болезней. Только 20 лет спустя, (преодолев невыра-
зимо большие препятствия, благодаря непреклонной энергии
одного молодого человека удалось превратить забытый нитро-
глицерин во всемирно известное взрывчатое вещество.
Этим человеком был швед Альфред Нобель, а его
взрывчатым веществом — динамит.
Альфред Нобель (произносится Нобель) происходил
из старинной шведской крестьянской семьи и родился 31 октября
1833 г. в Стокгольме; он был третьим из четырех своих братьев.
Его отец Эммануил Нобель (1801—1872 гг.) был сам
изобретателем и работал в частности в области взрывчатых ве-
ществ. В 1859—1861 гг. Нобель и его отец занимались открытым
Собреро нитроглицерином и пришли к убеждению, что это веще-
ство станет взрывчатым веществом будущего. Они усовершен-
ствовали процесс получения нитроглицерина, ранее называвше-
гося «пироглицерином», затем «глоноиновым маслом» и позже
«взрывчатым маслом Нобеля». Уже в 1862 г. Нобелю посчастли-
вилось взорвать смесь пороха и нитроглицерина под водой. Не-
большая ссора с отцом, который считал себя изобретателем
смеси, была улажена, и патент был присвоен сыну. Это новое
взрывчатое вещество стало изготовляться для продажи на фа-
брике отца в Геленеборге, около Стокгольма; однако уже осенью
1864 г. произошел взрыв, во время которого был убит младший
брат Нобеля и один сотрудник-химик. После этого Нобель про-
должал опыты на пароходе, стоявшем на якоре на Меларском
озере, и, после того как ему на основе практических успехов
удалось найти финансовую поддержку, в Крюммеле, у Гамбурга,
в 1865 г. был основан завод Alfred Nobel & Cie, из которого вырос
современный завод о-ва «Динамит». В этом и следующем году
мы видим Нобеля, занятого публичным демонстрированием под-
рывов, выступающего с докладами, доказывающего в журналах
и проспектах преимущества своего «патентованного взрывчатого
масла» по сравнению с дымным порохом. Он энергично пере-
ходит затем к основанию обществ и заводов для реализации
своих патентов. Уже в 1865 г. был построен второй завод в Вин-
тервикене, близ Стокгольма, в 1866 г. — в Норвегии, в 1868 г.—
в Калифорнии и в Замки, близ Праги. С этих пор производство
нитроглицерина распространяется все более и более; кроме су-
ществовавших заводов в ближайшие 5 лет были построены еще
десять: в 1870 г. — в Ганге (Финляндия): в 1871 г. — в Ардире
(Шотландия) и в Полилле (Франция); в 1872 г. — в Шлебуше
(около Кёльна) и в Бильбао (Испания); в 1873 г. — в Нью-Йорке,
в Ислетене (Швейцария), в Авильяна (около Турина), в Тра-
фальде (около Лиссабона) и в Прессбурге (Венгрия).
В первые годы призводства нитроглицерина Нобель применял
его в жидком виде, непосредственно заливая в шпур, или же
в случае горизонтально или наклонно расположенных шпуров
заключал в специальный закрытый пробкой патрон, вводив-
III. Бризантные взрывчатые вещества
29
Рис. 2. Ни-
троглицери -
новый пат-
рон с запа-
лом из ды-
много поро-
ха:
I— зажигатель-
ный шнур;
2—-деревянная
колодка; 3—
дымный порох;
4—пробка;
б—нитроглице-
рин.
тийся в шпур. Первоначально особые затруднения заключались
в том, чтобы безопасно и нацело взорвать нитроглицерин. Но
даже и тут Нобель скоро оказался изобретателем. Он сконструи-
ровал так называемый патентованный запал, который
содержал сначала дымный порох, затем порох и гремучую
ртуть и наконец одну гремучую ртуть. Одна из первых кон-
струкций такого рода, относящаяся в 1864 г., показана на
рис 2. После многочисленных изменений Нобель пришел к сча-
стливой мысли заменить инертный дымный порох
более интенсивно гремучей ртутью, с тем
чтобы усилить начальный импульс, так называемое
инициирование. Для этой цели он воспользовал-
ся употреблявшимся еще с 1815 г. ружейным кап-
сюлем, усилил его' заряд и сконструировал из него
гремучертутный капсюл ь-д е т о н а т о р,
описанный им впервые 7 мая 1867 г. в английском
патенте 1345.
С появлением этого изобретения и открытием
факта, что посредством гремучей ртути в качестве
инициирующего заряда взрывчатая сила нитрогли-
церина, пироксилина и многих других веществ мо-
жет быть возбуждена по желанию, благодаря
Нобелю стало возможно применение бризант-
ных взрывчатых веществ и тем самым
достигнуты величайшие успехи со времени введения
дымного пороха.
Применение жидкого взрывчатого (вещества,
каким является нитроглицерин, представляет для
подрывных работ, а также для транспорта и для
хранения большие неудобства. В целях пони-
жения чувствительности нитроглицерина к удару
и толчку Нобель еще ранее пытался раство-
рять его в метиловом спирте и затем вы-
делять его из раствора путем добавления воды.
Однако этот способ оказался слишком громозд-
ким, и Нобель пытался превратить нитроглицерин
путем смешения с твердыми веществами в масля-
нистую вязкую массу, способную принимать форму
патрона. Эту задачу ему и удалось довольно удачно разре-
шить в 1867 г. путем применения кизельгура, чрезвычайно
пористой инфузорной земли, которая в сухом виде легко адсор-
бирует до 75% нитроглицерина. Такую вязкую пластичную
массу Нобель назвал динамитом, что должно было отра-
зить необычайную мощь, присущую этому веществу, которому
ничто не может противостоять. Это название было пе-
вещСеН° И На ВСе поздне^шие нитроглицериновые взрывчатые
Гур динамит имел все же еще некоторые недостатки: прежде
30
Исторический обзор
всего, нитроглицерин из него легко извлекался водой, и кроме
того 25% содержащегося в нем кизельгура составляли негорю-
чую часть, которая не участвовала во взрыве и помимо того
поглощала часть освобождающейся энергии в виде тепла. По-
этому необходимо было найти активное вещество, которое само
участвовало бы во взрыве. Соревнуясь со многими другими хи-
миками, Нобель после многих тщетных попыток открыл наконец
в 1875 г., что нитроглицерин при добавлении 7—8% нитроклет-
чатки превращается в пластичную, подобную резине, массу,
которая удерживает нитроглицерин даже под водой и соединяет
в себе почти все свойства идеального взрывчатого вещества. Эта
вязкая, эластичная, полупрозрачная желатина желтого цвета
была названа Нобелем гремучим студнем. Открытием этого
мощного состава было получено взрывчатое вещество, не пре-
взойденное по своей работоспособности и по настоящее время,
почти незаменимое в строительстве туннелей.
Нобель дал кроме того столь же много обещавший вариант
этого выдающегося открытия в форме так называемого жела-
тинированного масла — вязкой желатины, которая содержала
только 3—4% коллодионного хлопка и была в состоянии погло-
щать до 60—70% посторонних веществ; желатина стала осно-
вой целого класса пластичных взрывчатых веществ, которые под
названием желатин дин амито в нашли широчайшее распро-
странение. Особо следует упомянуть э к с т р а д и н а м и т, ко-
торый Нобель получил в 1879 г. .прибавлением аммиачной се-
литры к 70% желатинированного нитроглицерина, после того
как шведы Ольгой и Норбин открыли аммяачносе-
л и т р е н н ы е взрывчатые вещества. Эти исследова'-
тели, исходя из теоретических предпосылок, предложили смесь
аммиачной селитры и угля (вместе с другими углеродистыми ве-
ществами) и в 1867 г. запатентовали ее под названием Ammo-
niakkrut («аммиачный порох»). Это вещество рассматривается
как прообраз позднейших безопасных взрывчатых веществ.
Нобель оказался достаточно дальновидным, чтобы оценить
значение, которое могла иметь подобная смесь, и купил у своих
соотечественников этот патент, после чего дал комбинацию
в виде прекрасных _аммонжелатиндинамитов. На этой
значительно более жизнеспособной основе началось составле-
ние ряда взрывчатых веществ, которые в качестве б е з о п а с-
н ы х в о б р а щ е н и и ив качестве антигризутных веществ при-
обретали все возрастающее значение.
Между тем назрело уже новое требование к взрывчатым ве-
ществам, исходившее от каменноугольной промышленности: во-
прос шел об антиг р и з у тн о ст и, т. е. о способности
взрывчатого вещества воспламенять или не воспламенять при его
взрыве в шпуре каменноугольную пыль и взрывчатые смеси руд-
ничного газа. Стало известно, что многие несчастные случаи от
взрыва рудничного газа в угольных копях являются следствием
111. Бризантные взрывчатые вещества
ЗГ
производства подрывных работ и в частности результатом высо-
кой температуры пламени взрыва; были образованы государ-
ственные антигризут.ные комиссии (Франция — 1877г.,
Англия и Бельгия — 1879 г., Германия — 1880 г.), которые при-
ступили к теоретическим и практическим исследованиям в этой
области и на основании опытных данных установили совершенно-
определенные нормы антигризутности взрывчатого
вещества. Практическим следствием этих новых норм было
производство экстрадинамита Нобеля, состоящего из
70—80% аммиачной селитры, 12—30% желатинированного нитро-
глицерина, и сходного по составу гризутина, потребление-
которого сильно возросло во Франции и Бельгии. От этих анти-
гризутных желатиндинамитов Нобеля берут свое начало появив-
шиеся впоследствии карбониты и ваттердинамиты,
между тем как в 1884 г. во Франции в качестве взрывчатых ве-
ществ нежелатинированного типа употреблялись антигризутные
«взрывчатые вещества Ф а в ь е», содержавшие около 90% амми-
ачной селитры и 10% нитронафталина.
Своеобразное, хотя и временное значение приобрели с 1873 г.
взрывчатые вещества Шпренг ел я. Они составлялись из ды-
мящей азотной кислоты и предварительно пронитрованного угле-
водорода, например нитробензола, которые смешивались на месте-
потребления. Несмотря на безопасность изготовления и обраще-
ния и большую взрывчатую силу, эти чрезвычайно едкие смеси
могли иметь, понятно, только теоретический интерес. Не боль-
ший успех имела замена азотной кислоты хлоратом калия: пори-
стые лепешки или кубики из этой соли пропитывались горючими'
жидкостями, например нитробензолом или сероуглеродом. Ра-
боты Шпренгеля оказали однако чрезвычайно плодотворное
влияние на промышленность того времени, и его продукты
являются предшественниками позднейших хлоратных и
перхлоратных взрывчатых веществ.
Пример того, как Шпренгель сумел благодаря своей настой-
чивости расположить общественное мнение в пользу своих «не-
возможных» взрывчатых веществ, подал в 1879—1880 гг. Гель-
гофу мысль запатентовать смесь 1 ч. динитробензола в Рд ч.
дымящей азотной кислоты; эта масса, залитая в стеклянные со-
суды, должна была служить для снаряжения снарядов. Руково-
дясь подобными же, но более практичными соображениями,
Тюр пен в 1881 г. пытался заменить азотную кислоту менее'
агрессивной, но более летучей жидкой двуокисью азота. Однако
ни смесь с нитробензолом, ни смесь с сероуглеродом — пан-
кластит Тюр пена — не были приняты французским воен-
ным министерством; и только- лишь 35 лет спустя, в разгар миро-
вой войны, Тюрпен стал свидетелем возрождения его забытых
взрывчатых смесей для снаряжения смертоносных авиационных
бомб.
Нобелевские взрывчатые вещества быстро распространились,
32
Исторический обзор
и их потребление увеличивалось из года в год: в то время как
в 1867 г. было продано только Пт динамита, потребность
в 1874 г. достигла 3120 т. Гремучий студень впервые был приме-
нен при постройке Сен-Готардского туннеля и дай отличные ре-
зультаты.
Зато как боевые взрывчатые вещества нитроглицериновые
препараты, за исключением временно состоявшего на вооруже-
нии в Австрии1 камфорированного гремучего студня, не
имели никакого успеха. Это объясняется их чувствительностью,
а также тем фактом, что в результате старения их бризантность
уменьшается; наконец не последнее значение имело то обстоя-
тельство, что у нитроглицерина появился сильный конкурент,
который непосредственно после своего открытия стал при-
меняться для чисто военных целей и имел за плечами солидную
производственную практику уже тогда, когда Нобель только что
приступал к работе над забытым нитроглицерином Собреро.
Речь идет о пироксилине или нитроклетчатке.
Пироксилин был открыт в начале 1846 г. Шёнбейном
(1799—1868 гг.) в Базеле. Работая над активным кислородом,
ГНёнбейн, действуя смесью концентрированной серной и азотной
кислот на вату, получил препарат, который из-за его взрывчатых
свойств Шёнбейн назвал пироксилином. Занимаясь аналогич-
ными исследованиями, Б ё т х е р во Франкфурте-на-Майне не-
сколькими неделями позже, также получил пироксилин, и оба
исследователя вскоре объединились, чтобы сообща реализовать
свое открытие. В том же году они заключили соглашение с ан-
глийской фирмой Галланд в Фавершаме, которая рядом со сво-
ими пороховыми заводами построила пироксилиновый завод. Но
уже в июле 1847 г. здесь произошел опустошительный взрыв,
уничтоживший всю установку, причем были убиты 21 чел. Это
•потрясающее происшествие, наряду с которым бледнели не-
счастные случаи с дымным порохом, заставило содрогнуться от
жуткой силы бризантных взрывчатых веществ весь мир. Подоб-
ные же несчастные случаи имели место на французских заводах
.в Буше и Венсене в 1848 г. Отголоски этих жутких происше-
ствий прокатились по всей Европе и вызвали прекращение про-
изводства пироксилина.
Владельцы первоначально хранившихся в тайне способов
производства склоняли Германский союз к покупке нового
взрывчатого средства. Переговоры однако не увенчались успе-
хом, несмотря на благоприятный отзыв Либиха. Зато Австрия
купила способ, и благодаря трудам австрийского артиллерий-
ского офицера Ленка пироксилин вскоре стал изготовляться
•в большом количестве. Но два имевших место сильных взрыва
свели на-нет благоприятные вначале результаты: в 1862 г. раз-
рушило взрывом, напоминавшим землетрясение, производство
1 И России. Прим. ред.
III. Бризантные взрывчатые вещества
33
в Гиртенберге, а в 1865 г. взлетел на воздух завод в Штейн-
фельд-Г айде.
Несчастные случаи происходили из-за недостаточной про-
мывки и последующего саморазложения нитроцеллюлозы при
хранении. Ленк уделил большое внимание тщательной от-
мывке пироксилина от остатков кислоты; пироксилин в тече-
ние 14 дней промывался водой, затем кипятился с мыльной водой
и наконец обрабатывался жидким стеклом. Но и такая обработка
не давала стабильного продукта; для этого требовалось измель-
чение волокна. В 1865 г. английский химик Эбль1 * 3, который
изучал способ производства Ленка, ввел в производство пиро-
ксилина процесс измельчения волокна, с помощью машин, служив-
ших раньше для тончайшего измельчения хлопчатобумажного
тряпья. Для того чтобы сделать мезгу пригодной для взрывных
целей, он прессовал ее на гидравлическом прессе и таким обрат-
ном получал прессованный пироксилин. Одновременно
Эбль ввел метод контроля пироксилина, основанный на опреде-
лении небольших количеств азотистой кислоты (проба
Эбля), и этим положил начало производству пироксилина,
которое с небольшими изменениями сохранилось до настоящего
времени.
Надежда Шёнбейна, что пироксилин в один прекраийяй
день заменит дымный порох (письмо Фарадею ют 25 августа
1846 г.), заставила себя долго ждать: нитроцеллюлоза пока что
нашла себе применение только в качестве взрывчатого вещества,
и притом в .сухом прессованном виде. В 1869 г. ассистент Эбля
Броун нашел, что и влажный пироксилин взрывает, если
его воспламенить с помощью дополнительного заряда сухого
пироксилина и гремучей ртути. Этим пироксилину было дано
довольно .широкое распространение, впрочем только для воен-
ных целей (заряды для торпед и мин).
В то время как в Австрии производство пироксилина в 1865 г.
было запрещено, в Англии под руководством Эбля работали
два завода: один в Стоумаркете и другой в Уэлтем-Аббей, изго-.
ловившие в 1872 г. приблизительно 250 т пироксилина. В Германии
производство пироксилина в больших количествах впервые воз-
никло в 1884 г. на пороховом заводе Ганау.
Наряду с пироксилином начала приобретать постепенно все
большее и большее значение низконитрованная целлюлоза, так
называемый коллодионный хлопок. Еще Ш ё н б е й н нашел,
что в зависимости от условий реакции можно получить пирок-
силин совершенно нерастворимый, частично растворимый и пол-
1 Frederick Abel родился в Германии, но вся его деятельность
протекала в Англии. Этой двойственностью, невидимому, и объясняется
неустойчивость русской транскрипции его фамилии (Абель и Эбль). В рус-
ской химической литературе утвердился, правда, термин «проба Абеля»;
тем не менее в этой книге переводчики придерживались транскрипции
3 б л ь. Прим. ред.
3 Зак. 3171. Штетбахер.
34
Исторический обзор
ностью растворимый в сггирто-эфирной смеси. Этот раствори-
мый пироксилин явился впоследствии исходным продуктом для
производства совершенно нового copra метательных средств —
бездымных порохов.
IV. Бездымные пороха
Первоначально спирто-эфирные растворы нитроклетчатки
употреблялись в качестве лечебного средства при ранениях под
названием Liquor sulfurico-aethereus constringens; позднее их стали
называть коллодием. В 1850 г. стала известна пригодность
коллодия для производства фотографических пластинок, что в
дальнейшем привело к производству искусственного шелка, цел-
лулоида и других искусственных продуктов.
Неожиданно большое значение нитроклетчатка приобрела
с lex пор, как Нобель в 1875 г. открыл ее раствори-
мость и способность набухать в нитроглице-
рин е и благодаря этому получил гремучий студень, явившийся
основой позднейших желатинированных взрывча-
тых веществ и коллоидных бездымных порохов.
Однако лишь в 1884 г.1 заветная мечта Шёнбейна-— превра-
тить пироксилин в пригодный для метания снарядов порох, —
нашла свое осуществление во французском ленточном порохе
Вье ля (1854—1934 гг.). Хотя базельский изобретатель и не до-
жил до триумфа пироксилинового пороха, однако юн ясно
представлял себе все значение этого химического соединения
и первый понял, что оно относится к числу веществ, способных
произвести переворот в военном деле; эта заслуга навсегда
останется связанной с его именем.
С развитием артиллерии и введением нарезных орудий (в Гер-
мании в 1861 г.) требования к старому дымному пороху возра-
стали все больше и больше. Усилия соответствующей отрасли
промышленности еще раз удержали дымный порох на высоте
его могущества, сохранявшегося за ним в течение столетий. На-
чавшиеся энергичные исследования привели к появлению приз-
матического пороха: в 1862 г. в Америке появился маммут-
порох, в 1882 г. в Германии — бурый призматический порох для
орудий. Однако все эти успехи не удовлетворяли повелительным
требованиям совершенствовавшейся техники стрельбы.
Проблема пороха носилась, так сказать, в воздухе, особенна
потому, что еще раньше производились испытания с другими
сортами пироксилинового пороха. Уже в 1858 т. в Пруссии было
изготовлено 1200 пехотных патронов с пироксилиновым зарядом,
а в 1859 г. Австрия смогла вывести в поле большое число бата-
рей, имевших пироксилиновые заряды. Однако новые пороха
действовали слишком интенсивно, слишком бурно. Тем же недо-
статком обладал и «желтый порох» Шульце, изготовленный
в 1864 г. из чистой нитрованной древесной целлюлозы. Лишь
1 В оригинале 1886 г., что неточно. Прим. ред.
IV. Бездымные пороха
35
тогда, когда развитие целлулоидной промышленности (с 1869 г.)
показало, что большая скорость горения нитроклетчатки может
быть значительно понижена и поддается регулированию раство-
рителем, эти устремления получили надежную основу для даль-
нейшего развития. В 1882 г. англичане Рейд и Джонсон
приготовили частично желатинированный пироксилиновый охот-
ничий порох. Затем, в 1884 г. появился изобретенный Дуттен-
гофером в Ротвейле полностью желатинированный зерненый
порох. Наконец в 1888 г. Нобель противопоставил чистому
пироксилиновому пороху Вьеля свой нитроглицери-
новый порох, впоследстии названный балиститом, произведя
желатинизацию равных частей нитроглицерина и пироксилина.
В следующем 1889 г. на пороховых заводах в Ганау и Шпандау
началось массовое производство немецкого пироксилинового
бездымного винтовочного пороха.
Патенту Нобеля на балистит (1888 г.) предшествовали
многолетние исследования и опыты. Открытие, что два самые
сильные'взрывчатые вещества можно смешать в такой пропор-
ции, что получается медленно горящая масса, пригодная для
целей метания, было столь изумительно, что . вначале вызвало
недоверие и было принято с величайшим удивлением. Как раз
в этом открытии Нобель показал себя снова гениальным изобре-
тателем, сумев соединить два всем известные вещества в третье,
которого никто не мог предвидеть.
Этим нововведением, произведшим переворот в вооружениях,
Нобель закончил свою деятельность изобретателя в области
взрывной техники. Общее число заявленных им патентов до-
стигло 355. В 1891 г., после 18 лет жизни в Париже, далекий от
сплетен, возникших в результате соперничества с пироксилино-
вым порохом, незадолго до этого изобретенным В ь е л е м, Но-
бель переезжает в Сан-Ремо, чтобы посвятить себя научным
изысканиям и разрешению новых промышленных проблем.
Здесь он в 1894 г. пережил последнее тяжелое разочарование,
выразившееся в приговоре английского суда по делу о кордите,
лишившем Нобеля приоритета и плодов открытия им балли-
стита.
10 декабря 1896 г. от болезни сердца преждевременно прерва-
лась неутомимая жизнь Нобеля Ч
1 Культ Альфреда Нобеля в Скандинавских странах, в Германии и не-
которых других странах имеет необыкновенно широкое распространение.
В труде Штетбахера он отражается несколько мягче, изящнее, чем у других
ученых, например Каста, но тем не менее сильна Русскому читателю, при
рассмотрении бездымных порохов, представляется односторонним такое пре-
возношение Альфреда Нобеля и наряду с этим оставление в тени, в неко-
тором забвении, умолчание о выдающихся, исключительных заслугах Вьеля,
открывшего пироксилиновый порох в 1884 г., т. е. раньше открытия нитро-
глицеринового пороха Нобелем. Вьель фигурирует обыкновенно как «поро-
ховой инженер», просто «химик», «лабораторные работы» которого дали ему
возможность предложить бездымный пироксилиновый порох, между тем
Альфред Нобель — всегда только «гениальный изобретатель».
3*
36
Исторический обзор
V. Боевые взрывчатые вещества
В то время как применение нитроглицерина и пироксилина
достигло в 80-х годах кульминационного пункта, в Париже
в области взрывчатых веществ произошло чрезвычайно важное
по своим последствиям событие: в 1885 г. Тюрпен открыл спо-
собность пикриновой кислоты к детонации. У этого вещества,
известного в течение более 100 лет и уже в течение нескольких
десятилетий производившегося заводским путем, неожиданно
были открыты свойства чрезвычайно мощного взрывчатого ве-
щества, обладающего громадной разрушительной силой при
подрыве его и прочной оболочке сильным гре.мучертутным кап-
сюлем-детонатором. Военные учреждения с лихорадочной бы-
стротой овладевали э,тим новым достижением, и вскоре пикри-
новая кислота была введена на вооружение в большинстве
государств: во Франции под названием мелинит (1886 г.),
в Англии — лиддит (1888 г.), в Японии — шимозе. Артилле-
рия была полностью преобразована и благодаря опустошаю-
щей силе бризантных снарядов лицо войны стало еще
более страшным.
Правда, пикриновая кислота и раньше входила в состав мно-
гих взрывчатых и метательных смесей, как например в порок
Борлинетто (1867 г.), пороха Дезиньоля (1867 г.), Б р ю-
жераи Эбля (1869 г.,), содержавшие наряду с хлорнокислым
или азотнокислым калием пикраты калия и аммония. Дело в том,
что по общему существовавшему тогда мнению пикриновая кис-
лота вследствие недостатка кислорода считалась способной
к взрыву только в смеси с кислородсодержащими веществами;
это мнение было поколеблено лишь после того, как Нобель
изобрел капсюль с гремучей ртутью. Этот химический или, вер-
нее, стехиометрический предрассудок настолько укоренился,
что Ш п р е н г е л ю не поверили, когда он в одном из своих до-
кладов в 1873 г. указал, что пикриновая кислота сама по себе
содержит достаточно кислорода и может явиться могучим
Нитроглицериновый порох Нобеля, по составу имеет хотя отдаленное,
но все же некоторое сходство с гремучим студнем, открытым тем же Но-
белем в 1875 г. Естественно, что приблизительно 10 лет спустя Нобелю
не могли быть чужды, хотя бы теоретически, составы, аналогичные грему-
чему студню, но в других соотношениях компонентов и следовательно,
с иными свойствами, т. е. Нобель хорошо ориентировался в них и его откры-
тие не было делом случая, а только делом знания и труда.
В том же смысле Французская академия наук дает характеристику и
работе Вьеля:
«Автор этого открытия ии в чем не обязан случаю; его глубокие по-
знания в науке взрывчатых веществ и показания лабораторных приборов
привели его прямо к намеченной им цели; с первого же балистического
опыта результаты оказались согласными с заключениями автора».
Во всяком случае открытие бездымного пироксилинового пороха Въе-
дем имело до наших дней или большее значение, чем открытие нитрогли-
церинового пороха Нобелем, или равное. Прим. ред.
V. Боевые взрывчатые вещества
37
взрывчатым веществом без помощи посторонних окислителей,
если ее взорвать капсюлем-детонатором. Таким обра-
зом лишь Т ю р п е н практически является первым исследовате-
лем, открывшим у пикриновой кислоты свойства взрывчатого ве-
щества.
Несмотря на многочисленные подкупающие преимущества
нового средства, для снаряжения снарядов — большую нечувстви-
тельность, безопасность стрельбы, высокую плотность и легкость
плавки и заливки при дешевом производстве и несложном транс-
порте, — пикриновая кислота вскоре выявила опасные свойства,
явившиеся причиной многочисленных несчастных случаев: склон-
ность к образованию очень чувствительных к удару солей, так
называемых пикратов, которые получаются при взаимодействии
пикриновой кислоты с металлическими стенками снарядов. Вслед-
ствие образования подобных детонирующих пикратов в 1887 г.
в Корнбруке, около Манчестера, произошел первый колоссаль-
ный взрыв пикриновой кислоты. Весьма неприятная
ядовитость, а также красящая способность этого вещества
побудили вскоре к изысканиям различных и прежде всего ней-
тральных заменяющих ее средств. Так, за тринитрофено-
лом последовал трияитрокрезол, который в смеси с пи-
криновой кислотой был временно введен во Франции под
названием крез и лит, а в Австрии под названием э к р а-
з и т.
Однако в большинстве государств применение крезилита не
пошло дальше опытного изучения; с его применением медлили,
потому что в то время было уже найдено несравненно лучшее
взрывчатое вещество; остановка была только за дешевым спо-
собом его производства: это был тринитротолуол —
взрывчатое вещество, ставшее во время мировой войны интерна-
циональным.
После того как Девилль в 1841 г. наряду с динитробензо-
лом получил «нитротолуол, в 1863 и 1869 гг. В и л ь б р а н д о м,
Бейль штейном и Кульбергом были изолированы два
изомера тринитротолуола. Третий изомер — симметричный
тринитротолуол, который позднее нашел себе примене-
ние в качестве взрывчатого вещества, был получен в 1880 г.
в чистом виде и с прекрасным выходом из пара- и ортонитро-
толуола Г е п п о м. В это же самое время и теми же исследова-
телями в результате кропотливых опытов был получен трини-
тробензол.
Техническое изготовление тринитротолуола относится к 1891 г.
В сотрудничестве с химическим заводом Грисгейм Г ей се р-
ман осуществил способ Геппа; однако производство в боль-
ших масштабах стало мыслимо лишь с 1900 г., когда было вве-
дено промышленное получение олеума контактным способом.
В последующие годы Бихель и Кёниг получили в виде
опыта на заводе взрывчатых веществ «Карбонит» в Шлебуше
38
Исторический обзор
несколько килограммов тринитротолуола и вскоре пустили про-
изводство в больших размерах. Примеру завода «Карбонит»
сразу последовали остальные крупные заводы взрывчатых ве-
ществ, которые начали приготовлять тринитротолуол под раз-
личными названиями (тротил, тринол, трилит, тролит). Из дру-
гих государств первая начала производить тринитротолуол
Италия (1907 г.), затем Испания и Россия, и .наконец во время
мировой войны — почти все промышленные страны.
Рис. 3. Гремучий студень.
Рис. 4. Пентринит 50/50.
Рис. 3 и 4. 250 г каждого из указанных взрывчатых веществ
подвергнуто детонации в толстостенном железном тигле на пла-
стинке из инструментальной стали толщиною 25 мм и размером
20 X 20 см.
Вследствие высокой нечувствительности (безопасности
стрельбы) этого взрывчатого вещества с его появлением стало
возможно снаряжение крупнокалиберных снарядов. Легкоплав-
кость (80°), а также механическая и химическая индифе-
рентность тринитротолуола дали возможность ввести в артилле-
рии очередное техническое усовершенствование — конструкцию
долгожданного универсального' снаряда, т. е. приме-
нение одного' и того же артиллерийского снаряда в качестве
шрапнели и гранаты 1.
Таким образом применение тринитротолуола явилось осно-
вой усовершенствования боевых припасов в отношении разрыв-
ных зарядов, однако все больше и больше давало себя чувство-
вать одно неприятное свойство этого взрывчатого вещества,
именно — неполное горение и связанные с ним относительно
малая бризантность и взрывчатая сила; вследствие этого трини-
тротолуол не мог в полной мере удовлетворять возросшим тре-
1 Как показал опыт мировой войны, универсальные снаряды утратили
всякое значение. Прим. ред.
V. Боевые взрывчатые вещества
39
бованиям подводной войны для снаряжения торпед, обладаю-
щих достаточной пробивной способностью, и применялся для
этой цели только ввиду крайней
необходимости в такого рода ору-
жии. Из этой потребности во вре-
мя мировой войны выросло про-
изводство двух высокобризантных
взрывчатых веществ, которые
в Германии уже и раньше пыта-
лись изготовлять или изготовляли
в заводском масштабе. Одно из
них — гексанитро ди фенил-
а м и н, на производство которого
заводом Грисгейм в 1895 г. был
взят патент, реализованный лишь
20 лет спустя в Круппамюле; дру-
гое—т ринитро фенил мети л-
нитрамин (тетрил), промыш-
ленное получение которого с 1905 г.
привилось на многих заводах в Германии и Франции; наконец
во время войны тетрил изготовлялся большинством участвовав-
ших !в ней государств. Оба взрывчатые вещества, особенно
обладающий исключительными взрывными качествами тетрил,
Рчс. 5. Гремучий студень (см.
рис. 3).
Рис. 6. Пентринит 50 50 (см. рис. 4).
Рис. 5 и 6. Снимок в темноте железного тигля, раздробля-
емого на пластинке из инструментальной стали (вид спереди).
в прессованном виде служили мощными запальными зарядами
для снаряжения детонаторов и капсюлей-детонаторов, а в со-
единении с легкоплавким тринитротолуолом—также и для сна-
ряжения снарядов, бомб, мин и торпед.
40
Исторический обзор
Дальнейшее развитие со времени окончания мировой войны
характеризуется применением оксиликвидных взрывчатых
веществ и пентаэритриттетранитрата. Эти взрывчатые вещества
имеют много общего в том смысле, что могут быть получаемы из-
одного и того же по содержанию химических элементов исход-
ного сырья, в любом месте можно поставить их механическое
и синтетическое производство из угля, воды и воздуха. Являясь
чисто механическими смесями, оксиликвиты развивают при
взрыве без всяких промежуточных химических операций макси-
мальную энергию и таким образом воплощают старую мечту
положить в основу взрыва простейший процесс горения. Од-
нако неизбежная летучесть жидкого кислорода ограничивает
применение этого взрывчатого средства.
Напротив, пентаэритриттетранит, исходный спирт для про-
изводства которого получается из формальдегида и ацетальде-
гида, сыграет поводимому важную роль в качестве сильнейшего'
бризантного взрывчатого вещества как в военной, так и в граж-
данской технике. Пентаэритриттетранитрат более мощный и деше-
вый, чем до сих пор не имевший себе равных тетрил, стал все
больше и больше заменять последний. Применяемый в виде
флегматизированных смесей (пентринит), он передает старею-
щим динамитам свою огромную постоянную скорость детонации.
Из гремучего студня Нобеля с 1875 г. впервые был получен
не только самый мощный в отношении анергии, но и наиболее
бризантный и безотказно действующий взрывчатый материал
(см... рис. 3—6).
ГЛАВА ВТОРАЯ
ОБЩАЯ ХАРАКТЕРИСТИКА ВЗРЫВЧАТЫХ ВЕЩЕСТВ
I. Введение
Число приготовленных и известных до настоящего времени
взрывчатых веществ исчисляется тысячами, и химику всегда
легко скомбинировать по своему желанию и в зависимости от
целей все новые и новые взрывчатые вещества. По своему внеш-
нему виду они бывают самых разнообразных цветов и имеют
самые разнообразные формы, представляя зловещее множество
опасных материалов с самыми различными свойствами. По на-
ружному виду они часто настолько же разнообразны, насколько
разнообразны их взрывчатые свойства: в то время как одно,
имея вид светлой плавленой массы с подозрительной буровато-
желтой окраской, ведет себя самым безобидным образом даже
при грубых воздействиях, другое имеет вид белых, как сахар,
кристаллов, которые однако чрезвычайно опасны, так как до-
статочно даже легкого прикосновения к ним или слабого трения,
чтобы произошел сильнейший взрыв. Буровато-желтая масса
представляет собою военное взрывчатое вещество — трини-
тротолуол, по которому можно безопасно вести стрельбу и
которым можно пользоваться в качестве разрывного заряда
в снаряде. Сухой же белый кристаллический порошок есть
азид ртути, внутреннее напряжение которого постоянно
олизко к взрыву и делает какое-либо практическое применение
его невозможным. Вот две тяжелые желтоватые жидкостиг
одна при зажигании бесшумно горит слабым пламенем, другая
же взрывает от яркого солнечного света с резким звуковым
эффектом; это нитроглицерин и хлористый азот. Можно
привести десятки таких примеров и показать, как разнообразно
по своей форме и своим .свойствам большинство взрывчатых ве-
ществ и какою пестротой отличается этот класс химических сое-
динений.
В самом деле, до настоящего времени еще не удалось создать
общей классификации взрывчатых веществ. Йх физические
и химические свойства весьма сильно зависят от причин вну-
треннего и внешнего характера, что конечно отражается на их
систематизации. В большинстве случаев наиболее ценной до»
42 Общая характеристика взрывчатых веществ
сих пор оказывалась практическая классификация, построенная
на различии целей и возможностей применения взрывчатых ве-
ществ. По этой классификации взрывчатые вещества можно под-
разделить на две обширных основных группы: практически
применяемые и безопасные ,в обращен.ги взрывчатые вещества
и высокочувствительные, практически неприменяамые соедине-
ния, причем, число последних значительно больше.
Класс практически применяемых взрывчатых ве-
ществ в свою очередь делится на группы:
1. Промышленных (гражданских) взрывчатых
веществ, в большинстве случаев применяемых в виде па-
тронов при строительстве туннелей, в каменоломнях, в камен-
ноугольных шахтах, в сельском и лесном хозяйстве.
Рис. 7. Действие заряда инициирующего вещества весом
0,3 г в стеклянном колпачке на латунной пластинке тол-
щиною 1 мм:
0,3 г азида
свинца
0,3 г грему- I 0,2 г тротила 0,2 г пентрита,
чей pryiH | 0,1 г сме и гре- 0,1 г смеси гре-
мучая ртуть — мучая ртуть —
азид свинца азид свиица
(9:1) (9:1)
2. Военных или боевых взрывчатых веществ,
подвергаемых плавлению или прессованию или употребляемых
в виде пластичных масс, служащих для снаряжения снарядов,
бомб, мин, торпед.
3. Инициирующих взрывчатых веществ, упо-
требляемых для изготовления капсюлей-воспламенителей, капсю-
лей-детонаторов и детонаторов (гремучая ртуть, азид свинца,
смеси с хлоратом калия).
4. Метательных средств, куда относятся ружейные и
орудийные пороха с замедленной, регулируемой скоростью го-
рения, изготовляемые путем желатинизации бризантных взрыв-
чатых веществ.
Класс чувствительных, неприемлемых в обращении со-
единений включает огромное число сильно взрывчатых
химических соединений; к числу их относятся все
I. Введение
43
весьма многочисленные нестойкие вещества, внутренние силы ко-
торых всегда напряжены до такого состояния, граничащего со
взрывом, что взрыв их происходит от самых ничтожных причин.
В качестве особенно характерного предста1вителя этого класса
взрывчатых веществ можно назвать жидкий ацетилен;
известен случай, когда, вследствие того что опасность его эндо-
термического напряжения не была предусмотрена, ацетилен
с силой динамита распался на элементы от одного трения в от-
верстии вентиля стальной бомбы.
ТАБЛИЦА 1
Чувствительность к удару
(от 1~кг ударника)
! Взрывается от
Фульминаты, Йодистый азот Азид ртути двухвал, (иглы) легкого прикосновения обламывания кристаллика
высокочувстви- тельные взрыв- чатые вещества Гремучее золото Нитро диазобензолперхло- рат легкого давления падения ударника с выс. 0,4 см
Циануртриазид ,. 0,9 „
Сернистый азот „ 2,0 „
Ацетиленид серебра . . . 2,2 „
Инициирую- щие взрывча- ' Гремучее серебро (фульми- нат) » и 2,5 41
Гремучая ртуть 4 »» Я >’ * я
тые вещества Азид свинца (тонкая пыль)
Тринитрорезорцинатсвинца .. 9 „
Г ексаметилентрипероксид- диамин . „ ю „
( Нитроглицерин 6
Нитрогликоль „ 7 „
Оксиликвит (с карбеном) .
Желатиндинамит (65%) . . 20 „
взрывчатые ве- щества Нитропентаэритрит .... •. 26 „
Тринитрофенилметилнитра- мин .... V " я „ 30 „
Пикриновая кислота . . . „ 40 „
Тринитротолуол я Я Я 1 1 0 я
Дымный порох „ , „ 120 „
Динитробензол ,х я »» 150 и
Аммиачноселитренное взрывчатое вещество . „ 180 „
II. Основные свойства взрывчатых веществ
и их действие
При всяком взрыве химическая энергия выделяется
Почти мгновенно. Разность напряжений (разность потенциалов)
выравнивается с максимальным повышением давления и темпе-
44
Общая характеристика взрывчатых веществ
ратуры, причем материя, участвующая в процессе, разрушается
до атомов и превращается в новые соединения. До настоящего
времени неизвестно другого подобного процесса, который про-
текал бы с таким же нарастанием и концентрацией выделяемой
энергии, как это имеет место при детонации взрывчатых ве-
ществ.
Взрывчатое вещество, по крайней мере каждое технически
применяемое взрывчатое вещество, подобно нефти, спирту или
бензолу представляет собою горючую массу, состоящую из угле-
рода и водорода; кислород же, необходимый для сгорания, оно
заимствует не из воздуха, но содержит его в связанном виде.
В то время как горючее вещество сгорает при медленном
окислении, так как требующийся для этого и непрерывно расхо-
дуемый кислород поступает очень медленно, взрывчатое
вещество, если в какой-нибудь точке его капсюлем-детона-
тором или ударом молотка произведено воспламенение, способно
разложиться мгновенно, т. е. со взрывом превратиться в раска-
ленные газообразные продукты, увеличиваясь при этом в объеме
в тысячи раз. Следовательно, взрывчатые вещества отличаются
от горючих веществ только скоростью горения, временем, в те-
чение которого связанная химическая энергия превращается
в теплоту и затем — в энергию движения и механическое разру-
шение. Чем больше скорость окислительного разложения, тем
больше дробящее действие — б р ив ан two сть взрывчат
того вещества. Промежуточное положение между горючими ве-
ществами и бризантными взрывчатыми веществами занимают
метательные средства, которые дают только вспышку,
т. е., как например порох, сгорают очень быстро, не давая на-
стоящего взрыва. В то время как дымный порох, подвергнутый
воспламенению в открытом виде, сгорает, не производя никакого
действия на предмет, лежащий под ним, бризантные взрывчатые
вещества раздробляют этот предмет; в этом; последнем случае,
превращение в газообразные продукты происходит настолько
быстро, что воздух, окружающий взрывчатые вещества, не успе-
вает переместиться и противодействует удару взрыва как твердое
препятствие. Поэтому же в воде, обладающей значительно боль-
шей плотностью, действие оказывается еще более интенсивным,
если удар (приходится в направлении трюма корабля, заполненного
воздухом, чем и объясняется бронебойная сила торпед и мин.
Быстрота, с которой распространяется взрывчатое разложение
в массе взрывчатого вещества, называется скоростью дето-
нации; эта величина, поддающаяся определению с точностью
до нескольких метров, составляет для пороха 300—500 м, для
туннельных и горных взрывчатых веществ 2000—6000 т и для
новейших взрывчатых веществ, применяемых для снаряжения
снарядов, свыше 8000 м в секунду.
В соответствии с этим, если бы бомбе, снаряженной 7 кг
высокобризантного взрывчатого вещества, придать форму шара
11. Основные свойства взрывчатых веществ и их действие 45
диаметром 20 см и воспламенить взрывчатое вещество в центре,
то оно обратилось бы в газы в течение Veoooo секунды..
Несмотря на поразительное действие, которым характери-
зуются взрывчатые вещества благодаря их скорости разложения,
оказывается однако, что их энергия и рабочая мощность малы
в сравнении с таковыми горючих веществ; Так например четы-
рехместный автомобиль в 10 л. с. расходует 10 л бензина на
100 км пути. Если бы оказалось возможным преобразовать в ра-
боту мотора энергию разложения взрывчатых веществ, то для
Рис. 8. Взрыв бомбы.
прохождения указанного пути понадобилось бы 29,6 л сильней-
шего динамита (=48 кт гремучего студня), или 113 л дымного
пороха.
Истинное представление о взрыве дает только фотография
или, еще более совершенно, кинематограф. На рис. 8 предста-
влен относительно удачный снимок авиационной бомбы в момент
полного взрыва; густое шарообразное облако сажи резко отгра-
ничено от окружающего воздуха. Здесь нет и следов радиаль-
ных лучей пробивающегося пламени и летящих осколков, как
обыкновенно пытаются художественно изобразить силу взрыва.
Вздымающиеся клубы сажи, невидимому в момент наибольшего
развития объема, кажутся застывшими в воздухе, однако в мгно-
46
Общая характеристика взрывчатых веществ
вение ока облако подбрасывается кверху мощным красным пла-
менем и рассеивается. Это — период образования вторичного
пламени, когда нагретые до высокой температуры горючие газо-
образные продукты взрыва сгорают в кислороде воздуха уже
после того, как совершилось разрушительное действие.
Для бомбы, снаряженной примерно 20 кг плавленого тротила,
занимающего соответственно объем в 12,5 jf, объем газообраз-
ных продуктов взрыва в момент развития наивысшей темпера-
туры равен 180 м3, т. е. газообразные продукты образуют раска-
Рис. 9. Взрыв пентринита в железном тигле (снято сбоку в го-
ризонтальной плоскости).
ленный шар диаметром 7 м, в сфере действия которого происхо-
дит полное разрушение.
Особенно хорошо запечатлевается картина взрыва в темноте,
когда от центра взрыва исходит ослепительный свет. Но про-
цесс протекает неуловимо быстро и с таким излучением, что глаз
получает только общее впечатление, лишенное деталей. Напро-
тив, фотографическая пластинка запечатлевает более богатую
картину «молнии взрыва», она дает приблизительное представле-
ние о росте давления и температуры, которые в данном случае
составляют нераздельное целое с необыкновенно мощной, не
имеющей себе равной химической реакцией.
Сила взрывчатого вещества зависит, с одной стороны, от хи-
мической энергии, те п л о т ьи в зр ы в а, а с другой стороны, от
его ск ор ости детонации. Что скорость детонации яв-
ляется более важным фактором, действительно определяющим
III. Пределы развития силы в. в.
47
силу взрывчатого вещества, показывает сравнение дымного по-
роха с тринитротолуолом, употребляемым для снаряже-
ния снарядов; при приблизительно равной теплотворной спо-
собности тринитротолуол обращается в газы со скоростью
6 700 м/сек, т. е. в 20 раз быстрее дымного пороха. Какое резкое
различие во взрывчатом' действии! Если мина, снаряженная три-
нитротолуолом', дает пробоину в кора1бельной броне, то заряд
дымного пороха производит едва заметный прогиб. У взрывча-
тых веществ с еще большей скоростью детонации бризантность
и пробивная сила соответственно еще больше, так что можно
было бы думать, что с повышением скорости детонации увели-
чивается и сила взрыва. В действительности однако это не имеет
места. Разрушительная сила в известном смысле становится
более резко выраженной, однако только отчасти, так как она все
в большей и большей степени локализуется в непосредствен-
ной близости от места взрыва и здесь расходуется. Дымный
порох, выделяющий 700 б. кал/кг, и тринитротолуол, выделяю-
щий приблизительно столько же, — оба эти взрывчатые веще-
ства могут в конце концов произвести приблизительно одну и
ту же работу, как бы ни была велика разница в их скоростях
взрыва. В данном случае имеет место то же соотношение, как
и для электрической энергии и энергии воды: превратится ли
в работу ток в 100 А и 1 000 V напряжения или 1 000 А и 100 V
напряжения, приводятся ли во вращение колеса турбины мед-
ленно движущейся массой воды большой реки или свергаю-
щимся в долину небольшим горным ручьем, — энергетический
эффект в каждом случае один и тот же, как ни различны наблю-
даемые процессы. Порох раскалывает каменный уголь на не-
большое число крупных, объемистых кусков; равное количество
высокобризантного военного взрывчатого ве-
щества дало бы вероятно меньшее количество угля, но зато
превращенного в штыб и пыль; сила, направленная во-вне,
была бы равномерно поглощена окружающей средой и не проя-
вилась бы так, как это имеет место в случае порохового за-
ряда.
111. Пределы развития силы и энергетические возмож-
ности взрывчатых веществ
Из сказанного следует, что возрастание силы взрыва
с ростом скорости детонации практически имеет предел,
поскольку количество энергии не может увеличиваться с послед-
ней. Это количество энергии связано с количеством угле-
рода и водорода и представляет неизменную, определенную ве-
личину. Сгорает ли 1 кг бензола в моторе или разлагается со
взрывом в виде нитросоединения, — всегда выделяется одно и
то же неизменное количество энергии. Военные взрывчатые
48
Общая характеристика взрывчатых веществ
Кислородный баланс и содержание азота
важнейших взрывчатых веществ, представляющих собою определенные
химические соединения, а также наиболее употребительных стабилизаторов,
добавок и окислителей, необходимые для подсчета баланса и других сте-
хиометрических вычислений.
(Атомные веса: С = 12,00; Н — 1,008; N = 14,008; О = 16,00)
Химическое название веще- ства (в скобках техническое, большей частью сокращенное обозначение) Эмпирическая формула Молекулярный вес 1 Содержание азота В % Кислородный баланс на 100 г взрывчатого вещества; недостаток (—) илн избыток (4-) кислорода в %
Гликольдинитрат (нитроглн- коль) Нитроизобутилглицеринтри- C2H4N2Oe 152,05 18,43 ±0
нитрат Глицеринтринитрат (ннтрогли- C4HeN4On 286,08 19,59 18,508 ±0
церин) Q+.+ 3Ц9 227,06 + 3,52
Маннитгексанитрат Пентаэритриттетранитрат (пен- СбН^О^ 452,11 18,58 + 7,08
трит) 316,094 17,73 —10,12
Днпентаэритритгексанитрат . Ангидроэннеагептитпентани- CioHieNeOw 524,18 16,03 - 27,47
трат Одиннадцатиазотная нитро- 447,14 15,67 — 30,4
клетчатка (пироксилин) . . .Десятиазотная нитроклет- С24Н.291У11О42 1143,31 13,48 - 28,69
чатка. Коллодионный хлопок. Смесь коллодионных хлопков СыН .ч+io C)40 1098,31 12,76 — 33,51
для гремучего студня . . . — ' 12,27 - 36,66
Девятиазотная нитроклетчатка C^HjjNgOgg 1053,31 11,97 — 38,74
Тринитротолуол (тротил) . . . Монохлоргидриндинитрат (ди- C7H5N3O6 227,06 18,608 — 73,98
нитрохлоргидрин) C3H5N2OgCl C,H6N2O4 200,52 13,97 - 15,96
Динитротолуол 182,06 15,38 - 114,3
Нитротолуол c7h7no2 137,06 10,22 - 180,9
Тринитробензол CeHgN.jOo 213,05 19,72 — 56,32
Динитробензол c6h4n2o4 168,05 16,67 — 95,2
Нитробензол QH-NO2 123,05 11,39 —162.5
Тринитроксилол Тринитрофенилметилнитрамин CflH-'NgOg 241,08 17,43 — 89,6
(тетрил) C7H5N5O8 287,08 24,39 — 47,37
Тетранитроанилин Тринитрофенилэтанолнитра- c6h3n5o8 273,06 25,63 — 32,23
миннитрат Гексанитродифениламин (гек- CgrigNgOjj 362,1 23,21 — 35,35
сил) Циклотриметилентринитрамин С12^5б*?С)л2 439,10 22,32 — 52,84
(гексоген) Тринитрофенол (пикриновая CaHgNgVj 222,096 37,85 — 21,61
кислота) C6H3N3O7 229,05 18,34 — 45,4
Динитрофенол c6h4n2o3 184,05 15,23 — 78,3
III. Пределы развития силы
49
Химическое название веще- ства (в скобках техническое, большей частью сокращенное обозначение) Эмпирическая формула Молекулярный вес j, _ 1 Содержание азота । Кислородный баланс] ; на 100 г взрывчатого] вещества; недостаток ! (—) или избыток (-(-) I кислорода в %
Три нитрокрезол (крезилит) . - ] Тринитрорезорцин (стнфиино- вая кислота) Тетранитронафталин Трииитронафталин Динитронафталии Нитронафталнн Тринитротриазидобензол . . Циаиуртриазид .Гремучая ртуть Азид свинца Дифениламин Этиловый эфир карбаминовой кислоты (уретан) . . .Диэтил дифен ил м очеви на (цен- тралит 1) Лиметилдифенилмочевина (цеи- тралит II) Камфора Парафин твердый Вазелин Касторовое масло (кислота) . Древесная мука Пробковая мука Хлебная мука Карбен (купрен) 'Нитрат аммония (аммиачная селитра) Перхлорат аммония Хлористый аммоний (как анти- г ризутная/добавка) Нитрат калия (калиевая се- литра) Хлорат калия .. . Перхлорат калия Нитрат натрия (натриевая се- литра) . C7HSN3O7 C6H3N3Ob СщН4Ы4Он CloH5N306 CioHgNoO^ C10H7NO2 C-e^isOr, QjNia cl2HnN 1 C3H;NO« Ct*»Hl6N2O w CjJU C7HWO5.H2O 1C6H9O2-V2H,O 1 i NH4NO3 nh4cio4 nh4ci KNO3 KC1O3 ксю4 NaNO;i 243,06 245,05 i 308,06 263,06 1 218,06 ! 173,06 336,1 168,1 284,63 291,26 169,10 89,06 268,17 % 240,14 152,13 352,42 212,26 298,27 192,1 122,1 381,2 154,1 80,05 117,50 53,50 101,11 122,56 138,56 85,01 17,29 17,15 18,18 16,00 12,85 8,09 50,01 82,36 9,84 28,85 100 г нитрата аммония-мо- гут быть за-i менены еле-! дующими окислите- лями (в г) 58,55 50,38 50,89 43,15 42,36 — 62,52 — 36,24 — 72,70 — 100,4 — 139,4 — 198,74 — 28,56 — 57,11 — 11,24 — 279,1 - 134,8 — 256,7 -246,7 — 284,0 - 345,5 — 347,2 -268,0 - 116,7 - 190,2 —132,0 — 301,1 + 19,93 + 34,04 — 44,86 + 39,56 + 39,16 + 46,19 + 47,05
Хлорат натрия Двуокись азота NaC103 N3O1 106,46 97,02 44,20 28,66 + 45,09 + 69,55
Азотная кислота HNOS 63,02 31,38 + 63,48
Гетранитрометан . . . - . . CN4O8 196,03 40,67 + 48,98
4 Зак. 3171. — Штетбахер.
50
Общая характеристика взрывчатых веществ
вещества содержат не более 0,1 энергии, получающейся от сго-
рания углеводородов, лежащих в их основе (в пересчете на оди-
наковые веса). В состоянии ли таким образом даже максималь-
ная по размерам авиационная бомба весом в 1 800 кг,
имеющая разрывной заряд в 1 000 кт, разрушить четверть квар-
тала или даже город? .Такой снаряд выделяет при взрыве энер-
гию, приблизительно равную энергии, получаемой при сгорании
80 кг бензола. Далеко ли может продвинуться морское судно
или железнодорожный поезд на таком количестве горючего?
Во всяком случае, легко понять, что живая сила наших самых
крупных снарядов не только недостаточна для того, чтобы раз-
рушить хотя бы одно крупное здание, но даже часть его.
Всякое взрывчатое действие основывается на химической
энергии превращения, безразлично — будет ли то эндо-
термический или экзотермический процесс. Его практически до-
стижимую наибольшую величину имела бы невидимому смесь
твердого ацетилена и жидкого кислорода; 1 кг
этой смеси выделил бы 2 930 б. кал, т. е. не менее чем вдвое по
сравнению с нитроглицерином. Но эта величина является уже
пределом взрывчатой силы. Большие разности потенциалов
известны только для разрядов электрической энергии и разве
еще для процессов радиоактивного распада.
Возникает вопро^ нельзя ли мгновенный химический разряд
энергии, т. е. «взрыв», каким мы знаем и применяем его в настоящее
время, заменить каким-либо другим выравниванием сил и не привело ли бы
это к подобному, а возможно еще большему действию? Мысль наша обра-
щается прежде всего к электрическим разрядам, к искровым разрядам и
молнии, где разности потенциалов выравниваются также в кратчайший
промежуток времени и с большим повышением температуры. Так например
установка для эксплоатации разрядов молнии на Монте-Дженерозо дает
избыточное напряжение в 12—14 млн. V, что приблизительно соответствует
утроенной интенсивности магнитного потока а-лучей. Удары энергии дости-
гают многих миллиардов вольтампер в 0,00001 сек., следовательно имеют
колоссальную плотность и приводят к каналовым лучам, к скоростям про-
тонов, которые в состоянии разрушить не только легкие атомы (приблизи-
тельно такие как а-лучи радия), но и плотную электронную оболочку
тяжелых атомов. Вероятно первым шагом после этого было бы превраще-
ние ртути в золото.
Таким образом^ пользуясь электричеством* высокого напряжения,
можно достигнуть несравненно больших концентраций энергии, чем это
удается достигнуть химически, путем, реакции взрывчатого разложения.
Например, температура взрыва какого-нибудь взрывчатого вещества не
превосходит температуры искры лейденской банки, а при мгновенных кон-
денсаторных разрядах были достигнуты температуры до 20000°. Почему бы
невозможно послать миллионы вольтампер по тонкой металлической про-
волоке и, не пользуясь взрывчатыми веществами, получить при подобных
температурах увеличение объема, которое в течение тысячной доли
секунды составляло бы объем в сотни или даже тысячи раз больший
по сравнению с объемами, даваемыми современными взрывчатыми веще-
ствами?
Пока что мы далеки от этих «взрывов без взрывчатых веществ»,,
потому что электричество является формой энергии, довольно далекий
от взрыва, т. е. электрические силы в наименьшей мере проявляются в виде
механического движения, как-то: испарение, расширение, давление газа, и
IV. Термохимические основы важнейших взрывчатых веществ 51
связаны, как мы видели выше, почти исключительно с внутримолеку-
лярными процессами, с диссоциацией, ионизацией и внутриатом-
н ы м и процессами, сводящимися к распаду атомов, где колоссальные
количества энергии, которые мы не в состоянии себе представить, удержи-
ваются и расходуются «без всякого внешнего проявления». Подобные же
явления обнаруживаются при чрезвычайно высоких температурах, так что
было бы бесцельно стремиться к трансформации электричества, скажем,
в теплоту, для его более совершенного технического использования в форме
взрыва. Уже при температуре 4000° молекулы газов начинают распадаться
на атомы, а затем сами атомы начинают ионизироваться.
Точно так же следует признать непригодность для получения взрыва
энергии, получающейся при радиоактивном распаде. Хотя количества
теплоты, выделяющиеся при таких процессах, приблизительно в миллион
раз больше, чем максимальные количества энергии химических реакций,
но процессы эти совершаются так долго, что отпадает всякое внешнее
проявление в виде взрыва. И наоборот, если бы стало возможно, путем
нагрева до 40 млн. градусов (Эддингтон), выделение колоссальной,
по Эйнштейну, энергии, которая «дремлет» в материи, то весь процесс,
пока он связан с протонами и электронами, по необходимости должен
был бы также протекать «без взрыва», так как взрыв мыслим только в на-
шем осязаемом мире молекулярной материи.
IV. Термохимические основы важнейших взрывчатых
веществ
Первое и старейшее бризантное взрывчатое вещество —
нитроглицерин — вследствие своего почти идеального со-:
става еще и в настоящее время является 'непревзойденным взрыв-
чатым материалом из числа веществ, представляющих опре-
деленные химические соединения. При детонации молекула ни-
троглицерина без остатка разлагается на газообразные про-
дукты; внутримолекулярное горение протекало бы почти иде-
ально, если бы не податома, или 3,5 %, избыточного кислорода,
который несколько понижает общую энергию молекулы. 1 дг
нитроглицерина выделяет по расчету 1 485 б. кал и обладает наи-
высшей теплотой горения среди взрывчатых веществ, предста-
вляющих собою определенные химические «соединения. Факти-
чески до настоящего времени нельзя указать ни одного соеди-
нения, за исключением нацело распадающегося нитрогЛиколя,—
вещества однако' более летучего и дорогого, — которое по силе
было бы равно нитроглицерину. Правда, со времени войны
появились две еще более сильные смеси: о ксили к виты и
материал для снаряжения бомб (нитробензол — жидкая
двуокись азота); однако эти простые смеси имеют огра-
ниченное применение вследствие того, что каждая из них со-
держит летучий компонент.
Хотя нитроглицерин с самого начала его применения предста-
влял одну из наилучших возможностей в области взрывчатых
веществ, однако с чисто химической и термической точек зрения,
располагая этим азотнокислым эфиром, мы еще далеки от иде-
ала взрывчатого вещества: эта форма окисления дает только
4*
52
Общая характеристика взрывчатых веществ
часть энергии, которая выделялась бы при непосредственном
сгорании содержащихся в нитроглицерине углерода .и водорода.
Если мы последовательно сожжем некоторые количества эле-
ментарного углерода и водорода, затем те же количества —
в виде пропана и наконец в виде глицерина и нитроглицерина,
то сопоставление теплот горения обнаружит следующую потерю
энергии:
Потеря энергии при образовании алифатических и
ароматических взрывчатых нитро соединений
1000 г Кисло- родный баланс Темпера- тура горе- ния (б. кая) (вода жидкая) Потеря энергии при образовании (по отношению к эле- ментарным угле- роду-водороду) в б. кал
Углерод-водород Кислород
Углерод-водо- род .... Пропан.... ЗС +4Н, С3Н8 216 216 50, 50, 784 784 2728 2598 + 130= 5 о/о
Глицерин. . . C3HSO3 452 ЗУ',б. 548 1951 + 777 = 29 %
Нитроглице- рин 1. . . . С31 +(NO,)3 + 3,5 1510 + 1218= 45 %
Углерод-водо- род .... Толуол .... 7С + 4Н, С;Н, 242 242 + 90, + 90, 758 758 2453 2466 — 13 = 0,60.(,
Тринитрото- луол 1 . . . С8Н2 CH3(NO,)3 — 74,0 1016 + 1337 = 54 «о
Ацетилен . . . С,Н2 245 2V2O2 755 2953
Итак, чтобы перевести исходное количество углерода и водо-
рода, равное 216 г, через пропан и глицерин во взрывчатую
форму нитроглицерина, необходимо пожертвовать 45% перво-
начальной энергии горения. Как мы видим, нитрация является
процессом, в сильной степени понижающим количество
энергии, а азотная кислота оказывается плохим суррогатом
чистого кислорода, ибо она представляет собою группу атомов,
неизбежной составной частью которой является такой бедный
анергией спутник, как азот. Подобно буферу, между сжигаемой
и сжигающей материей, этот элемент, не принимающий участия
в процессе, воспринимает часть удара взрыва и ослабляет его при
своем расширении. Поэтому нет ничего более неправильного,
чем утверждение, что азотная кислота является аккуму-
1 Теплоты взрывчатого разложения нитроглицерина и тринитротолуола
соответствуют значениям, экспериментально определенным Гайдом и
Шмидтом в 1931 г., причем число калорий для нитроглицерина принято
равным найденному для гремучего студня, с тем чтобы во всех случаях
пользоваться максимальной величиной (теоретический подсчет и сжигание
в бомбе дают для нитроглицерина значительно большее число, именно
1565 б. кал).
IV. Термохимические основы важнейших взрывчатых веществ 53
лятором энергии, который содержит кислород в потенцирован-
ной форме. Жидкий кислород, жидкая1 двуокись азота и жидкий
тетранитрометан значительно превосходят -в этом отношении
азотную кислоту. Если бы азотная кислота не была столь удоб-
ным и дешевым средством введения кислорода, то от этого мате-
риала, служащего для получения взрывчатых веществ, давно
следовало бы отказаться.
Самое большее, что с точки зрения образования взрывча-
тых веществ может дать азотная кислота, — это старый нобе-
левский гремучий студень, представляющий собою
смесь нитратов глицерина и клетчатки, рассчитанную на полное
сгорание, затем высокобризантные пентриниты, которые
вместо пироксилина содержат переменные количества тетрани-
тропентаэритрита, и наконец жидкая смесь т е т р а н и т р о м е-
т а н-т о л у о л, беспримерная бризантность которой (при
—1700 б. кал) превосходит во всех отношениях работоспособ-
ность гремучего студня.
Алифатические нитраты спиртов, служащие для при-
готовления динамитов, резко отличаются от ароматических
нитросоединений. Обе группы взрывчатых веществ отличаются
не только по своему .внешнему виду; нитросоединения, несмотря
на значительный недостаток кислорода в молекуле, характери-
зуются прежде всего относительно большой энергией и бризант-
ностью и не уступают более совершенно распадающимся эфирам
спиртов в такой мере, в какой это позволяют ожидать данные
кислородного баланса.
ТАБЛИЦА 2
Теплоты образования алифатических и ароматических
углеводородов
У глеводороды б. KajijKZ Углеводороды б. кал'кг
Метан СН4 Пропан СзНк 4-1122 4- 615 Бензол СвН6 Толуол С;Н8 '. Ацетилен С2Н, .... - 160 — 52 — 2048
Если принять во внимание теплоты образования углеводо-
родов, являкмцихся основой упомянутых выше взрывчатых ве-
ществ, то это явление становится легко объяснимым. Из табл. 2
видно, что теплота образования ароматических углеводородов
отрицательна, алифатических же положительна. Если
даже отрицательная величина теплоты образования, например
толуола, и невысока, то она все же сказывается в тех энергети-
ческих преимуществах, которым можно приписать «взрывофиль-
ное» расшатывание ароматического ядра и благодаря которым
уже низконитрованные производные бензола становятся настоя-
54 Общая характеристика взрывчатых веществ
щими взрывчатыми веществами. С этим «ароматическим» усиле-
нием взрывчатых свойств близко связано, как бы парадоксально
это ни звучало, значительное выделение сажи, которая уве-
личивает коволюм, почему давление, производимое газообраз-
ными продуктами, также увеличивается почти наполовину. Эти
факты, на которые невидимому никто не обратил еще внимания
(стр. 116—117), а также эндотермический характер
ароматического ядра являются причиной того, что тринит-
ротолуол и даже динитробензол, несмотря на большой
недостаток кислорода, являются такими относительно сильными,
действительными материалами для снаряжения снарядов. Теперь
становится ясно, почему динитротолуол при недостатке кис-
лорода в 114,3% взрывает, а мононитроглицерин, недостаток
Рнс. 10. Смесь тетра- Рис. 11. Пентрииит
нитрометан-толуол 58/42, d— 1,45.
(100:15,66), 1,454.
Рис. 12. Динитрогли-
коль, d = 1,49.
Рис. 10 —-12. 45 г каждого из указанных взрывчатых веществ
подвергнуты детонации капсюлем-детонатором № 8 в закрытом
свинцовой крышкой железном тигле, вставленном в другой тигель,
установленный на 8-мм железной пластинке
кислорода в котором составляет 52,9%, совершенно не Является
взрывчатым веществом.
В этих отличительных особенностях ничего не могут изменить
весьма различные теплоты этерификации спир-
тов и нитрования углеводородов. То обстоя-
тельство, что при нитровании бензола вступление каждой нитро-
группы сопровождается выделением 36,5 б. кал, а при простой
этерификации азотной кислотой — только 5 б. кал, ни в коем
случае не дает права сделать вывод, что количество энергии
эфира больше количества энергии нитросоединени^ на разницу
теплоты образования, т. е. на 31,5 б. кал. Это количество тепла
выделилось уже раньше при образовании спирта. В самом деле,
оказывается, что введение гидроксильных групп в молекулу про-
пана СзНв, т. е. получение глицерина СзНвОз, связано с общей
потерей 131 б. кал, или соответственно 44 б. кал на одну гидро-
ксильную группу. Если сюда прибавить еще 5 б. кал теплоты
этерификации, то получится, что при вступлении каждой нит-
Термохимические основы важнейших взрывчатых веществ 55
патной группы (NO3) теряется 49 б. кал. Следовательно
потери энергии в данном случае больше, чем при простом нитро-
вании углеводорода, а именно на 12,5 б. кал (на одну нитро-
группу); таким образом ароматические нитросоединения и в этом
отношении при равном кислородном балансе превосходят али-
фатические сложные эфиры азотной кислоты.
Гидроксильная группа, вступая на место водорода, не улуч-
шает экзотермического эффекта, а ухудшает его; это видно из
того, что тринитробензол взрывает с несколько большей энер-
гией, чем тринитрофенол, и что пикриновая кислота
выделяет больше тепла, чем стифниновая кислота (тринитро-
резорцин), содержащая две гидроксильных группы. И дей-
ствительно, согласно последним определениям Р инке н б а х а
теплота образования пикриновой кислоты приблизительно
в .10 раз больше таковой тринитробензола и немного меньше,
половины теплоты образования стифниновой кислоты (табл. 8).
У атома кислорода в гидроксиле одна из валентностей с точки
зрения проявления экзотермического эффекта пропадает так, чго
недостающее количество тепла компенсируется обычно с избыт-
ком второй валентностью вследствие увеличения молекулы, свя-
занного с присутствием атома кислорода.
Калорийность кислорода в алифатических нитра-
тах и ароматических нитросоединениях должна быть одна и та
же, как это можно видеть на примере нитроглицерина и
тринитротолуола:
СН3
О о
СН2—О-^N-
1
сн—о—nC
I
CH2-O-Nf° Л
У нитроглицерина свободны для сгорания не трижды 3 атома
кислорода, а только трижды 214 атома, так как три валент-
ности уже компенсируются связью гидроксильной группы
с атомом углерода. Полноценными для окисления (в смысле вы-
деления тепла) остаются только те три валентности кислорода,
которые непосредственно связаны с атомом азота остатка азот-
ной кислоты. Сравнительное 'калориметрическое испытание ниже-
гредставление об этой
СН2О • NO
СН2 • ОН
гликольмононитрнт
следующих трех изомеров дает ясное
зависимости:
СН3 СН2 • NO2
СН2 • О • NO-2 СН2 • ОН
этилнитрат ^-нитооэтанол
м> Общая характеристика взрывчатых веществ
Это насыщение в термическом смысле кислородом объясняет
также кажущийся ненормальным факт, что меллитовая, или
бен зо л гексакарбо нова я, кислота Св(СООН)в, содер-
жащая в молекуле на 14% кислорода' больше, чем тринитрото-
луол, является стойким, совершенно невзрывчатым веществом..
Если кислород вместо азота связан с атомом кислорода же,
как например в органических перекисных соединениях
или же о з о н и д а х, то соответствующие валентности в терми-
ческом отношении являются не только полноценными, но даже-
заряженными некоторым количеством эндотермической
энергии, которое повышает взрывчатую силу и одновременно и
чувствительность в большей степени, чем то известно для нор-
мального баланса кислорода. Усиление взрывчатых свойств
объясняется в данном случае тем, что в газообразных продук-
тах взрыва отсутствует азот нитрогруппы, обычно разбавляющий
газообразные продукты взрыва.
СН2 -0-0- сн,ч
N^—СН2 -0—0- СН,—
Х СН.2—0-0— СН2 z
сн2—снй
о о
У
гекса мети 1ентрипероксидд намни
этиленозонид
о—о
.о— z 6
о/ I
4 о— х ‘—о
Y !
о—о
бензол триозожя
Рис. 19 показывает, что гексаметилентрипероксиддиамин, имён
недостаток кислорода в 92,4%, более бризантен, чем динитро-
бензол, имеющий приблизительно такой же недостаток кисло-
рода (застрявший в отверстии углубления кусочек металла не
может служить основанием к установлению различия, так как
первоначально такой же осколок металла был защемлен в про-
боину, произведенную динитробензолом, и затем вынут). В слу-
чае озонидов, которые образуются присоединением весьма
эндотермичного озона (20з == 30а + 70 б. кал) к ненасыщенным
углеводородам, происходит новое, из ряда вон выходящее по-
вышение взрывчатых свойств. Строение и распределение кисло-
рода в озобензоле показывает, что в нем имеются все данйые,
необходимые для наличия взрывчатых свойств:
С6 Н6 (ОзЪ
363 , 637 = 1003 г
1640 I 469 б. ка.1
Принимая, что бензолтриозонид при взрыве разлагается на
окись углерода и воду, получим, что на 363 г, составляющих
долю бензола, выделяется 1 640 б. кал и на 637 г озона
/I. Термохимические основы важнейших взрывчатых веществ 5/
350 б. кал (принимая во внимание потери на присоединение, со-
ставляющие около 30%), а всего следовательно около 2 000 б. кал
на килограмм; такое количество тепла делает эти соединения
самыми мощными и самыми опасными из всех известных взрыв-
Рис. 16. Тринитро-
толуол (техниче-
ский).
Рис. 13. 1, 2, 4-ди- Рис. 14. Динитро- Рис. 15. Дннитро-
нитротолуол (чис- нафталин (техни- бензол (техниче-
тый). ческий, т. пл. 125— ский).
160°).
Рис. 17. Гексаии-
тродифениламин.
Рис. 18. Тетрил.
Рис. 19. Гексаме-
тилентрнперок-
сиддиамни.
Рис. '20. Ангидро-
эннеагептитпента-
нитрат.я
Рис. 21. Тетрани- Рис. 22. Нитро-
тропентаэритрит. маннит.
Рис. 13—22. Во всех случаях 2,5 г взрывчатого вещества одинаковой плотно-
сти подвергнуты детонации капсюлем-детонатором № 8; заряд помещался
в винтовочной гильзе на 2,5-ллс свинцовой пластинке (15X15 см)
чатых веществ, ибо к этому колоссальному количеству энергии
присоединяется также исключительная бризантность, так как аро-
матическое бензольное кольцо с подобным расположением ато-
мов кислорода у каждого углерода в значительно большей сте-
3$ Общая характеристика взрывчатых веществ
1®ни склонно к мгновенному распаду и обладает значительно
Солее высокой скоростью детонации, чем например тринитро-
толуол, у которого распространение взрыва на все кольцо про-
исходит не непосредственно, а лишь при взаимодействии кисло-
рода с СН-группой. Однако вследствие внутреннего напряжения
молекулы, постоянно готовой к взрыву, эти соединения не имеют
практического значения.
V. Взрывчатые свойства и химическое строение
Определенной йзаимозависимости- между взрывчатыми свой-
ствами и химическим строением установить до сих пор не уда-
лось, хотя с наличием в молекуле отдельных групп давно свя-
зываются определенные свойства соединения и той или другой
•формуле строения или главной ее части не без основания при-
писываются признаки, являющиеся признаками взрывчатых
свойств.
1. Химически однородные взрывчатые вещества и механические
взрывчатые смеси
В этом случае особенно ясно выступает отсутствие связи
между строением и взрывчатыми свойствами; тринитрото-
луол и дымный порох представляют собой самый яркий
пример в этом отношении. В дымном порохе каждая из трех
составных частей сама по себе не взрывчата. Но механическая
седитренная смесь постольку приобретает взрывчатые совйства,
поскольку в состав ее входит химически однородное вещество,
casio по себе являющееся взрывчатым г. Взрывчатый компонент
в Этом случае действует на остальные составные части до неко-
торой степени как инициатор. Подобное же действие может про-
исходить и от такой соли, как хлорат калия, которая вследствие
эндотермического характера своего образования распадается как
взрывчатое вещество в ударных составах и вследствие мгновен-
ного превращения вызывает превращение окружающих ее горю-
чих компонентов. Однако во всех этих случаях, идет ли речь
об аммиачноселитренных или хлоратных взрывчатых веществах,
бризантность их не переходит известных пределов.
Несмотря на минимальное количество энергии, бризантность
тринитротолуола, являющегося определенным химическим
соединением, — максимальна, а при максимальном количестве
энергии (пераммона2, употребляемого для снаряжения снарядов
(1 200 б. кал), она минимальна. Поэтому твердые механические
взрывчатые смеси всегда менее бризантны, соответственно ско-
1 Неясная формулировка в оригинале. Прим. ред.
' Перхлората аммония. Прим. ред.
V. Взрывчатые свойства и химическое строение
59
рости разложения окислителя и процентному содержанию , горю-
чих компонентов, как это следует из рис. 23—28.
Иначе 'обстоит дело в случае коллоидных смесей
и особенно жидкостей, которые в растворах образуют фи-
зически однородные смеси с молекулярной степенью дисперс-
ности. В этом случае взрывные волны могут распространяться
беспрепятственно. Это особенно ярко сказывается в случае
смеси толуол — тетранитромета.н1. В то время как
Рис. 23.
Нижняя сторона
Рис. 25 Ряс. 27.
Верхняя сто р”о н а
Рнс. 26.
Рис. 25 и 26. Пер-
хлорат аммония
91%. Парафин 9%
(Пераммон), d=
1,35; 1250 б. кал.
Рис. 28.
Рис. 27 и 28. Пер-
хлорат аммония
68,5%.Тринитрото-
луол 31,5%, /4=1,3;
1215 б. кал.
Рис. 24.
Рис. 23 и 24." Три-
нитротолуол, d =
«= 1,35;
900 б. кал.
Рис. 23—28. В каждом случае 65 г взрывчатого вещества подвергнуто дето-
нации в железном тигле с промежуточным детонатором из пентринита
в количестве 6,5 г; тигли устанавливались на 8-мм железных пластинках
углеводороды обычно всегда действуют в высшей степени
флегматизирующим образом, в данном случае толуол, даже взя-
тый в значительном избытке, приводит к -беспримерно бризант-
ному взрыву. То же имеет место для раствора нитробензола
в жидкой двуокиси азота (рис. 110).
Обе «физические» смеси в виде растворов детонируют бы-
стрее, чем какой-либо из известных жидких сложных эфиров,
например нитроглицерин или нитрогликоль.
1Stettbacher, Hochbrisanzstudien zu dem Thema: Sprengwirkung
u. chemische Konstitution, Z. f. Schiess- u. Sprw. 1930, 430 и 461; 1931, 8 и 38.
60
Общая характеристика взрывчатых eeiuficme
Промежуточный класс образуют оксиликвиты, в которых
одна составная часть жидкая, а другая — твердая. В этом
случае скорости детонации достигают таких величин, каких не
достигают смеси, составленные из двух твердых компонентов.'
Так карбен В' зависимости от степени 'измельчения1 дает ско-
рость детонации с жидким кислородом от 4 800 до 6 000 ткец.
У оксиликвита, составленного на основе сажи, зависимость от
структуры поверхности проявляется: еще сильнее (3 450 —
5 400 м/сек); на этом примере особенно наглядно подтверждается
правило, что скорость взрыва повышается соответственно сте-
пени измельчения одного или нескольких
компонентов до тех пор, пока не будет достигнуто состоя-
ние молекулярного раздробления.
2. Определенные взрывчатые нитросоединения ароматического
ряда
У ароматических нитросоединений, где основой является эндо-
термическое ядро бензола или нафталина, связь между
взрывчатыми свойствами и строением выступает особенно ясно и
наглядно. По мере замещения водородов ядра нитрогруппами
скорость детонации значительно увеличивается, и одновременно
увеличивается также количество энергии в молекуле взрывчатого
вещества!. Возрастание идет скачками, что видно из ряда взры-
вов (рис. 13—16). Нижний предел проявления взрывча-
т ы х свойств образует, пожалуй, чисто ароматический д и ни-
тро на ф т а л ин, между тем, как лучше сбалансированный
динитротолуол благодаря наличию алифатической метильной
группы в смысле распада скорее более инертен. Если предполо-
жить, что испытуемый образец динитронафталина не содержит
заметных количеств тринитронафталина, то воспламеняемость и
способность к взрыву хуже сбалансированного производного
нафталина были бы больше, чем у соответствующих нитропро-
изводных толуола. В отличие от этого взрывчатость алифа-
тических нитратов исчезает уже при недостатке около
45% кислорода, так как не только мононитроглицерин, но даже
тетранитрат целлюлозы (коллодионный хлопок) с недостатком
кислорода в 44,4 % утрачивают свой взрывчатый характер.
‘Naoum (К. F. Meyer), Techn. Fortschrittsber., т. XVI, Лейпциг
1927, стр. 165.
V. Взрывчатые свойства и химическое строение 61
Поэтому важным критерием для каждого взрывчатого вещества является
го кислородный баланс-—число, которое показывает, сколько граммов
кислорода в 100 г взрывчатого вещества или смеси недостает для полноты
.сгорания или, наоборот, имеется в избытке. Кислородный баланс дает
ленную возможность классифицировать взрывчатые вещества в пределах
какой-нибудь однородной группы, так как от него зависят энергия,
бризантность, а в известной степени также н чувствительность
к ударУ- Знание кислородного баланса имеет решающее значение для
всех антигризутных взрывчатых веществ; точно так же его следует учиты-
вать при суждении о боевых взрывчатых смесях, и прежде всего' в тех
случаях, когда речь идет о ставшей столь актуальной проблеме система-
тического уменьшения чувствительности при макси-
мально возможном сохранении кислородного баланса1.
Для облегчения таких вычислений в настоящей книге приводится с п е-
цйальиая таблица. Если например поставлен вопрос; «до каких пре-
делов можно флегматнзировать 80%-ный пентринит коллодионным хлопком
с 12% N и централитом I, чтобы ои был все же ближе к чистому пентриту
с недостатком кислорода в 10,1%, чем к смеси пентрит — тетрил 8°/«о, то
данными в таблице величинами пользуются следующим образом:
Пентрит 80 Нитроглицерин 12,5 .... Коллодионный хлопок 6 . . Централит! 1,5 0,8 - —10,12 = —8,10<> 0 0,125- 4-3,52= 4-0,44% 0,06 — 38,7 = —2,32% 0,015 —256,7 = — 3,85% Пентрит 80 Тетрил 20 0,8 • —10,12 == — 8,10% 0,2 • —47,3*1 = —9,47%
Недостаток кислорода Чувствитель- ность к удару от 5-кг удар- ника .... — 13,83% 35 см - 17,57% 28 см
С точки зрения взрывчатых 'свойств особенно 'интересен слу-
чай, когда/при одном и том же суммарном числе нитро-групп
одна из них находится у одного соединения — в ядре, а у дру-
гого -— в боковой цепи, как это имеет место у тетрамитр о-
аналииа и тринитрофенилметил нитрамина (те-
трила):
/СНо
N-.
| VNOS NH2
NO-Z X—NO2 No/1 >NO2
,/ 4/no2
no2 no2
— 47,41-0 О — 32,To О
В данном случае разница в бризантности значительно больше,
чем можно было ожидать по величинам кислородного баланса:
Ср. Der Kampf urn das Pentrinit, Ohem. 7.tg. 1901, 672.
62
Общая характеристика взрывчатых веществ
именно тетрил, содержащий в боковой цепи нитрогруппу, свя-
занную с амидным атомом азота, представляет настоящее трини-
тросоединение; между тем у тетранитроанилина, у которого ни-
трогруппы расположены в ядре, молекула расшатана пятью за-
местителями, благодаря чему возникшее разложение приводит
к особенно быстрому и внезапному распаду.
В результате вступления четвертой нитрогруппы в положе-
ние 3, подвижность молекулы настолько возрастает, что уже при
медленном гидролизе на воздухе отщепляется азотистая кислота.
Эта склонность к разложению выражена в усиленной мере
у 2, 3, 4, 6-тетранитро-
феи и лнитрамина и
еще больше у пента-
нитрофенилм е тм лни-
т р а м и н а — наивысшей
ступени нитрации арома-
тического углеводорода,
которую удалось дости-
гнуть Б л а н к с м а х, поль-
зуясь теми же условиями.
Рис. 29. 3 г тетранитроанилина и 3 г тетри-
ла, подвергнутые детонации в гильзе из
белой жести на железной пластинке тол-
щиной 3,5 мм 2.
что и для тетра- и
пента нитрофено лов.
Склонность к гидролизу
у шестизамещенных соеди-
нений настолько велика^
что уже при кипячении с водой отщепляются две нитрогруппы
(3,5) и образуется соответствующий фенол:
/СН3
N<
I xno2
no/’Y-no,
/СН3
N\
I xno2
no2/1X>no2
/СНз
N<
| XNO2
no2^1X>no2
темп. пл. 206°
2, 4, 6-тринитрометадиметил-
динитрамннобензол
no2^4/>no2
no2
темп. пл. 147°
2, 3, 4, б-тетранитрофенил-
1 -метилнитрамин
темп. пл. 132°
пентанитрофенилметил-
нитрамни
Рис. 30 и 31 иллюстрируют различную бризантность соедине-
ний с тремя и четырьмя нитрогруппами в ядре (по опытам в ан-
Ду и н а).
1 Ср. С. F. van D u i n, Brisante Nitro-Explosiva, Диссертация, Амстердам.
1918, A. H. К r u у t; далее: van Romburgh u. Schepers, Verslagen Kon.
Akad. van Wetenschapen, XXH, 293, Амстердам, 1913.
3 Stettbacher, Chemie u. Sprengstoffideal, Z. f. Schiess- u. Sprw.
1916, 112.
V. Взрывчатые свойствами химическое строение
63‘
Как и следовало предвидеть теоретически, расхождения при
этом параллельном опыте еще больше, чем на рис. 29. Промежу-
точное положение занимает по 'своей взрывчатости тринитромета-
диметилдинитраминобензол, который в отношении взрывчатых:
свойств равноценен тетранитроанилину, но в отличие от него
достаточно стоек. Следовательно стойкость бензольного
ядра нарушается лишь с вступлением четвертой нитро-
группы, между тем как одна или две нитрогруппы при наличии
атома азота аминогруппы не нарушают еще устойчивости три- -
нитрофенилового комплекса.
Рис. 30. Тринитрофенил-
метилнитрамин (тетрил).
Рис. 31. Тетранитрофе-
иилметилнитрамин.
Рис. 30 и 31.1,5 г каждого из указанных взрывчатых веществ,
запрессованных в медную гильзу под давлением 770 кг[см*,
подвергнуты детонации капсюлем-детонатором из гремучей
ртути с бертолетовой солью, весом 0,5 г; взрыв произво-
дился на 3-мм железной пластинке.
3. Диазосоединенйя
Обособленную группу образуют давно известные, сильно
взрывчатые соли диазония. Автор в свое время изучал
особенно энергично взрывающие перхлораты фенил-
ди а з он ия1 и испытывал их взрывчатые свойства сравнительно
с азидом свинца и гремучей ртутью: в отношении бризантности
диазоперхлораты (по крайней мере в количестве до 0,5 с), судя
по пробиванию жести, уступают, а в оболочке, наоборот, значи-
тельно превосходят указанные инициирующие взрывчатые ве-
щества.
Взрывчатый распад диазосоединений, в особенности солей
диазония, как например распад оглушительно взрывающегося
перхлората диазония, происходит невидимому по сле-
Die hochexplosiven Korper der Chemie, Prometheus 1916, 530 li 560.
64
Общая характеристика взрывчатых веществ
лующей схеме:.
Сначала оба атома азота образуют простую насыщенную мо-
. лекулу: эндотермические связи разрываются с выделением
энергии, остаток хлорной кислоты отрывается и окисляет бен-
зольное ядро, которое после этого уже во второй экзотерми-
ческой фазе распадается со взрывом. Таким образом взрыв
диазосоединения ни в коем случае не может быть срав-
нен с одновременным общим распадом, происходящим например
при детонации тринитрозамещенных бензольного ядра. Подобно
распаду дназосоединения протекает вероятно и взрыв ароматиче-
ских перекисей, например перекиси бензоила.
4. Затухание взрывной волны пластичных и желатинообразных
нитроглицериновых взрывчатых веществ
Своеобразное колебание свойств и непостоянство жидкого и
желатинированного нитроглицерина, в отношении воспламеж-
:няя, проявляющиеся при хранении, представляют всем известное
явление старения динамитов, которое неизбежно' происходит уже
через несколько дней и в результате которого первоначальная
скорость детонации падает с 7 000—6 000 м/сек до 2 000 и даже
1 000 м/сек. Эти факты, охотно оставляемые заводами без вни-
мания, стали в последнее время предметом подробных исследова-
ний, прежде всего Государственного химико-технического инсти-
тута в Берлине 1 и лаборатории взрывчатых веществ Московского
высшего технического училища2 3. Зелле (Государственный
химико-технический институт в Берлине) на основании своих
опытов пришел к выводу, что желатиндинамит в патронах диа-
метром до 30 лги, подвергнутый инициированию капсюлем-дето-
натром № 8 в толстостенных железных трубах, уже через три
недели не дает полной скорости детонации, ранной около
6500 м/сек. Дзержкович и Андреев считают возможным
объяснить это уменьшение скорости превращением обоих а л де-
ло тропных’ форм нитроглицерина, что является
1 Selle, Versuche liber die Detonationsfahigkeit u. Explosionsgeschwindig-
keit von Gelatinedynamit, Z. f. Schiess- u. Sprw. 1929, 469—474.
3 Ober die Eigenschaften der Nitroglycerin-Isomeren; там же 1930, 353 и 400.
V. Взрывчатые свойства и химическое строение 65
ошибкой *. Напротив, Наум приписывает это явление физи-
ческим причинам и защищает взгляд, что колебания скорости
детонации следует искать в небольших изменениях чисто внеш-
них влияний, какими являются например содержание воздуха и
особенно вязкость.
Что ни то, ни другое объяснение не может считаться верным,
доказывает нитрогликоль, который, несмотря на свою
сравнительно с нитроглицерином меньшую вязкость, детонирует
•почти всегда с одною и тою же низшей скоростью. Далее, ока-
зывается', что сильно замерзший, правильно закристаллизовав-
шийся нитрогликоль от капсюля № 8 в железных тиглях вообще
не детонирует, а только дефлагрирует. То же имеет место в случае
сильно замерзшего гремучего студня. Совсем иное наблюдается
® случае смеси тетранитрометан —-толуол; несмотря на
"210 г гремучего студня, 40 г 250 г гремучего студня. 170 г гремучего студня, 80 г
•пикриновой кислоты (дето- аммонпентринита.
на тор).
Рис. 32. В каждом случае взрыва патрон привязывался к ребру 12-jhjK
железной пластинки и воспламенялся от капсюля-детонатора № 8; пла-
стинки были подвешаны в воздухе.
чрезвычайно сильное флегматизирующее действие углеводорода,
скорость детонации этой смеси не снижается и при отрицатель-
ном кислородном балансе в 13,4% приводит к наивысшему бри-
зантному действию (рис. 115). В данном случае агрегатное состоя-
ние, вязкость и присутствие воздуха не играют никакой роли:
наивысшая, ни с чем несравнимая скорость детонации сохра-
няется во всех случаях.
Ясно выраженное непостоянство и скачкообразность в отно-
шении детонации, свойственные азотнокислым сложным эфирам
алифатических многоатомных спиртов, основывается вероятно
на природе этих соединений, причем на отдельные явления ока-
В более поздней работе К. К. Андреева (см. Безопасность труда в гор-
ной промышленности 1933 г., стр. 21) причины старения динамитов выра-
жающиеся в уменьшении скорости детонации и восприимчивости к капсюлю-
учениГ°РУ’ СЧИТаЮГСЯ неопределенными и требующими дальнейшего из-
К этому же мнению склоняется невидимому и сам Штетбахеп Гем сьи
miker-Zeitung 71, 719 (1934 г.)]. Прим. ред. тетоахер [см. Che-
5 Зак. 3171. — ГПтетбахер.
66 Общая характеристика взрывчатых веществ
зывают известное влияние особые химические или физические
причины. Самым надежным и действительным средством разви-
тия максимальной скорости детонации является «пентринитиро-
вание» динамита к этому заключению, кроме вышеуказанного
опыта с 25G г гремучего студня, хранившегося 16 дней, приводят
рис. 100 и 153, служащие тому наглядными примерами.
1 Т. е. введение в динамит определенного процента так называемого
пентринита. Прим. ред. Stettbacher, Hochbrisanz-Studien III: Dynamit ц.
Pentrinit im plastischen und im gefrorenen Zustande, там же, 1931, 8—10.
ГЛАВА ТРЕТЬЯ
ОСНОВНЫЕ ПОНЯТИЯ ИЗ ТЕОРИИ ВЗРЫВЧАТЫХ
ВЕЩЕСТВ
I. Взрывчатые и метательные средства
Дать четкое понятие о взрывчатом веществе,
равно как ио взрыве, трудно, хотя практика и предъявляет
определенные требования такого рода.
Основное, без чего немыслим процесс взрыва, — это положи-
тельное выделение теплоты, которое дает возможность
раз начавшемуся разложению развиваться самостоятельно
дальше и, быстро прогрессируя, в своем развитии достигнуть
скорости детонации. Будет ли эта теплота экзотермического или
эндотермического происхождения — безразлично; необходимо
только одно, чтобы взрывчатый распад проходил с выделением
энергии. Без этого условия ни один взрыв, не может иметь
места. Так например оксиликвитная смесь, состоящая из по-
ристого угля и жидкого кислорода, — взрывчата, а жидкая угле-
кислота— не взрывчата, хотя обе системы при их переходе
в углекислый гав приводят к одному и тому же конечному со-
стоянию, характеризующемуся почти одинаковым увеличением
объема. Поэтому справедливо общее положение, что если си-
стема требует для своего превращения постоянного притока
энергии извне, то она не обладает взрывчатыми свойствами. Это
очень хорошо можно проследить на свойствах ряда щавелево-
кислых солей тяжелых металлов. Разложение только тогда со-
вершается со взрывом, когда оно связано с экзотермиче-
ским тепловым эффектом:
Реакция
РЬС2О4 = РЬ (тверд.) -f- 2СО2
СиСоО* = Си (тверд.) Ц- 2СО2
HgC2O4 = Hg (жидк.) -f- 2СО2
Тепловой эффект
(в б. кал)
—16,7; не взрывчата
4- 5,9; взрывчатые свойства
выражены очень слабо
4- 17,3; взрывчата
Во времена дымного пороха, до открытия нитроглицерина,
под взрывчатым веществом понимали твердую горючую массу, ко-
торая, будучи воспламененной пламенем или искрой, мгновенно
превращается в газы и затем благодаря выделению большого
5s
68
Основные понятия из теории взрывчатых веществ
количества тепла занимает в тысячи раз больший объем, так что
ближайшая окружающая среда, оболочка, испытывает мощное
давление. В настоящее время характерным для взрывчатого ве-
щества считают способность его выделять в момент взрыва газы,
нагретые до высокой температуры и обра-
зующиеся в кратчайший п р о ме ж у т оте в р е м е н и.
Это определение распространяется на твердые, жидкие и газо-
образные тела, как на экзотермические, так и эндотермические.
Исключений из этого общего определения до настоящего вре-
мени не наблюдалось. То обстоятельство, что твердый карбид
(ацетиленид) серебра, получаемый из аммиачного раствора
азотнокислого серебра, ।
AgaCs 2Ag -|- 2С -}- 87 6. кал
разлагается при взрыве с сильным звуком и появлением пламени
на две негазообразных составных части—серебро и углерод —
является кажущимся противоречием и объясняется без всякой
натяжки тем, что это соединение чаще всего содержит небольшое
.количество примесей (например Ag2O), которые при взрывчатом
распаде дают некоторое количество газов. Эти газы и непосред-
ственно прилегающий воздух благодаря теплоте разложения рас-
ширяются, и таким образом1 получается явление взрыва. Чистый
продукт, точно отвечающий формуле AgaCa, будучи воспламенен
в безвоздушном пространстве раскаленной проволокой, не обна-
руживает взрывчатого действия.
В этой связи следует назвать также и те переходные смеси,
которые в качестве своего рода промежуточной ступени обра-
зуют мост от термита к взрывчатому веществу; например п о-
р о ш к о о бр а зн ы й алюм1иний в смеси с хлоратом
калия сгорает в нелетучую окись алюминия (темп. пл. 2500°)
с выделением хлористого калия, переходящего в парообразное
состояние лишь около 1 000°; однако, несмотря на это, вследствие
огромного выделения теплоты достигается высокое и мгновенное
давление паров. В действительности, будучи насыпана без утрам-
бовки в железный тигель или мортирку, при воспламенении обык-
новенным бикфордовым шнуром эта смесь взрывает с резким
звуком, но не обнаруживает взрывчатого действия. Подобным
же образом следует объяснить реакцию между щелочными
металлами и водой или кислотами: в этом случае мгно-
венно образуются сперва нелетучие окиси, затем гидроокиси
с выделением такого количества тепла, которое не только дово-
дит прилежащую жидкость до максимальной упругости взрыва,
но также обращает часть остающегося металла в пар. Но. и здесь
детонирующее действие также маскируется снопами искр и пуле-
метным треском того же характера, который получается напри-
мер при погружении 1 кг металлического натрия в воду.
Если рассматривать взрыв как мгновенное возникновение и
увеличение объема газообразных продуктов, то противополож-
I. Взрывчатые и метательные средства
69
ным или отрицательным понятием взрыва будет взрыв
разрежения — мгновенное исчезновение или уменьшение
объема газообразных продуктов. Взрывы разрежения могут про-
исходить во всех тех случаях, когда газы реагируют с уменьше-
нием объема, если только при этом не происходит компенсации
уменьшения объема вследствие теплового эффекта, как на-.
пример в случае гремучего газа
Метательные средства представляют собою взрывча-
тые вещества с регулируемой скоростью горения. Так например
современный ружейный порох состоит почти из чистого пирокси-
лина, а орудийный порох — из смеси пироксилина — нитроглице-
рина (1 :1), взрывающей еще более энергично; оба они однако
благодаря особому процессу — желатинизации — утрачивают
мгновенность горения
и приобретают спо-
собность к прогрессив-
ному развитию давлений.
Поэтому резкое разли-
чие между бризантными
и небризантными взрыв-
чатыми веществами от-
сутствует, тем более что
каждый из названных
порохов можно подверг-
нуть детонации с бри-
зантностью его компо-
нентов, если только для
воспламенения их приме-
нить вместо капсюля-
воспламенителя сильный
Рис. 33. Действие высокобризантного веще-
ства в толстостенной стальной трубе.
капсюль-детонатор.
На рис. 33 представлена цельнотянутая стальная труба (20 X 42 мм)
до взрыва и после взрыва пентринита. */s толстостенной трубы разбито
на бесчисленное множество осколков, и на железной плите осталась только
тонкая зазубренная полоса (ср. стр. 336—337). Если взять современное поле-
вое орудие, у которого толщина стенок обычно меньше диаметра канала,
то в этом случае должно было бы произойти по крайней мере такое же
разрушение канала ствола, если бы вместо прогрессивно горящего пороха
было взято равное по силе взрывчатое вещество, но детонирующее
со скоростью не менее 8000 м/сек. Преждевременный взрыв
в канале орудия, при котором разрывной заряд преодолевает сверх того
1 Термин «взрыв разрежения» вводится впервые в нашу литературу
по ВВ, соответствует немецкому Implosion и противоположен Explosion; вы-
текает из определения, даваемого Штетбахером и другими. Оба явления
взрыва сопровождаются мгновенным повышением давления в месте взрыва,
но при взрыве (explosion) в обычном понимании этого явления увеличи-
вается объем газообразных продуктов, а при взрыве разрежения объем га-
зообразных продуктов уменьшается и получается разрежение в месте
взрыва. Прим, ред
70
Основные понятия из теории взрывчатых веществ
прочные стенки снаряда, приводит, естественно, к значительно меиынему
эффекту. Обыкновенно ствол орудия в месте взрыва настолько разду-
вается, что образуются полосы и продольные трещины.
Для порохов характерно прежде всего то, что образова-
ние газообразных продуктов и связанное с этим
повышение и распределение давления внутри орудийного и ору-
жейного ствола происходит в некоторый промежуток
времени. От этих факторов зависит в высокой степени как
тип орудия, так и его балистическая мощность. Живая сила сна-
ряда {дульная энергия) не является результатом одного давления
(например удара газообразных продуктов при воспламенении),
го составляет сумму непрерывного ряда давлений, которые от
снарядной каморы- до дульного среза действуют на дно снаряда.
Нижеследующая диаграмма представляет нарастание давления
трех порохов, сгорающих с различной скоростью («живых»),
Рис. 34. Ход развития давления и работы пороховых газов в ка-
налах орудий различной длины.
в орудиях различной длины. Нормальный шорох примерно со-
ответствует бездымным ружейным порохам. В момент воспла-
менения начинается образование газов; но пока давление до-
стигнет такой величины, чтобы преодолеть инерцию тяжелого
снаряда и заставить его двигаться, .проходит еще некоторый
очень короткий промежуток времени. Поэтому движение начи-
нается за нулевой точкой, быстро возрастает до момента макси-
мального давления и затем постепенно уменьшается в направле-
нии к дулу. Заштрихованные площади представляют общий
импульс (== давление X время), сообщаемый снаряду порохом;
участки площади, выходящие за длину ствола, представляют
тот остаток энергии, который теряется с пороховыми газами,
вылетающими из дула>. Согласно схеме наилучшее энергетиче-
ское использование нормального пороха имело бы место
в канале винтовки длиною в 92 калибра;- но для значительно
более длинноствольного 'сверхдальнобойного орудия оно было
бы совершенно неудовлетворительно, так как нарастание энер-
I. Взрывчатые и метательные средства
71
гии на дополнительном участке канала орудия слишком мало,
чтобы сообщить снаряду еще более значительное ускорение.
Идеальный порох дает исключительно выгодное разви-
тие пороховых газов в канале винтовки, равномерное среднее
давление, благодаря которому к оружию предъявляются мень-
шие требования, оружие упрощается в конструктивном отноше-
нии и теряется очень немного дульной энергии. Метательное
средство с такой ровной кривой давления на практике не встре-
чается. Подобным же образом протекает работа сверхмощ-
ного пороха («ультрапорох») (еще не осуществленного) для
скоростей ружейной пули в 1500 м/сек или даже выше. В этом
случае давление удерживается в период наибольшего нарастания
на верхнем пределе в 4000 ат, так как только этим способом
снаряду может быть сообщена сумма количеств движения, ко-
торая дает ему возможность приобрести такие начальные ско-
рости. Этому требованию удовлетворяет германская пехотная
винтовка (Ordonnanzwaffe); как будет указано ниже, «теоретиче-
ское» максимальное давление в этом случае уже при
vo —889 м/сек достигает 4560 кг/см2, конечно только на одно
мгновение. Соответственно этому такие же сверхскорости могут
быть получены в каждой пехотной винтовке, если применить
достаточно большой заряд нормального пороха..
Для 28-сантиметрового орудия, имеющего снаряд
весом 340 кг с начальной скоростью 850 м, при пороховом заряде
93,2 кг и объеме пороховой каморы в 84,3 л получается следую-
щее распределение энергии (на 1 лд пороха):
Работа ускорения снаряда (дульная энергия) ...........312 б. кал
Работа ускорения газов (расширение)................... 27 „
Работа трения •....................................... 19 ”
Отдача теплоты стволу................................226
Остаток теплоты (теплота в выброшенных из канала горячих поро-
ховых газов)......................................... 516 я „
1100 б. кал
Наивысшее давление газов было вычислено 2900 ат; оно же
у дула 1000 ат. Среднее давление газов в германской пе-
хотной винтовке составляет 3201 ат. Сечение, на которое
приходится наивысшее давление, определено Кранцем1 по-
средством оптического измерителя отката в расстоянии 95 мм от
первоначального положения дна снаряда; к этому сечению по
(вычислениям должно сгореть около 70-—75% порохового за-
ряда. Сгорание заряда весом в 3,2 г происходит в 0,4Ю 1 сек., т. е.
приблизительно за то же время, которое необходимо для про-
хождения длины канала пулей. Для орудий обе величины больше:
так например 40,64-см снаряд крупповского орудия L/50 прохо-
дит канал его за 1/ю сек.
1 Lehrbuch der Ballistik, Берлин 1926.
72
Основные понятия из теории взрывчатых, веществ
Наиболее совершенным образом энергия используется в ка-
нале винтовки. Но даже и в этом случае только 35% общей
энергии превращаются в движение. Для швейцарской пехотной
винтовки полезный эффект при начальной скорости 805 м/сек^
весе пули 11,3 г и пороховом заряде 3,2 г, выделяющем 90 б. кал/г,.
вычисляется следующим образом.
tnv^
Живая сила пули — по формуле — %где масса т равна весу
пули G, деленному на ускорение силы тяжести g:
G-v2 11,3 -8052 Q„c,no
= 2 9 80 = °™ гм (граммометров).
Механический эквивалент энергии метательного заряда:
3,2 900 - 426,9 = 1 229 472 гм.
,, , „ дульная энергия-100
Коэфнцнент полезного действия = —----------------
энергия метательного
заряда
378 708 100 _ 30 go,
1 229 472 ~
В 1884 г. 1 г дымового пороха давал наивысшую дульную
энергию 50 кгм; в 1905 г. бездымный пластинчатый порох давал
уже 123 кгм. Если вычислить всю энергию в больших калориях,.
точдля дымного пороха получается 265 кгм и бездымного 382 кгм;
следовательно в первом Случае теряется более чем 4/s, а во вто-
ром— приблизительно 2/з метательной энергии. Если большая
часть потерь объясняется потерями тепла, то все же значитель-
ное количество энергии теряется благодаря несовершенству
передачи по короткому каналу ствола; поэтому сверхдально-
бойные орудия, стрелявшие по Парижу, имели по сравнению-'
с калибром необычно большую длину (стр. 319).
Совершенно очевидно, что при таком использовании энергии
и скоростей снаряда осколки снаряда, если последний
снаряжен даже самым бризантным взрывчатым веществом, ни-
когда не могут достигнуть скорости пушечного снаряда, потому
что путь, на котором может действовать давление детонации
газов взрыва до разрыва стального корпуса снаряда, слишком
мал, чтобы отдельный осколок получил необходимую для этого
энергию. Все же Б ю р л о вычислил, что скорость металличе-
ских осколков при взрыве шнейдерита в цинковом ящике соста-
вляет 2450 м/сек.
Скорость снаряда зависит от требований, предъявляемых
к орудию. Наряду с максимальным давлением решающее значе-
ние имеет также среднее давление. Среднее давление
есть то давление, которое получалось бы в канале орудия, если
сумму давлений, образующихся ’в течение выстрела от среза за-
твора до дульного среза, привести к некоторой средней величине-
/. Взрывчатые и метательные средства 73
Так, среднее (идельное) давление германской винтовки М/98
графически выражающееся средней линией между наивысшим'
и наинизшим давлениями, идущей параллельно оси абсцисс
(рис. 123), составляет около 1600 кг/см1 2, а вычисленное по*
нижеследующей формуле выражается близкой цифрой-—
1530 кг/см2. Между тем действительное максимальное давление-
(имеющее место быть может только в течение одной миллионной
секунды) достигает 4561 кг/см2. Предел упругости луч-
шей никелевой орудийной стали2 составляет только около
5000 кг!см2, между тем как сопротивление на раарыв достигает-
Рис. 35. Максимальная дальность стрельбы н высота подъема снаряда орудия
сверхдальней Стрельбы образца 1918 г. по сравнению с 30,5-сж снарядом
пушки Круппа L/40.
6800 кг/см2. Поэтому практически переходить давление
в 5000 кг/см2 ни в коем случае нельзя, хотя в единичных опытах
стрельбы, например при определении вибрации старого ствола,
Давление можно доводить до 6000 ат, т. е. довольно близко
к пределу текучести.
Для вычисления среднего давления (D,n ) Гейден-
Рейх дал формулу:
D™=2^-s - - 1,0333’
1 R о h n е, Gemeinverstandliches aus dem Gebiete der inneren Ballistik,.
2. f. Schiess- u. Sprw. 1931, 162; 1932, 258, 289, 333, 371; P. Curti, Schweiz.
Monatsschrift f. Offiziere aller Waffen 1932, № 12.
2 L. Hahnert, Geschiitz u. Schuss, Берлин 1928, 147,
74 Основные понятия-из теории взрывчатых веществ
где G — вес снаряда, получающего ускорение, L — вес порохо-
вого заряда (половина которого получает ускорение),^—дуль-
ная скорость снаряда, s— путь снаряда в канале, q — поперечное
сечение снаряда, g — ускорение силы тяжести.
Например для 21-сл сверхдальнобойного снаряда весом 120 кг при весе
порохового заряда 200 кг и начальной скорости 1700 м/сек среднее давление
‘ „ (120 +100) • 17002 __ .,
°гл~ 2 • 9,81 • 33 • 10,52 • я • 1,0333 ~ 2750 кг!см~’
т. е. выше среднего давления германской винтовки (Ordonnanzgewehr), рав-
ного 1530 кг/см2, что прн очень больших начальных скоростях вполне
понятно ’.
Быстрота, с которой порох сгорает в оружии, называется живостью;
это свойство выражается отношением среднего давления газов
к максимальному:
По Гейденрейху различают пороха мощные '/1=0,30—0,45 (мортиры);
пороха средней мощности ч = 0,45—0,60 и пороха маломощные Т1 = 0,60—0,75
'(.винтовки, орудия настильной стрельбы).
Такого рода деление применяется только для определенного типа
оружия и пуль или снарядов и не является общим для всех случаев.
Например для германской пехотной винтовки со слабым пироксилиновым
порохом
такое число соответствует боевым порохам орудий навесного огня. По этой
характеристике один и тот же порох для одного оружия может быть
бризантным, для другого слабым.
После этих основных положений из «термодинамики в канале
орудия» приведем некоторые данные из внешней б а л и-
стики. Пренебрегая кривизной земли, для безвоздуш-
ного пространства можно принять следующие формулы:
для сверхдальнобойного снаряда при v0 = 1600 ml сек наибольшая
теоретическая дальность полета составляет:
тъ 16ПО2
v02sin2a = -|- (при 45°) = -g-gj- — 261 км;
высота траектории (теоретическая):
«'o2'sin2a
16002 - 0,7071а
2 • 9,81
= 65,2 км;
1 Ср. также Rohn е, Gewaltige Steigerung der ballistischen Leistung
der Gewehre, Z. f. Schiess- u. Sprw. 1931, 397—399 (формулы для вычисления
среднего давления дают слишком низкие величины).
I. Взрывчатые и метательные средства
75.
наибольшее время полета (теоретическое):
®osina
1600 • 0,7071
4,905
= 231 сек.
Высота траектории и дальность полета сильно уменьшаются
вследствие сопротивления воздуха, и, как можно видеть из при-
меров, приведенных на стр. 303—304, даже при самых благо-
приятных условиях действительная дальность полета достигает
не больше 60% теоретической.
1. Снаряд или ракета
Проблема многократного увеличения наивысших скоростей
полета снаряда, а тем самым и полет, подобно метеорам, с земли
в мировое пространство материальных тел По траекториям, не
подверженным могущественному действию силы тяжести, ранее
казалась абсурдной и балистически неразрешимой, К разреше-
нию этой проблемы за последние десять лет подошли вплотную.
Все то, что теоретики межпланетных сообщений и конструкторы
ракет вычислили и сконструировали до настоящего времени,
имеет целью осуществление этой мысли в будущем. И так как
ракета в качестве чего-то среднего между снарядом и самолетом,
имеет свое будущее и с военной точки зрения, мы кратко оста-
новимся на этом вопросе.
Старейшим и повидимому наиболее действительным средством метания
тела на значительную высоту над поверхностью земли в мировое простран-
ство является стрельба из орудия. 120-кг снаряды орудия сверхдальней
стрельбы, стрелявшего по Парижу, поднимались в воздух на высоту
около 40 км и падали в расстоянии 128 км от места выстрела. Если соответ-
ствующую начальную скорость увеличивать все больше и больше, то вер-
шина траектории также поднимается все выше и выше, а сама траектория
удлиняется, так что полет снаряда в конце концов совершается по кривой,
параллельной поверхности земли, т. е. снаряд после этого не падает
на землю, а движется около нее, подобно сателлиту. Это было бы возможно^
только в том случае, если бы снаряд был выстрелен с некоторой высоты
горизонтально по отношению к поверхности земли и с теоретической
начальной скоростью 7897 м/сек. В действительности такое движение сна-
ряда не может быть достигнуто ни при какой, даже еще ббльшей, ско-
рости, так как сопротивление воздуха при горизонтальном выстреле можно
•было бы преодолеть только прн почти бесконечно большой начальной
скорости. Чтобы вывести какое-либо тело из поля действия сил земного
притяжения, остается только стрельба под некоторым углом с начальной
скоростью 11 050 м/сек. В этом случае снаряд пробил бы сначала слой атмо-
сферного воздуха, а затем летел бы в бесконечные высоты мирового про-
странства по траектории, представляющей параболу, и никогда больше не
возвратился бы на землю. Однако и здесь скорость должна значительно
превосходить вычисленный 11 -км предел вследствие сопротивления воздуха
в начале полета снаряда.
Скорости этого порядка превосходят однако наши технические воз-
можности, причем препятствия заключаются не столько в требующейся
Для этого энергии пороха, сколько в совершенно недостаточной прочности
наших лучших сортов орудийной стали, необходимой для сопротивления
давлениям пороховых газов при температурах горения 4000°. Достигнуть
необходимого запаса энергии можно было бы в крайнем случае посред-
76 Основные понятия из теории взрывчатых веществ
ством очень сильного, весьма плотного и сконцентрированного в большой
каморе заряда взрывчатого вещества', особенно, как это видно на примере
орудия сверхдальной стрельбы, если работу метательного заряда передать,
снаряду с исключительно высоким коэфициентом полезного действия
в очень длинной сравнительно с калибром орудия трубе. Но, с другой
стороны, одновременно необходимо иметь сталь, которая выдержала бы
давление раскаленных пороховых газов не только максимум 5000 аг, но.
и 20000 ат. Эту непреодолимую пока трудность невозможно Обойти путем
последовательного выстреливания на полете одного или нескольких снаря-
дов из основного снаряда, так как этому сложному, вызывающему сильное
сопротивление воздуха снаряду, тоже нельзя сообщить сразу требующуюся
начальную скорость.
Следовательно, работая над снарядом в указанном направлении, невоз-
можно достигнуть больших дистанций и тем более проникнуть в мировое
пространство. Наоборот, обратный принцип — явление отдачи при в ы-
стреле — приводит к значительно большим, почти космическим скоростям;
остается, собственно, непонятным, почему наши специалисты до настоящего-
времени не обратили внимания на этот простой и .обещающий безграничные
возможности -факт.
Если произвести выстрел из горизонтально подвешенной винтовки, т<
не только пуля и пороховые газы выбрасываются из канала с определенной
скоростью, но и винтовка, вес которой приблизительно в 400 раз больше
движется вследствие удара газообразных продуктов горения в обратное
направлении. Если представить себе специальную винтовку, из которой
можно было бы последовательно произвести два, три и больше выстрелов,
прежде чем она успела бы замедлить свое движение от предшествующей
отдачи, то отдельные скорости складывались бы1 в равномерное ускорение
в направлении, противоположном выстрелу. По закону равенства действия
и противодействия тот же процесс должен происходить и в безвоздушно*,
пространстве; не менее очевидно, что отдача получится и при выстрел!
холостым зарядом, так как молекулы, вылетающие из канала ствола
в форме сильно сжатых пороховых газов, представляют не что иное, Kai
бесконечно малые снаряды.—-частицы массы, которые соответственно своей
сумме, т. -е. весу порохового заряда и скорости вылета, сообщат винтовке
совершенно определенную силу отдачи. Если вместо пороха, содержа
щего азот (энергетически менее производительного), взять углеводороды
выделяющие значительно большее количество тепла, и если например
взрывообразно выбрасывать из специального сопла через короткие проме-
жутки времени смесь бензина и жидкого кислорода, то это и составит
Принцип действия современного снаряда-ракеты.
Наилучшим энергетическим материалом явился бы гремучий газ,
который -выделяет 3800 б. кал на 1 кг и имеет скорость вспышки около
4000 л/сек, между тем как употребительные сорта моторного топлива обла-
дают несколько меньшей энергией и скоростью горения около 3000 д/сек.
Однако и они дают еще достаточно высокий коэфициент полезного дей-
ствия, т. е. химическая энергия метательного вещества, его скорость
вспышки и количество газов, выбрасываемое с каждым, взрывом, позволяют
сообщить ракете ускорение, требуемое для возможно быстрого достиже-
ния максимальной скорости. Ракета отрывается от земли тотчас же, как
только ее ускорение в секунду превосходит таковое силы тяжести, рав-
ное 9,81 м. При ускорении нетто 20 м (равном 30 м собственного ускорения
за вычетом 9,8 м земного ускорения) через 100 сек. была бы достигнута
скорость 2000 м/сек, и ракета уже через несколько минут двигалась бы
в самых высоких слоях воздуха без трения. Так например для почтовой
ракеты из Европы в Америку время полета, принимая за исходные данные
300 кг горючего и 30 кг полезного груза, вычислено в 25 мин. Воздушная
торпеда в качестве «управляемого с расстояния» военного снаряда могла бы
подняться на высоту 1000 км и точно попасть в цель. При скорости полета
не менее 3000 м/сек сообщение движения ракете стоило бы не дороже, чем
движение от обыкновенного мотора.
I. Взрывчатые и метательные средства
77
2. Воспламенение или начальный импульс
Взрыв через влияние
В отличие от легко воспламеняющегося дымного пороха бри-
зантные взрывчатые вещества требуют для взрыва сильного
источника воспламенения или начального
импульса — удара от взрыва небольшого заряда гремучей
ртути или азида свинца в форме капсюля-детонатора. Если раз-
ложение началось, то за ним: следует «детонация1» с исключи-
тельно большой скоростью — до 9000 м/сек.
Сущность воспламенения (инициирования) по современным
представлениям1 заключается прежде всего в том, что взрывчатое
вещество под влиянием мгновенно развивающегося, чрезвычайно
высокого давления газов детонатора разлагается в месте дей-
ствия на него начального импульса. Соседние частицы взрывча-
того вещества воспринимают у-дар, который в виде постоянной
волны давления механически распространяется затем от слоя
к слою по всей массе. Возможно, что непосредственной причиной
воспламенения является адиабатическое нагревание, про-
изводимое огромным давлением газообразных продуктов взрыва
гремучей ртути. Например достаточно уже давления сжатия
в 200 аг, чтобы нагреть воздух от О до 1000°, так что в резуль-
тате удара газообразных продуктов детонатора, сжатых до де-
сятков тысяч атмосфер, возникают чрезвычайно высокие темпе-
ратуры, которые, естественно, могут вызвать детонационный рас-
пад взрывчатого вещества. В действительности наилучшими ини-
циирующими свойствами обладают те взрывчатые вещества, кото-
рые разлагаются с большой скоростью детонации, между
тем как богатые энергией, но имеющие меньшую скорость раз-
ложения сбединения заметно менее активны. Что «давление дето-
нации», или «бризантность», взрывчатого вещества следует счи-
тать «основным фактором инициирующего действия», довольно
наглядно видно из опытов взрыва одного и того же гремучего
студня (рис. 36 и 37) в одном случае сильным, но детонирую-
щим с несколько меньшей скоростью циклотриметилен-
тринитрамином (гексогеном) и в другом случае менее
сильным (по расширению в свинцовом цилиндре), но быстро де-
тонирующим нитропентаэритритом.
Взгляд, что взрывчатый распад является следствием меха-
нического удара и возникающего благодаря этому в кратчай-
ший промежуток времени почти адиабатического нагревания со-
ответствующие частиц, совпадает с представлением, что детона-
ция взрывчатого вещества происходит от удара и перегрева. На-
пример действие удара ударника копра объясняется
прежде всего предположением, что теплота, возникающая в ре-
зультате превращения исчезающей энергии движения, нагревает
частицы, по которым произведен удар, до температуры, при ко-
78
Основные понятия из теории взрывчатых веществ
.торой происходит 'мгновенное повышение скорости разложения
до скорости взрыва. Наоборот, при перегреве, сгорании
взрывчатых веществ, образующиеся в месте горения газы уплот-
няются до давлений, которые, когда нет свободного выхода., вы-
зывают ударную волну, а затем взрыв всего заряда. На этом
явлении основаны, возможно, различные загадочные случаи
взрыва.
Но приведенные объяснения оказываются неудовлетворитель-
ными, коль скоро приходится говорить об известном явлении
передачи детонации на более или менее значительные
расстояния, о так называемом взрыве через влияние.
Взрывная волна уподобляется звуковой волне в том отноше-
нии, что она в смысле акустических явлений резонанса передается
Рис. 36. 50% гексогена. Рис. 37. 50° 0 пентрита,
смешанные каждый с 50% гремучего студия.
Рис. 36 и 37. Вид отверстия, пробитого 32 г взрывчатой
смеси одинаковой плотности, равной 1,6, в 8-мм железной
пластинке.
по воздушной среде на те же самые или другие взрывчатые ве-
щества и может непосредственно вызывать детонацию.
Это явление подтверждено опытным путем. Так, чрезвычайно
чувствительный иодистый азот может быть взорван от
звука с более, чем 60 колебаниями в секунду или от звука своего
собственного взрыва, если взрывные волны собирать в вогнутом
зеркале и отражать на другую пробу. Явлением взрыва «через
влияние» можно было бы по Маху объяснить также взрыв
нитроглицерина, помещенного между двумя вогнутыми зеркалами
с совпадающими осями; различные несчастные случаи объяс-
няются такой передачей на расстояние. Таков например часто
упоминаемый случай взрыва в Шюрполе-на-Рейне в 1895 г. На
транспортное судно производилась погрузка большого количества
динамита, во время которой взорвалось 20 000 кг уже погружен-
ного динамита. На берегу стояли три тачки с динамитом по 175 кг
I. Взрывчатые и метательные средства 79'
на каждой; две из них, находившиеся на расстоянии в 22 и 28,5 л,
взорвались через влияние, третья же, находившаяся на расстоя-
нии в 48 м, осталась невредимой. Были ли это действительно
взрывы через влияние, а не взрывы от механического дей-
ствия разлетавшихся осколков, — остается неясным. Во всяком
случае тот, кто видел, как открыто уложенные детонирующие
динамитные патроны не только не воспламеняются от взрыва
таких же патронов, уложенных в расстоянии 2—3 ел, но даже
отбрасываются, как снаряды (с небольшим .раздроблением со
стороны взрыва), не удовлетворится такими объяснениями.
При ©сем' том, согласно обширным опытам Б ю р л о передача
взрыва на расстояние наблюдается в отдельных случаях и без
всякой возможности непосредственного механического воздей-
ствия со стороны активного заряда на пассивный заряд. Так,
в одном случае заряд был взорван в результате взрыва другого
заряда, хотя они были разделены большой толстой стальной пли-
той: пример настоящего взрыва через влияние!
После колоссального взрыва французского склада взрывчатых
веществ в Боссенке (дельта Роны) 4 июня 1918 г., одновременно
уничтожившего 6500 т порохов и взрывчатых веществ, по пору-
чению Commission des Substances explosives были подвергнуты
широкому изучению все факторы, которые оказывают влияние
на .передачу взрыва иа расстояние *. С целью установления зако-
номерностей, явления изучались на самых разнообразных взрыв-
чатых веществах, причем заряды брались от 50 г до нескольких
тонн. При этом было найдено, что если активный заряд (с) пи-
криновой кислоты весом 50 г в состоянии еще инициировать
такое же количество пикриновой кислоты, находящейся на рас-
стоянии 15 см, то соответствующие активные заряды (ся ) соста-
вляют: для тринитротолуола 64, для тетрила — всего 28 и для.
безопасного состава Ф а в ь е даже 2500 г.
Коэфициент передачи или чувствительности
I с
— согласно этим исследованиям составляет
ci
для пикриновой кислоты по отношению к пикриновой же
50
кислоте 1,
50
Для
для
для
тринитротолуола по отношению к пикриновой кислоте
§=0,78,
64
50
тетрила по отношению к пикриновой кислоте = 1,80'
50
2500 ==0,02‘
малочувствительного состава Фавье
1 L. Vennin, F. Burlot, Н. Lecorche, Les Poudres et Explosifs,.
Париж 1932, стр. 203—210; русское издание 1936 г., стр. 187—194.
80 Основные понятия из теории взрывчатых веществ
На основании этого зависимость между расстоянием
передачи d (в метрах) и взорвавшейся массой взрывчатого
вещества с (в килограммах) выражается равенством
d— к Ус,
причем множитель к зависит от плотности и содержания влаги
во взрывчатом веществе и других физических условий окружаю-
щей среды. Для надземного склада взрывчатых веществ (без ва-
лов) к принимается равным приблизительно 2,5. Таким образом
на основании лабораторных опытов, подтвержденных при про-
верке в большом масштабе, можно вычислить требуемые дистан-
ции, при которых передача взрыва детонацией не может иметь
места и которые действительны для всякого взрывчатого веще-
ства и склада, рассчитанного на любое количество взрывчатых
веществ. При этом различают максимальное расстояние De, при
котором передача еще имеет место и расстояние Рв, при кото-
ром получается уже достаточная безопасность. Так например
относительные расстояния De и Ds на открытом воз-
духе составляют: для аммиачноселитренного взрывчатого* ве-
щества 3 и 9, для мелинита 58 и 67 и для еще более чувстви-
тельного гурдинамита 98 и 123.
3. Взрывы на открытом воздухе
Упругое действие давления
При больших взрывах на открытом воздухе часто наблю-
даются два совершенно различные по своему характеру дей-
ствия: в одном случае обломки предметов, непосредственно при-
легающих к месту взрыва и расположенных на некотором рас-
стоянии от него, разбрасываются, а в другом — отбра-
сываются к центру взрыва. Эта странная двойственность
явлений изучалась посредством указателей воздушных ударов на
искусственно расположенных местах взрыва, но до настоящего
времени она получила столь же мало удовлетворительное объяс-
нение, как и кольцеобразные зоны неслышимости при катастро-
фических взрывах. Возможно, что около места взрыва обра-
зуются зоны сжатия, которые через более или менее пра-
вильные промежутки приводят к действию силы положительного
или отрицательного направления. Доказательством этого мог бы
служить гигантский взрыв в Штейнфельде (около Вены),
где 16 июня 1917 г. взорвалось более 2,5 млн. кг взрывчатых
веществ. Действие взрыва распространилось до Вены (40 км), где
было выбито много оконных стекол. В заводской местности
Блюмау, отстоящей на 4—8 км, в определенных расстояних от
места взрыва осколки стекол оказались внутри зданий; в других
заводских поселениях разбитые оконные стекла падали на улицу.
Местечко Зигерсдорф, расположенное в 3 км, было почти совер-
шенно разрушено. Не поддается объяснению однако то обстоя-
1. Взрывчатые и метательные средства
81
тельство, что открыто стоящее здание в расстоянии менее 2 км
от места взрыва осталось невредимым. И еще более удивительно,
что на расстоянии едва ли большем 300 м от места взрыва
стеклянный фонарь с ауэровским газокалильным колпаком был
найден на столбе совершенно целым.
Эти данные были подтверждены опытом в Ля-Куртин, у Ли-
можа, 15 мая 1924 г.,, произведенным ,с научными целями. В от-
крытом поле было взорвано сразу 10 т мелинита. На месте
взрыва образовалась воронка глубиною 6 м и диаметром 20 м.
Рельсы, вертикально вкопанные в землю в непосредственной бли-
зости, были отброшены на 20—30 м, погнуты и частью сломаны
пополам. Но уже в расстоянии 60 м взрыв не в состоянии был
произвести никаких видимых повреждений, что служит доказа-
тельством быстроты падения давления в сторону от места взрыва
и показывает, как часто переоценивается сила взрыва бомбы
в том случае, когда бомба не имеет прочной оболочки, дающей
осколки. Специалисты, наблюдавшие за местом взрыва с возвы-
шения, находившегося на расстоянии 85 км, не слышали даже
звука взрыва, а сотрясение было зарегистрировано в пределах
ограниченной зоны, т. е. не наблюдалось уже даже в Тулузе.
Измерение давлений масс воздуха, приведенных в движение
вследствие открыто произведенных взрывов, производилось
в Г осу дарственном химик о-т ехническом институте
в Берлине посредством особых мембран. Так, при взрыве 1000 кг
нитросоединения ароматического ряда максимум ударной волны
составлял:
жри расстоянии........... 500 м 0,040 кг'см2, или 400 кг/м2
,................. 1000 „ 0,019 „ „ 190 „
.............. . -2000 , 0,012 „ „ 120 „
Поэтому давление взрыва 1000 кг бомбы уже на расстоянии
500 м. было бы настолько мало, что самое большее могли бы по-
лопаться оконные стекла.
На основании теории волны сжатия Шмидт1 вычисляет
интенсивность взрывной волны на различных расстояниях от
места взрыва. Так, взрыв 500 кг взрывчатого вещества создал бы
на расстоянии 101 м в окружности избыточное давление
в 0,5 кг/см2, следовательно такой взрыв мог бы причинить тяже-
лые повреждения. При 2000 кг взрывчатого вещества опасная
зона достигала бы 160 м.
4. Влияние способа воспламенения на детонацию
Еще несколько десятков лет тому назад полагали, что детона-
цию взрывчатого вещества можно вызвать только одним опреде-
ленным способом; в настоящее время известно, что способ-
ность к детонации, а вместе с тем и взрывчатая сила
1 Z. f. Schiess- u. Sprw. 1932, 301.
'6 Зак. 3171. Штетбахер.
82
Основные понятия из теории взрывчатых веществ
в значительной мере зависят от внешних условий, прежде всего
от .начального импульса (инициирующего удара) и
оболочки. Конечно существует предел, начиная с которого
всякое взрывчатое вещество взрывает, давая картину полного
разложения; однако этот предел является только кажущимся, так
как в действительности возможны дальнейшие градации измене-
ния вплоть до наиболее 'Сильного бризантного действия. Уже
у дымного порока скорость взрыва может измениться, смотря
по крепости оболочки в пределах 300—500 лг, большинство бри-
зантных взрывчатых веществ, главным образом безопасных, во-
обще оказывают большее действие, если воспламенение их про-
изводится тетриловым, а не гремучертутным капсюлем-детона-
тором того же веса. В свою очередь капсюли-детонаторы,
снаряженные пентаэритриттетрани-
тратом, превосходят капсюли-дето-
наторы, снаряженные тетрилом.
Для инертных желатиндинамитов
недостаточен и наибольший кап-
сюль-детонар № 10, если необхо-
димо получить максимальную ско-
рость детонации. В таких случаях,
как например для пераммона (пер-
хлората аммония) необходимо
включение бризантных детонаторов
весом не менее 5 г (рис. 25 и 26).
Дальнейшим усовершенствова-
нием можно считать детона-
тор ы, имеющие форму удли-
простая кумулятивная
детонация
Рис. 38. Способы детонации: н е н « ы X почти сквозных 3 а р Я-
—бикфордов шнур: 2—капсюль-детонатор; А О В («1ПП1<11еП»? риС. 38), КОТОрые
детонирующий стержень; 4—детонирую- 'ВЫЗЫВЭЮТ ВЗРЫВ 6ЫСТРО И С ОДИ-
щий шнур, е—место встречи взрывных „ г г "
волн. наковои силой по всей массе
взрывчатого вещества. Ясно, что
этим способом легко можно повысить бризантность за-
рядов взрывчатых веществ, детонирующих с умеренными скоро-
стями, располагая в них воспламенитель из взрывчатого веще-
ства, имеющего большую скорость детонации, чем сам заряд.
Взрыв этих воспламенителей опережает распространение взрыва
в массе основного заряда и доводит разложение до конца
раньше, чем детонационная волна, вызванная в нем капсюлем-
детонатором, успела бы пройти по всему заряду. В длинных заря-
дах торпед, изготовленных из пироксилина, скорость детонации
которого 6000 м, запальный патрон флегматизированного пентри-
нита должен весьма значительно повысить бризантность. Осо-
бенно действительным оказался этот принцип при подрывах по
методу Негсо.
Все эти инициирующие импульсы, производимые силой удара
отдельных взрывчатых веществ, уступают совершенно новому
I. Взрывчатые и метательные средства
83
в стороны с удвоенной скоростью,
Неподвижная Движущаяся
пластинка. пленка.
Рис. 39 и 40. 8 патронов аммпачноселит-
ренного взрывчатого вещества, воспламе-
ненные одновременно с обоих концов. Рас-
ширенная светлая часть на неподвижной
пластинке, а также расширение светящейся
полоски иа подвижной пленке указывают
место встречи детонационных волн. Не-
большой сдвиг вниз показывает, что оба
электродетонатора взорвались не совсем од-
новременно.
способу воспламенения, открытому Брунсвигом, так на-
зываемому кумулятивному воспламенению. В этом
способе действие получается в результате столкновения двух
взрывных волн, которые исходят из противоположных направле-
ний и сталкиваются между собою в одном пункте, подобно тому
как это можно видеть на свинцовой пластинке (отметка) при
определении скорости детонации по способу Д о т р и ш а
(рис. 52). Принято считать, что взрывные волны, например обык-
новенного тэнового детонирующего шнура, в результате столк-
новения распространяются
т. е. со скоростью 14 500
м/сек, и таким образом
вызывают давление и
удар, которые действуют
как детонатор, взрываю-
щийся с такой огромной
скоростью.
При взрыве 50 г гре-
мучего студня в свинцо-
вом шаре посредством
капсюля-детонатора № 8
получилось расширение
в 2 700 ом3, а в слу-
чае столкновения взрыв-
ных волн — 3 300 см3:
при взрыве гранаты, сна-
ряженной 250 г трини-
тротолуола, получалось
50 или 206 убойных ос-
колков, смотря по тому,
производилось ли воспла-
менение взрывной вол-
ной, распространявшейся
по одному направлению,
или сталкивавшимися
взрывными волнами.
Несмотря на превосходное действие, производимое на каждое
взрывчатое вещество, способ кумулятивного воспламенения до
настоящего времени редко находил применение. Распростране-
ние его для. зарядов, имеющих важное военное значение, веро-
ятно будет облегчено пентринитовыми патронами в. удобной
флегматизированной форме. . •
5. Бризантность и давление бризантности
Бризантность — традиционный военный термин; первона-
чально он обозначал способность взрывчатого вещества разби-
вать, раздроблять твердую оболочку или основание на мелкие
84
Основные понятия из теории взрывчатых веществ
куски. Бризантность обнаруживается в поразительной форме про
бивного и осколочного действия, проявляющейся прежде всегс
при открытом расположении зарядов; достаточно сослаться
на рис. 4 и 153, а также другие многочисленные воспроизведен-
ные в этой книге фотографии взрывов.
Давление бризантности, если под этим терминох'
понимать давление взрыва взрывчатых веществ, не помещенных
в оболочку и по крайней мере с одной стороны соприкасаю-
щихся с воздухом, зависит прежде всего от скорости дето-
нации и коренным образом отличается от статического давле-
ния взрыва; последнее представляет функцию температуры
взрыва и расширения газообразных продуктов и в твердой обо-
лочке становится почти бесконечно большим. В то время как
давление взрыва гремучего студня достигает вероятно
100 000 ат, а давление взрыва' п е нтр и н и т а 5О/5о имеет вели-
чину примерно того же порядка, но по абсолютному значению
несколько меньшую, давления бризантности их, наоборот, весьма
значительно отличаются друг от друга. Но даже и для пентри-
йита, взрывчатого .вещества, детонирующего с наибольшей ско-
ростью, давление бризантности составляет только часть давления
взрыва, примерно V4 и максимум 1/з. Воздух, являющийся под-
вижно-упругой средой, при этих скоростях разложения обладает
слишком малой инерцией; лишь при значительно большей, почти
бесконечно большой скорости детонации он мог бы оказать со-
противление расширяющимся газам почти как твердое препят-
ствие (заманчивая задача для физика—вычислить, исходя из
веса и ускорения массы газообразных продуктов взрывчатого
вещества и отдачи в окружающую атмосферу, давление бризант-
ности на твердое основание). Для рассматриваемых скоростей де-
тонации, равных максимум 8500 м/сек, давление для пробивания
железной пластинки толщиною 12 мм (рис. 110 и 111) вероятно
едва ли превосходит 20 000 ат, если даже принять во внима-
ние, что колоссальное нагревание, производимое взрывом,
одновременно нарушает сопротивляемость, облегчая действие
давления.
В какой мере можно сравнить такое мгновенное давление про-
бивания со значительно более медленно действующим давлением
штампования гидравлического пуансона, диаметр которого имеет то же
сечение, что и патрон взрывчатого вещества, — вопрос особый, так как
по-данным Поппенберга железная пластинка толщиной 0,7 см оказы-
вает ружейной пуле сопротивление свыше 20 000 аг, между тем как при
простом штамповании требовалось бы давление только 5000 ат.
"Во всяком случае давление бризантности с возрастанием
скорости детонации достигает крайне высоких величин, для которых
формула бризантности как мера сравнения оказывается неудовлетворитель-
ной. По определению Каста разрушительная сила взрывчатого вещества
должна быть пропорциональна удельному давлению, умноженному на
соответствующие плотность и скорость детонации:
/. Взрывчатые и метательные средства
85
(бризантность = удельной энергии X плотность заряжания X скорость дето-
нации), причем удельная энергия, или сила,
j. < . , 273 /
f = 1 ат {кг см-) v(l (л кг)-’
где I— температура взрыва, Л — плотность заряжания (кг/л), 3?—скорость
детонации в м/сек. Для гремучего студня при верхнем пределе
2? =7600 м/сек получаем:
В = 1,0333 711,4 - - ~3^41- 1,60 • 7500 = 151 000 000.
Л /о
Между тем при скоростях детонации ниже 2000 м/сек и открыто взры-
ваемых зарядах величина бризантности В уменьшается до 40 000000; дей-
Рис. 41.
Стальной
цилиндр
высотою
15 см, диа-
метром 6 см,
с толщиною
стеиок ? см
(к рис. 42 и 43).
Рис. 42. Опыт взрыва стального цилиндра зарядом
7 с г гмрги I тетрила 70>,0
I тротила 30'и
34 осколка, из них 5 весом менее 10 г. Бризантность 107 • 106.
ствие на стальную пластинку или на железнодорожный рельс — в связи
с этим изменением скорости детонации в 4 раза — должно измениться зна-
чительно больше, минимум пропорционально отношению квадратов верх-
него и нижнего пределов скорости взрыва. Поэтому формула бризантности
больше подходит для случая зарядов в оболочке. Но даже в этом
случае наблюдается значительное расхождение действия с вычисленными
цифрами в зависимости от характера оболочки. Цилиндр из обыкновенной
стали с несовершенной забойкой (рис. 41) при отношении бризантностей
107:178 раздробляется на осколки в отношении 34:101; количества же
осколков прочно закрытой бронебойной гранаты из вязкой бёлеровской
стали (рис. 44 и 45) сходятся с величинами их бризантности и приближаются
к величинам энергии зарядов. Дальнейшие различия кроме того наблю-
даются при переходе из одной среды в другую, например от взрывов
в воздухе к подводным взрывам. Во всяком случае числа, выражающие
бризантность 'для столь разносторонним образом1 применяемых в практике
взрывчатых веществ, имеют только условное значение, хотя с теоре-
тической точки зрения они и представляют надежный критерий для
сравнения.
86 Основные понятия из теории взрывчатых веществ
Что выражение для бризантности в своей простейшей и на-
гляднеишеи форме (В ——• а, где Е — количество энергии, d—•
плотность взрывчатого вещества и t — время развития энергии)
является только схематическим приближением к действитель-
ности, показывают следующие примеры. Так, бризантность не
уменьшается вдвое, если время удваивается; с другой стороны,
она не увеличивается вдвое, если время взрыва уменьшается
в два раза. В противном случае, как удачно аргументирует Г е р-
л и н, дробящее действие заряда, воспламененного из центра,
должно было бы быть в 2 раза сильнее, чем у заряда, воспламе-
Рпс. 43. Опыт взрыва стального цилиндра зарядом
{80°;'о пентрита
15,5' о нитроглицерина
1,0® о дифениламина
3,5°iv коллодионного хлопка
101 осколок, из них 48 весом менее 10 г. Бризантность
178 • 106.
ненного с одного конца. Подобные явления, представляющие со-
бою исключения, были впервые продемонстрированы Монрое
в 1888 г. на так называемых пустотелых зарядах и позд-
нее на многочисленных вариантах этого опыта.
Предположим, что из трех цилиндрических тротиловых ша-
шек первая и третья — сплошные и каждая весит 211 г, средняя
же имеет коническую пустоту и весит только 112 г. Если, поль-
зуясь выделанным для капсюля-детонатора каналом, взорвать все
три заряда над 30-лы» стальной пластинкой, то сплошные шашки
дают только сильные отпечатки, между тем как пустотелая
шашка, имея почти вдвое меньший вес, совершенно пробивает
пластинку. Объяснение этого парадоксального явления, как бу-
дет указано ниже, вытекает из различного направления
. , лпонебойная гр
Рис. 44 и 45. ШвейцаРСК’сЯтаХ взорванная зарядом
20 г пеитринита
80о;0 пентрита и ла
12,Ь нитроглипери^«а » г Р
6,O°io коллодионного л
1,5° о дифениламина
Баланс............*
Бризантность ............
Сна'рад раздроблен: на 28 осколков
37
- 14,1е,о О
. 170-10*
Всего осколков
91
весом менее 5 г
от 5—9 г -
10 и более г зз
65
74,01,о О
86 • 1*>
18 осколков весом менее 5 г
15
от 5-9 2
10 н более г
от напра-
Рис.
88 Основные понятия из теории взрывчатых веществ
взрывных волн; именно: в случае сплошных шашек волны
входят одной стороной одна в другую, при пустотелых же
шашках они сталкиваются с двух сторон и интенсивно распро-
страняются книзу. Никакого увеличения энергии не наблюдается;
она концентрируется только в одном месте, причем получается
чрезвычайное усиление давления *. На двух цилиндрических
шашках, которые соответственно шашкам 1 и 3 на рис. 46 взры-
вались сначала сверху, а затем снизу, Каст показал, что сила
детонации действует не по всем направлениям одинаково, но
главным образом в направлении взрывной волны. В первом слу-
чае (7) сжатие получилось в 2,81 тити, во втором же (3) — 1,73 тити..
6. Искусственные сотрясения почвы посредством взрывов
Искусственные сотрясения почвы посредством взрывов
с 1923 г. успешно применяются, особенно в Калифорнии и Пер-
сии, для разведок нефти, солей и руд и вообще для отыскания
залежей полезных ископаемых. Американские нефтяные компа-
Рис. 47. Сейсмографическая запись колебаний почвы, производимых взрывами.
нии применяют для этого передвижные лаборатории, снабженные
приемными радиоустановками и усилителями. Возбуждение волн
в земле производится взрывом от 5 до 300 кг высокопроцентного
динамита на глубине 3—6 ти. На том же месте, но на поверхности
земли одновременно взрывается заряд, достаточный для пере-
дачи звука (на 5, максимум на 10 км). Сущность способа, как
видно из приложенной схемы, заключается в следующем:
В момент прекращения радиосигнала происходит взрыв, что
отмечается на движущейся пленке 0 сек.,, и через 3,24 сек. первая
волна (в земле) доходит до сейсмографа. Через 18,9 сек. от мо-
мента взрыва звуковая волна достигает слуха наблюдателя, ко-
торый регистрирует этот момент на пленке ударом ноги в землю.
При скорости звука 344 м/сек (отнесенной к атмосферным усло-
виям в день опыта) расстояние от места взрыва до наблюдателя
исчислено в 6506 ии. Это расстояние волна в земле прошла
в 3,24 сек., что соответствует скорости около 2000 м/сек для гли-
нистой почвы той местности, где был произведен описанный
опыт. Если бы подпочва состояла из соли, то скорость распро-
1 Ср. L о d a t i, Giorn. chim. ind. e appl. Г932, 1.30.
II. Скорость детонации
89
странения достигла бы около 5000 м/сек. На эти «динамитные»
геологические разведки в США расходуется ежегодно 1% млн. кг
взрывчатых веществ. Такой метод исследований грунта \ кото-
рый применяется в последнее время для определения толщины
льдов глетчеров, быстрее приводит к цели и оказывается де-
шевле, чем обычное бурение.
Сотрясение почвы2, производимое подобными взры-
вами, хотя и может привести к дрожанию стен и окон, но очень
редко причиняет материальный ущерб, так как длина перио-
дов этих волн Потрясения колеблется в пределах 0,004—0,2 сек.,
между тем как соответствующие величины в случае землетрясе-
ний равны 0,5—5 сек. Измерения показывают, что при средней
длине периода в 0,02 сек. амплитуды колебаний зданий, располо-
женных по соседству с местом взрыва, достигают только
0,003—0,005 мм. Такие сотрясения не выходят из пределов допу-
стимых напряжений для зданий и строительных материалов и не
представляют опасности даже в том случае, если повторяются
годами и непрерывно вызывают сотрясение прочного здания
в продолжение 15—.18 час. ежедневно. Недавно опытным путем
установлено, что взрыв 3—4 патронов, уложенных впритык, при
горизонтальном расстоянии в 28 м и глубине 45 м дает сотрясе-
ние меньшее, чем движение 10-т грузовика на сплошных резино-
вых шинах по дороге среднего качества.
II. Скорость детонации
Скорость детонации, т. е. скорость распространения взрывча-
того разложения по массе взрывчатого вещества, является важ-
нейшей и наиболее значительной характеристикой взрывчатого
вещества. .Чем более внезапно, мгновенно совершается распад —
превращение твердого или жидкого вещества в газообразные
продукты, занимающие в сотни раз больший объем по сравне-
нию с объемом первоначально взятого вещества, — тем больше
сила разрушения, дробящая сила или бризантность взрыв-
чатого вещества.-
Детонацию можно рассматривать как чрезвычайно интенсив-
ное горение, скорость распространения которого исчисляется
километрами в секунду. Относительно же механизма ее распро-
странения почти ничего достоверно не известно. Явление э^о еще
оолее усложняется тем, что как горение, так и детонация не пред-
ставляют определенных, резко отграниченных процессов; оба
они в зависимости от внешних условий могут произвольно пере-
водить одна в другой (переход дефлаграции в детонацию и на-
ооорот).
' ——‘--------------------------1---------------------—------
Ть w а n s ° п» Synthetic earthquakes created bv dynamite aid oil explorers,
lfte Ex. Eng. 1929, 249—251.
Erschutterungen durch Sprengungen, Nobelhefte 1930, 2—5.
90 Основные понятия из теории взрывчатых веществ
Согласно Б е р т л о распространение детонации во взрывча-
тых веществах следовало бы представлять себе подобно распро-
странению звуковых волн. Толчок, получаемый взрывча-
тыми веществами в результате.воспламенения последних капсю-
лем-детонатором (начальный импульс, воспламеняющий удар)
возбуждает взрывную волну, которую согласно представле
ниям того же исследователя можно равложить на химическую,
и физическую ударные волны. Чисто химическая удар-
ная волна, состоящая в непрерывном превращении химиче-
ской энергии в тепловую и механическую, распространяется с по-
стоянной скоростью до 9000 м/сек, между тем как физиче-
ская ударная волна непрерывно ослабевает пропорцио-
нально квадрату расстояния, ибо ее движущая сила, перво-
начально полученная от химического импульса, рассеивается
в инертную окружающую среду.
Предположение, что первоначально возникающая химическая ударная
волна (сопровождающая превращение взрывчатого вещества в газообраз-
ные продукты) распространяется со скоростью звука, приводит к теорети-
ческим любопытным данным, рассмотрением которых в свое время зани-
мался Диксон и недавно — более подробно Голь м’с *. Из формулы
следует, что скорость звука г увеличивается пропорционально корню
квадратному из температуры, так что при заданной скорости распростране-
ния звука, которая соответствует в нашем случае скорости детонации,
можно вычислить соответствующую температуру. Следовательно если под-
ставить в вышеуказанную формулу г> = 8000 м/сек (что равно скорости
детонации пентринита или высшей скорости детонации динамита), то при
скорости звука 340 м/сек получается температура выше 40000° — цифра
беспримерно высокая. Между тем такая температура для неизмеримо корот-
кого промежутка времени начального экзотермического молекулярного
распада, когда образующиеся газообразные продукты, находясь в условиях,
близких к адиабатическим, не успевают расшириться (что связано с охла-
ждением и обнаруживается позднее в виде значительно более низкой тем-
пературы взрыва), не представляет собой с точки зрения порядка этой
величины ничего невероятного. В пользу такого объяснения должен бы
говорить и «световой эффект» — явление, которое состоит в том что свет,
распространяющийся через детонирующую массу, предшествует собственно
взрывной волне. Однако если для такой температуры допустить значитель-
ную степень ионизации газообразных продуктов взрыва, то все имеющееся
количество теплоты было бы в большей своей части снова поглощено
этими процессами. Кроме того строгому применению вышеуказанной фор-
мулы препятствует и то обстоятельство, что по Шмидту* 8 ударная и
звуковая волны существенно отличаются друг от друга.
1 The detonation waves from solid explosives, Journ. Franklin Inst 1927,
549—560.
8 Theorie des Verdichtungsstoses, Z. f. Schiess- u. Sprw. 1932, 6
f оттиск).
II. Скорость детонации
91
1. Экспериментальное определение
Первые определения скорости детонации произвели в 1885 г.
Берт ло и Вье ль; они пользовались для этого зарядами
взрывчатого вещества длиною до 200 время прохождения
взрыва по таким зарядам определялось посредством чувстви-
тельного хронографа. Принцип этого способа применяется также
и в настоящее время, но взрываемые заряды значительно укоро-
чены, а хронограф берется соогветственно более точный.
Рис. 48. «Новейшая схема определения скорости детонации хроно-
графом:
1—батарея; 2—включатель для воспламенения; з—искровые индукторы; 4—ряд патро-
нов: [5—барабан; 6—платиновые острия; 7—зубчатое колесо; 8—червячная передача:
9—мотор; 10—резонатор-тахометр; 10—земля.
Испытуемое взрывчатое вещество снаряжается в виде непре-
рывного патрона в металлическую трубку длиною несколько
метров. В срез патрона вставляется электродетонатор, затем по-
перек патрона, в точно отмеренном расстоянии, вводятся две
тонкие медные проволочки, каждая из которых замыкает эле-
ктрическую цепь. Всю систему целесообразно закапывать
в землю. Как только воспламененный капсюль-детонатор вызы-
вает детонацию патрона (с одного конца), ближайшая медная
проволочка обрывается, и благодаря этому ток прерывается.
По мере распространения взрыва он достигает второй медной
проволочки, обрывает ее, и благодаря этому ток прерывается и
3Десь; металлическая трубка, естественно, разрывается при этом
иа куски.
92
Основные понятия из теории взрывчатых веществ
Если теперь измерить чувствительным приспособлением —
хронографом л е-Б у л анж е или лучше, искровым индуктором
Сименса — время между разрывами обеих проволочек, тс
простой расчет дает скорость детонации в секунду.
Меттеганг еще лет 30 тому назад предложил метод опре
деления скорости детонации, который при длине патрона в 3 л
дает точные .результаты. Это устройство до настоящего времен!
является образцовым. Ниже приводится краткое описание ме-
Рис. 49. Хронограф Меттеганга для определения скорости дето-
нации (Опытная станция Bureau of Mines, Брустон, Пенсильвания,
США).
тода производства испытания и описание (рис. 49) усовершен-
ствованного хронографа, выпускаемого одним германским
инструментальным заводом:
Аппарат Меттеганга состоит из барабана, покрытого сажей, с уста-
новленными над барабаном платиновыми остриями (иглами), электромотора,
тахометра, измерительного микроскопа с особо точным приспособлением для
измерения расстояний, а также искрового индуктора (катушки) и распре-
делительной доски со всеми необходимыми приборами.
Металлический барабан, являющийся важнейшей частью аппарата,
несет по окружности столько зубьев, сколько миллиметров составляет
его длина. Электромотор приводит барабан во вращение; окружная ско-
рость, определяемая тахометром, составляет от 7,5 до 50 м/сек.
Число катушек и платиновых игл определяется числом измеряемых
зарядов или же числом последовательных контрольных измерений в пре-
делах одного заряда (рис. 48). Электрический ток от батареи акку-
муляторов идет по первичным обмоткам искрового индуктора .и снова
II. Скорость детонации
93
возвращается к своему источнику. Вторичные обмотки одним полюсом
соединены с каждым платиновым острием, установленным над барабаном,
а вторым полюсом — с хорошо заземленным, основанием остриев. Провода,
ведущие к первичным катушкам, проходят через начало и конец ряда
взрываемых патронов. Нормальная длина измеряемого заряда, равная 1 м,
в случае надобности может быть уменьшена до 50 см и менее; однако
во избежание отклонений, зависящих от расположения заряда и характера
взрывчатого вещества, рекомендуется брать заряды длиной 1 м; при такой
длине заряда проволочки, проходящие через патроны, находятся на рас-
стоянии 1 .и друг от друга, что дает ряд удобств.
Как только при детонации в первичной катушке вследствие разрыва
первой проволоки прерывается ток, одновременно во вторичной цепи
с платинового острия на вращающийся законченный барабан проскакивает
искра. Тот же самый процесс повторяется, когда взрывная волна разрывает
вторую проволоку. Проскакивающие искры запечатлеваются на барабане не
в виде отдельных точек, но — вследствие колебательных разрядов электри-
чества — в виде ряда точек. Таким образом соответственно длине опытного
заряда и окружной скорости барабана получаются
две сдвинутые начальные точки.
Приспособление для измерения расстояния
между точками, получившимися от искр, состоит
из бесконечного винта, который, когда барабан
находится в покое, поджимом удерживается
своими зубьями в зубьях барабана. На бесконеч-
ном винте находится стрелка, которая переме-
щается по диску, разделенному на 100 частей, так
что при вращении барабана на I мм стрелка со-
вершает полный оборот.
Благодаря этому при скорости вращения до 50 м/сек при помощи микро-
скопа и перекрещивающихся нитей можно точно отсчитывать время, равное
одной пятимиллионной секунды. При заданной длине заряда в 1 м, рас-
стоянии между началом рядов точек на закопченном барабане в 6 или 6,1 мм
(рис. 50) и окружной скорости 60 м/сек вычисляется соответствующее
время детонации:
J -Р^6- или = 0,000120 или 0,000122 сек.
Скорость детонации составляет в этом случае 8333, соответ-
ственно 8197 м/сек. л
Отмечаемые на закопченном барабане точки видны настолько
отчетливо, что с помощью измерительного микроскопа без труда можно
отсчитать расстояния с точностью до 0,01 л.и. Таким образом, если нет
Других отклонений, аппарат Меттеганга дает ошибку в± Veoo для наи-
высших скоростей детонации, т. е. в указанном случае при 8333 м/сек-—
только на 14 м в ту или иную сторону.
Так как хронограф в качестве универсального прибора
в известной мере служит для поверки всех других косвенных
способов определения, то важно знать степень точности работы
этого относительно сложного приспособления.
В качестве первой возможной ошибки следовало бы назвать
рассеивание искр. Оно достигает приблизительно 0,1 мм
и может исказить значение скорости детонации до 1%. По
Касту1 эту ошибку можно уменьшить удлинением патрона и
увеличением скорости вращения барабана. Второй источник
Рис. 50. Отметки, полу-
чающиеся на закопчен-
ном барабане.
Z. f. Schiess- u. Sprw. 1913, 90.
94
Основные понятия из теории взрывчатых веществ
ошибок кроется в замедлении, которое возникает при разрыве
измерительных проволочек от детонации. На замедление влияют:
1) толщина проволочки, 2) возможность отклонения проволочки
от давления и 3) применяемое напряжение тока. Это замедление
можно сделать заметным следующим путем.
На равных расстояниях через каждые 100 мм располагают
параллельно несколько проволочек — обыкновенно три ряда, —
половина которых проходит через начало, а другая — через ко-
нец заряда длиною 1000 мм (рис. 51). Если замедление вызы-
вается проволочками, расположенными в начале заряда, то вы-
численная скорость будет слишком велика; если же замедление
вызывается проволочками, расположенными на конце заряда,
то значение скорости будет слишком малым. Эту ошибку
можно устранить, если по указанному выше способу произ-
Рис. 51. Параллельные измерения,
давшие правильные и ошибочные
искровые отметки.
вести три измерения: непо-
средственно по отметкам искр
можно судить, какая прово-
лочка вызывает замедление
(Г, 4').
Джонс1 указывает, что
фактором замедления является
кроме того и о н и з» а ц и,и
газообразных и р' о-
ду ктов взрыва, вслед-
ствие чего после разрыва
проволочек они, будучи силь-
но нагретыми, проводят ток,
т. е. перерыв тока в кон-
денсаторной цепи до некото-
кость.
Если по предложению
рой степени теряет свою чет-
названного автора обе электро-
цепи удалить из области взрывной волны и горячих газообраз-
ных продуктов, то длину заряда мсжно по Джонсу уменьшить
до 2 см и уже после этого определить отклонения, которые
почти всегда имеют место в пределах практически применяемой
длины шпуров благодаря увеличению, уменьшению или ослабе-
ванию скорости детонации.
Для устранения всех видов замедления на промежуточной
электропроводке в качестве индикатора для маркировки бара-
бана используется сама взрывная волна. Этот прием пригоден,
само собою разумеется, только для детонирующих шну-
ров. Вместо искровых острий перед вращающимся барабаном
устанавливается стальной блок, имеющий два отверстия
малого диаметра, в которые вставляются соответствующие
концы шнура, чтобы при взрыве последовательно отметить иа
барабане резкие точки «времени».
Mines Department,-Safety in Mines'Research Board Paper 22, Лондон 1926.
II. Скорость детонации
95
Два отрезка шнура длиною один 0,4 м, другой 8,4 м, соеди-
няются с тетриловым капсюлем-детонатором № 8, оба других
свободных конца вставляются в два расположенных рядом от-
верстия стального блока, помещенного перед барабаном, и
прочно закрепляются в них. После этого можно пустить в ход
мотор и, когда тахометр укажет верхний предел скорости вра-
щения барабана в 50 м/сек, произвести детонацию шнура.
В одном опыте с пентритовым шнуром было определено рас-
стояние между отметками по вертикали 60,92 мм. Оно соответ-
ствует промежутку времени в 0,0012184 сек. За это время дето-
нация прошла патрон длиною 8,4—0,4 —8,0 лг; таким образом
скорость детонации достигает 6566 м/сек. Описанный способ,
предложенный Меттегангом, дает исключительно точные
результаты. я
2. Косвенный способ определения скорости детонации по
Дотришу
Этот столь же изящный, сколько и остроумный способ введен
в 1906 г. французским инженером Дотришем (1876—1914 гг.).
Он отличается просто-
той и дешевизной ап-
паратуры, а главное
дает возможность
пользоваться коротки-
ми зарядами и опре-
делять скорость дето-
нации быстро и на-
дежно с точностью по
меньшей мере до 0,5%.
Метод основан на
сравнении скорости де-
тонации подлежащего
исследованию взрыв-
чатого вещества со
скоростью детонации
детонирующего шну-
Ра, предварительно
определенной каким-
либо из упомянутых
способов. Д о т р и ш
ИСХОДИЛ из того, что
каждый детонирую-
щий шнур, будучи
включен в цепь, т. е.
присоединен к концам
заряда взрывчатого
вещества, скорость де-
Длина заряда $
^-300мм
Стальная
Рис. 52. Определение скорости детонации
посредством детонирующего шнура. У,-.. -
тонации которого неизвестна, и затем воспламенен с одного
96 Основные понятия из теории взрывчатых веществ
конца благодаря большой и равномерной скорости передачи
может играть роль чувствительного хронографа. При этом
предполагалось, что место встречи движущихся в проти-
воположных направлениях взрывных волн может быть точно
отмечено.
Как лучше всего осуществить этот способ, видно из схемы
(рис. 52). «
Если бы оба отрезка детонирующего шнура 1 и 2 не разделялись за-
рядом s, скорость детонации которого неизвестна, а были бы уложены ря-
дом, то обе взрывных волны встретились бы в его середине, т. е. после
того, как каждая из них прошла бы 1 м шнура. Однако в нашем случае
взрыв должен пройти сначала по заряду длиною в 300 мм, так что встреча
взрывных волн происходит на небольшом расстоянии правее середины.
В таком случае между этими длинами, расстоянием между отметками т
и длиною заряда s существует зависимость. Поскольку скорость детонации
^детонирующего шнура V точно известна, скорость детонации х исследуе-
jMoro взрывчатого вещества вычисляется по следующему уравнению:
где т было измерено циркулем в двух опытах и оказалось равным 131,1 и
131,3 мм, а V — измерено хронографом и равно 7200 м/сек, откуда искомая
скорость детонации жидкого нитроглицерина равна:
7 200-0,3 7 200-0,3 Q„_ ,
2-0,1311 ~8240 и 2-0,1313 “ 8225 м‘сек-
Прежде концы детонирующего шнура укладывались на свин-
цовой пластинке рядом; отметка встречи волн при этом получа-
лась косой и особенно ясной, но не вполне удобной для измере-
ния. Поэтому в настоящее время принято брать ординарный
шнур; получающаяся в этом случае вертикальная отметка хотя
и не так хорошо видна, но зато выступает резче. В случае тро-
тилового шнура, в свинцовой оболочке1 отметку можно измерить
с точностью до 1 мм, а для пентритового в оплетке или гремуче-
ртутного шнура — лишь с точностью до 0,2 мм (рис. 53 и 54).
Сильно изогнутый шнур детонирует — соответственно
небольшому повышению плотности на внутреннем изгибе кри-
вой — несколько быстрее, чем.уложенный по прямой. Однако
разница (0,9% для особенно равномерно детонирующего пентри-
тового шнура) настолько мала, что это обстоятельство примени-
тельно к схеме опыта, изображенной на рис. 52, не имеет зна-
чения 2.
Чрезвычайно удобный и зарекомендовавший себя способ
.Д о т р и ш а может быть применен и для решения обратной
задачи, т. е. для апробирования детонирующего шнура, если для
заряда s имеется взрывчатое вещество, детонирующее с постоян-
1 К a s t u. G u n t h е г, Z. f. Schiess- u. Sprw. 1919, Г20.
• - E r ie d e r i c h, там же, 1931, 184.
II. Скорость детонации
97
ной и определенной скоростью. Таковым является например
плавленый тринитротолуол, который, будучи залит
сплошным куском в 'Стальные трубы, при инициировании доста-
точным зарядом пентринита дает скорость приблизительно
6750 м/сек. Вычисление неизвестной скорости детонации шнура
производится путем решения обратного уравнения. Так, при
длине тротилового заряда 30 см и расстоянии между отметками
146,7 мм скорость детонации гремучертутного шнура равна:
6750-2-0,1467 ,
-----’------= 6600 м/сек.
Рис. 53. След от детонации и место встречи взрывных волн
сложенного вдвое тротилового детонирующего шнура на 8-мм
свинцовой пластинке.
Рис. 54. След от детонации и место встречи взрывных волн ор-
динарного тэнового детонирующего шнура на З-лгж свинцо-
вой пластинке.
3. Зависимость скорости детонации от свойств взрывчатого
вещества
Зависимость между скоростью детонации и физическими свой-
ствами взрывчатого вещества имеет большое практическое зна-
чение. Еще Эбль и Б е ip т л о нашли, что скорость (взрыва
зависит от трех факторов, а именно:
1) диаметра патрона взрывчатого вещества,
2) крепости оболочки,
3) гравиметрической плотности взрывчатого вещества.
Сущность этой зависимости была выяснена благодаря рабо-
там Дотриша и в особенности благодаря обширным экспе-
7 Зак, 3171.—Штетбахер.
98
Основные понятия из теории взрывчатых веществ
риментальным исследованиям Каста1, а также данным, полу-
ченным косвенным путем Ф ё р г о м2. Вообще говоря, диа-мет;:
заряда взрывчатого вещества не оказывает большого влияния я;
скорость разложения, за исключением нитроглицерина и ег<
желатинированных видоизменений. Так например найдено, чтс
нитроглицерин в трубках малого диаметра, приблизительно до
6 мм, не детонирует. При диаметре трубок, равном 9 мм, ско
рость детонации по определениям К о м е я равна всего
Скорость
детонации
654 м/сек, между тем как при диаметре 25 мм была получена ско-
рость детонации 1500 м/сек, а при 38 мм — свыше 8000 м/сек.
Соответственным образом ведет себя и гремучий студень, ско-
рость детонации которого постоянно равна 7600 м/сек, если он
взрывается от сильного детонатора в виде патронов диаметром
5 см или в толстостенных стальных трубках (ср. стр. 336).
Характерна зависимость, существующая между плотно-
стью и скоростью детонации.
1 Z. f. Schiess.- u. Sprw. 1913, 134; 1916, 138.
2 Там же, 1916, 38.
И. Скорость детонации
99
Для определенных химических соединений с увеличением
плотности наблюдается сильное и постоянное повышение ско-
рости детонации. Напротив, механические взрывчатые смеси
в большинстве случаев ведут себя по-иному: здесь скорость сна-
чала достигает максимума, а затем с повышением гравиметриче-
ской плотности снова быстро падает.
Этот совершенно неожиданный перегиб кривой ско-
рости детонации с повышением плотности вполне обосно-
ванно приводит Г е р л и н а 1 к представлению о «физическом
сопротивлении» соответствующих взрывчатых смесей. Под этим
сопротивлением он подразумевает сопротивление, которое
взрывчатая масса, предварительно сжимаемая собственными газо-
образными продуктами взрыва, оказывает следующей за ними
взрывной волне. Опыт показывает, что уплотнение может при-
вести к затуханию взрыва, если невзорвавшиеся еще части за-
ряда спрессовываются до максимума, вмертвую. Так например
Каст для шведского безопасного взрывчатого вещества —
герр нт в патронах — получил следующие скорости (табл. 3).
. ТАБЛИЦА 3
Скорость детонации взрывчатых веществ, представляю-
щих собою смеси и определенные химические соедине-
ния, при увеличении гравиметрической плотности
(по Касту)
Взрывчатое вещество
Шеддит 60 бис . . .
I 0,7
0,9
Взрывчатое вещество
2283
2608
2901
2846
2777
2451
II
। I
Тринитротолуол . .
1’,35
1,40
1,02 1,18 3995 4775
Монахит 1,20 4835
1,33 3600
1 1,56 1755
0,85 3977
Аммонал I . . . 1,22 4699
' 1,38 5097
1,50 5419
1,62 5460
Террит (воспламенение при 0 мм)
1 Z. f. Schiess- u. Sprw. 1913, 451.
Пикриновая кислота. (
I
I
Тетрил............I
0,81 4440
0,94 4700
1,31 5815
1,40 6265
1,61 6760
0,81 4670
0,94 4870
1,30 5980
1,41 6465
1,49 6885
1,60 7220
1,69 7285
1,53 7075
1,63 7215
120—200 200—400 400—720 мм
4505 2060 350 м{сек
7«
100 Основные понятия из теории взрывчатых веществ
Согласно этим данным детонационная волна этого взрывча-
того вещества уже при патронах длиннее 70—80 см совершенно
затухает. Образцом противоположной тенденции может слу-
жить гурдинамит, который взрывался, будучи воспламенен
2-г капсюлем-детонатором, и давал следующие скорости дето-
нации:
длина патрона......... 100—200 250—630 630—730 мм
скорость детонации . . . 2080 2685 6045 м[сек
Таким образом с плотностью заряжания изменяется не ско-
рость детонации, а только сопротивление взрывной волне. Ско-
рость детонации в момент воспламенения при любой плотности
вероятно одна и та же; однако с изменением сопротивления за-
ряда взрывчатого вещества усиливается или ослабевает распро-
странение взрывной волны, смотря по роду взрывчатого веще-
ства. Этим объясняется также факт, что отдельные взрывчатые
вещества в открытом виде детонируют быстрее, чем в оболочке
или в предварительно «запрессованном» шпуре. Так например
в свое время, при прорытии Симплонского туннеля, при практи-
ческих испытаниях в е н д е р и т а, нитроглицеринового взрыв-
чатого вещества, флегматизированного динитроацетином, было
найдено, что в шпуре он просто не взрывает, хотя при откры-
том расположении взрывает легко и полностью.
Менее четкой является зависимость скорости детонации от
диаметра патрона и крепости оболочки. Из обширных работ
Каста можно видеть, что взрывчатые вещества, представляю-
щие собою определенные химические соединения, при повышен-
ных плотностях не претерпевают заметного изменения ско-
рости детонации от увеличения диаметра патрона, между тем
как при малых плотностях заряжания Ф ё. р г нашел явное уве-
личение:
Пикриновая
кислота . .
( 20
I 30
I. 50
0,80
0,92
0,93
4225
4390
4505
Тринитрото-
луол . . . •
20
30
50
0,80
0,80
0,83
3765
3905
4100
Меньше всего скорость детонации (за исключением одних
только динамитов) изменяется под влиянием крепости обо-
лочки, особенно при высоких плотностях заряжания. По-
вышения скорости детонации и в этом случае можно достигнуть
II. Скорость детонации
101
только при малых плотностях. Кроме названных трех факторов
скорость детонации, что весьма любопытно, зависит от а г г ре-
гат н о г о состояния взрывчатого вещества. В то время
как для жидких азотнокислых эфиров — метилнитрата и нитро-
глицерина— скорости составляют около 1500 м, замерзший
нитроглицерин имеет скорость, равную 8000 м. Неожиданно четко
проявляется эта особенность у динамита, который несмотря на
свою полужидкую консистенцию и разбавление 25% недеятель-
ного кизельгура, имеет в 3—4 раза большую скорость детонации,
чем чистый .нитроглицерин. На основании этого можно предпо-
лагать, что кристаллическая структура (в случае
динамита кристаллические диатомеи) весьма благоприятствует
распространению взрывной волны. Так например Каст уста-
новил, что скорость детонации тринитротолуола не уменьшалась
после добавления 10% динитробензола невидимому потому, что
тесная смесь обоих видов кристаллов легче передает инициирую-
щий удар. В остальном различии в аггрегатном состоянии одного
и того же вещества не имеют значения; низкие температуры, на-
пример охлаждение до —190°, не оказывают ника-
кого влияния на скорость детонации; явление детонации может
быть в крайнем случае облегчено или затруднено.
Согласно приведенным в табл. 4 данным измеренные скоро-
сти детонации ни в одном случае не превосходят 8700 м/сек.
Максимальную величину имеет смесь тетранитрометана с толуо-
лом, равную примерно 9000 м/сек.
В табл. 4 приведены те (Известные в настоящее время скорости
детонации газообразных, жидких и твердых взрывчатых веществ,
которые согласно современному состоянию исследования заслу-
живают наибольшего доверия.
4. Величина и продолжительность пламени взрыва
Уже полвека назад стало известно, что антигризутность
взрывчатого вещества находится в тесной связи с величиной,
продолжительностью и температурой его пламени взрыва.
В стремлении найти для каждого взрывчатого вещества надеж-
ный критерий антигризутности удалось чрезвычайно наглядно
установить фотографическим путем связь между составом' и
опасностью воспламенения. Чем более длинно и горячо пламя
и чем более оно продолжительно, тем меньше безопас-
ность взрывчатого вещества в отношении
рудничного газа и угольной пыли; впрочем не
следует широко толковать это определение в том смысле, что
все взрывчатые вещества с коротким пламенем и малой продол-
жительностью —‘безопасны.
Нижеследующие снимки в темноте (показывают распространение света
от 33 г взрывчатых веществ в свободно подвешенном стеклян-
ном шарике, взорванных медным капсюлем № 8. Снимки производи-
102 Основные понятия из теории взрывчатых веществ
ТАБЛИЦА 4
Скорости детонации взрывчатых веществ
Названия ВВ Плотность заряжания Скорость детона- ции (м/сек) Условия опыта Автор
Макси- мальная S • те £ S g 5 ~ «S S о Си к С =г Е X
Газовые взрыв-
чатые смеси
Гремучий газ (2Н2-|- — 0,00054 2820 -—— Бертло,
+ °2) 1883 г.
Хлористо водородн ы й — — , 1730
гремучий газ (Н2 + +су
Смесь ацетилен-кисло- .— 0,00136 2390 —-
род (2С2Н2 -|- 5O.j Рудничный газ (СН4 Ц- + 2О2) — 0,00119 2320 — Диксон, 1893 и 1903 гг.
Смесь окись угле- — 0,00131 1680 —
рода — кислород (2СО+О2) 0,00173
Смесь циан-кислород — 2730 —
(С^ + ЗО,)
Жидкие взрыв-
чатые вещества
Нитроглицерин жид- 1,60 1.6 1525 В свинцовой Эбль 1866 г.
кий трубке 0 30 мм
То же — -— 2050 В железной Меттегаиг,
трубке 0 30 мм 1903 г.
» » -— — 1388-1627 В трубке Комей и
025 мм Флетчер,
1912 г.
» »> — — 8410-8530 В трубке 0 37,5 мм —
»> » — — 7430 В цельнотяну- , Гюитер,
той стальной 1920 г.
7760 трубке
» » — — ) В стальной Фридрих,
| трубке 1931 г.
8240 } 34 X 42 мм с | зарядом 75 г
и я J пеитринита
II. Скорбеть детонации
ЮЗ
Продолжение
Названия ВВ
Плотность заряжания Скорость
Макси- ' мальная ® о к * § X § 5 5 s о о* о к Суси детона- ции (м/сек) Условия опыта Автор
Нитроглицерин жид- кий я м М V Нитроглицерин за- мерзший То же —75° Нитрогликоль жид- кий То же .г> я я Нитрогликоль полу- твердый — 40° То же твердый — 70° Этилнитрат Метилнитрат 1,73 1,49 1,12 1.21 1 1 1 1 1 1 1 £ S S । 1 । СО 6500 8580 8625 8130 -8290 Свыше 8000 7830 8190 8310 1000 -300С Около 8000 Ниже Ю0С 6000 —7000 2480 В прессованной цельнотянутой трубке 35 X 43 мм, капсюль № 8 В прессованной без шва трубке 35 X 43 мм с зарядом 50 г пикриновой кислоты Цельнотянутая стальная труб- ка 51 X 57 мм, капсюль Ns 8 В стеклянной трубке 30 и 20 мм внутрен- него диаметра В железном тигле, капсюль № 8 В цельнотяну- той стальной трубке 32 X 38 мм То же с дето- натором — 50 г пикриновой кислоты В прессованной трубке со швом 35 X 43 мм с детонатором— пикриновой кислотой | В железном J тигле с капсю- 1 лем № 8 В прочной обо- лочке В стеклянных трубках 0 4,5 мм Наум и • Бертманн, 1931 г. Штетбахер, 1930 г. Наум и Бертманн, 1931 г. Штетбахер, 1930 г. Бертло, 1891 г.
104 Основные понятия из теории взрывчатых веществ
Продолжение
Названия ВВ Макси- и — мальная й S' м Q гность жания S Л Н У W “ м S S g. u S о С ЕГ К Д Скорость детона- ции (м!сек) Условия опыта Автор
Метилнитрат Двуокись азота — се- роуглерод (65:35) То же Двуокись азота — ни- тробензол (70:30) Тетран итрометан - то- луол (100:15,66) Тетранитрометан- о-нитротолуол (100:28,9) Оксилнквиты Кислород—сажа (2,66:1) То же (2,66:1) Кислород— карбен (3,04:1) То же (3,04 : 1) Кислород-пробковая мука (2,03:1) То же (2,03 :1) < Твердые взрыв- чатые вещества (определенные хи- мические соеди- нения) Маннит гексанитрат . Пентаэритрит тетра- нитрат 1,40 1,38 1,45 1,50 0,8 0,8 1,06 1,06 0,67 0,7 1,78 1,77 1,4 1,38 1,45 1,50 1,7 1,62 Около 8000 4600-6600 7650 Около 8500 Около 9000 Около 9000 5000-6000 3450-5400 5600 4800-6000 3300 3500- 4500 8260 8400 В широких же- лезных трубках В железном тигле с капсю- лем № 8 В железном тигле с капсю- лем № 8 В зависимости от большей или меньшей вели- чины частиц сажи В железной трубке Q4 см В зависимости от величины частиц карбена В бумажных гильзах 0 3,3 см В зависимости от величины частиц Бертло, 1891 г. Паскаль, 1930 г. Штетбахер, 1930 г. Штетбахер, 1930 г. Наукгоф, К. Ф. Мейер, 1927 г. Каст, 1924 г. К. Ф. Мейер, 1927 г. Каст, 1924 г. К. Ф. Мейер, 1927 г. | Каст, 1923 г.
II. Скорость детонации
105
Продолжение
Плотность заряжания Скорость
Названия ВВ Макси- мальная S • к и - О rt « ® g s о S о и С- К С 5* Е К детона- ции (м/сек) Условия опыта Автор
Пентаэритрит тетра- нитрат Дипентаэритрит гек- санитрат Циклотрнметилен- тринитрамин Пироксилин сухой с 16°/0Н2О „ 2%Н2О Тринитрофени лметил - нитрамин То же Гексанитродифенил- амин То же Пикриновая кислота То же Тринитроанизол Трииитробензол То же Тринитрохлорбензол Тринитротолуол • Тринитроксилол Динитробензол Гремучая ртуть Азид свинца Циануртриазид Тринитрорезорцинат свинца 1,63 1,82 1,73 1,7 1,7 1,7 1,61 1,58 4,3 1,7 1,59 1,70 1,3 1,4 1,25 1,68 1,63 1,58 1,67 1,63 1,69 1,60 1,64 1,76 1,59 1,57 1,57 1,51 1,50 1,25 4,20 4,60 1,54 2,90 8700 7400 8380 6305 6795 6660-6980 7740 7250 7100 7150 7250 7260 7600 7000 7000 7150 6870 6710 6830 6600 6100 2250 5400 5300 7500 5200 Экстраполиро- ванная вели- чина Запрессован- ный в 10-лглг медной гильзе Залитый в стальную трубку 34 X 42 мм С детонатором из 75 г пен- трита Экстраполиро- вано Брюн, 1932 г_ Каст, 1923 г. | Каст, 1915 г.. Фёрг, 1912 г. Фридерих, 1933 г. Каст Джнуа Фридрих, 1931 г. Робертсон Каст Кинг н Флорентен, 1913 г. Каст; | Каст
106 Основные понятия из теории взрывчатых веществ
Продолже ние
Плотность заряжания Скорость
Названия ВВ Макси- мальная Практи- чески приме- няемая детона- ции (м/сек) Условия опыта Автор
Твердые взрыв- чатые смеси Гремучий студень 92/8 92/8 » 92/8 . 92/8 . 92/8 . 92/8 То же замерзший от —40 до —-50° Гур динамит (25% гура) То же (25% гура) , (25% гура) „ „ с 75% нитро- гликоля То же (25% гура) ЭКелатиндннамит 65% 65% 1,63 1,63 1,65 1,6 1,55 1,55 1,5 1.4 1,55 1,7 1,7 1,65 1,62 1,6 1,5 1,6 1,59 1,65 1535 2285 6855 2445—6860 7400-7550 7630-7875 8000 Около 1000 6650 6700 5700 6000 4990 2055 6120 В газовых же- лезных трубах 0 26 мм В железных трубках 27 X 33 мм, одногодичный до двухгодич- ного В железных трубках 15 х 21 мм, выдержанный несколько дней 3,2-см патроны с детонатором из 40%-ного динамита В стальной трубке 34 X 42 мм с детонатором нз 75 г пентри- ннта В железных тиглях с кап- сюлем № 8 В 3,2-см кар- тонных патро- нах Каст 1913 г. Герлин 1У13.Г, Герлнн, 1913 г. Bureau of Mines, 1929 г. Фридрнх, 1931 г. Наукгоф Штетбахер, 1931 г. Каст, 1924 г. Дотрнш, 1906 г. | Наум, 1919 г Bureau of Mines, 1929 г. Каст, 1913 г Каст, 1920 г
II. Скорость детонации
107
Продолжение
Плотность 1 заряжания | Скорость
Названия ВВ Макси- мальная практи- чески приме- няемая детона- ции (м/сек) Условия опыта Автор
Желатнядинамит 65% 65% 65% 50% 70% Экстрадинамнт 70% 700/о Военный пентринит 80% Пентрит с 10% пара- фина Альдорфит (81% NH4NO3) Донарит (80% NH4NO3) Шеддит (80% КС1Оа) Макарнт (70% РЬ (NO3)2 с 30% тринитротолуола] Пироксилиновый по- рох, желатиниро- ванный Дымный порох (75% KNO3) Взрывчатая селитра (73% NaNO3) То же (73Р/0 NaNO;i) 1 1 1 1 1111 1 1 1 1 1 1 II 1 1,5 1,4 1.7 1,59 1,10 1,14 1,2 2,80 0,9-1,2 1,04 1,25 1250—2750 6150 6000—6600 2900—5610 6940 2900 6300 - 7400 около 8400 8020-8090 4800-4900 3700 2900 4800 1000-1800 380—420 500 469 В маннесманов- ских трубках с толщиною стенки 3—4 мм, капсюль № 8; взрывчатое ве- щество выдер- жано 2—3 не- дели То же с 10 г запрессованной пикриновой кислоты В железной трубке 0 32 мм В 32-л/ле патро- нах По опытам пробивания С тетриловым капсюлем Бриска № 8 — В железных трубках 0 35—21 мм В железной трубке 0 32 мм В шпуре (забитом) Зелле, 1923 г. Bureau of Mines, 1929 г. ] Герлин, 1 1913 г. Штетбахер, 1930/31 г. Фридрих, 1931 г. Каст, 1913 г. Каст, 1924 г. Дотриш, 1906 г. Каст, 1913 г. | Каст, 1920 г. * Bureau of Mines, 1929 г. Монрое и Гель, 1915 г.
108 Основные понятия из теории взрывчатых веществ
лись с расстояния 9 м объективом Тессар с фокусным расстоянием в 15 c.v
на пластинках «Хромоизоляр».
Вследствие вторичной реакции — горения окиси углерода — наиболее
мощное и самое светлое пламя дает 'пикриновая кислота, затем следует
дымный порох и значительно уступающий им в этом отношении вязкий гре-
Рнс. 57. Дымный порох (115 см).
Рнс. 56. Пикриновая кислота
(высота пламени около 2 м).
мучий студень, который, несмотря на избыток кислорода, отличается
большей пламенностью, чем желатиадинамит, содержащий аммиачную се-
литру. Для аммиачноселитренного и хлоратного взрывчатых веществ све-
товая поверхность уменьшается почти до величины точки, как бы отмечая
Рис. 58. Грему-
чий студень 98/2
(85 см).
Рис. 60.
Альдорфит.
Рис. 61.
Шедд ит.
Рнс. 59.
65%-ный жела-
тиндинамит
(10 см).
только капсюль-детонатор. Хотя оба заряда и взрывались с сильным звуком,
однако взрыв был не настолько интенсивен, чтобы лучи светового явле-
ния при относительно малом отверстии объектива могли дать заметное по-
темнение на фотографической пластинке.
Приведенные выше фотографии (рис. 56—61) характеризуют
только наибольший объем пламени, действующего на пластинку,
который можно зафиксировать фотографическим путем; о вре-
II. Скорость детонации
109
мени развития пламени они не дают никакого представления.
Меттеганг первый выступил в 1902 г. с предложением поль-
зоваться приспособлением для измерения продолжитель-
ности пламени; его аппарат, употреблявшийся Виллем1 и
другими исследователями для характеристики антигризутности
взрывчатых веществ, в основном отличался тем, что между мор-
тиркой, из которой выбивалось пламя взрывчатого вещества, и
неподвижной фотографической пластинкой устанавливался снаб-
женный прорезями вращающийся алюминиевый диск; свет от
пламени проходил через прорези, падал на пластинку и фикси-
ровался. При скорости вращения диска, равной 16,8 м/сек, за-
Рнс. 62. Пикриновая кислота.
Рис. 63. Пикриновая кислота
с 5% NaCl.
фиксированная полоса соответствовала времени 0,024 сек., так
что по числу светлых полос можно было непосредственно опре-
делять продолжительность пламени (рис. 62). На примере п и-
криновой кислоты очень ясно наблюдается образование
последующего пламени, вызываемого горением газо-
образных продуктов взрыва, и разделение на два пламени и
две записи на шкале, между тем как добавка 5% поваренной
соли или 5% бикарбоната натрия совершенно уничтожает второе
пламя, а с ним и вторую запись на шкале.
Этот аппарат, дающий пофазные фотографические снимки,
несколько лет назад был оставлен и заменен вращающейся
• 1 Z. f. Schiess- u. Sprw. 1909, 341.
НО Основные понятия из теории взрывчатых веществ
пленкой, которая на одном и том же фотографиче-
ском снимке фиксирует одновременно длину и
продолжительность пламени.
Рис. 64. Аппарат для измерения длины и продолжительности
пламени взрывчатых веществ.
Рис. 65. Фотография пламени веттерно-
белита В на подвижной пленке.
Аппарат этот, также бази-
рующийся на предложении Мет-
те г а н г а, состоит из:
1) электромотора с тахоме-
тром,
2) фотографического аппарата
с вращающимся барабаном, на ко-
тором укреплена пленка, и электри-
ческим приводом,
3) нормальной мортирки для
производства выстрелов (рис. 160).
Из вертикально установленной
мортирки обыкновенно произво-
дится в темноте выстрел 100 г
взрывчатого вещества в виде
30-Л4Л4 патрона. Приблизительно
в 6 м от него располагается в виде
деревянного ящика фотографиче-
ский аппарат, объективом которого
служит система кварцевых линз
большой светосилы; эта система
линз пропускает большую часть
ультрафиолетовых лучей, отвечаю-
щих самой горячей части пламени.
Фотографический барабан, находя-
щийся в ящике, обернут пленкой,
а два конца пленки пропущены в
прорезь барабана, где они закр^
111. Развитие явления взрыва
11Г
плены латунной скобкой. Для привода служит электромотор, который со-
общает барабану окружную скорость до 20 м/сек. Бблыпие скорости не
увеличивают точности измерения, так как рассеивание также соответственно
увеличивается и снимок вследствие меньшей силы света получается менее
отчетливым и труднее поддается обмеру. Число оборотов фотографического
барабана определяется тахометром, так же как и в случае хронографов для
определения скорости детонации. Устройство для воспламенения располо-
жено так, чтобы можно было сделать три снимка на одну пленку.
Продолжительность пламени (ср. стр. 356) вы-
ражается в тысячных долях секунды и составляет:
для антигризутных взрывчатых веществ 0,35—0,60—1,20 мил-
лисекунд;
для горных взрывчатых веществ 1,4—8,8 миллисекунд;
для дымного пороха 1540 миллисекунд.
III. Развитие явления взрыва
1. Вычисление объема газообразных продуктов по реакции
взрывчатого разложения
По закону Авогадро каждый моль (грамм-молекула) газа
при 0° и 760 мм на 45° географической широты занимает объем-
22,412 л. Поэтому объем газа легко можно вычислить из урав-
нения разложения взрывчатого вещества: необходимо только-
число молекул газа умножить: на молярный объем, равный 22,412,
чтобы выразить объем газообразных продуктов взрыва в литрах.
Для нитроглицерина вычисление дает следую-'
щие цифры:
4СзН5(1ЧОз)2 = 12СОг + IOH2O (парообр.) + 6N2 + О2;
•4 - 227,06 = (12 + 10 + 6+ 1)22,412 л газов;
908,24 г 649,95 л, или на 1 кг 715,6 л газов.
При средней температуре воздуха 20° и барометрическом да-
влении 720 мм (Швейцарское горное плато) молекулярный объем
по закону Бойл я-М а р и о т т а увеличивается до 25,4 л:
22,412^+°-00^7'20> 76 =25,4 л;
вследствие этого вычисленный выше объем газообразных про-
дуктов разложения нитроглицерина возрастает с 715,6 до 811 л.
Для гремучего студня, который на 12,633 кг дает
401 моль газов (стр. 127), объем продуктов взрывчатого разло-
жения составит:
401-22,412 V11. ,
12,633 711,4 л/кг.
112 Основные понятия из теории взрывчатых веществ
Тринитротолуол дает:
2CeH2CH3(NO2)3== 7СО + 7С + 5Н2О + 3N2;
2 227,1 = (7 + 5 + 3) 22,412 ;
454,2 г 336,35 л, или 740,6 л «а 1 кг.
Несмотря на значительное выделение сажи, тринитротолуол
дает следовательно больший объем газов, чем нитроглицерин,
нацело превращающийся в газообразные продукты. Однако
необходимо заметить, что уравнение разложения (или, точнее,
стехиометрические соотношения продуктов распада, получаю-
щихся в момент наивысшего давления) для взрывчатых веществ
с большим недостатком кислорода значительно менее надежно
и справедливо только для бинарных соединений, распадающихся
на элементы, например для азида свинца или ацетилена. Даже
в случае взрывчатых веществ, представляющих собою опреде-
ленные химические соединения (как например нитроглицерин),
которые благодаря небольшому избытку кислорода могут дать
полный окислительный распад молекулы, теоретическое равно-
весие между четырьмя различными продуктами распада — водой,
углекислым газом, кислородом и азотом — все же легко нару-
шается. В какой мере это нарушение имеет место даже в слу-
чае идеально распадающегося гремучего студня, показывает
табл. 6 (см. стр. 120).
Объем, занимаемый газообразными продуктами, образующи-
мися при взрыве 1 г взрывчатого вещества при 0° и 760 Ш
давления, выраженный в кубических сантиметрах, по аналогии
с удельным весом называется удельным или нормаль-
ным объемом (уо). Этот объем зависит от химического со-
става взрывчатого вещества и является понятием, характеризую-
щим взрывчатое вещество.
Максимальный объем! газообразных продуктов, примерно
1500-кратный по отношению к единице веса, дает (по теорети-
ческому подсчету) азид аммония; минимальный — всего
лишь 230-кратный по отношению к единице веса — азид свинца.
2. Объем газообразных продуктов в момент взрыва
По объему газообразных продуктов при 0° и 760 мм.и темпе-
ратуре взрыва по стоградусной шкале t или абсолютной темпе-
ратуре взрыва Т можно, считая давление постоянным, вычислить
объем газообразных продуктов взрыва (у,) по закону Гей-
Люссака:
__ (273 + 0 __ ъ0Т
* 273 273 ’
Если применить эту формулу для н и т р о г л и ц е р и на, то
при нормальном объеме 715,6 Л и температуре взрыва 4210° по-
III. Развитие явления взрыва
113
лучается объем газообразных продуктов взрыва, равный 11 751 л
на 1 кг, или, принимая плотность нитроглицерина равной 1,6 —
в 18 802 раза больше первоначального объема взрывчатого ве-
щества. Для тринитротолуола (vo = 740,6; 1 = 3050°) по-
лучается 9015 л на 1 кг, или в 14 604 раза больше начального
объема при плотности плавленого или пресованного тринитро-
толуола 1,62. Однако в действительности такие объемы никогда
не получаются, так как ни объем продуктов взрывчатого разло-
жения, ни температура взрыва не могут рассматриваться как по-
стоянные, и весь процесс расширения, не являющийся строго
адиабатическим, сопряжен с небольшими потерями тепла путем
излучения. Но вычисления показывают, что каждое взрывчатое
вещество при средней плотности 1,5 (плотность динамита) дает
при взрыве объем газообразных продуктов по крайней мере
в 10 000 раз больший, чем его первоначальный объем.
3. Давление газообразных продуктов взрыва (Давление взрыва)
Давление газообразных продуктов взрыва, т. е. происходящее
при всяком взрыве повышение давления, является причиной
действительной работы, производимой взрывом; это давление
можно было бы назвать с некоторым приближением к истине
«взрывчатой силой», хотя с физической точки зрения это, быть
может, и не вполне удачное выражение.
Давление взрыва можно вычислить по закону Б о й л я - Ма-
ри о т т а, согласно которому объемы обратно пропорциональны
соответствующим давлениям; из отношения объема газообраз-
ных продуктов взрыва vt к первоначальному объему взрывча-
того вещества vo получается:
Po-Pt = vt-.vo.
Это характерное для каждого взрывчатого вещества давле-
ние газов называется по предложению Берт л о удельным
давлением и представляет собою давление, производимое
газообразными продуктами взрыва единицы веса взрывчатого
вещества (1 кг) в единице объема (1 л), т. е. давление при плот-
ности заряжания 1 (в атмосферах). Оно обозначается через I
(force1) и в общей форме выражается следующим уравнением:
f= «4273 +1) =povo -a.T{ = RT),
О
где po во всех случаях равно 1 ат.
Для подсчитанных выше объемов газообразных продуктов,
образующихся в момент взрыва, для нитроглицерина
/ 273 4-42101
11751 л = 1 • 715,6----------
\ & I Съ I
1 Force — сила.
8 Зак. 3171.—Штетбахер-
114 Основные понятия из теории взрывчатых, веществ
и для тринитротолуола 9015 л «удельное давление» в еди-
нице объема (1 л) выразится соответствующим числом атмосфер:
подставляя вместо ро, равного 1 ат, 1,0333 кг/см3, получаем
1,0333 - 11 751 = 12 142 и 1,0333 • 9015 = 9315 кг/см2. Поэтому
термину Б е р т л о соответствует размерность не силы, а энер-
гии, так что «силу» в этом смысле лучше понимать как работо-
способность, ибо f выражает работу, которая совершается, когда
газ расширяется под атмосферным давлением до объема v ,
почему название «удельная энергия» и является наиболее подхо-
дящим.
Что «сила» f, рассматриваемая при изменяющихся плотностях заряжа-
ния, представляет определенную числовую характеристику взрывчатого ве-
щества, а не только приблизительную цифру «практического характера»,
ясно из следующего сопоставления: согласно исследованиям А. Нобля,
являющимся и по настоящее время образцовыми, нитроглицериновый по-
рох— кордит — дает при различных плотностях заряжания следующие
давления в бомбе:
д р (ат) f (вычисленная) v0 — 962 л
0,05 412 7840 а = 0,962
1. 0,1 1052 9510 1
1 0,2 3217 9350 } /=9480
1 0,25 3155 9580 J
0,4 5808 8930
0,45 6587 8300
Экспериментальное определение давления р в атмосферах позволяет
вычислить значение f из нижеприводимого уравнения Э б л я:
Согласно этому f оказывается приблизительно постоянной величиной, по-
скольку принятые давления соответствуют изменению плотностей заряжа-
ния -от 0,1 до 0,25 и составляет несколько больше 3000 ат.
Наоборот, из средней величины f = 9480 для каждой плотности заря-
жания можно вычислить соответствующие давления в атмосферах вплоть
до Д = 1, когда р и f становятся равными (если пренебречь величиной а)
и на это мгновение принимают одну и ту же величину. Но ввиду того
что коволюм а при больших давлениях изменяется, такой подсчет может
быть применен только для средних указанных величин.
Максимальное давление газообразных продуктов зави-
сит главным образом от плотности заряжания, т. е. от отноше-
ния веса заряда L в килограммах или граммах к объему каморы
сгорания (детонации) V в литрах или кубических сантиметрах.
Это частное -у обозначается через Д. В таком случае'да-
вление газообразных продуктов р равно произведе-
нию из удельного давления и плотности заряжания:
Р = / • Д.
В этом уравнении необходимо принять во внимание влияние
так называемого коволюма. Под коволюмом подразуме-
III. Развитие явления взрыва
115
вается объем самих газовых молекул, не поддающийся умень-
шению, т. е. наинизший предел сжатия газообразных продуктов
взрыва. Этот абсолютный остаток, состоящий из несжимаемых
молекул, проявляет себя тем, что объем газообразных продук-
тов взрыва при очень высокой температуре уменьшается не без-
гранично и не пропорционально повышению давления, а быстрее,
так что если через ро обозначить низкое давление, а через pt —
высокое, то закон Бойля-Мариотта будет справедлив
только после вычитания поправки на объем:
Povo=Pt(vt—a).
С а р р о установил, что коволюм а для наиболее часто встре-
чающихся взрывчатых веществ равен 0,001 соответствующего
объема газов при 0° и 760 мм
V 1 ооо /•
С учетом этой величины приведенное выше уравнение по
Эблю принимает следующий вид:
Согласно этому уравнению коволюм уменьшает объем, в ко-
тором происходит взрыв, и вместе с тем повышает давление.
Нобль, приняв во внимание эту поправку, получал в бомбе
очень точные значения давлений до 8000 кг/см2. Однако для
взрывчатых веществ с большим удельным весом при высоких
плотностях заряжания получается, что еще до взрыва в своем
объеме коволюм равен или больше первоначального объема
взрывчатоТо вещества: тогда давление взрыва возрастает до
бесконечности, как например для гремучего студня, кото-
рый на 1 л дает объем в 1153 раза больший первоначального
(ко) и таким образом с новыми молекулами в его составе после
взрыва занимает объем в 1,15 раза больший (vo/1000), чем само
твердое взрывчатое вещество. Но так как бесконечно большое
давление взрыва, хотя бы и при максимальной плотности заря-
жания, совершенно невероятно, то необходимо принять, что ко-
волюм при высоких давлениях значительно уменьшается; в свете
современной атомной физики такое представление вполне зако-
номерно. Уже при уменьшении величины С а р р о на 2/з полу-
чаются давления, которые даже при наивысших плотностях за-
ряжания не превышают 100 000 аг.
Итак, хотя объем коволюма и известен только приблизи-
тельно и представляет собою чисто теоретическую, практически
неопределимую величину, но все же из изложенного ясно, что
взрывчатое вещество должно разрушить всякую оболочку, всякое
сопротивление, если плотность заряжания (например в шпуре
8*
116 Основные понятия из теории взрывчатых веществ
с забойкой) приближается к плотности взрывчатого вещества.
В случае взрывчатых веществ, которые при взрыве дают твер-
дый остаток (сажа или продукты разложения 'селитры), их объем
и (равный весу, разделенному на плотность) прибавляется к ко-
волюму,:
-(« + «)]• •
Давление взрыва определяется на основании закона
Г е й-Л ю с с а к а-М ариотта по уравнению:
п VoPo 273 + f
р 273 * V—a V— а ’
где ро — давление атмосферы = 1,0333 кг/см2;
vo — объем газообразных продуктов, полученных после
взрыва единицы веса взрывчатого вещества (1 кг или
1 г) при 0° и 760 мм (удельный объем);
t — температура взрыва (абсолютная температура взрыва
7 = 273 + 1);
V — объем, предоставляемый газообразным продуктам
взрыва единицы веса (1 кг взрывчатого вещества)';
а — коволюм, принимаемый равным
•
1000
Если уравнение состояния газов выразить без поправки на
объем следующим образом:
= JL
р0 V ‘ 273 ’
то ясно видно, что повышение давления зависит, с одной сто-
(<?„ \
У---объемный фактор I, а
* / Т
с другой стороны, от отношения абсолютных температур I —
\ Z/о
температурный фактор) после и до взрыва. Если объемный фак-
тор мал, как в случае взрывчатых газовых смесей, то это зна-
чит, что соответствующее исходное вещество непригодно в ка-
честве взрывчатого материала.
Чтобы получить живое, практическое представление об
абстрактной формуле, произведем на примере для тротила
три расчета, а именно: без учета коволюма, с учетом коволюма
и с учетом выделения сажи.
Согласно теоретическому уравнению разложения при взрыве 1 кг три-
нитротолуола образуется объем газообразных продуктов (то), равный
740 л, и выделяется 185 г сажи; такой твердый остаток, если принять его
плотность равной 2,0, занимает в 1 л объем 0,0925 л. На основании этих
данных вычислим давление взрыва, «удельную энергию», при плотности
заряжания 1, приняв температуру взрыва в 3150°.
1П. Развитие явления взрыва
117
I. Без учета коволюма. Так как А = 1 то по формуле Эбля Р = f:
P = f= 1,0333 • 740 • 273 +q3150" = 9590 кг/см*.
2. / о ’
II. С учетом коволюма Qqqq
1.0333-740 .^^+^”^-36800^.
ПТ. С учетом коволюма и выделения сажи:
₽= 1-(+) = l'0333 740 ' 27311 — (++ 0,0925)) ~ 57 100
Если положить в основу расчета опытные данные табл. 6, то Р достигло бы
практически лишь величины 37 700 кг/см-.
Если в последнем случае желательно знать, когда давление
возрастает до бесконечности, то коволюм вместе с твердым
остатком точно отцрсят к 1 х Это имеет место при объеме
газообразных продуктов, равном 912,5 л; разделив это число на
цифру, выражающую удельный объем (740 л), получаем> плот-
ность 1,23. Так как тринитротолуол ни при этой, ни при макси-
мальной плотности (1,62) не может давать бесконечно большого
давления, то коволюм при таких давлениях должен быть опреде-
ленно меньше 0,001, т. е. меньше общепринятого значения.
Далее из этих вычислений становится очевидным, что выделе-
ние сажи при взрыве ароматических нитросоеди-
нений сильно повышает давление ив полном смысле
слова должно быть оценено как положительный фак-
тор взрыва, хотя из чисто термохимических соображений и по
аналогии с соединениями, которые, как например нитрогликоль,
полностью обращаются в газообразные продукты, совершенно
неправильно делают как раз обратные выводы.
Табл. 5 (стр. 118) представляет те идеальные давления без
учета коволюма, которые должны были бы получаться в за-
мкнутом сосуде объемом 1 л, если бы в этом сосуде произошел
взрыв при указанных плотностях заряжания (P = f • д).
Что эти постоянно указываемые в учебниках числа имеют
лишь приближенное значение и, самое большее, указывают на
быстрое повышение давления при плотности заряжания, равной
единице, можно 'видеть из двух примеров. По табл. 6 (см. стр. 120)
для пироксилина при д =0,2 давление получилось бы равным
р= 1,0333
800-
(3270 + 273)
273
0,2 = 2139 кг/сти2, для пикриновой
кислоты при д = 0,9, наоборот, Р~ 88 700 кг/ст2.
Малляр и Лешателье были первыми исследовате-
лями, пытавшимися измерить посредством манометра весь про-
цесс нарастания давления от iHaMaWa воспламенения до достиже-
ния максимального давления и далее в продолжение охлаждения.
118 Основные понятия из теории взрывчатых веществ
ТАБЛИЦА 5
Давление взрыва различных взрывчатых веществ в кг/см?
Плотность заряжания Д Дымный порох Бездымный порох Пирокси- лин Нитрогли- церин Пикрино- вая кислота Аммиачная селитра Гремучая ртуть
0,1 336 858 1061 1098 983 542 468
0,2 708 2 026 2 343 2351 2174 1217 966
0,3 1123 3 275 3 921 3 947 3 650 2 077 1501
0,4 1 587 —. 5 912 5640 5 523 3211 2 072
0,5 2112 —- 8 502 7 829 7 982 4 779 2686
0,6 2 708 — 12 000 10 560 11 350 7082 3347
0,7 3 393 —. 17 020 14060 16 240 10 800 4 062
0,8 4 201 — 21810 21520 24 030 17 870 4 952
0,9 5126 — 38 500 25 270 38 310 36 250 5 683
1,0 6 236 — .—. 35010 — со 6602
1,2 9255 .—_ ОС- — со — 8 726
1,4 14 130 — — со — — 11 320
1,6 29340 — — — —. — 14 560
1,8 — —. —. —- — — 18 790
2,0 со 1 — — — —. — 24 350
2,4 — — — .— —• — 43970
3,2 '—* •— — — СЮ
Они впервые нашли также необходимым внести поправку на по-
тери теплоты. Эти потери были приписаны или рассеиванию
и, прежде в<сего невыгодной цилиндрической форме бомбы, по-
глощающей (даже в ничтожно малый промежуток времени
взрыва) заметные количества тепла.
Чтобы исключить влияние внутренних охлаждающих поверх-
ностей, еще Б и х е л ь применил оригинальный способ экстра-
поляции, описанный на стр. 143—144. В самом деле, этим путем
удается получить давление взрыва, не зависящее от каких бы
то ни было потерь на излучение, как бы абсолютную неизме-
няемую величину давления взрыва. Но если пользоваться этим
же методом при различных давлениях, то между теплотой и
давлением обнаруживаются несоответствия, которые при приня-
тых допущениях невозможно объяснить. Именно оказывается,
что во время взрыва с повышением давления возникают потери,
которые нельзя объяснить ни излучением, ни абсорбцией.
Если Q — тепловой эффект реакции, протекающей со взры-
вом, то
Q = (T-T^Ct,
т. е. здесь Q без всяких оговорок принимается! равным тепловому
эффекту реакции (произведению разности температуры взрыва
Эта величина не имеет значения, так как плотность не бывает выше 1,9
111. Развитие явления взрыва
119
и нормальной температуры на сумму теплоемкостей образую-
щихся газов); при этом учитываются те количества тепла, ко-
торые могут теряться благодаря проводимости или излучению
через стенки бомбы во время нарастания кривой 1восплам1енения.
Все имеющие место сверх того потери тепла вызываются хими-
ческими промежуточными реакциями, отчасти диссоциацией, от-
части поглощением тепла вторичными реакциями.
В каких размерах в пределах температуры взрыва может
иметь место диссоциация, показывает следующая таблица
для водяного пара и углекислоты (по Нернсту):
Температура (абсолютная) 1 am 100 am
HaO co2 H2O co2
1500° 0,0202% 0,0483% 0,00433% 0,010%
2500° 4.21% 17,6% 0,927% 4,090/o
3500° 30,9% 83,20/0 7,79O/o 39,8%
Согласно этим цифрам при температуре 3500° для взрыва пропадает
уже Via теплоты горения водорода и */s теплоты горения углерода, правда,
яри небольшом давлении в 100 ат. В какой степени могла бы быть принята
во внимание, кроме молекулярной, еще атомарная диссоциация
(ионизация) при наивысших температурах (как для оксиликвитов или сме-
сей с тетранитрометаном):
Н2 = Н + Н — 81 б. кал
Оа — О +' О— 118 б. кал,
до настоящего времени не ясно. С повышением давлений детонации
в 100—1000 раз диссоциация снова значительно уменьшается: во всяком слу-
чае в условиях практики можно считать, что значительных потерь энергии,
зависящих от этой причины, нет. Впрочем, по вычислениям Шмидта 1
диссоциация углекислоты при р = 100 000 ат и Т — 4500° может доходить
До 15%.
Но диссоциация не является единственным фактором умень-
шения количества теплоты. Предполагают, что образуются тер-
мически слабо эффективные и кроме того эндотермиче-
ские промежуточные соединения, которые при очень высоких
температурах всегда более постоянны. Так например озон и пе-
рекись водорода обнаруживаются при взрыве гремучего газа
«ак_ постоянные спутники воды. В результате всего этого давле-
ние взрыва и температура взрыва относительно уменьшаются тем
сильнее, чем выше температура детонации вообще, т. е. чем
больше в момент последнего повышения температуры число про-
цессов образования новых соединений и явлений диссоциации,
------———_____________________________________________________________
1 Beitrage zur Behandlung explosibler Vorgange, Z. f. Schiess- u. Sprw., 1929„ 45
120 Основные понятия из теории взр ывчатых веществ
ТАБЛИЦА 6
Диализ газообразных продуктов взрыва и важнейшие дан-
ные, характеризующие свойства некоторых типичных
взрывчатых веществ, подвергнутых детонации
в свинцовом цилиндре
1000 г взрывчатого вещества Гремучий студень 92/8 Пентаэрит- риттетра- нитрат Пи рокси- лин (13,3% N) Тетрил Пикрино- вая кислота Тротил ।
воспламеняемого при плотности заряжания Д 1,45 1,54 1,3 0,9 1,56 1,0 1,45 1,52
СО, 13,27 9,34 8,05 3,02 5,59 4,49 7,88 5,30
СО 0,83 6,44 10,29 18,83 10,85 17,6 10,18 8,79
С(сажа) — — 2,5 0,3 5,8 0,8 6,8 15
Число молей на кило- Н,0 н2 11,17 0,17 11,05 1,53 9,93 2,45 3,03 3,64 5,91 1,89 4,02 1,70 4,60 1,08 7,05 1,69
Для пентрита напри- мер всего 35,6 моля (теоретически 34,8 моля) 35,6 • 22,412 = = 798 л газов о2 NO n2 NH3 сн4 СлиНп 0,30 0,50 6,15 0,03 0,40 1,0 5,82 0,14 4,81 0,15 7,73 0,3 0,48 0,02 7,82 0,27 0,03 5,02 0,1 0,16 0,04 5,81 0,3 0,12 0,01 5,2 0,9 0,03 0,05
HCN — .— -— 1,2 0,6 0,66 0,33 1,4
(CN)2 — — — 0,2 0,58 1,2 0,4 0,1
СО2:СО 16 1,5 0,8 0,16 0,5 0,25 0,7 0,6
Теплота взрыва
б. кал’кг Температура взрыва t 1510 1395 1045 850 1095 820 1030 918
4150° 4010° 3270° 3000° 3530° 3050° 3500° 2940°
Удельный объем га-
зообразных продук- тов (л/кг) 727 798 800 860 750 780 690 688
быстро и в хаотическом беспорядке следующих один за дру-
гим. Поэтому температуры взрыва, вычисляемые из стехиоме-
трических уравнений, всегда выше, чем температуры, определен-
ные на основании экспериментальных данных состава газообраз-
ных продуктов.
Непостоянство течения реакции особенно ясно видно из этого
сопоставления. «Взрыв» есть крайне .сложный процесс, который
зависит не только от внешних условий, но в не меньшей степени
и от природы самого взрывчатого вещества. Согласно предло-
жению Поппе нберга взрывчатые вещества при их рас-
Составлена по Н a i d u. Schmidt, Z. f. Schiess- u. Sprw. 1931, 295—297
III. Развитие явления взрыва
121
смотрении с чисто химической точки зрения .и с целью термо-
динамических вычислений делятся на три группы:
1. Взрывчатые вещества, которые содержат большее или по край-
ней мере достаточное количество кислорода, необходимое
для полного внутримолекулярного сгорания водорода и углерода. Важней-
шие представители — нитроглицерин, нитрогликоль и гремящий студень.
2. Взрывчатые вещества, которые при детонации без остатка превра-
щаются в газообразные продукты, но содержат недостаточное количество-
кислорода для полного сгорания водорода и углерода. Представители — ни-
тропентаэритрит, пироксилин и бездымный порох (но толрко сгорающий
в оружии, а не подвергаемый детонации).
3. Взрывчатые вещества, значительный недостаток кислорода в которых
приводит к выделению твердого углерода В' виде сажи. Предста-
вители— все ароматические нитросоединения во главе с пикриновой кисло-
той и тринитротолуолом.
Для первой группы, особенно для нитроглицерина,
имеющего 3,5% избыточного кислорода, составление уравнения
разложения очень просто: продукты взрыва соответствуют пол-
ному сгоранию, а диссоциация, равно как и превращение согла-
сно уравнению равновесия водяного газа, ничтожна. (Для гре-
мучего студня, как показывает опыт, отклонения имеют уже
заметную величину.) Давления и температуры, вычисленные по
стехиометрическому уравнению разложения, являются верхними
пределами этих величин, которые в действительности полностью
достигнуты быть не могут. Предпосылкой для этого является
правильная детонация взрывчатого вещества; при частичном
превращении («сгорании») образование окислов азота и окиси
углерода может преобладать над образованием двуокиси угле-
рода.
Для второй группы взрывчатых веществ, в которых
содержится меньшее количество кислорода (но еще достаточное
для полного превращения их в газообразные продукты) и при
сгорании которых образуется значительное количество окиси
углерода, уравнение разложения составляется в соответствии
с равновесием водяного газа:
СО + НгО СО2 + Н2(+ 10,1 б. кал)
или в другой форме:
СО Н2О
СО2 • Н2 А’
Где константа равновесия К определяется равновесием
Диссоциации водяного пара и углекислоты. Реакция водяного
газа протекает без изменения объема и при температурах выше
830° сдвигается с поглощением тепла справа налево (при 830°
^=1). По данным анализа газообразных продуктов взрыва
тетрила (Д = 1,56) получаем:
Д’ = Fir,5»9 = 6,9 при t = 3530°.
0,0 • 1,У
122 Основные понятия из теории взрывчатых веществ
Константа «6» соответствует детонации с выделением работы
(unter Arbeitsleistung), когда состав продуктов взрыва в период
охлаждения не изменяется никакими последующими реакциями.
По определяемой эмпирическим путем или принятой величине 6
и неизвестному числу молекул (хСОг, уНг, zCO, wHaO), которые
связаны между собою четырьмя уравнениями:
1) х Ц-z = числу атомов углерода С,
2) 2х + z +w — числу атомов кислорода О,
3) у +w — половине числа атомов водорода Н,
Л у
можно, принимая во внимание равновесие газов, соста-
вить уравнение разложения, т. е. уравнение состава
газообразных продуктов в момент детонации. Если желательно
учесть образующиеся в небольших количествах побочные про-
дукты (аммиак, синильную кислоту, циан, метан, углеводороды
и окись азота), то из соответствующих концентраций необходимо
отнять входящие в эти соединения молекулярные количества
водорода, углерода и азота.
Проведение таких вычислений по образцу Поппенберга1
не представляет затруднений. Несколько ненадежной величиной
является только константа К, которая например цо данным
табл. 6 имеет не вполне определенное значение, т. е. слишком
сильно колеблется даже при одинаковых внешних условиях.
Поэтому наиболее достоверно — составление уравнения разложе-
ния на основе анализа газообразных продуктов по методу Госу-
дарственного химико-технического института в Берлине.
Третья группа охватывает взрывчатые вещества, кото-
рые только частично превращаются в газообразные продукты;
при разложении этих взрывчатых веществ выделяются различ-
ные количества элементарного углерода. Полное чисто
теоретическое составление уравнения разложения представляет
в этом случае значительные трудности. В то время как для
второй группы взрывчатых веществ количества' отдельных со-
ставных частей газообразных продуктов устанавливаются по
равновесию водяного газа, в данном случае. приходится учиты-
вать еще равновесие между двуокисью и окисью углерода:
2СО^СОа + С ( + 42,3 б. кал).
И в этом случае примеры вычисления мы находим у П on-
ней б ер г а, причем в качестве пятого неизвестного в уравне-
ние входит количество выделяющегося углерода и:
5x + z + tz = C (числю атомов углерода).
1 Приведены в книге Cranz, Lehrbuch der Ballistik, т. II. 23—28 (1926);
примеры подобных расчетов см. также Schmidt. Z. f. Schiess- и. Sprw.,
1929, 43 и 91; Friederich u. Er tin, там же, 1932, 127.
III. Развитие явления взрыва
123
В отличие от уравнения равновесия водяного газа, для кото-
рого состав есть функция температур ы, уравнение равно-
весия «углерода» зависит не только от температуры, но и от да-
вления. Как правило, высокие давления благоприятствуют реак-
циям, которые протекают с уменьшением объема. В самом деле,
при детонации нитросоединений, даже в тех случаях, когда
кислорода достаточно для полного превращения в окись угле-
рода, наблюдается, как это следует из данных анализа табл. 6,
заметное выделение свободного углерода при одновременном об-
разовании больших количеств углекислого газа и значительного
остатка более высокомолекулярных соединений. В связи с этим
и отношение СОг к СО получится всегда( меньше единицы, между
тем как для взрывчатых веществ, полностью обращающихся
в газообразные продукты, оно значительню больше.
ТАБЛИЦА 7
Продукты взрыва пикриновой кислоты при различных
условиях
Продукты взрыва Пикриновая кислота взрывается
в калориметрической бомбе в собственном объеме Д= 1,53
Д 0,1 Д0,3 Д0,5 в стальной бомбе в свинцовом цилиндре
С02о/0 .... СО/0 СН4% • • • • Сотн„% • • • С (сажа) . . . NH» . . . .*. СН4 СтН„ (С2Н4) . HCN 7,61 61,58 1,19 12,52 на 100 г 15,40 54,34 5,75 6,31 пикриновой 20,55 48,80 7,83 3,06 кислоты — 9,4 44,5 0,5 следы 2,2 7 0,5- С С 1 29,1 44,6 0,2 0,2 2,3 ,0 -1,0 >,23 ,29 Л
Количества углерода, выделяющиеся при взрыве в бомбе, по
Данным Поппенберга и Стефана:
Взрыв производится
прн Д = 0,2 (%) в собственном объеме (%)
Пикриловая кислота . . 0,29 6,5
Тринитробензол .... — 10,7
Тринитротолуол .... 4,82 17,2
Динитробензол .... — 19,7
124 Основные понятия из теории взрывчатых веществ
Детонация в собственном объеме производилась таким обра-
зом, что стальная бомба, имевшая стенки толщиною 3—4 см, по-
мещалась в большую эвакуированную бомбу, где и производился
взрыв, между тем как параллельные опыты ставились в свинцо-
вом цилиндре (за отсутствием осколочного действия) под мед-
ным эвакуированным колоколом. Благодаря работе разрушения
маленькой бомбы или при расширении в свинцовом цилиндре
продукты взрыва так быстро охлаждались, что они не успевали
превращаться в новые соединения, ибо их состав изменялся лишь
тогда, когда толщина стенок железной бомбы обтачивалась на
0,5 см. «Замораживание» равновесия газов в прочной оболочке,
т. е. фиксацию их неизменного состава в момент наивысшего
давления, по крайней мере в начале периода охлаждения, можно
считать осуществленным фактом.
Обращают на себя внимание значительные колебания в отно-
шении метана согласно данным анализа табл. 7. Этот угле-
водород, постоянно имеющийся в числе продуктов взрыва, слу-
жит до некоторой степени показателем течения реакции. Секрет
его образования привел даже к созданию теории, ведущей свое
начало от Поппенберга1 и считающейся в настоящее время
почти доказанной. На основании различных наблюдений при-
нято считать, что каждое взрывчатое вещество при взрыве раз-
лагается совершенно определенным, свойственным
ему образом и что устанавливаемый анализом состав продуктов
взрыва, изменяющийся с плотностью заряжания, является след-
ствием позднейших реакций, протекающих в период
охлаждения. Смесь СО — НгО, существующая еще при раз-
витии взрыва, должна превращаться в направлении СОг — Нг до
тех.щор, пока скорость охлаждения станет больше скорости
реакции и равновесие установится. В частности метан должен
образоваться по уравнению:
СО ЗНг СН« + НОа(+ 50,6 б. кал).
При температуре около 900° между обеими сторонами равен-
ства устанавливается равновесие; при более низких температурах
образуются почти исключительно метан и вода; напротив, выше
2000° метана почти нет. Имеются многочисленные доказательства
непостоянства метана при высоких температурах, несмо-
тря на высокие давления; но самым убедительным из них является
упомянутый взрыв в собственном объеме толстостенной бомбы,
особенно при пользовании изображенным на рис. 66 аппаратом
для охлаждения продуктов взрыва посредством
уменьшения давления.
Эти немногие выводы в дополнение к уже сказанному в раз-
ных местах показывают, как сложен процесс взрыва и как во-
обще трудно разобраться во всей проблеме в целом с точки
1 Ober die Zersetzung von Explosivstoffen, Z. f. angew. Chem., 1923, 80—85-
1П. Развитие явления взрыва
125
зрения химической динамики. Достаточно представить себе сле-
дующие одна за другой с быстротою молнии взаимно перекрещи-
вающиеся реакции, разыгрывающиеся с постоянным смещением
равновесия от начала нарастания давления и выделения теплоты
до кульминационного пункта.
Однако, так как метан почти всегда встречается в продуктах
взрыва, образование его прямым синтезом из углерода и
водорода в период нарастания давления исключить нельзя. На
тот же период падает и образование эндотермических
соединений, как ацетилен, циан, синильная кислота и окись азота,
которые однако, наоборот, постоянны при наивысших темпера-
турах взрыва и разлагаются по мере того, как происходит охла-
Рис. 66. Аппарат М ю р а у р а для доказательства отсутствия
метана в газообразных продуктах взрыва при максимальном
давлении в бомбе (Laboratorie central des Poudres, Paris):
7—крешерный цилиндрик; 2—взрывная бомба; 3—запальние стержни; 4— при-
емник для газов; 5—кран для взятия пробы газов; 6—-соединительная стальная
• трубка с каналом диаметром 1 мм для понижения давления.
ждение; в случае повышенных плотностей заряжания в бомбе их
разложение замедляется. Подобно образующемуся таким же об-
разом аммиаку эти нестойкие промежуточные продукты можно
уловить лучше всего мгновенным охлаждением в мо-
мент «высшего равновесия», как это видно из табл. 6.
4. Теплота взрывчатого разложения
Под теплотой взрывчатого разложения подразумевается ко-
личество теплоты в калориях, выделяющееся при детонации 1 кг
взрывчатого вещества. Эта величина служит одновременно для
выражения содержания энергии и работоспособ-
ности и наряду со скоростью детонации является одной из
важнейших характеристик взрывчатого вещества; она может
быть с достаточной точностью вычислена по термическим дан-
126 Основные понятия из теории взрывчатых веществ
ны,м или определена экспериментально в калориметрической
бомбе.
Теплота взрыва технических взрывчатых веществ колеблется
в пределах от 700 до 2000 б. кал; нижний предел представляет
дымный порох, верхний — оксиликвйты. Числа эти
при сравнении с горючими веществами оказываются слишком
малыми; так, нефть дает 12 000 б. кал, а каменный уголь — до-
8000 б. кал. Но если названные горючие материалы сжигать по-
добно взрывчатым материалам, т. е. с точно необходимым коли-
чеством кислорода, то количество тепла падает до —*/з коли-
чества тепла оксиликвитов.
Непосредственное калориметрическое определе-
ние в настоящее время все больше и больше уступает расчет-
ному (по данным! анализа продуктов взрыва). Это вызвано:
1) соображениями, связанными с аппаратурой и безопас-
ностью, так как при малых навесках полная детонация взрывча-
тых веществ сомнительна;
2) тем, что при детонации без выделения работы на оконча-
тельные результаты вследствие медленного охлаждения газов
сильно влияют последующие реакции, благодаря чему
измеренные количества теплоты едва ли пригодны для. вычисле-
ния, скажем, температуры взрыва.
Для вычисления теплоты взрыва необходимо знать
теплоту образования взрывчатых веществ и теплоту
образования продуктов взрыва; такое вычисление стано-
вится тем менее надежным, чем более отличается фактический
процесс от химически вероятного уравнения разложения. В ка-
кой мере теплота взрыва зависит от хода реакции, кроме табл. 6,
показывает особенно следующий ряд опытов, произведенных
Ноблем с пироксилином, содержавшим 13,2% N при различ-
ных плотностях заряжания:
Пироксилин иа 1 л объема каморы в г Уравнение р азложения 46241129 (NO^O^ б. кал!кг
50 30СО2 - 1-71СОН |-41Н2Н и СН4-] - 35Н2О -J h 22N, 820
150 35СО2- - 67СО - -39Н2- - зсн4- -34HsO- -22N- 825
300 47СО2- (-57СО- -29H.J 13СН4 —| (-32Н8О- -22N2 900
500 63СО2- (-42СО- Н6НаН (-20СН4- h 7Н2О - |-22N2 1010
Те л л,о т а образования. Эта основная для каждого бри-
зантного и метательного взрывчатого вещества величина равна
избытку теплоты горения всех элементарных компонентов соеди-
III. Развитие явления взрыва
127
нения (С, Н, S) по сравнению с количеством теплоты горения
самого соединения, полученным в бомбе. При этом считают, что
продуктами разложения являются исключительно газообразная
углекислота и парообразная или жидкая вода,.
и все теплоты горения пересчитываются на постоянное
давление. Примеры выделения положительной и отрицатель-
ной теплот образования (тепловые эффекты) были приведены
в табл. 2. «Теплоты образования» в строгом смысле слова от-
носятся только к веществам, представляющим собою определен-
ные химические соединения; для взрывчатых же смесей соответ-
ствующую величину можно вычислить по разности теплот.
Для определения теплоты горения взрывчатого вещества
последнее в количестве около 0,2 г прессуется в миниатюрную чашечку (для
быстрого по возможности обращения в газы) и сжигается лучше всего
в микробомбе Рота. Чтобы при всех условиях достигнуть полного окис-
ления, кислород нагнетается с избытком и под сильным давлением до 30 ат:
Например для пироксилина CaiHaeCUaNii с 13,48% N теплота полного
горения экспериментальным путем была определена в 2538 б. кал на моль
при сжигании в кислороде под давлением 50 ат. Атомарные же составные
части при сжигании порознь дают: С24 • 96 — 2304 и На» • 34,2 = 991,8, всего'
следовательно 3295,8 б. кал на каждый моль жидкой воды. Отсюда теп-
лота образования 1 моля (1143,3 г) пироксилина равна разности
ЗЙ95,8 — 2538=i757,8 б. кал или 663 б. кал в пересчете на 1 кг. По новейшим
определениям 1 теплота образования на 1 кг составляет 510—530 б. кал при
13,7% 41 и 590 б. кал при 13,3—13,4% N. Этим же способом теплоты обра-
зования для пентаэритриттетранитрата были определены в 296
и для гремучего студня 92/8 в 389 б. кал на 1 кг.
К сожалению, многие из этих определений произведены очень
неудовлетворительно и настолько отличаются по числовым зна-
чениям, что они, как показывает нижеследующее сопоставление,
совершенно непригодны для вычисления теплоты взрыва, а по
ней и температуры взрыва. Например во многих руководствах
теплота образования гликольдинитрата указана равной 67,7 б. кал*
на моль2; вычисленная на основании этой цифры температура
взрыва ниже температуры взрыва нитроглицерина, что не может
соответствовать действительности, ибо температура этого иде-
ально распадающегося соединения должна несколько превосхо-
дить даже рекордную температуру взрыва гремучего студня.
Вычисление термохимических данных в отношении различных
взрывчатых процессов и уравнений предполагает знание важней-
ших определений и фактов из области термохимии и тер-
модинамики, вследствие чего мы кратко остановимся на
этом.
Единицей теплоты является г р а м м-к а л о р и я, или малая
калория (м. кал), т. е. такое количество теплоты, которое необхо-
димо для нагревания 1 г воды с 14,5 до 15,5°; в тысячу раз боль-
шее количество теплоты называется большой калорией (б. кал)
* z. f. Schiess-u. Sprw., 1932, 117.
Ср. Наум, Нитроглицерин, 1934 г., стр. 194 (в новом издании Лан-
До л ь т-Б ер и штейна даио более точное значение: 56,0).
J28 Основные понятия из теории взрывчатых веществ
ТАБЛИЦА 8
Теплоты образования и нитрования важнейших
ароматических нитросоединений1
На 1 кг Теплота образова- ния Теплота нитрования
б. кал при постоянном
давлении
Нитробензол - 18,7
л-Динитробеизол | - 22,6
ь 40,8
Г 26,3
1. 2, 4- „ - 22,1
о-Нитротолуол - 21,9
2, 4, 6-Триинтротолуол 1 - 48,9
2, 4, 6- , ........ t - 72,7
2, 4, 6-Тринитро-л-ксилол - 95,5
Тринитрофенилметилнитрамии { - 16,3
- 36,6
Гексаиитродифениламии - 31,5
Нитроиафталин - 41,3
1, 5-Динитроиафталин - 25,0
1, 8- „ - 12,2
1, 3, 8-Тринитронафталии - 21,8
Пикриновая кислота ( -244
н -249
- -209
2, 4, ^^ринитрорезорцин -539
4-303
4-196
4-214
-135
— 101
4-239
--129
--106
-- 49
4- 49
4-288
4-136
4-144
4-134
4-119
4- 88
или килограмм-калорией. В настоящее время при вычислениях
пользуются также большими калориями, отнесенными к 20°; эти
калории очень мало (меньше чем> на 1%) отличаются от обычных
калорий, отнесенных к 15°.
Основные реакции каждого взрыва .протекают эк-
зотермически и рассчитываются (по крайней мере для практи-
чески применяемых взрывчатых веществ) на соединение углерода
и водорода с кислородом: большинство эндотермических соеди-
нений азота, так же как прочие побочные реакции, имеют лишь
второстепенное значение.
Таблица важнейших элементарных уравне-
ний горения, которые лежат в основе процессов взрыва2
1 Составлено по таблицам W. Rijikenbach, Journ, American Soc., 1930,
115. Цифры даются в пересчете на 1 кг.
2 Теплота горения углерода здесь принята более высокой, чем принято
считать для графита или алмаза (94,27 и 94,48 б. кал), так как в этих кри-
сталлических модификациях углерода часть энергии расходуется на силы
молекулярного сцепления для образования кристаллической решетки. Для
расчетов принята теплота горения чистого аморфного углерода,
равная 97J0 б. кал, уменьшенная до 96 б. кал, так как «калориметрическая
сажа» все же содержит вероятно следы водорода н кислорода. В новейшее
1П. Развитие явления взрыва
129
(грамм-калория на грамм-атом или грамм-молекулу при п о-
стоянном давлении):
В пересчете
на 1 кг сго-
ревшего ве-
щества
(32,000 г) = СО2 (44,000 г) 4- 96 000 кал
(16,000 г) = СО (28,000 г) 4- 28 300 .
С
С
(12,000 г) + О2
_ (12,000 г) 4-У2О2 . .
С0(28,000 г) 4- у2О2 (16,000 г) = СО2 (44,000 г) ф- 67 700 ,
Н2 (2,0156 г) -|- у2О2 (16,000 г) = Н2О (18,0156 г) жидкая 4-
4-68350 кал.................................................
Н2 (2,0156 г) -|- i/2O2 (16,000 г) = Н2О (18,0156 г) парооб-
разная -|- 57 810 кал................". .................
8000 б. кал
2358 . „
2 418 .
33910 „ „
28 680 „ .
Для пересчета на постоянный объем указанные выше
величины калорий необходимо повысить на 0,583 б. кал. Т е-
плота испарения моля воды составляет 10,54 б. кал при
20°. Далее, для оксиликвитов теплота испарения жидкого
кислорода 95 б. кал/кг вычитается из полученного теплового
эффекта для воды.
Кроме этих основных реакций в период нарастания
давления имеют место еще побочные реакции, которые дают
экзотермические соединения:
6) С + 2На — СН4 -J- 18,0 б. кал
7) Ns 4 ЗН« = 2NHs 4 24,4 б. кал
и эндотермические соединения:
8) 2С4Н2 = С2Н2 —53,3 б. кал
(наиболее достоверная величина по Микстеру)
9) 2С 4- N- = (CN)s — 71,0 б. кал.
10) 2С 4 Ns 4 Н, = 2HCN — 59,6 б. кал.
В присутствии элементарного избыточного кислорода про-
исходит еще как побочная реакция образование окиси азота:
11) Ns + Os = 2NO — 43,2 б. кал;
в то время как соответствующей реакцией образования закиси
азота (2№ 4-Оа = 2N2O — 41,0 б. кал) можно пренебречь.
О вторичных превращениях в течение периода охлажде-
ния было указано на стр. 124.
Теплота взрыва (горения) при постоянном
давлении и постоянном объеме
Для того чтобы нагреть 1 моль (идеального) газа при определенном
постоянном объеме (например в стальной бомбе) на 1°, мы должны во-
время Ми кете р при определении теплоты образования ацетилена
в основу расчета тоже положил теплоту горения сажи. Значения урав-
нений 3—5 соответствуют последним, наиболее надежным определениям
р°та, произведенным при 20°.
9 Зак. 3171. Штетбахер
130 Основные понятия из теории взрывчатых веществ
общить определенное количество теплоты (молярная теплота газов
при постоянном объеме). Это количество теплоты равно теплоемкости с„
газа, взятого в количестве его молекулярного веса.
Если мы в другом опыте сохраним постоянное давление газа,
давая газу возможность при нагревании расширяться, преодолевая давле-
ние атмосферы (например через отверстие в бомбе), то сообщаемая при
этом теплота Ср (молярная теплота газа при постоянном давлении), не-
обходимая для повышения температуры на 1°, несколько больше, чем в пре-
дыдущем случае, а именно на величину, необходимую газу на его рас-
ширение. Этот избыток работы, необходимый молярному объему г> (равному
22,412 л) для преодоления атмосферного давления, имеющего постоянную»
величину р, выражается уравнением:
р • v — R • Т эргов = газовой константе (8,313 • 107), умноженной на
абсолютную температуру (273,2° + 1°). Поэтому работа расширения растет
с повышением температуры и составляет при комнатной температуре 20°
(7 = 293°):
p-v = 8,313-107-293 = 2,44-1010 эргов.
Так как всякий вид энергии может быть выражен в единицах другого
вида энергии, то этой величине работы в абсолютной системе единиц со-
ответствует эквивалентное количество теплоты, равное
2,44-Ю10 _ /или 572 м. кал при 15' \
4,186 10" ( = 1 л. кал) — ° М' КаЛ ^или 542 „ „ „ 0° ).
Другими словами, молярная теплота (идеального) газа, измеренная при
постоянном атмосферном давлении, больше молярной теплоты газа, изме-
ренной при постоянном объеме в бомбе, на 583 м. кал при 20° (комнат-
ная температура).
При взрыве гремучего газа или при горении чистого водо-
рода в воздухе, когда реагирующее количество газов иногда исчезает бла-
годаря следующей непосредственно за этим конденсации -воды, необходимо
от молярной теплоты горения отнять теплоту, полученную системой от
сжатия ее атмосферой, из расчета 583 м. кал на моль воды:
Н2 + V2 О2 = Н2О 68 350 м. кал
(1 + V2) молей 1V9 583 = 875 „ „
/ 67 475 м. кал
Наоборот, при детонации твердых взрывчатых веществ,
когда вода образуется в меньшем во много сотен раз объеме, никакой
работы со стороны атмосферного давления не прибавляется, так как оба
процесса—испарение и расширение воды, и давление воздуха, проникаю-
щего в место взрыва,—-взаимно уничтожаются. Поэтому теплоты де-
тонации твердых, содержащих воду взрывчатых ве-
ществ принимаются без всякой поправки на исчезающий
объем водяных паров.
Под теплотой взрыва Q понимают разность между теплотами
образования начального и конечного состояний, т. е. избыток
выделяющейся при детонации теплоты О? над теплотой образо-
вания взрывчатого вещества Qi:
Q = 0‘2 — Qi.
Как «конечное состояние» следует рассматривать равновесие га-
зов при максимальной температуре, т. е. то состояние, которое
имеется в виду, когда говорится о «замораживании» системы
при взрыве с выделением работы. Но до сих пор теплота
III. Развитие явления взрыва
131
взрыва выводилась почти всегда из теоретического уравнения
разложения.
Поясним этот способ расчета следующими примерами:
Гремучий студень, состоящий из 91,67% нитроглицерина и 8,33%
•коллодионного хлопка с 11,97% N, детонирует с образованием продуктов
полного горения:
51 С3Н5 (NO3)3 + С24 HS1N9 Ogg = 177 СО2 + 143Н2О 4- 81 N2
'll 580 г 1053,3г
12 633,3 г
Вычисление теоретической теплоты взрыва Qp
Теплота конечного состояния слагается из
СО2 :177 96,0 = 16 992 б. кал
Н2О : 143 • 57,8 = 8 265,4 „
(пар) ------------ „
для 12,633 кг гремучего студня .... 25 257,4 б. кал
На 1 кг гремучего студня это составит 1999 б. кал, а после вычитания теп-
лоты образования 389 б. кал1кг, теплота взрыва будет Qp = 1610 б. кал
при парообразной воде и постоянном давлении.
Если принять, что взрыв, как например в шпуре, происходит при п о-
стояниом объеме, то никакой работы в направлении внешнего атмо-
сферного давления не совершаете^, и каждый моль газа получает 0,583 б. кал:
Qc = Qp 4- л • 0,583 б. кал (при 20°).
Для 401 моля (12,633 кг) гремучего студня получается прирост теплоты
401 • 0,583 = 233,8 б. кал или 18,5 б. кал/кг.
Теплота взрыва Qv составит таким образом 1628,5 б. кал (вода
парообразная).
Для самой сильной оксиликвитной смеси (при вероятном пред-
положении, что образование углеродистого компонента — продукта поли-
меризации ацетилена — приближается к нулю) получим:
карбен + жидкий кислород (теплота испарения = 95 б. кал1кг)
24,8%- 75,2%
С»3Н20 4~ 56 0 = 23СО2-Ь 10 Н2О (парообразная)
296 896 23-96 4- 10-57,81 - 95 - 0,896 б. кал
1192 г. 270Г06. кал
1, кг 22 66 б. кал при постоянном давлении.
Подобным же образом получается теплота взрыва Qp важной в воен-
ном отношении смеси нитробензол—двуокись азота:
8CeH5NO2 4- 25 N2O4 = 48СО2 4- 20Н2О 4- 29 N2
8 -123,05 4-25 - 97,02 48-96,04-20 - 57,81 б. кал
3509 г 5764,2 б. кал
Теплота образования нитробензола: 8-(—2,30)4- 18,4 б. кал
N2O4 25-(4-2,6) —65,0
5717,6 б. кал
1 кг 1629 б. кал (НгО парообразная).
132 Основные понятия из теории взрывчатых веществ
Эти вычисленные теплоты взрыва являются приблизительными и притом *
наивысшими, как видно из вычислений, произведенных ниже на основании
анализа газообразных продуктов взрыва гремучего студня.
Гайд и Шмидт установили следующий состав газов для 10 г грему-
чего студня, взорванного в свинцовом цилиндре с прочной забойкой (число
молей в пересчете на 1000 г):
13,27 СО2 4- 0.98СО + 11,13 Н,О + 0,21 Н2 -|- 0,03СН4 + 0,15 О2 + 0,50 NO + 6,05 N,
Отсюда, суммируя количества теплот, получим:
СО<> 13,27 • 96,0 = 1273,9 б. кал
СО" 0,98-28,3 = 27,7 „ „
Н,О 11,13-57,8 = 643,3 , „
СН4 0,03-18,0= 0,5 ,, „
NO — 0,50 • 21,6 = —10,8 „ „
1934,6 б. кал — 389 б. кал. (теплота
образования) = 1545,6 б. кал
при постоянном давлении (вода парообразная); эта цифра на
64,4 б. кал, или 4%, менее величины, полученной из теоретического урав-
нения разложения. Эта разница, на чем мы позднее остановимся подробнее,
Рис. 67. Калориметрическая
бомба для взрывчатых веществ
из высококачественной хромо-
никелевой стали для очень
больших плотностей заряжа-
ния. по Ю. Петерсу.
еще больше у пентаэритриттетра-
ии т р а т а, имеющего недостаточный кис-
лородный баланс, и составляет — 126 б. кал,
или почти 8% от теоретически вычисленной
теплоты взрыва.
Для взрывчатых веществ,, содержа-
щих еще меньше кислорода,
как например тетрила или тринитро-
толуола, которые разлагаются с вы-
делением углерода и для которых
помимо этого имеет значение плот-
ность заряжания, вычисление пред-
ставляет, как уже указано на стр. 122,
большие затруднения. Значения, най-
денные согласно теоретическому ура-
внению разложения и анализу про-
дуктов взрыва, расходятся очень зна-
чительно.
Определение теплоты
взрыва в калориметре
Основным прибором является ка-
лориметрическая бомба — продолго-
ватый цилиндрический толстостен-
ный сосуд из хромоникелевой или
нержавеющей (V2A) стали, закрывае-
мый нарезной шайбой. Последняя
имеет отверстие для изолированного
стержня, который служит для воспла-
менения заряда. Вторым полюсом
для соединения с воспламенительной машинкой служит сама го-
ловка. Для взятия газовой пробы и для откачивания бомбы
III. Развитие явления взрыва
133
служит боковой вентиль. Изображенная на рис. 67 модель имеет
объем 40 см3 и рассчитана на 3000 at давления.
Навеска взрывчатого вещества (10 г} помещается в бомбу, оба по-
люса электрического искрового запала присоединяются к головке н сталь-
ному штифту, бомба основательно эвакуируется и погружается в кало-
риметр. Последний представляет никелевый сосуд, который должен быть
такой величины, чтобы вода покрывала всю бомбу; количество воды (взве-
шенное с точностью до 1 г) при этом рассчитывается так, чтобы, тем-
пература при проведении опыта не поднималась более чем на 1°. Бомба
устанавливается в никелевом сосуде на эбонитовом треножнике. С целью
лучшей тепловой изоляции калориметр ставят в небольшой дубовый ящик.
Изменение температуры воды в продолжение опыта измеряется тер-
мометром Бекмана с точностью до 0,001°. Отсчеты производят с рас-
стояния 2—3 .г посредством подзорной трубы. Чтобы избегнуть задержки
в движении ртутного столбика, термометр непрерывно встряхивается эле-
ктрическим молоточком. Для достижения равномерной отдачи теплоты
бомбой и равномерного поглощения теплоты вода размешивается электри-
ческой мешалкой.
Вся система на случай взрыва ограждена броневыми щитами. Наблю-
датель находится за стеной и отсчитывает оттуда температуры через под-
зорную трубу.
Отсюда же наблюдатель приводит в действие все вспомогательные
аппараты, как то: искровую машиику, сопротивление, включение запала, вы-
ключатель для колотушки и рабочей мешалки, проверку электропроводки
и хронометр.
В то время как Б и х е л ь употреблял калориметрическую
бомбу объемом 30 л и заряд 100 <г взрывчатого вещества, вслед-
ствие чего плотность заряжания не превосходила 0,02, в настоя-
щее время стремятся приблизить испытание к условиям, имеющим
место в шпуре, и пользуются конструкциями, при которых испы-
тание возможно при еще более высоких плотностях заряжания.
По указанным соображениям калориметр не употребляется в на-
стоящее время для определения теплоты взрыва и температуры
взрыва так часто, как раньше. Между тем калориметры все еще
остаются основными аппаратами для надежного определения
теплоты полного горения военных бездымных порохов; помимо
этого чаще всего производят ещ£ определение удельного объ-
ема газов.
Анализ газообразных продуктов, образую-
щихся в стальной камере, после взрыва в за-
ключенном в ней свинцовом цилиндре
Это приспособление, как уже указывалось, имеет целью иссле-
дование газообразных продуктов взрыва в условиях, по воз-
можности близких к условиям в шпуре, с производством боль-
шой работы и с быстрым охлаждением для закрепления наивыс-
шего равновесия, что дает возможность избегнуть последующих,
затемняющих результат и приводящих к ошибкам реакций. Бла-
годаря этому на основании анализа продуктов путем теоретиче-
ского подсчета можно очень точно определить теплоту и темпе-
134 Основные понятия из теории взрывчатых веществ
ратуру взрыва. Конструкция аппарата была предложена К а-
с т о м и построена в Химико-техническом институте.
Стальной камерой служит цилиндрический сосуд диаметром 20 см; на-
винчиваемой крышкой он герметически закрывается. Крышка и камера
имеют вентиль, посредством которого внутреннее пространство камеры свя-
зано с воздушным насосом и ртутным манометром. Свинцовые цилиндры
имеют диаметр 140 мм, высоту 300 мм и глубину канала 200 мм; в них
помещают 10 г взрывчатого вещества в форме шашки диаметром 21 мм.
Свинцовые цилиндры прочно закрепляются в стальной камере железными
болтами. После введения заряда с капсюлем и воспламенителем канал
возможно плотнее забивается сухим песком и свинцовой шайбой. Затем
прибор эвакуируется, и посредством электрического запала производится
взрыв. После выравнивания температуры содержимого бомбы с окружающей
средой отмечают давление и температуру и берут на анализ продукты
взрыва. Как видно из параллельных определений, точность аппаратуры до-
статочна для определения отдельных составных частей продуктов, что
позволяет производить по ним дальнейшие вычисления. К сожалению,
весьма важная в термохимическом отношении вода при этом методе не
поддается непосредственному определению.
5. Температура взрыва
Под температурой взрыва или детонации подразумевают наи-
высшую температуру, до которой теплотою химического превра-
щения могут нагреваться газообразные продукты взрывчатого
разложения. При этом взрывчатое горение рассматривается как
вполне адиабатический процесс, при котором не произ-
водится внешней работы и не происходит потери теплоты. Зна-
ние температуры взрыва имеет большое значение с различных
точек зрения: от нее зависят действительная работоспособность
взрывчатой системы, выгорание канала орудия, производимое
порохами, и не в последнюю очередь — антигризутность горных
взрывчатых веществ. В течение какого промежутка времени до-
стигается наивысшая температура — непосредственно ли после
распада первых твердых молекул взрывчатого вещества, т. е.
еще до наступления собственно расширения, или мгновением
позже, на отрезке пути к достижению наибольшего объема, —
решить нельзя, так как мы не можем установить темпа этих по-
следовательных явлений ни измерением, ни кинематографическим
путем. Поэтому нет ничего удивительного, что каждый из суще-
ствующих трех методов определения температуры взрыва имеет
некоторые недостатки и дает только теоретические цифры.
Расчеты по этим методам основаны:
1)на количестве т е п л'о т ы и на теплоемкости
продуктов разложения;
2) на максимальном давлении газообразных про-
дуктов в бомбе при определенных плотностях заряжения и
3)на кинетической теории газов (этот метод в ос-
новном представляет собой лишь изменение второго).
III. Развитие явления взрыва
135
Вычисление температуры взрыва
Самым общеупотребительным и наиболее приближенным
является первый метод, согласно которому температура взрыва t
равна частному от деления количества выделившейся при
взрыве теплоты Она сумму теплоем-
костей С отдельных газообразных продук-
тов взрыва:
^4
Теплота взрывчатого разложения определя-
ется или вычислением по стехиометрическому,
уравнению разложения, или экспериментэдь-
ньим путем в калориметрической бомбе, или
лучше всего путем анализа газообразных про-
дуктов после взрыва в свинцовом цилиндре.
Следовательно необходимо только полу-
чить величину С, т. е. общую теплоемкость га-
зообразных продуктов, и вычислить неизвест-
ную температуру из чрезвычайно простого
уравнения. Однако как раз в этом и заклю-
чаются трудности, ибо теплоемкости
представляют собою функцию темп ер а ту-
р ы и при высоких температурах весьма трудно
поддаются определению.
Для того чтобы повысить температуру одинаковых
количеств разных веществ на одно и то же число
градусов, требуется различное количество теплоты о;
способность поглощать различные количества теплоты
измеряется удельными теплотами или теплоемкостями
с. Теплоемкость есть количество теплоты в кало-
риях, необходимое для нагревания 1 г вещества на 1°;
произведение теплоемкости на атомный или молекуляр-
ный вес дает атомную или молекулярную
теплоемкость соответствующего элемента или ве-
щества. За среднюю теплоемкость (сот) веще-
ства в пределах двух температур принимают частное
от деления количества теплоты q, которое необходимо
для нагревания вещества от одной температуры до
другой, на разность температур t—to:
Рис. 68. Пламя и
раскаленные же-
лезные осколки,
получившиеся от
взрыва 7'2 пентри-
нпта 50/50 в желез-
ном тигле на 12-дьи
железной пластин-
ке (снимок сделан
сверху и под углом
около 45° и о ч е н ь
сильно пере-
держан, так что
видны только наи-
более раскаленные
части). В центре
виднапластинка,на
которой произво-
дился взрыв, а по
ее краям круги от
расширявшихся га-
зообразных про-
дуктов; над ними—
пламя, имеющее
температуру 4300°
и высоту 30 см. Из
бесчисленного мно-
жества осколков
тигля видны только
те, которые осо-
бенно раскалены.
= д
f — to ’
Для углерода, который при взрывах многих взрывчатых веществ вы*
деляется в виде сажи и который подобно газам влияет на температуру
136 Основные понятия из теории взрывчатых веществ
взрыва, были найдены следующие величины:
Температура Тепло- емкость Атомная тепло- емкость
Графит — 244° 0,005 0,06
— 50° 0,114 1,37
138° 0,254 3,05
я 977° 0,461 5,60
Подобные же соотношения имеют место и для газов, но в этом случае
повышение теплоемкости возрастает вместе с величиной молекулы. Напри-
мер теплоемкости двухатомных газов {СО, Нг) увеличиваются одинаково,
теплоемкости же воды и углекислоты возрастают несколько быстрее. Эмпи-
рически найденные теплоемкости выражаются не точно линейной функцией.
Чтобы упростить вычисление, Малляр и Л е-Ш ателье впервые пред-
ложили формулу для молекулярной теплоемкости газов при
постоянном объеме, согласно которой с выражается через а + b • t. Кон-
станты о и Ь впоследствии ие раз 'пересчитывались и заново определялись
различными авторами; по Касту1 в настоящее время наиболее вероят-
ными приближенными величинами для интервала температур 2000—4000J
считаются следующие:
а b
Двухатомные газы СО, N2, Н3, О2, NO (постоянные) .... 4,8 0,00045 t
Н2О (парообразн.)...............•......................... 4,0 0,00215 • t
СО2..................................................... 9,0 0,00058 -t
Четырехатомные газы: NH3, (CN)2, ................. 10,0 0,00045-/
Пятиатомные газы СН4 .................................... 12,0 0,00045-/
В последнее время Мю pay р произвел экстраполяцию для указанных
высших пределов в 2500—4000°, воспользовавшись средними значениями
теплоемкостей при постоянном объеме, определенными Нерестом и
В о л е м 2 3 в 1929 г., н получил значения, которые довольно хорошо согла-
суются с данными Каста. Для одного только водяного пара числа по-
лучились ниже, именно 9,7 вместо 12,6 при 4000° у Каста. Для интервала
2000—4000° кривые роста представляют собою почти прямую линию. Для
двухатомных газов следовало бы еще указать, что значения для Ог, СО
и Ns довольно близки между собой н в интервале 3700—3800° пересекаются,
а кривая Нг приблизительно параллельна, но все точки ее лежат ниже *.
По этим величинам Нернста н Воля Мюраур вычислил максимальное
давление и температуру горения различных порохов, и оказалось, что най-
денные им данные довольно удовлетворительно согласуются с величинами,
найденными экспериментально в бомбе (ср. стр. 145).
Достоверных данных о влиянии высоких давлений взрыва на теплоем-
кость пока нет; все же можно предполагать, что высокие давления по-
добно высокой температуре увеличивают теплоемкость.
•Schmidt, Beitrage zur thermodyn. Behandlung explosibler Vorgange,
Z. f. Schiess- u. Sprw., 1929, 42.
2 Z. f. techn. Physik, 10, 608 (1929).
3 Об оригинальном методе взрыва для определения теплоемкости газов
при высоких температурах, см. В. Lewi s, Journ. Am. Cihem. Soc., 1931,
4227—4228.
И1. Развитие явления взрыва 137
Если вместо с подставить линейную функцию а + Ь •#, то
расчетная формула для определения температуры взрыва
примет следующий вид:
a-\-bt
или
ЬР —at — Q = 0.
Решая уравнение, получаем:
— /а24-46- Q
2Ь
Q необходимо умножить на 1000, так как теплоемкости отно-
сятся к грамм-молекулам, а-калории даны для грамма.
Ниже приведены два примера вычисления температуры
взрыва по формуле и приближенному способу,
рекомендованному М ю р а у р о м.
Температура взрыва гремучего студня
По приведенному на стр. 131 уравнению разложения и теплоте
взрыва 1610 б. кал/кг (вода парообразная) при постоянном давле-
нии после подстановки в формулу необходимых величин полу-
чаем 177 + 143 + 81 = 401 моля, которые соответствуют 12,633 кг
гремучего студня. Соответствующая теплота взрыва составляет
25257,4 — 389 • 12,633 = 20343,2 б. кал. Теплоемкость смеси
газов определяется путем умножения вышеуказанных темпера-
турных коэфициентов на число молей и сложения полученных
цифр:
а = 177 - 9 4-143 - 4 4-81-4,8 = 2553,8
b = 177 • 0,00058 4- 143 • 0,00215 4- 81 • 0,00045 = 0,44656
. — 2553,8± /2553,824-4 - 0,44656 • 20343,2 • 1000 ,
/ = .2-0Л4656-----------------= 4471 •
По приближенному или, точнее, упрощенному
способу, принимая температуру (вычисленную по формуле) рав-
ной 4400°, получаем 1М1О!лекулярные теплоемкости:
СО2 177-(9,OO -f-0,00058-4400) = 2044,3
Н2О 143 • (4,00 4- 0,00215 • 4400) = 1924,8 Q = 20343,2 б. кал
N2 81-(4,8 4-0,00045 - 4400)= 549,2
4518,3 м. кал
' = °4502°
ЕС 4518,3 м.кал.
138 Основные понятия из теории взрывчатых веществ
/=4450-,2034^,-og-4479°;
4541,9
таким образом
(= 4450±44ГО=4465о
Если вычислить температуру взрыва по указанному на
стр. 131—132 анализу продуктов и по найденной там теплоте
взрыва 1546,6 б. кал/кг, то t будет несколько меньше:
—197,48 + ^Т97Л8ЯГ4Тб^34700Л545^-. TOGO _
2 • 0,034700 — 4409 ‘
Но и это значение постольку еще не вполне соответствует
действительности, поскольку не принимается во внимание хотя
и небольшая, но все же имеющая место диссоциация углекислоты.
Во всяком случае температура взрыва гремучего студня выше
4000°. Если даже допустить, что знание теплоемкостей и степени
диссоциации не вполне точно и что, несмотря на чрезвычайно
быстрое охлаждение продуктов взрыва, в последующем происхо-
дит смещение равновесия, сказывающееся на температуре, то все
же температура 4000° вероятна, и все прежние вычисления, да-
вавшие для гремучего студня и нитроглицерина температуру
3200—3100°, следует отвергнуть.
Особенно высока температура взрыва чистых о к си-
лик в и т о в, так как в этих смесях отсутствует азот, являю-
щийся элементом, разбавляющим и отнимающим те-
плоту. Для стехисиметрически точной смеси из 27,28% сажи и
72,72% жидкого кислорода получим:
С 4* О.2 = СО2 + 966. кал — 3,0 б. кал (теплота испарения
. кислорода)
12 г 32 г 44 г
1000 г —* 2114 б. кал,
Приняв f = 7080°
Q _ 1 (96 — 3,0) • 1 000 93 000 _
С 1 • (9,00 4- 0,00058 • 7080) 13,106 ’
Теоретическая температура взрыва оксиликвита дости-
гает согласно этому 7090° — цифры, которая, учитывая значи-
тельную диссоциацию углекислоты при этой исключительно вы-
сокой температуре, несомненно является слишком высокой;
ближе к действительности будет цифра около 6000°.
Кроме того наиболее сильный оксиликвит с карбе-
ном дает наивысшую температуру взрыва, именно 9460°;
между тем для стехиометрической смеси тетранитроме-
III. Развитие явления взрыва
139
тан-толу о л тоже получается необычайная температура:
7350°. В последнем случае потери на диссоциацию сравнительно
малы, так как здесь образуется много воды и азота; но так как
одновременно с установлением равновесия водяного газа про-
исходит реакция окисления азота с поглощением тепла, то тем-
пература все же должна быть лишь немного выше 6000°.
То обстоятельство, что температуры взрыва оксиликвитных
смесей значительно выше, чем температуры взрыва лучших азот-
Рис. 69. Пламя и раскаленные железные осколки,
получившиеся от взрыва 45 г смеси тетраиитро-
ме тан-толу о л (100:15,66) в двух железных тиглях,
вставленных одни в другой, на 8 -м.и железной плитке
л(ср. рис. 10). Снимок сделан сбоку, в горизонтальной
плоскости, выдержка нормальная; дальность разлета
светящихся осколков 6—7 мм (i см на снимке = 75 см).
Изображенный на рисунке снимок, сделанный сбоку, на
котором „газы взрыва” растянуты, является менее ха-
рактерным, чем снимки, сделанные сверху с большего
или меньшего расстояния, как например рис. 9 и 68.
содержащих взрывчатых веществ, как например нитрогликоля,
следует из более значительной силы света пламени взрыва —
различие, которое наблюдается также при детонации смеси те-
транитрометан-толуол и известно уже давно для панкластитов,
содержащих жидкую двуокись азота. Если бы сила действия
света на фотографическую пластинку возрастала с повышением
температуры взрыва по определенному закону, то степень зачер-
нения очень малочувствительных пластинок при самом сильном
диафрагмировании могла бы вероятно иметь значение для срав-
нительной оценки температуры взрыва.
140 Основные понятия из теории взрывчатых веществ
Вычисление температуры взрыва пентаэри-
триттетранитрата
производится:
1. По теоретическому уравнению разложения.
2. По теоретическому уравнению разложения, выведенному
с учетом равновесия диссоциации углекислоты и водяного пара
при температуре около 4000°.
3. На основе анализа газообразных продуктов,
после взрыва в свинцовом цилиндре с выделением работы и по-
следующего анализа газообразных продуктов из стальной бомбы,,
в которой находился цилиндр.
1. С (CH2NO3)4 = ЗСО« -Ь 2СО + 4Н2О -f- 2Na.
316,1 г
Теплота взрывчатого разложения равна 3 96,0 + 0-28,3 +
+ 4 • 57,8 = 575,8 б. кал на моль. Это количество теплоты в пересчете на
1 кг составляет 1822 б. кал-, от него, отняв теплоту образования пентаэри-
триттетранитрата, равную 296 б. кал/кг, 'получим теплоту взрыва
1526 б. кал/кг пентрита при воде парообразной и постоянном давлении.
Температура взрыва. Принимая <— 4200°, вычисляем, как уже
было показано иа стр. 137, сумму теплоемкостей газообразных продуктов
взрыва при этой температуре:
СО2 ......... 34,32 0 1 1 000
П2О............52,12 на килограмм = = 4261°
COjNj......... 26,76 ~с
113,20 на моль
Повторив вычисление с подстановкой температуры 4260°, получим I =
= 4234°; отсюда температура взрыва получается как среднее арифмети-
ческое
426Ц-4234 =Ш8О
2. 1 кг нитропентаэритрита, содержащего 15,82 атомов С, 25,51 атомов Н,.
37,96 атомов О и 12,66 атомов N, дает газообразных продуктов в молях:
9,02 СО2 + 6,80 СО + 12,44 Н2О + 0,22 Н, -f- 0,35 О2 + 6,33 N2.
Отсюда получается теплота взрыва Q:
9,02-96 4-6,80-28,3 4-12,44 • 57,8 = 1777 б. кал — 296 б. кал = 1481 б. кал.
Если принять температуру взрыва равной 4200°, то теплоемкости при
этой температуре будут равны1.
Для двухатомных газов (6,80 4~ 0,22 + 0,35 + 6,33) (4,8 4- 0,00045 • 4200) = 91,65
СО2: 9,02 (9,00 4- 0,00058 • 4200) = 103,19
Н2О : 12,44 (4,00 4~ 0,00215 • 4200) = 162,09
Q
2с
1481 •1000
356,93
= 4150°.
356,93
При подстановке t — 415O2 3 получаем:
Q
2с
1481 • 1000
352,53
= 4202°.
1П. Развитие явления взрыва
141
Следовательно искомая температура взрыва будет находиться между
4150 и 4200°, т. е. составит 4175°.
3. 1 кг пентрита при полном взрыве в свинцовом цилиндре при плот-
нести заряжания 1,54 дает (по табл. 6) 798 л газообразных продуктов сле-
дующего состава (в молях)
9,34 СО» + 6,44 СО 4- 11,05 Н2О 4- 1,53 Н, 4- 1,0 NO 4- 0,40 Os 4- 5,82 N2.
Так как вычисление температуры взрыва, основывающееся на анализе
газообразных продуктов взрыва, является в настоящее время самым на-
дежным, мы приведем детальный пример расчета по этому методу.
Теплота взрыва:
СО, 9,34-
СО 6,44 -
Н2О 11,05-
96,0 = 896,44 б. кал
28,3 = 182,25 „ „
57,8 = 638,69 , ,
NO 1,0 -21,6 = —21,6
1695,98 б. кал — 296 б. кал = 1400 б. кал
при постоянном давлении и воде парообразной.
Температура взрыва. Сумма теплоемкостей всех молей газов при
4— 4000° равна:
СО 4- Оа 4- Н2 4- N2 4- NO : 15,29 (4,80 4- 0,00045 • 4000) = 100,91
СО2 : 9,34 (9,00 4-0,00058 - 4000) = 105,73
Н2О : 11,05 (4,00 4- 0,00215 4000) = 139,23
2с = 345,87
345,87
Подставляя 4050°:
Эта температура 4038° невидимому ближе всего к действи-
тельности. Оба предыдущих вычисления показывают, что при
пользовании чисто стехиометрическим уравнением разложения
получаются слишком высокие значения и что даже, если принять
во внимание реакцию равновесия водяного газа, получаемые
числа все же будут слишком высоки.
Другой способ определения теплоты и температуры взрыва,
основанный одновременно на опыте и теории, был недавно при-
менем Фридерихом и Брюном1 2 для пентаэритриттетра-
нитрата и дипентаэритритгексанитрата.
Сначала в калориметрической бомбе определяется теплота взрыва,
как произведение количества воды и повышения температуры. Как среднее
1 Н a i d u. Schmidt, Experimentelle Untersuchungen fiber den detona-
tiven Zerfall von Sprengstoffen, Z. f. Schiess- u. Sprw., 1931, 297.
2 Там же, 1932, 127 и 157.
142 Основные понятия из теории взрывчатых веществ
из трех определений для пентрита было найдено 1400 б. калИсг (вода паро-
образная). Анализ газообразных продуктов из бомбы дал следующие цифры:
Весовые проценты Молей на 1 кг Состав в пересчете на тем- тературу взрыва К = 6
со2 со н2 Н2о N2 43,1 17,2 0,6 21,4 17,7 9,80 = А 6,16 = С 2,80 = В 11,88 = 0 6,33 9,80—1,03 = 8,77 моля 6,164- 1,03= 7,19 , 2,80—1,03= 1,77 „ 11,88 4- 1,03 = 12,91 , 6,33 „ 36,97 моля X X 22,41 л = 828,5 л газов на 1 кг
Так как взрыв в бомбе все же происходит без выделения работы и
равновесие в охлажденном состоянии не соответствует таковому при тем-
пературе взрыва, то из уравнения для водяного газа, приняв константу
равновесия К = 6 (для предполагаемой температуры детонации), определяем
величину х:
(С 4-х)
(Л-х)
Эта величина является поправкой для ранее вычисленных (на основании ана-
лиза газообразных продуктов) значений состава в момент взрыва. По теплоте
взрыва, равной 1400 б. кал, я вычисленному составу продуктов для наи-
высшей температуры получают наконец после подстановки средних моле-
кулярных теплоемкостей и решения уравнения взрыва температуру t = 3920°,
которая довольно хорошо согласуется с дававшейся ранее цифрой 4038°.
Вышеописанный способ вследствие пользования произвольной
константой К и обусловливаемого этим гипотетического состава
газообразных продуктов заключает в себе некоторую неопреде-
ленность; эта неопределенность исключена в методе, предложен-
ном Государственным химико-техническим институтом в Бер-
лине. Поэтому определение теплоты и температуры взрыва, про-
изводимое на основании взрыва с выделением работы,
можно считать в настоящее время наиболее совершенным.
Определение температуры взрыва по макси-
мальному давлению в бомбе при определен-
ной плотности заряжания и по удельному
объему.
Поясним на примере пользование этим вторым эксперимен-
тальным способом вычислений, находящим общее применение
для бездымных порохов и до тонкости усовершенствованным
французами, особенно Мюрауром.
а) Измерение давления газообразных продук-
тов взрыва в бомбе. Среди разнообразных, иногда слож-
1П. Развитие явления взрыва
143
ных приборов для определения давлений до 4000 кг/см2 следует
кратко упомянуть о крешерном приборе Нобля. Давление га-
зообразных продуктов действует на расположенный в стенках
опытной бомбы легкоподвижный поршень, который в свою оче-
редь деформирует (обжимает) медный цилиндрик высотою 13 мм
и диаметром 8 мм. Поршень, сжимая медный цилиндрик,
действует на упорный винт; перемещение поршня и вместе с тем
деформирование мягкого крешерного цилиндра отмечается пе-
ром на покрытом сажей барабане, имеющем определенную ско-
рость вращения; таким образом определяется время нарастания
давления до максимального. Медные крешерные цилиндрики
должны быть, само собой разумеется, предварительно прокали-
брованы для сравнения с теми обжатиями, которые получатся
в бомбе. Это производится или статически на рычажном прессе,
или динамически — посредством тяжелой бабки, или, также чисто
динамически, по методу «Piston libre», описанному в 1923 г.
Б ю р л о и устраняющему источники ошибок обоих предыду-
щих методов. По таражным таблицам или диаграммам
для каждого обжатия медного цилиндрика или величине орди-
наты, зачерченной регистрирующим пером, можно определить
соответствующее давление в бомбе.
Вместо медных цилиндриков часто употребляются сталь-
ные пружинки, увеличение изгиба которых определяется
оптическим путем. Например „при сгорании 1010 г нитроглицери-
нового пороха в. крупповской бомбе емкостью 3,45 г
при плотности заряжания, равной 0,2925, получились следующие
величины.
Калибровка пружинки: изгиб 0—4000 кг — в среднем на 1000 кг/cjf
25,2 единицы.
Скорость вращения барабана 10 м/сек. Абсцисса: 1 см — 0,001 сек.
Абсцисса (см) 1 5 10 20 30 32 35 (макси- мум) 101,3 4020 через 0,035 сек.
Ордината (мм) .... Давление (кг/см2) . . . 0,52 21 2,80 111 7,5 298 22,7 901 69,4 2754 38,75 3520
Эти определенные практическим путем величины давлений при постоян-
ном объеме, так же как и вычисленные на основании их температуры
взрыва, несколько низки, так как не принято во внимание охлаждение
на внутренних стенках бомбы. Однако для большинства целей важно
знать возможное для каждой плотности заряжания какого-нибудь пороха
давление, которое не зависело бы от постоянно меняющегося отношения:
поверхность охлаждения „
-----— —-------Это будет давление с поправкой, т. е. такое
оцрлД llUjjUAa
давление, которое получалось бы в бомбе, если бы не имело место по-
нижение температуры, вызываемое холодными стенками. Это идеальное
Давление очень легко получить простым, можно сказать, хитроумным,
косвенным путем: изменяют внутреннюю поверхность бомбы посредством
144 Основные понятия из теории взрывчатых веществ
вкладышей и для каждого опыта употребляют всегда столько пороха,
чтобы плотность заряжания оставалась постоянной. Если затем нанести
на абсциссе величины уже указанного отношения:
поверхность охлаждения___ S
заряд пороха G ’
а в качестве ординат соответствующие давления и соединить получен-
ные таким образом точки прямыми, которые продолжены до пересе-
чения с осями ординат, то путем экстраполяции получается исправленное
давление для= 0. Например Мюраур определил для бездымного
пороха, выделяющего 794,2 6. кал!кг при всех четырех опытах с постоян-
ной плотностью заряжания А = 0,2029, давления:
Пороховой заряд (В г) Отношение и Давление (кг/см2)
29,476 6,92 (бомба без вкладышей) 2398
24,115 17,29 (бомба со стальным вкладышем) . 2080
22,460 21,05 ( , „ стальной спиралью) . . 1911
19,631 26,92 ( „ „ спиралью и 8 сталь- ными шариками) 1755
Давление, полученное экстраполяцией для поверхности О, с поправкой
равно 29,476 г и 2633 кг/см?.
Давления с поправкой, найденные при различных плотностях заряжа-
ния, приводят к согласующимся температурам взрыва и
показывают, что понижение давления пропорционально поверхности и что
наивысшая температура не зависит от плотности заряжания. Лишь при
малых плотностях заряжания с давлениями ниже 1000 кг/см2 исправленные
давления и получаемые отсюда температуры взрыва слишком низки, ве-
роятно потому, что в данном случае не происходит полного химического
превращения (и даже при максимальном давлении все еще остается не-
изменная двуокись азота).
По уравнению Эбля абсолютная температура взрыва равна:
Т ( = t + 273) = P1' У° ~ . 273 = • -~-gA . 273,
pov-L ро v0- Д
где р —атмосферное давление,
Р1— измеренное максимальное давление пороховых газов в бомбочке
в тех же единицах,
L— пороховой заряд в кг,
Vo— объем пустой бомбы,
— удельный объем (л/кг),
а — коволюм (л/кг).
£
Если подставить для ту плотность заряжания Д , то формула упро-
щается, как уже указано выше.
Для нитроглицеринового пороха, состоящего из 48% ни-
троглицерина и 52% нитроклетчатки (12,2% N) и имеющего теплоту взрыва
42=1169 б. кал при плотности заряжания Д =0,2029, по методу давления
III. Развитие явления взрыва
145
было экспериментальным путем найдено v0 = 812 л/кг и pi = 2885 кг/см?
(с поправкой):
2885
1 • 1,0333
1 -0,812-0,2029
812 0,2029
• 273 = 3864° абс, или / = 3591°.
Принимая во внимание частичную диссоциацию, в результате чего объем
= 817 л1кг, получим Т = 3836°, или t = 3563°.
Если бы вместо исправленного давления подставить в последнее урав-
нение давление, экспериментально найденное в бомбе, то температура
взрыва получилась бы более низкой: Т = 3676°, или t = 3403°.
М ю р а у р, сопоставляя ^температуру взрыва, вычисленную
по давлению с введенной поправкой Т —3864° (—3836°, прини-
мая во внимание диссоциацию), и температуру, вычисленную из
теплоемкостей газов, нашел, что результаты довольно хорошо
совпадают, а именно:
Нернст и Воль Пир и Бьеррум Кроу и Гримшоу
3910° (3845°) 3714° ‘ 3830°
Эти числа доказывают также правильность первоначального
тм
предположения С а р р о, что коволюм равен примерно Jqqq* по
крайней мере для практически измеримых давлений до 6000 кг/смг.
Непосредственное измерение температуры взрыва предста-
вляется еще на долгое время невозможным. Все же можно экспе-
риментально установить известные максимальные или минималь-
ные границы, что уже проводил несколько десятков лет назад
Нобль. Он взрывал в чрезвычайно прочной бомбе при плот-
ности заряжания 0,28 по 3 кг пироксилина и 3 кг кордита. В пер-
вом заряде находился небольшой пакет с металлом осмием
(темп. пл. 2500°), во втором — электрически осажденный углерод.
После взрыва можно было в первом случае установить присут-
ствие парообразного осмия, во втором — образование алмаза.
Нобль заключил из этого, что температура взрыва пирокси-
лина достигает 3000°; температуру горения кордита на основа-
нии превращения неплавящегося углерода в алмаз (сублимация
около 3500° ?) Крукс определяет равной более 4000°.
Чтобы проверить абсолютную точность полученной различ-
ными способами температуры взрыва, М ю р а у р 1 применил
не менее оригинальный способ. Он пользовался аммиачносели-
тренной смесью с 7% тротила, которая в зависимости от условий
опыта имела температуру взрыва то выше, то ниже температуры
плавления платины (1771°). При опыте в бомбе происходило как
раз плавление тонкой платиновой проволочки, вследствие чего
примененный Мюрауром метод, при помощи которого была
установлена температура 1803°, указывает на ошибочность дан-
ных, полученных при других методах вычисления. В дальнейшем
этим же путем удалось'провести точное сравнение между темпе-
1 Bull, de la Soc. chim. de France, 1925, 390.
10 Зак. 3171. — Штетбахер.
Характеристики важнейших взрывчатых веществ
ТАБЛИЦА 9
Взрывчатое вещество (определенное химическое соединение или смесь) Плотность заряжания Д Удельный объем »0 при 0°/760 мм Теплота взрыва Q- (Н2О паро- образная) (б. кал/кг) Температура взрыва t° Скорость детонации to (м/сек) Величина бризант- ности (в млн.) 1,0333 • »0 - а - Т • Д • b
106
Тетранитрометан-толуол (86,5/13,5)1. 1,45 659 1702 7350 (6400) — 9000 212
Жидкая двуокись азота-нитробен- зол (70/30)1 1,38 619 1629 5230(4800) — 8500 139
Оксиликвит (27,3% С -|- 72,7% Оа) 1. 0,8 509 2114 7090 (6200) 4700 45
„ (24,8% карбена 4-75,2% О2) 1,06 631 2266 9400 (7500) 5600 ИЗ
Гремучий студень (92/8)1 1,63 711 1610 4460 7500 148
Нитроизобутилглицеринтринитрат 1 . 1,68 705 15972 4510 — 8000 168
Гликольдинитрат! . 1,50 737 1655 2 4430 8000 158
Нитроглицерин! 1,60 716 14852 4250 7400 145
Маниит-гексанитрат 1,7 694 14543 4300 8260 174
Нитроглицериновый порох (48 НГ 52 НЦ) 1,6 812 1170 3570 3000 55
Желатиндинамит 65%-ный . . 1,6 630 1295 3700 6100 112
Пироксилин (13,5% N) 1,3 765 1050 3150 6800 77
Циклометилеи-тринитрамин . . . . 1.7 908 15002 3700 8380 188
Пентаэритрит-тетранитрат 1,7 780 15262 4248 f 8600 193
Пентринит 80 ^Ц^0,5 1,72 770 1480 4120 8400 178
Дипеитаэритрит-гексанитрат . . . . 1,63 903 1092 3240 J 7400 148
Тринитрофенилметилнитрамин . . . 1,65 710 1090 3370 7250 116
Гексаиитродифениламин 1,67 675 1035 3450 7150 111
g Пикриновая кислота 1,69 675 1000 3230 7250 107
Тринитробензол 1,63 670 1065 3540 7000 105
Динитробензол • 1,50 670 870 2500 6100 64
Тринитротолуол 1,59 t 690 1000 2800 6800 86
Дымный порох 1,2 280 665 2380 400 1,4
Нитрат аммония 1,1 980 3502 1230 2500 13
Перхлорат аммония 1,2 763 3122 1410 3000 17
Хлоратное взрывчатое вещество (шеддит) 1,3 335 1185 4500 3000 24
Аммиачноселитренное взрывчатое вещество (доварит) 1.1 900 930 2620 4000 51
Тринитрорезорцииат свинца .... 2,9 440 368 2730 5200 75
Гремучая ртуть • .... 4,2 315 368 4450 5400 128
Азид свинпа 4,6 310 260 3450 5300 107
Циаиуртриазид 1,54 660 1140 3950 7500 122
1 Характеристики этих взрывчатых веществ и смесей были заново вычислены автором. Температуры
взрыва, помещенные в скобках, невидимому ближе к действительности и положены в основу, расчета величин
бризантности. Величины, касающиеся остальных взрывчатых веществ, заимствованы у различных авторов, чаще всего
у К а ст а.
2 Указанные здесь теплоты взрыва при сравнении их друг с другом и с величинами расширения в бомбе пред-
ставляются мало вероятными. Ошибки зависят от теплот образования, точность которых (ср. табл. 8) почти
во всех случаях оставляет желать большего. Указываемая в литературе величина теплоты взрыва циклотриметилеитри-
нитрамииа определенно слишком низка, почему в этой таблице она и была увеличена до 1500. С другой стороны, цифра
1526 для нитропентаэритрита слишком велика по сравнению с нитроглицерином, или, наоборот, приведенная здесь теп-
лота взрыва нитроглицерина сравнительно слишком низка.
146 Основные понятия из теории взрывчатых веществ ш развитие явления взрыва
148 Основные понятия из теории взрывчатых веществ
ратурами взрыва, полученными из теплоемкостей и из давления,
определенного в бомбе. Сопоставление показывает, что указан-
ные Кастом величины теплоемкостей приближаются к дей-
ствительности, ибо по давлению, полученному в бомбе Б ю р л о,
для гремучего студня вычислена температура 4469°, между тем
как нами в приведенных выше расчетах найдено 4471, 4465
и 4509°.
Наконец в последнее время Ланжевен и Мюраур по-
лучили также и экспериментальное согласование между давле-
ниями, полученными по методу «Piston libre» Бюрло, и'давле-
ниями, измеренными посредством пьезоэлектрических
кварцевых индикаторов. Пьезоэлектрический способ1
(до 3000 ат) не связан с инерцией; он основывается на напряже-
нии, которое испытывает кварцевый кристалл при сдавливании.
Количество энергии и работоспособность
Газообразные продукты, образующиеся при каждом взрыве,
расширяются под влиянием выделяющейся одновременно те-
плоты и, преодолевая на более или менее значительном пути
«сопротивление», производят работу. Мерилом этой работы
является количество теплоты, которое вообще выде-
ляется каким-либо взрывчатым или метательным веществом, т. е.
то количество теплоты, которое в форме давления газа может
быть превращено в механическое действие. Поэтому, чтобы опре-
делить количество энергии, или работоспособ-
ность, «теоретическую работоспособность» взрывчатого ве-
щества, необходимо умножить его теплоту взрыва, выраженную
в больших калориях, на механический эквивалент тепла;
А — Q • 426,9 кгм.
Но теоретическая работоспособность А так же мало выражает
фактическое взрывчатое действие вещества, как и «характе-
ристическое произведение» Бертл о, полученное
как произведение из количества тепла Q на объем газов v0
(для 1 кг).
Наиболее совершенным способом сравнения является вели-
чина бризантности Каста, так как она учитывает время дето-
нации. Числа вышеприведенной таблицы (стр. 146—147) выве-
дены из теоретических уравнений, и поэтому теплота и особенно
температура взрыва несколько высоки по сравнению с величи-
нами табл. 6, определенными экспериментальным путем. Несмотря
на это, теоретический способ вычисления сохраняет свое значе-
ние, так как сравнение величин возможно только в пределах одного
и того же способа определения, и величины, экспериментально
определенные на основании анализов газообразных продуктов,
получены только для немногих основных взрывчатых веществ.
* Gasdruckmessun’gen mit dem Piezo-Indikator, Z. f. Schiess- u. Sprw., 1932,
76 и 121.
III. Развитие явления взрыва
149
С практической точки зрения величина бризантности, равно
как и работоспособность могут быть рассматриваемы только при
детонации взрывчатых веществ в очень прочных оболочках,
например в центре толстостенного стального шара с завинчен-
ным вводным отверстием. Внутреннее расширение и степень рас-
плавления дали бы возможность сравнить
между собою те различия, которые автор
наблюдал при опытных взрывах гремучего
студня и пентринита в тяжелом стальном
цилиндре малого диаметра. Но для широ-
кой 'практики, когда материал оболочки раз-
рушается, т. е. раздробляется на1 большее
или меньшее число кусков, разбрасываемых
в стороны, сопротивление падает так
быстро, что последующая теплота не нахо-
дит объектов для дальнейшего действия
и большей частью рассеивается в воздухе.
В данном1 случае полезный эффект за-
висит в значительной мере от скорости де-
тонации. Однако даже при самых бла-
гоприятных условиях коэфициент по-
лезного действия взрыва опре-
деляется в 15 и самое большее — в 20%
расчетной работоспособности. Лишь при
взрывах более или менее крупных масс же-
леза к глубокими буровыми скважинами в
них использование силы взрыва достигает
1/з; следовательно предельная эффектив-
ность метательных средств и горючих мате-
риалов в ружейном стволе и двигателе Ди-
зеля достигает одной и той же величины
в 32%.
Для перевода энергии взрывчатых ве-
ществ в распространенные единицы мер при-
водится следующая таблица.
Рис. 70. Разрез мано-
метрической бомбы
В ь е л я (Laboratoire
central des Poudres).
j—упорный винт; 2~кре-
шерный ме дн ый цилиндрик;
3—-поршень; 4—взрывная
камера; 5—-электровоспла-
менение; 6—оптюратор;
7—стальной корпус.
Сводка важнейших эквивалентов энергии
в1 Тепловые единицы кал (15е) Механическ л/ат ие единицы кгм Электриче- ские единицы в атт-се- кунды Абсолют- ные единицы эрги
1 л . ’ • II II II II 1 24,205 2,342 6,324 • 10& 4,131 • 10~2 1 2 9,678 • 10~2 261,3-105 4,269 -10-1 10,333 1 2700-105 4,186 1,0133-102 9,806 2,647 • 10е 4,186-10’ 1,0133-109 9,806-10’ 2,648 • 1013
ГЛАВА ЧЕТВЕРТАЯ
ДЫМНЫЙ (ЧЕРНЫЙ) ПОРОХ
С 1650 г. и до настоящего времени дымный порох с незначи-
тельными отклонениями имеет следующий состав: *
75% калиевой селитры,
15% угля,
10% серы.
До этого периода селитра входила в порох в значительно
меньшем количестве. Состав самой первой, приводимой Мар-
ком Греком смеси требует поразительно близкого к совре-
менному соотношения частей, а именно: 6:2:1*, и, собственно
говоря, непонятно, почему тогдашние пороходелы не пользова-
лись этим соотношением для своих смесей, имевших гораздо
худший состав.
Изменения состава дымного пороха в хронологическом
порядке
Селитра Уголь Сера
Марк Грек (1250 г.) 67 22 11
1250 г. Англия 41,2 29,4 29,4
1338 г. Франция 50 25 25
1595 г. Германия 52,2 26,1 21,7
1650 г. Франция 75,6 13,6 10,8
1781 г. Англия 75 15 10
В настоящее время составы смесей в зависимости от целей
применения также в большей или меньшей степени отличаются
друг от друга.
Отсюда видно, что выбор отдельных составов в большинстве
случаев скорее произволен и не базируется на эмпирической
основе, иначе соотношение отдельных составных частей не
Т. е. 66,66% селитры, 22,22% угля, 11,11% серы. Прим. ред.
Дымный {черный) порох
151
отошло бы так далеко от обычных норм, как это имеет место
в отдельных государствах.
ТАБЛИЦА 10
Состав современного дымного пороха
Селитра Уголь Сера
Военный,охотничий, ору- дийный и минный по- роха - в большинстве стран. . 75 15 10
Орудийный по- рох Кубический Россия (до 1918 г.) . . 75,5 16 8,5
Шашки цилиндрической формы Франция 78 19 3
Бельгия (в 1914 г.) . . 51,8 38,8 9,4
Минный порох германский 65 18 17
итальянский 70 12 18
Минный порох № 3 . . французский 58 18 24
В то время как сера играет более второстепенную роль, ха-
рактер дымного пороха определяется в основном углем. Наряду
с этим характер пороха определяется содержанием селитры, от
которого зависит скорость взрыва: смотря по происхождению
угля и количеству селитры, можно изготовить либо легче вос-
пламеняющийся, более взрывчатый, либо труднее воспламеняю-
щийся порох; первая форма представляет собою охотничий по-
рох, а вторая — военный и в частности орудийный порох. Секрет
фабрикации пороха заключается не столько в химической сто-
роне дела, сколько в механической; пригодность и работо-
способность дымного пороха зависят не только от соотношения
составных частей, но и в весьма значительной степени от их тща-
тельного измельчения и тщательного смешения; не менее важно
также равномерное уплотнение пороха в форме пороховых зерен.
Нет ничего удивительного в том, что опыт столетий способство-
вал усовершенствованию качеств дымного пороха, и современный
процесс его изготовления должен считаться самым продолжи-
тельным по сравнению с теми, какие знает до настоящего вре-
мени взрывная техника. , , ,ч
152
Дымный (черный) порох
1. Исходные материалы
1. Калиевая селитра (азотнокислый калий) KNOs
Из различных встречающихся в природе селитр только калие-
вая пригодна для изготовления пороха, тогда как гигроскопич-
ная натриевая (чилийская) селитра, а также и две другие, сте-
хиометрически даже более пригодные кальциевая и аммонийная
(аммиачная) селитры дают порох балистически неоднородный.
Рис. 71. Мельницы „Бурма“.
Калиевая селитра получается реакцией обменного разложения из на-
триевой (чилийской) селитры или, еще лучше, из чистой, синтетической
натриевой селитры и хлористого калия в горячем насыщенном водном рас-
творе (конверсионная селитра). Продукт первой кристаллизации загрязнен
не только поваренной солью, но и натриевой селитрой, поэтому требуемая
степень чистоты достигается только после однократного или многократного
рафинирования.
В настоящее время селитра требуемой чистоты может быть получена
пороховыми заводами иа рынке. Гигроскопические примеси допускаются
в ией только в виде следов. В Германии например к калиевой селитре
предъявляются следующие требования: влажность не более 0,5%, содержа-
ние хлора до 0,007% н перхлората (сверх ничтожного количества хлората)
до 0,2%; такая селитра считается еще приемлемой *.
1 Ср. Каст и Метц, Химическое исследование взрывчатых и воспла-
менительных веществ, Госхимтехиздат, 1934.
I. Исходные материалы
153
При изготовлении минного пороха к селитре в отношении
ее чистоты предъявляются пониженные требования, так как в дан-
ном случае неприятные последствия влажности имеют меньшее
значение, чем для более чувствительных порохов.
Свойства. Азотнокислый калий представляет собою бес-
цветные, нередко полые кристаллы холодящего остросоленого
вкуса. Удельный вес кристаллов, равный 2,11, обусловливает
относительно высокий удельный вес готового пороха. При на-
гревании до 339° селитра плавится,, превращаясь в подвижную
жидкость, которая около 400° разлагается с выделением кисло-
рода и образованием азотистокислого калия. Растворимость се-
литры с повышением температуры значительно увеличивается:
100 г воды растворяют при 0° всего 13,3 г, при 20° 31,6 г и при
100° — уже 246 г. В спирте и эфире она нерастворима.
Селитру измельчают на специальных, весьма подходящих для
данной цели высокопроизводительных мельницах «Бурма»
(Burma), из которых измельченный материал тотчас же удаляется
и поступает в. желаемое место.
Кроме того для этой цели применяются еще шаровые мель-
ницы (рис. 72) с бронзовыми шарами, существующие с давних
пор. Измельчение в шаровых мельницах продолжается до тех
пор, пока при растирании между пальцами не перестанут ощу-
щаться грубые частицы. Для высших сортов пороха измельчен-
ный сырой материал пропускают через тонкие волосяные сита;
кроме того применяют веялки и получают особенно однородно
измельченный материал, обладающий однако неприятным свой-
ством образовывать комки.
2. Древесный уголь
Для фабрикации пороха требуется древесный уголь, который
должен быть по возможности беззольным и однородным по со-
ставу, легко растираться и прежде всего легко воспламеняться.
Для обыкновенных сортов пороха (минных) применяется древес-
ный уголь любого происхождения. Буковый или сосновый уголь,
содержащий 74—78% углерода, в данном случае вполне приго-
ден.
Для высших сортов пороха выбирают по возможности мяг-
кие породы дерева: ольху и главным образом крушину, ко-
торые в виде ретортного угля применяются для хороших охот-
ничьих порохов. В то время как ранее все сорта угля изготовля-
лись самими пороховыми заводами, теперь чаще всего готовят
только крушинный уголь, а остальные сорта приобретают на
рынке.
Дерево, идущее для фабрикации пороха, после полного осво-
бождения его от коры и колки на поленья толщиной от 20 до
40 мм складывают в кучи и предоставляют действию дождя и
ветра в течение года и дольше. При этом из дерева «выветри-
154
Дымный (черный) порох
вается» значительная часть нецеллюлозных примесей, и в таком
виде древесина поступает на обжиг. Чем свежее дерево, т. е. чем
больше в нем осталось нецеллюлозы, тем труднее загорается
уголь; поэтому выдерживание древесины снижает также золь-
ность, уменьшает влажность пороха и повышает его стойкость.
Затем следует процесс обжига. Для этого пользуются огне-
упорной чугунной ретортой, в которую загружают две
корзины подготовленного для обжига дерева. Реторта устроена
так, что продукты сухой перегонки — смола и подсмольная
вода — могут быть улавливаемы. Процесс обугливания произво-
дится при 270—340°.
До 150° происходит только высушивание дерева, а выше этой темпе-
ратуры изменяется его структура: масса становится легкорастираемой и при
250—260° полностью теряет волокнистый характер. Полученный при это!
температуре продукт бывает бурого цвета и называется поэтому бурым
угле м; он очень легко загорается и поэтому вполне подходит для изго-
товления охотничьего пороха. С повышением температуры, уголь становится
чернее, богаче углеродом, плотнее и загорается труднее.
Вместо старого ретортного способа с непосредственным обогревом (при-
меняемого с 1847 г.) употребляется также способ перегонки дерева обра-
боткой водяным паром. Перегретый до 350° пар проходит через де-
рево и уносит с собой смолистые вещества.
Температура обжига Удельный вес Температура воспламене- ния
150° 1,06 340-360°
250—260° 1,42 370°
350° 1,50 около 400°
440° 1,71 „ 600°
1000° 1,84 „ 800°
1500° 1,87
Часа через два обугливание при работе по этому способу заканчи-
•вается, между тем! как обугливание голым огнем длится от 9 до 11 час.
Реторту при этом1 нужно немедленно освободить, чтобы бурый уголь не
перешел в черный, для чего при высокой температуре достаточно 3—4 мин.
Способ обугливания паром дает бурый уголь с 70% углерода и черный
уголь с содержанием около 85% углерода; обугливание на голом огне дает
уголь с содержанием углерода 71—72%.
Признаками хорошего ретортного угля служат: большое
число поперечных, но ни одной продольной трещины, тупые
углы, излом незанозистый, коричневая черта на синей бумаге и
в растертом состоянии — вид, выцветшего черного бархата. Хо-
роший бурый уголь горит голубым слабожелтым пламенем и
полностью растворяется в едком кали.
Прежде чем ^выгрузить уголь из реторты, необходимо его
охладить. Свежеобожженный теплый уголь самовоспламе-
if-
/. Исходные материалы 155
н --------------------------------------------------------
Д. .ни лея бы при соприкосновении с воздухом, так как он обладает
И склонностью абсорбировать газы и уплотнять их на своей no-
il верхности. В случае кислорода при таком уплотнении разви-
II вается тепло, и может произойти самовоспламенение. По Калю
Ц древесный уголь вбирает в зависимости от погоды 7—10% паров
Ц воды и газов.
Уголь должен вылежаться не менее двух недель и тогда мо-
жет поступить на измельчение для изготовления пороховой
смеси. На заводе в Шпандау для этого применяются железные
вращающиеся барабаны, в которые загружается 80 кг угля и
115 кг бронзовых шаров. Измельчение длится П/2 часа при
10 об/мин.
3. Сера
Для изготовления порохов употребляется исключительно про-
дажная очищенная черенковая сера, но никак не сер-
ный цвет, получаемый возгонкой обыкновенной серы, хотя при-
менение серного цвета благодаря его порошкообразному состоя-
нию и может казаться целесообразным. Серный цвет всегда
содержит некоторое количество сернистой и серной кислот и
вследствие этого совершенно непригоден для изготовления
взрывчатых веществ. Особенно чистая сера получается в каче-
стве отхода при фабрикации соды. Для лучших сортов пороха,
кроме полного отсутствия кислот, необходимо также отсутствие
мышьяка. Наибольшее количество остатка после сжигания серы
не должно превышать 0,06%.
Сера представляет собою твердое светложелтое тело без вкуса
и запаха, нерастворимое в воде. В спирте и эфире растворяется
с трудом, легко — в сероуглероде и хлористой сере. Она очень
плохой проводник тепла и электричества; легко электризуется
при трении. При обыкновенной температуре сера тверда и
хрупка. При 120° плавится в легкоподвижную желтую жидкость,
которая кипит при 448°.
Измельчение серы ранее производилось в железных
барабанах; при этом сера электризовалась, и нередко
вследствие образования искры происходило воспламенение смеси
серной пыли с воздухом1. Поэтому обычно для измельчения при-
меняют деревянные барабаны; сера и уголь измель-
чаются одновременно, в одной и той же операции. В буко-
вые барабаны засыпают обе составные части в том весовом
отношении, которое требуется для данного сорта пороха, и воз-
можно тоньше измельчают посредством шаров из бакаутового
Дерева (рис. 72). Загрузка такого барабана равна примерно
100 кг серы и угля и 100 кг бакаутовых шаров. Продолжитель-
ность измельчения зависит от сорта изготовляемого пороха и
составляет от 1% до 4 час. при 12—14 об/мин. Для уменьшения
выделения пыли барабан заключают в фанерный кожух. Кониче-
156
Дымный (черный) порох
ское сужение в нижней части барабана позволяет выгружать из-
мельченную смесь непосредственно в подставленные вагонетки.
Роль серы в порохе выяснена еще недостаточно. По более новым
воззрениям ее считают веществом, связывающим уголь и селитру: порох,
не содержащий серы после прессования и зернения, пылит и плохо связан.
По Гофманну сера сообщает пороху более легкую горючесть
вследствие образования при температурах выше 150° из содержащегося
в угле водорода — сероводорода, благодаря чему селитра легко вступает
в реакцию ниже 280°. Кроме того сера способствует переносу кислорода
от селитры к неплавящемуся и нелетучему углю.
Если бы сера не выполняла свою задачу в этом или подобном смысле,
ее давно заменили бы углем, который значительно более активен в энерге-
тическом отношении.
Рис. 72. Шаровая мельница для непрерывного размола со сквозным валом
и раздвижными размалывающими плитами (новая модель):
я—дырчатые части, е—предварительное просеивание, /—тонкое просеивание, обратный выход
отсевок, i— воронка для засыпки, п—вал, о-тбольшое зубчатое колесо, г?—кожух, —заслонка
кожуха.
Лан г ганс составлял смеси, подобные дымному пороху и содержав-
шие вместо серы равные количества аморфного селена, чтобы исследо-
вать, как будет влиять на разложение смесей этот элемент, стоящий в пе-
риодической системе рядом с серой. Вопреки ожиданиям эти смеси ока-
зались совершенно индиферентными как в отношенйи механического, так
и теплового воздействия, т. е. вели себя совершенно иначе, чем смеси
с серой.
II. Фабрикация пороха1
Измельчение и смешение отдельных составных частей при из-
готовлении пороха уже в предыдущие столетия достигло высо-
кой степени совершенства, и утверждение, что уже 300 лет тому
1 Подробнее см. R. Е s с а 1 е s, Schwarzpulver u. Sprengsalpeter, Лейпциг
1914.
II. Фабрикация пороха
157
назад изготовлялся продукт, одинаковый по качеству с современ-
ным дымным порохом, не является преувеличенным. Конечно
средства, которые давали возможность получать такой продукт,
были тогда очень примитивны, а технологический процесс произ-
водства чрезвычайно длителен и непродуктивен.
В настоящее время процесс фабрикации пороха
распадается'на следующие восемь основных операций:
1) измельчение исходных материалов,
2) смешение компонентов,
3) уплотнение состава,
4) прессование порохового состава,
5) зернение,
6) придание зерну круглой формы и полировка,
7) сушка и сортировка,
8) укупорка и хранение.
1. Измельчение исходных материалов
Об измельчении исходных материалов все необходимое было
сказано в предыдущей главе. Необходимо лишь добавить, что
измельчение селитры в барабанах часто производят вместе с се-
рой; смешиваются они в тех весовых соотношениях, которые
требуются для данного сорта пороха. Для удаления попавших
в смесь посторонних тел измельченный материал пропускают че-
рез цилиндры с медными ситами.
Целесообразное расположение зданий представлено на рис. 73:
отдельные маленькие мастерские построены с вышибной стенкой
и отделены одна от другой предохранительной стеной.
2. Смешение компонентов
После измельчения материалы в требуемом соотношении и
с мерами предосторожности, предупреждающими отсыревание,
навешиваются в бочки для (смешения. Бочки для смешения пред-
ставляют собою такие же барабаны, какие служат для измельче-
ния, с тою разницей, что все железные части здесь заменены де-
ревом, обитым кожей, или же вращающийся цилиндр барабана
изготовлен из одной твердой подошвенной кожи, которая
укреплена в деревянном каркасе с латунной осью. Загрузка в ко-
личестве 100—150 кг подвергается обработке бронзовыми или
лучше бакаутовыми шарами, вес которых равен весу закладки
в течение 1—3 час. при 12—15 об/мин. Перемешивание считается
законченным, когда масса приобретает равномерный серый цвет
и при рассматривании в лупу кажется совершенно однородной.
3. Уплотнение состава
Эту работу раньше исполняли обыкновенно в толчея х, где
смешение и уплотнение производилось в одну операцию. Поро-
и
Рис. 73. План расположения современного завода дымного пороха.
-обжиг угля, 2— склад сырых материалов, 3—измельчение, 4—смешение и растирание, 5—бегуны, б—прессование лепешек., 7—зернение и сортир
ровка и отсеивание, 9— склад тары, 10—укупорка, 11 -сушильная (обвалована), 12— калорифер, 13—пороховой погреб (обвалован).
II. Фабрикация пороха
159
ховую смесь увлажняли 15% воды и толкли тяжелыми пестами
с бронзовым башмаком, которые с высоты 40 см около 60 раз
в минуту падали в дубовые ступы, имевшие форму полушара.
Работа песта, наряду с перемешиванием основных частей, произ-
водила также и сильное уплотнение состава, следствием чего-
были многочисленные несчастные случаи от сильных ударов, по-
чему от этого способа уже давно пришлось отказаться и перейти
к дробилкам или бегунам. Конструкция, применяемая в настоя-
щее время на многих заводах, представлена на рис. 74.
Аппарат состоит из чугун-
ной тарелки (лежень) и двух
катков весом по 5500 кг, изго-
товленных из лучшего твердого чу-
гуна и насаженных на коленчатый
вал, укрепленный цапфами на пол-
зунке вертикальной оси; катки
установлены так, что могут дви-
гаться независимо друг от друга.
Отшибы и скребки из фосфори-
стой бронзы или латуни равно-
мерно распределяют пороховую
массу под катки и мешают обра-
зованию твердой корки. Загрузка
равна 50—75 кг; смесь увлажняется
водой до 5%, и обработка про-
изводится при 9—10 об/мин. Для
минного пороха продолжитель-
ность работы 1% часа, для воен-
ного пороха 2% часа и для охот-
ничьего пороха 4 часа. Перед
остановкой аппарат переводят на
медленный ход (1—2 оборота) и
дают возможность смеси запрессо-
ваться в твердую лепешку боль-
шой плотности. Более длительная
обработка состава вредна, так как
плотность через определенное вре-
мя размола опять уменьшается по
причинам, которые будут рассмо-
трены при описании аммиачно-
селитренны-х взрывчатых веществ.
Рис. 74. Бегуны.
Обработанная таким образом смесь называется бегуьной
лепешкой и применяется большей частью только для приго-
товления фейерверков или для минного пороха. Для изгото-
вления высших сортов пороха и для получения плотного зер-
неного пороха необходимо обработанную под бегунами смесь
уплотнять еще на прессе.
Под бегунами пороховая смесь не только уплотняется,
но также еще тесно перемешивается. Высокосортный порох
после обработки под бегунами еще раз измельчается в бочках
с бакаутовыми шарами, и только тогда прессуется на гидравли-
ческом прессе и перерабатывается в зерна на машине для зер-
нения.
160
Дымный (черный) порох
4. Прессование порохового состава
Эта операция производится на вальцах, или, лучше, по-
средством гидравлического пресса. Применяемые для
этого аппараты — гидравлические прессы — состоят из нижней
площадки, колонок, цилиндра с поршнем и поршневой насадки.
Пороховую массу измельченной бегунной лепешки прессуют
между бронзовыми или йедными поверхностями в слое от 2
до 5 см толщины. Продолжительность прессования составляет
30—40 мин.; наименьшее давление 25 ат и удельный вес по-
роха 1,7. Пороховая масса с целым рядом заложенных слоев по-
мещается на подвижной платформе, на которой она подается
под пресс.
5. Зернение
После прессования твердые лепешки разбиваются деревян-
ными молотками и направляются в машину для зернения,
где они зернятся между зубчатыми бронзовыми валами и разде-
Рис. 75. Гидравлический пресс.
ляются на качающихся си-
тах на крупные и мелкие
зерна. Производительно ра-
ботают вальцовые маши-
ны для зернения, в
которых две или три пары
зубчатых вальцов помеща-
ются друг над другом1 и
установлены так, что свер-
ху вниз промежутки между
ними становятся все уже,
так что все крупные зерна
размалываются до желае-
мой величины.
Зерна падают на с и то,
которое тут же под валь-
цами освобождает порох
от пыли. Зерненый порох
сортируется в находя-
щемся в том же помещении
цилиндре с ситами
разных размеров на желае-
мые сорта и направляется в
помещение для полировки.
Пыль и отход поступают
эбратно под бегуны или на
гидравлический пресс, воз-
вращаясь в производство.
HI. Фабрикация пороха
161
6. Придание зерну круглой формы и полировка (сырая или пред-
варительная)
Чтобы получить красивые, круглые зерна, необходимо
сгладить острые углы и края. Это округление и одновременно
и полировку производят в полировочных барабанах,
подобных бочкам для смешения и изготовленных из кожи. По-
лировка производится путем простого трения зерен одно о дру-
гое без применения шаров. В барабан загружается 150—300 кг
свежезерненого, еще влажного пороха, и при 16 об/мин обра-
Рис. 76. Вальцы для зернения.
ботка производится для ружейного пороха 4 часа, для охот-
ничьего— 12-18 час. Вследствие продолжительного трения по-
рох нагревается и теряет частично свою влажность, отчего при-
обретается больший удельный вес, чем при удалении влаги после
полировки сушкой. Чтобы еще более улучшить внешний вид
пороха, производят глянцевую п б л и р о в к у, т. е. приба-
вляют небольшое количество тонкоизмельченного графита, бла-
годаря чему способность к воспламенению и метательная сила
пороха легко могут быть снижены. С другой стороны, надо при-
нять во внимание, что чем более полирован порох, тем меньше
влаги он притягивает. Кроме того полировка уменьшает проме-
жутки между отдельными зернами, и от этого повышается грави-
метрическая плотность пороха.
Ц Зак. 3171. — Штетбахгр.*
162
Дымный {черный) порох
7. Прессованный (призматический) порох
За несколько лет до появления бездымного пороха обыкно-
венному орудийному пороху удалось сообщить определенные
балистические свойства, а именно более медленное горение и
однообразное действие, для чего зерненый порох прессовали
в виде кружков, кубиков, призм и правильных форм другого
вида. Исключительное значение приобрел бурый призма-
тический порох, открытый в Германии; с 1882 г. он приме-
нялся во всех крупных государствах для тяжелой артиллерии.
Эти призмы шестигранной формы, высотою 25 мм и шириною
34 мм с одним центральным каналом диаметром в 10 мм, весили
44 г при среднем удельном весе в 1,82. Прессованный призмати-
ческий порох применяется еще и в настоящее время в Америке 1
под названием Pellet Powder в форме прессованных цилиндров
с центральным каналом. Дюпон изготовляет 6 различных ма-
рок диаметром от 3 до 6,5 см с тремя различньпми скоростями
горения.
8. Сушка и сортировка
В то время как раньше сушка производилась на ситах на
солнце, что весьма вредило однородности пороха, в настоящее
время сушка производится в сушилках с паровым или, лучше,
Рис. 77. Минный
порох.
Рис. 78. Ружей-
ный порох.
водяным обогревом при 35—60е. Порох, зерненый или прес-
сованный, помещается на плоских рамках, дно которых натянуто
полотном, слоем в 4—6 ом толщиной, и выдерживается 5 час.
в камере перед сушилкой для удаления влаги. После этого порох
вносится в сушильную камеру, где он в течение 10—12 час. при
55—60° высушивается окончательно и содержание влаги пони-
жается до 1%. Если порох сохнет слишком* быстро, то обра-
зуются трещины, и поверхность зерна покрывается, выкристалли-
зовавшейся селитрой, вследствие чего порох разделяется на
составные части и как метательное средство становится негодным.
’ Du Pont, Blaster’s Handbook, Вильмингтон 1932.
III. Фабрикация пороха
163
После сушки порох поступает в цилиндры с двойными
стенками, предназначенные специально для сортировки и
одновременно для освобождения от пыли.
Последняя операция —с мешение готового порох а-—
имеет целью сгладить небольшие различия в суточных партиях,
которых невозможно избежать даже при тщательной фабрика-
ции, и тем самым обеспечить высокую однородность большой
производственной партии.
Зерна порохов имеют обычно следующие размеры:
Мелкий охотничий порох............. 0,3 — 0,5 мм
, ружейный ......................0,7 —1,6 »
Мелкозернистый орудийный порох . . 0,7 — 1,3 „
Крупнозернистый орудийный порох С/86 6 — 18
Минный порох......................... 4 — 16
9. Укупорка и хранение
Готовый порох хранится до отправки в специальных помеще-
ниях. Обычно его насыпают в толстые джутовые (тиковые)
мешки по 50 кг и укладывают в деревянные бочки. Как в отно-
шении безопасности перевозки, так и в отношении предохра-
нения1 от сырости целесообразно пользоваться ящиками с двой-
ными деревянными стенками, которые выложены листовым
цинком. Военный порох обыкновенно хранится в металлических
сосудах, у которых крышка или отверстие для наполнения
снабжено латунной нарезкой и завинчивается. Отсыревший по-
рох после высыхания меняет свои балистические свойства; если
продукт сделался рыхлым и покрылся' трещинами, то бризант-
ность может повыситься, но если произошло изменение состава,
то способность воспламенения и метательная сила могут сни-
зиться. Хорошо укупоренный и хранимый сухим порох не изме-
няется неопределенно долгое время. Был испытан образчик по-
роха, который хранился более 100 лет и остался совершенно
неизмененным. В 1856 г. на острове Родосе взлетела на воздух
Церковь, которая служила складом для хранения пороха, изго-
товленного в 1522 г.
10. Свойства дымного пороха
Дымный порох имеет аспидно-серый цвет и матовый глянец;
большие зерна бывают часто от сине-черного до серо-черного
Цвета с металлическим блеском. Интенсивно черный цвет указы-
вает на присутствие в порохе влаги. Ружейный порох имеет
Удельный вес зерна1 1,5—1,6, прессованный 1,7—1,9. Естественно.
’ «Абсолютный удельный вес> зерна (пороха или взрывчатого вещества)
определяется в особом приборе (денсиметре); для этого сначала из пор на-
сосом удаляется воздух, а затем по количеству ртути, вытесненной зернами
Мли кристаллами, определяют удельны* вес.
11*
164
Дымный {черный) порох
что гравиметрическая плотность, г. е. вес пороха, который за-
полняет объем, равный 1 л, меньше удельного веса. Эта величина
зависит от удельного веса и формы порохового зерна и равно-
значна с его наибольшей плотностью заряжания: она составляет
для ружейного пороха 0,905—0,925 кг и для крупнозернистого
пороха 0,960—0,980 кг.
Хороший порох оказывает сопротивление раздавливанию
между пальцами, не пачкает рук и, насыпанный на бумагу, совер-
шенно не оставляет пыли. При падении пробы с высоты 1 м на
твердую поверхность порох не должен давать пыли. Маленькая
кучка пороха, зажженная на бумаге, должна быстро вспыхнуть,
давая вертикально поднимающийся дым, причем бумага не
должна загореться. Бели порох оставляет пятна или частицы
твердых продуктов горения, то перемешивание состава было не-
достаточным.
Содержание влаги в порохе колеблется от 0,8 до 1,5%. Хоро-
шие марки пороха содержат не более 1% влаги, так как уже де-
сятые доли процента лишней влажности изменяют балистические
свойства и понижают начальную скорость. Отсыревший порох
все еще сохраняет способность воспламеняться и свойства взрыв-
чатого вещества; лишь при содержании 15% воды способность
воспламеняться теряется.
Дымный порох легко воспламеняется от пламени и от искры;
удар молнии всегда вызывает сильный взрыв. Небольшие коли-
чества пороха только вспыхивают; большие же, напротив, сильно
взрывают. Температура вспышки лежит около 300°, следова-
тельно выше, чем у бризантных взрывчатых веществ. Если нагре-
вание вести очень медленно, то можно перегнать всю серу, не
воспламенив пороха.- В безвоздушном пространстве порох сго-
рает медленно. Необходимо также отметить отношение его к га-
зам. В атмосфере водорода порох накаливается, но воспламене-
ния не происходит; порох с трудом горит в азоте и довольно
легко в атмосфере углекислоты.
В отношении своей чувствительности к удару и трению порох
принадлежит к числу наиболее безопасных в обращении взрыв-
чатых веществ; однако это свойство пороха нельзя переоцени-
вать. При падении груза в 10 кг с высоты более 45 см происходи!
взрыв пороха; при -высоте падения ниже 35 см получается отказ
Чем тверже ударяющиеся детали, тем легче происходит взрыв
легче всего—при ударе стали (железа) о сталь (железо), зате.\
латуни о железо, труднее — при ударе меди о бронзу и бронзы
о дерево. Однако воспламенение может произойти даже от
сильного удара свинца о дерево.
Дымный порох образует при взрыве полезное количество
газа, равное всего 43%л в то время как твердый остаток (дым)
составляет почти ®/з всего веса пороха. Вообще можно сказать,
что образующиеся при взрыве газы занимают около 280 объемов
взятого пороха, и давление на стенки сосуда достигает 6400 ат.
III. Фабрикация пороха
165
Горение пороха при взрыве протекает настолько сложно, что
реакцию разложения невозможно представить одним уравнением,
правильно отображающим процесс.
Стехиометрически разложение пороха можно было бы пред-
ставить следующим простым уравнением:
2KNO3 + ЗС + S = K.S + збо, +
74,9% 13,3'/с 11,8%
Однако запах и цвет, наблюдаемые при взрыве, показывают,
что продуктов разложения образуется гораздо больше.
В 1823 г. Г е й-Л ю с с а к впервые определил продукты разло-
жения свободно сгорающего на воздухе пороха. По его данным
газообразных продуктов получается 450 объемов, т. е. почти
вдвое более против действительной величины. В 1857 г. Б у н з е н
и Шишков произвели свои известные являвшиеся в то время
руководящими анализы, в которых порох разлагался под обыч-
ным атмосферным давлением. Они получили 68% твердого
остатка и 31% газообразных продуктов, что на 1 г или прибли-
зительно 1 сма пороха давало около 194 см3.
В 1875 и 1880 гт. в том же направлении стали работать англи-
чане Нобль и Эбль. Для образчика пороха (Kieselpulver)
состава:
Селитры........................>
Сернокислого калия ..............
Серы............................ .
Древесного угля .................
74,67%
0,09%
10,07%
I
14,22%
0,95%
12,12% углерода
0,42% водорода
1,45% кислорода
0,23% золы
Воды..........................
они установили продукты разложения, приведенные в табл. 11.
Таким образом продукты разложения в закрытой бомбе со-
стоят из 57 весовых процентов твердых веществ и 43% газо-
образных. Интересно, что с повышением1 плотности заряжания
содержание серы в твердом остатке повышается до 5%, равно
как вес углекислоты повышается за счет уменьшения количества
окиси углерода. При попытках составить для пороха нормаль-
ного состава (с учетом содержащихся в угле водорода, кисло-
рода и воды)
77KNOS+ 128С (+ 5Н2О) ф- 32S
74,8% 14,7% (<+ 9,9%) 9,8%
молярное уравнение горения на основании данных выше про-
дуктов горения всегда получается остаток, который не удается
ввести в уравнение.
Это обстоятельство более всего доказывает, как запутанно и
стехиометрически непонятно протекает весь процесс разложения
Дымного пороха. Практически для наивысшей плотности (1 кг
пороха в 1 jf) можно принять, что в среднем получается при-
166
Дымный (черный) порох
ТАБЛИЦА II
Продукты разложения 1000 г дымного пороха при различ-
ных плотностях заряжания
Плотность заряжания Д Граммы
0,1 0,5 0,9
Твердый остаток • К2СО, K2SO4 ....... К^О, K,S KtNS KNOg (NH4)2COS с 311,5 84,3 116,3 41,6 0,5 2,7 0,9 3,4 " следы 309,8 65,8 33,8 105,5 1.3 1,1 0,4 34,0 следы 368,0 52,3 76,1 22,0 2,3 2,5 0,7 48,4
В Газообразные про- дукты сего. . . . . . со. со N, H,S сн4 .- . Н, О, 561,2 257,7 51,9 415,1 13,4 0,7 551,7 277,0 47,3 113,9 8,4 1,2 0,5 572,3 271,0 36,2 109,0 8,6 1,3 0,5
В Объем в литрах . сего 438,8 281 442,3 282 426,7 266
Мерно 270 л газообразных продуктов, или 270-кратное увеличение
первоначального объема. При нагревании до температуры взрыва
(2400°) этот объем газообразных продуктов претерпевает даль-
нейшее 10-кратное расширение: газообразные продукты произво-
дят на стенки сосуда (принимая во внимание уменьшение объема,
вызываемое остатком) максимальное давление, равное минимум
6000 ат. Данные опыта в отношении теплоты взрывчатого раз-
ложения пороха различны: но она невидимому не превышает
700 б. кал. Скорость взрыва дымного пороха часто ука-
зывается со значительными отклонениями: в 1920 г. Каст уста-
новил, что при плотности заряжания в 1,06 в толстых маннесман-
новских трубках диаметром 35 мм скорость взрыва равна
420 м/сек, в тонких газовых трубках диаметром 41 мм
380 м/сек. При этом оказалось, что способ воспламенения
(обыкновенный шнур, капсюль-детонатор, промежуточный дето-
натор) не оказывает влияния на скорость горения.
III. Отдельные сорта дымного пороха
167
В большом противоречии с этими простыми и естественными
данными в отношении пороха находятся наивные представления
и теории средних веков. Еще в начале XVIII столетия предста-
вления о пороховом взрыве были чрезвычайно старомодными и
свойственными алхимикам. Некий Мит в 1705 г. объясняет
в своем часто цитировавшемся тогда сочинении процесс разло-
жения пороха следующим образом:
«Селитра является ведущим веществом- в порохе; она есть действующее
начало; по своей природе она холодная; при всем том содержит в себе
скрытый огонь, который удерживается в ней принудительно; но это не есть
его естественное местонахождение. Этот огонь укрепляется и умножается,
если в смесь добавляется правильная пропорция серы, но излишки серы
вследствие ее маслянистости увеличивают дымность и уменьшают огонь.
Эти две противоположности — жар н холод, огонь и вода — уживаются
вместе с помощью угля, но при воспламенении они тотчас же проявляются и
превращаются в вещественный воздух, который властно ищет себе выходах
В отличие от таких напыщенных фраз существовали также и
чисто научные объяснения, например объяснения Ньютона.
Логичны и правильны представления о давлении и увеличении
объема, хотя числа приводятся почти в 10 раз большие. Напри-
мер Румфорд в 1797 г. определил абсолютную силу пороха
в 54 000 ат, а французский морской офицер М о р о г в 1737 г.—
увеличение объема (образование -газа по тогдашним представле-
ниям) 4500-кратное. О температуре взрыва не имели представле-
ния, что и неудивительно, так как еще в 80-х годах прошлого
столетия в этой области не велось никаких систематических ис-
следований.
III. Отдельные сорта дымного (черного) пороха
и сходные с ним составы
1. Охотничий порох
Величина зерен и качество пороха обозначаются марками 1а,
Па, Ша. Сильная конкуренция, которую должен был выдержать
охотничий порох вскоре после введения бездымного пороха,
привела к тому, что изготовление дымного пороха вследствие
тщательного выбора угля и особенно тонкого измельчения со-
ставных частей достигло высокой степени совершенства. Не-
смотря на это сила охотничьего и пушечного порохов прибли-
зительно вдвое меньше, чем бездымного пороха. Это видно по
результатам стрельбы из оружия одного и того же калибра
(см. табл. 12).
Если в балистическом отношении дымный порох стоит
ниже бездымного, то, с другой стороны, он в два-три раза де-
шевле, производит небольшое изнашивание ствола, имеет по-
стоянную скорость горения вследствие незначительной чувстви-
тельности к колебаниям температуры и влажности и наконец
168
Дымный (черный) порох
ТАБЛИЦА 12
Сравнительные данные о дымном и бездымном порохах
Сорт пороха Вес заряда (г) Дробь илн пуля (г) Скорость (м[сек) Давление в атмосфе- рах
Высший сорт пороха охот- ничьего и для штуцера. . . Бездымный п< рох охотничий и для штуцера 5,75 2,75 42 38 305 310 395 460
Французская 9-c.w пушка . . . (кг) Снаряд (кг) Среднее давление (кг/см2 3)
Дымный порох .... • . . Бездымный ленточный порох 85X20X0/ мм ' 1,900 0,720 8,00 8,00 460 460 2 360 1 750
очень стоек при высокой температуре (основные же компоненты
бездымного пороха, наоборот, представляют собою легко разла-
гающиеся вещества).
2. Минный порох
О минном порохе все существенное сказано уже ранее. В за-
висимости от цели применения его состав часто значительно
изменяется.
Отдельные сорта различаются по содержанию селитры, кото-
рое колеблется от 75 до 62%. Соответственно невысоким требо-
ваниям в отношении постоянства и взрывчатых свойств он обхо-
дится дешевле. Величина зерен (рис. "77 и 78) равна 5—15, иногда
18 мм.
Простое испытание минного пороха можно произвести на
пружинных весах, которые дают отклонение при вспышке опре-
деленной навески пороха.
3. Порох для снаряжения средств воспламенения
Этот порох представляет собою медленно горящий состав и
служит для снаряжения бикфордова шнура. В большинстве слу-
чаев для этого употребляется обыкновенная незерненая порохо-
вая масса (пороховая мякоть), скорость горения которой умень-
шают путем добавки 1—6% тяжелого шпата.
III. Отдельные сорта дымного пороха
169
Во Франции приняты три сорта дымного пороха:
Продолжительность горения
на 1 м
Состав пороха
150 сек. 100 сек. 40 сек.
В процентах
Селитра .............
Уголь ...............
Сера.................
40
30
30
62
18
20
72
15
13
В среднем скорость горения можно принять равной 1 м
в Р/2 мин.
4. Пороховые столбики, трубочный порох
Эти пороха появились впервые с введением разрывных сна-
рядов типа шрапнели и служили для воспламенения в определен-
ный момент после выстрела снарядов типа гранат. В настоящее
время они стали необходимым элементом средств воспламенения
и применяются не только в разнообразных дистанционных труб-
ках, но и в качестве замедлительных составов в бронебойных,
гранатах, авиационных бомбах, в бомбометных и минометных
снарядах и ручных гранатах (рис. 278 и 282).
Поэтому для изготовления такого сорта пороха необходимо
обращать особенное внимание на качественный выбор материала
и при его. составлении помнить основное условие, что незначи-
тельное отклонение во времени горения уничтожает весь смысл
действия снаряда. Следующая таблица дает состав и'время го-
рения этого вида порохов:
Селитра Сера Уголь крушины, 70%-ный Удельный вес Время горения 10 см в секунду Отклонения во время горения
59 37 4 1845 33,82 0,76
67 27 6 1825 26,52 0,58
76 17 7 1836 29,00 1,27
Эти смеси следует строго проводить по всем операциям поро-
хового производства, а после прессования на .гидравлических
170 Дымный (черный) порох
прессах измельчать до величины зерна в 0,3—0,5 мп в попереч-
нике. Пороховая пыль вследствие ее недостаточной однород-
ности является непригодной.
По одному новому предложению 1 можно заменять никогда не
бывающий однородным древесный уголь более чистым американ-
ским нефтяным коксом (обуглившимся остатком жидких
углеводородов), а также купреном. Время горения от этого не
только становится якобы равномернее^- но и значительно увели-
чивается.
5. Составы, сходные с дымным порохом: взрывчатые селитры
Путем бесчисленных изменений первоначального состава дым-
ного пороха делались попытки приспособить его для самых раз-
нообразных целей. Переходя по очереди от одного компонента
к другому, пробовали замшить другими веществами прежде
всего селитру, затем уголь или серу, а также оба последние
ингредиента как полностью, так и частично. Из этих опытов
в отношении изменения состава пороха произошли обширные
классы взрывчатых веществ —- аммиачноселитренных, хлоратных
и перхлоратных. Поэтому в качестве составов, сходных
с дымным порохом (в узком смысле этого слова), рассма-
триваются только такие смеси, которые содержат натриевую
селитру взамен калиевой. Они называются взрывчатыми
селитрами (по американской терминологии black blasting
powder, или черный минный порох). Вследствие того что они со-
держат гигроскопическую натриевую селитру, они подходят
только для взрывных целей. Так как натриевая селитра имеет
меньший молекулярный вес, то эти взрывчатые селитры дают
больше газообразных продуктов, именно 330 л; точно так же
скорость горения достигает большей величины, именно 500 м/сек
(табл. 4). Взрывчатые селитры успешно применяются в мягкой
породе, так что их потребление в калийной промышленности и
при добыче некоторых руд в Америке возрастает 2.
Медленнее разлагается п е т рок ласти т (Petroklastit), со-
стоящий из 69% натриевой селитры, 5% калиевой селитры,
10% серы, 15% каменноугольного пека и 1% бихромата калия.
Чувствительная к влаге масса прессуется в цилиндры, по весу
одинаковые с патронами; в центре оставляется канал для введения
капсюля-детонатора и бикфордова шнура. Другие смеси, напри-
мер к а г ю ц и т (Cahiicit) и боббинит (Bobbinit), содержат
в качестве добавок, ослабляющих их действие, средние соли ме-
таллов, каковы железный и медный купоросы.
1 Герм. пат. 499402.
5 С о a t е s и Crawshow, Reports of investigations, 1929, стр. 2940,
Bureau of Mines.
III. Отдельные сорта дымного пороха
171
Новая более си л ья а я, растворимая в воде взрывчатая се-
литра приготовляется по способу Р а ш и г а 1 путем смешения
мононитрофенол- и мононитрокрезолсульфокислот с чилийской
селитрой. Эти смеси детонируют уже от бикфордова шнура,
медленно горят на воздухе, но в случае применения забойки раз-
вивают значительно большую силу, не обнаруживая в то же
время бризантного разрушительного действия родственных ни-
тросоединений.
В Америке, особенно на тихоокеанском побережье, приме-
няются взрывчатые сейитры, содержащие нитроглицерин2,
под названием Judson Type Powder; их действие при содержании
от 5 до 20% нитроглицерина близко к действию безопасных ди-
намитов. В настоящее время предложены «подобные же смеси * *
из калиевой селитры, нитроглицерина и древесного угля.
1 Z. f. angew. Chemie, 1912, 1914.
* Hercules Powder Co.; Modern Blasting, Вильмингтон 1927.
a Герм. пат. 513Г54.
ГЛАВА ПЯТАЯ
КИСЛОТЫ, ПРИМЕНЯЕМЫЕ ДЛЯ НИТРАЦИИ
X
Для производства взрывчатых веществ необходимы кислоты
азотная и серная; последняя в виде обычной концентрированной
серной кислоты удельного веса 1,84, олеума и, реже, моноги-
драта. Кислотой, непосредственно участвующей в образовании
взрывчатого вещества в собственном смысле слова, является азот-
ная кислота, в то время как серная представляет собой только
вспомогательный ингредиент, предназначенный для усиления
эффективности действия азотной кислоты.
1. Азотная кислота
Азотная кислота получается в настоящее время главным обра-
зом синтетическим путем, а именно окислением синтетического
аммиака \ который в свою очередь получается по известным
способам Габера, Казале, Клода из чистого азота и водо-
рода в присутствии катализатора под давлением в 200—1000 ат.
Окисление аммиака осуществляется в высоких башнях из стали
V2A. Образующаяся двуокись азота под действием кислорода и
воды под давлением непосредственно превращается в дымящую
азотную кислоту. Однако на больших производствах промежу-
точные продукты — аммиак и двуокись азота — редко нацело
перерабатываются в конечный продукт — азотную кислоту;
поэтому они хранятся в сжиженном состоянии в цилиндрических
резервуарах для использования по мере надобности.
Азотная кислота HNO3, состав которой известен с 1784 г.,
представляет собой в чистом виде бесцветную, легкоподвижную
'жидкость, кипящую с частичным разложением при 86° и 760 мм
давления и затвердевающую при —41,3°. Получить совершенно
чистую азотную кислоту можно только вымораживанием; при
этом она образует белоснежные кристаллы. Ее удельный вес
равен 1,559 при 0° и 1,530 при 15°. Наиболее концентрирован-
ная техническая азотная кислота содержит 98, максимум 99%
HNO3 при удельном весе 1,515. Азотная кислота жадно притяги-
1 Ср. статью Оствальда н Брауфа «Историческое развитие окисле-
ния аммиака> в издании, посвященном 50-летию существования платиновых
сплавов, G. Siebert G.m.b.H., Ганау 1931, 240—256.
Кислоты, применяемые для нитрации
173
вает влагу, почему и дымит на воздухе, образуя белый туман.
Под действием света она окрашивается в желтый цвет и, как и
при перегонке под атмосферным давлением, разлагается на воду,
кислород и бурую двуокись азота по уравнению:
4HNO3 = 4NO2 + 2Н2О + О2.
Двуокись азота при этом растворяется в неразложившейся
азотной кислоте, образуя красную дымящую азотную
кислоту. При смешении с водой выделяется довольно боль-
шое количество тепла. При перегонке разбавленной кислоты сна-
чала перегоняется вода и часть разбавленной кислоты, и темпе-
ратура кипения все время повышается, а при 120,5° перегоняется
кислота постоянного состава, содержащая 68% Н1ЧОз. Наоборот,
при перегонке концентрированной кислоты сначала переходят
более концентрированные смеси; как только количество образую-
щейся в результате разложения воды увеличивается, темпера-
тура кипения вновь подымается до 120,5°, и получается обычная
лабораторная недымящая азотная кислота удельного веса 1,414.
Азотная кислота — одна из сильнейших, наиболее активных
кислот; она растворяет большинство металлов, в том числе и
серебро. Своеобразно ее отношение к железу и алюминию,
которые невидимому вполне устойчивы к действию концентриро-
ванной азотной кислоты. Такая стойкость или пассивность осно-
вывается на том, что железо и алюминий при погружении в азот-
ную кислоту определенной концентрации покрываются пленкой
нерастворимых окислов, которые препятствуют дальнейшему
действию кислоты. Стоит только удалить с поверхности металла
защитную пленку, например растворением в разбавленной кис-
лоте, как начинается энергичное действие, приводящее к бы-
строму окислению и растворению металла.
Транспорт азотной кислоты связан с большими затрудне-
ниями из-за легкости разложения и пожарной опасности. Од-
нако, с тех пор как вместо хрупких стеклянных баллонов и гли-
няных горшков стали применять резервуары из специальных
материалов, перевозка азотной кислоты значительно облегчи-
лась. Дымящую азотную кислоту удельного веса 1,5 в настоя-
щее время особо выгодно перевозить и хранить в цистернах из
чистого алюминия. Один известный завод взрывчатых
веществ пользуется алюминиевыми цистернами емкостью 65 т
и кислотой, содержащей 98,99% HNOs. Применявшиеся ранее
железные железнодорожные цистерны требовали для перевозки
добавки к азотной кислоте 10% серной кислоты, и поэтому от
этого вида транспорта повсюду отказались.
2. Серная кислота H2SO4
Водную серную кислоту крепостью до 78% (60° Вё) все еще
получают главным образом в свинцовых камерах, в то время
174
Кислоты, применяемые для нитрации
как высокопроцентную кислоту, преимущественно олеум, полу-
чают почти исключительно контактным способом.
Чистая серная кислота представляет собою бесцветную тяже-
лую маслянистую жидкость, кипящую при 338° и плавящуюся
при 10,5°. Удельный вес 1,84 при 15°. Чистая серная кислота
называется также моногидратом; в противоположность
концентрированной продажной кислоте, так называемой англий-
ской серной кислоте, которая содержит 6—5% воды, моногидрат
представляет собою 100/4 -ную серную кислоту. Однако моно-
гидрат .почти не употребляется для целей нитрации, тем более,
что с тех пор, как введен контактный способ, в продаже широко
распространена 96—97%-ная кислота. 'Перегонкой концентра-
ция серной кислоты может быть доведена лишь до 98,5%.
Раньше моногидрат получали вымораживанием 95—98%-ной кис-
лоты. Теперь к ней добавляют дьгмящую серную кислоту до
полного связывания воды. Концентрированная серная кислота
с жадностью поглощает влагу и поэтому при пребывании на воз-
духе постепенно разбавляется.
При соприкосновении с органическими веществами серная
кислота отнимает от них воду, вызывая побурение и затем обу-
гливание. С водой серная кислота смешивается во всех отно-
шениях. Разогревание при этом настолько велико, что вызывает
вскипание и - выбрасывание жидкости; 50 объемных частей сер-
ной кислоты' и 50 частей воды при смешении занимают объем,
равный всего 97,1 части. При этом вода образует с серной кис-
лотой химические соединения (гидраты).
3. Олеум (дымящая серная кислота)
Концентрированная серная кислота смешивается с серным ан-
гидридом во всех отношениях. При этом образуется целый ряд
соединений, которые различаются по температурам плавления;
все эти соединения имеют свойство отдавать при нагревании сер-
ный ангидрид. Наиболее известна из этих соединений пиросерная
кислота H2SO4 SOs с температурой плавления 35°. Продажная
дымящая серная кислота, или олеум, представляет
собой смесь серного ангидрида и серной кислоты в различных
соотно!шениях.
Для укрепления серной кислоты и составления нитрующей
смеси употребляется большей частью 66%-ный олеум, а иногда
также и 20%-ный.
Следует заметить, что при укреплении серной кислоты или оживлении
нитрующей смеси успех обеспечен лишь при сравнительно небольшом
содержании воды, потому что по уравнению
H2O-f-SO3......................
18 80 ....................
1 4,44......................
= 6,35 (70%) олеума . . . .
= H2SO4
98,09
5,44
7,35 моногидрата
Кислоты, применяемые для нитрации
175
1 кг воды требует для связывания 6,35 кг 70%-ного олеума; при смешении
этих количеств образуется 7,35-кратное количество моногидрата; при же-
лании например из 1 л кислоты удельного веса 1,40 (состоящей из 910 г
HNOs и 490 г НгО) получить безводную кислотную смесь на 490 г воды
требуется 3112 г 70%-кого олеума, и полученная смесь содержит 3602 г,
или 1,96 л, моногидрата и 0,61 л безводной азотной кислоты, т. е. нитрую-
щая смесь содержит слишком много серной кислоты.
ТАБЛИЦА 13
Удельные веса азотной и серной кислот, употребительных
в промышленности концентраций при 15° (отнесенные
к воде при 4° по Л у иге, Рею, Излеру и Нефу)
HNO3
уд. в. кислоты (не содержа- щей воздуха) градусы Вё | I весовой про- цент HNO3 j уд. в. кислоты (не содержа- 1 щей воздуха) 1 градусы Вё 1 весовой про- | цент HNO3 j - 1 1 азотистой ки- ! слоты % ' увеличение ! удельного веса । благодаря на- | личию N2O4 .
1,3325 36,0 52,80 1,500 48,1 94,09 0,25 0,0005
1,3833 40,0 61,92 1,502 48,2 95,08 0,50 0,0007
1,400 41,2 65,30 1,504 48,3 96,00 1,00 0,0030
1,415 42,3 68,83 1,506 48,4 96,76 1,50 0,0067
1,440 44,1 74,68 1,508 48,5 97,50 2,00 0,0105
1,450 44,8 77,28 1,510 48,7 98,10 3,00 0,0180
1,460 45,4 79,98 1,512 48,8 98,53 4,00 0,0252
1,470 46,1 82,90 1,514 48,9 98,90 6,00 0,0395
1,480 46,8 86,05 1,515 49,0 99,07 8,00 0,0532
1,485 47,1 87,70 1,516 49,1 99,21 10,00 0,0660
1,490 1.495 47,4 47,8 •я 89,60 91,60 1,520 49,4 99,67 12,50 0,0820
।
H2SO4 Олеум
3 СО ‘ц? о * * О сх * Я Я о х 'О 0 О Ю г-4 О
с сер? □3 сО CQ = 0 СЮ
О CD X ч § 3S о CW X 4 й •Я СЮ Р- « д
* о g CJ ох и о g о о д- —“ X
CG CQ О Ч
«=[ О Н « «с П о н =3 =
,4 Ч> qj о з; о S ^0
а & ве це а Ci- » СЙ =1 сх я 02 и = «
1,400 41,2 50,11 1,833 65,6 92,97 1,805 10,5
1,500 48,1 59,70 1,835 65,7 93,56 1.915 15 -11,2
1,600 54,1 68,51 1,838 65,8 94,60 1,920 20 —11
1,700 59,5 77,17 1,840 65,9 95,60 1,93 25 - 0,6
1,800 64,2 86,90 1,8410 96,38 1,95 30 15
1,810 64,6 88,30 1,8415 — 97,35 1,97 40 34
176 Кислоты, применяемы? для нитрации
Таблица 13 (окончание)
H2SO4 Олеум
уд. в. кислоты (не содержа- щей воздуха) градусы Вё весовой про- цент H2SO4 уд. в. кислоты (не содержа- щей воздуха) градусы Вё f весовой про- цент H2SO4 | уд. в. при 15° процент SO3 темйература плавления в °C
1,820 65,0 90,05 1,8410 98,20 1,98 50 28
1,825 65,2 91,00 1,8400 — 98,72 2,020 60-65 1
1,830 65,5 92,10 1,8390 — 99,12 2,018 70 9
1,831 65,5 92,30 1,8385 — 99,31 2,014 75 17
2,008 80 22
«Английская» серная кислота, так же как и моногидрат и
олеум (в виде удобного для продажи жидкого 60%-него олеума),
хранится и перевозится в ж е л е з них бочках или, лучше,
в железных цистернах емкостью 10—40 т. Несмотря на чрезвы-
чайную едкость и удушающие свойства дымящей серной кислоты
опасность разложения здесь меньше, чем в случае дымящей
азотной кислоты, где кроме того легко возникает опасность по-
жара и отравления.
Благодаря присутствию окислов азота плотность красной ды-
мящей азотной кислоты изменяется по сравнению с плотностью
бесцветной азотной кислоты чрезвычайно неравномерно. В таб. 13
даны по Лунге и Мархлевско м,у величины, которые
нужно вычесть из удельного веса дымящей азотной кислоты
1,496 (15°), чтобы получить действительный удельный вес содер-
жащейся в ней азотной кислоты в том случае, если известен про-
цент окислов азота.
В то* время как удельный вес не слишком концентрированных
кислот может быть очень точно определен с помощью арео-
метра, удельный вес дымящей азотной кислоты удельного веса
около 1,5 и серной кислоты удельного веса 1,84 определяется
таким путем! недостаточно точно.
Содержание кислот в этом случае следует определять титро-
метрически или с помощью нитрометра (для азотной кислоты).
Так как обыкновенная пипетка не дает достаточно точных ре-
зультатов, то кислоты взвешивают в шаровой пипетке с краном1.
4. Ядовитость кислот
За исключением нитрозных газов, двуокиси азота, являющейся медленно
действующим опасным ядом', кислоты, применяемые в промышлен-
ности взрывчатых веществ, нельзя назвать токсичными в полном
* Т. е. в пипетке Лунге-Рея. Прим. ред.
Кислоты, применяемые для нитрации 177
смысле этого слова, ибо они не действуют ни на нервную систему, ни на
весь физиологический аппарат человека; они являются только едкими
веществами, действующими на кожу и разрушающими клеточную
ткаиь. Однако все без исключения кислоты высокой концентрации являются
очень опасными жидкостями. Особенно вредно действие азотной и дымящей
серной кислоты (олеума). Азотная кислота и нитрующая смесь сжи-
гают кожу, окрашивая ее в желтый цвет; вследствие окислительного дей-
ствия изъязвление в этом' случае происходит скорее, чем от ожога какой,
либо другой кислотой. В равной степени опасен и олеум. Он отнимает
у клеточной ткани воду и сжигает и разрушает ее; подобного рода ожоги
оставляют обычно рубцы, более или менее заметно стягивающие кожу.
Другим опасным свойством этих обеих кислот, особенно олеума, является
их летучесть. На воздухе они дают белый туман, который действует на
слизистые оболочки. Вдыхаемый в большом количестве этот туман разру-
шает ткань легких, вызывая отек. В тяжелых, острых случаях кашель может
вызвать кровотечение и удушье.
К числу наиболее частых несчастных случаев на заводах взрывчатых
веществ относится упомянутое выше отравление нитрозными газами. Легко
выделяющиеся бурые ’пары окислов азота сопровождают почти все про-
цессы нитрации, а также процесс подготовки кислот для нитрации и реге-
нерацию отработанных кислот. Воздух, содержащий 0,5 г N2O4 в 1 л3, при
вдыхании в течение % или 1 часа вызывает опасные для жизни заболе-
вания. Последствия подобного отравления сказываются не сразу, а не ранее
чем спустя несколько часов, а иногда даже дней,— тогда когда оказать по-
мощь уже поздно. При вдыхании нитрозных паров окись азота окисляется
за счет кислорода оксигемоглобина, результатом чего является разложение
крови. В наиболее легких случаях отравление выражается в головокружении,
раздражении дыхательных путей, кашле, бронхиальном катаре. В тяжелых
случаях получается ожог слизистых оболочек, глотательные движения и речь
затрудняются, нарушается деятельность сердца, вызывая ослабление мышц,
носящее характер паралича, и наконец, подобно тому как и при отравлении
фосгеном, наступает смерть от отека легких. Один из самых значительных
несчастных случаев подобного рода произошел в 1897 г., когда от разрыва
одного баллона с азотной кислотой треснул целый ряд подобных баллонов
и 60 пожарных получили тяжелые, а некоторые даже смертельные отра-
вления.
5. Мешка кислот
Хранение каждой кислоты в отдельности и их подготовка для
различных целей нитрации происходит в одном и том же зда-
нии — помещении для мешки кислот. Крупные
заводы взрывчатых веществ в большинстве случаев оборудуются
для этой цели специальной установкой с большим количеством
трубопроводов. Помещения эти обеспечены паровым отопле-
нием для того, чтобы легко замерзающий олеум и в холодное
время года находился в жидком состоянии.
При помощи парового эжектора кислоты из бочек передаются
в монтежю и оттуда передавливаются в смеситель. Следует за-
метить, что при операции смешения ни в коем случае нельзя
подавать олеум и азотную кислоту (кислотную смесь) непосред-
ственно друг за другом, но необходимо включить между ними
подачу серной кислоты, иначе может произойти разогревание и
повышение давления, что является опасным. «Английская» сер-
ная кислота и олеум (обычно 66%) хранятся в толстостенных
12 Зак. 3171, — Штетбахер.
178
Кислоты, применяемые для нитрации
чугунных баках, в то время как для хранения азотной кислоты
употребляются глиняные горшки, а для нитрационной кислотной
смеси — железные хранилища. Употреблению моногидрата ме-
шает его сильная корродирующая способность по отношению
к свинцу, сказывающаяся в разъедании фланцевых, клапанных
и крановых прокладок.
Рис. 79. Железные резервуары для нитрующей смеси; слева видны кера-
миковые резервуары для азотной кислоты (Акц. о-во В of о rs No bel-
ls г и t).
6. Освежение отработанной кислоты
При многочисленных операциях нитрации отработанная кис-
лота (например 'суточная загрузка) собирается в запасные ци-
стерны и после анализа в лаборатории вновь регенерируется
добавлением израсходованных составных частей. Иначе говоря,
состав ее приводится к первоначальному. Такой процесс реге-
нерации, например при производстве нитроцеллюлозы, может
повторяться до тех пор, пока отработанная кислота не загустеет
из-за присутствия большого количества волокон нитроклетчатки
и прочих примесей и не станет непригодной для дальнейшего
употребления. После этого кислоту отправляют на денитрацию,
т. е. из нее удаляется содержащаяся в ней азотная кислота.
Регенерация отработанной кислоты может осуществляться
двумя путями: 1) основываясь на содержании воды, добавляют
Кислоты, применяемые для нитрации
179
смесь 92%-ной азотной и 96%-ной серной кислот в отношении
1 ; 1 или 2) согласно проанализированной средней пробе по со-
ответствующим формулам или графическим методом вычис-
ляются недостающие количества серной кислоты, азотной ки-
слоты и воды, которые следует прибавить к отработанной ки-
слоте, чтобы получить необходимый для нитрации состав
кислотной смеси *•
•
7. Перекачивание кислот насосами
Со времени мировой войны перекачивание кислот было ре-
конструировано: от существовавших до тех пор чугунных
монтежю (или от еще более старых глиняных пульсометров)
все больше и больше стали переходить к вполне оправдавшим
Рис. 80. Центробежный насос нз термнсилида с прямым
приводом от электромотора.
себя центробежным насосам. Как известно, пневмати-
ческие установки работают с очень малым коэфициентом полез-
ного действия; за последнее время появились конструкции на-
сосных установок с производительностью втрое большей, не
говоря уже о чрезвычайно простом и дешевом1 устройстве,
а также и обслуживании.
Обычно при конструировании насосов и арматуры для подачи
азотной кислоты и кислотной смеси отдают предпочтение нержа-
веющей стали V2A, так как она обладает большим механическим
сопротивлением, чем кислотоупорный ферросилиций. Широкому
применению этого мате,риала мешает его высокая стоимость и
дорогая •обработка (она отнимает в 5 раз больше времени, чем
обработка бронзы).
1 Н. Schwarz, Z. f. Schiess- u. Sprw., 1913, 313 (Описание графического
метода Redpath); Berl, Sam 11 eb en u. Boltenstern, Graphik
Mischsaureeinstellung u. Wasserbestimmung, Z. f. angew. Chemie, 1922 270 и
1921, 527.
12-
180
Кислоты, применяемые для нитрации
В настоящее время известны и распространены следующие типы
центробежных кислотных насосов:
из крупповского термисилида, стойкого по отношению к действию сер-
ной и азотной кислот;
из крупповской стали V2A, стойкой по отношению к действию азотной
кислоты; последний тип — с двойным сальником.
Сальник этих насосов во время работы разгружен, т. е. насос рабо-
тает без него; при этом вспомогательным колесом, расположенным во
втулке рабочего колеса, во всасывающей линии создается разрежение.
При Остановке сальник предотвращает возможность просачивания
кислоты из насоса и нагнетательного трубопровода.
Конструктивный чертеж поперечного сечения термисилидного насоса
представлен на рис. 81.
Согласно патенту насосная часть из кислотоупорного мате-
риала помещается 'между двумя чугунными боковыми фланцами.
Рнс. 81. Устройство патентованного кислотного центро-
бежного насоса типа VS из крупповской стали V 2А.
G—напорная камера (сталь V2A); S-—всасывающий штуцер (сталь
V2A); Т1 и Га—флянцы (железо); /?—сток кислоты; D—точно при-
гнанная поверхность, обеспечивающая герметичность; I—опоры для
подшипников.
представляющими собой очень устойчивую и надежную опору;
при таком расположении материал насоса, во-первых, испытывает
лишь давление, не подвергаясь изгибающим и растягивающим
усилиям, и, во-вторых, насос и сальник устанавливаются таким
образом, что они выдаются за пределы фундамента насоса.
Просачивающиеся сквозь сальник капли кислоты попадают в специально
для этого подставленный сосуд, не повреждая чугунных частей насоса и
фундамента.
Все соприкасающиеся с кислотой части насоса изготовляются или из
термисилида, или из V2A. Вал удерживается на месте насадки грундбуксой;
грундбукса имеет термисилидную предохранительную' втулку, которая по
направлению к втулке рабочего колеса снабжена коническим шлифом. Един-
ственное уплотнение, имеющееся в насосе и расположенное между корпусом
насоса и всасывающим патрубком, отшлифовано особым способом и «дер-
жит» даже при наибольшем напоре без набивочного материала.
Кислоты, применяемые для нитрации
181
Ниже дана таблица производительности насосов и потребная для при-
ведения их в действие затрата энергии:
Производительность Высота подъема манометри- ческая Число оборотов Расход энергии Мощность мотора Центробежный кислотный на- сос из
крупповского термиснлида крупповской стали V2A
100 л!мин 19 м 1450 6,8 л. с. при уд. в. 1 7,5 л. с. 750 л/мин 25 м 2850 6,5 л. с. при уд. в. 1 7,5 л. с.
Центробежные кислотные насосы находят себе применение
для (производительности до 3000 л/ммн и высоты подъема до
40 м, в то время как для перекачивания небольших количеств
серной кислоты (до 200 л/мян) на высоту до 40 м вполне доста-
точны коленчатые насосы, ибо перекачка небольших
количеств кислоты на большую высоту центробежными насосами
экономически невыгодна. Недавно для подачи азотной кислоты
на башни Гловера в сернокислотном производстве начали при-
менять поршневые насосы из стали V2A со строго определен-
ной производительностью. В кислотной промышленности в дан-
ное время идет борьба мнений о преимуществах и недостатках
центробежных насосов без сальника и с сальником. Высокоустой-
чивые кислотоупорные насосы (например системы Весселинг) не
имещт ни сальника, ни каких-нибудь набивочных 'Материалов.
Однако подобной устройство, особенно при продолжительной
работе, функционирует не всегда безукоризненно, и при оста-
новке нагнетательный трубопровод начинает пропускать кислоту.
Такие конструкции более сложны, чем конструкция насосов
с сальником, в которых разрежение во всасывающей линии, пре-
пятствующее просачиванию кислоты, также создается с помощью
вспомогательного колеса во втулке рабочего колеса. Указанные
выше сальники двойного действия работают преимущественно
при остановке насоса.
Согласно компетентным данным срок службы кислотных цен-
тробежных насосов без сальника и с сальником при работе круг-
лые сутки без ремонта равен 1—2 и даже 3>у2 годам.
8. Денитрация. Регенерация кислот
Описываемая установка регенерации кислот включает:
1) д е н ит р а ц и о н н у ю установку, где одновременно
с разделением отработанных кислот может подвергаться
концентрации получаемая при этом разбавленная азотная кислота;
182
Кислоты, применяемые для нитрации
2) абсорбционную установку;
3) установку для концентрации серной кислоты, получаемой
в результате денитрации слабой серной кислоты;
4) хранилище для кислот.
Схема действия установки следующая.
Денитрационная колонна представляет собой аппарат, в который отра-
ботанная кислота вводится сверху и стекает с тарелки на тарелку через
сифонные трубки, в то время как снизу в колонну поступает греющий пар.
Пар подымается вверх в направлении, противоположном движению отрабо-
танной кислоты, и при помощи особых устройств на тарелках интенсивно
перемешивается с отработанной кислотой. Отработанная кислота жадно по-
глощает воду, и освобождающаяся при этом теплота конденсации водяных
паров вызывает испарение азотной кислоты и остальных нитрозных со-
ставных частей; пар насыщается азотной кислотой и выходит из колонны
сверху, состоя главным образом из азотной кислоты и нитрозных газов.
Серная же кислота, вытекающая из колонны снизу, практически свободна
от азотной кислоты. Выходящая из верхней части колонны смесь газа
и пара конденсируется в конденсаторе. Образующаяся при этом азотная
кислота имеет максимальную крепость, какая может быть получена, исходя
из отработанной кислоты данного состава. Не конденсирующиеся нитрозные
газы поступают в абсорбционную установку, где и улавливаются, образуя
примерно 50%-ную азотную кислоту.
Денитрационная колонна может быть использована в качестве
аппарата для концентрации азотной кислоты.
Для этой цели в аппарат вводится азотная кислота, полученная
при денитрации, и 95%-ная серная кислота. При этом в колонну
снизу подается пар, и происходит тот же процесс испарения и
концентрации азотной кислоты» как и при денитрации. Однако
в этом случае вместо разбавленной отработанной кислоты упо-
требляется концентрированная серная кислота; вследствие этого
из колонны выделяются пары азотной кислоты высокой концен-
трации, конденсируемые в холодильнике, причем получается го-
товая концентрированная азотная кислота. Серная кислота выте-
кает из колонны снизу, свободная от азотной кислоты.
Процесс получения высококонцентрированной серной кис-
лот ы по одному новому способу основывается на том, что
в соответственной величины сосуде из кислотоупорного ферро-
силиция испаряется 95%-ная серная кислота’ и смесь серная
кислота—'Водяной пар поступает в ректификационный
аппарат, работающий по принципу противотока; бла-
годаря этому пары серной кислоты полностью конденсируются
при одновременном испарении эквивалентного количества воды.
В прежних способах смесь паров вследствие меняющегося содер-
жания паров воды подвергалась фракционированной
конденсации.
Работа аппарата является как бы идеальной, т. е. он расхо-
дует лишь теоретически необходимое количество энергии для
испарения и вместе с тем не дает потерь серной кислоты.
Концентрируемая в денитрационных колоннах азотная кис-
лота передается на установку для мешки кислот и может не-
медленно итти на составление нитрующей смеси.
ДТП
Рис. 82. ДениТрационная установка с концентрацией азотной и серной кислот.
П Й Й
184
Кислоты, применяемые для нитрации
Концентрированная серная кислота с концентрационных уста-
новок поступает на заводы азотной кислоты и используется там
для концентрации азотной кислоты, постоянно совершая замкну-
тый цикл операций и вновь возвращаясь на установку для кон-
центрации серной кислоты.
При денитрационной установке находятся хранилища для
отработанных кислот, а также для слабых и крепких кислот.
Хранимые здесь запасы служат для удовлетворения текущих
нужд производства.
9. Металлы и материалы для аппаратуры в производстве
взрывчатых веществ
В то время как раньше в промышленности взрывчатых ве-
ществ, там, где имели дело с кислотой или кислой водой, прихо-
'дилось обходиться керамикой, эмалированным чугуном или свин-
цом, в настоящее время все больше и больше находит примене-
ние алюминий и особенно кислотоупорный ферроси-
лиций, а также кислотоупорные и нержавеющие
сплавы.
Алюминий оказывается тем более пригодным, чем он чище
(99—99,5%) и чем концентрированнее азотная кислота (выше
1,33 или 53% НЬЮз). Алюминий используется для трубопрово-
дов и хранилищ азотной кислоты любой концентрации; в отли-
чие от теплой и горячей кислоты холодная кислота практически
не разъедает алюминия. Однако чистый алюминий до сих пор
оказывался непригодным для конструирования нитрационных
аппаратов.
Необходимо отметить, что в случае резервуаров или труб
подъемных устройств кислота, удерживающаяся на стен-
ках, поглощая влагу воздуха, быстро разбавляется и после этого
разъедает защитный слой окислов. Алюминий находит постоян-
ное и обширное применение в производстве нитроклетчатки; из
алюминия готовятся кожух и крышка нитрационных центрофуг,
а также вытяжные зонты над ними и промывные устройства,
в которые продукт после нитрации передается из центрофуги
с помощью алюминиевых вил. Сплав чистого алюминия
с 2% марганца1 обладает такою же кислотоупорностью, как и
чистый алюминий, но лучшими механическими свойствами.
Нержавеющая кислотоупорная сталь фирмы Крупп делится на
4 группы сплавов. Группа VM содержит 13—15% хрома, 0,5—2%
никеля и около 0,5% углерода; группа V2A — 18—25% хрома
и 8—9% никеля (тем. пл. 1450°), тогда как стали V4A и V6A со-
держат еще кройе того молибден или медь.
Новый крупповский сплав нироста с высоким содержанием
углерода и соответственно высоким содержанием хрома, а также
1 Die cbemische Fabrik, 1931, 493.
Кислоты, применяемые для нитрации 185
с примесью никеля в общем имеет ту же область применения,
что и V2A. Крупные американские фирмы химической промыш-
ленности недавно занялись испытанием различных сталей, кото-
рые лучше всего применимы в промышленности азотной кислоты.
Оптимум соответствует содержанию 16—17% хрома и 7% никеля
и некоторому проценту остальных составных частей. Богатый
цифровой материал дает произведенное Везером1 исследова-
ние о применении и пригодности алюминия, сталей, металлов VA
и ферросилиция в технике азотной кислоты.
Крупповский термисилид с большим содержанием кремния
(16%) чрезвычайно стоек по отношению к серной и азотной
кислотам, однако благодаря высокому содержанию кремния не-
сколько хрупок и довольно тверд и поэтому поддается обра-
ботке только шлифовкой. То же самое относится и к другим,
маркам ферросилиция — ацидуру (Azidur), дурациду (Durazid) и
антациду (Antazid).
Термисилид-экстра содержит еще больше кремния,
чем обыкновенный термисилид. Большие преимущества терми-
силида перед обычным ферросилицием состоят в высокой хими-
ческой стойкости и в физической однородности при сравни-
тельно небольшой хрупкости и твердости и отсутствии вредных
напряжений в материале. Термисилид является по некоторым
данным единственным сплавом Fe-Si, для которого, применяя
силикатную теорию Вальтера, удалось достигнуть полного
расплавления тпихты, сопровождаемого тончайшим распределе-
нием кремния, вследствие чего структура этого сплава чрезвы-
чайно плотна и однородна.
Сравнительная таблица физических свойств нержавею-
щей стали, ферросилиция и чугуна
* V2A Терми- силид Антацид Чугун
Температура плавления Удельный вес Твердость пр Бринелю Изгиб в мм 200-лгл бруска диаметром 12 мм .............. Теплопроводность (по отношению к чу- „ ГУНУ) Электропроводность 1400-1450° 7,86 150-180 0,04 0,7—0,8 1220° 6,9 290-350 1,0 0,5 0,05 1250° 7 310-320 0,6 1,0 1150° 7 150-250 2,0—2,4 1,0 1,3-2,0
В какой мере нержавеющая сталь и кислотоупорный ферро-
силиций вытеснили в настоящее время ранее употреблявшиеся
материалы, видно из рис. 82: башни, колонны, котлы - и насосы
1 Там же, 1928, 529 и 544.
186 Кислоты, применяемые для нитрации
любой формы и размеров, изображенные на этом рисунке, изго-
товлены преимущественно из этих материалов, обладающих
большим механическим сопротивлением и удовлетворяющих всем
требованиям в термическом отношении. Чаши, трубы, запорные
вентили, краны всех видов и в особенности кислотные центро-
бежные и коленчатые насосы, изготовляются в настоящее время
не из керамики, свинца или бронзы, а из термисилида и
стали V2A.
ГЛАВА ШЕСТАЯ
ПИРОКСИЛИН (НИТРОКЛЕТЧАТКА)
При возникновении производства пироксилина пришлось пре-
одолеть такие препятствия, как ни для одного другого взрывча-
того вещества. Потребовалась целая четверть века на выполне-
ние ряда работ исследователями разных стран, пока это ориги-
нальное волокнистое взрывчатое вещество сделалось пригодным
для применения и пока были найдены многочисленные средства
и способы', которые сколько-нибудь гарантировали от взрыва при
продолжительном хранении продукта. Сколько нибудь! — по-
тому что твердого критерия для суждения об абсолютной стой-
кости нитроклетчатки все еще не было, а при дальнейшем расши-
рении области применения этого взрывчатого вещества в связи
с неожиданными катастрофами обнаруживались все новые и но-
вые загадочные особенности в поведении этого своеобразного
сложного эфира. Частые взрывы на военных заводах, особенно
на французских, имевшие место за последнее десятилетие, явля-
лись следствием саморазложения пироксилинового пороха. И
в настоящее время стоящее на очереди изучение проблемы пи-
роксилинового пороха в смысле изыскания легкого и безопасного
способа его стабилизации и выбора надежного метода анализа
нисколько lie потеряло своей остроты.
Производство пироксилина требует большого количества
вспомогательных аппаратов и длительного технологического про-
цесса, в котором все операции должны проводиться одинаково
тщательно и основательно. Процесс производства пироксилина
делится на следующие основные стадии.
1. Очистка хлопка (или древесной целлюлозы):
а) переборка и предварительная очистка;
б) обезжиривание кипячением со щелочами (бучение) или
обработка древесины бисульфитом кальция.
в) отбелка хлорной известью или гипохлоритом натрия,
г) промывка и
д) сушка клетчатки.
2,^-1итрация клетчатки:
а) нитрация в центрофугах или горшках и следующая непо-
средственно за этим отжимка отработанной кислоты
в центрофуге,
б) предварительная промывка нитроклетчатки.
188
Пироксилин (нитроклетчатка)
3. Промывка и стабилизация пироксилина:
а) промывка путем кипячения в течение нескольких дней
в воде,
б) измельчение пироксилина в голландерах,
в) нейтральная промывка в лаверах с просеиванием мезги,
г) стабилизация в чанах кипячением с известковой водой,
д) отжимка и сушка.
4. Прессование влажного пироксилина.
I. Клетчатка
Исходным материалом для производства пироксилина
является целлюлоза, называемая также клетчаткой. Чем чище
клетчатка, тем чище нитроклетчатка, тем больше выход. Наи-
более чистой формой естественной клетчатки является хлопок,
волокна которого в сыром (неочищенном) виде содержат до
83—87% целлюлозы, т. е. чистой клетчатки; остаток состоит из
нецеллюлозных примесей и других веществ растительного про-
исхождения, как то: высохших остатков клетчатки, кожуры, про-
топлазмы, растительного клея, растительных жиров и масел и
смолистых веществ; в хлопчатобумажных концах кроме того
могут содержаться грязь, пыль, машинное масло, металлические
предметы. Со времени войны, наряду с хлопком и его отбро-
сами, стала применяться древесная целлюлоза главным образом
в форме целлюлозы так называемой сульфитной варки. Состав
обоих видов сырья дан в следующей таблице1:
Целлюлоза................
Протеин .................
Вода ................. . .
Экстрактивные вещества, не
содержащие азота . . . .
Жир.......................
Зола..................
Смолы.................. .
Гемицеллюлоза и пентрзан .
Хлопок-сырец Сульфит-
(американский) целлюлоза
В процентах
83,71 1,50 6,73 75,6-80 9,0—12,0
5,79 —
0,61 —.
1,65 0,1— 0,3
— 0,5- 0,6
— 10,0—14,0
Химический состав целлюлозы до сих пор еще не вполне вы-
яснен. Не только величина молекулы, но и ее эмпиричес^й со-
став еще спорны. Предполагают, что молекула целлюлозы пред-
1 S t е u d е, Baumwolle u. Zellstoffe fur Nitrocellulosefabriken, Nitrocellulose,
1930, 194.
I. Клетчатка
189
ставляет собой комплекс неопределенного числа глюкозных
остатков, соответствующий формуле (C6HieOs)n. В такой про-
стейшей форме целлюлоза оказывается спиртом с тремя гидро-
ксильными группами, причем альдегидные группы как таковые
отсутствуют. В соответствии с новейшими достижениями в об-
ласти химии клетчатки и рентгеновского анализа в настоящее
время согласно Мейеру и Марку1 можно предполагать,
что 100—200 глюкозных остатков соединяются посредством
f-глюкозидных связей в одну прямую цепь и что 40—60 подоб-
ных цепей главной валентности располагаются параллельно друг
другу и под влиянием мицеллярных сил образуют пучок (элемен-
тарное вещество, мицеллу) толщиною в 60 А. Этой точке зрения
противопоставляется теория Ш т а у д и н г е р а 2, положенная
автором этой книги в основу объяснения строения гелей, обра-
зуемых .нитроглицерином, и изложенная на стр. 332.
Чистая клетчатка из хлопка (американский стандартный про-
дукт) содержит до 99,84% а-целлюлозы 3, 0,11% золы и ничтож-
ную примесь оксицеллюлозы, соответствующую медному
числу 0,17%.
Чистая клетчатка чрезвычайно гигроскопична. Высушивание
до постоянного веса удается достигнуть лишь в эксикаторе над
пятиокисью фосфора. Волокно имеет удельный вес 1,61 и выше
150° начинает разлагаться с побурением.
Оксицеллюлоза получается при непосредственном окислении
целлюлозы хлорной известью, азотной кислотой, перманганатом
или перекисными соединениями; волокна целлюлозы при этом
легко превращаются в порошок. Едкий натр вызывает укорачи-
вание целлюлозных волокон, и после отмывки щелочи получается
гидрат целлюлозы. При гидролизе целлюлозы образуется
гидроцеллюлоза.
Целлюлоза нерастворима в обычных растворителях, легко рас-
творима в аммиачном растворе окиси меди и смеси
хлористого цинка с соляной кислотой и выпадает при нейтра-
лизации этих растворов в виде студня. Промытая спиртом цел-
люлоза представляет собою аморфный белый порошок. В этом
виде она менее стойка к действию большинства химических реа-
гентов, чем исходная целлюлоза.
Наилучш1И1М материалом для пирсийсилиновых заводов яв-
ляются'отходы бумагопрядильных фабрик. Если эти отходы не мо-
гут быть доставлены <в достаточном количестве и по приемлемой
цене, то на втором месте по пригодности в качестве сырья для
производства пироксилина стоят отходы хлопка, в том числе так
называемый линтер— очень тонкие короткие волокна, которые
1 Physik и. Chemie der Cellulose, Берлин 1932 (330 стр., 145 рис.).
2 Die hochmolekularen organischen Verbindungen, Берлин 1932 (540 стр.,
ИЗ рис.).
3 Та часть природных препаратов целлюлозы, которая не растворяется
в 17—18%-ном едком натре. Прим. ред.
190
Пироксилин (нитроклетчатка)
покрывают семя хлопчатника и остаются на нем после-съема
длинноволокнистого хлопка. Хотя в линтере больше примесей,
чем в длинноволокнистом хлопке, но при соответствующей пред-
варительной обработке этот материал, так же как и неочищенная
древесная целлюлоза, дает одинаково хороший пироксилин.
Исходный материал, прежде чем поступить в нитрационное отде-
ление, должен быть подвергнут основательной механической
очистке и последующей химической обработке. Для обезжири-
вания применяется раствор щелочи. Путем обработки каусти-
ческой содой, отбеливания и промывки хлопок превращается
в чистую целлюлозу; по новейшим усовершенствованным мето-
дам^ удается получить хлопок, содержащий, наряду с минималь-
ным количеством окси- и гидроцеллюлозы, всего 0,2—0,3% ве-
ществ, растворимых в эфире.
Нитрация необработанного хлопка-сырца связана с большой
опасностью: этот процесс сопровождается бурным выделением
тепла вследствие окисления примесей, в связи с чем неизбежно
саморазложение и воспламенение содержимого центрофуги;
кроме того образуются лабильные азотнокислые эфиры, понижаю-
щие стойкость нитроклетчатки при хранении или по крайней
мере чрезвычайно усложняющие процесс стабилизации. Далее,
благодаря содержанию жиров и масел волокно хлопка окружено
тонкой жировой оболочкой, которая препятствует равномерному
прониканию и смачиванию волокна кислотой, а следовательно и
равномерной и полной нитрации целлюлозы. Примеси металлов
также являются вредными, так как металлы при нитрации обра-
зуют пропитывающие волокна трудно удаляемые соли, которые
в уже промытом пироксилине являются катализаторами, уско-
ряющими разложение.
Основные операции очистки хлопка могут подвер-
гаться изменениям как в отношении выбора реагентов, так и
концентрации щелочи. Практикуемый в настоящее время про-
цесс очистки хлопка и служащий для этой цели аппарат опи-
сывает Эрбан1.
Рыхлые волокна — линтер или хлопчатобумажные отбросы — в количе-
стве до 1000 кг загружают для предварительной обработки и кипячения
в бучильный котел диаметром 2 м и высотой 2 .ч. Загрузка длится около
% часа; при помощи остроумного приспособления содержимое котла при-
водится в непрерывное движение и постепенно нагревается до высокой тем-
пературы. Размягченный материал кипятится со свежим щелоком без до-
ступа воздуха при повышенном давлении в течение 4—6 час.; при этом
достигается полное обезжиривание и разложение примесей. В этом же
котле материал промывается водой и обрабатывается затем в снабженном
приспособлением для перемешивания отбельном чане в течение 2—4 час.
слабым прозрачным раствором, хлорной извести или гипохлорита натрия
(2 г хлора на 1 л). Затем следует основательная промывка водой, получа-
совая кисловка. (SOa вместо H2SO4) при перемешивании и еще одна про-
мывка водою. Наконец хлопок из отбельного чана попадает в промыв-
1 Kunststoffe, 1911, 1, затем Baumwollreinigung filr die Herstellung rauch-
loser Pulver: Army Ordnance, 12, стр. 255—257.
I. Клетчатка
191
и ой аппарат, где он вновь механически промывается, автоматически
выбрасывается и после отжимки пропускается через трепальную ма-
шину и поступает в сушильный аппарат, где высушивается в токе горя-
чего воздуха. Отсюда хлопок может быть непосредственно передан в отде-
ление нитрации. Сушка в вакууме теперь уже не применяется.
В результате подобной обработки волокна хлопка приобретают чистый
белый цвет, освобождаются ют окси- и гидроцеллюлозы, содержат очень
небольшие количества жировых веществ и золы и способны легко смачи-
ваться. Американский хлопок содержит 0,10% золы и 0,11% жира, ост-
индский всего 0,07% золы и 0,06% жира.
Во время войны, наряду с хлопком, стала применяться в боль-
ших масштабах древесная целлюлоза. Первая попытка
приготовления нитроклетчатки из древесной целлюлозы была
сделана Шульце, который в 1865 г. получил белый порох, так
называемый порох Шульце. Впоследствии от древесной
клетчатки, как от исходного материала, отказались главным обра-
зом из-за необходимости обрабатывать большое количество дре-
весины и из-за содержания в ней трудно отделимой древесной
смолы, которая сильно ухудшает стойкость получаемой нитро-
клетчатки. Однако под давлением военных нужд это препятствие
быдр преодолено, и оказалось, что при подходящей химической,
обработке можно получить древесную клетчатку, которая так же
пригодна для производства пироксилина, как и хлопок Ч Измель-
ченная древесина подвергается сначала химической обработке,
т. е. освобождается от инкрустирующих веществ и от лигнина.
Это лучше всего достигается варкой под давлением с раствором
бисульфита кальция. Л
Древесная клетчатка доставляется в виде бумаги;
при погружении в нитрующую смесь она должна немедленно
пропитаться последней, не принимая кашицеобразной консистен-
ции, не расползаясь и не разлагаясь; в древесной клетчатке
должно содержаться не более 1% золы, экстрагируемых спир-
том веществ — -не более 0,5%, смолистых веществ — не более
1% (на сухое вещество).
Требования, предъявляемые к очищенному хлопку
Хлопок должен быть однороден, должен содержать лишь не-
значительное количество пыли, семян, семенных коробочек и
прочих примесей. 1 г такого хлопка (в слетка подпрессованном
виде должен в течение 3 мин. тонуть в нитрационной смеси. Во
время нитрации он не должен разбухать или переходить в каши-
цеобразное состояние, а также не должен разлагаться.
Содержание влаги должно быть не выше 9%, при
более строгих требованиях—не выше 6%, а в сухом хлопке,
поступающем на нитрацию, от 0,5 до максимум 1%. При извле-
чении эфиром в аппарате Сокслета в течение 4 час. хлопок дол-
жен давать не более 0,9% (по' принятым во Франции требова-
1 См. обстоятельную статью Шримпфа, Nitrocellulose aus Baumwolle
u. Holzstoff, Z. f. Schiess- u. Sprw., 1919 (оттиск).
192
Пироксилин {нитроклетчатка}
ниям 0,3—0,7%) жира. Содержание хл.ора допускается лишь
в виде следов, а золы — до 1%. Содержание смолистых ве-
ществ, т. е. веществ, подобных древесной смоле, растворимых
в едком натре, не должно превышать 2% Ч
До каких размеров поднялось потребление хлопка во время
войны, можно судить по количеству хлопка, потребовавшегося
в 1916 г. для военных целей и составившего в одной лишь Аме-
рике 440 000 000 фунтов.
II. К теории образования нитроклетчатки
Нитроклетчатка представляет собой смесь продуктов
различной степени нитрации целлюлозы. Даже высоконитро-
ванный и хорошо очищенный пироксилин содержит, помимо не-
органических веществ в количестве до 1%, несколько десятых
долей процента растворимых в спирте низконитрованных продук-
тов и по крайней мере 1% растворимой в спирто-эфирной смеси
нитроклетчатки, обладающей незначительной взрывчатой силой.
Таким образом содержание азота изменяется в широких пре-
делах и лишь в среднем соответствует определенным соотноше-
ниям, требуемым формулой. Состав нитроклетчатки остается
неопределенным и неясным, так же как и состав самой цел-
люлозы.
Различают следующие степени нитрации (табл. 14).
ТАБЛИЦА 14
Сводка нитратов целлюлозы (пироксилинов)
[С24Н40—и (NOg^C^oJ-p
Степень нитрации Формула Содержание азота Недостаток кислорода2 Молекулярный! вес j
В про центах
Додека-нитроцеллюлоза (0N02)12 14,146 24,2 1188,3
пирокси- (Эндека-нитроцеллюлоза. 6-24 ЧгзОя (ONl-Mu 13,48 28,7 1143,3
™н (Дека- (-24'~'зо01о(ОМ02)10 12,76 33,5 1098,3
Колло дион- (Энне а- к Г-24Нз10п(ОМ02)9 11,97 38,7 1053,3
НЫЙ ХЛОПОК 1 Окто- '-24Пз2О12(О N (J2)g 11,12 44,4 1008,3
Гепта- , О2)7 10,18 — 963,3
Гекса- „ 6-24 Цн1-1и2)6 9,15 — 918,3
Целлюлоза (клетчатка) [СуН^Ода], или (С6Н10О5)я - 117,8 648,3
1 Выполнение этих, а также и других определений описано с исчерпы-
вающей полнотой в книге Каст и М е ц, Химические исследования взрыв-
чатых и воспламенительных веществ, Госхимтехиздат, 1934.
2 Соответственно линейной пропорциональной зависимости между со-
держанием N и недостатком О можно, зная содержание N в процентах, по
формуле О% — Ы% • (—6,6606) + 118,456 вычислить недостаток кислорода
в процентах в смеси нитратов целлюлозы.
//. К теории образования нитроклетчатки
193
Ниже геисанитроклетчатыи были получены пента-, тетра-, три-
и динитроклетчатки, которые не имеют значения во взрывной
технике. Продукт высшей степени нитрации целлюлозы с содер-
жанием не менее 12,76% N обычно носит название пирокси-
лина.
С уменьшением содержания азота нитроклетчатка приобре-
тает другие, практически чрезвычайно ценные свойства: она на-
бухает и растворяется в спирто-эфирной смеси (1:2), а в смеси
с нитроглицерином или нитрогликолем дает однородный про-
зрачный студень, так называемый гремучий студень. Этот
растворимый сорт нитроклетчатки называется коллодионным
хлопком. Типичным представителем коллодионного хлопка
является эннеанитрат целлюлозы с содержанием азота около
12%. Однако растворимость не является резко выраженной ха-
рактеристикой, так как продукты как высшей, так и, наоборот,
низшей степени нитрации целлюлозы тоже обладают этим свой-
ством, но в меньшей степени. Лунге и Беби нашли следую-
щую зависимость между содержанием азота и растворимостью
нитроклетчатки.
Содержание азота и растворимость нитроклетчатки
Содержание азота в % 9,31 9,76 10,93 11,59 12,05 12,31 12,58 12,76 13,21 13,65
Растворимость в спирто-эфирной смеси в о/п . . . 1,15 74,22 99,82 100,02 99,84 99,14 60,00 22,01 5,40 1,50
Коллодионный хло- пок (франц СР2) Пироксилин (франц. СР,)
Если растворимость лишь до известной степени свя-
зана с определенным содержанием азота, то она в силь-
ной степени зависит от состава и продолжительности действия
нитрующей смеси; с увеличением содержания воды в нитрующей
смеси увеличивается растворимость, и одновременно умень-
шается вязкость продукта нитрации. Для производства колло-
дионного хлопка наиболее подходящее содержание воды равно
16%. В более разбавленной нитрующей смеси с 18,5% воды
волокна хлопка начинают внешне изменяться; при еще большем
разбавлении (22,5—-28%) волокна быстро разрушаются и превра-
щаются, даже при низкой температуре, в желатинообразную,
непригодную к употреблению массу, содержание азота в кото-
рой ниже 8%.
Этим данным, считавшимся в течение десятилетий нормаль-
\ ними, Ленце1 и Рубенс недавно противопоставили данные
1 Ueber die Darsteilung von Nitrocellulose mit hochstem fj-Gehalt u. hoher
Losiichkeit in Aether-Alkohol, Z. f. Schiess- u. Sprw., 1932, 154.
13 Зак. 3171. — Штетбахер.
194
Пироксилин {нитроклетчатка)
своих поразительных опытов, согласно которым нитроклетчатка
с 13,5% N еще полностью растворяется в спирто-эфирной смеси
и в количестве до 25% — в спирте. Такая необычайная раство-
римость была получена при нитрации в течение 20 дней при 20°
смесью, состоявшей из дымящей азотной кислоты (1,52) и 40%
фосфорного ангидрида. Продолжительность нитрации может
быть сокращена до 2 дней, если нитровать при 35—40°. Более
высокая растворимость получается, если исходить из уже про-
нитрованной, обработанной кипячением под давлением нитро-
клетчатки.
В табл. 15 приведен ряд опытов по нитрации, проведенных
Л у н г е.
Нижние три столбца относятся к важнейшим соотношениям
кислотных смесей, получаемым на практике.
Соотношение между нитрационной смесью
продуктом
ТАБЛИЦА 15
и конечным
Состав нитрующей смеси Выход Раствори- мость Азот
H2SO4 HNOg Н2О
В процентах
31,86 35,82 22,32 134 14,22 9,27
38,47 40,19 21,34 142 92,30 10,32
42,92 37,40 19,68 153 98,90 11,02
48,03 34,18 17,79 155 99,58 12,33
49,37 33,38 17,25 166 99,82 12,77
50,71 32,50 16,79 165 99,32 13,02
52,81 31,27 15,92 167 7,65 13,11
54,92 30,06 15,02 173 2,63 13,45
65,35 25,3 11,34 Наивысшая достижимая
степень нитрации . . . 13,92 i
61,00 23,00 16,00 Коллодионвый хлопок для
балистических целей и желатинирования . 17,7—12,3
59,5 24,5 16,00
67,2 22,2 10,6 Пироксилин для взрыв-
ных целей 13,3
1 Ленце путем тщательного повторения этого опыта достиг наивыс-
шего содержания N —13,6%; более высокие степени нитрации могут быть
получены только при прибавлении к азотной кислоте №Оз и PaOs.
П. К теории, образования нитроклетчатки 195
100 ч. хлопка при нитрации 3500 ч. нитрующей смеси со-
става, указанного в последнем столбце, дают 165 ч. раствори-
мого в спирто-эфирной смеси в количестве около 6% пирокси-
лина с содержанием азота 13,3%.
Этерификация целлюлозы азотной кислотой предста-
вляет собой сложный процесс, зависящий от многих условий.
Благодаря установлению состояния равновесия между нитра-
тами целлюлозы и кислотной смесью степень нитрации клетчатки
определяется концентрацией не исходной, а конечной кис-
лоты. Чистая азотная кислота никогда не применяется для нитра-
ции, так как вследствие разбавления ее водой, выделяющейся
при нитрации клетчатки, ее нитрующая способность падает.
Высококонцентрированная 97%-ная азотная кислота (1,5) дает
продукт с 9,05% азота; средней крепости азотная кислота (1,4)
почти не способна нитровать. В целях удаления образующейся
воды Ш ё н б е й н предложил добавлять концентрированную сер-
ную кислоту и применил смесь из 2 ч. концентрированной сер-
ной кислоты и 1 ч. дымящей азотной кислоты. Серная кислота
связывает воду, поддерживая в течение долгого времени постоян-
ную концентрацию азотной кислоты, результатом чего является
более высокая степень нитрации и лучший выход. Содержание
воды в кислотной смеси является решающим для данной степени
нитрации и для качества нитратов..
Согласно исследованиям Сапожникова предел этерифи-
кации достигается, как только вся азотная кислота переходит
в соединение Н!ЧОз • НгО.
Химическое действие серной кислоты выражается тогда ура-
внением:
'НЬЮз • Н2О + H2SO4 = HNO3 + H2SO4 НгО.
Связывание образующейся в процессе реакции воды — не
единственная роль, которую играет серная кислота в реакции
нитрации; образуются также промежуточные эфиры серной
кислоты и целлюлозы, которые при дальнейшей нитрации
вытесняются азотной кислотой. Однако такое замещение не
всегда бывает полным. Новейшие исследования показали, что
с увеличением содержания серной кислоты в нитрующей смеси
увеличивается также содержание серы в конечном продукте и
что сернокислые и азотнокислые эфиры целлюлозы образуются
параллельно, а также что результатом большого избытка серной
кислоты является образование нерастворимого сернокислого
эфира целлюлозы, который нельзя удалить из нитроклетчатки
ни промывкой, ни кипячением. Одновременное образование
обоих эфиров целлюлозы иллюстрирует следующая серия
опытов:
13*
196
Пироксилин {нитроклетчатка)
HsS04: HNO» Продолжи- тельность нитрации Содержание N Содержание H2SO4
В пре шентах
1: 1 1 час 13,64 0,79
3:1 1 , 13,35 1,01
8:1 6 „ ' 10,72 4,33
8:1 10 дней 13,31 2,03
Согласно данным Гака и Белла стойкость пироксилина в зна-
чительной степени зависит от содержания сернокислых эфиров
в том смысле, что нерастворимые, остающиеся в волокнах серно-
кислые эфиры могут привести к разложению (при хранении).
Кроме серной кислоты другим фактором нестойкости пиро-
ксилина считали эфиры азотистой кислоты. Однако это
предположение оказалось необоснованным, так как эфиры азо-
тистой кислоты и целлюлозы нестойки и при стабилизации (ки-
пячении) разрушаются и удаляются еще скорее, чем эфиры сер-
ной кислоты.
В ы с о к о а з о т н а я нитроклетчатка с содержанием
азота до 14%
До сих пор еще не получен нитрат с содержанием 14,146%
азота, что соответствует формуле продукта высшей степени
нитрации клетчатки — тринитроклетчатке. Согласно
Л е.н ц е 1 содержание азота можно довести до 14% и выше, если
нитрацию вести дымящей азотной кислотой с добавлением 20—
40% пятиокиси фосфора, между тем как по данным Б е р л я и
Р у е ф ф а 2 достаточно прибавить фосфорную кислоту, чтобы
легко получить нитроклетчатку, содержащую 13,7—14,0% азота.
Наивысшее содержание азота 14,09% получил Ленце непосред-
ственной нитрацией линтера при 203 в течение 5 час.; линтер
предварительно был подвергнут кипячению в течение 5 час.
с 50%-ным раствором бисульфата натрия в автоклаве при 150°;
нитрация велась азотной кислотой удельного веса 1,52 с добавкой
35—40% пятиокиси фосфора. Соотношение хлопка и нитрую-
щей смеси составляло 1 :60. При экстракции полученного
подобным способом пироксилина метиловым спиртом получается
продукт высшей степени нитрации с содержанием
азота 14,12%.
Это исключительно высокое содержание азота является, ве-
роятно, следствием уменьшения величины мицеллы целлюлозы
1 Z. f. Schiess- u. Sprw., 1931, 3; затем Ленце и Рубенс, там же, 1932,
114 и 154.
2 Вег., 1930, 3212.
III. Производство пироксилина
197
в результате тщательной предварительной обработки хлопка
в автоклавах, во время которой освобождаются и приобретают
способность образовывать эфиры спиртовые гидроксильные
группы.
Полученный с помощью смеси фосфорной и азотной
кислот пироксилин оказался, несмотря на высокое содержание
азота, совершенно стабильным даже при непродолжитель-
ном кипячении, в противоположность обычному пироксилину,
полученному нитрацией смесью, содержащей серную кислоту.
Благоприятное действие фосфорной кислоты основывается на
том, что. она вызывает сильное набухание волокна хлопка (мер-
серизацию) и этим облегчает проникновение азотной кислоты
в мицеллы целлюлозы; кроме того фосфорная кислота.в отличие
от серной кислоты не образует эфиров и не действуем омыляю-
щим или расщепляющим образом на образующиеся нитраты.
Несмотря на все преимущества, фосфорная кислота не приме-
няется из-за высокой стоимости ее и из-за того, что в ее при-
сутствии скорость этерификации уменьшается.
Согласно новейшим опытам Демужена1 для достижения
высшей степени нитрации хлопка наиболее благоприятен сле-
дующий состав нитрующей смеси: 67—68% H2SO4; 22—23%Н!ЧОз
и 10,2—10,49с НгО и для вполне растворимой, нитроклетчатки 2
63% H2SO4, 21—21,5% HNO3 и 15,8—15,7%НгО. Содержание
воды следует точно учитывать, так как она сильно влияет на со-
держание азота в нитроклетчатке. Для стабилизации продукта
высшей степени нитрации хлопка2 его необходимо кипятить
минимум1 100 час. , лучше всего в слабокислой воде. Затем сле-
дует обработка слабощелочной, содержащей известь водой и
наконец основательная промывка. Стабилизация продукта низ-
шей степени нитрации хлопка происходит значительно легче.
Целлюлоза из хвойной древесины не дает продукта
столь высокой степени нитрации, как хлопок, кроме того для
достижения определенного содержания азота требуется более
высокая концентрация кислот, и выхода хуже, чем для хлопка.
Поэтому стоимость производства пироксилина из древесной клет-
чатки, несмотря на более дешевый исходный материал, гораздо
выше.
III. Производство пироксилина
1. Старый способ нитрации в горшках
В первый период производства пироксилина, еще в 60-х годах в ре-
зультате работ в этой области Ленка и Эбля нитрация проводилась
в керамиковых сосудах или чугунных ваннах, помещавшихся в железных
баках и охлаждавшихся проточной водой. Хлопок в количестве нескольких
сотен до тысячи граммов погружали в кислоту с помощью железных вил
и затем через 21—3 часа отжимали избыточную кислоту из нитроцеллюлозы
1 Mem. d. Poudres, 23, стр. 262—267 (1930).
2 Ср. Stark, Die Collodiumwolle, Берлин 1932, стр. 171.
198
Пироксилин (нитроклетчатка)
путем прессования. Отжатый пироксилин закладывался в закрываемые крыш-
кой керамиковые горшки, где он вместе с частично оставшейся в нем кисло-
той выдерживался в течение некоторого времени в целях «донитровывания».
Затем содержимое горшков поступало на центрофуги. Отработанная кис-
лота вновь отжималась, и пропитанный остаточной кислотой пироксилин
быстро погружался в большие резервуары с водой и промывался.
Способ нитрации в горшках давал хорошо пронитрованный,
хотя и не всегда однородный продукт. Способ однако был сложен, дорог
н опасен, не говоря уже о том, что работать можно было лишь с неболь-
шими количествами н установка горшков требовала наличия большого по-
мещения; при донитровыванин нередко происходили вспышки, которые
уничтожали все содержимое горшка.
Первая многообещающая попытка упрощения способа нитрации в горш-
ках была введена в практику в Англии под названием способа про-
стого погружения. Нововведение состояло в том, что донитровыва-
ние и последующий отжим нитроцеллюлозы отпадали; вместо этого содер-
жимое нитрационного горшка непосредственно передавалось на центрофугу,
и пироксилин после центрофугировання спускался в промывной бак.
Дальнейший этап в отношении упрощения способа погруже-
ния состоял в том, что нитрация проводилась уже не в отдель-
ном сосуде, а непосредственно в центрофуге. Первым приспо-
соблением такого рода была центрофуга с циркуля-
цией кислот, с нижним приводом и закрепленным шпинде-
лем, барабан (корзинка) которой, так же как и окружающий его
кожух, наполнялись кислотой, причем подшипник шпинделя
с кислотой не соприкасался. На этом принципе основаны и
конструкции современных центрофуг; разрез центрофуги новей-
шей конструкции представлен на рис. 84.
Процесс производства пироксилина в центрофуге с циркуля-
цией кислот состоит в следующем.
Пока корзина центрофуги вращается медленно и центрофуга на % на-
полняется кислотой, вводится небольшими порциями хлопок. При скорости
вращения в 50 об/мин собственно нитрация длится 30—40 мин. Под дей-
ствием центробежной силы кислота непрерывно циркулирует через нитро-
целлюлозу и выходит наружу через перфорированные стенки корзины, а за-
тем через отверстия в конусе возвращается обратно. По окончании нитра-
ции кислота спускается, и оставшаяся жидкость отжимается при полном
числе оборотов, после чего нитроцеллюлоза сбрасывается посредством алю-
миниевых вил в промывной аппарат и оттуда направляется сильной струей
воды в предварительную промывку. Обычно за один прием перерабаты-
вается 8—20 кг хлопка в 50-кратном количестве нитрующей смеси. На-
чальная температура нитрации 15°, конечная 23°. После центрофугировання
нитроцеллюлоза содержит еще некоторое количество кислоты, которое уда-
ляется при промывке. Из новейших конструкций центрофуг следует особо
упомянуть центрофуги Акц. о-ва Гаубольд, из которых две особенно
употребительные модели представлены на рис. 85. Центрофуга приводится
в движение от электромотора с ременной передачей или, с целью предотвра-
щения возможности искрения, посредством гидравлического привода.
Средний расход энергии достигает при пуске 10 л. с., а во время центро-
фугирования составляет 2,5 л. с.
Нитрационная центрофуга наряду с американским нитратором до сих
пор является основным аппаратом для производства пироксилина и колло-
дионного хлопка. Например самый мощный германский пироксилиновый
завод в Тройсдорфе работал во время войны на 100 подобных аппаратах,
а французский завод в Ангулеме работал на 96 центрофугах, что соответ-
ствует производительности 70 000 кг в сутки'.
III. Производство пироксилина
199
Относительно промышленных выходов нитроклетчатки было уже упо-
мянуто: они могут достигать 96% от теоретического. Так. чистый хлопок
дает около 172% нитроклетчатки с 13,48% N вместо теоретического выхода
200
Пироксилин {нитро клетчатка)
176,35%. После стабилизации остается не больше 166%, однако такой выход
всегда немного превосходит наилучшие выходы нитроглицерина.
Рис. 84. Нитрацнониая центрофуга с фундаментом и трубопроводом (разрез):
1 — впускная труба; 2 — спускная труба, 3 — сток; 4— вытяжная труба.
3. Нитрация хлопка в нитраторах по американскому способу
В настоящее время значительное число больших производств,
изготовляющих в больших количествах пироксилин и
коллодионный хлопок, оставило имевший до сих пор широкое
HI. Производство пироксилина
201
распространение способ нитрации в центрофугах и перешло к но-
вому способу нитрации в нитраторах по так называемой амери-
канской системе, которая не имеет ничего общего с примитивным
способом нитрации в керамиковых горшках, много раз снова
применявшимся во время мировой войны.
По новому способу четыре нитратора работают на одну
центрофугу, используемую исключительно для отжатия отрабо-
танной кислоты. Нитратор рассчитан на загрузку хлопка в 10,
15, 20 и больше килограммов: он имеет форму высокого слегка
Рнс. 85. Нитрационные центрифуги с откидной алюминиевой крышкой,
вытяжной трубой и промывным аппаратом (Акц. О-во Bofors Nobel-
k г u t, Швеция).
сплющенного цилиндра соответственно расположению двух или
трех мешалок, вращающихся в различном направлении Ч
Рис. 86 иллюстрирует разрез подобного нитратора по наиболее
широкой его части. В забалчиваемой крышке имеются три
отверстия: сравнительно большой люк для загрузки целлюлозы,
патрубок для отвода газов и отверстие для термометра. Привод
имеет вид конических шестерен на общем валу; лопасти мешалки
для лучшей циркуляции жидкости и уменьшения сопротивления
перфорированы или прорезаны. На 1 ч. хлопка приходится 60 ч.
нитрующей смеси, т. е. на загрузку 15 кг целлюлозы требуется
900 кг кислотной смеси, что соответствует 25 кг пироксилина.
1 Ср. Schiesswollherstellung in Kesseln, Nitrocellulose, 1930, 26 и 122.
Пироксилин (нитроклетчатка)
Рис. 86. Нитратор современной кон-
струкции из кислотоупорной стали для
работы по т. и. американскому способу.
Процесс нитрации при 4 нитраторах протекает следующим
образом. В первый нитратор заливается нитрующая смесь
вполне определенного состава и температуры (кислота хранится
в резервуаре, установленном при умеренной температуре над
нитратором). Затем быстро загружается хлопок; как только
в первом нитраторе началась нитрация, подобным же образом
пускается второй, затем третий нитратор. Наконец через 40 мин.
после пуска первого нитратора пускается четвертый нитратор;
за эти 40 мин. содержимое первого нитратора успевает уже про-
иитроваться и может быть вы-
гружено в центрофугу для от-
жима отработанной кислоты.
Центрофуга для от-
жима отработанной
кислот ы, которую обслу-
живает другой рабочий, в ко-
роткий промежуток времени
отжимает отработанную кис-
лоту. Центрофуга снабжена
нижним спуском, через кото-
рый большая часть отжатого
пироксилина поступает в
спускной ж о л о б, присо-
единенный непосредственно к
нижней части центрофуги и
снабженный трубой для под-
вода промывной воды. По-
средством этого жолоба про-
мытый продукт непосред-
ственно из чанов горячей про-
мывки поступает в голлан-
деры и на стабилизацию.
Нитрация в нитраторах по
сравнению с нитрацией в цен-
трофугах имеет различные
преимущества:
1. Благодаря интенсивному перемешиванию содержимого ни-
траторов хлопок нитруется лучше и самое главное — равномер-
нее, чем в центрофуге.
2. Опасность воспламенения меньше, так как хлопок, находя-
щийся в нитраторе в постоянном движении, не застаивается на
поверхности кислоты; одновременно уменьшается также обра-
зование окислов азота.
3. Благодаря механизации работы аппаратуры отпадает вы-
грузка кислой нитроцеллюлозы, и рабочий не должен носить во
время тяжелой работы защитную маску, как при нитрации
в центрофугах.
4. Расход энергии при равной производительности — меньше,
III. Производство пироксилина
203
особенно по сравнению с центрофугой с гидравлическим при-
водом.
Однако наряду с преимуществами по сравнению с нитрацией
в центрофугах имеются также и некоторые недостатки:
наблюдение за ходом процесса менее удобно, так как аппара-
тура, употребляемая при этом способе, обычно расположена
в два этажа; кроме того, как только центрофуга для отжима
отработанной кислоты
вследствие порчи вы-
ходит из строя, все че-
тыре связанные с нею
нитратора вынуждены
простаивать.
Но преимущества
способа работы в ни-
траторах перекрывают
его недостатки, по-
чему его и стали при-
менять на большинстве
пороховых и целлу-
лоидных заводов на
континенте.
4. Английский способ
вытеснения (способ
братьев Томсон)1
В 1905 г. братья
Томсон ввели на
английском государ-
ственном заводе в Уэл-
тем-Аббей новый СПО- Рис- 87- Центрофуга для огжатия кислот
соб, по которому от-
работанная кислота вытеснялась из нитроклетчатки водою, но
при котором смешение кислоты и воды не наступает. Это ново-
введение имеет прежде всего то преимущество, что отпадает
необходимость употребления движущихся машинных частей,
кислота может быть полностью регенерирована, и пироксилин,
полученный по способу вытеснения, гораздо легче стабилизи-
руется, чем полученный в центрофуге.
Ясное представление об английском способе вытеснения дает
рис. 88.
Каждая нз изображенных на рисунке плоских чаш имеет в центре дна
отверстие для подвода кислоты. Кислотная смесь для производства пирокси-
лина состоит из 23/5% азотной кислоты, 66,5% серной кислоты и 10% воды и
Герм. пат. 298479 (1917).
204
Пироксилин (н шпроклетчатка)
употребляется в количестве 750 фунтов на одну загрузку. Прежде чем пу-
стить кислоту в чашу, отверстие покрывается четырьмя перфорированными
пластинами, ясно видными на передней чаше (см. рисунок). Затем чаша за-
крывается алюминиевым колпаком, снабженным широкой отводной трубой
для ннтрозных паров. После этого в кислоту при помощи металлических вил
небольшими порциями загружается 25 фунтов хлопка, и наконец на содер-
жимое накладывается второй ряд перфорированных пластин. Таким образом
весь загруженный хлопок полностью покрыт нитрующей смесью и лежит
неподвижно между двумя слоями пластин. В конце операции на кислоту на-
чинают медленно наливать холодную воду с температурой 5° С. Как только
нитрация закончилась, кислоту спускают, а сверху подводят воду. Первая
порция отработанной кислоты освежается олеумом и азотной кислотой, сле-
дующая за ней порция более разбавленной отработанной кислоты идет на
денитрацию. После того как нитроклетчатка в чаше в результате много-
Рис. 88. Мастерская нитрации на пироксилиновом заводе Ардир,
Nobels Explosives Со, в Стивенсоне, Шотландия, оборудованная керами-
ковым чашами для нитрации по способу вытеснения братьев Томсон.
На заднем плане видны алюминиевые зонты для отвода паров’азотной
кислоты.
кратной промывки почти полностью освободится от кислоты, следует про-
цесс собственно стабилизации. Способ вытеснения бр. Томсон упрощается
соединением четырех таких чаш в батарею с общей кислотной н сточной
проводкой.
Способ вытеснения бр. Томсон распространен главным
образом в Англии, но им пользуются также во Франции и в Аме-
рике. Американские отзывы о нем не всегда благоприятны; основ-
ным неудобством при работе с чашами бр. Томсон является труд-
ность регулирования хода нитрации, а также невозможность
получать однородный продукт определенных свойств, как это
например необходимо для желатинизации динамитов. Поэтому
способ вытеснения применяется главным образом там, где коле-
бание свойств конечного продукта не затрудняет дальнейшей
переработки. Вместе с тем Аллан подчеркивает чрезвычай-
ную простоту обслуживания процесса нитрации в чашах
бр. Томсон, незначительность затруднений, вызываемых ни-
трозными газами, и небольшой износ аппаратуры.
III. Производство пироксилина
205
ТАБЛИЦА 16
Сравнительные данные онекоторых английских способах
нитрации
Способ Состав нитрующей смеси в процентах Загрузка хлопка (лгг) Количество кг кис- лоты на кг хлопка Длительность ни- трации в часах Выход
о <Л Г О Z х; О Z Н2О в процентах в' кг на 1 ра- бочего в не- делю
Способ Эбля 74,0 18,0 0,6 7,4 0,6 11,0 12 163,7 208
Способ погружения . . . 75,0 15,8 1,3 7,9 2 28,2 12 159 505
Нитрация в центрофуге. . 69,3 23,2 — 7,5 11 50,0 1 160 -—
Способ вытеснения .... 66,5 ,23,5 0,6 10,0 П.4 30,0 2,5 170 792
Получение продуктов более низкой степени нитрации, обла-
дающих полной растворимостью, т. е. различных сортов колло-
дионного хлопка, совершенно аналогично производству пирокси-
лина, с той разницей, что нитрующая смесь менее концентриро-
вана и содержит больше воды (ср. стр. 197).
5. Мешка кислот
Производство пироксилина требует наличия больших запасов
готовой нитрующей смеси, так как частое составление небольших
порций не обеспечивает постоянства состава конечного продукта.
Поэтому установка должна иметь большое число хранилищ,
в которых, постоянно находится запас кислоты однородного
состава, которой можно пользоваться для большого числа опе-
раций. Смешение и хранение кислот происходит в мастерской
так называемой мешки кислот (рис. 83).
Для составления нитрующей смеси1 взвешивают соответ-
ствующие количества серной, азотной кислот и воды 2 и сливают
их в смеситель; серная кислота вливается в воду, а затем прили-
вается азотная кислота. Содержимое смесителя после прибавле-
ния каждого компонента перемешивается сжатым воздухом,
охлаждается и спускается в монтежю, из которого смесь пере-
давливается в хранилища для нитрующей смеси емкостью до
30 №. Отсюда кислоту расходуют, спуская ее непосредственно
‘Вег! и Boltenstern, Analyse der Mischsauren fiir die Cellulosenit-
raterzeugung, Z. angew. Chem‘e 1921, 19—21; Lorie tte и Jovinet, Mem.
Ц d. Poudres, 1926, 174—179.
j 2 Практически кислоты обыкновенно отмеривают, а не взвешивают,
а водою при составлении нитрующих смесей почти никогда не пользуются.
М Прим. ред.
206
Пироксилин (нитроклетчатка)
в центрофугу до определенного уровня на мерном стекле, пере-
качивают центробежным насосом или передавливают сжатым
воздухом по месту назначения.
6. Промывка и стабилизация
Пропитанный кислотой, отжатый в центрофуге пироксилин
способен самовоспламеняться и должен быть, как уже упомина-
лось выше, быстро погружен в большое количество воды. Раньше
отжатый продукт сбрасывали в небольшой резервуар, из которого
он поступал в большой чан с водой. В настоящее время посту-
пают иначе: содержимое центрофуги алюминиевыми вилами пе-
реносится в расположенный рядом промывной аппарат (так на-
зываемый гидравлический транспортер), посредством которого
он вполне безопасно транспортируется в здание промывки. Про-
мывной аппарат для нитроклетчатки (рис. 85) представляет ши-
рокую керамиковую или алюминиевую трубу, которая может
быть соединена с центрофутой при помощи жолоба из легкого
металла. У входа в промывной аппарат вода со скоростью
400 л/мин увлекает нитроклетчатку через сифон по наклонному
проточному керамиковому трубопроводу в резервуар для пред-
варительной промывки, где продукт промывается холодной во-
дой до тех пор, пока кислота не будет удалена. Этот резервуар
для предварительной промывки представляет собой бетонный
или деревянный чан емкостью 5—7,5 м3, в первом случае обычно
выложен глазированными плитками и снабжен дырчатым змее-
виком, расположенным на дне аппарата и служащим для под-
вода сжатого воздуха. Большое количество сточных кислых вод
должно быть каким-либо образом обезврежено.
После предварительной промывки продукт поступает для
промывки в деревянный или керамиковый чан высотой 1,5—2 ,м
и емкостью 3—5 №, рассчитанный для одновременной промывки
50—100 кг пироксилина. Впуском пара вода доводится до кипе-
ния и в течение дня несколько раз меняется. Раньше в Англии
кипячение производилось 5—7 суток, 10—14 раз по 12 час. за
один раз.
В отличие от прежнего способа Э б л я, согласно которому
для .скорейшей нейтрализации остатка кислоты пироксилин ки-
пятили со слабощелочным раствором, в настоящее время кипя-
чение производят в с л а б о к и с л о й с р е д е, т. е. кипятят
с чистой водой, которая от кислоты, содержащейся в нитроклет-
чатке, приобретает кислую реакцию. При кипячении в присут-
ствии небольших количеств кислоты продукты деструкции
растворяются в воде, благодаря чему процесс стабилизации
очень упрощается и ускоряется. Непосредственная обработка
пироксилина известковой водой хотя и позволяет быстрее
достигнуть конечной стадии, но стабильность такой нитроклет-
Ill. Производство пироксилина
207
Рис. 89. Голландер для измельчения.
чатки меньше, чем нитроклетчатки, подвергнутой кипячению
в кислой среде.
Эбль в свое время не обратил внимания на то, что добавка
щелочи при горячей промывке гидролизует и деструктирует
молекулу нитроклетчатки, благодаря чему стабильность конеч-
ного продукта уменьшается, так как остающиеся в нем продукты
распада служат катализаторами процессов разложения пирокси-
лина. Конечно кислая промывка, если ее продолжать слишком
долго, может также привести к разложению; так, при долгом
кипячении содержание азота в пироксилине уменьшается и рас-
творимость увеличивается. Таким образом экономически столь
важный вопрос, как наиболее рационально удалить отработанную
кислоту, не может счи-
таться разрешенным.
Представление о воз-
можности полного удале-
ния отработанной кислоты
из пироксилина путем пред-
варительной холодной и
длящейся несколько дней
горячей промывки является
глубоким заблуждением.
Волокна пироксилина проч-
но удерживают определен-
ное количество кислоты,
от которого удается осво-
бодиться лишь при из-
мельчении (обращение в
мезгу) и последующей ста-
билизации. Процесс собственно стабилизации распа-
дается на три операции, а именно:
1) измельчение в голландерах,
2) промывка в лаверах,
3) короткая окончательная обработка в контрольном кипя-
тильнике х.
Голландер обычно состоит из ванны длиной 4 м шириной 2 м
и высотой 60 см, емкостью 4500 л. При конструировании аппа-
ратуры для обработки пироксилина употребляется главным обра-
зом чугун; для коллодионного хлопка во избежание окрашивания
или загрязнения железными солями — керамика. Голландер на-
полняется водой, затем загружается около 200 кг пироксилина, и
барабан с ножами приводится во вращение. Стальные ножи
установлены параллельно. Масса, которой от вращения барабана
1 О голландерах высокой производительности, рассчитанных на загрузки
оОО кг волокна, см. Der Papierfabrikant № 3, 1930. Аппаратура для произ-
водства нитроцеллюлозы детально описана в книге Eckelt u. Gassner,
Prolektierungen и. Apparaturen fur die Chem. Ind., Лейпциг 1926.
208
Пироксилин {нитроклетчатка)
сообщается поступательное движение, попадает в промежуток
между ножами, установленными в дне голландера, и растирается,
размалывается и постепенно превращается в мезгу. Благодаря
вращению барабана измельченный продукт передвигается вдоль
стенок и в то же время проталкивается между движущимися и
неподвижными ножами. Мезга обрабатывается до тех пор, пока
нитроклетчатка не превратится в тонкий рыхлый порошок, что
в зависимости от величины загрузки и требуемой степени измель-
чения длится от 10 до 40, а в среднем 20 час. Измельчение в гол-
ландерах значительно уменьшает время стабилизации. Так
Г у й о н отмечает, что неиз мельченная нитроклетчатка
с 13,15—13,27% N для стабилизации кипятилась в течение 260—
333 час. и затем подвергалась холодной щелочной промывке
СаСОз, в то время как для измельченной нитроклетчатки оказа-
лось_достаточно 120—190 час. кипячения, включая сюда 20 час.
на измельчение и 2 часа на кипячение со слабой известковой
водой.
Тот же автор заметил, что измельчение в голландерах вполне
стабилизированной нитроклетчатки приводит к увеличению
скорости разложения, между тем как стойкость не вполне стаби-
лизированной нитроцеллюлозы повышается, очевидно, благо-
даря удалению в процессе измельчения некоторых примесей.
Из голландеров мезга поступает в чугунные промывные ла-
веры аналогичных размеров, снабженные барабаном без ножей.
Здесь продукт промывается до нейтральной реакции постоянным
притоком воды, спускаемой через дырчатый барабан, на который
натянута фильтрующая ткань. Имеются голландеры, в которых
объединены обе системы, т. е. водоотливной барабан помещен
в суживающейся части ванны. После промывки мезга проходит
через сито, задерживающее крупные частицы и комки, и посред-
ством насоса передается в контрольные кипятильники, где обра-
батывается горячей водой до тех пор, пока будут удалены ма-
лейшие следы кислоты и нестойких продуктов разложения.
Контрольные кипятильники или стабилизаторы представляют
собой большие железные сосуды цилиндрической формы с ме-
шалкой пропеллерного типа, служащей для перемешивания ни-
троцеллюлозной массы; лучше всего производить перемешивание
посредством лопастных колес, расположенных на манер колеса
центробежного насоса у самого дна. Емкость такого аппарата
от 6 до 30 м3, и он может быть также использован для смешения
частных партий, полученных при разных операциях. Воду сли-
вают декантацией, благодаря чему потерь не происходит. Обычно
кипячение длится 3 часа, и вода сменяется до тех пор, пока не
будет дос тигнуто так называемое предельное состояние Вилл я,
т. е. до тех пор, пока при продолжительном нагревании пробы
при высокой температуре в равные промежутки вре-
мени будет выделяться равное количество окис-
ло в азота. (Не достигнувшая предельного состояния, не
Ш. Производство пироксилина
209
вполне стабильная нитроклетчатка разлагается вначале быстрее
и лишь спустя больший или меньший промежуток времени —
с равномерной скоростью.)
Согласно исследованию Г у й о н а стабилизацию нитроклетчатки целе-
сообразно вести, не меняя кислой воды при кипячении. За этим
следует обработка в голландерах и наконец окончательная промывка в со-
держащей известь воде; во время всей этой операции реакция среды
должна быть щелочной. Например для полной стабилизации пироксилина
вполне достаточно кипячения в течение 144 час., 20-часового измельчения
н наконец 2-часового кипячения в лаверах с водой, содержащей 1% CaCOs.
Кипячение коллодионного хлопка длится всего 24 часа.
При кипячении под давлением можно было бы сильно сократить про-
должительность операции; так, при 130° она выполняется в 20 раз скорей,
чем при 100°. Однако обработка в автоклавах под давлением в том виде,
как она практиковалась до сих пор, небезопасна.
После испытания на полноту отмывки кислот нитроклетчатка
отжимается наконец на центрофуге; после 20-минутного отжима
содержание воды составляет 27—30%. Для дальнейшего употре-
бления нитроклетчатка сушится или же хранится во влажном
состоянии.
Влажная нитроцеллюлоза обладает удивительной способ-
ностью к- заражению бактериями, которые изменяют
ее состав. Так например влажный спрессованный пироксилин
вскоре начинает плесневеть с поверхности, если его не
предохранить от заражения слоем парафина или каким-нибудь
средством, например фенолом или сулемой. Бактерии постепенно
понижают в нитроклетчатке содержание азота; поэтому влаж-
ную нитроклетчатку стремятся сразу высушить.
7. Обезвоживание нитроклетчатки
Сушка1. Сухая нитроклетчатка благодаря своей способно-
сти воспламеняться и чувствительности к механическому воздей-
ствию является чрезвычайно опасным веществом, и поэтому обра-
щаться. с ним следует осторожно. Операция сушки нитроклет-
чатки производится в особых окруженных защитными валами
зданиях, площадью, не превышающей 6 X 6 м.
Перед сушкой сырой продукт протирается сквозь латунную
сетку и затем рассыпается равномерно слоем ца лотках, кото-
рые состоят из прямоугольных деревянных рам (1 X 0,6 м) с на-
тянутым на них полотном и расположенных одна над другой
в деревянных стойках. Сушка производится воздухом, нагре-
ваемым с помощью секций парового отопления, которые распо-
ложены вне сушильного помещения в закрытом ящике. Между
сушильным помещением и ящиком, в котором заключены секции
парового отопления, находится электрический вентилятор, ко-
1 Обезвоживание нитроклетчатки путем сушки по описываемому ниже
методу является чрезвычайно опасной операцией и на современных пирокси-
линовых заводах не применяется. Прим. ред.
14 Зак. 3171. — ШтетСахер.
210
Пироксилин {нитроклетчатка)
торий просасывает через ящик воздух и нагнетает в сушильное
помещение уже нагретый воздух. Подача пара и воздуха регу-
лируется так, чтобы установить в сушильном помещении темпе-
ратуру 35—40°. Для контроля температуры служит максималь-
ный или сигнальный термометр. Насыщенный водяными парами
воздух выходит через отдушину в верхней части сушильного по-
мещения; сушка длится в зависимости от установки 2—3 дня.
Нагретая сухая нитроклетчатка сильно электризуется,
и так как сушильные лотки и деревянные стойки являются изо-
ляторами и электрический заряд легко может дать искру, то,
чтобы предотвратить такую возможность, скопляющееся эле-
ктричество необходимо отводить. Для этой цели всю сушильную
систему заземляют, т. е. каждый лоток соединяют с землей.
Особого внимания требует пироксилиновая пыль, которая, соби-
раясь в сушильных шкафах и находясь там в течение долгого
времени, разлагается и взрывает. Поэтому установка должна
быть сконструирована так, чтобы пыль можно было легко соби-
рать влажной суконкой и удалять без остатка. Сушка в в а-
к у у м-ш к а ф а х, несмотря на то, что она идет значительно
скорей, из-за опасности взрыва применяется только в редких
случаях.
Высушенная до содержания 0,1% влаги нитроклетчатка поме-
щается в герметические сосуды, взвешивается и отправляется
по назначению.
Обезвоживание спиртом. Менее опасным и более
быстрым способом удаления воды йз нитроклетчатки является
спиртовый способ, состоящий в том, что содержащаяся
в нитроклетчатке влага вытесняется постепенной обработкой
спиртом в особых центрофугах или же с помощью сжатого воз-
духа в бронзовых или медных цилиндрах. В центрофуге обраба-
тывается одновременно до 90 кг влажного продукта; отжим про-
должают до тех пор, пока содержание спирта понизится до 30%.
Вода вытесняется спиртом быстро — в течение 2—3 час. Детали
и преимущества этого метода описаны в производстве бездым-
ного пороха. Содержащая спирт нитроклетчатка хранится в гер-
метических металлических сосудах и может быть непосредственно
употреблена для желатинизации, что составляет особое преиму-
щество метода вытеснения воды спиртом.
8. Исследование нитроклетчатки
Ни одно взрывчатое вещество не требует столь постоянного
наблюдения за своей химической стойкостью и столь деталь-
ного контроля в специальной аппаратуре, как пироксилин. Соот-
ветственно этому полное исследование пироксилина сопряжено
с большоц затратой труда и значительного количества времени
и является довольно дорогим испытанием.
III. Производство пироксилина
211
Ниже будут сопоставлены методы испытания, имеющие прак-
тическое значение, и будут изложены принципы менее употреби-
тельных, но имеющих научное значение методов.
При анализе пироксилина и коллодионного хлопка опреде-
ляется их растворимость в спирто-эфирной смеси и содержание
азота, а также некоторых примесей; примесями являются зола,
содержащаяся в исходном сырье, и непронитрованная целлюлоза
в конечном продукте, а также специально вводимые добавки,
служащие для увеличения химической стойкости, как например
сулема, отмученный мел и дифениламин.
Пронитрованная целлюлоза обладает той же структурой, что
и исходный материал, так что под микроскопом ясно видно,
получена ли нитроклетчатка при нитрации хлопка или же дре-
весины. Непронитрованную целлюлозу легко обнаружить иссле-
дованием в поляризационном микроскопе по светложелтому,
вплоть до красного, яркому оттенку, в то время как продукты
высших степеней нитрации целлюлозы можно узнать по слабо-
синему оттенку. Кроме того Д е м а р у 1 удалось тем же путем
установить различие между растворимыми и нерастворимыми
волокнами пироксилина.
Исследование пироксилина начинается с отбора и правильного
составления средней пробы различных образцов. Иссле-
дование проводится в следующем порядке.
Длина волокон измеряется с помощью снабженного измеритель-
ным аппаратом микроскопа с 30-кратным увеличением; она не должна пре-
вышать 1 мм.
Влажность определяется сушкой точной навески до постоянного
веса. Обычно сушат 24 часа при 50°, затем 24 часа при комнатной темпе-
ратуре в вакуум-эксикаторе над серной кислотой; в связи с возможностью
незначительного разложения рекомендуется сушку при 50° производить
только несколько часов, а остаток воды удалять сушкой над свежепрока-
ленной СаО.
Зольность определяется в платиновом тигле смачиванием взвешен-
ной пробы (2 г) чистой концентрированной азотной кислотой или пергидро-
лем с прибавлением аммиака, выпариванием досуха и прокаливанием. Со-
держание золы допускается до 1% (0,5%).
Углекислый кальций (отмученный мел). 5 г нитроклетчатки ки-
пятят с 20 см3 0,2 N НС1 и 100 см3 воды в течение % часа и по охлаждении
избыток соляной кислоты оттитровывается 0,2 N NaOH в присутствии
фенолфталеина.
Сулема и ртуть. Проба выполняется в пробирках шириной 16 мм
и длиной 25 мм с 2 г влажного пироксилина (содержание влаги 25—30%)
при нагревании на водяной бане до 80°; испытание повторяется 3—4 раза.
Пробирка неплотно прикрыта пробкой, через которую проходит короткая
стеклянная палочка. Эта стеклянная палочка на расстоянии 5 мм от пробки
покрыта полоской листового золота 12 мм шириной. После по крайней
мере 4-часового нагревания в присутствии ртути образуются серовато-
белые пятна амальгамы.
Не пронитрованная целлюлоза может содержаться в количе-
стве не более 2%. Один грамм нитроклетчатки кипятят точно 10 мин;
с 25 см3 20%-ного раствора сульфида натрия, и раствор отсасывают через
1 Mem. d. Poudres 1928, т. XXIII, стр. 4.
14'
212
Пироксилин {нитроклетчатка)
тигель Гуча. Нерастворимый остаток промывается водой, нагретой до 80°,
сушится и взвешивается (асбест для фильтрации следует предварительно
прокипятить с раствором сернистого натрия, затем с водой и наконец с со-
ляной кислотой).
Растворимость. Определение растворимости производится в спир-
то-эфирной смеси. Лучше всего пользоваться смесью из 4 ч. абсолютного
эфира и 3 ч. абсолютного спирта. 2 г тонкопро.сеянного и хорошо высу-
шенного пироксилина обрабатываются в мерном цилиндре на 500 см'3,
снабженном пришлифованной пробкой, 215 см3 спирта (0,816 при 15°) и
285 см3 эфира (0,720). Содержимое встряхивается время от времени в те-
чение 5 час. и затем отстаивается по крайней мере в течение 15 час.
К 250 см3 отстоявшегося светлого раствора прибавляют 10 см3 воды и осто-
рожно выпаривают досуха. Остаток сушится в течение Vi часа при 80° и
взвешивается.
Определение содержания азота производится или в нитро-
метре Л у н г е, или с помощью специального г а з о в о л ю м е т р а. По
первому менее сложному методу разлагается в среднем 0,3—0,4 г нитро-
клетчатки и получается 60—90 см3 окиси азота; точность определения
в среднем 0,06?;;.
Наряду с этим методом применяется определение азота по методу 111 л ё-
зинга в различных видоизменениях, связанных преимущественно с усо-
вершенствованиями аппаратуры (Шульце-Тиман). Этот метод, основанный
на восстановлении азотной кислоты с помощью хлористого железа н соля-
ной кислоты, дает в большинстве случаев содержание азота ниже действи-
тельного на 0,2%. Особенно точным (0,03%) является согласно собствен-
ному опыту автора определение азота ib виде аммиака по способу Д е-
варда. В этом случае нитратный азот пироксилина с помощью едкого
натра и 30%-ного пергидроля переводится в селитру.
Химическая стойкость еще со времени Ленк а
являлась предметом серьезных исследований, приведших впо-
следствии к так называемым пробам на стойкость, назначение
которых количественно и качественно проследить кинетику про-
цесса разложения при повышенной температуре.
Старейшей качественной пробой на стойкость является проба
Эбля. В пробирку с пироксилином помещается влажная иод-
крахмальная бумажка, и содержимое нагревается на водяной
бане до тех пор, пока начнет отщепляться азотйстая кислота и
бумажка от выделившегося иода окрасится в синий цвет. По
английскому способу для пробы берут 1,3 г (25 гран) сухого ве-
щества и пробирки длиной 135—140 мм и такой ширины, что
20—22 см3 воды наполняют их по высоте на 127 м. Пробирки
наполовину погружаются в подогретую до 76,7 (170° F) водя-
ную баню, после чего на платиновую проволочку, проходящую
через пробку, подвешивается иодкрахмальная бумажка шири-
ною 10 мм и длиною 20 мм, до половины смоченная 40—50% -ным
раствором глицерина. Испытание заканчивается, когда светло-
коричневая линия, появляющаяся через некоторое время на гра-
нице между сухой и влажной частью бумажки, совпадает с ко-
ричневым цветом стандартной бумажки. Окраска не должна
появиться раньше, чем через 10 мин. после погружения бумажки
в пробирку.
Иодкрахмальная бумажка приготовляется следую-
щим образом: чистую сухую полоску фильтровальной бумаги
III. Производство пироксилина 213
погружают на 10 сек. сначала в растовор 3 г крахмала в 250 см3
воды и затем в раствор 1 г йодистого калия в том же количестве
воды. Иодкрахмальная бумага, разрезанная на полоски желае-
мой величины, помещается в чистый свеженаполненный экси-
катор и хранится в темноте. Пользоваться иодкрахмальной бу-
мажкой следует лишь по истечении месяца со времени приго-
товления. Шестимесячное хранение в эксикаторе обеспечивает
большую пригодность к употреблению, однако иодкрахмалыные
бумажки следует время от времени проверять разбавленной
уксусной кислотой (коричневое окрашивание).
В Германии вместо пробы Эбля употребляется более чув-
ствительная проба с иодцинккрахм альной бумажкой.
1 г нитроклетчатки (влажность не более 0,5%) помещается в пробирку
длиной 125 мм и диаметром 16 мм, и при осторожном встряхивании высота
слоя, образуемого навеской, доводится до 30—40 мм. Сосуд закрывается
пробкой, в которую вставлена стеклянная палочка, заканчивающаяся крюч-
ком из платиновой проволоки с подвешенной на ней иодцинккрахмальной
бумажкой, шириной 12 мм и длиной 25 мм, так что нижний край бумажки
находится на расстоянии 20 мм от пироксилина; нижняя половина бумажки
пропитана 10%-ным раствором глицерина. Пробирка погружается на 90 мм
в водяную баню, нагретую до 80°, и наблюдается время, в течение кото-
рого на линии раздела выступает отчетливая синяя или фиолетовая полоска.
Такая окраска должна появляться не раньше, чем через 10 мин.
Иодцинккрахмальная бумажка приготовляется следующим образом.
4 г пшеничного крахмала растворяются в небольшом количестве воды, и
затем при перемешивании постепенно добавляются к кипящему раствору
20 г чистого хлористого цинка в 100 см3 воды. Восполняя испаряющуюся
воду, продолжают нагревание до тех пор, пока крахмал не растворится и
жидкость станет совершенно прозрачной, на что требуется около 2 час
Затем раствор разбавляется водой, к нему добавляется 2 г свежепригото-
вленного йодистого цинка, доливается водой до литра, фильтруется и
помещается в темное место. Иодцинккрахмальный раствор, разведенный
10-кратным объемом дестиллированной воды, не дает с разбавленной сер-
ной кислотой (1 :3) синей окраски. В такой раствор погружают на 1 мин.
шведскую фильтровальную бумагу, и высушенные полоски хранят в тем-
ноте в стеклянном сосуде.
Эти пробы, особенно проба, принятая в Германии, которая
уже в присутствии 0,0001 мг азотистой кислоты дает заметную
полосу, чрезвычайно чувствительны, и поэтому на них влияют
различные примеси, содержащиеся в пироксилине (ртуть, спирт,
эфир, ацетон, дифениламин). Предложенный Гутманом
раствор дифениламина, смешанный с глицерином, и м-фенилен-
диаминхлоргидрат, предложенный Спике, также могут слу-
жить индикаторами.
Однако подобного рода испытания связаны с различными
трудностями.
К этим пробам на стойкость примыкает способ более силь-
ного нагревания: до 110е (проба В ь е л я) и до 132° (прежняя
немецкая проба при 135~). В этих пробах отмечается время по-
краснения лакмусовой бумажки, затем время выделения бурых
паров окислов азота и наконец время взрыва.
214
Пироксилин {нитроклетчатка)
Эти качественные пробы на стойкость, являющиеся или че-
ресчур чувствительными, или не дающими возможности четко
установить характерный момент разложения, Билль в 1900 г.
впервые заменил количественным методом, который по-
зволяет графически отобразить течение процесса разложения
нитроклетчатки. 2,5 г высушенного при 40° пироксилина нагре-
ваются до 135°, и летучие азотсодержащие продукты разложения
увлекаются током углекислоты и пропускаются над раскален-
ной медью. Нагревание длится 4 часа и каждые % часа произ-
водится измерение объема элементарного азота, полученного при
восстановлении продуктов разложения.
По принципу Билля в свое время были сконструированы
очень сложные аппараты, так что способ не нашел себе практи-
ческого применения. Между тем основанный на том же принципе
метод отщепления о к и с л о в азота Бергмана и
Юнка (1904 г.) сохранился до сих пор и является в Германии
наиболее употребительным способом испытания при приемке.
Подобно старой пробе при 132э в этом способе отщепляющиеся
в определенный промежуток времени газообразн’йе продукты
разложения количественно исследуются на содержание окислов
азота. I ; й:
Аппарат (рис. 90) состоит из закрытого медного ящика, шириною 30 см
и высотою 25 см, герметически закрывающегося отвинчивающейся крышкой.
В него наливается амиловый спирт (темп, кип. 132°) или, лучше, смесь
глицерина с водой, которые служат греющей жидкостью. Крышка остается
завинченной, и к ней хорошо припаиваются 10 толстостенных латунных
трубок с длиной 20 см, в которые вставляются испытательные трубки, и
кроме того футляр для термометра d и наконец металлический шарообраз-
ный холодильник е для конденсации паров греющей жидкости. Аппарат
с помощью безопасной горелки В нагревается до постоянной темпера-
туры 132°. Испытательные трубки f изготовлены из толстостенного стекла
длиной 35 см с наружным диаметром 20 мм и внутренним 15—16 мм и
снабжены отметкой для объема в 50 см3. Пришлифованная к испытательной
трубке насадка состоит из стеклянного стакана д, в который помещена
стеклянная трубка /г. На трубку h надета вторая запаянная сверху трубка ?,
имеющая посредине шарообразное расширение. Стакан д при испытании,
т. е. при помещении стеклянной трубки в нагретый аппарат, наполовину
наполняется водой. Вместо такой похожей на стакан насадки в настоящее
время употребляется U-образная насадка, в которой окисли азота погло-
щаются лучше.
2 г тщательно высушенной нитроклетчатки нагреваются (как правило)
в течение 2 час. до 132° в толстостенной стеклянной трубке с U-образной
насадкой и водяным затвором. Затем поступившую внутрь трубки вслед-
ствие охлаждения воду доливают до 50 см3 и фильтруют; 25 см3 этого
раствора для окисления азотистой кислоты обрабатывают 1 см3 0,5 Д’ рас-
твора перманганата калия и все находящиеся в растворе в виде азотной кис-
лоты окислы азота отщепляют по способу Шульц е-Т и м а н а и опре-
деляют в виде газа. Хороший пироксилин при 2-часовом нагревании не дол-
жен отщеплять больше чем 2,5, а хороший коллодионный хлопок—максимум
2 см3 окислов азота в пересчете на 1 г. При испытании бездымного
пороха нагревают в течение 5 час. до 132° 5 г пороха параллельно
с нормальным образцом. Хорошо желатинированный порох с стабилизатором
дает при этом 5—8 см3 окиси азота; наивысший допустимый предел
1? см3 NO. Для полной абсорбции таких количеств окислов азота насадка
III. Производство пироксилина
215
с 25—30 см3 воды уже недостаточна и согласно Беккеру и Гуно1 заме-
няется большей насадкой с 75 см3 едкого натра.
В Италии и во Франции распространен манометриче-
ский метод Обермюллера, измененный Т а л и а н и.
2 г исследуемого образца нагреваются в вакууме до 135°; кри-
Рис. 90. Аппарат Бергман а-Ю н к а для коли-
чественной пробы на стойкость.
терием стойкости служит время, потребное для появления да-
вления в 300 мм или по Гужону2-—до 100 мм. Хороший пи-
роксилин дает по Обермюллеру за первые % часа давле-
ние, не превышающее 20 мм, коллодионный хлопок — около
1 Z. f. Schiessl- u. Sprw. 1932, 79.
2 Усовершенствованный метод испытания Талиани, Z. f. Schiess- u.
Sprw., 1931, 217, 261, 289, 330, 362, 400 (основная работа).
216 Пироксилин (нитроклетчатка)
15 мм. Метод исследования Та ли а ни очень 'подходит для
контроля производственного процесса стаби-
лизации. Присутствие углекислого кальция не влияет на ре-
зультаты; чувствительность этого метода обеспечивает возмож-
ность целесообразной стабилизации различного рода нитроклет-
чатки.
Далее следует упомянуть о пробах на определение потерь
в весе при температурах 115—140°, а также о введенной
Ганзеном и недавно разработанной М е ц о м пробе на
стойкость путем измерения концентрации водородных
моно в; согласно этой пробе 8 образчиков по 2,5 г нитроклет-
чатки нагреваются в течение 8 час. до 110°, и через каждый час
одна из проб встряхивается с водой и в ней электрометрически
определяется значение pH.
Одной из проб на стойкость является проба на стойкость
яри хранении, разработанная Ленце и Плеусом:
по этому методу стойкость определяется при температуре 75° С.
Этот способ, проводимый в условиях очень близких к естест-
венным, требует для своего осуществления очень продолжитель-
ного времени и вследствие этого непригоден для контроля про-
изводства, но является наилучшим критерием при контроле го-
тового продукта. Ленце правильно отметил то обстоятель-
ство, что ни один из многочисленных методов испытания стой-
кости нельзя считать полноценным, ибо искусственно вызванное
и ограниченное небольшим промежутком времени разложение
лишь с оговоркой может быть сопоставлено с реакциями, про-
текающими годами.
9. Прессованный пироксилин
Прежде прессованный пироксилин находил себе широкое
применение для военных целей, для снаряжения мин и торпед,
в качестве разрывных зарядов в снарядах и кроме того для под-
рывных целей в гражданской промышленности. Однако в на-
стоящее время пироксилин, когда-то не имевший соперников
в области своего применения, вытесняется ароматическими ни-
тросоединениями. Чистая нитроклетчатка как бризантное взрыв-
чатое вещество навсегда отошла в прошлое.
Благодаря своей чувствительности и связанной с нею опасности взрыва
пироксилин прессуется только во влажном состоянии. В связи с этим
возникают следующие трудности: во-первых, нельзя изготовлять шашки
больших размеров (больше 1 кг) и, во-вторых, зарядам неправильной
формы (например конической части заряда для мин и торпед) не удается
придать равномерную плотность. Поэтому такие разрывные заряды при-
ходится прессовать из маленьких шашек и придавать им правильную форму
обточкой и обстругиванием. В материале с эластичным волокном давление
не распространяется на большую глубину, и поэтому шашка спрессован-
ного пироксилина обладает тем более неравномерной плотностью и твер-
достью, чем она больше. После выталкивания из матрицы наблюдается
расширение, достигающее в продольном направлении 1 см.
/V. Свойства нитроклетчатки 217
При давлении 500—1000 аг удельный вес равен 1,1—1,3; прессование
длится 1—2 мин. После сушки удельный вес такой шашки оказывается
равным 1,1—1,15. Исключительно большой удельный вес получил Фойгт1
прессованием сухой нитроклетчатки под давлением в 200 кг/см2: полу-
ченные таким способом шашки были тверды, блестящи, негигроскопичны и
имели удельный вес, равный 1,6, сгорали медленно, но детонировали от
капсюля-детонатора с колоссальной скоростью.
Высушенные спрессованные шашки хранятся до применения в герме-
тически закрытых сосудах или парафинируются. Часто заливается пара-
фином также и влажный пироксилин, чтобы предохранить его от образо-
вания плесени; лучше однако обработать его антисептическим раствором,
например сулемой или фенолом.
IV. Свойства нитроклетчатки
Неизмельченная длинноволокнистая нитроклетчатка по внеш-
нему виду ничем не отличается от обыкновенного хлопка. За-
жженная нитроклетчатка необыкновенно быстро горит желтым
пламенем, настолько быстро, что при воспламенении небольшого
количества ее над черным порохом последний даже не успевает
загореться. Удельный вес нитроклетчатки больше, чем удельный
вес хлопка, и равен в среднем 1,66, в то время как удельный вес
пронитрованной древесной клетчатки достигает более высокой
цифры — 1,71.
Нитроклетчатка не имеет ни запаха, ни вкуса, совершенно
нерастворима как в холодной, так и в горячей воде, но легко
растворяется в ацетоне, уксусном эфире, нитробензоле и пири-
дине. Особенно характерно отношение ее к спирт о-э ф и р-
н о й смеси, в которой ее растворимость зависит от содер-
жания азота (пироксилин, коллодионный хлопок). Наилучшие
пропорции смеси: 1 объем эфира (0,720) и 1 объем 99,5%-ного
спирта, Jj.fi я более слабого спирта (95%) наилучшие результаты
получаются при смешении 1 объема спирта с 2 объемами эфира.
При низких температурах продукт высшей степени нитрации
целлюлозы также желатинируется и растворяется в спирто-эфир-
ной смеси. Согласно исследованиям Берля считается устано-
вленным, что способность желатинироваться или раство-
римость увеличиваются с увеличением степени деструк-
ции нитроклетчатки. При особой обработке целлюлозы как во
время очистки, так и во время нитрации может быть получен
более деструктированный коллодионный хлопок, который при
равном содержании азота значительно более способен к набуха-
нию. Это явление имеет значение главным образом при желати-
нировании нитроглицерина, так как в этом случае экономические
соображения вынуждают обходиться возможно меньшими коли-
чествами нитроклетчатки. Так например известные гремучие
студни, в которых 5% коллодионного хлопка связывают нитро-
глицерин настолько же прочно, как 7—8% нитроклетчатки, обла-
1 Герм. пат. 249272 (1912),
218
Пироксилин {нитроклетчатка)
дающей большей величиной молекулы. Коллоидная, макромоле-
кулярная структура нитроклетчатки вполне убедительно доказы-
вается тем фактом, что пироксилин, растворенный в ацетоне, пол-
ностью задерживается ультрапористым Cella-фильтром.
Что продукт высшей степени нитрации клетчатки состоит из
менее деструктированных молекул, доказывается измере-
нием вязкости1, которую связывают с различным содер-
жанием азота:
ТАБЛИЦА 17
Зависимость м е жду с одерж ан и ем азота
и вязкостью растворов нитроклетчатки
Содержание азота (процент) Вязкость 2%-ного ацетонного раствора
Время вытекания в секундах Вязкость ацетона принята равной единице
9,09 447 14
10,41 1800 590
12,48 16 227 460
13,50 322465 9 500
Молекулы клетчатки при нитрации разбавленной нитрующей
смесью деструктируются, что выражается в сильном уменьшении
внутреннего трения (вязкости) 2%-ного ацетонного раствора.
В подобной же связи с величиной молекулы находится и
гигроскопичность нитроклетчатки. По Бидлу погло-
щенное при пребывании во влажном воздухе количество воды
прямо пропорционально количеству не вступивших в реакцию
этерификации гидроксильных групп.
Медленно при действии прямых солнечных лучей и быстрее
при действии ультрафиолетовых лучей содержание азота в пиро-
ксилине постепенно уменьшается. Так же действует продолжи-
тельное нагревание до 40°; в этом случае выделение газа является
признаком начинающегося разложения. С момента образования
окислов азота разложение молекулы нитроклетчатки продол-
жается автокаталитически. Температура вспышки хо-
рошо стабилизированного пироксилина лежит в зависимости от
способа нагревания между 186 и 200°, плохо промытого пиро-
ксилина— между 130 и 150°. Воспламенение большого количе-
ства может привести к взрыву. Скорость детонации
в значительной степени зависит от плотности, а также от содер-
жания влаги, повышающей скорость детонации (табл, на стр. 105).
Технически достижимая наивысшая скорость детонации пирокси-
1 В е г 1 и. К 1 а у е, Z. f. Schiess, u. Sprw., 1907, 386.
IV. Свойства нитроклетчатки
219
лина равна около 6900 м/сек. Влажный пироксилин детонирует
при содержании 20 и более процентов воды; правда, энергетиче-
ское действие при этом соответственно уменьшается.
Несмотря на большую «кристаллическую» плотность волокон
пироксилина, прессованием практически можно достигнуть плот-
ности не выше 1,3. Такая незначительная плотность заряжания
является основной причиной того, что столь мощное взрывчатое
вещество, как пироксилин, должно было уступить место при сна-
ряжении торпед и мин или крупнокалиберных снарядов (в послед-
ний раз в России в начале мировой войны) менее мощным, но
более плотным ароматическим нитросоединениям, допускающим
плавление. Другая возможность — превратить пироксилин путем
смешения с нитроглицерином во взрывчатое вещество большой
силы и плотности — оказалась с самого начала безнадежной, ибо
все сильно набухающие смеси, так же как и военный гремучий
студень, через короткое время совершенно теряют способность
к детонации.
Согласно одному предложению автора оказывается возмож-
ным использовать свойства пироксилина, имеющие значение
с точки зрения взрывной техники, в другой области и сделать
его пригодным для военных целей. Так как продукт высшей
степени нитрации клетчатки легко пропитывается нитроглицери-
ном и нитрогликолем и кроме того обладает способностью
прочно удерживать твердый нитропентаэритрит, можно приба-
влять пироксилин в различных пропорциях к пентринитам и без
всякого добавления воды прессовать эту смесь в плотную массу
с большим удельным весом. Целесообразно, кроме пироксилина,
вводить в пентриниты остальные составные части — пентрит,
нитроглицерин с растворенным стабилизатором и желатинирую-
щий коллбдионный хлопок—в таких пропорциях, чтобы смесь
при умеренном давлении прессования обладала достаточной пла-
стичностью.
ГЛАВА СЕДЬМАЯ
НИТРОГЛИЦЕРИН
Нитроглицерин, называемый также «взрывчатым маслом Н о-
б е л я» (Nobels Sprengol), представляет собой не нитросоедине-
ние, как ошибочно можно думать по названию, а подобно нитро-
целлюлозе — сложный эфир азотной кислоты. Пропилентрини-
трат, или, лучше, глицеринтринитрат, получается при
полной этерификации трехатомного алифатического спирта —
глицерина:
Глицерин Азотная кислота Глицерин- тринитрат Вода
С:!Н6(ОН)3 + HHNOg = C.,H.,(ONO,), -J- ЗН2О
92,06 3 • 63,02 227,06 3-18,016
100 205,4 246,64 58,7
Кроме тринитрата во взрывной технике приготовляются и
употребляются ди- и мононитраты глицерина.
Как и во всех случаях получения эфиров азотной кислоты,
нитрация глицерина производится исключительно взятой в из-
бытке азотной кислотой с добавлением значительного коли-
чества концентрированной серной кислоты.
100 вес. ч. глицерина дают при нитровании водной или без-
водной кислотной смесью 210—215 или соответственно 225—
230% нитроглицерина. По теории должно образоваться 246,64%;
однако выходы в производстве до сих пор, даже в наилучших
технических условиях непрерывного процесса, не превосходили
233,5%, что соответствует 94,7% "“теоретического.
Производство нитроглицерина является одной из опаснейших
операций в технологии взрывчатых веществ и требует в отно-
шении установки и транспорта величайшей предусмотритель-
ности и особых мер предосторожности. Благодаря значи-
тельному усовершенствованию нитрационного аппарата опас-
ность этого производства в настоящее время значительно умень-
шилась. Вместо употреблявшихся прежде глиняных горшков
в настоящее время пользуются совершенно закрытыми толсто-
стенными свинцовыми сосудами, снабженными наружным и
внутренним двойным и тройным охлаждением, приспособлением
для перемешивания, впускной и отводной трубами, а также не-
/. Глицерин
221
сколькими термометрами и автоматическими предохранитель-
ными устройствами. Подобный аппарат соединяют кроме того
с большими предохранительными чанами, с тем чтобы в случае
внезапного грозящего взрывом разложения все содержимое
могло бы быть быстро опорожнено в сосуд с большим коли-
чеством воды.
Однако, несмотря на все эти чрезвычайно целесообразные
приспособления, нельзя поручиться за безопасность производ-
ства нитроглицерина, если глицерин недостаточно чист.
I. Глицерин
Глицерин — симметричный пропантриол,''т. е. трехатомный
спирт, СНгОН — СНОН — СНзОН. Он представляет собою гу-
стой бесцветный сироп сладкого вкуса; удельный вес совер-
шенно безводного глицерина равен 1,265 при 15°. В совершенно
чистом состоянии затвердевает при 0 в виде ромбических кри-
сталлов, плавящихся при 17'. Глицерин летуч с водяными па-
рами; перегоняется при нормальном давлении (760 мм) почти
без разложения при температуре 290", в вакууме же при 12 мм—•
при 170\ Он чрезвычайно гигроскопичен и смешивается с водой
и спиртом во всех отношениях; напротив, в эфире глицерин.не-
растворим. Содержание воды в глицерине отражается на его
удельном весе и, как это видно из нижеследующих цифр по
Г р ю н у, особенно сказывается в понижении температуры ки-
пения:
Глицерин в 1, * ПЛОТНОСТЬ ( ) Температура кипе- ния (760 мм)
100 1,2653 290=
99 1,2628 224—225°
98,5 1,2615 207- 208=
98 1,2602 —
97 1,2577 178-179=
90 1,240 —
Продажный химически чистый глицерин представляет собою дважды
перегнанный продукт, тогда как для производства нитроглицерина глице-
рин, как правило, перегоняется один раз. К так называемому динамит-
ному глицерину предт.являются определенные повышенные
требования:
1. Удельный вес, определенный пикнометрически, должен быть при
15° не ниже 1,262, что соответствует содержанию 98,5% глицерина.
В отдельных странах, как например в Австрии, низшим пределом
является содержание 97% глицерина.
222
Нитроглицерин
2. Общий остаток (органический и неорганический) не должен
превышать 0,20%, а зола 0,05%. Хлор в пересчете на NaCl допускается
в количестве не выше 0,01%.
3. Продукт должен быть по возможности нейтральным и свобод-
ным от восстанавливающих веществ. На 50 см3 образчика,
взболтанного со 100 см3 дестиллированной воды, должно итти в присут-
ствии фенолфталеина максимум 0,3 см3 N соляной кислоты или N щелочи.
Смесь одинаковых объемов глицерина и 10%-ного раствора AgNO3 не
должна давать в темноте в течение 10 мин. черной мути.
4. Содержание воды в присутствии полиглицеринов (ко-
торые образуются вследствие отщепления воды из двух или более моле-
кул глицерина вследствие местных перегревов при перегонке) не может
быть определено на основании удельного веса. Так как глицерин имеет
удельный вес 1,265, а диглицерин 1,33, то возможна компенсация этой при-
меси за счет воды.
5. Цвет перегнанного глицерина не является мерилом его хорошего
качества. Напротив того, в некоторых условиях темнокоричневый продукт
может оказаться более пригодным для нитрации, чем светложелтый.
О пригодности динамитного глицерина лучше всего судить по пробной
нитрации, которая в то же время служит для точного определения
выхода. Добывавшийся центральными державами в последние годы ми-
ровой войны путем брожения сахара «ферментол», или «протол-
глицерин», никогда не достигал чистоты обыкновенного «жирового» глице-
рина; кроме того вследствие постоянного содержания триметилен-
глико л я СНаОН — СНа —• СНгОН он давал при нитрации несколько
меньшие выходы. Тем не менее производство ферментола в военное время
будет возобновлено.
Глицерин способен легко давать не только эфиры с кисло-
тами, но также и подобные алкоголятам металлические соеди-
нения с основаниями.
Динамитный глицерин окрашен в .слабожелтый цвет; он пере-
возится и хранится в железных бочках на 300—350 кг. Находясь
в течение долгого времени на морозе, глицерин превращается
в твердую кристаллическую массу, которая с большим трудом
оттаивает. Поэтому глицерин подобно олеуму и моногидрату
следует хранить в теплом помещении.
1. Получение нитроглицерина в лаборатории. Пробная нитрация
Для быстрого получения небольших количеств нитроглице-
рина в целях переработки его в пентринит или динамит может
быть предложен следующий способ.
200 г чистого глицерина (1,26) при непрерывном перемешивании и на-
блюдении за температурой по каплям или тонкой струей приливается из
капельной воронки емкостью 160 см3 к 1500 г кислотной смеси, состоящей
из 500 г (333 см3) дымящей азотной кислоты и 1000 г (544 erf) концентри-
рованной серной кислоты. Температура ни в коем случае не должна поды-
маться выше 30°. После окончания приливания первой половины глицерина
реакция протекает более умеренно, и температуру легко поддерживать
ниже 20°. 1%-л колба помещается на мягкой подставке в ванне с проточной
водой, уровень которой достигает половины содержимого колбы. Колба
закрыта просверленной в трех местах корковой или резиновой пробкой и
снабжена капельной воронкой, погруженным в кислоту термометром и изо-
гнутой хлоркальциевой трубкой; хлоркальциевая трубка закрыта с внутрен-
ней стороны ватой и наполнена небольшим количеством гранулированного
I. Глицерин
223
NaOH, поглощающего выделяющиеся пары нитроглицерина. Это приспосо-
бление предохраняет восприимчивых лиц от мигрени, вызываемой нитро-
глицерином, появляющейся у некоторых лиц во время нитрации и прохо-
дящей лишь на следующее утро. При температуре охлаждающей воды, рав-
ной 12°, этерификация легко заканчивается при 18—25° уже в течение часа,
а при перемешивании — в течение 15 мин.
После того как нитроглицерин всплывает над отработанной кислотой,
образуя резко отграниченный слой, что обычно происходит в течение
10 мин. (для более полного разделения лучше дать постоять в течение
часа), в колбу до дна опускают стеклянную трубку, выдувают из ниж-
него кислотного слоя случайно задержавшийся там нитроглицерин, затем
соединяют трубку с ловушкой, присоединенной в свою очередь к водо-
струйному насосу, и медленно и осторожно (наклоняя колбу) высасывают
отработанную кислоту. Нитроглицерин и небольшой остаток кислоты при
энергичном перемешивании стеклянной палочкой с надетой на кончик ее
резиновой трубкой вливают в цилиндр, содержащий 1 л холодной воды.
Первая сильно кислая промывная вода почти нацело отсасывается насосом,
а остаток отделяется в делительной воронке. Затем следует встряхивание
с холодной водой с постепенным добавлением концентрированного рас-
твора соды до тех пор, пока погруженная в жидкость лакмусовая бумажка
не посинеет. Тогда нитроглицерин отделяют от воды и взбалтывают
с 2%-ным раствором соды. При этом следует иметь в виду, что вследствие
выделения углекислого газа давление вначале' повышается. Последние следы
кислоты удаляются из нитроглицерина с трудом, лишь после продолжи-
тельного взбалтывания с избытком тепловатого раствора соды; бывает,
что, если смесь оставить некоторое время постоять и затем опять взбол-
тать, лакмусовая бумажка, плавающая для контроля в промывной жид-
кости, вновь окрасится в красный цвет. Целесообразно оставить нитро-
глицерин и промывную жидкость постоять ночь, а затем утром еще раз
сильно взболтать и отсосать ставшую щелочной промывную жидкость и
в заключение промыть нитроглицерин один или два раза чистой водой.
Для всей операции промывки следует расходовать не больше 4 л воды.
Окончательно промытый нитроглицерин оставляют в течение часа стоять
в делительной воронке, кран и пробка которой слегка смазаны воском или
вазелином, и затем отфильтровывают через бумажный фильтр с безводным
.сульфатом натрия в сосуд для хранения. Выход нитроглицерина составляет
вч лучшем случае 430 г, или 269 см3. Лаборатории динамитных заводов
пользуются специальным стеклянным аппаратом для пробной нитрации
(«груша» с перемешиванием при помощи сжатого воздуха), в котором по
установленному в заводских условиях рецепту этерифицируется 100 или
50 г глицерина и контролируется выход.
Производство нитроглицерина принадлежит к несложным хи-
мическим процессам; однако для неопытных и нерешительных
людей оно легко может стать опасным. Часто операция бывает
неудачной из-за неполного отделения от кислоты, вследствие
чего спустя несколько недель или месяцев — особенно летом —
наступает нежелательное разложение, которое приводит к не-
приятным последствиям ввиду необходимости немедленного уда-
ления и уничтожения такого нитроглицерина.
Как указано при рассмотрении нитрогликоля, нитроглицерин
можно получить, пользуясь также азотной кислотой средней
крепости (1,38—1,40) и водным глицерином. Так 191 г глицерина
(1,228, что соответствует 13,5% НгО) с кислотной смесью, состоя-
щей из 1300 см3 концентрированной H2SO4 и 750 см3 62%-ной
HNO3 (1,38), дали 288 г промытого нитроглицерина, т. е.
только 175%.
224
Нитроглицери н
2. Общие соображения о нитрации и выходах нитроглицерина
в прежнее и в настоящее время
За несколько лет до войны систематически стали стремиться
производить давно известный нитроглицерин наиболее эконо-
мичным путем и с наивысшими выходами. Согласно теории
100 ч. безводного глицерина должны давать 246,6 ч. нитрогли-
церина; в производстве же например, пользуясь кислотной
смесью из равных количеств молей серной и азотной кислоты
с 6% НаО (подобно тому как работали в течение многих лет
после Нобеля), можно получить выход, равный лишь 206—
210%. Обстоятельные исследования показали, что выход нитро-
глицерина зависит от равновесия, устанавливающегося между
нитроглицерином, азотной кислотой и водой, и что максималь-
ный выход ни в коем случае нельзя смешивать с максимальной
рентабельностью производства. Экономически выгодные резуль-
таты зависят от столь большого числа факторов, иногда диа-
метрально противоположного характера, что рассчитать или
определить их влияние вряд ли вообще воможно. Выход нитро-
глицерина прежде всего зависит от содержания воды в нитрую-
щей смеси, затем от пропорции, в которых смешаны серная
и азотная кислоты, от температуры нитрации и, что само собой
понятно, в значительной степени — от качества глицерина. При
одинаковом составе нитрующей смеси на величину выхода
влияют два фактора: 1) неполная этерификация на основании
закона действующих масс, вследствие чего наряду с тринитратом
образуются ди- и мононитрат и, возможно, также сульфат гли-
церина; 2) растворимость нитроглицерина в отработанной кис-
лоте. Для полной этерификации требуется большой избыток
нитрующей смеси, а следовательно количество отработанной
кислоты и потери на растворимость в ней нитроглицерина уве-
личиваются.
Натан и Р и н т у л ь, употребляя безводную нитрующую
смесь, получили в 1908 г. выход, равный 229%. Они связывали
всю воду олеумом и вели процесс по уравнению:
С3Н-(ОН)8 +1
92 4-
H2SO4 266,6 ( = 54,1%) _ с«(гю.л, +
HNOg 226,6 ( = 45,9%) “ с8пьб'1из)8 +
Q нитроглицерин
100 кг-------♦ 536 кг
229% при 15°
226% при 30°
H9SO4 266,6
HNO3 37,5
Н2О( 4- эфир) 58,7
362,8
394 кг
По старому способу нитрацию вели смесью концен-
трированной 96% -ной серной кислоты удельного веса 1,84 и ды-
I. Глицерин
225
мящей 93%-ной азотной кислоты:
[ H2SO4 442 ( = 60,9%)
С.Нг(ОН)ч+ < HNO, 251 (= 34,4%) = C3HB(NO3)3 +отработанная кислота
3 ° ( Н2О 33 ( = 4,7%) (+ растворенный эфир) 601
92+ “726
100 кг------* 789 кг-------------» 214%-----------» 653 кг
В новом, «безводном» способе количество отработанной кис-
лоты, отнесенное к килограмм-молекуле глицерина, уменьшается
с 601 до 363 кг, что при растворимости, равной 3,7 вес. ч. нитро-
глицерина, увеличивает выход на 11%. Содди в 1911 г. поуг-
твердил эти данные; он получил следующие результаты:
ТАБЛИЦА 18
Зависимость выхода нитроглицерина от содержания воды
в нитрующей смеси
Нитрующая смесь Выход нитро- глицерина в % от глицерина
Глице- рин Количество кислоты Кислоты и вода в %
H2SO4 HNO3 Н2О сумма H2SO HNO3 Н2О
100 448,2 240,9 40,9 830 61,4 33,0 5,6 215
100 418,1 241,5 30,4 790 60,6 35,0 4,4 217
100 373,0 239,4 17,6 730 59,2 38,0 2,8 220
100 344,0 236,0 10,0 690 58,3 40,0 1,7 222
100 285,4 230,1 — 615 55,4 44,6 — 224,6
100 273,5 227,6 — 601 54,6 45,4 — 225,3
100 261,9 224,5 — 586 53,8 46,2 — 225,7
Отработанная кислота содержит 4,3—4,4% растворенного
нитроглицерина, ’+ак что полученный с помощью безводной
нитрующей смеси полный выход равен 229—230%, или 93%
от теории. Го фв им мер из 100 г безводного и не содержа-
щего полиглицеринов глицерина и 594 г кислотной смеси состава
54% серной и 46% азотной кислоты получил даже выход, рав-
ный 235%. Последующее отделение проводилось при 8—10е, и
отработанная кислота была вполне осветлена, так что даже при
вымораживании (—5°) нитроглицерин из нее не выделялся.
В новом непрерывном процессе производства
нитроглицерина удалось достигнуть наибольшего вы-
хода в технике: 231—233,5%; нитрация по этому способу произ-
водится также с помощью безводной нитрующей смеси, но
при механическом перемешивании (без потерь) и осо-
бенно благоприятном соотношении реагирующих веществ — гли-
церина и кислотной смеси (50/50) — равном 1 : 5. Само собой
разумеется, что указанный выше выход можно получить лишь
15 Зак. 3171. — Штетбахер.