Текст
Вільям Ф. Ґанонґ
Фізіологія
людини
Затверджено
Міністерством охорони здоров’я України
як підручник
для студентів вищих медичних навчальних закладів
Ш-ІУ рівнів акредитації
Львів-2002
УДК 612 (075,8)
ББК 28.9
Вільям Ф. Ґанонґ. Фізіологія людини: Підручник / Переклад з англ.
Наук. ред. перекладу М.Гжегоцький, В.Шевчук, О.Заячківська. - Львів:
БаК, 2002. - 784 с.
І8В\ 966-7065-38-3
У книзі детально описано механізми функціонування, регулювання
та інтегрування діяльності всіх систем органів, біохімічне підгрунття
і молекулярні основи життєдіяльності, діапазон реалізації функцій
організму людини. Особливу увагу приділено результатам найновіших
наукових досліджень, даним молекулярної біології та генетики. Своє-
рідністю книги є велика кількість клінічних прикладів та доповнень
про можливі функціональні зміни організму здорової людини у різних
станах і випадках розвитку патології. Книга є теоретичним і прак-
тичним виданням, яке допоможе у вивченні класичних фундаменталь-
них основ фізіології, а також у повсякденній роботі лікаря.
Для студентів, інтернів, аспірантів, викладачів медико-біологічних
навчальних закладів, фізіологів, науковців та практичних лікарів.
Видавничий проект Львівського державного медичного університету ім. Данила Галицького.
Перший український переклад 20-го видання всесвітньовідомого базового підручника для медичних
університетів професора Каліфорнійського університету Вільяма Ф. Ґанонга “Фізіологія людини”
видавництва Ьап£е МеФсаІ Воок8/Мс6га\у-Ні11.
Затверджено Центральним методичним кабінетом з вищої медичної освіти Міністерства охорони
здоров’я України як підручник для студентів вищих медичних навчальних закладів II1-ІV рівнів акредитації
(протокол №4 від 04 вересня 2001 р.).
Наукові редактори перекладу:
Мечислав Гжегоцький, заслуж. діяч науки і тех. України, д-р мед. наук, проф.,
Віктор Шевчук, член-кор. АПН України, д-р мед. наук, проф.,
Оксана Заячківська, доц., канд. мед. наук.
Науковий переклад з англійської:
Олександр Луцик, д-р мед. наук, проф.,
Максим Луцик, д-р мед. наук, проф.,
Володимир Міхньов, член-кор. АМН України, д-р мед. наук, проф.,
Ірина Гаврилюк, канд. мед. наук, доц.,
Олена Гаврилюк, канд. мед. наук, доц.,
Анатолій Невзгода, канд. мед. наук, доц.,
Володимир Огурцов, канд. фармацевт, наук, доц.,
Андрій Цегельський, канд. мед. наук, доц.,
Богдана Стойко, аспірант,
Мар’ян Тарчинець, лікар-магістр,
Ростислав Білий, біохімік,
Левко Підлясецький, філолог.
Редактор:
Мирослава Мартиняк
Видання цієї книги фінансував добродій Григорій Малиновський.
Проектові сприяв професор д-р Володимир Бандера від Української Федерації Америки.
Ліцензія ТЬе МсОга\у-Ні11 Сотрапіев, Іпс., 1Че\¥ ¥огк
Назва оригіналу:
\У.Г.6апоп£. Кєуіє\¥ оГМеФсаІ РЬузіоІо^у, 20іЬ есі. I8ВN 0-8385-8282-6
Соругі§Ьі © 2001 Ьу ТЬе МсОга\у-Ні11 Сотрапіев, Іпс. А11 гі&Ь(8 ге8егуес1.
Усі права застережено. Жодна частина цієї книги не може бути відтворена у будь-якому вигляді та
жодним способом (електронним, механічним, зокрема фотокопіюванням, записом на магнітний чи
інший носій) без письмової згоди видавця.
І8В1М 966-7065-38-3
© Видання українською мовою, БаК, Львів, 2002
Вступ
Ця книга написана для студентів медицини та всіх інших з метою забезпечення
стислого викладу фізіології людини та ссавців. Її можна використовувати як основну
або додаткову літературу разом з іншими виданнями, теперішніми статтями,
монографіями та оглядами. В книзі також висвітлено актуальні аспекти загальної
та порівняльної фізіології. У кожній частині можна знайти також доцільні анатомічні
обґрунтування, хоча ця книга написана більше для тих, хто вже має початкові знання
з анатомії, хімії та біохімії. Наведені доречні приклади з клінічної медицини допо-
магають ілюструвати фізіологічні аспекти обговорюваних проблем. У багатьох роз-
ділах книги лікарі зможуть знайти інформацію або короткий огляд найважливіших
симптомів, що виникають у разі порушення функції.
Фізіологія людини також вміщує розділ для самопідготовки студентів, щоб допо-
могти повторити матеріал перед екзаменами і тестуваннями, а також додаток, який
складається з загальних посилань, обговорення методів статистичного аналізу, слов-
ника абревіатур, акронімів та символів, найчастіше вживаних у фізіології, а також
декілька допоміжних таблиць. Предметний покажчик є обширним.
У процесі написання цієї книги автор не зміг зробити виклад матеріалу повним
і стислим, не будучи догматичним. Більшість висновків наведені без детальної дис-
кусії про дані експериментів, на яких вони ґрунтуються, і підтверджень та доказів,
що доступні сьогодні. Значну частину інформації можна відшукати поряд з ілюстра-
ціями. Подальше обговорення окремих тем та предметів, які детально не розглянуті,
можна знайти у літературі, на яку є посилання у кінці кожної частини. Інформація
про серії опублікованих оглядів, які забезпечують найновіші дискусії з різнома-
нітних проблем фізіології, також є в загальних положеннях у додатку. З огляду на
стислість обговорення у більшості випадків знехтувано іменами дослідників, праці
яких зробили фундаментальний внесок у вивчення фізіології. Це зроблено не для
того, щоб навмисно зменшити значення їхніх внесків, проте наведення усіх імен та
посилань на оригінальні статті значно збільшило б розміри книги.
У двадцятому виданні, як і в попередніх, цілу книгу було повністю переглянуто
з метою усунути помилки, врахувати поради читачів, сучасні концепції, вилучити
недоцільний матеріал. З моменту останнього видання, коли розпочалась експансія
знань про започаткування позаклітинними сигналами змін в експресії генів і гене-
тичні основи хвороб, матеріал про ці теми оновлено. У частині, присвяченій імуно-
логії знову переписані та розширені питання про зв’язок між вродженим та набутим
імунітетом. Розділи про кору великих півкуль, відповідальну за зір, слух, нюх, також
переглянуті; розділ про сон та бадьорість перероблений з наголошенням на важливу
роль таламокортикальних осциляцій. Оновлено також багато тем, включно з описом
молекулярних моторів, гормонів серця, мотиліну та шлунково-кишкової моторики,
білків гострої фази, апное під час сну та механізму формування залежності.
Розділ для самопідготовки теж оновлений, акцент зроблено на висвітлення зміни
фізіології людини з огляду на розвиток хвороби, що відповідає сучасним вимогам
медичного ліцензійного екзаменування.
Я дуже зобов’язаний багатьом особам у підготовці цього видання книги. Особ-
лива подяка у підготовці двадцятого видання д-ру Уолтеру Міллеру, д-ру Мелвіну
Ґрумбачу, д-ру Стефану МакФію і д-ру Долорес Шобак. Джессі Лоуесберг забезпе-
чувала безцінну секретарську допомогу і, як завжди, співробітництво моєї дружини
сприяло написанню книги. Джим Рейсом, який редагував перше видання цієї книж-
ки 40 років тому, повернувся до співпраці та виконав роботу відмінно. Багато поміч-
ників і друзів забезпечили видання попередньо неопублікованими ілюстраціями, а
численні автори і видавці доброчинно надали дозвіл на передрук та використання
ілюстрацій з інших книжок та журналів. Я також дякую всім студентам та іншим
людям, які витратили свій час для того, щоб написати допоміжні критичні заува-
ження та побажання. Такі звернення є завжди бажаними і я чекаю на Ваші заува-
ження та побажання за адресою:
Вераіїтепі оГ Рйузіоіо^у
Упіуегзіїу о£ Саііїотіа
8ап Ргапсізсо, СА 94143-0444,158А
З часу першого видання в 1963 році наступні переклади були опубліковані бол-
гарською, грецькою (два видання), індонезійською (три видання), іспанською (шіст-
надцять видань), італійською (сім видань), китайською (два незалежні переклади),
корейською, малайською, німецькою (чотири видання), польською (два видання),
португальською (сім видань), сербохорватською, турецькою (два видання), угорсь-
кою, французькою, чеською (два видання) і японською (п’ятнадцять видань) мовами.
Більше інформації про це та інші видання Ьап^е апсі Мс-6га\у-Ні11 Ьоокз можна
знайти на веб-сайті \у\у\у.т§1іте(ііса1.сот
Вільям Ф. Ґанонґ
Сан-Франциско,
березень 2001 р.
Передмова до українського видання
Пропонована книга є першим в Україні перекладом з англійської визнаного в
світі базового підручника для студентів-медиків “Фізіологія людини”, створеного
високоавторитетним у світі спеціалістом професором Вільямом Ф. Ґанонґом. Для
перекладу взято 20-те видання 2001 р., що містить енциклопедичну інформацію з
усіх розділів сучасної фізіології людини як фундаментальної медико-біологічної
дисципліни, включаючи глибинні зв’язки навчального матеріалу з найновішими
відкриттями та здобутками біохімії, морфології, генетики та молекулярної біології.
Ідея видання підручника українською мовою виникла із започаткуванням широ-
ких міжнародних наукових контактів, що й спонукало нас до ініціації такого проекту.
Зазначимо, що від часу першого видання цієї книги в 1963 р. її наступні оновлення
відбуваються кожні два роки, а сам підручник перекладений сімнадцятьма різними
мовами: німецькою, французькою, іспанською, китайською, японською та ін.
У пропонованому українському перекладі останнього англомовного видання
цієї книги детально висвітлено механізми функціювання, регулювання та інтегру-
вання діяльності всіх систем і органів, біохімічне підґрунтя й молекулярні основи
життєдіяльності та діапазон реалізації функцій організму людини. У ній узагальнено
тисячі ключових статей та оглядів, найавторитетніші монографії та підручники,
що дає змогу читачеві ознайомитися з досягненнями фізіології людини на Заході.
Така інформація потрібне медикам різних фахів для розуміння і вміння викорис-
товувати функціональні методи дослідження, грамотно визначати відхилення від
норми, тобто правильно ставити діагноз, обґрунтовано обирати тактику лікування.
Особливу увагу приділено раніше не використовуваним дослідженням молекуляр-
них та генетичних механізмів у регулюванні функцій організму та їхньому значенню
у розвитку патології. Експансія генетики у різні розділи медицини, особливо в галузі
діагностики різних, часто хронічних захворювань, клінічна картина яких не вклада-
ється в рамки відомих синдромів, зумовлює актуальність появи такого видання.
Суттєво, що класичне теоретичне викладення навчального матеріалу супровод-
жується клінічними паралелями та доповненнями про можливі зміни функцій
організму здорової людини у різних функціональних станах та в разі виникнення і
розвитку патології. На наш погляд, такий метод клінічних прикладів, який викорис-
товують у провідних медичних закладах освіти, є закономірним та перспективним
для формування клінічного мислення майбутнього лікаря.
Книга складається з восьми частин, 39 розділів, додатка і предметного покаж-
чика, а також матеріалів для самопідготовки та самоконтролю, що містять завдання
у формі тестів, багата на схеми і таблиці Бібліографія в кінці кожної частини
охоплює джерела детальнішої інформації. Кожний розділ супроводжується впра-
вами, що дають змогу засвоїти теоретичний матеріал, та тестовими питаннями для
самооцінки знань. Логічне структурування матеріалу, відповідність програмі з
предмета робить доцільним використання книги як підручника для вивчення нор-
мальної фізіології у третьому та четвертому навчальних семестрах і клінічної фізіо-
логії у сьомому та восьмому навчальних семестрах у вищих медичних закладах
освіти. Книга також буде корисною інтернам, ординаторам, аспірантам, науковим
співробітникам, що займаються фізіологією та суміжними з нею галузями біології
та медицини. Її можна використовувати для післядипломного навчання лікарів та
підготовки біологів.
Під час виконання перекладу українською мовою ми користувалися медичною
термінологією, становлення якої здавна ґрунтується як на прямому запозиченні
лексичних основ з латинської та грецької мов, так і на власній мовній основі відпо-
відно до останніх міжнародних номенклатур. Це важливе для впровадження сучас-
ної термінології у практичну медицину. Досвід авторитетних київської та львівської
фізіологічних наукових шкіл свідчить про давні традиції використання наукових
термінів, які співвідносяться з інтернаціональними і відповідають нормам українсь-
кого правопису. У процесі розвитку світової науки та міжнародних контактів від-
бувається постійне збагачення лексичних ресурсів словами іншомовного поход-
ження. Запозичення деяких сучасних термінів з мови оригіналу було зумовлене
доцільністю та практикою їхнього використання у міжнародному спілкуванні, а
похідні слова від головних термінів утворені за правилами сучасного українського
словотворення.
Медична наукова термінологія багата на синоніми, проте ми вживали найпо-
ширеніші з них або їхній сучасний, оновлений варіант відповідно до змістового
навантаження. Книга з огляду на фундаментальність висвітлення матеріалу містить
численні скорочення та акроніми, які наведені згідно з поширеними формами
українською та латинською абревіатурами. У роботі ми опирались на праці “Слов-
ник медичної термінології” Інституту мовознавства Української академії наук, (Київ:
Державне медичне видавництво, 1936. - 220 с.), “Українська медична термінологія
у фаховій мові лікаря” (Київ: Книга плюс, 2001. - 176 с.) та сучасні міжнародні
номенклатури: “Міжнародна гістологічна номенклатура” (Львів: Наутілус, 2001. -
284 с.), “Анатомічний українсько-латинсько-англійський словник-довідник” (Київ:
Довіра, 1997. - 343 с.), “Українсько-латинський анатомічний словник” (Львів: Стрім,
1999. - 216 с.), “Хімічна термінологія і номенклатура” (Вип. 1. Київ: Українська
національна комісія з хімічної термінології і номенклатури, 1995. - 42 с.).
Висловлюємо щиру вдячність усім, хто причетний до створення цього підруч-
ника. Його видання, як і чимало інших видань, стало можливим завдяки допомозі
мецената Григорія Малиновського. В особі добродія Григорія Малиновського маємо
взірець шляхетної людини, для якої особистий успіх стає засобом для допомоги
ближнім, засобом допомоги вимріяній українській державі. Велика подяка д-ру,
професору Володимиру Бандері з Темпльського університету (США) за його цін-
ну консультативну допомогу в реалізації цього проекту.
Над упорядкуванням видання працював колектив, який має досвід викладання
українською та англійською мовами у Львівському державному медичному уні-
верситеті ім. Данила Галицького та Київському національному медичному універ-
ситеті ім. акад. О.О. Богомольця і виконання перекладів та адаптацій відомих підруч-
ників і книг. Сердечна подяка за виконану роботу д-ру мед. наук, професору Олек-
сандру Луцику, д-ру мед. наук, проф. Максиму Луцику, канд. мед. наук, доц. Ірині
Гаврилюк, канд. мед. наук, доц. Олені Гаврилюк, канд. мед. наук Анатолію Невзгоді,
канд. фармацевт, наук, доц. Володимиру Огурцову, канд. мед. наук, доц. Андрію
Цегельському, аспіранту Богдані Стойко, лікарю, магістру урології Мар’яну Тар-
чинцю, біохіміку Ростиславу Білому та філологу Левку Підлясецькому. Вислов-
люємо подяку за цінні консультації та поради члену-кор. АМН України, д-ру мед.
наук, проф. Володимиру Міхньову, засл. працівнику вищої школи України д-ру
фармацевт, наук, проф. Борису Зіменковському та д-ру біол. наук, проф. Ростиславу
Стойці.
Значних зусиль до цього видання доклали літературний редактор Мирослава
Мартиняк і видавець Орест Коссак, за що їм щира вдячність.
Ми глибоко переконані, що підручник допоможе студентам медичних та біоло-
гічних спеціальностей успішно оволодіти основами фізіології. Будемо вдячні за
всі критичні зауваження, які слугуватимуть подальшому вдосконаленню підруч-
ника.
Мечислав Гжегоцький
Віктор Шевчук
Оксана Заячківська
Львів-Київ, липень 2002 р.
Зміст
ЧАСТИНА І. ВСТУП.................................................................1
1. Загальні засади та клітинні основи фізіології людини..........................1
Вступ І
Загальні засади 1
Функціональна морфологія клітини 7
Структура та функції ДНК і РНК 16
Транспортування через клітинну мембрану 25
Капілярна стінка 32
Міжклітинний зв’язок 32
Гомеостаз 42
Старіння 43
Література до Частини І 44
ЧАСТИНА II. ФІЗІОЛОГІЯ НЕРВОВИХ І М’ЯЗОВИХ КЛІТИН.............................45
2. Збудлива тканина: нервова.........................................................................45
Вступ 45
Нервові клітини 45
Збудження і провідність 47
Йонні основи збудження і провідності 52
Властивості змішаних нервів 53
Типи нервових волокон та їхня функція 54
Нейротрофні речовини 54
Глія 57
3. Збудлива тканина: м’язова.........................................................................58
Вступ 58
Скелетні м’язи 58
Морфологія 58
Електричні явища та йонні потоки 61
Скоротлива відповідь 61
Джерела енергії та метаболізм 66
Властивості м’язів у інтактному організмі 67
Серцевий м’яз (міокард) 70
Морфологія 70
Електричні властивості 70
Механічні властивості 70
Метаболізм 73
Пейсмейкерна тканина 73
Гладкі м’язи 74
Морфологія 74
Вісцеральні гладкі м’язи 74
Поліелементні їладкі м’язи 76
4. Синаптичне і контактне передавання.................................................................77
Вступ 77
Синаптичне передавання 77
ЗМІСТ / їх
Функціональна анатомія 77
Електричні явища в постсинаптичних нейронах 80
Процеси гальмування і збудження в синапсах 84
Хімічний характер синаптичної активності 86
Головні нейротрансмітерні системи 90
Синаптична пластичність і навчання 105
Нервово-м’язове передавання 106
Нервово-м’язове з’єднання 106
Нервові закінчення у гладких м’язах і серцевому м’язі 107
Денерваційна підвищена чутливість 108
5. Ініціація імпульсів в органах чуття....................................................................110
Вступ ПО
Органи чуття і рецептори 110
Чуття 110
Електричні та хімічні явища у рецепторах 112
Йонні основи процесу збудження 113
Кодування сенсорної інформації 114
Література до частини II 115
ЧАСТИНА III. ФУНКЦІЇ НЕРВОВОЇ СИСТЕМИ.......................................117
6. Рефлекси.................................................................117
Вступ 117
Моносинаптичні рефлекси: рефлекс розтягування 117
Полісинаптичні рефлекси: рефлекс відсмикування 122
Головні властивості рефлексів 124
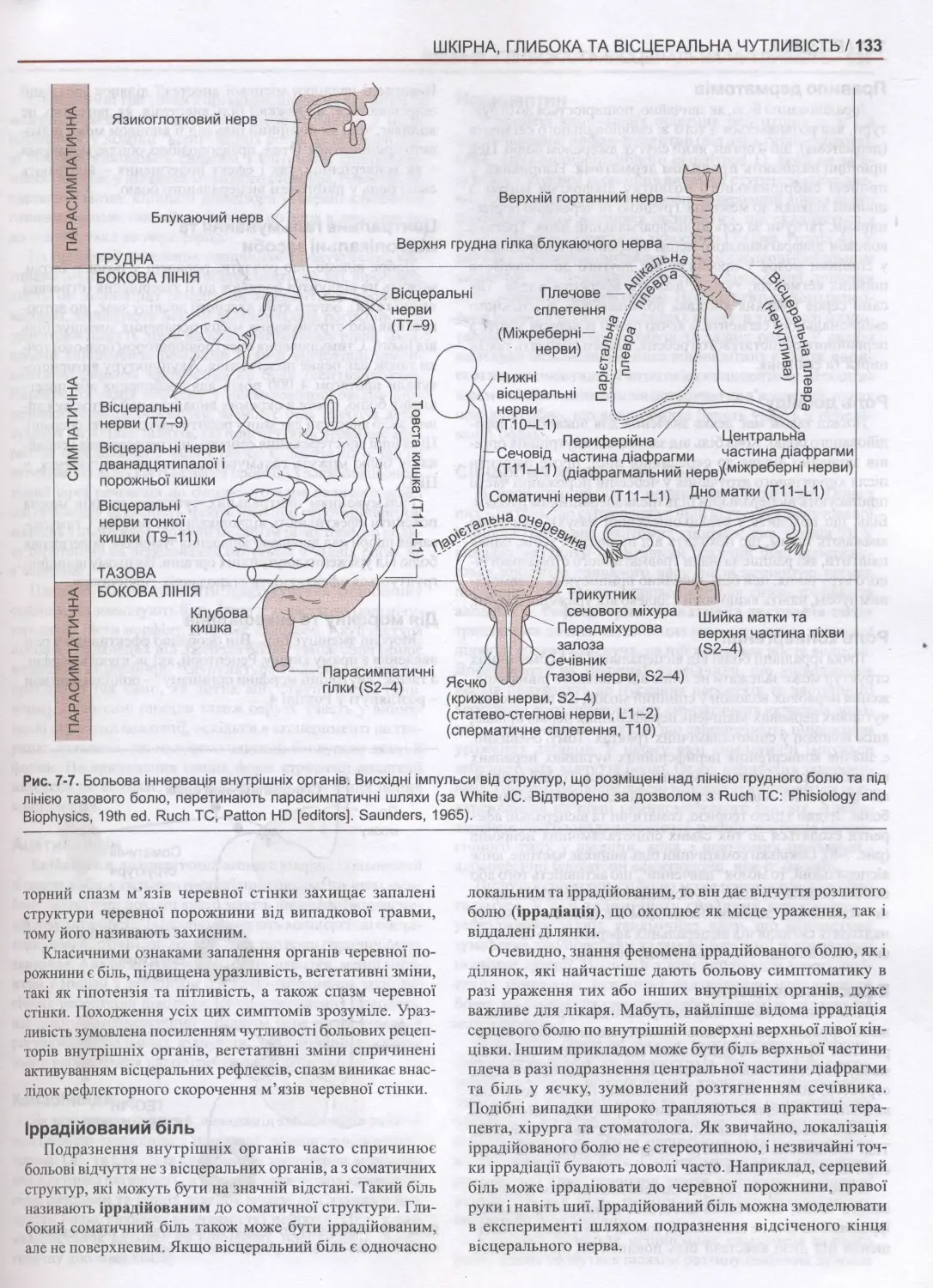
7. Шкірна, глибока та вісцеральна чутливість.........................................................126
Вступ 126
Провідні шляхи 126
Дотик 129
Пропріорецепція 130
Температурна чутливість 130
Больова чутливість 130
Інші відчуття 136
8. Зір...............................................................................................138
Вступ 138
Анатомічні характеристики 138
Механізм формування зображень 143
Механізм фоторецепції 146
Відповіді зорових шляхів і кори 149
Кольоровий зір 152
Інші аспекти зорової функції 154
Очні рухи 157
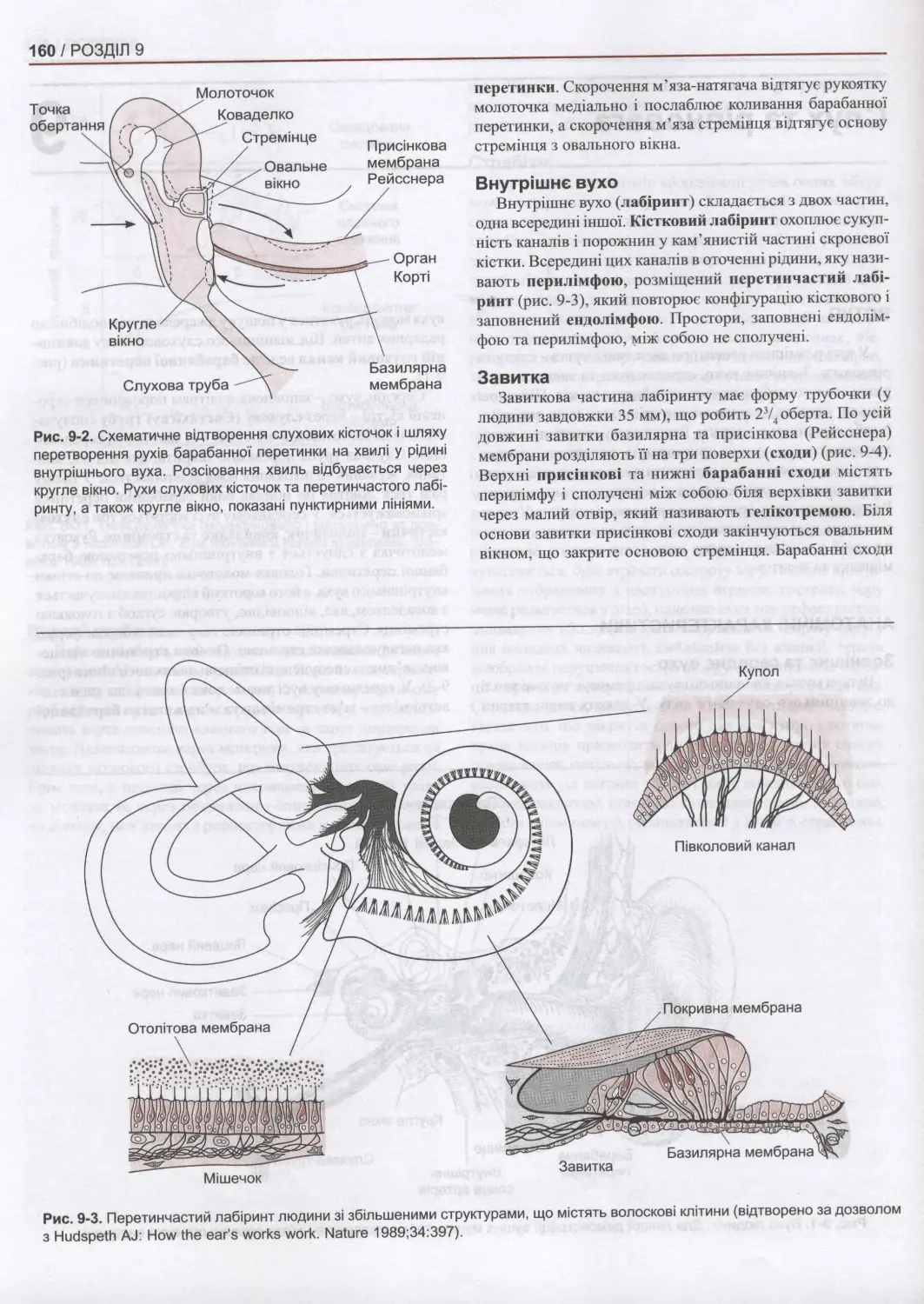
9. Слух та рівновага.................................................................................159
Вступ 159
Анатомічні характеристики 159
Волоскові клітини 162
Слух 164
Вестибулярна функція 170
10. Нюх та смак......................................................................................172
Вступ 172
х/ЗМІСТ
Нюх 172
Смак 175
Рецепторні органи та шляхи 175
11. Стан тривоги, сон та електрична активність мозку...............................................179
Вступ 179
Таламус та кора головного мозку 179
Ретикулярна формація та ретикулярна активаційна система 179
Біоелектричні потенціали кори головного мозку 180
Електроенцефалограма 181
Фізіологічна основа ЕЕГ, свідомості та сну 182
12. Регулювання постави і рухів....................................................................188
Вступ 188
Загальні принципи 188
Кірково-спинномозкова і кірково-ядерна система 189
Структура і функція 189
Система регулювання постави 192
Спінальна інтеграція 192
Роль довгастого мозку 195
Роль середнього мозку 197
Роль кори 198
Базальні ядра 198
Мозочок 202
13. Автономна нервова система......................................................................207
Вступ 207
Структурна організація автономних відцентрових шляхів 207
Хімічне передавання збудження в синапсах автономної нервової системи 209
Реакції ефекторних органів на імпульси, що надходять автономними нервами 211
14. Центральне регулювання вісцеральних функцій....................................................214
Вступ 214
Довгастий мозок 214
Гіпоталамус 215
Анатомічне уточнення 215
Функції гіпоталамуса 216
Відношення до забезпечення вісцеральних функцій 216
Відношення до сну 217
Відношення до циклічних процесів 217
Голод 217
Спрага 222
Регулювання секреції задньої частки гіпофіза 223
Регулювання секреції передньої частки гіпофіза 228
Терморегулювання 231
15. Нервові основи інстинктивної поведінки й емоцій................................................237
Вступ 237
Анатомічне уточнення 237
Функції лімбічної системи 238
Статева поведінка 238
Страх і лють 240
Мотивація і залежність 242
Нейрохімія і поведінка 243
16. Вищі функції нервової системи: умовні рефлекси, навчання та споріднені явища.................... 247
Вступ 247
Методи 247
ЗМІСТ / хі
Навчання та пам’ять 247
Функції нової кори 252
Література до частини III 256
ЧАСТИНА IV. ЕНДОКРИННА СИСТЕМА, МЕТАБОЛІЗМ І РЕПРОДУКТИВНА ФУНКЦІЯ.....257
17. Енергетичний баланс, метаболізм і живлення.........................257
Вступ 257
Обмін енергії 257
Проміжний обмін 260
Метаболізм вуглеводів 263
Метаболізм білків 269
Метаболізм жирів 275
Харчування 286
18. Щитоподібна залоза.................................................................................291
Вступ 291
Анатомічна будова 291
Утворення та секреція тиреоїдних гормонів 292
Транспортування та метаболізм тиреоїдних гормонів 295
Дія тиреоїдних гормонів 297
Регулювання секреції щитоподібної залози 299
Клінічні паралелі 301
19. Ендокринні функції підшлункової залози й регулювання метаболізму вуглеводів.......................306
Вступ 306
Будова клітин острівців 306
Структура, біосинтез і секреція інсуліну 307
Частка секретованого інсуліну 308
Дія інсуліну 308
Механізм дії 311
Наслідки нестачі інсуліну 312
Регулювання секреції інсуліну 317
Глюкагон 320
Інші гормони острівців 322
Вплив інших гормонів та фізичних навантажень на метаболізм вуглеводів 323
Гіпоглікемія та цукровий діабет у людини 324
20. Мозкова речовина і кора надниркових залоз..........................................................327
Вступ 327
Морфологія наднирників 327
Мозкова речовина надниркової залози 329
Структура і функція гормонів мозкової речовини наднирників 329
Регулювання секреції мозкової речовини надниркових залоз 331
Кора надниркових залоз 332
Структура і біосинтез адренокортикоїдних гормонів 332
Транспортування, метаболізм і виділення гормонів кори надниркових залоз 336
Ефекти надниркових андрогенів і естрогенів 338
Фізіологічні ефекти глюкокортикоїдів 338
Фармакологічні та патологічні ефекти глюкокортикоїдів 340
Регулювання глюкокортикоїдної секреції 341
Ефекти мінералокортикоїдів 344
Регулювання секреції альдостерону 345
Роль мінералокортикоїдів у регулюванні сольового балансу 348
Резюме ефектів адренокортикальних гіпер- та гіпофункцій у людей 348
хіі / ЗМІСТ
21. Гормональне регулювання метаболізму кальцію та фізіологія кістки................................350
Вступ 350
Метаболізм кальцію та фосфору 350
Фізіологія кістки 351
Вітамін О та гідроксихолекальцифероли 355
Паращитоподібні залози 357
Кальцитонін 361
Вплив інших гормонів та гуморальних речовин на метаболізм кальцію 362
22. Гіпофіз.........................................................................................363
Вступ 363
Морфологія 364
Гормони проміжної частки 364
Гормон росту 366
Фізіологія росту 372
Гіпофізарна недостатність 374
Гіперфункція гіпофізу у людини 376
23. Гонади: розвиток і функції репродуктивної системи...............................................377
Вступ 377
Статева диференціація і розвиток 377
Хромосомна стать 377
Ембріологія репродуктивної системи людини 378
Аберантна статева диференціація 380
Період статевого дозрівання 384
Передчасне та запізніле статеве дозрівання 385
Гіпофізарні гонадотропіни та пролактин 387
Чоловіча статева система 389
Структура 389
Гаметогенез та еякуляція 389
Ендокринна функція яєчок 393
Регулювання функції яєчок 396
Порушення функції яєчок 397
Жіноча статева система 397
Місячний цикл 397
Гормони яєчника 401
Регулювання функції яєчників 407
Порушення оваріальної функції 409
Вагітність 410
Лактація 413
24. Ендокринна функція нирок, серця та епіфіза......................................................416
Вступ 416
Ренін-ангіотензинова система 416
Еритропоетин 421
Гормони серця та інші натрійуретичні фактори 422
Епіфіз 424
Література до частини IV 426
ЧАСТИНА V. ФУНКЦІЇ ТРАВНОЇ СИСТЕМИ..................................................429
25. Травлення та всмоктування.......................................................429
Вступ 429
Вуглеводи 429
Білки й амінокислоти 432
Ліпіди 434
ЗМІСТ/хііі
Всмоктування води та електролітів 435
Всмоктування вітамінів і мінералів 437
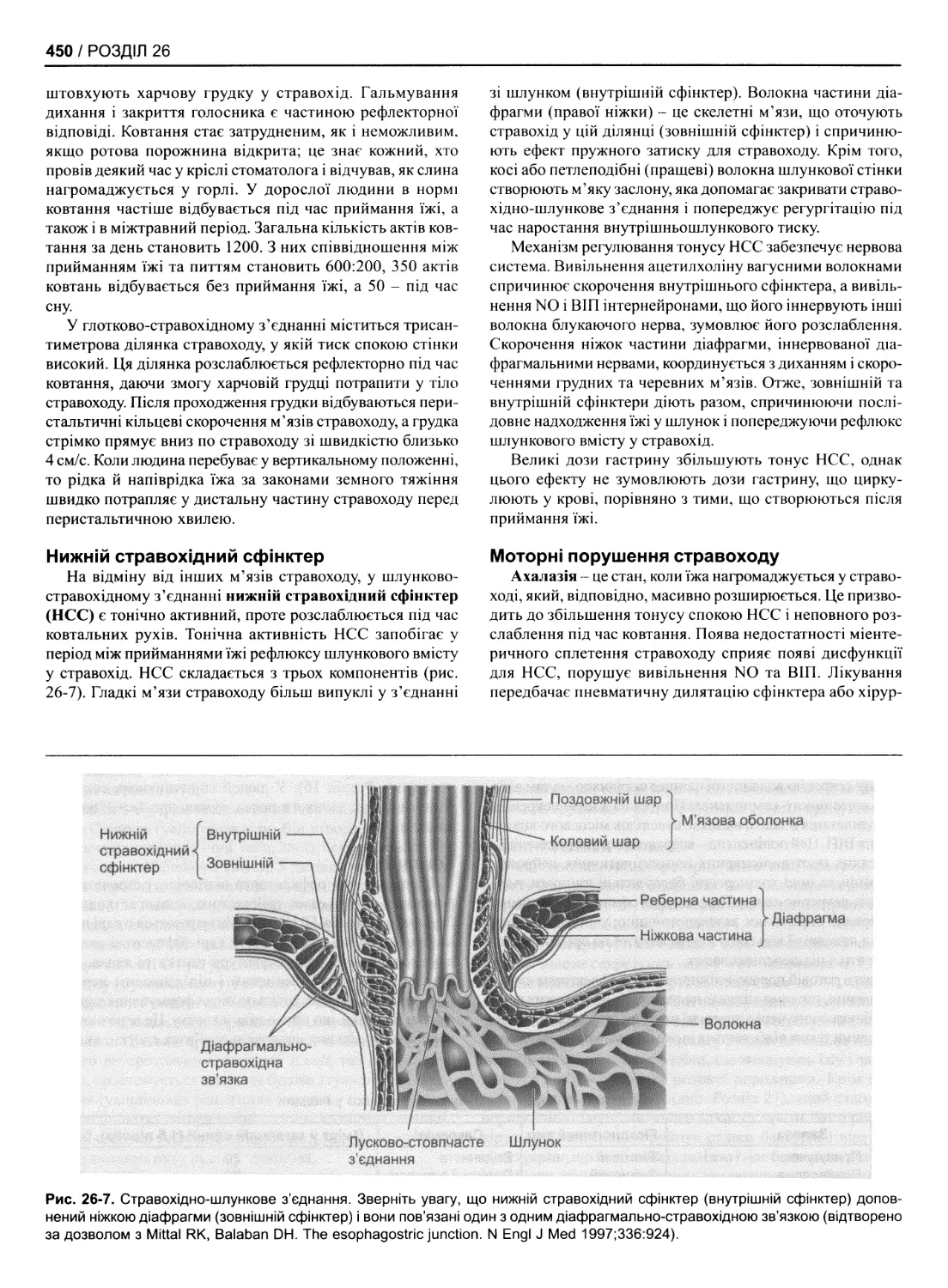
26. Механізми регулювання шлунково-кишкових функцій
Вступ 440
Загальні положення 440
Гастроінтестинальні гормони 442
Ротова порожнина і стравохід 448
Шлунок 451
Екзокринна частина підшлункової залози 457
Печінка та біліарна система 459
Тонка кишка 464
Товста кишка 467
Література до частини V 471
440
ЧАСТИНА VI. КРОВООБІГ.....................................................................473
27. Рідини, що циркулюють в організмі.....................................................473
Вступ 473
Кров 473
Кістковий мозок 473
Лейкоцити 474
Імунітет 478
Тромбоцити 487
Червоні кров’яні клітини 489
Групи крові 493
Плазма 495
Гемостаз 496
Лімфа 500
28. Природа серцевого скорочення й електричної активності серця...........................501
Вступ 501
Виникнення і поширення імпульсів у серці 501
Електрокардіограма 503
Серцеві аритмії 507
Зміни ЕКГ у разі інших серцевих і системних захворювань 513
29. Нагнітальна функція серця.............................................................517
Вступ 517
Механічні зміни під час серцевого циклу 517
Хвилинний об’єм крові 521
ЗО. Динаміка кровообігу та лімфообігу.....................................................528
Вступ 528
Анатомічні особливості 528
Біофізичні аспекти 532
Течія крові в артеріях та артеріолах 536
Циркулювання крові у капілярах 539
Циркулювання лімфи та об’єм інтерстиційної рідини 541
Кровообіг у венах 543
31. Регулювання серцево-судинної системи..................................................545
Вступ 545
Місцеві регуляторні механізми 545
Речовини, які виділяє ендотелій 546
Системне регулювання за допомогою гормонів 548
Механізми системного нервового регулювання 550
ХІУ / ЗМІСТ
32. Кровообіг в окремих ділянках організму.....................................................559
Вступ 559
Церебральний кровообіг 559
Анатомічні особливості 559
Спинномозкова рідина 560
Гематоенцефалічний бар’єр 562
Мозковий кровоплин 564
Регулювання мозкового кровообігу 565
Метаболізм у головному мозку і потреби кисню 567
Кровообіг у вінцевих судинах 568
Кровообіг у внутрішніх органах 571
Кровообіг у шкірі 572
Кровообіг у плаценті та плоді 573
33. Серцево-судинний гомеостаз у нормі та в разі патології.....................................577
Вступ 577
Пристосування до гравітаційних впливів 577
Фізичне навантаження 579
Запалення та загоєння ран 582
Шок 583
Гіпертензія 588
Серцева недостатність 589
Література до частини VI 591
ЧАСТИНА VII. ДИХАННЯ............................................................................593
34. Функції легень.............................................................................593
Вступ 593
Властивості газів 593
Анатомія дихальної системи 594
Механіка дихання 596
Газообмін у легенях 604
Кровообіг у легенях 606
Інші функції дихальної системи 609
35. Транспортування газів між легенями і тканинами.............................................611
Вступ 6Н
Транспортування кисню 611
Транспортування оксиду вуглецю 614
36. Регулювання дихання........................................................................616
Вступ 616
Нервове регулювання дихання 616
Регулювання дихальної активності 618
Хімічне регулювання дихання 618
Нехімічні впливи на дихання 622
37. Пристосувальні зміни дихання у нормі та патології..........................................625
Вступ 625
Вплив навантаження 625
Гіпоксія 627
Гіпоксична гіпоксія 628
Інші форми гіпоксії 633
Лікування киснем 634
Гіперкапнія та гіпокапнія 635
Інші респіраторні аномалії 635
Впливи збільшеного барометричного тиску 637
Штучне дихання 638
Література до частини VII 639
ЗМІСТ / XV
ЧАСТИНА VIII. УТВОРЕННЯ І ВИДІЛЕННЯ СЕЧІ...............................641
38. Функція нирок і сечовипускання.....................................641
Вступ 641
Функційна анатомія 641
Нирковий кровообіг 645
Клубочкове фільтрування 647
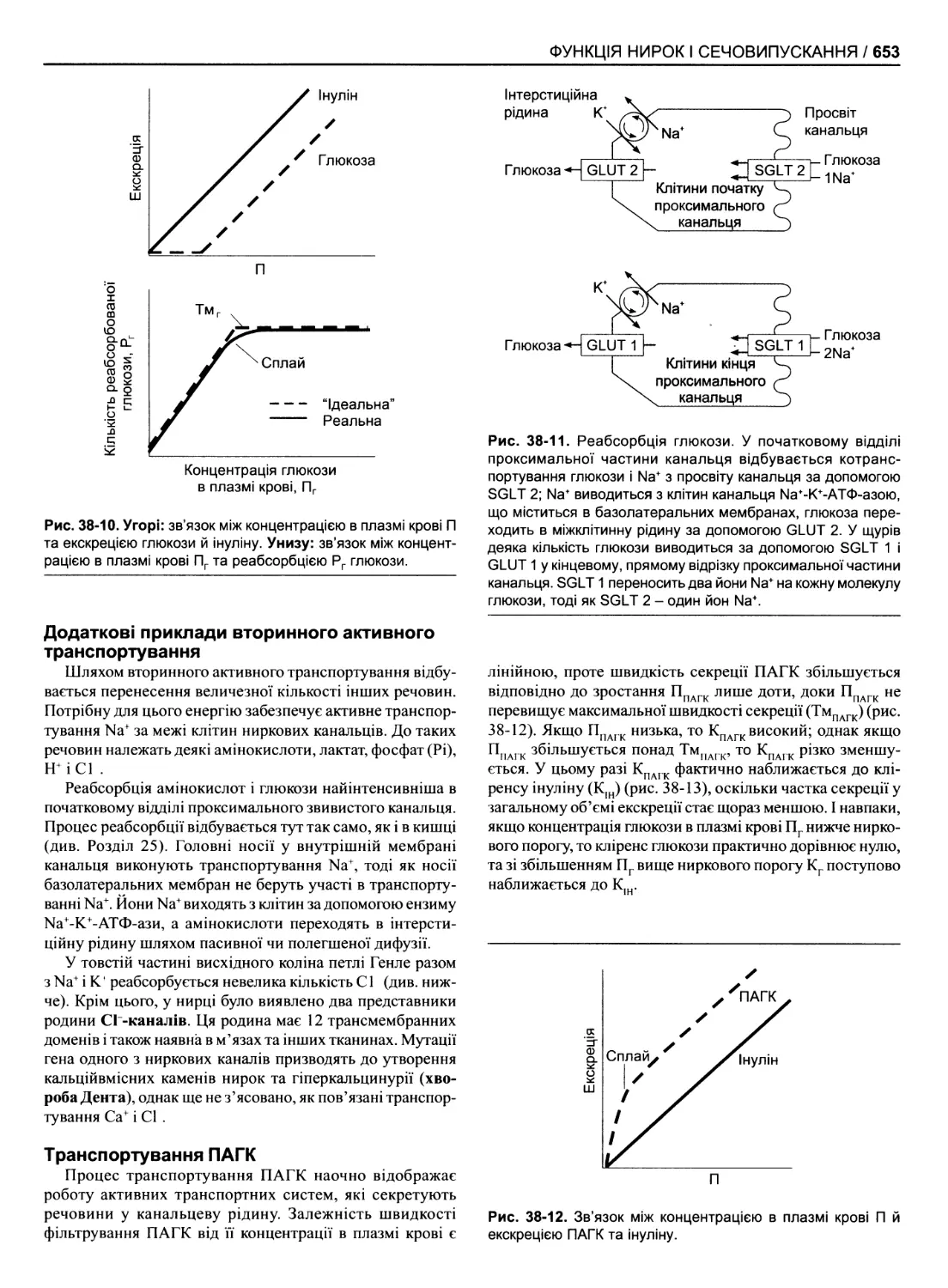
Функція канальців 649
Екскреція води 654
Окиснювання сечі та екскреція бікарбонату 660
Регулювання екскреції №* та СІ 663
Регулювання екскреції К+ 664
Діуретики (сечогінні засоби) 664
Розлади функцій нирок 665
Наповнення сечового міхура 666
Випорожнення сечового міхура 667
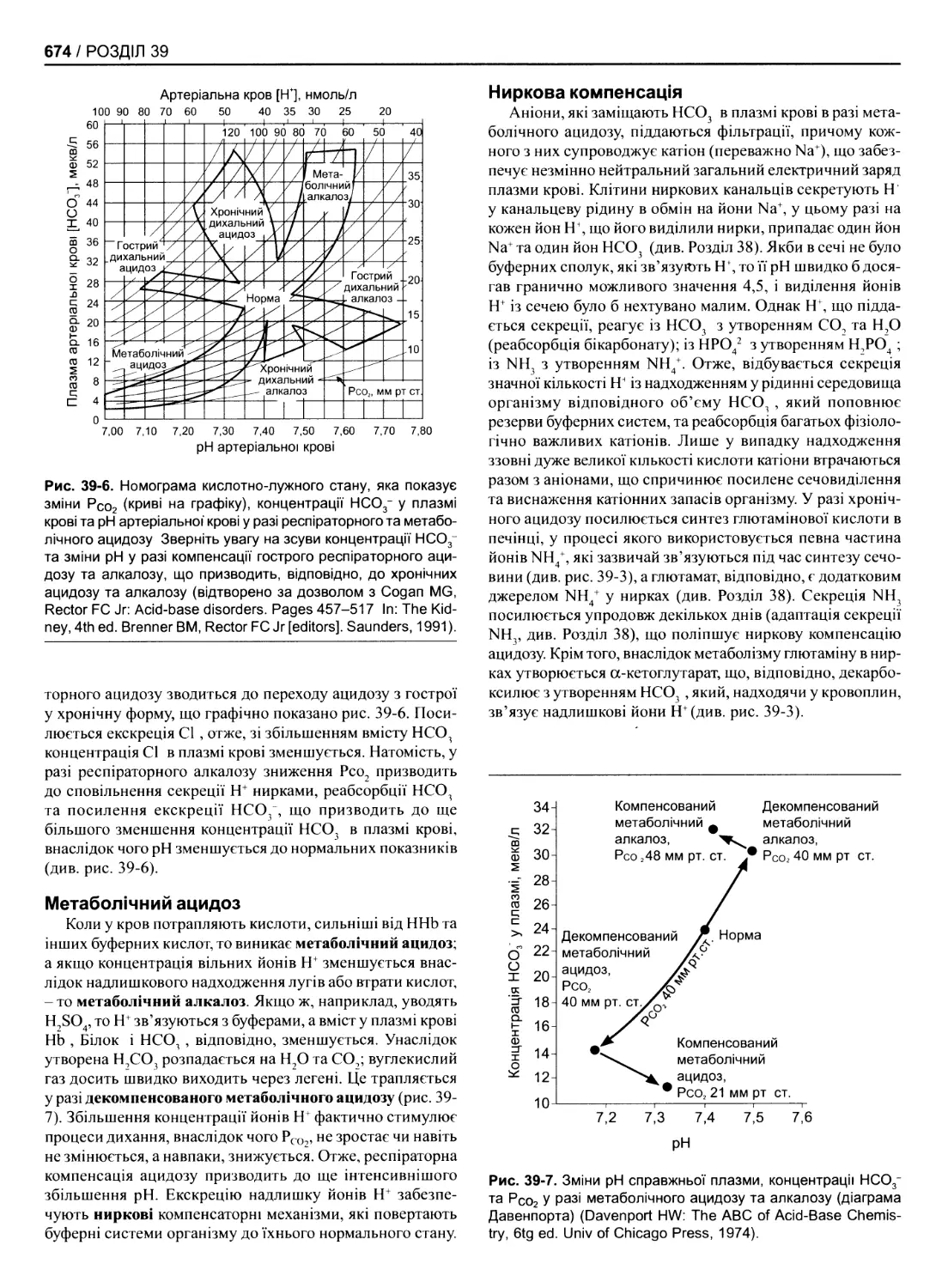
39. Регулювання складу та об’єму позаклітинної рідини................................................669
Вступ 669
Регулювання осмотичного тиску 669
Регулювання об’єму 669
Регулювання специфічного йонного складу 670
Регулювання концентрації Н+ 670
Література до частини VIII 677
Додаток......................................................................................... 679
Головні джерела 679
Показники норми та статистичне опрацювання даних 679
Стандартні респіраторні позначення 682
Еквіваленти метричних, американських та англійських вимірів 682
Грецький алфавіт 682
Тести............................................................................ 683
Відповіді........................................................................ 733
Перелік уживаних скорочень....................................................... 737
Покажчик......................................................................... 741
Частина І
Вступ
Загальні засади та клітинні основи
фізіології людини
ВСТУП
В одноклітинних органвмах усі процеси життєдіяль-
ності відбуваються в одній клітині. Завдяки еволюції до
багатоклітинних організмів різноманітні групи клітин набу-
ли окремих функцій. У людей та хребетних гварин спеціа-
лізовані групи клпин виконують функції іравної системи
для псреіравленпя і а всмоктування їжі, дихальної - для
поглинання О, і а виведення СОо, видільної-для видалення
шлаків, сисіеми кровообігу для поширення поживних ре-
човин, О2, продукнв метаболізму, репродуктивної - для
продовження біологічною виду, нервової та ендокринної
-для координації функцій і а інтеграції їх між собою. Про-
понована книга присвячена вивченню механізмів функціо-
нування цих систем і внеску кожної з них у діяльність орга-
нізму ЯК ЄДИНОГО ЦІЛОГО.
У цій частині описано загальні засади і принципи, які є
основою функціонування всіх систем, наведено короткий
огляд фундаментальних аспектів фізіології клітини, іцо є
підґрунтям діяльності всіх систем. Додаткові аспекти клі-
тинної та молекулярної біології розглянуті у відповідних
розділах, що описують інші системи організму.
ЗАГАЛЬНІ ЗАСАДИ
Будова організму
Клітини, з яких складаються всі організми, за винятком
найпростіших багаюклггинних водних і сухопутних тва-
рин, омиває позаклітинна рідина (ПКР), обмежена зов-
нішніми покривами. З цієї рідини клітини отримують О, і
харчові речовини, сюди ж вони виділяють метаболічні
шлакові продукти. ПКР більше розведена, ніж теперішня
морська вода, проте її склад подібний до первісного океану,
з якого, за припущеннями, виникло життя.
У гварин із замкненою системою кровообігу ПКР поді-
ляють на два іини’ ініерсіиційну рідину і внутрішньо-
судинну плазму крові. Плазма і клітинні елементи крові,
головно червоні кров’яні тільця, наповнюють судинну
систему і разом становлять загальний об’єм крові. Ін-
терсгиційна рідина перебуває поза межами судинного
русла й омиває клітини. Спеціальні рідини, що змішані ра-
зом як міжклітинні, описані нижче. Об’єм ПКР становить
третину від загальної води організму (ЗВО), решта
внутрішньоклітинна рідина (ВКР).
Устрій організму людини
У пересічного молодого дорослого чоловіка 18% маси
тіла становлять білки та споріднені речовини, 7% міне-
ральні речовини і 15% - жири. Решта 60% - це вода. Вод-
ні простори організму показані на рис. 1-1.
Внут рішньоклітинна рідина в організмі становить при-
близно 40% від маси тіла, а позаклітинна - 20%. Майже
25% ПКР міститься в системі судин (плазма становить 5%
від маси тіла) і 75%-у позасудинному руслі (інгерсіиційна
рідина станови гь 15% від маси тіла). Загальний об’єм крові
- близько 8% від маси тіла.
Вимірювання об’ємів водних середовищ
організму
Об’єм кожного типу рідини в організмі людини можна
визначити тільки теоретично. У разі введення речовини,
яка залишатиметься тільки в одному середовищі, обчис-
люють об’єм речовини, у якому тестована речовина поши-
рилась (об’єм поширення введеної речовини). Цей об’єм
дорівнює кількості введеної речовини (мінус КІЛЬКІСТЬ
будь-якої речовини, що виділяється і організму під час
метаболізму або піддається екскреції в разі змішування),
розділеній на концентрацію цієї речовини в зразку. Наприк-
лад: уведено 150 мг сахарози особі з масою 70 кг. Рівень
сахарози в плазмі - 0,01 мг/мл. Відомо, що 10 мг може
скскретуватись або піддатись метаболізму під час змішу-
вання. Об’єм поширення сахарози
150 мг-10 мг
0,01 мг/мл
= 14000 мл.
2 367’2
2 / РОЗДІЛ 1
іікіра
Чирки
Рис. 1-1. Водні середовища організму. Стрілками зображено
напрям руху рідини. Міжклітинні рідини, що становлять дуже
незначний відсоток серед усіх рідин тіла, не зображено
Оскільки 14 000 мг є простором розповсюдження саха-
рози, то його ще також називають сахарозним просто-
ром.
Об’єм поширення можна обчислити для будь-якої ре-
човини, яку вводять у тіло, за умови, що є змога точно ви-
значити її концентрацію в рідині тіла і кількість, виведену
внаслідок екскреції та метаболізму.
Незважаючи на те, що принцип, покладений в основу
такого вимірювання, простий, потрібно врахувати низку
чинників, які можуть призвести до ускладнень. Речовина,
яку вводять, повинна бути нетоксичною, рівномірно змі-
шуватися в об’ємі, що його вимірюють, а також самостійно
не впливати на поширення води чи інших речовин у тілі.
Окрім того, вона не повинна змінюватися під час змішу-
вання або ж кількість речовини, що змінилася, повинна
бути відомою. І неодмінно речовина повинна порівняно
легко піддаватися вимірюванню.
Об’єм плазми, загальний об’єм крові та
об’єм еритроцитів
Об’єм плазми вимірюють з використанням барвників,
які зв’язуються з білком плазми, зокрема Еванса синього
(Т-1824). Його також можна виміряти шляхом уведення
альбуміну, значеного радіоактивним йодом. Відповідні
порції введеного розчину та зразків плазми, отримані після
ін’єкції, досліджують за допомогою сцинтиляційного лі-
чильника. Середнє значення об'єму плазми - 3500 мл (5%
від маси тіла людини, яка має 70 кг).
Якщо відомий об’єм плазми, а також гематокрит (тобто
відсоток від об’єму зразка крові, зайнятий клітинами), то
загальний об’єм крові можна обчислити за такою форму-
лою:
юо
об єм плазми х-----------.
100-гематокрит
Приклад. Гематокрит становить 38, а об’єм плазми -
3500 мл. Тоді загальний об’єм крові
3500 х 100 5645 мл.
100 -38
Об’єм еритроцитів (об’єм усіх еритроцитів, що цир-
кулюють в організмі людини) визначають, віднімаючи
об’єм плазми від загального об’єму крові. Його можна
також визначити, увівши значені червоні кров’яні тільця і
після змішування обчисливши частку значених еритро-
цитів.
Загальноприйнятою позначкою є 51Сг, радіоактивний
ізотоп хрому, який приєднується до червоних кров’яних
тілець, і який визначають у конкретному об’ємі крові. Прак-
тикують використання ізотопів заліза і фосфору (59Ее і ^2Р),
а також антигенні позначки.
Об’єм позаклітинної рідини
Об’єм позаклітинної рідини важко виміряти тому, що
межі цього простору погано визначені, а речовин, які
швидко змішуються в цьому просторі і залишаються поза-
клітинними, є небагато. Лімфу не можна відокремити від
позаклітинної рідини, тому їх вимірюють разом. Багато
речовин надходять у спинномозкову рідину (СМР) повіль-
но внаслідок наявності гематоенцефалічного бар’єра (див.
Розділ 32). Зрівноважування концентрацій речовин у
суглобній рідині, водянистій рідині та позаклітинній рідині
у безсудинних тканинах, таких як щільна сполучна тканина,
хрящова, та в деяких часі инах кістки відбувається поволі
Речовини, що поширюються в позаклітинній рідині, можна
виявити в секретах залоз, а також у вмісті шлунково-киш-
кового тракту. Оскільки ці рідини відокремлені від решти
позаклітинної рідини, то їх, як і СМР, рідини ока та деякі
інші, називають міжклітинними рідинами. їхній об’єм
порівняно незначний.
Найточніше об’єм ПКР можна виміряти за допомогою
інуліну, полісахариду з молекулярною масою 5200. Для ви-
мірювання об’єму ПКР також застосовують манітол та са-
харозу. Загальноприйнятий об’єм ПКР становить 20% від
маси тіла, або Млу людини масою 70 кг (3,5 л - плазма;
10,5 л - інтерстиційна рідина).
ЗАГАЛЬНІ ЗАСАДИ ТА КЛІТИННІ ОСНОВИ ФІЗІОЛОГІЇ ЛЮДИНИ / З
Об’єм інтерстиційної рідини
Простір, який займає інтерстиційна рідина, не можна
виміряти безпосередньо, оскільки цю рідину важко отри-
мати, а речовини, що зрівноважуються в ній, також зрів-
новажуються в плазмі. Об’єм інтерстиційної рідини обчис-
люють, віднімаючи об’єм плазми від об’єму ПКР. Індекс
співвідношення об’єму ПКР до об’єму внутрішньоклітин-
ної рідини у немовлят та дітей більший, ніж у дорослих.
Однак зрозуміло, що загальний об’єм ПКР у дітей менший,
тому в них збезводнення розвивається набагато швидше і
часто має гостріші форми, ніж у дорослих.
Об’єм внутрішньоклітинної рідини
Об’єм внутрішньоклітинної рідини також не можна ви-
міряти безпосередньо. Його обчислюють відніманням
об’єму ПКР від ЗВО. ЗВО вимірюють за допомогою того
самого принципу розчинення, який використовують для
визначення інших обмежених просторів тіла. Найчастіше
для цього використовують дейтерій оксид (О2О - важка
вода). За властивостями О2О мало чим відрізняється від
Н,О, проте в експериментах з вимірювання об’ємів води
організму дає точніші результати завдяки принципу зрівно-
важування концентрацій речовин. З цією метою також
використовують тритій оксид та амінопурин. Вміст води в
пісній* масі тіла є сталим і становить 71-72 мл на 100 г
тканини, оскільки ж жир практично не містить води, то
співвідношення ЗВО до маси тіла змінюється пропорційно
до вмісту в ньому жиру. ЗВО є дещо нижчим у жінок, ніж
у чоловіків і в обидвох статей ці показники зменшуються
з віком (табл. 1-1).
Одиниці вимірювання концентрації
розчинених речовин
Кількість молекул, електричних зарядів чи частинок
речовини на одиницю об’єму певної рідини тіла під час
аналізування впливу різних фізіологічно важливих речовин
та взаємодії між ними є часто важливішими, ніж просто
маса речовини на одиницю об’єму. З огляду на це концент-
рацію часто виражають у молях, еквівалентах чи осмолях.
Моль
Моль відображає грам-молекулярну масу речовини, тоб-
то молекулярну масу речовини в грамах. В одному молі
міститься приблизно 6x1023 молекул. Мілімоль (ммоль)
становить 1/1000 моля, а мікромоль - 1/1 000 000 моля.
Отже, 1 моль №С1 має масу 23 + 35,5 = 58,5 г, а 1 ммоль -
58,5 мг. Моль є стандартизованою одиницею вимірюван-
ня кількості речовин у системі СІ (див. Додаток).
* Пісна маса тіла - маса тіла без жирової тканини.
Таблиця 1-1. Об’єм загальної води організму людини
(у відсотках до маси тіла) залежно від віку і статі
Вік Чоловіки Жінки
10-18 59% 57%
18—40 61% 51%
40-60 55% 47%
Понад 60 52% 46%
Молекулярна маса речовини - це відношення маси
молекули речовини до маси 1/12 атома карбону ^.Оскіль-
ки молекулярна маса є відношенням, то вона безрозмірна.
Одиницю маси, що дорівнює 1/12 маси атома карбону 12,
називають дальтон** (Да); а 1000 Да= 1 кілодальтон (кДа).
Кілодальтон, який часто позначають літерою К, є зручною
одиницею вимірювання маси білків. Наприклад, можна
говорити про 64 К білка, чи стверджувати, що молекулярна
маса білка становить 64 000 Да. Оскільки ж молекулярна
маса - це співвідношення, і вона безрозмірна, то тверджен-
ня про те, що молекулярна маса білка становить 64 кДа, є
неправильним.
Еквіваленти
Поняття електричної еквівалентності важливе для фі-
зіології з огляду на те, що багато важливих розчинених
речовин у тілі людини перебувають у вигляді заряджених
частинок. Один еквівалент (екв.) - це 1 моль йонізованої
речовини, поділений на її валентність. Один моль N301
дисоціює на 1 екв. №' та 1 екв. СІ . Один еквівалент N3’ =
23 г/моль = 23 г; а 1 екв. Са2+ = 40 г/2 = 20 г. Міліеквівалент
(мекв.) дорівнює 1/1000 одного еквівалента.
Електрична еквівалентність не завжди те саме, що хі-
мічна. Моль-еквівалент є масою речовини, що хімічно екві-
валентна до 8000 г кисню. Молярна концентрація еквіва-
лента (нормальність (н.)) у розчині - це кількість моль-
еквівалентів в 1 л; 1 н. розчин соляної кислоти містить
1+35,5 г/л = 36,5 г/л.
рН
Підтримання сталої концентрації йонів водню у водних
середовищах людини є життєво важливим. Уважають, що
рН розчину - це негативний логарифм [Н4]. Наприклад,
рН води при 25°С, у якій однакова кількість йонів Н4 та
ОН , становить 7,0 (рис. 1-2). Для кожної зміни показника
рН на одиницю, що менша ніж 7,0, [Н4] удесятеро збіль-
шується; для кожного показника рН, що збільшується від
7,0, [Н4] удесятеро зменшується.
** В Україні цю одиницю називають атомною одиницею маси
(а.о.м.).
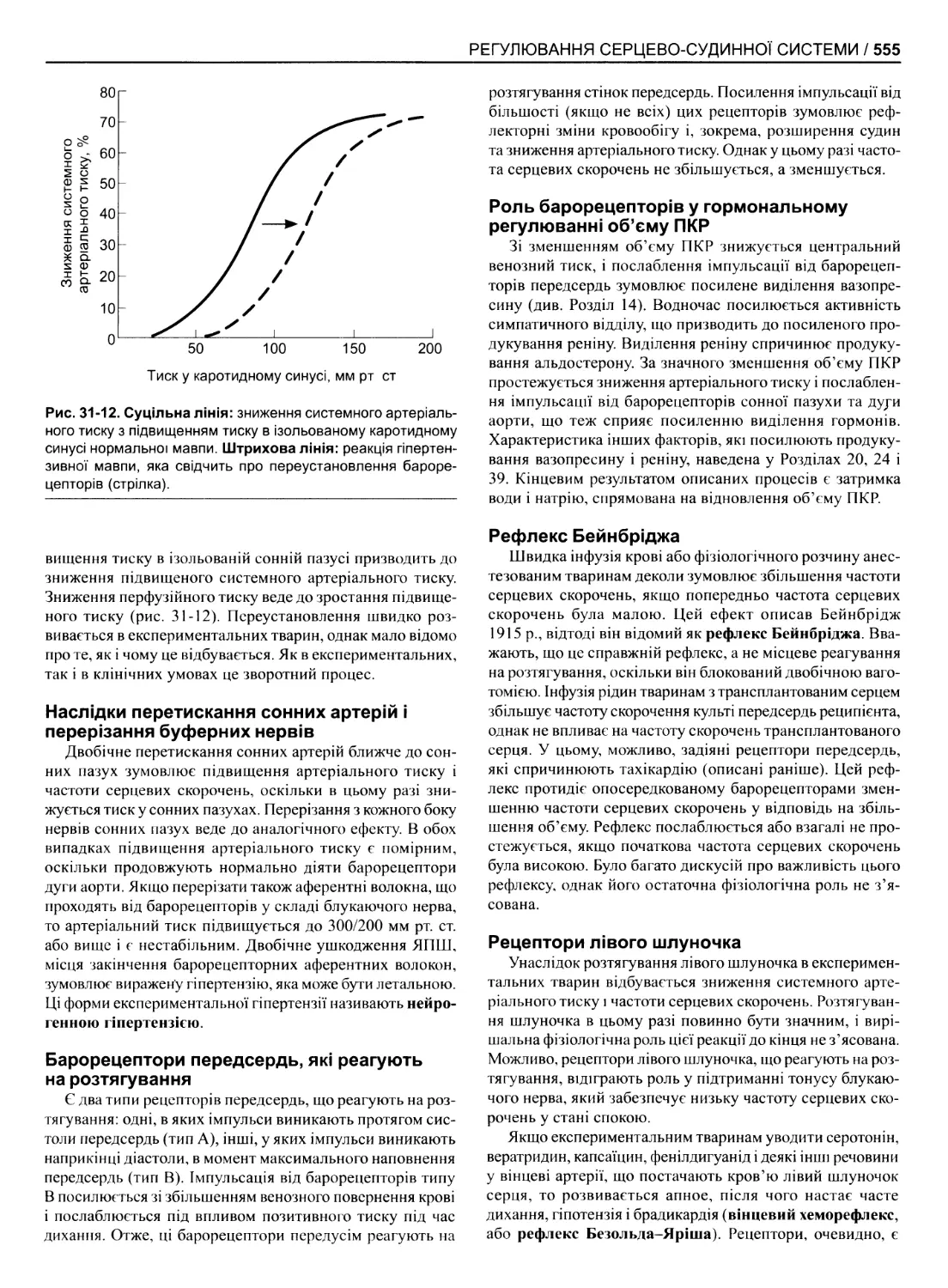
Рис. 1-2. Значення рН (відтворено за дозволом з АІЬегІз В еі
аі: Моїесиїаг Віоіоду о! іііе СеІІ. ОагІапсІ, 1983).
4 / РОЗДІЛ 1
Буфери
Внутрішньоклітинний та позаклітинний рН, як звичай-
но, є сталими. Наприклад, рН ПКР становить 7,40 і в здо-
рової людини цей показник, здебільшого, не відхиляються
більше ніж на ±0,05 рН В організмі рН стабілізує буферна
ємність рідин. Буфер - це система організму людини, що
має здатність зв’язувати чи вивільнювати Н у розчині,
тобто підтримувати рН розчину порівняно сталим, незва-
жаючи на значне збільшення концентрації кислоти чи лугу.
Одним з таких буферів є система, що утворюється з кар-
бонатної кислоти, яка тільки частково дисоціює на Н' та
гідрої енкарбонат: Н^СО, — Н ±НСО3 . Якщо додавати Н
до розчину карбонатної кислоти, то рівноваїа зміщувати-
меться ліворуч і більшість Н буде виведена з розчину. У
разі додавання ОН йони Н" та ОН сполучаються, унаслі-
док чого концентрація Н зменшується. Однак процес
зменшення концентрації Н зводить до мінімуму подальша
дисоціація Н2СОГ Інші буферні системи представлені
білками крові та білками в клітинах. Кількісні аспекти
процесу буферування, а також механізми регулювання ди-
хальною системою та ниркою, що керують буферами для
підтримання стабільної рН ПКР на рівні 7,40, описані в
Розділі 39.
Дифузія
Дифузія - це процес, під час якого газ-чи речовина, час-
тинки яких рухаються, поширюється, заповнюючи весь до-
ступний простір. Част инки (молекули чи атоми) речовини,
розчинені в розчиннику, перебувають у постійному хао-
тичному русі. Вони з однаковою ймовірністю можуть руха-
тися всередину або поза межі місця їхньої високої концент-
рації. Та оскільки в місці високої концентрації таких
частинок є більше, то загальна кількість частинок, що
рухаються в місця меншої концентрації, збільшується,
тобто, виникає потік частинок розчиненої речовини з місць
високої концентрації в місця низької концентрації. Час,
потрібний для досягнення рівноваги в разі дифузії, пропор-
ційний до квадрата дифузійної відстані. Схильність поши-
рення дифузії з одного місця в інше прямо пропорційна до
площі поперечною перерізу об’єму, у якому відбуває ІЬСЯ
дифузія, та градієнта концентрації, чи хімічного граді-
єнта, що є різницею концен і рації речовини, яка дифундує,
поділеної на щільність середовища (закон дифузії Фіка)
Оі же,
де 3 - рівень дифуиї; О - коефіцієнт дифузії; А - площа;
Ас/Ах - ірадієні концентрації. Знак мінус означає напрям
дифузії. Під час руху молекул від вищої концентрації до
нижчої Ас/Ах є від’ємним і у разі множення на ПА дає
додатне значення. Проникність середовищ, у яких відбу-
ває іься дифузія в орі анізмі, різна, однак дифузія є’ головним
чинником, який впливає на рошоділ води та розчинених
речовин.
Осмос
Якщо речовина розчинена у воді, то концентрація моле-
кул води у цьому розчині менша, ніж у чистій воді, оскільки
внаслідок додавання речовини до води утворюється роз-
чин, щє) має більший об’єм, ніж сама вода. І якщо цей роз-
чин помістити по один бік мембрани, що проникна для
води і не проникна для розчиненої речовини, а однаковий
об’єм води - по інший, то молекули води дифундуватимуть
до розчину, знижуючи градієнт концентрації (рис. 1-3).
Процес дифузії молекул розчинника в місця вищої кон-
центрації розчиненої речовини, для якої мембрана непро-
никна, називають осмосом. Він є важливим у фізіологічних
процесах. Схильність молекул розчинника до руху в місця
вищої концентрації розчинюваної речовини можна подо-
лати, застосовуючи тиск до конценгрованшюго розчину.
Тиск, потрібний для запобігання руху розчинника, нази-
вають осмотичним тиском.
Осмотичний тиск, як і зниження тиску пари, зниження
температури замерзання, підвищення температури кипін-
ня, залежить швидше від кількості, ніж від типу частинок
у розчині; це суттєва спільна властивість розчинів. В
ідеальному розчині осмотичний тиск Р співвідноситься
з температурою та об’ємом так само, як і тиск газу:
р ^Т
V ’
де п - кількість частинок; К - газова стала; Т - абсолютна
температура; V - об’єм. Очевидно, що в разі сталого зна-
чення Т осмотичний тиск пропорційний до кількості час-
тинок у розчині на одиницю об’єму розчину. Тому концент-
рацію осмотично активних частинок звичайно виражають
в осмолях. Один осмоль дорівнює молекулярній масі речо-
вини в грамах, поділеній на кількість частинок, вивільне-
них кожною молекулою в розчині. Міліосмоль (мосмоль)
- це 1/1000 осмоль.
У випадку, коли розчиненою речовиною є неелектроліт.
наприклад глюкоза, то осмотичний тиск є функцією кіль-
кості наявних молекул глюкози. Якщо ж розчинена речо-
вина йонізується й утворює ідеальний розчин, то кожний
йон є осмотично активною частинкою. Наприклад, №С1
дисоціюватиме на йони На' та СІ , отже, кожний моль у
розчині постачатиме 2 осмолі. Один моль №28О4 дисоцію-
ватиме на два № га 8О42 , постачаючи 3 осмолі. Проте
рідини організму не є ідеальними розчинами і, хоча дисо-
ціація сильних електролітів повна, кількість частинок, що
чинять осмотичний тиск, зменшується внаслідок взаємо-
дії між йонами. Отже, власне діюча концентрація (актив-
ніст ь) рідин організму швидше, ніж кількість еквівалентів
електроліту в розчині, визначає його осмотичну дію. Ось
чому, наприклад, на 1 ммоль №С1 в 1 л рідини тіла припа-
дає менше ніж 2 мосмолі осмотично активних частинок.
Чим розчин концет рованіший, тим більше відхилення від
ідеального.
Осмоляльну концентрацію речовини в рідині визначає
ступінь зниження температури замерзання за умови, що
одномоляльний розчин має температуру замерзання, мен-
шу на 1,86°С. Кількість мосмолів на літр розчину дорівнює
зниженню температури замерзання розчину, поділеної на
0,00186. Осмолярність - це кількіст ь осмолів на літр роз-
чину - наприклад плазми, а осмоляльність - це кількість
осмолів на кілограм розчинника. Тому на осмолярність
впливає об’єм розчинених речовин і а температура, тоді
ЗАГАЛЬНІ ЗАСАДИ ТА КЛІТИННІ ОСНОВИ ФІЗІОЛОГІЇ ЛЮДИНИ / 5
Рис. 1-3. Схематичне зображення осмосу Молекули води
показано у вигляді маленьких білих кілець, а молекули розчи-
неної речовини - у формі великих чорних кругів. На схемі
ліворуч воду розміщують з одного боку мембрани, проникної
для води і непроникної для розчиненої речовини, а з іншого
боку поміщають однаковий об’єм розчиненої речовини. Моле-
кули води рухаються в напрямі зниження їхнього концентра-
ційного ґрадієнта до розчину і, як зображено на схемі право-
руч, об’єм розчину збільшується Стрілкою праворуч вказано,
що осмотичний тиск - це тиск, який необхідно докласти, щоб
запобігти рухові молекул води
як на осмоляльність ці чинники не впливають. Осмотич-
но активні речовини в організмі розчиняються у воді, а
густина води дорівнює одиниці, отже, осмоляльні концент-
рації можна виразити в осмолях на літр (осмоль/л) води.
Ми більше розглядатимемо осмоляльні (а не осмолярні)
концентрації, і осмоляльність виражатимемо в мілюсмолях
на літр (води).
Незважаючи нате, що гомогенний розчин містить осмо-
тично активні частинки і, можна сказати, мас осмотичний
тиск, він може чинити його лише в разі контакту з іншим
розчином, відділеним мембраною, що є проникною для
розчинника і непроникною для розчиненої речовини.
Осмоляльна концентрація плазми:
ТОНІЧНІСТЬ
Температура замерзання плазми людини дорівнює в
середньому -0,54°С, що відповідає осмоляльній концент-
рації плазми 290 мосмоль/л, а іакож осмотичному тиску
7,3 атмосфери. Можна передбачати, що рівень осмоляль-
ності буде більшим, оскільки сума всіх катіонних та аніон-
них еквівалентів у плазмі перевищує 300. Однак цей рівень
не настільки високий, тому що плазма не є ідеальним роз-
чином і йонні взаємодії зменшуюіь кількість частинок,
що чинять осмотичний тиск. За винятком випадків, коли
після рантової зміни складу рівновага не встиіла відно-
витися, усі відділи організму людини, що міс і ять рідину,
перебувають в осмотичній рівновазі або в близькому до
неї стані.
Термін тонічність використовують для описання осмо-
ляльності розчину щодо плазми. Розчини, що мають таку
жосмоляльність, як і плазма, називають ізотонічними; ті,
що мають вищу, - гіпертонічними, а ті що мають нижчу,
-гіпотонічними. Всі розчини, які початково ізоосмотичні
з плаїмою (зокрема, мають такий же осмотичний тиск, чи
зниження температури замерзання) були б такими, якби
не іе, що деякі ро вчинені речовини дифундую 1Ь у КЛІТИНИ,
а деякі - піддаються метаболізму. Отже, 0,9% розчин №С1
ізотонічний, оскільки в ньому нема руху осмотично актив-
них частинок у клітини і вони не підлягають метаболізму.
З іншого боку, 5% розчин глюкози у разі внутрішньовен-
ного введення теж є ізотонічним, однак глюкоза піддається
метаболізму, внаслідок чого кінцевий ефект тотожний уве-
денню гіпотонічного розчину.
Важливим є вплив різноманітних компонентів плазми
на її загальну осмоль концентрацію. Майже 20 із 290 мос-
моль на кожен літр плазми дає \а та аніони, з якими він
сполучається, головно СІ та НСО3 . Частка інших катіонів
і аніонів порівняно мала. Незважаючи на те, що концент-
рація білків у плазмі, виражена у грамах на літр, значна,
вони, як звичайно, становлять менше 2 мосмоль/л. При-
чина цього - їхня надзвичайно висока молекулярна маса.
Головними неелектролітами плазми є глюкоза та сечовина,
які в стійкому стані перебувають у рівновазі з клітинами,
їхня частка осмоляльносгі здебільшого становить по
5 мосмоль/л, однак може значно збільшитися у разі гіпер-
глікемії та уремії.
Заі альна осмоляльність плазми важлива для визначення
рівня дегідратації, гіпергідратаціїта інших водно-електро-
літних відхилень. Г іперосмоляльність може спричинити
кому (гіпсросмолярну кому; див. Розділ 19). Незважаючи
на вплив багатьох розчинених речовин на осмотичний гиск
і відхилення плазми від ідеального розчину, можна легко
обчислити приблизний рівень осмоляльності плазми з
похибкою в кілька міліосмоль на літр, використовуючи
таку формулу:
Осмоляльність = 2[Ма+] + 0,055[глюкоза] + 0,36[ АСК],
(мосм/л) (мекв/л) (мг/дл) (мг/дл)
де с галі клінічні одиниці переводять у мілімолі розчиненої
речовини на літр; АСК - азот сечовини крові. Ця формула
важлива ще й тому, що свідчить про надмірно високу кон-
центрацію інших розчинених речовин. Якщо осмоляль-
нїсть плазми, яку розглядають (визначена за зниженням
температури замерзання), значно перевищує рівень, одер-
жаний за допомогою формули, то це може свідчити про
наявність чужорідної речовини, зокрема етанолу чи мані-
толу (які деколи вводять, щоб осмотично зменшити набряк-
лі клітини), або ж отруйних речовин, таких як етиленглі-
коль чи метанол (компоненти антифризу).
Регулювання об’єму клітин
На відміну від рослинних клітин, які мають негнучкі
стінки, мембрани клітин тварин еластичні. Клітини живих
орі анізмів розширюються, якщо вони піддані позаклітин-
ній гіпотонії, і звужуються в разі позаклітинної гіпертонії.
Внаслідок розширення клітин відбувається активування
каналів клітинної мембрани, що приводить до посилення
виходу К , СІ , органічних аніонів та незначної кількості
органічних розчинюваних речовин, відомих як органічні
ОСМОЛІ! ичні речовини.
Вода проходить за цими осмотично активними частин-
ками з клітини, після чого об’єм клітини стає нормальним.
Йонні канали та інші мембранні транспортні білки деталь-
ніше розглянуто нижче.
6 / РОЗДІЛ 1
Нейонна дифузія
Деякі слабкі кислоти й основи достатньо розчинні в клі-
тинних мембранах, якщо не дисоціювали, тоді як у вигляді
йонів вони важко проникають через мембрани. Отже, якщо
молекули непродисоційованої речовини дифундують з
одного боку мембрани до іншого і потім дисоціюють, то
виникає окреслений кінцевий напрям руху непродисоці-
йованої речовини з одного боку мембрани до іншого. Це
явище називають нейонною дифузією. Воно простежу-
ється в шлунково-кишковому тракті (див. Розділ 25) та нир-
ках (див. Розділ 38).
Ефект Доннана
У випадку, коли з одного боку мембрани міститься йон.
що не може дифундувати через мембрану, то розподіл
інших йонів, для яких мембрана проникна, є передбачу-
ваним. Наприклад, негативний заряд аніона, що недифун-
дує, сповільнює дифузію катіонів і прискорює дифузію
аніонів. Розглянемо такий приклад:
X У
м
к+ к+
СІ- СІ-
Білоїс
де мембрана (м) між секціями %та У непроникна для білка,
однак вільно проникна для К та СІ . Припустимо, що
концентрація аніонів та катіонів з обох боків початково
однакова; СІ дифундує, внаслідок чого зменшується його
градієнт концентрації з ¥ до X, а Ю рухається разом з не-
гативно зарядженим СІ , підтримуючи електронейтраль-
ність боку ¥, а отже, і стан рівноваги:
[К\] > [К*у].
Далі
[ К*х] + [ СІ х] + [ Білок~х] > [ К*у] + [ СІ ¥],
тобто на боці X осмотично активних частинок є більше,
ніж на боці V.
Доннан та Ґіббс довели, що за наявності йона, нездат-
ного до дифузії, йони, які дифундують розподіляються так,
що в разі рівноваги співвідношення їхніх концентрацій є
однаковими:
на наявність у клітинах білків (Білок ) кількість осмотично
активних частинок там більша, ніж в інтерстиційній рідині.
Оскільки клітини живих організмів мають еластичні стін-
ки, то внаслідок осмосу вони б розбухали чи навіть розри-
валися, якби Ха-К-АТФ-аза не випомповувала з них йо-
нів (див. нижче). Отже, нормальний об’єм клітини та тиск
залежать від Ха-К-АТФ-ази. По-друге, внаслідок рівно-
ваги розподіл йонів, що проникають через мембрану (м),
асиметричний, а це призводить до електричної різниці з
обох боків мембрани, значення якої можна обчислити за
рівнянням Нернста (див. нижче). У нашому прикладі бік
X стосовно ¥ буде негативно зарядженим. Зазначимо, що
в будь-якій макроскопічній частині розчину кількість пози-
тивних та негативних зарядів однакова. Проте в описува-
ній ситуації заряди розподіляться вздовж мембрани з гра-
дієнтом концентрації для СІ , що точно збалансований з
електричним градієнтом протилежного напряму; це також
стосується і К . По-третє, оскільки в плазмі є більше біл-
ків, ніж в інтерстиційній рідині, то ефект Доннана вини-
кає під час руху через капілярну стінку (див. нижче).
Сили, що діють на йони
Сили, що діють через мембрану клітин на кожен йон,
можна описати математично. У позаклітинній рідині кон-
центрація йонів хлору вища, ніж усередині клітин, тому ці
йони, як звичайно, дифундують у клітину за градієнтом
концентрації. Сумарний внутрішньоклітинний заряд
негативний щодо сумарного зовнішньоклітинного заряду,
тому відбувається виштовхування йонів хлору з клітини
вздовж електричного градієнта. Рівновага настає тоді,
коли приплив та відплив СІ однаковий. Мембранний по-
тенціал, за якого ця рівновага стабільна, називають потен-
ціалом рівноваги. Його значення можна обчислити з
рівняння Нернста
Есі
= рт |ДСІЛ
р2сі [СГ]В
де Ес| - потенціал рівноваги для СІ ; К - газова стала; Т -
абсолютна температура; Р - стала Фарадея (кількість куло-
нів на моль заряду); Х(| - валентність СІ (І); [СІ ]{ - кон-
центрація СІ ззовні клітини; [СІ ]в - концентрація СІ все-
редині клітини.
Після перетворення звичайного логарифма в десятковий
і заміни деяких сталих цифровими значеннями отримаємо
[К\] [СГу]
[К+у] [СГх]’
Перемноживши члени пропорції, отримаємо рівняння Ґіб-
бса-Доннана:
[ К\] [ СІ Х] = [ К\] [ СІ у].
Воно правильне для будь-якої пари катіонів та аніонів з
однаковою валентністю.
Ефект розподілу йонів Доннана по-різному впливає на
процеси, що відбуваються в організмі. По-перше, з огляду
Ес. =61,5Ід[СІ 1в за 37С.
[СІ],
Зазначимо, що в разі спрощення виразу, співвідношення
концентрації обернено пропорційне, тому що валентність
СІ -1 вилучена з виразу.
Потенціал рівноваги ЕС|, обчислений зі значень, наведе-
них у табл. 1 -2, становить -70 мВ, що ідентичне значенню
мембранного потенціалу. Отже, щоб пояснити розподіл СІ
на різні боки мембрани, потрібно враховувати ті сили, які
виражені в хімічних та електричних градієнтах.
Тотожний потенціал рівноваги можна обчислити й для
йонів К':
ЗАГАЛЬНІ ЗАСАДИ ТА КЛІТИННІ ОСНОВИ ФІЗІОЛОГІЇ ЛЮДИНИ / 7
с рт , [К ]3 [К+].
Ек Іп1 13 = 61,5 Ід1
р2к [К’]в [К+],
за 37 С,
де Е потенціал рівноваги для Ю; 2К - валентніст ь К (І);
[К ] - концентрація К ззовні клітини; [К+]|( - концент-
рація К всередині клітини.
У цьому випадку градієнт концентрації спрямований
назовні, а електричний - всередину. У спінальних мотор-
них нейронах ссавців Ек дорівнює -90 мВ (див. табл. 1 -2).
Оскільки ж мембранний потенціал становить -70 мВ, то в
нейронах міститься дещо більше К , ніж це визначено
електричним та хімічним градієнтами.
На відміну від співвідношення концентрацій К+ та СІ ,
хімічний градієнт №' спрямований досередини - у зону
його меншої концентрації, як і електричний. Потенціал рів-
новаги ЕНі становить +60 мВ (див. табл. 1-2). Оскільки ні
Ек, ні ЕНі не ототожнюються з мембранним потенціалом,
то можна було б очікувати, що клітина поступово набувати-
ме № і втрачатиме К за умови, що на мембрану діяли
тільки пасивні електричні та хімічні сили. Однак внутріш-
ньоклітинна концентрація На" та К є сталою, оскільки від-
бувається активне транспортування На' з клітини в напря-
мі, протилежному до його електричного та концентрацій-
ного градієнтів. Це транспортування поєднане з активним
транспортуванням К в клітину (див. нижче).
Значення мембранного потенціалу в будь-який момент
часу залежить, звичайно, від розподілу К4 та СІ і проник-
ності мембрани для кожного з цих йонів. Рівняння, що
досит ь точно описує цю взаємодію, називають рівнянням
сталого поля Ґолдмана:
Е КТ|пРкЛКЗ, + РНаЛМаЗ, + Рсг[СІ1в
Р РкЛКТ.+РНаЛ№3.+Рс1ЛСГ]3’
де Е - мембранний потенціал; К - газова стала; Т - абсо-
лютна температура; Е - стала Фарадея; Рг, Р№+ та Р(1 -
проникність мембрани для Кь, №' та СІ , відповідно. Дуж-
ки означають концентрацію, в та з стосуються внутріш-
нього та зовнішнього простору клітини. Оскільки РшТ по-
рівняно з Рк* в клітинах у стані спокою є низьким, то На4
мало впливає на значення Е.
Як випливає з рівняння Ґолдмана, зміни у зовнішній кон-
центрації На* не спричинюють значних змін клітинного
потенціалу, тоді як збільшення зовнішньої концентрації К
приводить до його зменшення.
Таблиця 1-2. Концентрація деяких йонів усередині та
ззовні спинномозкових мотонейронів у ссавців
Йон Концентрація, ммоль/л Н2О Потенціал спокою мембрани, мВ
усередині клітини ЗЗОВНІ клітини
15,0 150,0 +60
К+ 150,0 5,5 -90
СГ 9,0 125,0 -70
Описане властиве клітинам різноманітних типів. На-
приклад, у клітині скелетного м’яза, мембранний потенціал
спокою становить приблизно -90 мВ; Ес (дорівнює -86 мВ;
Е,, становить - 100 мВ і Ек, - +55 мВ.
К N3
Походження мембранного потенціалу
Процес переміщення йонів через клітинну мембрану та
природа цієї мембрани дають змогу пояснити виникнення
мембранного потенціалу. Як відомо, концентраційний
градієнт К‘ сприяє рухові К+ з клітини через К -канали,
натомість електричний градієнт К+ має протилежне (внут-
рішнє) спрямування. Унаслідок цього настає баланс, за яко-
го схильність К до руху з клітини врівноважена його ж
схильністю до руху у клітину. В такому випадку виникає
незначний надлишок катіонів ззовні та аніонів усередині.
Цей стан підтримує Ка -Ю-АТФ-аза, що перепомповує К4
назад у клітину й утримує внутрішньоклітинну концент-
рацію На' низькою. Дія Ка -К -помпи теж робить внесок
у створення мембранного потенціалу, оскільки на кожні
три Ка+, випомпованих з клітини, припадає два К\ упомпо-
ваних у неї. Отже, №4-К7-АТФ-аза також незначно впливає
на мембранний потенціал. Зазначимо, що йони, відпові-
дальні за мембранний потенціал, становлять дуже незначну
частину від загальної кількості йонів, загальна ж концент-
рація позитивних та негативних йонів однакова всюди, за
винятком концентрації тих, які розташовані вздовж мемб-
рани. Надходження Ка+ не компенсує відтоку К’, оскільки
завдяки К -каналам (див. нижче) мембрана є більше пере-
пускною для К4, ніж для №4.
ФУНКЦІОНАЛЬНА МОРФОЛОГІЯ
КЛІТИНИ
Застосування методів сучасної клітинної та молекуляр-
ної біології привело до низки революційних зрушень у тлу-
маченнях структури та функціонування клітини, як і у ви-
вченні ембріонального та постембріонального розвитку на
клітинному рівні. Хоча постембріональний розвиток, а
також деталі біології клітин є поза межами нашого до-
слідження, базові знання клітинної біології потрібні для
розуміння систем органів тіла і того, як вони функціону-
ють. Спеціалізація клітин різних органів надзвичайно
різноманітна, жодну клітину не можна назвати типовою
для цілого організму. Та все ж деякі спеціалізовані частини
(органели) спільні для більшості клітин. Ці частини по-
казано на рис. І -4. Багато з них можна відокремити ультра-
центрифугуванням у поєднанні з іншими технологіями.
Після гомогенізації клітин та ультрацентрифугування отри-
маної суспензії спочатку осідають ядра, а згодом - міто-
хондрії. Швидкісне центрифугування, що збільшує силу
тяжіння в 100 000 разів і більше, спричиняє виділення
фракції, яка складається з гранул, відомих як мікросоми,
за їхнє осідання. До цієї фракції належать такі органели,
як рибосоми та пероксисоми.
Клітинна мембрана
Мембрана, що оточує клітину, є надзвичайною струк-
турою. Вона складається з ліпідів та білків і є напівпро-
никною, тобто одні речовини вона пропускає через себе, а
8 / РОЗДІЛ 1
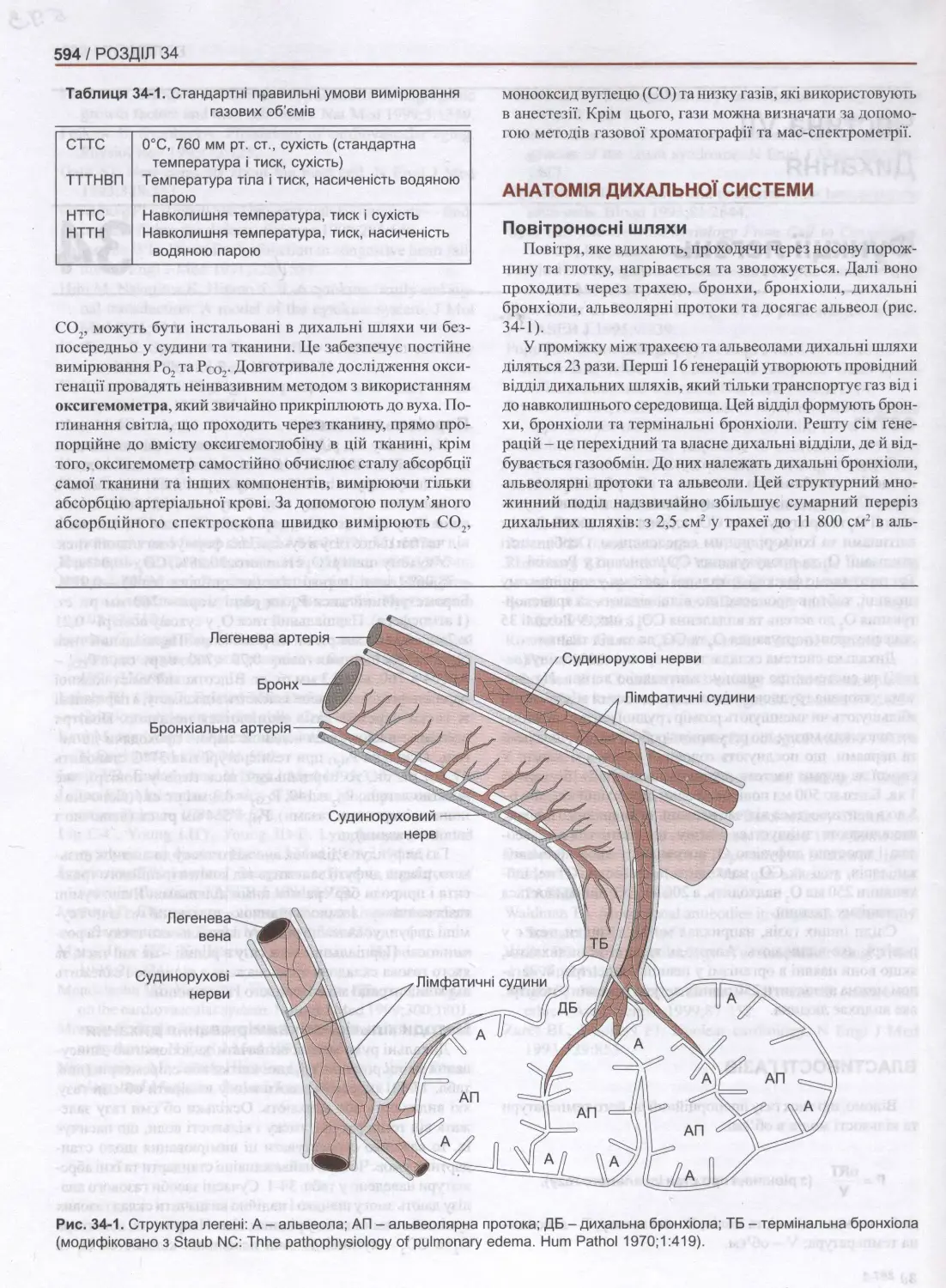
Рис. 1-4. На схемі в центрі зображено гіпотетичну клітину, вигляд через світловий мікроскоп. Навколо неї розташовано
різноманітні органели (за ВІоот апсі Еа\мсей. Відтворено за дозволом з Зипциеіга ЬС, Сагпеігоф КеІІеу КО: Вавіс Нізіоіоду. 9Ф
есі. МсСгаю-НіІІ, 1998).
Рис. 1-5. Біологічна мембрана. Кожна фосфоліпідна молекула
має два ланцюги жирної кислоти (хвилясті лінії), прикріплені
до фосфатної головки (куляста структура). Білки зображено
у вигляді затемнених утворів неправильної форми. Багато з
них - інтегральні білки, що проходять через мембрану, тоді
як периферійні білки прикріплені до внутрішньої (не зобра-
жено) та зовнішньої поверхні мембрани, інколи за допомогою
глікозилфосфатидилінозитольних (ГФТ) якорів (ліворуч).
інші - ні. Щоправда, перепускна здатність мембрани може
змінюватися, оскільки в ній містяться численні регульовані
йонні канали та інші транспортні білки, що здатні зміню-
вати об’єм речовин, які рухаються через мембрану. Таку
мембрану звичайно називають плазматичною мембра-
ною. Ядро клітини оточене мембраною подібного типу,
органели також оточені або складаються з неї.
Незважаючи на те, що хімічний склад та властивості
мембран значно залежать від їхнього розташування, можна
виділити деякі спільні ознаки. Зокрема, товщина мембрани
в середньому становить 7,5 нм (75 одиниць Ангстрема).
Складаються біомембрани з білків та ліпідів. Хімія білків
та ліпідів описана в Розділі 17. Головними ліпідами є
фосфоліпіди, такі як фосфатидилхолін та фосфатидилета-
ноламін. Фосфоліпідна молекула подібна за формою на
прищіпку до білизни (рис. 1-5). Верхній її кінець містить
фосфатну ділянку і є порівняно розчинним у воді (поляр-
ний, гідрофільний). Хвостові кінці порівняно нерозчинні
(неполярні, гідрофобні). Гідрофільні кінці молекул біо-
мембрани перебувають у водному середовищі, яке омиває
клітини ззовні і з боку водянистої цитоплазми; гідрофобні
кінці сходяться у безводному внутрішньому середовищі
мембрани. У прокаріот (клітинах, що не мають ядра, таких
як бактерії) мембрани є досить простими, натомість в
ЗАГАЛЬНІ ЗАСАДИ ТА КЛІТИННІ ОСНОВИ ФІЗІОЛОГІЇ ЛЮДИНИ / 9
Цитоплазматична, або зовнішня, поверхня мембрани
Ліпідна мембрана
О
Л/-Міристил
Білок —СООН
8-Суз—
Білок
— NN
8-Пальмітил
О
Геранілгераніл
Білок
— МИ
Фарнезил
Білок
— І\ІН2
О
С С СН2
С —С —СН
О
О
ГФЛ-якірець о
(Глікозилфосфатидилінозит)
С—О —Р —О-'Інозитол —О--С— Білок
Н
О
Гідрофобний домен
Гідрофільний домен
Рис. 1-6. Зчеплення білка з мембранними ліпідами Деякі зчіплюються за допомогою своїх амінокінців, інші - кінцевих карбо-
ксильних груп, а багато - за допомогою глікозильних форм фосфатидилінозиту (ГФЛ-якірців) (відтворено за дозволом з ГиІІег
ОМ, ЗГііеІсІз Б Моїесиїаг Вазіз оГ МесІісаІ СеІІ Віоіоду Мсбгаїл/ НІІІ8, 1998)
еукаріог (клітинах, то мають ядро) вони місіять різно-
манітні глікосфінголппди, сфінгомієліни та холестерин.
До складу мембрани належить багато різних білків.
Вони існуюіь як окремі одиниці, баїаю з них проникають
через мембрану (інтегральні білки), інші (периферійні
білки) скупчуються з її внутрішнього та зовнішнього боку
(див. рис. І-5). Кількість білків залежить від функції мем-
брани, однак у середньому вони становлять 50% від маси
мембрани; приблизно одна молекула білка припадає на 50
значно менших фосфоліпідних молекул. Білки мембрани
виконують багато різних функцій. Деякі з них є молеку-
лами адгезії, що прикріплюють молекули до сусідніх клі-
тин або до базальних мембран. Інші відіграють роль пом-
пи, активно транспортуючи йони через мембрану. Ще інші
функціонують як носії, транспортуючи під час дифузії ре-
човини в напрямі зниження електрохімічних градієнтів, або
ж є йонними каналами, які в активному стані перепуска-
ють йони через мембрану. Роль помп, носіїв та інших кана-
лів у транспортуванні через клітинну мембрану описана
нижче.
Білки ще однієї групи діють як рецептори, що зв’язу-
ють нейротрансмітери та гормони, спричинюючи фізіо-
логічні зміни всередині клітини. Білки також відіграють
роль ензимів, що ( каїалізаюрами реакцій на поверхнях
мембрани. Окрім іою, деякі глікопрогеїни сприяють до-
зріванню ангиііл і відрізняють клітини господаря від інших
як “свої” га “чужі” (див. Розділ 27).
Гідрофобні частини білків, як звичайно, розташовані
всередині мембрани, і оді як гідрофільні містяться на по-
верхнях. Периферійні білки прикріплені до поверхні мем-
брани різними способами. Один з таких способів - при-
кріплення глікозильних форм фосфатидилінозиту. Білки,
що утримують ці глікозилфосфатидилінозитні (ГФЛ)
якірці (рис. 1 -6), містять такі ензими, як лужна фосфатаза,
різноманітні антигени, низку молекул клітинної адгезії, а
також три протеїни, що запобігають лізису клітин за допо-
могою комплементу (див. Розділ 27). Сьогодні описано
понад 40 ГФЛ-зв’язаних білків поверхні клітини. Інші білки
ліпідизовані, тобто мають спеціальні прикріплені до них
ліпіди (див. рис. 1-6). Вони можуть бути міристильова-
ними, пальмітильованими чи пренильованими, тобто
прикріпленими до геранілгеранільних чи форнезильних
груп.
Структура білків, особливо ензимів біологічних мем-
бран, різна не лише в різних клітинах, а й навіть у межах
однієї. Наприклад, у клітинних та мітохондріальних мем-
бранах містяться різні ензими. У клітинах епітелію ензими
клітинної мембрани слизової поверхні відрізняються від
ензимів цієї мембрани на бокових поверхнях клітин; тобто
клітини поляризовані. Мембрани мають динамічну струк-
туру, і їхні складові постійно відновлюються на різних рів-
нях. Деякі білки прикріплені до цитоскелета, інші можуть
зміщуватися у латеральних напрямах. Наприклад, рецеп-
тори рухаються в мембрані і скупчуються в ділянках ендо-
цитозу (див. нижче).
До більшості клітинних мембран приляїас тонкий
невизначеної структури шар, у якому містяться фібрили,
що у сукупності формують базальну мембрану, або
10/РОЗДІЛ 1
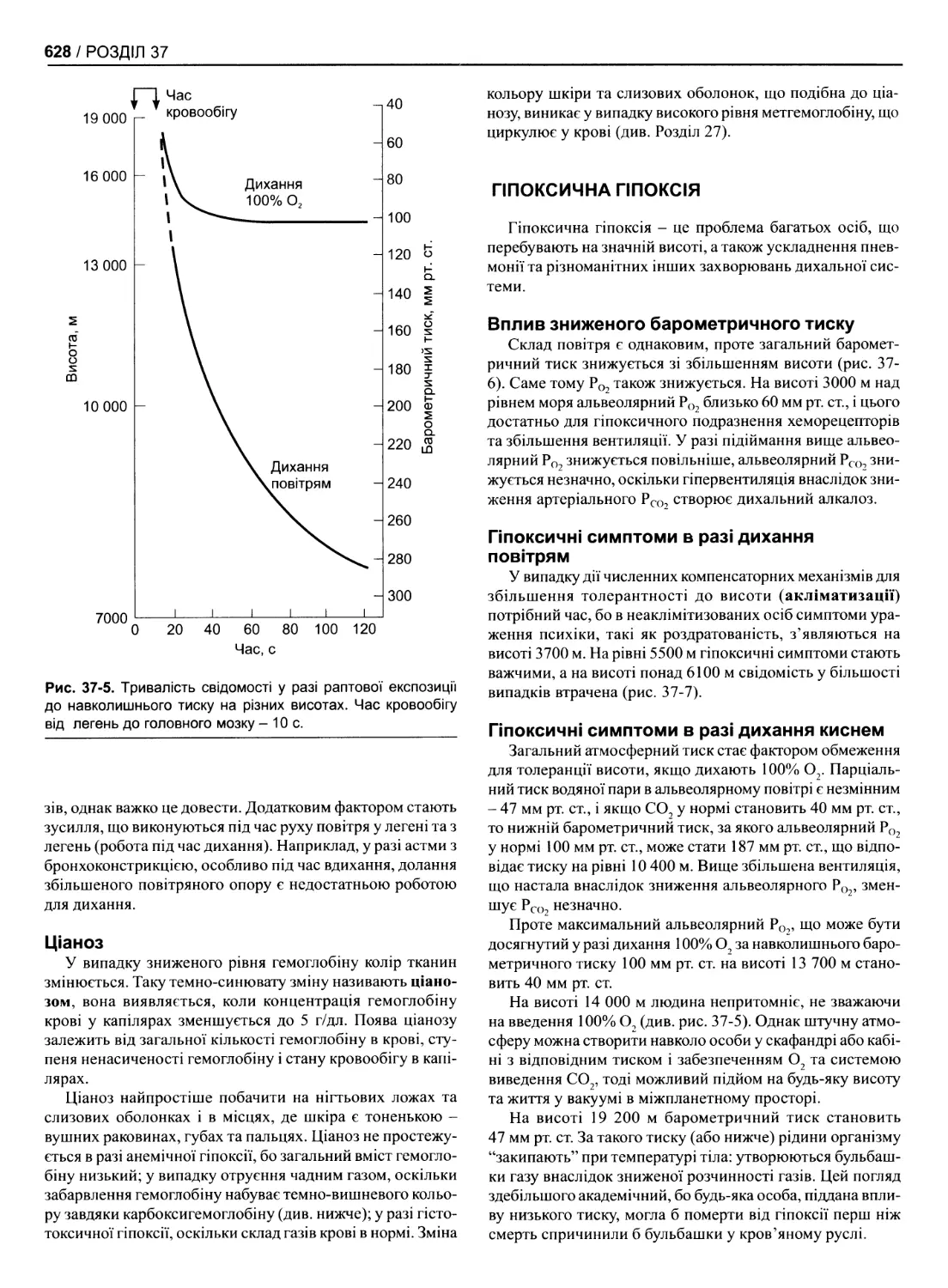
Простір усередині кристи
НАДН Сукцинат ▼ \ І У
Матриксовий простір АТФ
Рис. 1 -7. Головні ензими внутрішньої’ мітохондріальної мемб-
рани, що беруть участь в окисному фосфорилюванні; НАДН-
ДГ- НАДН дегідрогеназа; СДГ - сукцинат дегідрогеназа; Ьс1
- цитохром, ЦОК - цитохром оксидаза (модифіковано з
Загазіе М‘ Охісіаїіуе рЬозрЬогуїаїіоп аї Ше Лп сіє зіесіе. Зсі-
епсе 1999,283 1488)
базальну пластину. Базальна мембрана (а якщо узагаль-
нено, то міжклітинний матрикс) складається з багатьох біл-
ків, які утримую і ь клітини разом, регулюють їхній роз-
виток і визначають ріст. До цих білків належать колагени,
ламініни (див. нижче), фібронектин та протеоглікани.
Мітохондрії
Морфолог ія мі гохондрій дещо відмінна в різних кліти-
нах, однак, незважаючи на це кожна мітохондрія - це струк-
тура витягнутої овальної форми (див. рис. 1-4). Вона скла-
дається з зовнішньої та внутрішньої мембран. Внутрішня
мембрана має складчасту структуру й утворює кристи.
Проміжок між двома мембранами називають простором
усередині кристи, а проміжок всередині внутрішньої мемб-
рани - матриксовим простором. Мітохондрії є головним
джерелом енергії в клітині. Найчисленніші і найліпше роз-
винені ці органели в тих частинах клітин, де відбуваються
процеси, що супроводжуються затратами енергії. Хімічні
процеси в клітинах детально описані у Розділі 17. Зовнішня
мембрана кожної мітохондрії вкрита ензимами, що відпо-
відають за біологічне окиснення і забезпечують сировину
для хімічних реакцій, що відбуваються всередині міто-
хондрії. Всередині мітохондрії містяться ензими, які пере-
творюють продукти метаболізму вуглеводів, білків і жирів
у СО2 та воду за допомогою циклу лимонної кислоти. Комп-
лекс ензимів має чотири складники (рис. 1 -7): НАДН дегід-
рогеназу, сукцинатдегідрогеназу, цитохром Ьсі і цито-
хромоксидазу. Під час процесів, каталізованих цими ензи-
мами, відбувається помпування протонів (Н+) з матриксу
до простору всередині кристи і формування протонового
градієнта. Протони, що дифундують назад за цим градієн-
том, рухаються для синтезу аденозинтрифосфату (АТФ)
за допомогою АТФ синтетази. АТФ - це енергетично бага-
тий трифосфат, який є головним джерелом енергії для
метаболічних процесів не тільки у тварин (див. Розділ 17),
а й у бактерій і рослин, які, однак, синтезують його інакше.
Поєднання оксидації з формуванням АТФ у мітохондріях
називають окисним фосфорилюванням.
АТФ синтетаза це унікальний ензим, утворений кіль-
кома субодиницями з основою, яка залучена до внутріш-
ньої мітохондріальної мембрани, шийкою та сферичною
головкою, що розміщена в мігохондріальному маїриксі.
Більша частина шийки й основи фактично обер гається під
час утворення АТФ.
Майже немає сумніву втому, що колись мітохондріїбули
автономними мікроорганізмами, які налагодили симбіо-
тичні стосунки і а вкорінилися в спадкові еукарюі ичні клі-
тини. Наслідком такого походження є те, що мітохондрії
мають власний геном, у якому набагато менше ДНК, ніж у
геномі ядра (див. нижче), а 99% білків у мітохондрії ( про-
дуктами генів ядра. Однак ДНК мітохондрій відіграє важ-
ливу роль у процесі окисного фосфорилювання. Зокрема,
мітохондріальна ДНК - це подвійно-ланцюгова спірале-
подібна молекула, що містить 16 569 пар основ (порівняй-
те з понад мільярдом у ДНК ядра). Вона кодує 13 білкових
субодиниць, що пов’язані з білками, які кодують гени ядра,
щоб утворити чотири ензимні комплекси, а також дві рибо-
сомні РНК та 22 транспортні РНК (див. нижче), необхідні
для утворення білків внутрішньомітохондріальними рибо-
сомами.
Мітохондрії потрапляють до зиготи не від сперматозо-
їда, а з яйцеклітини, тому вони успадковуються винятково
по материнській лінії. В мітохондрії нема ефективної сис-
теми репарації ДНК, і рівень мутації мітохондріальної ДНК
більше ніж у 10 разів перевищує рівень мутації ДНК ядра.
З’ясовано також, що значна кількість порівняно рідкісних
хвороб спричинені мутаціями в мітохондріальній ДНК. Ці
порушення характерні для тканин з високим рівнем мета-
болізму, унаслідок якого порушується продукування АТФ.
Лізосоми
У цитоплазмі клітини містяться великі, без певної фор-
ми структури, оточені мембраною, - лізосоми. Ці струк-
тури мають вищу кислотність, ніж решта цитоплазми і мо-
жуть містити фрагменти інших компонентів клітини. Лі-
зосомами є також деякі гранули гранулоцитів крові. У кож-
ній лізосомі наявні різноманітні ензими (табл. 1-3), які б
призвели до руйнування більшості компонентів клітини,
якби не були відокремлені від цитоплазми мембраною лізо-
соми.
Лізосоми виконують функцію травного апарату клітини.
Екзогенні речовини, а також бактерії, що їх поглинає клі-
тина, потрапляють в оточені мембраною вакуолі. Вакуолі
цього типу (фагоцитарні) можуть зливатися з лізосомами,
внаслідок чого вміст вакуолі та лізосоми змішується в ме-
жах спільної мембрани. Деякі продукти “травлення” погли-
Таблиця 1-3. Ензими, що містяться в лізосомах, та їхні
внутрішньоклітинні субстрати
Ензим Субстрат
Рибонуклеаза Дезоксирибонуклеаза Фосфатаза Глікозидаза Арилсульфатаза Колагеназа Катепсин РНК Днк Фосфатні ефіри Складні вуглеводи, глікозиди та полісахариди Сульфатні ефіри Білки Білки
ЗАГАЛЬНІ ЗАСАДИ ТА КЛІТИННІ ОСНОВИ ФІЗІОЛОГІЇ ЛЮДИНИ /11
нутого матеріалу будуть абсорбовані через стінки вакуолі,
а залишки - виведені з клітини (екзоцитоз; див. нижче).
Лізосоми також поглинають відпрацьовані компоненти клі-
тини, у яких вони розташовані, утворюючи автофагічні
вакуолі. Коли клітина гине, лізосомальні ензими забез-
печують автоліз її залишків.
Відомо, що у випадку подагри фагоцити поглинають
кристали сечової кислоти, а це спричинює позаклітинне
вивільнення лізосомних ензимів, які сприяють запальній
реакції в суглобах. Якщо лізосомного ензиму бракує від
народження, то цитоплазму заповнює матеріал, який за
нормальних умов розщеплюють ензими. Це призводить
до однієї з лізосомних хвороб накопичення. Наприклад,
нестача катепсину К спричиняє пікнодисостоз, а нестача
глікозиласпарагінази - аспартатглікозамінурію. Таких хво-
роб описано понад 25. Вони трапляються зрідка, однак су-
проводжуються іакими добре відомими розладами, як хво-
роба Тей-Сакса.
Пероксисоми
Пероксисоми розміщені в мікросомній фракції клітини.
Вони мають 0,5 мкм у діаметрі й оточені мембраною. Ця
мембрана містить низку специфічних білків, що відпові-
дають за транспортування речовин у матрикс пероксисоми
та навпаки. У матриксі налічують понад 40 ензимів, які у
разі взаємодії з ензимами з-поза меж пероксисоми відігра-
ють роль каталізаторів різноманітних анаболічних та ката-
болічних реакцій. До катаболічних реакцій належить ката-
болізм довголанцюгових жирних кислот. На пероксисоми
треба звернути особливу увагу, оскільки мутація одного з
генів, що кодує транспортер пероксисомної мембрани,
спричиняє Х-зчеплену адренолейкодистрофію, яка у
дитячому віці призводить до смерті. У разі цієї хвороби
пошкоджується р-окиснення довголанцюгових жирних
кислот. Автосомна мутація, яка зумовлює ще значніші
порушення у транспортуванні через мембрану перокси-
соми, призводить до розвитку синдрому Зеллвегера, що
спричиняє смерть у ранньому дитинстві.
Кількість пероксисом збільшується завдяки пероксид-
ним проліфераторам, які впливають на проліферативно-
активуючі рецептори пероксисом (РРАКз - від англ. рег-
охізоте ргоІіГегаіог-асбуаіесІ гесеріогз) у ядрі. Ці рецепто-
ри є членами суперродини гормоночутливих факторів
ядерної транскрипції, які охоплюють рецептори стероїдних
гормонів (див. нижче). Кодування трьох різних ізоформ
відбувається за допомогою трьох різних генів, що вже іден-
тифіковані: РРАКа, РРАКу, РРАКб. Препарат троглітазон
зв’язується з РРАКу і збільшує чутливість клітин до інсуліну
(див. Розділ 19). Активація РРАКутакож стимулює клітини
до диференціації в адипоцити та спричинює інші поширені
метаболічні ефекти. Домінантна негативна мутація генів
у РРАКу збільшує інсулінову резистентність і призводить
до цукрового діабету і гіпертензії.
Цитоскелет
Усі клітини мають цитоскелет - систему органел, що
не тільки підтримує структуру клітини, а й дає змогу їй
змінювати форму та рухатися. Цитоскелет складається з
мікротрубочок, проміжних філаментів та мікрофіламентів,
а також білків, що утримують та зв’язують їх. Крім того,
білки й органели переміщаються вздовж мікротрубочок і
мікрофіламентів з однієї частини клітини до іншої, просу-
ваючись уперед завдяки молекулярним двигунам.
Мікротрубочки (рис. І-8, І-9) - це довгі, порожнисті
утвори зі стінками 5 нм завтовшки, що оточують порож-
нину 15 нм у діаметрі. Вони складаються з двох типів сфе-
Рис. 1.8. Ліворуч: електронна мікрофотографія цитоплазми фібробласта Видно мікрофіламенти (МФ) та мікротрубочки (МТ)
(відтворено за дозволом з Зипциеіга І_С, Сагпеіго КеІІеу ПО: Вазіс Нізіоіоду, 9іЬ есі. ТЬе МсСга\л/-НіІІ Сотрапіез, Іпс. 1998)
Праворуч: локалізація мікротрубочок у фібробластах. Клітини оброблені флюоресцентним антитілом до тубуліну, що робить
мікротрубочки видимими (відтворено за дозволом з СоппоІІу 3 еі аі: ІттипоЛиогезсепі зіаіпіпд ої суіоріазтіс апсі зріпсіїе
тісгоіиЬиІез іп тоизе ЛЬгоЬІазіз \л/КН апіібосіу іо і ргоіеіп Ргос ІМаіІ АсасІ 8сі ІІ8А 1977,74 2437).
12/РОЗДІЛ 1
ричних білкових субодиниць: ос- та р-губуліну. Третя суб-
одиниця - у-тубулін - відіграє роль у створенні з мікро-
грубочок центросоми (див. нижче). Субодиниці ос та р утво-
рюють геїеродимери (див. рис. І-8), під час агрегації яких
формуються довгі трубочки, що складаються з низки
кілець, кожне з яких містить ІЗ субодиниць. У трубочках
також є інші білки, які беруть участь у їхньому формуванні.
Процесу самозбирання мікротрубочок сприяє тепло, холод
призводить до їхнього розпаду. Кінець, на якому домінує
самозбирання, називають плюс-кінцем, а кінець, де пере-
важає дисоціація, - мінус-кінцем. Обидва процеси відбу-
ваються одночасно іп уНго.
Унаслідок пост ійного самозбирання та дисоціації мікро-
трубочки є динамічною частиною цитоскелета. Вони забез-
печують транспортування везикул, органел, таких як секре-
торні гранули та мітохондрії, з однієї частини клітини в
іншу, а також утворюють вереї єно, що рухає хромосоми
під час мітозу (див. нижче). Мікротрубочки можуть вико-
нувати транспортування в обох напрямах. Було навіть
спостережено, як одна мікротрубочка транспортувала дві
структури у протилежних напрямах.
Самозбирання мікротрубочки блокують колхіцин та він-
бластин. Протираковий препарат паклітаксел (Таксол),
іммобілізуючи мікротрубочки, знерухомлює органели і
порушує утворення мітотичних веретен, що призводить
до загибелі ракової клітини.
Крім мікротрубочок, клітини також містять проміжні
філаменти, що мають 8-14 нм у діаметрі і складаються з
різноманітних субодиниць. Деякі з них зв’язують мембрану
ядра з мембраною клітини. Ці філаменти утворюють гнуч-
кий каркас клітини і допомагають їй витримати зовнішній
тиск. Якщо проміжних філаментів нема, то клітини руй-
нуються набагато швидше. У людей аномалії проміжних
філаментів часто супроводжується утворенням пухирців
на шкірі.
Мікрофіламенти (див. рис. 1-8) - це довгі, міцні во-
локна 4-6 нм у діаметрі. Вони складаються з актину та
білка, який під час взаємодії з міозином призводить до
скорочення м’яза (див. Розділ 3). Актин, як і його мРНК
Рис. 1.9. Самозбирання та дисоціація мікротрубочки внаслідок
афеґації та дезафеґації димерів, що складаються з а- та р-
тубуліну (відтворено за дозволом з ЗІоЬосіа ВО ТЬе гоїе ої
тісгоіиЬиІез іп сеІІ зїгисїиге алеї сеІІ сімзіоп. Ат 8сі 1980;68*
290).
(див. нижче), наявний у всіх видах клігин. Це найпошире-
ніший білок у клітинах ссавців, він становить 15% від за-
гальної кількості білків у клітині. Структура актину над-
звичайно стабільна; наприклад, 88% амінокислотної послі-
довності актину дріжджів та кролика є ідентичними. Моле-
Рис. 1-10. Прикріплення цитоскелета до оболонки еритроцита. Зображено різні білки, що прикріплюють актинові філаменти
до мембрани Деякі з них мають номери (4.1, 4.2, 4.9), інші - назви (відтворено за дозволом з І_ипа ЕЗ, НІН АІ_ Суїозкеїеіоп-
ріазта тетЬгапе іпїегасїіопз. Зсіепсе 1992,258 955).
ЗАГАЛЬНІ ЗАСАДИ ТА КЛІТИННІ ОСНОВИ ФІЗІОЛОГІЇ ЛЮДИНИ /13
купи актину (С-актин) полімеризують іп уіуо, утворюючи
Е-актин - довгі ниткоподібні ланцюги, які називають
мікрофіламентами. Вони також часто деполімеризують іп
уіуо, причому полімеризація здебільшого відбувається на
одному кінці (плюс-кінець, як у мікротрубочках), а деполі-
меризація - на протилежному (мінус-кінець). Мікрофіла-
менти прикріплюються до різних частин цитоскелета (рис.
І - і 0). Багато мікрофіламентів прикріплюються до кінчиків
мікроворсинок клітин епітелію слизової оболонки кишки.
В значних кількостях вони наявні в ламелоподіях, відрост-
ках, які випускають клітини під час руху по поверхнях.
Актинові філаменти взаємодіють з рецепторами інтегрину
й утворюють фокальні комплекси адгезії (фокальні адге-
зини, див. нижче), які є місцями для руху на поверхні, де
клітина витягується.
Молекулярні двигуни
Молекулярними двигунами, за допомогою яких руха-
ються білки, органели та інші складові клітини (вантажі)
вздовж мікротрубочок і мікрофіламентів до всіх частин
клітини, є 100-500 кДа АТФ-ази, що приєднуються до
вантажів. їхні головки формують поперечні містки до во-
локна і перетворюють АТФ на енергію, що приводить до
вигинання цих містків і забезпечує рух молекул АТФ-ази.
Типи молекулярних двигунів наведено в табл. 1 -4, а при-
клади кожного типу показано на рис. 1-і І. Сьогодні відо-
мо, що кожен тип є великою надродиною з багатьма фор-
мами у тваринному світі.
Звичайна форма кінезину - двоголова молекула (див.
рис. 1-9), що рухає частинки та мембрани в напрямі плюс-
кінця мікротрубочок. Це відбувається таким способом:
одна головка прикріплюється до мікротрубочки і після
цього вигинає шийку так, щоб прикріпилася інша головка.
Таблиця 1-4. Молекулярні двигуни
Містяться в мікротрубочках
Кінезини
Динеїни
Містяться в актині
Міозини
Завдяки цьому відбувається майже безперервний рух. Деякі
кінезини пов’язані з мітозом та мейозом, а деякі виконують
інші функції, у тім числі забезпечують рух вантажу до мі-
нус-кінця мікротрубочок.
Динеїни мають дві головки, а їхні шийки частково зану-
рені в білковий комплекс (див. рис. І -11). Подібну будову має
цитоплазматичний динеїн, він рухає частинки та мембра-
ни до мінус-кінця мікротрубочок. Аксонемний динеїн віб-
рує, він відповідає за рух джгутиків та війок (див. нижче).
Міозини утворюють поперечні містки до актинових
філаментів і зміщуються, генеруючи силові імпульси. Це
забезпечує переміщення, подібні до рухів, що відбуваються
під час скорочення кишкової ворсинки, міграції клітин,
скорочень усіх скелетних та інших м’язів людини. Над-
родину міозину поділяють на 15 класів. Міозин-І і міозин-
II зображено на рис. 1-11. Міозин-І зв’язується з актином
у клітинних мембранах, тоді як міозин-ІІ (детально
описано в Розділі 3) міститься в скелетних м’язах. Усі відо-
мі сьогодні міозини рухаються в напрямі плюс-кінця акти-
нових полімерів, водночас досі не описані міозини, які б
рухалися в протилежному напрямі.
З актином зв’язуються різноманітні форми міозину. Мо-
лекула міозину містить округлі головки з активністю АТФ-
Рис. 1-11. Приклади трьох типів молекулярних двигунів. Звичайна форма кінезу прикріплюється до вантажу (органели, що
зв'язана з мембраною). Усі двигуни мають рухомі голівки, які гідролізують АТФ і використовують енергію для вигинання голівок
на шийках (відтворено за дозволом з Била ЕЗ, Ній АІ_: СуіозкеІеіоп-рІавта тетЬгапе іпіегасііопз. Зсіепсе 1992;258:955).
14/РОЗДІЛ 1
ази та хвосі ики різної довжини (див. рис. 1-10). Молекули
міозину-І мають одну головку. Разом з актином міозин-І
часто взаємодіє з клітинними мембранами. Молекули
міозину-ІІ мають дві головки і містяться переважно в м’я-
зах, хоча можуть бути і в інших місцях (див. табл. 1-4).
Утворення і а рух поперечних містків з молекулами актину,
що забезпечує скорочення м’язів, детально описано в Роз-
ділі 3.
Центросоми
Біля ядра у цитоплазмі еукаріотичних тваринних клітин
міститься центросома. Вона складається з двох центріоль
і оточена аморфним перицентріолярним матеріалом.
Центрюлі - цс короткі циліндри, розташовані біля ядра
під прямим кутом один до одного. У стінках кожної центрі-
олі в поздовжньому напрямі групами по три простягаються
мікротрубочки (див. рис. 1-4). Таких потрійних груп налі-
чують дев’ять, і вони розміщені через однакові інтервали.
Центросоми є центрами організації мікротрубочок
(ЦОМ), що містять у-тубулін. Мікротрубочки самоорга-
нізуються з у-тубуліну в перицентріолярному матеріалі. Під
час поділу клітини центросоми розділяються на дві, ці пари
розходяться, щоб утворити полюси мітотичного веретена,
яке складається з мікротрубочок. У багатоядерних клітинах
центросоми розташовані біля кожного ядра.
Війки
Відростки клітини бувають різних видів. Справжні вій-
ки - це рухомі відростки, що їх використовують одноклі-
тинні організми для руху у воді, а багатоклітинні - для
переміщення слизу та інших речовин по поверхні різно-
манітних епітеліїв. Вони нагадують центрюлі, оскільки
мають у стінці дев’ять пар мікротрубочок. Окрім того, у
них є ще пара центральних мікротрубочок, а кожна з дев’я-
ти периферійних структур нараховує не три, а дві мікротру-
бочки. Кожна війка прикріплена до структури, яку назива-
ють базальна гранула. Вона, подібно до центріолі, має
дев’ять периферійних потрійних мікротрубочок, і очевид-
но, що базальні гранули та центріолі взаємозамінні.
Молекули клітинної адгезії
Клітини прикріплюються до базальної мембрани та
одна до одної за допомогою молекул клітинної адгезії
(МКА), що відіграють визначальну роль у міжклітинних
зв’язках, описаних нижче. Останніми роками білки адгезії
привертають до себе посилену увагу дослідників, оскільки
вони відіграють важливу роль під час ембріонального
розвиїку, у процесі утворення нервової системи та інших
тканин, утримування тканин разом у дорослих, загоювання
запалень та ран, а також у випадку метастазування пухлин.
Багато з них проникають через клітинну мембрану і при-
кріплюються до цитоскелета всередині клітини, деякі
зв’язуються з подібними молекулами інших клітин (гомо-
фільне зв’язування), а інші - з будь-якими молекулами
(геїерофільнс зв’язування). Чимало МКА зв’язуються з
ламінінами - родиною великих хрестоподібних молекул
з численними рецепторними доменами у складі позаклі-
тинного матриксу.
Номенклатура МКА дещо хаотична частково внаслідок
швидкого збільшення їхньої кількості, а частково через
інтенсивне використання акронімів в інших галузях сучас-
ної біології. Та все ж МКА можна розділити на чотири
головні родини: інтрегрини, гетеродимери, що зв’язують-
ся з різними рецепторами; молекули адгезії суперродини
- імуноглобулінів, одна частина з яких зв’язується гете-
рофільно, інша - гомофільно; кадгерини - Са2 -залежні
молекули, що сприяють міжклітинній адгезії під час го-
мофільних реакцій; селектини, що мають подібні до лек-
тинів домени, які зв’язують вуглеводи. Функції МКА у скла-
ді гранулоцитів та тромбоцитів описані в Розділі 27, а їхнє
значення в загоюванні запалень та ран - у Розділі 33.
МКА не лише прикріплюють клітини до сусідніх клі-
тин, а також передають сигнали з клітини в клітину. Клі-
тини, що гублять контакт з позаклітинним матриксом за
посередництвом інтегринів, мають вищий рівень апоптозу
(див. нижче), ніж прикріплені, а взаємодія між ініегринами
та цигоскелетом забезпечує клітинний рух.
Міжклітинні зв’язки
Між клітинами тканин розрізняють два види з’єднань:
з’єднання, за допомогою яких клітини прикріплюються од-
на до одної та до навколишніх тканин, та з’єднання, що
дають змогу переносити йони й інші молекули з однієї
клітини до іншої. До з’єднань, за допомогою яких клітини
прикріплені одна до одної та які надають тканинам міц-
ності й стабільності, належить щільний контакт, відомий
також як зона злипання. Десмосома та зона адгезії (рис.
1-12) утримують клітини разом, а напівдесмосома та фо-
кальна адгезія прикріплюють клітини до базальних мем-
бран. Щільні контакти між епітеліальними клітинами
необхідні також для транспортування йонів через епітелій.
З’єднання, через яке відбувається перенесення молекул,
називають щілинним контактом.
Щільні контакти переважно оточують апікальні краї клі-
тин епітелію, зокрема слизової оболонки кишки, стінок
ниркових канальцівта судин. Вони складаються з виступів,
що розміщені одночасно половинками на обох клітинах,
які внаслідок адгезії прилягають так тісно, що майже зни-
кає простір між клітинами. Ці контакти забезпечують про-
ходження деяких йонів та солей, ступінь такого перепус-
кання різноманітний. Значна частина від загального по-
току позаклітинних йонів і розчинених речовин проходить
через епітелій у цих з’єднаннях.
Іншою функцією щільних контактів є підтримання по-
лярності клітин. Крім того, виступи запобігають рухові біл-
ків у площині клітинної мембрани, допомагають утриму-
вати специфічну топографію транспортних білків і каналів
у складі апікальної мембрани, забезпечуючи транспорту-
вання через епітелій (див. також Розділи 25 і 38).
У клітинах епітелію, кожна зона адгезії, як звичайно, є
суцільною структурою на базальній поверхні замикальної
зони й основною ділянкою прикріплення внутрішньоклі-
тинних мікрофіламентів. Зона адгезії містить кадгерини.
Десмосоми - це клаптики, утворені потовщенням діля-
нок контакту мембран двох сусідніх клітин. До потовще-
них ділянок у кожній клітині прикріплені проміжні філа-
менти, деякі розташовані паралельно до мембрани, інші
розходяться від неї радіально. Між потовщеннями двох
мембран у міжклітинному просторі міститься філаменто-
подібний матеріал, у якому є кадгерини та інші білки.
ЗАГАЛЬНІ ЗАСАДИ ТА КЛІТИННІ ОСНОВИ ФІЗІОЛОГІЇ ЛЮДИНИ /15
Десмосоми
Напівдесмосома
Зона
адгезії
Щілинні
контакти
Щільний
контакт
(зона
замикання)
Рис. 1-12. Міжклітинні зв'язки в слизовій оболонці тонкої киш-
ки. Різноманітні типи десмосом не деталізовані.
Напівдесмосоми нагадують половинки десмосом, що
прикріплюють клітини до базальної мембрани і з’єднані
всередині клітини з проміжними філаментами. Однак вони
містять не кадгерини, а інтегрини. Фокальні адгезини
також прикріплюють клітини до їхніх базальних пластин.
Як описано вище, вони є лабільними структурами, що з’єд-
нані з акгиновими філаментами всередині клітини і відігра-
ють важливу роль під час руху клітини. Ці структури утво-
рюють щільні ділянки у місцях, де трансмембранні інтег-
рини прив’язують позаклітинний матрикс до мікрофіла-
ментів.
Щілинні контакти
У місцях щілинних контактів міжклітинний простір
звужується від 25 до 3 нм, а шестикутні структури білкових
груп - конексонів -у мембрані кожної клітини прилягають
одна до одної (рис. 1-13). Кожний конексон складається з
шести субодиниць, що оточують канал. Якщо цей канал
розташувати в лінію з відповідним каналом, що утворений
конексоном сусідньої клітини, то можливим буде рух речо-
вин між клітинами без їхнього потрапляння через позаклі-
тинну рідину. Діаметр каналу становить близько 2 нм, що
дає змогу перепускати йони, цукри, амінокислоти та інші
розчинені речовини з молекулярною масою приблизно до
1000. Отже, щілинні контакти сприяють швидкому поши-
ренню потенціалу з клітини в клітину (див. Розділ 4) та
обміну хімічними чинниками. Діаметр кожного каналу
регулює внутрішньоклітинний Са2+; підвищення концент-
рації Са2+ приводить до того, що субодиниці, які утворюють
канал, зближаються, зменшуючи діаметр каналу. Діаметр
можуть регулювати зміни рН та різниця потенціалів.
Плазматична
мембрана
Щілина
(позаклітинний
простір)
Плазматична
мембрана
Конексон
(одиниця щілинного контакту)
Рис. 1-13. Щілинне з’єднання. Зверніть увагу на те, що кожен
конексон складається з шести субодиниць і кожен конексон
у мембрані однієї клітини прилягає до конексону в мембрані
сусідньої, утворюючи канал, через який речовини можуть по-
трапляти з однієї клітини в іншу, не потрапляючи до ПКР (від-
творено за дозволом з КапбеІ ЕК, Зсівліагіг Л-І, ЗеззеІІ ТМ
[есіііогз]: Ргісіріез оПМеигаІ Зсіепсе, 41К есі. Мс6гам/-НіІІ, 2000).
У гризунів ізоформи конексонів кодовані щонайменше
13 різними генами. У людей є щонайменше стільки ж генів
різних ізоформ. Відмінності в характерних для тієї чи іншої
тканини ізоформах дуже значні. У мишей яйцеклітина з’єд-
нана з клітинами гранульози щільними контактами, тому
миші, у яких відсутній один тип конексону, не здатні до
овуляції та повного мейозу. З мутацією конексонів пов’язані
багато захворювань у людей, зокрема, Х-зчеплена хвороба
Шарко-Марі-Тута, периферійна нейропатія, а ще гете-
ротаксія, що супроводжується численними порушеннями,
а також неможливістю відновити нормальну ліво-праву
асиметрію. Невідомо, як саме патологія конексонів призво-
дить до цих захворювань; що ж стосується гетеротаксїї,
то тут, імовірно, задіяні інші гени.
Ядро та пов’язані з ним структури
Ядро мають усі еукаріотичні клітини, що здатні до
поділу. Якщо клітину розрізати навпіл, то її частина, де не
буде ядра, загине. Значну частину ядра становлять хромо-
соми - структурні одиниці, що несуть повний набір усіх
спадкових, видових та індивідуальних характеристик
живого організму. За винятком статевих клітин, хромосоми
розміщені парами - по одній хромосомі від кожного з
батьків (див. рис. 23-2). Кожна хромосома складається з
велетенських молекул дезоксирибонуклеїнової кислоти
(ДНК) Ланцюг ДНК має близько 2 м довжини, однак він
поміщається в клітинному ядрі, оскільки намотаний на
основу з гістонів і утворює нуклеосому. В кожному ядрі є
понад 25 мільйонів нуклеосом. Структуру хромосом порів-
нюють з низкою намистин. Намистини - це нуклеотиди, а
нитка, що зв’язує їх, - ДНК. Комплекс ДНК та білків нази-
вають хроматином. Під час поділу клітини витки молекули
ДНК навколо гістонів послаблюються, очевидно, внаслідок
ацетилювання гістонів, і пари хромосом стають видимими,
тоді як у період між поділами в ядрі можна розрізнити лише
клубки хроматину. Первинними одиницями спадковості в
16/РОЗДІЛ 1
хромосомах є гени (див. нижче), кожен ген - це елемент
молекули ДНК.
Під час нормального поділу клітини шляхом мітозу
спочатку відбувається дублікація хромосом, а потім - їхній
поділ, унаслідок чого кожна дочірня клітина отримує пов-
ний (диплоїдний) набір хромосом. У період остаточного
дозрівання статевих клітин відбувається поділ, унаслідок
якого лише половина хромосом переходить до кожної до-
чірньої клітини (див. Розділ 23). Цей поділ (мейоз) має дві
стадії, однак важливо тс, що внаслідок цього зрілі сперма-
тозоїди та яйцеклітини містять половину (гаплоїдний
набір) від нормальної кількості хромосом. Коли спермато-
зоїд зливається з яйцеклітиною, то новоутворена клітина
(зигота) відновлює диплоїдний набір хромосом, отримую-
чи по половині від кожного з батьків. Хромосоми підляга-
ють процесу рекомбінації, внаслідок чого материнські та
батьківські гени змішуються.
Ядро більшості клітин містить ядерце (див. рис. 1-4),
набір з гранул, багатий на рибонуклеїнову кислоту (РНК).
У деяких клітин в ядерці є кілька таких структур. Ядерця
найпомітніші та найчисленніші в клітинах, що ростуть.
Вони є місцем синтезу рибосом - структур цитоплазми, в
яких синтезуються білки (див. нижче).
Усередині ядро має скелет з філаментів, що прикріплені
до ядерної мембрани, чи оболонки (див. рис. 1-4), яка
оточує ядро. Ця мембрана подвійна, а простір між двома
її шарами називають перинуклеарною цистерною. Мем-
брана перепускає лише йони та малі молекули, однак у ній
є комплекси ядерних пор. Кожний комплекс утворений з
близько 100 білків, організованих у формі тунелю, через
який відбувається транспортування білків і мРНК. Тут зосе-
реджено багато транспортних шляхів; виділено і схарак-
теризовано білки, які називають імпортери і експортери.
Білок Кап відіграє організаційну роль. Більшість сучасних
досліджень присвячено детальній інтерпретації питань
транспортування у ядро та у протилежному напрямі.
Ендоплазматична сітка
Ендоплазматична сітка - це лабіринт з послідовно
з’єднаних ірубочок у цитоплазмі клітини (див. рис. 1-4).
Стінки трубочок складаються з мембрани. В шорсткій,
або гранулярній, ендоплазматичній сітці гранули, відомі
як рибосоми, прикріплені до цитоплазматичного боку мем-
брани. Натомість у гладкій, або ж аґранулярній, ендо-
плазматичній сітці цих гранул нема. Вільні рибосоми
також містят ься у цитоплазмі. Гранулярна ендоплазматична
сітка забезпечує синтез білків та первинних ділянок полі-
псптидних ланцюгів з утворенням дисульфідних зв’язків.
Агранулярна ендоплазматична сітка є місцем синтезу сте-
роїдів у клітинах секреції стероїдів та місцем детоксифі-
кації в інших клітинах. Як саркоплазматична сітка (див.
Розділ 3), вона відіграє важливу роль у скелетних та серце-
вих м’язах.
Рибосоми
У клітинах сукаріот рибосоми мають від 22 до 32 нм
довжини. Кожна рибосома складається з великих та малих
субодиниць, які називають, на підсіаві їхнього осідання в
ультрацентрифузі, відповідно, субодиниці 608 та 408.
Рибосоми є складними структурами і містять багато різних
білків та щонайменше три рибосомальні РНК (див. нижче).
Вони також є місцем синтезу білків. Рибосоми, які при-
кріплюються до ендоплазматичної сітки, синтезують усі
трансмембранні білки, більшість секретованих білків та
більшість білків апарату Ґольджі, лізосоми й сндосоми.
Всі ці білки на одному кінці мають гідрофобний сигналь-
ний пептид (див. нижче). Поліпептидні ланцюги, з яких
формуються ці білки, утворюються в складі ендоплазма-
тичної сітки. Вільні рибосоми синтезують цитоплазматичні
білки, такі як гемоглобін (див. Розділ 27), та білки, що
містяться в пероксисомах та мітохондріях.
Апарат Ґольджі, що відіграє роль в обміні білків, утво-
рених у рибосомах та секреторних гранулах, везикулах га
сндосомах, описано нижче - у контексті синтезу та секреції
білків.
СТРУКТУРА ТА ФУНКЦІЇ ДНК І РНК
Геном
ДНК є в бактеріях, ядрах еукаріотичних клітин та мно-
хондріях. Вона складається з двох надзвичайно довгих ну-
клеотидних ланцюгів, що містять основи аденін (А), г уанш
((}), гимін (Т) га цитозин (С) (рис. 1-14). Хімічна структура
цих пуринових та піримідинових основ описана в Розділі
17. Ланцюги зв’язані між собою водневим зв’язком між
основами, причому аденін - з тиміном, а і уанш - з цито-
зином. Кінцева структура молекули у виїляді подвійної
спіралі зображена на рис. 1-15. Доказом складності циї
молекули є те, що в гаплоїдному геномі людини (повний
генетичний текст) ДНК налічує 3x109 пар основ.
ДНК є компонентом хромосом, у якому міститься гене-
тична інформація про всі спадкові характеристики клітини
га її попередників. Кожна хромосома містить сегмент
подвійної спіралі ДНК. Генетична інформація закодована
послідовністю пуринових та піримідинових основ у нукле-
отидних ланцюгах. Зчитування генетичної інформації
забезпечуване порядком, у якому амінокислоти розміщені
в білках, створених клітиною. Інформація передається за
допомогою РНК до рибосом, ділянок синтезу білків у
цитоплазмі. РНК відрізняється від ДНК тим, що має одно-
ниткову структуру, урацил замість тиміну, а її вуглеводним
залишком є рибоза, а не 2'-дезоксиробоза (див. Розділ 17).
Білки, утворені з матриці ДНК, містять усі ензими, які
відповідно, контролюють метаболізм клітини. Ген визна-
чають як обсяг інформації, необхідний для утворення
однієї молекули білка. Однак білок, кодований одним
геном, може пізніше розділитися на кілька білків з різною
фізіологічною акіивністю. Гени також містять промотори,
послідовності ДНК, що сприяють утворенню РНК. Мута-
ції трапляються, коли послідовність основ у складі моле-
кули ДНК змінюється під впливом рентгенівських чи кос-
мічних променів або інших мутагенних чинників. З’ясо-
вано, що геном людини складений з 50 000-100 000 генів
або з трьох мільярдів нар основ.
Поліморфізм ДНК
Білок-кодувальні гени (екзони) становлять лише 3%
геному людини; решта 97% - це інтрони (див. нижче) та
інші види ДНК, що мають невизначену чи невідому функ-
ЗАГАЛЬНІ ЗАСАДИ ТА КЛІТИННІ ОСНОВИ ФІЗІОЛОГІЇ ЛЮДИНИ /17
Рис. 1-14. Сегмент структури молекули ДНК, у якому пуринові та піримідинові основи аденін (А), тимін (Т), цитозин (С) та
гуанін (6) зв’язані скелетом, утвореним фосфодіестерними мостиками між молекулами 2‘-дезоксирибози, які прикріплені до
нуклеотидних основ М-глікозидними зв’язками. Зверніть увагу на те, що скелет має полярність (5‘ та 3‘ напрями) (відтворено
за дозволом з Миггау КК еї аі Нагрег’з ВіосЬетізігу, 25Ш есі МсСга\л/-НіІІ, 2000)
ції. Інколи ці 97% називають непотрібною ДНК. Харак-
терна ознака ДНК людини - це її структурна різноманіт-
ність у різних людей. Більшість варіацій виникають у неко-
дувальних ділянках, однак можуть траплятися і в кодуваль-
ник; вони бувають приховані або ж виражені як зміни у
білку, які можна ідею ифікуваги. Переважно варіації вияв-
ляються як змінні повторювання пар основ (тандемних
повторювань) від одного до сотень разів. Ця варіація змі-
нює довжину ланцюга ДНК між точками, де його роз-
щеплюють різні рестрикційні ензими. Отже, у фрагментах
ДНК різних людей простежується поліморфізм довжин
рестрикційних фрагментів (ПДРФ). Аналіз ПДРФ серед
населення дає зразки, що є, по суті, характерною картою
або фінгерпринтом ДНК. Важливість визначення фінґер-
принту ДНК було доведено за допомогою додаткових спе-
ціалізованих методів. Імовірність отримання ідентичних
зразків ДНК за умови використання цих методів у індивідів,
що не є монозигої ними близнюками, змінюється відпо-
відно до кількості застосовуваних ензимів, родинних зв’яз-
ків осіб, а також інших факторів. З огляду на це, питання
щодо того, які саме статистичні дані найбільше придатні
для аналізу, гостро дебатували. Все ж імовірність збігу
ПДРФ оцінювали в межах від І на І 000 000 до І на
100 000. ПДРФ можна аналізував за зразками сперми,
крові чи іншої тканини. Численні ж копії зразків ДНК
отримують, використовуючи полімеразно-ланцюгову
Менша борозна
Більша борозна
З 367-2
Рис. 1-15. Двоспіральна структура ДНК, де аденін (А) зв’язу-
ється з тиміном (Т), а цитозин (С) - з гуаніном (С) (відтворено
за дозволом з Миггау НК еі аі: Нагрег’з ВіосЬетізігу, 25Ф есі.
МсСга\л/-НіІІ, 2000).
18/РОЗДІЛ 1
реакцію (ПЛР) - винахідливий метод копіювання ДНК.
Фішерпринтування ДНК має надзвичайно важливе значен-
ня для розкриття злочинів та з’ясування батьківства, хоча
для цього необхідно використовувати надійні і перевірені
методи, а отримані результати тлумачити обережно. Аналіз
ПДРФ також є цінним у випадку вивчення еволюції тварин
та людини й ідентифікації хромосомного розміщення генів,
іцо спричиняють спадкові хвороби.
Мітоз
Під час кожного соматичного поділу клітини (мітозу)
два ланцюги ДНК роз’єднуються і кожен слугує матрицею
для синтезу нового комплементарного ланцюга. Цю
реакцію каталізує ДНК-полімераза. Перша з утворених
подвійних спіралей потрапляє до однієї дочірньої клітини,
а друга - до іншої, тому загальна кількість ДНК у кожній
дочірній клітині є такою ж, як і в батьківській.
Теломерази
У процесі реплікації клітини задіяна не лише ДНК-
полімераза, а також спеціальна зворотна транскриптаза,
яка синтезує короткі повторення ДНК, що характеризують
кінці хромосом (теломери). Клітини, у яких бракує транс-
криптази, яку ще називають теломеразою, поступово втра-
чає ДНК на тсломерах, а це може призводити до припи-
нення клітинного поділу з а їхнього старіння. З іншого боку,
клітини, у тому числі більшість ракових, у яких теломераза
виявляє високу активність, продовжують ділитися. Не
дивує велика зацікавленість до механізму дії теломерази
стосовно старіння та появи раку. Тепер уже зрозуміло, що
механізм реплікації хромосомних кінців є комплексним, і
погрібно провести додаткові дослідження для цілковитого
з’ясування можливостей терапевтичного застосування.
Мейоз
У статевих клітин редукційний поділ (мейоз) відбува-
ється впродовж їхнього дозрівання. Унаслідок цього одна
з кожної пари хромосом опиняється в кожній статевій клі-
тині; тому кожна зріла статева клітина містить половину
від кількості хромосомного матеріалу, що міститься в сома-
тичних клітинах. Відповідно, коли сперматозоїд зливається
з яйцеклітиною, новоутворена зигота має повний набір
ДНК, по половині від батьківської та материнської клітини.
Те, що відбувається з хромосомами в процесі запліднення,
детально описано в Розділі 23. Термін “плоїдність” інколи
використовують, маючи на увазі кількість хромосом у клі-
тині. Нормальні диплоїдні клітини в стані спокою є еупло-
їдними, і стають тетраплоїдними саме перед поділом.
Анеуплоїдія - це стан, у якому клітина містить збільшену
чи зменшену кількість хромосом, не кратну гаплоїдному
набору, такий стан типовий для ракових клітин.
Клітинний цикл
Очевидно, що мітоз та нормальний поділ ініційовані
відповідно до послідовності подій, які прийнято називати
клітинним циклом. Діаграму цих подій зображено на рис.
І-16. До біохімічних механізмів, що спричиняють мітоз,
виявляють значний інтерес з огляду на зв’язок мітозу з рако-
вими захворюваннями. Мітоз у клітинах ініціюють білки
цикліни і циклінозалежна протеїнкіназа, яка фосфорилює
інші білки. Однак зазначимо, що регулювання клітинного
циклу є складним процесом, ми його детально не аналізу-
ватимемо.
Транскрипція та трансляція
Ланцюги подвійної спіралі ДНК не тільки реплікуються,
а й завдяки вибудовуванню комплементарних основ
слугують матрицею для утворення в ядрі матричної РНК
(мРНК), транспортної РНК (тРНК), рибосомної РНК
(рРНК) та ін. Утворення мРНК називають транскрипцією
(рис. 1-17), його каталізують різноманітні РНК ноліме-
рази. Зазвичай, після посттранскрипційного процесингу
(див. нижче) мРНК сприяє утворенню поліпептидного
ланцюга - білка (трансляція). Цей процес відбувається в
рибосомах: гРНК прикріплює амінокислоти до мРНК.
Молекули мРНК менші, ніж молекули ДНК, і кожна є
транскриптом маленького сегмента ланцюга ДНК. Моле-
кула гРНК містить лише 70-80 азотистих основ (порів-
няйте з сотнями в мРНК та 3 мільярдами в ДНК).
Зазначимо, що ДНК відповідає за підтримання видів;
вона передається від покоління в покоління в статевих
клітинах. Натомість РНК відповідає за відтворення індиві-
дуума; вона транскрибує інформацію, закодовану в ДНК,
та формує' смертну людину. Цей процес назвали “бруньку-
вання зародкової лінії від накопичених гаплоїдних клітин”.
Гени
Обсяг інформації про структуру генів та їхнє регулюван-
ня накопичується зі значною швидкістю. Структура типо-
вого еукаріотичного гена зображена на рис. 1-18. Цей ген
складається з ланцюга ДНК, що містить кодувальні та
некодувальиі ділянки. В еукаріот, на відміну від прокаріот,
порції генів, що відповідають за утворення білків, як зви-
чайно, розділені на кілька сегментів (екзонів) та відок-
ремлені від сегментів, які не транслюються (інтрони). Пре-
мРНК утворюється від ДНК, згодом у ядрі внаслідок пост-
транскрипційного процесингу відбувається елімінація
інтронів та певної кількості екзонів. Отже, зріла мРНК,
яка потрапляє до цитоплазми, складається з екзонів (рис.
1-19). Інтрони елімінують, а екзони внаслідок кількох різ-
номанітних процесів з’єднуються. Елімінація інтронів
деяких генів відбувається за допомогою сплайсингосом
- утворень, що складаються з невеликих РНК та білків.
Інші інтрони елімінують унаслідок самосплайсингу РНК,
що спричинений двома різними механізмами. РНК може
також каталізувати інші реакції, тому сьогодні каталітична
активність РНК становить значний інтерес.
Завдяки наявності інтронів та сплайсингу з одного й
того самого гена може утворюватися більше ніж одна
мРНК. Відмінність між цими мРНК полягає у включенні
різних екзонів. Інших фізіологічних функцій інтронів усе
ще не виявлено, однак є ймовірність, що вони сприяють
змінам у генетичній інформації і, відповідно, еволюції.
Біля сайту початку транскрипції міститься промотер,
сайт на якому сполучається РНК-полімераза з власними
кофакторами. Він часто включає ТАТА послідовність
(ТАТА ділянка), яка забезпечує початок транскрипції в
належному місці. Далі, на 5'-кінці розташовані регулятор-
ні елементи, які охоплюють послідовності енхансерів та
сайленсерів. З’ясовано, що в середньому на один ген при-
ЗАГАЛЬНІ ЗАСАДИ ТА КЛІТИННІ ОСНОВИ ФІЗІОЛОГІЇ ЛЮДИНИ /19
Рис. 1-16. Послідовність подій під час клітинного циклу.
падає п’ять регуляторних сайтів. Регуляторні послідовності
інколи бувають на 3-кінці. Є докази, що послідовності в
цьому кінці можуть також впливати на функції інших генів.
Регулювання генної експресії
Кожна соматична клітина тіла містить повну генетичну
інформацію, проте серед різноманітних видів дорослих
клітин є значна диференціація та спеціалізація функцій і
тільки траскрибування незначної частини інформації відбу-
вається нормально. Отже, генетична інформація, як зви-
чайно, перебуває в репресивному стані. Однак гени контро-
льовані як у просторі, так і у часі. Що ж задіює гени саме
цієї клітини, а не інших? Що задіює гени в клітині саме на
цій стадії розвитку, а не на інших невідповідних стадіях?
Що підтримує впорядкований ріст кількості клітин і запо-
бігає неконтрольованому росту, який називають раком?
Звичайно ж послідовності ДНК, такі як ТАТА ділянка,
сприяють правильному транскрибуванню гена, частиною
якого вони є (дме-регулювання). Та все ж головний ключ
селективної експресії гена - білки, які прикріплюються до
регуляторних ділянок гена, посилюючи чи послаблюючи
його активність. Ці фактори транскрипції є продуктами
інших генів і тому діють як посередники у разі транс-регу-
лювання. Вони надзвичайно численні й охоплюють акти-
вовані стероїдні гормональні рецептори та багато інших
факторів.
Стимулятори, такі як нейротрансмітери, що прикріп-
люються до клітинної мембрани, зазвичай, ініціюють хі-
мічні дії, що активують гени негайного типу. Вони, від-
повідно, створюють фактори транскрипції, що діють в
інших генах. Найліпше описані гени негайного типу с-/о8
і с-іип. Білки, створені цими генами - с-Го$, с-Лпп і декіль-
ка споріднених - формують гомо- та гетеродимери, які
прикріплюються до регуляторної послідовності ДНК,
ДНК
Посттранскрипційна
модифікація
Плнюоґ РНК „іНсрсюии
на ланцюгу ДНК
Поділ ланцюга
Месенджер РНК
Кодувальнітриплети
Аз
Трансляція
Аденілат Амінокислота
тРНК
Рибосома
ензим
Рис. 1-17. Схематичне зображення синтезу білка Нуклеїнові кислоти показані у формі ліній з численними короткими виступами
-окремими основами.
1
20 / РОЗДІЛ 1
Рис. 1-18. Схематичне зображення компонентів типового еукаріотичного гена Кодувальна ділянка складається з інтронів та
екзонів, по боках межує з некодувальними ділянками. Бокова 5‘-ділянка містить фрагменти ДНК, що взаємодіють з білками,
сприяючи або інгібуючи транскрипцію, а 3‘ - полі(А) додатковий сайт (відтворено за дозволом з Миггау РК еі аі Нагрег’з
Віосїіетізігу, 25Ш есі. Мс6га\л/-НіІІ, 2000).
відомої як сайт АР-1 (рис. 1 -20). Одні димери посилюють
транскрипцію, інші її послаблюють. Наявність с-Роз, с-5ип
та деяких суміжних білків є загальною ознакою активації
клітини, й імуноцитохімічні методи для них чи для вимірю-
вання їхніх мРНК дають змогу визначити, які клітини в
Фланіова ДНК Інгрони Екзони
ПРЕ
мРНК
Транскрипція 'і
Флангова
ДНК
Попі(А)
ПРОІІЕСИНГ
РНК
мрнк о ПолКА)
ПРЕПРОГОРМОН
Сиінапьна
пешидна
послідовнісіь
ПРОГОРМОН
а Відщеплення
Гф ' Щ, сигнального пептиду
Проте ннз і/або
пжозилювання
ЕЕ* Фрагмент
ГОРМОН
Рис. 1-19. Транскрипція, посттранскрипційна модифікація
мРНК, трансляція в рибосомах та посттрансляційний процес
у разі утворення гормонів та інших білків Кеп - кеп-сайт (мо-
дифіковано та відтворено за дозволом з Вахіег ЗО. Ргіпсіріез
оГ епсіосгіпіііду. Іп Сесії ТехіЬоок ої Месіісіпе, 16Ш есі. \Л/упда-
агсіеп ЗВ, Зтііїт І_Н Зг [есіііогз] Заипсіегз, 1982).
нервовій чи будь-якій іншій системі активовані певними
стимуляторами.
Понад 80% відомих факторів транскрипції мають один
з чотирьох ДНК-зв’язувальних факторів. Найпоширеніший
- цинкозв’язані пальці, у якому комплекси характерної
форми утворюються шляхом зв’язування 2п2+ з двома
залишками цистеїну і гістидину чи з чотирма залишками
цистеїну. Різні фактори транскрипції містять 2-37 таких
цинкових пальців, які є посередниками прикріплення до
ДНК. Інший фактор - лейцинова защіпка (з англ. Іепсіпе
хіррег), у якій а-спіральні ділянки димерів мають регу-
лярно розміщені залишки лейцину, що взаємодіють один
з одним, утворюючи скручений клубок. Розгалуження
димеру поза межами з’єднаної ділянки багаті на аргінін та
лізин, які прив’язуються до ДНК. Крім того, до ДНК при-
в’язуються структури спіраль-вигин-спіраль, спіраль-пет-
ля-спіраль.
Сьогодні за допомогою методів молекулярної біології
можна підсилювати функції певних генів, переносити гени
людей тваринам, порушувати функцію окремих генів (ген-
ний нокаут). Метод генного нокауту використовують у
багатьох експериментах.
Синтез білка
Процес синтезу білка є складним і водночас викликає
захоплення. Як зазначено, він має чотири етапи: транскрип-
цію, посттранскрипційну модифікацію, трансляцію та
посттрансляційну модифікацію. Ці етапи зображено і
коротко схарактеризовано на рис. 1-19.
Коли активація достатня, транскрипція гена розпочи-
нається на так званому кеп-сайті (див. рис. 1 -19), а закін-
чується приблизно за 20 основ від послідовності ААТААА.
Транскрипт РНК кепується в ядрі шляхом додавання 7-
метилгуанозинтрифосфату до 5'-кінця; цей кеп необхідний
для правильного приєднання до рибосоми (див. нижче).
Полі(А) хвіст, що складається з понад 100 основ, прикріп-
люється до нетрансльованого сегмента на 3 '-кінці. Призна-
чення полі(А) хвоста нез’ясоване, однак, можливо, він
допомагає підтримувати стабільність мРНК. Під час проце-
сингу пре-мРНК, утворена внаслідок кепування і додаван-
ням полі(А) хвоста, проходить стадію елімінації інтронів
(див. рис. 1-19), і коли ця посттранскрипційна модифікація
завершується, то зріла мРНК переміщується до цитоплаз-
ЗАГАЛЬНІ ЗАСАДИ ТА КЛІТИННІ ОСНОВИ ФІЗІОЛОГІЇ ЛЮДИНИ / 21
Вторинний месенджер —► І Протеїнкіназа С
/
Цинк-зв’язаний палець Цинк-зв’язаний палець
Рис. 1-20. Угорі: активація генів вторинними месенджерами.
Вплив генів негайного типу збільшує кількість протеїнкінази
С, що призводить до утворення с-Еоз та с-Зип. Гетеродимер
с-Роз-с-Зип зв’язується з Ар-1 сайтом, активуючи транскрип-
цію інших генів Унизу: цинк-зв’язані пальці Кривими лініями
зображено поліпептидні ланцюги, що зв’язуються з ДНК, а
прямі лінії показують зв’язування цинку з цистеїнами (С) або
цистеїнами та гістидинами (6) (відтворено за дозволом з
Миггау КК еі аі Нагрег’8 Віосїіетієігу, 251Гі есі. МсСга\л/-НіІІ,
2000).
ми. Посттранскрипційна модифікація пре-мРНК є регу-
льованим процесом, і, як зазначено вище, внаслідок дифе-
ренційного сплайсингу з однієї пре-мРНК може утворитися
більше ніж одна мРНК.
Коли зріла мРНК досягає рибосоми в цитоплазмі, то
вона спричинює утворення поліпептидного ланцюга. Акти-
вування амінокислоти у цитоплазмі відбувається шляхом
поєднання з ензимом та аденозинмонофосфатом (аденила-
том) і тоді кожна активована амінокислота сполучається
зі специфічною молекулою тРНК. На кожну із 20 немоди-
фікованих амінокислот, що містяться в значних кількостях
у білках тіла тварин, припадає щонайменше одна тРНК
(див. Розділ 17), а на деякі амінокислоти - більше ніж одна
тРНК. Комплекс тРНК-амінокислота-аденілат прикріплю-
ється до матриці мРНК. Цей процес відбувається в рибо-
сомах; у вигляді діаграми він зображений на рис. 1-17.
МолекулатРНК “розпізнає” відповідне місце прикріплення
на матриці мРНК, оскільки на активному кінці має набір з
трьох основ, які є комплементарними до набору трьох
основ у певному місці ланцюга мРНК. Генетичний код
складається з відповідних триплетів або кодонів, послі-
довності трьох пуринових чи/і піримідинових основ; при-
чому кожен триплет відповідає за певну амінокислоту.
Трансляція починається в рибосомах з АГО (транскри-
бовані з АТО у гені), що кодує метіонін. Потім до них долу-
чає! ься амінний залишок амінокислоти, і ланцюг стає дов-
шим на одну амінокислоту. Матрична РНК прикріплюється
до субодиниці 408 рибосоми під час синтезу білка; утво-
рений поліпептидний ланцюг приєднується до субодиниці
608, а тРНК - як до однієї, так і до іншої. Оскільки додаван-
ня амінокислот відбувається в порядку, визначеному три-
плетним кодом, то рибосома рухається вздовж молекули
мРНК як намистина по нитці. Процес трансляції припиня-
ється на одному з трьох стоп або нонсенс кодонів - ІЮА,
ІЇАА чи ПАС, і поліпептидний ланцюг вивільняється. Мо-
лекули тРНК будуть використані повторно, а молекули
мРНК - ще приблизно десять разів, після чого відбувається
їхня заміна.
Як звичайно, на кожному ланцюгу мРНК міститься
більше ніж одна рибосома. Ланцюг мРНК та набір рибосом
можна побачити через електронний мікроскоп як сукуп-
ність рибосом, яку називають полірибосомами (полісо-
мами).
Принаймні теоретично, синтез деяких білків можна
припинити за допомогою десенсибілізувальних олігону-
клеотидів - коротких синтетичних фрагментів основ, ком-
плементарних до сегментів основ мРНК білка. Ці фраг-
менти зв’язуються з мРНК, блокуючи трансляцію. Перші
результати застосування цієї методики виявились невда-
лими. Причиною цього стали неспецифічне зв’язування
та імунна реакція, однак дослідження тривають і є надія,
що будуть отримані продукти, які допоможуть лікувати різ-
номанітні захворювання, в тому числі й рак.
Посттрансляційна модифікація
Модифікування утвореного поліпептидного ланцюга в
кінцевий білок відбувається за допомогою комбінації реак-
цій, зокрема гідроксилювання, карбоксилювання, глікози-
лювання чи фосфорилювання амінокислотних залишків;
розщеплення пептидних зв’язків, унаслідок чого великий
поліпептид перетворюється на меншу форму; а також утво-
рюється та упаковується білок і набуває кінцевої, часто
комплексної конфігурації.
Припускали, що типова еукаріотична клітина за період
існування синтезує близько 10 000 різних білків. Як же ці
білки потрапляють на своє місце в клітині? Синтез розпо-
чинається у вільних рибосомах. Як зазначено, більшість
білків, що будуть секретовані або зібрані в органелах, а
також усі трансмембранні білки мають на кінцевій аміно-
групі сигнальний пептид (лідерну послідовність), що
спрямовує їх до ендоплазматичної сітки. Цей пептид
складається з 15-30 переважно гідрофобних амінокислот-
них залишків. Синтезований сигнальний пептид зв’язу-
ється з сигнальною розпізнавальною частиною (СРЧ)
- складною молекулою, у якій є шість поліпептидів та 78
РНК, одна з малих РНК. СРЧ припиняє трансляцію до того
часу, доки не зв’яжеться з транслоконом - заглибленням
22 / РОЗДІЛ 1
Рис.-1-21. Трансляція білка в ендоплазматичну сітку відпо-
відно до сигнальної гіпотези. Рибосоми, що синтезують бі-
лок, рухаються вздовж мРНК з 5'- до 3'-кінця. Коли сигналь-
ний пептид білка, призначеного для секреції клітинної мемб-
рани чи лізосом, з’являється з великої одиниці рибосоми, він
зв’язується з частинкою розпізнавання сигналу (англ. зідпаї
гесодпИіоп рагіісіе - 8РР), і це припиняє подальшу трансля-
цію, аж доки він не зв’яжеться з транслоконом на ендоплазма-
тичній сітці. Це вивільняє 8РР, яка рециклюється в цитоплаз-
мі. Також відбувається зв’язування з рецептором рибосоми,
і тунель відкривається, забезпечуючи входження зростаючого
білкового ланцюга в ендоплазматичну сітку. Сигнальний пеп-
тид виводить сигнальна пептидаза. У разі завершення синтезу
білка дві субодиниці рибосоми дисоціюють, а кінцева карбо-
ксильна група потрапляє до ендоплазматичної сітки; N -
амінокінець білка; С - карбоксильний кінець білка (відтворено
за дозволом з Регага Е, Ьіпдарра \/Р: Тгапзрогї о( ргоіеіпз
іпіо апсі асгозз іґіе епсіоріазтіс геіісиїит тетбгапе. Іп. Рго-
іеіп Тгапзїег апсі Огдапеііе Віодепезіз. Оаз РС, РоЬЬіпз Р\Л/
[есІИогз]. Асасіетіс Ргезз, 1988)
в ендоплазматичній сітці, яка є гетеротримерною струк-
турою, що складається з 8ес 61 білків. Рибосома також
зв’язується, а сигнальний пептид спрямовує пептидний
ланцюг, що зростає, у порожнину ендоплазматичної сітки
(рис. 1-21). Далі сигнальний пептид відщеплюється від
решти пептиду за допомогою сигнальної пептидази, тоді
як синтез іншої частини пептидного ланцюга триває далі.
Сигнали, що спрямовують нові білки у відповідні час-
тини клітини, формуються в апараті Гольджі (див. нижче)
і спричиняють специфічні модифікації вуглеводневих
залишків у глікопротеїнів.
Секретовані білки
Більшість білків, що їх секретують клітини, синтезують-
ся як великі білки, і поліпептидні послідовності відщеплю-
ються від них у період дозрівання. У випадку з гормонами
ці більші форми називають прегормонами та прогормо-
нами (див. рис. 1-19, 1-22). Прикладом тут є паратиреоїд-
ний гормон (див. Розділ 21). Він синтезується як молекула,
іцо містить 115 амінокислотних залишків (препропаратгор-
мон). Лідерна послідовність-25 амінокислотних залишків
на кінцевій аміногрупі - швидко виводиться і, таким спо-
собом утворюється пропаратиреоїдний гормон. Перед сек-
рецією з кінцевої аміногрупи виводяться шість додаткових
амінокислот, утворюючи секретовану молекулу. Призна-
чення ензиму з шести амінокислот невідоме.
Хоча більшість поліпептидів та білків, які виділяю і ься,
мають лідерну послідовність, що спрямовує їх до ендо-
плазматичної сітки, і секретуються в разі екзоцитозу (див.
нижче), однак зростає перелік таких білків, які не мають
такої послідовності. В організмі людини це стосується
цитокінезу інтерлейкіну-іа (ІЛ-Іа) і а ІЛ-1р, трьох фак-
торів росту та різноманітних факторів, що задіяні під час
гемостазу. Секреція, очевидно, відбувається через АТФ-
залежні мембранні транспортери. Є велика група цих АТФ-
касетозв’язувальних (АКЗ) транспортних білків, які пере-
носять йони та інші речовини, а також білки між органе-
лами та через клітинну мембрану. Як звичайно, вони скла-
даються з двох цитоплазматичних АТФ-зв’язувальних
доменів та двох мембранних доменів, кожен з яких при-
кріплює мембрану і містить шість довгих а-спіральних по-
слідовностей (рис. 1-23). Муковісцидозний трансмем-
бранний провідний регулятор (МТР) є одним з АКЗ
транспортних білків, який частково регульований цАМФ.
Він транспортує СІ та є аномальним в осіб з муковісци-
дозом (див. Розділ 37).
Укладання білка
Укладання білка є додатковою посттрансляційною
модифікацією. Цей складний процес зумовлений головно
послідовністю амінокислот у поліпептидному ланцюгу.
Однак в окремих випадках новосформовані білки з’єдну-
ються з іншими білками, які називають шаперонами, або
білками-опікунами. Вони запобігають невідповідним
контактам з іншими білками і гарантують досягнення оста-
точної правильної конформації білка. Неправильно укла-
дені білки та інші білки, “помічені” для деградації, кон’ю-
гують убіквітином і розпадаються в органелах, які нази-
вають 268 протеосомами (див. Розділ 17).
Апоптоз
Під генетичним контролем перебувають не ТІЛЬКИ ПОДІЛ
та ріст клітини, а й її загибель та поглинання. Цей процес
називають запрограмованою загибеллю клітини (ЗЗК),
або апоптозом. Слово апоптоз у грецькій мові означає
листки, що падають з дерева. Такий процес можна також
назвати “самогубством клітини”, оскільки за її загибель
значно відповідають її власні гени. Його треба відрізняти
від некрозу (змертвіння клітини), за якого руйнування здо-
рових клітин відбувається внаслідок зовнішніх процесів,
наприклад запалення.
Апоптоз є звичним процесом на стадії розвитку та зрі-
лості. Зокрема, в центральній нервовій системі формується
значна кількість нейронів, які зрештою гинуть під час ремо-
делювання, що трапляється протягом розвитку та утворен-
ня синапсу (див. Розділ 4). В імунній системі за допомогою
апоптозу вилучаються невідповідні клони імуноцитів (див.
Розділ 27); він відповідає за літичні впливи глюкокортико-
їдів на лімфоцити (див. Розділ 20). Апоптоз також є важли-
вим чинником у таких процесах, як видалення в плода
перетинок між пальцями та регресія проточних систем
плода в період статевого розвитку (див. Розділ 23). У дорос-
лих апоптоз спричинює циклічний розрив ендометрію, що
призводить до місячних (див. Розділ 23), та відповідає за
відмирання ентероцитів, які злущилися з кінчиків кишко-
вих ворсинок (див. Розділ 26). Аномальний апошоз,
ЗАГАЛЬНІ ЗАСАДИ ТА КЛІТИННІ ОСНОВИ ФІЗІОЛОГІЇ ЛЮДИНИ / 23
Кількість
амінокислот
у прекурсорі
Кількість
амінокислот
у гормонах
166
9
242
З
267
265
5, 7, 8
39 АКТГ
1р-Ендорфін
236
17 Динорфін
Рис. 1-22. Приклади великих прекурсорів (препрогормонів) для малих пептидних гормонів Див також рис. 14-12 ТИН -
тиреотропінвивільнювальний гормон, А\/Р - аргінін вазопресин; Меі-епк - теі-енкефалін; Ьеи-епк - Іеи-енкефалін, М8Н -
меланоцитстимулювальний гормон; АКТГ - адренокортикотропний гормон; ЕпсІ - р-ендорфін; Суп - динорфін; ІМ-епсІ - неоен-
дорфін.
імовірно, виникає в разі автоімунного захворювання, ней-
родсгснеративних хвороб та ракових захворювань.
Різноманітні позаклііинні ліганди можуть активувати
рецептори, що запускають апоіпоз. Один з них - Еа$, між-
мембранний білок, що випинається з лімфоцитів - клітин
природних вбивців (>4К - від англ. паїигаї кіііег), і Т-лімфо-
пиіів (див. Розділ 27), що перебувають у різних формах і
Рис. 1-23. Загальна будова еукаріотичних АВС транспортних
білків, що переміщають йони, інші речовини та білки через
мембрани АВС1 та АВС2 - АТФ-зв’язуювальні домени; МД1
та МД2 - мембранні домени; 8 - субстрат (модифіковано з
КисІзІег К, Тїюгпег 3’ Зесгеііоп о( реріісіез апсі ргоіеіпз Іаскіпд
ГіусігорІзоЬіс зідпаї зедиепсез. ТІзе гоїе о( асіепозіпе ІгірГіоз-
рііаіе-сіпуеп тетЬгапеігапзІосаіогз. Епсіосг Кєу 1992; 13:499).
циркулюють у крові. Апоптоз зручно характеризувати в
категоріях активації, внутрішньоклітинного передавання
сигналів і їхнього виконання. Два головні позаклітинні
фактори, що активують процес, - це Раз та ТИР. Коли Раз
приєднується до свого рецептора, відбувається активація
каскаду внутрішньоклітинних ензимних реакцій, що при-
зводи! ь до руйнування клітини. Апоптозопродукувальний
каскад ініціюється активацією каспаз - представників ве-
ликої родини цистеїнових протеаз. Сьогодні вже іденти-
фіковано і схарактеризовано тринадцять каспаз у ссавців.
Фактор некрозу пухлин також може імітувати апоптоз.
Унаслідок цього починається дія активованих апоптичних
генів, що спричинюють у клітині фрагментацію ДНК, кон-
денсацію цитоплазми та хроматину, а також у кінцевому
підсумку утворення мембранного пухиря, розпад клітини
та видалення залишків за допомогою фагоцитозу.
Одним з головних механізмів, за допомогою якого
продукт гена супресора пухлин Р53 (див. нижче) виконує
свою антиракову функцію, є активація апоптозу.
Молекулярна медицина
Фундаментальні дослідження молекулярних аспекіів
генетики, регулювання генної експресії та білкового син-
тезу щораз більше потрібні в клінічній медицині.
Серед перших досягнень у цій галузі було розуміння
механізмів впливу антибіотиків (табл. 1-5). Багато з них
діють шляхом пригнічення синтезу білків на одному з
описаних вище рівнів. Антивірусні препарати впливають
24 / РОЗДІЛ 1
Таблиця 1-5. Механізми інгібування синтезу білка
антибіотиками та іншими сполуками
Агент Ефект
Хлорамфенікол (левоміцетин) Запобігає нормальному сполу- ченню мРНК з рибосомами
Стрептоміцин, неоміцин, канаміцин Спичиняють неправильне зчитування генетичного коду
Циклогексимід, тетрациклін Інгібують перенесення комплексу тРНК-амінокислота до поліпептиду
Пуроміцин Комплекс пуроміцин-аміно- кислота заміщує комплекс тРНК-амінокислота і запобігає додаванню амінокислот до поліпептиду
Мітраміцин, мітомі- цин С, дактиноміцин (актиноміцин 0) Зв’язуються з ДНК, запобіга- ють полімеризації РНК на ДНК
Хлорохін, колхіцин, новобіоцин Інгібують ДНК полімеразу
Азотисті іприти, наприк- лад, мехлоретамін (мустарген) Зв’язуються з гуаніном у парах основ
Токсин дифтерії Запобігає руху рибосоми на мРНК
двох клітинних циклів, сповільнюючи цикл та даючи змо-
гу виправляти мутації й інші дефекти ДНК. Ген Р53 під-
дається мутації майже в 50% пацієнтів, хворих на рак,
що впливає на продукування Р53 білків, які послаблюють
сповільнення клітинного циклу та не допускають появи
інших мутацій у ДНК. Акумульовані мутації зреш гою при-
зводять до раку.
Генна терапія все ще перебуває на початкових стадіях
розвитку, та незважаючи на це розробляють різноманітні
винахідливі підходи для отримання генів з клітини Один
з них уже клінічно випробовують для лікування деяких
хвороб. Він полягає у виділенні клітин з хворого пацієнта,
трансфекції цих клітин нормальними генами іп уИго та
їхній реін’єкції у вигляді автотрансплантатів. Інший метод
передбачає вставляння відповідного гена у порівняно без-
печні віруси, які після цього вводять пацієнтам з метою
донесення генів до клітин, які вони уражують.
Апарат Ґольджі та везикулярне
транспортування у клітинах
Апарат Ґольджі - це набір оточених мембраною мішеч-
ків (цистерн), що розташовані подібно до тарілок на
обідньому столі (див. рис. І-4). Таких мішечків здебіль-
шого близько шести, однак інколи може бути більше. Один
чи більше апаратів Ґольджі розташовані в усіх еукарютич-
подібним чином, наприклад, ацикловір і гансикловір при-
гнічують ДНК полімерази. Деякі з цих ліків передусім
впливають на бактерії, інші ж пригнічують синтез білків у
клітинах тварин, у тому числі ссавців. Цей факт свідчить
про важливість антибіотиків для досліджень, як і для ліку-
вання інфекцій.
Сьогодні ідентифіковано одиничні генетичні аномалії,
що спричиняють понад 600 людських хвороб. Багато з цих
хвороб рідкісні, однак є значна група відомих, а деякі навіть
призводять до серйозних, інколи й летальних наслідків.
Приклади таких аномалій: дефективно регульований СІ -
канал у разі кістозного фіброзу (муковісцедозу див. вище,
а також Розділ 34); нестабільні тринуклеотидні повтори
в різних частинах геному, що спричиняють хворобу Ган-
тінгтона; синдром крихкої Х-хромосоми та кілька інших
неврологічних захворювань (див. Розділ 12). Аномалії в
мітохондріальній ДНК також можуть зумовлювати різні
хвороби людини, зокрема спадкову оптичну нейропатію
Лебера та деякі форми кардіоміопатії. Не дивно, що най-
більше уваги приділяють генетичним аспектам раку. Деякі
ракові захворювання спричинені онкогенами, генами,
перенесення яких відбувається в геномах ракових клітин,
і які відповідають за їхні злоякісні характеристики. Онко-
гени виникають унаслідок соматичних мутацій від близь-
ких протоонкогенів. Уже описано понад 100 онкогенів.
Інша група генів продукує білки, що пригнічують пух-
лини, таких генів - супресорів пухлин - описано понад
10. З них найліпше вивченими є ген Р53 людської хромо-
соми 17. Білок Р53, вироблений цим геном, спричиняє
апоптоз. Він також є фактором транскрипції ядра, що
збільшує продукування 21 кДа білка, який блокує ензими
Рециклінг
Рис. 1-24. Шляхи, задіяні в процесингу білків в апараті Ґольд-
жі, секреція в разі екзоцитози та реґенерація мембрани у разі
ендоцитози ЕПР - ендоплазматична сітка з прикріпленими
рибосомами. Зверніть увагу на різноманітні шляхи для регу-
льованої (неконститутивної) та конститутивної секреції у разі
екзоцитози, МФРи - маноло-6-фосфат рецептори.
ЗАГАЛЬНІ ЗАСАДИ ТА КЛІТИННІ ОСНОВИ ФІЗІОЛОГІЇ ЛЮДИНИ / 25
них клпинах, як звичайно, біля ядра. Апарат Ґольджі є
поляризованою сірукіурою з цис- і транс-боками (рис. 1-
24). Мембранні пухирці, що містять щойно синтезовані
білки, відбруньковуються від гранулярної ендоплазматич-
ної сіїки і а зливаю і ься з цистерною на цис-боці апарату.
Потім через ніші пухирці білки потрапляють до середин-
них цис і ери і паренні до цистерни на транс-боці, звідки
пухирці розі алужуюіься в цитоплазму. Зтранс-боку пухир-
ці псрсходяїь у лізосоми та поза межі клітини конститу-
іивним і нскопсіигутивним шляхом, причому обидва спо-
соби спричипяюіь екзоцитоз (див. нижче). У протилеж-
ному напрямі пухирці витискаються із клітинної мембрани
ендоци юзом (див. нижче), потрапляють в ендосоми і зреш-
іою у лізосоми. З лізосом деякі білки переходять назад у
іранс-боки апарату Ґольджі. Остаточне глікозилювання
білків відбувається в разі приєднання раніше сформованих
оліюсахаридів в ендоплазматичній сітці, однак ці оліго-
сахариди перетворюються на велику кількість різноманіт-
них вуглеводневих складових в апараті Ґольджі.
Перевірка якості
Процеси, які відбуваються під час синтезу білка, його
укладання іа міграції до інших частин клітини, відобра-
жають складний комплекс різноманітних перевірок для
того, щоб уникнути появи помилок та аномалій. Відповід-
ний механізм “перевірки якості” є на кожному рівні. По-
шкоджена ДНК виявляється і піддається репарації. Різні
РНК також перевіряються під час процесу трансляції.
Кінцево, коли білкові ланцюги перебувають в ендоплаз-
матичній сітці або в апараті Ґольджі, дефектні структури
розкриваються і аномальні білки деградують у лізосомах і
протеосомах. Осіагочним результатом є точне перевіряння
продукції білків, що необхідне для нормальної діяльності
організму.
ТРАНСПОРТУВАННЯ ЧЕРЕЗ КЛІТИННУ
МЕМБРАНУ
Транспортування через клітинні мембрани відбувається
передусім за допомої ою екзоцитозу, ендоцитозу, руху через
йонні канали га первинного і вторинного активного транс-
портування.
Екзоцитоз
Білки, що їх секретуюгь клітини, рухаються з ендоплаз-
матичної сігки до апарату Ґольджі, а з транс-боку Ґольджі
відбувається їхнє виштовхування в секреторні гранули чи
пухирці (див. рис. 1-24). Ці гранули та пухирці рухаються
до клітинної мембрани, з якою потім зливаються їхні мем-
брани (рис. 1-25), а ділянка злиття руйнується. Унаслідок
цього вміст гранул чи пухирців опиняється за межами
клітини, клітинна ж мембрана залишається неушкод-
женою. Процес виштовхування поза межі клітини назива-
ють екзоцитозом. Він потребує Са2 та енергії, а також
акцепторних білків (див. нижче, а також Розділ 4).
Зазначимо, що є два шляхи секреції з клітини (див. рис.
1-24). У разі неконститутивного шляху білки з апарату
Ґольджі потрапляють у секреторні гранули, де перед екзо-
цитозом відбувається процесинг прогормонів у зрілі гор-
мони. Інший шлях - конститутивний - спричиняє швидке
транспортування білків до клітинної мембрани в пухирцях
з незначним процесингом чи накопичуванням або без
цього. Неконститутивний шлях інколи називають регульо-
ваним шляхом, однак цей термін неправильний, оскільки
виділення білків конститутивним шляхом також регульо-
ване.
Ендоцитоз
Процес ендоцитозу протилежний до екзоцитозу. Він
буває різних типів. Фагоцитоз (“поїдання клітини”) - це
процес, під час якого бактерії, мертву тканину чи інші част-
ки матерії, видимі під мікроскопом, поглинають клітини,
наприклад, поліморфоядерні лейкоцити крові. Матеріал
контактує з клітинною мембраною, яка інвагінує. Далі інва-
і інація відщеплюється, внаслідок чого поглинутий мате-
ріал опиняється в оточеній мембраною вакуолі, а клітинна
мембрана не ушкоджена. Піноцитоз (“випивання кліти-
ни”) подібний до фагоцитозу, з тою лише різницею, що
поглинуті частки перебувають у розчині і тому не видимі
під мікроскопом.
Кожен з типів ендоцитозу може бути конститутивним
або клатрин-опосередкованим. Конститутивний ендоци-
тоз є неспеціалізованим процесом, тоді як клатрин-
опосередкований ендоцитоз відбувається майже повніс-
тю через покриті клатрином заглиблення на клітинній
мембрані. Молекули клатрину мають форму трилисника з
трьома ніжками, що подібно до променів відходять від
центральної втулки (рис. 1-26). У разі прогресування ендо-
цитозу молекули клатрину утворюють геометричну мно-
жину, яка оточує ендоплазматичний пухирець. У шийці
пухирця міститься білок динамін (гуанозинтрифосфата-
за), який безпосередньо або опосередковано проколює
пухирець (тому цей білок називають пінказа (від англ. ріпсЬ
- ущипнути)). Як тільки пухирець повністю сформовано,
клатрин відпадає, і триніжкові білки внаслідок рециклінгу
залучаються до утворення інших пухирців, які надалі
розчиняються і передають свій вміст ранній ендосомі (див.
рис. 1-24). З ранньої ендосоми новий пухирець відбрунь-
ковується і повертається назад до клітинної мембрани (див.
рис. 4-5). Альтернативно, рання ендосома може ставати
пізньою ендосомою. Пізні ендосоми зливаються з лізо-
сомами (див. рис. 1 -24), а їхний вміст розчиняють лізосомні
ензими.
Клатрин-опосередкований ендоцитоз може відбуватися
швидше, ніж конститутивний, і специфічніше в тому сенсі,
що молекули, які стимулювали його, сконцентровані на
своїх рецепторах у покритих заглибленнях і, відповідно,
покритих пухирцях. Такий ендоцитоз відповідає за інтерна-
лізацію багатьох рецепторів, з якими зв’язуються ліганди,
наприклад, фактор росту нервів - ліпопротеїни низької
щільності - важливі елементи клітинного метаболізму
холестерину (див. Розділ 17). Він також відіграє важливу
роль у функціонуванні синапсів (див. Розділ 4).
Клітинна мембрана містить маленькі ямки кавеолі, по-
криті білком кавеоліном, а не клатрином. У них є сайти
для ендоцитозу, що сприяють поглинанню різних вітамінів
і пептидів.
Зрозуміло, що внаслідок екзоцитозу збільшується за-
іальний вміст мембрани, яка оточує клітини. Однак під
26 / РОЗДІЛ 1
Рис. 1-25. Екзоцитоз та ендоцитоз. Зверніть увагу на те, що в разі екзоцитозу зливаються цитоплазматичні частини двох
мембран, тоді як у разі ендоцитозу - дві нецитоплазматичні частини (відтворено за дозволом з АІЬегїз В еі аі. Моїесиїаг Віоіоду
оНїіе СІП, 2псІ есі. багіапсі, 1989).
час ендоцитозу вміст мембрани зменшується. Отже, пара
процесів екзоцитоз-ендоцитоз підтримує поверхню кліти-
ни в межах її нормального розміру.
Механізми, задіяні в транспортуванні
пухирців
Значного прогресу досягнуто в аналізі біохімічної осно-
ви утворення пухирців, їхнього транспортування та акцеп-
Рис. 1-26. Молекула клатрину на поверхні ендоцитозного пу-
хирця Зверніть увагу на характерну форму трилисника клат-
рину і факт утворення підтримувальної сітки для пухирця,
спільної з іншими молекулами
тування в клітинах. Транспортування в межах клітини до-
речно аналізувати поряд з екзо- та ендоцитозом, оскільки
тут задіяні дуже подібні механізми.
Уже відомо, що всі пухирці, які беруть участь у транс-
портуванні, мають білкові оболонки. Розрізняють чотири
оболонки: АР-1 клатрин, АР-2 клагрин, СОРІ таСОРІІ.
Пухирці, що транспортують білки з транс-боків апарату
Гольджі до лізосом, мають АР-1 клатрин оболонки, а ендО-
цитозні, що транспортують білки в ендосоми, - АР-2 кла-
трин. Пухирці, які забезпечують транспортування між
ендоплазматичною сіткою та апаратом Гольджі, мають
СОРІ та СОР1І оболонки. Певні амінокислотні послідов-
ності чи приєднані групи на транспортованих білках спря-
мовують їх у відповідні місця розташування. Наприклад,
амінокислотна послідовність Азп-Рго-будь-яка амінокис-
лота-Туг спрямовує транспортування з поверхні клітини
до ендосом, а прикріплені маноза-6-фосфат групи - з
апарату Гольджі до ендосом. Пухирці дифундують у клі-
тини на невелику відстань і рухаються по мікротрубочках
на довгі відстані. Як тільки пухирець досягає мішені, він
акцептується, коли У-пастка білків пухирця утворює
замок з Т-пасткою білків на мішені. Кожна мішень маг
унікальний набір Т-пасток білків, що гарантує акцепту-
вання лише пухирця з відповідним набором У-пасток біл-
ків. Білки-мішені та білки-акцептори детальніше описані
в Розділі 4 в контексті синаптичної трансмісії.
ЗАГАЛЬНІ ЗАСАДИ ТА КЛІТИННІ ОСНОВИ ФІЗІОЛОГІЇ ЛЮДИНИ / 27
З різноманітними типами пухирців пов’язані різнома-
нітні малі ГТФ (гуанозин 5'-трифосфат)-зв’язувальні білки
ИаЬ родини (див. нижче).
Поширення йонів та інших речовин через
клітинну мембрану
Від специфічних властивостей клітинних мембран зале-
жать відмінності у складі внутрішньоклітинної та інтер-
стиційної рідини. Специфічні вмісти для однієї тканини
ссавця наведено в табл. 1-2. Середні вмісти для людей
зображено на рис. 1 -27, а вміст На та К в різних частинах
тіла є в табл. 1-6.
Проникність мембрани та мембранне
транспортування білків
Клітинна мембрана практично непроникна для внутріш-
ньоклітинних білків та інших органічних аніонів, що
становлять більшість усіх внутрішньоклітинних аніонів.
Як звичайно, ці аніони позначають символом А . У разі
аналізування проникності мембрани для менших молекул
важливо чіт ко розмежувати власне ліпідний бішар та різно-
манітні численні транспортні білки, які містяться у ньому.
Транспортні білки є трансмембранними, що вибірково
сприяють руху кількох, а часто й однієї речовини через
мембрану. Ліпідний шар проникний головно для води. Його
проникність для інших речовин залежить від їхнього роз-
міру (табл. 1 -7), розчинності та заряду. Такі неполярні, тоб-
то гідрофобні молекули, як О? та N2, розчиняються в бішарі
та легко його проходять. Малі незаряджені полярні (гідро-
фільні) молекули, наприклад СО2, теж швидко дифундують
через ліпідні бішари, водночас дифузія великих незаряд-
жених полярних молекул, зокрема глюкози та заряджених
частинок, тобто йонів, надзвичайно повільна. Однак йони,
глюкоза, сечовина, а також багато інших малих молекул іп
уіуо використовують транспортні білки для проходження
через клітинну мембрану, дифузію ж води підсилюють
водні канали.
Значно розширює наші знання про транспортні білки
техніка петч клемп (прилипання до шматочка плазматич-
ної мембрани). За цією технологією кінець мікропіпетки
розміщують на мембрані клітини так, щоб був тісний
контакт. Шматочок мембрани під кінчиком піпетки містить
лише кілька транспортних білків, які піддають детальному
вивченню (рис. 1-28). Є декілька варіантів цієї техніки:
клітину можна залишити неушкодженою (прикріплений
до клітини захоплений шматочок); шматочок можна
відірвати від клітини й отримати відірваний шматочок;
можна втягнути шматочок мікропіпеткою, яка прикріплена
до решти клітинної мембрани, забезпечивши прямий до-
ступ до вмісту клітини (повне записування клітини).
Деякі транспортні білки є простими водянистими йон-
ними каналами. Окремі з них постійно відкриті, тоді як
інші мають ворота, які відкриваються і закриваються.
Деколи стан воріт залежить від змін мембранного потен-
ціалу (потенціалозалежні ворота), інші можуть відкрива-
тися і закриватися, коли зв’язуються з лігандом (канал,
що відкривається/закривається лігандом). Часто ліганд
є зовнішнім (наприклад, нейротрансмітер чи гормон).
Однак він може бути і внутрішнім. Зокрема, внутрішньо-
клітинний Са2', цАМФ чи один з 6-білків, продукованих у
клітинах (див. нижче), можуть зв’язуватися безпосередньо
з каналами й активувати їх. Деякі канали відкриваються
внаслідок механічного розтягування. Типовим потенціало-
залежним є №’-канал (див. нижче), а типовим каналом,
що пов’язаний з реакцією лігандів, - рецептор ацетилхо-
ліну (див. Розділ 4).
Інші транспортні білки - це носії, що зв’язують йони
та інші молекули, а потім змінюють конфігурацію, пере-
Рис. 1-27. Електролітичний склад рідин організму людини. Зверніть увагу на те, що величини виражені в мекв/л води, а не
рідини організму (відтворено за дозволом з Зопзоп І_Р [есіііог] ЕззепііаІ МесІісаІ Рґіузіоіоду. Рауеп Ргезз, 1992).
28 / РОЗДІЛ 1
Таблиця 1-6. Розподіл натрію та калію в організмі людини
Компонент Вміст, %
Иа* Ю
Повністю внутрішньоклітинний 9,0 89,6
Повністю позаклітинний 91,0 10,4
Плазма 11,2 0,4
Інтерстиційна рідина 29,0 1,0
Щільна сполучна тканина та хрящ 11,7 0,4
Кістка 36,51 7,6
Міжклітинне розташування 2,6 1,0
’ 3 них 11,0 можуть обмінюватися, а 25,5 - ні.
міщаючи зв’язану молекулу від одного боку клітинної мем-
брани до іншого. Молекули рухаються з ділянок високої
концентрації в ділянки низької (в напрямі зниження їхнього
хімічного градієнта), катіони - до негативно заряджених
ділянок, а аніони - до позитивно заряджених (у напрямі
зниження їхнього електричного градієнта). Процес пере-
міщення білками-носіями речовин у напрямі їхнього хі-
мічного чи електричного градієнтів не передбачає вико-
ристання енергії. Його називають полегшеною дифузією.
Типовим прикладом такого процесу є транспортування
глюкози глюкозотранспортером, який переміщає її в напря-
мі зниження концентраційного градієнта з ПКР до цито-
плазми клітини (див. Розділ 19). Інші носії транспортують
речовини в напрямі, протилежному до їхніх електричного
та хімічного градієнтів. Ця форма транспортування потре-
бує енергії і називається активним транспортуванням.
У тваринних клітинах енергія в переважній більшості
забезпечена гідролізом АТФ (див. вище, а також Розділ 17).
Таблиця 1-7. Розмір гідратованих йонів та інших біологічно
важливих речовин1
Речовина Атомна чи молекулярна маса Радіус, нм
сі- 35 0,12
К‘ 39 0,12
Н2О 18 0,12
Са2’ 40 0,15
№* 23 0,18
Сечовина 60 0,23
ЬГ 7 0,24
Глюкоза 180 0,38
Цукроза 342 0,48
Інулін 5 000 0,75
Альбумін 69 000 7,50
1 Дані взято з Мооге Е\А/: РІтузіоІоду ої Іпіезііпаї ХЛ/аІег апсі
Еіесігоіуіе АЬзогрІіоп, Атегісап базігоепіегоіодісаі Аззосіа-
ііоп, 1976.
Отже, не дивно, що молекулами-носіями є АТФ-ази -
ензими, які каталізують гідроліз АТФ. Одна з цих АТФ-аз
- натрін-калій-активована аденозинтрифосфатаза
(І9а+-К+-АТФ-аза), відома ще як №+-К+-помпа. Є також Н+-
К+-АТФ-ази в слизовій оболонці шлунка (див. Розділ 26)
та ниркових канальцях (див. Розділ 38). Зокрема, У-АТФ-
ази - це протон-АТФ-ази, що підкиснюють багато внут-
рішньоклітинних органел, у тому числі частини апарату
Ґольджі та лізосоми; Р-АТФ-ази наявні в мітохондріях та
синтезують АТФ з АДФ. Деякі мембрани містять АТФ-
ази, що транспортують Са2+.
А Шматочок, прикріплений до клітини
Електрод
І
-Піпетка
Клітина
мембрани
Відірваний шматочок
Шматочок з цілої клітини
Закрито
ЛРГПЛО
мс
Відкрито
Рис. 1-28. Типи захоплених шматочків, які використовують для вивчення активності йонних каналів через клітинну мембрану.
На А та В також зображено зміни в мембрані за певний час (модифіковано з Аскегтап М3, Сіартап ОЕ: Іоп сіїаппаіз: Вазіс
зсіепсе апсі сііпісаі сіезеазе. N ЕпдІ Ц Месі 1997;336:1575).
ЗАГАЛЬНІ ЗАСАДИ ТА КЛІТИННІ ОСНОВИ ФІЗІОЛОГІЇ ЛЮДИНИ / 29
Рис. 1-29. Дві родини К+ каналів Ліворуч: спрямований внутрішньо ректифікаційний К+ канал. Угорі: зв’язок з клітинними
мембранами Унизу: утворення водянистої пори чотирма субодиницями. Праворуч: потенціалозалежні “ворота” (відтворено
за дозволом з КиЬо У еі аі: Ргітагу зігисіиге апсі (ипсііопаї ехргеззіоп о( а таизе іп\л/агсі гесШіег роіаззіит сіїаппеї ІМаіиге
1993;362 127)
Деякі транспортні білки називають уніпортами, тому
що вони транспортують лише одну речовину. Інші назива-
ють симпортами, оскільки цей спосіб транспортування
передбачає зв’язування з транспортним білком більше ніж
однієї речовини, які разом транспортуються через мембра-
ну. Прикладом є симгюрт у слизовій оболонці кишки, що
відповідає за спільне транспортування у разі полегшеної
дифузії N3 та глюкози з кишкового просвіту в клітини
слизової оболонки (див. Розділ 25). Інші транспортери
називають антипортами, оскільки вони замінюють одні
речовини іншими. Типовим антипортом є згадана вище
№’-К*-АТФ-аза: на кожні три N3 , які вона переміщує з
клітини, припадають два К , які вона переносить у клітину.
Йонні канали
Відомо йонні канали для К*, N3 , Са2* та СІ . Кожен з
них має численні форми з різноманітними властивостями.
Першими, можливо, розвинулися внутрішньоспрямовані
ректифікаційні К*-канали, названі так тому, що вони спри-
яють надходженню К , майже не впливаючи на їхній відтік.
Ці канали не містять потенціалозалежних воріт, і кожен
складається з чотирьох субодиниць, що мають два транс-
мембранні домени (МІ та М2; рис. І-29). Ці субодиниці
оточують водянисту нору. Інша родина Кт-рецепторів, ймо-
вірно, розвинулася пізніше і має чотири додаткові транс-
мембранні домени в зовнішній оболонці. Вони МІСТЯТЬ
потенціалозалежні ворота й амінозакінчення їхніх субоди-
ниць мають форму м’яча і ланцюга. Після активації відбу-
вається розхитування м’яча, який, потрапляючи в пору,
спричинює швидку інактивацію каналу, незважаючи на
Закриті Відкриті Інактивовані
Рис. 1-30. Швидка інактивація потенціалозалежних воріт К+-
каналів. Деполяризація відкриває активовані ворота, а пізніше
амінозакінчення субодиниць коливається у напрямі до каналу,
зупиняючи провідність і незважаючи на деполяризацію, що
триває Після реполяризаціі мембрани зміни конформації біл-
ка відновлюються так, як у стані спокою (відтворено за до-
зволом з Апі2 С, Ракіег В: Газі іпасіі уаііоп о( 7оКаде-даіесІ К+
сіїаппеїз (гот сагїооп іо сігисіиге ІМе\л/з РііузіоІ Зсі 1998;
13:177)
ЗО / РОЗДІЛ 1
Рис. 1-31. Схематичне зображення будови головних субодиниць двох йонних каналів. Деякі І\Іа+- та Са2+-канали мають додаткові
субодиниці Арабськими цифрами позначено «-спіральні домени, що перетинають клітинну мембрану. Домен Н5 не зображений
(за СаИегаІ \/\/К. Модифіковано і відтворено з НаІІ 2.УУ: Ап Іпігосіисііоп іо Моїесиїаг ІМеигоІоду. Зіпаиег, 1992).
деполяризацію, що ще триває. Після деполяризації конфор-
маційні зміни каналу набувають нормального стану під час
спокою (рис. 1-30).
У ссавців описано понад 40 різноманітних К-каналів.
Усі вони тетрамери і кожен тип субодиниці кодований
іншим геном.
Канали Са2ь та потенціалозалежні №'-ворота також
складаються з чотирьох груп, кожна з яких має шість транс-
мембранних доменів, що оточують водянисту пору діамет-
ром понад 0,5 нм. Однак від К -каналів вони відрізняються
тим, що кожен є продуктом єдиного гена зі сшивальними
пептидними ланцюгами, що з’єднують групи (рис. 1-31).
Описано понад ЗО різноманітних потенціалозалежних
воріт чи циклічних нуклеотидних воріт 1Ча+- та Са2 -кана-
лів. Деякі з них мають нетранспортувальні одиниці, пов’я-
зані з ними іп уіуо. Токсини тетрадоксин (ТТХ - від англ.
іеігасіохіп) та сакситоксин (8ТХ - від англ. захііохіп) зв’я-
зуються з №'-каналами та блокують їх. Кількість та поши-
рення №'-каналів можна визначати, приєднуючи до них
ТТХ чи 8ТХ, що мають відповідну мітку, та аналізуючи
поширення мітки.
Родину епітеліальних № -каналів, що мають іншу
структуру, виявлено в апікальних мембранах клітин епіте-
лію нирок, товстої кишки, легень та мозку. Кожен натрі-
євий канал епітеліальних клітин (№аКЕ) складається з
трьох субодиниць, кодованих трьома різними генами.
ЗАГАЛЬНІ ЗАСАДИ ТА КЛІТИННІ ОСНОВИ ФІЗІОЛОГІЇ ЛЮДИНИ / 31
Кожна субодиниця, ймовірно, двічі охоплює мембрану, а
кінцева аміноірупа та кінцева карбоксильна група розта-
шовані всередині кліт ини; ос-субодиниця транспортує №’,
тоді як р- та у-субодиниці цього не роблять. Точної стехіо-
метрії №КЕ не визначено, отже іп уіуо в рецепторах може
бути більше ніж одна з трьох субодиниць. Такі канали інгі-
бовані амілодіуретиком ридином, що зв’язується з ос-суб-
одиницсю Часіоїх називають амілоридин-інгібованими
№а+-каналами. У нирці вони відіграють важливу роль,
регулюючи об’єм ПКР за допомогою альдостерону (див.
Розділ 38). Піддослідні миші, у яких не функціонують
№КЕ, народжуються живими, однак швидко вмирають,
оскільки їхній організм не здатний випомпувати №', а
отже, - воду з легень.
Є також багато СІ -каналів, значно задіяних у регулю-
ванні об’єму клітин, трансепітеліальному йонному транс-
портуванні та, очевидно, в регулюванні функції м’язів і
нирок. Наприклад, ГАМКх-рецептор та гліцин-рецептор є
СІ -каналами (див. Розділ 4). У значних кількостях СІ -
канали містяться в скелетному м’язі. Нормальна функція
цих м’язових каналів невідома, однак мутації в гені, що їх
кодує, спричинюють вроджену міотонію, хворобу, що
супроводжується гіперзбудливістю м’язів.
№+-К+-АТФ-аза
Як зазначено вище, Ш-К-АТФ-аза каталізує гідроліз
АТФ до АДФ, використовуючи енергію для виштовхування
трьох N3’ з клітини га поглинання двох К? у клітину на
кожен моль пдролізованого АТФ. Відповідно, потенціало-
залежна помпа має коефіцієнт зв’язування 3:2, оскільки
переміщує три позитивні заряди з клітини на кожні два в
клітину. Такі помпи є в усіх частинах тіла. їхню діяльність
інгібують уабаїн і подібні глікозиди наперстянки, які вико-
ристовують для лікування серцевої недостатності. Це гете-
родимер, який складається з ос-субодиниці, що має молеку-
лярну масу приблизно 100 000, та р-субодиниці, що має
молекулярну масу приблизно 55 000. Обидві проходять
через клітинну мембрану (рис. І -32). Роз’єднання субоди-
ниць зумовлює припинення активності. Однак р-субоди-
ниця є глікопротеїном, годі як №'- та К'-транспортування
відбувається через ос-субодиницю. Субодиниця р має єди-
ний трансмембранний домен та три позаклітинні ділянки
глікозидювання, у кожному з яких є прикріплені вуглевод-
неві залишки. Ці залишки становлять одну третину її моле-
кулярної маси. Субодиниця ос охоплює мембрану десять
разів КН,таСООН кінцями, які розташовані всередині клі-
тини. Вона має внутрішньоклітинний №’-та АТФ-зв’язу-
вальні ділянки, ділянку фосфорилювання, а також позаклі-
тинну ділянку зв’язування для К' тауабаїну. Коли №+зв’я-
зується з ос-субодиницею, АТФ також зв’язується і перетво-
рюється в АДФ, а фосфат перетворюється на А§р 376 ді-
лянку фосфорилювання. Це спричиняє зміну в конфігура-
ції білка, виштовхуючи N3* у ПКР. Далі позаклітинно зв’я-
зується К , фосфорилюючи ос-субодиницю, що набуває
своєї попередньої конфігурації, вивільнюючи К/у цито-
плазму.
Зазначимо, що ос- та р-субодиниці гетерогенні і мають
осґ ос, та осг а також рр р, і р^ субодиниці; ос,-ізоформа
міститься в мембранах більшості клітин, тоді як ос,є в м’я-
зах, серці, жировій тканині та в мозку, а ос, - у серці та
Рис. 1-32. І\Іа+-К+-АТФ-аза Внутрішньоклітинна частина р-суб-
одиниці має І\Іа+-зв’язувальний сайт (1), сайт фосфорилю-
вання (4) та АТФ-зв’язувальний сайт (5). Позаклітинна частина
має К+- (2) та уабаінзв’язувальні сайти (3) (з НогізЬегдег 3-0
еі аі. Зігисіиге-їипсііоп геїаііопзітір ої ІМа-К-АТРазе Аппи Рєу
РІтузіо11991 ;53:565. Відтворено за дозволом з АппиаІ Рєуієуу
ої РІтузіоІоду, уоі. 53. АппиаІ Рєуіємз, 1991).
мозку. Субодиниця Р] поширена, однак її нема в певних
астроцитах, вестибулярних клітинах внутрішнього вухата
гліколітичних м’язах, здатних до швидких скорочень; ці
м’язи містять тільки Р2-субодиницю. Різноманітні структу-
ри ос- та р-субодиниць №'-К -АТФ-ази в різноманітних
тканинах, очевидно відображають спеціалізацію специфіч-
них функцій тканини.
Регулювання Ма+-К+-АТФ-ази
Звичайно, кількість насиченого в клітину, не є ста-
більною. Наприклад,- якщо вона збільшується, то посилю-
ється активність помпи і, відповідно, збільшується кількість
1Ма\ що виштовхується з клітини. На активність помпи
впливають вторинні месенджери, продуковані в клітинах,
зокрема, цАМФ, діацилгліцерол (ДАТ) та похідні арахі-
донової кислоти (див. нижче). Розмір та напрям таких
впливів змінюються відповідно до експериментальних умов.
Гормони щитоподібної залози підвищують активність
помпи геномною дією, прискорюючи утворення молекул
№'-К -АТФ-ази. Альдостерон також збільшує кількість
помп, хоча цей вплив є вторинним (див. Розділ 20 і 38).
Дофамін у нирці гальмує помпу, фосфорилюючи її і спри-
чинюючи натрійурез. Інсулін підвищує активність помпи
за допомогою різноманітних механізмів. Нарешті, 1Маг-К/-
АТФ-аза зв’язана в мембрані цитоскелетоном, і, що цікаво,
6-актин (див. вище) також підвищує активність помпи.
Вторинне активне транспортування
У багатьох випадках активне транспортування N3*
пов’язане з транспортуванням інших речовин (вторинне
активне транспортування). Наприклад, люмінальні мем-
брани клітин слизової оболонки тонкої кишки містять сим-
порт, що транспортує глюкозу в клітину ТІЛЬКИ тоді, коли
N3' одночасно приєднується до білка і транспортується в
напрямі зменшення його електрохімічного градієнта.
32 / РОЗДІЛ 1
Рис. 1-33. Складена схема головних вторинних ефектів актив-
ного транспортування №+ та К+; №+-К+-АТФ-аза конвертує
хімічну енергію гідролізу АТФ на підтримку спрямованого
внутрішньо ґрадієнта для І\Іа+ та зовнішньо спрямованого для
К Енергія ґрадієнтів використовується для контртранспор-
тування, котранспортування та підтримки мембранного по-
тенціалу (відтворено за дозволом з 8кои ЗС' ТНе І\Іа-К ритр.
ІМєууз РНузіоІ Зсі 1992;7 95)
Електрохімічний градієнт № підтримується активним
транспортуванням На* з клітин слизової оболонки в ПКР
(див. Розділ 25). Інші приклади зображено на рис. 1-33. У
серці На -К -АТФ-аза непрямо впливає на транспорту-
вання Са2 . Антипорт у мембранах клітин серцевого м’яза
в нормальному стані виконує обмін внутрішньоклітинного
Са2' на позаклітинний На . Коефіцієнт цього обміну про-
порційний до концентраційного градієнта На через клі-
тинну мембрану. Якщо діяльність Иа-К-АТФ-ази інгібо-
вана (наприклад уабаїном), то внутрішньоклітинна кон-
центрація На збільшується, градієнт На через клітинну
мембрану зменшується, а виштовхування Са2 послаблю-
ється. Унаслідок цього збільшення внутрішньоклітинного
Са2* поліпшує скорочення серцевого м’яза (позитивний
інотропний ефект; див. Розділ 3).
Активне транспортування На' та К є одним з головних
енергозатратиих процесів у тілі організму людини. В серед-
ньому він потребує близько 24% енергії, виробленої кліти-
нами, а в нейронах - 70%. Отже, він відповідає за значну
частину основного метаболізму.
КАПІЛЯРНА СТІНКА
Фільтрування
Капілярна стінка, що відділяє плазму від інтерстиційної
рідини, відрізняється від клітинних мембран, які відділя-
ють інтерстищйну рідину від внутрішньоклітинної, оскіль-
ки на них діє різний тиск. Це призводи і ь до того, що фільт-
рування стає важливим чинником у русі води га розчине-
ної речовини. За означенням, фільтрування - цс процес,
під час якого рідина проштовхується через мембрану чи
інший бар’єр унаслідок рвниці тисків з обох боків. Кіль-
кість фільтрованої рідини за певний інтервал часу пропор-
ційна до різниці тисків, поверхні мембрани і а проникності
мембрани.
Онкотичний тиск
Будова капілярної стінки різна в різних судинних ложах
(див. Розділ ЗО). Однак у скелетному м’язі та багатьох
інших органах лише вода т а порівняно невеликі розчинені
речовини легко проходять крізь стінку. Аперіури В СИНЦІ
(місця егику між клітинами ендотелію) занадто малі, щоб
пропускати білки плазми й інші колоїди в значних кіль-
костях. Невеликі кількос п проходят ь через с і піку капіляра
у разі трансцитозу (див. нижче), та їхній вилив незначний.
Відповідно, капілярна стінка поводить себе як мембрана,
непроникна для колоїдів, що чинит ь осмот ичний і иск при-
близно 25 мм рт. ст. Колоїдний осмотичний тиск, спричи-
нений колоїдами плазми, називають онкотичним. Фільтру-
вання через капілярну мембрану, що є результатом гідро-
статичного тиску в судинній системі, чинит ь опір онкотич-
ному тиску. Як саме рівновага між гідростатичним та онко-
тичним тиском контролює обмін через капілярну синку,
детально описано у Розділі ЗО.
Трансцитоз
У цитоплазмі клітин ендотелію містяться пухирці. В
пухирцях та інтерстиції виявлено введені в кровообіг моле-
кули шаченого білка. Це свідчить про те, що незначні кіль-
кості білка транспортує ендоцитоз, а за ним і екзоцитоз з
капілярів через клітини ендотелію на інтерстищйний бік
клітини. Цей механізм транспортування задіюс нокрин
оболонкою пухирці, його називають трансцитозом, пу-
хирцевим транспортуванням чи цигопемнсисом.
МІЖКЛІТИННИЙ ЗВ’ЯЗОК
Клітини контактують між собою за допомогою хімічних
месенджсрів. У межах конкретної тканини деякі месендже-
ри рухаються від клітини до клітини через щілинні кон-
такти (див. вище), не потрапляючи до ПКР. Окрім того, на
клітини впливають хімічні месенджери, сскреговані до
ПКР. Такі месенджери зв’язуються з білковими рецепто-
рами на поверхні клітини чи, в окремих випадках, у цито-
плазмі ядра, стимулюючи послідовність внутрішньоклітин-
них змін, що мають фізіологічну дію. Месенджери в ПКР
є посередниками трьох головних типів міжклітинних зв’яз-
ків, а саме: нервового зв’язку, за якого нервові клітини
вивільняють у синаптичних з’єднаннях нейротрансмітери,
що впливають через вузьку синаптичну щілину на постси-
наптичну клітину (див. Розділ 4); ендокринного зв’язку,
у разі якого гормони та фактори росту досягають клітин
завдяки кровообігу (див. Розділи 18-24); паракринної о
зв’язку, за якого продукти клітин дифундують у ПКР, впли-
ваючи на сусідні клітини, що можуть перебувати на деякій
відстані (рис. 1-34). Клітини також секрсгуюіь хімічні ме-
ЗАГАЛЬНІ ЗАСАДИ ТА КЛІТИННІ ОСНОВИ ФІЗІОЛОГІЇ ЛЮДИНИ / 33
ЩІЛИННІ З’ЄДНАННЯ СИНАПТИЧНІ /ДК ПАРАКРИННІ ТА АУТОКРИННІ ЕНДОКРИННІ
Передавання інформації Безпосередньо від клітини до клітини Через синаптичну щілину Шляхом дифузії в інтерстиційну рідину Через циркулювальні рідини тіла
Локальна чи загальна відповідь Локальна Локальна Локально дифузна Загальна
Специфічно залежить від Анатомічного розташування Анатомічного розта- шування і рецепторів Рецепторів Рецепторів
Рис. 1-34. Міжклітинний зв’язок за допомогою хімічних медіаторів
сспджери, що в окремих сиіуаціях зв’язуються з рецепто-
рами іиГ ж клпини, яка сскрсгувала месенджери (авто-
кринний зв’язок). До хімічних мссенджсрів належать
аміни, амнюкислої и, сіероїди, поліпептиди та інколи інші
речовини Зазначимо, що в різних частинах тіла цей же
хімічний месенджср може дія їй як нейро трансмітер, пара-
кринний посередник, юрмон, сскрстований нейронами в
кров (нейрої ормоп), і а юрмон, виділений клітинами зало-
зи в кров.
Додаїковою формою міжклітинною зв’язку є юкста-
кринний зв’язок. Деякі клпини позаклітинно експресу-
ють численні повюренпя факторів росту, зокрема транс-
формувального фактора росі у альфа (ТФРа) на транс-
мембранних білках, що забезпечують прикріплення до
клітини. Інші клпини маюіь ТФРос-рсцептори. Отже,
ТФРа, прикріплені до клііини, можуїь зв’язуватися з
ТФРа-рсцспіорами на іншій клітині, з’єднуючи дві клі-
тини. Цс може буїи важливим у разі сіворсння локальних
осередків росі у в і кани пах
Радіоімуноаналіз
Сьої одні вжссіворсш аніиила до поліпептидів і а біл-
ків, а спеціальні іехполоіії даюіь змоіу також створити
антипладо інших хімічних месснджерів. Антитіла можна
використовувати для вимірювання месснджерів у рідинах
організму і а в екстрактах тканин методом радіоімуноана-
лізу. Ця ісхпологія полягає в тому, що позначений ліганд і
доданий радіоактивний ліганд конкурують за зв’язування
заніиплом до ліганду. Чим більшу кількість переліченого
лпанду в зразку аналізуюі ь, і им більше він конкурує, і тим
менша кількісіь радюакіивною лпанду, що зв’язу( гься з
аіпиплом Меюд радюімупоапалізу широко застосовуюіь
у наукових дослідженнях іа клінічній медицині.
Рецептори для гормонів,
нейротрансмітерів та інші ліґанди
Багато рсцсіпорів для хімічних месснджерів уже виді-
лено та схарактеризовано. Ці білки не є постійними компо-
нентами клпини, їхня кількість збільшується та зменшу-
ється внаслідок рішоманпних подразників, а їхні власти-
4 367-2
вості змінюються відповідно до змін фізіологічних умов.
Коли гормон чи нейроірансмітер є в надлишку, то кількість
активних рецепторів, як звичайно, зменшується (регулю-
вання рецепторів пригніченням), у разі нестачі хімічних
месснджерів кількість активних рецепторів збільшується
(регулювання рецепторів посиленням). Анпотензин II
у дії на кіркову речовину наднирника є винятком: він
збільшує, а не зменшує кількість рецепторів у наднирнику.
Щодо рецепторів у мембрані, то рецепторно опосередко-
ваний ендоцитоз відповідає за негативне регулювання;
ліґанди зв’язуються зі своїми рецепторами і комплекси
ліґанд-рецептор рухаються латерально в мембрані до
заглибин, покритих оболонкою, де вони втягуються в клі-
тину під час ендоцитозу (інтерналізація). Це зменшує кіль-
кісіь рецепторів у мембрані. Деякі рецептори будуть
використані після штерналізації, тоді як інших заміняє де
поуо синтез у клітині. Ще одним типом негативного регу-
лювання є десенсибілізація, за якої рецептори хімічно мо-
дифікуються, що робить іх менш чутливими (див. Розділ 4).
Механізм дії хімічних месенджерів
Головні механізми внуїрішньоклітинної дії хімічних
месснджерів наведено в габл. І-8. Такі ліганди, як ацетил-
холін, зв’язуються безпосередньо з йонними каналами в
кліт инній мембрані, змінюючи їхню провідність. Тиреоїдні
та стероїдні гормони 1,25-дигідроксихолскальціферол та
ретиноїди потрапляють у клітини і діють на того чи іншого
прсдсіавника родини подібних за структурою цитоплаз-
матичних чи ядерних рецепторів. Активований рецептор
зв’язується з ДНК і підсилює транскрипцію вибраних
мРНК. Майже всі інші ліґанди в ПКР зв’язуються з рецеп-
торами на поверхні клітин і багато з них стимулює виді-
лення внутрішньоклітинних посередників, зокрема цАМФ,
ІФ3 та ДАГ (див. нижче), що ініціюють зміни в діяльності
клітини. З огляду на цс позаклітинні ліґанди називають пер-
винними мссенджерами, а внутрішньоклітинні посеред-
ники - вторинними месснджерами.
Вторинні месенджери призводять до багатьох коротко-
тривалих змін у діяльності клітини, змінюючи єн зимну
активність, стимулюючи екзоцитоз тощо, однак, окрім
34 / РОЗДІЛ 1
Таблиця 1-8. Головні механізми, за допомогою яких хімічні месенджери у ПКР спричинюють зміни клітинної функції
Механізм Приклади
Відкривають чи закривають йонні канали в клітинній мембрані Ацетилхолін на нікотиновому холінергічному рецепторі, норадреналін на К+-каналі в серці
Діють через цитоплазматичні чи ядерні рецептори, посилюючи транскрипцію вибраних м-РНК Тиреоїдні гормони, ретинова кислота, стероїдні гормони
Активують фосфоліпазу С поряд з внутрішньоклітинним виробленням ДАГ, ІФ3 та інших інозитфосфатів Ангіотензин II, норадреналін через о^-адренорецептор, вазопресин через Х^-рецептор
Активують чи інгібують аденілатциклазу, спричиняючи підвищення або зниження вироблення цАМФ Норадреналін через р-адренорецептор (збільшення цАМФ); норадреналін через а2-адренорецептор (зменшення цАМФ)
Збільшують цГМФ у клітині АНП, N0 (ФРЕ)
Підвищують тирозинкіназну активність цитоплазматичних ділянок трансмембранних рецепторів Інсулін, Е6Е, Р06Е, М-С8Е
того, вони перебудовують транскрипцію різних генів і
роблять це частково завдяки вже наявним у автивованій
клітині активації транскрипційним факторам. Ці фактори
спричиняють транскрипцію генів негайного типу (див. рис.
І -20). Фактори транскрипції, що є продуктами таких генів,
активують інші гени, що мають довготриваліші наслідки.
Після активування багато з мембранних рецепторів
зумовлюют ь виділення вторинних месенджерів, або ж інші
внутрішньоклітинні зміни через ГТФ-зв’язувальні білки
(6-білки, див. нижче). Вторинні месенджери переважно
активують протеїн кін ази - ензими, що каталізують фосфо-
рилювання тирозину або серину та треонінових залишків
у білках. Описано понад 300 протеїнкіназ. Деякі з них, що
мають важливе значення для ссавців, наведені в табл. І-9.
Додавання фосфатних груп змінює конфігурацію білків,
змінюючи їхні функції та, як наслідок, функції клітини. У
деяких випадках, наприклад у випадку з рецептором інсу-
ліну, внутрішньоклітинні ділянки рецепторів і є протеїн-
кіназами, інколи ж вони самі себе фосфорилюють (авто-
фосфорилювання). Інші рецептори, зокрема рецептори
ци гокіну, не є протеїнкіназами, однак спричиняють фосфо-
рилювання багатьох внутрішньоклітинних білків. Очевид-
но, важливими є також фосфатази, оскільки усунення
Таблиця 1-9. Головні протеінкінази
Фосфорилюють серинові та/або треонінові залишки
Кальмодулінозалежні
Міозин легколанцюгова кіназа
Кіназа фосфорилази
Са2+/кальмодулін кіназа І
Са2+/кальмодулін кіназа II
Са27кальмодулін кіназа III
Кальцій-фосфоліпідозалежні
Протеїнкіназа С (сім підвидів)
Циклічні нуклеотидозалежні
цАМФ-залежна кіназа (протеїнкіназа А; два підвиди)
цГМФ-залежна кіназа
Фосфорилюють тирозинові залишки
Інсулін-рецептор, ЕСЕ-рецептор, РО6Е-рецептор та
М-С8Е-рецептор мають активність тирозинкінази
фосфатних груп дезактивує чи активує низку транспортних
білків чи ензимів.
Стимулювання транскрипції
Коли тиреоїдні та стероїдні гормони, 1,25-дигідрокси-
холекальциферол та ретиноїди зв’язуються зі своїми рецеп-
торами всередині клітини, то змінюється конформація
рецепторного білка, а ДНК-зв’язувальний домен експону-
ється (рис. І-35). Комплекс рецептор-гормон рухається до
ДНК, де він зв’язується з підсилювальними елементами в
нетрансльованих 5"-ділянках певних генів. Естроген та
трийодотиронін (Т3) зв’язуються з рецепторами в ядрі; Т3-
рецептори також зв’язуються з тироксином (Т4), однак
менш інтенсивно. Глюкокортикоїдний рецептор розташо-
ваний переважно в цитоплазмі, однак, як тільки він зв’я-
зується зі своїм лігандом, то мігрує прямо до ядра. Почат-
кове розташування інших рецепторів, що діють подібно,
не з’ясоване. В будь-якому випадку зв’язування комплексу
рецептор-гормон з ДНК підсилює транскрипцію мРНК,
Рис. 1-35. Механізм дії стероїдних та тиреоїдних гормонів Г
- гормон, Р - рецептор
ЗАГАЛЬНІ ЗАСАДИ ТА КЛІТИННІ ОСНОВИ ФІЗІОЛОГІЇ ЛЮДИНИ / 35
кодованих геном, з яким він зв’язується. В рибосомах
транслюються мРНК, продукуючи підвищену кількість
білків, що змінюють клітинну функцію.
У випадку, якщо нема стероїда, рецептор зв’язується з
білком теплового шоку Н§р90 та іншими білками, які
покривають домен, що зв’язує ДНК. Під час взаємодії
стероїда з рецептором розривається його конформація, від-
ривається білок теплового шоку, який буде міститися на
ДНК-зв’язувальному домені.
Білки теплового шоку є групою внутрішньоклітинних
білків, кількість яких збільшується у разі теплового впливу
на клітину та інших стресів. Вони допомагають клітинам
виживати у випадках різноманітних стресів. Тому правиль-
ніше було б називати їх стресорними білками.
Структура рецепторів
Структура глюко- та мінералокортикоїдних рецепторів
людини зображена на рис. 1-36. Було ідентифіковано два
естроген-рецептори (ос та (3) та два Т3-рецептори (а та (3);
ос-естроген-рецептор та Р-Т3-рецептор зображено на рис.
1-36. Усі ці рецептори є частиною великої родини рецеп-
торів, що мають спільний висококонсервативний, багатий
на цистеїн ДНК-зв’язувальний домен; ліганд-зв’язувальний
домен на або біля кінцевої карбоксильної групи рецептора
та порівняно змінну, низькоконсервативну ділянку кінцевої
аміногрупи. Зв’язування з ДНК відбувається через цинк-
вмісні пальці (див. вище). До інших рецепторів цієї родини
належать рецептори прогестерону, андрогена та 1,25-дигід-
роксихолекальциферолу. Багато інших факторів, що регу-
люють гени, діють через рецептори цього типу в різнома-
нітних біологічних видах від фруктової мушки до людини.
Сьогодні описано понад 70 представників суперродини
рецепторів. Тепер відомо ліганди близько половини цих
рецепторів, а решту становлять орфанові рецептори, ліган-
ДНК Ліґанд
Суз| Кортізол
1 421 486 528 777
4
602 670 734 984
Альдостерон
Рис. 1-36. Будова людського глюкокортикоїдного, мінерало-
кортикоїдного, «-естрогенного та р-Т3-рецепторів Зверніть
увагу на те, що кожен рецептор має багатий на цистеїн ДНК-
та ліґандозв’язувальний домен на/або біля кінцевої карбо-
ксильної групи та надзвичайно змінну кінцеву аміногрупу біл-
ка. Цифрами позначено амінокислотні залишки.
ди яких не ідентифіковані. Ретинова кислота - похідна від
ретинолу (вітаміну А) - відіграє екстенсивну роль у роз-
витку плоду. Є три рецептори ретинової кислоти - а, р і у,
кодовані двома родинами рецепторів ретинової кислоти -
КАК та кхк, кожна з яких має а-, р- і у-форми. Рецептори
Т3 утворюють гомодимери перед тим, як зв’язуватися з
ДНК; гетеродимери з ретиновими рецепторами також фор-
мують і зв’язують їхню діяльність, отже, ця діяльність є
досить складною (див. Розділ 18).
Швидка дія стероїдів
Деякі дії стероїдів набагато швидші, ніж ті, що опосе-
редковані шляхом зв’язування з ДНК. Як приклад, можна
навести швидке збільшення концентрації Са2+ в головках
сперматозоїдів, зумовлене прогестероном, та швидку сте-
роїдно-зумовлену зміну у функціях багатьох нейронів. Це
привело до гіпотези, що стероїди можуть також зв’язува-
тися з рецепторами мембрани і діяти через негеномні меха-
нізми. Є певні докази існування таких рецепторів. Стероїди
також зв’язуються з ГАМКд-рецепторами, активізуючи
їхню діяльність (див. Розділ 4).
Внутрішньоклітинний Са2*
Катіон Са2' регулює надзвичайно велику кількість різ-
номанітних фізіологічних процесів, зокрема проліферацію,
нейрональне передавання сигналів, запам’ятовування, ско-
рочення, секрецію та запліднення. Отже, Са2' відіграє над-
звичайно важливу роль. Концентрація вільного Са2' підтри-
мується на рівні приблизно 100 нмоль/л; у міжклітинній
рідині вона приблизно у 12 000 разів вища від концентрації
в цитоплазмі, тобто становить 1 200 000 нмоль/л, тому кон-
центраційний та електричний градієнти мають чітке внут-
рішнє спрямування. Значна частина внутрішньоклітинного
Са2+ зв’язана ендоплазматичною сіткою та іншими органе-
лами (рис. 1-37), що забезпечують пул, з якого Са2+ може
вивільнюватися, збільшуючи концентрацію вільного Са2
у цитоплазмі. Завдяки підвищенню вмісту цитоплазма-
тичний Са2' зв’язується з кальційзв’язувальними білками,
активуючи їх, а ті, відповідно, активують низку протеїн-
кіназ.
У клітину Са2+ потрапляє через різноманітні канали.
Серед них - канали з потенціалозалежними воротами та
лігандні ворота. Потенціалозалежні ворота Са2'-каналів,
яких налічується щонайменше чотири види, активуються
деполяризацією, натомість лігандні ворота Са2' каналів
активовані багатьма різними нейротрансмітерами та гор-
монами. Окрім того, є Са2'-канали, активовані розтягуван-
ням.
Потенціалозалежні ворота Са2'-каналів часто поділяють
на Т- (від англ. ігапзіепі - короткотривалі) або Б- (від англ.
1оп£-1а8Іп£ - довготривалі) типи, які залежать від трива-
лості активації під час деполяризації. Підтипи таких кана-
лів теж описані, однак їхню появу пояснюють альтерна-
тивним сплайсингом мРНК і комбінацією субодиниць.
Нон Са2+ випомповується з клітини в обмін на два Н за
допомогою Са2+-Н+-АТФ-ази, його транспортує з клітин
антипорт, якого приводить у рух N а -градієнт, що виконує
обмін трьох На' на кожен Са2'.
Багато вторинних месенджерів підвищують цитоплаз-
матичну концентрацію Са2+ шляхом вивільнення Са2 з
36 / РОЗДІЛ 1
внутрішньоклітинних пулів, передусім з ендоплазматичної
сітки, або шляхом підвищення рівня Са2+, що потрапляє в
клітину, або ж шляхом дії обох механізмів. ІФ3 є основним
вторинним месенджером, що спричиняє вивільнення Са24
з ендоплазматичної сітки. Окрім того, може бути задіяна
циклічна аденозиндифосфатрибоза (цАДФР) - метабо-
літ НАД4, що діє на ріанодин-рецептори (див. Розділ 3). У
багатьох тканинах швидкий витік Са2+ з внутрішніх пулів
у цитоплазму спричиняє відкривання Са24-каналів та при-
плив Са2 (пул-керований приплив Са2+). Це робить мож-
ливим триваліші реакції та допомагає відновити внутріш-
ньоклітинні пули.
Зазначимо, що реакції на незначне збільшення цито-
плазматичного Са2 можуть відрізнятися від реакцій на
значне його збільшення. Це важливо, оскільки в багатьох
випадках вивільнення з пулу в одній частині клітини спри-
чиняє високу локальну концентрацію Са2+ з подальшим
поширенням в інші частини, зумовлюючи дифузну, однак
нижчу концентрацію. Крім того, цитоплазматична концент-
рація Са2' часто коливається в межах норми, а гормони та
інші позаклітинні месенджери переважно можуть зміню-
вати частоту, а не амплітуду цих коливань.
Кальційзв’язувальні білки
Описано багато різних Са2 -зв’язувальних білків, у тому
числі тропонін, кальмодулін та кальбіндін. Тропонін
задіяний у скороченні скелетного м’яза (див. Розділ 3).
Кальмодулін містить 148 амінокислотних залишків (рис.
1-38) і має чотири Са2^-зв’язувальні домени. Він унікаль-
ний, оскільки 115-й залишок є триметильований і надзви-
чайно консервативний; наявний він як у рослинних, так і в
тваринних білках. Коли кальмодулін зв’язується з Са2+, він
здатний активувати п’ять різних кальмодулінозалежних
С» СзЗЬ ....Е.фекіи
О/гНВ..-....
\\ АТФ
2Н*
Са2+
ЗИа1
Са2+
Мітбхбндрія •Ендопіа^
Рис. 1-37. Метаболізм Са2+ у клітинах ссавців Цитоплазма-
тичний Са перебуває в стані рівноваги з Са2+, що зв’язаний
з мітохондрією та ендоплазматичною сіткою Кальційзв’я-
зувальні білки (СаЗБ) зв’язують Са2+ і, активовані у такий
спосіб, спричиняють різноманітні фізіологічні ефекти Са2+ по-
трапляє до клітини через потенціалозалежні (уоіі) “ворота”
та пов’язані з ліґандом (Іід) Са2+-канали 3 клітини Са2+ виво-
дить Са2+-Н*-АТФ-аза та №+-Са2+-антипорт.
Рис. 1-38. Будова кальмодуліна в мозку бика Одною літерою
позначено амінокислотні залишки (табл. 17-2) Зверніть увагу
на чотири домени кальцію (забарвлені залишки), оточені з
кожного боку ділянками а-спіралі (відтворено за дозволом з
СГіеипд \Л/¥: Саїтобиііп. Ап оуєп/ієулл ЕесІ Ргос 1982,41:2253)
кіназ (див. табл. 1 -9). Одна з них - міозин лег коланцюгова
кіназа, що фосфорилює міозин; а це спричиняє скорочення
гладкого м’яза. Інша - кіназа фосфорилази, що активує
фосфорилазу (див. Розділ 17). Крім того, Са27кальмодулін
кінази І та II задіяні в синаптичній функції, а Са27кальмо-
дулін кіназа III - у синтезі білка. Ще одним кальмодулін-
активованим білком є кальциневрин - фосфатаза, що дез-
активує Са2-канали шляхом їхнього фосфорилювання.
Вона також бере участь у активації Т-клітин та інгібується
деякими імуносупресорами (див. Розділ 27).
С-білки
Як звичайно, трансляція сигналу на біологічну реакцію
всередині клітини відбувається за допомогою нуклеотидо-
регуляторних білків (С-білків), що зв’язуються з ГТФ.
ГТФ є гуанозиновим аналогом АТФ (див. Розділ 17). Коли
сигнал досягає С-білка, то білок обмінює ГДФ на ГТФ.
Комплекс ГТФ -білок зумовлює реакцію. Спадкова ГТФ-
азна активність білка конвертує ГТФ на ГДФ, відновлюючи
стан спокою. ГТФ-азну активність посилюють Г ТФ-аз-ак-
тивовані білки (ГАБ) (регулятори передавання сигналів 6-
білків).
Малі С-білки задіяні в багатьох клітинних функціях.
Представники КаЬ родини цих білків регулюють інтенсив-
ність транспортування пухирців між ендоплазматичною
сіткою, апаратом І ольджі, лгзосомами, сндосомами та клі-
тинною мембраною (див. вище). Інша родина малих ГТФ-
зв’язувальних білків - КГю/Кас - опосередковує взаємодії
між цитоскелетом та клітинною мембраною, а ще інша -
ЗАГАЛЬНІ ЗАСАДИ ТА КЛІТИННІ ОСНОВИ ФІЗІОЛОГІЇ ЛЮДИНИ / 37
Кав - регулює ріст, переносячи сигнали з клітинної мембра-
ни до ядра. Представники цих трьох родин пов’язані з про-
дуктом газ протоонкогена.
Ще одна родина 6-білків - великі гетеротримерні 6-
білки - зшивають рецептори поверхні клітини в каталі-
тичні одиниці, що каталізують внутрішньоклітинне утво-
рення вторинних месенджерів або ж скріплюють рецеп-
тори безпосередньо в йонні канали. Ці 6-білки складають-
ся з трьох субодиниць - ос, р і у (рис. 1-39). Субодиниця а
зв’язана з ГДФ. Коли ліганд зв’язується з 6-зшитим рецеп-
тором, то цей ГДФ обмінюється на ГТФ, а ос-субодиниця
відділяється від з’єднаних р- і у-субодиниць. Відділена ос-
субодиниця чинить багато біологічних впливів. Субодиниці
Р і у не роз’єднуються одна від одної і ру активує багато
різноманітних ефекторів. Внутрішня ГТФ активність ос-
субодиниці конвертує ГТФ на ГДФ, що призводить до з’єд-
нання а- з ру-субодиницею та завершення активування
ефекторів.
Гетеротримерні 6-білки затримують сигнали з понад
1 000 рецепторів, а їхніми ефекторами в клітині є йонні
канали й ензими. Приклади наведені в табл. 1-10. Щонай-
менше 16 різних ос-субодиниць, 6 різних р-субодиниць та
12 різних у-субодиниць можуть з’єднуватися, утворюючи
численні комбінації. Відповідно до дії на ефектор та спорід-
нених характеристик, їх поділяють на п’ять родин: 6, 6,
6,6 та 6...
І’ ч в
Багато 6-білків унаслідок прикріплення до них специ-
фічних ліпідів модифікуються, тобто стають ліпідованими
(див. рис. 1-6). Тримерні 6-білки можуть бути міристольо-
вані, пальмітильовані чи пренильовані, а малі 6-білки -
лише пренильовані.
Нуклеотидний
обмін
_ . Вихід
Вхід -----► ГДФ ГТФ---------►
ГТФ-азна
активність
Рис. 1-39. Гетеродимерні 6-білки. Вгорі: сумарний огляд
повної реакції Внизу: коли ліґанд (квадрат) зв’язується зі
серпентиновим рецептором у клітинній мембрані. ГТФ заміняє
ГДФ на а-субодиниці. ГТФ-а від’єднується від ру-субодиниці,
і ГТФ-а та ру активують різноманітні ефектори, чинячи
фізіологічні впливи Далі внутрішня ГТФ-азна активність ГТФ-
а конвертує ГТФ у ГДФ, а а-, р- і у-субодиниці з’єднуються.
Таблиця 1-10. Головні ліґанди для рецепторів, з’єднаних з
6-білками
Клас Ліґанд
Нейротрансмітери Адреналін Норадреналін Дофамін 5-Гідрокситриптамін Гістамін Ацетилхолін Аденозин Опіоїди
Тахікініни Речовина Р Нейрокінін А Нейропептид К
Інші пептиди Ангіотензин II Аргінін вазопресин Окситоцин ВІП, СТР-РГ, ТРГ, ПТГ
Глікопротеїнові гормони ТСГ, ФСГ, ЛГ, ХГл
Похідні арахідонічної кислоти Тромбоксан А2
Інші Одоранти Тастанти Ендотеліни Фактор активування тромбоцитів Канабіноїди Світло
Серпентинові рецептори
Усі гетеродимерні зшиті 6-білком рецептори є білками,
що оточують клітинну мембрану сім разів (серпентинові
рецептори). Ці рецептори можуть бути пальмітильовані.
Надзвичайно велику кількість їх було клоновано, а їхні
функції є численними та різноманітними. Структуру двох
з них зображено на рис. 1 -40. Переважно малі ліґанди зв’я-
зуються з амінокислотними залишками в мембрані, тоді
як великі поліпептидні та білкові ліґанди зв’язуються з
позаклітинними доменами, що є більшими і ліпше роз-
виненими в рецепторах для поліпептидів та білків. Це, як
звичайно, амінокислотні залишки в третій цитоплазма-
тичній петлі, що є найближчою до кінцевої карбоксильної
групи і взаємодіє з 6-білками.
Інозитолтрифосфат та діацилгліцерол як
вторинні месенджери
Контакт між мембранним з’єднанням ліганду, що діє
через Са2+, та швидким збільшенням цитоплазматичної
концентрації Са2+ часто забезпечує інозитолтрифосфат
(інозитол 1,4,5-трифосфат, ІФ3). Коли один з цих лігандів
зв’язується зі своїм рецептором, то активування рецептора
спричиняє активування фосфоліпази С на внутрішній
поверхні мембрани через 6ч~білок. Сьогодні визначено
вісім ізоформ фосфоліпази С (ФЛС), а ФЛСр^ та ФЛСре-
форми активовані 6-білками. Вони каталізують гідроліз
фосфатидилінозиту 4,5-дифосфату (ФІФ2), утворюючи ІФ3
та діацилгліцерол (ДАГ) (рис. 1-41). З’єднані з тирозин-
кіназою рецептори (див. нижче) можуть також продукувати
1Ф3 та ДАГ шляхом активування ФЛСрґ ІФ3 дифундує в
38 / РОЗДІЛ 1
ОПж
Рис. 1-40. Структура р2-адренорецептора та родопсину. Окремі амінокислотні залишки позначені однолітерними кодами, а
забарвлені в темний колір є сайтами фосфорилювання. ¥-подібними символами на N залишках позначено сайти глікозилювання.
Зверніть увагу на позаклітинну кінцеву аміногрупу, позаклітинну карбоксильну групу та забарвлені ясним кольором сім ділянок
кожного білка, що охоплюють мембрану (відтворено за дозволом з Маіиге 1986;321:869. МастіІІап Мадагіпез, 1986).
Рис. 1-41. Метаболізм фосфатидилінозиту в клітинних мембранах. Фосфатидилінозит фосфорилює, утворюючи фосфатиди-
лінозит 4-фосфат (ФІФ), а далі - фосфатидилінозит 4,5-дифосфат (ФІФ2). Фосфоліпаза Ср1 та р2 каталізує розпад ФІФ2 на
інозит 1,4,5-трифосфат (ІФ3) та діацилгліцерол. Також можуть утворюватися інші інозитфосфати та фосфатидилінозитпохідні.
ІФ3 дефосфорилює до інозиту, а діацилгліцерол метаболізує до цитозиндифосфат (ЦДФ) діацилгліцеролу. Далі ЦДФ-діацил-
гліцерол та інозит з’єднуються, утворюючи фосфатидилінозит, і цикл завершується (модифіковано з Веггсіде М4: ІпозіїоІ
ігірїіозрїіаіе апсі біасуїдіусегої аз зесопсі теззепдегз. Віосїіет 4 1984;220:345).
ЗАГАЛЬНІ ЗАСАДИ ТА КЛІТИННІ ОСНОВИ ФІЗІОЛОГІЇ ЛЮДИНИ / 39
ІНпН
|||||||||||ІІ^
Рис. 1-42. Схематичне зображення виділення інозитолтри-
фосфату (ІФ3) та діацилгліцеролу (ДАГ) як вторинних
месенджерів. Зв’язування ліґанду зі з’єднаним з 6-білком
рецептором активує фосфоліпазу С (ФЛС) р1 чи р2. Активу-
вання рецепторів внутрішньоклітинними доменами тирозин-
кінази може активувати ФЛС уг Унаслідок цього гідроліз ФІФ2
продукує ІФ3, що вивільнює Са2+ з ендоплазматичної сітки
(ЕС) та ДАГ, що активує протеїнкіназу С (ПКС). СаЗБ - Са2+-
зв’язувальні білки, ІСР - інтерстиційна рідина.
ендоплазматичну сітку, де спричиняє вивільнення Са2+ в
цитоплазму (рис. 1-42). ІФ3-рецептор подібний до ріано-
дин-рецептора, що є Са2+-каналом у саркоплазматичній
сітці скелетного м’яза (див. Розділ 3), лише з тією різницею,
що ІФ3-рецептор удвічі більший. ДАГ також є вторинним
месенджером; він залишається в клітинній мембрані, де
активує один з семи підвидів протеїнкінази С (див. табл.
1-9). Приклади лігандів, що діють через ці вторинні месен-
джери, наведено в табл. 1-8.
Попередником ФІФ2 є фосфатидилінозитол (див. рис.
1-41). Цей фосфоліпід міститься в порівняно невеликих
кількостях у внутрішній пластинці клітинної мембрани.
Спочатку він конвертується у фосфатидил-4-фосфат (ФІФ),
а пізніше у ФІФ2-похідний, що гідролізується, утворюючи
ІФ3 та ДАГ. Інші інозитолфосфати також формуються в
клітинах, однак їхні функції точно нез’ясовані. ІФ3 мета-
болізується шляхом послідовних кроків дефосфорилю-
вання до інозитолу. ДАГ конвертується у фосфатидну
кислоту, а далі - у цитозиндифосфат (ЦДФ) діацилгліцерол,
який з’єднується з інозитолом, утворюючи фосфатидил
інозитол і завершує цикл.
Циклічний АМФ
Вторинним месенджером є також циклічний АМФ
(цАМФ) (рис. 1-43). Деякі з багатьох лігандів, що діють
через це з’єднання, наведені в табл. 1-8. Циклічний АМФ
є циклічним аденозин-3',5'-монофосфатом. Він утворю-
ється від АТФ унаслідок дії ензиму аденілатциклази і кон-
вертується в неактивний 5 -АМФ унаслідок дії ензиму фос-
фодіестерази. Циклічний АМФ активує циклічну нукле-
отидозалежну протеїнкіназу (протеїнкіназу А), що, як і про-
теїнкіназа С, каталізує фосфорилювання білків, змінюючи
їхню конформацію та активність. Типовим прикладом є
активування кінази фосфорилази в печінці адреналіном
через цАМФ та протеїнкіназу А (див. рис. 17-13). Окрім
цього, активна каталічна субодиниця РКА рухається до
ядра і фосфорилює цАМФ-чутливий елементозв’язу-
вальний білок (СКЕВ - від англ. сАМР-гезропзіуе еіе-
тепГЬіпс1іп£ ргоіеіп). Цей фактор транскрипції надалі зв’я-
зується з ДНК і змінює транскрипцію низки генів.
Циклічний АМФ метаболізує фосфодіестераза. Цю
фосфодіестеразу інгібують метилксантини, зокрема ко-
феїн та теофілін, унаслідок чого такі з’єднання посилю-
ють впливи гормонів та трансмітерів, опосередковані че-
рез цАМФ.
Активування аденілатциклази
У механізмі, за допомогою якого ліганди спричиняють
зміни у внутрішньоклітинній концентрації цАМФ, задіяно
п’ять компонентів: каталітичну одиницю - аденілатцик-
лазу, що каталізує конверсію АТФ у цАМФ; стимулювальні
та інгібувальні рецептори; а також стимулювальні та інгі-
бувальні 6-білки, що з’єднують рецептор з каталітичною
одиницею (рис. 1-44). Як і рецептори, аденілатциклаза є
трансмембранним білком, що перетинає мембрану 12 разів.
Описано вісім ізоформ цього ензиму, а їхнє поєднання з
багатьма різними формами О-білків дає змогу пристосо-
вувати цАМФ шляхи до специфічних потреб тканини. Коли
відповідний ліганд зв’язується зі стимулювальним рецеп-
тором, 6ч-а-субодиниця активує одну з аденілатциклаз. І
навпаки, коли відповідний ліганд зв’язується з інгібуваль-
ним рецептором, то О^а-субодиниця інгібує аденілатцик-
О
II
н Н О=Р-О’
цАМФ
О
II
І І
О О
н н
Аденозинтрифосфат
(АТФ)
5’-аденозинмонофосфат
(5’-АМФ)
Рис. 1-43. Утворення та метаболізм цАМФ. АЦ - аденілатциклаза; ФД - фосфодіестераза.
40 / РОЗДІЛ 1
Протече рь'мз А
Ачюфоїцхшчни
Фізіологічні впливи
Рис. 1-44. Система цАМФ. Активування аденілатциклази ката-
лізує конверсію АТФ у цАМФ. Циклічний АМФ активує протеїн-
кіназу А, що фосфорилює білки, спричиняючи фізіологічні
ефекти. Стимульовані ліґанди зв’язуються зі стимульованими
рецепторами й активують аденілатциклазу через С5. Інгі-
бувальні ліґанди інгібують аденілатциклазу через інгібуваль-
ні рецептори, ІСР - інтерстиційна рідина.
лазу. Рецептори є специфічними і відповідають лише одно-
му або групі споріднених лігандів. Незважаючи на це, гете-
родимерні 6-білки опосередковують стимулятивні та інгі-
бувальні ефекти, створювані багатьма різними лігандами.
Окрім цього, є взаємозв’язок між системою фосфоліпази
С та системою аденілатциклази, а кілька ізоформ аденілат-
циклази стимульовані кальмодуліном. Нарешті, впливи
протеїнкінази А та протеїнкінази С значно поширені. Як
же, враховуючи таку складність, досягаються специфічні
реакції на специфічні стимули? Відповідь полягає в при-
в’язуванні 6-білків, аденілатциклази та протеїнкінази до
цитоскелета таким способом, що утворюються локальні
мікродомени. Деякі з цих прив’язувань виконують ліпідні
продукти (див. рис. І -6).
Частина циклічного АМФ покидає клітину внаслідок
стимулювання певних гормонів, однак ці кількості малі
порівняно з внутрішньоклітинною концентрацією, і лише
незначні кількості позаклітинного цАМФ потрапляють у
клітини.
Важливий вплив на аденілатциклазу мають два бакте-
ріальні токсини, опосередковані 6-білками. Субодиниця
А токсину холери каталізує обмін АДФ-рибози на аргіні-
новий залишок у середині а-субодиниці 6 . Це інгібує її
ГТФ-азну активність, спричиняючи продовжене стиму-
лювання аденілатциклази (див. Розділ 25). Токсин коклю-
шу каталізує АДФ-рибозилювання цистеїнового залишку
біля кінцевої карбоксильної групи а-субодиниці 6Ґ Це
інгібує функцію 6.
Крім того, що ці зміни призводять до захворювання,
обидва токсини використовують у фундаментальних до-
слідженнях функції 6-білка. Лікарський засіб форсколін
стимулює активність аденілатциклази шляхом прямої дії
на ензим.
Гуанілатциклаза
Іншим циклічним фізіологічно важливим нуклеотидом є
циклічний гуанозинмонофосфат (циклічний ГМФ,
цГМФ). Циклічний ГМФ є важливим для зору. Світло діє на
родопсин, що міститься в паличках, фоторецепторних клі-
тинах сітківки. Родопсин зв’язаний з фосфодіестеразою за
допомогою 6(|, і активування фосфодіестерази пришвидшує
конверсію цГМФ у 5'-ГМФ (див. Розділ 8). Подібний про-
цес відбувається в колбочках. Окрім цього, € цГМФ- ре-
гульовані йонні канали, і цГМФ активує цГМФ-залежну кі-
назу (див. табл. І -9), спричиняючи низку фізіологічних впли-
вів.
Гуанілатциклази є родиною ензимів, що каталізують
утворення цГМФ. Вони бувають у двох формах (рис. I-
45). Одна форма має позаклітинний кінцевий амінодомен,
що є рецептором, простий трансмембранний домен та
цитоплазматичну кінцеву карбоксильну групу, у якій міс-
титься тирозинкіназоподібний та циклічний домени гуані-
латциклази. Схарактеризовано три такі гаунілатциклази.
Дві є рецептором для АНП (АНП-А та АНП-В; див. Розділ
24), а третя зв’язує ентеротоксин кишкової палички та
шлунково-кишковий поліпептид гуанілін (див. Розділ 26).
Інша форма гуанілатциклази розчинна, містить гем і є
повністю внутрішньоклітинною. Є кілька ізоформ внут-
рішньоклітинного ензиму. їх активує оксид азоту (N0) та
сполуки, що містять N0. Оксид азоту є фактором релаксації
ендотелію (ФРЕ) та міжклітинним месенджсром. Він утво-
рений він від аргініну, що відіграє важливу роль у регулю-
ванні діаметра кровоносних судин (див. Розділ 31). Також
N0 задіяний у багатьох інших функціях, у тому числі
ерекції статевого члена (див. Розділ 23) та синаптичному
передаванні в мозку (див. Розділ 4). Нещодавно отримані
дані свідчать про те, що, крім ефектів, опосередкованих
цГМФ, N0 також може, діяти прямо на них, активуючи
Са2+-залежні К -канали.
Фосфатази
У клітині містяться численні фосфатази, що виводять
фосфатні групи з білків. Часто вони близько споріднені з/
або спаровані з тирозинкіназами і серинтреоніновими кіна-
зами. Два представники цієї групи показані на рис. 1-45.
Фактори росту
Фактори росту стають щораз важливішими в багатьох
різних аспектах фізіології. Вони є поліпептидами та біл-
ками, що розділені на три групи. До першої групи належать
агенти, що сприяють збільшенню чи розвитку різних типів
клітин: фактор росту нервів (див. Розділ 2), інсуліноподіб-
ний фактор росту І (ІФР-І; див. Розділ 22), активіни та
інгібіни (див. Розділ 23), фактор росту епідермісу (Е6Е -
від англ. ерідегтаї §гоМЬ Расіог). Усього описано понад
20 представників цієї групи. Другу групу утворюють
цитокіни. Ці фактори створені макрофагами та лімфоци-
тами, вони важливі в регулюванні імунної системи (див.
Розділ 27). їх також описано понад 20. Третя група скла-
дається з колонієстимулювальних факторів, що регулюють
проліферацію та дозрівання червоних і білих кров’яних
тілець. Ця група також описана в Розділі 27.
Рецептори для Е6Е, фактори росту тромбоциту (РО6Е
- від англ. ріаіеіеі-сіегіуєсі §гоМй Еасіог) та багатьох інших
ЗАГАЛЬНІ ЗАСАДИ ТА КЛІТИННІ ОСНОВИ ФІЗІОЛОГІЇ ЛЮДИНИ / 41
факторів, що сприяють росту та збільшенню клітин, мають
єдиний домен, що охоплює мембрану з внутрішньоклітин-
ним доменом тирозинкінази (див. рис. 1-45). Коли ліганд
зв’язується з рецептором, то домен тирозинкінази автофос-
форилюється. Деякі з рецепторів у разі зв’язування з ліган-
дами димеризуються, а домени внутрішньоклітинної тиро-
зинкінази перехресно фосфорилюють один одного. Один
зі шляхів, активований фосфорилюванням, веде через
продукт гах протоонкогена та кілька МАР-кіназ, прямо до
утворення в ядрі факторів транскрипції, що змінюють екс-
пресію гена. Цей важливий прямий шлях від поверхні
клітини до ядра схематично зображено на рис. 1- 46.
Зверніть увагу нате, що Кав є одним з малих О-білків, який
для активування потребує зв’язування з ГТФ.
Рецептори для цитокінів та колонієстимулювальних
факторів відрізняються від інших факторів росту тим, що
більшість з них не мають доменів тирозинкінази у своїх
цитоплазматичних ділянках, а інші мають маленький або
зовсім не мають кінцевого цитоплазматичного сегмента.
Однак вони ініціюють активність тирозинкінази в цито-
плазмі. У деяких випадках це спричиняє зв’язування з
асоційованим мембранним білком §р 130 (див. Розділ 27).
Рецептори для цитокінів, зокрема, активують так звані
Янус-тирозинкінази (ЛАК - від англ. Дапиз іугозіпе кіпазез)
в цитоплазмі (див. рис. 1-47), які, відповідно, фосфори-
люють сигнальний трансдуктор та активатор білків
транскрипції (8ТАТ - від англ. 8І§па1 ігапзсіисег апсі асііуа-
іог о£ ігапзсгірбоп). Фосфорильовані 8ТАТ утворюють
гомо- та гетеродимери і рухаються до ядра, де діють як
Рис. 1-45. Схематичне зображення гуанілатциклаз, тирозин-
кіназ та тирозинфосфатаз. АНП - атріальний натрійуретичний
пептид; Ц - цитоплазма; сус - домен циклази; ФРЕ - фактор
росту епідермісу; ІСР - інтерстиційна рідина; М - клітинна
мембрана; РОСЕ - фактор росту тромбоциту; ДТК - домен
тирозинкінази; ДТФ - домен тирозинфосфатази; ЕКП - енте-
ротоксин кишкової палички (модифіковано та відтворено за
дозволом з Коезііпд О, Воїіте Е, ЗсґіиИг С: Сиапуіуп Сус-
Іазез, а дгохл/іпд їатіїу оїзідпаї ігапзсіисіпд епгутез. ЕА8ЕВ З
1991;5'2785).
фактори транскрипції. Сьогодні у ссавців відомо чотири
1АК та сім 8ТАТ. Шлях 1АК-8ТАТ - ще один важливий
прямий шлях з клітинної поверхні до ядра. Однак зазна-
чимо, що Кав та ІАК-8ТАТ шляхи дуже складні, між ними
та шляхами фосфоліпази С і цАМФ є взаємозв’язок.
Рецептори іншої родини зв’язують трансформувальний
фактор росту р (ТФРр) та споріднені поліпептиди. Ці ре-
цептори мають активність серинтреонінкінази, а їхні впли-
ви опосередковані 8МАВ - внутрішньоклітинними білка-
ми, які після фосфорилювання рухаються до ядра, зв’язу-
ються з ДНК і разом з іншими білками ініціюють транс-
крипцію різних генів.
І нарешті, як зазначено вище, інтегрини також ініціюють
фосфорилювання білків, що потрапляють до ядра і змі-
нюють генну транскрипцію.
Захворювання, пов’язані з рецепторами
та 6-білком
Щораз більшу кількість хвороб спричиняють мутації
генів, які відповідають за рецептори. Наприклад, рецеп-
торні мутації “втрати функції рецептора”, що спричиняють
Рис. 1-46. Один з прямих шляхів, через який фактори росту
змінюють генну активність. ТК - домен тирозинкінази; СгЬ2 -
активатор контролер Раз; 8оз-активатор Раз; Раз-продукт
газ гена; МАРК - мітогенактивована протеїнкіназа; МАРКК -
МАР кіназа; ТЕ - фактор транскрипції. Є взаємовплив між
цим шляхом та шляхом цАМФ, а також взаємозв’язок з ІФ3-
ДАГ шляхом.
42 / РОЗДІЛ 1
хворобу, було виявлено в 1,25-дигідроксихолекальциферол-
рецептора (див. Розділ 21), інсулін-рецептора (див. Розділ
19). Певні захворювання спричинює продукування антитіл
проти рецепторів. Зокрема, антитіла проти ТСГ-рецепторів
зумовлюють хворобу Ґрейва (див. Розділ 18), тоді як анти-
тіла проти нікотинових ацетилхолінових рецепторів - важ-
ку міастенію (див. Розділ 44).
Мутовані рецептори можуть як набувати, так і втрачати
функцію. Це відображено в табл. 1-11, де перелічено хво-
роби, спричинені змінами у зшитих з 6-білками рецепто-
рах, та хвороби, зумовлені змінами у субодиницях 6-білків.
Прикладом втрати функції рецептора є нефрогенний не-
цукровий діабет, що виникає внаслідок втрати здатності
У2-вазопресинового рецептора опосередковувати концент-
рацію сечі (див. Розділи 14 та 38). 1 навпаки, мутація набут-
тя функції в Са2+-рецептора (див. Розділ 21) призводить до
надмірного пригнічення паратиреоїдного гормону і зумов-
лює родинну гіперкальційуричну гіпокальціємію.
Мутаціям втрати чи набуття функції, що спричиняють
хворобу, також можуть піддаватися 6-білки. У випадку
одної з форм псевдогіпопаратиреоїдизму мутована б^х
втрачає здатність реагувати на паратиреоїдний гормон,
зумовлюючи симп гоми гіпопаратиреоїдизму без будь-яких
відхилень у циркуляції паратиреоїдного гормону. Цікавим
захворюванням є тестоксикоз, що поєднує набуття і втрату
функції. У цьому стані активована мутація 6 а зумовлює
надмірну секрецію тестостерону та препубертатне статеве
дозрівання. Однак вона чутлива до температури й активна
лише в разі порівняно низької температури яєчок (33°С,
див. Розділ 23). При температурі 37°С - нормальній
температурі решти тіла - відбувається заміна набуття
функції втратою, що спричинює гіпопаратиреоїдизм та
послаблену реактивність до ТСГ. Інша мутація в 6 а пов’я-
зана з наявністю ділянок пігментації шкіри з шорсткими
краями та гіперкортицизмом у разі синдрому Мак-Кюна-
Олбрайта. Ця мутація виникає протягом фетального роз-
витку, утворюючи мозаїку з нормальних та аномальних
клітин. Ще одна мутація в б^х послаблює її внутрішню
ГТФ-азну активність. Унаслідок чого вона набагато актив-
ніша в соматотропних клітинах переднього відділу гіпо-
фізу, що призводить до постійного зростання рівнів цАМФ.
Далі це призводить до того, що клітини стають неопластич-
ними, утворюючи аденоми гіпофізу, які спричиняють
акромегалію (у 40% від усіх випадків акромегалій) (див.
Розділ 22).
ГОМЕОСТАЗ
Рис. 1-47. Проходження сигналу через ЗАК-8ТАТ шлях. А:
зв’язування ліґанду призводить до димеризації рецептора.
В: активування та тирозинфосфорилювання ЗАК. С: ЗАК
фосфорилюють 8ТАТ. О: 8ТАТ димеризуються з відповід-
ним елементом ДНК, що реагує (модифіковано з Такеба К,
Кізїіітоіо Т, Акіга 8: 8ТАТ6: Ііз гоїе іп іпіегіеикіп 4-тесІіаЬл/сІ
ЬіоІодісаІ їипсііопз. З Мої Месі 1997;75:17).
Навколишнє середовище більшості клітин тіла стано-
вить інтерстиційний компонент ПКР. Оскільки нормальна
клітинна функція залежить від сталості цієї рідини, то не
дивно, що в багатоклітинних організмах для її підтримання
розвинулася величезна кількість регуляторних механізмів.
Для того, щоб описати “різноманітні фізіологічні процеси,
що підпорядковані відновленню нормального стану, як
тільки його було порушено”, В.Б.Кеннон використав термін
гомеостаз. Буферні властивості рідин тіла, ренальні та ди-
хальні пристосування до надлишку кислот чи лугів є гомео-
статичними механізмами. Таких прикладів безліч, і значна
ЗАГАЛЬНІ ЗАСАДИ ТА КЛІТИННІ ОСНОВИ ФІЗІОЛОГІЇ ЛЮДИНИ / 43
Таблиця 1-11. Хвороби, спричинені мутаціями втрати чи набуття функції гетеродимерних, з’єднаних з
6-білком рецепторів та 6-білків1
Сайт Тип мутації Хвороба
Рецептор Опсини колбочки Втрата Втрата кольорового зору
Родопсин Втрата Вроджена куряча сліпота
Дві форми пігментного ретиніту
\/2-вазопресин Втрата Х-зчеплений нефрогенний нецукровий діабет
АКТГ Набуття Родинна глкжокортикоїдна недостатність
ЛГ Набуття Родинне передчасне статеве дозрівання в чоловічої статі
ТСГ Втрата Родинний неавтоімунний гіпертиреоїдизм
ТСГ Набуття Родинний гіпотиреоїдизм
Са2+ Втрата Родинна гіпокальціємія
Тромбоксан А2 Втрата Вроджена кровотеча
Ендотелій В Втрата Хвороба Пршспрунґа
6-білок 65а Втрата Псевдогіпотиреоїдизм, тип 1а
65а Набуття/втрата Тестотоксикоз
65а Набуття (мозаїчне) Синдром Мак-Кюна-Олбрайта
65а Набуття Соматотропні аденоми з акромегалією
6,а Набуття Оваріальні та адренокортикальні пухлини
1 Модифіковано з І_ет 3: Оізеазез о( 6-ргоіеіп-соирІесІ зідпаї ігапзсіисііоп раіїі\л/ауз: іїіе таттаїіап уізиаі
зузіет аз а тосіеі. Зетіп Меигозсі 1998;9:232.
частина фізіології вивчає регуляторні механізми, що діють
для підтримання сталого стану внутрішнього середовища.
Багато з цих регуляторних механізмів діють за принципом
негативного зворотного зв’язку; відхилення від нормаль-
ного стану визначають сенсором, а сигнали від сенсора
стимулюють компенсаторні зміни, що тривають до віднов-
лення нормального стану.
СТАРІННЯ
Старіння є загальним фізіологічним процесом, який усе
ще погано вивчений. У багатьох країнах світу простежу-
ється зростання середньої тривалості життя, чого, на жаль,
нема в Україні. В Україні у 1999 році тривалість життя
жінок становила 73,3, чоловіків - 62,9, а середня тривалість
життя - 68,3 року. У Сполучених Штатах тривалість життя
зросла з 47 років у 1900 до понад 75 років сьогодні. Однак
це збільшення відбулося внаслідок поліпшення лікування,
запобігання інфекцій та інших причин ранньої смерті,
завдяки чому більше людей переживають 70-річний поріг.
Натомість максимальна тривалість життя в 100-110 років
майже не зросла. Старіння впливає на клітини та системи,
з яких вони складаються, а також на компоненти тканин,
наприклад, колаген. Для пояснення цього феномена було
висунуто цілу низку теорій.
Відповідно до однієї з теорій старіння, тканини старіють
унаслідок випадкових мутацій у ДНК соматичних клітин,
що призводить до кумулятивних аномалій. За іншою, куму-
лятивні аномалії зумовлені збільшенням перехресного
зшивання колагену та інших білків, можливо внаслідок
неензимної комбінації глюкози з аміногрупами на цих
молекулах. Ще інша теорія трактує старіння як кумулятив-
ний результат пошкодження тканин вільними радикалами,
що в них містяться. Це цікаво з огляду на те, що види з
довшою тривалістю життя виробляють супероксиддис-
мутазу - ензим, що дезактивує безкисневі радикали (див.
Розділ 27).
З’ясовано, що в гризунів хронічно знижене споживання
калорій продовжує тривалість життя. Попередні дані свід-
чать, що це стосується також і мавп, і, можливо, людей.
Поясненням ефекту калорійного обмеження, мабуть, є
послаблений метаболізм зі зниженим утворенням білкових
зшивок та вільних радикалів. Доказом на користь акуму-
ляції кумулятивних аномалій ДНК є нещодавнє з’ясування
того, як у разі синдрому Вернера - стану, за якого люди
старіють прискореними темпами,- генетичне порушення
полягає в мутації гена, що кодує ДНК геліказу - один з
ензимів, який допомагає розщеплювати ланцюги ДНК
перед реплікацією. Вважають, що ця аномалія спричиняє
надзвичайно швидку акумуляцію хромосомного пошкод-
ження. Миші, що втратили один з компонентів теломерази
(див. вище), старіють швидко і мають дефекти, характерні
для синдрому Вернера у людей. Крім того, в разі старіння
людських клітин велика частина мутацій акумулюється в
порції власної мітохондріальної ДНК, що контролює ре-
продукцію. Це може призвести до дефекту вироблення
енергії або, можливо, збільшити кількість вільних ради-
калів у клітинах. Однак справжню роль подібних до цього
факторів у процесі старіння все ще не з’ясовано.
У людей, що старіють, простежується послаблення рів-
нів циркулювання деяких статевих гормонів, андрогенів
44 / РОЗДІЛ 1
наднирників дегідроепіандростерону та його сульфату,
гормону росту. Замінна терапія естрогенами та прогесте-
роном у жінок (див. Розділ 23) зменшує захворюваність
на остеопороз та серцеві хвороби. Замінні терапії тесто-
стероном (див. Розділ 23), дегідроепіандростероном (див.
Розділ 20) та гормоном росту (див. Розділ 22) мають ліку-
вальні властивості, однак, дають небажані побічні ефек-
ти, і майже немає доказів, що вони продовжують життя.
ЛІТЕРАТУРА ДО ЧАСТИНИ І: ВСТУП
АІЬегіз В еі аі: Моїесиїаг Віоіоуу о/іке СеІІ, Згд ед. баг-
Іапд, 1994.
Веск К, Нипіег І, Еп§е1 3: 8ігисіиге апсі Еипсііоп оЕІатіпіп:
Апаіоту оГ а тикідотаіп §1усоргоіеіп. ЕА8ЕВ І 1990;
4:148.
Вег§ Р, 8іп§ег М: Оеаііпу ІРіік Оепез: Тке Тапуиауе о/Не-
гесіііу. ІЗпіу 8сі Воокз, 1992.
Веггід^е МЗ, Вооітап МО, Ьірр Р: Саісіит - а Ійе апсі деаіЬ
8І§па1. Каіиге 1998;395:645.
Вид1Ьагд)о І еі аі.: ВіосЬетісаІ раіЬ\уау8 оЕсазразез асііуа-
ііоп дигіп§ ароріозіз. Аппи кеу СеІІ Оєу Віоі 1999; 15:
267.
Саппоп \¥В: Тке іїРсІот о/іке Воду. Коїіоп, 1932.
Сгозз РС, Мегсег КЕ: СеІІ апсі Ті88ие С1іга8ігисіиге. Егее-
тап, 1993.
Оге\уеи 36, багЬег ОЬ: ТЬе Гатіїу о£ §иапу1у1 сусіазе
гесеріогз апсі іЬеіг 1і§апд8. Епсіосг кеу 1994; 15:135.
Оупіаскі ВО: ке§и1аііоп оГ ігапзсгірііоп Ьу ргоіеіпз іЬаі соп-
Ігої іЬе сеІІ сусіе. Каіиге 1997;389:149.
ЕагГеї 2, Воите Нк, Іігі Т: ТЬе ехрапдіп§ зресігит о£ 6
ргоіеіп дізеазез. N Еп£І 3 Мед 1999;340:1012.
боЬгІісЬ О, Киіау V: Тгапзрогі Ьеі\уееп іЬе сеІІ писіеиз апсі
іЬе суіоріазт. Аппи кеу СеІІ Оєу Віо1о§у 1999; 15:607.
біапсоЬі Е6, киозІаЬГі Е: Іпіе§гіп 8І§па11іп§. 8сіепсе 1999;
285:1028.
НІН \¥Е еі аі (едйогз): Тке ВіЬозоте: Вігисіиге, Еипсііоп,
апсі Еуоіиііоп. Атегісап 8осіеіу Еог МісгоЬіо1о§у, 1990.
НоЯтап ЗЕ, Затіезоп ЗО (едйогз): НапсІЬоок о/РкухіоІоуу:
8есііоп 14: СеІІ Рку8ІоІоуу. Охіогд ІЗпіу Рге88, 1997.
Ноизтап ОЕ: ОКА оп ігіаі: ТЬе тоїесиїаг Ьа8І8 о£ ОКА
Гіп§егргіпбп§. К Еп£І 3 Мед 1995;332:534.
Нипііеу 8М (едйог): Егопііегз іп сеІІ Ьіо1о§у: циаїйу сопігоі.
(8ресіа1 8есііоп). 8сіепсе 1999:286:1881.
Зап Ь¥, Зап ¥К: Сіопед роіа88Іит сЬаппеК Ггот еикагуоіез
апд ргокагуоіе8. Аппи кеу Кеигозсі 1997;20:91.
ЗоЬп8 Ок: ТЬе оіЬег Ьитап §епоте: МйосЬопдгіаІ ОКА апд
дІ8еа8е. Каі Мед 1996;2:1065.
Кахпеі8оу 6, Кі§ат 83: Ео1діп§ о£ зесгеіогу апд тетЬгапе
ргоіеіпз. К Еп§1 3 Мед 1998;339:1688.
К1и§ А, 8сЬ\уаЬе 3\¥к: /іпс Гт£ег8. ЕА8ЕВ 3 1995;9:597.
Ктіес ЕВ: бепе іЬегару. Ат 8сіепіІ8І 1999;87:240.
КисЬІег К, ТЬотег 3: 8есгеііоп оЕрерйдез апд ргоіеіпз Іаск-
іп§ ЬудгорЬоЬіс 8І£па1 зедиепсез: ТЬе гоїе о£ адепозіпе
ігірЬозрЬаіе-дгіуеп тетЬгапе ігапзіосаіогз. Епдосг кеу
1992:13:497.
ЬатЬеї18 8\¥3, Уап деп Веїд А\¥, Уап дег Ьеіу А-3: ТЬе епдо-
сгіпо!о§у о£ а§іп£. 8сіепсе 1997;278:419.
Макіп§ 8еп8е оЕ сЬаппеї діуегзйу. Каі Кеигозсі 1998; 1:169.
МсКизіск УА: Мепсіеііап Іпкегііапсе іп Мап. СаіаІо§8
Аиіозотаї Оотіпапі, Аиіо8отаІ Весе88іуе, апсі Х-Ііпкесі
Ркепоіурез, 1 ОіЬ ед. ЗоЬп8 Норкіпз Опіу Рге88. 1992.
Міііег ЬЗ, Магк8 3 (едйогз): Ароріо8І8. (8ресіа1 8есііоп).
8сіепсе 1999;286:1881.
МосЬІу-козеп О: Еосаііхайоп оЕ ргоіеіп кіпа8Є8 Ьу апсЬог-
іп£ ргоіеіпз: А дієте іп 8І£па1 ігапздисііоп. 8сіепсе 1995;
268:247.
МикЬецее 8, 6ЬозЬ кК, МахГіеїд Ек: Епдосуіозіз. РЬузіоІ
кеу 1997;77:759.
Миггау А, Нипі Т: Тке СеІІ Сусіе. Егеетап, 1993.
Кі§§ ЕА: Кисіеосуіоріазтіс ігапзроїї: 8і§паІ8, тесЬапІ8т8,
апд ге§и1аііоп. Каіиге 1997;386:779.
РагекЬ АВ, Реппе к: 8іоге деріеііоп апд саісіит іпЛих.
РЬу8Іо1 кеу 1997;77:901.
Ріиіа АЕ еі аі: ТЬе сепіготеге: НиЬ о£ сЬготозотаї асііуі-
ііе8. 8сіепсе 1995;270:1591.
кау ЕВ: ТЬе 8сіепсе о£ 8І§па1 ігапздисііоп. 8сіепсе 1999;
284:755.
ко8епіЬа1 К: ТооІ8 оЕіЬе ігаде: кесотЬіпапі ОКА. К Еп§1 З
Мед 1994;331:315.
кодітап ЗЕ, \¥іе1апд ЕТ: Ргоіеіп 8огїіп§ Ьу ігапзроїї ує8І-
с1е8. 8сіепсе 1996;272:227.
ки88е11 ЗМ: 8одіит-роіа88Іит-сЬ1огіде соігап8рої1. РЬузіоІ
кеу 2000;20:211.
8ІГПОП8 К, Ікопеп Е: Еипсііопаї гаїїз іп сеІІ тетЬгапез. Ка-
іиге 1997;387:569.
8кои ЗС: ТЬе Ка-К ритр. Ке\¥8 РЬузіоІ 8сі 1992;7:95.
8іе11аг Н: МесЬапізтз апд £епез оЕсеііиіаг зиісіде. 8сіепсе
1995;267:1445.
8ігап§е К, Етта Е, Заскзоп Р8: Сеііиіаг апд тоїесиїаг рЬузі-
о1о£у оЕ уоіите зєпзйіує апіоп сЬаппеїз. Ат 3 РЬузіоІ
1996;270:С711.
Уегта ІМ, 8отіа К: бепе Йіегару: Рготізез, ргоЬІетз, апд
ргозресіз. Каіиге 1997:389:239.
\¥а11асе 06: МйосЬопдгіаІ дізеазез іп тап апд тоизе. 8сі-
епсе 1999;283:1482.
ХУеіпдгисЬ к, 8сЬа1 к8: Саіогіс іпіаке апд а§іп§. К Еп§1 З
Мед 1997;337:986.
/Ьи X, ВітЬаитег Ь: Саісіит сЬаппеїз Гогтед Ьу татта-
1 іап Тгр Ьото1о£у. Кє\уз РЬузіоІ 8сі 1998; 11:211.
Частина II
Фізіологія нервових і м’язових клітин
Збудлива тканина: нервова
2
ВСТУП
Центральна нервова система (ЦНС) людини містить
близько 1011 (100 мільярдів) нейронів, а також гліальні
клітини, кількість яких у 10-50 разів перевищує кількість
нейронів. Нейрони - основні структурні одиниці нервової
системи - еволюціонували з примітивних нейроефектор-
них клітин, що відповідають на різні подразники скоро-
ченням. У складніших організмах скорочення стає спеціа-
лізованою функцією м’язових клітин, тоді як інтеграція та
проходження нервових імпульсів і надалі є спеціалізованою
функцією нейронів. Розглянемо питання механізмів виник-
нення збуджень у нейронах, інтеграції й проходження нер-
вових імпульсів.
НЕРВОВІ КЛІТИНИ
Морфологія
Нейрони центральної нервової системи ссавців мають
різноманітні форми і розміри (рис. 2-1). Проте більшість
із них складається з тих самих частин, що й типові спин-
номозкові рухові нейрони (рис. 2-2). Ці клітини мають від
п’яти до семи відростків, які інтенсивно розгалужуються
від тіла клітини; їх називають дендритами. Зокрема, в
мозковій корі та корі мозочка дендрити формують неве-
ликі шишкоподібні виступи-дендритні шипики. Типовий
нейрон теж має довгий волокнистий відросток - аксон,
який починається з дещо потовщеної ділянки тіла клітини
- горбика аксона. Початкову частину аксона називають
початковим сегментом. Ближче до закінчення аксон роз-
галужується на аксонні терміналі, кожна з яких закінчу-
ється численними синаптичними потовщеннями, які
називають кінцевими ґудзиками, або аксонними тело-
дендронами. Вони містять гранули або пухирці, у яких
накопичуються синтезовані в нервах синаптичні трансмі-
тери (див. Розділ 4).
Аксони багатьох нейронів мієлінізовані, тобто вкриті
оболонкою мієліну, білково-ліпідного комплексу, утворе-
ного багатьма шарами клітинних мембран - клітинами
Шванна (нейролемоцитів) (рис. 2-3). Клітини Шванна -
це гліоподібні клітини, розміщені вздовж периферійних
нервів. Мієлінова оболонка утворюється внаслідок багато-
разового (до 100) обгортання аксона мембраною клітини
Шванна. Мієлін ущільнюється, якщо позаклітинні частини
мембранного білка, що називають білком нуль (Р0-від англ.
ргоіеіп), змикаються з позаклітинними частинами прилег-
лої мембрани. Різні мутації в гені Р() призводять до пери-
ферійних нейропатій; описано 29 різних мутацій, що є
причиною як помірних, так і важких порушень. Мієлінової
оболонки нема в ділянці термінальних розгалужень аксона
і в періодичних (приблизно через кожен 1 мм розміром до
1 мкм) ділянках звужень, які називають вузловими пере-
тяжками Ранв’є. Ізолювальну функцію мієліну описано
нижче. Однак не всі нейрони в організмі ссавців укриті
мієліном, деякі з них безмієлінові, тобто просто оточені
клітинами Шванна без багаторазового обгортання аксона
мембраною клітин Шванна й утворення мієліну. Безмієлі-
новими є більшість нейронів безхребетних.
У ссавців нейрони головно вкриті мієліном, проте мієлін
тут утворений здебільшого не клітинами Шванна, а оліго-
дендроцитами (див. рис. 2-3). На відміну від клітин Шван-
на, які формують мієлінову оболонку між двома вузловими
перетяжками Ранв’є одного нейрона, олігодендроцити по-
ширюють свої відростки, що утворюють мієлін, до бага-
тьох суміжних аксонів. У разі розсіяного склерозу, важкого
автоімунного захворювання, у ЦНС відбувається багато-
вогнищева деструкція мієліну. Втрата мієліну супровод-
жується сповільненням або припиненням передавання ім-
пульсів демієлінізованими аксонами.
Розміри окремих нейронів справді вражають. Наприк-
лад, якщо припустити, що тіло клітини спинномозкового
нейрона, який іннервує м’язи стопи, має розмір тенісного
м’ячика, то його дендрити можуть заповнити середнього
розміру житлову кімнату, а аксон простягнеться на 1,6 км,
будучи 13 мм у діаметрі.
Загальноприйняті назви частин нейрона зрозумілі, якщо
вони стосуються спинномозкових рухових нейронів та ін-
тернейронів, проте виникають деякі незручності з викорис-
танням термінів дендрит і аксон стосовно інших типів ней-
ронів. З функціонального погляду (див. нижче, а також Роз-
діли 4 та 5) нейрони переважно складаються з чотирьох
головних зон: рецепторної, або дендритної, зони, яка інтег-
рує множинні локальні зміни потенціалу, генеровані синап-
46 / РОЗДІЛ 2
КІРКОВІ НЕЙРОНИ
Великий мозочок
Мозочок
Зорові частки
ІНТЕРНЕЙРОНИ
Вторинні
Чутливі клітини
Клітини
короткоаксонного типу
ЦЕНТРАЛЬНІ ЕФЕКТОРНІ
НЕЙРОНИ
Мотонейрони
Автономні нейрони
Гіпофізарні нейрони
ПЕРИФЕРІЙНІ ЕФЕКТОРНІ
НЕЙРОНИ
Автономні вузли
Вузли безхребетних
Неирогіпофіз
ЕФЕКТОРНІ ПОЛЯ
(2)
(3)
і—Н
ЧУТЛИВІ поля
БІПОЛЯРНІ НЕЙРОНИ
Зоровий
Слуховий (1)
Вестибулярний
Нюховий
Шкірний
ТІЛО
ЦЕНТРАЛЬНОГО
НЕЙРОНА
ТІЛО
ПЕРИФЕРІЙНОГО
НЕЙРОНА
Рис. 2-1. Окремі типи нейронів нервової системи ссавців (відтворено за дозволом, з ВосІіап О. Іпігосіисіогу зигуеу оТ пеигопз.
СоїсІ Зргіпд НагЬог 8утр Оиапі ВіоІ. 1952; 17:1).
тичними зв’язками (рис. 2-4); зони, яка генерує потенціали
дії, що поширюються (початковий сегмент спинномозко-
вих рухових нейронів, початкова вузлова перетяжка Ранв’є
шкірних чутливих нейронів); відросток аксона, який пере-
дає імпульси, що поширюються до нервових закінчень; і
нервові закінчення, де потенціали дії зумовлюють вивіль-
нення синаптичних нейротрансмітерів.
Тіло клітини в більшості випадків розміщене в ден-
дритній зоні кінця аксона, проте воно може бути і всере-
дині аксона (наприклад, у слухових нейронах) або збоку
від нього (наприклад, у шкірних нейронах; див. рис. 2-1).
Розміщення тіла нейрона не впливає на рецепторну функ-
цію дендритної зони і функцію передавання аксоном ім-
пульсу.
Рис. 2-2. Руховий нейрон з мієлінізованим аксоном.
ЗБУДЛИВА ТКАНИНА: НЕРВОВА/47
Рис. 2-3. Угорі: співвідношення клітин Шванна з аксонами
периферійних нервів. Ліворуч зображено переріз безмієлі-
нового аксона, а праворуч - мієлінового. Як бачимо, клітинна
мембрана клітини Шванна згортається й охоплює аксон. Уни-
зу: мієлінізація аксонів ЦНС олігодендроцитами. Один оліго-
дендроцит поширює відростки понад 40 аксонів.
Рецепторна зона
ґрадієнтний електрогенез
Місце початку
передавання імпульсів
Аксон
передавання за принципом
“усе або нічого”
Нервові закінчення.
секреція
синаптичних трансмітерів
Рис. 2-4. Функційна організація нейрона. Локальні потенціали
накопичуються в рецепторній зоні, а потенціал дії виникає в
ділянці, що поблизу рецепторної зони (стрілка). Аксон поши-
рює потенціал дії до нервових закінчень, де він зумовлює
виділення синаптичних трансмітерів.
Зазначимо, що дендритні розгалуження нейронів поміт-
но відрізняються за розмірами і складністю структури (рис.
2-1; див. також рис. 11-1 і 12-17). Окрім інтегрування па-
сивної електричної активності, дендрити в окремих випад-
ках можуть генерувати і поширювати потенціал дії.
Синтез білків і аксонне транспортування
Нервові клітини належать до секреторних, проте відріз-
няються від інших клітин цього типу тим, що їхня секре-
торна зона розміщена переважно у кінці аксона, а тому
значно віддалена від тіла клітини. Рибосом в аксоні і його
терміналах небагато або й зовсім нема, синтез усіх потріб-
них білків відбувається в ендоплазматичній сітці та апараті
Ґольджі, і лише згодом аксон транспортує їх до синаптич-
них ґудзиків аксоплазматичним транспортуванням.
Отже, тіло нервової клітини забезпечує функційну і струк-
турну цілісність аксона: у випадку перерізання аксона його
дистальна частина підлягає переродженню (дегенерація
Валлєра). Антероградне транспортування забезпечують
мікротрубочки; його молекулярні механізми описані в Роз-
ділі 1. Швидке антероградне транспортування відбувається
зі швидкістю приблизно 400 мм за добу, а повільне - близь-
ко 0,5-10,0 мм за добу. Ретроградне транспортування,
тобто переміщення речовин у протилежному напрямі, має
швидкість приблизно 200 мм за добу.
Синаптичні пухирці відновлюються в мембрані, проте
деякі використані переміщуються до тіла нервової клітини
і накопичуються в лізосомах. Окремі речовини, наприклад
фактор росту нервів, а також різноманітні віруси, що про-
никають у нервові закінчення шляхом ендоцитозу, теж по-
трапляють до тіла нервової клітини внаслідок ретроград-
ного аксонного транспортування.
ЗБУДЖЕННЯ І ПРОВІДНІСТЬ
Нервовим клітинам властивий низький поріг збудження.
Подразник може бути електричного, хімічного або меха-
нічного походження. Відомі два типи реакцій на фізико-
хімічні подразники: місцева, яка не поширюється, залежно
від місця виникнення її називають синаптичною, генера-
торною або електротонічними потенціалами; і така, що
поширюється - потенціали дії, або нервові імпульси. Для
нервів та інших збудливих тканин характерні лише реакції
електричного походження, що є головною “мовою” нер-
вової системи. Вони зумовлені змінами проникності клі-
тинної мембрани для іонів, що залежать від стану йонних
каналів.
Аксон передає нервовий імпульс до свого закінчення.
Нерви не передають імпульси пасивно, як це відбувається,
наприклад, у телефонній мережі; проходження нервових
імпульсів, навіть швидке, є набагато повільнішим, ніж про-
тікання електричного струму дротами. Нервова тканина
насправді - це порівняно слабкий пасивний провідник: для
отримання сигналу до 1 В на іншому кінці 1-метрового
аксона, якщо нема активних процесів у нерві, потрібен
багатовольтовий потенціал. Передавання нервового ім-
пульсу в нерві є активним самостійним процесом, який
поширюється зі сталою амплітудою і швидкістю. Цей
процес часто порівнюють з процесом горіння доріжки,
48 / РОЗДІЛ 2
укладеної крупинками пороху: запалювання кожної кру-
пинки спричинює запалювання сусідньої безпосередньо
спереду, і полум’я неухильно та рівномірно поширюється
вздовж доріжки до її кінця.
Електричні процеси, що відбуваються в нейроні, є швид-
коплинними, їх вимірюють у мілісекундах (мс); зміни по-
тенціалів теж незначні; їх вимірюють у мілівольтах (мВ).
Поєднання мікроелектродної техніки, у якій застосовують
мікроелектроди діаметром до 1 мкм, з використанням
електронних підсилювачів і катодного осцилоскопа дає
змогу детально досліджувати процеси електричної актив-
ності в нервах. Сучасні прилади підсилюють зміни потен-
ціалів у 1000 і більше разів, а катодний осцилоскоп забез-
печує майже безінерційне й одночасне відтворення елект-
ричних процесів у нерві.
Катодний осцилоскоп
Катодний осцилоскоп (КО) застосовують для вимірю-
вання електричних процесів, що відбуваються в живих
тканинах. У КО електрони, що їх випромінює катод, спря-
мовані у вигляді сфокусованого пучка на екран скляної
трубки, у якій розміщений цей катод (рис. 2-5). Екран
вкритий однією з численних субстанцій (фосфори), що
випромінює світло під впливом електронів. З кожного
боку пучка електронів розміщена вертикальна металева
пластина. У випадку подання напруги на пластини пози-
тивно заряджена пластина притягує негативно заряджені
електрони, які відштовхує негативно заряджена пластина.
У разі поступового збільшення напруги, яку подають на
вертикальні пластини (Х-пластини), і потім її раптового
зменшення і подальшого збільшення, пучок електронів
рухається поступово до позитивно зарядженої пластини,
згодом повертається до попереднього положення і знову
відхиляється до позитивно зарядженої пластини. Засто-
сування такого типу “зубчастої” напруги спричинює від-
Каюд
Екран Пучок
ОЛОК іронін
Рис. 2-5. Катодний осцилоскоп Спрощене зображення основ-
ної схеми для реєстрації змін потенціалів у нерві.
хилення пучка електронів упоперек екрана трубки, швид-
кість цього відхилення пропорційна до ступеня збільшен-
ня застосованої напруги.
Інша пара пластин (¥-пластини) розміщена горизон-
тально, одна пластина вище, а друга нижче від місця про-
ходження пучка електронів. Еіапруга, яку подають на ці
пластини, відхиляє пучок електронів догори і донизу, коли
він перетинає впоперек екран трубки. Значення вертикаль-
ного відхилення пропорційне різниці потенціалів між го-
ризонтально розміщеними пластинами. Якщо ці пластини
приєднані до електродів, розміщених на нерві, то можна
зафіксувати будь-які зміни потенціалів у нерві у вигляді
вертикального напряму відхилень пучка електронів під час
його руху впоперек трубки.
Реєстрація змін потенціалів в ізольованих
аксонах
Аксони ссавців мають невеликий діаметр (20 мкм або
й менше), тому їх важко ізолювати від інших аксонів нерва,
тоді як велетенські безмієлінові нервові клітини містяться
в значних кількостях в організмі безхребетних і їхнє відок-
ремлення не викликає великих труднощів. Такі велетенські
клітини є, наприклад, у крабів (Сагсіпиз) і каракатиць (5е-
ріа), проте найбільшого розміру аксони виявлені в тілі
кальмара Шийна ділянка м’язової мантії кальмара
містить поодинокі аксони діаметром до 1 мм. Головні
властивості цих аксонів близькі до головних властивостей
аксонів ссавців.
Мембранний потенціал спокою
Якщо два електроди, розміщені на поверхні ізольова-
ного аксона, приєднати через підсилювач до КО, то прилад
не зафіксує зміни напруги. Однак якщо один з електродів
увести через мембрану всередину клітини, то прилад за-
реєструє постійну різницю потенціалів між негативно за-
рядженим середовищем усередині клітини і позитивно за-
рядженою поверхнею. Мембранний потенціал спокою
властивий майже всім клітинам. Механізм генерації мемб-
ранного потенціалу спокою розглянуто в Розділі 1. У ней-
ронах його значення дорівнює приблизно -70 мВ.
Латентний період
У випадку нанесення подразнення і передавання аксо-
ном нервових імпульсів виникають характерні короткочас-
ні зміни потенціалів, які називають потенціалом дії і реєст-
рують у разі досягнення імпульсами поверхневого елект-
рода.
Одразу ж після подразнення виникає короткочасне,
змінного характеру, відхилення від базової лінії - арте-
факт подразника. Цей артефакт зумовлений поширенням
електричного струму від подразнювального електрода до
реєструвального. Таке явище звичайно простежується, на-
віть незважаючи на старанне екранування, проте воно має
важливе позитивне значення, оскільки реєстрація його на
екрані катодної трубки дає змогу точно визначити час ви-
никнення подразнення.
Після артефакту подразника настає ізопотенціальний
інтервал (латентний період), який завершується з почат-
ком потенціалу дії і відповідає часові, упродовж якого ім-
пульс проходить аксоном від точки подразнення до реєст-
ЗБУДЛИВА ТКАНИНА: НЕРВОВА / 49
Рис. 2-6. Потенціал дії в нейроні. Один з електродів міститься
всередині клітини.
рувального електрода. Тривалість цього періоду пропор-
ційна до відстані між подразнювальним і реєструвальним
електродами, а також обернено пропорційна до швидкості
проходження. Якщо тривалість латентного періоду і від-
стань між електродами відомі, то можна обчислити швид-
кість в аксоні. Наприклад, припустимо, що відстань між
катодним подразнювальним електродом і розміщеним на
поверхні електродом (рис. 2-6) дорівнює 4 см. Постійний
електричний струм, що слугує подразником, звичайно по-
дають з катода. Якщо латентний період триває 2 мс, то
швидкість проходження - 4 см за 2 мс, тобто 20 м/с.
Потенціал дії
Першим проявом виникнення потенціалу дії є деполя-
ризація мембрани. Після початкових 15 мВ швидкість де-
поляризації зростає. Точку, від якої розпочинається ця зміна
швидкості, називають критичним рівнем деполяризації,
або порогом. Стосовно до цього, крива, яку відтворює ос-
цилоскоп, швидко досягає і перевищує рівень ізопотенці-
альної лінії (потенціал нуль), сягаючи приблизно +35 мВ
(овершут). Згодом потенціал швидко зменшується до рівня
потенціалу спокою. Як тільки реполяризація досягає при-
близно 70%, швидкість реполяризації знижується і крива
наближається до рівня потенціалу спокою повільніше.
Швидке збільшення і згодом раптове зменшення потенці-
алу називають піковим потенціалом аксона, а повільне
зменшення наприкінці процесу - слідовою деполяри-
зацією. Після досягнення початкового рівня, що відповідає
значенню потенціалу спокою, крива, хоч і незначно, знову
підіймається в напрямі гіперполяризації, реєструючи яви-
ще слідової гіперполяризації. Потенціал дії, зареєстро-
5 367'2
ваний в умовах, коли один електрод перебуває всередині
клітини, називають монофазовим, оскільки процес від-
бувається, головно, в одному напрямі.
Співвідношення частин кривої, зображеної на рис. 2-6,
умисно дещо спотворене з метою ліпшої ілюстрації фаз
потенціалу дії. Крива, складові частини якої реально від-
творюють часові характеристики і значення потенціалу в
нейроні ссавців, показана на рис. 2-7. Зазначимо, що збіль-
шення потенціалу дуже швидке і не дає змоги чітко просте-
жити зміни внаслідок деполяризації та критичний рівень
деполяризації, а значення слідової гіперполяризації відпо-
відає лише 1-2 мВ, хоча триває цей період майже 40 мс.
Тривалість слідової деполяризації в цьому випадку дорів-
нює приблизно 4 мс. У багатьох нейронах вона ще менш
тривала і має мале значення. Зміни в значеннях слідової
поляризації можуть відбуватися без суттєвих змін у решті
фаз потенціалу дії. Наприклад, якщо нерв упродовж три-
валого часу передає імпульси, то значення слідової гіпер-
поляризації звичайно збільшується.
Закон “усе або нічого”
Якщо потенціал дії реєструють в умовах, як це зобра-
жено на рис. 2-6 - з розміщенням реєструвальних елект-
родів на значній відстані від електродів, за допомогою яких
завдають подразнення, то можна з’ясувати мінімальне зна-
чення постійного струму (порогова сила), який, діючи
упродовж певного часу, зумовлює виникнення потенціалу
дії. Між силою струму і тривалістю його дії є залежність.
У разі використання слабкого струму тривалість його дії
збільшується, а в разі сильного - зменшується. Співвідно-
шення між силою струму і тривалістю його дії описує спе-
ціальна крива. Повільне збільшення струму не призводить
до збудження в нерві, оскільки нерв адаптується до такого
типу збудника; цей процес називають акомодацією.
У випадку порогової сили подразника виникає потен-
ціал дії. Подальше зростання сили подразника не призво-
дить до збільшення значення чи інших показників потен-
-і +35
Пік
0
сп
з
Слідова
гіперполяризація
Слідова
деполяризація
0 10 20 30 40 50
мс
-70
Рис. 2-7. Реєстрація потенціалу дії у великому мієліновому
волокні ссавців, що відображає реальне співвідношення його
фаз.
50 / РОЗДІЛ 2
ціалу дії за умови, що інші дані експерименту незмінні.
Підпороговий, недостатній, подразник не викликає появи
потенціалу дії. Потенціал дії постійної амплітуди і форми
незалежно від сили подразника виникає за умови, якщо
цей подразник є пороговим або надпороговим. Отже, по-
тенціал дії підлягає закону “все або нічого”.
Електротонічні потенціали, локальна
відповідь і критичний рівень деполяризації
Хоча підпорогові подразники не викликають появи
потенціалу дії, вони впливають на мембранний потенціал.
Цей ефект можна простежити за умови розміщення реєст-
рувальних електродів на відстані декількох міліметрів від
подразнювального електрода і застосування підпорого-
вого подразника упродовж деякого часу. Використання
підпорогового струму, який подають з катода, спричинює
локальну деполяризувальну зміну потенціалу, значення
якого різко збільшується та експоненціально, упродовж
певного часу, зменшується. Крива цієї реакції спадає
швидше, якщо відстань між подразнювальним і реєстру-
вальним електродами збільшувати. Анодний струм зумов-
лює таку ж за тривалістю зміну потенціалу в напрямі
гіперполяризації. Такого типу зміни потенціалу називають
електротонічними потенціалами, а залежно від напряму
струму (тобто спричинені дією катода чи анода), - відпо-
відно, кателектротонічними або анелектротонічними.
Названі зміни потенціалу т- це пасивні зміни поляризації
мембрани, зумовлені додаванням або відніманням заряду
в разі дії певного електрода. За умови низького значення
струму, що спричинює деполяризацію або гіперполяри-
зацію приблизно 7 мВ, їхні значення пропорційні до сили
подразника. Якщо подразник значної сили, то ця законо-
мірність справджується для анелектротонічних типів змін
потенціалу, проте не виявляється в разі подразнювання з
катода; у випадку дії катода зміна потенціалу є сильнішою,
ніж можна було б сподіватися, орієнтуючись на силу
подразника. Врешті, якщо катодне подразнення є достат-
ньої сили, щоб викликати деполяризацію 15 мВ, за умови,
що мембранний потенціал спокою -55 мВ, то мембранний
потенціал раптово зменшується і розпочинається поши-
рення потенціалу дії.
Непропорційно високого рівня зміни потенціалу до-
статнього за силою катодного подразника, що спричинює
7-15 мВ деполяризації, виникають унаслідок відкриття
воріт потенціалозалежних Ка+-каналів (див. нижче); їх
називають локальною відповіддю (рис. 2-8). Точка, у якій
ініційоване різке сходження до пікового потенціалу, є кри-
тичним рівнем деполяризації. Отже, катодний струм,
який спричиняє деполяризацію рівня 7 мВ, зумовлює
винятково пасивну реакцію мембрани як наслідок дода-
вання негативних зарядів. Катодний струм, що спричинює
деполяризацію 7-15 мВ, теж незначно впливає на процес
деполяризації. Сили реполяризації все ще переважають
сили деполяризації, і потенціал зменшується. У разі
деполяризації 15 мВ сили деполяризації достатні, щоб
переважити сили реполяризації, унаслідок чого виникає
потенціал дії.
Подразнення звичайно завдають з катода, оскільки ка-
тодні подразники мають деполяризувальний вплив. Анодні
струми, зміщуючи мембранний потенціал далі від критич-
Рис. 2-8. Електротонічні потенціали і локальна відповідь. Криві
зміни мембранного потенціалу в нейроні після завдання
подразнення, що відповідає значенням 0,2; 0,4; 0,8 та 1,0
порогового струму, розміщені на шкалі часу. Криві реакцій,
розташовані нижче від горизонтальної лінії, відтворюють про-
цеси, що виникають у разі дії анодного струму, а криві, що
розташовані вище, - у разі дії катодного струму. Подразник
порогового рівня використаний двічі. За першим разом він
спричинив потенціал дії, а за другим - не спричинив.
ного рівня деполяризації, пригнічують утворення імпульсу.
Однак припинення дії анодного струму може спричинити
овершут мембранного потенціалу в напрямі деполяризації.
Цей рикошет часом буває настільки сильним, що одразу ж
після припинення анодного подразнення спричиняє збуд-
ження в нерві.
Зміна збудливості упродовж
електротонічних потенціалів і потенціалу дії
У випадку потенціалу дії, як і в разі кателектротонічних
та анелектротонічних потенціалів, а також локальної
відповіді змінюється рівень порога подразнення нейрона.
Гіперполяризувальні анелектротонічні відповіді підвищу-
ють рівень порога, а деполяризувальні кателектротонічні
- знижують його, оскільки наближають мембранний потен-
ціал до критичного рівня деполяризації.
Під час локальної відповіді рівень порога знижується,
однак упродовж фази підіймання і фаз, що супроводжу-
ються зниженням після пікового потенціалу, нейрон не
чутливий до подразнення. Цей рефрактерний період поді-
ляють на період абсолютної рефрактерності, який від-
повідає часу збільшення потенціалу від критичного рівня
деполяризації до точки проходження однієї третини репо-
ляризації, і період відносної рефрактерності, який триває
від цієї точки до початку слідової деполяризації.
Під час періоду абсолютної рефрактерності жоден по-
дразник будь-якої сили не викликає збудження нерва, проте
під час періоду відносної рефрактерності подразник, біль-
ший за силою від застосованого раніше, може це зробити.
У разі слідової деполяризації рівень порогової сили знову
знижується, а у випадку слідової гіперполяризації - зрос-
тає. Залежність рівня порога від фаз потенціалу дії відоб-
ражена на рис. 2-9.
ЗБУДЛИВА ТКАНИНА: НЕРВОВА / 51
Електрогенез потенціалу дії
У стані спокою мембрана нервової клітини поляризо-
вана. Зовнішня поверхня мембрани має позитивний заряд,
а внутрішня - негативний. У разі формування потенціалу
дії ця полярність змінюється й упродовж короткого часу
стає насправді оберненою (рис. 2-10). Позитивне переза-
рядження мембрани у двох напрямах попереду і позаду
потенціалу дії переходить у ділянку, де містяться негативні
заряди, зумовлені потенціалом дії. Завдяки переміщенню
позитивних зарядів знижується полярність мембрани по-
переду потенціалу дії. Така електротонічна деполяризація
спричинює локальну відповідь, і, як тільки досягнуто кри-
тичного рівня деполяризації, збудження поширюється, що,
відповідно, далі допереду електротонічно деполяризує
мембрану. Завдяки такій почерговості подій збудження без-
мієліновим аксоном рівномірно поширюється до його
кінця. Отже, здатність нервового імпульсу самопоширю-
ватись зумовлена циркуляцією струму з наступною депо-
ляризацією мембрани аж до критичного рівня попереду
потенціалу дії. Поширюючись, нервовий імпульс не депо-
ляризує до критичного рівня ділянку позаду себе, оскільки
ця ділянка є рефракторною.
Потенціали дії, що виникають у синаптичних контактах
і чутливих закінченнях, теж залежать від електротонічної
деполяризації мембрани нервової клітини до критичного
рівня (див. Розділи 4 та 5).
Механізм сальтаторної провідності
Провідність у мієліновому аксоні залежить від подібних
процесів поширення струму. Однак мієлін є ефективним
ізолятором, тому циркуляція струму крізь нього незначна.
Рис. 2-9. Зміни збудливості клітинної мембрани нейрона під
час поширення нервового імпульсу. Як видно, збудливість
обернено пропорційна до рівня порога (модифікована схема,
відтворена за дозволом з Могдап СТ. РЬузіоІодісаІ РзусЬоІ-
оду. МсСгах/у-НіІІ, 1943).
Неактивний
вузол
ПКР
Мієлін
Аксон
Активний
вузол
Т- Г
Напрям поширення
Рис. 2-10. Локальний струм в аксонах / рух позитивних зарядів
навколо імпульсу. Угорі: безмієліновий аксон. Унизу: мієлі-
новий аксон; ПКР - позаклітинна рідина.
)- І
Ось чому деполяризація в мієліновому аксоні поширюється
стрибкоподібно, наче сальто, від одного вузла нервового
волокна (перетяжка Ранв’є) до іншого зі згасанням струму
в активному вузлі, що спричинює електротонічну депо-
ляризацію аж до критичного рівня у вузлі, розміщеному
попереду потенціалу дії (див. рис. 2-10). Такого типу поши-
рення деполяризації від вузла до вузла називають сальта-
торною, або стрибкоподібною провідністю. Це швидкий
процес, провідність у мієліновому аксоні відбувається у
50 разів швидше, ніж провідність у найшвидшому безміє-
ліновому волокні.
Ортодромна й антидромна провідність
Аксон здатний передавати збудження в обох напрямах.
Якщо потенціал дії ініційовано посередині аксона, то по-
ширення імпульсів в обох протилежних напрямах зумов-
лює електротонічна деполяризація з кожного боку від місця
подразнення.
Проте в живому організмі імпульси звичайно поширю-
ються лише в одному напрямі, тобто від синаптичного кон-
такту або рецепторів аксоном до його кінця. Таку провід-
ність називають ортодромною. Провідність у протилеж-
ному напрямі - антидромна. Оскільки синапси, на відміну
від аксона, забезпечують провідність лише в одному на-
прямі, то будь-які антидромні імпульси, що утворюються,
не спроможні пройти крізь уже перший синапс, який трап-
ляється на їхньому шляху, і згасають.
Двофазовий характер потенціалу дії
Відмінності мембранного потенціалу спокою від потен-
ціалу дії, описані раніше, ґрунтуються на записуванні по-
тенціалів за допомогою двох електродів: один з них розмі-
52 / РОЗДІЛ 2
щений на поверхні аксона, а інший - усередині. Якщо обид-
ва реєструвальні електроди розмістити на поверхні аксона,
то осцилоскоп не зафіксує різниці потенціалів між ними в
стані спокою. Коли нерв подразнюють, то поза цими двома
електродами відбувається проходження імпульсу, що зу-
мовлює характерні послідовності змін потенціалу. Як тіль-
ки хвиля деполяризації сягає ближчого до місця подраз-
нення електрода, - першого, - то цей електрод реєструє
негативний заряд щодо другого (рис. 2-11). Якщо ж імпульс
поширюється в частині нерва між двома електродами, то
осцилоскоп зареєструє відсутність потенціалу, тобто ізо-
лінію. В разі надходження імпульсу до другого електрода,
він зареєструє другий потенціал і перший стає позитивно
зарядженим щодо другого. Загальноприйнято приєднувати
до підсилювача електроди так, щоб перший був негативно
зарядженим щодо другого, і тоді запис фіксує відхилення
догори. Далі настає ізоелектричний інтервал і після нього
крива відхиляється донизу. Таку послідовність називають
двофазовим потенціалом дії (див. рис. 2-11). Тривалість
ізоелектричного інтервалу пропорційна до швидкості про-
відності в нерві і відстані між двома реєструвальними
електродами.
Провідність в об’ємному провіднику
Оскільки рідини організму містять значну кількість
електролітів, то нерви в організмі діють в оточенні добре
провідного середовища, яке називають об’ємним про-
відником. Описані вище моно- і двофазний потенціали
дії досліджені в умовах непровідного середовища поза ор-
ганізмом. Зміни потенціалів, які реєструють у разі зовніш-
Рис. 2-11. Двофазовий потенціал дії. Обидва реєструвальні
електроди розміщені на поверхні мембрани нейрона.
ньоклітинного дослідження, в оточенні об’ємного провід-
ника, тобто за умов цілісного організму, головно відпові-
дають описаним вище, проте в цьому випадку виникають
перешкоди, спричинені поширенням струму через об’єм-
ний провідник. Ці перешкоди зумовлені впливом чинників,
пов’язаних з орієнтуванням електродів стосовно напряму
поширення потенціалу дії, відстанню між записувальним
електродом, що перебуває над активною тканиною, та
індиферентним електродом. Загалом під час реєстрації
потенціалу дії в середовищі об’ємного провідника просте-
жуються електропозитивні відхилення в обох напрямах від
електронегативного піка.
ЙОННІ ОСНОВИ ЗБУДЖЕННЯ
І ПРОВІДНОСТІ
Клітинні мембрани нейронів, як і інших клітин, мають
багато різного типу йонних каналів. Деякі з них пасивні,
тобто постійно відкриті, тоді як інші є потенціалозалеж-
ними, а ще інші - ліґандозалежними. Функціюванням цих
каналів, зокрема Иа+- і К+-каналів, пояснюють електричні
явища в нервах.
Йонні основи мембранного потенціалу
спокою
Як зазначено в Розділі 1, з нейронів та інших клітин
відбувається активне транспортування Ма+, тоді як у клі-
тини - К+. Шляхом дифузії К+ виходить з клітин, а Ма+
дифундує в клітини, проте завдяки К4 -каналам проникність
мембрани для К+ є значно вищою, ніж для Иа+. Оскільки
мембрана непроникна для більшості аніонів клітини, то
вихід К+ з клітин не супроводжується відповідним відті-
канням аніонів, завдяки чому виникає поляризація мемб-
рани. Її зовнішня поверхня має позитивний, а внутрішня -
негативний заряд.
Йонні потоки під час потенціалу дії
Зміни проникності мембрани для Иа+ і К+, що відбува-
ються протягом потенціалу дії, відображені на рис. 2-12.
Проникність для йона обернено пропорційна до його
електричної опірності в мембрані і є мірою проникності
цього йона.
Незначне зменшення мембранного потенціалу спокою
спричинює відтікання К+ і надходження СІ , що забезпечує
відновлення мембранного потенціалу спокою. Однак коли
деполяризація сягає 7 мВ, то прохідність потенціалозалеж-
них Ма+-каналів збільшується (активування ^ -каналів),
і як тільки досягнуто критичного рівня деполяризації, про-
никність мембрани для Иа+ збільшується настільки, що він
лавиноподібно надходить у волокно, створюючи високу
концентрацію та електричні градієнти, що тимчасово пере-
кривають реполяризувальні чинники.
Потенціал рівноваги для у нейронах ссавців, обчис-
лений за рівнянням Нернста, дорівнює приблизно +60 мВ.
Мембранний потенціал наближається до цього значення,
проте упродовж потенціалу дії його не досягає, головно
тому, що збільшення проникності для Иа+ є короткочас-
ним. Ворота №+-каналів швидко закриваються (стан ін-
активування), це триває декілька мілісекунд - до від-
ЗБУДЛИВА ТКАНИНА: НЕРВОВА / 53
Рис. 2-12. Зміни проникності мембрани для Ма+ і К+ у разі
формування потенціалу дії у велетенському аксоні кальмара.
Штрихова лінія, що відтворює криву потенціалу дії, нанесена
на шкалу часу. Як бачимо, початкова електротонічна депо-
ляризація ініціює зміну проникності для Ма+, а це, відповідно,
сприяє деполяризації (відтворено, за дозволом, з Носікіп АІ_.
Іопіс тоуетепіз апсі еіесігісаі асіміу іп діапі пегуе ТіЬегз. Ргос
К 8ос І_опд 8ег В 1958; 143.1).
ловлення мембранного потенціалу спокою. Крім того, на-
прям електричного градієнта для №+ змінюється на про-
тилежний під час овершута тому, що змінюється мембран-
ний потенціал, і це обмежує надходження в аксон Иа+.
Третім чинником, що забезпечує реполяризацію, є акти-
вування відкриття воріт К+-каналів, яке триває довше, аніж
активування № -каналів, і, отже, максимум провідності
для К+ настає пізніше, ніж для №*. Ефективний рух пози-
тивних зарядів назовні клітини, зумовлений виходом йонів
К+, завершує процес реполяризації. Явище слідової гіпер-
поляризації пояснюють повільним інактивуванням К+-
каналів.
Зменшення позаклітинної концентрації Иа+ спричинює
зменшення потенціалу дії, проте воно незначно впливає
на мембранний потенціал спокою. Незначний вплив на
мембранний потенціал спокою можна пояснити на підста-
ві рівняння Ґольдмана (див. Розділ 1), оскільки проник-
ність мембрани для №+ в стані спокою порівняно неве-
лика. І навпаки, збільшення позаклітинної концентрації
К+ знижує мембранний потенціал спокою.
Хоча під час формування потенціалу дії Иа+ проникає в
нервові клітини, а К? виходить з них, кількість йонів, задія-
них у цих переміщеннях незначна щодо їхньої загальної
кількості.
Факт, що нерв протягом активності отримує Иа+ і втра-
чає К+, досліджено експериментально, проте помітну різ-
ницю виявлено лише в дослідах з тривалим багаторазо-
вим подразненням.
Повільне відкривання та закривання воріт К+-каналів
пояснює також явище акомодації аксона. Якщо деполя-
ризація відбувається швидко, то відкривання № -каналів
зумовлює перевершення сил реполяризації, якщо ж інду-
кована деполяризація повільна, то відкривання К+-кана-
лів встигає зрівноважити поступове в цьому випадку від-
кривання №'-каналів, і потенціал дії не виникає.
Зменшення позаклітинної концентрації Са2+ посилює
збудливість нервових і м’язових клітин шляхом зниження
рівня деполяризації, що потрібно для ініціювання змін і
проникності для Иа+ й К+ та виникнення потенціалу дії.
Навпаки, збільшення позаклітинної концентрації Са2+ ста-
білізує мембрану шляхом зниження збудливості.
Розподіл йонних каналів у мієлінових
нейронах
Як зазначено в Розділі 1, деякі речовини, що специ-
фічно пов’язані з Иа+- і К+-каналами, можуть бути сполу-
чені, позначені і застосовані для ідентифікування локалі- \
зації каналів у клітинній мембрані. Потенціалозалежні
Иа+-канали сконцентровані у вузлах нервового волокна
Ранв’є і початкових сегментах мієлінових нейронів. По-
чатковий сегмент і перший вузол Ранв’є в чутливих ней-
ронах є ділянками, де генеруються імпульси. Інші вузли
Ранв’є - це ділянки, у яких відбувається сальтаторна про-
відність. Кількість Иа+-каналів на 1 мкм2 мієлінового ней-
рона ссавців становить 50-75 на тілі клітини, 350-500 у
початковому сегменті, до 25 на поверхні мієліна, 2000-
12000 у ділянці вузла Ранв’є і 20-25 у терміналах аксона.
На аксонах безмієлінових нейронів ця кількість становить
приблизно 110. У багатьох мієлінових нейронах №‘-ка-
нали межують з К+-каналами, які відіграють важливу роль
у процесі реполяризації.
Джерела енергії та метаболізм нерва
Більша частина енергетичних потреб нерва - приблизно
70% - потрібна для підтримання стану поляризації мемб-
рани за допомогою активності На+-К+-АТФ-ази. Під час
максимальної активності рівень метаболізму в нерві подво-
юється (для порівняння: рівень метаболізму в скелетному
м’язі збільшується в 100 разів). Гальмування утворень мо-
лочної кислоти не впливає на функцію м’яза.
Як і в м’язі, у нерві відбувається теплоутворення в стані
спокою; початкове теплоутворення - під час потенціалу
дії і затримане - після активності. Однак у нерві затримане •
теплоутворення, що виникає після поодинокого імпульсу,
в 30 разів перевищує початкове. Є докази, що початкове
теплоутворення відбувається протягом слідової деполяри-
зації активніше, ніж під час піка потенціалу. Метаболізм у
м’язах детально описаний у Розділі 3.
ВЛАСТИВОСТІ ЗМІШАНИХ НЕРВІВ
Периферійні нерви ссавців утворені великою кількістю
аксонів, оточених волокнистою обгорткою - епіневрієм.
Зміни потенціалів, які реєструють зовнішньоклітинно,
унаслідок цього становлять алгебричну суму змін потен-
ціалів багатьох аксонів. Сила порогового струму для окре-
мих аксонів нерва і відстань від електродів, які завдають
подразнення, відрізняються. Підпорогові подразники не-
достатні для виникнення збудження. Подразники порогової
сили спричинюють збудження в аксонах, що мають низь-
кий поріг збудливості; унаслідок цього виникають незначні
зміни потенціалів. Якщо ж інтенсивність подразнюваль-
ного струму зростає, то виникає збудження і в аксонах, що
мають високий поріг збудливості. Посилення електричних
54 / РОЗДІЛ 2
явищ пропорційне до сили подразнювального струму доти,
доки процес не охоплює всі аксони нерва. Подразник, який
спричинює збудження всіх аксонів нерва, називають мак-
симальним; подальше підвищення його рівня (надмак-
симальний подразник) уже не зумовлює збільшення за-
фіксованого потенціалу.
Складний потенціал дії
Іншою властивістю змішаних нервів, що відрізняє їх
від ізольованого аксона, є наявність множинних піків у
кривій потенціалу дії. Цей багатопіковий потенціал дії
називають складним потенціалом дії (рис. 2-13). Його
особливий вигляд зумовлений тим, що змішані нерви утво-
рені групами волокон, які мають різну швидкість провід-
ності. Отже, коли подразнені всі волокна нерва, то актив-
ність швидкопровідних волокон досягає реєструвальних
електродів раніше, ніж активність повільнопровідних, і
чим більшою є відстань між подразнювальними і реєстру-
вальними електродами, тим більше розмежовані піки по-
тенціалів швидкопровідних і повільнопровідних волокон.
Кількість і розмір піків залежать від типів волокон, з яких
складається конкретний досліджуваний нерв. У разі вико-
ристання подразника, меншого за силою від максималь-
ного, форма складного потенціалу дії теж залежить від
кількості і типу волокон, що відповідають на подразнення.
ТИПИ НЕРВОВИХ ВОЛОКОН
ТА ЇХНЯ ФУНКЦІЯ
Ерлянґер і Ґассер розподілили нервові волокна ссавців
на групи А, В та С, а групу А - ще на а-, [3-, у- і 5-волокна.
Шляхом порівняння неврологічних ушкоджень після обе-
режного перерізання заднього корінця, а також інших нер-
вових структур за умов експерименту з наступними гісто-
логічними змінами в нервових волокнах вдалося визначити
функції і гістологічні характеристики кожної з груп воло-
кон, подразнення яких призводить до утворення різних
піків складного потенціалу дії. З’ясовано, що великі аксони
переважно пов’язані з пропріоцептивним відчуттям, сома-
тичною руховою функцією, свідомим відчуттям дотику і
Потенціал дії
Подразник Напрям поширення імпульсу
Рис. 2-13. Складний потенціал дії. Зображено криві запису,
отримані за допомогою реєструвальних електродів, що роз-
міщені на змішаному нерві на різних відстанях від подразню-
вальних електродів.
тиску, тоді як менші передають відчуття болю і темпера-
тури, а також імпульси, що забезпечують автономні функ-
ції. В табл. 2-1 наведено перелік різного типу волокон із
зазначенням їхнього діаметра, електричних характеристик
і функцій. С-волокна заднього корінця передають імпульси,
генеровані больовими і температурними рецепторами. По-
дальші дослідження дали змогу виявити, що не всі охоплені
класифікацією компоненти є однорідними, і тому деякі фі-
зіологи використовують для класифікації чутливих волокон
іншу - цифрову систему (Іа, Ів, II, III, IV), хоча вона теж
має недоліки. В табл. 2-2 наведено порівняння літерної і
цифрової систем класифікації.
Крім різниці у швидкості передавання і діаметрах, різні
типи волокон периферійних нервів відрізняються чутли-
вістю до гіпоксії та засобів знечулення (табл. 2-3). Це має
як фізіологічне, так і клінічне значення. Анестетики місце-
вої дії гальмують передавання у волокнах групи С швидше,
ніж вони діють на дотикові волокна групи А. Навпаки, стис-
кання нерва може спричинити втрату провідності у великих
за діаметром рухових волокнах і волокнах, що передають
відчуття дотику і тиску, тоді як больове відчуття практично
не зміниться. Особливості цього типу волокон можна оці-
нити на прикладі стискання нервів, що виникає в ділянці
плеча під час тривалого і міцного сну в осіб, які сплять
підклавши руку під голову. Оскільки цей тривалий сон у
такому положенні нерідко трапляється після алкогольної
інтоксикації в дні відпочинку, то отримане ушкодження на-
звали “паралічем суботньої ночі”, або “паралічем неділь-
ного ранку”.
НЕЙРОТРОФНІ РЕЧОВИНИ
Трофічні фактори нервів
Виділено і вивчено велику кількість білків, потрібних
для життєдіяльності і росту нейронів. Окремі з них - ней-
ротрофіни - утворені м’язами або іншими структурами,
що їх іннервують нейрони, інші виділені астроцитами. Ці
білки зв’язуються з рецепторами нервових закінчень, ін-
терналізуються і ретроградно переміщуються до тіла нер-
вової клітини, де сприяють синтезу білків, потрібних для
розвитку, росту і життєдіяльності нейронів. Інші нейро-
трофіни утворюються в нейронах, антероградно транс-
портуються до нервових закінчень; вони потрібні для нор-
мального функціювання постсинаптичного нейрона.
Рецептори
У табл. 2-4 наведені чотири достеменно визначені ней-
ротрофіни та їхні високоафінні рецептори. Кожен з цих
Тгк рецепторів димеризується і таким способом ініціює
автофосфорилювання в доменах цитоплазматичної тиро-
зинкінази рецепторів. Відомий також додатковий низько-
афінний рецептор ФРН - фактор росту нервів; білок з
молекулярною масою 75 кДа, його називають р75ІЧ1тк. Цей
рецептор зв’язує всі чотири названі нейротрофіни з одна-
ковим ступенем афінності. Є підстави вважати, що він
здатний утворювати гетеродимер з мономером ТгкА. Такий
димер підвищує афінність і специфічність зв’язування
фактора росту нервів. Однак з’ясовано: гомодимери р75ІЧ1тк,
які зв’язують нейротрофіни, можуть самі бути посередни-
ЗБУДЛИВА ТКАНИНА: НЕРВОВА / 55
Таблиця 2-1. Типи нервових волокон у нервах ссавців1
Тип волокна Функція Діаметр волокна, мкм Швидкість передавання, м/с Тривалість піка, мс Період абсолютної рефрактерності, мс
А а Пропріоцептивна, соматомоторна 12-20 70-120 0,4-0,5 0,4-1,0
р Дотик, тиск 5-12 30-70
7 Рухова щодо м’язових веретен 3-6 15-30
5 Біль, холод, дотик 2-5 12-30
В Прегангліонарне автономне волокно <3 3-15 1,2 1,2
С Задній корінець Біль, температура, окремі види механорецепції, рефлекторні відповіді 0,4-1,2 0,5-2 2 2
Симпатичне Постгангліонарне симпатичне волокно 0,3-1,3 0,7-2,3 2 2
1 А- і В-волокна мієлінові, С-волокна безмієлінові.
ками реакцій, що ведуть до апоптозу - явища, протилеж-
ного до звичайного ростостимулювального і трофічного
ефекту нейротрофінів.
Фактор росту нервів
Першим дослідженим нейротрофіном був фактор рос-
ту нервів (ФРН) білкового типу, потрібний для росту та
функціювання симпатичних і деяких чутливих нейронів.
Цей фактор є в багатьох тваринних видів, у тім числі і в
людини: міститься в різних тканинах. Особливо високу
його концентрацію виявлено в підщелепній залозі самців
миші. Після кастрації самців концентрація ФРН зменшу-
ється до рівня, властивого самкам. Фактор побудований з
двох ос-, двох р- і двох у-субодиниць. У р-субодиницях,
молекулярна маса кожної з яких 13 200, є уся ростостиму-
лювальна активність, ос-субодиниці виявляють трипсино-
подібну дію, а у-субодиниці - це серинпротеази. Функція
цих протеаз нез’ясована. Структура р-одиниці ФРН нага-
дує структуру інсуліну.
ФРН проникає в нейрони з позачерепних органів, що
їх іннервують ці нейрони, і переміщується ретроградно від
нервових закінчень до тіл нервових клітин. Крім того, ФРН
Таблиця 2-2. Цифрова система, яку інколи використовують
для класифікації волокон чутливих нейронів
Номер Початок волокна Тип волокна
Іа Ів М’язове веретено, кільцево- спіральне закінчення Сухожильний орган Ґольджі Аа Аа
II М’язове веретено, гроноподібне розширення; рецептори дотику, тиску АР
III Рецептори болю, холоду і деякі рецептори дотику АЗ
IV Рецептори болю, температури й інші С-волокно заднього корінця
міститься в головному мозку й, очевидно, необхідний для
росту і життєдіяльності холінергічних нейронів основи пе-
реднього мозку та смугастого тіла. Ін’єкція антитіл до ФРН
новонародженим тваринам спричинює майже повну де-
струкцію симпатичних вузлів, зумовлюючи імуносимпа-
тектомію. Можна вважати, що під впливом ФРН явища
апоптозу в нейронах менше виражені.
Інші нейротрофіни
Продукований мозком нейротрофний фактор (ВОИР -
від англ. Ьгаіп-сіегіуесі пеигоігоріс Гасіог), нейротрофін-3
(N7-3), N7-4/5 і ФРН забезпечують різні сторони життє-
діяльності нейронів, запобігаючи апоптозу, хоча їхні
функції перекриваються. Створення дефіциту N7-3 шляхом
нокауту гена спричинює помітну втрату механорецепторів
у шкірі (див. Розділ 7) навіть у гетерозиготних організмах.
ІИЖГ діє швидко і може фактично деполяризувати ней-
рони. Дефіцит ВОЖ’ у мишей спричинює втрату перифе-
рійних чутливих нейронів і глибокі дегенеративні зміни в
вестибулярних вузлах, а також пригнічення Ь7Р (див. Роз-
діл 4). Описаний також фактор N7-6.
Інші фактори росту нейронів
Клітини Шванна й астроцити виділяють циліарний
нейротрофний фактор (€N77 - від англ. сіїіагу пеиго-
Ігоріс Гасіог), який сприяє виживанню ушкоджених і
зародкових нейронів спинного мозку; тому його можна
Таблиця 2-3. Порівняльна чутливість нервових волокон
ссавців А, В і С типів до різних інгібіторів провідності
Чутливість до Найбільше чутливі Середньо- чутливі Найменше чутливі
Гіпоксія В А С
Стискання А В С
Анестетики місцевої дії С В А
56 / РОЗДІЛ 2
Таблиця 2-4. Нейротрофіни
Нейротрофін Рецептор
Фактор росту нервів ТгкА
Нейротрофний фактор, продукований мозком ТгкВ
Нейротрофін 3 ТгкС, меншою мірою ТгкА і ТгкВ
Нейротрофін 4/5 ТгкВ
застосовувати для лікування хвороб, у разі яких відбува-
ються дегенеративні зміни в нейронах. Нейротрофний
фактор, продукований лінією гліальних клітин (СВІ\Г
- від англ. £Ііа1 сеі 11 іпе-бегіуеб пеигофоріс Гасіог), активізує
дофамінергічні нейрони середнього мозку іп уйго. У тварин
з нокаутом дофамінергічні нейрони виглядають нор-
мальними. Однак у них нема нирок і порушений розвиток
ентеричної нервової системи (див. Розділ 26). Іншим фак-
тором, що сприяє росту нейронів, є інгібувальний фактор
лейкемії (НЕ - від англ. Іеикетіа іпЬіЬйогу Гасіог). Крім
того, нейрони, як і інші клітини, реагують на інсуліно-
подібний фактор росту І (ІФР-І), різні форми трансфор-
мувального фактора росту (ТФР), фібробластний фак-
тор росту (ЕСЕ - від англ. ГіЬгоЬІазІ £ґоМЬ Гасіог) і фактор
Рис. 2-15. Глютамат-глютаміновий цикл між глютамінергіч-
ними нейронами й астроцитами. Глютамат (бій), що виділився
в синаптичну щілину, зв’язує І\Іа+-залежний глютаматний
транспортер і в астроциті перетворює на глютамін (6Іп). Глю-
коза з капілярів проникає в астроцити і нейрони. В астроци-
тах вона метаболізується до лактату з утворенням двох моле-
кул АТФ. Одна з них забезпечує перетворення глютамату на
глютамін, а іншу використовує І\Іа+-К+-АТФ-аза для перемі-
щення трьох йонів І\Іа+ з клітини в обмін на два йони К+. У
нейронах глюкоза метаболізується в циклі лимонної кислоти
з утворенням 34 молекул АТФ.
Рис. 2-14. Гліальні клітини головного мозку (відтворено за дозволом з Зипциеіга І_, Сагпеіго 3, КеІІеу К Вазіс Нізіоіоду, 91Н есі.
Мс6га\л/-НіІІ, 1998).
ЗБУДЛИВА ТКАНИНА: НЕРВОВА / 57
росту тромбоциту (РОСЕ - від англ. ріаіеіеі-сіегіуесі §гоШй
іасіог). Отже, регулювання росту нейронів є складним
процесом.
ГЛІЯ
У складі нервової системи, окрім нейронів, є гліальні
клітини (нсйроглія). Ці клітини численні; як зазначено
вище, їхня кількість у 10-50 разів перевищує кількість ней-
ронів. Клітини Шванна, що обгортають аксони в складі
периферійних нервів, теж належать до глії. У ЦНС містять-
ся три головні типи гліальних клітин. Клітини мікроглії
(рис. 2-14) - це клітини-санітари, що нагадують тканинні
макрофаги. Вони походять, імовірно, з кісткового мозку і
потрапляють до нервової системи по кровоносних судинах.
Функцією олігодендроцитів є утворення мієліну (див. рис.
2-3). Астроцити розповсюджені по всьому головному
мозку. їх поділяють на два підтипи. Волокнисті астроци-
ти, які містять багато проміжних філаментів, є переважно
в білій речовині. Протоплазматичні астроцити містяться
в сірій речовині і вирізняються зернистою цитоплазмою.
Відростки астроцитів обох підтипів прямують до крово-
носних капілярів і разом з ними беруть участь у формуванні
гематоенцефалічного бар’єра (див. Розділ 32). їхні відрост-
ки теж утворюють синаптичні контакти на поверхні нер-
вових клітин.
Астроцити мають мембранний потенціал, що залежить
від позаклітинної концентрації К+, проте не генерує поши-
рення потенціалів. Астроцити виділяють речовини, що
трофічно впливають на нейрони і забезпечують сталість
необхідної концентрації йонів та нервових трансмітерів,
акумулюючи К+ і нервові трансмітери - глютамат і у-аміно-
масляну кислоту (ГАМК) (див. Розділ 4).
Характер взаємодії між астроцитами і глютамінергіч-
ними нейронами показано на рис. 2-15. Виділений нейро-
нами глютамат поглинають астроцити і перетворюють на
глютамін. Глютамін повертається в нейрони і знову пере-
творюється в глютамат, що виділяється як синаптичний
трансмітер.
з
Збудлива тканина: м’язова
ВСТУП
М’язові клітини, як і нейрони, можуть збуджуватись під
дією хімічних, електричних та механічних подразників,
унаслідок чого виникає потенціал дії, який передається уз-
довж мембрани цих клітин. Суттєвою відмінністю м’язових
клітин від нейронів є те, що вони мають скоротливий меха-
нізм, активований потенціалом дії. Скоротливі білки ак-
тин і міозин містяться в м’язовій тканині у великій кіль-
кості та спричинюють скорочення. Вони наявні також у
багатьох інших типах клітин. Як зазначено у Розділі 1, бі-
лок міозин, який зв’язує актин, виконує функцію молеку-
лярного двигуна і перетворює енергію, що вивільняється
внаслідок гідролізу АТФ, у рух клітинних компонентів один
уздовж іншого.
М’язи прийнято поділяти на три головні типи - ске-
летні, серцевий та гладкі, хоча гладкі м’язи не є однорід-
ною окремою категорією. Скелетні м’язи утворюють ве-
ликий об’єм соматичної мускулатури. Вони мають добре
виражену поперечну смугастість і в нормі, якщо немає нер-
вового подразнення, не скорочуються. У цих м’язах не за-
фіксовано анатомічних та функційних зв’язків між окре-
мими м’язовими волокнами. Регулювання їхніх скорочень
відбувається свідомо (довільно). Серцевий м’яз також має
поперечно-смугасту структуру, однак він є функційним
синцитієм і скорочується ритмічно, навіть якщо не просте-
жується зовнішня іннервація, завдяки наявності в міокарді
пейсмейкерних1 клітин, які створюють спонтанні нервові
імпульси. У гладких м’язах поперечної смугастості нема.
Цей тип мускулатури властивий більшості порожнистих
органів, проте він теж є функційним синцитієм і містить
пейсмейкерні клітини, які утворюють хаотичні нервові ім-
пульси. В очному яблуку і деяких інших органах містить-
ся особливий тип м’язової тканини, позбавлений спонтан-
ної активності, він дещо нагадує за структурою скелетні
м’язи.
СКЕЛЕТНІ М’ЯЗИ
МОРФОЛОГІЯ
Структура
Скелетні м’язи складаються з окремих м’язових воло-
кон, що є так званими будівельними елементами м’язової
тканини. Більшість скелетних м’язів починається і закін-
чується сухожилками, м’язові волокна проходять паралель-
но до закінчень сухожилків. Отже, у разі скорочення м’язів
сила скорочень окремих їхніх елементів додається. Кожне
м’язове волокно - це окрема багатоядерна довгаста клітина
циліндричної форми, оточена клітинною мембраною -
сарколемою (рис. 3-1). Між клітинами немає синцитіаль-
них містків. М’язові волокна складаються з міофібрил, а
ті, відповідно, - з окремих міофіламентів, утворених ско-
ротливими білками.
Скоротливий механізм м’язової тканини формують біл-
ки міозин II (молекулярна маса 43 000), тропоміозин (мо-
лекулярна маса 70 000) і тропонін. Тропонін складається
з трьох субодиниць - тропоніну І, тропоніну Т та тропо-
ніну С; молекулярна маса кожної з них коливається в межах
18 000-35 000. Інші білки м’язової тканини виконують важ-
ливу функцію координації скоротливих білків.
Смугастість
Під час електронної мікроскопії унаслідок відмінності
рефрактерних індексів у різних частинах м’язового волокна
простежуються характерні поперечні смуги, які чітко
видно у скелетних м’язах. На рис. 3-2 окремі частини попе-
речної смуги позначені латинськими літерами. Світлу I-
смугу перетинає темна /-лінія, а темна А-смуга в центрі
містить світлу Н-смугу. Посередині Н-смуги є поперечна
М-лінія, яку разом з вузькими світлими проміжками з боків
деколи називають псевдо Н-зоною. Ділянку між двома
найближчими /-лініями називають саркомером. Порядок
взаємного розташування ниток актину, міозину та інших
білків, завдяки якому утворюється описана вище структура,
зображений на рис. 3-3. Товсті міофіламенти, діаметр яких
майже вдвічі більший, ніж у тонких, складаються з міозину;
а тонкі - з актину, тропоміозину та тропоніну. Крім того,
товсті міофіламенти утворюють А-смуги (анізотропні
диски), тоді як сукупність тонких - менш щільні І-смуги
(ізотропні диски). Світлі Н-смуги у центрі А-смуг - це
ділянки, де в розслабленому стані м’яза тонкі міофіламен-
ти не накладаються на товсті. Лінії / перетинають фібри-
ли, з’єднуючись з тонкими міофіламентами. Під час до-
слідження А-смуги під електронним мікроскопом можна
виявити, що кожний товстий міофіламент оточений шість-
ма тонкими, які утворюють правильний шестикутник.
Різновид білка міозину, що міститься в м’язовій тканині,
називають міозин II. Він має дві глобулярні головки і дов-
гий хвіст (див. рис. 1-11). Головки і шийки міозинових мо-
лекул утворюють поперечні з’єднання з актином. Міозин
1 Пейсмейкерна клітина - атипова м’язова малодиференційова-
на клітина
ЗБУДЛИВА ТКАНИНА: М’ЯЗОВА / 59
Рис. 3-1. Скелетний м’яз у ссавців М’язове волокно оточене сарколемою; його поперечний переріз відображає окремі міофібрили
(1). На перерізі видно товсті та тонкі філаменти Саркоплазматична сітка (2) з термінальними цистернами (3) оточує кожну
міофібрилу. Система Т-трубок (4) (випинання сарколеми) стикається з міофібрилами через А- та І-смуги в кожному саркомері;
Т-система і цистерни саркоплазматичної сітки утворюють тріаду. Базальна мембрана (5) оточує сарколему; 6 - мітохондрії
(модифіковано і відтворено за дозволом з Кгзііс НУ. ІЛігазігизіиге ої ійе Маттаїіап СеІІ, Зргіпдег, 1979).
містить легкі та важкі ланцюги, а його головки складаються
з легких ланцюгів та амінових закінчень важких ланцюгів.
У головках є актинозв’язувальний сайт, а також каталітич-
ний сайт, у якому відбувається гідроліз АТФ (див. нижче).
Молекули міозину розташовані симетрично по обидва боки
центру саркомера, і власне завдяки такому розміщенню
утворюються світлі ділянки в псевдо Н-зоні. Місцем, де
змінюється полярність молекул міозину в кожному товсто-
му міофіламенті, є М-лінія. У світлих ділянках наявні тонкі
поперечні з’єднання, які утримують товсті міофіламенти
в певному порядку. В кожному товстому сегменті міститься
декілька сотень міозинових молекул.
Рис. 3-2. Електронна мікроскопія литкового м’яза людини. Угорі позначено смуги та лінії (збільшено у 13 000 разів) (за 8М
\А/аІкег та 6В Зсйгосй)
62 / РОЗДІЛ З
Молекулярні основи м’язового скорочення
Укорочення скоротливих елементів м’яза відбувається
внаслідок ковзання тонких міофіламентів по товстих.
Ширина А-смуг є сталою, тоді як /-лінії в разі скорочення
м’яза зближуються, а під час розтягнення - віддаляються
(див. рис. 3-3).
Ковзання у випадку скорочення м’яза виникає, коли
головки міозину міцно зв’язуються з актином, шийка міо-
зинової молекули згинається, втягуючи актинове волокно
в міозинову вилку, а потім відділяється. Інтенсивність
ковзання залежить від паралельного гідролізу АТФ. Де-
тально цей процес ще не з’ясовано; він може складатися з
декількох кроків, проте загалом цикл є таким, як зображено
на рис. 3-6. Велика кількість головок приєднується одно-
часно, що приводить до максимального скорочення м’яза.
Кожен цикл ковзання скорочує саркомер на 10 нм. Тонка
нитка контактує з близько 500 міозиновими голівками,
кожна з яких у випадку швидкого скорочення м’яза виконує
за 1 с близько п’яти повних циклів приєднання-від’єднання
від молекули актину.
Процес, унаслідок якого деполяризація м’язового волок-
на приводить до його скорочення, називають збудливо-
скоротливою координацією. Потенціал дії надходить до
всіх фібрил у волокні через Т-систему (табл. 3-2). Він спри-
чинює вивільнення Са2+ з термінальних цистерн (мішкопо-
дібних розширень саркоплазматичної сітки, розміщених з
боків від Т-системи), а це сприяє скороченню м’яза .
Йони Са2+ ініціюють скорочення, зв’язуючись з тропо-
ніном С. Коли м’яз перебуває в стані спокою, тропонін І
щільно зв’язаний з актином, а тропоміозин покриває ті
сайти, де головки міозину з’єднані з актином. Отже, тропо-
нін-тропоміозиновий комплекс є розслаблювальним біл-
ком, який інгібує взаємодію між актином та міозином. Коли
йони Са2+, що вивільнились унаслідок поширення потен-
ціалу дії, з’єднуються з тропоніном С, то зв’язок тропоні-
Рис. 3-6. Механізм дії міозину у скелетних м’язах. Головка
міозину відділяється від актину (угорі), просувається на де-
кілька нм паралельно до актинового ланцюга і знову приєдну-
ється (посередині). Після цього головка молекули міозину
згинається на шийці і ковзає вздовж актинового ланцюга, тяг-
нучи за собою всю молекулу. На відстані 3,5 нм від сайта
зв’язування з актином є сайт зв’язування АТФ. Гідроліз АТФ
відбувається під час ковзання, хоча детальний зв’язок цього
процесу з рухом молекул актину та міозину одна щодо іншої
ще не з’ясовано (модифіковано з Ігуіпд М, богсітап ¥Е; Ап-
оійег зіер айеасі Тог туозіп. ІМаТиге 1999;398:463).
мс
Рис. 3-5. Електричні та механічні відповіді волокон скелетного
м’яза ссавців на поодинокі подразнення максимальної сили
Електрична (зміна різниці потенціалів, мВ) і механічна (Т, у
довільних одиницях) відповідь показані на графіку зі спільною
віссю абсцис (час, мс)
ну І з актином значно послаблюється, і внаслідок цього
молекули тропоміозину зміщуються вбік (рис. 3-7). Після
такого руху оголюються сайти зв’язування з головками міо-
зину. Відбувається розщеплення АТФ і скорочення волокон.
Зв’язування однієї молекули тропоніну з йоном Са2+ при-
водить до оголення семи сайтів зв’язування міозину.
Відразу ж після вивільнення Са2+ саркоплазматична
сітка починає відновлювати його запас шляхом активного
транспортування в довгасту частину сітки. Цей процес
виконує помпа Са2+-М§2+-АТФ-аза. У подальшому Са2+
шляхом дифузії переходить у термінальні цистерни, де й
зберігається до наступного потенціалу дії. Якщо концент-
рація Са2+ за межами сітки значно зменшується, то хімічна
взаємодія між міозином та актином припиняється, і м’яз
ЗБУДЛИВА ТКАНИНА: М’ЯЗОВА / 63
Таблиця 3-2. Послідовність явищ у разі скорочення
і розслаблення скелетних м’язів
Скорочення1
(1) Поява імпульсу в руховому нейроні
(2) Вивільнення ацетилхоліну у кінцевій пластинці
(3) Зв’язування ацетилхоліну з нікотиновими
ацетилхоліновими рецепторами
(4) Збільшення проникності мембрани кінцевої
пластинки до Ма+ і К+
(5) Утворення потенціалу кінцевої пластинки
(6) Утворення потенціалу дії в м’язових волокнах
(7) Поширення деполяризації у Т-трубках
(8) Вивільнення Са2+ з термінальних цистерн
саркоплазматичної сітки і дифузія його в товсті і
тонкі волокна
(9) Зв’язування Са2+ з тропоніном С, оголення ділянок
зв’язування міозину з актином
(10) Утворення перехресних зв’язків між актином та
міозином і ковзання тонких волокон по товстих, що
спричинює вкорочення м’яза
Розслаблення
(1) Са2+ повертається в саркоплазматичну сітку
(2) Вивільнення Са2+, що був зв’язаний з тропоніном
(3) Припинення взаємодії між актином і міозином
1 Явища 1-4 описані в Розділі 4.
розслаблюється. Зазначимо, що АТФ забезпечує енергією
процеси як скорочення, так і розслаблення. Якщо транс-
портування Са2+ у саркоплазматичній сітці пригнічене, то
розслаблення не відбувається навіть у разі, коли нема
потенціалів дії. Постійне тривале скорочення м’яза, що
виникає внаслідок цього, називають контрактурою.
Саркоплазматична сітка унаслідок деполяризації мем-
брани Т-трубочок активується завдяки дигідропіридино-
вим рецепторам, які є потенціалозалежними Са2+-кана-
лами в мембрані Т-трубок. У міокарді надходження Са2+
через ці канали приводить до вивільнення Са2+, що містить-
ся в саркоплазматичній сітці, проте в скелетних м’язах над-
ходження Са2+ з ПКР не обов’язкове для такого вивіль-
нення. Замість цього дигідропіридинові рецептори відігра-
ють роль електричного реле, яке регулює надходження Са2+
з розташованої поряд саркоплазматичної сітки. Дигідропі-
ридинові рецептори одержали назву від медикаментозного
препарата-дигідропіридину, який, власне, блокує їх. Такий
рецептор має чотири гомологічні ділянки, кожна з яких
перетинає Т-трубку шість разів. Канал Са2+ саркоплазма-
тичної сітки, відкриття якого забезпечує викидання йонів
Са2+, не є потенціалозалежним; його названо ріанодино-
вим рецептором, тому що його блокує рослинний алкалоїд
ріанодин. Він тісно пов’язаний з ІФ3-рецептором - ліґанд-
ним Са2+-каналом, який, зв’язуючись з ІФ3, забезпечує над-
ходження Са2+ в цитоплазму з ендоплазматичної сітки (див.
Розділ 1).
Процеси, що забезпечують скорочення та розслаблення
м’яза, наведені в табл. 3-2.
Типи скорочень
Під час скорочення м’язів зменшується довжина скорот-
ливих елементів, та оскільки м’язи містять як еластичні,
так і в’язкі елементи, то скорочення може відбуватись без
значного зменшення загальної довжини м’яза (рис. 3-8А).
Таке скорочення називають ізометричним (від гр. І808 -
сталий, теїгоз - довжина). Скорочення м’яза у разі сталого
навантаження із наближенням його кінців називають
ІЗОТОНІЧНИМ (від гр. І808 - СТаЛИЙ, І0ПЦ8 - напруження).
Оскільки робота є добутком сили на відстань, то у випадку
ізотонічного скорочення виконується робота, тоді як у разі
ізометричного - ні. В інших випадках м’язи під час скоро-
чення можуть виконувати негативну роботу. Це відбува-
Рис. 3-7. Ініціація м’язового скорочення за допомогою Са2+. Коли Са2+ зв’язується з тропоніном С, тропоміозин зміщується
латерально, оголюючи сайт зв’язування міозину з актином (темна ділянка). Згодом відбувається зв’язування головки міозину,
гідроліз АТФ та зміна конфігурації головки і шийки молекули міозину. Для зручності показано лише одну з двох головок
молекули міозину-ІІ.
64 / РОЗДІЛ З
ється, наприклад, унаслідок опускання важких предметів.
У цьому разі м’язи активно опираються опусканню пред-
мета, проте в кінцевому підсумку видовжуються, незва-
жаючи на їхнє скорочення.
Сумація скорочень
Електрична відповідь м’язового волокна на повторне
подразнення подібна до тої, що виникає у нервах. Волокно
є електрично рефрактерним лише під час фази підвищення
і частково під час фази спадання потенціалу дії. У цей
момент скорочення, що його ініціює перший подразник,
лише починається. Оскільки ж для скоротливого механізму
не характерний рефрактерний період, то повторне стиму-
лювання м’язових волокон перед їхнім розслабленням при-
водить до додаткового активування скоротливих елементів,
і в цьому разі додаткова скоротлива відповідь накладається
на вже наявне скорочення. Це явище назвали сумац’я ско-
рочень: тонус м’яза, що розвивається під час сумації, знач-
но більший, ніж під час поодинокого скорочення м’яза. У
разі швидкого повторення подразників активування скорот-
ливого механізму багаторазово повторюється, перш ніж
Рис. 3-8. А: препарат м’яза, приготований для запису ізото-
нічних скорочень. В: препарат м’яза, приготований для запису
ізометричних скорочень. А - м’яз з’єднаний із записувальним
важелем, фіксованим до затискача. В - м’яз з’єднаний з елек-
тронним пристроєм, який вимірює силу скорочення, якщо дов-
жина м’яза стала.
м’яз встигає розслабитись, унаслідок чого окремі відповіді
зливаються в одне тривале скорочення. Такий процес нази-
вають тетанусом (тетанічне скорочення). У випадку пов-
ного (суцільного) тетанусу в інтервалах між подразни-
ками не відбувається жодного розслаблення м’яза, тоді як
у разі неповного (зубчатого) тетанусу скорочення під дією
сумованих подразників чергується з періодами часткового
розслаблення. Під час повного тетанусу тонус м’яза майже
в чотири рази перевищує тонус у разі його поодиноких
скорочень. Процес розвитку неповного, а згодом - повного
тетанусу під впливом подразників частоти, що зростає,
показаний на рис. 3-9.
Частота подразників, за якої відбувається сумація скоро-
чень, визначена тривалістю скорочення конкретного м’яза.
Наприклад, якщо тривалість посмикування становить
10 мс, то за частоти подразнення до 1/10 мс (100/с) про-
стежуються поодинокі скоротливі відповіді, що чергуються
з періодами повного розслаблення, а за частоти понад 100/с
виникає їхня сумація.
“Феномен сходів”
Якщо м’яз піддається дії подразників максимальної
сили, то за частоти, що наближена до тої, за якої виникає
тетанус, м’язовий тонус із кожним скороченням поступово
посилюється доти, доки після декількох скорочень не буде
сталим. Це явище відоме як феномен сходів або треп (англ.
ігерре, від гр. Ігерр - сходи, драбина). Воно, зокрема, трап-
ляється в міокарді. Вважають, що цей феномен спричине-
ний надходженням додаткової кількості Са2+, які зв’язують-
ся з тропоніном С. Важливо не плутати феномен сходів із
сумацією скорочень і тетанусом.
Співвідношення між довжиною м’яза,
м’язовим тонусом та швидкістю скорочення
Тонус, що розвивається в м’язі під час ізометричного
скорочення (повний тонус), і пасивний тонус, притаман-
ний м’язові у стані спокою, залежать від довжини м’язового
волокна. Цей зв’язок можна досліджувати на суцільному
препараті скелетного м’яза, як це схематично зображено
на рис. 3-8В. Довжина м’яза змінюється внаслідок збіль-
шення чи зменшення відстані між його кінцями. Пасивний
тонус вимірюють для кожного послідовного значення дов-
жини м’яза, потім м’яз піддають електричному стимулю-
ванню і визначають повний його тонус. Різницю між цими
двома показниками для будь-якої довжини м’яза, спричи-
нену процесом скорочення, називають активним тонусом.
Графіки залежності пасивного та повного тонусу від дов-
жини м’яза показані нарис. 3-10. Подібні криві одержують
у разі дослідження окремих м’язових волокон. Довжину
м’яза, за якої активний тонус максимальний, називають
довжиною спокою. Назва походить від експериментів, під
час яких доведено, що в більшості м’язів максимальний
тонус виникає при тій довжині, яка характерна для стану
спокою.
Співвідношення між довжиною і тонусом скелетних
м’язів пояснюють механізмом ковзання волокон, що
відбувається під час скорочення м’язів. У разі ізометрич-
ного скорочення м’язових волокон тонус прямо пропор-
ційний до кількості перехресних з’єднань між молекулами
актину та міозину. Внаслідок розтягу м’язів взаємодія між
ЗБУДЛИВА ТКАНИНА: М’ЯЗОВА / 65
Рис. 3-9. Тетанус. Ізометричне скорочення поодинокого м’язового волокна під час зростання або зменшення частоти подразника.
Відстань між двома крапками відповідає проміжку часу 0,2 с (відтворено за дозволом з ВисґіІНаІ Р: Оап ВіоІ. Месі 1942; 17;1).
актином та міозином послаблюється і кількість перехрес-
них з’єднань зменшується. Відповідно, коли довжина м’яза
значно менша, ніж довжина в стані спокою, то відстань,
на яку можуть зміщуватись тонкі м’язові волокна, значно
зменшується.
Швидкість скорочення м’язів обернено пропорційна до
навантаження, що припадає на них. Для кожного заданого
значення навантажень швидкість скорочення максималь-
на за довжини спокою і сповільнюється, якщо довжина
м’яза збільшується або зменшується.
Типи м’язових волокон
Волокна скелетних м’язів у загальних рисах подібні,
однак скелетні м’язи - це різнорідна тканина, що склада-
ється з волокон, які відрізняються за активністю міозинової
АТФ-ази, швидкістю скорочення та іншими характерис-
тиками. Загалом волокна поділяють на два типи (тип І і
тип II), хоча обидва ці типи є насправді спектром різнома-
Збільшення довжини м’яза, см
Рис. 3-10. Співвідношення між довжиною та напруженням для
трицепсу людини. Крива пасивного напруження відповідає
силі, яку розвиває цей скелетний м’яз за певної довжини без
стимулювання. Крива загального напруження відображає си-
лу, що виникає у випадку ізометричного скорочення м’яза у
відповідь на подразник максимальної сили. Активне напру-
ження - це різниця між цими двома показниками.
6 367-2
нітних волокон. Головні властивості волокон типів І та II
наведені в табл. 3-3.
М’язи, що містять багато волокон типу І, називають
червоними м’язами, оскільки вони виглядають темніши-
ми від інших. Червоні м’язи, які повільно реагують і мають
триваліший латентний період, призначені для тривалих
повільних скорочень, головна функція яких - підтримання
сталого положення тіла. Білі м’язи, які складаються пере-
важно з волокон типу II, мають коротку тривалість скоро-
чення і призначені для точних координованих рухів. М’язи
очного яблука і деякі з м’язів кисті містять багато волокон
типу II, отже, їх класифікують як білі.
Ізоформи м’язових білків та їхнє генетичне
регулювання
В основі відмінностей між м’язовими волокнами є різ-
ниця між білками, з яких вони складаються. Більшість біл-
ків кодовані так званими мультигенами.
Виділяють десять різних ізоформ важких ланцюгів міо-
зину (ВЛМ). Ці ізоформи подібні за біологічною актив-
ністю, однак мають різний амінокислотний склад. У кожно-
му з двох типів легких ланцюгів також розрізняють повіль-
ні та швидкі ізоформи. Вважають, що є лише одна форма
Таблиця 3-3. Класифікація типів м’язових волокон1
Тип І Тип II
Інші назви Повільні, окисні, червоні Швидкі, гліколітичні, білі
Активність міозинової АТФ- ази " Низька Висока
Здатність саркоплазма- тичної сітки транспор- тувати Са2+ Помірна Висока
Діаметр Помірний Великий
Резерви системи гліколізу Помірні Високі
Окиснювальна здатність (залежить від вмісту мітохондрій, щільності капілярів та концентрації міоглобіну) Висока Низька
1 Модифіковано з МигрНу ВА: Мизсіе. Іп: РЬузіоІоду, 2псІ есі.
Вегпе ВМ, 1_еуу МІМ [есіііогсі]. МозЬу, 1988.
66 / РОЗДІЛ з
актину, три - тропоніну, і велика кількість ізоформ тропо-
міозину. Загальний склад повільних та швидких волокон
наведений у табл. 3-4. Для волокон міокарда також харак-
терно багато ізоформ.
Експресія ВЛМ чітко регульована в процесі розвитку
організму і відмінності в експресії ВЛМ відіграють визнач-
ну роль у формуванні м’язової конституції людини. У
дорослих осіб на функцію м’язів можуть впливати зміни
фізичної активності, іннервації та гормонального фону; ці
зміни, як звичайно, спричинені порушенням транскрипції
генів ВЛМ. Прикладом цього є перетворення швидких
скелетних м’язів на повільні в разі розладів іннервації (див.
нижче) та значні зміни ізоформ білків скелетних м’язів і
міокарда у випадку гіпотиреоїдизму.
ДЖЕРЕЛА ЕНЕРГІЇ ТА МЕТАБОЛІЗМ
Скорочення м’язів потребує енергії, саме тому їх назва-
ли “машиною для перетворення хімічної енергії в меха-
нічну роботу”. Безпосереднім джерелом цієї енергії є мак-
роергічні сполуки органічних фосфатів, що містяться в
м’язовій тканині. Ці речовини утворюються внаслідок
метаболізму вуглеводів та ліпідів. Гідроліз АТФ, що забез-
печує енергією процес скорочення м’язів, розглянуто
вище.
Фосфорилкреатин
АТФ утворюється шляхом зворотного синтезу з АДФ.
У цьому разі до молекули АДФ додається один фосфатний
залишок. Енергія для забезпечення цієї ендотермічної
реакції частково надходить від розпаду глюкози на СО2 та
Н2О. Проте у м’язовій тканині міститься інша макроергічна
фосфатна сполука, яка є альтернативним короткочасним
джерелом енергії для такої реакції, - фосфорилкреатин
Таблиця 3-4. Ізоформи міофібрилярних білків у дорослих
щурів12
Повільні Швидкі
Важкі ланцюги міозину Легкі ланцюги міозину: лужні фосфорильовувані Тропоміозин Тропонін: ТІМ-Т ТІМ-І ТІМ-С НСІ(=НСригд), НСІ10П, НСа^ І8 , І8Ь а’ о 2з а8<р 13, 28 8 8 НСІІЬ, НСІІсІ, НСНа, НСеот, нс5Р неть, НСпео 11, ЗТ 2Т «V Р 11, 21, ЗТ, 4Т т т
1 Модифіковано з Рейе □, 8іагоп Р8: ТНе тоїесиїаг сііуегзіїу
о! таттаїіап тизсіе ЛЬегз. ІМєууз РЬузіоІ 8сі 1993;8:153.
2 Ужиті скорочення: ізоформи важких ланцюгів (НС): НСІ -
типу І; НСІІ - типу II; НС(ЗсаМ, НСасаггі - серцеві; НСІІ0П - тонічні;
НСеот - м’язів очного яблука; НС5( - надшвидкі; НетЬ - ембріо-
нальні; НСпео - характерні для новонароджених. Субодиниці
тропоніну (ТГ\І): 8 - повільні; І- швидкі; ТІМ-Т - тропоміозин-
зв’язувальні; ТМ-і - інгібіторні; ТІМ-С - Са2+-зв’язувальні.
(див. рис. 17-21), який розпадається на креатин та фосфатні
залишки із вивільненням значної кількості енергії. В стані
спокою у мітохондріях фосфатні групи приєднуються до
креатину, внаслідок чого запаси фосфорилкреатину віднов-
люються. Під час інтенсивних фізичних навантажень у
ділянках з’єднань між головками міозину та актину від-
бувається гідроліз фосфорилкреатину з відщепленням від
АТФ одного фосфатного залишку й утворення енергії, що
забезпечує безперервність м’язового скорочення.
Розпад вуглеводів та ліпідів
У період відпочинку та в разі незначних фізичних’
навантажень м’язи накопичують ліпіди у вигляді вільних
жирних кислот, які є одним з джерел енергії. З посиленням
навантаження метаболізм ліпідів уже не в стані достатньо
швидко забезпечувати енергією процес м’язового скоро-
чення, і головним компонентом енергії для м’язів стають
вуглеводи. Отже, під час фізичних навантажень значна
кількість енергії для ресинтезу фосфорилкреатину та АТФ
надходить унаслідок розпаду глюкози. Головні метаболіч-
ні шляхи розпаду глюкози розглянуто в Розділі 17. Тут
достатньо лише нагадати, що глюкоза, яка міститься в кро-
ві, надходить до клітин, у яких вона внаслідок складних
біохімічних перетворень зрештою розпадається до піру-
вату. Іншим джерелом надходження глюкози і, як наслідок,
пірувату до клітин є глікоген, вуглеводний полімер, який
міститься переважно у печінці. За умов адекватного над-
ходження О2 піруват включається в цикл лимонної кис-
лоти, метаболізується в цьому циклі і так званому дихаль-
ному ферментному ланцюгу до СО2та Н2О. Цей процес
називають аеробним гліколізом. Розпад глюкози або
глікогену до СО2 та Н2О вивільняє багато енергії, якої
достатньо для утворення з АДФ значної кількості АТФ.
Якщо О2 надходить у достатніх кількостях, то піруват,
який утворюється з глюкози, не включається до циклу три-
карбонових кислот, а розщеплюється до лактату. Цей про-
цес - анаеробний гліколіз - супроводжується утворен-
ням значно меншої кількості макроергічних фосфатних
сполук, однак натомість не потребує наявності О2. Різно-
манітні хімічні реакції, що забезпечують надходження
енергії до скелетних м’язів, показані на рис. 3-11.
Механізм “кисневого боргу”
Під час фізичних навантажень відбувається розширен-
ня кровоносних судин м’язів і посилення кровоплину,
унаслідок чого збільшується надходження О2. Споживан-
ня О2 пропорційне до витрат енергії, яку повністю забез-
печують процеси аеробного гліколізу. Проте у разі дуже
інтенсивних навантажень аеробний ресинтез запасів енер-
гії не встигає поповнювати їхнє використання. За цих умов
для ресинтезу АТФ застосовний фосфорилкреатин. Певна
кількість АТФ утворюється під час анаеробного розщеп-
лення глюкози до лактату. Використання шляху анаероб-
ного розщеплення досить обмежене, бо, незважаючи на
високу швидкість дифузії лактату в кровоплин, лактат
швидко накопичується в м’язах у кількості, яка значно
перевищує спроможність буферних систем зв’язувати
його. У цьому випадку різко зменшується рН середовища,
що пригнічує активність ферментних систем. Однак на
короткий час анаеробне розщеплення глюкози може
ЗБУДЛИВА ТКАНИНА: М’ЯЗОВА / 67
АТФ + Н2О — АДФ + Н3РО4 + 7.3 ккал
Фосфорилкреатин + АДФ Креатин + АТФ
Глюкоза + 2 АТФ (або глікоген + 1 АТФ)
Анаеробна ~
_г ► 2 Молочна кислота + 4 АТФ
реакція
Глюкоза + 2 АТФ (або глікоген + 1 АТФ)
О2
----—> 6 СО2 + 6 Н2О + 40 АТФ
О2
ВЖК-----СО2 + Н2О + АТФ
Рис. 3-11. Енергія, що вивільнюється внаслідок гідролізу
1 моль АТФ та реакції ресинтезу АТФ. Кількість АТФ, що утво-
рюється в разі окиснення 1 моль вільних жирних кислот (ВЖК),
досить значна, однак залежить від розміру молекули ВЖК.
Наприклад, у випадку повного окиснення 1 моль пальмітино-
вої кислоти утворюється 140 моль АТФ.
забезпечити значно інтенсивніше скорочення м’язів, ніж
аеробне. Наприклад, анаеробне розщеплення під час
забігу на 100 метрів, що триває 10 с, забезпечує 85%
енергії; у разі забігу на 2 км, що триває 7 хв, - 20% , а під
час забігу на довгу дистанцію тривалістю близько 1 год -
лише 5%.
Після завершення періоду максимального навантаження
надлишкова кількість О2 витрачається для видалення над-
лишку лактату, поповнення запасів АТФ та фосфорилкреа-
тину і заміщення тієї невеликої кількості О2, яку переніс
міоглобін. Кількість додатково спожитого О2 пропорційно
залежить від того, на скільки енергетичні потреби під час
навантаження перевищують можливості аеробних систем,
тобто від кисневого боргу. Кисневий борг вимірюють
експериментально. У цьому разі визначають споживання
О2 після навантаження до досягнення певного сталого рів-
ня, який відповідає базальному споживанню О2. Від значен-
ня повного споживання віднімають значення базального й
одержують показник кисневого боргу. Цей показник може
в шість разів перевищувати базальне споживання О2, що
свідчить про таке: особа спроможна розвивати м’язове
зусилля, в шість разів потужніше, аніж без залучення
механізму кисневого боргу. Кисневий борг є кумулятивним,
він накопичується поступово, досягаючи певного гранич-
ного значення. Зрозуміло, що від швидкості його накопи-
чення залежить час, упродовж якого м’яз здатний створю-
вати конкретне зусилля. Саме тому напруження високої
інтенсивності триває недовго, тоді як помірне може бути
достатньо тривалим.
Професійні спортсмени більше, ніж нетреновані особи,
здатні посилювати споживання О2 м’язами. Крім того,
вони значно ефективніше використовують запаси вільних
жирних кислот (ВЖК), отже спроможні створювати знач-
но більші м’язові зусилля без залучення запасів глікогену
та посилення утворення лактату в м’язах. Через це для
них характерні менші показники кисневого боргу в разі
конкретного напруження м’яза. За декілька днів до відпо-
відальних змагань спортсмени переходять на дієту, збага-
чену вуглеводами, збільшуючи запаси глікогену, що саме
по собі лише сприяє збільшенню їхньої витривалості.
Риґідність (заклякання)
Коли в м’язах повністю вичерпуються запаси АТФ та
фосфорилкреатину, то вони переходять у стан заклякання,
який називають ригідністю. Якшо цей стан настає внас-
лідок смерті, його називають трупною ригідністю. У разі
ригідності всі головки міозину нерухомо з’єднані з акти-
ном.
Утворення тепла в м’язах
Згідно з законами термодинаміки, вся енергія, що надхо-
дить до м’язів, повинна дорівнювати енергії, яку вони
витрачають. Енергія у м’язах витрачається на м’язову
роботу, утворення макроергічних фосфатних зв’язків для
майбутнього використання, а також на продукування тепла.
Коефіцієнт корисної дії скелетних м’язів (співвідношення
виконана робота/витрати енергії) досягає 50% під час
піднімання вантажу в разі ізотонічного скорочення і стано-
вить практично 0 у разі ізометричного скорочення. На
утворення фосфатних зв’язків іде небагато енергії. Отже,
у м’язах виникає значна кількість тепла. Її можна досить
точно виміряти за допомогою термопар.
Тепло спокою, утворене під час спокою, є зовнішнім
проявом основних метаболічних процесів. Додаткову кіль-
кість тепла, що утворюється під час скорочення м’яза, нази-
вають теплом ініціації. Таке тепло складається з тепла
активації, тобто тепла, що завжди утворюється під час
скорочення м’яза, та тепла укорочення, що виникає лише
в разі зменшення довжини м’яза.
Після скорочення м’яза надлишкове тепло в ньому утво-
рюється упродовж ще близько 30 хв. Це тепло віднов-
лення, яке вивільняється внаслідок метаболічних процесів
відновлення стану м’яза, що передував скороченню. Тепло
відновлення приблизно дорівнює теплу ініціації; тобто
кількість тепла, утворена під час відновлення, дорівнює
кількості тепла, що виникла під час скорочення.
Коли м’яз після ізотонічного скорочення відновлює
початкову довжину, то, окрім тепла відновлення, утворю-
ється додаткова кількість тепла, яке називають теплом
релаксації. Для повернення м’яза у попередній стан
необхідно виконати роботу, тепло ж релаксації, власне, і є
проявом цієї роботи.
ВЛАСТИВОСТІ М’ЯЗІВ
У ІНТАКТНОМУ ОРГАНІЗМІ
Вплив денервації
У нормі в інтактних людей і тварин скелетні м’язи, якщо
нема подразнення з боку рухових нервів, не скорочуються.
Порушення іннервації спричинює атрофію м’язів, і, крім
того, призводить до патологічної збудливості м’язової
тканини та підвищення її чутливості до ацетилхоліну, що
міститься в кровоплині (денерваційна гіперчутливість, див.
Розділ 4). Унаслідок цього з’являються слабкі невпоряд-
ковані скорочення окремих м’язових волокон (фібриляції).
Це класична ознака враження нижнього рухового ней-
68 / РОЗДІЛ З
рона. Якщо руховий нерв регенерує, то фібриляції припи-
няються. Як звичайно, такі скорочення не видно неозбро-
єним оком; важливо не плутати їх з фасцикуляціями -
видимими посіпуваннями груп м’язових волокон унаслідок
патологічної імпульсації рухових нейронів спинного мозку.
Рухова одиниця
Аксон спинномозкового рухового нейрона розгалужу-
ється на декілька гілок, кожна з яких відходить до одного
м’язового волокна. Отже, в нормі скорочення окремого
м’язового волокна іп уіуо неможливе. Внаслідок подраз-
нення одного рухового нейрона скорочується декілька
волокон.
Сукупність рухового нейрона та волокон, які він іннер-
вує, називають руховою одиницею. Кількість волокон, що
припадає на одну рухову одиницю, різна і залежить від
функції конкретного м’яза. В м’язах кисті та очного яблука,
тобто тих, що забезпечують точні, висококоординовані
рухи, одна рухова одиниця містить три-шість м’язових
волокон. У литкових м’язах кота на одну рухову одиницю
припадає 120-165 волокон, а великі м’язи спини у людини
містять їх навіть більше.
Кожен спинномозковий руховий нейрон іннервує волок-
на лише одного типу, тому всі м’язові волокна рухової
одиниці мають ідентичні характеристики. Залежно від типу
м’язових волокон (див. табл. 3-3) і тривалості поодинокого
скорочення рухові одиниці поділяють на швидкі та повіль-
ні. Повільні рухові одиниці містять невеликі за розміром
нейрони із низькою швидкістю проходження імпульсу, а
швидкі, відповідно, - великі нейрони із високою швидкіс-
тю проходження імпульсу (принцип розміру). У великих
м’язах кінцівок під час виконання переважної більшості
рухів повільні (малі) одиниці залучені першими, вони
резистентні до втоми і фактично найчастіше застосовні.
Швидкі одиниці, які легко і швидко втомлюються, як зви-
чайно, беруть участь у рухах, що потребують значної сили
м’язового скорочення.
Відмінності між різними типами рухових одиниць не
лише генетично детерміновані, а й значно залежать від
інших чинників, зокрема, від ступеня їхньої активності
(див. нижче). Якщо нерв, що проходить до повільного
м’яза, перерізати і на його місце імплантувати нерв, який
до цього іннервував швидкий м’яз, то після регенерації
пересадженого нерва він згодом почне виконувати іннер-
вацію м’яза. Внаслідок цього м’яз поступово набуде харак-
теристик швидкого з відповідними змінами ізоформ м’язо-
вих білків та активності міозинової АТФ-ази. Такі зміни
відбуваються після перебудови профілю активності м’яза.
В дослідах зі стимуляцією цих м’язів, лише модифікуючи
профіль електричного стимулювання, можна спричинити
зміни експресії генів та ізоформ ВЛМ.
Електроміографія
Активування рухових одиниць можна вивчати за допо-
могою електроміографії - реєстрації електричної актив-
ності м’яза, яка графічно відображається на екрані осци-
лоскопа. Це дослідження є абсолютно безболісним, його
виконують, накладаючи на шкіру над досліджуваним м’я-
зом невеликі металеві диски або вводячи підшкірні голкові
електроди. Графічний запис змін електричної активності
м’яза називають електроміограмою (ЕМГ). Типова ЕМГ
зображена на рис. 3-12.
Фактори, що визначають м’язову активність
За допомогою електроміографії з’ясовано, що скелетні
м’язи здорових осіб у стані спокою практично не виявля-
ють спонтанної активності. У разі довільних рухів малої
інтенсивності нервові імпульси надходять з невеликої кіль-
кості нейронів рухових одиниць, а зі збільшенням наван-
таження кількість задіяних рухових одиниць збільшується.
Цей процес деколи називають залученням рухових оди-
ниць. Отже, сила м’язової відповіді залежить від кількості
активованих рухових одиниць. Крім того, значну роль
відіграє частота нервових імпульсів, адже напруження, що
розвивається під час тетанічного скорочення, є набагато
більшим, ніж під час поодиноких скорочень. Певним
визначним фактором є й довжина м’яза. І, зрештою, нервові
імпульси в рухових одиницях утворюються асинхронно,
тобто із зсувом за фазою один щодо іншого. Внаслідок
асинхронності роботи нейронів відповіді окремих м’язо-
вих волокон зливаються у плавне суцільне скорочення
м’яза.
Сила скелетних м’язів
Скелетні м’язи людини можуть створювати напру-
ження 3-4 кг на 1 см2 площі перерізу. Цей показник
ідентичний до того, який одержують у багатьох дослідах
на тваринах, і є, ймовірно, сталим для усіх видів ссавців.
Оскільки багато м’язів у людини мають порівняно велику
площу перерізу, то вони можуть розвивати досить значне
напруження.
Наприклад, литковий м’яз не лише підтримує масу
всього тіла під час пересування угору, а й витримує в
декілька разів більше навантаження, коли стопа сти-
кається з поверхнею землі під час бігу або стрибків. Ще
більше вражає приклад із великим сідничним м’язом, який
може розвивати силу до 1200 кг. Сила, яку б розвинули
всі м’язи тіла здорової людини, якби скоротились одно-
часно, дорівнює приблизно 22 т.
Рис. 3-12. Електроміографічний запис біопотенціалів двого-
лового та триголового м’язів людини під час почергового зги-
нання та розгинання у ліктьовому суглобі (за ВС Сагоийе).
ЗБУДЛИВА ТКАНИНА: М’ЯЗОВА / 69
Роль м’язів у підтриманні пози і руху
Будь-які рухи відбуваються із максимальним викорис-
танням описаних вище фізіологічних принципів. Наприк-
лад, точки прикріплення м’язів на скелеті розташовані так,
що більшість з них на початку скорочення мають довжину
спокою.
У м’язах, що поширюються більше ніж на один суглоб,
рухи в одному суглобі можуть компенсувати рухи в
іншому, завдяки чому під час скорочення м’яза його дов-
жина лише незначно змінюється. Таке скорочення, що є
майже ізометричним, дає змогу розвинути максимальне
напруження. Зокрема, кравецькі м’язи проходять з таза
через кульшовий і колінний суглоби до велико- та мало-
гомілкової кісток. Скорочення цього м’яза спричинює зги-
нання стегна.
У разі згинання стегна в кульшовому суглобі подов-
ження частини кравецького м’яза, що проходить через
кульшовий суглоб, компенсує скорочення тієї його час-
тини, що проходить через колінний суглоб. Під час склад-
них рухів із залученням великої кількості м’язів їхня вза-
ємна координація відбувається так, щоб забезпечити опти-
мальні умови скорочення для принаймні деяких з них.
Точки прикладання м’язової сили часто так розташовані
щодо суглобів, що утворюють важелі, за допомогою яких
за мінімального напруження м’яза створюється макси-
мальна сила. Це важливо не лише для самих м’язів, а й
для кісток та сухожилків. Скорочення м’язів організовані
так, що навантаження на кістки та суглобово-зв’язковий
апарат зрідка перевищує 50% їхньої міцності, а це захищає
їх від пошкодження.
Під час ходіння кожна кінцівка ритмічно проходить
через фазу опори, коли стопа дотикається землі, і фазу
підіймання, коли стопа перебуває у повітрі. Фази опори
обох ніг накладаються, отже, під час кожного циклу ходи
є два періоди подвійної опори.
На початку кожного кроку у м’язах-згиначах ноги про-
стежується короткочасне стрибкоподібне підвищення
напруження, а потім нога переходить до періоду із незнач-
ним зростанням напруження. Отже, під час кожного кроку
м’язи перебувають в активному стані лише упродовж ко-
роткого проміжку часу, тому тривале ходіння викликає
лише порівняно незначну втому.
Здорова молода особа під час ходіння в зручному для
неї темпі рухається зі швидкістю близько 80 м/хв, у цьому
разі виникає потужність 150-175 Вт.
У дослідженнях, які проводили з молодими волонте-
рами, їх просили ходити у найзручнішому для них темпі.
Виявилось, що всі вони обрали швидкість близько 80 м/хв,
за якої витрати енергії мінімальні. Ходіння із швидкістю,
що більша або менша від оптимальної, потребує більше
енергії.
Незважаючи на те, що ходіння є складним рефлектор-
но-руховим актом, воно відбувається більш-менш автома-
тично. За допомогою дослідів на тваринах з’ясовано, що
такий процес запрограмований у певним чином організо-
ваних провідних шляхах спинного мозку і, відповідно,
активований конкретними командними сигналами. Це
досить подібне до процесу ініціювання профілів актив-
ності внаслідок імпульсації командних нейронів у без-
хребетних тварин.
Патологія м’язів
Як уже зазначено, мутації генів, що кодують різнома-
нітні компоненти дистрофін-глікопротеїнового комплексу,
спричинюють м’язову дистрофію - синдром, що супро-
воджується м’язовою слабкістю, яка прогресує. Деякі з
багатьох форм цього захворювання можуть зумовлювати
стійку інвалідність або смерть. М’язову дистрофію Дю-
шена, пов’язану з Х-хромосомою, виявляють в одного з
близько 3000 новонароджених хлопчиків, як звичайно,
вона призводить до смерті у віці до 30 років. Спричинена
ця дистрофія мутаціями гена дистрофіну, внаслідок яких
дистрофіну в м’язах зовсім нема. У випадку легшої форми
цього захворювання - м’язової дистрофії Бекера, -
дистрофін у м’язах наявний, проте він модифікований або
міститься у недостатній кількості. Різноманітні дистрофії
м’язів пояса кінцівок пов’язані із мутацією генів, які коду-
ють саркоглікани.
У ділянках нервово-м’язових з’єднань дистрофін замі-
нений утрофіном - подібним за структурою білком, що
кодований іншим геном. У генетично модифікованих
мишей із дефіцитом дистрофіну, у яких утрофін продуко-
ваний у надлишкових кількостях, простежується значне
поліпшення м’язової функції; а це доводить, що дистрофін
значно заміщений утрофіном. Тому сьогодні триває актив-
ний пошук медикаментозних або інших засобів стимулю-
вання гена утрофіну у людей, що хворіють на м’язову дис-
трофію Дюшена.
Мутації генів, що кодують ензими, які беруть участь у
метаболізмі вуглеводів, жирів, білків та утворенні АТФ у
м’язовій тканині, спричинюють метаболічні міопатії.
Одна з них - синдром Мак-Кардля, що описаний у Розділі
17.
Метаболічні міопатії мають різноманітні прояви залеж-
но від конкретних генетичних порушень, однак їхньою
загальною ознакою є швидка втомлюваність м’язів і, ймо-
вірно, розпад м’язової тканини внаслідок накопичення
токсичних продуктів обміну.
У разі різноманітних форм міотонїї збільшується трива-
лість розслаблення м’язів після їхнього довільного скоро-
чення. Міотонїї спричинені аномаліями генів, що містяться
в 7, 17 та 19 хромосомах і призводять до порушення
структури Ка+- або С1~-каналів.
Сьогодні тривають інтенсивні дослідження щодо мож-
ливостей імплантації нормальних генів, які відповідають
за розвиток м’язової тканини у хворих на м’язові дистро-
фії, проте в цьому напрямі ще багато невирішених проб-
лем.
Розвиток м’язів
Хоча розгляд ембріогенезу м’язів не є метою цієї книги,
та варто зазначити, що останніми роками з’ясовано чимало
раніше невідомих механізмів генетичного контролювання
розвитку м’язів.
Провідну роль у цьому процесі відіграє білок міогенін,
що є фактором транскрипції відповідних генів. Під його
впливом фібробласти перетворюються на м’язові клітини.
Піддослідні миші, гомозиготні за мутантним геном міо-
геніном, помирають невдовзі після народження внаслідок
недостатнього розвитку м’язів, у тому числі дихальної
мускулатури.
70 / РОЗДІЛ З
СЕРЦЕВИЙ М’ЯЗ (МІОКАРД)
МОРФОЛОГІЯ
Поперечні смуги в серцевому м’язі подібні до тих, що є
в скелетних м’язах; чітко виявляються /-лінії. В міокарді
наявна велика кількість довгастих мітохондрій, що щільно
контактують із м’язовими фібрилами. М’язові волокна
розгалужені і переплетені між собою, однак кожне з них є
повноцінною одиницею, що оточена клітинною мембра-
ною. Коли кінець одного волокна з’єднується з іншим, то
мембрани обох паралельних волокон утворюють численні
складки. Ці ділянки, які завжди припадають на /-лінії,
називають вставними дисками (рис. 3-13). Такі диски
забезпечують міцне з’єднання між волокнами так, що
зусилля однієї скоротливої одиниці передається в напрямі
її осі до іншої. По боках м’язових волокон, розташованих
близько до дисків клітинної мембрани, сусідні волокна
зливаються на значному відрізку, утворюючи щілинні
контакти, які слугують містками, що мають низький елект-
ричний опір і по яких збудження передається від одного
волокна до іншого (див. Розділ 1). Завдяки їм серцевий
м’яз працює як синцитій, хоча між клітинами насправді
протоплазматичних містків немає. У серцевому м’язі Т-
системи розташовані біля /-ліній, а не в ділянках А-І-з’єд-
нань, як це властиве скелетним м’язам ссавців.
ЕЛЕКТРИЧНІ ВЛАСТИВОСТІ
Мембранні потенціали спокою та дії
Мембранний потенціал спокою окремої клітини серце-
вого м’яза у ссавців становить близько -90 мВ (внутрішній
бік мембрани заряджений негативно щодо зовнішнього).
Зовнішнє подразнення спричинює потенціал дії, який
поширюється, зумовлюючи скорочення. Деполяризація
поширюється швидко, потім настає овершут (з англ. оуєг-
зЬооі - зміна заряду; як і в скелетних м’язах та нервовій
тканині), далі швидко - плато, а після цього мембранний
потенціал набуває початкових значень (рис. 3-14). Для
серця ссавців характерна тривалість періоду деполяризації
- близько 2 мс, однак фази плато і реполяризації тривають
до 200 мс і більше. Отже, реполяризація закінчується тоді,
коли минає лише половина часу скорочень. У разі поза-
клітинної реєстрації електричних потенціалів одержують
криву, що має характерні пік і хвилю, які нагадують комп-
лекс РК8 і Т-хвилю ЕКГ.
Як і в інших збудливих тканинах, зміни концентрації К+
в позаклітинній рідині впливають на мембранний потен-
ціал спокою серцевого м’яза, тоді як зміни концентрації
№+ впливають на потенціал дії. Початкова швидка деполя-
ризація й овершут (фаза 0) відбуваються внаслідок відкрит-
тя потенціалозалежних Ка+-каналів подібно до того, як є у
нервовій тканині й скелетних м’язах (рис. 3-15). Почат-
кова швидка реполяризація (фаза 1) виникає внаслідок
закриття Ха4-каналі в. Наступне протяжне плато (фаза 2)
зумовлене повільним, але тривалим відкриттям потенціа-
лозалежних Са2+-каналів. Остаточна реполяризація мемб-
рани (фаза 3), за якої її потенціал повертається до рівня
потенціалу спокою (фаза 4), відбувається внаслідок закрит-
тя Са2+-каналів та виходу К+ із клітини через різноманітні
К+-канали. Характеристику типів йонних каналів серцевого
м’яза наведено в табл. 3-5.
Потенціалозалежний №’ -канал міокарда має двоє воріт
- зовнішні, які відкриваються на початку деполяризації при
мембранному потенціалі від -70 до -80 мВ, і внутрішні,
які в цьому випадку закриваються і перешкоджають
подальшому надходженню №’ всередину клітини аж до
закінчення потенціалу дії (інактивування Ха -каналів).
Повільні Са2+-канали активні, якщо мембранний потенціал
становить від -30 до -40 мВ. Загалом К+-каналів, завдяки
яким відбувається реполяризація, є три типи. Перший
(ініціальний зовнішній перехідний канал) створює пере-
хідний ранній зовнішній потік йонів (Іто), що приводить
до ранньої неповної реполяризації. Другий (канал із внут-
рішнім вирівнюванням) у фазі плато пропускає йони К+
всередину клітини, але перешкоджає їхньому виходу в
позаклітинну рідину і лише при низьких значеннях мемб-
ранного потенціалу починає їх пропускати за межі клітини.
Йонний потік, що його створює цей канал, позначають ІКг.
Третій тип (канал із відтермінованим вирівнюванням) -
це канал, який повільно активується й утворює потік йонів
(позначають Ік§). Сукупність ІКг та ІК8 - це невеликий за
інтенсивністю зовнішній потік йонів, який з часом поси-
люється і приводить до реполяризації.
Білкові субодиниці, з яких складаються К+-канали, що
відповідають за І перетинають клітинну мембрану шість
разів. Вони є продуктом гена НЕКС (від англ. Ьшпап еіЬег-
а-£О-£О-ге1аіес1 £епе). Цей ген подібний до того, який вияв-
ляють у Огозокіїсг. в разі його мутації у цих комах просте-
жується посмикування лапок під час ефірної анестезії.
Йонний канал, який відповідає за Ік$, складається з білка,
що перетинає клітинну мембрану шість разів, у поєднанні
з невеликим за розміром білком тіпК (назва пов’язана з
його розміром). Білок тіпК має лише один домен, що
перетинає мембрану. Мутації НЕКС та названого вище
каналу, поряд з мутаціями Ха4-каналів серцевого м’яза,
спричинюють синдром подовженого інтервалу (}Т. Осо-
би з цією патологією мають схильність до шлуночкових
аритмій та раптової смерті (див. Розділ 28).
Для серцевого м’яза характерне зменшення часу репо-
ляризації зі збільшенням частоти серцевих скорочень
(ЧСС). При ЧСС 75 уд/хв тривалість потенціалу дії (0,25 с)
майже на 70% більша, ніж тоді, коли ЧСС дорівнює
200 уд/хв (0,15 с).
МЕХАНІЧНІ ВЛАСТИВОСТІ
Скоротливість
Скоротлива відповідь міокарда починається відразу ж
після початку деполяризації і триває майже в півтора раза
довше, ніж потенціал дії (див. рис. 3-14). Роль Са2’ у коор-
динації збудження та скорочення є такою ж, як і в скелетних
м’язах (див. вище). Проте, як зазначено вище, власне над-
ходження всередину клітини Са2+ з позаклітинної рідини,
що відбувається шляхом активування дигідропіридинових
ЗБУДЛИВА ТКАНИНА: М’ЯЗОВА / 71
А
В
Рис. 3-13. А: електронна мікроскопія серцевого м’яза. Розпливчасті товсті лінії є вставними дисками (збільшення у 12 000
разів) (відтворено за дозволом з ВІоогп \/\/, ЕатусеП О\/\/: А ТехІЬоок ої Нізіоіоду, 101Н есі. Заипсіегз, 1975). В: схематичне
зображення серцевого м’яза у разі світлової та електронної мікроскопії; N - ядро (відтворено за дозволом з Вгаип\л/аІсі Е, Розз
Л ЗоппепЬІіск ЕН: МесНапізтз ої сопігасііоп ої ІНе погтаї апсі Гаіііпд Неагі. N ЕпдІ З Месі 1967;277:794. Соигіезу ої І_ійіе, Вга\л/п,
Іпс.)
каналів у Т-системі, а не сама по собі деполяризація спри-
чинює вивільнення йонів Са24 з їхнього депо у саркоплаз-
матичній сітці.
Під час фаз 0-2 й упродовж близько половини фази З
(доки під час реполяризації мембранний потенціал не
досягне близько -50 мВ) серцевий м’яз не може бути знову
збудженим, тобто перебуває в періоді абсолютної рефрак-
терності (див. рис. 3-4). Він є порівняно рефрактерним до
настання фази 4. Отже, тетанус у тому вигляді, в якому
його спостерігають у скелетних м’язах, у серцевому м’язі
неможливий. Зрозуміло, що перехід міокарда у стан тета-
нусу навіть на нетривалий час міг би мати смертельні
72 / РОЗДІЛ З
мс
Рис. 3-14. Потенціали дії і скоротливі відповіді серцевого м’яза
ссавців зображені у вигляді кривих потенціал-час; АРП - аб-
солютний рефракторний період; ВРП - відносний рефрак-
торний період.
наслідки, і з цього погляду неспроможність серцевого м’яза
до тетанусу є засобом безпеки.
Ізоформи
Серцевий м’яз загалом повільний і має порівняно низьку
активність АТФ-ази. Його робота залежить від окисного
метаболізму, а отже, від надходження О2. Серцевий м’яз
людини містить як а-, так і [3-ізоформи важких ланцюгів
міозину (а-ВЛМ і [3-ВЛМ). Ланцюг [3-ВЛМ має нижчу
активність міозинової АТФ-ази, ніж а-ВЛМ. Обидві ці
ізоформи наявні в передсерді, де переважає а-ізоформа,
тоді як у шлуночку виявлена лише [3-ізоформа. Вплив
гормонів щитовидної залози на ізоформи ВЛМ розглянуто
в Розділі 18. Тиреоїдні гормони також спричиняють зміни
в ізоформах ВЛМ скелетних м’язів, проте в цьому випадку
їхній ефект є складнішим, багатокомпонентним.
Співвідношення між довжиною
м’язових волокон та напруженням,
яке вони спричинюють
Співвідношення між початковою довжиною м’язового
волокна і загальним напруженням, що виникає в серцевому
м’язі, ідентичне до того, яке простежується в скелетному
м’язі. Є певна довжина спокою, за якої напруження, що
виникає під впливом зовнішнього стимулювання, макси-
мальне. Початкова довжина волокон визначена діастоліч-
ним наповненням камер серця, а тиск, що виникає в шлу-
ночку, пропорційний до його загального напруження (за-
кон Старлінґа для серцевого м’яза, див. Розділ 29). Отже,
сила скорочення (рис. 3-16) збільшується зі збільшенням
діастолічного об’єму, доки не досягне максимального зна-
чення (висхідна частина кривої Старлінґа), а згодом почи-
Рис. 3-15. Угорі: фази потенціалу дії серцевого волокна: 0 -
деполяризація; 1 - початкова швидка реполяризація; 2-фазг
плато; 3 - пізня швидка реполяризація; 4 - базальний рівені
потенціалу. Унизу: графіки, що відображають потоки І\Іа+, К
та Са2+ під час потенціалу дії. Внутрішній потік - крива донизу
зовнішній потік - крива догори. Потоки К+ позначені безпосе
редньо на кривій потенціалу дії в ті моменти, коли вони віді
грають вирішальну роль. Див. текст підручника.
нає зменшуватись (низхідна частина кривої Старлінґа)
Однак, на відміну від скелетних м’язів, зменшення силг
скорочення в разі значного розтягнення не зумовлене
зменшенням кількості поперечних містків між актином Тс
міозином тому, що навіть у випадку значного розширенню
Таблиця 3-5. Йонні канали в серцевому м’язі
Потенціалозалежні канали
І\Іа+
Т Са2+
І_Са2+
К+
канал із внутрішнім вирівнюванням
канал із відтермінованим вирівнюванням
ініціальний зовнішній перехідний канал
Ліґандозалежні канали
Са2+-активовані
І\Іа+-активовані
АТФ-чутливі
ацетилхолінактивовані
активовані арахідоновою кислотою
ЗБУДЛИВА ТКАНИНА: М’ЯЗОВА / 73
камер серця розтягнення міокарда до такого ступеня не
зафіксовано. Низхідна частина кривої Старлінґа відповідає
початку руйнування серцевих волокон. Гомеостатичне
значення закону Старлінґа розглянуто в Розділі 29.
Катехоламіни також здатні збільшувати силу скорочення
серцевого м’яза (див. Розділи 13 і 20), не змінюючи його
довжини. Таке посилення сили скорочення називають пози-
тивним інотропним ефектом катехоламінів. Він опосеред-
кований Р]-адренергічними рецепторами та цАМФ (див.
Розділ 1). Серце теж містить позбавлені іннервації [32-адре-
нергічні рецептори, які діють через цАМФ. Однак прита-
манний їм інотропний ефект значно слабший і здебільшого
виявляється в міокарді передсердь; цАМФ активує білок
кіназу А, що призводить до фосфорилювання потенціало-
залежних Са2+-каналів, унаслідок чого ті тривалий час
перебувають у відкритому стані, а також посилює процес
активного транспортування Са2 у саркоплазматичну сітку,
прискорюючи розслаблення міокарда і, отже, вкорочуючи
систолу. Цей механізм відіграє важливу роль у разі тахі-
кардії, оскільки забезпечує за цих умов адекватне діасто-
лічне наповнення камер серця (див. Розділ 29).
Глікозиди наперстянки (дигіталіс) посилюють силу
скорочення серцевого м’яза, інгібуючи Ма -К -АТФ-азу у
клітинних мембранах м’язових волокон. Унаслідок цього:
збільшується внутрішньоклітинний вміст На4, і відповідно,
зменшується градієнт концентрації з різних боків
клітинної мембрани; зменшується надходження до клітини
На4 з позаклітинної рідини і, отже, втрата внутрішньоклі-
тинного Са2ь через \а"-Са2+-обмінну помпу, що міститься
в клітинній мембрані м’язових волокон (див. Розділ 1);
збільшується внутрішньоклітинна концентрація Са2+ і це,
відповідно, посилює скорочення серцевого м’яза. Іншим
ефектом глікозидів наперстянки є посилення повільного
внутрішньоклітинного потоку Са2" всередину клітини під
час потенціалу дії, що також збільшує концентрацію Са2+
всередині клітини.
Діастолічний об’єм, мл
Рис. 3-16. Співвідношення між довжиною та напруженням сер-
цевого м’яза собаки.
Гіпертрофія міокарда
Серцевий м’яз, як і м’язи скелетні, гіпертрофується,
коли впродовж тривалого часу постійно працює за умов
збільшеного навантаження, наприклад, у разі артеріальної
гіпертензії. Гіпертрофія міокарда простежується й у випад-
ку мутацій генів, які кодують різноманітні білки, що утво-
рюють скоротливий апарат. До таких станів належить врод-
жений дефіцит дистрофіну, що виникає у разі м’язових
дистрофій Дюшена або Бекера. Кінцевим наслідком є над-
мірна гіпертрофія, що призводить до розвитку серцевої
недостатності (гіпертрофічна кардіоміопатія; див. Розділ
33). Більшість таких генетичних дефектів виявляються кар-
діоміопатією вже в ранньому віці, проте деякі з них просте-
жуються у середньому або літньому віці. Нещодавно з’ясо-
вано, що кальциневрин-КЕ-АТ-шлях, раніше описаний для
Т-клітин імунної системи, є також одним з трансмітерів
гіпертрофії серцевого м’яза. Детально функціювання імун-
ної системи, яку блокує циклоспорин, описано в Розділі
27. Є докази того, що цей шлях відіграє важливу роль у
гіпертрофії скелетних м’язів.
МЕТАБОЛІЗМ
Серце у ссавців має добре кровопостачання, численні
мітохондрії і високий вміст міоглобіну - м’язового пігмен-
ту, що відіграє роль одного з механізмів зберігання О2 (див.
Розділ 25). У нормі анаеробний метаболізм забезпечує до
І % загальної кількості енергії. Під час гіпоксії цей показ-
ник може збільшуватись до майже 10%; однак за повністю
анаеробних умов кількість утвореної енергії недостатня
для скорочення міокарда шлуночків. У нормі 35% енергії,
яку використовує серце людини, утворюється внаслідок
метаболізму вуглеводів, джерелом 5% є кетони та аміно-
кислоти, а 60% - ліпіди. Проте кількісні співвідношення
енергетичних субстратів значно змінюються залежно від
харчового раціону організму. Після вживання великої кіль-
кості глюкози більше використовуються лактат і піруват;
під час тривалого голодування - жири. ВЖК, що містяться
в крові, становлять у нормі близько 50% від загальної кіль-
кості ліпідів, які витрачаються на покриття енергетичних
потреб міокарда. У діабетиків, які не одержують відповід-
ного лікування, рівень метаболізму вуглеводів у серцевому
м’язі суттєво знижується, а ліпідів - підвищується. Чинни-
ки, що впливають на споживання О2 серцевим м’язом лю-
дини, описані в Розділі 29.
ПЕЙСМЕЙКЕРНА ТКАНИНА
Серце продовжує скорочуватись навіть після перетину
усіх нервів і навіть якщо розрізати його на шматки. Це
явище пояснюють наявністю у серці спеціалізованої пейс-
мейкерної тканини, яка може спричинювати утворення
потенціалів дії. Пейсмейкерна тканина формує провідну
систему серця, яка у нормі надсилає імпульси до всіх його
відділів. Вона має нестабільний мембранний потенціал,
який повільно спадає після кожного імпульсу доти, доки
не буде досягнуто деякого порогового значення, за якого
генерується наступний імпульс (див. Розділ 28).
74 / РОЗДІЛ З
ГЛАДКІ М’ЯЗИ
МОРФОЛОГІЯ
Гладкі м’язи анатомічно відрізняються від скелетних та
серцевого тим, що не мають видимої поперечної смугас-
тості. Тут також є актин та міозин II, філаменти яких
почергово ковзають один щодо іншого, внаслідок чого від-
бувається скорочення м’язів. Швидкість скорочення глад-
ких м’язів у 100-1000 разів менша, ніж скелетних. Однак
для них не характерне впорядковане розташування філа-
ментів, що простежується в скелетних м’язах та міокарді,
і саме завдяки цьому нема поперечних смуг. Аналогом 2-
ліній у гладких м’язах є щільні тільця, які містяться в цито-
плазмі і з’єднані з клітинною мембраною та з актиновими
філаментами (за допомогою а-актиніну). Гладкі м’язи
також містять тропоміозин, проте тропоніну, ймовірно,
нема.
Ізоформи актину та міозину суттєво відрізняються від
тих, що є в скелетних м’язах. Тут наявна саркоплазматична
сітка, та вона погано розвинута. Загалом же гладкі м’язи
містять мало мітохондрій, їхні метаболічні потреби забез-
печує переважно процес гліколізу.
Типи гладких м’язів
Залежно від органа гладкі м’язи значно відрізняються
за структурою та функціями. Усі гладкі м’язи поділяють
на вісцеральні та поліелементні. Вісцеральні гладкі м’язи
мають вигляд великих листків, між окремими м’язовими
клітинами наявні містки слабкого електричного опору,
функційно вони є синцитіями. Містки, що подібні до
аналогічних структур у серцевому м’язі, є ділянками з’єд-
нань мембран сусідніх клітин, у яких утворюються щілинні
контакти.
Вісцеральні гладкі м’язи переважно містяться у стінках
порожнистих органів. їхнім прикладом є мускулатура
кишки, матки та сечоводів. Поліелементні гладкі м’язи
складаються з окремих одиниць без сполучних містків.
Вони є в таких анатомічних утворах, для яких характерні
точні, чітко дозовані скорочення. Ці м’язи позбавлені
довільного контролю, однак за функціями багато чим
подібні до скелетних.
Розвиток гладких м’язів
Оскільки проліферація клітин м’язової оболонки судин
є причиною атеросклерозу, артеріальної гіпертензії та
збільшення товщини стінки судин у разі пошкодження
їхнього ендотелію, то регулювання росту гладких м’язів -
об’єкт значного зацікавлення дослідників. Ріст гладких
м’язів регульований складним механізмом, у якому беруть
участь чимало різних факторів росту. Катехоламіни та
ангіотензин II стимулюють ріст та проліферацію гладко-
м’язових елементів, тоді як глюкокортикоїди його галь-
мують.
До інших можливих регуляторних факторів належать
похідні арахідонової кислоти, аденозин, гепариноїди та
серотонін.
ВІСЦЕРАЛЬНІ ГЛАДКІ М’ЯЗИ
Електрична та механічна активність
Вісцеральні гладкі м’язи мають нестабільний мембран-
ний потенціал, їм властиві хаотичні скорочення, які не
залежать від впливу іннервації. Такий стан постійного
неповного скорочення називають тонусом. Для мембран-
ного потенціалу вісцеральних гладких м’язів не характерне
таке поняття, як потенціал спокою, оскільки мембранний
потенціал порівняно низький в активному стані тканини, і
високий у разі гальмування, проте під час періодів спокою
він становить близько -50 мВ. На мембранний потенціал
накладаються різноманітні електричні хвилі (рис. 3-17).
Ці хвилі є повільними синусоїдними коливаннями з амплі-
тудою декілька мілівольтів і піками, які інколи переходять
через нульову відмітку потенціалу дії, а деколи - ні. У
більшості тканин піки тривають близько 50 мс. Однак для
деяких тканин характерні подовжені плато під час фази
реполяризації, подібно до потенціалу дії міокарда. Піки
можуть простежуватися як під час фази підіймання, так і
під час фази спадання синусоїдних коливань. Крім того, у
гладких м’язах утворюються пейсмейкерні потенціали,
подібні до тих, що їх генерують аналогічні серцеві пейс-
мейкерні клітини. Проте у вісцеральних гладких м’язах ці
потенціали утворюються у багатьох ділянках, розташуван-
ня яких постійно змінюється. Піки, що генеруються в пейс-
мейкерних клітинах, поширюються у м’язі на певну
відстань. Оскільки м’яз постійно перебуває в активному
стані, то вивчати зв’язки між електричними та механічними
явищами у вісцеральних гладких м’язах досить важко.
Поодинокі електричні піки можна одержати у деяких пре-
паратах порівняно малоактивних м’язів. М’яз скорочується
через близько 200 мс від початку піка і за 150 мс після
його закінчення. Максимальне напруження в разі скоро-
чення буде лише через 500 мс від початку піка. Отже,
10с
Рис. 3-17. Спонтанна електрична активність окремих глад-
ком’язових клітин товстої кишки мурчака: а - пейсмейкерний
тип; Ь - синусоїдні хвилі з потенціалами дії у фазі підіймання;
с - синусоїдні хвилі з потенціалами дії у фазі спадання; сі -
суміш пейсмейкерних, синусоїдних електричних коливань та
потенціалів дії (відтворено за дозволом з ВиІЬгіпд Е: РЬувіоІ-
оду апсі рИагтасоІоду ої іпіезііпаї соїоп втооІЇї тивсіе. 1_ес-
іигев оп ІЬе Всіепігїіс Вавів ої Месіісіпе 1957;7:374).
ЗБУДЛИВА ТКАНИНА: М’ЯЗОВА / 75
координація збудження та скорочення у вісцеральних
гладких м’язах є дуже повільним процесом, на відміну від
такого процесу у скелетних м’язах і міокарді, де інтервал
між початком деполяризації та ініціацією скорочення
становить до 10 мс.
Молекулярні основи м’язового скорочення
Як і в скелетних м’язах, ініціація скорочення гладких
м’язів відбувається завдяки Са2+. Проте вісцеральні гладкі
м’язи мають погано розвинену саркоплазматичну сітку.
Тому збільшення концентрації Са2+ всередині клітини, яке
є безпосередньою причиною скорочення, виникає головно
внаслідок надходження Са2+ з ПКР через потенціалозалеж-
ні Са1 2 3 4 5 6 7 8*-канали. Крім того, у гладких м’язах для активування
міозинової АТФ-ази необхідне фосфорилювання самої
молекули міозину. Фосфорилювання та дефосфорилю-
вання міозину відбувається також і в скелетних м’язах,
однак воно не є обов’язковою передумовою активування
АТФ-ази. У гладких м’язах Са2+ зв’язується з кальмодулі-
ном (див. Розділ 1), і комплекс, що утворюється внаслідок
цього, активує кальмодулінозалежну кіназу легких лан-
цюгів міозину. Цей ензим є каталізатором реакції фосфо-
рилювання легких ланцюгів міозину, під час якої фосфат-
ний залишок приєднується до серину в положенні 19. Фос-
форилювання забезпечує подальше активування АТФ-ази,
і молекули актину починають ковзати по міозинових лан-
цюгах, спричинюючи скорочення м’яза. Цей процес цілком
протилежний до того, що відбувається у скелетних м’язах
та міокарді, де скорочення спричинене зв’язуванням Са2+
з тропоніном С.
Дефосфорилювання міозину зумовлює міозин-фосфа-
таза. Цей ензим у фосфорильованому стані інгібований, а
його активування відбувається внаслідок дефосфорилю-
вання. Його дефосфорилює гЬо-асоційована кіназа, яку,
відповідно, активують ліґанди, що пригнічують активність
гладкої мускулатури. Проте, дефосфорилювання кінази
легких ланцюгів міозину не обов’язково призводить до
розслаблення гладких м’язів. Для гладких м’язів характер-
не утворення так званих поперечних містків, тобто міозин
зв’язаний з актином упродовж деякого часу після змен-
шення концентрації Са2+ у цитоплазмі. Це явище забезпечує
тривале скорочення із незначними витратами енергії, що
особливо важливо для гладкої мускулатури судин. Уважа-
ють, що м’яз розслаблюється тоді, коли відбулась остаточ-
на дисоціація Са2+-кальмодулінового комплексу або коли
почали діяти інші механізми. Головні процеси, що відбу-
ваються під час скорочення і розслаблення вісцеральних
гладких м’язів, наведені в табл. 3-6. У поліелементних
гладких м’язах відбуваються загалом ідентичні процеси.
Варто описати відмінності між серцевим та гладкими
м’язами, оскільки обидва ці типи м’язової тканини утво-
рюють серцево-судинну систему. Скоротливі відповіді
міокарда мають фазовий характер із чітким чергуванням
скорочень та розслаблень, тоді як скорочення гладких
м’язів часто є тонічними завдяки утворенню поперечних
містків. Підвищення внутрішньоклітинної концентрації
цАМФ збільшує силу скорочень серцевого м’яза, водночас
на гладкі м’язи цАМФ впливає зворотним чином - розслаб-
ляє їх, оскільки інгібує реакцію фосфорилювання кінази
легких ланцюгів міозину.
Подразнення
Вісцеральні гладкі м’язи мають одну унікальну влас-
тивість, якої нема в усіх інших типів м’язової тканини.
Вони скорочуються в разі розтягування без будь-якої іннер-
вації. Реагуванням на розтяг є зменшення мембранного
потенціалу, збільшення частоти піків і посилення загаль-
ного тонусу м’язів.
Якщо іп уііго до середовища, в якому перебуває препа-
рат гладкої мускулатури стінки кишки, додати адреналін
або норадреналін, то мембранний потенціал збільшиться,
частота піків стане меншою, і м’яз розслабиться (рис. 3-
18). Норадреналін - це хімічний трансмітер, що його
вивільнюють норадренергічні нервові закінчення (див.
Розділ 4); подразнення норадренергічних нервів чинить
гальмівний вплив на гладкі м’язи (див. Розділ 4). Стиму-
ляція іп уіуо норадренергічних нервів, які проходять до
кишки, зумовлює послаблення її активності. Норадреналін
впливає як на а-, так і на [3-адренергічні рецептори м’язів
(див. Розділ 4). Вплив на [3-рецептори виявляється знижен-
ням тонусу м’язів у відповідь на подразнення. Трансміте-
ром цього ефекту є цАМФ (див. Розділ 1), а безпосеред-
ньою причиною - збільшення внутрішньоклітинного зв’я-
зування Са2+. Вплив на а-адренорецептори, що також вияв-
ляється гальмуванням скорочення, зумовлений посиленням
виходу йонів Са2+ за межі м’язових клітин.
Вплив ацетилхоліну на мембранний потенціал та ско-
ротливу активність гладких м’язів цілком протилежний до
дії норадреналіну. Якщо ацетилхолін додати в рідину, у якій
міститься препарат гладкого м’яза іп уйго, то мембранний
потенціал зменшиться, і піки стануть частішими (див. рис.
3-18). М’яз стане активнішим, посилиться тонічне напру-
ження і збільшиться кількість ритмічних скорочень. Медіа-
торами цього ефекту є фосфоліпаза С та ІР3 які збільшують
концентрацію Са2+ всередині клітини. У інтактних тварин
стимулювання холінергічних нервів спричинює вивіль-
нення ацетилхоліну, виникнення збудливих потенціалів
(див. Розділ 4) та посилення перистальтики кишки. Подібні
ж ефекти іп уйго зумовлені дією холоду та розтягу.
Функція нервів гладкої мускулатури
Вплив ацетилхоліну та норадреналіну відображає дві
важливі риси гладких м’язів: по-перше, їхню спонтанну
Таблиця 3-6. Послідовність явищ у разі скорочення
і розслаблення вісцеральних гладких м’язів1
(1) Зв’язування ацетилхоліну з мускариновими
рецепторами
(2) Збільшення надходження Са2+ всередину клітини
(3) Активування кальмодулінозалежної кінази легких
ланцюгів міозину
(4) Фосфорилювання міозину
(5) Збільшення активності міозинової АТФ-ази та
зв’язування міозину з актином
(6) Власне скорочення
(7) Дефосфорилювання міозину міозиновою
фосфатазою
(8) Розслаблення або стан залишкового напруження
завдяки утворенню поперечних містків
1 Порівняйте з табл. 3-2.
76 / РОЗДІЛ З
активність без будь-якого нервового подразнення; по-друге,
чутливість до різноманітних хімічних чинників, що вивіль-
няються з нервових закінчень або містяться у кровоплині.
У ссавців вісцеральні м’язи, як звичайно, мають подвійну
іннервацію з двох відділів автономної нервової системи.
Структура та функції сполучень між цими нервами та
гладкими м’язами описані у Розділі 4. Завданням нервово-
регуляторних механізмів є не ініціювання активності глад-
ких м’язів, а радше, модулювальний вплив на нього. Сти-
мулювання одного відділу автономної нервової системи
посилює активність гладких м’язів, тоді як стимулювання
іншого - послаблює її. У деяких органах норадренергічне
стимулювання посилює, а холінергічне - послаблює актив-
ність гладкої мускулатури, для інших же характерні проти-
лежні властивості.
Зв’язок між довжиною та напруженням.
Пластичність
Іншою специфічною властивістю гладких м’язів є
варіабельність напруження, що виникає у разі заданої
довжини. Якщо шматочок вісцерального гладкого м’яза
розтягнути, то він спочатку виявляє збільшення напружен-
ня (див. вище). Однак якщо м’яз утримувати в розтягнуто-
му положенні, то напруження у ньому поступово спадає.
Деколи воно стає таким же або навіть меншим від того,
що спостерігали до розтягнення. Практично неможливо
з’ясувати зв’язок між довжиною і напруженням гладкого
м’яза. Для нього нема такого поняття, як довжина спокою.
Певною мірою гладкі м’язи більше нагадують в’язку масу,
аніж тканину пружної структури. Цю властивість нази-
вають пластичністю гладкої мускулатури.
Фізіологічне значення пластичності можна відобразити
у дослідах на здорових людях. Наприклад, можна вимірю-
вати напруження, що виникає в гладком’язових стінках
сечового міхура за різних ступенів розтягу (рідину в цьому
випадку вводять у сечовий міхур через катетер; див. рис.
38-27). На початку в разі збільшення об’єму простежується
порівняно незначне зростання напруження завдяки плас-
тичності стінок сечового міхура, однак згодом у деякий
момент сечовий міхур із силою скорочується.
Ацетилхолін, вплив парасимпатичної
нервової системи, холоду, розтягу
Адреналін, вплив симпатично!
нервової системи
Рис. 3-18. Вплив різноманітних чинників на мембранний по-
тенціал гладких м’язів кишки.
ПОЛІЕЛЕМЕНТНІ ГЛАДКІ М’ЯЗИ
За будовою поліелементна гладка м’язова тканина, на
відміну від вісцеральної, не є синцитієм, і скорочення
окремих елементів у ній не поширюється. Завдяки цьому
скорочення поліелементних гладких м’язів дискретніші і
точніші, ніж скорочення вісцеральних гладких м’язів. Як і
вісцеральні гладкі м’язи, поліелементні дуже чутливі до
різноманітних хімічних речовин, які містяться в кровопли-
ні, й активуються за допомогою хімічних трансмітерів (аце-
тилхолін та норадреналін), які вивільнюються у закінчен-
нях їхніх рухових нервів. Зокрема, норадреналін має здат-
ність підтримувати тривале скорочення м’яза після одно-
моментної дії подразника. Отже, скоротлива відповідь полі-
елементних гладких м’язів більше подібна до хаотичного
тетанусу, ніж до поодинокого скорочення. Поодиноке
скорочення поліелементного м’яза подібне до поодинокого
скорочення м’яза скелетного, за винятком того, що у випад-
ку поліелементного м’яза тривалість скорочення у десять
разів більша.
Синаптичне і
контактне передавання
4
ВСТУП
Передавання за законом “усе або нічого”, характерне
для аксонів і скелетної мускулатури, описане в Розділах 2
та 3. Імпульси передаються з однієї нервової клітини до
іншої в синапсах (рис. 4-1) - сполученнях, за допомогою
яких аксон або інша частина однієї клітини (пресинап-
тична клітина) контактує з дендритами, тілом або аксоном
іншого нейрона (постсинаптична клітина). Передавання
в більшості синапсів є хімічним, тобто нервовий імпульс
пресинаптичного аксона зумовлює вивільнення нейро-
трансмітера, наприклад, ацетилхоліну чи серотоніну. Цей
хімічний трансмітер зв’язується з рецептором поверхні
постсинаптичної клітини, внаслідок чого відкриваються
або закриваються канали в мембрані цієї клітини. У деяких
контактах, проте, передавання є електричним, а ще в інших
- одночасно як хімічним, так і електричним. У будь-якому
випадку, передавання імпульсу не є простим перестрибу-
ванням потенціалу дії з пресинаптичної клітини до пост-
синаптичної. Дія нервового імпульсу на окремі синаптичні
закінчення може бути збуджувальною або гальмівною, і
якщо постсинаптичною клітиною є нейрон, то сумація всіх
збуджувальних і гальмівних впливів визначає, чи відбу-
деться генерація потенціалу дії. Отже, синаптичне пере-
давання - складний процес, що забезпечує характер і при-
стосування нервової діяльності, яке необхідне для вико-
нання нормальних функцій в організмі.
В електричних синапсах мембрани пре- і постсинаптич-
них нейронів тісно прилягають одна до одної, і між кліти-
нами утворюється щілинний контакт (див. Розділ 1). Подіб-
но до міжклітинних контактів в інших тканинах ці контакти
утворюють низькоопірні перемички, через які порівняно
легко проникають йони. Електричні і комбіновані синапси
функціонують у ссавців, наприклад, між окремими нейро-
нами латерального присінкового ядра. Та оскільки біль-
шість синаптичних передавань є хімічними, то розгляда-
тимемо передавання цього типу.
Передавання від нерва до м’яза подібне до хімічного
синаптичного передавання з одного нейрона до іншого.
Нервово-м’язовий контакт (спеціалізована ділянка, де
руховий нерв закінчується на волокні скелетного м’яза) є
місцем стереотипного процесу передавання. Контакти між
автономними нейронами і гладкими та серцевим м’язами
менше спеціалізовані, і передавання є різноріднішим про-
цесом.
СИНАПТИЧНЕ ПЕРЕДАВАННЯ
ФУНКЦІОНАЛЬНА АНАТОМІЯ
Типи синапсів
Анатомічна будова синапсів у різних частинах нервової
системи ссавців дуже різноманітна. Кінцеві відділи пре-
синаптичних нейронів у більшості випадків потовщені,
тобто утворюють термінальні розширення (синаптичні
пухирці) (див. рис. 4-1). Закінчення розміщені переважно
на дендритах (рис. 4-2) і часто на дендритних шипах -
невеликих синаптичних пухирцях, які виступають з ден-
дритів (рис. 4-3). У деяких випадках терміналі аксонів
пресинаптичних нейронів утворюють кошики, або сітки,
навколо тіла постсинаптичної клітини (кошикові клітини
мозочка й автономних вузлів). В інших ділянках вони
переплітаються з дендритами постсинаптичної клітини
(ліаноподібні волокна мозочка) або закінчуються безпо-
середньо на дендритах (верхівкові дендрити пірамідних
клітин кори) чи аксонах (аксо-аксонні закінчення). У серед-
ньому кожний аксон утворює понад 2000 синаптичних
закінчень. Оскільки в центральній нервовій системі (ЦНС)
містяться 10і 1 нейронів, то кількість синапсів становить
приблизно 2x1014. Без сумніву, кількість шляхів, якими
може проходити нервовий імпульс за наявності такої склад-
ної мережі, надзвичайно велика.
В спинному мозку пресинаптичні закінчення тісно при-
лягають до тіл і проксимальних кінців дендритів постси-
наптичних нейронів. Кількість синаптичних пухирців, що
контактують з окремим мотонейроном спинного мозку,
становить приблизно 10 000, у тому числі з тілом клітини
- 2 000 і з дендритами - 8 000. Нейрон утворює настільки
багато контактів, що він ніби інкрустований дендритними
шишками.
Площа мембрани нейрона, що контактує з окремим си-
наптичним пухирцем, невелика, проте ці пухирці настільки
численні, що в цілому ділянка нейрона, яка контактує з
ними, часто становить 40% від поверхні мембрани тіла
нейрона і 75% від поверхні мембрани дендритів. Підрахо-
вано, що в корі великого мозку 98% усіх синапсів створю-
ються з дендритами і лише 2% - з тілами клітин. Велика
кількість збудливих закінчень у корі великого мозку і мо-
зочка закінчуються на дендритних шипиках. Багато з них
78 / РОЗДІЛ 4
Рис. 4-1. Синапси на типовому мотонейроні. Нейрон має
дендрити (1), аксон (2) і велике ядро (3). Зверніть увагу, що
шорстка ендоплазматична сітка поширюється в дендрити і
не поширюється в аксон. Багато різних аксонів сходяться до
нейрона, і їхні термінальні розширення контактують з ним,
утворюючи аксодендритні (4) й аксосоматичні (5) синапси; 6
- мієлінова оболонка (відтворено за дозволом з КгзіісНХ/:
ІЛігазігисіиге оїіііе Маттаїіап СеІІ. Зргіпдег, 1979).
мають вужчі шийки, ніж головки, і їхні електричні влас-
тивості зумовлені співвідношенням ділянки головки до
ділянки шийки. Обчислено, що співвідношення кількості
синапсів до кількості нейронів у передньому мозку людини
становить 40 000:1.
Пластичність дендритних шипів
Численні шипи містяться на дендритах не лише в корі
великого мозку (див. рис. 4-3), а й у мозочку. Вони також є
досить лабільними структурами. їхня кількість збільшу-
ється, наприклад, у складних умовах зовнішнього середо-
вища іп уіуо, внаслідок подразнення ділянок морського
коника (гіпокампа).
Морфологічні зміни в шипах можна виявити упродовж
секунд; вони залежать від актину і міозину. Вірогідно теж,
що принаймні в певних умовах ці зміни зумовлені
спонтанним вивільненням пресинаптичними нейронами
глютамату і його дією на АМПА-рецептори (див. нижче).
Дендритні шипи підпадають і під вплив гормонів;
наприклад, естрадіол сприяє ростові шипів у культурі
клітин гіпокампа.
Рис. 4-2. Електронна мікрофотографія синаптичного пухирця
(8), що контактує з дендритом (О) у центральній нервовій
системі; Р - постсинаптичне потовщення; М - мітохондрія.
(збільшення у 56 000 разів; з люб’язного дозволу ОМ МсОо-
паїсі).
Пре- та постсинаптичні структури і
їхня функція
Між пре- і постсинаптичною частинами синапсу міс-
титься синаптична щілина 20^-0 нм завширшки. Вздовж
синаптичної щілини в постсинаптичній мембрані є багато
нейротрансмітерних рецепторів і постсинаптичні потов-
щення (див. рис. 4-2,4-4). Скупчення рецепторів зумовлені
зв’язувальними білками, які утримують рецептори і від-
повідні йонні канали.
Усередині пресинаптичної частини є велика кількість
мітохондрій, а також багато вкритих мембраною синап-
тичних пухирців, що містять нейротрансмітери. Налічують
три типи синаптичних пухирців: маленькі прозорі синап-
тичні пухирці, що містять ацетилхолін, гліцин, ГАМК або
глютамін (див. нижче); маленькі електроннощільні пухир-
ці, що містять катехоламіни; великі електроннощільні пу-
хирці, що містять нейропептиди. Пухирці і білки, що міс-
тяться в них, утворюються в комплексі Ґольджі тіла нер-
вової клітини і мігрують аксоном до закінчень завдяки швид-
кому аксоплазматичному транспортуванню. Нейропепти-
ди, що містяться у великих електроннощільних пухирцях,
теж утворюються в тілі клітини. Однак маленькі прозорі і
маленькі електроннощільні пухирці рециклізуються в
закінченнях. Вони там наповнюються нейротрансмітером,
унаслідок екзоцитозу виділяють свій вміст у синаптичну
щілину, внаслідок ендоцитозу повертаються в ендосоми,
згодом відділяються від ендосом, наповнюються нейро-
трансмітером, і цей цикл повторюється знову (рис. 4-5).
СИНАПТИЧНЕ І КОНТАКТНЕ ПЕРЕДАВАННЯ / 79
Плід Ново- Немовля Синдром
7 місяців народжений 8 місяців Дауна
18 місяців
Рис. 4-3. Шипи верхівкових дендритів великих пірамідних нейронів кори великого мозку людини. Зверніть увагу, що кількість
шипів швидко збільшується від народження до восьмимісячного віку. У випадку синдрому Дауна шипи тонкі і невеликі (моди-
фіковано з ЗНерЬегс! 6М: МеигоЬіоІоду, 2псІ есі. ОхТогсІ Опіу Ргезз, 1988).
Зазначимо, що великі електроннощільні пухирці міс-
тяться всюди в пресинаптичній частині, утвореній термі-
нальною гілочкою аксона, і виділяють свої нейропептиди
внаслідок екзоцитозу в усіх ділянках терміналі. Маленькі
пухирці, локалізовані поблизу синаптичної щілини, зли-
ваються з мембраною і виділяють свій вміст дуже швидко
в синаптичну щілину в ділянках синаптичних потовщень,
які називають активними зонами (див. рис. 4-4). Актив-
ні зони містять ряди кальцієвих каналів.
Молекула Са2ь є ключовою в процесах злиття синап-
тичних пухирців з пресинаптичною мембраною і виділення
трансмітера в синаптичну щілину. Потенціал дії, що надхо-
дить до закінчення пресинаптичного нейрона, відкриває
потенціалозалежні Са2+-канали, і надходження Са2+ зумов-
лює вивільнення трансмітера. Концентрація Са2+ усталю-
ється на початковому рівні внаслідок їхнього швидкого
видалення з клітини, головно внаслідок Са2+-№а+ антипорту.
Як зазначено в Розділі 1, утворення пухирців, їхнє злиття
з мембраною, виділення їхнього вмісту і подальша рецик-
лізація їхньої мембрани є фундаментальними процесами,
що відбуваються в усіх клітинах. У комплексі Ґольджі і
клітинній мембрані вони відбуваються внаслідок екзо- і
ендоцитозу. Такого типу механізми мають свої особливості
в конкретних умовах. Ці тонко регульовані процеси, що
стосуються виділення вмісту синаптичних пухирців і їхньої
рециклізації, відображені нарис. 4-5. Деталі процесу, завдя-
ки якому синаптичні пухирці зливаються з клітинною
мембраною усе ще з’ясовують, проте відомо, що до цього
процесу причетний у-петлеподібний білок мембрани
пухирців - синаптобревін, що зв’язується з і-петлепо-
дібним білком клітинної мембрани - синтаксином (рис.
4-6).
Клінічний інтерес становить факт, що деякі смертоносні
токсини, які блокують виділення нейротрансмітера - це
цинквмісні ендопептидази, які розщеплюють і, отже, інак-
тивують білки комплексу, що забезпечує процеси злиття й
екзоцитозу. Правцевий токсин і ботулінічні токсини В, В,
Р і (З діють на синаптобревін, ботулінічний токсин С - на
синтаксин, а ботулінічні токсини А та В - на 8\АР-25 (див.
рис. 4-6). Клінічно правцевий токсин спричинює спастич-
ний параліч, блокуючи виділення в ЦНС пресинаптичного
трансмітера, а в разі ботулізму внаслідок блокування ви-
ділення в місці нервово-м’язового сполучення ацетилхо-
ліну виникає млявий параліч. Позитивне значення має те,
що місцеве введення невеликих доз ботулінічного токсину
ефективне в лікуванні широкого спектра хвороб, що супро-
воджуються м’язовою гіперактивністю. Прикладом може
слугувати ін’єкція в нижній стравохідний сфінктер з метою
полегшення стану, що виникає в разі ахалазії, або ж ін’єкція
в мімічні м’язи для усунення зморшок.
Конверґенція і диверґенція
Лише в окремих випадках синаптичні пухирці, що
контактують з постсинаптичним нейроном, є закінченням
певного одного пресинаптичного нейрона. Переважно ж
вплив на клітину множинний. Наприклад, на спинномоз-
ковому мотонейроні закінчуються нейрони заднього корін-
ця, нейрони довгих низхідних спинномозкових шляхів і
велика кількість інтернейронів - коротких проміжних
нейронів спинного мозку. Отже, багато пресинаптичних
нейронів конвертують, тобто сходяться, на кожному по-
одинокому постсинаптичному нейроні. І навпаки, аксони
більшості пресинаптичних нейронів розділені на велику
кількість гілок, що диверґують, закінчуючись на багатьох
постсинаптичних нейронах. Конверґенція і диверґенція
- анатомічні субстрати процесів підсилення, оклюзії і
реверберації (див. нижче).
Однонапрямлене передавання
Синапси забезпечують проходження нервових імпульсів
лише в одному напрямі - від пресинаптичного нейрона до
постсинаптичного. Імпульс, що його передає аксон перед-
нього корінця антидромно, загасає після деполяризації в
тілах клітин спинномозкових мотонейронів. Оскільки аксо-
80 / РОЗДІЛ 4
Аксо-дендритний
Аксо-аксонний
Аксо-соматичний
Рис. 4-4. Аксо-дендритний, аксо-аксонний і аксо-соматичний
синапси. Багато пресинаптичних нейронів закінчуються на
дендритних шипах, як показано вгорі, проте деякі - безпосе-
редньо на тілах дендритів. Зверніть увагу на наявність у закін-
ченнях прозорих синаптичних пухирців, а також на скупчення
прозорих пухирців біля активної зони. А - поздовжній переріз;
В, С - поперечний переріз.
ни можуть передавати нервовий імпульс у будь-якому
напрямі, то однонапрямлений процес у синапсах необхід-
ний для впорядкування функцій нервової системи. Хіміч-
не передавання в синаптичних контактах забезпечує такий
односторонній процес.
Хімічний трансмітер міститься в синаптичних пухирцях
пресинаптичних волокон, проте його нема в постсинап-
тичних мембранах. Тому імпульс, що надходить антидром-
но до постсинаптичної мембрани, не зумовлює вивільнен-
ня синаптичного трансмітера. Поширення імпульсу мож-
ливе лише за умови, що потенціал дії досягає пресинап-
тичних закінчень і зумовлює виділення накопиченого в них
хімічного трансмітера.
Розвиток синапсів
Цікавим є питання про те, як протягом розвитку нейро-
ни знаходять один одного і налагоджують відповідні синап-
тичні контакти. Під час росту організму на верхівках аксо-
нів містяться конуси нарос тання, що забезпечують мігра-
цію крізь тканини. Ці конуси діють за участі атрактантів і
репелентів тканин і, якщо нема принаймні однієї з цих
речовин, то аксон відмирає. Деталі розвитку в цій книзі не
описані. Однак треба звернути увагу на важливість у цьому
процесі білків, які називають семифоринами. Окремі
представники цієї великої родини тісно пов’язані з транс-
мембранними доменами, тоді як інші здатні до переміщен-
ня. В хребетних описано понад 20 семифоринів. Репеленти
відштовхують конуси наростання, а атрактанти, навпаки,
притягують їх. Проте вплив цих білків залежить теж від
концентрації вторинних месенджерів, що містяться в кону-
сі наростання, який перебуває в ділянці впливу семифори-
нів. Рецептори для семифоринів називають нейрофіліна-
ми. Крім того, багато нейронів налагоджують синаптичні
контакти з великою кількістю інших нейронів або скелет-
ними м’язами, надалі невідповідні контакти ліквідуються
і залишаються лише ті, які згодом функціонують у дорос-
лому організмі. Багато нейронів відмирають під час роз-
витку (апоптоз; див. Розділ 1), залишаються ж лише най-
активніші нейрони і їхні синаптичні контакти. Між ней-
ронами є також певна конкуренція за утворення синаптич-
них сайтів, і нервові закінчення сусідніх нейронів вроста-
ють у ділянки, що позбавлені іннервації.
ЕЛЕКТРИЧНІ ЯВИЩА В
ПОСТСИНАПТИЧНИХ НЕЙРОНАХ
Методика, що дає змогу проникнути в клітину спинного
мозку, допомагає вивчати явища електричної активності в
постсинаптичному нейроні. Цього досягають шляхом уве-
дення мікроелектрода в вентральну частину спинного моз-
ку. Прокол клітинної мембрани ідентифікують за виник-
ненням стійкої (-70 мВ) різниці потенціалів між мікро-
електродом і електродом, що розміщений поза клітиною.
Підтвердженням того, що клітина є спинномозковим мото-
нейроном, слугує подразнення відповідного переднього
корінця і наступне фіксування електричної активності клі-
тини. Таке подразнення зумовлене антидромним імпульсом
(див. Розділ 2), який поширюється до тіла клітини і зупи-
няється в цій точці. Отже, наявність потенціалу дії в клітині
СИНАПТИЧНЕІ КОНТАКТНЕ ПЕРЕДАВАННЯ/81
Синаптична
щілина
Рис. 4-5. Цикл маленьких синаптичних пухирців у пресинаптичному нервовому закінченні. Пухирці відділяються від ранньої
ендосоми і наповнюються нейротрансмітером (НТ; угорі ліворуч). Далі вони рухаються до плазматичної мембрани, після чого
і відбувається їхній докінг і праймінг. У випадку надходження до закінчення потенціалу дії, надходження Са2* зумовлює процеси
злиття й екзоцитозу, і вміст пухирця виділяється в синаптичну щілину. У подальшому стінка пухирця вкривається клатрином
і захоплюється внаслідок ендоцитозу. В цитоплазмі вона зливається з ранньою ендосомою і цикл повторюється (відтворено
за дозволом з Зисіїїої ТС: Тїіе вупарііс уезісіе сусіе: а сазсабе ої ргоіеіп-ргоіеіп іпіегасііопз. №(иге 1995:375:645).
Нейрон:
-----------► Плазматична
Синаптичний
пухирець
мембрана
Рис. 4-6. Головні білки, що взаємодіють, зумовлюючи акцеп-
тування і злиття синаптичних пухирців нервових закінчень
(відтворено за дозволом з Еегго-Моуіск 3, Зоїтп Р: Уезісіе їи-
зіол йот уеазі іо тал. Наіиге 1994:370:191).
після антидромного подразнення свідчить про те, що клі-
тина, у яку введено мікроелектрод, справді є мотонейро-
ном спинного мозку, а не інтернейроном. Активність у пев-
них пресинаптичних закінченнях, що контактують з клі-
тиною, у яку введено мікроелектрод, може бути ініційова-
на шляхом подразнення заднього корінця (рис. 4-7).
Збуджувальні
постсинаптичні потенціали
Поодинокі подразнення чутливих нервів за умов експе-
риментів, описаних вище, не призводять до появи в пост-
синаптичному нейроні потенціалу дії, здатного поширю-
ватись. Замість цього подразнення зумовлює або коротко-
часну часткову деполяризацію, або короткочасну гіперпо-
ляризацію.
Реакція деполяризації, спричинена поодиноким відпо-
відної сили подразником, розпочинається через 0,5 мс після
надходження імпульсу в спинний мозок, досягає макси-
муму через 1,0-1,5 мс і згодом експоненціально припи-
няється. Протягом цього потенціалу збудливість нейрона
щодо іншого подразника зростає, внаслідок чого цей по-
тенціал названо збуджувальним постсинаптичним по-
тенціалом (ЗПСП).
ЗПСП утворюється шляхом деполяризації постсинап-
тичної клітинної мембрани, суміжної з пресинаптичним
закінченням. Збуджувальний трансмітер відкриває №+- або
Са2+-канали постсинаптичної мембрани, чим зумовлює
виникнення внутрішнього струму. Ділянка утвореного
таким способом струму є настільки маленькою, що він не
поширюється, доки позитивні заряди не деполяризують
7 367-2
82 / РОЗДІЛ 4
Рис. 4-7. Розміщення реєструвального і подразнювального
електродів під час дослідження синаптичної активності в спин-
номозкових мотонейронах ссавців. Подразнення П2 викорис-
товують для виникнення антидромних імпульсів, що дає змогу
ідентифікувати клітину, а подразнення П1 - для ортодром-
ного подразнення через рефлекторну дугу.
цілу мембрану. ЗПСП, зумовлені активністю в одному
синаптичному пухирці, невеликі, проте деполяризації, що
виникають у кожному з активних синаптичних пухирців,
додаються.
Сумація може бути просторовою або часовою. Якщо
активність виникає одночасно в більше ніж одному синап-
тичному пухирці, то простежується просторова сумація,
і активність одного синаптичного пухирця підсилює
активність іншого, наближаючись до критичного рівня
деполяризації. Часова сумація виникає, коли повторні
аферентні подразники зумовлюють нові ЗПСП, перш ніж
згасають попередні. Очевидно, що чим довше триває
ЗПСП, тим більша можливість виникнення сумації. Явища
просторового і часового підсилення відображені на рис.
4-8. Отже, ЗПСП не підлягає законові “усе або нічого”, а
його значення пропорційне до сили аферентних подраз-
ників. Якщо ЗПСП у разі досягнення критичного рівня
деполяризації в клітині є значним, то виникає повноцінний
потенціал дії.
Синаптична затримка
Між часом надходження імпульсу до пресинаптичного
закінчення і початком реакції в постсинаптичному нейроні
виникає перерва тривалістю 0,5 мс, яку називають синап-
тичною затримкою. Затримка в умовах максимального
подразнення пресинаптичного нейрона відповідає латент-
ності ЗПСП і зумовлена часом, що потрібний для виділення
синаптичного трансмітера і його дії на мембрану постси-
наптичної клітини. Внаслідок цього час, затрачений на
передавання імпульсу в ланцюгу нейронів, що містить
Рис. 4-8. Просторова (А-С) і часова сумація (О-Е) ЗПСП. Зміни
потенціалів зафіксовано за допомогою одного електрода, уве-
деного всередину постсинаптичної клітини. А-С: застосовано
аферентні подразники зростаючої сили. У цьому випадку акти-
вується щораз більша кількість синаптичних пухирців, унаслі-
док чого (С) досягається критичний рівень деполяризації і
ґенерується потенціал дії. О-Е: застосовано два різні, однакові
за силою, подразники. У випадку Е часовий інтервал між ними
зменшено, внаслідок чого теж досягається критичний рівень
деполяризації і ґенерується потенціал дії.
велику кількість синапсів, є тривалішим, ніж у ланцюгу,
де синапсів лише декілька. Оскільки відомо, що мінімаль-
ний час, потрібний для передавання через один синапс,
становить 0,5 мс, то шляхом вимірювання часу затримки
в передаванні від заднього корінця через спинний мозок
до переднього корінця можна з’ясувати: є задана рефлек-
торна дуга моносинаптичною чи полісинаптичною (тобто
містить більше одного синапсу).
Гальмівні
постсинаптичні потенціали
У деяких випадках подразнення спричинене ЗПСП в
одних нейронах, зумовлює явища гіперполяризації в інших.
Подібно до ЗПСП, ці явища досягають максимуму через
1,0-1,5 мс після подразнення, а потім експоненціально за-
гасають за часовою сталою (час загасання, що відповідає
1/е; або 1/2,718 максимуму). Загасання триває приблизно
З мс (рис. 4-9). Протягом дії цього потенціалу збудливість
нейрона у відповідь на інші подразники послаблюється,
тому його названо гальмівним постсинаптичним потен-
ціалом (ГПСП). ГПСП властиві явища як просторової
сумації, про що свідчить зростання значення відповіді у
разі зростання сили гальмівного аферентного впливу, так
і часової. Такий тип гальмування називають постсинап-
тичним, або прямим, гальмуванням.
ГПСП може бути зумовлений місцевим зростанням про-
никності мембрани для СГ. У випадку активності галь-
мівних синаптичних пухирців виділення трансмітера спри-
чинює відкривання СІ -каналів у суміжній зі синаптичним
пухирцем ділянці постсинаптичної мембрани; СГ пере-
ходить за концентраційним градієнтом, унаслідок чого
негативний заряд переміщується всередину клітини, і мем-
бранний потенціал збільшується.
Послаблення збудливості нервової клітини під час
ГПСП зумовлене зміщенням мембранного потенціалу в
СИНАПТИЧНЕ І КОНТАКТНЕ ПЕРЕДАВАННЯ / 83
-90 мВ----— Ек
Рис. 4-9. ГПСП, зумовлений збільшенням надходження СІ-,
що виникає внаслідок подразнення в умовах, коли мембран-
ний потенціал досягає різних рівнів за допомогою потен-
ціалозалежної фіксації; МПС-мембранний потенціал спокою
нейрона. Зверніть увагу, що у випадку досягнення мемб-
ранним потенціалом рівня, який відповідає ЕСІ, ГПСП зникає,
а в умовах найвищого мембранного потенціалу стає пози-
тивним.
протилежному щодо критичного рівня деполяризації на-
прямі. Внаслідок цього для досягнення критичного рівня
деполяризації необхідна набагато більша збуджувальна
(деполяризувальна) активність. Факт, що ГПСП зумовле-
ний СІ , можна довести в досліді з повторним подразнен-
ням, коли відбувається зміна мембранного потенціалу спо-
кою й утримання його за допомогою потенціалозалежної
фіксації (кліпси). Коли мембранний потенціал спокою
перебуває на рівні ЕС1, то гальмівний потенціал зникає (див.
рис. 4-9), а в разі більш негативного мембранного потен-
ціалу він стає позитивним.
ГПСП теж може бути зумовлений відкриванням К+-
каналів, унаслідок чого К+ виходить з постсинаптичної клі-
тини. Крім того, ГПСП також виникає у випадку закриття
№’- і Са2+-каналів.
Повільні
постсинаптичні потенціали
Окрім ЗПСП та ГПСП, описаних вище, в автономних
вузлах, серцевому і гладких м’язах, а також у кіркових ней-
ронах виникають повільні ЗПСП та ГПСП. Ці постсинап-
тичні потенціали мають латентність, що дорівнює 100—
500 мс, і тривають декілька секунд. Повільні ЗПСП зумов-
лені головно зниженням провідності К+, а повільні ГПСП
- її підвищенням.
У симпатичних вузлах виявлено також пізні повільні
збуджувальні постсинаптичні потенціали з латентністю в
1-5 с і тривалістю 10-30 хв. Цей потенціал теж зумов-
лений, принаймні частково, зниженням провідності К+, а
трансмітером цього є пептид, тісно пов’язаний з ГнРГ -
гормоном, що утворений нейронами гіпоталамуса і сти-
мулює секрецію ЛГ (див. Розділ 14).
Виникнення потенціалу дії в
постсинаптичному нейроні
Постійний взаємний вплив збуджувальної і гальмівної
активностей на постсинаптичний нейрон зумовлює коли-
вання мембранного потенціалу, що відповідає алгебричній
сумі гіпер- і деполяризувального впливів. Тіло нейрона,
отже, є певного типу інтегратором. Якщо 10-15 мВ достат-
ні для досягнення критичного рівня деполяризації, то ви-
никає пік. Однак електричні явища в нейроні складніші. В
мотонейронах частиною клітини, що має найнижчий поріг
стосовно виникнення повноцінного потенціалу дії, є по-
чатковий сегмент - ділянка аксона, розміщена безпосе-
редньо за його горбиком. Цей безмієліновий сегмент де-
або гіперполяризують джерела струму, що виникає в збуд-
ливих або гальмівних синаптичних пухирцях. Ця ділянка
нейрона активізується першою, а далі потенціал поширю-
ється в двох напрямах - уздовж аксона і в зворотному
напрямі, тобто до тіла клітини. Ретроградні імпульси, що
досягають тіла клітини, ймовірно, важливі для “очищення”
від попередніх впливів, що необхідно для наступного
повторення взаємного впливу на клітину збуджувальної та
гальмівної активностей.
Функція дендритів
Тривалий час уважали, що дендрити - це ділянки, де
виникають імпульси, які змінюють мембранний потенціал
початкового сегмента, тобто є просто виступами тіла кліти-
ни, що збільшують площу інтеграції. Якщо дендритне
дерево нейрона велике і містить численні пресинаптичні
пухирцеподібні закінчення, то виникає змога більшої взає-
модії гальмівних і збуджувальних впливів. Потоки імпуль-
сів, що надходять до дендритів і відходять від них, нароста-
ють і загасають. Роль дендритів у виникненні електроенце-
фалограми (ЕЕГ) розглянуто в Розділі 11.
Сучасні дані свідчать, що функція дендритів у забезпе-
ченні нервової діяльності є складнішою. В дендритах мож-
на зафіксувати потенціали дії. В багатьох випадках вони
ініційовані в початковому сегменті і переходять ретроград-
но, проте потенціал дії, що здатний поширюватись, виникає
теж і в самих дендритах. Врешті, посилений інтерес вияв-
ляється до мікродоменів, що містяться в цитоплазмі бага-
тьох різних типів клітин, і, ймовірно, формування поблизу
окремих дендритних шипів пулів Са2+, що збільшує мож-
ливість локальних змін в інтенсивності синаптичної про-
відності й, отже, може стосуватися процесів навчання та
пам’яті.
Електрична провідність
У синаптичних контактах, де виникає електрична про-
відність, імпульс, що надходить до закінчення аксона,
генерує в постсинаптичній клітині збуджувальний постси-
наптичний потенціал, який унаслідок існування в ділянці
контакту низькорезистентних містків має коротший ла-
тентний період, ніж ЗПСП у синапсах з хімічною провід-
ністю. В синапсах мішаного типу відбуваються як такого
типу коротколатентна реакція, так і довголатентна, опосе-
редкована хімічно.
СИНАПТИЧНЕ І КОНТАКТНЕ ПЕРЕДАВАННЯ / 85
кає внаслідок ушкодження спинного мозку, і у випадку
розсіяного склерозу, зокрема, у разі інтратекального вве-
дення за допомогою імплантованої помпи. Інші трансміте-
ри теж зумовлюють пресинаптичне гальмування шляхом
6-білок-опосередкованої дії на' Са2+- і К+-канали.
І навпаки, у разі пролонгованого потенціалу дії виникає
пресинаптичне збудження (див. рис. 4-12), і Са2+-канали
відкриваються на триваліший час. Молекулярні механізми,
що забезпечують пресинаптичне збудження і які опосеред-
ковують серотоніном, детально вивчені на морських слима-
ках Аріухіа. Виділення в аксо-аксонних закінченнях
серотоніну зумовлює збільшення внутрішньоклітинної
концентрації циклічного АМФ, і наступне фосфорилюван-
ня одного з видів К+-каналів зумовлює закриття цих кана-
лів, сповільнюючи реполяризацію і пролонгуючи потен-
ціал дії.
Організація гальмівних систем
Пресинаптичне і постсинаптичне гальмування виника-
ють переважно внаслідок збудження в певних системах,
що конверґують на конкретному постсинаптичному ней-
роні (аферентне гальмування). Нейрони можуть теж галь-
Пресинаптичне гальмування
Пресинаптичне полегшення
Рис. 4-12. Вплив пресинаптичного гальмування та пресинап-
тичного полегшення на потенціал дії, надходження Са2+ до
пресинаптичного нейрона і ЗПСП в постсинаптичному ней-
роні. В кожному випадку суцільні лінії відображають конт-
рольні значення, а штрихові - зміни, що виникають унаслідок
гальмування і полегшення (модифіковано з КапсІеІ ЕР,
8сїі\л/аіІ2 ЛН, ЗеззеІІ ТМ [есІИогз]. Ргіпсіріез о! МеигаІ Зсіепсе,
4іїі есі. Мс6га\л/-НіП, 2000).
мувати шляхом негативного зворотного зв’язку. Наприк-
лад, кожен мотонейрон спинного мозку регулярно віддає
зворотну колатераль, що утворює синаптичний контакт з
гальмівним інтернейроном, який закінчується на тілі
спинномозкового нейрона, а також інших мотонейронах
спинного мозку (рис. 4-13). Цей специфічний гальмівний
нейрон інколи називають клітиною Реншоу. Імпульси, що
генеруються в мотонейроні, активують гальмівний інтер-
нейрон, який зумовлює виділення гальмівного трансміте-
ра і, отже, сповільнення або навіть припинення розряду в
мотонейроні. Подібні гальмування через зворотні кола-
тералі простежуються в корі великого мозку і лімбічній
системі.
Пресинаптичне гальмування за участю низхідних шля-
хів, що закінчуються на аферентних шляхах у задньому
розі, може брати участь у передаванні відчуття болю (див.
Розділ 7).
Іншого типу гальмування виникає в мозочку. В цій
частині головного мозку стимулювання кошикових клітин
зумовлює ГПСП у клітинах Пуркіньє (див. Розділ 12).
Однак кошикові клітини і клітини Пуркіньє збуджуються
тими ж паралельними волокнами. Така організація, яку
називають гальмуванням прямим зв’язком, мабуть, обме-
жує тривалість збудження, зумовленого певними аферент-
ними імпульсами.
Сумація і оклюзія
Взаємодія між збуджувальними і гальмівними впли-
вами в синаптичних контактах нервової мережі відобра-
жає інтегрувальну і модулювальну діяльність нервової
системи.
У гіпотетичній нервовій мережі, яка зображена на рис.
4-14, нейрони А і В конверґують на X, а нейрон В диверґує
на X і ¥. Подразнення А або В зумовлює виникнення ЗПСП
А
Рис. 4-13. Гальмування зворотним зв’язком спинномозкового
мотонейрона за допомогою інтернейрона (клітини Реншоу).
86 / РОЗДІЛ 4
в X. Якщо А і В подразнені одночасно і виникають потен-
ціали дії, то в X виникають дві ділянки деполяризації і
відбувається сумація їхньої дії. Унаслідок цього ЗПСП в X
буде вдвічі більшим, ніж у разі окремого подразнення А
або В, і потенціал в X з легкістю досягає критичного рівня
деполяризації. Ефект деполяризації, зумовлений імпуль-
сами в А, підсилює імпульси, що спричинюють активність
у В, і навпаки; отже, виникає просторове підсилення. В
цьому випадку У не збуджується, проте його збудливість
підвищена, і в ньому легше виникне ЗПСП за умови актив-
ності нейрона С. Отже, У, як кажуть, перебуває в підпо-
роговому стані стосовно X.
Загалом нейрони перебувають у підпороговому стані,
якщо без впливу аферентних імпульсів (тобто поза зоною
розряду), у них підвищена збудливість. Нейрони, що мають
на собі декілька активних пухирцеподібних закінчень,
перебувають у підпороговому стані, а ці, що мають їх ба-
гато - у зоні розряду. Гальмівні імпульси зумовлюють по-
дібне часове та просторове підсилення й ефект підпоро-
гового стану.
Якщо в нейроні В потенціали дії виникають один за
одним, то X і У збуджуються внаслідок часової сумації
утворених ЗПСП. Якщо С подразнено декілька разів, то У
і X теж збуджуються. Якщо В і С збуджуються повторно в
цей же час, то розряд буде виникати в X, У і 7. Отже, відпо-
відь на одночасне подразнення В і С не є більшою, ніж
сума відповідей на окремі подразнення В і С, оскільки В і
С закінчуються на нейроні У. Таке зниження рівня
очікуваної відповіді, що відбувається в разі подразнення
пресинаптичних волокон, називають оклюзією.
Збуджувальний і гальмівний підпорогові ефекти, а
також явище оклюзії можуть значно впливати на провід-
ність імпульсів у кожному конкретному шляху. Внаслідок
цих впливів часові характеристики під час проходження
імпульсів з периферії до головного мозку через низку
синапсів змінюються. Ці явища можуть теж пояснювати
такий важливий феномен, як передавання відчуття болю
(див. Розділ 7).
Рис. 4-14. Проста мережа нейронів. Нейрони А, В і С утво-
рюють збуджувальні закінчення на нейронах X, У і 2.
Нейромодуляція
Термін модуляція у фізіології часто трактують настіль-
ки вільно, що його визначення мало інформує про цю
функцію. Однак у нейробіології термін нейромодуляція
використовують для чіткого означення несинаптичної дії
речовин на нейрони, що змінює їхню чутливість до синап-
тичного збудження або гальмування. Нейромодуляція зде-
більшого зумовлена дією нейропептидів і циркулювальних
стероїдів, а також стероїдів, що продукуються в нервовій
системі (нейростероїди; див. нижче).
ХІМІЧНИЙ ХАРАКТЕР
СИНАПТИЧНОЇ АКТИВНОСТІ
Значення
Факт, що провідність у більшості синапсів є хімічною,
має важливе фізіологічне і фармакологічне значення. Нер-
вові закінчення назвали біологічними перетворювачами,
оскільки вони перетворюють електричну енергію у хімічну.
В загальних рисах цей процес охоплює синтез трансміте-
рів, їхнє накопичення в синаптичних пухирцях і виділення
під впливом нервових імпульсів у синаптичну щілину. Далі
трансмітери діють на відповідні рецептори мембрани пост-
синаптичної клітини і швидко виходять з синаптичної
щілини шляхом дифузії, метаболізму або, у багатьох випад-
ках, унаслідок зворотного поглинання пресинаптичним
нейроном. Усі ці процеси, а також післярецепторні явища
в постсинаптичному нейроні, регульовані багатьма фізіо-
логічними факторами і, принаймні теоретично, їх можна
змінити за допомогою фармакологічних засобів. Отже,
фармакологи можуть створювати засоби, що не тільки
регулюють сомато- і вісцеромоторні функції, а й здатні
впливати на емоції, поведінку та всі інші складні функції
головного мозку.
Хімічний склад трансмітерів
У випадку, коли деяка сполука нерівномірно розподілена
в нервовій системі, і цей розподіл відповідає розподілу її
рецепторів, а також ензимів, що синтезують і катаболізують
цю речовину, то можна передбачати, що ця сполука є транс-
мітером. Додатковим доказом слугує те, що сполука виді-
ляється у відповідних ділянках головного мозку і що вона
впливає на певні окремі нейрони у разі нанесення на їхні
мембрани за допомогою мікропіпетки (мікройонофорез).
Багато трансмітерів, а також ензимів, що беруть участь у
їхньому синтезі і катаболізмі, ідентифіковано в нервових
закінченнях головного мозку і різних інших тканинах за
допомогою імуноцитохімічних методів з використанням
значених антитіл. Антитіла специфічно зв’язуються з пев-
ною речовиною, і локалізацію цієї речовини визначають
за позначкою методами світлової або електронної мікро-
скопії. Гістохімічна гібридизація іп 8Ііи, яка дає змогу
виявляти мРНК, що беруть участь у синтезі певних ензимів
або рецепторів, теж є важливим методом дослідження.
Виявлені нейротрансмітери за хімічною структурою
можна розділити на головні класи, або родини: аміни,
амінокислоти, поліпептиди. Деякі становлять пурини, а N0
та СО (див. нижче) - гази. Окрім того, трансмітери можуть
бути похідними арахідонової кислоти. Зазначимо, що біль-
СИНАПТИЧНЕ І КОНТАКТНЕ ПЕРЕДАВАННЯ / 87
шість цих речовин не тільки виділяються в синаптичні
щілини, де чинять суто місцевий вплив. В інших умовах
вони дифундують у ПКР, навколо синапсу, впливають на
певній відстані від місця їхнього виділення (паракринний
зв’язок; див. Розділ 1). В окремих випадках їх теж виді-
ляють нейрони в кров’яне русло, як гормони. Дещо довіль-
на компіляція більшості відомих або ймовірних синаптич-
них трансмітерів і нейромодуляторів наведена в табл. 4-1.
Рецептори
Клонування й інші відповідні сучасні молекулярно-
біологічні методи дослідження дали змогу зробити важливі
відкриття стосовно структури і функції рецепторів нерво-
вих трансмітерів та інших хімічних посередників. Окремі
рецептори разом з лігандами описано далі в цьому розділі.
Проте виникають п’ять питань, які треба з’ясувати перед-
усім.
По-перше, детальне дослідження на сучасному рівні
допомогло виявити, що для кожного ліґанда є багато під-
типів рецепторів. Наприклад, норадреналін діє на о^- і а2-
рецептори, і ще клоновано по три їхні підтипи. Крім того,
Є Р(-, Р2- і Р3-рецептори. Очевидно, це помножує і робить
вибірковішим можливі впливи в певній клітині конкрет-
ного ліганду.
По-друге, у багатьох трансмітерів рецептори розміщені
як у постсинаптичній, так і в пресинаптичній частинах.
Такі пресинаптичні рецептори, або авторецептори, час-
то гальмують подальшу секрецію ліганду, забезпечуючи
регулювання шляхом зворотного зв’язку. Наприклад, нор-
адреналін діє на пресинаптичний ос2-рецептор, гальмуючи
секрецію норадреналіну. Проте авторецептори можуть теж
збуджувати виділення нервових трансмітерів.
По-третє, незважаючи на те, що лігандів і підтипів
рецепторів для кожного з них багато, рецептори можна
об’єднувати у великі родини відповідно до їхньої функції і
структури. Багато з них є серпентиновими рецепторами,
що діють через 6-білки і протеїнкінази (див. Роділ 1), інші
- йонними каналами. Об’єднані в групи рецептори визна-
чених нервових трансмітерів наведені в табл. 4-2. Зазна-
чимо, однак, що таблиця дуже спрощена. Наприклад,
активування ос2-рецепторів зумовлює зменшення внутріш-
ньоклітинної концентрації цАМФ, утім, вірогідно, що 6-
білки, активовані пресинаптичними а2-рецепторами, без-
посередньо діють на Са2+-канали, зумовлюючи гальмуван-
ня виділення норадреналіну шляхом зменшення надход-
ження Са24.
По-четверте, рецептори концентруються в постсинап-
тичних структурах поблизу закінчень нейронів, які проду-
кують специфічні для них нейротрансмітери. Це головно
зумовлене наявністю специфічно зв’язувальних білків. Для
нікотиноподібних ацетилхолінових рецепторів нервово-
м’язового закінчення таким білком є рапсин, а для глюта-
мінергічних рецепторів цю функцію виконують представ-
ники родини РВ2-зв’язувальних білків. ГАМКА-рецеп-
тори зв’язані з білком гефірином, що теж зв’язує і гліцинові
рецептори. ГАМКс-рецептори зв’язані з цитоскелетом
сітківки за допомогою білка МАР-1В.
По-п’яте, тривале зв’язування з лігандом робить біль-
шість рецепторів несприйнятливими, тобто настає десен-
сибілізація. Є два типи десенсибілізації: гомологічна
десенсибілізація, що супроводжується втратою сприйнят-
ливості стосовно якогось певного ліганду і збереженням
чутливості клітини до інших лігандів, і гетерологічна
десенсибілізація, за якої клітина стає несприйнятливою
до всіх лігандів. Десенсибілізація, що виникає в р-адре-
нергічних рецепторах, вивчена особливо детально. У разі
однієї з форм такої десенсибілізації відбувається фосфори-
лювання карбоксильної кінцевої ділянки рецептора специ-
фічною кіназою Р-адренергічного рецептора (р-АКК) за
участю іншого білка - р-арестину. Бета-арестин зв’язу-
ється теж з клатрином - речовиною, що активує рецептор-
залежний ендоцитоз. Крім того, десенсибілізація Р-адре-
нергічного рецептора може відбуватися шляхом фосфори-
лювання в карбоксильній кінцевій ділянці за допомогою
РКА (див. Розділ 1). Інтерналізація Р-адренергічних рецеп-
торів веде до посилення деградації мРНК рецептора, унас-
лідок чого кількість рецепторів зменшується (регулювання
пригнічення).
Зворотне поглинання
Останніми роками з’ясовано, що відбувається зворот-
не поглинання більшості, а можливо, і всіх, амінових та
амінокислотних нейротрансмітерів з синаптичної щілини
до цитоплазми пресинаптичного нейрона (рис. 4-15),
тобто нейрона, в якому ці речовини продукуються. Висо-
коафінні системи поглинання формують дві родини транс-
портних білків. Одна родина має 12 трансмембранних
доменів і переносить трансмітер разом з \а+ і СІ . До
членів цієї родини належать транспортери норадреналіну,
дофаміну, серотоніну, ГАМК, гліцину, а також проліну,
таурину і попередника ацетилхоліну - холіну. Крім того,
сюди ж належить і транспортер адреналіну. Інша родина
складається принаймні з трьох транспортерів, що опосе-
редковують поглинання глютамату. Ці транспортери зв’я-
зані з котранспортуванням Ж і К+, проте вони незалежні
від транспортування СІ". Дискусія стосовно їхньої струк-
тури триває: очевидно, вони мають 6, 8 або 10 трансмем-
бранних доменів. Один з цих транспортерів швидше за
все переносить глютамат у клітини глії, а не в нейрони
(див. Розділ 2).
Крім того, є два пухирцеві моноамінові транспортери:
УМАТ1 і УМАТ2. Хоча вони кодовані різними генами, їм
властива значна гомологічність: обидва мають широку
специфічність, переносячи дофамін, норадреналін, адре-
налін, серотонін і гістамін з цитоплазми до секреторних
гранул. Обидвох їх гальмує резерпін, що пояснює стан
значного виснаження пулу моноамінів, який виникає в разі
застосування цього засобу. Як і члени родини мембранних
транспортерів нейротрансмітерів, вони мають 12 транс-
мембранних доменів, проте їхня гомологія з мембранними
транспортерами незначна. Є теж пухирцевий транспортер
ГАМК (У6АТ), що переносить ГАМК та гліцин усередину
пухирців, і пухирцевий транспортер ацетилхоліну (див.
нижче).
Зворотне поглинання є важливим фактором часового
регулювання дії нервових трансмітерів. У разі інгібування
цього процесу ефект виділення трансмітера посилюється
і стає тривалішим. Це має клінічне значення. Наприклад,
численні ефективні антидепресанти власне є інгібіторами
процесу зворотного поглинання амінових нейротрансмі-
88 / РОЗДІЛ 4
Таблиця 4-1. Нейротрансмітери і нейромодулятори нервової системи ссавців1
Речовина Місце розташування
Ацетилхолін М’язово-нервове закінчення, прегангліонарні автономні закінчення, постгангліонарні симпатичні закінчення потових залоз і м’язів-вазодилятаторів; багато відділів головного мозку; закінчення деяких амакринових клітин сітківки
Аміни Дофамін ЗІР клітини симпатичних вузлів; смугасте тіло; серединне підвищення й інші частини гіпоталамуса; лімбічна система; частини нової кори; закінчення деяких інтернейронів сітківки
Норадреналін Більшість постгангліонарних симпатичних закінчень; кора великого мозку; гіпоталамус, стовбур головного мозку, мозочок, спинний мозок
Адреналін Гіпоталамус, таламус, навколоводопровідна сіра речовина, спинний мозок
Серотонін Гіпоталамус, лімбічна система, мозочок, спинний мозок; сітківка
Гістамін Гіпоталамус, інші частини головного мозку
Збуджувальні амінокислоти Глютамат Кора великого мозку, стовбур головного мозку
Аспартат Зорова кора
Гальмівні амінокислоти Гліцин Нейрони, що опосередковують пряме гальмування в спинному мозку, стовбур головного мозку, передній мозок; сітківка
Гамма-аміномасляна кислота (ГАМК) Мозочок; кора великого мозку; нейрони, що опосередковують пресинаптичне гальмування; сітківка
Поліпептиди Речовина Р, інші тахікіни Закінчення первинних аферентних нейронів, що опосередковують передавання відчуття болю; багато частин головного мозку; сітківка
Вазопресин Задня частка гіпофіза; довгастий мозок; спинний мозок
Окситоцин Задня частка гіпофіза; довгастий мозок; спинний мозок
КРГ Серединне підвищення гіпоталамуса; інші частини головного мозку
ТРГ Серединне підвищення гіпоталамуса; інші частини головного мозку; сітківка
СРГ Серединне підвищення гіпоталамуса
Соматостатин Серединне підвищення гіпоталамуса; інші частини головного мозку; драглиста речовина, сітківка
ГнРГ Серединне підвищення гіпоталамуса; навколошлуночкові органи; прегангліонарні автономні закінчення; сітківка
Ендотеліни Задня частка гіпофіза; стовбур головного мозку
Енкефаліни Драглиста речовина; багато інших частин ЦНС; сітківка
Бета-ендорфін, інші похідні проопіомеланокортину Гіпоталамус, таламус, стовбур головного мозку; сітківка
Ендоморфіни Таламус, гіпоталамус, смугасте тіло
Динорфіни Навколоводопровідна сіра речовина, передньовентральна ділянка довгастого мозку, драглиста речовина
Холецистокінін (ССК-4 і ССК-8) Кора великого мозку, гіпоталамус; сітківка
Вазоактивні кишкові пептиди Постгангліонарні холінергічні нейрони; деякі чутливі нейрони; гіпоталамус; кора великого мозку; сітківка
Нейротензин Гіпоталамус; сітківка
Гастрин-рилізинг пептид Гіпоталамус
Гастрин Гіпоталамус; довгастий мозок
Глюкагон Гіпоталамус; сітківка
Мотилін Нейрогіпофіз; кора великого мозку, мозочок
Секретин Гіпоталамус, таламус, нюхова цибулина, стовбур головного мозку, кора великого мозку, перемичка, морський коник, смугасте тіло
Кальцитонін ген-зв’язаний пептид-а Закінчення первинних аферентних нейронів; шляхи смаку; чутливі нерви; медіальний пучок переднього мозку
СИНАПТИЧНЕ І КОНТАКТНЕ ПЕРЕДАВАННЯ / 89
Таблиця 4-1. Закінчення
Речовина Місце розташування
Нейропептид ¥ Норадренергічні, адренергічні й інші нейрони довгастого мозку, навколоводопровідна сіра речовина, гіпоталамус, автономна нервова система
Активіни Стовбур головного мозку
Інгібіни Стовбур головного мозку
Ангіотензин II Гіпоталамус, мигдалеподібне тіло, стовбур головного мозку, спинний мозок
РМЯР амід Гіпоталамус, стовбур головного мозку
Галанін Передсердний натрійуретичний пептид Гіпоталамус, морський коник, середній мозок, спинний мозок Гіпоталамус, стовбур головного мозку
Пурини Аденозин Нова кора, нюхова кора, морський коник, мозочок
АТФ Автономні вузли, повідці
Гази N0, СО ЦНС
Ліпіди Анандамід Морський коник, базальні ядра, мозочок
1 Трансмітерна функція деяких поліпептидів не доведена.
Таблиця 4-2. Механізм дії вибраних нейротрансмітерів
Трасмітер Рецептор Вторинний месенджер Загальний вплив на канали
Ацетилхолін Нікотиноподібний м, М2 (серцевий) Мз М4 (залозистий) М6 Т ІФ3, ДАГ 4- Циклічна АМФ 4- Циклічна АМФ Т ІФ3, ДАГ Т ІФ3, ДАГ Т N3, інші малі йони Т Са2* Т К*
Дофамін сГ сҐ сГ сґ сГ Т Циклічна АМФ 4, Циклічна АМФ 4, Циклічна АМФ Т К‘, 4- Са2*
Норадреналін аіА’ аіВ’ аЮ а2А’ а2В’ а2С р, р2 Рз Т ІР3, ДАГ 4, Циклічна АМФ ? Циклічна АМФ Т Циклічна АМФ 4, Циклічна АМФ і К* Т К*. 4- Са2*
5НТ1 5НТ,а 5НТ,В 5НТ,В 5НТ2Д 5НТ2С 5НТ, 5НТ4 4, Циклічна АМФ 4, Циклічна АМФ 4, Циклічна АМФ Т ІФ3, ДАГ Т ІФ3, ДАГ Т Циклічна АМФ Т К* 4- к* 4 к* Т№*
Аденозин А, а2 X Циклічна АМФ ? Циклічна АМФ
Глютамат Метаботропний2 Іонотропний АМПА, каїнатний ММОА Т №* Т К‘, Са2*
ГАМК ГАМКа ГАМКВ ї ІФ3, ДАГ Т сі- Т К*. 4 Са2*
1 Рецептори 5НТ1Р, 5НТ1Р, 5НТ„В, 5НТ.., 5НТ„, 5НТК та 5НТ7 теж клоновані.
~ ~ 1Е’ 1г’ 2В’ 5А 5В о 7
2 Ідентифіковано одинадцять підтипів; усі вони зменшують концентрацію цАМФ або збільшують концентрацію ІФ3 (інозитол-
3-фосфат) і ДАГ (діацилгліцерол), за винятком одного, що підвищує концентрацію цАМФ.
90 / РОЗДІЛ 4
Рис. 4-15. Перетворення моноамінів, що продукуються в синаптичному контакті. У кожному нейроні, який продукує моноаміни,
ці речовини синтезуються в цитоплазмі і секреторних ґранулах (1); концентрація моноамінів у ґранулах є сталою (2) завдяки
двом пухирцевим моноаміновим транспортерам (\/МАТ). Моноамін виділяється шляхом екзоцитозу ґранул (3) і діє на рецептори
(4) (У-подібні структури, позначені як Р). Велика кількість рецепторів постсинаптичні, проте деякі пресинаптичні, а інші розміщені
на клітинах глії. Врешті відбувається активне поглинання моноаміну до цитоплазми пресинаптичного нейрона (5) за допомогою
моноамінового транспортера (МТТ) (відтворено за дозволом з Ноїїтап В^ еі аі: ОізігіЬиііоп ої топоатіпе пеигоігапзтіНег
ігапзрогїегз іп іііе гаї Ьгаіп. Ргопі МеигоепсІосппоІ 1998; 19:187).
терів. Уважають, що кокаїн інгібує зворотне поглинання
дофаміну. Регулювання поглинань глютамату нейронами і
клітинами глїї теж важливе, оскільки глютамат є збуджу-
вальним токсином, що здатний убивати клітини шляхом
їхнього надмірного подразнення (див. нижче). Вірогідно,
що під час ішемії й аноксії втрата кількості нейронів збіль-
шується, оскільки відбувається інгібування зворотного
поглинання глютамату.
ГОЛОВНІ НЕЙРОТРАНСМІТЕРНІ
СИСТЕМИ
Фізіологія синапсів - це складний розділ нейрофізіоло-
гії, що швидко розвивається, тому її не можна в деталях
відтворити в цій книзі. Однак все ж доцільно підсумувати
інформацію, що стосується головних нейротрансмітерів і
їхніх рецепторів.
Ацетилхолін
Порівняно проста структура алетилхоліну, що є оцтовим
ефіром холіну, зображена на рис. 4-16. Ацетилхолін міс-
титься у високих концентраціях переважно в маленьких
прозорих синаптичних пухирцях кінцевих ґудзиків нейро-
нів, що продукують ацетилхолін (холінергічні нейрони).
Синтез ацетилхоліну
Ацетилхолін синтезується в реакції холіну з ацетатом.
Холін - це важливий амін, який теж є попередником
мембранних фосфоліпідів - фосфатидилхоліну і сфінго-
СИНАПТИЧНЕ І КОНТАКТНЕ ПЕРЕДАВАННЯ / 91
мієліну, сигнальних фосфоліпідів тромбоцитарного акти-
вувального фактора і сфінгозилфосфорилхоліну. Холін
активно поглинають холінергічні нейрони за допомогою
транспортера (рис. 4-17), він також синтезується в нейро-
нах. Ацетат активується шляхом сполучення ацетатних
груп з відновленим коензимом А. Реакцію між активо-
ваним ацетатом (ацетил-коензим А, ацетил КоА) і холіном
каталізує ензим холінацетилтрансфераза. Цей ензим у
високій концентрації міститься в цитоплазмі холінергічних
нервових закінчень. Його локалізація настільки специ-
фічна, що наявність цього ензиму у високій концентрації
в певній нервовій ділянці є свідченням, що синапси в цій
ділянці належать до холінергічних. Ацетилхолін потрапляє
в синаптичні пухирці за допомогою пухирцевого транс-
портера - УАСЬТ.
Холінестерази
У разі реполяризації ацетилхолін повинен бути швидко
видалений з синаптичної щілини. Це відбувається шляхом
гідролізу ацетилхоліну з утворенням холіну й ацетату: цю
реакцію каталізує ензим ацетилхолінестераза (інша назва
справжня, або специфічна, холінестераза). Ацетилхолін-
естераза виявляє найвищу афінність стосовно ацетилхолі-
ну, проте гідролізує й інші ефіри холіну.
В організмі є багато естераз. Одна з них, що міститься
в плазмі, теж здатна гідролізу вати ацетилхолін, хоч і від-
різняється від ацетилхолінестерази. Цей ензим названо
псевдохолінестеразою, або неспецифічною холінесте-
разою. Псевдохолінестераза плазми частково регульована
гуморально, а також перебуває під впливом функційних
змін у печінці. З іншого боку, молекули специфічної холін-
естерази утворюють кластери в постсинаптичній мембрані
холінергічних синапсів. Естераза кодована одним геном,
однак завдяки альтернативному з’єднанню різних мРНК
утворюються дві каталітичні одиниці: одна з них фіксується
до клітинної мембрани за допомогою гліколіпідів, а інша
має колагеновий хвіст. Гідроліз ацетилхоліну відбувається
швидко, що пояснює зміни в провідності і явища
електричної активності під час синаптичної провідності.
Ацетилхолінові рецептори
Традиційно ацетилхолінові рецептори поділяють на два
головні типи, які відрізняються за фармакологічними влас-
тивостями. Мускарин - це токсичний алкалоїд отруйних
грибів: він лише незначно впливає на рецептори в авто-
номних вузлах, проте повністю імітує стимулювальну дію
ацетилхоліну на гладкі м’язи і залози. Тому цю дію ацетил-
холіну називають мускариноподібною дією, а відповідні
рецептори - мускариноподібними холінорецепторами.
Цій дії запобігає атропін, що блокує мускариноподібні
рецептори. В симпатичних вузлах невеликі кількості аце-
тилхоліну стимулюють постгангліонарні нейрони, а великі
кількості блокують проходження імпульсів з пре- на пост-
гангліонарні нейрони. Такого типу вплив усуває атропін,
проте його відтворює нікотин. Ця дія ацетилхоліну названа
нікотиноподібною, а відповідні рецептори - нікотинопо-
дібними холінорецепторами. Нікотиноподібні рецептори
поділяють на ті, що містяться в нервово-м’язових контак-
тах, і ті, що містяться в автономних вузлах та центральній
нервовій системі. Як мускарино-, так і нікотиноподібні
рецептори у великих кількостях є в головному мозку.
Нікотиноподібні холінорецептори належать до надро-
дини ліґандозалежних йонних каналів, у складі якої є теж
ГАМКД, гліцинові рецептори та деякі глютамінові рецеп-
тори. Вони утворені багатьма субодиницями, що кодовані
різними генами. Кожен нікотиноподібний холінорецептор
складається з п’яти субодиниць, що утворюють централь-
ний канал, який у разі активування рецептора проводить
Иа+ або інші катіони. Ці п’ять субодиниць належать до
набору, що складається з 16 відомих субодиниць: а,-а9,
Холін
+
Ацетилкоензим А
О І Холінацетилтрансфераза
II 1
СН3-С-О-СН-Н-М+-СН3
сн3 сн3
Ацетилхолін
| Ацетилхолінестераза
Холін
+
Ацетат
Рис. 4-16. Біосинтез і катаболізм ацетилхоліну.
Рис. 4-17. Біохімічні перетворення в холінергічних закінчен-
нях. АХ - ацетилхолін; АХЕ - ацетилхолінестераза; X - ре-
цептор Порівняйте з рис. 4-21 та 4-24.
92 / РОЗДІЛ 4
р2-р5, у, 6 та є, кодованих 16 різними генами. Деякі
рецептори є гомомерними, тобто містять, наприклад, п’ять
оц-субодиниць, проте більшість - гетеромерні. Нікотино-
подібний рецептор м’язового типу, виявлений у плоду,
утворений двома о^-субодиницями, р^субодиницею, у-
субодиницею і 8-субодиницею (рис. 4-18). У дорослих
ссавців 8-субодиниця заміщена є-субодиницею, яка змен-
шує тривалість часу, протягом якого канал відкритий, проте
збільшує його провідність. Нікотиноподібні холінорецеп-
тори автономних вузлів є гетеромерами, що містять пере-
важно оц-субодиниці, які комбінуються з іншими субодини-
цями, а нікотиноподібні рецептори головного мозку утво-
рені багатьма різними субодиницями. Велика кількість
нікотиноподібних холінорецепторів у головному мозку роз-
міщені пресинаптично, на аксонних закінченнях, що про-
дукують глютамін (див. нижче), і вони підсилюють вивіль-
нення цього трансмітера. Проте інші займають постсинап-
тичне положення. Деякі містяться в позанейронних струк-
турах, а окремі, ймовірно, навіть в інтерстиційній рідині,
тобто займають перисинаптиче положення.
На кожній ос-субодиниці міститься сайт зв’язування
ацетилхоліну, і коли молекула ацетилхоліну зв’язується із
кожним з цих сайтів, то вони індукують зміну конфігурації
білка, унаслідок чого цей канал відкривається, що зумов-
лює провідність №+ та інших катіонів, а надходження 1Ча+
приводить до виникнення деполяризаційного потенціалу.
Важливою особливістю нейронних нікотиноподібних холі-
норецепторів є їхня висока проникність для Са2+, що може
свідчити про їхню участь у процесах синаптичного збуд-
ження і навчання (див. нижче).
Мускариноподібні холінорецептори дуже відрізняються
від нікотиноподібних. Клоновано п’ять типів цих рецеп-
торів, що кодовані п’ятьма окремими генами. Характер М5-
рецептора точно не з’ясований. Інші чотири - це серпан-
тинові рецептори, зв’язані за допомогою 6-білків з адені-
латциклазою, К? -каналами або фосфоліпазою С (див. табл.
4-2). Номенклатура цих рецепторів ще не стандартизована.
Рецептор, позначений М у табл. 4-2, у великих кількостях
міститься в головному мозку. Рецептор М2 виявлений у
серці (див. Розділ 28), рецептор М4 - у тканині панкреа-
тичних ацинусів і панкреатичних острівців, де зумовлює
підвищення секреції підшлункових ензимів та інсуліну.
Рецептори і М4 містяться в гладких м’язах.
Норадреналін і адреналін
Хімічним трансмітером у більшості симпатичних пост-
гангліонарних закінчень є норадреналін. Він міститься в
синаптичних пухирцях нейронів, які синтезують трансмі-
тер і накопичують його в характерних невеликих пухирцях,
що містять щільну гранулу (зернисті пухирці; див. вище).
Норадреналін і його метиловий похідний адреналін проду-
кує мозкова речовина надниркової залози (див. Розділ 20),
однак адреналін не є трансмітером симпатичних постганг-
ліонарних закінчень. Закінчення симпатичних постганг-
ліонарних нейронів на гладких м’язах описані нижче;
кожен нейрон має численні варикозні розширення вздовж
аксонів, кожна з яких, очевидно, слугує місцем, де виділя-
ється норадреналін. У головному мозку теж є норадрена-
ліно-, дофаміно- і адреналінопродукувальні нейрони (див.
Розділ 15). Нейрони, що синтезують норадреналін, відпо-
<--------8,5 н м--------►
Рис. 4-18. Нікотиноподібний ацетилхоліновий рецептор пло-
ду; вигляд збоку (вгорі) і від верхівки (внизу). оц, у, 3 -
субодиниці рецептора (з МсСагїйу МР е! аі: Моїесиїаг Ьіоіоду
ої Нде асеіуїсіюііпе гесерїог. Аппи Рєу ІМеигозсі 1986;9:383.
Відтворено за дозволом з АппиаІ Рєуієуу ої іхіеигозсіепсе, уоі.
9, 1986).
відно, називають норадренергічними нейронами, хоча
теж використовують термін адренергічні нейрони. Оче-
видно, що для адреналінопродукувальних нейронів прий-
нятнішим є другий термін. Нейрони, що синтезують дофа-
мін, називають дофамінергічними нейронами.
Біосинтез і виділення катехоламінів
Головні катехоламіни організму - норадреналін, адре-
налін і дофамін - утворюються шляхом гідроксилюваннг
і декарбоксилювання амінокислоти тирозину (рис. 4-19)
Частина тирозину утворюється з фенілаланіну, проте біль-
шість-харчового походження. Фенілаланінгідроксилаз?
міститься головно в печінці. Тирозин транспортується де
нейронів, що синтезують катехоламіни, а також до клітиг
мозкової речовини надниркової залози завдяки концент
раційному механізму. В цитоплазмі клітин тирозин пере
творюється на диоксифенілаланін (ДОФА), а далі тиро
зингідроксилаза і ДОФА декарбоксилаза перетворююті
його на дофамін. Декарбоксилаза, інша назва якої - декар
боксилаза ароматичних Ь-амінокислот, дуже подібна до 5
гідрокситриптофандекарбоксилази, проте, очевидно, не
ідентична з нею. Далі дофамін проникає в зернисті пухирці
всередині яких дофамін (3-гідроксилаза перетворює йоп
СИНАПТИЧНЕ І КОНТАКТНЕ ПЕРЕДАВАННЯ / 93
на адреналін. У цій реакції вихідною речовиною є Ь-
ДОФА, проте норадреналін, який утворюється, перебуває
в О-конфігурації. Це саме так, незважаючи на те, що він
обертає поляризоване світло ліворуч (-). Правооберталь-
ний (+) норадреналін набагато менше активний. Стадією,
що лімітує швидкість реакції в цьому синтезі, є перетво-
рення тирозину на ДОФА. Тирозингідроксилазу, що ката-
лізує цю стадію, інгібує дофамін і норадреналін, таким спо-
собом відбувається внутрішнє регулювання процесу син-
тезу шляхом зворотного зв’язку. Кофактором тирозингідро-
ксилази є тетрагідробіоптерин, який під час перетворення
тирозину на ДОФА перетворюється на дигідробіоптерин.
Частина нейронів і клітини мозкової речовини наднир-
кової залози містять цитоплазматичну фенілетаноламін-
М-метилтрансферазу (Р\МТ - від англ. рйепуІеШапоІаші-
по-К-теШуИгапзГегаза), що каталізує перетворення норад-
реналіну на адреналін. У цих клітинах норадреналін,
очевидно, виходить з пухирців, перетворюється на адре-
налін і тоді проникає в інші пухирці, де накопичується.
У зернистих пухирцях норадреналін і адреналін зв’я-
зуються з АТФ і приєднуються до хроматограніну А -
білка, функція якого невідома. Великі зернисті пухирці
деяких норадренергічних нейронів містять теж нейропеп-
тид V (див. нижче). Хроматогранін А - це білок з моле-
кулярною масою 49 кДа, що міститься у багатьох ендо-
кринних та нейроендокринних клітинах і може відігравати
важливу роль у секреції та накопиченні гормонів. У деяких
тканинах виробляється подібний білок-хроматогранін В.
Кількість хроматограніну А в плазмі збільшується в хворих
з різними пухлинами ендокринних органів.
Транспортування катехоламінів у зернисті пухирці вико-
нують два пухирцеві транспортери (див. вище), а це транс-
портування гальмує резерпін.
Катехоламіни виділяються з автономних нейронів і клі-
тин мозкової речовини надниркової залози внаслідок екзо-
цитозу (див. Розділ 1). Оскільки в зернистих пухирцях
містяться теж не зв’язані з мембраною АТФ, хроматогранін
А і дофамін р-гідроксилаза, то вони виділяються з пухирців
разом з норадреналіном і адреналіном. Період півжиття
дофамін р-гідроксилази, що циркулює, набагато довший,
ніж період півжиття катехоламінів, а кількість цього цирку-
лювального ензиму перебуває під впливом генетичних та
інших факторів і, крім того, залежить від рівня активності
симпатичної нервової системи. Очевидно, що рівень цирку -
лювального хроматограніну А є ліпшим показником актив-
ності симпатичної нервової системи.
Фенілпіруватна олігофренія
Фенілкетонурія, або фенілпіруватна олігофренія, - за-
хворювання, яке супроводжується значним розумовим від-
ставанням і накопиченням у крові, тканинах і сечі великих
кількостей фенілаланіну та його кетокислотних похідних.
Це зумовлено вродженим дефіцитом фенілаланінгідро-
ксилази (див. рис. 4-19). Ген цього ензиму міститься в дов-
гому плечі хромосоми 12. Описано численні мутації цього
гена, що спричинюють фенілкетонурію. Катехоламіни
Фенілаланін-
гідроксилаза
Тетрагідро-
біоптерин
МН2
І
нс-соон нс-соон
ДОФА
(Диоксифенілаланін)
Фенілаланін
Фенілетаноламін-Л/-
метилтрансфераза
8-Аденозилметіонін
Адреналін
Тирозин-
гідроксилаза
Тетрагідро- НО
біоптерин
НО
ДОФА-
декарбоксилаза
Піродоксаль-
фосфат
Дофамін
(дигідроксифеніл-
етиламін)
ОН
ОН
Норадреналін
Рис. 4-19. Біосинтез катехоламінів. Штриховими лініями показано інгібування тирозингідроксилази норадреналіном і дофаміном.
Головні кофактори виокремлені курсивом.
94 / РОЗДІЛ 4
постійно утворюються з тирозину, і розумове відставання
зумовлене головно накопиченням у крові фенілаланіну і
його похідних. Тому в разі лікування фенілкетонурії необ-
хідне дієтичне харчування - обмежене вживання феніл-
аланіну.
Захворювання може бути теж спричинене недостатніс-
тю тетрагідробіоптерину. Оскільки тетрагідробіоптерин -
кофактор тирозингідроксилази, триптофангідроксилази
(див. вище), а також фенілаланінгідроксилази, то його дефі-
цит зумовлює нестачу катехоламінів і серотоніну, що поєд-
нується з гіперфенілаланінемією. Внаслідок цього вини-
кають гіпотонія, знижена активність і вади розвитку. Для
лікування застосовують тетрагідробіоптерин, леводопа, 5-
гідрокситриптофан, а також низькофенілаланінову дієту.
Катаболізм катехоламінів
Норадреналін, як і інші амінові та амінокислотні транс-
мітери, видаляється з синаптичної щілини шляхом зв’язу-
вання з пост- або пресинаптичними рецепторами (див. рис.
4-15), зворотного поглинання пресинаптичними нейрона-
ми або внаслідок катаболізму (рис. 4-20). Головним меха-
нізмом видалення норадреналіну є його зворотне погли-
нання, і цим частково пояснюють надмірну чутливість
структур, що позбавлені симпатичного впливу внаслідок
денервації.
Після перетинання норадренергічних нейронів їхні
закінчення дегенерують і, відповідно, зворотне поглинання
стає неможливим. Тому значна кількість норадреналіну,
що надходить з інших джерел, має змогу стимулювати
рецептори автономних ефекторних органів.
Адреналін і норадреналін метаболізуються шляхом
окиснення і метилювання з утворенням біологічно неак-
тивних продуктів. Окиснення каталізує моноаміноокси-
даза (МАО), а метилювання - катехол-О-метилтрансфе-
раза (КОМТ) (див. рис. 4-20). МАО міститься на зовніш-
ній поверхні мітохондрій.
Є дві ізоформи МАО: МАО-А та МАО-В, що відрізня-
ються за субстратною специфічністю і чутливістю до фар-
макологічних засобів. Обидві ізоформи містяться в ней-
ронах. МАО досить поширена, особливо значна її кількість
є в нервових закінченнях, у яких продукуються катехо-
ламіни. КОМТ теж поширена, особливо в печінці, нирках
і гладких м’язах. У головному мозку вона міститься в клі-
тинах глії, і лише невелика кількість - у постсинаптичних
нейронах, а в пресинаптичних норадренергічних нейронах
КОМТ взагалі не виявлена. Отже, є два різні шляхи мета-
болізму катехоламінів.
Позаклітинні адреналін і норадреналін здебільшого О-
метильовані, і вимірювання концентрації О-метильованих
похідних (норметанефрину і метанефрину в сечі) є важ-
ливим показником рівня секреції норепінефрину й епінеф-
рину. О-метильовані похідні не виділяються, а переважно
окиснюються, і в сечі найбільша кількість катехоламіно-
вого метаболіту перебуває у вигляді З-метокси-4-гідрокси-
манделової кислоти (ванілілманделова кислота, МГМК).
(див. рис. 4-20). Невеликі кількості О-метильованих похід-
них зв’язуються також з сульфатами і глюкуронідами.
У норадренергічних нервових закінченнях (рис. 4-21),
з іншого боку, частину норадреналіну МАО постійно пере-
творює на фізіологічно неактивні деаміновані похідні -
3,4-дигідроксиманделову кислоту (ДГМК) і її відповідниі
гліколь (ДГФГ). Далі вони перетворюються на їхні від
повідні О-метилові похідні - МГМК та МГФГ (див. рис
4-20).
Альфа- і бета-рецептори
Адреналін і норадреналін діють, відповідно, на ос- і (З
рецептори, оскільки норадреналін більше споріднений
ос-адренергічними рецепторами, а адреналін - з р-адре
нергічними. Як зазначено вище, а- і р-рецептори є типо
вими серпентиновими рецепторами, зв’язаними з 6-біл
ками, й існують у вигляді різних складних форм. Вони тісне
пов’язані з клонованими рецепторами дофаміну і серото
ніну, а також з мускариноподібними холінорецепторами.
Дофамін
У малих інтенсивно флуоресцентних (ЗІР - від англ
8та11 Іпіеп8е1у Лиоге8сеп1:) клітинах автономних вузлі]
(див. Розділ 13) і в деяких ділянках головного мозку (див
Розділ 15) синтез катехоламінів припиняється на утворен
ні дофаміну (див. рис. 4-19), і цей катехоламін слугує си
наптичним трансмітером. Дофамін підлягає активному
зворотному поглинанню за допомогою №'- і СГ-залеж
ного транспортера (див. вище). Його метаболізують МАС
і КОМТ з утворенням неактивних компонентів (рис. 4
22), і відбувається це таким самим способом, як інакти
вація норадреналіну. ДОФОК і ГВК теж кон’югуютьс;
переважно із сульфатами.
Клоновано п’ять різних дофамінових рецепторів, окрем
з них існують у вигляді складних форм. Усі вони зв’язан
за допомогою О-білків з сімома трансмембранними доме
нами. Рецептори Б] та О5 зумовлюють збільшення концент
рації цАМФ (див. табл. 4-2), проте вони по-різному
розміщені в головному мозку. Рецептори Б2, Б3 та О
зумовлюють зниження рівня цАМФ, і теж дещо відрізня
ються за розміщенням. Рецептор О4 більше, ніж інш
дофамінові рецептори, споріднений з “атиповим” анти
психотичним засобом - клозапіном, який ефективний у раз
шизофренії, однак має декілька екстрапірамідальних ефек
тів, як і більшість інших транквілізаторів. Крім того, яі
зазначено, кількість Б4-рецепторів у головному мозку у
випадку шизофренії збільшується в шість разів.
Серотонін
Серотонін (5-гідрокситриптамін, 5-НТ - від англ. 5
Ьудгохуігуріатипе) у високих концентраціях є в тромбо
цитах і шлунково-кишковому тракті, де міститься в ентеро
хромафінних клітинах і м’язово-кишковому сплетенні (див
Розділ 26). Менші кількості серотоніну виявлено в голов
йому мозку і сітківці.
Утворюється серотонін в організмі шляхом гідро-
декарбоксилювання незамінної амінокислоти триптофану
(рис. 4-23 та 4-24). У нормі гідроксилаза не насичується, і
відповідно, збільшення рівня надходження триптофану :
їжею може призвести до збільшення вмісту серотоніну І
головному мозку. Після виділення з серотонінергічню
нейронів більша частина серотоніну повертається внаслі
док активного зворотного поглинання (див. рис. 4-24), <
також його інактивує МАО (див. рис. 4-23) з утвореннял,
5-гідроксііндолацетатної кислоти (5-ГІАК). Ця речовині
СИНАПТИЧНЕ І КОНТАКТНЕ ПЕРЕДАВАННЯ / 95
НІМСНз
СН2
І
Невідомі
метаболіти
ОН
соон
І
неон
З-Метокси-4-гідрокси-
З-Метокси-4-гідрокси-
манделова кислота (МГМК)
манделовий альдегід
Кон’югати
Норадреналін
Норадреналін
(З-Метоксінорепінефрин)
3,4-Дигідрокси-
фенілгліколь
(ДГФГ)
Рис. 4-20. Угорі: катаболізм зовнішньоклітинних адреналіну і норадреналіну. Катаболізм відбувається головно в печінці.
Продукти катаболізму зв’язуються переважно з глюкуронідами і сульфатами (кон’югати). З-метокси-4-гідроксифунілгліколь
(МГФГ) теж зв’язується. Внизу: катаболізм норадреналіну в норадренергічних нервових закінченнях. Кислота і гліколь, що
утворюються за допомогою МАО, проникають у позаклітинну рідину і далі підлягають О-метилюванню з утворенням 3-метокси-
4-гідроксимонделової кислоти (МГМК) та МГФГ. Адреналін у нервових закінченнях, очевидно, катаболізується тим самим шляхом.
96 / РОЗДІЛ 4
— Тирозин
.. Деаміновані
похідні
ІМН2
І
—► Норметанефрин
Дигідроксифеніл-
етиламін
(дофамін)
| КОМТ
І\ІН2
І
сн2
3,4-Дигідроксифеніл-
ацетатна кислота
(ДОФОК)
КОМТ
СООН
МАО
ОН ОН
Рис. 4-21. Біохімічні перетворення в ділянці норадренергічних
закінчень НА-норадреналін; КОМТ - катехол-О-метилтранс-
фераза; МАО - моноамінооксидаза; X - рецептор. Для
спрощення схеми не зображено пресинаптичних рецепторів.
Зверніть увагу, що МАО розміщується внутрішньоклітинно,
тому норадреналін постійно деамінується в нервових закін-
ченнях. КОМТ діє головно на продукований норадреналін.
Порівняйте з рис 4-17 та 4-24.
З-Метокситирамін
(МТА)
Гомованілова кислота
(ГВК)
Рис. 4-22. Катаболізм дофаміну. Як і в інших реакціях окисного
деамінування, що їх каталізує МАО, спочатку утворюються
альдегіди, далі вони окиснюються в присутності альдегідде-
гідрогенази з утворенням відповідних кислот (ДОФОК і ГВК)
Альдегіди теж відновлюються до 3,4-дигідроксифенілетанолу
і З-метокси-4-гідроксифенілетанолу. ДОФОК і ГВК утворюють
сульфатні кон’югати.
становить головний метаболіт серотоніну, який виділяється
з сечею, тому визначення його кількості в сечі є показником
швидкості метаболізму серотоніну в організмі. В шишко-
подібній залозі серотонін перетворюється на мелатонін
(див. Розділ 24).
Кількість клонованих і характеризованих серотонінових
рецепторів постійно збільшується. Відомі 5-НТ]-, 5-НТ2-,
5-НТ3-, 5-НТ4-, 5-НТ5-, 5-НТ6- і 5-НТ7-рецептори. В межах
5-НТ(-групи розрізняють 5-НТ|Л-, 5-НТ|В-, 5-НТш-, 5-НТи -,
5-НТн -підтипи. У 5-НТ2-групі виділяють 5-НТ2д-, 5-НТ2В-
і 5-НТ2С (раніше відома як 5-НТ|С)-підтипи. Є два 5-НТ5-
підтипи: 5-НТ5А та 5-НТ5В. Більша частина цих рецепторів
зв’язана з О-білками і діє на аденілатциклазу і фосфоліпазу
С (див. табл. 4-2). Рецептори 5-НТ3, як і нікотиноподібні
холінорецептори, є йонними каналами. Деякі серотонінові
рецептори пресинаптичні, а інші - постсинаптичні.
Рецептори 5-НТ2А опосередковують агрегування тром-
боцитів і скорочення гладких м’язів. Миші з нокаутом гена
5-НТ2А-рецепторів набирають масу внаслідок збільшення
кількості споживання їжі, незважаючи на адекватне реа-
гування налептин (див. Розділ 14), і досягають дивовижних
розмірів. Рецептори 5-НТ3 містяться в шлунково-кишко-
вому тракті, а також задньому полі і пов’язані з актом блю-
вання (див. Розділ 14). Рецептори 5-НТ4 теж є в шлунково-
кишковому тракті, де вони зумовлюють посилення секреції
і перистальтики, і, крім того, у головному мозку. Рецептори
5-НТ6 та 5-НТ7 головного мозку містяться в межах лімбіч-
ної системи, а 5-НТ6 - виявляють високу афінність до анти-
депресантів.
Гістамін
Тіла гістамінергічних нейронів містяться в горбо-сосоч-
кових ядрах задньої гіпоталамічної ділянки (див. рис. 15-
6), а їхні аксони прямують до всіх відділів головного мозку,
у тім числі до кори великого мозку і спинного мозку. Отже,
гістамінергічна система подібна до норадренергічної, адре-
нергічної, дофамінергічної і серотонінергічної в тому, ще
порівняно невелика кількість клітин цієї системи налагод-
жує зв’язки з усіма відділами ЦНС.
Гістамін міститься також у клітинах слизової оболонки
шлунка (див. Розділ 6) та в гепариновмісних клітинах, як
називають повними клітинами, і яких особливо багато б
передній та задній частках гіпофіза.
Утворюється гістамін шляхом декарбоксилюваню
амінокислоти гістидину (рис. 4-25). Ензим, що каталізу*
цю стадію, відрізняється від декарбоксилаз Ь-ароматични?
кислот, що декарбоксилюють 5-гідрокситриптофан і Ь
ДОФА. Гістамін перетворюється на метилгістамін або
альтернативно, на імідазолацетатну кислоту. Остання реак
ція в людини кількісно менш значна. Для неї більше придат
ний ензим діамінооксидаза (гістаміназа), ніж МАО, хоч<
МАО каталізує окиснення метилгістаміну до метилімід
азолацетатної кислоти.
СИНАПТИЧНЕ І КОНТАКТНЕ ПЕРЕДАВАННЯ / 97
Триптофан
ІМН2
І
сн2- сн- соон
4птофан-
ПАК
Триптофан-
гідроксилаза
Моноамінооксидаза +
альдегіддегідрогеназа
Рис. 4-23. Біосинтез і катаболізм серотоніну (5-гідрокситрип-
таміну). Ензим, що каталізує декарбоксилювання 5-гідро-
кситриптофану, дуже подібний, проте, очевидно, не ідентич-
ний до екзиму, який каталізує декарбоксилювання ДОФА. Ко-
фактором триптофангідроксилази є тетрагідробіоптерин.
Утворення мелатоніну показано детально на рис. 24-11.
Відомі три типи гістамінових рецепторів: Нр Н2 та Н3
(від англ. ЬІ8іатіпе), усі вони містяться як у периферійних
тканинах, так і в головному мозку. Більшість, якщо не всі,
Н3-рецептори пресинаптичні і зумовлюють гальмування
виділення гістаміну та інших трансмітерів, діючи через
Рис. 4-24. Біохімічні перетворення в серотонінергічних си-
напсах. Порівняйте з рис. 4-17 та 4-21. 5-НТР - 5-гідрокси-
триптофан; 5-НТ - 5-гідрокситриптамін (серотонін); 5-ГІАК -
5-гідроксііндолацетатна кислота; X - серотоніновий рецеп-
тор. З метою спрощення на схемі не зображено пресинаптич-
них рецепторів.
6-білки. Рецептори Н] активують фосфоліпазу С, а Н2 -
підвищують внутрішньоклітинну концентрацію цАМФ.
Функція гістамінергічних систем головного мозку не з’ясо-
вана, проте відомо, що гістамін бере участь у процесах,
пов’язаних зі спонуканням, мотивацією, статевою пове-
дінкою, у регулюванні секреції окремих гормонів передньої
частини гіпофіза, кров’яного тиску, приймання рідин і
порога болю.
Збуджувальні амінокислоти:
глютамат і аспартат
Глютамат і аспартат деполяризують багато різних ней-
ронів ссавців, безпосередньо впливаючи на їхні клітинні
мембрани шляхом йонофорезу. Глютамат є головним збуд-
жувальним трансмітером у головному і спинному мозку.
Підраховано, що глютамат забезпечує 75% передавань
збуджувального типу в межах головного мозку. Аспартат,
ймовірно, є трансмітером у пірамідних і шипуватих зірчас-
тих клітинах зорової кори, проте це детально не дослід-
жено. Глютамат утворюється внаслідок відновного аміну-
вання проміжного продукту циклу Кребса - ос-кетоглюта-
рату (рис. 4-26), а аспартат - трансамінування проміжного
продукту циклу Кребса - оксалоацетату (див. Розділ 17).
Обидві реакції зворотні, і подальший метаболізм відбува-
ється в циклі лимонної кислоти. Як зазначено вище, гліаль-
ні клітини і пресинаптичні нейрони знову поглинають глю-
тамат за допомогою принаймні трьох різних транспор-
терів.
Є два типи глютамінових рецепторів: метаболотропні
та йонотропні. Метаболотропні рецептори - це зв’язані з
6-білками серпантинові рецептори, які зумовлюють збіль-
8 367-2
98/РОЗДІЛ 4
шення кількості внутрішньоклітинних ІФ3 та ДАГ, або
зменшення кількості внутрішньоклітинного цАМФ. Іден-
тифіковано 11 різних субодиниць цих рецепторів (див.
табл. 4-2). Вони поширені в головному мозку і, очевидно,
беруть участь у забезпеченні синаптичної пластичності,
зокрема в морському конику і мозочку. Нокаут гена одного
з цих рецепторів (однієї з форм тСіІиК.1), спричинює значні
порушення координації рухів і просторового навчання.
Ионотропні рецептори - це ліґандозалежні йонні кана-
ли, близькі до нікотиноподібних холінорецепторів (див.
вище), а також до ГАМК і гліцинових рецепторів (див.
нижче). Є три головні типи йонотропних рецепторів, назви
яких подібні до назв споріднених з глютаматом сполук:
каїнатні рецептори (каїнат - кислота, виділена з морських
водоростей), АМПА-рецептори (рецептори для ос-аміно-
3-гідрокси-5-метил-4-ізоксазолпропріонату) і NМ^А-ре-
цептори (рецептори для М-метил-О-аспартату). Як і ніко-
тинові, ГАМК та гліцинові йонотропні рецептори утворені
багатьма субодиницями. Ідентифіковано чотири субоди-
ниці АМПА-рецепторів, п’ять субодиниць каїнатних
рецепторів і шість субодиниць ММБА-рецепторів; усіх їх
кодують різні гени. Вважають, що ці рецептори мають пен-
тамерну структуру, проте окремі з них можуть бути тетра-
мерами, наразі ж їхня стехіометрія не з’ясована.
Каїнатні і АМПА-рецептори - це прості йонні канали,
які в разі відкривання забезпечують надходження і
зменшення К+. ММОА-рецептор теж є катіонним каналом.
Він забезпечує проходження порівняно великих кількостей
Са2+ і є унікальним у такому. По-перше, гліцин, що зв’я-
зується з ним, підсилює його функцію. Вірогідно, що гліцин
необхідний для нормального реагування рецептора на глю-
тамат (рис. 4-27). По-друге, зв’язування з глютаматом
зумовлює відкривання каналу, проте в разі нормального
мембранного потенціалу канал блокують йони М§24. Це
блокування усувається лише у випадку, коли нейрон, що
містить рецептор, частково деполяризується шляхом акти-
вування АМПА або інших каналів, які зумовлюють швидку
деполяризацію іншими синаптичними ланцюгами. По-
третє, фенциклідин і кетамін - засоби, що спричинюють
амнезію і відчуття дисоціації з довкіллям, - зв’язуються з
іншими сайтами каналу. Більшість глютамінергічних ней-
ронів забезпечені АМПА- і ИМВА-рецепторами. Каїнатні
рецептори розміщені пресинаптично на ГАМК-продуку-
вальних нервових закінченнях і постсинаптично - в різних
точках у межах головного мозку. Каїнатні і АМПА-рецеп-
тори містяться як у глії, так і в нейронах, а ММОА-рецеп-
тори, - ймовірно, лише в нейронах.
Висока концентрація ИМОА-рецепторів виявлена в
морському конику. Блокування цих рецепторів запобігає
довготривалій потенціації - тривалому збудженню в
нервових шляхах, що виникає після короткого періоду
високочастотного подразнення (див. нижче). Отже, ці
рецептори можуть мати важливе значення для процесів,
пов’язаних з пам’яттю і навчанням.
Особливістю глютамату і деяких його синтетичних ана-
логів є те, що, діючи на тіла нервових клітин, вони можуть
проводити в клітину таку велику кількість Са2\ яка спри-
чинить загибель клітини. Це дає змогу використовувати ці
МН2
І
НС С-СН2СН-СООН
І І
нм
Гістидин
Н
Гістидин-
декарбоксилаза
НС = С-СН2СН2МН2
НМ Л
Гістамін
Н
Гістамін-Л/-
метил-
трансфераза
Діаміноксидаза
(гістаміназа)
НС = С-СН2СН2МН2
СН3М
^С^ Метилгістамін
Н
Моноамін-
оксидаза
НС = С-СН-СООН
НІЧ
^С^ Імідазолацетатна
Н кислота
НС = С-СН2СООН
І І
СНзІМ
^С^ Метилімідазол-
Н ацетатна кислота
Рибозний кон’югат
Рис. 4-25. Синтез і катаболізм гістаміну.
СИНАПТИЧНЕ І КОНТАКТНЕ ПЕРЕДАВАННЯ / 99
Ізоцитат
Оксалосукцинат
Глютамат
а-кетоглютарат
±І\ІН3
Цикл лимонної
кислоти
Сукцинат
Глютаматдекарбоксилаза
СН;
Г амма-амінобутилат
(Г амма-аміномасляна
кислота, ГАМК)
ГАМК трансаміназа
(ГАМК-Т)
◄----- Малат
Фумарат
СОО"
Бурштиновий
напівальдегід
Рис. 4-26. Утворення і метаболізм глютамату і ГАМК.
збуджувальні речовини шляхом мікроін’єкцій для дискрет-
ного руйнування тіл нервових клітин, уникаючи ушкод-
ження суміжних аксонів.
Є багато доказів того, що збуджувальні речовини
відіграють важливу роль в ушкодженні головного мозку у
разі апоплексії (див. Розділ 32). Усування глютамату з поза-
клітинної рідини головного мозку відбувається переважно
за допомогою №+-залежних поглинальних систем нейронів
і глії. У випадку закупорення мозкової артерії клітини
гостро ішемізованої ділянки гинуть, а клітини навколиш-
ньої частково ішемізованої ділянки можуть виживати,
проте втрачають здатність утримували трансмембранний
градієнт №+, завдяки якому відбувається поглинання
глютамату. Внаслідок цього глютамат накопичується в ПКР
до рівня, що спричинює збуджувальне ушкодження і заги-
бель клітин у ділянці навколо інфаркту (ішемічна півтінь).
Вплив цих змін у процесі лікування наслідків апоплексії
розглянуто в Розділі 33.
Гальмівні амінокислоти:
гамма-аміномасляна кислота
Гамма-аміномасляна кислота (ГАМК, гамма-амінобу-
тират) є головним гальмівним трансмітером у головному
мозку, де забезпечує проведення приблизно в 20% синапсів
ЦНС. ГАМК теж міститься в сітківці і є трансмітером, при-
четним до пресинаптичного гальмування (див. вище).
ГАМК, що в рідинах організму перебуває у вигляді у-
амінобутирату, утворюється шляхом декарбоксилювання
глютамату (див. рис. 4-26). Цю реакцію каталізує глюта-
матдекарбоксилаза (6АБ - від англ. §1иіатаіе десагЬоху-
Іазе) - ензим, що, як виявлено за допомогою імуноцитохі-
мічних методів, міститься в нервових закінченнях у бага-
тьох частинах головного мозку. (ГАМК метаболізує пере-
важно трансамінуванням до сукцинатного півальдегіду і
далі перетворюється в циклі лимонної кислоти на сукцинат
(див. Розділ 17). Трансамінування каталізує ГАМК-транс-
аміназа (ГАМК-Т). Кофактором О А О і ГАМК-Т слугує
піридоксаль фосфат - похідне піридоксину (вітамін В6).
ГАМК активно поглинається за допомогою ГАМК-транс-
Са2+ Ма+
К+ г
Гліцин
Зовнішньо-
клітинна
частина
Закритий
йонний канал
Рис. 4-27. Схематичне зображення ММОА-рецептора. У ви-
падку зв’язування з рецептором гліцину і глютамату йонний
канал, що був закритий (ліворуч), відкривається, проте в умо-
вах мембранного потенціалу спокою канал блокований Мд2+
(праворуч). Цей блок усувається у разі часткової деполяри-
зації, зумовленої іншим впливом на нейрон, що містить рецеп-
тор, і Са2+ та Ма2+ надходять до нейрона. Блокування може
зумовити також і дизоцилпін малеат (МК-801).
Ь-глютамат
Внутрішньо-
клітинна
частина
Мд
МК-801
Блокатор
каналу
Відкритий
йонний канал
100/РОЗДІЛ 4
портера (див. вище). Пухирцевий транспортер ГАМК
забезпечує проникнення ГАМК усередину секреторних
пухирців. Цей транспортер має 10 трансмембранних доме-
нів, тоді як пухирцевий моноаміновий - 12 (див. вище).
Автоімунна реакція до 6АО і, як наслідок, нестача
ГАМК, спричинюють синдром ригідності (8М8 - від англ.
зйїТ-пзап зупсіготе), що супроводжується нестійкою, але
прогресуючою м’язовою ригідністю і болісними м’язови-
ми спазмами.
Цікаво, що ОАБ міститься теж у подібних до синап-
тичних пухирців структурах інсулінопродукувальних В-
клітин підшлункової залози, і ГАМК може відігравати роль
паракринового трансмітера в острівцях (див. Розділ 19).
Інсулінозалежний цукровий діабет (тип 1 діабету) - це авто-
імунне захворювання, яке характеризує деструкція В-
клітин, а більша частина автоантитіл є антитілами до ОАО.
Однак 8М8 є рідкісним захворюванням, тоді як діабет
типу 1 досить поширений, і не всі хворі 8М8 мають діабет
типу 1. Отже, співвідношення цих двох захворювань не
з’ясоване.
Описано три типи ГАМК-рецепторів: ГАМКД, ГАМКВ
та ГАМКС. Рецептори ГАМКД і ГАМКВ поширені в ЦНС,
тоді як у дорослих організмах хребетних ГАМКс-ре-
цептори містяться майже винятково в сітківці; ГАМКД- і
ГАМКс-рецептори- це йонні канали, утворені п’ятьма суб-
одиницями, які оточують отвір, що характерно для будови
нікотиноподібних холінорецепторів, а також багатьох глю-
тамінових рецепторів. У конкретному випадку йоном, що
проходить, є СІ (рис. 4-28).
Рецептори ГАМКВ - це метаболотропні рецептори, які
зв’язані з гетеродимерними 6-білками, що підвищують
провідність Кч-каналів, гальмують активність аденілат-
циклази і надходження Са2\ Збільшення надходжень СІ ,
виходу К+ і зменшення надходжень Са2+ зумовлюють гіпер-
поляризацію в нейронах з виникненням ГПСП. Характер
опосередковування дії ГАМКв-рецептора 6-білками в кон-
кретному випадку унікальний, оскільки в цьому процесі
переважно бере участь гетеродимер 6-білка, а не його
поодинока молекула.
Рецептори ГАМКС мають порівняно просту будову. Це
пентамери, утворені трьома р-субодиницями, які поєдну-
ються в різних комбінаціях. Рецептори ГАМКД теж є пента-
мерами, проте утворюються шляхом різного комбінування
шести ос-, чотирьох Р~, чотирьох у-, однієї 6- та однієї є-
субодиниць. Цим зумовлена значна різноманітність їхніх
властивостей у різних точках розташування.
Надходження СІ , зумовлене ГАМКД, стимулюють бен-
зодіазепіни - речовини, що мають помітну заспокійливу
дію, а також є ефективними міорелаксантами й антисудом-
ними засобами. Бензодіазепіни зв’язуються з ос-субоди-
ницями. Діазепам та інші бензодіазепіни широко застосо-
вують в усьому світі. Барбітурати й алкоголь, принаймні
частково, теж стимулюють проходження СІ через СІ -
канали. Метаболіти стероїдних гормонів - прогестерону
і деоксикортикостерону - зв’язуються з ГАМКд-рецепто-
рами і посилюють провідність СІ . Упродовж багатьох
років відомо, що прогестерон і деоксикортикостерон у
великих дозах виявляють снодійну і знеболювальну дію;
такі ефекти зумовлені впливом цих гормонів на ГАМКД-
рецептори.
Іншого класу бензодіазепінові рецептори виявлено в
стероїдопродукувальних ендокринних залозах та інших
периферійних тканинах, тому їх названо периферійними
бензодіазепіновими рецепторами. Вони, ймовірно,
беруть участь у біосинтезі стероїдів, виконуючи функцію,
подібну до функції 8іАК-білка (див. Розділ 20), тобто забез-
печують проникнення стероїдів у мітохондрії. Інша мож-
лива роль периферійних бензодіазепінових рецепторів
полягає у регулюванні клітинної проліферації. Периферійні
бензодіазепінові рецептори виявлені також в астроцитах
та пухлинах головного мозку.
Гліцин
Впливом на ИОМА-рецептори гліцин виявляє збуджу-
вальний ефект у головному мозку. Втім, він теж бере участь
у прямому гальмуванні, здебільшого у стовбурі головного
і спинному мозку. Як і ГАМК, гліцин діє шляхом посилення
провідності СГ. Його антагоністом щодо цього є стрихнін.
Клінічна картина конвульсій і м’язової гіперактивності,
спричинених стрихніном, свідчить про важливість постси-
наптичного гальмування для нормального функціонування
нервової системи. Гліцинові рецептори, що зумовлюють
гальмування - це СІ -канали. Вони є пентамерами, що
утворені двома субодиницями: ліґандозв’язувальною ос-
субодиницею і структуральною р-субодиницею. Нещодав-
но наведено вагомі докази стосовно наявності трьох видів
нейронів, які беруть участь у прямому гальмуванні в спин-
ному мозку: це нейрони, що виробляють гліцин; нейрони,
що виробляють ГАМК; нейрони, що виробляють і гліцин,
і ГАМК. Вірогідно, що нейрони, які виробляють лише
гліцин, містять гліциновий транспортер 6Ь¥Т2; нейрони,
які виробляють лише ГАМК, містять 6АО; а нейрони, які
виробляють і гліцин, і ГАМК, містять обидві ці речовини.
Третій вид нейрона становить особливий інтерес, оскільки
в нейронах, очевидно, гліцин і ГАМК містяться в одних і
тих самих пухирцях.
У деяких осіб простежуються надмірно активні реф-
лекси переляку (гіперексплексія), і, принаймні в окре-
мих випадках, у цьому разі виявлено заміни поодиноких
амінокислот у складі гліцинових рецепторів.
Анестезія
Механізм дії головних анестетиків донедавна був таєм-
ницею. Однак нові дані свідчать, що не тільки алкоголь і
барбітурати, а й інгаляційні анестетики діють на йонні
канали, зокрема на ГАМКВ- і гліцинові рецептори, зумов-
люючи посилення провідності СІ .
Речовина Р та інші тахікініни
Речовина Р - це поліпептид, який складається з 11 аміно-
кислотних залишків і міститься в кишці, різних пери-
ферійних нервах і багатьох відділах ЦНС. Його структура
наведена в табл. 26-2. Речовина Р є одним з шести пред-
ставників родини поліпептидів ссавців, які називають тахі-
кінінами. Ці сполуки відрізняються МН2-кінцями, проте
мають спільну карбоксильну кінцеву послідовність Рйе-
Х-бІу-Ьен-МеГМН,, де X - Уаі, НІ8, Ьуз або Різе. Пред-
ставники цієї родини перелічені в табл. 4-3. Багато подіб-
них тахікінінів є в організмах інших хребетних та безхре-
бетних.
СИНАПТИЧНЕ І КОНТАКТНЕ ПЕРЕДАВАННЯ /101
СІ
Внутрішньоклітинна
частина
Рис. 4-28. Схематичне зображення ГАМКа- і ГАМКв-рецепторів і головних механізмів їхньої дії. С-білок, що опосередковує дію
ГАМКв-рецепторів, є гетеродимером (відтворено за дозволом з Во\л/егу N6, Вго\л/пОА: Тїіе сіопіпд ої 6АВАВ гесеріогз. Маіиге
1997;386:223).
Тахікініни ссавців кодовані двома генами. Ген нейро-
кініну В кодує лише один поліпептид - нейрокінін В, ген
речовини Р (нейрокініну А) кодує решта п’ять поліпеп-
тидів. Три з них утворені шляхом альтернативного проце-
сингу первинної РНК, а два інші - посттрансляційного
процеси нгу.
Є три нейрокінінові рецептори. Два з них - рецептор
речовини Р та рецептор нейрокініну К, клоновано. З’ясо-
вано, що це серпентинові рецептори, зв’язані з (3-білками.
Активування рецептора речовини Р зумовлює активування
фосфоліпази С і збільшення утворень ІФ^ та ДАГ.
Речовина Р у високих концентраціях міститься в закін-
ченнях первинних аферентних нейронів спинного мозку
і, ймовірно, є трансмітером перших синапсів провідних
шляхів відчуття тупого болю (див. Розділ 7). Крім того,
цю речовину виявлено в чорноречовинно-смугастій сис-
темі, де її концентрація пропорційна до концентрації до-
фаміну, а також у гіпоталамусі, де може відігравати певну
роль у нейрогуморальному регулюванні. У разі внутріш-
ньошкірного введення речовина Р спричинює почерво-
ніння і припухлість, ймовірно, вона є трансмітером, що
його виділяють нервові волокна під час аксон-рефлексу
(див. Розділ 32). Речовина Р бере участь у процесі регу-
лювання перистальтики кишок. Нещодавно з’ясовано, що
центрально активний антагоніст МК-І рецептора виявляє
антидепресантну активність у людини. Подібно, як під час
дії антидепресантів, що впливають на обмін моноамінів у
головному мозку (див. Розділ 15), для розвитку цього
антидепресантного ефекту потрібний певний проміжок
часу. Проте інгібітор ТЧК-І в експерименті на тваринах не
спричинив змін в обміні моноамінів у головному мозку.
Функції інших тахікінінів не з’ясовані.
Опіоїдні пептиди
У головному мозку і шлунково-кишковому тракті
містяться рецептори, що зв’язують морфін. Дослідження
ендогенних лігандів цих рецепторів дало змогу виявити
два споріднені між собою пентапептиди, названі енкефа-
лінами (табл. 4-4), які зв’язуються з цими опіоїдними
рецепторами. Один з них містить метіонін (мет-енкефа-
лін), а інший - лейцин (лей-енкефалін). Ці, а також інші
поліпептиди, що зв’язуються з опіоїдними рецепторами,
називають опіоїдними пептидами. Енкефаліни містяться
в нервових закінченнях у шлунково-кишковому тракті, а
також у багатьох різних ділянках головного мозку і функ-
ціонують, очевидно, як синаптичні трансмітери. Вони є в
драглистій речовині, і в разі введення в стовбур головного
мозку виявляють знеболювальну дію. Енкефаліни також
сповільнюють перистальтику кишок (див. Розділ 26).
Як і інші невеликі пептиди, опіоїдні синтезуються в
складі великої молекули-попередника (див. Розділ 1).
Ідентифіковано понад 20 активних опіоїдних пептидів. На
Таблиця 4-3. Тахікініни ссавців
Ген Поліпептидні речовини Рецептори
8Р/МКА К+ Н2О Са2+ Иа+ МКВ Речовина Р Нейрокінін А Нейропептид К Нейропептид а Нейрокінін А (3-10) Нейрокінін В Речовини Р (МК-1) Нейропептиду К (МК-2) Нейрокініну В (МК-3)
102/РОЗДІЛ 4
відміну від інших пептидів, опіоїдні мають багато різних
попередників. Кожен з них є у вигляді препроформи і
проформи, від якої відщеплюється сигнальний пептид. Три
досліджені попередники, а також опіоїдні пептиди, що
утворюються з них, наведені в табл. 4-4. Проенкефалін
уперше виявлено в мозковій речовині надниркової залози
(див. Розділ 20), він теж є попередником мет-енкефаліну і
лей-енкефаліну в головному мозку. Кожна молекула проен-
кефаліну містить чотири мет-енкефаліни, один лей-енке-
фалін, один октапептид і один гептапептид. Проопіомела-
нокортин - велика молекула-попередник, виявлена в
передній і проміжній частках гіпофіза і в головному мозку,
- містить р-ендорфін - поліпептид, що складається з 31
амінокислотного залишка, в складі якого на ЬІН2-кінці міс-
титься мет-енкефалін (див. Розділ 22). Утворюються й інші,
коротші ендорфіни.
Молекула-попередник дає початок також АКТГ та
меланоцитостимулювальному гормону (МСГ). У голов-
ному мозку є окремі енкефаліно- і р-ендорфінопродуку-
вальні системи нейронів (див. Розділ 15). Бета-ендорфін
у кров’яне русло виділяє гіпофіз. Третьою молекулою-
попередником є продинорфін - білок, який має три лей-
енкефалінові залишки, зв’язані з динорфіном і неоендор-
фіном. Динорфін 1-17 міститься в дванадцятипалій кишці,
а динорфін 1 -8 - у задній частці гіпофіза і гіпоталамусі. В
гіпоталамусі теж є а- і р-неоендорфіни. Причина існу-
вання багатьох молекул-попередників опіоїдних пептидів,
а також наявності цих пептидів як у кровоносному руслі,
так і в головному мозку та шлунково-кишковому тракті
сьогодні остаточно не з’ясована.
Енкефаліни метаболізовані головно двома пептидазами:
енкефаліназою А, яка розщеплює СІу-РЬе-зв’язок, і енке-
фаліназою В, яка розщеплює СІу-ОІу-зв’язок. У метабо-
лізмі енкефалінів теж бере участь амінопептидаза, яка роз-
щеплює Туг-ОІу-зв’язок.
Опіоїдні рецептори вивчені детально. Ідентифіковано
ц-, к- та 5-рецептори, які відрізняються за фармакологіч-
ними властивостями, розміщенням у головному мозку та
інших органах, а також афінністю до різних опіоїдних пеп-
тидів. Усі три є серпентиновими рецепторами, що зв’язані
з О^-білками, і всі вони гальмують активність аденілат-
циклази. Ймовірно, є підтипи ц- та к-рецепторів. Акти-
вування ц-рецепторів зумовлює підвищення провідності
К+ шляхом гіперполяризації центральних і первинних
аферентних нейронів. Активування к- та 5-рецепторів
зумовлює закривання Са2+-каналів.
Нещодавнє дослідження природних лігандів ц рецеп-
тора - рецептора, на який діє морфін, дали змогу виявити
ще два опіоїдні пептиди: ендоморфін 1 (Туг-Рго-Тгр-РЬе-
ЬІН2) і ендоморфін 2 (Туг-Рго-РИе-РЬе-1ЧН2). Молекула-
попередник цих двох ц-агоністів ще невідома. Афінність
природних опіоїдних пептидів до к-, ц- та 5-рецепторів
показана на рис. 4-29. Фізіологічні ефекти, що виникають
під час стимулювання рецепторів, значно перекривають
один одного, проте головні результати цього стимулювання
можна визначити, вони наведені в табл. 4-5.
Інші поліпептиди
У головному мозку виявлено численні інші поліпептиди.
В різних відділах нервової системи містяться тропні гор-
мони гіпофіза, і, очевидно, більшість з них (якщо не всі)
виконують функції як нейротрансмітерів, так і гормонів.
Препросоматостатин є попередником двох поліпептидів:
соматостатину 14 (див. рис. 14-19) і соматостатину 28 (рис.
4-30). Вони трапляються в тканинах разом. Соматостатин
міститься в різних відділах головного мозку, де, очевидно,
виконує функцію нейротрансмітера, впливаючи на над-
ходження чутливих імпульсів, рухову активність і проце-
си пізнання. В гіпоталамусі він виділяється в портальні
гіпофізарні судини і відіграє роль гормону, що інгібує
утворення гормону росту (див. Розділ 14). В ендокринній
частині підшлункової залози він гальмує секрецію інсу-
ліну й інших панкреатичних гормонів (див. Розділ 19), у
шлунково-кишковому тракті теж є важливим гальмівним
гормоном (див. Розділ 26). Обидва поліпептиди біологічно
активні, проте щодо пригнічення секреції інсуліну сома-
тостатин 28 активніший, ніж соматостатин 14. Родина
соматостатинових рецепторів налічує п’ять різних, зв’яза-
них з О-білком, членів (від 88ТК1 до 88ТК5). Усі вони
пригнічують активність аденілатциклази і впливають на
системи внутрішньоклітинних месенджерів. Ймовірно, що
88ТК2 опосередковує процеси пізнання і пригнічує секре-
цію гормону росту, а 88ТК5 зумовлює гальмування секреції
інсуліну.
Вазопресин і окситоцин не тільки виділяються в кров,
а також містяться в нейронах, аксони яких прямують до
стовбура головного мозку і до спинного мозку. В головному
мозку є брадикінін, ангіотензин II і ендотелій (див. Розділи
Таблиця 4-4. Опіоїдні пептиди та їхні попередники
Попередник Опіоїдні пептиди Структура
Проенкефалін (див. Розділ 20) Мет-енкефалін Лей-енкефалін Октапептид Гептапептид Туг-6Іу-6Іу-Рїіе-Меі5 Туг-6Іу-6Іу-Рїіе-І_еи5 Туг-6Іу-6Іу-Рїіе-Меі-Агд-6Іу-І_еи8 Т уг-6Іу-6Іу-Рїіе-Меі-Агд-Рїіе7
Проопіомеланокортин (див. Розділ 22) р-Ендорфін Інші ендорфіни Див. Розділ 22 Див. Розділ 22
Продинорфін Динорфін 1-8 Динорфін 1-17 ос-Неоендорфін Р-Неоендорфін Туг-6Іу-6Іу-Рїіе-І_еи-Агд-Агд-ІІе8 Туг-6Іу-6Іу-Рїіе-І_еи-Агд-Агд-ІІе-Агд-Рго-І_у8-І_еи-І_у8-Тгр-А8р-А8п-6Іп17 Т уг-6Іу-6Іу-Рґіе-І_еи-Агд-І_у8-Т уг-Рго-І_у810 Т уг-6Іу-6Іу-РЬе-І_еи-Агд-І_у8-Т уг-Рго9
СИНАПТИЧНЕІ КОНТАКТНЕ ПЕРЕДАВАННЯ/103
24 та ЗІ), гормони шлунково-кишкового тракту ВІГІ, ХЦК-
4 та ХЦК-8 (див. Розділ 26), а також два види ХЦК-
рецепторів: ХЦК-А та ХЦК-В. ХЦК-8 діє на сайти зв’язу-
вання обидвох рецепторів, тоді як ХЦК-4 - лише на сайти
ХЦК-В рецепторів (див. Розділи 14 та 26). Гастрин, нейро-
тензин, галанін і гастрин-рилізинг-пептид теж наявні як у
шлунково-кишковому тракті, так і в головному мозку. Ней-
ротензинові і ВІП-рецептори клоновані; виявлено, що вони
є серпентиновими рецепторами. Гіпоталамус містить гаст-
рин 17 і гастрин 34 (див. Розділ 26). ВІП зумовлює роз-
ширення судин і є в вазомоторних нервових волокнах.
Функції цих пептидів у нервовій системі не з’ясовані.
Пептид, залежний від гена кальцитоніну (ССКР -
від англ. саісйопіп §епе-ге1аІес1 рербсіе) - це пептид, який
у щурів і людини існує в двох формах: С(ЗКРа та С(ЗКРр.
У людини, ці дві форми відрізняються лише трьома аміно-
кислотними залишками, і їх кодують різні гени. У щурів
і, ймовірно, в людини ССКРр міститься в кишково-шлун-
ковому тракті, а С(ЗКРа - у первинних аферентних нейро-
нах, нейронах, якими імпульси відчуття смаку надходять
до таламуса, і нейронах медіального пучка переднього
мозку. Він разом з речовиною Р також є в розгалуженнях
первинних аферентних нейронів, що закінчуються на кро-
воносних судинах. С(ЗКР-подібна імунореактивність вияв-
ляється в крові, і ін’єкція ССКР зумовлює розширення
судин. Пептид С(ЗКРа і кальцитонін - гормон, що зменшує
концентрацію кальцію (див. Розділ 21), кодовані геном
кальцитоніну. Однак у щитоподібній залозі під час сплай-
сінґу утворюється мРНК, що кодує кальцитонін, тоді як у
головному мозку під час альтернативного сплайсінґу фор-
мується мРНК, що кодує СОКРа; ССКР незначно впливає
на обмін Са2+, а кальцитонін виявляє лише слабкий судино-
розширювальний ефект.
Нейропептид ¥ - це поліпептид, що містить 36 аміно-
кислотних залишків і споріднений з панкреатичним полі-
пептидом (див. Розділ 19). Він міститься в багатьох відді-
лах головного мозку і в автономній нервовій системі. Поза
головним мозком, а також в автономній нервовій системі
він переважно є в норадренергічних нейронах, з яких виді-
Рис. 4-29. Опіоїдні рецептори. Товщина стрілок, що простя-
гаються від назв лігандів к-, ц- та 8-рецепторів, пропорційна
афінності рецептора до кожного з ліґандів (відтворено за доз-
волом з Зиііиз 03: Апоіїїег зрагк Тог іііе таззез? Маіиге 1997;
386:442).
Таблиця 4-5. Фізіологічні ефекти, що виникають у разі
стимулювання рецепторів опіоїдних пептидів
Рецептор Ефект
ц Знеболювання Місце впливу морфіну Пригнічення дихання Закреп Ейфорія Заспокоєння Збільшення секреції гормона росту і пролактину Мейоз
к Знеболювання Діурез Заспокоєння Мейоз Тривога
8 Знеболювання
ляється у відповідь на високочастотне подразнення. Ней-
ропептид ¥ підсилює судинозвужувальну дію норадрена-
ліну. Кількість нейропептиду ¥, що циркулює і походить з
симпатичних нервів, збільшується під час важкої фізичної
праці. В гіпоталамусі нейропептид ¥ опосередковує під-
вищення апетиту і зростання рівня споживання їжі (див.
Розділ 14). Клоновано ¥1-, ¥2-, ¥4-, ¥5- та ¥6-рецептори
цього поліпептиду.
Пуринергічні трансмітери
Зв’язки між АТФ, аденозином і метаболітами аденозину
відображено на рис. 4-31. АТФ позаклітинної рідини - це
АТФ, що вивільняється разом з норадреналіном, дофа-
-24
Прекурсорний пропептид соматостатину
Сигнальний пептид
ЗХкХОІЕІРІЕХкІАІОІМІЕІТХОХМХРХЕХЗІкХк
^ТмхкТсХсХАХкТкХЕкЗ
ТІЕІТХЗІС
РХкХКХОХЕХкЮХКХЗХкІАХАХАХАХСІКХОХЕХк
Соматостатин 28
□ХЕІМІкХкХЕІкІОІкІЗХАХМХЗІМХРХА
УІСІбІкХАІкІVI І ІЗ ІкІАХАХкІАІСХОХкІКІС
Соматостатин 14 92
Рис. 4-30. Препросоматостатин людини. Головні залишки, по
яких на М-кінці відбувається розщеплення молекули-поперед-
ника з утворенням соматостатину 14 і соматостатину 28, виді-
лені кольором. Амінокислотні залишки позначені однією бук-
вою (відтворено за дозволом з Кеізіпе Т, ВеІЮІ: Моїесиїаг
Ьіоіоду ої зотаіозіаііп гесеріогз. Епсіосг Кєу 1995; 16:427).
104/РОЗДІЛ 4
міном, ГАМК, глютаматом, ацетилхоліном і гістаміном з
нейронів, у яких ці речовини виробляються. Аденозин є
нейромодулятором, що діє як головний депресант ЦНС.
Аденозин виявляє також судинорозширювальну дію в серці
(див. Розділ 32) і різноманітно впливає по всьому організму.
Він діє на чотири рецептори: Ар А2Л, А2В та А3, що є сер-
пентиновими і зв’язані з 6-білком. Рецептори А2а та А2В
підвищують концентрацію цАМФ, а А] та А3 знижують її.
Стимулювальна дія кави і чаю зумовлена блокуванням аде-
нозинових рецепторів кофеїном і теофіліном. Значний інте-
рес становить можливість застосування антагоністів А! з
метою зменшення надмірного виділення глютамату і, отже,
мінімізації наслідків інсультів.
АТФ теж має властивості трансмітера, і його дія на
рецептори виявляється у всьому організмі. Вірогідно, що
не зв’язані зі структурами нуклеотидази виділяються разом
з АТФ, і завдяки цьому прискорюється усунення АТФ після
виконання ним його функції. Вивчено чотири пуринергічні
рецептори, що зв’язують АТФ: Р2¥ та Р21І, які через 6-
білки активують фосфоліпазу, і Р2Х та Р2Х, які є лігандо-
залежними йонними каналами. Ідентифіковано три під-
типи Р2Х-рецептора: Р2Хр Р2Х2 та Р2Х3. Рецептори Р2Х]
та Р2Х2 містяться в задніх рогах спинного мозку, а Р2Х3 -
у спинномозкових вузлах і трійчастому вузлі, що свідчить
про значення АТФ у проходженні імпульсів чутливими
шляхами. Окрім того, є Р2Т-рецептор; це вірогідно, йонний
канал, активований АДФ. Як засвідчили останні дослід-
ження, АТФ опосередковує швидкі синаптичні реакції в
автономній нервовій системі і повідцях. Пуринергічні
рецептори виявлені також у клітинах глїї.
Канабіноїди
Клоновано два рецептори, афінні до Д9-тетрагідрока-
набінолу (ТГК) - психогенного інгредієнта маріхуани.
Рецептор СВ] зумовлює опосередковане (3-білком зни-
ження внутрішньоклітинного рівня цАМФ. Він поширений
у центральних нейронах шляхів проведення відчуття болю,
а також у частині мозочка, у морському конику (гіпокампі)
і корі великого мозку. Ендогенним лігандом цього рецеп-
тора є анандамід - похідний арахідонової кислоти (рис.
4-32). Ця сполука, як і маріхуана, спричинює ейфорію,
заспокоєння, сонливість, дрімоту і знеболення. Рецептори
СВ] містяться також у периферійних тканинах, і блоку-
вання їх призводить до зменшення судинорозширюваль-
ного впливу анандаміду. Втім, очевидно, цей судинорозши-
рювальний ефект є непрямим. Клоновано теж СВ2-рецеп-
тор, і його ендогенним лігандом, вірогідно, є пальмітоїл-
етаноламід (ПЕА). Фізіологічна роль цієї сполуки, однак,
не з’ясована.
Інші вірогідні трансмітери
Оксид азоту (N0) - це сполука, яку виділяє ендотелій
кровоносних судин, вона є фактором релаксації ендотелію.
Він утворюється також у головному мозку. Синтез N0 з
аргініну - реакція, яку каталізує одна з трьох форм N0-
синтази, - описаний у Розділі 31 (див. рис. 31-1). Оксид
азоту активує гуанілатциклазу (див. Розділ 1) і, на відміну
від інших трансмітерів, є газом, тому легко проникає крізь
клітинну мембрану і безпосередньо зв’язується з гунілат-
циклазою. Це може бути сигналом, за допомогою якого
। 8-Аденозил-
I | метіонін
АДФ |
11 8-Аденозил-
АМФ гомоцистеїн
Аденозин
І
Гіпоксантин
І
Ксантин
І
Сечова кислота
Рис. 4-31. Зв’язок між АТФ та аденозином і метаболізм аде-
нозину до сечової кислоти.
постсинаптичні нейрони налагоджують зв’язок з пре-
синаптичними закінченнями у разі довготривалих потен-
ціації і депресії (див. нижче). Синтаза N0 є НАДФН-
залежним ензимом. Тепер відомо, що НАДФН-діафораза,
гістохімічне забарвлення якої використовують уже багато
років, - це власне Г\Ю-синтаза. Отже, ИО-синтазу можна
легко виявити гістохімічними методами в головному мозку
та інших тканинах.
Оксид вуглецю (СО) - це ще один газ, який є вірогідним
трансмітером у головному мозку. Він утворюється в про-
цесі метаболізму гему (див. Розділ 27) за допомогою одно-
го з підтипів гемоксигенази (ГО), позначеного на рис. 4-
33 як Г02. Оксид вуглецю, як і N0, активує гуанілілциклазу.
Простагландини - це похідні арахідонової кислоти
(див. Розділ 17), що є в нервовій системі. Вони містяться у
фракції нервових закінчень гомогенатів головного мозку і
виділяються з нервової тканини іп уйго. Ймовірний транс-
портер простагландинів має 12 фіксованих у мембрані
доменів. Однак простагландини виконують свою дію,
швидше за все, шляхом модуляції реакцій, опосередкова-
них цАМФ, а не як синаптичні трансмітери.
Багато стероїдів нейроактивні, тобто впливають на
функції головного мозку, хоч і не є нейротрансмітерами в
загальноприйнятому розумінні. Стероїди, що циркулюють,
легко проникають до головного мозку, де в нейронах міс-
тяться численні рецептори до статевих стероїдів і глюко-
кортикоїдів. Окрім відомої дії шляхом зв’язування з ДНК
(геномний ефект), деякі стероїди, вірогідно, швидко впли-
вають, діючи безпосередньо на клітинні мембрани (неге-
номний ефект). Роль стероїдів у нейрокринному регулю-
ванні висвітлена в Розділі 14. Вплив стероїдів на ГАМК-
рецептори описаний вище.
Щораз більше даних свідчать про те, що в головному
мозку можуть вироблятися окремі гормонально активні
стероїди. Вони утворюються з простіших стероїдних попе-
редників, і їх називають нейростерощами. Прогестерон
сприяє утворенню мієліну (див. Розділ 2). Роль більшості
стероїдів у процесах регулювання функцій головного моз-
ку, проте, до кінця не з’ясована.
СИНАПТИЧНЕ І КОНТАКТНЕ ПЕРЕДАВАННЯ /105
Рис. 4-32. Анандамід.
Котрансмітери
Сьогодні наведено багато прикладів того, що нейрони
містять і продукують два або навіть три трансмітери.
Котрансмітерами в такому випадку часто є катехоламін
або серотонін плюс поліпептид, або ж поліпептид і ГАМК,
або ацетилхолін. Трапляється також суміщення двох полі-
пептидів або ГАМК з різними катехоламінами або ацетил-
холіном. У деяких нейронах стовбура головного мозку є
серотонін, речовина Р та ТРГ. Багато холінергічних нейро-
нів містять ВІП, багато норадренергічних і адренергічних
нейронів - АТФ і нейропептид ¥. Нейрони, що містять
декілька трансмітерів, часто розташовані поряд з нейро-
нами, що містять один трансмітер. Уважають, що низько-
частотні імпульси в нейронах зумовлюють виділення низь-
комолекулярних трансмітерів, тоді як високочастотні -
також і поліпептидних котрансмітерів. Проте це ще оста-
точно не доведено, і фізіологічне значення котрансмітерів
не з’ясоване. Відомо, однак, що ВІП, який виробляється
разом з ацетилхоліном, підсилює його постсинаптичну дію,
а нейропептид ¥ підсилює дію норадреналіну.
СИНАПТИЧНА ПЛАСТИЧНІСТЬ
І НАВЧАННЯ
Унаслідок попередніх впливів на збудження, що
надходить до синапса, в ньому можуть виникати тривалі
функціональні зміни, тобто синаптична провідність може
посилюватись або послаблюватись на підставі досвіду.
Такого типу зміни становлять значний інтерес, оскільки
вони, очевидно, є в основі певних форм навчання і пам’яті
(див. Розділ 16). За локалізацією зміни поділяють на
пресинаптичні і постсинаптичні.
Посттетанічна потенціація
Однією з форм пластичності є посттетанічна потен-
ціація - збудження постсинаптичних потенціалів у від-
повідь на подразнення. Такий ефект триває до 60 с і вини-
кає після короткочасного тетанічного стимулювання пре-
синаптичного нейрона. Тетанічне стимулювання зумов-
лює накопичення в пресинаптичному нейроні Са2+ до
такого рівня, що внутрішньоклітинні сайти, завдяки яким
утримується низький рівень цитоплазматичного Са2+,
повністю заблоковані.
Звикання
У випадку подразника невисокого рівня, що раз за разом
повторюється, відповідь на цей подразник поступово
послаблюється (звикання). Це зумовлене зниженням рівня
виділення пресинаптичними закінченнями нейротрансмі-
Гем
ГО2
Білівердин + Ге + СО
і
Гуанілінциклаза
цГМФ ГТФ
Рис. 4-33. Утворення і дія СО іп уіуо.
тера, що настає внаслідок зменшення кількості внутріш-
ньоклітинного Са2г, спричиненого поступовим інактиву-
ванням Са2+-каналів. Цей процес може бути короткотри-
валим або ж пролонгованим, якщо такий, невисокого рівня,
подразник діє багато разів.
Сенсибілізація
Сенсибілізація полягає у виникненні тривалих посиле-
них постсинаптичних реакцій на подразник, до якого в тва-
рини розвинулось звикання, за умови, що його поєднано
один або декілька разів зі шкідливим подразником. При-
наймні в морського слимака Аріузіа шкідливий подразник
зумовлює збудження в серотонінових нейронах, що мають
кінці на пресинаптичних закінченнях чутливих нейронів
(див. вище).
Сенсибілізація може виникати як тимчасове реагування,
або ж, якщо її підтримують додатковим поєднанням шкід-
ливого та ініціювального подразників, виявляти власти-
вості короткотривалої чи довготривалої пам’яті. Корот-
котривалу сенсибілізацію зумовлює Са2+-залежна зміна
активності аденілатциклази, що веде до збільшення утво-
рень цАМФ. У разі довготривалої потенціації стимульовані
процеси синтезу білків, ріст та кількість пре- і постсинап-
тичних нейронів та їхніх зв’язків, що беруть участь у цьо-
му процесі.
Довготривала потенціація
Довготривала потенціація (ДТП) - це стійке, що
швидко розвивається, підсилення постсинаптичних потен-
ціалів, яке виникає у відповідь на пресинаптичне подраз-
нення після короткого періоду частого стимулювання пре-
синаптичного нейрона. Це явище нагадує посттетанічну
потенціацію, проте набагато пролонгованіше і може
тривати навіть декілька днів. На відміну від посттетанічної
потенціації, довготривала потенціація ініційована збіль-
шенням внутрішньоклітинної концентрації Са2+ більше в
постсинаптичному нейроні, ніж у пресинаптичному. Вини-
кає ДТП в багатьох відділах нервової системи, проте най-
детальніше її вивчено в гіпокампі.
У колатеральних синапсах Шаффера (дендритах піра-
мідних клітин ділянки СА1 гіпокампа) глютамат, що
виділяють пресинаптичні терміналі, зумовлює деполяри-
зацію в постсинаптичних нейронах, діючи переважно на
АМПА-рецептори. Це сприяє блокуванню магнієм \МВА-
рецепторів, проникненню Са2+ разом з у нейрон. Катіон
106/РОЗДІЛ 4
Са2+ активує кальмодулін, який, відповідно, активує Са2+/
кальмодулінкіназу II. Кіназа фосфорилює суміжні АМПА-
рецептори, внаслідок чого посилюється їхня провідність.
Крім того, ймовірно, що Са2+/кальмодулінкіназа змушує
якимось чином АМПА-рецептори пересуватись до клітин-
ної мембрани в ділянці синаптичної щілини (рис. 4-34).
Уважають, що хімічний сигнал надходить від синаптичного
нейрона до пресинаптичного, зумовлюючи довготривале
квантове виділення глютамату у відповідь на аферентне
подразнення. Вірогідно, цим сигналом слугує арахідонова
кислота або N0, однак походження і навіть наявність цього
ретроградного сигналу детально не з’ясовані.
Описаний вище механізм досить добре вивчений сто-
совно синапсів дендритів СА1 клітин морського коника,
проте й інші механізми можуть забезпечувати виникнення
довготривалої потенціації в інших частинах ЦНС. Щодо
цього цікаво, що в разі надходження до постсинаптичного
нейрона Са2+ через АМПА-рецептори, в ГАМК-ергічних
нейронах мигдалеподібного тіла може виникати ИМВА -
незалежна довготривала потенціація.
Довготривала депресія
Довготривала депресія (ДТД) - це явище, протилежне
до довготривалої потенціації. Багато в чому ці явища
подібні між собою, проте для ДТД характерне зниження
синаптичної провідності. Довготривала депресія виникає
у відповідь на повільне подразнення пресинаптичних
нейронів і супроводжується меншим підвищенням внут-
рішньоклітинної концентрації Са2+, ніж у разі ДТП. Ймо-
вірно, це зумовлене дефосфорилюванням АМПА-рецеп-
торів, зменшенням їхньої провідності і переміщенням убік
від синаптичної ділянки плазматичної мембрани.
НЕРВОВО-М’ЯЗОВЕ ПЕРЕДАВАННЯ
НЕРВОВО-М’ЯЗОВЕ З’ЄДНАННЯ
Структура
Аксон, що іннервує скелетні м’язи, закінчується термі-
нальними розгалуженнями. У цьому разі він втрачає мієлі-
нову оболонку й утворює велику кількість закінчень -
синаптичних бляшок (рис. 4-35). Синаптична бляшка
містить багато невеликих прозорих пухирців, заповнених
ацетилхоліном - трансмітером цих з’єднань. Нервові
закінчення розташовані в заглибинах рухової кінцевої
пластинки, що є потовщенням м’язової мембрани в місці
з’єднання. Під нервовим закінченням м’язова мембрана
кінцевої пластинки формує складки. Проміжок між нер-
вовим закінченням і потовщенням м’язової мембрани
відповідає синаптичній щілині інших синапсів. Цілу цю
структуру називають нервово-м’язовим, або м’язово-нер-
вовим з’єднанням, або ж нервово-м’язовим, чи м’язово-
нервовим синапсом. На кожній кінцевій пластинці закін-
чується лише одне нервове волокно, яке називають синап-
тичною бляшкою, і, отже, тут не відбувається конвергенції
нервових імпульсів.
Послідовність процесів
під час передавання
Процеси, що відбуваються під час передавання імпуль-
сів з рухового нерва до м’яза (див. табл. 3-2), частково
відповідають процесам, які відбуваються в інших синапсах.
Під впливом імпульсу, що надходить до терміналі рухового
нейрона, активізується проникність нервових закінчень для
Са2+. Катіон Са2+ надходить до закінчень і.зумовлює поміт-
не посилення процесу екзоцитозу ацетилхолінових пухир-
ців. Ацетилхолін дифундує до нікотиноподібних холіно-
рецепторів м’язового типу (див. рис. 4-18), що скупчені
на верхівках складок мембрани рухової кінцевої пластинки.
Зв’язування ацетилхоліну з цими рецепторами спричинює
посилення провідності мембрани стосовно N3' та К+, а над-
ходження №+ приводить до виникнення деполяризацій-
ного потенціалу - потенціалу кінцевої пластинки. Під
впливом цього локального потенціалу відбувається депо-
ляризація суміжних ділянок м’язової мембрани, а також
досягається критичний рівень деполяризації. Зі синап-
тичної щілини ацетилхолін розщеплює ацетилхолінесте-
раза, що в високих концентраціях міститься в нервово-м’я-
зовому синапсі. Потенціали дії генеруються по обидва боки
від кінцевої пластинки, і їх проводить м’язове волокно в
обидвох напрямах. М’язовий потенціал дії, відповідно,
ініціює м’язове скорочення, як це описано в Розділі 3.
Потенціал кінцевої пластинки
Кінцева пластинка в людини містить у середньому 15-
40 мільйонів ацетилхолінових рецепторів. Кожен нервовий
імпульс зумовлює виділення ацетилхоліну приблизно з 60
пухирців, а кожний пухирець містить близько 10 000 моле-
кул нейротрансмітера. Цієї кількості достатньо для активу-
вання приблизно в 10 разів більшої кількості ацетилхолі-
нових рецепторів, ніж це необхідно для виникнення в
кінцевій пластинці повноцінного потенціалу. Тому м’яз
систематично відповідає скороченням, і ця відповідь при-
ховує справжній потенціал. Потенціал кінцевої пластинки
можна оцінити, якщо застосувати певний чинник, що в 10
разів знизить його, і він стане недостатнім, щоб спричи-
нити деполяризацію суміжної м’язової мембрани. З цією
метою застосовують невеликі дози кураре-речовини, що
конкурує з ацетилхоліном за зв’язування з нікотиночут-
ливими холінорецепторами. В цьому випадку реакцію
можна зареєструвати лише в ділянці кінцевої пластинки,
далі ж вона експоненціально загасає. За цих умов можна
спостерігати часову сумацію потенціалів кінцевої плас-
тинки.
Квантове виділення трансмітера
Невеликі кванти (“пакети”) ацетилхоліну безладно виді-
ляються через мембрану аксона навіть у стані спокою,
зумовлюючи кожен незначну деполяризацію постсинап-
тичної мембрани амплітудою близько 0,5 мВ, що нази-
вають мініатюрним потенціалом кінцевої пластинки.
Кількість квантів ацетилхоліну, що виділяються таким
способом, прямо пропорційна до концентрації Са2+ й обер-
нено пропорційна до концентрації М§2+ у кінцевій пластин-
ці. Коли ж нервовий імпульс надходить до нервового закін-
чення, то кількість квантів ацетилхоліну, що виділяються,
збільшується на багато порядків, і, як наслідок, виникає
СИНАПТИЧНЕІ КОНТАКТНЕ ПЕРЕДАВАННЯ/107
Рис. 4-34. Виникнення довготривалої потенціації (ДТП) в ден-
дритах клітин СА1 гіпокампа. Глютамат (бій), що виділяється
з пресинаптичного нейрона, зв'язується з АМПА- та ММОА-
рецепторами мембрани дендрита. Деполяризація, спричине-
на активуванням АМПА-рецепторів, зумовлює припинення
магнієвого блокування каналів ІММОА-рецепторів, і Са2* разом
з N3* надходять у нейрон. Збільшення внутрішньоклітинної
концентрації Са2* забезпечує активування кальмодуліну
(СаМ), що, відповідно, зумовлює активування Са2* кальмоду-
лінкінази II (СаМ кІІ). Кіназа фосфорилює АМПА-рецептор
(Р), збільшуючи його провідність і, вірогідно, сприяючи пере-
суванню більшої кількості АМПА-рецепторів до синаптичної
ділянки клітинної мембрани. Крім того, до пресинаптичного
нейрона може надходити хімічний сигнал (ХС), зумовлюючи
довготривале збільшення квантового вивільнення глютамату.
значний потенціал кінцевої пластинки, який зумовлює
появу критичного рівня деполяризації м’язового волокна.
Квантове виділення ацетилхоліну, що відбувається в
нервово-м’язовому синапсі, характерне також для інших
холінергічних синапсів. Подібні процеси виникають, оче-
видно, і в норадренергічних та інших синаптичних контак-
тах.
Важка міастенія і синдром Ламберта-Ітона
Важка міастенія - це серйозне, інколи смертельне
захворювання, за якого скелетні м’язи слабшають і легко
втомлюються. Захворювання виникає внаслідок утворення
антитіл, що циркулюють до нікотиноподібних холіноре-
цепторів. Ці антитіла одні рецептори руйнують, а інші зв'я-
зують з сусідніми рецепторами, після чого вони усувають-
ся шляхом ендоцитозу (див. Розділ 1). Причина виникнення
автоімунності стосовно ацетилхолінових рецепторів досі
не з’ясована.
Іншим захворюванням, подібним до важкої міастенії, є
синдром Ламберта-Ітона. У цьому випадку м’язова слаб-
кість спричинена утворенням антитіл до одного з Са2+-ка-
налів нервових закінчень нервово-м’язового синапсу. Це
призводить до зменшення кількості надходження Са2+ і,
відповідно, виділення меншої кількості трансмітера. Однак
за умов тривалих скорочень зі збільшенням виділення Са2+
м’язова сила наростає.
НЕРВОВІ ЗАКІНЧЕННЯ У ГЛАДКИХ М’ЯЗАХ
І СЕРЦЕВОМУ М’ЯЗІ
Структура
Постгангліонарні волокна нейронів, що іннервують
гладкі м’язи, інтенсивно розгалужуються і тісно контак-
тують з м’язовими клітинами (рис. 4-36). Деякі з цих
нервових волокон містять прозорі пухирці і належать до
холінергічних, тоді як інші містять характерні електронно-
щільні пухирці, заповнені норадреналіном. У такого типу
з’єднаннях не виявлено ні кінцевих пластинок, ні інших
специфічних постсинаптичних структур. Нервове волокно
Рис. 4-35. Нервово-м'язовий синапс. Зауважте, що прозорі пухирці, які містять ацетилхолін, скупчуються в активних зонах
нервового закінчення. Зони розміщені над складками сполучення рухової кінцевої пластинки (відтворено за дозволом з Оохл/І іпд
ЗЕ: ІМеигопз алеї ІМеі'л/огкз: Ап Іпігосіисііоп (о ІМеигозсіепсе. Тіїе Веікпар Ргезз ої Нагуагсі Ііпіуегзііу Ргезз, 1992).
108/РОЗДІЛ 4
проходить уздовж мембран м’язових клітин, часом заглиб-
люючись у них. Численні розгалуження норадренергічних,
а також, очевидно, і холінергічних нейронів утворюють
потовщення (варикозності), які не вкриті клітинами
Шванна і містять синаптичні пухирці (див. рис. 4-36).
Норадренергічний нейрон має понад 20 000 варикознос-
тей, і ці потовщення розміщені одне від одного на відстані
приблизно 5 мкм. Кожна варикозність, очевидно, виділяє
нервовий трансмітер, тобто він виникає в багатьох місцях
уздовж кожного аксона. Таке облаштування дає змогу одно-
му нейронові іннервувати велику кількість ефекторних
клітин. Тип з’єднання, у якому нейрон утворює синапси
на поверхні іншого нейрона або гладком’язової клітини і,
продовжуючись далі, формує подібні контакти з іншими
клітинами, названо непровідним синапсом (зупарзе еп
раззапі).
У серцевому м’язі, холін- і норадренергічні волокна
закінчуються на пазушно-передсердному вузлі, передсерд-
но-шлуночкових вузлі і пучку. Норадренергічні волокна
іннервують також мускулатуру шлуночків. Структура нер-
вових закінчень на тканині вузлів не з’ясована. В шлуноч-
ках контакти між норадренергічними волокнами і волок-
нами серцевого м’яза подібні до таких же контактів у глад-
кому м’язі.
Електричні реакції
У гладких м’язах, для яких збуджувальним є норадре-
нергічний вплив, подразнення норадренергічних нервів
зумовлює переривчасті часткові деполяризації, що подібні
до мініатюрних потенціалів кінцевої пластинки, їх нази-
вають збуджувальними потенціалами з’єднання (ЗПЗ).
Сумація цих потенціалів відбувається у разі повторних
подразнень. Подібні ЗПЗ виявлено в тканинах, для яких
збуджувальним є холінергічний вплив. У тканинах, функ-
цію яких гальмує адренергічний вплив, у випадку подраз-
нення норадренергічних нервів виникають гальмівні по-
тенціали з’єднання (ГПЗ).
Такого типу електричні реакції виявлено в багатьох
гладком’язових тканинах у разі подразнення поодинокого
нерва, проте їхня латентність різна. Це, очевидно, зумов-
лене контактами, що описані вище (зупарзе еп раззапі), а
також може бути пояснене наявністю між клітинами
гладкого м’яза низькорезистентних з’єднань, або ж дифу-
зією нервового трансмітера від місця його виділення до
багатьох гладком’язових клітин. Мініатюрні збуджувальні
потенціали з’єднання, досліджені на окремих гладком’я-
зових препаратах, подібні до мініатюрних потенціалів кін-
цевої пластинки в скелетних м’язах, проте значно відріз-
няються як за значенням, так і за тривалістю. Вони можуть
бути відповіддю на виділення поодиноких пакетів транс-
мітера, що змінюються під впливом його дифузії на різні
відстані.
ДЕНЕРВАЦІЙНА ПІДВИЩЕНА ЧУТЛИВІСТЬ
У разі перетинання рухового нерва скелетного м’яза і
наступної його дегенерації в м’язі поступово виникає вкрай
висока чутливість до ацетилхоліну. Ця денерваційна
підвищена чутливість характерна також і для гладких
м’язів. На відміну від скелетних, гладкі м’язи в цьому
випадку не атрофуються, однак стають надмірно чутливи-
ми до хімічного трансмітера, що в нормальному стані
збуджує його. Позбавлені іннервації екзокринні залози, за
винятком потових, теж виявляють підвищену чутливість.
Вдалим прикладом денерваційної підвищеної чутливості
є реакція райдужки, що позбавлена іннервації. Якщо в
експериментальної тварини перетяти, з одного боку, пост-
гангліонарні симпатичні волокна, що іннервують райдужку,
і через декілька тижнів увести внутрішньовенно норадре-
налін, то зіниця райдужки, що позбавлена іннервації,
значно розшириться. На іншому, інтактному боці зіниця
розшириться незначно, і ця реакція менш тривала.
Реакції, зумовлені перетинанням аксона, показані на
рис. 4-37. Підвищена чутливість постсинаптичних струк-
тур до трансмітера, що виробляється в закінченнях аксона,
- поширений феномен, зумовлений переважно синтезом
більшої кількості рецепторів або їхнім активуванням.
Окрім того, відбуваються ортоградна (дегенерація Вал-
лєра; див. Розділ 2) і ретроградна дегенерація кукси аксона
до найближчої колатералі (підтримувальна колатераль).
Низка змін виникає в тілі клітини, зокрема зменшується
кількість речовини Ніссля (хроматоліз). Згодом нерв почи-
Аксон—
Рис. 4-36. Закінчення постгангліонарних волокон автономної
нервової системи на гладкому м’язі (відтворено за дозволом
з КапсІеІ ЕР, 8сїі\л/агї2 ЛЧ [есіііогз]: Ргілсіріез ої МеигаІ 8сі-
епсе, 2псІ есі Еізєуієг, 1985).
СИНАПТИЧНЕ І КОНТАКТНЕ ПЕРЕДАВАННЯ /109
нає відростати, утворюючи багато дрібних гілок, що
прямують уздовж шляху, де раніше був аксон (регене-
раційне галуження). Часом аксони ростуть у зворотному
напрямі - до їхньої початкової точки, зокрема в разі
ушкодження біля нервово-м’язового синапсу. Регенерація
нерва, однак, переважно затруднена, оскільки розірвана
частина аксона часто міститься в ділянці загального ушкод-
ження тканин. Цікаві нові експериментальні дані свідчать,
що це ускладнення можна частково подолати шляхом
застосування нейротрофінів. Наприклад, чутливі нейрони
втрачають цілість, якщо задні корінці нервів відриваються
від спинного мозку, але вони здатні відростати, налагод-
жуючи функційні зв’язки в спинному мозку, якщо експери-
ментальним тваринам уводять фактор росту нервів нейро-
трофін 3 або (див. Розділ 2).
У випадку ушкодження вищих нервових центрів актив-
ність нижчих центрів, що перебувають під їхнім контролем,
переважно зростає (феномен вивільнення). Ця підвищена
активність може бути частково зумовлена денерваційним
підвищенням чутливості нижчих центрів. Утім, одна з
теорій стверджує, що багато ознак і симптомів невроло-
гічних захворювань зумовлені дегенеративним підвищен-
ням чутливості різних груп нейронів у межах головного
мозку.
Підвищена чутливість обмежена структурами, що їх
безпосередньо іннервує цей ушкоджений нейрон, і не роз-
вивається в нейронах та м’язах, розміщених нижче. Над-
сегментне ушкодження спинного мозку не зумовлює підви-
щення чутливості до ацетилхоліну паралізованих скелет-
них м’язів, а деструкція прегангліонарних автономних
нервів не спричиняє підвищення чутливості в позбавлених
іннервації внутрішніх органах. Цей факт має практичне
значення для лікування захворювань, зумовлених спазмом
кровоносних судин кінцівок. Наприклад, в умовах симпа-
тектомії верхньої кінцівки, спричиненої видаленням верх-
ніх вузлів симпатичного стовбура і зірчастого вузла, вини-
кають гіперестезія гладких м’язів судин до норадреналіну,
що циркулює, і епізодично - вазоспазм. Проте якщо вико-
нати прегангліонарну симпатектомію верхньої кінцівки
шляхом перетинання симпатичного стовбура нижче тре-
тього вузла (з метою переривання висхідних прегангліо-
нарних волокон) і білих сполучних гілок перших трьох груд-
них нервів, то підвищення чутливості не простежується.
Денерваційна підвищена чутливість може мати різні
причини. Як зазначено в Розділі 1, нестача певного хіміч-
ного месенджера призводить переважно до збільшення
Рецептор
Гілка аксона
Ретроґрадна Гіперчутливий
дегенерація рецептор
Ретроґрадна Реґенераційне Ортоґрадна
реакція: галуження деґенерація
хроматоліз (Валлєра)
Рис. 4-37. Зміни, які відбуваються в нейроні і структурах, що
іннервовані ним, після перетискання або перерізання аксона
в точці, позначеній X.
кількості його рецепторів. У закінченнях, де в нормі про-
дукується норадреналін, втрачається певний чинник, при-
четний до процесу зворотного поглинання катехоламінів;
нервові закінчення нормальних тканин поглинають значні
кількості норадреналіну, проте після їхньої дегенерації
норадреналін, що циркулює, досягаючи рецепторів, зумов-
лює значно більший ефект, ніж можна було б очікувати.
Денервація скелетних м’язів посилює чутливість до
ацетилхоліну мембран м’язових волокон. Зазвичай, нікоти-
ноподібні холінорецептори є лише в ділянках кінцевих
пластинок, і в дорослих осіб вони містять £-субодиниці
(див. вище). Після денервації чутливість самих кінцевих
пластинок не зростає, проте в багатьох інших, значних за
розмірами, ділянках мембрани м’язових волокон з’явля-
ються ацетилхолінові рецептори фетального (у-субодини-
цівмісного) типу. Після відростання нерва вони зникають,
і чутливість повертається до норми. Під час розвитку про-
стежується подібний розподіл ацетилхолінових рецепторів.
Вони починають скупчуватись у ділянках нервово-м’язо-
вих синапсів лише тоді, коли руховий нерв досягає м’яза і
продукує білок, що називають агрином, який зв’язується
з м’язовим білком - м’язово-специфічною кіназою (МСК).
Очевидно, агрин відіграє таку ж роль у процесі регенерації
після ушкодження нерва.
5
Ініціація імпульсів
в органах чуття
ВСТУП
Інформація про внутрішнє та зовнішнє середовища
досягає ЦНС через різноманітні органи чуття, або чутливі
рецептори. Ці рецептори є трансдукторами, що перетво-
рюють різні форми енергії довкілля у потенціали дії в ней-
ронах. Характеристики цих рецепторів, спосіб генерування
імпульсів в аферентних нейронах і загальні принципи, або
“закони”, чутливості описані у цьому розділі.
ОРГАНИ ЧУТТЯ І РЕЦЕПТОРИ
Зазначимо, що термін “рецептор” використовують у
фізіології не тільки стосовно органів чуття, або чутливих
рецепторів, а також у зовсім іншому значенні, - щодо про-
теїнів, які з високою специфічністю зв’язують нейротранс-
мітери, гормони та інші речовини, що є першим кроком в
ініціації специфічної фізіологічної відповіді (див. Розділ
1). Чутливий рецептор може бути частиною нейрона або
спеціалізованої клітини, що генерує потенціали дії у ней-
ронах. Такий рецептор часто пов’язаний із клітинами, що
не належать до нервових, однак його оточують, утворю-
ючи орган чуття. Форми енергії, які сприймають рецеп-
тори, охоплюють, наприклад, механічну (дотик, тиск),
температурну (ступені теплоти), електромагнітну (світло),
а також хімічну (запах, смак, вміст О2 у крові). Рецептори
у кожному органі чуття пристосовані відповідати на один
з видів енергії із набагато нижчим порогом, ніж інші
рецептори, що відповідають на цей самий вид енергії.
Особливий вид енергії, до якої рецептор найчутливіший,
називають адекватним подразником. Таким адекватним
подразником для паличок і колбочок сітківки ока, наприк-
лад, є світло. Рецептори здатні відповідати на інші види
енергії, відмінні від адекватного подразника, однак поріг
цих неспецифічних реакцій набагато вищий. Тиск на очне
яблуко, наприклад, буде подразнювати палички і колбочки,
але порогова сила для цих рецепторів на тиск є значно
вищою, ніж аналогічна для шкірних рецепторів.
ЧУТТЯ
Різновиди відчуттів
Оскільки чутливі рецептори спеціалізовані до відповіді
на один особливий вид енергії, а у навколишньому сере-
довищі є багато видів енергії, то звідси випливає, що повин-
но бути багато різних типів рецепторів. Зі шкільного курсу
відомо, що є п’ять відчуттів, однак неправильність цього
твердження стає очевидною в разі переліку головних різно-
видів відчуттів та їхніх рецепторів у людини. Перші 11
різновидів у табл. 5-1 - це свідомі відчуття. Крім того, є
велика кількість чутливих рецепторів, що ґрунтуються на
інформації, яка не досягає свідомості. Наприклад, м’язові
веретена сприймають інформацію про довжину м’яза, а
інші рецептори - про такі змінні величини, як артеріальний
тиск крові, температура крові в голові та рН спинномоз-
кової рідини. Припускають наявність інших рецепторів
цього типу, і в майбутньому дослідження, безумовно, до-
повнять список “несвідомих відчуттів”. Проте будь-який
перелік відчуттів обмежений, і його не можна вважати
остаточним. Палички і колбочки, наприклад, реагують
максимально на світло із різною довжиною хвилі, є також
різні колбочки для кожного з трьох первинних кольорів.
Відомо чотири різновиди смаку - солодкий, солоний,
кислий та гіркий, кожний з яких забезпечений окремим
типом рецептора. Звуки різної висоти чути, головно, завдя-
ки тому, що різні групи волоскових клітин в органі Корті
активуються максимально звуковими хвилями різної час-
тоти. Чи треба вважати ці різні реакції на світло, смак і
звук окремими відчуттями - питання семантичне, яке у
цьому контексті є суто академічним.
Класифікація органів чуття
Учені робили чимало спроб класифікувати відчуття,
однак жодна не є вичерпною. Традиційно до відчуттів
зачислюють нюх, зір, слух, ротаційне і лінійне прискорення
та смак; шкірні відчуття пов’язані з рецепторами в шкірі,
а вісцеральні - зі сприйняттям сигналів від внутрішнього
середовища. Біль, що йде від вісцеральних структур, зазви-
чай належить до вісцеральних.
За іншою класифікацією різні рецептори розділені на
такі: телерецептори (дистантні приймачі), пов’язані з
подіями на відстані; екстерорецептори, пов’язані із зов-
нішнім середовищем на близькій відстані; інтерорецеп-
тори, пов’язані із внутрішнім середовищем; пропріорецеп-
тори, які постачають інформацію про положення тіла у
просторі в будь-який конкретний момент. Однак свідомий
компонент пропріорецепції (“образ тіла”) синтезується з
інформації, яка надходить не тільки від рецепторів усере-
дині і навколо суглобів, а також від шкірних тактильних
рецепторів і барорецепторів. Іноді використовують також
ІНІЦІАЦІЯ ІМПУЛЬСІВ В ОРГАНАХ ЧУТТЯ /111
Таблиця 5-1. Головні різновиди відчуття
Різновиди відчуття1 Рецептор Орган чуття
Зір Слух Нюх Смак Кутове прискорення Лінійне прискорення Дотик-тиск Тепло Холод Біль Положення і рух суглобів Довжина м’яза Скорочення м’яза Артеріальний тиск крові Центральний венозний тиск Наповнення легень повітрям Температура крові в голові Артеріальний Ро2 рН спинномозкової рідини Осмотичний тиск плазми Артеріовенозна різниця рівня глюкози в крові Палички і колбочки Волоскові клітини Нюхові нейрони Смакові рецепторні клітини Волоскові клітини Волоскові клітини Нервові закінчення Нервові закінчення Нервові закінчення Вільні нервові закінчення Нервові закінчення Нервові закінчення Нервові закінчення Нервові закінчення Нервові закінчення Нервові закінчення Нейрони в гіпоталамусі Гломусні клітини Рецептори на вентральній поверхні довгастого мозку Клітини у СОКП і, можливо, інших навколошлуночкових органів у передньому гіпоталамусі Клітини у гіпоталамусі (глюкостатичні) Око Вухо (орган Корті) Нюхова слизова оболонка Смакові бруньки Вухо (півколові канали) Вухо (маточка і мішечки) Різні2 Різні2 Різні Різні2 М’язове веретено Сухожильний орган Ґольджі Рецептори розтягнення в каротидному синусі і дузі аорти Розтягнення рецепторів у стінці великих вен Розтягнення рецепторів у паренхімі легень Каротидні й аортальні тільця (АМФ)
1 Перші 11 - свідомі відчуття.
2 Див текст.
інші спеціальні терміни. Оскільки больові волокна мають
зв’язки, які опосередковують сильні рефлекси відсмику-
вання (див. Розділ 6) й оскільки біль ініціюється потен-
ційно небезпечними або руйнівними подразниками, то
больові рецептори іноді називають ноцирецепторами.
Термін хеморецептор застосовують для тих рецепторів,
що їх подразнює зміна хімічного складу середовища, у
якому вони розташовані. До таких рецепторів належать
рецептори смаку і нюху, а також вісцерорецептори, чутливі
до змін у плазмі рівня кисню, рН і осмотичного тиску.
Шкірні органи чуття
Розрізняють чотири шкірні відчуття: дотик-тиск (тиск
- це продовжений дотик), холод, тепло і біль. Шкіра міс-
тить різні типи чутливих закінчень. До них належать вільні
нервові закінчення, розширені кінці на сенсорних нервових
закінченнях та інкапсульовані закінчення. Поширені закін-
чення містять диски Меркеля і закінчення Руфіні (рис. 5-
1), а інкапсульовані - тільця Пачіні, тільця Мейснера і колби
Краузе. Закінчення Руффіні і тільця Пачіні є також у глибо-
кому фіброзному шарі дерми, де, крім того, наявні чутливі
нервові закінчення волосяних фолікулів. Однак ні поши-
рені, ні інкапсульовані закінчення не є необхідними для
шкірного відчуття. їхній розподіл відмінний у різних ділян-
ках тіла. Неодноразово доведено, що всі чотири шкірні від-
чуття можна викликати з ділянок, у яких, згідно з гісто-
логічним дослідженням, містяться лише вільні нервові
закінчення. Поширені або інкапсульовані закінчення, там
де вони є, виконують функцію механорецепторів, які від-
повідають на тактильні подразники. Тільця Мейснера і Па-
чіні - це тактильні рецептори, що швидко адаптовуються,
Рис. 5-1. Чутливі рецептори в шкірі. Тільця Руфіні (А) і диски
Меркеля (В) є поширеними типами закінчень чутливих нер-
вових волокон. Тільця Мейснера (С), Пачіні (О) та кінцеві кол-
би Краузе (Е) є капсульованими закінченнями; Е - вільні
нервові закінчення серед клітин у тканині.
112/РОЗДІЛ 5
а диски Меркеля і закінчення Руфіні - тактильні рецеп-
тори, що повільно адаптуються. Нервові закінчення воло-
сяних фолікулів опосередковують дотик, а рухи волосків
ініціюють тактильні відчуття. Зазначимо, що хоча шкірні
чутливі рецептори не мають гістологічної специфічності,
проте фізіологічно вони специфічні. Отже, будь-яке нер-
вове закінчення дає сигнал про один і лише про один різ-
новид шкірного відчуття.
ЕЛЕКТРИЧНІ ТА ХІМІЧНІ ЯВИЩА
У РЕЦЕПТОРАХ
Анатомічні взаємозв’язки
Питання про те, як рецептори перетворюють енергію у
потенціал дії в чутливих нервах, інтенсивно вивчали. У
складних органах чуття, таких як орган зору, слуху, рівно-
ваги і смаку, є окремі рецепторні клітини і синаптичні спо-
лучення між рецепторами та аферентними нервами. Однак
у більшості шкірних органів чуття рецептори є спеціалі-
зованими, гістологічно модифікованими кінцями чутливих
нервових волокон.
Детально вивчені тільця Пачіні, які є тактильними
рецепторами. Завдяки порівняно великому розміру і
доступності у брижі експериментальних тварин їх можна
ізолювати, дослідити за допомогою мікроелектродів і під-
дати мікропрепаруванню. Кожне тільце складається з пря-
мого немієлінізованого закінчення чутливого нервового
волокна 2 мкм діаметром, оточеного концентрично плас-
тинками сполучної тканини, що надає органові вигляду
крихітної цибулини. Мієлінова оболонка чутливого нерва
починається всередині тільця. Перший вузол Ранв’є також
міститься всередині, тоді як другий, зазвичай, розташо-
ваний біля місця виходу нервового волокна з тільця (рис.
5-2).
Ґенераторні потенціали
У місці, де чутливий нерв виходить з тільця Пачіні,
можна розмістити реєструвальні електроди і піддати тільце
дозованому тиску. У разі застосування невеликого тиску
реєструють потенціал деполяризації, що не поширюється
і нагадує ЗПСП. Його називають генераторним, або ре-
цепторним, потенціалом. З підвищенням тиску рецептор-
ний потенціал збільшується. Коли значення генераторного
потенціалу досягає приблизно 10 мВ, то у чутливому нерві
генерується потенціал дії. Якщо тиск підвищується ще
більше, то генераторний потенціал стає більшим, і чутли-
вий нерв збуджується повторно.
Джерело ґенераторного потенціалу
За допомогою мікропрепарування з’ясовано, що від-
окремлення сполучнотканинних пластинок від немієліні-
зованого нервового закінчення і їхнє видалення з тільця
Пачіні не веде до зникнення ґенераторного потенціалу
Якщо перший вузол Ранв’є блокувати тиском або нарко-
тичними засобами, то генераторний потенціал буде збері-
гатися, однак провідні імпульси зникнуть (див. рис. 5-2).
Якщо ж перерізати чуливий нерв і дати немієлінізованому
кінцю дегенерувати, то генераторний потенціал не виник-
не. Завдяки цим та іншим експериментам з’ясовано, ще
Рис. 5-2. Виникнення ґенераторного потенціалу у немієлінізованому закінченні нерва всередині тільця Пачіні: 1 - електричн
реакції на тиск 1х (запис а), 2х (Ь), Зх (с), 4х (сі). Найсильніший стимул спричиняє появу потенціалу дії у чутливому нерві (е); 1
- подібні відповіді зафіксовано після видалення сполучнотканинної капсули, однак реакції були тривалішими внаслідок частково
втрати адаптації; 3 - ґенераторні реакції зберігались, але потенціалу дії не зафіксовано, коли перший вузол Ранв’є буї
блокований тиском або наркотиками (стрілка); 4 - усі реакції зникали, коли до експерименту чутливий нерв перерізали і вії
деґенерував
ІНІЦІАЦІЯ ІМПУЛЬСІВ В ОРГАНАХ ЧУТТЯ /113
генераторний потенціал виникає в немієлінізованому кінці
нерва. Доведено також, що такі нервові закінчення є місцем
виникнення генераторного потенціалу в дисках Меркеля.
Отже, рецептор перетворює механічну енергію в електрич-
ну відповідь, яка пропорційна до інтенсивності подразника.
Генераторний потенціал, відповідно, деполяризує чутливий
нерв на рівні першого вузла Ранв’є. З досягненням рівня
збудження виникає потенціал дії, і мембрана реполяризу-
ється. Якщо генераторний потенціал достатньо великий,
то нейрон збуджується знову, як тільки він реполяризується,
і продовжує збуджуватись доти, доки генераторний потен-
ціал є достатнім, щоб довести мембраний потенціал вузла
до рівня збудження. Отже, вузол перетворює відповідну
реакцію рецептора у потенціали дії, частота яких пропор-
ційна до сили подразника.
Подібні генераторні потенціали досліджені у м’язових
веретенах. Співвідношення між довжиною м’яза, яка визна-
чає інтенсивність подразнення у веретені, і розміром
генераторного потенціалу та відношення між довжиною
м’яза і частотою потенціалів дії в аферентному нервовому
волокні, що відходить від веретена, показано на рис. 5-3.
Частота потенціалів дії у нормальних умовах пов’язана з
інтенсивністю подразника через силу функції (див. нижче).
Генераторні потенціали виникають також в інших органах
і в цілому вони необхідні, щоб ініціювати деполяризацію
у чутливих нервових волокнах, що відходять від органа.
ЙОННІ основи
ПРОЦЕСУ ЗБУДЖЕННЯ
У деяких випадках механічне викривлення відкриває
канали у мембрані рецептора. Є докази, що такі механо-
рецептори пов’язані з натрієвими каналами епітеліальних
клітин (КаЕК); див. Розділ 1). Як наслідок, надходження
№’ спричинює генераторний потенціал і, можливо, кіль-
кість відкритих каналів є пропорційною до інтенсивності
подразника. Вірогідно, що такий механізм діє у тільцях
Пачіні і волоскових клітинах органа слуху та рівноваги. В
інших рецепторах, таких як палички і колби, відповіді зале-
жать від гетеротримерних 6-білків і циклічних нуклео-
тидів. У деяких випадках ці механізми поки що невідомі.
Адаптація
Якщо на рецептор діє тривале подразнення сталої сили,
то частота потенціалів дії у його чутливому нерві з часом
зменшується. Цей феномен відомий як адаптація, чи де-
сенситизація. Ступінь адаптації залежить від типу органа
чуття (рис. 5-4). Дотик є відчуттям, до якого швидко настає
адаптація, і його рецептори називають фазовими. З іншого
боку, каротидний синус, м’язові веретена, холодові та
больові рецептори, а також рецептори наповнення легень
повітрям адаптують дуже повільно й неповністю; їх нази-
вають тонічними рецепторами.
Тиск на тільце Пачіні спричинює появу генераторного
потенціалу, який швидко загасає, незважаючи на продов-
ження тиску. Якщо видалити сполучнотканинну капсулу і
піддавати дії тиску оголене нервове закінчення, то генера-
торний потенціал можна спричинити, однак загасає він
повільніше (див. рис. 5-2). Причиною швидкого загасання
9 367-2
Довжина
Рис. 5-3. Співвідношення між довжиною м’яза і ґенераторним
потенціалом (угорі) та частотою імпульсів (внизу) у рецепторі
розтягнення рака. Квадратики і кружечки показують значення
в двох різних препаратах (відтворено за дозволом з ТеггиоІо
СА, Мазїііги ¥: Кеіаііоп ЬеЬл/ееп зіітиіиз зІгепдІГі, депегаїог
роіепііаі, апсі ітриїзе їгециепсу іп зігеісії гесеріог ої сгизіасеа.
З ІМеигорЬузіоІ 1962;25:56).
в разі застосування тиску до інтактного тільця є, можливо,
латеральне зміщення сполучнотканинних пластинок, що
зменшує тиск на нервове закінчення. Однак це не єдиний
фактор адаптації, є ще повільне зменшення кількості потен-
ціалів дії, генерованих з часом у випадку постійного подраз-
ника після видалення зовнішніх пластинок тільця Пачіні.
Це зменшення відбувається завдяки акомодації (звиканню)
чутливого нервового волокна до генераторного потенціалу.
Повільна неповна адаптація м’язового веретена пов’я-
зана з тим, що його генераторний потенціал продовжується
і загасає дуже повільно в разі застосування постійного
подразнення. Повільна адаптація м’язових веретен, каро-
тидних синусів, больових і холодових рецепторів має деяку
цінність для індивіда. Розтягнення м’язів відіграє роль у
регулюванні ефекту довгого збереження лої. Крім того,
відчуття болю і холоду спричинене потенційно небезпеч-
ними подразниками, і якби їхні рецептори мали значну
адаптацію, то вони б значно втрачали свою попереджу-
114/РОЗДІЛ 5
Рис. 5-4. Адаптація. Висота кривої у кожному випадку відоб-
ражає частоту розрядів у чутливих нервових волокнах у різний
час після початку постійного подразнення (відтворено за доз-
волом з Асігіап ЕО: Вазіз о( зепзаііоп, Сїігізіорїіегз, 1928).
вальну цінність. Каротидні й аортальні рецептори постійно
використовувані в механізмах регулювання кров’яного
тиску, тому адаптація цих рецепторів обмежувала б точ-
ність, з якою працює ця регуляторна система.
КОДУВАННЯ
СЕНСОРНОЇ ІНФОРМАЦІЇ
Є відмінності у швидкості передавання та інших особли-
востях чутливих нервових волокон (див. Розділ 2), однак
потенціали дії подібні у всіх нервах. Наприклад, потенціали
дії у нерві від рецептора дотику ідентичні до потенціалів у
нерві від теплового рецептора. З огляду на це постає пи-
тання, чому стимулювання дотикового рецептора спричи-
нює відчуття дотику, а не тепла. Постає також питання, як
можна передати легкий або важкий дотик.
Доктрина специфічних нервових енергій
Відчуття, спричинене імпульсами, що генеровані в
рецепторі, залежить від специфічної ділянки мозку, яку
вони кінцево активують. Специфічні сенсорні шляхи є
окремими від органа чуття до кори. Отже, коли подразню-
ють нервові шляхи від окремого органа чуття, то відчуття,
що з’являється, є таким, до якого цей рецептор спеціалі-
зований, незалежно від того, як і де протягом цього сенсор-
ного шляху спричинено активність. Цей принцип, уперше
сформульований Мюлером 1835 р., отримав досить гро-
міздку назву доктрини специфічних нервових енергій.
Наприклад, якщо чутливий нерв від тільця Пачіні в руці
стимульовано тиском біля ліктя або подразненням від пух-
лини у плечовому сплетенні, то спричинене відчуття буде
дотиком. Подібно, якби достатньо тонкий електрод вста-
вити у відповідні волокна дорсальних стовпів спинного
мозку, таламуса або постцентральної звивини мозкової
кори, то відчуття, спричинене подразненням, було б
дотиком. Цю доктрину час від часу ставили під сумнів,
особливо ті, хто вважав, що біль зумовлений дуже сильним
подразненням дуже різних рецепторів. Однак гіпотеза су-
перстимулювання значно дискредитована, і принцип спе-
цифічних нервових енергій є одним з наріжних каменів
сенсорної фізіології.
Проекція
Незалежно від того, де подразнюють чутливий тракт
уздовж його шляху до кори, спричинене свідоме відчуття
буде локалізоване у місці розташування рецептора. Цей
принцип називають законом проекції. Експерименти з
подразненням кори головного мозку під час нейрохірур-
гічних операцій на хворих, що перебувають у свідомості,
моделюють цей феномен. Наприклад, якщо подразнюють
кіркову сприймальну ділянку для імпульсів від лівої руки,
то хворий локалізує відчуття у лівій руці, а не у голові.
Інший приклад - люди з ампутованими кінцівками. Деякі
з таких хворих можуть скаржитися на біль, часто сильний,
і пропріорецептивні відчуття у кінцівці, якої нема (фан-
томна кінцівка). Кінці нервів, перерізаних під час ампутації
часто формують нервові клубки, які називають невроно-
мами. У цих неврономах може виникати біль спонтанно
або в разі натискання. Імпульси, які в цьому разі генеру-
ються, виникають у нервових волокнах, які попередньо
йшли від органів чуття в ампутованій кінцівці, а спричинені
відчуття проектуються туди, де були рецептори. Однак є
докази, що феномен фантомної кінцівки також пов’язаний
із пластичністю в сенсорних системах ЦНС (див. Розділ 7).
Розпізнавання інтенсивності подразнення
Є два шляхи, якими інформація про інтенсивність
подразнення передається у мозок: зміна частоти потенці-
алів дії, генерованих активністю конкретного рецептора, і
зміна кількості активованих рецепторів.
Давно з’ясовано, що інтенсивність відчуття пропорцій-
на до логарифма інтенсивності подразника (закон Вебера-
Фехнера). Однак тепер виявили, що точніше цей феномен
описує формула
ККЗА,
де К - відчуття; 8 - інтенсивність подразнення, К і А -
сталі для будь-якого різновиду відчуття. Частота потенці-
алів дії, Генерованих подразненням чутливого нервового
волокна, також співвідноситься до інтенсивності подраз-
ника як функція ступеня. Приклад такого співвідношення
показано на рис. 5-3, де експонента дорівнює приблизно
1,0. Інший приклад зображено на рис. 5-5, де розрахована
експонента дорівнює 0,52. Сучасні дані свідчать, що у ЦНС
співвідношення між подразником і відчуттям та інтенсив-
ністю подразника первинно визначена властивостями
самих периферійних рецепторів.
Одиниці відчуття
Термін “сенсорна одиниця” стосується одного чутли-
вого відростка й усіх його периферійних гілок. Кількість
цих гілок різна, проте вони можуть бути численними,
особливо для шкірних органів чуття. Рецептивне поле
ІНІЦІАЦІЯ ІМПУЛЬСІВ В ОРГАНАХ ЧУТТЯ /115
100
I 90
0)
І 80
о.
с 70
0)
I 60
03
І 50
03
т 40
03
І
!|. ЗО
03
о. 20
о: ю
_і_____і_____і_____і____і_____і_____і____і_____і_____і_
10 20 ЗО 40 50 60 70 80 90 100
8, % максимальних подразнень
Рис. 5-5. Співвідношення між тактильним подразником (8) і частотою потенціалів дії у чутливих нервових волокнах (Р). Крапки
відповідають індивідуальним значенням у котів та розташовані у лінійній системі координат (ліворуч) і в системі координат
логарифмів цих значень (праворуч). Рівняння описує степеневу залежність між Р і 8 (відтворено за дозволом з ЇА/егпег 6,
Моипісазіїе УВ: МеигаІ асііуііу іп тесіїапогесерііуе сиіапеоив аіїегепіз. З ІЧеигорЬузіоІ. 1965;28:359).
сенсорної одиниці - це ділянка, з якої подразник спричи-
нює відповідь у цій одиниці. У рогівці і прилеглій склері
ока ділянка поверхні, яку забезпечує одна сенсорна одини-
ця, дорівнює 50-200 мм2. Загалом ділянки, що забезпечені
одною сенсорною одиницею, перекриваються та інтерди-
гітують з ділянками, які забезпечені іншими одиницями.
Поповнення сенсорних одиниць
Якщо сила подразника збільшується, то виникає тен-
денція його поширення на більшу ділянку, і загалом він
активує органи чуття, розташовані не лише у безпосеред-
ньому контакті, а й навколишні ділянки. Крім того, по-
дразники слабкої сили активують рецептори з найнижчими
порогами, тоді як сильні подразники - рецептори з вищими
порогами подразнення. Деякі з активованих рецепторів є
частиною тієї ж сенсорної одиниці, і частота імпульсів в
одиниці зростає. Однак завдяки перекриттю та інтерди-
гітації одної одиниці з іншою рецептори інших одиниць
також подразнюються, а, отже, більше одиниць збуджу-
ються. Таким способом відбувається активування більшої
кількості аферентних шляхів, а це інтерпретується в голов-
ному мозку як зростання інтенсивності відчуття.
ЛІТЕРАТУРА ДО ЧАСТИНИ II: ФІЗІОЛОГІЯ НЕРВОВИХ І М’ЯЗОВИХ КЛІТИН
Акії Н еі аі: Епбо^епоиз оріоіск: Віо1о§у апсі іипсііоп. Акти
Кєу Кеигозсі 1984;7:223.
Ваиііеи Е-Е: №иго8іегоісІ8: О£ іЬе пегуоиз 8у8іет, Ьу іЬе
пегуоиз 8у8іет, Гог іЬе пегуои8 8у8іет. Песеті Рго§ Ногт
Ке8 1997;22:1.
Веппеіі МК: Тгап8тІ88Іоп аі 8утраіЬеііс уагісо8Іііе8. Ке\¥8
РЬузіоІ 8сі 1998;13:79.
Вепохуііг КЬ: Вги§ іЬегару: РЬагтасо1о§іс а8ресі8 о£ сі§а-
геііе 8токіп§ апсі пісоііпе асісіісііоп. N Еп§1 3 Месі 1988;
319:1318.
СЬеп Н, Не 7, Те88Іег-Еауі§пе М: Ахоп §иіс!апсе тесЬа-
ПІ8ГП8: 8етірЬогіп8 а8 8Іти1іапеои8 гере11епі8 апсі апііге-
ре11епі8. №і Неиго8сі 1998; 1:436.
Соорег Ж, Віоот ЕЕ, КоіЬ КН: Тке Віоскетісаі Вазіх о/
№игоркагтасоІо%у, бік есі. ОхГогсІ ііпіу Рге88, 1991.
ВгасЬтап ВВ: Муазікепіа §гауІ8. N Еп§1 І Месі 1994;330:
1797.
Е11І8 ТМ, Аікіпзоп МА: ТЬе сііпісаі 8І§піїїсапсе оГ ап аиіо-
іттипе ге8роп8е а§аіп8і §1иіатіс асісі сІесагЬохуІазе. №і
Месі 1996;2:148.
116/РОЗДІЛ 5
Еип£ ¥С: Віотескапісх, 2пс1 есі. 8ргіп§ег, 1993.
6гІ£§8 КС, Мепсіеіі ЗК, Міііег КО: Ечаїиаііоп апсі Тгеаітепі
о] Муораїкіех Оауіз, 1994.
Наїї 7\У: Ап Іпіїосіисііоп іо Моїесиїаг МеигоЬіоІоуу. 8іпаиег,
1992.
НаІІе» М: Опсе тап’з роізоп - сііпісаі арріісаііопз оГЬоШ-
Ііпит іохіп. N Еп§1 5 Месі 1999;341:188.
НаппаЬ МЗ, 8сЬтіск АА, НиПпег XVВ: 8упарйс уєзісіє Ьіо-
£епе8І8. Аппи Кєу Сеіі Оєу Віоі 1999; 15:723.
Напп8оп Е, КоппЬаск Ь: Азігосуіез іп §1иіатаіе пеигоігапз-
тІ88Іоп. ГА8ЕВ 3 1995;9:343.
Наггі8 К, Каїег 8В: Вепсігійс 8ріпе8: Сеііиіаг зресіаііхаііопз
ітрагїіп£ ЬоШ зіаЬіІііу апсі ЕІехіЬіїйу іо зупарНс Гипсгіоп.
Аппи Кєу \еигозсі 1994; 17:341.
Ніііе В: Іопіс Скаппеїз о/ ЕхсііаЬІе МетЬгапез, 2пс1 есі.
8іпаиег, 1992.
Ноіітапп М, Неіпетапп 8: Сіопесі §1иіатаіе гесеріогз. Аппи
Кєу №иго8сі 1994; і7:31.
Ного\уіі2 А еі аі: МесЬапізтз о£ зтооіЬ тизсіе сопігасііоп.
РЬУ8ІОІ Кєу 1996:76:967.
Зопез йА, Коипсі ЗМ: ЗкеїеіаіМизсіе іп Неаіік апсіОі$еа$е:
А ТехіЬоок о/Мизсіе Ркухіоіоуу. МапсЬезіег ІЗпіу Рге88,
199О.Каіх АМ: Сагсііас іоп сЬаппеїз. N Еп§1 3 Месі
1993;328:1244.
Массіопаїсі КЕ, ОІ8ЄП КХУ: 6АВАД гесеріог сЬаппеїз. Аппи
Кєу Неиго8сі 1994;17:569.
Маїепка КС, ІЧісоП КА: Еоп§-іегт роіепііаііоп - а сіесасіе
оГ рго§ге88? 8сіепсе 1999;285:1870.
МаппІ8іо Р, Кааккоіа 8: СаіесЬоІ-О-теіЬуІігапзГегазе
(СОМТ): ВіосЬетізігу, тоїесиїаг Ьіо1о§у, рЬагтасо1о§у,
апсі сііпісаі еіїїсіепсу оГ іЬе пе\у зєієсііує СОМТ іпЬіЬі-
іогз. РЬагтасоІ Кєу 1999;51:593.
МіІЬот ОЕ, НокЕек Т: СЬетісаІ те88еп§ег8 апсі іЬеіг соех-
ізіепсе іп іпсііуісіиаі пеигопз. Иеш8 РЬузіоІ 8сі 1988;3:1.
Моипісазіїе УВ: Регсеріиаі їїеигозсіепсе. Нагуагсі ІЗпіу
Ргезз, 1999.
Оізика М, УозЬіока К: Жигоігапзттсг Еипсііопз оЕ тат-
таїіап іасЬукіпіпз. РЬузіоІ Кєу 1993;73:229.
РеКе О, 8іагоп К8: ТЬе тоїесиїаг сііуегзку оЕ таттаїіап
ти8с1е ГіЬег8. Ке\¥8 РЬу8Іо1 8сі 1993;8:153.
8актапп В: Еіетепіагу 8іер8 іп 8упарііс Ігап8тІ88Іоп геуеаіесі
Ьу СШТЄПІ8 ікгои§к 8Іп§1е іоп сЬаппеїз. 8сіепсе 1992;256:
503.
8а1реіег ММ (есіііог): Тке УеПеЬгаіе ^еи^опги8си^а^ Зипс-
ііоп. Ріепит, 1987.
8ап£иіпеПі МС, Кеаііп£ МТ: Коїе оЕсіеіауесі гесііГіег роіа8-
8Іит сЬаппеІ8 іп сагсііас героіагіхаііоп апсі аггЬуШтіа8.
Ке\У8 РЬУ8Іо1 8сі 1997; 12:152.
8сЬіауо 6, Маіїеоіі М, Мопіесиссо С: Неигоіохіпз аНесііп§
пеигоехосуіо8І8. РЬузіоІ Кєу 2000;80:717.
8сЬитап ЕМ, Масіізоп ОУ: ІЧіїгіс охісіе апсі 8упарііс Еипс-
ііоп. Аппи Кєу Кеиго8сі 1994; 17:153.
8сЬ\уагі7 3-С еі аі (есіііогз): Тке Ні8іапгіпе Ресеріог. ХУіІеу-
ЬІ88, 1992.
8іе§е1 03 еі аі (есіііогз): Вазіс Меигоскепгізігу, 501 есі. Кауеп
РґЄ88, 1993.
8от1уо АР, 8от1уо АУ: 8і§па11гап8с1ис6оп апсі ге^иіайоп іп
8тооШ ти8с1е. КаШге 1994;372:231.
8ис1Ьо£ТС: ТЬе 8упарііс уєзісіє сусіе: А сазсасіе оГ ргоіеіп-
ргоіеіп іпіегасііоп8. №іиге 1995;375:645.
ТЬоепеп Н: №игоігорЬіп8 апсі пеигопаї ріазйсііу. 8сіепсе
1995;270:593.
Уаіее КВ, Віоот О: МесЬапІ8Ш8 о£Еа8і апсі 8іо\у ахопаї 1гап8-
рогі. Аппи Кєу Кеиго8сі 1991; 14:59.
Уісіаі С, СЬап§еих 3-Р: Неигопаї пісоііпіс асеіуїсЬоІіпе
гесеріог8 іп іИе Ьгаіп. Ие\У8 РЬузіоІ 8сі 1996; 11:202.
ХУіІІіатз М (есіііог): АВепозіпе апсі Асіепозіпе Кесеріогх.
Нитапа, 1990.
Частина III
Функції нервової системи
Рефлекси
6
ВСТУП
Головною одиницею інтеґративної рефлекторної актив-
ності є рефлекторна дуга. Вона складається з чутливого
органа, аферентного нейрона, одного або більше синапсів
у межах центральної інтеґративної ділянки або в симпа-
тичному вузлі, еферентного нейрона й ефектора. У ссавців
аферентний і еферентний соматичні нейрони сполучені в
межах головного або спинного мозку. Аксони аферентних
нейронів проходять через задні корінці або черепні нерви,
а їхні тіла містяться в спинномозкових вузлах або гомоло-
гічних вузлах черепних нервів. Еферентні волокна виходять
з ЦНС через передні корінці або відповідні рухові черепні
нерви. Правило, за яким задні корінці спинного мозку чут-
ливі, а передні - рухові, називають законом Белла-Ма-
жанді.
Активність у рефлекторній дузі розпочинається з виник-
нення потенціалу в чутливому рецепторі; цей потенціал
пропорційний до сили подразника (рис. 6-1). Це призво-
дить до генерування потенціалів дії в аферентному нерві,
що виникають за законом “усе або нічого”. Кількість потен-
ціалів дії пропорційна до генерованого потенціалу. В синап-
тичних контактах у межах ЦНС збудження градуйовано
змінюється під впливом ЗПСП і ГПСП (див. Розділ 4). Коли
потенціали досягають ефектора, то вони знову спричиню-
ють градуйовану реакцію. У випадку, коли ефектором є
гладкий м’яз, відбувається сумація реакцій, що зумовлюють
у гладкому м’язі потенціали дії. Якщо ж ефектором є ске-
летний м’яз, то градуйована реакція завжди адекватна
потенціалам дії, які зумовлюють м’язове скорочення (див.
Розділ 4). Зазначимо, що сполучення між аферентним та
еферентним нейронами міститься переважно в межах
ЦНС, а діяльність рефлекторної дуги модифікована багать-
ма впливами, що конверґують на еферентних нейронах.
Найпростіша рефлекторна дуга містить один синапс, у
якому контактують аферентний і еферентний нейрони. Такі
дуги називають моносинаптичними, а рефлекси, що від-
буваються в них, - моносинаптичними рефлексами.
Рефлекторні дуги, у складі яких між аферентним та ефе-
рентним нейронами містяться один або більше вставних
нейронів (інтернейронів), називають полісинаптичними.
Кількість синапсів у таких дугах - від двох до багатьох
сотень. В обох типах дуг, особливо в полісинаптачних
рефлекторних, активність модифікована шляхом просто-
рового і часового полегшення, оклюзії, підпороговими та
іншими впливами.
МОНОСИНАПТИЧНІ РЕФЛЕКСИ:
РЕФЛЕКС РОЗТЯГУВАННЯ
Розтягнутий скелетний м’яз без порушень іннервації
скорочується. Цю реакцію називають рефлексом розтягу-
вання (міотатичним). Подразником, що спричинює цей
рефлекс, є розтягування м’яза, а відповіддю - скорочення
розтягнутого м’яза. Функцію чутливого рецептора у цьому
разі виконує м’язове веретено. Імпульси, що виникають у
м’язовому веретені, проходять до ЦНС по швидких чут-
ливих волокнах безпосередньо до мотонейронів, які іннер-
вують цей м’яз. Нейротрансмітером у центральних синап-
сах є глютамат. Рефлекси розтягування - найвідоміші і най-
ліпше вивчені моносинаптичні рефлекси організму.
Клінічні приклади
Ударяння молоточком по сухожилку нижче від колінної
чашечки спричинює колінний рефлекс - рефлекс розтягу-
вання чотириголового м’яза стегна, оскільки вдаряння по
його сухожилку приводить до скорочення м’яза. Подібне
скорочення можна спостерігати і в разі розтягування чоти-
риголового м’яза руками. Рефлекси розтягування можна
спровокувати також у більшості інших великих м’язів тіла.
Вдаряння по сухожилку триголового м’яза плеча, наприк-
лад, спричинює розгинання в лікті, що виникає внаслідок
скорочення цього м’яза; вдаряння по сухожилку Ахілла
спричинює рефлекс розтягування, зумовлений скорочен-
ням литкового м’яза; а вдаряння збоку обличчя зумовлює
рефлекс розтягування в жувальному м’язі. Інші рефлекси
розтягування описані в підручниках з неврології.
Структура м’язового веретена
Кожне м’язове веретено містить приблизно 10 м’язових
волокон, охоплених сполучнотканинною капсулою. Ці
волокна більше наближені за структурою до волокон ембрі-
онального типу і менше посмуговані, ніж інші волокна
м’яза. їх називають внутрішньоверетенними волокнами,
на відміну від зовнішньоверетенних волокон, що є регу-
118/РОЗДІЛ 6
Рис. 6-1. Рефлекторна дуга. Зауважте, що в рецепторі та ЦНС виникає непоширювальна ґрадуйована реакція. Вона пропор-
ційна до сили подразника. Реакція в нервово-м’язовому синапсі теж ґрадуйована, тому за нормальних умов вона достатня,
щоб спричинити реакцію скелетного м’яза. З іншого боку, в частинах рефлекторної дуги, призначених для проведення імпульсів
(аферентний та еферентний нейрони, м’язова мембрана), потенціали дії виникають за принципом “усе або нічого”.
лярними скоротливими одиницями м’яза. Внутрішньовере-
тенні волокна розміщені паралельно щодо інших волокон
м’яза, оскільки кінці капсули веретена прикріплені до сухо-
жилків на кожному з кінців м’яза або з боків зовнішньо-
веретенних волокон.
У м’язових веретенах ссавців є два типи внутрішньове-
ретенних волокон. Один тип волокон містить у розширеній
центральній ділянці багато ядер, тому його називають
волокном ядерної сумки (рис. 6-2). Переважно у веретені
містяться два волокна ядерної сумки: волокно ядерної сум-
ки 1 з низьким рівнем активності міозин АТФ-ази і волокно
ядерної сумки 2 з високим рівнем активності міозин АТФ-
ази. Інший тип волокон - волокна ядерного ланцюжка -
тонші і коротші, не мають окресленої сумки. Таких волокон
у веретені чотири або й більше, їхні кінці прикріплені з
боків до волокон ядерної сумки. Кінці внутрішньоверетен-
них волокон скоротливі, тоді як їхні центральні частини,
вірогідно, не скорочуються.
У кожному веретені є два типи чутливих закінчень.
Первинні (кільцево-спіральні) закінчення - це закін-
чення швидкопровідних аферентних волокон групи Іа (див.
табл. 2-2). Одна гілка волокна Іа іннервує волокно ядерної
сумки 1, тоді як інша - волокна ядерної сумки 2 і волокна
ядерного ланцюжка. Ці чутливі волокна спіраллю оточують
центральні ділянки волокон ядерної сумки і волокон
ядерного ланцюжка. Вторинні (гроноподібні) закінчення
є закінченнями чутливих волокон групи II. Вони розміщені
поблизу кінців внутрішньоверетенних волокон ядерного
ланцюжка.
Веретена мають власну рухову іннервацію. Ці нерви,
3-6 мкм у діаметрі, становлять приблизно 30% волокон
переднього корінця і належать до групи Ерлянґера і Ґассера
А у. Завдяки такому розміру їх названо у-еферентами Лек-
селя, або малою руховою нервовою системою. Ці волок-
на прямують винятково до веретен. Крім того, як внутріш-
ньо-, так і зовнішньоверетенні волокна іннервовані більши-
ми р-мотонейронами. Закінчення еферентних волокон
бувають двох гістологічних типів: рухові кінцеві пластинки
(пластинчасті закінчення) волокон ядерної сумки і закін-
чення у вигляді сіток (протяжні закінчення), що містяться
головно на волокнах ядерного ланцюжка.
У веретенах є два типи чутливих волокон - динамічні
та статичні (див. нижче), а у- та р-мотонейрони забезпе-
чують два функційні типи відповідей. Подразнення пер-
шого типу посилює динамічне реагування (динамічні ве-
ретено-моторні аксони), а подразнення другого типу -
статичне за сталої довжини (статичні веретеноподібні
аксони).
Центральні зв’язки аферентних волокон
За допомогою експерименту можна з’ясувати таке:
волокна Іа, що прямують від первинних закінчень м’яза,
закінчуються безпосередньо на мотонейронах, які іннер-
вують зовнішньоверетенні волокна цього ж м’яза. Час, що
минає між початком подразнення і відповіддю, називають
часом рефлексу. В організмі людини час рефлексу розтягу-
вання, наприклад колінного рефлексу, становить 19-24 мс.
Слабке подразнення чутливого нерва, який відходить від
м’яза, що, як відомо, призводить до збудження лише воло-
кон Іа, спричинює скорочувальну реакцію, з такою ж
латентністю. Оскільки швидкість передавання імпульсів в
аферентних та еферентних нейронах відома, а відстань від
м’яза до спинного мозку легко виміряти, то можна обчис-
лити частку часу реакції, потрібну для передавання збуд-
ження від м’яза до спинного мозку і в зворотному напрямі.
Якщо це значення відняти від загального часу реакції, то
залишок, який називають центральною затримкою, від-
повідатиме часу, необхідному для рефлекторної активності
в межах спинного мозку. В організмі людини центральна
затримка розвитку колінного рефлексу становить 0,6-
0,9 мс. Подібні значення отримані також в експериментах
на тваринах. Оскільки мінімальна синаптична затримка
становить 0,5 мс (див. Розділ 4), то зрозуміло, що рефлек-
торна дуга такого типу рефлексу містить лише один синап-
тичний контакт.
Збудження від м’язових веретен, яке спричинює м’язове
скорочення, поширюється полісинаптичними шляхами, і
воно, ймовірно, надходить від вторинних закінчень. Волок-
РЕФЛЕКСИ/119
ІІІШШІІ^^ШШІІІІІІВіОШІІІІІШІІІІІІІІ^/ІІІВІ^^рІ^^^^І^Ш^Ш^^^^Ші^^^ШІІІІ
Рис. 6-2. Схематичне зображення головних компонентів м’язового веретена ссавців. Кожне веретено охоплене капсулою і
містить два волокна ядерної сумки та чотири або більше волокна ядерного ланцюжка.
на групи II, що утворюють моносинаптичні контакти з
мотонейронами, роблять невеликий внесок у рефлекси роз-
тягування.
Функція м’язових веретен
Під час розтягування м’язового веретена його чутливі
закінчення деформуються, і в них генеруються рецепторні
потенціали. Це, відповідно, зумовлює виникнення потен-
ціалів дії в чутливих волокнах, що за частотою пропорційні
до ступеня розтягування. Веретена розміщені паралельно
щодо зовнішньоверетенних волокон, і коли м’яз пасивно
розтягується, то вони теж підлягають розтягуванню. Внас-
лідок цього виникає скорочення зовнішньоверетенних
волокон м’яза. З іншого боку, аференти веретена харак-
терним способом припиняють збудження, якщо м’яз скоро-
чується внаслідок електричного подразнення нервових
волокон, що надходять до зовнішньоверетенних волокон,
оскільки тоді м’яз скорочується, а веретено - ні (рис. 6-3).
Отже, веретено і його рефлекторні зв’язки є механізма-
ми зворотного зв’язку, що діє зі збільшенням довжини
м’яза. Коли м’яз розтягується, то зростає збудження у вере-
тені і виникає рефлекторне скорочення м’яза. З іншого
боку, коли м’яз скорочується без зміни збудження в ефе-
рентах, то збудження у веретені зменшується, і м’яз роз-
слаблюється.
У разі розтягування веретена подразнюються первинні
закінчення волокон як ядерної сумки, так і ядерного лан-
цюжка, проте тип відповіді в цьому випадку відрізняється.
Нерви, що відходять від закінчень ділянки ядерної сумки,
зумовлюють динамічну реакцію, тобто імпульсація в них
відбувається швидше, коли м’яз розтягнутий, і повільніше,
якщо розтягування тривале (рис. 6-4). Нерви, що відходять
від первинних закінчень волокон ядерного ланцюжка, ство-
рюють статичну реакцію, тобто імпульсація в них відбу-
вається з високою швидкістю протягом усього періоду, до-
ки м’яз розтягнутий. Отже, первинні закінчення реагують
на зміну як довжини м’яза, так і ступеня його розтягування.
Реакція первинних закінчень на фазові та статичні явища,
що відбуваються в м’язі, має важливе значення, оскільки
швидке фазове реагування допомагає зменшувати амплі-
туду осциляцій, спричинених затримками проведення в
дузі зворотного зв’язку, що регулює довжину м’яза. Неве-
ликі осциляції в дузі зворотного зв’язку, звичайно ж, вини-
кають. Цей фізіологічний тремор відбувається з частотою
приблизно 10 Гц. Проте тремор був би сильнішим, якби
не змінювалась чутливість веретена до швидкості розтягу-
вання.
Ефект референтної імпульсації
Подразнення у-еферентної системи зумовлює дуже різ-
номанітні явища, що виникають під час скорочення зовніш-
ньоверетенних волокон. Воно не призводить безпосе-
редньо до помітного скорочення м’язів, оскільки внутріш-
ньоверетенні волокна недостатньо потужні, кількість їх
недостатня щоб спричинити скорочення. Проте у-еференти
скорочують скоротливі кінці внутрішньоверетенних
волокон, що зумовлює розтягування ділянки ядерної сумки
веретен, деформуючи кільцево-спіральні закінчення й
ініціюючи імпульси у волокнах Іа. Це, відповідно, може
призводити до рефлекторного скорочення м’яза. Отже,
м’яз може скорочуватись унаслідок подразнення (X-
мотонейронів, що іннервують зовнішньоверетенні волок-
на, або у-еферентних нейронів, що ініціюють м’язове ско-
рочення опосередковано - шляхом рефлексу розтягування.
З посиленням у-еферентної імпульсації, внутрішньове-
ретенні волокна стають коротшими від зовнішньовере-
тенних. Коли ж цілий м’яз розтягується під час подраз-
нення у-еферентів, то внаслідок додаткового розтягування
ділянки ядерної сумки генеруються додаткові потенціали
дії, і кількість імпульсів у волокнах Іа далі збільшується
(див. рис. 6-3). Посилення у-еферентної імпульсації, отже,
приводить до зростання чутливості веретена, а чутливість
веретен до розтягування змінюється залежно від ступеня
у-еферентної імпульсації.
Є значна вірогідність посилення у-еферентної імпуль-
сації одночасно з посиленням імпульсації (Х-мотонейронів,
120/РОЗДІЛ 6
Сухожилок Зовнішньо*
Екфєтзно веретенне
волокно
Чутливий нерв
Імпульси в
чутливому нерві
М’яз у стані спокою
Рис. 6-3. Вплив різних умов на імпульсацію в м’язовому ве-
ретені.
іцо ініціює рухи. Внаслідок цього «-зв’язку веретено скоро-
чується разом з м’язом, і імпульсація веретена триває про-
тягом скорочення. Отже, веретено зберігає здатність від-
повідати на розтягування і рефлекторно регулювати рівень
збудження в мотонейронах упродовж скорочення.
Зростання
Довжина
м’яза
Нерв, що відходить
від волокна ядерної
сумки
Нерв, що відходить
від волокна ядерного
ланцюжка
Рис. 6-4. Реакція аферентів веретена у відповідь на розтягу
вання м’яза. Дві нижні лінії відображають кількість збуджен
в аферентних нервах, що відходять від первинних закінчен
волокон ядерної сумки і ядерного ланцюжка, за умов, кол
м’яз розтягнутий, а також коли він набуває попередньої дое
жини.
Динамічні та статичні у- і р-еференти описані раніше
Подразнення динамічних еферентів зумовлює зростанн
чутливості веретена до швидкості зміни довжини м’яза пі,
час розтягування, а статичних - зростання чутливості верє
тена у разі стійкого тривалого розтягування. Отже, є змог
роздільно регулювати реакції, що виникають у веретені
відповідь на фазові або статичні явища.
Регулювання у-еферентної імпульсації
Рухові нейрони у-еферентної системи регульовані ни:
хідними шляхами, що відходять з багатьох ділянок голое
ного мозку. За допомогою цих шляхів може відбуватис
регулювання чутливості м’язових веретен і, відповідне
поріг рефлексів розтягування багатьох ділянок тіла, щ
важливо для постави (див. Розділ 12).
Інші чинники теж впливають на у-еферентну імпульсе
цію. Хвилювання призводить до посилення імпульсації
цей факт, імовірно, пояснює гіперактивність сухожилкови
рефлексів, що інколи простежуються в схвильованих пе
цієнтів. Крім того, з посиленням еферентної імпульсац
пов’язані також несподівані рухи. Подразнення шкірі
зокрема, небезпечними агентами, призводить до посиленн
еферентної імпульсації у веретенах іпсилатеральних м’язії
згиначів та її послаблення у веретенах м’язів-розгиначії
а також виникнення протилежних явищ в іншій кінцівц
Добре відомо, що намагання розвести руки в разі зчеплени
пальців обидвох кистей посилює колінний рефлекс (фене
мен Єндрасіка), і це теж може бути зумовлене посилення
у-еферентної імпульсації, ініційованої аферентним
імпульсами, що надходять від ділянок кистей.
Реципрокна іннервація
Під час рефлексу розтягування протилежні за функціє]
м’язи щодо м’язів, які рефлексують, тобто їхні антагоністі
розслаблюються. Цей феномен зумовлює реципрокн
іннервація. Імпульси, що надходять по волокнах Іа ві
м’язових веретен м’язів-агоністів, спричинюють посг
синаптичне гальмування в мотонейронах, які проходяї
до антагоністів. Шлях, що опосередковує цей ефект, міс
тить два синаптичні контакти. Колатеральна гілка кожної
РЕФЛЕКСИ/121
волокна Іа прямує до гальмівного інтернейрона спинного
мозку (пляшкоподібний нейрон Ґольджі), який утворює
безпосередній синаптичний контакт з одним із мотоней-
ронів, що іннервує м’яз-антагоніст. Приклад такого типу
постсинаптичного гальмування наведено в Розділі 4, а його
шлях зображений на рис. 4-9.
Зворотний рефлекс розтягування
Чим вище від точки сильного розтягування м’яза, тим
сильніше виявляється рефлекторне скорочення. Проте коли
ступінь напруження достатньо великий, то скорочення рап-
тово припиняється і м’яз розслаблюється. Це розслаблення
у відповідь на сильне розтягування називають зворотним
інверсним рефлексом розтягування, або автогенним
гальмуванням.
Рецептором зворотного рефлексу розтягування є сухо-
жилковий орган Ґольджі (рис. 6-5) - сітчасте скупчення
шишкоподібних нервових закінчень, розміщене серед пуч-
ків волокон сухожилка. Один сухожилковий орган відхо-
дить від 3 до 25 м’язових волокон. Нервові волокна, що
відходять від сухожилкового органа Ґольджі, є мієліно-
вими, швидкопровідними чутливими волокнами групи ІЬ
(див. табл. 2-2). Подразнення цих волокон зумовлює ГПСП
у мотонейронах, що іннервують м’язи, від яких відходять
ці чутливі волокна. Волокна ІЬ закінчуються в спинному
мозку на інтернейронах, а ті, відповідно, безпосередньо
на мотонейронах (рис. 6-6). Ці волокна теж формують збуд-
жувальні контакти з мотонейронами, які іннервують анта-
гоністи м’яза.
Оскільки сухожилкові органи Ґольджі, на відміну від
веретен, реєструють натяг серії м’язових волокон, то їхнє
подразнення виникає внаслідок як пасивного розтягування,
так і активного скорочення м’яза. Поріг збудження в сухо-
жилкових органах Ґольджі невисокий. Рівень подразнення
шляхом пасивного розтягування незначний, тому що
більша частина м’язових еластичних волокон переймає на
себе силу розтягування, і внаслідок цього сильне розтя-
гування приводить не до скорочення, а до розслаблення.
Проте скорочення м’яза зумовлює постійну імпульсацію,
і сухожилковий орган Ґольджі, отже, функціонує як пере-
творювач у ланцюгу зворотного зв’язку, що регулює м’язо-
ву силу, подібно до того як ланцюг зворотного зв’язку вере-
тена регулює довжину м’яза.
Про значення первинних закінчень веретен і сухожил-
кових органів Ґольджі в регулюванні швидкості м’язового
скорочення, довжини м’яза і сили м’язового скорочення
може свідчити той факт, що перерізання аферентних нер-
вів, які прямують до ділянки плеча, спричинює вільне
звисання верхньої кінцівки, як у разі геміпарезу. Структура
описаної системи зображена на рис. 6-7, а взаємодія
імпульсації веретена, імпульсації сухожилкового органа
Ґольджі і реципрокної іннервації у визначенні рівня імпуль-
сації в мотонейронах - на рис. 6-8.
М’язовий тонус
Резистентність м’яза стосовно розтягування часто
характеризують як його тонус. Якщо руховий нерв м’яза
перерізати, то м’яз виявлятиме дуже невелику резистент-
ність і, як кажуть, стане розслабленим, кволим. Гіпер-
тонічний (спастичний) м’яз - це м’яз, у якому резистент-
ність щодо розтягування внаслідок гіперактивності реф-
лексу розтягування є високою. Десь між станом розслаб-
лення й еластичності виникає нечіткий стан нормального
тонусу. Гіпотонічність м’язів настає, насамперед, тоді,
коли рівень у-еферентної імпульсації невисокий, а гіперто-
нічність - у протилежному випадку.
Реакція подовження
За умов гіпертонічності м’язів чітко простежується така
послідовність: помірне розтягування м’язове скорочен-
ня, сильне розтягування м’язове розслаблення. У разі
пасивного згинання в лікті, наприклад, фіксують негайну
резистентність, що виникає внаслідок рефлексу розтягу-
вання триголового м’яза плеча. Подальше розтягування
активує зворотний рефлекс розтягування. Резистентність
щодо згинання раптово зникає і відбувається згинання в
лікті. Продовження пасивного згинання знову розтягує
м’яз, і послідовність повторюється. Така послідовність
резистентності, коли кінцівка рухається пасивно, відома в
клініці як ефект складаного ножа. Фізіологічний термін
цього явища - реакція подовження, оскільки в цьому
випадку відбувається реагування спастичного м’яза (у
Рис. 6-5. Сухожилковий орган Ґольджі (відтворено за дозволом з бозз СМ [есіііог]- бгау’з Апаіоту оїйіе Нитап Восіу, 29Й1 есі.
І_еа & РеЬідег, 1973).
122 / РОЗДІЛ 6
Рис. 6-6. Схема шляхів, що забезпечують рефлекс розтягу-
вання й інверсний рефлекс розтягування. Розтягування м’яза
спричинює подразнення м’язового веретена, й імпульси, що
поширюються волокнами Іа, спричинюють збудження в мото-
нейронах. Розтягування теж зумовлює подразнення сухожил-
кового органа Ґольджі, й імпульси, що поширюються волок-
нами ІЬ, спричинюють виділення інтернейроном гальмівного
трансмітера - гліцину. В умовах сильного розтягування гіпер-
поляризація, яка виникає в мотонейронах, є настільки знач-
ною, що імпульсація припиняється.
попередньому прикладі - триголового м’яза плеча) на
подовження.
Клонус
Іншою ознакою станів, що супроводжуються зростан-
ням у-еферентної імпульсації, є клонус. Цей неврологічний
симптом полягає у регулярних ритмічних скороченнях
м’яза, що піддається раптовому і тривалому розтягуванню.
Типовим прикладом слугує гомілково-стопний клонус.
Його ініціює різке і тривале тильне згинання стопи, а від-
повіддю є ритмічне згинання в гомілково-стопному суглобі.
Основою реакції може бути описана вище послідовність:
рефлекс розтягування - зворотний рефлекс розтягування.
Проте реакція може відбуватися внаслідок синхронізова-
них збуджень у мотонейронах і без участі імпульсації з боку
сухожилкового органа Ґольджі. М’язові веретена дослід-
жуваного м’яза гіперактивні, і раптова поява імпульсів, що
поширюються від них, негайно зумовлює збудження в усіх
мотонейронах, які іннервують м’яз. М’язове скорочення,
що виникає внаслідок цього, припиняє імпульсацію вере-
тен. Проте якщо продовжувати розтягування, то в розслаб-
леному м’язі під час повторного розтягування знову вини-
кає збудження веретен.
ПОЛІСИНАПТИЧНІ РЕФЛЕКСИ:
РЕФЛЕКС ВІДСМИКУВАННЯ
Полісинаптичні рефлекторні шляхи утворюють складні
розгалуження (рис. 6-9). Кількість синапсів у кожному з
цих розгалужень змінна. Внаслідок синаптичної затримки,
що виникає в кожному із синапсів, активність по розгалу-
Рис. 6-7. Блок-схема периферійної рухової регулювальної системи. Штрихова лінія відображає безнейронний зворотний зв’я
зок, що обмежує довжину і швидкість за допомогою фізичних властивостей самого м’яза; уа - динамічні у-мотонейрони; у5 -
статичні у-мотонейрони (відтворено за дозволом з Ноок в МебісаІ Рґіузіоіоду, 1Зіїї есі. Моипісазіїе \/В [есіііог]. МозЬу, 1974)
РЕФЛЕКСИ/123
Рис. 6-8. Частота імпульсації мотонейрона, що іннервує лит-
ковий м’яз кота. Крива частоти імпульсації нанесена стосовно
значень довжини м’яза в умовах різного за силою гальмівного
подразнення нерва, що йде від м’яза-антагоніста (відтворено
за дозволом з Неппетап Е еі аі: ЕхсііаЬіІііу апсі іпґііЬііаЬіІИу ої
тоіог пеигопз ої біЯегепі зігез. МеигорґіузіоІ 1965;28:599).
женнях з меншою кількістю синаптичних контактів швид-
ше досягає мотонейронів, ніж активність, що поширюється
довшими шляхами. Тому після поодинокого подразнення
простежується пролонговане бомбардування мотонейронів
і, відповідно, відбуваються пролонговані реакції. Крім того,
як показано на рис. 6-9, окремі розгалужені шляхи повер-
тають назад, замикаючись на собі, і спричинюючи ревер-
берацію активності, аж доки імпульсація стане нездатною
зумовити поширення транссинаптичної реакції і загасне.
Такі ревербераційні кола поширені в головному і спин-
ному мозку.
Рефлекс відсмикування
Рефлекс відсмикування - це типова полісинаптична
реакція, що відбувається у відповідь на небезпечне, пере-
важно больове, подразнення шкіри або підшкірних тканин
і м’язів. Він полягає в скороченні м’яза-згинача і гальму-
ванні скорочення м’язів-розгиначів, унаслідок чого в час-
тині тіла, яку подразнюють, виникає згинання і відсми-
кування кінцівки від подразника. У випадку сильного
подразнення в ділянці кінцівки відповіддю є не тільки зги-
нання і відсмикування цієї кінцівки, а й розгинання іншої
кінцівки. Ця перехресна розгинальна реакція, власне
кажучи, є частиною рефлексу відсмикування. В експери-
ментальних тварин сильні подразники генерують актив-
ність у пулі інтернейронів, звідки імпульсація поширюється
до м’язів усіх чотирьох кінцівок. Це важко продемонстру-
вати на нормальних тваринах, однак таку реакцію легко
відтворити під час експериментів на тваринах, у яких моду-
лювальні впливи імпульсів, що надходять з головного
мозку, усунуті шляхом перетинання спинного мозку (спі-
нальні тварини). Наприклад, якщо ущипнути задню
кінцівку спінального кота, то подразнена кінцівка відсмик-
неться, інша задня кінцівка розігнеться, іпсилатеральна пе-
редня кінцівка теж розігнеться, а контрлатеральна перед-
ня кінцівка зігнеться. Таке поширення збуджувальних
імпульсів догори і донизу в спинному мозку з охопленням
щораз більшої кількості мотонейронів називають іррадіа-
цією подразника, а явище, що полягає у збільшенні кіль-
кості активних рухових одиниць, - поповненням рухових
одиниць.
Значення рефлексу відсмикування
Згинальні реакції можна спровокувати безпечними
подразненнями шкіри або розтягуванням м’яза, проте силь-
ні згинальні реакції, що супроводжуються відсмикуванням,
спричинюють лише небезпечні подразники або такі, що
принаймні потенційно небезпечні для тварин; тому їх на-
звано больовими подразниками. Шеррінґтон зазначав
про життєву важливість рефлексу відсмикування. Згинання
кінцівки, на яку діє подразник, зумовлює відсмикування її
подалі від джерела подразнення, а розгинання іншої кін-
цівки сприяє утриманню рівноваги тіла. Положення в цьо-
му випадку усіх чотирьох кінцівок забезпечує тварині пози-
цію готовності до втечі від подразника. Рефлекси відсми-
кування домінують, тобто мають перевагу перед іншими
рефлексами, що відбуваються у цей момент у спинному
мозку.
У дослідах наукових лабораторій на прикладі рефлексу
відсмикування можна продемонструвати багато власти-
востей полісинаптичних рефлексів. Слабкий ушкоджуваль-
ний подразник однієї стопи спричинює мінімальну зги-
Рис. 6-9. Схема полісинаптичних зв’язків між аферентним та
еферентним нейронами в спинному мозку. Збудження в нер-
вовому волокні заднього корінця активує шлях А, що містить
три інтернейрони, шлях В, що містить чотири інтернейрони, і
шлях С, що містить чотири інтернейрони. Зверніть увагу на
те, що один з інтернейронів шляху С сполучається з нейро-
ном, який контактує з попереднім інтернейроном шляху,
утворюючи реверберувальне коло.
124/РОЗДІЛ 6
наявну реакцію. Сильніші подразники зумовлюють щораз
сильнішу згинальну реакцію у міру іррадіації подразника
до щораз більшої кількості пулу мотонейронів, які іннер-
вують м’язи кінцівки. Сильніші подразники спричинюють
також тривалішу реакцію. Слабкий подразник викликає
один швидкий згинальний рух. Сильний подразник зумов-
лює тривале згинання, а деколи і серію згинальних рухів.
Така тривала реакція спричинюється тривалим, повторним
збудженням мотонейронів. Повторне збудження називають
постпотенціацією, і воно зумовлюється тривалим бомбар-
дуванням мотонейронів імпульсами, що надходять до
мотонейронів складними і кільцевими полісинаптичними
шляхами.
З посиленням небезпечного подразника час реакції
зменшується. В синапсах полісинаптичного шляху вини-
кають явища просторового і часового полегшення. Сильні-
ший подразник зумовлює виникнення більшої кількості
потенціалів дії за секунду в активних розгалуженнях, а
також активує більшу кількість розгалужень; тому сумація
ЗПСП з виникненням критичного рівня деполяризації від-
бувається набагато швидше.
Ознака місця
Характер згинальних рухів під час рефлексу відсмику-
вання в кінцівці змінюється залежно від того, яку частину
ківцівки подразнюють. Наприклад, якщо подразнюють
медіальну поверхню кінцівки, то в складі рухової реакції є
елементи відведення, а якщо латеральну, то згинання від-
бувається разом із відсмикуванням. Рефлекторна відповідь
у кожному з цих випадків слугує, перш за все, для ефек-
тивного усунення кінцівки від подразника. Залежність
чіткої рухової реакції від місця подразнення називають
ознакою місця. Ступінь залежності окремих реакцій від
місця подразнення показано на рис. 6-10.
Фракціювання й оклюзія
Інша особливість рефлексу відсмикування полягає в
тому, що супермаксимальне подразнення будь-якого чут-
ливого нерва, що надходить від кінцівки, ніколи не спри-
чинює такого сильного скорочення м’язів-згиначів, яке
виникає в разі безпосереднього електричного подразнення
самих м’язів. Це означає, що аферентний вплив фракціо-
нує пул мотонейронів.Тобто, наприклад, кожен вплив пере-
ходить лише до частини пулу мотонейронів м’язів-згиначів
певної кінцівки. З іншого боку, якщо всі чутливі нерви
перерізані, і їх подразнюють окремо, один за одним, то
сума напруження, що розвивається внаслідок подразнення
кожного з них, більша, ніж ефект, спричинений безпосе-
реднім електричним подразненням м’яза або подразнен-
ням усіх чутливих нервів одночасно. Це означає, що різні
аферентні впливи розходяться до окремих мотонейронів,
а у випадку одночасного подразнення всіх чутливих нервів
виникає явище оклюзії (див. Розділ 4).
Інші полісинаптичні рефлекси
Крім рефлексу відсмикування, є багато інших поліси-
наптичних рефлексів, що мають однакові властивості. Чис-
ленні полісинаптичні рефлекси, що пов’язані зі специфіч-
ними регулювальними функціями, описані в інших части-
нах книги.
Аферентний
шлях
М’яз-згинач суглоба
колінного
100
гомілково-
стопного
кульшо-
вого
Внутрішній
підшкірний
нерв
Підколінний
нерв
Мало-
гомілковий
нерв
-67
-33
-100
-67
-33
-100
100
-67
-33
87 -100
Рис. 6-10. Важливість ознаки місця подразнення у визначенні
типу реакції відсмикування нижньої кінцівки. У разі подраз-
нення аферентних волокон кожного з трьох зазначених ліво-
руч нервів м’язи-згиначі кульшового, колінного і гомілково-
стопного суглобів скорочуються. Однак відносне напружен-
ня, що виникає в кожному з випадків (заштриховані стовпці),
різне.
100
ГОЛОВНІ ВЛАСТИВОСТІ РЕФЛЕКСІВ
З описаних вище особливостей моносинаптичних і
полісинаптичних рефлексів зрозуміло, що рефлекторне
активність є стереотипною з погляду як подразнення, так
відповіді; конкретний подразник зумовлює конкретну
відповідь.
Адекватний подразник
Подразник, який спричинює рефлекторну реакцію
здебільшого є відповідним, тобто адекватним для кон
кретного рефлексу. Яскравим прикладом може слугуватр
рефлекс почухування у собак. Цей спінальний рефлекс
зумовлений адекватним подразником - множинним!
лінійними дотиками, що виникають, зокрема, під час пов
зання комахи по шкірі. Відповіддю є енергійне почуху
вання подразненої ділянки. (У цьому випадку, точність,
якою кінцівка, що виконує почухування, сягає місщ
подразнення, є гарним прикладом ознаки місця). Якщо я
множинні дотикові подразники на значній відстані аб<
розміщуються не лінійно, то цей подразник не є адекват
ним, і рефлекс почухування не виникає. Блохи повзають
проте вони можуть і перестрибувати з місця на місце. Ц
стрибання зумовлює значне розмежування між дотико
вими подразненнями, внаслідок чого рефлекс почухуванн
не виникає. Сумнівно, чи популяція бліх могла б вижити
якби не була здатна пересуватися стрибками.
Кінцевий спільний шлях
Мотонейрони, що іннервують зовнішньоверетенн
волокна скелетних м’язів, є еферентною частиною бага
тьох рефлекторних дуг. Усі нервові впливи, що зумовлюют
РЕФЛЕКСИ/125
м’язове скорочення, врешті-решт сходяться до них і через
них діють на м’язи. Ось чому мотонейрони назвали кін-
цевим спільним шляхом. До мотонейронів сходиться
велика кількість нервових шляхів, проте на поверхні серед-
нього мотонейрона і його дендритів розміщені приблизно
10 000 синаптичних пухирців. З того ж спинномозкового
сегмента, у якому міститься мотонейрон, до нього надхо-
дять принаймні п’ять впливів. Крім того, є збуджувальні і
гальмівні впливи, що звичайно проходять через інтерней-
рони, а також від інших сегментів спинного мозку та від
головного мозку через низхідні провідні шляхи. Всі ці шля-
хи сходяться на кінцевих спільних шляхах і визначають
їхню активність.
Центральні збуджувальний та
гальмівний стани
Поширення спинним мозком висхідних і низхідних
підпорогових впливів, що виникають унаслідок збуджу-
вального подразнення, описані вище. Безпосередні і преси-
наптичні гальмівні ефекти також значно поширені; вони
переважно швидкоплинні. Проте в спинному мозку трап-
ляються і пролонговані зміни збудливості, ймовірно, внас-
лідок активності ревербераційних циклів або пролонгова-
ної дії синаптичних трансмітерів. Терміни центральний
збуджувальний стан і центральний гальмівний стан
використовують для описання пролонгованих станів, за
яких збуджувальні впливи перевищують гальмівні, і нав-
паки. Коли центральний збуджувальний стан стає поміт-
ним, то збуджувальні імпульси іррадіюють не тільки до
багатьох соматичних ділянок спинного мозку, а й до авто-
номних ділянок. У хронічних параплегічних хворих,
наприклад, слабкий небезпечний подразник може спричи-
нити, крім пролонгованої розгинальної відсмикувальної
реакції в усіх чотирьох кінцівках, сечовипускання, дефе-
кацію, потіння і коливання кров’яного тиску (мас-реф-
лекс).
Звикання і сенсибілізація
рефлекторних реакцій
Факт, що рефлекторні реакції є стереотипними, не
означає, що їх не можна модифікувати досвідом. Прикла-
дом можуть слугувати звикання і сенсибілізація, що розгля-
нуті щодо функціювання синапсів у Розділі 4, і щодо
процесів навчання та пам’яті - у Розділі 16.
Шкірна, глибока та
вісцеральна чутливість
ВСТУП
Рецептори механічних подразнень (дотику і тиску), теп-
лові, холодові та больові рецептори описані у Розділі 5, а
типи нейронів, які передають до ЦНС генеровані в них
імпульси, наведені у табл. 2-1. Клітинні тіла перших афе-
рентних нейронів містяться у гангліях задніх корінців або
в аналогічних гангліях черепних нервів. Вони входять у
спинний мозок або мозковий стовбур і формують поліси-
наптичні рефлекторні зв’язки з мотонейронами на різних
рівнях, а також зв’язки, що передають імпульси до кори
мозку. Усі відчуття, які вони опосередковують, описані в
цьому розділі.
ПРОВІДНІ шляхи
За гістологічними характеристиками задні роги спин-
ного мозку поділяють на пластинки І-УІ; пластинка І є най-
ближче до поверхні, а VI - найглибша. Пластинка II і час-
тина пластинки IV утворюють драглисту речовину -
слабко забарвлену ділянку біля верхівки кожного заднього
рогу. Розрізняють три типи первинних чутливих волокон,
які забезпечують шкірну чутливість: великі мієлінові А|3-
волокна, які передають імпульси, що генеруються у відпо-
відь на механічні подразнення; малі мієлінові Аб-волокна,
з яких частина передає імпульси від холодових рецепторів
і ноцирецепторів, що опосередковують швидкий біль (див.
нижче), а інша частина - імпульси від механорецепторів;
малі безмієлінові волокна С, які пов’язані головно з від-
чуттями болю і температури. Є також незначна кількість
волокон С, які передають імпульси від механорецепторів.
Розподіл цих волокон у задніх канатиках і різні шари зад-
нього рогу показані на рис. 7-1.
Головні прямі провідні шляхи шкірної чутливості до
кори головного мозку зображені на рис. 7-2. Волокна, які
забезпечують відчуття дотику і пропріорецепцію, прохо-
дять через задні канатики до довгастого мозку, де закінчу-
ються синапсами у ніжному та клиноподібному ядрах. Ней-
рони другого порядку від цих ядер перетинають середню
лінію і піднімаються у складі медіальної петлі до заднього
вентрального ядра і пов’язаних з ним специфічних сенсор-
них перемикальних ядер таламуса (див. Розділ 11). Цю
висхідну систему часто називають дорсальним стовпом,
або петельною системою.
Інші тактильні волокна разом із тими, що передають
відчуття температури і болю, закінчуються синапсами на
нейронах дорсального стовпа. Аксони цих нейронів пере-
тинають середню лінію і проходять у передньолатеральному
квадранті спинного мозку, де вони утворюють передньо-
латеральну систему висхідних волокон. Інші волокна ідуть
дорсальнільше. Загалом відчуття дотику пов’язане із
вентральним спіноталамічним трактом, тоді як болю і тем-
ператури - з латеральним, однак жорсткої локалізації
функцій нема. Деякі волокна передньолатеральної системи
закінчуються у специфічних перемикальних ядрах таламуса,
інші проектовані на ядра середньої лінії, а також внут-
рішньопластинчасті неспецифічні проекційні ядра. Є знач-
ний потік імпульсації від передньолатеральної системи до
ретикулярної формації середнього мозку. Отже, сенсорні
імпульси активують ретикулярну активаційну систему, яка,
відповідно, підтримує тонус кори мозку (див. Розділ 11).
Колатералі від волокон, які є в складі задніх канатиків,
проходять через задні роги. Вони можуть змінювати вхідну
інформацію до інших шкірних сенсорних систем, у тім
числі до больової системи. Задній ріг - це так звані воро-
та, у яких імпульси сенсорних нервових волокон пере-
творюються в імпульси висхідних трактів і, ймовірно, що
До дорсальних стовпів
Механорецептори
— Ноціцептори
Рис. 7-1. Схематичне відтворення закінчень трьох типів пер-
винних аферентних нейронів у різних шарах заднього рогу
спинного мозку.
ШКІРНА, ГЛИБОКА ТА ВІСЦЕРАЛЬНА ЧУТЛИВІСТЬ /127
Рис. 7-3. Поперечний зріз спинного мозку. Показана локалі-
зація висхідних чутливих шляхів. Зверніть увагу на пластинки
у складі кожного з них: 8 - крижові; І_ - поперекові; Т - грудні;
С - шийні.
Рис. 7-2. Дотикові, больові та температурні шляхи від тулуба
та кінцівок. Передньолатеральна система (вентральний і ла-
теральний спіноталамічні, а також споріднені висхідні тракти)
також проектується на ретикулярну формацію середнього
мозку та неспецифічні таламічні ядра.
проникність цих воріт залежить від природи і характеру
імпульсів, які досягають губчастої речовини та прилеглих
ділянок. Ці ворота також перебувають під впливом імпуль-
сів, що йдуть по низхідних трактах від головного мозку.
Зв’язок воріт з больовими імпульсами розглянуто нижче.
Аксони спіноталамічних трактів від крижових і попе-
рекових сегментів зміщені латерально аксонами, які пере-
тинають середню лінію на рівнях, що послідовно підви-
щуються. З іншого боку, волокна дорсального стовпа змі-
щені медіально волокнами вищих сегментів (рис. 7-3). З
огляду на це обидві висхідні системи розділені на плас-
тинки з відповідними шийними, грудними, поперековими
і крижовими сегментами, що орієнтовані у медіально- лате-
ральному напрямі в передньолатеральних шляхах, і від кри-
жових до шийних сегментів, орієнтованих у медіально-
латеральному напрямі у дорсальних стовпах. Завдяки тако-
му поділу на пластинки пухлини, що виникають ззовні від
спинного мозку, спочатку перетискають спіноталамічні во-
локна крижових і поперекових ділянок, спричинюючи ран-
ній симптом втрати больової і температурної чутливості у
крижовій ділянці. Пухлини, що виникають усередині спин-
ного мозку, спочатку зумовлюють втрату чутливості у
вищих сегментах.
У мозковому стовбурі до волокон петельної і передньо-
латеральної систем долучаються волокна, що забезпечують
чутливість голови. Перемикання больових та температур-
них імпульсів відбувається у спинномозковому ядрі трій-
частого нерва, а тактильні і пропріорецептивні імпульси
переважно перемикаються через головні чутливі та серед-
ньомозкові ядра цього нерва.
Кіркове представництво
Карти сенсорних зон кори складають за допомогою
експериментів на тваринах і під час нейрохірургічних опе-
рацій у людей. Новітні способи картування кори головного
мозку людини без хірургічних втручань ґрунтуються на
використанні методів позитронної емісійної томографії
(ПЕТ) та ядерно-магніторезонансних (ЯМР) зображень. Ці
методи, описані у Розділі 32, стали основою більшості
досягнень не тільки у сенсорній фізіології, а й у всіх аспек-
тах досліджень нормальних кіркових функцій людини.
Від спеціальних сенсорних ядер таламуса нейрони, що
переносять сенсорну інформацію, утворюють високоспе-
цифічні проекції на дві соматосенсорні ділянки кори:
соматосенсорну ділянку І (81) у зацентральній закрутці і
соматосенсорну ділянку П (811) у Сильвієвій борозні. Окрім
того, 81 проектується на 811; 81 відповідає 1-, 2- та 3-му
полям Бродмана. Бродман був гістологом, який ретельно
розподілив кору мозку на численні поля за особливостями
їхньої гістологічної будови.
Таламічні волокна у ділянці 81 організовані так, що час-
тини тіла представлені впорядковано вздовж зацентральної
закрутки - ноги на її вершині, а голова біля основи закрутки
128 / РОЗДІЛ 7
(рис. 7-4). У зацентральній закрутці лише сфокусована
точна топографія волокон від різних частин тіла, а й роз-
міри ділянки кори, які отримують імпульси від певної час-
тини тіла, пропорційні до кількості рецепторів у цій час-
тині тіла. Відносні розміри кіркових ділянок показані на
рис. 7-5, де пропорції гомункула змінені відповідно до
розмірів цих ділянок кори. Сенсорні ділянки кори, які
сприймають імпульси від тулуба і спиниг порівняно малі,
тоді як ділянки, що сприймають імпульси від руки і частин
рота, пов’язаних з мовою, - дуже великі.
Вивчення сенсорних ділянок засвідчує дискретну при-
роду надзвичайно точної локалізації периферійних ділянок
тіла у корі мозку і дає додаткові докази важливості теорії
специфічності нервової енергії (див. Розділ 5). Стимуляція
різних частин зацентральної закрутки зумовлює відчуття,
які проектуються на відповідні частини тіла. Зазвичай
таким способом можна створити відчуття оніміння поко-
лювання або руху, однак за допомогою достатньо тонких
електродів можна спричинити порівняно чіткі відчуття
дотику, тепла, холоду або болю. Клітини у зацентральній
закрутці організовані у вигляді вертикальних колонок,
подібно до клітин зорової кори (див. Розділ 8). Усі клітини
певної колонки активуються висхідними імпульсами від
певної частини тіла й усі відповідають певній формі чуття.
8П локалізована у верхній частині Сильвієвої борозни,
яка відокремлює скроневу частку від лобової та тім’яної;
голова у нижньому кінці зацентральної закрутки, а ноги -
на дно Сильвієвої борозни. Частини тіла тут представлені
не так повно і детально, як у зацентральній закрутці.
Кіркова пластичність
Сьогодні відомо, що численні нервові зв’язки, описані
вище, не є вродженими і незмінними, і принаймні у сен-
сорних ділянках їх можна порівняно швидко змінити шля-
хом набуття досвіду, який передбачає використання від-
Рис. 7-4. Відповідність полів кори головного мозку соматич-
ній чутливості, а також деякі ділянки кіркового сприйняття для
інших типів чуття мозку людини. Цифрові позначки відпові-
дають нумерації кіркових полів Бродмана. Первинна слухо-
ва ділянка локалізована у Сильвієвій борозні на вершині верх-
ньої скроневої закрутки, і в нормі її не видно.
Рис. 7-5. Чутливий гомункул, що лежить на вінцевому розрізі
через зацентральну закрутку (відтворено за дозволом з Рег-
ТіеІсІ \Л/, Казгпиззеп С: ТЬе СегеЬгаІ Согїех о( Мап. МастіІІап,
1950).
повідної ділянки. Наприклад, якщо у мавпи ампутувати
палець, то кіркове представництво сусідніх пальців поши-
риться на ділянку, яка до цього відповідала ампутованому
пальцю. І навпаки, якщо видалити ділянку кори, яка від-
повідає за той чи інший палець, то соматосенсорна карта
цього пальця пересунеться до прилеглої кори. Широка
довготривала деаферентація кінцівок призводить до ще
більших зрушень соматосенсорного представництва у
корі, коли, наприклад, кіркова ділянка кінцівки відповідає
на дотик до обличчя. Крім того, якщо мавпа тренована
розрізняти найдетальніші відмінності між різними вібра-
ційними відчуттями на одному пальці однієї руки, то кір-
кове представництво цього пальця розширюється. Такі
пластичні процеси відбуваються як упродовж розвитку,
так і у дорослих. Наприклад, рецепторні поля окремих
нейронів частини поля 3 сенсорної кори для пальців у
нормі розташовані на одному пальці (рис. 7-6, ліворуч).
Однак якщо дорослу мавпу постійно піддавати дії сти-
мулів, які подразнюють лише дистальні частини першого,
другого і третього пальців, то рецепторні поля окремих
нейронів поширяться на дистальні частини усіх трьох
пальців (див. рис. 7-6). Пояснення цих зрушень, очевидно,
полягає у тому, що кіркові зв’язки сенсорних одиниць кори
мають велику здатність до конвергенції і дивергенції зі
зв’язками, які можуть ставати слабкими від невикорис-
тання і сильними від використання. У щурів цей процес
пов’язаний з базальною частиною кінцевого мозку:
імпульси з цієї ділянки кори збільшуються у разі вико-
ристання слухових подразників. Розміри слухової сен-
сорної ділянки стають більшими, ніж тоді, коли подраз-
ШКІРНА, ГЛИБОКАТАВІСЦЕРАЛЬНА ЧУТЛИВІСТЬ /129
нення поєднують з низьким рівнем імпульсів із базальної
частини головного мозку.
Пластичність цього типу простежується в разі надход-
ження вхідних імпульсів не лише від шкірних рецепторів,
а також від інших сенсорних систем. Наприклад, у котів із
невеликими ушкодженнями сітківки кіркова ділянка сліпої
плями починала відповідати на світлове подразнення інших
ділянок сітківки. Розвиток проекцій сітківки дорослого на
зорову кору є іншим прикладом цієї пластичності. В екстре-
мальних випадках експериментальне скерування зорової
інформації у слухову кору під час розвитку створювало
зорові рецепторні поля у слуховій системі.
У людей також відбуваються пластичні зміни, подібні
до тих, іцо описані вище в експериментальних тварин.
Наприклад, у деяких інвалідів із ампутованою рукою дотик
до обличчя зумовлює відчуття, що проектуються на руку,
якої нема. ПЕТ дала змогу також виявити пластичні зміни
однієї форми чутливості на іншу. Наприклад, тактильні та
слухові стимули збільшують метаболічну активність
зорової кори у сліпих осіб. Навпаки, глухі швидше і
точніше реагують на рухові стимули в ділянці перифе-
рійного зору порівняно з нормальними людьми. Плас-
тичність характерна також для рухової кори (див. Розділ
12). Наведені приклади свідчать про гнучкість мозку і його
здатність до адаптації.
Ефекти ушкоджень мозкової кори
Видалення соматичної сенсорної ділянки І у тварин
зумовлює недостатність у відчутті пози та змозі розріз-
няти розмір і форму, а соматичної сенсорної ділянки II -
порушує здатність до навчання розрізняти дотики. Вида-
лення 81 призводить до дефіциту опрацювання сенсорної
інформації у 8II, тоді як видалення 811 незначно впливає
на процес опрацювання інформації у 81. Очевидно, ділянки
81 і 811 опрацьовують сенсорну інформацію швидше послі-
Поверхня,
охоплена
тренуванням
Рецепторне поле
після завершення
тренування
Нормальне
рецепторне
поле
Рис. 7-6. Роль вхідних імпульсів в утворенні рецепторних
полів кіркових нейронів. Ліворуч: нормальне рецепторне
поле одного нейрона кори головного мозку на бічній поверхні
середнього пальця мавпи. Посередині: тренування мавпи
до виконання завдань, що потребують подразнення дисталь-
них частин першого, другого та третього пальців. Праворуч:
змінене внаслідок тренувань рецепторне поле кіркового ней-
рона (за \Л/апд еі аі, модифіковано з 8иг М: Марз ої іігпе апсі
зрасе. ІМаіиге 1995;378:13).
довно, аніж паралельно. Ділянка 81 також проектується на
задню тім’яну кору (див. рис. 7-4), і ушкодження цієї асоціа-
тивної ділянки спричинює комплекс відхилень у просто-
ровій орієнтації протилежної частини тіла (див. Розділ 16)
Зазначимо, що і в експериментальних тварин, і у людей
пошкодження кори не означає, що зникнуть тілесні від-
чуття. Найлегше уражаються внаслідок кіркових ушкод-
жень пропріорецепція і відчуття дотику. Менш вразливими
є відчуття температури і лише злегка уражається больове
відчуття. Отже, сприйняття можливе й тоді, якщо кори
нема. Під час одужання, відчуття болю повертається пер-
шим, за ним відновлюється температурне відчуття, і, на-
решті, пропріорецепція і легкий дотик.
Принципи сенсорної фізіології
Найважливіші загальні принципи, що стосуються фізіо-
логії сенсорних систем, детально описані у Розділі 5. Кож-
ний орган чуття спеціалізований на перетворенні окремого
виду енергії у потенціал дії сенсорних нервів. Кожна форма
чуття має окремий шлях до мозку, а отримане відчуття,
так само, як і частина тіла, у якій воно локалізоване, виз-
начене окремою ділянкою активованого мозку.
Відмінності в інтенсивності того чи іншого відчуття
передаються двома способами: зміною частоти потенціалів
дії сенсорних нервів і зміною кількості активованих
рецепторів. Збільшення інтенсивності подразнення органа
чуття на якість відчуття впливає дуже слабко або не впливає
зовсім.
Іншим принципом, який стосується органів чуття шкір-
ної локалізації, є принцип точкового представництва. Якщо
виконати детальне, міліметр за міліметром, картування
шкіри за допомогою тонкого волоска, то можна з’ясувати,
що відчуття дотику відходить з точок, які лежать над так-
тильними рецепторами. Його не можна викликати з діля-
нок, що лежать між цими точками. Подібно цього, відчу гтя
болю і температури спричинені подразненням шкіри лише
над тими точками, де розташовані відповідні рецепторні
структури для цього подразника.
ДОТИК
Як зазначено у Розділі 5, тиск - це тривалий дотик.
Дотик наявний у ділянках, які не мають спеціалізованих
рецепторів; у тих ділянках де вони є тільця Мейснера і
Пачіні відіграють роль дотикових рецепторів, які швидко
адаптуються, а диски Меркеля і закінчення Руффіні - доти-
кових рецепторів, що адаптуються повільно. Дотикові
рецептори найчисленніші у шкірі пальців і губ, їх порівняно
мало у шкірі тулуба. Окрім того, багато рецепторів розмі-
щено навколо волосяних фолікулів. Коли волосина руха-
ється, вона діє як важіль з точкою опори на кінці фолікула,
тому легкі рухи волосин переї ворюються у порівняно силь-
ні стимули для нервових закінчень навколо фолікулів.
Жорсткі вібриси на мордах деяких тварин є прикладом
високоспеціалізованих волосин, які діють як важелі для
посилення тактильних подразників. Тільця Пачіні містять-
ся у підшкірній тканині, м’язах, суглобах та шкірі. їх також
багато у брижі тонкої кишки, однак їхня функція там не
відома.
10 367-2
130/РОЗДІЛ 7
Чутливі волокна А[3, які передають імпульси від рецеп-
торів дотику до центральної нервової системи, мають діа-
метр 5-12 мкм і швидкість передавання 30-70 м/с. Деякі
дотикові імпульси також проходять по С-волокнах.
Тактильна інформація передається як по петельному,
так і по передньолатеральному шляхах, тому лише дуже
великі ураження повністю усувають дотикові відчуття.
Однак є відмінності у типі дотикової інформації, яка пере-
дається по цих двох системах. Коли зруйновані задні кана-
тики, то вібраційне відчуття і пропріорецепція ослаблені,
поріг дотикового відчуття підвищений, а кількість чут-
ливих зон дотику у шкірі зменшена. Окрім того, здатність
до локалізації дотиків ослаблена. Зростання порога від-
чуття дотиків і зменшення кількості дотикових точок у
шкірі також простежується після переривання спінотала-
мічних трактів. У цьому випадку недостатність дотикового
відчуття незначна, а локалізація дотикових зон є нормаль-
ною. Інформація, передавання якої проводиться по системі,
пов’язана з детальною локалізацією, просторовою формою
і часовою моделлю дотикових подразнень. З іншого боку,
інформація, передавання якої відбувається по спінотала-
мічних трактах, пов’язана із великими дотиковими відчут-
тями грубої локалізації.
ПРОПРІОРЕЦЕПЦІЯ
Передавання пропріорецептивної інформації відбува-
ється вгору по дорсальних стовпах спинного мозку. Велика
кількість вхідної пропріорецептивної інформації потрапляє
до мозочка, а частина проходить через медіальні петлі і
таламічні проекції до кори. Захворювання задніх стовпів
спричинюють атаксію внаслідок порушеного передавання
пропріорецептивних імпульсів до мозочка.
Є докази того, що пропріорецептивна інформація пере-
ходить у свідомість по передньолатеральних стовпах спин-
ного мозку. Усвідомлення позиції різних частин тіла у
просторі залежить частково від імпульсів, які надходять
від органів чуття, що містяться в суглобах та навколо них.
До таких органів належать закінчення дифузного типу із
повільною адаптацією, структура яких нагадує сухожильні
органи Ґольджі, і, можливо, тільця Пачіні синовіальних
оболонок і зв’язок. Імпульси від цих органів, дотикових
рецепторів шкіри та інших тканин, а також м’язових
веретен, синтезуються у корі мозку в усвідомлення поло-
ження тіла у просторі.
Мікроелектродні дослідження засвідчують, що багато
нейронів сенсорної кори реагують на специфічні рухи, а
не лише на дотик чи статичну позицію. У цьому розумінні
сенсорна кора за організацією нагадує зорову кору (див.
Розділ 8).
ТЕМПЕРАТУРНА ЧУТЛИВІСТЬ
Відомо два типи температурних рецепторів: ті, що мак-
симально реагують на температуру, трохи вищу від тем-
ператури тіла, і ті, які максимально реагують на темпе-
ратуру, трохи нижчу від температури тіла. Перші називають
тепловими рецепторами, другі - холодовими. Однак аде-
кватними подразниками обох типів рецепторів є два різні
теплові рівні, оскільки холод не є формою енергії.
Експерименти із картуванням свідчать, що є окремі
холодо- і теплочутливі точки на шкірі. Холодових точок у
чотири-десять разів більше, аніж теплових. Температурні
рецептори - це вільні нервові закінчення, які реагують на
абсолютну температуру, а не на перепад температур через
шкіру. Холодові рецептори реагують на температуру від
10 до 38°С, а теплові - від ЗО до 45°С. Холодовими
аферентними волокнами є волокна Аб і С, тоді як тепло-
вими аферентами - волокна С (див. табл. 2-1). Ці аферентні
волокна передають інформацію у зацентральну закрутку
через латеральний спіноталамічний тракт і таламічну про-
менистість.
Оскільки органи температурної чутливості локалізовані
субепітеліально, то їхнє подразнення визначене темпера-
турою підшкірних тканин. Холодні металеві об’єкти
сприймаються як холодніші порівняно з дерев’яними
об’єктами такої самої температури, тому що метал від-
водить тепло від шкіри швидше і підшкірна тканина
охолоджується більше. Адаптації нема при температурі
шкіри до 20°С і понад 40°С, проте між 20 і 40°С адаптація
є, так що відчуття, спричинене зміною температури,
поступово загасає. Понад 45°С починається пошкодження
тканин, температурне відчуття перетворюється на больове.
Відчуття тепла в межах 43-50°С, ймовірно, передається
капсаїциновими рецепторами (див. нижче).
БОЛЬОВА ЧУТЛИВІСТЬ
Рецептори і провідні шляхи
Больові рецептори є вільними нервовими закінченнями,
які містяться майже у всіх тканинах тіла. Больові імпульси
передаються до ЦНС двома системами волокон. Одна
ноцицепторна система складається з тонких мієлінових
волокон Аб, що мають діаметр 2-5 мкм і передають
імпульси зі швидкістю 12-30 м/с. Інша система складається
із безмієлінових волокон С діаметром 0,4-1,2 мкм. Ці
волокна містяться у латеральних ділянках задніх корінців,
їх часто називають волокнами С задніх корінців; вони про-
водять імпульси з низькою швидкістю 0,5-2 м/с. Обидві
групи волокон закінчуються у задніх рогах: волокна Аб -
переважно на нейронах пластинок І та V, тоді як волокна
С задніх корінців - на нейронах пластинок І та II. Є докази
такого: синаптичним трансмітером, що його виділяють
первинні аферентні волокна, які забезпечують відчуття
швидкого болю середньої сили (див. нижче), є глутамат, а
трансмітером, який передає повільний сильний біль, -
речовина Р.
Синапси між периферійними ноцицепторними волок-
нами і клітинами заднього рогу у спинному мозку є місцями
значної пластичності. З огляду на це задній ріг називають
воротами, де больові імпульси можуть бути модифіковані.
Наприклад, стимулювання аферентних волокон великого
діаметра, які йдуть від ділянки, де був спричинений біль,
зменшує його. Колатеральні гілки дотикових волокон дор-
сальних стовпів проходять у драглисту речовину; було зроб-
лено припущення, що імпульси з цих колатералей, або
інтернейронів, на яких вони закінчуються, гальмують
ШКІРНА, ГЛИБОКА ТА ВІСЦЕРАЛЬНА ЧУТЛИВІСТЬ /131
передавання від больових волокон задніх корінців до спіно-
таламічних нейронів: Механізм цього процесу може охоп-
лювати пресинаптичне гальмування (див. Розділ 4) на
закінченнях первинних аферентних нейронів, що переда-
ють больові імпульси.
Деякі аксони нейронів задніх рогів закінчуються у спин-
ному мозку і мозковому стовбурі. Інші проходять у перед-
ньолатеральну систему, у тім числі в бічний спінотала-
мічний шлях. Деякі піднімаються у задньолатеральній
частині спинного мозку. Частина висхідних волокон проек-
тована на задні вентральні ядра, які є специфічними чут-
ливими перемикальними ядрами таламуса, і звідти надхо-
дить у кору мозку. Дослідження нормальних людей з
використанням зображень ПЕТ та функційного ЯМР дали
змогу виявити, що біль активує кортикальні зони 81, 811, а
також поясну закрутку протилежного до подразнення боку.
Окрім того, активними стають присередня лобова закрут-
ка, острівцева частка кори, а також мозочок.
Шеррінґтон назвав біль “фізичним додатком до імпера-
тивного захисного рефлексу”. Реакцією на больове подраз-
нення звичайно є швидке відсмикування з наступним уни-
канням. Крім того, біль унікальний серед відчуттів, оскіль-
ки він зумовлює неприємне навантаження. В експери-
ментах, розроблених з метою відокремити передчуття
болю від болю як такого, передчуття болю активувало
присередню лобову закрутку, острівцеву частку кори та
мозочок, зумовлюючи активування ділянок лобової кори
швидше, ніж тих ділянок, що були активовані власне болем.
Багато волокон, що їх активує біль, закінчуються у рети-
кулярній системі, яка проектується на ядра середньої лінії
та неспецифічні проекційні внутрішньопластинчасті ядра
таламуса, а звідти - до різноманітних ділянок кори мозку.
Інші волокна проектуються на гіпоталамус, а деякі закін-
чуються у навколоводопровідній сірій речовині, яка відома
як больова ділянка (див. нижче).
Швидкий та повільний біль
Наявністю двох провідних шляхів для болю - одного
повільного, а іншого швидкого - пояснюють фізіологічні
спостереження двох типів болю. Больовий подразник
зумовлює чітке, різке локальне відчуття, яке змінюється
тупим, інтенсивним, дифузним і неприємним. Ці два типи
відчуттів мають різні назви - швидкий і повільний, або
перший і другий біль. Чим далі від мозку завдано больове
подразнення, тим більша різниця часу між цими двома
компонентами. Це та інші спостереження доводять, що
швидкий біль забезпечений активністю волокон болю Аб,
тоді як повільний - активністю волокон С.
Адекватний подразник
Больові рецептори є специфічними, біль не виникає у
разі надмірного стимулювання інших рецепторів. З іншого
боку, адекватні подразники для рецепторів болю не такі
специфічні, як для інших видів чуття, тому їх можна стиму-
лювати різними сильними подразниками. Наприклад,
больові рецептори реагують на високу температуру, проте
підраховано, що поріг теплового подразнення для них у
100 разів вищий, ніж для температурних рецепторів. Больо-
ві рецептори реагують також на електричну, механічну і,
особливо, хімічну енергію.
Учені припустили, що опосередковування болю відбу-
вається хімічно і що незалежно від енергії, подразники,
які його спричинюють, здатні вивільняти хімічний чинник,
що подразнює нервові закінчення. Таким хімічним чин-
ником може бути АТФ, який за посередництва рецепторів
Р2Х відкриває керовані лігандами канали на сенсорних
нейронах (див. Розділ 4). Крім того, АТФ наявний у цито-
плазматичних екстрактах, які спричинюють біль, а також
зумовлює біль у разі внутрішньошкірного введення. Інший
можливий чинник - поки що не ідентифікований ендоген-
ний ліґанд капсаїцинового рецептора. Капсаїцин - це
речовина, яка зумовлює пекучий біль у випадку вживання
в їжу червоного гіркого перцю (гострого чілі). Капсаїци-
новий рецептор, який є неселективним йонним каналом,
забезпечує проникнення Ка+ та Са2’ всередину активова-
них ноцирецепторних нейронів, що спричинює їхню депо-
ляризацію. Цей рецептор, інша назва якого завдяки близь-
кій спорідненості капсаїцину і ванілі - ванілоїдний, також
активований теплом (див. вище) і може відігравати роль
температурного рецептора. Окрім того, його активують
протони. У мишей з блокованими капсаїциновими рецеп-
торами послаблена реакція на теплове стимулювання та
дію хімічних подразників, однак збережена нормальна від-
повідь на механічні подразнення.
Підкіркове сприйняття та афект
Є переконливі докази того, що сприйняття чутливих
подразнень відбувається навіть тоді, коли нема кори
головного мозку, особливо це стосується больових подраз-
нень. Кіркові сприймальні ділянки, очевидно, пов’язані із
розрізненням, уточненням та інтерпретацією болю і деяких
його емоційних компонентів, однак саме сприйняття болю
не потребує наявності кори.
Посттравматичний та нейропатичний біль
Загоювання рани супроводжується посттравматичним
болем. У цьому випадку подразнення травмованої ділянки,
які у нормальних умовах спричинили б лише незначний
біль, зумовлюють патологічну больову реакцію (гіпер-
алгезія), біль спричинюють також звичайні небольові
подразники, наприклад, дотик (алодинія). Якщо нерви, що
забезпечують іннервацію травмованої ділянки, пошкод-
жені, то біль може бути постійним і перетворитися на
нестерпний навіть після загоювання рани (нейропатичний
біль). Нейропатичний біль можна змоделювати в експери-
менті шляхом ушкодження нервів. Клінічно для нього
характерна нечутливість до анальгетиків і він може бути
надзвичайно стійким до лікування.
Посттравматичний та нейропатичний біль супроводжу-
ється посиленням чутливості периферійних больових
рецепторів унаслідок місцевого виділення речовин сен-
сибілізації. Підвищується також інтенсивність синаптич-
ного передавання сигналів між нейронами першого та дру-
гого порядку у задніх рогах спинного мозку. До появи цього
болю може спричинитися багато різних механізмів. Один
із них полягає у посиленні активності пресинаптичних
рецепторів КМБА первинних аферентних закінчень з
одночасним збільшенням продукування речовини Р. Інший
механізм пов’язаний із перемиканням генів, унаслідок чого
субпопуляція волокон АР, що надходять від механорецеп-
132/РОЗДІЛ 7
торів, починає продукувати речовину Р. Окрім того, з’ясо-
вано, що нейропатичний біль зменшується або цілком зни-
кає у мишей, які не мають 5-форми протеїнази С, у мишей
без простациклінових рецепторів, а також у щурів зі змен-
шеною кількістю рецепторів речовини Р на нейронах плас-
тини І. Конкретну роль кожного з означених механізмів
уточнюють, однак спільними для усіх означених спосте-
режень є посилене виділення речовини Р первинними
аферентами та продукування речовини Р конвергентними
нервовими волокнами, які у нормі сприймають лише дотик
і тиск.
Глибокий біль
Головна відмінність між поверхневою та глибокою
чутливістю зумовлена різною природою болю, спричине-
ного небезпечними подразниками. На відміну від поверх-
невого болю, глибокий біль погано локалізований, спричи-
нює нудоту, часто його супроводжують пітливість та зміни
артеріального тиску. Його можна змоделювати в експери-
менті шляхом ін’єкції гіпертонічного сольового розчину в
окістя або зв’язки. Такий змодельований біль спричинює
рефлекторне скорочення прилеглих скелетних м’язів, яке
подібне до спазму м’язів, що супроводжує ушкодження
кісток, сухожиль та суглобів. Постійно скорочені м’язи
ішемізуються, що стимулює їхні больові рецептори (див.
нижче). Біль, відповідно, спричинює ще більше спазму-
вання, й утворюється замкнуте коло.
М’язовий біль
Під час ритмічного скорочення м’язів за умов відповід-
ного кровопостачання біль, як звичайно, не виникає. У разі
порушення кровообігу м’язові скорочення швидко спричи-
нюють біль, який не зникає і після завершення скорочення
аж до повного відновлення нормального кровообігу.
Ці спостереження важко тлумачити без використання
концепції, яка пояснює біль місцевим нагромадженням у
м’язах певного хімічного чинника (Р-фактор за Левісом).
У разі відновлення кровообігу цю речовину вимиває кров,
або ж вона метаболізує. Ідентичність означеного чинника
та речовини Р не доведена, ним можуть бути також йони
К+.
Клінічний розвиток загрудинного болю в разі ішемізації
серцевого м’яза внаслідок фізичного навантаження (так
звана грудна жаба) є класичним прикладом нагромадження
у м’язі Р-фактора. Симптоми загрудинного болю зменшу-
ються після відпочинку, бо тоді зменшується потреба міо-
карда у кисні, і кров видаляє Р-фактор. Переміжна куль-
гавість пов’язана з виникненням болю у нижніх кінцівках
в осіб з хворобами закупорення судин. Її характерною
рисою є біль під час ходьби і припинення болю після від-
починку.
Вісцеральний біль
Біль з внутрішніх органів погано локалізований, непри-
ємний, зумовлює нудоту і вегетативну симптоматику. Часто
він іррадіює або пов’язаний з іншими частинами тіла.
Автономна нервова система, подібно до соматичної,
складається з аферентних компонентів, інтегративних
центрів та ефекторних шляхів. Рецептори болю та інших
форм чуття з внутрішніх органів подібні до відповідних
рецепторів шкіри, проте характер їхнього розподілу сут-
тєво відрізняється. У внутрішніх органах нема пропріоре-
цепторів, міститься незначна кількість рецепторів темпе-
ратурної та дотикової чутливості. Больові рецептори наяв-
ні, однак розкидані вони рідше, ніж у соматичних струк-
турах.
Аферентні волокна від вісцеральних структур досяга-
ють ЦНС по симпатичних або парасимпатичних провідних
шляхах. Тіла цих нейронів містяться у спинномозкових та
гомологічних гангліях черепних нервів. Зокрема, вісце-
ральні аференти є у складі лицевого, язикоглоткового та
блукаючого нервів; у складі задніх корінців грудних та
верхніх поперекових, а також крижових нервів (рис. 7-7).
Вісцеральні аференти від очних яблук належать до трійчас-
того нерва. Принаймні деякі аферентні волокна, що містять
речовину Р, через колатералі утворюють зв’язки з пост-
гангліонарними симпатичними нейронами у колатераль-
них симпатичних вузлах, таких як нижній брижовий
ганглій. Ці зв’язки можуть відігравати відповідну роль у
рефлекторному, незалежному від ЦНС, контролі за робо-
тою внутрішніх органів.
У ЦНС вісцеральна чутливість проходить по тих самих
шляхах, що й соматична, а саме: по спіноталамічних
трактах і таламічних проекціях; кіркові сприймальні ділян-
ки вісцеральної чутливості чергуються з соматичними.
Подразнення больових волокон
З огляду на порівняно малу кількість больових рецеп-
торів у внутрішніх органах вісцеральний біль погано лока-
лізований. Очевидно, кожен з власного досвіду знає, що*
вісцеральний біль може бути дуже сильним. Рецептори в
стінках порожнистих внутрішніх органів особливо чутливі
до розгягу. Такий розтяг можна змоделювати в експери-
менті шляхом надування заковтнутого балончика, сполу-
ченого трубкою із зовнішнім середовищем. Надування
балончика супроводжується приступами болю, що періо-
дично послаблюється (так званими кишковими кольками),
відповідно до скорочення та розслаблення кишки навколо
балончика. Подібні кольки виникають у разі кишкової
непрохідності внаслідок скорочень розширеної кишки над
місцем закупорення. Якщо внутрішні органи у стані запа-
лення або гіперемії, то навіть порівняно слабкий подразник
може спричинити сильний біль. Це, ймовірно, є однією з
форм первинної гіпералгезії (див. вище). Натяг брижі
також спричинює біль, проте його значення у виникненні
вісцерального болю не з’ясоване. Вісцеральний біль особ-
ливо неприємний тому, що багато аферентів від внутрішніх
органів, збуджених тим самим процесом, що й біль, утво-
рюють рефлекторні зв’язки, які спричинюють нудоту, блю-
вання та інші вегетативні рефлекси.
Спазм та заціпеніння м’язів
Вісцеральний біль, подібно до глибокого соматичного,
зумовлює рефлекторне скорочення прилеглих скелетних
м’язів. Цей спазм звичайно захоплює черевну стінку, від
чого вона ціпеніє. Особливо характерне це заціпеніння в
разі охоплення запальним процесом очеревини, хоча може
простежуватися і без цього. Анатомічні деталі рефлектор-
них шляхів, які є в основі спазмогенного впливу уражених
внутрішніх органів на скелетні м’язи, не з’ясовані. Рефлек-
ШКІРНА, ГЛИБОКА ТА ВІСЦЕРАЛЬНА ЧУТЛИВІСТЬ /133
Язикоглотковий нерв
Блукаючий нерв
ГРУДНА
БОКОВА ЛІНІЯ
Вісцеральні
нерви
(Т7-9)
Верхній гортанний нерв
Трикутник
сечового міхура
Передміхурова
залоза
Сечівник
(тазові нерви, 82-4)
----Парасимпатичні
гілки (82-4) Яєчко
Плечове —ТІЙ?
сплетення
(Міжреберні—
нерви)
Вісцеральні
нерви (Т7-9)
Вісцеральні нерви
дванадцятипалої і
порожньої кишки
Вісцеральні
нерви тонкої
кишки (Т9—11)
ТАЗОВА______
БОКОВА ЛІНІЯ
Клубова
кишка
Верхня грудна гілка блукаючого нерва
Л\ьна
І
ц о??
Нижні
вісцеральні
нерви
(Т10-П)
Периферійна
Сечовід частина діафрагми
Центральна
частина діафрагми
(Т11-И) (діафрагмальний нерв)(м'жРе6еРн' неРви)
Соматичні нерви (Т11-И) Дн,° матки (Т11-П)
%
(крижові нерви, 82-4)
(статево-стегнові нерви, И -2)
(сперматичне сплетення, ТЮ)
Шийка матки та
верхня частина піхви
(32—4)
Рис. 7-7. Больова іннервація внутрішніх органів. Висхідні імпульси від структур, що розміщені над лінією грудного болю та під
лінією тазового болю, перетинають парасимпатичні шляхи (за \Л/Ьііе ,ІС. Відтворено за дозволом з Росії ТС: РЬізіоІоду апсі
Віоріїузісз, 19Ф еФ Росії ТС, Райоп НО [ебіїогз]. Заипсіегз, 1965).
торний спазм м’язів черевної стінки захищає запалені
структури черевної порожнини від випадкової травми,
тому його називають захисним.
Класичними ознаками запалення органів черевної по-
рожнини є біль, підвищена уразливість, вегетативні зміни,
такі як гіпотензія та пітливість, а також спазм черевної
стінки. Походження усіх цих симптомів зрозуміле. Ураз-
ливість зумовлена посиленням чутливості больових рецеп-
торів внутрішніх органів, вегетативні зміни спричинені
активуванням вісцеральних рефлексів, спазм виникає внас-
лідок рефлекторного скорочення м’язів черевної стінки.
Іррадійований біль
Подразнення внутрішніх органів часто спричинює
больові відчуття не з вісцеральних органів, а з соматичних
структур, які можуть бути на значній відстані. Такий біль
називають іррадійованим до соматичної структури. Гли-
бокий соматичний біль також може бути іррадійованим,
але не поверхневим. Якщо вісцеральний біль є одночасно
локальним та іррадійованим, то він дає відчуття розлитого
болю (іррадіація), що охоплює як місце ураження, так і
віддалені ділянки.
Очевидно, знання феномена іррадійованого болю, як і
ділянок, які найчастіше дають больову симптоматику в
разі ураження тих або інших внутрішніх органів, дуже
важливе для лікаря. Мабуть, найліпше відома іррадіація
серцевого болю по внутрішній поверхні верхньої лівої кін-
цівки. Іншим прикладом може бути біль верхньої частини
плеча в разі подразнення центральної частини діафрагми
та біль у яєчку, зумовлений розтягненням сечівника.
Подібні випадки широко трапляються в практиці тера-
певта, хірурга та стоматолога. Як звичайно, локалізація
іррадійованого болю не є стереотипною, і незвичайні точ-
ки іррадіації бувають доволі часто. Наприклад, серцевий
біль може іррадіювати до черевної порожнини, правої
руки і навіть шиї. Іррадійований біль можна змоделювати
в експерименті шляхом подразнення відсіченого кінця
вісцерального нерва.
134/РОЗДІЛ 7
Правило дерматомів
Іррадійований біль, як звичайно, поширюється до струк-
тури, яка розвивається з того ж ембріонального сегмента
(дерматома), що й орган, який слугує джерелом болю. Цей
принцип називають правилом дерматома. Наприклад, у
процесі ембріонального розвитку діафрагма мігрує з
шийної ділянки до межі між грудною та черевною порож-
нинами, тягнучи за собою діафрагмальний нерв. Третина
волокон діафрагмального нерва аферентна, вони входять
у спинний мозок у проміжку від другого до четвертого
шийних сегментів; туди ж входять аференти плеча. Так
само серце і верхня кінцівка розвиваються зі спільного
ембріонального сегмента, а яєчко разом із нервом мігрує з
первинного сечостатевого гребеня, з якого походять також
нирка та сечівник.
Роль досвіду
Досвід також має деяке значення для локалізації ірра-
дійованого болю. Хоча біль від запалених внутрішніх орга-
нів звичайно віддає до серединної лінії, проте пацієнти
після хірургічного втручання у черевній порожнині часто
приписують вісцеральний біль післяопераційним рубцям.
Біль, що походить з верхньощелепної пазухи, звичайно
вважають таким, що походить від прилеглих зубів, однак
пацієнти, які раніше зазнали травматичного стоматологіч-
ного втручання, цей біль звичайно приписують травмова-
ним зубам, навіть якщо вони є далеко від ураженої пазухи.
Роль конверґенції
Точка іррадіації болю від вісцеральних або соматичних
структур може залежати не лише від спільного рівня вход-
ження нервових волокон у спинний мозок, а й від того, що
чутливих нервових закінчень периферійних нервів більше,
аніж волокон у спіноталамічних трактах. Тому, очевидно,
є значна конвергенція периферійних чутливих нервових
волокон на рівні спіноталамічних нейронів. На цій концеп-
ції ґрунтується одна з теорій походження іррадійованого
болю. Згідно з цією теорією, соматичні та вісцеральні афе-
ренти сходяться до тих самих спіноталамічних нейронів
(рис. 7-8). Оскільки соматичний біль виникає частіше, аніж
вісцеральний, то мозок “навчений”, що активність того або
іншого больового шляху зумовлена подразенням конкрет-
ної соматичної ділянки. Якщо цим же шляхом до мозку
надходять сигнали від вісцеральних аферентів, то біль про-
ектується на відповідну соматичну ділянку.
Ефекти полегшення
Полегшення також може відігравати деяку роль у поход-
женні іррадійованого болю. Колатеральні зв’язки вісце-
ральних аферентів з нейронами заднього рогу спинного
мозку, які сприймають больові імпульси від соматичних
структур, можуть забезпечувати шляхи, по яких посилена
активність вісцеральних аферентів продукуватиме ЗПСП
і, таким способом, підвищуватиме збудливість нейронів.
Тоді мінімальна активність соматичних аферентів може
спричиняти постійний біль.
Якщо б конвергенція була єдиним поясненням іррадійо-
ваного болю, то місцева анестезія соматичних ділянок
іррадіації на біль не впливала б, тоді як у разі ефекту полег-
шення під дією анестезії біль повинен би припинитися.
Насправді наслідки місцевої анестезії ділянок іррадіації
відрізняються: на важкий біль анестезія, як звичайно, не
впливає, тоді як помірний біль під її впливом може цілко-
вито припинитися. Отже, правдоподібно, обидва механізми
- як конвергенція, так і ефект полегшення - відіграють
свою роль у патогенезі вісцерального болю.
Центральне гальмування та
відволікальні засоби
Добре відомо, що солдати, поранені у розпалі битви,
можуть не відчувати болю аж до її завершення (стресова
анальгезія). Багато хто з власного досвіду знає, що дотор-
кування або струшування місця поранення зменшує біль
від нього. Стимулювання електровібратором больової точ-
ки також дає певне полегшення. Акупунктуру використо-
вували протягом 4 000 років для знеболення або полег-
шення болю, проте в окремих випадках цей метод як єди-
ний засіб анестезії дає змогу робити навіть великі операції.
Ці та інші спостереження свідчать, що передавання і сприй-
няття болю можуть гальмуватися, як і полегшуватися, у
ЦНС.
Гальмуванням центральних чутливих шляхів можна
пояснити ефективність відволікальних засобів. Стимулю-
вання шкіри над ділянкою запалення зумовлює полегшення
болю від уражених внутрішніх органів. На цьому принципі
ґрунтується ефективність стародавніх гірчичників.
Дія морфіну та енкефалінів
Морфін зменшує біль. Він особливо ефективний у разі
введення в пряму кишку. Рецептори, які зв’язують морфін,
а також “внутрішні морфіни організму” - опіоїдні пептиди
- розглянуті у Розділі 4.
структури
ТЕОРІЯ
КОНВЕРГЕНЦІЇ
Внутрішні
органи
|||!1і!|
ТЕОРІЯ
полегшення
Рис. 7-8. Ілюстрації до теорій конверґенції та полегшення у
механізмі виникнення іррадійованого болю.
ШКІРНА, ГЛИБОКА ТА ВІСЦЕРАЛЬНА ЧУТЛИВІСТЬ /135
Є принаймні три точки в організмі, діючи на які, опіоїди
можуть спричинити анальгезію: периферійно - у місці
поранення; у ділянці “воріт” задніх рогів, де ноцицептор-
ні волокна утворюють синапси з клітинами спинномоз-
кових гангліїв; у ділянках мозкового стовбура, ближчих до
головного мозку. Опіоїдні рецептори утворені клітинами
спинномозкових гангліїв і мігрують по їхніх відростках як
до центра, так і на периферію.
На периферії запалення спричинює продукування клі-
тинами імунної системи опіоїдних пептидів, які, вірогідно,
діють на відповідні рецептори аферентних нервових
волокон, зменшуючи біль. У ділянці задніх рогів опіоїдні
рецептори можуть діяти на пресинаптичному рівні, змен-
шуючи вивільнення речовини Р, хоча відповідні преси-
наптичні нервові закінчення не були ідентифіковані.
Нарешті, ін’єкція морфіну у навколоводопровідну сіру
речовину середнього мозку зменшує біль шляхом акти-
вування низхідних шляхів, які пригнічують первинне афе-
рентне передавання у задніх рогах. Є докази того, що це
активування відбувається через проекції з навколоводопро-
відної сірої речовини до сусіднього ядра великого шва і
що гальмівну активність мають низхідні серотонінергічні
волокна з цього ядра. Тонкий механізм інгібіторного впли-
ву серотоніну на передавання імпульсів у задніх рогах не
з’ясований.
Плацебо здатне зумовити продукування ендогенних
опіоїдів, які зменшують біль. їхню дію частково пригнічу-
ють антагоністи морфіну, зокрема, налоксон. Акупунктура
ділянок, віддалених від джерела болю, також спричинює
виділення ендорфінів. Акупунктура больової точки діє
приблизно так само, як дотик або струшування (див.
вище). Ендогенні опіоїди також беруть участь у виник-
ненні стресової аналгезії, оскільки в експерименті на тва-
ринах доведено, що налоксон здатний блокувати деякі її
форми. На виникнення інших форм стресової аналгезії
налоксон не впливає, що свідчить про залучення інших
компонентів.
Ацетилхолін
Епібатидин, холінергічний агоніст, уперше ізольований
зі шкіри жаби, є сильним неопіоїдним анальгетичним засо-
бом, синтетичні похідні якого мають ще вищу болезаспо-
кійливу активність. їхню дію блокують холінергічні блока-
тори; досі не отримано доказів того, що вони спричинюють
звикання. Анальгетична дія нікотину, навпаки, менш вира-
жена у мишей з дефіцитом а4- та р2-субодиниць холінер-
гічних рецепторів нікотину. Ці спостереження доводять,
що нікотин-холінергічний механізм бере дієву участь у
регулюванні больових відчуттів, хоча тонкий механізм
цього регулювання ще потребує дослідження.
Канабіноїди
Як зазначено у Розділі 4, анандамід канабіноїдів та ПЕА
продуковані ендогенно і пов’язані, відповідно, з рецеп-
торами СВ] та СВ2. Для анандаміду характерна виражена
анальгетична активність, а у складі навколоводопровідної
сірої речовини та інших ділянок мозку, пов’язаних з від-
чуттям болю, виявлені анандамісткі нейрони. ПЕА у разі
використання впливає на периферії, посилюючи аналь-
гетичну дію анандаміду.
Ноцицептин
У процесі клонування опіатних рецепторів ц, к і 5
ідентифіковано орфан-рецептор (від англ. огїап - сирота),
ОКЬ1 (для опіоїдоподібного рецептора 1), який не зв’я-
зувався з жодним із опіоїдів високим ступенем спорідне-
ності. Нещодавно ідентифіковано природний ліганд цього
рецептора. Ним виявився поліпептид, що складається з
17 амінокислот і нагадує динорфін-17 (див. Розділ 4). У
випадку внутрішньомозкової ін’єкції експериментальним
тваринам він зумовлював гіпералгезію. З цієї причини
його названо ноцицептином. Ноцицептин та його рецеп-
тори наявні у багатьох ділянках мозку, в тім числі в гіпо-
таламусі, мозковому стовбурі та задніх рогах. У складі
молекули білка-попередника ноцицептину є також ноци-
статин, поліпептидний антагоніст ноцицептину. Механізм
взаємодії цих поліпептидів остаточно не з’ясований, однак
правдоподібно, що вони обидва беруть участь у переда-
ванні болю.
Синдроми хронічного болю
Нейропатичний біль у людини має різні форми. Одна з
них - це біль, що супроводжує інші відчуітя з ампутованої
кінцівки (так звана фантомна кінцівка; див. Розділ 5). У
випадку каузалгії спонтанний пекучий біль простежу-
ється протягом тривалого часу після порівняно легких
поранень. Він часто супроводжується гіпералгезією та
алодинією. Рефлекторна симпатична дистрофія також
трапляється досить часто. У цих випадках шкіра ураженої
ділянки тонка і блискуча, на ній посилено росте волосся.
Дослідження на тваринах засвідчили, що ушкодження
нервів призводять до пускання паростків та наступного
вростання норадренергічних симпатичних нервових воло-
кон у спинномозкові вузли, що забезпечують іннервацію
уражених ділянок. У цьому разі симпатичні імпульси
забезпечують відчуття болю. Отже, периферія закорочу-
вана, і відповідні пошкоджені волокна стимулюються нор-
адреналіном на рівні спинномозкового ганглія. Альфа-
адренергічна блокада забезпечує зменшення болю каузал-
гічного типу у людини, хоча з невідомих причин ОС]-
адренергічні блокатори ефективніші, ніж а2-засоби.
Відчуття спонтанного болю може генеруватися нарівні
таламуса. У разі таламічного синдрому характерним є
ушкодження задніх таламічних ядер, що найчастіше
зумовлене закупоренням таламоколінчастої гілки задньої
мозкової артерії. Пацієнти з цим синдромом мають при-
ступи тривалого, важкого і надзвичайно неприємного
болю, які виникають спонтанно або у відповідь на звичайні
подразнення.
Біль часто, проте не завжди, можна усунути викорис-
танням відповідних доз анальгетиків. Для зменшення неку-
рабельного болю запропоновано хронічне стимулювання
задніх рогів спинного мозку за допомогою імплантованих
електродів. Електроди можна приєднати до портативного
стимулятора, і пацієнти отримають змогу самостійно
контролювати свій біль. Самостимулювання навколово-
допровідної сірої речовини також допомагає зменшити
некурабельний біль, імовірно, завдяки підвищеному
виділенню [3-ендорфінів.
У деяких випадках неприємних симптомів важкого
болю можна позбутися шляхом розтину глибоких зв’язків
136/РОЗДІЛ 7
лобових часток з рештою мозку (префронтальна лобото-
мія). Після такої операції пацієнти відчувають біль, та він
їх більше не турбує. Така операція, однак, зумовлює значні
зміни особистості (див. Розділ 16). Зменшення болю можна
також досягти шляхом видалення поясної закрутки. Назва-
ні операції, а також інші можливості оперативного розтину
больових шляхів показані на рис. 7-9. Одне із таких опера-
тивних втручань називають передньолатеральною кордо-
томією. Ця операція передбачає вставляння скальпеля у
бічну частину спинного мозку з наступним охопленням
передньолатеральних ділянок. За належного виконання
таке втручання забезпечує розтин латеральних спінотала-
мічних та передньолатеральних систем волокон больової
провідності, залишаючи інтактними більшість вентраль-
них спіноталамічних волокон дотикової чутливості. Іноді
біль може відновлюватися через місяці і навіть роки, відоб-
ражаючи можливості короткого перемикання його провід-
них шляхів.
ІНШІ ВІДЧУТТЯ
Свербіння та лоскіт
Порівняно слабке подразнення, особливо якщо воно
спричинене тим, що хтось рухається по шкірі, зумовлює
свербіння та лоскіт. Ділянки свербіння можна ідентифі-
кувати в разі детального картування шкіри; подібно до
больових місць, вони відповідають ділянкам концентрації
вільних нервових закінчень безмієлінових нервових воло-
кон. Свербіння полегшується під час чухання внаслідок
активування великих аферентів з високою провідністю, що
перекривають передавання імпульсів у дорсальних стов-
пах, подібно до того, як стимулювання аферентів пригнічує
біль (див. вище). В експериментах з вилученням окремих
нервових волокон з’ясовано, що свербіння разом з пекучим
болем триває, якщо імпульси проводять лише волокна С, і
цілковито припиняється внаслідок розтину спіноталаміч-
них трактів. Звичайно, розподіл болю і свербіння відріз-
няється: можливе свербіння лише шкіри, очей та деяких
слизових оболонок, але не глибоких тканин чи нутрощів.
Окрім того, низькочастотне стимулювання больових воло-
кон зумовлює біль, а не свербіння; високочастотне стиму-
лювання ділянок свербіння на шкірі може лише посилити
інтенсивність свербіння, не спричинюючи болю. Ці спосте-
реження доводять, що системи волокон С для свербіння
та болю відрізняються. Цікаво, що лоскіт сприймається
як приємне відчуття, свербіння як докучливе, а біль є
неприємним.
Свербіння може виникнути внаслідок не лише повтор-
ного обмеженого механічного подразнення шкіри, а також
дії різноманітних хімічних засобів. Відчуття свербіння
може бути спричинене аплікацією на шкіру плазматичних
концентрацій жовчних солей. Інтенсивне свербіння зумов-
лює гістамін, його виділення у шкірі відбувається після
поранень. Звичайно, у переважній більшості випадків
причиною свербіння є не гістамін; у разі внутрішньошкір-
ного введення доз гістаміну, недостатніх для свербіння,
розвиваються почервоніння і набряк, тоді як інтенсивне
свербіння часто виникає без жодних зримих змін. Сильне
свербіння викликають кініни.
Рис. 7-9. Схематичне зображення різноманітних хірургічних
втручань з метою полегшення болю: 1 - розтин нерва; 2 -
симпатектомія (для вісцерального болю); 3 - мієлотомія з
метою розтину спіноталамічних волокон у передній білій спай-
ці; 4 - задня різотомія; 5 - передньобічна кордотомія; 6 -
трактотомія всередині довгастого мозку; 7 - трактотомія все-
редині середнього мозку; 8 - таламотомія; 9 - видалення
поясної закрутки; 10 - префронтальна лоботомія.
“Синтетичні” відчуття
Шкірні відчуття, для яких є окремі рецептори, - це
дотик, тепло, холод, біль і, можливо, свербіння. Поєднання
цих відчуттів, характерні особливості подразнення, і, в
окремих випадках, кіркові складники, синтезуються у від-
чуття вібрації, розрізнення двох точок та стереогнозис.
Вібраційна чутливість
Якщо до шкіри доторкнутися камертоном, що вібрує,
то можна відчути тремтіння або дрижання. Це відчуття
найліпше виражене над кістками, однак відчувається і в
разі інших локалізацій камертона. Такі подразнення
сприймають рецептори дотику, зокрема тільця Пачіні,
проте суттєву роль відіграє також і часовий фактор. Рит-
мічне стимулювання тиском сприймається як вібрація.
Відповідні імпульси надходять до дорсальних стовпів.
Дегенерація цих частин спинного мозку простежується у
разі погано лікованого діабету, перніцинозної анемії,
недостатності деяких вітамінів, і спорадично за інших
форм патології. Пригнічення порогу вібраційної чутли-
вості є одним із перших симптомів такої дегенерації. Віб-
раційна чутливість і пропріорецепція - близько спорід-
ШКІРНА, ГЛИБОКА ТА ВІСЦЕРАЛЬНА ЧУТЛИВІСТЬ /137
нені відчуття, тому в разі пригнічення одного із них, так
само пригнічується й інше.
Розрізнення двох точок
Мінімальну відстань між двома дотиковими подразнен-
нями, які сприймаються відокремлено одне від одного,
називають двоточковим порогом. Цей поріг залежить як
від дотикових рецепторів, так і від кіркових компонентів
ідентифікації одного або двох подразників. Його значення
відрізняється для різних частин тіла і є найнижчим у місцях
найвищої концентрації рецепторів дотику. Наприклад, на
спині відстань між точками для їхнього самостійного сприй-
няття повинна становити щонайменше 65 мм, тоді як для
кінчиків пальців вона не перевищує 3 мм. На долонях дво-
точковий поріг приблизно відповідає ділянці, яку охоплює
окремий сенсорний елемент. Периферійні нервові меха-
нізми, на яких ґрунтується розрізнення двох подразнених
точок, остаточно не з’ясовані, особливо з огляду на знач-
не перекривання та взаємовростання сенсорних елементів.
Стереогнозис
Здатність до ідентифікації предметів на дотик без їхньо-
го розглядання називають стереогнозисом. У нормі люди-
на може легко розрізнити такі предмети, як ключі або моне-
ти різної вартості. Ця здатність, очевидно, залежить від
нормального відчуття дотику й тиску і порушена в разі
ушкодження дорсальних стовпів. Важливе значення має
також кірковий компонент: порушення стереогнозису є
ранньою ознакою ушкодження кори головного мозку й
інколи простежується без будь-яких дефектів відчуття до-
тику та тиску, якщо уражена ділянка тім’яної частки поза-
ду від зацентральної закрутки.
8
Зір
ВСТУП
Очі є складними органами чуття, що розвинулися з при-
мітивних світлочутливих плямок на поверхні тіла безхре-
бетних. Усередині захисного покриву кожне око містить
шар рецепторів, систему лінз, що фокусує світло на ці
рецептори, а також систему нервових шляхів, що передає
імпульси від рецепторів до мозку. Механізм взаємодії цих
елементів для забезпечення сприйняття зорових відчуттів
розглянемо у цьому розділі.
АНАТОМІЧНІ ХАРАКТЕРИСТИКИ
Головні структури ока показані на рис. 8-1. Зовнішня
захисна оболонка очного яблука - склера - у передній час-
тині ока трансформована в прозору рогівку, через яку світ-
лові промені проникають усередину ока. Зсередини склеру
вкриває судинна оболонка, у якій міститься велика кіль-
кість кровоносних судин, що живлять структури очного
яблука. Задні дві третини судинної оболонки вкриті сіт-
ківкою - нервовою тканиною, у якій містяться рецепторні
клітини.
Кришталик є прозорою структурою, яку утримує у фік-
сованому положенні зв’язка кришталика, що прикріп-
лена до потовщеного переднього краю судинної оболонки
- так званого війкового тіла. Війкове тіло містить цирку-
лярні і поздовжні м’язи, що прикріплені біля рогівково-
склерального сполучення. Перед кришталиком міститься
непрозора забарвлена райдужна оболонка. Вона містить
циркулярний м’яз-звужувач, та радіальний м’яз-розширю-
вач зіниці. Зміни діаметра зіниці можуть до п’яти разів
змінювати кількість світла, що досягає сітківки.
Простір між кришталиком та сітківкою заповнений
прозорим гелеподібним матеріалом, який називають
склистим тілом (склистою вологою). Війкове тіло внас-
лідок дифузії та активного транспортування плазми крові
продукує водянисту рідину - прозору рідину, яка живить
рогівку і кришталик. Водяниста рідина проходить через
зіницю і заповнює передню камеру ока. В нормі надлишок
водянистої рідини реабсорбується через мережу трабекул
у канал Шлемма - венозний канал у ділянці переходу
рогівки у склеру (у ділянці так званого кута передньої
камери). Закриття цього шляху відтікання водянистої ріди-
ни спричинює підвищення внутрішньоочного тиску. Висо-
кий внутрішньоочний тиск не призводить до глаукоми -
захворювання, що супроводжується втратою гангліонар-
них клітин сітківки, у випадку якого значний відсоток
пацієнтів має нормальний внутрішньоочний тиск (10-
20 мм рт. ст.). Однак підвищений внутрішньоочний тиск
ускладнює перебіг глаукоми, тому лікування у цих випадках
спрямоване на зниження внутрішньоочного тиску. Однією
з причин підвищення тиску є зменшення відтоку рідини
через мережу трабекул (глаукома відкритого кута), інша
полягає у зміщенні райдужної оболонки допереду (глау-
кома закритого кута). Глаукому лікують [3-адреноблока-
торами чи інгібіторами карбоангідрази (обидва ці чинники
зменшують продукування водянистої рідини) або холінер-
гічними препаратами, які збільшують відтік водянистої
рідини.
Рис. 8-1. Горизонтальний зріз правого ока (відтворено за доз-
волом з Мапллск К: Еидепе МоІЯ’з Апаіоту ої ІНе Еуе апсі
ОгЬіІ. 71ґі есі. Заипсіегз, 1977).
ЗІР /139
Сітківка
Спереду сітківка майже досягає війкового тіла. Вона
складається з десяти шарів і містить палички та колбочки,
що є зоровими рецепторами, а також чотири інші типи
нейронів: біполярні, гангліонарні, горизонтальні й ама-
кринні клітини (рис. 8-2). Палички і колбочки, які при-
лягають до судинної оболонки, утворюють синаптичні кон-
такти з біполярними клітинами, а ті, відповідно, - синапси
з гангліонарними клітинами. Аксони гангліонарних клітин
збираються докупи й виходять з очного яблука у вигляді
зорового нерва. Горизонтальні клітини сполучають між
собою рецепторні клітини у складі зовнішнього сітчастого
шару, а амакринні клітини - гангліонарні клітини у складі
внутрішнього сітчастого шару. Вони не мають аксонів і
їхні відростки формують пре- та постсинаптичні контакти
з сусідніми нейрональними елементами. Є виражена кон-
верґенція в напрямі від рецепторних до біполярних, і від
біполярних до гангліонарних клітин (див. нижче). Нейро-
ни сітківки також сполучені між собою щілинними кон-
тактами (нексусами) з регульованою проникністю.
Оскільки рецепторний шар сітківки розміщений на піг-
ментному епітелії, що, відповідно, прилягає до судинної
оболонки, то світлові промені, перш ніж потрапити на па-
лички та колбочки, повинні пройти через шари гангліо-
нарних та біполярних клітин. Пігментний епітелій вбирає
світлові промені, запобігаючи їхньому відбиванню від сіт-
ківки; таке віддзеркалення могло б зумовити порушення у
сприйнятті світлових зображень. Нейрональні елементи
сітківки утримуються разом за допомогою гліальних, так
званих клітин Мюллера. Відростки формують внутрішню
пограничну мембрану на внутрішній поверхні сітківки та
зовнішню - на рівні паличок і колбочок.
Піґментний епітелій
Палички і колбочки
Зовнішній сегмент
Внутрішній сегмент
Зовнішній ядерний шар
Зовнішній сітчастий шар
Внутрішній ядерний шар
Внутрішній сітчастий шар
Шар гангліонарних клітин
Волокна зорового нерва
Рис. 8-2. Нейрональні компоненти позаямкової частини сітківки: К - колбочка; П - паличка; КБ, ПБ, ПлБ - карликові, паличкові
та плоскі біполярні клітини; ДГ, КГ -дифузні та карликові гангліонарні клітини; Г - горизонтальні клітини; А - амакринні клітини
(відтворено за дозволом з Оои/ііпд ЗЕ, Воусой ВВ: Огдапігаііоп ої ІЬе ргітаїе геііпа: ЄІесігоп тісговсору. Ргос К Зос ІопсІ Зег
В [Віоі] 1966;166:80).
140 / РОЗДІЛ 8
Зоровий нерв виходить за межі очного яблука, а крово-
носні судини вростають у нього в точці, що розміщена на
З мм медіальніше і дещо вище від його заднього полюса.
Цю ділянку можна бачити за допомогою офтальмоскопа
як зоровий диск (рис. 8-3). Зоровий диск не містить світло-
чутливих рецепторів і тому його називають сліпою пля-
мою.
Біля заднього полюса ока міститься ділянка, що має
жовтувате забарвлення - так звана жовта пляма. Вона є
місцем локалізації центральної ямки - потоншеної без-
паличкової частини сітківки, що характерна для людини
та інших приматів. У жовтій плямі колбочки укладені дуже
щільно і кожна утворює синаптичний контакт з однією
біполярною клітиною, яка, відповідно, контактує з однією
гангліонарною клітиною, формуючи прямий шлях до моз-
ку. У цій ділянці дуже незначна кількість клітин взаємона-
кладаються і практично немає кровоносних судин. Тому
центральна ямка - це місце найвищої зорової активності.
Коли певний об’єкт привертає увагу, то очі звичайно пере-
міщаються у такому напрямі, щоб промені від нього по-
трапляли у центральну ямку.
Артерії, артеріоли та вени поверхневих шарів сітківки,
що розміщені біля поверхні склистого тіла, можна розгля-
дати за допомогою офтальмоскопа. Оскільки це єдине
місце в організмі, де можна бачити артерії, то їхнє дослід-
ження за допомогою офтальмоскопа має важливе значення
для діагностики та оцінки ступеня важкості цукрового діа-
бету, гіпертензії, а також інших захворювань, для яких
характерне ураження кровоносних судин. Судини сітківки
постачають кров до біполярних та гангліонарних клітин,
а рецепторні клітини більше живляться завдяки капілярним
сплетенням судинної оболонки. Ось чому відшарування
сітківки є таким руйнівним для рецепторних клітин.
Нервові ШЛЯХИ
Аксони гангліонарних клітин у складі зорового нерва
та зорового шляху проходять у каудальному напрямі і
закінчуються у бічному колінчастому тілі - частині
таламуса (рис. 8-4). Волокна від кожної носової половини
сітківки перетинаються у ділянці зорового перехрестя. У
колінчастому тілі волокна від носової половини однієї сіт-
ківки і скроневої половини іншої утворюють синаптичні
контакти з нейронами, аксони яких формують колінчасто-
шпорний шлях, що доходить до потиличної частки кори
головного мозку.
Первинна зорова ділянка (первинна зорова кора,
17 зона Бродманна, або VI) локалізована переважно по
обидва боки від шпорної борозни (рис. 8-5). Організація
первинної зорової кори описана нижче.
Аксони окремих гангліонарних клітин проходять із
зорового шляху до передпокришкового поля середнього
мозку і верхнього горбика, де утворюють зв’язки, що впли-
вають на зіничні рефлекси та рухи очних яблук. Інші аксони
проходять безпосередньо від зорового перехрестя до су-
прахіазматичного ядра гіпоталамуса, де утворюють чис-
ленні контакти, що синхронізують ендокринні та інші цир-
кадні ритми з чергуванням дня і ночі (світла і темряви)
(див. Розділ 14).
Ділянки мозку, активовані під впливом зорових сти-
мулів, досліджено у мавп та людей з використанням ПЕТ
та інших сучасних технологій (див. Розділ 32). Активуван-
ня охоплювало не лише потиличну ділянку, а також частину
нижньої скроневої кори, задньо-нижню тім’яну кору, окре-
мі зони лобової кори та мигдалеподібного тіла. Підкіркові
структури, крім бічного колінчастого тіла, охоплювали
верхній горбик, подушку, хвостате ядро, лушпину та ого-
рожу.
Рис. 8-3. Вигляд нормально! сітківки людини в офтальмоскопі. Ліворуч на схемі позначені головні структури, які можна розрізнити
на фотографії праворуч (відтворено за дозволом з УаидЬап О, АзЬигу Т, Кіогсіап-Еуа Р: бепегаї ОрЬіКаїтоІоду, 151Н есі.
МсСга\л/-НіІІ, 1998).
ЗІР/141
Рис. 8-4. Зорові шляхи. Перетинання шляхів на рівнях, позначених відповідними літерами, призводить до розладів
світосприйняття, показаних у правій частині рисунка (див. текст). У випадку ушкодження потиличних ділянок можуть зберегтися
волокна, що йдуть від жовтої плями (див. фрагмент О), унаслідок їхнього відокремлення у складі мозку від інших волокон, що
забезпечують світосприйняття (див. рис. 8-5).
Рецептори
Кожна паличка і колбочка має зовнішній сегмент,
внутрішній сегмент, що охоплює ядерну частину клітини,
Верхній периферійний
пижж .вадпніп'
Верхній квадрант
жовтої плями
Рис. 8-5. Медіальний вигляд правої півкулі мозку людини з
проекціями окремих частин сітківки на потиличну кору навколо
шпорної борозни.
квадрант сітківки
та синаптичну зону (рис. 8-6). Зовнішній сегмент є видо-
зміненою війкою: він утворений правильно укладеним сто-
сом сплюснутих мішечків або мембранних дисків. Ці
мішечки (диски) містять фотосенсорні речовини, що реагу-
ють на світло генерацією потенціалу дії у зорових шляхах
(див. нижче). Внутрішній сегмент багатий на мітохондрії.
Палички названо так тому, що їхні зовнішні сегменти
паличкоподібні. Колбочки переважно мають товсті внут-
рішні сегменти і конусоподібні зовнішні, хоча у різних
ділянках сітківки є певні морфологічні особливості. У
колбочках мішечки зовнішніх сегментів утворені склад-
ками плазмолеми, а у паличках мембранні диски відок-
ремлені від клітинної оболонки.
Зовнішні сегменти паличок постійно самовідновлюють-
ся шляхом формування нових дисків на внутрішньому кінці
сегмента і фагоцитозу відпрацьованих дисків з його зов-
нішнього кінця клітинами пігментного епітелію. Самовід-
новлення колбочок дещо складніше і відбувається одно-
часно у багатьох місцях зовнішнього сегмента.
У позаямковій частині сітківки переважають палички
(рис. 8-7) зі значним ступенем конвергенції. Плоскі біпо-
142 / РОЗДІЛ 8
Рис. 8-6. Схема будови палички і колбочки (відтворено за
дозволом з І_атЬ ТО: ЕІесігісаІ гезропзез ої рбоїогесеріогз.
Іп: Ресепі Асіуапсез іп РНузіоІоду. N0. 10. Вакег РЕ [есіііог].
СЬигсКіІІ Ьмпдзіопе, 1984).
лярні клітини (див. рис. 8-2) утворюють синаптичні кон-
такти з кількома колбочками, а паличкові біполярні клітини
- з кількома паличками. Оскільки в оці людини налічують
близько 6 мільйонів колбочок, 120 мільйонів паличок і
лише 1,2 мільйона нервових волокон у кожному зоровому
нерві, то конвергенція рецепторів через біполярні клітини
до гангліонарних становить у середньому 105:1. Водночас
треба зазначити, що на подальших зорових шляхах відбу-
вається дивергенція нервових імпульсів, оскільки у колін-
часто-шпорних шляхах міститься вдвічі більше нервових
волокон, аніж у зорових нервах, а в зоровій корі кількість
нейронів, залучених до світлосприйняття, у 1 000 разів
перевищує кількість волокон у складі зорових нервів.
Очні м’язи
Око рухається в очній ямці черепа завдяки наявності
шести очних м’язів (рис. 8-8), що їх іннервують окорухо-
вий, блоковий та відвідні нерви. Детальніше м’язи і напря-
ми переміщення ними очного яблука розглянуті у кінці
цього розділу.
Захист
Від ушкоджень око захищене кісткою очної ямки.
Рогівку зволожують і очищають сльози, які циркулюють
від сльозової залози у верхній частині кожної очної ямки
через поверхню ока та сльозову протоку до носової
порожнини. Моргання допомагає підтримувати поверхню
очного яблука зволоженою.
Одна із найважливіших властивостей системи зору -
здатність до дії у широкому діапазоні світлової інтенсив-
ності. Коли людина виходить із сутінок на яскраве сонячне
світло, то інтенсивність освітлення збільшується на 10 по-
рядків, тобто у 10 мільярдів разів. Одним із факторів змен-
шення коливань освітленості є діаметр зіниці (див. нижче);
якщо зіниця звужується з 8 до 2 мм, то її площа змен-
шується у 16 разів, а інтенсивність світла, що потрапляє
на сітківку, - більше ніж на порядок.
Іншим фактором, що забезпечує адаптацію ока до коли-
вань інтенсивності освітлення, є наявність двох типів
рецепторів. Палички надзвичайно чутливі до світлових
Відстань від центральної ямки
Рис. 8-7. Динаміка насиченості паличками і колбочками сітківки ока людини вздовж горизонтального меридіана. Розміщення
відносної гостроти зору у різних частинах адаптованого до світла ока відповідатиме кривій насиченості колбочками; місце
найліпшого бачення у сутінках відповідає ділянці найвищої насиченості паличками.
ЗІР/143
Рис. 8-8. Шість окорухових (позаочних) м’язів, вигляд згори
(модифіковано з Оох І, МеІІопі ВЗ, Еізпег <ЗМ: МеІІопі’з ІІІиз-
Ігаїесі МесІісаІ Оісііопагу. \Л/іІІіатз & \Л/іІІіатз, 1979).
променів і є рецепторами нічного зору (нічний, скотопіч-
ний зір). Апарат скотопічного зору не дає змоги розрізняти
деталі та межі об’єктів, а також їхній колір. Колбочки
мають значно вищий поріг подразнення, проте система
колбочок забезпечує набагато вищу гостроту зору і присто-
сована до сприйняття яскраво освітлених об’єктів (денний,
фотопічний зір) та кольору. Отже, до ЦНС із сітківки над-
ходять два типи подразнень - від паличок і від колбочок.
Наявність сигналів двох типів, кожен з яких із максималь-
ною ефективністю працює в інших умовах освітленості,
називають теорією подвоєння. Окрім того, як палички,
так і колбочки можуть адаптуватися до різної інтенсив-
ності освітлення (див. нижче).
МЕХАНІЗМ ФОРМУВАННЯ ЗОБРАЖЕНЬ
Очі перетворюють енергію світлових променів видимої
частини спектра на потенціал дії у зоровому нерві. Дов-
жина хвиль видимої частини спектра коливається від 397
до 723 нм. Образи об’єктів зовнішнього середовища фоку-
суються на сітківку. Світлові промені, що потрапляють на
сітківку, зумовлюють генерування потенціалів дії палич-
ками і колбочками. Імпульси, що виникають у сітківці,
надходять до кори головного мозку, де й формують зорові
відчуття.
Принципи оптики
Світлові промені, переходячи із середовища однієї
густини в середовище з іншою густиною, заломлюються,
за винятком тих випадків, коли вони падають перпенди-
кулярно до межі поділу середовищ. Паралельні світлові
промені, що падають на двоопуклу лінзу (рис. 8-9), залом-
люються в точку позаду лінзи. Цю точку називають голов-
ним фокусом. Головний фокус розміщений на лінії, що
проходить через центри кривин лінзи - так звану головну
оптичну вісь. Відстань між лінзою та головним фокусом
називають головною фокусною відстанню. З практичною
метою світлові промені, що надходять від об’єкта з від-
стані понад 6 м від лінзи, вважають паралельними. Промені
від об’єкта, розташованого ближче, ніж 6 м, перед падінням
на лінзу розходяться і тому фокусують за головним фоку-
сом (див. рис. 8-9). Двоввігнуті лінзи спричинюють роз-
ходження світлових променів.
Чим більша кривина лінзи, тим більшою є її заломлю-
вальна сила, яку звичайно вимірюють у діоптріях. Кіль-
кість діоптрій є величиною, оберненою до значення голов-
ної фокусної відстані у метрах. Наприклад, лінза з голов-
ною фокусною відстанню 0,25 м має заломлювальну силу
1/0,25, або 4 діоптрії. У стані спокою око людини має
заломлювальну силу близько 60 діоптрій.
Рис. 8-9. Заломлення світлових променів лінзами. А - дво-
опукла лінза. В - двоопукла лінза більшої заломлювальної
сили, ніж на фрагменті А; С - лінза як на фрагменті А, схема
'відображає вплив ближчої відстані до об’єкта; О - двоввігнута
лінза. Центральна лінія на кожному фрагменті є головною
оптичною віссю. Точка X позначає головний фокус.
144/РОЗДІЛ 8
Акомодація
Коли війковий м’яз розслаблений, то паралельні світлові
промені, що потрапляють до оптично нормального (еме-
тропічного) ока, фокусуються на сітківці. Якщо за умов
розслабленого війкового м’яза розглядати предмети, від-
стань до яких менша від 6 м, то промені фокусуватимуть
позаду сітківки, й обриси втратять чіткість. Проблему
фокусування на сітківці зображень близьких предметів
можна вирішити, збільшивши або відстань між кришта-
ликом і сітківкою, або кривину (заломлювальну силу)
кришталика. В остистих риб ця проблема вирішена шляхом
видовження очного яблука, що нагадує принцип роботи
фотокамери, де зображення близьких предметів фокусу-
ється на плівку за допомогою віддалення від неї лінзи; у
ссавців змінюється кривина кришталика.
Процес, за допомогою якого досягають збільшення кри-
вини кришталика, називають акомодацією. Під *тзс від-
починку кришталик утримує в стані розтягу зв’язка криш-
талика . Оскільки структура кришталика піддається роз-
тягу, а його капсула має значну еластичність, то натяг криш-
таликової зв’язки приводить до набуття кришталиком плос-
кішої форми. Якщо погляд спрямовують на близький пред-
мет, то війковий м’яз скорочується, унаслідок чого змен-
шується відстань між краями війкового тіла і послаблю-
ється натяг волокон кришталикової зв’язки, унаслідок чого
кришталик набуває опуклішої форми. В осіб молодого віку
зміна кривини кришталика може додати до заломлюваль-
ної сили ока до 12 діоптрій. Зменшення натягу волокон
кришталикової зв’язки відбувається частково завдяки
сфінктероподібному скороченню циркулярних волокон
війкового м’яза, частково внаслідок скорочення поздовж-
ніх м’язових волокон, що прикріплені спереду - у ділянці
рогівково-склерального з’єднання. Коли ці м’язові волокна
скорочуються, то вони тягнуть війкове тіло вперед і досере-
дини, що призводить до зближення його країв.
Зміна кривини кришталика в разі акомодації впливає
насамперед на його передню поверхню (рис. 8-10). Цей
факт доведений багато років тому простим експериментом.
Якщо тримати предмет перед очима особи, що дивиться
вдалину, то в очах цієї особи можна побачити три відбиті
зображення: маленьке, чітке і пряме зображення з рогівки;
більше, слабше і так само пряме зображення з передньої
Рис. 8-10. Акомодація. Суцільними лініями показана форма
кришталика, райдужної оболонки і війкового тіла у розслаб-
леному стані; штриховими - ці ж структури у випадку акомо-
дації.
поверхні кришталика; маленьке обернене зображення з
задньої поверхні кришталика. Якщо ж погляд перевести
на близький предмет, то велике розмите пряме зображення
зменшиться і зміститься до іншого прямого зображення,
тоді як обернене зміниться незначно. Зміна розміру другого
зображення зумовлена збільшенням кривини передньої
поверхні кришталика (див. рис. 8-10). Незмінність ма-
ленького прямого зображення і незначні зміни оберненого
зображення свідчать про те, що в разі акомодації кривина
рогівки не змінюється, а кривина задньої поверхні криш-
талика змінюється дуже мало.
Найближча точка бачення
Акомодація є активним процесом, що потребує м’язо-
вих зусиль, і тому може втомлювати. Війковий м’яз - один
із найуживаніших м’язів людського тіла. Ступінь збільшен-
ня кривини кришталика звичайно має межу, тому світлові
промені від дуже близького об’єкта не можуть бути сфоку-
совані на сітківку навіть за умов найбільшого напруження.
Найближчу до ока точку, з якої в разі акомодації ще можна
отримати чітке зображення, називають найближчою точ-
кою бачення. Впродовж життя найближча точка бачення
спочатку поволі, а потім дедалі швидше видовжується від
9 см у десятирічному віці до приблизно 83 см у віці 60
років. Це видовження зумовлене, перш за все, зростанням
ригідності кришталика, наслідком чого є втрата акомодації
з огляду на поступове зниження можливого ступеня ви-
кривлення кришталика (рис. 8-11). Звичайно у віці 40-45
років втрата акомодації призводить до затруднень під час
читання та виконання роботи на близькій відстані. Цей
стан, який називають пресбіопією, звичайно коригують
за допомогою окулярів з увігнутими лінзами.
Відповідь на наближення
На додаток до акомодації, під час розглядання близьких
предметів оптичні осі сходяться і зіниця звужується. Цю
потрійну реакцію - акомодацію, конвергенцію оптичних
осей та звуження зіниці - називають відповіддю на на-
ближення.
Інші зіничні рефлекси
Якщо світло спрямоване в одне око, то зіниця цього ока
звужується (зіничний світловий рефлекс); водночас також
звужується зіниця іншого ока (поєднаний світловий реф-
лекс). Волокна зорового нерва, які передають імпульси,
що спричинюють ці ефекти, відходять від зорових нервів
біля латеральних колінчастих тіл. З кожного боку вони
входять до середнього мозку через ручку верхнього гор-
бика і закінчуються у передпокришковому ядрі. З цього
ядра нейрони другого порядку проектуються до іпси- та
контралатеральних ядер Едінгера-Вестфаля. Нейрони тре-
тього порядку проходять звідти до війкового ганглія у скла-
ді окорухового нерва, а нейрони четвертого порядку, відпо-
відно, - від цього ганглія до війкового тіла. Цей шлях
пролягає дорсальніше від шляху відповіді на наближення.
Тому іноді в разі нереагування на світло реакція акомодації
незмінена (зіниця Арджилл-Робертсона). Однією з при-
чин такої патології може бути сифіліс ЦНС, однак зіниця
Арджилл-Робертсона може виникати також під час інших
захворювань, коли вибірково уражений середній мозок.
ЗІР/145
14
Рис. 8-12. Схематизоване очне яблуко: п - вузлова точка;
АпВ і апЬ - подібні трикутники. У цьому спрощеному оці вуз-
лова точка розташована на відстані 15 мм від сітківки. Умовно
вважають, що всі промені заломлюються біля поверхні рогівки
на відстані 5 мм від вузлової точки, між середовищем з гус-
тиною 1,000 (повітря) та середовищем з густиною 1,333 (во-
да). Штрихові лінії відображають напрям променів світла, що
йдуть від точки А і після заломлення рогівкою фокусуються у
точці а на сітківці.
2 -
0 2_____і_______і______і_
10 20 ЗО 40
Є > • • •
І ? і
50 60 70
Вік, роки
Рис. 8-11. Зниження амплітуди акомодації у людей з віком.
Різними символами показані дані різних авторів (відтворено
за дозволом з Еізіїег РР: РгезЬуоріа апсі ІЬе сЬапдез \л/ііґі аде
іп ІЬе Китай сгузіаіііпе Іепз. З РЬузіоІ 1973;228:765).
Зображення на сітківці
Очне яблуко заломлює світлові промені передньою
поверхнею рогівки, а також передньою та задньою поверх-
нями кришталика. Процес заломлення можна відобразити
графічно без суттєвих помилок, уважаючи, ніби все залом-
лення відбувається лише біля передньої поверхні рогівки.
На рис. 8-12 показане таке спрощене, схематичне око. На
цій діаграмі вузлова точка (оптичний центр ока) збі-
гається з місцем контакту середньої і задньої третин криш-
талика, що за 15 мм від сітківки. Це точка, проходячи через
яку, світлові промені не заломлюються. Усі інші промені,
що проходять через зіницю від будь-якої точки об’єкта,
заломлюються і фокусують на сітківці.
Якщо висота об’єкта спостереження (АВ) та його від-
стань до спостерігача (Вп) відомі, то розмір зображення
на сітківці можна обчислити, тому що трикутники АпВ та
апЬ на рис. 8-12 подібні між собою. Кут АпВ називають
зоровим кутом для об’єкта АВ. Зазначимо, що на сітківці
утворюється обернене зображення. Характерно те, що з
цього оберненого зображення сприймається і передається
до зорових полів кори контралатеральної половини мозку
правильне положення об’єкта. Таке світлосприйняття є у
немовлят, воно вроджене. Якщо за допомогою спеціальних
лінз зображення на сітківці перевернути, то об’єкти також
сприйматимуться у перевернутому вигляді.
Найпоширеніші дефекти
формування зображень
У деяких осіб очне яблуко коротше від нормального, і
паралельні промені фокусуються позаду сітківки. Цю
патологію називають гіперметропією, або далекозорістю
1 1 367-2
(рис. 8-13). Постійна акомодація навіть під час спостере-
ження за віддаленими об’єктами може частково компенсу-
вати цей дефект, однак постійне напруження війкових м’я-
зів виснажує і може стати причиною болю голови та втрати
чіткості зображень. Тривала конвергенція зорових осей у
разі акомодації може призводити до розвитку косоокості
(страбізму) (див. нижче). Цей дефект коригують вико-
ристанням окулярів з опуклими лінзами, які збільшують
заломлювальну силу ока і вкорочують фокусну відстань.
У випадку міопії (короткозорості) передньо-задній
діаметр очного яблука перевищує норму. Вважають, що
міопія спадкова. В експерименті на тваринах міопію можна
змоделювати, спричинюючи зміни заломлювальної сили
ока у процесі розвитку. У людини виявлено зв’язок між
розвитком міопії та спанням дитини до дворічного віку в
освітленій кімнаті. Отже, форма очного яблука частково
визначена умовами світлозаломлення у ньому. Напружена
праця очима на близькій відстані у молодому віці, як от
під час навчання, прискорює розвиток міопії. Цей дефект
коригують використанням окулярів з двоввігнутими лін-
зами, які забезпечують розходження паралельних променів
перед їхнім потраплянням в око.
Астигматизм - це доволі поширена форма патології,
зумовлена нерівномірною кривиною рогівки. Якщо кри-
вина рогівки вздовж одного з меридіанів відрізняється від
кривини вздовж іншого, то світлові промені фокусують по-
різному, унаслідок чого частина зображення втрачає чіт-
кість. Подібний дефект простежується також у разі зміще-
ного положення кришталика або у випадку його неодно-
рідної кривини, однак така патологія мало поширена.
Астигматизм звичайно коригують циліндричними лінзами,
розміщуючи їх у той спосіб, щоби вони зрівноважували
світлозаломлення вздовж усіх меридіанів. Пресбіопію
розглянуто вище.
У разі порушення узгодженості роботи лівих і правих
ланок окорухового апарату, зображення об’єкта проекту-
ється на диспартні (неідентичні) ділянки сітківки. Це буває
у випадку ушкодження окремих м’язів ока та окорухових
ядер, що зумовлює порушення конвергенції зорових ліній.
У такому разі людина сприймає об’єкт подвоєним.
146/РОЗДІЛ 8
Рис. 8-13. Найпоширеніші дефекти оптичної системи ока. У випадку гіперометропії очне яблуко коротше від нормального, і
світлові промені фокусують позаду сітківки. Двоопукла лінза коригує цей дефект, збільшуючи заломлювальну силу ока. У разі
міопії очне яблуко довше від нормального, і світлові промені фокусують перед сітківкою. Двоввігнута лінза зумовлює розход-
ження світлових променів перед їхнім потраплянням на рогівку, внаслідок чого досягається фокусування на сітківці.
МЕХАНІЗМ ФОТОРЕЦЕПЦІЇ
Походження електричних імпульсів
Різниця потенціалів, яка ініціює генерування потенціалу
збудження, зумовлена впливом світла на світлочутливі
елементи паличок і колбочок. Поглинання ними світлових
променів спричинює конформаційні зміни їхніх молекул,
що ініціює серію послідовних перетворень, які активують
нейрони.
Око є унікальним органом, оскільки потенціали дії
фоторецепторних клітин, як і електричні імпульси пере-
важної більшості його нейрональних елементів, є локаль-
ними та ступеневими, і лише генерування потенціалів
гангліонарних клітин, що здатні передаватися на значну
відстань, відбувається за принципом “усе або нічого”.
Відповіддю на подразнення паличок, колбочок та
горизонтальних клітин є гіперполяризація (рис. 8-14),
відповіддю біполярних клітин - гіпер- або деполяризація,
тоді як амакринні клітини генерують потенціали деполя-
ризації і піки, які можуть слугувати ініціаторами збудження
гангліонарних клітин.
У разі порівняння потенціалів дії у колбочках та палич-
ках простежують, що потенціал дії колбочок має гострий
початок і закінчення, тоді як потенціал дії паличок має
гострий початок і пологе закінчення. Криві, що узалеж-
нюють амплітуди потенціалів дії від інтенсивності збуд-
ника, подібні у паличок і колбочок, проте палички значно
чутливіші. Тому відповідь паличок пропорційна до інтен-
сивності збудника, якщо рівні опромінення нижчі від поро-
гового рівня колбочок. З іншого боку, відповідь колбочок
пропорційна до інтенсивності збудника у разі високих рів-
нів опромінення, коли відповідь паличок досягла макси-
муму і вже не може змінюватися. Ось чому колбочки гене-
рують адекватну відповідь на зміни інтенсивності освіт-
лення, вищі від певного рівня, однак погано відображають
абсолютну освітленість, тоді як палички сприймають
абсолютну освітленість.
Йонні основи
фоторецепторних потенціалів
Натрієві канали зовнішніх сегментів паличок і колбочок
відкриті у темряві, так само як постійним є потік йонів із
внутрішніх до зовнішніх сегментів (рис. 8-15). Потік йонів
також рухається в напрямі синаптичного закінчення фото-
рецепторної клітини; Ка+-К+-АТФ-аза внутрішнього сег-
мента підтримує йонну рівновагу. Вивільнення синаптич-
ного нейротрансмітера стабільне у темноті. Коли світло
потрапляє на зовнішній сегмент, то спричинені ним реакції
закривають частину ^"-каналів, наслідком чого є гіпер-
поляризувальний рецепторний потенціал. Гіперполяриза-
ція зменшує вивільнення синаптичного нейротрансмітера,
що, відповідно, слугує сигналом, який у кінцевому під-
сумку зумовлює Генерування потенціалів дії гангліонар-
ними клітинами. Ці потенціали дії надходять до мозку.
Світлочутливі речовини
Світлочутливі речовини очей людини та більшості ссав-
ців утворені білковим компонентом, опсином, а також
ретиненом( - альдегідом вітаміну А . Термін ретинен]
використовують для вирізнення цієї речовини від рети-
нену2, що міститься в очах деяких видів тварин. Молекули
ретиненів - це альдегіди, тому часто їх називають рети-
налями. Вітаміни групи А є спиртами, і їх називають рети-
нолами.
Родопсин
Світлочутливий пігмент паличок називають родопси-
ном, або зоровим пурпуром. Опсин у складі молекули
родопсину називають скотопсином. Родопсин виявляє
максимум чутливості до світла з довжиною хвилі 505 нм.
Родопсин людини має молекулярну масу 41 000. Він
локалізований у мембранах дисків паличок, становить до
90% білка цих мембран і є одним із багатьох рецепторів з
покрученою формою молекули, що зв’язані з 6-білками
(див. рис. 1-40). РетиналЬ] розміщений паралельно до
ЗІР/147
Рис. 8-14. Внутрішньоклітинна реєстрація відповіді клітин сіт-
ківки на світлове подразнення. Показані також синаптичні кон-
такти між клітинами. Паличка (Р) ліворуч сприймає спалах
світла, тоді як паличка праворуч сприймає постійне освітлен-
ня помірної сили. Н - горизонтальна клітина; В - біполярна
клітина; А-амакринна клітина; 6 - гангліонарна клітина (від-
творено за дозволом з Оо\л/Ііпд Огдапігаііоп ої уегіеЬгаіе
геііпаз. іпуєзі ОрЬіЬаІтоІ 1970;9:655).
поверхні мембрани (рис. 8-16) і приєднаний до залишку
лізину у 296-му положенні сьомого трансмембранного
домену.
У темноті ретиналЬ] родопсину перебуває в 11 -цис-кон-
фігурації. Дія світла полягає у зміні форми молекули рети-
налЮ] - її перетворенні на повний транс-ізомер (рис. 8-
17). Це, відповідно, впливає на конфігурацію опсину, зміна
форми якого активує приєднаний до нього гетеротри-
мерний О-білок, який називають трансдуцином, або Си.
Цей білок обмінює ГДФ на ГТФ, після чого від нього
відокремлюється а-субодиниця, яка зберігає притаманну
їй ГТФ-азну активність доти, доки відбувається гідроліз
ГТФ.
Припинення дії трансдуцину прискорюється під впли-
вом зв’язування ним р-арестину (див. Розділ 4); ос-
субодиниця активує цГМФ фосфодіестеразу, яка перетво-
рює цГМФ на 5-ГМФ (рис. 8-18); цГМФ забезпечує
Рис. 8-15. Вплив світла на транспортування йонів у фоторе-
цепторних клітинах. У темряві І\Іа+-канали зовнішнього сег-
мента відкриті завдяки цГМФ. Світло зумовлює перетворення
цГМФ на 5’-ГМФ, що призводить до закриття частини каналів
і гіперполяризації синаптичного закінчення фоторецептора.
утримання Ка+-каналів відкритими, зменшення ж цито-
плазматичної концентрації цГМФ призводить до закриття
частини цих каналів. Це спричинює виникнення потен-
ціалу гіперполяризації.
Внутрішньо-
дискова
поверхня
Мембрана
диска
палички
Цито-
плазматична
поверхня
Рис. 8-16. Схематичне відтворення структури родопсину, що
відображає локалізацію ретиналю1 Я у мембрані диска па-
лички.
148 / РОЗДІЛ 8
Цикл реакцій, описаних вище, відбувається дуже швид-
ко і посилює дію світлового сигналу. Ефект підсилення дає
змогу пояснити надзвичайно високу чутливість паличкових
фоторецепторів, які здатні генерувати відповідь навіть на
один фотон світла.
Після набуття повної транс-конфігурації, ретиналЬ] від-
окремлюється від опсину (явище вибілювання). Частина
родопсину підлягає прямій регенерації, частина ретиналЮ]
за наявності НАДН відновлюється ензимом алкогольдегід-
рогеназою до вітаміну Ар який, відповідно, взаємодіє зі
скотопсином для формування родопсину (див. рис. 8-17).
Усі означені реакції, за винятком утворення повного транс-
ізомеру ретиналю , не залежать від інтенсивності освіт-
лення і відбуваються однаково добре на світлі та в темряві.
Кількість родопсину у рецепторах обернено пропорційно
залежить від інтенсивності освітлення.
Піґменти колбочок
У приматів є три різновиди колбочок. Ці рецептори
забезпечують кольорове сприйняття зображень і максимум
чутливі до світлових променів з довжиною хвилі 440, 535
та 565 нм (див. нижче). Кожен з них містить ретиналЬ] та
опсин. Опсин колбочок нагадує той, який належить до
складу родопсину паличок. Його молекула семиразово про-
низує мембрану колбочки і має свої особливості у кожного
типу колбочок. Як зазначено, плазмолема колбочки, інва-
гінуючись, утворює мішечки, на відміну від дисків, харак-
терних для паличок. Відповідь колбочок на світлове по-
Родопсин
Ретинал^
НАД*
Вітамін Ат
И-цис-ретиналЬт
і
Повний транс-ретиналь.
+ Скотопсин
НАДН
+ Скотопсин
Рис. 8-17. Угорі: структура ретиналю1 з відображенням 11-
ф/с-конфігурації (суцільні лінії) та зумовленого світлом пере-
ходу до повної т/ла/ус-конфігурації молекули (штрихові лінії).
Унизу: вплив світла на родопсин.
Мембрана зовнішнього сегмента
цГМФ і
фосфо-
Родопсин Трансдуцин діестераза
Рис. 8-18. Початкові етапи перетворення світла в паличках.
Світло активує родопсин, який стимулює зв’язування ГТФ
трансдуцином. Це, відповідно, активує фосфодіестеразу, яка
каталізує перетворення цГМФ на 5’-ГМФ. Як наслідок, зни-
ження внутрішньоцитоплазматичноі концентрації цГМФ приз-
водить до закриття регульованих цГМФ йонних каналів.
дразнення загалом нагадує реагування паличок. Світло
активує ретинальр який, відповідно, активує білок Сгі2, що
має деякі відмінності від трансдуцину паличок; 6(2 активує
фосфодіестеразу, каталізуючи перетворення цГМФ на 5 '-
ГМФ. Результатом є закриття №+-каналів між позаклітин-
ною рідиною і цитоплазмою колбочки, зменшення внут-
рішньоклітинної концентрації та гіперполяризація
синаптичного закінчення.
Послідовність реакцій, унаслідок яких світлове подраз-
нення фоторецепторних клітин призводить до генерування
сигналу у наступному нейральному елементі сітківки, під-
сумована на рис. 8-19.
Ресинтез циклічного ГМФ
Світло зменшує у фоторецепторах концентрацію Са2+ і
№'. Зниження рівня Са2+ активує гуанілатциклазу, яка
генерує утворення цГМФ. Вона також пригнічує активо-
вану світлом фосфодіестеразу. Обидва означені ефекти
сприяють поверненню фоторецепторів до вихідного стану
шляхом відкриття N3’-каналів.
Синаптичні трансмітери сітківки
У сітківці виявлено багато різноманітних синаптичних
трансмітерів, серед них ацетилхолін, глютамат, дофамін,
серотонін, ГАМК, гліцин, речовина Р, соматостатин, тиро-
тропін-рилізинг гормон, гонадотропін-рилізинг гормон,
енкефаліни, р-ендорфіни, холецистокінін, вазоактивний
інтестинальний поліпептид, нейротензин та глюкагон (див.
Розділ 4). Каїнатні рецептори беруть участь у забезпеченні
синаптичних зв’язків між колбочками та одним із
різновидів біполярних клітин. Амакринні клітини єдині
серед клітин сітківки синтезують ацетилхолін. У деяких
видів хребетних гварин клітини, що локалізуються на межі
ЗІР/149
Світло, що падає
І
Структурні зміни
ретиналю1 фотопіґменту
І
Конформаційні зміни
фотопіґменту
І
Активування трансдуцину
І
Активування фосфодіестерази
І
Зменшення внутрішньоцито-
плазматичної концентрації цГМФ
І
Закриття ІМа+-каналів
І
Гіперполяризація
І
Зменшення вивільнення
синаптичного нейротрансмітера
І
Відповідь біполярних клітин
та інших нейронних елементів
Рис. 8-19. Послідовність перетворень світла в паличках і кол-
бочках.
внутрішнього ядерного і внутрішнього сітчастого шарів
(див. рис. 8-2), виділяють дофамін, що дифундує по всій
сітківці. Один з ефектів дофаміну виявляється у його впливі
на щілинні контакти, які забезпечують вільне проходження
йонних потоків між горизонтальними клітинами у темряві,
збільшуючи цим розміри рецепторних полів фоторецеп-
торів. Світло зменшує йонні потоки і роз’єднує зв’язки між
горизонтальними клітинами, що досягається завдяки зрос-
танню продукування дофаміну за умов денного світла.
Формування зображень
Опрацювання зорової інформації в сітківці передбачає
формування трьох зображень. Перше зображення, яке
утворюється внаслідок дії світлових променів на фоторе-
цептори, перетворюється у друге у біполярних клітинах, а
те, відповідно, трансформується у третє в гангліонарних
клітинах. Під час формування другого зображення сигнал
модифікують горизонтальні клітини, а під час формування
третього - амакринні. Зміни у разі проходження імпульсів
через бічні колінчасті тіла є незначними, тому третє зобра-
ження досягає потиличних зон кори мозку.
Характерним для біполярних та гангліонарних клітин
(як і для клітин бічних колінчастих тіл і клітин четвертого
шару зорової кори) є те, що вони найліпше реагують на
малі округлі подразники, а також те, що в межах одного
рецепторного поля кільце світла навколо темного центра
(окреслене освітлення) гальмує відповідь центральної точ-
ки (рис. 8-20). Центр може бути збуджувальним з гальму-
ванням реагування на периферії (“центральноувімкнена”
клітина) або гальмівним зі збудженням на периферії (“цент-
ральновимкнена” клітина). Гальмування центральної від-
повіді прилеглими збудженими ділянками, правдоподібно,
відбувається внаслідок механізму від’ємного зворотного
зв’язку між сусідніми фоторецепторами, що виникає за
участю горизонтальних клітин. Наприклад, активація
сусідніх фоторецепторів світловим кільцем ініціює гіпер-
поляризацію горизонтальних клітин, які, відповідно, галь-
мують відповідь центральних фоторецепторів. Гальмуван-
ня центральної відповіді шляхом підвищення інтенсив-
ності освітлення периферії є прикладом латерального, або
аферентного, гальмування - своєрідної форми гальму-
вання, за якої активація окремого нейрального елемента
поєднується з гальмуванням прилеглих елементів. Це є
загальним принципом дії сенсорних систем ссавців, який
загострює сприйняття подразнень і поліпшує розпізна-
вання.
Електроретинограма
Електрична активність ока вивчена шляхом записування
коливань різниці потенціалів між електродом усередині ока
та іншим електродом на його задній поверхні або під час
дослідження ока людини між поверхнею рогівки та шкірою
голови. Спалах світла спричинює характерну послідовність
хвиль: швидкі хвилі а та Ь, пов’язані з електричною актив-
ністю сітківки, та повільну хвилю с, Генеровану пігментним
епітелієм. Електроретинограма може допомогти в діаг-
ностиці захворювань ока у тих випадках, коли огляд сіт-
ківки неможливий з огляду на мутність середовищ ока. Цей
метод обстеження також дає змогу діагностувати вроджені
дистрофії сітківки, за яких офтальмоскопія виявляється
неефективною.
ВІДПОВІДІ ЗОРОВИХ ШЛЯХІВ І КОРИ
Шляхи до кори мозку
Аксони гангліонарних клітин забезпечують детальну
просторову проекцію сітківки на бічне колінчасте тіло.
Кожне колінчасте тіло має шість відокремлених шарів
клітин (рис. 8-21). Шари 3-6 утворені дрібними клітинами,
тому їх називають дрібноклітинними. Шари 1-2 містять
великі клітини і, відповідно, їх називають великоклітин-
ними. Шари 1,4 та 6 кожного колінчастого тіла отримують
імпульси від ока протилежного боку, тоді як шари 2, 3 та 5
- від ока того ж боку. У кожному шарі є надзвичайно дета-
лізоване відображення сітківки, і усі шість шарів перебу-
вають у певній взаємозалежності, тобто рецепторні поля
клітин, що локалізовані вздовж проведеного через шари
перпендикуляра, практично збігаються. Зазначимо, що
лише 10-20% імпульсів, які виходять із бічного колінчас-
того тіла, досягають сітківки. Значна частина додаткових
імпульсів походить із зорової кори та інших ділянок мозку.
Механізм зворотного зв’язку із зоровою корою має важливе
значення у просторовій орієнтації та координації рухів.
У сітківці розрізняють два різновиди гангліонарних
клітин: великі гангліонарні клітини (або М-клітини від лат.
гладиш - великий), які сприймають імпульси від різних
типів колбочок і пов’язані з координацією рухів та об’єм-
ним зором, і малі гангліонарні клітини (або Р-клітини від
лат. рагупз - малий), які розрізняють імпульси, що надхо-
150/РОЗДІЛ 8
Світло
Центральне поле
у разі вмикання світла
Центральне
освітлення
Центральне поле
у разі вимикання світла Світло
Рис. 8-20. Відповідь гангліонарних клітин сітківки на світло, що падає на частини їхніх рецепторних полів, показаних білим
кольором. Біля діаграми кожного рецепторного поля наведена діаграма відповіді гангліонарної клітини, визначена шляхом
позаклітинної реєстрації потенціалів дії. Зверніть увагу на те, що у трьох випадках із чотирьох інтенсивність розряду посилюється
після вимкнення світла (модифіковано з КапсІеІ Е, 8сН\л/агїг ЛЧ, □еззеІІ ТМ [есіііогз]: Ргіпсіріез ої ІМеигаІ Зсіепсе, 41Н есі. Мс6га\л/-
НіІІ, 2000).
дять від різних типів колбочок і забезпечують сприйняття
кольору, структури та форми об’єктів. Великі клітини про-
ектують імпульси на великоклітинні шари бічного колін-
частого тіла, тоді як проекція Р-клітин відбувається на дріб-
ноклітинні шари (рис. 8-22).
Від бічного колінчастого тіла велико- і дрібноклітинні
шляхи проходять до зорової кори. По велико клітинних
шляхах від шарів 1 та 2 (див. рис. 8-21) надходять сигнали,
що стосуються сприйняття рухів, глибини і мерехтіння зоб-
ражень. Дрібноклітинні шляхи передають від шарів 3-6
сигнали, що стосуються кольорів, форми і структури, а
також тонких деталей об’єктів спостереження.
Клітини міжпластинчастих ділянок бічного колінчас-
того тіла також отримують імпульси від Р-клітин, імовірно,
через дендрити, що пронизують дрібноклітинні шари.
Вони проектуються через окремий компонент дрібноклі-
тинних шляхів до плямок зорової кори (див. нижче).
Первинна зорова кора
Подібно до того, як аксони гангліонарних клітин забез-
печують просторове відтворення сітківки у бічному колін-
частому тілі, це колінчасте тіло точка за точкою забезпечує
аналогічне відтворення у первинній зоровій корі (див. рис.
8-5). З кожним нервовим волокном у зоровій корі контактує
значна кількість нервових клітин. Як і інші ділянки нової
кори, зорова кора складається з шести шарів (див. рис. 11-
2). Аксони клітин бічного колінчастого тіла, що формують
великоклітинний шлях, закінчуються у шарі 4, а точніше,
у його найглибшій частині - 4С. Багато аксонів дрібно-
клітинного шляху також закінчуються у шарі 4С, а аксони
міжпластинчастих клітин - у шарах 2 і 3.
Шари 2 та 3 кори мозку містять скупчення клітин діа-
метром близько 0,2 мм, які мають вибірково високий рівень
мітохондріального ензиму цитохромоксидази. Ці клітинні
кластери названо плямками (блобсами, від англ. ЬІоЬз)
(див. рис. 8-22). Вони утворюють своєрідну мозаїку у зоро-
вій корі і пов’язані зі сприйняттям кольорів. Дрібно-
клітинний шлях також несе інформацію про зустрічні
кольори до глибокої частини шару 4 (див. нижче).
Подібно до гангліонарних клітин нейрони бічного колін-
частого тіла та шару 4 зорової кори відповідають на подраз-
нення їхніх рецепторних полів збудженням центра і галь-
муванням периферії або, навпаки, гальмуванням центра і
збудженням периферії. Смуга світла, що покриває центр,
слугує ефективним подразником, оскільки збуджує пере-
важно центр і значно менше - периферію. Ця смуга не має
орієнтаційної переваги (преференції) і як подразник одна-
ково ефективна за будь-якого кута падіння.
Відповідь на подразнення нейронів інших шарів зорової
кори суттєво відрізняється. Так звані прості клітини реа-
гують на світлові смуги, лінії або краї лише у тому випадку,
коли вони мають певну орієнтацію у просторі. Якщо,
наприклад, світлова смуга повернута всього на 10° щодо
преферентної орієнтації, то інтенсивність відповіді простої
клітини послаблюється, а якщо кут повертання збільшити,
то відповідь зникне цілковито. Є також складні клітини,
подібні до простих тими перевагами, що вони надають орі-
єнтаційну преференцію лінійним подразникам, проте вод-
ночас вони менш залежні від локалізації подразників у
зоровому полі порівняно з простими клітинами або кліти-
нами шару 4. Складні клітини звичайно генерують макси-
мальну відповідь, якщо лінійний стимул зсунути латераль-
ніше без зміни його орієнтації у просторі. Ймовірно, склад-
ні клітини отримують імпульси від простих клітин.
Якщо у зорову кору мозку перпендикулярно до її
поверхні помістити мікроелектрод і поступово заглиблю-
вати його у різні шари, то орієнтаційна преференція ней-
ронів буде незмінною. Отже, зорова кора, подібно до сома-
тосенсорної (див. Розділ 7), організована у вигляді верти-
кальних колонок, що пов’язані з орієнтацією (орієнтаційні
колонки). Кожна колонка має близько 1 мм у діаметрі.
Орієнтаційні преференції сусідніх колонок упорядковано
змінюються. У разі пересування від колонки до колонки
орієнтаційна преференція послідовно змінюється в межах
ЗІР/151
Первинна зорова кора
(поле 17)
Рис. 8-21. Проекції гангліонарних клітин з правої половини
сітківки кожного ока до правого бічного колінчастого тіла і
далі до правої первинної зорової кори. Зверніть увату на шість
шарів колінчастого тіла. Гангліонарні Р-клітини проектуються
на шари 3-6, гангліонарні М-клітини - на шари 1 та 2. Іпси- (І)
та контрлатеральні (С) очі проектуються на шари, що чергу-
ються. Не показані клітини міжшарових ділянок, які проекту-
ються через окремі компоненти дрібноклітинного шляху на
плямки зорової кори (модифіковано з КапсІеІ Е, ЗсНмагіг ЗН,
ЗеззеІІ ТМ [есіііогз]: Ргіпсіріез ої ІМеигаІ Зсіепсе, 41Н есі.
Мсбгату-НіІІ, 2000).
5-10° (рис. 8-23). Тому правдоподібно, що для представ-
ництва рецепторного поля кожної гангліонарної клітини
сітківки у зоровому полі кори є набір колонок у межах
дрібних ділянок цього поля, що охоплюють усі можливі
варіанти орієнтаційних преференцій у межах повних 360°.
Прості і складні клітини називають детекторами ознак,
оскільки вони сприймають і аналізують специфічні особ-
ливості того або іншого подразника. Детектори ознак
виявлені також у кіркових представництвах інших органів
чуття.
Орієнтаційні колонки можна картувати за допомогою
радіоактивної 2-дезоксиглюкози. Засвоєння цього похід-
ного глюкози пропорційне до активності нейронів (див.
Розділ 32). Якщо це позначення застосувати для дослід-
ження тварин, яких подразнюють рівномірно розміщеними
світловими стимулами, такими як вертикальні лінії, то
мозок виявляє значну кількість складно укладених рівно-
мірно розподілених орієнтаційних колонок на великій пло-
щі зорової кори.
Ґангліональні М
клітини
Бічне Велико-
колінчасте клітинні
тіло пластинки
Зорова
кора
Функція
Поверхневий
шар А4
І
Рух,
розташування,
просторова
організація
Р
Міжплас- Дрібно-
тинчасті-----клітинні
ділянки пластинки
І І
Плямки Глибокий
шар А4
І
Колір Форма,
колір
Рис. 8-22. Організація зорових шляхів. Гангліонарні М-клітини
проектуються на великоклітинні пластинки бічного колінчас-
того ядра, а гангліонарні Р-клітини - на дрібноклітинні плас-
тинки; Р-клітини утворюють також контакти з міжпластинчас-
тими клітинами, ймовірно, за допомогою дендритів.
Іншою особливістю зорової кори є наявність колонок
домінування очей. Окремі клітини колінчастого тіла і
шару 4 кори отримують вхідні імпульси лише від одного
ока. Реалізація функціонування клітин шару 4 та клітин
колінчастого тіла відбувається почергово. Якщо в одне око
ввести велику кількість амінокислоти з радіоактивним
позначенням, то ця амінокислота ввійде до складу синтезо-
ваного білка і за допомогою аксонного транспортування
буде перенесена до закінчень гангліонарних клітин, а далі
- через синапси у колінчастих тілах по колінчасто-шпорних
волокнах до зорової кори. У шарі 4 кори позначені закін-
чення, що надходять від ока з радіоізотопом, чергуються
із нерадіоактивними закінченнями, що надходять від
іншого ока. Результатом є характерне чергування світлих і
темних смужок, що охоплює значну частину зорової кори
(рис. 8-24), і є незалежним від сітки орієнтаційних колонок.
Близько половини простих і складних клітин отримують
імпульси від обох очей. Ці імпульси є ідентичними або
близькими з огляду на охоплену зону зорової кори та пре-
ферентну орієнтацію. Однак вони відрізняються силою
імпульсів, і, окрім клітин, до яких імпульси надходять лише
від іпси- або контралатерального ока, є значна кількість
клітин, що перебувають під впливами різного ступеня вира-
женості з обох очей.
Отже, первинна зорова кора розподіляє інформацію, яка
стосується кольору, та інформацію про форму і рух об’єк-
тів, інтегрує імпульси від обох очей і перетворює видимий
світ у короткі відрізки різної просторової орієнтації.
Інші поля мозкової кори, пов’язані з зором
Як зазначено вище, первинна зорова кора (V1) проек-
тується у багато різних ділянок потиличної частки та інші
частини мозку. Ці ділянки часто ідентифікують номерами
(У2, УЗ та ін.) або літерами (ЬО, МТ та ін.). Локалізація
деяких із цих ділянок у мозку людини показана на рис. 8-
25, а їхні ймовірні функції наведені у табл. 8-1. Функції
означених ділянок досліджували у мавп, навчених вико-
152/РОЗДІЛ 8
Рис. 8-23. Угорі: орієнтаційні преференції 15 нейронів, що
локалізувалися на шляху косого введення електрода у зорову
кору. Перевага в орієнтації змінюється поступово в напрямі
проти руху годинникової стрілки. Унизу: результати анало-
гічного експерименту зіставлені з довжиною шляху, пройде-
ного електродом. У цьому випадку зафіксовано численні зміни
напряму ротації (модифіковано і відтворено за дозволом з
НиЬеІ ОН, \Л/іезеІ ТІ\Г Зециепсе гедиіагііу ої огіепіаііоп сої-
игппз іп ІЬе топкеу зігіаіе согїех. З Сотр ІМеиго11974; 158:267).
нувати різні завдання, у мозок яких пізніше були імплан-
товані мікроелектроди. Крім цього, використання зобра-
жень ПЕТ та функційного ЯМР (див. Розділ 16 та Додаток)
уможливило виконання складних досліджень зорового
пізнання та інших зорових функцій кори мозку здорових
людей за умов повної свідомості. Зорові проекції з VI
можна розділити на дорсальні, або тім’яні шляхи, функ-
ція яких пов’язана переважно з рухом, та вентральні, або
скроневі шляхи, пов’язані з розпізнанням конфігурації,
форми та облич. Окрім того, є багато перехресних зв’язків.
Зорове поле У8 у людини, правдоподібно, має унікальну
відповідальність за кольоровий зір.
Як відомо, відбувається паралельне проходження зоро-
вої інформації по численних шляхах. Відповідно до поки
Рис. 8-24. Реконструкція колонок домінування очей у сегменті
шару 4 частини право! зорової кори мавпи. Темні смужки ре-
презентують одне око, світлі - інше (відтворено за дозволом
з І_еУау 8, НиЬеІ ОН, МіезеІТІМ: ТЬе раКегп ої осиїаг сіоті-
папсе соїитпз іп тасацие уізиаі согїех геуеаіесі Ьу гебисесі
зііуєг зіаіп. З Сотр ІМеигоІ 1975; 159:559).
що невідомого механізму вся ця інформація поступово
інтегрується у сприйняття свідомого зорового образу.
КОЛЬОРОВИЙ ЗІР
Характеристики кольору
Колір має три головні характеристики: відтінок, інтен-
сивніть та насиченість (її визначають як ступінь відсут-
ності білого кольору). Для кожного кольору є комплемен-
тарний колір, змішування з яким у відповідній пропорції
дає білий колір. Сприйняття чорного кольору зумовлене
відсутністю світла, однак воно, ймовірно, несе позитивну
інформацію, оскільки сліпе око не бачить чорного: воно
не бачить нічого. Відомі явища послідовних і паралельних
контрастів, оптичних ілюзій, що дають відчуття кольору,
коли його нема, негативні та позитивні залишкові образи,
а також різноманітні психологічні аспекти кольорового
зору. Детальна характеристика цих явищ не є метою цієї
книги.
Іншим чинником, що має важливе значення, є змога
отримання білого або будь-якого іншого кольору спектра і
навіть позаспектрального пурпурного кольору шляхом змі-
шування у різних пропорціях червоного (довжина хвилі
723-647 нм), зеленого (575-492 нм) та синього (492-
450 нм) світла. Саме тому червоний, зелений і синій нази-
вають первинними кольорами. Ще одним важливим
чинником є спостереження, зроблене Ландом, відповідно
до якого сприйняття кольору частково залежить також від
кольору інших об’єктів у полі зору. Наприклад, червоний
предмет сприймається як червоний, якщо його освітлено
зеленим або синім світлом, проте він набуває блідо-роже-
вого або навіть білого кольору у випадку освітлення чер-
воним світлом.
ЗІР/153
Рис. 8-25. Частина головних зон первинної зорової кори (VI) мозку людини. Вигляд збоку і зсередини. Див. також табл. 8-1
(модифіковано з ЬодоіНеііз ІЧ: 7ізіоп: а \л/іпсіо\л/ оп сопзсіоизпезз. 8сі Ат [ІМоу] 1999;28:99).
Сітківкові механізми
Теорія кольорового зору Юнґа-Гельмгольца перед-
бачає наявність у людини трьох типів колбочок, кожен з
яких містить особливий світлочутливий пігмент з макси-
мальною чутливістю до одного із трьох первинних кольо-
рів, а відчуття будь-якого кольору визначене відносною
частотою імпульсів від кожного типу колбочок.
Правильність цієї теорії доведена за допомогою іден-
тифікації та хімічної характеристики кожного з трьох піг-
ментів. Один із них (синьочутливий, або короткохвильовий
пігмент) має максимум поглинання у синьо-фіолетовій
частині спектра (рис. 8-26); інший (зеленочутливий, або
середньохвильовий) - у зеленій, а ще інший (червоно-
чутливий, або довгохвильовий) - у жовтій частині спектра.
Колбочки з максимальною чутливістю у жовтій частині
спектра достатньо чутливі також у його червоній частині,
Таблиця 8-1. Функція ділянок зорових проекцій мозку
людини1
VI Первинна зорова кора; отримує імпульси з
бічних колінчастих ядер, розпочинає
опрацювання інформації стосовно
орієнтації, країв об’єктів тощо
V2, V3, VР Продовжують опрацювання зображень,
мають більші зорові поля
VЗА Рух
V4V Функція невідома
МТА/5 Контролювання руху
І_О Розпізнавання великих об’єктів
V? Функція невідома
V8 Кольоровий зір
1 Модифіковано з ЬодоІНеІіз ІЧ: VІ8іоп: а \л/іпсіо\л/ оп сопзсіоиз-
пез8. 8сі Ат (Моу) 1999,281:99.
маючи для червоного світла нижчий поріг збудження, ніж
для зеленого. Усі ці експериментальні дані задовольняють
вимоги теорії Юнґа-Гельмгольца.
У людини ген родопсину локалізований на 3-й хро-
мосомі, а ген, що кодує синтез синьочутливого 8-пігменту
колбочок, - на 7-й. Два інші пігменти колбочок кодовані
двома спареними генами, що розміщені на ц-плечі X-
хромосоми. Зеленочутливий пігмент М та червоночутли-
вий пігмент Ь подібні за будовою: їхні опсини виявляють
96% гомології амінокислотного складу, тоді як кожен з цих
пігментів має лише 43% гомології з опсином синьочут-
ливого пігменту, й усі три колбочкові пігменти виявляють
близько 41% гомології з родопсином. Багато ссавців є ди-
хроматами, тобто мають лише два типи колбочкових піг-
ментів - коротко- та довгохвильовий. Мавпи Старого Світу
і люди є трихроматами з окремими середньо- та довго-
хвильовими пігментами, що, ймовірно, було зумовлене
дублікацією довгохвильового гена предків з наступною
дивергенцією.
Недавно виявлено, що в межах людської популяції є
певні варіанти довгохвильових (червоночутливих) пігмен-
тів. Віддавна відомо, що відповідь на пропорцію Рейлі,
тобто співвідношення кількості червоного і зеленого світ-
ла, яке різні індивіди змішують для отримання монохрома-
тичного оранжевого, є бімодальною.
Цей феномен добре пояснюють нові дані про те, що
62% осіб з нормальним кольоросприйняттям у 180-му
положенні ланцюга довгохвильового опсину колбочок
мають залишок серину, тоді як решта 38% - аланіновий
залишок.
Пік поглинання пігменту в осіб з сериновим залишком
у 180-му положенні відповідає довжині хвилі 556,7 нм,
тобто цей варіант пігменту є чутливішим до червоного
світла, тоді як крива осіб з аланіновим залишком має пік
поглинання 552,4 нм.
154/РОЗДІЛ 8
Довжина хвилі, нм
Рис. 8-26. Спектри поглинання трьох типів колбочкових піґ-
ментів сітківки людини. Піґмент 8 з піком поглинання 440 нм
забезпечує сприйняття синього, а піґмент М з піком погли-
нання 535 нм - зеленого кольорів. Піґмент І_ з піком погли-
нання 565 нм (жовтий колір спектра) сприймає також довгі
хвилі червоної частини спектра (відтворено за дозволом з
МісНаеі СР: Соіог уізіоп. N Епді 3 Месі 1973;288:724).
Нервові механізми
Інформацію про колір передають гангліонарні клітини,
які віднімають або додають імпульси, що надходять від
колбочок різних типів. Опрацювання інформації у гангліо-
нарних клітинах та нейронах бічного колінчастого тіла
забезпечує формування імпульсів, що трьома різними шля-
хами надходять до VI: червоно-зелений шлях передає
сигнали, які відображають різницю між відповідями Ь- та
М-колбочок; синьо-жовтий шлях - сигнали, що відобра-
жають різницю між відповіддю 8-колбочок та сумарною
відповіддю Ь- і М-колбочок; третій шлях - сумарну відпо-
відь Ь- та М-колбочок. Ці три шляхи проектуються на зону
плямок та глибоку частину шару 4С поля VI. Від зони
плямок та шару 4 інформація стосовно кольору передається
до поля У8. Механізм подальшої трансформації сигналів,
що надходять до V8, у відчуття кольору, до цього часу не
з’ясований.
Кольорова сліпота
Є численні тести для виявлення кольорової сліпоти.
Найпоширеніші - це підбір ниток відповідного кольору і
таблиці Ішігара (в Україні використовують поліхроматичні
таблиці Рабкіна). У першому варіанті обстежуваному
дають набір ниток різного кольору і пропонують виокре-
мити нитки подібних кольорів. Таблиці Ішігара та подібні
до них містять цифри, що складаються з різноколірних пля-
мок, фоном для яких слугують подібні за формою плямки
іншого кольору. Цифри навмисне намальовані кольорами,
що зливатимуться з фоном для особи, що має кольорову
сліпоту.
Частина осіб з кольоровою сліпотою не здатні розріз-
няти певні кольори (анопія), тоді як інші мають лише
ослаблене сприйняття кольорів (аномалія). Префікси прот-,
дейтер- та трит- стосуються дефектів червоної, зеленої та
синьої колбочкових систем, відповідно. Осіб з нормаль-
ним кольоросприйняттям, а також осіб з протаномалією,
дейтераномалією та тританомалією називають трихрома-
тами: у них наявні усі три колбочкові системи, одна з яких
може бути ослабленою. Дихроматами є особи, що мають
лише дві колбочкові системи: у них може бути протанопія,
дейтеранопія або тританопія. Монохромати мають тільки
одну колбочкову систему. Дихромати можуть урізноманіт-
нювати спектр свого кольоросприйняття шляхом комбі-
нування двох первинних кольорів, монохромати можуть
лише змінювати інтенсивність одного кольору.
Кольорова сліпота найчастіше є спадковим захворюван-
ням. Іноді вона простежується в осіб з ушкодженнями поля
V8 (див. вище), у яких виникає ахроматопсія. Окрім того,
в чоловіків, які уживають віагру для лікування еректильної
дисфункції, виникає тимчасова слабкість сприйняття си-
ньо-зеленого кольору, оскільки цей лікарський засіб при-
гнічує активність фосфодіестерази сітківки (див. Розділ 23).
Успадкування кольорової сліпоти
Популяційні дослідження осіб, що походять з кавказь-
кого регіону дали змогу виявити, що аномалії кольоро-
сприйняття успадковують 8% чоловіків та 0,4% жінок.
Тританомалія та тританопія порівняно мало поширені і
не виявляють статевої вибірковості. Близько 2% чоловіків
з кольоровою сліпотою є дихроматами з протанопією або
дейтеранопією, близько 6% є аномальними трихроматами
з порушеною спектральною чутливістю червоно- або зеле-
ночутливого пігментів. Ці аномалії успадковані за рецесив-
ним типом і пов’язані з Х-хромосомою, тобто з’являються
за наявності аномального гена у складі Х-хромосоми.
Оскільки всі соматичні клітини чоловічого організму
додатково до 44 аутосом містять одну X- та одну У-хро-
мосому (див. Розділ 23), то кольорова сліпота виникає у
чоловіків за наявності дефектного гена в складі їхньої X-
хромосоми. Соматичні клітини жіночого організму містять
дві Х-хромосоми - по одній від кожного з батьків. З огляду
на рецесивний характер успадкування цієї патології кольо-
рова сліпота виявляється у жінок тільки за наявності
дефектних генів в обох Х-хромосомах. Половина дівчаток,
народжених від чоловіків з Х-зумовленою кольоровою
сліпотою, є носіями прихованої кольорової сліпоти і пере-
дають цей дефект половині своїх синів. Тому пов’язана з
Х-хромосомою кольорова сліпота перескакує через поко-
ління і виявляється у чоловіків кожного другого покоління.
Гемофілія, міодистрофія Дюшенна та багато інших спад-
кових захворювань зумовлені мутаціями генів Х-хромосо-
ми.
Порівняно значне поширення дейтер- та протаномалії,
ймовірно, пов’язане з молекулярною організацією генів,
що кодують синтез зелено- та червоночутливих пігментів
колбочок. Вони розміщені один біля одного (спарені “голо-
вою до хвоста” у складі ц-плеча Х-хромосоми) і схильні
до нерівнозначної гомологічної рекомбінації (нерівнознач-
ний кросинговер) у процесі розвитку статевих клітин. Це
призводить до виникнення гібридних пігментів зі зміненою
просторовою чутливістю; значна кількість таких гібридів
уже досліджена й описана.
ІНШІ АСПЕКТИ ЗОРОВОЇ ФУНКЦІЇ
Темнова адаптація
Надзвичайно широкий діапазон освітлення, на яке
здатне реагувати людське око, показаний на рис. 8-27. Якщо
людина тривалий час перебуває в умовах яскравого освіт-
ЗІР/155
лення і раптом переходить у слабко освітлене середовище,
то сітківка поволі, у міру звикання до темряви, стає щораз
чутливішою до світла. Це зниження зорового порога нази-
вають темновою адаптацією. Темнова адаптація майже
цілковито завершується протягом 20 хв, хоча незначне
зниження порога світлового подразнення простежується
й пізніше. З іншого боку, коли людина раптово переходить
з умов слабкої освітленості у яскраво освітлене середови-
ще, то виникає відчуття надмірно інтенсивного, неприєм-
ного освітлення, аж доки очі не адаптуються до нових умов,
і не підвищиться поріг світлового подразнення. Таку адап-
тацію називають світловою адаптацією, вона триває
близько 5 хв, хоча насправді у цьому випадку відбувається
просте зникнення темнової адаптації.
Фактично у розвитку темнової адаптації можна виділи-
ти два компоненти (рис. 8-28). Перше зниження рівня зо-
рового порога відбувається швидко і на незначну глибину
завдяки темновій адаптації колбочок, що виявлено під час
дослідження ямкової, безпаличкової ділянки сітківки. Дру-
ге зниження порога чутливості виникає у периферійних
ділянках сітківки внаслідок адаптації паличок. Діапазон змі-
ни порога чутливості між оком, адаптованим до світла, та
цілковито адаптованим до темряви, надзвичайно великий.
Радіологи, пілоти літаків та інші особи можуть, у разі
потреби, зменшити 20-хвилиний період темнової адаптації,
якщо за умов яскравого освітлення використовуватимуть
захисні окуляри з червоним склом. Червоні хвилі у випадку
незначного стимулювання паличок забезпечують порів-
няно добре функціонування колбочок. Тому особа, що
використовує червоні окуляри, може добре бачити за яскра-
вого освітлення протягом того часу, доки відбувається тем-
нова адаптація паличок.
Час темнової адаптації також залежить від часу, необхід-
ного для нагромадження запасів родопсину. За умов яскра-
вого освітлення велика кількість цього пігменту постійно
руйнується, тому в разі слабкого освітлення потрібен де-
який час, щоб нагромадилася кількість пігменту, необхідна
для нормального функціювання паличок. Колбочки також
підлягають темновій адаптації, однак у цьому випадку, без
сумніву, залучені додаткові чинники.
Вплив на око вітамінної недостатності
З огляду на важливість вітаміну А у синтезі ретиналЮ]
не дивно, що авітаміноз А зумовлює аномалії зору. Серед
інших проявів, однією з перших розвивається нічна сліпота
(нікталопія). Цей феномен спершу привернув увагу до
значення вітаміну А у діяльності паличок; пізніше з’ясува-
лося, що дефіцит вітаміну А призводить також до дегене-
рації колбочок. Тривала недостатність цього вітаміну су-
проводжується змінами морфології паличок і колбочок з
наступною дегенерацією нейральних елементів сітківки.
Вітамінотерапія сприяє відновленню функції сітківки,
якщо вона розпочата до початку руйнування рецепторів.
Інші вітаміни, особливо групи В, також потрібні для
нормальної діяльності сітківки та інших нейрональних тка-
нин.
Гострота зору
Сакадовані рухи очних яблук (див. нижче) є одним із
багатьох чинників, що забезпечують гостроту зору. Цей
0,0000001
0,000001
0,00001
0,0001
Нижній поріг зору після"
темнової адаптації
Біла поверхня в
освітленні безмісячного
нічного неба
Світло-
>сприйняття
паличками
0,001 -
0,01 -1 Освітлена місяцем
/ біла поверхня [Перехідна
0,1 “І Читання газети з І 30на
1 _] певними труднощами І
10
100
1000
10 000
100 000
1 000 000
10 000 000
Комфортне читання
ї Освітлення для тонких
/зорових операцій
1 Аркуш білого паперу за
І умов яскравого
сонячного освітлення
у Нитка увімкненої
/лампи розжарення
,00 000 000
1 000 000 000 -уСонце
Світло-
>сприйняття
колбочками
Руйнування
сітківки в разі
тривалого
опромінення
Перші 3 мс після
вибуху атомної бомби
10 000 000 000
Рис. 8-27. Діапазон випромінювання, на яке реагує око лю-
дини, з характеристикою механізмів світосприйняття (відтво-
рено за дозволом СатрЬеІІ Е\А/ з ВеІІ ОН, Етзііе О, Раіегзоп
СН: ТехіЬоок оТ РНузіоІоду апсі ВіосНетізігу, 9іЬ есі. СНигсНіІІ
Ьмпдзїопе, 1976).
показник зорової функції не можна плутати із зоровим
порогом - мінімальною кількістю освітленості, що дає
відчуття світла. Гострота зору - це ступінь сприйняття дета-
лей та контурів об’єкта. Хоча є точніші способи, гостроту
зору звичайно визначають як роздільний мінімум - най-
коротшу відстань, на якій дві лінії сприймаються як окремі,
не зливаючись. Клінічно гостроту зору визначають за допо-
могою таблиць Снеллена (ряди літер різного розміру, які
пропонують розпізнати з відстані 6 м (20 футів)). Особі,
яку обстежують, пропонують прочитати вголос найдріб-
ніший рядок, що його вона може розрізнити. Результати
записують у вигляді дробу. Чисельником є відстань до таб-
лиці, а знаменником - найбільша відстань від таблиці, з
якої нормальна особа може прочитати найдрібніший рядок,
що його ще читає на таблиці особа, яку обстежують. Нор-
мальна гострота зору становить 20/20; особа із показником
20/15 має гостроту зору, вищу від норми (однак не дале-
козорість); індивід із гостротою зору 20/100 має поганий
зір. У таблицях Снеллена висота літер в останньому рядку,
що його здорова особа може прочитати з відстані 20 футів,
становить зоровий кут 5Усі лінії в складі літер розділяє
відстань 1' дуги. Отже, мінімальна роздільна здатність
нормального індивіда становить близько 1' зорового кута.
Гострота зору є складним показником, на який впливає
багато різноманітних чинників, зокрема: оптичні, що зале-
156/РОЗДІЛ 8
Тривалість перебування в темряві, хв
Рис. 8-28. Темнова адаптація. Графік змін інтенсивності по-
дразника, потрібної для стимулювання сітківки у випадку слаб-
кого освітлення залежно від тривалості перебування спосте-
рігача у темряві.
жать від стану очних механізмів формування зображень;
чинники, визначені сітківкою (стан паличок і колбочок), а
також чинники, що залежать від якості подразника, у тім
числі його яскравості, контрасту між подразником і фоном,
тривалістю експозиції подразника перед спостерігачем
тощо.
Критична частота злиття
Час роздільної здатності очного яблука визначають
вимірюванням критичної частоти злиття - максимальної
швидкості, з якою можуть змінюватися подразнення і ще
сприйматися відокремлено одне від одного. Подразнення,
які змінюються з більшою частотою, сприймаються цілісно
- як один постійний подразник. Рухомі об’єкти у фільмах
рухаються скоординовано, бо кадри змінюються зі швид-
кістю, що перевищує критичну частоту злиття; у разі спо-
вільнення руху кінопроектора зображення починає мерех-
тіти.
Поля зору та бінокулярний зір
Поле зору кожного ока - це частина зовнішнього світу,
яку бачить це око. Теоретично поле зору повинно бути
округлим, проте насправді медіально його обмежує ніс, а
згори - дах очної ямки (рис. 8-29). Картування поля зору
має важливе значення у неврологічному діагностуванні.
Периферійні частини полів зору картують за допомогою
інструмента периметра, а сам процес картування нази-
вають периметрією. Одне око в цьому випадку заплющу-
ють, а інше фіксують на центральній точці. Маленький
об’єкт переміщують до цієї точки вздовж обраних мери-
діанів, і точку на кожному меридіані, у якій вперше вдалося
побачити об’єкт, позначають у вигляді дугових градусів,
віддалених від центральної точки (див. рис. 8-29). Цент-
ральну частину поля зору картують за допомогою дотич-
ного екрана - чорного фетрового екрана, по якому руха-
ється білий об’єкт. Фіксуючи місця, у яких зникає, а потім
знову з’являється рухомий об’єкт, можна локалізувати сліпу
пляму та інші об’єктивні скотоми - сліпі плями, набуті
внаслідок захворювання.
Центральні частини полів зору обох очей збігаються,
тому будь-який об’єкт у цій частині поля зору розглядають
бінокулярним зором. Імпульси, що виникають під впли-
вом світлових променів в обох сітківках, зливаються на
рівні кори мозку в один образ (злиття). Точки на сітківці,
у які повинне потрапити зображення предмета, щоб цей
предмет у разі бінокулярного зору сприймався як єдине
ціле, називають точками відповідності. Коли під час
спостереження за об’єктом, розташованим у центрі поля
зору, одне око обережно повернути в інший бік, то виникає
подвійне зображення, яке називають диплопією: зобра-
ження на сітківці повернутого ока більше не потрапляє у
точки відповідності.
Бінокулярний зір відіграє важливу роль у сприйнятті
глибини зображень. Окрім того, для сприйняття глибини
зображень мають значення такі монокулярні компоненти,
як відносні розміри об’єктів, їхні тіні, а для рухомих об’єк-
тів - взаємне переміщення (руховий паралакс). Звичайно,
бінокулярний зір посилює відчуття глибини і пропорції.
Вплив ушкоджень зорових шляхів
Анатомія зорових шляхів від очей до мозку показана
на рис. 8-4. Рівень ушкодження зорових шляхів можна
визначити доволі точно за тим ефектом, який ці ушкод-
ження спричинюють
Волокна носової частини кожної сітківки перетинають-
ся в ділянці зорового перехрестя, так що кожний зоровий
шлях містить волокна від скроневої половини однієї
сітківки та носової половини іншої. Ушкодження одного
зорового нерва зумовлює сліпоту відповідного ока, тоді
як ушкодження одного зорового шляху - втрату половини
поля зору (див. рис. 8-4). Цю патологію називають гомо-
німною (такою, що охоплює однойменні половини обох
полів зору) геміанопією (половинною сліпотою). Ушкод-
ження ділянки зорового перехрестя (наприклад, пухлиною
гіпофіза, що вийшла за межі турецького сідла) руйнує
волокна від обох носових півсітківок і спричинює гетеро-
німну (ту, що охоплює протилежні половини полів зору)
геміанопію. Оскільки волокна, що йдуть від жовтих плям,
локалізовані у задній частині зорового перехрестя, то геміа-
нопічні скотоми виникають у разі пухлин гіпофіза перед
повною втратою зору з обох півсітківок. Часткові дефекти
поля зору додатково класифікують як бітемпоральні або
біназальні, праві або ліві тощо.
Волокна зорового нерва, що проходять від верхніх
квадрантів сітківки і забезпечують нижню половину поля
зору, закінчуються у медіальній половині бічного колін-
частого тіла, тоді як волокна від нижніх квадрантів - у його
латеральній половині. Колінчасто-шпорні волокна з меді-
альної половини бічного колінчастого тіла закінчуються
на верхній губі шпорної борозни, а волокна з латеральної
половини - на нижній губі. Окрім того, волокна з бічного
колінчастого тіла, що забезпечують центральний зір, відок-
ремлюються від тих, що забезпечують периферійний зір, і
закінчуються дорсальніше на губах шпорної борозни (див.
рис. 8-5). З огляду на такі анатомічні особливості ушкод-
ження потиличної частки мозку можуть зумовлювати квад-
ЗІР/157
Рис. 8-29. Моно- та бінокулярні поля зору. Штриховою лінією
окреслено поле зору лівого ока, суцільною - поле зору право-
го ока. Спільне поле (незафарбована центральна зона у фор-
мі серця) спостерігач бачить бінокулярним зором. Зафарбо-
вані ділянки видимі монокулярним зором.
Латеральний
прямий "
Верхній Нижній
прямий косий
Рис. 8-30. Окорухові м’язи, які забезпечують шість головних
напрямів погляду. Зведення погляду забезпечує медіальний
прямий, відведення - латеральний прямий. Зведене око підні-
має нижній косий, а опускає верхній косий; відведене око
піднімає верхній прямий, а опускає нижній прямий (відтворе-
но за дозволом з Зігпоп НР, Атіпоїї ІУМ, СгеепЬегд ОА: СІіпі-
саі ІМеигоІоду, 41И есі. Мсбгам-НіІІ, 1999).
рантне випадіння поля зору (випадіння верхніх і нижніх
квадрантів кожної половини поля зору). Збереження
жовтої плями - втрата периферійного зору зі збереженням
центрального світлосприйняття - також характерний симп-
том потиличних ушкоджень (див. рис. 8-4). Він зумовлений
тим, що кіркове відображення жовтої плями відокремлене
від периферійного і значно більше. Тому для цілковитого
вилучення центрального та периферійного зору площа
потиличних ушкоджень повинна бути дуже значною. Дво-
стороннє руйнування потиличної кори у людини призво-
дить до суб’єктивної сліпоти. Водночас є так званий зір
сліпого - залишкові реакції на світлові подразники навіть
у тому випадку, якщо вони не свідомі. Наприклад, коли
особу з ушкодженою зоровою корою попросити локалізу-
вати подразник під час периметрі!’, то вона робить це з біль-
шою точністю, ніж можна пояснити випадковим збігом.
Зберігається також певна здатність розрізняти рухи, мерех-
тіння, орієнтацію і навіть кольори. Подібні відповіді
можуть також бути спричинені подразненням сліпих зон у
пацієнтів з геміанопією, що зумовлено ушкодженнями
зорової кори.
Волокна, що проходять від передпокришкових ділянок
і забезпечують рефлекторне скорочення зіниці у відповідь
на світлове подразнення ока, відокремлюються від зорових
шляхів біля колінчастих тіл. Тому сліпота зі збереженням
зіничного рефлексу простежується у разі двосторонніх
ушкоджень позаду зорових шляхів.
ОЧНІ РУХИ
Напрями переміщення очних яблук під дією окорухо-
вих м’язів показані на рис. 8-30. Оскільки косі м’язи пра-
цюють у медіальному напрямі, то ефект їхньої дії зале-
жить від положення очей. Якщо око повертається в напря-
мі носа, то косі м’язи піднімають і опускають його, тоді
як верхній і нижній прямі забезпечують обертальний рух;
коли око повертається у напрямі скроні, то верхній і ниж-
ній прямі м’язи піднімають і опускають його, а косі - обер-
тають.
Значна частина поля зору є бінокулярною, тому очевид-
но, що для постійного збігання зображень на обох сітківках
і уникнення диплопії необхідна надзвичайно добра скоор-
динованість дії очних м’язів.
Розрізняють чотири головні типи очних рухів, кожний
з яких контрольований іншою нейронною системою, які,
однак, мають спільні кінцеві ланки - мотонейрони око-
рухових м’язів (рис. 8-31). Сакадовані, або раптові,
поривчасті рухи відбуваються в разі перенесення погляду
з одного об’єкта на інший. Вони забезпечують фіксування
центральної ямки на нових об’єктах і зменшують адапта-
цію зорових шляхів, що розвивається у випадку тривалого
спостереження за одним об’єктом. Рухи плавного сте-
ження забезпечують відстежування рухомих об’єктів.
Вестибулярні рухи коригують погляд із рухами голови у
відповідь на стимули, що надходять від півколових каналів
внутрішнього вуха. Конвергентні рухи забезпечують
сходження зорових осей у разі перенесення погляду на
ближчі об’єкти. Є певна аналогія між рухами очних яблук
і створеними людиною системами стеження, що розмі-
щені на рухомих платформах, наприклад, на кораблях. За
допомогою сакадованих рухів шукають ціль; рухи плав-
ного стеження відстежують її переміщення; вестибулярні
рухи стабілізують положення системи стеження, роблячи
необхідні корективи стосовно зміщень платформи, на якій
вони встановлені. У приматів вестибулярні рухи залежать
від інтактної зорової кори. Сакадовані рухи програмують-
ся у верхніх горбиках, а рухи стеження - у мозочку.
158/РОЗДІЛ 8
Сакадована
система
Система
плавного
стеження
Конверґентна
система
Вестибулярна
система
Час, с
Рис. 8-31. Типи рухів ока (модифіковано і відтворено за доз-
волом з РоЬіпзоп ОА: Еуе тоуетепі сопігої іп рптаіез. 8сі-
епсе 1968;161:1219).
Верхні горбики
Верхні горбики, які керують сакадованими рухами,
іннервовані М-волокнами з сітківки. Вони також отриму-
ють значну іннервацію з кори мозку. У кожному верхньому
горбику є своєрідна карта зорового простору, яку допов-
нюють карта поверхні власного тіла та карта поширення
звуку. Наявна також карта моторики, яка проектується на
ділянки мозкового стовбура, що контролюють очні рухи.
Крім того, є проекції через покришково-мостовий тракт
до мозочка та через покришково-спинномозковий тракт
до ділянок, пов’язаних з рефлекторними рухами голови та
шиї. Верхні горбики постійно активно коригують поло-
ження очних яблук; вони мають один із найвищих у мозку
рівнів кровообігу та метаболізму.
Страбізм
Порушення механізмів координації рухів очних яблук
може мати різноманітні причини. Якщо зорові образи пере-
стають потрапляти на відповідні точки сітківки, то виникає
страбізм (косоокість). Деякі форми страбізму успішно
лікують шляхом хірургічного вкорочення окремих окору-
хових м’язів, за допомогою відповідного тренування цих
м’язів, а також за допомогою окулярів з призмами, що
відповідно заломлюють світло для компенсації аномаль-
ного положення очного яблука. У цьому разі, однак, збе-
рігаються незначні порушення відчуття глибини; ймовірно,
вроджені вади окорухових механізмів можуть зумовлювати
як страбізм, так і порушення глибини зору.
Якщо у дітей, які не досягли шестирічного віку, зорові
образи постійно проектуються на невідповідні точки обох
сітківок, то одне із зображень поступово пригнічується
(скотома пригнічення), і диплопія зникає. Це пригнічення
має кіркову природу і, як звичайно, не виявляється у
дорослих. Дуже важливо розпочати лікування односто-
роннього пригнічення зору до досягнення дитиною шести-
річного віку, бо поступово око, зображення з якого пригні-
чуватиметься, буде втрачати гостроту зору. Подібне пригні-
чення зображення з наступною втратою гостроти зору
може розвиватися у дітей, одне око яких має дефект світло-
заломлення або дефект світлосприйняття. Втрату зору у
цих випадках називають амбліопією без анопсії: термін
відображає порушення гостроти зору, що не підлягає корек-
ції і прямо не стосується органічного захворювання ока.
Спостереження, проведені на новонароджених мавпах,
засвідчили, що закриття одного ока пов’язкою протягом
трьох місяців призводить до зникнення колонок очного
домінування; імпульси, що надходять від ока, яке працює,
охоплюють усі клітини зорової кори, внаслідок чого око,
що було закритим, стає функціонально сліпим. Можливо,
подібні зміни можуть розвиватися й у дітей зі страбізмом.
Слух та рівновага
9
ВСТУП
У вусі розміщені рецептори двох типів чуття - слуху та
рівноваги. Зовнішнє вухо, середнє вухо та завитка внут-
рішнього вуха забезпечують сприйняття звуків. Півколові
канали, маточка та мішечок внутрішнього вуха пов’язані
із забезпеченням рівноваги. Рецептори у півколових кана-
лах сприймають кутове прискорення, рецептори маточки
-лінійне прискорення у горизонтальному напрямі, рецеп-
тори мішечка - прискорення у вертикальному напрямі.
Рецепторами слуху і рівноваги є волоскові клітини. У внут-
рішньому вусі локалізовані шість груп волоскових клітин:
по одній у кожному з трьох півколових каналів, маточці,
мішечку та завитці.
АНАТОМІЧНІ ХАРАКТЕРИСТИКИ
Зовнішнє та середнє вухо
Вушна мушля зовнішнього вуха спрямовує звукові хвилі
до зовнішнього слухового ходу. У деяких видів тварин
вуха можуть рухатися у пошуку джерела звуків подібно до
радарних антен. Від зовнішнього слухового ходу зовніш-
ній слуховий канал веде до барабанної перетинки (рис.
9-1).
Середнє вухо - заповнена повітрям порожнина у скро-
невій кістці - через слухову (Євстахієву) трубу сполуча-
ється із носоглоткою, а через неї - із зовнішнім середови-
щем. Слухова труба переважно закрита, але під час ков-
тання, жування та позіхання вона відкривається. У цьому
разі тиск повітря по обидва боки барабанної перетинки
зрівноважується. У середньому вусі містяться три слухові
кісточки - молоточок, коваделко та стремінце. Рукоятка
молоточка з’єднується з внутрішньою поверхнею бара-
банної перетинки. Головка молоточка прилягає до стінки
внутрішнього вуха, а його короткий відросток сполучається
з коваделком, яке, відповідно, утворює суглоб з головкою
стремінця. Стремінце отримало таку назву завдяки формі,
яка нагадує кінське стремено. Основа стремінця кільце-
вою зв’язкою сполучена зі стінкою овального вікна (рис.
9-2). У середньому вусі також локалізовані два малі ске-
летні м’язи - м’яз стремінця та м’яз-натягач барабанної
Півколові канали:
Рис. 9-1. Вухо людини. Для ліпшої демонстрації вушна мушля трохи відвернута і м’язи середнього вуха видалені.
160 / РОЗДІЛ 9
Рис. 9-2. Схематичне відтворення слухових кісточок і шляху
перетворення рухів барабанної перетинки на хвилі у рідині
внутрішнього вуха. Розсіювання хвиль відбувається через
кругле вікно. Рухи слухових кісточок та перетинчастого лабі-
ринту, а також кругле вікно, показані пунктирними лініями.
перетинки. Скорочення м’яза-натягача відтягує рукоятку
молоточка медіально і послаблює коливання барабанної
перетинки, а скорочення м’яза стремінця відтягує основу
стремінця з овального вікна.
Внутрішнє вухо
Внутрішнє вухо (лабіринт) складається з двох частин,
одна всередині іншої. Кістковий лабіринт охоплює сукуп-
ність каналів і порожнин у кам’янистій частині скроневої
кістки. Всередині цих каналів в оточенні рідини, яку нази-
вають перилімфою, розміщений перетинчастий лабі-
ринт (рис. 9-3), який повторює конфігурацію кісткового і
заповнений ендолімфою. Простори, заповнені ендолім-
фою та перилімфою, між собою не сполучені.
Завитка
Завиткова частина лабіринту має форму трубочки (у
людини завдовжки 35 мм), що робить 23/4оберта. По усій
довжині завитки базилярна та присінкова (Рейсснера)
мембрани розділяють її на три поверхи (сходи) (рис. 9-4).
Верхні присінкові та нижні барабанні сходи містять
перилімфу і сполучені між собою біля верхівки завитки
через малий отвір, який називають гелікотремою. Біля
основи завитки присінкові сходи закінчуються овальним
вікном, що закрите основою стремінця. Барабанні сходи
Рис. 9-3. Перетинчастий лабіринт людини зі збільшеними структурами, що містять волоскові клітини (відтворено за дозволом
з НисізреіЬ АЗ: Но\л/ (Ие еаг’з іл/огкз игогк. Маіиге 1989;34:397).
СЛУХ ТА РІВНОВАГА /161
закінчуються круглим вікном - отвором у медіальній
стінці середнього вуха, який закриває еластична вторинна
барабанна перетинка. Середні сходи - середня камера
завитки - є частиною перетинчастого лабіринту, яка не має
сполучення з присінковими та барабанними сходами і
заповнена ендолімфою (див. рис. 9-3, 9-4).
Орган Корті
Розміщений на базилярній мембрані орган Корті міс-
тить волоскові клітини, що є слуховими рецепторами. Цей
орган проходить від верхівки завитки до її основи і має
спіральну форму. Апікальні відростки волоскових клітин
пронизують щільну волокнисту пластинку, яку під-
тримують клітини-стовпи, або палички Корті (див. рис.
9-4). Волоскові клітини розміщені чотирма рядами: три
ряди зовнішніх волоскових клітин містяться латераль-
ніше від утвореного клітинами-стовпами внутрішнього
тунелю, один ряд внутрішніх волоскових клітин -
медіальніше. У кожній завитці людини міститься близько
20 000 зовнішніх волоскових клітин та 3 500 внутрішніх.
Ряди волоскових клітин вкриває тонка, в’язка, еластична
покривна мембрана, у яку втоплені кінчики волосків
зовнішніх волоскових клітин. Волоски внутрішніх волос-
кових клітин покривної мембрани не досягають. Тіла афе-
рентних нейронів, відростки яких охоплюють основи
волоскових клітин, утворюють спіральний ганглій, що
локалізований у складі веретена - кісткової осі, навколо
якої закручена завитка. Близько 90-95% нейронів спіраль-
ного ганглія іннервують внутрішні волоскові клітини, і
лише 5-10% забезпечують іннервацію набагато численні-
ших зовнішніх волоскових клітин; у цьому разі один ней-
рон іннервує кілька таких клітин. На противагу описаному
вище, більшість еферентних волокон слухового нерва (див.
нижче) закінчуються на зовнішніх волоскових клітинах.
Аксони аферентних нейронів, що іннервують волоскові
клітини, формують слухову (завиткову) частину присінко-
во-завиткового слухового нерва і закінчуються на дорсаль-
них та вентральних завиткових ядрах довгастого мозку.
Загальна кількість аферентних та еферентних волокон у
складі кожного слухового нерва становить близько 28 000.
У завитці волоскові клітини утворюють щільні контакти
з прилеглими до них фаланговими клітинами; це створює
бар’єр для проникнення ендолімфи до основ волоскових
клітин. Водночас з барабанних сходів через базилярну
мембрану просочується перилімфа, яка заповнює внутріш-
ній тунель і простір між основами внутрішніх та зовнішніх
волоскових клітин. Однакові щільні контакти призводять
до однотипного розташування волоскових клітин в інших
частинах внутрішнього вуха. Відрости волоскових клітин
занурені в ендолімфу, тоді як їхні основи омиває перилімфа.
Центральні слухові шляхи
Від завиткових ядер слухові імпульси різними шляхами
проходять до нижніх горбиків, що є центрами слухових
рефлекторних дуг, та через медіальні колінчасті тіла
таламуса до слухової кори. Інші імпульси проходять до
ретикулярної формації (рис. 9-5). Інформація від обох вух
сходиться до верхніх олив, і більшість нейронів усіх
вищих рівнів отримує імпульси з обох боків голови. Пер-
винна слухова кора, або 4 поле Бродмана, міститься у верх-
Спіральний
ганглій
Веретено
Спіральна
кісткова
пластинка
Спіральна
випуклість
Спіральна
зв’язка
Судинна
смужка
Спіральна
зв’язка
Орган Базилярна
Корті мембрана
Середні
сходи
Барабанні
сходи
Присінкові
сходи
Присінкова
мембрана Реисснера
Покривна
мембрана
Лімб
Зовнішні
кісткова пластинка
Рис. 9-4. Угорі: поперечний зріз завитки, що відображає топо-
графію Кортієвого органа та присінкових, середніх і барабан-
них сходів. Унизу: будова органа Корті нижньої частини завит-
ки; КД - зовнішні фалангові клітини (клітини Дейтерса), що
створюють основу для зовнішніх волоскових клітин (відтво-
рено за дозволом з Ріскеїз ЗО: Ап Іпігосіисііоп Іо йіе РґіузіоІ-
оду ої Неагіпд, 2псІ есі. Асасіетіс Ргезз, 1988).
ній частині скроневої частки. У людини вона локалізована
у Сильвієвій борозні (див. рис. 7-4) і в нормі її не видно
на поверхні мозку. У первинній слуховій корі більшість
нейронів отримує імпульси від обох вух, але тут також є
смужки клітин, що їх стимулюють імпульси від контра-
латерального і пригнічують імпульси від іпсилатерального
вуха. Є кілька додаткових звукосприймальних полів,
подібно до наявності кількох полів шкірної чутливості
(див. Розділ 7). Асоціативні слухові поля прилягають до
первинних і охоплюють значну площу (див. нижче).
Оливо-завитковий пучок є великим пучком еферентних
волокон у кожному слуховому нерві, який починається як
від іпсилатерального, так і контралатерального верхньо-
оливних комплексів і закінчується переважно навколо
162 / РОЗДІЛ 9
Верхній горбик
Шишкоподібна залоза
Нижній горбик
Ретикулярна система
До кори мозку (верхня
скронева завитка)
Спіральний
ганглій
Дорсальні та вентральні
ядра завитки
Таламус
Медіальне колінчасте тіло
Бічна петля
Ручка моста
Верхні оливи
Від завитки
Рис. 9-5. Спрощена схема головних слухових шляхів мозкового стовбура, вигляд ззаду. Мозочок та кора мозку видалені.
До кори мозку (верхня
скронева завитка)
До хробака мозочка
МозОк
Сполучна ручка
Бічний канатик
Слухові смужки мозку
Трапецієподібне тіло
базальної частини зовнішніх волоскових клітин органа
Корті.
Півколові канали
По обох боках голови півколові канали розміщені пер-
пендикулярно один до одного й орієнтовані у трьох прос-
торових площинах. Усередині кісткових каналів в оточенні
перилімфи містяться перетинчасті канали. Рецепторний
утвір - ампульний гребінь - локалізований у розширеній
частині (ампулі) кожного перетинчастого каналу. Кожний
гребінь складається з волоскових та підтримувальних клі-
тин, над якими розміщена желатиноподібна перегородка
(купол), що перегороджує ампулу (рис. 9-6). Відростки
волоскових клітин включені у купол, а їхні основи утво-
рюють контакти з еферентними волокнами присінкової
частини присінково-завиткового нерва.
Маточка і мішечок
У складі кожного перетинчастого лабіринту на дні
маточки розміщений отолітовий орган - пляма. Інша
пляма локалізована у напіввертикальному положенні в
стінці мішечка. Кожна пляма складається з волоскових та
підтримувальних клітин, над якими міститься отолітова
мембрана з кристалами карбонату кальцію - отолітами
(див. рис. 9-3). Отоліти, які називають ще отоконіями, або
вушним пилом, у людини завдовжки від 3 до 19 мкм і
мають густину, більшу від густини ендолімфи. Відростки
волоскових клітин втоплені в отолітову мембрану. Нервові
волокна, що охоплюють основи волоскових клітин плям,
долучаються до волокон, що йдуть від ампульних гребенів,
у присінковій частині присінково-завиткового нерва.
Нервові шляхи
Тіла 19 000 нейронів, що іннервують гребені та плями
кожного вуха, локалізовані у присінковому ганглії. Кожний
присінковий нерв закінчується в іпсилатеральному чотири-
компонентному присінковому ядрі та у жмутково-вузли-
ковій частці мозочка (рис. 9-7). Волокна з півколових кана-
лів закінчуються переважно у верхній та середній частинах
присінкового ядра і проектовані, головно, на ядра, що конт-
ролюють очні рухи. Волокна з маточки і мішечка закінчу-
ються здебільшого у латеральній частині присінкового ядра
(ядро Дейтерса), яке проектоване на спинний мозок. Вони
теж закінчуються в низхідному ядрі, яке проектоване на
мозочок та ретикулярну формацію. Присінкове ядро також
проектоване на таламічну ділянку, і звідти - на дві частини
первинної соматосенсорної кори.
ВОЛОСКОВІ КЛІТИНИ
Будова
Усі волоскові клітини внутрішнього вуха мають подібну
будову (рис. 9-8). Кожна волоскова клітина розміщена в
СЛУХ ТА РІВНОВАГА /163
Рис. 9-6. Схематичне відтворення ампульних гребенів. Купол
на верхівці гребеня перекриває ампулу і може згинатися.
Унаслідок інерційності ендолімфа під час кутового приско-
рення зміщується у напрямі, протилежному до напряму обер-
тання. Це зумовлює згинання відростків і, як наслідок, зміну
проникності та мембранного потенціалу волоскових клітин.
оточенні опорних, або підтримувальних, клітин. За винят-
ком зовнішніх волоскових клітин завитки, базальна частина
цих клітин охоплена дендритами аферентних нейронів. Від
апікальної поверхні волоскових клітин відходить 30-150
паличкоподібних відростків, або волосків. За винятком
завитки, один з цих відростків - кіноцилія - є справжньою,
проте нерухомою війкою, що містить дев’ять периферійних
і одну центральну пару мікротрубочок (див. Розділ 1). Це
один із найдовших відростків з булавоподібним розширен-
ням на кінці. Кіноцилії втрачаються волосковими кліти-
нами завитки у дорослих ссавців. Інший тип відростків -
стереоцилії - наявні в усіх без винятку волоскових клі-
тинах. Вони мають серцевину, утворену паралельними
актиновими філаментами, що вкриті різноманітними ізо-
формами міозину. Сукупність відростків кожної волоскової
клітини є впорядкованою: висота стереоцилій поступово
збільшується у напрямі до кіноцилії; у перпендикулярному
напрямі, в межах одного і того ж ряду, стереоцилії мають
однакову висоту.
Електричні відповіді
Мембранний потенціал волоскових клітин у спокої
становить близько -60 мВ. Коли стереоцилії рухаються у
напрямі до кіноцилії, то мембранний потенціал змен-
шується до -50 мВ. Зі зміщенням стереоцилій у протилеж-
ному напрямі клітини гіперполяризуються. Зміщення від-
ростків у напрямі, перпендикулярному до означеної осі,
не зумовлює змін мембранного потенціалу. Зміщення у
косому напрямі спричинює де- або гіперполяризацію
волоскових клітин, пропорційно та залежно від того, до
НІШ
І спінальнийшг
Від маточки,
півколових
нне
ово-
каналів
Рис. 9-7. Головні присінкові шляхи мозкового стовбура, вигляд
ззаду. Мозочок та кора мозку видалені.
чи від кіноцилії рухаються стереоцилії. Отже, волоскопо-
дібні відростки реалізують механізм трансформації напря-
му і розміру відхилень у зміни мембранного потенціалу
волоскових клітин.
Походження потенціалів дії в аферентних
нервових волокнах
Як зазначено вище, відростки волоскових клітин оточені
ендолімфою, тоді як їхню базальну частину омиває пери-
лімфа. Таке співвідношення потрібне для нормального
утворення потенціалів дії. Перилімфа утворюється щонай-
більш з плазми крові. Хоча транспортування манітолу та
сахарози з плазми до перилімфи барабанних сходів спо-
вільнене порівняно з транспортуванням цих речовин до
перилімфи вестибулярних сходів та є інші дрібні відмін-
ності між рідинами у цих двох порожнинах, проте обидва
різновиди перилімфи нагадують позаклітинну рідину.
Ендолімфа, яку продукує судинна смужка, має високу
концентрацію К+ і низьку концентрацію №+ (рис. 9-9). Для
клітин судинної смужки характерний високий рівень Иа"-
Кь-АТФ-ази. Окрім того, цим клітинам притаманна уні-
кальна потенціалозалежна К+-помпа, яка забезпечує різ-
ницю потенціалів, що дорівнює 85мВ, між середніми та
присінковими або барабанними сходами.
164/РОЗДІЛ 9
Рис. 9-8. Ліворуч: структура волоскової клітини мішечка жаби, яка відображає її взаємозв’язок із отолітовою мембраною
(ОМ); К - кіноцилія; С - стереоцилія; ВК - волоскова клітина з аферентними (А) та еферентними (Е) нервовими волокнами; ОЛ
- отоліт; ПК - підтримувальна клітина (відтворено за дозволом з НіІІтап ОЕ: Могїоіоду о/ регірілегаї апсі сепігаї уевііЬиІаг
зузіетз. Плав К, Ргесґіі \Л/ [есіііогз]: Егод ІМеигоЬіоІоду. 5ргіпдег,1976). Праворуч: сканована електронна мікрофотографія
відростків волоскової клітини плями мішечка жаби. Отолітова мембрана видалена. Короткі відростки навколо волоскової
клітини - мікроворсинки підтримувальних клітин (АЗ НибзреіГі).
Дуже тонкі відростки, так звані верхівкові з’єднання
(рис. 9-10), сполучають верхівку кожної стереоцилії з
бічною поверхнею сусідньої вищої стереоцилії, яка у
ділянці цього контакту містить чутливі до механічних
подразнень катіонні канали. Коли нижчі стереоцилії змі-
щуються у напрямі до вищих, то час перебування цих кана-
лів у відкритому стані збільшується. Вважають, що стан
напруження кожного каналу регулює “адаптаційний мо-
тор”, утворений міозином вищої стереоцилії. Зміщення
стереоцилій у протилежному напрямі зменшує час пере-
бування каналу у відкритому стані. Функцію цього каналу
може виконувати а-субодиниця №’-каналу епітеліоцитів,
яка сама по собі утворює низькоселективний катіонний
канал (див. Розділ 1), а амілорид приєднаний до ділянки
контакту між коротшою та довшою стереоциліями. Озна-
чені канали є порівняно низькоспецифічними катіонними
каналами, та оскільки їх омиває ендолімфа з підвищеним
вмістом йонів К+,то йони проникають всередину волос-
кової клітини через відкриті канали, зумовлюючи депо-
ляризацію мембрани. Проникнення Са2± зумовлює вики-
дання нейротрансмітера, який спричинює деполяризацію
мембрани одного або кількох аферентних нейронів, що
контактують з волосковою клітиною. Хоча нейротранс-
мітер до цього часу не ідентифіковано, правдоподібно, що
ним може бути глютамат.
Йони К+, що проникають усередину волоскової клітини
через механочутливі катіонні канали, рециклізують (див.
рис. 9-9). Спершу вони потрапляють до підтримувальної
клітини, звідки через щільні контакти дифундують до
інших підтримувальних клітин. Нарешті вони досягають
судинної смужки, звідки, завершуючи цикл, відбувається
їхня секреція до ендолімфи.
СЛУХ
Звукові хвилі
Звук є відчуттям, яке виникає під час потрапляння на
барабанну перетинку поздовжніх коливань, а точніше - фаз
згущення і розрідження молекул зовнішнього середовища.
Результатом цих рухів є зміна тиску на барабанну пере-
тинку за одиницю часу, що має вигляд серії хвиль (рис. 9-
СЛУХ ТА РІВНОВАГА /165
Рис. 9-9. Йонний склад перилімфи присінкових та барабан-
них сходів, а також ендолімфи середніх сходів. Штриховою
лінією показаний шлях рециклізації К+: від волоскових клітин
через підтримувальні клітини до спіральної зв’язки і через
клітини судинної смужки до ендолімфи.
11). Сукупність таких рухів зовнішнього середовища нази-
вають звуковими хвилями. Звукові хвилі поширюються у
повітрі зі швидкістю 344 м/с при 20°С на рівні моря.
Швидкість хвиль зростає з підвищенням температури та
висоти над рівнем моря. Інші середовища, у які може
потрапляти людина, також проводять звукові хвилі, проте
з іншою швидкістю. Наприклад, швидкість звуку у прісній
воді при 20°С становить 1450 м/с, у морській воді вона ще
вища. Вважають, що свист голубого кита досягає сили 188
децибел (див. нижче), і його чути на відстані 900 км.
Сила звуку корелює з амплітудою звукової хвилі, а
висота тону - з її частотою (кількістю коливань за оди-
ницю часу). Чим більша амплітуда, тим голосніший звук,
чим вища частота коливань - тим вищий тон. Окрім часто-
ти, на висоту тону впливають і деякі інші, не зовсім зрозу-
мілі фактори; частота дещо впливає і на силу звуку,
оскільки поріг звукового подразнення для певних частот
нижчий, ніж для інших (див. нижче). Звукові хвилі, що
повторюються, навіть у разі їхньої комплексності, сприй-
маються як музичні звуки; неперіодичні, неповторювані
коливання дають відчуття шуму. Більшість музичних звуків
складається з хвилі головної частоти, що визначає висоту
звуку, на яку накладається низка гармонійних коливань
(обертонів), що надають звукові характерного тембру
(якість звуку). Відмінності тембру дають змогу розрізняти
звучання.різних музичних інструментів, навіть якщо
виконують звуки однакової висоти.
Амплітуду звукової хвилі можна виразити як максималь-
ну зміну тиску на барабанну перетинку, однак зручнішою
є відносна, так звана децибельна шкала. Інтенсивність
звуку в белах є записом логарифмічної залежності зна-
чення інтенсивності досліджуваного звуку до певного зву-
кового стандарту: 1 децибел (дБ) становить 0,1 бела. Отже,
Рис. 9-10. Будова апікальної частини волоскової клітини.
Зверніть увагу на верхівкові з’єднання між рядами стереоци-
лій. Стрілкою показаний напрям, за яким зміщення стереоци-
лій призводить до збільшення потоку йонів усередину волос-
ків (відтворено за дозволом з Наскпеу СМ, Бигпезз ОМ: Ме-
сїіапоігапзсіисііоп іп уегіеЬгаІе ґіаіг сеііз: Зігисіиге апсі їипс-
Ііоп оТНіе зіегеосіїіагу ЬипсІІе. Ат РґіузіоІ 1995;268:С1).
1Г. _ інтенсивність досліджуваного звуку
Кількість дБ = ЮІод-----------------
інтенсивність звукового стандарту
Інтенсивність звуку пропорційна до площі тиску звуку.
Тому
... - ЛЛ1 тиск досліджуваного звуку
Кількість дБ = 20 Іод * 3 * * * .
тиск звукового стандарту
Відповідно до стандарту Американського Акустичного
Товариства за 0 децибел прийнятий тиск 0,000204 Н/см2,
що є порогом слухових відчуттів середньостатистичної
людини. На рис. 9-12 показані значення у децибелах
найпоширеніших звуків. Треба пам’ятати, що шкала деци-
бел є логарифмічною. Тому 0 децибел не означає, що звуку
нема, а відображає наявність звуку, інтенсивність якого
відповідає стандартові. Крім того, діапазон між 0 та 140
децибелами, який охоплює рівні від нижнього порогу слу-
хового відчуття до такого, що може пошкодити орган Корті,
практично відображає десятимільйонну (107) різницю в
тискові, який чинять хвилі на барабанну перетинку. Іншими
словами, якщо атмосферний тиск на рівні моря становить
1 бар, то діапазон інтенсивності від звуку ледь чутного до
потенційно руйнівного для завитки, охоплює тиск від
0,0002 до 2000 мікробарів.
Людина може чути звукові частоти від 20 до 20 000 Гц
(герц, або коливань за секунду). Деякі тварини, особливо
кажани та собаки, чують звуки набагато вищої частоти.
Пороги відчуттів людського вуха відрізняються для тонів
різної висоти, досягаючи максимальної чутливості в діа-
166/РОЗДІЛ 9
Рис. 9-11. Характеристика звукових хвиль: А - запис простого
тону; В - запис звуку з більшою амплітудою і голоснішого,
ніж на фрагменті А; С - звук з такою ж амплітудою,-що й на
фрагменті А, проте більшої частоти і, відповідно, вищого тону;
□ - складна звукова хвиля, що періодично повторюється.
Фрагменти А-0 є графічним відтворенням музичних звуків,
тоді як хвилі на фрагменті Е не упорядковані і мають характер
шуму.
пазоні 1-4 кГц. Для порівняння, тон чоловічого голосу
становить близько 120 Гц, тон голосу середньо статистич-
ної жінки - 250 Гц. Пересічна людина може розрізнити
до 2 000 тонів, однак музичні вправи дають змогу цю кіль-
кість значно збільшити. Найлегше розрізняють тони у діа-
пазоні 1-3 кГц, значно важче - тони вищих або нижчих
частот (рис. 9-13).
Рис. 9-13. Графіки звукосприйняття людини. Середня крива
отримана внаслідок аудіометрії у звичайних умовах, нижня -
в ідеальних умовах. У разі 140 дБ звуки чують, а також відчу-
вають фізично.
Децибели
160 —
120 —
80 —
40 —
Реактивний літак з форсажем
Біль
Дискомфорт
Шум метро, жива рок-музика
Шум інтенсивного вуличного руху
Нормальна розмова
Шепіт
0 — Слуховий поріг (0,0002 дин/см2)
Рис. 9-12. Інтенсивність найпоширеніших звуків.
Маскування
Загальновідомо, що один звук може погіршувати здат-
ність особи чути інші звуки. Це явище називають маску-
ванням. Причиною маскування вважають відносну або
абсолютну рефрактерність попередньо стимульованих слу-
хових рецепторів та нервових волокон до нових стимулів.
Ступінь маскування залежить від тону. Маскувальний
ефект шуму оточення, якщо нема надійного протишумо-
вого захисту, призводить до певного підвищення слухового
порогу.
Передавання звуків
У вусі звукові хвилі, що надходять із зовнішнього сере-
довища, перетворюються на потенціали дії слухових нер-
вів. За участю барабанної перетинки та слухових кісточок
звукові коливання передаються на основу стремінця, рухи
якого спричинюють коливання рідини у внутрішньому вусі.
Під дією цих коливань орган Корті генерує потенціали дії
у нервових волокнах.
Функції барабанної перетинки та
слухових кісточок
У відповідь на зміни тиску, спричинені дією звукових
хвиль на її зовнішню поверхню, барабанна перетинка
рухається всередину і назовні. Вона діє як резонатор, що
відтворює коливання джерела звуку. Коливання барабанної
перетинки припиняються майже одночасно із припинен-
ням звуку, тобто вона має дуже короткий період критично-
го загасання. Рухи барабанної перетинки передаються на
рукоятку молоточка, який обертається навколо осі, що
проходить через точку сполучення його довгого і короткого
відростків, унаслідок чого короткий відросток передає
коливання на коваделко, а воно, відповідно, - далі на
головку стремінця. Рухи головки стремінця змушують його
основу рухатися вперед-назад подібно до шарнірних
дверей, закріплених біля заднього краю овального вікна.
Таким способом слухові кісточки діють як система важелів,
що перетворює резонансні коливання барабанної перетин-
ки у рухи стремінця, а через нього - у рухи перилімфи
СЛУХ ТА РІВНОВАГА /167
присінкових сходів завитки (див. рис. 9-2). Ця система
підсилює тиск звукових хвиль, що доходять до овального
вікна, оскільки важільна система молоточка і коваделка
збільшує силу поштовхів у 1,3 раза, а площа барабанної
перетинки значно перевищує площу основи стремінця.
Хоча інерційність та опір усієї системи і зумовлюють деяку
втрату енергії звуків, та підраховано, що за частоти до
З 000 Гц близько 60% звукової енергії, що потрапляє на
барабанну перетинку, досягає перилімфи присінкових
сходів.
Барабанний рефлекс
Під час скорочення м’язи середнього вуха (м’яз стре-
мінця та м’яз-натягач барабанної перетинки) тягнуть
молоточок досередини, а основу стремінця - назовні. Це
послаблює передавання звуку. Голосні звуки спричинюють
рефлекторне скорочення означених м’язів, що називають
барабанним рефлексом. Барабанний рефлекс має захисне
значення, запобігаючи надмірному стимулюванню слу-
хових рецепторів сильними звуками. Реакційний час
барабанного рефлексу становить 40-160 мс, тому він не
може захистити від коротких інтенсивних звуків, наприк-
лад, звуків пострілів.
Кісткова і повітряна провідність
Поширення звукових хвиль через барабанну перетинку
та слухові кісточки до рідини внутрішнього вуха - головний
шлях нормального слуху - називають кісточковою про-
відністю. Звукові хвилі також спричинюють коливання вто-
ринної барабанної перетинки, якою закрите кругле вікно.
Це явище називають повітряною провідністю, воно не
відіграє значної ролі у нормальному звукосприйнятті.
Третій тип звукопоширення - кісткова провідність - поля-
гає у передаванні коливань із зовнішнього середовища до
рідини внутрішнього вуха кістками черепа. Виражена кіст-
кова провідність виникає в разі прикладання камертона або
іншого вібрувального предмета безпосередньо до черепа.
Цей тип провідності також має значення в разі сприйняття
дуже голосних звуків.
Пересувні хвилі
Рухи основи стремінця зумовлюють виникнення серії
пересувних хвиль у перилімфі присінкових сходів. Гра-
фічно такі хвилі зображено на рис. 9-14. З пересуванням
хвилі по завитці її висота досягає максимуму у певній точці,
після чого швидко спадає. Відстань від основи стремінця
до місця у завитці, де хвиля досягає максимальної висоти,
залежить від частоти коливань, що зумовлюють її виник-
нення. Високочастотні звуки генерують хвилі, що досяга-
ють макимуму біля основи завитки; наслідком дії низь-
кочастотних звуків є хвилі з максимумом біля верхівки
завитки. Кісткові стінки вестибулярних сходів жорсткі,
проте гнучкою є мембрана Рейсснера. Базилярна мембрана
під впливом тику також може легко зміщуватися в бара-
банні сходи піками хвиль, що виникають у присінкових
сходах. Коливання перилімфи барабанних сходів розсію-
ються у повітрі через кругле вікно. Таким способом звукові
хвилі зумовлюють зміщення базилярної мембрани, у цьому
разі точка максимального зміщення визначена частотою
хвилі. Апікальну частину волоскових клітин органа Корті
Відносна
амплітуда
Відстань від стремінця, мм
1600 Гц 800 Гц 400 Гц 50 Гц
6 10 20 ЗО
Зміщення
базилярної
мембрани
Відстань від стремінця, мм
Рис. 9-14. Пересувні хвилі. Угорі: суцільна і короткоштрихова
лінії відображають хвилі, зафіксовані в різні часові моменти.
Довгоштрихова лінія відображає звуковий “коридор”, що утво-
рюється у разі сполучення лінією піків, які виникають у часо-
вій прогресії. Внизу: зміщення базилярної мембрани хвилями,
що утворюються внаслідок коливань стремінця з частотою,
зазначеною біля піка кожної кривої.
фіксує ретикулярна пластинка, волоски зовнішніх волос-
кових клітин включені у покривну мембрану (див. рис. 9-
4). Під час рухів стремінця обидві означені мембрани
зміщуються в тому самому напрямі, та оскільки вони орієн-
товані у просторі під різними кутами, то їхнє взаємозмі-
щення призводить до згинання волосків. Волоски внут-
рішніх волоскових клітин не торкаються покривної мемб-
рани, однак вони також згинаються під дією зміщень ендо-
лімфи у проміжку між покривною мембраною та верхів-
ками волоскових клітин.
Функції внутрішніх та зовнішніх
ВОЛОСКОВИХ КЛІТИН
Внутрішні волоскові клітини є головними сенсорними
клітинами органа Корті, що зумовлюють генерування по-
тенціалів дії у слухових нервах, правдоподібно, у відповідь
на описані вище зміщення рідини.
Зовнішні волоскові клітини іннервовані холінергічними
еферентними нервовими волокнами, що надходять з верх-
ньооливних комплексів. Ці клітини стають нижчими в разі
деполяризації і видовжуються у випадку гіперполяризації.
Зовнішні волоскові клітини гіперполяризують під дією
ацетилхоліну, що його виділяють еферентні нервові волок-
на. Функція цих клітин полягає у збільшенні амплітуди і
загостренні піків вібрації базилярної мембрани, хоча тонкі
механізми цього процесу вивчені недостатньо.
Потенціали дії слухових нервових волокон
Частота потенціалів дії окремих слухових нервових
волокон пропорційна до сили звукових подразнень. За
низької інтенсивності звуку кожен аксон розряджається
лише під дією звуку певної частоти, відповідно до частини
завитки, яку він репрезентує. У разі вищої інтенсивності
168 / РОЗДІЛ 9
Рис. 9-15. Залежність амплітуди імпульсів у волокнах слухо-
вого нерва від частоти та інтенсивності звуку. Оскільки діа-
грама відображає загальний тип відповіді багатьох нервових
волокон, то шкала не містить цифрових показників (модифіко-
вано і відтворено за дозволом з Кіапд N¥8: РегірґіегаІ пеигаї
ргосеззіпд оТ аисіііогу іпТогтаІіоп. НапсІЬоок оТ рґіузіоіоду.
Зесііоп 1, Тґіе Меп/оиз Зузіет, уоі 3, рагі 2. Вгоокґіагі ЛУІ,
Моипісазіїе \/В [есіііогз] Атегісап РґіузіоІодісаІ Зосіеіу, 1984).
звуку аксони розряджаються у відповідь на ширший спектр
звукових частот (рис. 9-15), а точніше, реагують на хвилі,
частота яких нижча від порога збудження.
Головним чинником, який визначає висоту сприйнятого
звуку, є ділянка максимального стимулювання органа
Корті. Пересувна хвиля, спричинена звуком певної частоти,
зумовлює максимальне вгинання базилярної мембрани і,
відповідно, максимальне збудження рецепторних клітин
лише в одній точці. Як зазначено вище, відстань між цією
точкою й основою стремінця обернено пропорційно зале-
жить від висоти звуку: низькі тони зумовлюють макси-
мальне стимулювання біля верхівки завитки, високі - біля
її основи.
Провідні шляхи, що йдуть від різних частин завитки до
мозку, відрізняються. Додатковим чинником сприйняття
тонів з частотою до 2 000 Гц може бути структура потен-
ціалів дії слухового нерва. У разі низької частоти звуку
нервові волокна відповідають імпульсом на кожний цикл
коливань звукової хвилі. Значення цього ефекту лавини
імпульсів обмежене, оскільки частота потенціалів дії
певного нервового волокна визначає більше силу, аніж
висоту звуку.
Хоча висота тону головно залежить від частоти звукової
хвилі, та деяку роль у його сприйнятті відіграє також сила
звуку; низькі тони (до 500 Гц) здаються нижчими, а високі
(понад 4 000 Гц) - вищими у разі збільшення сили звуку.
Тривалість звуку також незначно впливає на сприйняття
його тону. Тональність звуку неможливо визначити, якщо
він триває до 0,01 с; у проміжку між 0,01 та 0,1 с сприй-
няття висоти тону зростає зі збільшенням тривалості зву-
чання. Нарешті, висота комплексних звуків, що склада-
ються з сукупності гармонійних частот, сприймається
навіть без головної частоти (базового тону).
Слухові відповіді нейронів довгастого мозку
Відповідь окремих нейронів другого порядку ядра
завитки на звукові подразнення подібна до відповідей
окремих волокон слухового нерва. Частота, за якої звуки
найнижчої інтенсивності зумовлюють відповідь, відрізня-
ється між окремими сегментами; зі збільшенням сили звуку
діапазон частот, на які генерується відповідь, зростає.
Головна відмінність між відповідями нейронів першого та
другого порядків полягає у гострішому “запиранні” мозко-
вих нейронів з низькочастотного боку. Можливо, вища спе-
цифічність нейронів другого порядку зумовлена певними
гальмівними процесами у мозковому стовбурі, однак меха-
нізм цього явища поки що не з’ясований.
Первинна слухова кора
Провідні шляхи від завитки до слухових ділянок кори
мозку схарактеризовані на початку цього розділу. Висхідні
імпульси проходять з дорсального та вентрального завит-
кових ядер по складних шляхах, частина з яких перети-
нається, інші - не перетинаються. У тварин є впорядкована
система представництва різних тонів у первинній слуховій
корі - ніби над нею розкручена завитка. У людини низькі
тони сприймають передньолатеральні, а високі - задньо-
медіальні ділянки слухової кори. В цьому випадку у моз-
ковій корі кодується висота тону, а не власне звукова час-
тота, бо під час звучання комплексного звуку без головного
тону (див. вище) стимулюється та ділянка кори мозку, яка
відповідає сприйнятій тональності. Тому перетворення
частоти звуку на тональність повинні відбуватися на суб-
кортикальному рівні.
Інші ділянки кори, пов’язані зі слухом
Використання зображень позитронної емісійної томо-
графії та функційного ЯМР (див. Розділ 16) забезпечило
швидке збільшення обсягу інформації стосовно асоціатив-
них слухових зон мозку людини. Слухові шляхи мозкової
кори нагадують зорові шляхи складністю процесів опра-
цювання інформації, а також наявністю двох головних шля-
хів. У випадку слухового сприйняття дорсально-тім’яний
шлях, правдоподібно, пов’язаний з локалізацією джерела
звуку (дає відповідь на питання “звідки”). Тім’яні зони
пов’язані із переміщенням джерела звуків; цікавим є той
факт, що у лобовій частці кори мавпи виявлені нейрони,
які реагують лише на близькі звуки, що, очевидно, мають
найбільше значення для виживання тварин. З іншого боку,
скроневі частки людини містять вентральні шляхи, які
відповідають на питання “що”; нейрони цих шляхів вибір-
ково реагують на голоси. Ці вибіркові до голосів ділянки
можуть бути подібні до ділянок зорової кори, що відпо-
відають за розпізнавання облич (див. Розділ 8).
Подібно до соматичних та зорових кіркових систем слу-
хова система змінюється під впливом набутого досвіду та
інших чинників. Збільшення розміру звукосприймальних
ділянок кори під впливом слухових подразнень, доповне-
них високочастотним стимулюванням базальних шляхів
переднього мозку, описане у Розділі 7. Свідченням слухової
пластичності людини можуть бути результати спостере-
СЛУХ ТА РІВНОВАГА /169
жень за особами, що втратили слух перед набуттям мовних
навичок: розглядання письмових мовних символів активує
у цих індивідів слухові асоціативні зони за межами пер-
винної слухової кори. Натомість, особи, які у ранньому
дитинстві втратили зір, достовірно ліпше локалізують дже-
рело звуку, аніж особи з нормальним зором. Іншими дослід-
женнями з’ясовано, що діти після досягнення ними шести-
місячного віку швидко набувають здатності давати підви-
щені нейронні відповіді на звуки, специфічні для їхньої
рідної мови, тоді як відповіді на неспецифічні звуки посту-
пово зникають.
Музиканти дають додаткові приклади кіркової пластич-
ності. Наприклад, унаслідок постійної активації музични-
ми тонами розмір слухових зон у них збільшений. Окрім
того, скрипалі мають дещо змінене соматосенсорне пред-
ставництво ділянок, на які проектуються пальці, потрібні
для гри на скрипці. У музикантів також достовірно більший
мозочок порівняно з немузикантами з огляду на набуті
навички до точних рухів пальцями.
Частина задньої верхньої скроневої закрутки, відома як
скронева площина (рис. 9-16), як звичайно, більша ліво-
руч, аніж праворуч, особливо це стосується осіб із перева-
жанням правої руки (“праворукі”). Ця зона виявилася
пов’язаною з мовно-слуховим сприйняттям. Цікавим є
спостереження, яке до цього часу не пояснене: ліва скро-
нева площина перевищує свої нормальні розміри у музи-
кантів та осіб з музикальним слухом. Загальні питання
кортикальної асиметрії розглянуто у Розділі 16.
Локалізація звуків
Визначення напряму джерела звуку у горизонтальній
площині ґрунтується на визначенні різниці часу надход-
ження подразнення до обох вух, наслідком чого є різниця
у фазах звукових хвиль з обох боків голови. Має значення
також той факт, що звук буде голоснішим з того боку, що
ближчий до джерела звуку. Визначення часової різниці, яка
може не перевищувати 20 мкс, уважають головним чин-
ником визначення джерела звуку при частотах до 3 000 Гц,
тоді як у разі вищих частот вирішальну роль відіграє
різниця в силі звуку. Нейрони слухової кори, що отримують
подразнення від обох вух, дають максимальну або міні-
мальну відповідь, коли надходження звукового сигналу до
одного вуха відстає на деякий проміжок від часу надход-
ження цього сигналу до іншого вуха. Цей проміжок від-
різняється у різних нейронів.
Звуки, джерело яких міститься спереду від слухача, від-
різняються від тих, що надходять ззаду, оскільки кожна
вушна мушля трохи повернута допереду. Окрім цього,
характер відбивання звукових хвиль від поверхні вушної
мушлі змінюється зі зміщенням звуку вгору або вниз; зміни
звукових хвиль є головним чинником локалізації звуків у
вертикальній площині. Локалізація джерела звуків суттєво
порушена у разі ушкоджень слухової кори.
Аудіометрія
Гостроту слуху звичайно вимірюють за допомогою ауді-
ометра. Цей прилад слугує джерелом чистих тонів певної
частоти, які обстежувана особа сприймає через навушники.
Для кожної частоти визначають поріг чутності, значення
якого наносять на діаграму у вигляді процентного співвід-
Рис. 9-16. Ліва та права скроневі площини півкуль головного
мозку. Горизонтальний зріз уздовж Сильвієвої борозни (орієн-
тація площини зрізу показана на нижній частині рисунка) (від-
творено за дозволом з КапсІеІ ЕК, Зсіїмаїіг ЛЧ, ЧеззеІ ТМ
[есіііогз]: РгіпсірІезоїМеигаІ Зсіепсе, ЗгсІ есі. Мс6га\л/-НіП, 1991).
ношення до нормальної чутності. Така діаграма дає об’єк-
тивне відображення ступеня глухоти і якісну характерис-
тику найураженіших діапазонів тональності.
Глухота
Клінічна глухота може бути зумовлена порушеннями
передавання звуків у зовнішньому або середньому вусі
(глухота передавання, або кондуктивна), ушкодженнями
волоскових клітин або провідних шляхів (сенсоневральна
глухота). Ці дві форми патології звукосприйняття розріз-
няють за допомогою різноманітних простих тестів з камер-
тоном. Три такі тести, названі за прізвищами їхніх авторів,
наведені у табл. 9-1. Тести Вебера і Швабаха відображають
маскувальний вплив шуму оточення на слуховий поріг.
Причинами глухоти передавання може бути закриття
зовнішніх слухових каналів вушною сіркою або сторонніми
тілами, ушкодження слухових кісточок, потовщення бара-
банної перетинки внаслідок повторних інфекцій середньо-
го вуха, надто жорстке прикріплення основи стремінця до
овального вікна. Аміноглікозидні антибіотики, такі як
стрептоміцин та гентаміцин, закривають механочутливі
йонні канали у стереоциліях волоскових клітин і можуть
зумовити дегенерацію волоскових клітин, спричинюючи
сенсоневральну глухоту та порушення вестибулярних
функцій. Руйнування зовнішніх волоскових клітин унас-
лідок тривалої дії сильного шуму також пов’язане з втра-
170 / РОЗДІЛ 9
тою слуху. Іншими причинами є пухлини присінково-за-
виткового нерва та мосто-мозочкового кута, ушкодження
мозку судинного генезу. Стареча глухота - поступова,
пов’язана з віком, втрата слуху, від якої страждає більше
третини осіб віком понад 75 років, правдоподібно, зумов-
лена поступовим відмиранням як волоскових клітин, так і
нейронів.
Глухота, спричинена генними мутаціями, вражає близь-
ко 0,1 % усіх новонароджених. У 30% випадків вона супро-
воджуються аномаліями інших систем (синдромна глу-
хота), у решти 70% - це єдиний явний дефект (несиндром-
на глухота). Є дані про те, що зумовлена мутаціями
несиндромна глухота спершу виявляється у дорослих і
охоплює до 16% осіб зі значними порушеннями слуху.
Протягом останніх років описано багато генних мутацій,
які призводять до глухоти. Це не лише розширило уявлення
про патофізіологію глухоти, а й дало цінну інформацію
про фізіологію слуху. Сьогодні відомо, що для нормального
слуху потрібні продукти транскрипції понад 100 генів, і
локуси, що можуть зумовити глухоту, описані у складі 19 з
24 хромосом людини.
Цікавим прикладом білків, мутація яких призводить до
втрати слуху, може бути конексин 26. Спричинені цим
білком дефекти конексонів (див. Розділ 1), імовірно, пере-
шкоджають нормальній рециклізації К+ через підтриму-
вальні клітини (див. рис. 9-9). Глухоту також зумовлюють
мутації трьох нем’язових міозинів (див. Розділ 1). До них
належить міозин УІІа, що у зв’язаній з актином формі
локалізований у відростках волоскових клітин; міозин ІЬ,
який, правдоподібно, є одним із компонентів “адаптацій-
ного мотора”, що регулює силу натягу верхівкових з’єднань
волосків (див. вище); а також міозин IV, який має суттєве
значення для формування нормальних війок. Глухота може
бути пов’язана і з мутантними формами ос-тектину, одного
із головних білків покривної мембрани.
Приклад синдромної глухоти - синдром Пендреда, у
разі якого мутація транспортного білка сульфатів зумовлює
глухоту та зоб. Іншим прикладом може слугувати синдром
продовженого інтервалу (}Т, за якого простежується
мутація одного з білків К+-каналів, а саме: КУЬ(2Т1. У
складі клітин судинної смужки цей білок забезпечує
підтримання високої К+-концентрації в ендолімфі, тоді як
у механізмі серцевих скорочень його роль полягає у
забезпеченні нормального РТ інтервалу. Особи, гомози-
готні за мутантним КУЬрТІ-геном, глухі і мають схиль-
ність до шлуночкових аритмій та раптової смерті, що є
найхарактернішими ознаками синдрому продовженого
інтервалу РТ (див. Розділ 28).
ВЕСТИБУЛЯРНА ФУНКЦІЯ
Реагування на кутове прискорення
Кутове прискорення у площині того або іншого пів-
колового каналу стимулює його гребінь. Інерція ендолімфи
зумовлює її зміщення у напрямі, протилежному до напряму
обертання. Рух рідини деформує купол, що спричинює
згинання відростків волоскових клітин (див. рис. 9-6). У
разі досягнення сталої швидкості обертання ендолімфа
рухається з такою ж швидкістю, як усе тіло, і купол повер-
тається у початкове положення. Зі зменшенням кутової
швидкості купол деформується у напрямі, протилежному
до напряму деформації прискорення. Через 25-30 с він
повертається до середнього положення. Зміщення купола
в одному напрямі звичайно зумовлює збільшення руху
імпульсів у нервових волокнах, що відходять від відповід-
ного гребеня, тоді як зміщення у протилежному напрямі
пригнічує нейронну активність (рис. 9-17).
Обертання спричинює максимальне стимулювання пів-
колового каналу, найближчого до площини обертання.
Оскільки канали однієї половини голови є віддзеркаленням
каналів іншої половини, то в одному вусі ендолімфа руха-
ється у напрямі до ампули, а у вусі протилежного боку -
від ампули. Тому сукупність імпульсів, які досягають мозку,
відрізняється і залежить як від напряму, так і від площини
обертання. Лінійне прискорення, правдоподібно, не зумов-
Таблиця 9-1. Найпоширеніші тести з камертоном для диференціювання нейронної глухоти та глухоти проведення
Вебера Рінне Швабаха
Метод Основу камертона, який вібрує, розміщують на маківці черепа Основу камертона, який вібрує, тримають на соско- подібному відростку доти, доки пацієнт перестає його чути, після чого підносять до іншого вуха Кісткову провідність пацієнта порівнюють з нормальною кістковою провідністю
Норма Звукосприйняття однакове з обох боків Вібрації у повітрі чутні після загасання кісткової провідності
Глухота проведення (на одне вухо) Звук голосніший з боку ура- женого вуха, оскільки мас- кувальний ефект шуму ото- чення на хворе вухо не діє Вібрації у повітрі не чутні після загасання кісткової провідності Кісткова провідність вища від норми (дефект звукової провідності виключає маскувальну дію шуму)
Нейронна глухота (на одне вухо) Звук голосніший у нормальному вусі Вібрації у повітрі чутні після загасання кісткової провід- ності, оскільки глухота є частковою Кісткова провідність нижча від норми
СЛУХ ТА РІВНОВАГА /171
швидкість
Час, с
Рис. 9-17. Відповідь ампул на обертання. Час Генерування
імпульсів ампульними гребенями двох півколових каналів у
відповідь на кутове прискорення, рівномірне обертання та
кутове сповільнення (відтворено за дозволом з Асігіап ЕО:
□ізсїіагдез Тгот уезІіЬиІаг гесеріогз іп Іґіе саі. РЬузіоІ [І_опсІ]
1943;101:389).
лює зміщень купола і не подразнює гребенів. Відомо, що
руйнування певної частини лабіринту зумовлює компен-
сацію функцій втраченої частини збереженими частинами,
тому експериментальне дослідження функцій лабіринту
надзвичайно важке.
Функція вестибулярних ядер пов’язана головно з під-
триманням положення голови. Низхідні шляхи від цих ядер
забезпечують корекцію положення голови щодо шиї та
інших частин тіла (див. Розділ 12). Висхідні зв’язки з
ядрами черепних нервів пов’язані переважно з рухами
очних яблук.
Ністагм
Характерні судомні рухи очей на початку та наприкінці
обертання називають ністагмом. Фактично ністагм є реф-
лекторним реагуванням для забезпечення фіксації погляду
на нерухомих предметах під час обертання тіла, хоча він
не зумовлений зоровими імпульсами і зафіксований у слі-
пих. З початком обертання очі починають повільно пере-
міщуватися у напрямі, протилежному до напряму обер-
тання, забезпечуючи зорову фіксацію (присінково-очний
рефлекс). Коли досягнуто певної межі обертання, то очні
яблука швидко перескакують на нову точку фіксації і знову
починають рух у напрямі, протилежному до напряму
обертання тіла. Повільний компонент ністагму спричи-
нюють імпульси з лабіринту; швидкий компонент запускає
особливий центр мозкового стовбура. Ністагм найчастіше
буває горизонтальним (тобто очі рухаються у горизонталь-
ній площині), однак може бути також вертикальним, коли
під час обертання нахиляти голову з боку в бік, та обер-
тальним - у разі нахиляння голови допереду. За напрям
руху очей у разі ністагму прийнято вважати напрям швид-
кого компонента. Як звичайно, напрям швидкого ком-
понента збігається з напрямом обертання, проте у випад-
ку постротаційного ністагму, який простежується внас-
лідок зміщення купола в разі припинення обертання, він
має протилежний напрям. Клінічний ністагм можна спос-
терігати у пацієнтів з ушкодженнями мозкового стовбура.
Реагування на лінійне прискорення
У ссавців на лінійне прискорення реагують плями
маточки та мішечка. Загалом маточка сприймає горизон-
тальне прискорення, а мішечок - вертикальне. Порівняно
з ендолімфою отоліти мають більшу густину, тому приско-
рення у будь-якому напрямі зміщує їх у протилежний бік,
що призводить до згинання відростків волоскових клітин
та активування нервових волокон. Без зміщень голови
плями генерують тонічні розряди внаслідок дії на отоліти
сили земного тяжіння. Ці імпульси беруть участь у забез-
печенні правильного положення голови та тіла, що роз-
глянуто у Розділі 12.
Хоча більшість реагувань на подразнення плям є реф-
лекторними, вестибулярні імпульси досягають кори голов-
ного мозку. Ймовірно, вони забезпечують усвідомлене
сприйняття руху і дають частину інформації, потрібної для
орієнтації тіла у просторі. Запаморочення, зумовлене від-
чуттям обертання у разі його реальної відсутності, є го-
ловним симптомом, що свідчить про запалення одного
лабіринту.
Теплове стимулювання
Півколові канали можна подразнювати введенням у зов-
нішній слуховий канал води з температурою вищою або
нижчою від температури тіла. Різниця температур зумов-
лює виникнення конвекційних потоків в ендолімфі зі змі-
щенням купола. Методика теплового (температурного)
стимулювання, яку інколи застосовують з діагностичною
метою, може спричинити ністагм, запаморочення та нудо-
ту. Для уникнення цих симптомів під час лікування вушних
інфекцій ліки повинні мати температуру тіла.
Орієнтація у просторі
Орієнтація у просторі частково залежить від імпульсів,
що надходять від вестибулярних рецепторів, проте важ-
ливими є також зорові сигнали. Відповідну інформацію
дають імпульси від пропріорецепторів суглобових капсул,
які сигналізують про взаєморозміщення різних частин тіла,
а також імпульси від шкірних екстерорецепторів, особливо
рецепторів дотику та тиску. Ці чотири групи імпульсів
використовує кора мозку для постійного синтезування
образу орієнтації тіла у просторі.
Морська хвороба
Нудота, зміни тиску крові, пітливість, блідість та блю-
вання - головні симптоми морської хвороби - спричинені
надмірним подразненням вестибулярного апарату. Ймо-
вірно, їх зумовлюють рефлекси, що передаються через вес-
тибулярні зв’язки у мозковому стовбурі та жмутково-вуз-
ликовій часточці мозочка (див. Розділ 12).
Космічна морська хвороба - нудота, блювання та запа-
морочення - розвивається у космонавтів, які вперше пере-
бувають в умовах невагомості і, як звичайно, зникає через
кілька днів космічного польоту. Її симптоми можуть поно-
витися після повернення до умов земного тяжіння, оскільки
зростає сила гравітації. Причина цього - невідповідність
між нейрональними імпульсами, що спричинені змінами
в окремих частинах вестибулярного апарату та інших
гравітаційних сенсорах, без зміни інших типів імпульсів,
які характеризують орієнтацію тіла у просторі.
10
Нюх та смак
ВСТУП
Нюх та смак уважають вісцеральними чуттями завдяки
їхньому тісному зв’язку із функцією шлунково-кишкового
тракту. Фізіологічно вони також тісно пов’язані один з
одним. Аромат різноманітної їжі головно складається з
комбінацій її смаку та запаху. Ось чому їжа може мати
інший смак для застудженої людини, у якої пригнічені
нюхові відчуття. Як смакові, так і нюхові рецептори за
природою є хеморецепторами, їх подразнюють молекули,
розчинені у слизі носової або у слині ротової порожнин.
Водночас анатомічно ці органи зовсім різні. Нюхові рецеп-
тори дистантні (телорецептори); нюхові провідні шляхи
не зв’язані із таламусом і у новій корі нема проекційних
нюхових ділянок. Смакові провідні шляхи підіймаються
по стовбурі мозку до таламуса і проектуються на постцент-
ральну закрутку разом з рецепторами дотику та тиску рото-
вої порожнини.
нюхових рецепторних нейронів через решітчасту плас-
тинку решітчастої кістки проникають до нюхових цибулин
мозку.
Нюхові рецепторні нейрони подібні до смакових рецеп-
торних клітин (див. нижче) і на відміну від інших видів
нейронів, постійно відновлюються з півперіодом у кілька
тижнів. Процес відновлення нюхових рецепторних клітин
регульований різноманітними чинниками; зокрема, з’ясо-
вано, що кістковий морфогенетичний білок (ВМР - від
англ. Ьопе тогрйо§епіс ргоіеіп) виявляє стосовно цих клі-
тин інгібіторний ефект. ВМР утворює велику родину фак-
торів росту, для яких спершу описаний регуляторний вплив
на ріст кісток, а згодом виявлено участь у регулюванні рос-
ту і розвитку більшості тканин організму, у тім числі нер-
вової.
Нюхова слизова оболонка постійно вкрита слизом, який
продукують залози Боумена, що локалізовані безпосеред-
ньо під базальною мембраною нюхової ділянки.
НЮХ
Нюхова слизова оболонка
Нюхові рецепторні клітини локалізовані у спеціалізо-
ваній ділянці слизової оболонки носа - у так званій нюхо-
вій слизовій оболонці, що вирізняється жовтуватим
забарвленням. У собак та інших тварин із високорозвине-
ним нюхом (макросматичні тварини) площа нюхової ділян-
ки велика; у мікросматичних тварин та людини вона
незначна. Нюхова ділянка у людини охоплює 5 см2 площі
даху носової порожнини біля носової перегородки (рис.
10-1). Тут містяться підтримувальні клітини, клітини-по-
передники рецепторних клітин та 10-20 мільйонів рецеп-
торних клітин. Кожна нюхова рецепторна клітина є ней-
роном, тому нюхову слизову оболонку вважають ділянкою
тіла, де нервова система перебуває у найтіснішому контакті
із зовнішнім світом. Кожний нюховий нейрон має короткий
товстий дендрит з розширеним закінченням - нюховою
паличкою (рис. 10-2). Від нюхових паличок до поверхні
слизової оболонки проходять нюхові війки. Кожна війка
має довжину 2 мкм та діаметр 0,1 мкм. Кожний рецеп-
торний нейрон утворює 10-20 нюхових війок. Аксони
Рис. 10-1. Нюхова слизова оболонка (відтворено за дозволом
з \А/ахтап 86: Соггеїаііуе Меигоапаіоту. 241Ь есі. МсОгам-
НіІІ, 2000).
НЮХ ТА СМАК/173
Базальна пластинка
Дендрит
Війки
Аксони (нюхові
нервові волокна)
Рецепторна
клітина
Підтримувальна
клітина
Термінальний
замикальний
контакт
Ендоплазматична
сітка
Нюхова
Пухирець паличка
Рис. 10-2. Будова нюхової слизової оболонки.
Є
Нюхові цибулини
У нюхових цибулинах аксони рецепторних нейронів
контактують з первинними дендритами митральних та
пучкових клітин (рис. 10-3), формуючи складні синапси
кулястої форми, які називають нюховими клубочками.
Пучкові клітини менші від митральних і мають тонші
аксони, проте обидва ці клітинні типи надсилають аксони
до слухової кори та інших ділянок мозку і з погляду
виконання функцій подібні. До одного нюхового клубочка
в середньому сходяться 26 000 аксонів нюхових рецептор-
них клітин. Окрім митральних та пучкових клітин, у нюхо-
вих цибулинах локалізовані приклубочкові клітини, які
виконують функцію гальмівних нейронів, що сполучають
клубочки між собою, а також зернисті клітини, які не
мають аксонів і формують реципрокні синаптичні контакти
з латеральними дендритами митральних та пучкових
клітин (див. рис. 10-3). За участю цих синапсів митральні
та пучкові клітини збуджують зернисті клітини шляхом
вивільнення глютамату, а синаптичні зони зернистих клі-
тин, відповідно, пригнічують митральні та пучкові клітини,
вивільняючи ГАМК. Фізіологічне значення такої будови
розглянуто нижче.
Нюхова кора
Аксони митральних та пучкових клітин проходять доза-
ду через проміжні та латеральні нюхові смуги до нюхо-
вої кори. Вони закінчуються на апікальних дендритах
пірамідних клітин цієї кори. У людей принюхування акти-
вує грушоподібну кору, проте самі по собі запахи - як з
принюхуванням, так і без нього - активують бічні та перед-
ні очнолобові закрутки лобової частки. Очно-лобове акти-
До нюхової кори
Рис. 10-3. Головні нейронні ланцюги нюхової цибулини.
Зверніть увагу на те, що нюхові рецепторні клітини з одним
типом рецепторів до ароматних речовин проектуються на
один нюховий клубочок (НК), клітини з рецепторами до аро-
матних речовин іншого типу проектуються на інший нюховий
клубочок; РП - решітчаста пластинка; ПК - приклубочкова
клітина; М - митральна клітина; П - пучкова клітина; 3 - зер-
ниста клітина (модифіковано з Могі К, Иадао Н, УозГііГіага У:
Тґіе оНасіогу ЬиІЬ: сосііпд апсі ргосеззіпд ої осіог тоїесиїаг іп-
їогтаііоп. Зсіепсе 1999:286;711).
вування, звичайно, є сильнішим праворуч, аніж ліворуч.
Отже, кіркове нюхове представництво асиметричне. Інші
волокна проектуються до мигдалеподібних тіл, які, прав-
доподібно, пов’язані з емоційним реагуванням на подраз-
нення запахами, а також до внутрішньонюхової (ендори-
нальної) кори, яка забезпечує нюхову пам’ять.
Пороги нюхових відчуттів та
розрізнення запахів
Нюхові рецептори реагують лише на речовини, що
контактують з нюховим епітелієм і розчиняються у тонкому
шарі слизу, яким цей епітелій вкритий. Пороги нюхових
відчуттів, наведені у табл. 10-1, відображають надзвичайно
високу чутливість нюхових рецепторів до деяких речовин.
Наприклад, метилмеркаптан, - один із складників часнику,
можна відчути на нюх при концентрації до 500 піко грам/
літр повітря. Окрім того, надзвичайно високою є здатність
розрізняти запахи; наприклад, людина може розрізнити
понад 10 000 різних запахів. З іншого боку, здатність до
розрізнення інтенсивності запаху розвинена доволі слабко:
концентрація запашної речовини у повітрі повинна змі-
нитися щонайменше на 30%, щоб ця зміна стала відчут-
ною. Для порівняння, око здатне розрізняти близько 1%
174/РОЗДІЛ 10
Таблиця 10-1. Пороги нюхового відчуття деяких речовин1
Речовина Концентрація, мг/л повітря
Етиловий спирт 5,83
Хлороформ 3,30
Піридин 0,03
М’ятна олія 0,02
Йодоформ 0,02
Масляна кислота 0,009
Пропілмеркаптан 0,006
Штучний мускус 0,00004
Метилмеркаптан 0,0000004
1 Дані з АІІізоп УС, Каіг 8Н. З ІпсІ СКет 1919; 11:336
зміни освітлення. Джерело запаху можна виявити на під-
ставі незначної відмінності у часі надходження запашної
речовини до кожної ніздрі.
Молекули запашних речовин, як звичайно, невеликі,
вони містять від 3-4 до 10-20 атомів вуглецю; молекули з
однаковою кількістю вуглецевих атомів, проте з іншою
конфігурацією молекули, мають різні запахи. Речовини, що
сильно пахнуть, мають порівняно високу розчинність у воді
та ліпідах.
Передавання сигналів
Останніми роками системі нюху приділяли досить знач-
ну увагу з огляду на таке запитання: як такий доволі прос-
тий орган чуття, яким є нюхова слизова оболонка, без
достатньо складного кіркового представництва, дає змогу
розрізняти понад 10 000 різноманітних запахів. Перша час-
тина відповіді пов’язує цей феномен з наявністю великої
кількості нюхових рецепторів; друга частина зумовлена
здатністю нюхових клубочків відігравати роль детекторів
образів.
У миші налічують близько 1 000 різних рецепторів запа-
хів; приблизно така ж кількість характерна і для людини.
Оскільки геном людини має лише близько 50-100 тис.
генів, то це означає, що приблизно 1% усього геному залу-
чено до продукування нюхових рецепторів. Отже, гени, які
забезпечують нюхові відчуття, є найбільшою родиною
генів, виявленою до цього часу у ссавців; їхня кількість
перевищує кількість імуноглобулінових генів та генів
рецепторів Т-лімфоцитів, разом узятих. Усі рецептори
запаху приєднані до гетеротримерних 6-білків. Частина
їх діє через аденілатциклазу і цАМФ, інші - через фосфо-
ліпазу С та продукти гідролізу фосфатидилінозитолу. Біль-
шість з них відкриває катіонні канали, зумовлюючи зворот-
ний потік Са2+.
Незважаючи на те, що різних рецепторів налічують
1 000, людина може розрізнити у 10 разів більшу кількість
запахів. Відповідно, повинен бути додатковий механізм
їхнього розрізнення. Цей механізм виявився пов’язаним з
нюховими клубочками, які діють як детектори образів, що
надсилають сигнали різної послідовності до нюхової кори.
Кожний клубочок отримує імпульси від рецепторів лише
одного типу (див. рис. 10-3); кожний тип рецептора здатний
реагувати на різноманітні запашні речовини, тобто кожний
запах може бути розпізнаний значною кількістю нюхових
рецепторів. Отже, кожен запах творить свою характерну
комбінацію активованих клубочків, за якою їх і розпізнає
мозок. Прямі докази цієї гіпотези отримані на щурах з
використанням методу оптичних зображень: запашні речо-
вини з мінімальною різницею у будові молекули, проте з
різним запахом, зумовлювали утворення різних комбінацій
клубочкового активування.
У нюхових клубочках відбувається латеральне гальму-
вання активності за участю приклубочкових та зернистих
клітин. Таким способом загострюються і фокусуються
нюхові сигнали. Окрім цього, позаклітинний потенціал
поля кожного клубочка зазнає постійних коливань, і зер-
нисті клітини регулюють їхню частоту. Фізіологічне зна-
чення цього коливання остаточно не з’ясоване, та, ймо-
вірно, воно також сприяє фокусуванню нюхових сигналів,
що надходять до кори мозку.
Нюхові стимули усувають протеїнкінази та ензими, що
каталізують ковалентну модифікацію молекул пахнучих
речовин.
Білки, що зв’язують запашні речовини
На противагу характерному для інтактної нюхової сли-
зової оболонки низькому порогові збудження поодинокі
нюхові рецептори, які зазнали групового подразнення,
мають порівняно високий поріг збудження і довгий латент-
ний період. Крім того, ліпофільні молекули, перш ніж
досягти нюхових рецепторів, повинні перейти через шар
гідрофільного слизу. Ці факти стали основою гіпотези про
наявність одного або більшої кількості білків, що кон-
центрують запашні речовини і доносять їх до рецепторів.
Таким уважають нещодавно ізольований унікальний для
носової порожнини білок молекулярної маси 18 кД, ймо-
вірна також наявність споріднених до нього білків. Цей
білок має значну гомологію з іншими білками людського
тіла, які відіграють роль носіїв для малих ліпофільних
молекул. Подібний зв’язувальний білок пов’язаний зі
смаком (див. нижче).
Лемешево-носовий орган
У гризунів та інших ссавців у носовій порожнині лока-
лізована додаткова ділянка нюхової слизової оболонки, від-
окремлена у вигляді добре розвиненого лемешево-носо-
вого (вомероназального) органа (орган Якобсона). Цей
утвір пов’язаний зі сприйняттям запахів, що діють як феро-
мони (див. Розділ 15). Рецептори лемешево-носового орга-
на проектуються на додаткову нюхову цибулину, а звідти
- переважно на ділянки мигдалеподібного тіла та гіпота-
ламуса, що пов’язані з репродукцією і харчовою поведін-
кою. Подразнення, що надходять від лемешево-носового
органа, мають вирішальний вплив на ці функції. Прикла-
дом може слугувати блокування вагітності у миші: феро-
мони самця перешкоджають настанню вагітності в разі
парування з самкою іншої лінії; у випадку парування самки
і самця однієї лінії подібне блокування вагітності не вини-
кає. Лемешево-носовий орган містить близько 30 серпен-
тинових нюхових рецепторів, структура яких суттєво від-
різняється від решти нюхового епітелію.
Лемешево-носовий орган у людини розвинутий незнач-
но, проте наявна анатомічно відокремлена та біохімічно
унікальна ділянка нюхової слизової оболонки у ямці перед-
НЮХ ТА СМАК/175
ньої третини носової перегородки, яка, правдоподібно, є
його гомологом. Відомі докази наявності феромонів люди-
ни, а також тісного зв’язку між запахами і статевою функ-
цією. Додатковим доказом цього слугує використання пар-
фумів. Уважають, що нюхові відчуття гостріші у жінок,
аніж у чоловіків, причому максимальної гостроти вони
набувають під час овуляції. Запах і, менше, смак мають
унікальну здатність зумовлювати довготривалі спогади.
Цей факт спершу помітили письменники, а пізніше експе-
риментально довели психологи.
Принюхування
Частина носової порожнини, у якій містяться нюхові
рецептори, погано вентильована. В нормі більша частина
повітря під час кожного дихального циклу плавно прохо-
дить через носові мушлі, хоча турбулентний рух спрямовує
частину повітря до нюхової слизової оболонки. Ці турбу-
лентні повітряні потоки, ймовірно, зумовлені контактом
холодного повітря з нагрітою поверхнею слизової оболон-
ки. Об’єм повітря, що досягає нюхових ділянок, значно
збільшується в разі принюхування. Процес принюхування
полягає у зближенні нижньої частини ніздрів до носової
перегородки для спрямовування повітряних потоків дого-
ри. Принюхування є напіврефлекторною реакцією на появу
у повітрі нового запаху, що зацікавив.
Роль больових рецепторів носової
порожнини
У нюховій слизовій оболонці містяться вільні нервові
закінчення багатьох больових нервових волокон трійчас-
того нерва. їх стимулюють подразнювальні речовини і
подразнювальний трійчастий компонент є частиною харак-
терного “запаху” таких речовин, як перцева м’ята, ментол
та хлор. Больові нервові закінчення зумовлюють чхання,
сльозогінність, затримку дихання та інші рефлекторні від-
повіді на нюхові подразники.
Адаптація
Відомо, що людина поступово перестає сприймати
навіть найнеприємніший запах, постійно перебуваючи в
його оточенні. Це інколи корисне явище є наслідком над-
звичайно швидкої адаптації, або десенситизації, що харак-
терна для нюхової системи. Адаптація стосується лише
конкретної речовини, поріг подразнення для інших речо-
вин незмінний. Принаймні частково цей факт зумовлений
центральними механізмами і, очевидно, пов’язаний з гіпер-
поляризацією кіркових нейронів.
Аномалії нюху
До аномалій нюху належать аносмія (відсутність нюхо-
вих відчуттів), гіпосмія (погіршення нюхових відчуттів)
та дизосмія (спотворення нюхових відчуттів). У людини
виявлено кілька десятків різноманітних аномалій. У кож-
ному конкретному випадку вони, ймовірно, зумовлені від-
сутністю або порушеннями функції одного з численної
родини нюхових рецепторних генів. З віком пороги нюхо-
вих відчуттів підвищуються; понад 75% осіб у віці 80 років
і старших мають порушене сприйняття запахів. Аносмію,
пов’язану із гіпогонадизмом (синдром Кальмана), розгля-
нуто у Розділах 14 та 23.
СМАК
РЕЦЕПТОРНІ ОРГАНИ ТА ШЛЯХИ
Смакові бруньки
Органами смакових відчуттів є смакові бруньки - оваль-
ні тільця розміром 50-70 мкм. Кожна смакова брунька
складається з чотирьох типів клітин (рис. 10-4): базальних
клітин; клітин першого та другого типу, які виконують
функцію підтримування; клітин третього типу, які є сма-
ковими рецепторними клітинами, що утворюють синап-
тичні зв’язки з чутливими нервовими волокнами. Клітини
першого-третього типу мають мікроворсинки, що спрямо-
вані у смакову пору - отвір в епітелії язика. Шийкові ділян-
ки усіх трьох типів клітин з’єднані між собою, а також з
прилеглим язиковим епітелієм щільними замикальними
контактами, що робить доступною для контакту з рідинами
ротової порожнини лише корону апікальних мікроворси-
нок. Кожну смакову бруньку іннервує близько 50 нервових
волокон, а кожне нервове волокно сприймає імпульси в
середньому від п’яти смакових бруньок. Базальні клітини
утворюються з епітеліального мікрооточення смакових
бруньок. З них диференціюються нові рецепторні клітини,
півперіод життя яких становить близько десяти днів. У разі
перетинання сенсорного нерва іннервовані ним смакові
бруньки поступово дегенерують і зникають. У випадку
регенерації нерва клітини його мікрооточення самоорга-
нізовуються у нові смакові бруньки, ймовірно, внаслідок
своєрідної хімічної індукції з боку реґенерувального во-
локна.
Рис. 10-4. Схема будови смакової бруньки: видно клітини
першого-третього типів. Ліворуч показано локалізацію сма-
кових бруньок у складі грибоподібних та жолобчастих сосочків
язика (модифіковано і відтворено за дозволом з Зґіерґіегсі
6М: МеигоЬіоІоду, 2псі есі. Охїогсі ііпіу Ргезз, 1988).
176/РОЗДІЛ 10
У людини смакові бруньки локалізовані у слизовій обо-
лонці надгортанника, піднебіння, глотки, і, головно, у стінці
грибоподібних та жолобчастих сосочках язика. Грибо-
подібні сосочки мають округлу форму і є найчисленнішими
біля кінчика язика; жолобчасті сосочки мають досить вели-
кий розмір і локалізовані у формі літери V на межі між
задньою та середньою третинами спинки язика. У кожному
грибоподібному сосочку налічують до п’яти смакових бру-
ньок, вони, звичайно, розміщені біля верхівки сосочка (див.
рис. 10-4). Більші за розміром жолобчасті сосочки містять
до 100 смакових бруньок, які здебільшого локалізовані на
боковій поверхні сосочка. Найчисленніші дрібні ниткопо-
дібні сосочки смакових бруньок не містять. Загальна кіль-
кість смакових бруньок становить близько 10 000.
Смакові шляхи
Чутливі нервові волокна від смакових бруньок передніх
двох третин язика проходять у складі слухової струни,
волокна від задньої третини язика досягають мозкового
стовбура через язикоглотковий нерв (рис. 10-5), а волокна
від смакових бруньок позаязикової локалізації - у складі
блукаючого нерва. Смакові волокна трьох означених нер-
вів, що є мієлінізованими, проте мають порівняно малу
швидкість передавання імпульсів, з кожного боку об’єднані
у ядрі поодинокого шляху довгастого мозку (рис. 10-6).
Тут вони утворюють синапси з нейронами другого порядку,
аксони яких перетинають серединну лінію і досягають
присередньої петлі, закінчуючись разом з волокнами доти-
кової, больової та температурної чутливості у специфічних
перемикальних ядрах таламуса. Звідси імпульси надходять
до смакових проекційних зон кори головного мозку біля
основи зацентральної закрутки. Смак не має відокремле-
Основа
центральної
завитки
II
Таламічні ~~~
радіації
Присередня петля
| СЕРЕДИННА
; ЛІНІЯ
пора
Смакова брунька
Рис 1(И. смсссс СіСХС.
Рис. 10-5. Сенсорна іннервація язика. Цифрами позначені
черепні нерви: V - трійчастий; VII - лицевий; IX - язикоглот-
ковий.
ного кіркового проекційного поля, він відображений у
ділянці зацентральної закрутки спільно зі шкірною чут-
ливістю лиця.
Головні смакові якості
Людина розпізнає чотири головні смаки: солодкий, кис-
лий, гіркий та солоний. Хоча зони сприйняття різних смаків
на язику значно перекриваються, проте гіркий смак сприй-
має головно задня стінка, кислий - бічні поверхні, солодкий
- кінчик, солоний - передня частина спинки язика (див.
рис. 10-5). Кислі та гіркі речовини, менше - солодкі та
солоні, сприймає також піднебіння. Усі чотири смакові
якості може також сприймати глотка та надгортанник. Гіс-
тологічно смакові рецепторні клітини ділянок з чутливістю
до різних смаків не відрізняються між собою, однак за
допомогою методу реєстрації потенціалів від окремої
смакової клітини з’ясовані фізіологічні відмінності між
смаковими клітинами тварин. Ці дослідження дали змогу
виявити, що одні клітини ліпше реагують на гіркі подраз-
ники, інші - на солоні, солодкі або кислі. Деякі клітини
реагують більше ніж на один смак, окремі - на усі чотири
смаки.
Недавно сформульовано концепцію наявності додатко-
вого смаку, так званого юмамі. Вважають, що він передає
відчуття глютаматів, зокрема, глютамату натрію, які широ-
НЮХ ТА СМАК/177
ко використовують у східній кухні. Рецептором цього смаку
вважають один із метаботропних глютаматних рецепторів
- стовбуровий т61пК4.
Речовини, що зумовлюють первинні
смакові відчуття
Кислий смак мають кислоти. Рецептори кислого смаку,
ймовірніше, стимульовані Н+-катіонами, аніж відповід-
ними аніонами. Для будь-якої кислоти сила кислого смаку
пропорційна до концентрації Нойонів, проте за однакової
концентрації Н -йонів органічні кислоти дають кисліший
смак, аніж мінеральні. Правдоподібно, це зумовлене ліп-
шою проникністю клітин для органічних кислот, аніж для
мінеральних.
Солоний смак дають йони Деякі органічні сполуки
також мають солоний смак, зокрема, дипептиди лізилтау-
рин та орнітилтаурин, причому за однакової молярної кон-
центрації лізилтаурин буде солонішим, ніж ИаСІ.
Більшість солодких речовин є органічними сполуками.
Найзвичніші - сахароза, мальтоза, лактоза та глюкоза,
однак полісахариди, гліцерол (гліцерин), деякі спирти та
кетони, а також значна кількість речовин без прямого зв’яз-
ку із названими вище, як от хлороформ, солі берилію,
різноманітні аміди аспарагінової кислоти, теж мають
солодкий смак. Штучні підсолоджувані, такі як сахарин та
аспартам, використовують у дієтах для схуднення, оскільки
вони здатні забезпечувати задовільний ефект підсолод-
ження за незначної концентрації. Сьогодні у світі щорічно
виробляють понад 100 мільйонів тонн штучних підсо-
лоджу вачів.
Два білки, очищені з африканських ягід - тауматин та
монелін - виявилися у 100 000 разів солодшими від
сахарози за однакової молярної концентрації. За будовою
ці білки відрізняються один від одного, хоча антитіла проти
одного з них дають перехресну реакцію з іншим. Це
свідчить про подібність просторової конфігурації моле-
кул, яка, очевидно, і є в основі зв’язування з рецепторами
солодкого.
Для тестування гіркого смаку загальноприйнято вико-
ристовувати хініну сульфат. Смак цієї речовини сприйма-
ється у концентрації 8 мкмоль/л, хоча стрихніну гідрохло-
рид має ще нижчий поріг подразнення (табл. 10-2). Гіркий
смак мають також інші органічні сполуки, особливо мор-
фін, нікотин, кофеїн, сечовина. Неорганічні сполуки маг-
нію, амонію та кальцію дають відчуття гіркого завдяки
катіонам. Тому певної молекулярної структури, з якою мож-
на було б пов’язати гіркий смак, нема.
Поріг смакового подразнення та
розрізнення інтенсивності
Здатність людини розрізняти інтенсивність смаку, подіб-
но до здатності розрізняти інтенсивність запаху, є доволі
обмеженою. Для того, щоб можна було відрізнити інтен-
сивність смаку, потрібна зміна концентрації смакової речо-
вини не менше, ніж на 30%. Поріг смакових відчуттів для
різних речовин відрізняється (див. табл. 10-2).
Механізм збудження рецепторів
Смакові рецепторні клітини є хеморецепторами, які
реагують на речовини, розчинені у рідині ротової порож-
)3 367-2
Таблиця 10-2. Смакові пороги деяких речовин
Речовина Смак Порогова концентрація, мкмоль/л
Хлористоводнева кислота Кислий 100
Натрію хлорид Солоний 2 000
Стрихніну гідрохлорид Гіркий 1.6
Глюкоза Солодкий 80 000
Сахароза Солодкий 10 000
Сахарин Солодкий 23
нини, що їх омиває. Ці речовини діють на мікроворсинки,
що містяться у смаковій порі, спричинюючи генерування
потенціалів рецепторною клітиною, що зумовлює виник-
нення потенціалів дії у чутливих нейронах.
Механізм збудження рецепторних клітин відрізняється
для різних смакових подразників. Дослідження смакових
рецепторів швидко прогресують і вже клоновано багато
потенційних кандидатів на рецепторні молекули. Білок,
який названо деґенерином-1 ссавців, є ймовірним рецеп-
тором кислих речовин. Альтернативний механізм полягає
у деполяризації кислотами рецепторних клітин кислого
смаку шляхом активування катіонних каналів, регульова-
них Н+-йонами; Иа+ деполяризує рецепторні клітини соло-
ного за посередництвом На4-каналів, які споріднені з №+-
каналами епітеліоцитів. Ці канали блокує амілорид (див.
Розділ 1), тому пряма дія цього діуретика на язик людини
блокує відчуття солоного. Солодкі речовини активують
аденілатциклазу за посередництвом гетеротримерного 6-
білка; спричинене цим зростання внутрішньоклітинної
концентрації цАМФ зменшує проникність плазмолеми для
К+ шляхом фосфорилювання К+ -каналів базолатеральної
поверхні клітинної оболонки, зумовлюючи цим деполяри-
зацію клітини. Речовини з гірким смаком зменшують кон-
центрацію цАМФ у відповідних рецепторних клітинах,
ймовірно, за посередництвом гетеротримерного 6-білка,
і підвищують концентрацію ІФ3 та ДАГ (див. Розділ 1).
Недавно був клонований новий 6-білок рецепторних
клітин гіркого смаку, названий а-гусдуцином. Він має
здатність знижувати рівень внутрішньоклітинного цАМФ
активуванням фосфодіестерази. Крім того, а-гусдуцин був
виявлений також у рецепторних клітинах солодкого смаку,
збудження яких пов’язане з підвищенням внутрішньоклі-
тинного рівня цАМФ. Тонкий механізм дії а-гусдуцину не
з’ясований.
Клоновано також білок, що має властивість зв’язувати
смакові молекули. Його продукують залози Ебнера, які
виділяють свій секрет у щілину навколо жолобчастих
сосочків (див. рис. 10-4). Ймовірно, функція цього білка
подібна до функції білка-зв’язувача запашних речовин і
полягає у накопиченні та транспортуванні смакових речо-
вин до рецепторних клітин.
Аромат
Найчисленніші комбінації смаків, що так цінують гур-
мани, формуються з чотирьох головних складників. У
деяких випадках специфіка смаку потребує температурного
стимулювання (наприклад, у “гарячих” приправах). Окрім
178/РОЗДІЛ 10
того, важливу роль у загальному відчутті, яке дає їжа, віді-
грає запах, як і консистенція та температура, які долуча-
ються до її “аромату”.
Варіабельність та ефекти післядії
Є значні видові та індивідуальні відмінності у розподілі
смакових бруньок, спеціалізованих на сприйнятті різних
смаків. У людини цікава варіабельність сприйняття смаку
фенілтіокарбаміду: у розбавлених розчинах ця речовина
має гіркий смак для 70% осіб кавказької популяції, і не
має смаку для решти 30%. Нездатність до сприйняття смаку
фенілтіокарбаміду успадкована як аутосомно рецесивна
ознака. Тестування цієї особливості має важливе значення
у генетичних дослідженнях людини.
Для смакових відчуттів характерні ефекти післядії та
явища контрасту, які нагадують візуальні залишкові образи
та контрасти. Деякі з цих явищ можуть мати хімічну основу,
інші - центрального генезу. З рослинного джерела виділено
білок-модифікатор смаку, який названо міракуліном. Його
дія на язик приводить до зміни смаку кислої речовини на
солодку.
Людина та тварини набувають сильної відрази до нової
їжі, якщо її споживання супроводжувалося хворобою. Жит-
тєва цінність такої відрази стає очевидною з огляду на
профілактику отруєнь.
Аномалії
До аномалій смаку належать агевзія (відсутність смако-
вих відчуттів), гіпогевзія (ослаблення смакової чутливос-
ті) та дисгевзія (порушення смакових відчуттів). Гіпогев-
зію можуть спричинювати багато захворювань. Окрім того,
такі ліки, як каптоприл та пеніциламін, що містять суль-
фгідрильні групи, зумовлюють тимчасову втрату смаку.
Причина цього ефекту сульфгідрильних сполук невідома.
Стан тривоги, сон та
електрична активність мозку
11
ВСТУП
Більшість сенсорних шляхів, описаних у Розділах 7-10,
передають імпульси від органів чуття через три- або чоти-
ринейронні ланцюги до відповідних ділянок кори головно-
го мозку. Імпульси відповідають за сприйняття та локаліза-
цію індивідуальних відчуттів. Очевидно, для того, щоб бути
сприйнятими, їх повинен опрацювати мозок у стані неспан-
ня. Ссавцям притаманний цілий спектр станів поведінки -
від глибокого до легкого та швидкого сну, а також два стани
неспання: розслабленого усвідомлення та усвідомлення зі
сконцентрованою увагою. Кожному з цих станів відпові-
дають певні види електричної активності мозку, в тому чис-
лі електроенцефалографічні (ЕЕГ). Останніми роками при-
вертають до себе увагу спричинені механізмом біоелект-
ричної активності зворотного зв’язку осциляції кори го-
ловного мозку та осциляції між таламусом і корою, як такі,
що продукують ЕЕГ та, ймовірно, визначають поведінкові
стани. Види ЕЕГ під час пробудження, неспання та зміни
потенціалів у таламусі можуть бути продуковані сенсор-
ними подразненнями та імпульсами з ретикулярної форма-
ції середнього мозку, а сон і види снів - шляхом подраз-
нення основи переднього мозку та інших “зон сну”. Цей
розділ присвячений різноманітним станам під час сну та
неспання, а також біоелектричній активності, що є їхньою
основою.
ТАЛАМУС ТА КОРА ГОЛОВНОГО МОЗКУ
Ядра таламуса
З огляду на розвиток і топографію таламуса його можна
розділити на три частини: епіталамус, дорсальний таламус
та вентральний таламус. Епіталамус має зв’язки з нюхо-
вою системою. Проекції та функції вентрального тала-
муса остаточно не визначені. У дорсальному таламусі
виділяють ядра, що мають дифундивні проекції до усієї
нової кори, та ядра, що мають проекції до специфічних
дискретних ділянок нової кори і лімбічної системи. Про-
екції до всіх частин нової кори мають присерединні та внут-
рішньоламінарні ядра.
У ядрах дорсального таламуса, що мають проекції до
специфічних ділянок, є специфічні сенсорні релейні ядра
та ядра, задіяні в еферентних регулювальних механізмах.
Специфічні сенсорні передавальні ядра мають медіальні
та латеральні колінчасті тіла, які передають слухові та зо-
рові імпульси у слухову та зорову кору, а також вентроба-
зальну групу ядер, які передають соматосенсорну інфор-
мацію до постцентральної звивини. Ядра, задіяні в ефе-
рентних (регулювальних) механізмах, охоплюють низку
ядер, що відповідають за рухову функцію. Вони отримують
сигнал від базальних гангліїв та мозочка і передають його
до моторної кори. До цієї групи також належать передні
ядра, які отримують аферентні сигнали із сосочкоподібних
тіл і передають до лімбічної кори.
Будова кори
Нова кора, як звичайно складається з шести шарів (рис.
11-1). Нейрони є переважно пірамідальними клітинами з
витягненими вертикальними деревоподібними структура-
ми (рис. 11-1, 11-2), що можуть досягати аж до поверхні
кори. Аксони цих клітин зазвичай випускають зворотні ко-
латералі, які розвертаються й утворюють синапс на поверх-
невих ділянках деревоподібних структур.
Аферентні імпульси зі специфічних ядер таламуса за-
тримуються головно в кірковому шарі 4, тоді як неспеци-
фічні аферентні - розподіляються по шарах 1-4.
РЕТИКУЛЯРНА ФОРМАЦІЯ
ТА РЕТИКУЛЯРНА АКТИВАЦІЙНА СИСТЕМА
Ретикулярна формація, філогенетично стара ретику-
лярна серцевина мозку, займає середньовентральну ділянку
довгастого та середнього мозку. Головно це - анатомічна
зона, що складається з різних нейрональних кластерів і
волокон із різними функціями. Наприклад, вона містить
клітинні тіла та волокна серотонінергічних, норадренер-
гічних та адренергічних систем, що розглянуті в Розділі
15, а також багато ділянок, задіяних у регулюванні частоти
серцевих скорочень, кров’яного тиску та дихання, що опи-
сано в Розділах 33 і 36. Деякі з низхідних волокон сповіль-
нюють передавання в сенсорних шляхах спинного мозку
(див. Розділ 7). Різні ділянки ретикулярної формації та шля-
хи від них відповідають за еластичність і регулюють реф-
лекси розтягу (див. Розділ 12). Ретикулярна активаційна сис-
тема (РАС) і пов’язані з нею компоненти мозку, що відпові-
дають за стан свідомості та сну, розглянуто в цьому розділі.
РАС є складною полісинаптичною мережею. Колатералі
потрапляють до неї не тільки з довгих висхідних сенсор-
них шляхів, а й з трійчастої, слухової, зорової, а також ню-
хової систем. Складність нейрональної мережі та рівень
180/РОЗДІЛ 11
Рис. 11-1. Будова кори головного мозку. Кіркові шари позначено цифрами. А: за допомогою забарвлювання за Ґольджі показано
тіла та дендрити нервових клітин. В: за допомогою забарвлювання за Ніселем показано тіла клітин. С: за допомогою
забарвлювання за Вейґертом показано мієлінові нервові волокна. О: зображення нервових з'єднань (А, В та С відтворено за
дозволом з Рапзоп 8\А/, СІагк 8І_: Тґіе Апаіоту оТіґіе Иегуоиз Зузіет. 10111 есі. Заисіегз, 1959).
конвергенції в ній нігілюють специфічність виду чуття, і
більшість ретикулярних нейронів можуть бути активовані
з однаковою легкістю різними сенсорними подразниками.
Отже, система є неспецифічною, тоді як класичні сенсорні
шляхи специфічні, оскільки волокна в них активує лише
один вид сенсорного подразника. Частина РАС оминає
таламус, поширюючи проекції дифундивно до кори. Інша
частина закінчується у внутрішньоламінарних та спорід-
нених таламічних ядрах, від яких ідуть дифундивні та не-
специфічні проекції до всієї нової кори (рис. 11-3).
БІОЕЛЕКТРИЧНІ ПОТЕНЦІАЛИ КОРИ
ГОЛОВНОГО МОЗКУ
Біоелектричні реакції, що відбуваються в корі після по-
дразнення органів чуття, можна перевіряти за допомогою
електрода, що розташований на певній відстані і має зв’я-
зок з іншим електродом в індиферентній точці. Характерна
реакція простежується у тварин під барбітуратною анесте-
зією, яка значно послаблює основну біоелектричну актив-
ність. Якщо досліджувальний електрод міститься над пер-
винною зоною сприймання для відповідного відчуття, то
поверхнево позитивна хвиля має латентний період трива-
лістю 5-15 мс. Далі надходить мала негативна хвиля, у
цьому разі виникає більший, видовженіший позитивний
зубець з латентним періодом 20-80 мс. Першу позитивно-
негативну хвильову послідовність називають первинним
збудженим потенціалом, другу - вторинною дифузною
реакцією.
Первинний збуджений потенціал надзвичайно специ-
фічний з огляду на розташування. Його можна виявити
тільки на закінченнях шляхів від конкретного органа чуття.
Електрод на поверхні м’якої мозкової оболонки кори фіксує
активність на глибині лише до 0,3-0,6 мм. Первинна реак-
ція є швидше негативною, ніж позитивною, якщо її
фіксувати мікроелектродом, уведеним вглиб між шарами
2-6 кори головного мозку, а після негативної хвилі в корі
настає позитивна. Негативно-позитивна послідовність
свідчить про деполяризацію на дендритах і тілах клітин у
корі, після якої настає гіперполяризація. Позитивно-нега-
тивна хвильова послідовність, записана з поверхні кори,
виникає тому, що поверхневі шари кори є позитивними
порівняно з внутрішньою негативністю і негативними по-
рівняно з глибокою гіперполяризацією. У тварин чи людей,
що не були піддані анестезії, первинний збуджений потен-
ціал значно затінений спонтанною активністю мозку, однак
його наявність є наслідком, що виявляється поза середнім
рівнем головної біоелектричної активності. Цей потенціал
дещо більше дифузійний у тварин, не підданих анестезії,
однак порівняно з дифузійною вторинною реакцією добре
локалізований.
СТАН ТРИВОГИ, СОН ТА ЕЛЕКТРИЧНА АКТИВНІСТЬ МОЗКУ /181
Рис. 11-2. Пірамідальна клітина нової кори, показано поши-
рення нейронів, що закінчуються на ній. А - неспецифічні
аференти з ретикулярної формації і таламуса; В - повторю-
вані колатералі аксонів пірамідальної клітини; С - спайкові
волокна з ділянок дзеркального відображення у протилежній
півкулі; О - специфічні аференти з сенсорних ядер таламуса
(відтворено за дозволом з Сїюуу КІ_, І_еітап АІ_: Тґіе зігисіигаї
апсі їипсііопаї огдапігаііоп ої ІЬе пеосогіех. Иеигозсі Рез Рго-
дгат ВиІІ. 1970; 8: 157).
Рис. 11-3. Схематичне зображення висхідної ретикулярної
системи у середньому мозку людини, її проекції до внутріш-
ньоламінарних ядер таламуса та вихід внутрішньоламінарних
ядер до багатьох частин кори головного мозку. Активування
цих ділянок показано за допомогою ПЕТ сканування у разі
переходу суб’єкта зі стану розслаблення у випадку неспання
до стану концентрації уваги під час виконання завдання (дані
з Кіпотига 8 еі аі: Асііуаііоп Ьу айепііоп ої ІГіе Гіитап геіісиїаг
їогтаїіоп апсі ІЬаІатіс іпігаїатіпаг писіеі. Зсіепсе 1996; 271:
512).
Вторинна поверхнево-позитивна дифузійна реакція, на
відміну від первинної, не є чітко локалізованою. Вона з’яв-
ляється одночасно майже по всій корі головного мозку і
відповідає активності в проекціях з серединних та спорід-
нених таламічних ядер.
ЕЛЕКТРОЕНЦЕФАЛОГРАМА
Головну електричну активність мозку тварин, не підда-
них анестезії, вперше описано у XIX ст. Пізніше її систе-
матично аналізував німецький психіатр Ганс Берґер, який
і ввів термін електроенцефалограма (ЕЕГ), щоб окрес-
лити записування коливань мозкових потенціалів. ЕЕГ
можна записати за допомогою черепних електродів на не-
розкритому черепі або ж за допомогою електродів у голов-
ному мозку. Інколи використовують термін електрокор-
тикограма (ЕКоГ) для означення запису, отриманого за
допомогою електродів, розміщених на м’якій мозковій
оболонці кори головного мозку.
Записи ЕЕГ можуть бути дво- або однополярними. Дво-
полярні записи відображають коливання потенціалів між
двома кірковими електродами; однополярні - різницю між
потенціалами кіркового електрода і теоретично індифе-
рентним електродом на віддаленій від кори частині тіла.
Альфа-ритм
У разі записування ЕЕГ зі шкіри голови у дорослих лю-
дей, що вже не сплять, однак відпочивають із заплющеними
очима та нефіксованою увагою, головним компонентом є
стабільний тип хвиль з частотою 8-12 Гц та амплітудою
50-100 мВ. Таку криву називають альфа-ритмом. Най-
помітніша вона в тім’яно-потиличній ділянці, хоча інколи
простежується і в інших місцях. Подібний ритм спостере-
жено в багатьох видів ссавців (рис. 11-4). Наприклад, у
котів він не набагато швидший, ніж у людини. Незважаючи
на незначні відмінності залежно від виду, у всіх ссавців
альфа-ритм дуже подібний.
Інші ритми
Окрім домінантного, інші ритми з частотою 18-30 Гц
та нижчою амплітудою зафіксовано на лобових ділянках.
Наприклад, бета-ритм може бути гармонічною хвилею
альфа. Гамма-коливання з частотою 30-80 Гц здебіль-
шого виникають, коли особа перебуває в стані збудження
й акцентує на чомусь свою увагу. Інколи це змінюється не-
регулярною швидкою активністю під час ініціації моторної
активності як реагування на подразник. Великоамплітудні
регулярні хвилі з частотою 4-7 Гц, які називають тета-
ритмом, трапляються в дітей, а у піддослідних тварин гене-
ровані завдяки морському конику (див. нижче).‘Великі по-
вільні хвилі з частотою до 4 Гц інколи називають дельта-
хвилями.
Відхилення в ЕЕГ
З віком у людей частота домінантного ритму ЕЕГ у стані
спокою змінюється. У немовлят бета-подібна біоелектрич-
на активність швидка, однак потиличний ритм повільний,
з частотою 0,5-2,0 Гц. У дітей цей ритм пришвидшений, а
такий альфа-ритм, як у дорослих, поступово з’являється
182/РОЗДІЛ 11
Морська свинка:
Кіт:
Рис. 11-4. Запис ЕЕГ, показано альфа-ритми представників
різних видів.
впродовж пубертатного періоду. Частота альфа-ритму спо-
вільнюється в разі низького рівня глюкози в крові, низької
температури тіла, низького рівня надниркових глюкокор-
тикоїдних гормонів та високого артеріального парціаль-
ного тиску СО2 (РасО2). Підвищення частоти простежується
у випадку протилежних станів. У клініці примусове фор-
соване дихання інколи використовують для виявлення ла-
тентних аномалій ЕЕГ.
Блокада альфа-ритму
Коли увагу сфокусовано на чомусь, то альфа-ритм змі-
нює швидка, дещо нерегулярна низьковольтна активність.
Цей феномен називають блокадою альфа-ритму. Пере-
ривання альфа-ритму також може бути зумовлене будь-
якою формою сенсорного подразнення (рис. 11 -5) чи розу-
мовою концентрацією, наприклад, під час розв’язування
арифметичних задач. Загальний термін, який використо-
вують для означення заміни регулярного альфа-ритму нере-
гулярною низьковольтною біоелектричною активністю, -
збудження, чи реакція тривоги (вона пов’язана зі збуд-
женням, тривожним станом). Її ще називають десинх-
ронізацією, оскільки припиняється синхронізована ней-
рональна активність, необхідна для утворення регулярних
хвиль. Щоправда, підвищена активність ЕЕГ, яку спосте-
рігають у разі піднесеного стану, також синхронізована,
однак на вищому рівні. Отже, термін десинхронізація не-
точний.
Ритми в стані сну
Є два різновиди сну: сон у разі швидкого руху очей
(ШРО) та сон у разі повільного руху очей - не-ШРО
(НШРО), або повільнохвильовий сон. НШРО поділяють
на чотири стадії. Особа, що засинає, потрапляє в першу
стадію, під час якої простежується низькоамплітудна ви-
сокочастотна ЕЕГ-активність (рис. 11-6). На другій стадії
з’являються так звані веретена сну - спалахи альфа-по-
дібних (10-14 Гц, 50 мВ) хвиль. На третій стадії зафіксо-
вано ритм з нижчою частотою та підвищеною амплітудою
ЕЕГ-хвиль, а на четвертій - максимальне сповільнення по-
ряд з великими хвилями. Отже, для глибокого сну харак-
терні ритмічні повільні хвилі з вираженою синхроніза-
цією.
Сон у разі ШРО
Високоамплітудні повільні хвилі, що простежуються на
ЕЕГ упродовж сну, деколи змінює швидка низьковольтна
ЕЕГ-активність, яка в приматів, а також і в людей, нагадує
стан першої стадії сну. Щоправда, сон у цьому разі не пере-
ривається; поріг збудження сенсорними подразниками та
стимулюванням ретикулярної формації інколи підвищений.
Такий стан називають парадоксальним сном, оскільки
активність ЕЕГ висока. Протягом парадоксального сну від-
буваються швидкі блукальні рухи очей, тому його також
називають сном ШРО. Таких рухів нема у разі повільно-
хвильового сну, який з огляду на це називають сном НШРО.
Інша характерна ознака сну ШРО - великофазні потенціали
(групою від трьох до п’яти), які виникають у мості і швидко
рухаються до латерального колінчастого тіла, а звідти -
до потиличної ділянки кори. З огляду на це їх називають
мосто-колінчасто-потиличними (МКП) спайками,* або
піками. Упродовж такого сну значно знижується тонус ске-
летних м’язів у шийній ділянці (див. рис. 11 -6). Інші м’язи
зберігають тонус, щоправда відбувається відносний пара-
ліч вольової активності, який залежить від голубої плямки.
У котів з ушкодженнями голубої плямки сон у разі ШРО по-
в’язаний з метанням, ніби вони діють у контексті свого сну.
ФІЗІОЛОГІЧНА ОСНОВА ЕЕГ,
СВІДОМОСТІ ТА СНУ
ЕЕГ є записом електричної активності невральних оди-
ниць кори в об’ємному провіднику (див. Розділ 2). Зазвичай
її записують від шкіри голови або черепа, тому вона має
* Від англ зріке - максимальний пік у разі біоелектричної активності.
Новий запах і---1
Рис. 11-5. ЕЕГ кори кролика, показано стан реакції тривоги, зумовлений нюховим подразником.
СТАН ТРИВОГИ, СОН ТА ЕЛЕКТРИЧНА АКТИВНІСТЬ МОЗКУ /183
Неспання
ЕМГ
ЦЕНТРАЛЬНЕ
ФРОНТАЛЬНЕ
ПОТИЛИЧНЕ
Стадія З
ййМ>»^ .«м Ми
Стадія 4
*^Ч/**^^ <
50
мв
2с
Рис. 11-6. ЕЕГ та м’язова активність під час різних стадій сну. ЕОГ - електроокулограма, що реєструє рухи очей; ЕМГ -
електроміограма, що реєструє активність скелетних м’язів; ЦЕНТРАЛЬНЕ, ФРОНТАЛЬНЕ, ПОТИЛИЧНЕ розташування трьох
електродів ЕЕГ. Зверніть увагу на низький м’язовий тонус поряд з екстенсивними рухами очей у разі швидкого сну (відтворено
за дозволом з Каїев А еї аі: 8Іеер апсі сігеатв: Ресепї гезеагсЬ оп сііпісаі азресїз. Апп Іпїегп Месі. 1968;68:1078).
значно менший вольтаж, ніж у випадку, якби записували
безпосередньо з кори головного мозку. Як зазначено вище,
записування з поверхні кори чи шкіри голови реєструє
позитивну хвилю, якщо струм напрямлений до електрода,
і негативну, якщо цей напрям від поверхні.
Диполі кори
У всіх випадках наявність хвиль на ЕЕГ свідчить про
те, що активність у ділянці кори головного мозку, виміряна
ЕЕГ, то підвищується, то знижується. Однак якби актив-
ність була хаотичною, то не виникали б розряди, і, як наслі-
док, хвилі. Впливу цих ритмів на поведінкові стани і навіть
на свідомість досі не з’ясовано. Водночас є серйозні докази
того, що ці хвилі зумовлені осциляційною активністю в
корі та коливаннями у механізмах зворотного зв’язку між
таламусом і корою.
Дендрити клітин кори - це деревоподібні однаково
орієнтовані, щільно укладені одиниці в поверхневих шарах
кори головного мозку (див. рис. 11-1). Поширювані потен-
ціали можуть генеруватися у дендритах (див. Розділ 4).
Окрім того, на дендритах у поверхневих шарах закінчу-
ються зворотні колатералі аксонів. Щоправда, дендрити
переважно є місцем непоширювальних гіпополяризуваль-
них місцевих потенціалів. Коли збуджувальні та гальмівні
закінчення на дендритах кожної клітини стають активними,
то вони стають джерелом або приймачем біострумів для
решти дендритних відростків і тіла клітини. Отже, між
клітиною та дендритом є постійно змінна двополярність.
Потік імпульсів у цьому диполюсі виробляє хвилеподібні
коливання потенціалу в об’ємному провіднику (рис. 11-7).
Якщо загальна дендритна активність від’ємна щодо клі-
тини, то клітина стає гіпополяризованою та гіперзбудли-
вою, якщо ж вона позитивна, то клітина гіперполяризована
й менш збудлива. Дві інші частини ЦНС, у яких багато
складних паралельних дендритних відростків розташовані
під м’якою мозковою оболонкою над шаром клітин, - це
кора головного мозку та морський коник. На обидвох
ділянках простежується характерне ритмічне коливання
поверхневого потенціалу, подібне до того, яке спостері-
гають на кірковій ЕЕГ.
184/РОЗДІЛ 11
Рис. 11-7. Схематичне порівняння електричних реакцій аксона
та дендритів великого кіркового нейрона. Потік біопотенціалів
через активні синаптичні бляшки на дендритах зумовлює хви-
льову активність, тоді як “все або нічого” потенціали дії пере-
ходять уздовж аксона.
Таламокіркові коливання
Ще одним джерелом хвиль ЕЕГ є зворотна коливальна
активність між серединними ядрами таламуса та корою
головного мозку (рис. 11 -8). Нейрони таламуса гіперполя-
ризовані і змінюють заряд лише у веретеноподібних фазних
спалахах під час повільнохвильового сну. У стані свідо-
мості вони частково деполяризовані і тонічно “спалаху-
ють” з великою швидкістю. Це пов’язано з вищою швид-
кістю “спалахування” кіркових нейронів.
Стан нейронів таламуса змінюється з гіперполяризова-
ного фазного “спалахування” на деполяризоване тонічне
внаслідок сенсорного подразнення, що зумовлює збуджен-
ня. І навпаки, стан нейронів змінюється від деполяризації
до гіперполяризації шляхом стимулювання зон сну (див.
нижче). Є підстави вважати: якщо нейрони гіперполяри-
зовані і “спалахують” тільки під час фазового вибуху, то
активність у таламокіркових коливаннях запобігає прий-
манню чи опрацюванню нейронами кори специфічних
вхідних сигналів.
Механізми, що зумовлюють ЕЕГ збудження
Заміна ритмічного типу ЕЕГ низьковольтною високою
активністю відбувається внаслідок стимулювання специ-
фічних сенсорних систем до рівня середнього мозку. Вод-
ночас стимулювання цих систем над середнім мозком, по-
дразнення специфічних сенсорних релейних ядер таламуса
чи стимулювання самих приймальних ділянок кори не
спричинює реакції тривоги. З іншого боку, високочастотне
стимулювання середньомозкової ретикулярної формації
зумовлює ЕЕГ реакцію тривоги (рис. 11-9) і пробуджує
сплячу тварину. Значні двосторонні ушкодження бічної та
верхньої ділянок середнього мозку, що переривають меді-
альні петлі й інші висхідні специфічні сенсорні системи,
ЕЕГ
Неспання
АиТч^***
20-80 Гц ритми
Таламокіркова петля
Кора
головного мозку
0,5-4 Гц ритми
Таламус
Властивості клітини
Таламокіркова клітина
0,5-4 Гц спалахи Тонічне спалахування
Перехід від сну до пробудження
Рис. 11-8. Зв’язок між поведінковими станами, ЕЕГ та клітинними реакціями в корі головного мозку і таламусі (модифіковано
та відтворено з МсСогтіск ОА: Аге ИіаІатосогіісаІ гїіуїїітв їїіе Ковейа віопе оїа виЬвеї ої пеигоіодісаі сіівогсіегв? Маі Месі. 1999;
12:1349).
СТАН ТРИВОГИ, СОН ТА ЕЛЕКТРИЧНА АКТИВНІСТЬ МОЗКУ /185
Рис. 11-9. Одночасне записування поверхневої ЕЕГ, ЕЕГ на
1,2 мм у корі та реакції кіркових нейронів, зареєстровані внут-
рішньоклітинним електродом у кота під легкою анестезією.
Подразнення ретикулярної формації середнього мозку
(РФСМ) частотою 300 Гц зумовило реакцію тривоги. Зверніть
увагу на те, що рівень зміни потенціалів внутрішньокіркового
нейрона збільшується під час та після подразнення (відтво-
рено за дозволом з Зіегіаде М, Агпгіса Е, Сопігегає □: 8уп-
сїігопігаііоп ої (азі (30-40 Нг) зропіапеоиз согіісаі гґіуйітє
сіигіпд Ьгаіп асііуаііоп. З ІМеиговсі. 1996,16:392).
не запобігають появі “тривожної” ЕЕГ, спричиненої сен-
сорними подразненнями, натомість ураження в покришці
середнього мозку, що впливають на РАС, у разі неушкод-
жених специфічних систем, пов’язані з повільнохвильовим
синхронізованим типом ритму, на який не діють сенсорні
подразнення. Тварини з першим типом ушкодження пере-
бувають у стані неспання, з другим - у стані коми впродовж
тривалого періоду. Пацієнти з ушкодженням, що перериває
РАС, також перебувають у стані сну чи коми. Отже, вис-
хідна активність, що відповідає за ЕЕГ реакцію тривоги,
внаслідок сенсорних подразнень надходить через специ-
фічні сенсорні системи до середнього мозку, потрапляє до
РАС через колатералі і через внутрішньоламінарні ядра
таламуса та неспецифічну таламічну систему проекцій -
до кори великого мозку.
Походження повільнохвильового сну
Повільні хвилі на ЕЕГ та їхній вплив на поведінку, а
також повільнохвильовий сон, можуть бути зумовлені сти-
мулюванням щонайменше трьох підкіркових зон.
Сонна зона проміжного мозку міститься в задній час-
тині гіпоталамуса і сусідніх внутрішньоламінарних та пе-
редніх таламічних ядрах. Частота подразника повинна ста-
новити приблизно 8 Гц; швидші стимули спричинюють
збудження. Важливо, що низько- і високочастотне стиму-
лювання зумовлюють різні реакції. Іншою зоною є меду-
лярна синхронізувальна в ретикулярній формації дов-
гастого мозку на рівні ядра солітарного шляху. Подразнен-
ня її низькими частотами подібне до стимулювання сонної
зони проміжного мозку і спричинює сон, а високими -
збудження. Механізми, за допомогою яких це відбувається,
нез’ясовані, однак припускають, що у ньому задіяні шляхи,
що ведуть до таламуса. Ще одна синхронізувальна ділянка
- це базальна передньомозкова зона сну. Вона охоплює
передоптичну ділянку та діагональну смугу зони Брока і
відрізняється від інших двох тим, що стимулювання базаль-
ної передньомозкової зони зумовлюють повільні хвилі й
сон, незалежно від частоти стимулювання. Нейрони у
вентролатеральній частині передоптичної зони мають про-
екції до горбово-сосочкового ядра - частини заднього гіпо-
таламуса, що перебуває в діенцефальній зоні сну.
Зазначимо, що подразнення аферентів через механоре-
цептори шкіри з частотою 10 Гц чи менше також спричи-
нює сон у тварин; відомо також, що внаслідок дії регуляр-
них повторюваних монотонних стимулів засинають люди.
З іншого боку, повільнохвильовий сон перебуває під
вираженим циркадним контролем. Роль супрахіазматичних
ядер гіпоталамуса в регулюванні сну та інших циркадних
ритмів описано в Розділі 14.
Гострі суперечки були щодо впливу серотонінергічних
нейронів у мозку (див. Розділ 15) на сон, однак сьогодні
з’ясовано, що агоністи серотоніну пригнічують сон, а анта-
гоніст серотоніну ритансерин посилює повільнохвильовий
сон у людей. Концентрація аденозину збільшується в хо-
лінергічних ділянках базального переднього мозку та мезо-
мостових холінергічних ядрах (див. нижче) упродовж
періоду неспання і зменшується під час сну. Ці дві ділянки
пов’язані зі сном, отже, аденозин може бути чинником, що
зумовлює сон. Такий висновок не суперечить загальнові-
домим збуджувальним впливам кофеїну, що є антагоністом
аденозину.
Відповідно до ще однієї гіпотези, вивільнення проста-
гландину Д2(ПГД2; див. Розділ 17) у медіальній передоп-
тичній ділянці гіпоталамуса посилює повільнохвильовий
сон та ШРО, тоді як ПГЕ7 - неспання. Вважають, що ліпід,
вироблений мозком, має властивості стимулювання сну.
Деякі дослідники доводили, що за сон відповідає пептид,
вироблений мозком. Щоправда, наразі нема єдиного погля-
ду, який саме пептид є цим пептидом сну і яка його фізіо-
логічна роль, якщо він її взагалі відіграє.
Фактори, що сприяють сну в разі ШРО
Люди, яких розбудили в період, коли на ЕЕГ у них були
характерні для швидкого сну показники, як звичайно
стверджують, що бачили сон, тоді як особи, яких розбудили
під час повільнохвильового сну, його не бачили. Це спосте-
реження, а також інші докази свідчать про те, що швидкий
сон та сновидіння тісно пов’язані. Скреготіння зубами
(бруксизм), що трапляється в окремих осіб, також зумов-
лене сновидінням. Швидкий сон притаманний усім вивче-
ним видам ссавців та птахів, однак він, очевидно, не влас-
тивий іншим класам організмів.
Якщо людей будити щоразу під час швидкого сну, а
згодом дозволяти їм спати, то тривалість у них швидкого
сну протягом кількох ночей значно збільшиться порівняно
з нормою. Відповідно, тривала депривація ШРО не має
зворотного фізіологічного ефекту. Щоправда, піддослідні
тварини, яких повністю позбавляли швидкого сну на
тривалий час, втрачали масу і зрештою вмирали, а це свід-
чить, що швидкий сон відіграє ще не до кінця зрозумілу,
однак важливу гомеостатичну роль. З іншого боку, депри-
вація повільнохвильового сну спричинює подібні наслідки,
отже, можна вважати, що вони не стосуються власне швид-
кого сну.
186/РОЗДІЛ 11
Походження швидкого сну
Низьковольтний швидкий ритм кори головного мозку
під час швидкого сну подібний до того, який зафіксовано
у вигляді ЕЕГ реакції тривоги, і ймовірно, генерований
таким самим способом. Головна відмінність між швидким
сном та станом неспання полягає в тому, що сонній
свідомості властиві дивні образні та нелогічні думки, і сни,
як звичайно, не запам’ятовуються. Причина такої відмін-
ності невідома. Щоправда, ПЕТ сканування в людей у стані
швидкого сну відображає підвищену активність у мостовій
ділянці, мигдалеподібному тілі та передній поясній звивині,
однак знижену - у передлобовій та тім’яній корі. Актив-
ність у ділянках візуальних асоціацій є підвищеною, проте
знижена активність зафіксована в первинній зоровій корі.
Все це узгоджується з підвищеним збудженням та дією
закритих нейрональних систем, відрізаних від ділянок, що
пов’язують активність мозку із зовнішнім світом.
Механізми, які спричинюють швидкий сон, розташовані
в ретикулярній формації мосту. МКП піки походять з
латеральної ретикулярної покришки і відповідають за змі-
ну заряду холінергічних нейронів. З’ясовано, що зміна заря-
ду норадренергічних нейронів у голубій плямці та серото-
нінергічних нейронів у середньомозковому шві спричиняє
безсоння, і що ці нейрони неактивні, коли холінергічні
МКП піки спричинюють швидкий сон. Резерпін, який
зменшує вміст серотоніну та катехоламінів, блокує повіль-
нохвильовий сон і деякі аспекти швидкого сну, однак під-
вищує активність МКП піків. Барбітурати зменшують три-
валість швидкого сну.
Розподіл стадій сну
Під час типового нічного сну молода людина спочатку
перебуває у стадії сну НШРО, згодом переходить у першу
і другу стадії, а протягом 70-100 хв - третю і четверту.
Далі сон полегшується і настає період швидкого сну. Цей
цикл повторюється з інтервалом приблизно до 90 хв упро-
довж ночі (рис. 1-10). Цикли майже подібні, хоча ближче
до ранку третя і четверта стадії стають коротшими, а швид-
кий сон - довшим. Отже, протягом ночі буває від чотирьох
до шести періодів швидкого сну. Такий сон становить 80%
від загальної тривалості сну у недоношених немовлят (рис.
11-11) та 50% у доношених. Надалі відсоток швидкого сну
зменшується, стає на рівні 25% і знову зменшується вже в
Рис. 11-10. Цикли нормального сну в осіб різного віку. Швид-
кий сон позначено ділянками темнішого кольору (відновлено
за дозволом з Каїев АМ, Каїев ЗО: 8Іеер сіівогбегв. N ЕпдІ З
Месі. 1974;290:487).
Рис. 11-11. Вікові зміни сну людини. На кожному графіку по-
казано дані для віку 6, 10, 21, ЗО, 69 та 84 роки (дані з КапсІеІ
ЕР, Всіжагіг ЗН, ЗеввеІ ТМ [есіііогв]: Ргіпсіріев ої МеигаІ 8сі-
епсе, ЗгсІ есі. Мсбгауу-НіІІ Сотрапіев, Іпс. 1991).
СТАН ТРИВОГИ, СОН ТА ЕЛЕКТРИЧНА АКТИВНІСТЬ МОЗКУ /187
лЛЛ/\
~*ч'лЛд
1 с
Рис. 11-12. Малий епілептичний напад. Запис чотирьохелект-
родної ЕЕГ у шестирічного хлопчика під час одного з нападів,
за якого він не усвідомлював, де перебуває, і кліпав очима.
Час показано горизонтальною лінією (Відтворено за дозволом
з Махтап 86: Соггеїаііуе ІЧеигоапаїоту, 241Н есі. Мс6га\л/-
НіІІ, 2000).
старому віці. У дітей загальна тривалість сну та тривалість
четвертої стадії довша, ніж у дорослих.
Розлади сну
Безсоння, яке можна означити як суб’єктивну проблему,
пов’язану з недостатнім чи невідновлювальним сном, не-
зважаючи на наявність потрібних для нього умов, буває
майже у всіх дорослих людей. Тривале ж безсоння зумов-
лене багатьма різними ментальними та медичними стана-
ми. Тимчасово його можна полегшити за допомогою сно-
дійного, наприклад бензодіазепіну. Однак тривале вжи-
вання будь-яких із цих таблеток недоцільне, оскільки вони
впливають також на діяльність людини в денний час і приз-
водять до звикання.
Фатальне родинне безсоння - це хвороба, спричинена
пріонами, яка прогресує і виявляється в успадкованих та
спорадичних формах. Воно супроводжується безсонням,
що прогресує, погіршенням автономних та рухових функ-
цій, деменцією та смертю. У пацієнтів з цією хворобою
відбувається раптова втрата нейронів, простежується гліоз
у вентральних і медіодорсальних ядрах таламуса, оливах
та довгастому мозку. Хвороби, спричинені пріонами, - це
енцефалопатії, що можуть переходити до тварин і виявля-
ються в людей у кількох формах: хвороба Крейтцфельда-
Якоба, хвороба Ґерстмана-Штройслера-Шайнкера та куру,
що пов’язана з ритуальним канібалізмом.
Ходіння уві сні (сомнабулізм), нічний енурез та нічні
страхи трапляються під час пробудження від повільнохви-
льового сну. Вони не пов’язані зі швидким сном. Випадки
ходіння уві сні частіше бувають у дітей, ніж у дорослих,
переважно в осіб чоловічої статі й можуть тривати кілька
хвилин. Сомнабули ходять з розплющеними очима й оми-
нають перешкоди на шляху, однак якщо їх розбудити, то
не можуть пригадати епізоди ходіння уві сні.
Нарколепсія є хворобою, за якої виникає епізодична
раптова втрата м’язового тонусу та фактично непереборна
схильність до засинання впродовж дня. У деяких випадках
це починається раптовими напливами швидкого сну. У здо-
рових осіб швидкий сон майже ніколи не передує повільно-
хвильовому. Спадковість цього стану в людей - рідкісне
явище, натомість успадковані форми у собак зумовлені му-
тацією в одному чи двох рецепторах орексину - поліпеп-
тиду, задіяного в регулюванні апетиту (див. Розділ 14).
Асфіксію уві сні спричинює обструкція дихальних шля-
хів під час вдихання. Детально це описано в Розділі 37.
Якщо такий стан повторюється неодноразово, як це часто
трапляється в людей похилого віку, то втрата сну зумовлює
втому і млявість упродовж дня. Такий стан можна полег-
шити, відівчивши хворих спати на спині, а також уникаючи
вживання респіраторних депресантів, гіпнотичних препа-
ратів та алкоголю, а в разі гострих форм - за допомогою
позитивного тиску дихальних шляхів під час сну.
Розлад поведінки у разі швидкого сну є нещодавно
виявленим станом, під час якого не розвивається гіпотонія.
Як наслідок, стан таких пацієнтів нагадує стан котів з експе-
риментальним ушкодженням голубої плямки - він “діє в
контексті своїх снів”: вони неспокійні і можуть навіть зіско-
чити з ліжка, готові боротися з удаваним супротивником.
Цей розлад, як звичайно, лікують бензодіазепінами. Інші
специфічні розлади сну описано також у науково-лабора-
торних дослідженнях сну.
Клінічне застосування ЕЕГ
Інколи ЕЕГ корисна для виявлення патологічних про-
цесів. Якщо внаслідок накопичення рідини перекрито ді-
лянку кори головного мозку, то активність над такою зоною
може бути знижена. Цей факт дає змогу діагностувати та
виявляти субдуральні гематоми. Ушкодження в корі спри-
чинюють локальне утворення нерегулярних чи повільних
хвиль, які може вловлювати ЕЕГ. Епілептогенні осередки
інколи генерують високовольтні хвилі, які також можна
виявити.
Епілепсія - це синдром, який може бути зумовлений ба-
гатьма причинами. У випадку деяких форм простежується
характерний вигляд ЕЕГ під час нападів, щоправда у
періоди між ними ці аномалії важко відобразити. Загалом
напади поділяють на такі, що походять з однієї півкулі
головного мозку (часткові, чи локальні, напади), і ті, що
стосуються обидвох півкуль одночасно (глобальні напа-
ди). Кожна з категорій має підкатегорії. Напади тонічно-
клонічного типу (великі судомні напади) супроводжують-
ся раптовою втратою свідомості. Далі настає тонічна фаза
з безперервним скороченням м’язів кінцівок, згодом - кло-
нічна фаза з симетричним посмикуванням кінцівок, а внас-
лідок цього - альтернаційне скорочення та розслаблення.
У разі тонічної фази активність ЕЕГ висока. Під час кож-
ного клонічного посмикування виникають повільні хвилі,
вслід за кожною з яких настає пік. Повільні хвилі тривають
упродовж короткого проміжку часу після нападу. Подібні
зміни простежуються у піддослідних тварин під час кон-
вульсій, зумовлених електрошоком. Напади короткотри-
валої втрати свідомості (малі епілептичні напади) є
однією з форм хвороби з одномоментною втратою реак-
тивності. Вони пов’язані з триразовим подвоєнням, кожне
з яких складається з типового піка та заокругленої хвилі
(рис. 11-12).
12
Регулювання
постави і рухів
ВСТУП
Соматична рухова активність у кінцевому підсумку зале-
жить від типу і рівня збудження в спинномозкових мото-
нейронах і гомологічних нейронах рухових ядер черепних
нервів. Ці нейрони становлять спільну кінцеву ланку вели-
кої кількості шляхів, які прямують до скелетних м’язів, і
отже, підлягають впливові імпульсів, що поширюються ци-
ми провідними шляхами.
До кожного спинномозкового мотонейрона різними
шляхами надходять імпульси зі спинномозкового сегмента
(див. Розділ 6). Численні імпульси прямують до цих клітин
також з інших спинномозкових сегментів, стовбура голов-
ного мозку і кори великого мозку. Деякі з цих імпульсів
закінчуються безпосередньо на мотонейронах, проте вели-
ка їхня кількість виявляє ефект через інтернейрони або у-
еферентну систему, діючи на м’язові веретена і повертаю-
чись через Іа-аферентні волокна до спинного мозку. Така
інтерактивна активність множинних впливів зі спинномоз-
кового, довгастомозкового, середньомозкового і кіркового
рівнів забезпечує поставу тіла і робить можливими коор-
диновані рухи.
Ці впливи необхідні для такого: довільної рухової діяль-
ності; регулювання постави і забезпечення постійної
готовності до виконання наступних рухів; координування
діяльності різноманітних м’язів у виконанні плавних і точ-
них рухів. Планування типу довільної рухової активності
відбувається в головному мозку, і накази у формі імпульсів
поширюються здебільшого за допомогою кірково-спин-
номозкової і кірково-ядерної систем. Постава тривалий
час забезпечена не тільки перед початком рухової діяль-
ності, а й під час неї завдяки системі, що регулює
поставу.
Плавність і координованість рухів забезпечує вплив, що
надходить з медіальної і проміжної ділянок мозочка (спі-
нальний мозочок). Базальні ядра і латеральні ділянки
мозочка (новий мозочок) становлять частину системи
зворотного зв’язку, що спрямовує інформацію до премо-
торної і моторної кори, які причетні до планування й фор-
мування виконань довільних рухів.
ЗАГАЛЬНІ ПРИНЦИПИ
Організація
В організмі відбуваються два типи м’язової діяльності:
рефлекторний, або мимовільний, і довільний. Можна було
б зачислити до рефлекторної діяльності і такі ритмічні
рухи, як ковтання, жування, почухування і ходьбу, які
здебільшого є мимовільними, проте підлягають довільно-
му коригуванню і регулюванню.
Багато ще невідомо стосовно регулювання довільних
рухів. Для їхнього виконання в межах, наприклад, кінцівки
в головному мозку повинні визріти план цих рухів, про-
грама узгодження відповідних рухів одночасно в різних
суглобах і відбутися регулювання рухів шляхом порівняння
попереднього плану з результатом його виконання. Руховий
апарат “навчається” за допомогою виконання дії, і вико-
нання рухів удосконалюється шляхом повторних дій, спри-
яючи синаптичній пластичності.
Зі значним ступенем вірогідності загальна схема регу-
лювання рухової активності показана на рис. 12-1. Накази
щодо виконання довільних рухів виникають у кіркових
асоціативних полях. Програмування рухів відбувається як
у корі, так і в базальних ядрах та латеральних ділянках
півкуль мозочка як наслідок зростання електричної актив-
ності перед рухом. Інформація з базальних ядер і півкуль
мозочка надходить через таламус до передмоторної і мо-
торної кори. Рухові команди з моторної кори потрапляють,
здебільшого, кірково-спинномозковими і відповідними
кірково-ядерними шляхами до мотонейронів стовбура
головного мозку. Проте колатералі цих шляхів і декілька
безпосередніх сполучень, що відходять з моторної кори
до ядер стовбура головного мозку, теж передають імпуль-
си до мотонейронів стовбура головного мозку і спинного
мозку і, отже, можуть опосередковувати довільні рухи. Рух
спричинює зміни в потоках чутливих нервових імпульсів,
що проходять від м’язів, сухожилків, суглобів і шкіри. Ця
зворотна інформація, необхідна для забезпечення точнос-
ті й плавності рухів, потрапляє безпосередньо до моторної
РЕГУЛЮВАННЯ ПОСТАВИ І РУХІВ /189
ПЛАН
ДІЯ
Базальні ядра
Намір
Кіркові
асоціативні
поля
Премоторна і
моторна кора
\ Бічні
ділянки мозочка
Рух
4 Проміжна
ділянка мозочка
Рис. 12-1. Регулювання довільних рухів.
кори і спінального мозочка, який, відповідно, передає
інформацію до ядер стовбура головного мозку. Головними
шляхами стовбура головного мозку, що пов’язані з забез-
печенням постави і координації, є червоноядерно-спин-
номозковий, ретикуло-спинномозковий, покришко-спин-
номозковий, присінково-спинномозковий і відповідні шля-
хи, спрямовані до мотонейронів стовбура.
Іннервація осьової і дистальної мускулатури
Для розгляду регулювання моторної діяльності важливе
також те, що в стовбурі головного і в спинному мозку меді-
альні або вентральні провідні шляхи відповідальні за конт-
роль над м’язами тулуба і проксимальних відділів кінцівок,
тоді як латеральні - за контроль над м’язами дистальних
відділів кінцівок. Осьова мускулатура забезпечує поставу
тіла і прості примітивні рухи, тоді як м’язи дистальних
відділів кінцівок виконують тонкі і точні рухи. Відповідно,
наприклад, нейрони медіальної частини переднього рогу
іннервують м’язи проксимальних відділів кінцівок, зокрема
згиначі, а нейрони його латеральної частини - м’язи дис-
тальних відділів кінцівок. Подібно до цього, передній кір-
ково-спинномозковий шлях і розміщені медіально низхідні
шляхи, що відходять від стовбура головного мозку (по-
кришко-спинномозковий, ретикуло-спинномозковий і при-
сінково-спинномозковий шляхи), забезпечують регулю-
вання проксимальних м’язів і постави тіла, тоді як лате-
ральний кірково-спинномозковий і червоноядерно-спинно-
мозковий - регулювання м’язів дистальних відділів кінці-
вок і, зокрема, якщо йдеться про латеральний кірково-спин-
номозковий шлях, - виконання точних і тонких довільних
рухів. Філогенетично медіальні шляхи давніші, а латераль-
ні - новіші.
Інші терміни
Оскільки волокна латерального кірково-спинномозко-
вого шляху формують піраміди в межах довгастого мозку,
то кірково-спинномозкові шляхи назвали пірамідною
системою. Решту низхідних шляхів стовбура головного
мозку і спинномозкових, що не проходять у пірамідах і
пов’язані з регулюванням постави, називають екстрапі-
рамідною системою. Однак передній кірково-спинномоз-
ковий шлях не проходить крізь піраміди, а багато пірамід-
них волокон виконують інші функції, водночас екстрапіра-
мідна система теж містить різні шляхи, пов’язані з багатьма
різними функціями. Отже, терміни пірамідний і екстрапіра-
мідний не зовсім коректні й, очевидно, їх треба уникати.
Окрім того, рухову систему часто поділяють на верхні
і нижні мотонейрони. Ушкодження нижніх рухових ней-
ронів - спінальних і краніальних мотонейронів, що без-
посередньо іннервують м’язи, - спричинює млявий пара-
ліч, м’язову атрофію і втрату рефлексів. Синдром спастич-
ного паралічу і гіперактивні рефлекси розтягування без м’я-
зової атрофії є наслідком деструкції верхніх рухових ней-
ронів - нейронів у головному і спинному мозку, що акти-
вують рухові нейрони. Однак треба пам’ятати, що є три
типи верхніх рухових нейронів. Ушкодження шляхів, що
регулюють поставу, зумовлює спастичний параліч, проте
ушкодження лише кірково-спинномозкового і кірково-
ядерного шляхів спричинює швидше парез, ніж параліч, і
уражена мускулатура є переважно гіпотонічною. Ушкод-
ження мозочка призводить до порушення координації.
Отже, термін верхній руховий нейрон теж є помилковим.
КІРКОВО-СПИННОМОЗКОВА І КІРКОВО-
ЯДЕРНА СИСТЕМА
СТРУКТУРА І ФУНКЦІЯ
Провідні шляхи
Нервові волокна, що йдуть від моторної кори до ядер
черепних нервів, формують кірково-ядерний шлях. Нер-
вові волокна, які перетинають серединну лінію в ділянці
пірамід довгастого мозку й утворюють латеральний
кірково-спинномозковий шлях, становлять 80% кірково-
спинномозкового шляху. Решта 20% утворюють передній,
або вентральний, кірково-спинномозковий шлях (рис.
12-2), який не перетинає серединної лінії аж доки не сягне
рівня, на якому ці волокна формують синаптичні контакти
з руховими нейронами. Крім того, цей шлях містить кір-
ково-спинномозкові нейрони, які закінчуються на тому ж
боці тіла. Передній шлях, філогенетично старіший, спо-
190/РОЗДІЛ 12
чатку закінчується на інтернейронах, які утворюють синап-
си на нейронах медіальної частини переднього рогу, звідки
відбувається іннервування мускулатури осьового скелета і
проксимальних відділів кінцівок. Відповідно, латеральний
кірково-спинномозковий шлях прямує до нейронів лате-
ральної частини переднього рогу, які іннервують мускула-
туру дистальних відділів кінцівок і, отже, регулюють тонкі
й точні рухи. В людини волокна цієї філогенетично новішої
системи безпосередньо закінчуються на латеральних рухо-
вих нейронах.
Кіркові моторні поля
Подразнення кіркових полів, з яких починаються кір-
ково-спинномозковий і кірково-ядерний шляхи, спричи-
нює швидкі і диференційовані рухи. Найвідоміша така зона
- моторна кора (МІ) передцентральної закрутки (рис. 12-
3). Однак є також додаткове моторне поле, розміщене
вище від поясної борозни на медіальній поверхні півкулі,
яке сягає передмоторної кори, поширюючись на лате-
ральну поверхню (див. рис. 12-3). Рухові відповіді теж
виникають під час подразнення соматосенсорного поля І,
Рис. 12-3. Медіальна (вгорі) і латеральна (внизу) поверхні
кори півкуль великого мозку людини. Показано моторну кору
(4 поле Бродмана) та інші поля, причетні до регулювання до-
вільних рухів, нумеровані за Бродманом (відтворено за доз-
волом з КапсІеІ ЕР, Зсїжагіг ЛЧ, Зеввеїі ТМ [есІИогв]: Ргіпсі-
ріев ої МеигаІ Зсіепсе, 4ііл есі. МсОгам-НіІІ, 2000).
Рис. 12-2. Кірково-спинномозкові шляхи.
розміщеного в зацентральній закрутці, і соматосенсорного
поля II, розміщеного з боків Сильвієвої борозни (див. Роз-
діл 7). Ці спостереження узгоджуються з фактом, що 30%
волокон кірково-спинномозкового і кірково-ядерного шля-
хів виходять з моторної кори, 30 - з премоторної, а 40% -
з тім’яної частки, зокрема з соматосенсорної ділянки.
Експериментальне подразнення кори пацієнтів після
виконаної під місцевою анестезією трепанації черепа дало
змогу ідентифікувати більшість моторних проекцій ділянок
кори. Отримані результати підтверджені скануванням ПЕТ
і ЯМР головного мозку в людей, які не зазнавали опера-
тивного втручання чи знеболення (рис. 12-4). Різні ділянки
тіла відображені в передцентральній закрутці так, що стопа
проектується у верхній частині закрутки, а обличчя - внизу
(рис. 12-5). Поле обличчя відтворене білатерально (в обид-
вох півкулях), тоді як решта тіла - унілатерально і таким
способом, що кіркове моторне поле регулює роботу муску-
латури протилежної частини тіла. Відображення в корі кож-
ної з ділянок тіла за розмірам пропорційне до майстерності
виконання довільних рухів. Наприклад, ділянки кори, по-
в’язані з регулюванням артикуляції мови чи рухами, що їх
виконують м’язи кисті, є особливо широкими; викорис-
тання гортані, губ і язика для вимови слів, а також пальців,
особливо великого, забезпечує діяльність, що досягає в лю-
дини найвищого рівня.
Умови, у яких можливе дослідження кори великого
мозку людини, не дають змоги подразнювати краї борозен
та інші недоступні ділянки. Детальними дослідженнями
на мавпах виявлено, що в корі є відповідне відображення
частин тіла, причому осьова мускулатура і проксимальні
ділянки кінцівок відображені вздовж переднього краю
передцентральної закрутки, а дистальні ділянки кінцівок
- уздовж її заднього краю. Іншою особливістю МІ є як
РЕГУЛЮВАННЯ ПОСТАВИ І РУХІВ /191
Рис. 12-4. Ділянка кисті моторної кори семирічного хлопчика,
зображена за допомогою ЯМР. Зміни активності, зумовлені
стисканням гумового м’ячика правою кистю, відображені бі-
лим кольором, лівою кистю - чорним кольором. У цьому окре-
мому випадку активування лівої рухової кори руховою актив-
ністю лівої руки (див. текст) не помітне (відтворено за дозво-
лом з Махгпап 86: Соггеїаїіуе Меигоапаїоту, 241Ї1 есі. Мсбгам-
НіІІ, 2000).
наявність значного перекриття ділянок іннервації м’язів,
так і значна розмежованість зон іннервації м’язів-синер-
гістів. Тривають дискусії щодо питання: у МІ проек-
туються окремі м’язи чи певні рухові реакції; найновіші ж
дані свідчать, що в ній проектуються як ті, так і інші.
Клітини ділянок моторної кори впорядковані у вигляді
Рис. 12-5. Руховий гомункул. Схема фронтального перерізу
передцентральної закрутки, що відображає кіркове відобра-
ження різних ділянок тіла. Розміри різноманітних ділянок тіла
гомункула пропорційні до відповідних кіркових полів закрутки
(відтворено за дозволом з РепЛеІсІ УУ, Кавтиввеп 6: Тіїе Се-
геЬгаІ Согіех оТ Мап. МастіІІап, 1950).
окремих колонок, або стовпців. Клітини кожного стовпця
отримують численні чутливі вхідні імпульси з периферій-
ної ділянки, у якій вони регулюють рухи, і таким способом
відбувається забезпечення основи для контролю рухів за
зворотним зв’язком. Деякі з цих імпульсів є прямими, а
інші перемикаються в сенсорному полі І зацентральної
закрутки.
Домінування головного мозку, про що детально йдеться
в Розділі 16, стосується і моторної кори людини. Рухи
пальців лівої кисті переважно супроводжуються активу-
ванням правої моторної кори, і навпаки, як досліджено за
допомогою ЯМР (див. Розділ 32); проте рухи пальців лівої
кисті теж активують і ліву моторну кору, зокрема в осіб,
які ліпше володіють правою рукою. Це узгоджується з фак-
том, що ушкодження лівої моторної кори спричинює пору-
шення функції лівої кисті, як і правої, тоді як у разі ушкод-
ження правої моторної кори функція правої кисті послаб-
люється незначно.
Пластичність
Завдяки ПЕТ і функційному ЯМР з’ясовано, що в інтакт-
них експериментальних тварин, як і в людини, моторна
кора має таку ж пластичність, як і сенсорна (див. Розділ
7). Тому, наприклад, ділянка відображення пальців у мо-
торній корі контрлатерального боку збільшується в розмі-
рах завдяки тренуванню швидких рухів пальців однієї руки;
ці зміни помітні вже через тиждень і досягають максималь-
ного рівня на четвертий тиждень. Ділянки кори, що регу-
люють скорочення інших м’язів, також збільшуються в
розмірах унаслідок тренування. Незважаючи на невелике
ішемічне ушкодження ділянки відображення кисті в мотор-
ній корі мавпи, з відновленням рухової функції віднов-
люється ділянка відображення кисті в сусідній, не ушкод-
женій частині кори. Отже, карта відображення в моторній
корі змінюється з набуттям досвіду.
Додаткове моторне поле
Більшість імпульсів з додаткового моторного поля пря-
мує до моторної кори. Відповідно, це поле бере участь у
програмуванні рухових послідовностей. Ушкодження його
в мавп спричинює виникнення труднощів у виконанні
складних комбінованих рухів і порушення бімануальної
координації.
Якщо людина підраховує мовчки, то моторна кора без-
діяльна, проте якщо вона починає вимовляти цифри, якими
маніпулює, то притік крові до моторної кори і додаткового
моторного поля зростає. Отже, додаткове моторне поле
разом з моторною корою забезпечують складні довільні
рухи, пов’язані з їхнім попереднім плануванням. Притік
крові зростає незалежно від того, виконується планований
рух чи ні. Збільшення притоку крові простежується в будь-
якому випадку, тобто незважаючи на те, чи планований рух
виконує контрлатеральна кисть, чи іпсилатеральна.
Премоторна кора
Імпульси з премоторної кори надходять до ділянок
стовбура головного мозку, причетних до регулювання
постави, і до моторної кори, зокрема до її ділянок, з яких
починаються кірково-спинномозковий і кірково-ядерний
шляхи. Функція премоторної кори досі остаточно не з’я-
192/РОЗДІЛ 12
сована; вважають, що вона пов’язана з регулюванням
постави на початку планованого руху, зокрема з підготов-
кою до його виконання.
Задня тім’яна кора
Крім волокон, що є в складі кірково-спинномозкового і
кірково-ядерного шляхів, з соматосенсорного поля і при-
леглої ззаду ділянки тім’яної частки відходять волокна до
премоторної кори. Ушкодження соматосенсорного поля
спричинює дефекти у виконанні завчених послідовностей
рухів, наприклад, користування під час їди ножем і видел-
кою. Частина нейронів поля 5 (див. рис. 12-3) пов’язана з
регулюванням таких рухів, як націлювання кисті в напрямі
будь-якого об’єкта або маніпулювання нею, а деякі нейрони
поля 7 причетні до координування реакції кисть-око.
Роль у регулюванні рухів
Кірково-спинномозковий і кірково-ядерний шляхи, як
зазначено, - це система забезпечення тонких і точних рухів.
Однак це не означає, що рухи, навіть тонкі, неможливі без
участі цієї системи. Нижчі хребетні, по суті, не мають кір-
ково-спинномозкової і кірково-ядерної системи, проте вони
досить спритно пересуваються. Коти і собаки можуть стоя-
ти, ходити, бігати і навіть їсти після цілковитого руйну-
вання цієї системи. Лише в приматів таке втручання спри-
чинює суттєві зміни.
Обережне перетинання пірамід, що зумовлює високо-
вибіркову деструкцію латерального кірково-спинномозко-
вого шляху в лабораторних приматів, призводить до
раптової і тривалої втрати здатності до захоплення й утри-
мування малих предметів двома пальцями та ізольованих
рухів у зап’ястку. Ці порушення зумовлені втратою регу-
лювання дистальної мускулатури кінцівок, що в нормі
забезпечує тонкі і точні рухи. З іншого боку, ушкодження
переднього кірково-спинномозкового шляху спричинює
порушення функцій осьових м’язів з затрудненням під-
тримки рівноваги, ходьби і підіймання вгору.
Вплив на рефлекси розтягування
Перетинання пірамід у мавпи зумовлює переважно
тривалу гіпотонію і млявість, а не еластичність. У людини,
з огляду на особливості будови відділів ЦНС, патологічний
процес лише зрідка ушкоджує кірково-спинномозковий і
кірково-ядерний шляхи ізольовано, тобто без ушкодження
шляхів, що беруть участь у регулюванні постави. Поява
еластичності свідчить, очевидно, про ушкодження власне
цих шляхів, а не кірково-спинномозкового і кірково-
ядерного.
У випадку ушкодження латерального кірково-спинно-
мозкового шляху в людини виникає симптом Бабінського:
тильне згинання великого пальця і віялоподібне положення
решти пальців стопи під час подразнення шкіри лате-
рального краю підошви. За винятком немовлят, нормаль-
ним реагуванням на це подразнення є підошовне згинання
всіх пальців стопи. Симптом Бабінського означає зникнен-
ня цього згинального рефлексу, що в нормі використовують
для оцінки функції латерального кірково-спинномозкового
шляху. Він є важливий для визначення локалізації пато-
логічного процесу, однак фізіологічні підстави його неві-
домі.
СИСТЕМА РЕГУЛЮВАННЯ ПОСТАВИ
Механізми регулювання постави багатогранні. У цьому
процесі беруть участь чимала кількість ядер та інші струк-
тури, у тім числі спинний мозок, стовбур головного мозку
і кора великого мозку. Ці механізми стосуються не тільки
суто статичної постави, а й узгодження з кірково-спинно-
мозковою і кірково-ядерною системами, а також процеса-
ми ініціювання та регулювання рухів.
Інтеграція
Аферентні імпульси спричинюють рефлекторні ВІДПО-
ВІДІ на рівні спинного мозку. На вищих рівнях нервової
системи складніші нервові зв’язки зумовлюють рухові
реакції щораз більшої складності. Ця ієрархія рівнів рухо-
вої інтеграції наведена в табл. 12-1. В інтактних тварин
окремі рухові реакції підпорядковані загальній руховій
активності. У випадку перетинання нервової системи на
певному рівні рухова активність, інтегрована нижче від
місця перетину, виходить з-під контролю вищих мозкових
центрів і часто стає помітною. Такого типу процес є в осно-
ві одного з головних принципів неврології і може бути
зумовлений певними ушкодженнями, які призводять до
усунення гальмівного впливу вищих нервових центрів.
Важливішою причиною появи гіперактивності нижче від
ушкодження є втрата диференціації реакцій, що в цьому
випадку не пристосовуються до широкого спектра рухової
активності. Додатковим фактором може бути денервація
надмірної чутливості центрів нижче від перетинання, проте
роль цього фактора не з’ясована.
Регулювання постави
Неможливо чітко розмежувати регулювання постави і
довільних рухів, однак можна диференціювати окремі реф-
лекси, пов’язані з формуванням постави (табл. 12-2), які
не тільки забезпечують здатність до стояння і рівновагу, а
й зумовлюють постійну готовність до вольової активнос-
ті. Серед комплексу цих рефлексів є статичні і динамічні,
тобто короткочасні, фазові. Статичні стосуються трива-
лого скорочення мускулатури, тоді як динамічні забезпе-
чують швидкоплинні рухи. Обидва типи рефлексів інтегру-
ються на різних рівнях ЦНС, починаючи зі спинного мозку
і закінчуючи корою великого мозку, і відбуваються пере-
важно за допомогою різних провідних шляхів. Важливим
фактором регулювання постави є різні рівні порогів спі-
нальних рефлексів розтягування, що, відповідно, залежить
від збудливості рухових нейронів і, опосередковано, від
зміни потенціалу в у-еферентних нейронах, що діє на м’я-
зові веретена.
СПІНАЛЬНА ІНТЕГРАЦІЯ
Відповіді організмів як тварин, так і людей, що вини-
кають після перетинання спинного мозку в шийній ділянці,
відображають процеси інтеграції рефлексів на рівні спин-
ного мозку. Окремі спінальні рефлекси детально розгля-
нуто в Розділі 6.
РЕГУЛЮВАННЯ ПОСТАВИ І РУХІВ /193
Таблиця 12-1. Рівні інтеграції різних функцій нервової системи
Функції Характер втручання1 Рівень інтеграції
норма декорти- кація2 середній мозок задній мозок (децеребрація3) спинний мозок децеребляція
Ініціатива, пам’ять тощо + 0 0 0 0 + Кора великого мозку
Умовні рефлекси + +4 0 0 0 + Кора великого мозку (сприяє)
Емоційні реакції + ++ 0 0 0 + Гіпоталамус, лімбічна система
Локомоторні рефлекси + ++ + 0 0 Дискоординація Середній мозок, таламус
Рефлекси випрямлення + + ++ 0 0 Дискоординація Середній мозок
Антигравітаційні рефлекси + + + ++ 0 Дискоординація Довгастий мозок
Дихання + + + + 0 + Нижня частина довгастого мозку
Спінальні рефлекси5 + + + + + + + Спинний мозок
1 0 - нема; + - наявне; ++ - посилене.
2 Усунена кора великого мозку.
3 Стовбур головного мозку перетятий на рівні верхньої частини мосту.
4 Умовні рефлекси важче викликати в декортикованих тварин, ніж у нормі.
5 Окрім рефлексів розтягування.
Спінальний шок
У всіх хребетних одразу після перетинання спинного
мозку виникає період спінального шоку, упродовж якого
всі спінальні рефлекси глибоко пригнічені. Під час цього
періоду мембранний потенціал спокою спінальних мото-
нейронів на 2-6 мВ вищий, ніж у нормі. Згодом рефлек-
торні реагування відновлюються і навіть посилюються.
Тривалість спінального шоку пропорційна до ступеня енце-
фалізації рухової функції в різних видів. У жаб і щурів цей
шок триває декілька хвилин, у собак і котів - 1-2 години,
у мавп - декілька днів, а в людини - мінімум два тижні.
Причини виникнення спінального шоку точно не відомі.
Припинення регуляторних тонічних збуджувальних впли-
вів на спінальні нейрони, що проходять низхідними шля-
хами, безперечно, відіграє роль, проте наступне віднов-
лення і надалі посилення рефлексів (гіперрефлексія) теж
потребують пояснення. Відновлення рефлексів можна
пояснити розвитком денерваційної надмірної чутливості
до нервових трансмітерів, що їх виділяють спінальні збуд-
жувальні закінчення. Іншою можливістю, яка також має
підстави, є утворення колатералей від наявних нейронів з
формуванням збуджувальних закінчень на інтернейронах
і мотонейронах.
Першим рефлексом, який виникає після припинення спі-
нального шоку в людини, найчастіше є легке скорочення у
відповідь на подразнення м’язів-згиначів гомілки і при-
відних м’язів. У деяких пацієнтів спочатку відновлюється
колінний рефлекс. Від перетинання спинного мозку і до
початку відновлення рефлекторної діяльності минає, якщо
тільки нема ускладнень, приблизно два тижні. Якщо ж такі
ускладнення виникають, то спінальний шок триває наба-
]4 367-2
гато довше. Не зрозуміло, чому інфекція, недоїдання чи
інші ускладнення, що виникають після перетинання спин-
ного мозку, гальмують активність спінальних рефлексів.
Ускладнення після перетинання
спинного мозку
Догляд за хворим, що має пара- або квадриплегію,
пов’язаний з цілим комплексом проблем. Як і у всіх іммо-
білізованих пацієнтів, у них розвивається від’ємний азот-
ний баланс і катаболізм значної кількості білків організму.
Маса тіла перетискає судини шкіри над кістковими висту-
пами і, якщо такого хворого часто не перевертати, то в
цих точках виникає змертвіння шкіри й утворюються про-
лежні. Зазначимо, що пролежні важко загоюються і схильні
до інфікування внаслідок втрати білків. Тканинні маси, що
некротизуються, містять білковий матрикс кісток, і це ра-
зом з іммобілізацією спричинює вивільнення у великих
кількостях Са2+. Виникає гіперкальціємія, гіперкальціурія
й утворення кальцієвих каменів у сечовивідних шляхах.
Камені і параліч мускулатури сечового міхура призводять
до затримки сечовиділення, а це сприяє інфікуванню сечо-
вивідних шляхів - найчастішого ускладнення ушкоджень
спинного мозку. Отже, прогноз у випадку перетинання
спинного мозку завжди був невтішним, і летальність ста-
новила понад 80% унаслідок септицемії, уремії або висна-
ження. Від часів Другої світової війни низка запобіжних
заходів, таких як використання антибіотиків, відповідне
живлення, підтримання водно-сольового балансу, профі-
лактика пролежнів і ускладнень у сечовивідних шляхах,
удосконалення загальної опіки, дала змогу в спеціалізо-
ваних лікувальних закладах знизити смертність до 6%, а
194/РОЗДІЛ 12
Таблиця 12-2. Головні рефлекси постави
Рефлекс Подразник Відповідь Рецептори Інтегрований у
Рефлекси розтягування Розтягування Скорочення м’яза М’язові веретена Спинний мозок, довгастий мозок
Позитивна реакція опори Контакт з підошвою або долонею Простягання стопи для опори тіла Пропріорецептори в дистальних м’язах-згиначах Спинний мозок
Негативна реакція опори Розтягування Послаблення позитивної реакції опори Пропріорецептори в м’язах-розгиначах Спинний мозок
Тонічні лабіринтні рефлекси Тяжіння Скорочення м’язів-розгиначів кінцівки Отолітові органи Довгастий мозок
Тонічні шийні рефлекси Повертання голови: убік догори донизу Зміна в характері скорочення м’язів-розгиначів: розгинання кінцівок у бік, куди повернуто голову згинання задніх кінцівок згинання передніх кінцівок Пропріорецептори м’язів в ділянці шиї Довгастий мозок
Лабіринтні рефлекси випрямлення Земне тяжіння Утримання голови Отолітові органи Середній мозок
Шийні рефлекси випрямлення Розтягування м’язів шиї Випрямлення в грудній, плечовій і далі - тазовій ділянках М’язові веретена Середній мозок
Рефлекси випрямлення “з тулуба на голову” Натискання збоку на тулуб Випрямлення голови Екстерорецептори Середній мозок
Рефлекси випрямлення “з тулуба на тулуб” Натискання збоку на тулуб Випрямлення тулуба, навіть якщо голова повернута вбік Екстерорецептори Середній мозок
Зорові рефлекси випрямлення Оптичні сигнали Випрямлення голови Очне яблуко Кора великого мозку
Реакція розміщення Різні оптичні, екстеро- і пропріо- рецептивні сигнали Стопа розміщена на поверхні для підтримки положення тіла Різні рецептори Кора великого мозку
Реакції стрибання Бічне зміщення у разі стоячого положення Стрибки, утримання кінцівок у положенні, що сприяє підтримуванню тіла М’язові веретена Кора великого мозку
таким пацієнтам і надалі провадити змістовне життя. Вве-
дення високих доз глюкокортикоїдів, наприклад 10 г метил-
преднізолону на добу для дорослих, зводить до мінімуму
наслідки ушкодження спинного мозку Застосування цього
засобу доцільне одразу ж після ушкодження з наступною
перервою з огляду на сильно виражений побічний шкід-
ливий ефект довготривалого лікування великими дозами
таких препаратів (див. Розділ 20). Швидкий ефект у разі
негайного застосування цих засобів, очевидно, зумовлений
зменшенням запальних явищ в ушкоджених тканинах.
Водночас тривають пошуки засобів, які б забезпечили
відростання аксонів нейронів спинного мозку в місці пере-
тинання. Обнадіює застосування в експериментах на тва-
ринах нейротропінів (див. Розділ 4). Подібно впливає ім-
плантація в місце ушкодження зародкових стовбурових клі-
тин. Однак ці підходи ще перебувають на етапі вивчення,
хоча вони необхідні.
Реакції в хронічних спінальних тварин і
людини
Після спінального шоку розпочинається відновлення
спінальних рефлексів, водночас рівень їхнього порога
неухильно знижується. В хворих з крадриплегією рівень
порога рефлексів відсмикування особливо низький. Навіть
невелике подразнення може спричинити в них не тільки
тривале утримання відсмикнутої кінцівки, а й помітні зги-
нально-розгинальні рухи трьох інших кінцівок. Багатора-
зові згинальні рухи можуть тривати довго і переходити в
контрактуру м’язів-згиначів. Гіперактивними є рефлекси
розтягування, а також багато складних реакцій, що ґрун-
туються на цих рефлексах. Наприклад, якщо доторкнутись
пальцем до підошви тварини, у якої перетято спинний
мозок (спінальна тварина), то її кінцівка випростається
в напрямі пальця, який на той час уже відсмикнутий. Ця
“магнітна” реакція (позитивна реакція опори), що зу-
мовлена подразненням пропріорецепторів, а також так-
тильних аферентних закінчень, перетворює кінцівку в не-
гнучку опору, що протистоїть земному тяжінню, для під-
тримання тіла. Припинення цієї реакції теж є у певному
розумінні активним феноменом (негативна реакція опо-
ри), оскільки його ініціює розтягування м’язів-розгиначів.
Завдяки позитивним реакціям опори спінальні тварини
(коти чи собаки), можуть перебувати у стоячому положенні,
хоч і невпевнено, протягом 2-3 хв.
РЕГУЛЮВАННЯ ПОСТАВИ І РУХІВ /195
У випадку неповного перетинання спинного мозку конт-
рактура м’язів-згиначів, зумовлена подразненням, може
супроводжуватися докучливими нападами болю. Ці напади
усувають за допомогою баклофену, агоніста ГАМКв-рецеп-
торів, який проходить крізь гематоенцефалічний бар’єр,
сприяючи інгібуванню (див. Розділ 4). Цей засіб теж з успі-
хом застосовують у пацієнтів зі еластичністю, що виникає
внаслідок ураження стовбура головного мозку або внут-
рішньої капсули (див. нижче).
Руховий ґенератор пересування
Спінальні тварини можуть не тільки перебувати у стоя-
чому положенні. Цикли всередині спинного мозку в разі
відповідного подразнення здатні забезпечувати їхнє пере-
сування. В спинному мозку є два модельні рухові гене-
ратори, один у шийному, а інший у поперековому відділі.
Однак це не означає, що спінальні тварини чи людина
можуть пересуватися без стимулювання цих генераторів;
функціювання генератора активізують імпульси, що над-
ходять з окремого центру середнього мозку - мезенцефа-
лічної локомоторної ділянки, і, очевидно, таке активування
виникає в пацієнтів з неповним перетинанням спинного
мозку. Цікаво, що генератори можуть активуватись в екс-
периментальних тварин з повним перетинанням спинного
мозку під впливом попередника норадреналіну - Ь-ДОФА,
або агоніста ос-адренергічних рецепторів - клонідину. В
людей з ушкодженням спинного мозку значного прогресу
в пересуванні можна досягти шляхом навчання з застосу-
ванням для підтримки спеціальних пристроїв або на тред-
мілі (біжучій доріжці).
Автономні рефлекси
У спінальних тварин і людини відбувається рефлекторне
скорочення сечового міхура і прямої кишки, хоча сечовий
міхур лише зрідка випорожнюється повністю. Гіперактивні
сечоміхурові рефлекси можуть утримувати міхур у стані
тривалого скорочення, що призводить до гіпертрофії та фіб-
розу його стінки. Кров’яний тиск у стані спокою переважно
нормальний, однак тонкого регулювання шляхом зворотного
зв’язку, що відбувається за допомогою барорецепторних
рефлексів, нема, тому досить частими є значні коливання
тиску. Трапляються також напади потіння і блідість шкіри.
Статеві рефлекси
Для спінальних тварин характерні деякі рефлекторні
реакції, проте в цілому вони є лише фрагментами відпо-
відей, які в нормальних тварин інтегруються в цілеспря-
мовані послідовності виконання певних функцій. Прикла-
дом цього можуть слугувати статеві рефлекси. Координо-
вана статева активність залежить від низки рефлексів,
інтегрованих на багатьох рівнях нервової системи, вплив
яких припиняється після перетинання спинного мозку.
Однак шляхом подразнення геніталій у спінальних тварин
і людини можна викликати ерекцію і навіть еякуляцію. У
спінальних самок собак подразнення піхви зумовлює від-
хилення хвоста вбік і рух таза, як перед копуляцією.
Рефлекс маси
У хронічних спінальних тварин аферентні імпульси
іррадіюють від одного рефлекторного центру до іншого.
Навіть за незначного подразнення шкіри одночасно з від-
сахненням тварини відбувається іррадіація імпульсів до
автономних центрів, що сприяє випорожненню сечового
міхура і прямої кишки, зумовлює потіння, блідість і коли-
вання кров’яного тиску. Цю аварійність рефлексу маси
можуть використати пареплегічні хворі для часткового
регулювання функції сечового міхура і кишок. Погладжу-
ванням чи пощипуванням шкіри стегон їм доступно трену-
вати ініціацію сечовиділення і дефекації.
РОЛЬ ДОВГАСТОГО МОЗКУ
В експериментальних тварин, у яких унаслідок пере-
тинання стовбура головного мозку на рівні верхнього краю
мосту задній і спинний мозок відокремлені від решти ЦНС,
головним проявом ушкодження є виражена еластичність
мускулатури тіла. Це оперативне втручання називають
децеребрацією, а характерну еластичність, що виникає
після нього, -децеребраційною ригідністю. Децеребрація
спричинює наслідки, що відрізняються від спінального
шоку, оскільки ригідність настає одразу ж після перети-
нання стовбура головного мозку.
Механізм децеребраційної риґідності
Проявом децеребраційної риґідності є еластичність, що
виникає внаслідок дифузного посилення рефлексів роз-
тягування. Це явище зумовлене двома факторами: зрос-
танням загальної збудливості пулу мотонейронів і відпо-
відної зміни потенціалів у у-еферентних нейронах.
Супраспінальне регулювання рефлексів
розтягування
Ділянки головного мозку, з яких надходять імпульси,
що посилюють або гальмують рефлекси розтягування, зоб-
ражені на рис. 12-6. Ці імпульси, здебільшого, або підви-
щують, або знижують чутливість м’язових веретен (рис.
12-7). Значного розміру стимулювальна ділянка ретику-
лярної формації стовбура головного мозку діє спонтанно,
очевидно, під впливом аферентних імпульсів, подібно до
РАС. Однак меншого розміру ділянка стовбура головного
мозку, що інгібує збудження в у-еферентних нейронах, діє
не спонтанно, а під впливом імпульсів, які надходять з кори
великого мозку і мозочка. Інгібувальна ділянка в базальних
ядрах або діє безпосередньо через низхідні шляхи, як це
показано на рис. 12-6, або ж стимулює кірковий інгібу-
вальний центр. Імпульси з інгібувальної і стимулювальної
ділянок ретикулярної формації надходять донизу в складі
латерального канатика спинного мозку.
У випадку перетинання стовбура головного мозку на
рівні верхнього краю мосту, дві з трьох інгібувальних діля-
нок, що керують інгібувальним центром ретикулярної
формації, залишаються вище перетину і їхній вплив при-
пиняється. Вплив стимулювальної ділянки залишається і,
отже, баланс між стимулювальними та інгібувальними
імпульсами, що впливають на у-еферентні нейрони, змі-
щується в бік стимулювання. Потенціал в у-еферентних
нейронах збільшується і, як наслідок, рефлекси розтягу-
вання стають гіперактивними. Екстирпація мозочка в деце-
ребраційних тварин, і тим самим вилучення ще одної
196/РОЗДІЛ 12
Рис. 12-6. Ділянки головного мозку кота, подразнення яких
чинить стимулювальний (знак плюс) або інгібувальний (знак
мінус) вплив на рефлекси розтягування: 1 - моторна кора; 2
- базальні ядра; 3 - мозочок; 4 - інгібувальна ділянка рети-
кулярної формації; 5 - стимулювальна ділянка ретикулярної
формації; 6 - присінкові ядра (відтворено за дозволом з Ііпсіз-
Іеу ОВ, ЗсЬгеіпег ЬН, Мадоип Н\Л/: Ап еіесігоглуодгаріпіс зіисіу
о( зразіісііу 3 ІМеигорґіузіоІ 1949; 12 197).
інгібувальної ділянки, призводить до підвищення рівня
ригідності. Механізм впливу мозочка складний. Наприк-
лад, деструкція мозочка в людини призводить більше до
гіпотонії, ніж до еластичності.
Присінково-спинномозковий і ще деякі інші низхідні
шляхи теж посилюють рефлекси розтягування, спричиню-
ючи ригідність; на відміну від шляхів з ретикулярної фор-
мації, вони проходять переважно в складі переднього кана-
тика спинного мозку, і ригідність, зумовлену збудженням
2 мм
3-5 мм
8 мм
Інтактні Збуджені Інгібовані Деаферентовані
13 мм
50 Гц
Рис. 12-7. Відображення ізольованих аферентних волокон,
що проходять від м’язових веретен, на різного ступеня роз-
тягування м’яза. Числа ліворуч позначають ступінь розтягу-
вання. Виступи догори відображають рівень потенціалів дії,
виступи донизу - артефакти подразника Запис виконано пе-
ред подразненням головного мозку (перший стовпець), під
час подразнення ділянок головного мозку, що стимулюють
(другий стовпець) або інгібують (третій стовпець) рефлекси
розтягування, і після перетинання рухових нервів (четвертий
стовпець) (відтворено за дозволом з ЕІсІгесІ Е, бгапії К, Мегіоп
РА: ЗиргазріпаІ сопігої о( гпизсіе зріпсІІез. З РЬузіоІ [ІопсІ] 1953;
122:498).
у них, не можна зняти шляхом деаферентації м’язів. Це
означає, що ця ригідність спричинена безпосереднім впли-
вом на ос-мотонейрони, який підвищує їхню збудливість,
більше, аніж дією через малу рухову нервову систему, що,
звичайно, могла б бути заблокованою шляхом деаферен-
тації.
Суть децеребраційної ригідності
У собак і котів еластичність, що виникає внаслідок деце-
ребрації, найбільше позначається на функції м’язів-розги-
начів. Шеррінгтон зазначав, що ці м’язи в тварин проти-
діють земному тяжінню; постава котів і собак після деце-
ребрації, якщо їм надати стоячого положення, є “карика-
турою на нормальне стояння”.
Досліди з децеребрацією дали змогу також розкрити
механізми тонічних статичних рефлексів, що сприяють
підтриманню тіла тварини, протидіючи земному тяжінню.
Додатковим аргументом щодо правильності інтерпретації
цього феномену є дані спостережень над тваринами, що
живуть на деревах. Більшість часу ці тварини висять догори
ногами на гілках, і в них виникає ригідність м’язів-згиначів.
У людей, як і в дослідних котів і собак, справжня децереб-
раційна ригідність супроводжується підвищенням тонусу
м’язів-розгиначів. Очевидно, людина в своїй еволюції не
так далеко відійшла від своїх чотириногих предків, щоб
мати відмінні особливості в реакції м’язів верхніх кінцівок,
навіть незважаючи на те, що основні м’язи, які протидіють
тяжінню в положенні стоячи, - це згиначі. Однак децереб-
раційна ригідність зрідка трапляється в людини, а ушкод-
ження, що спричинюють її, переважно призводять до
смерті.
Найчастіше ригідність м’язів-розгиначів нижніх кін-
цівок і помірне згинання у верхніх кінцівках виникають як
ознаки декортикаційної ригідності, зумовленої ушкод-
женням кори великого мозку, у разі неушкодженого стов-
бура головного мозку (рис. 12-8).
Тонічні лабіринтні рефлекси
У децеребраційних тварин тип ригідності в кінцівках
залежить від положення, яке ці кінцівки займають. Рефлек-
сів випрямлення нема, і тварини перебувають у тому поло-
женні, у якому їх залишити. Якщо тварину покласти на
спину, то простежується максимальне розгинання в усіх
чотирьох кінцівках, у положенні на будь-якому боці ригід-
ність зменшується, а якщо її покласти ниць, то ригідність
стає мінімальною. Ці зміни ригідності - тонічні лабі-
ринтні рефлекси - зумовлені впливом земного тяжіння
на отолітові органи і відбуваються через присінково-спин-
номозкові шляхи. Такий ефект дещо несподіваний з погля-
ду розуміння ролі ригідності в положенні стоячи, і його
детальне фізіологічне значення не з’ясоване.
Переконливим доказом важливості вестибулярного апа-
рату для регулювання постави є вплив лабіринтектомії в
котів. У нормі кіт легко навчається пересуватись по балці,
що обертається. Після односторонньої лабіринтектомії ця
здатність зникає, проте після приблизно шести тижнів
відновлюється внаслідок адаптивних змін у решті шляхів,
що забезпечують регулювання постави. Однак після
двосторонньої лабіринтектомії здатність пересуватись по
балці, що обертається, не відновлюється.
РЕГУЛЮВАННЯ ПОСТАВИ І РУХІВ /197
Рис. 12-8. Декортикаційна ригідність (А-С) і справжня декор-
тикаційна ригідність (0). А - пацієнт, що лежить навзнак з
неповернутою головою; В та С - тонічний шийний рефлекс,
зумовлений повертанням голови праворуч або ліворуч (від-
творено за дозволом з ЕиКоп [есіііог]: ТехіЬоок о( РГіузіоІ-
оду, 17іГі есі. Заипсіегз, 1955)
Тонічні шийні рефлекси
Зміна положення голови стосовно тулуба в децеребра-
ційних тварин спричинює зміни типу ригідності. Якщо
голова повернута в один бік, то кінцівки цього ж боку
(“щелепні кінцівки”) випростовуються і стають більш
ригідними, тоді як ригідність кінцівок контрлатерального
боку зменшується. Це положення характерне і для інтакт-
них тварин, які повертають голову, щоб дивитись убік. Зги-
нання голови спричинює згинання передніх кінцівок і
наступне розгинання задніх: виникає постава, характерна
для тварини, що заглядає в нору. Розгинання голови спри-
чинює згинання задніх кінцівок і розгинання передніх:
виникає постава, характерна для тварини, що споглядає
поверх перешкоди. Ці реакції називають тонічними ший-
ними рефлексами. їх ініціюють пропріорецептори внаслі-
док розтягування м’язів у верхній ділянці шиї, і тривати
вони можуть довго.
РОЛЬ СЕРЕДНЬОГО МОЗКУ
Після перетинання ЦНС на рівні верхнього краю серед-
нього мозку (мезенцефалічні тварини) ригідність м’язів-
розгиначів, характерна для децеребраційних тварин, вияв-
ляється лише тоді, коли тварина спокійно лежить на спині.
Ригідність децеребраційних тварин - це статичний рефлекс
постави, і він помітний тому, що в цьому випадку нема
змінених фазових рефлексів. Хронічні мезенцефалічні
тварини можуть підійматись,набуваючи положення стоячи,
пересуватись і відновлювати рівновагу. Коли у тварин вияв-
ляються ці фазові активності, то статичний феномен ригід-
ності непомітний.
Рефлекси випрямлення
Рефлекси випрямлення необхідні для забезпечення
нормального положення стоячи і підтримки нормального
положення голови. Вони становлять послідовність від-
повідних реакцій, інтегрованих здебільшого в ядрах серед-
нього мозку.
Коли мезенцефалічна тварина, перехиляючись з боку
на бік, утримує рівновагу тіла, її голова зберігає положення
завдяки лабіринтним рефлексам випрямлення. Нахили
голови спричинюють подразнення отолітових органів і
внаслідок цього компенсаторно скорочуються м’язи шиї,
утримуючи положення голови.
Якщо тварину покласти на бік, то тиск на цей бік тіла
зумовить рефлекс випрямлення голови, навіть якщо лабі-
ринти зруйновані. Таке реагування називають рефлексом
випрямлення “з тулуба на голову”. Якщо голова випрям-
лена за допомогою будь-якого з цих механізмів, а тулуб
нахилений, то м’язи шиї розтягуються. їхнє скорочення
спричинює випрямлення і в грудній ділянці. Далі хвиля
подібних рефлексів розтягування поширюється уздовж
усього тіла, випрямляючи ділянку живота і решту тулуба
(шийні рефлекси випрямлення). Натискання на бік тулу-
ба може зумовити випрямлення тіла, навіть якщо зафік-
сувати голову, перешкоджаючи цьому (рефлекс випрям-
лення “з тулуба на тулуб”).
Оптичні сигнали в котів, собак і приматів спричинюють
зорові рефлекси випрямлення, які супроводжуються
випростанням тіла тварини без лабіринтних або таких, що
подразнюють тіло, стимулів. На відміну від інших рефлек-
сів випрямлення, ці реакції неможливі без участі кори вели-
кого мозку.
У практично здорових людей завдяки таким рефлексам
голова утримується в стабільному положенні, а очні яблука
фіксовані на об’єктах уваги, незважаючи на рухи тіла, пош-
товхи, що трапляються. Реакції ініціює подразнення вести-
булярного апарату, розтягування м’язів шиї і переміщення
зорових образів на сітківці. Ці реакції супроводжуються
вестибулоочним рефлексом (ВОР; див. Розділ 8) та іншими
тонкими рефлекторними скороченнями м’язів шиї й очного
яблука.
Хапальний рефлекс
Якщо примата, у якого екстирповано речовину мозку
вище таламуса, покласти на бік, то кінцівки, наближені до
поверхні, на якій лежить тварина, випростаються. Інші
кінцівки будуть зігнуті в цей час і їхні кисті міцно захоплять
будь-який предмет, якого вони торкнуться (хапальний реф-
лекс). У цілому ця відповідь, ймовірно, є реакцією опори,
що відображає намір тварини піднятись.
Інші реакції, регульовані з середнього мозку
У тварин з інтактним середнім мозком і неушкодженими
зоровими нервами простежуються зіничні світлові реф-
лекси. Іншим реагуванням є ністагм, - рефлекторна від-
повідь на ротаційне прискорення, детально описана в
Розділі 9. Якщо тварині зав’язати очі і швидко опустити,
то її передні кінцівки випростаються, а пальці розведуться.
Ця реакція лінійного прискорення, яку називають вес-
тибулярною реакцією положення, готує тварину до при-
землення.
198/РОЗДІЛ 12
РОЛЬ КОРИ
Вплив декортикації
Екстирпація кори великого мозку (декортикація) не
спричинює значних порушень рухової функції в багатьох
видів ссавців. У приматів наслідки цього втручання поміт-
ніші, проте рухи все ж можливі. Декортикованим тваринам
властиві всі реакції, характерні для мезенцефалічних тва-
рин. Крім того, цих тварин легше утримувати, ніж мезен-
цефалічних, оскільки в них не порушені терморегуляція й
інші вісцеральні гомеостатичні механізми, інтегровані в
гіпоталамусі (див. Розділ 14). Найразючішим порушенням
є нездатність відповідати, використовуючи попередньо
набуті (завдяки досвіду) реакції. У тварин, в яких екстир-
пована кора, умовні рефлекси можна поновити лише за
допомогою спеціальних тренувань, проте в звичайних
лабораторних умовах цього досягти дуже важко.
Декортикаційна риґідність
Помірна риґідність настає в декортикованих тварин
після екстирпації кіркового поля, з якого через ретикулярну
формацію відбувається інгібування у-еферентного впливу.
Подібно до риґідності, що виникає після перетинання ЦНС
вище від верхнього краю середнього мозку, декортика-
ційна риґідність маскована фазовими рефлексами постави
і помітна лише за умов повного спокою тварини; вона
простежується на боці, де виникла геміплегія в людей після
геморагії або тромбозу у внутрішній капсулі. Вірогідно, з
огляду на особливості анатомічної будови малі артерії
внутрішньої капсули особливо схильні до розриву або
тромбування. Отже, такого походження декортикаційна
ригідність є досить поширеним явищем: 60% внутрішньо-
мозкових геморагій трапляється у внутрішній капсулі, 10
- у корі великого мозку, 10-у мості, 10-у таламусі і 10%
- у мозочку.
Питання про точне місцезнаходження в корі великого
мозку волокон, які інгібують рефлекси розтягування, дис-
кусійне. Є дані про те, що за певних умов експерименту
подразнення переднього краю передцентральної закрутки
спричинює інгібування рефлексів розтягування і зумовле-
них корою рухів. Цю ділянку, що прилягає до базальних ядер,
називають четвертим полем, або супресорною смугою.
Реакції стрибання і розміщення
Два типи реакцій постави, стрибання і розміщення,
серйозно ушкоджуються у разі децеребрації. Перша з них
- це стрибкові рухи, що забезпечують положення кінцівок,
необхідне для підтримання тіла у випадку поштовху збоку.
Друга забезпечує міцний контакт стопи з поверхнею опори.
Ці реакції ініціюються в тварин, у яких зав’язані очі і які
підвішені в повітрі, у разі торкання поверхні опори будь-
якою точкою стопи. Подібним способом, якщо мордочка
тварини або навіть волоски на ній торкаються поверхні
стола, тварина одразу ж ставить на стіл обидві передні
лапи; а якщо одну з кінцівок тварини, що стоїть, усунути з
поверхні, то вона негайно ставить її знову на поверхню
опори. Про вестибулярну реакцію розміщення йшлося
вище. Коти, собаки і примати в разі опускання простяга-
ють кінцівки в напрямі поверхні опори, якщо вони можуть
її бачити.
БАЗАЛЬНІ ЯДРА
Анатомічні підстави
Термін базальні ядра звичайно стосується п’яти струк-
тур кожної півкулі мозку: хвостатого ядра, лушпини і
блідої кулі, трьох великих ядерних мас, розміщених під
корою великого мозку (рис. 12-9), а також зв’язаних з ними
підталамічного ядра (тіло Люїса) і чорної речовини.
Бліду кулю поділяють на латеральний і медіальний
сегменти. Чорна речовина складається зі щільної і сітчас-
тої частин. Ядра таламуса теж тісно пов’язані з базаль-
ними ядрами. Хвостате ядро і лушпину часто називають
смугастим тілом; лушпина і бліда куля разом утворюють
сочевицеподібне ядро (табл. 12-3).
Головні аферентні зв’язки, що проходять до базальних
ядер, закінчуються в смугастому тілі (рис. 12-10). Вони
містять волокна кірково-смугастого напряму, які відхо-
дять з усіх ділянок мозкової кори. Є також зв’язки між
центросерединним ядром таламуса і смугастим тілом.
Зв’язки між окремими структурами базальних ядер
охоплюють дофамінергічний чорноречовинно-смугастий
шлях, тобто шлях від чорної речовини до смугастого тіла,
і відповідний ГАМК-ергічний шлях від смугастого тіла до
сітчастої частини чорної речовини. Хвостате ядро і луш-
пина пов’язані з обома сегментами блідої кулі. З латераль-
ного сегмента блідої кулі нервові волокна проходять до
субталамічного ядра, від якого, відповідно, відходять
волокна до обох сегментів блідої кулі і чорної речовини.
Головний шлях поширення збуджень від базальних ядер
- від медіального сегмента блідої кулі через таламічний
пучок до латерального вентрального, переднього вент-
рального і центросерединного ядер таламуса. З ядер тала-
муса волокна відходять до передлобової та передмоторної
кори. З чорної речовини волокна теж проходять до тала-
муса. Ці зв’язки, а також їхні ймовірні синаптичні транс-
мітери показані на рис. 12-10. Є ще декілька додаткових
зв’язків, спрямованих, зокрема, до повідців і верхніх
горбиків. Проте найважливіші серед зв’язків базальних
ядер шляхи з мозкової кори до смугастого тіла, зі смугас-
того тіла до медіального сегмента блідої кулі, з медіального
сегмента блідої кулі до таламуса і з таламуса знову до кори,
замикаючи цикл циркулювання збудження. Шлях від
медіального сегмента блідої кулі до таламуса є гальмівним,
тоді як шлях від таламуса до мозкової кори - збуджуваль-
ним.
Смугасте тіло містить унікальну мозаїку стріосом, утво-
рену нервовими закінченнями в межах матриксу. Сам мат-
рикс отримує інші закінчення. Нейрони кірково-смугастого
шляху, що починаються в глибокій ділянці п’ятого шару
кори, первинно закінчуються в стріосомах, тоді як нейро-
ни, що починаються в другому і третьому, а також у по-
верхневій ділянці п’ятого шару, первинно закінчуються в
матриксі. Нейрони, тіла яких розміщені в стріосомах, зде-
більшого спрямовують аксони до дофамінергічних ней-
ронів щільної частини чорної речовини, тоді як значна кіль-
кість нейронів, тіла яких розміщені в матриксі, - до ГАМК-
ергічних нейронів сітчастої частини чорної речовини.
Фізіологічне значення цих зв’язків, однак, не з’ясоване.
РЕГУЛЮВАННЯ ПОСТАВИ І РУХІВ /199
Рис. 12-9. Базальні ядра.
Особливості метаболізму
Метаболізм базальних ядер унікальний за кількістю
його шляхів. У цих структурах підвищений рівень вико-
ристання О2. Вміст міді в чорній речовині і суміжному голу-
бому ядрі особливо високий. У разі хвороби Вільсона,
спадкового аутосомно рецесивного розладу обміну міді,
коли рівень в плазмі мідьвмісного білка церулоплазміну
звичайно знижений, виникають хронічна мідна інтокси-
кація і значні дегенеративні зміни в сочевицеподібному
ядрі.
Функція
Наші знання щодо функції базальних ядер досі обме-
жені. Ушкодження базальних ядер у тварин не спричинює
значного ефекту. Однак з’ясовано, що нейрони базальних
ядер, як і нейрони латеральних ділянок півкуль мозочка,
збуджуються перед початком рухової реакції. Ці спосте-
реження, а також детальний аналіз проявів захворювань,
що виникають у базальних ядрах людини, та ефект хіміч-
них речовин, які руйнують дофамінергічні нейрони в експе-
Таблиця 12-3. Базальні ядра
Хвостате ядро л
І Смугасте тіло
(Лушпина '
Бліда куля
Субталамічне ядро (тіло Люїса)
Чорна речовина
риментах на тваринах (див. нижче), наводять на думку, що
ці ядра беруть участь у плануванні і програмуванні рухів,
або, ширше, у процесах, за допомогою яких абстрактна
думка втілюється в вольову рухову реакцію (див. рис. 12-
1). Імпульси з базальних ядер через таламус поширюються
Рис. 12-10. Схематичне зображення головних зв’язків базаль-
них ядер. Суцільними лініями позначено збуджувальні шляхи,
штриховими лініями - гальмівні. Біля шляхів наведено ней-
ротрансмітери, де вони відомі. Сій - глютамат; ДА-дофамін.
Нейротрансмітер ацетилхолін утворюють інтернейрони сму-
гастого тіла. СЧЧР - сітчаста частина чорної речовини; ЩЧЧР
- щільна частина чорної речовини. Підталамічне ядро має
також зв’язки зі щільною частиною чорної речовини. Для спро-
щення схеми цей шлях не показано.
200 І РОЗДІЛ 12
до ділянок, що належать до моторної кори, а кірково-
спинномозковий шлях забезпечує передавання імпульсів
до рухових нейронів. Крім того, збуджувальні потенціали
в базальних ядрах коливаються, і треба думати, що ці коли-
вання можуть мати подібне функційне значення, як коли-
вання в таламо-кортикальних циклах (див. Розділ 11).
Базальні ядра теж відіграють роль в окремих процесах
пізнання, і це забезпечує хвостате ядро. Це ядро має взає-
мозв’язки з лобовою часткою неокортексу і, вірогідно, тому
в разі його ушкодження неможливе оцінювання реакцій,
що стосуються зміни і відтермінування почерговості. Крім
того, ушкодження лише головки лівого хвостатого ядра і
суміжної білої речовини в людини пов’язане з виникненням
дисартикуляційної форми афазії, яка нагадує афазію Вер-
ніке, проте відрізняється від неї (див. Розділ 16).
Захворювання базальних ядер у людини
Цікаво, що ураження базальних ядер в експерименталь-
них тварин спричинює невеликий ефект, тоді як патологічні
процеси, що ушкоджують ці ядра в людини, призводять
до значних характерних порушень рухової функції. Є два
типи порушень рухової функції, пов’язані з захворюванням
базальних ядер у людини: гіпокінетичний і гіперкінетич-
ний. Гіперкінетичні порушення супроводжуються виник-
ненням надмірних та аномальних рухів. Це, зокрема, хорея,
атетоз і балізм. Гіпокінетичні порушення - акінезія і гіпо-
кінезія.
Хорея виявляється швидкими мимовільними танцю-
вальними рухами; атетоз - тривалими повільними судом-
ними. Рухи в разі хореї й атетизму спочатку подібні до
довільних, проте далі стають мимовільними і дезоргані-
зованими. У випадку балізму мимовільні рухи раптові,
інтенсивні, насильницькі.
Акінезія супроводжується утрудненням початку руху і
послабленням спонтанних рухів. Брадикінезія полягає в
сповільненні рухів.
Хвороба Гантінґтона
Першими змінами, які можна виявити в разі хвороби
Гантінґтона, є ураження проміжних шипикових нейронів
хвостатого ядра і лушпини сочевицеподібного ядра. Ранній
симптом хвороби - уривчаста траєкторія руху руки у випад-
ку намагання доторкнутись до певної точки, особливо
помітна наприкінці руху. Згодом з’являються гіперкіне-
тичні хорейні рухи, що поступово наростають, доки зовсім
не виснажать хворого. Мова стає невиразною, а потім
незрозумілою. Настає недоумство, а згодом і смерть (пере-
важно через 10-15 років після появи симптомів). У базаль-
них ядрах у нормі збалансовано діють три біохімічно
відмінні шляхи: чорноречовинно-смугаста дофамінергічна
система; внутрішньосмугаста холінергічна система і
ГАМК-ергічна система, що сполучає смугасте тіло з блідою
кулею і чорною речовиною. У випадку хвороби Гантінґ-
тона ушкоджені внутрішньосмугасті ГАМК-ергічні та холі-
нергічні нейрони. Ушкодження ГАМК-ергічних шляхів, що
ведуть до латеральної блідої кулі, послаблює її інгібу-
вальний вплив, унаслідок чого розвивається гіперкінети-
чність захворювання. Дегенерація чорноречовинно-сму-
гастої дофамінергічної системи спричинює хворобу Пар-
кінсона (див. нижче).
Хворобу Гантінґтона успадковують за аутосомно домі-
нантним типом, і симптоми її з’являються переважно у віці
від ЗО до 50 років. Ненормальний ген, що зумовлює це
захворювання, розміщений біля кінця короткого плеча
хромосоми 4 і переважно містить 11-34 цитозин-аденін-
гуанін (САО)-послідовностей, кожна, з яких кодує глюта-
мін. У пацієнтів з хворобою Гантінґтона ця кількість кодо-
нів зростає до 42-86 і більше. Чим більша кількість цих
послідовностей, тим швидше з’являються симптоми хво-
роби і вона прогресує. Ген кодує гантінгтин - білок, функ-
ція якого ще не відома. Вірогідно, що втрата функції цього
білка пропорційна до збільшення кількості САб-послі-
довностей. Сьогодні нема засобів ефективного лікування
хвороби Гантінґтона, і вона має переважно фатальні наслід-
ки. Проте є і деяка надія. В дослідах з моделюванням хво-
роби на тваринах імплантація в смугасте тіло реципієнта
донорської тканини смугастого тіла плоду поліпшувала
пізнавальну здатність. Відомо, що в мозку хворих людей і
тварин посилюється активність тканинної капсази-1 -
ензиму, що регулює апоптоз. У мишей з нокаутом гена регу-
лювального процесу апоптозу ензиму прогресування хво-
роби сповільнювалось.
Хвороба Гантінґтона - це одне з генетичних захворю-
вань, кількість яких збільшується. Таким хворобам властиві
збільшення кількості тринуклеотидних послідовностей.
Більшість з них стосується зміни кількості САС-послі-
довностей (табл. 12-4), одна - зміни кількості Сбб-послі-
довностей, а ще одна - зміни кількості СТб-послідовнос-
тей. Усі вони пов’язані зі змінами кодувальних послідов-
ностей у гені. Однак ОАА-послідовність, що належить до
некодувальних послідовностей у гені, теж пов’язана з
захворюванням - атаксією Фрідрайха. Є також попередні
дані про те, що збільшення кількості 12-нуклеотидних
послідовностей пов’язане з виникненням рідкісної форми
епілепсії.
Хвороба Паркінсона
(тремтячий параліч)
У хворобі Паркінсона виявляються як гіпо-, так і гіпер-
кінетичні ознаки. У випадках, уперше описаних Джеймсом
Паркінсоном (хвороба названа його іменем), патогенетич-
ною основою була дегенерація чорноречовинно-смугастої
системи дофамінергічних нейронів. У цьому разі особливо
сильно уражуються волокна, що проходять до лушпини.
Паркінсонізм, що був частим пізнім ускладненням епідемій
грипу в період Першої світової війни, сьогодні є спора-
дичною ідіопатичною формою в багатьох людей середньо-
го і похилого віку. В цьому віці простежується стійке змен-
шення кількості дофаміну і дофамінових рецепторів у
базальних ядрах, і прискорення цього процесу, очевидно,
може бути підставою для виникнення хвороби.
Паркінсонізм може виникати теж як ускладнення після
лікування транквілізаторами групи фенотіазину й іншими
засобами, що блокують О2-дофамінові рецептори, або в
гострій і важкій формі після ін’єкцій МФТП (рис. 12-11).
Цей ефект виявлено випадково завдяки тому, що продавець
лікарських засобів у Північній Каліфорнії постачав клієнтів
препаратом “синтетичного героїну” кустарного вироб-
ництва, у якому був МФТП. МФТП є попередником висо-
коактивного оксиданту МФП+, що метаболізується в астро-
РЕГУЛЮВАННЯ ПОСТАВИ І РУХІВ / 201
цитах за допомогою ензиму моноамінооксидази В. У гри-
зунів МФП швидко виводиться з головного мозку, проте в
приматів його видалення набагато повільніше; він зв’я-
зується транспортером дофаміну і надходить у дофамін-
ергічні нейрони чорної речовини, спричинюючи їхні
деструкції. Інші дофамінергічні нейрони не уражуються
до такого ступеня. Тому МФТП можна використовувати
для моделювання паркінсонізму в мавп, саме ця його влас-
тивість прискорила дослідження функції базальних ядер.
Гіпокінетичними проявами хвороби Паркінсона є акі-
незія і брадикінезія, а гіперкінетичними - ригідність і
тремор. Відсутність рухової активності й утруднення запо-
чаткування довільних рухів вражають. Простежується
послаблення комбінованих рухів, таких як нормальні
підсвідомі рухи, зокрема розмахування руками під час
ходіння, а також збідніння міміки, що емоційно виражає
думку і мову, нема численних метушливих рухів і жестів,
властивих усім нам. Ригідність відрізняється від еластич-
ності, оскільки в цьому разі знижується рівень збудження
в рухових нейронах, що іннервують як м’язи-агоністи, так
і м’язи-антагоністи. Пасивність рухів кінцівок поєднана з
дифузною м’язовою ригідністю, що нагадує опір, який
виникає під час згинання свинцевої трубки, тому її нази-
вають ригідністю свинцевої трубки. На фоні пасивності
рухів виникає серія “посіпування” (риґідність зубчастого
кола), проте раптової втрати резистентності, як у разі елас-
тичності кінцівки, не відбувається. Тремор, що простежу-
ється в стані спокою і зникає під час рухів, зумовлений
регулярними почерговими 8/с скороченнями м’язів-анта-
гоністів.
Згідно з загальноприйнятим поглядом в основі пато-
генезу хвороби Паркінсона є дисбаланс між збудженням
Таблиця 12-4. Приклади хвороб, спричинених зміною
кількості тринукпеотидних послідовностей
Захворювання Тринуклео- тидна послідовність Дефектний білок
Хвороба Гантінґтона САС Гантінгтин
Спіноцеребелярна атаксія першого типу САС Атаксин 1
Спіноцеребелярна атаксія другого типу САС Атаксин 2
Спіноцеребелярна атаксія третього типу САС Атаксин 3
Спіноцеребелярна атаксія шостого типу САС сх1А-субодиниця Са2+-каналу
Спіноцеребелярна атаксія сьомого типу САС Атаксин 7
Зубчастоядерно- палідолюїсова атаксія САС Атрофій
Спінобульбарна м’язова атрофія САС Рецептор андрогена
Минущий Х-синдром С66 ЕМР-1
Міотонічна дистрофія СТО ОМ-протеїн- кіназа
Атаксія Фрідрайха 6АА Фратаксин
та інгібуванням у базальних ядрах, що виникає внаслідок
втрати дофамінергічного інгібування лушпини (рис. 12-
12). Зменшення інгібувального впливу на латеральну бліду
кулю, що виникає в цьому разі, веде до зменшення інгібу-
вального впливу субталамічного ядра, і це збільшує збуджу-
вальний ефект цього ядра у медіальній блідій кулі. Унас-
лідок цього знижується рівень інгібувального впливу меді-
альної блідої кулі на таламус, а також рівень поширення
збуджень до кори великого мозку.
Лікування
Важливим у разі обговорення патогенезу хвороби Пар-
кінсона є питання балансу між рівнем збудження в холі-
нергічних інтернейронах та інгібувальним дофамінергіч-
ним впливом на нейрони в смугастому тілі. Певного успіху
досягнуто шляхом зменшення холінергічного впливу за
допомогою антихолінергічних засобів. Сильнішого впливу
можна досягти, застосувавши Ь-ДОФА. На відміну від
дофаміну, цей його попередник проникає через гемато-
енцефалічний бар’єр (див. Розділ 15) і допомагає ліквідува-
ти дефіцит дофаміну. Проте Ь-ДОФА перетворюють на
дофамін головно дофамінергічні нейрони, а дегенерація
цих нейронів триває. Отже, ефективність застосування Ь-
ДОФА після декількох років зменшується.
Хірургічне втручання з метою руйнування медіальної
блідої кулі (палідотомія) або субталамічного ядра дає змогу
відновити баланс еферентних імпульсів до нормального
(див. рис. 12-12). Результат, досягнутий хірургічно, можна
підсилити шляхом уживлення електродів, приєднаних до
розміщеного підшкірно подразника. Застосування струму
високої частоти дає змогу в разі потреби тимчасово роз-
ривати цикли в ділянці кінчиків електродів.
Іншим хірургічним підходом є імплантація дофаміно-
продукувальної тканини в ділянку базальних ядер або біля
неї. Трансплантанти тканини мозкової речовини наднир-
кової залози або сонного гломуса того ж хворого діють як
дофамінові мініпомпи, проте таким способом досягають
лише короткочасного ефекту. Набагато ліпшими є наслідки
трансплантації тканини смугастого тіла плоду. Є вірогід-
ність, що клітини трансплантанта не тільки виживають у
цих умовах, а й налагоджують відповідні зв’язки зі струк-
турами базальних ядер реципієнта.
Рис. 12-11. Перетворення 1-метил-4-феніл-1,2,5,6-тетрагід-
ропіридину (МФТП) в 1-метил-4-фенілпіридин (МФП+) моно-
амінооксидазою В (МАО-В).
202/РОЗДІЛ 12
Водночас тривають пошуки засобів, які б запобігали яви-
щам дегенерації дофамінергічних нейронів. Стосовно цьо-
го цікавий факт, що мутації в гені а-синуклеїну - синап-
тичного білка з нез’ясованою функцією - пов’язані з однією
із родинних форм паркінсонізму, а тільця Леві - включення
нервових клітин, характерні для всіх форм хвороби
Паркінсона - саме значною мірою утворені а-синуклеїном.
Врешті, тільця Леві багаті на убіквітин (див. Розділ 1), а
мутація гена одного з білків, необхідних для його накопи-
чення, пов’язана з іншою родинною формою хвороби Пар-
кінсона. Однак зрозуміло, що потрібно ще багато дослід-
жень, щоб зрозуміти причину дегенерації дофамінергічних
нейронів, якою супроводжується хвороба Паркінсона.
мозочок
Структурний поділ
Мозочок розміщений над важливими чутливими і рухо-
вими системами стовбура головного мозку (рис. 12-13).
Він сполучений зі стовбуром головного мозку з кожного
боку верхніми мозочковими ніжками, середніми, або
мостовими, мозочковими ніжками і нижніми мозоч-
ковими ніжками. Середня частина мозочка - черв’як - і
розміщені латерально півкулі мозочка набагато складчас-
тіші і мають глибші борозни, ніж кора великого мозку; маса
Рис. 12-12. Базальноядерно-таламокортикальний цикл у ви-
падку хвороби Паркінсона. Суцільні стрілки означають збуд-
жувальні, а штрихові - інгібувальні впливи. Сила кожного
впливу означена різної товщини стрілками. Смугасте тіло міс-
тить О^дофамінові рецептори, що підсилюють безпосеред-
ній вплив на медіальну бліду кулю (БКм), і О2-рецептори, що
знижують рівень непрямого інгібувальйого впливу на БКм
через лушпину, латеральну бліду кулю (БКл) і субталамічні
ядра (СТЯ). ЧР - чорна речовина; Талам - таламус; НМЯ -
ніжко-мостові ядра (відтворено за дозволом з бгайоп 8С, Ое-
І_опд М: Тгасіпд іііе Ьгаіп’з сігсиіігу \л/Иіі (ипсііопаї ітадіпд. Иаі
Месі 1997;3:602).
Паркінсонізм
мозочка становить лише 10% від маси кори великого мозку,
проте площа його поверхні - близько 75% від площі кори
великого мозку. Анатомічно мозочок розділений двома
поперечними щілинами на три частини. Задньолатеральна
щілина відмежовує розміщений медіально вузлик і розмі-
щений латерально жмуток з кожного боку від решти мозоч-
ка, а перша щілина розділяє решту мозочка на передню і
задню частки. Менші щілини розділяють черв’як на десять
первинних часточок, які нумерують зверху донизу від 1 до
X. Ці часточки зображені на рис. 12-14.
Функціональний поділ
З погляду функцій мозочок теж поділяють на три час-
тини, проте цей поділ відрізняється від анатомічного (рис.
12-15). Вузлик черв’яка і жмуток півкулі кожного боку
утворюють жмутково-вузликову частку, або вестибу-
лярний (присінковий) мозочок. Ця частка, що є філоге-
нетично найстаршою частиною мозочка, пов’язана з вес-
тибулярною системою і важлива для підтримання рівно-
ваги та зумовлених навчанням змін вестибулоочного реф-
лексу (див. Розділ 9). Решта черв’яка і суміжні з ним меді-
альні ділянки півкуль становлять спінальний мозочок, до
якого проходять пропріорецептивні шляхи від тіла, а також
шляхи, по яких надходить інформація щодо відображення
частин тіла в моторній корі. Зіставляючи планування з реа-
лізацією виконання рухів у частинах тіла, мозочок забез-
печує плавність і координованість рухів. Зв’язки черв’яка
мозочка з ділянками стовбура головного мозку потрібні
для регулювання осьових м’язів і м’язів проксимальних
відділів кінцівок, тоді як такі ж зв’язки півкуль мозочка зі
стовбуром головного мозку - для регулювання м’язів дис-
тальних відділів і кінцівок. Латеральні ділянки півкуль
мозочка називають новим мозочком. Ці з філогенетичного
Мозочкові
ніжки
М СТ
Довгастий мозок
Ніжка мозку
Верхня ніжка
і Середня ніжка
Нижня ніжка
Рис. 12-13. Головні частини головного мозку. Деяке зміщення
частин на рисунку дає змогу показати мозочкові ніжки, а також
структуру у формі кільця, утворену мозочком, передньою
частиною мосту і середньою мозочковою ніжкою, що “пеле-
нає” стовбур головного мозку (відтворено за дозволом з бозз
СМ [есіііог]: (Згау’з Апаіоту ої Йіе Уитап Восіу, 27Й1 есі. І_еа &
БеЬідег, 1959).
РЕГУЛЮВАННЯ ПОСТАВИ І РУХІВ / 203
ВЕРХНЯ ПОВЕРХНЯ
НИЖНЯ ПОВЕРХНЯ
СЕРЕДИННИЙ ПЕРЕРІЗ
Рис. 12-14. Верхня та нижня поверхні і сагітальний переріз мозочка людини. Позначено (від І до X) і наведено назви головних
часточок черв’яка мозочка.
погляду найновіші структури мозочка досягають найбіль-
шого розвитку в людини. Разом з моторною корою струк-
тури нового мозочка виконують планування і програму-
вання рухів.
Організація мозочка
Мозочок складається з розміщеної ззовні кори мозочка,
білої речовини і розташованих глибоко в ній ядер мозочка.
Первинні аферентні шляхи мозочка, мохоподібні і ліано-
подібні волокна (див. нижче) утворюють колатералі з гли-
бокими ядрами і надходять до кори (рис. 12-16). Розріз-
няють чотири ядра мозочка: зубчасте, кулясте, кіркопо-
дібне і ядро шатра. Кулясте і кіркоподібне ядра інколи
об’єднують назвою проміжне ядро. Більша частина шля-
хів від вестибулярного мозочка проходить безпосередньо
до стовбура головного мозку, а решта - від кори мозочка
до його ядер, звідси - до стовбура головного мозку. Отже,
ядра мозочка забезпечують єдиний шлях імпульсів від
спінального і нового мозочків. Медіальна частина шляху
від спінального мозочка проходить до ядра шатра, а звідси
- до стовбура головного мозку. Шлях від суміжних частин
півкулі мозочка, що теж належать до спінального мозочка,
проходить до кіркоподібного та кулястого ядер, а від них
- до стовбура головного мозку. Волокна від нового мозочка
йдуть до зубчастого ядра, а від нього безпосередньо або
опосередковано - до вентролатерального ядра таламуса.
204/РОЗДІЛ 12
Спінальний мозочок г,
............................
низхідної
системи
Церебральний
мозочок
Вестибулярний
мозочок
вшившії
рухів
До
моторної і ' ^Планування
премоторної І рухів
кори
До
вестибулярних
ядер
Рівновага
і рухи
очних яблук
Рис. 12-15. Поділ мозочка за функціями (модифіковано з
КапсІеІ ЕП, Зсіїхл/агіг ЛЧ, Зеззеїі ТМ [есіііогз]: ргіпсіріез ої Меи-
гаї Зсіепсе, 4йі есі. Мс6га\л/-НіІІ, 2000)
Кора мозочка містить п’ять різновидів нейронів: клітини
Пуркіньє, зерноподібні клітини, кошикові клітини, зірчасті
клітини і клітини Ґольджі. Вона має тришарову структуру
(рис. 12-17): зовнішній, молекулярний шар, гангліонарний
Рис. 12-16. Схема нервових зв’язків усередині мозочка. Плюс
і мінус позначають, відповідно, збуджувальні і гальмівні впли-
ви. КК - кошикова клітина; КҐ - клітина Ґольджі; ЗК - зерно-
подібна клітина, КЯМ - клітина ядра мозочка; КП - клітина
Пуркіньє. Зверніть увагу на те, що КП і КК чинять гальмівний
вплив. Зв’язки зірчастих клітин подібні до зв’язків кошикових
клітин, проте в більшості вони закінчуються на дендритах клі-
тин Пуркіньє
шар, утворений одним шаром клітин Пуркіньє, і внутріш-
ній, зернистий, шар. Клітини Пуркіньє - одні з найбіль-
ших нейронів тіла. їхні значно розгалужені дендрити про-
ходять крізь молекулярний шар кори. Аксони клітин Пур-
кіньє, що формують єдиний еферентний шлях від кори
мозочка, йдуть переважно до ядер мозочка. Кора мозочка
теж містить зерноподібні клітини, які отримують імпуль-
си через мохоподібні волокна і передають їх на клітини
Пуркіньє. Тіла зернистих клітин розміщені в зернистому
шарі. Аксон кожної зернистої клітини проникає в молеку-
лярний шар, де утворює Т-подібнс розгалуження. Ці довгі
прямі розгалуження названо паралельними волокнами.
Дендрити клітин Пуркіньє утворюють численні кущопо-
дібні розгалуження, розміщені в одній площині й орієн-
товані під прямими кутами стосовно паралельних волокон.
Паралельні волокна створюють синаптичні контакти з ден-
дритами багатьох клітин Пуркіньє і, отже, разом з дендри-
тами клітин Пуркіньє формують дивовижну регулярну
сітку.
Інші три різновиди нейронів кори мозочка є інпбітор-
ними інтернейронами. Кошикові клітини (див. рис. 12-
17) розміщені в молекулярному шарі. Вони отримують
імпульси від паралельних волокон, і кожна кошикова клі-
тина передає інформацію багатьом клітинам Пуркіньє.
Аксони клітин утворюють розгалуження у формі кошика
навколо тіла і горбка аксона клітин Пуркіньє. Зірчасті клі-
тини подібні до кошикових, проте розташовані ближче до
поверхні кори. Клітини Ґольджі розміщені в зернистому
шарі. їхні дендрити, що проникають у молекулярний шар,
одержують інформацію від паралельних волокон. Тіла
клітин отримують імпульси через колатералі від мохопо-
дібних волокон і клітин Пуркіньє. Аксони клітин Ґольджі
контактують з дендритами зернистих клітин.
Як зазначено вище, головні шляхи збуджувальних впли-
вів, що надходять до кори мозочка, сформовані ліано- і
мохоподібними волокнами (див. рис. 12-16). Ліаноподіб-
ні волокна походять з єдиного джерела - ядер оливи - і
проходять до первинних дендритів клітин Пуркіньє та
звиваються навколо них як ліани. До ядер оливи пропріо-
рецептивні імпульси надходять від усіх частин тіла. З іншо-
го боку, мохоподібні волокна передають інформацію безпо-
середньо від усіх ділянок тіла, а також імпульси від кори
великого мозку через ядра мосту до кори мозочка. Ці волок-
на закінчуються на дендритах зернистих клітин складними
синаптичними скупченнями, які називають клубочками.
Ці клубочки містять також терміналі клітин Ґольджі, що
чинять гальмівний вплив, про які згадувалось раніше.
Головні цикли циркуляції збудження в корі мозочка
порівняно нескладні (див. рис. 12-16). Імпульси, які передає
ліаноподібне волокно, чинять потужний збуджувальний
вплив на поодинокі клітини Пуркіньє, тоді як мохоподібні
через зернисті клітини забезпечують слабкий збуджуваль-
ний вплив на низку клітин Пуркіньє. Кошикові і зірчасті
клітини збуджувані зернистими клітинами через паралельні
волокна і їхній вплив на клітини Пуркіньє є гальмівним
(гальмування прямим зв’язком). Клітини Ґольджі збуджу-
ють імпульси, що надходять через колатералі мохоподібних
волокон, колатералі клітин Пуркіньє та паралельні волокна
і гальмують передавання імпульсів від мохоподібних воло-
кон до зернистих клітин.
РЕГУЛЮВАННЯ ПОСТАВИ І РУХІВ / 205
Рис. 12-17. Розміщення і структура нейронів кори мозочка (відтворено за дозволом з КиГЛег 8\Л/, МісІїоІІз 36, Магііп АР: Егот
ІМеигоп іо Вгаіп, 2псІ есі. Зіпаиег, 1984).
Нейротрансмітером, що його, ймовірно, виділяють зір-
часті, кошикові клітини, клітини Ґольджі та клітини Пур-
кіньє, є ГАМК, тоді як зернисті клітини виділяють глю-
тамат. ГАМК діє на ГАМКл-рсцептори, проте комбінація
субодиниць у цих рецепторах (див. Розділ 4) в різних типів
клітин різна. Унікальність зернистих клітин полягає в тому,
що вони - це єдиний різновид нейронів ЦНС, ГАМ ^-ре-
цептор яких містить осб-субодиницю.
Імпульси, що надходять з клітин Пуркіньє, відповідно,
чинять гальмівний вплив на ядра мозочка. Як зазначено
вище, ці ядра теж отримують збуджувальні імпульси через
колатералі ліано- і мохоподібних волокон. Цікаво, що,
незважаючи на гальмівний вплив клітин Пуркіньє на ядра
мозочка, імпульси, які надходять від цих ядер до стовбура
головного мозку і таламуса, є збуджувальними. Отже,
майже всі шляхи циркуляції збудження в мозочку, очевидно,
стосуються модуляції чи регулювання синхронності пере-
давання імпульсів від ядер мозочка до стовбура головного
мозку і таламуса.
Первинні аферентні шляхи, що проходять до мозочка
мохо- і ліаноподібними волокнами, наведені в табл. 12-5.
Жмутково-вузликова частка
Тварини, у яких зруйнована жмутково-вузликова част-
ка, втрачають стійкість і пересуваються, хитаючись на
рівній площині. Вони не підтримують рівноваги і можуть
впасти без сторонньої підтримки. Подібні порушення, що
є ранніми ознаками розвитку пухлини в серединних ділян-
ках мозочка, яка походить з клітин вузлика, можна спосте-
рігати в дітей. У цьому разі швидко ушкоджуються струк-
тури, розміщені в межах жмутково-вузликової частки.
Вибіркове хірургічне видалення жмутково-вузликової
частки в собак спричинює синдром хвороби руху (див.
Розділ 9), тоді як широке ушкодження інших ділянок
мозочка чи головного мозку не має такого наслідку.
Вплив на рефлекси розтягування
Подразнення ділянок мозочка, до яких надходять про-
пріорецептивні імпульси, в деяких випадках гальмує, а в
деяких - підсилює рухи, спричинені подразненням кори
великого мозку. Ушкодження листків І—VI та присере-
динних ділянок зумовлює в експериментальних тварин
еластичність у частинах тіла, що проектовані в ушкодже-
них ділянках мозочка. Однак у людей відповідні деструк-
тивні зміни в мозочку призводять до гіпотонії м’язів.
Вплив на рухи
За винятком змін, що простежуються в рефлексах роз-
тягування, в експериментальних тварин і людей з ушкод-
женням півкуль мозочка в стані спокою не зафіксовано
інших відхилень. Проте під час рухів починають виявля-
тись різко виражені ненормальності. Ці вади ані не є па-
ралічем, ані не пов’язані з втратою чутливості, а мають
характер виразної атаксії, що виявляється в дискоордина-
206/РОЗДІЛ 12
Таблиця 12-5. Функція головних аферентних систем
мозочка1
Аферентні шляхи Проводять
Присінково-мозочковий Вестибулярні імпульси 3 лабіринтів безпосередньо або через присінкові ядра
Задній спинномозочковий Пропріо- й екстерорецептивні імпульси від тіла
Передній спинномозочковий Пропріо- й екстерорецептивні імпульси від тіла
Клиномозочковий (дорсальна частина зовнішніх дуго- подібних пучків) Пропріорецептивні імпульси, зокрема від ділянок голови та шиї
Покришко-мозочковий Слухові і зорові імпульси, що проходять через нижні і верхні горбики покришки середнього мозку
Мосто-мозочковий Імпульси від моторної та інших ділянок кори великого мозку, що йдуть через ядра моста
Оливо-мозочковий Пропріорецептивні імпульси від усього тіла, що йдуть через ядра оливи
1 Оливо-мозочковий шлях проходить до кори мозочка ліано-
подібними волокнами, інші перечислені шляхи - мохоподіб-
ними волокнами. Ще деякі шляхи проводять імпульси від ядер
стовбура головного мозку до кори і ядер мозочка, зокрема
серотонінергічний шлях від ядер шва до молекулярного і зер-
нистого шарів, а також норадренергічний шлях від голубої
плями до всіх трьох шарів.
ції, зумовленій порушенням швидкості, амплітуди, сили і
напряму рухів. У цьому разі атаксія може виявлятись на
одній половині тіла. У випадку ушкодження лише кори мо-
зочка вади руху внаслідок компенсації поступово зника-
ють. Ушкодження ядер мозочка спричинює вираженіші та
стійкіші порушення. З огляду на це в разі хірургічного втру-
чання на мозочку треба уникати ушкодження його ядер.
Ще інші ознаки ушкодження мозочка в людини свідчать
про важливість цієї частини мозку для регулювання рухової
діяльності. Атаксія виявляється не тільки, грубо кажучи,
хиткою, “п’яною” ходою, а також порушенням тонких і
точних рухів, що особливо позначається на процесі мов-
лення. Мова стає невиразною або, як її називають, - скан-
дованою. Інші довільні рухи є теж значно ненормальними.
Наприклад, у разі намагання доторкнутися до певного
об’єкта палець опиняється то з одного, то з іншого боку
від цього об’єкта. Така дисметрія швидко ініціює нама-
гання корекції руху, проте внаслідок грубої корекції палець
знову опиняється з іншого боку предмета і так осцилює
туди й назад. Подібного типу коливання в разі ушкодження
мозочка називають тремором наміру. На відміну від тре-
мору у випадку паркінсонізму, що наявний у стані спокою,
тремор наміру виникає тоді, коли пацієнт намагається
виконати певний довільний рух. Іншим прявом ушкод-
ження мозочка є нездатність “швидко гальмувати”, тобто
раптово припиняти виконуваний рух. У нормі, наприклад,
під час згинання передпліччя за умов долання певного
опору можна швидко припинити рух, якщо цей опір раптом
зникає. Хворий з ушкодженням мозочка не може припи-
нити рух кінцівки і його передпліччя рухається назад, опи-
суючи широку дугу. Таку ненормальну реакцію називають
феноменом рикошета, такого типу вади виявляються і в
разі виконання інших рухів. Це є однією з важливих причин
прояву в таких пацієнтів адіадохокінезїї - неможливості
послідовно виконувати протилежні за напрямом рухи, такі
як, наприклад, послідовно повторювальні пронація і супі-
нація кисті. Пацієнти з ушкодженням мозочка мають також
утруднення з виконанням рухів одночасно в декількох
суглобах. Ці рухи в них відбуваються роздільно в часі в
кожному з суглобів. Такий феномен відомий за назвою
декомпозиція рухів.
Мозочок і навчання
Функція мозочка пов’язана з пристосуванням за допо-
могою навчання, і коли завдання виконують раз за разом,
то координація рухів поліпшується. Під час виконання
рухового завдання активність у головному мозку переміщу-
ється з передлобової ділянки до кори тім’яної частки,
моторної кори і мозочка. Ймовірно, основу навчання в
мозочку становлять імпульси, що надходять з ядер оливи.
Щодо цього зазначимо, що кожна клітина Пуркіньє отри-
мує імпульси аж від 250 000 до 1 млн мохоподібних
волокон, проте лише від одного ліаноподібного волокна,
що проходить від оливи. Це волокно утворює 2 000-3 000
синаптичних контактів з клітиною Пуркіньє. Активування
ліаноподібного волокна спричинює в клітині Пуркіньє
сильний складний пік активності, і цей пік певним чином
зумовлює тривалу модифікацію імпульсів, що через мохо-
подібні волокна надходять до клітини Пуркіньє. Активність
у ліаноподібних волокнах зростає з кожним новим навчаль-
ним рухом, а вибіркове ушкодження оливного комплексу
спричинює нездатність до формування тривалих пристосу-
вальних механізмів, необхідних для виконання певних
рухових відповідей. Роль мозочка в регулюванні вестибуло-
очного рефлексу й інших форм рефлекторної пам’яті роз-
глянуто в Розділі 1 6.
Механізми
Хоча функції жмутково-вузликової частки, спінального
мозочка і нового мозочка порівняно зрозумілі, а мозочкові
цикли не такі складні, проте точні механізми дії його час-
тин досі невідомі. Співвідношення електричних явищ у
мозочку з дією його як центру рухової діяльності - це одна
з цікавих нез’ясованих проблем. Корі мозочка властивий
базальний, 150-300/с, 200 мкВ, електричний ритм, на який
накладається 1000—2000/с компонент з меншою амплі-
тудою. Отже, частота базального ритму більше ніж у 10
разів вища від зареєстрованого таким самим способом кір-
кового ос-ритму мозочка. Імпульси, що надходять до мозоч-
ка, звичайно змінюють амплітуду його ритму подібно до
того, як радіомовний сигнал модулює несучу частоту радіо-
передавача. Однак значимість цього біоелектричного
феномену для функції мозочка не з’ясована.
Автономна нервова система
13
ВСТУП
Організація роботи автономної нервової системи, як і
соматичної, ґрунтується на рефлекторних дугах. Імпульси,
що виникають у вісцеральних рецепторах, потрапляють
по аферентних автономних шляхах до ЦНС, інтегруються
на різних її рівнях і переходять еферентними шляхами до
вісцеральних ефекторів. Потрібно звернути особливу увагу
на цілісність цієї організації, оскільки роль функційно
важливих аферентних компонентів часто применшували.
Вісцеральні рецептори й аферентні шляхи описано в Роз-
ділах 5 і 7, а головні автономні ефектори, гладкі м’язи - в
Розділі 3. У цьому розділі розглянуто еферентні шляхи,
що ведуть до внутрішніх органів. Питання автономної
інтеграції описано в Розділі 14.
СТРУКТУРНА ОРГАНІЗАЦІЯ АВТОНОМНИХ
ВІДЦЕНТРОВИХ ШЛЯХІВ
Периферійний відділ еферентної частини автономної
нервової системи утворений пре- і постгангліонарними
нейронами (рис. 13-1, 13-2). Тіла прегангліонарних ней-
ронів розміщені у вісцеромоторних проміжнолатеральних
сірих стовпах (ПЛСС) спинного мозку або в гомологічних
ядрах черепних нервів. їхні аксони, переважно мієлінові,
- це порівняно повільно провідні В-волокна, що утворю-
ють синаптичні контакти з тілами постгангліонарних ней-
ронів, розміщених винятково поза ЦНС. Кожен преганг-
ліонарний аксон формує синапси в середньому з восьма
чи дев’ятьма постгангліонарними нейронами. Таким спо-
собом відбувається розсіювання імпульсів у відцентрових
Від спинного мозку,
довгастого мозку і
гіпоталамуса
Пре-
Превертебральний ганглій
Сіра сполучна
гілка
Внутрішній
орган
-------До кровоносних судин
і потових залоз
Паравертебральний ганглій
Спинномозкові
неРвиТ^ Пост-
Біла
СГ
СИМПАТИЧНА ЧАСТИНА
Стовбур
головного
мозку
Черепні нерви -
III, VII, IX, X пари
Пост-
Пре-
Еферентні
шляхи черепного
відділу Внутрішній
орган
Спинномозкові
нерви Зг-84
Еферентні шляхи
крижового
відділу
Пре-
ПАРАСИМПАТИЧНА ЧАСТИНА
Рис. 13-1. Автономна нервова система. Пре--прегангліонарний нейрон; Пост-- постгангліонарний нейрон; СГ-сполучна гілка.
208/РОЗДІЛ 13
Війковий вузол
5
2
З
4
СПИННИЙ
МОЗОК
Верхній шийний
вузол
ДОВГАСТИЙ-
МОЗОК
_____— --- Очне яблуко
Крилопіднебіннии Сльозова
вузол у — ц— залоза
З
4
9
С.1
2
6
__7
_8
Т. 1
2
З
___5
5. 1
10
11
12
СЕРЕДНІЙ ~
МОЗОК
4
5
£
7
Легеня
Шлунок
Нирка
Пряма кишка
2
Сечовий міхур
5 а3'
Тонка
кишка
Привушна
залоза
Ободова
кишка
Підщелепна
залоза
Під’язикова
залоза
Кровоносні
судини черевної
порожнини
Печінка
Жовчний міхур
Жовчні протоки
Підшлункова залоза
Мозкова речовина
надниркової залози
Серце
Гортань,
трахея і
бронхи
Черевний
Великий вузол
вісцеральний
нерв
Нижній
брижовии
Рис. 13-2. Схема еферентних автономних шляхів. Прегангліонарні волокна зображені суцільними лініями, а постгангліонарні
- штриховими. Грубими лініями позначено парасимпатичні волокна, а тонкими - симпатичні (модифіковано та відтворено за
дозволом з Уоитапз '!і Рипсіатепіаіз ої Нитап Рїіузіоіоду, 2лсІ еб. Уваг Воок, 1962).
Середній шийний
вузол
Нижній шийний
вузол
Сонні артерія
і сплетення
Підщелепний-
вузол
Вушний вузол
Блукаючий нерв
Симпатичний
стовбур
Верхній
брижовий
вузол
вузол
—і— Статеві
органи
автономних шляхах. Аксони постгангліонарних нейронів
- це переважно безмієлінові С-волокна, які закінчуються
на вісцеральних ефекторах. Анатомічно відцентровий від-
діл автономної нервової системи розділений на симпатичну
і парасимпатичну частини. Обидві частини сполучені за
допомогою ентеричної нервової системи, яку названо тре-
тьою частиною автономної нервової системи.
Симпатична частина
Аксони симпатичних прегангліонарних нейронів від-
ходять зі спинного мозку через передні корінці спинно-
мозкових нервів, починаючи з першого грудного і закін-
чуючи третім або четвертим поперековим. Зі спинномоз-
кових нервів аксони в складі білих сполучних гілок
проникають у паравертебральні ганглії, що утворюють
АВТОНОМНА НЕРВОВА СИСТЕМА / 209
симпатичний стовбур, де більшість з них закінчується на
тілах постгангліонарних нейронів. Частина аксонів пост-
гангліонарних нейронів проходить до внутрішніх органів
у складі різних симпатичних нервів, а решта відходить з
паравертебрального вузла до спинномозкового нерва сірою
сполучною гілкою і до автономних ефекторів ділянок, у
яких розгалужується спинномозковий нерв. Постгангліо-
нарні симпатичні нерви, що надходять до ділянок голови,
починаються від верхнього, середнього та зірчастого вуз-
лів симпатичного стовбура, і проходять до ефекторів
уздовж кровоносних судин. Аксони окремих прегангліо-
нарних нейронів проходять, не перериваючись, крізь пара-
вертебральні ганглії і закінчуються на тілах постгангліо-
нарних нейронів, розміщених у превертебральних (кола-
теральних) гангліях, які лежать ближче до внутрішніх
органів. Частина матки і чоловічі статеві шляхи іннерво-
вані спеціальною системою коротких норадренергічних
нейронів, тіла яких розміщені у вузлах, що є в стінках цих
органів або безпосередньо біля них. Отже, нерви, що пря-
мують до цих органів, повністю утворені аксонами пре-
гангліонарних нейронів (див. рис. 13-2).
Крім того, як зазначено вище, принаймні в щурів є
внутрішньосерцеві адренергічні клітини (ІСА клітини
- від англ. іпігіпзіс сагбіас абгепег^іс сеііз), які містять
адреналін і норадреналін, а також близько 15% від загаль-
ного вмісту катехоламінів у серці. Функція їх до кінця не
з’ясована, проте експерименти з нокаутом генів засвід-
чили, що катехоламіни необхідні в процесі нормального
розвитку серця.
Парасимпатична частина
Еферентні волокна черепного відділу парасимпатичної
нервової системи, що іннервують вісцеральні структури
голови, проходять у складі окорухового, лицевого і язико-
глоткового нервів, а до органів грудної і черевної порожнин
- у складі блукаючого нерва. Еферентні волокна крижо-
вого відділу парасимпатичної нервової системи, що іннер-
вують органи таза, проходять у складі тазових вісцеральних
нервів - гілок другого, третього і четвертого крижових
спинномозкових нервів. Прегангліонарні волокна обох цих
відділів закінчуються на тілах постгангліонарних нейро-
нів, які розміщені в стінках вісцеральних органів або без-
посередньо біля них (див. рис. 13-2).
ХІМІЧНЕ ПЕРЕДАВАННЯ ЗБУДЖЕННЯ В
СИНАПСАХ АВТОНОМНОЇ НЕРВОВОЇ
СИСТЕМИ
Збудження в синаптичних контактах між прегангліонар-
ними нейронами і нейронами автономних вузлів, а також
між постгангліонарними волокнами й автономними ефек-
торами передається за допомогою хімічних трансмітерів.
Головними нейротрансмітерами в цьому разі є ацетилхо-
лін і норадреналін. В інтернейронах симпатичних вузлів
виділяється дофамін, а в окремих прегангліонарних ней-
ронах - ГнРГ (табл. 13-1). За посередництвом ГнРГ від-
буваються повільні збуджувальні реакції (див. нижче). Крім
того, в автономній нервовій системі виділяються котранс-
15 367-2
Таблиця 13-1. Швидкі та повільні реакції постгангліонарних
нейронів симпатичних вузлів
Потенціал Тривалість Трансмітер Рецептор
Швидкий ЗПСП ЗО мс Ацетилхолін Нікотинопо- дібний холін- ергічний
Повільний ІПСП 2с Дофамін О2
Повільний ЗПСП ЗО с Ацетилхолін м2- холінергічний
Пізній повільний ЗПСП 4 хв ГнРГ ГнРГ
мітери: наприклад, разом з ацетилхоліном - ВІП, а разом з
норадреналіном - АТФ і нейропептид V . Хімізм усіх цих
трансмітерів і рецепторів, на які вони діють, описаний у
Розділі 4. Котрансмітер ВІП спричинює розширення брон-
хів і, отже, повинна бути окрема ВІП-продукувальна не-
адренергічна і нехолінергічна нервова система, що
іннервує гладкі м’язи бронхіол (див. Розділ 34).
Хімічний поділ автономної
нервової системи
Стосовно типу хімічного трансмітера автономну нер-
вову систему можна розділити на холінергічну і норадре-
нергічну частини (табл. 13-2). Холінергічними нейронами
є такі: всі прегангліонарні нейрони; анатомічно парасим-
патичні постгангліонарні нейрони; анатомічно симпатичні
постгангліонарні нейрони, що іннервують потові залози;
анатомічно симпатичні нейрони, що закінчуються на кро-
воносних судинах скелетних м’язів і в разі подразнення
спричинюють розширення судин (симпатичні вазодилята-
тори! нерви; див. Розділ 31). Решта постгангліонарних
симпатичних нейронів є норадренергічними або, очевидно,
у випадку ІСА клітин - адренергічними. Мозкова речовина
наднирникової залози - це, по суті, симпатичний вузол, у
якому постгангліонарні нейрони втратили свої аксони. Ці
клітини виділяють норадреналін, адреналін, а деякі - дофа-
мін безпосередньо в кров’яне русло. Аксони холінергічних
прегангліонарних нейронів, що надходять до клітин мозко-
вої речовини надниркової залози, є, отже, секреторними
нервами цієї залози.
Передавання збуджень у симпатичних
вузлах
Принаймні в експериментальних тварин реакції, що
виникають у постгангліонарних нейронах під час подраз-
нення прегангліонарних волокон, охоплюють не тільки
швидку деполяризацію (швидкий ЗПСП), що генерує
потенціал дії, а також і пролонгований інгібувальний пост-
синаптичний потенціал (повільний ІПСП), пролонгова-
ний збуджувальний постсинаптичний потенціал (повіль-
ний ЗПСП) і пізній повільний ЗПСП (див. Розділ 4). Піз-
ній повільний ЗПСП сильно пролонгований, він триває не
мілісекунди, а хвилини. Ці повільні реакції, очевидно,
модулюють і регулюють нейротрансмісію в симпатичних
вузлах. Початкова деполяризація зумовлена дією ацетил-
210/РОЗДІЛ 13
Таблиця 13-2. Реакції ефекторних органів на імпульси автономної нервової системи і циркулювальні катехоламіни1
Норадренергічні імпульси
Ефекторні органи Реакція на холінергічні імпульси тип рецептора2 реакція
Очні яблука Радіальний м’яз райдужки М’яз-сфінктер райдужки Війковий м’яз Скорочення (міоз) Скорочення для бачення на близькі відстані а, Р2 Скорочення (мідріаз) Розслаблення для бачення на далекі відстані
Серце Синусно-передсердний вузол Передсердя Передсердно- шлуночковий вузол Система пучка Гіса і волокон Пуркіньє Шлуночки Сповільнює серцеві скорочення Сповільнює скорочення і (переважно) підвищує швидкість проведення Знижує швидкість проведення Знижує швидкість проведення Сповільнює серцеві скорочення Р,.Р2 РгР2 Р,.Р2 РгР2 РрР2 Прискорює серцеві скорочення Прискорює скорочення і швидкість проведення Підвищує швидкість проведення Підвищує швидкість проведення Прискорює скорочення
Артеріоли Вінцеві Шкіри і слизової оболонки Скелетних м’язів Великого мозку Легеневі Органів черевної порожнини Слинних залоз Ниркові Звуження Розширення Розширення Розширення Розширення Розширення аг а2 р2 а2 «і Р2 «і «і Р2 «і Р2 аг а2 аг а2 РГР2 Звуження Розширення Звуження Звуження Розширення Звуження Звуження Розширення Звуження Розширення Звуження Звуження Розширення
Вени великого кола кровообігу аг а2 р2 Звуження Розширення
Легені М’язи бронхів Залози бронхів Скорочення Стимулювання р2 а, Р2 Розслаблення Гальмування Стимулювання
Шлунок Рухи і тонус Сфінктери Секреція Підвищення Розслаблення (переважно) Стимулювання (Х2, р2 «1 а2 Послаблення (переважно) Скорочення(переважно) Гальмування
Кишка Рухи і тонус Сфінктери Секреція Підвищення Розслаблення (переважно) Стимулювання а2, Р1( Р2 «і а2 Послаблення (переважно) Скорочення (переважно) Гальмування
Жовчний міхур і протоки Скорочення р2 Розслаблення
Сечовий міхур М’яз-випорожнювач Трикутник міхура і сфінктер Скорочення Розслаблення р2 а, Розслаблення (переважно) Скорочення
Сечоводи Рухи і тонус Підвищення (?) «1 Послаблення (переважно)
Матка Варіабільна3 а, Р2 Скорочення (у стані вагітності) Розслаблення (у стані вагітності та невагітності)
Чоловічі статеві органи Ерекція «1 Еякуляція
Капсула селезінки а, Р2 Скорочення Розслаблення
АВТОНОМНА НЕРВОВА СИСТЕМА / 211
Таблиця 13-2. (Закінчення)
Ефекторні органи Реакція на холінергічні імпульси Норадренергічні імпульси
тип рецептора2 реакція
Мозкова речовина надниркової залози Секреція адреналіну і норадреналіну
Шкіра М’язи, що піднімають волосся Потові залози Загальна секреція «і «і Скорочення Слабка локальна секреція4
Печінка а,, Р2 Глікогеноліз
Підшлункова залоза Ацинуси Острівці Підвищена секреція Підвищена секреція інсуліну і глюкагону а а2 Р2 Зниження секреції Зниження секреції інсуліну і глюкагону Підвищення секреції інсуліну і глюкагону
Слинні залози Сильна водяниста секреція Знижена швидкість проведення а" оо- Густа тягуча секреція Секреція амілази
Сльозові залози Секреція а Секреція
Носогорлові залози Секреція
Жирова тканина а,, р2, Р3 Ліполіз
Юкстаґломерулярні клітини Р, Підвищена секреція реніну
Шишкоподібна залоза Р Підвищений синтез і секреція мелатоніну
1 Модифіковано з Нагсіта ЗО еі аі (есіііогз): Соосітап апсі Сіїтап’з ТІїе РІіагтасоІодісаІ Вавіз оТ ТІїегареїЛісз, 9Ф есі Мсбгауу-
НіІІ, 1996
2 У випадку, якщо підтип рецептора точно не визначений, результати не є достатніми для характеристики реакції.
3 Залежить від стадії місячного циклу, кількості естрогену і прогестерону, що циркулюють, вагітності та інших факторів.
4 На долонях і деяких інших ділянках (“адренергічне потіння”).
холіну на нікотиновий рецептор. Повільний ІПСП зале-
жить, очевидно, від дофаміну, що його виділяє інтернейрон
вузла. Збудження в інтернейроні спричинює активація М2
мускаринового рецептора. Інтернейрони, що виділяють
дофамін, - це малі, інтенсивно флуоресцентні клітини (81Е
клітини - від англ. зтаіі іпіепзеїу Пиогезсепі) вузлів.
Виникнення низького ІПСП не опосередковане циклічним
АМФ, як можна було б уважати, оскільки в процесі бере
участь О2-рецептор (див. Розділ 4). Повільний ЗПСП вини-
кає під впливом ацетилхоліну, що діє на мускариновий
рецептор мембрани постгангліонарного нейрона, а пізній
- під впливом ГнРГ або пептиду, що близький до нього за
структурою.
РЕАКЦІЇ ЕФЕКТОРНИХ ОРГАНІВ НА
ІМПУЛЬСИ, ЩО НАДХОДЯТЬ
АВТОНОМНИМИ НЕРВАМИ
Головні принципи
Реакції з боку вісцеральних органів на подразнення
норадренергічних і холінергічних постгангліонарних нер-
вових волокон наведені в табл. 13-2. Гладкі м’язи стінок
порожнистих вісцеральних органів загалом іннервовані як
норадренергічними, так і холінерпчними волокнами, і
активність однієї з цих систем підвищує активність гладких
м’язів, тоді як активність іншої - знижує її. Однак єдиного
правила, згідно з яким певна система стимулює або інгібує
ефекторний орган, нема. У випадку м’язів-сфінктерів як
адренергічна, так і холінергічна системи діють збуджу-
вально, проте одна з систем іннервує звужувальний елемент
сфінктера, а інша - розширювальний.
Ацетилхоліну переважно нема в крові, що циркулює, і
локальний холінергічний вплив здебільшого є дискретним
і короткотривалим унаслідок високої концентрації в холі-
нергічних нервових закінченнях ензиму ацетилхолінесте-
рази. Норадреналін має ознаки гормону і трансмітера і
більш пролонговану дію, ніж ацетилхолін. Норадреналін,
адреналін і дофамін містяться в плазмі (див. Розділ 20).
Адреналін і дофамін надходять з мозкової речовини
надниркової залози, тоді як більша частина норадреналіну
дифундує в кров’яне русло з норадренергічних нервових
закінчень. Метаболіти норадреналіну і дофаміну надходять
у кров’яне русло теж з симпатичних нервових закінчень і
гладком’язових клітин (рис. 13-3). Мсіаболізм катехола-
мінів описано в Розділі 4. Зазначимо, що навіть за умов
інгібування МАО і КОМТ швидкість метаболізму норад-
реналіну є високою. Проте інгібування зворотного погли-
нання продовжує період його півжиття.
212/РОЗДІЛ 13
Симпатичне
нервове закінчення
Гладка
м'язова тканина
Кров’яне русло
Рис. 13-3. Метаболізм катехоламінів у симпатичній нервовій системі. ТГ-тирозингідроксилаза; ДОФА-дигідрооксифенілаланін;
ДА - дофамін; НА - норадреналін; НМН - норметанефрин; ДГФГ - дигідроксифенілгліколь; ГВК - голюванілінова кислота;
МГМК-З-метокси-4-гідроксиманделова кислота; МГФГ-З-метокси-4-гідроксифенілгліколь; КОМТ-катехол-О-метилтрансфера;
ДОФОК - дигідрооксифенілоцтова кислота. Інші скорочення див. на рис. 4-18 та 4-20 (від 08 боІсМеіп).
Холінергічний вплив
Загалом, функції, зумовлені активністю холінергічної
частини автономної нервової системи, пов’язані з вегета-
тивними потребами щоденного життя. Наприклад, холінер-
гічний вплив сприяє травленню і всмоктуванню їжі шляхом
підвищення активності мускулатури шлунково-кишкового
тракту, зростання шлункової секреції і розслаблення сфінк-
тера пілоруса. З огляду на це і на відміну від “катаболічно'ї”
за впливом норадренергічної частини холінергічну частину
автономної нервової системи інколи називають анаболіч-
IIон» нервовою системою.
Функція котрансмітера В1П, що його виділяють пост-
гангліонарні холінергічні нейрони, не з’ясована, проте є
правдоподібність, що цей котрансмітер сприяє постсинап-
тичній активності ацетилхоліну. Оскільки ВІП є вазодиля-
татором, то він може теж поліпшувати кровопостачання
відповідних органів.
Норадренергічний вплив
Вплив норадренергічної частини виявляється в кри-
тичних ситуаціях. Він набуває особливого значення за умов
підготовки особи до долання екстремальної ситуації, хоча
важливо уникати помилкових, телеологічних тверджень
стосовно того, що ця система впливає для того, щоб ство-
рювати такі ситуації. Наприклад, норадренергічний вплив
зумовлює розширення зіниці (даючи змогу більшій кіль-
кості світла проникати всередину очного яблука), приско-
рює серцебиття, підвищує кров’яний тиск (забезпечуючи
ліпше кровопостачання життєво важливих органів і м’язів),
звужує кровоносні судини шкіри (що зменшує крововтрату
з ран). Норадренергічна дія також спричинює зниження
рівня порогів збудження в ретикулярній формації (поси-
люючи настороженість, стан збудження і підвищуючи
рівень глюкози та вільних жирних кислот (постачаючи
більше енергії). З огляду на це Кеннон назвав норадренер-
гічну систему екстреного впливу системою приготування
до реакції “втікати чи воювати”.
Крім масового впливу системи за умов стресових ситу-
ацій, норадренергічні автономні волокна забезпечують ще
й інші функції. Наприклад, тонічний норадренергічний
вплив на артеріоли спричинює підвищення артеріального
тиску, а зміни цього тонічного впливу є в основі механізму
зворотного зв’язку, що відбувається за участю рецепторів
сонної пазухи в разі регулювання кров’яного тиску. Актив-
ність симпатичної нервової системи послаблюється в тва-
рин, що голодують, і посилюється, коли відновлюють їхнє
годування. Цим можна пояснити зниження кров’яного тис-
ку і рівня обміну речовин за умов голодування і протилеж-
ного типу зміни, що настають у разі споживання їжі.
Малі зернисті пухирці в постгангліонарних адренер-
гічних нейронах містять АТФ і норадреналін, а великі зер-
нисті - нейропептид ¥. Є підстави вважати, що низькочас-
АВТОНОМНА НЕРВОВА СИСТЕМА / 213
Таблиця 13-3. Окремі фармакологічні засоби і токсини, що впливають на автономну нервову систему1
Точка впливу Сполуки, що підсилюють функцію автономної нервової системи Сполуки, що пригнічують функцію автономної нервової системи
Симпатичні і парасимпатичні вузли Стимулюють постгангліонарні нейрони: нікотин диметифенілпіперазин Інгібують ацетилхолінестеразу: ДФФ (діізопропілфлюорофосфат) фізостигмін (езерін) неостигмін (простигмін) паратіон Блокують провідність: гексаметоній (С-6) мекаміламін (інверсин) пентоліній триметафан (арфонад) високі концентрації ацетилхоліну
Закінчення постгангліонарних норадренергічних нейронів Вивільнюють норадреналін: тирамін ефедрин амфетамін Блокують синтез норадреналіну: метирозин (демсер) Протидіють накопиченню норадреналіну: резерпін гуанетидин2 (ісмелін) Запобігають вивільненню норадреналіну: бретилій (бретилол) гуанетидин2 (ісмелін) Утворюють несправжні трансмітери: метилдопа (альдомет)
Мускаринові рецептори Атропін, скополамін
«-Рецептори Стимулюють -рецептори: метоксамін (вазоксил) фенілефрин (неосинефрин) Стимулюють о^-рецептори: клонідин3 (катапрес) Блокують а-рецептори: феноксибензамін (дибензилін) фентоламін (регітин) празозин (мініпрес) - блокує а1 йогімбін - блокує а2
р-Рецептори Стимулюють р-рецептори: ізопротеренол (ізупрел) І Р2 Блокують (3-рецептори: пропранолол (індерал) та інші - блокують Р, і Р2 Атенолол (тенормін) та інші - блокують рг бутоксамін - блокує Р2
1 Перечислені тільки головні впливи.
2 Уважають, що гуанетидин має два головні впливи
3 Клонідин стимулює а2-рецептори на периферії, проте поряд з цим він разом з іншими а2-агоністами, що проникають через
гематоенцефалічний бар’єр, стимулює а2-рецептори в головному мозку, чим знижує ефект автономної іннервації.
тотне подразнення стимулює вивільнення АТФ, тоді як
високочастотне подразнення - вивільнення нейропептиду
¥. Однак функційне значення вивільнення АТФ і нейро-
пептиду V остаточно не з’ясоване.
Фармакологія автономної нервової системи
Синаптичні контакти рухових шляхів периферійного
відділу автономної нервової системи є точками фармаколо-
гічного впливу на вісцеральні функції, що логічно, оскіль-
ки збудження в цих контактах передається за допомогою
хімічних трансмітерів. Нейротрансмітери синтезуються,
накопичуються в нервових закінченнях і вивільнюються,
діючи на нейрони, м’язові клітини або клітини залоз. Вплив
на рецептори цих клітин ініціює їхні специфічні функції, а
хімічні трансмітери усуваються шляхом поглинання або
метаболізуються. Кожен з цих етапів може бути стимульо-
ваний або інгібований з передбачуваним наслідком. У нор-
адренергічних нервових закінченнях певні фармакологічні
засоби зумовлюють утворення сполук, які заміщують у
гранулах норадреналін, і ці слабкі або неактивні “несправж-
ні нейротрансмітери” вивільняються замість норадрена-
ліну під впливом потенціалу дії, що надходить до нервового
закінчення.
Окремі фармакологічні засоби і токсини, які впливають
на синаптичні контакти автономної нервової системи, і
механізми їхньої дії наведені в табл. 13-3. Сполуки, які
діють мускариноподібно, - це речовини, споріднені з аце-
тилхоліном, а також засоби, що інгібують ацетилхолін-
естеразу. До таких засобів належить інсектицид паратіон і
діізопропілфлюорофосфат (ДФФ) - компонент так званих
нервово-паралітичних газів, що вбивають шляхом масив-
ного інгібування ацетилхолінестерази.
14
Центральне регулювання
вісцеральних функцій
ВСТУП
Рівні інтеграції автономної нервової системи в ЦНС,
як і соматичної, облаштовані згідно з певного ієрархією.
Прості рефлекси, такі як скорочення мускулатури напов-
неного сечового міхура, координовані центрами в спин-
ному мозку. В цьому розділі розглянуто регулювання склад-
ніших рефлексів. Центри регулювання дихання і рівня
кров’яного тиску містяться в довгастому мозку, а центр
регулювання зіничного рефлексу на світло і центр акомо-
дації - у середньому. Інтеграція складних автономних меха-
нізмів, тцо забезпечують сталість хімічного складу і темпе-
ратури внутрішнього середовища в організмі, відбувається
в гіпоталамусі. Гіпоталамус також пов’язаний з лімбічною
системою, ретулюючи емоції та інстинктивну поведінку;
ці аспекти функції гіпоталамуса теж розглянуто в цьому
розділі.
ДОВГАСТИЙ МОЗОК
Регулювання дихання, серцевих скорочень
і кров’яного тиску
Ділянки довгастого мозку, де містяться центри автоном-
ного рефлекторного регулювання кровообігу, серцевої
діяльності і дихання, називають життєво важливими, або
вітальними, центрами, оскільки їхнє ушкодження пере-
важно має згубні наслідки. Аферентні волокна до цих цент-
рів відходять від спеціалізованих вісцеральних рецепторів,
що містяться не тільки, наприклад, у тільцях каротидному,
сунусу й дузі аорти, а й у довгастому мозку. Рухові реф-
лекси чітко узгоджені й охоплюють як соматичний, так і
вісцеральний компоненти. Детально рефлекси описані в
розділах, що с іосуюі ься регулювання кровообігу і дихан-
ня.
Інші автономні рефлекси, регульовані
центрами довгастого мозку
Ковтання, кашель, чхання і блювання теж є рефлектор-
ними актами, що інтегруються на рівні довгастого мозку.
Ковтання регульоване центральним програмним гене-
ратором довгастого мозку. Воно розпочинається довіль-
ним актом проштовхування їжі з ротової порожнини в
напрямі задньої стінки глотки (див. Розділ 26), який ініціює
чітко узгоджені рефлекторні рухи низки органів як дихаль-
ної, так і травної систем. Подразнення вистілки трахеї і
позалегеневих бронхів спричинює кашель. Голосова щіли-
на закривається, скорочення дихальної мускулатури ство-
рює значний тиск усередині легень, після чого голосова
щілина раптово відкривається, унаслідок чого виштовху-
ється повітря з нижніх дихальних шляхів (див. Розділ 35).
Чхання є дещо подібним рефлексом, який виникає внас-
лідок подразнення епітелію слизової оболонки носа або
ініційований больовими подразненнями, що передаються
чутливими волокнами трійчастого нерва.
Блювання
Блювання є ще одним прикладом вісцерального реф-
лексу, інтегрованого в центрах довгастого мозку, і перед-
бачає чітке узгодження як соматичного, так і вісцерального
компонентів. Воно розпочинається слиновиділенням і
відчуттям нудоти. Зворотна перистальтика спричинює
переміщення мас з верхньої частини тонкої кишки до
шлунка. Голосова щілина закривається, запобігаючи про-
никненню блювотиння в трахею. Дихання затримується
на середині вдиху. М’язи черевної стінки скорочуються і,
оскільки грудна клітка перебуває у фіксованому положенні,
внутрішньочеревний тиск підвищується. Нижній сфінктер
та м’язи стінки стравоходу розслаблюються і вміст шлунка
виходить назовні.
Центр блювання в ретикулярній формації довгастого
мозку (рис. 14-1) насправді утворений окремими розкида-
ними скупченнями нейронів, що регулюють певні компо-
ненти акту блювання.
Аферентні шляхи
Подразнення слизової оболонки в верхній частині трав-
ного тракту спричинює блювання. Нервові імпульси від
слизової оболонки до довгастого мозку переходять по віс-
церальних аферентних шляхах у складі симпатичних нервів
і блукаючого нерва. Аферентні волокна від присінкових
ядер передають імпульси, що спричинюють нудоту і спону-
кають до блювання. Інші чутливі волокна проходять до
ділянок проміжного мозку, які регулюють акт блювання, і
лімбічної системи, що зрозуміло, оскільки відома відпо-
відність між дією блювотних засобів та емоційних подраз-
ЦЕНТРАЛЬНЕ РЕГУЛЮВАННЯ ВІСЦЕРАЛЬНИХ ФУНКЦІЙ / 215
Апоморфін, глікозиди
наперстянки, сульфат міді
Хеморецепторна
пускова зона
--- Блювотний
центр
Аферентні
волокна
блукаючого
нерва
Подразнення
слизової оболонки
Рис. 14-1. Аферентні шляхи блювотного рефлексу і хеморе-
цепторна пускова зона в довгастому мозку (відтворено за доз-
волом з Везеагсїі іп Іїіе 8еп/ісе о( Месіісіпе. УоІ 44. Зеагіе &
Со, 1966).
ників. Отже, можна говорити про “нудотні запахи” і “нудот-
ний вигляд”.
Хеморецепторні клітини в довгастому мозку ініціюють
блювання, якщо їх подразнювати певними хімічними
агентами, що циркулюють у крові. Хеморецепторна пус-
кова зона, у якій є ці клітини (див. рис. 14-1), розміщена
всередині або біля заднього поля - У-подібної смуги на
латеральній стінці четвертого шлуночка недалеко від засув-
ки. Вона належить до навколошлуночкових органів (див.
Розділ 32) і є проникнішою для багатьох речовин, ніж роз-
міщений під нею довгастий мозок. Ушкодження заднього
поля незначно впливає на блювотну реакцію в разі подраз-
нення травного тракту або нудотних рухів, однак воно
запобігає блюванню, яке спричинює ін’єкція апоморфіну
чи інших препаратів, а також послаблює блювання у ви-
падку уремії й опромінення, що може бути спричинене
ендогенним продукуванням речовин, що циркулюють у
кровоплині.
У тонкій кишці містяться 5-НТ3-рецептори, і серотонін
(5-НТ), що його виділяють ентерохромафінні клітини,
ініціює імпульси в аферентних волокнах, які спонукають
блювання. Крім того, у задньому полі і в ядрі поодинокого
шляху є дофамін Д2 і 5-НТ3-рецептори. Антагоністи 5-НТ3,
такі як ондансетрон, і антагоністи Д,, такі як хлорпромазин
чи галоперидол, є ефективними протиблювотними засо-
бами. Застосування кортикостероїдів, канабіноїдів і бензо-
діазепінів як окремо, так і в комбінації з антагоністами 5-
НТ31Д2 теж доцільне в разі блювання, спричиненого хіміо-
терапією. Механізм дії кортикостероїдів і канабіноїдів неві-
домий, а бензодіазепіни, ймовірно, зменшують відчуття
тривоги, зумовлене хіміотерапією.
ГІПОТАЛАМУС
АНАТОМІЧНЕ УТОЧНЕННЯ
Гіпоталамус (рис. 14-2) є частиною передньої ділянки
проміжного мозку, яка розміщена спереду міжніжкових
ядер нижче гіпоталамічної борозни. Він містить низку ядер
і ядерних зон.
Зв’язок з гіпофізом
Між гіпоталамусом і задньою часткою гіпофіза є нер-
вові зв’язки, а між гіпоталамусом і передньою часткою
гіпофіза - також судинні. Ембріологічно задня частка гіпо-
фіза розвивається з випинання дна третього шлуночка.
Вона утворена переважно кінцевими відділами аксонів, що
проходять від тіл клітин надзорового і пришлуночкового
ядер (рис. 14-3) по гіпоталамо-гіпофізарному шляху.
Переважна більшість надзорових волокон закінчується в
задній частці гіпофіза, а частина пришлуночкових - у сере-
динному підвищенні. Передня частка і проміжна частина
гіпофіза розвиваються в ембріональному періоді з кишені
Ратке - випинанні в ділянці склепіння горла (див. рис. 22-
1). Симпатичні нервові волокна проникають у передню
частку через її капсулу, а парасимпатичні відгалужуються
від кам’янистих нервів, проте частина нервових волокон
переходить і через гіпоталамус. Гіпофізарні портальні
судини забезпечують прямий судинний зв’язок між гіпота-
ламусом і передньою часткою гіпофіза. Артеріальні гілки,
що відходять з внутрішньої сонної артерії і судин кола
Віллізія, утворюють на вентральній поверхні гіпоталамуса
(див. рис. 14-2) “вікончасту” сітку капілярів - первинне
сплетення. Петлі капілярів проникають також у серединне
підвищення. Капіляри переходять у судини гіпофізарної
портальної системи, по яких кров через гіпофізарну ніжку
тече до капілярів передньої частки. Ця система починається
і закінчується капілярами, її кров не проходить через серце
і, отже, є справжньою портальною системою. У птахів і
деяких ссавців, у тім числі в людини, нема іншого шляху
артеріального кровопостачання передньої частки, окрім
капсулярних судин і анастомозів з капілярами задньої
частки.
В інших ссавців частина крові надходить до передньої
частки окремою сіткою передніх гіпофізарних артерій,
проте більшість все-таки тече по портальних судинах.
Серединне підвищення переважно зачислюють до вент-
ральної ділянки гіпоталамуса, з якої і відходять портальні
судини. Ця ділянка є “позагематоенцефалічним бар’єром”
(див. Розділ 32).
Аферентні й еферентні зв’язки гіпоталамуса
Головні аферентні й еферентні нервові шляхи до гіпо-
таламуса і в зворотному напрямі утворені переважно без-
216/РОЗДІЛ 14
Гіпофізарна портальна судина
Дугоподібне ядро
Зоровий перехрест
Серединне підвищення
Верхня гіпофізарна артерія
Передня частка
Задня частка
Медіальне сосочкове ядро
Латеральне сосочкове ядро
Сосочкове тіло
Рис. 14-2. Гіпоталамус людини зі схематичним зображенням гіпофізарних портальних судин.
Заднє гіпоталамічне поле
Пришлуночкове ядро
Переднє гіпоталамічне поле
Передзорове поле
Надзорове ядро
Надперехрестове ядро
Заднє гіпоталамічне ядро
Дорсомедіальне ядро
Вентромедіальне ядро
Передсосочкове ядро
мієліновими волокнами. Є багато зв’язків між гіпотала-
мусом і лімбічною системою, важливі зв’язки сполучають
гіпоталамус з ядрами покришки середнього і заднього
мозку.
Нейрони, що виділяють норадреналін і тіла яких міс-
тяться в задньому мозку, закінчуються в багатьох різних
ділянках гіпоталамуса (див. рис. 15-6); нейрони пришлу-
ночкового ядра, що, ймовірно, виділяють окситоцин і вазо-
пресин, відповідно, доходять до заднього і спинного мозку,
а нейрони, що виділяють адреналін і тіла яких містяться в
задньому мозку, закінчуються у вентральній ділянці гіпо-
таламуса.
Крім того, є внутрішньогіпоталамічна система нейро-
нів, що виділяють дофамін і тіла яких містяться в дугопо-
дібному ядрі, а відростки закінчуються на (або ж біля)
капілярах, які формують портальні судини серединного
підвищення. Відростки нейронів, що виділяють серото-
нін, переходять до гіпоталамуса від сітчастих ядер шва
мосту.
ФУНКЦІЇ ГІПОТАЛАМУСА
Головні функції гіпоталамуса перелічені в табл. 14-1.
Окремі з них фактично забезпечують чітко визначені віс-
церальні рефлекси, а інші зумовлюють складні поведінкові
й емоційні реакції, проте всі вони становлять конкретні
реакції на певні подразники. Це треба мати на увазі, роз-
глядаючи функції гіпоталамуса.
ВІДНОШЕННЯ ДО ЗАБЕЗПЕЧЕННЯ
ВІСЦЕРАЛЬНИХ ФУНКЦІЙ
Багато років тому Шеррінгтон назвав гіпоталамус голов-
ним вузлом автономної системи. Подразнення ділянок
гіпоталамуса справді зумовлює окремі вісцеральні реакції,
проте багато фактів наводить на думку, що гіпоталамус не
є центром регулювання самих по собі вісцеральних функ-
цій. Швидше за все автономні реакції, які запускає гіпота-
ламус, - це складові частини складніших феноменів,
зокрема, гніву чи інших емоцій.
Ефекти стимулювання гіпоталамуса
Подразнення верхньо-передньої ділянки гіпоталамуса
іноді спричинює скорочення мускулатури сечового міхура,
що є парасимпатичною реакцією. Однак подразнення гіпо-
таламуса зумовлює дуже невелику кількість таких реакцій,
тому маловірогідно, що в ньому є локальні парасимпатичні
центри.
Подразнення певних ділянок гіпоталамуса може спри-
чинити серцеву аритмію, що наводить на думку про таке:
цей ефект зумовлений активуванням блукаючого або сим-
патичного нервів серця.
Подразнення різних ділянок гіпоталамуса, зокрема його
латеральних частин, зумовлює дифузний симпатичний
вплив і підвищення секреції з боку мозкової речовини
наднирникової залози, подібно до того масивного симпа-
тичного впливу, що спричинює в тварин стресову реакцію
типу “воювати чи втікати” (див. Розділ 13).
ЦЕНТРАЛЬНЕ РЕГУЛЮВАННЯ ВІСЦЕРАЛЬНИХ ФУНКЦІЙ / 217
передньої
частки гіпофіза
Рис. 14-3. Секреція гормонів гіпоталамуса. Гормони задньої
частки (34) проходять у загальне русло із закінчень нейронів
надзорового і пришлуночкового ядер, тоді як гіпофізотропні
гормони потрапляють у гіпофізарну портальну систему із за-
кінчень нейронів дугоподібного й інших ядер гіпоталамуса;
ПЧ - передня частка; СТ - сосочкові тіла; ЗП - зоровий пере-
хрест.
Припускають, що в гіпоталамусі є окремі ділянки регу-
лювання секреції адреналіну і норадреналіну. Диферен-
ційна секреція того чи іншого катехоламіну мозкової речо-
вини надниркової залози справді відбувається в певних
ситуаціях (див. Розділ 20), однак вибіркове зростання сек-
реції в цьому разі невелике.
ВІДНОШЕННЯ ДО СНУ
Зона сну основи переднього мозку охоплює частини
гіпоталамуса. Ці ділянки, як і фізіологічні основи сну і
неспання, описані в Розділі 11.
ВІДНОШЕННЯ ДО ЦИКЛІЧНИХ ПРОЦЕСІВ
Життєві функції більшості (якщо не всіх) живих орга-
нізмів підлягають ритмічним коливанням з періодом, що
дорівнює приблизно 24 год, тобто такий ритм є циркад-
ним (від лат. Сігса - приблизно і діа - доба). У нормі ці
функції синхронізовані з циклом день-ніч. У тварин (а
також у людей) до регульованих належать ритми в секреції
АКТГ (див. рис. 20-18), секреції мелатоніну (див. рис. 24-
13), цикли спання-неспання, циклічні зміни температури
тіла й особливостей поведінки лабораторних тварин. Біль-
шість цих ритмів регульована надперехресними ядрами
(НПЯ), що розміщені по одному з кожного боку над зоро-
вим перехрестям (див. рис. 14-2).
Нейрони ЦНС зберігають властивості ритмової актив-
ності, навіть будучи виділеними з головного мозку і культи-
вованими іп уйго. Крім того, після трансплантації тканини
ЦНС тваринам зі зруйнованим ЦНС у них відновлюються
циркадні ритми. Незрозуміло, чи цей вплив трансплантан-
та відбувається гуморальним шляхом, чи за допомогою
нових зв’язків, що їх налагоджують відростки нейронів
трансплантанта. Ендокринні і нервові шляхи з гіпотала-
муса до різних частин організму регулюють ритми, у тім
числі нічне виділення мелатоніну, що нагадує функцію сис-
тематичного сигналу часу (див. Розділ 24).
Біологічні годинники в рослин, комах і ссавців дуже
подібні. У ссавців клітини ЦНС містять годинник, утво-
рений принаймні з шести білків. РЕК-білки продуковані і
потім фосфорильовані кіназами. Фосфорильовані РЕК ін-
гібують утворення власне РЕК, зумовлюючи регулярний
циркадний ритм.
Аферентні сигнали, що забезпечують циркадні ритми
за циклом день-ніч, надходять з очних яблук (якщо
вирізати очні яблука, то цей вплив зникне), де є сітківко-
гіпоталамічні волокна, що проходять безпосередньо із
зорового перехрестя до ЦНС. Проте в мишей, у яких пору-
шено процес утворення паличок і колбочок, такі аферентні
сигнали теж надходять, а це свідчить, що у процесі беруть
участь інші фоторецептори. Криптохроми - це фотопіг-
ментні молекули, які забезпечують циркадні ритми в рос-
лин і комах, у ссавців же є два гомологи цих молекул -
СК¥ 1 та СК¥ 2. Імовірно, вони відіграють роль фоторе-
цепторів, проте забезпечують лише частину годинникового
механізму, тому пошуки структур, відповідальних за фото-
рецепцію, тривають.
Цікаво, що яскраве світло може впливати позитивно,
негативно або ж не впливати на цикл спання-неспання в
людини залежно від пори дня. Упродовж дня це світло не
має впливу, проте одразу після настання темряви експозиція
яскравого світла відтерміновує початок сну, а перед сві-
танком зумовлює прискорення початку наступного періо-
ду сну. Ін’єкції мелатоніну спричинюють подібний ефект.
В експериментальних тварин експозиція світла активує
гени негайного реагування (див. Розділ 1) нейронів над-
перехресних ядер, проте лише в години циркадного циклу,
упродовж яких світло здатне впливати. Стимулювання
протягом дня неефективне. ЦНС піддається також знач-
ному серотонінергічному впливові з боку ядер шва. Однак
досі не відомо, як ці ядра впливають на регулювання рит-
мів.
ГОЛОД
Споживання їжі і насичення
Маса тіла залежить від балансу між надходженням кало-
рійних речовин і витратою енергії. Обидва ці процеси регу-
льовані щоденно і довготерміново.
Надходження поживних речовин регульоване не тільки
процесом приймання їжі, а й механізмами, що, як звичайно,
стабілізують масу тіла. Це відбувається так. Якщо тварину
218/РОЗДІЛ 14
Таблиця 14-1. Підсумок головних регуляторних механізмів гіпоталамуса
Функція Аферентні імпульси Інтегральні ділянки
Терморегулювання Температурні рецептори шкіри, глибоких тканин, спинного мозку, гіпоталамуса й інших частин головного мозку Передня ділянка гіпоталамуса відповідає за тепло. Задня ділянка гіпоталамуса відповідає за холод
Нейроендокринне регулювання: Катехоламінів Лімбічна ділянка, пов’язана з емоціями Дорсальна і задня ділянки гіпоталамуса
Окситоцину Рецептори дотику молочної залози, матки і геніталій Надзорове і пришлуночкове ядра
Тиреотропного гормону (тиро- тропін, ТТГ) за допомогою ТРГ Температурні рецептори в немовлят; можливо, інші Пришлуночкові ядра і суміжні ділянки
Адренокортикотропного гормону (АКТГ) і р-ліпотропіну за допомогою КРГ Лімбічна система (емоційні подразники) ретикулярна формація (“системні” подразники); клітини гіпоталамуса і передньої частки гіпофіза, чутливі до концентрації кортизолу, що циркулює в крові, надперехресні ядра (добовий ритм) Пришлуночкові ядра
Фолікуло-стимулювального гормону (ФСГ) і лютеїнізу- вального гормону (ЛГ) за допомогою ГнРГ Клітини гіпоталамуса чутливі до естрогенів, орган зору, рецептори дотику в шкірі та геніталіях тільки у видів з рефлекторною овуляцією Передзорове поле, інші ділянки
Пролактину за допомогою ПІГ і ПРГ Рецептори дотику в молочній залозі та інші невідомі рецептори Дугоподібне ядро, інші ділянки (гіпоталамус пригнічує секрецію)
Гормону росту за допомогою соматостатину і СТГ-РГ Невідомі рецептори Навколошлуночкове ядро, дугоподібне ядро
Інстиктивна потреба Спрага Осморецептори, ймовірно, розміщені в судинному органі кінцевої пластинки; збільшення кількості ангіотензину II в субфорнікальному органі Верхньолатеральна ділянка гіпоталамуса
Голод Глюкостатичні клітини, чутливі щодо рівня утилізації глюкози; лептинові рецептори; рецептори інших поліпептидів Вентромедіальне, дугоподібне і пришлуночкове ядра; латеральні ділянки гіпоталамуса
Статевий потяг Клітини, чутливі до естрогену й андро- гену, що циркулюють у крові та інші Передньовентральні ділянки гіпоталамуса, а також в осіб чоловічої статі грушоподібна кора
Захисні реакції (страх, гнів) Органи чуття, нова кора; шляхи невідомі Дифузні, у лімбічній системі і гіпоталамусі
Регулювання ритмів ендокринної секреції та ритмів активності Сітківка, через сітківко-гіпоталамічні волокна Надперехресні ядра
примусово відгодувати до повноти і згодом дозволити їсти
досхочу, то вона добровільно споживатиме їжу в менших
кількостях, унаслідок чого її маса зменшиться до конт-
рольного рівня (рис. 14-4). І навпаки, якщо тварина голо-
дувала, а потім їй дозволили їсти досхочу, то вона спожи-
ватиме більше їжі, надолужуючи втрачену масу. Загально-
відомо, що таке ж трапляється і в людей. У разі дотримання
дієти зі зменшенням споживання калорійних речовин мож-
на втратити частину маси, проте після закінчення дієти
95% осіб відновлюють попередню масу. Подібно, під час
одужання після хвороби зростає рівень споживання їжі аж
до відновлення попередньої маси.
Питання щодо надолужування росту в дітей розглянуто
в Розділі 22, а зв’язок характеру харчування і довголіття -
у Розділі 1.
Витрата енергії теж регульована. Вона зростає після
приймання їжі внаслідок специфічної динамічної дії (СДД)
поживних речовин (див. Розділ 17) і посилення впливу
симпатичної нервової системи. СДД не регульована, проте
зростає у випадку симпатичного впливу. Значне зниження
рівня обміну речовин під час голодування дає змогу
зберігати енергію протягом деякого періоду (див. Розділ
18).
Виявляється, що в регулюванні апетиту бере участь
низка чинників і цей процес ше мало вивчений. Гіпотала-
мус, без сумніву, також бере участь у його регулюванні.
Значення гіпоталамуса
Регулювання апетиту у гіпоталамусі залежить пере-
важно від взаємодії двох ділянок: латеральної - харчового
ЦЕНТРАЛЬНЕ РЕГУЛЮВАННЯ ВІСЦЕРАЛЬНИХ ФУНКЦІЙ / 219
Рис. 14-4. Вплив різного споживання їжі й ушкодження вен-
тромедіальної ділянки гіпоталамуса на добровільне спожи-
вання їжі і масу тіла А - щурі спочатку примусово відгодова-
ні упродовж трьох-шести тижнів, а потім їм дозволено їсти
досхочу В - щурі піддані частковому голодуванню протягом
трьох-шести тижнів, а потім їм дозволено їсти досхочу С -
двобічне ушкодження вентромедіальної ділянки гіпоталамуса
Упродовж трьох тижнів щурам дозволяли їсти досхочу (від-
творено за згодою з Зілскег ЕМ НурегрЬасІіа N ЕпдІ 3 Месі
1978,298 1010)
цеп і ру. що міс і и і вся в і оловному ядрі медіального пучка
передньої о мопсу біля йоіо сполучення і налідо-і пюіа-
.іамічнимн во юкнамл. і медіа іьної - центру насичення,
розміщеною в вен і ромедіальпому ядрі. Подразнення
харчовою неп іру у іварин і а людини супроводжує! ься
форт НІМІНЯМ МОЇ ИНаЦІИНОІ іюнопнки. що передує процесу
приймання гжі.а ісеїрхкщя цьою центру спричинюю силь-
ну і зіубну анорексно в практико здорових іварин (рис
14-5) 11о гра знення ж вен і ромедіальнот о ядра призводи іь
до відмови ві і їжі, а ушкодження цкі ділянки зумовлюю
і шерфаі но і, якщо їжі ( вдосіаль, синдром гіпоіала-
мічііоі о ожиріння (рис 14-6) Десірукція харчової о цсні-
ру в щурів раюм з ушкодженням ценіру насичення при-
зводить до анорексії. Це означає, що центр насичення галь-
мує харчовий центр. Виявляється, що харчовий центр
постійно активний, однак цю його активність періодично,
після приймання їжі, гальмую активність центру насичення
Проте нсмаю впевненості, що харчовий центр і центр наси-
чення просто регулюють бажання поїсти. Наприклад, щурі,
в яких ушкоджене вентромедіальне ядро, набирають масу
до певного рівня, і кількість їжі, яку вони споживають, сягаю
певної межі. Після цього механізми, що зумовлюють апе-
тит, працюють для формування мотиваційної поведінки,
щоб утримувати нову, вищу за рівнем, масу тіла. За одніс ю
з теорій, запропонованих для пояснення цього феномену,
все ж існує певний настановний пункт стосовно маси пла,
а не тільки механізми приймання їжі, регульовані гіпоїа-
ламусом
З часу відкриття лептину і його рецепторів (див нижче)
відбулося стрімке накопичення інформації про гени, пеп-
тиди, а іакож інші нейрої рансмітери і рецептори у і іпота-
ламусі і а суміжних ділянках, що беруть участь у регулю-
ванні апетиту
Одним з таких важливих чинників є нейропеиіид У
(див. Розділ 4) 1 Іісля ін'с кції в і шоіаламічну ділянку цьото
36-ампюкислоіното поліпептиду споживання збільшу-
( ІЬСЯ, 1 ОДІ як ші ібпори йоіосинісзу призводять до нроіи-
лежної о ре зультату Нейрони, у яких ю нейропеи і ид У, міс-
тяться в дуіоподібних ядрах, а їхні аксони проходяїь до
нринілуночкових ядер. Кількість мРНК нейропеи і йду ¥ в
гіпоталамусі збільшуються під час приймання їжі і зменшу-
ються встати насичення. Нейропептид ¥ виливаю через іри
відомі рецепюри - ¥р ¥, і ¥., пов’язані з 6-білками Акти-
вування реценюра ¥., підвищую рівень споживання їжі,
однак це питання складне, оскільки активування рецеп-
тора ¥, маю', очевидно, іальмівну дію Нокаут ієна нейро-
петпиду ¥ помп но не виливаю на кількість спожитої їжі.
що свідчи і ь про наявність іакож інших шляхів регулю-
вання, проіе нокаут ієна нейропеигиду ¥ оЬ/оЬ мишей з
дею|)іциіом дентину (див. нижче) зумовлюю зменшення
споживання їжі і збільшення ви і раг енері її порівняно з
коні рольними мишами, у яких с інтактний ієн нейронсії-
і йду ¥.
ГІПЕРФАГІЯ
АНОРЕКСІЯ
Ураження латеральних
ділянок гіпоталамуса
Ураження вентро-
медіальних ядер
Рис. 14-5. Вплив ушкодження гіпоталамуса на апетит
220 / РОЗДІЛ 14
Рис. 14-6. Гіпоталамічне ожиріння. Маса тварини праворуч,
у якої чотири місяці тому ушкоджено вентромедіальні ядра -
1080 г Маса контрольної тварини (ліворуч) 520 г (відтворено
за згодою з Зієуєпзоп ^Е іп: Тїіе Нуроіїїаіатиз Наутакег
УУ, Апсіегзоп Е, Маиіа \А/ЛЧ [есІКогз], Тїіотаз, 1969).
Інші поліпептиди, що підвищують рівень споживання
їжі, містять орексин-А і орексин-В та кодовані тим самим
геном за допомогою почергового сплайсинґу. Вони діють
на два рецептори. Орексини синтезуються в нейронах
латеральної гіпоталамічної ділянки і теж становлять інте-
рес, оскільки відомо, що мутація в одному з генів орекси-
нових рецепторів зумовлює нарколепсію в собак.
Ще іншим поліпептидом, що підвищує рівень спожи-
вання їжі в ссавців, є меланінконцентрувальний гормон
- 19-амінокислотний поліпептид, що продукований гіпо-
фізом риб і бере участь у регулюванні кольору їхньої шкіри
(див. Розділ 22). У ссавців його мРНК виявлена лише в
латеральній гіпоталамічній ділянці і невизначеній зоні.
Похідні проопіомеланокортину (ПОМК) (див. Розділ 22)
знижують рівень споживання їжі. Є чотири визначені
рецептори цих похідних: МС1-К (необхідний для пігмен-
тації шкіри), МС2-К. (забезпечує синтез глюкокортикоїдів
у наднирковій залозі), МСЗ-К. (пов’язаний з регулюванням
секреції сальних залоз) і МС4-К. (опосередковує вплив на
апетит). Іншим нейропептидом, що знижує рівень спожи-
вання їжі і міститься в гіпоталамусі, є кокаїн- і амфетамін-
регулювальний транскрипт (САК.Т - від англ. сосаіпе- апсі
атрйе1апіпе-ге§и1а1ес1 Ггапзсгірі). КРГ - гормон головного
мозку, що стимулює секрецію АКТГ (див. нижче), теж зни-
жує рівень споживання їжі.
Дослідження цих та інших поліпептидів, що впливають
на споживання їжі і витрати енергії, тривають, та наразі
отримані дані не можна застосувати для детальної харак-
теристики процесу регулювання апетиту.
Катехоламіни також беруть участь у регулюванні маси
тіла. Миші, у яких нокаут гена дофамін-[3-гідроксилази бло-
кує синтез норадреналіну й адреналіну, мають підвищений
рівень споживання їжі. Цікаво, що такі тварини не хворіють
на ожиріння, оскільки в них одночасно, що не цілком зро-
зуміло, підвищений рівень метаболізму. Механізм дії амфе-
таміну й інших подібних лікарських засобів, які засто-
совують з метою зниження апетиту, полягає, очевидно, у
вивільненні в ЦНС норадреналіну. Миші з нокаутом 5НТ?( -
рецептора повніють, що свідчить про причетність серото-
ніну до регулювання споживання їжі.
Механізми аферентного впливу
Запропоновано чотири головні гіпотези для пояснення
процесу регулювання приймань їжі, однак вони взаємови-
лучають одна одну. Згідно з ліпостатичною гіпотезою жи-
рова тканина виділяє гуморальні фактори, кількість яких
пропорційна до накопиченої жирової тканини, і таким спо-
собом відбувається вплив на гіпоталамус. Унаслідок цього
знижується рівень споживання їжі і збільшується витрата
енергії. За кишково-пептидною гіпотезою поживні речо-
вини в шлунково-кишковому тракті зумовлюють вивіль-
нення одного або більше поліпептидів, що впливають на
гіпоталамус, спричинюючи зниження рівня споживання
їжі. Відповідно до глюкостатичної гіпотези виникає від-
чуття ситності внаслідок того, що структури гіпоталамуса
збільшують використання глюкози. За термостатичною
гіпотезою зниження температури тіла нижче деякої межі
стимулює апетит, а підвищення його пригнічує.
Лептин
Результати клонування гена оЬ мишей, щурів і людини
спонукали зосередити увагу на ліпостатичній гіпотезі.
Гомозиготні за дефективним геном оЬ миші (оА/оА-миші)
не насичуються внаслідок приймання їжі, стають товстими
і хворіють на діабет. Продукт цього гена, що його вироб-
ляють головно ліпоцити, - це циркулювальний білок, який
містить 167 амінокислот, його називають лептин (з гр.
Іеріоз - тонкий, слабкий).
Інший ген - сІЬ - регулює продукування рецептора
лептину. Миші лінії сІЬ/сІЬ, у яких цей ген дефектний, теж
повніють, що зумовлено відсутністю в тварин лептинових
рецепторів, хоча рівень циркулювального лептину в них
високий. Ген лептинового рецептора регулює утворення
декількох різних за конфігурацією форм рецептора. Довга
форма, що міститься в гіпоталамусі, має один трансмем-
бранний домен, а також внутрішньоклітинний, що нагадує
такий самий домен декількох цитокінів, зокрема ІЛ-6 (див.
Розділи 1 та 27). Ця форма рецептора, особливо численна
в дугоподібному ядрі, опосередковує характер впливу
(центральний тип) лептину на апетит і витрати енергії.
Ауротіоглюкоза, яка, як давно відомо, спричинює ожиріння
в мишей, зумовлює деструкцію дугоподібного ядра.
Лептин, що циркулює, досягнувши центральної точки
впливу, повинен проникнути крізь гематоенцефалічний
бар’єр. Коротка форма лептинового рецептора в значній
кількості міститься у мікросудинах головного мозку й, оче-
видно, причетна до транспортування лептину в його струк-
тури.
Лептинові рецептори є як у головному мозку, так і в
різних периферійних тканинах. У гризунів зумовлене голо-
дуванням зниження рівня плазматичного лептину супро-
воджується затримкою статевого дозрівання, пригніченням
функції щитоподібної залози, підвищенням секреції глю-
кокортикоїдів. Уважають, що ці зміни є пристосувальними
реакціями, які виникають у відповідь на зниження рівня
лептину і спрямовані на збереження калорій. Інше цікаве
ЦЕНТРАЛЬНЕ РЕГУЛЮВАННЯ ВІСЦЕРАЛЬНИХ ФУНКЦІЙ / 221
спостереження: лептинові рецептори містяться також у
бурій жировій тканині, і, що ймовірно, лептин підвищує
активність незв’язаних білків (див. Розділ 17), чинячи без-
посередній периферійний вплив на збільшення витрат
енергії.
У людини інактивувальні мутації гена лептину спри-
чинюють ожиріння вже в ранньому періоді життя. Рівень
плазматичного лептину в жінок вищий, ніж у чоловіків,
проте цс не єдиний чинник наявності більшої кількості
жирових відкладень у жіночому організмі. Рівень лептину
високий і в повних людей. Його кількість пропорційна до
процентного відношення кількості жирової тканини і маси
тіла; водночас є позитивна кореляція між концентрацією
лептинової мРНК у жировій тканині і кількістю цієї тка-
нини. Тому, як уважають, принаймі в багатьох випадках,
причина ожиріння в людини швидше подібна до причини
цієї хвороби в (ІЬ/(ІЬ мишей, ніж в оЬ/оЬ', тобто внаслідок
дефекту гена рецептора лептину. Звичайно, є й інші мож-
ливості, зокрема порушене транспортування лептину до
головного мозку чи порушення процесів, які регулює ген.
Необхідні подальші дослідження для з’ясування цього
питання.
Отже, є підстави вважати, що лептин діє як частина ме-
ханізму зворотного зв’язку, за допомогою якого інформація
у вигляді цього гуморального фактора, сигналізує про кіль-
кість відкладень жирової тканини в організмі людини і бере
участь у регулюванні споживання їжі (рис. 14-7).
Кишкові пептиди
Шлунково-кишкові гормони, зокрема ГРП, глюкагон,
соматостатин і ХЦК, як уважають, можуть понижувати
мотивацію до споживання їжі. Гіпотеза, за якою їжа в шлун-
ково-кишковому тракті ініціює виділення речовин, що
впливають на центри в головному мозку, зумовлюючи стан
насичення, інтригує. Дія лептину, вочевидь, достатньо три-
вала. Отже, кишкові пептиди можуть забезпечувати корот-
кочасне контролювання процесу приймання їжі.
Значна частина анорексигенного ефекту циркулюваль-
ного ХЦК, очевидно, зумовлена збудженням вісцеральних
рецепторів, оскільки цей вплив помітно зменшується після
субдіафрагмальної ваготомії. Рецептори ХЦК містяться в
одному з навколошлуночкових органів у задньому полі,
проте роль заднього поля в регулюванні споживання їжі
не з’ясована. Ін’єкція ХЦК в ділянку гіпоталамуса теж зни-
жує рівень приймання їжі. Можливо, у процесі регулюван-
ня беруть участь як центральні, так і периферійні меха-
нізми. Периферійні - це, здебільшого, ХЦК-А-рецептори,
тоді як головний мозок містить ХЦК-А- і ХЦК-В-рецеп-
тори (див. Розділ 26). Специфічні антагоністи рецепторів
обох типів пригнічують насичення. Проте антагоністи
ХЦК-В в 100 разів активніші, ніж антагоністи ХЦК-А.
Отже, центральні ХЦК-рецептори, очевидно, відіграють
важливішу роль.
Поліпептид СЬР-1 (7-36), що утворюється в шлунково-
кишковому тракті, теж є в гіпоталамусі. Внутрішньошлу-
ночкова ін’єкція СЬР-1 (7-36) гальмує мотивацію прий-
мання їжі, а цей ефект усуває антагоніст 6ЬР-1 (7-36).
Однак роль цього гормону, як і інших шлунково-кишкових,
у регулюванні споживання їжі потрібно ще детально
вивчити, перш ніж вважати їх регуляторами апетиту.
Підвищене споживання
їжі, зменшена
витрата енергії
ГІПОТАЛАМУС
Підвищене активування
лептинових рецепторів
ЖИРОВІ ДЕПО
Підвищене
накопичення жиру
І
Підвищений синтез
лептину
Підвищена концентрація
лептину у плазмі
Рис. 14-7. Процес регулювання лептином накопичення жиру
за допомогою механізму зворотного зв’язку. Суцільні стрілки
позначають стимулювання, штрихова стрілка - гальмування.
Глюкоза
Активність центру насичення, розміщеного в вентро-
медіальних ядрах, очевидно частково залежить від рівня
використання їхніми нейронами глюкози. З’ясовано: якщо
використання цими клітинами глюкози невелике, і, від-
повідно, артеріовенозна різниця кількості глюкози в крові,
що тече через ці ядра, низька, то активність у них зростає.
За цих умов активність харчового центру невпинна, й особа
відчуває голод. У випадку високого рівня використання
глюкози активність глюкостатів послаблюється, харчовий
центр пригнічується й особа відчуває ситість. Ця глюко-
статична гіпотеза регулювання апетиту ґрунтується на чис-
ленних експериментальних даних. Наприклад, прийман-
ня їжі різко зростає після внутрішньошлуночкового вве-
дення окремих речовин, таких як 2-діоксиглюкоза, що
зменшують використання клітинами глюкози. У разі гіпо-
глікемії використання глюкози послаблюється внаслідок
зменшення її кількості, що надходить до клітин, і апетит
зростає. Поліфагія простежується у випадку цукрового діа-
бету, за якого концентрація глюкози в крові хоча й висока,
та використання її клітинами незначне з огляду на недос-
татній синтез інсуліну (див. Розділ 19). Однак наводять
аргументи стосовно того, що інсулін швидше гальмує, ніж
стимулює апетит.
Інші фактори впливу на приймання їжі
Споживання їжі збільшується в холодну погоду і змен-
шується в гарячу пору. Однак є незначна вірогідність того,
іцо температура тіла може бути важливим чинником регу-
лювання апетиту.
Розтягнення стінок шлунково-кишкового тракту при-
гнічує апетит, а скорочення порожнього шлунка (голодове
скорочення) посилює його, проте денервація шлунка і
кишок не впливає на кількість споживання їжі. Зокрема, в
людини на апетит впливають культура харчування, умови
споживання їжі, спогади, пов’язані з виглядом їжі, її смаком
і запахом.
Бура жирова тканина - це окрема форма жирової
тканини, яку інтенсивно іннервує симпатична нервова
система і яка, ймовірно, може брати участь у регулюванні
222 / РОЗДІЛ 14
маси тіла. Це питання розглянуто вище, а також у Розділі
17.
Тривале регулювання апетиту
Оптимальний ефект механізмів, що регулюють апетит
у практично здорових тварин і людини полягає в тому, щоб
звести приймання їжі до такого рівня, коли кількість отри-
маних калорій збалансована з витратами енергії, завдяки
чому підтримується стала маса тіла. В дитячому віці спо-
живання їжі неврівноважене. Відомо, що дітям смакує одна
їжа і несмакує інша. Проте згодом відбувається збалансу-
вання споживаної їжі з витратами енергії на безпосередні
потреби і ріст. З віком людина набирає маси, цей процес є
повільним і добре відрегульованим. В одному з досліджень
зазначено, що маса жіночого організму в середньому
збільшується на 11 кг за період від 25 до 65 років. Прий-
маючи, що загальна кількість спожитої їжі за цей період
(40 років) становить понад 18 тонн, можна обчислити, що
перевага кількості спожитої їжі над витраченою енергією
становить менше ніж 0,03%.
Проблеми ожиріння, а також інші аспекти харчування
розглянуто в Розділі 17. Тут, однак, зазначимо, що є значна
генетична залежність у визначенні максимальної маси
тіла. Дослідження близнюків, яких виховували в різних
родинах і різних середовищах, дали змогу виявити, що
чинники середовища впливають на масу тіла менше, ніж
на 30%.
СПРАГА
Іншою інстинктивною потребою, яку регулює гіпота-
ламус, є спрага. Потреба в рідині залежить від осмоляль-
ності плазми, об’єму ПКР, а також від рівня секреції вазо-
пресину (див. нижче). Споживання води збільшується з
підвищенням осмотичного тиску в плазмі (рис. 14-8),
зменшенням об’єму ПКР і під впливом психологічних та
деяких інших чинників. Осмоляльність регульована за
допомогою осморецепторів - нервових закінчень, що
реагують на осмоляльність рідин організму. Ці осморецеп-
тори містяться в передній ділянці гіпоталамуса.
ЗменЩення об’єму ПКР стимулює спрагу іншим спо-
собом, ніж осмоляльність плазми (рис. 14-9). Отже, внас-
лідок крововтрати споживання води збільшується навіть
тоді, коли осмоляльність не змінюється. Зменшення об’єму
ПКР унаслідок крововтрати впливає на спрагу частково
через систему реніну-ангіотензину (див. Розділ 24). У разі
гіповолемії секреція реніну збільшується, завдяки чому
зростає кількість ангіотензину II, що циркулює і діє на
субфорнікальний орган - спеціальну рецепторну ділянку
проміжного мозку (див. рис. 32-7), стимулюючи нервові
поля, пов’язані з регулюванням спраги. Вірогідно, що
ангіотензин II впливає також на судинний орган кінцевої
пластинки. Ці ділянки мають високу проникність і є двома
навколошлуночковими органами, що розміщені поза
гематоенцефалічним бар’єром (див. Розділ 32). Проте
засоби, що блокують дію ангіотензину II, повністю не галь-
мують реакції спраги на гіповолемію. Ймовірно, цю
реакцію теж забезпечують барорецептори серця і крово-
носних судин.
Споживання рідини збільшується під час їди (обіднє
пиття). Цю реакцію названо навчальною, або реакцією
звички, і вона детально не досліджена. Однією з причин
пиття під час їди може бути збільшення осмоляльності
плазми внаслідок всмоктування поживних речовин страви.
Іншою причиною може слугувати дія одного чи кількох
шлунково-кишкових гормонів безпосередньо на субфор-
нікальний апарат. Є підстави вважати, що шлунково-киш-
кові гормони стимулюють ті ж нейрони субфорнікального
органа, які підлягають впливові ангіотензину II.
Якщо відчуття спраги притуплюється внаслідок запа-
морочення чи прямого ушкодження ділянок гіпоталамуса,
то людина перестає приймати потрібну кількість рідини,
після чого порушується водний баланс і виникає дегідра-
тація. У випадку споживання великої кількості білків про-
дукти їхнього метаболізму спричинюють осмотичний діу-
рез (див. Розділ 38), тому необхідна значна кількість води,
щоб запобігти збезводненню.
Більшість випадків гіпернатріємії сьогодні зумовлена
простою дегідратацією в пацієнтів з психозами або цереб-
ральними розладами, які не можуть або не хочуть збіль-
шувати кількість споживання рідини, хоча механізми спра-
ги в цьому разі стимульовані.
Інші фактори регулювання об’єму
споживання води
Виявлено велику кількість чинників, що сприяють регу-
люванню об’єму споживання води. Важливі серед них пси-
хологічні і соціальні. Зокрема, відчуття спраги може бути
зумовлене сухістю слизової оболонки горла. Хворі, яким
Рис. 14-8. Співвідношення осмоляльності плазми і спраги в
практично здорових людей у разі вливання гіпертонічного роз-
чину. Інтенсивність спраги оцінено за допомогою спеціаль-
ної аналогової шкали (відтворено за дозволом з ТИотрзоп
СЗ еі аі: Тйе озтоііс Плгезітіїсіз Тог Ппігзі апсі уазоргеззіп ге-
Іеазе аге зітіїаг іп НеаІПпу ііитапз. СІіп 8сі Іопс11986;71:651).
ЦЕНТРАЛЬНЕ РЕГУЛЮВАННЯ ВІСЦЕРАЛЬНИХ ФУНКЦІЙ / 223
Гіпертонія Гіповолемія
Рис. 14-9. Схема шляхів, по яких зміни осмоляльності плазми
й об’єму ПКР спричинюють спрагу.
обмежено споживання води, інколи намагаються вгамувати
спрагу, смокчучи шматочки льоду або вологий одяг.
Дегідратовані собаки, коти, верблюди і деякі інші тва-
рини швидко випивають саме таку кількість води, яка
потрібна для поповнення її дефіциту. Вони припиняють
пити перш ніж вода всмокчеться (тобто їхня плазма в цей
час є ще гіпотонічною), отже, повинен бути горлово-шлун-
ково-кишковий “лічильник” поповнення кількості рідини.
Ймовірно, що організм людини має подібну здатність, хоч
і не таку досконалу.
РЕГУЛЮВАННЯ СЕКРЕЦІЇ
ЗАДНЬОЇ ЧАСТКИ ГІПОФІЗА
Вазопресин і окситоцин
У більшості ссавців гормонами задньої частки гіпофіза
є аргініновий вазопресин (АУР) і окситоцин. У молекулі
вазопресину гіпопотамів і більшості видів свиней аргінін
заміщений лізином (лізиновий вазопресин). Задня част-
ка гіпофіза деяких видів свиней і сумчастих містить суміш
аргінінового і лізинового вазопресину. Гормони задньої
частки гіпофіза - це дев’ятиамінокислотні сполуки з дисуль-
фідним кільцем на одному з кінців молекули (рис. 14-10).
Біосинтез, внутрішньонейронне
транспортування і секреція
Гормони задньої частки гіпофіза синтезуються в тілах
великоклітинних нейронів надзорового і пришлуночкового
ядер, їх транспортують аксони цих нейронів до нервових
закінчень, розміщених у задній частці гіпофіза, де вони
виділяються у відповідь на електричні сигнали, що надхо-
дять до нервових закінчень. Деякі нейрони синтезують
окситоцин, а інші - вазопресин. Окситоцин- і вазопресин-
вмісні нервові клітини є в обох ядрах.
Окситоцин і вазопресин — це типові нервові гормони,
тобто гормони, що їх виділяють нервові клітини в кров’яне
русло. Цей тип нервового регулювання для порівняння з
іншими показано на рис. 14-11. Термін нейросекреція
початково стосувався процесу секреції гормонів нервовими
клітинами, проте інколи його можна зрозуміти помилково,
оскільки виявляється, що всі нейрони продукують певні
хімічні речовини — нервові трансмітери (див. Розділ 1).
Гормони задньої частки гіпофіза, як і інші пептидні,
синтезуються у вигляді великої молекули-попередника
(прекурсора). В гранулах нейронів, де відбувається синтез,
як окситоцин, так і вазопресин з’єднані з особливою спо-
лукою - нейрофізином. У випадку окситоцину - це ней-
рофізин 1, а у випадку вазопресину - нейрофізин II. Спо-
чатку вважали, що нейрофізини становлять зв’язувальні
поліпептиди, які утворюють слабкі нетривкі зв’язки з моле-
кулами вазопресину або окситоцину. Сьогодні з’ясовано,
що вони є частинами молекули-попередника. Прекурсор
аргінінового вазопресину - препропресофізин - містить
лідерну послідовність, утворену 19 амінокислотними
залишками, а також аргініновий вазопресин, нейрофізин
11 і, врешті, глікопептид (рис. 14-12). Молекула препро-
оксифізину - прекурсора окситоцину - менша за розміром,
оскільки не містить глікопептиду.
Молекули-попередники синтезуються в рибосомах клі-
тинних тіл нейронів. їхні лідерні послідовності переходять
в ендоплазматичну сітку. Сполуки накопичуються в сек-
реторних гранулах у комплексі Ґольджі і переміщуються
за допомогою аксоплазматичного транспортування до
закінчень у задній частці гіпофіза. Секреторні гранули, які
називають тільцями Геррінґа, легко піддаються дослід-
женню, оскільки добре зафарбовуються на гістологічних
зрізах. Розщеплення молекули-попередника відбувається
під час аксонного транспортування, внаслідок чого гранули
нервових закінчень містять вже вільні окситоцин і вазо-
пресин, відповідні нейрофізини, а також глікопептид -
фрагмент прекурсора вазопресину. Функція цих сполук,
що беруть участь у синтезі гормонів задньої частки гіпо-
фіза, не з’ясована.
Електрична активність великоклітинних
нейронів
Нейрони, у яких синтезуються окситоцин і вазопресин,
також генерують і передають потенціали дії. Ці потенціали,
г8 8П
Су8-Туг-Рііе-6Іп-А8П-Су8-Рго-Агд-6Іу-МН2
123 45 6789
Аргініновий вазопресин
г8 8П
Су8-Туг-ІІе-6Іп-А8П-Су8-Рго-І_еи-6Іу-МН2
1 2345 6789
Окситоцин
Рис. 14-10. Аргініновий вазопресин і окситоцин.
224/ РОЗДІЛ 14
Ацетилхолін
ф ф & ф
Ацетилхолін
Норадреналін
або
ацетилхолін
Рухові нерви
скелетних
м’язів
Ацетилхолін
Ацетилхолін
Норадреналін
Ренін
Рилізинг-
гормони й
інгібувальні
гормони
Адреналін,
норадреналін
АКТС, ТТГ,
СТГ, ФСГ, ЛГ,
пролактин
Вазопресин
— Загальне
кров’яне
русло
Рухові нерви Юкста- Мозкова
гладких гломерулярні речовина
м’язів клітини надниркової
залози
Передня
частка
гіпофіза
Задня
частка
гіпофіза
Рис. 14-11. Механізми нервового регулювання. Два .крайні шляхи ліворуч: нейротрансмітери діють на нервові закінчення
м’язів. Два шляхи посередині: нейротрансмітери регулюють секрецію ендокринних залоз. Два крайні шляхи праворуч: нейрони
продукують гормони, що виділяються в судини гіпофізарної портальної системи або в загальне кров’яне русло.
досягаючи нервових закінчень нейронів, зумовлюють
вивільнення гормону шляхом Са2+-залежного екзоцитозу.
Принаймні в щурів після анестезії в цих нейронах не
простежується електричних явищ у стані спокою або ж
виникають низького рівня нерівномірні потенціали (0,1-
3,0 піки за 1 с). Однак реакція таких нейронів на подраз-
нення буває різною (див. рис. 14-13). Подразнення сосків
спричинює синхронні високочастотні потенціали в оксито-
цинових нейронах, які виникають після відповідного
латентного періоду. Ці потенціали зумовлюють вивільнен-
ня окситоцину і, як наслідок,-виділення молока (див.
нижче). З іншого боку, стимулювання вазопресинових
нейронів, наприклад у разі крововтрати, зумовлює спочатку
стійке посилення збуджень з наступним пролонгованим
фазовим збудженням, під час якого періоди високочас-
тотного збудження чергуються з періодами електричного
спокою (фазові спалахи). Ці фазові спалахи переважно
не синхронізуються в різних вазопресиносинтезувальних
нейронах. Такий тип збудження забезпечує пролонговане
посилюване виділення вазопресину, що відрізняється від
синхронного порівняно короткочасного і високочастотного
збудження окситоцинсинтезувальних нейронів.
Вазопресин і окситоцин інших ділянок
Вазопресиносинтезувальні нейрони містяться в надпе-
рехресних ядрах, а вазопресин і окситоцин - також у закін-
ченнях нейронів, аксони яких проходять з пришлуночкових
ядер до стовбура головного мозку і спинного мозку. Ці
нейрони, очевидно, беруть участь у регулюванні серцево-
судинної діяльності. Крім того, вазопресин і окситоцин
(1) Сигнальний пептид 19 ак
Вазопресин 9 ак
е Нейрофізин II 95 ак
Глікопептид 39 ак
(?) Сигнальний пептид
(2) Окситоцин
ф Нейрофізин І
19 ак
9 ак
93 ак
Рис. 14-12. Структура препропресофізину (ліворуч) і препрооксифізину (праворуч) бика. Гліцин у положенні 10 обох пептидів
необхідний для амінування гліцинового залишку в положенні 9; ак - амінокислотні залишки (відтворено за дозволом з Вісіїіег
□: Моїесиїаг єуєпіз іп ехргеззіоп о( уазоргеззіп апсі охуіосіп апсі іііеіг содпаіе гесеріогз).
ЦЕНТРАЛЬНЕ РЕГУЛЮВАННЯ ВІСЦЕРАЛЬНИХ ФУНКЦІЙ / 225
интезуються в статевих залозах і кірковій речовині над-
ирникової залози, а окситоцин виявлений ще й у загру-
инній залозі. Функція пептидів у цих органах невідома.
’ецептори вазопресину
Є принаймні три типи вазопресинових рецепторів: У|А,
1В і У2. Усі вони сполучені з 6-білком; типи У)Д і У2 було
лоновано. Це серпентинові рецептори (див. Розділ 1).
ецептори У|Л і У|В діють шляхом гідролізу фосфатиди-
інозитолу, підвищуючи внутрішньоклітинну концент-
ацію Са2', а У2 - за допомогою С5, підвищуючи рівень
АМФ.
[ія вазопресину
Оскільки головна фізіологічна функція вазопресину -
втримання нирками води, то його часто називають анти-
іуретичним гормоном (АДГ). Цей гормон підвищує
роникність збиральних трубочок нирки, тому вода про-
икає до гіпертонічної інтерстиційної тканини ниркових
ірамід (див. Розділ 38), унаслідок чого сеча концентру-
А ВЧР
Одиниця ▼
ЦІННІЇ НІНІ ПІННІЙ ІІІІІІИИІІІІ1ІІІПІІІ
Стискання протоки молочної залози
В
Контроль
І II І І І І І
Пускання 5 мл крові
—ИІММИМІИІИИМІІІІІ11ІИ
Пускання 5 мл крові (+ 20 хв)
ис. 14-13. Реагування великоклітинних нейронів на подраз-
ення. Запис відображає окремі, зареєстровані зовнішньо-
пітинним електродом, потенціали дії, частоту збудження і
тискання протоки молочної залози. А - реакція окситоцин-
интезувального нейрона. ВЧР - високочастотний розряд;
М - виділення молока. Подразнення сосків розпочато перед
аписуванням В - реагування вазопресиносинтезувального
ейрона. Після подразнення сосків не простежується змін час-
зти нервового імпульсу, вона є низькою. Проте після пус-
ання 5 мл крові на тлі типового фазового збудження частота
ервового імпульсу відразу збільшується (відтворено з
/акегіу ЗВ: НуроФаІатіс пеигозесгеїогу (ипсііоп: Іпзідїііз (гот
ІесігорїіузіоІодісаІ зіисііез о( Фе тадпосеїіиіаг писіеі. ІВРО
Іе\л/з 1985;4:15).
6 367-2
ється, Й об’єм її зменшується. Загалом же ефект полягає у
затриманні води в організмі. Завдяки цьому ефективний
осмотичний тиск знижується. Якщо ж вазопресину немає,
то сеча стає гіпотонічною стосовно плазми, кількість виді-
леної сечі збільшується, відбувається втрата води і, отже,
підвищення осмоляльності рідин організму.
Механізми, за допомогою яких вазопресин виконує
антидіуретичну дію, активовані У2-рецепторами й охоп-
люють процес підвищення проникності водних каналів
зверненої в просвіт мембрани клітин збиральних трубочок.
У деяких ситуаціях проникнення води внаслідок звичайної
дифузії збільшується завдяки цим водним каналам, їх
названо аквапоринами.
Ідентифіковано п’ять типів аквапоринів. Аквапорини
1, 2 і 3 містяться в нирках (див. Розділ 38), аквапорин 4
знайдено в головному мозку, аквапорин 5-у слинних і
сльозовій залозах, а також у дихальних шляхах. Вазопре-
синозалежний водний канал збиральних трубочок - це
аквапорин 2. Водні канали містяться в ендосомах усередині
клітин, і вазопресин зумовлює переміщення їх до зверненої
в просвіт мембрани клітин.
Рецептори У|А забезпечують судинозвужувальну дію
вазопресину, який також є потужним стимулятором гладкої
мускулатури іп уйго. Однак потрібні порівняно великі кон-
центрації вазопресину, щоб підвищити кров’яний тиск іп
УІУО, оскільки він діє й на центри головного мозку, зу-
мовлюючи зменшення серцевого викиду. Одним з центрів
регулювання цієї функції є навколошлуночковий орган -
заднє поле (див. Розділ 32). Крововтрата - це сильний
подразник, що зумовлює секрецію вазопресину. Виявлено,
що зниження кров’яного тиску після крововтрати більше
виражене в тварин, яким уведено синтетичні пептиди, що
блокують судинозвужувальну дію вазопресину. Отже, оче-
видно, вазопресин відіграє деяку роль у стабілізації кров’я-
ного тиску. Рецептори V] А виявлено також у печінці і голов-
ному мозку. Вазопресин зумовлює глікогеноліз у печінці,
і, як зазначено вище, є нейротрансмітером у головному і
спинному мозку.
Рецептори У|В (які теж називають У3-рецепторами)
сприяють секреції кортикотропними ендокриноцитами
аденогіпофіза АКТГ.
Синтетичні агоністи й антагоністи
Заміною амінокислотних залишків синтезовано пеп-
тиди, що мають вибіркову дію і є активнішими, ніж при-
родний вазопресин. Наприклад, 1-деаміно-8-О-аргінінова-
зопресину (десмопресину; ВОАУР - від англ. 1 -беатіпо-
8-О-аг§іпіпе уазорге88Іп) властива дуже сильна антидіуре-
тична і водночас слабка судинозвужувальна активність, що
робить доцільним його використання в умовах дефіциту
вазопресину (див. нижче). Синтезовані також антагоністи,
що вибірково пригнічують судинозвужувальну або анти-
діуретичну дію вазопресину.
Метаболізм
Вазопресин, що циркулює у кров’яному руслі, швидко
інактивується, переважно в печінці і нирках, його період
біологічного півжиття (час, необхідний для інактивації
половини цієї кількості) в людини становить приблизно
18 хв. На нирки гормон діє швидко, проте недовго.
226/РОЗДІЛ 14
Регулювання секреції вазопресину:
осмотичні подразники
Вазопресин накопичується в задній частці гіпофіза і
виділяється в кров’яне русло у відповідь на імпульси, що
надходять нервовими волокнами, які містять цей гормон.
Фактори, що впливають на секрецію, наведені в табл. 14-
2. З підвищенням ефективного осмотичного тиску в плазмі
понад нормальний рівень (285 мосмоль/кг) частота імпуль-
сів у нейронах збільшується і, відповідно, зростає рівень
секреції вазопресину (рис. 14-14). За рівня 285 мосм/кг
концентрація вазопресину у плазмі є біля або на межі чут-
ливості наявних методів, проте очевидно, що вона ще мен-
ша у випадку зменшення осмоляльності плазми нижче від
нормального рівня. Секрецію вазопресину регулюють
осморецептори передньої ділянки гіпоталамуса. Вони є
поза гематоенцефалічним бар’єром і, вірогідно розміщені
в навколошлуночкових органах, головно в судинному орга-
ні кінцевої пластинки (див. Розділ 32). Осмотичний поріг
спраги (див. рис. 14-8) перебуває на тому ж рівні або не-
значно вищому від рівня порогу збудження, що забезпечує
зростання секреції вазопресину (див. рис. 14-14), проте
досі незрозуміло, чи ті ж самі рецептори опосередковують
обидві реакції.
Отже, регулювання секреції вазопресину відбувається
за допомогою чутливого механізму зворотного зв’язку, що
забезпечує постійність осмоляльності плазми. Рівень
секреції вазопресину помітно змінюється у разі зміни осмо-
ляльності вже на 1%. Тому осмоляльність плазми практич-
но здорових людей перебуває на рівні, дуже близькому до
285 мосмоль/л.
Рис. 14-14. Співвідношення осмоляльності плазми і концент-
рації вазопресину в плазмі практично здорових людей під час
уведення гіпертонічного розчину. МВ-межа визначення (від-
творено за дозволом з Тґютрзоп СЗ еі аі: Тґіе озтоііс Ііігезії-
оісіз Тог Йіігзі апсі уазоргеззіп аге зітіїаг іп ііеаКіїу ґіитапз.
СІіп 8сі [СоїсГі] 1986;71:651).
Таблиця 12-2. Фактори впливу на секрецію вазопресину
Підвищують секрецію вазопресину Знижують секрецію вазопресину
Підвищений ефективний осмотичний тиск плазми Зменшений об’єм позаклітинної рідини Біль, емоції, “стрес”, фізичні вправи Нудота і блювання Стояння Клофібрат, карбамазепін Ангіотензин II Знижений ефективний осмотичний тиск плазми Збільшений об’єм поза- клітинно! рідини Алкоголь
Вплив об’єму
Зміна об’єму ПКР, як зазначено вище, зумовлює зміну
секреції вазопресину. Секреція вазопресину підвищується
зі зменшенням об’єму ПКР і знижується у разі її збільшення
(див. табл. 14-2). Є обернена залежність між рівнем сек-
реції вазопресину і частотою імпульсів в аферентних ней-
ронах, що проходять від рецепторів розтягування судин-
ної системи в її відділах з низьким і високим тиском. Рецеп-
тори низького тиску містяться в стінках великих вен,
правому і лівому передсердях, а також у легеневих судинах;
рецептори високого тиску - це рецептори сонної пазухи і
дуги аорти (див. Розділ 31). Крива експоненціального
підвищення концентрації вазопресину в плазмі, зумовле-
ного зниженням кров’яного тиску, показана на рис. 14-15.
Проте рецептори низького тиску реагують на наповнення
судинної системи. Незначне зменшення об’єму крові зни-
жує тиск у великих венах без зниження тиску артеріаль-
ного, а також підвищує рівень вазопресину в плазмі.
Отже, рецептори низького тиску є важливими ініціато-
рами впливу, зумовленого наповненням судинного русла,
на секрецію вазопресину. Імпульси від цих рецепторів
поширюються блукаючим нервом до ядра поодинокого
шляху (ЯПШ). З ЯПШ гальмівні імпульси проходять до
каудального відділу вентролатеральної частини довгастого
мозку (КВЛМ), а звідси починається безпосередній збуд-
жувальний шлях до гіпоталамуса. Ангіотензин II, вплива-
ючи на навколошлуночкові органи (див. Розділ 32), підви-
щує секрецію вазопресину, посилюючи цим реакцію на
гіповолемію і гіпотензію.
У разі гіповолемії та гіпотензії, зумовлених, зокрема,
крововтратою, виділяються значні кількості вазопресину,
і у випадку гіповолемії крива осмотичності зміщується
ліворуч (рис. 14-16); її кут теж зростає. Наслідком дії вазо-
пресину є затримання води і зменшення осмоляльності
плазми. У цьому разі простежується зменшення концент-
рації в плазмі №+, розвивається гіпонатріємія.
Інші фактори впливу на секрецію
вазопресину
Окрім зміни осмотичного тиску й об’єму ПКР, факто-
рами впливу на секрецію вазопресину є біль, нудота, хірур-
гічний стрес і деякі емоції (див. табл. 14-2). Особливо знач-
на кількість вазопресину виділяється в разі нудоти. Алко-
голь знижує секрецію вазопресину.
ЦЕНТРАЛЬНЕ РЕГУЛЮВАННЯ ВІСЦЕРАЛЬНИХ ФУНКЦІЙ / 227
Клінічні аспекти
За умов різних клінічних ситуацій зміна об’єму рідини
чи інші неосмотичного типу подразники впливають на
осмотичне регулювання секреції вазопресину. Наприклад,
у пацієнтів після хірургічного втручання може підвищу-
ватися рівень вазопресину в плазмі внаслідок болю і гіпо-
волемії, що спричинить зниження осмоляльності плазми і
дилюційну гіпонатріємію. В пацієнтів з гіперсекрецією
вазопресину високий рівень споживання рідини може зумо-
вити водну інтоксикацію.
У разі синдрому “невідповідної” гіперсекреції анти-
діуретичного гормону (8ІАЛН - від англ. зупсіготе оГ“іп-
арргоргіаіе” Ьурегзесгеііоп оГ апіісііигеііс Ьогтопе) вазо-
пресин спричинює не тільки дилюційну гіпонатріємію, а
також, зменшуючи секрецію альдостерону (див. Розділ 20),
- втрату солей з сечею, якщо процес утримання води до-
статній, щоб поповнювати об’єм ПКР. Такий стан є в хво-
рих з мозковими (“церебральна втрата солей”) або легене-
вими патологіями (“легенева втрата солей”). Гіперсекреція
вазопресину в хворих з легеневими патологіями, зокрема
в разі раку легень, може бути частково зумовлена при-
пиненням гальмівних імпульсів в аферентних волокнах
блукаючого нерва, що Генеруються в рецепторах розтягу-
вання передсердь і великих вен. Однак відомо, що значна
кількість пухлин легень і деякі інші новоутворення про-
дукують вазопресин. Пацієнтів з невідповідною гіперсек-
рецією вазопресину можна успішно лікувати демеклоцик-
ліном - антибіотиком, що послаблює реагування нирок на
вазопресин.
Рис. 14-15. Співвідношення артеріального тиску і концентрації
вазопресину в плазмі практично здорових людей, у яких уве-
денням сумірних доз гангліоблокатора триметафану спри-
чинено поступове зниження кров’яного тиску. Крива співвід-
ношення більше експоненційна, ніж лінійна (за даними з Вауііз
РН: Озтогедиіаііоп апсі сопігої о( уазоргеззіп зесгеііоп іп
ііеаІІІіу Ііитапз. Ат РГіузіоІ 1987; 253Я671).
Нецукровий діабет - це синдром, зумовлений недос-
татністю вазопресину або нечутливістю до нього епітелію
ниркових канальців.
Причини недостатності вазопресину - патологічні
процеси в надзоровому і пришлуночковому ядрах, у ппо-
таламогіпофізарному тракті або в задній частці гіпофіза.
З’ясовано, що 30% клінічних випадків спричинені ушкод-
женням гіпоталамуса пухлинним процесом (як первинним,
так і метастазами); 30% є наслідком отриманої травми;
30% мають ідіопатичний характер; решта зумовлені ушкод-
женням судин, інфекціями, системними захворюваннями,
зокрема саркоїдозом, що ушкоджує гіпоталамус, або мута-
ціями в гені препропресофізину.
Порушення, що виникають після хірургічного видален-
ня задньої частки гіпофіза, можуть бути тимчасовими,
якщо ушкоджено лише дистальні кінці волокон, що від-
ходять з надзорового і пришлуночкового ядер, оскільки ці
волокна регенерують, налагоджують нові зв’язки з суди-
нами і відновлюють виділення вазопресину. Симптомами
нецукрового діабету є виділення великої кількості розве-
деної сечі (поліурія), споживання великої кількості рідини
(полідипсія) за умови, що механізми контролювання спра-
ги не порушені. Полідипсія в цьому випадку позитивна.
За умов гальмування відчуття спраги з будь-якої причини
Рис. 14-16. Вплив гіповолемії і гіперволемії на співвідношення
між концентрацією вазопресину в плазмі (АДГ) і осмоляль-
ністю плазми (посмоль). Сім зразків крові взяті в різний час
від десяти практично здорових людей, у яких утриманням
від пиття води спричинено гіповолемію, а згодом - гіперво-
лемію введенням гіпертонічного розчину (чорні кружки, суціль-
на лінія). За допомогою лінійного регресивного аналізу вияв-
лено співвідношення АДГ=0,52 (посмоль - 283,5) у випадку
утримання від споживання води і АДГ=0,38 (посмоль - 285,6)
у разі введення гіпертонічного розчину. МВ - межа визна-
чення. Зверніть увагу на збільшення кута кривої та перемі-
щення кривої ліворуч у разі гіповолемії (СЗ ТІютрзоп).
228/РОЗДІЛ 14
споживання води зменшується, з’являється дегідратація,
яка може мати фатальні наслідки.
Інша причина нецукрового діабету - нечутливість епі-
телію ниркових канальців до вазопресину (нефрогенний
нецукровий діабет). У випадку одної з форм захворювання
природжений дефект У2-рецептора, що виникає внаслідок
різних мутацій гена цього рецептора, призводить до пору-
шеності утворення цАМФ. Ця вада Х-залежна, оскільки
У2-ген розміщений у Х-хромосомі. В іншій формі мутації
в аутосомному гені аквапорину 2 зумовлюють утворення
нефункційних водних каналів. Цікаво, що аквапорин 2 у
нормі наявний у сечі, а в разі нецукрового діабету, зумов-
леного дефіцитом вазопресину, ін’єкція агоніста вазопре-
сину спричинює швидке збільшення концентрації акво-
порину 2 в сечі. Однак у випадку нефрогенного нецукро-
вого діабету такого зростання не простежується.
Вплив на перебіг нецукрового діабету супутньої недо-
статності передньої частки гіпофіза розглянуто в Розділі 22.
Дія окситоцину
Окситоцин діє головно на молочну залозу і матку, хоча
може також брати участь і в процесі лютеолізу (див. Розділ
23). Зв’язані з 6-білком серпентинові окситоцинові рецеп-
тори виявлені в міометрії людини, а ідентичні або подібні
рецептори - також у тканинах молочної залози і яєчника.
Ці рецептори зумовлюють зростання внутрішньоклітинної
концентрації Са2+.
У ссавців окситоцин спричинює скорочення міоепіте-
ліальних клітин - клітин, подібних до гладком’язових,
що вистилають протоки молочної залози. Під час лактації
це зумовлює витискання молока з альвеол залози в молоч-
ний синус і витікання його через сосок (виділення моло-
ка). Багато гормонів, взаємодіючи, забезпечують процес
зростання молочної залози і секрецію молока (див. Розділ
23), проте виділення молока в більшості видів регульоване
окситоцином.
Рефлекс виділення молока
Виділення молока ініційоване нейрогуморальним реф-
лекторним шляхом. Рецепторами слугують нервові закін-
чення дотику, яких багато в молочній залозі, особливо нав-
коло соска. Імпульси, що генеруються в цих рецепторах,
проходять соматичними шляхами дотику до над зорового
і пришлуночкового ядер. Збудження в окситоциновмісних
нейронах приводить до виділення окситоцину задньою
часткою гіпофіза (див. рис 14-13). Немовля, смокчучи гру-
ди, подразнює рецептори дотику, внаслідок чого відбува-
ється стимулювання нейронів надзорового і пришлуноч-
кового ядер, виділяється окситоцин, молоко надходить у
молочні синуси і далі до ротової порожнини зголоднілого
немовляти. В період лактації подразнення статевих органів,
а також емоції теж можуть зумовити виділення окситоцину,
інколи спричинюючи витікання молока.
Інші функції окситоцину
Окситоцин спричинює скорочення гладких м’язів
матки. Чутливість мускулатури матки до окситоцину
підсилює естроген і пригнічує прогестерон. Гальмівний
вплив прогестерону зумовлений безпосередньою дією сте-
роїдів на окситоцинові рецептори матки. В пізній період
вагітності чутливість матки до окситоцину посилюється,
що супроводжується помітним збільшенням кількості
окситоцинових рецепторів і мРНК окситоцинових рецеп-
торів (див. Розділ 23). Секреція окситоцину збільшується
під час пологів. Після розкриття шийки матки просування
плоду пологовим каналом ініціює імпульси в аферентних
нервах, які проходять до надзорового і пришлуночкового
ядер, зумовлюючи секрецію тієї кількості окситоцину, що
потрібна для посилення родової діяльності (див. рис. 23-
41). Кількість окситоцину є нормальною на початку поло-
гів. Можливо, що помітне в цей період збільшення кіль-
кості окситоцинових рецепторів за нормального рівня
окситоцину ініціює скорочення і забезпечує позитивний
зворотний зв’язок. Проте кількість окситоцину в матці у
цей період збільшена і, отже, локальне продукування ок-
ситоцину теж може відігрівати деяку роль.
Окситоцин може так само впливати і на невагітну матку,
сприяючи рухові сперми. Проходження сперми через
жіночі статеві шляхи до маткових труб, де переважно від-
бувається запліднення, залежить не тільки від рухливості
сперматозоїдів, а й, принаймні в деяких випадках, від ско-
рочення матки. Подразнення геніталій під час статевого
акту зумовлює виділення окситоцину, однак не доведено,
що саме окситоцин у цьому разі ініціює спеціфічні рухи
матки, які сприяють переміщенню сперми. Секрецію окси-
тоцину стимулюють стресові подразники і пригнічує, як і
вазопресину, алкоголь.
Кількість окситоцину в крові, що циркулює, збільшу-
ється в чоловічому організмі під час еякуляції, і можливо,
це зумовлює посилене скорочення гладких м’язів сім’яви-
носної протоки, а, отже, просування сперми в напрямі
сечівника.
РЕГУЛЮВАННЯ СЕКРЕЦІЇ ПЕРЕДНЬОЇ
ЧАСТКИ ГІПОФІЗА
Гормони передньої частки гіпофіза
Передня частка гіпофіза виділяє шість гормонів: адре-
нокортикотропний гормон (кортикотропін, АКТГ),
тиреотропний гормон (тиротропін, ТТГ), гормон росту,
фолікулостимулювальний гормон (ФСГ), лютеїнізу-
вальний гормон (ЛГ) і пролактин. Поліпептид р-ліпо-
тропін (р-ЛТП) виділяється разом з АКТГ, проте фізіоло-
гічна роль його не відома. Дія цих гормонів відображена
на рис. 14-17, а синоніми і скорочення їхніх назв наведені
в табл. 22-1. Функції гормонів детально описані в розділах,
що стосуються ендокринної системи. Гіпоталамус відіграє
важливу стимулювальну роль у регулюванні секреції АКТГ,
Р-ЛТП, ТСГ, гормону росту, ФСГ і ЛГ. Він також регулює
секрецію пролактину, проте ця його дія швидше гальмівна,
ніж стимулювальна.
Природа гіпоталамічного регулювання
Секреторну діяльність передньої частки гіпофіза регу-
люють хімічні агенти, що потрапляють до гіпофізарної
портальної системи судин з гіпоталамуса. Ці речовини
називають рилізинг-факторами та гальмівними факторами.
Останнім часом використовують спільну назву - гіпофі-
зогропні гормони. Новий термін є відповідним, оскільки
ЦЕНТРАЛЬНЕ РЕГУЛЮВАННЯ ВІСЦЕРАЛЬНИХ ФУНКЦІЙ / 229
Альдостерон,
статеві гормони
Рис. 14-17. Гормони передньої частки гіпофіза. У жіночому організмі ФСГ і ЛГ послідовно впливають на ріст фолікула в
яєчнику, овуляцію й утворення та підтримання функції жовтого тіла В чоловічому організмі ФСГ і ЛГ регулюють функцію яєчок
(див. Розділ 23). Пролактин стимулює лактацію.
ці речовини виділяються в кров і діють на відстані від місця
їхнього утворення. Вони не проникають у загальне кро-
в’яне русло, а у високих концентраціях містяться в гіпо-
фізарних портальних судинах.
Гіпофізотропні гормони
Сьогодні виявлено шість гіпоталамічних рилізинг- та
гальмівних гормонів (рис. 14-18): кортикотропін-ри-
лізинг гормон (КРГ); тиротропін-рилізинг гормон
(ТРГ); гормон росту-рилізинг гормон (ГР-РГ); гормон
росту-інгібувальний гормон (ГРІ; інша назва сомато-
статин); лютеїнізувальний гормон-рилізинг гормон
(ЛГРГ), відомий також як гонадотропін-рилізинг гормон
(ГнРГ) і пролактинінгібувальний гормон (ПІГ). Крім
того, екстракт гіпоталамуса має пролактин-рилізинг
активність. Отже, вважають, що є пролактин-рилізинг
гормон (ПРГ), ТРГ, ВІП і декілька інших поліпептидів,
що містяться в гіпоталамусі, стимулюють секрецію про-
лактину, однак незрозуміло: один чи декілька поліпептидів
становлять фізіологічний ПРГ. Нещодавно з передньої
частки гіпофіза виділено орфановий рецептор, а під час
пошуків його ліганду з гіпоталамуса - 31 -амінокислотний
поліпептид. Цей поліпептид стимулює секрецію пролак-
тину, діючи на рецептор передньої частки гіпофіза, однак
потрібні додаткові дослідження, щоб з’ясувати, що це він
становить фізіологічний ПРГ. ГнРГ стимулює секрецію як
ФСГ, так і ЛГ, отже, вірогідно, що окремого фолікулости-
мулювального гормону-рилізинг гормону нема.
Структура шести гіпофізотропних гормонів показана
на рис. 14-19. Будова генів і препрогормонів ТРГ, ГнРГ,
соматостатину, КРГ і ГР-РГ відома. ПрепроТРГ містить
шість копій ТРГ (див. рис. 1-22). Окремі препрогормони,
поряд з гіпофізотропними, можуть містити й інші гормо-
нально активні пептиди.
Рис. 14-18. Вплив гіпофізотропних гормонів на секрецію гормонів передньої частки.
230/РОЗДІЛ 14
ТРГ (руго)6Іи-Ніз-Рго-МН2
ГнРГ (руго)СІи-НІ5-Тгр-8ег-Туг-(ЗІу-Іеи-Агд-Рго-6Іу-МН2 г3 Зі
Соматостатин АІа-бІу-Суз-Іуз-Азп-РГіе-РНе-Тгр-Іуз-ТНг-РЬе-ТЬг-Зег-Суз
КРГ Зег-6Іи-СІи-Рго-Рго-ІІе-Зег-Ьеи-Азр-Іеи-ТІіг-РЬе-Ніз-иеи-иеи-Агд-СІи-\/аІ-Іеи-СІи-Меі-АІа-Агд-АІа-СІи-СІп-Іеи- АІа-вІп-бІп-АІа-Ніз-Зег-Азп-Агд-Ьуз-Ьеи-Меі-СІи-ІІе-ІІе-НН;
ГР-ГР Туг-АІа-Азр-АІа-ІІе-РКе-ТИг-Азп-Зег-Туг-Агд-Ьуз-ї/аІ-Ьеи-СІу-вІп-Іеи-Зег-АІа-Агд-Ьуз-Ьеи-Іеи-СІп-Азр-ІІе-МеГ- Зег-Агд-СІп-вІп-6Іу-СІи-Зег-Азп-6Іп-6Іи-Агд-6Іу-АІа-Агд-АІа-Агд-Іеи-МН2
ПІГ Дофамін
Рис. 14-19. Структура гіпофізотропних гормонів людини. Препросоматостатин перетворюється в тетрадекапептид (соматостатин
14, [8314], формула якого зображена вище), а також у поліпептид, що містить 28 амінокислотних залишків (3328).
Ділянка, в якій відбувається виділення гіпоталамічних
рилізинг- та гальмівних гормонів, є серединним підви-
щенням гіпоталамуса. Вона містить небагато тіл нервових
клітин, проте має чимало нервових закінчень, розміщених
безпосередньо біля капілярних петель, з яких починаються
портальні судини.
Локалізація тіл нейронів, що продукують гіпофізарні
гормони і відростки яких прямують до зовнішнього шару
серединного підвищення, показана на рис 14-20. Там же
відображено розміщення нейронів, що синтезують окси-
тоцин і вазопресин. Нейрони, які продукують ГнРГ, розта-
шовані головно в медіальній частині передзорового поля,
соматостатинопродукувальні - у навколошлуночкових
ядрах, ТРГ- і КРГ-продукувальні у медіальних частинах
пришлуночкових ядер, а ГР-РГ- і дофамінопродукувальні
- у дугоподібних ядрах.
Більшість (якщо не всі) гіпофізотропних гормонів впли-
вають на секрецію не одного гормону передньої частки
гіпофіза (див. рис. 14-18). Про ФСГ-стимулювальну актив-
ність ГнРГ уже зазначено вище. ТРГ стимулює секрецію
як пролактину, так і ТСГ. Соматостатин пригнічує секрецію
як ТСГ, так і гормону росту. В нормі він не інгібує секреції
інших гормонів передньої частки гіпофіза, однак пригнічує
ненормально високу секрецію АКТГ у хворих із синдро-
мом Нельсона. КРГ стимулює секрецію АКТГ і р-ЛТП
(див. Розділ 22).
Рецептори багатьох гіпофізотропних гормонів серпен-
тиноподібні і зв’язані з О-білками. В людини є два КРГ
рецептори: КРГЛ-К1 і КРГ;|-КІІ. Другий відрізняється від
першого наявністю 29-амінокислотної частини, вбудованої
в першу цитоплазматичну петлю рецептора. Фізіологічна
роль КРГЛ-КІІ невідома, хоч він міститься в багатьох
частинах головного мозку. Крім того, в крові циркулює
КРГ-зв’язувальний білок, який інактивує КРГ Він теж
виявляється в цитоплазмі кортикотропоцитів передньої
частки гіпофіза і тут може відігравати роль у процесі інтер-
налізації рецепторів. Утім, точно фізіологічне значення
цього білка не відоме. Інші гіпофізотропні гормони не
мають відомих зв’язувальних білків.
Уведення КРГ в шлуночки великого мозку спричинює
гіперглікемію, збільшення серцевого викиду, послаблення
Рис. 14-20. Розміщення тіл нейронів, що виділяють гіпофізо-
тропні гормони (проекція на вентральну поверхню гіпотала-
муса і гіпофіза щура). ВСА - внутрішня сонна артерія; ГА -
головна артерія; ДПЯ - дугоподібне ядро; ЗМА - задня
мозкова артерія; 34 - задня частка; НЗ - надзорове ядро;
НШЯ - навколошлуночкове ядро; ПрЧ - проміжна частка; ПЧ
- передня частка; ПЯ - пришлуночкове ядро; СМА - середня
мозкова артерія; СП - серединне підвищення. Назви гормонів
наведено в рамках (І_\Л/ Зууапзоп і ЕТ СиппіпдНат 4г).
ЦЕНТРАЛЬНЕ РЕГУЛЮВАННЯ ВІСЦЕРАЛЬНИХ ФУНКЦІЙ / 231
репродуктивної функції, анорексію, зниження функцій
травної системи й інші зміни, які простежуються під час
стресу. Втім, поки що не можна стверджувати, що проду-
кований ендогенно КРГ причетний до змін, які виникають
у разі стресу.
В інших ділянках головного мозку, сітківці, автономній
нервовій системі гіпофізотропні гормони діють як нейро-
трансмітери (див. Розділ 4). Крім того, соматостатин міс-
титься в панкреатичних острівцях (див. Розділ 19). СТР-
РГ продукують клітини пухлин підшлункової залози, а
соматостатин і ТРГ виявлено в травної системи (див.
Розділ 26).
Значення і клінічні аспекти
Дослідження численних нейрогуморальних регулятор-
них функцій гіпоталамуса важливе, оскільки дає змогу
пояснити їхню відповідність вимогам середовища, що
постійно змінюється. Нервова система отримує інформа-
цію про зміни у внутрішньому і зовнішньому середовищах
за допомогою сенсорних органів. Це допомагає присто-
суватися до змін за допомогою ефекторних механізмів, що
охоплюють не тільки соматичні рухові реакції, а й і зміни
рівня секреції гормонів. Є багато прикладів діяльності ней-
рогуморальних ефекторних шляхів. У птахів і багатьох
ссавців збільшення кількості світлових годин навесні сти-
мулює секрецію гонадотропіну, активує статеві залози,
зумовлюючи початок сезону розмноження. Відомо, що
протягом тривалої зимової ночі в ескімосок припиняються
овуляції; регулярні місячні цикли та сексуальна активність
поновлюються з настанням весни. В країнах з теплішим
кліматом менструації в жінок відбуваються впродовж усьо-
го року, хоча на їхню регулярність помітно впливають сома-
тичні й емоційні подразники. Зафіксовано випадки припи-
нення регулярних періодів у молодих дівчат, які покидають
дім (“аменорея інтернату”), гальмування місячних, зумов-
лене боязню завагітніти, а також тенденція в близьких под-
руг у жіночих коледжах до синхронізації місячних циклів.
Отже, простежується низка випадків впливу психічних
чинників на ендокринну секрецію.
Проявами патологічних процесів, що виникають у
ділянці гіпоталамуса, є неврологічні відхилення, зміни
функції ендокринних залоз, метаболічного типу відхилен-
ня, зокрема гіперфагія чи гіпертермія. Відносна частота
ознак і симптомів, що виникають у разі патології гіпота-
ламуса, наведена в табл. 14-3. Патологією гіпоталамуса
часто можна пояснити і чимало ознак дисфункції гіпофіза,
зокрема тих, що зумовлені недостатністю окремих гі-
пофізотропних гормонів.
Щодо цього на особливу увагу заслуговує синдром
Калеманна, у якому гіпогонадизм, зумовлений низьким
рівнем гонадотропінів (гіпогонадотропний гіпогона-
дизм), що циркулюють, поєднаний з частковою або повною
втратою відчуття нюху (гіпосмія або аносмія). Ембріо-
логічно ГнРГ-продукувальні нейрони розвиваються в носо-
вій порожнині та мігрують нюховими нервами і далі речо-
виною головного мозку до гіпоталамуса. Порушення про-
цесу міграції у випадку вродженої вади нюхових шляхів
призводить до того, що ГнРГ-продукувальні нейрони не
досягають гіпоталамуса, і в період статевого дозрівання
не розвиваються статеві залози. Синдром переважно трап-
Таблиця 14-3. Симптоми й ознаки в 60 хворих з патологією
гіпоталамуса, підданих після смерті автопсії1
Симптоми й ознаки % від кількості випадків
Ендокринні і метаболічні
Передчасне статеве дозрівання 40
Гіпогонадизм 32
Нецукровий діабет 35
Ожиріння 25
Порушене терморегулювання 22
Виснаження 18
Булімія (вовчий голод) 8
Анорексія (відсутність апетиту) 7
Неврологічні
Очні симптоми 78
Пірамідні і чутливі порушення 75
Головний біль 65
Екстрапірамідні симптоми 62
Блювання 40
Психічні порушення, напади гніву 35
тощо
Сонливість ЗО
Судоми 15
1 Дані взято з Ваиег НО: Епсіосппе апсі ойіег сііпісаі гпапіїез-
їаїіопз ої ііуроіаіатіс сіізеазе. З Сііп Епсіосгіпої 1954; 14:13.
Див. також Каїїапа І еі аі: Епсіосгіпе тапіїезїаїіопв ої іпїгапісаі
ехїгазеїіаг Іезіопз. З СІіп Епсіосгіпої 1962;22:304.
ляється в осіб чоловічої статі, а причиною його в більшості
випадків є мутація в КАЬЮ1-ген\ - одному з генів Х-хро-
мосрми, що кодує, вірогідно, молекулу зчеплення, потрі-
бну для нормального розвитку нюхового нерва, яким ГнРГ-
продукувальні нейрони мігрують до головного мозку.
Подібний синдром виникає і в осіб жіночої статі, проте
він може бути зумовлений іншими генетичними вадами.
ТЕРМОРЕГУЛЮВАННЯ
Тепло в тілі утворюється внаслідок м’язової діяльності,
засвоєння поживних речовин і всіх життєвих процесів, що
забезпечують основний обмін (див. Розділ 17). Воно витра-
чається шляхом випромінювання, провідності та випаро-
вування води з дихальних шляхів і поверхні шкіри. Неве-
ликі кількості тепла втрачають з сечею і калом. Баланс між
теплоутворенням і тепловіддачею визначає температуру
тіла. Оскільки швидкість хімічних реакцій залежить від
температури, і системи ензимів в організмі мають вузькі
температурні межі, у яких їхня активність оптимальна, то
нормальна життєдіяльність організму визначена порівняно
сталою температурою тіла.
Безхребетні переважно не здатні регулювати темпера-
туру свого тіла, тому вона залежить від температури дов-
кілля. В хребетних механізми підтримання сталої темпе-
ратури ґрунтуються на регулюванні процесів теплоутво-
рення і тепловіддачі. В рептилій, амфібій і риб механізми
терморегулювання порівняно рудиментарні, і ці види нази-
вають холоднокровними (пойкілотермними), оскільки
температура їхнього тіла коливається в значних межах. У
232 / РОЗДІЛ 14
птахів і ссавців, тобто теплокровних (гомойотермних)
тварин, комплекс рефлекторних реакцій, що інтегровані
переважно в гіпоталамусі, забезпечує підтримання тем-
ператури тіла у порівняно вузьких межах, незважаючи на
значні коливання температури довкілля. Ссавці, що впа-
дають в зимову сплячку, є винятком: після пробудження
вони є гомойотермними, а під час зимової сплячки темпе-
ратура їхнього тіла знижується.
Нормальна температура тіла
Температура тіла різних видів гомойотермних тварин
відрізняється. Менше різниця температури простежується
між окремими суб’єктами всередині виду. В людини тра-
диційно нормальною температурою ротової порожнини
вважають 37°С проте вимірювання температури у групи
практично здорових дорослих людей засвідчило, що вранці
в ротовій порожнині вона становить 36,7° зі стандартним
відхиленням 0,2°. Отже, можна припустити, що в 95% усіх
молодих людей ранкова температура в ротовій порожнині
становить 36,3-37,1 °С; середнє значення середнього від-
хилення ± 1,96; (див. Додаток). У різних частинах тіла за-
фіксовано різні значення температури. Також різною є
залежність температури різних частин тіла від температури
навколишнього середовища (рис. 14-21): кінцівки звичайно
холодніші; температура калитки утримується в межах
32°С; температура в прямій кишці має особливості порів-
няно з температурою поверхні тіла - вона менше залежить
від температури оточення; температура в ротовій порож-
нині у нормі на 0,5°С нижча, ніж у прямій кишці, проте
вона залежить від низки факторів, зокрема вживання гаря-
чих або холодних напоїв, жуйки, куріння чи дихання через
рот.
Нормальна температура поверхні тіла підлягає постій-
ним циркадного типу коливанням у межах 0,5-0,7°. В осіб,
що сплять вночі і пробуджуються вранці (навіть якщо вони
перебувають у лікарні за умов ліжкового режиму), найниж-
ча температура буває о 6 годині, а найвища - о 18 (рис. 14-
22); вона є найнижчою під час сну, злегка підвищується в
разі спокійного пробудження і максимальна в активному
стані. В жінок простежуються додаткові місячні цикли змін
температури, тобто вона підвищується в період овуляції
(див. Розділ 23 і рис. 23-30). Температура тіла в дітей
молодшого віку в нормі може бути на 0,5°С (або близько
до цього) вищою від норми дорослої людини.
Під час фізичної праці тепло, що виникає внаслідок м’я-
зових скорочень, акумулюється в тілі, і температура в пря-
мій кишці підвищується до 40°С. Це зростання частково
зумовлене слабкістю механізмів тепловиділення в разі різ-
кого збільшення кількості утвореного тепла, проте є під-
стави вважати, що під час інтенсивної м’язової роботи по-
ряд з посиленням теплоутворення відбувається також акти-
вування механізмів тепловіддачі. Температура тіла дещо
підвищується і під час емоційного збудження, можливо,
внаслідок підсвідомого напруження м’язів. Стійке підви-
щення температури (приблизно на 0,5°) простежується в
разі зростання рівня обміну речовин, зокрема у випадку
гіпертиреоїдизму, а зниження - за умов низького рівня об-
міну речовин, зокрема у випадку гіпотиреоїдизму (рис. 14-
23). Окремі практично здорові дорослі люди постійно ма-
ють підвищену температуру (конституційна гіпертермія).
22 23 24 25 26 27 28 29 ЗО 31 32 33 34
Температура в калориметрі, °С
Рис. 14-21. Температура різних частин тіла оголеного суб’єкта
за умови різних температурних режимів калориметра (відтво-
рено за дозволом з Нагсіу ЗО, ОиВоіз ЕЕ. Х/азаІ теіаЬоІізт,
гасііаііоп, сопуєсііоп апсі уарогігаііоп аі іетрегаіигез ої 22-
35°С. З Миіг 1938; 15:477).
Теплоутворення
Теплоутворення й енергетичний баланс розглянуто в
Розділі 17.
Значна кількість реакцій основного обміну забезпечує
постійне теплоутворення. Споживання їжі підвищує тепло-
утворення внаслідок специфічної динамічної дії продуктів
харчування (див. Розділ 17), проте головним джерелом
тепла є скорочення скелетних м’язів (табл. 14-4). Окрім
споживання їжі і м’язової діяльності, на інтенсивність теп-
лоутворення впливають ендокринні механізми. Адреналін
і норадреналін спричинюють швидке, проте короткочасне
посилення теплоутворення. Рівень же збудження в симпа-
00
о
о О 38
“ х"
сп н
• Гіпер-
• ш «тиреоїдизм
Норма
• х * Гіпо-
тиреоїдизм
і * 1 2 1 3 ' 4 1 5 г
Дні перебування в клініці
Рис. 14-22. Типова температурна карта госпіталізованого
пацієнта без ознак запального процесу. Зверніть увагу на
незначне підвищення температури внаслідок збудження і
страху в разі потрапляння в клініку, а також на регулярні цир-
кадні температурні цикли.
ЦЕНТРАЛЬНЕ РЕГУЛЮВАННЯ ВІСЦЕРАЛЬНИХ ФУНКЦІЙ / 233
тичних нейронах знижується під час голодування і підви-
щується у разі приймання їжі (див. Розділ 13).
Значним джерелом тепла, зокрема в немовлят, є бурий
жир (див. вище і Розділ 17). Йому властивий високий
рівень обміну речовин і його термогенну функцію можна
порівняти хіба що з електричною ковдрою.
Тепловіддача
Процеси, завдяки яким відбувається тепловіддача, у
випадку нижчої, ніж температура тіла, температури сере-
довища, наведені в табл. 14-4. Теплопровідність - це
обмін теплом між об’єктами або речовинами, що мають
різну температуру і контактують між собою. Важлива
властивість матерії та, що її молекули перебувають у
постійному русі, а ступінь цього руху пропорційний до тем-
ператури. Ці молекули стикаються з молекулами холодні-
шого об’єкта, передаючи йому термічну енергію. Кількість
переданого тепла пропорційна до різниці температур між
об’єктами, що контактують (термічний градієнт). Провід-
ності сприяє конвекція - рух молекул від місця контакту.
Наприклад, об’єкт, що контактує з повітрям і відрізняється
за температурою, змінює питому вагу повітря, а оскільки
тепле повітря підіймається, а холодне опускається, то з
об’єктом контактують нові порції повітря. Звичайно кон-
векція значно посилюється, якщо об’єкт рухається в повіт-
рі, пливе в воді, або вентилятор рухає повітря в кімнаті.
Випромінювання забезпечує передавання тепла за допо-
могою інфрачервоних електромагнітних променів від
одного об’єкта до іншого, що відрізняються температурою,
у випадку, якщо об’єкти не контактують. Якщо особа пере-
буває в холодному середовищі, то тепловіддача відбуваєть-
ся шляхом конвекції до навколишнього повітря і випромі-
нювання -до холоднішого об’єкта, що розміщений побли-
зу. І навпаки, тепло надходить до особи і вона нагрівається
завдяки цим процесам, якщо температура середовища ви-
ща, ніж температура тіла. Зазначимо, що завдяки випро-
°Е °С У прямій кишці
У ротовій порожнині
104--40
102 ’39
-37
98-.
'-36
96--
І Важка фізична
| праця
л Емоції або помірна
І фізична праця, декілька
Гздорових дорослих,
І багато активних дітей
Звичайний рівень
норми
І Вранці,
। холодна погода тощо
Важка праця, емоції;
/декілька здорових дорослих,
7 багато активних дітей
і Звичайний рівень
норми
І Вранці,
[ холодна погода тощо
Рис. 14-23. Температурні рівні в прямій кишці і ротовій по-
рожнині практично здорових людей (відтворено за дозволом
з ОиВоіз ЕЕ: Еєуєг апсі ІГіе Кедиіаііоп ої ІГіе Восіу Тетрега-
іиге Тіютаз, 1948).
Таблиця 14-4. Теплоутворення і тепловіддача тіла людини
Тепло утворюється внаслідок:
Процесів основного обміну
Приймання їжі (специфічна динамічна дія)
М’язової діяльності Тепловіддача
Віддача тепла відбувається внаслідок: при 21 °С, %
Випромінювання і провідності 70
Випаровування поту 27
Дихання 2
Сечовиділення і дефекації 1
мінюванню особа може відчувати холод у кімнаті з холод-
ними стінами, навіть якщо повітря там порівняно тепле.
У холодний, проте сонячний день тепло сонячних променів
відбивається від світлих об’єктів, забезпечуючи значний
зігрівальний ефект. Наприклад, теплові промені відбива-
ються від снігу, що створює умови для катання на лижах у
досить легкому одязі, навіть якщо температура повітря
нижча від точки замерзання.
Оскільки теплопровідність відбувається між поверхня-
ми об’єктів, то на температуру шкіри значно впливають
процеси віддачі й отримання тепла. Кількість тепла, що
надходить до шкіри з глибше розміщених тканин, може
збільшуватись залежно від рівня припливу крові. У випадку
розширення судин шкіри туди надходить тепла кров, тоді
як за умов їхнього максимального звуження кров більше
затримується всередині тіла. Ступінь надходження тепла
до шкіри з глибоких тканин відображає тканинну про-
відність. Птахи мають шар пір’я безпосередньо біля шкі-
ри, а шкіра більшості ссавців укрита значним волосяним
покривом або хутром. Тепло з поверхні шкіри потрапляє
в цей захисний шар і щойно звідти - до навколишнього
повітря. Товщина цього захисного шару збільшується в разі
настовбурчування пір’я або підіймання волосся, тоді тепло-
віддача (або надходження тепла за умов гарячої пори) змен-
шується. В людей у холодну погоду так звана гусяча шкіра
виникає внаслідок скорочення м’язів-підіймачів волосся,
що кріпляться до коренів волосяного покриву. Проте люди-
на доповнює цей захисний шар одним або декількома ша-
рами одягу. Тепло переходить з поверхні тіла до захисного
шару, утвореного одягом, а звідти - назовні, до повітря
середовища. Теплопровідність одягу, структура його ткани-
ни, товщина визначають те, наскільки одяг захищає від
холоду чи спеки. Темний одяг абсорбує випромінювання
тепла, а одяг світлих тонів відбиває його.
Іншим важливим процесом, що забезпечує тепловіддачу
в людини і тварин, є випаровування води, яка виходить з
потом через шкіру, а також з поверхні слизових оболонок
ротової порожнини і дихальних шляхів. Випаровування 1 г
води зумовлює віддачу з організму приблизно 0,6 ккал
тепла. Деяка кількість води випаровується постійно. Ця
невідчутна втрата води становить у людини до 50 мл/год.
З посиленням потовиділення ступінь випаровування зале-
жить від вологості середовища. Відомо, що за умов вологої
погоди висока температура середовища більше впливає на
організм. Частково це зумовлене зменшенням випарову-
вання поту, проте навіть у випадку, коли випаровування
234/Р03ДІЛ14
поту відбувається повною мірою, особа, що перебуває в
вологому середовищі, більше відчуває вплив тепла, ніж
особа в сухому Причина цього невідома, проте, вірогідно,
вона стосується факту, що у вологому середовищі піт перед
випаровуванням виділяється з більшої площі поверхні
шкіри. Під час напруженої м’язової роботи в гарячому
середовищі потовиділення досягає рівня 1600 мл/год, і в
сухій атмосфері більшість поту випаровується. Тепловід-
дача шляхом випаровування води коливається від ЗО до
900 ккал/год.
Деякі ссавці віддають тепло за допомогою поверхне-
вого частого дихання, завдяки чому збільшується випа-
ровування води з поверхні слизових оболонок ротової
порожнини і дихальних шляхів. Оскільки дихання в цьому
разі поверхневе, то воно не сприяє повноцінному онов-
ленню складу альвеолярного повітря (див. Розділ 34).
Співвідношення процесів, що забезпечують тепловід-
дачу (див. табл. 14-4), змінюється залежно від температури
зовнішнього середовища. При температурі 21 °С у стані
відпочинку випаровування незначне; при температурі сере-
довища, що наближається до температури тіла, роль випа-
ровування посилюється, а роль випромінювання послаб-
люється.
Механізми теплорегулювання
Перелік рефлекторних і напіврефлекторних терморегу-
ляторних реакцій у людини наведено в табл. 14-5. Він охоп-
лює автономні, соматичні, ендокринні і поведінкові меха-
нізми. Одна з груп реакцій зумовлює посилення тепловід-
дачі і послаблення теплоутворення, інша - послаблення
тепловіддачі і посилення теплоутворення. Загалом, дія
тепла стимулює першу групу реакцій і пригнічує другу, а
дія холоду чинить протилежний вплив.
Згортання калачиком - поширена реакція на холод у
тварин, вона відповідає положенню, якого набуває людина,
лягаючи у холодну постіль. Таке згортання зменшує по-
верхню контакту тіла з зовнішнім середовищем. Тремтіння
становить підсвідому реакцію скелетних м’язів. Холод
спричинює також напівсвідоме загальне підвищення рухо-
вої активності; прикладом може слугувати тупцювання і
пританцьовування в холодну погоду. Підвищення секреції
катехоламінів є важливою реакцією на холод. Миші, орга-
нізм яких не спроможний виробляти норадреналін і адре-
налін унаслідок нокауту гена дофамін-р-гідроксилази, не
переносять холоду. З огляду на недостатню вазоконстрик-
цію вони не здатні підвищувати рівень термогенезу в бурій
жировій тканині за допомогою ІІСР 1 (див. Розділ 17). За
умов холоду в лабораторних тварин посилюється секреція
ТСГ, яка послаблюється в умовах тепла. В дорослих людей
спричинені холодом зміни секреції ТСГ незначні і мають
сумнівне значення. Відомо, що рухова активність знижу-
ється в гарячу пору - це реакція, яка характеризується ви-
словом “є надто гаряче, щоб рухатись”.
Терморегуляторні пристосувальні реакції є як місцеви-
ми, так і більш ґенералізованими. Охолодження шкірних
кровоносних судин робить їх чутливішими до катехоламі-
нів, унаслідок чого артеріоли і венули звужуються. Цей
локальний ефект на холод спрямовує кров від шкіри. Іншим
теплозбережним механізмом, важливим для тварин, що
проживають у холодній воді, є передавання тепла з артері-
альної крові до венозної в ділянці кінцівок. Глибокі вени
(вени-супутниці) розміщені поряд з артеріями, що поста-
чають кров у кінцівки, і тепло передається з гарячої артері-
альної крові, яка надходить у кінцівки, до холодної веноз-
ної, що йде від кінцівок (обмін протиходу; див. Розділ 38).
Таким способом, хоч кінцівки й охолоджуються, однак
тепло тіла зберігається.
Рефлекторні реакції, що їх активує холод, регульовані
із задніх ділянок гіпоталамуса, а реакції, що їх активує теп-
ло, - переважно з передніх ділянок гіпоталамуса, хоча окре-
мі реакції на тепло зберігаються навіть після децеребрації
на рівні переднього краю середнього мозку. Стимулювання
передніх ділянок гіпоталамуса спричинює розширення
судин шкіри і потовиділення, а руйнування цієї ділянки
зумовлює гіпертермію, за якої ректальна температура інко-
ли досягає 43°С. Стимулювання задніх ділянок гіпотала-
муса спричинює тремтіння, а температура тіла тварин, у
яких ушкоджена ця ділянка, знижується до рівня темпера-
тури навколишнього середовища.
Правдоподібно, що серотонін у приматів і людини вико-
нує функцію синаптичного трансмітера в центрах, що регу-
люють механізми, активовані холодом, і що норадреналін
відіграє подібну роль у центрах, активованих теплом.
Однак є помітні видові особливості температурних реакцій
стосовно цих амінів. Деяку роль можуть відігравати також
і пептиди, проте детальна характеристика центральних
синаптичних контактів апарату терморегулювання ще досі
остаточно не з’ясована.
Аферентний вплив
Гіпоталамус виконує інтегроване регулювання темпе-
ратури тіла у відповідь на інформацію, яку він отримує від
чутливих рецепторів (головно холодових) шкіри, глибоких
тканин, спинного мозку, позагіпоталамічних частин голов-
ного мозку і самого гіпоталамуса. Внесок кожної з цих п’я-
ти ділянок впливу становить приблизно 20% від інформа-
ції, що її інтегрує гіпоталамус. Для кожної важливої темпе-
ратурної реакції є свій рівень порогу, і коли його досягнуто,
Таблиця 14-5. Терморегуляторні механізми
Механізми, активовані холодом
Збільшують теплоутворення
Тремтіння
Голод
Підвищена вольова активність
Підвищена секреція норадреналіну й адреналіну
Зменшують тепловіддачу
Звуження судин шкіри
Згортання калачиком
Гусяча шкіра
Механізми, активовані теплом
Збільшують тепловіддачу
Розширення судин шкіри
Потовиділення
Зростання частоти дихання
Зменшують теплоутворення
Анорексія
Апатія й інертність обміну
ЦЕНТРАЛЬНЕ РЕГУЛЮВАННЯ ВІСЦЕРАЛЬНИХ ФУНКЦІЙ / 235
Рис. 14-24. Кількісні співвідношення між температурою все-
редині голови людини (внутрішня температура), інтенсивніс-
тю кровоплину в шкірі (прямокутники, шкала праворуч) і пото-
виділенням (кружечки і трикутники, шкала ліворуч). Стрілка
спрямована до різкого повороту (поріг), починаючи з якого
параметри різко зростають; порогове значення в цього суб’єк-
та - 36,9°С (відтворено за дозволом з Вепгіпдег ТН: Весеріог
огдапз апсі циапіііаііуе тесіїапізтз оТ ііитап Іетрегаїиге соп-
ІгоІ іп а \л/агт епуігоптепі. ЕесІ Ргос 1960; 19:32).
реакція розпочинається. Для потовиділення і вазодилятації
він становить 37°С, для вазоконстрикції - 36,8, для тер-
могенезу, що не супроводжується тремтінням, - 36, а з
тремтінням - 35,5°С. Рівень порогу для виникнення вазо-
дилятації і потовиділення показано на рис. 14-24, де зна-
чення, що відображають ці реакції, нанесено на темпера-
турну шкалу.
Гарячка
Мабуть, з давніх часів гарячка - найвідоміша ознака
захворювання. Вона буває не тільки в ссавців, а й у птахів,
рептилій, амфібій і риб. У гомойотермних тварин у стані
гарячки терморегуляторні механізми такі, ніби вони від-
регульовані для підтримання температури тіла на вищому,
ніж нормально, рівні, тобто “ніби регулятор термостата
встановлений в іншому положенні”, і цей новий рівень
відповідає температурі понад 37°С. Температурні рецеп-
тори і далі інформують, що наявна температура нижча, ніж
новий заданий рівень, і механізми, завдяки яким вона під-
вищується, надалі активуються. Внаслідок цього виникає
відчуття холоду, зумовлене звуженням судин, а інколи
навіть тремтіння, що переходить в озноб. Характер відпо-
віді залежить від температури оточення. Підвищення тем-
ператури після ін’єкції пірогену експериментальним тва-
ринам більше зумовлене підсиленням реакції теплоутво-
Ендотоксин
Запалення
Інші пірогенні фактори
І
Моноцити
Макрофаги
Клітини Купфера
Цитокіни
Передзорове поле
гіпоталамуса
Простагландини
Підвищення заданого
температурного рівня
І
Гарячка
Рис. 14-25. Патогенез гарячки.
рення, якщо тварини перебувають у холодному середовищі,
і зниженням тепловитрати, якщо тварини є в теплі.
Патогенез гарячки схематично зображений на рис. 14-
25. Токсини бактерій, такі як ендотоксин, впливають на
моноцити, макрофаги і клітини Купфера, змушуючи їх ви-
робляти цитокіни, що діють як ендогенні пірогени (ЕП).
Є значна вірогідність, що ІЛ-1 В, ІЛ-6, р-ІРМ, у-IРN і ФНП-
а (див. Розділ 27) можуть самі спричинити гарячку. Ці
цитокіни - поліпептиди, і сумнівно, щоб вони проникали
в речовину головного мозку. Навпаки, вірогідно, що вони
впливають на СОКП, один із навколошлуночкових органів
(див. вище і Розділ 32). Це, відповідно, зумовлює акти-
вування передзорового поля гіпоталамуса. Цитокіни теж
утворені клітинами ЦНС за умов їхнього стимулювання в
разі інфекції, і тоді вони можуть діяти безпосередньо на
центри терморегулювання.
Гарячка, що виникає під впливом цитокінів, очевидно,
зумовлена локальним виділенням у гіпоталамусі проста-
гландинів. Інфекція простагландинів у ділянку гіпотала-
муса спричинює гарячку. Крім того, жарознижувальний
засіб аспірин впливає безпосередньо на таламус. Відомо
також, що аспірин пригнічує синтез простагландинів. Од-
нак досі тривають дебати стосовно ролі простагландинів
гіпоталамуса. ПГЕ2 - один з простагландинів, що спри-
чинюють гарячку. Він діє на чотири субтипи простаглан-
динових рецепторів - ЕРр ЕР2, ЕР3 і ЕР4. Нокаут ЕР3-
рецептора послаблює температурну реакцію, що виникає
під впливом ПГЕ2, ІЛ-1 р і бактеріального ліпополісахариду
(ЛПС).
Значення гарячки для організму не з’ясоване. Вона, оче-
видно позитивна, оскільки розвинулась у процесі еволюції
і є реакцією на розвиток інфекції та інші захворювання.
Багато мікроорганізмів ліпше розвиваються і розмножу-
ються за умов деякого, порівняно вузького, температур-
ного режиму, і підвищення температури пригнічує їхній
ріст. Крім того, синтез антитіл посилюється в умовах під-
вищення температури тіла. Перед винайденням антибіо-
236/РОЗДІЛ 14
тиків гарячку штучно спричинювали, намагаючись ліку-
вати нейросифіліс, і ці спроби виявились успішними. Гі-
пертермія доцільна в разі захворювання на сибірку, пнев-
мококову пневмонію, проказу, грибкові, вірусні інфекції і
рикетсіози. Вона також сповільнює ріст окремих злоякіс-
них пухлин. Однак дуже висока температура шкідлива.
Якщо температура в прямій кишці підвищується понад
41 °С і зберігається на цьому рівні протягом тривалого часу,
то виникають певні незворотні ушкодження в тканинах
головного мозку, а якщо вона сягає 43°С, то настає тепло-
вий удар і часто смерть.
У разі злоякісної гіпертермії мутація гена, що кодує
рецептор ріанодину (див. Розділ 3), спричинює надмірне
вивільнення Са2+ під час скорочення м’язів, зумовленого
стресом. Це, відповідно, спричинює контрактуру м’язів,
підвищення в них рівня метаболізму і теплоутворення.
Посилене теплоутворення призводить до сильного підви-
щення температури тіла, яке без втручання спричинює
смерть. Такий стан зумовлюють різні мутації рецепторного
гена в людини, а поодинока мутація цього гена в свиней
доволі поширена.
Гіпотермія
У ссавців, які впадають у зимову сплячку, температура
тіла значно знижується, не спричинюючи ніяких патоло-
гічних змін, про що свідчить їхнє наступне пробудження й
активність. Ці спостереження спонукали до експериментів
з індукованою гіпотермією. Якщо шкіру або кров охоло-
дити до температури, що нижча від температури тіла, то в
тварин, які не впадають у сплячку, а також у людини рівень
метаболічних і фізіологічних процесів послабиться: спо-
вільниться дихання і серцеві скорочення, знизиться кров’я-
ний тиск аж до непритомності. Зі зниженням температури
в прямій кишці до 28°С можливість спонтанного повер-
нення температури до нормального рівня втрачається,
проте особа жива, і відігрівання зовнішнім теплом поверне
її до нормального стану. Якщо в разі охолодження вжити
заходів, що запобігають утворенню в тканинах кристалів
льоду, то температура тіла експериментальних тварин може
бути знижена нижче від точки замерзання, і після наступ-
ного відігрівання не настане ніяких ушкоджень.
Зниження температури тіла в людини до 21-24°С не
спричинює стійких патологічних змін, і таку індуковану
гіпотермію широко використовують у хірургічній практиці.
В пацієнта, який перебуває в стані гіпотермії, протягом
порівняно тривалого часу може бути зупинена кровотеча,
оскільки потреба тканин в О2 значно зменшується; кро-
в’яний тиск знижується, а крововтрати стають мінімаль-
ними. За умов гіпотермії з’являється можливість зупинити
серце, оперувати його, а також виконувати інші маніпуляції,
зокрема операції на головному мозку, які неможливі без
охолодження.
З іншого боку, випадкова гіпотермія, зумовлена трива-
лим перебуванням на холодному повітрі або в холодній
воді, може мати серйозні наслідки і тому потребує старан-
ного обстеження та негайного відігрівання.
Нервові основи інстинктивної
поведінки й емоцій
15
ВСТУП
В емоціях розрізняють два компоненти: психічний і фі-
зичний. Вони охоплюють пізнання, усвідомлення відчуття,
а також, зазвичай, і його причини; афект, нервово-психічне
збудження; спонукання до дії; фізичні зміни, такі як
гіпертензія, тахікардія і потіння. З виявом і походженням
емоцій тісно пов’язані структури гіпоталамуса і лімбічної
системи.
У цьому розділі розглянуто анатомо-гістологічну струк-
туру та головні зв’язки лімбічної системи, фізіологічні
основи емоцій, статевої поведінки, мотивацій, відчуття
страху та гніву, а також пов'язаність з цими процесами най-
важливіших нервових трансмітерів головного мозку.
АНАТОМІЧНЕ УТОЧНЕННЯ
Термін лімбічна частка, або лімбічна система, сто-
сується частини головного мозку, що становить край кір-
кової речовини навколо воріт півкулі великого мозку, і по-
в’язаних з нею глибоких утворів - мигдалеподібного тіла,
морського коника (гіпокампа) і перегородкових ядер (рис.
15-1, 15-2). Цю ділянку раніше називали нюховим мозком,
проте сьогодні лише невелику її частину пов’язують з
функцією нюху.
Гістологічна структура
Лімбічна кора є філогенетично найстаршою частиною
кори великого мозку. Гістологічно це кіркова тканина
2] Нова кора (неокортекс)
Л Алокортекс і юксталокортекс (перехідна кора)
Рис. 15-1. Співвідношення лімбічної (алокортекс і юксталокортекс) і нової (неокортекс) кори у щурів, котів, мавп і людини.
238/РОЗДІЛ 15
Лімбічна кора „
Мозолисте тіло Поздовжні смуги
Склепіння
- Повідець
Зубчаста закрутка
коник
Прозора
перегородка
Пере-
городкове поле
Передні ядра
таламуса
Сосочкове тіло
Мозолисте тіло
Латеральний
нюховий шлях
Погранична
смужка
Медіальний
передньо-
мозковий пучок
Мигдалеталамічні
волокна (безпосередні)
Перегородкове
поле
Нюхова цибулина
Мигдалеподібний
ядерний комплекс
(мигдалеподібне
тіло)
Рис. 15.2. Головні зв’язки лімбічної системи. Вгорі: система
морського коника (гіпокампа). Внизу: нюхові та мигдалеподіб-
ні зв’язки (відтворено за дозволом з Махтап 86: Соггеїаііуе
Меигоапаіоту, 24іЬ есі. Мс6га\л/-НіІІ, 2000).
примітивного типу, яку називають алокортексом і яка в
більшості ділянок має тришарову структуру. Алокортекс
оточений перехідною корою - юксталокортексом - і від-
межовує алокортекс від нової кори (неокортекса). Пере-
хідна кора має від трьох до шести шарів і розмішена, зокре-
ма, в ділянках поясної закрутки та острівця.
Нова кора - це кіркова речовина нелімбічних ділянок
півкулі. Вона побудована переважно з шести шарів (див.
Розділ 11) і є корою найрозвинутішого типу. Площа ало-
кортекса і юксталокортекса в процесі еволюційного роз-
витку ссавців змінюється незначно, проте ці ділянки пере-
криті новою корою внаслідок її надзвичайно інтенсивного
росту, що досягає найбільшого розвитку в людини (див.
рис. 15-1).
Аферентні й еферентні зв’язки
Головні зв’язки лімбічної системи показані на рис. 15-2.
Склепіння сполучає морський коник з сосочковими тілами,
а вони, відповідно, сполучені за допомогою сосочково-
таламічного шляху з передніми ядрами таламуса. Аксони
передніх ядер таламуса надходять до кори поясної закрут-
ки, яка сполучена з морським коником, замикаючи цикл
циркуляції емоційного збудження. Цей цикл уперше опи-
саний Пейпецом, тому його називають циклом Пейпеца.
Співвідношення структури і функції
Одна з особливостей лімбічної системи - нечисленність
її зв’язків з новою корою. Наута зазначав, що “неокортекс
сидить верхи на лімбічній системі як вершник на коні, без
віжок”. Насправді ж є декілька таких зв’язків; з функцій-
ного погляду активність нової кори модифікує емоційну
поведінку, і навпаки. Проте особливістю емоцій є те, що
вони не можуть виникати/зникати завдяки силі волі. Інша
властивість лімбічних циклів - пролонгованість їхньої
діяльності після виникнення збуджень. Цим частково пояс-
нюють факт, що емоційні реакції переважно не є швидко-
плинними і тривають набагато довше, ніж подразники, що
спричинюють їх.
ФУНКЦІЇ ЛІМБІЧНОЇ СИСТЕМИ
Експерименти з подразненням або екстирпацією окре-
мих ділянок лімбічної системи засвідчили, що, крім регу-
лювання нюхової функції, ця система забезпечує вегетатив-
ні реакції. Разом з гіпоталамусом вона також бере участь у
регулюванні статевої поведінки, емоцій, таких як гнів чи
страх, а також у виникненні мотивації.
Вегетативні реакції і поведінка, пов’язані з
прийманням їжі
Подразнення окремих ділянок лімбічної системи спри-
чинює вегетативні реакції, зокрема, зміни кров’яного тиску
і частоти дихання. Ці реакції виникають у випадку подраз-
нення багатьох нервових структур лімбічної системи, тому
малоймовірним є наявність у ній окремих центрів, що
відповідають за конкретні вегетативні реакції. Швидше за
все, ці реакції становлять частину складнішого феномену
реалізації механізмів емоційної поведінки. Подразнення
мигдалеподібних ядер зумовлює рухи, пов’язані з прий-
манням їжі, зокрема жування й облизування, а ушкодження
мигдалеподібних ядер призводить до помірної гіперфагії
і невибагливості щодо їжі, можливо, внаслідок втрати здат-
ності розрізняти їстівну їжу від неїстівної (див. Розділ 16).
СТАТЕВА ПОВЕДІНКА
Статева функція - це складний феномен, у регулюванні
якого беруть участь багато відділів нервової системи. Сам
по собі статевий акт зумовлений низкою рефлексів, інтегро-
ваних у спинному мозку і центрах нижніх відділів стовбура
головного мозку, проте поведінкові компоненти, що супро-
воджують акт, статевий потяг і координовану послідовність
статевих реакцій чоловіків і жінок, які завершуються вагіт-
ністю, значно регульовані лімбічною системою і гіпота-
ламусом. Навчання відіграє важливу роль у формуванні
поведінкових пристосувальних реакцій, зокрема в при-
матів, проте в ссавців-неприматів залицяння й успішне спа-
рювання можливі без набування попереднього досвіду.
Головні реакції, отже, є природженими, і без сумніву, влас-
тиві усім ссавцям. Однак у людини статеві функції значно
НЕРВОВІ ОСНОВИ ІНСТИНКТИВНОЇ ПОВЕДІНКИ Й ЕМОЦІЙ / 239
енцефалізовані і підлягають впливові соціальних та психо-
логічних чинників. Ось чому спочатку розглядають фізіо-
логічні механізми статевої поведінки в експериментальних
тварин, а згодом порівнюють їх з відповідними реакціями
в людини.
Зв’язок з ендокринною функцією
У ссавців-неприматів видалення статевих залоз зумов-
лює зниження або втрату статевої активності як у самців,
так і в самок, хоч у самців окремих видів цей процес від-
бувається дуже повільно. Ін’єкція гормонів статевих залоз
кастрованим тваринам відновлює їхню статеву активність.
Найпомітніший ефект настає після введення самцям тес-
тостерону, а самкам естрогену. Значні дози тестостерону
або інших андрогенів у кастрованих самок спричинюють
характерні для них реакції статевої поведінки, а великі дози
естрогенів у самців - реакції, характерні для них під час
спарювання. Не зрозуміло, чому введення гормонів
протилежної статі зумовлює реакції, що відповідають статі
цієї експериментальної тварини.
Гормональні ефекти в людини
Видалення в дорослої жінки яєчників не обов’язково
призводить до зменшення лібідо (у розумінні статевої заці-
кавленості й потягу) чи здатності до статевого життя. Жін-
ка після менопаузи продовжує статеві стосунки, часто з
такою ж періодичністю, як і раніше. Цей феномен, оче-
видно, зумовлений секрецією стероїдних гормонів кірко-
вою речовиною надниркової залози (і ці гормони перетво-
рюються в естрогени, що циркулюють) або значною енце-
фалізацією статевої функції в людини та її відносною неза-
лежністю від інстинктивного і гормонального контролю.
Застосування статевих гормонів підвищує в людини стате-
ву зацікавленість і потяг. Наприклад, тестостерон підви-
щує лібідо в чоловіків, як і естроген, який застосовують
для лікування карциноми простати. Статева поведінка в
цьому разі стимульована, проте її характер не змінюється.
Наприклад, використання тестостерону гомосексуалами
підвищує їхній гомосексуальний потяг, а не перетворює
його у гетеросексуальний.
Нервове регулювання в чоловічому
організмі
Екстирпація нової кори в тварин-самців переважно галь-
мує статеву поведінку. Часткове усунення кори теж зумов-
лює таке гальмування, і його ступінь не залежить від супут-
нього порушення рухових функцій. Це явище більше вира-
жене в разі ушкодження лобових часток. З іншого боку, у
котів і мавп двостороннє ушкодження лімбічної частки в
ділянці грушоподібної кори над мигдалеподібними ядрами
(рис. 15-3) зумовлює помітне посилення статевої актив-
ності. Ці тварини покривають не тільки дорослих самок, а
й статево незрілих, а також інших самців, роблячи спроби
копуляції з тваринами інших видів і навіть з неживими.
Така поведінка зумовлена наявністю тестостерону і не змі-
нюється зі зростанням його секреції.
Гіпоталамус теж бере участь у регулюванні статевої
поведінки в самців. Подразнення ділянок уздовж медіаль-
ного пучка переднього мозку і суміжних ділянок гіпота-
ламуса зумовлює ерекцію прутня і помітні супутні емоційні
реакції в мавп. Уведення в гіпоталамус кастрованих щурів
тестостерону відновлює характерну статеву поведінку.
Ушкодження в щурів відповідних ділянок передньої час-
тини гіпоталамуса призводить до втрати сексуального інте-
ресу.
Звичайно, важко визначити ступінь екстраполяції даних,
отриманих під час дослідів на тваринах-самцях з ушкод-
женням ділянок, що розміщені навколо мигдалеподібного
тіла, на організм людини, однак є повідомлення про гіпер-
сексуальність у чоловіків з двостороннім ушкодженням
мигдалеподібних ядер або суміжних ділянок.
Статева поведінка жінок
Статева активність самців ссавців є більш чи менш
сталою, водночас у багатьох видів статева активність самок
циклічна. Більшість часу самки уникають самців, відхиля-
ючи їхні статеві домагання. Однак періодично настає рап-
това зміна в їхній поведінці і вони домагаються парування.
Ці короткі періоди еструсу настільки характерні, що ста-
теві цикли видів ссавців, які не мають місячних, теж назва-
ли еструсними циклами.
Зміни в статевій поведінці самок зумовлені зростанням
рівня естрогену, що циркулює в крові. Деякі тварини, особ-
ливо кролики і тхори, входять у стан еструсу і перебувають
у ньому доти, доки не настає вагітність.
У цих видів овуляція спричинена нейроендокринним
рефлексом. Подразнення геніталій або інша чутлива сти-
муляція під час парування призводять до виділення гіпо-
фізом ЛГ, унаслідок чого розривається фолікул яєчника.
В багатьох інших видів, наприклад у мавп (і передусім
людиноподібних), спонтанна овуляція відбувається регу-
лярно через певні проміжки часу, і періоди еструсу збіга-
ються з нею. В неволі ці види паруються зрідка, проте на
волі самки допускають до себе самців під час кожної ову-
ляції. В жінок статева активність виявляється упродовж
усього місячного циклу, однак детальні дослідження за-
свідчили, що, як і в інших приматів, вона буває найвищою
під час овуляції.
Феромони
Речовини, що їх виділяють організми тварин і які зу-
мовлюють гормональні, поведінкові та інші зміни в інших
тварин цього ж виду, називають феромонами. Найвідо-
мішими з них є статеві приваблювальні речовини певних
видів комах, а також запашні феромони, що діють на леме-
шево-носовий орган гризунів (див. Розділ 10). У мавп ста-
тевий потяг самців сильніший, коли їх допускають до сам-
ки в період її овуляції, ніж в інші періоди її циклу. Сигна-
лом, що надходить у цей час від самки до самця, слугує
запах певних жирних кислот вагінального секрету. Збіль-
шення концентрації цих жирних кислот у вагінальному
секреті в середині циклу виявлено також і в жінок. Є під-
стави вважати, що в організмі жінки відбувається проду-
кування запашних феромонів. Наприклад, жінки, що є
близькими подругами, або такі, що проживають разом,
мають тенденцію синхронізувати свої місячні цикли:
пахвинний запах жінок, як уже зазначено, може модифі-
кувати місячний цикл. Крім того, немовлята віддають
перевагу груді і пахвинній подушечці власної матері, а не
будь-якої жінки.
240 / РОЗДІЛ 15
Нервове регулювання в жіночому організмі
Екстирпація нової і лімбічної кори спричинює в тварин-
самок втрату здатності активного шукання і домагання
ними самця під час еструсу (втрата реакції зваблювання).
Ушкодження ділянки навколо мигдалеподібного ядра не
приводить до гіперсексуальності, як це є в самців. Однак
вибіркове ушкодження передньої гіпоталамічної ділянки
зумовлює втрату всіх поведінкових реакцій, характерних
для еструсу (див. рис. 15-3), не впливаючи на гіпофізарно-
яєчниковий цикл (див. Розділ 23).
Уведення незначної кількості естрогену в передню ді-
лянку гіпоталамуса спричинює еструс у щурів, у яких про-
ведено оварієктомію (див. рис. 23-33), однак уведення його
в інші ділянки головного мозку і поза ним не дає цього
ефекту. Очевидно, деякі структури у складі гіпоталамуса
чутливі до дії естрогену, що циркулює, і їхнє стимулювання
зумовлює поведінку, характерну для еструсу.
Вплив статевих гормонів, уведених
під час ранніх стадій розвитку, на
реакції зрілого організму
Статеві стероїдні гормони, введені під час внутрішньо-
утробного розвитку або на ранніх стадіях постнатального
періоду, спричинюють помітні порушення статевої пове-
дінки тварин у разі досягнення ними зрілості. Самки щурів,
яким до п’ятого дня життя вводили одноразово порівняно
невелику дозу андрогену, після досягнення зрілості втра-
чали нормальні періоди еструсу. У них не простежувалося
характерного для дорослих самок циклічного виділення
гіпофізарного гонадотропіну; цей процес набував власти-
вого дорослим самцям тонічного рівномірного характеру,
тобто їхній мозок “маскулінізувався” після одноразової
короткочасної дії андрогену. В таких тварин зафіксовано
також прояви чоловічої статевої поведінки. І навпаки, у
[<"] Поле, що охоплює всі ділянки ушкодження
Ні Ділянка, спільна для всіх ушкоджень
Рис. 15-3. Ділянки гіпоталамуса овець, ушкодження яких
блокує прояви поведінки, характерні для періоду еструсу, без
порушення яєчникових циклів ПГД - проміжна гіпоталамічна
ділянка; СТ - сосочкове тіло; ЗП - зоровий перехрест; Гіпо -
гіпофіз (за даними МТ СІедд і \А/Е бапопд)
самців щурів, кастрованих одразу після народження, вве-
дення гормонів яєчника зумовлює характерну для жіночого
організму циклічну секрецію гонадотропіну і появу ознак
статевої поведінки, властивих самкам. В інтактних самців
такого ефекту не виявлено. Отже, формування “жіночого
гіпоталамуса” на ранніх стадіях розвитку більше зумовлене
відсутністю андрогенів, ніж дією гормонів жіночої статі.
Новонароджені щурі особливо недорозвинуті. В тварин
інших видів, які народжуються розвинутішими, описані
зміни, що формуються під впливом уведення в постнаталь-
ному періоді андрогену, не простежуються. Проте в цих
тварин статеві відхилення виникають у разі дії андрогену
в період внутрішньоутробного розвитку (див. Розділ 23).
Самки мавп, яких під час внутрішньоутробного розвитку
піддавали впливові андрогену, не втрачали “жіночого”
характеру секреції гонадотропіну, однак у них у разі досяг-
нення зрілості простежувались ненормальності статевої
поведінки.
Не виявлено впливу андрогену, уведеного під час внут-
рішньоутробного розвитку жіночого організму людини, на
циклічні особливості секреції гонадотропіну у випадку
досягнення цим організмом зрілості (див. Розділ 23). Однак
деякий маскулінізувальний ефект на статеву поведінку все
ж зафіксовано.
Материнська поведінка
Ушкодження поясної і заваликової частин лімбічної
кори позбавляє тварин характерних особливостей мате-
ринської поведінки. Вірогідно, гормони, окрім пролактину,
що у великих кількостях виділяється під час вагітності і
лактації, суттєво не впливають на цю поведінку.
У самок мишей нокаут /о5#-гена, одного з чотирьох/оз-
генів швидкого реагування (див. Розділ І), зумовлює втрату
післяпологового прийняття та опіки новонароджених.
Знехтувані новонароджені миші гинуть, тоді як такі ж до-
глянуті, хоч і чужою, проте нормальною матір’ю-году вал ь-
ницею, ростуть і розвиваються. Отже, для регулювання
материнської поведінки, потрібні генетичні фактори.
СТРАХ І ЛЮТЬ
Зв’язок лімбічної системи з такими емоціями, як страх
і лють, уперше виявили Клювер і Бюсі, які довели, що після
двосторонньої скроневої лобектомії в мавп виникає низка
характерних порушень (тварини Клювер-Бюсі). Після
екстирпації лімбічних структур скроневої частки тварини
ставали лагідними, у них виникала зорова агнозія (див. Роз-
діл 16), а в самців - також гіперсексуальність. Тварини мог-
ли раз у раз підбирати і переносити різні предмети, слух-
няно виконувати команди щодо маніпулювання ними,
жувати, облизувати і кусати їх, а згодом, якщо предмет не-
їстивний, залишати його, однак через деякий час знову
підбирати як новий.
Страх і лють - це емоції, дещо пов’язані між собою.
Зовнішніми проявами страху, втечі, або реакції уникан-
ня, у тварин є вегетативні реакції, такі як потовиділення і
розширення зіниць, щулення і повертання голови у
пошуках напряму втечі. Лють, бійка, або реакція нападу,
в котів пов’язані з шипінням, пирханням, мурчанням,
НЕРВОВІ ОСНОВИ ІНСТИНКТИВНОЇ ПОВЕДІНКИ Й ЕМОЦІЙ / 241
насювбурченням шерсті, розширенням зіниць і точно
націленими кусанням і дряпанням. Ці реакції, або інколи
їхнє поєднання, можуть бути спричинені подразненням
гіпоталамуса. Якщо тварині щось загрожує, то вона пере-
важно намагається втікати. Загнана в кут тварина готується
до бійки. Отже, страх і лють, очевидно, - це пов’язані між
собою підсвідомі захисні реакції у відповідь на чинники
небезпеки довкілля.
Страх
Реакцію страху в тварин, яким властива свідомість,
можна зумовити подразненням гіпоталамуса і мигдалепо-
дібних ядер; і навпаки, цю реакцію та її вегетативні й ендо-
кринні прояви неможливо спричинити, якщо мигдалепо-
дібні ядра зруйновані. Яскравим прикладом цього може
слугувати реагування мавп на змій. У нормі мавпи відчу-
вають жах, коли бачать змій. Однак після двосторонньої
скроневої лобектомії вони без страху наближаються до реп-
тилій, підіймають їх і навіть можуть з’їсти.
Є значна вірогідність, що мигдалеподібні ядра пов’язані
з кодуванням у пам’яті інформації, яка зумовлює страх.
Навчання страху блоковане, якщо вивільнення ДТП (див.
Розділ 4) перерване на шляхах до мигдалеподібного тіла.
В разі ушкодження мигдалеподібних тіл людини реакції
страху у відповідь на слухові і зорові подразники стають
неповноцінними. В практично здорових людей вигляд
обличчя з виразом страху активований лівим мигдалепо-
дібним тілом. Ступінь цього активування пропорційний до
інтенсивності відчуття страху, що відображене на обличчі.
Щасливі обличчя не зумовлюють такої реакції.
Чутливі імпульси, що спричинюють умовно-рефлектор-
не відчуття страху, можуть надходити безпосередньо до
мигдалеподібних тіл, минаючи чутливі поля нової кори.
Тривога
Тривожне відчуття є нормальною емоцією, що виникає
у відповідних ситуаціях, однак надмірна тривога, а також
тривога у невідповідних ситуаціях може мати згубні на-
слідки. В людини відчуття тривоги супроводжується дво-
стороннім підсиленням кровообігу в обмеженій ділянці
переднього полюса кожної скроневої частки. Бензодіазе-
піни послаблюють це відчуття. Вони зв’язуються з ГАМК-
рецепторами і підвищують провідність СІ по цих йонних
каналах. У хворих з відчуттям тривоги чутливість до бензо-
діазепінів знижена. Ці речовини зв’язуються з субодини-
цями ГАМК-рецепторів. Проте ¥2-субодиниця теж повин-
на бути достатньо чутливою до бензодіазепінів. Миші, гете-
розиготні за нокаутом У2-субодиниці, виявляють знижену
чутливість до цього засобу, і в їхній поведінці помітне під-
вищене відчуття тривоги. Цих тварин можна використати
для дослідження причин і лікування розладів, що супро-
воджуються відчуттям паніки, у людей.
Лють і спокій
У більшості тварин, а також у людини підтримується
баланс між люттю і протилежним станом, який можна
схарактеризувати як спокій. Чималої сили подразники знач-
но впливають на нормальну особу, тоді як подразники малої
сили вона ігнорує. В тварин з ушкодженням головного
мозку цей баланс порушений. Деякі ушкодження зумов-
17 367-2
люють стан, за якого незначні подразники спричинюють
несамовиті напади люті, а інші - стан, під час якого най-
більш травмувальні та провокувальні до гніву подразники
не здатні вивести з рівноваги особу, що ненормально спо-
кійна.
Реакції люті у відповідь на незначні подразники про-
стежуються після екстирпації нової кори або деструкції
вентромедіальних і перегородкових ядер у тварин з інтакт-
ною корою. З іншого боку, двостороннє руйнування миг-
далеподібних ядер у мавп спричинює стан ненормального
спокою, що може перейти в лють після наступного втру-
чання-руйнування вентромедіальних ядер гіпоталамуса.
Лють можна зумовити також подразненням поля, що про-
ходить через латеральну ділянку гіпоталамуса до централь-
ної сірої речовини середнього мозку.
На агресивність поведінки впливають гормони статевих
залоз. У тварин-самців агресивність зменшується після
кастрації і збільшується під впливом андрогенів. Деякий
вплив мають теж соціальні чинники; агресивність більше
виражена в чоловіків, що живуть з жінками, і збільшується
у разі появи суперника.
Удавана лють
Раніше вважали, що напади люті в тварин з ушкоджен-
нями проміжного і переднього мозку, - це лише фізичні,
рухові прояви злості, тому їх називали удаваною люттю.
Однак це неправильно. Хоча напади люті в тварин з ушкод-
женням проміжного мозку індуковані незначними подраз-
никами, та вони звичайно дуже влучно спрямовані до дже-
рела подразнення. Крім того, подразнення гіпоталамуса,
що спричинює реакцію страх-лють, явно неприємне для
тварин, оскільки вони неохоче стають на місце, де прово-
дять такі експерименти, намагаючись уникнути цієї проце-
дури. Тварини з легкістю навчаються натискати на важіль
або виконувати якусь іншу дію, яка дає змогу уникати по-
дразнення гіпоталамуса. Дуже важко або взагалі немож-
ливо виробити умовнорефлекторні реакції (див. Розділ 16)
шляхом подразнення лише рухової системи. Також цього
важко досягти, якщо безумовний подразник не зумовлює
чи то приємного, чи то неприємного відчуття. Факт, що
подразнення гіпоталамуса є набутим безумовним стимулом
у виробленні умовних реакцій уникнення, а також те, що
реакції уникнення є надзвичайно стійкими, свідчить про
таке: подразник неприємний. Отже, навряд чи треба сум-
ніватись у тому, що напади люті мають як психічний, так і
фізичний компоненти, а тому термін удавана лють непра-
вильний.
Клінічні аспекти
Хоча емоційні реакції в людини є складнішими і тон-
шими, ніж у тварин, та їхні нервові субстрати, очевидно,
ті ж. Навряд чи спокій треба зачислюватити до клінічних
синдромів, проте напади люті, зумовлені незначними
повсякденними подразниками, можна простежувати в хво-
рих з ураженнями головного мозку. Ці напади виникають
як ускладнення в разі оперативних втручань на гіпофізі,
якщо є неумисне ушкодження основи головного мозку, а
також можуть супроводжувати низку захворювань нервової
системи, зокрема епідемічний грип і енцефаліт, за яких
ушкоджені нейрони лімбічної системи і гіпоталамуса.
242/РОЗДІЛ 15
МОТИВАЦІЯ І ЗАЛЕЖНІСТЬ
Самостимулювання
Якщо тварину помістити в клітку зі спеціальними важе-
лями чи бар’єрами, то вона раніше чи пізніше випадково
натрапить і натисне на них. А якщо ж важіль сполучений з
електродом, імплантованим у конкретну ділянку головного
мозку (задоволення), то таке натискання зумовить подраз-
нення цієї ділянки, і тварина постійно буде біля важеля,
раз за разом натискаючи на нього. Згодом цей процес зай-
матиме в тварини більшість часу; деякі тварини можуть
навіть відмовлятись заради цього від їжі і пиття, натиска-
ючи на важіль доти, доки не впадуть від виснаження. На-
приклад, щурі натискають на важіль 5 000-12 000 разів за
годину, мавпи - до 17 000. З іншого боку, якщо електрод
уживлений у деяких інших ділянках (незадоволення), то
тварини уникають натискання на важіль, а подразнення цих
ділянок становить потужний безумовний стимул вироблен-
ня умовних реакцій уникання.
Ділянки, подразнення яких заохочує до повторного
натискання на важіль, розміщені в медіальній смузі речо-
вини мозку, що проходить від лобової частки кори через
гіпоталамус до покриву середнього мозку (рис. 15-4). Най-
активнішим щодо цього є дофамінергічний шлях від вент-
ральної частини покриву до напівлежачого ядра (див. ниж-
че). Точки, подразнення яких спричинює реакцію уникан-
ня, розміщені в латеральній частині задньої ділянки гіпо-
таламуса, дорсальних ділянках середнього мозку і внутріш-
ньонюховій корі. Ці ділянки інколи є поряд з ділянками,
подразнення яких спричинює повторні натискання важеля,
проте становлять окрему систему. Ділянки, подразнення
яких спричинює повторні натискання важеля, просторіші,
ніж ті, що зумовлюють уникання. З’ясовано, що в щурів
повторне натискання важеля пов’язане з 35% головного
мозку, тоді як реакція уникання виникає в разі подразнення
5%, а подразнення решти 60% індиферентне.
Без сумніву, деякий ефект подразнення заохочує тварину
стимулювати себе ще і ще, однак не відомо, що тварина в
цьому разі відчуває. Є інформація про відповідні експери-
менти з натисканням на важіль у людей з хронічно імплан-
тованими електродами. Більшість з них - це хворі на шизо-
френію або епілепсію, а окремі - з пухлинами внутрішніх
органів і нестримним болем. Як і тварини, люди повторно
натискають на важіль. Описуючи свій стан під час експе-
рименту, вони звичайно зазначають, що внаслідок цього
отримують задоволення, звільняються від напруження,
відчувають заспокоєння і розслаблення. Зрідка відчуття
характеризують як “радість” чи “екстаз”; а окремі особи з
найвищим рівнем самостимуляції не могли пояснити при-
чини багаторазового натискання. Якщо ж електроди були
в ділянках, стимулювання яких спричинює уникання, особи
характеризували свій стан як гаму відчуттів від невираз-
ного страху аж до жаху. Тому, очевидно, доцільніше не
використовувати різні яскраві терміни, а назвати відповідні
системи головного мозку системою винагороди, або
задоволення, і системою покарання, або уникання.
Засоби, що блокують постсинаптичні Д2-дофамінергічні
рецептори, знижують рівень самостимуляції, а агоністи
дофаміну підвищують його. Головне місце локалізації цих
рецепторів, очевидно, - це напівлежаче ядро.
кора
Рис. 15-4. Ділянки, стимуляція яких зумовлює повторні на-
тискання на важіль, спроектовані на сагітальний переріз го-
ловного мозку щура. Ділянки найвищого рівня самостимуляції
позначені прямокутниками (модифіковано з КоийепЬегд А:
ТЬе геууагсі зузіет оНЬе Ьгаіп. 8сі Ат [Моу] 1978;239:154).
Наведені вище дослідження становлять фізіологічні
підстави для твердження, що поведінка мотивована не
тільки зменшенням чи запобіганням неприємного відчуття,
а також, і головно, задоволенням, як це відбувається в разі
стимулювання системи нагороди головного мозку. Таке
стимулювання забезпечує потужну мотивацію в подоланні
навчального лабіринту або виконанні інших завдань.
Оцінка цих фактів важлива для розуміння згубних звичок,
класичної драйв-блокувальної теорії мотивації поведінки
з послабленням і посиленням життєвої активності, залеж-
ності.
Залежність
Згубні звички - повторне нестримне бажання вживати
речовини, незважаючи на негативні наслідки, - можуть
виникати під впливом різних чинників. Не дивно, що ця
залежність пов’язана з системою нагороди, зокрема з
напівлежачим ядром, розміщеним в основі смугастого
тіла (рис. 15-5), і мезокортикальними дофамінергічними
нейронами, аксони яких проходять з середнього мозку до
цього ядра і лобової частки (див. нижче). Тварини натис-
катимуть на важіль або виконуватимуть інші завдання доти,
доки не отримають через вживлені катетери ін’єкцію речо-
вини, що спричинила в них залежність. Найліпше вивче-
ними засобами, що зумовлюють залежність, є опіати, такі
як морфін, героїн, кокаїн, етиловий алкоголь і нікотин. Усі
вони діють на головний мозок різними шляхами, однак
спільне те, що вони підвищують концентрацію дофаміну,
який діє на В3-рецептори напівлежачого ядра, стимулюючи
систему винагороди головного мозку. З часом згубні звички
зумовлюють толерантність, тобто виникає потреба вжи-
вати щораз більшу кількість засобів, щоб досягти стану
задоволення. Абстиненція зумовлює виникнення психічних
і фізичних симптомів. Причини толерантності й абстинен-
ції ще недостатньо зрозумілі.
Однією з особливостей залежності є тенденція до реци-
дивів після лікування. Для опіатів, наприклад, частота реци-
дивів на першому році після лікування сягає 80%. Рецидиви
НЕРВОВІ ОСНОВИ ІНСТИНКТИВНОЇ ПОВЕДІНКИ Й ЕМОЦІЙ / 243
Рис. 15-5. Ключові поля головного мозку, пов’язані з виник-
ненням залежності. Вентральна ділянка покриву (ВДП) зв’яза-
на через мезокортикальну дофамінергічну систему з напів-
лежачим ядром (НЯ). Присередня передлобова кора (ППК),
морський коник (МК) і мигдалеподібне тіло (М) надсилають
збуджувальні глютамінергічні імпульси до напівлежачого
ядра.
часто виникають під впливом зорових образів, звуків і ситу-
ацій, які супроводжували вживання наркотичних речовин,
що спричинили залежність. З присередньої передлобової
кори, морського коника і мигдалеподібного тіла збуджу-
вальні глютамінергічні волокна надходять до напівлежа-
чого ядра, унаслідок чого може виникати та активність,
яка під впливом згаданих вище умов оточення, а також па-
м’яті зумовлює рецидиви.
НЕЙРОХІМІЯ І ПОВЕДІНКА
До фармакологічних засобів, що модифікують поведін-
ку людини, належать галюциногенні речовини (засоби,
що зумовлюють галюцинації й інші прояви психозів);
транквілізатори (засоби, що загальмовують тривогу й
інші психіатричні симптоми); антидепресанти (засоби, що
підіймають настрій, підвищують інтерес і головні праг-
нення (драйв)). Ці та ще багато інших засобів модифікують
передавання в синаптичних контактах головного мозку.
Нейрохімію відомих і вірогідних синаптичних трансміте-
рів як периферійної, так і центральної нервової системи
розглянуто в Розділі 4. Цей параграф присвячений зна-
ченню названих речовин у процесах інстинктивної пове-
дінки й емоцій.
Аміноергічні системи головного мозку
Виділяють такі чотири великі аміноергічні системи,
тіла нейронів яких розміщені у порівняно нечисленних
ділянках головного мозку, проте аксони цих нейронів
сильно розгалужені й утворюють зв’язки майже з усіма
відділами нервової системи (рис. 15-6): серотонінергічну,
норадренергічну, адренергічну і гістамінергічну. Тіла до-
фамінергічних нейронів розміщені в багатьох відділах
головного мозку, однак їхні аксони теж прямують до різ-
них ділянок.
Серотонін
Тіла серотонінвмісних нейронів розміщені в серединних
ядрах шва стовбура головного мозку, а їхні аксони прохо-
дять до ділянок гіпоталамуса, лімбічної системи, нової
кори і спинного мозку (див. рис. 15-6).
Галюциногенний агент діетиламідлізергінова кислота
(ДЛК) є агоністом серотоніну, який виявляє дію шляхом
активування 5-НТ2-рецепторів (див. Розділ 4) головного
мозку. Швидкоплинні галюцинації й інші психічні від-
хилення, що виникають під впливом цієї речовини, уперше
виявив хімік, який під час синтезу випадково вдихнув її.
Це відкриття привернуло увагу дослідників до проблеми
зв’язку між поведінкою і коливанням вмісту серотоніну в
головному мозку. Псилоцин, сполука, що міститься в
певних грибах, і 7У,7У-діметилтриптамін (ДМТ) теж мають
галюциногенний ефект і, як і серотонін, є похідними трип-
таміну. Сполука 2,5-диметокси-4-метиламфетамін (ДОМ),
мескалін і споріднені з ним сполуки, що теж є справжніми
галюциногенами, становлять радше фенілетиламіни, ніж
індоламіни. Проте дія всіх цих галюциногенів, очевидно,
зумовлена зв’язуванням з 5-НТ2-рецепторами. Сполука 3,4-
метилендіоксиметамфетамін (МДМА), або екстазі, теж
зумовлює залежність. Вона призводить до ейфорії, проте
згодом виникають труднощі з концентрацією, депресія і
(у мавп) безсоння. Цей засіб спричинює виділення серо-
тоніну і вичерпання його; отже, ейфорія може бути зумов-
лена надлишковим виділенням серотоніну, а подальші
симптоми - його вичерпанням.
Як зазначено в Розділі 11, є докази, що агоністи серото-
ніну - це супресори сну. Потенціал у серотонінергічних
нейронах поширюється швидко під час пробудження,
повільно - під час дрімання, ще повільніше - у разі заси-
нання і зовсім не поширюється під час сну зі швидкими
парадоксальними рухами очей (див. Розділ 11).
Уважають, що серотонін у головному мозку виконує ще
багато інших функцій. Він може відігравати стимулюваль-
ну роль у регулюванні секреції пролактину (див. Розділ
23). Вірогідно, що системи низхідних серотонінергічних
волокон гальмують передавання больової чутливості в зад-
ніх рогах спинного мозку. Крім того, відбувається значний
серотонінергічний вплив на надперехресні ядра гіпотала-
муса, і серотонін може брати участь у регулюванні циркад-
них ритмів (див. Розділ 14). З патофізіологічного погляду,
ймовірно, що поява імпульсу в серотонінергічних нейронах
дорсальних ядер шва спричинює мігрень, а протимігренні
засоби саме сповільнюють поширення таких імпульсів.
У хворих на депресію простежується зменшення кон-
центрації в СМР головного метаболіту серотоніну 5-НІАА
(див. рис. 4-23). Цей факт використовують для заперечення
того, що депресію зумовлює низька зовнішньоклітинна
концентрація норадреналіну в головному мозку (див. ниж-
че), а засоби, які інгібують зворотне поглинання норадре-
наліну, мають важливе значення для лікування депресії.
Однак ці засоби теж інгібують зворотне поглинання серото-
ніну, а речовини, такі як флуоксетин (прозак), що інгібують
зворотне поглинання серотоніну, не пригнічуючи зворот-
ного поглинання норадреналіну, були такі ж ефективні, як
антидепресанти. Отже, центр уваги в разі клінічної депресії
переходить від норадреналіну до серотоніну. Цікаво, що
всі ці сполуки треба застосовувати заздалегідь, тобто їхня
244/РОЗДІЛ 15
НОРАДРЕНАЛІН
пляма
Латеральна ділянка покриву
Рис. 15-6. Аміноергічні шляхи головного мозку щура. Подібні шляхи є в головному мозку людини. Дві головні норадренергічні
системи (голубої плями і латеральної ділянки покриву) зображені окремо. ПС - погранична смужка; ДРЯБН - дорсальне
рухове ядро блукаючого нерва; ПЯ - поодиноке ядро; ЦСР - центральна сіра речовина; ЧСС - чорноречовинно-смугаста
система; СКС - середньомозково-кіркова система; НШС - навколошлуночкова система; НГС - невизначено-гіпоталамічна
система; ГЛС - горбово-лійкова система; Д, М і ВЦ - дорсальне, медіальне і верхнє центральне ретикулярні ядра шва.
антидепресивна дія виявляється через чотири-шість тиж-
нів. Це свідчить, що їхня дія є швидше вторинною, а не
власне інгібуванням, яке зумовлює поліпшення стану хво-
рого.
Як зазначено в Розділі 4, блокування МК-1-рецепторів,
що опосередковують дію речовини Р, теж послаблює де-
пресію шляхом поки що невідомого механізму.
У мишей з нокаутом гена МАО типу А (див. Розділ 4) і
в людей з мутантними МАО А генами підвищується
агресивність поведінки. У цьому разі в мишей кількість
серотоніну в головному мозку помітно збільшується. В тва-
рин з нокаутом ауторецептора 5-НТ1в агресивність пове-
дінки теж зростає.
Норадреналін
Тіла нейронів головного мозку, що містять норадрена-
лін, розміщені в голубій плямі та інших ядрах мосту і дов-
гастого мозку. Аксони норадренергічних нейронів, що
виходять з голубої плями, утворюють систему голубої
плями. Вони опускаються до спинного мозку, проникають
до мозочка і підіймаються до пришлуночкового, вадзоро-
вого і навколошлуночкового ядер гіпоталамуса, таламуса,
основи кінцевого мозку і всієї нової кори (див. рис. 15-6).
Аксони норадренергічних нейронів дорсального рухового
ядра блукаючого нерва, поодинокого ядра, дорсальної і
латеральної ділянок покриву середнього мозку формують
латеральну систему покриву, яка передає імпульси до
спинного мозку, стовбура головного мозку, усіх ділянок
гіпоталамуса й основи кінцевого мозку. Висхідні волокна,
що відходять з голубої плями, утворюють дорсальний
норадренергічний пучок, а висхідні волокна латеральної
системи покриву - вентральний норадренергічний пу-
чок (див. рис. 15-6).
Засоби, що збільшують концентрацію норадреналіну в
головному мозку, поліпшують настрій, а засоби, що зни-
жують її, спричинюють депресію. Проте, як зазначено
вище, в разі дослідження патогенезу депресії акцент сьо-
годні переходить від норадреналіну до серотоніну. Крім
того, в осіб з вродженим дефіцитом ВВН депресії не про-
стежується. Звичайно, проблема значення моноамінів у
діяльності головного мозку складна, оскільки висока поза-
клітинна концентрація нейротрансмітерів може спри-
чинити вторинну дію, зокрема на рецептори.
Функція системи голубої плями не з’ясована, хоч відо-
мо, що її електрична активність зростає під впливом
раптових сенсорних подразників, і це може бути пов’язане
НЕРВОВІ ОСНОВИ ІНСТИНКТИВНОЇ ПОВЕДІНКИ Й ЕМОЦІЙ / 245
з пильністю і безсонням. Вентральна норадренергічна
система покриву впливає на секрецію гіпофізотропних
гормонів, що регулюють продукування гормонів перед-
ньої частки гіпофіза (див. Розділ 14). Норадреналін і серо-
тонін, очевидно, беруть участь у регулюванні температури
тіла.
Адреналін
У довгастому мозку є система нейронів, які містять фе-
нілетаноламін-М-метилтрансферазу і які впливають на
гіпоталамус. Ці нейрони виробляють адреналін, однак
функція їхня точно не відома. Адреналінопродукувальні
нейрони мають зв’язки з таламусом, центральною сірою
речовиною і спинним мозком. У ЦНС виявлено також знач-
ні кількості тираміну, функція якого чітко не визначена.
Дофамін
У головному мозку міститься багато дофамінергічних
систем. Стосовно довжини їхніх аксонів ці системи доціль-
но поділяти на ультракороткі, проміжні і довгі. До ультра-
коротких дофамінергічних нейронів належать клітини, роз-
міщені між внутрішнім ядерним і внутрішнім сітчастим
шарами сітківки ока (див. Розділ 8), та навколоклубочкові
клітини нюхової цибулини (див. Розділ 10). Дофамінергічні
нейрони з аксонами проміжної довжини є в складі таких
систем: горбово-лійкової системи (див. рис. 15-6 і 15-7),
де дофамін надходить у гіпофізарні портальні судини і
гальмує секрецію пролактину; невизначено-таламічної
системи, що сполучає гіпоталамус з латеральними пере-
городковими ядрами; навколошлуночкової групи ней-
ронів довгастого мозку, клітини якої розсіяні в речовині
мозку вздовж стінок четвертого шлуночка. Довгоаксонні
дофамінергічні системи (див. рис. 15-6) - це чорноречо-
винно-смугаста система, аксони нейронів якої проходять
з чорної речовини до смугастого тіла, і яка бере участь у
регулюванні рухової активності (див. Розділ 12); і серед-
ньомозково-кіркова система, аксони нейронів якої з по-
криву середнього мозку проходять до лімбічної кори, нюхо-
вого горбика, напівлежачого ядра і відповідних підкіркових
ділянок лімбічної системи. Сучасні дослідження, виконані
в практично здорових людей за допомогою сканувальної
ПЕТ (див. Розділ 32), засвідчили, що з віком кількість дофа-
мінових рецепторів у базальних ядрах значно зменшується.
Цей процес більше виражений у чоловічому організмі, ніж
у жіночому.
Питання зв’язку середньомозково-кіркової системи,
зокрема її вентральної частини від покришки до напівле-
жачого ядра із залежністю розглянуто вище. Вірогідно, що
ушкодження середньомозково-кіркової системи зумовлює
щонайменше частину симптомів шизофренії. Початково
дослідники зосереджували увагу на переподразненні В2-
дофамінових рецепторів лімбічної системи. Амфітамін,
що, як і норадреналін, зумовлює виділення дофаміну в
головному мозку, спричинює подібний до шизофренії пси-
хоз. Оскільки ж кількість О2-рецепторів у головному мозку
в разі шизофренії підвищена, то є логічною позитивна
кореляція між протишизофренічною активністю багатьох
фармакологічних засобів і їхньою здатністю блокувати О2-
рецептори. Однак багато сучасних засобів, активних у ліку-
ванні психозів, блокують не О2-, а О4-рецептори, тому
Рис. 15-7. Горбово-лійкова дофамінергічна система. Попереч-
ний переріз гіпоталамуса щура (люмінесцентна мікроскопія).
Зверніть увагу на тіла дофамінергічних клітин дугоподібного
ядра з кожного боку третього шлуночка, а також на дні шлу-
ночка, та дофамінергічні закінчення на судинах гіпофізарної
портальної системи в зовнішньому шарі серединного підви-
щення (відтворено за дозволом з Нокїеіі Т, Еихе: Оп іґіе тог-
рйоїоду апсі іґіе пеигоепсіосгіпе гоїе ої Нпе Иуроіізаіатіс саі-
есїюіатіпе пеигопз. Іп: Вгаіпе-Епсіосгіпе Іпіегасііоп. Кпідде
К, 8сой □, \Л/еіпсІІ А [есіііогз]. Кагдег, 1972).
сьогодні вивчають питання, чи ці рецептори не є змінені в
осіб з шизофренією.
Гістамін
Як зазначено в Розділі 4, тіла гістамінергічних нейронів
містяться в горбово-сосочковому ядрі вентральної частини
задньої ділянки гіпоталамуса. Аксони цих нейронів прохо-
дять до всіх частин головного мозку (див. рис. 15-6). Функ-
ція цих дифузних гістамінергічних систем остаточно не
з’ясована, однак є очевидним зв’язок впливу гістаміну
головного мозку на пробудження, статеву поведінку, кро-
в’яний тиск, споживання води, поріг болю і регулювання
секреції низки гормонів передньої частки гіпофіза.
Ацетилхолін
Ацетилхолін поширений по всій ЦНС. Висока його кон-
центрація виявлена в корі великого мозку, таламусі та різ-
них ядрах основи переднього мозку. Розподіл холінацетил-
трансферази й ацетилхолінестерази відповідає розподілу
ацетилхоліну. Головна кількість ацетилхолінестерази є в
нейронах, проте її теж виявлено і в клітинах глії. Псевдо-
холінестераза міститься в багатьох відділах ЦНС. Як зазна-
чено в Розділі 4, у головному мозку є різні типи нікотинових
і мускаринових рецепторів. Множинні нікотинові холін-
ергічні субодиниці, гени і білки, кодовані ними, утворюють
різні за компонуванням пентамерні гетеродимери. В голов-
246/РОЗДІЛ 15
йому мозку містяться як постсинаптичні, так і пресинап-
тичні нікотинові холінергічні рецептори, по-різному ском-
поновані в різних ділянках.
Застосування антитіл, специфічних до холінацетил-
трансферази, та імуноцитохімічних методів дало змогу
картувати холінергічні шляхи в головному мозку. Розподіл
холінергічних нейронів подібний до їхнього розподілу в
моноаміноергічній системі тим, що їхня частина дифузно
спрямована до багатьох відділів головного мозку, а відріз-
няється в тому, що є холінергічні інтернейрони і короткі
холінергічні системи по всій ЦНС. Зафіксовано також бага-
то зв’язків базального ядра Мейнерта і сусідніх ядер з
мигдалеподібним тілом та усією новою корою, і ці зв’язки
забезпечують мотивацію, усвідомлення сприйняття і пізна-
вальну здатність. Значна втрата нейронів цієї системи про-
стежується в разі хвороби Альцгеймера (див. Розділ 16).
Система ПГО-піків, відповідальна за ШРО-сон, теж нале-
жить до холінергічних. Про зв’язок нікотину із залежністю
йшлося вище. У великих дозах мускариноергічні блоку-
вальні засоби, такі як атропін, можуть зумовлювати галю-
цинації, а скополамін має седативну дію.
Як зазначено у Розділах 12 і 13, соматомоторні, пре- і
деякі постгангліонарні нейрони автономної нервової сис-
теми належать до холінергічних. Рівень ацетилхолінесте-
рази в корі вищий у щурів, яких утримують групами, ніж у
щурів, яких тримають в умовах ізоляції. Ацетилхолін у
базальних ядрах є збуджувальним посередником, тоді як
дофамін у цих структурах - інгібувальним (див. Розділ 12).
Опіоїдні пептиди
У головному мозку є три типи нейронів, що виділяють
три молекули-попередники опіоїдних пептидів (див. табл.
4-4). Крім того, наявні ще два ендорфіни, прекурсори яких
не відомі. Нейрони, у яких відбувається синтезування про-
енкефаліну, розсіяні по всьому головному мозку, тоді як
тіла нейронів, що продукують проопіомеланокортин, міс-
тяться в дугоподібному ядрі, а їхні аксони проходять до
таламуса і частин стовбура головного мозку (рис. 15-8).
Продинорфін утворюється в нейронах, розміщених пере-
важно в гіпоталамусі, лімбічній системі і стовбурі голов-
ного мозку. Опіоїдні пептиди беруть участь у різних про-
цесах, зокрема розвитку толерантності і наркотичної
і
Ці
а РОМС/р-ендорфінові клітини ! • Енкефалінові клітини
Рис. 15-8. Розподіл у головному мозку р-ендорфінових (ліво-
руч) та енкефалінових (праворуч) нейронів (відтворено за
дозволом з Вагсйаз ЗО еі аі: ВейауіогаІ пеигосйетізігу: ІМеиго-
гедиіаіогу апсі ЬеЬауіогаІ зіаіез. Зсіепсе 1978;200:964).
залежності до морфіну, однак детально ці процеси не
досліджені.
Інші трансмітери
Зв’язок ГАМК з відчуттям тривоги і заспокійлива дія
бензодіазепінів розглянуті в Розділі 4. Крім енкефалінів і
р-енкефаліну, ще інші пептиди, очевидно, беруть участь у
забезпеченні емоційних та інших поведінкових реакцій,
однак це питання не з’ясоване.
Вищі функції нервової системи:
умовні рефлекси, навчання та
споріднені явища
16
ВСТУП
У попередніх розділах описано соматичні й вісцеральні
вхідні та вихідні сигнали з мозку. Серед інших питань роз-
глянуто специфічні вхідні та вихідні сигнали, стани три-
воги, неспання й сну, роль взаємозв’язку між лімбічною
системою та гіпоталамусом у підтриманні гомеостазу й
регулюванні інстинктивної й емоційної поведінки. По-
трібно ще описати явища, які з огляду на відсутність точ-
нішого терміна означили вищими функціями нервової сис-
теми, або вищою нервовою діяльністю. Сюди належать
навчання, пам’ять, мислення, мова та інші розумові функ-
ції. Саме ці процеси розглянуто в цьому розділі.
МЕТОДИ
Розуміння функцій людського мозку стало можливим
завдяки розробці, а сьогодні й широкому використанню
ПЕТ, функційного ЯМР (фЯМР) тощо. Завдяки цим тех-
нологіям можна визначити активність різноманітних діля-
нок мозку як здорових людей, так і людей з багатьма хво-
робами. їх використовують для вивчення не лише прос-
тих реакцій, а й складних аспектів навчання, пам’яті та
сприйняття (перцепції). Фізіологічна основа цих техноло-
гій описана в Розділі 32. Зразок їхнього використання для
вивчення функцій кори головного мозку показано на рис.
16-1; інші приклади застосування в разі вивчення нормаль-
ної фізіології та патофізіології хвороби наведено в Розділах
7-15.
До інших технологій, що дають інформацію про діяль-
ність кори головного мозку, належать подразнення кори
головного мозку людей у стані свідомості, які виникають
підчас нейрохірургічного втручання. В окремих випадках
вивчення провадять за допомогою імплантованих на де-
який час електродів. Цінну інформацію також отримано
завдяки спостереженню за піддослідними приматами. Що-
правда, в цьому випадку важливо мати на увазі, по-перше,
складність спілкування з такими тваринами, а, по-друге, і
це головне, те, що розміри мозку макаки-резус становлять
лише четвертину від розміру мозку шимпанзе - найближ-
чого до людини примата. Відповідно, розміри мозку шим-
панзе в чотири рази менші від розмірів мозку людини.
НАВЧАННЯ ТА ПАМ’ЯТЬ
Характерна ознака живих організмів, передусім людини,
- здатність змінювати поведінку на підставі набутого
досвіду. Це відбувається завдяки навчанню, що є процесом
отримання інформації, та пам’яті, тобто зберігання та
нагромадження інформації. Названі два тісно споріднені
явища треба розглядати нерозривно одне від одного.
Форми пам’яті
З фізіологічного погляду пам’ять поділяють на свідому
й підсвідому (табл. 16-1). Свідома пам’ять, яку також
називають декларативною, чи пізнавальною, пов’язана зі
станом свідомості чи, принаймні, неспання. За її зберігання
відповідає морський коник та інші ділянки медіальних
скроневих часток мозку. Цю форму пам’яті поділяють так:
на події (епізодична пам’ять) та пам’ять на слова, правила,
мову тощо (семантична пам’ять). Підсвідома пам’ять не
стосується стану неспання, її також називають недеклара-
тивною, чи зворотною, а зберігання її в більшості випадків
не пов’язане з морським коником. До підсвідомої пам’яті
належать уміння, навички, умовні рефлекси та ін. (див.
табл. 16-1). Щоправда, свідома пам’ять, необхідна, скажі-
мо, для їзди на велосипеді, стає підсвідомою, як тільки
людина навчиться добре це робити.
Свідома та багато форм підсвідомої пам’яті пов’язані,
по-перше, із короткочасною пам’яттю, що триває від
кількох секунд до кількох годин, упродовж яких процеси в
морському конику та інших ділянках закладають довго-
часні зміни у силі синаптичних зв’язків; та, по-друге, із
довготривалою пам’яттю, яка зберігає спогади роками,
а інколи - усе життя. Спогади, які зберігає короткочасна
пам’ять, піддаються руйнуванню внаслідок травм чи дії
різноманітних ліків, натомість спогади довготривалої
пам’яті стійкіші. Робоча пам’ять - це форма короткочас-
ної пам’яті, яка зберігає інформацію доступною, як зви-
чайно, протягом дуже коротких періодів часу, коли особа
планує на її підставі якусь дію.
Підсвідома пам’ять
Як видно з табл. 16-1, підсвідома пам’ять охоплює
вміння й навички, що одразу ж після набуття стають несві-
домими та автоматичними, а також натаскування, тобто
248/РОЗДІЛ 16
Рис. 16-1. Отримане за допомогою ПЕТ сканування зображення лівої півкулі головного мозку. Показано зони найвищої нейронної
активності, коли суб’єкт виконує різні дії. А-дивиться на слова; активна первинна зорова кора та частина зорово-асоціативної
кори. В - слухає слова; активна зона на стику скроневої та тім’яної ділянок кори. С - вимовляє слова; активна зона Брока та
прилегла лобова частка. О - думає про слова; активні великі зони, в тому числі значна частина лобової частки (на підставі
ПЕТ сканування з КапсІеІ ЕР, 8сґі\л/агі2 ЛЧ, Чеззеїі ТМ: Еззепііаіз оГ ІМеигаІ Зсіепсе апсі Веґіа7іог. МсСга\л/-НіІІ, 1995).
полегшення розпізнавання слів чи об’єктів за допомогою
їхньої попередньої демонстрації. Як приклад можна на-
вести ситуацію, за якої особі легше пригадати слово, якщо
їй підказують кілька перших букв.
Інші форми підсвідомої пам’яті можна розділити на
неасоціативні та асоціативні. У разі неасоціативного на-
вчання організм вивчає окремий подразник, у разі асо-
ціативного навчання відбувається вивчення взаємо-
зв’язків між різними подразниками.
Набування навичок та сенсибілізація
Набування навичок - це проста форма навчання, за якої
нейтральний подразник часто повторюють. За першим ра-
зом цей подразник є повним і зумовлює реакцію (орієнту-
вальний рефлекс, або реакцію “що це?”); зі збільшенням
кількості повторювань він спричинює щораз слабшу біо-
Таблиця 16-1. Типи пам’яті
Свідома
Епізодична
Семантична
Підсвідома
Неасоціативна
Набування навичок
Сенсибілізація
Асоціативна
Класичне вироблення умовного рефлексу
Оперантне (інструментальне) вироблення умовного
рефлексу
Навички та звички
Муштрування
електричну реакцію. Зрештою, суб’єкт звикає до подраз-
ника та ігнорує його. Сенсибілізація є в певному сенсі
протилежною. Повторюваний подразник спричинює силь-
нішу реакцію, якщо його поєднують один чи кілька разів
із неприємним або приємним подразником. Загальнові-
домо, що у людей від подразника виникає інтенсифікація
рівня збудження. Наприклад, мама, сну якої не заважають
різноманітні шуми, моментально прокидається від плачу
своєї дитини.
Процес набування навичок є класичним прикладом
неасоціативного навчання. Класичний приклад асоціатив-
ного навчання - умовний рефлекс.
Умовні рефлекси
Умовний (набутий) рефлекс є рефлекторною реакцією
на подразник, який раніше спричиняв слабку реакцію, на-
буту шляхом повторюваного поєднання цього подразника
з іншим, який подібну реакцію зумовлює, або ж не спри-
чиняв жодної. У класичному експерименті вироблення
умовного рефлексу Павлова вивчали слиновиділення,
зумовлюване вкладанням у рот собаки шматка м’яса. Без-
посередньо перед цим дзвонили у дзвоник, повторюючи
це доти, доки у собаки не почалося слиновиділення на звук
дзвоника, навіть якщо їй не давали м’яса. У цьому експе-
рименті м’ясо, яке вкладали в рот собаки, відігравало роль
безумовного подразника (БП), тобто подразника, що, як
звичайно, спричинює конкретну природну реакцію. Умов-
ним подразником (УП) був звук дзвоника. Після поєднан-
ня безумовного та умовного подразників необхідну кіль-
кість разів УП зумовив реакцію, яку первинно спричиняв
лише БП. Для цього потрібно, щоб УП передував БП. Ін-
ший приклад показано на рис. 16-2. Це так зване класичне
вироблення умовного рефлексу. Сьогодні можна зробити
ВИЩІ ФУНКЦІЇ НЕРВОВОЇ СИСТЕМИ / 249
так, щоб багато соматичних, вісцеральних та інших нев-
ральних змін, які відбуваються, стали умовними рефлек-
торними реакціями. Вироблення цих реакцій часто нази-
вають біологічним зворотним зв’язком. Зміни, які в цьо-
му випадку можуть виникати, охоплюють альтерацію час-
тоти серцевих скорочень та кров’яного тиску. Вважають,
що за допомогою зумовлених знижень кров’яного тиску
можна лікувати гіпертензію. Щоправда, депресорні реакції,
спричинені у такий спосіб, є незначними.
Якщо У П діє тривалий час без БП, то умовний рефлекс,
зрештою, зникає. Цей процес називають загасанням, чи
внутрішнім гальмуванням. Якщо ж на тварину відразу
після УП вплине зовнішній подразник, то умовної реакції
може не відбутися (зовнішнє гальмування). Однак якщо
умовний рефлекс підсилювати час від часу поєднанням УП
та БП, то він не зникне.
Як зазначено в Розділі 15, умовні рефлекси важко фор-
мувати, якщо БП не поєднаний з приємним чи неприємним
впливами. Сильним БП є подразнення як системи винаго-
роди мозку (приємне, чи позитивне підсилення), так і сис-
теми уникання, або больовий шок шкіри (неприємне, чи
негативне, підсилення).
Оперантне (інструментальне) вироблення умовного
рефлексу - це така форма вироблення рефлексів, за якої
тварину вчать виконувати певні завдання для того, щоб
вона отримала винагороду чи уникла покарання. Як БП у
цьому разі є приємна чи неприємна подія, а УП - світло
чи інший сигнал, що спонукає тварину виконувати завдан-
ня. Зумовлені рухові реакції, що дають змогу тварині уник-
нути неприємної події, називають умовними рефлексами
уникнення. Наприклад, тварину вчать, що, натискаючи
на планку, вона зможе уникнути удару електричним стру-
Рис. 16-2. Умовний рефлекс у кролика. Першою стрілкою по-
значено звук, який подають (УП), другою - ніжний струмінь
повітря (БП), який спрямовують кроликові в око. Спочатку ми-
гальна мембрана витягується, реагуючи тільки на струмінь
повітря (вгорі). Після кількаразових повторювань двох подраз-
ників у парі мигальна мембрана починає скорочуватись, реа-
гуючи на звук, що передує струменю повітря (внизу) (модифі-
ковано з АІкоп ОС Метогу віогаде апсі пеигаї вувіетв. 8сі
Ат Циіу] 1989;261:42).
мом по кінцівках. Іншим прикладом є умовний рефлекс
відрази до їжі. У тварин виникає сильна відраза до певної
категорії їжі, якщо під час приймання цієї їжі вводити їй
ін’єкцію препарату, який спричинює нудоту чи хворобу.
Подібні реакції відрази трапляються у людей. Ці умовні
реакції дуже сильні, інколи їх можна вивчати у випадку
одноразового поєднання УП та БП і, на відміну від інших
умовних рефлексів, вони розвиватимуться тоді, коли УП
та БП розділені в часі (годину чи й більше). Вироблення
умовних рефлексів відрази до їжі має важливе значення
для виживання, оскільки ці рефлекси допомагають уникати
отрут. Отже, не дивно, що мозок, можливо, генетично
запрограмований на те, щоб сприяти розвитку реакцій
відрази до їжі.
Міжкіркове переміщення пам’яті
Якщо кіт чи мавпа виявляють умовні рефлекси на візу-
альний подразник, маючи одне око закрите, а після цього
їх тестують, переносячи пов’язку на інше око, то тварина
також відображає збереження умовної реакції. Це відбу-
вається навіть у випадку перерізаного зорового перехрестя,
коли візуальний сигнал із кожного ока йде винятково до
іпсилатеральної ділянки кори. Якщо ж, окрім перерізаного
зорового перехрестя, розділені передня та задня спайки, а
також мозолисте тіло (“тварина з роздвоєним мозком”),
то переміщення пам’яті не виникає. Експерименти з част-
ковим розділенням мозолистого тіла свідчать про те, що
переміщення пам’яті відбувається в передній ділянці мозо-
листого тіла. Подібні результати простежувалися в людей,
вроджених без мозолистого тіла, або в тих, кому його хірур-
гічно видалили з метою запобігти епілептичним нападам.
Це доводить таке: невральне кодування, потрібне для того,
щоб “запам’ятовувати одним оком те, що побачило інше”,
було перенесене до протилежної ділянки кори через спай-
ки. Є докази того, що подібне переміщення інформації від-
бувається через інші сенсорні шляхи.
Молекулярна основа пам’яті
Ключовим пунктом у пам’яті є альтерація сили відпо-
відних синаптичних зв’язків. Майже у всіх найпростіших
випадках така зміна зумовлює синтезування білка та акти-
вування генів. Це відбувається під час зміни короткочасної
робочої пам’яті довготривалою. У тварин набуттю довго-
тривалих завчених реакцій можна запобігти, якщо про-
тягом п’яти хвилин після кожного навчального заняття під-
давати їх анестезії, електрошоку, гіпотермії або ж дії пре-
паратів, антитіл чи олігонуклеотидів, які блокують синте-
зування білків. Якщо ж такі заходи вживати через чотири
години після навчальних занять, то вони жодного впливу
на набуття реакцій уже не матимуть.
У людей подібним явищем є втрата пам’яті про події,
що відбулися безпосередньо перед струсом головного
мозку чи електрошокової терапії (ретроградна амнезія).
Така амнезія простежується впродовж триваліших періо-
дів часу, ніж у піддослідних тварин (інколи протягом
багатьох днів), однак вона не впливає на віддаленіші в
часі спогади.
Біохімічні процеси, що відбуваються під час набуття
навичок та сенсибілізації у Аріузіа та інших безхребетних,
вивчені детально. Разом із процесами, що є в основі кількох
250/РОЗДІЛ 16
форм довготривалої потенціацїї (ДТП) та довготривалої
депресії (ДТД), вони розглянуті у Розділі 4.
Набуття навичок зумовлене зниженням рівня Са2+ у
сенсорних закінченнях, що опосередковують реагування
на певний подразник. Відповідно, сенсибілізацію спри-
чинює пролонгація потенціалу дії у цих закінченнях, що
приводить до збільшення внутрішньоклітинного Са2+,
який сприяє вивільненню нейротрансмітера в разі екзо-
цитозу.
Класичне вироблення умовних рефлексів також зафіксо-
вано в Аріузіа та ссавців в ізольованому спинному мозку
У Аріузіа БП діє пресинаптично на закінчення нейронів,
активованих УП. Унаслідок цього в клітині з’являється
вільний Са2+, що спричинює довготривалу зміну молекули
аденілатциклази.
Отже, внаслідок активування цього ензиму умовним
подразником утворюється більше цАМФ. Це, відповідно,
закриває К+-канали та продовжує тривалість потенціалів
дії за допомогою механізму, описаного у Розділі 4. Вирі-
шальним моментом тут є взаємозв’язок з БП, що діє неза-
довго після УП.
У Аріузіа простежуються морфологічні відповідники
до навчання та пам’яті. Наприклад, 40% відповідних сен-
сорних закінчень у нормальному стані містять активні
зони, тоді як у тварин із набутими навичками активні зони
мають 10% сенсорних закінчень, а у сенсибілізованих -
65%. Довготривала пам’ять приводить до активування
генів, що зумовлюють збільшення кількості синаптичних
контактів.
Кодування підсвідомої пам’яті у ссавців
Без сумніву, молекулярні процеси, подібні до тих, що
відбуваються в Аріузіа, є в основі деяких аспектів підсві-
домої пам’яті у ссавців. Щоправда, тут задіяні процеси,
які стосуються різноманітних частин ЦНС. Деякі дослід-
ники стверджують, що в цьому бере участь також смугасте
тіло.
Відомо, що процес навчання переривається внаслідок
ушкодження базальних ядер. Окрім цього, є докази участі
у процесі й мозочка. Наприклад, вестибулоочний рефлекс,
(ністагм) що підтримує зорову фіксацію під час рухів
головою (див. Розділ 9), можна пристосувати до нової
позиції очей. Однак ця здатність буде втрачена у випадку
уражень жмутка мозочка. Вироблення умовного рефлексу
кліпання очима, коли для цього на око спрямовують стру-
мінь повітря як УП (див. рис. 16-2), не можливе за умов
ушкоджень проміжного ядра. У цьому разі імпульси, зумов-
лені БП, діють через нижню оливу та волокна, спрямовані
вгору до кори головного мозку, щоб змінити реагування
клітини Пуркіньє на тонус, який з’являється через ядра
мосту головного мозку та мохоподібні волокна. Модифі-
кація перенесеної мохоподібними волокнами деполяри-
зації клітини Пуркіньє опосередкована спрямованими
вгору волокнами і також відповідає за зміни у ВОР та вивче-
них м’язових рухах.
Кодування свідомої пам’яті
Кодування свідомих спогадів стосується робочої пам’яті
у лобових частках та специфічного опрацювання у морсь-
кому конику.
Робоча пам’ять
Як уже зазначено, робоча пам’ять утримує інформацію,
що надходить, доступною протягом короткого періоду часу,
доки особа вирішує, що з нею робити. Це така форма па-
м’яті, що дає нам змогу, скажімо, відшукавши у записній
книжці номер телефону, пам’ятати його стільки часу, скіль-
ки потрібно, щоб підняти трубку і набрати його. Вона скла-
дається з так званої центральної виконавчої системи,
що розташована у передлобовій ділянці кори головного
мозку, та двох “систем повторювання” - вербальної сис-
теми для зберігання вербальних спогадів та паралельної
візуоспатичної системи для зберігання візуальних і прос-
торових характеристик об’єктів. Інформацію у ці системи
повторювання спрямовує виконавча система.
Морський коник та
медіальна скронева частка
Ділянки робочої пам’яті сполучені з морським коником
та закрутками морського коника медіальної скроневої
ділянки кори, що примикають (див. рис. 15-1 та 16-3). У
людей двостороннє руйнування вентрального морського
коника, або ж хвороба Альцгеймера, та подібні процеси,
що руйнують СА1-нейрони, призводять до значних дефек-
тів короткочасної пам’яті. Такі ж наслідки спричинюють
двосторонні ураження у мавп. Водночас подібні ушкод-
ження в людей не впливають на робочу пам’ять та пам’ять
про минуле. Окрім цього, як звичайно, неушкодженими є
процеси підсвідомої пам’яті. В контексті свідомої пам’яті
такі особи поводять себе адекватно доти, доки концент-
рують увагу на тому, що роблять. Однак як тільки їх від-
волікти від заняття навіть на короткий час, то вся пам’ять
про те, що вони нещодавно робили, буде втрачена. Отже,
такі люди здатні засвоювати нові знання та зберігати
спогади про події, що відбулися до ушкодження, проте не
можуть формувати нові довготривалі спогади.
Морський коник тісно пов’язаний із закруткою морсь-
кого коника у медіальній лобовій частці кори (див. рис.
12-3). Сьогодні процеси пам’яті вивчають не лише за допо-
Рис. 16-3. Зони, задіяні у кодуванні свідомих спогадів (моди-
фіковано з Кизз МО: Метогіез аге тасіе оТІіііз. Зсіепсе 1998;
281:1151).
ВИЩІ ФУНКЦІЇ НЕРВОВОЇ СИСТЕМИ / 251
могою фЯМР, а й вимірюванням збуджених потенціалів
(тобто потенціалів пов’язаних із подією (ППП)) у хворих
на епілепсію з імплантованими електродами. Коли ці особи
згадують слова, то підвищена активність простежується у
їхній лівій лобовій частці та у лівій закрутці морського
коника, натомість, коли вони згадують образи чи сцени,
то активність фіксують у правій лобовій частці та закрутках
морського коника з обох боків.
У процесах пам’яті задіяні також зв’язки морського ко-
ника з проміжним мозком. У деяких алкоголіків із ушкод-
женням мозку погіршується пам’ять на недавні події. Таку
втрату пам’яті пов’язують із наявністю патологічних змін
у сосочкових тілах, що мають розгалужені еферентні з’єд-
нання, які йдуть через склепіння до морського коника, і
проекційні нервові волокна, які через сосочково-таламіч-
ний шлях проходять до переднього таламуса. Зазначимо,
що ушкодження таламуса у мавп також спричинюють втра-
ту пам’яті на недавні події. З таламуса волокна, що
відповідають за пам’ять, відходять до передлобової ділянки
кори, потім - до основи переднього мозку, звідки йдуть
дифундивні холінергічні проекційні нервові волокна до
всієї нової кори, мигдалеподібного тіла та морського кони-
ка з базального ядра Мейнерта. У випадку хвороби Альц-
геймера простежуються серйозні втрати цих волокон (див.
нижче).
Мигдалеподібне тіло тісно пов’язане з морським кони-
ком і задіяне у кодуванні емоційних спогадів. Як зазначено
у Розділі 15, унаслідок ушкодження мигдалеподібних тіл
тварини стають менш лякливими. Здорові люди запам’я-
товують події, пов’язані з переживанням сильних емоцій,
набагато ліпше, ніж події без емоційного навантаження.
Натомість у пацієнтів із двосторонніми ушкодженнями
мигдалеподібного тіла такої різниці нема.
Конфабуляція є цікавим, однак слабко вивченим ста-
ном, що інколи трапляється в осіб з ушкодженнями вент-
ромедіальних ділянок лобових часток. Такі люди погано
складають тести на пам’ять, однак невимушено описують
події, яких ніколи не було. Такий стан ще називають
“чесною брехнею”.
Довготривала пам’ять
На відміну від процесу кодування короткочасної пам’яті,
що відбувається у морському конику, довготривалі спогади
зберігаються у різноманітних частинах нової кори. Оче-
видно, різні елементи спогадів - візуальні, нюхові, слухові
тощо - містяться у відповідних ділянках кори, що пов’язані
з такими функціями. Ці елементи поєднуються внаслідок
довготривалих змін сили передавання на відповідних си-
наптичних з’єднаннях таким способом, що всі компоненти
образу переходять до свідомості, коли особа відтворює
спогад у пам’яті.
Як тільки довготривалі спогади закладено, їх можна від-
творити за допомогою значної кількості різноманітних асо-
ціацій. Наприклад, спогад про яскраву сцену можна від-
новити не лише у випадку подібної сцени, а й за допомогою
звуків чи запаху, пов’язаного зі сценою чи словами “сцена”,
“яскравий” та ін. Отже, до кожного кумульованого спогаду
повинні бути численні шляхи. Крім того, багато спогадів
мають емоційний компонент. Говорячи простіше, спогади
можуть бути приємними чи неприємними.
Відоме та невідоме
Цікаво, що подразнення деяких ділянок скроневих час-
ток у людей зумовлює зміни у сприйнятті навколишнього
середовища. Наприклад, від дії подразника суб’єкт може
почуватися незвично у відомому місці або ж відчувати: те,
що стається, вже було в минулому. Виникнення такого
почуття у відповідних ситуаціях, можливо, допомагає нор-
мальній особі пристосуватися до середовища довкілля. У
невідомому оточенні особа перебуває в стані тривоги й
настороженості, тоді як у відомому її пильність послаблена.
Неадекватне відчуття знайомості під час нових подій чи в
новому оточенні КЛІНІЧНО відоме ЯК явище дер VII (у
перекладі із фр. - вже побачене). Це явище трапляється
від часу до часу у здорових людей, однак може виникати
як аура (особливе відчуття безпосередньо перед нападом)
у пацієнтів з епілепсією у випадку ураження скроневої
частки.
Висновок
Отже, кодування свідомої пам’яті все ще потребує де-
тального вивчення. Відповідно до різних поглядів інфор-
мація про відчуття тимчасово нагромаджується у різно-
манітних частинах передлобової ділянки кори як робоча
пам’ять. Інформація в робочій пам’яті переходить до меді-
альної скроневої частки і, особливо, до закрутки морського
коника, а звідти - до морського коника, де відбувається її
опрацювання у досі нез’ясований спосіб. У цей період, як
описано вище, активність є вразливою. Сигнал із морсь-
кого коника переходить через підставку в напрямі нюхової
кори і якимось чином зв’язує та посилює кругообіг у бага-
тьох різних ділянках нової кори, формуючи з часом стійкі
спогади, які можна відновити за допомогою багатьох різ-
них асоціацій.
Хвороба Альцгеймера і стареча деменція
Для хвороби Альцгеймера характерною є втрата корот-
кочасної пам’яті, що прогресує, після якої настає загальна
втрата коґнітивної (від англ. соп§епіїіуе - пізнавальний)
функції та смерть у людей середнього віку. Подібний деґра-
даційний процес в осіб старшого віку називають старечою
деменцією типу Альцгеймера, однак часто також хворобою
Альцгеймера. Здебільшого ця хвороба спорадична, та трап-
ляються й сімейні типи захворювання. Вони становлять
50-60% від усіх випадків старечої деменції. Пацієнти з хво-
робою Альцгеймера потребують цілодобового догляду.
Оскільки 10-15% населення віком понад 65 років та майже
50% населення віком понад 85 років притаманний певний
рівень деменції, то такий стан є не лише серйозною медич-
ною проблемою, а й економічною, особливо з огляду на
те, що кількість старших людей серед населення розви-
нутих країн збільшується.
Ранніми змінами у випадку хвороби Альцгеймера є
атрофія морського коника та нюхової кори. Ці зміни можна
фіксувати за допомогою ЯМР упродовж двох років, перш
ніж буде визначено точний діагноз. У цьому разі відбува-
ється втрата холінергічних та інших нейронів у корі голов-
ного мозку і гостра втрата холінергічних нейронів у базаль-
ному ядрі Мейнерта й подібних ядрах, що містять тіла клі-
тин цих нейронів, які проектують до морського коника,
мигдалеподібного тіла та нової кори (див. Розділ 15). Не-
252/РОЗДІЛ 16
значних тимчасових поліпшень стану у випадку хвороби
Альцгеймера інколи можна досягти за допомогою препа-
ратів, що інгібують ацетилхолінестеразу і, відповідно,
послаблюють втрату ацетилхоліну. Щоправда, таке ліку-
вання не впливає на дегенеративні процеси, що є в основі
цієї хвороби.
Причина нейронної дегенерації у випадку хвороби
Альцгеймера досі не з’ясована. Цитопатологічними озна-
ками хвороби є внутрішньоклітинні нейрофібрилярні
клубочки, які складаються частково з гіперфосфорильо-
ваних форм білка тау, що в нормальному стані зв’язується
з мікротрубочками (див. Розділ 1), та позаклітинних ста-
речих бляшок, що мають серцевину з Р-амілоїда (АР),
оточеного нервовими волокнами та реактивними гліаль-
ними клітинами. Бета-амілоїди - це пентиди АР40 та АР42,
утворені з амілоїдного прекурсорного білка (АПБ). Зокре-
ма, Ар42 формує нерозчинні агрегати внаслідок гідролізу
АПБ. У цьому разі ключовим ензимом є у-секретаза. У
близько 50% ранніх випадків хвороби Альцгеймера вини-
кають мутації генів, що відповідають за два білки, які міс-
тяться в мембранах органел клітин: пресенілін 1, кодова-
ний геном на хромосомі 14, та майже ідентичний до нього
пресенілін 2, кодований геном на хромосомі 1. Обидва
пресеніліни пов’язані з активністю у-секретази. Мутації
гена на хромосомі 21, кодованого АМБ, також призводять
до ранніх випадків хвороби Альцгеймера. Цікаво, що паці-
єнти із синдромом Дауна мають додаткову хромосому 21
(трисомія 21), і відомо, що у них деменція типу Альцгей-
мера розвивається в ранньому віці. Якщо АР42 акумульо-
ваний позаклітинно, то він може бути токсичним для нер-
вових клітин. Є думки, що саме це й може спричиняти хво-
робу Альцгеймера.
Сьогодні відомо, що естроген сповільнює прогресуван-
ня хвороби Альцгеймера. Крім того, є взаємозв’язок між
ізоформами аполіпопротеїну Е (АПО Е; див. Розділ 17) та
віком виникнення хвороби. Ген, що відповідає за цей білок,
міститься на хромосомі 19 і утворює три головні ізоформи,
відмінні між собою одними чи двома амінокислотами. В
осіб, гомозиготних для ізоформи АПО-4, хвороба Альц-
геймера розвивається раніше, ніж у тих, хто гомозиготний
для ізоформ АПО-2 та АПО-3 чи гетерозиготний для будь-
якої з них. Однак для того, щоб з’ясувати роль Ар, естро-
гену та ізоформи АПО Е в патогенезі цієї хвороби, треба
виконати значну кількість додаткових досліджень.
Цікаво, що вибіркова дегенерація в процесі старіння
може відбуватися в трьох різних типах клітин у ЦНС, спри-
чинюючи три різні хвороби, що прогресують, призводять
до деформації, а в кінцевому підсумку - до смерті. Як уже
зазначено, дегенерація холінергічних нейронів в основі
переднього мозку пов’язана з хворобою Альцгеймера,
дегенерація дофамінергічних нейронів у чорній речовині
- з хворобою Паркінсона (див. Розділ 12), а дегенерація
холінергічних рухових нейронів у стовбурі мозку та спин-
ному мозку - з однією з форм бокового аміотрофічного
склерозу (БАС). БАС часто називають хворобою Лу Ґеріґа,
оскільки цей відомий американський бейсболіст помер від
неї. Усі три хвороби переважно спорадичні, однак бувають
і родинні форми. У 5% випадків БАС є родинним, у 40% із
цих п’яти фіксують мутацію гена, відповідального за Си/
7п супероксиддисмутазу (СОД-1) на хромосомі 21. Дефек-
тивний СОД-1 ген може допускати нагромадження вільних
радикалів, які руйнують нейрони. Дегенеративні хвороби
нервової системи, зумовлені посиленими тринуклеотид-
ними повторюваннями, розглянуто у Розділі 12.
ФУНКЦІЇ НОВОЇ КОРИ
За пам’ять та навчання відповідають багато частин моз-
ку, однак центри, що контролюють деякі інші функції ви-
щої нервової діяльності, зокрема, механізми, пов’язані з
мовою, переважно зосереджені у новій корі. Мовлення й
інші розумові функції особливо добре виражені у людей,
оскільки саме в них покривний шар нової кори розвинутий
найліпше.
Анатомічні особливості
Лише у трьох сучасних видів розміри мозку більші, ніж
у людини (бурий дельфін, слон та кит), однак за співвідно-
шенням маси мозку до маси тіла людина впевнено посідає
перше місце. З порівняльного погляду найхарактернішою
ознакою людського мозку є надзвичайний ріст трьох голов-
них асоціативних ділянок: передньої, що міститься перед
премоторною ділянкою; тім’яно-скронево-потиличної,
що є між соматосенсорною та зоровою ділянками кори і
проходить у задню ділянку скроневої частки; скроневої,
що розташована від нижчої ділянки скроневої частки до
лімбічної системи (рис. 16-4). Пропорції між різними час-
тинами мозку людини й мавпи подібні, та оскільки людсь-
кий мозок більший, то більшим є і загальний розмір діля-
нок асоціації. Ділянки асоціації - це елементи шестишаро-
вого покриття нової кори. Такий шар із сірої речовини по-
криває бокові поверхні півкуль головного мозку від кон-
центричних алокіркових та юксталокіркових кілець навко-
ло воріт (див. Розділ 15).
Нейронні зв’язки в межах нової кори утворюють склад-
ну мережу (див. рис. 11-2). Низхідні аксони з великих клі-
тин у пірамідальному клітинному шарі випускають кола-
тералі, що зворотно зв’язуються через асоціативні нейрони
Рис. 16-4. Вигляд збоку кори головного мозку людини. Пока-
зано сенсорні, рухові та асоціативні зони.
ВИЩІ ФУНКЦІЇ НЕРВОВОЇ СИСТЕМИ / 253
з дендритами клітин, із яких вони походять, закладаючи
основу складного регуляторного механізму зворотного
зв’язку. Зворотні колатералі також зв’язуються із сусідніми
клітинами. Великі складні дендрити глибоких клітин прий-
мають специфічні та неспецифічні таламічні аферентні,
ретикулярні аференті та асоціативні волокна з інших діля-
нок кори. Специфічні таламічні аферентні волокна мають
закінчення у четвертому шарі кори. Пластичність кіркових
зв’язків та їхню здатність пристосовуватися описано в
Розділі 7.
Комплементарна спеціалізація півкуль
порівняно з “домінуванням головного
мозку”
Однією групою функцій, за яку тою чи іншою мірою
відповідає нова кора, є мова, тобто розуміння сказаного та
писаного слова, а також висловлення ідей за допомогою
мовлення чи писання. Остаточно з’ясовано, що функції
людської мови залежать більше від одної півкулі головного
мозку, ніж від іншої. Ця півкуля відповідає за категоризацію
та символізацію, і її часто називають “домінуючою пів-
кулею”. Звичайно ж, інша півкуля не є менш розвиненою;
вона провідна у сфері просторово-часових відносин. Саме
у цій півкулі відбувається, наприклад, ідентифікування
об’єктів за їхньою формою чи розпізнавання мелодій; вона
також відіграє первинну роль у розпізнаванні облич. Від-
повідно, концепцію “домінування головного мозку” та
домінуючої і недомінуючої півкулі було замінено кон-
цепцією комплементарної спеціалізації півкуль. Одна пів-
куля спеціалізується на послідовно-аналітичних процесах
(категорична півкуля), інша - на візуоспатичних (репре-
зентативна півкуля). За функції мови відповідає кате-
горична півкуля. Спеціалізація півкуль є й у мавп, отже,
вона розпочалася до еволюції мови.
Ушкодження категоричної півкулі зумовлюють мовні
розлади, які не виникають навіть після важких ушкоджень
репрезентативної. Наслідком ушкодження репрезентатив-
ної півкулі є астереогноз (нездатність визначати форми
об’єкта на дотик зі збереженою тактильною та м’язовою
чутливістю) та інші агнозії. Агнозія - це загальний термін,
яким означають нездатність розпізнавати об’єкти за допо-
могою певного чуття. Такі дефекти є наслідком уражень
переважно тім’яної частки. Ушкодження в репрезен-
тативній півкулі нижньої тім’яної частки, а також у задній
ділянці тім’яної частки, що міститься близько до потилич-
ної, зумовлює односторонню неуважність та недбальст-
во. Особи з такими ураженнями не мають явних первинних
візуальних, слухових чи соматосенсорних дефектів, однак
вони ігнорують подразники з контралатеральної частини
тіла чи з простору навколо цих частин. Це призводить до
того, що особа не піклується про половину свого тіла. У
разі крайніх проявів особа може голити половину лиця,
одягати половину тіла або читати половину кожної сторін-
ки. Така нездатність скласти картинку видимого простору,
з одного боку, зумовлена зміщенням зорової уваги в сто-
рону ушкодження мозку; її можна полегшити, якщо не пов-
ністю виправити, за допомогою окулярів із призмами.
Зазначимо, що спеціалізація кожної з півкуль зумовлена
також іншими частинами кори. Пацієнти з ушкодженнями
категоричної півкулі часто стурбовані своїм станом і пере-
бувають у депресії, натомість пацієнти з ушкодженнями
репрезентативної півкулі часто безтурботні, а інколи є в
стані ейфорії. Крім того, пацієнти з ушкодженнями репре-
зентативної півкулі мають проблеми з розпізнаванням
емоцій інших людей.
Спеціалізація півкуль пов’язана з переважним викорис-
танням однієї руки. Це явище визначене генетично. У 96%
правшів, що становить 91% людства, домінує ліва, або
категорична, півкуля, у решти 4% - права. Приблизно у
15% лівші в права півкуля є категоричною, а ще у 15% чіткої
латералізацїї не зафіксовано, у решти 70% лівшів катего-
рична ліва півкуля. Цікаво, що нездатність до навчання,
наприклад, дислексія, тобто обмежена здатність навчитися
читати, у лівшів трапляється в 12 разів частіше, ніж у прав-
шів. Це можна пояснити тим, що деякі суттєві порушення
у лівій півкулі призводять до зміни переважного корис-
тування однією з рук на ранній стадії розвитку. Щоправда,
просторові здібності лівшів на порядок вищі від середньо-
го рівня. Непропорційно велика частина художників, музи-
кантів та математиків - лівші. З поки що нез’ясованих
причин тривалість життя лівшів є коротшою, ніж правшів.
Між двома півкулями є анатомічні відмінності, і це може
впливати на відмінності у функціях. Як зазначено у Розділі
9, скронева площина, ділянка верхньої скроневої закрут-
ки, що відповідає за пов’язані з мовою слухові процеси, з
лівого боку стабільно більша, ніж із правого. Таке ж спів-
відношення притаманне шимпанзе, хоча, як відомо, мова
є рисою, майже винятково властивою людині. Завдяки візу-
алізацїї з’ясовано, що інші ділянки поверхні лівої скроневої
частки більші у правшів, права лобова частка, як звичайно,
більше потовщена, ніж ліва, а ліва потилична частка шир-
ша і простягається через серединну лінію. Частини поверх-
ні лівої скроневої частки є стабільно більшими у правшів.
Зафіксовано також хімічні відмінності між двома части-
нами мозку. Наприклад, у шляху між чорною речовиною
та смугастим тілом концентрація дофаміну вища з лівого
боку у правшів і з правого - у лівшів. Фізіологічне значення
цих відмінностей поки що невідоме.
У пацієнтів, хворих на шизофренію, за допомогою ЯМР
виявлено знижений рівень сірої речовини з лівого боку, у
передній ділянці морського коника, мигдалеподібного тіла
та закрутці морського коника, а також у задній верхній
скроневій закрутці. Ступінь зменшення її рівня у лівій верх-
ній скроневій закрутці зумовлює відповідні зміни у роз-
ладах мислення в разі шизофренії. Для цього захворюван-
ня характерними є розлади дофамінергічних систем (див.
Розділ 15) та кровоплину головного мозку (див. Розділ 32).
ФІЗІОЛОГІЧНІ основи мови
Мова - одна з фундаментальних основ людського інте-
лекту та ключовий елемент культури. Головні ділянки моз-
ку, що відповідають за мову, розташовані вздовж та біля
Сильвієвої борозни (бічної борозни головного мозку) кате-
горичної півкулі. Ділянка в задній частині верхньої скроне-
вої закрутки, яку називають зоною Верніке (рис. 16-5),
відповідає за сприймання слухової та візуальної інформації.
Вона має проекції через дугоподібний пучок до зони
Брока (зона 44) у лобовій частці відразу перед нижнім
кінцем рухової кори. В зоні Брока відбувається деталізу-
вання та впорядкування інформації, отриманої із зони
254/РОЗДІЛ 16
Зона Вагонне
Рис. 16-5. Розташування деяких зон у категоричній півкулі,
що відповідають за функції мови.
Верніке, і далі вона переходить через зону артикуляції
мовлення на острівці до рухової кори, ініціюючи відповідні
рухи губ, язика та гортані й витворюючи мову. Імовірна
послідовність процесів, що відбуваються, коли особа нази-
ває побачений об’єкт, зображена на рис. 16-6. У кутовій
закрутці, що за зоною Верніке, відбувається опрацювання
інформації від прочитаних слів таким способом, що їх
можна перевести в слухові форми слів у зоні Верніке.
За допомогою фЯМР з’ясовано, що в осіб, які вивчають
іншу мову в дорослому віці, відповідальна за це ділянка
Зона Брока
Зона
Верніке
(зона 22)
Права
півкуля
Ліва
півкуля
Кутова закрутка
(зона 39)
Первинна зорова кора
(зона 17)
З бокового
колінчастого ядра
Лицева сторона 74
рухової кори
(зона 4)
Зони зорової кори
вищого порядку
(зона 18)
Рис. 16-6. Шлях, який проходять імпульси, коли особа називає
візуальний об’єкт. Проекція на горизонтальний зріз людського
мозку.
зони Брока розміщена біля зони, відповідальної за рідну
мову, однак відокремлена від неї. Натомість у дітей за ви-
вчення двох мов у ранньому віці відповідає одна зона.
Відомо також, що діти опановують іноземну мову набагато
легше, ніж дорослі.
Розлади мовлення
Порушення мовних функцій, не зумовлене дефектами
зору чи слуху або руховим паралічем, називають афазією.
Вони зумовлені ушкодженнями в категоричній півкулі.
Найпоширеніші причини їхньої появи - емболія або тром-
боз кровоносних судин головного мозку. Є багато різно-
манітних класифікацій афазій, однак найдоречніший їхній
поділ на афазію зі здатністю вільно говорити, афазію
без здатності вільно говорити й аномічну афазію. У
випадку афазії без здатності вільно говорити ушкоджена
зона Брока (табл. 16-2); мовлення є повільним, слова
вимовляти складно. За важких ушкоджень цієї зони
пацієнти обмежені у висловленні цілого спектра значень
та емоцій лише двома-трьома словами. Інколи особа
пам’ятає саме ті слова, які вона вимовляла в час отримання
травми або тромбозу судин.
Одна з форм афазії зі здатністю вільно говорити настає
після ушкодження зони Верніке. В такому стані мова паці-
єнта нормальна, інколи він говорить непомірно багато. Що-
правда, для такого мовлення характерна значна кількість
жаргонізмів і неологізмів, які часто не мають змісту. Крім
того, пацієнт не розуміє значення вимовлених чи написаних
слів, тому інші аспекти використання мови заблоковані.
За іншої форми афазії зі здатністю вільно говорити паці-
єнт може порівняно добре говорити й розуміти вимовлені
кимось слова, однак не може скласти в одне ціле частини
слів чи відтворити слова в уяві. Цей стан називають про-
відниковою афазією, оскільки вважали, що вона зумов-
лена ушкодженнями дугоподібного пучка, який з’єднує
зони Верніке та Брока. Сьогодні відомо, що насправді опи-
саний вище стан спричинюють ушкодження у слуховій
ділянці кори та навколо неї (зони 40, 41 та 42).
У випадку ураження кутової закрутки в категоричній
півкулі, що не зачіпає зон Брока чи Верніке, труднощів із
мовленням та розумінням слухової інформації не виникає,
однак є проблеми з розумінням писаних слів чи малюнків,
бо опрацювання візуальної інформації не відбувається і не
Таблиця 16-2. Характерні реакції пацієнтів з
ушкодженнями різних зон, яким показали малюнок із
зображенням стільця
Тип афазії / зона ушкодження Характерні помилки в разі називання предмета
Без здатності вільно говорити / зона Брока “Сстіллець”
Зі здатністю вільно говорити / зона Верніке “Табуретка” чи “столець” (неологізм)
Зі здатністю вільно говорити / зони 40, 41 та 42; провідникова афазія “Кінець...ні, кілець... сільце”
Аномічна / кутова закрутка “Я знаю, що це,... у мене таких багато”
ВИЩІ ФУНКЦІЇ НЕРВОВОЇ СИСТЕМИ / 255
потрапляє до зони Верніке. Унаслідок цього виникає стан,
який називають амнестична (номінативна) афазія.
Сьогодні описано багато вибіркових дефектів мовлення.
Наприклад, ушкодження лівої скроневої частки (зона 38)
зумовлюють нездатність відтворювати в пам’яті назви
місць чи імена осіб, однак не впливають на здатність вико-
ристовувати загальні назви, дієслова та прикметники.
Ізольовані ушкодження, що спричинюють описані ви-
ще вибіркові дефекти, все ж трапляються. Як звичайно,
ураження мозку є загальнішими. Відповідно, частіше фік-
сують кілька форм афазії. Здебільшого афазія буває загаль-
ною (глобальною) і вражає як рецептивні, так і експре-
сивні функції. У таких випадках мовлення обмежене. У
разі всіх афазій, що вражають функції мовлення, ушкод-
жені й функції письмової мови, однак відповідальні за це
невральні процеси ще не з’ясовані. Цікаво також, що глухі
пацієнти у випадку пошкодження категоричної півкулі
втрачають здатність спілкуватися мовою знаків.
Як уже зазначено, афазії зумовлені ушкодженнями кате-
горичної півкулі. Ушкодження ж репрезентативної півкулі
мають інші специфічні наслідки. Наприклад, вони можуть
спричинити нездатність розповісти історію чи пожарту-
вати, а окрім того, негативно впливають на здатність особи
зрозуміти суть жарту, розпізнавати різницю в інтонації. Це
є ще одним доказом твердження про те, що кожна півкуля
має свою спеціалізацію.
Заїкання пов’язане з домінуванням правої частини кори
та поширеною високою активністю в мозочку й корі голов-
ного мозку, що стосується і підвищеної активності в допо-
міжній руховій зоні. Подразнення частини цієї зони зумов-
лює сміх, причому його тривалість та інтенсивність про-
порційна до інтенсивності подразника.
Розпізнавання облич
У веретеноподібній закрутці на внутрішній поверхні
правої скроневої частки у правшів відбувається опрацю-
вання інформації, потрібної для аналізу облич. За допо-
могою названої, а також сусідніх зон стає можливе і їхнє
розпізнавання (рис. 16-7). Ушкодження цієї зони спри-
чинюють прозопагнозію, нездатність розпізнавати облич-
чя. Пацієнти з такою аномалією можуть розпізнавати фор-
ми та відтворювати їх, розрізняти людей за голосами, а у
багатьох простежуються автономні реакції, коли вони ба-
чать знайомі обличчя. Відповідно, таких реакцій нема, коли
пацієнти бачать незнайомі обличчя. Щоправда, вони не
можуть ідентифікувати знайомі обличчя, які бачать. У
цьому разі задіяною є і ліва півкуля. Однак роль правої
півкулі первинна. Наявність автономної реакції на знайоме
збличчя у випадку нездатності його розпізнати пояснюють
твердженням щодо окремого дорсального шляху опрацю-
вання інформації про обличчя, що зумовлює розпізнавання
пише на підсвідомому рівні.
Локалізація інших функцій
Завдяки використанню фЯМР і ПЕТ, а також обстежен-
чю пацієнтів з інсультами та травмами голови зроблено
перші кроки у розумінні того, як постійне опрацювання
сенсорної інформації впливає на пізнання, мислення, розу-
міння та мову. Під час аналізу ділянок мозку, відповідаль-
пих за арифметичні підрахунки, виявлено дві зони. У ниж-
біографічною інформацією обличчя
Рис. 16-7. Зони у правій півкулі головного мозку правшів, що
відповідають за розпізнавання облич (модифіковано з Згріг
М: АссивіотесІ іо уоиг Гасе. Ат 8сі 1992;80:539).
ній ділянці лівої лобової частки міститься зона, відпові-
дальна за числа та точні підрахунки. Ушкодження цієї част-
ки може призвести до акалькулії - вибіркової нездатності
виконувати математичні підрахунки. У ділянках навколо
внутрішньотім’яних борозен тім’яних часток з обох боків
є зони, відповідальні за візуопросторові вигляди чисел і,
можливо, рахування за допомогою пальців.
У людей дві підкіркові структури у правій півкулі від-
повідають за точну навігацію. Одна з них - праве хвостате
ядро, що сприяє орієнтуванню та руху до об’єктів. Оскільки
у чоловіків мозок більший, ніж у жінок, то стверджують,
що чоловіки ліпше орієнтуються у просторі і мають ліпші
здібності до навігації. Припускали, частково жартома, що
більша маса мозку у чоловіків зумовлена більшою кіль-
кістю в них нейрональних компонентів, відповідальних за
добирання з одного місця в інше. З огляду на це чоловіки
неохоче питають дорогу, коли загубляться, тоді як жінки
роблять це, не вагаючись.
До інших дефектів, що простежуються у пацієнтів із
локальними ушкодженнями кори, належать, зокрема,
нездатність називати тварин із збереженою здатністю нази-
вати інші живі істоти чи об’єкти. Один пацієнт із ушкод-
женням лівої тім’яної частки мав труднощі з вимовлянням
другої частини слів. Деякі пацієнти з ушкодженнями тім’я-
но-потиличних зон пишуть слова лише з приголосних, про-
пускаючи голосні. Подібні дослідження дають змогу з’ясо-
вувати точний послідовний процес опрацювання інфор-
мації у відповідних зонах мозку. Подальші вивчення в цьо-
му напрямі покликані значно розширити наше розуміння
функцій нової кори.
256/РОЗДІЛ 16
ЛІТЕРАТУРА ДО ЧАСТИНИ III: ФУНКЦІЇ НЕРВОВОЇ СИСТЕМИ
А^иг/і А еі аі: Тгап8£епіс апсі кпоскоиі тісе іп іЬе 8Іиду оГ
пеигодс^епегаїіуе ді.8са8Є8. 1 Мої Мед 1996;74:111.
А^іі/71 А, \¥сі88тапп С: Ргіоп гезеагсН: ТЬе пехі Гґопіієґ8.
№іиге 1997:389:795.
АІіігпа К8 еі аі: Еерііп ге^иіаіюп оГпеигоспдосгіпе 8у8Іет8.
Егопі Меигоепдосгіпої 2000;21 [Іп рге88.]
Апдгса8оп N0: Епдсг8Іапдіп£ іЬе саи8С8 оГ 8сЬІ7орЬгспіа.
N Еп^І і Мед І999;340:645.
Вагіоху .18: Тке Еіесігоепсеркаїо^гат: /А’ Раїїегпх апсі Огі-
%іп$ МІТ Рге88, 1993.
Веппсі NІ Я: 8упарііс Ігап8ті88Іоп аі 8іп£Іс Ьоиіопз іп 8ут-
раїЬеІіс &ап&Ііа. 1Ме\¥8 РЬу8Іо1 8сі 2000; 15:98.
ВоисЬагд С, Вгау СА (едіІог8): Ке^иіаііоп о] Восіу Жеіукі
Віоіоуіеаі апсі Векауіогаї Мескапіхтх ХУіІсу, 1996.
Вгопі8СІі Е\¥: Тке Сііпісаііу Ітрогіапі Сгипе &
8(гаПоп. 1952.
Саісппа МІ сі аі: Ітраігед посісерііоп апд раіп 8сп8а1юп іп
тісе 1аскіп£ (Ье сарзаісіп гсссріог. 8сіепсс 2000;288:306.
Сєгусго Р: 8сп8огу іппегуаіюп оГіЬе Уі8сега: РепрЬсгаІ Ьа-
8І8 оГуі8ссга! раіп. РЬу8Іо1 Кеу 1994;74:95.
Согдо Р, Нагпаид 8 (сдіїогз): Моуетепі Сопігоі. СатЬпд^е
ту Рге88, 1994
□ата8Іо Н сі аі: А псигаї Ьа8І8 Гог Іехісаі геїпеуаі. №іиге
1996;380:499.
□ііиппо Л71г, Рогтаї СЕ: СЬгопіс 8рта1 согд іпрігу. N Еп^І
.1 Мед 1994:330:550.
□иппсіі 8В, В)дгк1ііпд А: Рго8ресІ8 Гог пс\у ге8ІогаІіуе апд
псигоргоіесіїус Ігсаїтспі іп Рагкіп8оп’8 дІ8са8е. №іигс
1999;399(8иррІ)А32.
Еоггс8Ісг .IV сі аі: Тке Еуе' Вахіс Всіепсе іп Ргасіїее 8аип-
дег8, 1996.
Оіітап 8: Іта^іп^ Ікс Ьгаїп. N Еп§1 1 Мед 1998:338:812.
бгеспГісІд 8А: .Аоигпеу іо іке Сепіегх о/ іке Міпсі Тоухагсісі
Всіепсе о] Сопхсіоихпехх Егеетап, Еопдоп, 1995.
Натп^іоп А (едіїог): Тке РІасеЬо ЕЦееГ Ап ІпіегсІТеірІі-
пагу Ехріогаііоп Нагуагд Спіу Рге88, 1999.
І8ас8оп О, ВгеакГіеїд ХО: ВспсГіІ8 апд П8к8 оГЬо8Ііп§ апі-
таї сс1І8 іп діє Ьитап Ьгаіп. N31 Мед 1997:3:964.
Іугу КВ, КоЬсгІ8ОП ЕС: Тке Тхуо 8ісІе\ о] Регсерііоп МІТ
Рге88, 1997.
.іонусіМ: Тке Рагасіох о/81еер: Тке Віспу о{ Егеатіпу, МІТ
Рге88, 1999.
КаІа8ка .ІЕ, Сгаттопі Р.І: СсгеЬгаІ согіїсаі тссІіапі8іті8 оГ
геасЬіп^ тоусіпспІ8 8сіспсе 1992:255:1517
КапдсІ ЕК, 8с1і\узґі7 Лі, 1с88СІ1 ТМ (еді1ог8): Ргіпсіріех о]
Иеигаї Зсіепсе, 4іЬ ед. МсСга\у-НіІІ, 2000
Ка8 .ІН (сдііог): Еипсіюпаї рІ38Іісііу іп адиіі соїїсх. 8етіп
№иго8Сі 1997:9 1
КІоск^еіЬег Т, ОісЬ§ап8 і: Тгіписіеоііде гереаІ8 апд Ьегеді-
Іагу аіахіаз. N31 Мед 1997;3:149.
КиЬап КСК, Ьєуііоп А: СегеЬгаІ раІ8у. N Еп^і .1 Мед 1994;
330:188.
КирГег ОІ, Кеупоідз СЕ III: Мапа^еіпспі оГіп8оітіпіа. N Еп§1
1 Мед 1997:336:341.
Ьауіе Р: Тке Епекапіесі ІТогІсІ о/81еер. ¥а1е Спіу Рге88, 1996
ЕеУау 8: Тке Зехиаі Вгаіп. МІТ Рге88, 1993.
Еоске 1Е: Тке СкіїсГь Раік іо Зрокеп Ьап^иа^е. Нагуагд Спіу
РґЄ88, 1993.
Магііп 1В: Моїесиїаг §епеІЮ8 оГ псиго1о§іса1 ді8еа8Є8. 8сі-
епсе 1993:262 674.
МегЬ8 8Ь, Х'аі1іап8 1: АЬ8огрІіоп 8рес1га оГ діє ЬуЬгід рі£-
1ПСПІ8 ГЄ8рОП81Ь1Є Гог аП0ГПаІ0П8 СОІОГ М8І0П. 8сіепсе
1992:258:464.
Оу8Іег С\У: Тке Нипіап Еуе Вігиеіиге апсі Еипсііоп 8іпаиег.
1999.
Ріотіп Я, О\уеп МІ, МсбиГГіп Р: ТЬе §спс1іс Ьа8і8 оГ сот-
ріех Ьитап ЬеІіауіог8. 8сіепсс 1994:264:1733.
Каутопд .ІЬ, Еі8Ьег&сг 86, Мапк МО: ТЬе ссгеЬеІІиїті: А
пеигопаї Іеагпіп^ тасЬіпе. 8сіспсе 1996:272*225
КоЬЬіп8 Т\¥, Еуєгєіі ВЛ Оги§ аддісіюп: Ьад ІіаЬіІ8 адд ир
№їиге 1999:398:567.
КоЬсП8оп О, Ьо\ус РА, Ро1іп8ку К4 (едіІ0Г8)‘ Ргітег оп іке
Аиіопотіс Неггоііх Зумієш Асадетіс Рге.88, 1996.
8сЬопЬаит Е, котах Р (сдіІ0Г8): Ткеппогеуиіаііоп 2 уоі8
Рег§атоп Ргс88, 1990.
8е1кое ОІ: Тгап.8ІаІіп£ сеІІ Ьіо1о§у іпіо іЬегареиІіс адуапсс8
іп АкЬеїтег’з дІ8еа8е N31111’0 1999;399(8ирр1)-А23
8Ьау\уіі7 8: Оу8Іехіа. N Еп^І 1 Мед 1998:338 307
8іе£е1 .ІМ- №гсо1ер8у. 8сі Ат [Лап] 2000:282:76
8тііЬ ЕЕ, 1отде8 1 8іога^е апд схесиїїус ргосе88Є8 іп іЬс
Ггопіаі ІоЬе 8сіепсс 1999:283:1657
8диіге ЕК. Капдеї Е: Метопу. Егспп Міпсі Іо Моїесиїеч 8сі-
спІіГіс Атегісап ЕіЬгагу, 1999.
8іегіадс М: Агои8а1: Кєуі8іііп£ (Ье геїісиїаг асіїуаііп^ 8У8-
іст. 8сіспсе 1996:272:225.
8іегп Р, Магк8 1 (еді1ог8): Макіп^ 8еп8е оГ 8ссп(8 (8рссіа1
8есІюп ) 8сіепсе 1999:286-703.
8іих 6, Ротсгап7 В- ВаМсх о/ Асирипсіиге, 2пд ед 8рппцег.
1991.
\¥а!1 Р.І, МеІ7аск К. ТехіЬоок о{ Раіп Мо8Ьу. 1994.
ХУсІІег А Соттитсаіюп іЬгои^Ь Ьоду одоиг №іигс
1998:392:120
\¥і 11егп8 РЛ бепеїіс саи8Є8 оГ Ьеапп^ ІО88 N Еп^І .1 Мед
2000:342:1101
\УіІ8оп КА, Кеіі ЕС: Тке МІТ Епсусіоресііа о/ іке Соупіііуе
Зсіепсех МІТ Рге88, 1999.
Частина IV
Ендокринна система, метаболізм і
репродуктивна функція
Енергетичний баланс, метаболізм і
живлення
17
ВСТУП
Ендокринна система, як і нервова, координує діяльність
різних систем організму, пристосовуючи їх до змін зов-
нішнього і внутрішнього середовища. Ендокринна інте-
грація відбувається за допомогою гормонів - хімічних
посередників, що їх виробляють безпроточні залози, а
переносить до відповідних клітин кров. Інші типи хімічних
посередників описані в Розділі 1. Деякі гормони - це аміни,
а інші - амінокислоти, поліпептиди, білки або стероїди.
Гормони регулюють процеси метаболізму. Назву мета-
болізм, що буквально означає обмін, використовують для
окреслення всіх хімічних та енергетичних перетворень, які
відбуваються в організмі.
У тканинах тваринних організмів відбувається окис-
нення вуглеводів, білків і жирів з утворенням ГОЛОВНО СО2,
Н2О й вивільненням енергії, потрібної для життєдіяльності.
Вуглекислий газ, вода й енергія утворюються також під
час спалювання поживних речовин поза організмом. Проте
в організмі окиснення є не одноступеневою напіввибу-
ховою реакцією, а складним поступовим процесом - ката-
болізмом, під час якого енергія вивільняється в невели-
ких кількостях, які здатні утилізуватись. Енергія може нако-
пичуватись в організмі у вигляді високоенергетичних
фосфатних сполук, а також білків, жирів і складних вугле-
водів, що синтезуються з простих молекул. Утворення цих
сполук, що потребує затрат енергії, називають анаболіз-
мом. У цьому розділі розглянуто головні питання, необ-
хідні для розуміння впливу ендокринної системи на вивіль-
нення та використання енергії, а також на обмін вуглеводів,
білків і жирів.
ОБМІН ЕНЕРГІЇ
Інтенсивність обміну
Кількість енергії, що вивільняється під час катаболізму
поживних речовин в організмі, відповідає кількості енергії,
що вивільняється в разі їхнього спалювання поза організ-
мом. Енергія, що вивільняється внаслідок катаболізму,
потрібна для підтримання функцій організму, процесів
травлення й утилізації поживних речовин, терморегу-
лювання і фізичної активності. Вона забезпечує активну
діяльність, утворення тепла, а також накопичується:
Вивільнена Зовнішня Запаси ~
= + + Тепло,
енергія робота енергії
Кількість енергії, що вивільняється за одиницю часу,
характеризує інтенсивність обміну. Максимальна ефек-
тивність ізотонічних м’язових скорочень становить приб-
лизно 50%:
_ . Виконана робота
Ефективність =-------------------.
Загальні витрати енергії
По суті, майже вся енергія під час ізометричного ско-
рочення виділяється у вигляді тепла, оскільки в цьому разі
виконується дуже незначна зовнішня робота або ж вона
зовсім не виконується (сила помножена на відстань, на яку
переміщується певна маса) (див. Розділ 3). Енергія нако-
пичується шляхом утворення високоенергетичних сполук.
Кількість накопиченої енергії змінюється, а в активних
осіб, що постять, може дорівнювати нулю чи мати від’єм-
258/РОЗДІЛ 17
не значення. В дорослих осіб натще у стані емоційного і
фізичного спокою і температурному комфорті майже вся
енергія витрачається на теплоутворення. У випадку спалю-
вання поживних речовин поза організмом енергія теж
виділяється у вигляді тепла.
Калорії
Стандартною одиницею теплової енергії є калорія
(кал); 1 кал дорівнює кількості теплової енергії, потрібної
для підвищення температури 1 г води на 1 градус (від 15
до 16°С). Цю одиницю також називають грам-калорією,
малою калорією або стандартною калорією. Одиницею,
яку переважно використовують у фізіології та медицині, є
Калорія (кілокалорія, ккал), що дорівнює 1000 кал.
Калориметрія
Енергію, що виділяється під час спалювання харчових
продуктів поза організмом, можна вимірювати безпосеред-
ньо (пряма калориметрія) шляхом окиснення її складових
частин у приладі, наприклад такому, як калориметрична
бомба. Цей апарат є герметичною металевою посудиною,
зануреною у воду, що виповнює ізольований контейнер.
Речовину спалюють електричною іскрою. Зміна темпе-
ратури води становить міру утворення калорій. Подібні
вимірювання енергії, що вивільняється під час окиснення
сполук у живих організмах тварин і людини, набагато
складніші, і конструкція калориметра повинна враховувати
ще й пристосувальні реакції організму. Тепло, що утворю-
ється в організмі, вимірюють за зміною температури води
в калориметрі.
Енергетична характеристика головних харчових про-
дуктів за результатами вимірювання в калориметричній
бомбі для вуглеводів становить 4,1 ккал/г, для жирів - 9,3,
і для білків - 5,3 ккал/г. В організмі такі ж значення обчис-
лено для вуглеводів і жирів, проте окиснення білків непов-
не, кінцевими продуктами катаболізму білків, окрім СО2 і
Н2О, є також сечовина й інші азотовмісні речовини (див.
нижче). Тому енергетична характеристика білка в організмі
становить лише 4,1 ккал/г.
Непряма калориметрія
Вироблену енергію можна обчислити шляхом кількіс-
ного визначення продуктів біологічного окиснення - СО2,
Н2О і кінцевих продуктів катаболізму білків, або шляхом
визначення кількості спожитого О2, тобто методом непря-
мої калориметрії. Визначити ж кількість кінцевих про-
дуктів досить важко, простіше з’ясувати кількість спожи-
того О2. Оскільки О2 не накопичується в організмі, а його
споживання, за винятком стану кисневого голодування,
завжди відповідне негайним потребам, то кількість О2, спо-
житого за одиницю часу, відповідає кількості утвореної
енергії.
Труднощами, що виникають у разі використання показ-
ника кількості спожитого О2 з метою визначення кількості
виробленої енергії, є те, що кількість енергії на 1 МОЛЬ О2
дещо змінюється залежно від типу речовин, які окисню-
ються. Приблизна кількість енергії, що вивільняється в разі
споживання 1 л О2, становить 4,82 ккал, і для більшості
досліджень це значення є достатньо точним. Проте для
точніших вимірювань потрібні детальні дані про харчові
продукти, що окиснюються. Такі дані можна отримати,
якщо визначати дихальний коефіцієнт і кількість виділе-
ного азоту.
Дихальний коефіцієнт
Дихальний коефіцієнт (ДК) - це відношення об’єму
виділеного СО2 до об’єму спожитого О2 в стані спокою за
одиницю часу. Його можна обчислити з коефіцієнта ди-
хального обміну (КДО), який є відношенням СО2 до О2 в
конкретний час незалежно від того, досягнута в цьому разі
рівновага чи ні. На значення ДК впливають чинники поза
метаболізмом. Дихальний коефіцієнт і коефіцієнт дихаль-
ного обміну можна обчислити для реакцій, що відбувають-
ся поза організмом, для окремих органів і тканин, а також
для цілого організму. Дихальний коефіцієнт для вуглеводів
становить 1,00, а для жирів - приблизно 0,70, оскільки Н
та О містяться у вуглеводах у тому ж співвідношенні, що й
у воді, тоді як у різних жирах для утворення Н2О потрібні
додаткові кількості О2.
Вуглеводи:
С16Н12О6 + 6О2 —> 6СО2 + 6Н2О
(глюкоза)
ДК = 6/6 =1,00.
Жири:
2С51Н О6 + 1450, Ю2СО + 98Н,О
ої Уо о с сі
(трипальмітин)
ДК = 102/145 =0,703.
Визначення дихального коефіцієнта білків в організмі
є складним процесом. Його середнє значення становить
0,82. Приблизну кількість вуглеводів, білків і жирів, що
окиснюються в організмі за конкретний час, можна визна-
чити за допомогою дихального коефіцієнта і кількості
азоту, що виділяється з сечею. Дихальний коефіцієнт і кое-
фіцієнт дихального обміну для цілого організму мають
різні значення за різних умов. Наприклад, у разі гіпервен-
тиляції значення КДО збільшується, оскільки СО2 виво-
диться з видихуваним повітрям. Під час важкої праці КДО
може досягати 2,00, оскільки СО2 виходить, а молочна кис-
лота, що утворюється внаслідок анаеробного гліколізу, теж
перетворюється на СО2 (див. нижче). Після праці значення
КДО може зменшуватися до 0,50 і далі. В умовах мета-
болічного ацидозу КДО збільшується, оскільки респіра-
торна компенсація, що з’являється в цьому разі, посилює
виведення СО2 (див. Розділ 39). За умов вираженого аци-
дозу КДО може перевищувати 1,00. У випадку метаболіч-
ного алкалозу показник КДО зменшується.
Споживання О2 й утворення СО2 в окремому органі
можна обчислити за допомогою рівняння, помноживши
об’єм крові, що протікає через орган за одиницю часу, на
артеріовенозні різниці О2 і СО2. Звідси можна визначити
ДК. Дані щодо ДК окремих органів мають важливе зна-
чення для характеристики процесів обміну, що відбува-
ються в цих органах. Наприклад, значення ДК головного
мозку постійно становить 0,97-0,99, це свідчить, що най-
важливішим джерелом енергії цього органа є вуглеводи.
Під час секреції шлункового соку КДО у шлунку є від’єм-
ЕНЕРГЕТИЧНИЙ БАЛАНС, МЕТАБОЛІЗМ І ЖИВЛЕННЯ / 259
ним, оскільки з артеріальної крові поглинається більше
СО2, ніж його надходить у венозну кров (див. Розділ 26).
Визначення інтенсивності обміну
У разі визначення інтенсивності обміну кількість погли-
нутого О2 вимірюють за допомогою заповненого киснем
спірометра і системи поглинання СО2. Схема такого при-
ладу зображена на рис. 17-1. Спірометричний дзвін спо-
лучений з записувальним пристроєм, барабан якого обер-
тається під час руху дзвона догори і донизу. Нахил лінії,
що сполучає кінці кожної спірометричної екскурсії, про-
порційний до кількості поглинутого О2. Кількість спожи-
того за одиницю часу О2 (у мілілітрах) коректують сто-
совно показників температури і тиску (див. Розділ 34) і
перетворюють на показник, що відображає кількість утво-
реної енергії, множенням на 4,82 ккал/л спожитого О2.
Чинники, що впливають на інтенсивність
обміну
На інтенсивність обміну впливає низка чинників (табл.
17-1). Найважливішим з них є м’язова робота. Споживання
О2 збільшується не лише під час роботи, а ще й тривалий
час після її виконання, оскільки потрібно поповнити ви-
трати О2 (див. Розділ 3). Після їди інтенсивність обміну
теж посилюється, що зумовлене її специфічно динаміч-
ною дією (СДД). СДД - це обов’язкова енергетична ви-
трата, необхідна для засвоєння їжі в організмі. Кількість
білка, що відповідає забезпеченню організму 100 ккал, при-
водить до підвищення рівня метаболізму на ЗО ккал; така
ж кількість вуглеводів збільшує його на 6 ккал, а жирів -
на 4 ккал. Це означає, що кількість калорій, яку насправді
постачає конкретний харчовий продукт, є меншою на ці
значення. Енергія, потрібна для їхнього засвоєння, надхо-
дить або від цих же продуктів, або із запасів енергії орга-
нізму. Суть СДД, яка може тривати до 6 год, до кінця не
з’ясована.
Таблиця 17-1. Чинники, що впливають на інтенсивність
обміну
Фізична праця
Споживання їжі
Висока або низька температура навколишнього середовища
Зріст, маса і площа поверхні тіла
Стать
Вік
Ріст
Репродукція
Лактація
Емоційний стан
Температура тіла
Рівень тиреоїдних гормонів, що циркулюють у крові
Рівні адреналіну і норадреналіну, що циркулюють у крові
Інший чинник, що посилює обмін, - це температура нав-
колишнього середовища. Крива співвідношення інтенсив-
ності обміну до температури навколишнього середовища
є 17-подібною. Якщо температура навколишнього середо-
вища нижча від температури тіла, то посилюються процеси
теплоутворення, такі як тремтіння, й інтенсивність обміну
збільшується. Якщо ж температура навколишнього сере-
довища висока, а температура тіла підвищується, то проце-
си метаболізму прискорюються, й інтенсивність обміну
збільшується приблизно на 14% з підвищенням темпера-
тури на кожен 1°С.
Рівень обміну, визначений у стані спокою в термонейт-
ральній зоні кімнати з температурою комфорту через 12-
14 год після останнього приймання їжі, називають стан-
дартним, або основним, обміном (ОО). Значення ОО
знижується приблизно на 10% під час сну і на 40% під час
тривалого голодування. За цих умов рівень обміну нази-
вають мінімальним рівнем обміну. Рівень обміну про-
тягом нормальної денної активності, звичайно, вищий від
Рис. 17-1. Схема модифікованого апарата Бенедикта - записувального спірометра, який застосовують для вимірювання
кількості спожитого людиною О2, і запис, виконаний ним. Кут нахилу лінії АВ пропорційний до кількості спожитого О2; V -
клапан, що забезпечує рух повітря в одному напрямі.
260/РОЗДІЛ 17
ОО. Це зумовлено фізичною активністю і споживанням
їжі. Його інколи називають рівнем загального обміну.
Максимальний, чи робочий, рівень обміну, що настає
під час виконання роботи, може бути в 10 разів вищим від
стандартного ОО, а в тренованих атлетів - навіть у 20 разів.
ОО чоловіків середньої статури становить приблизно
2000 ккал за добу. Великі тварини мають вищий абсолют-
ний показник ОО, проте відношення ОО до маси тіла в
малих тварин набагато більше. Площа поверхні тіла різних
тварин добре корелює з показником інтенсивності обміну.
Цього можна було сподіватись, оскільки теплообмін від-
бувається з поверхні тіла. Однак лінія, що відображає спів-
відношення показника теплоутворення і маси тіла, насправ-
ді стрімкіша; площа поверхні тіла корелює з масою тіла
згідно з коефіцієнтом 0,67, тоді як теплоутворення - 0,75
(рис. 17-2). Це можна пояснити високим обміном речовин
у великих тварин, оскільки їм потрібно більше енергії для
протистояння земному тяжінню на масу їхнього тіла.
Іншою причиною більшого теплоутворення може бути, від-
повідно, більша площа капілярної сітки. Однак правильних
пояснень цих взаємозв’язків усе ще нема.
Співвідношення між масою, зростом і площею поверхні
тіла в людини описує така формула:
8 = 0,007164 хМ0 425 х З0 725,
де 8 - площа поверхні, м2; М - маса тіла, кг; 3 - зріст, см.
За допомогою номограм, побудованих на підставі цієї
формули, можна легко обчислити площу поверхні тіла. ОО
дорослої людини чоловічої статі становить приблизно
40 ккал/м2 за годину. Для зручності ОО виражають у вигля-
ді відсоткового збільшення або зменшення стандартних
нормальних значень. Отже, число 65 означає, що ОО кон-
кретної особи є на 65% вищим від стандарту, який відпо-
відає її вікові й статі.
Рис. 17-2. Кореляція між інтенсивністю обміну і масою тіла,
показники яких нанесені на логарифмічну шкалу. Нахил ко-
льорової лінії становить 0,75. Чорна лінія відображає, як пло-
ща поверхні збільшується щодо маси тіла тварин, які мають
геометрично подібні форми. Її нахил становить 0,67 (моди-
фіковано з КІеіЬег М., відтворено за дозволом з МсМайоп
ТА: 8іге апсі зйаре іп Ьіоіоду. Зсіепсе 1973; 179:1201).
У жінок різного віку ОО дещо нижчий, ніж у чоловіків.
Споживання О2 збільшується під час вагітності внаслідок
додаткових потреб плоду. Найвищий ОО у дітей; з віком
його інтенсивність зменшується. Хвилювання і напружен-
ня збільшують ОО, оскільки в цьому разі підвищується
секреція адреналіну і напружуються м’язи, навіть коли осо-
ба перебуває в стані спокою. Водночас в апатичних осіб
або в осіб, що перебувають у депресії, ОО може зменшу-
ватися. Про стимулювальний вплив катехоламінів і тирео-
їдних гормонів на ОО зазначено в розділах, де описано ці
гормони. Під час тривалого голодування ОО зменшуєть-
ся, оскільки активність симпатичної нервової системи теж
послаблюється, і зниження концентрації катехоламінів, що
циркулюють, може сприяти зменшенню ОО. Окрім того,
знижується рівень біологічно активних тиреоїдних гормо-
нів, що циркулюють (див. Розділ 18). Зменшенням інтен-
сивності обміну пояснюють факт, коли під час худнення
особа спочатку втрачає масу швидко, а згодом повільніше.
Енергетичний баланс
Перший закон термодинаміки, за яким енергія не утво-
рюється і не зникає, а лише переходить з однієї форми в
іншу, стосується як живих організмів, так і неживих систем.
Отже, треба говорити про енергетичний баланс між над-
ходженням і витратами енергії. Якщо калорійність їжі, яку
споживають, нижча від витрат енергії, тобто баланс нега-
тивний, то відбувається використання ендогенних запасів.
Глікоген, білки і жири організму катаболізують, і організм
втрачає масу. Якщо ж кількість калорій у спожитій їжі пере-
вищує енергетичні витрати на теплоутворення і зовнішню
трудову діяльність, а поживні речовини нормально пере-
травлюються та засвоюються, то енергетичний баланс є
позитивним і організм набирає масу.
Механізми регулювання приймання їжі описані в Розділі
14. Для забезпечення головних життєво важливих функцій
середній дорослій людині достатньо приблизно 2 000 ккал
за добу. Потреба в калоріях понад основний обмін зале-
жить від активності організму. Студент (або викладач), що
веде переважно сидячий спосіб життя, потребує додатково
500 ккал, тоді як лісоруб - майже 3000 ккал на добу.
ПРОМІЖНИЙ ОБМІН
Загальні поняття
Кінцеві продукти процесу травлення (див. Розділи 25
та 26) - це здебільшого амінокислоти, а також продукти
розщеплення жирів і гексози: фруктоза, галактоза та глю-
коза. Всмоктування і метаболізування цих сполук в орга-
нізмі відбувається різними шляхами. Деталі їхнього мета-
болізму стосуються біохімії, тому ми їх не розглядаємо.
Та оскільки деякі знання шляхів метаболізму важливі для
розуміння дії тиреоїдних, панкреатичних і надниркових
гормонів, то в цьому розділі описано загальні принципи
обміну вуглеводів, білків і жирів.
Загальна схема обміну речовин
Коротколанцюгові фрагменти, що утворюються внас-
лідок розщеплення гексози, амінокислоти і жиру, подібні.
З цього спільного метаболічного пулу проміжних про-
ЕНЕРГЕТИЧНИЙ БАЛАНС, МЕТАБОЛІЗМ І ЖИВЛЕННЯ / 261
дуктів можуть синтезуватись вуглеводи, білки і жири, хоча
перетворення жирів у вуглеводи обмежене (див. нижче).
Проміжні продукти також входять у цикл лимонної кислоти
- кінцевий спільний шлях катаболізму, у якому вони роз-
щеплюються до атомів водню і СО2. Атоми водню окис-
нюються з утворенням води в ланцюгу флавопротеїнових
і цитохромних ензимів.
Перенесення енергії
Більшість енергії, що вивільняється під час катаболізму,
не використовують безпосередньо клітини, вона витрача-
ється на утворення зв’язків між залишками фосфорної кис-
лоти і деякими органічними сполуками. Оскільки для утво-
рення такого типу зв’язку потрібно багато енергії, то під
час наступного гідролізу цього зв’язку відбувається
вивільнення енергії також у відповідно великих кількостях
(10-12 ккал/моль). Сполуки, що містять такі зв’язки, нази-
вають високоенергетичними фосфатними сполуками.
Не всі органічні фосфати є високоенергетичними сполу-
ками. Багато з них, зокрема глюкозо-6-фосфат, належать
до низькоенергетичних фосфатів, і під час їхнього гідролізу
вивільняється лише 2-3 ккал/моль.
Окремі проміжні продукти, що утворюються внаслідок
метаболізму вуглеводів, є високоенергетичними, проте
найважливіша високоенергетична фосфатна сполука - аде-
нозинтрифосфат (АТФ). Ця молекула (рис. 17-3) є голов-
ним носієм енергії в організмі.
Під час гідролізу АТФ до аденозиндифосфату (АДФ)
вивільняється енергія для виконання таких процесів, як
м’язові скорочення, активне транспортування і синтез
багатьох хімічних сполук. Відщеплення ще одного фосфату
з утворенням аденозинмонофосфату (АМФ) теж зумовлює
вивільнення великої кількості енергії. Інша високоенерге-
тична фосфатна сполука, що міститься в м’язах, - креа-
тинфосфат (КФ; фосфокреатин) (див. нижче).
Важливими фосфорильованими сполуками, які зреш-
тою теж можуть слугувати донорами енергії, є трифосфатні
похідні інших піримідинових і пуринових основ (див. рис.
17-22), а саме: похідна гуаніну - гуанозинтрифосфат
(ГТФ), важлива сполука для передавання сигналів (див.
Розділ 1); похідна цитозину - цитидинтрифосфат (ЦТФ),
похідна урацилу - уридинтрифосфат (УТФ), похідна гіпо-
ксантину - інозинтрифосфат (ІТФ). З утворенням високо-
енергетичних фосфатів пов’язана значна кількість катабо-
лічних реакцій.
Іншою групою високоенергетичних сполук є тіоефіри
- ацильні похідні меркаптанів. Коензим А (КоА) - це
поширений меркаптан, що містить аденін, рибозу, панто-
тенову кислоту і тіоетаноламін (рис. 17-4).
Відновлений КоА (Н8-КоА) реагує з ацильними гру-
пами (К-СО-), утворюючи похідні К-СО-8-КоА. Прикла-
дом може бути реакція Н8-КоА й ацетатної кислоти з утво-
ренням ацетилкоензиму А (ацетил-КоА) - однієї з головних
сполук проміжного обміну. Оскільки ацетил-КоА є висо-
коенергетичнішою сполукою, ніж ацетатна кислота, то він
легко сполучається з речовинами в реакціях, що в інших
випадках потребували б значних зовнішніх затрат енергії.
Тому ацетил-КоА часто називають “активним ацетатом”.
З погляду енергетики утворення 1 моля будь-якої сполуки
ацеїил-КоА еквівалентне утворенню 1 моля АТФ.
Рис. 17-3. Високоенергетичні похідні аденозину (відтворено
за дозволом з Миггау РК еі аі: Нагрег’з Віосйетізігу, 2501 есі.
Мсбга^-НіІІ, 2000).
Біологічне окиснення
Окиснення - це сполучення речовини з О2 або відщеп-
лення від неї водню чи електронів. Зворотні процеси нази-
вають відновленням. Біологічне окиснення каталізують
спеціальні ензими. Кофактори, або коензими (органічні не-
білкові сполуки), є допоміжними речовинами, що слугують
переважно для перенесення продуктів реакції. Як і ензими,
коензими теж можуть каталізувати різноманітні реакції.
Багато коензимів є акцепторами водню. Одна з найпо-
ширеніших форм біологічного окиснення - відщеплення
водню від К-ОН груп з утворенням К=О. У таких реакціях
дегідрогенізації нікотинамідаденіндинуклеотид (НАД+) і
нікотинамідаденіндинуклеотидфосфат (НАДФЦ приєд-
нують водень, перетворюючись на відновлений нікотин-
амідаденіндинуклеотид (НАДхН) або нікотинамідаденін-
динуклеотидфосфат (НАДФхН) (рис. 17-5). Далі водень
переходить у флавопротеїнцитохромну систему, а коензими
реоксидується до НАД+ і НАДФ+. Флавінаденіндинуклео-
тид (ФАД) виникає шляхом фосфорилювання рибофлавіну,
і утворений таким способом флавінмононуклеотид (ФМН)
далі сполучається з АМФ, формуючи динукдеотид. ФАД
може подібно приєднувати водень, утворюючи гідро-
(ФАДхН) і дигідропохідні (ФАДхН2).
Флавопротеїнцитохромна система - це ланцюг ензимів,
що переносять водень (протони й електрони) до кисню з
утворенням води. Цей процес відбувається в мітохондріях.
Під час перенесення водню кожен ензим ланцюга почер-
гово відновлюється й окиснюється. Кожен ензим ланцюга
- це білкова молекула, до якої приєднана небілкова прос-
тетична група. Останнім ензимом у ланцюзі є цитохром-
оксидаза, яка переносить електрони до О2 з утворенням
Н2О. Цей ензим містить два атоми Ре і три атоми Си. Він
має 13 субодиниць.
Окисне фосфорилювання
Утворення АТФ, пов’язане з окисненням у флавопро-
теїнцитохромній системі, називають окисним фосфори-
262/РОЗДІЛ 17
Пантотенова кислота 0-Апанін Тіоетаноламін
Н3С ОН О О
І І II н II н
Рис. 17-4. Ліворуч: формула відновленого коензиму А (Н8-КоА). Праворуч: реакція коензиму А та біологічно активних сполук
з утворенням тіоефірів; Р - залишок молекули.
люванням. АТФ може утворюватись і в інших умовах,
коли хімічні реакції відбуваються з вивільненням значної
кількості енергії. Ці реакції називають фосфорилюванням
на субстратному рівні. У разі окисного фосфорилювання
протони переносяться через внутрішню мембрану, що
утворює кристи мітохондрій, і відбувається це одночасно
з окисненням у дихальному ланцюгу (рис. 17-6). У мем-
брані виникає електрохімічний градієнт протонів, а зво-
ротне переміщення протонів у матрикс є рушійною силою
процесу сполучення АДФ та неорганічного фосфату (Рі) з
утворенням АТФ, що його каталізує АТФ-аза мембрани
(АТФ-синтаза, Р-АТФ-аза) (рис. 17-7). Цей складний
ензим, або подібний до нього, міститься в мембранах
бактерій, де його активує окиснення, і в рослинах, де його
активує світло (фотосинтез). Він має Р1 та Ро частини і
містить більше, ніж дванадцять субодиниць.
Аденін Рибоза Дифосфат
Рибоза Нікотинамід
Н Н
І
Р
Окиснений коензим
Відновлений коензим
Рис. 17-5. Угорі: Окиснена форма нікотинамідаденіндинуклеотиду (НАД+). Нікотинамідаденіндинуклеотидфосфат (НАДФ4)
має додаткову фосфатну групу, позначену зірочкою. Внизу: Реакція, у якій НАД+ і НАДФ+ відновлюються з утворенням НАДхН
і НАДФхН; Р - залишок молекули; Р’ - донор водню.
ЕНЕРГЕТИЧНИЙ БАЛАНС, МЕТАБОЛІЗМ І ЖИВЛЕННЯ / 263
Окисне фосфорилювання залежить від забезпечення
молекулами АДФ і, отже, частково регульоване шляхом
зворотного зв’язку; інтенсивніше використання тканинами
АТФ зумовлює більше накопичення АДФ і, відповідно,
вищий рівень окисного фосфорилювання. Іншими чинни-
ками регулювання рівня утворення АТФ є рівень поста-
чання жирів, лактату і метаболітів глюкози до матриксу
мітохондрій, а також наявність О2.
Здебільшого 90% спожитого О2 використовується в про-
цесах, що відбуваються в мітохондріях, а 80% цієї кількості
- для синтезування АТФ. Близько 27% АТФ викорис-
товується для синтезування білків, майже 24% - Ма+-К+-
АТФ-азою, 9 - для глюконеогенезу, 6 - Са2+ АТФ-азою, 5 -
міозин АТФ-азою і 3% - для синтезування сечовини. Крім
функції перенесення енергії, АТФ є молекулою-поперед-
ником цАМФ (див. Розділ 1).
ОБМІН ВУГЛЕВОДІВ
Вуглеводи харчових продуктів - це переважно полімери
гексоз, з яких найважливішими є глюкоза, галактоза і
фруктоза (рис. 17-8). Більшість моносахаридів в організмі
перебуває у вигляді В-ізомерів. Головний продукт, що
всмоктується в травному тракті і циркулює в крові, -
глюкоза. В нормі рівень глюкози в плазмі периферійної
венозної крові становить 70-110 мг/дл (3,9-6,1 ммоль/л),
а в плазмі артеріальної крові на 15-30 мг/дл вищий, ніж у
венозній.
Після поглинання клітинами глюкоза переважно фос-
форилює до глюкозо-6-фосфату. Ензим, який каталізує цю
Рис. 17-7. Спрощена схема транспортування протонів через
внутрішню і зовнішню поверхні внутрішньої мітохондріальноі
мембрани за допомогою транспортної системи електронів
(флавопротеїнцитохромна система) з подальшим зворотним
рухом протонів за протонним ґрадієнтом, унаслідок чого утво-
рюється АТФ.
реакцію, називають гексокіназою. У печінці, крім того,
міститься глюкокіназа, яка більше споріднена з глюкозою
й активність якої, як і гексокінази, посилюється під впли-
вом інсуліну і послаблюється під час голодування та в разі
діабету. Глюкозо-6-фосфат або використовується для
утворення глікогену, або розщеплюється (катаболізм). Ці
шляхи зображені на рис. 17-9. Процес утворення глікогену
називають глікогенезом, а процес розщеплення - гліко-
генолізом. Глікоген, як форма зберігання глюкози, міс-
титься в багатьох тканинах організму, проте найбільше
його в печінці і скелетних м’язах. Розщеплення глюкози
до пірувату або лактату (чи до обох) називають гліколізом.
Катаболізм глюкози відбувається шляхом утворення фрук-
този і розщеплення її до тріоз або ж шляхом окиснення і
декарбоксилювання з утворенням пентоз. Шлях, що веде
Жири
НАДН-----Флавопротеїнцитохромна система
Цикл Кребса
Піруват ----- Амінокислоти
Глюкоза
Рис. 17-6. Спрощена схема окисного фосфорилювання. В процесі обміну жирів, глюкози й амінокислот утворюються протони
(НГ), які переходять крізь внутрішню мітохондріальну мембрану (штрихова лінія). Дифузія цих протонів за концентраційним
фадієнтом, який виник, спонукає АТФ-азу до перетворення АДФ на АТФ. Ключові ензими цього перетворення показані на рис.
1-7.
264/РОЗДІЛ 17
до утворення пірувату через формування тріоз, називають
шляхом Ембдена-Мейєргофа, а шлях, що веде до утво-
рення 6-фосфоглюконату і пентоз, - пентозофосфатним
шляхом окиснення (пентозомонофосфатний шунт) (див.
рис. 17-9). Піруват перетворюється на ацетил-КоА. У
процесі взаємного перетворення вуглеводів, жирів та білків
гліцерин жирів перетворюється на діоксіацетонфосфат, а
низка амінокислот, вуглецевий скелет яких подібний на
проміжні продукти шляху Ембдена-Мейєргофа і циклу
лимонної кислоти, - на ці проміжні продукти після дезамі-
нування. Таким способом, а також шляхом перетворення
лактату до глюкози неглюкозні молекули можуть попов-
нювати кількість глюкози (глюконеогенез).
Глюкоза через ацетил-КоА може перетворюватись на
жири, та оскільки перетворення пірувату на ацетил-КоА,
на відміну від інших реакцій гліколізу, є незворотним (рис.
17-10), то жири цим способом не можуть перетворюватись
на глюкозу. В організмі перетворення жирів на глюкозу
мінімальне (виняток становить кількісно незначне утво-
рення глюкози з гліцерину) з огляду на те, що шляхів цього
перетворення нема.
Цикл лимонної кислоти
Цикл лимонної кислоти (цикл Кребса, цикл трикар-
бонових кислот) - це послідовність реакцій, у яких ацетил-
коензим А метаболізується до СО2 та атомів водню. Аце-
тил-коензим А спочатку конденсується з аніоном дикар-
бонової кислоти - оксалоацетатом, унаслідок чого утво-
рюється цитрат і Н8-КоА. В серії семи послідовних реакцій
вивільняються дві молекули СО2, а також регенерується
оксалоацетат (див. рис. 17-10). Чотири пари атомів водню
переходять на флавопротеїнцитохромний ланцюг, завдяки
чому утворюються 12 молекул АТФ і 4 молекули Н2О, з
яких дві молекули Н2О використані в циклі. Цикл лимонної
кислоти є спільним шляхом окиснення вуглеводів, жирів і
деяких амінокислот до СО2 і Н2О.
Головним шляхом, що приводить до циклу лимонної
кислоти, є шлях через ацетил-КоА, проте деякі амінокис-
лоти можуть перетворюватись на проміжні продукти циклу
лимонної кислоти дезамінуванням. Для перетворення в
циклі лимонної кислоти потрібний О2, і він не діє в анае-
робних умовах.
Н-С=О Н-С = О СН2ОН
і і і
н-с-он н-с-он с=о
І І І
но-с-н но-с-н но-с-н
І І І
н-с-он но-с-н н-с-он
І І І
н-с-он н-с-он н-с-он
І І І
СН2ОН СН2ОН СН2ОН
0-Глкжоза О-Галактоза О-Фруктоза
Рис. 17-8. Структура головних харчових гексоз. Зображені
формули головних природних ізомерів.
Генерування енергії
Чистий вихід високоергічних фосфатних сполук, що
утворюються під час метаболізму глюкози і глікогену до
пірувату, залежить від того, чи відбувається метаболізм
шляхом Ембдена-Мейєргофа чи пентозо-фосфатним. Під
час фосфорилювання на субстратному рівні з І моля
фосфогліцеральдегіду утворюється 1 моль АТФ, а пере-
творення 1 моля фосфоенолпірувату на піруват-ще 1 моль
АТФ. Оскільки внаслідок перетворення 1 моля глюкозо-
6-фосфату по шляху Ембдена-Мейєргофа утворюється
2 молі фосфогліцеральдегіду, то з 1 моля глюкози, що мета-
болізується до пірувату, утворюється 4 молі АТФ. Усі ці
реакції відбуваються без О2 і, відповідно, є шляхом анае-
робного утворення енергії. Однак у цьому разі 1 моль АТФ
потрібен для утворення фруктозо-1,6-дифосфату з фрук-
тозо-6-фосфату, а 1 моль - для фосфорилювання глюкози.
Отже, внаслідок утворення пірувату з глікогену в анаероб-
них умовах утворюються 3 молі АТФ на 1 моль глюкозо-
6-фосфату; якщо ж піруват утворюється з 1 моля глюкози,
то ця кількість становить лише 2 молі АТФ.
Для перетворення фосфогліцеральдегіду на фосфогліце-
рат потрібний НАД". Можна було б сподіватись, що в ана-
еробних умовах (анаеробний гліколіз) повинно наставати
блокування на рівні перетворення фосфогліцеральдегіду
в міру перетворення наявного НАД+ на НАДН. Проте цього
не відбувається, оскільки акцептором водню НАДН є піру-
ват і, отже, утворюються НАД* і лактат:
піруват + НАДН <=> лактат + НАД*.
Цим шляхом метаболізм глюкози й утворення енергії
можуть відбуватися без О2. Лактат, що накопичується, може
перетворюватись знову на піруват, а за наявності О2 НАДН
передає свій водень на флавопротеїнцитохромний ланцюг.
Під час аеробного гліколізу чистий вихід АТФ у 19 разів
більший, ніж в анаеробних умовах. Чотири молекули АТФ
утворюються внаслідок окиснення в флавопротеїнцито-
хромному ланцюгу двох молекул НАДН, які утворились
під час перетворення 2 молів фосфогліцеральдегіду на
фосфогліцерат (див. рис. 17-9); ще шість молекул АТФ
утворюються внаслідок перетворення двох молекул НАДН,
що виникли у разі конвертації пірувату на ацетил-КоА; 24
молекули АТФ утворюються під час послідовного двора-
зового проходження через цикл лимонної кислоти: з них
18 - унаслідок окиснення шести молекул НАДН; чотири -
під час окиснення двох молекул ФАДН; дві - унаслідок
фосфорилювання на субстратному рівні, коли сукциніл-
КоА перетворюється на сукцинат. За умов цієї реакції
фактично утворюється ГТФ, проте він еквівалентний до
АТФ. Отже, чистий вихід АТФ на 1 моль глюкози, що мета-
болізується шляхом Ембдена-Мейєргофа і в циклі
лимонної кислоти, становить 2 + [2 х 3] + [2 X 3] + [2 х 12]
= 38.
У випадку окиснення глюкози по пентозофосфатному
шляху утворюються значні кількості НАДФН. Цей віднов-
лений коензим потрібний для багатьох метаболічних про-
цесів. Пентози, що виникають, є матеріалом, необхідним
для синтезування нуклеотидів (див. нижче). Кількість АТФ,
що утворюється, залежить від кількості НАДФН, який
обмінюється на НАДН, що далі окисню ється.
ЕНЕРГЕТИЧНИЙ БАЛАНС, МЕТАБОЛІЗМ І ЖИВЛЕННЯ / 265
іііііііів
Фосфорилаза
Глюкозо-1 -фосфат
ВУГЛЕВОДИ ||
Глюкоза в поза- —
кпітинній рідині
и
Клітинна
стінка
АТФАДФ
Гексокіназа
Глюкоза ''**
Глюкозо-6-
фосфатаза
(лише в печінці)
ЮЮіОЮб фоюїюі
6-фосфоглюканат
І
Пентози
Фруктозо-6-фосфат
АТФ -► АДФ Т фруктозо-1,6-дифосфатаза
Фосфофруктоюназа 11 г
Фруктозо-1,6~дифосфат
(/.-Гліцерофосфат Дигідроацетонфосфат
ФосфогліцеральдегІд
(з жирів)
АДФ-> АТФ
НАД' НАДН
Фосфогліцерат
Фосфоенолпіруват-
карбоксилаза
Оксалоацетат —- >
А П Ж ЛТИ> І
БІЛКИ Іф::!: Аланін Піру
Фосфоенолпіруват
Рис. 17-9. Схема метаболізму вуглеводів у клітинах. Наведені головні ензими перетворення вуглеводів.
“Спрямовувальні клапани”
Метаболізм регулюють різноманітні гормони та інші
чинники. З метою регулювання деяких метаболічних про-
цесів потрібно скеровувати хімічні реакції в одному напря-
мі.
Більшість реакцій проміжного обміну зворотні, однак
серед них є декілька “спрямовувальних клапанів”, тобто
реакцій, що відбуваються під впливом певного одного
ензиму або транспортного механізму в одному напрямі, а
їхній зворотний хід потребує іншого ензиму. На рис. 17-11
показано п’ять таких реакцій проміжного обміну вугле-
водів. Прикладом можуть слугувати також різні шляхи син-
тезування і катаболізму жирних кислот (див. нижче). Чин-
ники регулювання впливають на метаболізм шляхом пря-
мої або опосередкованої дії на такого типу “спрямовувальні
клапани”.
266/РОЗДІЛ 17
Піруват ЗС
НАД+ -
НАДН + Н+ <-
фадн2
ФАД
СО2
НАДН + Н+
НАД+
Рис. 17-10. Цикл лимонної кислоти. Числа (6С, 5С та інші) означають кількість атомів вуглецю в проміжних продуктах. Пере-
творення пірувату на ацетил-КоА і кожен обіг циклу зумовлюють утворення чотирьох молекул НАДН та однієї молекули ФАДН2,
які далі окиснюються у флавопротеїнцитохромному ланцюгу, а також однієї молекули ГТФ, що легко перетворюється на АТФ
(модифіковано і відтворено за дозволом з АІЬегіз ВМ еі аі: Моїесиїаг Віоіоду оТ Міе СеІІ, 2псІ есі. Сагіапсі, 1989).
Синтез і розщеплення глікогену
Глікоген - це розгалужений полімер глюкози, утворений
за допомогою двох типів глікозидних зв’язків: 1:4а та 1:6а
(рис. 17-12). Він синтезується на глікогеніні - білковому
індукторі - з глюкозо-1-фосфату через уридиндифосфо-
глюкозу (УДФГ). Ензим глікогенсинтаза завершує синтез.
Наявність глікогеніну є одним з чинників, що визначає
кількість утворення глікогену. Розщеплення глікогену за
1:4а-зв’язком каталізує фосфорилаза, тоді як розщеплення
за 1:6а-зв’язком - інший ензим.
Фосфорилазу активує частково адреналін, який діє на
Р2-адренорецептори печінки. Це, відповідно, ініціює послі-
довність реакцій, що слугують класичним прикладом
гормонального впливу через цАМФ (рис. 17-13). Протеїн-
кіназа А активується за допомогою цАМФ і каталізує пере-
несення фосфатної групи на кіназу фосфорилази, пере-
творюючи її на активну форму. Кіназа фосфорилази ката-
лізує фосфорилювання і відповідне активування фосфо-
рилази. Неактивна фосфорилаза відома як фосфорилаза а
(дефосфофосфорилаза), а активована - як фосфорилаза Ь
(фосфофосфорилаза).
Активування протеїнкінази А за допомогою цАМФ не
тільки посилює розщеплення глікогену, а й гальмує його
синтезування. Глікогенсинтаза (див. рис. 17-12) активна в
дефосфорильованому вигляді і неактивна у фосфорильо-
ваному. Її фосфорилює кіназа фосфорилази, коли відбува-
ється активування протеїнкінази А.
Глікоген розщеплюється також під впливом катехола-
мінів, що діють на а^адренорецептори печінки. Це роз-
щеплення опосередковане внутрішньоклітинним Са2+ і
зумовлюване активуванням незалежної від цАМФ кінази
фосфорилази. Великі дози вазопресину й ангіотензину II
теж можуть зумовлювати глікогеноліз таким шляхом, однак
це малоймовірно, бо ці гормони позитивно впливають на
гомеостаз глюкози.
Оскільки в печінці міститься ензим глюкозо-6-фосфа-
таза, то більшість глюкозо-6-фосфату, що утворюється в
цьому органі, може перетворюватись на глюкозу і перехо-
дити в кров’яне русло, підвищуючи рівень плазматичної
глюкози. Функція нирок теж сприяє підвищенню такого
рівня. Інші тканини не містять цього ензиму, тому в них
переважна кількість глюкозо-6-фосфату катаболізується
ЕНЕРГЕТИЧНИЙ БАЛАНС, МЕТАБОЛІЗМ І ЖИВЛЕННЯ / 267
1. Проникнення глюкози в клітини і вихід її з клітин
Гексокіназа
2. Глюкоза Глюкозо-6-фосфат
Г люкозо-6-фосфатаза
Глікогенсинтаза
3. Глюкозо-1-фосфат Глікоген
Фосфорилаза
Фосфо-
фруктокіназа
4. Фруктозо-6-фосфат Фруктозо-1,6-
диФ°сФат
дифосфатаза
АДФ—► АТФ
Піруваткіназа
5. Фосфоенолпіруват -----------------► Піруват
Фосфоенолпіруват-
карбоксикіназа
Оксалоацетат
Малат
Рис. 17-11. П’ять прикладів “спрямовувальних клапанів”
метаболізму вуглеводів, тобто реакцій, що відбуваються в
одному напрямі за допомогою одного механізму, а в проти-
лежному - за допомогою іншого. Подвійна лінія в прикладі 5
позначає мітохондріальну мембрану. Піруват перетворюється
на малат у мітохондріях, а малат дифундує з мітохондрій до
цитозолю, де перетворюється на фосфоенолпіруват.
шляхом Ембдена-Мейєргофа, а також за допомогою глю-
козомонофосфатного шунта. Зростання катаболізму глюко-
зи в скелетних м’язах зумовлює збільшення концентрації
лактату в крові (див. Розділ 4).
Адреналін, стимулюючи аденілатциклазу, призводить
до активування фосфорилази в печінці і скелетних м’язах.
Наслідком цього є підвищення рівня глюкози в плазмі і
збільшення кількості лактату в крові. Глюкагон має подібну
дію, проте він впливає лише на фосфорилазу печінки. Від-
повідно, глюкагон зумовлює підвищення рівня глюкози в
плазмі, однак не приводить до зміни кількості лактату в
крові.
Хвороба Мак-Ардла
У випадку захворювання, відомого як хвороба Мак-
Ардла, або міофосфорилазодефіцитний глікогеноліз,
глікоген накопичується в скелетних м’язах унаслідок де-
фіциту м’язової фосфорилази. Такі хворі відчувають біль
у м’язах, у них виникає риґідність під час фізичних зусиль
і значно знижується працездатність. У скелетних м’язах
не відбувається розщеплення глікогену, що потрібно для
забезпечення енергії м’язового скорочення (див. Розділ 3),
а кількість глюкози, що надходить до м’язів з кров’яного
русла, достатня лише для виконання дуже обмежених рухів.
У разі введення глюкагону або адреналіну рівень глюкози
в плазмі стає нормальним, а це свідчить про те, що дефі-
циту печінкової фосфорилази в цих хворих немає.
“Печінковий глюкостат”
Якщо рівень глюкози у плазмі високий, то її поглинає
печінка, а якщо низький, то глюкоза надходить з печінки у
кров. Отже, печінка діє як “глюкостат”, що підтримує сталу
концентрацію глюкози в крові. Ця функція не відбувається
автоматично. Процеси поглинання глюкози печінкою та її
вивільнення перебувають під контролем численних гормо-
нів. Питання ендокринного регулювання рівня плазматич-
ної глюкози й обміну вуглеводів розглянуто в Розділі 19.
Нирковий регулятор ГЛЮКОЗИ
У нирках легко відбувається фільтрування глюкози,
проте у випадку нормального рівня глюкози в плазмі вся
глюкоза, за винятком дуже незначної кількості, підлягає
реабсорбції в проксимальних канальцях (див. Розділ 38).
Якщо ж кількість профільтрованої глюкози збільшується,
то збільшується і її реабсорбція, проте до певної межі. Тоб-
то у випадку перевищення максимальної можливості ре-
абсорбції в канальцях (Кмг) у сечі з’являються помітні
кількості глюкози (глюкозурія). Нирковий поріг для глю-
кози, тобто концентрація глюкози в артеріальній крові, за
якої виникає глюкозурія, дорівнює приблизно 180 мг/дл.
Проте він може бути і вищим, якщо рівень клубочкової
фільтрації невисокий.
Глюкозурія
Глюкозурія виникає, якщо рівень глюкози в плазмі збіль-
шується внаслідок нестачі інсуліну (цукровий діабет) або
надмірного глікогенолізу після фізичного чи емоційного
навантаження. В окремих осіб простежується природже-
на вада транспортних механізмів глюкози в ниркових
канальцях, і в цьому випадку глюкозурія виникає і за
нормального рівня глюкози в плазмі. Такий стан називають
нирковою глюкозурією. Аліментарна глюкозурія, тобто
глюкозурія після приймання багатої на вуглеводи їжі,
обов’язково виникає в практично здорових людей, проте
в значної кількості таких осіб насправді в легкій формі є
цукровий діабет. Максимальна інтенсивність всмоктування
глюкози в кишці становить 120 г/год.
Чинники, що визначають концентрацію
глюкози в плазмі
Рівень глюкози в плазмі залежить від балансу між
кількістю глюкози, що надходить до кров’яного русла, і
кількістю, що поглинається. Головними чинниками, що
впливають на цей баланс, є надходження глюкози з їжі,
ступінь проникнення її в м’язові клітини, жирову та інші
тканини і глюкостатична активність печінки (рис. 17-14).
П’ять відсотків глюкози, що всмоктується в кишку,
одразу перетворюється в печінці на глікоген, а 30-40% -
на жири. Решта метаболізується в м’язах та інших тка-
нинах. Під час голодування глікоген печінки розщеп-
люється і глюкоза надходить з печінки в кров’яне русло. У
випадку тривалого голодування запаси глікогену вичер-
пуються, а в печінці відбувається глюконеогенез з аміно-
268/РОЗДІЛ 17
СН2ОН СН2ОН
---1:6а-3в’язок
СН2ОН СН2ОН СН2ОН СН2ОН СН2ОН сн2
о
Глюкозо- Глюкозо-
1 -фосфат 6-фосфат
Рис. 17-12. Синтезування і розщеплення глікогену. Процес активування фосфорилази зображено на рис. 17-13.
02-Рецептор------Адреналін
Аденілатциклаза
АТФ цАМФ
Протеїнкіназа А
Неактивна Активна
фосфорилаза Ь фосфорилаза Ь
кіназа + АТФ кіназа
Фосфорилаза Ь Фосфорилаза а
Глікоген Глюкозо-1-фосфат
Рис. 17-13. Каскад реакцій, за допомогою якого відбувається
активування адреналіном фосфорилази. Подібною є дія глю-
кагону в печінці, проте не в скелетних м’язах.
кислот і гліцерину. В практично здорових людей унаслідок
тривалого голодування рівень глюкози в плазмі може
знижуватись приблизно до 60 мг/дл, проте в цьому разі не
виникають симптоми гіпоглікемії, оскільки глюконеогенез
запобігає подальшому зниженню рівня глюкози.
Гомеостаз вуглеводів у випадку фізичного
навантаження
У людини масою 70 кг резерв вуглеводів становить
приблизно 2500 ккал; вони зберігаються у вигляді 400 г
м’язового глікогену, 100 г печінкового глікогену і 20 г глю-
кози, що міститься в міжклітинній рідині. Для порівняння:
112 000 ккал (приблизно 80% від енергетичних запасів
організму) накопичені у вигляді жирів, а решта - у білкових
сполуках. М’язи в стані відпочинку, а також після фізичної
праці для потреб обміну використовують жирні кислоти.
В разі утримання від споживання їжі в стані спокою голов-
ний мозок людини використовує 70-60% глюкози, а ерит-
роцити - більшу частину решти.
Під час фізичної праці потреба м’язів у калоріях почат-
ково задоволена завдяки глікогенолізу і посиленому над-
ходженню глюкози. Рівень глюкози в плазмі спочатку під-
вищується внаслідок посиленого глікогенолізу в печінці,
проте у випадку напруженої тривалої праці він може
суттєво знижуватись. Простежується зростання глюконео-
генезу (рис. 17-15). У плазмі зменшується кількість інсуліну
і збільшується кількість глюкагону й адреналіну. Після
праці кількість глікогену в печінці поповнюється шляхом
додаткового глюконеогенезу, а вихід глюкози з печінки
зменшується.
ЕНЕРГЕТИЧНИЙ БАЛАНС, МЕТАБОЛІЗМ І ЖИВЛЕННЯ / 269
Метаболізм інших гексоз
Окрім глюкози, у шлунково-кишковому тракті відбува-
ється всмоктування галактози, яка утворюється під час роз-
щеплення лактози і перетворюється в організмі на глюкозу,
а також фруктози, частина якої надходить з їжі, а частина
утворюється внаслідок гідролізу сахарози. Після фосфори-
лювання галактоза реагує з УДФГ, завдяки чому утворю-
ється уридиндифосфогалактоза, яка знову перетворюється
на УДФГ і бере участь у синтезі глікогену (див. рис. 17-
12). Ця реакція є зворотною, і перетворення УДФГ на
уридиндифосфогалактозу слугує для забезпечення галак-
тозою процесів утворення гліколіпідів та мукопротеїнів,
якщо надходження галактози з їжею недостатнє. Викорис-
тання галактози, як і глюкози, є інсулінозалежним (див.
Розділ 19). У разі спадкового порушення обміну речовин,
відомого як галактоземія, простежується нестача галак-
тозо- 1-фосфатуридилтрансферази - ензиму, що каталізує
реакцію між галактозо-1 -фосфатом і УДФГ, унаслідок чого
абсорбована галактоза накопичується в крові. У цьому ви-
падку виникають значні порушення росту і розвитку орга-
нізму. Застосування безгалактозного дієтичного харчуван-
ня значно поліпшує стан хворого, завдяки цьому не вини-
кає дефіциту галактози, оскільки уридиндифосфогалактоза
утворюється з УДФГ.
Фруктоза частково перетворюється на фруктозо-6-фос-
фат і далі метаболізує через фруктозо-1,6-дифосфат (див.
рис. 17-9). Ензим, що каталізує утворення фруктозо-6-фос-
фату, називають гексокіназою, саме він каталізує перетво-
рення глюкози на глюкозо-6-фосфат. Проте набагато біль-
ша кількість фруктози перетворюється на фруктозо-1-фос-
фат у реакції, яку каталізує фруктокіназа. Більша частина
фруктозо-1-фосфату розщеплюється на діоксіацетонфос-
фат і гліцеральдегід, який фосфорилює і разом з діоксі-
ацетонфосфатом бере участь у метаболізмі глюкози. Ос-
кільки реакції, що розпочинаються фосфорилюванням
фруктози в першому положенні, можуть відбуватися з
нормальною швидкістю без інсуліну, то застосування фрук-
този рекомендують хворим на діабет з метою поповнення
в їхньому організмі запасу вуглеводів. Та оскільки більша
їжа
Аміно- Гліцерин
кислота І |
II її
| Нирка |
ї
Сеча (якщо глюкози в плазмі
понад 180 мг/дл)
Рис. 17-14. Гомеостаз глюкози в плазмі. Зверніть увагу на
глюкостатичну функцію печінки, а також на видалення глюкози
з сечею в разі перевищення її ниркового порога (штрихова
стрілка).
частина фруктози метаболізує в кишці та печінці, то мож-
ливість поповнення вуглеводів в інших органах обмежена.
Фруктозо-6-фосфат може теж фосфорилювати у друго-
му положенні з утворенням фруктозо-2,6-дифосфату. Ця
сполука є важливим регулятором глюконеогенезу в печінці.
За умов високої концентрації фруктозо-2,6-дифосфату
посилюється процес перетворення фруктозо-6-фосфату на
фруктозо-1,6-дифосфат і, як наслідок, активується розщеп-
лення глюкози до пірувату. Зменшення кількості фруктозо-
2,6-дифосфату посилює зворотну реакцію і, відповідно,
сприяє глюконеогенезові. Протеїнкіназа під впливом глю-
кагону зумовлює зниження кількості фруктозо-2,6-дифос-
фату в печінці (див. Розділ 19).
МЕТАБОЛІЗМ БІЛКІВ
Білки
Білки складаються з великої кількості амінокислот (рис.
17-16), з’єднаних у ланцюги пептидними зв’язками, які
сполучають аміногрупу однієї кислоти з карбоксильною
групою іншої. Окрім цього, деякі білки містять вуглеводи
(глікопротеїни) і ліпіди (ліпопротеїни). Менші ланцюги
амінокислот називають пептидами або поліпептидами.
Межі між пептидами, поліпептидами та білками визначені
не чітко. У цій книзі ланцюги завдовжки 2-10 амінокис-
лотних залишків названо пептидами, ланцюги, що містять
їх понад 10, але менше 100, - поліпептидами, а ланцюги,
що містять 100 і більше амінокислотних залишків, - біл-
ками. Термін олігопептид, який деколи застосовують для
позначення малих пептидів, ми не використовуємо.
Порядок розташування амінокислот у пептидному лан-
цюгу називають первинною структурою білка. Ланцюги,
І1І Амінокислоти
□ Гліцерин
ГИ Піруват
и Лактат
40' 240 хв
Фізичне —►
Рис. 17-15. Вихід з печінки глюкози, утвореної внаслідок глі-
когенолізу (незабарвлена частина стовпця), і глюкози, утво-
реної завдяки, вірогідно, глюконеогенезу (обмежена фігур-
ною дужкою частина стовпця). Показано внесок у глюконео-
генез різних попередників глюкози (відтворено за дозволом
з Ееіід Р, Маґігеп 4: ЕиеІ Ітотеозіазіз іп ехегсізе. N ЕпдІ 4 Месі
1975;293:1078).
270/РОЗДІЛ 17
зігнуті й скручені складним способом, і термін вторинна
структура білка стосується його просторової організації,
утвореної згинанням і скручуванням. Типовою вторинною
структурою є правильна спіраль із трьома, сімома аміно-
кислотними залишками у витку (а-спіраль). Інша типова
вторинна структура - Р-складчастий шар. Антипаралель-
ний Р-складчастий шар утворюється, коли розтягнутий
поліпептидний ланцюг згортається з утворенням водне-
вих зв’язків між пептидними зв’язками сусідніх ланцюгів.
Крім того, паралельні р-складчасті шари виникають між
поліпептидними ланцюгами. В так званій стрічковій моделі
білка (див. рис. 27-8) а-спіралі показані у вигляді витків, а
Р-складчасті шари - у вигляді паралельних стрілок.
Третинна структура білка - це упакування згорнутих
ланцюгів у шари, кристали чи волокна. Термін четвер-
тинна структура використовують для позначення розта-
шування субодиниць, із яких складено багато білкових мо-
лекул (наприклад, гемоглобін; див. Розділ 27).
Амінокислоти
Амінокислоти, що містяться в білках, наведені в табл.
17-2. їх позначено три- чи однобуквеними скороченнями.
Багато інших важливих амінокислот, таких як орнітин, 5-
гідрокситриптофан, Ь-ДОФА, таурин та тироксин (Т4), є в
організмі, однак їх не виявлено в білках. У вищих тварин
природними формами амінокислот є Ь-ізомери. Зокрема,
Ь-ізомери гормонів, наприклад, тироксину, набагато
активніші, ніж О-ізомери. Амінокислоти мають основну,
нейтральну чи кислу реакцію залежно від співвідношення
вільних кислотних (-СООН) та основних (-МН2) груп у
молекулі.
Деякі з амінокислот є незамінними амінокислотами,
тобто їх потрібно отримувати з їжею, тоді як інші можуть
синтезуватись іп уіуо у кількостях, достатніх для задово-
лення метаболічних потреб (див. нижче).
Пул амінокислот
Незважаючи на те, що в шлунково-кишковому тракті
відбувається всмоктування невеликої кількості білків та
деяких пептидів, більшість спожитих білків перетравлю-
ються і їхні складові амінокислоти всмоктуються. Білки
самого організму постійно розщеплюються до амінокислот
і ресинтезуються. Обіг ендогенних білків у середньому
становить 80-100 г/д і є найбільшим у слизовій оболонці
кишки та майже нульовим у колагені. Амінокислоти,
Таблиця 17-2. Амінокислоти, що містяться в білках
Амінокислоти з аліфатичними бічними ланцюгами
Гліцин* (6Іу, 6)
Аланін (АІа, А)
Валін** (УаІ, V)
Лейцин (І_еи, І)
Ізолейцин (Не, І)
Гідроксилозаміщені амінокислоти
Серин (8ег, 8)
Треонін (ТГіг, Т)
Сірковмісні амінокислоти
Цистеїн (Суз, С)
Метіонін (Меі, М)
Амінокислоти з ароматичним бічним ланцюгом
Фенілаланін (РГіе, Е)
Тирозин (Тут, ¥)
Триптофан (Тгр, 77)
Амінокислоти з кислотним бічним ланцюгом, або їхні аміди
Аспарагінова кислота (Азр, О)
Аспарагін (Азп, І\І)
Глутамін (Сіп, О)
Глутамінова кислота (бій, Е)
у-Карбоксиглутамінова кислота1 (ОІа)
Амінокислоти з бічним ланцюгом, що містить основні групи
Аргінін2 (Агд, Я)
Лізин (І_уз, К)
Гідроксилізин1 (НуІ)
Гістидин2 (Ніз, Н)
Імінокислоти (містять іміно-, а не аміногрупу)
Пролін (Рго, Р)
4-Гідроксипролін1 (Нур)
З-Гідроксипролін1
Селеноцистеїн3
* У дужках наведено загальноприйняті три- і однобуквені ско-
рочення амінокислот.
* * Жирним шрифтом виділені незамінні амінокислоти.
1 Нема тРНК для цих чотирьох амінокислот; вони утворені
посттрансляційною модифікацією відповідних немодифіко-
ваних амінокислот у пептидному зв’язку. Є тРНК для селе-
ноцистеїну та інших 20 амінокислот, і вони входять у білки
під прямим генетичним контролем.
2 Аргінін і гістидин іноді називають напівнезамінними - вони
не є необхідними для підтримання азотного балансу, однак
потрібні для нормального росту.
3 Селеноцистеїн є рідкісною амінокислотою, у якій сірка цис-
теїну замінена селеном. Кодон ІІ6А зазвичай є стоп-кодоном,
проте в деяких випадках він кодує селеноцистеїн.
Н О
ї
н — І\К І ^С^
р
Амінокислота
Поліпептидний ланцюг
Рис. 17-16. Структура амінокислот і утворення пептидних зв’язків. Штрихова лінія відображає утворення пептидних зв’язків з
виділенням Н2О; Р - амінокислотний залишок; наприклад, у гліцині Р = Н, у глутаматі Р = -(СН2)2-СОО“.
ЕНЕРГЕТИЧНИЙ БАЛАНС, МЕТАБОЛІЗМ І ЖИВЛЕННЯ / 271
утворенні під час ендогенного розпаду білків, ідентичні
до амінокислот білків їжі. Разом вони формують пул
амінокислот, що забезпечує потреби організму (рис. 17-
17). У нирках відбувається реабсорбція більшості від-
фільтрованих амінокислот. Під час росту рівновага між
амінокислотами та білками організму зсувається в бік
білків так, що синтез перевищує розпад. За будь-якого віку
частина білків утрачається у вигляді волосся, у жінок
невеликі кількості білків відходять під час місячних. Деякі
малі білки виходять із сечею, а у випорожненнях наявні
нереадсорбовані білки травних секретів. Утрати поповню-
ються шляхом синтезування з пулу амінокислот.
Специфічні метаболічні функції
амінокислот
Тиреоїдні гормони, катехоламіни, гістамін, серотонін,
мелатонін та проміжні сполуки в циклі сечовини утворю-
ються з деяких амінокислот. Метіонін та цистеїн поста-
чають сірку, що міститься в білках, КоА, таурині та інших
біологічно важливих сполуках. Метіонін перетворюється
в 8-аденозилметіонін - активний метилювальний агент у
синтезі таких сполук, як адреналін. Він є головним доно-
ром біологічно лабільних метальних груп, однак метальні
групи можуть також надходити з похідними мурашиної
кислоти, приєднаними до похідних фолієвої кислоти, якщо
в харчовому раціоні є достатня кількість фолієвої кислоти
та ціанокобаламіну.
Сульфати сечі
Окиснення цистеїну - головне джерело сульфатів у сечі.
Більшість екскрецій сечі є у вигляді сульфатів ($О42 ), які
супроводжують відповідні кількості катіонів (Ка+, К+, КН4+,
чи Н+). Ефірні сульфати в сечі - це органічні естери суль-
фокислот (К-О-8О3Н), що утворюються в печінці з ендо-
генних та екзогенних фенолів, у тім числі естрогенів та
інших стероїдів, індолів та ліків.
Дезамінування, амінування і
трансамінування
Взаємоперетворення між амінокислотами та продук-
тами катаболізму вуглеводів і жирів на рівні загального
метаболічного пулу та циклу лимонної кислоти охоплюють
перенесення, відщеплення та утворення аміногруп. Реакції
Креатин Пурини, Гормони, МН4
Піримідини нейротрансмітери |
Сеча
Рис. 17-17. Метаболізм амінокислот.
трансамінування, перетворення однієї амінокислоти у
відповідну кетокислоту з одночасним перетворенням іншої
кетокислоти в амінокислоту:
Аланін + а-Кетоглутарат <=> Піруват + Глутамат,
відбуваються у багатьох тканинах. Трансамінази, що бе-
руть участь у цих процесах, наявні також у кровообігу. Як-
що виникає ушкодження багатьох активних клітин як нас-
лідок патологічного процесу, то рівень сироваткових транс-
аміназ зростає. Прикладом є підвищення рівня аспартат-
амінотрансферази (АСТ) у плазмі крові у разі інфаркту
міокарда.
Окислювальне дезамінування амінокислот відбува-
ється в печінці. Імінокислота утворюється шляхом дегід-
рогенації, далі реакція гідролізу приводить до відповідної
кетокислоти з утворенням ИН4+:
Амінокислота + НАД* -> Імінокислота + НАДН + Н+;
Імінокислота + Н2О -> Кетокислота + МН4+.
Катіон ИН4+ перебуває в рівновазі з МН3. Амінокислота
може також приєднувати ИН4+, утворюючи відповідний
амід. Прикладом такої реакції є приєднання ИН4+ до глута-
мату, яке фіксують у мозку (рис. 17-18). Зворотна реакція
відбувається в нирках з утворенням КН4+ і його екскре-
цією із сечею (див. Розділ 38).
Взаємоперетворення між пулом амінокислот і загаль-
ним метаболічним пулом відображені на рис. 17-19. Лей-
цин, ізолейцин, фенілаланін та тирозин називають кето-
генними, оскільки вони перетворюються в ацетоацетат
(кетонові тіла, див. нижче). Аланін та багато інших аміно-
кислот є глюкогенними, бо вони дають початок сполукам,
які можуть легко перетворитися в глюкозу.
Біосинтез сечовини
Більшість ИН4+, утвореного деамінуванням амінокислот
у печінці, перетворюється в сечовину. Катіон Ь1Н4+ утворює
карбамоїлфосфат, який у мітохондріях переноситься на
орнітин, утворюючи цитрулін. Ензимом, що каталізує про-
цес, є карбамоїлтрансфераза. Цитрулін перетворюється в
аргінін, від якого відщеплюється сечовина, і регенеруєть-
ся орнітин (цикл сечовини; рис. 17-20). Більшість сечо-
вини утворюється в печінці, і в разі серйозних хвороб пе-
чінки азот сечовини крові (АСК) знижується, а рівень МН3
у крові підвищується. Спадковий дефіцит орнітинкарбо-
моїлтрансферази також може призвести до інтоксикації
МН3 навіть в осіб, що є гетерозиготними за цією ознакою.
Креатин і креатинін
Креатин синтезується в печінці з метіоніну, гліцину й
аргініну. У скелетних м’язах він фосфорилюється з утво-
ренням фосфокреатину (рис. 17-21), який є важливим
резервом енергії для синтезу АТФ (див. Розділ 3). АТФ,
що виникає під час гліколізу та окисного фосфорилювання,
реагує з креатином, завдяки чому утворюється АДФ та
фосфокреатин. Під час фізичних навантажень реакція
відбувається у зворотному напрямі, забезпечуючи поста-
чання АТФ, який є безпосереднім джерелом енергії для
272/РОЗДІЛ 17
МНз’ п
1
не—с
єн Х°
О N 2
I
сн2
І
О=с-І\ІН2
Глутамін
Глутаміназа
/(нирки)
+ Н20
\ АДФ — АТФ
(Головний мозок)
МН3’ п
1 о°
нс-с
єн Х°’
оп2
І
СН2
І
о = с-о
Глутамат
+ N4/
ічн; +................ мн2 + н+
Рис. 17-18. Вивільнення та приєднання N4/ під час взаємоперетворення глутаміну і глутамату. Катіон N4/ перебуває в стані
рівноваги з І\ІН3. Рівновага реакції зміщується правобіч у нирках, і МН3 секретується в сечу. Рівновага реакції зміщується
лівобіч у головному мозку, видаляючи токсичний для нервових клітин І\ІН3.
скорочення м’язів. Деякі атлети споживають креатин як
харчовий додаток і стверджують, що він підвищує їхні
результати в спринті та інших формах короткотривалих
навантажень.
Креатинін у сечі утворюється з фосфокреатину. Креа-
тин прямо не перетворюється в креатинін. Рівень екскреції
креатиніну порівняно сталий протягом тривалого часу. Під
час дослідження метаболізму часто вимірюють кількість
креатиніну в сечі для перевірки точності. Визначають
середнє денне виділення креатиніну і значення денного
утворення інших сполук співвідносять до певного рівня
виведеного креатиніну.
Креатинурія інколи простежується в дітей, жінок під
час та після вагітності й інколи в невагітних жінок. У нормі
Гідроксипролін
Серин
Цистеїн
Треонін
Гліцин
Лактат
Рис. 17-19. Участь циклу лимонної кислоти в трансамінуванні та глюконеогенезі. Виділені стрілки позначають головний шлях
глюконеогенезу (відтворено за дозволом з Миггау ВК еі аі: Нагреґз Віосґіетізігу, 251Н есі. Мс<Зга\л/-НіН, 2000).
ЕНЕРГЕТИЧНИЙ БАЛАНС, МЕТАБОЛІЗМ І ЖИВЛЕННЯ / 273
НМ НМ
І Цитрулін
(СН2)3
І
Аргінін І
(СН2)3
І
Рис. 17-20. Цикл сечовини.
в сечі чоловіків є дуже мало креатину або ж узагалі нема,
проте за будь-якого стану, пов’язаного з інтенсивним м’я-
зовим розпадом його рівень помітно збільшується. Креа-
тинурія виникає внаслідок голодування, тиреотоксикозу,
некомпенсованого цукрового діабету та різноманітних
первинних і вторинних хвороб м’язів (міопатіях).
Пурини та піримідини
Фізіологічно важливі пурини та піримідини показані
нарис. 17-22. Нуклеозиди - пурини чи піримідини, з’єд-
нані з рибозою, - є компонентами не тільки різноманітних
коензимів та пов’язаних із ними сполук (НАД+, НАДФ+,
АТФ, УДФГ тощо), а також РНК та ДНК (табл. 17-3).
Структура та функції ДНК і РНК, а також їхня роль у син-
тезуванні білків розглянуті у Розділі 1.
Нуклеїнові кислоти їжі розщеплюються (перетравлю-
ються), а їхні складові пурини і піримідини абсорбуються,
проте більшість пуринів і піримідинів синтезується з
амінокислот головно в печінці, з яких далі синтезуються
нуклеотиди та РНК і ДНК. РНК перебуває в динамічній
рівновазі з пулом амінокислот, однак ДНК, будучи
сформованою, метаболічно стабільна протягом життя.
Пурини та піримідини, вивільнені внаслідок розпаду
нуклеотидів, можуть знову бути використані або катаболі-
зовані. Лише невелика їхня частина виводиться в незмі-
неному стані із сечею. Піримідини катаболізуються до СО2
і МН3, а пурини перетворюються в сечову кислоту.
Розпад білків
Як і синтез білків, їхній розпад є ретельно регульованим
складним процесом. Сполучення білків із 74-амінокислот-
ним поліпептидом убіквітином є позначкою для білків,
призначених для розпаду. Цей поліпептид високо консер-
вативний і наявний в усіх клітинах - від бактерій до люди-
ни. Убіквітинація цитоплазматичних білків, у тім числі
інтегральних білків ендоплазматичної сітки, маркує білки
для розпаду в багатосубодиничних протеолітичних час-
тинках - 268 протеасомах, а убіквітинація мембранних
білків, таких як рецептори гормону росту, маркує їх для
розпаду в лізосомах.
Зафіксовано беззаперечний баланс між інтенсивністю
синтезу білків та їхнього розпаду, отже, приєднання
убіквітину має важливе значення в клітинній біології,
наприклад, у регулюванні клітинного циклу (див. Розділ
1). Рівні метаболізму окремих білків відрізняються, а тому
в організмі є механізм, за допомогою якого аномальні білки
розпізнаються й руйнуються швидше, ніж нормальні
складові. Наприклад, аномальні гемоглобіни швидко ката-
болізуються в осіб зі спадковими гемоглобінопатіями (див.
Розділ 27). Розпад білків зменшується у гіпертрофованих
тренованих скелетних м’язах і збільшується під час атрофії
у денервованому м’язі чи скелетному м’язі, що з якихось
Н2М Відпочинок НМ — РО3
Н --------------------І
Н2І\Ґ = С + АТФ Н2М+ = С + АОР
І -------І
СН3 - МСН2СОО Фізичні СН3 - МСН2СОО"
навантаження
Креатин Фосфорилкреатин
Пуринове ядро
Аденін-
Гуанін:
Гіпоксантин:
Ксантин:
6-амінопурин
1-аміно-
6-оксипурин
6-оксипурин
2,6-діоксипурин
нм-с = о
І
нм = с
І
сн3 -м-сн2
Креатинін
Піримідинове ядро
Рис. 17-21. Креатин, фосфорилкреатин та креатинін.
Цитозин: 4-аміно-
2-оксипіримідин
Урацил: 2,4-діоксипіримідин
Тимін: 5-метил-
2,4-діоксипіримідин
Рис. 17-22. Головні фізіологічно важливі пурини та піримідини.
Оксипурини та оксипіримідини можуть утворювати енольні
похідні (гідроксипурини та гідроксипіримідини) шляхом пере-
міщення атома водню до кисневмісного замісника.
10 367-9
274/РОЗДІЛ 17
Таблиця 17-3. Пурино- і піримідиновмісні сполуки
Тип сполуки Компоненти
Нуклеозид Пурин чи піримідин плюс рибоза чи 2-дезоксирибоза
Нуклеотид (мононуклеотид) Нуклеозид плюс залишок фосфорної кислоти
Нуклеїнова кислота Багато нуклеотидів, що утворюють дволанцюгові структури чи два полінуклео- тидні ланцюги
Нуклеопротеін Нуклеїнова кислота плюс один чи більше простих основних білків
Рибозовмісні Рибонуклеїнова кислота
2-Дезоксирибозовмісні Дезоксирибонуклеїнова кислота
Аденозин Гуанозин
Сечова кислота (екскретована людиною)
причин не працює. Окрім того, він є чинником у визна-
ченні розміру органа (наприклад, рівень розпаду печін-
кових білків помітно зменшується під час компенсаторної
гіпертрофії, яка настає після часткової гепатектомії).
Сечова кислота
Сечова кислота утворюється внаслідок розпаду пуринів
і прямого синтезування з 5-фосфорибозилпірофосфату (5-
ФРПФ) та глутаміну (рис. 17-23). У людей вона виводиться
з сечею, а в деяких тварин перед екскрецією окиснюється
до алантоїну. Нормальний рівень сечової кислоти в крові
людини становить близько 4 мг/дл (0,24 ммоль/л). У нир-
ках відбувається її фільтрування, реабсорбування й
виведення. Зазвичай 98% відфільтрованої сечової кислоти
реадсорбується, а решта 2% відповідають близько 20%
кількості сечової кислоти, яка виводиться. Інші 80%
надходять завдяки канальцевій секреції. Виведення сечової
кислоти в разі бсзпуринової дієти становить 0,5 г/добу, а у
випадку нормального харчування - близько 1 г/добу.
Первинна та вторинна подагра
Подагра - це хвороба з повторюваними приступами арт-
риту, уратними відкладеннями в суглобах, нирках та інших
тканинах, а також збільшеним рівнем сечової кислоти в
крові та сечі. Спочатку зазнає враження плеснофаланговий
суглоб великого пальця ноги. Є дві форми первинної
подагри: у разі одної збільшується утворення сечової
кислоти внаслідок різних ензимних аномалій; у випадку
іншої вибірково порушується канальцеве транспортування
сечової кислоти в нирках. У разі вторинної подагри рівень
сечової кислоти в рідинах організму збільшується внас-
лідок зменшення екскреції або посиленого її утворення,
яке є вторинним щодо якоїсь хвороби. Наприклад, екск-
реція зменшується в пацієнтів, які вживають триазидні
сечогінні засоби (див. Розділ 38), та в осіб із хворобами
нирок. Утворення сечової кислоти збільшується в разі
лейкемії та пневмонії внаслідок активного руйнування
лейкоцитів.
Лікування подагри полягає у зниженні симптоматики
гострого артриту за допомогою таких ліків, як колхіцин
Алантоїн (екскретований іншими ссавцями)
Рис. 17-23. Синтезування та розпад сечової кислоти. Аде-
нозин переходить у гіпоксантин, який потім перетворюється
в ксантин, а ксантин - у сечову кислоту. Дві останні реакції
каталізує ксантиноксидаза. Гуанозин прямо перетворюється
в ксантин. Ксантиноксидазу інгібує алопуринол - один з пре-
паратів, який застосовують для лікування подагри.
чи нестероїдні протизапальні препарати, та зменшенні
рівня сечової кислоти в крові. Колхіцин не впливає на мета-
болізм сечової кислоти, він, очевидно, зменшує приступи
подагри, інгібуючи фагоцитоз кристалів сечової кислоти
лейкоцитами, тобто певним чином зумовлюючи суглобні
симптоми. Фенілбутазон та пробенецид інгібують реаб-
сорбцію сечової кислоти в ниркових канальцях. Алопури-
нол, що інгібує ксантиназу (див. рис. 17-23), є одним з
препаратів, який використовують із метою зменшити утво-
рення сечової кислоти.
Азотний баланс
Для заміни втрачених білків і амінокислот потрібно що-
денно споживати певну кількість білка. Це стосується не
самих білків, а їхніх складових - амінокислот, які можна
споживати в чистому вигляді. Втрата білків та їхніх похід-
них із випорожненнями зазвичай дуже мала. Тому кількість
азоту в сечі є надійним показником кількості незворотного
розпаду білків і амінокислот. Якщо кількість азоту в сечі
дорівнює вмісту азоту в білку їжі, то кажуть, що в особи
настав азотний баланс. Зі зростанням споживання білків
більша кількість амінокислот деамінується, екскреція сечо-
вини посилюється, і азотний баланс відновлюється. Незва-
жаючи на це, у випадках, коли підвищена секреція катабо-
ЕНЕРГЕТИЧНИЙ БАЛАНС, МЕТАБОЛІЗМ І ЖИВЛЕННЯ / 275
лічних гормонів кори надниркових залоз чи зменшена
секреція інсуліну, та під час голодування чи вимушеної ім-
мобілізації втрати азоту перевищують його надходження,
і азотний баланс стає негативним. Під час росту, одужання
від хвороби чи введення анаболічних стероїдів, таких як
тестостерон, надходження азоту перевищує його екскре-
цію, і азотний баланс стає позитивним.
У випадку нестачі однієї з незамінних амінокислот, що
потрібна для синтезування білків, білок не синтезується.
Інші амінокислоти, які повинні бути у складі білка, деамі-
нують, як і інші надлишкові амінокислоти, а їхній азот
виділяється у вигляді сечовини. Це є причиною того, що
азотний баланс стає негативним, якщо одну з незамінних
амінокислот вилучають із харчового раціону.
Відповідь на голодування
Якщо особа споживає їжу, яка містить мало білків, однак
є достатньо калорійною, то екскреція сечовини та сульфо-
ефірів знижується; екскреція сечової кислоти зменшується
на 50%, а екскреція креатину не змінюється. Внаслідок
цього креатин та близько половини сечової кислоти в сечі
утворюються тільки завдяки процесу “зношення”, на який
не впливає кількість спожитого білка. Загальна екскреція
азоту менше 3,6 г/добу під час білкового голодування,
навіть коли їжа достатньо калорійна, оскільки негативним
є азотний баланс, спричинений дефіцитом незамінних
амінокислот.
У випадку недостатньо калорійного харчування екскре-
ція азоту в сечовині в середньому становить 10 г/добу, тому
що білки розщеплюються для отримання енергії. Невеликі
кількості глюкози протидіють цьому катаболізму до поміт-
ного рівня (глюкозний ефект білкового резервування).
Такий ефект виникає головно внаслідок того, що глюкоза
збільшує секрецію інсуліну, який, відповідно, гальмує роз-
пад білків у м’язах, а також після введення порівняно не-
великих кількостей амінокислот.
Жири теж сприяють затриманню азоту. Під час трива-
лого голодування кетокислоти, утворені з жирів (див. ниж-
че), використовуються у мозку та інших тканинах. Ці речо-
вини є кофакторами метаболізму в м’язах разом із трьома
амінокислотами, що мають розгалужений ланцюг: лейци-
ном, ізолейцином та валіном. Під час утилізації жиропо-
хідних кетокислот ці амінокислоти, очевидно, нагромад-
жуються. Введення безазотних аналогів названих аміно-
кислот зумовлює білкове резервування та зменшує утво-
рення сечовини й аміаку в пацієнтів з ушкодженнями нирок
і печінки.
Більшість білків, розпад яких відбувається під час
загального голодування, надходить з печінки, селезінки та
м’язів і, порівняно мало, - із мозку та серця. Після вичер-
пання запасів глікогену в печінці рівень глюкози в крові
дещо знижується (див. вище), однак завдяки глюконео-
генезу він є вищим від того рівня, що спричинює гіпогліке-
мічні симптоми. Простежується кетонемія, нейтральні
жири швидко катаболізують. Коли запаси жиру вичерпані,
то катаболізм білків ще більше посилюється і швидко
настає смерть. Середня людина масою 70 кг має 0,1 кг
глікогену в печінці, 0,4 кг глікогену в м’язах та 12 кг жиру.
Цих запасів глікогену достатньо для одноденного голоду-
вання. В госпіталізованих опасистих пацієнтів, яким дають
лише воду та вітаміни, простежується втрата маси в межах
1 кг/добу протягом перших 10 днів. Потім втрата маси
зменшується й стабілізується на значенні близько 0,3 кг за
добу. Упродовж деякого часу пацієнти почуваються досить
добре, проте інколи трапляються ускладнення у вигляді
постуральної гіпотензії та подагричного артриту. У людини
середній час від початку голодування до смерті становить
60 днів.
МЕТАБОЛІЗМ ЖИРІВ
Ліпіди
Біологічно важливими ліпідами є жирні кислоти та їхні
похідні, нейтральні жири (тригліцериди), фосфоліпіди і
пов’язані з ними сполуки й стерини. Тригліцериди скла-
даються з трьох жирних кислот, приєднаних до гліцерину
(табл. 17-4). Жирні кислоти природного походження міс-
тять парну кількість атомів вуглецю. Вони можуть бути
насиченими (не мають подвійних зв’язків) та ненасиче-
ними (дегідрогенізовані, із різною кількістю подвійних
зв’язків). Фосфоліпіди є складовими компонентами клітин-
них мембран. Стерини утворені з різних стероїдних гор-
монів та холестерину.
Окиснення жирних кислот та їхнє
синтезування
В організмі жирні кислоти розпадаються до ацетил-
КоА, який потрапляє до циклу лимонної кислоти. Головний
розпад відбувається в мітохондріях шляхом Р-окиснення.
Окиснення жирних кислот починається з їхнього активу-
вання (рис. 17-24) - реакції, що відбувається всередині й
ззовні мітохондрій. Жирні кислоти із середнім та коротким
ланцюгом надходять у мітохондрії без активування, тоді
як жирні кислоти з довгим ланцюгом повинні бути приєд-
нанні до карнітину естерним зв’язком, перш ніж вони змо-
жуть пройти через внутрішню мітохондріальну мембрану.
Карнітин - це Р-гідрокси-у-триметиламоній бутират, який
синтезується в організмі з лізину і метіоніну. Транслоказа
переміщає естер жирної кислоти і карнітину в матрикс
мітохондрії в обмін на вільний карнітин. У матриксі естер
переноситься на КоА, утворюючи активовану молекулу
жирної кислоти, доступну для Р-окиснення, і постачаючи
карнітин для подальшого обміну. Бета-окиснення полягає
в повторному відщепленні фрагментів із двох атомів вуг-
лецю від жирної кислоти (див. рис. 17-24). Енергетичний
вихід цього процесу досить великий. Наприклад, ката-
болізм 1 моля шестивуглецевої жирної кислоти в циклі
лимонної кислоти до СО2 та Н2О дає 44 молі АТФ, тоді як
під час катаболізму шестивуглецевого вуглеводу глюкози
утворюється лише 38 молів.
Недостатнє Р-окиснення жирних кислот може бути
спричинене нестачею карнітину чи генетичними дефек-
тами в транслоказі або інших ензимах, задіяних у пере-
несенні жирних кислот із довгим ланцюгом у мітохондрії.
Такий стан зумовлює кардіоміопатію, а також призводить
до гіпокетонічної гіпоглікемії з комою - серйозним і
часто смертельним станом, який виникає після голодування
з вичерпанням запасів глюкози внаслідок недостатнього
окиснення жирних кислот, яке постачає енергію, а кето-
276 /РОЗДІЛ 17
Таблиця 17-4. Ліпіди
Типові жирні кислоти:
Пальмітинова кислота
Стеаринова кислота
Олеїнова кислота
О
II
СН3(СН2)14-С-ОН
о
II
СН3(СН2)16-С-ОН
о
II
СН3(СН2)7СН=СН(СН2)-С-ОН
(ненасичена)
Тригліцериди (триацилгліцероли): Естери гліцерину і
трьох жирних кислот
о
II
СН-О-С-К СН2ОН
І о І о
І II І II
сн-о-с-к + ЗН2О^СНОН + зно-с-к
о
І II І
сн-о-с-к СН2ОН
Тригліцерид Гліцерин
Р - Аліфатичний ланцюг різної довжини й ступеня
насиченості.
Фосфоліпіди:
А. Естери гліцерину, двох жирних кислот і
1) фосфату = фосфатидна кислота
2) фосфату плюс інозиту = фосфатидилінозит
3) фосфату плюс холіну = фосфатидилхолін (лецитин)
4) фосфату плюс етаноламіну = фосфатидил-
етаноламін (цефалін)
5) фосфату плюс серину = фосфатидилсерин
В. Інші фосфатвмісні похідні гліцерину.
С. Сфінгомієліни: Естери жирної кислоти, фосфату,
холіну та аміноспирту сфінгозину.
Цереброзиди: Сполуки, що містять галактозу, жирну
кислоту та сфінгозин.
Стерини: холестерол та його похідні, у тім числі стеро-
їдні гормони, жовчні кислоти та різноманітні вітаміни.
нові тіла (див. нижче) не утворюються в достатніх кіль-
костях з огляду на нестачу КоА в печінці.
Багато тканин здатні синтезувати жирні кислоти з аце-
тил-КоА. Деякі синтези довголанцюгових жирних кислот
із коротколанцюгових відбуваються в мітохондріях прос-
тим обігом реакцій, показаних на рис. 17-24. Однак зде-
більшого жирні кислоти синтезуються сіє поуо з ацетил-
КоА за допомогою різних шляхів, що розміщені головно
поза мітохондріями в мікросомах. Етапи цих шляхів
зображені на рис. 17-25.
З невідомих причин в усіх клітинах синтезування жир-
них кислот припиняється, коли довжина ланцюга сягає 16
вуглецевих атомів. Тільки невеликі кількості жирних кис-
лот мають довжину 12- чи 14-вуглецевих атомів, і не утво-
рюється жодної кількості кислот із довжиною вуглецевого
ланцюга понад 16 атомів. Продовження вуглецевого лан-
цюга до 18 і більше атомів С (стеаринова кислота) від-
бувається у мікросомах печінкових клітин. Жирні кислоти
сполучаються з гліцерином, утворюючи нейтральні жири,
зокрема, цей процес відбувається у жирових відкладах, а
саме з’єднання - в мітохондріях.
Кетонові тіла
У багатьох тканинах залишки ацетил-КоА конденсують-
ся з утворенням ацетоацетил-КоА (рис. 17-26). У печінці,
яка (на відміну від інших тканин) містить деацилазу, утво-
рюється вільний ацетоацетат. Ця Р-кетокислота перетво-
рюється в Р-гідроксибутират та ацетон, а оскільки ці спо-
луки погано метаболізують у печінці, то вони дифундують
до кровоносної системи. Ацетоацетат у печінці виникає
також унаслідок утворення З-гідрокси-З-метилглутарил-
КоА (див. рис. 17-26), і цей шлях є важливішим, ніж деаци-
лювання. Ацетоацетат, Р-гідроксибутират та ацетон нази-
вають кетоновими тілами. Тканини, окрім печінки, пере-
носять КоА із сукциніл-КоА до ацетоацетату та метаболі-
зують “активний” ацетоацетат до СО2 і Н2О через цикл
лимонної кислоти. Відомі й інші шляхи, за допомогою яких
відбувається метаболізування кетонових тіл. За деяких
умов кетони є важливим джерелом енергії. Ацетон виділя-
ється із сечею та видихуваним повітрям.
Нормальний рівень кетонових тіл у крові людини низь-
кий (близько 1 мг/дл) і оскільки ці тіла за нормальних умов
метаболізують настільки ж швидко, як і утворюються, то
за 24 год їх екскретується менше 1 мг. Та якщо надходження
ацетил-КоА до циклу лимонної кислоти зменшується внас-
лідок поганого постачання продуктами метаболізму глю-
кози чи не збільшується зі збільшенням постачання ацетил-
КоА, то ацетил-КоА нагромаджується, рівень конденсації
ацетоацетил-КоА підвищується, і в печінці утворюється
більше ацетоацетату. Здатність тканин до окиснення
кетонових тіл швидко сягає межі, і ці тіла накопичуються
в системі кровообігу (кетонемія). Два з трьох кетонових
тіл - ацетоацетат і Р-гідроксибутират - є аніонами серед-
ньої сили кислот: ацетооцтової і Р-гідроксимасляної, вони
мають буферні властивості, протидіючи відхиленню рН,
що відбулося б в іншому випадку. Проте буферна ємність
може бути перевищена, і метаболічний ацидоз, що роз-
вивається за таких станів, як і діабетична кетонемія, буває
важким і навіть фатальним.
До нестачі постачання внутрішньоклітинної глюкози
призводять три стани: голодування, цукровий діабет та ви-
сокожирова низьковуглеводна дієта. У разі діабету зни-
жується надходження глюкози в клітину. Якщо ж більшість
калорій їжі надходить із жирів, то виникає дефіцит вугле-
водів, оскільки нема головного шляху перетворення жирів
у вуглеводи. Клітини печінки наповнюються жиром, який
їх ушкоджує й витісняє глікоген. За усіх цих станів кето-
немія розвивається первинно з огляду на надмірне утво-
рення кетонових тіл.
Запах ацетону у видихуваному повітрі у дітей після
блювання виникає внаслідок кетонемії від голодування.
Парентеральне введення порівняно малих кількостей глю-
ЕНЕРГЕТИЧНИЙ БАЛАНС, МЕТАБОЛІЗМ І ЖИВЛЕННЯ / 277
Жирна кислота "Активна" жирна кислота
О О
11 Мд2+ 11
в- СН2СН2 -С-ОН + Н8-КоА -------------► Н2О + В - СН2СН2 - С-8-КоА
АТФ АДФ
Окиснений
флавопротеїн
І
Відновлений
флавопротеїн
ОН О О
| II II
Р-С-СН2 - С-8-КоА <-------------------Н2О + В -СН= СН-С-8-КоА
І
Н Р-Пдроксижирна кислота-КоА аф-Ненасичена жирна кислота-КоА
НАД+ — НАДН + Н+
О О О О
II II II II
Р — С—СН2 — С — 8 — КоА + Н8-КоА -----► В—С—8—КоА + СН3 -С-8-КоА
р-Кетожирна кислота-КоА "Активна" жирна кислота + ацетил-КоА
В - залишок ланцюга жирної кислоти
Рис. 17-24. Окиснення жирних кислот. Цей процес одночасного відщеплення фрагментів з двох атомів вуглецю повторюється
до кінця ланцюга.
О
СН3- С-8-КоА +
Мп2+
Біотин
СО2 ----------►
АТФ—* АДФ
СООН
сн2
с-8- КоА
Ацетил-КоА
О
Малоніл-КоА
СООН
сн2
С-8- КоА
О
|АТБ|- 8Н
СООН
сн2
^С-3-[МБ]
О
Малоніл-АТБ
СООН
сн2
\ С-8-[аТБ|
О
+ СН3 -С-8-
| АТБ |
О
О
СН3 — С — СН2 — С — 8 — [АТБ] + Н8-|АТБ| + СО2
О
О О о
СН3 — С — СН2 — С —8 — ІАТБІ + 2Н+ -------------► СН3СН2СН2 -С-8-ІАТБІ + Н2О
1---1 2Н+ + 2НАДФН — 2НАТФ+ 1---1
Бутирил-АТБ
Рис. 17-25. Синтезування жирних кислот через шляхи, виявлені в мікросомах. АТБ - ацилтранспортний білок, який є частиною
ензимного комплексу, до якого приєднуються ацильні залишки під час синтезування жирних кислот. Процес, показаний тут,
повторюється, завдяки чому відбувається додавання одного комплексу ацетил-АТБ до бутирил-АТБ з утворенням шестивуг-
лецевого АТБ похідного жирної кислоти, потім інший комплекс ацетил-АТБ з утворенням восьмивуглецевої сполуки і т.д.
278/РОЗДІЛ 17
О О
II II
СН3-с-8-КоА + СН3 -С-8-КоА
2 Ацетил-КоА
р-Кетотіолаза
О О
II II
СН3-С-СН2 -С-8- КоА + Н8-КоА
Ацетоацетил-КоА
0 0 0 0
11 11 Деацилаза 11 II
СНз—С —СН2 — С —8—КоА + Н20 -----------*\СН3 - С - СН2 - С-О + Н+ + Н8-КоА
(лише печінка)
Ацетоацетил-КоА А цето ацетат
ОН О
І . II
Ацетил-КоА + Ацетоацетил-КоА —* СН3 — С — СН2 — С — 8 — КоА + Н+
СН2 - СОО
З-Пдрокси-З-метилглутарил-КоА
(ГМГ-КоА)
ГМГ-КоА —* Ацетоацетат + Н+ + Ацетил-КоА
Ацетоацетат
О О
II II
сн3-с-сн2 - с -о + н+
Усі тканини, крім
печінки
+2Н -2Н
О Ацетон
II
сн3-снон-сн2 — с —о + н+
Р-Пдроксибутират
Рис. 17-26. Утворення та метаболізм кетонових тіл. Зверніть увагу, що є два шляхи утворення ацетоацетату.
кози запобігає утворенню кетонемії, саме тому цей вугле-
вод називають антикетогенним.
Клітинні ліпіди
Ліпіди в клітинах поділяють на два головні типи: струк-
турні ліпіди, які є складовими мембран та інших частин
клітини, та нейтральний жир, що його нагромаджують
клітини-адипоцити у жирових відкладах. Нейтральний жир
окиснюється під час голодування, а структурні ліпіди збері-
гаються. Звичайно ж, запаси жиру відрізняються за розмі-
рами, проте в неопасистих осіб вони становлять 15% від
маси тіла в чоловіків і 21 % - у жінок. Вони є не інертними
масами, як уважали раніше, а активними динамічними тка-
нинами, що зазнають постійного розпаду і ресинтезу. У
жировій тканині глюкоза метаболізує до жирних кислот, і
відбувається синтез нейтральних жирів. Відповідно, ней-
тральні жири розкладаються, і вільні жирні кислоти над-
ходять у систему кровообігу.
Бурий жир
Третім - спеціальним - типом ліпідів є бурий жир, який
становить лише малий відсоток від загальної кількості
ліпідів організму. Бурий жир, який здебільшого простежу-
ється в дітей, однак буває і в дорослих, розташований між
лопатками, на потилиці, вздовж великих судин у грудній
клітці й черевній порожнині, а інколи і в інших місцях. У
відкладах бурого жиру жирові клітини, як і кров’яні судини,
мають виражену симпатичну іннервацію, на противагу від-
кладам білого жиру, у яких іннервуються лише деякі жирові
клітини, проте основна симпатична іннервація є лише у
кров’яних судинах. Окрім того, звичайні жирові клітини
мають одну велику краплю білого жиру, тоді як клітини
бурого жиру складаються з кількох маленьких крапель.
Клітини бурого жиру містять також багато мітохондрій. У
цих мітохондріях є звичайна внутрішня протонна про-
відність, яка утворює АТФ (окиснювальне фосфорилюван-
ня, див. вище), а також інша протонна провідність, що не
утворює АТФ. Така закорочувальна провідність залежить
від роз’єднувального білка масою 32 кДа, тепер названого
ИСР 1 (від англ. ипсоирііп^ ргоїеіп). Цей білок зумовлює
роз’єднання окиснювального процесу та утворення АТФ,
унаслідок чого утворюється більше тепла (рис. 17-27).
Нещодавно відкрито другий білок - 15СР 2, що міститься
у білій та бурій жирових тканинах, є також докази наявності
ЕНЕРГЕТИЧНИЙ БАЛАНС, МЕТАБОЛІЗМ І ЖИВЛЕННЯ / 279
ще кількох таких білків. Активування симпатичної іннер-
вації бурої жирової тканини вивільняє норадреналін, який,
діючи на р3-адренергічні рецептори, стимулює ліполіз, а
посилене окиснення жирних кислот у мітохондріях збіль-
шує теплопродукування. Отже, зміни активності симпа-
тичної системи у бурому жирі спричинюють зміни в
ефективності, із якою відбувається засвоювання їжі й утво-
рюється енергія. Зміни в експресії білків ССР також мо-
жуть впливати на ефективність засвоєння їжі.
Є докази, що бурий жир діє таким способом у тварин і,
можливо, людей, пристосованих до холоду, у яких поси-
лено утворюється тепло в бурому жирі, а також пришвид-
шений кровообіг. Нервове стимулювання бурого жиру під-
вищене після споживання їжі, внаслідок чого теж збіль-
шується утворення тепла. Зазначимо, що посилене утво-
рення тепла після їжі зумовлене двома чинниками: негай-
но специфічною динамічною дією (див. вище) унаслідок
засвоєння їжі, та дещо слабшим підвищенням вироблення
тепла бурим жиром. Залежність кількості бурого жиру від
споживання їжі розглянуто в Розділі 14.
Ліпіди плазми й транспортування ліпідів
Більшість ліпідів порівняно нерозчинні у воді і не
циркулюють у вільній формі. Вільні жирні кислоти
приєднані до альбуміну, тоді як транспортування холес-
терину, тригліцеридів та фосфоліпідів відбувається у
вигляді ліпопротеїнових комплексів. Комплекси значно
збільшують розчинність ліпідів. Є шість родин ліпопро-
теїнів (табл. 17-5) залежно від їхніх розмірів і вмісту ліпідів.
Густина цих ліпопротеїнів (і, відповідно, швидкість седи-
ментації в ультрацентрифузі) обернено пропорційна до
вмісту в них ліпідів. Загалом ліпопротеїни мають гідро-
фобну серцевину з тригліцеридів і естерів холестеролу,
оточених фосфоліпідами та білком (рис. 17-28). Шляхи,
якими ліпопротеїни потрапляють із кишки до печінки
(екзогенний шлях), і якими ліпіди переходять до та від
тканин (ендогенний шлях), зображені на рис. 17-29.
Білкові складові ліпопротеїнів називають апопротеї-
нами. Головні апопротеїни - АРО Е, АРО С та АРО В
(див. рис. 17-29). Відомо дві форми АРО В: низькомоле-
Рис. 17-27. Протонне транспортування через мітохондріальну
мембрану у бурому жирі. Транспортування протонів назовні
відбувається у електроннотранспортній системі, як і в інших
мітохондріях; окрім руху протонів усередину, який сприяє
утворенню АТФ, наявна “втеча” протонів усередину міто-
хондрії, яка не утворює АТФ. Унаслідок цього метаболізм жиру
й утворення АТФ роз’єднані. Порівняйте з рис. 17-7
кулярна форма АРО В-48, притаманна екзогенному шляху,
що транспортує екзогенні поглинуті ліпіди (див. нижче),
та високомолекулярна форма АРО В-100, притаманна
ендогенному транспортному шляху.
Хіломікрони утворюються в слизовій оболонці кишок
під час абсорбції продуктів травлення жирів (див. Розділ
25). Вони є дуже великими ліпопротеїновими комплексами,
що потрапляють у систему кровообігу через лімфатичні
судини. Після споживання їжі в крові цих частинок так
багато, що плазма набуває вигляду молока (ліпемія). Хіло-
мікрони виводяться з кровообігу за участю ліпопротеїнлі-
пази, яка розміщена на поверхні ендотелію. Цей ензим ка-
талізує розпад тригліцеридів у хіломікронах до вільних
жирних кислот та гліцерину, які потім потрапляють в ади-
поцити й реестерифікуються. Як альтернатива, вільні жир-
ні кислоти залишаються в кров’яному руслі зв’язаними з
альбуміном. Ліпопротеїнліпаза, яка потребує гепарин як
кофактор, також видаляє тригліцериди з циркулювальних
ліпопротеїнів дуже низької щільності (ЛПДНЩ) (див.
нижче). Хіломікрони та ЛПДНЩ містять АРО С, - комп-
лекс білків, що відділяються від них у капілярах. Один із
компонентів комплексу - аполіпопротеїн С-ІІ - активує
ліпопротеїнліпазу.
Таблиця 17-5. Головні ліпопротеїни. До ліпідів плазми належать ці компоненти плюс вільні жирні кислоти з
жирових тканин, які циркулюють у зв’язаному з альбуміном стані
Ліпопротеїн Розмір, нм Склад, % Походження
білок вільний холестерол естери холестеролу тригліцерид фосфоліпіди
Хіломікрони 75-100 2 2 3 90 3 Кишка
Залишки хіломікронів 30-80 Капіляри
Ліпопротеїни дуже низької щільності 30-80 8 4 16 55 17 Печінка та кишка
Ліпопротеїни серед- ньої щільності 25—40 10 5 25 40 20 ЛПДНЩ
Ліпопротеїни низької щільності 20 20 7 46 6 21 ЛПСЩ
Ліпопротеїни високої щільності 7,5-10 50 4 16 5 25 Печінка та кишка
280/РОЗДІЛ 17
Рис. 17-28. Схематичне зображення структури ліпопротеїну
низької щільності, рецептора ЛПНЩ та зв'язування ЛПНЩ з
рецептором через АРО В-100.
Позбавлені тригліцеридів хіломікрони залишаються в
кров'яному руслі як багаті на холестерол ліпопротеїни,
названі хіломікронними залишками, що мають 30-80 нм
у діаметрі. Ці залишки потрапляють до печінки, де при-
єднуються до хіломікронних залишків та рецепторів ЛНЩ,
і починається внаслідок рецепторопосередкованого ендо-
цитозу (див. Розділ 1) розщеплення в лізосомах.
Хіломікрони та їхні залишки є транспортною системою
для екзогенних ліпідів їжі (див. рис. 17-29). Наявна також
ендогенна система, що складається з ЛПДНЩ, ліпопро-
теїнів середньої щільності (ЛПСЩ), ліпопротеїнів низь-
кої щільності (ЛПНЩ) та ліпопротеїнів високої щіль-
ності (ЛПВЩ), які транспортують тригліцериди і холес-
терол в організмі. ЛПДНЩ утворюються в печінці і транс-
портують тригліцериди, сформовані з жирних кислот та
вуглеводів, до периферійних тканин. Якщо багато триглі-
церидів, то вони перетворюються в ЛПСЩ, які віддають
фосфоліпіди і під дією плазматичного ензиму лецитин-
холестеролацилтрансферази (ЛХАТ; див. рис. 17-29)
приєднують естери холестерольного і ЛПВЩ походження.
Деякі ЛПСЩ видаляє печінка; інші втрачають тригліце-
риди та білок, очевидно, в синусоїдах печінки, і перетво-
рюються в ЛПНЩ. Під час цього перетворення вони втра-
чають АРО Е, проте АРО В-100 залишається.
ЛПНЩ постачають тканинам холестерол - важливу
складову клітинних мембран, яка в специфічних залозах
Рис. 17-29. Спрощена схема ліпопротеїнової системи транспортування ліпідів у людини. В екзогенній системі хіломікрони,
багаті на тригліцериди, що надходять з їжі, під дією ліпопротеїнліпази перетворюються в залишки хіломікронів, багаті на
естери холестеролу. В ендогенній системі печінка секретує ЛПДНЩ, багаті на тригліцериди, вони перетворюються в ЛПСЩ, а
потім - у ЛПНЩ, багаті на естери холестеролу. ЛХАТ - лецитинхолестеролацилтрансфераза. Букви на хіломікронах, залишках
хіломікронів, ЛПДНЩ, ЛПСЩ, ЛПНЩ позначають головні апопротеїни, знайдені в них. Одну третину ЛПСЩ поглинають макро-
фаги та інші клітини за допомогою альтернативних механізмів.
ЕНЕРГЕТИЧНИЙ БАЛАНС, МЕТАБОЛІЗМ І ЖИВЛЕННЯ / 281
використовується для утворення стероїдних гормонів. У
печінці та більшості позапечінкових тканин відбувається
поглинання ЛПНЩ рецепторопосередкованим ендоцито-
зом в облямованих ямках (див. Розділ 1). Рецептори роз-
пізнають компонент ЛПНЩ - АРО В-100 (див. рис. 17-
28); вони також зв’язуються з АРО Е, але не з АРО В-48.
Рецептори ЛПНЩ людини належать до родини рецеп-
торів, які транспортують макромолекули всередину клі-
тини шляхом ендоцитозу у клатриноблямованих ямках
(див. Розділ 1). Це велика комплексна молекула, в якій є
багата на цистеїн ділянка з 292 амінокислотних залиш-
ків, що приєднується до ЛПНЩ; ділянка з близько 400
амінокислотних залишків, що є гомологічною до поперед-
ника епідермального фактора росту; ділянка з 58 аміно-
кислот, що багата на серин і треонін та є місцем глікози-
лювання; ділянка з 22 гідрофобних амінокислотних за-
лишків, що пронизує клітинну мембрану; ділянка з 50 амі-
нокислотних залишків, що виходять у цитоплазму (див.
рис. 17-28). Ген цього білка містить 18 екзонів, 13 із яких
кодують білкові послідовності, що є гомологічними до
послідовностей в інших білках. Отже, рецептор ЛПНЩ є
мозаїчним білком, утвореним з екзонів, які кодують також
інші білки.
У процесі рецепторопосередкованого ендоцитозу кожна
облямована ямка відділяється з утворенням облямованого
пухирця, а потім - ендосоми. Ионоселективні помпи в
мембранах ендосом знижують рН у цих органелах. У
випадку рецептора ЛПНЩ, але не рецептора залишків
хіломікронів, це ініціює вивільнення рецепторів ЛПНЩ,
які інкорпоруються у клітинну мембрану (рис. 17-30). Після
цього ендосоми зливаються з лізосомами, і холестерол,
утворений з естерів холестеролу під дією кислої ліпази в
лізосомах, стає придатним для використання на клітинні
потреби (див. рис. 17-30). Холестерол у клітинах гальмує
внутрішньоклітинне синтезування холестеролу шляхом
інгібування ГМГ-КоА редуктази (див. нижче) та стимулює
естерифікацію надлишку вивільненого холестеролу й
інгібує синтезування нових рецепторів ЛПНЩ. Усі ці
реакції забезпечують механізм зворотного контролювання
за кількістю холестеролу в клітинах.
Виділення ЛПНЩ також поглинає система з нижчою
спорідненістю в макрофагах і деяких інших клітинах.
Окрім того, макрофаги переважно поглинають ЛПНЩ,
змінені внаслідок окиснення. Проте окиснення може також
відбуватись у макрофагах. У тварин великі дози антиокси-
дантів, таких як вітамін Е, сповільнюють прогресування
атеросклерозу, однак досі результати подібних дослідів у
людей незадовільні. Рецептори ЛПНЩ на макрофагах та
споріднених клітинах називають очисними рецепторами.
Вони відмінні від рецепторів на інших клітинах і більше
споріднені зі зміненими ЛПНЩ. Якщо макрофаги пере-
вантажені окисненими ЛПНЩ, то вони перетворюються
в “пінисті клітини”, які можна виявити в уражених раннім
атеросклерозом судинах.
За стабільних умов холестерол проникає в клітини та
виходить із них. Уважають, що він виводиться з клітин
одним із білків АВС-касети (див Розділ 1), і його погли-
нають ЛПВЩ. Ці ліпопротеїни синтезуються в печінці та
кишці. Індивідуальний рецептор ЛПВЩ виявлений і кло-
нований. Спершу його виявили в ендокринних залозах, що
р
Л
ЛПНЩ всередину “^гідроліз
Рис. 17-30. Поглинання клітиною холестеролу та його мета-
болізм. ЛПНЩ зв’язуються з рецепторами та переходять зав-
дяки рецепторопосередкованому ендоцитозу в ендосоми з
низьким рН. Рецептори вивільняються і рециркулюють у мем-
брану. Естери холестеролу потрапляють у лізосоми, де ви-
вільняється холестерол, потрібний для клітинних процесів.
Холестерол також інгібує ГМГ-КоА-редуктазу (1), потім його
частково перетворює в інший естер холестеролу ензим аце-
тил-КоА (2): холестеролацилтрансфераза (АХАТ), та інгібує
утворення рецепторів ЛПНЩ (3) (з дозволу М8 Вгоууп).
утворюють стероїдні гормони, та в печінці. Система
ЛПВЩ переносить холестерол у печінку, після чого він
екскретується в жовч. У цьому випадку відбувається зни-
ження вмісту холестеролу в плазмі.
Апопротеїн Е синтезують клітини мозку, селезінки,
легень, надниркових залоз, яєчників та нирок, а також
печінки. Його концентрація значно збільшується в разі
ушкодження нервів, адже він бере участь у їхньому від-
новленні. Ген аполіпопротеїну Е наявний у популяції у
трьох алелях: АРО-2, АРО-3 та АРО-4. Алель АРО-4 мен-
ше поширений, ніж АРО-2 і АРО-3, однак більше поши-
рений у пацієнтів із хворобою Альцгеймера (див. Розділ
16), і, мабуть, причетний до її розвитку.
Метаболізм вільних жирних кислот
Вільні жирні кислоти (ВЖК) надходять у жирові клітини
та інші тканини завдяки хіломікронам та ЛПДНЩ (див.
вище). їхнє синтезування відбувається також у жирових
відкладах, де вони зберігаються. ВЖК циркулюють, будучи
зв’язаними з альбуміном, і є головним джерелом енергії
багатьох органів. їх інтенсивно засвоює серце, крім того,
можливо, усі тканини, у тім числі мозок, можуть окисню-
вати ВЖК до СО2 та Н2О.
Постачання тканинам ВЖК регульоване двома ліпаза-
ми. Як зазначено, ліпопротеїнліпаза на поверхні ендотелію
капілярів гідролізує тригліцериди в хіломікронах та
ЛПДНЩ, унаслідок чого утворюються ВЖК та гліцерин,
які знову з’єднуються в нові тригліцериди в жирових клі-
тинах. Внутрішньоклітинна гормоночутлива ліпаза ади-
поцитів каталізує розпад акумульованих тригліцеридів на
гліцерин та жирні кислоти, після чого вони потрапляють у
систему кровообігу.
Гормоночутлива ліпаза перетворюється з неактивної в
активну форму за допомогою цАМФ через протеїнкіназу
282/РОЗДІЛ 17
А (рис. 17-31). Аденілатциклазу в адипоцитах, відповідно,
активує глюкагон, а також катехоламіни (норадреналін та
адреналін) через р-адренергічний рецептор. Реакції цього
рецептора атипові; наприклад, він резистентний до анапри-
ліну та інших препаратів, що блокують [3,- та р2-рецептори,
і є, можливо, р3-адренергічним рецептором. Тривають
спроби розробити селективний р3-агоніст для можливого
використання в лікуванні ожиріння. АКТГ, ТТГ, ЛГ,
серотонін та вазопресин збільшують ліполіз через цАМФ,
однак фізіологічна роль цих речовин у регулюванні ліполізу
остаточно не з’ясована.
Гормон росту, глюкокортикоїди та тиреоїдні гормони
також збільшують активність гормоночутливої ліпази,
проте завдяки сповільненню процесу синтезування нового
білка. Припускають, що гормон росту стимулює утворення
білка, що збільшує здатність катехоламінів активувати
цАМФ, тоді як кортизол сприяє утворенню білка, що
підсилює дію цАМФ. З іншого боку, інсулін та проста-
гландин Е зменшують активність гормоночутливої ліпази,
можливо, гальмуючи утворення цАМФ.
Активність гормоночутливої ліпази збільшується під час
голодування та стресу і зменшується у разі споживання
їжі та інсуліну. Харчування збільшує, а голодування та
стрес, навпаки, зменшують активність ліпопротеїнліпази.
Метаболізм холестеролу
Попередником стероїдних гормонів та жовчних кислот
є холестерол - як уже зазначено, важливий складовий
компонент клітинних мембран (див. Розділ 1). Його вияв-
лено тільки у тварин. Подібні стерини є у рослин, проте
вони за нормальних умов не поглинаються в шлунково-
кишковому тракті. Більшість холестеролу їжі міститься в
яєчних жовтках і тваринному жирі.
Поглинання холестеролу відбувається в кишці, де він
інкорпорується в хіломікрони, що утворюються в слизовій
оболонці. Після того, як хіломікрони в жировій тканині
Катехоламіни
І
р-Рецептор
І
Аденілат-
циклаза
АТФ------------цАМФ
1
Протеїн-
А кіназа А ..
Активна ------------ Неактивна
ліпаза ліпаза
Тригліцериди ВЖК + Гліцерин
Рис. 17-31. Механізм, за допомогою якого катехоламіни збіль-
шують активність гормоночутливої ліпази в жировій тканині.
Бета-рецептор є, можливо, Р3-адгенергічним рецептором.
звільняються від тригліцеридів, залишки хіломікронів
постачають холестерол у печінку. Печінка та інші тканини
також синтезують холестерол. Частина холестеролу в
печінці екскретується в жовч як у вільній формі, так і у
вигляді жовчних кислот, і реабсорбується в кишках. Біль-
шість холестеролу в печінці входить у ЛПДНЩ і циркулює
у ліпопротеїнових комплексах (див. вище).
Біосинтез холестеролу з ацетату показано на рис. 17-
32. Холестерол за допомогою механізму зворотного зв’язку
гальмує своє синтезування шляхом інгібування ГМГ-КоА-
редуктази - ензиму, що перетворює 3-гідроксиметилглу-
тарил-коензим А у мевалонову кислоту. Отже, якщо спожи-
вання холестеролу з їжею високе, то зменшується синте-
зування холестеролу в печінці, і навпаки. Проте компен-
сація за допомогою механізму зворотного зв’язку непов-
на, оскільки їжа з малим умістом холестеролу і насичених
жирів призводить лише до незначного зниження рівня
холестеролу в крові.
Рівень холестеролу в плазмі знижується під дією тирео-
їдних гормонів, які збільшують кількість рецепторів
ЛПНЩ у печінці, та під дією естрогенів, які підвищують
концентрацію ЛПВЩ у плазмі та знижують рівень ЛПНЩ.
Естрогени посилюють катаболізм ЛПНЩ, що циркулю-
ють, ймовірно, шляхом збільшення кількості рецепторів
ЛПНЩ у печінці. Рівень холестеролу в плазмі підвищу-
ється в разі закупорення жовчних шляхів та нелікованого
цукрового діабету. Якщо реабсорбцію жовчних кислот у
кишці послаблюють смоли, такі як колестипол, то для утво-
рення жовчних кислот потрібно більше холестеролу. Однак
зниження рівня холестеролу в плазмі є порівняно малим
унаслідок компенсаторного збільшення синтезу холесте-
ролу. Ловастатин та близькі статини гальмують синтезу-
вання холестеролу шляхом прямого інгібування ГМГ-КоА-
редуктази (див. рис. 17-32). Іншим препаратом, який широ-
ко використовують для зниження рівня холестеролу в
плазмі, є вітамін ніацин; він у великих дозах інгібує мобі-
лізацію вільних жирних кислот з периферійних відкладів
жиру, а отже, зменшує синтезування ЛПДНЩ у печінці.
Ще один препарат - клофібрат - діє комплексно збільшу-
ючи окиснення жирних кислот у печінці та м’язах і змен-
шуючи секрецію ліпопротеїнів у печінці. Незважаючи на
це, сьогодні статини є загальновідомими широко викорис-
товуваними високоефективними препаратами.
Зв’язок з атеросклерозом
Холестерол має важливе значення в етіології та пато-
генезі атеросклерозу. Ця винятково поширена хвороба
спричинює розвиток інфаркту міокарда, церебрального
тромбозу, ішемічної гангрени кінцівок та інших серйозних
захворювань. Вона виникає внаслідок інфільтрації холес-
теролу та появи пінистих клітин в уражених артеріальних
стінках. Це супроводжується складним каскадом змін, що
охоплює тромбоцити, макрофаги, гладкі м’язові клітини
та фактори росту, що утворюють проліферувальні ушкод-
ження, які врешті-решт кальцифікуються. Ці зміни приз-
водять до деформування судин і роблять їх ригідними.
Нефахівці зачислюють цей стан до артеріосклерозу, однак
формально артеріосклероз є загальнішим поняттям, що
означає втрату еластичності чи затвердіння артерій з будь-
якої причини. В осіб із підвищеним рівнем холестеролу
ЕНЕРГЕТИЧНИЙ БАЛАНС, МЕТАБОЛІЗМ І ЖИВЛЕННЯ / 283
Ацетил-КоА
Ацетоацетил-КоА ----► З-Гідрокси-3-
І метилглутарил-КоА
І
Ацетоацетат ▼
Ацетоацетат
ГМГ-КоА-
редуктаза
-----т---► Мевалонова кислота
СН3
І
НООС — СН2 — С — СН2 — СН2 -ОН —► Сквален
ін (сл)
Мевалонова кислота
Сквален
І
Рис. 17-32. Біосинтез холестеролу. Шість молекул мевалонової кислоти конденсують з утворенням сквалену, який потім
гідроксилює та перетворюється в холестерол. Штрихова .стрілка показує інгібування холестеролом завдяки регулюванню
механізму зворотного зв’язку, ГМГ-КоА-редуктази, ензиму, що каталізує утворення мевалонової кислоти.
це є причиною розвитку атеросклерозу та його ускладнень.
Нормальний рівень холестеролу в плазмі становить 120-
200 мг/дл, проте в чоловіків простежується чіткий тісний
позитивний взаємозв’язок між рівнем смертності від
ішемічної хвороби серця й рівнем холестеролу в плазмі
(понад 180 мг/100 мл). Крім того, тепер відомо, що зни-
ження рівня холестеролу в плазмі шляхом дієти чи вжи-
вання ліків сповільнює і навіть спричинює регресію ате-
росклеротичних ушкоджень та ускладнень, зумовлених
ними. Цікаво, що зменшення кількості інфарктів міокарда
безпосередньо корелює зі ступенем звуження коронарних
артерій. Доведено також, що зниження рівня холестеролу
в плазмі може запобігти розриву атеросклеротичних
бляшок, навіть таких, що часто ініціюють утворення тром-
бів (див. Розділ. 32).
Рівень холестеролу в плазмі підвищується під час спо-
живання їжі та за деяких станів, у тім числі родинної
гіперхолестеролонемії внаслідок різноманітних мутацій
рецептора ЛПНЩ. Під час обстеження пацієнтів, окрім
рівня холестеролу, варто також аналізувати рівні ЛПНЩ
та ЛПВЩ у плазмі. Особи із збільшеним рівнем ЛПНЩ
мають вищий, ніж звичайно, рівень захворюваності та
ускладнень, тоді як особи з підвищеним рівнем ЛПВЩ -
навпаки. Цікаво, що жінки, серед яких рівень захворю-
ваності на інфаркт міокарда є нижчим, ніж серед чоловіків,
мають вищі рівні ЛПВЩ. Окрім того, рівень ЛПВЩ під-
вищується в тренованих осіб і тих, що випивають одну чи
дві порції алкогольних напоїв (100 мл) денно, а знижується
в осіб, що курять, є огрядними чи ведуть сидячий спосіб
життя. Помірне споживання алкоголю зменшує частоту
інфарктів міокарда, а повнота та куріння - це фактори ризи-
ку, що її збільшують.
Є докази, що підвищені рівні ЛПСЩ, залишків хіло-
мікронів та тригліцеридів також призводять до атероскле-
розу, тоді як підвищені рівні ЛПДНЩ та хіломікронів - ні.
Інші фактори, що сприяють атеросклерозу, розглянуто в
Розділі 32.
Незамінні жирні кислоти
Тварини, що не отримують жирів із їжею, перестають
рости, в них розвиваються ушкодження шкіри та нирок,
вони стають безплідними. Додавання ліноленової, ліно-
левої та арахідонової кислот до їхнього раціону дає змогу
вилікувати всі симптоми дефіциту. Ці три кислоти є полі-
ненасиченими жирними кислотами і завдяки їхній дії їх
називають незамінними жирними кислотами. Подібні
дефіцитні симптоми не зафіксовано однозначно у людей,
однак є причини вважати, що деякі ненасичені жири -
незамінні складові їжі, зокрема, в дітей. В організмі відбу-
вається дегідрогенація жирів, проте не синтезуються вуг-
лецеві ланцюги з таким розташуванням подвійних зв’язків,
як у незамінних жирних кислот.
Ейкозаноїди
Одна з причин, а можливо і єдина, того, що незамінні
жирні кислоти необхідні для здоров’я, - вони є поперед-
никами простагландинів, простациклінів, тромбоксанів,
ліпоксинів, лейкотрієнів та близьких сполук (рис. 17-33).
Ці сполуки називають ейкозаноїдами, бо вони походять
від 20-вуглецевої (ейкоза-) поліненасиченої жирної кислоти
- арахідонової кислоти (арахідонату), і 20-вуглецевих
похідних лінолевої та ліноленової кислот. Зазначимо, що
вони утворюються з арахідонової кислоти за допомогою
трьох окремих груп ензимів (див. рис. 17-33).
Простагландини - це ряд 20-вуглецевих ненасичених
жирних кислот, що містять циклопентанове кільце. Спершу
їх виділили з передміхурової залози, однак тепер з’ясовано,
що вони синтезуються в більшості, а можливо, й усіх
органах тіла. Структура деяких з них показана на рис. 17-
34.
Простагландини (ПГ) поділяють на групи - наприклад,
на ПГЕ та ПГР - за конфігурацією циклопентанового
кільця. Кількість ненасичених зв’язків у бічних ланцюгах
позначає нижній індекс, наприклад, простагландин групи
Е, зображений на рис. 17-34, є простагландином ПГЕ2.
284/РОЗДІЛ 17
Мембранні гліцерофосфоліпіди
ПГН2
12-ГЕТЄ
15-ГЕТЄ
Ліпоксини
5-ГЕТЄ
ДНГ
ЕЕТ
12-ГЕТЄ
Простагландини,
простациклін, Лейкотрієни
тромбоксани
Рис. 17-33. Головні біологічно активні сполуки, що утворюють-
ся з арахідонової кислоти; ГЕТЄ - гідроксиейкозатетраєнова
кислота; ДГТ - дигідроксиейкозатетраєнова кислота; ЕЕТ -
епоксиейкозатриєнова кислота.
Попередником різноманітних інших простагландинів,
тромбоксанів та простацикліну є простагландин Н2 (ПГН2).
У цьому синтезі (див. рис. 17-34) задіяні різні ензими.
Утворюється ПГН2 з арахідонової кислоти циклооксиге-
назами (СОХ - від англ. сусіооху^епазе). Є дві ізоформи
циклооксигеназ, що кодовані різними генами: цикло-
оксигеназа-1 (СОХ-1) та циклооксигеназа-2 (СОХ-2): СОХ-
1 експресована постійно, тоді як СОХ-2 індукована факто-
рами росту, цитокінами та активаторами росту пухлин.
Відомими рецепторами простагландинів є серпентинові
рецептори, що діють через гетеротримерні 6-білки. Виді-
лено чотири рецептори ПГЕ2, що отримали відповідні наз-
ви - від ЕР 1 до ЕР 4 (табл. 17-6), а також простациклінові
та рецептор ПГЕ2а.
Ефекти дії простагландинів різноманітні. Багато з них
описано в розділах, що присвячені тим системам, у яких
вони відіграють важливу роль. Вони особливо важливі в
жіночому репродуктивному циклі, під час пологів, у сер-
цево-судинній системі, у разі запальної відповіді та виник-
ненні болю. Нові докази свідчать, що вони беруть участь у
канцерогенезі, регулюванні апоптозу та ангіогенезу.
Тромбоцити синтезують тромбоксан А2, який спричи-
нює агрегацію тромбоцитів та є судинозвужувальним аген-
том. Рецептор тромбоксану А - це типовий серпентино-
Нестероїдні
протизапальні
засоби
Арахідонова кислота
-----сохи
СОХ-2
(конститутивно) у у (внаслідок індукції)
Рис. 17-34. Метаболізм арахідонової кислоти за участю циклооксигенази-1 (СОХ-1) та циклооксигенази-2 (СОХ-2).
ЕНЕРГЕТИЧНИЙ БАЛАНС, МЕТАБОЛІЗМ І ЖИВЛЕННЯ / 285
вий рецептор, з’єднаний з 6-білком (див. табл. 17-6); він
діє через фосфатидилінозитол, який відкриває Са2+-активо-
вані канали СІ . Тромбоксан В2 є метаболітом тромбоксану
А2. Простациклін же інгібує агрегацію тромбоцитів і є
судинорозширювальним агентом. Його утворюють клітини
ендотелію та гладких м’язів у стінках кровоносних судин.
Вивільнення тромбоксану А2 у кров, яке забезпечують
тромбоцити, у місці безпосереднього ушкодження спри-
чинює утворення тромбу, тоді як вивільнення проста-
цикліну в сусідніх ділянках судин приводить до локалізації
тромбу і підтримує прохідність інших ділянок судин.
Оскільки дія аспірину на тромбоцити триваліша, ніж дія
на стінки кровоносних судин, то він зумовлює анти-
коагуляційний ефект, цінний для запобігання міокардіаль-
ним ускладненням та інсульту (див. Розділ 31).
Арахідонова кислота також перетворюється в 5-гідро-
пероксиейкозатетраєнову кислоту (5-ГПЕТЄ) та 5-ліпокси-
геназу, що беруть участь в активуванні 5-ліпоксигеназоакти-
вувального білка (ПЛАБ). 5-ГПЕТЄ перетворюється в
лейкотрієни (ЬТ - від англ. Іеикоігіепез). Чотири лейкотрієни
є аміноліпідами, що містять амінокислоти; лейкотрієн С4
(ЬТС4) містить три пептид глутатіон, ГГО4 - гліцин та цис-
теїн, ЬТЕ4 - цистеїн, а ЬТЕ4 - цистеїн та глутамінову кисло-
ту (рис. 17-35). Окрім того, арахідонова кислота перетво-
рюється в ліпоксини через 15-ГПЕТЄ (див. рис. 17-35).
Лейкотрієни, тромбоксани, ліпоксини та простагланди-
ни називають місцевими гормонами. Вони мають корот-
кий період півжиття, інактивуються в багатьох різних тка-
нинах і, без сумніву, діють у тих тканинах, де й утворю-
ються.
Протизапальні стероїди, такі як кортизол, за допомогою
фосфоліпази А2 гальмують вивільнення арахідонової кис-
лоти з її фосфоліпідних запасів, а отже, сповільнюють
утворення усіх її похідних (див. рис. 17-33). Нестероїдні
протизапальні засоби (НСПЗЗ), такі як аспірин та індоме-
тацин, інгібують циклооксигенази, не торкаючись шляхів
каталізу ліпоксигенази та С¥Р-ензимів (див. рис. 17-34).
Інгібування СОХ-1 в експериментальних тварин спричи-
нює шлунково-кишкові та ниркові аномалії, тоді як інгібу-
вання СОХ-2 послаблює біль, запалення та лихоманку.
Аспірин, індометацин та більшість інших клінічно доступ-
них НСПЗЗ блокують одночасно і СОХ-1, і СОХ-2, однак
важливою є розробка СОХ-2-інгібіторів із метою зменшен-
ня шлунково-кишкових та ниркових побічних ефектів у разі
застосування названих препаратів для лікування болю,
запалень та артриту.
Лейкотрієни є трансмітерами алергічної відповіді та
запалення. їхнє вивільнення спричинене приєднанням
специфічних алергенів до І§Е-антитіл на поверхні гладких
м’язових клітин. Лейкотрієни зумовлюють бронхоконст-
рикцію, звужують артеріоли, збільшують судинну проник-
Таблиця 17-6. Рецептори простагландинів та тромбоксанів
ПГІ2 ІР
пге2 ЕР 1, ЕР2, ЕРЗ, ЕР 4
ПГР2а РР
Тромбоксан А ТР
ність та притягують нейтрофіли й еозинофіли до місць
запалень. У нокаутних мишей зі зруйнованим геном 5-
лшоксигенази розвиток та загальний стан нормальні, однак
є резистентність до деяких форм запалення. У людей роз-
виток астми, псоріазу синдрому розладу дихання в дорос-
лих, алергічного риніту, хвороби Крона та виразкового
коліту пов’язують з нокаутом такого гена.
Два рецептори лейкотрієнів, що містять цистеїн, -
СузЬТ] та Су§ЕТ2, схарактеризовані фармакологічно, хоча
їхні структури і досі невідомі. Рецептор лейкотрієну В4 -
ВЛТ - є серпентиновим рецептором, з’єднаним із 6-біл-
ком. Рецептор СузЬТ] опосередковує бронхоконстрикцію,
хемотаксис та підвищену судинну проникність, рецептор
Су§ЕТ2 - скорочення гладких м’язів судин легенів, а рецеп-
тор ВЬТ - переважно хемотаксис. Зв’язок цих рецепторів
з астмою розглянуто в Розділі 37.
Ліпоксин А розширює малі судини, ліпоксин А та ліпо-
ксин В зменшують цитотоксичний ефект справжніх клітин-
убивць (див. Розділ 27). Проте їхнє фізіологічне значення
досі не з’ясоване.
Зазначимо, що 12-ГЕТЄ, кілька дигідроксипохідних
ейкозатетриєнової кислоти (ДГТ) та кілька епоксиейкоза-
триєнових кислот (ЕЕТ) утворені з арахідонової кислоти
цитохром Р450 (С¥Р) монооксигеназами (див. рис. 17-
33). Роль цих продуктів невідома, однак ДГТ та ЕЕТ впли-
вають на екскрецію нирками солей та води, що може мати
важливе фізіологічне значення. Цитохром Р450 є дивовиж-
ною групою з понад 300 ензимів, що каталізують окис-
нення, епоксидування, аліфатичне гідроксилювання та інші
реакції. У ссавців вони задіяні не лише в метаболізмі ейко-
заноїдів, а й у синтезі стероїдних гормонів, метаболізмі
ліків та окисненні жирних кислот. їх розподілено на родини
та підродини за гомологічною послідовністю (С¥Р1,
С¥Р2, С¥РЗ і т.д.), у людини виявлено 12 родин.
Ожиріння
Ожиріння - найпоширеніший та найдорожчий з харчо-
вих розладів у країнах з високим розвитком. Воно вже вра-
зило 33% дорослого населення і поширюється далі. Пов’я-
зують його з підвищеним ризиком атеросклерозу, діабету
та хвороб жовчного міхура. Нормальні відклади жиру
становлять 12-18% від маси тіла в чоловіків і 18-25% - у
жінок. Про ожиріння говорять, коли ці значення переви-
щують 20% у чоловіків та 25% у жінок. Також широко
використовують таблицю норм росту та маси. Однак показ-
ником, що найліпше пов’язаний з жиром тіла, є індекс маси
тіла; він дорівнює масі тіла (у кілограмах), поділеній на
квадрат зросту (у метрах). Нормальне значення цього
індексу становить 20-25 кг/м2. Маса тіла зростає і є стабіль-
ною під час третього десятиліття життя, потім дещо збіль-
шується, а у похилому віці зменшується. Якщо споживання
їжі з віком не зменшується, то виникає ожиріння. Окрім
того, із віком знижується основний обмін речовин.
У людей простежується виражений генетичний компо-
нент в ожирінні, однак на нього також впливають і чинники
навколишнього середовища. Наприклад, у США ожиріння
серед жінок з вищих соціально-економічних груп трапля-
ється набагато рідше, ніж серед жінок із нижчих груп. Зв’я-
зок ожиріння з діабетом розглянуто в Розділі 19, а з контро-
лем споживання їжі - у Розділі 14.
286/РОЗДІЛ 17
О;
ОН Лейкотрієн В
Глутамінова кислота
- Глутамінова кислота
Лейкотрієн 04 -----------------------
- Гліцин
Лейкотрієн Е4 Лейкотрієн Г4
+ Глутамінова
Лейкотрієн С4
кислота
Рис. 17-35. Метаболізм арахідонової кислоти ліпоксигеназами; ПЛАБ - 5-ліпоксигеназоактивувальний білок.
ХАРЧУВАННЯ
Мета науки про харчування - визначення видів і кількос-
ті їжі, що забезпечує здоров’я та благополуччя. Це охоплює
не лише проблеми недоїдання, а й переїдання, смаку та до-
ступності. Деякі речовини є незамінними складовими дієти
людини. Багато з них уже названо, однак коротке резюме
незамінних та бажаних компонентів дієти наведено нижче.
ЕНЕРГЕТИЧНИЙ БАЛАНС, МЕТАБОЛІЗМ І ЖИВЛЕННЯ / 287
Незамінні компоненти дієти
Оптимальна дієта, окрім достатньої кількості води (див.
Розділ 38), передбачає відповідну кількість калорій, білка,
жиру, мінералів та вітамінів (табл. 17-7).
Споживання та розподіл калорій
Як зазначено вище, для підтримання сталої маси тіла
калорійність спожитої їжі повинна приблизно дорівнювати
енергії, витраченій у вигляді тепла та роботи. Якщо спо-
живання калорій недостатнє, то запаси білків і жирів в орга-
нізмі зменшуються, якщо ж споживання є надлишковим,
то настає ожиріння. Окрім необхідних для підтримання
життєвих процесів 2000 ккал/добу, щоденна активність
потребує 500-2500 ккал/добу (чи більше).
Розподіл калорій між вуглеводами, білком і жиром част-
ково визначена фізіологічними чинниками, а частково -
смаком та економічними міркуваннями. Для того, щоб за-
безпечити постачання восьми незамінних та інших аміно-
кислот, бажане щоденне споживання білка з розрахунку
1 г/кг маси тіла.
Важливе також походження білка. Білки першого кла-
су - тваринні білки м’яса, риби та яєць - містять аміно-
кислоти в співвідношеннях, близьких до необхідних для
синтезування білка й інших потреб. Деякі рослинні білки
також належать до першого класу, однак більшість із них
-до другого класу, оскільки забезпечують різні пропорції
амінокислот, а деякі не містять однієї чи більше незамінних
амінокислот. Білкові потреби може задовольняти суміш
білків другого класу, проте їхнє споживання повинно бути
високим з огляду на нестачу незамінних амінокислот.
Жир - найкомпактніша форма їжі, він дає 9,3 ккал/г. Та
часто він є найдорожчим. Справді, у всьому світі просте-
жується позитивний взаємозв’язок між споживанням жиру
та життєвим рівнем. У минулому західні дієти містили
багато (100 г/добу чи більше) жиру. Докази, які свідчать
про те, що високе співвідношення ненасичених/насичених
жирів у їжі є важливим для запобігання атеросклерозу,
можуть змінити теперішній інтерес до профілактики ожи-
ріння.
В центрально- та південноамериканських індіанських
общинах, де головним продуктом харчування є зернові
(вуглеводи), люди живуть без ознак хвороб роками, спо-
живаючи мало жирів. Отже, якщо задовольняти потреби в
незамінних жирних кислотах, то низький рівень спожи-
вання жирів не є шкідливим, і бажане харчування з низьким
умістом насичених жирів.
Вуглеводи є найдешевшим джерелом калорій і забез-
печують 50% чи більше калорій у багатьох дієтах. У харчу-
ванні американця з середнього класу близько 50% калорій
надходить з вуглеводів, 15% - з білків та 35% - з жирів.
Під час підрахунку споживчих потреб варто насамперед
враховувати потреби в білку, а решту необхідних калорій
розділяти між вуглеводами та жирами залежно від смаку,
доходів та інших чинників. Наприклад, чоловік із масою
65 кг і помірною активністю потребує 2800 ккал/добу. Йо-
му щоденно варто споживати принаймні 65 г білків, що
дадуть 267 (65x4,1) ккал, причому деякі з них повинні бути
білками першого класу. Прийнятним значенням для жирів
є 50-60 г, тоді як решту потреб у калоріях повинні забез-
печувати вуглеводи.
Мінеральні речовини
Для підтримання здоров’я щоденно треба споживати
певну кількість мінералів. Окрім тих, про які йшлося в
рекомендованих дієтичних нормах (див. табл. 17-7), варто
застосовувати різноманітні мікроелементи, тобто елемен-
ти, що містяться в тканинах у найменших кількостях. Ті з
них, які вважають необхідними для життя, принаймні в
піддослідних тварин, наведені в табл. 17-8. У людей дефі-
цит заліза спричинює анемію (див. Розділ 26). Кобальт є
частиною молекули вітаміну В)2, а дефіцит вітаміну В12
призводить до мегалобластної анемії (див. Розділ 26).
Нестача йоду зумовлює тиреоїдні розлади (див. Розділ 18);
нестача цинку - шкірні виразки, пригнічення імунних від-
повідей та гіпогонадну карликовість; дефіцит міді - ане-
мію, зміни в окостенінні, та, можливо, підвищення рівня
холестеролу в плазмі; нестача хрому - резистентність до
інсуліну; нестача фтору - підвищення ризику виникнення
зубного карієсу. Дефіцит мікроелементів трапляється зрід-
ка, оскільки будь-яке харчування, що відповідає іншим ви-
могам, легко забезпечує ці потреби.
Водночас деякі мінерали можуть бути токсичними,
якщо вони наявні в надлишку. Наприклад, надмірна кіль-
кість заліза спричинює гемохроматоз (див. Розділ 25), над-
лишок міді - пошкодження мозку (хворобу Вільсона, див.
Розділ 12), а отруєння алюмінієм у пацієнтів, у яких від-
мовили нирки і які проходять курс діалізу, зумовлює швид-
ко прогресуюче слабоумство, що призводить до хвороби
Альцгеймера (див. Розділ 16).
Натрій і калій також є незамінними елементами, однак
про них не йтиметься, оскільки дуже важко приготувати
безнатрієву чи безкалієву їжу. Низькосольову дієту легко
переносити протягом тривалого часу завдяки компенса-
торним механізмам, що зберігають №+.
Вітаміни
Вітаміни виявили тоді, коли помітили, що харчування з
достатньою кількістю калорій, незамінних амінокислот,
жирів та мінералів не здатне забезпечити здоров’я. Сьо-
годні термін вітамін застосовують до будь-якої органічної
складової їжі, що потрібна для життя, здоров’я та росту і
яка не виконує функції постачання енергії.
Оскільки є незначні відмінності в метаболізмі різних
видів, то деякі сполуки є вітамінами в одних видів, однак
втрачають значення в інших. Джерела та функції головних
вітамінів у людей наведені в табл. 17-9, а їхні рекомендовані
добові дози - у табл. 17-7. Більшість вітамінів виконують
важливі функції у проміжному чи спеціальному метабо-
лізмі різних систем органів. Водорозчинні вітаміни (комп-
лекс вітамінів В, вітамін С) поглинаються легко, а жиро-
розчинні (вітаміни А, В, Е та К) - слабко, якщо нема жовчі
Таблиця 17-8. Мікроелементи, що необхідні для життя
Ванадій Мідь
Залізо Молібден
Йод Нікель
Кобальт Селен
Кремній Фтор
Марганець Хром
Миш’як Цинк
Таблиця 17-7. Компоненти харчування та дієтичні норми, рекомендовані Національною академією наук (США) і Національною науково-дослідною радою (США)
(переглянуті у 198912)
Категорія Вік, роки чи стан Маса, кг Зріст3, см Білок, г Жиророзчинні вітаміни Водорозчинні вітаміни Мінеральні речовини
А, мкг РЕ4 д. мкг5 Е, мг аТЕ6 к, мкг С, мг тіа- мін, мг рибо- фла- він, мг ніа- цин, мг НЕ7 В6, мг фо- лат, мкг віта- мін В12, мкг каль- цій, мг8 фос- фор, мг маг- ній, мг залі- зо, мг цинк, мг йод, мкг се- лен, мкг
Ново- 0,0-0,5 6 60 13 375 7,5 3 5 ЗО 0,3 0,4 5 0,3 25 0,3 400 300 40 6 5 40 10
народжені 0,5-1,0 9 71 14 375 10 4 10 35 0,4 0,5 6 0,6 35 0,5 600 500 60 10 5 50 15
Діти 1-3 13 90 16 400 10 6 15 40 0,7 0,8 9 1,0 50 0,7 800 800 80 10 10 70 20
4-6 20 112 24 500 10 7 20 45 0,9 1,1 12 1,1 75 1,0 800 800 120 10 10 90 20
7-10 28 132 28 700 10 7 ЗО 45 1,0 1,2 13 1,4 100 1,4 800 800 170 10 10 120 ЗО
Чоловіки 11-14 45 157 45 1000 10 10 45 50 1,3 1,5 17 1,7 150 2,0 1200 1200 270 12 15 150 40
15-18 66 176 59 1000 10 10 65 60 1,5 1,8 20 2,0 200 2,0 1200 1200 400 12 15 150 50
19-24 72 177 58 1000 10 10 70 60 1,5 1,7 19 2,0 200 2,0 1200 1200 350 10 15 150 70
25-50 79 176 63 1000 5 10 80 60 1,5 1,7 19 2,0 200 2,0 800 800 350 10 15 150 70
51 + 77 173 63 1000 5 10 80 60 1,2 1,4 15 2,0 200 2,0 1200 800 350 10 15 150 70
Жінки 11-14 46 157 46 800 10 8 45 50 1,1 1,3 15 1,4 150 2,0 1200 1200 280 15 12 150 45
15-18 55 163 44 800 10 8 55 60 1,1 1,3 15 1,5 180 2,0 1200 1200 300 15 12 150 50
19-24 58 164 46 800 10 8 60 60 1,1 1,3 15 1,6 180 2,0 1200 1200 280 15 12 150 55
25-50 63 . 163 50 800 5 8 65 60 1,1 1,3 15 1,6 180 2,0 800 800 280 15 12 150 55
51 + 65 160 50 800 5 8 65 60 1,0 1,2 13 1,6 180 2,0 1500 800 280 10 12 150 55
Вагітні 60 800 10 10 65 70 1,5 1,6 17 2,2 400 2,2 1200 1200 320 ЗО 15 175 65
Жінки, що го- Перші шість місяців 65 1300 10 12 65 95 1,6 1,8 20 2,1 280 2,6 1200 1200 355 15 19 200 75
дують грудьми Другі шість місяців 62 1200 10 11 65 90 1,6 1,7 20 2,1 260 2,6 1200 1200 340 15 16 200 75
1 Змінено й відтворено за дозволом з ЯесоттепсІесІ Оіеіагу АІІоууапсез, 10Ж есі, МаііопаІ Асасіету Ргевв, 1989. СоругідИі © 1989 Ьу Же МаііопаІ Асасіету оТ Зсіепсев.
Соигіеву оГ Же МаііопаІ Асасіету Ргевв, \Л/азІііпдІоп, О.С.
2 Норми, виражені як середнє денне споживання протягом часу, можуть мати індивідуальні відхилення серед більшості нормальних осіб, які живуть у США, під дією
звичних навколишніх чинників. Дієти повинні передбачати багато різних страв, щоб забезпечити постачання інших харчових компонентів, людські потреби в яких гірше
вивчені.
3 Зріст і маса дорослих осіб є середніми для популяції людей певного віку в США. Наведені середні значення зросту та маси осіб до 19 років не обов’язково є ідеальними.
4 РЕ - ретинолові еквіваленти. 1 ретиноловий еквівалент = 1 мкг ретинолу або 6 мкг р-каротину.
5 Як холекальциферол. 10 мкг холекальциферолу = 400 МО (міжнародних одиниць) вітаміну Д.
6 Еквіваленти а-токоферолу 1 мг с!-а токоферолу = 1 а-ТЕ.
7 1 НЕ (ніациновий еквівалент) дорівнює 1 мг ніацину чи 60 мг харчового триптофану.
8 Значення для кальцію збільшуються після 50 років.
288/РОЗДІЛ 17
ЕНЕРГЕТИЧНИЙ БАЛАНС, МЕТАБОЛІЗМ І ЖИВЛЕННЯ / 289
Таблиця 17-9. Незамінні чи можливо незамінні для людського харчування вітаміни. Холін синтезується в організмі у малих
кількостях, однак нещодавно його додали до списку незамінних харчових речовин
Вітамін Дія Симптоми дефіциту Джерела Хімія
А (А,, А2) Складова зорових піґментів (див. Розділ 8); необхід- ний для ембріо- нального розвитку та розвитку клітин під час життя Куряча сліпота, сухість шкіри Овочі та фрукти Н3С. /СНз СН. Н2С Х-(СН=СН-С=СН)2-СН2ОН І II Н2С. ,с-сн3 л , | Спирт вітаміну А, (ретинол) Н2
Комплекс вітамінів В Тіамін (вітамін Кофактор у декарбоксилюванні Хвороба бері- бері, неврит Печінка, неочищене зерно / 5 М^'''Ч-СН2-,М СН3—\ \| СН3 СН2СН2ОН
Рибофла- він (віта- мін В2) Складовий флавопротеїнів Глосит, хейлоз Печінка, молоко Н СН2(СНОН)3—СН2ОН н3с-с^ с х=о І II І І Нзс-С. XX ЛХ .N-4 чг І II Н 0
Ніацин Складова НАД+ і НАДФ+ Пелагра Дріжджі, нежирне м’ясо, печінка Г^тгсоон Може синтезуватись в к У організмі з триптофану
Піридо- ксин (вітамін В6) Утворює просте- тичні групи деяких декарбоксилаз і трансаміназ. В організмі перетво- рюється в пірид- оксальфосфат і піридоксамін- фосфат Конвульсії, надподраз- ливість Дріжджі, пшениця, зерно, печінка СН2ОН НО-г/^^СН2ОН н3с-Л N
Пантоте- нова кислота Складова КоА Дерматит, ентерит, облисіння, надниркова недостатність Яйця, печінка, дріжджі Н СН3 Н 0 II І II но-с-с—С—С—М—СН2СН2СООН III І н сн3 он н
Біотин Каталізує “фікса- цію” СО2 (у синтезі жирних кислот тощо) Дерматит, ентерит Яєчний жовток, печінка, помідори 0 II н-м м-н І І н-с с-н І І Н2О /СН-(СИ2)4СООН
Фолати (фолієва кислота) та близькі сполуки Коензими для “1-вуглецевого” перенесення; задіяні в реакціях метилювання Спру, анемія; дефекти нервової трубки в дітей, народжених матір’ю з дефіцитом фолатів Листяні зелені овочі н°ос /їм. /И. “ ° X Т Vі СН.-СНМН-С-// Х)-МН-СН2-^ Зк соон .х=/ І Фолієва кислота им
20 367-2
290/РОЗДІЛ 17
Таблиця 17-9. Закінчення
Вітамін Дія Симптоми дефіциту Джерела Хімія
Ціанко- баламін (вітамін В12) Коензим у метаболізмі амінокислот; стимулює еритропоез Злоякісна анемія (див. Розділ 26) Печінка, м’ясо, яйця, молоко Комплекс чотирьох заміщених пірольних кілець навколо атома кобальту (див. Розділ 26)
с Підтримує простетичні метали в їхніх відновлених формах; усуває вільні радикали Цинга Цитрусові, фрукти, листяні зелені овочі СН2ОН Н Аскорбінова кислота (синтезується —СО в Ус'х ссавців, окрім морських свинок І р/ та приматів, а також людини) Н І І ОН ОН
Група 0 Збільшує кишкове поглинання кальцію та фосфатів (див. Розділ 21) Рахіт Риб’яча печінка Родина стеринів (див. Розділ 21)
Група Е Антиоксиданти, кофактори в ланцюгу перенесення електронів Атаксія та інші симп- томи спино- церебраль- них розладів Молоко, яйця, м’ясо, листяні овочі сн3 н2 НОТ II ГНг 9й- 9Н’ сн3 і і / Н3С-А А. ^-(СН2)3—СН—(СН2)3—СН—(СН2)3—сн Т 0 сн3 Р|_| 3 3 а-Токоферол; р- і у-токоферол також активні
Група К Каталізує у- карбоксилювання залишків глутаміновоі кислоти на білках, пов’язаних із зсіданням крові Геморагічні явища Листяні зелені овочі 0 ґ^1ГігСНз .А. У Вітамін К3; велика кількість подібних сполук має 0 біологічну активність
чи панкреатичної ліпази. Для їхнього поглинання необхідне
споживання з їжею деякої кількості жиру; однак у разі
обструктивної жовтяниці чи хвороб підшлункової залози
можуть розвинутись дефіцити жиророзчинних вітамінів
навіть за умови їхнього достатнього споживання (див. Роз-
діл 26). Вітаміни А і О транспортовані білками крові. Фор-
ма вітаміну Е - ос-токоферол - зазвичай пов’язана з хіло-
мікронами і потрапляє в печінці в ЛПДНЩ, звідки за допо-
могою ос-токоферолотранспортного білка переноситься в
тканини. Якщо цей білок є аномальним унаслідок мутації
його гена, то в людини настає клітинний дефіцит вітаміну
Е і розвивається стан, анологічний до атаксії Фрідрейха.
Нещодавно виділено №+-залежні переносники Ь-аскорбі-
нової кислоти. Один з них виявлений у нирках, кишці та
печінці, а інший - у мозку та очах.
Хвороби, спричинені нестачею кожного з вітамінів, пе-
релічені в табл. 17-9. З огляду на рекламні кампанії різних
вітамінів та додатків варто нагадати, що великі дози жиро-
розчинних вітамінів є токсичними. Гіпервітаміноз А
супроводжується анорексією, болем голови, гепатоспле-
номегалією, дратівливістю, лусковим дерматитом, гніздо-
вою алопецією, кістковим болем та гіперостозом. Уперше
гостру інтоксикацію вітаміном А описали дослідники Арк-
тики, у яких розвинувся головний біль, діарея та запа-
морочення після споживання печінки полярного ведмедя,
оскільки страва особливо багата на вітамін А. Гіпервіта-
міноз В пов’язаний з втратою маси, кальцифікацією бага-
тьох м’яких тканин, та, врешті, відмовою нирок. Гіперві-
таміноз К призводить до шлунко-кишкових розладів та
анемії. Вважають, що великі дози водорозчинних вітамінів
менше можуть спричинити проблеми, оскільки вони швид-
ко виходять з організму. Проте виявлено, що введення над-
великих доз піридоксину (вітамін В6) може спричинити
периферійну нейропатію.
Щитоподібна залоза
18
ВСТУП
Щитоподібна залоза підтримує рівень метаболізму в
тканинах на оптимальному для нормальної діяльності
рівні. Її гормони стимулюють поглинання О2 у більшості
клітин організму людини, допомагають регулювати
метаболізм ліпідів і вуглеводів. Вони життєво необхідні
для нормального росту та розвитку. Щитоподібна залоза
не є обов’язково потрібного для життя, однак якщо її нема,
то сповільнюються розумові та фізичні процеси, знижу-
ється опірність холоду, а в дітей затримується розумовий
розвиток і виникає карликовість. Навпаки, надмірна сек-
реція її гормонів призводить до виснаження організму,
підвищеної нервозності, тахікардії, тремору та надлишко-
вого утворення тепла. Функцію щитоподібної залози конт-
ролює тиреотропний гормон (ТТГ, тиреотропш) передньої
частки гіпофіза. Секрецію цього тропного гормону, відпо-
відно, частково регулює тиреоліберин (тиреотропін-ри-
лізинг гормон, ТРГ) гіпоталамуса, вона є місцем контролю-
вання за механізмом зворотного зв’язку в разі дії високих
рівнів гиреоїдних гормонів, що циркулюють, на передню
частку іпюфіза чи гіпоталамус. У цьому випадку зміни
внутрішнього та зовнішнього навколишнього середовища
роблять потрібні корективи у секреції щитоподібної залози.
У ссавців щитоподібна залоза також секретує кальци-
тонін гормон, що знижує рівень кальцію. Цей гормон та
йою вплив описані в Розділі 21
АНАТОМІЧНА БУДОВА
Тирсоїдна тканина є в усіх хребетних тварин. У ссавців
щитоподібна залоза утворюється з евагінації дна глотки.
Щиіоподібно-язикова протока, що відображає розташу-
вання щиіоподібної залози від язика до шиї, іноді просте-
жує іься і в дорослих. Дві бічні частки щитоподібної залози
сполучені іканинним містком - перешийком щитоподіб-
ної залози, попереду і органі від перешийка відходить пі-
рамідна частка (рис. 18-1). Залоза є добре васкуляризо-
ваною, для неї характерне одне з найбільших співвідно-
шень кровоплину на один грам тканини серед усіх органів
людської о т їла.
Щиіоподібна залоза складається з багатьох ацинусів
(фолікулів). Кожний сферичний фолікул оточений одним
шаром клітин і заповнений білковими речовинами, що
забарвлені в рожевий колір, - колоїдом. Якщо залоза неак-
тивна, то колоїду багато; фолікули стають великими, а клі-
тини, що їх вистилають, - плоскими. Якщо залоза пере-
буває в активному стані, то фолікули зменшуються, клітини
стають кубічними або циліндричними, а край колоїду -
хвилястим і утворює багато малих лакун реабсорбції (рис.
18-2).
З верхніх клітин щитоподібної залози в колоїд відходять
мікроворсинки, до яких ідуть канальці. У клітинах добре
помітна ендоплазматична сітка - ознака, характерна для
більшості залозистих клітин, та секреторні краплі тирео-
глобуліну (рис. 18-3). Кожна клітина щитоподібної залози
прикріплена до базальної мембрани, яка відділяє клітини
Рис. 18-1. Щитоподібна залоза людини.
292/РОЗДІЛ 18
Неактивна Активна
Колоїд Реабсорбційні Парафолікулярні
лакуни клітини
Рис. 18-2. Гістологія щитоподібної залози. Зверніть увагу на
малі випуклі лакуни реабсорбції одразу за клітинами в колоїді
активної залози.
від сусідніх капілярів. Капіляри є фенестрованими (див.
рис. 18-3), як і капіляри інших ендокринних залоз (див.
Розділ ЗО).
УТВОРЕННЯ ТА СЕКРЕЦІЯ ТИРЕОІДНИХ
ГОРМОНІВ
Хімія
Головними гормонами, які секретує щитоподібна за-
лоза, є грийодотиронін (Т3) та тироксин (Т4). Трийодо-
тиронін також утворюється в периферійних тканинах
шляхом дейодування Т4 (див. нижче). Обидва гормони є
йодовмісними амінокислотами (рис. 18-4). У венозній
крові щитоподібної залози виявлено невеликі кількості
оберненого трийодотироніну (3,3',5'-трийодотироніну,
ОТ3) та інших сполук. Трийодотиронін активніший, ніж
Т , тоді як ОТ3 неактивний. Природні форми Т4 і його
похідні з асиметричним атомом вуглецю є Г-ізомерами.
Водночас О-тироксин становить лише невелику частину
активності Ь-форми.
Тиреоглобулін
Гормони Т3 та Т4 синтезуються в колоїді шляхом йоду-
вання, а також конденсації молекул тирозину, з’єднаних
пептидним зв’язком із тиреоглобуліном. Цей глікопротеїн
складається з двох субодиниць і має молекулярну масу
660 000. Близько 10% його маси становлять вуглеводи. Він
також містить 123 залишки тирозину, однак лише від
чотирьох до восьми з них зазвичай входять у тиреоїдні гор-
мони. Синтезування тиреоглобуліну відбувається в фоліку-
лярних епітеліальних клітинах щитоподібної залози, а сек-
ретування в колоїд шляхом екзоцитозу - у гранулах, що
також містять тиреопероксидазу (див. нижче). Гормони
зв’язані з тиреоглобуліном аж до секреції. Після секреції
колоїд поглинають клітини щитоподібної залози, і пептидні
зв’язки гідролізуються, в цьому разі вільні Т3 і Т4 виходять
у капіляри. Отже, фолікулярні клітини щитоподібної залози
виконують три функції: накопичують та транспортують
йод; синтезують тиреоглобулін і секретують його в колоїд;
Просвіт
фолікула
Секреторні
пухирці
Нормальна
Стимульована
Базальна
пластинка
капіляра
Апарат
Ґольджі
Базальна
пластинка
клітини
Лізосома,
що зливається
з ендо-
цитозною
вакуолею
Поглинання
колоїду
шляхом
ендоцитозу
Ендотелій
капіляра
Рис. 18-3. Клітина щитоподібної залози. Ліворуч: нормальна.
Праворуч: після помітного стимулювання ТТГ. Стрілки ліво-
руч показують секрецію тиреоглобуліну в колоїд. Праворуч
відображено ендоцитоз колоїду та злиття вакуолі, що містить
колоїд, з лізосомою. Клітини примикають до капілярів з отво-
рами (фенестраціями) ендотеліальної стінки.
відщеплюють тиреоїдні гормони від тиреоглобуліну й
секретують їх у кров.
Тиреоглобулін надходить у кров разом із колоїдом. Нор-
мальна концентрація тиреоглобуліну в плазмі становить
близько 6 нг/мл, і цей рівень підвищується в разі гіпер-
3,5,3’,5'-Тетрайодотиронін (тироксин, Т4)
3,5,3'-Трийодотиронін (Т3)
Рис. 18-4. Тиреоїдні гормони. Числа в кільцях у формулі Т4
відображають місце розташування йоду в молекулі.
ЩИТОПОДІБНА ЗАЛОЗА / 293
тиреоїдизму та деяких видів раку щитоподібної залози.
Проте функція тиреоглобуліну, що циркулює в крові, якщо
така є, невідома.
Метаболізм йоду
Йод є вихідним матеріалом для синтезування тирео-
їдних гормонів. Спожитий йод перетворюється В ЙОДИД 1
абсорбується. Частка абсорбованого І показана на рис. 18-
5. Мінімальне добове поглинання йоду, яке підтримує нор-
мальну діяльність щитоподібної залози, становить 150 мкг
у дорослих (див. табл. 17-7), проте у розвинутих країнах
середнє поглинання йоду з їжею дорівнює 500 мкг/добу.
Нормальний рівень І у плазмі - близько 0,3 мкг/дл, а роз-
поділяється він у об’ємі 25 л (35% від маси тіла). Головни-
ми органами, що накопичують І , є щитоподібна залоза,
яка використовує його для синтезування тиреоїдних
гормонів, та нирки, які екскретують його із сечею. За
нормальних рівнів синтезу та секреції тиреоїдних гормонів
у щитоподібну залозу надходить 120 мкг/добу. Щитопо-
дібна залоза секретує 80 мкг/добу у вигляді йоду в Т31 Т4.
Сорок міліграмів І у день дифундує в ПКР. Секретовані
Т3 і Т4 метаболізуються в печінці та інших тканинах зі
щоденним вивільненням 60 мкг І у ПКР. Деякі похідні
тиреоїдних гормонів екскретують у жовчі, і незначна час-
тина йоду в них реабсорбується (ентерогепатична цирку-
ляція), однак сумарна втрата І із випорожненнями ста-
новить близько 20 мкг/добу. Отже, загальне надходження
І в ПКР - 500 + 40 + 60 = 600 мкг/добу; 20% цього І
надходить у щитоподібну залозу, тоді як 80% екскретує з
сечею.
Концентрування йодиду
Щитоподібна залоза концентрує йодид шляхом актив-
ного його транспортування з кровообігу в колоїд. Цей
транспортний механізм часто називають механізмом кон-
центрування йодиду, або йодидною помпою. Помпа є при-
480 мкг Г 20 мкг Г
у сечі у випорожненнях
Рис. 18-5. Метаболізм йоду.
кладом вторинного активного транспортування (див. Роз-
діл 1); №' та І котранспортують у клітини щитоподібної
залози, а Иа+ накопичує в інтерстиції Ка+-К+-АТФ-аза.
Клоновано котранспортер Иа+-І , він має 12 трансмембран-
них доменів з аміно- та карбоксильними кінцями всередині
клітини.
Клітина щитоподібної залози приблизно на 50 мВ нега-
тивніша порівняно з інтерстиційною ділянкою колоїду;
тобто вона має потенціал спокою мембрани -50 мВ. Йодид
накопичується в клітині проти цього електричного граді-
єнта, а потім дифундує за градієнтом у колоїд. Поглинання
йоду можна вивчати шляхом уведення радіоактивного йоду
у відстежувальних дозах, що становлять малі кількості,
які не можуть суттєво підвищити рівень йодиду в організмі.
В залозі йодид швидко окиснюється і зв’язується з тиро-
зином. Незважаючи на це, співвідношення вільного йодиду
тиреоїду до йодиду сироватки плазми (відношення Т/С)
за нормальних умов більше від 1. Якщо зв’язування із за-
лишками тирозину блокують антитиреоїдні препарати, такі
як пропілтіоурацил (див. нижче), то йодид накопичується
в щитоподібній залозі, а співвідношення Т/С помітно збіль-
шується. Перхлорат та багато інших аніонів зменшують
транспортування йодиду шляхом конкурентного інгібуван-
ня.
Варто зазначити, що реагування щитоподібної залози
на йодид є унікальним; йодид потрібний для нормальної
діяльності щитоподібної залози (це детально описано ниж-
че), однак і його нестача, і надлишок гальмують функції
цього органа.
Слинні залози, слизова оболонка кишки, плацента, вій-
часте тіло ока, судинне сплетення та молочні залози також
транспортують йодид проти градієнта концентрації, проте
на їхнє поглинання не впливає ТТГ. Молочні залози теж
зв’язують йод; дийодотирозин утворюється в тканині мо-
лочних залоз, а Т3 і Т4 - ні. Фізіологічна важливість усіх
таких позащитоподібних йодидоконцентрувальних меха-
нізмів остаточно не з'ясована.
Синтез тиреоїдних гормонів
У щитоподібній залозі йодид окиснюється до йоду й
за лічені секунди зв’язується в трьох положеннях молекул
тирозину, приєднаного до тиреоглобуліну (рис. 18-6). Ензи-
мом, відповідальним за окиснення та зв’язування йоду, є
тиреопероксидаза, а також пероксид водню, що приймає
електрони. Після цього утворений монойодотирозин (МІТ)
йодується в положенні 5 з утворенням дийодотирозину
(Д1Т). Дві молекули Д1Т зазнають окиснювальної кон-
денсації з утворенням Т4 та відщепленням бічного ланцюга
аланіну від молекули, яка утворює зовнішнє кільце. Є дві
теорії того, як відбувається реакція сполучення. За однією
сполучення відбувається між двома молекулами ДІТ, зв’я-
заними з тиреоглобуліном (внутрішньомолекулярне сполу-
чення); за іншою ДІТ, який утворює зовнішнє кільце, спер-
шу від’єднується від тиреоглобуліну (міжмолекулярне спо-
лучення). У будь-якому випадку, тиропероксидаза задіяна,
крім йодування, також у сполученні. Ймовірно, Т3 утво-
рюється шляхом конденсації МІТ та ДІТ. Унаслідок конден-
сації ДІТ і МІТ, мабуть, утворюються також невеликі кіль-
кості ОТ3. У нормальній щитоподібній залозі людини
середній розподіл йодованих сполук становить 23% МІТ,
294/РОЗДІЛ 18
Рис. 18-6. Схема біосинтезу тиреоїдних гормонів. Йодування тирозину відбувається на апікальній поверхні клітин щитоподібної
залози, тоді як молекули з’єднуються пептидними зв’язками з тиреоглобуліном.
33 - ДІТ, 35 - Т4 та 7% Т3, і лише сліди припадають на ОТ3
та інші сполуки.
Секреція
Щитоподібна залоза людини виділяє близько 80 мкг
(103 нмоль) Т , 4 мкг (7 нмоль) Т3 та 2 мкг (3,5 нмоль)
ОТ3 за день (рис. 18-7), проте МІТ та ДІТ не секретує.
Клітини щитоподібної залози поглинають колоїд шляхом
ендоцитозу (див. Розділ 1). Таке постійне поглинання на
краю колоїду утворює лакуни реабсорбції, які видно в
активних залозах (див. рис. 18-2). У клітинах глобули
колоїду зливаються з лізосомами (див. рис. 18-3). Пептид-
ні зв’язки між йодованими залишками та тиреоглобуліном
руйновані протеазами в лізосомах, а Т4, Т3, ДІТ та МІТ
вивільняються в цитоплазму. Йодовані залишки тирозину
дейодує мікросомальна йодотирозиндейодаза. Цей ензим
не атакує йодовані тироніни, і Т4 та Т3 виходять у кров.
Йод, вивільнений унаслідок дейодування МІТ і ДІТ, залоза
використовує повторно, що забезпечує вдвічі більше йоди-
ду для синтезування гормонів, ніж дає йодидна помпа. У
пацієнтів і суб’зктів, у яких спадково нема йодотирозин-
дейодази, МІТ та ДІТ з’являються в сечі і простежуються
симптоми нестачі йоду (див. нижче).
Щитоподібна
Кон’югати
та ін.
Рис. 18-7. Секреція та взаємоперетворення тиреоїдних гор-
монів у нормальних дорослих людей. Значення наведені у
мікрограмах за день. Зауважте, що більшість Т3 та ОТ3 утво-
рюється з Т4 шляхом дейодування в тканинах і лише невеликі
кількості секретує щитоподібна залоза.
ЩИТОПОДІБНА ЗАЛОЗА / 295
ТРАНСПОРТУВАННЯ ТА МЕТАБОЛІЗМ
ТИРЕОЇДНИХ ГОРМОНІВ
Білкове зв’язування
Нормальний загальний рівень Т4 у плазмі дорослих
людей становить близько 8 мкг/дл (103 нмоль/л), а рівень
Т3 у плазмі - близько 0,15 мкг/дл (2,3 нмоль/л). Дуже
багато цих гормонів зв’язані з білками плазми. Кількості
обох гормонів визначають радіоімунологічним аналізом.
Вільні тиреоїдні гормони в плазмі перебувають у рівно-
вазі з білокзв’язувальними тиреоїдними гормонами в плаз-
мі й тканинах (рис. 18-8). їх додає до циркуляційного пулу
щитоподібна залоза. Саме вільні тиреоїдні гормони в плаз-
мі є фізіологічно активними, вони сповільнюють секрецію
ТТГ гіпофізом.
Велика кількість інших гормонів зв’язана з білками
плазми, між їхніми активними та зв’язаними неактивними
формами в кровообігу є рівновага. Функція білкового зв’я-
зування - підтримання великого пулу швидкодоступних
вільних гормонів. Окрім цього, принаймні для Т3, зв’я-
зування гормонів запобігає їхньому надмірному поглинан-
ню першими зустрічними клітинами та сприяє рівномір-
ному розподілу в тканинах.
Ємність та спорідненість білків плазми з
тиреоїдними гормонами
До білків плазми, що зв’язують тиреоїдні гормони, нале-
жать: альбумін; преальбумін (колись називали преальбу-
міном, що зв’язує тироксин (ПАЗТ), а тепер - трансти-
ретином); глобулін, що зв’язує тироксин (ГЗТ), - гло-
булін з електрофоретичною рухомістю, середньою між
рухомістю ОС] - та ос2-глобуліну. З трьох білків альбумін має
найбільшу ємність у зв’язуванні Т4, тобто він може зв’язати
найбільше Т4 до досягнення стану насичення, а ГЗТ - най-
меншу. Проте спорідненості білків до Т4 - тобто афінність,
із якою вони зв’язуються з Т4 за фізіологічних умов - є
такими, що більшість Т4, що циркулює в крові, зв’язана з
ГЗТ (табл. 18-1), займаючи понад третини усіх сайтів
зв’язування білка. Менші кількості Т4 зв’язані з трансти-
ретином та альбуміном. Період півжиття транстиретину
становить два дні, ГЗТ - п’ять, а альбуміну - 13 днів.
За нормальних умов 99,98% Т4 у плазмі зв’язані; рівень
вільного Т4 - лише 2 нг/дл. У сечі міститься ще менша
Білокзв’язувальний
Т4 у плазмі (8 мкг/дл)
Білокзв’язувальний
Т4 у тканинах
Рис. 18-8. Розподіл Т4 в організмі. Розподіл Т3 подібний. Штри-
хова лінія показує сповільнення секреції ТТГ шляхом збіль-
шення рівня вільного Т4 в ПКР. У дужках наведені приблизні
концентрації в крові людини.
Таблиця 18-1. Зв’язування тиреоїдних гормонів білками
плазми в дорослих людей у нормі
Білок Концентрація в плазмі, мг/дл Кількість гормонів, що циркулює у крові, %
Т4 Тз
Глобулін, що зв’язує тироксин 2 67 67
Транстиретин (преальбумін, що зв’язує тироксин) 15 20 20
Альбумін 3500 13 13
кількість Т4. Період його біологічного півжиття тривалий
(шість—сім днів), а об’єм, у якому він розподіляється, - мен-
ший від об’єму ПКР (10 л, близько 15% від маси тіла). Усі
ці властивості притаманні речовинам, що сильно зв’язані
з білком.
Тироксин не зв’язаний так сильно; з 0,15 мкг/дл, зазви-
чай наявних у плазмі, 0,2% (0,3 нг/дл) є вільними. Решта
99,8% зв’язані з білком: 46% із - ГЗТ, решта - з альбуміном.
І лише невелика кількість зв’язана з транстиретином (див.
табл. 18-1). Менше зв’язування Т3 пов’язане з тим, що у Т3
коротший період півжиття, ніж у Т4, і його вплив на тка-
нини швидший; ОТ3 також зв’язується з ГЗТ.
Вільні Т4 та Т3 можна виміряти рівноважним діалізом,
однак це лабораторний метод. Індекс вільного тироксину
(ІВТ4) можна обчислити, помноживши загальний Т4 на
відсоток позначеного Т4. поглинутого смолою чи деревним
вугіллям, доданим до зразка плазми; смола чи вугілля
зв’язують вільний Т4 у плазмі. Індекс вільного трийодо-
тироніну (1ВТ3) обчислюють подібним способом. Ці індек-
си цінні для визначення тактики лікування деяких пацієнтів
із хворобами щитоподібної залози. Проте зазначимо, що
ІВТ4 та ІВТ3 не є прямими вимірюваннями вільних Т4 та
Т3, а лише індексами їхньої концентрації.
Коливання зв’язувань
Коли відбувається різке тривале збільшення концент-
рації тиреоїдозв’язувальних білків у плазмі, то концентра-
ція вільних тиреоїдних гормонів зменшується. Ця зміна
тимчасова, оскільки зменшення концентрації вільних
тиреоїдних гормонів у кровообігу стимулює секрецію ТТГ,
що, відповідно, зумовлює утворення вільних тиреоїдних
гормонів. Зрештою, настає нова рівновага, за якої загальна
кількість тиреоїдних гормонів у крові підвищена, однак
концентрація вільних гормонів, рівень їхнього метаболізму
та рівень секреції ТТГ є нормальними. Відповідні зміни у
зворотному напрямі відбуваються в разі зменшення кон-
центрації білків, зв’язаних із тиреоїдними гормонами.
Пацієнти з підвищеними чи зниженими концентраціями
зв’язувальних білків, зокрема ГЗТ, не є ні гіпер-, ні гіпоти-
реоїдними; тобто вони еутиреощні.
Рівні ГЗТ підвищені у пацієнтів, яких лікують естро-
генами, та під час вагітності, а також після лікування різ-
номанітними лікарськими засобами (табл. 18-2). Вони зни-
296/РОЗДІЛ 18
жуються під дією глюкокортикоїдів, андрогенів, слабкого
андрогена даназолу та протиракового хіміотерапевтичного
препарату Ь-аспарагінази. Багато інших ліків, зокрема салі-
цилати, антиконвульсант фенітоїн та протираковий хіміо-
терапевтичний препарат мітотан і 5-флуоро-
урацил гальмують зв’язування Т4 та Т3 з ГЗТ і зумовлюють
зміни, що подібні до симптомів зменшення концентрації
ГЗТ. Зміни загальних рівнів Т4 і Т3 у плазмі можуть також
бути зумовлені змінами концентрацій альбуміну та
преальбуміну в плазмі.
Метаболізм тиреоїдних гормонів
Гормони Г4 та Т3 дейодуються в печінці, нирках та інших
тканинах. Третина Т4, що циркулює у крові дорослих лю-
дей, за нормальних умов перетворюється в Т3, а 45% - у
ОТ3. Як показано на рис. 18-7, лише 13% циркулюваль-
ного Т3 секретує щитоподібна залоза, а 87% утворюється
внаслідок дейодування ОТ4; подібно, лише 5% циркулю-
вального ОТ3 секретує щитоподібна залоза, а 95% утво-
рюється дейодуванням Т4. У цьому процесі задіяні два різні
ензими: 5'-дейодаза каталізує утворення Т3, а 5-дейодаза-
ОТ3 (рис. 18-9); Т3 та ОТ3 потім перетворюються в різні
дийодотироніни.
Описано три різні 5'-дейодази. Дейодаза в мікросомах
печінки та нирок (йодотироніндейодаза першого типу,
5-ОЇ) каталізує й дейодування зовнішнього кільця з утво-
ренням Т3, і перетворення О3 у 3,3'-дийодотиронін (див.
рис. 18-9). Дейодаза другого типу (5'4)11), яка має подібну
дію, виявлена в головному мозку, гіпофізі та бурому жирі.
Дейодаза третього типу (5-Ої) діє лише на внутрішнє
кільце і є в плаценті та головному мозку.
Гормон 5'-ПІ унікальний тим, що містить рідкісну амі-
нокислоту селеноцистеїн, у якій сірка цистеїну заміщена
селеном; він є селенопротеїном. Гормон 5'-ОІІ не селе-
нопротеїн, він відповідає за локальне постачання Т3 до тка-
нин; 5-Ої відповідає за утворення більшої частини Т3 у
плазмі.
У печінці Т4 та Т3 кон’югують з утворенням сульфатів
та глюкуронідів. Ці кон’югати потрапляють у жовч і вихо-
дять у кишку. Тиреоїдні кон’югати гідролізують, і їхня час-
тина реабсорбується (ентерогепатична циркуляція), однак
деякі екскретують із випорожненнями. Окрім цього, деяка
кількість Т4 і Т3 із кровообігу прямо потрапляє в просвіт
3,5-Дийодотиронін
3,3'-Дийодотиронін
Рис. 18-9. Перетворення Т4 у Т3 та ОТ3, а потім у дийодоти-
роніни в печінці, нирках та інших тканинах. 5' = 5 -Ої; 5 = 5-
ОІ.
3',5'-Дийодотиронін
кишки. Цим шляхом втрачається близько 4% йоду від його
загальних щоденних втрат.
Зміни в дейодуванні
Під час внутрішньоутробного життя утворюється наба-
гато менше Т3 і набагато більше ОТ3, їхні кількості
змінюються до значень дорослих осіб приблизно через
шість тижнів після народження. Різноманітні лікарські
засоби пригнічують 5'-ПІ, спричинюючи в плазмі
зниження рівня Т3 і підвищення рівня ОТ3. Деякий ефект
зумовлює і дефіцит селену. Різноманітні захворювання, не
пов’язані зі щитоподібною залозою, зокрема опіки, травми,
ракові захворювання на пізніх стадіях, цироз, відмова
нирок, інфаркт міокарда і лихоманковий стан, також при-
гнічують 5'-ОІ. Низький рівень Т3, спричинений цими
факторами, підвищується в разі одужання. Важко визна-
чити, чи особи з низьким рівнем Т3, що зумовлений прий-
манням ліків та хворобою, мають помірний гіпотирео-
їдизм. Причину змін кількості тиреоїдних гормонів складно
пояснити і в разі підозри хвороби щитоподібної залози.
Частково це пояснюють тим, що багато лікарських засобів
впливають на тиреоїдні гормони, а частково - тим, що й
хвороби спричинюють інші зміни в організмі людини.
Харчування також впливає на перетворення Т4 у Т3. В
осіб, що голодують, рівень Т3 у плазмі зменшується на 10-
20% за 24 год і на 50% за три-сім днів із відповідним
підвищенням рівня ОТ3 (рис. 18-10). Рівні вільного та зв’я-
Таблиця 18-2. Вплив зміни концентрацій тиреоїдних гормонозв’язувальних білків у плазмі на різні параметри тиреоїдних
коливань після настання рівноваги
Умови Концентрація зв’язувальних білків Загальний рівень Т4, Т3, ОТ3 у плазмі Рівень вільних Т4, Т3, ОТ3 у плазмі Рівень ТТГ у плазмі Клінічний стан
Гіпертиреоїдизм Нормальна Високий Високий Низький Гіпертиреоїд
Гіпотиреоїдизм Нормальна Низький Низький Високий Гіпотиреоїд
Естрогени, метадон, героїн, більшість транквілізаторів, клофібрат Висока Високий Нормальний Нормальний Еутиреоїд
Глюкокортикоїди, андрогени, даназол, аспарагіназа Низька Низький Нормальний Нормальний Еутиреоїд
ЩИТОПОДІБНА ЗАЛОЗА / 297
Дні
Рис. 18-10. Вплив голодування на рівні Т4, Т3 та ОТ3 у плазмі
людини. Подібні зміни відбуваються в разі гіпотрофічних хво-
ріб. Шкали для Т3 та ОТ3 розташовані ліворуч, а для Т4 -
праворуч (відтворено за дозволом з Вигдег АС І\Іе\л/ азресіз
оїЖе регірЬегаІ асііоп оїНіугоісІ ґіогтопез. Тгіапдіе, Запсіог З
Месі 8сі 1983;22.175)
заного Т4 є в нормі. Під час тривалішого голодування рівень
ОТ3 стає нормальним, однак рівень Т3 і надалі знижений.
Водночас знижується рівень основного обміну речовин, а
екскреція азоту із сечею - показник розпаду білків - по-
слаблена. Отже, зменшення Т3 веде до збереження калорій
та білків. І навпаки, переїдання збільшує рівень Т3 і змен-
шує рівень ОТГ
ДІЯ ТИРЕОЇДНИХ ГОРМОНІВ
Інші далекосяжні ефекти тиреоїдних гормонів в орга-
нізмі є вторинними і спрямовані на стимульоване погли-
нання кисню (теплоутворювальна дія), хоча гормони та-
кож впливають на ріст та розвиток ссавців, допомагають
регулювати метаболізм ліпідів, збільшують поглинання ву-
глеводів із кишки (табл. 18-3). Вони також посилюють
дисоціацію кисню з гемоглобіну шляхом збільшення рівня
2,3-дифосфогліцерату (ДФГ) в еритроцитах (див. Розділ 35).
Механізм дії
Тиреоїдні гормони надходять у клітину, і Т3 зв’язується
з тиреоїдними рецепторами (ТР) у ядрі; Т4 також може
зв’язуватись, проте не так сильно. Після цього гормоноре-
цепторний комплекс зв’язується з ДНК через цинкові клас-
тери і збільшує (чи в деяких випадках зменшує) експресію
різних генів, які кодують білки-регулятори клітинних
функцій (див. Розділ 1). Отже, ядерні рецептори тиреоїдних
гормонів є членами надродини гормоночутливих ядерних
факторів транскрипції.
Відомо два людські гени ТР: ген ос-рецептора в 17-й
хромосомі й ген р-рецептора в 3-й хромосомі. Кожний з
них, впливаючи на сплайсинг, утворює принаймні дві різні
мРНК, а отже, і два різні рецепторні білки. Ген ТРр2
знайдений лише в головному мозку, тоді як ТРосІ, ТРос2
та ТРр 1 значно поширені. Ген ТРос2 відрізняється від ін-
ших форм тим, що він не зв’язується з Т3 і його функція
до кінця не з’ясована. Тиреоїдні рецептори зв’язуються з
ДНК у вигляді мономерів, гомодимерів та гетеродимерів
з іншими ядерними рецепторами, зокрема рецептором ре-
тиноїду X (КХР - від англ. геііпоісі X гесеріог). Цей гетеро-
димер не зв’язує 9-г/мс-ретиноєву кислоту, - звичайний
ліґанд КХР, однак зв’язування ТР з ДНК значно підсилене.
Є також коактиваторні та корепресорні білки, що вплива-
ють на дію тиреоїдних рецепторів. Можливо, ця склад-
ність дає змогу тиреоїдним гормонам виявляти їхні різ-
номанітні ефекти в організмі, проте сумарна фізіологічна
значимість складності цих механізмів здебільшого невідома.
Таблиця 18-3. Фізіологічна дія тиреоїдних гормонів1
Тканина-мішень Дія Механізм
Серце Хронотропна Збільшення кількості та спорідненості [3-адренергічних рецепторів
Інотропна Підсилення відповідей на катехоламіни, що циркулюють у крові Збільшення кількості важких ланцюгів а-міозину (із вищою активністю АТФ- ази)
Жир Катаболічна Стимулювання ліполізу
М’язи Катаболічна Збільшення розпаду білків
Кістки Пов’язана з розвитком Стимулювання нормального росту та розвитку скелета
Нервова система Пов’язана з розвитком Стимулювання нормального розумового розвитку
Кишка Метаболічна Збільшення швидкості абсорбції вуглеводів
Ліпопротеїни Метаболічна Стимулювання утворення рецепторів ЛПНЩ
Інша Т еплоутворювальна Стимулювання поглинання кисню метаболічно активними тканинами (винятки: яєчка, матка, лімфатичні вузли, селезінка, передня частка гіпофіза) Збільшення рівня метаболізму
1 Модифіковано та відтворено за дозволом з МсРйее 8Л еі аі: РаЖорґіувіоІоду ої Оівеазе. ЗгсІ есі. Мсбгам-НіІІ, 2000.
298/РОЗДІЛ 18
У разі більшості цих ефектів Т3 діє швидше та потуж-
ніше (від трьох до п’яти разів сильніше, ніж Т4) (рис. 18-
11). Це пояснюють тим, що Т3 слабше з’єднаний з білками
плазми й енергійніше зв’язується з рецепторами тиреоїд-
них гормонів; ОТ3 є інертним.
Теплоутворювальна дія
Гормони Т4 і Т3 збільшують поглинання кисню майже в
усіх метаболічно активних тканинах. Виняток становлять
головний мозок, яєчка, матка, лімфатичні вузли, селезінка
та передня частка гіпофіза. Зокрема, Т4 фактично пригнічує
поглинання О2 передньою часткою гіпофіза, можливо тому,
що він сповільнює секрецію ТТГ. Збільшення рівня мета-
болізму, створене дозою Т , можна вимірювати після ла-
тентного періоду в кілька годин та аж протягом шести днів
чи більше.
Деякі з теплоутворювальних впливів тиреоїдних гормо-
нів виникають унаслідок метаболізму жирних кислот, які
вони мобілізують. Окрім того, тиреоїдні гормони збіль-
шують активність зв’язаної з мембраною Иа+-К+-АТФ-ази
в багатьох тканинах.
Вторинна дія теплоутворення
Якщо рівень метаболізму в дорослих збільшується під
дією Т3 чи Т , то одночасно підвищується й екскреція азоту.
Якщо споживання їжі не зростає, то ендогенні білки та
запаси жиру катаболізують і відбувається втрата маси. В
гіпотиреоїдних дітей малі дози тиреоїдних гормонів зу-
мовлюють позитивний азотний баланс унаслідок стимулю-
вання росту, проте великі дози спричинюють катаболізм
білків, подібно як у дорослих. Калій, вивільнений під час
катаболізму білків, з’являється в сечі, підвищуються рівні
гексозаміну в сечі та екскреція сечової кислоти.
Великі дози тиреоїдних гормонів зумовлюють достатнє
утворення надлишкового тепла, щоб призвести до слабкого
підвищення температури тіла (див. Розділ 14), що, відпо-
відно, активує механізми тепловиділення. Периферійна
Рис. 18-11. Зміна теплоутворення у щурів з видаленою щито-
подібною залозою на підшкірне введення Т4 та Т3 (відтворе-
но за дозволом з Вагкег 8В: РегірНегаІ асііопз ої ЙіугоісІ Ног-
топез. ЕесІ Ргос 1962;21:635).
резистентність зменшується внаслідок шкірної вазодиля-
тації, однак хвилинний об’єм крові збільшується завдяки
об’єднаній дії тиреоїдних гормонів та катехоламінів на
серце, отже, пульсовий тиск і частота серцевих скорочень
збільшуються, а час кровообігу зменшується.
У разі підвищеного рівня метаболізму гостріше можуть
виявлятись синдроми вітамінної недостатності внаслідок
збільшення потреб організму у вітамінах. Тиреоїдні гор-
мони також потрібні для печінкового перетворення каро-
тину у вітамін А, а накопичення каротину в крові (кароти-
немія) у випадку гіпотиреоїдизму зумовлює появу жов-
туватого відтінку шкіри (каротинова жовтяниця). Ця форма
жовтяниці відрізняється від інших тим, що склери не набу-
вають жовтого кольору.
Зазвичай шкіра містить багато білків, з’єднаних із полі-
сахаридами, гіалуроновою кислотою та хондроітинсуль-
фатом. У разі гіпотиреоїдизму ці комплекси накопичують-
ся, сприяючи утриманню води й утворенню характерної
набряклості шкіри (мікседеми). Після введення тиреоїдних
гормонів білки метаболізують, збільшується діурез, зни-
кають симптоми мікседеми.
Секреція молока зменшується в разі гіпотиреоїдизму, а
стимулює її введення тиреоїдних гормонів. Цей факт інко-
ли використовують у молочній промисловості. Тиреоїдні
гормони не стимулюють метаболізму в матці, однак по-
трібні для нормальних місячних циклів та плідності.
Вплив на нервову систему
У разі гіпотиреоїдизму розумові процеси сповільнені,
а рівні білків у спинномозковій рідині підвищені. Застосу-
вання тиреоїдних гормонів нормалізує ці зміни. Великі їхні
дози спричинюють прискорення розумових процесів, дра-
тівливість та невгамовність. Загальний мозковий крово-
обіг та поглинання глюкози й кисню мозком є нормаль-
ними в дорослих людей з гіпо- та гіпертиреоїдизмом. Не-
зважаючи на це, тиреоїдні гормони надходять у головний
мозок дорослих і виявлені в сірій речовині в різних ділян-
ках. Окрім того, мозок перетворює Т4 у Т3. Після видалення
щитоподібної залози різко підвищується активність 5 х-де-
йодази мозку, яка повертається до норми через 4 год після
внутрішньовенного введення дози Т3. Деякі дії тиреоїдних
гормонів на головний мозок вторинні, пов’язані зі збіль-
шенням відповіді на катехоламіни, і закономірним зростан-
ням активування ретикулярної активу вальної системи (див.
Розділ 11). Ці гормони також помітно діють на розвиток
мозку. Вони найбільше впливають на такі ділянки ЦНС,
як кора мозку та базальні ганглії, а також на завитку.
Нестача тиреоїдних гормонів під час розвитку спричинює
розумову затримку, моторну риґідність та глухонімоту.
Тиреоїдні гормони впливають на усі рефлекси. Час реак-
ції на захисні рефлекси (див. Розділ 6) зменшується в разі
гіпертиреоїдизму і збільшується у випадку гіпотиреоїдиз-
му. Вимірювання часу реагування на ахіллів рефлекс при-
вернуло увагу як клінічний тест оцінки діяльності щитопо-
дібної залози, однак на нього впливають ще й інші хвороби.
Зв’язок із катехоламінами
Дія тиреоїдних гормонів та катехоламінів (норадрена-
ліну й адреналіну) тісно пов’язана. Адреналін підвищує
рівень метаболізму, стимулює нервову систему та зумовлює
ЩИТОПОДІБНА ЗАЛОЗА / 299
серцево-судинні ефекти, подібні до тих, що їх спричиню-
ють тиреоїдні гормони, хоча тривалість його дії коротко-
часна. Норадреналін загалом виявляє подібні дії. Ток-
сичність катехоламінів значно збільшувалась у щурів, яким
давали Т4. Хоча рівні катехоламінів у плазмі в разі гіпер-
тиреоїдизму нормальні, однак серцево-судинні ефекти, тре-
мор і збільшене потовиділення, зумовлені тиреоїдними
гормонами, можна зменшити чи повністю усунути симпа-
тектомією, а також такими ліками, як пропанолол, що бло-
кує Р-адренергічні рецептори. Справді, пропанолол та інші
Р-блокатори інтенсивно використовують для лікування
тиреотоксикозу та складних загострень гіпертиреоїдизму
- тиреоїдних кризів. Проте хоч р-блокатори є слабкими
інгібіторами міжтиреоїдних перетворень Т4 у Т3 і можуть
незначно знизити рівень Т3 у плазмі, вони несуттєво впли-
вають на інші дії тиреоїдних гормонів.
Вплив на серце
Для тиреоїдних гормонів характерні множинні дії на
серце. Деякі з них зумовлені прямим впливом Т3 на міо-
цити, однак взаємодія між тиреоїдними гормонами, катехо-
ламінами та симпатичною нервовою системою теж впли-
ває на серцеві функції. Наприклад, загальне активування
метаболізму може спричинити гемодинамічні зміни та
збільшити хвилинний об’єм крові.
Тиреоїдні гормони збільшують кількість та спорідне-
ність р-адренергічних рецепторів у серці, посилюючи його
чутливість до іно- та хронотропної дії катехоламінів. Вони
також, хоч і частково, шляхом прямого активування міо-
цитів впливають на тип міозину, що міститься в серцевому
м’язі. В серці є дві ізоформи важких ланцюгів міозину
(ВЛМ): а- і р-ВЛМ. їх кодують два високогомологічні гени,
розташовані тандемом у короткому плечі 17-ї хромосоми
людини. Кожна молекула міозину складається з двох важ-
ких і двох пар легких ланцюгів (див. Розділ 3). Міозин, що
містить р-ВЛМ, має меншу АТФ-азну активність, ніж міо-
зин, що містить а-ВЛМ. У передсерді дорослих людей
переважає а-ВЛМ, його рівні підвищуються під дією тире-
оїдних гормонів. Це збільшує швидкість серцевих скоро-
чень. Натомість, якщо експресія гена а-ВЛМ пригнічена,
а гена р-ВЛМ стимульована, то простежується гіпотирео-
їдизм.
Вплив на м’язи
У разі гіпертиреоїдизму в більшості пацієнтів виникає
м’язова слабість (тиреотоксична міопатія), а якщо гіпер-
тиреоїдизм сильний і тривалий, то міопатія може набути
важкої форми. Слабість м’язів частково є наслідком поси-
леного катаболізму білків. Тиреоїдні гормони впливають
на експресію генів ВЛМ не лише в серцевому, а також і в
скелетних м’язах (див. Розділ 3). Проте вони зумовлюють
комплексні ефекти, і їхній зв’язок із міопатією остаточно
не з’ясований. Гіпотиреоїдизм також пов’язаний зі сла-
бістю м’язів, судомами та ригідністю.
Вплив на метаболізм вуглеводів
Тиреоїдні гормони збільшують швидкість поглинання
вуглеводів зі шлунково-кишкового тракту; ця дія, відпо-
відно, не залежить від їхнього теплоутворювального ефек-
ту. Тому в разі гіпертиреоїдизму рівень глюкози в плазмі
швидко підвищується після вуглеводневої їжі, інколи пере-
ходячи нирковий поріг. Проте він швидко і спадає.
Вплив на метаболізм холестеролу
Крім того, тиреоїдні гормони знижують рівні циркулю-
вального холестеролу в плазмі до підвищення рівня мета-
болізму, що свідчить про незалежність цієї дії від стимульо-
ваного поглинання О2. Як зазначено в Розділі 17, зменшен-
ня концентрації холестеролу в плазмі є наслідком збільше-
ного утворення рецепторів ЛПНЩ у печінці, що призво-
дить до інтенсивнішого печінкового виділення холестеролу
із системи кровообігу. Незважаючи на значні зусилля, ство-
рити клінічно прийнятного аналога тиреоїдних гормонів,
що знижував би рівень холестеролу без збільшення рівня
метаболізму, не вдалось.
Вплив на ріст
Тиреоїдні гормони потрібні для нормального росту та
формування скелета (див. Розділ 22). У гіпотиреоїдних
дітей ріст кісток сповільнений, а замикання зон росту епі-
фіза затримане. Без тиреоїдних гормонів також пригнічена
секреція гормону росту, отже, тиреоїдні гормони підси-
люють дію гормону росту в тканинах.
Іншим прикладом ролі тиреоїдних гормонів у забезпе-
ченні нормального росту та дозрівання є їхній вплив на
метаморфоз амфібій. Пуголовки, на яких діють Т4 та Т3,
рано перетворюються в карликових жаб, тоді як гіпоти-
реоїдні пуголовки ніколи не перетворюються в жаб.
РЕГУЛЮВАННЯ СЕКРЕЦІЇ
ЩИТОПОДІБНОЇ ЗАЛОЗИ
Функцію щитоподібної залози регулюють перш за все
зміни циркулювального рівня ТТГ гіпофіза. Секреція ТТГ
збільшується під впливом гіпофізотропного тиреотропін-
рилізинг гормону (ТРГ, див. Розділ 14) і зменшується
завдяки механізму зворотного зв’язку через дію вільних
Т4 і Т3, що циркулюють у крові. Вплив Т4, що є у крові,
збільшується під час утворення в цитоплазмі клітин гіпо-
фіза ТТГ за допомогою ензиму 5'-ОП Т3. Секреція ТТГ
також пригнічується під дією стресу; в експериментальних
тварин її стимулював вплив холоду, а пригнічувало тепло.
Хімія та метаболізм ТТГ
Людський ТТГ є глікопротеїном, що містить 211 аміно-
кислотний залишок, а також гексози, гексозаміни та сіалову
кислоту. Він складається з двох субодиниць: а і р; а-суб-
одиницю кодує ген у 6-й хромосомі, а р-субодиницю - ген
у 1-й хромосомі. Дві субодиниці нековалентно зв’язані між
собою. ТТГ-а ідентична до а-субодиниці ЛГ, ФСГ та ХГл-
а (див. Розділ 22 і 23). Функційна специфічність ТТГ
пов’язана з р-субодиницею. Структура ТТГ змінюється в
різних видів, проте інші ТТГ ссавців є також активними в
людини.
Біологічний період півжиття людського ТТГ становить
близько 60 хв. Більшість ТТГ руйнується в нирках, а деяка
частина - у печінці. Секреція є циклічною, середнє зна-
чення виходу починає зростати близько 9-ї години вечора,
досягає максимального значення опівночі і спадає протя-
300/РОЗДІЛ 18
гом дня. Нормальний рівень секреції становить близько
110 мкг/добу; середній рівень у плазмі - 2 мкОД/мл (рис.
18-12).
Оскільки ос-субодиниця ХГл є такою ж, як і у ТТГ, то
великі кількості ХГ можуть активувати рецептори щито-
подібної залози. У деяких пацієнтів із добро- чи злоякіс-
ними пухлинами плацентарного походження рівні ХГ у
плазмі можуть підвищуватись до такого рівня, що він
здатний спричинювати помірний гшертиреоїдизм.
Вплив ТТГ на щитоподібну залозу
Коли видаляють гіпофіз, то відбувається депресія функ-
ції щитоподібної залози, і вона атрофується; уведення ТТГ
стимулює функцію залози. Упродовж кількох хвилин після
введення ТТГ збільшується зв’язування йодиду, синтезу-
вання Тг Т4 та йодотирозинів, секреція тиреоглобуліну в
колоїд, а також ендоцитоз колоїду. Концентрування йоду
настає через кілька годин унаслідок чого прискорюється
кровообіг; у випадку тривалого лікування ТТГ клітини
зазнають гіпертрофії, і маса залози збільшується.
У разі тривалого стимулювання ТТГ щитоподібна зало-
за помітно збільшується. Цей стан називають зобом (як
синонім використовують термін воло).
Рецептори ТТГ
Рецептор ТТГ є типовим серпснтиновим рецептором,
що активує аденілілциклазу через 6 -білок. Він також
зумовлює активування ФЛС. Як і рецептори інших гліко-
протеїнових гормонів, він має видовжений, глікозильо-
ваний позаклітинний домен.
Рис. 18-12. Зв’язок між рівнем ТТГ у плазмі, що виміряний
високочутливим радіоімунологічним аналізом, та рівнем віль-
ного Т у плазмі, визначеного за допомогою діалізу (ЕТ4). Звер-
ніть уйагу, що шкала ТТГ є логарифмічною.
Інші фактори, що впливають на розвиток
щитоподібної залози
Окрім рецепторів ТТГ, клітини щитоподібної залози
містять також рецептори ІФР-І, ФРЕ, та інших факторів
росту. Рецептори ІФР-І та ФРЕ сприяють росту, годі як у-
інтерферон та фактор некрозу пухлин його гальмують.
Точна фізіологічна роль цих факторів у щитоподібній зало-
зі остаточно не з’ясована.
Механізми регулювання
Механізми, що регулюють секрецію щитоподібної зало-
зи, показані на рис. 18-13. Механізм регулювання за зворот-
ним зв’язком - вплив тиреоїдних гормонів на секрецію ТТГ
- частково набуває дії на гіпоталамному рівні, однак також
значно є наслідком дії гіпофіза, оскільки Т4 та Т? блокують
збільшення секреції ТТГ, зумовленої ТРГ. Зв’язок між
рівнем ТТГ у плазмі та значенням індексу ІВТ4 відоб-
ражений на рис. 18-12. Інфузія Т , як і Т , зменшує рівень
ТТГ, що циркулює в крові, який помітно спадає протягом
години. У дослідних тварин початкове збільшення вмісту
гіпофізарного ТТГ триває до початку спадання секреції,
це свідчить про те, що тиреоїдні гормони гальмують секре-
цію, перш ніж сповільнюватимуть синтез. Відомо, що
вплив на секрецію й синтез ТТГ залежить від білкового
синтезу, хоч він спершу є порівняно швидким.
Щоденне підтримання відповідного рівня секреції щи-
топодібної залози залежить від механізму зворотного зв’яз-
ку тиреоїдних гормонів з ТТГ та ТРГ (див. рис. 18-13).
Регулювання, що, вірогідно, відбувається через ТРГ, охоп-
лює підвищену секрецію тиреоїдних гормонів, зумовлену
холодом, і, можливо, знижену секрецію, спричинену теп-
лом. Зазначимо, що холод зумовлює чітке зростання ТТГ
Рис. 18-13. Регулювання секреції щитоподібної залози меха-
нізмом зворотного зв’язку Штрихова стрілка позначає галь-
мівну дію, а суцільна - стимулювальну. Порівняйте з рис. 20-
20, 22-11,23-24 та 23-38.
ЩИТОПОДІБНА ЗАЛОЗА / 301
крові в експериментальних тварин і новонароджених дітей,
однак майже не впливає на цей рецептор у дорослих. Унас-
лідок цього в дорослих збільшене утворення тепла завдяки
підвищеній секреції тиреоїдних гормонів (тиреоїдний гор-
мональний термогенез) відіграє незначну роль у відповіді
на холод. Стрес гальмує секрецію ТРГ. Дофамін та сомато-
статин діють на гіпофізарному рівні, сповільнюючи секре-
цію ТТГ, проте не відомо, чи вони відіграють фізіологічну
роль у регулюванні секреції ТТГ.
Кількість тиреоїдних гормонів, потрібну для підтриман-
ня нормальних клітинних функцій в осіб із видаленою
щитоподібною залозою, визначали як кількість, потрібну
для нормалізації швидкості основного обміну. Однак тепер
її визначають як кількість, необхідну для повернення рівня
ТТГ у плазмі до норми. Насправді, враховуючи виняткову
точність та чутливість сучасних аналізів на ТТГ і помітну
обернену залежність між вільними тиреоїдними гормона-
ми плазми та рівнем ТТГ в плазмі, вимірювання ТТГ тепер
практикують як один із найліпших тестів для оцінки
функцій щитоподібної залози. Кількість Т4, що нормалізує
рівень ТТГ у плазмі в осіб, у яких нема щитоподібної зало-
зи, у середньому становить 112 мкг перорального Т4 у день
для дорослих осіб. Близько 80% цієї дози поглинається зі
шлунково-кишкового тракту. Вона спричинює дещо вищий
ІВТ4, однак нормальний ІВТ3; це свідчить про те, що у
людей, на відміну від деяких дослідних тварин, у плазмі
більше Т3, ніж Т4, який є головним регулятором секреції
ТТГ за механізмом зворотного зв’язку.
КЛІНІЧНІ ПАРАЛЕЛІ
Ознаки, симптоми й ускладнення гіпотиреоїдизму та
гіпертиреоїдизму в людей, що є передбачуваними наслід-
ками фізіологічних впливів тиреоїдних гормонів, описані
вище.
Гіпотиреоїдизм
Синдром гіпотиреоїдизму у дорослих людей загалом
називають мікседемою, хоча цей термін також використо-
вують для позначення саме шкірних змін у разі цього синд-
рому. Гіпотиреоїдизм може бути кінцевим наслідком бага-
тьох хвороб щитоподібної залози або виникати вторинно
з огляду на недостатність гіпофіза (гіпофізарний гіпотирео-
їдизм) чи гіпоталамуса (гіпоталамічний гіпотиреоїдизм).
У двох станах, названих останніми, на відміну від першого,
врахована відповідь щитоподібної залози на тестову дозу
ТТГ. Принаймні теоретично, гіпоталамічний гіпотиреої-
дизм можна відрізнити від гіпофізарного гіпотиреоїдизму
за наявністю підвищеного рівня ТТГ у плазмі, що виникає
у відповідь на тестову дозу ТРГ. Відповідь ТТГ на ТРГ є
зазвичай нормальною у випадку гіпоталамічного гіпоти-
реоїдизму, тоді як вона є збільшеною в разі гіпотиреої-
дизму, спричиненого хворобою щитоподібної залози, і
зменшеною у випадку гіпертиреоїдизму внаслідок регу-
лювання гіпофіза за механізмом зворотного зв’язку тире-
оїдними гормонами.
У людей, які не мають щитоподібної залози, рівень
основного обміну знижується до значення ^40. Волосся
стає грубим і рідким, шкіра - сухою та жовтуватою (каро-
тинемія - жовтяниця), а холод вони переносять погано.
Голос у них хрипне, вимова повільнішає; на підставі цього
факту виник вислів, що мікседема - єдина хвороба, діагноз
якої можна визначити по телефону. Розумові процеси в
цьому разі сповільнені, пам’ять погана, а в деяких пацієнтів
є серйозні розумові симптоми (мікседемне безумство).
Рівень холестеролу в плазмі підвищений.
Кретинізм
Дітей, що хворіють на гіпотиреоїдизм від народження
або до нього, називають кретинами. Вони мають карлико-
вість і розумову відсталість, вип’ячений живіт та макро-
глосію (збільшений язик, що виступає і не вміщається в
ротовій порожнині) (рис. 18-14). У світі вроджений гіпоти-
реоїдизм є однією з найпоширеніших причин затримки
розумового розвитку, яку можна попередити. Головні при-
чини наведені в табл. 18-4. До них належать не лише неста-
ча йоду у матері та різноманітні вроджені аномалії гіпота-
ламо-гіпофізарно-щитоподібної системи плоду, а також
материнські антитиреоїдні антитіла, що проникають у пла-
центу та ушкоджують щитоподібну залозу плоду. Гормон
Т4 проходить через плаценту, і, якщо мати не є гіпотире-
оїдною, ріст і розвиток дитини нормальні аж до народ-
ження. Якщо лікування розпочинають з народження, то
прогноз нормального росту хороший, і загалом можна
уникнути затримки розумового розвитку. З цієї причини
скринінгові тести на вроджений гіпотиреоїдизм є звичай-
ною процедурою у більшості розвинених країн. Якщо ж
мати гіпотиреоїдна, особливо у випадку нестачі йоду, то
розумові розлади складніші і менш піддаються лікуванню
після народження. Окрім цього, симптоми доповнює
глухонімота та риґідність (див. вище). Підвищене вико-
ристання йодованої солі зменшило частоту виникнення
материнської нестачі йоду. Проте ця недуга ще поширена
в багатьох частинах світу; підраховано, що 20 мільйонів
людей у світі мають різні ступені ушкодження мозку, спри-
чинені нестачею йоду під час внутрішньоутробного роз-
витку.
Гіпертиреоїдизм
Гіпертиреоїдизм (тиреотоксикоз) характеризують нер-
вовість, втрата маси, гіперфагія, нестерпність підвищеної
навколишньої температури, збільшений пульсовий тиск,
легке тремтіння витягнутих пальців, тепла м’яка шкіра,
потіння та рівень основного обміну від +10 аж до +100.
Найпоширенішим випадком гіпертиреоїдизму є хвороба
Ґрейвса, або базедова хвороба (екзофтальмічний зоб),
її можуть спричинити багато інших розладів, у тім числі
рідкісні випадки ТТГ-секретувальних пухлин передньої
частки гіпофіза чи нерегульована активація рецепторів ТТГ
(табл. 18-5).
У випадку хвороби Ґрейвса щитоподібна залоза дифузно
збільшена, часто простежується випинання очних яблук,
що називають екзофтальмом (рис. 18-15). Ця патологія є
автоімунним захворюванням (див. Розділ 27), у випадку
якого циркулювальні антитіла, утворені проти рецептора
ТТГ, активують рецептор, зумовлюючи гіперактивність
залози. Виявлено чотири типи антитіл проти щитоподібної
залози. ТТГ-рецепторостимулювальні антитіла (Т8Н-К
18Ііт| АЬ - від англ. Т8Н гесеріог-збтиіабп^ апііЬосііез) є
302/РОЗДІЛ 18
Рис. 18-14. Двояйцеві близнята, вік 8 років. Хлопчик має
вроджений гіпотиреоїдизм (відтворено за дозволом з \Л/іІкіпз
І_ іп СІіпісаІ Епсіосгіпоіоду І. АвЬлюосІ ЕВ, Саззісіу СЕ [есіііогсі].
Сгипе & Зігайоп, 1960).
Рис. 18-15. Хвороба Ґрейвса. Зверніть увагу на зоб та екзо-
фтальм (з дозволу РН Еогзїіат).
антитілами, що відповідають за виникнення базедової
хвороби. Інші ТТГ-рецепторні антитіла (Т8Н-К [Ьіоск] АЬ
- від англ. Т8Н гесеріог-Ь1оскіп§ апїіЬосІіез) мають не
стимулювальну, а блокувальну дію. Окрім цього, є антитіла
проти тиреоглобуліну (Т§ АЬ) та проти тиреопероксидази
(ТРО АЬ). Рівень тиреоглобулінових антитіл підвищується
на початку хвороби, а в разі хронічного автоімунного
тиреоїдиту (тиреоїдиту Хашімото) рівень тиреоперокси-
дазних антитіл підвищується у пізніші терміни. Це стан,
за якого ушкоджені клітини щитоподібної залози і може
розвинутись гіпотиреоїдизм. У деяких випадках тиреоїдиту
Хашімото функцію щитоподібної залози також пригнічу-
ють Т8Н-К [Ьіоск] АЬ. Механізм, що відповідає за утво-
Таблиця 18-4. Причини вродженого гіпотиреоїдизму
Нестача йоду в матері
Дисгенезія щитоподібної залози плоду
Спадкові помилки синтезу тиреоїдних гормонів плоду
Материнські антитиреоідні антитіла, що проходять
через плаценту
Гіпопітуїтарний гіпотиреоїдизм плоду
рення автоімунних антитіл проти щитоподібної залози, ще
остаточно не з’ясований.
Під час хвороби Ґрейвса відбувається помітне стиму-
лювання секреції тиреоїдних гормонів, і високі циркулю-
вальні рівні Т4 та Т3 гальмують секрецію ТТГ, унаслідок
чого рівень циркулювального ТТГ знижений. Підвищені
рівні тиреоїдних гормонів намагаються спричинити
збільшене утворення антитіл, тоді як знижені в разі
лікування хвороби - знизити, але не повністю припинити
утворення антитіл.
Таблиця 18-5. Причини гіпертиреоїдизму
Підвищена активність щитоподібної залози
Хвороба Ґрейвса
Поодинока токсична аденома
ТТГ-секретувальна пухлина гіпофіза
Тиреоїдит
Мутації, що спричинюють активування рецептора ТТГ
Позащитоподібні
Уведення Т3 чи Т4 (штучний, чи ятрогенний, гіпер-
тиреоїдизм)
Ектопічна тканина щитоподібно! залози
ЩИТОПОДІБНА ЗАЛОЗА / 303
Екзофтальм у разі цієї хвороби виникає внаслідок набря-
ку м’язів очного яблука і, менше, сполучної тканини твер-
дих кісткових стінок очної впадини, що призводить до
виштовхування очного яблука назовні. Тиреоїдні гормони
безпосередньо не відповідають за виникнення екзофталь-
му, хоча його зазвичай пов’язують із гіпертиреоїдизмом.
Цей симптом зменшується або зникає після лікування хво-
роби, він може виникати до, під час та після тиреотоксич-
ного стану. У деяких пацієнтів із тиреотоксикозом після
видалення щитоподібної залози прояви екзофтальму про-
гресують. Окрім того, такий стан інколи простежується в
еутиреоїдних пацієнтів з тиреоїдитом Хашімото, у паці-
єнтів з мікседемою та в пацієнтів із невідомими захворю-
ваннями щитоподібної залози. З’ясовано, що причиною
екзофтальму, безперечно, є автоімунне ушкодження м’язів
очного яблука та сполучної тканини очної впадини цито-
токсичними антитілами. Антитіла утворюються до анти-
генів, що містяться в очних м’язах і щитоподібній залозі.
Цей стан прогресивно реагує на використання глюкокорти-
коїдів та інших препаратів, що зумовлюють імуносупресію.
Тиреотоксикоз створює значне навантаження на серце-
во-судинну систему, особливо в старших осіб, у яких біль-
шість чи навіть усі симптоми серцево-судинні. Збільшу-
ється кількість випадків фібриляції передсердь та змен-
шується периферійна резистентність як наслідок шкірної
вазодилятації, що створює у пацієнтів виражену серцеву
недостатність (див. Розділ 33).
Резистентність до тиреоїдних гормонів
Деякі мутації у гені, що кодує ТГлр людини, пов’язані з
резистентністю до дії Т3 та Т4. Поширенішою є резистент-
ність до тиреоїдних гормонів у периферійних тканинах та
передній частці гіпофіза. Хворі з такими аномаліями
зазвичай не є клінічно гіпотиреоїдними, тому що вони під-
тримують рівні Т4 і Т3 у плазмі на достатньо високому рів-
ні, щоб побороти резистентність, а Тіла не змінюється.
Рівні ТТГ у плазмі недоцільно високі для високих рівнів
циркулювальних Т3 і Т4, тому їх варто знизити екзогенними
тиреоїдними гормонами. Деякі хворі мають резистентність
до тиреоїдних гормонів лише в гіпофізі. Для них харак-
терний підвищений рівень метаболізму та підвищені рівні
Т3 і Т4 у плазмі з нормальним рівнем ТТГ, що не можна
знизити. Інші хворі можуть мати периферійну резистент-
ність із нормальною чутливістю гіпофіза. їм властивий зни-
жений рівень метаболізму, незважаючи на нормальні рівні
Т3, Т4 та ТТГ у плазмі, і вони потребують великих доз тире-
оїдних гормонів для збільшення рівня метаболізму.
Цікавим відкриттям є те, що гіперактивне порушення
з нестачею концентрації уваги, стан, що часто просте-
жується в надактивних та імпульсивних дітей, набагато
поширеніший серед осіб із резистентністю до тиреоїдних
гормонів, ніж в інших осіб популяції. Це СВІДЧИТЬ, ЩО ТГлр
можуть відігравати особливу роль у розвитку мозку (див.
више).
Нестача йоду
Якщо поглинання йоду з їжею є меншим 50 мкг/добу,
то синтезування тиреоїдних гормонів стає недостатнім, і
їхня секреція зменшується. Як наслідок збільшеної секреції
ТТГ виникає гіпертрофія щитоподібної залози, зумовлю-
ючи йододефіцитний зоб, що може бути дуже великим за
розмірами. Такий “ендемічний зоб” відомий ще з давніх
часів. До того, як метод додавання йоду до столової солі
став загальноприйнятим, ця хвороба була дуже поширена
у Центральній і Східній Європі та на території біля Вели-
ких озер у Сполучених Штатах Америки, - територіях
“зобних поясів”, де йод вимивали з ґрунту дощі, тому хар-
чові продукти були бідні на цей елемент.
Поглинання радіоактивного йоду
Поглинання йоду є показником діяльності щитоподібної
залози, його можна легко виміряти за допомогою дослід-
них доз радіоактивних ізотопів йоду, які не завдають шко-
ди щитоподібній залозі. Дослідну дозу вживають перораль-
но, а його поглинання щитоподібною залозою визначають
за допомогою лічильника у-частинок навколо шиї. Під-
рахунок провадять також у ділянці стегон, його значення
віднімають від значень для шийних ділянок, щоб кори-
гувати нетиреоїдну радіоактивність у шиї. Найчастіше
використовуваним ізотопом йоду є 123І, оскільки період
його піврозпаду становить лише 0,55 дня, тоді як 131І - 8,1
дня, а 125І - аж 60 днів. Однак діагностичне використання
радіоактивного йоду стало рідкісним унаслідок загальної
доступності методів визначення Т4, Т3 та ТТГ у плазмі.
Крім того, застосування йодованої солі значно поширене,
і це зумовлює мале поглинання через надто великий пул
йоду. Проте аналіз поглинання радіоактивного йоду корис-
ний для розуміння фізіології щитоподібної залози. Погли-
нання в нормі показане на рис. 18-16. У разі гіпертиреої-
дизму йодид швидко входить у Т4 та Т3, і ці гормони вивіль-
няються з прискореною швидкістю. Отже, кількість радіо-
активності в щитоподібній залозі різко зростає, та потім
вирівнюється й починає спадати через 24 год, коли погли-
нання за нормального стану все ще зростає. У випадку гіпо-
тиреоїдизму поглинання повільне.
Великі кількості радіоактивного йоду руйнують тканину
щитоподібної залози, оскільки її клітини гинуть від
радіації. Терапія радіоактивним йодом корисна для деяких
видів раку щитоподібної залози: її можна використовувати
для лікування доброякісних пухлин, проте, особливо коли
йдеться про молодих пацієнтів, варто пам’ятати про небез-
пеку можливого індукованого радіаційного канцерогенезу
та мутації статевих клітин.
Радіоактивні ізотопи йоду є головними продуктами
радіоактивного розпаду. Коли продукти розпаду виділяють-
ся в атмосферу внаслідок аварії на атомній станції чи вибу-
ху атомної бомби, то ізотопи поширюються на значні від-
стані в атмосфері, оскільки вони є леткішими, ніж інші
продукти. Лікування йодидом калію постійно застосовують
у зоні радіоактивних опадів для збільшення пулу йоду й
зниження рівнів його поглинання щитоподібною залозою.
Антитиреоїдні препарати
Більшість препаратів, що пригнічують функцію щито-
подібної залози, діють, або перешкоджаючи механізму кон-
центрування йоду, або блокуючи органічне зв’язування
йоду в організмі. В будь-якому випадку секрецію ТТГ сти-
мулює зменшення концентрації тиреоїдних гормонів, що
циркулюють у крові, унаслідок чого виникає зоб. Багато
моновалентних аніонів конкурують із йодидом за активне
304/РОЗДІЛ 18
Рис. 18-16. Розподіл радіоактивного йоду в осіб з порівняно
низьким рівнем йоду в харчовому раціоні. Відсотки наведені
залежно від часу після споживання дози радіоактивного йоду.
У разі гіпертиреоідизму радіоактивність плазми швидко змен-
шується, а потім знову збільшується внаслідок вивільнення
щитоподібною залозою позначених Т4 та Т3.
Тіоурилени, - група сполук, близьких до тіосечовини,
- інгібують йодування монойодотирозину (зв’язування
йоду в організмі) та блокують реакції сполучення. Двома
представниками цієї групи, які клінічно застосовують, є
пропілтіоурацил та метимазол (рис. 18-17). Йодування
тирозину пригнічене внаслідок того, що пропілтіоурацил
та метимазол конкурують із тирозиновими залишками за
йод, відбувається їхнє йодування. Окрім того, пропілтіоу-
рацил, але не метимазол, інгібує 5-ОЇ, зменшуючи пере-
творення Т4 у Т3 у багатьох тканинах поза щитоподібною
залозою. Обидва препарати можуть також поліпшувати
тиреотоксикоз, пригнічуючи імунну систему, а отже, і
утворення Т8Н-К [зйт] АЬ. Вони також можуть гальмувати
біосинтез або впливати на структуру тиреоглобуліну.
Пропілтіоурацил та метимазол впливають на зв’язуван-
ня у дозах, менших, ніж ті, що впливають на йодування.
Вони не блокують механізм концентрації йоду. Внаслідок
збільшення секреції ТТГ початкове поглинання радіо-
активного йоду є насправді збільшеним під час терапії, а
співвідношення Т/С може сягати 250. Та оскільки процес
зв’язування пригнічений, то йод не накопичується; проте
через 24 години після введення ізотопу поглинання нор-
малізується.
Іншою речовиною, що пригнічує функції щитоподібної
залози за певних умов, є сам йод. Значення йоду у фізіології
щитоподібної залози унікальне в тому, що хоч для нормаль-
ного функціювання залози потрібна певна кількість йодиду,
але надто мала чи надто велика кількість йодиду спричи-
нюють аномалії функціонування щитоподібної залози. В
нормі у людей великі дози йодидів діють прямо на щито-
подібну залозу, внаслідок чого помірно та тимчасово при-
гнічується органічне зв’язування йодиду, а отже, й синтезу
гормонів. Це пригнічення відоме як ефект Вольффа-Чай-
коффа. Воно тривале у разі збільшення транспортування
йодиду і є причиною того, що пацієнти з тиреотоксикозом
чутливіші до йодиду, ніж нормальні особи. Сприйнят-
ливість ефекту також збільшується за наявності дефекту в
механізмі органічного зв’язування, і тому пригнічення
посилене в осіб із частково зруйнованою або видаленою
щитоподібною залозою чи тиреоїдитом. Є принаймні два
додаткові механізми, за допомогою яких надлишок І при-
гнічує функції щитоподібної залози. Він зменшує дію ТТГ
на залозу шляхом зменшення відповіді цАМФ на цей
гормон та інгібує протеоліз тиреоглобуліну. Немає прямого
впливу на механізм концентрування Г, однак його загальне
поглинання низьке внаслідок пригнічення органічного
зв’язування та, менше, внаслідок того, що кількість йодиду,
що циркулює у крові, надто велика, і введена позначка
транспортування у щитоподібну залозу, і отже, пригнічу-
ють поглинання до рівня, коли співвідношення Т/С досягає
одиниці. Таке зниження транспортування йодиду можна
подолати споживанням додаткового йодиду. До цих аніонів
належать хлорат, пертехнетат, перйодат, бійодат, нітрат та
перхлорат. Тіоціанат - інший моновалентний аніон - при-
гнічує транспортування йоду, однак сам не накопичується
в залозі. Активність перхлорату в десять разів більша, ніж
активність тіоціанату.
Н — N---С = О СН3-М С —Н
І І І
8 = С С—Н Н8—С
І II II
Н—N-----с—С3Н7 N с —Н
Пропілтіоурацил Метимазол
Рис. 18-17. Поширені тіоурилени.
ЩИТОПОДІБНА ЗАЛОЗА / 305
негайно розводиться. У разі тиреотоксикозу йодиди нако-
пичуються в колоїді, і васкуляризація гіперпластичної зало-
зи зменшується, що відіграє важливу роль у підготовці
тиреотоксичних пацієнтів до операції.
Природні зобогени
Тіоціанати інколи споживають із їжею, а в деякій їжі є
порівняно великі кількості природних зобогенних речовин.
Овочі родини хрестоцвітих, особливо бруква, капуста та
ріпа, містять прогойтрин - речовину, що перетворюється
в гойтрин, активний антитиреоїдний препарат (рис. 18-18).
Активатор прогойтрину в овочах нестійкий у разі нагрі-
вання, та оскільки активатори є і в кишці (можливо, бакте-
ріального походження), то гойтрин утворюється навіть зі
зварених овочів. Споживання гойтрину в нормальному зба-
лансованому харчуванні не є достатнім для завдавання
шкоди, проте у вегетаріанців та осіб із дивним раціоном
виникає “капустяний зоб”. Можливі й інші, не виявлені ще
рослинні зобогени, які можуть відповідати за випадкові
малі “епідемії зобу”, повідомлення про які надходять із різ-
них частин світу.
Використання тиреоїдних гормонів у разі
нетиреоїдних захворювань
Коли гіпофізарно-щитоподібна система перебуває в
нормі, то дози екзогенних тиреоїдних гормонів помітно
не впливають на метаболізм завдяки компенсаторному
спаду ендогенної секреції внаслідок сповільнення секреції
ТТГ. В еутиреоїдних людей пероральні дози Т4, що супре-
сують ендогенну функцію щитоподібної залози, можна
оцінити за дозами, що нормалізують рівень ТТГ у плазмі
дорослих людей з видаленою щитоподібною залозою, а
Прогойтрин
І
Н — N-----СН2
8 = С
І
О------С — С — СН2
І І
н н
Гойтрин
(І_-5-вініл-2-тіоксазолідон)
Рис. 18-18. Природний зобоген в овочах родини хрестоцвітих.
вони становлять 100-125 мкг/добу. Супресія секреції ТТГ
екзогенним Т4 або хворобою гіпофіза врешті-решт веде
до атрофії щитоподібної залози. Атрофічна залоза спершу
повільно відповідає на ТТГ, та в разі тривалої супресії
потрібен деякий час для повернення її нормальної відпо-
віді. Кора надниркових залоз та деякі інші ендокринні
залози утворюють відповідь подібним способом. Коли
вони позбавлені підтримки своїх тропних гормонів на де-
який час, то стають атрофічними й здатні лише до слабкої
відповіді на їхні тропні гормони, аж доки гормон не діяти-
ме на залозу.
Використання тиреоїдних гормонів для зменшення маси
цінне лише тоді, коли пацієнт готовий заплатити ціну у
вигляді збільшення нервовості та нестерпності до підви-
щеної температури довкілля. Окрім того, треба стримувати
апетит, щоб не відбувалось компенсаторне збільшення спо-
живання їжі.
21 367’2
19
Ендокринні функції
підшлункової залози й
регулювання метаболізму вуглеводів
ВСТУП
Принаймні чотири пептиди, що мають гормональну
активність, секретовані острівцями Ланґерганса в підшлун-
ковій залозі. Два з цих гормонів - інсулін та глюкагон -
виконують важливі функції у регулюванні проміжного
обміну вуглеводів, білків і жирів. Третій гормон (со-
матостатин) відіграє роль у регулюванні секреції острів-
ців, а четвертий (панкреатичний поліпептид) імовірно,
пов’язаний головно зі шлунково-кишковою функцією. Глю-
кагон, соматостатин, та, можливо, панкреатичний поліпеп-
тид також секретовані клітинами слизової оболонки киш-
ки.
Інсулін є анаболіком, що підвищує запасання глюкози,
жирних кислот та амінокислот. Глюкагон - катаболік, що
мобілізує глюкозу, жирні кислоти й амінокислоти з їхніх
відкладень у кровообіг. Отже, ці два гормони мають про-
тилежну дію і за більшості умов їхнє секретування відбу-
вається почергово. Надлишок інсуліну спричинює гіпоглі-
кемію, яка супроводжується конвульсіями та комою. Неста-
ча інсуліну, абсолютна чи відносна, зумовлює цукровий
діабет - комплексну виснажливу хворобу, яка без лікування
призводить до смерті. Нестача глюкагону може спричини-
ти гіпоглікемію, а його надлишок загострює діабет. Над-
мірне утворення соматостатину в підшлунковій залозі
зумовлює гіперглікемію та інші прояви діабету.
У регулюванні метаболізму вуглеводів відіграють важ-
ливу роль також багато інших гормонів.
БУДОВА КЛІТИН ОСТРІВЦІВ
Острівці Ланґерганса (рис. 19-1) - це яйцеподібні, 76 х
175 мкм, скупчення клітин, розкидані по підшлунковій
залозі; їх більше в хвості, ніж у тілі та головці. Вони ста-
новлять близько 2% об’єму залози, тоді як екзокринна
частина - 80%; решта припадає на протоки та кров’яні
судини. У людини є 1-2 млн. острівців. Кожний з них має
добре кровопостачання; кров з острівців, як зі шлунково-
кишкового тракту (але не інших ендокринних органів), тече
у ворітну вену печінки.
Клітини в острівцях можна розділити на типи за їхніми
властивостями щодо фарбування та морфології. В людей
є принаймні чотири різні типи клітин: А, В, В та Е Клітини
А, В та В ще називають а, р і А. Проте це призводить до
плутанини в разі використання грецьких літер для позна-
чення інших структур організму, зокрема адренергічних
рецепторів (див. Розділ 4). Клітини А секретують глюкагон,
В - інсулін, В - соматостатин, а Р - панкреатичний полі-
пептид. Клітини типу В, що є найпоширенішими і станов-
лять 60-75% клітин в острівцях, розташовані, як звичайно,
в центрі кожного острівця. Вони оточені А-клітинами, що
становлять 20% від загальної кількості клітин, та менш
численними В і Р. Острівці в хвості, тілі та передній і верх-
ній частині головки підшлункової залози людини мають
багато А-клітин, і лише кілька (або взагалі не мають) Р-
клітин у зовнішній частині, тоді як у задній - порівняно
багато Р-клітин і мало А-клітин, зокрема, у щурів та, мож-
ливо, людини. Острівці, багаті на А-клітини (глюкагон),
ембріологічно утворюються із дорсальної панкреатичної
бруньки, а острівці, багаті на Р-клітини (багаті на панкре-
атичний поліпептид) - із вентральної. Ці бруньки форму-
ються незалежно з дванадцятипалої кишки.
Рис. 19-1. Острівець Ланґерганса підшлункової залози щура.
Клітини, зафарбовані в темний колір, - це В-клітини. Навко-
лишня панкреатична ацинарна тканина забарвлена в світлий
колір (збільшення у 400 разів; з дозволу І_І_ Веппей).
ЕНДОКРИННІ ФУНКЦІЇ ПІДШЛУНКОВОЇ ЗАЛОЗИ Й РЕГУЛЮВАННЯ МЕТАБОЛІЗМУ ВУГЛЕВОДІВ / 307
Ґранули В-клітин є пакетами інсуліну в цитоплазмі клі-
тини. Кожний пакет міститься в обмеженому мембраною
пухирці (рис. 19-2); зазвичай, між стінкою пухирця й паке-
том є світла ділянка (гало). Форма пакета змінюється в різ-
них видів; у людини деякі з них округлі, а деякі - прямо-
кутні. У В-клітинах молекули інсуліну утворюють полімери
та комплекси з цинком. Відмінності у формі пакетів є,
ймовірно, наслідком різниці розмірів полімерів та цинко-
вих агрегатів інсуліну Ґранули А-клітин, що містять глюка-
гон, приблизно однакової форми у різних видів (рис. 19-
3). Клітини О також містять велику кількість порівняно
гомогенних ґранул.
СТРУКТУРА, БІОСИНТЕЗ І СЕКРЕЦІЯ
ІНСУЛІНУ
Структура та видова специфічність
Інсулін - це поліпептид, що містить два ланцюги аміно-
кислот, сполучених дисульфідними мостиками (табл. 19-1).
Є незначні відмінності в амінокислотному складі молекул
різних видів; однак вони, зазвичай, не настільки суттєві,
щоб вплинути на біологічну активність певного інсуліну в
гетерологічних видів, та достатні для того, щоб зробити
інсулін антигенним. Якщо інсулін одного виду протягом
тривалого періоду вводити об’єктам іншого виду, то утво-
рені антиінсулінові антитіла інгібуватимуть його. Майже
всі люди, що отримували промисловий бичачий інсулін
понад два місяці, мають антитіла проти нього, але їхній
титр звичайно низький. Свинячий інсулін відрізняється від
людського лише одним амінокислотним залишком і має
низьку антигенність. Крім того, тепер для уникнення
Рис. 19-3. Клітини А та В; показано їхній зв’язок із кровонос-
ними судинами; ҐЕС - ґранулярна ендоплазматична сітка.
Інсулін з В-клітини та глюкагон з А-клітини секретовані шля-
хом екзоцитозу через базальну пластинку клітини та базальну
пластинку капілярів, перш ніж потрапити в просвіт фенест-
рованих гемокапілярів (відтворено за дозволом з бипциеіга
І_С, Сагпеіго б, КеІІеу КО: Вазіс НізіоІоду, 91ґі еб. Мс6га\л/-НіІІ,
1998).
Рис. 19-2. Електронна мікрофотографія двох сусідніх В-клітин
підшлункової залози людини. Ґранули типу В - пухирці, обме-
жені мембраною, що містять кристали, які змінюються у формі
від ромбічної до округлої (збільшення у 26 000 разів; з дозволу
А І_іке. Відтворено за дозволом з ЕамсеН О\А/: ВІоогп апсі Еа\л/-
сей, А ТехІЬоок ої Нізіоіоду, 1 Йіі еб. Заипбегз, 1986).
проблем з утворенням антитіл широко використовують
людський інсулін, вироблений бактеріями за допомогою
технологій рекомбінантної ДНК.
Біосинтез і секреція
Синтезування інсуліну відбувається в гранулярній ендо-
плазматичній сітці В-клітин (див. рис. 19-3). Після цього
гормон надходить в апарат Ґольджі, де упаковується в ґра-
нули, обмежені мембраною. Ці ґранули за допомогою про-
цесу, в якому задіяні мікротрубочки, рухаються до плазма-
тичної мембрани, і їхній вміст вивільняється назовні за до-
помогою екзоцитозу (див. Розділ 1). Потім, щоб потрапити
в кров, інсулін перетинає базальні мембрани В-клітин і сусід-
ніх капілярів та фенестрований ендотелій капілярів. Де-
тально фенестровані гемокапіляри розглянуто в Розділі ЗО.
Як і інші поліпептидні гормони та подібні білки, що
потрапляють в ендоплазматичну сітку, інсулін синтезується
як частина більшого препрогормону (див. Розділ 1). Ген
інсуліну розташований у короткому плечі 11-ї хромосоми
людини. Він має два інтрони і три екзони (рис. 19-4). Пре-
проінсулін містить 23-амінокислотний сигнальний пептид
(лідерну послідовність), що відщеплюється, потрапивши
в ендоплазматичну сітку. Після цього залишок молекули
згортається і утворюються дисульфідні зв’язки - форму-
ється проінсулін. Пептидний сегмент, що сполучає ланцю-
ги А і В, з’єднувальний пептид (С-пептид - від англ.
308/РОЗДІЛ 19
Таблиця 19-1. Структура людського інсуліну (молекулярна маса 5808) та мінливість його структури в інших видів ссавців.
У щурів клітини острівців секретують два дещо відмінні інсуліни, а в деяких риб знайдено чотири різні форми
Ланцюг А ।— 8------------8-----1
6Іу-ІІе-\/аІ-6Іи-6іп-Су8-Суз-ТІіг-8ег-ІІе-Суз-8ег-І_еи-Туг-6Іп-І_еи-6Іи-Азп-Туг-Суз-Азп
1 2 3 4 5 6 \ 8 9 10 11 12 13 14 15 16 17 18 19 / 21
8 8
\ /
Ланцюг В 8 8
\ І
РІіе-УаІ-Азп-бІп-НІп-Іеи-Суз-бІу-Зег-Ніз-Іеи-УаІ-бІи-АІа-Іеи-Туг-Іеи-УаІ-Суз-бІу-бІи-Агд-вІу-РІїе-РІїе-Туг-ТІїг-Рго-Іуз-ТІїг
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 ЗО
Види Відмінності від амінокислотної послідовності людини
Позиції ланцюга А 8 9 10 Позиція ланцюга Б ЗО
Свині, собаки, кашалоти ТІіг-8ег-ІІе АІа
Кролики ТІіг-8ег-ІІе 8ег
Велика рогата худоба, кози АІа-8ег-\/аІ АІа
Вівці АІа-СІу-\/аІ АІа
Коні Тіїг-бІу-ІІе АІа
Кити сейвали АІа-8ег-ТІіг АІа
сопесііп£ реріісіе - С рергіде) сприяє згортанню і потім
відділяється в гранулах перед секрецією. В обробці проін-
суліну задіяні дві протеази. Для нього не виявлено іншої
фізіологічної активності. Зазвичай, 90-97% продуктів, що
вивільняються з В-клітини, припадають на інсулін разом з
еквімолярною кількістю С-пептиду. Решту становить про-
інсулін. Зазначимо, що С-пептид можна визначити радіо-
імунологічним дослідженням, а його рівень відображає
індекс діяльності В-клітин у пацієнтів, що отримують екзо-
генний інсулін.
Він руйнується в ендосомах, утворених унаслідок ендо-
цитозу. Головним ензимом, задіяним у цьому процесі, є
інсулінова протеаза - ензим клітинної мембрани, що
інтерналізується разом з інсуліном. Зазначимо, що інсулі-
нові рецептори виявлені в багатьох клітинах тіла, крім кла-
сичних інсуліночутливих клітин, у яких гормон підвищує
поглинання глюкози. Насправді майже всі тканини тіла
можуть метаболізувати деяку кількість інсуліну. Проте 80%
секретованого інсуліну за нормальних умов руйнується в
печінці та нирках.
ЧАСТКА СЕКРЕТОВАНОГО ІНСУЛІНУ
Інсулін та інсуліноподібна активність у крові
Плазма, крім інсуліну, містить багато сполук з інсуліно-
подібною активністю (табл. 19-2). Активність, яку не при-
гнічують антитіла, називають несупресорною інсуліно-
подібною активністю (НСІПА). Майже повністю така
активність зберігається після панкреатомїї, її забезпечують
інсуліноподібні фактори росту ІФР-І та ІФР-ІІ (див.
Розділ 22). Ці фактори росту є поліпептидами, малі їхні
кількості у вільному стані містяться в крові (низькомоле-
кулярна фракція), а великі зв’язані з білками (високомоле-
кулярна фракція).
Може виникнути запитання, чому ж тоді панкреатомія
спричинює цукровий діабет (див. нижче), якщо НСІПА
зберігається в плазмі. З цього приводу зазначимо, що інсулі-
ноподібна активність ІФР-І та ІФР-ІІ низька порівняно з
інсуліном.
Метаболізм
Період півжиття інсуліну в крові людини становить
близько 5 хв. Цей гормон зв’язується з інсуліновими рецеп-
торами, і деяка його частина інтерналізується (див. нижче).
ДІЯ ІНСУЛІНУ
Фізіологічні ефекти інсуліну далекосяжні і складні. їх
легко можна розділити на швидкі, проміжні та повільні,
як у табл. 19-3. Найліпше відомий гіпоглікемічний ефект,
однак є також додаткові впливи на транспортування аміно-
кислот та електролітів, багатьох ензимів та ріст (див. ниж-
че). Дія гормону також пов’язана із запасанням вуглеводів,
білків і жиру. Саме тому інсулін називають гормоном до-
статку.
Таблиця 19-2. Речовини з інсуліноподібною активністю в
людській плазмі
Інсулін
Проінсулін
Несупресорна інсуліноподібна активність
Низькомолекулярна фракція
ІФР-І
ІФР-ІІ
Високомолекулярна фракція (переважно ІФР зв’язаний з
білком)
ЕНДОКРИННІ ФУНКЦІЇ ПІДШЛУНКОВОЇ ЗАЛОЗИ Й РЕГУЛЮВАННЯ МЕТАБОЛІЗМУ ВУГЛЕВОДІВ / 309
Хромосомна ДНК (ядро)
Секреторна ґранула Ензими конвертації
Рис. 19-4. Біосинтез інсуліну. Три екзони гена інсуліну (вгорі)
розділені двома інтронами (ІНТ1 і ІНТ 2). Екзони 1 і 2 кодують
нетрансльовану частину мРНК, екзон 2 - сигнальний пептид
та ланцюг В (В), екзони 2 і 3 - С-пептид (С), а екзон 3 - ланцюг
А (А) і нетрансльовану частину мРНК. Сигнальний пептид
скеровує поліпептидний ланцюг до ендоплазматичної сітки,
а потім виводиться. Після цього молекула згортається з
утворенням дисульфідних зв’язків. С-пептид відокремлюють
ензими конвертації в секреторній ґранулі.
Дія гормону на жирову тканину, скелетні, гладкі та сер-
цевий м’язи, а також на печінку наведена в табл. 19-4.
Переносники глюкози
Глюкоза надходить у клітину за допомогою полегшеної
дифузії (див. Розділ 1) чи вторинного активного транспор-
тування з №+ у кишці та нирках. У м’язовій, жировій та
деяких інших тканинах інсулін полегшує надходження глю-
кози в клітини, збільшуючи кількість переносників у клі-
тинній мембрані.
Переносники глюкози (ПГ), що відповідають за полег-
шену дифузію глюкози через плазматичну мембрану, - це
родина близьких білків, що перетинають мембрану 12
разів, а їхні аміно й карбоксильні кінці містяться всередині
клітини. Вони відрізняються один від одного і не є гомоло-
гічні з натрійзалежними переносниками глюкози (НЗПГ 1
Таблиця 19-3. Головні дії інсуліну* 1
Швидка (секунди)
Підвищення рівня транспортування глюкози, аміно-
кислот та йонів К+ всередину інсуліночутливих клітин
Проміжна (хвилини)
Стимулювання синтезу білків
Сповільнення руйнувань білків
Активування гліколітичних ензимів та глікогенсинтази
Інгібування фосфорилаз та глюконеогенних ензимів
Повільна (години)
Збільшення кількості мРНК ліпогенних та інших ензимів
1 3 дозволу Ю боїсІЛпе.
та НЗПГ 2), які відповідають за вторинне активне транс-
портування глюкози з кишки (див. Розділ 25) та ниркових
трубочок (див. Розділ 38), незважаючи нате, що НЗПГтеж
мають 12 трансмембранних доменів. Зокрема, у трансмем-
бранних спіральних сегментах 3, 5, 7 та 11 амінокислоти
полегшувальних переносників оточують канали, по яких
може проходити глюкоза. Очевидно, що після цього кон-
формація змінюється, і глюкоза вивільняється всередину
клітини.
Сім різних переносників глюкози, названих за порядком
виявлення від СШТ 1 до 6ГГТ 5 (від англ. §1исозе їгапз-
рогіегз), наведені в табл. 19-5. Вони містять 492-524
амінокислоти; їхня спорідненість до глюкози також різна.
Здається, що кожний з переносників розвинувся для вико-
нання спеціальних завдань. Зокрема, 6ГГТ 4 є перенос-
ником у м’язах та жировій тканині, його стимулює інсулін.
Пул молекул СПІТ 4 підтримується в пухирцях у цито-
плазмі інсуліночутливих клітин. Якщо інсулінові рецептори
Таблиця 19-4. Вплив інсуліну на різні тканини
Жирова тканина
1. Збільшує надходження глюкози
2. Збільшує синтезування жирних кислот
3. Збільшує синтезування гліцерофосфатів
4. Збільшує депонування тригліцеридів
5. Активує ліпопротеїнліпазу
6. Інгібує гормоночутливу ліпазу
7. Збільшує поглинання К+
М’язи
1. Збільшує надходження глюкози
2. Збільшує синтезування глікогену
3. Збільшує поглинання амінокислот
4. Збільшує білкове синтезування у рибосомах
5. Зменшує катаболізм білків
6. Зменшує вивільнення глюконеогенних амінокислот
7. Збільшує поглинання кетонових тіл
8. Збільшує поглинання К+
Печінка
1. Зменшує кетогенез
2. Збільшує синтезування білків
3. Збільшує синтезування жирів
4. Зменшує вихід глюкози внаслідок зменшення глюко-
неогенезу чи збільшення синтезування глікогену
Загальний вплив
1. Прискорює клітинний ріст
310/РОЗДІЛ 19
Таблиця 19-5. Переносники глюкози у ссавців1
Функція ТКт(мМ)2 Головні ділянки експресії
Втрринне активне транспортування (Ма*-глюкозний симпорт) НЗПГ 1 Абсорбція глюкози 0,1-1,0 Тонка кишка, ниркові канальці
НЗПГ 2 Абсорбція глюкози 1,6 Ниркові канальці
Полегшена дифузія 6ШТ 1 Основне поглинання глюкози 1-2 Плацента, гематоцеребральний бар’єр, мозок, еритроцити, нирки, товста кишка, багато інших органів
6ПІТ 2 Глюкозний сенсор В-клітин; транспортування з клітин кишки та ниркових епітеліальних клітин 12-20 Клітини В острівців, печінка, епітеліальні клітини тонкої кишки, нирки
6ШТЗ Основне поглинання глюкози < 1 Головний мозок, плацента, нирки, багато інших органів
6 ПІТ 4 Інсуліностимульоване поглинання глюкози 5 Скелетні та серцевий м’язи, жирова тканина, інші тканини
(ЗНІТ 5 Транспортування фруктози 1-2 Голодна кишка, сперма
(ЗШТ6 Не має - Псевдоген
(З ПІТ 7 Транспортер глюкозо-6- фосфату в ендоплазматич- ній сітці — Печінка, 9 інші тканини
1 Модифіковано з ЗіерИепз им, РіІсИ РР: ТНе теіаЬоІіс гедиіаііоп апсі уезісиїаг ігапзрогі ої 6ШТ 4, ІГіе та]ог іпзиііп-гезропзіуе
діисозе ігапзрогіег, Епсіосг Рєу 1995; 16.529.
2 Кт - це концентрація глюкози, за якої транспортування є на рівні половини максимального значення
цих клітин активовані, то інсулінові пухирці швидко руха-
ються до клітинної мембрани і зливаються з нею, захоп-
люючи переносників у клітинну мембрану (рис. 19-5).
Якщо дія інсуліну припиняється, то ділянки мембрани, що
містять переносники, зазнають ендоцитозу, і пухирці ста-
ють готовими до наступного інсулінового сигналу. Акти-
вування інсулінових рецепторів спричинює рух пухирців
до поверхні клітини шляхом активування фосфоінозитол-
3-кінази (див. рис. 19-5), проте як це відбувається - досі
невідомо. Більшість 6ШГ, що не є інсуліночутливими, роз-
ташовані в клітинній мембрані.
У тканинах, де інсулін збільшує кількість переносників
глюкози в клітинних мембранах, швидкість фосфорилю-
вання глюкози, після того, як вона потрапила в клітину,
регулюють інші гормони. Наприклад, гормон росту та
кортизол інгібують фосфорилювання в певних тканинах.
Однак зазвичай цей процес настільки швидкий, що стає
лімітувальною стадією в метаболізмі глюкози лише тоді,
коли швидкість надходження глюкози висока.
Інсулін також збільшує надходження глюкози до клітин
печінки, однак не шляхом збільшення кількості пере-
носників глюкози (див. нижче) у клітинній мембрані. У
цьому разі він індукує глюкокіназу, а це збільшує фосфори-
лювання глюкози, тому внутрішньоклітинна концентрація
глюкози низька, що сприяє її додатковому надходженню в
клітину.
Інсуліночутливі тканини також містять 6ІАІТ 4 пухирці,
що рухаються до клітинної мембрани внаслідок фізичних
навантажень і не залежать від дії інсуліну. Це є причиною
того, що фізичні навантаження знижують кількість цукру
в крові (див. нижче). За вставлення цих пухирців у клітинну
мембрану може бути відповідальна 5'-АМФ-активована
кіназа.
Препарати інсуліну
Максимальне зниження рівня глюкози в крові відбува-
ється через 20 хв після внутрішньовенної ін’єкції крис-
талічного інсуліну. Внаслідок підшкірного введення мак-
симальне зниження простежується через 2-3 год. Тепер
доступна велика кількість різноманітних комерційних
препаратів інсуліну. Вони містять інсуліни в комплексі з
протаміном та іншими поліпептидами для сповільнення
абсорбції, та синтетичні інсуліни зі зміненими амінокис-
лотними залишками. Загалом їх поділяють натри категорії:
швидкодійні, середньої дії та тривалої дії (24-36 год).
Зв’язок з калієм
Інсулін сприяє надходженню К+ в клітину, внаслідок
чого зменшується позаклітинна концентрація К\ Введення
інсуліну та глюкози помітно знижує рівень К+ в плазмі крові
нормальних людей і є дуже ефективним засобом для тимча-
сового зменшення гіперглікемії в пацієнтів із нирковою
недостатністю. Гіпокаліємія часто виникає тоді, коли паці-
єнтів із діабетичним ацидозом лікують за допомогою інсу-
ліну. Причина внутрішньоклітинного переходу К+ невідо-
ма. Однак інсулін збільшує активність №'-К'-АТФ-ази в
клітинних мембранах, унаслідок чого більше К4 надходить
у клітини.
ЕНДОКРИННІ ФУНКЦІЇ ПІДШЛУНКОВОЇ ЗАЛОЗИ Й РЕГУЛЮВАННЯ МЕТАБОЛІЗМУ ВУГЛЕВОДІВ / 311
Рис. 19-5. Цикли переходу переносників 6ИІТ 4 через ендосоми в інсуліночутливих тканинах. Активування інсулінового
рецептора спричинює активування фосфоінозитол-3-кінази, яка прискорює входження 6ШТ 4-вмісних ендосом у клітинну
мембрану. Після цього 6ШТ 4 опосередковує транспортування глюкози в клітину.
ІНШІ дії
Гіпоглікемічний та інші ефекти інсуліну коротко наве-
дені в табл. 19-3, а кінцевий вплив на різні тканини - у
табл. 19-4. Дія глікогенсинтази стимулює запасання гліко-
гену, а дія гліколітичних ензимів сприяє метаболізму глю-
кози до двовуглецевих фрагментів (див. рис. 17-9), що в
підсумку зумовлює ліпогенез. Стимулювання білкового
синтезу завдяки надходженню амінокислот у клітину та
сповільнення руйнування білків прискорює ріст.
Анаболічний ефект інсуліну, що полягає у заощадженні
білків, підтримуваний унаслідок достатнього внутрішньо-
клітинного надходження глюкози. Затримка росту є симп-
томом діабету в дітей. Водночас інсулін стимулює ріст
незрілих гіпофізектомічних щурів майже на такому самому
рівні, як і гормон росту. Максимальний інсуліноіндукова-
ний ріст простежується, однак лише тоді, коли білково-
ощадливу дію глюкози підтримують раціоном з високим
вмістом вуглеводів.
МЕХАНІЗМ ДІЇ
Інсулінові рецептори
Інсулінові рецептори виявлені в багатьох клітинах тіла,
навіть у тих, де інсулін не збільшує поглинання глюкози.
Зазначимо, що рецептор інсуліну має молекулярну масу
близько 340 000 дальтон, це тетрамер, що складається з
двох а- і двох Р-глікопротеїнових субодиниць (рис. 19-6).
Усі вони синтезуються на одній мРНК, а потім протеолі-
тично розщеплюються й з’єднуються одна з одною дисуль-
фідними зв’язками. Ген інсулінового рецептора має 22
екзони і розташований у 19-й хромосомі. Альфа-суб-
одиниці приєднують інсулін і є позаклітинними, тоді як Р-
субодиниці проходять через мембрану. Внутрішньоклі-
тинні частини Р-субодиниць мають тирозинкіназну актив-
ність. Обидві а- і Р-субодиниці глікозильовані залишками
цукрів, що поширюються у інтерстиційну рідину.
Приєднання інсуліну зумовлює тирозинкіназну актив-
ність Р-субодиниць, спричинюючи їхнє автофосфорилю-
вання по залишках тирозину. Автофосфорилювання, яке
потрібне для прояву біологічних ефектів інсуліну, приво-
дить до фосфорилювання одних цитоплазматичних білків
та дефосфорилювання інших, переважно по залишках
серину та треоніну (рис. 19-7). Описано чотири близькі
субстрати інсулінового рецептора в клітинах: ІК8-1, ІК.8-
2, 1138-3 та ІК.8-4 (ІК8 - від англ. іпвиїіп гесеріог виЬвІгаїе).
Напевно, що кожний з них відповідає за якусь частину дії
інсуліну. Наприклад, у миші з нокаутом гена інсулінового
рецептора простежується помітне сповільнення внутріш-
ньоутробного росту, аномалії ЦНС та шкіри, і вона помирає
під час народження внаслідок дихальної недостатності.
Проте Ж8-1 нокаутної миші лише помірно сповільнюється
внутрішньоутробний ріст, вона виживає і є інсулінорезис-
тентною, водночас за іншими ознаками практично нор-
мальна. Отже, внутрішньоклітинні шляхи, що не містять
ІК8-1, повинні брати участь в інсуліновій активності. Зв’я-
зок ІКС-2 із нагромадженням В-клітин розглянуто нижче.
Цікаво порівняти інсуліновий рецептор з іншими близь-
кими рецепторами. Він дуже подібний до рецептора ІФР-
I, однак відрізняється від рецептора ІФР-ІІ (див. рис. 19-
6). Інші рецептори факторів росту та рецептори різних
онкогенів також є тирозинкіназами. Незважаючи на це, амі-
нокислотний склад цих рецепторів цілком відмінний.
Коли інсулін зв’язується зі своїми рецепторами, то від-
бувається їхнє агрегування і поглинання в клітину шляхом
рецепторопосередкованого ендоцитозу (див. Розділ 1).
312/РОЗДІЛ 19
Рис. 19-6. Інсулін, ІФР-І та ІФР-ІІ. Кожний гормон зв’язується,
головно, зі своїм рецептором, однак інсулін також зв’язується
з рецептором ІФР-І, а ІФР-І - з усіма трьома. Прямокутники
темного кольору - це внутрішньоклітинні домени тирозин-
кіназ Зверніть увагу на подібність між рецептором інсуліну
та рецептором ІФР-І, а також на 15 повторних послідовностей
зовнішньокпітинної частини рецептора ІФР-ІІ.
Рис. 19-7. Внутрішньоклітинні відповіді на зв’язування інсуліну
з його рецептором. Темні кульки та кульки з буквою Р позна-
чають фосфатні групи; ІР8-1 - субстрат-1 інсулінового ре-
цептора.
Комплекси інсулін-рецептор потрапляють у лізосоми, де
рецептори переважно розпадаються або використовуються
повторно. Період півжиття інсулінового рецептора стано-
вить близько 7 год.
Інсулін та інші гормони, фізичні навантаження, їжа й
інші чинники впливають на кількість чи спорідненість
інсулінових рецепторів або ж на обидві ознаки. Дія великих
кількостей інсуліну зменшує концентрацію рецепторів
(низхідне регулювання), а зниження рівня інсуліну збіль-
шує їхню спорідненість. Кількість рецепторів на одну клі-
тину збільшується під час голодування і зменшується в разі
ожиріння й акромегалії. Спорідненість рецепторів збіль-
шується у випадку наднирникової недостатності і змен-
шується за надлишку глюкокортикоїдів (див. нижче).
НАСЛІДКИ НЕСТАЧІ ІНСУЛІНУ
Далекосяжні фізіологічні ефекти інсуліну пояснюють з
огляду на передбачувані всебічні та важливі наслідки дефі-
циту інсуліну.
Цукровий діабет
У людей дефіцит інсуліну є поширеним і серйозним
патологічним станом. У тварин він може бути спричинений
панкреатектомією; уведенням алоксану, стрептозоцйну та
інших токсинів, що в певних дозах зумовлюють вибіркове
руйнування В-клітин панкреатичних острівців; уведенням
препаратів, що інгібують секрецію інсуліну; уведенням
антиінсулінових антитіл. Відомі та описані деякі лінії
мишей, щурів, хом’яків, морських свинок та мавп, що
мають часту захворюваність на спонтанний цукровий
діабет.
Сукупність аномалій, спричинених нестачею інсуліну,
називають цукровим діабетом. Грецькі та римські лікарі
використовували термін діабет для опису станів, головною
ознакою яких був великий об’єм сечі. Розрізняли такі два
типи: цукровий діабет, за якого сеча мала солодкий смак,
та нецукровий діабет, за якого сеча не мала смаку. Тепер
термін нецукровий діабет використовують для станів, за
яких виникає дефіцит утворення або дії вазопресину (див.
Розділ 14), а саме слово діабет є синонімом до цукрового
діабету.
Діабет супроводжується поліурією, полідипсією, втра-
тою маси за поліфагії (збільшеного апетиту), гіпергліке-
мією, глюкозурією, кетонемією, ацидозом та комою. Є різ-
номанітні біохімічні аномалії, проте головні дефекти, до
яких можна звести всі аномалії, - це, по-перше, зменшене
надходження глюкози до різних периферійних тканин та,
по-друге, збільшене виділення печінкою глюкози в кров’я-
не русло. Отже, виникає позаклітинний надлишок глюкози,
а в багатьох клітинах - внутрішньоклітинна нестача
глюкози, стан, який назвали голодуванням серед достатку.
Також зменшується надходження амінокислот у м’язи та
збільшується ліполіз.
Тепер відомо, що в разі діабету виникає абсолютна чи
відносна гіперсекреція глюкагону. Це відбувається навіть
за умов видалення підшлункової залози, оскільки глюкагон,
крім підшлункової залози секретується також у інших від-
ділах травної системи. Соматостатин зменшує секрецію
глюкагону та інсуліну (див. Розділ 14), і коли його вводять
тваринам із видаленою підшлунковою залозою, то рівень
ЕНДОКРИННІ ФУНКЦІЇ ПІДШЛУНКОВОЇ ЗАЛОЗИ Й РЕГУЛЮВАННЯ МЕТАБОЛІЗМУ ВУГЛЕВОДІВ / 313
глюкози в плазмі спадає до норми. Здається, що позаклі-
тинний надлишок глюкози є частково наслідком гіперглю-
кагонемії. Проте деяка гіперглікемія простежується навіть
тоді, коли секреція глюкагону зменшена до нуля.
Толерантність до глюкози
У разі діабету глюкоза накопичується в крові, особливо
після їжі. Якщо діабетик піддається дії глюкозного наван-
таження, то його рівень глюкози у плазмі зростає й повер-
тається до початкового рівня повільніше, ніж у нормальних
людей. Відповідь на стандартну оральну тестову дозу
глюкози - тест на толерантність до глюкози, - викорис-
товують у клінічному діагностуванні діабету (рис. 19-8).
Погіршена толерантність до глюкози у разі діабету част-
ково є наслідком зменшеного надходження глюкози в клі-
тини (зменшена периферійна утилізація). Без інсуліну
надходження глюкози в скелетні, серцевий і гладкі м’язи
та інші тканини зменшується (рис. 19-9). Поглинання глю-
кози в печінці також зменшується, однак результат цього
опосередкований. Абсорбція глюкози в кишці не зміню-
ється, як і реабсорбція із сечі клітинами проксимальних
канальців нирок. Поглинання глюкози більшою частиною
мозку та еритроцитами також у нормі.
Другою, і головною, причиною гіперглікемії в разі діа-
бету є розлад глюкостатичної функції печінки (див. Розділ
17). Печінка поглинає глюкозу з крові і запасає її у вигляді
глікогену, та оскільки вона містить глюкозо-6-фосфат, то
також вивільняє глюкозу в кров. Справді, Клод Бернард
говорив про печінку як про ендокринну залозу, що секретує
глюкозу. Інсулін сприяє синтезуванню глікогену і пере-
шкоджає печінковому вивільненню глюкози. Якщо плазма
вміщує багато глюкози, то зазвичай збільшується секреція
інсуліну, і печінковий глюкогенез зменшується. Цей ефект
зникає внаслідок діабету. Глюкагон теж робить внесок у
гіперглікемію; якщо стрес чи хвороба серйозні, то печін-
кове вивільнення глюкози стимулюють катехоламіни, кор-
тизол та гормон росту.
Ефекти гіперглікемії
Сама по собі гіперглікемія може зумовити симптоми
внаслідок гіперосмолярності крові. Крім того, якщо нир-
кова здатність реабсорбції глюкози зменшується, то вини-
кає глюкозурія. Екскреція осмотично активних молекул
глюкози супроводжується втратою великих кількостей
води (осмотичний діурез; див. Розділ 38). Спричинена
дегідратація активує механізми регулювання споживань
води, що веде до полідипсії. Простежується помітна втрата
№+ та К+ із сечею. На кожний грам екскретованої глю-
кози організм втрачає 4,1 ккал енергії. Збільшене спожи-
вання їжі для покриття цих втрат просто підвищує рівень
глюкози в плазмі з наступним посиленням глюкозурії, не
перешкоджаючи мобілізації ендогенних білків та жирових
нагромаджень, а також втраті маси.
Якщо плазматичний рівень глюкози епізодично під-
вищується, то невеликі кількості гемоглобіну А неензимно
глікозилюють з утворенням НЬАІС (див. Розділ 27). Старан-
ний контроль діабету за допомогою інсуліну знижує цей
рівень, тому концентрацію НЬАІС у клініці використовують
як інтегрований показник діабетичного контролювання для
періоду тривалістю чотири-шість тижнів до вимірювань.
Час після орального споживання
глюкози, год
Рис. 19-8. Оральний тест на глюкозну толерантність. Дорос-
лим дають 75 г глюкози на 300 мл води. В нормальних осіб
венозний плазматичний рівень глюкози натще становить мен-
ше 115 мг/дл, через дві години після введення - менше
140 мг/дл, і жодне із значень не перевищує 200 мг/дл. Цукро-
вий діабет є, якщо двогодинне і будь-яке інше значення пе-
ревищує 200 мг/дл. Зменшена толерантність до глюкози ви-
никає тоді, коли значення є більшими, ніж верхня межа норми,
однак меншими від діагностичних значень діабету.
Значення хронічної гіперглікемії у формуванні тривалих
ускладнень діабету розглянуто нижче.
Ефекти внутрішньоклітинного дефіциту
глюкози
Надлишок глюкози поза клітиною в разі діабету конт-
растує з її внутрішньоклітинною нестачею. Катаболізм
глюкози, зазвичай, є головним джерелом енергії для
Гліцерин
(глюкозурія)
Рис. 19-9. Розлади гомеостазу плазматичної глюкози у разі
дефіциту інсуліну. Порівняйте з рис. 17-14. Грубі стрілки пока-
зують реакції, описані в тексті. Прямокутники поперек стрі-
лок позначають блоковані реакції.
314/РОЗДІЛ 19
клітинних процесів і у випадку діабету енергетичні потреби
можуть бути задоволені тільки завдяки використанню запа-
сів білка й жиру. В цьому разі відбувається активування
механізмів, що сильно підвищують катаболізм білків і
жирів, один із наслідків підвищеного катаболізму жирів -
кетонемія.
Дефіцит утилізації глюкози в клітинах гіпоталамних
вентромедіальних ядер є, можливо, причиною гіперфагії
в разі діабету. Якщо активність центру насичення цього
ядра послаблюється внаслідок зменшення утилізації глю-
кози в клітинах, то латеральна зона апетиту діє, не зазнаючи
опору, і споживання їжі збільшується (див. Розділ 14).
Проте є й інші пояснення цього явища.
Виснаження глікогену є звичним наслідком дефіциту
глюкози. Звісно, що вміст глікогену в печінці та скелетних
м’язах у діабетичних тварин знижений.
Зміни в метаболізмі білків
У випадку діабету швидкість, із якою відбувається ката-
болізування амінокислот до СО2 і Н2О, зростає. Окрім цьо-
го, більше амінокислот перетворюється в глюкозу у печінці.
Ці зміни показані на рис. 19-10, де також відображено інші
головні аномалії проміжного обміну в печінці.
Деякі значення швидкості глюконеогенезу в діабетичної
тварини, що голодує, можна отримати вимірюванням спів-
відношення кількості глюкози (декстрози) до азоту в сечі
(відношення Д/А). У тварин, що голодують, глікоген
печінки вичерпується, а гліцерин перетворюється в глю-
козу в дуже обмеженій кількості, так що єдиним важливим
джерелом глюкози плазми є білок (див. Розділ 17). Можна
обчислити, що кількість вуглецю в білку, яка відповідає
1 г азоту сечовини, достатня для утворення 8,3 г глюкози.
Отже, відношення Д/А « 3, яке простежується під час діа-
бету, свідчить про перетворення в глюкозу близько 33%
вуглецю метаболізованого білка.
Підвищення глюконеогенезу зумовлене багатьма при-
чинами. Глюкагон стимулює глюконеогенез, а гіперглю-
кагонемія, зазвичай, виникає у разі діабету. Надниркові
глюкокортикоїди також призводять до збільшення глюко-
неогенезу, якщо їхній рівень підвищується в серйозно хво-
рих діабетиків. Простежується збільшене постачання амі-
нокислот для глюконеогенезу, оскільки без інсуліну в м’я-
зах синтезується менше білків, а отже, рівень амінокислот
у крові збільшується. Аланін особливо легко перетворю-
ється в глюкозу. Окрім цього, посилюється активність
ензимів, що каталізують перетворення пірувату та інших
двовуглецевих обмінних фрагментів у глюкозу. Це, зокре-
ма, стосується фосфоенолпіруваткарбоксикінази, яка
полегшує перетворення оксалоацетату у фосфоенолпіруват
(див. Розділ 17), а також фруктозо-1,6-дифосфату, що
каталізує перетворення фруктозодифосфату у фруктозо-6-
фосфат і глюкозо-6-фосфат, який контролює надходження
глюкози з печінки у кров. Збільшення ацетил-КоА сти-
мулює піруваткарбоксилазну активність, а нестача інсуліну
веде до збільшеного утворення ацетил-КоА, оскільки
ліпогенез сповільнюється. Піруваткарбоксилаза каталізує
перетворення пірувату в оксалоацетат (див. рис. 17-9).
Наслідок впливу прискореного перетворення білка в
СО2, Н2О і глюкозу разом зі зменшеним білковим синтезом
у разі діабету зумовлює негативний азотний баланс,
білкову недостатність та виснаження. Білкове виснаження
з будь-якої причини пов’язане з низькою резистентністю
до інфекцій.
Метаболізм жирів у разі діабету
Головними аномаліями метаболізму жирів у випадку
діабету є прискорення катаболізму ліпідів зі збільшеним
утворенням кетонових тіл та зменшення синтезу жирних
кислот і тригліцеридів. Прояви цих розладів метаболізму
жирів настільки помітні, що діабет називають більше хво-
робою метаболізму жирів, ніж вуглеводів.
За нормальних умов відбувається спалення 50% спожи-
тої глюкози до СО2 та Н2О; 5% її перетворюється в глікоген;
а 30-40% перетворюється в жир у жирових відкладах. У
разі діабету менш ніж 5% перетворюється в жир, незва-
жаючи на те, що кількість, спалена до СО2 та Н2О, також
зменшена, а кількість, що перетворюється в глікоген, не
збільшується. Отже, глюкоза накопичується в крові і пере-
ходить у сечу.
Роль ліпопротеїнліпази та гормоночутливої ліпази в
регулюванні метаболізму жирів розглянуто в Розділі 17. У
разі діабету зменшується перетворення глюкози в жирні
кислоти за умов депонування внаслідок внутрішньоклі-
тинного дефіциту глюкози. Інсулін інгібує гормоночутливу
ліпазу в жировій тканині, і без цього гормону рівень віль-
них жирних кислот (ВЖК) у плазмі підвищується більше
ніж удвічі. Збільшення глюкагону також сприяє мобілізації
ВЖК. Отже, рівень ВЖК змінюється одночасно з рівнем
глюкози в плазмі і є дещо ліпшим показником складності
діабетичного стану. В печінці та інших тканинах жирні
кислоти катаболізують до ацетил-КоА. Деяка частина
ацетил-КоА згорає разом з амінокислотними залишками з
утворенням СО2 і Н2О в циклі лимонної кислоти. Однак
надходження перевищують здатність тканин катаболізу-
вати ацетил-КоА.
Процеси, що відбуваються в печінці у разі діабету, пока-
зані на рис. 19-10. Крім уже згаданого збільшення глюко-
неогенезу та значного викиду глюкози в кров, також від-
чутно погіршується перетворення ацетил-КоА в малоніл-
КоА, а з нього - у жирні кислоти. Воно виникає внаслідок
нестачі ацетил-КоА карбоксилази, ензиму, що каталізує
перетворення. Надлишок ацетил-КоА перетворюється в
кетонові тіла (див. нижче).
У випадку нелікованого діабету збільшується концент-
рація тригліцеридів, хіломікронів та ВЖК у плазмі; такий
стан називають ліпемією (гіперліпемією). Збільшення
вмісту цих складових є наслідком зменшеного переміщен-
ня тригліцеридів у жирові відклади. Зменшення активності
ліпопротеїнліпаз робить внесок у зменшене видалення
тригліцеридів.
Кетонемія
Якщо в організмі є надлишок ацетил-КоА, то деяка його
частина перетворюється в ацетоацетил-КоА, а потім, у
печінці, в ацетоацетат. Ацетоацетат та його похідні -
ацетон і р-гідроксибутират - надходять у кров у значних
кількостях (див. Розділ 17).
Ці кетонові тіла, що циркулюють, є важливим джерелом
енергії під час голодування. Вважають, що в нормальних
собак під час голодування половина метаболізму відбува-
ЕНДОКРИННІ ФУНКЦІЇ ПІДШЛУНКОВОЇ ЗАЛОЗИ Й РЕГУЛЮВАННЯ МЕТАБОЛІЗМУ ВУГЛЕВОДІВ / 315
Глікоген
Жир
(жирова
тканина)
Глюкоза
(гіперглікемія)
Г л юкозо-6-фосфат
Гексо-
І моно- \
1 фосфатний і
шунт /
Тріоза-Ф
ВЖК
(плазма)
Глюкоза
в сечі
(глюкозурія)
Ацетил-КоА
Аміно-
кислоти
а-Кетоглутарат
Фосфоенолпіруват
Аміно-
кислоти
Тригліцерид
Оксалоацетат
Кетонові тіла
(гіперкетонемія)
Піруват
Ацетил-
КоА
Цитрат
Кетонові тіла
в сечі
(кетонурія)
Амінокислоти
Активність шляхів
Вище норми
------ Ймовірно, нижче норми
Збільшений глюконеогенез
------► Відчутно зменшено
Рис. 19-10. Метаболічні аномалії в печінці у випадку нелікованого діабету (відтворено за дозволом з Миггау ВК еі аі: Нагреґз
Віосіїетізігу, 25іГі есі. МсОгам-НіІІ, 2000).
ється внаслідок метаболізму кетонових тіл. У діабетиків
рівень утилізації кетонових тіл також суттєвий. З’ясовано,
що у хворих на діабет максимальний рівень, за якого жир
може катаболізуватись без помітної кетонемії, становить
2,5 г/кг маси тіла за добу. У разі нелікованого діабету
продукування набагато вище від зазначеного, і кетонові
тіла накопичуються в кров’яному руслі. Є деякі докази
того, що в разі важкого діабету рівень утилізації кетонових
тіл може знижуватися, погіршуючи кетонемію, інсулін же
збільшує використання кетонових тіл м’язами.
Ацидоз
Більшість йонів водню, вивільнених з ацетоацетату та
р-гідроксибутирату, буферизують, та все ж сильний метабо-
лічний ацидоз розвивається. Зниження рН крові стимулює
дихальний центр, що веде до появи швидкого глибокого
дихання, описаного Куссмаулем як повітряний голод і
названим на його честь диханням Куссмауля. У цьому
випадку сеча стає кислою. Якщо здатність нирок заміщати
катіони плазми, що супроводжують органічні аніони, на
Н+ і ИН4+ перевищена, то№і К+ виходять із сечею. Втрата
води та електролітів веде до дегідратації, гіповолемії та
зниження кров’яного тиску. Нарешті, ацидоз та дегідра-
тація пригнічують свідомість до стану коми. Незважаючи
на те, що тепер інфекції, які ускладнюють хворобу, вдається
контролювати за допомогою антибіотиків, ацидоз є
найпоширенішою причиною ранньої смерті в разі
цукрового діабету у клініці.
316/РОЗДІЛ 19
У разі вираженого ацидозу загальна кількість натрію в
організмі значно зменшується, а якщо втрати натрію пере-
вищують втрати води, то рівень Иа+ в плазмі також стає
низьким. Загальний рівень калію в організмі теж неви-
сокий, однак його плазматичний рівень зазвичай нормаль-
ний частково внаслідок зменшення об’єму ПКР, а частково
тому, що К+ рухається з клітин до ПКР, коли позаклітинна
концентрація Н+ висока. Іншим фактором, що підтримує
рівень К+ у плазмі, є відсутність інсуліноіндукованого над-
ходження К+ у клітину.
Ступінь, з яким кетоацидоз ускладнює експерименталь-
ний діабет, змінюється в різних видів. Розмір запасів жиру
в організмі також є фактором, що визначає відповідь на
діабет. До виділення інсуліну Бантінгом і Вестом 1921 р.
головним методом лікування діабету в людей було голо-
дування (режим харчування Аллена). Це зменшувало не
лише рівень глюкози в плазмі, а й депонування жиру до
тої міри, коли вже було мало жиру для мобілізації.
Кома
Кома в разі діабету може виникати внаслідок ацидозу
та дегідратації. Проте глюкоза в плазмі може збільшитись
до такого рівня, що не залежить від рН плазми, і гіперос-
молярність плазми призведе до втрати свідомості (гіпер-
осмолярна кома). Накопичення лактату в крові (лактоци-
доз) також ускладнює діабетичний кетоацидоз, якщо тка-
нини стають гіпоксичними (див. Розділ 33), і може приз-
вести до коми. Набряк мозку простежується в значної кіль-
кості пацієнтів із діабетичним ацидозом, він також може
призвести до коми. Причина набряку мозку остаточно не
з’ясована, однак це серйозне ускладнення з поганим про-
гнозом.
Метаболізм холестеролу
У разі діабету характерне підвищення рівня холестеролу
в плазмі, що прискорює розвиток судинної хвороби атеро-
склерозу, яка є головним довготривалим ускладненням
діабету в людини. Рівень холестеролу підвищується внас-
лідок збільшення концентрації ЛПДНЩ та ЛПНЩ у плазмі
(див. Розділ 17), що може бути наслідком збільшеного
утворення ЛПДНЩ у печінці чи зменшеного видалення
ЛПДНЩ та ЛПНЩ із кров’яного русла.
Висновки
Складність метаболічних порушень у разі діабету потре-
бує підсумування описаних вище положень. Однією з клю-
чових ознак дефіциту інсуліну (рис. 19-11) є зменшене над-
ходження глюкози до багатьох тканин (зменшена перифе-
рійна утилізація). Простежується також збільшення чис-
того вивільнення глюкози з печінки (збільшене утворення)
частково внаслідок надлишку глюкагону. Як наслідок,
гіперглікемія веде до глюкозурії та дегідратаційного осмо-
тичного діурезу. Дегідратація спричинює полідипсію. На
тлі внутрішньоклітинної нестачі глюкози стимульований
апетит; глюкоза утворюється з білків (глюконеогенез), а
енергетичні потреби підтримує метаболізм білків та жирів.
Результатом цього є втрата маси, слабкість, дефіцит білків
та виснаження.
Катаболізм жирів посилюється, і в організмі виникає
надлишок тригліцеридів і ВЖК. Синтез жирів пригнічений,
Нестача інсуліну
(і надлишок глюкагону)
Зменшення
поглинання
глюкози
Збільшення
катаболізму
білків
Збільшення
ліполізу
Збільшення рівня
ВЖК у плазмі,
кетогенез,
кетонурія,
кетонемія
Гіперглікемія, ◄---- Збільшення
глікозурія, амінокислот
осмотичний діурез, у плазмі,
електролітичне втрати азоту
виснаження в сечі
Кома,
смерть
Рис. 19-11. Ефекти нестачі інсуліну (з дозволу НауеІ).
а перевантажені катаболічні шляхи не можуть дати собі
раду з надлишком утвореного ацетил-КоА. У печінці аце-
тил-КоА перетворюється в кетонові тіла. Кетонові тіла,
головно, є органічними кислотами, які накопичуються в
крові (кетонемія), оскільки швидкість їхнього утворення
перевищує здатність організму до їхньої утилізації. З
накопиченням кетонових тіл розвивається метаболічний
ацидоз. Зменшення кількості №+ і К+ супроводжує дегід-
ратація, оскільки катіони плазми екскретуються з орга-
нічними аніонами, які не з’єднуються з Н+ і МН +, що їх
секретують нирки. Зрештою, ацидоз, гіповолемія, гіпотен-
зія виснаженої тварини чи пацієнта зумовлюють стан коми
внаслідок токсичних ефектів ацидозу, дегідратації та гіпер-
осмолярності на нервову систему і, якщо їм вчасно не
надано медичну допомогу, - смерть.
Усі ці порушення коректують уведенням інсуліну. Хоча
негайне лікування ацидозу також передбачає парентераль-
не олужнення для боротьби з ацидозом та наводнення для
поповнення запасів і К+організму, однак лише інсулін
виліковує головні дефекти, уможливлюючи повернення до
нормального стану.
НАДЛИШОК ІНСУЛІНУ
Симптоми
Усі відомі наслідки надлишку інсуліну є проявами, пря-
мими чи опосередкованими, ефектів гіпоглікемії в нервовій
системі. У людей, що якийсь час голодують, глюкоза - єди-
не джерело енергії, яке використовує мозок у значних кіль-
костях. Вуглеводневі запаси в нервовій тканині дуже обме-
жені, а нормальна її діяльність залежить від безперервного
постачання глюкози. Перші симптоми зниження рівня глю-
кози в крові - прискорене серцебиття, спітніння та нер-
возність унаслідок вегетативних розладів. За нижчих рівнів
глюкози в плазмі з’являються так звані нейроглікопенічні
ЕНДОКРИННІ ФУНКЦІЇ ПІДШЛУНКОВОЇ ЗАЛОЗИ Й РЕГУЛЮВАННЯ МЕТАБОЛІЗМУ ВУГЛЕВОДІВ / 317
симптоми, зокрема голод, збентеження поряд з іншими
пізнавальними аномаліями. За ще нижчих рівнів глюкози
в плазмі настають летаргія, кома, конвульсії й смерть.
Пороги цих аномалій показані на рис. 19-12. Очевидно,
що прояви гіпоглікемічних симптомів потребують негай-
ного лікування глюкозою або глюкозовмісними напоями,
наприклад, апельсиновим соком. Хоча звичайною відпо-
віддю є драматичне зникнення симптомів, за тяжкої або
тривалої гіпоглікемії можуть виникати порушення - від
тимчасових інтелектуальних розладів до тривалої коми.
Компенсаторні механізми
Важливою компенсацією гіпоглікемії є припинення сек-
реції ендогенного інсуліну; воно повне, якщо рівень глю-
кози в плазмі становить 80 мг/дл (див. рис. 19-12, 19-13).
Окрім того, гіпоглікемія спричинює збільшення секреції
принаймні чотирьох гормонів із протилежною регулятор-
ною дією: глюкагону, адреналіну, гормону росту та корти-
золу. Адреналінова відповідь зменшується під час сну.
Адреналін та глюкагон збільшують печінковий вихід глю-
кози внаслідок збільшення глікогенолізу. Гормон росту
зменшує утилізацію глюкози в різних периферійних ткани-
нах, як і кортизол. Основу зворотного зв’язку в механізмах
регулювання становлять адреналін та глюкагон: якщо кон-
центрація одного з них у плазмі збільшується, то зниження
рівня глюкози в плазмі замінюється її зростанням. Однак
якщо концентрація жодного з них не зростає, то відбува-
ється невисоке (або взагалі не відбувається) компенсаторне
підвищення рівня глюкози в плазмі. Дія інших гормонів є
доповнювальною.
Зазначимо, що вегетативні розлади та вивільнення кон-
трінсулярних гормонів, зазвичай, виникають у разі вищого
рівня глюкози в плазмі, ніж когнітивні розлади та інші
Глюкоза в плазмі, мг/дл
Рис. 19-13. Середні значення вивільнення інсуліну та глюка-
гону зі штучної підшлункової залози за різних рівнів глюкози
в плазмі. Пристрій запрограмований на усталення і підтри-
мання різних рівнів глюкози в плазмі в інсулінозалежних хво-
рих на діабет, значення виходу гормонів відображають при-
близний вихід з нормальної підшлункової залози людини.
Форма інсулінової кривої також відображає інсулінову відпо-
відь інкубованих В-клітин на різні концентрації глюкози (від-
творено за дозволом з Магіівв ЕВ еі аі: Могтаїігаііоп о( діус-
етіа іп сІіаЬеІісв сіигіпд теаіз \л/НГі іпзиііп апсі діисадоп сієііу-
егу Ьу ІГіе агііїісіаі рапсгеаз. ОіаЬеІез 1977;26:663.)
серйозні зміни центральної нервової системи (див. рис. 19-
12). Симптоми, зумовлені вегетативними розладами, є
попередженням для пошуку замінників глюкози, на що
доводиться звертати увагу хворим на діабет, яких лікують
інсуліном. Проте, особливо у разі довготривалого відре-
гульованого діабету, вегетативні симптоми можуть не вини-
кати, і відбувається неусвідомлена гіпоглікемія, що ство-
рює клінічні проблеми (див. нижче).
Глюкоза плазми
ммоль/л
4,6
3,8
3,2
2,8
мг/дл
90
— Припинення секреції інсуліну
75
— Секреція глюкагону, адреналіну,
60 гормону росту
— Секреція кортизолу
— Когнітивні дисфункції
45
2,2 — Летаргія
1,7 ЗО — Кома
1,1 —Конвульсії
15
0,6 —Тривале ушкодження мозку, смерть
Рис. 19-12. Рівні глюкози крові, за яких виявляються різні
ефекти гіпоглікемії.
РЕГУЛЮВАННЯ СЕКРЕЦІЇ ІНСУЛІНУ
Нормальна концентрація інсуліну, виміряна радіоімуно-
логічними дослідженнями в периферійній венозній крові,
у здорової людини натще становить 0-70 мкОД/мл (0-
502 пмоль/л). Рівень базальної секреції інсуліну - 1 ОД/г.
Приймання їжі супроводжується 5-10-разовим підвищен-
ням рівня інсуліну. Отже, загальна денна кількість у
нормальної людини становить близько 40 ОД (287 нмоль).
Вплив глікемії
Секреція інсуліну головно контрольована за допомогою
впливу глікемії на В-клітини підшлункової залози завдяки*
механізму зворотного зв’язку. Глюкоза потрапляє в В-
клітини через транспортер ОЬПТ 2, який є у значній кіль-
кості і не залежить від інсулінового активування. Глюкозу
метаболізує ензим глюкокіназа, що є обмежувальною лан-
кою у реакції. Утворюється АТФ, що закриває АТФ-чутливі
К+-канали (рис. 19-14). Унаслідок цього зменшений витік
К+ деполяризує клітинну мембрану. Це приводить до від-
кривання потенціалозалежних Са2+-каналів, і Са2+ надхо-
дить у клітину. Збільшення внутрішньоклітинного каль-
цію веде до вивільнення інсуліну шляхом екзоцитозу.
Зв’язок вивільнення інсуліну з рівнем глюкози в плазмі
показаний на рис. 19-13. Маноза також стимулює секрецію
318/РОЗДІЛ 19
Рис. 19-14. Регулювання секреції інсуліну глікемією. Глюкоза
надходить у В-клітини через транспортер глюкози 6ПІТ 2, її
метаболізує глікокіназа, збільшуючи вміст внутрішньоклі-
тинного АТФ. АТФ інгібує АТФ-чутливі К+-канали, зменшуючи
відтікання К+ і деполяризуючи клітину. Це активує потен-
ціалозалежні Са2+-канали, унаслідок чого збільшується над-
ходження Са2+ у клітину, що спричинює вивільнення інсуліну
шляхом екзоцитозу.
інсуліну (табл. 19-6). Таку ж дію має фруктоза, яка внут-
рішньоклітинно перетворюється в глюкозу. Маногептулоза
і 2-дезоксиглюкоза, які оберігають глюкозу від метаболі-
зації, пригнічують секрецію інсуліну.
В експериментальних тварин (рис. 19-15) та людей
вплив глюкози на секрецію інсуліну двофазовий: швидке
Рис. 19-15. Секреція інсуліну з перфузійної підшлункової
залози щура у відповідь на тривале введення глюкози. Наве-
дено середні значення трьох препаратів Верхній запис відо-
бражає концентрацію глюкози у перфузійній суміші (відтво-
рено за дозволом з Сиггу ОЬ, Веппей І_І_, Сгосізку 6М: Оу-
патісз ої іпзиііп зесгеііоп Ьу ІГіе регїиззесі гаї рапсгеаз. Епсіо-
сгіпоіоду 1968;83:572).
Таблиця 19-6. Фактори, що впливають на секрецію інсуліну
Стимулятори Інгібітори
Глюкоза Маноза Амінокислоти (лейцин, аргінін та ін.) Кишкові гормони (ШІП, бЬР-1 [7-36], гастрин, секретин, ХЦК; інші?) р-Кетокислоти Ацетилхолін Глюкагон Циклічний АМФ та різні цАМФ-утворювальні сполуки р-Адренергічні стиму- лятори Теофілін ^Сульфонілсечовини Соматостатин 2-Деокси глюкоза Маногептулоза а-Адренергічні стиму- лятори (норадреналін, адреналін) а-Адренергічні блокатори (анаприлін) Галангін Діазоксид Тіазидні сечогінні Виснаження запасів К+ Дифенін Алоксан Інгібітори мікротрубочок Інсулін
збільшення секреції з наступною повільною пролонгова-
ною відповіддю. Первинна реакція виникає внаслідок
вивільнення утвореного інсуліну у відповідь на збільшення
цитоплазматичного Са2+. Пролонгована реакція є наслідком
вивільнення новосинтезованого інсуліну, аж доки не від-
будеться блокування інгібіторами білкового синтезу. Якщо
перфузія глюкози відновлюється після періоду спокою, то
відповідь на глюкозу збільшується.
Механізми зворотного контролювання глюкози плазми
чи секреції інсуліну мають високу точність, адже рівні глю-
кози й інсуліну змінюються паралельно з високим ступенем
відповідності.
Похідні білків та жирів
Інсулін стимулює входження амінокислот у білки і запо-
бігає катаболізму жирів з утворенням р-кетокислот. Тому
й не дивно, що аргінін, лейцин та деякі інші амінокислоти,
а також Р-кетокислоти та ацетоацетат стимулюють секре-
цію інсуліну. Як і глюкоза, ці сполуки внаслідок обміну
утворюють АТФ, який закриває АТФ-чутливі К+-канали у
В-клітинах. Окрім цього, Ь-аргінін є попередником N0, а
N0 стимулює секрецію інсуліну.
Пероральні гіпоглікемічні засоби
Толбутамід та інші похідні сульфонілсечовини, такі як
ацетогексамід, толазамід, гліпізид та глібурид, є перораль-
ними активними гіпоглікемічними засобами, що знижують
рівень глюкози в крові, підвищуючи секрецію інсуліну.
Вони діють лише в пацієнтів з деяким залишком В-клітин,
неефективні після панкреатектомії чи в разі цукрового
діабету першого типу; зв’язуються з АТФ-інгібованими К+-
каналами в мембранах В-клітин, пригнічують активність
каналів, деполяризуючи мембрану В-клітин і збільшуючи
надходження Са2+, а, отже, і вивільнення інсуліну.
Тривала гіперінсулінемічна гіпоглікемія новонарод-
жених - це рідкісний стан, за якого кількість інсуліну
збільшується, незважаючи на гіпоглікемію. Цей стан спри-
чинений інактивувальною мутацією АТФ-інгібованих К -
ЕНДОКРИННІ ФУНКЦІЇ ПІДШЛУНКОВОЇ ЗАЛОЗИ Й РЕГУЛЮВАННЯ МЕТАБОЛІЗМУ ВУГЛЕВОДІВ / 319
каналів. Лікування полягає у введенні діазоксиду - препа-
рату, що збільшує активність К'-каналів, або, у легших ви-
падках - у субтотальній панкреатектомії.
Бігуанідини, фенформін та метформін є пероральними
гіпоглікемічними засобами, що діють без інсуліну. Фен-
формін спричинив лактат-ацидоз у надто великої кількості
пацієнтів, і внаслідок серйозності цього побічного ефекту
його вилучено з ринку Сполучених Штатів Америки. Мет-
формін також може зумовити лактат-ацидоз, однак такі
випадки становлять лише 5-10% від випадків лактат-аци-
дозу, пов’язаного з фенформіном. Первинна дія мет-
форміну пов’язана зі зменшенням глюконеогенезу, а, отже,
зменшенням печінкового виходу глюкози. Його інколи
поєднують із препаратами сульфонілсечовини у разі ліку-
вання діабету другого типу (див. нижче).
Троглітазон (резулін) та близькі тіазолідиндіони також
використовують для лікування діабету, оскільки вони збіль-
шують інсулінопосередкований периферійний глюкозний
розподіл, зменшуючи в такий спосіб інсулінову резистент-
ність, а також зв’язуються й активують пероксисомний про-
ліфератор-активований рецептор у (РРАКу- від англ. рег-
охізоте ргоІіГегаіог-асйуаІесІ гесеріог у) у ядрі клітин (див.
Розділ 1). Активування цього рецептора, який є членом
надродини гормоночутливих ядерних факторів транс-
крипції (див. Розділ 1), має виняткову здатність нормалі-
зувати численні метаболічні функції.
Циклічний АМФ і секреція інсуліну
Фактори, що збільшують рівні цАМФ у В-клітинах,
посилюють секрецію інсуліну, можливо, шляхом збільшен-
ня внутрішньоклітинного Са2+. Вони містять р-адренер-
гічні агоністи, глюкагон та фосфодіестеразні інгібітори,
такі як теофілін.
Катехоламіни чинять подвійний вплив на секрецію інсу-
ліну: вони блокують її через ос2-адренергічні рецептори та
стимулюють через р-адренергічні рецептори. Сумарним
ефектом впливу адреналіну та норадреналіну є пригнічення
(секреції інсуліну). Однак якщо катехоламіни вводять після
приймання ос-адренергічних блокувальних препаратів, то
сповільнення секреції переходить у її стимулювання.
Вплив автономної нервової системи
Відгалуження правого блукаючого нерва іннервують
підшлункові острівці, а його стимулювання зумовлює
збільшення секреції інсуліну через рецептори М4(див. табл.
4-2). Атропін блокує цю відповідь, а ацетилхолін стимулює
секрецію інсуліну. Ацетилхолін, як і глюкоза, впливає внас-
лідок збільшення цитоплазматичного Са2+, однак ацетил-
холін активує фосфоліпазу С з вивільненням ІФ3, що забез-
печує вихід Са2' з ендоплазматичної сітки.
Стимулювання симпатичних нервів підшлункової зало-
зи пригнічує секрецію інсуліну. Це відбувається шляхом
вивільнення норадреналіну, який діє на а2-адренергічні
рецептори. Та якщо ос-адренергічні рецептори блоковані,
то стимулювання нервів підшлункової залози спричинює
збільшення секреції інсуліну, що зумовлена ^-адренергіч-
ними рецепторами. Поліпептид галанін, знайдений у де-
яких нервах автономної нервової системи, що іннервують
острівці, сповільнює секрецію інсуліну, активуючи К+-ка-
нали, інгібовані АТФ. Отже, автономна іннервація під-
шлункової залози задіяна в регулюванні секреції інсуліну.
Ефекти глюкози не потребують інтактної іннервації, хоч
вони і відбуваються в трансплантованій підшлунковій
залозі; однак є докази, що нервові волокна підтримують
нормальну чутливість острівців до глюкози.
Кишкові гормони
Глюкоза, яку вводять перорально, зумовлює більший
інсуліностимулювальний ефект, ніж уведена внутрішньо-
венно; а амінокислоти, введені перорально, також спри-
чинюють сильнішу інсулінову відповідь, ніж внутрішньо-
венні. Ці спостереження спонукали дослідити можливість
того, що речовини, які секретує слизова оболонка шлун-
ково-кишкового тракту, стимулюють секрецію інсуліну.
Глюкагон, його похідні, секретин, холецистокінін (ХЦК),
гастрин та шлунковий інгібіторний поліпептид (ШІП)
мають таку дію (див. Розділ 26), а ХЦК уможливлює
інсуліно-стимулювальний ефект амінокислот. Однак ШІП-
єдиний з цих пептидів, що спричинює стимулювання, якщо
його вжито в дозах, що роблять рівні ШІП у крові сумір-
ними з рівнями, які створює пероральна глюкоза.
Останнім часом увага звернута на глюкагоноподібний
пептид 1 (7-36) (ОГР-1 [7-36], від англ. £Іиса£оп-1іке
роїурерїісіе 1 (7-36)) як додатковий кишковий фактор, що
стимулює секрецію інсуліну. Цей поліпептид є продуктом
препроглюкагону (див. нижче). У В-клітинах наявні рецеп-
тори ОГР-1 (7-36) і ШІП; ОЬР-1 (7-36) - це сильніший
інсулінотропний гормон, ніж ШІП. Обидва - ШІП та ОЬР-
1 (7-36) - діють, збільшуючи надходження Са2' через
потенціалозалежні Са2+-канали.
Можлива роль підшлункового соматостатину й глюка-
гону в регулюванні секреції інсуліну розглянута нижче.
Вплив виснаження К+
Виснаження пулу йонів калію зменшує секрецію інсу-
ліну, і в пацієнтів за таких станів, наприклад із первинним
гіперальдостеронізмом (див. Розділ 20), розвиваються
зміни кривої діабетичної глюкозної толерантності. За наси-
чення К+ можливе повернення до норми. Тіазидні діуре-
тики, що спричинюють втрату К+ та №+ із сечею (див.
Розділ 38), знижують толерантність до глюкози і погір-
шують перебіг діабету. Вони виявлять таку дію, найперше,
внаслідок ефектів виснаження К+, хоча деякі з них також
зумовлюють ушкодження клітин острівців.
Довготривалі зміни у відповіді В-клітин
Інсулінова відповідь на конкретний стимул частково ви-
значена секреторною історією В-клітин. Особи, що спожи-
вали їжу з високим вмістом вуглеводів протягом кількох
тижнів, не лише мають вищі рівні інсуліну в плазмі (натще),
а й виявляють на введення глюкози більш секреторну від-
повідь, ніж особи, що споживали ізокалорійну їжу з низь-
ким вмістом вуглеводів.
Хоча В-клітини відповідають на стимулювання гіпер-
трофією, як і інші ендокринні клітини, вони виснажуються
й припиняють секрецію (виснаження В-клітин), коли сти-
мулювання є сильним чи тривалим. Підшлунковий резерв
великий, тому досить важко спричинити виснаження в
нормальних тварин; однак якщо підшлунковий резерв
зменшується частковою панкреатектомією чи малими
320/РОЗДІЛ 19
дозами алоксану, то виснаження В-клітин, що залишились,
може бути зумовлене будь-яким процесом, що хронічно
підвищує рівень глюкози в плазмі. Це є причиною діабету,
що виникає у тварин з обмеженими підшлунковими запа-
сами у разі дії екстрактів передньої частки гіпофізу, гор-
мону росту, тиреоїдних гормонів чи тривалого введення
самої глюкози. Спричинені гормонами діабети у тварин є
спочатку зворотними, проте в разі тривалої дії стають по-
стійними. їх, зазвичай, називають за агентом, який їх
утворює, наприклад, гіпофізарний діабет, тиреоїдний діа-
бет. Довготривалі діабети, що зберігаються після дії препа-
ратів, позначають префіксом мета-, наприклад, метагіпо-
фізарний діабет чи метатиреоїдний діабет. Якщо ж інсулін
вживали разом з діабетогенними гормонами, то В-клітини
є захищеними, можливо, внаслідок зниження рівня глюкози
в плазмі, і тому діабет не розвивається.
Цікаво, що в разі контролювання резерву В-клі^ин мо-
жуть бути задіяні генетичні фактори. У мишей нокаутом
гена ІК.8-1 (див. вище) є сильна компенсаторна відповідь
клітин В. Проте у випадку нокауту гена ІВ.8-2 компенсація
зменшена, і утворюється серйозніший діабетичний фено-
тип.
ГЛЮКАГОН
Хімія
Глюкагон у людей - лінійний поліпептид із молекуляр-
ною масою 3485 - утворюють А-клітини підшлункових
острівців та верхній відділ шлунково-кишкового тракту.
Він містить 29 амінокислотних залишків (див. табл. 26-2).
Глюкагони усіх ссавців мають однакову структуру. Людсь-
кий препроглюкагон (рис. 19-16) є 179-амінокислотним
поліпептидом, знайденим в А-клітинах, Ь-клітинах у ниж-
ньому відділі шлунково-кишкового тракту та в мозку. Це
продукт однієї мРНК, яка, проте, по-різному оброблена в
різних тканинах. В А-клітинах вона спершу перетворю-
ється в глюкагон та головний проглюкагоновий фраг-
мент (МРСЕ - від англ. та)ог рго£Іиса£оп Гга^тепі), а в
Ь-клітинах - у гліцентин (поліпептид, що складається з
глюкагону, видовженого завдяки додатковим амінокислот-
ним залишкам на кожному кінці), та глюкагоноподібні
пептиди 1 і 2 (СЬР-1 і СЬР-2 - від англ. £Іиса£Оп-1іке
роїурерйдез 1, 2). Утворюється також деяка кількість ок-
синтомодуліну, а в А- та Ь-клітинах - гліцентинозв’яза-
ний поліпептид (СКРР - £Іісепйп-ге1аіес1 роїурерйбе). Глі-
центин має деяку глюкагонну активність. Пептиди СЬР-1
і СЬР-2 самі по собі не мають визначеної біологічної актив-
ності. Незважаючи на це, СЬР-1 (7-36) є сильним сти-
мулятором секреції інсуліну, що також збільшує утилізацію
глюкози (див. вище). Крім того, СЬР-1 та СЬР-2 також
утворюються в мозку, однак їхні функції в центральній
нервовій системі не з’ясовані. Оксинтомодулін гальмує
секрецію шлункового соку, проте його фізіологічна роль
невідома, а СКРР не має визначених фізіологічних ефектів.
Дія
Глюкагон є глікогенолітичним, глюконеогенним, ліпо-
літичним та кетогенним фактором. Він діє на серпентино-
ві рецептори з молекулярною масою близько 190 000, а в
печінці - через С8 для активування аденілатциклази та
збільшення внутрішньоклітинного цАМФ. Це через про-
теїнкіназу А веде до активування фосфорилази, а отже, до
збільшення розпаду глікогену та підвищення рівня глюкози
в плазмі. Етапи, задіяні в цьому класичному прикладі посе-
редництва цАМФ щодо прояву дії гормону, розглянуто в
Розділі 17. Однак глюкагон діє на інші рецептори, розта-
шовані на тих самих гепатоцитах, для активування фосфо-
ліпази С, а завдяки збільшеному цитоплазматичному Са2+
також стимулює глікогеноліз. Протеїнкіназа А знижує ме-
таболізм глюкозо-6-фосфату (рис. 19-17), зменшуючи пере-
Глікоген
Глюкагон
Глюкозо-6-фосфат * * Глюкоза
8 6КРР Глюкагон СЬР-1 СЬР-2
цАМФ
Фруктозо-6-фосфат
|----Гліцентин----11------ МРСР
А-клітини Ь-клітини
Глюкагон Гліцетин
МРСР СЬР-1
СРРР СЬР-2
| І _____Фруктозо-
I 2,6-дифосфат
Фруктозо-1,6-дифосфат
Протеїн-
кіназа А
Оксинтомодулін
СРРР
Рис. 19-16. Посттрансляційна обробка препроглюкагону в А-
і Ь-клітинах; 8 - сигнальний пептид, МРОР - головний про-
глюкагоновий фрагмент; Оху - оксинтомодулін; СВРР - глі-
центинозв’язаний поліпептид; СЬР - глюкагоноподібний пеп-
тид (модифіковано з Огискег 03: СІисадоп апсі діисадоп-ііке
реріісіез. Рапсгеаз 1990;5:484).
Фосфоенолпіруват
Піруват
Рис. 19-17. Механізми, якими глюкагон збільшує вихід глюкози
з печінки. Суцільні лінії показують стимулювання, а штрихові
- пригнічення.
ЕНДОКРИННІ ФУНКЦІЇ ПІДШЛУНКОВОЇ ЗАЛОЗИ Й РЕГУЛЮВАННЯ МЕТАБОЛІЗМУ ВУГЛЕВОДІВ / 321
творення фосфоенолпірувату в піруват, і зменшує концент-
рацію фруктозо-2,6-дифосфату, а це, відповідно, запобігає
перетворенню фруктозо-6-фосфату у фруктозо-1,6-дифос-
фат. Як наслідок, накопичення глюкозо-6-фосфату веде
до збільшеного вивільнення глюкози.
Глюкагон не спричинює глікогенолізу у м’язах, однак
збільшує глюконеогенез із наявних амінокислот у печінці
та підвищує рівень метаболізму. Він збільшує утворення
кетонових тіл шляхом зменшення рівнів малоніл-КоА у
печінці (див. Розділ 17). Його ліполітична активність, яка
веде до збільшення кетогенезу, розглянута в Розділі 17.
Калоригенна дія глюкагону сама по собі є наслідком не
гіперглікемії, а, ймовірно, збільшеного печінкового деамі-
нування амінокислот.
Великі дози екзогенного глюкагону зумовлюють пози-
тивний інотропний ефект у серці (див. Розділ 29) без фор-
мування підвищеної серцевої збудливості, очевидно, внас-
лідок збільшення серцевого цАМФ. Цей гормон викорис-
товували для лікування серцевих хвороб, однак немає дока-
зів фізіологічної ролі глюкагону в регулюванні функцій сер-
ця. Глюкагон також стимулює секрецію гормону росту,
інсуліну та підшлункового соматостатину.
Метаболізм
У кров’яному руслі глюкагон має період півжиття 5-
10 хв. Його руйнують багато тканин, особливо печінка.
Оскільки ж глюкагон секретується в портальну вену і дося-
гає печінки, перш ніж периферійного кровообігу, то його
вміст у периферійній крові порівняно низький. Підвищення
рівня периферійного глюкагону в крові, спричинене збуд-
жувальними подразниками (див. нижче), є анормально
великим у пацієнтів із цирозом, імовірно, внаслідок змен-
шення печінкової деградації гормону.
Регулювання секреції
Головні чинники, що впливають на секрецію глюкагону,
наведені в табл. 19-7. Секреція збільшується в разі гіпоглі-
кемії і зменшується з підвищенням рівня глюкози в плазмі.
Зокрема, В-клітини містять ГАМК; є також докази, що
одночасно зі збільшенням секреції інсуліну, створеної
гіперглікемією, вивільняється ГАМК, діючи на А-клітини
через рецептори ГАМКа з пригніченням секреції глюкаго-
ну. Рецептори ГАМКД - це канали СГ, а надходження СГ
гіперполяризує А-клітини.
Таблиця 19-7. Фактори, що впливають на секрецію глюкагону
Стимулятори Інгібітори
Амінокислоти (зокрема, глюкогенні амінокислоти: аланін, серин, гліцин, цистеїн та треонін) ХЦК, гастрин Кортизон Фізичне навантаження Інфекції Інші стреси р-Адренергічні подразники Теофілін Ацетилхолін Теофілін Ацетилхолін Глюкоза Соматостатин ВЖК Кетонові тіла Інсулін Дифенін а-Адренергічні подразники ГАМК
Секрецію також збільшує подразнення симпатичних
нервів підшлункової залози; цей симпатичний ефект
зумовлений р-адренергічними рецепторами і цАМФ.
Вірогідно, що А-клітини подібні до В-клітин, оскільки
подразнення р-адренергічних рецепторів збільшує сек-
рецію, а стимулювання «-адренергічних рецепторів її
зменшує (див. вище). Проте відповіддю підшлункової
залози на симпатичне подразнення, якщо нема блокуваль-
них препаратів, є підсилення секреції глюкагону. Отже,
ефект р-рецепторів переважає в глюкагоносекретувальних
клітинах. Спонукальні ефекти різних стресів і, можливо,
фізичних навантажень та інфекцій опосередковані, при-
наймні частково, симпатичною нервовою системою. По-
дразнення блукаючого нерва також збільшує секрецію
глюкагону.
Білкова їжа й уведення різних амінокислот збільшують
секрецію глюкагону. Вірогідно, що глюкогенні амінокис-
лоти особливо сильні щодо цього, адже під дією глюкагону
вони у печінці перетворюються в глюкозу. Збільшення сек-
реції глюкагону, що відбувається в разі споживання білкової
їжі, також є цінним, оскільки амінокислоти стимулюють
секрецію інсуліну, а секретований глюкагон запобігає роз-
виткові гіпоглікемії, тоді як інсулін сприяє запасанню спо-
житих вуглеводів, жирів та ліпідів. Секреція глюкагону
збільшується під час голодування. Вона досягає максимуму
на третій день посту під час максимального глюконео-
генезу. Після цього, якщо жирні кислоти та кетонові тіла
стають головним джерелом енергії, рівень глюкагону в
плазмі зменшується.
Під час фізичного навантаження простежується збіль-
шення утилізації глюкози (див. нижче), яке збалансовує
збільшене утворення глюкози, зумовлене підвищенням рів-
ня глюкагону в кровообігу.
Глюкагонова відповідь на пероральне введення аміно-
кислот більша, ніж відповідь у разі внутрішньовенного
уведення амінокислот. Це наводить на думку, що глюкаго-
ностимулювальний фактор секретований кишковим епі-
телієм. ХЦК та гастрин збільшують секрецію глюкагону,
тоді як секретин її пригнічує. Оскільки секреції і ХЦК, і
гастрину збільшуються після білкової їжі, то будь-який з
гормонів може бути шлунково-кишковим трансмітером
глюкагонової відповіді. Пригнічення внаслідок впливу
соматотропіну, розглянуто нижче.
Секрецію глюкагону також знижують ВЖК і кетонові
тіла. Проте це зниження може бути знівельоване, оскільки
рівні глюкагону в плазмі у разі діабетичного кетоацидозу
високі.
Молярні співвідношення інсулін-глюкагон
Як зазначено вище, інсулін виявляє глікогенну, анти-
глюконеогенну, антиліполітичну та антикетонічну дії. От-
же, він сприяє запасанню поглинутих поживних речовин і
є гормоном енергетичних запасів. Глюкагон, з іншого боку,
є глікогенолітичним, глюконеогенним, ліполітичним та
кетогенним гормоном. Він мобілізує запаси енергії і є гор-
моном вивільнення енергії. З огляду на їхні протилежні
ефекти у кожній ситуації треба розглядати рівні обох гор-
монів у крові. Зручно аналізувати молярні співвідношення
цих гормонів. Молярне співвідношення інсулін-глюкагон
можна легко визначити для кожного зразка крові на підставі
22 367-2
322/РОЗДІЛ 19
рівнів гормонів у крові, визначених радіоімунологічним
аналізом, та їхніх молекулярних мас.
Молярні співвідношення інсулін-глюкагон помітно змі-
нюються, оскільки секреція і глюкагону, і інсуліну залежить
від умов, що передують застосуванню будь-якого подраз-
ника (табл. 19-8). Наприклад, молярне співвідношення
інсулін-глюкагон у разі збалансованого харчування ста-
новить близько 2,3. Уведення аргініну збільшує секрецію
обох гормонів і підвищує співвідношення до 3,0. Після три-
денного посту співвідношення знижується до 0,4, а вве-
дення аргініну в цьому стані знижує його до 0,3. Навпаки,
це значення дорівнює 25 в осіб, яким постійно вводять
глюкозу, і підвищується до 170 у разі споживання білкової
їжі та введення глюкози. Підвищення відбувається через
різке збільшення секреції інсуліну, тоді як звичайна глю-
кагонова відповідь на білкову їжу нівельована. Отже, якщо
під час голодування потрібна енергія, то молярне співвід-
ношення інсулін-глюкагон є низьким, що сприяє розпаду
глікогену і глюконеогенезу; і навпаки, якщо потреба в
мобілізації енергії низька, то співвідношення високе, що
сприяє відкладам глікогену, білка та жиру.
ІНШІ ГОРМОНИ ОСТРІВЦІВ
Окрім інсуліну та глюкагону, острівці підшлункової
залози секретують у кров соматостатин та панкреатичний
поліпептид. Соматостатин також може бути задіяним у
регуляторних процесах усередині острівців, що відпові-
дають за вивільнення гормонів на різні подразники.
Соматостатин
Соматостатин та його рецептори описані в Розділі 4.
Соматостатин 14 (СС 14) та його видовжена з амінокінця
форма - соматостатин 28 (СС 28) - виявлені в И-клітинах
острівців підшлункової залози. Обидві форми знижують
секрецію інсуліну, глюкагону та панкреатичного поліпеп-
тиду і можуть діяти локально всередині острівців за пара-
кринним зразком. Соматостатин 28 активніший, ніж СС
14 у стимулюванні секреції інсуліну; він, імовірно, діє через
Таблиця 19-8. Молярне співвідношення інсулін-глюкагон
(І/Г) у крові за різних станів1
Стан Печінкове запасання (3) чи утворення (У) глюкози2 І/Г
Наявність глюкози Велика кількість вугле- водної їжі 4+ (3) 70
Внутрішньовенна глюкоза 2+ (3) 25
Мала кількість їжі 1+(3) 7
Потреба глюкози Голодування протягом ночі 1+(У) 2,3
Харчування з низьким 2+ (У) 1,8
вмістом вуглеводів Голодування 4+ (У) 0,4
1 3 дозволу КН ІІпдег.
2 Числа від 1+ до 4+ позначають відносну силу.
рецептор 88ТК 5 (див. Розділ 4). У пацієнтів з соматоста-
тиносекретувальними пухлинами підшлункової залози роз-
вивається гіперглікемія та інші прояви діабету, що зника-
ють з видаленням пухлини. В них також виникає диспепсія,
внаслідок повільного випорожнення шлунка й зниження
секреції шлункового соку, а також з’являються жовчні ка-
мені, які викристалізовуються у разі зменшеного скоро-
чення жовчного міхура внаслідок уповільнення секреції
ХЦК. Секреція підшлунковою залозою соматостатину
збільшується в разі дії деяких факторів, що підвищують
секрецію інсуліну, наприклад глюкози, амінокислот, зокре-
ма аргініну та лейцину. Її також стимулює дія ХЦК. Сома-
тостатин вивільняється з підшлункової залози та шлунково-
кишкового тракту в периферійну кров.
Панкреатичний поліпептид
Панкреатичний поліпептид людини - це лінійний полі-
пептид, що містить 36 амінокислотних залишків, його
утворюють Р-клітини острівців. Він дуже близький до двох
інших 36-амінокислотних поліпептидів: поліпептиду ¥¥
(Р¥¥, від англ. роїуреііде ¥¥), що знайдений у кишці і
може бути шлунково-кишковим гормоном, та нейропеп-
тиду ¥, виявленого в головному мозку й автономній нер-
вовій системі (див. Розділ 4). Усі вони закінчуються тиро-
зином і є амідованими на карбоксильному кінці. Панкреа-
тичний поліпептид можна визначити радіоімунологічним
аналізом периферійної крові. Хоч частково, його секреція
перебуває під холінергічним контролем; і рівень у плазмі
знижується після введення атропіну. Крім того, його сек-
реція збільшується в разі вживання їжі, що містить білок,
та під час посту, фізичного навантаження та гострої гіпо-
глікемії. Секреція зменшується під дією соматостатину та
внутрішньовенної глюкози. Введення лейцину, аргініну та
аланіну на неї не впливають, отже, стимуляторний ефект
білкової їжі може бути опосередкованим. Панкреатичний
поліпептид сповільнює абсорбцію їжі в людей, може зглад-
жувати різкі коливання абсорбції. Проте його точна фізіо-
логічна функція досі остаточно не з’ясована.
Організація підшлункових острівців
Наявність у панкреатичних острівцях гормонів, що
впливають на секрецію інших гормонів острівців, свідчить
про те, що острівці діють як секреторні одиниці в регулю-
ванні гомеостазу харчування. Соматостатин гальмує секре-
Рис. 19-18. Вплив гормонів клітин острівців на секрецію інших
гормонів клітин острівців. Суцільні стрілки позначають стиму-
лювання; штрихові - гальмування.
ЕНДОКРИННІ ФУНКЦІЇ ПІДШЛУНКОВОЇ ЗАЛОЗИ Й РЕГУЛЮВАННЯ МЕТАБОЛІЗМУ ВУГЛЕВОДІВ / 323
цію інсуліну, глюкагону та панкреатичного поліпептиду
(рис. 19-18); інсулін сповільнює секрецію глюкагону; глю-
кагон стимулює секрецію інсуліну та соматостатину. Як
зазначено вище, А- і О-клітини та панкреатичний поліпеп-
тид - це секретувальні клітини, що звичайно розташовані
по периферії острівців, а В-клітини містяться у їхньому
центрі. Є два чіткі типи острівців: підшлункові острівці,
бідні й багаті на глюкагон, однак функційне значення цього
розподілу невідоме. Гормони клітин острівців, вивільнені
в ПКР, дифундують до інших клітин острівців і впливають
на їхні функції (паракринний зв’язок; див. Розділ 1).
Доведено, що є щілинні контакти між клітинами А, В та
□, які уможливлюють перехід йонів та інших малих моле-
кул з одних клітин до інших, що може координувати їхні
секреторні функції.
ВПЛИВ ІНШИХ ГОРМОНІВ ТА ФІЗИЧНИХ
НАВАНТАЖЕНЬ НА МЕТАБОЛІЗМ
ВУГЛЕВОДІВ
Фізичні навантаження безпосередньо впливають на
метаболізм вуглеводів. Багато гормонів, окрім інсуліну,
ІФР-І, ІФР-ІІ, глюкагону та соматостатину, також відігра-
ють важливу роль у регулюванні процесів метаболізму
вуглеводів. До них належать адреналін, тиреоїдні гор-
мони, глюкокортикоїди та гормон росту. Інші функції цих
гормонів розглянуто в інших розділах, тут лише підсумо-
вано їхній вплив на метаболізм вуглеводів. Місце дії цих
гормонів на окремі ланки обміну речовин описано в Роз-
ділі 17.
Фізичні навантаження
Надходження глюкози в скелетні м’язи збільшується
під час фізичних навантажень без інсуліну, що зумовлено
інсулінонезалежним збільшенням кількості транспортерів
6ЬПТ 4 у мембранах м’язових клітин (див. вище). Це збіль-
шення чутливості простежується протягом кількох годин
після навантажень, і регулярні тренування дають змогу
виробити тривале збільшення чутливості до інсуліну.
Фізичні навантаження можуть прискорювати гіпоглікемію
в діабетиків не лише внаслідок збільшеного поглинання
глюкози в м’язах, а й тому, що поглинання введеного інсу-
ліну швидше у разі навантажень. Пацієнти з діабетом по-
винні споживати додаткові калорії або зменшити дозу інсу-
ліну у випадку фізичних навантажень.
Катехоламіни
Активування фосфорилази в печінці за допомогою кате-
холамінів розглянуто в Розділах 17 і 20. Цей процес від-
бувається через р-адренергічні рецептори, які збільшують
внутрішньоклітинний цАМФ, та «-адренергічні рецепто-
ри, які збільшують внутрішньоклітинний Са2+. Печінковий
вихід глюкози збільшується, створюючи гіперглікемію. В
м’язах фосфорилаза також активована через цАМФ і, мож-
ливо, через Са2+, однак сформований глюкозо-6-фосфат
може катаболізуватись лише до пірувату, оскільки нема
глюкозо-6-фосфатази. З причин, які остаточно нез’ясовані,
великі кількості пірувату перетворюються в лактат, який
дифундує з м’язів у кров’яне русло (рис. 19-19). Лактат
Час після введення адреналіну, год
Рис. 19-19. Вплив адреналіну на тканинний глікоген, глюкозу
плазми та рівні лактату у крові годованих щурів (відтворено
за дозволом з КисК ТС, Район НО [ебііогз]: РИузіоІоду апсі
Віорґіузісз, 20іґі есі. УоІ. 3. Заипсіегз, 1973).
окиснюється в печінці до пірувату і перетворюється в гліко-
ген. Отже, відповіддю на введення адреналіну є початковий
глікогеноліз, що супроводжується підвищенням печінко-
вого вмісту глюкози. Окиснення лактату може відповідати
за калоригенний ефект адреналіну (див. Розділ 20). Адре-
налін та норадреналін також вивільняють ВЖК в кров’яне
русло, а адреналін знижує периферійну утилізацію глю-
кози.
Надниркові медулярні пухлини (феохромоцитоми), що
секретують адреналін, спричинюють гіперглікемію, глю-
козурію та підвищення рівня метаболізму. Проте гіперглі-
кемічна дія адреналіну є загалом надто короткотривалою,
щоб спричинити постійний діабет, і метаболічні аномалії
зникають після видалення пухлин.
Тиреоїдні гормони
Тиреоїдні гормони погіршують експериментальний діа-
бет: тиротоксикоз загострює клінічний діабет; а метати-
реоїдний діабет можна зумовити у тварин зі зменшеним
резервом підшлункової залози. Головним діабетогенним
ефектом тиреоїдних гормонів є збільшене поглинання глю-
кози з кишки, однак вони також спричинюють (можливо,
шляхом підсилення дії катехоламінів) певний ступінь
виснаження глікогену печінки. Гепатоцити із глікогеновим
виснаженням легко ушкоджуються. Якщо печінка пошкод-
жена, то крива толерантності до глюкози набуває діабетич-
ного вигляду, оскільки печінка поглинає менше абсорбо-
ваної глюкози. Тиреоїдні гормони також можуть приско-
рювати розпад інсуліну. Усі ці дії мають гіперглікемічний
ефект і, якщо резерви підшлункової залози низькі, можуть
призвести до виснаження В-клітин.
Надниркові глюкокортикоїди
Глюкокортикоїди з кори наднирників (див. Розділ 20)
підвищують рівень глюкози в крові і зумовлюють діабе-
тичний тип кривої толерантності до глюкози. В людей така
дія може виявлятись лише в осіб з генетичною схильністю
до діабету. Толерантність до глюкози зменшена у 80% лю-
дей з синдромом Кушінґа (див. Розділ 20); 20% з них мають
явний діабет. Глюкокортикоїди потрібні для глюконеоген-
324/РОЗДІЛ 19
ної дії глюкагону під час голодування. Вони є глюконео-
генними самі по собі, однак їхня роль головно факульта-
тивна. У разі наднирникової недостатності рівень глюкози
в крові є в межах норми під час споживання їжі, однак
голодування спричинює гіпоглікемію і колапс. Глюкозозни-
жувальна дія інсуліну значно підсилена в пацієнтів з над-
нирниковою недостатністю. У тварин з експерименталь-
ним діабетом адреналектомія помітно поліпшує діабет.
Складні дії глюкокортикоїдів, що впливають на мета-
болізм вуглеводів, підсумовані в табл. 19-9. Головними діа-
бетогенними ефектами є підвищення катаболізму білків зі
збільшенням глюконеогенезу в печінці; збільшення печін-
кового глікогенезу та кетогенезу; зменшення периферійної
утилізації глюкози щодо рівня інсуліну в крові, що може
бути наслідком сповільненого фосфорилювання глюкози
(див. нижче).
Гормон росту
Гормон росту людини погіршує клінічний діабет, а 25%
пацієнтів з пухлинами передньої частки гіпофіза, що сек-
рету ють гормон росту, мають діабет. Гіпофізектомія поліп-
шує діабет і збільшує чутливість до інсуліну навіть більше,
ніж адреналектомія, тоді як дія гормону росту зменшує
здатність реагувати на інсулін.
Крім того, гормон росту мобілізує ВЖК з жирової тка-
нини, сприяючи кетогенезу; зменшує поглинання глюкози
в деяких тканинах (антиінсулінова дія); збільшує печінко-
вий вихід глюкози і може зменшувати тканинне зв’язування
інсуліну. Зроблено припущення, що кетонемія і зменшена
толерантність до глюкози, утворені під час голодування, є
наслідком гіперсекреції гормону росту. Цей гормон прямо
не стимулює секреції інсуліну, однак гіперглікемія, яку він
спричинює, вторинно стимулює підшлункову залозу і
врешті-решт може виснажити В-клітини.
Таблиця 19-9. Дії глюкокортикоїдів, що впливають на
метаболізм вуглеводів
1. Збільшення катаболізму білка на периферії, що веде
до збільшення концентрації амінокислот у плазмі
2. Збільшення печінкового поглинання (“вловлювання”)
амінокислот
3. Збільшення дезамінування й трансамінування
амінокислот
4. Збільшення печінкового перетворення оксалоацетату
у фосфопіруват
5. Збільшення активності печінкової фруктозодифос-
фатази, що сприяє дефосфорилюванню фруктозо-
1,6- дифосфату
6. Збільшення активності печінкової глюкозо-6-фос-
фатази, що вивільняє більше глюкози в кров
7. Зменшення периферійної утилізації глюкози та
утилізації в печінці, можливо, внаслідок зниження
фосфорилювання
8. Збільшення рівнів лактату і пірувату в крові
9. Зменшення печінкового ліпогенезу
10. Збільшення рівня ВЖК у плазмі й утворення
кетонових тіл (коли панкреатичний резерв низький)
11. Збільшення утворення активної форми глікоген
синтази
Є докази, що гормон росту зменшує кількість інсуліно-
вих рецепторів, а глюкокортикоїди зменшують їхню спо-
рідненість (до інсуліну). Однак зменшення утилізації
глюкози, спричинене цими гормонами, є більше наслідком
пригнічення фосфорилювання глюкози, ніж зменшення
надходження глюкози в клітини. Вхід у клітини - це обме-
жувальний у швидкості етап метаболізму глюкози, однак
якщо є достатня кількість інсуліну, то зменшення фосфо-
рилювання може зменшити утилізацію.
ГІПОГЛІКЕМІЯ ТА ЦУКРОВИЙ ДІАБЕТ У
ЛЮДИНИ
Гіпоглікемія
Інсулінові реакції звичні в разі діабету першого типу,
тоді як рідкісні гіпоглікемічні випадки є ознакою хорошого
діабетичного контролю в більшості хворих на діабет. Під
час фізичних навантажень збільшується поглинання глю-
кози скелетними м’язами та поглинання введеного інсуліну
(див. вище). Діабетики, що приймають інсулін, повинні
вміти передбачити цей ефект за допомогою зміни кількості
їжі чи дози інсуліну в разі фізичних навантажень.
Симптоматична гіпоглікемія також трапляється в осіб-
недіабетиків. Огляд деяких найважливіших випадків дає
підстави акцентувати увагу на змінах, які відбуваються з
глюкозою крові. Хронічна помірна гіпоглікемія спричинює
неузгоджену й нерозбірливу мову, цей стан можна сприй-
няти за сп’яніння. Можуть виникнути також розумові від-
хилення та конвульсії без коми. Якщо в разі інсуліноми,
рідкісної інсуліносекретувальної пухлини підшлункової
залози, рівень секреції інсуліну хронічно підвищений, то
симптоми найбільше виявляються зранку. Це відбувається
тому, що нічне голодування виснажує печінкові запаси глі-
когену. Проте симптоми можуть виявлятись у будь-який
час, і таким пацієнтам інколи ставлять неправильний діаг-
ноз. Деякі випадки інсуліноми помилково визначали як
епілепсію чи психоз. Гіпоглікемія також трапляється в паці-
єнтів з великими злоякісними пухлинами, що не містять
панкреатичних острівців, у таких випадках гіпоглікемія є
частково наслідком надмірної секреції ІФР-П.
Як зазначено вище, вегетативні розлади, що створюють
тремор, потіння, занепокоєння та голод, частіше виникають
за вищого рівня глюкози в плазмі, на відміну від когнітив-
них, і є попередженням для введення цукрів. Однак у
деяких осіб ці попереджувальні ознаки не передують симп-
томам церебральних розладів, тому безсимптомна гіпо-
глікемія потенційно небезпечна. Цей стан найчастіше
буває у пацієнтів з інсуліномами та діабетом, які проходять
інтенсивну інсулінову терапію. Отже, приступи гіпогліке-
мії, які повторюються, зрештою і спричинюють розвиток
безсимптомної гіпоглікемії. Якщо цукор у крові знову на
якийсь час підвищується, то попереджувальні ознаки по-
вторно з’являються за вищого рівня глюкози в плазмі, ніж
когнітивні розлади та кома. Причини того, чому тривала
гіпоглікемія зумовлює втрату попереджувальних ознак,
остаточно не з’ясовані.
У випадку хвороб печінки крива толерантності до глю-
кози набуває діабетичного вигляду, однак рівень глюкози
в плазмі під час голодування низький (рис. 19-20). У разі
ЕНДОКРИННІ ФУНКЦІЇ-ПІДШЛУНКОВОЇ ЗАЛОЗИ Й РЕГУЛЮВАННЯ МЕТАБОЛІЗМУ ВУГЛЕВОДІВ / 325
• • Нормальний рівень
Надто швидка
абсорбція вуглеводів
25-
1 2 3 4
0
Час, год
Рис. 19-20. Типові криві толерантності до глюкози після перо-
рального введення глюкози у разі захворювання печінки та
за станів, що спричиняють надто швидку абсорбцію глюкози
з кишок. Горизонтальна лінія - це приблизний рівень глюкози
в плазмі, за якого можуть виявлятися гіпоглікемічні симптоми.
функціональної гіпоглікемії підвищення глюкози в плаз-
мі після тестової дози глюкози нормальне, однак наступне
“перерегульоване” зниження переходить через гіпогліке-
мічний рівень, виявляючи симптоми через 3-4 год після
їжі. Ця модель інколи простежується в людей, у яких згодом
розвинеться діабет. Пацієнтів з цим синдромом потрібно
відрізняти від численніших пацієнтів з подібними симп-
томами внаслідок психічних чи інших проблем, у яких не
виявляється гіпоглікемії під час аналізу крові в разі симп-
томатичного випадку. Зроблено припущення, що зміна
рівня глюкози в плазмі є наслідком секреції інсуліну, сти-
мульованої імпульсами в правому блукаючому нерві, однак
холінергічні блокуючі агенти не виправляють цю аномалію
як треба.
У деяких пацієнтів з тиреотоксикозом, а також у паці-
єнтів після гастректомій та інших операцій, що приско-
рюють проходження їжі в кишку, абсорбція глюкози ано-
мально висока. Кількість глюкози у плазмі збільшується у
вигляді високого раннього піка, а потім швидко знижується
до гіпоглікемічних рівнів унаслідок того, що гіпергліке-
мічна хвиля збуджує вище від нормального зростання сек-
реції інсуліну. Характерні симптоми виявляються через
2 год після їжі.
Діти, народжені матерями, що хворіють на діабет, часто
мають високу масу та великі органи (макросомія). Цей
стан спричинений надлишком інсуліну, що циркулює в
плоді, який, відповідно, частково зумовлений стимулюван-
ням підшлункової залози плоду глюкозою та амінокисло-
тами з крові матері. Вільний інсулін у материнській крові
руйнують протеази плаценти, однак інсулін, зв’язаний з
антитілами, захищений, і саме він досягає плоду. Тому мак-
росомія плоду трапляється в жінок, які виробляють анти-
тіла до різних тваринних інсулінів і продовжують прий-
мати тваринний інсулін під час вагітності.
Новонароджені з нестачею СЬІІТ 1 мають порушення
транспортування глюкози через гематоцеребральний
бар’єр. У них мало глюкози в спинномозковій рідині за
нормальної кількості глюкози в плазмі, і тому виникають
приступи та затримка розвитку.
Цукровий діабет
Цукровий діабет поширений у людей, хоч трапляється
і в тварин. Підраховано, що 5-7% населення Сполучених
Штатів вражено цією хворобою. Діабет інколи ускладне-
ний ацидозом та комою, і в разі тривалого діабету вини-
кають додаткові ускладнення, зокрема мікросудин, макро-
судин та неврологічні захворювання. До мікросудинних
ушкоджень належать проліферативне рубцювання сітківки
(діабетична ретинопатія) та хвороба нирок (діабетична
нефропатія). Макросудинні ушкодження спричинені
прискореним атеросклерозом, який є вторинним після
збільшення рівня ЛПНЩ у плазмі (див. вище). Це приз-
водить до збільшення кількості інсультів та інфарктів міо-
карда. Неврологічна патологія (діабетична нейропатія)
вражає автономну нервову систему та периферійні нерви.
Нейропатія разом з недостатністю кровообігу атероскле-
ротичного генезу в крайніх випадках та у разі зниженої
опірності інфекціям приводить до утворення хронічних
виразок та гангрени, зокрема на ногах. Ретинопатія вини-
кає через надмірний ріст кровоносних судин, і цю неоваску-
ляризацію підсилює гормон росту.
Кінцевою причиною капілярних та неврологічних
ускладнень є хронічна гіперглікемія. Суворе контролю-
вання діабету дає змогу зменшити частоту цих захворю-
вань. Внутрішньоклітинна гіперглікемія активує ензим
альдозоредуктазу. Це збільшує утворення сорбіту в клі-
тинах, що веде до зменшення №-К-АТФ-ази. Крім того,
внутрішньоклітинна глюкоза може бути перетворена в так
звані продукти Амадорі, що зумовить підвищене гліко-
зид ювання кінцевих продуктів (АСЕ§ - від. англ. аб-
уапсесі £Іусо8у1абоп епб ргосіисіз), зі зшиванням білків
матриксу. Цей процес ушкоджує кровоносні судини; АСЕз
також заважає лейкоцитарній відповіді на інфекцію.
Типи діабетів
Причиною клінічного діабету завжди є нестача дії інсу-
ліну на тканинному рівні, однак цей недолік інколи від-
носний. Одна з поширених форм - перший тип, або інсу-
лінозалежний цукровий діабет (ІЗЦД) - є наслідком не-
стачі інсуліну, зумовленої автоімунним руйнуванням В-
клітин у панкреатичних острівцях; А-, Б- та Р-клітини не
ушкоджені. Іншу поширену форму - другий тип, або ін-
сулінонезалежний цукровий діабет (ІНЗЦД), - харак-
теризує інсулінова резистентність та недостатня секре-
ція інсуліну. Невідомо, який з них настає першим, проте
можна уявити ситуацію, коли інсулінова резистентність
підвищує рівень глюкози в плазмі, що веде до стимулю-
вання секреції інсуліну, аж доки не вичерпуються запаси
В-клітин. У такій ситуації рівень інсуліну в плазмі є
частіше підвищеним, ніж зниженим, однак він не є таким
високим, яким би міг бути у разі такого ж рівня глюкози в
плазмі за нормальних умов.
Міжнародна комісія рекомендувала назви перший тип і
другий тип (замість ІЗЦД та ІНЗЦД) для двох поширених
типів діабету. Кожна з термінологій має свої переваги,
зокрема, терміни ІЗЦД та ІНЗЦД надають патофізіологічну
інформацію. Однак терміни перший тип і другий тип вико-
326/РОЗДІЛ 19
ристано в цій книзі для узгодження з сучасною міжнарод-
ною номенклатурою.
Трапляються випадки діабету внаслідок інших хвороб
чи станів, таких як хронічний панкреатит,.повна панкреа-
тектомія, синдром Кушінґа (див. Розділ 20) та акромегалія
(див. Розділ 22). Вони становлять 5% від загальних випад-
ків та інколи класифіковані як вторинний діабет.
Діабет першого типу звичайно виникає до сорокаріч-
ного віку, тому його називають ювенільним діабетом.
Пацієнти з цією недугою не є повними, у них бувають часті
випадки кетонемії та ацидозу. Діабет цього типу мають
близько 10% хворих. Це суто автоімунне захворювання з
різноманітними анти-В-клітинними антитілами, що руй-
нують В-клітини. Простежується генетична схильність до
цієї хвороби: якщо в одного з однояйцевих близнюків
виникла ця хвороба, то є один шанс із трьох, що в іншого
захворювання також виникне. Іншими словами, рівень
конкордантності становить близько 33%. Визначальна
генетична аномалія міститься в головному комплексі гісто-
сумісності у 5-й хромосомі, що характеризує особи з різ-
ними типами антигенів гістосумісності (див. Розділ 27),
від яких залежить виражена схильність до розвитку хво-
роби. У цих процесах задіяні також інші гени.
Деякі з антитіл є проти глютаматдекарбоксилази (див.
Розділ 4). Цей ензим наявний у В-клітинах, однак не
виконує в них важливих функцій, як це робить у мозку. В
мишей запобігання експресії глютаматдекарбоксилази у В-
клітинах не веде до їхнього автоімунного руйнування.
Імуносупресія такими препаратами, як циклоспорин,
поліпшує цукровий діабет першого типу в людей, якщо їх
застосовано на початку розвитку хвороби до моменту
втрати усіх В-клітин.
Діабет другого типу найпоширеніший. Він зазвичай
розвивається після 40 років і не залежить від втрати здат-
ності секретувати інсулін. Ця хвороба має прихований
початок, зрідка пов’язана з кетонемією. У цьому випадку
морфологія В-клітин нормальна, і вміст інсуліну в В-клі-
тинах не виснажується. Більшість пацієнтів з цією формою
діабету є повними, а їхня толерантність до глюкози поліп-
шується в разі схуднення. Зазвичай, виникає перебільшена,
тривала інсулінова відповідь на глюкозу, що повільно роз-
вивається і є вторинною до неадекватної ранньої відповіді
В-клітин. Відповідь не пригнічує вихід глюкози з печінки
до нормального рівня, і гіперглікемія, що виникає внас-
лідок цих процесів, спричинює пізню інсулінову відповідь.
Для пацієнтів з діабетом другого типу характерна нормаль-
на кількість транспортерів ОЬОТ 4 у їхніх інсуліночутли-
вих клітинах, які, проте, не здатні вставляти транспортери
у клітинну мембрану в достатніх кількостях у відповідь на
активування інсулінових рецепторів. Особливістю захво-
рювання є виражене генетичне успадкування. Наприклад,
в однояйцевих близнюків рівень конкордантності в разі
діабету другого типу набагато вищий, ніж у випадку діабету
першого типу, досягаючи в деяких випадках близько 100%.
У деяких пацієнтів з діабетом другого типу є генетичні
дефекти глюкокінази (близько 1% випадків), самої моле-
кули інсуліну (близько 0,5% випадків), інсулінового рецеп-
тора (близько 1 % випадків), 6ІЛ5Т 4 (близько 1 % випадків)
чи ІВ.8-1 (близько 15% усіх випадків). У разі діабету дорос-
лих, що трапляється в молодих осіб (МОВУ - від англ.
таіигіїу-опзеі сІіаЬеІез оссигіп£ іп уоип§) і становить 1%
від випадків цукрового діабету другого типу, описано три
мутації втрати функції. Одна з них є в гені глюкокінази
(див. рис. 19-14), ензиму, що відповідає за метаболізм
глюкози у В-клітинах (МОВУ 2), інша - в гені Н\Р-1а,
транскрипційного фактора (МОВУЗ); ще інша - у гені
Н\Р-4а, регулятора експресії РІКР-1а (МОВУ1). Однак
здебільшого причина діабету другого типу невідома.
Мозкова речовина і
кора надниркових залоз
20
ВСТУП
У наднирковій залозі є два ендокринні органи, один
навколо іншого. Головні секрети внутрішньої мозкової
речовини надниркових залоз (рис. 20-1) - катехоламіни:
адреналін, норадреналін і дофамін; зовнішньо розташо-
вана кора виділяє стероїдні гормони.
Мозкова речовина надниркових залоз насправді є
симпатичним ганглієм, у якому постгангліонарні нейрони
втратили аксони і стали секреторними клітинами. Клітини
утворюють секрет у разі стимулювання прегангліонарних
нервових волокон, які досягають залози через вісцеральні
нерви. Гормони мозкової речовини не є життєво необхідні,
проте вони допомагають особі підготуватися до критичних
станів.
Надзвичайно необхідна в організмі кора надниркових
залоз. Вона виділяє глюкокортикоїди - стероїди з різно-
манітним впливом на метаболізм вуглеводів і білків; міне-
ралокортикоїди - потрібні для підтримки балансу натрію
й об’єму ПКР; а також статеві гормони, які незначно впли-
вають на репродуктивну функцію. Лише мінерало- і глюко-
кортикоїди необхідні для виживання. Адренокортикальну
секрецію регулює перш за все АКТГ - гормон передньої
частки гіпофіза, проте секреція мінералокортикоїдів під-
порядкована незалежному контролю різних факторів, що
циркулюють у кров’яному руслі, з яких найважливішим є
ангіотензин II (синтезується у кров’яному руслі). Утворен-
ня цього пептиду залежить від реніну, що його виділяють
нирки.
МОРФОЛОГІЯ НАДНИРКОВИХ ЗАЛОЗ
Мозкова речовина, яка становить 28% від маси наднир-
кової залози, утворена сплетенням щільно іннервованих
ґрануловмісних клітин, які межують з венозними сину-
сами.
Морфологічно розрізняють два типи клітин: адрена-
лінопродукувальні типи, які мають великі, менш щільні
гранули, і норадреналінопродукувальні, у яких малі, щіль-
ніші гранули, що неспроможні виповнити пухирці, у яких
вони містяться (рис. 20-2).
У людей 90% клітин є адреналінопродукувальними, а
10% - норадреналінопродукувальними. Тип клітин, що
виділяють дофамін, невідомий. Параганглія, малі групи
клітин, що подібні до клітин мозкової речовини наднир-
кових залоз, розміщені біля грудного та черевного симпа-
тичних нервових вузлів (див. рис. 20-1).
Рис. 20-1. Надниркові залози людини. Ачренокортикальна
тканина позначена крапками, тканина мозкового шару -
чорна. Залози розміщені на верхньому полюсі кожної нирки.
Показано позанаднирникове місцезнаходження кори і мозко-
вої тканини, що іноді трапляється (відтворено за дозволом з
Еогзіїат РН: ТГіе асігепаї согіех. Іп їехІЬоок ої Епсіосппоіоду,
4Пз еб. ЇА/іІІіатз КН [есіііог]. Заипбегз, 1968).
328 / РОЗДІЛ 20
Холінергічне
Позаклітинний
Рис. 20-2. Норадреналінопродукувальна клітина мозкової
речовини надниркових залоз. Ґранули вивільняються внас-
лідок екзоцитозу, і їхній вміст надходить у кров’яне русло
(стрілка) (модифіковано з Роігіег ф Оитаз ЛР: Рєуіє\а/ ої
МесІісаІ Нізіоіоду. Заипсіегз, 1977).
У дорослих ссавців, кора наднирників розділена на три
зони змінної чіткості (рис. 20-3). Зовнішня клубочкова
зона утворена скрученими клітинами, які переходять у
колони клітин, що формують пучкову зону. Ці колони
розділені венозними синусами. Внутрішня частина клу-
бочкової зони переходить у сітчасту зону, де клітинні
колонки переплітаються у сітку. Клубочкова зона становить
15% від маси надниркової залози, пучкова зона - 50% а
сітчаста - 7%.
Надниркові клітини містять велику кількість жиру,
особливо в зовнішній частині пучкової зони. Всі три зони
виділяють кортикостерон (див. нижче), проте активний
ензимний механізм біосинтезу альдостерону обмежений
клубочковою зоною, тоді як ензимний механізм утворення
кортизолу і статевих гормонів є у двох внутрішніх зонах.
Отже, простежується функційна спеціалізація між двома
внутрішніми зонами: пучкова відповідальна за секрецію
більшості глюкокортикоїдів, а клубочкова - більшості
статевих гормонів.
Артеріальна кров досягає надниркової залози з багатьох
малих відгалужень діафрагмальної та ниркової артерій і
аорти. Зі сплетення в капсулі кров тече до синусоїдів
мозкової речовини. Її постачають туди декілька артеріол,
що проходять безпосередньо від капсули. У більшості
видів, у тім числі людини, є окрема велика надниркова вена.
Плин крові через надниркові залози великий, як у більшості
ендокринних залоз.
Протягом ембріонального життя регульовані гіпофізом
надниркова залоза людини велика, однак три зони кори
становлять тільки 20% від залози. Залишок у 80% - це ве-
лика ембріональна кора надниркової залози, яка зазнає
стрімкої дегенерації під час народження. Головна функція
цієї ембріональної надниркової залози - синтез і секреція
сульфатопохідних андрогенів, які в плаценті перетворю-
ються на естрогени (див. Розділ 23). Структури, подібної
до ембріональної надниркової залози людини, нема у лабо-
раторних тварин.
Крім біосинтезу альдостерону, важливою функцією клу-
бочкової зони є утворення нових клітин кори. Подібно до
інших тканин нервового походження, мозкова речовина не
відновлюється, однак якщо дві внутрішні зони кори вида-
лено, то нові пучкова та сітчаста зони відновлюються з
гломерулярних клітин, що приєднані до капсули. Малі кап-
сулярні залишки повторно формують великі ділянки адре-
нокортикальної тканини. Безпосередньо після гіпофізек-
томії пучкова і сітчаста зони атрофуються, тоді як клубоч-
кова не змінюється (див. рис. 20-3) завдяки дії на неї ангіо-
тензину II. Здатність виділяти альдостерон і зберігати
є нормальною протягом деякого часу, однак у разі трива-
лого гіпопітуїтаризму (недостатній функції гіпофіза) може
розвинутися недостатність альдостерону, очевидно тому,
що нема гіпофізного фактора, який підтримує чутливість
клубочкової зони (див. нижче). Ін’єкції АКТГ і дія подраз-
ників, які стимулюють ендогенну секрецію АКТГ, зумов-
люють гіпертрофію пучкової і сітчастої зон, однак відбува-
ється фактичне зменшення, а не збільшення, розміру клу-
бочкової зони.
Клітини кори надниркових залоз містять великі кіль-
кості гладких ендоплазматичних сіток, які задіяні в процесі
утворення стероїдів. Інші етапи біосинтезу стероїдів від-
буваються у мітохондріях. Структура стероїдопродуку-
вальних клітин дуже подібна в усьому організмі. Типові
ознаки таких клітин показані на рис. 20-4.
Рис. 20-3. Вплив гіпофізектомії на морфологію кори наднир-
кової залози собаки. Зверніть увагу, що атрофія не зачіпає
клубочкової зони. Морфологія людської надниркової залози
така ж.
МОЗКОВА РЕЧОВИНА І КОРА НАДНИРКОВИХ ЗАЛОЗ / 329
Гладка
Рис. 20-4. Схематичне зображення цитологічних особливос-
тей стероїдопродукувальних клітин Зверніть увагу на роз-
винуту гладку ендоплазматичну сітку, плеоморфну мітохонд-
рію і краплі жиру (відтворено за дозволом з Еамсей О\А/, І_опд
Зопез АІ_: Тґіе иіігазігисіиге оГ епсіосгіпе діапсіз. Веселі
Ргод Ногт Кез 1969;25:315).
МОЗКОВА РЕЧОВИНА НАДНИРКОВОЇ
ЗАЛОЗИ
СТРУКТУРА І ФУНКЦІЯ ГОРМОНІВ МОЗКОВОЇ
РЕЧОВИНИ НАДНИРКОВИХ ЗАЛОЗ
Катехоламіни
Кора надниркових залоз виділяє норадреналін, адрена-
лін і дофамін. У котів і деяких інших тварин головно утво-
рюється норадреналін, однак у собак і людини у наднир-
кову вену надходить переважно адреналін. Норадреналін
також потрапляє у кров’яне русло з норадренергічних
нервових закінчень.
Структура молекул норадреналіну, адреналіну та дофа-
міну, а також шляхи їхнього біосинтезу й обміну зображені
на рис. 4-18, 4-20 і 4-21. Норадреналін утворюється під
час гідроксилювання та декарбоксилювання тирозину, а
адреналін - метилюванням норадреналіну. Фенилетано-
ламін-А-метилтрансфераза (Р\МТ - від англ. рЬепукЬапоІ-
атіпе-А-теФуІІгапзГегазе) - ензим, що каталізує утворення
адреналіну з норадреналіну, - у помітних кількостях вияв-
лена лише у мозку та мозковій речовині надниркових залоз.
Індукція адреномедулярної РNМТ, що потребує досить
значних кількостей глюкокортикоїдів, забезпечена високою
концентрацією стероїдів у крові, що надходить з кори до
мозкового шару. Після гіпофізектомії концентрація глю-
кокортикоїдів у крові зменшується і синтез адреналіну
послаблюється.
У плазмі близько 95% дофаміну і 70% норадреналіну
зв’язано з сульфатом. Сульфатопохідні неактивні, їхня
функція остаточно не з’ясована. У людини, що лежить, нор-
мальний рівень норадреналіну в плазмі становить приблиз-
но 300 пг/мл (1,8 нмоль/л). В активному стані простежу-
ється збільшення рівня норадреналіну на 50-100% (рис.
20-5). Рівень норадреналіну в плазмі звичайно сталий і
становить близько 30 пг/мл (0,16 нмоль/л); а після вида-
лення надниркових залоз його концентрація зменшується
до нуля. Адреналін, що міститься в інших тканинах, окрім
надниркових залоз і мозку, здебільшого надходить з кро-
в’яного русла, а не синтезується у цій тканині. Цікаво, що
після двосторонньої адреналектомії незначні кількості
адреналіну знову з’являються в крові, причому його рівень
регульований подібно до адреналіну, утвореного в наднир-
кових залозах. Цей адреналін, можливо, утворюється в клі-
тинах, подібних до ІСА клітин (див. Розділ 13), однак точ-
не джерело їхнього утворення не відоме.
Концентрація вільного дофаміну в крові становить
близько 35 пг/мл (0,23 нмоль/л), крім того, деяка кількість
його є у сечі. Половина плазмового дофаміну надходить з
мозкової речовини надниркової залози, решта - із сим-
патичних гангліїв або інших складових периферійної нер-
вової системи.
Період піврозпаду катехоламінів у кров’яному руслі -
близько 2 хв. Головно вони метоксилюють і потім окисню-
ються до З-метокси-4-гідроксиманделової кислоти (вані-
лілманделової кислоти (ВМК)). Близько 50% катехоламі-
нів, які виділяються, з’являються у сечі як у вільному, так
і в зв’язаному (метадреналін і норметадреналін) вигляді, а
також 35% - у складі ВМК. Вільного норадреналіну й адре-
наліну виділяються тільки незначні кількості. У нормі
упродовж доби людина виділяє близько 30 мкг норадре-
наліну, 6 мкг адреналіну і 700 мкг ВМК.
Інші речовини, що утворюються в мозковій
речовині наднирників
У мозковій речовині норадреналін і адреналін зберіга-
ються у гранулах з АТФ. Гранули містять також хромо-
гранін А (див. Розділ 4). їхнє утворення розпочинається з
ацетилхоліну, що вивільняється з прегангліонарних ней-
ронів, які іннервують секреторні клітини. Ацетилхолін від-
криває катіонні канали, і Са2+, який надходить до клітини з
ПКР, зумовлює екзоцитоз (див. Розділ 1). Отже, катехола-
міни, АТФ і білки в гранулах вивільняються разом.
Адреналіновмісні клітини мозкової речовини також міс-
тять і виділяють опіоїдні білки (див. Розділ 4). Молеку-
лою-попередником є препроенкефалін (див. табл. 4-4) -
білок, який містить основний ланцюг з 25 амінокислот-
них залишків і бічний ланцюг з 242 додаткових залишків
амінокислот, які включають чотири метенкефаліни, а та-
кож гептапептид, що містить метенкефалін, октапептид,
що містить метенкефалін і один леуенкефалін (див. рис.
1-22). Більша кількість циркулювального метенкефаліну
виділяється з кори надниркових залоз. Однак циркулюваль-
ні опіоїди не проходять через гематоенцефалічний бар’єр,
і їхня функція в крові сьогодні остаточно не з’ясована.
330 / РОЗДІЛ 20
Сон (60)
Стан спокою (40)
Куріння цигарки (10)
ґ до < 40 мг/дл (6)
Гіпоглікемія <
[95 >60 мг/дл (10)
слабке (8)
Навантаженням помірне (8)
важке (8)
~ . ґ під час (11)
Операціям
[ після (11)
Кетоацидоз(10)
Інфаркт міокарда (11)
Феохромоцитома (16)
Плазмовий норадреналін, пг/мл
Плазмовий адреналін, пг/мл
Рис. 20-5. Рівень норадреналіну й адреналіну у венозній крові людини за різних фізіологічних і патологічних станів. Зверніть
увагу, що горизонтальний масштаб різний. Число у круглих дужках - кількість протестованих осіб. У кожному випадку вертикальні
штрихові лінії позначають порогову концентрацію у плазмі, за якої простежуються фізіологічні зміни (модифіковано і відтворено
за дозволом з Сгуег РЕ. Рґіузіоіоду апсі раіКорґіузіоІоду оТ Же Китай зутраіґюасігепаї пеигоепсіосгіпе зузіет. N ЕпдІ 9 Месі
1980;303 436).
Адреномедулін, вазодепресор поліпептидної природи,
виявлений у мозковій речовині надниркових залоз, роз-
глянуто у Розділі 31.
Ефекти адреналіну і норадреналіну
Крім пристосувальних ефектів норадренергічної нер-
вової системи, норадреналін і адреналін виявляють мета-
болітичні ефекти, які охоплюють глікогеноліз у печінці і
скелетних м’язах, мобілізацію ВЖК, збільшення лактату
плазми, і стимулювання рівня метаболізму. Ефекти норад-
реналіну й адреналіну зумовлені дією на два класи рецеп-
торів - а- і Р-адренергічні рецептори. Альфа-рецептори
поділяють на дві групи: а(- і а2-рецептори, а р- на р]-, р2-
і р3-рецептори, як описано в Розділі 4. Є три підтипи а}-
рецепторів і три підтипи а2-рецепторів (див. табл. 4-2).
Норадреналін і адреналін збільшують силу і ступінь
скорочення ізольованого серця, що є відповіддю р]-рецеп-
торів. Катехоламіни збільшують також міокардіальну
збудливість, спричинюючи екстрасистоли й іноді серйоз-
ніші аритмії серця. Норадреналін зумовлює вазоконстрик-
цію в багатьох, якщо не у всіх органах, через -рецептори,
адреналін розширює кровоносні судини у скелетних м’язах
і печінці через Р2-рецептори. Це, звичайно, перевершує
вазоконстрикцію, спричинену адреналіном в іншому місці,
і загальна периферійна резистентність знижується. Якщо
норадреналін уводять повільно, то у нормальних тварин і
людей систолічний і діастолічний тиски крові підвищу-
ються. Гіпертонія стимулює каротидні й аортні барорецеп-
тори, спричинюючи рефлекторну брадикардію, яка блокує
прямий кардіохронотропний ефект норадреналіну. Отже,
серцевий викид за хвилину зменшується. Адреналін спри-
чинює збільшення пульсової амплітуди, однак тому, що
збудження барорецепторів недостатнє, щоб перекрити пря-
мий ефект гормону на серце, серцеві скорочення і викид
збільшуються. Ці зміни показані на рис. 20-6.
Катехоламіни збільшують нервову напруженість (див.
Розділ 11). Адреналін і норадреналін виявляють однакову
силу щодо цього, хоча в людей адреналін звичайно спри-
чинює сильніше занепокоєння.
Крім того, катехоламіни дещо по-різному діють на глю-
козу крові. Адреналін і норадреналін спричинюють глі-
когеноліз. Цей ефект зумовлюють р-адренергічні рецепто-
ри, які збільшують цАМФ з активуванням фосфорилази, і
а-адренергічні рецептори, які збільшують внутрішньоклі-
тинний Са2+ (див. Розділ 17). Катехоламіни також
збільшують секрецію інсуліну і глюкагону через Р-
адренергічні механізми та інгібують секрецію цих гормонів
через а-адренергічні механізми.
Норадреналін і адреналін спричинюють швидке збіль-
шення рівня метаболізму, що не залежить від печінки, і
деяке збільшення, яке простежується у разі гепатектомії і
збігається зі збільшенням концентрації лактату крові. Ця
калоригенічна дія не відбувається, якщо нема щитопо-
дібної залози і кори надниркових залоз. Причина почат-
кового підвищення рівня метаболізму до кінця не зрозу-
міла. Вона може бути спричинена шкірною вазоконст-
рикцією, яка зменшує теплові втрати і призводить до під-
вищення температури тіла чи збільшеної м’язової актив-
ності або обох цих ефектів. Інше пояснення можливе з
огляду на окиснення лактату в печінці. Миші, що не здатні
продукувати норадреналін або адреналін, у разі нокауту
гена дофамін-р-гідролази, інтолерантні до застуди, однак
їхній основний обмін підвищений. Причина цього неві-
дома.
МОЗКОВА РЕЧОВИНА І КОРА НАДНИРКОВИХ ЗАЛОЗ / 331
Час, хв
Адр - Адреналін Нор - Норадреналін
Рис. 20-6. Зміни у кровообігу людей, зумовлені повільним
внутрішньовенним уведенням адреналіну і норадреналіну.
Уведення адреналіну і норадреналіну зумовлює почат-
кове збільшення Ю у плазмі завдяки виходу К* з печінки,
а потім простежується тривале зменшення плазмового К+,
спричинене збільшенням надходження К+ у скелетні м’я-
зи, пов’язане з медіацією р2-адренергічних рецепторів. Є
певні дані про те, що активування а-рецепторів блокує
цей ефект. Отже, катехоламіни можуть відігравати суттєву
роль у регулюванні співвідношення поза- і внутрішньо-
клітинного К\
Збільшення у плазмі норадреналіну і адреналіну, що не-
обхідне для прояву описаних вище ефектів, було виявлено
введенням катехоламінів людям у стані спокою. Взагалі по-
ріг для серцево-судинного і метаболічного ефектів норад-
реналіну становить приблизно 1500 пг/мл, тобто практич-
но у п’ять разів більше, ніж у стані спокою (див. рис. 20-5).
Адреналін, з іншого боку, спричинює тахікардію, коли його
рівень у плазмі становить 50 пг/мл, тобто удвічі більший
від стану спокою. Поріг для збільшення систолічного
кров’яного тиску і ліполізу - приблизно 75 пг/мл; для
гіперглікемії збільшення лактату плазми і зменшення діа-
столічного тиску - близько 150 пг/мл; для зменшення а-
трансмітерної секреції інсуліну - 400 пг/мл. Рівень адрена-
ліну плазми часто перевищує ці концентрації. З іншого бо-
ку, норадреналін плазми унаслідок місцевого виходу з пост-
гангліонарних симпатичних нейронів зрідка перевищує по-
ріг його серцево-судинних, метаболічних і більшості інших
ефектів. Більшість пухлин мозкового шару надниркових
залоз (феохромоцитоми) виділяє норадреналін і найоче-
видніше виявляються періодичною або стабільною гіпер-
тензією. Фетохромоцитоми, які виділяють адреналін, спри-
чинюють меншу гіпертензію і часто зумовлюють епізодичну
гіперглікемію, глюкозурію та інші метаболічні ефекти.
Ефекти дофаміну
Фізіологічна функція дофаміну в кров’яному руслі
остаточно не з’ясована. Однак уведений дофамін спричи-
нює ниркову вазодилятацію, діючи, можливо, на певний
дофамінергічний рецептор. З іншого боку, дофамін зумов-
лює вазоконстрикцію, можливо, вивільняючи норадрена-
лін, що чинить позитивний інотропний ефект на серце
завдяки впливу на р-адренергічні рецептори. Загальний
вплив помірних доз дофаміну - підвищення систолічного
тиску і сталий діастолічний тиск. Завдяки цьому дофамін
корисний для лікування травматичного і кардіогенного
шоку (див. Розділ 33).
Дофамін утворюється у корі наднирників і у відчутних
кількостях міститься у сечі. Він спричинює натрійурез або
може посилювати його, інгібуючи Иа+-К+-АТФ-азу.
РЕГУЛЮВАННЯ СЕКРЕЦІЇ МОЗКОВОЇ
РЕЧОВИНИ НАДНИРКОВИХ ЗАЛОЗ
Нервове регулювання
Деякі ліки діють безпосередньо на мозкову речовину
надниркових залоз, однак її фізіологічне стимулювання
відбувається через нервову систему. Секреція катехоламінів
в основних станах стабільно низька, проте у період сну
секреція адреналіну і частково норадреналіну зменшена.
Збільшення секреції мозковою речовиною надниркових
залоз є частиною дифузної симпатичної активності, спро-
вокованої критичними станами, які Кеннон назвав “надзви-
чайною функцією симпатоадреналової системи”. Шляхи,
якими ця секреція готує особу до дії або боротьби, описані
у Розділі 13, а збільшення вмісту катехоламінів у плазмі у
різних станах показано на рис. 20-5.
Метаболічні ефекти циркулювальних катехоламінів
важливі, особливо в деяких ситуаціях. Прикладом може
бути теплоутворювальна дія катехоламінів у тварин, під-
даних холоду. Тварини з іннервованими наднирковими
залозами на холоді тремтять швидше й енергійніше, ніж
контрольні. Іншим прикладом є глікогеноліз у гіпогліке-
мічних тварин, зумовлений адреналіном і норадреналіном.
Гіпоглікемія - це сильний подразник для секреції кате-
холамінів. Як зазначено у Розділі 19, глюкагон може замі-
щувати катехоламіни як протирегулювальний гормон і
навпаки, однак якщо секреція обох блокована, то чутли-
вість до інсуліну значно зменшена.
Вибіркова секреція
Якщо мозкова секреція надниркових залоз збільшена,
то співвідношення кількості норадреналіну й адреналіну
в секреті залози загалом незмінне. Однак асфіксія і гіпоксія
збільшують це співвідношення. Факт, що вихід норадре-
наліну може бути збільшений вибірково, на жаль, призвів
до телеологічних спекуляцій, а саме: мозкова речовина
надниркових залоз виділяє адреналін або норадреналін
залежно від того, до виділення якого гормону більше при-
стосована тварина, щоб протистояти критичній ситуації.
Помилковість такого припущення доводить відповідь на
крововилив, у якому переважає не норадреналін, а адре-
налін, який знижує периферійну стійкість. Секреція нор-
адреналіну збільшується під час емоційного стресу, який
332 / РОЗДІЛ 20
в особи вже був, а секреція адреналіну - у нових ситуаціях,
коли наслідки невідомі.
КОРА НАДНИРКОВИХ ЗАЛОЗ
СТРУКТУРА І БІОСИНТЕЗ
АДРЕНОКОРТИКОЇДНИХ ГОРМОНІВ
Класифікація і структура
Гормони кори надниркових залоз є похідними холесте-
ролу. Подібно до холестеролу, жовчних кислот, вітаміну В
і тестикулярних стероїдів, вони містять циклопентанпер-
гідрофенантренове ядро (рис. 20-7). Гонадні та адрено-
кортикальні стероїди є трьох типів: С21 -стероїди, які мають
двокарбоновий боковий ланцюг у положенні 17; С19, які
мають кето- або гідроксигрупу в положенні 17; С ^-стеро-
їди, які мають 17-кето- або гідроксигрупу, однак не мають
метильної групи в положенні 10. Кора надниркових залоз
виділяє передусім С2)- і С19-стероїди. Більшість С)9-стеро-
їдів має кетогрупу в положенні 17, тому їх називають 17-
кетостероїдами. Стероїди С2І, які містять гідроксильну
групу в положенні 17 і додатковий боковий ланцюг, часто
називають 17-гідроксикортикоїдами, або 17-кортикостеро-
їдами.
Крім того, С19-стероїди мають андрогенну активність;
а С2]-стероїди поділяють за термінологією Сельє на міне-
рал окортикоїди і глюкокортикоїди. Всі С2І-стероїди, що
виділяються, мають як глюко-, так і мінералокортикоїдну
активність. Домінуючим впливом мінералокортикоїдів
є виділення Иа+ і К+, а глюкокортикоїдів - обмін глюкози
та білків.
Детальна номенклатура стероїдів та їхня ізомерія опи-
сані в літературі з номенклатури стероїдів, однак зазна-
чимо, що грецька літера А означає подвійний зв’язок, а
групи, що розміщені вище від площини ядра, позначають
грецькою літерою Р і простою лінією (-ОН), на відміну
від груп, що є під стероїдним кільцем і які позначають
літерою а і штриховою лінією (—ОН). Отже, С21-стероїди,
що їх виділяють надниркові залози, мають А4-3-кетокон-
фігурацію в А-кільці.
Найчастіше природні надниркові стероїди мають 17-
гідроксигрупи в а-конфігурації, а 3-, 11- і 21-гідроксигрупи
в Р-конфігурації; 18-альдегідконфігурація в природному
альдостероні - О-форма; Ь-альдостерон є фізіологічно
неактивним.
Стероїди, що виділяються
Велика кількість стероїдів була виділена з тканин над-
ниркових залоз, однак єдиними стероїдами, що виділя-
ються у фізіологічно суттєвих кількостях, є мінералокор-
тикоїд альдостерон, глюкокортикоїди кортизол і кор-
тикостерон, андрогени дегідроепіандростерон (ДГЕА) і
андростендіон. Структури цих стероїдів показані на рис.
20-8, 20-9. Дезоксикортикостерон є мінералокортикої-
дом, який звичайно виділяється в таких же кількостях, як і
альдостерон (табл. 20-1), Однак має тільки 3% мінерало-
кортикоїдної активності альдостерону. Його вплив на міне-
Ядро циклопентанопергідрофенантрену
Рис. 20-7. Головні структури адренокортикальних і гонадних
стероїдів. Літери у формулі холестеролу відображають чотири
головні цикли, а цифри - нумерацію положення замісників у
молекулі. Ангулярні метильні групи (положення 18 і 19) зви-
чайно позначають рисками.
ральний обмін звичайно незначний, проте у випадку захво-
рювань, що супроводжуються збільшенням його секреції,
може бути помітним. Більшість естрогенів, які не утво-
рюються в яєчниках, надходять до кровообігу з наднир-
кового андростендіону. Майже весь дегідроепіандростерон
виділяється у вигляді сульфату, хоча більшість, якщо не
всі стероїди, - у вільній некон’югованій формі.
Ступінь секреції для окремих стероїдів можна визна-
чити за допомогою введення дуже малих доз позначених
ізотопами стероїдів і з’ясування ступеня розведення його
непозначеними гормонами у сечі, що виділяється. Цю
методику використовують для вимірювання виділень
багатьох гормонів.
Видова диференціація
У всіх видів (від амфібій до людей) головними С2 -сте-
роїдними гормонами, що їх виділяє адренокортикальна
тканина, є альдостерон, кортизол і кортикостерон, хоча
співвідношення кортизолу і кортикостерону змінюється.
Птахи, миші та щурі виділяють практично тільки корти-
костерон; собаки - приблизно однакові кількості цих двох
глюкокортикоїдів; у котів, овець, мавп і людей переважає
МОЗКОВА РЕЧОВИНА І КОРА НАДНИРКОВИХ ЗАЛОЗ / 333
17а-Гідроксилаза
СН3
17,20-Ліаза
СН3
Холестерол
Холестерол-
десмолаза ’
с=о
СН.
С = О
- ОН
Прогненолон
НО
ЗЬ-Гідроксистероїд
дегідрогеназа
О
Прогестерон
СН2ОН
С = 0
21Ь-Гідроксилаза
11 Ь-Гідроксилаза
О
Кортикостерон
О
НО
11-Дезокси-
кортикостерон
СН2ОН
С=ошавж
О
Кортизол
17-Гідрокси-
прегненолон
СН3
17-Гідрокси-
прогестерон
СН2ОН
С = 0
- ОН
О Сульфо-
кіназа ДГЕА
сульфат
Дегідроепіандростерон
НО
* С = О - -
- ОН
О
Андростендіон
Тестостерон
11 -Дезоксикортизол
СН2ОН
с = о
- он
Естрадіол
Рис. 20-8. Схема біосинтезу гормонів у пучковій і сітчастій зонах кори надниркових залоз. Головні продукти секреції підкреслені.
Ензими відповідних реакцій показані ліворуч і зверху схеми. Якщо відповідного ензиму нема, то утворення гормону блоковано
у точках, позначених штриховою лінією.
кортизол. У людей співвідношення кортизолу і кортикосте-
рону приблизно 7:1.
Синтетичні стероїди
Як і багатьох природних речовин, активність адренокор-
тикальних стероїдів можна збільшити у разі зміни їхньої
структури. Сьогодні відомо багато синтетичних стероїдів,
що в декілька разів активніші від кортизолу. У табл. 20-2
наведені відносна глюко- і мінералокортикоїдна активність
природних та синтетичних стероїдів - 9а-флюорокорти-
зону, преднізолону і дексаметазону. Активність дексамета-
зону є найбільшою, що пояснюють його високою спорід-
неністю до глюкокортикоїдних рецепторів і великим періо-
дом напіврозпаду (див. нижче). Преднізолон також має
великий період напіврозпаду.
Біосинтез стероїдів
Головні шляхи синтезу природних гормонів кори над-
ниркових залоз, що синтезуються в організмі, показані на
рис. 20-8 і 20-9. Попередником усіх стероїдів є холестерол.
Частина холестеролу синтезується з ацетату, однак біль-
шість утворюється з ЛПНЩ у кровотоку (див. Розділ 17).
Найбільша кількість ЛПНЩ-рецепторів є в адренокорти-
кальних клітинах. Холестерол естерифікується і відкла-
дається у крапельках жиру. Холестиролгідролаза каталізує
утворення вільного холестеролу в крапельках жиру (рис.
20-10). Холестерол потрапляє до мітохондрій за допомо-
гою білка, носія стеролів. У мітохондрії він перетворюється
в прегненолон під час реакції, яку каталізує холестерол-
десмолаза. Цей ензим з надродини мітохондріальних цито-
хромів Р450, відомий також як ензим відщеплення
бокового ланцюга, Р450§сс або СУР11А. Основи нової
С¥Р-термінології цитохромів Р450з описані у Розділі 17.
У табл. 20-3 наведені різні назви ензимів, що беруть участь
у біосинтезі адренокортикальних стероїдів.
Таблиця 20-1. Головні гормони кори надниркових залоз у
дорослих людей1
Назва Синонім Середня концентрація у плазмі (вільний і зв’язаний)1, мкг/дл Середня кількість секреції, мг/доба
Кортизол Сполука Е, гідрокорти- зон 13,9 10
Кортикостерон Сполука В 0,4 3
Альдостерон 0,006 0,15
Дезоксикорти- костерон док 0,006 0,20
Дегідроепіанд- ростерон моносульфат ДГЕАС 175,0 20
1 Усі концентрації у плазмі виміряні після стану спокою, крім
ДГЕАС, для якого наведена ранкова концентрація.
334 / РОЗДІЛ 20
Холестерол
АКТГ
АІІ
Прегненолон
Кортизол
> і статеві
стероїди
Прогестерон
Дезокси корти костерон
Альдостерон
Рис. 20-9. Гормональний синтез у клубочковій зоні. Ця зона
потребує 17а-гідроксилазу і тільки у ній може відбуватись пере-
творення кортикостерону в альдостерон, тому що тільки тут
у нормі є альдостеронсинтаза, А II та ангіотензин II.
Прегненолон переходить у гладку ендоплазматичну
сітку, де частина його дегідрогенізується з утворенням про-
гестерону в реакції, яку каталізує Зр-гідроксистероїдоде-
гідрогеназа. Цей ензим має молекулярну масу 46 000 і не
є Р450. У пучковій і сітчастій зонах частина прегненолону
і прогестерону гідролізується в шорсткій ендоплазматичній
сітці з утворенням 17а-гідроксипрегненолону та 17а-
гідроксипрогестерону (див. рис. 20-8). Ензим, який ката-
лізує ці реакції, - 17а-гідроксилаза - це є інший Р450
цитохром, який також відомий як Р450с17 (СУР17). Той
же ензим є 17,20-ліазою і може каталізувати розрив 17,20-
зв’язку з перетворенням 17а-прегненолону і 17а-прогес-
терону у С|9-стероїди дегідроепіандростерон і андро-
стендіон.
Гідроксилювання прогестерону до 11-дезоксикортикос-
теролу і 17а-гідроксипрогестерону до 11-дезоксикортизо-
лу також відбувається в гладкій ендоплазматичній сітці,
його каталізує цитохром 21р-гідроксилаза, яка також
відома як Р450с17, або СУР21А2.
11-Дезоксикортикостерон і 11-дезоксикортизол транс-
портуються назад у мітохондрії, де вони гідроксилюються
у положення 11 з утворенням кортикостерону і кортизолу,
відповідно. Ця реакція відбувається у пучковій та сітчастій
ГЕС
Рис. 20-10. Механізм дії АКТГ на кортизолопродукувальні
клітини у двох внутрішніх зонах кори наднирників Коли АКТГ
зв’язується зі своїм рецептором (Р) аденілатциклаза (АЦ)
активується через С5. Унаслідок цього збільшення цАМФ
активує протеїнкіназу А, а кіназа фосфорилює холестерол-
естергідролазу (ХЕГ), збільшуючи її активність. Отже, утво-
рюється більша кількість вільного холестеролу, який пере-
творюється в прегненолон у мітохондрії Зверніть увагу, що
у наступних стадіях біосинтезу стероїдів продукти курсують
між мітохондрією й гладкою ендоплазматичною сіткою (ГЕС).
Кортикостерон також синтезується і виділяється.
зонах, її каталізує 11р-гідроксилаза, цитохром Р450,
відомий як Р450сп, або СУР11В1.
У клубочковій зоні ті ж самі ензими каталізують стеро-
їдний біосинтез до 11-дезоксикортикостерону. Однак
інший ензим - альдостеронсинтаза - каталізує утворення
кортикостерону і його подальше гідроксилювання й окис-
нення з утворенням альдостерону. Альдостеронсинтаза,
відома також як Р450с11а8, або СУРПВ2, на 95% подібна
до С¥Р 11В1, і гени для них обох містяться в тій же частині
Таблиця 20-2. Відносна активність кортикостероїдів
порівняно з кортизоном1
Стероїд Глюкокорти- коїдна активність Мінералокор- тикоїдна активність
Кортизол 1,0 1,0
Кортикостерон 0,3 15
Альдостерон 0,3 3000
Дезоксикортикостерон 0,2 100
Кортизон 0,7 1,0
Преднізолон 4 0,8
9а-Флюорокортизол 10 125
Дексаметазон 25 ~0
1 Середні значення, що ґрунтуються на виділенні печінкового
глікогену або протизапальних тестах для глюкокортикоїдної
активності і впливу на вміст Ма+/К+ у сечі або мінералокорти-
коїдної активності у тварин з адреналектомією. Останні три з
наведених стероїдів є синтетичними і не утворюються в орга-
нізмі (дані з різних джерел).
МОЗКОВА РЕЧОВИНА І КОРА НАДНИРКОВИХ ЗАЛОЗ / 335
Таблиця 20-3. Номенклатура надниркових стероїдогенних ензимів та їхнє розміщення у клітинах
надниркових залоз
Тривіальна назва Р450 СУР Місцезнаходження
Холестеролдесмолаза, ензим розщеплення ланцюга Р4508СС СУР11А1 Мітохондрія
Зр-Пдроксистероїдодегідрогеназа ГЕС
17а-Пдроксилаза, 17,20-ліаза Р450С17 СУР 17 ГЕС
21р-Пдроксилаза Р450С21 СУР21А2 ГЕС
11 р-Гідроксилаза Р450С11 СУР11В1 Мітохондрія
Альдостеронсинтаза Р450С11А8 СУР11В2 Мітохондрія
Примітка ГЕС - гладка ендоплазматична сітка.
8-ї хромосоми. Однак альдостеронсинтаза звичайно наявна
тільки в клубочковій зоні. У цій зоні є недостатня кількість
17а-гідроксилази. Це пояснює те, чому клубочкова зона
виробляє альдостерон, однак не здатна утворювати 17-
гідроксистероїди або статеві гормони.
Велика кількість дегідроепіандростерону, утвореного
у двох внутрішніх зонах, перетворюється у дегідроепі-
андростеронсульфат під дією адреналсульфокінази. Анд-
ростерон перетворюється у тестостерон і етрадіол.
Дія АКТГ
АКТГ зв’язується з високоафінними рецепторами на
плазматичній мембрані адренокортикальних клітин. Це
активує аденілатциклазу (див. Розділ 1) через 6-білок.
Унаслідок збільшення внутрішньоклітинного цАМФ
настає активування протеїнкінази А. Протеїнкіназа фос-
форилює холестеролестергідролазу, збільшуючи її актив-
ність, і перетворення естерів холестеролу у вільний холес-
терол збільшується (див. рис. 20-10). Це, відповідно, приз-
водить до пришвидшеного утворення прегненолону та
його похідних. У довших циклах АКТГ також збільшує
синтез Р450, що залучений у синтез глюкокортикоїдів.
Дія ангіотензину II
Ангіотензин II зв’язується з рецепторами клубочкової
зони, які діють через О-білок, активуючи фосфоліпазу С
(див. Розділ 1). Це сприяє збільшенню протеїнкінази С і
перетворенню холестеролу у прегненолон (див. рис. 20-9)
та полегшує утворення 18-гідроксикортикостерону, який,
відповідно, полегшує утворення альдостерону.
Недостатність ензимів
Наслідки блокування будь-якої з ензимних систем, які
беруть участь у біосинтезі стероїдів, можна передбачити з
рис. 20-8 і 20-9. Вроджені дефекти ензимів призводять до
недостатньої секреції кортизолу і синдрому вродженої
надниркової гіперплазії. Гіперплазія є результатом збіль-
шення секреції АКТГ. Недостатність холестеролдесмолази
фатальна для внутрішньоутробного розвитку, тому що бло-
кується синтез прогестерону у плаценті, необхідного для
підтримання вагітності. Причина важкої вродженої ліпоїд-
ної гіперплазії надниркових залоз у новонароджених -
мутація з втратою функції гена білка негайного регулю-
вання стероїдогенезу (8ґАК- від англ. 8іегоіс1о§епіс асиіе
ге^иіаіогу). Цей білок потрібний у надниркових залозах і
гонадах, однак не в плаценті, для нормального транс-
портування холестеролу у мітохондрію до холестерол-
десмолази, яка розташована на матриксній поверхні внут-
рішньої мітохондріальної мембрани. Якщо його нема, то
синтезуються невеликі кількості стероїдів. Ступінь АКТГ
стимулювання значний, і як наслідок, простежується
нагромадження великої кількості жирових вкраплень у
надниркових залозах. Такий стан називають вродженою
ліпоїдною гіперплазією надниркових залоз. Оскільки
андрогени не сформовані, то жіночі геніталії розвиваються
незалежно від генетичної статі (див. Розділ 23). У разі не-
достатності Зр-гідроксистероїдодегідрогенази, що також
зрідка трапляється, секреція ДГТ збільшена. Цей стероїд
- слабкий андроген, який може спричиняти деяку маску-
лінізацію у хворих жінок, проте не здатний створити повну
маскулінізацію геніталій у генетичних чоловіків. Пошире-
на також гіпоспадія (вада розвитку), коли зовнішній отвір
сечівника відкривається в калитці або в піхві. У разі повної
відсутності 17ос-гідроксилази виникає третя рідкісна пато-
логія, зумовлена недостатністю ензиму, кодованого С¥Р17
геном на 10-й хромосомі, коли жодні статеві гормони не
утворюються і формуються жіночі зовнішні статеві органи.
Однак шляхи синтезу кортикостерону і альдостерону не
ушкоджені і підвищення рівня 11-дезоксикортикостерону
та інших мінералокортикоїдів спричинює гіпертонію і
гіпокаліємію. Недостатність кортизолу частково компенсує
глюкокортикоїдна активність кортикостерону. Різновиди
цього синдрому можуть простежуватись у разі втрати ак-
тивності 17,20-ліази, яка попереджує утворення нормаль-
ної кількості статевих гормонів, у випадку адекватної 17-
гідроксилазної активності для утворення кортизолу.
На відміну від трьох патологій, описаних вище, недос-
татність 21 р-гідроксилази і 11 р-гідроксилази трапляється
частіше і становить 90-95% від загальної кількості випад-
ків вродженої надниркової гіперплазії. Однак останні під-
рахунки свідчать, що майже всі випадки спричинені цією
патологією і лише 1 % - іншими. Недостатність обох ензи-
мів супроводжується вірилізацією, тому що збільшення
секреції АКТГ призводить до накопичення стероїдів і зміни
шляху синтезу до утворення андрогенів. Характерним
прикладом є андрогенітальний синдром, який виникає у
жінок без лікування (рис. 20-11). Ген 21 р-гідроксилази
міститься на короткому плечі 6-ї хромосоми; він тісно
пов’язаний з НЬА - головним комплексом тканинної
сумісності (див. Розділ 19), і різноманітні дефекти можуть
бути спричинені помірною або значною недостатністю
21 р-гідроксилази. Для підтримки життєдіяльності зви-
336 / РОЗДІЛ 20
чайно синтезується достатня кількість глюко- і мінерало-
кортикоїдів. У важких випадках геніталії генетичних жінок
маскулізують (жіночий псевдогермафродизм; див. Розділ
23). Однак у помірних випадках маскулінізацію можна
визначити тільки лабораторним дослідженням. Багато
пацієнтів з недостатністю 21 р-гідроксилази втрачають
значну частину натрію (вроджена вірилізована надниркова
гіперплазія, що супроводжується втратою солей). Втрату
може також зумовлювати недостатність мінералокор-
тикоїдів і альдостеронантагоністичний ефект деяких стеро-
їдів, що утворюються в надлишкових кількостях. За недос-
татності 11 р-гідроксилази простежується вірилізація з над-
лишковою секрецією 11-дезоксикортизолу і 11-дезокси-
кортикостерону, оскільки 11-дезоксикортикостерон є
активним мінералокортикоїдом, то у пацієнтів виникає
затримка солей та води і другий-третій ступінь гіпертонії
(гіпертонічна форма вродженої вірилізованої надниркової
гіперплазії).
Глюкокортикоїдна терапія рекомендована у всіх випад-
ках вірилізованих форм вродженої надниркової гіперплазії,
тому що відновлює нестачу глюкокортикоїдів і блокує
секрецію АКТГ (див. нижче), зменшуючи патологічну
секрецію андрогенів та інших стероїдів. Однак дози, які
тільки відновлюють нормальну глюкокортикоїдну актив-
ність, не повністю усувають надлишкове утворення андро-
генів, оскільки наявна патологія у стероїдному біосинтезі
і деякий ендогенний субстрат відхилений у бік синтезу
АДРЕНОГЕНІТАЛЬНИЙ СИНДРОМ
андрогену. Інколи на практиці цю проблему вирішують
призначенням супернормальних доз глюкокортикоїдів, або
комбінуючи глюкокортикоїдну терапію з ліками, що попе-
реджують ефекти надлишку статевих гормонів.
Прояв активності ензимів цитохрому Р450, що відпо-
відають за біосинтез стероїдних гормонів, залежить, від-
повідно, від стероїдного фактора-1 (8Е-1), ядерного
рецептора (орфану). У разі Е12-Е1, гена для 8Р-1, статеві
органи, як і надниркові залози, не в стані розвиватися, що
зумовлює додаткову аномалію на гіпофізарно-гіпотала-
мічному рівні.
ТРАНСПОРТУВАННЯ, МЕТАБОЛІЗМ І
ВИДІЛЕННЯ ГОРМОНІВ КОРИ
НАДНИРКОВИХ ЗАЛОЗ
Зв’язування глюкокортикоїдів
Кортизол у кров’яному руслі зв’язаний з ос-глобуліном,
його називають транскортин, або кортикостероїдозв’я-
зувальний глобулін (СВ6 - від англ. соііісозієгоісі-Ьіпсі-
іп£ §1оЬи1іп). Частково він також зв’язується з альбуміном
(див. табл. 23-5). Кортикостерон зв’язаний подібно, однак
менше. Тому період напіврозпаду кортизолу у кров’яному
руслі більший (приблизно 60-90 хв), ніж кортикостерону
(50 хв). Зв’язані стероїди фізіологічно неактивні. Зв’язу-
вання білками призводить до порівняно невеликої кількості
вільного кортизолу і кортикостерону в сечі.
Рівновагу між кортизолом та його зв’язувальним білком,
а також тканинним кортизолом та секрецією АКТГ по-
казано на рис. 20-12. Функцією зв’язаного кортизолу є збе-
рігання гормону у крові, що забезпечує постачання віль-
ного кортизолу тканинам. Зв’язок подібний, як у Т4 і його
зв’язувального білка (див. рис. 18-8). За нормального рівня
загального кортизолу (13,5 мкг/дл, або 375 нмоль/л) у плаз-
мі вільного кортизолу є дуже небагато, однак центри СВО
стають повністю насиченими, коли загальний кортизол
плазми перевищує 20 мкг/дл. За вищих концентрацій
простежується деяке збільшення зв’язування альбуміном,
проте основний надлишок є у незв’язаній формі.
АКГТ
Передня частка
^гіпофіза
Вільний
кортизол у плазмі
__(-0,5 мкг/дл)
Зв’язаний білками
Тканинний
кортизол у плазмі
(13 мкг/дл)
кортизол
Рис. 20-11. Типові ознаки адреногенітального синдрому у
постпубертантної жінки (відтворено за дозволом з Еогзйат
РН, Юі Раітопсіо \/С: Тгаитаїіс Месіісіпе апсі Зигдегу Тог Ніе
Аіїотеу. Вийегууогїіз, 1960).
Рис. 20-12. Взаємозв’язок вільного і зв’язаного кортизолу
Штрихова стрілка позначає, що кортизол блокує секрецію
АКТГ. Вміст вільного кортизолу - приблизне значення бага-
тьох вимірювань і обчислене як різниця кількості загального
кортизолу плазми та протеїнозв’язаного кортизолу.
МОЗКОВА РЕЧОВИНА І КОРА НАДНИРКОВИХ ЗАЛОЗ / 337
СВО синтезується у печінці, його утворення посилю-
ється під дією естрогенів. Концентрація СВ6 збільшується
під час вагітності і зменшується у разі цирозу, нефрозу і
мієломи. Коли концентрація СВ6 збільшується, то пере-
важна кількість кортизолу зв’язана, і спочатку зменшується
рівень вільного кортизолу. Це стимулює секрецію АКТГ,
що зумовлює посилення синтезу кортизолу, доки не буде
досягнуто нової рівноваги, за якої кількість зв’язаного
кортизолу збільшена, проте вільний кортизол у нормі.
Зміни у протилежному напрямі відбуваються у випадку
зменшення концентрації СВ6. Це пояснює, чому вагітні
жінки мають високу концентрацію загального кортизолу
плазми без ознак надлишку глюкокортикоїдів і, навпаки,
чому деякі пацієнти з нефрозом мають низький загальний
кортизол плазми без ознак недостатності глюкокортико-
їдів.
Метаболізм і виділення глюкокортикоїдів
Метаболізм кортизолу відбувається в печінці, яка є
головним місцем катаболізму глюкокортикоїдів. Основна
кількість кортизолу відновлюється до дигідрокортизолу, а
потім до тетрагідрокортизолу, який зв’язаний з глюку-
роновою кислотою (рис. 20-13). Глюкуронілтрансферазна
система, що відповідає за це перетворення, теж каталізує
утворення глюкуронідів білірубіну (див. Розділ 26), а також
багатьох гормонів і ліків. Для такої ензимної системи є
конкурентне інгібування між цими субстратами.
Печінка та інші тканини містять ензим 11 р-гідроксисте-
роїдодегідрогеназу (див. нижче). Є щонайменше дві форми
цього ензиму. Тип 1 каталізує перетворення кортизолу у
кортизон, і навпаки, хоча він насамперед є редуктазою,
утворюючи кортизол з кортикостерону. Тип 2 каталізує
практично лише необоротне перетворення кортизолу у
кортизон.
Кортизон - активний глюкокортикоїд, відомий завдяки
його широкому використанню у медицині, однак його у
помітних кількостях не синтезують надниркові залози.
Лише невелика кількість утвореного в печінці кортизону
надходить у кровообіг, тому що він швидко відновлюється
і зв’язується, формуючи тетрагідрокортизонглюкуронід.
Тетрагідроглюкуронідні похідні (кон’югати) кортизолу і
кортикостерону добре розчинні. Вони надходять у кро-
вообіг, де не зв’язуються білками; швидко виділяються з
сечею, зокрема канальцевою секрецією.
Близько 10% виділеного кортизолу перетворюється в
печінці у 17-кетостероїдні похідні кортизолу і кортизону
Кетостероїди кон’югуються, головно, з сульфатом, а потім
виділяються з сечею. Утворюються також інші метаболіти,
у тому числі 20-гідроксипохідні.
Наявна також внутрішньопечінкова циркуляція глюко-
кортикоїдів, і близько 15% утовреного кортизолу виді-
ляється з калом. Кортизон метаболізується подібно до кор-
тизолу, однак з нього не утворюється 17-кетостероїдна по-
хідна.
СН2ОН СН2ОН СН2ОН
І І І
с=о оо оо
Тетрагідрокортизону глюкуранід СООР
Рис. 20-13. Схема метаболізму кортизолу в печінці.
23 36?-2
338 / РОЗДІЛ 20
Зміни у швидкості печінкового метаболізму
Швидкість інактивації глюкокортикоїдів у печінці зни-
жена в разі захворювань печінки, а також, що цікаво, під
час операцій та інших стресів. Отже, у людей, що зазнали
стресу, концентрація вільного кортизолу у плазмі вища, ніж
у випадку максимального стимулювання АКТГ без стресу.
Альдостерон
Альдостерон лише незначно зв’язаний з білками, і
період його напіврозпаду короткий (близько 20 хв). Кіль-
кості, що виділяються, невеликі (див. табл. 20-1), і в нормі
загальна концентрація альдостерону в плазмі людини
приблизно 0,006 мкг/дл (0,17 нмоль/л). Для порівняння:
рівень кортизолу (зв’язаного і вільного) становить при-
близно 13,5 мкг/дл (375 нмоль/л). Головна кількість аль-
достерону перетворюється в печінці у похідне тетраглю-
кураніду, однак деяка кількість - у 18-глюкуронід. Це
похідне, на відміну від продуктів метаболізму інших сте-
роїдів, перетворюється у вільний альдостерон шляхом
гідролізу при рН=1,0; тому його часто називають кислотно
нестійким кон’югатом. Менше 1% альдостерону, що виді-
ляється, міститься в сечі у вільній формі, 5% - у вигляді
кислотно нестійкого кон’югату і понад 40% є у вигляді тет-
рагідроглюкураніду.
17-Кетостероїди
Головним андрогеном надниркових залоз є 17-кетосте-
роїд дегідроепіандростерон, хоча також утворюється анд-
ростендіон. І І-Гідроксипохідні андростендіону і І7-кето-
стероїди утворюються з кортизолу і кортизону шляхом від-
щеплення бокового ланцюга у печінці. Вони є тільки 17-
кетостероїдами, які мають =О- або -ОН-групу в положенні
11(11 -окси-17-кетостероїди). Тестостерон також перетво-
рюється у 17-кетостероїди. Оскільки добове виділення 17-
кетостероїдів у дорослих становить 15 мг для чоловіків і
10 мг для жінок, то близько двох третин кетостероїдів сечі
у людини виділяють надниркові залози або вони утворю-
ються з кортизолу в печінці, а близько одної третини - тес-
тикулярного походження.
Етіохоланолон - один з метаболітів надниркових андро-
генів і тестостерону - може спричинити лихоманку, коли
він некон’югований (див. Розділ 14). Деякі особи мають
епізодичні лихоманки, зумовлені періодичним накопи-
ченням у крові некон’югованого етіохоланолону (етіохола-
нолонова лихоманка).
ЕФЕКТИ НАДНИРКОВИХ АНДРОГЕНІВ І
ЕСТРОГЕНІВ
Андрогени
Андрогени - це гормони, які посилюють ефекти маску-
лінізації і стимулюють білковий анаболізм та ріст (див.
Розділ 23). Тестостерон з яєчок є найактивнішим андроге-
ном, а андрогени надниркових залоз мають активність, на
20% меншу. Секреція надниркових андрогенів контрольо-
вана АКТГ і, можливо, гіпофізарним наднирковим андро-
геностимулювальним гормоном (див. Розділ 23), однак не
гонадотропінами. Концентрація дегідроепіандростерону
у плазмі досягає максимуму (150-200 нг/дл) у віці 25 років
у нормальних чоловіків і жінок, і стійко знижується в стар-
шому віці (див. рис. 23-11). Всі, крім близько 0,3% цир-
кулювальних гормонів, зв’язані у сульфати. Секреція над-
ниркових андрогенів така ж висока у кастрованих чоловіків
і жінок, як і в нормальних чоловіків. Отже, зрозуміло, що
ці гормони спричинюють дуже слабкий маскулінізаційний
ефект, якщо вони продуковані у нормальних кількостях.
Однак вони можуть призводити до помітної маскулінізації
у випадку надмірної секреції. У дорослих чоловіків над-
лишок надниркових андрогенів просто виділяє наявні
ознаки, проте у препуберантних хлопчиків він може спри-
чиняти передчасний статевий розвиток вторинних стате-
вих ознак без тестикулярного росту (швидкозріла псевдо-
статева зрілість). У жінок їхній надлишок спричинює
жіночий псевдогермафродитизм і андрогенітальний синд-
ром (див. рис. 20-11). У клініці деякі практикуючі лікарі
рекомендують ін’єкції дегідроепіандростерону для подо-
лання ефектів старіння (див. Розділ 1), однак результати
досі суперечні.
Естрогени
Наднирковий андроген - андростендіон - перетворю-
ється у тестостерон і естрогени (ароматизовані) у кров’я-
ному руслі. Він є важливим джерелом естрогенів у чоло-
віків і жінок після менопаузи (див. Розділ 23).
ФІЗІОЛОГІЧНІ ЕФЕКТИ ГЛЮКОКОРТИКОЇДІВ
Надниркова недостаність
У тварин і людей, яких лікують, після адреналектомії
недостатність мінералокортикоїдів призводить до змен-
шення рівня На" з недостатністю кровообігу, гіпотонії і, в
кінцевому підсумку, до фатального шоку. Оскільки глю-
кокортикоїдів нема, а водний, вуглеводний, білковий та
жировий обмін патологічні, то навіть незначні подразники
можуть призвести до колапсу або смерті. Невеликі кіль-
кості глюкокортикоїдів виправляють метаболітичні пору-
шення, частково безпосередньо, а частково - опосеред-
ковано. Важливо відрізняти ці фізіологічні ефекти глюко-
кортикоїдів від дуже різноманітних ефектів, зумовлених
великою кількістю гормонів.
Механізм дії
Численні ефекти глюкокортикоїдів виникають унаслідок
зв’язування з глюкокортикоїдними рецепторами, і утворені
стероїднорецепторні комплекси діють як фактори транс-
крипції, що посилює транскрипцію деяких сегментів ДНК
(див. Розділ 1). Це через відповідні мРНК призводить до
синтезу ензимів, які змінюють клітинну функцію. Інколи
вони подібні до негеномного впливу глюкокортикоїдів
(див. Розділ 1).
Вплив на проміжний обмін
Дії глюкокортикоїдів на проміжний обмін вуглеводів,
білків і жирів описані у Розділі 19. Вони охоплюють збіль-
шення білкового катаболізму, збільшення печінкового
глікогенезу і глюконеогенезу. Оскільки активність глюкозо-
6-фосфатази збільшена, то рівень глюкози у плазмі під-
вищений. Глюкокортикоїди активують антиінсулінову дію
МОЗКОВА РЕЧОВИНА І КОРА НАДНИРКОВИХ ЗАЛОЗ / 339
у периферійних тканинах і посилюють діабет, однак, у разі
збільшення рівня глюкози в плазмі додаткова кількість її
надходить у мозок та серце. У діабетиків глюкокортикоїди
збільшують рівень ліпідів і кетонових тіл у плазмі, проте у
нормальних людей збільшення секреції інсуліну, зумовлене
підвищенням рівня глюкози у плазмі, нівелює ці дії. У
випадку надниркової недостатності рівень глюкози у плаз-
мі є в нормі доти, доки підтримується адекватне надход-
ження теплоти, однак ця гіпоглікемія може бути фаталь-
ною. Кора надниркових залоз несуттєва для кетогенетичної
відповіді на голодування.
Дозвільна дія
Невеликі кількості глюкокортикоїдів є необхідними для
багатьох метаболічних реакцій, хоча самі їх не спричи-
нюють. Цей ефект називають дозвільною дією. Він перед-
бачає обов’язкову наявність глюкокортикоїдів для глюка-
гону і катехоламінів з метою потенціювання їхніх тепло-
утворювальних ефектів (див. вище і Розділ 19), лшолітич-
ного, бронходиляторного і пресорного ефектів катехола-
мінів.
Вплив на секрецію АКТГ
Глюкокортикоїди інгібують секрецію АКТГ, тому у
тварин, підданих адреналектомії, секреція АКТГ збіль-
шена. Наслідки дії зворотного зв’язку кортизолу на секре-
цію АКТГ описані нижче в параграфі про регулювання
глюкокортикоїдної секреції.
Судинна реактивність
У тварин з наднирковою недостатністю гладкі м’язи
судин стають нечутливими до дії норадреналіну й адре-
наліну. Капіляри розширюються і стають незворотно про-
никними до колоїдних барвників. Неможливість відповісти
на адреналін, що утворюється у норадренергічних нер-
вових закінченнях, ймовірно, шкодить судинній компенса-
ції у разі гіповолемії, надниркової недостатності і провокує
судинний колапс. Глюкокортикоїди відновлюють судинну
реактивність.
Дія на нервову систему
Зміни у нервовій системі за надниркової недостатності,
що пов’язані лише з глюкокортикоїдами, передбачають
сповільнення електроенцефалографічних хвиль порівняно
з нормальним ос-ритмом, зміни індивідуальності і збіль-
шення чутливості до нюхових та смакових подразників.
Зміни особистості, які є незначними, - роздратованість і
нездатність концентруватися.
Вплив на водний обмін
Надниркова недостатність супроводжується нездатніс-
тю до виділення води. Виділення зрештою відбувається,
проте так повільно, що є небезпека водної інтоксикації.
Тільки глюкокортикоїди здатні подолати цей ефект. У паці-
єнтів з наднирковою недостатністю, які не одержували
глюкокортиїдів, вливання глюкози може спричинити
сильну лихоманку (глюкозна лихоманка), яка супроводжу-
ється колапсом і смертю. Можливо, глюкоза метаболізу-
ється, вода розводить плазму, внаслідок чого осмотичний
градієнт між плазмою і клітинами спонукає клітини тер-
морегуляторних центрів у гіпоталамусі збільшуватись до
такого ступеня, що їхнє функціювання переривається. *
Причина патологічного водного виділення в разі над-
ниркової недостатності остаточно не з’ясована. Рівень
вазопресину у плазмі в цьому випадку підвищений і змен-
шується внаслідок глюкокортикоїдної терапії. Швидкість
клубочкової фільтрації низька, що, ймовірно, робить вне-
сок у недостатність водовиділення. Вибіркова дія глюко-
кортикоїдів на патологічне водовиділення пояснюється
тим, що мінералокортикоїди поліпшують фільтрацію, від-
новлюючи об’єм плазми, а також значно збільшують швид-
кість клубочкової фільтрації.
Вплив на кров’яні клітини і лімфатичні
органи
Глюкокортикоїди зменшують кількість циркулювальних
еозинофілів, збільшуючи їхню секвестрацію у селезінці та
легенях. Вони також зменшують кількість базофілів у
кровообігу і збільшують кількість нейтрофілів, тромбоци-
тів та еритроцитів (табл. 20-4).
Крім того, глюкокортикоїди зменшують кількість цирку-
лювальних лімфоцитів та розмір лімфатичних вузлів і
тимуса, блокуючи лімфоцитомітотичну активність. їхня
здатність зменшувати секрецію цитокінів шляхом інгібу-
вання дії Ь^Г-КВ у ядрі розглянута у Розділі 33. Зменшена
секреція цитокіну ІЛ-2 зумовлює зменшення лімфоцитів
(див. Розділ 27), і ці клітини піддаються апоптозу.
Стійкість до стресу
Коли тварина або людина піддається будь-якому з
багатьох шкідливих або потенційно шкідливих подразнень,
то простежується збільшена секреція АКТГ і, як наслідок,
збільшення рівня глюкокортикоїдів, що циркулюють у кро-
ві. Це підвищення суттєве для виживання. Тварини, що під-
дані гіпофіз- або адреналектомії і перебувають на підтри-
мувальних дозах глюкокортикоїдів, помирають унаслідок
дії тих самих шкідливих подразників.
Сельє назвав шкідливі подразники, що збільшують сек-
рецію АКТГ, стресорами, сьогодні ж їх об’єднують загаль-
ним терміном стрес, який визначає будь-які подразники,
що доведено призводять до збільшення секреції АКТГ у
нормальних тварин і людей.
Досі причина збільшення рівня глюкокортикоїдів у
крові, яка суттєва для опору стресу, остаточно невідома.
Більшість стресових подразників, які посилюють секре-
Таблиця 20-4. Типовий вплив кортизолу на лейкоцити й
еритроцити крові людини
Клітина Норма Лікування кортизолом
Лейкоцити Загальна кількість 9000 10 000
Нейтрофіли 5760 8330
Лімфоцити 2370 1080
Еозинофіли 270 20
Базофіли 60 ЗО
Моноцити 450 540
Еритроцити 5 млн 5,2 млн
340 / РОЗДІЛ 20
цію АКТГ, також активізують симпатичну нервову систе-
му, і додатковою функцією циркулювальних глюкокорти-
коїдів може бути забезпечення судинної реактивності до
катехоламінів. Глюкокортикоїди теж потрібні для потенці-
ювання повної ВЖК-мобілізувальної активності катехо-
ламінів. Однак піддані симпатектомії тварини порівняно
легко переносять стрес. За іншою теорією глюкокорти-
коїди попереджують деякі стресіндуковані зміни.
ФАРМАКОЛОГІЧНІ ТА ПАТОЛОГІЧНІ
ЕФЕКТИ ГЛЮКОКОРТИКОЇДІВ
Синдром Кушінґа
Клінічну картину, зумовлену тривалим збільшенням
рівня глюкокортикоїдів у плазмі, описав Генрі Кушінґ, її
називають синдромом Кушінга (рис. 20-14). Цей синд-
ром буває АКТГ-незалежний або АКТГ-залежний. При-
значення великих доз екзогенних гормонів (наприклад, у
разі ревматоїдного артриту), глюкокортикоїдопродуку-
вальні адренокортикальні пухлини та надниркова гіпер-
плазія зумовлюють АКТГ-незалежний синдром Кушінґа.
Синдром Кушінґа, спричинений попередніми пухлинами
гіпофіза, часто називають хворобою Кушінґа, тому що
саме ці пухлини були причиною випадків, описаних Ку-
шінґом. Однак не зовсім правильно вважати хворобу
Кушінґа підтипом синдрому Кушінґа, тому що різниця
значно більша.
Пацієнти з синдромом Кушінґа є протеїновиснажені
внаслідок надлишкового білкового катаболізму. Шкіра і
підшкірні тканини тонкі, м’язи погано розвинені. Рани
загоюються погано. Волосся рідке і тонке. Багато пацієнтів
Рис. 20-14. Типові прояви синдрому Кушінґа (відтворено за
дозволом з Богзііат РН, Оі Раітопсіо \/С: Тгаитаііс Месіісіпе
апсі Зигдегу (ог ІЬе Айогпеу. ВиКеплюгїІі, 1960).
з цією хворобою мають збільшене оволосіння і велику кіль-
кість вугрів, однак це зумовлено збільшеною секрецією
надниркових андрогенів, що часто супроводжує збільшену
глюкокортикоїдну секрецію.
Жирова тканина перерозподілена так: кінцівки тонкі, а
жир збирається у черевній стінці, обличчі та верхній час-
тині спини, утворюючи “горб бізона”. Оскільки тонка шкі-
ра черевної порожнини розтягнута зі збільшеними підшкір-
ними жировими відкладеннями, то простежується підшкір-
не руйнування тканин з утворенням помітних червоно-
фіолетових стрічок - стрій. Вони виникають кожного разу,
коли відбувається швидке розтягування шкіри (наприклад,
навкруги грудей дівчат у статевій зрілості або в черевній
стінці під час вагітності), проте у нормі ці смуги звичайно
не помітні.
Багато з амінокислот, які вивільняються під час ката-
болізму білків, перетворюються у глюкозу в печінці, що
спричинює гіперглікемію. Зменшення периферійної утилі-
зації глюкози може призвести до інсуліностійкого діабету,
особливо у пацієнтів, спадково схильних до цієї хвороби.
Внаслідок діабету виникають гіперліпемія і кетонемія,
однак ацидоз звичайно помірний.
У разі синдрому Кушінґа глюкокортикоїди наявні у
таких великих кількостях, що можуть спричинити потен-
ціювання ефектів мінералокортикоїдів. Секреція дезокси-
кортикостерону також збільшена внаслідок гіперсекреції
АКТГ. Затримка солі й води разом з лицевим ожирінням
зумовлюють появу характерного круглого обличчя (місяце-
подібного), суттєвого зменшення К і слабкості. Приблизно
85% пацієнтів із синдромом Кушінґа є гіпертоніками.
Гіпертонія може бути спричинена гіперсекрецією дезокси-
кортикостерону й ангіотензиногену або прямою дією глю-
кокортикоїдів на кров’яні судини (див. Розділ 33).
Надлишок глюкокортикоїдів веде до порозності кістки
внаслідок зменшення остеогенезу і збільшення кісткового
поглинання. Це призводить до остеопорозу, зменшення
кісткової маси, а в кінцевому підсумку сприяє руйнуванню
хребта й інших наслідків. Механізми, за допомогою яких
глюкокортикоїди спричинюють ці кісткові ефекти, описані
у Розділі 21.
Глюкокортикоїди у надлишку прискорюють основні
енцефалографічні ритми і зумовлюють психічні розлади,
а саме: збільшення апетиту, безсоння, ейфорію і психози.
Як зазначено вище, недостатність глюкокортикоїдів пов’я-
зана з психічними симптомами, однак симптоми, спри-
чинені надлишком глюкокортикоїдів, ще серйозніші.
Протизапальні й антиалергічні ефекти
гл юкокорти коїд і в
Глюкокортикоїди гальмують запальну відповідь на
пошкодження тканини, а також зменшують прояви алер-
гічної хвороби, які з’являються внаслідок виходу гістаміну
з тканини. Обидва ці ефекти потребують високих рівнів
циркулювальних глюкокортикоїдів і не можуть бути досяг-
нуті призначенням стероїдів, не зумовивши проявів ознак
надлишку глюкокортикоїдів. Крім того, великі дози екзо-
генних глюкокортикоїдів блокують секрецію АКТГ і, по
суті, після припинення терапії можливе виникнення небез-
печної надниркової недостатності. Однак місцеве засто-
сування глюкокортикоїдів (тобто введення у вогнище
МОЗКОВА РЕЧОВИНА І КОРА НАДНИРКОВИХ ЗАЛОЗ / 341
запалення або біля подразненого нерва) зумовлює високу
місцеву концентрацію стероїду часто без значного його
поглинання організмом і серйозних побічних ефектів.
Дія глюкокортикоїдів у хворих з бактеріальними інфек-
ціями яскрава, проте небезпечна, наприклад у разі пнев-
мококової пневмонії або активного туберкульозу лихоман-
кова реакція, токсикоз легко зникають; однак якщо анти-
біотики не приймають у той самий час, то інфекція поши-
рюється по цілому тілу. Треба пам’ятати, що симптоми
попереджують про наявність хвороби. Коли вони замас-
ковані використанням глюкокортикоїдів, то можуть бути
серйозні або навіть фатальні затримки у діагностуванні і
початку лікування антимікробними ліками.
Коли деякі типи антитіл зв’язуються з їхніми антигена-
ми, то спричинюють вихід гістаміну з мастоцитів різних
тканин, що, відповідно, провокує багато симптомів алергії.
Глюкокортикоїди блокують вихід гістаміну і завдяки цьому
зменшують симптоми у випадку астми та алергічних реак-
цій, тому їх можна використати також у разі імуноглобу-
лінозалежних хвороб, наприклад, у випадку серологічної
хвгуюбк
Протизапальні й антиалергічні ефекти глюкокортикоїдів
пояснюють також блокуванням виходу цитокінінів унас-
лідок інгібування руху №Р-КВ до ядра (див. вище і Розділ
33). Додатковою дією, що протидіє локальному місцевому
запаленню, є інгібування фосфоліпази А2. Це зменшує
вихід арахідонової кислоти з фосфоліпідів тканини і,
відповідно, зменшує утворення лейкотрієнів, тромбоксанів,
простагландинів і простацикліну (див. рис. 17-33).
Інші ефекти
Великі дози глюкокортикоїдів сповільнюють ріст, змен-
шуючи секрецію гормону росту (див. Розділ 22), стиму-
люють фенілетаноламін-А-метилтрансферазу (Р\МТ) і
зменшують секрецію ТТГ Упродовж ембріонального
періоду глюкокортикоїди прискорюють дозрівання сурфак-
танту в легенях (див. Розділ 34).
РЕГУЛЮВАННЯ ГЛЮКОКОРТИКОЇДНОЇ
СЕКРЕЦІЇ
Роль АКТГ
Базальна секреція глюкокортикоїдів і підвищена секре-
ція, спричинена стресом, залежить від АКТГ передньої
частки гіпофіза. Ангіотензин II також стимулює кору над-
ниркових залоз, проте його ефект полягає головно у сти-
мулюванні секреції альдостерону. Великі дози багатьох
інших природних речовин, у тім числі вазопресину, серо-
тоніну та ВІП, здатні безпосередньо стимулювати наднир-
кову залозу, однак немає даних про те, що ці речовини
відіграють будь-яку роль у фізіологічному регулюванні
глюкокортикоїдної секреції.
Хімія та метаболізм АКТГ
АКТГ - це поліпептид, що містить 39 амінокислотних
залишків у простому ланцюгу. Його утворення з проопіо-
меланокортину (ПОМК) в гіпофізі описано в Розділі 22.
Перші 23 амінокислоти ланцюга формують активне “ядро”
молекули; 24-39 амінокислоти - “хвіст”, який стабілізує
молекулу і дещо змінюється за складом амінокислот залеж-
но від виду (рис. 20-15). Ізольований АКТГ активний у
всіх видах.
АКТГ інактивується в крові іп уііго повільніше, ніж іп
уіуо; період його піврозпаду у кров’яному руслі людей при-
близно 10 хв. Головна частина введеної дози АКТГ міс-
титься у нирках, однак ні нефректомія, ні евісцерація
помітно не збільшує його обмін ІП УІУО.
Вплив АКТГ на надниркову залозу
Після гіпофізектомії глюкокортикоїдний синтез і виді-
лення зменшується упродовж 1 год до дуже незначного рів-
ня, хоча деяка кількість гормону надалі виділяється.
Упродовж короткого часу після введення АКТГ (у собак
менш ніж через 2 хв) виділення глюкокортикоїдів збіль-
шується (рис. 20-16). У випадку низьких доз АКТГ є
лінійна залежність між логарифмом дози і збільшенням
глюкокортикоїдної секреції. Однак максимальний ступінь
виділення глюкокортикоїдів досягається швидко; і в собак
доза понад 10 мОД тільки пролонгує період максимальної
секреції. Подібна “межа на виході” є і в людей. Вплив АКТГ
на морфологію надниркових залоз і збільшення стероїдної
секреції описаний вище.
Надниркова реактивність
АКТГ не тільки спричинює моментальне збільшення
глюкокортикоїдної секреції, а також збільшує чутливість
надниркових залоз до наступних доз АКТЕ Навпаки, окре-
мі дози АКТГ не збільшують секреції глюкокортикоїдів у
хронічних тварин з гіпозектомією і хворих з гіпопітуїта-
ризмом, і повторне або тривале АКТГ потрібне для від-
новлення нормальної надниркової відповіді на АКТГ.
Рис. 20-15. Структура АКТГ. У різних видів амінокислотний
склад змінюється лише у положеннях 25, 31 і 33 (відтворено
за дозволом з Ьі СН: АсІгепосогТісоігоріп 45: Кєуізєсі атіпо
асісі зесщепсез Тог зТіеер апсі Ьоуіпє Тюггпопез. Віосйет
ВіорТіуз Кез Соттип 1972;49:835).
342 / РОЗДІЛ 20
Рис. 20-16. Зміни у секреції глюкокортикоїдів наднирковими
залозами в гіпофізектомованих собак після внутрішньовен-
ного (IV) введення різних доз АКТГ.
Зменшену реактивність також спричинюють дози глюко-
кортикоїдів, які інгібують секрецію АКТГ. Послаблена над-
ниркова реактивність до АКТГ виявляється в межах 24 год
після гіпофізектомії і прогресивно посилюється з часом
(рис. 20-17). Це простежується, коли надниркова залоза
атрофована, однак перед тим були видимі зміни в її розмірі
і морфології. Є свідчення, що чутливість у двох внутрішніх
і клубочковій зонах до АКТГ збільшена завдяки аміно-
кінцевій частині молекули ПОМК (див. Розділ 22), яка
виділяється разом з АКТГ.
Рис. 20-17. Втрата чутливості до АКТГ унаслідок зменшення
його секреції у людей. 1-24-Амінокислотну послідовність
АКТГ уводили внурішньовенно дозою 250 мкг протягом 8 год;
Н - особи у нормі; ДМ - 0,75 мг дексаметазону кожні 8 год
протягом трьох днів; КСТ - довготривала кортикостероїдна
терапія; НГ- недостатність попереднього гіпофіза (відтворено
за дозволом з Коіапо\л/зкі □ еі аі: Асігепосоїіісаі гезропве ироп
гереаіесі зіітиіаііоп \л/ііїі согїісоігоріп іп раііепіз Іаскіпд епсіод-
епоиз согїісоігоріп зесгеііоп. Асіа ЕпсІосппоІ [КЬН] 1977;85:
595).
Циркадний ритм
Упродовж дня АКТГ виділяється у вигляді нерегулярних
викидів, і рівень плазмового кортизолу має тенденцію до
підвищення або зниження у відповідь на ці викиди (рис.
20-18). У людей викиди АКТГ найчастіше простежуються
рано вранці, приблизно 75% щоденного продукування
кортизолу відбувається між 4- та 10-ю годинами ранку.
Вечірні викиди трапляються зрідка. Цей добовий (цир-
кадний) ритм секреції АКТГ виникає у пацієнтів з над-
нирковою недостатністю, які одержують постійні дози
глюкокортикоїдів. Таке явище зумовлене не стресом від
ранкового прокидання, а пояснюється збільшенням секре-
ції АКТГ перед пробудженням. Якщо добу подовжено екс-
периментально більше ніж на 24 год, тобто якщо особу в
експерименті ізолювати і добовий цикл розтягнути більше
ніж на 24 год, то наднирковий цикл також подовжиться,
проте збільшення секреції АКТГ все ж таки відбуватиметь-
ся під час періоду сну. Біологічний годинник, що відповідає
за добовий ритм АКТГ, розташований у надперехресто-
вому ядрі гіпоталамуса (див. Розділ 14).
Відповідь на стрес
Зранку концентрація АКТГ у плазмі здорової людини у
стані спокою дорівнює приблизно 25 пг/мл (5,5 пмоль/л).
Рівні АКТГ і кортизолу за різних патологічних станів
показані на рис. 20-19. Під час важкого стресу кількість
утвореного АКТГ перевищує кількість, потрібну для про-
дукування максимальної кількості глюкокортикоїдів. Однак
тривале виділення АКТГ у випадку станів типу ектопічного
АКТГ синдрому збільшує наднирковий максимум.
Збільшення секреції АКТГ з метою підготовки до над-
звичайних ситуацій відбувається практично винятково
через гіпоталамус завдяки виділенню КРГ. Цей поліпептид
200
180
120-
?
А
. 160
. 140
н 100-
2
со
го
80-
ь
60-
ї
£
40-
\ І \ . . • І"
и Чо А/У ч
ОПІ_ « ° е
Перекуска
Обід Вечеря Перекуска
Сон
-25
-20
- 15
я.
•)»
10
-5
Сніданок
%
о
0
12 16 20
0 4 8 12 год
Рис. 20-18. Коливання рівнів АКТГ і глюкокортикоїдів протягом
дня у нормальної дівчини (вік 16 років). АКТГ визначали за
допомогою імунологічного аналізу, а глюкокортикоїди - за 11-
оксистероїдами (11-ОНКС). Зверніть увагу, що рівень АКТГ і
глюкокортикоїдів збільшений зранку перед пробудженням
(відтворено за дозволом з Кгіедег ОТ еі аі: Сґіагасіегігаїіоп ої
іїіе погтаї ІетрогаІ раіїегп ої ріазта согїісозіегоісі ієуєів. З
Сііп ЕпсІосппоІ МеіаЬ 1971;32:266).
МОЗКОВА РЕЧОВИНА І КОРА НАДНИРКОВИХ ЗАЛОЗ / 343
Стан
АКТГ плазми, Кортизол плазми,
пг/мл мкг/дл
Норма, ранок
Норма, вечір
Норма, дексаметазон
Норма, метирапон
Норма, стрес
Хвороба Аддісона
Гіпопітуїтаризм
Вроджена надниркова гіперплазія
Синдром Кушінґа, гіперплазія
Синдром Кушінґа, дексаметазон
Синдром Кушінґа, постадреналектомія
Синдром Кушінґа, ектопічний АКТГ
Синдром Кушінґа, пухлина наднирника
0 12 25 50 100
0 12 25 50 100
Рис. 20-19. Концентрація АКТГ і кортизолу в плазмі у разі різних клінічних станів (відтворено за дозволом з Іісісіїе 6: Тґіе
абгепаї согїех. Іп: ТехіЬоок ої Епсіосгіпоіоду, 5іГі есі. ХА/іІІіатз КН [есІИог]. Заипсіегз, 1974).
продукують нейрони в паравентрикулярних ядрах. Він
виділяється у серединному підвищенні і транспортується
через зворотну гіпофізну судину у передню частку гіпофіза,
де стимулює секрецію АКТГ (див. Розділ 14). Якщо сере-
динне підвищення зруйноване, то збільшена секреція у
відповідь на багато різних стресових ситуацій блокована.
Аферентні нервові шляхи від багатьох частин мозку схо-
дяться у паравентрикулярних ядрах. Нервові волокна від
мигдальних ядер у відповідь на емоційний стрес і страх
спричинюють збільшення секреції АКТГ. Надперехресні
ядра забезпечують підтримування добового ритму. Збіль-
шення імпульсів до гіпоталамуса через больові нервові
шляхи і ретикулярну формацію зумовлює секрецію АКТГ
у відповідь на поранення (рис. 20-20). Є також інгібуваль-
ний вхід від барорецепторів через ядро поодинокого шляху.
Протилежно до попередньо запропонованих теорій, адре-
налін і норадреналін, що циркулюють, не збільшують сек-
реції АКТГ у людей, тому що адренокортикальна та адре-
номедулярна секреції незалежно регульовані гіпоталаму-
сом.
Глюкокортикоїдний зворотний зв’язок
Вільні глюкокортикоїди інгібують секрецію АКТГ, і
його ступінь щодо гіпофіза пропорційний до рівня цирку-
лювальних глюкокортикоїдів. Інгібувальний ефект вияв-
ляється на гіпофізарному і гіпоталамусному рівнях. Інгі-
бування відбувається перш за все завдяки дії на ДНК, для
розвитку максимального блокування потрібно декілька
годин, хоча, крім того, є швидший зворотний зв’язок.
АКТГ-інгібувальна активність різноманітних стероїдів
відповідає їхній глюкокортикоїдній активності. Зниження
рівня кортикоїдів у спокої стимулює секрецію АКТГ, і в
разі хронічної надниркової недостатності простежується
збільшення ступеня синтезу і секреції АКТГ.
Отже, ступінь секреції АКТГ визначений двома про-
тилежними чинниками: сума невральних і, можливо, інших
подразників, що сходяться у гіпоталамусі, збільшує сек-
рецію АКТГ; іншою є гальмівна дія глюкокортикоїдів на
секрецію АКТГ, яка пропорційна до їхнього рівня у крові,
що циркулює (див. рис. 20-20).
Заслуговує на увагу можлива небезпека припинення
тривалого лікування протизапальними дозами глюкокор-
Травма у
Емоції через
Рис. 20-20. Контроль секреції кортизолу та інших кортикосте-
роїдів за механізмом зворотного зв’язку. Штрихові стрілки
показують інгібувальні, а суцільні - стимулювальні ефекти
ядер солітарного тракту (ЯСТ). Порівняйте з рис. 18-3, 22-
11, 23-24 і 23-38
344 / РОЗДІЛ 20
тикоїдів. Крім того, що надниркова залоза атрофована і не
чутлива після такого лікування, гіпофіз навіть якщо чут-
ливість відновлена за допомогою ін’єкцій АКТГ, може бути
нездатний утворювати нормальні кількості АКТГ упро-
довж місяця. Можливою причиною недостатності є змен-
шення синтезу АКТГ, після чого простежується повільне
збільшення кількості АКТГ до супранормального рівня.
Це, відповідно, стимулює надниркові залози, і рівень виді-
лення глюкокортикоїдів за принципом зворотного зв’язку
поступово зменшує збільшені рівні АКТГ до норми (рис.
20-21). Ускладненням раптового припинення стероїдної
терапії можна запобігти, повільно зменшуючи дозу сте-
роїдів упродовж достатньо тривалого періоду.
ЕФЕКТИ МІНЕРАЛОКОРТИКОЇДІВ
Дії
Альдостерон та інші стероїди з мінералокортикоїдною
активністю збільшують реабсорбцію з сечі, поту, слини
та шлункового соку. Отже, мінералокортикоїди зумовлю-
ють затримку №+ у ПКР, що збільшує її об’єм. У нирках
вони перш за все діють на головні клітини (Р-клітини -
від англ. ргіпсіраї - головний) збірних проток (див. Розділ
38), а також можуть збільшувати рівень К+ і зменшувати
рівень №+ у м’язових і мозкових клітинах. Під дією аль-
достерону збільшені кількості №" обмінюються на К+ і Н+
у ниркових канальцях, спричинюючи К+-діурез (рис. 20-
22) і збільшення кислотності сечі.
Механізм дії
Альдостерон зв’язується з внутрішньоклітинними міне-
ралокортикоїдними рецепторами (див. рис 1-36). Це впли-
ває на ДНК закріплювальний домен рецептора, і наступне
закріплення на ДНК зумовлює утворення мРНК, які, від-
повідно, сприяють утворенню нових білків (див. рис. 1-
35). У головних клітинах альдостерон збільшує кількість
Місяці після припинення
глюкокортикоїдної терапії
Рис. 20-21. Приклад концентрації АКТИ і кортизолу в плазмі
пацієнтів, які виздоровлюють після тривалого Лікування вели-
кими дозами глюкокортикоїдів (з дозволу Е ІЧеу).
Час, хв
Рис. 20-22. Вплив альдостерону (одноразова внутрішньо-
аортна ін’єкція дозою 5 мкг) на виведення електролітів у собак
після адреналектомїі. Шкала для кліренсу креатину праворуч.
відкритих епітеліальних Ма+-каналів №ЕК в апікальних
мембранах, збільшуючи котранспортування №’ у них (див.
рис. 38-24). Простежується також збільшення кількості
базолатеральних мембран N а-К-АТФ-ази, молекули яких
перепомповують №+ з клітин, однак це, напевне, вто-
ринний ефект. Білок, індукований альдостероном, може
посилювати відкриття апікальних \а+-каналів або ново-
утворення їх у мембрані. Один з генів, що швидко акти-
візує альдостерон, - це ген для натрій- і глюкокортикоїдо-
регулювальної кінази (8§К - від англ. зосііит апсі §1исо-
согіїсоісі ге^иіаіесі кіпазе), серинтреонінпротеїнкінази; коли
цей ген активований поряд з генами для трьох підгруп
№ЕК, то простежується ефективне збільшення у актив-
ності №ЕК, однак точний механізм, за яким білки, інду-
ковані альдостероном, спричинюють зміни у №"-транс-
портних молекулах, не з’ясований.
Очевидно, що альдостерон зв’язаний клітинною мемб-
раною і завдяки швидкій негеномній дії збільшує актив-
ність мембранного Ма+-К+-обміну. Це зумовлює збіль-
шення внутрішньоклітинного і іншим задіяним
посередником є, напевне, ІФ3. У будь-якому випадку
головний ефект альдостерону на ^ -транспортування
виявляється упродовж 10-30 хв або більше (див. рис. 20-
22), що свідчить про залежність цього процесу від синтезу
нового білка за геномним механізмом.
Зв’язок мінералокортикоїдів з
глюкокортикоїдними рецепторами
Цікаво те, що іп уіїго мінералокортикоїдний рецептор
значно більше споріднений з глюкокортикоїдами, ніж
МОЗКОВА РЕЧОВИНА І КОРА НАДНИРКОВИХ ЗАЛОЗ / 345
глюкокортикоїдний рецептор, а глюкокортикоїди наявні у
великих кількостях іп уіуо. Тому постає питання: чому
глюкокортикоїди не зв’язуються з мінералокортикоїдними
рецепторами у нирках та інших місцях і не зумовлюють
ефектів мінералокортикоїдів. Частково це пояснюють тим,
що нирки та інші чутливі до мінералокортикоїдів тканини
містять також ензим ПР-гідроксистероїдодегідрогеназу
типу 2. Цей ензим не змінює альдостерон, однак пере-
творює кортизол у кортизон (див. рис. 20-13) і кортико-
стерон у його 11-оксипохідні, що не зв’язуються з рецеп-
торами.
Видимий надлишок мінералокортикоїдів
Роль 11 Р-гідроксистероїд©дегідрогенази типу 2 у попе-
редженні стимулювання мінералокортикоїдних рецепторів
кортизолом описана вище. Якщо цей ензим інгібований
або його нема, то кортизол виявляє ефекти мінералокор-
тикоїдів. Такий синдром називають видимим надлишком
мінералокортикоїдів (ВНМ). Пацієнти у такому стані
мають клінічну картину гіперальдостеронізму, однак рівень
альдостерону плазми, як і активність реніну, низька. Цей
стан може бути спричинений вродженою відсутністю ензи-
му або тривалим уживанням лакриці (вона містить гліцир-
хітінову кислоту, яка інгібує ензим).
Інші мінералокортикоїди
Альдостерон є головним мінералокортикоїдом, що його
виділяють надниркові залози, хоча і кортикостерон утво-
рюється у достатніх для прояву незначного мінералокор-
тикоїдного ефекту кількостях (див. табл. 20-1,20-2). Дезок-
сикортикостерон, який утворюється у помітних кількостях
тільки в разі патологічних ситуацій, має лише близько 3%
активності альдостерону. Великі кількості прогестерону і
деяких інших стероїдів спричинюють натрійурію. Однак є
деякі свідчення того, що вони відіграють деяку роль у
контролюванні виділення Иа+ в непатологічному стані.
Ефект адреналектомії
У випадку надниркової недостатності рівень Иа+ у сечі
низький, К+- незмінний, а у плазмі - підвищений. Коли
надниркова недостатність розвивається швидко, то кіль-
кість втраченого №* у ПКР перевищує ту кількість, що
виділяється з сечею, а це свідчить про те, що Иа+ пере-
ходить у клітини.
Якщо ушкоджена задня частка гіпофіза, то сольова
втрата перевищує втрату води, і рівень Ка+ у плазмі зни-
жується (табл. 20-5). Однак об’єм плазми також зменшу-
ється, що призводить до гіпотензії, недостатності крово-
обігу і в кінцевому підсумку закінчується фатальним
шоком. Ці зміни можна частково попередити, збільшивши
кількість споживання ІМаСІ. Щурі виживають у разі вико-
ристання додаткової солі, однак у собак і більшості людей
ця кількість додаткової солі настільки велика, що прак-
тично колапс і смерть попередити неможливо, якщо не
проводити одночасно мінералокортикоїдну терапію.
Вторинні ефекти надлишку
мінералокортикоїдів
Недостатність К?, спричинена тривалим К*-діурезом, є
помітною особливістю тривалого надлишку мінерало-
Таблиця 20-5. Типовий рівень електролітів плазми у
нормальних людей і пацієнтів з адренокортикальними
захворюваннями
Стан Електроліти плазми, мекв/л
Ма* К* СГ нсо3-
Норма 142 4,5 105 25
Надниркова недостатність 120 6,7 85 25
Первинний гіперальдостеронізм 145 2,4 96 41
кортикоїдів (див. табл. 20-5). У сечі також зменшується
вміст Н+. Кількість №* не змінюється, однак у плазмі його
рівень тільки дещо збільшений, тому що вода зберігається
з осмотично активними йонами Як наслідок, об’єм
ПКР збільшений і кров’яний тиск підвищений. Якщо
збільшення об’єму ПКР досягає певної межі, то виділення
N3’ звичайно збільшується, незважаючи на тривалий вплив
мінералокортикоїдів на ниркові канальці. Це явище вихо-
ду (рис. 20-23) можливе, напевно, завдяки збільшеній
секреції ПНП (див. Розділ 24). Унаслідок збільшеного виді-
лення коли об’єм ПКР великий, мінералокортикоїди
не спричинюють набряку в нормальних осіб та пацієнтів з
гіперальдостеронізмом. Однак виділення не може відбу-
ватися у деяких патологічних станах і в такому випадку
тривале збільшення об’єму позаклітинної рідини призво-
дить до набряку (див. Розділ 38).
РЕГУЛЮВАННЯ СЕКРЕЦІЇ АЛЬДОСТЕРОНУ
Подразники
Головні подразники, які збільшують секрецію альдосте-
рону, наведені у табл. 20-6. Деякі з них також збільшують
глюкокортикоїдну секрецію; інші селективно впливають
на утворення альдостерону. Первинними регуляторними
факторами є АКТГ гіпофіза, ренін ниркового походження
через ангеотензин II, а також прямий стимулювальний
ефект збільшеної концентрації К+ у плазмі на кору над-
ниркових залоз.
Таблиця 20-6. Типові стимули, що збільшують секрецію
альдостерону
Глюкокортикоїдна секреція також збільшена
Хірургічне втручання
Неспокій
Фізична травма
Крововилив
Глюкокортикоїдна секреція природна
Посилене всмоктування калію
Послаблене всмоктування натрію
Стискання нижньої порожнистої вени
Вертикальне положення
Вторинний гіперальдостеронізм (у деяких випадках
застійної серцевої недостатності, цирозу і нефрозу)
346 / РОЗДІЛ 20
Чоловік, 29 років
Двостороння адреналектомія
Дексаметазон, 0,25 мг/6 год
150
ДОКСА 10 мг ВМ кожні 12 год
К+ сироватки,
мекв/л
К+сечі,
мекв/24 год
100
50
0
Всмоктування
150 Ма+сироватки,
Зд мекв/л
Маса тіла, кг
ПКР
ЗОК
ОЕ
ОП
9,14 л
3,55 л
1,48 л
2,07 л
11,40 л
4,26 л
1,14 л
3,12 л
Дні 1 3 5 7 9 11 13 15 17
Рис. 20-23. “Вихід” з натрійутримувального ефекту дезоксикортикостеронацетату (ДОКСА) а адреналектомізованих хворих;
ПКР - об’єм позаклітинної рідини; ЗОК - загальний об’єм крові; ОЕ - об’єм еритроцитів; ОП - об’єм плазми (з дозволу ТО
Відііегі).
Ефект АКТГ
У випадку першого введення АКТГ стимулює виділення
альдостерону, як і глюкокортикоїдних та статевих гормо-
нів. Хоча кількість АКТГ, необхідна для збільшеного виді-
лення альдостерону, дещо більша, ніж кількість, яка сти-
мулює максимальну глюкокортикоїдну секрецію (рис. 20-
24), проте вона є в межах ендогенної секреції АКТГ. Цей
ефект минає, і навіть якщо секреція АКТГ підвищена, ви-
ділення альдостерону зменшується через один-два дні, а
виділення дезоксикортикостерону посилене. Хронічні за-
хворювання зі зменшеним виділенням альдостерону част-
ково пов’язані з послабленням секреції реніну та вторин-
ною гіперволемією (див. нижче), однак, можливо, що деякі
інші фактори також зменшують перетворення кортикосте-
рону в альдостерон. Після гіпофізектомії основний рівень
секреції альдостерону нормальний. Збільшення нормаль-
ного продукування під час операції та інших стресів не
зафіксовано. Не простежується деякий час збільшення аль-
достерону і в разі обмеження солі у дієті. Пізніше, у разі
тривалого гіпопітуїтаризму, атрофія клубочкової зони
ускладнює картину і може призвести до втрати солі та гіпо-
альдостеронізму.
У нормі глюкокортикоїдна терапія не зменшує секреції
альдостерону. Однак недавно описано цікавий синдром -
глюкокортикоїдноподібний альдостеронізм (ГПА). Це
автосомальне домінуюче порушення, за якого збільшення
секреції альдостерону, зумовлене АКТГ, нетривале. Гіпер-
секреція альдостерону і супровідна гіпертонія зникають, ко-
ли секреція АКТГ супресована завдяки призначенню глю-
кокортикоїдів. Гени, що кодують альдостеронсинтазу і 11 Р~
гідроксилазу, ідентичні на 95% і містяться поряд на 8-й
хромосомі. В осіб з ГПА є нееквівалентний кросенговер,
так що 5'-регулювальна ділянка гена 11 Р-гідроксплази з’єд-
нується з кодувальною ділянкою альдостеронсинтази. Це
створює гібридний ген АКТГ-чутливої альдостеронсинтази.
Ефекти ангіотензину II та реніну
Октапептид ангіотензин II утворюється в організмі з
ангіотензину І, який вивільняється внаслідок впливу реніну
на ангіотензиноген, що циркулює в крові (див. Розділ 24).
Введення ангіотензину II стимулює адренокортикальну
секрецію і в малих дозах перш за все секрецію альдосте-
рону (рис. 20-25). Ділянки дії ангіотензину II містяться на
шляхах біосинтезу стероїдів. Початковою дією є перетво-
рення холестеролу у прегненолон, кінцевою - перетворен-
ня кортикостерону в альдостерон (див. рис. 20-9). Ангіо-
тензин II не зумовлює збільшення секреції дезоксикорти-
костерону, яку контролює АКТГ.
МОЗКОВА РЕЧОВИНА І КОРА НАДНИРКОВИХ ЗАЛОЗ / 347
Рис. 20-24. Зміни у наднирковому венозному виділенні сте-
роїдів, продукованих під дією АКТГ, у гіпофізектомізованих
собак.
Доза ангіотензину II, мкг/хв
Зміни у
виділенні
альдостерону,
нг/хв
№ собак (5)* (2) (8) (7) (7)
кількість альдостерону для трьох собак
Рис. 20-25. Зміни у наднирковому венозному виділенні стеро-
їдів, продукованих під дією ангіотензину II, у нефро- та гіпо-
фізектомізованих собак.
Ренін утворюється у юкстагломерулярних клітинах, які
оточують ниркові аферентні артеріоли, оскільки вони є в
клубочках (див. Розділ 24). Секреція альдостерону регу-
льована через ренін-ангіотензинну систему за типом зво-
ротного зв’язку (рис. 20-26). Зменшення об’єму ПКР або
внутрішньоартеріального судинного об’єму призводить до
рефлекторного збільшення іннервації нирки і зниження
ниркового артеріального тиску. Обидві зміни збільшують
секрецію реніну, і ангіотензин II, що утворюється внаслідок
дії реніну, підвищує ступінь секреції альдостерону. Аль-
достерон призводить до затримки і води, збільшення
об’єму ПКР припинює подразнення, яке ініціалізує збіль-
шення секреції реніну.
Крововилив стимулює секрецію АКТГ і реніну. Подібно
до крововиливу перетискання нижньої грудної вени змен-
шує внутрішньоартеріальний судинний об’єм. Обмеження
солі у харчовому раціоні також збільшує секрецію аль-
достерону через ренін-ангіотензинну систему (рис. 20-27).
Таке обмеження зменшує об’єм ПКР, однак секреція аль-
достерону і реніну збільшена завдяки передусім зменшен-
ню кров’яного тиску. Отже, початкове збільшення секреції
реніну, зумовлене обмеженням споживання натрію, ймо-
вірно, пов’язане з активністю ниркових нервів. Збільшення
кількості циркулювального ангіотензину II, спричинене
сольовим виснаженням, відновлює ангіотензин II рецеп-
тори у корі надниркових залоз, унаслідок чого збільшується
відповідь на ангіотензин II, тоді як у кровоносних судинах
простежується зниження чутливості.
Електроліти та інші фактори
Різке зменшення рівня Иа+ у плазмі близько 20 мекв/л
стимулює секрецію альдостерону, проте такі зміни трап-
ляються зрідка. Однак рівень К+ у плазмі, щоб стимулювати
секрецію альдостерону, треба підвищити лише до 1 мекв/л,
Ангіотензин І
Ангіотензин-
перетворювальний ензим
надниркової залози
Рис. 20-26. Механізм зворотного зв’язку, що регулює секрецію альдостерону. Штрихова стрілка позначає інгібування.
Підвищення середнього
артеріального тиску в нирках,
зменшене подразнення
ниркових нервів
Збільшення об’єму
позаклітинної рідини
Зменшене виділення
І\Іа+ (і води)
348 / РОЗДІЛ 20
Рис. 20-27. Вплив низько-, нормально- і високосольових дієт
на натрієвий метаболізм, активність реніну плазми, альдо-
стерон, вазопресин і ПНП в людей у нормі (дані з ЗадпеІІа
(ЗА еі аГ. РІавта аігіаі паігіигеііс реріісіе: Из геїаііопзііір іо
сґіапдез іп зосііит іпіаке ріазта гепіп асіміу апсі аісіозіегопе
іп тап. СІіп 8сі 1987;72:25).
до ангіотензину II і, відповідно, до гіпонатрієвої дієти змен-
шується під дією низько калієвої дієти.
У нормальних осіб простежується збільшення концент-
рації альдостерону в плазмі у певні періоди доби, коли
особа перебуває у вертикальному положенні. Це збіль-
шення зумовлене зменшенням ступеня видалення альдо-
стерону з кровообігу печінкою і збільшенням секреції аль-
достерону внаслідок постурального збільшення секреції
реніну. Особи, які в експериментальних умовах постійно
перебувають у ліжку, мають циркадний ритм секреції аль-
достерону і реніну з найвищим рівнем вранці перед про-
будженням.
ПНП інгібує секрецію реніну і зменшує чутливість клу-
бочкової зони до ангіотензину II (див. Розділ 24).
Механізми, за якими АКТГ, ангіотензин II і К+ стиму-
люють секрецію альдостерону, наведені в табл. 20-7.
РОЛЬ МІНЕРАЛОКОРТИКОЇДІВ У
РЕГУЛЮВАННІ СОЛЬОВОГО БАЛАНСУ
Зміна в секреції альдостерону є лише одним з багатьох
факторів, що впливають на виділення \а+. Інші головні
фактори такі: ступінь клубочкової фільтрації, ПНП, наяв-
ність або відсутність осмотичного діурезу і зміни в каналь-
цевій реабсорбції Иа+, незалежній від альдостерону. Для
дії альдостерону потрібний деякий час. Отже, коли особа,
яка лежала, встає, то секреція альдостерону збільшується,
і простежується затримка На'; проте зменшене виділення
настає занадто швидко, щоб пояснити його винятково
збільшенням секреції альдостерону. Первинною функцією
альдостеронопродукувального механізму є захист внут-
рішньосудинного об’єму, однак це лише один із задіяних
гомеостатичних механізмів.
РЕЗЮМЕ ЕФЕКТІВ АДРЕНОКОРТИКАЛЬНИХ
ГІПЕР- ТА ГІПОФУНКЦІЙ У ЛЮДЕЙ
Обговорення станів організму, пов’язаних з проявами
надлишку і недостатності адренокортикальних гормонів
у людей, - зручний спосіб підсумувати різноманітні і
складні прояви цих стероїдів. Характерний клінічний синд-
ром пов’язаний з надлишком секреції гормонів кожного
типу. Надлишкова андрогенна секреція спричинює маскулі-
зацію (адреногенітальний синдром), передчасно розви-
нуту псевдостатеву зрілість або жіночий псевдогермафро-
дитизм.
Надлишок глюкокортикоїдної секреції призводить до
утворення місяцеподібного обличчя, ожиріння щиї, фіо-
і тимчасове збільшення його рівня може відбутися після
приймання їжі, збагаченої К+. Подібно до ангіотензину II,
К+ стимулює перетворення холестеролу у прегненолон і
перетворення кортикостерону у альдостерон. Це, вірогід-
но, можливе внаслідок деполяризації клітини, яка від-
криває потенціалозалежний кальцієвий канал, збільшуючи
внутрішньоклітинний Са2'. Чутливість клубочкової зони
Таблиця 20-7. Вторинні речовини, залучені у регулювання
секреції альдостерону
Речовина Внутрішньоклітинний трансмітер
АКТГ Ангіотензин II К+ Циклічний АМФ, протеїнкіназа А Діацилгліцерол, протеїнкіназа С Са2+ через потенціалозалежні Са2+-канали
МОЗКОВА РЕЧОВИНА І КОРА НАДНИРКОВИХ ЗАЛОЗ / 349
летових черевних стрій, гіпертонії, остеопорозу, гіпопро-
теінемії, розумової слабості і часто діабету (синдром Ку-
шінґа). Причини синдрому Кушінґа описані вище.
Надлишок мінералокортикоїдної секреції призводить до
К*-виснаження і №+-затримки, звичайно без набряку, проте
зі слабістю, гіпертонією, тетанією, поліурією і гіпокаліє-
мічним алколозом (гіперальдостеронізм). Такий стан
може бути зумовлений первинною хворобою надниркових
залоз (первинний гіперальдостеронізм), такою як аде-
нома клубочкової зони (синдром Конна), одностороння
або двостороння гіперплазія, рак надниркових залоз або
ГПА (див. вище). У пацієнтів з первинним гіперальдо-
стеронізмом секреція реніну знижена. Вторинний гіпер-
альдостеронізм з великою активністю плазмового реніну
спричинюваний цирозом, серцевою недостатністю і неф-
розом. Збільшена секреція реніну виявлена також в осіб з
солевтратною формою адреногенітального синдрому (див.
вище), що пояснюють низьким об’ємом ПКР у них. У
пацієнтів з підвищеною секрецією реніну внаслідок стис-
кання ниркової артерії секреція альдостерону збільшена;
якщо ж секреція реніну не підвищена, то секреція альдо-
стерону в нормі. Зв’язок між альдостероном і гіпертонією
розглянутий у Розділі 33.
Первинну недостатність надниркових залоз, зумов-
лену патологічними процесами, які знищують кору над-
ниркових залоз, називають хворобою Аддісона. Раніше
цей стан був ускладненням туберкульозу, а тепер звичайно
настає внаслідок автоімунного запалення надниркових
залоз. Хворі помітно худнуть, слабшають і страждають на
хронічну гіпотензію. Вони мають маленькі розміри серця,
напевне тому, що гіпотензія зменшує роботу серця. В кін-
цевому підсумку в них розвивається серйозна гіпотензія і
шок (гостра недостатність кори надниркових залоз, Ад-
дісонова криза). Це призводить не тільки до мінерало-
кортикоїдної, а й до глюкокортикоїдної недостатності. У
випадку гіпоглікемічного голодування або будь-якого стре-
су можливий колапс. Вода в організмі затримується, що
завжди становить небезпеку водної інтоксикації. Рівень
циркулювального АКТГ збільшений. Тонка шкіра та пля-
миста пігментація є характерними ознаками хронічної
глюкокортикоїдної недостатності (рис. 20-28), яка, мож-
ливо, частково зумовлена МСГ-активністю АКТГ у крові
(див. Розділ 22). Незначні місячні дисфункції простежу-
ються у жінок, проте недостатність кортикальних статевих
гормонів здебільшого незначно впливає у разі нормальної
функції яєчників.
Рис. 20-28. Піґментація у разі хвороби Аддісона. А - загар і
вітиліго; В - піґментація рубців від ушкоджень, які виникли
після розвитку захворювання; С - піґментація шкіри на згинах;
О - піґментація навколососкових кілець; Е - піґментація точок
натискання; Е - піґментація ясен (відтворено за дозволом з
ЕогзЬат РН, Оі Раітопсіо УС: Тгаитайс Месіісіпе апсі 8иг-
дегу Тог ІГіе Айогпеу. ВиНеплюїІй, 1960).
Вторинну недостатність надниркових залоз спри-
чинюють хвороби гіпофіза, які зменшують секрецію АКТГ,
а третинна недостатність надниркових залоз зумовлена
гіпоталамічною дисфункцією, яка блокує КРГ-секрецію.
У цих випадках звичайно недостатність надниркових залоз
помірніша, ніж у разі первинної, тому що метаболізм
електролітів пов’язаний з ними менше. Крім того, нема
пігментації, бо в обох станах рівень АКТГ плазми є низь-
ким.
Випадки ізольованої недостатності альдостерону зафік-
совано також у пацієнтів з нирковою хворобою і низьким
рівнем циркулювального реніну (гіпореніновий гіпоаль-
достеронізм). Крім того, псевдогіпоальдостеронізм вини-
кає у випадку стійкості до дії альдостерону. У хворих з
такими синдромами простежується гіперкаліємія, втрата
солі і гіпотензія, а також можливий розвиток метаболіч-
ного ацидозу.
21
Гормональне регулювання
метаболізму кальцію та
фізіологія кістки
ВСТУП
У регулюванні метаболізму кальцію задіяні головно три
гормони. 1,25-Дигідроксихолекальциферол - це стеро-
їдний гормон, утворений з вітаміну О шляхом гідрокси-
лювання в печінці та нирках. Його первинною дією є збіль-
шення абсорбції кальцію з кишки. Паратгормон (ПТГ)
секретують паращитоподібні залози, його головна функ-
ція - мобілізація кальцію з кісток та збільшення екскреції
фосфату з сечею. Кальцитонін, кальційзнижувальний
гормон, що у ссавців секретують головно клітини щито-
подібної залози, інгібує резорбцію кістки. І хоча роль каль-
цитоніну здається другорядною, усі три гормони, очевид-
но, діють узгоджено з метою підтримання сталого рівня
Са2+ у рідинах організму. Четвертий гормон, - пептид, по-
дібний до паратгормону (РТНгР - від англ. рагайіугоісі
Ьогтопе-геїаіесі ргоіеіп), - діє на один з рецепторів парат-
гормону і є важливим для розвитку скелетних м’язів іп
иіего. На метаболізм кальцію також можуть впливати гор-
мони, що регулюють вміст фосфату, глюкокортикоїди, гор-
мон росту, естрогени та різноманітні фактори росту .
МЕТАБОЛІЗМ КАЛЬЦІЮ ТА ФОСФОРУ
Кальцій
Організм молодої дорослої людини містить близько
1100 г (27,5 моль) кальцію, з них 99% є в скелеті. Кальцій
у плазмі за норми 10 мг/дл (5 мекв/л, 2,5 ммоль/л) частково
зв’язаний з білками, а частково розчинний (табл. 21-1).
Його розподіл у клітині описаний у Розділі 1.
Саме вільний, йонізований кальцій у рідинах організму
- життєво важливий вторинний месенджер (див. Розділ 1),
він потрібний для коагуляції крові, скорочення м’язів та
діяльності нервів. Зменшення позаклітинного Са2+ спри-
чинює кінцевий збуджувальний ефект у нервових і м’язо-
вих клітинах іп уіуо (див. Розділ 2). Результатом цього є
гіпокальціємічна тетанія, що супроводжується значними
спазмами скелетних м’язів, у тім числі м’язів кінцівок та
гортані. Ларингоспазм настільки сильний, що дихальні
шляхи можуть повністю закриватися, і настає смертельна
асфікція. Йони Са2' відіграють важливу роль у зсіданні
крові (див. Розділ 27); проте іп уіуо рівень Са2+, за якого
настає летальна тетанія, все ж вищий від рівня, за якого
виявляються порушення зсідання крові.
Оскільки ступінь зв’язування Са2+ білками плазми про-
порційний до рівня білків у плазмі, то важливо знати цей
рівень у разі оцінювання загального вмісту кальцію у плаз-
мі. Йонізований кальцій у плазмі можна виміряти з вико-
ристанням кальційчутливого електрода. На рівень Са2г
впливають електроліти та рН. Наприклад, симптоми тета-
нії з’являються у разі значно вищих рівнів кальцію, коли
пацієнт має гіпервентиляцію, що призводить до збільшення
рН плазми. Білки плазми більше йонізовані за високих
значень рН унаслідок утворення більшої кількості білкових
аніонів для зв’язування Са2+.
Кальцій у кістках буває двох типів: легкообмінний ре-
зервуар та набагато більший пул стабільного кальцію, що
здатний лише до повільного обміну. Є дві різні незалежні
гомеостатичні системи, що взаємодіють і впливають на
кальцій у кістках. Одна система регулює Са2+ у плазмі, за
її допомогою щодня 500 ммоль Са2 переходить через кіст-
ковий пул кальцію, що здатний до легкого обміну (рис. 21 -
1). Інша система пов’язана з ремоделюванням кістки шля-
хом постійної взаємодії між резорбцією та утворенням
кістки (див. нижче), і в дорослих людей вона на 95% від-
повідає за утворення кістки. Проте взаємообмін Са2+ між
плазмою та цим стабільним пулом становить 7,5 ммоль за
добу.
Велику кількість кальцію фільтрують нирки, однак 98-
99% його реабсорбується. Близько 60% реабсорбції відбу-
вається в проксимальних канальцях, а решта - у висхідній
Таблиця 21-1. Розподіл кальцію у плазмі крові людини в
нормі, ммоль/л
Загальний дифузійний 1,34
Йонізований (Са2+) 1,18
У складі комплексів з НСО3~, цитратом тощо 0,16
Загальний недифузійний (білокзв’язаний) 1,16
Зв’язаний з альбуміном 0,92
Зв’язаний з глобуліном 0,24
Загальний кальцій у плазмі 2,50
ГОРМОНАЛЬНЕ РЕГУЛЮВАННЯ МЕТАБОЛІЗМУ КАЛЬЦІЮ ТА ФІЗІОЛОГІЯ КІСТКИ / 351
25 ммоль
з їжею
І
Кістка
Шлунково-
кишковий
тракт
Абсорбція
15 ммоль
Секреція
12,5 ммоль
ПКР
35 ммоль
Швидкий
обмін
500 ммоль
Приріст
7,5 ммоль
Реабсорбція
7,5 ммоль
Здатний
до обміну
100 ммоль
Стабільний
27 200 ммоль
Реабсорбція
247,5 ммоль
Клубочковий
фільтрат
250 ммоль
22,5 ммоль
з випорожненнями
І
Сеча
2,5 ммоль
Рис. 21-1. Метаболізм кальцію в дорослої людини, яка споживає 25 ммоль (1000 мг) кальцію за день.
частині петлі Генле та дистальних канальцях нефрону. Ре-
абсорбцію в дистальних канальцях регулює паратгормон.
Абсорбція Са2+ зі шлунково-кишкового тракту описана
в Розділі 25. Катіони Са2+ з кишки активно транспортує
система посмугованої облямівки епітеліальних клітин, що
охоплює кальційзалежну АТФ-азу; цей процес регулює
1,25-дигідроксихолекальциферол (див. нижче). Відбуваєть-
ся також деяка абсорбція шляхом пасивної дифузії. Коли
поглинання Са2+ стає високим, то рівень 1,25-дигідрокси-
холекальциферолу знижується внаслідок підвищення рівня
Са2+ в плазмі. Зрештою, абсорбція Са2+ зазнає адаптації;
тобто вона висока, якщо поглинання Са2+ низьке, і змен-
шується з підвищенням рівня Са2+. Абсорбція кальцію
також зменшується під впливом речовин, що утворюють
нерозчинні солі з Са2+ (наприклад, фосфати та оксалати),
чи під дією лугів, які сприяють утворенню нерозчинних
кальцієвих мил. Високобілкова дієта збільшує абсорбцію
у дорослих людей.
Фосфор
Фосфат є в складі АТФ, цАМФ, 2,3-дифосфогліцерату,
багатьох білків та інших життєво важливих сполук орга-
нізму. Фосфорилювання та дефосфорилювання білків заді-
яне в регулюванні клітинних функцій (див. Розділ 1). Тому
не дивно, що метаболізм фосфату ретельно регульований.
Загальний вміст фосфору в організмі становить 500-800 г
(16,1-25,8 моль), 85-90% з нього міститься в скелеті. За-
гальний рівень фосфору в плазмі - близько 12 мг/дл, дві
третини з нього є в складі органічних сполук, а решта неор-
ганічного фосфору (Рі, з англ. іпог§апіс рЬозрЬогиз) наявна
переважно у вигляді РО43 , НРО42 , та Н7РО4 .
Кількість фосфору, що в нормі надходить у кістку, ста-
новить приблизно 3 мг (97 мкмоль)/кг/добу, вона еквіва-
лентна кількості, що покидає її через реабсорбцію.
Фільтрування плазмового Рі відбувається в клубочках
нефронів, а 85-90% відфільтрованого Рі реабсорбується.
Активне транспортування у проксимальних канальцях від-
повідає за більшу частину реабсорбції, цей процес значно
пригнічує дія паратгормону (див. нижче).
Абсорбція Рі в дванадцятипалій та тонкій кишках від-
бувається за допомогою як активного транспортування, так
і пасивної дифузії. Проте, на відміну від абсорбції Са2+,
абсорбція Рі лінійно пропорційна до його споживання з
їжею. Багато чинників, які збільшують абсорбцію Са2+, у
тім числі 1,25-дигідроксихолекальциферол, також підси-
люють абсорбцію Рі.
ФІЗІОЛОГІЯ КІСТКИ
Будова
У дорослих і дітей кістки бувають двох типів: ком-
пактна, або трубчаста, кістка, що формує зовнішній шар
більшості кісток (рис. 21-2) і становить 80% від кісток тіла;
та губчаста, або трабекулярна, кістка всередині компакт-
ної, що становить решту 20% кісток в організмі людини.
В компактній кістці співвідношення площі поверхні до
об’єму низьке, а остеоцити - кісткові клітини в цьому типі
кістки - малоактивні. Вони лежать у лакунах і отримують
поживні речовини через кісткові канальці, розгалужені в
компактній кістці (рис. 21-3). Трабекулярна кістка складена
зі спікул, або пластинок з великим співвідношенням площі
поверхні до об’єму та з великою кількістю клітин, розта-
шованих на поверхні пластин. їй притаманна висока мета-
болічна активність. У губчастій кістці поживні речовини
дифундують з позаклітинної рідини кістки в трабекули, тоді
як у компактну їх постачають гаверсові канали (див. рис.
21-3), що містять кровоносні судини. Навколо кожного
352 / РОЗДІЛ 21
Епіфіз -
Епіфізарна -С
пластинка
Діафіз -
Епіфіз -
Рис. 21-2. Будова типової довгої кістки до (ліворуч) та після
(праворуч) замикання зони росту епіфіза.
гаверсового каналу розміщений колаген у вигляді концент-
ричних шарів, які утворюють циліндри, названі остеонами,
чи гаверсовою системою.
Кістка є спеціальною формою сполучної тканини, побу-
дованою з мікроскопічних кристалів фосфатів кальцію все-
редині матриксу з колагену. Колаген, відповідно, органі-
зований у складну тривимірну систему. З огляду на високий
вміст кальцію та фосфату кістка відіграє важливу роль у
гомеостазі кальцію. Вона захищає життєво важливі органи,
а створена нею міцність уможливлює переміщення та під-
тримання ваги проти дії сили тяжіння. Стара кістка постій-
но резорбує, а натомість утворюється нова (див. нижче),
що дає змогу таким способом пристосовуватись до при-
кладених напружень та натягів. Це жива тканина, яка є доб-
ре васкуляризованою і має загальний кровоплин 200-
400 мл/хв у дорослих людей.
Білок матриксу кістки - це здебільшого колаген першого
типу, який також є головним структурним білком у сухо-
жилках та шкірі. Колаген, що такий же міцний, як і сталь,
складається з потрійної спіралі з міцно з’єднаних трьох
поліпептидів. Два з них - ідентичні -поліпептиди, кодо-
вані одним геном, а третій - ос2-поліпептид, кодований
іншим геном. Колагени - це родина структурно близьких
білків, що забезпечують цілісність багатьох органів. Сьо-
годні їх визначено 15 типів, кодованих 20 різними генами.
Для підтримки нормальної структури кістки повинні
надходити достатні кількості білків та мінеральних речо-
вин. Кісткові кристали мають розмір 20±(3-7) нм і скла-
даються переважно з гідроксіапатитів загальної формули
Са10(РО4)6(ОН)2. Натрій та невеликі кількості магнію і кар-
бонатів також наявні в кістці. Окрім того, одним з мінералів
кістки є аморфний фосфат кальцію, який не має зв’язаної
структури, здатної до дифракції рентгенівських променів.
Остеобласти та остеокласти
Клітини, що безпосередньо пов’язані з утворенням та
резорбцією кістки - це остеобласти та остеокласти. Обид-
ва типи клітин походять із кісткового мозку. Остеобласти
є кісткоутворювальними клітинами, що походять від попе-
редників клітин кістковомозкової строми в кістковому моз-
ку. Вони секретують великі кількості колагену першого ти-
пу, інших білків кісткового матриксу та лужної фосфатази.
Клітини цього типу диференціюють в остеоцити.
Остеокласти є багатоядерними клітинами, що руйнують
та резорбують попередньо утворену кістку. Вони форму-
ються з гематопоетичних стовбурових клітин через моно-
цити (див. Розділ 27). Стовбурові клітини приєднуються
до кістки за допомогою інтегринів у видовженні мембрани,
названих замикальною зоною. Ця зона створює ізольо-
вану ділянку між кісткою та частиною остеокласта (рис.
21-4). Після цього протонні помпи, що є Н -залежними
АТФ-азами, переміщуються з ендосом у клітинну мембра-
ну, протилежну до ізольованої ділянки, і закиснюють це
місце до рН 4. Подібні протонні помпи виявлені в ендосо-
мах та лізосомах усіх еукаріотичних клітин (див. Розділ
1), однак вони лише в кількох інших випадках переміщу-
ються в клітинну мембрану. Зверніть увагу, що замкнутий
простір, утворений остеокластами, нагадує велику лізо-
сому. Кисле рН розчиняє гідроксіапатит, а кислі протеази,
що їх секретує клітина, руйнують колаген, утворюючи
невелику порожнину в кістці. Продукти дегенерації після
цього ендоцитуються і рухаються через остеокласт шляхом
трансцитозу (див. Розділ 1) з вивільненням в інтерстиційну
рідину. Продукти розпаду колагену містять піридинолінові
структури, а піридиноліни можна вимірювати в сечі як
показник швидкості резорбції кістки.
РІСТ кістки
Кістки черепа утворюються внаслідок скостеніння обо-
лонок (внутрішньомембранне утворення кістки). Довгі
кістки спершу формуються як хрящі, а потім перетворю-
ються в кістку шляхом скостеніння, яке розпочинається в
діафізі кістки (енхондральне утворення кістки).
Під час росту спеціалізовані ділянки на кінцях кожної
довгої кістки (епіфізи) відділені від діафіза кістки плас-
тинкою активно проліферувального хряща - епіфізарною
пластинкою (див. рис. 21-2). Кістка видовжується, коли
ця пластинка відкладає досередини нову кістку на краях
діафіза. Ширина епіфізарної пластинки пропорційна до
швидкості росту. На неї впливає низка гормонів, однак най-
помітніше - гормон росту гіпофіза та ІФР-І (див. Розділ
22).
Лінійний ріст кістки може відбуватись доти, доки епіфіз
відділений від діафіза кістки, однак припиняється, коли
епіфізи з’єднуються з діафізом (замикання зон росту епі-
фіза). Епіфізи різних кісток замикаються в чіткій часовій
послідовності, останні - після настання статевої зрілості.
Нормальний вік, за якого відбувається закривання кожного
епіфіза, відомий, тому “вік кістки” молодої особи можна
визначити шляхом рентгенографії скелета і дослідженням
того, які епіфізи відкриті, а які закриті.
ГОРМОНАЛЬНЕ РЕГУЛЮВАННЯ МЕТАБОЛІЗМУ КАЛЬЦІЮ ТА ФІЗІОЛОГІЯ КІСТКИ / 353
Рис 21-3. Будова компактної та трабекулярної кістки. Компактна кістка показана у горизонтальному (угорі) та вертикальному
(ліворуч) перерізі (відтворено за дозволом з \Л/іІІіатз РІ_ еі аі (есіііогз): Сгау’з Апаіоту, 37іГі есІИіоп, СНигсіїіІІ Імпдзіопе, 1989).
Утворення кістки та резорбція
Протягом життя людини кістки постійно резорбують, а
на їхньому місці утворюються нові. Кальцій у кістках онов-
люється зі швидкістю 100% за рік у новонароджених та
18% за рік у дорослих. Ремоделювання кістки є переваж-
но місцевим процесом, що відбувається на малих ділян-
ках за допомогою клітин, названих ремоделювальними
одиницями кістки. Спершу остеокласти резорбують кістку,
а потім остеобласти у цій же ділянці відкладають нову. Цей
цикл триває близько 100 днів. Однак ремоделювання
дрейфує, у цьому разі форма кістки змінюється, оскільки
кістка резорбується в одному місці, а відкладається в ін-
шому. Остеокласти проникають у трубчасту кістку, за ними
надходять остеобласти; у трабекулярній кістці ремоделю-
вання відбувається на поверхні. Близько 5% маси кістки
дорослої людини щомиті ремодельовані двома мільйонами
кістковоремоделювальних одиниць скелета людини.
Швидкість оновлення кістки становить близько 4% за рік
для трубчастої кістки і 20% - для трабекулярної. Ремоде-
лювання частково пов’язане з тиском і розтягом скелета
під дією сили тяжіння та інших чинників і регульоване
гормонами, що циркулюють у крові, факторами росту та
24 367-2
354 / РОЗДІЛ 21
Таблиця 21-2. Чинники, що впливають на остеобласти та
остеокласти
ІІІіІІіВІОШіВІІІІІІІІІІІІІвІІІІІІіІІІВІІІІІІІйІІ^^Ш^^іЖ^^^ЖІіі^ИІІ
Рис. 21-4. Остеокласт, що резорбує кістку. Краї клітини щільно
з’єднані з кісткою, що уможливлює секрецію кислоти зі
складчастої апікальної мембрани та наступне руйнування
кістки під клітиною. Зверніть увагу на численні ядра (я) та
мітохондрії (м) (з дозволу Р Вагон).
Стимулюють остеобласти
Паратгормон
1,25-Дигідроксихолекальциферол
ІЛ-1
т3.т4
Гормон росту людини, ІФР-1
Простагландин Е2, (ПГЕ2)
ФНП
Естрогени?
Пригнічують остеобласти
Кортикостероїди
Стимулюють остеокласти
Паратгормон
1,25-Дигідроксихолекальциферол
ІЛ-6, ІЛ-11
Пригнічують остеокласти
Кальцитонін
Естрогени (пригнічуючи утворення певних цитокінів)
ТФР-Р
ІРМа
Простагландин Е2, (ПГЕ2)
цитокінами. Попередники остеобластів секретують фак-
тори, що впливають на розвиток остеокластів, і це не дивує,
адже воно пояснює підтримання балансу між резорбцією
та утворенням кістки. Деякі з факторів, що діють на остео-
бласти та остеокласти, наведені в табл. 21-2.
Деталі процесу, відповідального за кальцифікацію ново-
утвореного кісткового матриксу, незважаючи на інтенсивне
вивчення, до кінця не з’ясовані. В цьому процесі задіяні
кілька генів, і нокаут одного з них у мишей веде до утво-
рення тварин з хрящовим скелетом без кісток у тілі. Остео-
бласти секретують лужну фосфатазу, що гідролізує фос-
фатні естери. Концентрація фосфатів, вивільнених внас-
лідок гідролізу складних ефірів, збільшується біля остео-
бластів, а це може спричинювати випадання осаду фосфату
кальцію.
Сьогодні виділено та схарактеризовано, окрім колагену,
ще кілька білків кістки. Кісткові морфогенні білки (ВМР§
- від англ. Ьопе тогрйо§епіс ргоіеіпз) стимулюють ріст
кістки; тепер також відомо, що вони відіграють провідну
роль у розвитку нервової системи та багатьох інших тканин
у тілі. Білок 61а матриксу (МОР - від англ. таігіх 61а рго-
іеіп) та білок 61а кістки (В6Р - від англ. Ьопе 61а ргоіеіп,
остеокальцин) містять у-карбоксильовані залишки глута-
мінової кислоти (61а), а у-карбоксилювання каталізоване
вітаміном К (див. Розділ 17). Залишки 61а зв’язують Са2+,
однак нестача вітаміну К зумовлює скелетні аномалії лише
у плоду. Два додаткові білки - остеонектин та остеопон-
тин - синтезовані остеобластами. Синтез остеокальцину
та остеопонтину збільшується з початком кальцифікації.
Проте точні функції усіх цих білків у кістці ще треба з’ясу-
вати.
Поглинання інших мінералів
Свинець та деякі інші токсичні елементи кістка поглинає
та вивільняє так само, як і кальцій. Швидке кісткове погли-
нання цих елементів інколи називають механізмом дето-
ксикації, оскільки воно слугує для їхнього вилучення з
рідин організму, що зменшує їхній токсичний вплив. Фто-
рид, поглинутий кісткою, зумовлює утворення нової кістки.
Він також входить в емаль зубів, а невеликі його кількості
підвищують стійкість до карієсу. Проте великий вміст спри-
чинює знебарвлення емалі (мармуровість емалі).
Хвороби кісток
Хвороби, спричинені вибірковими аномаліями клітин
та процесів, розглянутих нижче, відображають взаємозв’я-
зок між чинниками, що забезпечують нормальні функції
кістки.
Різноманітні мутації в генах, які кодують колаген, роб-
лять кістки крихкими, зумовлюючи недосконале кістко-
утворення (хворобу крихких кісток), а також спричиню-
ють різноманітні хондродисплазії й принаймні одну форму
синдрому Елерса-Данлоса. Можливо, що деякі випадки
остеопорозу (див. нижче), остеоартриту та аневризми
аорти теж є наслідками мутацій у генах колагену. У випадку
остеопетрозу, іншої рідкісної та часто важкої хвороби,
остеокласти дефективні і нездатні до резорбції кістки, яку
вони виконують за нормальних умов. Це призводить до
рівномірного збільшення густини кістки, неврологічних
розладів унаслідок звуження отворів, крізь які зазвичай
проходять нерви, та гематологічних аномалій унаслідок
витіснення порожнин кісткового мозку. У миші, що не має
білка, кодованого негайним раннім геном с-/о8, розвива-
ються ознаки остеопетрозу, який також простежується в
мишей, що не мають фактора транскрипції РИ.1, та в
мишей з дефіцитом остеокальцину. Це наштовхує на дум-
ку, що усі три фактори задіяні в процесі нормального роз-
витку та діяльності остеокластів.
Стан, за якого кількість відкладення кальцію на одини-
цю кісткового матриксу недостатня, називають рахітом у
дітей та остеомаляцією в дорослих. У разі остеопорозу
ГОРМОНАЛЬНЕ РЕГУЛЮВАННЯ МЕТАБОЛІЗМУ КАЛЬЦІЮ ТА ФІЗІОЛОГІЯ КІСТКИ / 355
відбувається втрата матриксу та мінералів і зменшення
маси кістки (рис. 21 -5) та її міцності, унаслідок чого збіль-
шується частота переломів. Цю хворобу, на противагу
остеопетрозу, характеризує сумарне переважання резорбції
кістки над її утворенням. Вона має багато причин, однак
найпоширенішою формою є інволюційний остеопороз,
пов’язаний переважно зі старшим віком та менопаузою.
Інволюційний остеопороз - поширена хвороба, він став
головною проблемою для охорони здоров’я в Сполучених
Штатах та Європі, тому що кількість людей старшого віку
збільшилася.
В усіх нормальних людей кістки утворюються в ран-
ньому періоді життя, під час росту. Після стабільного періо-
ду з віком вони починають втрачати масу (рис. 21-6). Якщо
ця втрата прискорена або збільшена, як у разі остеопорозу,
то це призводить до збільшення частоти переломів, зокре-
ма передпліччя (переломів Колліса), тіл хребців та стег-
нових кісток. Усі ці ділянки мають високий вміст трабеку-
лярної кістки; оскільки ж вона є метаболічноактивнішою,
то й втрачається найшвидше. Переломи хребців зі здав-
ленням спричинюють кіфоз з утворенням типового “горба
вдови”, що поширений серед старших жінок з остеопо-
розом. Травми стегна та ушкодження кульшового суглоба
у старших осіб пов’язані з рівнем смертності у 12-20%
випадків, а половина з тих, хто вижив потребують трива-
лого дорогого догляду.
Дорослі жінки мають меншу масу кісток, ніж дорослі
чоловіки, і після менопаузи на початковій стадії втрачають
її швидше, ніж чоловіки такого ж віку (див. рис. 21-6), з
огляду на це вони більше схильні до розвитку серйозного
остеопорозу. Першою причиною втрати маси кісток після
менопаузи є нестача естрогену, тому лікування естрогеном
дає змогу зупинити прогресування хвороби. Естрогени
інгібують секрецію цитокінів, зокрема ІЛ-1, ІЛ-6 та ФНПос,
які пришвидшують розвиток остеокластів. Естроген також
стимулює утворення ТФР-р, який, відповідно, збільшує
апоптоз остеокластів. На остеобластах є рецептори естро-
гену і їх можна безпосередньо стимулювати. Великі дози
естрогенів збільшують частоту інфарктів міокарда та
інсультів, однак малі їхні дози, що ефективні у сповільненні
втрати маси кісток, захищають від серцево-судинних хво-
роб. Естрогени також збільшують частоту ендометріаль-
Рис. 21-5. Нормальна трабекулярна кістка (ліворуч) порів-
няно з трабекулярною кісткою у разі остеопорозу (праворуч).
Вік, роки
Рис. 21-6. Загальний рівень кальцію в організмі як показник
маси кісток у чоловіків та жінок різного віку. Зверніть увагу на
швидке збільшення цих рівнів у молодих дорослих людей
(фаза І), неухильну втрату маси кістки з віком в обох статей
(фаза III) та накладену, спершу прискорену, втрату у жінок
після менопаузи (фаза II) (відтворено за дозволом з Кіддз
ВІ_, Меііоп Ш III: ІпуоІиііопаІ озіеорогозіз. Іп ЕуапзТб, МіІІіагпз
ТЕ (ебііогз): ОхїогсІ ТехіЬоок ої бегіаііс Мебісіпе. Охїогб ііпіу
Ргезз, Іопбоп, 1992).
ного раку, та здається, цього можна уникнути, якщо естро-
ген вживати з прогестином. З іншого боку, тривале ліку-
вання естрогенами може збільшити частоту раку молочної
залози. Отже, тактика лікування жінок після менопаузи за
допомогою естрогенів залежить від ретельного зважування
всіх за і проти.
Збільшене поглинання кальцію, особливо з природних
джерел, наприклад, молока, та помірні фізичні наванта-
ження можуть також допомогти запобігти чи сповільнити
прогресування остеопорозу, хоча їхній вплив не дуже силь-
ний. Бісфосфонати, такі як етидронат, що інгібує остео-
кластичну активність, збільшують мінеральний вміст кіс-
ток, якщо їх вживати за циклічною схемою, і зменшують
частоту нових переломів хребців. Фторид стимулює остео-
бласти, роблячи кістку щільнішою, однак він не має важ-
ливого значення в разі лікування цієї хвороби.
У пацієнтів, що з якоїсь причини іммобілізовані, та у
космонавтів (див. Розділ 33) резорбція кісток перевищує
її утворення, і розвивається дифузний остеопороз. Рівень
кальцію в плазмі не є помітно збільшеним, проте концент-
рація паратгормону та 1,25-дигідроксихолекальциферолу
зменшується, і великі кількості кальцію виходять з сечею.
Остеопороз також розвивається у пацієнтів з надлишко-
вою секрецією глюкокортикоїдів (синдром Кушінґа; див
Розділ 20).
ВІТАМІН О ТА
ГІДРОКСИХОЛЕКАЛЬЦИФЕРОЛИ
Хімія
Активне транспортування Са2+ та РО43 з кишки збіль-
шується завдяки метаболіту вітаміну В. Термін вітамін О
використовують для позначення групи близьких стеринів,
356 / РОЗДІЛ 21
утворених під дією ультрафіолетового світла на деякі про-
вітаміни (рис. 21-7). Вітамін Б3, який ще називають холе-
кальциферолом, виникає в шкірі ссавців з 7-дегідрохо-
лестеролу під дією сонячного світла. Реакція полягає у
швидкому утворенні провітаміну В3, який згодом повіль-
ніше перетворюється у вітамін О3 (холекальциферол). Віта-
мін Б3 та його гідроксильовані похідні транспортуються в
плазмі зв’язано з глобуліном вітамін О-зв’язувальним біл-
ком (ОВР - від англ. уйатіп О-Ьіпс1іп§ ргоіеіп), який також
відомий як Ос-білок і зв’язує О-актин (див. Розділ 1). Крім
того, він підсилює стимулювання хемотактичної активнос-
ті нейтрофілів, індукованих комплементом. Спорідненість
ОВР до провітаміну О3 низька, а до вітаміну О3 висока,
отже, ОВР переносить вітамін О3зі шкіри в кров’яне русло.
Вітамін О3 також надходить з харчовими продуктами.
Метаболізують вітамін О3 ензими, що є членами над-
родини цитохрому Р450 (С¥Р) (див. Розділи 17 і 20). У
печінці вітамін О3 перетворюється в 25-гідроксихолекаль-
циферол (кальцидіол, 25-ОНО3), а той у клітинах прокси-
мальних канальців нирок - в активніший метаболіт 1,25-
дигідроксихолекальциферол, який ще називають каль-
цитріолом, чи 1,25-(ОН)2О3. Також 1,25-дигідроксихоле-
кальциферол утворюється в плаценті, у кератиноцитах шкі-
ри та в макрофагах. У пацієнтів з саркоідозом 1,25-дигід-
роксихолекальциферол утворюють легеневі альвеолярні
макрофаги, очевидно, в разі стимулювання у-інтерферо-
ном. Нормальний рівень у плазмі 25-гідроксихолекальци-
феролу становить близько ЗО нг/мл, а рівень 1,25-ди-
гідроксихолекальциферолу - 0,03 нг/мл (100 пмоль/л).
Менш активний метаболіт - 24,25-дигідроксихолекальци-
ферол - теж утворюється в нирках (див. рис. 21-7).
Вітамін О3 та його похідні є секостероїдами, тобто сте-
роїдами з одним відкритим кільцем, у нашому випадку це
В-кільце (див. рис. 21-7). Крім того, 1,25-дигідроксихоле-
кальциферол є гормоном, оскільки утворюється в організ-
мі, впливає на клітини-мішені, і його переносить кров.
Механізм дії
Оскільки 1,25-дигідроксихолекальциферол є стероїдом,
то не дивно, що він діє через рецептор, який належить до
надродини рецепторів, через які стероїди, тиреоїдні гор-
мони та багато інших сполук зумовлюють зміни в експресії
генів (див. Розділ 1). Зв’язування стероїду з рецептором
впливає на ДНК-зв’язу вальну ділянку, і результатом цього
є посилення транскрипції одних мРНК та пригнічення -
інших.
Дії
Унаслідок дії 1,25-дигідрохолекальциферолу утворю-
ються мРНК, які контролюють утворення білків родини
кальбіндинів-О. Вони є представниками надродини тро-
поніну С - Са2+-зв’язувальних білків, що також містять
кальмодулін (див. Розділ 1). Кальбіндин-Оз знайдений у
кишці, мозку та нирках людини, а також у багатьох різних
тканинах щурів. В епітелії кишки та інших тканинах
індукуються два кальбіндини: кальбіндин О9К, який має
Сонячне світло
7-Дигідрохолестерол------І-----► Провітамін О,------------► (холеВк^иферол) ШКІРА
7-Дигідрохолестерол
ПЕЧІНКА
125-Пдроксилаза|
Рис. 21-7. Утворення та гідроксилювання вітаміну О3; 25-гідроксилювання відбувається в печінці, а інші типи - головно в
нирках. Наведені також формули 7-дигідроксихолестеролу, вітаміну О3 та 1,25-дигідроксихолекальциферолу.
ГОРМОНАЛЬНЕ РЕГУЛЮВАННЯ МЕТАБОЛІЗМУ КАЛЬЦІЮ ТА ФІЗІОЛОГІЯ КІСТКИ / 357
молекулярну масу 9000 та зв’язує 2 Са2+, і кальбіндин О28К
з молекулярною масою 28 000, який зазвичай зв’язує 4 Са2+,
хоч і має 6 Са2+-зв’язу вальних ділянок. У кишці збільшення
рівнів кальбіндину О9К та кальбіндину О28К залежать від
транспортування Са2\ однак точний шлях, яким вони спри-
яють проходженню Са2+ через епітелій кишки, не з’ясова-
ний. Є також докази того, що 1,25-дигідроксихолекаль-
циферол збільшує кількість Са2+-Н+-АТФ-азних молекул у
клітинах кишок; вони необхідні для нагнітання Са2+ в інтер-
стиційний простір.
Окрім збільшення абсорбції Са2+ з кишки, 1,25-дигід-
роксихолекальциферол сприяє реабсорбції Са2+ в нирках.
Він діє на кістки, де мобілізує Са2+ та РО43 , збільшуючи
кількість зрілих остеокластів, а також стимулює остеоблас-
ти, проте кінцевим результатом знову є мобілізація Са2+.
Рецептори 1,25-дигідроксихолекальциферолу виявлені
в багатьох тканинах, окрім кишки, нирок та кісток. До них
належать шкіра, лімфоцити, моноцити, скелетні та серце-
вий м’язи, молочна залоза і передня частка гіпофіза. Щораз
більше з’являється доказів того, що 1,25-дигідроксихоле-
кальциферол стимулює диференціацію клітин імунної сис-
теми та кератиноцитів у шкірі. Щодо цього простежується
збільшення частоти інфекцій у пацієнтів з нестачею віта-
міну В. Крім того, з’ясовано, що 1,25-дигідроксихолекаль-
циферол задіяний у регулюванні росту та утворенні фак-
торів росту. Однак його точну роль ще треба дослідити.
Регулювання синтезу
Утворення 25-гідроксихолекальциферолу, здається, не
регульоване надто суворо. Проте формування 1,25-дигідро-
ксихолекальциферолу в нирках, яке каталізує Іос-гідрокси-
лаза, регульоване за механізмом зворотного зв’язку вмістом
Са2+ та РО43 у плазмі (рис. 21-8). Його утворення при-
скорює паратгормон, і коли рівень Са2+ в плазмі низький,
то секреція паратгормону збільшується. Якщо ж рівень Са2+
у плазмі високий, то утворюється мало 1,25-дигідрокси-
холекальциферолу, і нирки, натомість, продукують порів-
няно неактивний метаболіт 24,25-дигідроксихолекальци-
ферол. Цей вплив Са2+ на утворення 1,25-дигідроксихоле-
кальциферолу є механізмом, що забезпечує адаптацію
абсорбції Са2+ з кишки (див. вище). Утворення 1,25-дигід-
роксихолекальциферолу також пришвидшує дія низьких,
а сповільнює дія високих рівнів РО43 у плазмі, безпосе-
редньо пригнічуючи вплив РО43 на Іос-гідроксилазу.
Додаткове контролювання за утворенням 1,25-дигідрокси-
холекальциферолу відбувається за допомогою безпосеред-
нього негативного зворотного зв’язку метаболіту на Іос-
гідроксилазу, позитивної зворотної дії на формування
24,25-дигідроксихолекальциферолу та безпосередньої дії
паращитоподібної залози - інгібування утворення мРНК
для паратгормону. Пролактин посилює активність Іос-гід-
роксилази, і кількість 1,25-дигідроксихолекальциферолу,
що циркулює, збільшена під час лактації. Естроген збіль-
шує загальну кількість 1,25-дигідроксихолекальциферолу,
що циркулює, однак цей вплив, імовірно, відбувається внас-
лідок збільшення секреції його зв’язувального білка без
помітної зміни вільного 1,25-дигідроксихолекальциферолу.
Гіпертиреоїдизм пов’язаний зі зменшенням 1,25-дигідро-
ксихолекальциферолу, що циркулює, та збільшеною час-
тотою остеопорозу. Утворення 1,25-дигідроксихолекаль-
циферолу пригнічуване метаболічним ацидозом. Гормон
росту, ХСл та кальцитонін також стимулюють утворення
1,25-дигідроксихолекальциферолу.
Рахіт та остеомаляція
Нестача вітаміну О спричинює порушення кальцифі-
кації кісткового матриксу та хворобу, що названа рахітом
у дітей та остеомаляцією в дорослих. У різко вираженому
стані в дітей рахіт зумовлює слабість та вигин опорних
кісток, зубні дефекти та гіпокальцинемію. В дорослих цей
стан менш помітний і найчастіше спричинений недостат-
ньою кількістю сонячного світла в задимлених містах,
однак тепер він все щораз є наслідком недостатнього спо-
живання провітамінів, на які діє сонячне світло в шкірі. В
таких випадках треба вживати вітамін Б. Названі захво-
рювання також можуть бути зумовлені інактивувальними
мутаціями в гені ниркової Іос-гідроксилази, у цьому випад-
ку немає відповіді на вітамін Б, проте є нормальна відпо-
відь на 1,25-дигідроксихолекальциферол (тип 1 вітамін-
Л-резистентного рахіту). В рідкісних випадках хвороба
може виникати внаслідок інактивувальних мутацій гена
рецептора 1,25-дигідроксихолекальциферолу (тип II
вітамін Л-резистентного рахіту), за якого простежується
недостатня відповідь на вітамін Б та 1,25-дигідроксихо-
л екал ьциферол.
Рис. 21-8. Механізм зворотного контролювання за утворенням
1,25-дигідроксихолекальциферолу (1,25-[ОН]2О3) з 25-гідро-
ксихолекальциферолу (25-ОН03) в нирках. Суцільні стрілки
позначають стимулювання, штрихові - пригнічення.
ПАРАЩИТОПОДІБНІ ЗАЛОЗИ
Анатомія
У людей в нормі є чотири паращитоподібні (синонім -
прищитоподібні) залози: дві вкраплені у верхні полюси щи-
топодібної залози і дві - у нижні (рис. 21-9). Проте розта-
шування паращитоподібних залоз у різних осіб та їхня кіль-
кість може помітно змінюватись. Паращитоподібну ткани-
ну іноді виявляють у середостінні.
Кожна паращитоподібна залоза добре васкуляризована,
розмірами близько 3x6x2 мм і містить два типи клітин.
Численні головні клітини, що мають помітні апарат Ґольд-
жі, ендоплазматичну сітку та секреторні гранули (рис. 21-
10), синтезують і секретують паратгормон. Менш числен-
ні та більші за розмірами оксифільні клітини містять
358 / РОЗДІЛ 21
Рис. 21-9. Паращитоподібні залози людини, вигляд ззаду.
оксифільні ґранули та велику кількість мітохондрій у цито-
плазмі. В людини до досягнення статевої зрілості їх лише
декілька, однак з віком їхня кількість збільшується. Функція
їхня невідома, хоча дехто й вважає їх деґенерованими
головними клітинами.
Синтез та метаболізм паратгормону
Паратгормон людини є лінійним поліпептидом з моле-
кулярною масою 9500, що містить 84 амінокислотні залиш-
ки (рис. 21-11). Його будова дуже подібна до будови бича-
чого і свинячого паратгормонів. Він синтезується як
частина більшої молекули, що містить 115 амінокислотних
Рис. 21-10. Переріз паращитоподібної залози людини (змен-
шено 50% з х960). Малі клітини - це головні; великі шороху-
ваті (особливо виразні в лівому нижньому куті зображення) -
оксифільні (відтворено за дозволом з Рамсей О\А/: ВІоот апсі
Ра\л/сеїі, А ТехїЬоок ої Нізіоіоду, 11іґі есі. Заипсіегз, 1986).
Людський (^)
Бичачий ф Свинячий (^)
Рис. 21-11. Паратгормон. Символи під та над будовою гор-
мону людини відображають відмінні амінокислотні залишки
бичачого та свинячого паратгормону (відтворено за дозволом
з Кеиітапп НТ еі аі: Сотріеіе атіпо асісі зециепсе ої Ііитап
рагаїїіугоісі іюгтопе. Віосїіетізігу 1978; 17 5723).
залишків (препропаратгормон). У разі надходження
препропаратгормону в ендоплазматичну сітку лідерна
послідовність виходить з амінокінця, утворюючи 90-
амінокислотний поліпептид пропаратгормон. Шість
інших амінокислотних залишків відходять з амінокінця
пропаратгормону в апараті Ґольджі, і 84-амінокислотний
поліпептид паратгормон входить у секреторні ґранули і
вивільняється як основний секреторний продукт головних
клітин.
Нормальний рівень інтактного паратгормону в плазмі
становить 10-55 пг/мл; період півжиття - близько 10 хв,
секретований поліпептид швидко розщеплюють клітини
Купфера в печінці до фрагментів з карбоксильного кінця
та середньої частини молекули, що, очевидно, є біологічно
неактивними. Паратгормон та ці фрагменти потім виходять
через нирки. Цікаво, що синтетичний поліпептид, у складі
амінокінця якого є 34 амінокислотні залишки парат-
гормону, виявляє всі відомі біологічні ефекти цілої
молекули паратгормону.
Оскільки в багатьох старих радіоімунологічних аналізах
на паратгормон використовували антитіла проти середньої
ділянки молекули, то вони, окрім інтактного гормону, ви-
значали також і фрагменти, тому давали помилково зави-
щені значення. Це особливо стосувалося хворих з нирко-
вою недостатністю, адже в них ці фрагменти не виводи-
лись. Щоб усунути цю проблему, вчені розробили дво-
сайтові імунологічні аналізи, що використовують одні
ГОРМОНАЛЬНЕ РЕГУЛЮВАННЯ МЕТАБОЛІЗМУ КАЛЬЦІЮ ТА ФІЗІОЛОГІЯ КІСТКИ / 359
антитіла проти амінокінця, а інші - проти карбоксильного
кінця молекули. Спершу плазма реагує з радіоактивно зна-
ченими амінокінцевими антитілами, а потім долучається
до кульок, до яких були зв’язані незначені антитіла до
карбоксильного кінця. Кульки відмивають і вимірюють
їхню зв’язану радіоактивність. Лише інтактний парат-
гормон впізнають обидва антитіла, завдяки чому отриму-
ють точне значення паратгормону, що циркулює (1-84).
Дії
Паратгормон діє безпосередньо на кістки, збільшуючи
їхню резорбцію та мобілізацію Са2+. Окрім збільшення Са2+
та зменшення рівня фосфату в плазмі, паратгормон збіль-
шує екскрецію фосфату з сечею. Ця фосфатурична дія є
наслідком зменшення реабсорбції фосфату в проксималь-
них канальцях. Паратгормон також збільшує реабсорбцію
Са2" в дистальних канальцях, хоча екскреція Са2" часто
збільшена в разі гіперпаратиреозу, тому що кількість фільт-
рагу перевищує вплив реабсорбції. Паратгормон також
збільшує утворення 1,25-дигідроксихолекальциферолу, а
це посилює абсорбцію Са2" з кишки.
У тривалішому часовому масштабі паратгормон стиму-
лює остеокласти та остеобласти (див. табл. 21 -2), причому
вплив на остеокласти переважає, завдяки чому більше Са24
мобілізується з кістки.
Механізм дії
Тепер уважають, що є принаймні три різні рецептори
паратгормону. Один з них також зв’язує пептид, залежний
від паратгормону (РТНгР - від англ. раШугоіб-геІаіед рго-
Іеіп) (див. нижче) і відомий як рецептор ЬРТН/РТНгР.
Інший рецептор - РТН2 (НРТН2-К) - не зв’язує РТНгР, його
виявлено в мозку, плаценті та підшлунковій залозі. Крім
того, є докази існування ще одного рецептора - СРТН, -
який реагує з карбоксильним, а не амінокінцем паратгор-
мону. Перші два рецептори серпентинові, зв’язані з 6, і
через цей гетеротримерний 6-білок активують аденілат-
циклазу, збільшуючи вміст внутрішньоклітинного цАМФ.
Рецептор ЬРТН/РТНгР також активує ФЛС через 6ч, збіль-
шуючи внутрішньоклітинний вміст Са2+ та активуючи про-
теїнкіназу С (рис. 21-12). Проте шлях, яким ці вторинні
месенджери діють на Са2+ в кістці, остаточно не з’ясований.
У випадку хвороби, названої псевдогіпопаратиреозом,
розвиваються ознаки та симптоми гіпопаратиреозу, однак
рівень паратгормону, що циркулює, нормальний або підви-
щений. Оскільки тканини не відповідають надію гормону,
то ця хвороба пов’язана з рецепторами. Є дві її форми. У
поширенішій виникає спадкове зменшення активності Оч
на 50%, і паратгормон не здатний забезпечити достатнє
збільшення концентрації цАМФ. В іншій, менш поширеній
формі, відповідь цАМФ нормальна, проте фосфосечова
дія гормону дефектна.
Регулювання секреції
Йонізований кальцій, що циркулює, діє безпосередньо
на паращитоподібні залози за механізмом негативного зво-
ротного зв’язку, регулюючи секрецію паратгормону (рис.
21-13). Ключем до такого регулювання є рецептор Са2+ у
клітинній мембрані. Цей серпентиновий рецептор зв’яза-
ний через 6-білок з фосфоінозитидним перетворенням, він
\ /
Діацилгліцерин 1,4,5-ІпзР3
І І
Активація Внутрішньоклітинна
протеїн- мобілізація
кінази С кальцію
Рис 21-12. Шляхи передавання сигналів, активованих зв’я-
зуванням ПТГ чи РТНгР з рецептором ЬРТН/йРТНгР. Внут-
рішньоклітинний цАМФ збільшується через 6з та аденілат-
циклазу (АЦ). Діацилгліцерин та ІФ3 (1,4,5-ІпзР3) збільшуються
під дією 6ч та фосфоліпази С (ФЛС) (модифіковано за
дозволом з ЗіюЬаск ОМ, 8іге\л/Іег (33: Оізогсіегз оїїйе рагаійу-
гоісіз апсі саісіит теіаЬоІізт. Іп МсРЬее 8Н еі аі. Раііюріїузі-
оіоду ої 0ізеазе, ЗгсІ есі. Мс(Зга\л/-НіІІ, 2000).
виявлений у багатьох тканинах. У паращитоподібних
залозах його активування пригнічує секрецію паратгор-
мону. Якщо рівень Са2+ у плазмі високий, то секреція парат-
гормону пригнічена, і кальцій відкладається в кістках. Як-
що ж його концентрація низька, то секреція посилюється і
Са2+ мобілізується з кісток.
Гормон 1,25-дигідроксихолекальциферолу впливає без-
посередньою на паращитоподібні залози, зменшуючи
мРНК препропаратгормону. Підвищена кількість фосфатів
Рис. 21-13. Взаємозв’язок між концентрацією Са2+ в плазмі
та відповіддю паратгормону у людини. Контрольна точка від-
повідає концентрації Са2+ у плазмі, за якої відбувається поло-
вина максимальної відповіді (модифіковано за дозволом з
Вго\л/п Е: Ехїгасеїіиіаг Са2+ зепзіпд, гедиіаїіоп ої рагаїйугоісі
сеІІ їипсііопз, апсі гоїе ої Са2+ апсі оїЬег іопз аз ехїгасеїіиіаг
(ЇІГ8Ї) глеззепдегз. РЬузіоІ Нєу 1991;71:371).
360 / РОЗДІЛ 21
у плазмі стимулює секрецію паратгормону, знижуючи кон-
центрацію Са2+ в плазмі та інгібуючи утворення 1,25-ди-
гідроксихолекальциферолу. Для підтримання нормальної
секреторної відповіді паращитоподібних залоз потрібен
магній. Погіршене вивільнення паратгормону разом з
послабленою відповіддю органа-мішені на дію паратгор-
мону призводить до гіпокальціємії, що інколи простежу-
ється внаслідок нестачі магнію.
Вплив паратиреоїдектомії
Паратгормон абсолютно необхідний для життя. Після
паратиреоїдектомії стійко знижується рівень Са2+ в плазмі.
З’являються ознаки нервово-м’язової надмірної збудли-
вості, що супроводжуються повною гіпокальціємічною
тетанією (див. вище). Звичайно, у разі зниження рівня
кальцію після паратиреоїдектомії підвищується рівень фос-
фату в плазмі, однак не завжди.
У людей тетанія найчастіше є наслідком недбалої пара-
тиреоїдектомії під час операцій на щитоподібній залозі.
Симптоми зазвичай виникають через два-три дні після опе-
рації, проте можуть не з’являтись протягом кількох тижнів
чи й більше. У щурів, які з їжею отримують малий вміст
кальцію, тетанія розвивається набагато швидше, через 6-
10 год після паратиреоїдектомії. Введення паратгормону
усуває хімічні аномалії, і симптоми зникають. Уведення
солей кальцію дає тимчасове полегшення.
Ознаки тетанії в людини охоплюють симптом Хвостека
- швидке скорочення іпсилатеральних лицьових м’язів,
зумовлене відгалуженням лицьового нерва на куті нижньої
щелепи; та симптом Труссо - спазм м’язів верхніх кін-
цівок, що спричинює згинання зап’ястя та великого пальця
з розгинанням інших пальців (рис. 21-14). В осіб з помір-
ною тетанією, в яких не виявляються спазми, симптом
Труссо іноді може бути зумовлений припиненням крово-
обігу в разі накладання манжети для вимірювання кров’я-
ного тиску.
Надлишок паратгормону
Гіперпаратиреоїдизм унаслідок уведення великих доз
екстракту паратгормону в тварин чи гіперсекреції функцій-
ної паращитоподібної пухлини в людей зумовлює гіпер-
Рис. 21-14. Положення руки у випадку гіпокальціємічної тетанії
(синдром Труссо).
кальціємію, гіпофосфатемію, демінералізацію кісток, гі-
перкальцинурію та утворення кальцієвмісних ниркових
каменів.
Хвороба кісток, спричинена тривалим гіперпарати-
реоїдизмом, - це остеофіброма, за якої відбувається фіб-
роз кісткового мозку та збільшене ремоделювання кістки
з резорбцією, що випереджає утворення кістки.
Вторинний гіперпаратиреоїдизм
У випадку таких станів, як хронічна хвороба нирок та
рахіт, за яких рівень Са2+ у плазмі хронічно низький,
стимулювання паращитоподібних залоз зумовлює компен-
саторну паращитоподібну гіпертрофію та вторинний гі-
перпаратиреоїдизм. Рівень Са2+ в плазмі низький у разі
хронічної хвороби нирок тому, що хворі нирки втрачають
здатність виробляти 1,25-дигідроксихолекальциферол.
Проте утримування фосфату з кінцевою гіперфосфатемією
також робить внесок у зменшення Са2+ в плазмі.
Родинна гіперкальціємія та гіпокальціємія
Мутації в гені рецептора Са2+ спричинюють передба-
чувані довготривалі зміни рівня Са2+ в плазмі. Гетерози-
готні за інактивувальною мутацією особи мають родинну
м’яку гіпокальцинуричну гіперкальціємію, стан, за
якого простежується хронічне помірне підвищення рівня
Са2+ в плазмі, оскільки зворотне інгібування секреції парат-
гормону кальцієм зменшене. Рівні паратгормону в плазмі
нормальні чи навіть підвищені. Проте в осіб, що є гомози-
готними за інактивувальною мутацією, розвивається нео-
натальний важкий первинний гіперпаратиреоїдизм. В
осіб з активувальними мутаціями гена рецептора Са2+
виникає родинна гіперкальцинурична гіпокальціємія
внаслідок збільшеної чутливості паращитоподібних залоз
до Са2+ в плазмі.
Пептид, подібний до паратгормону
Білок з активністю паратгормону утворюють багато
різних тканин організму. Він має 140 амінокислотних
залишків, на відміну від паратгормону, у якому їх 84, і кодо-
ваний геном 12-ї хромосоми людини, тоді як паратгормон
- геном в 11-й хромосомі. Незважаючи на це, паратгормон
та пептид, подібний до паратгормону, мають помітну гомо-
логію на їхніх амінокінцях. У цьому разі у 8 з перших 13
амінокислот однакове розташування і вони обидва зв’язу-
ються з рецептором ЬРТН/РТНгР. У хрящі, що розвиваєть-
ся, РТНгР стимулює проліферацію хондроцитів і пригнічує
їхню мінералізацію. Він, здається, також діє як фактор
росту на розвиток шкіри, волосяних фолікулів та молочних
залоз. Миша, в якої обидві копії гена РТНгР зазнали нокау-
ту, помирає невдовзі після народження і має сильні аномалії
скелета. Мутація, що робить рецептор ЬРТН/РТНгР конс-
титутивно активним, пов’язана із однією з форм карлико-
вості.
В дорослих РТНгР у великих кількостях утворюється в
молочних залозах і великі його кількості знайдені в моло-
ці. Проте його рівень у плазмі не збільшується під час лак-
тації, а функція РТНгР в молоці невідома. Пептид РТНгР
також виявлений у клубочках і канальцях нирок та в мозку,
де він є в корі головного мозку, морському конику та гра-
нулярному шарі кори мозочка.
ГОРМОНАЛЬНЕ РЕГУЛЮВАННЯ МЕТАБОЛІЗМУ КАЛЬЦІЮ ТА ФІЗІОЛОГІЯ КІСТКИ / 361
Злоякісна гіперкальціємія
Гіперкальціємія є поширеним метаболічним усклад-
ненням раку. Близько 20% гіперкальціємічних пацієнтів
мають кісткові метастази внаслідок роз’їдання кістки (міс-
цева остеолітична гіперкальціємія). Є докази, що цей
процес відбувається під впливом пухлинних простаглан-
динів, таких як ПГЕ. З’ясовано, що кілька лімфом секре-
тують 1,25-дигідроксихолекальциферол, однак це рід-
кість. Гіперкальціємія у решти 80% пацієнтів, здається, є
наслідком підвищених рівнів РТНгР (гуморальна зло-
якісна гіперкальціємія). Пухлини, що відповідають за
гіперсекрецію, - це раки молочної залози, нирок, яєчників
та шкіри.
КАЛЬЦИТОНІН
Походження
У собак перфузія щитоподібно-паращитоподібної ділян-
ки розчинами, що містять високі концентрації Са2+, веде
до зниження рівня периферійного Са2+ у плазмі, після
ушкодження ж цієї ділянки інфузії Са2+ спричинюють
збільшення Са2+ у плазмі порівняно з контрольними твари-
нами. Ці та інші спостереження привели до відкриття того,
що Са2+-знижувальний та Са2+-підвищувальний гормони
секретовані утворами в шиї; Са2+-знижувальний гормон
названо кальцитоніном. У хребетних нессавців джерелом
кальцитоніну є ультимобранхіальні тільця - пара залоз,
що мають ембріологічне походження з п’ятих зябрових
дуг. У ссавців ці тільця здебільшого є в щитоподібній зало-
зі, де ультимобранхіальна тканина поширюється навколо
фолікулів як парафолікулярні клітини, відомі ще як світ-
лі, або С-клітини (рис. 18-2 та 21-15).
Будова
Кальцитонін людини має молекулярну масу 3500 і
містить 32 амінокислотні залишки (рис. 21-16). Велика
кількість мРНК, транскрибованої з гена кальцитоніну,
зазнає процесинґу в інші мРНК у нервовій системі, завдяки
чому утворюється кальцитонін гензалежний пептид
(СВКР - з англ. саісіїопіп £епе-ге1аІе<і реріібе), а не каль-
цитонін (див. Розділ 4). Кальцитоніни інших досліджених
видів також містять 32 амінокислотні залишки, проте
амінокислотний склад значно змінюється. Цікавим є каль-
цитонін лосося, оскільки його активність у 20 разів пере-
вищує людський кальцитонін.
Рис. 21-15. Парафолікулярні клітини в щитоподібній залозі
(модифіковано з Роігіег 3, Питав ЛР: Еєуіє\а/ ої МесІісаІ Ніз-
іоіоду. ЗаипсІегз, 1977).
Секреція та метаболізм
Секреція кальцитоніну збільшується, коли щитоподібну
залозу перфузують розчинами, що містять високі концент-
рації Са2+. Вимірювання кальцитоніну, що циркулює, радіо-
імунологічним аналізом свідчить про те, що він не секре-
гується доти, доки рівень кальцію в плазмі не досягне при-
близно 9,5 мг/дл, вище цього рівня у плазмі кальцитонін
прямо пропорційний до кальцію.
Бета-адренергічні агоністи, дофамін та естрогени
також стимулюють секрецію кальцитоніну, як і гастрин,
ХЦК, глюкагон та секретин, однак гастрин має найсиль-
ніший вплив (див. Розділ 26). Рівень кальцитоніну в плазмі
підвищений у разі синдрому Золлінґера-Еллінсона (див.
Розділ 26) та перніціозної анемії, за якої також підвищу-
ється рівень гастрину в плазмі. Проте доза гастрину,
потрібна для стимулювання секреції кальцитоніну, значно
збільшує концентрацію гастрину в плазмі, ніж їжа, тому
ще рано робити висновок, що кальцій в кишці ініціює
Суз-бІу-Азп-Іеи-Зег-ТЬг-Суз-Меі-Іеи-бІу-ТІїг-Туг-ТІїг-бІп-Азр-Рґіе-Азп-
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17
Іу8-РГіе-Ні8-ТГіг-РІіе-Рго-6Іп-ТІіг-АІа-ІІе-СІу-\/аІ-(ЗІу-АІа-Рго-МН2
18 19 20 21 22 23 24 25 26 27 28 29 ЗО 31 32
Рис. 21-16. Людський кальцитонін.
362 / РОЗДІЛ 21
секрецію кальційзнижувального гормону до своєї абсорб-
ції.
Період півжиття людського кальцитоніну - менше
10 хв.
Дії
Серпентинові рецептори для кальцитоніну виявлені в
кістках та нирках. Кальцитонін знижує рівні кальцію та
фосфату, що циркулюють. Він спричинює свій кальційзни-
жувальний ефект, пригнічуючи резорбцію кістки. Ця дія
пряма, кальцитонін інгібує активність остеокластів іп уііто,
а також підсилює екскрецію Са2+ з сечею.
Точна фізіологічна роль кальцитоніну невизначена.
Вміст кальцитоніну в щитоподібній залозі людини низький,
тому після її видалення густина кісток та рівень кальцію в
плазмі є нормальними, якщо паращитоподібні залози
інтактні. Окрім цього, є лише короткочасні аномалії мета-
болізму кальцію, якщо його вводять після видалення щито-
подібної залози. Це частково можна пояснити секрецією
кальцитоніну з інших, крім щитоподібної залози, тканин.
Проте панує загальна думка, що гормон має слабкий довго-
тривалий вплив на рівень кальцію в плазмі у дорослих
тварин та людини. Крім того, хворі на медулярні карци-
номи щитоподібної залози мають дуже високі рівні кальци-
тоніну, що циркулює, однак не мають симптомів, що могли
б безпосередньо стосуватися гормону, а їхні кістки є, по
суті, нормальними. У разі нестачі кальцитоніну не було
описано жодних симптомів. У молодих осіб секретується
більше гормону, і він може відігравати роль у формуванні
скелета, а також захищати від післяобідньої гіперкаль-
ціємії. Кальцитонін захищає кістки матері від надмірної
втрати кальцію під час вагітності. Утворення кісток немов-
ляти та лактація є головними споживачами запасів кальцію,
і рівні 1,25-дигідроксихолекальциферолу під час вагітності
підвищені. Вони б спричинили втрату кісткової маси в
матері, якби резорбцію кісток одночасно не пригнічувало
збільшення рівня кальцитоніну в плазмі.
Клінічні паралелі
Кальцитонін корисний для лікування хвороби Педжета,
стану, за якого збільшена остеокластична активність спри-
чинює компенсаторне утворення неорганізованої нової
кістки. Він також має лікувальну дію у разі важкої гіпер-
кальціємїї, однак гормон треба вводити у вигляді ін’єкцій
і його вплив зазвичай втрачається.
Підсумок
Тепер можна підсумувати дію трьох головних гормонів,
що регулюють концентрацію Са2+ в плазмі. Паратгормон
збільшує концентрацію кальцію в плазмі, мобілізуючи цей
йон з кісток. Він збільшує реабсорбцію Са2+ нирками, однак
це може бути наслідком зростання відфільтрованого Са2 ,
а також посилює утворення 1,25-дигідроксихолекальци-
феролу, який підсилює абсорбцію Са2+ з кишки, мобілізує
йон з кісток та збільшує реабсорбцію кальцію нирками.
Кальцитонін пригнічує резорбцію кісток та збільшує кіль-
кість Са2+ в сечі.
ВПЛИВ ІНШИХ ГОРМОНІВ ТА
ГУМОРАЛЬНИХ РЕЧОВИН НА
МЕТАБОЛІЗМ КАЛЬЦІЮ
На метаболізм кальцію, окрім 1,25-дигідроксихолекаль-
циферолу, паратгормону, пептиду, подібного до паратгор-
мону, та кальцитоніну, впливає багато інших гормонів.
Глюкокортикоїди знижують рівні Са2+ у плазмі, пригні-
чуючи утворення та активність остеокластів; унаслідок дії
протягом тривалого часу зумовлюють остеопороз завдяки
зменшенню утворення та збільшенню резорбції кісток.
Вони зменшують утворення кістки шляхом пригнічення
білкового синтезу в остеобластах, а також сповільнюють
абсорбцію Са2+ та РО43 з кишки і збільшують ниркову екск-
рецію цих йонів. Саме тому вони пригнічують гіперкаль-
ціємію в разі інтоксикації вітаміном О, зменшення кон-
центрації Са2+ у плазмі стимулює секрецію паратгормону,
який сприяє резорбції кістки.
Гормон росту зумовлює екскрецію кальцію в сечі, проте
також підсилює кишкову абсорбцію кальцію, і ця дія може
бути більшою, ніж вплив на екскрецію з підсумковим
позитивним балансом кальцію.
ІФР-І, утворений дією гормону росту, стимулює біл-
ковий синтез у кістці. Як зазначено, тиреоїдні гормони
можуть спричинити гіперкальціємію, гіперкальцинурію та,
в деяких випадках, остеопороз.
Естрогени запобігають розвитку остеопорозу, можли-
во, шляхом безпосереднього впливу на остеобласти (див.
вище).
Інсулін сприяє утворенню кістки, тому в разі неліко-
ваного діабету простежується помітна втрата маси кіс-
ток.
Гіпофіз
22
ГІПОФІЗ
Вступ
Передню, проміжну і задню частки гіпофіза можна вва-
жати сукупністю окремих ендокринних органів, які у пред-
ставників деяких видів тварин містять 14 чи більше гор-
монально активних речовин. У людини проміжна частка є
рудиментом. Виявлено шість гормонів, що їх секретує
передня частка гіпофіза: тиреотропний гормон (ТТГ, ти-
ротропін), адренокортикотропний гормон (АКТГ),
лютеїнізувальний гормон (ЛГ), фолікулостимулюваль-
ний (ФСГ), пролактин і гормон росту (табл. 22-1). АКТГ,
пролактин і гормон росту - це прості поліпептиди чи білки,
тоді як ТТГ, ЛГ, ФСГ є глікопротеїнами. Пролактин діє на
молочну залозу. Згадані п’ять гормонів певною мірою троп-
ні, тобто вони стимулюють виділення гормонально актив-
них речовин іншими ендокринними залозами або, як у
випадку з фактором росту, печінкою чи іншими тканинами
(див. нижче). Крім того, передня частка гіпофіза виділяє
р-ліпотропін (р-ЛПГ). Цей одношаровий поліпептид має
91 залишок амінокислот і, хоча його фізіологічна роль точ-
но не відома, містить послідовності амінокислот, які є в
структурі ендорфінів та енкефалінів - пептидів, що зв’я-
зуються із опіатними рецепторами (див. Розділ 4). Передня
і проміжна частки містять також інші гормонально активні
похідні молекули проопіомеланокортину (див. нижче). Гор-
мони, тропні до кожної ендокринної залози, розглянуто в
інших розділах: ТТГ - у Розділі 18; АКТГ - у Розділі 20;
гонадотропіни ФСГ і ЛГ та пролактин - у Розділі 23. Гор-
мони (окситоцин і вазопресин), що їх виділяє задня частка
гіпофіза у ссавців, та нервове регулювання секреції перед-
ньої і задньої часток гіпофіза описані у Розділі 14. Гормон
росту, р-ліпотропін і меланотропні гормони (МТГ) про-
міжної частки гіпофіза а-МТГ та р-МТГ є темою цього
розділу поряд із загальними відомостями про гіпофіз.
Таблиця 22-1. Гормони гіпофіза у ссавців1
Назва і джерело Основна дія
Передня частка Тиреотропний гормон (ТТГ, тиротропін) Стимулює виділення гормонів щитоподібною залозою та її ріст
Адренокортикотропний гормон (АКТГ, кортикотропін) Стимулює секрецію і ріст пучкової та сітчастої зон кори над- ниркових залоз
Гормон росту (ГР, соматотропін, СТГ) Прискорює ріст тіла; стимулює виділення інсуліноподібного фактора росту І (ІФР-І)
Фолікулостимулювальний гормон (ФСГ) Стимулює ріст фолікула в яєчнику у жінок та сперматогенез у чоловіків
Лютеїнізувальний гормон (ЛГ) Стимулює овуляцію та лютеїнізацію оваріальних фолікулів у жінок та виділення тестостерону у чоловіків
Пролактин (ПРЛ) Стимулює виділення молока і поведінку матері
р-Ліпотропін (р-ЛПГ) ?
у-Меланотропний гормон (у-МТГ) Див. Проміжна частка
Проміжна частка а-, р-, у-Меланотропні гормони (а-, р-, у-МТГ; загальна назва меланотропін, чи інтермедин) Проліферація меланофорних клітин у риб, амфібій та реп- тилій; стимулює синтез меланіну меланоцитами у людей в серці
у-Ліпотропін (у-ЛПГ), кортикотропіноподібний пептид про- міжної частки (КППП), інші фрагменти проопіомеланокор- тину ?
Задня частка Вазопресин (антидіуретичний гормон, АДГ) Сприяє затримуванню рідини
Окситоцин Зумовлює виділення молока, скорочення матки вагітних
1 Крім того, різні шлунково-кишкові та інші поліпептиди виявлені в одній чи кількох частках гіпофіза: холецистокінін (ХЦК),
гастрин, ренін, ангіотензин II, пептид, споріднений з геном кальцитоніну (ПСГК).
364 / РОЗДІЛ 22
МОРФОЛОГІЯ
Загальна анатомія
Анатомія гіпофіза показана на рис. 22-1 і детально опи-
сана у Розділі 14. Задня частка гіпофіза утворена більше з
закінчень кровоносних судин аксонів із супраоптичного
та паравентрикулярного ядер гіпоталамуса, тоді як передня
має спеціальний судинний зв’язок з головним мозком через
портальні гіпофізарні судини. Проміжна частка формуєть-
ся під час ембріонального розвитку із дорсальної частини
кишені Ратке вип’ячуванням верхньої стінки глотки,
однак тісно зростається із задньою часткою у дорослих.
Вона відділена від передньої частки рештками кишені Рат-
ке і залишковою щілиною.
ГІСТОЛОГІЯ
У задній частці закінчення супраоптичних та паравен-
трикулярних аксонів розміщені поблизу кровоносних су-
дин. У деяких видів ці закінчення мають вигляд віникопо-
дібних структур. Розрізняють також пітуїтоцити - зірчасті
клітини, що містять кульки жиру; раніше вважали, що вони
виділяють гормони задньої частки, а сьогодні їх трактують
як модифіковану астроглію.
Проміжна частка є рудиментом у людей та інших пред-
ставників ссавців: у них більшість клітин аґранулярні, хоча
часто трапляються базофільні елементи, що є клітинами
передньої частки. Вздовж залишкової щілини розміщені
маленькі тиреоїдоподібні фолікули, деякі містять незначну
кількість колоїду. Функція колоїду досі невідома.
Передня частка гіпофіза побудована із переплетених клі-
тинних тяжів і розгалуженої сітки синусоїдних капілярів.
Ендотелій капілярів фенестрований і нагадує ендотелій
інших ендокринних органів. Клітини містять ґранули із
накопиченим гормоном, які відходять з клітини шляхом
екзоцитозу. Проникнення гранул у капіляри не виявлено,
тому, ймовірно, що вони розпадаються у перикапілярній
зоні.
Типи клітин передньої частки гіпофіза
Клітини передньої частки гіпофіза людини традиційно
поділяють за реакціями їхнього забарвлення на хромофобні
та хромофільні. Відповідно, хромофільні клітини бувають
Рис. 22-1. Схема формування гіпофіза та різних його частин
у дорослих.
ацидофільними, що їх забарвлюють кислі барвники, і базо-
фільними, що їх забарвлюють лужні барвники. Багато хро-
мофобних клітин є секреторними, вони неактивні і містять
незначну кількість секреторних гранул. Інші клітини - це
зірчасті (фолікулярні) (див нижче). За допомогою імуно-
цитохімічних і електронно-мікроскопічних методів вияв-
лено п’ять типів секреторних клітин, а саме: соматотропні,
які виділяють гормон росту; лактотропні (їх називають
також мамотропними), які виділяють пролактин; тирео-
тропні, що виділяють ТТГ; гонадотропні, що виділяють
ЛГ та ФСГ; кортикотропні, які виділяють АКТГ і р-ЛПГ.
Характеристики цих клітин наведені у табл. 22-2. їхня
поява та вміст гранул можуть змінюватися зі змінами
гормонального статусу. Зазначимо, що відповідно до цієї
класифікації два чи більше поліпептидних гормонів можуть
бути виділені декількома типами клітин.
Передня частка гіпофіза містить також зірчасті клітини,
які утворюють відростки між секреторними клітинами.
Доведено, що ці клітини містять і виділяють цитокін інтер-
лейкін 6 (ІЛ-6) (див. Розділ 27), однак їхня фізіологічна
роль невизначена.
Двосубодинична структура ФСГ, ЛГ, ТТГ
Усі три гіпофізарні глікопротеїнові гормони ФСГ, ЛГ,
ТТГ утворені з двох субодиниць. Кожна субодиниця - їх
позначено а і р - має певну активність, однак для прояву
максимальної фізіологічної дії вони повинні об’єднатися.
Крім того, у плацентарному глікопротеїні - хоріонічному
гонадотропіні людини (ХГл) - також є а- і р-субодиниці
(див. Розділ 23). Усі а-субодиниці цих гормонів - продукти
одного гена, у них однаковий амінокислотний склад, проте
різні залишки вуглеводів. Бета-субодиниці, що їх проду-
кують різні гени, відрізняються за структурою і надають
гормону специфічності. Альфа-субодиниці надзвичайно
взаємозамінні, тому, як наслідок, можуть утворюватися гіб-
ридні молекули. Фізіологічне й еволюційне значення уні-
кальної двосубодиничної структури цих глікопротеїнових
гормонів недостатньо вивчене.
ГОРМОНИ ПРОМІЖНОЇ ЧАСТКИ
Проопіомеланокортин
Клітини проміжної і кортикотропоцити передньої час-
ток синтезують великий білок-попередник, унаслідок роз-
щеплення якого виникає група гормонів. Після видалення
сигнального пептиду утворюється прогормон, відомий як
проопіомеланокортин (ПОМК). Синтезування цієї моле-
кули відбувається також у гіпоталамусі та інших части-
нах нервової системи, легенях, шлунково-кишковому
тракті і плаценті (див. Розділ 4). Структуру молекули
зображено на рис. 22-2. У кортикотропоцитах цей про-
гормон гідролізує до АКТГ, р-ЛПГ і невеликої кількості
р-ендорфіну, після чого ці субстанції виділяються. У про-
міжній частці ПОМК далі гідролізує до корти котроп і не-
подібного пептиду проміжної частки (КППП), у-ЛПГ і
значної кількості р-ендорфіну. Функції КППП і у-ЛПГ
невідомі, а р-ендорфін є опіоїдним пептидом (див. Розділ
4), має п’ять амінокислотних залишків метенкефаліну з
його И-кінця у людини. Утворюються також а- і р-МТГ.
ГІПОФІЗ / 365
Таблиця 22-2. Гормоносекретувальні клітини передньої частки гіпофіза у людини
Тип клітин Гормони, які виділяють % від загальної кіль- кості секреторних клітин Здатність до забарвлення Діаметр секреторних ґранул, нм
Соматотропні Гормон росту 50 Ацидофільні 300^00
Лактотропні Пролактин 10-30 Ацидофільні 200
Кортикотропні АКТГ, р-ЛПГ 10 Базофільні 400-550
Тиреотропні ТТГ 5 Базофільні 120-200
Гонадотропні ФСГ, ЛГ 20 Базофільні 250-400
Проміжна частка є рудиментом, і в дорослих а- чи р-МТГ
інколи не виділяються.
Контроль за пігментацією шкіри
Риби, рептилії та амфібії змінюють колір шкіри для тер-
морегулювання, маскування та підтримання реакцій пове-
дінки. Вони це роблять завдяки руху чорних чи коричневих
гранул до чи з периферії пігментних клітин, які називають
меланофорами. Гранули утворені з меланіну, що синте-
зується з ДОФА (див. Розділ 4) і ДОФА-хінону. Рух гранул
контролюють різні гормони і нейротрансмітери, у тім числі
а- і р-МТГ, меланіноконцентрувальний гормон, мелатонін
і катехоламіни.
У ссавців немає меланофорів із пігментними гранулами,
які поширюються й аґреґують, однак є меланоцити, що ма-
ють меланосоми і синтезують меланіни. Меланоцити пере-
носять далі меланосоми до клітин шкіри (кератиноцитів) та
волосяних фолікулів. Це причина пігментації волосся і шкі-
ри. Меланоцити мають рецептори до меланотропіну 1, од-
ного із декількох типів рецепторів меланотропіну, які кло-
новано. Лікування з використанням МТГ посилює синтезу-
вання меланіну і зумовлює ледь видиме потемніння шкіри
людей протягом 24 год. Як зазначено вище, а- і р-МТГ не
циркулюють у дорослих людей, і їхня функція невідома.
АКТГ зв’язується із рецепторами до меланотропіну 1.
Порушення пігментації у людини
Зміни пігментації у разі деяких ендокринних захворю-
вань спричинені змінами у циркулюванні АКТГ. Наприк-
лад, ненормальна блідість є ознакою гіпопітуїтаризму. Гі-
перпіґментація виникає у пацієнтів із недостатністю кори
надниркових залоз внаслідок захворювання надниркових
Сигнальний
пептид
(-131)
у- МТГ
(-55 до -44)
АКТГ (1-39) р-ЛПГ (42-134)
ПЧ і ПрЧ
Фрагмент амінозакінчення
р-лпг
І Швидко в ПрЧ
І Повільно в ПЧ
^Тільки ПрЧ
у-МТГ а-МТГ КППП
(1-13) (18-39)
у-ЛПГ р-Ендорфін
(42-101) (104-134)
р-МТГ Метенкефалін
(84-101) (104-108)
Рис. 22-2. Схематичне зображення молекули препроопіомеланокортину, що утворюється в клітинах гіпофіза, нейронах та
інших тканинах. Номери в дужках означають послідовність амінокислот у кожному поліпептидному фрагменті. Для зручності
амінокислотні послідовності пронумеровані від М-кінця АКТГ і читаються до С-кінця батьківської молекули, тоді як амінокислотна
послідовність іншої частини молекули - наліво до -131, в М-кінець батьківської молекули. Розташування Ьуз-Агд та інших пар
головних амінокислотних залишків також показано; це ділянки протеолітичного розщеплення в разі утворення менших
фрагментів батьківської молекули; ПЧ - передня частка; ПрЧ - проміжна частка.
366 / РОЗДІЛ 22
залоз. Справді, наявність гіперпіґментації у поєднанні з
недостатністю кори надниркових залоз свідчить про те,
що недостатність є вторинною стосовно до хвороби гіпо-
фіза чи гіпоталамуса, оскільки в разі цих станів АКТГ у
плазмі не є підвищеним (див. Розділ 20).
Альбіноси мають вроджену неспроможність синтезу-
вати меланін. Альбінізм виникає у людей та багатьох інших
видів ссавців. Він може бути спричинений різними гене-
тичними дефектами на шляху синтезу меланіну. У випадку
неповного альбінізму виникають плями на шкірі, що
пов’язано зі зменшенням меланіну внаслідок вроджених
дефектів у міграції попередників пігментної клітини із
нервового валика під час ембріонального розвитку. Не тіль-
ки стан, а й точний характер втрати пігментації передається
з покоління в покоління. Вітиліго - захворювання, спри-
чинене подібною втратою меланіну, - виникає після народ-
ження і прогресує упродовж життя.
ГОРМОН РОСТУ
Біосинтез І ХІМІЯ
Довге плече 17-ї хромосоми людини містить кластер
гормону росту - хоріонічного соматомамотропіну людини
(ХСл) з п’яти генів: перший, ГРл-Н (нормальний), кодує
найпоширенішу форму гормону росту; другий, ГРл-В (ва-
ріантний), - іншу форму гормону росту (див. нижче); два
кодують ХСл (див. Розділ 23), а п’ятий, імовірно, ХСл, є
псевдогеном.
Нормальний гормон росту людини - це продукт ГРл-
Н, він становить 75% усіх молекул ГРл, що циркулюють.
Завдяки молекулярній масі - 22 000 він відомий також як
22 К ГРл. На рис. 22-3 показано його структуру, яку порів-
няно зі структурою ГРл, що також має 191 амінокислот-
ний залишок і відрізняється тільки за 29 залишками. Ген
ГРл-В, який первинно виділяється у плаценті, продукує
191-амінокислотний гормон росту, що відрізняється від
нормального людського гормону росту 13 амінокислота-
ми, розкиданими по поліпептидному ланцюгу. Помітна
кількість гормону простежується в циркуляції лише під
час вагітності. Матрична РНК, яку продукує ген ГРл-Н,
підлягає альтернативному сплайсингу з утворенням
гормону росту, ідентичного до 22 К ГРл, за винятком
делегованих амінокислотних залишків 32-46. Менша
форма - 20 К ГРл - також є біологічно активною і ста-
новить близько 10% гормону росту, що циркулює. Фізіоло-
гічне значення наявності двох основних форм - 22 К і
20 К - невідоме. Крім того, в кров’яному руслі виявлені
дезаміновані та різні інші форми, що свідчить про мно-
жинність типів гормону росту в організмі.
Рис. 22-3. Структура головної форми гормону росту людини (неперервний ланцюг). Темними проміжками позначені дисульфідні
мостики; 29 залишків уздовж ланцюга визначають залишки, які відрізняються у хоріонічному соматомамотропіні людини (ХСл;
див. Розділ 23). Усі інші залишки у ХСл є такими самими, і ХСл також має 191 амінокислотний залишок.
ГІПОФІЗ / 367
Видова специфічність
Виявлено значні відмінності у структурі гормону росту
між різними видами. Гормон росту, що виділяється у свині
і хом’ячка, має короткочасну дію у морської свинки, мож-
ливо тому, що він стимулює швидке утворення антитіл до
гормону росту. У мавп і людини гормон росту бика і свині
не має навіть значного короткочасного впливу на ріст. Хоча
мавп’ячий і людський гормони росту, повністю активні,
виявлено як у мавпи, так і в людини. Гормон росту людини
має також лактогенну активність.
Концентрації у плазмі, зв’язування і
метаболізм
Гормон росту пов’язаний з білком плазми, що є великим
фрагментом позаклітинного домену рецептора гормону
росту (див. нижче). Він виникає внаслідок розщеплення
рецепторів у людини, його концентрація є показником кіль-
кості рецепторів гормону росту у тканинах. Близько поло-
вини активного гормону росту перебуває у зв’язаній формі,
що є джерелом гормону для компенсації широкомасштаб-
них коливань під час його секреції (див. нижче).
Гормон росту швидко розщеплюється, принаймні част-
ково, у печінці. Період півжиття гормону росту, що цирку-
лює, у людини становить 6-20 хв. З’ясовано, що добове
виведення гормону росту у дорослих - 0,2-1,0 мг/добу.
У нормі базальний рівень гормону росту в плазмі дорос-
лої людини, визначений радіоімунологічним методом, -
менше 3 нг/мл. Він головно представлений 22 К ГРл,
оскільки спорідненість 20 К ГРл для більшості антитіл
становить близько 30% від спорідненості 22 К ГРл. Білок-
зв’язану і вільну форми гормону визначають радіоіму-
нологічним методом, оскільки антитіла, які використову-
ють для цього, мають більшу спорідненість до гормону,
ніж до зв’язувальних білків.
Рецептори гормону росту
Рецептором гормону росту є білок, що складається з
620 амінокислот, має велику позаклітинну частину, транс-
мембранний домен і велику цитоплазматичну частину. Він
належить до надродини цитокінових рецепторів, розгля-
нутих у Розділі 27.
Гормон росту має дві ділянки зв’язування з рецептором,
і коли він зв’язується з однією субодиницею рецептора, то
інша зв’язувальна ділянка притягує іншу субодиницю,
утворюючи гомодимер (рис. 22-4). Димеризація є в основі
активування рецептора.
Рис. 22-4. Головні сигнальні шляхи, активовані димеризацією рецептора фактора росту (РФР). Підтверджені реакції впливу
гормону росту позначені суцільними стрілками і забарвленими молекулами. Штрихові стрілки і незабарвлені молекули відоб-
ражають ефекти, зумовлені факторами росту, однак поки що не виявлені для гормону росту. Детальніше шлях від 6гЬ2 до
МАР К та ФЛС-шлях розглянуто у Розділі 1; СЬЕ-1, (ЗІЕ-2 - елементи інтерферон у-активованої відповіді; СІР - субстрат
інсулінового рецептора; р90Р8К - 86 кіназа; ФЛА2 - фосфоліпаза А2; 81Е - 8із-індукований елемент; ЕСВ - елемент сироваткової
відповіді; ФСВ - фактор сироваткової відповіді; ТСЕ - фактор четвертинного комплексу. Гени, активовані у випадку С-їоз (див.
Розділ 1): Р450-ЗА10 - цитохром; 8рі 2.1 - інгібітор серинової протеази (модифіковано за дозволом з Агдеізіпдег 18, Сагїег-8у
С: Месїіаізт ої зідпаїїіпд Ьу дго\л/їГі їюгтопе гесеріог. РГіузіоІ Кєу 1996;76.1089).
368 / РОЗДІЛ 22
Гормон росту виконує багато функцій в організмі (див.
нижче). Хоча поки що неможливо визначити кореляцію
між його внутрішньоклітинним впливом і дією на весь
організм, та відомо, що, як і інсулін, він активує різнома-
нітні внутрішньоклітинні ензимні каскади (див. рис. 22-
4). Потрібно зазначити про активування гормоном росту
.)АК2-8іа( шляху. ЗАК2 є представником родини Дапиз, до
якої належать цитоплазматичні тирозинові кінази. Білки
8іаі (провідники сигналів і активатори транскрипції) нале-
жать до родини цитоплазматичних факторів транскрип-
ції, які після фосфорилювання 1АК кіназами мігрують до
ядра й активують різні гени. ДАК-Зіаі шлях також опосе-
редковує дію пролактину та різних факторів росту.
Вплив на ріст
У молодих тварин, у яких епіфізи ще не злилися з дов-
гими кістками (див. Розділ 23), ріст пригнічує гіпофізек-
томія (рис. 22-5), а стимулює гормон росту. Хондрогенез у
цьому випадку прискорений, і оскільки хрящові епіфізіаль-
ні пластинки розширюються, то вони відкладають більше
кісткового матриксу на кінцях довгих кісток (рис. 22-6).
Унаслідок цього розміри тіла збільшуються, тому довго-
тривале лікування гормоном росту призводить до гіган-
тизму.
Якщо епіфізи закриті, то лінійний ріст стає неможли-
вим, а гормон росту спричинює характерну деформацію
кісток і м’яких тканин, відому у людини як акромегалія
(рис. 22-7). Розміри більшості внутрішніх органів у цьому
разі збільшені. Ендокринні органи можуть також підпадати
під вплив гормону росту, який діє синергічно з АКТГ, спри-
чинюючи збільшення розмірів надниркових залоз, та з
Рис. 22-6. Вплив лікування гормоном росту упродовж чоти-
рьох днів на проксимальні епіфізи гомілкової кістки щурів після
епіфізектомії. Простежується збільшення ширини незабарв-
леної хрящової пластинки великогомілкової кістки у лікованої
тварини праворуч (для порівняння ліворуч наведено конт-
роль) (відтворено за дозволом з Еуапз НМ еі аГ Віоаззау ої
рйиііагу дгоууйі Ьогтопе. Епсіосгіпоіоду 1943;32:14).
андрогенами, зумовлюючи збільшення додаткових репро-
дуктивних органів. Вміст білка в організмі за цих умов
збільшується, а вміст жиру зменшується.
Вплив на метаболізм білків та електролітів
Гормон росту є анаболічним гормоном для білків, він
забезпечує позитивний баланс азоту та фосфору, збільшен-
ня вмісту фосфору у плазмі і зменшення вмісту сечовин-
*
Рис. 22-5. Вплив гіпофізектомії на ріст незрілої резус мавпи.
Два роки тому обидві мавпи мали однаковий зріст і масу,
пізніше тварині ліворуч було виконано гіпофізектомію (від-
творено за дозволом з КпоЬіІ Е іп бгоміїї іп Ііуіпд Зузіетз.
2агго\л/ МХ [есіііог]. Вазіс Воокз, 1961).
Гірсутизм
Гінекомастія
і лактація
Збільшений розмір
кисті та стопи
Прогнатія й
акромегалічне обличчя
Рис. 22-7. Характерні зміни у разі акромегалії.
Остеоартричні
зміни
хребта
Зміни полів зору
(бітемпоральна геміанопія)
Є з
ГІПОФІЗ / 369
ного азоту та амінокислот у крові. У дорослих із його
недостатністю створений за рекомбінантною технологією
гормон росту людини спричинює збільшення маси тіла і
зменшення кількості жиру поряд зі зростанням метаболіч-
ної активності і зниженням рівня холестеролу в плазмі кро-
ві. Одночасно посилюється всмоктування кальцію у шлун-
ково-кишковому тракті. Екскреція натрію і калію пригні-
чена незалежно від впливу надниркових залоз, імовірно
тому, що ці електроліти переходять з нирок до тканин, що
ростуть. Під час росту і в разі акромегалії, а також багатьох
інших захворювань посилюється екскреція амінокислоти
4-гідроксипроліну. Більша частина виділеного гідрокси-
проліну походить з колагену, тому екскреція гідроксипро-
ліну збільшується у випадку захворювань, пов’язаних з
активним руйнуванням колагену. Цей процес також поси-
люється під час активного синтезування розчинного кола-
гену, що його стимулює саме гормон росту.
Вплив на метаболізм вуглеводів і жирів
Вплив гормону росту на метаболізм вуглеводів розгля-
нуто у Розділі 19. Гормон росту має діабетогенну дію,
оскільки підвищує виділення печінкової глюкози і виявляє
антиінсуліновий ефект у м’язах. Він також має кетогенну
дію, оскільки підвищує рівень вільних жирних кислот
(ВЖК), що циркулюють у крові. Збільшення ВЖК, що
виникає через декілька годин, є джерелом енергії для тка-
нин під час гіпоглікемії, голодування чи стресу. Гормон
росту прямо не стимулює В-клітини підшлункової залози,
однак посилює здатність цієї залози реагувати на інсуліно-
генні подразники, такі як аргінін чи глюкоза. Це додаткове
свідчення того, як названий гормон сприяє росту, оскільки
інсулін має анаболічний ефект щодо білків (див. Розділ 19).
Соматомедини
Вплив гормону росту на ріст, хрящову тканину та мета-
болізм білків залежить від взаємодії між цим гормоном і
соматомединами, які є поліпептидними факторами росту,
що їх виділяє печінка й інші тканини. Перший виділений
такий фактор названо фактором сульфатації, оскільки він
стимулює проникнення сульфату у хрящову тканину. Однак
згодом з’ясували, що він також стимулює утворення кола-
гену, тому назву змінено на соматомедин. Крім того, сьо-
годні відомо велику різноманітність соматомединів; вони
є членами великої родини факторів росту, які впливають
на різні тканини й органи.
Головними (а у людини, ймовірно, єдиними) соматоме-
динами, що циркулюють, є інсуліноподібний фактор рос-
ту І (ІФР-І, соматомедин С) та інсуліноподібний фактор
росту II (ІФР-ІІ). Ці фактори дуже подібні до інсуліну,
однак у їхньому складі є С-ланцюги (рис. 22-8) і продов-
жений А-ланцюг, який ще називають П-доменом. Гормон
релаксин (див. Розділ 23) теж член цієї родини. У людини
розрізняють дві споріднені форми релаксину; обидві вони
подібні до ІФР-ІІ. Варіантна форма ІФР-І, на 1Ч-кінці якої
нема залишків трьох амінокислот, виявлена у головному
мозку людини; є також декілька варіантних форм людсь-
кого ІФР-ІІ (рис. 22-9). Матричну РНК ІФР-І, ІФР-ІІ знай-
дено в печінці, хрящовій і багатьох інших тканинах, що
свідчить про їхній синтез у цих тканинах.
Властивості ІФР-І, ІФР-ІІ та інсуліну наведено у табл.
22-3. Обидва фактори тісно пов’язані з конкретними біл-
ками плазми крові, що продовжує період півжиття фактора
у кровообігу. Виявлено шість ІФР-зв’язувальних білків з
різним поширенням у тканинах. Вони всі містяться в плаз-
мі, причому ІФР-зв’язувальний білок-3 (ІФРЗБ-З) забез-
печує 95% зв’язування ІФР у кровоплині. Внесок ІФР в
інсуліноподібну активність у крові розглянуто у Розділі 19.
Рецептор ІФР-І дуже подібний до інсулінових рецепторів
і, вірогідно, використовує такі самі внутрішньоклітинні
механізми дії. Рецептор ІФР-ІІ є рецептором манозо-6-
фосфату (див. рис. 19-6), що задіяний у внутрішньоклі-
тинному прикладенні кислої гідролази та інших білків до
внутрішньоклітинних органел. Секреція ІФР-І не залежить
від гормону росту до народження, однак стимульована ним
після народження і має помітну ростостимулювальну
активність. Його концентрація в плазмі крові збільшується
в дитячому віці, досягає максимального рівня під час ста-
тевого дозрівання і спадає до низького рівня у старечому
віці. ІФР-ІІ значно менше підпадає під вплив гормону росту
і відіграє роль у рості плоду до народження. У людського
плоду з надмірною експресією цього фактора непропор-
ційно ростуть органи, зокрема, язик, м’язи, нирки, серце і
печінка. У дорослих ген ІФР-ІІ експресується тільки у
хоріоїдальному сплетенні і мозкових оболонках.
В С А 0
।--------------------------- Н--------------И-------------------- Н------
І
ІФР-І СРЕТЬССАЕЬУОАЬ0ЕУССПКСЕ¥Е№РТС¥С885ККАР0ТСІУОЕССЕК5СОЬКЕЕЕМ¥САРЬКРАК5А
ІФР-ІІ А¥КР8ЕТЬСССЕЕУОТЬ0ЕУСС0КСЕ¥Р8КРА--8КУ8КК8К--8ІУЕЕССГК8СЕЕАЕЬЕТ¥САТ--РАК8Е
Інсулін ЕУК0НЬСС8НЬУЕАЬ¥ЬУССЕКСГГ¥ТРКТ
СІ¥Е0ССТ8ІС8Ь¥0ЬЕК¥СЕ
Рис. 22-8. Будова ІФР-І, ІФР-ІІ та інсуліну людини із вишикуваними в ряд амінокислотними залишками для демонстрації
гомологічних, які позначені кольоровими ділянками. Коди з однієї букви використані для амінокислотних залишків. Зазначимо,
що в інсуліні С-пептиду нема, тоді як у ІФР-І, ІФР-ІІ А- і В-ланцюги (домени) зв’язані С-пептидом. Крім того, є 13-домени
(модифіковано і відтворено за дозволом з Вага УР, НаІІ К: Іпзиііп-Ііке дго\л4:ґі Тасіогз алеї ІНеіг Ьіпсііпд ргоіеіпз РНузіоІ Рєу
1990;70:591).
25 367-2
370 / РОЗДІЛ 22
Таблиця 22-3. Порівняння інсуліну та інсуліноподібних факторів росту
Інсулін ІФР-І ІФР-ІІ
Інші назви Соматомедин С Активність, що стимулює поділ клітин
Кількість амінокислот 51 70 67
Джерело В-клітини підшлункової залози Печінка та інші тканини Різні тканини
Концентрація регульована Глюкозою Гормоном росту, харчуванням Невідомо
Концентрація у плазмі 0,3-2,0 нг/мл 10-700 нг/мл максимальна у період пубертату 300-800 нг/мл
Зв’язувальний білок плазми Ні Так Так
Головна фізіологічна дія Регулювання метаболізму Ріст кісткової і хрящової тканин Ріст під час внутрішньоутроб- ного розвитку
Безпосередня та опосередкована дія
гормону росту
Інтерпретації механізмів впливу гормону росту зміню-
вались, аж доки не отримали нових даних. Початково вва-
жали, що гормон росту зумовлює ріст, безпосередньо дію-
чи на тканини, згодом - винятково через посередництво
соматомединів. Проте якщо гормон росту ввести в один із
проксимальних великогомілкових епіфізів, то виникає
однобічне збільшення ширини хряща, оскільки хрящ, як і
інші тканини, виробляє ІФР-І. Недавно запропоновано
гіпотезу, що пояснює такі наслідки дії гормону росту на
хрящ шляхом перетворення стовбурових клітин у клітини,
які відповідають на вплив ІФР-І. Після цього ІФР-І, який
виробляється локально і потрапляє в кровообіг, зумовлює
ріст хряща.
Рис. 22-9. Первинна структура людського ІФР-ІІ і трьох вияв-
лених варіантів; продовження з 21-го залишка амінокислоти
на карбоксильному кінці; тетрапептидна заміна 8ег-29 і три-
пептидна заміна 8ег-33. Коди з одної букви використані для
амінокислотних залишків (відтворено за дозволом з 8ага \/К,
НаІІ К: Іпзиііп-ііке дго\л/іН їасіогз апсі ІНеіг Ьіпсііпд ргоіеіпз РїіузіоІ
Рєу 1990;70:591)
Значення ІФР-І, що циркулюють, є важливим, оскільки
введення ІФР-І щурам після гіпофізектомії відновлює ріст
кісток і тіла.
На рис. 22-10 підсумовано сучасні погляди на дію гор-
мону росту та ІФР-І. Гормон росту, ймовірно, діє спільно
з циркулювальними і локально продукованими ІФР-І,
зумовлюючи принаймні деякі з названих ефектів.
Ппоталамічний контроль за виділенням
гормону росту
Виділення гормону росту контрольоване гіпоталаму-
сом. Гіпоталамус виділяє соматотропін-рилізинг гормон
(СТР-РГ) та інгібувальний гормон гормону росту сомато-
статин у портальну гіпофізальну кров, тому ураження гіпо-
таламуса чи перерізання гіпофізальної ніжки пригнічує
виділення гормону росту. Якщо гормон росту виділяється
постійно і тривалий час або тільки у дітей, то важко зрозу-
міти гіпоталамічний контроль його секреції. Проте велика
кількість гормону росту міститься у гіпофізах як дорослих,
так і дітей; рівень виділення гормону росту тут значно і
швидко спонтанно коливається, а не лише зростає чи
спадає у відповідь надію специфічних стимулів. Виділення
СТР-РГ є епізодичним і зростає після більшості, однак не
всіх, викидів гормону росту. Виділення соматостатину у
портальну кров є детермінованішим.
Механізм виділення гормону росту регульований зво-
ротним зв’язком, як і секреція інших гормонів передньої
частки гіпофіза. Гормон росту підвищує кількість ІФР-І,
що циркулюють у крові, а ІФР-І, відповідно, пригнічує
виділення гормону росту гіпофізом та стимулює виділення
соматостатину (рис. 22-11).
Чинники, які впливають на виділення
гормону росту
Як зазначено, базальна концентрація гормону росту в
плазмі крові в нормі у дорослих коливається від 0 до
З нг/мл. У дітей вона несуттєво вища. Проте показники
секреції не можна оцінювати за одним значенням, оскільки
протягом дня відбуваються нерегулярні її стрибки (див.
нижче). Виділення гормону росту зменшується у старшому
віці, тому особливий інтерес становить його введення для
противаги процесів старіння (див. Розділ 1). Гормон, як
ГІПОФІЗ / 371
ГР
і і г
Затримка Послаблена Ліполіз
Ма+ чутливість
інсуліну
ІФР-І
Інсуліно- Антиліполі-
подібна дія тична дія
Синтезування Ріст
білка епіфізів
Синтез Ріст
білка епіфізів
Рис. 22-10. Сучасний погляд на дію, опосередковану гормоном росту, інсуліноподібним фактором росту ІФР-І (з дозволу Р
СІагк і Сезипсіїїеіі).
відомо, збільшує “пісну” масу тіла і зменшує жирові
відкладення, однак не зумовлює статистично вірогідного
підвищення м’язової сили чи розумового розвитку.
Чинники, які посилюють виділення гормону росту, уза-
гальнені в табл. 22-4. Більшість з них належать до складу
трьох головних категорій: такі стани, як гіпоглікемія і голо-
дування, за яких простежується справжнє чи загрозливе
зменшення кількості субстратів для вироблення енергії у
клітинах; стани, у разі яких збільшується кількість певних
амінокислот у плазмі; стресові фактори. Підтверджено, що
відповідь на глюкагон можна використати як тест меха-
нізму виділення гормону росту у пацієнтів з ендокринними
захворюваннями. Хоча зміни кількості гормону росту у
відповідь на дію інших чинників порівняно однакові, та
вони все ж можуть відрізнятися у різних осіб. Максималь-
ний рівень секреції гормону росту виникає із помітною
регулярністю під час сну, проте значення взаємовідношень
між гормоном росту і сном досі є загадкою. Виділення гор-
мону росту збільшене в осіб, що повільно засинають (див.
Розділ 11), і пригнічене під час нормального швидкого сну.
Уведення глюкози знижує рівень гормону росту в плазмі
і пригнічує відповідь на фізичне навантаження. Підвищен-
ня, зумовлене дією 2-дезоксиглюкози, виникає внаслідок
внутрішньоклітинної недостатності глюкози, оскільки ця
сполука блокує катаболізм глюкозо-6-фосфату. Статеві гор-
мони, зокрема естрогени, посилюють відповідь гормону
Рис. 22-11. Роль зворотного зв’язку у регулюванні виділення
гормону росту. Штрихові стрілки показують інгібіторний, а су-
цільні - стимулювальний вплив. Зазначимо, що ІФР-І стиму-
лює виділення соматостатину (СС) з гіпоталамуса, безпосе-
редньо впливає на гіпофіз, пригнічує виділення гормону росту
(ГР) (порівняйте з рис. 18-13, 20-20, 23-24, 23-38).
Таблиця 22-4. Чинники, які впливають на виділення
гормону росту у людини
Чинники, які підвищують виділення
Дефіцит енергетичного субстрату
Гіпоглікемія
2-Дезоксиглюкоза
Фізичні вправи
Голодування
Збільшення концентрації певних амінокислот у кровообігу
Білкова їжа
Введення аргініну чи деяких інших амінокислот
Глюкагон
Стресовий фактор
Піроген
Лізин-вазопресин
Різні психологічні стреси
Сон
І_-ДОФА й а-адренергічні агоністи, які проникають у мозок
Апоморфін та інші агоністи дофамінових рецепторів
Естрогени й андрогени
Чинники, які знижують виділення
Сон ШРО
Глюкоза
Кортизол
Вільні жирні кислоти
Медроксипрогестерон
Гормон росту
372 / РОЗДІЛ 22
росту на провокаційні фактори, такі як аргінін та інсулін.
Виділення гормону росту пригнічує дія кортизолу, вільних
жирних кислот і медроксипрогестерону.
Посилює виділення гормону росту дія Ь-ДОФА, що
збільшує вивільнення дофаміну і норадреналіну у голов-
ному мозку, та вплив агоніста дофамінового рецептора
апоморфіну Стимулювальні впливи норадреналіну і дофа-
міну визначальні, проте дофамін також має активність кон-
курентного інгібітора, який діє через В2-рецептори і впли-
ває безпосередньо на соматотропні клітини.
ФІЗІОЛОГІЯ РОСТУ
Ріст - це комплексний феномен, який залежить від
впливу не тільки гормону росту і соматомединів, а й тирео-
їдних гормонів, андрогенів, естрогенів, глюкокортикоїдів
та інсуліну. Крім того, ріст, звичайно, залежить від гене-
тичних факторів та відповідного харчування. У нормі він
передбачає послідовність змін під час дозрівання; зумов-
лює наростання білкової маси та збільшення лінійних роз-
мірів, маси, що можна трактувати як наслідок утворення
жирової клітковини чи затримки солі й води.
Роль харчування
їжа - це найважливіший зовнішній фактор, який впливає
на ріст. Харчування повинне бути збалансованим не тільки
за вмістом білка, а й потрібних вітамінів, мінералів (див.
Розділ 17) та кількістю калорій, оскільки білок, який спо-
живають, не витрачається для отримання енергії. Важливе
значення має також вік, коли виникає дефіцит харчування.
Наприклад, у пубертатному періоді триває інтенсивний ріст
у висоту, навіть якщо надходження калорій зменшене.
Травми і хвороби затримують ріст, оскільки підвищують
активність катаболізму білків.
Періоди росту
Процес росту відрізняється у різних видів. Щурі ростуть
упродовж усього життя, хоча темпи росту сповільнюються.
У людини виділяють два періоди швидкого росту (рис. 22-
12): перший у ранньому дитячому віці і другий у період
досягнення статевої зрілості, саме перед припиненням рос-
ту. Перший період є продовженням внутрішньоутробного
росту, а другий припадає на час статевого дозрівання і зу-
мовлений дією гормону росту, андрогенів та естрогенів, а
наступне припинення росту пов’язане переважно із закрит-
тям епіфізів під впливом естрогенів (див. Розділ 23). Оскіль-
ки дівчата дозрівають швидше, ніж хлопці, то максималь-
ний ріст виявляється раніше у них. Звичайно, в осіб обох
статей швидкість росту окремих тканин різна (рис. 22-13).
Цікаво зазначити, що принаймні у ранньому дитячому
віці ріст не є безперервним процесом, швидше епізодич-
ним чи стрибкоподібним. У дітей збільшення висоти на
0,5-2,5 см за декілька днів розділене періодами у 2-63 дні,
коли збільшення росту не відбувається. Причина цього
невідома.
Гормональний вплив
Вплив гормонів на ріст після народження відображає
діаграма на рис. 22-14. У лабораторних тварин та людини
Вік, роки
Рис. 22-12. Швидкість росту у хлопців і дівчат від народження
до 20 років.
внутрішньоутробний ріст не залежить від ембріонального
гормону росту. Щурі після гіпофізектомії в разі народження
ростуть протягом ЗО днів, а далі ріст припиняється. Цікаво,
що мозок у цих щурів продовжує рости після припинення
росту черепа, внаслідок чого настає стиснення мозку, що
може призвести до смерті.
0 2 4 6 8 10 12 14 16 18 20
Вік, роки
Рис. 22-13. Ріст окремих тканин у різному віці у відсотках до
значення у 20-річному віці. Криві побудовані з урахуванням
даних про хлопців і дівчат.
ГІПОФІЗ / 373
Тиреоїдні
гормони
Гормон
росту
Андрогени
й естрогени
Народження 2 4 6 8 10 12 14 16 18 20
Вік, роки
Рис. 22-14. Відносне значення гормонів у рості людини в різ-
ному віці (з дозволу ОА ЕізНег).
У новонароджених рівень гормону росту у плазмі підви-
щений. Згодом його середня базова концентрація зменшу-
ється, однак стрибки виділення більші, особливо у період
статевого дозрівання, так що рівень концентрації в плазмі
протягом 24 год підвищений. У нормі в дорослих цей рі-
вень становить 2-4 нг/мл, у дітей - 5-8 мг/мл. Гормон росту
є одним з чинників, які стимулюють виділення ІФР-І, тому
рівень ІФР-І у плазмі підвищений у дитинстві, досягаючи
максимуму в 13-17 років. Водночас концентрація ІФР-ІІ
незмінна протягом усього постнатального росту.
Стрибок росту, який простежується у період статевого
дозрівання (див. рис. 22-12), частково зумовлений анабо-
літичною дією андрогенів щодо білків (виділення наднир-
ковими залозами андрогенів у цей час збільшується в обох
статей), а також взаємодією між статевими стероїдами, гор-
моном росту та ІФР-І. Лікування естрогенами та андроге-
нами підвищує відповідь гормону росту на дію таких сти-
муляторів, як інсулін і аргінін. Статеві стероїди підвищують
також рівень ІФР-І у плазмі, однак не спроможні зумовити
це підвищення в осіб із недостатністю гормону росту. От-
же, статеві гормони призводять до збільшення амплітуди
піків у виділенні гормону росту, що підвищує виділення
ІФР-І, який, відповідно, спричинює ріст.
Хоча естрогени та андрогени первинно стимулюють
ріст, однак естрогени його остаточно припиняють, зумов-
люючи закриття епіфізів трубчастих кісток (див. Розділ 21).
З огляду на це пацієнти із передчасним статевим дозріван-
ням схильні до затримки розвитку. З іншого боку, чоловіки,
кастровані до настання статевого розвитку, мають схиль-
ність до високого зросту, оскільки епіфізи відкриті і ріст
відбувається після досягнення нормального віку статевого
дозрівання.
У разі введення гормону росту після гіпофізектомії тва-
рини росли не так швидко, як ті, яким давали гормон росту
в поєднанні з тиреоїдними гормонами. Самі тиреоїдні гор-
мони не впливали на ріст у цій ситуації, проте їхня дія спри-
яла впливу гормону росту, можливо шляхом потенціювання
дії соматомединів. Тиреоїдні гормони також потрібні для
повністю нормального стану секреції гормону росту: ба-
зальні рівні гормону росту нормальні у разі гіпотиреозу,
однак реакція на гіпоглікемію у дітей з гіпотиреозом часто
знижена. Крім того, тиреоїдні гормони впливають на окос-
теніння хряща, ріст зубів, форму обличчя, пропорції тіла.
Тому у випадку кретинізму простежується затримка роз-
витку, виникають ознаки інфантилізму (рис. 22-15). Паці-
єнти із затримкою розвитку внаслідок пангіпопітуїтаризму
мають вигляд, що відповідає їхньому віку до настання часу
статевого дозрівання, та оскільки вони статево не розви-
ваються, то ювенільні риси залишаються у дорослому віці.
Вплив інсуліну на ріст розглянуто у Розділі 19. Тварини
з діабетом не здатні рости, однак інсулін спричинює ріст у
тварин після гіпофізектомії. Значний ріст простежується,
коли разом з інсуліном надходить велика кількість вугле-
водів і білків.
Адренокортикоїди, на відміну від андрогенів, сприяють
росту в той спосіб, що тварини після видалення наднир-
кових залоз не здатні рости без підтримки їхнього артері-
ального тиску і кровообігу замісною терапією. З іншого
боку, глюкокортикоїди є сильними інгібіторами росту
завдяки безпосередній дії на клітини. Якщо діти прийма-
ють фармакологічні дози стероїдів, то це сповільнює або
припиняє їхній ріст на час, доки триває лікування.
Період “наздоганяння росту”
Після хвороби чи голодування у дітей простежується
період “наздоганяння росту” (рис. 22-16), під час якого
швидкість росту більша, ніж у нормі. Зростання триває
доти, доки не досягне значення, що відповідає нормальній
кривій росту. Механізми, що зумовлюють і контролюють
процес “наздоганяння росту”, невідомі.
Нанізм
Низькорослість може бути спричинена недостатністю
соматотропін-рилізинг гормону (СТГ-РГ), гормону росту,
зниженою секрецією ІФР-І чи іншими причинами. Недос-
татність гормону росту часто зумовлена недостатністю
СТГ-РГ, у цьому випадку виділення гормону росту у від-
повідь на дію СТГ-РГ є нормальним. Проте у деяких паці-
єнтів з недостатністю гормону росту порушується діяль-
ність клітин, які секретують цей гормон.
В іншої групи дітей з нанізмом концентрація гормону
росту в плазмі нормальна чи підвищена, однак їхні рецеп-
тори гормону росту не діють унаслідок мутацій гена, що
приводить до втрати функції. Стан, який виникає у цьому
разі, відомий як нечутливість до гормону росту, чи нанізм
Ларона. Рівень ІФР-І в плазмі помітно знижений, як
ІФРЗБ-З (див. вище), що також залежний від гормону росту.
Африканські пігмеї мають нормальний рівень гормону
росту у плазмі та незначне зниження рівня білка, який зв’я-
зує цей гормон. Проте концентрація ІФР-І у їхній плазмі
не збільшується у період статевого дозрівання, оскільки у
них простежується сповільнений ріст порівняно з непіг-
меями (контрольна група) упродовж періоду статевого
дозрівання, тож низькорослість пігмеїв досі пояснити не
вдалося.
Як уже зазначено, низькорослість характерна для кре-
тинізму і буває у пацієнтів із передчасним статевим дозрі-
ванням. Вона також є частиною синдрому дисгенезії гонад
у пацієнтів з ХО хромосомним набором замість XX чи Х¥
(див. Розділ 23). Затримку росту можуть спричинити різні
кісткові та метаболічні захворювання, у багатьох випадках
374 / РОЗДІЛ 22
Дюйми
60 г-
Сантиметри
—1150
55
Висота симфізу
140
Рис. 22-15. Нормальний і патологічний ріст. Гіпотиреоїдні карлики (кретини) зберігають інфантильну будову тіла, тоді як
карлики конститутивного та, менше, гіпопітуїтарного типів мають будову тіла, відповідну до хронологічного віку (відтворено за
дозволом з \Л/іІкіп8 І_: ТНе Оіадпозіз апсі Тгеаітепі оТ Епсіосгіпе Оізогсіегз іп СїлІсІНоосІ апсі Асіоіезсепсе, Згс! есі/ ТНотаз, 1966).
причина невідома (конституційна затримка росту). Со-
ціальні негаразди теж можуть зумовити нанізм у дітей. Цей
стан відомий як психосоціальний нанізм, чи синдром
Каспера Гаузера (названо іменем пацієнта, у якого вперше
його описано).
Найпоширенішою формою нанізму у людини є ахонд-
роплазія. Її ознака - вкорочені кінцівки за нормального
тулуба. Це аутосомно-домінантне захворювання зумовлене
мутацією гена, який кодує рецептор 3 фібробластичного
фактора росту (ФФРЗ). Рецептор 3 належить до родини
фібробластних рецепторів росту і в нормі виявляється у
хрящовій тканині та головному мозку.
ГІПОФІЗАРНА НЕДОСТАТНІСТЬ
Зміни в інших ендокринних залозах
У разі хірургічного видалення гіпофіза чи ураження
йопУ хворобою в людини або тварини часто виникають
зміни, як і у випадку розладів гормональних функцій зало-
зи. Внаслідок гіпопітуїтаризму відбувається атрофування
кори надниркових залоз, і виділення надниркових глюко-
кортикоїдів та статевих гормонів суттєво знижується, хоча
незначна секреція все ж простежується. Стрес не сприяє
збільшенню виділення альдостерону, однак базальна секре-
ція альдостерону та підвищення в разі сольового висна-
ження перебувають у межах норми принаймні деякий час.
Оскільки недостатності мінералокортикоїдів нема, то не
виникають втрата солі і гіповолемічний шок. Проте не-
спроможність збільшити виділення глюкокортикоїдів
робить пацієнтів із гіпофізарною недостатністю чутливими
до стресу. Розвиток стану з втратою солі внаслідок трива-
лого гіпопітуїтаризму розглянуто у Розділі 20. Ріст у цьому
випадку пригнічений (див. вище). Функція щитоподібної
залози суттєво знижується, тому людина погано витримує
холод. У цьому разі також відбувається атрофування ста-
тевих залоз, статеві цикли припиняються, а деякі вторинні
статеві ознаки зникають.
Чутливість до інсуліну
Тварини після гіпофізектомії мають тенденцію до гіпо-
глікемії, особливо в разі ожиріння. У деяких видів, але не
в людини, фатальні гіпоглікемічні реакції досить часті.
Гіпофізектомія зменшує симптоми цукрового діабету (див.
Розділ 19) і помітно збільшує гіпоглікемічний ефект інсу-
ліну. Частково це зумовлене недостатністю гормонів кори
надниркових залоз, хоча тварини після гіпофізектомії чут-
ливіші до інсуліну, ніж тварини після видалення наднир-
кових залоз, оскільки вони також позбавлені антиінсулі-
нового ефекту гормону росту.
ГІПОФІЗ / 375
Рис. 22-16. Крива росту для нормального хлопця, який хворів
з 5 до 7 років. За період наздоганяння росту він набув висоти,
що відповідала нормальній кривій росту (модифіковано з
Воегзта В, \Л/іі ЛУЇ: Саісґі-ир дго\л/іН. Епсіосг Кєу 1997; 18:646).
мом. У дорослих може простежуватися деяка втрата білка,
хоча зазначимо, що гіпотрофія не є ознакою гіпопітуїта-
ризму у людини, і більшість хворих із гіпофізарною
недостатністю мають надлишкову масу (рис. 22-17). Вва-
жали, що кахексія - це частина клінічної картини, однак
сьогодні визначають, що виснажені хворі, описані в літе-
ратурі минулих років, швидше за все, мали нервову ано-
рексію, а не гіпопітуїтаризм.
Причини гіпофізарної недостатності у
людини
Пухлини передньої частки гіпофіза поділяють за їхньою
здатністю до забарвлення на хромофобні та ацидофільні,
чи базофільні. Деякі з очевидно недієвих пухлин є хромо-
фобними, вони спричинюють гіпопітуїтаризм, руйнуючи
нормальну тканину гіпофіза. Близько 70% пацієнтів із хро-
мофобними пухлинами мають високий рівень пролактину
у кров’яному руслі. Це свідчить, що пухлини, які виділяють
пролактин, також тиснуть на гіпоталамус чи гіпофізарну
ніжку, порушуючи транспортування дофаміну з гіпотала-
муса до передньої частки гіпофіза. Кисти над турецьким
сідлом та рудименти кишені Ратке, які збільшуються і стис-
кають гіпофіз, а також деякі інші розлади призводять до
гіпопітуїтаризму. У жінок, які зазнали шоку внаслідок піс-
Водний метаболізм
Хоча селективне порушення механізму дії супраоптич-
ного заднього гіпофіза спричинює нецукровий діабет (див.
Розділ 14), та видалення обох (передньої і задньої) часток
залози переважно призводить лише до тимчасової поліурії.
Раніше припускали, що передня частка гіпофіза виділяє
діуретичний гормон, однак зменшення симптомів нецук-
рового діабету пояснювали зменшенням осмотичного
навантаження, призначеного для виділення. Осмотично
активні частинки затримують воду у ниркових канальцях
(див. Розділ 38). Недостатність АКТГ у тварин після гіпо-
фізектомії зумовлює зниження швидкості катаболізму біл-
ків. Унаслідок недостатності ТТГ, швидкість метаболізму
мала. Тому відбувається фільтрування осмотично активних
продуктів катаболізму, і об’єм сечі зменшується навіть без
вазопресину. Недостатність гормону росту призводить до
зменшення швидкості клубочкового фільтрування у тварин
після гіпофізектомії; відповідно, гормон росту збільшує
швидкість клубочкової фільтрації і нирковий потік плазми
у людини. Внаслідок недостатності глюкокортикоїдів вини-
кає таке саме порушене виділення навантаження водою,
як і в тварин після видалення надниркових залоз. Діуре-
тичну активність передньої частки гіпофіза можна пояс-
нити дією АКТГ, ТТГ і гормону росту.
Інші порушення
Недостатність АКТГ та інших гормонів гіпофіза, які
активують меланоцитостимулювальний гормон (МСГ),
відповідає за блідість шкіри у пацієнтів із і іпопітуїтариз-
Рис. 22-17. Характерний вигляд у разі гіпопітуїтаризму в до-
рослих. Простежуються ознаки нормальної маси та блідість
(відтворено за дозволом з Оаидїіасіау \Л/Н‘ Тйе асіепоїіуро-
рґіузіз. Іп: ТехіЬоок ої Епфсгіпоіоду, есі. ХЛ/іІІіатз КН [есіі-
Іог]. Заипсіегз, 1974).
376 / РОЗДІЛ 22
ляпологової кровотечі, може виникнути інфаркт гіпофіза
з подальшим розвитком післяпологового некрозу (синдром
Шигена). Кровопостачання передньої частки гіпофіза
досить чутливе, оскільки вона опускається на гіпофізарну
ніжку через ригідну діафрагму сідла, тому під час вагітності
гіпофіз збільшується. Інфаркт гіпофіза в чоловіків трапля-
ється зрідка. Зокрема, він поширений серед солдатів, які
хворіли на геморагічну лихоманку у Кореї. У випадку цієї
хвороби виникає дифузний васкуліт, який, очевидно, зумов-
лює збільшення гіпофіза внаслідок набряку. Пацієнтами з
інфарктом гіпофіза були ті, хто зазнав шоку під час захво-
рювання.
ГІПЕРФУНКЦІЯ ГІПОФІЗУ У ЛЮДИНИ
Акромегалія
Пухлини соматотропних клітин передньої частки гіпо-
фіза виділяють велику кількість гормону росту, що у дітей
призводить до гігантизму, а в дорослих - до акромегалії.
У 20-40% пацієнтів з акромегалією гіперсекреція гормону
росту супроводжується гіперсекрецією пролактину. Крім
того, у 37% хворих простежується виділення а-субодиниць
глікопротеїнового гормону. Акромегалія може бути спри-
чинена як позагіпофізарними, так і внутрішньогіпофізар-
ними пухлинами, які секретують гормон росту, та гіпота-
ламічними пухлинами, що виділяють рилізинг-фактор гор-
мону росту, хоча такі трапляються зрідка.
Головні клінічні прояви в разі акромегалії (збільшення
турецького сідла, головні болі, порушення зору) пов’язані
з місцевою дією пухлини, що впливає на виділення гормону
росту. Як зазначено вище, простежується збільшення роз-
мірів кисті та стопи (акральні частини, звідси термін акро-
мегалія) і виступ допереду нижньої щелепи (прогнатія)
(див. рис. 22-7). Надмірний ріст скулової, лобної та кісток
лицьового черепа у поєднанні з прогнатією формують грубі
риси обличчі, яке називають акромегалічним обличчям.
Крім того, збільшується кількість волосся на тілі. Зміни
скелета слугують передумовою до виникнення остеоарт-
риту. Близько 25% пацієнтів мають порушення тесту толе-
рантності до глюкози і 4% випадків - появу лактації без
вагітності.
Синдром Кушінґа
Клінічну картину синдрому Кушінґа і його різноманітні
причини описано у Розділі 20. Багато пацієнтів із двобіч-
ною гіперплазією надниркових залоз мають малі АКТГ-
секретувальні пухлини гіпофіза (мікроаденоми), які важко
виявити. У значного відсотка хворих після видалення дво-
бічно гіперплазованих надниркових залоз швидко росли
пухлини гіпофіза, що секретують АКТГ (синдром Нельсо-
на). Ці пухлини спричинюють гіперпіґментацію шкіри і
неврологічні ознаки, зумовлені тиском на структури у ді-
лянці сідла. Деякі з них є злоякісними. Концентрація АКТГ
у крові надзвичайно висока, й активність МСГ, властива
АКТГ, може бути відповідальною за пігментацію шкіри.
Важко сказати, чи у таких пацієнтів не вдалося виявити
пухлину, чи відбулися неопластичні зміни у гіпофізі, коли
припинилася дія зворотного зв’язку щодо секреції АКТГ.
Інші пухлини, які секретують гормони
У тварин деколи пухлини, які секретують ТТГ, вини-
кають після тиреоїдектомії, а пухлини, які секретують гона-
дотропін, - після гонадектомії. У людини ТТГ-позитивні
пухлини трапляються зрідка, тоді як пролактинопозитивні
досить поширені (див. Розділ 23). Крім того, багато несек-
реторних пухлин гіпофіза у жінок виділяють гонадотропі-
ни. В деяких жінок виявлено виділення а- або Р-субоди-
ниць гонадотропіну, або обидвох одночасно. Виділення цих
сполук не зумовило клінічних порушень, однак підвищені
їхні концентрації у крові можна виявити за допомогою
відповідних лабораторних тестів. Більшість, якщо не всі,
пухлини передньої частки гіпофіза є моноклональними,
вони розвиваються з однієї атипової клітини.
Гонади:
розвиток і функції
репродуктивної системи
23
ВСТУП
Сучасна генетика й експериментальна ембріологія дали
змогу з’ясувати, що у більшості видів ссавців множинні
відмінності між чоловічим і жіночим організмами залежать
головно від однієї хромосоми (¥-хромосоми) та однієї пари
ендокринних структур, яєчок у чоловіків і яєчників у жінок.
Диференціація незрілих гонад у яєчка чи яєчники гене-
тично детермінована у людей під час внутрішньоутробного
розвитку. Однак формування чоловічих геніталіїв залежить
від наявності активних яєчок, якщо ж тестикулярної тка-
нини нема, то відбувається розвиток за жіночим типом. Є
докази, що статева поведінка осіб чоловічої статі у деяких
видів та особливість секреції у них гонадотропіну зумов-
лені дією чоловічих гормонів на головний мозок під час
раннього розвитку. Після народження гонади перебувають
у стані спокою до настання періоду юності, коли вони акти-
вуються гонадотропінами передньої частки гіпофіза. Гор-
мони, що їх виділяють гонади в цей період, спричинюють
появу ознак, притаманних чоловіку чи жінці дорослого віку,
і статевого циклу у жінок. Функція яєчників у жінок після
багатьох років регресує, статеві цикли припиняються (на-
стає менопауза). У чоловіків з віком функція гонад повільно
загасає, однак змога стати батьком дітей і надалі є.
В осіб обох статей гонади виконують подвійну функцію:
продукують зародкові клітини (гаметогенез) і сприяють
виділенню статевих гормонів. Андрогени - це стероїдні
статеві гормони, які мають маскулінізувальну дію, тоді як
естрогени - фемінізувальну. У нормі ці види гормонів
секретовані в осіб обох статей. Яєчка виділяють велику
кількість андрогенів, найбільше тестостерон, а також ест-
рогени. Яєчники ж виділяють багато естрогенів і невелику
кількість андрогенів. Андрогени формуються у корі над-
ниркових залоз і можуть перетворюватись в естрогени у
жировій та інших тканинах. Яєчники також утворюють
прогестерон - стероїд, який виконує спеціальні функції
щодо підготовляння матки до вагітності. Під час вагітності
яєчники виділяють поліпептидний гормон релаксин, який
послаблює зв’язки лобкового симфізу і забезпечує розм’як-
шення шийки, сприяючи народженню дитини. В організмі
осіб обох статей гонади виділяють й інші поліпептиди, на-
приклад, інгібін, який пригнічує виділення ФСГ.
Секреторна і гаметогенна функції гонад залежать від
секреції передньою часткою гіпофіза гонадотропінів ФСГ,
ЛГ. Статеві гормони та інгібін взаємодіють через механізми
зворотного зв’язку, пригнічуючи виділення гонадотропіну.
У чоловіків виділення гонадотропіну не циклічне, а в жінок
у постпубертатному періоді воно регулярне і послідовне,
необхідне для появи місячних, вагітності й лактації.
СТАТЕВА ДИФЕРЕНЦІАЦІЯ І РОЗВИТОК
ХРОМОСОМНА СТАТЬ
Статеві хромосоми
На генетичному рівні стать визначена двома хромосо-
мами, які називають статевими хромосомами, на відміну
від соматичних хромосом (аутосом). У людей та багатьох
ссавців статевими є X- та ¥-хромосоми. Наявність ¥-хро-
мосоми потрібна і достатня для утворення яєчок; продукт
гена, який визначає розвиток яєчка, називають 8К¥ (від
англ. 8ех сІеіегтіпіп^ ге^іоп о£Фе ¥ сЬготозоте - ділянка
¥-хромосоми, яка визначає стать). 8К¥ - це регуляторний
білок, який зв’язує ДНК. Він розгортає ДНК і діє як фактор
транскрипції каскаду генів, необхідних для тестикулярної
диференціації, охоплюючи ген для ІРМ (див. нижче). Ген
8К¥ локалізований біля кінця короткого плеча ¥-хромо-
соми людини. Чоловічі клітини з диплоїдним набором
хромосом містять X- та ¥-хромосоми (Х¥-набір), тоді як
жіночі - дві Х-хромосоми (ХХ-набір). Під час гаметогенезу
внаслідок мейозу кожна нормальна зріла яйцеклітина отри-
мує одну Х-хромосому, проте одна половина нормальних
сперматозоїдів містить Х-хромосому, а інша - ¥-хромо-
сому (рис. 23-1). Якщо сперматозоїд з ¥-хромосомою
запліднює яйцеклітину, то виникає Х¥-набір і зигота роз-
вивається як генетично чоловіча стать. Коли у заплід-
ненні бере участь Х-вмісний сперматозоїд, то формується
ХХ-набір, і розвивається генетично жіноча стать. Клі-
тинний поділ і хімічна природа хромосом розглянуті у Роз-
ділі 1.
378 / РОЗДІЛ 23
Хромосоми людини
Хромосоми людини можна детально вивчити. Якщо
клітини людини культивувати (іп уіїґо), то за допомогою
колхіцину можна припинити мітоз у метафазі. Під впливом
гіпотонічного розчину хромосоми набухають і диспергу-
ють, що дає змогу виготовити цитологічні препарати. Флю-
оресцентні та інші методи фарбування допомагають іден-
тифікувати окремі хромосоми і детально їх вивчити (рис.
23-2). Виділяють 46 хромосом: у чоловіків це 22 пари
аутосом та X- і ¥-хромосоми; у жінок - 22 пари аутосом
та дві Х-хромосоми. Звичайно окремі хромосоми розмі-
щені довільно (каріотип). Окремі пари аутосом познача-
ють номерами 1 -22 на підставі їхніх морфологічних ознак.
Зазначимо, що ¥-хромосома людини менша від Х-хро-
мосоми; це дало змогу висловити таку гіпотезу: спермато-
зоїди з ¥-хромосомою легші, тому здатні швидше плисти
по статевих шляхах жінки і першими досягати яйцекліти-
ни. На користь цієї гіпотези свідчить факт, що кількість
народжених хлопців дещо перевищує кількість дівчат.
Статевий хроматин
• Після клітинного поділу, який починається під час емб-
ріонального розвитку, одна з двох Х-хромосом соматичних
клітин у здорових жінок втрачає активність. У разі відхи-
лення від норми в осіб, які мають більше двох Х-хромосом,
активність зберігає лише одна з них. Процес, який у нормі
відповідає за таку інактивацію, індукований в Х-інакти-
ваційному центрі хромосоми. Інактивування відбувається
за допомогою гена Хіві, який продукує беззмістовну мРНК,
що виконує цей процес. Однак деталі процесу інактиву-
вання поки що до кінця не зрозумілі. Вибір хромосоми,
яка буде активною, очевидно, випадковий. Отже, в нормі
у приблизно половини клітин активна одна Х-хромосома,
а в решти - інша. Відбір також відбувається і під час наступ-
них поділів клітин, унаслідок чого деякі соматичні клітини
здорової жінки містять активну Х-хромосому батьківського
походження, а інші - активну Х-хромосому, успадковану
від матері.
У нормальних клітинах неактивна Х-хромосома конден-
сує, після чого її можна побачити у різних типах клітин
переважно біля мембрани ядра як тільце Барра (рис. 23-
3). Отже, у клітині кожній Х-хромосомі відповідає одне
тільце Барра. Неактивна Х-хромосома виглядає як малень-
ка барабанна паличка хроматину, що виступає з ядра 1-
15% поліморфноядерних лейкоцитів жінок, її немає у чоло-
віків (див. рис. 23-3). Тільце Барра ще називають статевим
хроматином.
ЕМБРІОЛОГІЯ РЕПРОДУКТИВНОЇ СИСТЕМИ
ЛЮДИНИ
Розвиток гонад
Первинні гонади розвиваються з кожного боку ембріона
із генітального гребінця - ущільненої тканини поблизу над-
ниркової залози. У гонадах формується кора і мозкова
речовина (рис. 23-4). До шести тижнів розвитку ці струк-
тури ідентичні в осіб обох статей. У генетичних чоловіків
мозкова речовина розвивається у яєчка протягом сьомого
і восьмого тижня, а кора регресує; з’являються клітини
Рис. 23-1. Генетична детермінація статі У випадку двостадійного мейотичного поділу у жінок лише одна клітина виживає як
зріла яйцеклітина. У чоловіків мейотичний поділ завершується утворенням чотирьох сперматозоїдів, причому два містять Х-,
а два - ¥-хромосоми Внаслідок запліднення формується чоловіча зигота з 22 парами аутосом та X- і ¥-хромосомами або
жіноча з 22 парами аутосом і двома Х-хромосомами. Зазначимо, що для наочності тут, як і на рис. 23-5 та 23-8, не показано
сучасної міжнародної класифікації каріотипів, яка відображає повний набір хромосом, після чого зазначено статеві хромосоми,
тобто ХО означає 45,X; Х¥ - 46,Х¥; ХХУ - 47,ХХУ і т д.
ГОНАДИ: РОЗВИТОК І ФУНКЦІЇ РЕПРОДУКТИВНОЇ СИСТЕМИ / 379
і по
•' *• ’ І Н Н н >, 2 *
1 2 3 4 5
• 7 і/ * я *.
••о 5в М ні» 3* **
6 7 8 9 10 11 12
0* - * * 4 вл пп сг
13 14 15 16 17 18
И
19 20 21 22 X У
Рис. 23-2. Нормальний каріотип хромосом чоловіка Хромо-
соми, зафарбовані за Гімзою, смугасті. Ця смугастість і ха-
рактеристики, отримані за допомогою інших методів, дають
змогу ідентифікувати окремі хромосоми з високою точністю
(відтворено за дозволом з Сопіе ЕА, СгитЬасїі ММ: АЬпогта-
ІИІЄ8 оізехиаі сІіІТегепїіаііоп. Іп: Вазіс & СІіпісаІ Епсіосгіпоіоду,
5ііі есі. Сгеепзрап Е8, 8іе\л/1ег СІ_ [есіііогз]. Мс-6га\/у-НіІІ, 1997).
Лейдіґа і Сертолі, відбувається секретування тестостерону
та інгібувальної речовини Мюллера (рис. 23-5). У гене-
тичних жінок кора перетворюється в яєчник, а мозкова
речовина регресує. Ембріональний яєчник не виділяє гор-
монів. Гормональне лікування матері не впливає на дифе-
ренціацію гонад у людини (на відміну від диференціації
проток і геніталіїв), хоча це простежується у деяких лабо-
раторних тварин. Водночас простежується вплив статевих
гормонів на диференціювання гонад та їхній розвиток у
деяких лабораторних тварин.
Ембріологія геніталіїв
На сьомому тижні вагітності в ембріона наявні як чоло-
вічий, так і жіночий генітальні канали (рис. 23-6). У нор-
мального плоду жіночої статі протокова система Мюллера
потім розвивається у маткові труби (яйцеводи) і матку; у
нормального плоду чоловічої статі Вольфієва протокова
система з кожного боку - у придатки яєчок і секреторний
канал яєчок. До восьми тижнів усі зовнішні геніталії по-
дібні, а надалі - можливі два шляхи розвитку (рис. 23-7).
Після зникнення урогенітальної щілини формуються чоло-
вічі геніталії, а якщо вона й надалі відкрита, - то жіночі.
У разі наявності яєчок в ембріона розвиваються зов-
нішні і внутрішні чоловічі геніталії. Клітини Лейдіґа яєчок
плоду виділяють тестостерон, а клітини Сертолі - інгібу-
вальну речовину Мюллера (ІРМ, або регресійний фактор
Мюллера (РФМ)). ІРМ - це 536-амінокислотний гомоди-
мер, який є членом надродини трансформувальних фак-
торів росту типу р-ТФР, що охоплює також інгібіторні
активатори (див. нижче). За впливом на внутрішні геніталії
ІРМ і тестостерон подібні. ІРМ зумовлює регресію проток
Мюллера шляхом апоптозу з того боку, з якого він виділя-
ється, а тестостерон сприяє розвитку екскреторного каналу
яєчок і споріднених структур з вольфіївських проток. Мета-
боліт тестостерону дигідротестостерон (див. нижче) спри-
чинює формування чоловічих зовнішніх геніталіїв і вто-
ринних чоловічих статевих ознак (див. рис. 23-5).
Клітини Сертолі виділяють ІРМ до рівня 48 нг/мл у
плазмі одно-дворічних хлопчиків. Відтоді концентрація
гомодимеру зменшується до часу настання статевої
зрілості й утримується на низькому, проте визначальному
рівні протягом усього життя. ІРМ також продукують гра-
нульозні клітини в малих фолікулах у яєчниках, однак його
концентрація у плазмі дуже низька чи невизначальна до
періоду статевого дозрівання. Надалі концентрація ІРМ у
плазмі приблизно така ж, як у дорослого чоловіка, тобто
становить близько 2 нг/мл. Функція ІРМ після закінчення
періоду ембріонального життя невідома, проте він, імо-
вірно, задіяний у процесі дозрівання зародкових клітин
обох статей та у регулюванні опущення яєчок у хлопців
(див. нижче).
Розвиток головного мозку
Принаймні у деяких видів ссавців розвиток головного
мозку, як і зовнішніх геніталіїв, підпадає під вплив андро-
Рис. 23-3. Ліворуч: тільце Барра (стрілка) в епідермальному остистому клітинному шарі. Праворуч: ядерний відросток
(барабанна паличка) позначений стрілкою у білих клітинах крові (відтворено за дозволом з бплпЬасії ММ, Вагг МІ: Суіоіодус
ІЄ8І8 о! сґіготозотаї зех іп геїаііоп іо зех апотаїіез іп тап. Несені Ргод Ногт Нез 1958; 14:255).
380 / РОЗДІЛ 23
Рис. 23-4. На діаграмі показано розвиток яєчника з кори та яєчка з мозкового шару біпотенціальних примордіальних гонад
людини (відтворено за дозволом з СгитЬасІт М іп: СІІпісаі Епсіосгіпоіоду І. Азіи/оосі ЕВ [едііог]. Сгипе & Вігайоп, 1960).
генів на ранніх етапах життя. У щурів короткий вплив анд-
рогенів під час перших днів життя сприяє появі особли-
востей поведінки чоловічої статі і становленню відпо-
відних особливостей гіпоталамічного контролювання за
виділенням гонадотропіну для розвитку після періоду ста-
тевого дозрівання. Без андрогенів розвиваються жіночі
ознаки (див. Розділ 15). У мавп такий самий вплив на ста-
теву поведінку зумовлений дією андрогенів внутрішньо-
утробно, однак виділення гонадотропіну і надалі циклічне.
Ранній вплив андрогенів на плоди жіночої статі у людини
також спричинює легкий, проте помітний маскулінізуваль-
ний ефект. У жінок з адреногенітальним синдромом і врод-
женою недостатністю адренокортикального ензиму (див.
Розділ 20) нормальний місячний цикл настає після ліку-
вання кортизоном. Отже, у людей, як і у мавп, зберігається
циклічність виділення гонадотропіну, незважаючи на
внутрішньоутробний вплив андрогенів.
АБЕРАНТНА СТАТЕВА
ДИФЕРЕНЦІАЦІЯ
Хромосомні порушення
З огляду на зазначене вище можна очікувати, що пору-
шення статевого розвитку зумовлене генетичними чи гор-
мональними порушеннями, а також іншими неспецифіч-
ними тератогенними чинниками. Головні групи таких
порушень наведені у табл. 23-1.
Визначеним дефектом у гаметогенезі є нерозходження
хромосом - феномен, за якого пара хромосом не може
розділитися, тому під час мейозу до однієї з дочірніх клітин
потрапляють обидві хромосоми. Чотири ненормальні зиго-
ти, які можуть утворитися через нерозходження однієї з
Х-хромосом під час оогенезу, показані на рис. 23-8. В осіб
з хромосомним набором ХО гонади рудиментарні або їх
нема, а зовнішні жіночі статеві органи розвинені. Зріст у
Таблиця 23-1. Класифікація головних порушень статевої
диференціації у людини. Багато з цих синдромів можуть
мати різні форми залежно від ступеня та проявів
Хромосомні порушення
Дисгенезія гонад (ХО і різновиди)
“Супержінки" (XXX)
Дисгенезія сім’явивідних канальців (ХХУ і різновиди)
Справжній гермафродитизм
Порушення розвитку
Жіночий псевдогермафродитизм
Вроджена гіперплазія надниркових залоз плоду із
вірилізацією
Надмір андрогенів у матері
Пухлина яєчників із вірилізацією
Ятрогенний: лікування андрогенами чи синтетич-
ними прогестеронами
Чоловічий псевдогермафродитизм
Резистентність до андрогенів
Неповноцінний розвиток яєчок
Вроджена недостатність 17а-гідроксилази
Вроджена гіперплазія надниркових залоз, зумовлена
блокадою утворення прегненолону
Різні негормональні порушення
ГОНАДИ: РОЗВИТОК І ФУНКЦІЇ РЕПРОДУКТИВНОЇ СИСТЕМИ / 381
Біпотенціальна
первинна клітина Біпотенціальна
Відсутність
внутрішніх жіночих
статевих органів
Внутрішні
чоловічі
статеві органи
Зовнішні
чоловічі
статеві органи
"Чоловіче
мислення” -------
Вторинні
чоловічі статеві
ознаки
гонада
Ембріональний
яєчник
Біпотенціальна
первинна клітина
Внутрішні
жіночі статеві
органи
Зовнішні
жіночі статеві
органи
Яєчник
жінки
Вторинні
жіночі статеві
ознаки
"Жіноче
мислення” —
Рис. 23-5. Статева детермінація, диференціація і розвиток людини в нормі (схематичне зображення); ІРМ - інгібувальна
речовина Мюллера; Т - тестостерон; ДГТ - дигідротестостерон.
них малий, часто наявні інші вроджені вади, а у відповідний
період не настає статевого дозрівання. Цей синдром нази-
вають дисгенезією гонад, агенезією яєчників, або синд-
ромом Тернера.
Особи з набором ХХУ - найпоширенішим порушенням
статевих Х-хромосом - мають нормальні чоловічі статеві
органи. Під час періоду статевого дозрівання виділення
тестостерону у них цілком достатнє для розвитку чолові-
чих ознак, проте формуються ненормальні сім’яні каналь-
ці, крім того, серед них частіші випадки розумового
відставання. Цей синдром відомий як дисгенезія сім’яних
канальців, чи синдром Кляйнфельтера. Набір XXX
(супержінка) на другому місці за частотою після набору
ХХУ; його навіть можна вважати найпоширенішим у
загальній популяції, хоча цей набір не поєднується з
іншими характерними вадами. Набір УО, очевидно,
летальний.
Мейоз є двоетапним процесом; нерозходження пере-
важно трапляється під час першого мейотичного поділу,
однак може відбутися і під час другого, спричинюючи
складніші хромосомні порушення. Крім того, нерозход-
ження чи проста втрата статевої хромосоми може статися
під час ранніх мітотичних поділів після запліднення. У ран-
ньої зиготи наслідком помилкових мітозів є виникнення
мозаїки - наявність в особи двох чи більше популяцій клі-
тин з різними хромосомними комплектами. Справжній
гермафродитизм - стан, за якого в особи одночасно наявні
яєчники та яєчка, - ймовірно зумовлений ХХ/ХУ-моза-
їцизмом і подібними мозаїчними наборами, хоча можливі
й інші генетичні аберації.
Хромосомні порушення також охоплюють транслока-
цію частин хромосом на інші хромосоми. Зрідка у гене-
тичних чоловіків виявляють каріотип XX, який з’являється
внаслідок того, що коротке плече батьківської У-хромо-
соми транслоковане на батьківську Х-хромосому під час
мейозу, і вони отримали цю Х-хромосому разом із їхньою
материнською. Подібно делеція малої частини У-хромо-
соми, що містить 8КУ, спричинює формування жінки з
каріотипом ХУ
Звичайно, порушення статевих Х-хромосом не єдине,
що пов’язане із хворобливими станами; відомі також нероз-
ходження деяких аутосомних Х-хромосом. Наприклад,
нерозходження 21 хромосоми зумовлює трисомію 21 -
хромосомне порушення, пов’язане з синдромом Дауна
(монголізм). У більшості випадків нерозходження виникає
в яєчниках, а не в яєчках, тому частота випадків синдрому
Дауна збільшується з віком матері.
Є багато інших Х-хромосомних порушень, як і числен-
них хвороб, спричинених дефектом одного гена. Ці стани
можна діагностувати внутрішньоутробно, аналізуючи
382 / РОЗДІЛ 23
Придаток
(гідатида) яєчка
Яєчко
Сім'явиносна
протока
Напрямна зв’язка
Передміхурова
залоза
Сім’яний
міхурець
Сечівник
ЧОЛОВІК
Фімбрія
Гонада
Напрямна зв'язка
Протока Мюллера
Первинна
нирка
Протока Вольфа
Сечовий міхур
Сечостатевий
синус
ІНДИФЕРЕНТНИЙ
Маткопіхвовий
канал
Над'яєчник
Яєчник
Матка
Напрямна
зв’язка
Маткова труба
Протока Ґартнера
ЖІНКА
Рис. 23-6. Ембріональна диференціація чоловічих та жіночих внутрішніх статевих органів (генітальних трактів) з чоловічого
(Вольфа) та жіночого (Мюллера) зачатків (відтворено за дозволом з ОгитЬасІт М, Сопіе ЕА іп: 77іІІіатз ТехіЬоок ої Епсіо-
сгіпоіоду, 7ііі есі. \А/іІзоп ЗО, Еозіег 077 [есіііогз]. Заипбегз, 1985).
клітини плоду в зразках амніотичної рідини, отриманої
шляхом пункції голкою через черевну стінку (амніо-
центез), чи на ранніх термінах вагітності, досліджуючи
клітини плоду, отримані шляхом біопсії голкою ворсин
хоріона (хоріонцентез).
Гормональні порушення
У нормі зовнішні чоловічі статеві органи розвиваються
в генетичних чоловіків завдяки дії андрогенів, що їх виді-
ляють ембріональні яєчка. Однак статевий розвиток за
чоловічим типом може також відбуватися у генетичних
ГОНАДИ: РОЗВИТОК І ФУНКЦІЇ РЕПРОДУКТИВНОЇ СИСТЕМИ / 383
ЧОЛОВІК
— Задній прохід
ЖІНКА
Голівка
— Статевий горбик
- Сечостатева
щілина
Сечівникова
складка
Губокалитковий
валик
СЬОМИЙ-ВОСЬМИЙ ТИЖДЕНЬ
Борозна
— Задній прохід —
Мала губа
Отвір сечівника
Піхвовий отвір
Отвір сечівника
Голівка прутня
Клітор
Велика губа
Калитка
ДВАНАДЦЯТИЙ ТИЖДЕНЬ
Рис. 23-7. Диференціація чоловічих та жіночих зовнішніх статевих органів з індиферентних зародкових структур ембріона.
жінок під впливом андрогенів із деяких інших джерел
протягом 8-13 тижнів вагітності. Синдром, який у цьому
разі виникає, називають жіночим псевдогермафродитиз-
мом. Псевдогермафродит - це особа із генетичною консти-
туцією та гонадами однієї статі й статевими органами
іншої. Відомо, що після 13-го тижня статеві органи пов-
ністю сформовані, проте вплив андрогенів може спричи-
нити гіпертрофію клітора. Жіночий псевдогермафроди-
тизм може бути зумовлений як уродженою гіперплазією
надниркових залоз із вірилізацією (див. Розділ 20), так і
призначенням андрогенів матері. І, навпаки, розвиток жіно-
чих статевих органів у генетичних чоловіків (чоловічий
псевдогермафродитизм) виникає в разі неповноцінності
ембріональних яєчок. Оскільки яєчка також виділяють
ІРМ, то генетичні чоловіки із неповноцінними яєчками
мають внутрішні жіночі статеві органи.
Ще однією причиною чоловічого псевдогермафроди-
тизму є резистентність до андрогенів, за якої внаслідок різ-
них уроджених порушень чоловічі гормони не повністю
впливають на тканини. Одна з форм резистентності до анд-
рогенів - недостатність 5(Х-редуктази, за якої знижується
рівень ензиму, що відповідає за утворення дигідротестос-
терону - активної форми тестостерону. Наслідки цієї
недостатності розглянуто у частині про чоловічу статеву
систему. Інші форми резистентності до андрогенів зумов-
лені різними мутаціями гена рецепторів до андрогенів,
причому порушення функції рецепторів коливаються від
легких до важких. Легкі порушення спричинюють неплід-
384 / РОЗДІЛ 23
Яйцеклітина Зигота Сперматозоїд
Ненормальний
мейоз ।
Дисгенезія гонад
Супержінка
Смерть
Дисгенезія
сім’яних канальців
Рис. 23-8. Короткий опис чотирьох можливих порушень унас-
лідок материнського нерозходження статевих хромосом під
час мейозу. Хромосомний набір ¥0 уважають летальним, він
спричинює внутрішньоутробну смерть плоду.
ність із гінекомастією чи без неї (див. нижче). Якщо втрата
рецепторної функції суттєва, то виникає тестикулярний
синдром фемінізації. За цього стану ІРМ наявний, і виді-
лення тестостерону нормальне чи навіть посилене. Зовніш-
ні статеві органи є жіночими, однак піхва закінчується
сліпо, оскільки жіночих внутрішніх статевих органів нема.
В осіб із цим синдромом під час статевого дозрівання роз-
виваються збільшені молочні залози, і їх уважають нор-
мальними жінками, аж доки не обстежать з приводу від-
сутності місячних.
Зазначимо, що генетичні чоловіки з вродженою блока-
дою утворення прегненолону, є гермафродитами, оскільки
тестикулярні, як і андрогени надниркових залоз, у нормі
утворюються з прегненолону. Чоловічий псевдогермафро-
дитизм також виникає у разі вродженої недостатності 17 а-
гідроксилази (див. Розділ 20).
ПЕРІОД СТАТЕВОГО ДОЗРІВАННЯ
Як зазначено вище, посилене виділення тестостерону
плодом чоловічої статі відбувається ще до народження
(рис. 23-9). Під час неонатального періоду простежується
подальше зростання, роль якого невідома, однак після
цього активність клітин Лейдіґа послаблюється. Далі у всіх
ссавців настає період, коли гонади обох статей неактивні,
аж доки їх не індукують гонадотропіни гіпофіза для завер-
Рис. 23-9. Концентрація тестостерону в плазмі чоловіка за-
лежно від віку.
шеного дозрівання репродуктивної системи. Період завер-
шеного дозрівання відомий як підлітковий; його ще нази-
вають пубертатним, або періодом статевого дозрівання;
у цей час ендокринні та гаметогенні функції гонад уперше
досягають стану, коли можливе розмноження. У дівчат пер-
шою подією є телархе (розвиток молочних залоз), далі
настає пубархе (ріст аксилярного та лобкового волосся),
і, нарешті, менархе (перший місячний цикл). Як звичайно,
перші цикли ановуляторні, а регулярна овуляція настає при-
близно через рік.
На відміну від осіб дорослого віку, у дітей після народ-
ження і до періоду статевого дозрівання простежується
незначне підвищення виділень гонадотропіну, тобто виді-
лення гонадотропіну не залежить від статевих гормонів.
У дітей віком від 7 до 10 років повільне збільшення виді-
лень естрогенів та андрогенів передує швидшому росту в
ранньому юнацькому віці (рис. 23-10).
Вік настання статевого дозрівання непостійний. У Євро-
пі та Північній Америці він знижується на один-три місяці
за десятиліття протягом понад 175 років. У Східній Європі
(включно з Україною) останніми роками час статевого
дозрівання припадає на вік від 8 до 13 років у дівчат та від
9 до 14 у хлопців.
Іншим явищем, що простежується у людини в період
статевого дозрівання, є збільшене виділення андрогенів
наднирковими залозами (рис. 23-11). Його називають адре-
нархе. Це явище буває у віці 8-10 років у дівчат та 10-12
років у хлопців. Найвищі показники ДГЕА зафіксовані у
віці 25 років серед жінок, що дещо пізніше, ніж у чоловіків.
Після 60 років вони повільно зменшуються.
Секреція андрогенів наднирковими залозами під час
адренархе збільшується без будь-яких змін у виділенні кор-
тизону чи АКТГ. Це може бути зумовлене зміною в системі
ензимів у надниркових залозах, завдяки чому більше прег-
ненолону відходить в андрогеновий шлях (див. Розділ 20).
З іншого боку, є докази, що цей процес спричинений збіль-
ГОНАДИ: РОЗВИТОК І ФУНКЦІЇ РЕПРОДУКТИВНОЇ СИСТЕМИ / 385
7,7 12 13,7 15,7 Кістковий вік
170-
Естрадіол,
пг/мл
Стадія пубертату
7,0 10,5 11,6 13,0 14,0 Кістковий вік
Рис. 23-10. Зміни концентрацій гормонів у плазмі під час ста-
тевого дозрівання у хлопців (угорі) та дівчат (унизу). Стадія
1 періоду статевого дозрівання - це передпідростковий період
в обох статей ХУ хлопців стадії 2 відповідає початкове збіль-
шення яєчок, стадії 3 - збільшення прутня, стадії 4 - ріст
залоз прутня, стадії 5 - зрілі статеві органи. У дівчат стадії 2
- поява грудей, стадії 3 - підвищення та збільшення грудей,
стадії 4 - виділення ареол, стадії 5 - зрілі груди (модифіковано
і відтворено за дозволом з СгитЬасИ ММ: Опзеі ої риЬегіу.
Іп: РиЬегіу: Віоіодіс апсі РзусИозосіаІ Сотропепіз. ВегепЬегд
8Р [есНог]. НЕ ЗІепїоеП Кгоезе ВУ, 1975).
шенням секреції гормону, який стимулює виділення
андрогенів наднирковими залозами (АА8Н - від англ.
адгепаї апдго£еп-$ііти1аііп£ когтопе) з гіпофіза.
Регулювання статевого дозрівання
У дітей статеві залози можуть бути стимульовані гона-
дотропінами, що їх містить гіпофіз; у гіпоталамусі ж є ГнРГ
(див. Розділ 14). Проте в цей період гонадотропіни не виді-
ляються. У незрілих мавп нормальні місячні цикли можна
спричинити пульсаційним уведенням ГнРГ; вони трива-
тимуть доти, доки вводитимуть гормон.
Зазначимо, що ГнРГ виділяється пульсаційним спосо-
бом внутрішньоутробно. Отже, зрозуміло, що протягом
періоду від народження до настання статевої зрілості ней-
ромеханізм спрямований на запобігання нормальному
пульсаційному виділенню ГнРГ. Природа механізму при-
гнічення пульсаційного генератора ГнРГ сьогодні не з’ясо-
вана.
Рис. 23-11. Зміни рівня дегідроепіандростеронсульфату
(ДГЕАС) у сироватці залежно від віку. Середня лінія - зна-
чення, а штрихові - ±1,96 від стандартних відхилень (відтво-
рено за дозволом з 8тііїі МИ еі аі: А гасііоіттипоаззау Тог
іґіе езіітаііоп ої зегит сіеґіусігоеріапсігозіегопе зиїїаіе іп пог-
таї апсі раіуоіодісаі зега. СІіп Сїііт Асіа 1975; 65:5).
Вплив лептину
Деякий час уважали, що є критична маса тіла, після
досягнення якої настає період пубертату. Наприклад, моло-
да жінка, яка займається важкою атлетикою, втрачає масу,
і місячні у неї припиняються. Так трапляється і з дівчат-
ками, що мають нервову анорексію: якщо вони починають
нормально їсти і набирати масу, то місячні в них віднов-
люються, тобто вони повертаються до періоду пубертату.
Тепер виявлено, що лептин - гормон, що його надмірно
продукують жирові клітини (див. Розділ 14), - може бути
ланкою між масою тіла та періодом пубертату. Миші з ожи-
рінням і генотипом оЬ/оЬ, які не здатні виробляти лептин,
є безплідними, а здатність до розмноження у них віднов-
люється після введення лептину. Лікування лептином
зумовлює також передчасне статеве дозрівання у незрілих
мишей жіночої статі. Поки що не з’ясовано, як лептин за-
діяний у загальному регулюванні статевого дозрівання.
ПЕРЕДЧАСНЕ ТА ЗАПІЗНІЛЕ СТАТЕВЕ
ДОЗРІВАННЯ
Передчасне статеве дозрівання
Головні причини передчасного статевого розвитку у
людини наведені у табл. 23-2. Ранній розвиток вторинних
статевих ознак без гаметогенезу зумовлений патологічною
дією андрогенів на незрілих осіб чоловічої та естрогенів
на незрілих осіб жіночої статі. Цей синдром називають пе-
редчасним псевдопубертатом, щоб розрізняти його від
справжнього передчасного статевого дозрівання, спри-
чиненого раннім, однак нормальним пубертатним станом
виділення гонадотропіну гіпофізом (рис. 23-12).
Описано чимало випадків, коли настання передчасного
пубертату було ендокринним симптомом гіпоталамічної
хвороби (див. Розділ 14). Цікаво, що у деяких піддослідних
тварин та людей ураження вентрального гіпоталамуса біля
26 367 2
386 / РОЗДІЛ 23
Таблиця 23-2. Класифікація причин передчасного
статевого розвитку у людини
Справжній передчасний пубертат
Конститутивний
Церебральний розлади, пов’язані із заднім гіпоталамусом
Пухлини
Інфекції
Аномалії розвитку
Гонадотропінонезалежне передчасне дозрівання
Передчасний псевдопубертат (без сперматогенезу чи
розвитку яєчників)
Надниркових залоз
Вроджена гіперплазія надниркових залоз із
вірилізацією
• Пухлини, що виділяють андрогени (у чоловіків)
Пухлини, що виділяють естрогени (у жінок)
Надмір андрогенів у матері
Гонадний
Пухлини клітин Лейдіґа яєчок
Пухлини ґранульозних клітин яєчників
•Змішані
задньої частки гіпофіза спричинює передчасний пубертат.
Ураження може бути зумовлене розриванням нервових
шляхів, пригніченням пульсаційного генератора ГнРГ або
хронічним подразненням зони виділення ГнРГ завдяки
створенню вогнища довкола ураження. Пухлини епіфіза
деколи пов’язані із передчасним пубертатом, однак є дока-
зи, що це відбувається тільки у разі вторинного ураження
гіпоталамуса. Передчасне дозрівання, зумовлене цими чи
іншими ураженнями гіпоталамуса, трапляється з однако-
вою частотою в осіб обох статей, хоча його конститутивна
форма частіше буває у дівчат. Крім того, передчасний гаме-
тогенез та стероїдогенез можуть виникати і без пубертатної
форми виділення гонадотропіну (гонадотропінонезалежне
передчасне дозрівання). За цього стану принаймні у деяких
випадках чутливість ЛГ рецепторів до гонадотропінів
збільшується внаслідок активованої мутації в 6-білку, який
з’єднується із рецепторами аденілатциклази.
Пізній пубертат чи його відсутність
У нормі віковий період настання юнацьких змін такий
широкий, що пубертат не вважають патологічно пізнім до
настання менархе у 17 років чи розвитку яєчок до 20 років.
Затримка дозрівання внаслідок пангіпопітуїтаризму поєд-
нується із карликовістю та іншими ендокринними пору-
шеннями. Пацієнти із хромосомним набором ХО і дисге-
незією гонад також низькорослі. У деяких осіб пубертат
затримується навіть за наявності гонад та збереження
інших ендокринних функцій. У чоловіків виявлені клінічні
зміни називають євнухоїдизмом; у жінок - первинною
аменореєю (див. нижче).
Менопауза
Із віком яєчники жінок стають нечутливими до гона-
дотропінів, і їхня функція послаблюється, тому припиня-
ються статеві цикли (менопауза). Ця нечутливість поєдну-
ється з і, ймовірно, зумовлена зменшенням кількості при-
мордіальних фолікулів, які перестають діяти під час мено-
Рис. 23-12. Конститутивна форма передчасного пубертату у
трирічної дівчинки. У пацієнтки з’явилося лобкове волосся
та почалися місячні у віці 17 місяців (відтворено за дозволом
з ^Ну Н: ЗехиаІ Ргесосііу. Тіютаз, 1955).
паузи (рис. 23-13). Яєчники більше не виділяють про-
гестерон та 17р-естрадіол у потрібних кількостях; естро-
гени в незначній кількості утворюються тільки шляхом
ароматизації андростенедіону у кровообігу (див. Розділ 29).
Матка та піхва поступово атрофуються. Завдяки негатив-
ному або зворотному зв’язку внаслідок зменшення естро-
генів і прогестерону збільшується виділення ФСГ та ЛГ;
концентрація ФСГ і ЛГ у плазмі досягає високих рівнів.
Старі особи жіночої статі у мишей та щурів мають три-
валий період діеструсу (від грец. сііа - між і азігоз - потяг,
час між періодами статевого потягу у ссавців жіночої статі)
та підвищений рівень гонадотропінів, однак чіткої мено-
паузи у цих тварин поки що не описано.
У жінок місячні, як звичайно, стають нерегулярними і
припиняються у віці від 45 до 55 років. Від початку XX
століття середній вік настання менопаузи збільшився і
тепер становить 52 роки.
Після припинення функції яєчників часто простежуєть-
ся відчуття жару, яке поширюється від тулуба до обличчя
(припливи жару), нічна пітливість і різноманітні фізичні
симптоми. Припливи жару бувають у 75% жінок з менопау-
зою і можуть тривати з перервами протягом 40 років. їх
також фіксують у випадку ранньої менопаузи, яка виникає
після двостороннього видалення яєчників. Лікують цей
симптом естрогенами. Крім того, припливи жару бувають
ГОНАДИ: РОЗВИТОК І ФУНКЦІЇ РЕПРОДУКТИВНОЇ СИСТЕМИ / 387
Рис. 23-13. Кількість примордіальних фолікулів у яєчнику
жінок різного віку. Зафарбовані квадратики - це премено-
паузальні жінки (регулярні місячні); чорні квадратики - пери-
менопаузальні (нерегулярні місячні принаймні рік), чорні три-
кутники - постменопаузальні жінки (нема місячних принайм-
ні рік). Зазначимо, що вертикальний масштаб логарифміч-
ний, а показники наведені для одного, а не двох яєчників
(відтворено за дозволом з РісИагсІзоп 8Л Зепіказ V, ІЧеІзоп
Л3, ЕоІІісиІаг сіеріеііоп сіигіпд ІИе тепораизаі ІгапзШоп: Еуі-
сіепсе Гог ассеїегаіес! Іозв апсі иііітаїе ехґіаизііоп. З СІіп Епсіо-
сгіпої МеІаЬ 1987;65:1231).
у чоловіків після кастрації; причина їхнього виникнення
невідома, хоча вони збігаються з періодами виділення ЛГ,
що відбувається епізодично з інтервалом 30-60 хв чи біль-
ше (епізодична секреція); без гонадних гормонів ці пе-
ріоди збільшуються. Кожний приплив жару починається
із настанням виділення. Однак сам по собі ЛГ не відповідає
за симптоми, оскільки вони можуть бути і після видалення
гіпофіза. З’ясовано, що певний естрогеночутливий чинник
у гіпоталамусі ініціює виділення ЛГ та період припливу
жару.
Хоча функція яєчок з віком повільно згасає, та наукові
докази свідчать, що нема чоловічої менопаузи (клімакс),
яка буває у жінок.
ГІПОФІЗАРНІ ГОНАДОТРОПІНИ ТА
ПРОЛАКТИН
Хімічна будова
Як ФСГ, так і ЛГ складаються із а- та р-субодиниць,
будова яких описана у Розділі 22. Вони є глікопротеїнами,
які містять гексози: манозу та галактозу, гексозаміни 14-
ацетилгалактозамін та М-ацетилглікозамін і метилпенто-
зову фукозу, а також сіалову кислоту. Вуглеводи у молекулах
гонадотропіну збільшують його активність, помітно спо-
вільнюючи метаболізм. Період півжиття ФСГ людини
становить 170 хв; а ЛГ - приблизно 60 хв. Підтверджені
мутації у р-субодиниці ФСГ виявляють тепер у чоловіків
із гіпогонадизмом та у жінок із пізнім пубертатом і гіпого-
надизмом.
Гіпофізарний пролактин людини містить 199 амінокис-
лотних залишків, три дисульфідні мостики (рис. 23-14) і
має помітну структурну подібність до гормону росту люди-
ни та ХСл. Період півжиття для пролактину, як і для гор-
мону росту, - 20 хв. Структурно подібні пролактини виді-
ляють ендометрій та плацента (див. нижче).
Рецептори
Рецептори ФСГ та ЛГ - це серпентиноподібні рецеп-
тори, які зв’язуються з аденілатциклазою через 68-білок
(див. Розділ 1). Крім того, кожен має витягнутий, глікозо-
ваний зовнішньоклітинний домен.
Рецептор пролактину людини подібний до рецептора
гормону росту, він належить до надродини рецепторів, яка
охоплює рецептор гормону росту та рецептори до багатьох
цитокінів і гемопоетичних факторів росту (див. Розділи 1,
22, 24 і 27). Він димеризує й активує ЗАК-8іаі та інші
каскади внутрішньоклітинних ензимів.
ДІЯ
Яєчка та яєчники атрофуються після видалення чи руй-
нування гіпофіза. Вплив пролактину та гонадотропінів
ФСГ і ЛГ, як і гонадотропінів, що їх виділяє плацента,
детально описаний далі. Тут зазначимо лише, що ФСГ
підтримує сперматогенний епітелій, стимулюючи клітини
Сертолі у чоловіків, і відповідає за ранній ріст фолікулів у
яєчниках жінок. ЛГ тропний до клітин Лейдіґа і у жінок
відповідає за кінцеве дозрівання фолікулів яєчника та виді-
лення з них естрогенів, а також за овуляцію, первинне фор-
мування жовтого тіла і виділення прогестерону.
Пролактин зумовлює виділення молока з грудей після ест-
рогенової і прогестеронової підготовки. Він діє на молочну
залозу, підвищуючи активність мРНК і збільшуючи про-
дукування казеїну та лактальбуміну. Однак вплив гормону
не поширюється на клітинні ядра, цьому запобігають інгібі-
тори мікротрубочок. Пролактин також пригнічує дію гонадо-
тропінів, можливо на рівні яєчників. Його значення у запо-
біганні овуляції в жінок з лактацією розглянуто нижче. Функ-
ція пролактину у здорових чоловіків до кінця не з’ясована,
проте надмірне виділення пролактину пухлинами спричи-
нює імпотенцію. Пролактин, який використовують як основу
для кількісного визначення біологічної активності цього
гормону, стимулює ріст і появу у голубів та інших птахів
вола, здатного до “секреції”. Спарені вола є вип’ячуванням
стравоходу, де шляхом десквамації клітин внутрішнього
шару утворюється продукт живлення (“молоко”), яким птахи
годують потомство. Пролактин ФСГ і ЛГ визначають радіо-
імунологічним методом.
Регулювання виділення пролактину
У нормі концентрація пролактину в плазмі становить
близько 5 нг/мл у чоловіків та 8 нг/мл у жінок. Його виді-
лення тонічно пригнічує гіпоталамус, а видалення гіпофі-
зарної ніжки приводить до підвищення рівня пролактину у
кровообігу. Вплив гіпоталамічного гормону дофаміну, який
пригнічує виділення пролактину (пролактинінгібувальний
гормон - ПІГ), у нормі сильніший, ніж вплив багатьох
388 / РОЗДІЛ 23
Рис. 23-14. Будова пролактину людини.
гіпоталамічних білків із пролактин-рилізинг активністю. У
людини виділення пролактину посилюється після фізичних
вправ, хірургічних і психологічних стресів та стимулювання
пипки (табл. 23-3). Рівень пролактину у плазмі підвищується
під час сну, починаючи від настання сну і закінчуючи про-
будженням. Його виділення збільшується також протягом
вагітності, досягаючи максимального значення під час
пологів. Протягом восьми днів після пологів його концент-
рація у плазмі зменшується до показників, які були перед
вагітністю. Годування грудьми приводить до пришвидше-
ного виділення пролактину, однак його кількість поступово
зменшується після трьох місяців вигодовування. Із про-
довженням лактації рівень пролактину є у нормі.
Ь-ДОФА зменшує виділення пролактину, збільшуючи
утворення дофаміну, а бромкриптин та інші агоністи дофа-
міну пригнічують цей процес унаслідок стимулювання
дофамінових рецепторів. Хлорпромезин та інші ліки, які
блокують дофамінові рецептори, сприяють збільшеному
виділенню пролактину. ТРГ стимулює виділення пролак-
тину разом із ТТГ, а в тканині гіпоталамуса є додаткові
пролактин-рилізинг поліпептиди. Естрогени сприяють
повільному зростанню виділення пролактину завдяки пря-
мій дії на лактотропи.
З’ясовано, що пролактин полегшує виділення дофаміну
у серединному підвищенні. Отже, пролактин діє у гіпота-
ламусі, пригнічуючи власну секрецію внаслідок негатив-
ного зворотного зв’язку.
Пперпролактинемія
До 70% пацієнтів із хромофобною аденомою передньої
частки гіпофіза мають підвищений рівень пролактину у
Таблиця 23-3. Чинники, які впливають на секрецію
пролактину і гормону росту в людини
Фактор Пролактин1 Гормон росту1
Сон С+ с+
Грудне вигодовування С++ н
Стимулювання молоч- них залоз у жінок без лактації с н
Стрес с+ с+
Гіпоглікемія с с+
Фізичні вправи с с
Статевий акт у жінок с н
Вагітність С++ н
Естрогени с с
Гіпотиреоз с н
ТРГ с+ н
Фенотіазини, бутиро- фенони с+ н
Опіати с с
Глюкоза н м
Соматостатин н м+
Ь-ДОФА м+ с+
Апоморфін м+ с+
Бромкриптин і подібні похідні споришу м+ с
1 С - середньо збільшена; С+ - відчутно збільшена; С++ -
дуже збільшена; Н - незмінна; М - середньо зменшена; М+
- відчутно зменшена.
ГОНАДИ: РОЗВИТОК І ФУНКЦІЇ РЕПРОДУКТИВНОЇ СИСТЕМИ / 389
плазмі. У деяких випадках підвищення зумовлене ура-
женням гіпофізарної ніжки, однак частіше пухлинні клі-
тини самі секретують гормон. Гіперпролактинемія може
спричинити галакторею, проте у більшості осіб немає про-
явів ендокринних порушень. І навпаки, більшість жінок із
галактореєю мають нормальну концентрацію пролактину.
Його реальне підвищення виявляють менш ніж у третини
пацієнтів з таким станом.
Іншим цікавим фактом є те, що у 15-20% жінок із вто-
ринною аменореєю виявлено підвищений рівень пролак-
тину; якщо ж виділення пролактину зменшується, то від-
новлюються нормальний місячний цикл і здатність до за-
пліднення. Пролактин також зумовлює аменорею, блокую-
чи дію гонадотропінів на яєчники, однак це остаточно не
з’ясовано. Гіпогонадизм, спричинений пролактиномами,
поєднується з остеопорозом, що є наслідком недостатності
естрогенів.
Як зазначено вище, гіперпролактинемія у чоловіків
поєднується з імпотенцією та гіпогонадизмом, які зника-
ють зі зменшенням виділення пролактину.
ЧОЛОВІЧА СТАТЕВА СИСТЕМА
СТРУКТУРА
Яєчка утворені із петель звивистих сім’яних каналь-
ців, у стінках яких із первинних зародкових клітин
формуються сперматозоїди (сперматогенез). Обидва кінці
кожної петлі мають мережу проток у голівці придатка яєчка
- над’яєчка. Звідти сперматозоїди через хвіст над’яєчка
потрапляють до сім’явиносних проток. Під час еякуляції
вони через сім’явипорскувальні протоки у сечівнику
проходять до тіла передміхурової залози (рис. 23-15). Між
канальцями яєчок розміщені групи клітин, які містять
ліпідні гранули, інтерстиціальні клітини Лейдіґа (рис.
23-16,23-17), що виділяють тестостерон у кров’яне русло?
Спермальні артерії яєчок звивисті, і кров по них тече
паралельно, проте у протилежному напрямі до потоку крові
у гроноподібному сплетенні спермальних вен. Така анато-
мічна особливість дає змогу підтримувати сталу темпера-
туру і виділення тестостерону. Основи такого обміну сто-
совно нирок детально розглянуто у Розділі 38.
ГАМЕТОГЕНЕЗ ТА ЕЯКУЛЯЦІЯ
Гематотестикулярний бар’єр
Стінки звивистих сім’яних канальців вистелені пер-
винними зародковими клітинами (див. нижче), клітинами
Сертолі та великими складними глікогеновмісними клі-
тинами, які поширюються від базальної мембрани до
порожнини (див. рис. 23-17). Тісні зв’язки між клітинами
Сертолі, що прилягають до базальної мембрани, утво-
рюють гематотестикулярний бар’єр, який запобігає про-
никненню багатьох великих молекул з інтерстиційної
тканини до порожнини канальця. Проте стероїди легко
переходять через цей бар’єр. Є докази, що деякі білки
також паракринним шляхом переходять із клітин Сертолі
до клітин Лейдіґа та навпаки. Крім того, зародкові клітини,
що дозрівають, повинні перейти через бар’єр, оскільки
вони прямують до порожнини. Цей перехід відбувається
без порушення цілісності бар’єра завдяки тимчасовому
розриву тісних зв’язків над зародковими клітинами та
наступному утворенню нових тісних зв’язків під ними.
Рідина у порожнині звивистих сім’яних канальців від-
різняється від плазми; вона містить мало білка і глюкози,
однак багата на андрогени, естрогени, К+, інозитол, глута-
мінову та аспарагінову кислоти. Підтримка цього складу
залежить від гематотестикулярного бар’єра, який захищає
зародкові клітини від шкідливих чинників, що походять з
крові, а також запобігає потраплянню антигенних про-
дуктів поділу та дозрівання зародкових клітин у кров’яне
Рис. 23-15. Ліворуч: чоловіча статева система. Праворуч: система проток у яєчках.
390 / РОЗДІЛ 23
Звивисті сім’яні
Рис. 23-16. Зріз яєчка людини.
русло, формуванню автоімунної відповіді. Цей бар’єр
також допомагає підтримувати осмотичний градієнт, який
сприяє руху рідини до порожнини канальців.
Сперматогенез
Сперматогонїї- це первинні зародкові клітини, що роз-
міщені біля базальної мембрани звивистих сім’яних
канальців і дозрівають до первинних сперматоцитів (див.
рис. 23-17). Цей процес починається у зрілому віці. Пер-
винні сперматоцити підлягають мейотичному поділу,
внаслідок якого зменшується кількість їхніх хромосом. Під
час цього двостадійного процесу вони діляться до вторин-
них сперматоцитів і далі - до сперматид, які містять гап-
лоїдний набір - 23 хромосоми. Сперматиди дозрівають до
сперматозоїдів (сперміїв). Під час поділу і дозрівання
одного сперматогонія його “потомство” зв’язане між
собою через цитоплазматичні мостики аж до пізньої спер-
матидної фази. Очевидно, це забезпечує синхронність
диференціації кожного клону зародкових клітин. Підрахо-
вана кількість сперматид, які утворюються з одного спер-
матогонія - становить 512. У людини утворення зрілого
спермія з первинної зародкової клітини шляхом нормаль-
ного сперматогенезу в середньому триває 74 дні.
Кожний сперматозоїд - це складна рухлива клітина,
багата на ДНК, з голівкою, яка головно побудована із хро-
мосомного матеріалу (рис. 23-18). Голівка покрита акро-
сомою, наче шапкою. Це лізосомоподібна органела, яка
Рис. 23-17. Епітелій звивистого сім’яного канальця. Зазначимо, що зародкові клітини, які дозрівають, є зв’язаними цитоплаз-
матичними мостиками на ранній сперматидній стадії, вони щільно оточені цитоплазмою клітин Сертолі, оскільки рухаються
від базальної мембрани до порожнини (відтворено за дозволом з Зипциеіга І_С, Сагпеіго 3, КеІІеу НО: Вавіс Нівіоіоду , 9їґі есі.
Мс6га\л/-НіІІ, 1998).
ГОНАДИ: РОЗВИТОК І ФУНКЦІЇ РЕПРОДУКТИВНОЇ СИСТЕМИ / 391
5 мкм
Кінцева ділянка
Головна ділянка
Середня ділянка Голівка
Рис. 23-18. Сперматозоїд людини, зображений у профіль. Акросома - це органела, яка покриває половину голівки спер-
матозоїда всередині плазмової мембрани спермія (відтворено за дозволом з Зипдиеіга І_С, Сагпеіго ф КеІІеу ВО: Вавіс НізіоІ-
оду, 91И есі. Мс6га\л/-НіІІ, 1998).
містить ензими, задіяні у пенетрації сперматозоїда в яйце-
клітину та інших процесах запліднення. У проксимальній
частині рухомий хвіст сперматозоїда має оболонку з
численними мітохондріями. Мембрани пізніх сперматид і
сперматозоїдів містять спеціальну малу форму ангіотен-
зинконвертувального ензиму, який називають зародковим
ангіотензин-ІІ-перетворювальним ензимом (див. Розділ
24). Функція цього ензиму у сперматозоїдах невідома, хоча
з’ясовано, що миші чоловічої статі, у яких порушена функ-
ція гена ангіотензинперетворювального ензиму, мали зни-
жену плідність.
Сперматиди дозрівають до сперматозоїдів у глибоких
складках цитоплазми клітин Сертолі (див. рис. 23-17). Зрілі
сперматозоїди вивільняються з клітин Сертолі у порожнині
канальців. Клітини Сертолі виділяють андрогенозв’язу-
вальний білок (АВР - від англ. апс!го§еп-Ьіпс1іп§ ргоіеіп),
інгібін і ІРМ; не виділяють андрогенів, однак містять
ароматазу (С¥Р19) - ензим, який відповідає за перетво-
рення андрогенів в естрогени. Крім того, вони можуть про-
дукувати естрогени. Очевидно, функція АВР полягає у під-
триманні стабільного постачання андрогенів до каналь-
цевої рідини; інгібін пригнічує виділення ФСГ (див. ниж-
че); ІРМ зумовлює регресію мюллерових протоків у чоло-
віків під час внутрішньоутробного життя (див. вище).
ФСГ й андрогени підтримують гаметогенну функцію
яєчок. Після гіпофізектомії введення ЛГ зумовлює суттєве
збільшення локальної концентрації андрогенів у яєчках, а
це сприяє гаметогенезу. Стадії розвитку від сперматогоній
до сперматид є андрогенозалежними. Дозрівання від спер-
матид до сперматозоїдів залежить від дії андрогенів на клі-
тини Сертолі, які оточують сперматозоїди, що розвивають-
ся. ФСГ впливає на клітини Сертолі, підтримуючи останні
стадії дозрівання сперматид, а також стимулює виділення
АВР.
Є нові докази високого вмісту естрогену в рідині сітки
яєчок (див. рис. 23-15) та значного рівня естрогенових
рецепторів типу альфа у стінках мереж. У цій ділянці ріди-
на реабсорбується, і сперматозоїди концентруються. Якщо
ж цього не відбувається, то сперматозоїди потрапляють
до над’яєчка зі значним об’ємом рідини, що призводить
до неплідності.
Сперматозоїди, які виходять з яєчка, не є повністю рух-
ливими. Вони продовжують дозрівати і набувають рухли-
вості під час проходження через над’яєчко. Якщо відсоток
яйцеклітин, запліднених сперматозоїдами з хвоста над’-
яєчка людини (див. рис. 23-15), прийняти за 100, то відпо-
відне значення для сперматозоїдів із середньої частини
над’яєчка становитиме 50, а для сперматозоїдів із голівки
над’яєчка - 0. Запліднення можливе, якщо сперматозоїд із
голівки яєчка ввести шляхом мікроін’єкції безпосередньо
в яйцеклітину. Отже, головна проблема - слабка рухливість
сперматозоїда.
Здатність сперматозоїда до запліднення збільшується в
разі подальшого надходження до середовища статевих
шляхів жінки. Цей ще до кінця не зрозумілий процес капа-
цитації має два компоненти: підвищення рухливості спер-
матозоїдів і сприяння їхній підготовці до акросомальної
реакції. Очевидно, роль капацитації полягає в полегшенні
і спрощенні процесу запліднення, оскільки можливе заплід-
нення й іп уйго. Наступні етапи запліднення розглянуто
нижче у контексті про вагітність.
Вплив температури
Для сперматогенезу потрібна температура, значно ниж-
ча від тієї, що є у нижній частині тіла. У нормі в яєчках
температура становить близько 32°С. Охолодження під-
тримуване завдяки циркуляції повітря навколо калитки і,
очевидно, теплообміну між спермальними артеріями та
венами. У випадку, коли яєчка затримуються в черевній
порожнині, або у піддослідних тварин, у яких вони розта-
шовані близько до тіла завдяки міцним тканинним зв’язкам,
настає дегенерація стінок канальців та неплідність. Гарячі
ванни (43-45°С протягом ЗО хв кожного дня) та важкі
фізичні навантаження призводять до зменшення кількості
сперматозоїдів у людини, у деяких випадках навіть на 90%.
Однак зменшення, спричинене в такий спосіб, є недостат-
нім, щоб зробити цю процедуру однією з форм чоловічої
контрацепції. Крім того, є докази сезонних змін у чоловіків
- кількість сперматозоїдів збільшується взимку, коли тем-
пературні умови сприятливіші для калитки.
Сперма
Сперма - це рідина, яка виділяється під час оргазму.
Вона містить сперматозоїди і секрет сім’яних міхурців,
передміхурової залози, залоз Купера та, очевидно, залоз
сечівника (табл. 23-4). Середній об’єм однієї порції еяку-
ляту становить 2,5-3,5 мл після кількох днів утримання.
Об’єм сперми і кількість сперматозоїдів швидко зменшу-
ються із повторними еякуляціями. Хоча потрібен тільки
один сперматозоїд для запліднення яйцеклітини, у нормі
392 / РОЗДІЛ 23
Таблиця 23-4. Складники сперми людини
Колір- Білий з опалесценцією
Питома вага: 1,028
рН: 7,35-7,50
Кількість сперматозоїдів- у
середньому близько
100 млн/мл, із менш ніж
20% атипових форм
Інші компоненти:
Фруктоза (1,5-6,5 мг/мл)
Фосфохолін
Ерготіонін
Аскорбінова кислота
Флавіни
Простагландини
Спермін
Лимонна кислота
Холестерол, фосфоліпіди
Фібринолізин, фібриногеназа
Цинк
Кисла фосфатаза
Фосфат
Бікарбонат
Гіалуронідаза
Із сім’яних міхурців
> (становлять 60%
загального об’єму)
Із простати
> (становлять 20%
загального об’єму)
Буфери
їх налічується близько 100 мільйонів в одному мілілітрі
сперми. П’ятдесят відсотків чоловіків із кількістю 20-
40 млн/мл і практично всі із кількістю до 20 млн/мл є сте-
рильними. У спермі також простежується висока концент-
рація простагландинів. Вони фактично походять із сім’я-
них міхурців. Функція цих похідних жирних кислот у спер-
мі остаточно не з’ясована. їхня будова та множинний вплив
на інші частини тіла розглянуто у Розділі 17.
Сперматозоїди людини рухаються по статевих шляхах
жінки зі швидкістю близько 3 мм/хв і досягають маткових
труб через 30-60 хв після статевого акту. У деяких видів
тварин скорочення жіночих органів сприяє просуванню
сперматозоїдів до маткових труб, однак невідомо, чи такі
скорочення бувають у людей.
Ерекція
Ерекція відбувається внаслідок розширення артеріол
прутня. У цьому разі еректильна тканина прутня напов-
нюється кров’ю, вени стискуються, блокуючи відтік і нада-
ючи тургор органу. Інтеграційні центри у поперекових сег-
ментах спинного мозку активовані імпульсами від аферен-
тів, іцо відходять від геніталіїв та низхідними шляхами,
які опосередковують ерекцію у відповідь на еротичне пси-
хічне стимулювання. Еферентні парасимпатичні волокна
проходять у тазових вісцеральних нервах. Вірогідно, що
вони містять ацетилхолін і ВІП як котрансмітери (див.
Розділ 4). Деякі волокна закінчуються пресинаптично на
норадренаргічних нейронах, де ацетилхолін діє на мус-
каринові рецептори, зменшуючи вивільнення норадрена-
ліну вазоконстрикторами. Крім того, ВІП зумовлює вазо-
дилатацію. Проте введення ВІП не забезпечує повністю
ерекції. Введення у сечівник ПГЕ] (алпростадилу) також
розширює гладку мускулатуру прутня, його застосовують
клінічно для сприяння ерекції.
Є також неадренаргічні нехолінергічні волокна у тазо-
вих нервах. Вони містять велику кількість NО-синтази -
ензиму, що каталізує утворення окису азоту (N0; див. Роз-
діл 31). N0 активує гуанілатциклазу, завдяки чому збіль-
шується вироблення цГМФ - сильного вазодилятатора.
Введення інгібіторів МО-синтази піддослідним тваринам
запобігає ерекції, яку у нормі стимулює тазовий нерв. Отже,
зрозуміло, чому N0 відіграє важливу роль у виникненні
ерекції. Віагра (сілденефіл) пригнічує руйнування цГМФ
через фосфодіестерази, тому сьогодні його широко вико-
ристовують для лікування імпотенції. Множинні фосфоді-
естерази (РБЕз - від англ. рйо8рЬос1іе8їега8Є8) організму
поділяють на сім ізоензимних родин. Сілденефіл найактив-
ніший стосовно РБЕ5 - різновиду фосфодіестерази, вияв-
леного у печеристому тілі. Проте зазначимо, що сілденефіл
помітно пригнічує РП6. Цей різновид фосфодіестерази ви-
явлений у сітківці. Тому один із побічних ефектів сілдене-
філу - транзиторна втрата здатності розрізняти синій і зеле-
ний кольори (див. Розділ 8).
У нормі ерекція закінчується внаслідок дії симпатичних
вазоконстрикторних імпульсів на артеріоли прутня.
Еякуляція
Еякуляція - це двохетапний спинальний рефлекс, який
охоплює емісію (рух сперми до сечівника) і власне еяку-
ляцію (виділення сперми з сечівника під час оргазму).
Аферентні шляхи - це насамперед волокна від чутливих
рецепторів у голівці прутня, які приходять до спинного
мозку через внутрішні соромітні нерви. Емісія є симпа-
тичною реакцією, інтегрованою у верхніх поперекових
сегментах спинного мозку, вона впливає на скорочення
гладкої мускулатури сім’явиносної протоки та сім’яних
міхурців у відповідь на подразнення підчеревних нервів.
Сперма випорскується із сечівника внаслідок скорочення
цибулино-губчастого скелетного м’яза. Спинальні реф-
лекторні центри цієї частини рефлексу містяться у верхніх
крижових та нижніх поперекових сегментах спинного
мозку і рухових шляхах на рівні першого-третього кри-
жових корінців та внутрішніх пудендальних нервах. Окис
вуглецю бере участь у регулюванні еякуляції, доки НО2-
ензим, який каталізує його утворення в нервовій системі
(див. Розділ 4), є в достатній кількості у шляхах, пов’яза-
них з еякуляцією. Еякуляторна здатність зменшується,
коли НО2 гена нема.
Простатоспецифічний антиген
Передміхурова залоза виробляє і виділяє у сперму та
кров’яне русло ЗОкОа-серинову протеазу, відому як про-
статоспецифічний антиген (Р8А - від англ. ргозіаіе-зре-
сіГіс апб§еп). Ген Р8А містить два андрогеночутливі еле-
менти. Він гідролізує семеногелін, інгібітор рухливості
сперматозоїдів у спермі, і має декілька субстратів у плазмі,
однак його функція для кровообігу не з’ясована. Рівень Р8А
у плазмі підвищується у випадку раку передміхурової за-
лози; це широко використовують як скринінг-тест для
цього захворювання. Р8А також підвищений у разі доб-
роякісної гіпертрофії передміхурової залози і простатиту.
ГОНАДИ: РОЗВИТОК І ФУНКЦІЇ РЕПРОДУКТИВНОЇ СИСТЕМИ / 393
Вазектомія
Доведено, що двостороннє перев’язування сім’явино-
сних проток (вазектомія) є порівняно безпечною контра-
цептивною процедурою. Проте відомо також і про склад-
ність відродження функцій протоки в осіб, які хочуть від-
новити фертильність. Рівень успішності таких операцій,
який оцінювали за настанням вагітності, становить близько
50%. Після вазектомії у половини чоловіків утворювалися
антитіла до сперматозоїдів. У мавп наявність таких антитіл
пов’язана з високим рівнем неплідності після відновлення
роботи протоки. Інших негативних впливів антиспермаль-
них антитіл не виявлено.
ЕНДОКРИННА ФУНКЦІЯ ЯЄЧОК
Хімічна будова і синтез тестостерону
Тестостерон - головний гормон яєчок - це С]9-стероїд
(див. Розділ 20) з ОН-групою у положенні 17 (рис. 23-19).
Він синтезується із холестеролу у клітинах Лейдіґа, а також
утворюється з андростендіону, що його виділяє кора над-
ниркових залоз. Шляхи біосинтезу стероїдних гормонів в
усіх ендокринних органах подібні. Органи ж різняться між
собою системою ензимів, які вони містять. У клітинах Лей-
діґа нема 11 - і 21 -гідроксилази, які наявні в корі наднир-
кових залоз (див. рис. 20-8), однак є 17ос-гідроксилаза.
Прегненолон гідроксилює у положенні 17 і далі підлягає
розщепленню бокового ланцюга до дегідроепіандросте-
рону. Андро стенд іон також утворюється через прогестерон
і 17-гідроксипрогестерон, однак цей шлях менше відомий
у людей. Дегідроепіандростерон та андростендіон пізніше
перетворюються в тестостерон.
Виділення тестостерону контрольоване ЛГ; механізм,
через який ЛГ стимулює клітини Лейдіґа, охоплює поси-
лене утворення цАМФ через серпентиновий рецептор ЛГ
і 6. Циклічний АМФ посилює утворення холестеролу з
холестеролового естеру і перетворення холестеролу у пре-
гненолон шляхом активування протеїнкінази А.
Секреція
Рівень виділення тестостерону становить 4-9 мг/добу
(13,9-31,33 нмоль/добу) у здорових дорослих чоловіків.
Невелика кількість тестостерону виділяється також у жі-
нок, вірогідно, завдяки яєчникам, а можливо, і наднир-
ковим залозам.
Транспортування та метаболізм
Близько 98% тестостерону плазми перебуває у зв’язаній
із білком формі: 65% зв’язується з р-глобуліном, який нази-
вають глобуліном, що зв’язує гонадні стероїди (СВС -
від англ. §опа<іа1 8іегоісІ-Ьіпс1іп§ §1оЬи1іп), чи глобуліном,
що зв’язує статеві стероїди, а 33% - з альбуміном (табл.
23-5). 6В6 зв’язує також естрадіол. Рівень тестостерону
у плазмі (вільного і зв’язаного) становить 300-1000 нг/дл
(10,4-34,7 нмоль/л) у дорослого чоловіка (див. рис. 23-9) і
30-70 нг/дл (1,04-2,43 нмоль/л) у дорослої жінки. Його
рівень дещо знижується з віком у чоловіків.
Невелика кількість тестостерону, що циркулює, пере-
творюється в естрадіол (див. нижче), однак більша частина
- до 17-кетостероїдів, головно андростерону та його ізо-
меру етіохоланолону (рис. 23-20), і виводиться з сечею.
Близько двох третіх 17-кетостероїдів сечі походять з над-
ниркових залоз, а одна третя з яєчок. Хоча більшість кето-
Таблиця 23-5. Розподіл гонадних стероїдів і кортизолу в
плазмі1
Стероїд % незв’язаного % зв’язаного із
СВС 6ВС альбуміном
Тестостерон 2 0 65 33
Андростендіон 7 0 8 85
Естрадіол 2 0 38 60
Прогестерон 2 18 0 80
Кортизол 4 20 0 6
1 СВ6 - глобулін, що зв’язує кортикостероїди; 6В6 - глобулін,
що зв’язує гонадні стероїди (з дозволу 8 Мопгое).
Холестерол
Прегненолон
І
Прогестерон
17а-Гідроксипрегненолон
І
17а-Гідроксипрогестерон -
Дегідроепіандростерон
І
Андростендіон
Дигідротестостерон
ОН
У деяких
тканинах-мішенях
5а-редуктаза,
типу 1 чи 2
О
Тестостерон
Рис. 23-19. Біосинтез тестостерону. Формули попередників стероїдів показані на рис. 20-8. Хоча головним продуктом секреції
клітин Лейдіґа є тестостерон, деякі попередники теж потрапляють у кров’яне русло
394 / РОЗДІЛ 23
стероїдів - слабкі андрогени (вони мають 20% чи менше
дії тестостерону), однак зазначимо, що не всі 17-кето-
стероїди є андрогенами і не всі андрогени є 17-кетостеро-
їдами. Наприклад, етіохоланолон не має андрогенової
активності, а тестостерон сам по собі не є 17-кетостеро-
їдом.
ДІЯ
Окрім впливу під час розвитку (див. вище), тестостерон
та інші андрогени, по-перше, виявляють зворотний
інгібувальний ефект на виділення ЛГ гіпофізом; по-друге,
впливають на розвиток та усталення вторинних чоловічих
статевих ознак; по-третє, мають важливий білок-анабо-
лічний ефект та активність, що стимулює ріст; по-четверте,
разом із ФСГ підтримують сперматогенез (див. вище).
Вторинні статеві ознаки
У хлопців під час пубертату відбуваються зміни у
розподілі волосся, формі тіла та розмірах статевих органів.
Чоловічі вторинні статеві ознаки наведені у табл. 23-6.
Передміхурова залоза і сім’яні міхурці збільшуються, сім’я-
ні міхурці починають виділяти фруктозу. Цей цукор є голов-
ним джерелом живлення для сперматозоїдів. Вплив тесто-
стерону на психіку людини важко визначити, однак у під-
дослідних тварин андрогени спричинюють бурхливу та
агресивну поведінку. Вплив андрогенів та естрогенів на
статеву поведінку детально розглянуто у Розділі 15. Хоча
ріст волосся на тілі під впливом андрогенів посилюється,
проте кількість волосся на голові зменшується (рис. 23-
21). Спадкове облисіння не виявляється доти, доки є дигід-
ротестостерон.
Анаболічний вплив
Андрогени посилюють синтез і гальмують розщеплення
білка, що веде до пришвидшення росту. Вважали дове-
деним фактом, що вони спричинюють закриття епіфізів
трубчастих кісток, завдяки чому припиняється ріст, однак
Етіохоланолон
Рис. 23-20. Два 17-кетостероїдні метаболіти тестостерону.
Таблиця 23-6. Зміни в організмі, які виникають у хлопців
під час пубертату (чоловічі вторинні статеві ознаки)
Зовнішні статеві органи: розміри прутня збільшуються у
довжині та ширині Калитка стає піґментованою та
зморшкуватою.
Внутрішні статеві органи: сім’яні міхурці збільшуються і
починають виконувати функцію, виділяючи фруктозу
Передміхурова та цибулино-сечівникові залози
збільшуються і секретують.
Голос: гортань збільшується, голосові зв’язки збільшу-
ються у довжині і товщині, голос стає грубшим.
Ріст волосся: з’являється борода. Лінія росту волосся
на голові зміщується у передньолатеральному
напрямі. Волосся на лобку росте за чоловічим типом
(трикутником з вершиною догори). З’являється
волосся в аксилярній ділянці, на грудній клітці,
довкола ануса; збільшується кількість волосся на тілі.
Поведінка: агресивніша, активніша. Виникає зацікавлен-
ня до осіб протилежної статі.
Будова тіла: плечі ширшають, м’язи збільшуються
Шкіра: збільшуються густина й об’єм виділень сальних
залоз (передумови до виникнення акне)
сьогодні з’ясовано, що закриття епіфізів зумовлюють
естрогени (див. нижче і Розділ 22). Вторинно до анабо-
лічного впливу андрогени зменшують затримування нат-
рію, калію, води, кальцію, сульфатів і фосфатів, а також
сприяють збільшенню розмірів нирок. Дози екзогенного
тестостерону, які дають помітний анаболічний ефект, спри-
чинюють також маскулінізацію та підвищення лібідо, що
обмежує використання гормонів як анаболічного засобу
для пацієнтів із виснаженням. Спроби створення синте-
тичних стероїдів, у яких анаболічна активність була б
відділеною від андрогенної, не були успішними.
Механізм дії
Як і інші стероїди (див. Розділ 1), тестостерон зв’язу-
ється із внутрішньоклітинним рецептором, надалі комп-
лекс рецептор-стероїд зв’язується із ДНК у ядрі, сприяючи
транскрибуванню різних генів. Крім того, тестостерон у
деяких клітинах-мішенях (див. рис. 23-19) за участю 5а-
редуктази перетворюється у дигідротестостерон (ДГТ),
який зв’язується із тим самим внутрішньоклітинним
рецептором, що й тестостерон. ДГТ також циркулює кро-
в’яним руслом; його рівень у плазмі становить близько 10%
від рівня тестостерону. Комплекси тестостерон-рецептор
менш стійкі, ніж комплекси ДГТ-рецептор у клітинах-
мішенях, і вони гірше перетворюються до ДНК-зв’язаного
стану. Отже, утворення ДГТ є засобом посилення дії тесто-
стерону у тканинах-мішенях. У людини розрізняють два
види 5а-редуктаз, кодованих різними генами. Тип 1 5а-
редуктази наявний у шкірі всього тіла і є домінантним
ензимом у шкірі тої частини голови, де росте волосся.
Тип 2 5а-редуктази міститься у шкірі статевих органів,
простаті та інших їхніх тканинах.
Комплекси тестостерон-рецептор відповідають за до-
зрівання структур протоки Вольфа, отже, за формування
чоловічих зовнішніх статевих органів під час розвитку.
Комплекси ДГТ-рецептор потрібні для формування чоло-
ГОНАДИ: РОЗВИТОК І ФУНКЦІЇ РЕПРОДУКТИВНОЇ СИСТЕМИ / 395
Рис. 23-21. Лінія росту волосся у дітей і дорослих осіб. Як бачимо, у жінки вона така ж, як у дитини, а в чоловіка піднімається
у латеральній лобній ділянці.
вічих внутрішніх статевих органів (рис. 23-22), вони голов-
но відповідають за ріст простати і, очевидно, прутня під
час пубертату, а також волосся на обличчі, акне та скроневі
зміщення лінії росту волосся. З іншого боку, збільшення
м’язової маси і розвиток чоловічого статевого потягу та
лібідо залежать більше від тестостерону, ніж від ДГТ.
Уроджена недостатність 5а-редуктази внаслідок
мутації гена для типу 2 5<х-редуктази І поширена у
центральних частинах Домініканської Республіки. Вона
спричинює цікаву форму чоловічого псевдогермафроди-
тизму. Особи з цим синдромом народжуються із внутріш-
німи чоловічими статевими органами, у тім числі яєчками,
однак мають зовнішні жіночі статеві органи і переважно
ростуть як дівчатка. Проте коли вони досягають пубертату,
то посилюється виділення ЛГ і збільшується концентрація
тестостерону у кров’яному руслі. Внаслідок цього тіло
набуває чоловічих форм, і розвивається чоловіче лібідо. У
цей період такі особи переважно змінюють свої ознаки
статі і “стають хлопцями”. їхні клітори збільшуються (англ.
“репІ8-аМ2 зупбготе”) настільки, що деякі із них мають
статеві контакти з жінками. Очевидно, таке збільшення
виникає внаслідок високого рівня ЛГ на фоні достатнього
вмісту тестостерону, який перекриває потребу у збільшенні
ДГТ в статевих органах.
Ліки, які інгібують 5а-редуктазу, сьогодні використо-
вують для лікування доброякісної гіпертрофії простати.
Найширше застосовують фінестерид, який сильніше впли-
ває на тип 2 5а-редуктази.
Продукування яєчками естрогенів
Понад 80% естрадіолу та 95% естрону у плазмі дорос-
лого чоловіка утворюється шляхом ароматизації циркулю-
вального тестостерону й андростендіону. Решта походить
з яєчок. Деяка частина естрадіолу у тестикулярній венозній
крові виникає в клітинах Лейдіґа, проте інша частина також
утворюється шляхом ароматизації андрогенів у клітинах
Сертолі. У чоловіків рівень естрадіолу в плазмі становить
20-50 пг/мл (73-184 пмоль/л), а рівень загального виді-
Регулювання
гонадотропіну
Спермато-
генез
Статева
диференціація
Вольфієве
подразнення
Зовнішня
вірилізація
Статеве
дозрівання під
час пубертату
Рис. 23-22. Схематичне зображення дії тестостерону (суцільні стрілки) та дигідротестостерону (штрихові стрілки). Зазначимо,
що обидва зв’язуються з тим самим рецептором, однак ДГТ - ефективніше (відтворено за дозволом з \Л/іІзоп ЗО, СгіГГіп ЛЕ,
РиззеІ \Л/ ЗіегоісІ бос-гесіисіазе 2 беГісіепсу. Епсіосг Кєу 1993; 14:577)
396 / РОЗДІЛ 23
лення - приблизно 50 мкг/добу (184 нмоль/добу). На від-
міну від жінок, у чоловіків з віком помірно збільшується
утворення естрогенів.
РЕГУЛЮВАННЯ ФУНКЦІЇ ЯЄЧОК
ФСГ є тропним до клітин Сертолі, спільно з андрогена-
ми підтримує гаметогенну функцію яєчок, а також стиму-
лює виділення АВР та інгібіну, який завдяки зворотному
зв’язку пригнічує виділення ФСГ. ЛГ тропний до клітин
Лейдіґа і стимулює виділення тестостерону, який унаслі-
док зворотного зв’язку пригнічує виділення ЛГ. Ураження
гіпоталамуса у тварин та захворювання гіпоталамуса в
людини призводить до атрофії яєчок і втрати їхньої функ-
ції.
Інгібін
Тестостерон у плазмі знижує рівень ЛГ, однак не впли-
ває на рівень ФСГ, за винятком великих доз. Рівень ФСГ у
плазмі збільшується у пацієнтів з атрофією звивистих сім’я-
них канальців, проте з нормальним рівнем тестостерону
та виділенням ЛГ. Ці спостереження сприяли ідентифікації
інгібіну - фактора тестикулярного походження, який
пригнічує виділення ФСГ. Розрізняють два інгібіни у витя-
гах з яєчок у чоловіка та в антральній рідині фолікулів яєч-
ників жінки. Вони складаються із трьох поліпептидних суб-
одиниць: глікозильованої р-субодиниці (молекулярна маса
18 000) та двох неглікозильованих р-субодиниць рА і рв,
(молекулярна маса кожної 14 000). Субодиниці утворю-
ються з білків-попередників (рис. 23-23); а-субодиниця
з’єднується з рА, щоб утворити гетеродимер, та з рв для
утворення іншого гетеродимера, де субодиниці зв’язані
дисульфідними зв’язками. Як <хрА (інгібін А), так і арв
(інгібін В) пригнічують виділення ФСГ, безпосередньо
діючи на гіпофіз, хоча сьогодні доведено, що саме інгібін
В регулює виділення ФСГ у дорослих жінок та чоловіків.
а-попередник
І І—....-І
рА-попередник
і ....................і—
рв-попередник
І І—
Рис. 23-23. Білкові попередники інгібіну та різні інгібіни й
активіни, які утворюються із карбоксильних кінцевих ділянок
цих попередників; 88 - дисульфідні зв’язки.
Місцем продукування інгібінів є клітини Сертолі у чоло-
віків і Гранульозні клітини у жінок.
Крім того, утворюються гетеродимери рАрв та гомоди-
мери рАрА І рврв Вони швидше стимулюють, а не пригні-
чують виділення ФСГ, тому їх називають активінами. їхня
роль у репродукуванні досі не з’ясована. Інгібіни та акти-
віни належать до суперродини білків ТФРр, які є димер-
ними поліпептидними факторами росту. До цієї родини
належать також ІРМ (див. вище). Клоновано два акти-
вінові рецептори, обидва виявилися сериновими кіназами.
Зазначимо, що інгібіни та активіни виявлені не тільки у
гонадах, а й у мозку та багатьох інших тканинах. У кістко-
вому мозку активіни задіяні у розвитку лейкоцитів; у період
ембріонального розвитку вони беруть участь у формуванні
мезодерми. Нормальний розвиток мишей із цілеспрямо-
ваною делецією гена ос-субодиниці інгібіну закінчувався
виникненням пухлини строми гонад. Тому цей ген також
уважають супресором пухлинного росту.
У плазмі активіни та інгібіни зв’язує а2-макроглобулін.
У тканинах активіни зв’язані чотирма глікопротеїнами, які
називають фолістатинами. Зв’язування активінів інакти-
вує їхню біологічну активність. Вплив фолістатинів на інгі-
біни та їхня фізіологічна функція не з’ясовані.
Шлях зворотного зв’язку стероїдів
Робоча гіпотеза щодо регулювання функції яєчок відоб-
ражена на рис. 23-24. Кастрація супроводжується збіль-
шенням гіпофізарного вмісту та виділенням ФСГ і ЛГ, а
ураження гіпоталамуса запобігає цьому збільшенню. Тес-
тостерон пригнічує виділення ЛГ, діючи безпосередньо на
передню частку гіпофіза і пригнічуючи виділення ГнРГ
Рис. 23-24. Схема взаємозв’язків між гіпоталамусом, перед-
ньою часткою гіпофіза та яєчками. Суцільними стрілками
показано стимулювання, штриховими - пригнічення. Порів-
няйте з рис. 18-13, 20-20, 22-11, 23-38.
ГОНАДИ: РОЗВИТОК І ФУНКЦІЇ РЕПРОДУКТИВНОЇ СИСТЕМИ / 397
гіпоталамусом. Інгібін діє на передню частку гіпофіза, при-
гнічуючи виділення ФСГ.
У відповідь на ЛГ частина тестостерону, виділена кліти-
нами Лейдіґа, впливає на епітелій звивистих сім’яних
канальців і спричинює високу локальну концентрацію
андрогенів у клітинах Сертолі, необхідну для нормального
сперматогенезу. Системне призначення тестостерону не
підвищує рівня андрогенів у яєчках до високих показників
і пригнічує виділення ЛГ. Внаслідок систематичного прий-
мання тестостерону простежується зменшення кількості
сперматозоїдів. Терапію тестостероном запропоновано як
засіб контрацепції для чоловіків, однак тестостерон у
дозах, необхідних для пригнічення сперматогенезу, зумов-
лює затримку натрію і води в організмі. Сьогодні дослід-
жують можливість використання інгібінів як контрацеп-
тивних засобів для чоловіків.
ПОРУШЕННЯ ФУНКЦІЇ яєчок
Крипторхізм
Яєчка розвиваються у черевній порожнині і в нормі
опускаються в калитку під час внутрішньоутробного роз-
витку. Опускання яєчок у пахову ділянку залежить від
ІРМ, а з пахової ділянки у калитку - від інших факторів.
Неповне опускання з одного чи обох боків трапляється у
10% новонароджених хлопчиків, у яких яєчка залишаються
у черевній порожнині чи паховому каналі. У деяких випад-
ках лікування гонадотропним гормоном прискорює опус-
кання, або ж дефект коригують хірургічним способом. Як
звичайно, яєчка опускаються самовільно, і відсоток хлоп-
чиків із неопущенням яєчок (крипторхізм) зменшується
до 2% у віці одного року і 0,3% після настання пубертату.
Сьогодні рекомендують якомога раніше лікувати це пору-
шення, оскільки є високий ризик злоякісного пухлинного
переродження у неопущених яєчках порівняно із опуще-
ними у калитку. Крім того, із настанням пубертату вища
температура в черевній порожнині з часом спричинює
незворотне ушкодження сперматогенного епітелію.
Чоловічий гіпогонадизм
Клінічна картина чоловічого гіпогонадизму залежить
від періоду, коли виникла тестикулярна недостатність: до
чи після настання пубертату. Якщо у дорослих це зумов-
лено захворюванням яєчок, то рівень циркулювального
гонадотропіну підвищений (гіпергонадотропний гіпого-
надизм), а якщо є наслідком порушень гіпофіза чи гіпо-
таламуса (синдром Кал мана; див. Розділ 14) - то знижений
(гіпогонадотропний гіпогонадизм). Якщо ж ендокринна
функція яєчок втрачена в юнацькому віці, то вторинні ста-
теві ознаки повільно регресують, оскільки потрібна хоча
б мінімальна кількість андрогенів для їхнього підтримання
після первинного усталення. Ріст гортані у дорослому віці
є постійним, і голос залишається грубим. У чоловіків,
кастрованих дорослими, виникає незначна втрата лібідо,
хоча здатність до статевого акту зберігається ще деякий
час. Вони періодично мають припливи жару і є дратівливі-
шими, пасивними та депресованими порівняно з чолові-
ками, у яких здорові яєчка. Якщо недостатність клітин Лей-
діґа простежується з дитинства, то розвивається клінічна
картина євнухоїдизму. У віці понад 20 років особи з євну-
хоїдизмом мають характерний високий зріст, хоча вони не
настільки високі, як гіпергіпофізарні велетні, оскільки їхні
епіфізи відкриті, і ріст триває після настання нормального
віку пубертату. Вони мають вузькі плечі і малорозвинені
м’язи, їхня фігура нагадує фігуру дорослої жінки. Статеві
органи у них малі, а голос дуже високий. Волосся в акси-
лярній ділянці та ділянці лобка росте, оскільки зберігається
виділення адренокортикальних андрогенів. Проте воно
рідкісне, а на лобку має швидше жіночу форму трикутника
з основою угорі, ніж чоловічу - трикутник з основою внизу
(чоловічий щит).
Пухлини, що їх виділяють андрогени
Гіперфункцію яєчок, якщо нема пухлинних утворів, не
можливо виявити. Пухлини клітин Лейдіґа, які виділяють
андрогени, трапляються зрідка і зумовлюють ендокринні
симптоми, які можна виявити у хлопчиків препубертат-
ного віку, у яких настає передчасний псевдопубертат (див.
табл. 23-2).
ЖІНОЧА СТАТЕВА СИСТЕМА
МІСЯЧНИЙ ЦИКЛ
Жіноча статева система (рис. 23-25), на відміну від чоло-
вічої, підпадає під регулярні циклічні зміни, які телеоло-
гічно розцінюють як періодичні приготування до заплід-
нення і вагітності. У людини та інших ссавців їх називають
місячними циклами. їхньою очевидною ознакою є періо-
дичні піхвові кровотечі. Вони виникають із відшаруванням
слизової оболонки матки (місячна). Тривалість циклу у
жінок неоднакова, проте в середньому становить 28 днів
(від першого дня однієї місячної до першого дня наступ-
ної). Дні циклу позначають номерами, починаючи з пер-
шого.
Яєчниковий цикл
Від моменту народження під капсулою яєчника міс-
титься багато примордіальних фолікулів. У кожному з
них є незріла яйцеклітина (рис. 23-26). На початку кожного
циклу декілька фолікулів збільшуються в розмірах, і дов-
кола яйцеклітини утворюється порожнина (фолікулярна
печера), заповнена фолікулярною рідиною. У людини один
фолікул в одному з яєчників починає швидко рости і на
шостий день стає домінантним фолікулом, тоді як інші
регресують, формуючи атретичні фолікули. Атретичний
процес передбачає апоптоз. Як відбувається вибір одного
фолікула, який стає домінантним під час фолікулярної
фази місячного циклу, не з’ясовано. Можливо, це пов’язане
зі здатністю фолікула секретувати естроген, потрібний для
кінцевого дозрівання. У випадку, коли жінці роблять ін’єк-
ції високоочищеного гіпофізарного гонадотропіну люди-
ни, одночасно може розвиватися багато фолікулів.
Структура зрілого (граафового) фолікула яєчника схе-
матично показана на рис. 23-26. Клітини внутрішньої
398 / РОЗДІЛ 23
Рис. 23-25. Жіноча статева система.
теки фолікула є головним джерелом естрогенів, що цир-
кулюють у кров’яному руслі. Крім того, внутрішня фолі-
кулярна рідина має високий вміст естрогенів, більша час-
тина з яких походить безпосередньо з гранульозних клітин
(див. нижче).
Приблизно на 14-й день циклу наповнений фолікул роз-
ривається, і яйцеклітина виходить у черевну порожнину.
Це процес овуляції. Яйцеклітину захоплюють фімбріальні
кінчики маткових труб (яйцеводів). Далі вона переходить
до матки і, якщо вагітність не настає, виходить через піхву.
Примордіальний Інтерстиціальна Антральний
Ембріональний фолікул клітинна маса
епітелій
Строма
яєчника
Зрілий
фолікул
Антрум
судини
Білувате
тіло
Овульований
овоцит
Геморагічне
тіло
Жовте тіло,
що регресує
Молоде
жовте тіло
Атрезований
фолікул
Зріле
жовте тіло
Рис. 23-26. Схематичне зображення яєчників ссавців, на якому простежено розвиток фолікула, утворення жовтого тіла і в
центрі атрезія фолікула. Частина стінки зрілого фолікула збільшена у верхньому правому куті. Інтерстиціальна клітинна маса
не виражена у приматів (відтворено за дозволом з богЬтал А, Вегп Н: ТехІЬоок ої Сотрагаїіуе Епсіосгіпоіоду. УУІІеу, 1962).
Зовнішня тека
Внутрішня тека
Зернистий шар
Фолікулярна рідина
ГОНАДИ: РОЗВИТОК І ФУНКЦІЇ РЕПРОДУКТИВНОЇ СИСТЕМИ / 399
Фолікул, який розривається під час овуляції, відразу
заповнюється кров’ю, утворюючи те, що деколи називають
геморагічним тілом. Незначна кровотеча з фолікула у
черевну порожнину може спричинити подразнення оче-
ревини і короткочасний біль низом живота. Гранульозні
клітини і клітини теки вистилки фолікула відразу почи-
нають проліферувати, і згусток крові швидко заміщується
жовтуватими лютеальними клітинами, які багаті на ліпі-
ди й утворюють жовте тіло. Це ініціює лютеїнову фазу
місячного циклу, під час якої лютеальні клітини виділяють
естрогени та прогестерон. Ріст жовтого тіла залежить від
достатності кровопостачання, є докази, що у цьому процесі
важливу роль відіграє судинний ендотеліальний фактор
росту (див. Розділ 20).
Якщо настає вагітність, то жовте тіло персистує, і місяч-
ні, як звичайно, не відбуваються аж до пологів. Якщо ж
вагітність не настає, то жовте тіло починає дегенерувати
протягом чотирьох днів до наступної місячної (24-й день
циклу), і його заміщує рубцева тканина, утворюючи білу-
вате тіло.
У багатьох ссавців яєчниковий цикл дуже подібний до
людського, за винятком того, що у багатьох видів овулює
більше одного фолікула, і це закінчується народженням
багатьох особин. Жовте тіло утворюється також у деяких
доссавцевих видів.
У людини після народження нові яйцеклітини вже не
утворюються. Під час внутрішньоутробного розвитку яєч-
ники містять понад 7 млн примордіальних фолікулів. Проте
багато з них підлягають атрезії (інволюції) до народження,
тоді як інші зникають після народження. На момент народ-
ження є близько 2 млн яйцеклітин, однак 50% з них атрезо-
вані. Мільйон із тих, які є нормальними, у цей час підлягає
першій частині першого мейотичного поділу і зупиняється
у стадії профази, в якій ті, котрі вижили, існують аж до
зрілості. Атрезія триває і під час розвитку, тому кількість
яйцеклітин в обох яєчниках під час пубертату менше
300 000 (див. рис. 23-13). За цикл тільки одна яйцеклітина
(чи близько 500 протягом нормального репродуктивного
життя) досягає зрілості; ті, що залишилися, дегенерують.
Перший мейотичний поділ завершується тільки перед ову-
ляцією. Одна з дочірних клітин - вторинний ооцит - отри-
мує більшу частину цитоплазми, тоді як інша - перше
полярне тільце - фрагментується і зникає. Вторинний
ооцит відразу ж вступає у другий мейотичний поділ, який
припиняється в метафазі і закінчується, якщо сперматозоїд
проникає в яйцеклітину. У цей час відділяється друге
полярне тільце, і з заплідненої яйцеклітини починає роз-
виватися новий організм. Зупинка у метафазі зумовлює,
принаймні у деяких видів, утворення в яйцеклітині білка
рр39т'“, структура якого кодована протоонкогеном с-тоз.
У випадку запліднення яйцеклітини рр39т08 руйнується за
30 хв калпаїном - кальційзалежною цистеїнспецифічною
протеїназою.
Матковий цикл
На кінець місячної відшаровуються всі, за винятком гли-
боких, шари ендометрія. Під впливом естрогенів фолікула,
який розвивається, товщина ендометрія протягом 4-14 днів
місячного циклу швидко збільшується. Зі збільшенням
товщини маткові залози видовжуються (рис. 23-27), однак
не стають звивистими і поки що не секретують. Такі зміни
ендометрія називають проліферативними, а цю частину
циклу - проліферативною фазою, або преовуляторною,
чи фолікулярною, фазою циклу. Після овуляції під впливом
естрогенів та прогестерону жовтого тіла ендометрій стає
ліпше васкуляризованим і злегка набрякає, а залози - зви-
вистими (див. рис. 23-27) і починають секретувати прозору
рідину. Цю фазу циклу називають секреторною, або люте-
їновою. Наприкінці лютеїнової фази ендометрій, як і
передня частка гіпофіза, виділяє пролактин, проте його
функція до кінця не з’ясована.
До ендометрія кров надходить через два типи артерій.
Поверхневі дві третини ендометрія, які відшаровуються
під час місячної (функціональний шар), отримують кров
через довгі звивисті спіральні артерії (рис. 23-28), тоді
як глибокий шар, який залишається (базальний шар), -
через короткі прямі базальні артерії.
Після регресії жовтого тіла гормональна підтримка
ендометрія припиняється. Ендометрій тоншає внаслідок
скручення спіральних артерій; у ньому з’являються вог-
нища некрозу, які зливаються між собою. Спазм і подаль-
ший некроз стінок спіральних артерій веде до появи гемо-
◄---------Проліферативна фаза------------► ◄-------------Секреторна фаза---------------►
__і___і__і__і__і___і__і__і__і__і___і__і__і І і__і__і__і__і___і__і__і і і і і і і І і і
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 1 2 3
День циклу
Рис. 23-27. Зміни ендометрія під час місячного циклу.
400 / РОЗДІЛ 23
рагій, які починають кровити і спричинюють місячну кро-
вотечу.
Очевидно, вазоспазм виникає внаслідок локального
вивільнення простагландинів, велика кількість яких у
секреторному ендометрії та місячній крові, а також інфузія
ПГР2а зумовлюють некроз ендометрію і кровотечу. Одна з
теорій настання місячної полягає в тому, що в некротичних
ендометріальних клітинах руйнуються лізосомні мембрани
із вивільненням ензимів, які сприяють утворенню проста-
гландинів із фосфоліпідів клітини.
З погляду функцій ендометрія проліферативна фаза
місячного циклу забезпечує відновлення ендометрія після
попередньої місячної, а секреторна - приготування матки
до імплантації заплідненої яйцеклітини. Тривалість секре-
торної фази стала і становить близько 14 днів, а коливання
у тривалості місячного циклу більше пов’язані із пролі-
феративною фазою. Якщо запліднення під час секреторної
фази не відбулося, то ендометрій відшаровується, і почи-
нається новий цикл.
Порожнина матки
Рис. 23-28. Спіральна артерія ендометрія. Зображення спі-
ральної артерії (ліворуч) і двох маткових залоз (праворуч)
ендометрія резус мавпи; рання секреторна фаза (відтворено
за дозволом з Оагоп 6Н: Тїіе агіегіаі раїїегп ої іїіе іипіса ти-
сова ої Ше иіегив іп іііе Масасив іііевив. Ат 3 Апаї 1936;58:
349).
Нормальна місячна
Кров місячних артеріального походження і лише 25%
її з вен. Вона містить тканинні залишки, простагландини і
велику кількість фібринолізину з ендометріальної тканини.
Фібринолізин розчиняє тромби, тому ця кров у нормі не
містить згустків, за винятком ситуації, коли виділення
надмірні.
Середня тривалість місячних виділень - три-п’ять днів,
хоча у здорової жінки вони можуть бути від 1 до 8 днів.
Крововтрата в нормі може коливатися від декількох кра-
пель до 80 мл; у середньому - ЗО мл. Втрата понад 80 мл є
порушенням. Кількість виділень залежить від багатьох чин-
ників: товщини ендометрію, приймання ліків і хвороб, що
порушують механізм зсідання крові. Після місячної із ба-
зального шару регенерується новий ендометрій.
Ановуляторні цикли
У деяких випадках овуляція під час місячного циклу не
настає. Такі ановуляторні цикли характерні у перші 12-18
місяців після менархе і перед настанням менопаузи. Якщо
овуляція не настає, то жовте тіло не утворюється, і прогес-
терон не діє на ендометрій. Естрогени продовжують викли-
кати ріст і ендометрій стає достатньо товстим, щоб поча-
лося відшарування. Період до настання кровотечі може
коливатися, однак переважно він менше 28 днів від остан-
ньої місячної. Кровотеча також буває різною - від незнач-
ної до профузної.
Циклічні зміни шийки матки
Шийка матки є продовженням тіла матки, однак вона
має деякі особливі ознаки. Слизова оболонка шийки матки
не підлягає циклічній десквамації, водночас у ній також
відбуваються регулярні зміни. Естрогени зумовлюють
потоншення слизової та її залужнення, що сприяє вижи-
ванню і просуванню сперматозоїдів. Прогестерон робить
її грубшою, липкою і пористою. Під час овуляції слиз стає
густішим, його еластичність збільшується настільки, що
в середині циклу краплю слизу можна розтягнути у тонку
нитку завдовжки 8-12 см чи й більше. Крім того, на пред-
метному склі слиз утворює рисунок папороті (див. рис.
23-29), тоді як рідкий просто розпливається. Після ову-
ляції та протягом вагітності слиз стає густим і не утво-
рює малюнка папороті.
ПІХВОВИЙ цикл
Під впливом естрогенів епітелій піхви стає зроговілим;
зроговілі епітеліальні клітини можна виявити у піхвовому
мазку. Під дією прогестерону виділяється густий слиз, епі-
телій проліферує, і його інфільтрують лейкоцити. Циклічні
зміни у піхвових мазках щурів досить помітні. Зміни у
людини та інших видів подібні, проте не такі чіткі.
Циклічні зміни у молочних залозах
У нормі лактація не починається до закінчення вагіт-
ності, однак протягом місячного циклу простежуються
циклічні зміни у молочних залозах. Естрогени зумовлюють
проліферацію проток молочних залоз, а прогестерон - ріст
часток і альвеол. Набрякання, чутливість і болючість гру-
дей протягом десяти днів до місячної, очевидно, спричи-
нені розширенням проток, гіперемією і набряком інтерсти-
ГОНАДИ: РОЗВИТОК І ФУНКЦІЇ РЕПРОДУКТИВНОЇ СИСТЕМИ / 401
Рис. 23-29. Малюнок, що його утворює шийковий слиз на
предметному склі, висушений і розглянутий під мікроскопом.
Прогестерон робить слиз густим і пористим У зразку паці-
єнтки без овуляції (нижній) немає прогестерону для при-
гнічення малюнка папороті, зумовлюваного естрогенами.
ційної тканини грудей. Усі ці зміни регресують разом із
симптомами під час місячної.
Зміни, які настають під час статевого акту
Під час статевого збудження у жінки відбувається виді-
лення рідини на стінки піхви, ймовірно, внаслідок вивіль-
нення ВІП з піхвових нервів. Змазку виділяють також вес-
тибулярні залози. Верхня частина піхви чутлива до метрич-
них змін, тоді як тактильне стимулювання малих статевих
губ і клітора додає сексуального збудження. Це збудження
підсилюють подразнення грудей і, як у чоловіків, зорові,
слухові і нюхові збудники, які приводять до оргазму. Під
час оргазму відбувається автономно опосередковане рит-
мічне скорочення стінок піхви. Імпульси також поширю-
ються по соромітних нервах і зумовлюють ритмічне скоро-
чення цибулино-губчастого та сіднично-печеристого м’я-
зів. Скорочення піхви сприяють просуванню сперми, однак
вони не обов’язкові для цього, оскільки запліднення яйце-
клітини не залежить від оргазму.
Показники овуляції
Розуміння та знання, коли під час місячного циклу
настає овуляція, потрібне для виявлення вірогідності
запліднення, тобто для планування сім’ї. Зручним і надій-
ним показником часу овуляції є зміна (як звичайно, під-
вищення) базальної температури тіла (рис. 23-30). Жінки,
зацікавлені в отриманні правильних результатів темпера-
тури, повинні використовувати термометр із широким ґра-
27 367-2
дуюванням і вимірювати температуру (оральну чи рек-
тальну) вранці, перш ніж встати з ліжка. Причиною зміни
температури під час овуляції є, ймовірно, збільшене виді-
лення прогестерону, оскільки він має термогенний вплив
(див. Розділ 14).
Хвиля виділення ЛГ', що спричинює овуляцію (див.
нижче), та овуляція в нормі настає через 9 год після досяг-
нення максимального рівня ЛГ усередині циклу (див. рис.
23-30). Яйцеклітина живе приблизно 72 год після виходу з
фолікула, однак придатна до запліднення значно менше.
Вивчення зв’язку між статевим актом і вагітністю дало змо-
гу виявити, що у 36% жінок вагітність настає після стате-
вого акту в день овуляції; у випадку статевих актів протягом
наступних днів цей показник зменшується до нуля. Статеві
акти за день чи два до овуляції також закінчувалися вагіт-
ністю у 36% жінок. Декілька вагітностей зафіксовано після
статевих актів за три, чотири чи п’ять днів до овуляції,
хоча відсоток був значно нижчим (наприклад, 8% за п’ять
днів до овуляції). Деякі сперматозоїди можуть жити у ста-
тевих шляхах жінки і запліднювати навіть за 120 год до
овуляції, однак найбільш фертильним періодом є 48 год
до овуляції. Для тих, хто цікавиться ритмічним методом
контрацепції, зазначимо, що зрідка (у літературі все ж
зафіксовано) трапляються випадки, коли вагітність настає
від коітусів у будь-який день циклу.
Еструс-цикл
Усі ссавці, крім приматів, не мають місячного циклу, а
їхній статевий цикл називають еструс-циклом з огляду на
помітний період “жару” (еструс) під час овуляції. У нормі
це єдиний час статевого потягу в осіб жіночої статі (див.
Розділ 15). У деяких видів зі спонтанною овуляцією та
еструс-циклами, наприклад, у щурів, епізодичних піхвових
кровотеч не виникає, однак відбуваються ендокринні зміни,
такі як під час місячного циклу. В інших видів овуляція
індукована копуляцією (рефлекторна овуляція).
ГОРМОНИ ЯЄЧНИКА
Хімічна будова, біосинтез та метаболізм
естрогенів
Естрогенами природного походження є 17|3-естрадіол,
естрон і естріол (рис. 23-31). Це С)8-стероїди (див. рис. 20-
7), тобто вони не мають бокової метальної групи у 10-му
положенні чи Д4-3-кето конфігурації в А-кільці. Головно їх
секретують гранульозні клітини фолікулів яєчників, жовте
тіло і плацента. Шлях біосинтезу передбачає їхнє утворення
з андрогенів. Вони також формуються шляхом ароматизації
андростендіону у кров’яному руслі. Ароматаза (СУР19) -
це ензим, який каталізує перетворення андростендіону в
естрон і тестостерону в естрадіол (див. рис. 23-31).
Внутрішня тека клітин багата на рецептори ЛГ; ЛГ діє
через цАМФ, збільшуючи перетворення холестеролу в
андростендіон. Частина андростендіону перетворюється
в естрадіол, який потрапляє в кровообіг. Клітини внутріш-
ньої теки постачають андростендіон у гранульозні клітини,
які утворюють естрадіол у разі забезпечення їх андроге-
нами (рис. 23-32). З’ясовано, що естрадіол, який вони утво-
рюють у приматів, секретується у фолікулярну рідину. Гра-
402 / РОЗДІЛ 23
Фолікулярна фаза
Лютеїнова фаза
36,8
36,6
36,4
Базальна
температура тіла
Рис. 23-30. Базальна температура тіла і концентрація гормонів у плазмі (значення ± стандартна похибка) під час нормального
місячного циклу людини. Показники розташовані стосовно дня максимального рівня ЛГ у середині циклу.
нульозні клітини мають багато рецепторів ФСГ, який під-
тримує секретування ними естрадіолу, діючи через цАМФ
для підвищення їхньої ароматазної активності. Зрілі грану-
льозні клітини набувають також рецепторів ЛГ, а ЛГ сти-
мулює продукування естрадіолу.
Стромальна тканина яєчників здатна до утворення анд-
рогенів та естрогенів. Імовірно, вони так і чинять, виділя-
ючи непомітні кількості в пременопаузальних жінок у
нормі. У крові 17р-естрадіол - головний естроген, який
секретується - перебуває в стані рівноваги з естроном. У
подальшому естрон метаболізує до естріолу переважно у
печінці. Зазначимо, що17р-естрадіол є найактивнішим із
трьох естрогенів, а естріол - найслабшим.
Два відсотки циркулювального естрадіолу є у вільній
формі, а решта зв’язана з білком: 60% з альбуміном, 38%
із глобуліном, що зв’язує гонадні стероїди (6В6 - від англ.
ГОНАДИ: РОЗВИТОК І ФУНКЦІЇ РЕПРОДУКТИВНОЇ СИСТЕМИ / 403
Холестерол
Прегненолон
17а-Гідроксипрегненолон-------► Дигідроепіандростерон
Рис. 23-31. Біосинтез та метаболізм естрогенів. Формули попередників стероїдів показані на рис. 20-8.
§опаба! зіегоісІ-ЬіисІіп^ £ІоЬи1іп), який зв’язує тестостерон
(див. табл. 23-5).
У печінці естрадіол, естрон та естріол перетворюються
у глюкоронові і сульфатні кон’югати. Ці сполуки виділя-
ються з сечею, як і інші метаболіти. Значна кількість секре-
тується в жовчі та реабсорбується в крові (ентерогепатична
циркуляція).
Секреція
Концентрація естрадіолу у плазмі під час місячного
циклу показана на рис. 23-30. Практично весь цей естроген
походить з яєчників. Виділяють два періоди максимальної
секреції: безпосередньо перед овуляцією та усередині
лютеїнової фази. Рівень виділення естрадіолу становить
36 мкг/добу (133 нмоль/добу) у ранню фолікулярну фазу,
380 безпосередньо перед овуляцією і 250 мкг/добу у сере-
дині лютеїнової фази (табл. 23-7). Після менопаузи виді-
лення естрогену значно знижується.
Як зазначено вище, рівень естрадіолу у чоловіків стано-
вить 50 мкг/добу (184 нмоль/добу).
Вплив на жіночі статеві органи
Естрогени підтримують ріст фолікулів у яєчниках та
посилюють рухливість маткових труб. їхній вплив на
КРОВООБІГ КЛІТИНИ ВНУТРІШНЬОЇ ТЕКИ Гранульозні клітини АНТРУМ
Холестерол ► Холестерол І Андростендіон 1 . — —► Андростендіон 1 .
СЬірсЩІО.11 естрадіол Естрадіол СС І раДІСМ 1
Рис. 23-32. Взаємодія між текою та ґранульозними клітинами у синтезуванні та секретуванні естрадіолу.
404 / РОЗДІЛ 23
Таблиця 23-7. Показники 24-годинного продукування статевих стероїдів у жінок під час різних стадій місячного циклу
Статеві стероїди Стадії
рання фолікулярна преовуляторна середина лютеїнової
Прогестерон, мг 1,0 4,0 25,0
17-Гідроксипрогестерон, мг 0,5 4,0 4,0
Дигідроепіандростерон, мг 7,0 7,0 7,0
Андростендіон, мг 2,6 4,7 3,4
Тестостерон, мкг 144,0 171,0 126,0
Естрон, мкг 50,0 350,0 250,0
Естрадіол, мкг 36,0 380,0 250,0
1 Модифіковано та відтворено за дозволом з ¥еп 88С, Заїїе РВ, ВагЬіегі РІ_: Рергосіисііуе Епсіосгіпоіоду, 41Н есі. Заипсіегз, 1999.
циклічні зміни в ендометрії, шийці та піхві розглянуто
вище. Вони також збільшують маткову кровотечу і впли-
вають на гладку мускулатуру матки, що дуже важливо. Не-
зрілі і кастровані жінки мають маленьку матку й атрофо-
ваний та неактивний міометрій. Естрогени збільшують
м’язову масу матки і вміст у ній скоротливих білків. Під
їхнім впливом м’язи стають активнішими та збудли-
вішими. Потенціали дії волокон частішають (див. Розділ
3). “Естроген-домінована” матка чутливіша до дії оксито-
цину.
Тривале лікування естрогенами веде до гіпертрофії
ендометрію. Якщо лікування естрогенами припинити, то
виникне синдром відміни - відшарування з кровотечею.
Інколи кровотечі виникають під час лікування, коли
естрогени призначають на тривалий час.
Вплив на ендокринні органи
Естрогени знижують секрецію ФСГ; за деяких умов
пригнічують секрецію ЛГ (негативний зворотний зв’язок);
за інших збільшують виділення ЛГ (позитивний зворотний
зв’язок; див. нижче). Деколи жінкам призначають великі
дози естрогенів на чотири-шість днів для запобігання
вагітності після коїтусу у фертильний період (посткоїталь-
на контрацепція). У цьому випадку вагітності, очевидно,
перешкоджає швидше порушення імплантації заплідненої
яйцеклітини, ніж зміни у виділенні гонадотропіну.
Естрогени спричинюють посилене виділення ангіотен-
зиногену (див. Розділ 24) та тиреоїдозв’язувального гло-
буліну (див. Розділ 18). Вони дають помітний білковий
анаболічний ефект у курчат та великої рогатої худоби, мож-
ливо, завдяки стимулюванню виділення андрогенів наднир-
ковими залозами. Тому лікування естрогенами часто ко-
мерційно використовують для збільшення маси домашніх
тварин. У людини вони зумовлюють закриття епіфізів.
Вплив на ЦНС
Естрогени відповідають за еструс-поведінку у тварин,
у людини ж вони підвищують лібідо, прямо впливаючи на
певні нейрони гіпоталамуса (рис. 23-33). Вплив естрогенів,
прогестерону та андрогенів на статеву поведінку розгляну-
то у Розділі 15.
Крім того, естрогени збільшують проліферацію денд-
ритів на нейронах і кількість синаптичних закінчень у
щурів. Зазначено, що у людини вони сповільнюють роз-
виток хвороби Альцгеймера (див. Розділ 16).
Вплив на молочні залози
Естрогени зумовлюють ріст проток молочних залоз і
значно відповідають за збільшення грудей під час пубер-
тату в дівчат. їх називають гормоном росту грудей. Збіль-
шення грудей унаслідок місцевого використання естро-
геновмісних шкірних кремів відбувається завдяки систе-
матичному всмоктуванню естрогенів, хоча зумовлене
також незначним місцевим впливом. Естрогени відпові-
дають за пігментацію ареол, хоча, як звичайно, пігментація
стає інтенсивно швидшою під час першої вагітності, ніж
у періоді пубертату. Роль естрогенів у загальному регулю-
ванні росту грудей і лактації розглянуто нижче.
Вторинні жіночі статеві ознаки
Зміни в організмі (збільшення грудей, матки і піхви),
які виникають у дівчаток під час пубертату, частково зумов-
лені дією естрогенів, які є фемінізувальними гормонами,
а частково - простою відсутністю тестикулярних андро-
генів. Жінки мають вужчі плечі і широкі стегна (широкий
несучий кут). Така будова тіла на додаток до жіночого типу
розподілу жирової клітковини на грудях та сідницях
Рис. 23-33. Ділянки, де імплантація естрогену в гіпоталамус
впливає на масу яєчників і статеву поведінку у щурів, спро-
ектовані на сагітальному зрізі гіпоталамуса. Імплантанти, які
стимулюють статеву поведінку, локалізовані у супрахіазма-
тичній ділянці біля перехрестя зорових нервів (сіра ділянка),
тоді як атрофію яєчників спричинюють імплантанти в аркуат-
ному ядрі та навколишньому вентральному гіпоталамусі (ко-
льорова ділянка); СТ - сосочкове тіло.
ГОНАДИ: РОЗВИТОК І ФУНКЦІЇ РЕПРОДУКТИВНОЇ СИСТЕМИ / 405
трапляється також у кастрованих чоловіків. У жінок гор-
тань зберігає допубертатні пропорції, і голос залишається
високим. Волосся на їхньому тілі менше, а на голові біль-
ше, на лобку воно росте характерним трикутником з осно-
вою вгорі. Лобкове та аксилярне волосся у жінок росте
швидше під дією андрогенів, ніж естрогенів, хоча лікуван-
ня естрогенами може спричинити його незначний ріст.
Андрогени походять із кори надниркових залоз і, менше, з
яєчників.
ІНШИЙ ВПЛИВ
У нормі в жіночому організмі відбувається затримка солі
та води і збільшення маси тіла безпосередньо перед місяч-
ною. Деяку затримку солі і води зумовлюють естрогени.
Крім того, простежується дещо посилене виділення альдо-
стерону під час лютеїнової фази, що також приводить до
передмісячної затримки рідини.
Естрогени спричинюють розрідження секрету сальних
залоз, тому виявляють зворотний до тестостерону ефект і
пригнічують утворення вугрів (“чорних голівок”) та акне.
Печінкові долоні, зірчасті гемангіоми і незначне збіль-
шення грудей, що бувають під час прогресування хвороб
печінки, зумовлені збільшенням вмісту циркулювальних
естрогенів. Таке збільшення зумовлене зниженням печін-
кового метаболізму андростендіону, який збільшує кіль-
кість андрогену, здатного до перетворення в естрогени.
Крім того, естрогени помітно впливають на зниження
рівня холестеролу в плазмі (див. Розділ 17). Вони швидко
спричинюють вазодилятацію, збільшуючи локальне утво-
рення оксиду азоту (N0) (див. Розділ 31). Це пригнічує
атерогенез і приводить до зменшення кількості випадків
інфаркту міокарда та інших ускладнень атеросклерозу
судин у пременопаузальних жінок. Малі дози естрогенів
зменшують кількість серцево-судинних захворювань після
менопаузи. Проте великі дози оральних активних естро-
генів зумовлюють тромбози, очевидно, тому, що вони дося-
гають печінки у високих концентраціях із портальною
кров’ю і змінюють печінкове продукування факторів зсі-
дання крові.
Механізм дії
Подібно до інших стероїдів (див. Розділ 1) естрогени
зв’язуються із білковими рецепторами в ядрі. Такі комп-
лекси взаємодіють з ДНК, сприяючи утворенню мРНК, що,
відповідно, забезпечує формування нових білків, які регу-
люють клітинні функції. Клоновано гени двох естроге-
нових рецепторів: естрогеновий рецептор а (ЕКа) та ест-
рогеновий рецептор Р (ЕКР). Незважаючи на подібність,
локалізація цих рецепторів різна. Експресія ЕКа помірна
порівняно з його високою експресією у матці, яєчках, гіпо-
фізі, нирках, над’яєчках і надниркових залозах, тоді як екс-
пресія ЕКР висока в яєчниках, простаті, легенях, сечовому
міхурі, головному мозку і кістках. Припускають, що регу-
лювання функції яєчників системою гіпофіз-яєчники опо-
середковане ЕКа, тоді як естрогени, секретовані у фоліку-
лах яєчників, діють через ЕК.р. Миші чоловічої і жіночої
статі, у яких блоковано ген ЕКа, є стерильними, у них
розвивається остеопороз і триває ріст, оскільки їхні епіфізи
не закриті. На відміну від цього, миші із блокованим геном
ЕКР нормально розвиваються, розмножуються і лактують,
хоча миші-самки народжують меншу кількість дрібніших
за розмірами мишенят. Однак потрібно ще виконати
додаткові дослідження для детальної характеристики
впливу ЕКа і ЕКР та їхньої взаємодії.
Більшість дій естрогенів є геномними, тобто опосеред-
ковані ЕКа і ЕІ<р. Проте деякі дії дуже швидкі, тому важко
повірити, що вони відбуваються завдяки продукуванню
мРНК. Сюди можна зачислити дію на нейронні викиди у
мозок і, очевидно, зворотний ефект на секрецію гонадо-
тропіну. Такі факти приводять до гіпотези про наявність
як негеномного, так і геномного впливу естрогенів, що опо-
середковані мембранними рецепторами. Подібна швидка
дія прогестерону, тестостерону, глюкокортикоїдів та альдо-
стерону може бути також забезпечена мембранними рецеп-
торами.
Синтетичні естрогени
Етинілопохідний продукт естрадіолу (рис. 23-34) є силь-
ним естрогеном, що, на відміну від естрогенів, які вини-
кають природним шляхом, порівняно активний у разі при-
значення рег 08, оскільки резистентний до печінкового
метаболізму. Активність природних гормонів у випадку
призначення рег 08 низька, оскільки портальна венозна
сітка кишки переносить їх до печінки, де вони інактиву-
ються, перш ніж потрапляють у загальний кровоплин.
Деякі нестероїдні субстанції і декілька сполук, виявлених
у рослинах, мають естрогенову активність. Рослинні естро-
гени зрідка зумовлюють порушення у людини, однак
можуть мати небажану дію у тварин. Діетилстильбестрол
(див. рис. 23-34) і споріднені сполуки є естрогенними, ймо-
вірно, тому, що вони набувають стероїдоподібної кільцевої
структури в організмі.
Естрадіол послаблює припливи жару та інші симптоми
менопаузи, а також запобігає розвиткові остеопорозу, змен-
шує прогресування атеросклерозу та випадки серцевих
атак і приступів. Однак він стимулює ріст ендометрія та
Діетилстильбестрол
Рис. 23-34. Синтетичні естрогени.
406 / РОЗДІЛ 23
молочних залоз, може призвести до раку матки і молочних
залоз. Тому триває активний пошук “чоловічих” естро-
генів, які б зумовлювали кістковий і серцево-судинний
вплив естрадіолу без ростостимулювального ефекту на
матку і груди. Дві сполуки - тамоксифен і ралоксифен -
є перспективними щодо цього. Хоча вони не усувають
симптомів менопаузи, однак сприяють збереженню кіст-
кової тканини і мають серцево-судинний ефект естрадіолу.
Крім того, тамоксифен не стимулює молочні залози, а рало-
ксифен не стимулює ні молочні залози, ні матку. Клінічне
використання цих двох препаратів активно досліджують.
Хімічна будова, біосинтез і метаболізм
прогестерону
Прогестерон є С21 -стероїдом (рис. 23-35), що його виді-
ляють жовте тіло, плацента і (в невеликій кількості) фолі-
кул. Він важливий посередник під час біосинтезу стероїдів
у тих тканинах, які виділяють стероїдні гормони, невелика
його кількість потрапляє в кровоплин з яєчок та кори над-
ниркових залоз. Очевидно, 17а-гідроксипрогестерон
Прегнандіол-20-глкжуронід натрію
Рис. 23-35. Біосинтез прогестерону та головні шляхи його
метаболізму. Утворюються також інші метаболіти.
виділяється разом з естрогенами із фолікула яєчника, і його
секреція відбувається водночас з 17[3-естрадіолом. Близько
2% циркулювального прогестерону перебуває у вільній
формі (див. табл. 23-5), 80% - зв’язано з альбуміном, а 18%
- з кортикостероїдозв’язувальним глобуліном (див. Розділ
20). Прогестерон має короткий період півжиття і перетво-
рюється в печінці у прегнандіол, який кон’югує з глюкуро-
новою кислотою і виводиться з сечею (див. рис. 23-35).
Секреція
Рівень прогестерону у плазмі чоловіків становить при-
близно 0,3 нг/мл (1 нмоль/л), у жінок - близько 0,9 нг/мл
(З нмоль/л) під час фолікулярної фази місячного циклу
(див. рис. 23-30). Різниця зумовлена тим, що клітини фолі-
кулів яєчника виділяють невелику кількість прогестерону;
а клітини теки передають прегненолон гранульозним клі-
тинам, які перетворюють його у прогестерон. У пізній
фолікулярній фазі виділення прогестерону посилюється.
Під час лютеїнової фази жовте тіло виділяє велику кількість
прогестерону (див. табл. 23-7), і в плазмі його рівень поміт-
но підвищується, досягаючи максимального значення -
18 нг/мл (60 нмоль/л).
Стимулювальний вплив ЛГ на виділення прогестерону
жовтим тілом відбувається внаслідок активування аденілат-
циклази і передбачає наступний крок, який залежить від
синтезу білка.
Вплив
Головними органами-мішенями прогестерону є матка,
молочні залози і мозок. Прогестерон відповідає за зміни в
ендометрії і циклічні зміни в шийці та піхві, описані вище.
Він має антиестрогенний вплив на клітини міометрія,
послаблюючи їхню збудливість, чутливість до окситоцину
та спонтанну електричну активність, збільшуючи їхній
мембранний потенціал, а також зменшує кількість естро-
генових рецепторів в ендометрії та підвищує рівень пере-
творення 17Р-естрадіолу до менш активних естрогенів.
У молочних залозах прогестерон стимулює розвиток
часточок та альвеол, індукує диференціацію підготовленої
естрогенами протокової тканини і забезпечує секреторну
функцію молочних залоз під час лактації.
Ефект зворотного зв’язку прогестерону комплексний і
виявляється на рівні гіпоталамуса та гіпофіза. Великі дози
прогестерону пригнічують секрецію ЛГ і посилюють інгі-
біторний ефект естрогенів, запобігаючи овуляції.
Прогестерон є термогеном і, очевидно, відповідає за
підвищення базальної температури тіла під час овуляції.
Він стимулює дихання та альвеолярний РСо2 (Рлсо2і Див-
Розділ 34) у жінок під час лютеїнової фази місячного циклу.
Його рівень у цьому разі нижчий, ніж у чоловіків. Під час
вагітності Рсо2 зменшується, оскільки збільшується виді-
лення прогестерону. Проте фізіологічне значення цієї рес-
піраторної відповіді поки що невідоме.
Великі дози прогестерону призводять до виділення нат-
рію з сечею, очевидно, блокуючи дію альдостерону на нир-
ки. Гормон не створює помітного анаболічного ефекту.
Механізм дії
Дія прогестерону, як і інших стероїдів, зумовлена актив-
ністю ДНК щодо ініціації синтезу нових мРНК. Як зазна-
ГОНАДИ: РОЗВИТОК І ФУНКЦІЇ РЕПРОДУКТИВНОЇ СИСТЕМИ / 407
чено у Розділі 1, без стероїда рецептори прогестерону пере-
бувають у комплексі з білком теплового шоку, а після зв’я-
зування прогестерону цей білок відділяється, що веде до
експозиції ДНК-зв’язувального домену рецептора. Синте-
тичний стероїд міфепристон (КІІ486) зв’язується з рецеп-
тором, однак не вивільняє білків теплового шоку, а це
блокує зв’язування прогестерону. Оскільки підтримка ран-
ніх стадій вагітності залежить від стимулювального ефекту
прогестерону на ріст ендометрія і пригнічення ним ско-
ротливості матки, то міфепристон спричинює викидень.
У деяких країнах міфепристон у поєднанні з простаглан-
дином використовують для вибіркових переривань вагіт-
ності.
Розрізняють дві ізоформи прогестеронових рецепторів,
які утворюються шляхом диференційного процесу мРНК
одного гена. Прогестероновий рецептор А (РКД) є зсіченою
формою, яка після активування здатна пригнічувати деякі
дії прогестеронового рецептора В (РКВ). Фізіологічне зна-
чення двох ізоформ не визначене.
Речовини, які імітують дію прогестерону, деколи ще
називають прогестиновими агентами, гестагенами, чи
прогестинами. їх використовують разом із синтетичними
естрогенами як оральні контрацептивні засоби (див. ниж-
че).
Релаксин
Релаксин - це поліпептидний гормон, що його вироб-
ляють жовте тіло, матка, плацента і молочні залози у жінок
та передміхурова залоза у чоловіків. Під час вагітності він
розслаблює лобковий симфіз та інші з’єднання таза; роз-
м’якшує і розширює шийку матки, отже, допомагає під час
пологів. Він також пригнічує скорочення матки і може
відігравати роль у розвитку молочних залоз. У невагітних
жінок релаксин виявляють у жовтому тілі та ендометрії
під час секреторної, однак не проліферативної фази місяч-
ного циклу. Його функція у невагітнцх жінок досі невідома.
У чоловіків він міститься у спермі, де, можливо, допомагає
підтримувати рухливість сперматозоїдів та їхню пенетра-
цію в яйцеклітину.
У більшості видів тварин є один ген релаксину, у людини
ж виявлено два на 9-й хромосомі. Вони кодують структуру
двох структурно відмінних поліпептидів, кожен з яких має
активність релаксину. Проте тільки один з цих генів актив-
ний у яєчниках і простаті. Структура поліпептидів, що їх
виробляють ці дві тканини, показана на рис. 23-36.
РЕГУЛЮВАННЯ ФУНКЦІЙ ЯЄЧНИКІВ
Гіпофізарний ФСГ відповідає за раннє дозрівання фолі-
кулів у яєчниках, а разом з ЛГ - за їхнє остаточне дозрі-
вання. Від спалаху виділення ЛГ (див. рис. 23-30) залежить
овуляція та початок формування жовтого тіла. Зазначимо
також, що виділення ФСГ дещо зростає в середині циклу.
Значення цього до кінця не з’ясовано. ЛГ стимулює виді-
лення естрогену і прогестерону жовтим тілом.
Гіпоталамічні компоненти
Гіпоталамус відіграє ключову роль у регулюванні виді-
лення гонадотропіну. Гіпоталамічне регулювання полягає
Рис. 23-36. Структура лютеїнового та спермального релак-
сину людини. Простежується подібність зі структурою інсулі-
ну, ІФР-І, ІФР-ІІ (див. рис. 22-9); Рса- піроглютамінова кислота
(модифіковано і відтворено за дозволом з \А/іпзІо\л/ 3\/\/ еі аі:
Нитап зетіпаї геїахіп із а ргосіисі ої їГіе зате депе аз битап
ІиіеаІ геїахіп. Епсіосгіпоіоду 1992; 130:2660).
у впливі на виділення ГнРГ в портальні гіпофізарні судини
(див. Розділ 14). ГнРГ стимулює виділення як ФСГ, так і
ЛГ. Малоймовірно, що є спеціальний ФРГ.
У нормі виділення ГнРГ відбувається епізодичними
спалахами, які спричинюють епізодичні піки секреції ЛГ
(див. вище). Вони потрібні для нормального виділення
гонадотропінів. Якщо ГнРГ призначають для постійного
введення, то кількість рецепторів до ГнРГ у передній частці
гіпофіза зменшується (див. Розділ 1), і виділення ЛГ прямує
до нуля. Проте якщо ГнРГ призначають епізодично з
розрахунку одна доза за годину, то це стимулює виділення
ЛГ, що відбувається навіть тоді, коли секреція ендогенного
ГнРГ припиняється внаслідок ураження вентрального
гіпоталамуса.
Тепер зрозуміло, що не тільки епізодичне виділення
ГнРГ є загальним явищем, а також коливання частоти та
амплітуди спалахів виділення ГнРГ важливі у виникненні
інших гормональних змін, відповідальних за місячний
цикл. Частоту виділення збільшують естрогени і зменшу-
ють прогестерон і тестостерон. Частота зростає у пізній
фолікулярній фазі циклу, що веде до підвищеного виділення
ЛГ. Під час секреторної фази частота зменшується внас-
лідок дії прогестерону (рис. 23-37), однак якщо виділення
естрогену і прогестерону зменшується наприкінці циклу,
то частота знову збільшується.
Під час ЛГ-хвилі у середині циклу чутливість гонадотро-
пінів до ГнРГ значно зростає (внаслідок власної незахище-
ності до кількості ГнРГ) з частотою, яка є в цей час. Цей
ефект самоіндукції ГнРГ важливий для забезпечення
максимальної відповіді ЛГ.
Усе ще не з’ясована природа і точна локалізація гене-
ратора ГнРГ у гіпоталамусі. У загальних рисах відомо, що
норадреналін і, очевидно, адреналін збільшують частоту
виділення ГнРГ у гіпоталамусі, і навпаки, опіоїдні пептиди,
такі як енкефаліни і Р-ендорфін, зменшують її.
Зменшення кількості гіпофізарних рецепторів і, відпо-
відно, виділення ЛГ, зумовленого постійним підвищенням
408 / РОЗДІЛ 23
16 г- О ЛГ імпульс Е2 98 пг/мл
(7,5/12 год) П 0,4 нг/мл
16 12 20
Години доби
Рис. 23-37. Епізодичне виділення ЛГ і ФСГ під час фоліку-
лярної (угорі) і лютеїнової (унизу) стадій місячного циклу.
Цифри біля кожного графіка означають кількість виділень ЛГ
за 12 год, а також концентрації естрадіолу Е2 і прогестерону
П у плазмі під час цих двох періодів циклу (відтворено за
дозволом з МагзіїаІІ ЗС, КеІсІї РО: бопасіоігоріп-геїеазіпд
Ьогтопе: гоїе ої риїзаіііе зесгеііоп іп Ніе гедиіаііоп ої герго-
бисііоп. N ЕпдІ З Месі 1986; 315:1459).
Андрогени
Рис. 23-38. Регулювання функції яєчників шляхом зворотного
зв’язку. Клітини внутрішньої теки постачають андрогени до
клітин ґранульози і клітини теки, що продукують циркулюваль-
ні естрогени, які пригнічують виділення ГнРГ, ЛГ і ФСГ. Інгібін,
який походить з клітин ґранульози, пригнічує виділення ФСГ.
ЛГ регулює клітини теки, тоді як клітини ґранульози регу-
льовані ЛГ і ФСГ. Штриховими лініями позначено інгібіторну
дію, а суцільними - стимулювальну. Порівняйте з рис. 18-13,
20-20, 22-11 і 23-24.
ГнРГ, веде до використання аналогів ГнРГ тривалої дії для
пригнічення виділень ЛГ у разі передчасного статевого до-
зрівання та раку простати (див. нижче).
Зворотний зв’язок
Зміни рівнів ЛГ, ФСГ, статевих стероїдів та інгібіну в
плазмі під час місячного циклу показано на рис. 23-30, а
шляхи їхнього зворотного зв’язку - на рис. 23-38. Під час
початкової стадії фолікулярної фази рівень інгібіну В низь-
кий, а ФСГ помірно підвищений, що сприяє росту фолі-
кула. Виділення ЛГ стримуване шляхом негативного зво-
ротного зв’язку на фоні зростання рівня естрогену у плазмі.
На 36-48-й годині до овуляції зворотний зв’язок естрогену
стає позитивним, і це зумовлює спалах виділення ЛГ, що
спричинює овуляцію. Овуляція відбувається через 9 год
після максимального рівня ЛГ. Виділення ФСГ також мак-
симально зростає, незважаючи на незначне збільшення
інгібіну, очевидно, завдяки сильному стимулюванню гона-
дотропінів ГнРГ. Під час лютеїнової фази виділення ЛГ і
ФСГ є низьким завдяки високим концентраціям естрогену,
прогестерону та інгібіну.
Зазначимо, що помірний постійний рівень циркулю-
вального естрогену має негативний зворотний ефект на
виділення ЛГ, тоді як під час циклу підвищений його рівень
має позитивний зворотний ефект і стимулює виділення ЛГ.
Виявлено, що у мавп також є мінімальний час підвищення
рівня естрогену для позитивного зворотного зв’язку. Зі
збільшенням циркулювального естрогену до близько 300%
за 24 год виявлено тільки негативний зворотний зв’язок;
та якщо він збільшувався на 300% за 36 год чи більше, то
після короткочасного зменшення виділень наставав спалах
секреції ЛГ, що подібне до підвищення всередині циклу. У
випадку високого рівня циркулювального прогестерону
пригнічується позитивний зворотний ефект естрогенів. Є
докази, що у приматів як негативний, так і позитивний
ефекти естрогенів відбуваються у медіобазальному гіпота-
ламусі, проте не з’ясовано, як саме у лютеїнову фазу нега-
тивний зворотний зв’язок стає спочатку позитивним, а далі
- знову негативним.
Регулювання циклу
Важливе значення має те, що регресія жовтого тіла (лю-
теолізис), яка починається за три-чотири дні до місячної,
є ключем місячного циклу. ПГГ2а є фізіологічним лютео-
лізином, однак цей простагландин активований за наяв-
ності ендотеліальних клітин, які продукують ЕТ-1 (див.
Розділ 31). Тому лютеолізис, принаймні у деяких видів,
спричинюваний поєднаною дією ПГР2а і ЕТ-1. У деяких
домашніх тварин окситоцин, що його виділяє жовте тіло,
має локальний лютеолітичний ефект, очевидно, тому, що
зумовлює виділення простагландинів. Коли починається
ГОНАДИ: РОЗВИТОК І ФУНКЦІЇ РЕПРОДУКТИВНОЇ СИСТЕМИ / 409
лютеолізис, рівні естрогену та прогестерону знижуються,
а секреція ФСГ та ЛГ посилюється. Розвивається новий
набір фолікулів, а далі внаслідок дії ФСГ і ЛГ з них дозріває
один домінантний. Приблизно всередині циклу збільшу-
ється виділення естрогену з фолікула, що підвищує чутли-
вість гіпофіза до ГнРГ і спричинює хвилю виділення ЛГ.
Після овуляції формується жовте тіло, послаблюється виді-
лення естрогену, однак далі одночасно підвищуються рівні
прогестерону та естрогену разом із інгібіном В. Підвищені
рівні тимчасово пригнічують виділення ФСГ і ЛГ, проте
знову настає лютеолізис, і починається новий цикл.
Рефлекторна овуляція
Самки котів, зайців, норок і деяких інших тварин мають
тривалі періоди еструсу, під час яких овуляція настає тільки
після копуляції. Таку рефлекторну овуляцію зумовлюють
аферентні імпульси зі статевих органів, очей, вух і носа,
які сходяться у вентральному гіпоталамусі і стимулюють
виділення ЛГ з гіпофіза, що спричинює овуляцію. У таких
видів, як щурі, мавпи, а також у людини овуляція відбу-
вається самовільно і періодично, однак у цьому процесі
задіяні також нейромеханізми. У щурів овуляцію можна
затримати на 24 год, призначивши пентобарбітал чи інші
нейроактивні ліки за 12 год до очікуваного розриву фолі-
кула. У жінок на місячний цикл значно впливають емоційні
подразники.
Контрацепція
Методи, які широко використовують для запобігання
заплідненню, а також їхні недоліки, перелічені у табл. 23-
8. Якщо запліднення відбулося, то викидень можна спро-
вокувати за допомогою такого антагоніста прогестерону,
як міфепристон (див. вище). Чоловіча контрацепція роз-
глянута в іншій частині цього розділу.
Уведення сторонніх тіл у матку спричинює зміни трива-
лості статевого циклу у багатьох ссавців. У людини такі
сторонні тіла не змінюють місячного циклу, однак діють
як ефективний контрацептивний засіб. Внутрішньоматкову
імплантацію шматків металу чи пластику (внутрішньо-
маткові спіралі (ВМС)) використовували у програмах
контролю за збільшенням кількості населення. Хоча меха-
нізм дії ВМС поки що до кінця не з’ясований, уважають,
що загалом вони запобігають заплідненню яйцеклітини
сперматозоїдом. Ті з них, які містять мідь, мають сперма-
тоцидну дію. ВМС, які повільно виділяють прогестерон
чи синтетичні прогестини, мають додатковий ефект загу-
щення цервікального слизу, що перешкоджає проникненню
сперматозоїдів у матку. ВМС можуть зумовлювати внут-
рішньоматкові інфекції, однак це трапляється переважно
у перший місяць після їхнього введення та у жінок із захво-
рюваннями, що передаються статевим шляхом.
Жінки, які піддаються довготривалому лікуванню висо-
кими дозами естрогенів, не мають овуляцій, очевидно,
тому, що у них пригнічене виділення ФСГ, і простежуються
численні нерегулярні спалахи виділення ЛГ, а не одне
максимальне виділення посередині циклу. Жінки, яких
лікують такими самими дозами естрогенів разом із про-
гестагенами, не овулюють, оскільки в них пригнічене виді-
лення обох гонадотропінів. Крім того, прогестини спри-
яють загущенню цервікального слизу, що перешкоджає
Таблиця 23-8. Відносна ефективність контрацептивних
методів, які найчастіше використовують1
Метод Кількість вагітностей на 100 жінок/рік
Вазектомія 0,02
Перев’язування труб і подібні 0,13
процедури
Оральні контрацептиви
>50 мкг естрогену і прогестину 0,32
<50 мкг естрогену і прогестину 0,27
Тільки прогестин 1,2
ВМС
Соорег 7 1,5
І_оор 0 1,3
Діафрагма 1,9
Презерватив 3,6
Перерваний статевий акт 6,7
Спермациди 11,9
Ритмічний 15,5
1 Відтворено за дозволом з \/е88еу М, І_а\л/ІЄ88 М, Уеаіез 0:
ЕГГісасу ої сІіГГегепІ сопігасерііуе теіііосіз. І_апсеі 1982; 1:841).
рухові сперматозоїдів та заплідненню. Для пероральної
контрацепції використовують такий естроген, як етиніл-
естрадіол (див. рис. 23-34) у поєднанні з синтетичним про-
гестином - норетиндроном. Таблетки призначають на 21-
й день з перервою на п’ять-сім днів, щоб пропустити місяч-
ну кровотечу, після чого їх знову треба приймати. Як і
етинілестрадіол, норетиндрон має етинільну групу у 17-
му положенні стероїдного ядра. Тому він резистентний до
печінкового метаболізму і його можна призначати для
перорального застосування. Водночас, будучи прогести-
ном, він частково метаболізується до етинілестрадіолу, і
тому також має естрогенову активність. З’ясовано, що
ефективними є як низькі, так і високі дози естрогенів (див.
табл. 23-8). Використання малих доз зменшує ризик тром-
бозів та інших ускладнень. Прогестини також можна засто-
совувати з метою контрацепції, хоча вони ефективніші у
поєднанні з естрогенами.
Імплантати, виготовлені із прогестинів, таких як лево-
норгестрел, теж почали широко використовувати. їх уво-
дять під шкіру, що дає змогу запобігати настанню вагітнос-
ті протягом п’яти років. Однак вони часто спричинюють
аменорею, та поза цим ефективні, і їх добре переносять.
ПОРУШЕННЯ ОВАРІАЛЬНОЇ! ФУНКЦІЇ
Порушення місячного циклу
У деяких безплідних жінок бувають ановуляторні цик-
ли; у них нема овуляцій, однак місячні цикли відбуваються
з порівняно регулярними інтервалами. Як зазначено вище,
ановуляторні цикли характерні для перших одного-двох
років після і перед менопаузою. Аменорея - це відсутність
місячних. Якщо місячних кровотеч ще взагалі не було, то
цей стан називають первинною аменореєю. Деякі жінки
з первинною аменореєю мають малі груди та інші ознаки
статевої незрілості. Припинення циклів у жінки з попе-
410/РОЗДІЛ 23
редньо нормальними місячними - це вторинна аменорея.
Найчастіше причиною вторинної аменореї є вагітність.
Відомо таке клінічне правило: вторинну аменорею по-
трібно пов’язувати з вагітністю, доки не доведено інше.
Іншими причинами аменореї можуть бути емоційні стани
та зміни у навколишньому середовищі, хвороби гіпота-
ламуса, гіпофізарні порушення, первинні оваріальні пору-
шення та різні системні захворювання. Є докази, що у
деяких жінок з гіпоталамічною аменореєю частота виді-
лень ГнРГ сповільнена унаслідок надмірної опіоїдної
активності в гіпоталамусі. Попередні експерименти за-
свідчили, що частота виділень ГнРГ збільшується в разі
призначення перорально активного опіоїдного блокатора
налтрексону.
Терміни гіпоменорея і менорагія використовують від-
повідно у випадку незначних чи патологічно надмірних
кровотеч під час регулярних циклів. Метрорагія - це мат-
кова кровотеча між місячними, а олігоменорея - зменшена
частота місячних. Дисменорея - це болюча місячна. Силь-
ні місячні спазми часто трапляються у молодих жінок і, як
звичайно, зникають після першої вагітності. Більшість
симптомів дисменореї виникає внаслідок акумулювання
простагландинів у матці, тому зменшити їх можна, при-
значивши інгібітори синтезу простагландинів (див. Розділ
17).
У деяких жінок під час останніх семи-десяти днів місяч-
ного циклу виникають такі симптоми, як дратівливість,
здуття живота, набряки, емоційна лабільність, знижується
здатність концентруватися, виникає депресійний стан, біль
голови і закрепи. Ці симптоми передмісячного синдрому
(ПМС) є наслідком затримки солі і води в організмі. Не
з’ясовано, що ці чи інші гормональні зміни, які виникають
у пізній лютеїновій фазі, відповідають за такий стан,
оскільки тривалість і важкість симптомів не змінюється,
якщо внаслідок призначення міфепрістону лютеїнова фаза
закінчується рано, і настає місячна. Антидепресант флю-
оксетин (прозак), який є інгібітором реутилізації серото-
ніну, і бензодіазепін алпрозалам сприяють полегшенню
симптомів; так само діють агоністи виділення ГнРГ у дозі,
яка пригнічує гіпофізарно-яєчниковий зв’язок. Поки що
не зрозуміло, як ці різноманітні клінічні спостереження
об’єднати у цілісну картину патогенезу ПМС.
Генетичні порушення
Багато моногенних мутацій, які виникають у жінок,
спричинюють репродуктивні порушення: наприклад, синд-
ром Кальмана, який зумовлює гіпогонадотропний гіпого-
надизм (див. вище); резистентність до ГнРГ, резистентність
до ФСГ, резистентність до ЛГ, зумовлену, відповідно,
дефектами рецепторів ГнРГ, ФСГ, ЛГ; недостатність аро-
матази, яка запобігає утворенню естрогенів. Усі вони спри-
чинені мутаціями, що ведуть до втрати функції. Цікава
мутація з набуттям функції призводить до синдрому
МакКюн-Олбрайт, за якого 6 а набуває конститутивної
активності у певних, однак не всіх клітинах (явище мозаї-
цизму). Цей синдром виникає внаслідок соматичних мута-
цій після початкового поділу клітин ембріона (див. Розділ
І) і поєднується з множинними ендокринними порушен-
нями, у тім числі передчасним статевим дозріванням та
аменореєю з галактореєю.
ВАГІТНІСТЬ
Запліднення й імплантація
У людини запліднення яйцеклітини сперматозоїдом
відбувається, як звичайно, у середній частині маткової тру-
би. Воно охоплює, по-перше, хемоатракцію сперматозоїда
до яйцеклітини завдяки речовинам, які утворюються в
яйцеклітині; по-друге, злиття з прозорою зоною, мемб-
ранною структурою, яка оточує яйцеклітину; по-третє,
пенетрацію прозорої зони й акросомальну реакцію; по-
четверте, злиття голівки сперматозоїда з клітинною мемб-
раною яйцеклітини і руйнування ділянки з’єднання з вихо-
дом ядра сперматозоїда у цитоплазму яйцеклітини (рис.
23-39). У піхві під час статевого акту накопичуються міль-
йони сперматозоїдів, однак лише 50-100 їх досягає яйце-
клітини і багато з них контактують з прозорою зоною.
Сперматозоїди зв’язуються зі спермальними рецепторами
2РЗ цієї зони, після чого відбувається акросомальна реак-
ція, тобто руйнування акросоми - лізосомоподібної орга-
нели на голівці сперматозоїда (див. рис. 23-18). У цьому
разі вивільняється багато ензимів, у тому числі трипсино-
подібна протеаза акрозин, що сприяє, однак не є необхід-
ною для пенетрації сперматозоїда через прозору зону. Коли
один сперматозоїд досягає мембрани яйцеклітини, то злит-
тя з нею опосередковує фертилін - білок, який міститься
на поверхні головки сперматозоїда і подібний до вірусних
білків, які дають змогу вірусам атакувати клітини. Таке
злиття дає сигнал, який ініціює розвиток, і, крім того,
сприяє зниженню мембранного потенціалу яйцеклітини,
що запобігає поліспермії - заплідненню яйцеклітини
більше ніж одним сперматозоїдом. Після цієї тимчасової
зміни потенціалу відбувається структурна перебудова про-
Рис. 23-39. Послідовність етапів запліднення у ссавців. Спер-
матозоїди наближаються до яйцеклітини, зв’язуються із про-
зорою зоною, виділяють акросомальні ензими, проникають у
прозору зону і зливаються з мембраною яйцеклітини, вивіль-
няючи ядро сперматозоїда в її цитоплазму (модифіковано з
Уасциіег \/О: Еуоіііііоп ої датеіе гесодпіііоп ргоіеіпз. Зсіепсе
1999:281:1995).
ГОНАДИ: РОЗВИТОК І ФУНКЦІЇ РЕПРОДУКТИВНОЇ СИСТЕМИ / 411
зорої зони, яка забезпечує захист від поліспермії на трива-
ліший час.
Ембріон, який розвивається (тепер його називають блас-
тоцистою), опускається по трубі до матки. Цей процес три-
ває близько трьох діб, під час яких бластоциста досягає 8-
чи І 6-клітинної стадії. У разі контакту з ендометрієм блас-
тоцисту оточують зовнішній шар синцитіотрофобласт -
багатоядерна маса без видимих клітинних меж, і внутріш-
ній шар цитотрофобласт, який складається з окремих клі-
тин. Синцитіотрофобласт руйнує ендометрій, і бластоциста
потрапляє в ямку (імплантація). Як звичайно, місцем
імплантації є задня стінка матки. Далі розвивається пла-
цента, а трофобласт і надалі зв’язаний з нею.
Недостатність відторгнення плоду-
трансплантата
Зазначимо, що плід і мати є двома генетично відмінними
організмами, і в цій ситуації плід відіграє роль трансплан-
тата чужої тканини в організмі жінки. Проте трансплантат
толерується, і не виникає реакції відторгнення, яка харак-
терна у разі трансплантації чужих тканин (див. Розділ 27).
Покищо до кінця не з’ясовано, як відбувається захист плід-
трансплантат. Одним з пояснень може бути те, що плацен-
тарний трофобласт, який відділяє материнську і плодову
тканини, не експресує поліморфних генів МИС класу І і
класу II, а, натомість, експресує неполіморфний ген НЬА-
(л. Тому не утворюються антитіла до білків плоду. Крім
того, на поверхні плаценти виявлено Газ ліганд, який
зв’язується із Т-клітинами і призводить до їхнього апоптозу
(див. Розділ 1). Фіксують також незначне зниження цирку-
лювальних антитіл в організмі матері. Наприклад, під час
вагітності знижується рівень материнських антитиреоїд-
них антитіл у крові жінки з хворобою Грейвса, і вони часто
стають еутиреоїдними до кінця вагітності.
Неплідність
Є клінічна проблема неплідності, яка часто потребує
виконання багатьох обстежень, аж доки не буде з’ясовано
причину її виникнення. У 30% випадків проблема пов’я-
зана з чоловіком, у 45% - з жінкою, у 20% - з обома парт-
нерами, а у 5% - причина невідома. Допомогою у цих
випадках є запліднення іп уііго, тобто видалення зрілих
яйцеклітин з яєчника, запліднення їх сперматозоїдами та
імплантація однієї чи декількох з них у матку на 4-клітинній
стадії розвитку. У цьому разі шанс отримання живої дитини
становить 5-10%.
Ендокринні зміни
У всіх ссавців під час запліднення жовте тіло в яєчнику
не регресує, а навпаки, збільшується під впливом гонадо-
тропних гормонів, що їх виділяє плацента. Плацентарний
гонадотропін людини називають хоріонічним гонадотро-
піном людини (ХГл). Збільшене жовте тіло вагітності
виділяє естрогени, прогестерон і релаксин. Релаксин під-
тримує вагітність, інгібуючи скорочення міометрію. У біль-
шості видів видалення яєчників під час будь-якого періоду
вагітності спричинює викидень. У людини плацента виді-
ляє достатню кількість естрогену і прогестерону з мате-
ринської та плодової частин, щоб перейняти функцію жов-
того тіла після шостого тижня вагітності. Оварієктомія до
шостого тижня вагітності призводить до викидня, а її про-
ведення після цього періоду не впливає на вагітність. Функ-
ція жовтого тіла починає загасати після восьмого тижня
вагітності, однак воно існує протягом усієї вагітності. Виді-
лення ХГл зменшується після раніше згаданого підйому,
проте виділення естрогену і прогестерону збільшується аж
до пологів (табл. 23-9).
Хоріонічний гонадотропін людини
Гормон ХГл - це глікопротеїн, який містить галактозу
і гексозамін. Його виробляє синцитіотрофобласт. Як і гліко-
протеїнові гормони гіпофіза, він має а- і Р-субодиниці;
ХГл-а ідентичний до а-субодиниці ЛГ, ФСГ і ТТГ. Молеку-
лярна маса ХГл-а становить 18 000, а ХГл-Р - 28 000 Да.
Гормон ХГл має лютеїнізувальну, лютеотропну та незначну
ФСГ активність. Визначають його методом радіоімунного
аналізу і виявляють у крові на шостий день після заплід-
нення, а наявність у сечі на ранніх термінах вагітності слу-
гує основою багатьох лабораторних тестів для підтверд-
ження факту вагітності (з’являється в сечі на 14-й день піс-
ля запліднення); діє на ті самі рецептори, що й ЛГ.
Зазначимо, що ХГл не є абсолютно специфічним для
вагітності. Невелику кількість його виділяють деякі пух-
лини, у тому числі шлунково-кишкового тракту, в осіб обох
статей. Тому його визначають в осіб з підозрою на пухлину
як пухлинний маркер. Виявлено, що невелику кількість ХГл
продукують також у нормі печінка і нирки плоду.
Хоріонічний соматомамотропін людини
Синцитіотрофобласт теж виділяє велику кількість біл-
кових гормонів, які мають лактогенну і незначну росто-
стимулювальну активність. Цей гормон називають хоріо-
нічний гормон росту - пролактин (ХРП), плацентарний
лактоген людини (ПЛл), однак сьогодні використовують
назву хоріонічний соматомамотропін людини (ЬС8).
Його структура дуже подібна до структури гормону росту
людини (див. рис. 22-4). Виявилося, що ці два гормони і
пролактин походять від одного загального гормону-
попередника. Велику кількість ЬС8 виявляють у материнсь-
кій крові, однак дуже мала кількість потрапляє до плоду.
Виділення гормону росту гіпофізом матері не збільшується
під час вагітності, і може зменшуватися під впливом ЬС8.
Гормон ЬС8 має більшість властивостей гормону росту і,
очевидно, діє, як материнський гормон росту вагітності,
спричинюючи затримку азоту, калію і кальцію в організмі,
Таблиця 23-9. Концентрації гормонів у материнській крові
під час нормальної вагітності
Гормон Приблизна максимальна концентрація Час максимального виділення
ХГл 5 мг/мл Перший триместр
Релаксин 1 нг/мл Перший триместр
ґіС8 15 мг/мл Термінові пологи
Естрадіол 16 нг/мл Термінові пологи
Естріол 14 нг/мл Термінові пологи
Прогестерон 190 нг/мл Термінові пологи
Пролактин 200 нг/мл Термінові пологи
412/РОЗДІЛ 23
ліполіз і зниження утилізації глюкози в цьому стані. Дві
останні дії сприяють притоку глюкози до плоду. Кількість
виділеного ИС8 пропорційна до розміру плаценти, маса
якої в нормі близько 1/6 маси плоду, а низький рівень ЬС8
є ознакою плацентарної недостатності.
Інші гормони плаценти
Окрім ХГл, ИС8, прогестерону й естрогенів, плацента
виділяє інші гормони. Окремі відділи плаценти людини,
очевидно, виділяють ПОМК, у культурі тканини - КтРГ,
Р-ендорфін, а-МСГ і динорфін А. Усі вони виявилися
ідентичними до своїх гіпоталамічних двійників, а також
виділяють ГнРГ та інгібін. Оскільки ГнРГ стимулює, а інгі-
бін пригнічує виділення ХГл, то місцеві ГнРГ та інгібін
діють у паракринний спосіб, регулюючи виділення ХГл.
Клітини трофобласту та амніону виділяють лептин (див.
Розділ 14) і зменшують кількість цього гормону ситості у
материнському кров’яному руслі. Частина його потрапляє
в амніотичну рідину, хоча його функція під час вагітності
поки що не відома. Плацента також виділяє пролактин у
різних формах.
Плацента секретує а-субодиниці ХГл, тому концентра-
ція вільних а-субодиниць у плазмі збільшується протягом
вагітності. Ці а-субодиниці набувають вуглеводних компо-
нентів, що робить їх нездатними до з’єднання з Р-субоди-
ницями. їхня експресія передбачає виконання ними власної
функції. Цікавим є те, що секреція пролактину ендометрієм
також посилюється впродовж вагітності, тому можливо,
що цей процес стимулюють саме а-субодиниці.
Цитотрофобласт людського хоріону містить проренін
(див. Розділ 24). Велику кількість прореніну виявляють в
амніотичній рідині, однак його функція тут невідома.
Фетоплацентарний зв’язок
Плід і плацента взаємодіють в утворенні стероїдних гор-
монів. Плацента синтезує прегненолон і прогестерон з
холестеролу. Частина прогестерону потрапляє у кровоплин
плоду і слугує субстратом для утворення кортизолу і корти-
костерону у його надниркових залозах (рис. 23-40). Час-
тина прегненолону переходить до плоду і разом із прегне-
нолоном, синтезованим у його печінці, є субстратом для
утворення дигідроепіандростерону сульфату (ДГЕАС) і 16-
гідроксидигідроепіандростерону сульфату (16-ГДГЕАС) у
його надниркових залозах. Частково 16-гідроксиляція
відбувається також у печінці плоду. ДГЕАС і 16-ГДГЕАС
потрапляють назад до плаценти, де з ДГЕАС утворюється
естрадіол, а з 16-ГДГЕАС - естріол. Головним естрогеном,
який утворюється, є естріол, і оскільки фетальний 16-
ГДГЕАС - основний субстрат для естрогенів, то виділен-
ня естріолу з сечею матері можна вважати показником для
моніторингу за станом плоду.
Пологи
Тривалість вагітності у людини в середньому становить
270 днів від запліднення (284 дні від першого дня останньої
місячної). В останній місяць вагітності збільшується час-
тота нерегулярних скорочень матки.
Різниця між тілом матки і шийкою стає очевидною під
час пологів. Шийка, яка є твердою у невагітному стані,
під час вагітності ближче до пологів розм’якшується і роз-
Плацента Надниркові
Рис. 23-40. Взаємодія між плацентою і корою надниркових
залоз плоду під час продукування стероїдів.
ширюється, тоді як тіло матки скорочується і виштовхує
плід.
До кінця не з’ясовані механізми, які відповідають за
початок пологів. Один із факторів - підвищення рівня
естрогенів у крові. Це робить матку чутливішою, збіль-
шує кількість щілинних з’єднань між клітинами міометрія
і зумовлює утворення більшої кількості простагландинів,
які сприяють її скороченню. Прогестерон заспокійливо
впливає на матку. У ссавців-неприматів рівень цирку-
лювального прогестерону перед пологами також знижу-
ється. Проте цей спад не виникає у приматів. У людини
продукування плацентою КтРГ збільшується в термін
пологів, і КтРГ може підвищувати секрецію ДГЕАС шля-
хом безпосередньої дії на надниркові залози плоду. Збіль-
шення ДГЕАС, відповідно, спричинює зростання рівня
естрогенів у крові. Крім того, як плацентарний, так і гіпо-
таламічний КтРГ плоду збільшують виділення плодом
АКТГ, а отже, й кортизолу, посилюючи дисфункцію ди-
хальної системи плоду.
Кількість рецепторів до окситоцину у міометрії і деци-
дуальній оболонці (ендометрій у разі вагітності) збільшу-
ється майже у 100 разів під час вагітності і досягає макси-
мального значення на початку пологів. Естрогени збіль-
шують кількість рецепторів до окситоцину; розтягнення
матки наприкінці вагітності теж може посилювати їхнє
утворення. На початку пологів концентрація окситоцину
у плазмі матері не відрізняється від допологового рівня,
що становить близько 25 пкг/мл. Можливо, що помітне
збільшення рецепторів до окситоцину зумовлює реагуван-
ня матки на нормальну концентрацію окситоцину у плазмі.
Проте принаймні у щурів кількість мРНК окситоцину в
матці збільшується, досягаючи максимального рівня під
час пологів; це означає, що утворений локально окситоцин
також бере участь у процесі.
Коли починаються пологи, скорочення матки розширю-
ють шийку, а це, відповідно, передає сигнали аферентними
нервами, що збільшує виділення окситоцину (рис. 23-41).
Рівень окситоцину у плазмі підвищується, тому більша
ГОНАДИ: РОЗВИТОК І ФУНКЦІЇ РЕПРОДУКТИВНОЇ СИСТЕМИ / 413
Збільшення рецепторів до окситоцину
І
Простагландини
V |
-------► Скорочення матки
▼
Розширення шийки матки
і розтягнення піхви
▼
Сигнали з шийки матки
і піхви
▼
Збільшене виділення
окситоцину
Рис. 23-41. Роль окситоцину під час пологів.
кількість окситоцину діє на матку. Отже, налагоджується
позитивний зворотний зв’язок, що сприяє пологам і закін-
чується видаленням продуктів запліднення. Окситоцин
збільшує маткові скорочення двома шляхами: він безпо-
середньо впливає на клітини гладкої мускулатури матки,
зумовлюючи їхнє скорочення; стимулює утворення про-
стагландинів у децидуальній оболонці. Простагландини
посилюють скорочення, зумовлені дією окситоцину.
Під час пологів задіяні також спінальні рефлекси і само-
вільні скорочення м’язів передньої черевної стінки (поту-
ги). Проте пологи можливі і без потуг чи рефлекторного збіль-
шення виділень окситоцину з передньої частки гіпофіза,
оскільки жінки із параплегією мали пологи і народжували.
ЛАКТАЦІЯ
Розвиток молочних залоз
Для повного розвитку молочних залоз потрібна участь
багатьох гормонів. У загальному естрогени головно від-
повідають за проліферацію молочних проток, а прогес-
терон - за розвиток часточок. Для розвитку молочних залоз
щурів під час пубертату необхідна також певна кількість
пролактину, однак не доведено, чи він потрібен людині. У
щурів після гіпофізектомії потрібні глюкокортикоїди,
інсулін і гормон росту для розвитку молочних залоз у
відповідь на дію інших гормонів, однак самі по собі вони
не спричинюють росту грудей (рис. 23-42). Під час вагіт-
ності рівень пролактину рівномірно зростає до терміну
пологів, під впливом цього гормону та високої концентрації
естрогенів і прогестерону завершується часточково-
альвеолярний розвиток грудей.
Секреція і виділення молока
Склад людського і коров’ячого молока наведений у табл.
23-10. У гризунів, яким попередньо вводили естроген та
прогестерон, застосування пролактину зумовлювало утво-
рення крапельок молока і їхню секрецію у протоки. Окси-
тоцин спричиняв скорочення міоепітеліальних клітин, які
вистилають протоки, з подальшим виділенням молока
через пипку (див. рис. 23-42). Рефлекторне виділення окси-
тоцину, спричинюване дотиком до пипок і ареол (рефлекс
виділення молока), розглянуто у Розділі 14. У деяких видів,
однак не в людей, окситоцин для виділення молока не
потрібний.
Інші гормональні зв’язки у людей загалом такі ж, як у
щурів, хоча нормальний ріст грудей і лактація можливі у
карликів із вродженою недостатністю гормону росту.
Передавання антитіл новонародженому через молозиво
розглянуто у Розділі 26.
Ініціація лактації після пологів
Груди під час вагітності збільшуються у відповідь на
високу концентрацію естрогенів, прогестерону, пролакти-
ну і, очевидно, ХГл у кровообігу. Деяка кількість молока
виділяється у протоки вже на п’ятому місяці, однак вона
надто мала порівняно із секрецією молока після пологів.
У більшості тварин молоко виділяється через годину після
пологів, проте у жінок - на перший-третій день.
Після виходу плаценти під час пологів простежується
різке зменшення концентрацій циркулювальних естрогенів
і прогестерону. Зменшення циркулювального естрогену
Таблиця 23-10. Складники молозива й молока1 (маса з
розрахунку на децилітр)
Компоненти Молозиво жінки Молоко жінки Коров’яче молоко
Вода, г 88 88
Лактоза, г 5,3 6,8 5,0
Білок, г 2,7 1,2 3,3
Співвідношення
казеін/лактальбумін 1:2 3:1
Жир, г 2,9 3,8 3,7
Ліноленова кислота 8,3% жиру 1,6% жиру
Натрій, мг 92 15 58
Калій, мг 55 55 138
Хлорид, мг 117 43 103
Кальцій, мг 31 33 125
Магній, мг 4 7 12
Фосфор, мг 14 15 100
Залізо, мг 0,092 0,152 0,102
Вітамін А, мкг 89 53 34
Вітамін Д, мкг 0,032 0,062
Тіамін, мкг 15 16 42
Рибофлавін, мкг ЗО 43 157
Нікотинова кислота,
мкг 75 172 85
Аскорбінова
кислота, мкг 4,42 4,32 1,62
1 Відтворено за дозволом з ЕіпсІІау АІ_Р: Ьасіаііоп. Рез РергосІ
(N07) 1974;6(6).
2 Бідне джерело.
414/РОЗДІЛ 23
Молочна залоза
Лактаційний
Е + П + Г + І + ГР + пролактин
Пубертатний
Хоріонічний
мамотропін
Естрогени
Прогестерон
Е + П + Г + І + ГР + пролактин
Під час вагітності
Рис. 23-42. Гормональне регулювання розвитку грудей і лактації у щурів Естрогени Е, прогестерон П і пролактин за наявності
глюкокортикоїдів Г, інсуліну І і гормону росту ГР спричинюють проліферацію проток і ріст під час пубертату (праворуч) Під
час вагітності ці гормони забезпечують повний розвиток альвеол і частково виділення молока (внизу) Після пологів збільшене
виділення пролактину і зниження рівнів естрогену та прогестерону зумовлюють значну секрецію молока і, за наявності
окситоцину, його виділення (ліворуч). Хоріонічний мамотропін є лактогенним гормоном, що його, вірогідно, виділяє плацента
у щурів, і який є аналогом ІіС8. Він сприяє дії пролактину.
ініціює лактацію. Пролактин та естроген діють синергічно
в ініціації зростання грудей, однак естроген перешкоджає
впливу пролактину на продукування молока у грудях.
Жінкам, які не хочуть годувати своїх дітей грудьми, для
припинення лактації можна призначити естрогени.
Смоктання не тільки спричинює рефлекторне вивіль-
нення окситоцину і виділення молока, а й підтримує та
збільшує секрецію молока, стимулюючи виділення пролак-
тину (див. вище).
Вплив лактації на місячний цикл
У жінок, які не вигодовують дитину, перша місячна
настає на шостий тиждень після пологів. Проте жінки, які
годують грудьми, мають аменорею протягом 25-30 тиж-
нів. Вигодовування стимулює виділення пролактину, і є
докази, що пролактин пригнічує виділення ГнРГ, його дію
на гіпофіз та перешкоджає впливу гонадотропінів на
яєчники. Завдяки цьому пригнічена овуляція, яєчники пере-
бувають у неактивному стані, а виділення естрогену і про-
гестерону знижується. Унаслідок цього тільки 5-10% жі-
нок знову вагітніють під час періоду годування грудьми,
тому тривалий час вигодовування вважали важливим, про-
те тільки частково ефективним методом регулювання
народжуваності. Крім того, майже 50% циклів у перші
шість місяців після відновлення місячних є ановулятор-
ними.
Синдром Чіері-Фроммеля
Цікавим, хоча і рідкісним, станом є продовження лак-
тації (галакторея) й аменорея у жінок, які не годують
грудьми після пологів. Цей стан, який називають синд-
ромом Чіері-Фроммеля, може поєднуватися з атрофією
статевих органів і виникає внаслідок продовження виді-
лень пролактину без секреції ФСГ і ЛГ, необхідних для
дозрівання нових фолікулів та овуляції. Подібна картина
галактореї й аменореї з високим рівнем циркулювального
пролактину трапляється у невагітних жінок із хромофоб-
ними пухлинами гіпофіза, а також у жінок із видаленою
ніжкою гіпофіза внаслідок лікування раку.
Гінекомастія
Ріст грудей у чоловіків називають гінекомастісю. Він
може бути одно- або, частіше, двобічним. Гінекомастія
простежується у близько 75% новонароджених унаслідок
трансплацентарного передавання естрогенів матері. Вини-
кає також у легкій, перехідній формі в 70% здорових хлоп-
ців під час періоду пубертату та у багатьох чоловіків після
50 років. Цей стан виявляється в андрогеновій резистент-
ності; його розцінюють як ускладнення лікування естро-
генами, буває у пацієнтів із пухлинами, які секретують
естроген. Трапляється гінекомастія у разі багатьох непов’я-
заних між собою станів, наприклад, євнухоїдизму, гіперти-
реозу та цирозу печінки. Вживання наперстянки також
зумовлює гінекомастію, оскільки серцеві глікозиди мають
слабку естрогенову активність. До цього може призводити
приймання інших ліків. Траплялася ця хвороба у виснаже-
них під час війни в’язнів, яких нещодавно звільнили і які
почали адекватно харчуватися. Загальною ознакою біль-
шості випадків гінекомастії є збільшене співвідношення
естроген-андрогену в плазмі, спричинене або збільшенням
ГОНАДИ: РОЗВИТОК І ФУНКЦІЇ РЕПРОДУКТИВНОЇ СИСТЕМИ / 415
кількості циркулювальних естрогенів, або зменшенням
кількості циркулювальних андрогенів.
Гормони і рак
Близько 35% карцином грудей у жінок дітородного віку
є естрогенозалежними; їхній подальший ріст залежить
від наявності естрогенів у крові. Пухлини не лікують галь-
муванням виділення естрогенів, однак це дає змогу змен-
шити симптоми, і регресу пухлини на місяці чи роки до
повернення процесу. Жінки з естрогенозалежними пух-
линами часто мають ремісію після видалення яєчників.
Ситуація ліпша, якщо пухлина містить естрогенові рецеп-
тори, і ще ліпша, коли в ній є як естрогенові, так і про-
гестеронові рецептори. Адже естроген стимулює утворен-
ня прогестеронових рецепторів, а їхня наявність виявляє,
що естроген не тільки зв’язується, а й впливає на пухлинні
клітини. Проте у декількох жінок без цих типів рецепторів
виявлено ефект від такої ендокринної терапії. Якщо ж хво-
роба повертається, то наступну ремісію досягають двобіч-
ним видаленням надниркових залоз. Оскільки виділення
естрогенів яєчниками і наднирковими залозами пригнічує
гіпофізектомія, то таку операцію роблять у ракових хво-
рих. Є також докази, що гормон росту і пролактин стиму-
люють ріст карцином грудей, а гіпофізектомія усуває ці
фактори.
Деякі карциноми простати є андрогенозалежними і
тимчасово регресують після видалення яєчок чи лікування
агоністами ГнРГ у дозах, які здатні спричинити регулю-
вання зниження рецепторів ГнРГ на гонадотропах і змен-
шення виділення ЛГ. Утворення пухлин гіпофіза після
видалення ендокринних залоз-мішеней, що їх регулюють
гіпофізарні тропні гормони, розглянуто у Розділі 22.
24
Ендокринна функція
нирок, серця та епіфіза
ВСТУП
Крім гіпофіза, щитоподібної, паращитоподібних та під-
шлункової залоз, наднирників і гонад, до органів з ендо-
кринною функцією належить чимало інших структур орга-
нізму. Гормони, що стимулюють чи пригнічують секрецію
гормонів передньої частки гіпофіза, секретовані гіпотала-
мусом (див. Розділ 14); крім того, велику кількість гормонів
виробляє слизова шлунково-кишкового тракту (див. Розділ
26). Багато різноманітних клітин продукують цитокіни,
інтерлейкіни і фактори росту (див. Розділи 1, 22 та 27).
Нирки виробляють три гормони: 1,25-дигідроксихоле-
кальциферол (див. Розділ 21), ренін та еритропоетин.
Натрійуретичні пептиди - це речовини, що їх продукує
серце та інші тканини. Вони збільшують екскрецію натрію
нирками, а надлишкова їхня кількість інгібує ензим №+-
К+-АТФ-азу. Епіфіз секретує мелатонін - це індол, який
теж може мати ендокринну функцію. В цьому розділі роз-
глянуто ендокринну функцію нирок, серця та епіфіза.
РЕНІН-АНГІОТЕНЗИНОВА СИСТЕМА
Ренін
Відомо, що у разі парентерального введення екстрактів
ниркової тканини підвищується артеріальний тиск. Це від-
бувається завдяки реніну - ензиму з групи кислих протеаз,
що його секретують нирки безпосередньо у кров. Ренін
діє у комплексі з ангіотензиноперетворювальним ензимом,
утворюючи ангіотензин II (рис. 24-1). Ангіотензин II -
це глікопротеїн, молекулярна маса якого у людини ста-
новить 37 326. Його молекула складається з двох часток,
або доменів, у глибокій щілині між якими розміщений
активний центр. В активному центрі суміщені два залишки
аспарагінової кислоти; один у 104 позиції, інший у 292
(номери залишків амінокислот у препрореніні людини).
Вони відіграють важливу роль в активності цього ензиму.
Отже, ренін належить до аспартилових протеаз.
Подібно до інших гормонів, ренін синтезується у вигляді
великого препрогормону. Препроренін людини містить
406 амінокислотних залишків. Проренін, що утворюється
внаслідок від’єднання від препрореніну початкової послі-
довності з 23 амінокислот, містить 383 амінокислотні
залишки. Відповідно, після від’єднання від прореніну так
званої пропослідовності амінокислот формується актив-
ний ренін, що містить 340 амінокислотних залишків.
Біологічної активності проренін практично не має. Деяка
його кількість перетворюється в нирках у ренін, а решта -
секретується. Проренін секретують також інші органи,
зокрема яєчники. Після нефректомії рівень прореніну у
крові, що циркулює, знижується незначно і може, фак-
тично, навіть підвищитися, однак рівень активного реніну
знижується практично до нуля. Отже, лише дуже незначна
кількість прореніну в крові перетворюється у ренін, а
активний ренін є продуктом переважно, якщо не винятково,
нирок. Проренін секретується в багатьох тканинах орга-
нізму, тоді як активний ренін утворюється переважно в
секреторних гранулах юкстагломерулярних клітин (див.
нижче).
Період напівжиття активного реніну в крові, що цирку-
лює, становить до 80 хв. Єдиною відомою сьогодні його
функцією є відщеплення ангіотензину І від амінового кін-
ця декапептиду ангіотензиногену (субстрату реніну).
Ангіотензиноген
Ангіотензиноген, що циркулює, виявлено в ос2-фракції
глобулінів плазми (див. рис. 24-1). Він містить близько 13%
вуглеводів і складається з 453 амінокислотних залишків;
синтезується в печінці з сигнальною послідовністю із 32
амінокислотних залишків, яка відокремлюється в ендо-
плазматичній сітці. Глюкокортикоїди, тиреоїдні гормони,
естрогени, деякі цитокіни й ангіотензин II підвищують
його рівень у крові, що циркулює.
Ангіотензиноперетворювальний ензим і
ангіотензин II
Ангіотензиноперетворювальний ензим (АПЕ) - це
дипептидилкарбоксипептидаза, яка відщеплює пстидин-
лейцин від фізіологічно неактивного ангіотензину І, утво-
рюючи октапептид ангіотензин II (рис. 24-2). Той самий
ензим інактивує брадикінін (див. Розділ 31). Більша части-
на перетворювального ензиму, що утворює ангіотензин II
у крові, міститься в ендотеліальних клітинах. Перетворен-
ня відбувається головно під час проходження крові через
легені, однак також і в багатьох інших ділянках організму.
АПЕ - це ектоензим, у якому наявні дві форми - сома-
тична, що є по всьому організму, і термінальна, що міс-
титься лише в постмейотичних сперматогенних тканинах
ЕНДОКРИННА ФУНКЦІЯ НИРОК, СЕРЦЯ ТА ЕПІФІЗА / 417
Неренінові,
не-АПЕ
шляхи
--->| Ангіотензин II
Різноманітні-----►
пептидази І
АНІ, АІУ,
інші
АТ^рецептори
АТ2-рецептори
Брадикінін
Неактивні
метаболіти
Неактивні
метаболіти
Рис. 24-1. Утворення і метаболізм ангіотензинів, що циркулюють у крові.
і сперматозоїдах (див. Розділ 23). Обидві форми АПЕ
мають єдиний трансмембранний домен і короткий цито-
плазматичний “хвіст”. Однак соматичний АПЕ є білком з
молекулярною масою 170 кДа і двома гомологічними
позаклітинними доменами, кожен з яких містить активний
центр (рис. 24-3). Термінальний АПЕ має молекулярну
масу 90 кДа, лише один позаклітинний домен і один
активний центр. Обидва ензими утворюються з одного
гена. Однак цей ген має два різні промоутери, які утво-
рюють дві різні мРНК. У мишей чоловічої статі з вилу-
ченим геном АПЕ артеріальний тиск нижчий від нор-
мального, а в таких же мишей жіночої статі він нормаль-
ний. Крім того, у мишей чоловічої статі в цьому разі зни-
жується плідність, чого не простежується у мишей жіночої
статі.
Метаболізм ангіотензину II
Ангіотензин II метаболізує швидко, період його напів-
життя в крові людини становить 1-2 хв. Його розщеплю-
ють різноманітні пептидази. Амінопептидаза відщеплює
залишок аспарагіну від амінового кінця пептиду. Гептапеп-
тид, що утворюється внаслідок цього, має фізіологічну
активність; деколи його називають ангіотензином III (див.
нижче). Відщеплення другої кінцевої амінокислоти від
ангіотензину III приводить до утворення гексапептиду -
ангіотензину IV, якому, ймовірно, також притаманна деяка
активність. Більшість інших пептидних фрагментів неак-
тивна. Крім того, амінопептидаза може впливати на ангіо-
тензин І, унаслідок чого утворюється (сІез-Азр^-ангіо-
тензин І, здатний перетворюватись безпосередньо в ангіо-
тензин III під впливом АПЕ. Здатність метаболізувати
А5р-Агд-УаІ-Туг-ІІе-НІ8-Рго-РКе-Ні8-Іеи-\/аІ-ІІе-НІ8-К
Ренін розщеплює цей зв’язок
Ангіотензиноген
Азр-Агд-УаІ-Туг-ІІе-Ніз-Рго-РКе-Ніз-І-еи
г
АПЕ розщеплює цей зв’язок
Ангіотензин І
Азр-Агд-\/аІ-Туг-ІІе-НІ8-Рго-РКе
І
Амінопептидаза розщеплює цей зв’язок
Ангіотензин II
Ангіотензин III
Рис. 24-2. Структура змінного кінця ангіотензиногену й ангіотензинів І, II та III у людини; Я - залишок білка. Після відщеплення
лідерної послідовності з 24 амінокислот ангіотензиноген містить 453 амінокислотні залишки. Структура ангіотензину II у собак,
щурів та багатьох інших ссавців ідентична до структури у людини. Ангіотензин II у корів і овець у 5-й позиції замість ізолейцину
містить валін.
28 367 2
418/РОЗДІЛ 24
Позаклітинне
поширення
Каталітичний сайт
амінового кінця
2п2+ 2п2+
С Каталітичний сайт
карбоксилового кінця
І\ІН2
- Транс-
мембранний
- домен
СООН
Внутрішньоклітинне
поширення
Рис. 24-3. Схематичне зображення структури соматичної
форми ангіотензиноперетворювального ензиму. Зверніть
увагу на короткий ендоплазматичний “хвіст” молекули та два
позаклітинні каталітичні сайти, кожен з яких зв’язується з
йоном цинку (2п2+) (Відтворено за дозволом з <іоґіпзіогі СІ:
ТІ551ІЄ апдіоїепзіп-сопуеіііпд епгуте іп сагсііас апсі уазсиїаг
ЬурегТгорЬу, гераігапсі гетосіеііпд. Нуреііепзіоп 1994;23258)
ангіотензин мають еритроцити та інші тканини організму.
Вилучення ангіотензину II з кровообігу відбувається, ймо-
вірно, за допомогою деякого механізму захоплення, який
діє в капілярних ложах різних тканин (за винятком легень).
Рівень реніну, як звичайно, вимірюють шляхом інкубації
зразка, який піддають аналізу, і визначенням за допомогою
імунохімічного аналізу кількості утвореного ангіотензину І.
Таким способом визначають ренінову активність плаз-
ми (РАП) зразка. РАП може знижуватись не лише зі змен-
шенням кількості реніну, а й у разі дефіциту ангіотензино-
гену, що може призвести до неправильної інтерпретації
результатів дослідження. Щоб уникнути цього, до зразка
часто додають екзогенний ангіотензиноген; у цьому випад-
ку визначають концентрацію реніну в плазмі (КРП), а
не РАП. В осіб, що одержують з їжею нормальну кількість
натрію, нормальне значення РАП у горизонтальному поло-
женні становить близько 1 нг ангіотензину І на 1 мл зразка
за 1 год. Концентрація ангіотензину II в плазмі крові у таких
людей становить близько 25 пг/мл (близько 25 пмоль/л).
Дія ангіотензинів
Ангіотензин І діє винятково як попередник ангіотензину
II і не має жодної іншої відомої сьогодні функції. Ангіо-
тензин II, який попередньо називали гіпертензином, або
ангіотоніном, зумовлює звуження артеріальних судин і
підвищення систолічного і діастолічного тиску крові. Це
один з найпотужніших відомих вазоконстрикторів, який у
нормальних осіб виявляє у 4-8 разів більшу активність,
ніж норадреналін. Однак його пресорна активність послаб-
люється в осіб з вираженою нестачею натрію і в хворих
на цироз печінки та деякі інші захворювання. За цих станів
рівень ангіотензину II в крові, що циркулює, підвищується,
і за механізмом негативного зворотного зв’язку відбува-
ється пригнічення ангіотензинових рецепторів у гладкій
мускулатурі судинної стінки. Цим же пояснюють той факт,
що ангіотензин II, уведений ззовні, зумовлює менш вира-
жений ефект, ніж ендогенний.
Ангіотензин II діє безпосередньо на кору надниркових
залоз, збільшуючи секрецію альдостерону. Отже, головною
регулювальною ланкою секреції альдостерону є ренін-
ангіотензинова система (див. Розділ 20). До додаткових
ефектів ангіотензину II належать полегшене вивільнення
норадреналіну шляхом прямої дії на постгангліонарні
симпатичні нейрони, скорочення мезангіальних клітин, яке
супроводжується значним зменшенням швидкості клубоч-
кової фільтрації (див. Розділ 38), а також безпосередня дія
на систему ниркових канальців, що спричинює збільшення
реабсорбції натрію.
Крім того, ангіотензин II впливає на мозок, знижуючи
поріг чутливості барорефлексу (див. Розділ 31), а це потен-
ціює пресорний ефект ангіотензину II. Він також діє на
мозок, посилюючи відчуття спраги (див. Розділ 14) і збіль-
шуючи секрецію вазопресину і АКТГ. Ангіотензин II не
проникає через гематоенцефалічний бар’єр, однак впливає,
діючи на навколошлуночкові органи - чотири невеликого
розміру структури, що містяться поза гематоенцефалічним
бар’єром (див. Розділ 32). Одна з цих структур, так звана
агеарозігета, відповідає передусім за потенціацію пресор-
ного впливу, тоді як дві інші (субфорнікальний орган (СФО)
і судинний орган кінцевої пластинки (СОКП)) - за збіль-
шене відчуття спраги (дипсогенний ефект). Проте сьогодні
не визначено, які з навколошлуночкових органів відпові-
дають за підвищення секреції вазопресину й АКТГ.
Ангіотензин III [(сІе8-А8р1)-ангіотензин II] має лише
близько 40% пресорної активності ангіотензину II, проте
100% його альдостероностимулювальної дії. Різні дослід-
ники припускали, що ангіотензин III є природним аль-
достероностимулювальним пептидом, тоді як ангіотен-
зин II регулює артеріальний тиск. Однак насправді ангіо-
тензин III - це просто продукт розпаду з притаманною йому
деякою біологічною активністю. Це ж стосується й ангіо-
тензину IV, хоча деякі дослідники вважають, що він має
деякий унікальний вплив на мозок.
Тканинні ренін-ангіотензинові системи
Крім системи, яка продукує ангіотензин II у крові, що
циркулює, багато інших тканин містять незалежні ренін-
ангіотензинові системи, які генерують ангіотензин II,
напевно, для місцевої дії. Компоненти ренін-ангіотензи-
нової системи містяться у стінці кровоносних судин, матці,
плаценті та оболонках плоду. Високу концентрацію про-
реніну зафіксовано в амніотичній рідині. Крім того, ренін-
ангіотензинова система або принаймні деякі її компоненти
є в очних яблуках, екзокринній частині підшлункової
залози, серці, жировій тканині, корі надниркових залоз, яєч-
ках, яєчниках, передній та середній частках гіпофіза, епі-
фізі та мозку. Функції цих тканинних ренін-ангіотензи-
нових систем ще не з’ясовані, хоча з’являється щораз біль-
ше доказів того, що ангіотензин II - це один з вирішальних
факторів росту серцевої тканини і кровоносних судин. Тка-
нинний ренін потрапляє у кровообіг лише у мізерних кіль-
ЕНДОКРИННА ФУНКЦІЯ НИРОК, СЕРЦЯ ТА ЕПІФІЗА / 419
костях, тому після двобічного видалення нирок активність
реніну плазми знижується до рівня, який сучасними мето-
дами не виявляють.
Рецептори ангіотензину II
Є принаймні два класи рецепторів ангіотензину II (див.
рис. 24-1). Рецептори АТ] - це ангіотензинові рецептори
плазунів, які за допомогою 6-білка (білок 6ч) з’єднуються
з фосфоліпазою С, після чого ангіотензин II підвищує
рівень вільного Са24 в цитозолі. Він також активує численні
ензими групи тирозинових кіназ. У гладких м’язах судинної
стінки АТ^рецептори з’єднуються з ямками на поверхні
клітини (див. Розділ І); у цьому разі ангіотензин II збільшує
утворення кавеоліну І - однієї з трьох ізоформ білка, який
є специфічним для клітинних ямок. У гризунів є два
відмінні, однак тісно пов’язані підтипи АТ]-АТ1Д і АТ
кодовані двома окремими генами. Підтип АТ]Д виявляють
у стінках кровоносних судин, мозку і багатьох інших
органах. Він є трансмітером більшої частини відомих
ефектів ангіотензину II. Рецептор АТ(В виявляють у перед-
ній частці гіпофіза і в корі надниркових залоз. У людини
ген АТ(-рецептора є в 3-й хромосомі. Відомі докази наяв-
ності й другого типу АТ,-рецепторів, однак ще не виріше-
но, чи у людини справді є такі ж окремі підтипи ангіо-
тензинових рецепторів, як АТ|Л і АТ
Наявні також АТ2-рецептори, які у людини кодовані
геном, що розташований в Х-хромосомі. Як і АТ]-рецеп-
тори, вони мають сім трансмембранних доменів, однак
виконують цілком інші функції: діють через 6-білок, акти-
вуючи різноманітні фосфатази, які, відповідно, діють як
антагоністи факторів росту і відкривають К -канали. Крім
цього, активування АТ2-рецепторів збільшує утворення N0
і, отже, підвищує внутрішньоклітинний вміст цГМФ.
Загальні фізіологічні наслідки цих вторинних месен-
джерних ефектів сьогодні ще нез’ясовані. У плоду і ново-
народженого є значно більше АТ2-рецепторів, проте їх
виявлено й у дорослих - у мозку та в деяких інших орга-
нах.
Регулювання АТ]-рецепторів в артеріолах і АТ]-рецеп-
торів у корі надниркових залоз відбувається протилежним
способом: надлишок ангіотензину II впливає на судинні
рецептори за механізмом негативного зворотного зв’язку,
однак на рецептори в корі надниркових залоз - за механіз-
мом позитивного зворотного зв’язку, що робить цю залозу
чутливішою до альдостероностимулювальних ефектів цьо-
го пептиду.
Юкстагломерулярний апарат
Ренін, що міститься в екстрактах нирки і судинному
руслі, продукують юкстагломерулярні клітини (ЮГ-
клітини). Ці епітеліальні клітини розташовані між
аферентних артеріол у місці їхнього входження в клубочок
(рис. 24-4). Вони містять секреторні пухирці, які є резер-
вуаром реніну. Ренін також виявляють в аїранулярних
клітинах, які заповнюють ділянку з’єднання між аферент-
ними та еферентними артеріолами, однак його функція в
цьому місці невідома.
У проміжку, де аферентна артеріола входить у клубочок,
а еферентна покидає його, канадець нефрону дотикається
до артеріол клубочка, з якого походить. У цьому місці, яке
позначає початок дистального покрученого канальця, є
ділянка зміненого канальцевого епітелію, яку називають
щільною плямою (див. рис. 24-4). Щільна пляма роз-
міщена в безпосередній близькості до ЮГ-клітин. Мезан-
гіальні, ЮГ-клітини, і щільна пляма утворюють юкста-
гломерулярний апарат.
Ниркові
нерви
Аферентна
артеріола
Рис. 24-4. Ліворуч: схематичне зображення клубочка з юкстагломерулярним апаратом. Праворуч: фазова контрастна мікро-
скопія аферентної артеріоли у незабарвленому замороженому препараті нирки миші. Зверніть увагу на еритроцит у просвіті
артеріоли і ґранульовані юкстагломерулярні клітини в стінці судини (з дозволу С РеіІ).
420 / РОЗДІЛ 24
Регулювання секреції реніну
На секрецію реніну впливають багато різноманітних
чинників (табл. 24-1), у будь-який момент часу вона зале-
жить від сумарної активності цих чинників. Одним з важ-
ливих чинників є внутрішньонирковий барорецепторний
механізм, що зменшує секрецію реніну у випадку, коли тиск
в артеріолах на рівні ЮГ-клітин підвищується, і збільшує
її, коли він знижується. Іншим сенсорним механізмом
регулювання секреції реніну є щільна пляма: рівень секреції
реніну обернено пропорційний до швидкості транспор-
тування \а+ і СІ через цю ділянку канальця. Швидкість
транспортування залежить не лише від активності щільної
плями, а й від кількості електролітів, що досягають її. Отже,
зменшене надходження і С1~ до дистальних канальців
пов’язане зі збільшенням секреції реніну. Простагландини,
особливо простациклін (див. Розділ 17), стимулюють секре-
цію реніну, очевидно, безпосередньо впливаючи на ЮГ-
клітини. Є деякі докази того, що трансмітер, через який
клітини щільної плями впливають на секрецію реніну, - це
N0 (див. Розділ 31). Рівень секреції реніну зворотно зале-
жить від концентрації К+ в плазмі крові, однак вплив К+,
ймовірно, опосередкований змінами надходження Ка+ і СІ
до клітин щільної плями.
Ангіотензин II за механізмом зворотного зв’язку при-
гнічує секрецію реніну шляхом прямої дії на ЮГ-клітини.
Вазопресин також пригнічує секрецію реніну іп уйго і іп
уіуо, хоча досі нез’ясовано, є його ефект іп уіуо прямим
чи опосередкованим.
Нарешті, посилення активності симпатичної нервової
системи також підвищує секрецію реніну. Цей ефект пов’я-
заний зі збільшенням концентрації катехоламінів у крові і
впливом норадреналіну, секретованого постгангліонарни-
ми симпатичними нервами нирки. Катехоламіни діють
найбільше на Р-адренергічні рецептори ЮГ-клітин. Зрос-
тання внутрішньоклітинної концентрації збільшує секре-
цію реніну.
Головні стани, що супроводжуються збільшенням сек-
реції реніну у людини, наведені в табл. 24-2. У більшості
випадків центральний венозний тиск знижується і це при-
зводить до збільшення симпатичної активності, що потен-
ційно може призвести до зниження тиску в ниркових арте-
ріолах. Звуження ниркової артерії й аорти в ділянці прокси-
мальніше до ниркових артерій призводить до зниження
тиску в ниркових артеріолах. Психологічні подразники
збільшують активність ниркових нервів.
Фармакологічний вплив на ренін-
ангіотензинову систему
Сьогодні вплив реніну можна пригнічувати багатьма
різними способами. Інгібітори синтезу простагландинів,
такі як індометацин і р-адреноблокатори (пропранолол),
можуть знижувати секрецію реніну.
Пептид пепстатин і нещодавно розроблені інгібітори
реніну, наприклад, препарат еналкірен, перешкоджають
реніну утворювати ангіотензин І. Інгібітори ангіотензино-
перетворювального ензиму, такі як каптоприл і енала-
прилд попереджають перетворення ангіотензину І в ангіо-
тензин II. Саралазин і деякі інші аналоги ангіотензину II
є конкурувальними інгібіторами дії ангіотензину II як на
АТ-, так і на АТ<рецептори. Лозартан (БиР-753) селек-
тивно блокує АТ]-рецептори, а РЛ-123177 та деякі інші
медикаментозні середники селективно блокують АТ2-ре-
цептори.
Роль реніну в розвитку артеріальної
гіпертензії
Звуження однієї ниркової артерії зумовлює раптове
збільшення секреції реніну і розвиток стабільної гіпертензії
(ниркова гіпертензія, або гіпертензія Ґольдблатта). Вида-
лення ішемізованої нирки або усунення артеріальної обст-
рукції усуває гіпертензію, якщо вона не була тривалою.
Загалом гіпертензія, спричинена обструкцією однієї нирко-
вої артерії в разі інтактної іншої нирки (див. табл. 33-5),
супроводжується збільшенням концентрації реніну в крові,
що циркулює. Клінічним відповідником цього стану є нир-
кова гіпертензія внаслідок атеросклеротичного ураження
ниркової артерії та інші аномалії ниркового кровообігу.
Однак активність реніну плазми за однобічної оклюзії, як
звичайно, є в межах норми.
Причини гіпертензії за цих обставин невідомі. У бага-
тьох пацієнтів, що страждають на гіпертонічну хворобу,
інгібітори АПЕ і лозартан дають добрий гіпотензивний
ефект навіть тоді, коли нирковий кровоплин нормальний,
а активність реніну плазми нормальна або навіть зни-
жена.
Роль реніну в механізмі зворотного зв’язку, що допо-
магає підтримувати сталість об’єму позаклітинної рідини
шляхом регулювання секреції альдостерону, описана в
Розділі 20. Високий рівень секреції реніну відповідає за
посилення секреції альдостерону (вторинний гіпераль-
достеронізм), що простежується у деяких нормотензивних
пацієнтів з цирозом печінки і нефрозом.
Таблиця 24-1. Чинники, що впливають на секрецію реніну
Стимулювальні
Посилення симпатичної активності ниркових нервів
Збільшення концентрації катехоламінів у крові
Простагландини
Інгібіторні
Збільшення реабсорбції І\Іа+ і СГ у щільній плямі
Збільшення тиску в аферентній артеріолі
Ангіотензин II
Вазопресин
Таблиця 24-2. Стани, у яких збільшується секреція реніну
Дефіцит І\Іа+
Діуретики
Гіпотензія
Кровотечі
Вертикальне положення тіла
Дегідратація
Серцева недостатність
Цироз печінки
Стеноз ниркової артерії або аорти
Різноманітні психологічні подразники
ЕНДОКРИННА ФУНКЦІЯ НИРОК, СЕРЦЯ ТА ЕПІФІЗА / 421
ЕРИТРОПОЕТИН
Структура і функція
Якщо людина втрачає кров або перебуває в стані гіпо-
ксії, то синтез гемоглобіну посилюється, продукування і
вивільнення еритроцитів з кісткового мозку (еритропоез)
значно збільшуються (див. Розділ 27). Натомість якщо
кількість еритроцитів збільшується понад норму у разі
гемотрансфузій, то еритропоетична активність кісткового
мозку послаблюється. Ці явища є наслідком зміни вмісту
в крові еритропоетину, циркулювального глікопротеїну,
який містить 165 амінокислотних залишків і чотири оліго-
сахаридні ланцюги, необхідні для його активності іп уіуо.
Рівень еритропоетину значно підвищується у разі анемії
(рис. 24-5).
Еритропоетин збільшує кількість еритропоетиночутли-
вих активованих стовбурових клітин у кістковому мозку,
які перетворюються у попередники еритроцитів, а згодом
- у зрілі еритроцити (див. рис. 27-2). Рецептор до еритро-
поетину є лінійним білком з одним трансмембранним
доменом, який належить до надродини цитокінових рецеп-
торів (див. Розділ 1). Він має тирозинкіназну активність і
активує каскад серинових та треонінових кіназ, стимулю-
ючи ріст і диференціацію клітин-мішеней. Коли рівень
еритропоетину знижується, то в еритроїдних стовбурових
клітинах відбувається розпад ДНК, за яким настає програ-
мована загибель клітин (апоптоз). Апоптоз клітин різного
типу, як відомо, - це складова частина нормального роз-
витку багатьох тканин. Еритропоетин же знижує інтенсив-
ність розпаду ДНК в еритроїдних стовбурових клітинах і
сприяє їхньому виживанню.
Рис. 24-5. Концентрація еритропоетину в плазмі здорових
донорів крові (трикутники) й пацієнтів з різними формами ане-
мії (квадрати) (відтворено за дозволом з Егзієу А± Егуіііго-
реііп. N ЕпдІ Месі 1991 ;324 1339).
Головним місцем інактивації еритропоетину є печінка.
Тривалість періоду напівжиття еритропоетину в крові ста-
новить близько 5 год. Однак збільшення кількості еритро-
цитів у судинному руслі під впливом еритропоетину вияв-
ляється лише через два-три дні, оскільки дозрівання ери-
троцитів - це порівняно повільний процес. Втрата навіть
невеликого фрагмента залишків сіалової кислоти у вугле-
водній частині молекули еритропоетину зменшує період
його напівжиття до 5 хв, що робить його біологічно неефек-
тивним.
Джерела еритропоетину
У дорослих близько 85% еритропоетину виробляють
нирки і 15% - печінка. Обидва ці органи містять мРНК
для синтезування еритропоетину. Еритропоетин може
також екстрагуватися з селезінки і слинних залоз, однак ці
тканини не містять відповідної мРНК, отже, не здатні про-
дукувати гормона.
Під час ембріонального розвитку та в перші дні життя
головним органом еритропоезу є печінка, вона ж - головне
місце синтезування еритропоетину, перш ніж функцію
еритропоезу візьме на себе кістковий мозок, а продуку-
вання еритропоетину - нирки. Якщо кількість повноцінної
ниркової тканини у дорослих зменшується внаслідок неф-
ректомії або захворювань нирок, то печінка вже не в стані
компенсувати дефіцит еритропоетину, і часто виникає ане-
мія.
У дорослих еритропоетин продукують інтерстиційні
клітини в перитубулярних капілярних ложах нирки і пери-
венозні гепатоцити печінки.
Ген, що відповідає за синтезування цього гормону, кло-
новано. Рекомбінантний еритропоетин, який продукують
клітини тварин, застосовують у клінічній практиці як пре-
парат епоетин-альфа. Він дуже цінний у лікуванні анемії
на ґрунті ниркової недостатності.
У 90% пацієнтів на термінальній стадії ниркової недос-
татності, які перебувають на гемодіалізі, є виражена
анемія внаслідок дефіциту еритропоетину. Крім того,
еритропоетин застосовують для стимулювання кровотво-
рення в осіб, які здають власну кров, готуючись до авто-
гемотрансфузії під час планових хірургічних втручань
(див. Розділ 27).
Регулювання секреції еритропоетину
Як звичайно, секрецію еритропоетину стимулює гіпо-
ксія, однак її також можуть посилювати солі кобальту й
андрогени.
Дослідження останніх років свідчать, що сенсорною
системою, яка регулює продукування еритропоетину
залежно від вмісту О2 в крові, є гемовий білок, який у
діоксиформі стимулює, а в оксиформі пригнічує транс-
крипцію гена еритропоетину, а отже, утворення еритропое-
тинової мРНК. Секрецію гормону полегшує алкалоз, який
розвивається на значних висотах.
Подібно до секреції реніну, секрецію еритропоетину
посилюють катехоламіни через [З-адренергічний механізм,
хоча ренін-ангіотензинова система цілком відокремлена
від еритропоетинової. Продукування еритропоетину сти-
мулює аденозин та інгібує антагоніст аденозину - тео-
філін.
422 / РОЗДІЛ 24
ГОРМОНИ СЕРЦЯ ТА ІНШІ
НАТРІЙУРЕТИЧНІ ФАКТОРИ
Структура
Наявність різноманітних натрійуретичних гормонів
визнана лише недавно. Два з них секретує серце. М’язові
клітини в передсердях і менше у шлуночках містять секре-
торні гранули (рис. 24-6), кількість яких збільшується зі
збільшенням приймання натрію хлориду й об’єму поза-
клітинної рідини. Екстракти тканини передсердя здатні
посилювати виділення натрію з сечею.
Першим натрійуретичним гормоном, виділеним з сер-
ця, був передсердний натрійуретичний пептид (А№Р -
від нагл. агїіаі паїгіигейс реріібе) поліпептид з характерним
кільцем із 17 амінокислот, утвореним за допомогою дисуль-
фідного зв’язку між двома залишками цистеїну. Циркулю-
вальна форма цього поліпептиду містить 28 амінокис-
лотних залишків (рис. 24-7). Вона утворена з великої пре-
курсорної молекули, яка містить 151 амінокислотний зали-
шок, у тім числі сигнальний пептид, що складається з 24
амінокислот. АКР згодом виділено з інших тканин, зокрема
мозку, де він є в двох формах, менших за розмірами, ніж
АКР у судинному руслі.
Другий натрійуретичний пептид виділено з мозку свині,
його назвали мозковий натрійуретичний пептид (ВКР
- від англ. Ьгаіп паігіигеііс реріісіе). У людини він також є в
мозку, однак більше виявляється в серці, у тім числі його
шлуночках. Форма цього гормону, що циркулює у крові,
містить 32 амінокислотні залишки і має таке ж кільце з 17
амінокислот, як і АКР, хоча деякі з цих амінокислот
відмінні від тих, що їх містить аналогічне кільце АКР (див.
рис. 24-7). Третього члена цієї родини названо натрійуре-
І
З
♦
ч
Рис.24-6. Гранули АМР (д), розсіяні між мітохондріями (т)
щура в м’язових клітинах передсердя; 6 - апарат Ґольджі; N
- ядро. Гранули у клітинах передсердь людини мають подіб-
ний вигляд. х17 640 (з дозволу М Сагііп).
тичний пептид С-типу (СКР - від англ. С-їуре паїгіигебс
рерббе), оскільки він був третім з виділених (тому позначе-
ний третьою літерою латинського алфавіту). Він містить
22 амінокислотні залишки (див. рис. 24-7), однак є й більша
його форма, що складається з 53 амінокислот. СКР наявний
у мозку, гіпофізі, нирках і клітинах ендотелію судин. Проте
його кількість у тканинах серця і кров’яному руслі дуже
мала; він, імовірно, передусім відіграє роль паракринного
трансмітера.
1 І---------------1 28
АМР ЗЬНКЗЗСЕССНМПНІСАОЗСЬССЕЗЕКУ
1 І--------------1 32
ВМР ЗРКМУОСЗССЕСККМПНІЗЗЗЗСЬССКУЬКНН
1 І------------------122
СМР СЬЗКССЕСЬКЬОНІСЗМЗСЬСС
Рис. 24-7. АМР, ВИР та СИР у людини. Вгорі: односимвольні коди амінокислотних залишків, де показано спільні амінокислотні
послідовності (позначені кольором). Унизу: форма молекул. Зверніть увагу, що термінальним залишком на карбоксильному
кінці СИР є цистеїн; таким способом карбоксильний кінець цього поліпептидного ланцюга замикається, утворюючи 17-членне
кільце (модифіковано з Ігпига Н, Макао К, Иоїі Н: Тйе паїгіигеііс реріісіе зузіет іп Піе Ьгаіп: Ітріісаііоп іп ійе сепігаї сопігої ої
сагсііоуазсиїаг апсі пеигоепсіосгіпе (ипсііопз. Егопі МеигопсІосгіпоІ 1992; 13:217).
ЕНДОКРИННА ФУНКЦІЯ НИРОК, СЕРЦЯ ТА ЕПІФІЗА / 423
Функція
Гормони АКР і ВКР, що містяться в крові, діють на
нирки, збільшуючи екскрецію Ка‘; уведений ін’єкційним
способом СКР теж дає подібний ефект. Імовірно, вони
впливають шляхом дилатації аферентних артеріол і релак-
сації мезангіальних клітин. Обидва ці ефекти посилюють
фільтрування у клубочках (див. Розділ 38), а також діють
на ниркові канальці, пригнічуючи реабсорбцію Ка+. До
інших ефектів належить збільшення проникності капілярів,
що призводить до екстравазації рідини і зниження артері-
ального тиску. Крім того, вони сприяють розслабленню
гладком’язових елементів в артеріолах і венулах. СКР має
більше виражений судинорозширювальний вплив на вени,
ніж АКР і ВКР. Ці пептиди також знижують секрецію рені-
ну і протидіють пресорним ефектам катехоламінів та ангю-
тензину II.
У мозку АКР наявний у нейронах. Нервовий провідни-
ковий шлях, що містить АКР, тягнеться від антеромеді-
альної частини гіпоталамуса до ділянок стовбура мозку,
які відповідають за нервове регулювання серцево-судинної
системи.
Загалом дія АКР на мозок протилежна до впливу ангіо-
тензину II, і нервові волокна, що містять АКР, найімовір-
ніше, відповідають за зниження артеріального тиску і поси-
лене виділення натрію з сечею. Значення СКР і ВКР для
мозку, мабуть, таке ж , як і АКР, однак детальнішої інфор-
мації з цього приводу ще не отримано.
Рецептори натрійуретичних пептидів
Сьогодні виявлено й описано три різні типи рецепторів
натрійуретичних пептидів (КРК) (рис. 24-8). Двоє з цих
рецепторів - КРК-А і КРК-В - разом перетинають клітинну
мембрану і мають цитоплазматичні домени, які за хімічною
суттю є гуанілатциклазами. Гормон АКР найбільше спо-
ріднений з рецептором КРК-А, а СКР - з КРК-В. Третій
рецептор - КРК-С - зв’язується з усіма трьома натрійуре-
тичними пептидами, проте має помітно усічений цитоплаз-
матичний домен. Є деякі докази, що він діє через 6-білки,
активуючи фосфоліпазу С і пригнічуючи аденілатциклазу.
Однак дискусійне твердження, що цей рецептор не є пуско-
ИРР-А МРР-В МРР-С
ПКР___________І
Мембрана клітини]
Цитоплазма І
Домен А
гуанілат- І
циклази "
Рис. 24-8. Схематичне зображення рецепторів до натрійуре-
тичного пептиду. Молекули МРР-А і МРР-В містять внутріш-
ньоклітинні гуанілатцикпазні домени, тоді як кпіренсний ре-
цептор МРР-С має лише один невеликий цитоплазматичний
домен.
вою точкою жодних внутрішньоклітинних процесів, а лише
так званий кліренсний рецептор, який просто зв’язує
натрійуретичні пептиди, що циркулюють у крові, і вивіль-
нює їх згодом, що допомагає підтримувати сталість кон-
центрації цих гормонів у крові.
Секреція і метаболізм
Концентрація АКР у плазмі крові в осіб, що споживають
помірну кількість натрію, становить у нормі близько
5 фмоль/мл. Секреція АКР збільшується тоді, коли об’єм
ПКР збільшується внаслідок довенного введення ізотоніч-
ного розчину натрію хлориду або дієти з високим вмістом
натрію, а також у разі занурення у воду до шиї (рис. 24-9)
(ця процедура протидіє впливові сили земного тяжіння на
Час, год
Рис. 24-9. Вплив занурення у воду до рівня шиї на концент-
рацію в плазмі крові АИР і альдостерону та активність плаз-
мового реніну (РРА) (модифіковано і відтворено за дозволом
з Ерзіеіп М еі аі: Іпсгеазез іп сігсиїаііпд аігіаі паїгіигеїіс їасіог
сіигіпд іттегвіоп-іпсіисесі сепїгаї йуреп/оіаетіа іп погтаї йи-
тапз. Нурегіепзіоп 1986;4 [ЗиррІ 2]:593).
424 / РОЗДІЛ 24
кровообіг, збільшуючи центральний венозний тиск, і як
наслідок - тиск у передсердях). Зазначимо, що занурення
у воду також зменшує секрецію реніну й альдостерону.
Натомість унаслідок переходу з положення лежачи у поло-
ження стоячи рівень АКР у плазмі крові незначно знижу-
ється, однак піддається реєстрації в поєднанні зі зниженням
центрального венозного тиску. Іп уйго смужки передсерд-
ної м’язової тканини вивільнюють АКР у разі їхнього
штучного розтягнення. Отже, ймовірно, що передсердя іп
уіуо безпосередньо відповідають на розтяг, а інтенсивність
секреції АКР пропорційна до того ступеня, на який перед-
сердя розтягуються в разі підвищення центрального веноз-
ного тиску.
АКР у крові, що циркулює, має короткий період пів-
життя. Його метаболізує нейтральна ендопептидаза (НЕП),
яку пригнічує триптофан. Отже, приймання триптофану
збільшує рівень АКР у крові.
Значно менше відомо про секретування тканинами
серця ВКР та його метаболізм, проте вони, швидше всьо-
го, подібні до відповідних процесів з АКР.
Фактор інгібування №*-К*-АТФ-ази
У крові є й інший натрійуретичний фактор, який сти-
мулює виділення натрію з сечею шляхом інгубування ензи-
му Ка+-К+-АТФ-ази і більше схильний підвищувати арте-
ріальний тиск, аніж знижувати його. Недавні дослідження
засвідчили, що ця речовина - оубаїн, стероїд із дигіталісо-
подібним ефектом, який синтезується в надниркових зало-
зах. Однак його фізіологічне значення ще не з’ясоване.
ЕПІФІЗ
Епіфізу (шишкоподібній залозі), яку Декарт уважав
вмістищем душі, колись приписували безліч різноманітних
функцій. Сьогодні відомо, що він секретує мелатонін, і най-
імовірнішою його функцією є роль внутрішнього годин-
ника, що синхронізує зміни стану організму з циклічними
змінами світлої і темної частини доби.
Анатомія
Епіфіз розвивається з даху третього шлуночка під заднім
кінцем мозолистого тіла і за допомогою корінця зв’язується
із задньою та повідцевою спайками. В корінці є нервові
волокна, однак вони не досягають залози. Епіфізарна
строма містить нейроглію і паренхіматозні клітини, ще
свідчить про її секреторну функцію (рис. 24-10). Подібне
до інших залоз внутрішньої секреції, епіфіз має надзви-
чайно проникні фенестровані капіляри. У молодих твариг
і немовлят шишкоподібна залоза великих розмірів, і її клі-
тини мають тенденцію об’єднуватись в альвеоли. Пере;
початком періоду статевого дозрівання починається інво-
люція епіфіза, і в людини у тканині залози формують^
невеличкі каменеподібні скупчення фосфату й карбонат}
кальцію (“епіфізарний пісок”). Оскільки ці конкременті
є рентґенконтрастними, то нормальна шишкоподібна зало
за часто візуалізується на рентгенограмах черепа доросли:
осіб. Зміщення кальцифікованого епіфіза порівняно з йоп
нормальним положенням свідчить про наявність об’ємноп
утвору, наприклад, пухлини мозку.
Рис. 24-10. Ліворуч: сагітальний розріз стовбура мозку людини, на якому показано епіфіз та його іннервацію. Ретиногіпоталаміч
волокна утворюють синапси в надперехресному ядрі спинного мозку. Прегангліонарні нейрони йдуть від спинного мозку ;
верхнього шийного вузла, а постгангліонарні - від цього вузла до епіфіза у складі вінцевих нервів. Праворуч: гістологічь
будова епіфіза. Малюнок тканинного препарату, забарвленого гематоксилінеозином (відтворено за дозволом з Еамсей О\/
ВІоогп апсі Еамсей, А ТехіЬоок ої Нізіоіоду, 11 есі. Заипсіегз, 1986).
ЕНДОКРИННА ФУНКЦІЯ НИРОК, СЕРЦЯ ТА ЕПІФІЗА / 425
Мелатонін
Шишкоподібна залоза в амфібій містить індол - М-аце-
тил-5-метокситриптамін, який називають мелатонін,
оскільки він робить світлішою шкіру головастиків, впли-
ваючи на меланофори. Однак він, вірогідно, не відіграє
фізіологічної ролі в регулюванні кольору шкіри. Мелатонін
і ензими, що відповідають за його синтез з серотоніну шля-
хом М-ацетилювання і О-метилювання (рис. 24-11), наявні
в епіфізарній тканині ссавців, хоча мелатонін синтезують
також інші органи. Крім того, мелатонін синтезують епіфі-
зарні паренхіматозні клітини і секретують у кров та спин-
номозкову рідину.
Визначено дві ділянки зв’язування мелатоніну: сайт МЬІ
з високою спорідненістю і сайт МЬ2 з низькою спорід-
неністю.
Триптофан
5-Гідрокситриптофан
5-Гідрокситриптамін
(серотонін)
А/-Ацетилтрансфераза
+ Ацетил-КоА
Н
А/-Ацетил-5-гідрокситриптамін
(А/-Ацетилсеротонін)
ГІОМТ +
8-Аденозилметіонін
Н
М-Ацетил-5-метокситриптамін
(мелатонін)
6-Гідроксимелатонін (у печінці)
та інші метаболіти (у головному мозку)
Рис. 24-11. Утворення та метаболізм мелатоніну; ГІОМТ -
гідроксиіндол-О-метилтрансфераза. Детальніше синтез та
метаболізм серотоніну показано на рис. 4-22.
Клоновано два підтипи МЕІ-рецепторів: Меі Іа і Меі
1Ь. Усі рецептори з’єднуються з 6-білками, у цьому разі
МЕІ-рецептори інгібують аденілатциклазу, а МЕ2-рецеп-
тори стимулюють гідроліз фосфоінозитиду. Однак сьогодні
остаточна функція кожного з них ще не з’ясована.
Регулювання секреції
У людини і всіх біологічних видів, які сьогодні вивчено,
синтез і секреція мелатоніну посилюються вночі, а впро-
довж дня є на низькому рівні (рис. 24-12). Цю значну добову
зміну секреції спричинює норадреналін, секретований
постгангліонарними симпатичними нервами (вінцевими
нервами), які іннервують шишкоподібну залозу (див. рис.
24-10). Норадреналін діє через р-адренергічні рецептори
епіфіза, збільшуючи внутрішньоклітинний вміст цАМФ,
що, відповідно, призводить до значного посилення
активності М-ацетилтрансферази. Це, власне, і зумовлює
збільшення синтезу та секреції мелатоніну.
Стимулювання епіфіза симпатичними нервами синхро-
нізоване з циклом зміни світла і темряви за допомогою
ретиногіпоталамічних нервових волокон, які проходять до
супрахіазматичних ядер. Як саме вони регулюють циркадні
ритми, описано в Розділі 14. У напрямі від гіпоталамуса
низхідні шляхи перетинаються в інтермедіолатеральних
сірих стовпах грудного відділу спинного мозку і закінчу-
ються у прегангліонарних симпатичних нейронах, які, від-
повідно, іннервують верхній шийний вузол - місце, де
починаються постгангліонарні нейрони нервів, що про-
ходять до епіфіза.
Мелатонін, який міститься у крові, швидко метаболізує
у печінці шляхом 6-гідроксилювання з наступною кон’ю-
гацією, у цьому разі близько 90% мелатоніну, що виді-
ляється з сечею, є у вигляді 6-гідроксикон’югатів і 6-суль-
фатоксимелатоніну. Шлях метаболізму мелатоніну в мозку
ще не з’ясований, однак може передбачити розщеплення
індолового ядра.
Рис. 24-12. Добові ритми вмісту різних сполук в епіфізі та
мелатоніну в крові. Затінені ділянки на шкалі часу стосуються
темного періоду доби.
426 / РОЗДІЛ 24
75-і
о-Н-------। ।-----1
18 22 02 06 10 14 18
Час доби, год
Рис. 24-13. Концентрація мелатоніну в плазмі крові упродовж
доби (± стандартна похибка) у чоловіків віком 20-27 (А) і 67-
84 (Б) роки (відтворено за дозволом з Тигек Б: Меіаіопіп Іуре
ЬагсІ Іо 8\л/аІІо\л/ Маїиге 1996;379:295).
Функції епіфіза
Мелатонін, уведений парентеральним шляхом, дещо
впливає на гонади, проте ці впливи значно відрізняються
залежно від біологічного виду, а також залежать від часу,
коли зроблено ін’єкцію. В деяких ситуаціях мелатонін
пригнічує функцію гонад, а в інших - посилює. Зазначена
відмінність привела до припущення, що річ не в самому
мелатоніні, а власне у добових коливаннях його секреції.
Це може бути правильним, особливо щодо тварин із сезон-
ною циклічністю розмноження, які реагують на зміни три-
валості доби. Однак регулювання яких саме процесів від-
бувається за допомогою цієї системи у людей, наразі не
відомо.
Суперечним є питання про те, чи шишкоподібна залоза
пригнічує початок статевого дозрівання у людини, оскільки
пухлини епіфіза деколи супроводжуються передчасним
статевим дозріванням. Проте, як зазначено в Розділі 23,
пухлини епіфіза призводять до передчасного статевого
дозрівання лише тоді, коли вони вражають гіпоталамус.
Нічна концентрація мелатоніну в плазмі крові у дітей
значно вища, ніж у дорослих, і з віком вона знижується. У
дітей віком один-три роки середня концентрація мелато-
ніну в плазмі крові становить 250 пг/мл (1080 пмоль/л); у
підлітків 8-15 років - у середньому 120; у молодих людей
20-27 років - 70; у старечих осіб віком 67-84 років - у
середньому 30 пг/мл (рис. 24-13). Як бачимо, це зниження
відбувається поступово упродовж усього життя, без різких
змін у період статевого дозрівання; денна концентрація
мелатоніну в плазмі крові у всіх вікових категорій стано-
вить близько 7 пг/мл. Отже, функції шишкоподібної залози
і мелатоніну у людини ще до кінця не з’ясовані.
ЛІТЕРАТУРА ДО ЧАСТИНИ IV: ЕНДОКРИННА СИСТЕМА, МЕТАБОЛІЗМ
І РЕПРОДУКТИВНА ФУНКЦІЯ
АсіазЬі Е¥, НеппеЬоІсі 50: 8іп§1е §епе тиіабопз ге8ийіп§ іп
гергосіисііуе (ЗузЕипсііоп іп \уотеп. N Еп§1 3 Месі 1999;
340:709.
Апсіегззоп К, \¥а§пег 6: РЬузіо1о§у оГрепііе егесгіоп. РЬузіоІ
Кєу 1995;75:191.
Ва§аіе11СЗ, Вгетпег \¥3: Апсіго^епз іп теп: Пзез апсі аЬизез.
N Еп£І 3 Месі 1996;334:707.
Ваитапп 6: СґохуіЬ Ьогтопе Ьіпсііп§ ргоіеіпз. Ргос 8ос
Ехрег Віоі Месі 1993;202:392.
Віїехікіап ЗР, Каізх Е6, Косіап 6А: Ргіпсіріез о/Вопе Віоі-
о§у. Асасіетіс Ргезз, 1996.
Воіе-Ееузоі С еі аі: Ргоіасбп (РКЕ) апсі Ьз гесеріог: Асбопз,
8І§па1 Ігапзсіисиоп раіЬхуауз, апсі рЬепоіурез оЬзегуесі іп
РКЬ гесеріог кпоскоиі тісе. Епсіосг Кєу 1998; 19:225.
Воиіііоп К: ТЬе тапу іасез оҐгіскеіз. N Еп§і 3 Месі 1998;338:
681.
Вгауегтап ЕЕ, ІЛі§ег КО (есійогз): їУегпег апсі ІпуЬаг Тке
Ткугоісі: А Рипсіапгепіаі апсі Сііпісаі Техі, 7іЬ есі. Ьірріп-
соП-Кауеп, 1996.
Вгхе/іпзкі А: Меіаіопіп іп Ьитапз. N Еп§1 3 Месі 1997;336:
186.
Согуоі Р, Зеипетайге X: Моїесиїаг §епебсз оЕЬитап Ьурег-
їепзіоп: Коїе оГап§іоіепзіпо§еп. Епсіосг Кєу 1997; 18: 662.
Оіах МИ еі аі: Апбохісіапіз апсі аїЬегозсІегоІіс Ьеагі сіізеазе.
N Еп§1 3 Месі 1997;337:408.
Оиппе МІ, Аупзіеу-Огееп А, ЕіпсПеу КІ: КаШге’з КАТР-
сЬаппеІ кпоскоиі. Хє\уз РЬузіоІ 8сі 1997; 12:197.
О\ууег ЗТ: Миітйіопаї сопзециепсез оЕ уе^еіагіапізт. Аппи
КеуИиіг 1991;11:61.
Еазіеіі К: Ош§ (Ьегару: Тгеаітепі оГ розітепораизаі озіе-
орогозіз. N Еп§1 3 Месі 1998;338:736.
Еізап ЬЗ, Ьоп§о М: біисозе ігапзрогіегз. Аппи Кєу Месі
1992;43:377.
Еаїкпег Е, Таппег ЗМ (есійогз): Нитап Огоууік, 2псі есі. З уоіз.
Ріепит, 1986.
ЕізЬег 3\¥: ЕгуіЬгороіеОп: РЬузіо1о§іс апсі рЬагтасо1о§іс
азресіз. Ргос 8ос Ехрег Віоі Месі 1997;216:358.
Егапсотапо СА: Сііпісаі ітрІісаОопз оЕЬазіс гезеагсЬ: ТЬе
£епебс Ьазіз оЕсЬуагїїзт. N Еп§1 3 Месі 1995;332:58.
Егахуіеу Ь8, ВооскГог ЕК: Маттозотаіоігорез: Ргезепсе апсі
ГипсОоцз іп погтаї апсі пеоріазііс ріШйагу їіззие. Епсіосг
Кєу 1991;12:337.
ЕНДОКРИННА ФУНКЦІЯ НИРОК, СЕРЦЯ ТА ЕПІФІЗА / 427
ЕгоЬтап ЬА, Оохупз ТК, СЬотсхупзкі Р: Ке§и1аїіоп оЕ
£ГО\уФ Ьогтопе зесгеііоп. Егопі Иеигоепсіосгіпої
1992; 13: 344.
СеЬІегї ОК: Микіріе гесеріогз Еог Фе рапсгеаНс роїуреріісіе
(РР-ЕоІсі) Еатіїу: рЬузіо1о§іса1 ітріісаіїопз. Ргос 8ос Ехрег
Віоі Месі 1998:218:7.
СегісЬ ЗЕ: Огаї Ьуро£Іусетіс а§етз. N Еп§і 3 Месі 1989;
321:1231.
СоосіЕгіепсі ТЕ, ЕПіоП МЕ, СаП КЗ: Ап§іоіепзіп гесеріогз
апсі ТЬеіг апіа^опізіз. N Еп§1 3 Месі 1996;334:1649.
НаскепФаІ Е еі аі: МогрЬоІо^у, рЬузіоІо^у апсі тоїесиїаг
Ьіо1о£у оЕгепіп зссгеПоп. РЬузіоІ Кєу 1990;70:1067.
Неапіп^ УЗ, ТзикатаФ К: Епхутаїіс сопігої оЕ рі§тепіа-
ііоп іп таттаїз. ЕА8ЕВ 3 1991 ;5:2902.
Ніттз-На^еп 3: Иеигаї сопігої оЕЬгохуп асііро8е їіззие Фег-
то£епе8і8, ЬурегІгорЬу, апсі аІгорЬу. Егот Кеигоепсіо-
сгіпої 1991; 12:38.
Нги8ка КА, ТеіІеІЬаит 8Ь: Кепаї озІеосіузІторЬу. N Еп§1 З
Месі 1995;333:166.
Іпа§аті Т: А тетогіаі Іо КоЬегІ Тіе§егзіесЬ: ТЬе сепіеппіаі
оЕ гепіп Фзсоуегу. Нурегїепзіоп 1998;32:953.
Кіт 8, І\уао Н: Моїесиїаг апсі сеііиіаг тесЬапізтз оЕап§і-
оіепзіп Іі-тесіїаіесі сагфоуазсиїаг апсі гепаї (ЗІ8еа8Є8.
РЬаппасоІ Кєу 2000;52:11.
КпоЬіІ Е, \еі11 ЗО (есФогз): Тке Ркушоїоуу о]Еергосіисііоп,
2псі есі. 2 уоі8. Кауеп Рге88, 1994.
Кпорр КН: Оги§ Ігеаітет оЕІірісі Фзогсіегз. N Еп§1 3 Месі
1999;341:498.
Котегз К, Угапа А: ТЬіахоїісііпесііопез - іооіз Еог Фе ге-
зеагсЬ оЕтеіаЬоІіс 8упсіготеХ. РЬузюІ Кез 1998;47:215.
Киірег ССЗМ є! аі: ТЬе езіго^еп гесеріог (3: а поуєі теФ-
аіог оЕ е8Іго§еп асііоп іп пеигоепсіосгіпе зузіетз. Егот
№игоепсіосгіпо1 1998; 19:253.
Еасу РЕ: Тгеаііп§ ФаЬеІез \уіФ Ігапзріатесі сеііз. 8сі Ат
(Зиіу) 1995;273:50.
Ьахаг МА: Песет рго§гезз іп ипсіегзіапсііп^ іЬугоісі Ьогтопе
асііоп. ТЬугоісі Тосіау 1997 (Осі);20:1.
Ьее ММ, ОопаЬие РК: Миііегіап іпЬФЬіп§ зиЬзіапсе: А
£опасіа1 Ьогтопе \уіФ тиКірІе Еипсііопз. Епсіосг Кєу
1993;14:152.
ЬеКоіФ О: Іпзиііп-Ііке §го\уФ Еасіогз. N Еп§1 3 Месі 1997;
336:633.
ЬеКоіФ О, ОІеЕзку ЗМ, Тауіог 81 (есііі:ог8): ЕіаЬеіех Меі-
ІЇШ8. ЕірріпсоК-Кауеп, 1996.
Ьєуіп ЕР, Сагсіпег ОС, 8ат8оп ХУК: №ігіигеііс рерїісіез. N
Еп§1 3 Месі 1998;339.
Мааск Т: Кесеріогз Еог аігіаі паїгіигейс Еасіог. Аппи Кєу
РЬузіоІ 1992;54:11.
Магсиз К, НоЕЕшап АР.: СгохуФ Ьогтопе аз ігеаїтет іп оісіег
теп апсі \уотеп. Аппи Кєу РЬаппасоІ Тохісої 1998;38:45.
Магїіп З В, КеісЬІіп 8: Сііпісаі №игоепсІосгіпоІо§у, 2псі есі.
Оауіз, 1987.
МаФег ЗР, Мооге А, Ьі К-Н: Асііуіпз, тЬіЬіпз, апсі Еоіііз-
іаііпз: ЕигФег Фои^Ьіз оп а §го\уіп§ Еатіїу оЕге§и1аіогз.
Ргос 8ос Ехрег Віоі Месі 1997;215:209.
Месіеіго8-\е1:о С: Сііпісаі апсі тоїесиїаг асіуапсез іп іпЬег-
ііесі Фзогсіегз оЕ Фе Фугоісі зузіет. ТЬугоісі Тосіау 1996
(Зиіу); 19:1.
Меїтесі 8 (есШог): Тке Ріішіагу. В1аск\уе11, 1994.
МепсіеїзоЬп МЕ, Кауаз КН: ТЬе ргоіесііуе еЕГесіз оЕезіго§еп
оп Фе сагфоуазсиїаг зузіет. N Еп§13 Месі 1999;340:1801.
Мопеу 3: Тке Казраг Наизег Еупсікоте о( “Рзускохосіаі
[)\\'аг]і^т Ое/їсіепі Вігисіигаї, Іпіеііесіиаі, апсі 8осіаІ
Сго\\'1к Іпсіисесі Ьу СкіШ АЬизе. РготеФіиз Воокз, 1994.
Мооге ССО, СгитЬасЬ ММ: 8ех сіеіегтіпаііоп апсі §о-пасіо-
§епезіз: А ігапзсгірііоп сазсасіе оЕ зех сЬготозоте апсі
аиіозоте §епе8. 8етіп РегіпаЮІ 1992; 16:226.
Иах КК (есіііог): Епсіосгіпе Оіхгиріогз. СКС Ргезз, 1998.
Кеїзоп КЗ: Векачіогаї Епсіосгіпоіору. 8іпаиег, 1994.
Коілуііх ЕР, КоЬіпзоп 314, СЬаІІіз ЗК.С: ТЬе сопігої оЕІаЬог.
N Еп§1 3 Месі 1999;341:660.
РЬіІірзоп ЬН, 8іеіпег ОН: Раз сіє сіеих ог тоге: ТЬе зиІЕо-
пуіигеа гесеріог апсі К' сЬаппеїз. 8сіепсе 1995;268: 372.
Ріапі ТМ, Еее РА (есііїогз): Тке МеигоЬіоІору р/ РиЬегіу.
8осіеіу Еог Епсіосгіпо1о§у, 1995.
Ргоскор О: Миіаііопз іп со!1а§еп §епез аз а саизе оЕсоппес-
ііує ііззие сіізеазе. N Еп§1 3 Месі 1992;326:540.
КеЕеіоЕЕ8, ХУеізз КЕ, ІЗзаІа 83: ТЬе зупсіготез оЕгезізіапсе
іо Фугоісі Ьогтопе. Епсіосг Кєу 1993; 14:348.
Кеізіпе Т, Веіі СІ: Моїесиїаг Ьіо1о§у оЕзотаїозіаНп гесеріогз.
Епсіосг Кєу 1995; 16:427.
КоіЕе ОЕ8, Вго\уп СС: Сеііиіаг епег§у иііІігаПоп апсі то-
Іесиїаг огі§іп оЕзіапсіагсі теіаЬоІіс гаіе. РЬузіоІ Кєу 1997;
77:731.
КозепЬаит М, ЬеіЬеІ КЕ, НігзсЬ 3: ОЬезЬу. N Еп§1 3 Месі
1997;337:396.
8сЬ\уагІ2 К8: ТЬе пе\у іттипо1о§у - Фе епсі оЕ іттипозир-
ргеззіуе сіги§ Фегару? N Еп§1 3 Месі 1999;341:754.
8Ьі1з МЕ, ¥оип§ УК (есФогз): Мосіегп ІТиігіІіоп іп Неаіік
апсі Еізеазе, 7Ф есі. Ееа & РеЬі§ег, 1987.
8іоссо ОМ: А гєуієху оЕФе сЬагасіегізіісз оЕ Фе ргоіеіп ге-
диігесі Еог Фе асиїе ге§и1аііоп оЕ зіегоід Ьогтопе Ьіозуп-
Фезіз: Фе сазе Еог Фе зіегоісіо^епіс асиіе ге^иіаіогу (8іАК)
ргоіеіп. Ргос 8ос Ехр Віоі Месі 1998;217:123.
8їге\у1ег СЕ: ТЬе рЬузюІо^у оЕрагаФугоісі Ьогтопе-геїаіесі
ргоїеіп. N Еп§1 3 Месі 2000;342:177.
8іги§пе11 8А, Оеіиса НЕ: ТЬе уііатіп О гесеріог-зітсШге
апсі ІгапзсгірНопаї асіїуаііоп. Ргос 8ос Ехрег Віоі Месі
1997;215:223.
Тгіетап К еі аі: ШО8: Ап ирсіаїе. Рориї Кер В 1995;6:1.
Уеепзіга ТО, РФІеікоху МК, Китаг К: Ке§и1аііоп оЕсеііиіаг
£го\уф Ьу 1,25-ФЬусігоху уііатіп ОЗ-теФаІесі §го\уф
Еасіог ехргеззіоп. Кєхуз РЬузіоІ 8сі 1999; 14:37.
Уоіре К: АиіоіттипеЕпсіосгіпораікіез. Нитапа Ргезз, 1999.
ХУаІкег \¥Н еі аі: ТЬе Ьитап ріасетаї 1асіо§еп §епез: 8ігис-
Шге, ЕипсОоп, еуоїтіоп, апсі ІгапзсгірПопаІ ге§и1аііоп.
Епсіосг Кєу 1991; 12:316.
\¥аіегтап МК, ВізсЬоЕЕЗ: Оіуегзііу оЕ АСТН (сАМР)-сіе-
репсіет ігапзсгірііоп оЕЬоуіпє зіегоісі Ьусігохуіазе §епез.
ЕА8ЕВ З 1997;11:419.
\УеЬ1іп§ М: 8ресіГіс, поп§епотіс асііопз оЕзіегоісі Ьогтопез.
Аппи Кєу РЬузіоІ 1997;59:365.
ХУеіпег 8, ТгаиЬе XV: Вопе зігисШге: Егот ап§зіготз Іо ті-
сгопз. ЕА8ЕВ З 1992;6:879.
ХУеіпігаиЬ ВО (есіког): Моїесиїаг Епсіосгіпоіо^у. Кауеп
Ргезз, 1994.
ХУеізз С: ТЬе рЬузіоІо^у оЕ Ьитап геіахіп. СопігіЬ Супесої
ОЬзІеІ 1991; 18:130.
428 / РОЗДІЛ 24
\¥е!сН ОМ: МесЬапізтз оГс1І8еа8е: Нотосузіеіпе апд аіИего-
±готЬо8І8. N Еп§1 3 Мед 1998;4338:1042.
\¥Ьке РС: ОІ80гдег8 оГ аідозіегопе Ьіо8упдіЄ8І8 апд асдоп.
N Еп§1 3 Мед 1994;331:250.
ХУіІІек \¥С: Оіеі апд кеаїйі: \УИаі 8Ііои1д \ує еаі? 8сіепсе
1994;264:532.
ХУіІІеК \¥С, Оіеіх \¥Н, Соїдіїх СгА: Оиіде1іпе8 Гог ЬеакЬу
\уеі§М. N Еп§11 Мед 1999;341:427.
\УіІ80п ЗО еі аі (едііогз): Мііііатз ТехіЬоок о/ Епсіосгіпоіоуу,
901 ед. 8аипдег8, 1998.
\¥ІІ8ОП ТО, бгіГГіп ЗЕ, Ки88е11 XV: Зіегоід 5а-гедисіа8е 2 деГі-
сіепсу. Епдосг Кеу 1993; 14:577.
Уапазе Т, Зітрзоп ЕК, ХУаіегтап МК: 170-НудгохуІазе/
17,20-Іуазе дейсіепсу: Ргот сііпісаі Іпуе8д§а1іоп Ю то-
Іесиїаг деГіпкіоп. Епдосг Кеу 1991; 12:91.
¥еп, 88С, Зайе КВ, ВагЬіегі КЬ: Кергосіисііче Епс1осгіпо1о§у:
Ркузіоіо^у, Раікоркузіоіо^у, апсі Сііпісаі Мапауетепі,
401 ед. 8аипдег8, 1999.
Частина V
Функції травної системи
Травлення та всмоктування
25
ВСТУП
До травної системи належать органи, через які харчові
речовини, вітаміни, мінерали та рідини надходять в орга-
нізм. Білки, жири і складні вуглеводи розпадаються до най-
простіших елементів (травлення), які всмоктуються голов-
но в тонкій кишці. Продукти травлення та вітаміни, міне-
рали, вода проходять через слизову оболонку і потрапляють
у лімфу або кров (всмоктування). У цьому розділі розгля-
нуто процеси травлення та всмоктування. Деталі функцій
різноманітних частин травного тракту описано у Розділі 26.
Травлення головних продуктів харчування - це процес,
у якому бере участь значна кількість травних ензимів
(табл. 25-1). Ензими, що їх виділяють секрети слинних і
язикових залоз, стимулюють розпад вуглеводів і жирів;
ензими шлункового соку - білків і жирів, а ензими екзо-
кринної секреції підшлункової залози - вуглеводів, білків,
ліпідів, ДНК та РНК. Інші ензими, що повністю завершу-
ють процес травлення, містяться на люмінальних мембра-
нах і в цитоплазмі клітин, що вистилають тонку кишку.
Впливу цих ензимів допомагає хлористоводнева кислота,
яку секретує шлунок, та жовч, яку секретує печінка.
Слизові клітини тонкої кишки називають ентероцита-
ми. В тонкій кишці вони мають щіточкову облямівку, утво-
рену з численних мікроворсинок, що вистилають їхню
апікальну поверхню (див. рис. 26-27). Ця облямівка багата
на ензими. Вона продовжується у люмінальну сторону глі-
кокаліксом - спеціальним шаром, що багатий на нейтральні
й аміноцукри. Мембрани слизових клітин вміщують
глікопротеїнові ензими, які гідролізують вуглеводи і пептиди.
Глікокалікс частково утворений вуглеводним сегментом,
який проходить у кишковий просвіт. Наступним після
щіточкової облямівки і глікокаліксу є нерухомий шар, по-
дібний до таких шарів усіх біологічних мембран (див. Роз-
діл 1). Розчинені речовини повинні дифундувати через цей
шар для проникнення у слизові клітини. Слизова плівка, що
вкриває клітини, також утворює певний бар’єр для дифузії.
Речовини переходять з просвіту шлунково-кишкового
тракту до інтерстиційної рідини, а звідти - у лімфу та кров
шляхом дифузії, полегшеної дифузії, осмосу, активного,
вторинного транспортування та ендоцитозу. Більшість
речовин повинні переміститися з кишкового просвіту у
клітини слизової (ентероцити), а вже потім - від ентеро-
цитів до інтерстиційної рідини. Процеси, відповідальні за
рух через люмінальні клітинні мембрани, часто відмінні
від тих, що забезпечують рух через базальні та латеральні
клітинні мембрани до інтерстиційної рідини. Динаміка
транспортування у різних частинах організму описана у
Розділі 1.
ВУГЛЕВОДИ
Травлення
Головними харчовими вуглеводами є полісахариди,
дисахариди та моносахариди. Крохмаль (полімер глюкози)
та інші похідні - це єдині полісахариди, що перетрав-
люються до будь-якого ступеня в травному тракті людини.
В глікогені більшість молекул глюкози мають лінійні довгі
ланцюги (молекули глюкози, об’єднані 1,4-а глікозидними
зв’язками), хоча інколи бувають і розгалужені ланцюги
(сформовані завдяки 1,6-а-зв’язкам; див. рис. 17-12). Амі-
лопектин, який становить 80-90% харчового крохмалю, є
нерозгалуженим полісахаридом, тоді як амілоза - ліній-
ний полісахарид, у якому мономери сполучені прямим
ланцюгом, має винятково 1,4-а-зв’язки. Глікоген міститься
в тварин, тоді як амілоза й амілопектин - рослинного
походження. Дисахариди лактоза (молочний цукор) і
сахароза (головний компонент харчового цукру, найпоши-
реніший у природі) теж перетравлюються до моносаха-
ридів фруктози і глюкози.
У ротовій порожнині крохмаль взаємодіє з а-амілазою
слини. Оптимальне рН для дії цього ензиму - 6,7, отже,
його активність гальмує кисле рН шлункового соку, коли
їжа потрапляє до шлунка. В тонкій кишці обидві а-амілази
(як слинна, так і панкреатична) діють на поглинуті полі-
сахариди. Ці ос-амілази гідролізують 1,4-а-зв’язки, однак
зберігають і 1,6-а-зв’язки, кінцеві 1,4-а- і наступні до місця
розгалуження 1,4-а. Кінцевим продуктом травлення а-
амілазою є олігосахариди: дисахарид мальтоза, трисаха-
рид мальтотріоза, деякі легкі великі полімери з глюкозою
в 1,4-а-зв’язку, а-декстрини - полімери глюкози із роз-
галуженою будовою, що містять у нормі понад вісім моле-
кул глюкози, основний тип зв’язку - 1,6-а глікозидний (рис.
25-1).
Олігосахариди, відповідальні за майбутнє травлення
похідних крохмалю, містяться на зовнішній ділянці щіточ-
кової облямівки - мембрані з мікроворсинками тонкої
430 / РОЗДІЛ 25
Таблиця 25-1. Головні травні ензими. Відповідні проензими наведені в круглих дужках
Джерело Ензим Активатор Субстрат Каталітична функція або продукт
Слинні залози Слинна а-амілаза СГ Крохмаль Гідроліз 1,4-а-зв’язків, продукування а-лімі- тованих декстринів, мальтотріози і мальтози
Язикові залози Лінгвальна ліпаза Тригліцериди Жирні кислоти плюс 1,2-діацилгліцерол
Шлунок Пепсини (пепсиногени) неї Білки і поліпептиди Роз’єднання пептидних зв’язків, суміжних до ароматичних амінокислот
Шлункова ліпаза Тригліцериди Жирні кислоти і гліцерол
Підшлункова залоза, екзокринний відділ Трипсин Ентеро- пепти- даза Білки і поліпептиди Роз’єднання пептидних зв’язків на карбо- ксильній стороні основних амінокислот (аргінін або лізин)
Хімотрипсин (хімотрипсиноген) Трипсин Білки і поліпептиди Роз’єднання пептидних зв’язків на карбо- ксильній стороні ароматичних амінокислот
Еластаза (проеластаза) Трипсин Еластин, деякі інші протеїни Роз’єднання зв’язків на карбоксильній стороні аліфатичних амінокислот
Карбоксипептидаза А (прокарбоксипептидаза А) Трипсин Білки і поліпептиди Роз’єднання карбоксильних кінцевих амінокислот, що мають ароматичні або розгалужені аліфатичні сторони ланцюгів
Карбоксипептидаза В (прокарбоксипептидаза В) Трипсин Білки і поліпептиди Роз’єднання карбоксильних кінцевих аміно- кислот, що мають основну сторону ланцюгів
Коліпаза (проколіпаза) Трипсин Крапельки жирів Сприяє реалізуванню дії активних сайтів панкреатичної ліпази
Панкреатична ліпаза Тригліцериди Моногліцериди і жирні кислоти
Холестеролестер гідролаза Ефіри холестеролу Холестерол
Панкреатична а-амілаза СГ Крохмаль Так само, як слинна а-амілаза
Рибонуклеаза РНК Нуклеотиди
Дезоксирибонуклеаза ДНК Нуклеотиди
Фосфоліпаза А2 (профосфоліпаза А2) Трипсин Фосфоліпіди Жирні кислоти, лізофосфоліпіди
Слизова оболонка кишки Ентеропептидаза Трипсиноген Трипсин
Амінопептидаза Поліпептиди Відщеплення амінокислот з амінокінців пептидів
Карбоксипептидаза Поліпептиди Відщеплення амінокислот з карбоксидних кінців пептидів
Ендопептидази Поліпептиди Роз’єднання між залишками всередині пептиду
Дипептидази Дипептиди Дві амінокислоти
Мальтаза Мальтоза, мальтотріоза, а-декстрини Глюкоза
Лактаза Лактоза Галактоза і глюкоза
Сахараза1 Сахароза, також мальтотріоза і мальтоза Фруктоза і глюкоза
а-Декстриназа а-Декстрини, мальтоза, мальтотріоза Глюкоза
Трегалаза Нуклеаза і споріднені ензими Трегалоза Нуклеїнові амінокислоти Глюкоза Пентози і пуринові та піримідинові основи
Цитоплазма слизових клітин Різноманітні пептидази Ди-, три- і тет- рапептидази Амінокислоти
1 Сахараза і а-декстриназа є від’єднаними субодиницями від окремого білка.
ТРАВЛЕННЯ ТА ВСМОКТУВАННЯ / 431
сс-Декстрин
Рис. 25-1. Головні кінцеві продукти травлення вуглеводів у
просвіті кишки. Кожне коло зображує молекулу гексози; Г -
глюкоза; Ф - фруктоза; Га - галактоза.
кишки (рис. 25-2). Деякі з цих ензимів мають понад один
субстрат. Ензим а-декстриназа, який також відомий як
ізомальтаза, головно відповідальний за гідроліз 1,6-ос-
зв’язків.
Разом з мальтазою і сахаразою ензими також розчеп-
люють мальтотріозу та мальтозу. Сахараза та ос-декстри-
наза, первісно синтезовані як окремий глікопротеїновий
ланцюг, долучаються до мембранного краю щіточкової
облямівки. Потім панкреатичні протеази його гідролізують
до субодиниць сахарази та ізомальтази, які нековалентно
реасоціюють до поверхні кишки.
Сахараза також гідролізує сахарозу в молекули глюкози
і фруктози. Додатково в щіточковій облямівці є два диса-
хариди: лактаза, яка гідролізує лактозу до глюкози та
галактози, і трегалаза, яка гідролізує тригалозу - 1,1 -ос-
ланцюговий димер глюкози - до двох молекул глюкози.
Дефіцит одного або більше олігосахаридів щіточкової
облямівки може спричинювати діарею, здуття та метео-
ризм після вживання солодощів. Діарея зумовлена збіль-
шенням кількості осмотично активних молекул олігосаха-
ридів, що залишаються в просвіті кишки, сприяючи збіль-
шенню об’єму інтерстинального вмісту. В ободовій кишці
бактерії розщеплюють деякі олігосахариди, у подальшому
збільшуючи кількість осмотично активних частинок. Про-
цеси гниття та бродіння в дистальній частині тонкої і товс-
тої кишки, відповідно, продукують гази (СО2 і НД із залиш-
ків дисахаридів.
Інтерес до лактази зумовлений тим, що у більшості ссав-
ців і в багатьох расах людей активність кишкової лактази
висока під час народження, а потім знижується в дитячому
та дорослому віці. Низький рівень лактази асоціюється з
несприйняттям молока (несприйняття лактози). Біль-
шість європейців та їхні американські потомки зберігають
активність інтестинальної лактази в зрілі роки. Випадки
дефіциту лактази для північних та західних європейців
становлять 15%, однак для афроамериканців та амери-
канських індіанців, орієнтальців та середземноморської
популяції - 70-100%. Проблему несприйняття молока
можна частково вирішити за допомогою комерційних пре-
паратів лактази, проте це дорого. Особи з непереносимістю
ліпше сприймають йогурти, ніж молоко завдяки безпосе-
редньому вмісту власної бактеріальної лактази.
Абсорбція
Гексози і пентози швидко всмоктуються через стінку
тонкої кишки (табл. 25-2). По суті, виведення всіх гектоз
відбувається вздовж термінальної частини клубової кишки.
Молекули цукрів проходять через клітини слизової і
потрапляють у кровоносні капіляри, а потім - до пор-
тальної вени.
Порожнинне травлення Мембранне травлення Продукт
сс-Декстриназа Мальтаза Цукраза
Амілаза
Рис. 25-2. Специфічні субстрати для ензимів, що беруть участь у травленні вуглеводів, та гексози як кінцеві продукти травлення.
Числа - відсотковий вміст кожного розщепленого субстрату відповідним ензимом. Зверніть увагу, що трегалаза, лактаза і
цукраза - це єдині ензими, що відповідають за розщеплення трегалози, лактози, цукрози, однак а-декстрини, мальтотріоза і
мальтоза - субстрати для декількох ензимів (відтворено за дозволом з иоїіпвоп ЬЕ [есіііог]: Еввепііаі МесІісаІ Рїіувіоіоду,
Еауеп, 1992)
432 / РОЗДІЛ 25
Транспортування більшості гексоз унікальне і відбу-
вається за участю що міститься в кишковому просвіті.
Висока концентрація №* у поверхні слизової полегшує, а
низька - пригнічує надходження цукрів до епітеліальних
клітин. Це трапляється тому, що глюкоза і №* беруть
участь у котранспортуванні, або симпорті, тобто нат-
рійзалежному транспортуванні глюкози (8СгЕГ - від
англ. зобіит-сіерепсіепі: §1исо8Є ігапзроіїег). Члени цієї
родини транспортерів 86ЕТ 1 і 8СгЕГ 2, подібно до транс-
портерів глюкози, відповідають за полегшену дифузію
(див. Розділ 19), пронизують клітинну мембрану 12 разів
і розміщують свої -СООН і -МН2-кінці на цитоплазма-
тичній стороні мембрани. Крім того, вони негомологічні
до серії ОЕЕТ-транспортерів. 8СгЕГ 1 і 8ОЕГ 2 також від-
повідають за транспортування глюкози з ниркових каналь-
ців (див. Розділ 38).
Якщо внутрішньоклітинна концентрація стає низь-
кою в ентероцитах, як і в інших клітинах, то Иа+ рухається
за концентраційним градієнтом. Глюкоза надходить разом
з №' і вивільнюється у клітину (рис. 25-3). Йони Иа+ пере-
ходять у бічні міжклітинні простори, а глюкоза за допо-
могою СЕЕІТ 2 - до інтерстиційного простору, а звідти -
до капілярів.
Отже, транспортування глюкози є прикладом вторин-
ного активного транспортування (див. Розділ 1). Енерге-
тичне забезпечення транспортування глюкози відбувається
безпосередньо за допомогою активного транспортування
з клітини. Це підтримує концентраційний Градієнт
уздовж люмінального краю клітини: більше Ка+ і, відпо-
відно, більше глюкози може увійти до неї. Наслідком
успадкованої вади Ка+/глюкози котранспортера є розви-
ток синдрому малабсорбції глюкози/галактози, що спри-
чинює важку діарею, яка часто є фатальною, якщо глю-
козу і галактозу не вилучити з раціону харчування. Вжи-
вання глюкози та її полімерів утримує №* і зумовлює про-
яви діареї, що описані нижче.
Транспортування галактози також відбувається за допо-
могою глюкози. Фруктоза утилізується за іншим механіз-
мом. Її реабсорбція не залежить від або транспорту-
вання глюкози чи галактози; це відбувається завдяки полег-
шеній дифузії: з просвіту кишки до ентероцитів за допо-
могою СгЕЕІТ 5 і в зворотному напрямі - за допомогою
6ЕЕГГ 2. Деяка кількість фруктози перетворюється в глю-
козу в слизових клітинах. Пентози всмоктуються шляхом
простої дифузії.
Інсулін незначно впливає на транспортування цукрів у
кишці. З цього погляду інтестинальна абсорбція у кишці
подібна до реабсорбції глюкози в проксимальних звивис-
тих канальцях у нирках (див. Розділ 38), не потребує фосфо-
рилювання і обидва процеси простежуються у разі цукро-
вого діабету (гальмує лікарський засіб флоризин). Макси-
мальний рівень всмоктування глюкози в кишці становить
120 г/год.
БІЛКИ Й АМІНОКИСЛОТИ
Травлення білків
Травлення білків розпочинається в шлунку, де пепсини
розщеплюють деякі з пептидних зв’язків. Подібно до
багатьох інших ензимів, причетних до травлення, пепсини
секретуються у формі неактивних попередників (проен-
зимів) і активуються в шлунково-кишковому тракті. Попе-
редники пепсинів називають пепсиногенами, їх активує
хлористоводнева кислота, яку виробляє шлунок. Слизова
оболонка шлунка людини містить певну кількість спо-
ріднених пепсиногенів, які можна розділити на дві відмінні
групи за гістохімічними ознаками: пепсиноген І та пепси-
ноген II. Пепсиноген І міститься тільки в кислотосекрету-
вальних ділянках, тоді як пепсиноген II - також ще й у
пілоричній ділянці. Максимальна секреція кислоти коре-
лює відповідно до рівня пепсиногену І.
Таблиця 25-2. Транспортування речовин у нормі та місця максимальної абсорбції або секреції1
Всмоктування Відділи тонкої кишки Ободова кишка
проксимальні2 середні дистальні
Цукри (глюкоза, галактоза та інші) ++ +++ ++ 0
Амінокислоти ++ +++ ++ 0
Водо- та жиророзчинні вітаміни, за винятком В12 +++ ++ 0 0
Бетаїн, диметилгліцин, саркозин + ++ ++ ?
Антитіла у новонароджених + ++ +++ ?
Піримідини (тимін та урацил) + + ? ?
Абсорбція жирних кислот з довгими ланцюгами та +++ ++ + 0
перетворення у тригліцериди
Жовчні солі + + +++
Вітамін В12 0 + +++ 0
Ма+ +++ + + +++ +++
К+ + + + Сек
Са2+ +++ ++ + ?
Ре2+ +++ ++ + ?
сі- +++ ++ + +
8О42- ++ + 0 ?
1 Рівень абсорбції позначено від + до +++. Сек - секретується, якщо К+ у просвіті кишки є низьким.
2 До проксимальних частин тонкої кишки належить голодна та дванадцятипала кишка (крім зауваженого винятку, коли
дванадцятипала кишка секретує НСО3 і має незначну кінцеву абсорбцію або секрецію МаСІ).
ТРАВЛЕННЯ ТА ВСМОКТУВАННЯ / 433
Рис. 25-3. Механізм транспортування глюкози через кишковий
епітелій. Транспортування глюкози до ентероцитів поєднане
з транспортуванням Ма+ і використанням котранспортера
86ЬТ 1. Потім Ма+ активно переходить з клітини, і глюкоза
потрапляє в інтерстиційний простір шляхом полегшеної ди-
фузії через СШТ 2, а звідси згодом дифундує у кров.
Пепсини гідролізують зв’язки між ароматичними аміно-
кислотами, такими як фенілаланін або тирозин, та іншою
амінокислотою, отже, продуктами пептичного травлення
є поліпептиди різноманітних розмірів. У шлунку також міс-
титься желатиназа, яка перетворює в рідкий стан жела-
тин. Хімозин - шлунковий ензим, що спричинює зсідання
молока, відомий також як ренін - міститься в шлунку моло-
дих тварин; інколи його немає у людей.
Оскільки пепсини оптимально активні при рН 1,6-3,2,
то їхня дія завершується, коли шлунковий вміст змішується
з лужним панкреатичним соком у дванадцятипалій та
голодній кишці. Значення рН кишкового вмісту в цибулині
дванадцятипалої кишки 2,0-4,0, проте в інших частинах -
близько 6,5.
У тонкій кишці поліпептиди, що утворились під час
протеолізу в шлунку, перетравлюються за допомогою висо-
коактивних протеолітичних ензимів підшлункової залози
та слизової оболонки кишки. Трипсин, хемотрипсин, елас-
таза гідролізують внутрішні пептидні зв’язки в пептидних
молекулах, тому їх називають ендопептидазами. Утворен-
ня активних ендопептидаз з їхніх неактивних попередників
описано у Розділі 26. Карбоксипептидази підшлункової
залози - це екзопептидази, які гідролізують амінокислоти
в карбоксильних та амінокінцевих групах поліпептидів.
Деякі вільні амінокислоти вивільняються у кишковий
просвіт, тоді як інші - у вільному стані на поверхню клітин
після попереднього розщеплення амінопептидазами, кар-
боксипептидазами, ендопептидазами та дипептидазами
щіточкової облямівки слизових клітин. Деякі ди- та трипеп-
тиди активно переходять до кишкових клітин, їхні внутріш-
ньоклітинні пептидази гідролізують до амінокислот, які
згодом потрапляють до кров’яного русла. Отже, остаточне
травлення білків до амінокислот відбувається в трьох міс-
цях: кишковому просвіті, щіточковій облямівці та цито-
плазмі слизових клітин.
Всмоктування
В ентероцитах є сім відмінних транспортних систем для
переміщення амінокислот. П’ять з них потребують наяв-
ності йонів крім того, котранспорт амінокислот і №4
відбувається подібно до котранспорту №' і глюкози (див.
рис. 25-3). Дві транспортні системи також потребують СІ .
У двох системах транспортування залежить від №+.
Ди- та трипептиди переходять до ентероцитів систе-
мою, що потребує Н+ замість на №4. Це так зване мале
всмоктування великих пептидів. В ентероцитах амінокис-
лоти вивільняються з пептидів шляхом внутрішньоклітин-
ного гідролізу, крім того, амінокислоти, що всмоктуються
з кишкового просвіту та щіточкової облямівки, транспорту-
ються назовні від ентероцитів через їхній базолатеральний
край за допомогою п’яти транспортних систем, а звідси
потрапляють у кров’яне русло печінкової ворітної вени.
Дві з цих транспортних систем залежать від а решта
- ні. Значна кількість малих пептидів також належать до
портальної системи.
Всмоктування амінокислот у дванадцятипалій та голод-
ній кишці відбувається швидко, а у клубовій - повільніше.
Зі спожитою їжею надходить близько 50% від усіх пере-
травлених білків, з білків травних соків - 25%, зі злущених
клітин слизової - 25%. Тільки 2-5% білків у тонкій кишці
не піддаються травленню та всмоктуванню. Деяка частина
від поглинутих білків потрапляє до ободової кишки і зреш-
тою їх перетравлюють бактерії. Наявність білка у фекаль-
них випорожненнях є не харчового походження, а наслід-
ком руйнування бактерій та клітин. Про це свідчать випад-
ки, коли пептидазна активність щіточкової облямівки і
цитоплазми клітин слизової збільшується після резекції
частини клубової кишки або незалежного ураження під
час голодування. Отже, ці ензими є суб’єктами гомеоста-
тичного регулювання. У людей вроджений дефект меха-
нізму, що транспортує нейтральні амінокислоти в кишці
та ниркових канальцях, спричинює хворобу Хартнупа.
Вроджений дефект транспортування головних амінокислот
зумовлює цистинурію.
У новонароджених помірна кількість неперетравлених
білків також може всмоктуватися. Білкові антитіла в мате-
ринському молозиві - це великі секреторні імуноглобуліни
(І§А), які за допомогою трансцитозу проходять через епі-
телій молочної залози; їхнє утворення збільшується в
молочній залозі наприкінці вагітності. У разі грудного ви-
годовування І§А всмоктуються з кишки в систему крово-
обігу немовлят і забезпечують пасивний імунітет проти
інфекцій. Всмоктування відбувається шляхом ендоцитозу
з наступним екзоцитозом.
З віком всмоктування білків послаблюється, хоча й у
дорослих простежується в незначних кількостях. Сторонні
білки, що потрапляють у кровоплин, зумовлюють утво-
рення антитіл і реакції антиген-антитіло, які трапляються
у випадку повторного потрапляння більшої кількості того
ж самого білка, спричинюють алергічні симптоми після
споживання певного виду їжі. Поширеність харчової алер-
гії у дітей перевищує 8%. Деяка їжа є сильнішим алерген-
29 367’2
434 / РОЗДІЛ 25
ним чинником порівняно з іншою. Ракоподібні, молюски,
риба - загальновідомі алергени, хоча досить часто просте-
жуються алергічні відповіді на коров’яче молоко, яйця та
різні делікатеси.
Всмоктування білкових антигенів, особливо бактеріаль-
них та вірусних білків відбувається у великих М-клітинах
(від англ. тісгоГоІсі - мікроскладка) спеціалізованих киш-
кових епітеліоцитах, що містяться у скупчених лімфатич-
них вузликах (плямках Пеєра). Ці клітини передають анти-
гени до лімфоїдних тканин, після чого розпочинається
активування лімфобластів. Активовані лімфобласти по-
трапляють у систему кровообігу, а пізніше повертаються
до слизової оболонки кишки й інших епітеліоцитів, де
секретують 1§А у відповідь на повторну появу того ж
самого антигену. Такий секреторний імунітет є важливим
захисним механізмом, він детально описаний у Розділі 27.
Нуклеїнові кислоти
У кишці нуклеїнові кислоти за допомогою панкреатич-
них нуклеаз розщеплюються на нуклеотиди, а ті в подаль-
шому за участю ензимів, що містяться на люмінальній
мембрані слизових клітин, - на нуклеозиди та фосфорну
кислоту. Нуклеозиди, відповідно, розщеплюються на такі
складові: цукри і пуринові та пірамідинові основи, що їх
абсорбує активне транспортування.
ЛІПІДИ
Травлення жирів
Лінгвальну ліпазу секретує залоза фон Ебнера, яка міс-
титься на дорсальній поверхні язика, а шлункову - шлунок
(див. табл. 25-1). Шлункова ліпаза є менш важливою, за
винятком випадків панкреатичної недостатності, тоді як
лінгвальна активна в шлунку і може перетравити понад
30% харчових тригліцеридів.
Головна частина процесу травлення жирів починається
в дванадцятипалій кишці, де один з найбільш задіяних
ензимів - панкреатична ліпаза. Цей ензим порівняно легко
гідролізує 1- та 3-зв’язки тригліцеридів, однак його дія на
2-зв’язок можлива за дуже низького рівня, тому головними
продуктами його дії є вільні жирні кислоти і 2-моногліце-
риди. Вплив ензиму на жири спричинює їхню емульгацію.
Активність панкреатичної ліпази реалізована за наявності
амфіпатичної спіралі, що вкриває активні сайти й згина-
ється подібно до оправи книги. Коліпаза - білок з молеку-
лярною масою 11 000 - також секретований підшлунковою
залозою. Коли ця молекула з’єднується з -СООН закін-
ченням домену панкреатичної ліпази, то відкриття оправи
полегшується. Коліпаза секретується в неактивній профор-
мі (див. табл. 25-1), її активує в кишковому просвіті трип-
син.
Відома ще одна панкреатична ліпаза, активована
жовчними кислотами. Ця 100 000 кДа ліпаза становить
понад 4% від загальної кількості білка, що міститься у соці
підшлункової залози. У дорослих цей ензим у 10-60 разів
активніший, однак, на відміну від панкреатичної ліпази,
він каталізує гідроліз ефірів холестеролу, жиророзчинних
вітамінів і фосфоліпідів до тригліцеридів. Ензим з подіб-
ною дією також міститься в материнському молоці.
Більшість холестеролу, що надходить з їжею, є у формі
ефірів холестеролу і гідролізується за участю гідролази
холестеролових ефірів у кишковому просвіті.
Жири остаточно емульгують у тонкій кишці завдяки
високоактивним детергентам - солям жовчних кислот,
лецитину і моногліцеридам. Коли концентрація солей
жовчних кислот у кишці збільшується як після скорочення
жовчного міхура, то вони спонтанно сполучаються з жира-
ми, утворюючи міцели (рис. 25-4). Ці циліндричні аґреґати
взаємодіють з ліпідами і, хоча концентрація жирів є різною,
головно містять жирні кислоти, моногліцериди і холесте-
рол у гідрофобних центрах. Утворення міцел, крім того,
розчиняє жири і забезпечує їхнє транспортування до енте-
роцитів. Наприклад, міцели знижують концентраційний
градієнт від нерухомого шару до щіточкової облямівки сли-
зових клітин; ліпіди дифундують назовні від міцел, і наси-
чений ліпідами водянистий розчин підтримує контакт зі
щіточковою облямівкою клітин слизової оболонки (див.
рис. 25-4).
Стеаторея
В експериментальних тварин після видалення підшлун-
кової залози та у хворих з порушенням екзокринної секреції
підшлункової залози простежується поява об’ємних кало-
вих мас жирнуватої консистенції та глинистого кольору
(стеаторея). Це спричинено неповноцінним травленням
та абсорбцією жирів. Стеаторея у більшості випадків вини-
Рис. 25-4. Травлення жирів та їхнє надходження до слизової
кишки. Жирні кислоти (ЖК) перетворюються у вільному стані
під впливом панкреатичної ліпази на харчові тригліцериди і
за наявності жовчних солей (ЖС) утворюють міцели (округлої
форми структури), які дифундують через непорушний шар
до поверхні слизової (відтворено за дозволом з Тіютзоп АВР:
Іпіезііпаї аЬзогрїіоп ої Іірісіз: ІпЯиепсе оі іНе ипзііггесі \л/а1ег
Іауег апсі Ьііе асісі тісеїіе. Іп: ОізІгигЬапсез іп ЕірісІ апсі 1_іро-
ргоіеіп МеІаЬоІізт. Оіеізсіїу ЛУІ, боїіо АМ Опіко [есіі-
іогз]. Атегісап РІіузіоІодісаІ Зосіеіу, 1978).
ТРАВЛЕННЯ ТА ВСМОКТУВАННЯ / 435
кає внаслідок дефіциту панкреатичної ліпази, а також якщо
нема бікарбонатів, які теж секретує підшлункова залоза,
бо порівняно кисле середовище дванадцятипалої кишки
сприяє преципітації частини жовчних солей (панкреатична
стеаторея). Кислота також інгібує панкреатичну ліпазу,
внаслідок цього пацієнти з гіперсекрецією соляної кислоти
в шлунку у випадках гастриносекретувальних пухлин (гаст-
рином) і, відповідно, з низьким рівнем рН у дванадцяти-
палій кишці мають стеаторею. Іншою причиною стеатореї
є порушення реабсорбції жовчних солей у дистальній час-
тині клубової кишки (див. Розділ 26) (ентерогенна стеа-
торея). Дефіцит жовчі в кишці, пов’язаний із захворюван-
нями печінки або жовчних шляхів, спричинює гепатогенну
стеаторею.
Всмоктування жирів
Традиційно ліпіди надходять в ентероцити шляхом
пасивної дифузії, проте у деяких випадках у цьому процесі
беруть участь носії. Всередині клітини ліпіди швидко
етерифікують, утримуючи сприятливий концентраційний
Градієнт від просвіту кишки до клітин (рис. 25-5). На від-
міну від слизової оболонки клубової кишки, рівень погли-
нання солей жовчних кислот у порожній кишці низький, і
більша частина солей жовчних кислот не покидає просвіту
кишки, будучи вільними для утворення нових міцел.
Тривалість ”життя” жовчних кислот в ентероцитах зале-
жить від їхнього розміру. Жирні кислоти, що містять до
10-12 атомів вуглецю, потрапляють від слизових клітин
прямо у систему портальних судин, де транспортуються
як вільні (неетерифіковані) жирні кислоти. Якщо ж жирні
кислоти вміщують понад 10-12 атомів вуглецю, то вони
реетерифікують до тригліцеридів у слизових клітинах.
Крім того, відбувається етерифікація частини абсорбо-
ваного холестеролу.
Тригліцериди і холестеролові ефіри, вкриті шаром з
білків, холестеролу і фосфоліпідів, утворюють Х1ЛОМІК-
рони. Вони вивільнюються від клітини і входять у лімфа-
тичні судини (див. рис. 25-5).
У слизових клітинах більшість тригліцеридів утворю-
ються ацилюванням абсорбованих 2-моногліцеридів
головно у гладкій ендоплазматичній сітці. Частина три-
гліцеридів утворюється з гліцерофосфату, який, відповідно,
є продуктом катаболізму глюкози. Гліцерофосфат також
перетворюється у гліцерофосфоліпіди, які беруть участь в
утворенні хіломікронів. Ацилювання гліцерофосфату й
утворення білків відбувається у шорсткій ендоплазматич-
ній сітці. Карбогідратна половина додається до білків у
апараті Ґольджі, і завершений хіломікрон виділяється через
базальну або латеральну поверхні клітини.
Абсорбція довголанцюгових жирних кислот більше
виражена у проксимальній частині тонкої кишки, однак
значна частина таки всмоктується у клубовій кишці (рис.
25-6). За помірного вмісту жирів у харчовому раціоні 95%
спожитих жирів абсорбує.
Процеси, що відбуваються під час всмоктування жирів,
неостатньо сформовані в разі народження дитини, тому у
немовлят відбувається абсорбція лише 10-15% жирів від
усіх спожитих, і в них більша ймовірність розвитку хво-
робливих проявів унаслідок зменшення всмоктувань
жирів.
Коротколанцюгові жирні кислоти
Сьогодні щораз більшу увагу приділяють ролі коротко-
ланцюгових жирних кислотах (КЛЖК), які утворюються
в ободовій кишці і звідти всмоктуються. За структурою
КЛЖК - це дво- або п’ятивуглецеві легкі кислоти, які за
нормальних умов містяться у просвіті кишки (їхня кон-
центрація 80 ммоль/л). Близько 60% від загальної кількості
становлять ацетатні, 25 - пропріонатні і 15% - бутанові
жирні кислоти. Вони утворюються внаслідок дії бактерій
у товстій кишці (див. Розділ 26) на комплексні вуглеводи,
резистентні крохмалі та інші компоненти харчової кліт-
ковини, які не перетравились у проксимальніших відділах
шлунково-кишкового тракту і потрапили у ободову кишку.
Після всмоктування КЛЖК беруть участь в обміні речо-
вин і роблять суттєвий внесок у загальну кількість спожи-
тих калорій. Крім того, вони мають трофічний ефект на
епітеліоцити ободової кишки, протизапальну дію, всмок-
туються, частково обмінюючись на Н\ завдяки чому допо-
магають утримувати кислотно-лужну рівновагу. У епіте-
ліоцитах ободової кишки є родина аніонних обмінників.
КЛЖК також активують всмоктування №+, проте точний
механізм спареного На4-КЛЖК всмоктування остаточно
не з’ясований.
Всмоктування холестеролу та інших
стеролів
Холестерол швидко абсорбується з тонкої кишки, якщо
наявні жовч, жирні кислоти та панкреатичний сік. Близь-
коспоріднені стероли рослинного походження всмоктують-
ся погано. Майже весь абсорбований холестерол входить
у хіломікрони, які потрапляють у кровообіг через лімфа-
тичні судини, як описано вище. Неабсорбовані рослинні
стероли, наприклад такі, що містяться у соєвих, зменшують
всмоктування холестеролу, можливо завдяки конкуруван-
ню з холестеролом для етерифікації з жирними кислотами.
ВСМОКТУВАННЯ ВОДИ ТА ЕЛЕКТРОЛІТІВ
Вода, натрій, калій, хлор
Весь водний баланс у шлунково-кишковому тракті під-
сумовано у табл. 25-3. Щодня в кишці є близько 2000 мл
спожитої рідини і 7000 мл різних секретів, що їх утворю-
ють слизова оболонка шлунково-кишкового тракту і приєд-
нані до нього залози. Із цієї рідини всмоктується 98%, а
денні втрати з випорожненнями становлять 200 мл. Лише
невелика кількість води проходить через слизову оболонку
шлунка, тоді як у тонкій та товстій кишці вода рухається у
двох напрямах відповідно до осмотичного Градієнта. Час-
тина дифундує до або назовні від тонкої кишки згідно
з концентраційним градієнтом. Оскільки люмінальні мемб-
рани всіх ентероцитів у тонкій та ободовій кишці проникні
для №+, а базолатеральні мембрани містять Ка4-К?-АТФ-
азу, то №+ також активно всмоктується у тонкій та товстій
кишці.
У тонкій кишці вторинне активне транспортування №+
важливе для постачання під час всмоктування глюкози,
деяких амінокислот (див. вище) та інших речовин, тоді як
наявність глюкози в кишковому просторі полегшує реаб-
сорбцію №+. Цей факт є фізіологічною основою для
436 / РОЗДІЛ 25
Просвіт
О МІЦЕЛА
к-с-он
Жирні кислоти
п
-о-с-к
-он
Непорушний шар 2-Моногліцериди
г-ОН
-ОН
“-ОРО,
Гліцерин 3-фосфат
Глюкоза
О
Жирні кислоти:
КоА лігаза
О
рО-С-К
О
ВС-З-КоА
Ацетил-КоА жирів
мгт
• О
II
го-с-к
о
II
-о-с-к
-о-с-к
У лімфу
Рис. 25-5. Всмоктування жирів. Тригліцериди утворюються у слизових клітинах з моногліцеридів та жирних кислот. Деякі з
гліцеридів також синтезуються з глюкози через фосфатидичну кислоту. Згодом тригліцериди перетворюються у хіломікрони,
і їх вивільняє екзоцитоз. З позаклітинного простору вони потрапляють у лімфу. Товсті лінії позначають головні шляхи; * -
реакцію інгібують моногліцериди; МГТ - моноацилгліцеридацилтрансфераза; ДГТ - діацилгліцеридацилтрансфераза.
лікування втрат На' і води в разі діареї рег оз за допомогою
різноманітних розчинів, що містять МаСІ і глюкозу. Плас-
тівці зернових, що містять вуглеводи, теж використовують
для лікування діареї. Такий тип лікування доцільний і у
випадку терапії холери - хвороби, що супроводжується
вираженою, а якщо не лікувати, то часто фатальною діа-
реєю.
За нормальних умов СІ з інтерстиційної рідини входить
в ентероцити через №'-К '-2С1 котранспортери базолате-
ральних мембран (рис. 25-7). Згодом він секретується в
просвіт кишки через канали, регульовані численними біл-
ковими кіназами. Один з них активує протеїнкіназа А і зго-
дом цАМФ. У випадку холери концентрація цАМФ збіль-
шується. Холерний вібріон перебуває в просвіті кишки,
однак він виробляє токсин, що зв’язується з ОМ-1 гангліо-
зидним рецептором, а це дає змогу частині А-субодиниці
(А'-пептиду) токсину увійти в клітину. Пептид А1 зв’язує
аденозиндифосфат рибози до а-субодиниці Оз, що гальмує
ГТФ-азну активність (див. Розділ 1). Отже, конститутивно
активований О-білок зумовлює тривале стимулювання
аденілатциклази і помітне підвищення внутрішньоклітин-
ної концентрації цАМФ. Поряд зі зростанням секреції СІ
функція носія слизової оболонки для №’ зменшується, і,
відповідно, зменшується абсорбція МаСІ. Результатом стає
збільшення водного об’єму та електролітного вмісту у киш-
ці і, як наслідок, поява діареї. Крім того, №*-К‘-АТФ-аза і
№7глюкоза котранспортер не активовані, тому й подвійна
опосередкована реабсорбція глюкози і N3’ теж неповно-
цінна.
Вода рухається в кишку та у зворотному напрямі тільки
тоді, коли осмотичний тиск інтестинального вмісту та
плазми однакові. Залежно від спожитих харчів осмоляль-
ТРАВЛЕННЯ ТА ВСМОКТУВАННЯ / 437
Рис. 25-6. Динаміка всмоктування жирів у людей, що ґрун-
тується на вимірюваннях після приймання жирної їжі. Стрілка
позначає дванадцятипалу кишку (відтворено за дозволом з
Оауепрогї НМ: РКувіоІоду оїШе Оідевііуе Тгасі, 2псІ есі. Уваг
Воок, 1966).
Рис. 25-7. Рух йонів через ентероцити у тонкій кишці: СІ_
потрапляє у клітину через І\Іа+-К+-2СГ-котранспортер базола-
теральної поверхні і секретує у кишковий простір через СГ-
канали, деякі з яких активовані цАМФ; К+ рециклює в інтести-
нальну рідину (ІР) через базолатеральні К+-канали (відтво-
рено за дозволом з РіеІсІ М, Роа МС, СКапд ЕВ: Іпіевііпаї еіес-
Ігоіуіе Ігапврогї апсі сІіаггЬеаІ сіівеаве. N ЕпдІ З Месі 1989;321:
800).
ність дуоденального вмісту може бути гіпертонічною або
гіпотонічною, однак на момент надходження в голодну
кишку стає близькою до осмоляльності плазми. Така ж
осмоляльність утримується в міжтравний період у кишці.
Осмотично активні частинки, що формуються під час трав-
лення, всмоктуються, і вода рухається пасивно назовні від
кишки за новоутвореним осмотичним градієнтом. В обо-
довій кишці відбувається активне випомповування Иа+
назовні, вода рухається пасивно разом з ним знову за осмо-
тичним градієнтом. Мінеральні послаблювальні засоби,
такі як магнезії сульфат, що належить до осмотично актив-
них солей, які погано абсорбуються, утримують воду в
кишці для відновлення осмотичної рівноваги. Унаслідок
збільшення інтестинального об’єму відбувається послаб-
лювальний ефект.
Таблиця 25-3. Щоденний баланс води у шлунково-
кишковому тракті1, мл
Спожито 2000
Ендогенні секрети 7000
Слинні залози 1500
Шлунок 2500
Жовч 500
Підшлункова залоза 1500
Кишка 1000
7000
Загальна кількість 9000
Реабсорбовано 8800
Голодна кишка 5500
Клубова кишка 2000
Ободова кишка 1300
8800
Вміст у калових масах 200
1 Дані з Мооге ЕМ: Рйувіоіоду ої ІпіевііпаІ \Л/аіег апсі ЕІесіго-
Іуіе АЬвогрііоп, Атегісап бавігоепіегоіодісаі Зосіеіу, 1976.
У просвіт кишки секретує незначна кількість К+ спеці-
ально як компонент слизу, а більша частина надходить
завдяки руху К+ через шлунково-кишкову слизову оболонку
шляхом дифузії. З іншого боку, К+ теж секретує в ободову
кишку, оскільки К+-канали є як у люмінальній, так і у
базолатеральній мембранах ентероцитів ободової кишки.
Рух К+ відбувається пасивно за електрохімічним градієн-
том.
Акумуляція К+ в ободовій кишці частково компенсована
Н+-К+-АТФ-азою у люмінальній мембрані клітин дисталь-
ного відділу ободової кишки з кінцевим активним транс-
портуванням К+ до клітин. Незважаючи на наявність такого
механізму, втрати рідини в разі хронічних діарей можуть
призводити до вираженої гіпокаліємії.
У випадках тривалого надмірного харчового приймання
К+ збільшується секреція альдостерону, і більше К+ надхо-
дить до ободової кишки. Це зумовлене частково появою
більшості Иа+-К+-АТФ-азних помп у базолатеральних
мембранах клітин і, як наслідок, зростанням внутрішньо-
клітинного вмісту К+ і дифузії К+ через люмінальні мемб-
рани клітин.
ВСМОКТУВАННЯ ВІТАМІНІВ І МІНЕРАЛІВ
Вітаміни
Всмоктування водорозчинних вітамінів відбувається
швидко, проте для жиророзчинних вітамінів А, Б, Е і К - є
недостатнім, якщо абсорбція жирів пригнічена з огляду
на нестачу панкреатичних ензимів або жовч не потрапляє
до кишки внаслідок обструкції жовчних проток. Більшість
вітамінів всмоктується у проксимальній частині тонкої
кишки, а вітамін В12 - у клубовій: він зв’язується з внут-
рішнім фактором - білком, що секретується в шлунку, а
утворений комплекс абсорбується через слизову оболонку
клубової кишки (див. Розділ 26).
438 / РОЗДІЛ 25
Всмоктування вітаміну В|2 і фолатів є № -залежним
процесом, проте всі решта сім водорозчинних вітамінів -
тіамін, рибофлавін, ніацин, піридоксин, пантотснат, біотин
і аскорбінова кислота - потрапляють в організм за допо-
могою носіїв, що є №'-котранспортерами.
Кальцій
В організмі людини всмоктується від ЗО до 80% спо-
житого кальцію. Активне транспортування Са24 з кишко-
вого просвіту відбувається головно у проксимальній час-
тині тонкої кишки і, частково, пасивною дифузією. Його
полегшує 1,25-дигідроксихолекальциферол (кальцитріол)
- метаболіт вітаміну О, що утворюється у нирках. Цей
метаболіт індукує синтезування двох форм Са2+-зв’язаних
білків у слизових клітинах і декілька форм Са2 -И -АТФ-
аз (див. Розділ 21). Однак остаточно механізми стимулю-
вання метаболітом вітаміну О всмоктування Са2+ ще нез’я-
совані. Рівень утворення 1,25-дигідроксихолекальциферо-
лу збільшується, коли концентрація Са2+ у плазмі зменшу-
ється, і навпаки, зі збільшенням вмісту Са2 у плазмі рівень
кальцитріолу зменшується (див. Розділ 21). Очевидно,
всмоктування Са2+ залежить від потреб організму: за неста-
чі Са2* збільшується, аза надлишку-зменшується. Всмок-
тування Са2' теж полегшує білок, інгібуючи фосфати й
оксалати, оскільки ці аніони утворюють нерозчинні солі з
Са2' у кишках. Всмоктування магнезії теж полегшене від-
повідним білком.
Залізо
У дорослих кількість заліза, що виходить з організму,
порівняно незначна. Ці втрати головно нерегульовані, а
кількість депонованого заліза регульована змінами у рівні
всмоктування цього мікроелемента з кишки. Чоловіки
втрачають понад 0,6 мг/добу, тоді як жінки - по-різному,
однак майже вдвічі більше, оскільки додатково втрачають
його під час місячних кровотеч. Щоденна доза заліза для
європейської популяції та Сполучених Штатів Америки
становить 20 мг. Кількість заліза, що абсорбується, майже
така ж, що й втрачається; у разі надлишкового приймання
настає перевантаження організму залізом. За нормальних
умов кількість абсорбованого заліза коливається від 3 до
6% від кількості спожитого. Засвоєння заліза під час всмок-
тування стимулюють різноманітні харчові фактори, на-
приклад, фігова кислота, що міститься у зернових плас-
тівцях, реагує з залізом, утворюючи нерозчинну сполуку у
кишці. Так само діють фосфати й оксалати.
Найліпше абсорбується двовалентне залізо (Ее2‘), однак
більшість харчового заліза міститься у феритичній формі
(Ее3‘). Не більше мінімальної кількості заліза всмоктується
у шлунку, проте шлунковий сік розчиняє залізо і дає змогу
Ее2' утворювати розчинні комплекси з аскорбіновою кисло-
тою та іншими речовинами, допомагаючи трансформу-
ватись у Те2 форму. Важливість цієї функції пояснює факт,
що після часткової гастроектомії порівняно часто розви-
вається виражена залізодефіцитна анемія. В щіточковій
облямівці також виявляється активність Ее3' редуктази.
Більшість заліза всмоктується в проксимальній частині
тонкої кишки. Гемне Ее2' та негемне Ее2" також абсорбу-
ються. Гем (див. Розділ 27) зв’язується до транспортного
білка, форму якого ще остаточно не ідентифіковано, і пере-
ходить у цитоплазму, де активність гемоксигенази виводить
Ее2 з порфірину й додає його до вільного пулу Ее2+ в енте-
роцитах (рис. 25-8). Негемне Ее2+ абсорбоване іншими
транспортними білками. Декілька білків-кандидатів було
ізольовано та клоновано, у тім числі протонозв’язаний з
металом транспортер, що має 12 сполучених з мембраною
доменів і зв’язує не тільки Ее2+, а й 2п24, Мп2’, Са24, СсР\
Си24, Иі2+ і РЬ2+. Проте досі остаточно не з’ясована кількість
і деталі діяльності цих транспортних білків.
Частина цитоплазматичного Ее2+ в ентероцитах окисню-
ється до Ее3+ і зв’язується з апоферитином, утворюючи
феритин (див. нижче). Є труднощі у вивільненні заліза з
депонованої форми, та назагал феритин утримується в
ентероцитах до моменту, доки він повністю не переміс-
титься на верхівку ворсинки, а згодом вийде з каловими
масами (див. Розділ 26).
Більша частина цитоплазматичного Ее2+, що залиши-
лася, активно транспортується через базолатеральні мемб-
рани ентероцитів і потрапляє в кров, де зв’язується з Ее3+
формою апоферитину, утворюючи трансферитин - актив-
ний залізотранспортний білок у плазмі. Цей поліпептид
має два залізозв’язувальні сайти. За нормальних умов
трансферитин насичений залізом на 35%, і рівень заліза у
плазмі становить 130 мг/дл (23ммоль/л) у чоловіків та
110 мг/дл (19 ммоль/л) у жінок.
Всмоктування заліза збільшується у випадку виснажен-
ня депонованого заліза організму або зростання еритро-
поезу і зменшується за протилежних станів. Деталі меха-
нізмів регулювання все ще остаточно не з’ясовані. Крім
того, ці процеси залучають поглинання вздовж щіточкової
облямівки, що полегшене в разі дефіциту заліза і виникає,
коли трансляція апоферитину мРНК зменшується, утво-
рюючи більше Ее2+ для транспортування у кров. За над-
лишку заліза утворюється більше феритину в ентероцитах,
який злущується з цими клітинами до калових мас.
Феритини наявні не тільки в ентероцитах (головному
місці депонації заліза), а й у багатьох інших клітинах. Апо-
феритин - це глобулярний білок, що складається з 24 суб-
одиниць. Залізо утворює міцели гідроксифосфату заліза
(II), і у феритині субодиниці оточують цю міцелу. Ферити-
нова міцела може вміщувати майже 4500 атомів заліза.
Феритин добре видно під електронним мікроскопом, тому
його застосовують як елемент-індикатор у разі вивчення
фагоцитозу та споріднених явищ. Він також є головною
формою депонації заліза в організмі; його молекули у
лізосомальних мембранах можуть аґреґуватись у відкла-
деннях, що містять понад 50% заліза. Такі відкладення
називають гемосидерином. В організмі людини 70% від
усього заліза містяться у гемоглобіні, 3% - у міоглобіні, а
решта - у феритині.
Нормальне співвідношення між факторами, що під-
тримують баланс заліза в організмі, необхідне для здоров’я.
Дефіцит заліза спричинює анемію. Якщо ж всмоктується
більше заліза, ніж виводиться, то простежується надлишок
заліза. У випадку, коли такий стан виражений і тривалий,
гемосидерин акумулюється в тканинах, і розвивається
гемосидероз. Значна кількість гемосидерину пошкоджує
тканини, спричинюючи гемохроматоз. Цей синдром су-
проводжується пігментацією шкіри, ураженням підшлун-
кової залози діабетом (“бронзовий діабет”), цирозом печін-
ТРАВЛЕННЯ ТА ВСМОКТУВАННЯ / 439
Посмугована
облямівка
Рис. 25-8. Всмоктування заліза. Гем потрапляє в ентероцити за допомогою гемтранспортувального білка (ГБ) Йони Ее2+
через посмуговану облямівку переносить один або кілька залізотранспортувальних білків (ЗТ). Частина Ее2+ оксигенує і
зв’язується з феритином. Інші йони проходять через базолатеральну мембрану завдяки активному транспортуванню (АТ).
Потім вони потрапляють у кров, де Ее3+ зв’язує їх до трансферитину (ТФ). Ентероцити міґрують з крипт до кінчиків ворсинок і
з часом злущуються у кишковий простір разом із залізовмісним феритином (модифіковано та відтворено за дозволом з ОеЬпат
Е8, Згаі 8К8‘ ІпіепзіпаІ ігоп аЬзогрііоп: СеІІиІаг тесґіапізт апсі гедиіаііоп. Иєууз РґіузіоІ 8сі 1997; 12:184).
ки, високим рівнем випадків печінкових карцином та атро-
фією гонад. Гемосидероз може бути первинним або вто-
ринним. Анормальний ген, що досить поширений у кав-
казької популяції, міститься на короткому плечі 6-ї хромо-
соми, близько зв’язаної з НЬА-А локусом. Особи, гомози-
готні за цим геном, мають характерну регуляторну систему
в слизовій оболонці, що поводиться так, наче дефіцит заліза
є навіть тоді, коли рівень споживання заліза високий. Якщо
цю аномалію діагностувати, перш ніж надлишок заліза
депонується у тканинах, то тривалість та якість життя
можна продовжити повторними кровопусканнями. Вто-
ринний гемохроматоз виникає у випадках, коли залізоре-
гулювальні системи переповнені надлишком заліза через
хронічну деструкцію еритроцитів, хвороби печінки або
хронічно підвищене приймання заліза. Частою причиною
надлишкового споживання заліза у деяких місцевостях
Африки є споживання страв з ягід, які готують у сталевих
барабанах.
26
Механізми регулювання
шлунково-кишкових функцій
ВСТУП
Функції травлення та всмоктування, описані у поперед-
ньому розділі, залежать від численних процесів: подріб-
нення їжі, проштовхування вздовж травного тракту й змі-
шування її з печінковою жовчю, яка депонується в жовч-
ному міхурі, та травними ензимами, що їх виділяють слинні
залози, підшлункова залоза та залози шлунка. Деякі з цих
процесів залежать від внутрішніх властивостей гладких
м’язів кишки. Інші охоплюють взаємовплив рефлексів, що
залучають внутрішні нейрони кишки і ЦНС, паракринні
ефекти хімічних месенджерів та гастроінтестинальних
юрмонів. Травні гормони - це гуморальні речовини, що
їх виділяють клітини слизової оболонки, а переносить сис-
тема кровообігу, вони впливають на діяльність шлунка,
кишки, підшлункової залози та жовчного міхура, а також
діють паракринно
ЗАГАЛЬНІ ПОЛОЖЕННЯ
Організація
Принцип організації структур, з яких утворена стінка
шлунково-кишкового тракту від задньої глотки до відхід-
ника, показано на рис. 26-1. Є незначні відмінності, однак
назагал вона містить чотири шари (від кишкового просвіту:
слизовий, підслизовий, м’язовий та серозний). У підслизо-
вому шарі розташовані волокна гладких м’язів, а у м’язо-
вому зовнішньому - два шари гладких м’язів: поздовжній
іа внутрішній косий. Уздовж травний тракт вистелений
слизовою оболонкою, за винятком стравоходу та дисталь-
ної частини прямої кишки, які вкриті серозною оболонкою.
Ця оболонка, відповідно, продовжена мезентерієм, який
містить нервові волокна, лімфатичні та кровоносні судини,
що оточують травний тракт.
Кровообіг у шлунково-кишковому тракті
Плин крові до шлунка, кишок, підшлункової залози та
печінки забезпечує серія паралельних кіл, з яких кров від
кишки та підшлункової залози потрапляє через портальну
вену до печінки. Фізіологія цієї важливої ділянки системи
кровообігу описана у Розділі 32.
Ентерична нервова система
Усередині шлунково-кишкового тракту є дві мережі нер-
вових волокон: міентеричне сплетення (Ауербахівське
сплетення) між зовнішнім поздовжнім і середнім цир-
куляторним м’язовими шарами, та підслизове сплетення
(Мейснерівське сплетення) між середнім циркуляторним
шаром і слизовою оболонкою (див. рис. 26-1). Разом ці
нейрони утворюють ентеричну нервову систему. Така
система у людей містить понад 100 мільйонів сенсорних
Серозна оболонка
Поздовжні м’язи
Міентеричне
сплетення Ауербаха
Слизова
Підслизова
основа
Підслизове
сплетення Мейснера
Циркуляторні
м’язи
Підслизові м’язи
(звичайно
поздовжні)
Епітелій кишки
оболонка і з підепітеліальною
сполучною тканиною
Брижа
(артерії, вени, нерви,
лімфатичні судини)
Рис. 26-1. Схематичне зображення шарів стінки шлунка, тон-
кої та ободової кишки. Будова стравоходу і дистальної час-
тини прямої кишки подібна, за винятком того, що в них нема
серозної оболонки або брижі. Крім того, м’язи верхньої чверті
стравоходу поперечно-посмуговані, у перехідній частині -
змішані: як гладкі, так і поперечно-посмуговані, а в дистальній
-лише гладкі (відтворено за дозволом з ВеІІ ОН, ЕтвІіе-ЗтіФ
□, Раіегвоп СР: ТехіЬоок ої Рйузіоіоду апсі Віосйетізігу, 91й
есі. СґіигсґііІІ Ьіуіпдзіопе, 1976).
МЕХАНІЗМИ РЕГУЛЮВАННЯ ШЛУНКОВО-КИШКОВИХ ФУНКЦІЙ / 441
нейронів, інтер- та мотонейронів, тобто більше, ніж є в
цілому спинному мозку, тому, мабуть, найліпше її розгля-
дати як “переміщену” частину ЦНС, що відповідає за регу-
лювання функцій травного тракту. Ця система пов’язана з
ЦНС за допомогою парасимпатичних та симпатичних
волокон, однак може діяти автономно без цих зв’язків (див.
нижче). Міентеричне сплетення іннервує поздовжній і цир-
куляторний гладкі м’язові шари та відповідає головно за
регулювання кишкової секреції. До нейротрансмітерів
ентеричної нервової системи належать ацетилхолін, аміни
- норадреналін та серотонін, амінокислоти - ГАМК, пурин
АТФ, гази N0 й СО та багато інших пептидів і поліпептидів
(табл. 26-1). Деякі з цих пептидів також впливають у пара-
кринний спосіб, а інші потрапляють у кровоплин і діють
як гормони. Відомо також, що більшість з них міститься і
в головному мозку.
Зовнішня іннервація
Кишка забезпечена подвійною зовнішньою іннерва-
цією: як парасимпатичною, холінергічною (зі збільшенням
активності гладких м’язів кишки), так і симпатичною, нор-
адренергічною (з протилежними ефектами і скороченнями
сфінктерів травної системи). Прегангліонарні парасимпа-
тичні волокна складаються з понад 2000 еферентних воло-
кон блукаючого нерва та інших волокон, що є у складі кри-
жових нервів. Назагал вони закінчуються в холінергічних
нейронах міентеричних та підслизових сплетеннях. Сим-
патичні волокна - це постгангліонарні, однак багато з них
закінчується в постганліонарних холінергічних нейронах,
де власний секретований норадреналін гальмує ацетилхолі-
нову секрецію внаслідок активування а2-пресинаптичних
рецепторів. Деякі симпатичні волокна закінчуються без-
посередньо на гладких м’язових клітинах кишки. Біоелект-
ричні властивості інтестинальних гладких м’язів описані
у Розділі 3. Інші волокна іннервують кровоносні судини
кишки і спричинюють їхню вазоконстрикцію. Вони харак-
терні для тих кровоносних судин кишки, де є подвійна
іннервація (зовнішня адренергічна та внутрішня іннервація
ентеричною нервовою системою). ВІП та N0 належать до
нейротрансмітерів внутрішньої іннервації та відповідають
за появу гіперемії, що супроводжує перетравлення їжі. Досі
остаточно не з’ясована локалізація додаткової холінергіч-
ної іннервації кровоносних судин.
Таблиця 26-1. Головні пептиди ентеричної нервової системи
С6РР
ХЦК
Ендотелін-2
Енкефаліни
Галанін
ГРП
Нейропептид ¥
Нейротензин
Пептид ¥¥
РАСАР
Речовина Р
ТРГ
ВІП
Перистальтика
Перистальтика - це рефлекторна відповідь, що розпо-
чинається після розтягнення стінки кишки її власним вміс-
том і простежується уздовж усього шлунково-кишкового
тракту - від стравоходу до прямої кишки. Розтягнення роз-
починає циркуляторне скорочення м’язів вище від місця
подразнення і в ділянці розслаблення перед ним. Хвиля
скорочення, яка йде від ротової порожнини у каудальному
напрямі, проштовхує вміст просвіту вперед зі швидкістю
від 2 до 25 см/с. Перистальтичну активність кишки збіль-
шують або зменшують автоматично вхідні імпульси, однак
вона також залежить від зовнішньої іннервації. Крім того,
прогресивний рух вмісту не блокований видаленням і
повторним ушиванням сегмента кишки в її попередньому
положенні, а гальмований лише тоді, коли сегмент у зво-
ротному напрямі повернеться у попереднє положення.
Перистальтика є прикладом інтегративної активності енте-
ричної нервової системи. Вона виявляється у вивільненні
серотоніну в разі місцевого розтягнення, що активує сен-
сорні нейрони, які, відповідно, збуджують міентеричне
сплетення. Холінергічні нейрони проходять у цих сплетен-
нях у ретроградному напрямі й активують нейрони, що
вивільняють речовину Р та ацетилхолін, спричинюючи
скорочення гладких м’язів. У цей час холінергічні нейрони,
що проходять в антеградному напрямі, активують нейрони,
що секретують N0, ВІП і АТФ, зумовлюючи розслаблення
розташованих вище ділянок від дії подразника.
Базальна електрична активність та
регулювання моторики
Гладкі м’язи шлунково-кишкової системи, крім стра-
воходу та проксимальної ділянки шлунка, мають спонтанну
біоелектричну активність. Коливання мембранного потен-
ціалу сягають від -65 до —46 мВ. Цей вихідний базальний
електричний ритм (БЕР) спричинюють інтестинальні
клітини Кажала, зіркоподібні пейсмейкерні клітини
мезенхіми з властивостями гладких м’язів, які простягають
довгі множинно-розгалужені відростки до гладких м’язів
кишки. У шлунку та тонкій кишці ці клітини містяться у
зовнішньому циркуляторному м’язовому шарі біля міенте-
ричного сплетення, у товстій кишці - біля підслизового
краю циркулярного м’язового шару. У шлунку та тонкій
кишці простежується низхідний градієнт пейсмейкерної
частоти, тоді як у серці пейсмейкер домінує, звичайно, з
більшою частотою.
Сам по собі БЕР зрідка спричинює м’язові скорочення,
розряди пікових потенціалів (або спайків, з англ. зріке)
нашаровуються над більшістю деполяризаційних частин
хвиль БЕР, що збільшують м’язове напруження (рис. 26-
2). Деполяризаційна частина кожного пікового потенціалу
відповідає надходженню Са2+, а реполяризаційна - виді-
ленню К+. На БЕР впливають численні поліпептиди та
нейротрансмітери. Наприклад, ацетилхолін збільшує кіль-
кість пікових потенціалів та напруження гладких м’язів,
тоді як адреналін - зменшує як кількість спайків, так і
напруження гладких м’язів (див. рис. 26-2). У шлунку рівень
БЕР становить 4/хв, у дванадцятипалій кишці - 12/хв, у
дистальній частині клубової кишки знижується до 8/хв. У
товстій кишці БЕР збільшується від 9/хв для сліпої кишки
до 16/хв для сигмоподібної. БЕР координує перистальтику
442 / РОЗДІЛ 26
-15—п
Запис
біоелектричних мВ
процесів
-50 —
Запис
механічних змін 1,5 г
(напруження)
Запис
механічних змін
Запис -15мВ
біоелектричних
процесів -50мВ —
Рис. 26-2. Базальний електричний ритм (БЕР) гладких м’язів шлунково-кишкового тракту. Угорі: морфологія та зв’язок із
м’язовим скороченням. Унизу: стимулювальний вплив ацетилхоліну та інгібувальний вплив адреналіну (модифіковано та
відтворено за дозволом з СЬапд ЕВ, Зіігіп МО, ВІаск ОО: базігоіпіезііпаї НераіоЬіІіагу апсі ІЧиІгіІіопаІ РКузіоІоду. ІірріпсоН-
Рауеп, 1996).
та інші види моторної активності, і скорочення відбува-
ються лише під час деполяризаційної частини хвиль.
Наприклад, після ваготомії або перетинання стінки шлунка
перистальтика в шлунку стає іррегулярною та хаотичною.
Міґрувальний моторний комплекс
У міжтравний період відбувається модифікація елект-
ричної та моторної активності гладких м’язів шлунково-
кишкової системи. Це призводить до того, що цикли мотор-
ної активності мігрують від шлунка до дистальної частини
клубової частини. Кожний цикл, або міґрувальний мотор-
ний комплекс (ММК), починається періодом спокою
(фаза І), що переходить у період іррегулярної та механічної
активності (фаза II) і закінчується “вибухом” регулярної
активності (фаза III) (рис. 26-3). Міграція ММК в абораль-
ному напрямі відбувається зі швидкістю близько 5 см/хв і
настає через кожні 90 хв. їхня функція остаточно не з’ясо-
вана, однак відомо, що шлункова секреція, жовчевиділення
та панкреатична секреція збільшуються під час кожного
ММС. Можливо, вони сприяють евакуації вмісту зі шлунка
і тонкої кишки, готуючи їх до наступного приймання їжі.
Під час їди ці комплекси негайно припиняють активність
і повертаються до перистальтики й інших форм БЕР та
пікових потенціалів.
Інші аспекти м’язових скорочень кишки є високоспе-
цифічними в кожному відділі й описані у частинах, при-
свячених цим відділам.
ГАСТРОІНТЕСТИНАЛЬНІ ГОРМОНИ
Біологічно активні поліпептиди, що їх секретують
нейрони та залозисті клітини слизової оболонки, вплива-
ють як паракринним способом, так і гуморальним, бо одно-
часно потрапляють у кровообіг. Експериментальні дослід-
ження ефектів та вимірювання їхньої концентрації в крові
за допомогою радіоімунологічного методу ідентифікують
роль цих гастроінтестинальних гормонів у регулюванні
секреції та моторики шлунково-кишкового тракту. В разі
введення великих доз цих гормонів їхні ефекти перекри-
ваються. Крім того, їхні фізіологічні ефекти з’являються
досить дискретно (відокремлено). На підставі структурної
подібності (табл. 26-2) і залежно від ступеня тотожного
функціювання частина гормонів належить до однієї з двох
родин гастринів, головними представниками яких є гаст-
рин та холецистокінін (ХЦК), і до секретинів, головними
представниками яких є секретин, глюкагон, гліцентин (6БІ
- від англ. £Іісепіуп), ВІП та шлунковий інгібувальний полі-
пептид (ШІП). Крім того, є ще інші гомони, які не належать
до цих двох родин.
Ентероендокринні КЛІТИНИ
У слизовій оболонці шлунка, тонкої та товстої кишки
містяться понад 15 типів гормонопродукувальних ентеро-
ендокринних клітин. Багато з них секретують тільки один
гормон та ідентифіковані літерами (6-клітини, 8-клітини
МЕХАНІЗМИ РЕГУЛЮВАННЯ ШЛУНКОВО-КИШКОВИХ ФУНКЦІЙ / 443
Фази ММК
Фаза і - Нама пікових гюгенціжіів
і(жорочень
«Фаза П - Нощолмрнпішові шшдщіяпи
і стромоння
Фя я: Ш Фиупярні пікові пшенцаши
і скорочення І
ПРИЙМАННЯ ЇЖІ
0 і Н у н о !< |
Шнллунль
і озлмяа-ння
Дистальна
частина
клубової
кишки
І І Віднонпсння
Шф ммк
Рис. 26-3. Міґраційні моторні комплекси (ММК) Зверніть увагу, що комплекси рухаються у шлунково-кишковому тракті вниз зі
звичайною швидкістю у міжтравний період, повністю загальмовані під час приймання їжі та поновлюються через 90-120 хв
після приймання їжі (відтворено за дозволом з СНапд ЕВ, Зіігіп МЮ, ВІаск ЮО базігоіпіезііпаї НераіоЬіІіагу апсі МиігіііопаІ
РИузіоІоду Гірріпсой-Науеп, 1996)
юіцо). Клпини, що виробляють серотонін (хоча не всі),
відомі як сн іерохромафінні к.іііини Клітини, що про-
дукуючі, нолніеніиди і а аміни, інколи називаю іь АРІЛ)-
клпинами (від анід, аіпіпе ргесипюг ирїакс апсі сіссатЬоху-
Іаке накопичення іа декарбоксилювання попередників
амінів), або нейроендокринними клітинами, які, крім
шлунково-кишковою і рак і у. місія н,ся в леїенях га інших
оріанах Вони іакожс клпинами, т яких формуються кар-
циноїдін пухлини
Гастрин
Гас і рип уїворююіь (і-клнипи в латеральних сі інках
зало і слизової оболонки в ашральшй частиш шлунка (рис.
26-4). Ці (і-клпипи маюіь колбонодібну форму широке
дно місі ні ь баїаю іасіринових ірапул, а вушка верхівка
відкривав і вся на поверхню слиювої оболонки. З апікаль-
ної о кінця у ироеві і відходя і ь мікроворсинки. На них міс-
тишся і асі рипові рецен і ори, що рсаі уюі ь на зміну вміє і у
гасі рину. Інші клпини шлунково-кишковою іракіу, що
сскреіуюіь юрмони, маюіь подібні морфологічні ознаки.
Іншим ішіом і асіринопродукувальних клнин ( Тб-клі-
іини, що місія і вся як у шлунку, іак і в юнкій кинщі. Вони
мають С 34 і карбоксильне закінчення тстрапеїииду іасг-
рину, однак втратили С17 (див. нижче).
Під час ембріонального життя гастрин також міститься
в острівцях підшлункової залози. Гасіриносекрстувальні
пухлини, які називають гастриноми, трапляються також
у підшлунковій залозі, проте досі не з’ясовано, чи за нор-
мальних умов будь-який гастрин наявний у підшлунковій
залозі дорослих. Крім того, гастрин також виробляють
передня та проміжна часіки і іпофіза, ипоіаламус, дов-
іасіий мозок, а також блукаючий та сідничий нерви.
Гастрин є типовим представником ноліненіидних гор-
монів, які мають як макрої етерогеннісгь, іак і мікроге-
терої енність. Макрогетерої енність сюсусіься випадків
появи у і калинах і а тканинних рідинах організму пептид-
них ланцюі їв різної довжини; мікрогстсрогснпість від-
мінностей у молекулярній будові залежно від походження
окремих амінокислотних залишків. Унаслідок процесингу
прспрогастрину утворюю! ься фрагменти різномані і них
розмірів. Три головні фрагменіи містять 34, 17 га 14 амі-
нокислотних залишків Усі вони мають однакову конфігу-
рацію з карбоксильними кінцями (див. табл. 26-2). Ці
форми часто називають, відповідно, 634-, (И7-, 614-
444 / РОЗДІЛ 26
Таблиця 26-2. Структура деяких гормонально активних поліпептидів, що їх секретують клітини шлунково-кишкового тракту
в людини1
Родина гастринів Родина секретинів Інші поліпептиди
ХЦК 39 гастрин 34 ГІП глюкагон секретин ВІП мотилін речовина Р ГРП гуанілін
Туг Туг Ніз Ніз Ніз РПе Агд УаІ Рго
Не АІа 8ег 8ег 8ег УаІ Рго Рго Азп
Сіп Сій Сіп | Азр Азр Рго І_уз І_еи ТНг
Сіп СІу СІу СІу АІа Не Рго Рго Суз
АІа ТНг ТКг ТНг УаІ РПе Сіп АІа Сій
_Агд (руго)СІи РПе РПе РПе РПе ТНг Сіп СІу Не
І_уз І_еи Не | ТКг ТНг ТНг Туг РПе СІу Суз
АІа СІу 8ег 8ег 8ег | Азр СІу РПе СІу АІа
| Рго Рго | Азр Азр Сій Азп Сій СІу ТНг Туг
8ег Сіп Туг Туг І_еи Туг І І_еи І_еи УаІ АІа
СІу біу | 8ег 8ег 8ег Туг Сіп МеЬІ\ІН2 І_еи АІа
Агд Рго Не І_уз Агд Агд Агд ТНг Суз
Меі Рго АІа Туг І_еи І_еи Меі І_уз ТНг
8ег НІЗ Меі І_еи Агд Агд Сіп Меі СІу
Не І_еи Азр Азр Сій І_уз Сій Туг Суз
| \/аІ УаІ | Ьуз | 8ег СІу Сіп І_уз Рго
І_у5 АІа Не Агд АІа Меі Сій Агд
Азп Азр Ніз І Агд Агд | АІа Агд СІу
І_еи Рго Сіп АІа І_еи УаІ Азп Азп
Сіп 8ег Сіп Сіп Сіп | І_уз Ьуз Ніз
Азп І_уз Азр Азр Агд І_уз СІу Тгр
І_еи І_уз РПе РПе І_еи Туг Сіп АІа
Азр Лзіп УаІ УаІ І_еи Ьеи | УаІ
Рго СІу І Азп 11 Сіп Сіп | Азп | СІу
8ег Рго Тгр Тгр І Оіу 8ег Ніз
НІЗ ^Тгр І_еи І_еи І_еи | Не І_еи
Агд І_еи | Ьеи | Меі УаІ-І\ІН2 | Ьеи | Меі-МН2
^Не СІсі АІа Азп Азп-МН2
8ег Сій Сій ТКг
Азр Сій І_уз
_Агд Сій СІу
Азр Сій І_уз
Туз АІа І_уз
Меі Туз Азп
СІу 6Іу Азр
Тгр ~Тгр Тгр
Меі Меі І_уз
Азр Азр Ніз
РПе-МН2 РНе-І\ІН2 Азп
Не
ТНг
Сіп
1 Гомологічні амінокислотні залишки оточені лініями, які переходять від одного поліпептиду до іншого. Стрілки позначають на
місця розщеплення для утворення менших варіантів; Туз - тирозинсульфат. Усі гастрини бувають у несульфатованих (гастрин І)
та сульфатованих (гастрин II) формах. Гліцентин - додатковий член родини секретинів з С-закінченням, що простягається
подібно до глюкагону (див. Розділ 19).
МЕХАНІЗМИ РЕГУЛЮВАННЯ ШЛУНКОВО-КИШКОВИХ ФУНКЦІЙ / 445
Гастрин
Глюкагон (А-клітини)
Секретин
ХЦК
ГІП
Мотилін
Нейротензин
ВІП
Речовина Р
Гліцентин (Ь-клітини)
Соматостатин
ГРП
Гуанілін
Рис. 26-4. Поширення гастроінтестинальних пептидів уздовж шлунково-кишкового тракту. Товщина кожної позначки пропорційна
до концентрації пептиду у слизовій. Препроглюкагон перетворюється до глюкагону найбільше в А-клітинах у проксимальній
частині та до гліцентину; СІ.Р-1, СІ.Р-2 та інші похідні у Ь-клітинах дистальної частини шлунково-кишкового тракту.
гастрини. Іншою формою є тетрапептид з карбоксильним
залишком, який як велика форма збільшений завдяки амі-
нозакінченню, що містить понад 45 залишків амінокислот.
Ще одна похідна форма - сульфатація тирозину, який є
шостим амінокислотним залишком на карбоксильному
кінці. У крові й тканинах міститься однакова кількість
несульфатованих та сульфатованих форм. Інші похідні
утворені амінуванням карбоксильних кінців фенілаланіну.
Фізіологічне значення виявленої гетергенності таке. Є
незначна відмінність в активності між різними компонен-
тами, а також розбіжна пропорційність компонентів у різ-
них тканинах, де міститься гастрин. Це підтверджене тим,
що утворення різних форм гастрину зумовлене модифіко-
ваним функційним впливом.
Отже, можна стверджувати, що 617 - головна форма,
яка відповідає за секрецію соляної кислоти у шлунку. Тет-
рапептид з карбоксильним залишком має всі активності
гастрину, проте лише 10% від потужності 017. Період
півжиття 014 та 017 у крові становить 2-3 хв, тоді як
034 - 15 хв. Інактивація гастринів відбувається головно
в нирках і тонкій кишці.
У великих дозах гастрин впливає по-різному, однак
головною фізіологічною дією є стимулювання шлункової
кислотності та секреції пепсину, а також спонукання росту
слизової оболонки в шлунку, тонкій та товстій кишці (тро-
фічна дія). Стимулювання шлункової моторики - ще один
наслідок впливу гастрину, який спричинює скорочення
шлунково-стравохцушх сфінктерів (див. нижче), однак зна-
чення цього фізіологічного ефекту не з’ясоване. Гастрин
також стимулює секрецію інсуліну, проте тільки після при-
ймання білкової, а не вуглеводної їжі. Зі збільшенням рівня
циркулювального ендогенного гастрину збільшується
секреція інсуліну. Функції гастрину гіпофіза, інших частин
головного мозку та периферійних нервів остаточно не
з’ясовані.
Секреція гастрину залежить від спожитої їжі, рівня
імпульсації блукаючого нерва та різних факторів, що міс-
тяться в крові (табл. 26-3). Атропін не гальмує виділення
гастрину в людей на пробний сніданок, оскільки трансмі-
тером, який секретують постгангліонарні волокна блу-
каючого нерва, що іннервують 6-клітини, є швидше гаст-
рин-рилізинг поліпептид (ГРП; див. нижче)*, ніж ацетил-
холін. Секреція гастрину також збільшується за наявності
перетравленої білкової їжі у шлунку, передусім амінокис-
лот, які безпосередньо впливають на 6-клітини. Особливо
ефективні фенілаланін та триптофан.
Наявність кислоти в антральному відділі шлунка галь-
мує секрецію гастрину частково завдяки безпосередній дії
на 6-клітини, а частково внаслідок вивільнення соматоста-
тину, порівняно потужного інгібітора секреції гастрину.
Вплив кислоти на секрецію гастрину - це основа для меха-
нізмів регулювання за принципом зворотного зв’язку.
Збільшення секреції гормонів спричинює зростання секре-
ції хлористоводневої кислоти парієтальними клітинами.
Наростання кислотності шлункового середовища спри-
чинює за механізмом зворотного зв’язку гальмування сек-
реції гастрину.
Роль гастрину в патогенетичних механізмах виразкової
хвороби дванадцятипалої кишки описана нижче. У ви-
падку перніціозної анемії, коли уражені кислотопроду-
кувальні клітини шлунка, секреція гастрину хронічно під-
вищена.
* Синонім гастрин-рилізинг поліпептиду - бомбезин.
446 / РОЗДІЛ 26
Таблиця 26-3. Фактори, які впливають на секрецію
гастрину
Фактори, які впливають на секрецію гастрину
Люмінальні
Пептиди й амінокислоти
Збільшення об’єму
Нейрональні
Збільшення вагусної імпульсації
Гуморальні
Кальцій
Адреналін
Фактори, які гальмують секрецію гастрину
Люмінальні
Кислота
Соматостатин
Гуморальні
Секретин, ГІП, ВІП, глюкагон, кальціотонін
Холецистокінін-панкреозимін
Раніше вважали, що гормон холецистокінін спричинює
скорочення жовчного міхура, тоді як зовсім інший гормон
- панкреозимін - збільшує секрецію панкреатичного соку,
що багатий на ензими. Тепер відомо, що це єдиний гормон,
який секретують клітини слизової оболонки проксимальної
частини тонкої кишки, який виконує ці дві функції, тому
його нова назва - холецистокінін-панкреозимін (ХЦК-
ПЗ, тепер поширеніше ХЦК).
Подібно до гастрину ХЦК є сполукою, що відображає
молекулярну як макро-, так і мікрогетерогенність. Під час
процесинґу пре-ХЦК утворює декілька фрагментів. Вели-
кий ХЦК містить 58 амінокислотних залишків (ХЦК 58).
Крім того, є декілька форм ХЦК з різною кількістю аміно-
кислотних залишків: ХЦК 39 - 39 амінокислотних залиш-
ків, ХЦК 33 - відповідно, 33, а також декілька форм, що
містять 12 (ХЦК 12) або трохи менше амінокислотних
залишків (ХЦК 8). Усі ці форми мають, як і гастрин, п’ять
амінокислот на карбоксильному кінці (див. табл. 26-2).
Тетрапептид з карбоксильним кінцем (ХЦК 4) також міс-
титься в тканинах. Карбоксильні кінці амінуються, і тиро-
зин, що є сьомим амінокислотним залишком у карбоксиль-
ному закінченні, сульфатується. Відмінна від гастрину
несульфатована форма ХЦК, якої нема в тканинах. Крім
того, відомо, що утворюються ще інші похідні від решти
амінокислотних залишків ХЦК. Період півжиття ХЦК у
кровообігу 5 хв, однак мало що відомо про його метабо-
лізм.
Секретують ХЦК ендокриноцити - І-клітини прокси-
мального відділу тонкої кишки, нервові кінці дистальної
частини клубової та ободової кишки. ХЦК міститься у
нейронах головного мозку, особливо в його корі, нервових
волокнах організму людини (див. Розділ 4). У головному
мозку цей гормон відповідає за регулювання споживання
їжі (див. Розділ 14), його поява пов’язана з почуттям страху,
тривоги, знеболення. ХЦК, що секретується в дванадця-
типалій та голодній кишці, представлений здебільшого
ХЦК 8, ХЦК 12. Крім цих форм, у кишці та крові, що
циркулює, у багатьох видах наявний ХЦК 58. Ентеричні
та панкреатичні нервові волокна містять передусім ХЦК 4.
У головному мозку є ХЦК 58 і ХЦК 8.
Крім описаних вище впливів, ХЦК посилює дію сек-
ретину, який стимулює секрецію лужного підшлункового
соку, сповільнює випорожнення шлунка, впливає на тро-
фіку підшлункової залози, збільшує секрецію ентерокінази
і може підвищувати моторику тонкої та ободової кишки.
У деяких випадках секретин посилює скорочення піло-
ричного сфінктера, попереджуючи рефлюкс дуоденального
вмісту до шлунка. Гастрин і ХЦК стимулюють секрецію
глюкагону в разі перетравлення білкових страв. Реалізо-
вуючи свій вплив окремо або разом, ці гормони стають
такими кишковими факторами, що стимулюють секрецію
глюкагону (див. Розділ 19). Як зазначено у Розділах 4 і 14,
сьогодні ідентифіковано два ХЦК-рецептори. На периферії
головно розташовані ХЦК-А-рецептори, тоді як у голов-
ному мозку - ХЦК-А і ХЦК-В. Обоє активовані ФЛС і
продукують ІФ3 і ДАГ (див. Розділ 1). Нещодавно клоно-
вано гастриновий рецептор у шлунку, який хоча дуже подіб-
ний, проте не однаковий з ХЦК-В-рецептором. Незважа-
ючи на це відмінності між впливом гастрину та ХЦК на
периферії та концентрацією ХЦК-В-рецепторів у головно-
му мозку, не зрозумілі.
Збільшення секреції ХЦК відбувається в разі контакту
перетравлених продуктів, особливо пептидів та амінокис-
лот з інтестинальною слизовою оболонкою, а також за
наявності в дванадцятипалій кишці жирних кислот, що
містять понад десять атомів вуглецю. З моменту стимульо-
ваного ХЦК надходження жовчі та підшлункового соку у
дванадцятипалу кишку, в ній утворюються нові порції
продуктів перетравлення білків і жирів, які знову підви-
щують секрецію ХЦК: це регулювання за механізмом пози-
тивного зворотного зв’язку. Воно завершується з надход-
женням перетравлених продуктів у дистальні відділи шлун-
ково-кишкового тракту.
Секретин
В історії фізіології секретин посідає унікальне місце. В
1902 р. Бейлісс та Стерлінг перші описали збуджувальний
ефект дуоденального стимулювання панкреатичної сек-
реції фактором, що міститься в крові. Виконані досліджен-
ня привели до відкриття секретину. Вчені також передба-
чили, що багато інших хімічних агентів повинні бути секре-
товані клітинами організму, які згодом потрапляють у кро-
вообіг від органів афектів, що розташовані на значній
відстані. Стралінґ увів термін гормон, який означив як
хімічний месенджер. Сучасна ендокринологія підтвердила
правильність та коректність цієї гіпотези.
Секретин виділяють 8-клітини, які розміщені глибоко
в залозах слизової оболонки проксимального відділу тонкої
кишки. Секреція секретину (див. табл. 26-2) відрізняється
від ХЦК і гастрину, та однакова з глюкагоном, ОН, ВІП і
ШІП. Виділено тільки одну форму секретину і фрагменти
молекули, які вивчено у дослідженнях як неактивні. Три-
валість півжиття секретину близько 5 хв, мало що відомо
про його метаболізм.
Секретин збільшує секрецію бікарбонатів у клітинах
проток підшлункової залози та біліарного тракту, а також
спричинює секрецію водянистого лужного підшлункового
соку. Його вплив на клітини проток опосередкований через
цАМФ. Відомо, що секретин впливає на ХЦК, який відпо-
відає за секрецію травних ензимів підшлунковою залозою.
МЕХАНІЗМИ РЕГУЛЮВАННЯ ШЛУНКОВО-КИШКОВИХ ФУНКЦІЙ / 447
Водночас він зменшує секрецію соляної кислоти у шлунку,
яка приводить до скорочення пілоричного сфінктера.
Секреція секретину збільшується в разі утворення про-
дуктів травлення білків і подразнення кислотним вмістом
слизової проксимального відділу тонкої кишки. Вивіль-
нення секретину внаслідок впливу кислоти є ще одним
прикладом регулювання за принципом зворотного зв’язку.
Секретин спричинює секрецію лужного підшлункового
соку і потрапляння його до дванадцятипалої кишки, ней-
тралізуючи кислотність у шлунку і припиняючи подальшу
секрецію гормону.
Шлунковий інгібувальний поліпептид
Шлунковий інгібувальний поліпептид (ШІП) скла-
дається з 43 амінокислотних залишків (див. табл. 26-2) і
утворюється в К-клітинах слизової оболонки дванадцяти-
палої та голодної кишки. Секрецію ШІП стимулюють глю-
коза і жири, що містяться у дванадцятипалій кишці. У ви-
падку продукування великої кількості пептиду відбувається
гальмування секреторної та моторної функцій шлунка. Ця
дія і зумовила його назву - шлунковий інгібувальний пеп-
тид. Окрім того, сучасні дані свідчать, що ШІП не реалізує
свого впливу - гальмування активності шлунка, якщо
вивільнюється малими дозами у кровоплин після їди.
Водночас відомо, що ШІП стимулює секрецію інсуліну.
Гастрин, ХЦК, секретин, глюкагон теж мають такий ефект,
та лише один ШІП стимулює секрецію інсуліну, створюючи
такий рівень у крові, що можна порівняти з аналогічним
як після орального приймання глюкози. З цього огляду
ШІП часто називають інсулінотропічним глюкозозалеж-
ним поліпептидом. Похідні глюкагону СШР-1 (7-36) (див.
Розділ 19) також стимулюють секрецію інсуліну і є в цих
випадках потужнішими, ніж ШІП. Отже, він може бути
також фізіологічним В-клітинним стимулювальним гор-
моном шлунково-кишкового тракту.
Інтеграція впливу гастрину, ХЦК, секретину та ШІП
полягає в поліпшенні травлення й утилізації абсорбованих
харчових продуктів (рис. 26-5).
Вазоактивний інтестинальний поліпептид
Вазоактивний інтестинальний поліпептид (ВІП) містить
28 амінокислотних залишків (див. табл. 26-2). Він містить-
ся у волокнах, що іннервують шлунково-кишковий тракт.
Препро-ВІП містить як ВІП, так і близькоспоріднений
поліпептид (РНМ-27 у людей, РНІ-27 в інших видів).
Період півжиття для ВІП становить 2 хв. У кишці він сти-
мулює інтестинальну секрецію електролітів та води. До
інших впливів належить розслаблення гладких м’язів киш-
ки, у тім числі сфінктерів, дилятація периферійних крово-
носних судин і гальмування секреції соляної кислоти шлун-
ком. ВІП також міститься в головному мозку та багатьох
нервових волокнах автономної нервової системи (див. Роз-
діл 4), де часто простежується в тих нейронах, що й ацетил-
холін. Він підсилює дію ацетилхоліну на слинні залози.
Проте ВІП і ацетилхолін не можуть співіснувати в нейро-
нах, що іннервують інші частини шлунково-кишкового
тракту. ВІП-секретувальні пухлини (ВІПоми) описують у
пацієнтів з тяжкими діареями. Зв’язок ШІП і ВІП з енте-
рогастроном, несправжнім гормоном, який гальмує секре-
цію кислоти у шлунку і моторику, досі остаточно не з’ясо-
ваний. Крім того, пептид ¥¥ (див. Розділ 19) також можна
вважати ентерогастроном. Жири спричинюють його
вивільнення в голодну кишку, і цей пептид є ефективним
інгібітором гастриностимульованої секреції соляної кис-
лоти.
Мотилін
Мотилін - поліпептид, що вміщує 22 амінокислотні
залишки, секретований ентерохромафінними клітинами і
Мо-клітинами шлунка, тонкої та ободової кишки. Він
впливає на рецептори, що зв’язані з 6-білком ентеричної
системи дванадцятипалої та ободової кишки. У разі вве-
дення мотиліну виникають скорочення гладких м’язів
шлунка та кишки. Рівень мотиліну в крові збільшується
періодично з інтервалами 100 хв у міжтравному періоді.
Мотилін є головним регулятором ММК, який регулює
шлунково-кишкову моторику в період між прийманням їжі.
Антибіотик еритроміцин зв’язується з рецепторами моти-
ліну, і похідні цих сполук мають значення для пацієнтів,
оскільки на тлі приймання цього лікарського засобу про-
стежується сповільнення шлунково-кишкової моторики.
Інші шлунково-кишкові гормони
Нейротензин- 13-амінокислотний поліпептид, що його
утворюють нейрони та клітини, які містяться у слизовій
їжа у шлунку
Секреція гастрину
Збільшення секреції
кислоти
Збільшення
моторики
їжа та кислота у !
дванадцятипалій кишці Пептид ¥¥?
Секреція
ХЦК та
секретину
І
Панкреатична та
біліарна секреція
І
Інтестинальне
Секреція
ГІП
І
Секреція
інсуліну
травлення
Рис. 26-5. Інтегрувальна дія гастроінтестинальних гормонів
у регулюванні травлення та засвоєння абсорбованих
поживних речовин. Штрихова стрілка позначає інгібіцію. Точна
ідентифікація гормонального або кишкових факторів, що
інгібують секрецію шлункової кислоти та моторику, досі не
з’ясована, однак ним може бути пептид ¥¥.
448 / РОЗДІЛ 26
оболонці клубової кишки. Він вивільняється внаслідок
подразнення жирними кислотами. Головний вплив ней-
ротензину - гальмування шлунково-кишкової моторики і
збільшення кровоплину у клубовій кишці. Речовина Р
(див. табл. 26-1) міститься в ендокриноцитах і нейронах
шлунково-кишкового тракту й може потрапляти у крово-
обіг. Вона збільшує моторику тонкої кишки. ГРП (гаст-
рин-рилізинг пептид) вміщує 27 амінокислотних залиш-
ків, а 10 амінокислотних залишків на їхніх карбоксильних
кінцях також ідентифіковані як двозначний бомбезин. Він
наявний у нервових волокнах блукаючого нерва, що закін-
чуються на О-клітинах. У разі їхнього подразнення вивіль-
нюється бомбезин, що збільшує секрецію гастрину. У
випадках значного збільшення секреції деяка частина гаст-
рину потрапляє до кровообігу. Соматостатин, гормон-
інгібітор виділення гормону росту, крім синтезу у гіпотала-
мусі, секретують у кровообіг О-клітини острівців підшлун-
кової залози (див. Розділ 19) і О-подібні клітини слизової
оболонки шлунково-кишкового тракту. Як описано у Розді-
лі 14, він наявний в тканинах у двох формах: соматостатин
14 (див. рис. 4-27) і соматостатин 28, які вивільняються
одночасно. Соматостатин гальмує секрецію гастрину, ВІП,
ШІП, секретину та мотиліну. Подібно до інших гастро-
інтестинальних гормонів, соматостатин секретується у
великих кількостях у просвіт шлунка, а потім - у кров’яне
русло. Його секреція збільшується з підвищенням рівня
кислотності у шлунку і, вірогідно, паракринна дія через
шлунковий сік спонукає до гальмування секреції гастрину,
що спричинюване впливом кислоти. Соматостатин також
гальмує екзокринну секрецію підшлункової кислоти, сек-
рецію соляної кислоти та моторику шлунка, скорочення
жовчного міхура, абсорбцію глюкози, амінокислот і триглі-
церидів. Глюкагон зі шлунково-кишкового тракту відпо-
відає (частково) за гіперглікемію після панкреатотомії.
Продукти, утворені з препроглюкагону у проксимальній
та дистальній частинах кишки, описані у Розділі 19 і
показані нарис. 19-16.
Гуанілін - гастроінтестинальний поліпептид, що зв’язу-
ється з С-типом гуанілатциклази. Він утворений з 15 амі-
нокислотних залишків (див. табл. 26-2); секретований клі-
тинами слизової оболонки кишки. У людини гуанілін також
можуть виробляти клітини Пейнета, ендокриноцити, що
містяться біля Люберкюнових крипт тонкої кишки. Стиму-
лювання гуанілатциклази збільшує концентрацію внутріш-
ньоклітинного цГМФ, який, вірогідно, спричинює поси-
лення активності СІ -регульованих каналів у разі кистозно-
го фіброзу (муковісцидозу) і збільшує секрецію СІ у киш-
ковий просвіт. Гуанілін здебільшого діє паракринно й утво-
рюється в клітинах від пілоричного відділу шлунка до пря-
мої кишки. Цікавий приклад клітинної мімікрії: у термо-
стійкого ентеротоксину зі штаму Е.соїі, що спричинює
діарею, простежується однакова будова з гуаніліном і акти-
вування гуанілінових рецепторів у кишці.
Гуанілінові рецептори також містяться в нирках, печінці,
жіночій статевій системі. Гуанілін теж гуморально впливає
на регулювання руху рідин у тканинах.
ТРГ і АКТГ містяться у шлунково-кишковому тракті;
очевидно, що ці гормони не потрапляють у систему кро-
вообігу внаслідок специфічності місця продукування з
моменту ураження гіпоталамуса або гіпофізектомії відбу-
вається вплив на щитоподібну та надниркові залози за
умови, що шлунково-кишковий тракт інтактний. Крім того,
відомі випадки, коли місцево утворені ТРГ або ТСГ залу-
чені до регулювання секреторного імунітету в кишці (див.
Розділ 25). ТРГ також виявляють в острівцях підшлункової
залози і, ймовірно, в В-клітинах. Речовина урогастрон
(назва зумовлена тим, що її вперше виділили з сечі) на-
лежить до трансмітерів захисту і бере участь у загоєнні
виразок; тепер відома як епідермальний фактор росту (див.
Розділ 22).
Клітини, які виділяють гастроінтестинальні поліпеп-
тиди, можуть утворювати пухлини. Гастриноми становлять
50%, глюкагономи - 25% від цих пухлин, у літературі опи-
сані також ВІПоми, нейротензиноми та ін.
РОТОВА ПОРОЖНИНА І СТРАВОХІД
У ротовій порожнині їжа змішується зі слиною, фор-
мується харчова грудка, яку проковтують у стравохід. Пери-
стальтичні хвилі стравоходу рухають харчову грудку до
шлунка.
Жування
Під час жування відбувається подрібнювання великих
частинок їжі і перемішування зі слиною - секретом слин-
них залоз. Зволожену та однорідну їжу проковтують, а зго-
дом вона піддається травленню. Великі частинки їжі інколи
проковтують без повноцінного жування, що спричинює
сильні та часто болючі скорочення м’язів стравоходу. Час-
тинки, які є меншими і схильними до дисперсності, без
слини теж можна проковтувати, проте з труднощами,
оскільки вони не утворюють харчової грудки. Кількість
жувальних рухів, яка є оптимальною для подрібнення їжі,
звичайно повинна сягати 20-25.
У пацієнтів без зубного ряду, які назагал обмежують
харчовий раціон тільки їжею м’ягкої консистенції, можуть
виникати труднощі в разі харчування сухими продуктами.
Слинні залози і слина
У слинних залозах секреторні (зимогенні) ґранули, що
містять слинні ензими, вивільняються з ацинарних клітин
у протоки (рис. 26-6). Характеристика кожної з трьох пар
слинних залоз наведена у табл. 26-4.
Щодня секретується близько 1500 мл слини. У стані
спокою залози секретують слину з рН дещо нижче 7,0; а
під час активної секреції рН збільшується до 8,0. Слина
вміщує два травні ензими: лінгвальну ліпазу, секретовану
залозами язика, і слинну а-амілазу, яку секретують слинні
залози. Функції ензимів описані у Розділі 25. Слина також
містить муцини, глікопротеїни, що змащують їжу і захи-
щають слизову оболонку ротової порожнини. Крім цих
компонентів, також є І&А (див. Розділ 27), який створює
першу лінію імунологічного захисту проти бактерій та
вірусів; лізозим, який руйнує стінки бактерій і вірусів;
лактоферин, що зв’язаний із залізом і має бактеріостатичну
дію; білки, збагачені проліном, що захищають зубну емаль
і зв’язують токсичні таніни.
Слина виконує декілька важливих функцій. Вона полег-
шує ковтання, зволожує ротову порожнину, забезпечує
МЕХАНІЗМИ РЕГУЛЮВАННЯ ШЛУНКОВО-КИШКОВИХ ФУНКЦІЙ / 449
розчинення молекул речовин, що стимулюють смакові
бруньки, полегшує рухи губ та язика під час вимовляння,
очищає ротову порожнину і зуби. Слина має також певний
антибактеріальний вплив, у пацієнтів з недостатністю
слиновиділення (ксеростомія) більша схильність до каріє-
су, ніж за нормальних умов. Буферні властивості слини
підтримують рН у ротовій порожнині близько 7,0. Вони
також нейтралізують кисле середовище шлунка, полегшу-
ють печію у випадках, коли відбувається регургітація шлун-
кового соку до стравоходу.
Йонний склад слини
Є виражена та значна відмінність йонного складу слини
у кожного окремого виду, а також залежно від того, яка
саме залоза виділяє секрет. Назагал слина, яку секретують
ацини, майже ізотонічна - концентрація Ка+, СІ, НСО3 ,
близька до їхньої концентрації у плазмі. Вивідні протоки
і, вірогідно, вставні, що проходять у них, модифікують
склад слини, видаляючи СІ і додаючи К+ та НСО3 .
Протоки є порівняно непроникні для води, отже, в системі
проток слина стає гіпотонічною. Тому в разі повільного
слиновиділення вона потрапляє в ротову порожнину гіпо-
тонічною, трохи кислою, багатою на К+, однак порівняно
виснаженою на№' і СІ . Коли слиновиділення інтенсивне,
то є мало часу для зміни йонного складу. Отже, все ще
гіпотонічна слина у людини стає більш ізотонічною внас-
лідок підвищення концентрації №+ і СГ. Вплив альдо-
стерону аналогічний до його дії в нирках - збільшує кон-
центрацію К і зменшує концентрацію №’ у слині (див.
Розділ 20 і 38). Для хвороби Аддісона (альдостеронова
недостатність) характерне високе співвідношення №7Ю
у слині.
Регулювання секреції слини
Секрецію слини регулює нервова система. Подразнення
парасимпатичної іннерваційної системи спричинює про-
фузну секрецію водянистої слини з порівняно малим вміс-
том органічного компонента. Пов’язана з цією секрецією
вазодилатація в залозі виникає внаслідок місцевого вивіль-
нення ВІП. Цей поліпептид - котрансмітер з ацетилхоліном
у деяких постганліонарних парасимпатичних нейронах.
Атропін та інші холінергічні блокувальні чинники змен-
шують секрецію слини. Подразнення симпатичної нервової
іннервації спричинює вазоконстрикцію; у людей - це сек-
реція невеликої кількості слини, багатої на органічні ком-
поненти з підщелепних залоз.
їжа в ротовій порожнині спричинює рефлекторне слино-
виділення, так само впливає подразнення аферентних воло-
кон блукаючого нерва черевної частини стравоходу. Секре-
ція слини також відбувається внаслідок умовно-рефлектор-
Білковий півмісяць
Рис. 26- 6. Будова підщелепних залоз. Зверніть увагу на клі-
тини у слизових ацинусах, базальні ядра яких стали пласкими,
тоді як клітини у білкових ацинусах мають округлі ядра і
вміщують зимогенні секреторні ґранули на верхівках. Вставні
вивідні протоки продовжуються посмугованими протоками, у
яких клітини спеціалізуються на йонному транспортуванні.
ного механізму, що підтверджують класичні досліди Пав-
лова (див. Розділ 16). У людей спричинюють секрецію
слини вигляд, запах та поява думки про їжу (“потекла
слина”).
Ковтання
Ковтання - це рефлекторна відповідь, розпочата афе-
рентними імпульсами трійчастого, язикоглоткового та
блукаючого нервів. Ці імпульси інтегруються в ядрі пооди-
нокого шляху та в подвійному ядрі. Еферентні волокна,
що проходять через мускулатуру глотки та язика, пред-
ставлені трійчастим, лицевим і під’язиковим нервами.
Ковтання ініційоване довільно після формування харчової
грудки на язику, що проходить у глотку. Це ж розпочинає
хвилю мимовільних скорочень у м’язах глотки, які про-
Таблиця 26-4. Характеристики слинних залоз у людини
Залоза Гістологічний тип Секреція1 Вміст у загальній слині2 (1,5 л/доба), %
Привушна Білковий Водяниста 20
Підщелепна Змішаний Помірної в’язкості 70
Під’язикова Слизовий В’язка 5
1 Серозні клітини секретують птіалін, а слизові - муцин.
2 Решту 5% об’єму слини продукують язикові та інші дрібні залози ротової порожнини.
ЗО 367 2
450 / РОЗДІЛ 26
штовхують харчову грудку у стравохід. Гальмування
дихання і закриття голосника є частиною рефлекторної
відповіді. Ковтання стає затрудненим, як і неможливим,
якщо ротова порожнина відкрита; це знає кожний, хто
провів деякий час у кріслі стоматолога і відчував, як слина
нагромаджується у горлі. У дорослої людини в нормі
ковтання частіше відбувається під час приймання їжі, а
також і в міжтравний період. Загальна кількість актів ков-
тання за день становить 1200. З них співвідношення між
прийманням їжі та питтям становить 600:200, 350 актів
ковтань відбувається без приймання їжі, а 50 - під час
сну.
У глотково-стравохідному з’єднанні міститься трисан-
тиметрова ділянка стравоходу, у якій тиск спокою стінки
високий. Ця ділянка розслаблюється рефлекторно під час
ковтання, даючи змогу харчовій грудці потрапити у тіло
стравоходу. Після проходження грудки відбуваються пери-
стальтичні кільцеві скорочення м’язів стравоходу, а грудка
стрімко прямує вниз по стравоходу зі швидкістю близько
4 см/с. Коли людина перебуває у вертикальному положенні,
то рідка й напіврідка їжа за законами земного тяжіння
швидко потрапляє у дистальну частину стравоходу перед
перистальтичною хвилею.
Нижній стравохідний сфінктер
На відміну від інших м’язів стравоходу, у шлунково-
стравохідному з’єднанні нижній стравохідний сфінктер
(НСС) є тонічно активний, проте розслаблюється під час
ковтальних рухів. Тонічна активність НСС запобігає у
період між прийманнями їжі рефлюксу шлункового вмісту
у стравохід. НСС складається з трьох компонентів (рис.
26-7). Гладкі м’язи стравоходу більш випуклі у з’єднанні
зі шлунком (внутрішній сфінктер). Волокна частини діа-
фрагми (правої ніжки) - це скелетні м’язи, що оточують
стравохід у цій ділянці (зовнішній сфінктер) і спричиню-
ють ефект пружного затиску для стравоходу. Крім того,
косі або петлеподібні (пращеві) волокна шлункової стінки
створюють м’яку заслону, яка допомагає закривати страво-
хідно-шлункове з’єднання і попереджує регургітацію під
час наростання внутрішньошлункового тиску.
Механізм регулювання тонусу НСС забезпечує нервова
система. Вивільнення ацетилхоліну вагусними волокнами
спричинює скорочення внутрішнього сфінктера, а вивіль-
нення N0 і ВІП інтернейронами, що його іннервують інші
волокна блукаючого нерва, зумовлює його розслаблення.
Скорочення ніжок частини діафрагми, іннервованої діа-
фрагмальними нервами, координується з диханням і скоро-
ченнями грудних та черевних м’язів. Отже, зовнішній та
внутрішній сфінктери діють разом, спричинюючи послі-
довне надходження їжі у шлунок і попереджуючи рефлюкс
шлункового вмісту у стравохід.
Великі дози гастрину збільшують тонус НСС, однак
цього ефекту не зумовлюють дози гастрину, що цирку-
люють у крові, порівняно з тими, що створюються після
приймання їжі.
Моторні порушення стравоходу
Ахалазія - це стан, коли їжа нагромаджується у страво-
ході, який, відповідно, масивно розширюється. Це призво-
дить до збільшення тонусу спокою НСС і неповного роз-
слаблення під час ковтання. Поява недостатності міенте-
ричного сплетення стравоходу сприяє появі дисфункції
для НСС, порушує вивільнення N0 та ВІП. Лікування
передбачає пневматичну дилятацію сфінктера або хірур-
Рис. 26-7. Стравохідно-шлункове з’єднання. Зверніть увагу, що нижній стравохідний сфінктер (внутрішній сфінктер) допов-
нений ніжкою діафрагми (зовнішній сфінктер) і вони пов’язані один з одним діафрагмально-стравохідною зв’язкою (відтворено
за дозволом з МійаІ РК, ВаІаЬап ОН. ТЬе езорйадозіпс іипсііоп. N ЕпдІ и Мес! 1997;336:924).
МЕХАНІЗМИ РЕГУЛЮВАННЯ ШЛУНКОВО-КИШКОВИХ ФУНКЦІЙ / 451
гічний переріз м’язів стравоходу (міотомія). Також є ефек-
тивним гальмування вивільнення ацетилхоліну введенням
токсину ботулізму у НСС, що дає полегшення на декілька
місяців.
Протилежним станом є функційна недостатність НСС,
коли відбувається рефлкжс кислого шлункового вмісту у
стравохід (гастроезофагальний рефлекс). Це поширене
захворювання спричинює печію та езофагіти і може приз-
вести до ульцерації та появи стриктур стравоходу, які вини-
кають унаслідок рубцювання. У важких випадках гастро-
езофагального рефлюксу розвивається слабість внутріш-
нього, зовнішнього чи обох сфінктерів, а в менш важких
простежуються інтермітуючі періоди з не до кінця зрозу-
мілим зменшенням неврональної координації обох сфінк-
терів. Такі стани можна лікувати гальмуванням секреції
соляної кислоти блокаторами Н2-рецепторів або омепра-
золом (див. нижче). Також ефективне хірургічне лікування,
під час якого створюються такі умови, що ділянка дна
шлунка огортає навколо дистальну частину стравоходу так,
що НСС міститься всередині короткого тунелю шлунка
(фундоплікація).
Аерофагія та кишковий газ
Неврастенічні особи, для яких характерна гіпервенти-
ляція, проковтують велику кількість повітря під час прий-
мання їжі або рідин (аерофагія). Частина повітря регур-
гітує (відрижка), частина газів, з яких складається повітря,
всмоктується, проте більшість з них проходить до обо-
дової кишки. Тут частина кисню абсорбується. Внаслідок
дії кишкових бактерій на вуглеводи та інші речовини, що
містяться у кишці, утворюються гідроген, гідрогенсуль-
фат, діоксид вуглецю і метан. Потім це видихають як від-
рижку. Її запах здебільшого залежить від сульфідів. Об’єм
газів, що у нормі міститься у шлунково-кишковому тракті
людини, - близько 200 мл, а продукування за день - 500-
1500 мл. У деяких осіб кишкові гази спричинюють ознаки
переїдання, гурчання в животі та абдомінальний диском-
форт.
Рис. 26-8. Анатомія шлунка. Головні речовини наведені в дуж-
ках під назвою частин шлунка, де вони секретовані. Штрихова
лінія позначає межу між тілом та антральною частиною.
ШЛУНОК
У шлунку їжа нагромаджується й перемішується з соля-
ною кислотою, слизом та пепсином і дозовано надходить
у дванадцятипалу кишку; це добре відрегульований процес.
Анатомічні особливості
Макроанатомія шлунка показана на рис. 26-8. Слизова
оболонка шлунка містить багато глибоких залоз. У піло-
ричній та кардіальній частині залози секретують слиз.
Залози тіла шлунка, у тім числі і дна, містять парієтальні
(оксинтні) клітини, які секретують соляну кислоту та
внутрішній фактор, головні (зимогенні, пептичні) кліти-
ни, які виділяють пепсиногени (рис. 26-9). їхні секрети
змішуються зі слизом, що його секретують клітини у ший-
ках залоз. Кілька залоз у разі відкривання на поверхню сли-
зової часто утворюють заглиблення (шлункова ямочка).
Слиз секретують слизові клітини епітелію (мукоцити), які
містяться між залозами, на поверхню слизової разом з
НСО3 .
П
ю
Г
Рис. 26-9. Схематичне зображення залоз у слизовій тіла
шлунка людини (відтворено за дозволом з ВеІІ 6Н, Оауісізоп
N. ЗсагЬогуидії 6: ТехіЬоок ої РГіузіоІоду апсі Віосїіетізігу,
бій есі. Ьмпдзіопе, 1965).
452 / РОЗДІЛ 26
Шлунок має добре розвинуте крово- та лімфопоста-
чання. Його парасимпатична іннервація забезпечена
блукаючим невром, а симпатична - з черевного вузла.
Секреція шлунка
Клітини шлункових залоз секретують понад 2500 мл
шлункового соку за день. Цей сік вміщує різноманітні
речовини (табл. 26-5). Шлункові ензими описані у Розділі
25. Соляна кислота, яку секретують залози тіла шлунка,
знищує більшість захоплених бактерій, допомагає трав-
ленню білків і стимулює надходження жовчі та підшлун-
кового соку. Її концентрація достатня для ушкодження
клітин, проте в нормальних осіб шлункова слизова не стає
ушкодженою чи перетравлюваною, оскільки шлунковий
сік містить слиз. Слиз, що його секретують шийкові та
поверхневі слизові клітини тіла та дна і подібні клітини у
будь-якій ділянці шлунка, складається з глікопротеїнів, які
називають муцинами. Кожний муцин уміщує чотири суб-
одиниці, зв’язані дисульфідними містками. Слиз утворює
гнучкий гель, що покриває слизову оболонку.
Поверхневі слизові клітини також секретують НСО3 ,
який затримується у слизовому гелі, так що градієнт рН
становить від 1-2 у люмінальній поверхні до 6-7 на
поверхні епітеліальних клітин. Соляна кислота, секрето-
вана парієтальними клітини шлункових залоз, проходить
цей бар’єр у пальцеподібних каналах, залишаючи інтакт-
ною решту гелевого шару.
Поверхневі мембрани слизових клітин і щілинні з’єд-
нання між клітинами також часто є частиною слизового
бар’єра, що захищає шлунковий епітелій від ушкодження.
Речовини, схильні уражувати бар’єр і зумовлювати подраз-
нення шлунка, - це спирт, оцет, жовчні солі та аспірин,
інші нестероїдні протизапальні препарати (НСПЗП). Про-
стагландини стимулюють секрецію слизу, а аспірин та спо-
ріднені лікарські засоби інгібують синтез простагландинів.
Частину резистентності шлункової кислоти до самопе-
ретравлення забезпечує наявність трефоїлових пептидів
у слизовій. їх є декілька типів і вони кислоторезистентні.
Ці пептиди також містяться в інших частинах шлунково-
кишкового тракту, у гіпоталамусі та гіпофізі й у швидко-
проліферувальних тканинах. Для цих сполук характерна
трипетлева будова біля амінокінців і скріплення їх дисуль-
фідними зв’язками. Отже, вони подібні до трилисної коню-
шини. У мишей з нокаутом гена одного з цих пептидів
шлунковий та кишковий епітелій стає гістологічно ано-
мальний і є великий ризик розвитку добро- та злоякісних
пухлин слизової.
Вміст електролітів у шлунковому соці змінюється від-
повідно до рівня секреції. За низького рівня секреції кон-
центрація висока, а Н+ - низька, однак зі збільшенням
секреції кислоти концентрація зменшується.
Таблиця 26-5. Склад шлункового соку у нормі (натще)
Катіони: І\Іа+, К+, Мд2+, Н+ (рН близьке до 1,0)
Аніони: СІ", НРО42-, 8О42~
Пепсини
Ліпаза
Слиз
Внутрішній фактор
Секреція пепсиногену
Головні клітини, які секретують пепсиногени, - неак-
тивні попередники пепсинів у шлунковому соці (див. Розділ
25); вони вміщують гранули зимогену. Секреторний процес
подібний до того, що відбувається під час секреції трипси-
ногену та інших панкреатичних ензимів підшлункової
залози. Активність пепсиногену можна визначити у плазмі
та в сечі, де його називають уропепсиногеном.
Секреція соляної кислоти
Складно одержати продукти секреції парієтальних
залоз без домішок інших секретів шлунка, однак найчис-
тіший проаналізований є ізотонічним, що важливо. Кон-
центрація цих продуктів Н+ еквівалентна до 0,17 Н НС1 з
рН до 0,87. Тому секрет парієтальних клітин як ізотоніч-
ний розчин може бути важливим для чистої НС1, що вмі-
щує 150 мекв СІ і 150 мекв для Н+ на літр. Незважаючи на
це, значення рН цитоплазми парієтальних клітин подібне
до рН інших клітин - 7,0-7,2 а порівняльна концентрація
на літр плазми - близько 100 мекв для СІ і 0,00004 мекв
для Н+.
На апікальній оболонці парієтальних клітин розташо-
вана Н -К -АТФ-аза, яка нагнітає Н+ у протилежному
напрямі до його концентраційного градієнта (рис. 26-10).
Парієтальні клітини поляризовані: апікальні мембрани
спрямовані в просвіт шлункових залоз, а базолатеральні
мембрани контактують з інтерстиційною рідиною. Ка-
нальці продовжуються з апікальної поверхні всередину
клітини (рис. 26-11). У решті клітин також розміщені в
значній кількості тубуловезикулярні структури з молеку-
лами Н4-К+-АТФ-ази на стінках. Рівень К+ всередині вези-
Рис. 26-10. Секреція Псі парієтальними клітинами шлунка.
Активне транспортування за участю АТФ позначено стрілками
у колах. Йони Н+ секретуються у простір канальців в обмін на
К+ за участю Н+-К+-АТФ-ази. НСО3_ обмінюється на Сґ у інтер-
стиційній рідині за допомогою антипорту, і І\Іа+-К+-АТФ-аза під-
тримує низький рівень внутрішньоклітинного І\Іа+. Штрихові
лінії позначають напрям дифузії. Порівняйте з рис. 38-20.
МЕХАНІЗМИ РЕГУЛЮВАННЯ ШЛУНКОВО-КИШКОВИХ ФУНКЦІЙ / 453
Рис. 26-11. Композитна схема парієтальної клітини, яка
відображає клітину в стані спокою (внизу ліворуч) і в
активному стані (вгорі праворуч). Клітина в стані спокою має
внутрішньоклітинні секреторні канальці (ВК), які відкрива-
ються на апікальну мембрану клітини, і систему тубуловези-
кулярних структур (ТВ) у цитоплазмі. У разі активування клі-
тини ТВ з’єднуються з клітинною мембраною, і мікроворсинки
(МВ) простягаються у канальці, так що площа контактування
клітинної мембрани зі шлунковим просвітом значно збільшу-
ється; М - мітохондрія, Ґ - апарат Ґольджі (відтворено за до-
зволом з иициеіга І_С, Сагпеіго З, КеІІеу ПО: Вазіс Нівіоіоду,
91Н есі. МсОга^-НіІІ, 1998).
кул зменшується, і молекули АТФ-ази неактивні. У разі
подразнення парієтальних клітин тубуловезикулярні
структури переміщуються до апікальної поверхні й зли-
ваються з нею, таким способом постачаючи значно більше
молекул АТФ-ази на мембрану. Це збільшує площу сек-
реторної поверхні та сприяє утворенню численних мікро-
ворсинок, які виступають до канальців. Молекули АТФ-
ази після цього експонують до К+ у ПКР, і розпочинається
Н+-К+-обмін.
Випомповування Н+ з парієнтальних клітин в обмін на
К+ потребує енергії, яку забезпечує гідроліз АТФ. Йони СІ
також виштовхуються проти електрохімічного градієнта
через канали, активовані цАМФ апікальної мембрани.
Концентраційний градієнт спрямований досередини, однак
назовні спрямований електричний градієнт, який є значно
більшим. Йони К+ теж виштовхуються. Звільнені йони Н+
об’єднуються з Н2СО3, а, відповідно, Н2СО3 утворюється
гідратацією (див. рис. 26-10). Цю реакцію каталізує карбо-
нонангідраза, а парієтальні клітини особливо багаті на цей
ензим.
Унаслідок дисоціації Н2СО3 утворюється НСО3 , що
його виштовхує антипорт на базалатеральну мембрану
парієтальних клітин, які обмінюють НСО3 на інший аніон
в інтерстиційній рідині, здебільшого на СІ . За рахунок від-
току НСО3 у кров шлунок набуває значень негативного
дихального коефіцієнта, - кількість СО2 в артеріальній
крові стає більшою, ніж у венозній крові шлунка. Після
приймання їжі простежується підвищення секреції соляної
кислоти, і може секретуватись достатня кількість Н+, спри-
чинюючи підвищення рівня рН у крові та сечі, що стає
більше лужною (транзиторне зменшення кислотності
сечі після приймання їжі).
Секрецію кислоти стимулює гістамін через ^-рецеп-
тори, ацетилхолін через М3 мускаринові рецептори і,
напевно, гастрин через гастринові рецептори на мембранах
парієтальних клітин (рис. 26-12). Рецептори Н2 збільшують
внутрішньоклітинний вміст цАМФ через Сг8, тоді як мус-
каринові гастринові рецептори впливають через збільшен-
ня внутрішньоклітинного вмісту вільного Са2+. Внутріш-
ньоклітинні ефекти взаємодіють так, що активування одно-
го рецептора потенціює відповідь іншого на подразнення.
Простагландини, особливо які належать до класу Е, інгі-
бують секрецію кислоти, активуючи (Зі. І це пояснює част-
ково збільшення випадків виразок у хворих, що приймають
протизапальні лікарські засоби, які інгібують синтез про-
стагландинів.
Гастрин
і
ЕСІ
Рис. 26-12. Регулювання секреції кислоти парієтальними
клітинами шлунка. Секреція кислоти посилюється у разі
впливу ацетилхоліну на М3 мускаринові рецептори і збіль-
шення внутрішньоклітинного Са2+. Крім того, гастрин сти-
мулює секрецію гістаміну ентерохромафіноподібними (ЕСІ_)
клітинами і це є головний шлях, яким гастрин стимулює
секрецію Н+ Гістамін зв’язується з Н2-рецепторами, і через
О8 збільшується активність аденілатциклази (АЦ) і внутріш-
ньоклітинного цАМФ. ПГЕ2 впливає через 6(, зменшуючи
активність аденілатциклази і вміст внутрішньоклітинної цАМФ;
цАМФ і Са2+ через протеїнкінази збільшують транспортування
Н+ у шлунковий простір за участю Н+-К+-АТФ-ази.
454 / РОЗДІЛ 26
ЕСЬ-клітини
Гастрин також стимулює секрецію гістаміну ентерохро-
мафіноподібними (ЕСЬ - з англ. епіегосЬготаїЕш-Ііке
сеііз) клітинами. Ці везикуло- або ґрануловмісні клітини
належать до предомінантного типу ендокринних клітин у
кислотосекретувальній ділянці шлунка. Тепер уже відомий
головний шлях, яким гастрин стимулює секрецію соляної
кислоти через ці клітини. ЕСЬ-клітини мають ацетилхолі-
нові рецептори в додаток до гастринових, однак відносне
значення ацетилхоліну у стимулюванні їхньої секреції ще
остаточно не з’ясоване. Соматостатин інгібує їхню діяль-
ність. ЕСЬ-клітини підлягають гіпертрофії у випадках, коли
секреція соляної кислоти у шлунку пригнічена протягом
тривалого часу.
Моторика шлунка та евакуація їжі зі шлунка
У разі надходження їжі у шлунок дно та верхня частина
шлунка розслаблюються і пристосовують об’єм до незнач-
ного підвищення тиску (рецептивне розслаблення, або
адаптивна релаксація). Потім розпочинається перисталь-
тика у дистальному відділі тіла, змішування та подрібнення
їжі. Невеликі, напіврідкі порції надходять через пілоричну
частину шлунка у дванадцятипалу кишку.
Вплив блукаючого нерва стимулює рецептивну релак-
сацію, яка розпочинається рухами глотки і стравоходу. Пе-
ристальтичні рухи, регульовані БЕР шлунка, швидко роз-
починаються та стрімко поширюються у напрямі до піло-
ричної частини шлунка. Кожна хвиля спричинює скоро-
чення дистальної частини шлунка, інколи їх називають ант-
ральними систолами, і вони можуть тривати понад 10 с.
Такі хвилі простежуються три або чотири рази за хвилину.
У механізмах регулювання евакуації вмісту шлунка,
очевидно, антральна і пілорична частини шлунка та про-
ксимальна частина дванадцятипалої кишки працюють як
єдина система. За скороченнями антральної частини шлун-
ка настають послідовні скорочення пілоричної частини і
дванадцятипалої кишки. В антральній частині особливо
сильні скорочення просовують допереду шлунковий вміст,
затримуючи потрапляння твердих мас у дванадцятипалу
кишку (вони знову змішуються і подрібнюються). Окре-
мими порціями рідший шлунковий вміст надходить наче
струмінь у тонку кишку. У нормі регургітація з дванадця-
типалої кишки не відбувається, оскільки скорочення піло-
ричної частини шлунка схильні тривати дещо довше, ніж
у дванадцятипалій кишці. Попередження регургітації вміс-
ту може також відбуватись унаслідок стимулювального
впливу ХЦК і секретину на пілоричний сфінктер.
Голодні скорочення
Уважають, що скорочення шлунка в періоди між прий-
манням їжі пов’язані з ММК; інколи вони можуть бути від-
чутними і навіть спричинювати помірний біль. Такі голодні
скорочення зумовлюють відчуття болю; колись думали, що
вони є важливим регулятором апетиту. Хоча експеримен-
тальні дослідження свідчать, що приймання їжі є нормаль-
ним у тварин після денервації шлунка та кишки (Розділ 14).
Мозкові впливи
Наявність їжі у ротовій порожнині рефлекторно стиму-
лює шлункову секрецію. Еферентними волокнами цього
рефлексу є блукаючий нерв. Реалізація умовних рефлексів
відбувається через вплив блукаючого нерва на підвищення
шлункової секреції. У людей, наприклад, вигляд, запах,
думки про їжу збільшують шлункову секрецію. Така дія
зумовлена травними умовними рефлексами, що усталю-
ються з раннього періоду життя.
Утворення умовних рефлексів та їхні нейромеханізми
описані у Розділі 16. Подразнення передньої частини
гіпоталамуса та прилеглих частин очноямкових закруток
лобової частки збільшує еферентну активність блукаючого
нерва та шлункову секрецію. Мозкові впливи відповідають
за одну третю (інколи за половину) секреції кислоти у
відповідь на звичайні нормальні харчові продукти.
Вплив емоцій
Психічні стани впливають на шлункову секрецію та мо-
торику, що реалізуються головно через блукаючий нерв.
Вільям Бюмонт виконав визначні спостереження за
А.Ст.Мартіном з Канади, який мав тривалу фістулу шлунка
внаслідок проникаючого вогнепального поранення, і заува-
жив, що гнів та ворожість супроводжувані тургором, гіпе-
ремією та гіперсекрецією у шлунковій слизовій. Подаль-
ші спостереження зроблені й на інших хворих зі шлунко-
вими фістулами. З’ясовано, що страх і депресія зменшують
шлункову секрецію, кровопостачання та інгібують шлун-
кову моторику.
Вплив шлунка
їжа, що надійшла в шлунок, збільшує шлункову сек-
рецію, зумовлювану виглядом і запахом їжі та наявністю
їжі у ротовій порожнині (рис. 26-13). Рецептори стінки
шлунка та слизової оболонки відповідають на розтяг та
хімічне подразнення головно амінокислотами і спорідне-
Базальна
поігпоиіа Час після приймання їжі, год
мСіхрСЦІл 1
Рис. 26-13. Динаміка секреції кислоти у шлунку людини після
приймання м’ясної їжі (відтворено за дозволом з Вгоокз ЕР:
Іпіедгаііуе Іесіиге: Пезропзе ої іііе 6І ігасі іо а тезі. СІпсІег-
дгасіиаіе Теасїііпд Ргсуесі. Атегісап базігоепіегоіодісаі Аззо-
сіаііоп, 1974).
МЕХАНІЗМИ РЕГУЛЮВАННЯ ШЛУНКОВО-КИШКОВИХ ФУНКЦІЙ / 455
ними продуктами травлення. Волокна від рецепторів пря-
мують до підслизового сплетення, де містяться тіла клітин
рецепторних нейронів. Вони утворюють синапси на пост-
гангліонарних парасимпатичних нейронах, що закінчують-
ся на парієтальних клітинах, і стимулюють секрецію. Отже,
відповідь (утворення кислоти) продукована місцевим реф-
лексом, у якому рефлекторна дуга є повністю всередині
стінки шлунка. Постгангліонарні нейрони місцевої реф-
лекторної дуги такі ж, як і ті, що їх іннервують низхідні
вагусні прегангліонарні нейрони з головного мозку, які
зумовлюють мозкову фазу секреції. Продукти травлення
білків теж стимулюють збільшення секреції гастрину і
збільшують кислотопродукування.
Регулювання шлункової секреції
Регулювання моторики та секреції у шлунку відбува-
ється із залученням нейрогуморальних механізмів. Нер-
вове регулювання представлене місцевими автономними
рефлексами, у тім числі холінергічними нейронами та пе-
редаванням імпульсів з ЦНС блукаючим нервом. Гумораль-
ні компоненти забезпечені гормонами, які описані вище.
Подразнення блукаючого нерва збільшує секрецію гаст-
рину завдяки вивільненню гастрин-рилізинг пептиду (див.
вище). Інші волокна блукаючого нерва вивільняють аце-
тилхолін, який безпосередньо впливає на клітини залоз тіла
і дна, збільшуючи секрецію соляної кислоти та пепсинів.
Подразнення шийного або грудного частин блукаючого
нерва збільшує секрецію кислоти і пепсину, проте вагото-
мія не блокує секреторну відповідь на місцевий подразник.
Для зручності фізіологічне регулювання шлункової
секреції звичайно характеризують у термінах мозковий,
шлунковий та кишковий вплив, хоча вони перекриваються.
Мозкові впливи - це опосередковані блукаючим нервом
відповіді внаслідок активності ЦНС. Шлунковий вплив
- це первинні місцеві рефлекторні відповіді та відповідь
на вплив гастрину. Кишковий вплив - це рефлекс та гор-
мональний ефект за механізмом зворотного зв’язку шлун-
кової секреції, розпочатий зі слизової тонкої кишки.
Вплив кишки
Незважаючи на те, що гастринопродукувальні клітини
містяться у слизовій тонкої кишки, як і в шлунку, введення
амінокислот безпосередньо у дванадцятипалу кишку не
підвищує рівня циркулювального гастрину. Жири, вуг-
леводи та кислота у дванадцятипалій кишці інгібують
секрецію шлункової кислоти і пепсину та шлункову мото-
рику за допомогою нейрогуморальних механізмів. Роль
ентерогастрону - кишкового гормону, що відповідає за інгі-
бування шлункової кислоти, - остаточно не з’ясована.
Можливо, цс буде пептид ¥¥ (див. вище). Секреція шлун-
кової кислоти збільшується в разі наступного видалення
великої частини тонкої кишки. Гіперсекреція, яка пропор-
ційна ступеню кількості видаленої кишки, можливо, настає
внаслідок руйнування джерела гормонів, що інгібують сек-
рецію кислоти.
ІНШІ впливи
Гіпоглікемія впливає через головний мозок га еферент-
ний блукаючий нерв, що стимулює секрецію кислоти і
пепсину. Іншими стимуляторами є алкоголь та кофеїн,
які безпосередньо впливають на слизову. Невеликі кіль-
кості алкоголю корисно впливають на травлення внаслідок
стимулювання шлункової секреції, що відомо ще зі старо-
давніх часів.
Регулювання шлункової моторики та
евакуювання
Евакуювання вмісту зі шлунка відбувається залежно від
якості спожитих харчових продуктів. їжа, багата на вугле-
води, виходить зі шлунка через декілька годин, білкова їжа
- повільніше, а евакуювання зі шлунка жирної їжі - ще
повільніше (рис. 26-14). Швидкість випорожнення також
залежить від осмотичного тиску хімусу, що надходить у
дванадцятипалу кишку. Гіперосмолярність дуоденального
вмісту аналізують осморецептори дванадцятипалої кишки,
які ініціюють сповільнення шлункової евакуації, що її
виконує нервова система.
Продукти травлення білків та йони гідрогену, що оми-
вають слизову дванадцятипалої кишки, розпочинають
шлункову моторику - ентерогастральний рефлекс. Роз-
тягнення дванадцятипалої кишки також ініціює цей реф-
лекс. Пептид ¥¥ інгібує шлункову моторику. У людей
ваготомія може часто спричинювати виражену атонію та
розтягнення шлунка. Збудження чи хвилювання прискорює
випорожнення шлунка, а страх - сповільнює.
Оскільки жири особливо ефективні для гальмування
випорожнень шлунка, то дехто п’є молоко, вершки або
оливкову олію чи їсть вершкове масло перед уживанням
алкогольних коктейлів. Жири затримують алкоголь у
шлунку триваліший час, у такий спосіб і відтерміновується
їхня абсорбція у тонкій кишці. Речовини, що спричинюють
інтоксикацію, потрапляють у тонку кишку поволі, устале-
ними порціями. Так, принаймні теоретично, раптове під-
вищення концентрації алкоголю в крові і як закономірний
результат - обтяжливу інтоксикацію, можна подолати.
Рис. 26-14. Вплив білків та жирів на швидкість евакуювання
зі шлунка людини. Особи спожили 300 мл рідкої їжі
(відтворено за дозволом з Вгоокз ЕР: Іпіедгайуе Іесіиге: Ре-
зропве оПйе (ЗІ ігасНо а тезі. ІІпсІегдгасІиаіе Теасґііпд Ргоіесі.
Атегісап (ЗазігоепіегоІодісаІ Аззосіаііоп, 1974).
456 / РОЗДІЛ 26
Пептична виразка
Виникнення шлункових і дуоденальних виразок та
ерозій у людей передусім пов’язане з порушенням бар’єра,
який за нормальних умов попереджує подразнення та
самоперетравлення слизової шлунковим секретом. Інфі-
кування бактеріями НеІісоЬасіегруїогі спричинює деструк-
цію цього бар’єру. Так діє аспірин та інші НСПЗП, які над-
звичайно широко використовують як знеболювальне і для
лікування артритів. Додатковою причиною ульцерації є
тривалий надлишок кислоти. Приклад цього типу -
виразки, що простежуються у випадку синдрому Золлін-
ґера-Еллісона. Цей синдром характерний для хворих з
гастриномами. Такі пухлини трапляються у шлунку та два-
надцятипалій кишці, однак найбільше їх знаходять у під-
шлунковій залозі. Гастрин спричинює гіперсекрецію кис-
лоти і появу важких виразок. Як звичайно, підвищена сек-
реція кислоти наявна у всіх хворих з виразками дванадця-
типалої кишки та препілоричної частини шлунка (немає
кислоти - немає виразки).
Речовини, які застосовують для симптоматичного ліку-
вання виразок, зумовлюють гальмування кислотосекреції
та підвищення резистентності слизової до кислоти. Різно-
маніття відмінних антацидів, більшість із яких вміщує
алюміній гідроксид, магній гідроксид або кальцій бікар-
бонат, є доступними. Блокада Н2 гістамінових рецепторів
за допомогою лікарських засобів Н2 блокаторів, таких як
циметидин, ранітидин, нізатидин і фамотидин, ефективно
зменшує кислотну секрецію, оскільки вони вилучають
потенційний ефект подразнення цих рецепторів у від-
повідь надію інших подразників (див. вище). Мускаринові
рецептори можна блокувати атропіном або новими специ-
фічнішими антихолінергічними засобами. Шлункова Н+-
К+-АТФ-аза може бути інгібована омепразолом. Сукраль-
фат, основна алюмінієва сіль цукрози октасульфату,
збільшує резистентність слизової до кислоти перш за все
завдяки утворенню прикріплених білків та інших ком-
плексів до місця виразки, вона також ефективна в ліку-
ванні виразок.
Використання блокаторів Н2-рецепторів та омепразолу
дало змогу зменшити потребу в хірургічному лікуванні
виразок. Крім того, важкі дуоденальні та препілоричні
виразки інколи лікують ваготомією в комбінації з видален-
ням гастриносекретувальної слизової антральної частини
шлунка. Довготривале лікування омепразолом спричинює
утворення в ЕСЬ-клітинах карциноїдних пухлин у щурів.
У людей тільки незначно збільшується кількість гастрину
в плазмі, проте карциноми не виявлені.
Сучасні дослідження причин пептичних виразок покли-
кані з’ясувати проникаючу роль інфекції Н. руїогі. Ера-
дикацію (знищення) Н. руїогі забезпечують призначенням
антибіотиків. Хворі з виразкою шлунка і дванадцятипалої
кишки, які приймають НСПЗП, повинні припинити вжи-
вати їх або, якщо це неможливо, продовжити лікування
довгодіючими агоністами ПГЕ, такими як мізопростол.
Гастриноми потрібно видаляти хірургічно.
Інші функції шлунка
Крім депонування їжі та регулювання надходжень її у
дванадцятипалу кишку, шлунок виконує ще декілька
функцій.
Парієтальні клітини шлункової слизової, крім соляної
кислоти, секретують внутрішній фактор, 49 кДа глікопро-
теїн, що зв’язує ціанокобаламін (вітамін В12), потрібний
для всмоктування у тонкій кишці. Ціанокабаламін (рис. 26-
15) - це комплексний кобальтовмісний вітамін, що його
синтезують мікроорганізми. Неадекватна абсорбція цього
вітаміну спричинює анемію, що супроводжується появою
у кров’яному руслі великих примітивних попередників
еритроцитів, які називають мегалобластами, та ушкоджен-
ням певних сенсорних шляхів у ЦНС. Повна ремісія дефі-
цитного синдрому настає в разі парентерального введення
ціанокобаламіну, однак не у випадку споживання рег оз,
оскільки внутрішній фактор секретований слизовою обо-
лонкою шлунка. Дефіцит унаслідок неадекватного харчо-
вого приймання ціанокабаламіну рідкісний, оскільки ден-
ний необхідний мінімум низький, і вітамін міститься у біль-
шості харчових продуктів тваринного походження. Дефі-
цитні стани виявляються клінічно, тому першочергово
потрібно думати про дефект абсорбції ціанокобаламіну.
Неадекватна абсорбція може бути внаслідок первинних
захворювань кишки, таких як спру або дефіцит внутріш-
нього фактора. Це трапляється після гастректомії або коли
парієтальні клітини зруйновані хворобою. У разі перніці-
озної анемії парієтальні клітини є мішенями для авто-
імунної деструкції (автоімунний гастрит) або порушені
хронічною бактеріальною інфекцією слизової оболонки
(неавтоімунний гастрит).
Рис. 26-15. Ціанокоболамін (вітамін В12). Емпірична формула
^63^88^14^14^^°-
МЕХАНІЗМИ РЕГУЛЮВАННЯ ШЛУНКОВО-КИШКОВИХ ФУНКЦІЙ / 457
Комплекс внутрішній фактор-ціанокобаламін потім
зв’язується зі специфічними рецепторами у клубовій кишці
й абсорбується ендоцитозом. В ентероцитах ціанокобала-
мін переміщається із зовнішнього фактора до транскоба-
ламіну II, іншого ціанокобаламінозв’язаного білка, який
транспортує його у плазму.
У хворих з тотальною гастректомією дефіциту внут-
рішнього фактора можна уникнути парентеральним уве-
денням ціанокобаламіну. Травлення білків є нормальним
без пепсинів, і живлення може бути збереженим. Крім того,
ці хворі схильні до розвитку залізодефіцитної анемії (див.
Розділ 25) та інших аномалій, тому вони повинні їсти часто
і невеликими порціями. Оскільки швидке всмоктування
глюкози з кишки і, як наслідок, гіперглікемія різко збільшує
секрецію інсуліну, то у хворих з гастроектомією інколи роз-
вивається гіпоглікемічний симптом через 2 год після прий-
мання їжі (див. Розділ 19).
Слабість, запаморочення, пітливість після приймання
їжі, що є частиною гіпоглікемії, створюють картину
демпінґ-синдрому, дистрес-синдрому, що виникає у
пацієнтів, у яких частини шлунка видалені, або голодна
кишка анастомозована зі шлунком. Іншою причиною
симптомів є швидке потрапляння гіпертонічного хімусу
до кишки, що провокує переміщення більшої кількості
води до кишки так, що виникає значна гіповолемія та
гіпотензія.
регулює частково рефлекторний механізм і частково гаст-
роінтестинальні гормони секретину та ХЦК.
Анатомічні особливості
Частина підшлункової залози, що секретує підшлунко-
вий сік, складається з альвеолярної тканини, що подібна
до слинних залоз. Гранули вміщують травні ензими (зимо-
генні гранули), які утворюються у клітинах і які вивільняє
екзоцитоз (див. Розділ 1) з верхівок клітин у просвіт пан-
креатичних проток (рис. 26-16). Міжчасточкові вивідні
протоки об’єднуються у загальну вивідну протоку (протока
Вірсунга), яка звичайно з’єднується із загальною жовчною
протокою, утворюючи печінково-панкреатичну ампулу
Фатера (рис. 26-17). Ампула відкривається через дуоде-
нальну пипку, і її устя оточене сфінктером Одді. У деяких
осіб є додаткова панкреатична протока (протока Санторі-
ні), яка долучується до дванадцятипалої кишки прокси-
мальніше.
Склад підшлункового соку
Підшлунковий сік має лужну реакцію (табл. 26-6),
оскільки вміщує високу концентрацію НСО3 (приблизно
113 мекв/л, у плазмі - 24 мекв/л). Понад 1500 мл підшлун-
кового соку секретовано щодня. Жовч та кишковий сік
також є нейтральними або лужними і разом ці три секрети
нейтралізують шлункову кислотність, збільшуючи рН дуо-
ЕКЗОКРИННА ЧАСТИНА ПІДШЛУНКОВОЇ
ЗАЛОЗИ
Підшлунковий сік уміщує ензими, які мають важливе
значення для травлення (див. табл. 25-1). Його секрецію
Таблиця 26-6. Склад підшлункового соку у нормі
Катіони- Ма+, К+, Са2+, Мд2+ (рН близьке до 8,0)
Аніони: НСО3-, СГ, 8О42-, НРО42-
Травні ензими (див. табл. 25-1; 95% білків у соці)
Інші білки
Рис. 26-16. Ацинозні клітини, що оточують кінцеву частину панреатичних проток. Зверніть увагу на багату ґранулярну (шорстку)
ендоплазматичну сітку та ґранули зимогену, що концентровані на верхівках клітин (відтворено за дозволом з Кгвііс П\/: Оіе
СєууєЬє сіев Мепзсґіеп ипсі сіег Заидеііеге. Зргіпдег, 1978).
458 / РОЗДІЛ 26
жовчної протоки кишка
Рис. 26-17. З’єднання проток жовчного міхура, печінки та під-
шлункової залози (відтворено за дозволом з ВеІІ ОН, Етзііе-
Зтіїґі О, Раіегзоп СР. ТехіЬоок ої Рііузіоіоду апсі Віосіїетіз-
ігу, 91Н есі. СґіигсґііІІ Імпдвіопе, 1976).
денального вмісту до 6,0-7,0. На момент надходження
хімусу у голодну кишку кислотно-лужна реакція стає май-
же нейтральною, проте інтестинальний вміст зрідка буває
лужним.
Потужні білковорозщеплювальні ензими панкреатич-
ного соку секретовані як неактивні проензими. Трипсино-
ген перетворюється в активний ензим трипсин за допомо-
гою ензиму посмугованої облямівки ентеропептидази (ен-
терокінази) в разі надходження панкреатичного соку у
дванадцятипалу кишку. Ентеропептидаза вміщує 41% по-
лісахаридів, і такий високий вміст полісахаридів поперед-
жує його самоперетравлення перш ніж він може вплину-
ти. Трипсин перетворює хімотрипсиногени у хімотрипси-
ни, а інші проензими в активні ензими (рис. 26-18). Він
також може активувати трипсиноген; однак утворюється
тільки один трипсин і це є автокаталітична ланцюгова ре-
акція. Дефіцит ентеропептидази трапляється як вроджена
аномалія і призводить до білкового порушення харчування.
Безперечно, потенційно небезпечним є вивільнення у
підшлункову залозу малих порцій трипсину. Внаслідок
ланцюгових реакцій можуть активізуватися активні ензи-
ми, здатні до самоперетравлення підшлункової залози,
тому не випадково підшлункова залоза у нормі вміщує
інгібітор трипсину.
Іншим ензимом, що активує трипсин, є фосфоліпаза А .
Цей ензим розщеплює жирні кислоти від лецитину, утво-
рюючи лізолецитин, який ушкоджує клітинні мембрани.
Є гіпотеза, що в разі гострого панкреатиту, важкого, а
інколи фатального захворювання, фосфоліпаза А2 активує
панкреатичні протоки до утворення лізолецитину з леціти-
ну, який у нормі є складовим компонентом жовчі. Це спри-
чинює розрив тканини підшлункової залози і некроз нав-
колишньої жирової тканини.
Проензим Ензим
Ентеро-
пептидаза
Трипсиноген-----------► Трипсин
Хімотрипсиногени------------► Хімотрипсини
Трипсин
Проеластаза------------► Еластаза
Трипсин
Прокарбоксипептидази-----------► Карбоксипептидази
Трипсин
Рис. 26-18. Активування панкреатичних протеаз у дванад-
цятипалій кишці
Невеликі кількості панкреатичних травних ензимів
потрапляють у кровообіг, однак у разі гострого панкреа-
титу рівень травних ензимів, що циркулюють у крові,
значно підвищується. Вимірювання концентрації амілази
або ліпази плазми є діагностичним критерієм захворю-
вання.
Регулювання секреції підшлункового соку
Секрецію підшлункового соку початково регулюють
гуморальні механізми. Секретин впливає на панкреатичні
протоки, спричинюючи значну секрецію лужного підшлун-
кового соку, багатого на НСО3 і бідного на ензими. Вплив
на клітини проток виявляється у збільшенні внутріш-
ньоклітинної цАМФ. Секретин також стимулює секрецію
жовчі. ХЦК діє на ацинарні клітини, спричинюючи вивіль-
нення гранул зимогену й утворення підшлункового соку,
багатого на ензими, однак невеликого об’єму. Цей вплив
стимулює фосфоліпаза С (див. Розділ І).
Відповідь на внутрішньовенне введення секретину
зображена на рис. 26-19. Зверніть увагу, що об’єм підшлун-
кового соку збільшується, концентрація СІ у ньому змен-
шується, а концентрація НСО3 збільшується. Хоча НСО3
секретують малі протоки, проте реабсорбування відбува-
ється у великих протоках в обмін на СІ . Інтенсивність
обміну протилежно пропорційна до швидкості, з якою виті-
кає підшлунковий сік.
Подібно до ХЦК ацетилхолін впливає на ацинарні клі-
тини через фосфоліпазу С, сприяючи вивільненню гранул
зимогену, а стимулювання блукаючого нерва спричинює
секрецію невеликої кількості підшлункового соку, багатого
на ензими. Це є свідченням умовного рефлексу, забез-
печуваного блукаючим нервом у відповідь на вигляд або
запах їжі.
Епітелій малих вивідних проток підшлункової залози
містить багато СЕТКз (див. Розділ І). Зв’язок СЕТКз з
секрецією НСО3 остаточно невідомий, однак у разі цис-
тичного фіброзу (муковісцидозу) вміст НСО3 та об’єм
панкреатичного соку зменшуються, а кількість випадків
хронічних панкреатитів збільшується.
МЕХАНІЗМИ РЕГУЛЮВАННЯ ШЛУНКОВО-КИШКОВИХ ФУНКЦІЙ / 459
Секретин 12,5 одиниць/кг IV
Об’єм І
Час, хв
Рис. 26-19. Вплив одноразової дози секретину на склад та
об’єм підшлункового соку в людей (модифіковано і відтво-
рено за дозволом з ^по\л/іЇ7 НО: Рапсгеаііс зесгеіуоп. РГіузіоІ
РІіуєісіапз [N07] 1964;2:11).
(клітини Купфера) фіксовані до ендотелію гемокапілярів
синусоїдного типу і виступають у просвіт. Детально функ-
ції цих клітин описані у Розділі 27.
Іншим поглядом на будову печінки є її поділ на печінкові
ацинуси. Відповідно до детального опису у Розділі 32
кровообігу печінки, центром кожного ацинуса є судинна
ніжка, що вміщує кінцеві розгалуження порожнистої вени,
печінкових артерій та жовчних проток (див. рис. 32-16).
Кров відтікає від судинної ніжки до кінцевих печінкових
венул, які містяться зовні від ацинуса. Отже, клітини, що
найближче розташовані до судинної ніжки, отримують
добре оксигеновану кров, а клітини на периферії ацинуса
- найменше оксигеновані, тому найімовірніше для них
гіпоксичне пошкодження.
Кожна печінкова клітина також з’єднана з декількома
жовчними капілярами (рис. 26-21). Вони впадають у
міжчасточкові жовчні протоки, які сполучені і утворюють
праву та ліву печінкові протоки. Ці протоки з’єднані поза
печінкою й формують загальну печінкову протоку. Від
жовчного міхура відходить міхурова протока. Печінкова
протока об’єднується з міхуровою протокою, утворюючи
загальну жовчну протоку, яка впадає у дванадцятипалу
кишку біля дуоденального сосочка. Його устя, оточене
сфінктером Одді, у нормі об’єднується з головною пан-
креатичною протокою безпосередньо перед входом у два-
надцятипалу кишку (див. рис. 26-17).
Стінки позапечінкових біліарних проток і жовчний
міхур містять фіброзну тканину та гладкі м’язи. Слизові
оболонки вміщують слизові залози і вистелені шаром
ПЕЧІНКА ТА БІЛІАРНА СИСТЕМА
Жовч секретують клітини печінки у жовчні протоки, які
впадають до дванадцятипалої кишки. У міжтравний період
у дванадцятипалій кишці більшість проток закриті, жовч
відтікає у жовчний міхур, де нагромаджується. Коли їжа
потрапляє у ротову порожнину, сфінктери навколо устів
розслаблені. Якщо шлунковий вміст потрапляє у дванад-
цятипалу кишку, то гормон слизової кишки ХЦК спричи-
нює скорочення жовчного міхура.
Анатомічні особливості
Печінка складається з часточок, через які кров протікає,
минаючи гепатоцити та синуси, до гілок портальних вен
від центральної вени з кожної часточки. Між ендотеліо-
цитами міститься велика кількість отворів, і плазма близько
контактує з гепатоцитами (рис. 26-20). У нормі є лише один
шар гепатоцитів між гемокапілярами синусоїдного типу,
тому загальна площа контакту між печінковими клітинами
і плазмою велика. Кров через печінкову артерію надходить
у гемокапіляри синусоїдного типу. Центральні вени з’єд-
нуються, утворюючи печінкові вени, які прямують до ниж-
ньої порожнистої вени. Кровоплин у печінці детальніше
описаний у Розділі 32. Середній транзитний час для крові
через печінкову часточку з портальної венули до централь-
ної вени печінки становить 8,4 с. Численні макрофаги
Клітина Купфера
Печінковий синусоїд
Рис. 26-20. Гепатоцит. Зверніть увагу на зв’язок клітини з
жовчним капіляром і синусами. Зауважте також, які широкі
отвори між ендотеліальними клітинами, наступні після гепа-
тоцитів (відтворено за дозволом з Еа\л/сей О\Л/ ВІоот апсі
Ра\л/сей, 8 ТехїЬоок ої Нієіоіоду, 11111 есі. Заипсіегє, 1986).
460 / РОЗДІЛ 26
циліндричних клітин. У жовчному міхурі слизова оболон-
ка виражено складчаста, це збільшує її поверхневу площу
і надає внутрішньому простору жовчного міхура вигляду
стільників. У приматів слизова оболонка жовчного міху-
ра також складчаста й утворює так звані спіральні засло-
ни.
Печінковий
порожнистої вени
Рис. 26-21. Угорі: структурна організація печінки; ЦВ - цент-
ральна вена; ПП - портальний простір, що вміщує розгалу-
ження жовчної протоки, порожнинної вени та печінкової арте-
рії. Внизу: порядок розташування гепатоцитів, синусоїдів і
жовчних проток у печінковій часточці, який показує доцент-
ровий плин крові з синусоїдів до центральної вени і відцент-
ровий плин жовчі з жовчних капілярів у жовчні протоки (від-
творено за дозволом з Ра\л/сей ВІоот апсі РамсеИ, 8
ТехіЬоок оТ Нівіоіоду, 11ііі есі. Заипсіегв, 1986)
Функції печінки
Печінка - це найбільша залоза в організмі, яка виконує
цілий комплекс функцій (табл. 26-7). Деякі з них описані у
цьому розділі, інші - в окремих розділах інших систем,
частиною яких вони є.
Синтез білків плазми
Головні білки, що їх синтезує печінка, наведені у табл.
27-10. Багато з них належать до білків гострої фази - біл-
ків, синтезування та секретування яких відбувається у плаз-
мі під впливом виражених подразників. Інші білки транс-
портують стероїди та деякі гормони у плазмі, а також фак-
тори зсідання крові.
Жовч
Складовими частинами жовчі є жовчні солі, жовчні піг-
менти та інші речовини, розчинені у лужному електро-
літному розчині, подібному до підшлункового соку (табл.
26-8). Щодня секретується близько 500 мл жовчі. Деякі
компоненти жовчі реабсорбуються у кишці, а потім їх
екскретує знову печінка (ентерогепатична циркуляція).
Глюкороніди жовчних пігментів - білірубін та білі-
вердин - відповідають за золотисто-жовтий колір жовчі.
Утворення цих продуктів розпаду гемоглобіну детально
описано у Розділі 27, а їхня екскреція - нижче.
Жовчні солі - це натрієва та калієва солі жовчних кис-
лот, вони секретуються у жовч і кон’югують з гліцином
або таурином, похідним цистеїну. Жовчні кислоти син-
тезуються з холестеролу. У людини їх відомо чотири (рис.
26-22). Звичайно з вітаміном В, холестеролом, різними
стероїдними гормонами, глікозидами дигіталісу жовчні
кислоти містять циклопентанопергідрофенантренове ядро
(див. Розділ 20). Дві головні (первинні) жовчні кислоти,
Таблиця 26-7. Головні функції печінки1
Утворення та секреція жовчі (26)
Участь у метаболізмі поживних речовин та вітамінів
(17, 27)
Глюкоза й інші цукри
Амінокислоти
Ліпіди
Жирні кислоти
Холестерол
Ліпопротеїн
Жиророзчинні вітаміни
Водорозчинні вітаміни
Інактивація різноманітних речовин
Токсини (17)
Стероїди (20, 23, 26)
Інші гормони (14, 18)
Синтез білків плазми (26, 27; див. табл. 27-10)
Білки гострої фази
Альбумін
Фактори зсідання крові
Білки, що зв’язуються зі стероїдами та іншими
гормонами
Створення імунітету
Клітини Купфера
1 Числа в дужках означають розділ нашої книги, в якому
описані ці функції.
МЕХАНІЗМИ РЕГУЛЮВАННЯ ШЛУНКОВО-КИШКОВИХ ФУНКЦІЙ / 461
Таблиця 26-8. Склад жовчі печінкової протоки у людини
Вода 97,0%
Жовчні солі 0,7%
Жовчні піґменти 0,2%
Холестерин 0,06%
Неорганічні солі 0,7%
Жирні кислоти 0,15%
Ліцетин 0,1%
Жир 0,1%
Лужна фосфатаза
ОН
групи
Пептидні
зв’язки
Карбо-
ксильні
групи
що утворюються у печінці, - холевата хенодезоксихолева.
В ободовій кишці бактерії конвертують холеву кислоту до
дезоксихолевої, а хенодезоксихолеву - до літохолевої.
Оскільки вони утворюються після впливу бактерій, то
дезоксихолеву та літохолеву кислоти називають вторин-
ними жовчними кислотами.
Солі жовчних кислот чинять декілька важливих впливів,
а також зменшують поверхневий натяг. Під час кон’югації
з фосфоліпідами та моногліцеридами жовчні солі відпові-
дають за емульгацію жирів, яка підготовлює їх до пере-
травлення та абсорбції у тонкій кишці (див. Розділ 25).
Жовчні солі - це амфіпатичні сполуки, які мають обидва
домени: як гідрофільний, так і гідрофобний. Одна поверхня
молекули гідрофільна, оскільки наявні полярний пептид-
ний зв’язок і карбоксильні та гідроксильні групи на їхній
поверхні, тоді як інша поверхня - гідрофобна. Тому жовчні
кислоти схильні утворювати циліндричні диски, які нази-
вають міцелами, з гідрофільною поверхнею назовні та
гідрофобною поверхнею досередини (рис. 26-23). За визна-
ченої концентрації, яку називають критичною концент-
рацією міцел, усі жовчні кислоти, що надходять до роз-
чину, утворюють міцели. Ліпіди нагромаджуються у міце-
Позиція групи
3 Відсоток у
З 7 12 жовчі людини
Холева кислота ОН ОН ОН 50
Хенодезоксихолева кислота ОН ОН Н ЗО
Дезоксихолева кислота ОН Н ОН 15
Літохолева кислота ОН Н Н 5
Рис. 26-22. Жовчні кислоти людини. Числа у формулі для
холевоі кислоти означають позицію стероїдного кільця.
Рис. 26-23. Поперечний переріз змішаної (жовчна кислота-
ліпід) міцели дископодібної форми з вільними жовчними
кислотами та холестеролом у гідрофобному середовищі. По-
верхня кожної жовчної кислоти, повернутої назовні, є гідро-
фільною завдяки полярним петидним зв’язкам і карбо-
ксильним та ОН-групам.
лах з холестеролом у гідрофобному центрі, а амфіпатичні
фосфоліпіди і моногліцериди простягають гідрофільні
голівки назовні, а гідрофобні хвости - до центру. Міцели
відіграють важливу роль в утримуванні ліпідів у розчині й
транспортуванні їх до посмугованої облямівки на інтес-
тинальних епітеліальних клітинах, де вони абсорбуються
(див. Розділ 25).
У тонкій кишці абсорбується 90-95% жовчних солей:
частина - нейонною дифузією, однак більшість (рис. 26-
24) - за допомогою ефективної №+-жовчносольової сис-
теми котранспортування базолатеральноїМа'-К-АТФ-ази
з термінальної частини клубової кишки, що подібно до \а+-
глюкоза системи перенесення (див. Розділ 25). Один з ]Ча+-
жовчносольових котранспортерів, що залучений у систему
вторинного активного транспортування, вже клоновано і
це є доказом про наявність інших.
Решта 5-10% жовчних кислот потрапляють до клубової
кишки і конвертуються у солі дезоксихолевої та літохолевої
кислоти. Літохолати порівняно нерозчинні, більшість з них
екскретується у калові маси і тільки 1% абсорбується.
Абсорбовані жовчні кислоти транспортують порожнис-
тою веною назад до печінки і реекскретуються у жовч
(ентерогепатична циркуляція). Ту кількість, що втрачається
зі стільцем, надолужує синтез у печінці, нормальний рівень
синтезу становить 0,2-0,4 г/л. Загальний пул жовчних кис-
лот, що повторно рециклюють через ентерогепатичну цир-
куляцію, становить близько 3,5 г. Уважають, що суцільний
пул рециклює двічі на кожне приймання страви, і щоденно
це становить шість-вісім разів. У випадках, коли жовч не
потрапляє до кишки, понад 50% спожитого жиру з’явля-
ється у калових масах. Таким шляхом абсорбуються жиро-
розчинні вітаміни. Коли реабсорбція жовчних солей
неможлива внаслідок резекції термінальної частини клу-
бової кишки або хворобливих станів у ній, то кількість
жиру у калових випорожненнях збільшується, оскільки в
разі порушення ентерогепатичної циркуляції печінка не
може збільшити рівень синтезу жовчних солей у кількості,
потрібній для компенсації щоденних втрат. Інші наслідки
резекції термінальної частини клубової кишки описані у
частині про мальабсорбцію.
462 / РОЗДІЛ 26
Клубова
кишка
Печінка
95% за день
Жовчний міхур
0,2 г/день
Портальна
система
г олодна
кишка
Холестерол
0,2 г/день
Жовчні солі (пул = 3,5 г)
Рис. 26-24. Ентерогепатична циркуляція жовчних кислот. Су-
цільні лінії, що проникають у портальну систему, позначають
жовчні кислоти печінкового походження, а штрихові - жовчні
кислоти, що утворилися внаслідок впливу бактерій.
Метаболізм та екскреція білірубіну
Більшість білірубіну організму утворюється з продуктів
розпаду гемоглобіну (див. Розділ 27). Білірубін сполу-
чається з альбуміном у системі кровообігу. Частина його
зв’язана нерозривно, однак більшість надходить у печінку,
де вільний білірубін потрапляє у гепатоцити і зв’язується
з цитоплазматичними білками (рис. 26-25). Наступним
кроком є кон’югація з глюкуроновою кислотою у реакції,
каталізованій ензимом глюкуронілтрансферазою (УДФ-
глюкуронілтрансферазою). Цей ензим міститься головно
у гладкій ендоплазматичній сітці. Кожна молекула білі-
рубіну реагує з двома молекулами уридиндифосфоглюку-
ронової кислоти (УДФГК), утворюючи диглюкуронід білі-
рубіну. Вважають, що цей глюкуронід, який є водороз-
чинним більше, ніж вільний білірубін, активно транспор-
тується проти концентраційного градієнта у жовчні капі-
ляри. Невелика кількість білірубінглюкуроніду потрапляє
у кров, де зв’язується менш щільно з альбуміном, потім -
з білірубіном і екскретується у сечу. Отже, загальний білі-
рубін плазми у нормі містить вільний білірубін і невелику
кількість кон’югованого білірубіну. Більша частина білі-
рубінглюкуроніду потрапляє через жовчні протоки у
кишку.
Слизова кишки порівняно непроникна для кон’юго-
ваного білірубіну, однак проникна для некон’югованого
білірубіну й уробіліногенів, групи безколірних похідних
білірубіну, утворених впливом бактерій у кишці. Очевидно,
що частина жовчних пігментів та уробіліногени реабсор-
буються у портальний кровообіг. Деякі реабсорбовані
речовини знову екскретує печінка (ентерогепатична цир-
куляція), проте невеликі кількості уробіліногенів потрап-
ляють у велике коло кровообігу і виходять сечею.
Жовтяниця
Коли вільний або кон’югований білірубіни нагромад-
жуються у крові, то шкіра, склери та слизові оболонки ста-
ють жовтими. Таке пожовтіння відоме як жовтяниця і за
нормальних умов виявляється в разі збільшення загального
білірубіну плазми понад 2 мг/дл (34 ммоль/л). Гіпербілі-
рубінемія може бути спричинена надлишковим утворенням
білірубіну (гемолітична анемія тощо); зменшенням погли-
нання білірубіну гепатоцитами; порушенням внутрішньо-
клітинного зв’язування білків або кон’югації; порушенням
секреції кон’югованого білірубіну у жовчні капіляри; внут-
рішньопечінковою або позапечінковою обструкцією жовч-
них проток. За наявності одного з перших трьох процесів
рівень вільного білірубіну збільшується. У випадку пору-
шення секреції кон’югованого білірубіну чи обструкції
жовчних проток глюкуронід білірубіну регургітує у кров, і
це супроводжується домінуванням підвищення рівня
Інші речовини, кон’юговані з
глюкуронілтрансферазою
Система глюкуронілтрансферази у гладкій ретикулярній
сітці каталізує, окрім білірубіну, утворення глюкуронідів
різноманітних речовин. До них належать стероїди (див.
Розділ 20 і 23) та різноманітні лікарські засоби. Ці різні
сполуки можуть конкурувати з білірубіном за ензимну сис-
тему, якщо вони наявні у значимих кількостях. Крім того,
деякі барбітурати, антигістамінні, антиконвульсанти та
інші сполуки спричинюють помітну проліферацію гладкої
Альбумінозв’язаний
білірубін
Плазма ||
Білірубін + Альбумін
Гепато- Білірубін + Б <-------- Білірубін Р
цит
2 УДФГК
Глюкуронат-
трансфераза
Білірубінодиглюкуронід + УДФ
1 ф___________________________________
Жовч Білірубінодиглюкуронід
Рис. 26-25. Метаболізм білірубіну у печінці; Б - внутрішньо-
клітинно зв’язазані білки; УДФГК - уридиндифосфоглюкуро-
нова кислота; УДФ - уридиндифосфат.
МЕХАНІЗМИ РЕГУЛЮВАННЯ ШЛУНКОВО-КИШКОВИХ ФУНКЦІЙ / 463
ендоплазматичної сітки в гепатоцитах з конкурентним
збільшенням активності глюкуронілтрансферази печінки.
Фенобарбітурати можна успішно застосовувати для ліку-
вання вроджених захворювань з відносним дефіцитом глю-
куронілтрансферази (тип 2 недостатності УДФ-глюку-
ронілтрансферази).
Інші речовини, що їх екскретує жовч
Холестерол та лужна фосфатаза також екскретуються
у жовч. У хворих із жовтяницею внаслідок внутрішньо- та
позапечінкової обструкції жовчних проток рівень цих двох
речовин у крові підвищується, а дещо менше зростання
простежується в разі жовтяниці, спричиненої необструк-
тивною гепатоцелюлярною хворобою. Гормони кори над-
ниркових залоз та інші стероїди і численні лікарські засоби
екскретують у жовч і згодом реабсорбуються (ентерогепа-
тична циркуляція).
Функції жовчного міхура
У нормі в здорових осіб жовч тече у жовчний міхур.
Доки сфінктер Одді є закритим, у жовчному міхурі відбу-
вається концентрація жовчі завдяки абсорбції води. Ступінь
концентрування відображений збільшенням концентрації
твердих речовин (табл. 26-9): у печінковій жовчі вода
становить 97%, тоді як вміст води у жовчному міхурі -
тільки 89%. Коли жовчні та міхурова протоки затиснуті,
то внутрішньобіліарний тиск підвищується до 320 мм
жовчі за ЗО хв і секреція жовчі припиняється. Проте коли
жовчні протоки зімкнуті, а міхурова протока відкрита, вода
реабсорбується у жовчному міхурі, внутрішньобіліарний
тиск підвищується тільки на 100 мм жовчі за декілька
годин. Ще одна функція жовчного міхура - це ацидифікація
жовчі (див. табл. 26-9).
Регулювання біліарної секреції
З моменту потрапляння їжі у ротову порожнину резис-
тентність сфінктера Одді зменшується. Жирні кислоти та
амінокислоти у дванадцятипалій кишці вивільняють ХЦК,
який спричинює скорочення жовчного міхура. Речовини,
які зумовлюють скорочення жовчного міхура, називають
холекінетики.
Утворення жовчі збільшується в разі подразнення блу-
каючого нерва та впливу гормону секретину, який збільшує
вміст води та НСО3 у жовчі. Речовини, які збільшують
секрецію жовчі, відомі як холеретики. Жовчні солі є
хорошими та важливими фізіологічними холеретиками.
Вони реабсорбуються з кишки саме для інгібування синтезу
нових жовчних кислот, однак, властиво, швидко секре-
туються і відчутно збільшують відтік жовчі.
Таблиця 26-9. Порівняльна характеристика жовчі з
печінкової протоки та міхурової жовчі у людини
Жовч печінкової протоки Міхурова жовч
Відсоток щільних речовин Жовчні солі, ммоль/л рН 2-4 10-20 7,8-8,6 10-12 50-200 7,0-7,4
Вплив холецистектомії
Періодичне вивільнення жовчі з жовчного міхура полег-
шує травлення, проте не є особливо необхідним для цього.
Хворі з холецистектомією мають порівняно нормальне
здоров’я, хоча в них простежується постійне повільне ви-
вільнення жовчі безпосередньо у дванадцятипалу кишку.
З часом жовчні протоки стають дещо дилятовані і виникає
тенденція до збільшення кількості жовчі, що потрапляє у
дванадцятипалу кишку, особливо після приймання їжі.
Хворі після холецистектомії можуть вживати навіть сма-
жені страви, хоча повинні уникати харчових продуктів з
високим вмістом жирів.
Візуалізація жовчного міхура
Дослідження правого верхнього квадранта черевної
порожнини ультразвуковими променями (ультрасоногра-
фія) та комп’ютерною томографією стали найуживаніши-
ми методами візуалізації жовчного міхура та виявлення
каменів у ньому. Оральна холецистографія - також поши-
рений метод. Непроникний для рентгенівських променів
йодовмісний барвник, такий як тетрайодофенолфталеїн,
екскретується у жовч і концентрується в ній у жовчному
міхурі. Коли жовчний міхур містить адекватну концент-
рацію такого барвника, то його можна візуалізувати рент-
генівськими променями. Для визначення здатності жовч-
ного міхура до нормальних скорочень потрібно спожити
їжу, що містить значну кількість жирів. Після вивільнення
ХЦК жовчний міхур скорочується, через ЗО хв розмір його
тіні на рентгенографії у нормі зменшується до однієї тре-
тини від початкового стану. Третім важливим діагнос-
тичним методом захворювань жовчного міхура є ядерна
холецистографія. Після внутрішньовенного введення
похідних імінодіацетичної кислоти, значених технетієм
99м, вони екскретуються в жовч і забезпечують досконалі
якісні зображення жовчного міхура та проток у гамма-
камері.
Жовчні камені
Холелітіаз, або наявність каменів у жовчному міхурі, -
поширене захворювання. Його частота збільшується з
віком. Наприклад, у Сполучених Штатах Америки 20%
жінок і 5% чоловіків у віці між 50 та 65 роками мають
каміння у жовчному міхурі. Розрізняють камені двох типів:
кальційбілірубінатні (пігментні) та холестеролові. У Європі
та Північній Америці 85% усіх каменів холестеролового
походження.
У формуванні холестеролових каменів розрізняють три
найважливіші фактори. Перший - безсумнівно, застій жов-
чі. Камені швидше утворюються у жовчі, яка концен-
трується у жовчному міхурі, ніж у тій, що протікає у жовч-
них протоках. Другим фактором є перенасичення жовчі
холестеролом. Майже нерозчинний у воді холестерол у
жовчі утримується в міцелах тільки за певної концентрації
жовчних солей та лецитину (рис. 26-26). У разі перенаси-
чення жовчі холестеролом (див. рис. 26-26, у випадку кон-
центрації понад лінію АВС), окрім міцел, простежуються
невеликі кристали холестеролу. Крім того, у багатьох
практично здорових осіб, у кого ще не утворились камені
в жовчному міхурі, виявляють перенасичену холестеролом
жовч. Третім фактором є змішування з факторами нуклеації
464 / РОЗДІЛ 26
Рис. 26-26. Ступінь розчинності холестеролу у жовчі як функ-
ція, відповідна до пропорційного вмісту лецитину, жовчних
солей та холестеролу. У жовчі, що має будь-який склад, опи-
саний нижче лінії АВС (наприклад, точка Р), холестерол є
винятково у міцеловій рідині; точки вище лінії АВС характе-
ризують жовч, у якій додатково містяться кристали холесте-
ролу (відтворено за дозволом з 8таІІ ОМ: ОаІІзіопез, N ЕпдІ
З Месі 1968;279:588).
холестеролу, що сприяють утворенню каменів у перенаси-
ченій жовчі. Поза організмом людини жовч хворих з холелі-
тіазом утворює камені вже через два-три дні, тоді як для
нормальних осіб потрібно понад два тижні. Природа
походження факторів нуклеації холестеролу ще остаточно
не з’ясована, однак відомо, що вони містять глікопротеїни
слизової жовчного міхура. Крім того, невідомо, чи камені
утворюються як наслідок надлишкового продукування
факторів, які стимулюють нуклеацію холестеролу, чи внас-
лідок зменшеного утворення інгібіції агрегування та нукле-
ації холестеролу, які попереджують утворення жовчних
каменів у здорових осіб.
ТОНКА КИШКА
У тонкій кишці хімус перемішується зі секретами сли-
зових клітин, панкреатичним соком та жовчю. Травлення,
яке розпочалося у ротовій порожнині та шлунку, завершу-
ється у порожнині та слизових клітинах тонкої кишки, а
продукти травлення абсорбуються разом з більшістю віта-
мінів та рідин. У тонкій кишці в нормі міститься понад 9 л
рідини, з них 2л- надходять з харчовими продуктами, які
споживають, 7л- секрети шлунково-кишкового тракту
(див. табл. 25-3) і тільки 1-2 л доходить до ободової кишки.
Анатомічні особливості
Загальне розташування м’язових шарів, нервових спле-
тень та слизової оболонки у тонкій кишці зображено на
рис. 26-1. Початкову частину дванадцятипалої кишки ін-
коли називають цибулиною дванадцятипалої кишки. Цю
ділянку уражує кислий шлунковий хімус, що проходить
через пілоричну частину шлунка, вона часто є місцем пеп-
тичної ульцерації. По зв’язці Трайтца (підвішувальний м’яз
дванадцятипалої кишки) дванадцятипала переходить у го-
лодну кишку. За узгодженням верхню частину (40%) тонкої
кишки нижче дванадцятипалої називають голодною киш-
кою, а нижню (60%) - клубовою, хоча чіткої анатомічної
межі між цими двома структурами нема. Клубово-сліпо-
кишкова заслона є місцем, де клубова кишка переходить у
ободову.
Тонка кишка коротша у живої людини, а після смерті
розслаблюється і видовжується. Відстань від пілоричної
частини шлунка до клубово-сліпокишкової заслони у
людей під час життя буває до 285 см (табл. 26-10), а під
час аутопсії - понад 700 см.
Слизова оболонка тонкої кишки містить поодинокі
лімфатичні вузлики і скупчені лімфатичні вузлики
(плямки Пеєра) вздовж антимезентеричного краю. По
всій тонкій кишці є прості трубчасті кишкові залози
(кишкові крипти, або залози Ліберкюна).
У дванадцятипалій кишці містяться додаткові малі зви-
висті трубчасто-альвеолярні дуоденальні залози (залози
Бруннера). Як зазначено вище, епітелій тонкої кишки
містить різноманітні види ентероендокринних клітин, а
слизова оболонка утворює багато клапаноподібних скла-
док.
По всій довжині тонкої кишки слизова оболонка вкрита
ворсинками (рис. 26-27). Кожний квадратний міліметр
слизової має 20-40 ворсинок. Кожна ворсинка - це паль-
цеподібне видовження 0,5-1,0 мм завдовжки, вкрите одно-
шаровим циліндричним епітелієм, яке вміщує мережу капі-
лярних і лімфатичних судин (молочна судина). Простежу-
ється витягнення гладких м’язів у підслизовій, що про-
стягаються уздовж до верхівки кожної ворсинки. Вільний
край клітин епітелію ворсинки розділений на дрібні мікро-
ворсинки. Вони, відповідно, покриті глікокаліксом, амор-
фним шаром, багатим на нейтральні та аміноцукри. Мікро-
ворсинки та глікокалікс утворюють посмуговану облямівку
(рис. 26-28). Клітини сполучені між собою щільними
непроникними з’єднаннями. Зовнішній шар клітинної
мембрани містить багато ензимів, які залучені у процес
травлення, що розпочався впливом слинних, шлункових
та панкреатичних ензимів. До ензимів, що містяться в цій
мембрані, належать різноманітні дисахаридази, пептидази
та ензими, які беруть участь у розщепленні нуклеїнових
кислот (див. Розділ 25).
Таблиця 26-10. Середні значення довжини різних ділянок
шлунково-кишкового тракту, виміряні під час інтубації у
здорових людей1
Ділянка Довжина, см
Глотка, стравохід та шлунок 65
Дванадцятипала кишка 25
Голодна і клубова кишка 260
Ободова кишка 110
1 Дані з Уігзсїі 4Е, Аґігепз ЕН 4г, ВІапкепІюгп ОН: Меазиге-
тепі ої Нитап іпїезїіпаї ІепдІН іп уіуо апб зоте саизез ої уагі-
аііоп. Сазїгоепіегоіоду 1956;31:274.
МЕХАНІЗМИ РЕГУЛЮВАННЯ ШЛУНКОВО-КИШКОВИХ ФУНКЦІЙ / 465
Ворсинки
Крипти
дібні клітини мають вузьку основу і широку апікальну час-
тину, що відкривається у кишковий просвіт. У широкій
ділянці сховані численні секреторні ґранули муцину. Сек-
рецію муцину збільшують холінергічна стимуляція і хімічні
та фізичні подразнення. Різноманітні келихоподібні клі-
тини секретують дещо відмінні муцини. Склад муцинів від-
різняється в осіб з пухлинами тонкої кишки та у хворих з
виразковим колітом порівняно зі здоровими людьми.
Моторика кишки
Регулювання ММК, що проходять уздовж кишки у між-
травний період через визначені інтервали та їхню заміну
на перистальтичні та інші скорочення, виконують БЕР, опи-
сані вище. У тонкій кишці в середньому відбувається від
12 БЕР циклів/хв у проксимальному відділі голодної киш-
ки, до 8/хв у дистальному відділі клубової кишки. Розріз-
няють три типи скорочень гладких м’язів: перистальтичні
хвилі, сегментарні й тонічні скорочення. Перистальтику
описано вище. Завдяки їй кишковий хімус проштовхується
вперед до товстої кишки. Сегментарні скорочення - це
кільцеподібні скорочення, які з’являються через достатньо
регулярні інтервали вздовж кишки, потім зникають, їх
відновлює друга серія кільцевих скорочень у сегментах між
попередніми скороченнями (рис. 26-29). Ці скорочення
переміщують хімус допереду-дозаду, збільшуючи час його
контактування з поверхнею слизової оболонки. Тонічні
скорочення - це порівняно триваліші скорочення, під час
яких ізолюється один сегмент кишки від іншого. Зверніть
увагу, що останні два типи скорочень повільно відбува-
ються у тонкій кишці до моменту, коли пасаж стає ще три-
валішим після споживання їжі, ніж у міжтравний період.
Рис. 26-27. Слизова тонкої кишки з криптами та ворсинками,
вистелена ентероцитами. Ентероцити утворюються у криптах,
мігрують уверх на ворсинки і потім злущуються з верхівок
ворсинок у кишковий просвіт (модифіковано та відтворено
за дозволом з Сіїапсігавота Р, Тауіог СК: Сопсізе Раїїюіоду,
Зііі есі. Мс(Зга^-НіІІ, 1998).
Поверхня всмоктування тонкої кишки збільшується у
600 разів завдяки клапаноподібним складкам, ворсинкам
та мікроворсинкам. Якщо уявити площу внутрішньої
поверхні слизової оболонки у вигляді простого циліндра,
то вона становитиме 3300 см2, складки збільшують по-
верхневу площу до 10 000 см2, ворсинки - до 100 000 см2,
а мікроворсинки - до 2 000 000 см2.
Кишковий слиз
Слиз секретують поверхня епітеліальних клітин уздовж
шлунково-кишкового тракту, залози Бруннера у дванадця-
типалій кишці, характерні келихоподібні клітини у тонкій
та товстій кишці. Секреція пов’язана з синтезом муцинів,
які є комплексними високомолекулярними глікопротеїна-
ми. Секретовані водянисті та гелеподібні муцини утворю-
ють слизову плівку, що вистилає і захищає епітелій кишки.
Плівка слизу є своєрідною змазкою, що зв’язує деякі бак-
терії та утримує імуноглобуліни у місцях так, що вони
можуть приєднатись до патогенних факторів. Келихопо-
Десмосома
Мікротрубочки
Мітохондрія
Власна —
пластина
Базальна —*
пластина
Лізосоми
Ядро
%
Аґранулярна
(гладка)
сітка
Ґранулярна
(шорстка)
сітка
Мікроворсинки
(посмугована
облямівка)
Замикальний
контакт
Рис. 26-28. Схема ентероцита тонкої кишки людини. Зверніть
увагу на мікроворсинки, замикальні контакти до інших клітин
на краю слизової і простір між клітинами на основі (міжклі-
тинний простір).
Неприєднані
рибосоми
Апарат
Ґольджі
Міжклітинний-----
простір
31
367-2
466 / РОЗДІЛ 26
Рис. 26-29. Схематичне зображення сегментарних скорочень
кишки. Стрілки позначають, які ділянки розслаблюються
перед ділянками скорочень і навпаки.
Це зумовлює тривалий контакт хімусу з ентероцитами і
стимулює абсорбцію.
Виражені інтенсивні перистальтичні хвилі називають
перистальтичним натиском; вони не характерні для здо-
рових осіб, однак простежуються в разі обструкції кишки.
Слабка антиперистальтика інколи виникає в ободовій
кишці, та більшість хвиль звичайно проходить в орально-
каудальному напрямі.
Регулювання кишкової секреції
Залози Брюннера у дванадцятипалій кишці секретують
густий лужний слиз, який частково захищає дуоденальну
слизову від шлункової кислоти. Тут також відбувається
значна секреція НСО3 незалежно від залоз Брюннера.
Секрет кишкових залоз - це ізотонічний розчин. Біль-
шість ензимів зазвичай містяться в цьому секреті у десква-
мованих слизових клітинах. Вільний від клітин кишковий
сік містить лише декілька ензимів. Шлунково-кишкові гор-
мони, такі як ВІП (див. вище), стимулюють секрецію киш-
кового соку. Подразнення блукаючого нерва збільшує сек-
рецію залоз Брюннера, однак, можливо, це не впливає на
кишкові залози.
Синдром мальабсорбції
Травна та всмоктувальна функції тонкої кишки потрібні
для нормальної життєдіяльності людини. Вилучення
короткого сегмента голодної або клубової кишки звичайно
не спричинює важких симптомів, бо розвивається компен-
саторна гіпертрофія та гіперплазія решти слизової обо-
лонки, яка поступово повертає абсорбційну функцію киш-
ки до норми (інтестинальна адаптація). Така адаптація
відбувається частково завдяки безпосередньому впливу
поживних речовин у інтестинальному просторі на слизову
і частково завдяки циркулювальним факторам, таким як
гастроінтестинальні гормони. Однак коли виконано резек-
цію понад 50% тонкої кишки або зроблено анастомоз, то
всмоктування поживних речовин і вітамінів порушене,
виникає ризик розвитку недостатності харчування, висна-
ження та атрофія (мальабсорбція).
Збільшення секреції шлункової кислоти, утвореної внас-
лідок резекції кишки, описано вище. Резекція клубової
кишки заважає всмоктуванню жовчних кислот і, відпо-
відно, приводить до недостатності абсорбції жирів. Це
також спричинює діарею, бо неабсорбовані жовчні солі
потрапляють в ободову кишку, де вони стимулюють актив-
ність аденілатциклази, збільшуючи кишкову секрецію (див.
Розділ 25), і малі молекули виходять у просвіт. Оскільки
об’єм голодної кишки компенсується значно менше, ніж
клубової, то резекція дистальної тонкої кишки спричинює
мальабсорбцію більше, ніж видалення порівняної довжини
проксимальної частини тонкої кишки. Інші ускладнення
резекції кишки або анастомозу - гіпокаліємія, артрит,
гіперурикемія та жирова інфільтрація печінки з наступним
цирозом. Оперативні втручання, під час яких на сегмент
тонкої кишки накладено обхідний анастомоз, рекомен-
дують для лікування ожиріння. Крім того, досліджено, що
часткове шунтування клубової кишки попереджує атеро-
склероз та його ускладнення, оскільки знижує рівень холес-
теролу у плазмі. Однак такі оперативні втручання можуть
бути нелегкими з огляду на їхні ускладнення та небезпеч-
ність. Іншим підходом до лікування ожиріння є хірургічний
метод, суть якого полягає у зменшенні об’єму шлунка,
проте ці втручання також супроводжуються ускладнен-
нями, зокрема, блюванням та непояснюваними невроло-
гічними порушеннями.
Різноманітні хворобливі процеси також порушують
абсорбцію (табл. 26-11). Унаслідок цього розвиваються
певні типи порушень, які інколи називають синдромом
мальабсорбції. Цей синдром змінюється залежно від при-
чини, може супроводжуватися недостатністю абсорбції
амінокислот з видимою надмірною втратою маси і також,
як наслідок, гіпопротеїнемією та едемою. Абсорбція вугле-
водів та жирів теж пригнічена. Унаслідок порушення
абсорбції жирів жиророзчинні вітаміни (вітаміни А, О, Е і
К) не абсорбуються в адекватних кількостях. У калових
випорожненнях збільшується кількість жирів та білків, а
також об’єм, вони стають масні, набувають кольору глини,
гидкий запах (стеаторея).
Порушення діяльності кишки простежується в разі тро-
пічного спру (див. табл. 26-11) внаслідок недостатності
фолієвої кислоти. Однак у випадку експериментально
змодельованої недостатності фолієвої кислоти кишкові змі-
ни є менш інтенсивними, ніж під час тропічного спру.
Таких хворих лікують антибіотиками, зокрема тетрацик-
Таблиця 26-11. Хвороботворні процеси, що
супроводжуються мальабсорбцією
Порушення травлення у кишковому просвіті
Мальабсорбція глюкози/галактози
Неадекватний ліполізис (наприклад, панкреатична
недостатність або надлишок секреції шлункової
кислоти)
Зменшення кон’югованих жовчних солей (наприклад,
резекція клубової кишки або надмірний бактеріальний
ріст)
Порушення транспортування у слизових клітинах
Неспецифічні (внаслідок тропічного спру, целіакії тощо)
Специфічні (внаслідок дефіциту різноманітних
дисахаридаз тощо)
Порушення транспортування жирів у кишкових
лімфатичних судинах
МЕХАНІЗМИ РЕГУЛЮВАННЯ ШЛУНКОВО-КИШКОВИХ ФУНКЦІЙ / 467
ліном. Целіакія - глютеночутлива ентеропатія - трапля-
ється у генетично схильних осіб, які мають у системі МНС
клас II антигени НЬА-ОК.3 і НЬА- Ор\У2. У цих осіб
гліадинова ділянка глютену - білка, що міститься у пше-
ниці, житі, ячмені і менше у вівсі, але не в рисі чи кукурудзі,
- спонукає інтестинальні Т-клітини брати участь в алер-
гічних реакціях, що руйнує та витоншує кишкову слизову.
Якщо оминати у харчуванні зернові, які містять глютен,
то діяльність кишки відновлюється.
Нерухома клубова кишка
У випадку травмування кишки відбувається безпосе-
реднє інгібування гладких м’язів, що зменшує кишкову
моторику. У разі подразнення очеревини виникає рефлекс
гальмування моторики внаслідок збільшення імпульсації
в норадренергічних волокнах у вісцеральних нервах.
Обидва типи гальмування спричинюють параліч (адина-
мію) клубової кишки після оперативних втручань. Оскіль-
ки зменшення перистальтичної активності поширюється
по тонкій кишці, то її хімус не проштовхується до ободової
кишки, і вона стає нерівномірно розширена міхуровим
газом та рідиною. Кишкова перистальтика відновлюється
через 6-8 год і настає після шлункової перистальтики.
Активність ободової кишки відновлюється лише через
два-три дні. Адинамію клубової кишки можна полегшити
введенням трубки через ніс до тонкої кишки й аспірацією
декілька днів рідини і газу, доки не відновиться перисталь-
тика.
Механічна обструкція тонкої кишки
Локалізована механічна обструкція тонкої кишки спри-
чинює виражені спазматичні болі (кишкову коліку), тоді
як адинамічна клубова кишка часто неболюча. Сегмент
кишки над місцем механічної обструкції розширюється і
наповнюється рідиною та газом. Тиск у сегменті підвищу-
ється, і кровоносні судини у її стінці стискаються, спричи-
нюючи місцеву ішемію. Активування вісцеральних афе-
рентних волокон від розтягнутого сегмента рефлекторно
спричинює потіння, зниження артеріального тиску, вира-
жене блювання і, як наслідок, метаболічний алкалоз і дегід-
ратацію. Якщо негайно не полегшити обструкцію, то нас-
лідки можуть бути фатальними.
ТОВСТА КИШКА
Головною функцією товстої кишки є всмоктування води,
На* та інших мінералів; виведення майже 90% рідини. Тут
перетворюється 1000-2000 мл ізотонічного хімусу, який
потрапляє щодня з клубової кишки, у 200-250 мл напів-
твердих калових випорожнень.
Анатомічні особливості
Діаметр товстої кишки більший, ніж тонкої. У нормі в
дорослих довжина товстої кишки - 100 см і понад 150 см
на аутопсії. Волокна її зовнішнього м’язового шару зібрані
у три поздовжні смужки - стрічки ободової кишки. Проте
ці стрічки коротші, ніж решта кишки, і стінки товстої киш-
ки утворюють випини (гаустри) між стрічками ободової
кишки (рис. 26-30). У слизовій товстої кишки нема ворси-
Лівий
Поперечна (селезінковий)
Правий
(печінковий) вигин
ВИГИН
ободова кишка
Сліпа
кишка
Червоподібний
відросток
Пряма кишка
Випини
ободової
кишки
Стрічка
ободової
кишки
Сигмоподібна
ободова кишка
Внутрішній! анальний
Зовнішній | сфінктер
Рис. 26-30. Ободова кишка людини.
Низхідна
ободова кишка
Висхідна
ободова
кишка
Клубова
кишка
нок. Залози ободової кишки - це короткі внутрішні випи-
нання слизової, що секретують слиз. Тут наявні поодинокі
лімфатичні вузлики, особливо у сліпій кишці і червопо-
дібному відростку.
Моторика та секреція у товстій кишці
Ділянка клубової кишки, що вміщує клубово-сліпо-
кишкову заслону, випинається у сліпу кишку так, що
підвищуваний внутрішній тиск стискає її, тоді як збіль-
шення внутрішньоклубового тиску відкриває заслону.
Окрім того, ця заслона ефективно попереджує рефлюкс
вмісту товстої кишки у клубову кишку. У нормі вона закри-
та. Кожного разу, коли перистальтична хвиля досягає її,
заслона відкривається швидко, даючи змогу частині хімусу
клубової кишки струменем увійти у сліпу кишку. Якщо
перерізати заслону експериментальним тваринам, то хімус
входить у товсту кишку швидко, так що абсорбція у тонкій
кишці зменшується, однак зазначене явище не відбувається
у людей. Коли харчові маси виходять зі шлунка, то сліпа
кишка розслаблюється і, пасаж хімусу через клубово-
сліпокишкову заслону збільшується (шлунково-клубовий
рефлекс). Уважають, що це вагусний рефлекс, хоча є деякі
докази, що зовсім не стимулювання блукаючого нерва діє
на клубово-сліпокишкову заслону. Симпатичне стимулю-
вання збільшує скорочення заслони.
Рухи товстої кишки охоплюють сегментарні скорочення
та перистальтичні хвилі подібно до тих, що простежуються
у тонкій кишці. Сегментарні скорочення перемішують
хімус в ободовій кишці й експонують його до слизової,
полегшуючи всмоктування. Перистальтичні хвилі про-
штовхують кишковий хімус уперед до прямої кишки, хоча
інколи простежується слабка антиперистальтика. Третій
тип скорочень є тільки в ободовій кишці - це скорочення
468 / РОЗДІЛ 26
внаслідок дії маси, за яких відбувається одночасне ско-
рочення гладких м’язів надвеликих близько розташованих
ділянок. Ці скорочення проштовхують речовину у пряму
кишку, і ректальне розтягнення розпочинає рефлекс дефе-
кації (див. нище).
Рухи товстої кишки координують БЕР товстої кишки.
Частота цієї хвилі, неподібна на хвилю у тонкій кишці,
збільшується вздовж ободової кишки від 2/хв у клубово-
сліпокишковому заслоні до 6/хв у сигмоподібній кишці.
Час проходження вмісту через тонку та
товсту кишку
Під час тестування перша порція їжі, яку застосовують
для визначення часу проходження вмісту через кишку,
потрапляє у сліпу кишку через 4 год, а всі неперетравлені
порції - в ободову через 8-9 год. У середньому перші
рештки їжі досягають печінкового вигину за 6 год, селе-
зінкового - за 9 год і тазової частини товстої кишки - за
12 год. Від тазової прямої кишки до відхідника транспор-
тування значно поволіше. Хоча відомо, що 25% залишків
їжі, застосованих для тестування, все ще наявні у прямій
кишці через 72 год. Коли спеціальні тестові невеликі кольо-
рові намистинки з’їсти разом з їжею, то в середньому 70%
їх буде у калових випорожненнях, однак повне виділення
може бути через 72 год. Час проходження, тиск коливань
та зміни рН у шлунково-кишковому тракті можна спосте-
рігати під час моніторингу просування маленької пілюлі,
що вміщує сенсори та мініатюрні радіопередавачі.
Абсорбція у товстій кишці
Всмоктувальні властивості слизової товстої кишки
прекрасні: №+ активно транспортується назовні з ободової
кишки, а вода відходить за осмотичним градієнтом, який
створюється. У нормі тут відбувається остаточна секреція
К+ і НСО3 в ободову кишку (див. Розділ 25). Абсорбційні
можливості товстої кишки робить використання ректаль-
них введень лікарських засобів у клінічній практиці рутин-
ним засобом, особливо для дітей. Багато сполук, у тім числі
анестетики, седативні, транквілізатори та стероїди, всмок-
туються швидше цим шляхом. Під час клізм частина води
всмоктується, а якщо об’єм клізми збільшений, то всмок-
тування може бути блискавичним наскільки, що виникає
водна інтоксикація. Кома та смерть унаслідок водної інток-
сикації з наступним відкачування води шляхом пункції відо-
мі у дітей з мегаколоном (розширення частини або всієї
ободової кишки) після водної клізми.
Калові маси
Калові маси вміщують неорганічні речовини, непере-
травлені рослинні волокна, бактерії та воду. їхній склад
(табл. 26-12) не співвідноситься з різноманітними харчо-
вими раціонами, бо більша частина калових мас нехарчо-
вого походження. Це пояснює, чому помітна кількість ка-
лових мас виходить навіть під час тривалого голодування.
Кишкові бактерії
У хімусі в голодній кишці містяться декілька видів
бактерій. Більше мікроорганізмів уміщує клубова кишка,
однак тільки в ободовій кишці звичайно є найбільша кіль-
кість бактерій. Погляд на відносну стерильність голодної
кишки незрозумілий, хоча шлункова кислота та порівняно
швидке переміщення хімусу через цю ділянку можуть галь-
мувати бактеріальний ріст. Мікроорганізми, наявні в обо-
довій кишці, це не тільки бацили, такі як Ескегіскіа соїі і
ЕпіегоЬасІег аего§епе8, а також плеоморфні організми, такі
як ВасіегоШез/Іа^іііз, коки різноманітних типів та мікро-
організми, такі як бацили газової гангрени, які можуть
спричинювати серйозні хвороби в тканинах поза ободовою
кишкою. Великі кількості бактерій виходять з каловими
масами. Після народження ободова кишка стерильна,
однак кишкова бактеріальна флора засіюється на ранніх
етапах життя.
Вплив кишкових бактерій на свого господаря (макро-
організм) є комплексним, частина з них є винятково корис-
ними, а інші - потенційно шкідливі.
Антибіотики поліпшують рівень росту у різноманітних
видах, зокрема в людей. Невелику кількість антибіотиків
додають до харчування домашніх тварин. Тварини ростуть
під впливом гігієнічних заходів швидше, ніж у контрольних
групах, проте не без мікроорганізмів. Вони асимулюють
їжу ліпше і не потребують визначених амінокислот, які є
необхідними складниками для інших тварин. Для них
характерний великий приріст і низький рівень неонаталь-
ної смертності.
Причини збільшення росту остаточно незрозумілі. Хар-
чові необхідні речовини, такі як аскорбінова кислота,
ціанокобаламін та холін, утилізовані іншими кишковими
бактеріями. З іншого боку, деякі ентеричні мікроорганізми
синтезують вітамін К і В-комплекс вітамінів. Фолієва кис-
лота, утворена бактеріями, абсорбується у певних кількос-
тях. Крім того, жирні кислоти з короткими ланцюгами,
утворені під впливом бактерій в ободовій кишці, мають
виняткове фізіологічне значення (див. Розділ 25).
Коричневого кольору калові маси набувають унаслідок
пігментів, які формуються із жовчних пігментів. Коли жовч
недостатньо потрапляє у кишку, то випорожнення стають
білими (ахолічні калові маси). Бактерії утворюють час-
тину газів під час метеоризму. Органічні кислоти, що
утворюються з вуглеводів бактеріями, відповідають за сла-
бокислу реакцію у випорожненнях (рН 5,0-7,0). Кишкові
Таблиця 26-12. Приблизний склад калових мас у разі
звичайної дієти
Складові Відсоток від загальної маси
Вода 75
Тверда частина 25
Відсоток у твердій частині
Целюльоза (клітковина) та грубоволокниста їжа Різноманітний
Бактерії ЗО
Неорганічні речовини (переважно кальцій та фосфати) 15
Жир та його похідні 5
Також десквамовані слизові клітини, слиз та малі кількості травних ензимів
МЕХАНІЗМИ РЕГУЛЮВАННЯ ШЛУНКОВО-КИШКОВИХ ФУНКЦІЙ / 469
бактерії також відіграють роль у метаболізмі холестеролу,
наприклад антибіотик неоміцин, що погано всмоктується,
модифікує бактеріальну кишкову мікрофлору, знижуючи
вміст НЩЛ і рівень холестеролу у плазмі.
Деяку кількість амінів, у тім числі з потенційно токсич-
ними речовинами, такими як гістамін та тирамін, утво-
рюють в ободовій кишці бактерійні ензими, які декарбок-
силюють амінокислоти. Водночас симптоми, що просте-
жуються у хворих із закрепами, виникають унаслідок впли-
ву абсорбції цих амінів, проте цю теорію “автоінтоксикації”
вже дискредитовано. Інші аміни, що їх утворюють кишкові
бактерії, особливо індол та скатол, надають запаху каловим
масам, як і сульфіди.
В ободовій кишці також формується аміак, який і всмок-
тується. У випадку захворювань печінки аміак не виво-
диться з крові, і гіперамоніємія (надмірне нагромадження
в організмі) може спричиняти неврологічні симптоми
(гепатична енцефалопатія). Кількість аміаку, що утво-
рюється, зменшують призначенням осмотичних послаблю-
вальних лікарських засобів, таких як лактулоза, яка виво-
дить частину аміаковмісних білків у ободову кишку, окис-
нює її вміст, сприяючи росту бактерій, які б не утворювали
аміаку.
Коли нормальних тварин зі звичайною кишковою бак-
теріальною флорою піддати йонізуючій радіації, то захисні
сили організму, що попереджають поширення кишкових
бактерій в інші частини організму, порушені, і головною
причиною смерті в разі радіаційного ураження є генера-
лізований сепсис. Тварини без мікрофлори мають вира-
жену гіпоплазію лімфоїдної тканини і погано розвинуті
імунні механізми, можливо тому, що такі механізми ніколи
не були попередньо спровоковані. Крім того, такі тварини
більш резистентні до радіації, ніж тварини зі звичайною
кишковою флорою, оскільки вони не мають бактерій, що
ініціюють сепсис.
Синдром сліпої петлі
Кишковий дисбактеріоз у інтестинальному просторі
може спричинювати характерні шкідливі впливи. Наприк-
лад, дисбактеріоз простежується, коли є стаз вмісту у тон-
кій кишці, і це спричинює макроцитарну анемію, маль-
абсорбцію ціанокобаламіну (вітаміну В)2) і стеаторею.
Такий стан виникає у хворих з хірургічно створеною слі-
пою петлею тонкої кишки (наявність замкнутих просторів
у тонкій кишці), крім того, це також відбувається за будь-
яких станів, що сприяють масивній бактеріальній контамі-
нації у тонкій кишці. Причиною анемії є недостатність
ціанокобаламіну, і його дефіцит всмоктування виникає
внаслідок зв’язування ціанокоболаміну анаеробними
бактеріями. Стеаторея виникає внаслідок надлишкового
гідролізу кон’югованих жовчних кислот бактеріями. Важ-
ливу роль жовчних кислот у травленні жирів описано у
Розділі 25.
Харчова клітковина
Адекватне харчування у травоїдних тварин залежить
від впливу шлунково-кишкових мікроорганізмів, які роз-
щеплюють целюлозу (клітковину) та споріднені рослинні
вуглеводи. У людей не відбувається помітного перетрав-
лення цих рослинних продуктів. Целюлоза, геміцелюлоза
та лігнін у харчових продуктах є важливими компонен-
тами харчової клітковини, яка наявна у спожитій їжі,
бо досягає товстої кишки у майже незмінному стані. Різ-
номанітні смоли, полісахариди морських водоростей та
пектинові речовини також містяться у харчовій кліт-
ковині.
Якщо кількість клітковини у їжі мала, то кажуть, що
харчування малооб’ємне. Якщо кількість речовини в
ободовій кишці є малою, то вона стає неактивною, і киш-
кова моторика виникає нечасто. Крім того, голодування
та парентеральне харчування приводить до атрофії сли-
зової в ободовій кишці, однак вона відновлюється до нор-
мального стану в разі потрапляння речовин, подібних до
пектину, в ободову кишку. Речовини грубоволокнистої їжі
- лаксатини - забезпечують більший об’єм для спожитих
речовин в ободовій кишці.
Останнім часом простежується підвищений інтерес до
харчової клітковини, оскільки епідеміологічні дослідження
свідчать, що групи людей, у яких в раціоні велика кількість
рослинної клітковини, мають низьку ймовірність дивер-
тикулітів, раку товстої кишки, цукрового діабету та хвороб
вінцевих артерій. Проте взаємозв’язок між харчовою кліт-
ковиною та ймовірністю розвитку хвороби ще досі оста-
точно не з’ясовано.
Дефекація
Розширення прямої кишки каловими масами розпочи-
нає рефлекторні скорочення м’язів кишки і зумовлює появу
поклику до дефекації. У людей симпатична іннервація
внутрішнього (мимовільного) анального сфінктера є збуд-
жувальною, тоді як парасимпатична іннервація є інгібу-
вальною. Цей сфінктер розслабляється, коли пряма кишка
розширена. Нервову іннервацію зовнішнього анального
сфінктера, що належить до скелетних м’язів, забезпечує
соромітний нерв. Сфінктер підтримується у стані тонічного
скорочення, і помірне розтягнення прямої кишки збільшує
силу її скорочень (рис. 26-31). Перше спонукання до дефе-
кації виникає, коли тиск у прямій кишці збільшується до
18 мм рт. ст. Коли цей тиск підвищується до 55 мм рт. ст.,
то зовнішній, як і внутрішній сфінктер, розслаблюється, і
вміст прямої кишки виштовхується. Внаслідок саме цього
рефлекторна евакуація з прямої кишки відбувається і в хро-
нічних спінальних хворих людей, і в тварин. Перш ніж
тиск, що розслаблює зовнішній анальний сфінктер, поши-
риться, розпочинається дефекація внаслідок вольового
розслаблення зовнішнього сфінктера та скорочення черев-
них м’язів (через напруження) для допомоги рефлектор-
ному випорожненню розширеної прямої кишки. Дефекація
- це спінальний рефлекс, він може бути вольово пригніче-
ний утримуванням скорочення зовнішнього сфінктера або
полегшений унаслідок розслаблення сфінктера та скоро-
чень черевних м’язів.
Розширення шлунка їжею ініціює скорочення у прямій
кишці і часто спонукає до дефекації. Таку відповідь нази-
вають шлунково-кишковим рефлексом, хоча є деякі
випадки впливу гастрину на ободову кишку, який виді-
ляється не через нервову систему. Тому, як звичайно, у дітей
дефекація настає після приймання їжі. У дорослих звички
та культурні традиції відіграють значну роль у визначенні
періоду дефекації.
470 / РОЗДІЛ 26
Пряма
кишка
Внутрішній
анальний
сфінктер
Зовнішній
анальний
сфінктер
! І !
Часткове Більше Значно більше
Розширення прямої кишки
Рис. 26-31. Відповіді прямої кишки на розтягнення тиском до 55 мм рт. ст. Розширення створює пасивний тиск унаслідок
розтягнення стінки прямої кишки і додатковий активний тиск, коли скорочуються гладкі м’язи стінки (відтворено за дозволом з
□ауепрогї Н\ЛЛ А Оідезі ої Оідезііоп, 2псІ есі. ¥еаг Воок, 1978)
Впливи колонектомії
Люди можуть жити після тотального видалення ободо-
вої кишки, якщо підтримувати водно-електролітний ба-
ланс. Після тотальної колонектомії клубову кишку виводять
назовні від черевної стінки (ілеостомія), і хімус виганяють
у пластиковий мішок, який прикріплюють навколо отвору.
Якщо раціон харчування добре відкорегований, то об’єм
виділень із клубової кишки зменшується, і його щільність
збільшуватиметься з часом. Догляд за ілеостомою потребує
багато часу, це важка робота, однак коли ілеостому накла-
дено згідно з сучасними позиціями, то проблем стає порів-
няно менше, хворі можуть вести нормальне повноцінне
життя.
Закреп
В Європі та Пінічній Америці інформування про над-
мірне побоювання стосовно закрепів перевищує всі інші
статті, присвячені здоровому способу життя. Хворим з хро-
нічними закрепами і частково тим, хто нещодавно змінив
харчові уподобання, рекомендовано пройти обстеження
щодо органічної патології. Однак у багатьох здорових осіб
дефекація буває тільки що два або що три дні, тоді як у
декого - щодня або навіть тричі на день.
Інколи єдиними симптомами, які спричинюють закреп,
є незначна анорексія і помірний дискомфорт у черевній
порожнині та здуття. Ці симптоми не залежать від всмок-
тування токсичних речовин, оскільки вони частіше пов’я-
зані з моторно-евакуаторними властивостями прямої киш-
ки і можуть відтворюватись у разі розтягнення прямої киш-
ки інертною речовиною. Інші симптоми закрепів - поява
занепокоєння тощо.
Мегаколон
Шкідливий вплив моторно-евакуаторних порушень у
кишці супроводжується відносною відсутністю симптомів,
за винятком здуття у черевній порожнині, анорексії та вто-
ми у дітей з агангліонарним мегаколоном (хвороба Гірш-
прунґа). Це захворювання внаслідок природженої відсут-
ності гангліонарних клітин у міентеричному та підслизо-
вому сплетеннях у дистальній частині ободової кишки,
можливе як наслідок порушення нормальної краніо-кау-
дальної міграції нейробластів під час ембріонального роз-
витку.
Відсутність перистальтики спричинює затруднення у
переміщенні калових мас через агангліонарну частину, і
діти з цією хворобою мають дефекацію раз на три тижні.
Такий стан можна полегшити резекцією агангліонарної
ділянки ободової кишки і шунтуванням частин ободової
кишки до прямої кишки.
Ендотеліни, що активують ендотеліальні В-рецептори
(див. Розділ 31), потрібні для нормальної міграції певних
клітин нервових валиків. Нокаут ендотеліальних В-рецеп-
торів у мишей призводить до розвитку мегаколона. Відомо,
що ще одною причиною вродженого агангліонарного мега-
колона у людей може бути мутація гена ендотеліальних В-
рецепторів.
МЕХАНІЗМИ РЕГУЛЮВАННЯ ШЛУНКОВО-КИШКОВИХ ФУНКЦІЙ / 471
Діарея
Численні фактори спричинюють діарею. Деякі з них
частково описані у цьому розділі. Важка діарея ослаблює
організм і може бути небезпечною, особливо для грудних
дітей. Великі кількості На* і ІС та води втрачаються з обо-
дової та тонкої кишки під час діарейних випорожнень,
спричинюючи дегідратацію, гіповолемію і, як наслідок -
шок та кардіоваскулярний колапс. Ще серйознішим усклад-
ненням хронічної діареї, навіть у разі підтриманого вод-
ного балансу, є гіпокаліємія. Гостра діарея - проблема
країн, що розвиваються. Вона часто простежується і в
мандрівників. Однак втрату рідини та електролітів можна
ефективно відновити введенням №+ та глюкози, оскільки
№ абсорбується через 86ЕТ 1-Ка‘-глюкозовий котранс-
портер (див. Розділ 25). З’ясовано, що бісмут субсаліцилат
ефективний для зменшення діарейних випорожнень, і
сполуки, які вміщують цю речовину, доступні для вжитку
в багатьох країнах.
ЛІТЕРАТУРА ДО ЧАСТИНИ V: ФУНКЦІЇ ТРАВНОЇ СИСТЕМИ
Аііеп А еі аі: Сазігосіиосіепаї тисозаі ргоіесбоп. РЬузіоІ Кєу
1993;73:823.
Апсігєхуз N0: Оізогсіегз оҐ ігоп теіаЬоІізт. N Еп^І 3 Месі
1999;341:1986.
Апкота-8еу V: Нерабс ге^епегабоп - гєуІ8ІП£ іЬе туіЬ оГ
РготеіЬеиз. №\У8 РЬузіоІ 8сі 1999:14:149.
Апаз ЗМ еі аі (есікогз): Тке Ьіуєг. Віоіоуу апсі Раїкоіоуу,
Згсі есі. Кауеп Ргезз, 1994.
Вагон ТН, Мог§ап ОЕ: Сиггепї сопсеріз: асійе песгоНхіп§
рапсгеаШіз. N Еп§1 З Месі 1999:340:1412.
Веп^тагк 8: Есопиігкюп апсі ЬеакЬ таіпіепапсе - а пе\у
сопсері їо ргеуепі СІ іпПаттабоп, иІсегаНоп, апсі зер-
зіз. Сііп Миіг 1996:15:1.
Воуег ЗЕ, СгаГ3, Меіег РЗ: Нераіосуіе ігапзроП зузіетз ге§и-
1абп£ рК, сеі 1 уоіите, апсі Ьііе зесгебоп. Аппи Кєу РЬузіоІ
1992:54:415.
СоЬеп 8, Рагктап НР: НеагіЬит - а зегіоиз зутріот. N Еп§1
З Месі 1999:340.
ОеЬпат Е8, 8гаі 8К8: Іпіезбпаї ігоп аЬзогрбоп: Сеііиіаг
тесЬапізт апсі ге^иІаЕоп. Кє\уз РЬузіоІ 8сі 1997:12:184.
Еіеісі М, Као МС, СЬап§ ЕВ: Іпіезітаї еіесігоіуіе Ітапзроії
апсі сііаггЬеаІ сіізеазе. N Еп§1 3 Месі 1989:321:800.
Еогїе ЬК, Натга ЕК: Сиапуііп апсі иго^иапуііп: Іпіезгіпаї
рербсіе Ьогтопез іЬаі ге^иіаіе еркЬеІіаІ Ігапзрогї. Кєхуз
РЬузіоІ 8сі 1996; 11:17.
Саііауап КН Зг, Рагкз ОА, ЗасоЬзоп ЕО: РаЙюрЬузіоІо^у о£
^азїгоіЩсзїіпаІ сігсиїабоп. НапсіЬоок о/Ркухіоіо^у, 8ес-
Іюп 6, Тке Са8ігоіпіе8ііпаІ Ву8іепг, уоі 1, рагї 1:1713.
8сЬикх 8 (есіког). Атегісап РЬузіо1о§іса1 8осіеіу, 1989.
Со УЕ\¥ еі аі: Тке Рапегеах: Віоіоуу, РаікоЬюІоуу апсіОІ8-
еа8е, 2псі есі. Кауеп Ргезз, 1993.
Соуаі КК, Нігпао І: ТЬе епіегіс пегуоиз зузіет. N Еп§1 З
Месі 1996:334:1106.
Негзеу 83, 8асЬз 6: Сазігіс асісі зесгеііоп. РЬузіоІ Кєу
1995:75:155.
НігзсЬ 03, Наузіей ЗР: Асіарїагіоп їо роіаззіит. №\уз РЬузіоІ
8сі 1986:1:54.
НоГтапп АЕ: Віїе асісіз: Йіе £оосі, іЬе Ьасі, апсі іЬе и§1у. Кє\уз
РЬузіоІ 8сі 1999:14:24.
коЬ 2: МоШіп апсі сііпісаі арріїсабоп. Реріісіез 1997:18:593.
ЗоЬпзоп ЕК еІ аі (есііґогз): Рку8ІоІоуу о^Тке Са8ігоіпіе8ііпаІ
Тгасі. Згсі есі. Кауеп Ргезз, 1994.
ЗоЬпзіоп ОЕ, Каріап ММ: РаїЗю^епезіз апсі ігеаітепі: оЕ§а11-
зіопез. N Еп§1 3 Месі 1993:328:412.
ЕатЬеіїз 8\УЗ еі аі: Осігеогісіе. N Еп§і 3 Месі 1996:334:246.
Еєуіії МО, Вопсі ЗН: Уоіите, сотрозкіоп апсі зоигсе оЕ іп-
ІезНпаІ §аз. Сазітоепіегоіо^у 1970:59:921.
Ее\уіз ЗН (есіког): А Ркагтасоїо^ісаі Арргоаск іо Си8-
ігоіпіезііпаї ОІ8огс1ег8. ХУіІІіатз & ХУіІкіпз, 1994.
Маско\уіак РА: ТЬе погтаї тісгоЬіаІ Нога. N Еп§1 3 Месі
1982:307:83.
Мапп N8, Мапп 8К: Епіегокіпазе. Ргос 8ос Ехр Віоі Месі
1994:206:114.
Мауег ЕА, 8ип ХР, ХУіПепЬисЬег КЕ: СопігасОоп соир1іп§
іп соїопіс зтооіЬ тизсіе. Аппи Кєу РЬузіоІ 1992:54:395.
Меіег РЗ, 8гіе£ег В: Моїесиїаг тесЬапізтз оГЬіІе Гогтакоп.
Ке\уз РЬузіоІ 8сі 2000:15:89.
МісЬаІороиІоз 6К, ОеЕгапсез МС: Ьіуєг ге^епегаНоп. 8сі-
епсе 1997:276:60.
МіКаІ КК, ВаІаЬап ОН: ТЬе е8орЬа§о§аз1гіс)ипсііоп. N Еп§1
З Месі 1997:336:924.
Регітап АЬ, 8сЬи1хе-Ое1гіеи К8 (есікогз): Оеуіиііііоп апсі
ІІ8 Т)І8ог(Іег8: Апаїоту, Рку8ІоІоуу, Сііпісаі І)іаупо8І8,
апсі Мапа^етепі. 8іп§и1аг РиЬІісаНоп Сгоир, 1997.
Роїіаск ЗМ: Епсіосгіпе сеііз оЕ іЬе §иі. НапсіЬоок о/Рку8ІоІ-
оуу, 8есЕоп 6, Тке Са8ігоіпіе8ііпаІ Ву8іет, уоі 11:79.
8сЬикх 8 (есіког). Атегісап РЬузіо1о§іса1 8осіе1у. 1989.
КаЬоп ЕС, КеиЬеп МА: ТЬе тесЬапізт апсі зігисіиге оЕ іЬе
£аз1гіс Н, К-АТРазе. Аппи Кєу РЬузіоІ 1990:52:321.
8асЬз 6,2еп§ Т4, Ргіпх С: РаїЬорЬузіоІо^у оЕ ізоіаіесі §азігіс
епсіосгіпе се1І8. Аппи Кєу РЬузіоІ 1997:59:234.
8ап(3егз КМ, \¥апп 8М: Ккгіс охісіе аз а тесііаіог оГ поп-
сЬо1іпег£Іс пеигоігапзтіззіоп. Ат 3 РЬузіоІ 1992:262:
С379.
8е11іп ЗН: 8СКАз: Ше епі§та оЕ\уеак еіесігоіуіе ігапзрогї іп
іЬе соїоп. Ке\¥8 РЬузіоІ 8сі 1999:14:58.
81еізеп§ег МН, ВгапсіЬог§ ЬЬ: МаІак8огрііоп. 8аип(3егз,
1977.
8ресіап КО, Оііуєг МС: Еипсбопаї Ьіо1о§у оГіпіезбпаІ §оЬ-
ІеісеПз. АтЗМесі 1991 ;260:С 183.
8іеег МЬ, ХУахтап І, Егеесітап 8: СЬгопіс рапсгеаійіз. N
Еп§1 3 Месі 1995;332:1482.
Тгаипег М, Меіег РЗ, Воуег ЗЬ: Моїесиїаг тесЬапізтз оГ
сЬоІезіазіз. N Еп^І 3 Месі 1998;339:1217.
472 / РОЗДІЛ 26
\Уа1зЬ ІН (есіііог): СсШгіп. Кауеп Рге88, 1993.
\Уа1зЬ ЗН, Реіегзоп \¥Р: ТЬе ігеаітепі: о£НеІісоЬасіегруїогі
іпГесііоп іп іЬе тапа^етепі о£ рерііс иісег с1І8еа8Є. N Еп§1
1 Мед 1995;333:984.
\¥апк 8А: СЬоІесузІокіпіп гесеріогз. Ат 3 РЬузіоІ 1995;269:
0628.
\¥і11іатз ЗА, Вієуіпз 6Т Зг: СЬоІесузіокіпіп апд ге§и1аііоп
оГрапсгеаііс асіпагсеїі їипсііоп. РЬузіоІ Кеу 1993;73:701.
\¥оИе ММ, ЬісЬіепзІеіп ОК, 8іп§Ь 6: Сіазігоіпіезііпаї іохіс-
Ьу о£ попзіегоідаї апйіпЛаттаіогу дги§8. N Еп§1 3 Мед
1999;340:1888.
^гі^Ьі: ЕМ: ТЬе іпіезііпаї Ка+/§1исо8Є соігапзроіїег. Аппи
Кеу РЬузіоІ 1993;55:575.
¥оип§ ЗА, уап Ьеппер Е\¥: Тке Могркоіо^у 8а1іуагу
Єіапсіз. Асадетіс Ргезз, 1978.
Частина VI
Кровообіг
Рідини, що циркулюють в організмі
27
ВСТУП
Система кровообігу - це транспортна система, що по-
стачає О2та речовини, абсорбовані зі шлунково-кишкового
тракту, тканинам, повертає СО2 до легень та інші продукти
метаболізму до нирок, бере участь у регулюванні темпе-
ратури тіла та розносить гормони й інші сполуки, що регу-
люють функцію клітин. Кров, як транспортер цих речовин,
нагнітає через закриту систему кровоносних судин серце,
яке у ссавців має дві помпи, що працюють разом. З лівого
шлуночка кров нагнітається по артеріях та артеріолах до
капілярів, де вона врівноважується з інтерстиційною ріди-
ною. Кров з капілярів відтікає через венули до вен і повер-
тається до правого передсердя. Це є велике (системне)
коло кровообігу. З правого передсердя кров рухається у
правий шлуночок, який перекачує її через судини легень -
мале (легеневе) коло кровообігу. У легеневих капілярах
вирівнюється вміст О, та СО2 у крові та повітрі альвеол.
Частина тканинної рідини надходить в іншу систему закри-
тих судин - лімфатичну, з якої лімфа повертається через
грудну та праву лімфатичну протоки у венозну систему
(лімфообіг). Циркуляція рідин контрольована множинни-
ми регуляторними системами, функція яких загалом поля-
гає у забезпеченні адекватного плину крові у капілярах (по
можливості в усіх органах, але особливо у серці та мозку).
У цьому розділі розглянуто кров та лімфу, а також різно-
манітні функції клітин, що містяться в цих рідинах.
КРОВ
Клітинні елементи крові - лейкоцити, еритроцити та
тромбоцити - містяться у вигляді суспензії у плазмі. В
нормі загальний об’єм крові, що циркулює’ становить 8%
від маси тіла (5600 мл у чоловіка масою 70 кг). Близько
55% цього об’єму становить плазма.
КІСТКОВИЙ мозок
У дорослої людини еритроцити, більшість лейкоцитів
та тромбоцитів утворюються у кістковому мозку. У плоду
клітини крові формуються також у печінці та селезінці. В
дорослого такий екстрамедулярний гемопоез може вини-
кати в разі захворювань, що супроводжуються руйнуван-
ням або фіброзом кісткового мозку. У дітей клітини крові
активно утворюються у кістковому мозку, що міститься у
порожнинах усіх кісток. Після 20 років мозок у порожни-
нах більшості довгих кісток, за винятком верхньої плечової
та стегнової, втрачає кровотворну активність (рис. 27-1).
Активний кістковий мозок називають червоним кістко-
вим мозком; неактивний мозок заміщує жирова тканина,
його називають жовтим кістковим мозком.
Кістковий мозок є одним з найбільших органів тіла,
досягаючи розміру та маси печінки. Він також один з найак-
тивніших органів. У нормі 75% клітин мозку представлені
мієлоїдним ростком, з якого розвиваються лейкоцити, і
тільки 25% становлять еритроцити, що дозрівають, хоча у
Рис. 27-1. Зміни целюлярності червоного кісткового мозку з
віком. За 100% узято ступінь целюлярності за народження
(відтворено за дозволом з \Л/НКЬу І_ЕМ, ВгіНоп СЛЗ: Оізогсіегз
оННе ВІоосІ, 10111 есі. СіїигсіїіІІ І_мпд8іопе, 1969).
474 / РОЗДІЛ 27
периферійній крові еритроцитів у 500 разів більше, ніж
лейкоцитів. Ця відмінність кісткового мозку відображає
той факт, що середня тривалість життя лейкоцитів є корот-
кою, тоді як еритроцитів - довгою.
У кістковому мозку містяться мультипотентні недетер-
міновані некомітовані стовбурові клітини (плюрипотентні
стовбурові клітини), що диференціюються у наступний
тип комітованих стовбурових клітин (клітини-поперед-
ники). Ці клітини, відповідно, перетворюються у різні види
клітин крові. Кількість плюрипотентних клітин невелика,
однак їхня популяція може повністю відтворити кістковий
мозок, якщо її ввести в організм, у якому власний кістковий
мозок зруйнований. Для мегакаріоцитів, лімфоцитів, ерит-
роцитів, еозинофілів та базофілів є окремі клітини-попе-
редники, тоді як нейтрофіли та моноцити походять зі спіль-
ної клітини-попередника. Стовбурові клітини кісткового
мозку є також джерелом для остеокластів (див. Розділ 21),
клітин Купфера (див. Розділ 26), мастоцитів, дендритних
клііин та клітин Лангерганса (див. нижче).
Плюрипотентні стовбурові клітини походять з недетер-
мінованих тотипотентних стовбурових клітин, у разі акти-
вування яких, принаймні в теорії, можуть утворюватись
будь-які клітини організму. Сьогодні вже створено культуру
тотипотентних клітин з людських ембріонів, тому інтерес
до дослідження стовбурових клітин значний. Однак постає
ще низка етичних та наукових питань, які потрібно вирішу-
вати.
ЛЕЙКОЦИТИ
У нормі в мікролітрі крові людини міститься 4 000-
11 000 лейкоцитів (табл. 27-1). З них найчисленнішими є
гранулоцити (поліморфонуклеарні лейкоцити (ПМН)).
Молоді гранулоцити мають сідлоподібне ядро, яке стає
мультилобулярним у разі дозрівання клітин (рис. 27-2).
Більшість із них містять нейтрофільні гранули (нейтрофі-
ли), однак деякі - гранули, що сприймають кислі барвники
(еозинофіли); частина клітин містить базофільні гранули
(базофіли). До інших двох клітинних типів, що в нормі
виявляються у периферійній крові, належать лімфоцити,
які мають велике округле ядро та незначну цитоплазму, і
моноцити з агранулярною цитоплазмою та ядром, форма
якого нагадує нирку (див. рис. 27-2). Взаємодія цих клітин
забезпечує ефективний захист організму від пухлин,
вірусів, бактерій та паразитів.
Гранулоцити
Усі гранулоцити мають цитоплазматичні гранули, що
містять біологічно активні речовини, задіяні у запальних
та алергійних реакціях. Середня тривалість напівжиття
нейтрофіла у периферійній крові становить 6 год. Отже,
для підтримки нормальної кількості цих клітин потрібне
утворення 100 мільярдів нейтрофілів за день. Багато
нейтрофілів проникає у тканини. їх приваблюють до
поверхні ендотелію сслектини, І ВОНИ КОТЯТЬСЯ ВЗДОВЖ ЦІЄЇ
поверхні. Пізніше формується щільний зв’язок між ендо-
телієм та лейкоцитами за допомогою адгезивних молекул
нейтрофілів з родини інтегринів. Наступним процесом є
проникнення нейтрофілів через стінку капілярів між ендо-
теліальнимими клітинами. Цей процес називають діапе-
дезом. Значна частина клітин, що виходить з крові,
надходить у шлунково-кишковий тракт і виводиться з
організму.
Інвазія бактерій в організм зумовлює запальну відпо-
відь. Кістковий мозок стає активним, продукує та виділяє
значну кількість нейтрофілів. Унаслідок взаємодії бакте-
ріальних продуктів та плазмових факторів і клітин крові
утворюються сполуки, що приваблюють нейтрофіли в
інфіковану ділянку (хемотаксис). Хемотаксичні фактори,
що є представниками великої та поширеної родини хемо-
кінів (див. нижче), охоплюють компоненти системи ком-
плементу (С5а), лейкотрієни та поліпептиди лімфоцитів,
мастоцитів та базофілів. Стимулювальний вплив С5а на
хемотаксичну активність посилює 6-глобулін. Цей білок
міститься на мембрані нейтрофілів і бере участь у зв’язу-
ванні та транспортуванні вітаміну О у плазмі (див. Розділ
21). Інші плазмові фактори, діючи на бактерії, роблять їх
поживними для фагоцитів (опсонізація). Головними опсо-
нінами, що вкривають бактерії, є імуноглобуліни певного
класу (І§6) та білки системи комплементу (див. нижче).
Вкриті бактерії пізніше приєднуються до рецепторів на
Таблиця 27-1. Показники кількості клітинних елементів у крові людини в нормі
Клітини Клітини/мкл, середнє значення Приблизні межі норми Відсотки від загальної кількості лейкоцитів
Загальна кількість лейкоцитів 9000 4000-11000
Ґранулоцити Нейтрофіли 5400 3000-6000 50-70
Еозинофіли 275 150-300 1-4
Базофіли 35 0-100 0,4
Лімфоцити 2750 1500-4000 20—40
Моноцити 540 300-600 2-8
Еритроцити Жінки 4,8 х 106
Чоловіки 5,4 х 106
Тромбоцити 300 000 200 000-500 000
РІДИНИ, ЩО ЦИРКУЛЮЮТЬ В ОРГАНІЗМІ / 475
Плюрипотентна
стовбурова клітина
КСФ-М КСФ-Ґ
Еритроцит Тромбоцити Нейтрофіл Еозинофіл Базофіл В Т
Тканинний Поліморфоядерні Лімфоцити
макрофаг клітини
Рис. 27-2. Розвиток різних формених елементів крові з клітин кісткового мозку Клітини під горизонтальною лінією виявляються
у периферійній крові в нормі. Позначені головні місця дії еритропоетину (еритро) та різноманітних колонієстимулювальних
факторів (КСФ), що забезпечують диференціювання клітин; Ґ - ґранулоцити; М - макрофаги; ІЛ - інтерлейкін; див. табл. 27-
2 та 27-3.
мембрані нейтрофілів, що зумовлює посилення рухової
активності клітини, екзоцитоз і так званий кисневий вибух.
Наведені реакції опосередковує гетеротримерний О-білок.
Посилена рухова активність призводить до швидкого пере-
травлення бактерії шляхом ендоцитозу (фагоцитоз). У
випадку екзоцитозу з гранул нейтрофілів виділяються спо-
лукй, що надходять у фагоцитарну вакуолю, де розміщені
бактерії, та частково в інтерстиційний простір (деґрану-
476 / РОЗДІЛ 27
ляція). Гранули містять різноманітні протеази й антимік-
робні білки, які називають дефензинами. У ссавців є два
типи дефензинів - а та р; у безхребетних та рослин
виявлено інші типи. Крім того, відбувається активування
мембранозв’язаного ензиму НАДФ-оксидази, що супро-
воджується утворенням токсичних похідних кисню.
Комбінація токсичних метаболітів кисню та протеолі-
тичних ензимів гранул робить нейтрофіл дуже ефектив-
ним знаряддям знищення мікроорганізмів.
Активування НАДФ-оксидази супроводжується знач-
ним посиленням поглинання та метаболізму О2 у нейтро-
філі (респіраторний вибух) та утворенням О2* унаслідок
таких реакцій:
НАДФ + Н+ + 2О2 -> НАДФ* + 2Н+ + 20, .
Зазначимо, що 02 є вільним радикалом, який утворю-
ється внаслідок додавання одного електрона до 02, це інко-
ли позначають додаванням крапки для утворення символу
°2 •
Два 02 спонтанно реагують з двома Н\ утворюючи
Н2О2 у реакції, яку каталізує цитоплазматична форма
супероксиддисмутази (СОД):
о2 + О2 + Н’ + Н-'З Н2О2 + о2.
Отже, стойхіометрія електронів (е ) буде такою:
13е_ + 13е_ + Ое~ + Ое_С^> 14е_ + 12е~.
Обидва - 02 та Н2О2 - є оксидантами зі значною бакте-
рицидною активністю, однак Н2О2 перетворює у Н20 ен-
зим каталаза. Цитоплазматична форма СОД містить 2п
та Си. Її фіксують у різних ділянках організму людини. У
випадку родинної форми аміотрофічного бокового скле-
розу (АБС) (див. Розділ 16) простежується дефектна форма
ензиму внаслідок генетичної мутації. Тому, можливо, під
час цього прогресуючого, фатального захворювання 02
нагромаджується у моторних нейронах, зумовлюючи їхню
загибель. У людей виявлено ще дві форми ензиму, кодовані
принаймні одним іншим геном.
Нейтрофіли містять також ензим мієлопероксидазу, що
каталізує перетворення СІ , Вг , І та 8СИ у відповідні
кислоти (НОСІ, НОВг та ін.). Ці кислоти є також потен-
ційними оксидантами. Оскільки СІ в рідинах організму є
найбільше, то головним продуктом буде НОСІ.
Крім мієлопероксидази та дефензинів, гранули нейтро-
філів містять еластазу, дві металопротеїнази, що руйнують
колаген, і різноманітні протеази, які допомагають знищити
мікроорганізми. Ці ензими діють спільно з 02, Н2О2 та
НОСІ, що утворюються внаслідок дії НАДФ-оксидази та
мієлопероксидази, формуючи зону знищення навколо
активованого нейтрофіла. Ця зона є ефективною для зни-
щення мікроорганізмів, однак у разі деяких захворювань,
наприклад ревматоїдного артриту, нейтрофіли можуть
спричинити місцеву деструкцію тканин організму.
Рухи клітини під час фагоцитозу, як і міграція у місце
інфікування, забезпечені участю мікротрубочок та мікро-
філаментів (див. Розділ 1). Нормальна діяльність мікро-
філаментів передбачає взаємодію актину, який вони
містять, з міозином І на внутрішній поверхні клітинної
мембрани (див. Розділ 1). Нейтрофіли виділяють також
тромбоксани, що є вазоконстрикторами, та фактори агре-
гації тромбоцитів, лейкотрієни, що підвищують проник-
ність судин і приваблюють інші нейтрофіли у місце запа-
лення, та інші простагландини, які виявляють помірну про-
тизапальну активність.
Подібно до нейтрофілів, еозинофіли теж мають корот-
кий період півжиття у периферійній крові, теж їх приваб-
люють до поверхні ендотеліальних клітин селектини, теж
вони приєднуються до інтегринів, що зв’язують їх з судин-
ною стінкою, та проникають у тканини шляхом діапедезу.
Як і нейтрофіли, вони виділяють білки, цитокіни та хемо-
кіни, що зумовлюють запалення та спроможні знищити
мікроорганізми. Однак є деяка специфічність у селектинах
та інтегринах, що забезпечують взаємодію клітин, та у
молекулах, які виділяються для знищення мікроорганізмів.
Дозрівання й активування еозинофілів у тканинах частково
стимульоване ІЛ-3, ІЛ-5 та КСФ-ҐМ (див. нижче). Особ-
ливо багато цих клітин у слизовій шлунково-кишкового
тракту, де вони забезпечують захист від паразитів, та у сли-
зових дихальних шляхів і сечовидільних органів. Кількість
еозинофілів, що циркулюють, збільшується в разі алергіч-
них захворювань, таких як астма, та у випадку різнома-
нітної патології дихальних шляхів і шлунково-кишкового
тракту.
Базофіли також проникають у тканини та виділяють
білки і цитокіни. Вони подібні, однак не є ідентичними до
мастоцитів (тканинних базофілів), та, як і ті, містять
гістамін та гепарин (див. нижче). Базофіли виділяють
гістамін та інші трансмітери запалення в разі активування
фактора виділення гістаміну, що його секретують Т-лім-
фоцити (див. нижче), які є важливими під час реакцій гіпер-
чутливості негайного типу. Діапазон таких реакцій охоп-
лює незначну кропивницю й анафілактичний шок.
Тканинні базофіли
Тканинні базофіли (мастоцити) - це гранульовані мо-
більні клітини, які виявляють у ділянках, багатих на спо-
лучну тканину, і особливо під епітеліальними поверхнями.
У гранулах клітин міститься гістамін, гепарин та багато
протеаз. Ці клітини також утворюють і виділяють лейко-
трієни та простагландини. На їхній клітинній мембрані
розміщені І§Е-рецептори, і, подібно до базофілів, після
приєднання до їхньої поверхні антигену, вкритого І&Е,
відбувається деґрануляція. Клітини беруть участь у запаль-
ній реакції, ініційованій І§Е та І§6 (див. нижче). У випадку
запалення вони знищують збудників, що зробили інвазію
в організм. Крім участі у реакціях набутого імунітету, кліти-
ни виділяють ФНП-а у відповідь на появу бактеріальних
продуктів, використовуючи антілонезалежні механізми.
Отже, вони беруть участь у неспецифічних імунних реак-
ціях, спрямованих проти інфекційних агентів (див. нижче).
Виражена деґрануляція тканинних базофілів зумовлює клі-
нічні прояви алергії, у тім числі анафілактичні реакції.
Моноцити
Моноцити потрапляють у кров з кісткового мозку і
циркулюють протягом 72 год. Потім вони проникають у
тканини і стають тканинними макрофагами (рис. 27-3).
РІДИНИ, ЩО ЦИРКУЛЮЮТЬ В ОРГАНІЗМІ / 477
Рис. 27-3. Тканинні макрофаги у гіпофізі. Макрофаги, позна-
чені стрілками, були пофарбовані імуногістохімічним методом
з використанням моноклональних антитіл, специфічних для
цих клітин; ПЧ - передня частка; ПрЧ - проміжна частка (за
дозволом 8 Оогсіоп)
ропоетином описане у Розділі 24. Три додаткові фактори
називають колонієстимулювальними факторами (КСФ),
оскільки вони зумовлюють проліферацію однієї відповід-
ної клітини на м’якому агарі, утворюючи колонії на цьому
середовищі. До факторів, що стимулюють утворення детер-
мінованих стовбурових клітин, належать КСФ грануло-
цитів та макрофагів (КСФ-ҐМ), КСФ гранулоцитів
(КСФ-Ґ), та КСФ макрофагів (КСФ-М). Інтерлейкіни (з
англ. іпїегіеикіпз) ІЛ-1, ІЛ-6, а потім ІЛ-3 (див. табл. 27-2)
діють послідовно, призводячи до перетворення плюри-
потентних недетермінованих стовбурових клітин у детер-
міновані клітини-попередники (див. рис. 27-2). Інтерлейкін
ІЛ-3 відомий також як мульти-КСФ. Кожний з КСФ вико-
нує головну функцію, проте, крім неї, усі КСФ та інтер-
лейкіни мають інші впливи. Вони можуть активувати та
підтримувати зрілі клітини крові. Цікаво стосовно цього,
що гени, які кодують більшість описаних факторів, розмі-
щені разом на довгому відрізку 5-ї хромосоми, і їхнє поход-
ження може бути пов’язане з подвоєнням гена-поперед-
ника. Цікаво також, що в мишей у нормі простежується
базальний гемопоез, за якого ген, що кодує КСФ-ҐМ,
Тривалість їхнього існування у тканинах невідома, однак
дані, одержані внаслідок трансплантації кісткового мозку
у людини, свідчать про те, що вони можуть існувати близь-
ко трьох місяців. Виявляється, що вони не повертаються у
систему кровообігу. Деякі з них закінчують існування у
вигляді багатоядерних велетенських клітин, що виявля-
ються в разі хронічних запальних процесів, наприклад,
туберкульозу. До тканинних макрофагів належать клітини
Купфера у печінці, альвеолярні макрофаги (див. Розділ 34)
та мікроглія головного мозку; всі вони виходять з крово-
носної системи. Раніше їх називали ретикулоендотелі-
альною системою, проте загальний термін система тка-
нинних макрофагів точніший.
Т-лімфоцити виділяють макрофаги, які активують лім-
фокіни. Активовані макрофаги мігрують у відповідь на
вплив хемотактичних стимулів, де вони поглинають та зни-
щують бактерії за допомогою механізмів, подібних до тих,
що відбуваються у нейтрофілах. Макрофаги відіграють
провідну роль у забезпеченні імунітету (див. нижче). Вони
також виділяють близько 100 різноманітних сполук, у тім
числі фактори, що впливають на лімфоцити й інші клітини,
простагландини групи Е та фактори зсідання крові.
Колонїєстимулювальні фактори
ґранулоцитів та макрофагів
Утворення еритроцитів та лейкоцитів, що чітко регу-
льоване у здоровому організмі, швидко і значно посилю-
ється в разі інфекцій. Проліферація та відновлення плюри-
потентних клітин у мишей та, вірогідно, у людей залежить
від утворення клітинами білка, кодованого геном 8СІ (від
англ. 8іет сеІІ Іеикетіа - лейкемія стовбурових клітин).
Задіяними є також інші фактори. Проліферація і дозрівання
клітин, що потрапляють у кров з кісткового мозку, регульо-
вані глікопротеїнами факторів росту або гормонами, які
спричинюють проліферацію та дозрівання клітин з однієї
або декількох детермінованих клітинних ліній (див. рис.
27-2, табл. 27-2). Регулювання утворень еритроцитів ерит-
Таблиця 27-2. Фактори, що регулюють гемопоез
Назва Клітинні джерела Тип клітини, що утворюється в збільшеній кількості
8СЬ ? Плюрипотентні клітини
Еритропоетин Клітини нирки, клітини Купфера Еритроцити
КСФ-Ґ Моноцити, фібробласти, ендотеліальні клітини Нейтрофіли
КСФ-М Моноцити, фібробласти, ендотеліальні клітини Моноцити
КСФ-ҐМ Т-клітини, моноцити, фібробласти, ендотеліальні клітини Нейтрофіли, моноцити, еозинофіли, мегакаріоцити, еритроцити
ІЛ-1 Макрофаги, фібробласти, ендотеліальні клітини Нейтрофіли, моноцити, еозинофіли, базофіли, мегакаріоцити, еритроцити
ІЛ-3 Т-клітини
ІЛ-4 Т-клітини Базофіли
ІЛ-5 Т-клітини Еозинофіли
ІЛ-6 Макрофаги, фібробласти, ендотеліальні клітини Нейтрофіли, моноцити, еозинофіли, базофіли, мегакаріоцити, еритроцити
478 / РОЗДІЛ 27
пригнічений. Це означає, що втрату одного з факторів
можуть компенсувати інші. З іншого боку, відсутність КСФ-
ҐМ зумовлює нагромадження сурфактанту у легенях (див.
Розділ 34).
Як зазначено у Розділі 24, еритропоетин частково про-
дукують клітини нирок, і він є гормоном, що циркулює.
Інші фактори утворювані макрофагами, що активовані Т-
клітинами, фібробластами та ендотеліальними клітинами.
Здебільшого фактори діють місцево у кістковому мозку.
Порушення функції фагоцитозу
Описано понад 15 первинних дефектів діяльності ней-
трофілів і ще щонайменше ЗО інших станів, за яких про-
стежується вторинне порушення функції нейтрофілів.
Хворі з такими ураженнями схильні до інфекцій, які мають
легкий перебіг за умови порушення функції лише нейтро-
філів; якщо ж уражена і система моноцитів - тканинних
макрофагів, то захворювання важкі. У випадку одного із
синдромів (послаблення рухової активності нейтрофілів)
не відбувається нормальної полімеризації актину, і рух клі-
тини стає повільним, у разі іншого простежується врод-
жена недостатність лейкоцитарних інтегринів. За умов
серйозніших захворювань (хронічні ґранулематозні хворо-
би) фіксують неспроможність утворювати О, як у нейтро-
філах, так і у моноцитах, унаслідок чого клітини не можуть
знищити фагоцитовані бактерії. За вираженої вродженої
недостатності глюкозо-6-фосфатдегідрогенази виникають
множинні інфекції, оскільки неможливим стає утворення
НАДФ, потрібного для продукування О2 . У випадку врод-
женої недостатності мієлопероксидази ефективність зни-
щення мікробів знижується внаслідок неспроможності
утворювати йони гіпогалідів; однак вона не зникає пов-
ністю, оскільки інші бактерицидні механізми збережені.
Лімфоцити
Лімфоцити є ключовими елементами у формуванні іму-
нітету (див. нижче). Після народження частина лімфоцитів
утворюється у кістковому мозку, проте більшість з них фор-
мується у лімфовузлах, тимусі та селезінці з клітин-попе-
редників. Клітини-попередники потрапляють у ці органи
з кісткового мозку, пройшовши попереднє диференці-
ювання у тимусі та місцях, еквівалентних бурсі Фабріціуса
(див. нижче) для того, щоб стати попередниками Т- та В-
клітин (рис. 27-4). Лімфоцити проникають у кров пере-
важно через лімфатичні судини. За звичайних умов тільки
2% лімфоцитів організму містяться у периферійній крові.
Більшість інших лімфоцитів перебувають у лімфоїдних
органах. Було підраховано, що у людини 3,5 х 1О10 лімфо-
цитів за день надходить у кров тільки через грудну протоку;
хоча ця кількість охоплює лімфоцити, які надходять у груд-
ну протоку повторно. Впливи гормонів надниркових залоз
на лімфоїдні органи, лімфоцити, що циркулюють у крові,
та гранулоцити розглянуто у Розділі 20.
ІМУНІТЕТ
Огляд
У комах та безхребетних простежується вроджений
імунітет. Головними у цій системі є рецептори, що при-
Кортикальні
фолікули,
В-клітини
Паракортикальна
зона, Т-клітини
Медулярні тяжі,
плазматичні клітини
Рис. 27-4. Анатомія нормального лімфовузла (відтворено за
дозволом з МсРйее 83 еі аі: [есіііогз]: Раійорйузіоіоду ої Оіз-
еазе, ЗгсІ есі. Мс6га\л/-НіІІ,2000).
єднуються до певних послідовностей цукрів, жирів та амі-
нокислот звичайних бактерій і активують різноманітні
захисні механізми. Рецептори кодовані ще у лінії статевих
клітин, і їхня основна структура не змінюється після
контакту з антигеном. Унаслідок активування захисних
механізмів у різних організмах фіксують виділення інтер-
феронів, фагоцитоз, утворення антибактеріальних пепти-
дів, активування системи комплементу і декількох протео-
літичних каскадних систем. Навіть у рослин у відповідь
на інфікування відбувається виділення антибактеріальних
пептидів.
У хребетних вроджений імунітет доповнений набутим
імунітетом, системою, у якій Т- та В-лімфоцити активовані
специфічними антигенами. Наслідком такого активування
є утворення клонів клітин, що атакують сторонні білки, а
після припинення інвазії продовжують існувати у вигляді
невеликої групи клітин пам’яті, щоб у разі повторного
контакту з тим самим антигеном зумовити швидку та
масивну імунну атаку. Генетичні зміни, що зумовили появу
набутого імунітету, відбулись 450 млн. років тому в пращу-
рів щелепних хребетних і, вірогідно, полягали у проник-
ненні транспосони у геном, що зробило можливим утво-
рення величезної кількості Т-лімфоцитів, які існують в
організмі.
У хребетних, у тім числі людей, вроджений імунітет
утворює першу лінію захисту від інфекцій і, крім того,
запускає каскад реакцій набутого імунітету (рис. 27-5).
Механізми природженого та набутого імунітету можуть
бути спрямовані також проти пухлин і трансплантатів від
інших тварин.
Після активування імунокомпетентні клітини взаємо-
діють через цитокіни і знищують віруси, бактерії та інші
сторонні клітини, виділяючи інші цитокіни та активуючи
систему комплементу.
Імунологія, у якій останніми роками простежується
великий прогрес, є значною за обсягом та досить складною
за змістом наукою. Тому у цій книжці викладено лише
загальні положення.
РІДИНИ, ЩО ЦИРКУЛЮЮТЬ В ОРГАНІЗМІ / 479
Бактерії
Віруси
Пухлини
Нова
Т-клітина
Рис. 27-5. Шлях, яким бактерії, віруси та пухлини активують вроджений імунітет та ініціюють реакції набутого імунітету, АПК -
антигенпрезентаційна клітина; М - моноцит; Н - нейтрофіл; Тн1 та Тн2 - Т-клітини хелпери типу 1 та 2, відповідно.
Цитокіни
Цитокіни - це гормоноподібні молекули, що регулюють
імунну відповідь паракринним шляхом. їх виділяють не
тільки лімфоцити і макрофаги, а й ендотеліальні клітини,
нейрони, гліальні та інші види клітин (табл. 27-3). Біль-
шість назв цитокінів пов’язана з їхньою функцією, наприк-
лад, фактор диференціювання В-клітин, фактор 2 стиму-
лювання В-клітин. Однак є домовленість, за якою в разі
виявлення послідовності амінокислот певного фактора у
людини назву фактора змінювали на інтерлейкін. Наприк-
лад, назву фактора диференціювання В-клітин змінено на
інтерлейкін-4. У галузі, що розвивається з такою швидкіс-
тю, дуже важко створити повний перелік факторів, однак
головні цитокіни наведено у табл. 27-3.
Більшість рецепторів цитокінів та факторів росту гемо-
поезу (див. вище), як і рецептори пролактину (див. Розділ
23) та гормонів росту (див. Розділ 22), є представниками
надродини рецепторів цитокінів, що складаються з трьох
підродин (рис. 27-6). Представники підродини 1, які охоп-
люють рецептори ІЛ-4 та 1Л-7, є гомодимерами. Представ-
ники підродини 2, до яких належать рецептори ІЛ-3, ІЛ-5,
та ІЛ-6, є гетеродимерами. Рецептори ІЛ-2 та деяких інших
цитокінів унікальні, оскільки вони складаються з гетеро-
димеру та неспорідненого білка, так званого Тас-антигену.
Інші представники підродини мають такий же у-ланцюг,
як і ІЛ-2Р. Позаклітинна частина субодиниць гомо- та
гетеродимерів містить чотири залишки цистеїну та домен
Тгр-8ег-Х-Тгр-8ег, і хоча внутрішньоклітинна частина
рецептора й не містить каталітичних доменів тирозинкі-
нази, вона здатна активувати цитоплазматичну тирозин-
кіназу в разі приєднання ліґанда до рецептора.
Впливи головних цитокінів наведені у табл. 27-3. Деякі
з них мають як системний, так і місцевий паракринний
ефекти. Наприклад, зверніть увагу на системний ефект ІЛ-
1 а та ІЛ-1 р (табл. 27-4). Послідовності цих двох цитокінів
мають мало спільного, а впливи подібні, і діють на ті самі
рецептори. Вони зумовлюють гарячку, яку можуть спри-
чинити також ІЛ-6, ФНП-а та ФНП-р. ФНП мають також
інші системні впливи, подібні до впливів ІЛ-1. Більшість
із цих впливів простежується у людини на початку інфек-
ційних захворювань.
Іншою надродиною цитокінів є родина хемокінів.
Хемокіни - це сполуки, що приваблюють нейтрофіли (див.
вище) та інші лейкоцити у ділянку запалення чи імунної
реакції. Сьогодні відомо понад 40 хемокінів і вже зрозу-
міло, що вони також беруть участь у клітинному рості та
ангюгенезі. Рецептори хемокінів є серпентиновими рецеп-
торами, що діють через гетеродимерні 6-білки, спричи-
нюючи також утворення псевдоподій з міграцією клітини
у напрямі до джерела хемокінів.
Система комплементу
Знищення клітин у разі вродженого та набутого імуні-
тету частково опосередковане системою білків плазми, яку
називають системою комплементу. Білки позначають
номерами С1-С9. Білок С1 складається з трьох субодиниць
- С1 ц, С1 г, та С18 - тому зрозуміло, що у системі є 11 білків.
С1 приєднується до імуноглобулінів, зв’язаних з антигеном,
це дає змогу розпочати послідовність реакцій, що акти-
вують СЗ. Таке активування системи комплементу нази-
вають активуванням класичним шляхом. Можливе також
активування альтернативним, або шляхом пропердину.
480 / РОЗДІЛ 27
Таблиця 27-3. Головні властивості інтерлейкінів людини та інших імунорегуляторних цитокінів1
Головні клітинні джерела Головні ефекти2
Інтерлейкіни ІЛ-Іа і р Макрофаги, інші АПК, інші соматичні клітини Костимулювання АПК і Т-клітин Проліферація В-клітин та утворення Ід Активування фагоцитів Запалення та гарячка (див. табл. 27-5)
ІЛ-2 Активовані Тн1-, Тц-, МК-клітини Проліферація активованих Т-клітин Проліферація В-клітин та експресія Ідб
ІЛ-3 Тн-лімфоцити Ріст ранніх гематопоетичних попередників
ІЛ-4 Тн2-клітини, мастоцити Проліферація В-клітин, експресія ІдЕ та молекул II класу МИС Проліферація та функціювання Тн2- та Т-клітин Ріст та функціювання еозинофілів і мастоцитів Пригнічення утворення цитокінів запалення
ІЛ-5 Тн2-клітини, мастоцити Ріст та функціювання еозинофілів
ІЛ-6 Активовані Тн2-клітини, АПК, інші соматичні клітини Синергічні ефекти з ІЛ-1 або ТНФ для стимулювання Т-клітин Проліферація В-клітин та утворення Ід Тромбопоез
ІЛ-7 Стромальні клітини тимусу та кісткового мозку Лімфопоез Т- та В-клітин Функції Тс-клітин
ІЛ-8 Макрофаги, інші соматичні клітини Посилення скупчень та активування нейтрофілів
ІЛ-9 Т-клітини культури клітин Деякі гемато- і тимопоетичні ефекти
ІЛ-10 Активовані Тн2, СО8Т і В-лімфоцити, макрофаги Пригнічення утворень цитокінів Тн1-клітинами, МК-клітинами та АПК Посилення проліферації В-клітин та гуморальної відповіді Пригнічення клітинного імунітету Ріст мастоцитів
ІЛ-11 Стромальні клітини Синергічні впливи на гемато- і тромбопоез
ІЛ-12 В-клітини, макрофаги Проліферація та функція активованих Тц- та МК-клітин Утворення у-ІФН Індукція Тн1-клітин; пригнічення функцій Тн2-клітин Посилення клітинних імунних реакцій
ІЛ-13 Тн2-клітини Ефекти, подібні до впливу ІЛ-4
Інші цитокіни ТНФ-а Активовані макрофаги, інші соматичні клітини Ефекти, подібні до впливу ІЛ-1 Судинний тромбоз та некроз пухлин
ТНФ-р Активовані Тн1-клітини Ефекти, подібні до впливу ІЛ-1 Судинний тромбоз та некроз пухлин
ІНФ-а і р Макрофаги, нейтрофіли, інші соматичні клітини Противірусні ефекти Індукція молекул І класу МИС на всіх соматичних клітинах Активування макрофагів та МК-клітин
ІФН-у Активовані Тн1-клітини та МК-клітини Індукція молекул І класу МИС на всіх соматичних клітинах Індукція молекул II класу МИС на АПК та соматичних клітинах Активування макрофагів, нейтрофілів та МК-клітин Посилення клітинного імунітету (пригнічення Тн2-клітин) Індукція високих ендотеліальних венул Противірусні ефекти
ТГФ-р Активовані Т-лімфоцити, тромбоцити, макрофаги, інші соматичні клітини ч Протизапальний (пригнічення утворення цитокінів та експресії молекул II класу МНС) Пригнічення проліферації макрофагів та лімфоцитів Посилення експресії ІдА В-клітинами Посилення проліферації фібробластів та загоєння ран
1 Відтворено за дозволом з 8Шез ОР, Тегг АІ, Рагвіом ТС [есіііогз]: МесІісаІ Іттипоіоду, 91Іп есі. Мс(Зга\л/-НіІІ, 1997.
2 Усі перелічені ефекти посилюються, окрім позначених інакше.
Головним у цьому варіанті активування є циркулювальний
білок, фактор 1, який розпізнає на клітинній мембрані
структури, що повторюються, - поліглюкозу або поліфрук-
тозу. Такі послідовності виявляються у бактерій та вірусів
і не характерні для клітин ссавців. Взаємодія між фактором
1 та поверхнею клітини-збудника започатковує реакції
РІДИНИ,ЩО ЦИРКУЛЮЮТЬ В ОРГАНІЗМІ / 481
Таблиця 27-4. Системні ефекти рекомбінантного ІЛ-1
Ефекти центральної нервової системи
Гарячка
Збільшення фази повільного сну
Підвищена секреція КРГ
Анорексія
Метаболічні ефекти
Підвищене синтезування білків печінкою
Підвищене виділення натрію
Зменшення вмісту цинку та заліза у плазмі
Зменшення кількості цитохрому Р450
Лактоацидоз
Гематологічні ефекти
Збільшення кількості нейтрофілів у крові
Зменшення кількості лімфоцитів у крові
Пригнічення ліпопротеїнліпази
Зменшення секреції колонієстимулювальних факторів
Підвищення неспецифічної резистентності
Ефекти судинної стінки
Підвищена адгезія лейкоцитів
Підвищене синтезування простагландинів
Підвищене виділення фактора активування
Підвищення проникності стінки капілярів
Гіпертензія
активування СЗ та С5. Пропердин є ще одним білком,
що циркулює у крові і стабілізує активувальний комп-
лекс ензимів. І класичний, і альтернативний шляхи
ведуть до утворення СЗ-конвертази, яка, відповідно,
перетворює СЗ в його активну форму СЗв.
Білок СЗв призводить до опсонізації бактерії, поси-
люючи фагоцитоз. Він також розпочинає реакції, що
активують інші компоненти каскаду системи компле-
менту. Після активування кінцеві продукти С5-С9
ведуть до утворення хемотаксичних речовин та виді-
лення гістаміну. Як і цитотоксичні Т-клітини, вони
також зумовлюють лізис бактерій, деяких вірусів та
сторонніх клітин шляхом уведення перфоринів, здат-
них до утворення пор у мембрані. Це спричинює віль-
ний рух йонів, і клітина гине внаслідок осмотичного
лізису.
Вроджений імунітет
До клітин, задіяних у реакціях вродженого імунітету,
належать нейтрофіли, макрофаги та природні цито-
токсичні клітини, або МК-клітини (від англ. паШгаї
Еритропоетин
КСФ-Ґ
ІЛ-4
ІЛ-7
Гормон росту
Пролактин
ІЛ-3
гЧ, І Містять спільну
КСФ-ҐМ ^субодиницюр
ІЛ-6
ІЛ-11
НЕ
О8М
СИТЕ
Містять спільну
субодиницю др1 ЗО
ІЛ-2
ІЛ-4
ІЛ-7
ІЛ-9
ІЛ-15
Підродина 1
Підродина 2 Підродина З
Рис. 27-6. У представників однієї з надродин рецепторів цитокінів виявлено спільні структурні елементи. Зауважимо, що всі
субодиниці підродини 3, крім а-субодиниці, мають чотири збережені залишки цистеїну (порожні комірки вгорі) та Тгр-8ег-Х-
Тгр-8ег-послідовність (чорний колір). Багато субодиниць містять також критичний регуляторний домен у їхніх цитоплазматич-
них ділянках (світлий колір) ІЛ-6, НЕ, О8М та СИТЕ містять др1 ЗО замість 0-субодиниці; СМТЕ(з англ сіїіагу пеигоігорґііс
їасіог) - війковий нейротрофічний фактор; НЕ (з англ. Іеикетіа іпйіЬИогу (асіог) - фактор інгібування лейкемії; О8М (з англ
опсозіаііп) - онкостатин М (модифіковано з О’АпсІгеа АО: Суіокіпе гесеріогз іп сопдепііаі ґіетаїороіеііс сіізеазе N ЕпдІ Н Месі
1994;330 839).
32 367-3
482 / РОЗДІЛ 27
кіііегз), великі лімфоцити, які не є Т-клітинами, однак
цитотоксичні. Всі ці клітини реагують на ліпіди та вугле-
води, специфічні для стінки бактерій, та на інші речовини,
характерні для пухлин та трансплантатів. Головний ефект
забезпечує участь системи комплементу та інших систем,
у цьому разі клітини-мішені гинуть переважно внаслідок
осмотичного лізису або апоптозу. Цитокіни цих клітин
активують також клітини, задіяні у реакціях набутого
імунітету.
Важливою ланкою вродженого імунітету у ВгохорИіІа
є рецепторний білок ІоП, який слугує для приєднання
антигену гриба та активування генів, що кодують проти-
грибкові білки. П’ять подібних до іоіі рецепторів (ТЬК)
сьогодні виявлено у людей. Один з них - ТЬК4 - приєднує
бактеріальні ліпополісахариди і білок, який називають
СОЇ4. Ці реакції розпочинають внутрішньоклітинні про-
цеси, що активують транскрипцію генів багатьох білків,
задіяних у реакціях природженого імунітету. Це важливо,
оскільки бактеріальні ліпополісахариди, що їх утворюють
грам-негативні збудники, спричинюють септичний шок.
Набутий імунітет
Як зазначено вище, головне для набутого імунітету -
спроможність лімфоцитів виділяти антитіла, що є специ-
фічними для кожного з мільйонів сторонніх агентів, які
потрапляють в організм. Антигени, що стимулюють утво-
рення антитіл, є зазвичай білками і поліпептидами, однак
антитіла можуть утворюватись і до нуклеїнових кислот та
ліпідів, якщо вони належать до складу нуклеопротеїнів та
ліпопротеїнів. Антитіла можуть утворюватись і до дрібних
молекул, якщо вони зв’язані з білками. Набутий імунітет
складається з двох ланок: гуморального та клітинного іму-
нітету. Гуморальний імунітет забезпечують імуноглобу-
лінові антитіла, що циркулюють у крові і належать до у-
глобулінової фракції білків плазми. Імуноглобуліни, що їх
утворюють В-лімфоцити, активують систему комплементу,
атакують та нейтралізують антигени. Гуморальний імуні-
тет є головним захисним механізмом у разі бактерійних
інфекцій. У випадку клітинного імунітету задіяні Т-лім-
фоцити. Ці процеси простежуються під час реакцій гіпер-
чутливості сповільненого типу та відторгнення трансплан-
тата чужої тканини. Цитотоксичні Т-лімфоцити атакують
та знищують клітини, що містять антиген, який їх активує.
Знищення клітин відбувається шляхом уведення перфори-
нів (див. вище) та стимулюванням апоптозу. Клітинний
імунітет є головним захисним механізмом у випадку інфек-
цій, спричинених вірусами, грибками та деякими бакте-
ріями, наприклад, бацилою туберкульозу. Він також є важ-
ливим протипухлинним механізмом.
Розвиток імунної системи
Під час фетального періоду попередники лімфоцитів
виходять з кісткового мозку. Ті, що заселяють тимус (рис.
27-7), перетворюються під впливом мікрооточення тканин
органа у лімфоцити, що відповідають за клітинний імунітет
(Т-лімфоцити). У птахів попередники, що заселюють бур-
су Фабріціуса, лімфоїдну структуру поблизу клоаки, пере-
творюються на лімфоцити, що відповідають за гумораль-
ний імунітет (В-лімфоцити). У ссавців немає бурси, і
трансформація у В-лімфоцити відбувається в еквівален-
тах бурси, наприклад у печінці плоду, а після народження
-у кістковому мозку. Після перебування у печінці чи тимусі
значна частина Т- та В-лімфоцитів мігрують у лімфовузли
і кістковий мозок. Процеси дозрівання попередників лім-
фоцитів у тимусі та еквівалентах бурси і міграція у лімфо-
вузли й інші тканини відбуваються у плоду та новонарод-
женого; однак повільне утворення нових лімфоцитів зі
стовбурової клітини - і в дорослому організмі.
Морфологічно Т- та В-лімфоцити розрізнити немож-
ливо, ідентифікувати їх можна за допомогою маркерів,
розміщених на клітинній мембрані. Представники В-клітин
диференціюються у плазматичні клітини та В-клітини
пам’яті. Розрізняють три головні види Т-лімфоцитів:
цитотоксичні Т-клітини, Т-клітини хелпери та Т-клі-
тини пам’яті. Крім того, є два підтипи клітин хелперів:
Т-хелпери першого типу (Тн1) виділяють ІЛ-2 та у-інтер-
ферон і пов’язані переважно з клітинним імунітетом; Т-
хелпери другого типу (Т 2) виділяють ІЛ-4 та ІЛ-5 і взаємо-
діють переважно з В-клітинами щодо гуморального
імунітету. Цитотоксичні Т-клітини руйнують трансплан-
товані й інші сторонні клітини, причому їхній розвиток
регульований Т-хелперами. Більшість цитотоксичних Т-
Т-клітини пам’яті
Тимус
Попередники
лімфоцитів
кісткового мозку
Т-лімфоцити
Т-клітини хелпери
(СО4 Т-клітини)
В-лімфоцити
Еквівалент бурси
(печінка, кістковий мозок)
Цитотоксичні
-►Т-клітини -------•
(переважно СО8 Т-клітини)
Клітинний
імунітет
Плазматичні
клітини
іде
ідА
ідм
ідо
ідЕ
Гуморальний
імунітет
В-клітини пам’яті
Рис. 27-7. Розвиток системи, що виконує реакції набутого імунітету.
РІДИНИ, ЩО ЦИРКУЛЮЮТЬ В ОРГАНІЗМІ / 483
клітин мають на поверхні глікопротеїни СБ8, а Т-клітини
хелпери - глікопротеїн СП4. Ці білки щільно зв’язані з
рецепторами Т-клітин і можуть діяти як корецептори.
Залежно від особливостей рецепторів та функції цитоток-
сичні Т-клітини розділяють на ар- і уб-типи (див. нижче).
Природні цитотоксичні клітини (див. вище) є також цито-
ксичними лімфоцитами, хоча вони не належать до Т-клі-
тин. Отже, є три головні види цитоксичних лімфоцитів в
організмі: арТ-клітини, убТ-клітини та МК-клітини.
Після контакту з антигеном невелика кількість активо-
ваних В- та Т-клітин залишаються у вигляді В- та Т-клітин
пам’яті. Ці клітини швидко перетворюються в ефекторні
клітини під час повторного контакту з тим самим анти-
геном. Здатність розвивати прискорену імунну відповідь у
разі повторного контакту з антигеном є ще однією важ-
ливою рисою набутого імунітету. Вона може зберігатися
протягом тривалого часу в лімфоїдній тканині, де розви-
валась імунна реакція, і ще довше у плазмі крові. В деяких
випадках (наприклад, імунітет проти кору) вона може три-
вати все життя. Багато суперечок зумовлює питання збе-
реження імунної пам’яті. За однією теорією, цей процес
спричинений повторними контактами з антигеном, які
призводять до слабкої імунної відповіді без розвитку інфек-
ційного захворювання. Згідно з іншою теорією, клітини
пам’яті мають дуже тривалий період життя завдяки періо-
дичному впливу фактора росту нервів, що запобігає їхньо-
му апоптозу. Як зазначено у Розділі 2, фактор росту нервів
виявляється у багатьох тканинах додатково до елементів
нервової системи.
Розпізнавання антигену
Кількість різних антигенів, що їх розпізнають лімфо-
цити в організмі, дуже велика. Здатність до розпізнавання
є природженою і розвивається без контакту з антигеном.
Стовбурові клітини диференціюються у мільйони різних
Т- га В-лімфоцитів, кожний з яких може реагувати на
певний антиген. У разі першого потрапляння антигену в
організм він може зв’язуватись безпосередньо з відповід-
ними рецепторами на В-клітинах. Однак повна гуморальна
відповідь потребує взаємодії В-клітин з Т-клітинами хел-
перами. У випадку Т-клітин антиген захоплює антигено-
презентувальна клітина та частково руйнує. Його пептид-
ний фрагмент представлений відповідним рецепторам на
Т-клітинах. У кожному випадку стимулюється клітинний
поділ з наступним утворенням клонів клітин, що реагують
на цей антиген (клональна селекція).
Презентування антигену
До антигенопрезен гувальних клітин (АПК) належать
спеціалізовані клітини, які називають дендритними
клітинами, лімфовузлів та селезінки і дендритні клітини
Ланґерганса у шкірі. Макрофаги та самі В-клітини теж мо-
жуть виконувати функцію антигенопрезентувальних клі-
тин. У антигенопрезентувальних клітинах поліпептидні
продукти розпаду антигену приєднуються до білкових про-
дуктів генів основного комплексу гістосумісності (МНС
- від англ. та)ог ЬізІосотраІіЬіІйу сотріех) і локалізовані
на поверхні клітин. Сполуки, що кодовані генами МНС,
називають лейкоцитарними антигенами людини (НЬА
- від англ. Ьитап Іеикосуіе апіщепз).
Гени МНС, що розміщені на короткому відрізку 6-ї хро-
мосоми людини, кодують глікопротеїни; їх розділяють на
два класи залежно від поширення та функції. Антигени
першого класу містять 45 кДа важкий ланцюг, приєднаний
нековалентним зв’язком до р2-мікроглобуліну, кодованого
генами, що розміщені поза МНС (рис. 27-8). Вони вияв-
ляються у всіх клітинах, що містять ядро. Антигени другого
класу є гетеродимерами, що складаються з а-ланцюгів
масою 29-34 кДа, приєднаних нековалентним зв’язком до
р-ланцюгів масою 25-28 кДа. Вони виявляються в анти-
генопрезентувальних клітинах, зокрема В-клітинах, та в
активованих Т-клітинах.
Білки першого класу МНС (МНС-І білки) переважно
приєднуються до пептидних фрагментів, утворених з біл-
ків, що синтезуються у клітині. Пептиди, до яких нема
толерантності, тобто ті, що походять з вірусів або є наслід-
ком мутацій, розпізнавані Т-клітинами. Розпад цих білків
відбувається у протеасомах - комплексі протеолітичних
ензимів, кодованих генами групи МНС, після чого пептидні
фрагменти зв’язуються з білками МНС в ендоплазматичній
Рис. 27-8. Структура антигену комплексу гістосумісності лю-
дини ША-А2. Кишеня для зв’язування антигену розміщена
вгорі й утворена частинами молекули а1 та а2. Ділянка а3 та
асоційований з нею р2-мікроглобулін (р2т) розміщені побли-
зу мембрани. Продовження С-терміналу з частини а3, яка є
трансмембранним доменом, та невелика цитоплазматична
частина молекули не зображені (відтворено за дозволом з
В]огктап РН еі аі: Зігисіиге оНЬе Ьитап ЬізІосотраІіЬіІііу апіі-
деп НБА-А2. Маіиге 1987;329:506).
484 / РОЗДІЛ 27
сітці. Білки другого класу МНС (МНС-П білки) переважно
зв’язуються з пептидними продуктами позаклітинних анти-
генів, таких як бактерії, що проникають у клітину шляхом
ендоцитозу, і руйнуються у пізніх ендосомах.
Рецептори Т-клітин
Комплекси МНС білки-пептиди на поверхні антигено-
презентувальних клітин приєднуються до відповідних Т-клі-
тин. Отже, рецептори Т-клітин повинні розпізнавати дуже
широкий спектр комплексів. Більшість рецепторів на Т-
клітинах, що циркулюють, складаються з двох поліпептид-
них одиниць, які позначають а та (3. Вони утворюють ге-
теродимери, що розпізнають МНС білки та фрагменти ан-
тигенів, з якими вони зв’язуються (рис. 27-9). Ці клітини
називають ар Т-клітини. Близько 10% Т-клітин, що цирку-
люють у крові, містять рецептори, у складі яких є два інші
поліпептиди, які позначають у та 5. Ці клітини називають уб
Т-клітини. їх виявляють у значній кількості в слизовій шлун-
ково-кишкового тракту. Відомо, що ці клітини є проміжною
ланкою між системами вродженого та набутого імунітету
завдяки цитокінам, що їх вони виділяють (див. рис. 27-5).
Білки СО8 виявляють на поверхні цитотоксичних Т-
клітин, що приєднуються до МНС-І білків, а СО4 просте-
жуються на поверхні Т-клітин хелперів, що зв’язуються з
МНС-П білками (рис. 27-10). Білки СО8 та СБ4 посилюють
приєднання МНС білків до рецепторів Т-клітин, а також
прискорюють розвиток лімфоцитів, однак механізми цих
впливів невідомі. Активовані СБ8 цитотоксичні Т-клітини
знищують клітини-мішені безпосередньо, тоді як активо-
вані СО4 Т-клітини хелпери виділяють цитокіни для акти-
вування інших лімфоцитів.
Мембрана антигено-
Рецептор Т-клітини
гетеродимер (а:Р)
Рис. 27-9. Взаємодія між антигенопрезентувальною клітиною
(угорі) і Т-лімфоцитом (унизу). МНС-білки (тут МНС 1) та їхній
фрагмент пептидного антигену приєднується до а- та р-
одиниць, які в комплексі формують рецептор Т-клітини.
Рецептори клітин оточені адгезивними молекулами і
білками, що приєднуються до комплементарних білків у
антигенопрезентувальних клітинах під час тимчасового
контакту між двома клітинами з утворенням “імуноло-
гічного синапсу”, що спричинює активування Т-клітини.
Загалом сьогодні вважають, що для активування клітини
необхідно два сигнали. Перший з них зумовлений при-
єднанням фрагментованого антигену до рецептора Т-клі-
тини, другий є наслідком приєднання навколишніх білків
“синапсу”. Якщо перший сигнал надійшов, а другий - ні,
то Т-клітина інактивується і не може реагувати.
В-клітини
Як зазначено вище, В-клітини можуть безпосередньо
зв’язуватись з антигеном, однак для розвитку повного акти-
вування та утворення антитіл вони повинні взаємодіяти з
Т-клітинами хелперами. Переважно задіяний підтип Тн2;
Т-клітини хелпери диференціюються у Тн2 під впливом
ІЛ-4 (див. нижче). З іншого боку, ІЛ-12 зумовлює дифе-
ренціювання у напрямі Тн1; ІЛ-2 спричинює проліферацію
активованих Т-клітин. Роль різних цитокінів у активуванні
В- та Т-клітин відображена на рис. 27-11.
Активовані В-клітини проліферують та перетворюють-
ся на В-клітини пам’яті (див. вище) і плазматичні клі-
тини. Плазматичні клітини виділяють велику кількість
антитіл у кров. Антитіла циркулюють у складі глобулінової
фракції плазми (див. нижче) і, подібно до антитіл будь-
якої локалізації, їх називають імуноглобулінами. Очевид-
но, що імуноглобуліни є секретованою формою антигено-
зв’язувальних рецепторів на поверхні мембрани В-клітин.
Імуноглобуліни
Антитіла, що циркулюють, захищають організм шляхом
зв’язування та нейтралізації деяких білкових токсинів,
запобігання прикріпленню деяких вірусів до клітини, опсо-
Рис. 27-10. Схема будови СО4 і СО8 та їхнє відношення до
МНС-І та МНС-П білків. Зверніть увагу, що СО4 є одним біл-
ком, тоді як СО8 - гетеродимером (відтворено за дозволом з
І_еаІіу 03: А зігисіигаї уієм ої СО4 апсі СО8. ЕА8ЕВ 3 1995;9:
17).
РІДИНИ, ЩО ЦИРКУЛЮЮТЬ В ОРГАНІЗМІ / 485
нізації бактерій (див. вище) та активування комплементу
(див. нижче). П’ять головних типів імуноглобулінових
антитіл утворює система лімфоцити-плазматичні клітини.
Головним компонентом кожного з них є симетрична оди-
ниця, що містить чотири поліпептидні ланцюги (рис. 27-
12). Два довгі ланцюги називають важкими ланцюгами,
а два короткі - легкими ланцюгами. Виявлено два типи
легких ланцюгів - к та X, і вісім типів важких. Ланцюги
зв’язані між собою дисульфідними зв’язками, що забез-
печує мобільність; усередині ланцюгів теж є дисульфідні
зв’язки. Крім того, важкі ланцюги є гнучкими у ділянці,
яку називають петля. Кожний важкий ланцюг має варіа-
бельний сегмент (V), у якому послідовність амінокислот
дуже варіабельна, сегмент різноманітності (Б), де послі-
довність теж дуже різна, з’єднувальний сегмент (І), у якому
послідовність помірно варіабельна, та константний сег-
ІЛ-2
Активована
В-клітина
Активування,
зумовлене ІЛ-2П
цитокінами
Активована \
Т-клітина \
Цитотоксична
Т-клітина
Антитіло-
утворювальна
клітина
МИС клас І
Запалення та
гіперчутливість
сповільненого типу
ІЛ-2Р
Загибель клітини
Рис. 27-11. Підсумок реакцій набутого імунітету. 1 -антигено-
презентувальна клітина захоплює та частково перетравлює
антиген, потім частина антигену презентується разом з пеп-
тидами МНС (у цьому випадку МНС II пептиди на клітинній
мембрані); 2 - утворення “імунного синапсу” неактивованою
СБ4 Т-клітиною, що призводить до активування лімфоцита
та виділення ІЛ-2; 3 - ІЛ-2 діє автокринним шляхом, зумов-
люючи проліферацію клітини й утворення клону; 4 - акти-
вована СО4-клітина може зумовлювати активування В-клітини
та утворення плазматичних клітин або активувати цитотоксич-
ні СО8-КЛІТИНИ. Активування СО8-клітин може бути зумовлене
також утворенням синапсу з МНС І антигенозв’язувальною
клітиною.
мент (С), де послідовність стабільна. Кожний легкий
ланцюг містить V-, 5- та С-сегменти. Сегменти V утво-
рюють ділянку приєднання антигену (РаЬ-ділянка молеку-
ли (див. рис. 27-12)). Ділянка Рс молекули є ефекторною,
вона опосередковує реакції, стимульовані антитілами.
Два класи імуноглобулінів містять додаткові поліпеп-
тидні компоненти (табл. 27-5). У І§М п’ять головних
імуноглобулінових одиниць об’єднані навколо 5-ланцюга,
утворюючи пентамер. У І§А - секреторних імуноглобу-
лінах - одиниці імуноглобулінів утворюють димери та
тримери навколо І-ланцюга та поліпептиду, що походить
з епітеліальних клітин, секреторного компонента (СК).
У кишці відбувається захоплення бактеріальних та
вірусних антигенів М-клітинами (див. Розділ 25), і вони
проходять через прилеглі скупчення лімфоїдної тканини,
де стимулюють лімфобласти. Потім ці лімфобласти про-
никають у систему кровообігу через лімфатичні судини, а
після “дозрівання” у кровоносних судинах мігрують до
дифузних скупчень лімфоїдних елементів, що розміщені
під слизовою оболонкою кишки та під епітелієм у легенях,
молочній залозі, сечостатевому тракті та жіночій репро-
дуктивній системі. Там після повторного контакту з анти-
геном, що спричинив первинну відповідь, вони виділяють
значну кількість І§А. Епітеліальні клітини утворюють СК,
який слугує рецептором і приєднує І§А. Унаслідок секре-
торні імуноглобуліни проходять через епітеліальну клітину
і виділяються шляхом екзоцитозу. Ця система секретор-
ного імунітету є важливим і ефективним механізмом
захисту.
Деякі імунні клітини містять індукувальну N08 (див.
Розділ 31); виявилось, що N0 посилює секреторний іму-
нітет у шлунково-кишковому тракті (див. Розділ 26).
Зв’язування
Рис. 27-12. Будова типової молекули імуноглобуліну 6; ГаЬ
- ділянка молекули, що зв’язується з антигеном; Гс -
ефекторна ділянка молекули. Константні ділянки забарвлені,
а варіабельні - світлі. Константний сегмент важкого ланцюга
ділиться на Сн1, Сн2 та Сн3. Праворуч лінії, які відображають
міжсегментарні дисульфідні зв’язки, опущені, що дає змогу
показати сегменти Зн, □, \/н, та Х/ґ.
486 / РОЗДІЛ 27
Таблиця 27-5. Імуноглобуліни людини У всіх випадках легкими ланцюгами є к або к
Імуно- глобулін Функція Важкий ланцюг Додатковий ланцюг Структура Концентрація в плазмі, мг/дл
іде Фіксація комплементу 71’ Ї2’ Уг У4 Мономер 1000
ІдА Місцевий захист у складі зовнішніх секретів (сльози, кишкові секрети тощо) ар а2 Ф 8С Мономер; димер з 3- або 8С-ланцюгами; тример з 3-ланцюгом 200
ідм Фіксація комплементу Р 3 Пентамер з 3-ланцюгом 120
ідо Розпізнавання антигену В-клітинами 8 Мономер 3
ідЕ Реагінова активність; виділення гістаміну базо- філами та мастоцитами є Мономер 0,05
Моноклональні антитіла
Велику кількість імуноглобулінів може синтезувати одна
плазматична клітина; якщо її з’єднати з пухлинною
клітиною - утвориться “фабрика” антитіл. На практиці
тварин імунізують певним антигеном або препаратом
клітин. Після їхнього розтину із селезінок виділяють анти-
тілопродукувальні клітини, які потім з’єднують з мієлом-
ними клітинами. Мієлома - це пухлина з В-лімфоцитів,
клітини якої легко зливаються з плазматичними клітинами,
формуючи антитілоутворювальні гібридоми, які добре
ростуть та відтворюються. Клітини, що злилися, виділяють
стандартними методами, і кожна з них дає початок клону
клітин, що походить з єдиної клітини.
Генетичні основи різноманітності імунної
системи
Генетичні механізми утворення надзвичайно великої
кількості різних конфігурацій імуноглобулінів у депоно-
ваних лімфоцитах організму є цікавою біологічною проб-
лемою. Частково різноманітність пояснюють наявністю
двох видів легких ланцюгів та восьми видів важких. Як
зазначено вище, у кожному ланцюгу є ділянки значної
варіабельності (гіперваріабельні ділянки). Варіабельні
зони важких ланцюгів складаються з V-, В- та 1-сегментів.
У родині генів, що кодують ці ділянки, є декілька сотень
різних кодувальних місць для У-сегмента, близько 20 для
□-сегмента та 4 для Д-сегмента. У разі дозрівання В-клі-
тини одне V-, одне □- і одне Д-кодувальні місця випадково
вибираються та рекомбінують з утворенням гена, що від-
повідає за певну варіабельну ділянку. У легких ланцюгах
простежується подібна варіабельна рекомбінація кодуваль-
них місць, що відповідають за два варіабельні сегменти
(V- та 1-). Крім того, варіабельність І-сегментів пов’язана
з тим, що сегменти гена зв’язуються по-різному і загалом
непередбачено (різноманітність, пов’язана з місцем зв’яз-
ку), а інколи простежується додавання нуклеотидів (різно-
манітність, пов’язана із вставкою у зв’язок). Було підра-
ховано, що ці механізми забезпечують утворення 108—1010
різних молекул імуноглобулінів. Додаткова варіабельність
досягається завдяки соматичним мутаціям.
Подібна реорганізація генів та механізми зв’язування
забезпечують різноманітність рецепторів Т-клітин. У
людей ос-субодиниця має У-ділянку, кодовану одним з 50
різних генів, та Д-ділянку, теж кодовану одним з інших 50
різних генів. У Р-субодиницях простежується У-ділянка,
кодована одним з 50 генів, О-ділянка, кодована одним з
двох генів, та Пділянка, кодована одним з трьох генів. Ці
варіабельні ділянки дають змогу утворити 1015 різних
рецепторів Т-клітин.
Розпізнавання власних структур
Завжди було цікавим питання, чому Т- та В-клітини не
утворюють антитіл та не руйнують клітини й органи влас-
ного організму. Згідно з сучасними поглядами власні анти-
гени з’являються разом зі сторонніми, однак потім елімі-
нуються у тимусі на ранніх етапах розвитку (клональна
делеція). Причини, з яких не відбуваються реакції від-
торгнення плоду як стороннього тіла організмом матері,
розглянуто у Розділі 23.
Автоімунні реакції
Іноді процеси елімінації антитіл проти власних анти-
генів не спрацьовують, унаслідок чого розвиваються різ-
номанітні автоімунні захворювання. їх поділяють на
опосередковані Т- або В-клітинами, а також на органо-
специфічні та системні. До таких захворювань належать
цукровий діабет першого типу (антитіла до В-клітин ост-
рівців підшлункової залози), міастенія (антитіла до ніко-
тинових холінергічних рецепторів) та розсіяний склероз
(антитіла до основного білка мієліну і деяких інших компо-
нентів мієліну).
У деяких випадках антитіла спрямовані проти рецеп-
торів, здатні їх активувати, наприклад, антитіла до Т8Н-
рецепторів підвищують активність щитоподібної залози і
зумовлюють базедову хворобу (див. Розділ 18).
Частина автоімунних реакцій пов’язана з утворенням
антитіл до мікроорганізмів, які перехресно реагують з
нормальними складовими організму (молекулярна мі-
мікрія). Інші ж розвиваються завдяки “ефекту свідка”,
за якого Т-клітини, що перебувають поблизу вогнища
запалення, сенсибілізують. Це призводить до їхнього акти-
вування, якого в інших умовах не повинно бути. Однак
щодо патогенезу автоімунних захворювань ще багато
нез’ясовано.
РІДИНИ, ЩО ЦИРКУЛЮЮТЬ В ОРГАНІЗМІ / 487
Трансплантація тканин
Система Т-лімфоцитів відповідає за відторгнення транс-
плантованої тканини. Якщо тканини, такі як шкіру або нир-
ки, пересаджують від донора до реципієнта таких тканин,
то трансплантат “приживається” і діє деякий час, однак
потім відбувається некроз та “відторгнення”, оскільки в
організмі реципієнта розвиваються імунні реакції проти
трансплантованої тканини. Зазвичай це простежується
навіть тоді, коли донор та реципієнт є близькими родичами.
Реакція відторгнення не відбувається тільки у випадку
ідентичних близнюків.
Розроблено багато різних методів пригнічення реакції
відторгнення трансплантованих органів у людей. Головна
мета лікування - припинення відторгнень за умов запобі-
гання розвитку інфекційних захворювань. Одним з методів
є знищення Т-лімфоцитів шляхом ліквідації всіх швидко
проліферувальних клітин такими ліками, як азатіоприн,
антиметаболітами пурину, однак це робить хворих чутли-
вими до інфекцій та раку. Інший метод - застосування
глюкокортикоїдів, які пригнічують проліферацію цитоток-
сичних Т-клітин шляхом зменшеного виділення ІЛ-2 Т -
клітинами, проте це може бути ускладнене остеопорозом,
психічними розладами та іншими ознаками синдрому
Кушінга (див. Розділ 20). Ще один метод - застосування
циклоспорину або такроліму (ГК-506). Активування
рецепторів Т-клітин у нормі збільшує концентрацію внут-
рішньоклітинного кальцію, що діє через кальмодулін, акти-
вуючи кальцинеурин (рис. 27-13). Кальцинеурин дефос-
форилює фактор транскрипції ИЕ-АТ, який рухається до
ядра та підвищує активність генів, що кодують ІЛ-2 та спо-
ріднені стимулювальні молекули. Однак ці сполуки при-
гнічують усі імунні реакції, опосередковані Т-клітинами,
а циклоспорин спричинює ураження нирок та рак. Новим
та перспективним напрямом лікування реакцій відторг-
нення є досягнення ареактивності Т-клітин із застосу-
ванням ліків, які блокують другий сигнал костимуляції,
потрібний для нормального активування (див. вище). Клі-
нічно ефективні препарати з такою дією можуть бути дуже
важливими для хірургів, що займаються трансплантацією.
Інші клінічні кореляції
З нагромадженням знань про імунну систему було опи-
сано понад 50 синдромів імунодефіциту, пов’язаних з
порушеннями функції імунокомпетентних клітин. Такі
зміни виявляються різними за важкістю станами - від
помірного збільшення частоти інфекцій до важких, зазви-
чай смертельних випадків. На рис. 27-14 показано, як
блокада на різних етапах шляху дозрівання В- та Т-клітин
призводить до розвитку передбачуваних патологічних змін.
Крім того, є різні види недостатності комплементу.
Злоякісна трансформація теж може відбутись на різних
стадіях дозрівання лімфоцитів. Більша частина (якщо не
всі) випадків хронічного лімфоїдного лейкозу пов’язані з
нсконтрольованою проліферацією В-лімфоцитів, хоча міє-
лома розвивається в разі пухлинної проліферації клонів
зрілих плазматичних клітин. Деякі випадки гострого лім-
фоїдного лейкозу пов’язані з пухлинною трансформацією
Т-клігин.
С индром набутого імунодефіциту (СНІД), який сьо-
годні є однією з головних проблем людства, унікальний у
Рецептор Т-клітини
І
• САМ
І
еь Кальцинеурин
ТСЬВР 1
СзАВР /
Активування
гена ІЛ-2
Ядро
Рис. 27-13. Дія циклоспорину (з англ. сусіозрогіпе СзА) та
такроліму (з англ. Іасгоіітиз ТСІ_) на лімфоцит. Активування
рецептора Т-клітини зумовлює надходження Са2+, що через
кальмодулін (з англ. саїтосіиііп САМ) призводить до
активування кальцинеурину. Кальцинеурин дефосфорилює
фактор транскрипції ІМР-АТ, який проникає у ядро та активує
ген ІЛ-2. Після приєднання до відповідного імунофіліну (ВР)
циклоспорин та такролім пригнічують вплив кальцинеурину
на ІМЕ-АТ, запобігаючи підвищенню продукування ІЛ-2.
тому, що ВІЛ (вірус імунодефіциту людини) -ретровірус,
що спричинює захворювання - приєднується до СО4 та
зумовлює значне зменшення кількості СО4 Т-клітин хел-
перів. Втрата лімфоцитів хелперів призводить, відповідно,
до порушення проліферації СВ8 та В клітин з втратою
імунної функції та загибелі від інфекцій, зумовлених
непатогенною флорою, або злоякісних пухлин.
ТРОМБОЦИТИ
Тромбоцити (кров’яні пластинки) - це маленькі грану-
льовані тільця діаметром 2-4 мкм (див. рис. 27-2). їхня
кількість у крові становить близько 300 000/мкл, а період
півжиття в нормі приблизно чотири дні. Тромбоцити утво-
рюються внаслідок відділення цитоплазми від велетенсь-
ких клітин кісткового мозку, мегакаріоцитів, після чого
виштовхуються у кровообіг. Близько 60-75% виділених з
кісткового мозку кров’яних пластинок міститься у крові,
решта локалізовані переважно у селезінці. Спленектомія
призводить до збільшення кількості тромбоцитів (тромбо-
цитоз).
Тромбоцити мають кільця з мікротрубочок по периферії
і численні інвагінації мембрани із складною системою
каналів, сполученою з позаклітинною рідиною. На мемб-
рані тромбоцитів локалізовані рецептори для колагену,
фактора Віллебранда судинної стінки (див. нижче) і фіб-
риногену. В їхній цитоплазмі містяться актин, міозин, глі-
коген, лізосоми і два типи гранул: щільні ґранули, що вмі-
щують небілкові речовини, які виділяються в разі акти-
488 / РОЗДІЛ 27
Плюрипотентна
стовбурова клітина
Автосомний
рецесивний 8СЮ
КІСТКОВИЙ
МОЗОК
Лімфоїдний
попередник
ТИМУС
Пре-В-клітина
Х-зв’язаний ЗСЮ
Х-зв’язана
агама-
глобулінемія
Незрілі
Т-клітини
Недостатність
В-клітина
Гіпер-ІдМ-
ІдМ ІдО ІдА ІдЕ
СО8-
клітина
СО4-
клітина
Недостатність
МНС класу II
Рис. 27-14. Місця вродженої блокади дозрівання В- та Т-лімфоцитів у різних імунодефіцитних станах (модифіковано з Новел
Е8, Соорег МО, \Л/есІд\л/оосІ КІР: ТЬе ргітагу іттипосІеЛсіепсіев. N ЕпдІ З Месі 1995;333:431).
вування тромбоцитів, у тім числі серотонін, АДФ та інші
аденінові нуклеотиди, а також ос-ґранули, що містять білки,
відмінні від гідролаз лізосом. До цих білків належать фак-
тори зсідання і фактор росту тромбоцитів (РОСЕ - від
англ. ріаіеіеі бепуесі §го\уф Еасіог). РВОР виробляють
також макрофаги й ендотеліальні клітини. Це димер, утво-
рений двома поліпептидними субодиницями А і В. Ці суб-
одиниці продукуються як гомодимери (АА і ВВ), так і гете-
родимери (АВ). РОСЕ стимулює загоєння ран і є сильним
мітогеном для гладких м’язів судинної стінки. Тромбоцити,
як і стінки кровоносних судин, містять фактор Віллебранда,
який, крім того, що відіграє роль в адгезії, регулює рівень
фактора VIII, що циркулює у крові (див. нижче).
У випадку ушкодження кровоносної судини кров’яні
пластинки прилипають до оголеного колагену, ламініну та
фактора Віллебранда стінки за допомогою інтегринів на
поверхні тромбоцитів. Цей процес адгезії тромбоцитів,
на відміну від агрегації, не потребує метаболічної актив-
ності кров’яних пластинок. Однак зв’язування з колагеном
призводить до активування тромбоцитів. Активування
можуть також спричиняти АДФ і тромбін. Активовані
пластинки змінюють форму, утворюють псевдоподії,
виділяють вміст гранул і прилипають до інших пластинок
(аґреґування тромбоцитів). Агрегуванню сприяє також
фактор активування тромбоцитів (РАГ - від англ. ріаіе-
Іеі асбуайп§ їасіог), цитокін, що його виробляють нейтро-
філи і моноцити, так само, як і тромбоцити. Ця речовина
виявляє також протизапальну активність, є фосфоліпідом,
І -алкіл-2-ацетилгліцерил-З-фосфорилхоліном, який утво-
рюється з ліпідів мембран. Його рецептор є типовим сер-
пентиновим рецептором, зв’язаним з С-білком. Він активує
фосфоліпазу С, унаслідок чого утворюється діацилгліце-
рол, який зумовлює виділення тромбоцитами вмісту їхніх
гранул. Збільшення внутрішньоклітинної концентрації Са24
і діацилгліцерол призводять до активування фосфоліпази
А2, яка спричинює виділення з фосфоліпідів мембран
арахідонової кислоти. З арахідонової кислоти утворюється
тромбоксан А2(див. Розділ 17), який сприяє подальшому
надходженню Са2+ і розпаду фосфатидилінозитолу. Тромбін
також зумовлює надходження Са2+ і гідроліз фосфатиди-
лінозитолу. Аспірин помірно пригнічує синтез тромбок-
сану. Доведено, що в малих дозах аспірин ефективний для
профілактики інфаркту міокарда, нестабільної стенокардії,
транзиторних ішемічних нападів та інсульту завдяки здат-
ності порушувати баланс між тромбоксаном А2-тромбо-
цитів і простацикліном судинної стінки (див. Розділ 31).
Продукування тромбоцитів регулюють колонієстиму-
лювальні фактори, які контролюють утворення мегакаріо-
цитів (див. табл. 27-2), а також тромбопоетин - білковий
фактор, що циркулює у крові. Цей фактор сприяє дозрі-
ванню мегакаріоцитів, його виробляють печінка і нирки.
На тромбоцитах є рецептори до тромбопоетину. Отже, за
малої кількості кров’яних пластинок зв’язується менше
тромбопоетину, а більше перебуває у вільній формі і спри-
чинює посилене продукування тромбоцитів. Навпаки, коли
кількість кров’яних пластинок велика, то більше тромбо-
поетину зв’язується, зумовлюючи зменшене продукування
тромбоцитів. Цей механізм регулює продукування тром-
боцитів за принципом зворотного зв’язку. Амінокінець
молекули тромбопоетину має тромбоцитарностимулю-
вальну активність, тоді як карбоксилкінець містить багато
залишків вуглеводів і визначає біодоступність молекули. З
терапевтичною метою застосовують ділянку амінокінця,
яку отримують за допомогою рекомбінантної технології.
Подальша кон’югація з поліетиленгліколем (ПЕГ) забез-
печує значне підвищення активності.
У разі недостатньої кількості тромбоцитів порушена
ретракція згустку і недостатньо звужуються ушкоджені
РІДИНИ, ЩО ЦИРКУЛЮЮТЬ В ОРГАНІЗМІ / 489
судини. Унаслідок цього розвивається клінічний синдром
(тромбоцитопенічна пурпура), який супроводжується
посиленим утворенням синців і численних підшкірних
геморагій. Пурпура може виникати і на тлі нормальної
кількості тромбоцитів, деколи в цьому випадку тромбоцити
є зміненими (тромбостенічна пурпура). Люди з тромбо-
цитозом схильні до тромбозу.
ЧЕРВОНІ КРОВ’ЯНІ КЛІТИНИ
Червоні клітини крові (еритроцити) переносять у крові
кисень. Це двоввігнуті диски, які утворюються у кістко-
вому мозку (рис. 27-15). У ссавців перед виходом у сис-
темний кровообіг еритроцити втрачають ядро. Тривалість
життя еритроцитів у людей становить у середньому 120
днів. У нормі середня кількість еритроцитів у чоловіків -
5,4 млн/мкл, у жінок - 4,8 млн/мкл. Кожний еритроцит
людини має діаметр 7,5 мкм, товщину 2 мкм і містить
приблизно 29 пг гемоглобіну (табл. 27-6). У крові дорослої
людини міститься 3x1013 еритроцитів і близько 900 г
гемоглобіну (рис. 27-16). Контроль еритропоезу за прин-
ципом зворотного зв’язку описано в Розділі 24. Роль ІЛ-1,
ІЛ-3, ІЛ-6 і КСФ-ҐМ у розвитку еритроїдного ростка пока-
зана на рис. 27-2.
Резистентність еритроцитів
Еритроцити, як і інші клітини, зморщуються в розчинах
з осмотичним тиском, вищим від нормального тиску
плазми. У розчинах з нижчим осмотичним тиском вони
набухають, змінюючи форму з дископодібної на сферичну,
і втрачають гемоглобін (гемоліз). Гемоглобін гемолізо-
ваних еритроцитів розчиняється в плазмі, забарвлюючи її
у червоний колір. Розчин натрію хлориду 0,9% концент-
рації є ізотонічний з плазмою. За нормальної осмотичної
резистентності гемоліз еритроцитів починається у 0,5%
сольовому розчині; 50% лізис відбувається у 0,40-0,42%
сольовому розчині, а повний лізис - у 0,35% розчині. У
разі спадкового сфероцитозу (вродженої гемолітичної
жовтяниці) клітини сфероцити нормальної плазми і
гемолізують швидше, ніж нормальні клітини у гіпотоніч-
ному розчині натрію хлориду. Сфероцити також видаляє
селезінка (див. нижче). Отже, спадковий сфероцитоз - це
Рис. 27-15. Людські еритроцити і нитки фібрину. Кров нане-
сена на полівінілхлоридну поверхню, зафіксована і сфото-
графована за допомогою скануючого електронного мікрос-
копа х 2590 (з дозволу МГ Росітап).
одна з головних причин спадкової гемолітичної анемії.
Сфероцитоз виникає внаслідок порушень білкової сітки,
яка зумовлює форму і гнучкість мембрани еритроцитів.
Мембранний скелет частково утворений спектрином і
прикріплений до трансмембранного білка смужки 3 за до-
помогою білка анкірину (див. рис. 1-11). Білок смужки З,
крім того, є важливим аніонним обмінником (див. Розділ
35). Описано дефекти білка смужки 3, спектрину та анкірину.
Лізис еритроцитів можливий також під впливом ліків і
в разі інфекцій. Схильність еритроцитів до гемолізу під
дією цих факторів посилена за наявності дефіциту ензиму
глюкозо-6-фосфатдегідрогенази (Г6ФД). Цей ензим ката-
лізує початковий етап окиснення глюкози у гексозомоно-
фосфатному шляху (див. Розділ 17), який забезпечує утво-
рення НАДФ, необхідного для нормальної резистентності
еритроцитів. Виражена недостатність Г6ФД зменшує
Таблиця 27-6. Характеристика еритроцитів людини1
Чоловіки Жінки
Гематокрит (Неї), % 47 42
Еритроцити (ЕРЦ), 106/мкл 5,4 4,8
Гемоглобін (НЬ), г/дл 16 14
Середній корпускулярний об’єм (МС\/2), фл = Неї х 10 / ЕРЦ (106/мкл) 87 87
Середній корпускулярний гемоглобін (МСН2), пг = НЬ х 10 / ЕРЦ (106/мкл) 29 29
Середня корпускулярна концентрація гемоглобіну (МСНС2), г/дл = НЬх 100/Нсі 34 34
Середній діаметр клітини (МСО2), мкг = Середній діаметр 500 клітин у мазку 7,5 7,5
1 Клітини із СКО > 95 фл називають макроцитами; клітини із СКО < 80 фл - мікроцитами; клітини із СКГ < 25 г/дл - гіпохромними.
2 МС\/ - від англ. теап согризсиїаг уоіите; МСН - від англ. теап согризсиїаг ИетодІоЬіп; МСНС - від англ. теап согризсиїаг
НетодІоЬіп сопсепігаїіоп, МСО - від англ. теап сеІІ сііатеіег.
490 / РОЗДІЛ 27
Рис. 27-16. Утворення і деструкція еритроцитів.
також здатність гранулоцитів спричиняти загибель
бактерій і сприяє розвитку важких інфекцій (див. вище).
Роль селезінки
Селезінка виконує важливу функцію фільтра, який ви-
даляє сфероцити та інші змінені еритроцити. Вона також
містить велику кількість тромбоцитів і відіграє важливу
роль в імунній системі. Кровообігу в селезінці притаманні
два компоненти: швидкий компонент за функцією забез-
печує переважно живлення, у цьому разі кров перебуває в
просвіті кровоносних судин; повільний компонент, за якого
кров покидає артеріоли і, перш ніж потрапити у синуси
селезінки і повернутися у загальний кровообіг, фільтру-
ється через велику кількість фагоцитів і лімфоцитів. Фаго-
цити видаляють бактерії і розпочинають імунну відповідь.
Змінені еритроцити видаляються, якщо вони є не настільки
гнучкими, як нормальні, а отже, не можуть проникнути
через щілини між ендотеліальними клітинами, які висте-
ляють синуси селезінки. Якщо нема селезінки, то бактері-
альні інфекції виникають частіше і бувають у важчій формі.
Підвищується також смертність від малярії, оскільки
деформовані еритроцити, які містять збудник малярії, не
видаляються.
Гемоглобін
Червоний пігмент, який переносить кисень і міститься
в еритроцитах хребетних, - це гемоглобін, білок з моле-
кулярною масою 64 450. Гемоглобін має глобулярну моле-
кулу, утворену чотирма субодиницями (рис. 27-17). Кожна
субоДиниця містить гем, зв’язаний з поліпептидом. Гем -
це залізовмісна сполука, похідна порфірину (рис. 27-18).
Комплекс поліпептидів називають глобіновою частиною
(глобіном) молекули гемоглобіну. В кожній молекулі гемо-
глобіну є дві пари поліпептидів. У гемоглобіні нормальної
дорослої людини (гемоглобіні А (від англ. адик - дорос-
лий)) два типи поліпептидів називають ос-ланцюгами, кож-
ний з яких містить 141 амінокислотний залишок, і р-лан-
цюгами, кожний з яких містить 146 амінокислотних залиш-
ків. Отже, гемоглобін А позначають оцр0. У нормі в дорос-
лих не весь гемоглобін крові є гемоглобіном А. Близько
Рис. 27-17. Схематичне зображення молекули гемоглобіну
А, яка складається з чотирьох субодиниць Молекула містить
два ос- і два р поліпептидні ланцюги, кожний з яких має гем
Гем зображено у вигляді дисків (відтворено за дозволом з
Нагрег НА еі аі РЬузіоІодізсґіе Сґіетіе. Зргіпдег, 1975)
2,5% гемоглобіну становить гемоглобін А^, у якому р-лан-
цюги заміщені 8-ланцюгами (а 8 ); 8-ланцюги також міс-
тять 146 амінокислотних залишків, однак 10 з них відріз-
няються від залишків р-ланцюгів.
Невелика кількість похідних гемоглобіну А представ-
лена глікозильованими гемоглобінами. Один з них - гемо-
глобін А1С (НЬА ) - містить глюкозу, прикріплену до термі-
нального валіну в кожному р-ланцюзі. Це особливо важ-
ливо, оскільки його концентрація в крові збільшується у
хворих з недостатньо компенсованим цукровим діабетом
(див. Розділ 19).
Реакції гемоглобіну
Гемоглобін зв’язує О2 з утворенням оксигемоглобіну;
О2 приєднується до Ее2ь-гему. Спорідненість гемоглобіну
до О2 залежить від рН, температури і концентрації в
еритроцитах 2,3-дифосфогліцерату (2,3-ДФГ). 2,3-ДФГ і
Н+ конкурують з О2 за зв’язування з деоксигенованим
гемоглобіном, змінюючи положення чотирьох пептидних
ланцюгів (четвертинна структура). Детально реакції окси-
генації і деоксигенації гемоглобіну та їхня фізіологічна
роль описані в Розділі 35.
Під час дії на кров різноманітних ліків та інших окис-
ників за умов іп уіуо та іп уйго двовалентне залізо (Ге2 ),
яке в нормі міститься в молекулі, перетворюється на три-
валентне (Ее3+), приводячи до утворення метгемоглобіну.
Метгемоглобін має темне забарвлення і за наявності у
великій кількості в системному кровообігу зумовлює від-
повідне забарвлення шкіри, яке нагадує ціаноз (див. Розділ
37). Незначне окиснення гемоглобіну до метгемоглобіну
незначно відбувається і в нормі, однак за допомогою сис-
теми ензимів у еритроцитах, системи НАДН-метгемогло-
бінредуктази, метгемоглобін знову перетворюється на
РІДИНИ, ЩО ЦИРКУЛЮЮТЬ В ОРГАНІЗМІ / 491
Деоксигенований гемоглобін
Рис. 27-18. Реакція взаємодії гему з О2. Абревіатура М, V та Р відповідає хімічним групам на рисунку ліворуч.
Оксигемоглобін
гемоглобін. Вроджена відсутність цієї системи є однією з
причин спадкової метгемоглобінемії.
Монооксид вуглецю взаємодіє з гемоглобіном з утво-
ренням карбоксигемоглобіну. Спорідненість гемоглобіну
до О2 значно нижча, ніж до монооксиду вуглецю, тому
монооксид вуглецю витісняє О2 з гемоглобіну, зменшуючи
кисеньзв’язувальну здатність крові (див. Розділ 37).
Гем також є в складі міоглобіну, кисеньзв’язувального
пігменту, що міститься у червоних (повільних) м’язах (див.
Розділ 35) і в складі ензиму дихального ланцюга, цито-
хрому с (див. Розділ 17). Порфірини, відмінні від тих, що
містяться в складі гему, відіграють роль у патогенезі деяких
метаболічних захворювань (вроджена і набута порфірія
тощо).
Гемоглобін плоду
У нормі в крові плоду людини міститься фетальний
гемоглобін (гемоглобін Е (від англ. ГеШь - плід)). За будо-
вою він подібний до гемоглобіну А, однак замість р-лан-
цюгів має у-ланцюги; гемоглобін Е позначають ос2у2. Гамма-
ланцюги також містять 146 амінокислотних залишків,
однак 37 з них відмінні від тих, що є в складі р-ланцюгів.
У нормі після народження фетальний гемоглобін заміщу-
ється гемоглобіном дорослих (рис. 27-19). У деяких людей
фетальний гемоглобін не зникає і є в крові протягом усього
життя. В організмі за заданого Рд2 вміст О9у фетальному
гемоглобіні вищий, ніж у гемоглобіні дорослих, тому що
він менше зв’язується з 2,3-ДФГ. Це полегшує транс-
портування О2 з материнського кровообігу у кровообіг
плоду (див. Розділ 32). На ранніх етапах ембріонального
розвитку, крім цього, виявляють і є-ланцюги, які утво-
рюють гемоглобін 6о\уєг-1 (^2є2) та гемоглобін Сю\уєг-2
(ос2єо). На людській 16-й хромосомі є дві копії гена «-гло-
біну. Крім того, на 11-й хромосомі міститься тандем п’яти
генів глобіну, які кодують р-, у- та 5-ланцюги глобіну і два
ланцюги, що в нормі виявляються лише протягом феталь-
ного періоду. Вважаю і ь, шо перехід віл однієї форми гемо-
глобіну до іншої в період розвитку регульований ділянкою
локусного контролю (ЬСК. - від англ. Іоспз сопігої ге§іоп)
ДНК людського гена для є-гемоглобіну. Однак детально
цей процес переходу ще не вивчений.
Порушення продукування гемоглобіну
Амінокислотна послідовність поліпептидних ланцюгів
гемоглобіну визначена генами глобіну.
Є два головні типи спадкових порушень продукування
гемоглобіну у людей: гемоглобінопатії, за яких утворю-
ються змінені поліпептидні ланцюги, і таласемії та спо-
ріднені порушення, за яких нормальні ланцюги утво-
рюються в недостатній кількості або взагалі не утворю-
ються внаслідок дефекту регуляторної ділянки генів гло-
біну. Таласеміям ос- і р-типу властива зменшена кількість
або відсутність ос- і р-поліпептидів, відповідно.
Рис. 27-19. Розвиток ланцюгів гемоглобіну в людини
492 / РОЗДІЛ 27
Мутантні гени, які продукують аномальні гемоглобіни,
досить поширені. У людей описано багато форм аномаль-
них гемоглобінів. Зазвичай, ці форми позначають літерою:
гемоглобін С, Е, І, 1, 8 і т.д. У більшості випадків
гемоглобіни відрізняються від нормального гемоглобіну
А за будовою поліпептидних ланцюгів. Наприклад, у гемо-
глобіні 8 ос-ланцюги нормальні, однак р-ланцюги змінені,
оскільки із 146 амінокислотних залишків у кожному р-
поліпептидному ланцюзі один залишок глутамінової кис-
лоти заміщений залишком валіну (табл. 27-7).
Якщо аномальний ген, успадкований від одного з бать-
ків, спричинює утворення аномального гемоглобіну, тобто
коли людина є гетерозиготною, то половина гемоглобіну,
що циркулює, аномальна, інша - нормальна. Якщо іден-
тичні аномальні гени успадковані від обох батьків, тобто
людина є гомозиготною, то весь гемоглобін аномальний.
Теоретично людина може успадкувати два різні аномальні
гемоглобіни, один від батька, інший від матері. Вивчення
особливостей успадкування і географічного розподілу ано-
мальних гемоглобінів дає змогу в деяких випадках з’ясу-
вати, де виник мутантний ген і приблизно наскільки давно
відбулася мутація. Загалом особи з мутаціями, що небез-
печні для життя, вмирають, однак мутантні гени, за яких
людина виживає, зберігаються і поширюються в популяції.
Багато аномальних гемоглобінів незагрозливі. Проте
деякі порушують процес з’єднання О2, інші спричинюють
анемію. Наприклад, гемоглобін 8 полімеризується в разі
низької напруженості О2. Це призводить до того, що ерит-
роцити набувають форми серпа, гемолізуються, утворюють
агрегати, що закупорюють кровоносні судини. Унаслідок
цього розвивається важка гемолітична анемія, відома як
серпоподібноклітинна анемія. У гетерезиготних осіб
прояви цієї анемії ледь помітні, у гомозиготних хвороба
виявляється повністю.
Ген серпоподібних клітин - це приклад гена, який збері-
гається і поширюється в популяції. Він виник серед чор-
ного населення Африки і зумовлює резистентність до
однієї з форм малярії. Це важлива позитивна особливість
в Африці, у деяких регіонах Африки гетерозиготну форму
серпоподібноклітинної анемії має 40% населення. Серед
чорного населення Сполучених Штатів Америки захворю-
ваність становить 10%.
Гемоглобін р здатний зменшувати полімеризацію деок-
сигенованого гемоглобіну 8. Гідроксисечовина зумовлює
продукування гемоглобіну Е і в дітей, і в дорослих. Дове-
дено, що ця речовина ефективна для лікування серпоподіб-
ноклітинної анемії. У хворих з важкою формою серпопо-
дібноклітинної анемії позитивні результати простежуються
після трансплантації кісткового мозку, однак цей метод
лікування потребує подальшого вивчення.
Синтез гемоглобіну
У нормі вміст гемоглобіну в крові становить у серед-
ньому 16 г/дл у чоловіків і 14 г/дл у жінок (весь міститься
в еритроцитах). В організмі чоловіка масою 70 кг міститься
близько 900 г гемоглобіну; 0,3 г гемоглобіну руйнується і
0,3 г синтезується протягом кожної години (див. рис. 27-
19). Гемічна частина гемоглобіну синтезується з гліцину і
сукциніл-КоА.
Катаболізм гемоглобіну
Коли відбувається руйнування старих еритроцитів сис-
темою тканинних макрофагів, глобін відщеплюється, а гем
перетворюється на білівердин. У цьому процесі бере
участь ензим гемоксигеназа (див. рис. 4-29), і утворюється
СО, який може відігравати роль внутрішньоклітинного
месенджера подібно до N0 (див. Розділ 4).
У людей основна частина білівердину перетворюється
на білірубін (рис. 27-20) і виділяється у жовч (див. Розділ
26). Залізо гему повторно використовується для синтезу-
вання гемоглобіну.
Унаслідок дії на шкіру білого світла відбувається пере-
творення білірубіну на люмірубін, який має коротший
період півжиття порівняно з білірубіном. Фототерапія (дія
світла) дає позитивний результат у лікуванні жовтяниці
новонароджених з гемолізом. Обов’язковим фактором у
процесі синтезування гемоглобіну є залізо. Якщо організм
втрачає залізо і його дефіцит не компенсований, то роз-
вивається залізодефіцитна анемія. Обмін заліза описано
в Розділі 25.
Таблиця 27-7. Частковий склад нормальних р-ланцюгів людини і р-ланцюгів деяких
аномальних гемоглобінів1
Гемоглобін Положення на р-поліпептидному ланцюгу гемоглобіну
1 2 3 6 7 26 63 67 121 146
А (нормальний) УаІ-Ніз-Ьеи біи-біи бій НІ8 УаІ бій НІ8
8 (серпоподібні клітини) УаІ
С І_у8
^Зап .Ьзе біу
Е 1-У8
М Зазкаїооп Туг
^МіЬаикее бій
ОдгаЬіа І_у8
11нші гемоглобіни містять змінені а-ланцюги. Аномальні гемоглобіни, які ведуть себе по-
дібно до нормальних у разі елекрофорезу, однак дещо відрізняються за складом,
позначають тією ж літерою; а за допомогою індекса зазначають місцевість, де вони вперше
виявлені, звідси М„ . .
’ т Зазкаіооп
Та ^МіЬаикее’
РІДИНИ, ЩО ЦИРКУЛЮЮТЬ В ОРГАНІЗМІ / 493
Рис. 27-20. Білірубін. Абревіатура М, V та Р відповідає хіміч-
ним групам, позначеним на рис. 27-18 ліворуч.
ГРУПИ КРОВІ
Мембрани еритроцитів людини містять різноманітні
антигени груп крові, які ще називають аглютиногенами.
Найважливіші і найліпше вивчені серед них А- і В-
антигени. Однак є ще багато інших антигенів.
Система АВО
Антигени А і В успадковані як менделівські домінанти.
Людей можна розділити на чотири головні групи за гру-
пами крові. Люди з групою А мають антиген А, з групою
В - антиген В, з групою АВ - мають обидва антигени, з
групою О - не мають жодного з антигенів. Ці антигени
містяться не тільки в крові, а й у багатьох інших тканинах:
слинних залозах, підшлунковій залозі, нирках, печінці,
легенях, яєчках, спермі, а також слині й амніотичній рідині.
Антигени А і В належать до олігосахаридів і відрізня-
ються за кінцевими цукрами. В еритроцитах вони є
переважно в складі глікосфінголіпідів, в інших тканинах -
глікопротеїнів. Ген Н кодує фукозотрансферазу, яка пере-
носить фукозу на кінцеву ділянку цих гліколіпідів або
глікопротеїнів, зумовлюючи утворення антигену Н. Цей
антиген зазвичай наявний у людей усіх груп крові (рис.
27-21). Люди з групою крові А мають ген, який кодує транс-
феразу, що каталізує приєднання кінцевого А-ацетилга-
лактозаміну до антигену Н. Люди з групою В мають ген,
який кодує трансферазу для приєднання кінцевої галактози.
Люди з групою АВ мають обидва види трансфераз. Люди
з групою О, не мають жодної з цих трансфераз, отже,
структура антигену Н у них збережена. Сьогодні з’ясовано,
що для людей групи О характерна делеція однієї основи
відповідного гена. Унаслідок цього утворюється білок, поз-
бавлений трансферазної активності.
Для груп крові А і В описані підгрупи, серед яких
найважливішими є А] і А2. Різниця між підгрупами А] і А2
кількісна: кожна А ^клітина має близько 1 000 000 копій
антигену А, а кожна А2-клітина - близько 250 000 копій.
Антитіла до аглютиногенів еритроцитів називають
аглютинінами. Антигени, дуже подібні до антигенів А і
В, містять бактерії кишки і, можливо, їжа новонароджених.
Тому в маленьких дітей швидко виробляються антитіла до
антигенів, які не містяться у їхніх власних клітинах. На-
Рис. 27-21. Антигени системи АВО на поверхні еритроцитів.
приклад, у людей групи А виробляються анти-В антитіла,
у людей групи В - анти-А антитіла, у людей групи О -
обидва види антитіл, у людей групи АВ антитіла не утво-
рюються (табл. 27-8). У випадку змішування плазми люди-
ни з групою крові А з еритроцитами групи В анти-В анти-
тіла спричинюють аглютинацію еритроцитів, як це пока-
зано на рис. 27-22. Інші реакції аглютинації, які простежу-
ються в разі невідповідності плазми й еритроцитів, наве-
дені в табл. 27-8. Групи крові визначають шляхом змішу-
вання на скляній пластинці еритроцитів людини з антиси-
роваткою, яка містить різноманітні аглютиніни, та спосте-
режень за тим, чи відбулась аглютинація.
Трансфузійні реакції
Небезпечні гемолітичні трансфузійні реакції виника-
ють унаслідок переливання людині несумісної крові, тобто
проти еритроцитів якої у людини є'аглютиніни. Плазма,
яку переливають, зазвичай настільки розводиться в орга-
нізмі хворого, що зрідка спричинює аглютинацію, навіть
за високого титру аглютинінів проти еритроцитів реци-
пієнта. Однак якщо плазма реципієнта містить аглютитіни
проти еритроцитів донора, то виникає аглютинація і гемо-
ліз еритроцитів. Вільний гемоглобін виходить у плазму.
Вираженість проявів трансфузійної реакції може колива-
тися від безсимптомного незначного підвищення рівня
білірубіну в плазмі до сильної жовтяниці й ураження нир-
Таблиця 27-8. Загальна характеристика системи АВО
Група крові Аглютиніни в плазмі Поширення у США, % Плазма аглютинує еритроцити типу
О Анти-А, анти-В 45 А, В, АВ
А Анти-В 41 В, АВ
В Анти-А 10 А, АВ
АВ Немає 4 Немає
494 / РОЗДІЛ 27
Рис. 27-22. Аглютинація еритроцитів у несумісній плазмі.
кових канальців (спричиненого речовинами, які виділя-
ються з гемолізованих еритроцитів) з анурією і смертю.
Несумісність груп крові в системі АБО коротко схарак-
теризовано в табл. 27-8. Люди з групою крові АВ - це
універсальні реципієнти; оскільки в них немає циркулю-
вальних аглютинінів, то їм можна переливати кров будь-
якої групи без ризику розвитку трансфузійної реакції
внаслідок несумісності АБО. Люди з групою крові О - це
універсальні донори; оскільки вони не мають антигенів А
і В, то кров цієї групи можна переливати будь-кому без
загрози розвитку трансфузійної реакції в системі АБО.
Однак переливати кров без попередньої перевірки на
несумісність можна лише в надзвичайних випадках, тому
що є можливість трансфузійних реакцій і сенсибілізації
унаслідок несумісності систем, відмінних від системи
АБО. Під час перевірки на несумісність на скляній плас-
тинці змішують еритроцити донора з плазмою реципієнта
і спостерігають, чи розвивається аглютинація. Доцільно
також перевіряти дію плазми донора на еритроцити реци-
пієнта, незважаючи на те, що ця дія зрідка приводить до
небезпечних наслідків.
Сьогодні поширена процедура заготовляння власної
крові хворого перед операцією і потім, у випадку потре-
би, її подальша інфузія протягом операції (автологічна
трансфузія). Якщо одночасно вводити препарати заліза,
то за три тижні можна заготувати 1000-1500 мл крові.
Популярність цього методу можна пояснити передусім
небезпекою інфікування СНІДом у разі гетерологічної
трансфузії, однак звичайно, іншою перевагою цього методу
є уникнення ризику трансфузійних реакцій.
Успадковування антигенів А і В
Антигени А і В успадковують як менделівські алело-
морфи, у цьому разі А і В - це домінанти. Наприклад, люди-
на з групою крові В могла успадкувати антиген В від
кожного з батьків, або антиген В від одного з батьків і анти-
ген О від іншого. Отже, особа з фенотипом В може мати
генотип ВВ (гомозиготна) або ВО (гетерозиготна).
Якщо відомі групи крові батьків, то можна передбачити
генотипи їхніх дітей. Батьки з групою крові В (обидва)
можуть мати дітей з генотипом В В (антиген В від кожного
з батьків), ВО (антиген В від одного з батьків, О від іншого
гетерозиготного батька) або ОО (антиген О від кожного з
батьків, які є гетерозиготними). Якщо відомі групи крові
матері і дитини, то можна з’ясувати, що чоловік не є бать-
ком дитини, визначивши його групу крові. Однак довес-
ти, що чоловік є батьком, неможливо. Точність результатів
значно поліпшена в разі визначення антигенів, відмінних
від аглютиногенів АВО. Із застосуванням методу ДНК-фін-
герпринту (див. Розділ 1) вірогідність визначення бать-
ківства наближається до 100%.
Інші аглютиногени
Крім системи антигенів АВО, є такі системи, як Кй,
МК$8, Лютеран, Келл, Кідд та багато інших. Відомо понад
500 мільярдів можливих фенотипів груп крові. Оскільки,
без сумніву, є ще не виявлені антигени, то підраховано, що
кількість фенотипів насправді повинна сягати трильйонів.
Кількість груп крові у тварин настільки ж велика, як і в
людей. Досить цікаве питання: чому в процесі еволюції
розвинувся та зберігся такий поліморфізм? Частота роз-
витку деяких захворювань більша у людей з певною групою
крові, однак ця відмінність не дуже значна. Один антиген,
антиген Даффі, є рецептором хемокіну. Багато інших ува-
жають клітинновпізнавальними молекулами, однак зна-
чення впізнавального коду такої складності поки остаточно
не вивчене.
КЬ-фактор
Дуже важливе значення в клініці, крім антигенів сис-
теми АВО, має Кй-система антигенів. Фактор Кй (назва
походить від назви макаки резус, оскільки в її крові його
вперше досліджено) - це система, яка складається перед-
усім з антигенів С, В та Е, хоча містить багато інших. На
відміну від антигенів АВО, цю систему визначають лише
в еритроцитах. Білок О - це основний антигенний компо-
нент, і термін Кй-позитивний зазвичай означає, що людина
має аглютиноген О. Білок О неглікозильований і функція
його невідома; Кй-негативна людина не має антигену □ і в
разі введення їй О-позитивних клітин виробляє анти-В
аглютиніни. Резус-належність унаслідок рутинних дослід-
жень визначають за допомогою анти-В сироватки. Насе-
лення Кавказу у 85% випадків В-позитивне і в 15% В-нега-
тивне; в Азії понад 99% населення В-позитивне. На відміну
від антитіл системи АВО, анти-В антитіла не виробляють-
ся, якщо В-негативна людина не контактувала з В-пози-
тивними еритроцитами під час гемотрансфузії або під час
надходження крові плоду в материнський кровообіг. В-
негативні люди, яким було зроблено гемотрансфузію В-
позитивної крові (навіть якщо це було декілька років тому),
можуть мати високий титр анти-В аглютиніну, внаслідок
чого у них розвиваються трансфузійні реакції у разі повтор-
ного переливання В-позитивної крові.
Гемолітична хвороба новонароджених
Інше ускладнення, яке є наслідком Кй-несумісності, роз-
вивається в разі виношування Кй-негативною жінкою Кй-
позитивного плоду. Невелика кількість крові плоду прони-
кає у материнський кровообіг під час пологів, і деякі жінки
у післяпологовий період мають досить високий титр анти-
Кй аглютинінів. Протягом наступної вагітності материнсь-
кі аглютиніни проникають через плаценту в організм плоду.
Крім того, упродовж вагітності можливі геморагії, унаслі-
док чого виникає сенсибілізація. В будь-якому випадку
анти-Кй аглютиніни у разі проходження через плаценту в
РІДИНИ, ЩО ЦИРКУЛЮЮТЬ В ОРГАНІЗМІ / 495
організм КЬ-позитивного плоду можуть спричиняти гемо-
ліз і різноманітні форми гемолітичної хвороби новона-
роджених (еритробластоз плоду). У разі вираженого
гемолізу плід може загинути в просвіті матки, або розви-
вається анемія, значна жовтяниця та набряк (водянка
плоду). Може розвинутися також неврологічний синдром,
за якого некон’югований білірубін відкладається в базаль-
них ядрах (ядерна жовтяниця), особливо якщо пологи
супроводжувалися гіпоксією плоду. У дорослих білірубін
зрідка проникає в головний мозок, однак у дітей з еритро-
бластозом це можливо, частково завдяки ліпшій проник-
ності гематоенцефалічного бар’єру. Однак головною при-
чиною є дуже високий рівень некон’югованого білірубіну
внаслідок незрілості білірубін-кон’югувальної системи.
Близько 50% КЬ-негативних людей сенсибілізовані (ма-
ють анти-КЬ титр) унаслідок переливання КЬ-позитивної
крові. Оскільки сенсибілізація КЬ-негативних жінок у разі
виношування КЬ-позитивного плоду розвивається пере-
важно під час пологів, то перша дитина зазвичай народ-
жується нормальною. У 17% КЬ-позитивних дітей, які на-
роджуються від КЬ-негативних жінок, що раніше були ва-
гітні один або більше разів КЬ-позитивним плодом, про-
стежується гемолітична хвороба. Розвитку сенсибілізації
під час пологів можна запобігти шляхом уведення у після-
пологовий період однієї дози анти-КЬ антитіл у вигляді
КЬ-імуноглобуліну. Доведено, що така пасивна імунізація
не спричинює ускладнень у матері й запобігає активному
утворенню у неї антитіл. Запровадження цього методу в
акушерську практику щодо КЬ-негативних жінок, які наро-
дили КЬ-позитивну дитину привело до зменшення частоти
гемолітичної хвороби більше ніж на 90%. Крім того, сьо-
годні можливе визначення КЬ-фактора у матеріалі, отрима-
ному внаслідок амнюцентезу або взятому із ворсин хоріо-
на, а подальше лікування малими дозами Кй-імунної си-
роватки дає змогу запобігги сенсибілізації під час вагітності.
ПЛАЗМА
Рідка частина крові - плазма - це розчин, який містить
величезну кількість йонів, неорганічних та органічних мо-
лекул, що транспортуються до різних ділянок тіла або самі
беруть участь у транспортуванні інших речовин. У нормі
об’єм плазми становить 5% від маси тіла, тобто для чо-
ловіка масою 70 кг - у середньому 3500 мл. У пробірці
плазма зсідається, рідкий стан її в цьому разі можна збе-
регти, лише додавши антикоагулянт. Рідину, яка утво-
рюється внаслідок зсідання крові і видалення утвореного
згустку, називають сироваткою. За складом сироватка ду-
же подібна до плазми крові, однак вона не містить фібри-
ногену та факторів зсідання II, V та VIII (табл. 27-9) і має
вищий рівень серотоніну завдяки розпаду тромбоцитів у
процесі зсідання. Вміст різноманітних речовин у плазмі
крові в нормі описаний у відповідних розділах і коротко
наведений у таблиці на внутрішній частині обкладинки цієї
книги.
Білки плазми крові
Білки плазми складаються із фракцій альбумінів, гло-
булінів і фібриногену. Фракцію глобулінів поділяють на
Таблиця 27-9. Класифікація факторів зсідання крові
Фактор1 Назва
І II III IV V VII VIII IX X XI XII XIII НМ\А'-К Рге-Ка Ка РІ_ Фібриноген Протромбін Тромбопластин Кальцій Проакцелерин, лабільний фактор, акцелератор глобулін Проконвертин, 8РСА, стабільний фактор Антигемофільний фактор (АНР2), антигемофільний фактор А, антигемофільний глобулін (АН62) Плазмовий тромбопластиновий компонент (РТС2), фактор Крістмаса, антигемофільний фактор В Фактор Стюарта-Прауера Плазмовий попередник тромбопластину (РТА2), антигемофільний фактор С Фактор Хагемана, скляний фактор Фібринстабілізаційний фактор, фактор Лакі- Лоранда Високомолекулярний кініноген, фактор Фітцджеральда Прекалікреїн, фактор Флетчера Калікреїн Фосфоліпід тромбоцитів
1 Фактор VI не є єдиною відокремленою структурою, тому його
опускаємо.
2 АНР - від англ. апїіґіеторґііііс (асіог; АН6 - від англ. апіі-
НеторЬіІіс дІоЬиІіп; РТС - від англ. ріавта їґіготЬорІавІіс сот-
ропепі; РТА - від англ. ріавта ФготЬорІавііп апіесесіепі.
декілька компонентів. Згідно з однією класифікацією, виді-
ляють ОС]-, ос2-, р]-, р2- та у-глобуліни і фібриноген.
Молекулярні маси і загальна конфігурація декількох білків
плазми показані на рис. 27-23. Звичайно, справжня струк-
тура білків значно складніша, однак цей рисунок дає змогу
порівняти наближені розміри та форми цих білків між
собою, а також з молекулою глюкози.
Капілярна стінка дещо непроникна для білків плазми,
це зумовлює осмотичний тиск близько 25 мм рт. ст. (онко-
тичний тиск; див. Розділ 1) і сприяє втримуванню води в
просвіті судин. Білки плазми забезпечують також 15%
буферної здатності крові (див. Розділ 39) завдяки слабкій
йонізації СООН- та МН2-груп. За нормального значення
рН плазми (7,40) білки перебувають в аніонній формі (див.
Розділ 1) і становлять значну частину аніонного компо-
нента плазми. Такі білки плазми, як антитіла, а також ті,
що беруть участь у зсіданні крові, виконують специфічні
функції. Деякі білки беруть участь у транспортуванні гор-
монів щитоподібних, надниркових і статевих залоз та де-
яких інших гормонів. Зв’язування гормонів з білками запо-
бігає їхній швидкій фільтрації у клубочках нирок і створює
певний запас гормонів. Крім того, альбумін слугує носієм
для металів, йонів, жирних кислот, амінокислот, білірубіну,
ензимів та ліків.
Походження білків плазми
Плазмоцити виробляють циркулювальні антитіла, які
належать до білків фракції у-глобулінів (див. вище). Біль-
496 / РОЗДІЛ 27
Шкала
10 нм N3* СГ Глюкоза
Альбумін
69 000
Гемоглобін
64 450
у-Глобулін
156 000
р<Глобулін
90 000
Фібриноген
340 000
Рис. 27-23. Відносні розміри і молекулярні маси деяких білків
та інших речовин плазми (модифіковано та відтворено з
Миггау КК еі аі: Нагрег’в Віосїіегпізігу, 25Ш есі. МсСга\л/-НіІІ,
2000).
шість інших білків плазми синтезується у печінці. Ці білки
і їхні головні функції наведені в табл. 27-10.
Отримані дані щодо обміну альбуміну свідчать про
важливу роль синтезу в забезпеченні нормального рівня
альбуміну. У здорової дорослої людини рівень альбуміну
у плазмі становить 3,5-5,0 г/дл, загальний пул альбуміну -
4,0-5,0 г/кг маси тіла; 38-45% альбуміну міститься в
просвіті судин, решта - переважно у шкірі. Близько 6-10%
загального пулу альбуміну руйнується протягом доби, мета-
болізований альбумін заміщується заново синтезованим
(200—400 мг/кг/добу). Очевидно, за допомогою везикуляр-
ного транспортування альбумін проходить через стінку
капілярів у позасудинний простір (див. Розділ 1). Синтез
альбуміну чітко регульований. Він послаблюється під час
голодування і посилюється у разі нефрозу, який супровод-
жується значною втратою альбуміну.
Ппопротеїнемія
У випадку голодування нормальний рівень білків плазми
підтримується доти, доки не виснажаться запаси білків в
організмі. Однак у разі тривалого голодування, а також
синдрому мальабсорбції внаслідок захворювань кишки
(наприклад, спру) рівень білків плазми крові знижується
(гіпопротеїнемія). Крім того, рівень білків у плазмі зни-
жується теж під час захворювань печінки (внаслідок пору-
шення синтезу білків у печінці) й у випадку нефрозу
(оскільки велика кількість альбуміну виходить із сечею).
Унаслідок зниження онкотичного тиску розвиваються
набряки (див. Розділ 30).
Деколи простежується вроджений дефіцит тої чи іншої
фракції білків плазми. Прикладом цього є вроджена форма
афібриногенемії, яка супроводжується порушенням зсі-
дання крові.
ГЕМОСТАЗ
Гемостаз - це процес утворення згустків в ушкоджених
судинах, спрямований на запобігання крововтраті і забез-
печення рідкого стану крові в просвіті кровоносних судин.
Баланс між коагуляцією та антикоагуляцією відновлюється
за допомогою складних взаємопов’язаних системних меха-
нізмів. Крім того, на цей баланс впливають локальні фак-
тори у різноманітних органах.
Відповідь на ушкодження
Ушкодження невеликих кровоносних судин спричинює
серію подій (рис. 27-24), які призводять до утворення
згустку (гемостаз). Унаслідок цього ушкоджена судина
закупорюється, що дає змогу запобігти подальшій крово-
втраті. Початковою подією є звуження судини й утворення
тимчасового гемостатичного тромбу з тромбоцитів
(тромбоцитарного тромбу) внаслідок зв’язування тромбо-
цитів з колагеном і їхньої агрегації. Далі відбувається пере-
творення тромбоцитарного тромбу на справжній тромб.
Звуження ушкоджених артеріол або малих артерій може
бути настільки вираженим, що призводить до їхньої обліте-
рації. Звуження судин відбувається внаслідок виділення
серотоніну й інших вазоконстрикторних речовин з тром-
боцитів, які прилипають до стінки ушкоджених судин.
Стверджують, що в разі поперечного перерізання артерій
навіть такого калібру, як променеві, відбувається звуження,
що може припинити кровотечу. Однак це не означає, що
можна не поспішати з накладанням лігатури на ушкоджену
судину. Крім того, у випадку поздовжнього або безладного
ушкодження артерій вазоконстрикція не забезпечує їхньої
оклюзії, і кровотеча триває.
Ушкодження
судинної стінки
Звуження Колаген Тканинний
Пригнічувальні
процеси
Рис. 27-24. Реакції, які беруть участь у гемостазі. Штрихове
стрілка означає пригнічення (модифіковано та відтворено з<
дозволом з Оеукіп О: ТбготЬодепевів, N ЕпдІ 3 Месі 1967;267
622).
РІДИНИ, ЩО ЦИРКУЛЮЮТЬ В ОРГАНІЗМІ / 497
Таблиця 27-10. Деякі білки, що їх синтезує печінка: фізіологічні функції та властивості1
Назва Головна функція Особливості зв’язування Концентрація у сироватці або плазмі
Альбумін Зв’язування і транспортування речовин; осмотичне регулювання Гормони, амінокислоти, стероїди, вітаміни, жирні кислоти 4500-5000 мг/дл
Орозомукоїд Не вивчена; можливо, бере участь у запаленні Сліди; підвищується в разі запалення
о^-Антипротеаза Інгібітор трипсину та інших протеаз Протеази сироватки і тканинних секретів 1,3-1,4 мг/дл
а-Фетопротеїн Осмотичне регулювання; зв’язуваль- ний та транспортувальний білок2 Гормони, амінокислоти У нормі міститься у крові плоду
а2-Макроглобулін Інгібітор ендопротеаз сироватки Протеази 150—420 мг/дл
Антитромбін III Інгібітор протеаз внутрішньої системи гемокоагуляції 1:1 зв’язування протеаз 17-30 мг/дл
Церулоплазмін Транспортування міді Шість атомів міді/моль 15-60 мг/дл
С-реактивний білок Не вивчена; бере участь у запаленні Комплемент С1ц <1 мг/дл; підвищується в разі запалення
Фібриноген Попередник фібрину у гемостазі 200-450 мг/дл
Гаптоглобін Зв’язування, транспортування вільного гемоглобіну 1:1 зв’язування гемоглобіну 40-180 мг/дл
Гемопексин Зв’язує порфірини, зокрема гем, для його повторного використання 1:1 з гемом 50-100 мг/дл
Трансферин Транспортування заліза Два атоми заліза/моль 3,0-6,5 мг/дл
Аполіпопротеїн В Складання частинок ліпопротеїнів Транспортер ліпідів
Ангіотензиноген Попередник пресорного пептиду ангіотензину II
Білки, фактори зсі- дання II, VII, IX, X Зсідання крові 20 мг/дл
Антитромбін С, білок С Пригнічення зсідання крові
Інсуліноподібний фактор росту І Трансмітер анаболічних ефектів гормону росту ІФР-І рецептор
Глобулін, що зв’язує стероїдні гормони Білок, що переносить стероїди у крові Стероїдні гормони 3,3 мг/дл
Тироксинозв’язу- вальний глобулін Білок, що переносить тиреоїдний гормон у крові Тиреоїдні гормони 1,5 мг/дл
Транстиретин (тиреоїдозв’язу- вальний пре- альбумін) Білок, що преносить тиреоїдний гормон у крові Тиреоїдні гормони 25 мг/дл
1 Відтворено за дозволом з МсРґіее 8^ еі аі: РаіИорІїузіоІоду ої Оізеазе, ЗгсІ есі. МсСга\л/-НіІІ, 2000.
2 Функція а-фетопротеїну остаточно не вивчена, однак завдяки структурній подібності до альбуміну йому приписують ці функції.
Коагуляційний механізм
Тимчасова гемостатична пробка за допомогою фібрину
перетворюється на справжній тромб. Коагуляційний меха-
нізм, який забезпечує утворення фібрину, передбачає кас-
кад реакцій, у процесі яких відбувається активування ензи-
мів, що, відповідно, активують інші ензими. В минулому
систему ускладнювала розбіжність у номенклатурі, однак
прийняття номенклатури з нумерацією більшості факторів
зсідання крові (див. табл. 27-9) дало змогу цього уникнути.
Фундаментальною реакцією в процесі зсідання крові є
перетворення розчинного білка плазми крові фібриногену 33
33 367 2
в нерозчинний фібрин (рис. 27-25). Реакція полягає у від-
щепленні двох пар поліпептидів від кожної молекули фіб-
риногену. Унаслідок цього залишається частина - фібрин-
мономер - яка потім полімеризується з іншими молеку-
лами-мономерами з утворенням фібрину. Спочатку фібрин
є сіткою переплетених ниток. Далі з утворенням ковалент-
них поперечних зв’язків він перетворюється на щільний
агрегат (стабілізація). Цю реакцію каталізує активований
фактор XIII, і вона потребує наявності Са2+.
Перетворення фібриногену на фібрин каталізоване
тромбіном. Тромбін належить до серинових протеаз і утво-
498 / РОЗДІЛ 27
ВНУТРІШНЯ СИСТЕМА
ВММ кініноген
Калікреїн
XII-------► ХІІа
ВММ кініноген
ЗОВНІШНЯ
XI-----► ХІа СИСТЕМА
ТПЛ
ІТФ
— VII
Рис. 27-25. Механізм зсідання крові; а - активна форма фак-
тора зсідання; ВММ - висока молекулярна маса; ФЛ - фос-
фоліпід тромбоцитів; ТПЛ - тканинний тромбопластин; ІТФ -
інгібітор фактора тканинного шляху.
тромбоцитів (ТР) та Са2+. Зовнішня (тканинна) система
починає працювати у випадку виділення тканинного
тромбопластину, суміші білка і фосфоліпіду, яка активує
фактор VII. Тканинний тромбопластин і фактор VII спри-
чинюють активування факторів IX і X. За наявності ТР,
Са2+ та фактора V активний фактор X каталізує перетво-
рення протромбіну в тромбін. Зовнішній шлях пригнічує
інгібітор шляху тканинного фактора, який утворює чет-
вертинну структуру з ТПЛ, фактором VIІа і фактором Ха.
Антикоагуляційні механізми
Здатності крові до тромбоутворення протидіють ІП УІУО
реакції, спрямовані на запобігання утворенню тромбів у
просвіті судин і розпад утворених тромбів. Ці реакції
передбачають взаємодію між тромбоксаном А2, який поси-
лює агрегацію тромбоцитів, і простацикліном, який при-
гнічує агрегацію. Така взаємодія сприяє утворенню тромбів
у разі ушкодження кровоносної судини, однак забезпечує
збереження цілісності ендотеліального шару (див. Розділ
зі).
Антитромбін III - це інгібітор протеаз, що циркулює в
крові, який зв’язується із сериновими протеазами системи
коагуляції і блокує їхню активність як факторів зсідання.
Зв’язування полегшене за наявності гепарину, природного
антикоагулянта, який є сумішшю сульфатованих поліса-
харидів із молекулярною масою 15 000-18 000. До фак-
торів зсідання, активність яких послаблюється, належать
активні форми факторів IX, X, XI та XII.
Важливу роль у попередженні поширення тромбів у
кровоносних судинах відіграє також ендотелій. Усі ендоте-
ліальні клітини, за винятком судин мікроциркуляторного
русла головного мозку, виробляють тромбомодулін -
тромбінозв’язувальний білок - і експресують його на своїй
поверхні. У крові, що циркулює, тромбін відіграє роль
рюється із попередника, що циркулює в крові, - протром-
біну - під дією активованого фактора X. Він спричинює й
інші ефекти, зокрема активування тромбоцитів, ендотелі-
альних клітин і лейкоцитів, діючи принаймні на один
рецептор, зв’язаний з 6-білком.
Активування фактора X може відбуватися внаслідок
реакцій двох систем - внутрішньої і зовнішньої (див. рис.
27-25). Початкова реакція внутрішньої (кров’яної) сис-
теми полягає у перетворенні неактивного фактора XII на
активний фактор XII (ХІІа). Це активування каталізоване
високомолекулярним кініногеном і калікреїном (див. Розділ
31), в умовах іп уііго ініціюється внаслідок контакту крові
з електронегативно зарядженими поверхнями, такими як
скло та колагенові волокна. Активування за умов іп уіуо
простежується завдяки контакту крові з колагеновими
волокнами, що лежать під ендотелієм кровоносних судин.
Далі активний фактор XII спричинює активування фактора
XI, активний фактор XI - фактора IX. Активний фактор
IX утворює комплекс з активним фактором VIII, активо-
ваний у разі відокремлення від фактора Віллебранда. Комп-
лекс факторів ІХа і VIIІа активує фактор X. Для повного
активування фактора X необхідні фосфоліпіди аґрегованих
Ендотеліальна клітина
| Тромбомодулін |
Тромбін
Білок С -------► Активний білок С (АБС)
7ІІІа
Активний 7а
Інактивує інгібітор активатора
плазміногена тканинного типу (ЬРА)
Плазміноген-------—► Плазмін
Тромбін
1-РА, и-РА
Лізис фібрину
Рис. 27-26. Фібринолітична система та її регулювання за до-
помогою білка С.
РІДИНИ, ЩО ЦИРКУЛЮЮТЬ В ОРГАНІЗМІ / 499
прокоагулянта, який активує фактори V і VIII. Однак у разі
зв’язування з тромбомодуліном він стає антикоагулянтом,
оскільки комплекс тромбомодулін-тромбін активує білок
С (рис. 27-26). Активований білок С (АБС) разом із
кофактором білком 8 інактивує фактори V і VIII, а також
приї ні чує активність інгібітора активатора тканинного
плазміногена, посилюючи утворення плазміну.
Плазмін (фібринолізин) - це активний компонент
системи плазміногену (фібринолітичної) (див. рис. 27-
26). Цей ензим спричинює лізис фібрину і фібриногену з
утворенням продуктів розпаду фібриногену (ПРФ), які
пригнічують тромбін. Плазмін формується з неактивного
попередника (плазміногену) під дією тромбіну і активато-
ра плазміногену тканинного типу (І-РА - від англ. бз-
зие-іуре ріазтіпо^еп асбуаіог). Його активує також акти-
ватор плазміногену урокіназного типу (п-РА - від англ.
игокіпазе-іуре ріазгліпо^еп асйуаіог). У випадку нокауту
гена і-РА або гена и-РА у мишей відкладається невелика
кількість фібрину і сповільнюється лізис згустку. У разі
нокауту обох генів простежується масивне відкладання
фібрину. Сповільнюється загоєння ран (див. Розділ 33).
Характерні також порушення росту та фертильності,
оскільки система плазміногену не тільки розщеплює згус-
ток крові, а також впливає на рух клітин і овуляцію.
Людський плазміноген складається з 560-амінокислот-
ного важкого ланцюга і 241-амінокислотного легкого лан-
цюга. Важкий ланцюг з глутаматом на амінозакінченні
формує п’ять петель, кожну з яких утримують три дисуль-
фідні зв’язки (рис. 27-27). Ці петлі називають крінглі, тому
що вони нагадують данське печиво з відповідною назвою.
Крінглі - це місця зв’язування лізину, за допомогою яких
молекула прикріплена до фібрину та інших факторів зсі-
дання, вони характерні також для протромбіну. Процес
перетворення плазміногену на плазмін полягає у тому, що
і-РА гідролізує зв’язок між Аг§ 560 та Vа1 561.
Рис. 27-27. Будова плазміногену людини. Зверніть увагу на
бій на амінозакінченні та Азп на карбоксильному закінченні,
а також на п’ять петлевих структур (крінглі). Під впливом 1-
РА відбувається гідроліз у місці, позначеному стрілкою. В ре-
зультаті легкий ланцюг із карбоксилзакінченням відокремлю-
ється від важкого ланцюга з амінозакінченням, дисульфідні
зв’язки в цьому разі є інтактними. Все це призводить до акти-
вування молекули (модифіковано та відтворено за дозволом
з ВасГітап Е, іп: ТІїготЬоєіє апсі Нетоєіаєіє. Vег8ігаеіе М еі
аі [ЄСІІІ0Г8]. 1_ЄІЛ/ЄП ІІПІ7ЄГ8ІІу РГЄ88, 1987).
Рецептори плазміногену локалізовані на поверхні різ-
номанітних клітин і особливо численні на ендотеліальних
клітинах. У разі зв’язування плазміногену зі специфічними
рецепторами відбувається його активування. Отже, для
інтактної стінки кровоносних судин характерний механізм,
який протидіє тромбоутворенню.
Сьогодні людський і-РА отримують за допомогою тех-
нології рекомбінантних ДНК і використовують у клінічній
практиці (як лікарський засіб альтеплазу). У випадку засто-
сування в перші години у хворих з інфарктом міокарда пре-
парат спричинює лізис тромбу в коронарних артеріях. До
фібринолітичних засобів, які використовують на ранніх
етапах лікування інфаркту міокарда, належать також бак-
теріальний ензим стрептокіназа (див. Розділ 32).
Є група гомологічних білків - анексинів, - які вплива-
ють на процеси коагуляції та фібринолізу. Описано понад
20 анексинів, зокрема 10 із них - у ссавців. Один із них,
анексин П, утворює на ендотеліальних клітинах “платфор-
му”, на якій відбувається взаємодія компонентів фібринолі-
тичної системи і фібриноліз. Анексин V утворює оболонку
навколо фосфоліпідів, що беруть участь у коагуляції,
спричинюючи антитромботичний ефект. Однак детально
фізіологічна роль різноманітних анексинів не вивчена.
Антикоагулянти
Як зазначено вище, гепарин - це природний антикоа-
гулянт, який посилює ефекти антитромбіну III. Він відіграє
також роль кофактора ліпопротеїнліпази (див. Розділ 17).
Білок протамін, який має виражені основні властивості,
незворотно зв’язується з гепарином, його використовують
у клініці для нейтралізації гепарину. Шляхом деполімери-
зації нефракціонованого гепарину отримують фрагменти
гепарину з низькою молекулярною масою (в середньому
5000). Сьогодні гепарини низької молекулярної маси щораз
ширше застосовують у клінічній практиці, оскільки вони
мають довший період півжиття і більшу передбачуваність
ефектів.
За умов іп уіуо концентрація Са2+низька настільки, щоб
це відобразилось на процесі гемокоагуляції, є смертель-
ною. Однак в умовах іп уііго запобігти зсіданню крові
можна, додавши оксалати, які утворюють з Са2+нерозчинні
солі, або хелатоутворювальні сполуки, які зв’язують Са24.
До ефективних антикоагулянтів належать також похідні
кумарину, такі як дикумарол та варфарин. Вони блокують
ефекти вітаміну К. Вітамін К відіграє роль кофактора для
ензиму, що каталізує перетворення залишків глутамінової
кислоти на залишки у-карбоксиглутамінової кислоти.
Шість білків з тих, що беруть участь у гемокоагуляції, перед
надходженням у кровообіг підлягають реакції перетворен-
ня залишків глутамінової кислоти на залишки у-карбокси-
глутамінової кислоти, отже, шість білків є вітамін-К-залеж-
ними. До них належать фактори II (протромбін), VII, IX і
X, білки С та 8 (див. вище).
Порушення гемостазу
Порушення тромбоутворення можуть бути спричинені
змінами тромбоцитів (див. вище), однак геморагічні роз-
лади виникають унаслідок селективного дефіциту більшос-
ті факторів зсідання (табл. 27-11). Досить поширеною є
гемофілія А, зумовлена дефіцитом фактора VIII. За цього
500 / РОЗДІЛ 27
Таблиця 27-11. Приклади захворювань, зумовлених
дефіцитом факторів зсідання крові
Дефіцит фактора Клінічний синдром Причина
1 Афібриногенемія Під час вагітності з передчасним відшаруванням плаценти; також вроджена (зрідка)
II Гіпопротромбінемія (схильність до геморагій у разі захворювань печінки) Пригнічення синтезу в печінці, здебільшого внаслідок дефіциту вітаміну К
V Парагемофілія Вроджена
VII Гіпоконвертинемія Вроджена
VIII Гемофілія А (класична гемофілія) Вроджений дефект, зумовлений різно- манітними змінами гена на хромосомі X, що кодує фактор VIII; спадкова хвороба, пов’язана зі статтю
IX Гемофілія В (хво- роба Крістмаса) Вроджена
X Дефіцит фактора Стюарта-Прауера Вроджений
XI Дефіцит РТА Вроджений
XII Дефект Хагемана Вроджений
захворювання позитивний результат дає застосування пре-
паратів фактора VIII, які виготовляють з плазми. Однак у
багатьох випадках уведення таких препаратів призвело до
інфікування хворих ВІЛ. Сьогодні є високоочищені пре-
парати, зокрема фактор VIII, отриманий за допомогою тех-
нології рекомбінантних ДНК. Крім того, що фактор Віл-
лебранда сприяє прилипанню тромбоцитів (див. вище),
він ще утворює комплекс з фактором VIII і регулює його
рівень у плазмі. Вроджений дефіцит фактора Віллебранда
призводить до розвитку кровотеч (хвороба Віллебранда).
Всмоктування вітаміну К, так само як і інших жиророз-
чинних вітамінів, пригнічене в разі механічної жовтяниці
внаслідок відсутності жовчі у кишці і подальшого пору-
шення всмоктування жирів (див. Розділ 26). У результаті
виникає дефіцит факторів зсідання, який може призводити
до кровотеч.
Утворення тромбів у просвіті кровоносних судин нази-
вають тромбозом (на відміну від екстраваскулярного тром-
боутворення, яке відбувається в нормі). Тромбози - це сер-
йозна медична проблема. Особливо часто тромбози вини-
кають у разі сповільнення плину крові, наприклад, у венах
нижніх кінцівок після операцій або пологів. Це пояснюють
тим, що внаслідок сповільнення плину крові активовані
фактори зсідання не вимиваються, а нагромаджуються.
Тромбоз виникає також у вінцевих і мозкових артеріях у
ділянках атеросклеротичних бляшок в інтимі і місцях ура-
ження ендокарда. Тромби часто спричиняють порушення
Таблиця 27-12. Приблизний вміст білків у лімфі людини1
Джерело лімфи Вміст білків, г/дл
Судинне сплетення 0
Війкове тіло 0
Скелетні м’язи 2
Шкіра 2
Легені 4
Шлунково-кишковий тракт 4,1
Серце 4,4
Печінка 6,2
1 Дані від Л\І Оіапа
надходження артеріальної крові до органів, у яких вони
утворилися. Частинки тромбів (емболи) можуть відрива-
тися від місць утворення, надходити з плином крові у від-
далені ділянки і спричиняти ураження органів. Наприклад,
тромби з вен нижніх кінцівок можуть закупорювати леге-
неву артерію або її гілки (емболія легеневої артерії), час-
тинки тромбів з лівого шлуночка в разі інфаркту міокарда
(пристінковий тромбоз) можуть зумовити емболію судин
мозку або нижніх кінцівок.
Вроджена відсутність білка С призводить до неконтро-
льованої внутрішньосудинної гемокоагуляцїї і зазвичай
смерті в дитинстві. Якщо своєчасно визначено діагноз і
призначено лікування препаратами крові з високим вміс-
том білка С, то порушення гемокоагуляцїї зникають. Іншою
досить поширеною причиною тромбозу є резистентність
до АБС. Вона виникає внаслідок точкової мутації гена
фактора V, що запобігає інактивації фактора АБС. Описані
також мутації, пов’язані з білком 8 та антитромбіном III,
які призводять до тромбозу, однак вони трапляються рідше.
Дисеміноване внутрішньосудинне зсідання належить
до важких ускладнень септицемії - масивного ушкодження
тканин та інших захворювань, за яких у кровоносних суди-
нах накопичується фібрин, і виникає тромбоз багатьох
судин малого та середнього калібру. Надмірне викорис-
тання тромбоцитів та факторів зсідання спричинює вод-
ночас розвиток кровотечі. Вважають, що головною при-
чиною цього синдрому є посилене утворення тромбіну,
зумовлене підвищеною активністю ТПЛ без адекватної
активності системи інгібіторів тканинних факторів.
ЛІМФА
Лімфа - це тканинна рідина, що надходить у лімфатичні
судини. Через грудну та праву лімфатичну протоки вона
потрапляє у венозну кров. Лімфа містить фактори зсідання
і здатна до утворення згустків за умов іп уіїго. Вона містить
також білки, які проходять через стінку капілярів і повер-
таються в кров із лімфою. Вміст білків у лімфі загалом
менший, ніж у плазмі, де становить близько 7 г/дл, і суттєво
коливається залежно від ділянки, в якій утворюється лімфа
(табл. 27-12). Водонерозчинні жири всмоктуються у кишці
і потрапляють у лімфатичні судини. Внаслідок високого
вмісту жирів після приймання їжі лімфа у грудній протоці
має вигляд молока (див. Розділ 25). Лімфоцити потрап-
ляють у кровообіг головно з лімфатичних судин; у грудній
протоці виявляють велику кількість лімфоцитів.
Природа серцевого скорочення й
електричної активності серця
28
ВСТУП
У нормі відділи серця скорочуються у певній послідов-
ності. Спочатку скорочуються передсердя (передсердна
систола), потім - шлуночки (шлуночкова систола). Про-
тягом діастоли всі чотири камери серця розслаблені. Сер-
цеве скорочення зумовлене електричними імпульсами, які
виникають у спеціалізованій провідній системі серця і
поширюються до всіх відділів міокарда. Провідна система
утворена синоатріальним вузлом (СА-вузлом), міжвузло-
вими передсердними шляхами, атріовентрикулярним
вузлом (АВ-вузлом), пучком Гіса та його ніжками і волок-
нами Пуркіньє. Різні відділи провідної системи серця, а
в умовах патології і ділянки міокарда, здатні спонтанно
генерувати імпульси. В нормі СА-вузол генерує імпульси з
найбільшою частотою. Ці імпульси досягають інших відді-
лів раніше, ніж там відбудеться спонтанна деполяризація.
Отже, у нормі СА-вузол є водієм ритму (пейсмекером)
серця. Частота генерації імпульсів у ньому визначає
частоту серцевих скорочень. Імпульси, які виникають у СА-
вузлі, поширюються передсердними шляхами до АВ-вузла,
через нього до пучка Гіса і ніжками пучка Гіса та волок-
нами Пуркіньє до м’язів шлуночків.
ВИНИКНЕННЯ І ПОШИРЕННЯ
ІМПУЛЬСІВ У СЕРЦІ
Анатомічні особливості
У серці людини СА-вузол міститься біля впадіння
верхньої порожнистої вени у праве передсердя. АВ-вузол
розміщений у правій задній ділянці міжпередсердної
перегородки (рис. 28-1). Від СА-вузла відходять три пучки
передсердних волокон типу волокон Пуркіньє, які сполу-
чають СА-вузол з АВ-вузлом: передній міжвузловий пучок
Бахмана, середній міжвузловий пучок Венкебахата задній
міжвузловий пучок Тореля. Однак триває дискусія про те,
які саме структури забезпечують передавання імпульсів від
СА- до АВ-вузла: названі пучки чи типові передсердні
кардіоміоцити. В нормі АВ-вузол - це єдиний провідний
шлях між передсердями і шлуночками. АВ-вузол продов-
жений пучком Гіса. У верхній ділянці міжшлуночкової
перегородки пучок Гіса розділений на праву і ліву ніжки.
Ліва ніжка, відповідно, має передню і задню гілки. Ніжки
та гілки йдуть субендокардіально з обох боків перегородки
і переходять у волокна Пуркіньє, які поширюються до всіх
ділянок міокарда шлуночків.
Гістологія серцевого м’яза описана у Розділі 3. Провідна
система утворена атиповими кардіоміоцитами, які мають
менше виражену посмугованість і нечіткі краї. СА-вузол та
менше АВ-вузол містять також маленькі округлі клітини з
малою кількістю органел, що з’єднані за допомогою щілин-
них контактів. Можливо, що це справжні пейсмекерні клі-
тини, тому їх називають Р-клітинами. М’язові волокна
передсердь відокремлені від волокон шлуночків кільцем із
фіброзної тканини. В нормі єдиною провідною тканиною
між передсердями та шлуночками є пучок Гіса.
СА-вузол розвивається зі структур правого боку ембрі-
она, а АВ-вузол - зі структур лівого боку. Тому в дорослих
людей правий блукаючий нерв іннервує переважно СА-
вузол, а лівий - АВ-вузол. Подібно до цього симпатичні
нерви правого боку підходять до СА-вузла, а симпатичні
нерви лівого боку - до АВ-вузла. З обох боків більшість
симпатичних волокон відходить від зірчастого вузла. Нор-
адренергічні волокна є епікардіальними, тоді як волокна
блукаючого нерва - ендокардіальні. Однак є сполучення
між парасимпатичними і симпатичними нервами серця,
які забезпечують реципрокні гальмівні ефекти. Наприклад,
ацетилхолін діє пресинаптично, пригнічуючи виділення
норадреналіну симпатичними нервами; а нейропептид ¥,
що його виділяють норадренергічні нервові закінчення,
може пригнічувати виділення ацетилхоліну.
Властивості серцевого м’яза
Електрична відповідь серцевого м’яза і тканини вузлів,
а також переміщення йонів, які є в основі цієї відповіді,
детально описано в Розділі 3. Волокна міокарда мають
потенціал спокою близько -90 мВ (див. рис. 3-15). Залеж-
ність між потенціалом дії і скороченням зображено на рис.
3-14. Хоча волокна відокремлені мембранами, однак
завдяки щілинним контактам деполяризація поширюється
по них радіально, як у синцитії. Трансмембранний потен-
ціал дії окремих кардіоміоцитів має фази швидкої депо-
ляризації, плато і повільної реполяризації (див. рис. 3-15).
Початкова деполяризація відбувається внаслідок надход-
ження Иа+ всередину клітини через швидкі \а+-канали
(Надструм, І ). Надходження Са2+ через повільні Са2>
канали (Са2+-струм, ІСа) зумовлює фазу плато. Реполяриза-
502 / РОЗДІЛ 28
Аорта
Пучок Пса
Міжвузлові
шляхи
Агріовенірикулярнии
вузол
Силові ріальний
вузол
Верхня порожниста
вена
Ніжки пучка
Волокна Пуркіньє
Волокна Пуркіньє
..
дня гілка лівої ні
І М'яз шлуночка
і —...- -.—..- - ~ - -
Рис. 28-1. Провідна система серця. Типові трансмембранні потенціали дії для СА- й АВ-вузлів та’інших ділянок провідної
системи, а також м’язів передсердь і шлуночків, співвіднесені з позаклітинно зареєстрованою електричною активністю, тобто
електрокардіограмою (ЕКГ). Потенціали дії та ЕКГ зображено щодо однієї осі часу, проте з різними печатками відліку на
вертикальній осі; ПГЛН - передня гілка лівої ніжки.
Права ніжка пучка х
ЕКВ
М’яз передсердя
АВ-вузол
. ----------------
пглн
Пучок Пса
У
0 6
ція спричинена виходом К+ через КС-канали трьох типів
(див. Розділ 3). ЕКГ - це позаклітинно зареєстрована,
сумована електрична активність усіх м’язових волокон
серця. Співвідношення між потенціалами дії окремих
ділянок серця та записом ЕКГ показано на рис. 28-1.
Пейсмекерні потенціали
Після кожного імпульсу мембранний потенціал пейсме-
керних клітин досягає порогового рівня. Отже, цей перед-
потенціал, або пейсмекерний потенціал (рис. 28-2),
зумовлює наступний імпульс. У момент піка кожного
імпульсу виникає Ік, який спричинює реполяризацію.
Потім Ік спадає, і зі зменшенням виходу К+ з клітин почи-
нається деполяризація мембрани, що зумовлює першу час-
тину передпотенціалу. Далі відкриваються Са2+-канали. В
серці розрізняють два типи цих каналів: Т-канали (від
англ. ігапзіепі - тимчасовий) і Ь-канали (від англ. Іоп§-
Іа8ііп£ - довготривалий). Кальцієвий струм ІСа завдяки від-
криттю Т-каналів завершує передпотенціал, і ІС) внаслідок
відкриття Ь-каналів спричинює імпульс.
Потенціал дії в СА- і АВ-вузлах виникає головно завдяки
надходженню Са2+, менш важливим є Иа\ Унаслідок цього
нема фази швидкої деполяризації, що характерна для інших
ділянок провідної системи, а також для м’язів передсердь
і шлуночків (див. рис. 28-1). У нормі передпотенціал про-
стежується лише в СА- і АВ-вузлах. Однак є “латентні пейс-
мекери” в інших ділянках провідної системи, які можуть
виявити себе в умовах пригнічення СА- і АВ-вузлів або в
разі порушення передавань імпульсів від них. М’язовим
волокнам передсердь і шлуночків передпотенціал не
притаманний, і вони здатні до спонтанної деполяризації
лише тоді, коли є ушкодженими або неповноцінними.
У випадку стимулювання холінергічних волокон блу-
каючого нерва, які підходять до вузлів, мембрана гіпер-
поляризується, і нахил передпотенціалу зменшується. Це
Час
Рис. 28-2. Мембранний потенціал у пейсмекерній тканині
Струм, що зумовлює кожну з фаз потенціалу, зазначено
нижче або поряд; І_- довготривалий; Т-тимчасовий. Зверніть
увагу на те, що мембранний потенціал спокою пейсмекерноі
тканини дещо нижчий, ніж у м’язах передсердь і шлуночків
ПРИРОДА СЕРЦЕВОГО СКОРОЧЕННЯ Й ЕЛЕКТРИЧНОЇАКТИВНОСТІ СЕРЦЯ / 503
пояснюють тим, що виділений нервовими закінченнями
ацетилхолін підвищує К+-провідність вузлової тканини.
Цей ефект відбувається через М2-мускаринові рецептори,
які за участю р-, у-субодиниць 6-білка зумовлюють від-
криття К*-каналів. Унаслідок виникає І , який протидіє
зменшенню Ік. Крім того, активування М2-рецепторів
знижує рівень цАМФ у клітинах, що веде до сповільненого
відкриття Са2ь-каналів, і, як наслідок, частота імпульсів
зменшується. Значне стимулювання блукаючого нерва
може на деякий час припинити спонтанне генерування
імпульсів.
Навпаки, стимулювання симпатичних нервів серця
сприяє швидшому зменшенню мембранного потенціалу, і
частота спонтанної генерації імпульсів збільшується (рис.
28-3). Виділений симпатичними нервовими закінченнями
норадреналін зв’язується з ^-рецепторами, унаслідок чого
підвищується внутрішньоклітинний рівень цАМФ, відкри-
ваються Ь-канали, збільшується ІСа і зменшується трива-
лість фази деполяризації потенціалу дії.
З урахуванням описаних вище особливостей іннервації
серця стимулювання правого блукаючого нерва сповільнює
частоту скорочення серця внаслідок пригнічення СА-вузла,
тоді як стимулювання лівого блукаючого нерва головно
сповільнює АВ-провідність. Подібно до цього, стимулю-
вання правого зірчастого вузла прискорює роботу серця, а
стимулювання лівого зірчастого вузла прискорює АВ-
провідність і зменшує рефрактерність.
Частота генерації імпульсів у СА-вузлі та інших ділянках
провідної системи може змінюватися під впливом тем-
ператури і ліків. Вона збільшується з підвищенням темпе-
ратури, і це сприяє розвитку тахікардії в разі гарячки.
Наперстянка пригнічує провідну систему і спричинює
вплив, подібний до ефекту стимулювання блукаючого
нерва (зокрема, на АВ-вузол).
Поширення збуджень у серці
Імпульси, що виникають у СА-вузлі, поширюються раді-
ально через передсердя і сходяться в АВ-вузлі. Деполяри-
зація передсердь завершується приблизно за 0,1 с. Оскільки
передавання імпульсів через АВ-вузол повільніше (табл.
28-1), то є деяка затримка приблизно на 0,1 с (затримка в
АЛАЛА,:-
СимпатичнаД
стимуляція
АЛ2МА
Стимуляція А
блукаючих
нервів
Рис. 28-3 Вплив стимулювання симпатичних (норадренер-
гічних) і блукаючих (холінергічних) нервів на мембранний
потенціал у СА-вузлі.
АВ-вузлі), перш ніж збудження пошириться на шлуночки.
Ця затримка зменшується в разі стимулювання симпа-
тичних нервів серця і збільшується у випадку стимулю-
вання блукаючих нервів. Від вершини перегородки хвиля
деполяризації з великою швидкістю поширюється волок-
нами Пуркіньє до всіх ділянок шлуночків (за 0,08-0,1 с).
У людей деполяризація м’язів шлуночків розпочинається
з лівого боку міжшлуночкової перегородки і спочатку
поширюється праворуч через середню частину перегород-
ки. Потім хвиля деполяризації поширюється вздовж пере-
городки до верхівки серця, а далі повертається вздовж
стінок шлуночків до АВ-борозни, поширюючись з ендо-
кардіальної поверхні до епікардіальної (рис. 28-4). Нашн у
ніше імпульси проходять по задній стінці лівого шлуночка
до основи серця, конуса легеневого стовбура і верхньої
ділянки перегородки.
ЕЛЕКТРОКАРДІОГРАМА
Рідини організму людини добре проводять струм (тіло
є об’ємним провідником), тому коливання біопотенціалу,
який є алгебричною сумою потенціалів дії волокон міо-
карда, можна зареєструвати позаклітинно. Запис цих
коливань біопотенціалу протягом серцевого циклу нази-
вають електрокардіограмою (ЕКГ). Більшість електро-
кардіографів реєструють ці коливання на стрічці паперу,
яка рухається.
ЕКГ можна записувати за допомогою активного елект-
рода, з’єднаного з індиферентним електродом, який має
нульовий потенціал (уніполярне записування) або за
допомогою двох активних електродів (біполярне запису-
вання). В об’ємному провіднику сума потенціалів на вер-
шинах рівностороннього трикутника з джерелом струму в
центрі завжди дорівнює нулю. Трикутник із серцем у центрі
(трикутник Ейнтховена) утворюється в разі розміщення
електродів на обох руках і лівій нозі. Це три стандартні
відведення від кінцівок, які застосовують в електрокар-
діографії. Якщо ці електроди приєднати до загального
електрода, то отримаємо індиферентний електрод з потен-
ціалом, близьким до нуля. Деполяризація, яка поширюється
до активного електрода об’ємного провідника, спричинює
позитивне відхилення, тоді як деполяризація, що поширю-
ється в протилежному напрямі, - негативне.
Назви різних зубців і сегментів на ЕКГ людини показано
на рис. 28-5. Загальноприйнято таке: якщо активний
електрод стає позитивним щодо індиферентного, то запи-
сується відхилення вгору, якщо активний електрод стає
негативним, то записується відхилення вниз. Зубець Р
Таблиця 28-1. Швидкість проходження імпульсів у серці
Тканина Швидкість проходження, м/с
СА-вузол Передсердні шляхи АВ-вузол Пучок Гіса Волокна Пуркіньє М’яз шлуночків 0,05 1 0,05 1 4 1
504 / РОЗДІЛ 28
Збудження передсердь
Збудження перегородки
зліва направо
Збудження передиьо-
перегородкової
ділянки міокарда
Збудження головної
частини міокарда
шлуночків (у напрямі
від ендокарда)
Пізнє поширення
імпульсів по задній
стінці лівого шлуночка
до основи серця і
конуса легеневого
стовбура
Рис. 28-4. Поширення електричної активності в серці у нормі
(відтворено за дозволом з боїсітап Ргіпсіріез оТ СІіпісаІ
ЕІесігосагсІіодгарЬу, 12Н1 есі. Мс(Зга\л/-НіІІ, 1986).
спричинений деполяризацією передсердь, комплекс РВ.8
- деполяризацією шлуночків, сегмент 8Т і зубець Т - репо-
ляризацією шлуночків. У нормі реполяризація передсердь
не виявляється, оскільки вона прихована комплексом РК8.
Зубець V виявляють не завжди, вважають, що він зумов-
лений реполяризацією папілярних м’язів. Інтервали між
різними зубцями ЕКГ і процеси, які є в їхній основі, наве-
дено в табл. 28-2.
Біполярні відведення
Біполярні відведення застосовували до впровадження
уніполярних відведень. У цьому разі за допомогою стан-
дартних відведень від кінцівок реєстрували різниці потен-
ціалів між двома кінцівками. Оскільки рідини організму
добре проводять струм, то немає значення де саме на кін-
цівках розміщені електроди. У відведенні І електроди
з’єднані так, що коли ліва рука є позитивною щодо правої,
то записується відхилення вгору (ліва рука позитивна). У
відведенні II електроди розміщені на правій руці і лівій
нозі (нога позитивна), у відведенні III на лівій руці і лівій
нозі (нога позитивна).
Уніполярні (V) відведення
У клінічній електрокардіографії зазвичай застосовують
дев’ять додаткових уніполярних відведень, які реєструють
різницю потенціалів між активним та індиферентним
електродами. Є шість грудних уніполярних відведень, які
позначають У-У6 (рис. 28-6), і три уніполярні відведення
від кінцівок: УК (права рука), УЬ (ліва рука) та УР (ліва
нога). Здебільшого застосовують підсилені відведення від
кінцівок, які позначають літерою а (аУК, аУЬ, аУР). За
допомогою підсилених відведень реєструють різницю
потенціалів між однією і двома іншими кінцівками. Це дає
змогу збільшити потенціал на 50%, не змінюючи конфігу-
рації непідсилених відведень.
Уніполярні відведення можна розміщувати на кінцях
катетерів і вводити в стравохід чи серце.
Електрокардіограма в нормі
ЕКГ людини в нормі зображено на рис. 28-7. У разі
інтерпретування конфігурації зубців у кожному відведенні
треба враховувати послідовність деполяризації ділянок
серця, а також положення серця щодо електродів. Перед-
сердя розташовані у задній частині грудної клітки. Шлу-
ночки утворюють основу і передню поверхню серця; пра-
вий шлуночок має передньобічне положення і повернутий
уліво. Отже, аУК “повернуте” до порожнин шлуночків.
Деполяризація передсердь та шлуночків і реполяризація
шлуночків поширюються в напрямі від активного елект-
рода, тому для зубця Р, комплексу РК8 та зубця Т харак-
терне негативне відхилення (донизу); аУЬ та аУЕ “повер-
Рис. 28-5. Зубці ЕКГ.
ПРИРОДА СЕРЦЕВОГО СКОРОЧЕННЯ Й ЕЛЕКТРИЧНОЇ АКТИВНОСТІ СЕРЦЯ / 505
Таблиця 28-2. Інтервали ЕКГ
Інтервали Тривалість у нормі, с Процеси, що відбуваються у серці упродовж інтервалу
середня у межах
РВ-інтервал1 0,182 0,12-0,20 Деполяризація передсердь і проведення імпульсів через АВ-вузол
Тривалість ОВ8 0,08 до 0,10 Деполяризація шлуночків і реполяризація передсердь
ОТ-інтервал 0,40 до 0,43 Деполяризація шлуночків плюс реполяризація шлуночків
8Т-інтервал (ОТ мінус ОК8) 0,32 Реполяризація шлуночків
1 Вимірюють від початку зубця Р до початку комплексу ОВ8.
2 Зменшується зі збільшенням частоти серцевих скорочень від середнього значення 0,18 за частоти 70 ударів/хв до 0,14 за
частоти 130 ударів/хв.
нуті” до шлуночків, тому відхилення головно позитивне
або двофазне. У відведеннях У1 і У2 немає зубця (), і почат-
ковій ділянці рК8-комплексу властиве незначне відхилення
вгору. Це пояснюють тим, що деполяризація шлуночків
поширюється спочатку через середню ділянку перегородки
зліва направо в напрямі до активного електрода. Потім
хвиля збудження проходить донизу по перегородці і в лівий
шлуночок у напрямі від електрода, що зумовлює вираже-
ний зубець 8. У кінці імпульси поширюються назад уздовж
стінки шлуночків у напрямі до електрода, спричинюючи
повернення кривої до ізоелектричної лінії. Навпаки, у
відведеннях від лівого шлуночка (У4-У6) можливий ма-
ленький зубець Р (деполяризація перегородки зліва напра-
во) на тлі вираженого зубця К (деполяризація перегородки
і лівого шлуночка), після чого у У4 і У5 виявляється середній
зубець 8 (пізня деполяризація стінок шлуночків, яка поши-
рюється у зворотному напрямі до АВ-з’єднання).
Можливі суттєві відмінності у позиції серця в нормі,
що відображається на конфігурації електрокардіографіч-
них комплексів у різних відведеннях.
Рис. 28-6. Уніполярні електрокардіографічні відведення.
Біполярні відведення від кінцівок
і вісь серця
Оскільки за допомогою стандартних відведень реєст-
рують різниці потенціалів між двома точками, то відхи-
лення в кожному відведенні у будь-який момент харак-
теризує значення і напрям на осі відведення електрору-
шійної сили, яку генерує серце (вісь, або вектор, серця).
Можна визначити вектор у будь-який заданий момент у
двох вимірах фронтальної площини за допомогою будь-
яких двох стандартних відведень від кінцівок, припустив-
ши, що три електроди розміщені на вершинах рівносторон-
нього трикутника (трикутника Ейнтховена), а серце роз-
ташоване у його центрі. Ці припущення не повністю пра-
вильні, однак обчислені вектори можуть бути корисними
як наближення. Наближений середній (}1<8-вектор
(“електричну вісь серця”) можна визначити за допомогою
середнього відхилення рв.8 у кожному відведенні, як це
зображено на рис. 28-8. Середній вектор відрізняється від
миттєвого вектора. Середні відхилення РК8 можна визна-
чити інтегруванням комплексів РВ.8. Однак наближені їхні
значення можна отримати вимірюванням різниць між
позитивними та негативними піками 0К8. У нормі напрям
середнього вектора 0К8 у системі координат, зображеній
на рис. 28-8, становить від -30 до +110. Відхиленням
електричної осі ліворуч називають зміщення вектора РК8
ліворуч від -30, відповідно, зміщення вектора праворуч
від + 110 називають відхиленням електричної осі право-
руч. Відхилення осі праворуч свідчить про гіпертрофію
правого шлуночка. Відхилення осі ліворуч можливе внаслі-
док гіпертрофії лівого шлуночка, хоча в цьому випадку є
ліпші і надійніші електрокардіографічні критерії.
Векторокардіографія
Якщо з’єднати кінці всіх миттєвих векторів серця у
фронтальній площині протягом серцевого циклу, від пер-
шого до останнього, то отримана лінія (векторокардіо-
грама) утворить три петлі: перша відповідає зубцю Р, друга
- комплексу 0К.8, третя - зубцю Т. Це можна зробити
електронним шляхом за допомогою катодно-променевого
осцилографа.
Електрограма пучка Пса
У хворих з блокадами серця досить часто вивчають
електричні зміни в АВ-вузлі, пучку Гіса і волокнах Пур-
кіньє за допомогою катетера з електродом на кінці, який
506 / РОЗДІЛ 28
Рис. 28-7 ЕКГ у нормі (відтворено за дозволом з боїбтап ІУШ: Ргіпсіріез оТ СІіпісаІ ЕІесІгосагсІіодгарГіу, 121:11 есі. Мс6га\л/-НіІІ,
1986)
уводять через вени у правий відділ серця поблизу три-
стулкового клапана. Реєструють три або більше стандарт-
них електрокардіографічних відведень одночасно. Запис
електричної активності за допомогою катетера біля три-
стулкового клапана називають електрограмою пучка
Гіса (ЕПГ). У нормі на ній виявляють відхилення А в разі
збудження АВ-вузла, зубець Н під час передавання імпуль-
сів через пучок Гіса і відхилення V протягом деполяризації
шлуночків (рис. 28-9). За допомогою електрограми пучка
Гіса і стандартних електрокардіографічних відведень
можна точно визначити тривалість трьох інтервалів: інтер-
вал РА з моменту появи деполяризації передсердь до зубця
А на електрограмі пучка Гіса відповідає часу проходження
імпульсів з СА-вузла до АВ-вузла; інтервал АН від зубця
А до початку виступу Н відповідає часу проходження
через АВ-вузол; інтервал НУ від початку зубця Н до почат-
ку комплексу ОК8 на ЕКГ свідчить про час проходження
імпульсів через пучок Гіса і його ніжки. Наближені зна-
чення цих інтервалів у нормі становлять, мс: РА - 27, АН
- 92 і НУ - 43. Ці значення свідчать про порівняно по-
вільне проходження імпульсів через АВ-вузол (див. табл.
28-1).
ПРИРОДА СЕРЦЕВОГО СКОРОЧЕННЯ Й ЕЛЕКТРИЧНОЇ АКТИВНОСТІ СЕРЦЯ / 507
15
мм
+5
-0
Рис. 28-8. Вісь серця Ліворуч: трикутник Ейнтховена. Перпендикулярні лінії, опущені з середини сторін рівностороннього
трикутника, перетинаються в центрі електричної активності. ПР - права рука; ЛР - ліва рука; ЛН - ліва нога. В центрі:
обчислення середнього вектора ОР8. Для кожного відведення від середини сторони трикутника відкладають відрізок, довжина
якого дорівнює різниці між висотою зубця Р і висотою найбільшого негативного відхилення у комплексі ОР8 Вектор з початком
у центрі електричної активності і кінцем у точці перетину перпендикулярів, опущених з отриманих на сторонах трикутника
точок, визначає довжину і напрям середнього вектора ОП8 Праворуч: осі для обчислення напряму вектора.
Моніторинг
Часто у кардіологічних відділеннях проводять довготри-
вале спостереження за ЕКГ. У цьому разі поява загрозливих
для життя аригмій супроводжується звуковим сигналом
тривоги. За допомогою портативного пристрою для запи-
сування (монітора Холтера) можна реєструвати ЕКГ в
амбулаторних хворих на тлі їхньої нормальної активності.
Потім запис на великій швидкості прокручують назад і
аналізують. Так можна отримати постійну реєстрацію ЕКГ
протягом тривалого періоду. Є також портативні пристрої
для ЕКГ, активування яких відбувається в разі появи у
хворого симптомів, після чого запис по телефону переда-
ють до офісу лікаря або в лабораторію. Доцільність запи-
сування ЕКГ за допомогою моніторів підтверджена під час
діагностування аритмій і планування тактики лікування
хворих після інфаркту міокарда.
Рис. 28-9 Електрограма пучка Пса (ЕПГ) у нормі з одночасно
зареєстрованою ЕКГ
СЕРЦЕВІ АРИТМІЇ
Частота серцевих скорочень у нормі
У нормі частота серцевих скорочень людини визначена
СА-вузлом (нормальний синусовий ритм (НСР)). У стані
спокою серце скорочується з частотою 70 ударів за хвилину.
Частота серцевих скорочень зменшується під час сну (бра-
дикардія) і збільшується під час фізичного навантаження,
гарячки, дії емоційних та багатьох інших факторів (тахі-
кардія). Механізми, що контролюють частоту серцевих
скорочень, розглянуті в Розділі 31. У здорових людей моло-
дого віку з нормальною частотою дихання частота серце-
вих скорочень змінюється залежно від фази дихання: збіль-
шує! ься під час вдихання і зменшується під час видихання,
особливо зі збільшенням глибини дихання. В нормі може
розвиватися синусова аритмія (рис. 28-10) завдяки коли-
ванням парасимпатичного впливу на серце. Під час вдихан-
ня імпульси від рецепторів легень, які реагують на розтя-
гування, по блукаючих нервах надходять до довгастого
мозку і спричинюють пригнічення кардіодепресивної
ділянки. Тонічна активність блукаючого нерва, який спо-
вільнює ритм серця, послаблюється, і частота серцевих
скорочень збільшується.
Захворювання, за яких уражений синусовий вузол, при-
зводять до вираженої брадикардії, що супроводжується
запамороченням і втратою свідомості (синдром слабкості
синусового вузла).
Ектопічні водії ритму
За умов патології АВ-вузол та інші ділянки провідної
системи можуть ставати водіями ритму серця. Крім того,
508/РОЗДІЛ28
Рис. 28-10. Синусова аритмія у чоловіка молодого віку і чо-
ловіка похилого віку. Зроблено п’ять дихальних рухів за хви-
лину. Під час кожного вдихання інтервал Р-Р зменшується,
що свідчить про збільшення частоти серцевих скорочень.
Зверніть увагу на меншу вираженість аритмії у чоловіка похи-
лого віку. Цей запис виконано після застосування р-адре-
ноблокаторів, однак аналогічні результати можна отримати і
без них (відтворено за дозволом з Рїіеїег МА еі аі: ОіЯегепііаІ
сііапдез оТ аиіопотіс пегуоиз зузіет їипсйоп хл/іІЬ аде іп тап.
Ат З Месі 1983;75;49).
в уражених м’язових волокнах передсердь і шлуночків
може пригнічуватися розвиток потенціалу дії і виникати
повторне збудження.
Як зазначено вище, СА-вузлу притаманна більша час-
тота генерації імпульсів, ніж іншим ділянкам провідної
системи. Тому в нормі СА-вузол задає серцевий ритм. Коли
проходження імпульсів від передсердь до шлуночків при-
пиняється, то виникає повна блокада серця (третього сту-
пеня), і шлуночки скорочуються в повільному ритмі (ідіо-
вентрикулярному) незалежно від передсердь (рис. 28-11).
Повна блокада може виникати внаслідок ураження АВ-
вузла (АВ-вузлова блокада) або ділянок провідної систе-
ми, що розміщені нижче від вузла (інфранодальна блока-
да). У хворих з АВ-вузловою блокадою роль водія ритму
відіграє збережена тканина провідної системи, і частота
скорочення шлуночків становить приблизно 45 ударів за
хвилину. У хворих з інфранодальною блокадою внаслідок
ураження пучка Гіса водій ритму шлуночків локалізований
у периферійних відділах провідної системи серця. Тому
частота скорочень шлуночків є меншою і становить у
середньому 35 ударів/хв, проте у деяких хворих може бути
15 ударів/хв. У таких хворих можуть виникати періоди
асистолії, які тривають 1 хв або більше. Унаслідок цього
розвивається ішемія головного мозку, яка виявляється запа-
мороченням і втратою свідомості (синдром Стокса-
Адамса). Блокада серця третього ступеня може бути спри-
РК = 0,16 с
Нормальний комплекс
РН = 0,38 с
Блокада серця першого ступеня
Блокада серця другого ступеня
(блокада 2:1)
Блокада серця другого ступеня
(феномен Венкебаха)
Повна блокада серця. Частота скорочень передсердь 107;
частота скорочень шлуночка 43
Два У-відведення
у разі блокади лівої ніжки
пучка Гіса
Рис. 28-11. Блокади серця.
ПРИРОДА СЕРЦЕВОГО СКОРОЧЕННЯ Й ЕЛЕКТРИЧНОЇ АКТИВНОСТІ СЕРЦЯ / 509
чинена інфарктом міокарда в ділянці перегородки й ушкод-
женням пучка Гіса під час операції з приводу вродженої
вади міжшлуночкової перегородки.
Якщо проходження імпульсів з передсердь до шлуночків
сповільнене, однак повністю не пригнічене, то розвива-
ється неповна блокада серця. У випадку блокади серця
першого ступеня всі імпульси з передсердь надходять до
шлуночків, проте тривалість інтервалу РК значно збільшу-
ється. У випадку блокади другого ступеня не всі імпульси
з передсердь проходять до шлуночків: може надходити
кожний другий або третій імпульс (блокада 2:1, блокада
3:1 тощо). У разі іншого типу неповної блокади другого
ступеня виявляють періоди з поступовим збільшенням
тривалості інтервалу РК, які завершуються випадінням
чергового скорочення шлуночків (феномен Венкебаха).
Тривалість інтервалу РК. після випадіння шлуночкового
комплексу зазвичай відповідає нормі або дещо збільшена
(див. рис. 28-11).
Деколи може бути пригнічене проходження імпульсів
через одну з ніжок пучка Гіса, що спричинює блокаду пра-
вої або лівої ніжки. У випадку блокади ніжки збудження
спочатку поширюється через неушкоджену ніжку до відпо-
відного шлуночка, а вже потім переходить на шлуночок,
ніжка якого заблокована. Частота скорочення шлуночків у
цьому разі нормальна, однак комплекси 0К8 розширю-
ються і деформуються (див. рис. 28-11). Блокада може
виникати також на рівні передньої і задньої гілок лівої ніж-
ки, спричинюючи так звану фасцикулярну блокаду, або
геміблокаду. У випадку блокади передньої гілки лівої ніж-
ки простежується відхилення електричної осі ліворуч, тоді
як у разі блокади задньої гілки - праворуч. Часто виявляють
поєднання фасцикулярної блокади і блокади ніжки (біфас-
цикулярна або трифасцикулярна блокада). Детально
визначити місце дефекту провідної системи серця можна
за допомогою електрограми пучка Гіса.
Імплантовані водії ритму
У випадку вираженої брадикардії хворим з синдромом
слабкості синусового вузла або блокадою серця третього
ступеня часто вживлюють електронні водії ритму. Ці при-
лади, які стали дуже складними і надійними, виявились
ефективними для хворих з дисфункцією синусового вузла,
АВ-блокадою, а також бі- і трифасцикулярними блокадами,
їх застосовують також для хворих з нейрогенною втратою
свідомості, у яких під час стимулювання каротидного
синуса пауза між серцевими скороченнями триває понад
З с, а також для деяких хворих з кардіоміопатією не стільки
для нормалізації ритму серця, скільки з метою поліпшення
гемодинаміки.
Ектопічні вогнища збудження
У нормі клітини міокарда здатні до спонтанного генеру-
вання імпульсів. Ймовірність такого спонтанного генеру-
вання у пучку Гіса і волокнах Пуркіньє низька, оскільки
СА-вузол, який є водієм ритму в нормі, генерує імпульси з
більшою частотою. Однак за деяких порушень пучок Гіса,
волокна Пуркіньє і типові кардіоміоцити можуть спонтан-
но генерувати імпульси. В цьому випадку кажуть про під-
вищення здатності до автоматії серця. Якщо ектопічне
вогнище самовільно генерує імпульс, то внаслідок цього
виникає скорочення до моменту наступного нормального
скорочення, і тимчасово порушується серцевий ритм
(передсердна, вузлова або шлуночкова екстрасистолія, чи
позачергове скорочення). Якщо вогнище генерує імпуль-
си повторно з частотою, більшою ніж СА-вузол, то це спри-
чинює виражену регулярну тахікардію (передсердну, шлу-
ночкову або вузлову пароксизмальну тахікардію, або трі-
потіння передсердь).
Повторний ВХІД
Головною причиною пароксизмальних аритмій є пору-
шене проходження імпульсів, унаслідок чого хвиля збуд-
ження поширюється постійно по колу (коловий рух).
Наприклад, у разі тимчасової односторонньої блокади
ділянки провідної системи імпульс може поширюватися з
іншого боку. Якщо блокада потім минає, то імпульс може
поширюватися в ретроградному напрямі через заблоковану
раніше ділянку до місця виникнення і далі, виконуючи
коловий рух. Прикладом цього є кільце тканини на рис.
28-12. Якщо повторне входження імпульсів виникає в АВ-
вузлі, то передсердя збуджується повторно. Скорочення
передсердя, яке в цьому разі відбувається, називають “лу-
на”-скороченням. Крім того, імпульси повторно поширю-
ються до шлуночків, зумовлюючи пароксизмальну вузлову
тахікардію. Коловий рух може виникати також у волокнах
передсердь або шлуночків. У людей з додатковим пучком
провідної тканини, який сполучає передсердя зі шлуноч-
ками (пучок Кента; див. нижче), коловий рух може відбу-
ватися в одному напрямі через АВ-вузол, а в іншому - через
пучок. Отже, коловий рух охоплює і передсердя, і шлу-
ночки.
Передсердні аритмії
Збудження, яке виникає в ектопічних вогнищах перед-
сердь, позачергово стимулює АВ-вузол і поширюється до
шлуночків. Для передсердних екстрасистол характерна
зміна конфігурації зубця Р, у цьому разі конфігурація ОЯ8Т
зазвичай нормальна (рис. 28-13). Збудження може спри-
чиняти деполяризацію СА-вузла. Після цього в ньому
повинна відбутися реполяризація, потім деполяризація до
порогового рівня, і тільки тоді СА-вузол може ініціювати
Рис. 28-12. Деполяризація кільця тканини серця. В нормі
імпульс поширюється по кільцю в обох напрямах (ліворуч),
у цьому разі тканина відразу стає рефрактерною. У випадку
односторонньої тимчасової блокади (у центрі) імпульс з іншо-
го боку поширюється навколо кільця. Якщо тимчасова бло-
када минає (праворуч), то імпульс може проходити через
раніше уражену ділянку і циркулювати упродовж невизна-
ченого періоду (коловий рух).
510/РОЗДІЛ 28
Фібриляція передсердь
Рис. 28-13. Передсердні аритмії. Показано передсердне
позачергове скорочення з зубцем Р, що нашаровується на
зубець Т попереднього скорочення (стрілка); передсердна
тахікардія; тріпотіння передсердь з АВ-блокадою (4:1); фібри-
ляція передсердь з нерегулярним шлуночковим ритмом (від-
творено за дозволом з боїсізсґііадег N. Ооісіплап МИ: Ргіпсі-
ріез ої СІіпісаІ ЕІесІгосагсІіодгарНу. 13іґі есі. Мс6га\л/-НіІІ, 1989).
наступне нормальне скорочення. Отже, між екстрасис-
толою і наступним нормальним скороченням є пауза, яка
за тривалістю дорівнює інтервалу між нормальними ско-
роченнями. Потім ритм відновлюється (див. нижче). Якщо
імпульс не досягає СА-вузла до його наступного нормаль-
ного збудження, то виникає пауза, яка дорівнює інтервалу
між двома нормальними скороченнями.
Передсердна тахікардія може бути зумовлена появою
ектопічного вогнища, яке регулярно генерує імпульси, або
явищем повторного входження. Частота скорочень серця
в цьому разі досягає 220 за хвилину. Деколи, особливо на
тлі дигіталізації, тахікардія може поєднуватися з атровент-
рикулярною блокадою (пароксизмальна передсердна
тахікардія з блокадою).
У випадку тріпотіння передсердь частота ритму стано-
вить 200-350 за хвилину (див. рис. 28-13). За найпоши-
ренішої форми цієї аритмії у правому передсерді просте-
жується значний коловий рух імпульсів проти годинникової
стрілки. Це спричинює характерні передсердні хвилі
(пилоподібні зубці). Тріпотіння передсердь здебільшого
супроводжується АВ-блокадою (2:1 або більше), оскільки
у дорослих людей АВ-вузол не може проводити понад 230
імпульсів за хвилину.
Під час фібриляції передсердь частота їхнього ритму
дуже висока (300-500 за хвилину), скорочення нерегулярні
й хаотичні. Оскільки АВ-вузол збуджується нерегулярно,
то шлуночки скорочуються теж нерегулярно з частотою
80-160 за хвилину (див. рис. 28-13). Цей стан може вини-
кати у вигляді нападів або бути хронічним, у деяких випад-
ках є генетично зумовлена схильність. Причина фібриляції
передсердь досі дискусійна. Однак здебільшого вона зу-
мовлена численними одночасними коловими рухами хвиль
збудження в обох передсердях. У деяких випадках парок-
сизмальна фібриляція передсердь спричинена генеруван-
ням імпульсів в одному або більше ектопічних вогнищах
збудження. Багато таких вогнищ локалізовані у легеневих
венах на відстані 4 см від серця. Вздовж легеневих вен
проходять м’язові волокна передсердь, які й генерують ці
імпульси.
Наслідки передсердних аритмій
Спорадичні передсердні екстрасистоли можуть вини-
кати час від часу у більшості здорових людей і не мають
жодних наслідків. У разі пароксизмальної передсердної
тахікардії і тріпотіння передсердь частота скорочень шлу-
ночків буває настільки значною, що протягом діастоли
шлуночки не встигають достатньо наповнитися кров’ю.
Унаслідок цього серцевий викид зменшується, і виникають
симптоми серцевої недостатності. Взаємозв’язок між час-
тотою серцевих скорочень і серцевим викидом детально
описано у Розділі 29. Серцева недостатність може виник-
нути також унаслідок фібриляції передсердь, коли шлу-
ночки скорочуються дуже швидко. Ацетилхолін, що його
виділяють нервові закінчення блукаючих нервів, пригнічує
проходження імпульсів через передсердні м’язи й АВ-
вузол. Саме тому рефлекторне стимулювання блукаючого
нерва шляхом делікатного натискання на очні яблука (око-
серцевий рефлекс) або масажу каротидного синуса часто
дає змогу відновити нормальний синусовий ритм у разі
тахікардії, а деколи й у випадку тріпотіння передсердь.
Водночас стимулювання блукаючого нерва посилює АВ-
блокаду і зменшує частоту скорочень шлуночків. Наперс-
тянка також пригнічує АВ-провідність, її застосовують для
зменшення частоти скорочень шлуночків у разі фібриляції
передсердь.
Шлуночкові аритмії
Позачергові скорочення, зумовлені ектопічними вогни-
щами у шлуночках, зазвичай супроводжуються зміною
конфігурації і збільшенням тривалості комплексів
(рис. 28-14). Це пояснюють повільним проходженням
імпульсів із вогнища збудження через м’яз шлуночків до
інших ділянок шлуночка. Пучок Гіса в цьому разі здебіль-
шого не збуджений, і ретроградне поширення імпульсів
до передсердь не відбувається. З часом наступний нормаль-
ний імпульс із СА-вузла зумовлює деполяризацію перед-
ПРИРОДА СЕРЦЕВОГО СКОРОЧЕННЯ Й ЕЛЕКТРИЧНОЇ АКТИВНОСТІ СЕРЦЯ / 511
Компенса-
торна
пауза
N N N Р N
Рис. 28-14. Угорі: позачергове скорочення шлуночків (ПСШ).
Лінії під записом позначають компенсаторну паузу і свідчать
про те, що тривалість позачергового скорочення плюс три-
валість попереднього нормального скорочення дорівнює три-
валості двох нормальних скорочень. Унизу: шлуночкова тахі-
кардія.
сердь. Здебільшого зубець Р нашаровується на рК8-екстра-
систоли. Коли нормальний імпульс досягає шлуночків, то
вони все ще перебувають у стані рефрактерності після
деполяризації, зумовленої ектопічним вогнищем. Однак
другий імпульс із СА-вузла зумовлює нормальне скорочен-
ня. Отже, після позачергового скорочення шлуночків на-
стає компенсаторна пауза, яка часто є довшою, ніж пау-
за після передсердної екстрасистоли. Крім того, шлуноч-
кові екстрасистоли не впливають на регулярний ритм СА-
вузла, тоді як передсердні позачергові скорочення спричи-
нюють його порушення.
Якщо передсердні і шлуночкові екстрасистоли вини-
кають на початку діастоли, коли шлуночки ще не встигли
наповнитися кров’ю, і м’язи шлуночків перебувають у стані
відносної рефрактерності, то вони недостатньо сильні для
того, щоб спричинити пульс на зап’ясті. Вони можуть
навіть не зумовити відкриття клапанів аорти і легеневого
стовбура, унаслідок чого другого тону серця не буде (див.
Розділ 29).
Пароксизмальна шлуночкова тахікардія (див. рис.
28-14) супроводжується частою регулярною деполяри-
зацією шлуночків, що звичайно зумовлена коловим рухом
імпульсів по шлуночках. Тахікардії, за яких ектопічні вог-
нища локалізовані вище шлуночків (надшлуночкові тахі-
кардії, наприклад, вузлова пароксизмальна тахікардія),
можна диференціювати з пароксизмальною шлуночковою
тахікардією за допомогою ЕПГ. У разі надшлуночкових
тахікардій виявляють відхилення Н, якого нема у випадку
шлуночкових тахікардій. Шлуночкові позачергові ско-
рочення трапляються досить часто і, якщо нема ішемічної
хвороби серця, є доброякісними. Пароксизмальна шлуноч-
кова тахікардія загрозливіша, оскільки спричинює змен-
шення серцевого викиду і може бути ускладнена фібри-
ляцією шлуночків.
У випадку фібриляції шлуночків (рис. 28-15) скоро-
чення м’язових волокон шлуночків зовсім нерегулярні і
неефективні, що зумовлено дуже швидким генеруванням
імпульсів численними ектопічними вогнищами або коло-
вим рухом імпульсів. Шлуночки під час фібриляції (як і
передсердя) нагадують “клубок з червами”. Фібриляція
шлуночків може бути спричинена електричним шоком або
екстрасистолами протягом критичного періоду (уразли-
вого періоду). Уразливий період за часом збігається із
серединою зубця Т, тобто він відповідає часу, у який деяка
частина шлуночкових волокон деполяризована, інша
частина не повністю реполяризована, а ще деяка частина
повністю реполяризована. Це найсприятливіші умови для
повторного входження і колового руху імпульсів. Шлуноч-
ки в стані фібриляції не можуть ефективно помпувати кров,
унаслідок чого кровообіг припиняється. Без швидкої допо-
моги фібриляція шлуночків, яка триває більше декількох
хвилин, спричинює летальний наслідок. Фібриляція шлу-
ночків - це головна причина раптової смерті хворих з
інфарктом міокарда.
Іншим підтвердженням уразливості серця під час репо-
ляризації є той факт, що у хворих з більшою тривалістю
інтервалу збільшується частота шлуночкових аритмій
і раптової смерті. Для трьох вроджених форм синдрому
довгого інтервалу ()Т описано генетичні дефекти. Пер-
ший дефект зумовлює блокаду одного типу К+-каналів
(НЕКО-канал), що призводить до сповільнення реполя-
ризації (рис. 28-16). Другий дефект супроводжується бло-
кадою К+-каналів іншого типу і глухотою (див. Розділ 9).
Третій дефект зумовлює активування \а+-каналів серце-
вого м’яза, що теж сповільнює реполяризацію.
Хоча фібриляція шлуночків розвивається під час страти
на електричному стільці, однак часто її вдається припинити
і відновити нормальний синусовий ритм за допомогою
електричного шоку. Електронні дефібрилятори сьогодні є
не лише в лікарнях, а й у машинах швидкої допомоги, їх
потрібно застосовувати якнайшвидше. Крім того, хворим
з високим ризиком фібриляції шлуночків дефібрилятори
можна імплантувати хірургічним способом.
Відновлення серцевої діяльності та дихання
У хворих з фібриляцією або зупинкою серця серцевий
викид і коронарний кровообіг можна частково забезпечити
за допомогою зовнішнього масажу серця. Ефективний
масаж можна зробити ззовні грудної клітки. Особа, яка
робить такий масаж, повинна покласти одну руку зап’ястям
у ділянці основи мечоподібного відростка грудини, а другу
Рис. 28-15. Фібриляція шлуночків, зумовлена позачерговим
скороченням шлуночків (ПСШ) в уразливий період у хворого
з інфарктом міокарда. Хворому негайно було зроблено
дефібриляцію, унаслідок чого фібриляція припинилась.
512/РОЗДІЛ 28
Рис. 28-16. Синдром довгого інтервалу ОТ унаслідок гене-
тичного дефекту, який веде до блокування НЕР6 К+-каналів.
Виникає схильність до шлуночкових аритмій, в основі якої-
сповільнення виходу К+ з клітини, збільшення тривалості по-
тенціалу дії і, відповідно, інтервалу ОТ (модифіковано з
Кеаііпд М, Запдиіпейі МС: Моїесиїаг депеііс іпзідіїїз іпіо саг-
сііоуазсиїаг сіізеазе. Зсіепсе 1996;272:681).
початком зубця Р і кінцем комплексу РК8 (“РІ-інтервал”)
нормальна. У випадку цього синдрому пароксизмальна
передсердна тахікардія часто розвивається після перед-
сердя ого позачергового скорочення. Передчасна деполя-
ризація поширюється з передсердь через АВ-вузол на фоні
рефрактерності додаткового пучка, оскільки для цього пуч-
ка характерний довший рефрактерний період, ніж для АВ-
вузла. Однак якщо збудження в шлуночках досягає шлу-
ночкової частини додаткового пучка, то пучок більше не
перебуває в стані рефрактерності, й імпульс поширюється
ретроградно до передсердя. Таким способом відбувається
коловий рух. Рідше передчасна деполяризація застає
рефрактерним АВ-вузол. Тоді вона досягає шлуночків по
пучку Кента, зумовлюючи коловий рух, за якого імпульси
надходять зі шлуночків до передсердь через АВ-вузол.
Напади пароксизмальної надшлуночкової тахікардії,
зазвичай вузлової тахікардії, простежуються в осіб з ко-
ротким інтервалом РК і нормальним комплексом РК8
(синдром Лауна-Ґанонґа-Левіне). У цьому разі деполя-
ризація поширюється з передсердь до шлуночків по додат-
ковому пучку, який обминає АВ-вузол, однак сполучається
з внутрішньошлуночковою провідною системою дисталь-
ніше АВ-вузла.
Антиаритмічні засоби
Сьогодні є багато різноманітних препаратів, ефективних
у разі аритмій завдяки здатності сповільнювати проход-
ження імпульсів у провідній системі серця і міокарді. Ці
- зверху на першу (рис. 28-17). Натискання виконують
прямо вниз, наближаючи грудину на 4-5 см до хребта. Цю
процедуру повторюють 80-100 разів за хвилину. Стискання
шлуночків рукою також є ефективним у випадку, коли груд-
на клітка вже відкрита, однак виконувати термінову тора-
котомію недоцільно. Якщо дихання також припиняється,
потрібно відновлювати серцеву діяльність і дихання.
Масаж серця треба чергувати зі штучним диханням рот у
рот (див. Розділ 37) з частотою одна вентиляція на п’ять
стискань грудної клітки.
Прискорена АВ-провідність
Досить цікавим явищем, яке трапляється у деяких
здорових людей зі схильністю до нападів пароксизмальної
передсердної аритмії, є прискорення АВ-провідності
(синдром Вольфа-Паркінсона-Уайта). У нормі АВ-
вузол - це єдиний провідний шлях між передсердями і
шлуночками. Особи з синдромом Вольфа-Паркінсона-
Уайта мають додаткове сполучення між передсердями і
шлуночками за допомогою м’язової тканини або атипових
кардіоміоцитів (пучок Кента), що проводять імпульси
швидше, ніж АВ-вузол, унаслідок чого один шлуночок
збуджується раніше. Прояви його активування зливаються
з нормальним комплексом 0К8, і це спричинює короткий
інтервал РК і довгий комплекс 0К8 з додатковою хвилею
на початку (рис. 28-18), хоча тривалість інтервалу між
Рис. 28-17. Техніка виконання зовнішнього масажу серця.
Чорний круг на діаграмі серця відповідає ділянці, до якої
потрібно прикласти силу. Круги на особі, що лежить, у ділянці
верхівки серця і праворуч від верхньої частини грудини від-
повідають місцям прикладання електродів у разі дефібриляції.
ПРИРОДА СЕРЦЕВОГО СКОРОЧЕННЯ Й ЕЛЕКТРИЧНОЇ АКТИВНОСТІ СЕРЦЯ / 513
Рис. 28-18. Прискорена АВ-провідність. Угорі: нормальний
синусовий ритм. Усередині: короткий інтервал РР; широкий,
зливний комплекс ОР8; нормальний інтервал Р^ (синдром
Вольфа-Паркінсона-Уайта). Внизу: короткий інтервал РР,
нормальний комплекс ОК8 (синдром Лауна-Ґаноні'а-Левіне).
препарати пригнічують активність ектопічних вогнищ і
зменшують відмінність між нормальними шляхами і шля-
хами повторного входження, унеможливлюючи коловий
хід імпульсів. Деякі з них блокують Ма+-канали (антиарит-
мічні препарати класу І), інші - р-адренорецептори або
іншим способом пригнічують адренергічну іннервацію
серця (препарати класу II). Є препарати, які збільшують
тривалість рефрактерного періоду серцевого м’яза (препа-
рати класу III), а також речовини, які блокують Са2+-канали
(препарати класу IV). Однак сьогодні очевидно, що у
деяких хворих усі ці препарати можуть мати аритмогенну
дію, тобто самі ці засоби спричинюють різноманітні арит-
мії. Тому для лікування аритмій замість цих засобів щораз
частіше застосовують радіочастотну деструкцію шляхів у
разі катетеризації серця (див. нижче).
Багато препаратів класу IV використовують також для
лікування стенокардії та інфаркту міокарда, оскільки вони
зумовлюють розслаблення гладких м’язів судин, розши-
рюють судини і зменшують постнавантаження на серце
завдяки зниженню артеріального тиску (див. Розділ 29).
Ендогенний аденозин, який зв’язується зі специфічними
рецепторами (див. Розділ 4), сповільнює провідність АВ-
вузла, тому його застосовують внутрішньовенно у випадках
надшлуночкових аритмій. Ефект настає завдяки виходу
йонів калію з кардіоміоцитів передсердь і клітин провідної
системи, однак не з кардіоміоцитів шлуночків. Дія пов’я-
зана з активуванням аденозинових рецепторів Аг
Радіочастотна деструкція шляхів
повторного входження
Сьогодні можна вводити в камери серця катетери з
електродами на кінці і точно визначати локалізацію екто-
пічного вогнища або додаткового пучка, які беруть участь
у повторному входженні імпульсів, і розвиток надшлу-
ночкової тахікардії. Додатковий шлях можна зруйнувати,
перепускаючи через нього радіочастотний струм. У досвід-
чених лікарів цей метод лікування дуже ефективний і
зумовлює мало ускладнень. Зокрема, його доцільно засто-
34 367-2
совувати у разі надшлуночкових аритмій, у тім числі
синдрому Вольфа-Паркінсона-Уайта і тріпотіння перед-
сердь. Його успішно застосовують також для деструкції
ектопічних вогнищ у легеневих венах, які спричинюють
пароксизмальну фібриляцію передсердь (див. вище).
ЗМІНИ ЕКГ У РАЗІ ІНШИХ СЕРЦЕВИХ
І СИСТЕМНИХ ЗАХВОРЮВАНЬ
Інфаркт міокарда
Унаслідок порушення кровопостачання ділянок міо-
карда в ньому розвиваються глибокі зміни, які ведуть до
незворотних уражень і загибелі м’язових клітин (інфаркт
міокарда; див. Розділ 32). ЕКГ використовують для діаг-
ностування і визначення локалізації інфаркту. Зміни ЕКГ
та їхні механізми є складними, тому ми описуємо їх лише
коротко.
Три головні види порушень, які спричинюють електро-
кардіографічні зміни в разі гострого інфаркту міокарда,
наведено в табл. 28-3. Спочатку це надзвичайно швидка
реполяризація м’язових волокон у зоні інфаркту внаслідок
прискореного відкривання К+-каналів; в експериментах
розвивається протягом секунд після оклюзії коронарної
артерії у лабораторних тварин. Ці зміни тривають лише
декілька хвилин, і до їхнього зникнення потенціал спокою
волокон у зоні інфаркту зменшується внаслідок втрати
внутрішньоклітинних йонів К+. Приблизно через ЗО хв у
волокнах в зоні інфаркту деполяризація починає відбува-
тися повільніше, ніж у навколишніх нормальних волокнах.
Усі три види порушень зумовлюють струми, які спри-
чинюють підіймання сегмента 8Т на ЕКГ у відведеннях,
за яких електроди розміщені над зоною ураження (рис. 28-
19). Унаслідок швидкої реполяризації в зоні інфаркту
мембранний потенціал у ній є більшим, ніж у нормальних
ділянках протягом останнього періоду реполяризації. Тому
нормальні ділянки стають негативно зарядженими щодо
зони інфаркту. Отже, позаклітинний струм спрямований
із зони інфаркту до нормальної ділянки (оскільки відомо,
що струм спрямований від позитивного заряду до нега-
тивного). Цей струм тече до електродів над зоною ура-
ження, спричинюючи позитивне зміщення на ЕКГ між
зубцями 8 і Т. Сповільнення деполяризації в уражених
клітинах теж призводить до того, що зона інфаркту стає
Таблиця 28-3. Три головні види порушень поляризації
мембрани у разі гострого інфаркту міокарда
Дефект ушкодженої клітини Струм Зміни ЕКГ у відведеннях на/} зоною інфаркту
Прискорена реполяризація Зменшення мембранного потенціалу спокою Сповільнена реполяризація Із зони інфаркту До зони інфаркту Із зони інфаркту Підвищення сегмента 8Т Депресія сегмента ОТ (виявляється підвищенням сегмента 8Т) Підвищення сегмента 8Т
514/РОЗДІЛ 28
І
II
III
а\7І_
аУЕ
В С
Рис. 28-19. Серія ЕКГ у випадку інфаркту передньої стінки. А: нормальна ЕКГ. В: ЕКГ у перші години після інфаркту: підвищення
сегмента 8Т у І, а\/І_ та \/36; реципрокна депресія 8Т у II, III та а\/Е. С: ЕКГ через багато годин або декілька днів: зубець О
з’являється в І, а\/І_ та \/56, комплекси О8-у \/3^. Це означає, що трансмуральний інфаркт локалізований у ділянці, яка
відповідає \/3^. Зміни сегмента 8Т є, однак менше виражені. Починається інверсія зубця Т у відведеннях, де є підвищення
сегмента 8Т. 6: ЕКГ через багато днів або декілька тижнів: наявні зубці О та комплекси 08, сегмент 8Т на ізоелектричній лінії.
Виявляється симетричність і глибока інверсія зубця Т у відведеннях, у яких було підвищення 8Т; зубець Т високий у від-
веденнях, у яких була депресія 8Т. Ці зміни можуть простежуватися до кінця життя хворого. Е: ЕКГ через місяці або роки після
інфаркту. Наявні патологічний зубець О і комплекс 08. Зубець Т поступово нормалізується (відтворено за дозволом з
(ЗоїсІзсЬІадег N. боїсігпап ІУН: Ргіпсіріез оГ СІіпісаІ Еіесігосагсііодгаріїу, 13ІГі есі. Мсбгауу-НіІІ, 1989).
позитивно зарядженою щодо нормальної тканини (див.
табл. 28-3) протягом першого етапу реполяризації. Внас-
лідок цього простежується підвищення сегмента 8Т. Змен-
шення потенціалу спокою під час діастоли спричинює
струм, спрямований у зону інфаркту протягом діастоли
шлуночків. Наслідком цього є зниження сегмента ОТ на
ЕКГ. Однак завдяки особливостям записування ЕКГ зни-
ження сегмента ОТ відображається у вигляді підіймання
ПРИРОДА СЕРЦЕВОГО СКОРОЧЕННЯ Й ЕЛЕКТРИЧНОЇ АКТИВНОСТІ СЕРЦЯ / 515
інтервалу 8Т. Отже, головна ознака гострого інфаркту
міокарда - підіймання сегмента 8Т у відведеннях над
зоною інфаркту (див. рис. 29-19). У відведеннях з про-
тилежного боку серця виявляють зниження сегмента 8Т.
Через декілька днів або тижнів зміни сегмента 8Т змен-
шуються. Некротизований м’яз та рубцева тканина стають
електрично неактивними. Отже, зона інфаркту стає нега-
тивно зарядженою щодо нормального міокарда протягом
систоли і тому не спричинює позитивного зміщення комп-
лексів ЕКГ. Прояви цієї негативності є численними і склад-
ними. Головні зміни - поява зубця 0 у відведеннях, у яких
він раніше не виявлявся, і збільшення розмірів зубця 0 у
відведеннях, у яких він був у нормі. Однак трапляються
інфаркти і без змін зубця (?. Цим інфарктам властивий лег-
ший перебіг, а, проте, в цьому разі вищий ризик повторного
інфаркту. У випадку інфаркту передньої стінки лівого шлу-
ночка нема наростання амплітуди зубця К. У нормі в кож-
ному наступному грудному відведенні з правого боку до
лівого зубець К повинен бути більшим, ніж у попередньому.
Унаслідок інфаркту перегородки провідна система може
бути ушкоджена і, як наслідок, виникає блокада ніжки
пучка Гіса або інші блокади серця.
Інфаркт міокарда часто ускладнений важкими шлуноч-
ковими аритміями із загрозою фібриляції шлуночків і
смерті. У лабораторних тварин і, можливо, у людей шлу-
ночкові аритмії виникають протягом трьох періодів. Упро-
довж перших ЗО хв інфаркту найчастіше розвиваються
аритмії за механізмом повторного входження. Потім настає
порівняно спокійний щодо розвитку аритмій період. Однак
через 12 год після інфаркту аритмії виникають унаслідок
підвищення автоматизму серця. Аритмії, що розвиваються
через три дні або декілька тижнів після інфаркту, здебіль-
шого зумовлені механізмом повторного входження. Зазна-
чимо, що в разі інфаркту з ураженням епікардіальних діля-
нок міокарда ушкоджені симпатичні нервові волокна.
Денервація ділянок за межами інфаркту спричиняє їхню
підвищену чутливість до катехоламінів (див. Розділ 4).
Навпаки, у випадку ураження ендокарда ушкоджені волок-
на блукаючого нерва (див. вище), внаслідок чого ефекти
симпатичних нервів не можуть бути блоковані парасим-
Нормальна ЕКГ (концентрація К+ у плазмі - 4-5,5 мекв/л). Інтервал РК = 0,16 с;
інтервал ОЯ8 = 0,06 с; інтервал ОТ = 0,4 с (нормальні показники при частоті серцевих
скорочень 60 ударів/хв).
Гіперкалійемія (концентрація К+ у плазмі - ±7,0 мекв/л). Інтервали РР і ОК8 у межах норми.
Дуже високий і загострений зубець Т.
Гіперкалійемія ((концентрація К+у плазмі - ±8,5 мекв/л). Немає ознак активності передсердь;
комплекс ОК8 розширений і зливний, його тривалість збільшена до 0,2 с. Зубець Т зальшається
високим і гострим. Подальше підвищення рівня К+у плазмі може спричинити шлуночкову
тахікардію і фібриляцію шлуночків.
Гіпокалійемія (концентрація К+у плазмі - ±3,5 мекв/л). Інтервал РК = 0,2 с;
інтервал ОЯ8 = 0,06 с; депресія сегмента 8Т. Виражений зубець II відразу після зубця Т.
Тривалість інтервалу ОТ залишається 0,4 с. Якщо зубець II помилково розцінити як частину
зубця Т, тоді тривалість ОТ може бути неправильно виміряна як 0,6 с.
Гіпокалійемія (концентрація К+у плазмі - ±2,5 мекв/л). Інтервал РК подовжується до 0,32 с;
сегмент 8Т знижений; інверсія зубця Т; яскраво виражений зубець II. Інтервал ОТ залишається
нормальним.
Рис. 28-20. Співвідношення між концентрацією К+ у плазмі та ЕКГ (за умови, що рівень Са+ у плазмі нормальний). Наведені
записи зроблено у лівих шлуночкових епікардіальних відведеннях (відтворено за дозволом з ОоІсІтап МТ РгіпсірІез ої СІіпісаІ
ЕІесігосагсІіодгарїіу, 12Й1 есі. МсСга\л/-НіІІ, 1986).
516/РОЗДІЛ 28
патичним впливом. Таке локальне посилення симпатичної
активності може спричиняти аритмії. Є дані про те, що
пригнічення проходження імпульсів до серця із лівого зір-
частого вузла, який іннервує АВ-вузол, ефективне в ліку-
ванні шлуночкових аритмій і профілактиці раптової смерті
після інфаркту міокарда.
Наслідки змін йонного складу крові
Очевидно, що зміни концентрації йонів Ма+ і К+ у ПКР
впливають на мембранний потенціал м’язових волокон,
оскільки електрична активність серця залежить від роз-
поділу цих йонів щодо мембран. Клінічно зниження рівня
На’ у плазмі може зумовлювати низький вольтаж електро-
кардіографічних комплексів. Однак зміни концентрації К+
у плазмі можуть спричинити важкі розлади серцевої діяль-
ності. Гіперкаліємія - це загрозливий для життя стан, який
призводить до летальних наслідків унаслідок впливу на
серце. Збільшення концентрації К+ у плазмі на ЕКГ вияв-
ляється передусім високим загостреним зубцем Т, який
свідчить про порушення реполяризації (рис. 28-20). За ще
більшого рівня К+ розвиваються параліч передсердь і збіль-
шення тривалості комплексу РК8. Інколи можуть вини-
кати шлуночкові аритмії. Зі збільшенням позаклітинної
концентрації К+ знижується мембранний потенціал спо-
кою м’язових волокон. Волокна стають незбудливими, і
серце зупиняється у діастолі. Навпаки, зниження рівня К+
у плазмі спричиняє збільшення тривалості інтервалу РК,
виражений зубець І), деколи пізню інверсію зубця Т у груд-
них відведеннях. Якщо зубці Т і 11 зливаються, то трива-
лість інтервалу РТ часто збільшується. Якщо ж зубці Т і 15
відокремлені, то інтервал РТ на ЕКГ має нормальну три-
валість. Гіпокаліємію треба розцінювати як небезпечний
стан, однак не настільки загрозливий, як гіперкаліємія.
Збільшення позаклітинної концентрації Са2+ зумовлює
посилення скоротливості міокарда. У разі введення великої
кількості Са2+ лабораторним тваринам їхнє серце менше
розслабляється протягом діастоли і зупиняється під час сис-
толи (кальцієвий рігор). Однак у випадках клінічних станів,
пов’язаних з гіперкальціємією, концентрація кальцію у
плазмі практично не буває настільки високою, щоб це приз-
вело до ураження серця. Гіпокальціємія спричинює збіль-
шення тривалості сегмента 8Т і внаслідок цього - інтер-
валу РТ. Ці ж зміни виникають під впливом фенотіазинів і
трициклічних антидепресантів, а також у разі різноманіт-
них захворювань ЦНС.
Зміни концентрації Са2+ і К+ у плазмі виражено впли-
вають на чутливість серця до наперстянки. Гіперкальціємія
посилює токсичність наперстянки, гіперкаліємія її послаб-
лює; М§2+, який пригнічує міокард, також знижує токсич-
ність наперстянки.
Нагнітальна функція серця
29
ВСТУП
Процес деполяризації, описаний у попередньому Роз-
ділі, зумовлює хвилю скорочення, яка поширюється по
міокарду. В окремих м’язових волокнах скорочення почи-
нається відразу після деполяризації і триває ще близько
50 с після завершення реполяризації (див. рис. 3-14).
Передсердна систола починається після зубця Р на ЕКГ;
шлуночкова систола починається біля закінчення зубця К.
і завершується відразу після зубця Т. Скорочення зумов-
люють зміни тиску і плину крові у камерах серця та кро-
воносних судинах. Зазначимо, що термін систолічний
тиск у судинній системі означає максимальний тиск, який
досягається протягом систоли, а не середній. Відповідно,
діастолічний тиск це найнижчий тиск під час діастоли.
МЕХАНІЧНІ ЗМІНИ ПІД ЧАС
СЕРЦЕВОГО ЦИКЛУ
Зміни протягом пізньої діастоли
Наприкінці діастоли митральний і тристулковий кла-
пани між передсердями та шлуночками відкриваються,
аортальний клапан і клапан легеневого стовбура закрива-
ються. Кров надходить у серце протягом діастоли, запов-
нюючи передсердя і шлуночки. Швидкість наповнення
зменшується у міру розтягнення шлуночків, і стулки атріо-
вентрикулярних (АВ) клапанів під дією течії крові закри-
ваються (рис. 29-1), особливо, коли частота серцевих ско-
рочень мала. Тиск у шлуночках залишається низьким.
Передсердна систола
Скорочення передсердь забезпечує виштовхування
деякої додаткової кількості крові у шлуночки, однак при-
близно на 70% шлуночки наповнюються пасивно протягом
систоли. Скорочення передсердних м’язів, які оточують
отвори верхньої і нижньої порожнистих і легеневих вен,
зумовлює звуження цих отворів. За інерцією кров по венах
рухається до серця, однак протягом передсердної систоли
відбувається регургітація крові до вени.
Шлуночкова систола
На початку шлуночкової систоли митральний і три-
стулковий (АВ) клапани закриваються. На початковій стадії
м’язи шлуночків скорочуються порівняно мало. Однак
внутрішньошлуночковий тиск різко підвищується внаслі-
док того, що міокард тисне на кров усередині шлуночка
(рис. 29-2). Цей період ізоволюметричного (ізоволюміч-
ного, ізометричного) скорочення шлуночків триває при-
близно 0,05 с, доки тиск у лівому і правому шлуночках не
перевищить тиск в аорті (80 мм рт. ст.; 10,6 кПа) та леге-
невому стовбурі (10 мм рт. ст.), і не відкриються аортальний
клапан і клапан легеневого стовбура. Упродовж фази ізо-
метричного скорочення АВ-клапани випинаються у перед-
сердя, спричинюючи там незначне, але різке підвищення
тиску (рис. 29-3).
Пізня Систола Ізометричне
діастола передсердь скорочення
шлуночків
Викидання Ізометричне
крові зі розслаблення
шлуночків шлуночків
Рис. 29-1. Рух крові у серці і великих судинах упродовж серцевого циклу. Ділянки серця, які скорочуються під час кожної фази,
зображено в кольорі; ПП, ЛП - праве і ліве передсердя, відповідно; ПШ, ЛШ - правий і лівий шлуночки.
518/РОЗДІЛ 29
Об’єм, мл
Рис. 29-2. Петля тиск-об’єм у лівому шлуночку. Під час діа-
столи шлуночок наповнюється, і тиск підвищується від сі до
а. Потім тиск різко підвищується від а до Ь під час ізометрич-
ного скорочення і від Ь до с упродовж фази викидання. В с
аортальний клапан закривається, і тиск знижується під час
ізометричного розслаблення з с знову до сі (відтворено за
дозволом з МсРґіее 83 еі аі [ебііогз]. Раііюріїузіоіоду оГ
□езеазе, ЗесІ есі. Мс6га\л/-НіІІ, 2000).
Із відкриттям клапанів аорти і легеневого стовбура
починається фаза викидання крові. Спочатку викидання
є швидким, та з часом сповільнюється. Внутрішньошлу-
ночковий тиск досягає максимуму, однак потім до завер-
шення систоли шлуночків дещо знижується. Найвищий
тиск у лівому шлуночку становить приблизно 120 мм рт. ст.,
у правому - 25 мм рт. ст. або менше. Наприкінці систоли
тиск в аорті перевищує тиск у шлуночках, та протягом
короткого періоду кров далі рухається за інерцією. Під час
скорочення м’язи шлуночків відтягують АВ-клапани
донизу, і тиск у передсердях знижується. Кількість крові,
яку викидає кожен шлуночок за одне скорочення у стані
спокою, становить 70-90 мл. Кінцеводіастолічний об’єм
шлуночків - приблизно 130 мл. Отже, близько 50 мл крові
залишається у кожному шлуночку наприкінці систоли
(кінцевосистолічний об’єм шлуночків). Фракція вики-
дання, тобто виражена у відсотках частина кінцеводіа-
столічного об’єму шлуночків, викидання якої відбувається
з кожним ударом, становить приблизно 65%. Фракція
викидання - це важливий показник роботи шлуночків.
Його можна визначити шляхом застосування значених
радіонуклідом еритроцитів і дослідженням серцевого пулу
крові наприкінці діастоли та наприкінці систоли (рівно-
важна радіоізотопна ангіографія), після чого можна роз-
рахувати фракцію викидання.
Рання діастола
Після того, як м’язи шлуночків скоротилися повністю,
тиск у шлуночках починає знижуватися швидше. Цей
період називають протодіастолою. Він триває близько
0,04 с. Протодіастола завершується, коли припиняється
плин виштовхнутої крові за інерцією і закриваються
клапани аорти та легеневого стовбура, що зумовлює тим-
часову вібрацію крові і стінок кровоносних судин. Після
закриття клапанів тиск продовжує швидко знижуватися
протягом періоду ізоволюметричного розслаблення
шлуночків. Ізоволюметричне розслаблення завершується,
коли тиск у шлуночках стає нижчим, ніж у передсердях, і
відкриваються АВ-клапани, що робить можливим напов-
нення шлуночків. Наповнення спочатку відбувається швид-
ко, та з наближенням наступного серцевого скорочення
сповільнюється. Тиск у передсердях продовжує підвищу-
ватися після завершення систоли шлуночків до відкриття
АВ-клапанів, потім він знижується і знову повільно підви-
щується до наступної систоли передсердь.
Перикард
Серце відокремлене від інших органів грудної клітки
за допомогою перикарда. Сам міокард вкритий фіброзним
епікардом. Перикардіальний мішок у нормі містить 5-
30 мл прозорої рідини, яка слугує своєрідною змазкою і
дає змогу серцю скорочуватися з мінімальним тертям.
Розподіл у часі
Хоча події, що відбуваються з обох боків серця, подібні,
їм притаманна деяка асинхронність. Систола правого
передсердя передує систолі лівого передсердя, а скорочен-
ня правого шлуночка починається пізніше, ніж лівого (див.
Розділ 28). Та оскільки тиск у легеневому стовбурі нижчий,
ніж в аорті, то викидання крові з правого шлуночка почи-
нається швидше, ніж з лівого. Протягом видихання клапани
легеневого стовбура й аорти закриваються одночасно.
Однак під час вдихання аортальний клапан закривається
дещо швидше. Повільніше закриття клапана легеневого
стовбура зумовлене меншим опором легеневих крово-
носних судин. Викид крові, виміряний за деякий період
часу, є зазвичай однаковим в обох шлуночках, хоча у здо-
рових людей можливі тимчасові відмінності викиду про-
тягом дихального циклу.
Тривалість систоли і діастоли
Унікальною властивістю серцевого м’яза є здатність до
швидшого скорочення та реполяризації зі збільшенням
частоти серцевих скорочень (див. Розділ 3). Унаслідок
цього тривалість систоли зменшується з 0,3 с за частоти
скорочень 65 уд/хв до 0,16 с за частоти 200 уд/хв (табл. 29-
1). Скорочення у систолі відбуваються головно завдяки
зменшенню тривалості систолічного викидання, хоча
тривалість систоли є сталішою, ніж діастоли, а зі збіль-
шенням частоти серцевих скорочень діастола скорочується
значно більше порівняно з систолою. Наприклад за частоти
серцевих скорочень 65 уд/хв тривалість діастоли становить
0,62 с, тоді як за частоти 200 уд/хв - лише 0,14 с. Цей факт
має важливе фізіологічне і клінічне значення. Саме
протягом діастоли м’язи серця відпочивають і лише упро-
довж діастоли коронарні судини постачають кров у субен-
докардіальні ділянки лівого шлуночка (див. Розділ 32).
Крім того, наповнення шлуночків відбувається головно
протягом діастоли. За частоти серцевих скорочень, яка не
НАГНІТАЛЬНА ФУНКЦІЯ СЕРЦЯ / 519
0 0,2 0,4 0,6 0,8
ГТТ..ГТЛ..I I І
Час, с
Тиск,
мм рт. ст.
Об’єм
шлуночка, мл
Плин крові в
аорті, л/хв
Фази серцевого циклу
Електрокардіограма
Тони серця
(фонокардіограма)
Тиск в аорті
(в о аортальний клапан відкривається;
ус- закривається)
Тиск у лівому шлуночку (—)
Тиск у лівому передсерді (—)
(аналогічно у правому)
Об’єм лівого шлуночка
(у с' митральний клапан закривається;
у о' - відкривається)
Тиск у яремній вені;
зумовлює зубці а, с, і V
Тиск,
мм рт. ст.
Тиск у сонній артерії
(п - диктротичний підйом)
Тиск у променевій артерії
Тиск у легеневій артерії
Тиск у правому передсерді
Рис. 29-3. Події упродовж серцевого циклу для частоти серцевих скорочень 75 ударів/хв. Фази серцевого циклу зазначено
цифрами внизу 1 - передсердна систола, 2 - ізометричне скорочення шлуночків; 3 - фаза викидання; 4 - ізометричне
розслаблення шлуночків; 5 - наповнення шлуночків. Зверніть увагу, що наприкінці систоли тиск в аорті значно перевищує
тиск у лівому шлуночку Однак за інерцією кров рухається зі шлуночків упродовж короткого проміжку часу. Співвідношення у
правому шлуночку і легеневій артерії подібні. Пер. сист. - передсердна систола; Шлуноч. сист. - шлуночкова систола.
перевищує 180 уд/хв, наповнення шлуночків є адекватним,
оскільки достатнє венозне повернення, і серцевий викид
за хвилину збільшується внаслідок збільшення частоти
серцевих скорочень. Однак за значної частоти серцевих
скорочень наповнення шлуночків може порушуватися
настільки, що серцевий викид за хвилину зменшується і
розвиваються симптоми серцевої недостатності.
Оскільки серцевий м’яз має тривалий потенціал дії і
довгий рефрактерний період, то він може скорочуватися у
відповідь на дію наступного подразника лише наприкінці
попереднього скорочення (див. рис. 3-14). Отже, у серце-
вому м’язі не виникає такого тетанічного скорочення, як у
скелетних м’язах. Найвища частота серцевих скорочень
теоретично становить близько 400/хв. Однак у дорослих
людей АВ-вузол проводить не більше 230 імпульсів за хви-
лину тому, що він має довгий рефрактерний період. Частота
скорочень шлуночків понад 230 простежується лише в разі
пароксизмальної тахікардії (див. Розділ 28).
520 / РОЗДІЛ 29
Таблиця 29-1. Зміни тривалості потенціалу дії та інших
показників зі зміною частоти серцевих скорочень1
Показник чсс 200/хв ЧСС 75/хв Скелетний м’яз
Тривалість серцевого циклу 0,80 0,30
Тривалість систоли 0,27 0,16
Тривалість потенціалу Дії 0,25 0,15 0,005
Тривалість абсолют- ного рефрактерного періоду 0,20 0,13 0,004
Тривалість відносного рефрактерного періоду 0,05 0,02 0,003
Тривалість діастоли 0,53 0,14
1 Усі показники наведено у секундах.
Точно виміряти тривалість ізоволюметричного скоро-
чення шлуночків у клінічних умовах важко. Однак досит Г>
легко визначити тривалість повної електромеханічної
систоли (<2$2), період передвикидання (ППВ) та час
викидання лівого шлуночка (ЧВЛШ) за допомогою
одночасного записування ЕКГ, фонокардіограми і каро-
тидного пульсу. Повна електромеханічна систола р82 - це
період від початку комплексу РВ.8 до закриття аортального
клапана, яке визначене початком другого тону. ЧВЛШ -
це період від початку підвищення каротидного тиску до
дикротичного підйому (див. нижче). ППВ - це різниця між
Р82 і ЧВЛШ, тобто час, який відповідає електричним і
механічним подіям, що передують систолічному викидан-
ню. Співвідношення ППВ/ЧВЛШ у нормі становить при-
близно 0,35. Цей індекс збільшується без змін р82 в разі
порушення функції лівого шлуночка, зумовленого різно-
манітними захворюваннями серця.
Артеріальний пульс
Кров, що надходить в аорту протягом систоли, не тільки
зумовлює рух крові по судинах, а й спричиняє ударну
хвилю, яка поширюється по артеріях. Ударна хвиля роз-
тягує стінки артерій у міру поширення, і це розтягнення
пальпують у вигляді пульсу. Швидкість, з якою поширю-
ється ударна хвиля, не залежить від швидкості плину крові,
є значно більшою за неї і становить близько 4 м/с в аорті,
8 м/с у великих артеріях і 16 м/с у дрібних артеріях дорос-
лих людей молодого віку. Отже, пульс пальпують у проме-
невій артерії на зап’ястку через 0,1 с після піка систоліч-
ного викидання крові в аорту (див. рис. 29-3). З віком арте-
рії стають ригіднішими, і ударна хвиля поширюється швид-
ше.
Сила пульсу визначена пульсовим тиском і мало зале-
жить від середнього тиску. Пульс є слабким (ниткоподіб-
ним) у випадку шоку, а сильним у разі збільшення удар-
ного об’єму, наприклад, під час фізичного навантаження
або після введення гістаміну. Коли пульсовий тиск є висо-
ким, пульсові хвилі можуть бути настільки значними, що
їх відчуватиме людина (серцебиття). За недостатності аор-
тального клапана пульс особливо сильний, і сила систо-
лічного викидання крові може бути достатньою, щоб спри-
чинити похитування голови під час кожного удару серця.
Пульс у разі аортальної недостатності називають колап-
суючим, пульсом Коррігана або пульсом “водяного мо-
лотка” (від англ. \¥аіег-1іаттег риїзе). Водяний молоток -
це скляна трубка, з якої випомповували повітря і запов-
нювали до середини водою. Це була популярна іграшка у
XIX ст. Якщо її тримати в руці і перевертати, вона спри-
чинює короткий важкий удар.
Дикротичний підйом - це незначне відхилення на низ-
хідній ділянці кривої пульсу, зумовлене закриттям аор-
тального клапана (див. рис. 29-3). Його виявляють у разі
реєстрації кривої пульсу, однак не пальпують на зап’ясті.
Дикротичний підйом простежується також на кривій тиску
в легеневій артерії, де він спричинений закриттям клапана
легеневої артерії.
Зміни тиску в передсердях та яремний пульс
Тиск у передсердях підвищується протягом перед-
сердної систоли і продовжує підвищуватися під час ізо-
волюметричного скорочення шлуночків, коли АВ-клапани
випинаються у передсердя. Після того, як АВ-клапани від-
тягуються донизу внаслідок скорочення шлуночкових м’я-
зів, тиск швидко знижується, а потім підвищується внас-
лідок надходження крові в передсердя до моменту, доки
АВ-клапани не відкриються на початку діастоли. Повер-
нення АВ-клапанів до стану релаксації теж сприяє підви-
щенню тиску завдяки зменшенню ємності передсердь.
Зміни тиску в передсердях поширюються на великі вени,
спричинюючи три характерні хвилі під час записування
яремного тиску (див. рис. 29-3). Хвиля а зумовлена
систолою передсердь. Як зазначено вище, під час скоро-
чення передсердь певна кількість крові повертається у
великі вени, незважаючи на те, що їхні устя звужені. Крім
того, венозний приплив припиняється, внаслідок чого
венозний тиск підвищується, що теж сприяє появі хвилі.
Хвиля с виникає внаслідок підвищення тиску в перед-
сердях, спричиненого випинанням тристулкового клапана
в передсердя протягом фази ізоволюметричного скорочен-
ня шлуночків. Хвиля V відображає підвищення передсерд-
ного тиску, перш ніж відкриється тристулковий клапан
протягом діастоли. Хвилі яремного пульсу накладаються
на коливання венозного тиску під впливом дихання. Ве-
нозний тиск знижується під час вдихання внаслідок підви-
щення негативного тиску в грудній порожнині і підвищу-
ється під час видихання.
Вивчення пульсації яремних вен у лежачому положенні
може дати важливу з погляду клініки інформацію. Наприк-
лад, у разі недостатності тристулкового клапана виявляють
велику хвилю с з кожною шлуночковою систолою. У
випадку повної блокади серця, коли передсердя і шлуночки
скорочуються з різною частотою, простежуються хвилі а,
які є асинхронними щодо радіального пульсу, а також
велика хвиля а (“гарматна” хвиля) в момент, коли шлуночки
скорочуються за закритого тристулкового клапана. На
підставі вивчення пульсації яремних вен можна також
відрізнити передсердні екстрасистоли від шлуночкових,
оскільки передсердні позачергові скорочення, на відміну
від шлуночкових, спричинюють хвилю а.
НАГНІТАЛЬНА ФУНКЦІЯ СЕРЦЯ / 521
Тони серця
У нормі протягом кожного серцевого циклу за допомо-
гою стетоскопа прослуховують два головні звукові прояви
роботи серця. Перший є низьким (дещо подовжене “ІиЬ”)
(перший тон), він зумовлений вібрацією внаслідок рап-
тового захлопування митрального і тристулкового клапанів
на початку шлуночкової систоли (див. рис. 29-3). Другий
- коротший, високий (“дир”) (другий тон), виникає під
час вібрації, спричиненої захлопуванням клапанів аорти і
легеневого стовбура відразу після завершення систоли.
М’який, низький третій тон прослуховують протягом діас-
толи (займає приблизно третю частину) у багатьох людей
молодого віку. Він збігається з періодом швидкого напов-
нення шлуночків і зумовлений вібрацією внаслідок рапто-
вого надходження крові. Четвертий тон прослуховують
деколи відразу перед першим у випадку високого перед-
сердного тиску або зменшення еластичності шлуночка,
наприклад, у разі шлуночкової гіпертрофії. Він зумовлений
наповненням шлуночків і зрідка прослуховується у здоро-
вих дорослих людей.
Перший тон має тривалість 0,15 с і частоту 25-Л5 Гц.
Він м’який за низької частоти серцевих скорочень, оскільки
шлуночки заповнені кров’ю і АВ-клапани плавно закри-
ваються перед систолою. Другий тон триває 0,12 с з час-
тотою 50 Гц. Він голосний і різкий з підвищенням діасто-
лічного тиску в аорті або легеневій артерії, що зумовлює
швидке захлопування відповідних клапанів наприкінці
систоли.
Проміжок часу між захлопуванням аортальних кла-
панів і клапанів легеневого стовбура протягом вдихання
є достатньо тривалим, щоб спричинити роздвоєння друго-
го тону (фізіологічне роздвоєння другого тону). Роздво-
єння виникає також унаслідок різних захворювань. Третій
тон триває 0,1 с.
Шуми
Шуми - це патологічні тони серця, які прослуховують
у різних ділянках серцево-судинної системи. Як описано в
Розділі ЗО, до досягнення критичної швидкості плин крові
є ламінарним і нетурбулентним. Якщо швидкість вища від
критичної (або в разі обструкції), він стає турбулентним.
Ламінарний плин є безшумним, тоді як турбулентний спри-
чинює шуми. Плин крові прискорюється у випадку зву-
ження артерій або деформації клапанів серця.
Прикладами шумів, які виникають за межами серця, є
шум над великим, добре васкуляризованим зобом; шум над
сонною артерією в разі звуження і деформації її просвіту
внаслідок атеросклерозу; шуми над аневризмою однієї з
великих артерій, артеріовенозною фістулою або артеріаль-
ною протокою.
Головна, але не єдина, причина серцевих шумів - ура-
ження клапанів серця. Зі звуженням атріовентрикулярного
отвору (стеноз) плин крові через нього прискорюється і
стає турбулентним. Якщо стулки клапанів повністю не
закривають отвору (недостатність клапанів), то відбува-
ється регургітація (повернення) крові через звужений про-
світ, що прискорює плин крові. Належність шуму, спричи-
неного стенозом або недостатністю конкретних клапанів
(табл. 29-2), до систоли або діастоли можна визначити на
підставі механічних подій протягом серцевого циклу. Шу-
ми, зумовлені ураженням конкретного клапана, найліпше
прослуховуються, якщо стетоскоп розміщений над від-
повідним клапаном. Наприклад, шуми, зумовлені уражен-
ням легеневого й аортального клапанів, зазвичай найліпше
прослуховувати біля основи серця, шуми, спричинені ура-
женням митрального клапана, - на верхівці серця. Для того,
щоб визначити, ураження якого конкретно клапану спри-
чинює шум, треба враховувати тривалість шуму, характер,
посилення тощо. Один із найголосніших шумів виникає в
разі зворотного плину крові протягом діастоли через отвір
утворений за неповного змикання стулок аортального
клапана. Більшість шумів можна прослухати лише за допо-
могою стетоскопа, однак цей високий музичний діасто-
лічний шум деколи чути без стетоскопа на відстані від
пацієнта.
У хворих з вродженими дефектами міжшлуночкової
перегородки плин крові з лівого у правий шлуночок зумов-
лює систолічний шум. М’які шуми можна прослухати
також у хворих із дефектами міжпередсердної перегород-
ки, однак їх виявляють не завжди.
М’які систолічні шуми часто прослуховують у людей
без захворювань серця. Вони виникають також у хворих з
анемією і зумовлені зменшенням в’язкості крові та її швид-
ким плином (див. Розділ ЗО).
Ехокардіографія
Рух стінок, а також деякі інші особливості функції серця
можна оцінити за допомогою ехокардіографії - неінва-
зивного методу, який не потребує ін’єкцій або введення
катетерів. Під час ехокардіографії пристрій випромінює
імпульси ультразвукових хвиль частотою 2,25 МГц і сприй-
має їхнє відображення від різних ділянок серця. Відобра-
ження виникають тоді, коли змінюється акустичний опір.
Ехо-сигнали реєструє осцилоскоп залежно від часу, вони
є записом рухів стінки шлуночків, перегородки і клапанів
протягом серцевого циклу. В комплексі з доплерографією
ехокардіографія дає змогу визначити швидкість і об’єм
плину крові через клапани. Вона має важливе клінічне зна-
чення, особливо для хворих з ураженням клапанів.
ХВИЛИННИЙ ОБ’ЄМ КРОВІ
Методи вимірювання
В експериментах з тваринами хвилинний об’єм крові
можна виміряти за допомогою накладання електромаг-
нітного давача на висхідну частину аорти. У людей для
вимірювання хвилинного об’єму, крім комбінації допле-
рографії з ехокардіографією, можна застосувати прямий
метод Фіка і метод розведення.
Таблиця 29-2. Шуми серця
Клапан Порушення Час появи шуму
Аортальний або Стеноз АВ-отвору Систолічний
легеневий Недостатність Діастолічний
Митральний або Стеноз АВ-отвору Діастолічний
тристулковий Недостатність Систолічний
522 / РОЗДІЛ 29
Згідно із принципом Фіка, кількість речовини, яку
поглинає орган (або весь організм) за одиницю часу, дорів-
нює різниці між артеріальним і венозним рівнем (А-В
різниці), помноженій на плин крові. Звичайно, цей прин-
цип можна застосувати лише у випадках, коли артеріальна
кров - єдине джерело поглинальної речовини. Його також
доцільно використовувати для визначення хвилинного
об’єму шляхом вимірювання кількості О2, яку споживає
організм за заданий проміжок часу, поділеної на А-В різ-
ницю в легенях. Оскільки системна артеріальна кров має
однаковий рівень О? у всіх ділянках тіла, то артеріальний
вміст О9 можна виміряти у крові із будь-якої доступної арте-
рії. Венозну кров із легеневої артерії отримують за допо-
могою серцевого катетера. Раніше з цією метою викорис-
товували кров із правого передсердя. Проте у цьому разі
недостатнє змішування крові може давати похибку, і взя-
тий взірець не буде показовим для всього організму. Наве-
демо приклад розрахунку хвилинного об’єму з викорис-
танням середніх показників:
п споживання О?
Викид лівого шлуночка =------------
[Ао2]~[Уо2]
250мл/хв
190 мл/л артеріальної крові -
140 мл/л венозної крові у легеневій артерії
Сьогодні звичною стала процедура введення довгого
катетера через вену передпліччя в серце за допомогою
флюороскопа. Цей метод розробив Форсман, який вводив
катетер особисто собі. Однак після того, як Форсман спро-
бував отримати дозвіл на випробування цього методу в
інших людей з діагностичною метою, його звільнили з
роботи. Тепер з’ясовано, що ця процедура безпечна. Кате-
тери можна вводити не тільки в праве передсердя, а й через
передсердя і правий шлуночок у малі (дрібні) гілки леге-
невої артерії, а також через периферійні артерії в ретро-
градному напрямі в серце та коронарні й інші артерії.
Метод розведення полягає в тому, що відому кількість
речовини, наприклад, барвника або частіше радіоактивного
ізотопу, вводять у плечову вену, після чого визначають
концентрацію речовини у серії зразків артеріальної крові.
Хвилинний об’єм дорівнює кількості введеного індика-
тора, поділеній на середню концентрацію в артеріальній
крові після одного проходження через серце (рис. 29-4).
Звичайно, що індикатором повинна бути речовина, яка
протягом дослідження перебуває в крові і не спричинює
небажаних гемодинамічних ефектів. На практиці будують
графік залежності логарифма концентрації індикатора в
серії зразків артеріальної крові від часу. Концентрація
збільшується, зменшується і знову збільшується внаслідок
рециркуляції індикатора. Початкове зниження концент-
рації, лінійне на напівлогарифмічному графіку, екстрапо-
люють на вісь абсцис, отримуючи час першого проход-
ження індикатора через кровообіг. Розраховують серцевий
викид за цей проміжок часу (див. рис. 29-4), а потім на
Е =
Е = течія
Е = кількість уведеного індикатора
С = концентрація індикатора в артеріальній крові
відразу після введення
У стані спокою (див. графік):
Течія за 39 с 5 мг ін’ЄКція
(час першого проходження) = їіґмг/л
(середня концентрація)
Течія = 3,1 л за 39 с
Течія (серцевий викид)/хв = 3,1 х— = 4,7 л
39
У разі фізичного навантаження (див. графік):
л 5 мг
Течія за 9 с = ———---— = 3,3 л
1,51 мг/л
Течія/хв = 3.3 X = 22,0 л
9
Рис. 29-4. Визначення хвилинного об’єму методом розведен-
ня індикатора (барвника).
його підставі обчислюють серцевий викид за хвилину (хви-
линний об’єм).
Поширеним методом розведення є метод термодилю-
ції, під час якого як індикатор застосовують охолоджений
ізотонічний розчин. Цей розчин вводять у праве передсердя
через один кінець катетера з двома просвітами. Одночасно
записують зміни температури крові у легеневій артерії за
допомогою термістора на другому, довшому боці катетера.
Зміна температури є обернено пропорційною до кількості
крові, що проходить через легеневу артерію, тобто рівня
розведення охолодженого ізотонічного розчину кров’ю.
Цей метод має дві важливі переваги: по-перше, ізотонічний
розчин зовсім нешкідливий; по-друге, холод поширюється
НАГНП^ЛЬНАФУНКЦІЯСЕРЦЯ / 523
в тканинах і тому не виникає проблем, пов’язаних з рецир-
куляцією, отже, вимірювання можна повторювати.
Хвилинний об’єм можна також вимірювати за допомо-
гою комбінації метода Доплера й ехокардіографії (див.
вище).
Хвилинний об’єм залежно від різних умов
Кількість крові, яку викидає кожен шлуночок за одне
скорочення, називають ударним об’ємом. Ударний об’єм
становить приблизно 70 мл у людини із середньою масою
тіла, що лежить у стані спокою (70 мл з лівого шлуночка і
70 мл з правого). Об’єм крові, що його викидає серце за
одиницю часу, називають хвилинним об’ємом (серцевим
викидом). У стані спокою в лежачому положенні він ста-
новить приблизно 5,0 л/хв (70 мл х 72 уд/хв). Є залежність
між серцевим викидом і площею поверхні тіла. Хвилин-
ний об’єм на квадратний метр площі тіла (серцевий індекс)
становить приблизно 3,2 л. Вплив різноманітних факторів
на серцевий викид схарактеризовано в табл. 29-3.
Фактори, що контролюють хвилинний об’єм
Зміни хвилинного об’єму можуть бути зумовлені зміна-
ми частоти серцевих скорочень або ударного об’єму (рис.
29-5). Частота серцевих скорочень контрольована перед-
усім нервовою системою. Стимулювання симпатичного
відділу збільшує частоту серцевих скорочень, а парасимпа-
тичного - зменшує (див. Розділ 28). Ударний об’єм теж
частково залежить від впливу нервової системи. Симпа-
тичне стимулювання змушує м’язові волокна скорочува-
тися з більшою силою за будь-якої довжини. Парасимпа-
тичне стимулювання спричинює протилежний ефект.
Якщо сила скорочення збільшується без збільшення дов-
жини волокон, то більше крові викидається зі шлуночків;
тобто збільшується фракція викидання і зменшується кін-
цевосистолічний об’єм. Вплив катехоламінів, що їх виді-
ляють симпатичні нерви, на частоту серцевих скорочень
називають хронотропною дією, а їхній вплив на силу
серцевого скорочення - інотропною дією. Фактори, які
збільшують силу серцевого скорочення, характеризують
як позитивні інотропні, а фактори, що її зменшують, - як
негативні інотропні.
Таблиця 29-3. Вплив різноманітних факторів на
хвилинний об’єм
Умова або фактор1
Без змін Сон Помірні зміни температури довкілля
Збільшення Тривога і збудження (50-100%) Приймання їжі (30%) Фізичні вправи ( до 700%) Висока температура довкілля Вагітність Адреналін
Зменшення Перехід від лежання до сидіння або стояння (20-30%) Тахіаритмії Захворювання серця
1 У дужках наведено наближений відсоток зміни.
Рис. 29-5. Взаємодія факторів, які регулюють хвилинний об’єм
крові й артеріальний тиск. Суцільна лінія означає збільшення,
штрихова - зменшення.
Сила скорочення серцевого м’яза залежить від перед- і
післянавантаження. Дія цих факторів показана на рис. 29-
6, де стрічку м’яза розтягують за допомогою вантажу
(переднавантаження), який лежить на площині. Почат-
кова фаза скорочення є ізоволюметричною; еластичний
компонент і скоротливий елемент розтягуються, і напру-
, женість збільшується до моменту, доки вона не буде достат-
ньою, щоб підняти вантаж.
Напруженість, за якої вантаж піднімається, є післяна-
вантаженням. Потім м’яз скорочується ізотонічно без
підвищення напруженості. В умовах іп уіуо переднаван-
таження - це ступінь розтягування міокарда перед скоро-
ченням, післянавантаження - це опір, який потрібно подо-
лати в разі викидання крові.
Залежність напруги від довжини волокон
серцевого м’яза
Залежність між довжиною і напруженням м’язових
волокон серця (див. рис. 3-16) подібна до залежності у
скелетних м’язах (див. рис. 3-10). Зі скороченням м’яза
напруженість збільшується, досягаючи максимального
значення, однак у разі дуже сильного розтягування вона
зменшується. Сгарлінґ звернув на це увагу, коли виявив,
що енергія скорочення прямо пропорційна до початкової
довжини м’язового волокна. Це положення відоме як закон
Старлінґа, або закон Франка-Старлінґа.
У серці довжина м’язових волокон (тобто рівень перед-
навантаження) прямо пропорційна до кінцеводіастолічного
об’єму. Залежність між ударним об’ємом шлуночків і кін-
цеводіастолічним об’ємом відображає крива Франка-Стар-
лінґа.
Регулювання хвилинного об’єму завдяки зміні довжини
м’язових волокон серця деколи називають гетерометрич-
ним регулюванням, а регулювання внаслідок зміни ско-
ротливості незалежно від довжини волокон - гомомет-
ричним.
524 / РОЗДІЛ 29
Рис. 29-6. Модель скорочення м’яза на фоні післянаванта-
ження: А: спокій; В: часткове скорочення скоротливого еле-
мента м’яза (СЕ) із розтягненням еластичного елемента (РЕ)
без скорочення; С: повне скорочення зі скороченням (відтво-
рено за дозволом з ЗоппепЬІіск ЕН іп: ТІїе МуосагсІіаІ СеІІ:
Зігисіуге, Еипсііоп апсі МобіТісаііоп. ВгіІІег 8А, Сопп НІ_ [ебі-
іогз]. ііпіу Реппзуїуапіа Ргезз, 1966).
Серцево-легеневий препарат
Те, до чого призводять зміни периферійного опору,
можна продемонструвати на серцево-легеневому препа-
раті. Анестезованій тварині, частіше собаці, вводять каню-
лі в аорту і порожнисту вену так, що кров з аорти через
систему трубок і резервуар надходить у праве передсердя,
а потім через серце тварини і легені - знову в аорту. Інші
тканини організму тварини позбавлені кровопостачання,
тому серце виявляється функційно денервованим, і час-
тота серцевих скорочень практично не змінюється. Зміню-
ючи калібр трубки, по якій відтікає кров, можна підви-
щувати опір (периферійний опір), який потрібно подо-
лати серцю, штовхаючи кров. Якщо периферійний опір
підвищується, то серце викидає менше крові, ніж у нього
надійшло, протягом декількох ударів. Кров накопичується
в шлуночках, і розмір серця збільшується. Розтягнуте серце
скорочується з більшою силою, внаслідок чого хвилинний
об’єм набуває початкового рівня.
На серцево-легеневому препараті можна простежити
також вплив зміни венозного повернення. Коли резервуар,
з якого кров надходить у праве передсердя, збільшують,
то венозний тиск і венозне повернення підвищуються. М’я-
зові волокна розтягуються, і це зумовлює збільшення хви-
линного об’єму.
Фактори, які впливають на
кінцеводіастолічний об’єм
Зміни систоли і діастоли по-різному впливають на функ-
цію серця. Коли систолічне скорочення послаблюється, то
відбувається зменшення хвилинного об’єму. Зміни діастоли
теж впливають на ударний об’єм, однак іншим способом.
Фактори, які в нормі регулюють кінцеводіастолічний
об’єм, наведені в табл. 29-4. Підвищення внутрішньопери-
кардіального тиску обмежує ступінь наповнення шлуноч-
ків. Так само впливає зменшення еластичності міокарда
внаслідок інфаркту міокарда, інфільтративних процесів та
інших розладів. Скорочення передсердь сприяє наповнен-
ню шлуночків. Інші фактори впливають на кількість крові,
Таблиця 29-4. Фактори, які в нормі збільшують або
зменшують довжину м’язових волокон шлуночків
Збільшення
Сильніші скорочення передсердь
Збільшення загального об’єму крові
Збільшення венозного тонусу
Посилення нагнітальної дії скелетних м’язів
Підвищення негативного інтраторакального тиску
Зменшення
Стояче положення
Підвищення інтраперикардіального тиску
Зменшення еластичності міокарда
що надходить до серця, а отже, опосередковано через діас-
толу діють на наповнення шлуночків. Збільшення об’єму
крові, що циркулює, збільшує венозне повернення. Звужен-
ня вен спричинює зменшення венозної ємності, знижує де-
понування венозної крові і збільшує венозне повернення.
Підвищення нормального негативного внутрішньо груд-
ного тиску збільшує градієнт тиску, за яким кров надходить
до серця, а зниження зменшує венозне повернення. У поло-
женні стоячи кількість крові, що надходить до серця, змен-
шується, а м’язова активність, навпаки, збільшує венозне
повернення завдяки нагнітальній дії скелетних м’язів.
Нарис. 29-7 зображено вплив систолічної і діастолічної
дисфункції на співвідношення тиск-об’єм у лівому шлу-
ночку.
Скоротливість міокарда
Скоротливість міокарда суттєво впливає на ударний
об’єм. У випадку стимулювання симпатичних нервів серця
крива довжина-напруга зміщується догори і ліворуч (рис.
29-8). Позитивну інотропну дію норадреналіну, що його
виділяють нервові закінчення, посилює норадреналін, що
циркулює. Подібний ефект зумовлює й адреналін. Стиму-
лювання блукаючих нервів спричинює негативний іно-
тропний вплив на м’язи передсердя і незначний негативний
інотропний ефект у м’язах шлуночків.
Зміни частоти серцевих скорочень і ритму також впли-
вають на скоротливість міокарда (залежність сила-частота,
див. рис. 29-8). У разі шлуночкових екстрасистол у міокарді
кожне наступне скорочення є сильнішим, ніж попереднє
нормальне. Постекстрасистолічне потенціювання не
залежить від наповнення шлуночків, оскільки воно виникає
в ізольованому серцевому м’язі і зумовлене підвищенням
внутрішньоклітинної концентрації Са2+. Постійне зростан-
ня скоротливості можна спричинити, якщо подавати на
серце подвійні електричні стимули так, що другий стимул
надходить відразу після рефрактерного періоду, зумовле-
ного першим імпульсом. Було з’ясовано також, що скорот-
ливість міокарда збільшується з посиленням частоти сер-
цевих скорочень, хоча цей ефект порівняно незначний.
Катехоламіни спричинюють інотропний ефект, впли-
ваючи на серцеві Р^адренорецептори та 65 з подальшим
активуванням аденілатциклази і збільшенням внутрішньо-
клітинної концентрації цАМФ. Ксантини, такі як кофеїн і
теофілін, пригнічують розпад цАМФ і зумовлюють пози-
тивний інотропний ефект. Глюкагон, який посилює утво-
НАГНІТАЛЬНА ФУНКЦІЯ СЕРЦЯ / 525
Рис. 29-7. Вплив систолічної і діастолічної дисфункції на петлю тиск-об’єм лівого шлуночка. Ліворуч: систолічна дисфункція
спричинює зміщення кривої ізометричний тиск-об’єм (див. рис. 29-2) до правого боку, зменшуючи ударний об’єм з Ь-с до Ь'-
с'. Праворуч: діастолічна дисфункція зумовлює збільшення кінцеводіастолічного об’єму і зміщує криву діастолічний тиск-
об’єм угору і до лівого боку. Це спричинює зменшення ударного об’єму з Ь-с до Ь'-с' (відтворено за дозволом з МсРЬее.83 еі
аі [есіііогз]: РаіЬорКузіоІоду оТ Оізеазе, ЗгсІ есі. Мсбгам-НіІІ, 2000).
Залежність
Рис. 29-8. Вплив скоротливості міокарда на криву Франка-Старлінґа. Крива зміщується вниз і праворуч зі зменшенням скорот-
ливості. Головні фактори, що впливають на скоротливість, наведені праворуч. Штриховими лініями позначені ділянки кривої
функції шлуночка, які відповідають перевищенню максимальної скоротливості міокарда, тобто це низхідні ділянки кривої
Франка-Старлінґа; КДО - кінцеводіастолічний об’єм (відтворено за дозволом з ВгаипмаІсІ Е, Козз 3, ВоппепЬІіск ЕН: МесИа-
пізтз ої сопігасйоп оїіКе погтаї апсі ТаіІіпд Ііеагї. N ЕпдІ 3 Месі 1967;277:794).
526 / РОЗДІЛ 29
рення цАМФ, рекомендують застосовувати у разі деяких
захворювань серця. Позитивний інотропний ефект наперс-
тянки і подібних речовин (див. рис. 29-8) зумовлений
їхньою здатністю пригнічувати Ка^-К -АТФ-азу міокарда.
Інгібування ензиму спричинює збільшення внутрішньо-
кліз инної концентрації №*, що, відповідно, призводить до
збільшення концентрації Са2' всередині клітини. Ключову
роль Са2' у скороченні скелетного і серцевого м’яза опи-
сано в Розділі 3. Гіперкапнія, гіпоксія, ацидоз та ліки, такі
як хінідин, новокаїнамід (прокаїнамід), барбітурати, по-
слаблюють скоротливість міокарда. Скоротливість міокар-
да зменшується також у разі серцевої недостатності (внут-
рішнє пригнічення). Механізм цього пригнічення остаточ-
но не з’ясований.
Інтегративне регулювання
хвилинного об’єму
В інтактних тварин і людей описані вище механізми
беруть участь в інтегративному регулюванні підтримки
хвилинного об’єму. Під час роботи скелетних м’язів
посилюється симпатична імпульсація, внаслідок чого ско-
ротливість міокарда і частота серцевих скорочень збіль-
шуються. Збільшення частоти серцевих скорочень особ-
ливо яскраво виражене у здорових людей, у цьому випадку
простежується лише незначне збільшення ударного об’єму
(табл. 29-5). Однак у хворих з трансплантованим серцем
хвилинний об’єм за фізичного навантаження може збіль-
шуватися без іннервації серця за допомогою механізму
Франка-Старлінга (рис. 29-9). Цьому сприяють також кате-
холаміни, що циркулюють у крові. Збільшення хвилинного
об’єму в таких хворих відбувається не так швидко, і мак-
симальний ефект є слабшим, ніж у здорових людей, однак
він суттєвий. Якщо венозне повернення збільшується, а
тонус симпатичної нервової системи не змінюється, то
венозний тиск підвищується, діастолічний приплив крові
збільшується, шлуночковий кінцеводіастолічний тиск під-
вищується, і серцевий м’яз скорочується з більшою силою.
За фізичного навантаження венозне повернення збільшу-
ється завдяки нагнітальній дії м’язів і посиленню дихання
(див. Розділ 33). Крім того, внаслідок розширення судин у
разі скорочення м’язів зменшується периферійний опір, а
отже, і післянавантаження. В кінцевому підсумку і в здо-
ровому, і у трансплантованому серці простежується швидке
і виражене збільшення хвилинного об’єму.
У нормі серце ніколи не розтягується так, щоб досягти
“низхідної частини” кривої Франка-Старлінґа (див. рис.
Споживання О2
Хвилинний
об’єм
Частота
серцевих
скорочень
Норма
Ударний
об’єм
Рис. 29-9. Зміни функції серця у випадку помірного фізичного
навантаження в лежачому стані у здорових людей і хворих з
трансплантованим і, отже, денервованим серцем (відтворе-
но за дозволом з Кепі КМ, Соорег Т: ТЬе сіепеїл/аіесі йеагі. N
ЕпдІ 3 Месі 1974;291Ю71)
Хронічна
денервація серця
Навантаження
і----------1
29-8), тобто стану, коли подальше розтягування призводить
не до збільшення, а до зменшення ударного об’єму. Якщо
це трапляється, то виникає зачароване коло, в якому
подальше збільшення наповнень шлуночків зумовлює
зменшення серцевого викиду, а це, відповідно, спричинює
ще більше наповнення шлуночків.
Одна з відмінностей між нетренованими людьми і
спортсменами полягає в тому, що у спортсменів менша
частота серцевих скорочень, більший кінцевосистолічний
об’єм шлуночків і більший ударний об’єм у стані спокою.
Тому, на відміну від нетренованих людей, спортсмени
можуть досягти збільшення хвилинного об’єму завдяки
збільшенню ударного об’єму без зростання частоти сер-
цевих скорочень.
Споживання кисню серцем
Базальне споживання міокардом О2, яке можна визна-
чити, зупинивши серце і підтримуючи коронарний крово-
Таблиця 29-5. Зміни функції серця у разі фізичного навантаження. Зверніть увагу, що ударний об’єм досягає максимуму,
однак потім за дуже високої частоти скорочень дещо зменшується (внаслідок зменшення діастоли)1
Навантаження, кгм/хв Споживання О2, мл/хв Частота пульсу, ударі в/хв Хвилинний об’єм, л/хв Ударний об’єм, мл Різниця А-В О2, мл/дл
Спокій 267 64 6,4 100 4,3
288 910 104 13,1 126 7,0
540 1430 122 15,2 125 9,4
900 2143 161 17,8 110 12,3
1260 3007 173 20,9 120 14,5
1 Відтворено за дозволом з Азтиззеп Е, ІМіеІзеп М: ТЬе сагбіас оиіриї іп тезі апсі \л/огк сіеіегтіпесі Ьу ІЬе асеіуіепе апсі ІЬе сіуе
іпіесііоп теНюсІз. Асїа РЬузіоІ ЗсапсІ 1952;27:217
НАГНІТАЛЬНА ФУНКЦІЯ СЕРЦЯ / 527
обіг, становить приблизно 2 мл/100 г/хв. Це значення пере-
вищує відповідний показник для скелетних м’язів у стані
відпочинку. Споживання О2 серцем, яке скорочується, ста-
новить приблизно 9 мл/100 г/хв у стані відпочинку. Цей
показник збільшується під час фізичного навантаження і
в разі деяких станів. Напруженість О2 у венозній крові сер-
ця низька, і мало додаткового кисню може поглинатися з
крові у вінцевих судинах. Тому для посиленого споживання
О? необхідно стимулювати вінцевий кровообіг. Регулю-
вання вінцевого кровообігу описане у Розділі 32.
Споживання О2 міокардом передусім залежить від внут-
рішньоміокардіальної напруженості, скоротливості міо-
карда і частоти серцевих скорочень. Робота шлуночків за
один удар корелює зі споживанням О2. Робота дорівнює
добутку ударного об’єму і середнього артеріального тиску
в легеневому стовбурі (для правого шлуночка) або аорті
(для лівого шлуночка). Оскільки тиск в аорті у сім разів
вищий, ніж у легеневому стовбурі, то робота лівого шлу-
ночка приблизно в сім разів більша, ніж робота правого
шлуночка. Теоретично збільшення ударного об’єму на 25%
без змін артеріального тиску повинно спричиняти збіль-
шене споживання О2 - таке, яке простежується в разі під-
вищення артеріального тиску на 25% без змін ударного
об’єму. Однак з незрозумілих причин робота в разі під-
вищення тиску спричинює більше зростання споживання
О2, ніж робота у випадку підвищення об’єму. Іншими сло-
вами, збільшення післянавантаження спричинює більше
підвищення споживання О2 міокардом, ніж зростання
переднавантаження. Цим пояснюють той факт, що стено-
кардія внаслідок недостатнього надходження О2 до міо-
карда частіше розвивається у випадку стенозу аорти, ніж
за недостатності аортального клапана. У разі стенозу аорти
внутрішньошлуночковий тиск повинен підвищуватися для
проштовхування крові через звужений аортальний отвір,
тоді як у разі аортальної недостатності регургітація крові
зумовлює збільшення ударного об’єму без суттєвих змін
опору.
Зазначимо, що зростання споживання О2, зумовлене
збільшенням ударного об’єму, коли м’язові волокна роз-
тягуються, є прикладом дії закону Лапласа. Згідно з цим
законом, детально описаним у Розділі ЗО, напруженість,
яка розвивається в стінці судин, прямо пропорційна до
радіуса судини, і радіус розслабленого серця збільшується.
Споживання О2 за одиницю часу збільшується в разі сти-
мулювання симпатичної нервової системи, оскільки збіль-
шується кількість ударів, а також швидкість і сила скоро-
чення. Однак цьому протидіє зменшення кінцевосисто-
лічного об’єму, а отже, і радіуса серця.
зо
Динаміка кровообігу та лімфообігу
ВСТУП
Кровоносні судини є закритою системою трубок, по
яких кров тече від серця до тканин і знову до серця. Частина
тканинної рідини надходить у лімфатичні судини і далі
через них у кровоносну систему. Кров тече по судинах
переважно завдяки прискореному руху, що виникає під
впливом нагнітальної функції серця, хоча для системного
циркулювання важливим є також діастолічне скорочення
стінок артерій, стискання вен скелетними м’язами під час
фізичного навантаження, а також від’ємний тиск у грудній
клітці під час вдихання. Опір кровоплину менше залежить
від в’язкості крові, а найбільше зумовлений діаметром су-
дин, переважно артеріол. Притікання крові до кожної тка-
нини регулюють місцеві хімічні та загальні нервові й гумо-
ральні механізми, які призводять до скорочення та розши-
рення судин тканини. Вся кров проходить через легені, а
системний кровообіг складається з багатьох різних пара-
лельних кіл (рис. 30-1). Така організація судинної системи
дає змогу значно змінювати регіональний кровоплин за
незмінного загального кровоплину. У цьому розділі розгля-
нуто загальні принципи, які стосуються всіх відділів судин-
ної системи, а також тиск та плин крові у системному кро-
вообігу. Гомеостатичні механізми, що забезпечують плин
крові, описані в Розділі 31, специфічні риси кровообігу у
легенях та нирках - у Розділах 34 та 38, а особливості плину
крові в інших органах - у Розділі 32.
АНАТОМІЧНІ ОСОБЛИВОСТІ
Артерії та артеріоли
Характеристики різних типів кровоносних судин наве-
дено у табл. 30-1. Стінка всіх артерій складається з таких
трьох оболонок: зовнішня оболонка сполучної тканини (ад-
вентиція); середня оболонка гладких м’язів (медіа); внут-
рішня, що містить ендотелій та сполучну тканину (інтима)
(рис. 30-2). У стінках аорти й інших артерій є порівняно
багато еластичних волокон. Вони розтягуються під час
систоли та набувають попереднього стану під час діастоли.
Стінка артеріол має менше еластичних волокон і набагато
більше гладких м’язів. М’язові клітини іннервовані нор-
адренергічними нервовими волокнами, які відіграють роль
констрикторів, і певною мірою холінергічними волокнами,
що розширюють судини. Артеріоли є головними судинами,
Рис. 30-1. Схема кровообігу дорослої людини; ШК- шлунково-
кишковий.
що забезпечують опір течії крові, деякі зміни їхнього
просвіту зумовлюють значні порушення загального пери-
ферійного опору.
Капіляри
Артеріоли розділяються на менші судини з м’язовою
стінкою, їх іноді називають метартеріолами, які, відпо-
відно, переходять у капіляри (рис. 30-3). У деяких відділах
судинної системи, які вивчали детально, метартеріоли зв’я-
зані безпосередньо із венулами через капілярні головні
судини, а справжні капіляри є анастомозувальною сіткою
бокових розгалужень цієї судини. Вхідні отвори справжніх
капілярів оточені з боку притікання крові невеликими пуч-
ками м’язів - прекапілярними сфінктерами. Невідомо,
чи відбувається іннервація метартеріол, а прекапілярних
сфінктерів - ні. Однак звичайно вони можуть реагувати
на місцеві або такі, що циркулюють у крові, вазоконст-
риктори! фактори. Діаметр справжніх капілярів становить
близько 5 мкм на артеріальному кінці і 9 мкм на венозному.
Якщо сфінктери розширені, то діаметр капілярів достатній
ИЛНкШКк КРОВООБІГУ Тк ГШФООБ\ГУ І 529
Таблиця 30-1. Характеристика різних типів судин у людини
Судина Діаметр просвіту Товщина стінки Усі судини кожного типу
Приблизна загальна площа поперечного перерізу, см2 Вміст крові1, %
Аорта 2,5 см 2 мм 4,5 2
Артерії 0,4 см 1 мм 20 8
Артеріоли ЗО мкм 20 мкм 400 1
Капіляри 5 мкм 1 мкм 4500 5
Венула 20 мкм 2 мкм 4000 54
Вена 0,5 см 0,5 мм 40
Порожниста вена 3 см 1,5 мм 18
1 У великому колі. Крім того, 12% міститься у серці та 18% - у малому колі кровобігу.
для просування поодиноких еритроцитів. Проходячи через
капіляри, еритроцити стають подібними до парашута,
оскільки плин крові виштовхує їхню центральну частину
вперед. Зміна форми пов’язана тільки з дією тиску в цент-
ральній частині судини, незалежно від того, контактують
краї клітини з капілярною стінкою чи ні.
Загальна площа стінок капілярів тіла у дорослого пере-
вищує 6 300 м2. Стінки товщиною 1 мкм побудовані з одно-
го шару ендотеліальних клітин. Структура стінок капілярів
різна в кожному органі. У багатьох руслах, у тім числі
скелетних, серцевих та гладком’язових, зв’язки між ендо-
теліальними клітинами (рис. 30-4) забезпечують проход-
ження молекул до 10 мкм у діаметрі. Виявляється, що
захоплення плазми та розчинених у ній білків відбувається
шляхом ендоцитозу, транспортування - через ендотеліальні
клітини, а виділення - шляхом екзоцитозу (везикулярне
транспортування; див Розділ 1). Однак цей процес забез-
печує лише незначну частину транспортування через ендо-
телій. У головному мозку капіляри нагадують капіляри
м’язів, та зв’язки між ендотеліальними клітинами щільніші
і транспортування через них обмежене лише дрібними
Рис. 30-2. Будова артерії м’язового типу (відтворено за доз-
волом з Во88 Р, (ЗІотзеї ЗА: ТЬе раіуодепезіз ої аіііегозсіе-
ГО8І8. N ЕпдІ З Месі 1976;295:369).
35 367-2
молекулами. У більшості ендокринних залоз, мікровор-
синках кишки та частинах нирки цитоплазма ендотеліаль-
них клітин стоншується та формує щілини, які називають
фенестрами. Ці фенестри становлять 2-100 нм у діаметрі
і дають змогу досить великим молекулам проходити через
стінку та роблять капіляри порозними. У всіх структурах,
крім ниркових клубочків, фенестри закриті тонкою мемб-
раною. Однак у частині тканин мембрана виявляється
несуцільною, що підтверджено використанням методу
швидкого пере лому вання в разі заморожування. В таких
випадках мембрана містить центральну частину, що з’єд-
нана за допомогою спиць з краями фенестри (рис. 30-5).
Артерія
Венозний кінець
> 50 мкм
капіляра Мала
Рис. 30-3. Мікроциркуляторне русло. Від артеріол відходять
метартеріоли, від яких, відповідно, відходять капіляри. Капі-
ляри дренують кров через короткі збірні венули до венул. У
стінках артерій, артеріол та дрібних венул міститься порівняно
велика кількість гладких м’язів. У стінках метартеріол трап-
ляються поодинокі гладком’язові клітини, а на вході у капіляр
розміщений м’язовий передкапілярний сфінктер. Зазначено
також діаметр різних судин (за дозволом ОМ Оіапа).
530 / РОЗДІЛ ЗО
Рис. 30-4. Поперечний переріз капіляра. Ліворуч: капіляри з суцільною стінкою, що виявляються у м’язах. Праворуч: капіляри
з фенестрованою стінкою (відтворено за дозволом з Еамсей ОМ: ВІоот апсі Еа\л/сей,ТехіЬоок ої Нізіоіоду, 11ііі есі. Заипсіегз,
1986).
У печінці, де синусоїдні капіляри високопроникні, ендо-
телій не суцільний, а між ендотеліальними клітинами є
великі щілини, не закриті мембранами (див. рис. 26-20).
Деякі зі щілин досягають 600 нм у діаметрі, інші можуть
становити понад 3000 нм. Проникність капілярів у різних
частинах тіла, виражена у термінах гідравлічної провід-
ності, наведена у табл. 30-2.
У капілярах та посткапілярних венулах є перицити, роз-
міщені зовні від ендотеліальних клітин (див. рис. 30-4). Ці
клітини мають довгі відростки, які обгортають стінки суди-
ни. Вони можуть скорочуватись та виділяти багато різних
вазоактивних сполук, а також синтезують елементи базаль-
ної мембрани та позаклітинного матриксу. Однією з їхніх
фізіологічних функцій є регулювання плину рідини через
міжендотеліальні з’єднання, що, зокрема, наявні в разі
запалення. Вони тісно зв’язані з мезангіальними клітинами
у нирковому клубочку (див. Розділ 38).
Лімфатичні судини
Лімфатичний дренаж з легень та інших частин тіла від-
бувається через систему судин, що зливаються і входять у
праву та ліву підключичні вени, у місці їхнього злиття є
відповідна внутрішня яремна вена. Лімфатичні судини міс-
тять клапани та регулярно проходять через лімфовузли,
що трапляються на їхньому шляху. Ультраструктурна будо-
ва дрібних лімфатичних судин відрізняється від будови
Рис. 30-5. Фенестри у капілярах острівців підшлункової залози. Ліворуч: стрілками показано фенестри на тангенціальному
(косому) зрізі ендотелію (х15 000); ПКП - позаклітинний простір. Праворуч: фенестри видно в ендотелії капілярів, обробленому
методом заморожування-розламування (х64 000). Зверніть увагу на розміщений центрально матеріал та спиці, які прикріплюють
його до кожної фенестри (відтворено за дозволом з Огсі І: ТИе іпзиііп сеІІ: Ііз сеііиіаг епуігоптепі апсі Ьа\л/ іі ргосеззез (рго)-
іпзиііп. ОіаЬеІез МеіаЬ Кеу 1986;2:71).
ДИНАМІКА КРОВООБІГУ ТА ЛІМФООБІГУ / 531
Таблиця 30-2. Гідравлічна провідність капілярів у різних
частинах тіла1
Орган Провідність2 Тип ендотелію
Головний мозок (за винят- ком навколошлуночкових органів) 3 Суцільний
Шкіра 100
Скелетні м’язи 250
Легені 340
Серце 860
Шлунково-кишковий тракт (слизова оболонка кишки) 13 000 Фенестро- ваний
Клубочки нирок 15 000
1 Дані наведені за дозволом ЛМ Піапа.
2 Одиниця провідності - 10-13 см3с1дин1.
Ангіогенез
Під час тканинного росту кровоносні судини повинні
проліферувати для підтримування нормального кровопо-
стачання. Тому ангіогенез є важливим як для життя та роз-
витку плоду, так і в дорослому організмі. У дорослого цей
процес важливий у разі загоєння ран, утворення жовтого
тіла після овуляції та утворення нового ендометрію після
місячної. У випадку патологічних процесів він відіграє
роль у пухлинному рості; якщо в пухлині не буде відповід-
ного кровопостачання, то вона не зможе рости.
Упродовж ембріонального розвитку частину крово-
носних судин утворюють ангіобласти, що формують труб-
ки, які потім зливаються. Цей процес іноді називають вас-
кулогенезом. Інші судини формуються брунькуванням від
попередніх судин зародка, цей процес називають ангіо-
генезом. Це переважна форма утворення нових судин у
дорослих.
Багато факторів росту та споріднених сполук стимулю-
ють ангіогенез, тоді як інші речовини пригнічують його
капілярів декількома ознаками: у лімфатичному ендотелії
немає фенестр; базальна мембрана, якщо є, то дуже тонка;
з’єднання між ендотеліальними клітинами відкриті, без
щільних міжклітинних контактів.
Артеріовенозні анастомози
На пальцях, долонях та мочках вух у людини, на лапах,
вухах та інших тканинах деяких тварин містяться короткі
канали, що з’єднують артеріоли з венулами в обхід капі-
лярів. Такі артеріовенозні (А-В) анастомози, або, як їх
ще називають - шунти, мають товсту м’язову стінку і є
добре іннервованими, переважно вазоконстрикторними
нервовими волокнами.
Венули та вени
Стінки венул лише незначно товстіші, ніж стінки капі-
лярів. Стінки вен теж тонкі й легко розтягуються. Вони
містять незначну кількість гладких м’язів; виражена вазо-
констрикція зумовлена активністю норадренергічних нер-
вів цих вен та вазоконстрикторними речовинами, що
циркулюють у крові, такими як ендотеліни. Кожен, хто мав
проблеми з венопункцією, міг спостерігати виражений
місцевий веноспазм, що виникав у поверхневих венах
передпліччя в разі ушкодження. Зміни венозного тонусу
важливі для судинного регулювання.
Інтима вен кінцівок через певні проміжки утворює
складки, формуючи венозні клапани, що запобігають рет-
роградному кровоплину. Вільям Гарвей уперше проде-
монстрував, як діють ці клапани (рис. 30-6). Таких клапанів
нема у дуже дрібних венах, великих венах та венах від
головного мозку і внутрішніх органів.
Ендотелій
Ендотеліальні клітини, розташовані між кров’ю, що
циркулює, та двома іншими шарами стінок судин (медією
та адвентицією) і утворюють великий і важливий “орган”.
Вони відповідають на зміни плину крові, розтягнення
стінки та речовини, що циркулюють, зокрема трансмітери
запалення. Ендотеліальні клітини виділяють регулятори
росту та вазоактивні сполуки (див. нижче та Розділ 31).
шИИИ
Рис. 30-6. Показано дію венозних клапанів на передпліччі
людини з книги Вільяма Гарвея Ехсегсіаііо Апаіотіса сіє Моїй
Согсііз еі Запдиіпіз іп АпітаїіЬиз, опублікованої 1628 р.; А -
джгут, накладений вище ліктя, припиняє венозне відтікання.
Якщо вену звільнити натисканням від (3 до Н (рис. 2), то вона
наповнюється зверху тільки до клапана О. Якщо ж її звільнити
від К до О іншим пальцем (рис. 3), то вона наповниться вище
О, а від О до Н залишиться вільною. Якщо вену перетиснути
на І (рис. 4) та звільнити іншим пальцем (М) від І_ до клапана
І\І, то вона залишиться вільною від І до N. Якщо ж палець з І
зняти, то вена наповниться знизу.
532 / РОЗДІЛ ЗО
(табл. 30-3). Рецепторами для багатьох факторів росту є
тирозинкінази. Судинний ендотеліальний фактор росту
(УЕОР - від англ. уазсиїаг епсіоіііеіеіаі £го\¥Ій Гасіог) вва-
жають найважливішим стимулювальним фактором. Ген,
що кодує УЕОР, забезпечує утворення трьох з’єднаних ізо-
форм - УЕОР120, УЕОР164 та УЕОР188. У мишей, що експре-
сують лише УЕОР120, розвиваються ішемічна кардіоміо-
патія та порушення ангіогенезу у міокарді. Виявлено що-
найменше три види рецепторів УЕОР. Вибірковій нокаут
гена, що кодує кожний із них, призводить до значних змін
у серцево-судинній та лімфатичній системах. Однак потріб-
но продовжити дослідження стосовно факторів, задіяних в
ангіогенезі, та механізмів їхнього впливу на утворення судин.
БІОФІЗИЧНІ АСПЕКТИ
Течія крові, тиск та опір
Кров тече звичайно від ділянок високого тиску у ділянки
низького, за винятком ситуацій, коли кровоплин тимчасово
припинений. Співвідношення між середньою швидкістю
течії, середнім тиском та опором у кровоносних судинах є
аналогічним до співвідношення між струмом, електро-
рушійною силою та опором у електричному колі, що його
описує закон Ома:
г _ Електрорушійна сила (Р) ,
ТРУМ" Опір (Я) ’
Течія у будь-якій ділянці судинної системи дорівнює
ефективному тиску перфузії у цій ділянці, поділеному
на опір. Ефективний тиск перфузії є різницею між середнім
інтралюмінальним тиском на артеріальному кінці та
середнім тиском на венозному кінці. Одиниця вимірювання
опору (тиск поділений на течію) - дина с/см5. Для того,
щоб уникнути таких складних одиниць, опір у серцево-
судинній системі виражають у К одиницях, які одержують
після ділення тиску (мм рт. ст.) на течію (мл/с) (див. також
табл. 32-1). Отже, наприклад, якщо середній тиск в аорті
становить 90 мм рт. ст., а швидкість викидання з лівого
шлуночка - 90 мл/с, то загальний периферійний опір
90 мм рт. ст. . _
г = 1 Я одиниця.
90 мл/с
Методи вимірювання течії крові
Течію крові можна виміряти введенням канюлі у кро-
воносну судину, однак цей метод має очевидні обмеження.
Багато приладів було створено для вимірювання течії крові
без ушкодження судинної стінки. Електромагнітні вимі-
рювачі течії ґрунтуються на принципі, згідно з яким гене-
рування напруги відбувається у провіднику, що рухається
у магнітному полі, а значення напруги пропорційне до
значення швидкості руху. Оскільки кров є провідником, то
магніт розміщується довкола судини, і напругу, що є про-
порційною до об’єму течії, вимірюють за відповідного
розміщення електрода на поверхні судини. Швидкість течії
крові вимірюють за допомогою Доплерівських вимірю-
Таблиця 30-3. Фактори, задіяні в ангіогенезі
Стимулятори
Судинний ендотеліальний фактор росту
Ангіотензин
Тромбоцитарний фактор росту ендотелію
Інтерлейкін-8
Кислий та лужний фактори росту фібробластів
Трансформувальні фактори росту а і р
Фактор некрозу пухлин а
Тканинний фактор
Фактор V
Інгібітори
Тромбоспондин-1
Фактор тромбоцитів 4
16К фрагмент пролактину
Ангіостатин (фрагмент плазміногена)
вачів течії. У цьому разі ультразвукові хвилі надсилають
у судину по діагоналі з одного кристала, а хвилі, що їх
відбивають еритроцити та лейкоцити, поглинає інший
кристал, розміщений нижче по течії. Частота відбитих
хвиль є більшою на значення, пропорційне до рівня течії у
напрямі до другого кристала, що пояснюють ефектом Доп-
лера.
Непрямі методи вимірювання течії крові у різних орга-
нах людини - адаптації Фіка та методи індикаторів розве-
дення - описані у Розділі 29. Одним з прикладів є вико-
ристання методу Кеті вдихання Г42О для вимірювання моз-
кового кровоплину (див. Розділ 32), іншим - визначення
ниркового кровоплину шляхом вимірювання кліренсу пара-
аміногіпурової кислоти (див. Розділ 38). Значну кількість
даних про кровоплин у кінцівках можна отримати завдяки
плетизмографії (рис. 30-7). У цьому разі, наприклад,
передпліччя розташовують у наповненій водою камері
ДИНАМІКА КРОВООБІГУ ТА ЛІМФООБІГУ / 533
(плетизмографі). Модифікування об'єму передпліччя
внаслідок зміни кількості крові та інтерстиційної рідини
переміщує рідину, і це реєструють під час записування об’є-
му. У випадку закупорення венозних судин передпліччя
рівень збільшення об’єму передпліччя відображає функцію
артеріального кровоплину (венозна оклюзійна плетиз-
мографія).
Застосування фізичних принципів до течії
у кровоносних судинах
Фізичні принципи та рівняння, які застосовують для
опису поведінки справжніх звичайних рідин у ригідних
трубках, часто неадекватно використовують для пояснення
поведінки крові у кровоносних судинах. Проте кровоносні
судини не є ригідними трубками, а кров є не справжньою
рідиною, а двофазовою системою рідини та клітин. Тому
поведінка кровоносної системи відрізняється, іноді значно,
від тої, яку можна було б передбачити за фізичними
принципами. Водночас фізичні принципи цілком можна
застосовувати для того, щоб зрозуміти, що відбувається в
організмі.
Ламінарна течія
Течія крові у кровоносних судинах, як і течія рідини у
вузьких ригідних трубках, у нормі є ламінарною (ліній-
ним потоком). Всередині судин дуже тонкий шар крові,
що контактує з судинною стінкою, не рухається. Подаль-
ший шар усередині судин має дуже низьку швидкість,
наступний - вищу, і так далі, причому швидкість досягає
максимальних значень у центральних ділянках потоку (рис.
30-8). Ламінарна течія простежується за швидкостей,
менших від деякої критичної швидкості. Критична або
вища від неї швидкість приводить до того, що течія стає
турбулентною. Лінійна течія є безшумною, а турбулентна
супроводжується звуками.
Ймовірність турбулентності також пов’язана з діамет-
ром судини та в’язкістю крові. Це можна виразити спів-
відношенням між силами інерції та в’язкості:
ке=£™,
п
де Ке - число Рейнольдса, назване на честь ученого, який
описав цю залежність; р - густина рідини; О - діаметр
трубки, яку досліджують; V - швидкість течії; ї| - в’язкість
рідини. Чим більше значення Ке, тим більша ймовірність
турбулентності. Якщо Б вимірюють у сантиметрах, V у
сантиметрах за секунду, а ї| - у пуазах, то течія, як звичайно,
не турбулентна, коли Ке не перевищує 2000. Якщо ж Ке
понад 3000, то турбулентність є практично завжди. Конст-
рикція артерії збільшує швидкість течії крові через ділянку
звуження, спричинюючи турбулентність, а отже, і звукові
прояви нижче від місця констрикції (рис. 30-9). Ознакою є
шум, який чути над артерією, що звужена атеросклеро-
тичною бляшкою, а також звуки Короткова, які чути під
час вимірювання кров’яного тиску (див. нижче).
У людини критична швидкість іноді перевищена у вис-
хідній аорті на висоті систолічного викиду, однак це пере-
вищення простежується лише в разі звуження артерії. Тур-
булентна течія трапляється значно частіше у випадку ане-
мії, внаслідок зменшення в’язкості крові. Цим можна пояс-
нити систолічні шуми, що є частими в разі анемії.
Механічний стрес та активування генів
Течія крові створює силу, спрямовану на ендотелій, яка
паралельна до довгої осі судини. Цей механічний стрес
зрізання (англ. зііеаг зігезз) у пропорційний до в’язкості
Т|, помноженої на рівень зрізання сіу/сіг, що є рівнем, за
якого поздовжня швидкість збільшується від судинної стін-
ки до центра просвіту:
у г|(сіу / сіг).
Зміни стресу зрізання та інших фізичних показників,
таких як циклічне скорочення та розтягнення, зумовлюють
виражені зміни в експресії генів ендотеліальних клітин,
що пов’язані з функцією серцево-судинної системи. Рецеп-
Рис. 30-8. Схема швидкостей на концентричній поверхні в’яз-
кої рідини, що тече по трубці, яка відображає параболічний
розподіл швидкостей (ламінарний потік).
к
Проти течії
Ламінарний Висока Турбулентний Ламінарний
швидкість
.Д
о
§ А
т
З
о
р
Рис. 30-9. Угорі: вплив констрикції (К) на напрям швидкості у
кровоносній судині. Стрілки показують напрям компонентів
швидкості, а їхня довжина пропорційна до швидкості. Внизу:
варіабельність швидкостей у кожній точці вздовж судини. На
ділянці турбулентного кровоплину є багато різних антеро-
(прямих) (А) та ретроградних (зворотних) (Р) швидкостей (мо-
дифіковано і відтворено за дозволом з КісіїагсІв КЕ: Оорріег
есіюсагсііодгаріїу іп сііадпозіз алеї диапіійсаііоп о^азсиїагсііз-
еазе. Моєї Сопсеріз СагсІі07а8с Оіз 1987;56:43).
534 / РОЗДІЛ ЗО
торами, ймовірно, слугують інтегрини цитоскелета клі-
тини. Вторинними месенджерами є ІФ3, ДАГ та компо-
ненти МАР кіназного шляху (див Розділ 1), а до активо-
ваних генів належать ті, що кодують фактори росту, інте-
грини та споріднені молекули (табл. 30-4). Близько 15 генів
ендотеліальних клітин активовані під час різноманітних
фізичних впливів.
Середня швидкість
У разі аналізування течії в системі трубок важливо роз-
різняти швидкість, яка є зміщенням за одиницю часу (на-
приклад, см/с), та течію, яка є об’ємом за одиницю часу
(наприклад, см3/с). Швидкість V пропорційна до течії Р,
поділеній на площу провідника А:
А
Отже, 0=АУ, і, якщо течія стала, то швидкість збіль-
шується прямо пропорційно до будь-яких зменшень А (див.
рис. 30-9).
Середня швидкість руху рідини у будь-якій точці сис-
теми паралельних трубок обернено пропорційна до загаль-
ної площі поперечного перерізу в цій точці. Тому середня
швидкість крові є найбільшою в аорті, постійно спадаючи
у менших судинах, і найменшою в капілярах, у яких загаль-
на площа поперечного перерізу в 1000 разів менша, ніж в
аорті (див. табл. 30-1). Середня швидкість знову збільшу-
ється, коли кров надходить у вени, і є порівняно значною у
порожнистій вені, хоча і не такою швидкою, як в аорті.
Клінічно швидкість плину крові можна виміряти в разі
введення препаратів жовчних кислот у вену верхньої
кінцівки та фіксування часу появи гіркого смаку, спричи-
неного цими сполуками (рис. 30-10). У нормі середній час
кровоплину від руки до язика становить 15 с.
Формула Пуазейля-Хаґена
Залежність між течією у довгій вузькій трубці, в’язкістю
рідини та радіусом трубки математично можна описати
формулою Пуазейля-Хаґена:
де Р - течія; Рд-Рв - різниця тиску на двох кінцях трубки;
ї| - в’язкість; г - радіус трубки; Г - довжина трубки.
Течія дорівнює різниці тиску, поділеній на опір К,
ЛГ
Оскільки течія залежить прямо пропорційно, а опір -
обернено пропорційно від радіуса в четвертому степені,
то кровоплин та опір іп уіуо значно змінюються за най-
менших змін калібру судини. Тому, наприклад, течія крові
через судину подвоюється зі збільшенням радіуса лише на
19%; а якщо радіус подвоюється, то опір зменшується до
6% від попереднього значення. Саме тому течія крові в
органі так ефективно регульована незначними змінами
калібру артеріол, а варіабельність діаметра артеріол має
таке важливе значення для системного артеріального тиску.
В’язкість та опір
Опір течії крові визначений не тільки радіусом крово-
носних судин (судинна перешкода), а також в’язкістю
Таблиця 30-4. Гени ендотеліальних клітин людини, бика та
кроля, уражені механічним стресом зрізання, та фактори
транскрипції, задіяні в цьому12
Гени Фактори транскрипції
Ендотелій-1 АР-1
УСАМ-1 АР-1, МР-КВ
АСЕ 88РЕ, АР-1, Едг-1
Тканинний фактор 8Р1
Тканинний фактор Едг-1
ТМ АР-1
РООЕ-а 88РЕ, Едг-1
РО(ЗЕ-р 88РЕ
ІСАМ-1 88РЕ, АР-1, МЕ-КВ
ТФР-Р 88РЕ, АР-1, І\ІЕ-КВ
Едг-1 8РЕз
с-їоз 88РЕ
с-]ип 88РЕ, АР-1
N08 3 88РЕ, АР-1, І\ІЕ-КВ
МСР-1 88РЕ, АР-1, І\ІЕ-КВ
1 Модифіковано з Вгабсіоск М еі аі: ПиісІ зґіеаг єігезз тосіиіа-
Ііоп о( депе ехргеззіоп іп епсіоіііеііаі сеііз. ІХІєууз РЬузіоІ Всі
1998;13:241.
2 Акроніми наведені у Додатку.
(поверхнева вена ліктьової ямки)
Рис. 30-10. Шлях проходження ін’єктованого матеріалу у ви-
падку вимірювання часу циркуляції від руки до язика.
ДИНАМІКА КРОВООБІГУ ТА ЛІМФООБІГУ / 535
крові. В’язкість плазми перевищує в’язкість води у 1,8 раза,
тоді як в’язкість цілісної крові - у 3-4 рази. Отже, в’язкість
насамперед залежить від гематокриту, тобто об’єму крові,
який займають клітини, вираженого у відсотках. Ефект
в’язкості іп уіуо відрізняється від значення, яке можна було
б передбачити за формулою Пуазейля-Хаґена. У великих
судинах збільшення гематокриту спричинює значне збіль-
шення в’язкості. Однак у судинах до 100 мкм у діаметрі,
наприклад, в артеріолах, капілярах та венулах, зміна в’яз-
кості на одиницю зміни гематокриту є значно меншою, ніж
у великих. Це пов’язано з відмінністю природи кровоплину
у дрібних судинах. Тому зміни в судинній мережі в’язкості
на одиницю змін гематокриту є набагато меншими іп уіуо,
ніж іп уйго (рис. 30-11). Саме тому зміни гематокриту
порівняно неважливі для периферійного опору, за винятком
випадків, коли вони численні. У разі вираженої поліците-
мії посилення опору збільшує роботу серця. І навпаки, у
випадку анемії периферійний опір послаблюється, част-
ково завдяки зниженню в’язкості. Звичайно, зниження
гемоглобіну зменшує можливість крові переносити кисень,
а поліпшення кровоплину внаслідок зменшення в’язкості
частково компенсує цей процес.
В’язкість залежить також від складу плазми та опору
клітин до деформації. Клінічно важливе збільшення в’яз-
кості простежується у випадку захворювань, які супровод-
жуються значним підвищенням рівня білків плазми, таких
як імуноглобуліни, а також у разі спадкового сфероцитозу
з патологічною ригідністю еритроцитів.
У судинах еритроцити мають тенденцію до скупчення
в центрі рухомого потоку. Внаслідок цього, кров уздовж
довгої осі судини має низький гематокрит, і гілки, що відхо-
дять з великої судини під прямим кутом, можуть одержати
непропорційну кількість крові, бідної на еритроцити. Це
явище, яке називають ковзанням плазми, може бути при-
чиною того, що гематокрит крові у капілярах регулярно
на 25% нижчий, ніж загальний гематокрит в організмі.
Критичний тиск закриття
У ригідних трубках залежність між тиском та течією
гомогенної рідини лінійна, проте у тонкостінних кровонос-
них судинах іп уіуо вона інша. Коли тиск у дрібних кро-
воносних судинах знижується, то може бути досягнута точ-
ка, за якої течії крові не буде, навіть якщо тиск не дорівнює
нулю (рис. 30-12). Це частково є проявом того, що тиск
потрібний для проштовхування еритроцитів через капіля-
ри, діаметр яких менший, ніж еритроцити. Крім того,
судини оточені тканинами, що чинять незначний, та цілком
визначений тиск на судини, і коли тиск у просвіті стає мен-
шим від тиску тканин, то судини спадаються. У неактивних
тканинах, наприклад, тиск у багатьох капілярах є низьким
унаслідок констрикції прекапілярних сфінктерів та мет-
артеріол, і багато із цих капілярів перебувають у стані
колапсу. Тиск, за якого течія крові припиняється, називають
критичним тиском закриття.
Закон Лапласа
Залежність між тиском розширення та напруженням
показано у вигляді діаграми на рис. 30-13. Дуже дивно,
що такі тонкостінні та ніжні структури, як капіляри,
порівняно не схильні до розриву. Найважливіша причина
їхньої відносної нечутливості - невеликий діаметр. Захис-
ний ефект малого розміру в цьому випадку є прикладом
дії закону Лапласа, важливого фізичного закону з декіль-
кома іншими застосуваннями у фізіології. Цей закон
Рис. 30-11. Вплив змін гематокриту на відносну в’язкість крові,
яку вимірювали скляним віскозиметром у задній нозі собаки.
Для кожного випадку середня лінія позначає середнє, а верх-
ня та нижня - стандартні відхилення (відтворено за дозволом
з Мйійакег ЗВЕ, МіпіопЕВ: ТЬе аррагепі 7І8С08і(у ої ЬІоосІ ЇІом-
іпд іп ііте ізоіаіесі ГііпсІ ІітЬ ої їГіе бод, апсі ІІ8 уагіаїіо мИИ сог-
ризсиїаг сопсепігаїіоп. З РГіузіоІ [Іопсі] 1933;78:338).
Кровоносні судини
-► Тиск
Рис. 30-12. Співвідношення між тиском і течією у системі з
риґідними стінками (вгорі) та у судинній системі (внизу).
536 / РОЗДІЛ ЗО
Рис. 30-13. Співвідношення між тиском розтягнення Т і натя-
гом стінки Н у порожнистому органі.
стверджує, що напруження стінки циліндра Т дорівнює
добутку трансмурального тиску Р та радіуса г, поділеного
на товщину стінки XV:
Т = РгАлл
У тонкостінних структурах \¥ дуже мале, ним можна
знехтувати, проте він є важливим фактором у таких суди-
нах, як артерії. Трансмуральний тиск - це різниця тиску
всередині циліндра та тиску поза циліндром, та оскільки
тканинний тиск в організмі людини низький, то Р дорівнює
тиску всередині органа. У тонкостінному органі (Р = Т),
поділеному на два основні радіуси кривини органа,
У сфері г( = г2, тому
У циліндрі, такому як кровоносна судина, один радіус є
невизначеним, тому
Отже, чим менший радіус кровоносної судини, тим
менше напруження стінки потрібне для підтримки тиску
розтягнення. В аорті людини, наприклад, напруження за
нормального тиску становить близько 170 000 дин/см, а у
порожнистій вені - близько 21 000 дин/см; проте в капіля-
рах він приблизно 16 дин/см.
Закон Лапласа допомагає зрозуміти недоліки розшире-
них сердець. Якщо радіус камери серця збільшується, то
більше напруження повинно розвиватись у міокарді для
досягнення потрібного тиску. Отже, розширене серце
повинно виконувати більшу роботу, ніж нерозширене. У
легенях радіуси кривини альвеол стають меншими під час
видихання, і тому з’являється тенденція до спадання цих
структур, пов’язана із силою поверхневого натягу. Цій силі
протистоїть фактор, що зменшує поверхневий натяг - сур-
фактант (див. Розділ 34). Ще одним прикладом може бути
дія цього закону у сечовому міхурі (див. Розділ 38).
Ємнісні судини та судини опору
Якщо частина порожнистої вени або іншої великої суди-
ни, що здатна розтягуватись, наповнюється кров’ю, то тиск
не піднімається швидко доти, доки не будуть нагромаджені
великі об’єми рідини (див. рис. 30-12). Вени іп уіуо є важ-
ливим резервуаром крові. У нормі вони частково в стані
колапсу й овальні на поперечному розрізі. Велика кількість
крові може додатково бути нагромаджена у венозній сис-
темі доти, доки вени розтягнуться до розміру, після якого
подальше збільшення об’єму призведе до значного підви-
щення венозного тиску. Тому вени називають ємнісними
судинами.
Дрібні артерії та артеріоли належать до судин опору,
оскільки вони є головним місцем периферійного опору
(див. нижче).
У стані спокою щонайменше 50% об’єму крові, що цир-
кулює, перебуває у системних венах, 20% розміщено у
порожнинах серця і 18% - у легеневих судинах з низьким
тиском. Тільки 2% міститься у аорті, 8 - в артеріях, 1 - в
артеріолах і 5% - у капілярах (див. табл. 30-1). Якщо
внаслідок трансфузії з’являється надлишок крові, то менше
1 % її розподіляється в артеріальній системі (“система ви-
сокого тиску”), а решта міститься у системних венах, леге-
невих судинах та порожнинах серця (крім лівого шлуночка)
(“система низького тиску”).
ТЕЧІЯ КРОВІ В АРТЕРІЯХ ТА АРТЕРІОЛАХ
Тиск і швидкість крові у різних частинах системи кро-
вообігу відображені на рис. 30-14. Залежність між ними є
такою ж і в малому колі, тільки тиск у легеневій артерії
становить 25/10 мм рт. ст. або ще менше.
Швидкість і течія крові
Хоча середня швидкість крові у проксимальних відділах
аорти - 40 см/с, та течія її є фазовою, проте швидкість
змінюється від 120 см/с під час систоли до негативних
значень під час транзиторного зворотного кровоплину
перед діастолічним закриттям аортального клапана. У
дистальних відділах аорти і великих артеріях швидкість
більша під час систоли, ніж під час діастоли. Однак ці
судини є еластичними, і плин крові продовжується завдяки
спаданню судинної стінки під час діастоли, що розвива-
ється після систолічного розтягнення стінок судин (рис.
30-15).
Ефект спадання інколи називають ефектом Віндкес-
сель, а судини - судинами Віндкессель (від нім. А¥іпс1ке88е1
- еластичний резервуар). Пульсова течія виявляється (не-
з’ясованим шляхом) найпридатнішою для підтримки опти-
мальної функції тканин. Якщо ж перфузія органа відбу-
вається за допомогою помпи, що забезпечує непульсівну
течію, то простежується поступове збільшення судинного
опору та зменшення тканинної перфузії.
ДИНАМІКА КРОВООБІГУ ТА ЛІМФООБІГУ / 537
Рис. 30-14. Графік зміни тиску та швидкості під час протікання
крові через велике коло кровообігу; ЗП - загальна площа
поперечного перерізу судин, яка збільшується від 4,5 см2 у
аорті до 4500 см2у капілярах (див. табл. 30-1); ВО - відносний
опір, який є найбільшим в артеріолах.
Рис. 30-15. Зміни кровоплину під час серцевого циклу в со-
баки. Після діастоли настає систола, починаючи о 0,1 і знову
о 0,5 с. Схема кровоплину у людини така ж; Ао - аорта; ЛА -
легенева артерія; ЛВ - легенева вена; НПВ - нижня порож-
ниста вена; НА - ниркова артерія (відтворено за дозволом з
МіІпог РиїзаііІе ЬІоосІ їіоуу. N ЕпдІ 0 Месі 1972;287:27).
Артеріальний тиск
Тиск у аорті й плечових та інших великих артеріях у
молодої дорослої людини підвищується до максимального
значення близько 120 мм рт. ст. (систолічний тиск) під
час кожного серцевого циклу та знижується до мінімаль-
ного рівня близько 70 мм рт. ст. (діастолічний тиск). Арте-
ріальний тиск звичайно записують у такому вигляді: спо-
чатку систолічний тиск, потім діастолічний. Та оскільки
1 мм рт. ст. дорівнює 0,133 кПа, то в одиницях СІ (див.
додаток) це дорівнює 16,9/9,3 кПа. Пульсовий тиск -
різниця між систолічним та діастолічним тиском - у нормі
становить 50 мм рт. ст. Середній тиск є середнім значен-
ням тиску протягом серцевого циклу. Оскільки систола
коротша від діастоли, то середній тиск дещо нижчий, ніж
середнє значення між систолічним та діастолічним тиском.
Очевидно, що його можна визначити тільки після інте-
грального обчислення ділянки кривої тиску (рис. 30-16).
Однак для наближення середній тиск дорівнює сумі діасто-
лічного тиску і третини пульсового.
Тиск дещо знижується у великих та середніх артеріях,
оскільки їхній опір течії крові є незначним. Проте тиск
різко знижується у дрібних артеріях та артеріолах, які є
головними місцями периферійного опору, що протистоїть
серцевим скороченням. Середній тиск на кінці артеріол -
30-38 мм рт. ст. Пульсовий тиск також швидко знижується
до 5 мм рт. ст. на кінці артеріол (див. рис. 30-14). Значення
знижень тиску вздовж артеріол значно змінюється залежно
від того, розширені вони чи звужені.
Ефект СИЛИ ТЯЖІННЯ
На рис. 30-14 зображено тиск у кровоносних судинах
на рівні серця. Тиск у будь-якій судині, що розміщена нижче
рівня серця, збільшується, а в судинах, розташованих над
рівнем серця, знижується завдяки ефекту сили тяжіння.
Гравітаційні впливи є наслідком густини крові, приско-
рення, зумовленого гравітацією (980 см/с2) та вертикаль-
ною відстанню вище або нижче серця; їхнє значення ста-
новить 0,77 мм рт. ст. на 1 см за густини нормальної крові.
Отже, якщо середній артеріальний тиск у дорослого, який
стоїть, на рівні серця становить 100 мм рт. ст., то середній
тиск у великих артеріях голови (50 см вище серця) -
62 мм рт. ст. (100 - [0,77 х 50]), а тиск у великих артеріях
Систолічний
тиск
Середній тиск
Діастолічний
тиск
і___і____і___і___к
0 12 3 4
Час, с
Рис. 30-16. Крива зміни тиску у плечовій артерії молодої
людини, що відображає співвідношення між систолічним та
діастолічним тиском до середнього тиску. Затінена ділянка
над середнім тиском дорівнює затіненій ділянці нижче серед-
нього тиску.
538 / РОЗДІЛ ЗО
стопи (105 см нижче серця) - 180 мм рт. ст. (100 + [0,77 х
105]) (рис. 30-17). Вплив сили тяжіння на венозний тиск
подібний (див. нижче).
Методи вимірювання тиску крові
У випадку введення канюлі в артерію артеріальний тиск
можна виміряти прямим методом (безпосередньо) за допо-
могою ртутного манометра або відповідно прокаліброва-
ного натягнутого вимірювального пристрою та осцилогра-
фа, пристосованого до прямого записування на папері, що
рухається. Якщо артерію перев’язати над місцем уведення
канюлі, то буде визначено кінцевий тиск. Течія крові в
артерії припиниться, і вся кінетична енергія течії перетво-
риться в енергію тиску. Якщо ж, як альтернативу, Т-подібну
трубку ввести у судину і тиск вимірювати на стороні труб-
ки, то тиск, визначений у цьому разі, буде бічним тиском,
що простежується в умовах, коли зниження тиску завдяки
незначному опору є меншим, ніж кінцевий тиск, зумовле-
ний кінетичною енергією кровоплину. Це можна пояснити
тим, що у трубці або у кровоносній судині загальна енергія
Рис. 30-17. Вплив сили тяжіння на артеріальний та венозний
тиск. На шкалі, розміщеній праворуч, позначено збільшення
(або зменшення) середнього тиску у великій артерії на різних
рівнях Середній тиск у всіх великих артеріях приблизно ста-
новить 100 мм рт. ст., якщо вимірювати на рівні лівого шлуноч-
ка. На шкалі, розміщеній ліворуч, показано підвищення веноз-
ного тиску на кожному рівні, пов’язане із дією ґравітації. Мано-
метр, розміщений ліворуч від фігури, показує висоту, до якої
піднімається стовпчик крові у трубці, якщо він сполучений з
веною на щиколотці (А), зі стегновою веною (В) або з правим
передсердям (С) (людина стоїть). Приблизний тиск у цих
ділянках у лежачому стані, коли щиколотка, стегно та праве
передсердя перебувають на одному рівні, мм рт. ст.: А -
10,0; В-7,5; С-4,6.
- сума кінетичної енергії течії та енергії тиску - є сталою
(принцип Бернуллі).
Важливо зазначити, що зниження тиску у будь-якому
відділі артеріальної системи зумовлене двома факторами
- опору та перетворення (конверсії) потенціальної енергії
у кінетичну. Зниження тиску, пов’язане із втратою енергії
за збільшуваного опору, є незворотним, оскільки енергія
розпорошується як тепло. Проте зниження тиску, пов’язане
з перетворенням потенціальної енергії у кінетичну під час
звуження судини, може бути компенсоване у разі розширен-
ня судини (рис. 30-18).
Принцип Бернуллі має важливе значення у патофізіо-
логії. Згідно з цим принципом, чим більша швидкість течії
крові у судині, тим нижчий латеральний тиск, що розтягує
судинну стінку. Якщо ж судина звужена, то швидкість кро-
воплину в ділянці звуження збільшується і тиск розтяг-
нення знижується. Отже, якщо судина є звуженою завдяки
патологічному процесу, такому як утворення атероскле-
ротичної бляшки, то латеральний тиск зі скороченням зни-
жується і звуження підтримує само себе.
Аускультативний метод
Артеріальний тиск крові у людини зазвичай вимірюють
аускультативним методом. Манжету, приєднану до ртут-
ного манометра (сфігмоманометра), яку надувають повіт-
рям (манжета Ріва-Роччі), обгортають довкола руки, а
стетоскоп розміщують на плечовій артерії в ділянці ліктя
(рис. 30-19). Її швидко надувають до рівня, щоб тиск у ній
значно перевищував систолічний, передбачуваний у пле-
човій артерії. Артерія стиснена манжетою, тому звуку у
стетоскопі нема. Після цього тиск у манжеті поступово
знижують. На рівні, коли систолічний тиск в артерії досягає
тиску в манжеті, струмінь крові проходить під час кожного
серцевого поштовху, і синхронно з цими поштовхами під
манжетою чути ляскаючий звук. Тиск у манжеті, за якого
з’являються перші звуки, відповідає систолічному тиску.
З подальшим зниженням тиску в манжеті, звуки стають
голоснішими, потім тихішими та глухими; зрештою у біль-
шості людей вони зникають. Ці звуки називають звуками
Короткова. У разі одночасного прямого та непрямого ви-
Рис. 30-18. Принцип Бернуллі. Коли рідина проходить через
ділянку звуження у трубці, то кінетична енергія течії збільшу-
ється зі збільшенням швидкості, а потенціальна зменшується.
Внаслідок цього вимірюваний тиск Р є нижчим, ніж він був би
без звуження трубки. Штриховою лінією показано рівень, на
якому перебувала б рідина, якби трубка була одного діаметра.
ДИНАМІКА КРОВООБІГУ ТА ЛІМФООБІГУ / 539
Рис. 30-19. Вимірювання тиску крові аускультативним мето-
дом (відтворено за дозволом з ЗсіюПеїіиз ВА, Зсіюйеііиз О
ТехіЬоок оТРЬузіоІоду, 18Ш есі. МозЬу, 1978).
мірювання тиску крові діастолічний тиск у дорослої лю-
дини в стані спокою найліпше корелює з тиском, за якого
звуки зникають. Однак у дорослих після навантаження та в
дітей діастолічний тиск найліпше корелює з тиском, за яко-
го звуки стають глухими. Це ж характерно для таких станів,
як гіпертиреоїдизм та недостатність аортального клапана.
Звуки Короткова утворюються під час турбулентного
кровоплину в плечовій артерії. Струменева течія у незву-
женій артерії не супроводжується звуками, та якщо артерія
звужується, то швидкість течії через цю ділянку сягає
критичної, і виникає турбулентна течія крові (див. рис.
30-9). Якщо ж тиск у манжеті близький до систолічного,
то течія через артерію відбувається лише на висоті систоли,
у цьому випадку переривчасті турбулентні потоки ство-
рюють ляскаючий звук. Коли тиск у манжеті вищий, ніж
діастолічний тиск в артерії, то течія переривається при-
наймні під час діастоли, і переривчасті звуки нагадують
стакато. Якщо тиск у манжеті наближається до артеріаль-
ного діастолічного тиску, то судина все ще звужена, однак
турбулентна течія триває. Звуки в цей період швидше глухі.
Аускультативний метод є точним, якщо його виконувати
ретельно, проте потрібно дотримуватись декількох вимог.
Манжету треба розміщувати на рівні серця для уникнення
впливу сили тяжіння. Тиск крові можна вимірювати в разі
накладання манжети на стегно і розміщення стетоскопа
на колінній артерії. Та оскільки на стегні є більше тканини
між манжетою й артерією, ніж на руці, то частина тиску
манжети втрачається. Отже, значення тиску, одержані з
використанням манжети на руці, є штучно завищеними.
Подібні явища простежуються під час вимірювання тиску
на плечовій артерії у повних людей, оскільки шар жиру
розсіює частину тиску манжети. В обох випадках точні зна-
чення тиску можна одержати з використанням манжети,
що є ширшою, ніж стандартна манжета для руки. Якщо
залишити манжету надутою на деякий час, то відчуття дис-
комфорту спричинює рефлекторну ґенералізовану вазокон-
стрикцію, підвищуючи тиск крові. Тому варто порівнювати
тиск крові на обох руках, обстежуючи пацієнта вперше.
Стала значна різниця між тисками на обох кінцівках озна-
чає наявність судинної обструкції.
Пальпаторний метод
Систолічний тиск можна визначати шляхом надування
манжети на руці завдяки зниженню тиску, і визначати тиск,
який виявляється при пальпації на променевій артерії. З
огляду на складність точного виявлення першого поштовху
значення тиску, одержане за допомогою пальпаторного
методу, зазвичай на 2-5 мм рт. ст. нижче, ніж з викорис-
танням аускультативного методу.
Варто набути звичку пальпації пульсу на променевій ар-
терії в разі надування манжети під час вимірювання тиску
аускультативним методом. Зі зниженням тиску в манжеті
звуки Короткова іноді зникають за значень, що вищі від
діастолічного тиску, а потім з’являються знову за нижчих
показників (“аускультативний проміжок”). Якщо ж манже-
та спочатку була надута до зникнення пульсу на променевій
артерії, то людина, яка вимірює тиск, може бути впевненою
в тому, що тиск у манжеті є вищим від систолічного, а це
допомагає уникнути штучного заниження тиску.
Нормальний тиск артеріальної крові
Тиск крові на плечовій артерії у молодих дорослих, які
сидять або лежать у стані спокою, становить приблизно
120/70 мм рт. ст. Він є значно нижчим уночі, а також ниж-
чий у жінок, ніж у чоловіків. Оскільки артеріальний тиск є
наслідком серцевого викиду та периферійного опору, то
його змінюють впливи, що стосуються одного або обох
цих факторів. Емоції, наприклад, підвищують серцевий
викид, і може бути досить важко одержати правильні показ-
ники артеріального тиску в стані спокою, якщо людина
збуджена або напружена. Загалом збільшення серцевого
викиду підвищує систолічний тиск, тоді як збільшення
периферійного опору - діастолічний. Є багато супереч-
ностей щодо того, де межа між нормальним та підвищеним
тиском крові (гіпертензія), особливо у людей похилого
віку. Водночас не викликає жодного сумніву те, що у прак-
тично здорових людей систолічний та діастолічний тиск з
віком підвищуються (рис. 30-20). Важливою причиною
підвищення систолічного тиску є зменшення еластичності
артерій; за однакового рівня серцевого викиду систолічний
тиск є вищим у літніх людей, ніж у молодих унаслідок
меншого зменшення об’єму артеріальної системи під час
систоли для компенсації кількості крові, що циркулює.
З огляду на нервове хвилювання під час візиту до лікаря
у 20% хворих з гіпертензією тиск крові є вищим (“гіпер-
тензія білих халатів”), ніж у звичайних умовах. Однак у
решти 80% цього не простежується, проте середній тиск у
великих групах нормальних осіб є однаковим в обох ситу-
аціях (див. рис. 30-20).
ЦИРКУЛЮВАННЯ КРОВІ У КАПІЛЯРАХ
У будь-який час тільки 5% крові, що циркулює, містить-
ся у капілярах, однак ці 5% є в деякому розумінні най-
важливішою частиною об’єму крові, оскільки саме через
540 / РОЗДІЛ ЗО
Денний час
Вік, роки
Рис. 30-20. Тиск крові у чоловіків (темні кружечки) та жінок (світлі кружечки) різного віку. Показники, одержані у медичних
установах, порівнювали зі значеннями, що визначені у денний та нічний час за допомогою постійних записувальних пристроїв.
Зверніть увагу на те, що показники у жінок нижчі, ніж у чоловіків, однак підвищуються після менопаузи. Зазначимо, що показники,
виміряні вночі, є нижчими, а також простежується загальна тенденція до підвищення тиску упродовж життя (дані з О’Вгіеп Е еі
аі: Т\л/еп1у-(оиг їюиг атЬиІаІогу ЬІоосі ргеззиге іп теп апсі мотеп адесі 17 іо 80 уеагз: ТЬе АІІіесі Ігізґі Вапк Зіисіу. З Нурегіепз
1991;9:335).
стінки капілярів кисень та поживні речовини проникають
в інтерстиційну рідину, а вуглекислий газ та продукти мета-
болізму повертаються у кровообіг. Обмін, що відбувається
через капілярну стінку, є життєво важливим для тканин.
Методи дослідження
Важко отримати точні показники тиску крові та течії в
капілярах. Капіляри у брижі експериментальних тварин, а
також у нігтьовому ложі людини доступні для дослідження
під препарувальною лупою. За допомогою цього та інших
методів були спостережені варіанти течії крові в різних
умовах у цих та інших тканинах. Тиск у капілярах визна-
чали шляхом вимірювання зовнішнього тиску, потрібного
для оклюзії капілярів, або тиску, потрібного для того, щоб
фізіологічний розчин почав текти через мікропіпетку, вве-
дену так, що її кінчик входить у артеріолярний кінець
капіляра.
Тиск і течія крові у капілярах
Капілярний тиск може значно змінюватись, проте у
капілярах нігтьового ложа він становить 32 мм рт. ст. на
артеріолярному кінці і 15 мм рт. ст. на венозному. Пульсовий
тиск становить приблизно 5 мм рт. ст. на артеріолярному
кінці і нуль на венозному. Капіляри є короткими, однак кров
рухається повільно (близько 0,07 см/с), оскільки загальна
площа поперечного перерізу капілярного русла велика. Час
проходження крові від артеріолярного до венозного кінця у
капілярі середнього розміру становить 1-2 с.
Рівновага з інтерстиційною рідиною
Як зазначено вище, стінка капіляра є тонкою мембра-
ною, що складається з ендотеліальних клітин. Речовини
проходять через проміжки між ендотеліальними клітинами
та фенестри, якщо вони наявні. Деякі проникають через
клітини шляхом везикулярного транспортування або, у ви-
падку жиророзчинних сполук, через цитоплазму.
Крім того, транспортування через капіляри може відбу-
ватися за допомогою дифузії та фільтрації (див. Розділ 1).
Дифузія кількісно є набагато важливішою щодо часу обмі-
ну поживних речовин та продуктів метаболізму між кров’ю
і тканиною. Концентрація кисню і глюкози є вищою у крові,
ніж в інтерстиційній рідині, тому ці речовини дифундують
в інтерстиційну рідину, тоді як вуглекислий газ рухається
у протилежному напрямі.
Рівень фільтрації у будь-якому місці капіляра залежить
від рівноваги сил, які інколи називають силами Старлінґа
на честь фізіолога, який уперше детально описав цей
механізм. Однією із цих сил є гідростатичний градієнт (різ-
ниця гідростатичного тиску у капілярі та інтерстиційній
рідині) у цьому місці. Тиск інтерстиційної рідини відмінний
у різних органах; є підтвердження, що у підшкірній тканині
він субатмосферний - близько 2 мм рт. ст. Тиск позитивний
у печінці та нирках, а у мозку становить 6 мм рт. ст. Інша
сила - градієнт осмотичного тиску через стінку капіляра
(різниця колоїдного осмотичного тиску плазми та колоїд-
ного осмотичного тиску інтерстиційної рідини). Цей ком-
понент спрямований досередини.
Отже,
Рух рідини = к[(рс + )- (Р| + пс)],
де к - коефіцієнт капілярної фільтрації; Рс - гідростатичний
тиск у капілярі; Рі - гідростатичний тиск в інтерстиції; лс -
осмотичний тиск у капілярі; п- осмотичний тиск в інтер-
стиції.
ДИНАМІКА КРОВООБІГУ ТА ЛІМФООБІГУ / 541
Зазвичай, л є незначним, тому градієнт осмотичного
тиску (я. - я) переважно дорівнює онкотичному тиску.
Коефіцієнт капілярної фільтрації беруть до уваги, він про-
порційний до проникності капілярної стінки та доступної
площі фільтрації. Співвідношення сил Старлінґа вздовж
типового капіляра м’язів показане на рис. 30-21. Рідина
переходить в інтерстиційний простір на артеріолярному
кінці капіляра, де тиск фільтрації через стінку перевищує
онкотичний тиск, а потрапляє всередину судини на вену-
лярному кінці, де онкотичний тиск перевищує тиск фільт-
рації. В інших капілярах баланс між силами Старлінґа може
бути іншим. Наприклад, рідина рухається із судини прак-
тично уздовж капілярів нефрону нирки, водночас перехо-
дить всередину до капілярів практично по всій їхній дов-
жині у кишці.
Важливо зазначити, що кількість невеликих молекул у
просвіті й тканині часто врівноважена на артеріолярному
кінці капіляра. В такій ситуації загальна дифузія може бути
збільшеною внаслідок збільшення течії крові; тобто обмін
є залежним від плину (рис. 30-22). І навпаки, проходження
речовин, що не перебуває у рівновазі між капіляром та
інтерстицієм, називають залежним від дифузії.
З’ясовано, що близько 24 л рідини капіляри фільтрують
кожного дня. Це становить близько 0,3% серцевого викиду.
Майже 85% профільтрованої крові реабсорбується у капі-
ляри, а решта надходить у кров’яне русло через лімфатичну
систему.
Активні та неактивні капіляри
У тканинах, що перебувають у стані спокою, більшість
капілярів є колапсованими, і кров переважно тече через
сполучні судини з артеріол у венули. В активних тканинах
метартеріоли та прекапілярні сфінктери розширюються.
Внутрішньокапілярний тиск підвищується внаслідок пере-
вищення критичного тиску закриття судин, і кров тече крізь
усі капіляри. Розслаблення гладких м’язів метартеріол та
прекапілярних сфінктерів пов’язане із впливом вазодила-
таторних речовин, що утворюються в тканинах у стані
Артеріола Венула
Інтерстиційний
простір
Онкотичний Р = 25
Інтерстиційний Р = 1
Рис. 30-21. Схематичне зображення ґрадієнта тиску через
стінку капіляра м’яза. Числа на артеріо- та венулярному кінцях
капіляра відповідають гідростатичному тиску (мм рт. ст.) у
цьому місці. Стрілками позначено приблизну кількість та
напрям руху рідини. В цьому прикладі різниця тиску на арте-
ріолярному кінці капіляра становить 11 мм рт. ст. ([37-1 ]-25)
назовні; а на протилежному - 9 мм рт. ст. (25-[17-1]) усе-
редину.
Рис. 30-22. Обмін через капілярну стінку у разі зміни течії та
дифузії. А і В означають артеріолярний та венозний кінці капі-
ляра. Речовину X у крові врівноважує її вміст у тканині (рух у
тканину дорівнює руху в протилежному напрямі) перед вихо-
дом крові з капіляра, тоді як речовина ¥ не зрівноважена. У
разі сталих інших факторів кількість X, що проникає у тканину,
може збільшуватися лише за умови посилення течії крові,
тобто вона зумовлена течією. Рух ¥ залежить від дифузії.
активності (див. Розділ 31). Можливо, також зменшується
активність симпатичних і вазоконстрикторних нервів, що
іннервують гладкі м’язи.
Після патологічного стимулювання внаслідок аксон-
рефлексу виділяється речовина Р (див. Розділ 32), яка
підвищує проникність капілярів. Брадикінін і гістамін
також збільшують проникність цих судин. Якщо капіляри
подразнювати механічно, то вони стають порожніми (біла
реакція; див. Розділ 32), однак це, ймовірно, пов’язане зі
скороченням прекапілярних сфінктерів.
ЦИРКУЛЮВАННЯ ЛІМФИ ТА ОБ’ЄМ
ІНТЕРСТИЦІЙНОЇ РІДИНИ
Циркулювання лімфи
Вихід рідини в нормі перевищує її зворотний притік
через стінку капіляра, проте надлишок рідини потрапляє
у лімфатичні судини і дренує через них у кров. Це дає змогу
запобігти підвищенню тиску інтерстиційної рідини та
забезпечує обмін тканинної рідини. В нормі протягом
24 год об’єм лімфоплину становить 2-4 л. Склад лімфи
описано у Розділі 27.
Лімфатичні судини можна розділити на два види: лім-
фатичні капіляри та лімфатичні судини-колектори (рис. 30-
23). У лімфатичних капілярах нема клапанів та гладких
м’язів у стінках, ці капіляри простежуються в таких ділян-
ках, як тонка кишка та скелетні м’язи. Тканинна рідина
проникає всередину капілярів через нещільні контакти між
ендотеліальними клітинами, що формують їхні стінки.
Рідина у капілярах рухається завдяки м’язовим скорочен-
ням органа та скороченню артеріол і венул, що часто
розміщені поряд. Капіляри впадають у лімфатичні судини-
колектори, які містять клапани та гладкі м’язи у стінках і
скорочуються перистальтично, проштовхуючи лімфу по
судинах. Течія лімфи у таких судинах посилюється завдяки
542 / РОЗДІЛ ЗО
Рис. 30-23. Лімфатичні капіляри дренують у збірні лімфатичні
судини брижі. Зверніть увагу на тісний взаємозв’язок з арка-
дами артеріол, позначених чорною лінією (відтворено за до-
зволом з 8сІітісІ-8сїюпЬеіп <3\Л/, 2еИасК В\Л/: РІиісІ ритр
тесіїапізтв іп іпіііаі Іутрґіаіісз. Ме\л/з РІіузіоІ 8сі 1994;9:67).
рухам скелетних м’язів, від’ємного внутрішньоторакаль-
ного тиску під час вдихання та ефекту зменшення “від-
смоктування” високої швидкості течії крові у венах, де
закінчуються лімфатичні судини. Однак скорочення все ж
є головним фактором, що забезпечує течію лімфи.
Сполуки, що посилюють лімфообіг, називають лімфо-
гогами. Вони охоплюють багато посередників, що збіль-
шують проникність капілярної стінки. Речовини, що спри-
чинюють скорочення гладких м’язів, теж посилюють течію
лімфи з тонкої кишки.
Інші функції лімфатичної системи
Значна кількість білків надходить в інтерстиційну ріди-
ну у печінці й тонкій кишці, і менша кількість виходить з
крові в інших тканинах. Макромолекули проникають у лім-
фатичні судини переважно через проміжки між ендоте-
ліальними клітинами, а білки потрапляють у кровоплин
через лімфатичні судини. Кількість білків, що переходить
таким шляхом за один день, дорівнює 25-50% від загальної
кількості білків плазми, що циркулює. Транспортування
абсорбованих довголанцюгових жирних кислот та холес-
теролу з тонкої кишки через лімфатичні судини описано у
Розділі 25.
Об’єм інтерстиційної рідини
Кількість рідини в інтерстиційному просторі залежить
від тиску у капілярі, тиску інтерстиційної рідини, онко-
тичного тиску, капілярного коефіцієнта фільтрації, кіль-
кості активних капілярів, течії лімфи та загального об’єму
ПКР. Співвідношення між прекапілярним та посткапі-
лярним венулярним опором теж має важливе значення.
Прекапілярна констрикція знижує тиск фільтрації, тоді як
посткапілярна підвищує його. Зміни будь-якого із цих
значень призводять до змін об’єму інтерстиційної рідини.
Фактори, що сприяють збільшенню цього об’єму, наведені
у табл. 30-5. Набряк - це нагромадження інтерстиційної
рідини у надмірній кількості.
В активних тканинах тиск у капілярах підвищується,
часто настільки, що перевищує онкотичний тиск уздовж
капіляра. Крім того, осмотично активні метаболіти інколи
тимчасово нагромаджуються в інтерстиційній рідині, ос-
кільки вони не можуть вимиватися з такою ж швидкістю,
з якою утворюються. Внаслідок їхнього скупчення поси-
люється осмотичний ефект, що призводить до зменшення
осмотичного градієнта завдяки онкотичному тиску. Тому
кількість рідини, що виходить з капілярів, значно збіль-
шується, а кількість рідини, що надходить у кров, змен-
шується. Лімфоплин збільшується завдяки зниженню рівня
акумуляції рідини, проте, наприклад, у м’язах під час наван-
таження об’єм все одно збільшується на 25%.
Інтерстиційна рідина нагромаджується переважно у
відповідних частинах завдяки дії гравітації. У вертикаль-
ному стані капіляри ніг захищені від високого артеріаль-
ного тиску артеріолами, однак високий венозний тиск
поширюється на них через венули. Скорочення скелетних
м’язів підтримує венозний тиск низьким завдяки помпу-
ванню крові в напрямі до серця (див. нижче), якщо людина
рухається. Однак якщо стояти протягом тривалого часу,
то рідина нагромаджується і розвивається набряк. Набряк
щиколоток простежується також під час тривалих подоро-
жей, коли мандрівники упродовж багатьох годин сидять,
тримаючи ступні у вимушеному положенні. Венозна
обструкція може в таких ситуаціях сприяти розвитку
набряку.
Якого б походження не була затримка солі в організмі,
вона завжди супроводжується затримкою води. Сіль та
рідина розподіляються у позаклітинній рідині, отже, об’єм
інтерстиційної рідини збільшується, що створює перед-
умови для розвитку набряку. Сіль та затримка води є фак-
торами розвитку набряку в разі серцевої недостатності,
нефрозів та цирозу. Однак є й інші механізми, що впли-
Таблиця 30-5. Причини збільшення об’єму інтерстиційної
рідини та набряку
Підвищений тиск фільтрації
Дилятація артеріол
Констрикція венул
Підвишений венозний тиск (серцева недостатність,
недостатність клапанів, венозна обструкція, підви-
щення загального об’єму ПКР, вплив Гравітації тощо)
Зменшення ґрадієнта осмотичного тиску через стінку
капіляра
Зниження рівня білків плазми
Нагромадження осмотично активних речовин у
інтерстиційному просторі
Підвищена проникність капілярів
Речовина Р
Гістамін і споріднені речовини
Кініни тощо
Неадекватний лімфообіг
ДИНАМІКА КРОВООБІГУ ТА ЛІМФООБІГУ / 543
вають на рух рідини через стінку капілярів у випадку цих
захворювань.
У разі застійної серцевої недостатності, наприклад,
здебільшого підвищується венозний тиск, що спричинює
підвищення тиску капілярного. Унаслідок цирозу печінки
знижується онкотичний тиск, оскільки пригнічений синтез
білків у печінці; у випадку нефрозу онкотичний тиск зни-
жується внаслідок того, що значна кількість білків вихо-
дить із сечею.
Ще однією причиною набряків є неадекватний лім-
фатичний дренаж. Набряк, зумовлений лімфатичною
обструкцією, називають лімфедемою. Набрякова рідина
в цьому разі містить значну кількість білків. Тривала лім-
федема призводить до хронічного запалення та фіброзу
сполучної тканини. Одна з причин лімфедеми - радикальна
мастектомія. Цю операцію роблять у разі ракової пухлини
молочної залози, вона передбачає видалення пахвових
лімфатичних вузлів з одного боку, тому спричинює пригні-
чення відтоку лімфи. У 10-30% хворих простежу* І вся
набряк руки з боку видалених лімфатичних вузлів. У ра й
філяріатозу паразитні гельмінти мігрують у лімфатичні су-
дини і спричинюють їхню обструкцію. Накопичення ріди-
ни і реакція тканин призводять до вираженого набряку, зде-
більшого ніг або калитки (слоновість). Вираженість змін
найяскравіше відображає приклад хворого зі слоновістю,
у якого був настільки сильний набряк калитки, що він зму-
шений був класти її на тачку і возити під час ходіння.
Цікавий і ефективний метод лікування лімфедеми -
застосування бензопіронів. Ці препарати посилюють про-
теоліз тканинними макрофагами. Зменшення вмісту білків
у набряковій рідині сприяє послабленню запальної реакції
і реабсорбції рідини.
КРОВООБІГУ ВЕНАХ
Кров рухається по кровоносних судинах, у тім числі
венах, передусім завдяки нагнітальній функції серця. Однак
плину крові по венах сприяють серцеві скорочення, під-
вищення негативного внутрішньоплеврального тиску під
час кожного вдихання, а також скорочення скелетних
м’язів, які стискають вени (м’язова помпа).
Венозний тиск і плин
Тиск у венулах становить 12-18 мм рт. ст. Зі збільшен-
ням калібру вен він знижується, досягаючи 5,5 мм рт. ст. у
великих венах за межами грудної порожнини. Тиск у вели-
ких венах у місцях їхнього впадіння у праве передсердя
(центральний венозний тиск) становить у середньому
4,6 мм рт. ст., однак він змінюється залежно від дихального
циклу і роботи серця.
Периферійний венозний тиск, як і артеріальний, зале-
жить від сил гравітації. Він підвищується на 0,77 мм рт. ст.
з кожним сантиметром нижче правого передсердя і знижу-
ється приблизно так само з кожним сантиметром вище
(див. рис. 30-17).
Кров з венул надходить у великі вени, де швидкість її
плину збільшується внаслідок зменшення загального по-
перечного перерізу судин. У великих венах швидкість у чо-
тири рази менша, ніж в аорті і становить близько 10 см/с.
Торакаяьна помпа
Під час вдихання внутрішньоплевральний тиск зни-
жується з -2,5 до -6 мм рт. ст. Цей негативний тиск
передається на великі вени і менше - на передсердя. Отже,
центральний венозний тиск коливається від 6 мм рт. ст.
протягом видихання до приблизно 2 мм рт. ст. протягом
спокійного вдихання. Зниження венозного тиску протягом
вдихання сприяє венозному поверненню крові. Під час вди-
хання діафрагма опускається, внутрішньочеревний тиск
підвищується, що теж сприяє надходженню крові до серця,
оскільки зворотному плину крові у вени нижніх кінцівок
запобігають венозні клапани.
Вплив серцевого скорочення
Зміни тиску у передсердях передаються на великі вени,
спричинюючи а, с та V хвилі кривої венозного пульсу (див.
Розділ 29). Тиск у передсердях різко знижується протягом
фази викидання шлуночкової систоли, оскільки атріовен-
трикуляні клапани відтягуються донизу, а це зумовлює
збільшення ємності передсердь. Унаслідок цього кров
“засмоктується” з великих вен до передсердь. Такий процес
сприяє венозному поверненню, особливо в разі високої
частоти серцевих скорочень.
З наближенням до серця венозний плин крові стає
пульсівний. За низької частоти серцевих скорочень фік-
сують два періоди максимального плину: один протягом
систоли шлуночків унаслідок відтягування донизу антріо-
вентрикулярних клапанів, а інший - на початку діастоли
протягом періоду швидкого наповнення шлуночків (див.
рис. 30-15).
М’язова помпа
На кінцівках вени оточені скелетними м’язами; скоро-
чення цих м’язів під час фізичної роботи зумовлює стис-
кання вен. Пульсація розташованих поблизу артерій теж
може стискати вени. Оскільки венозні клапани запобігають
зворотному плину, то кров рухається в напрямі до серця.
Коли людина стоїть, то повністю виявляється дія гравітації,
і венозний тиск у литці становить 85-90 мм рт. ст. (див.
рис. 30-17). Депонування крові у нижніх кінцівках спри-
чинює зменшення венозного повернення та серцевого
викиду, що деколи призводить до непритомності. Ритмічні
скорочення м’язів нижніх кінцівок, якщо людина стоїть,
сприяють проштовхуванню крові в напрямі до серця і
зумовлюють зменшення венозного тиску в нижніх кінців-
ках до ЗО мм рт. ст. і менше. Цей рух крові в напрямі до
серця послаблений у хворих з варикозним розширенням
вен, оскільки їхні клапани стають неповноцінними. Однак
навіть за неповноцінності клапанів рух крові до серця
забезпечують м’язові скорочення. Це пояснюється тим, що
опір великих вен, локалізованих ближче до серця, менший,
ніж опір дрібніших судин, розміщених на відстані від
серця.
Венозний тиск у голові
У вертикальному стані венозний тиск у ділянках тіла,
розміщених вище серця, знижується під впливом гравіта-
ційної сили. Вени шиї спадаються вище від рівня, де
венозний тиск близький до нуля. Тиск по всій довжині сег-
ментів, які спалися, близький до нуля, однак не нижче
544 / РОЗДІЛ ЗО
атмосферного. Пазухи твердої оболонки мають ригідні
стінки і не можуть спадатися, тому тиск у них під час
сидіння або стояння нижчий від атмосферного. Значення
негативного тиску прямо пропорційне значенню верти-
кальної відстані вище від вершини вен шиї, які спалися, і
у верхній сагітальній пазусі становить 10 мм рт. ст. Під
час нейрохірургічних операцій хворий деколи сидить.
Якщо протягом такої процедури один із синусів відкритий,
то в нього може всмоктуватись повітря, що призводить до
розвитку повітряної емболії.
Повітряна емболія
Оскільки, на відміну від рідини, повітря стискається,
то його наявність у кровообігу може мати небажані наслід-
ки. Рух крові вперед, як відомо, залежить від властивості
крові не стискатися. Значна кількість повітря, що виповнює
серце, зумовлює припинення кровообігу і призводить до
раптової смерті. Це пояснюють тим, що під час скорочення
шлуночків повітря не проштовхується в артерії, а стиска-
ється. Незначна його кількість із серця потрапляє в судини,
однак пухирці повітря спричинюють закупорення дрібних
кровоносних судин, сприяють значному збільшенню опору
плину крові, внаслідок чого течія сповільнюється або
припиняється. Закупорення дрібних судин головного мозку
призводить до важких і навіть летальних неврологічних
розладів. Лікувальний ефект у цьому разі може забезпе-
чувати гіпербарична оксигенація (див. Розділ 37), оскільки
під дією тиску зменшуються розміри газових емболів.
Кількість повітря, яка спричинює смертельну повітряну
емболію у лабораторних тварин, залежить, зокрема, від
швидкості його надходження у вени. В деяких випадках
навіть 100 мл не зумовлюють небажаних ефектів, тоді як
деколи лише 5 мл можуть спричинити смерть.
Вимірювання венозного тиску
Центральний венозний тиск можна виміряти, поміс-
тивши катетер у великі вени грудної порожнини. Перифе-
рійний венозний тиск здебільшого корелює із централь-
ним венозним.
Для вимірювання периферійного венозного тиску у
вену плеча вводять голку, сполучену з манометром, який
містить стерильний ізотонічний розчин. Периферійна ве-
на повинна бути на рівні правого передсердя (10 см, або
половина діаметра грудної клітки від спини в положенні
лежачи на спині). Значення, отримані в міліметрах ізото-
нічного розчину, можна перевести в міліметри ртутного
стовпчика, розділивши їх на 13,6 (густина ртуті). Значен-
ня, на яке периферійний венозний тиск перевищує цент-
ральний венозний, збільшується зі збільшенням відстані
від серця до вен. Середній тиск у передній ліктьовій вені
в нормі становить 7,1 мм рт. ст., середній тиск у цент-
ральних венах - 4,6 мм рт. ст.
Дуже точно виміряти центральний венозний тиск можна
без будь-якого обладнання, якщо визначити ступінь розтя-
гування зовнішніх яремних вен у положенні лежачи з голо-
вою, дещо припіднятою вище серця. Вертикальна відстань
між правим передсердям і місцем спадання вен (місцем,
де тиск дорівнює нулю) є венозним тиском, який виража-
ють у міліметрах крові.
Центральний венозний тиск знижується під дією нега-
тивного інтраторакального тиску і в разі шоку. Він підви-
щується під впливом позитивного інтраторакального тис-
ку, навантаження, збільшення об’єму крові, що циркулює,
і серцевої недостатності. У разі вираженої серцевої недос-
татності або обструкції верхньої порожнистої вени тиск
у передній ліктьовій вені може досягати 20 мм рт. ст. і
вище.
Регулювання серцево-судинної
системи
31
ВСТУП
У людей та ссавців розвинуті численні механізми регу-
лювання серцево-судинної системи, які поліпшують крово-
постачання активних тканин і збільшують або зменшують
тепловіддачу шляхом перерозподілу крові. У разі пато-
логічних станів, наприклад, під час кровотечі, регулю-
вальні механізми підтримують кровообіг у серці і голов-
ному мозку. За особливо загрозливих станів плин крові до
життєво важливих органів забезпечений завдяки іншим
тканинам.
Корекція кровообігу відбувається за допомогою зміни
хвилинного об’єму, зміни діаметра судин опору (передусім
артеріол) або кількості крові, депонованої у ємнісних суди-
нах (венах). Регулювання хвилинного об’єму описане в
Розділі 29. Діаметр артеріол змінюється частково шляхом
авторегулювання (саморегулювання). У тканинах з висо-
кою активністю діаметр артеріол збільшується під впливом
судинорозширювальних речовин, які там утворюються; а
змінюється під дією речовин, що їх виробляє ендотелій.
Системне регулювання забезпечують вазоактивні речо-
вини, що циркулюють у крові, і нерви, що іннервують арте-
ріоли. Діаметр ємнісних судин також змінюється від впли-
вом вазоактивних речовин крові і вазомоторних нервів.
Системні механізми разом із місцевими забезпечують регу-
лювання кровообігу в усьому організмі.
Зазвичай у випадку використання термінів вазоконст-
рикція і вазодилатація мають на увазі звуження і розши-
рення резистивних судин. Зміни діаметра вен називають
веноконстрикцією і венодилатацією.
МІСЦЕВІ РЕГУЛЯТОРНІ МЕХАНІЗМИ
Авторегулювання
Здатність тканин регулювати власний кровообіг нази-
вають авторегулюванням. Більшість судинних лож має
внутрішню здатність до компенсації помірних змін пер-
фузійного тиску завдяки зміні опору судин. Отже, плин
крові є порівняно сталим. Здатність до авторегулювання
добре виражена в нирках (див. Розділ 38). Вона притаман-
на також очеревині, скелетним м’язам, головному мозку,
36 367’2
печінці та міокарду. Ймовірно, авторегулювання відбу-
вається частково завдяки внутрішній скоротливій відпо-
віді гладких м’язів на розтягнення (міогенна теорія авто-
регулювання). З підвищенням тиску судини розтягу-
ються, а гладком’язові волокна скорочуються. Якщо прий-
няти, що м’язи реагують на напруження судинної стінки,
то можна пояснити, чому скорочення посилюється з під-
вищенням тиску. Напруження стінки прямо пропорційне
до добутку трансмурального тиску і радіуса судин (закон
Лапласа; див. Розділ ЗО). Тому, щоб підтримувати задане
напруження стінки за підвищення тиску, потрібно змен-
шувати радіус. В активних тканинах накопичуються суди-
норозширювальні речовини, що теж сприяють авторегу-
люванню (метаболічна теорія авторегулювання). Зі
зменшенням плину крові нагромадження цих речовин
веде до розширення судин. У разі посилення кровообігу
ці речовини вимиваються.
Судинорозширювальні метаболіти
До метаболічних змін, що спричинюють розширення
судин, у більшості тканин належать зменшення парціаль-
ного тиску О9 і рН крові. Ці зміни зумовлюють розслаб-
лення артеріол і прекапілярних сфінктерів. Збільшення
тиску СО2 й осмолярності також сприяє вазодилатації.
Пряма судинорозширювальна дія СО9 найбільше виражена
у шкірі і головному мозку. Опосередковані нервовою сис-
темою судинозвужувальні реакції на системну гіпоксію і
гіперкапнію (протилежні до реакцій на локальну гіпоксію
і гіперкапнію) описані нижче. Підвищення температури
зумовлює прямий судинорозширювальний ефект. У тка-
нинах з високою активністю підвищення температури
(завдяки теплу, утвореному під час метаболізму) теж може
сприяти розширенню судин. Ще одна речовина, яка нако-
пичується локально і відіграє роль у розширенні судин
скелетних м’язів, - це К+. Лактат теж може сприяти розши-
ренню судин. В ушкоджених тканинах гістамін, що його
виділяють уражені клітини, підвищує проникність капі-
лярів. Очевидно гістамін веде до розширення судин і появи
набряку в ділянках запалення. Аденозин має судинороз-
ширювальну дію в серцевому м’язі, однак не спричинює
цього ефекту в скелетних м’язах. Аденозин, крім цього,
пригнічує виділення норадреналіну.
546 / РОЗДІЛ 31
Місцеве звуження судин
Артерії й артеріоли інтенсивно скорочуються в разі
ушкодження. Одна з причин вазоконстрикції - місцеве
виділення серотоніну з тромбоцитів, які прилипають до
судинної стінки в місці її ушкодження (див. Розділ 27). Ура-
жені вени теж звужуються. Зі зниженням температури
тканин судини звужуються, і ця місцева реакція на холод
відіграє важливу роль у терморегулюванні.
РЕЧОВИНИ, ЯКІ ВИДІЛЯЄ ЕНДОТЕЛІЙ
Ендотеліальні клітини
Як зазначено в Розділі ЗО, ендотеліальні клітини утво-
рюють систему, що має дуже важливе значення. Ці клітини
виділяють багато факторів росту і вазоактивних речовин.
До вазоактивних сполук належать простагландини і тром-
боксани, оксид азоту, а також ендотеліни.
Простациклін і тромбоксан А2
Простациклін виробляють ендотеліальні клітини, а
тромбоксан А2 - тромбоцити. Обидві речовини утворю-
ються з арахідонової кислоти за участю циклооксигенази
(див. рис. 17-33). Тромбоксан А2 спричинює агрегацію
тромбоцитів і звуження судин, тоді як простациклін при-
гнічує агрегацію тромбоцитів і зумовлює розширення
судин. За допомогою тромбоксану А2 і простацикліну
забезпечена локальна агрегація тромбоцитів з подальшим
тромбоутворенням (див. Розділ 27), що дає змогу запобігти
надмірному системному тромбоутворенню, а також під-
тримувати кровообіг у прилеглих ділянках.
Баланс між тромбоксаном А2 і простацикліном може
зсуватися в бік простацикліну у разі введення малих доз
аспірину, оскільки аспірин спричинює незворотне пригні-
чення циклооксигенази, ацетилюючи залишок серину в
активному центрі ензиму. Унаслідок цього зменшується
продукування і тромбоксану, і простацикліну. Однак через
декілька годин ендотеліальні клітини синтезують нову цик-
лооксигеназу. В тромбоцитах синтез ензиму є неможли-
вим, і концентрація циклооксигенази в тромбоцитах під-
вищується лише з появою нових тромбоцитів. Цей процес
є повільним, оскільки період півжиття тромбоцитів ста-
новить близько чотирьох діб. Отже, тривале застосування
малих доз аспірину пригнічує процес тромбоутворення і
рекомендоване з метою профілактики інфаркту міокарда,
нападів нестабільної стенокардії, тимчасових ішемічних
розладів, інсульту.
Ендотеліальнорозширювальний фактор
Близько 20 років тому з’ясовано, що ендотелій відіграє
важливу роль у розширенні судин. Під впливом багатьох
факторів ендотеліальні клітини можуть виробляти ендоте-
ліальнорозширювальний фактор (ЕРФ) - речовину, що є
оксидом азоту (N0). N0 синтезується з аргініну (рис. 31-
1) в процесі реакції, каталізованої оксид азоту-синтазою
(ЬЮ-синтазою, N08 - від англ. N0 зупіЬазе). Виявлено
три ізоформи N08: N08 1 у нервовій системі; N08 2 у
макрофагах та інших імунокомпетентних клітинах; N08
З в ендотеліальних клітинах. N08 1 і N08 3 активовані
під дією факторів, що підвищують внутрішньоклітинну
Рис. 31-1. Синтез N0 з аргініну в ендотеліальних клітинах і
його дія, опосередкована стимулюванням розчинної гуанілат-
циклази та утворенням цГМФ, спрямована на розслаблення
гладком’язових клітин судин. Активування ендотеліальної
форми оксид азоту-синтази (N08) відбувається зі збіль-
шенням внутрішньоклітинної концентрації Са2+, яке може бути
спричинене дією на клітинну мембрану ацетилхоліну (Ах),
брадикініну або стресу зрізання. Роль кофакторів відіграють
тетрагідробіоптерин, ФАД і ФМН.
концентрацію Са2, у тім числі судинорозширювальних
речовин ацетилхоліну і брадикініну. N08 імунокомпетент-
них клітин активована не Са2‘, а цитокінами. Утворений
ендотелієм N0 дифундує у гладком’язові клітини, де акти-
вує розчинну гуанілатциклазу і спричинює утворення
цГМФ (див. рис. 31-1), який, відповідно, зумовлює роз-
слаблення гладких м’язів судин. Інактивування N0 забез-
печує гемоглобін.
Аденозин, А№ і гістамін діють на Н2-рецептори і спри-
чинюють розслаблення гладких м’язів судин, незалежне
від ендотелію. Однак дія ацетилхоліну, брадикініну, ВІП,
речовини Р і деяких інших поліпептидів опосередкована
ендотелієм. Різноманітні судинозвужувальні речовини, які
діють прямо на гладкі м’язи судин, спричиняли б ще більшу
вазоконстрикцію, якби вони одночасно не стимулювали
виділення N0. У випадку раптового поліпшення тканин-
ного кровообігу внаслідок розширення артеріол великі
артерії, що підходять до тканини, теж розширюються. Таке
розширення судин, зумовлене поліпшенням кровообігу,
відбувається також унаслідок локального утворення N0.
Речовини, що утворюються під час агрегації тромбоцитів,
також спричинюють виділення N0. Зумовлена N0 вазо-
дилатація сприяє підтримці кровообігу в судинах зі збере-
женим ендотелієм. Навпаки, в разі ушкодження ендотелію
відбувається агрегація тромбоцитів і звуження судин (див.
Розділ 27).
Іншим підтвердженням фізіологічної ролі N0 було вияв-
лення того факту, що введення похідних аргініну, які при-
гнічують NО-синтазу, лабораторним тваринам зумовлює
короткочасне підвищення тиску крові. Це свідчить про те,
що виділення N0 є необхідним для підтримки нормального
тиску крові.
РЕГУЛЮВАННЯ СЕРЦЕВО-СУДИННОЇ СИСТЕМИ / 547
Крім того, N0 бере участь у перебудові судин та ангіо-
генезі і відіграє роль у патогенезі атеросклерозу. Щодо
цього цікаво, що у деяких хворих після пересаджування
серця розвивається прогресуюча форма атеросклерозу
судин трансплантата. Вважають, що це пов’язано з ушкод-
женням ендотелію.
Нітрогліцерин та інші нітровазодилататори, які широко
використовують у разі стенокардії, стимулюють гуанілат-
циклазу подібно до N0.
Доведено, що ерекція прутня теж зумовлена виділенням
N0, яке веде до розширення судин і набухання печеристих
тіл (див. Розділ 23).
Інші ефекти N0
Уже стало правилом, що спочатку виявляють речовину,
яка відіграє важливу роль у регулюванні серцево-судинної
системи, а потім з’ясовують, що синтез її відбувається в
інших системах, і вона виконує інші функції. Так було,
наприклад, з ангіотензином II (див. Розділ 24) та ендоте-
лінами (див. нижче). Це ж сталося і з N0. Оксид азоту міс-
титься у головному мозку і, діючи через цГМФ, відіграє
важливу роль у його діяльності (див. Розділ 4). Він необ-
хідний для цитотоксичної активності макрофагів, зокрема
їхньої здатності спричиняти загибель пухлинних клітин.
У шлунково-кишковому тракті N0 є важливим фактором
розслаблення м’язів. Інші функції N0 описані в різних
частинах цієї книги.
Ендотеліни
Ендотеліальні клітини виробляють також ендотелін-1
- одну з найсильніших виділених судинозвужувальних
речовин. Ендотелін-1 (ЕТ-1), ендотелін-2 (ЕТ-2) і ендоте-
лін-3 (ЕТ-3) належать до родини трьох подібних поліпеп-
тидів, що містять 21 амінокислотний залишок (рис. 31-2).
Кожний ендотелій кодований різним геном. Унікальна
структура ендотелінів нагадує будову сарафотоксинів, полі-
пептидів, що містяться в отруті кобри.
Ендотелін-1
В ендотеліальних клітинах спочатку внаслідок пост-
трансляційної модифікації утворюється прогормон, який
містить 39 амінокислотних залишків - великий ендотелін-
1. Його активність становить близько 1% від активності
ендотеліну-1. Далі за допомогою ендотеліноперетворю-
вального ензиму відбувається розрив зв’язку Тгр-Уаі з
утворенням ендотеліну-1. Є родина ендотеліноперетворю-
вальних ензимів, яка забезпечує розрив великого ендо-
теліну-1, великого ендотеліну-2 і великого ендотеліну-3.
У незначній кількості великий ендотелін-1 і ендотелін-1
надходять у кров, проте головно вони виділяються у серед-
ню оболонку кровоносних судин і діють як паракринні
речовини.
Клоновано два різні види ендотелінових рецепторів,
обидва зв’язані з 6-білками і діють через фосфоліпазу С
(див. Розділ 1). Рецептори ЕТД, які є специфічними до
ендотеліну-1, містяться у багатьох тканинах і беруть участь
у звуженні судин, спричиненому ендотеліном-1. Рецептори
ЕТВ зв’язуються з трьома видами ендотелінів і зв’язані з
6]-білком. Вони беруть участь у розширенні судин і опосе-
редковують вплив ендотелінів (див. нижче).
Рис. 31-2. Будова ендотелінів людини й одного з сарафо-
токсинів зміїної отрути. Кольором позначено амінокислотні
залишки, які відрізняються в ендотеліну-1.
Регулювання секреції
Ендотелін-1 не накопичується у секреторних гранулах,
і більшість регулювальних факторів впливає на транскрип-
цію його гена, відразу після чого змінюється рівень його
секреції. Фактори, що активують і пригнічують транскрип-
цію гена, наведені в табл. 31-1.
Вплив на серцево-судинну систему
Як зазначено вище, ендотелін-1 передусім є місцевим
паракринним регулятором судинного тонусу. Великий
ендотелін-1 і ендотелін-1 містяться в кровообігу. Однак
їхня концентрація не підвищується в разі гіпертензії. У
мишей з нокаутом однієї алелі гена ендотеліну-1 більше
виражена тенденція до підвищення тиску крові, ніж до його
зниження. Концентрація ендотеліну-1, що циркулює в
крові, підвищується у випадку застійної серцевої недост-
атності і після інфаркту міокарда. Отже, ендотелін-1 віді-
грає роль у патогенезі цих захворювань.
Інші ефекти ендотелінів
Крім того, що ендотелін-1 міститься в ендотеліальних
клітинах, його виявляють також у головному мозку і нир-
ках. Ендотелін-2 утворюється головно в нервах і кишці.
Ендотелін-3 міститься в крові й у високій концентрації в
548 / РОЗДІЛ 31
Таблиця 31-1. Регулювання секреції ендотеліну-1 на рівні
транскрипції його гена
Стимулятори
Ангіотензин II
Катехоламіни
Фактори росту
Гіпоксія
Інсулін
Окиснені ЛПНЩ
ЛПВЩ
Стрес зрізання
Тромбін
Інгібітори
N0
АИР
ПГЕ2
Простациклін
головному мозку. Його виявляють також у нирках і шлун-
ково-кишковому тракті. Ефекти, наведені в табл. 31-2,
свідчать про роль ендотелінів у різних тканинах. У голов-
ному мозку ендотеліни є у великій кількості, і на початку
життя їх виробляють як астроцити, так і нейрони. їх вияв-
ляють у вузлах чутливих корінців, клітинах передніх рогів,
корі головного мозку, гіпоталамусі та клітинах Пуркіньє в
мозочку. Вони також беруть участь у регулюванні транс-
портування через гематоенцефалічний бар’єр. Ендотелі-
нові рецептори є в мезангіальних клітинах (див. Розділ 38).
Уважають, що поліпептид, діючи на мезангіальні клітини,
знижує рівень клубочкової фільтрації.
У мишей, які не мають двох алелей гена ендотеліну-1,
простежуються важкі черепно-лицеві вади, тварини вми-
рають під час народження внаслідок дихальної недостат-
ності. У них виявляють також мегаколон (хворобу Гірш-
прунґа), очевидно, тому, що клітини, які в нормі утворюють
сплетення м’язової оболонки кишки, не здатні мігрувати
до дистального відділу кишки. Крім того, ендотеліни віді-
грають роль у закритті артеріальної протоки на момент
народження.
СИСТЕМНЕ РЕГУЛЮВАННЯ
ЗА ДОПОМОГОЮ ГОРМОНІВ
Багато гормонів, що циркулюють у крові, діють на
судинну систему. До судинорозширювальних гормонів
належать кініни, ВІП і АКР. Гормони, що сприяють зву-
женню судин, - це вазопресин, норадреналін, адреналін і
ангіотензин II.
Кініни
В організмі містяться два споріднені пептиди, які нази-
вають кініками. Один із них - нонапептид брадикінін,
інший - декапептид лізилбрадикінін, відомий також як
калідин (рис. 31-3). Лізилбрадикінін під дією амінопеп-
тидази може перетворюватися на брадикінін. Обидва пеп-
тиди за участю кінінази І (карбоксипептидази, яка відщеп-
лює С-кінцеві залишки Аг§) метаболізують з утворенням
неактивних фрагментів. Крім того, дипептидилкарбокси-
Таблиця 31-2. Біологічні ефекти ендотелінів1
Гемодинамічні ефекти
Скорочує гладкі м’язи судин; вени, можливо, чутливіші,
ніж артерії
Спричинює початкову депресорну реакцію, після чого
розвивається тривалий пресорний ефект (наявні
регіональні відмінності у ступені звуження судин)
Вплив на серце
Має позитивну іно- і хронотропну дію на міокард
Стимулює виражене звуження вінцевих судин
Нейроендокринні ефекти
Підвищує рівень АМР, реніну, альдостерону і
катехоламінів у плазмі крові
Модулює синаптичне передавання
Різноманітні впливи на ендокринні залози
Вплив на нирки
Збільшує опір судин нирок
Знижує рівень клубочкової фільтрації, ниркового
кровообігу і коефіцієнт клубочкової ультрафільтрації
Підсилює реабсорбцію Иа+ завдяки гемодинамічним
ефектам
Зменшує реабсорбцію №+ завдяки пригніченню №+-К+-
АТФ-ази
Вплив на дихання
Спричинює звуження бронхів
Дія на шлунково-кишковий тракт
Підсилює глюконеогенез
Регулює кровообіг шлунково-кишкового тракту
Промітогенні ефекти
Стимулює ріст клітин у різноманітних клітинних лініях
1 Модифіковано з Тґіотаз СР, Зітопзоп М8, Оипп МЗ: Епсіо-
Ніеііп: Ресеріогз апсі ІгапзтетЬІапе зідпаїз. Ме\л/з РЬузіоІ 8сі
1992;7:207.
пептидаза - кініназа II - інактивує брадикінін і лізилбради-
кінін шляхом відщеплення РЬе-Аг§ від С-кінця. Кініназа II
- це той самий ензим, що й ангіотензин П-перегворю-
вальний ензим (див. Розділ 24), який відщеплює Ніз-Ееи
від С-кінця ангіотензину І.
Брадикінін і лізилбрадикінін формуються з двох білків-
попередників - високомолекулярного і низькомолекуляр-
ного кініногенів (рис. 31-4). Вони утворюються шляхом
альтернативного сплайсингу одного гена, розміщеного на
хромосомі 3. Біологічна активність брадикініну і лізилбра-
дикініну однакова, і незрозуміло, чому утворюються саме
два кініни.
|КІІ |КІ
І_уз-Агд-Рго-Рго-6Іу-РІіе-8ег-Рго-РІіе-Агд
Амінопептидаза
. Агд-Рго-Рго-6Іу-РІіе-8ег-Рго-РІіе-Агд
ікп Ткі
Рис. 31-3. Кініни. Лізилбрадикінін (угорі) під дією амінопеп-
тидази перетворюється на брадикінін (унизу). Пептидази інак-
тивовані кініназою І (КІ) або кініназою II (КН) у ділянках, по-
значених короткими стрілками.
РЕГУЛЮВАННЯ СЕРЦЕВО-СУДИННОЇ СИСТЕМИ / 549
Утворення пептидів з їхніх попередників відбувається
за допомогою протеаз, які називають калікреїнами. У
людей утворення калікреїнів кодоване родиною з трьох
генів, розміщених на 19-й хромосомі. Є два види калікреї-
нів: калікреїн плазми, який циркулює в неактивній формі,
і тканинний калікреїн, який міститься головно на апі-
кальній мембрані клітини, що є важливою для транспорту-
вання електролітів. Тканинний калікреїн виявляють у
багатьох тканинах, у тім числі потових та слинних залозах,
підшлунковій залозі, передміхуровій залозі, кишці та нир-
ках. Під дією тканинного калікреїну з високомолекуляр-
ного та низькомолекулярного кініногенів утворюється
лізилбрадикінін. Калікреїн плазми під час активування діє
на високомолекулярний кініноген, спричинюючи утворен-
ня брадикініну.
Перетворення неактивного калікреїну плазми (прекалі-
креїну) в активну форму - калікреїн - відбувається під
впливом активного фактора XII, який ініціює внутрішній
механізм процесу зсідання крові. Калікреїн активує фактор
XII за механізмом позитивного зворотного зв’язку. Здат-
ність активувати фактор XII має також високомолекуляр-
ний кініноген (див. рис. 27-25).
Дія кінінів подібна до дії гістаміну. Переважно вони віді-
грають роль тканинних гормонів, хоча в невеликій кіль-
кості циркулюють у крові. Кініни зумовлюють скорочення
м’язів внутрішніх органів. Гладкі м’язи судин вони роз-
слаблюють, діючи опосередковано через N0, і таким спо-
собом, знижують тиск крові. Кініни також збільшують про-
никність капілярів, приваблюють лейкоцити і спричи-
нюють біль у місці підшкірної ін’єкції. Вони утворюються
протягом активної секреції в потових і слинних залозах та
екзокринних відділах підшлункової залози (див. Розділ 26).
Крім того, кініни забезпечують посилення кровообігу в цих
тканинах у момент активної секреції. Кініни містяться
також у нирках, де їхня функція остаточно не з’ясована.
Ідентифіковано два види брадикінінових рецепторів -
В! і В2. їхні амінокислотні залишки на 36% ідентичні.
Обидва види належать до серпентинових рецепторів, зв’я-
заних з 6-білками. Рецептори Вґ можливо, беруть участь
у реалізації здатності кінінів спричиняти біль, однак їхній
розподіл і функція вивчені мало. Рецептори В2 дуже подібні
до Н2-рецепторів і містяться у багатьох тканинах.
XII-------------► XI Іа-----► Зсідання
Калікреїн
плазми -------------Прекалікреїн
Кініноген ВММ —----------------► Брадикінін
Кініноген НММ-----------------► Лізилбрадикінін
Калікреїн
тканин
Рис. 31-4. Утворення кінінів з кініногенів високої (ВММ) і
низької молекулярної маси (НММ).
Адреномедулін
Адреномедулін (АМ) - це депресорний поліпептид,
який уперше виділено з клітин феохромоцитоми. З його
прогормона утворюється ще один депресорний поліпептид
- проадреномедулін амінокінцевий 20 пептид (ПАМП).
АМ також пригнічує виділення альдостерону у тварин з
виснаженим резервом натрію хлориду і зумовлює депре-
сорний ефект унаслідок посиленого продукування N0.
ПАМП діє шляхом пригнічення активності периферійних
симпатичних нервів.
Крім мозкового шару надниркових залоз, АМ і ПАМП
містяться в плазмі та багатьох інших тканинах, у тім числі
нирках і головному мозку. Однак роль АМ і ПАМП (якщо
така є) у регулюванні серцево-судинної системи остаточно
нез’ясована.
Найтрійуретичні гормони
Передсердний натрійуретичний пептид (АКР) утворю-,
ється в серці (див. Розділ 24), він протидіє ефектам судино-
звужувальних речовин і знижує артеріальний тиск. Однак
остаточно його роль у регулюванні кровообігу наразі не
не з’ясована. Натрійуретичний інгібітор Ка+-К+-АТФ-ази,
який тепер уважають ендогенним оубаїном (строфанти-
ном), не знижує, а навпаки, підвищує тиск крові.
Судинозвужувальні речовини,
що циркулюють у крові
Вазопресин - це сильна судинозвужувальна речовина,
однак у разі введення здоровим людям вона суттєво не
змінює рівня артеріального тиску внаслідок компенсатор-
ного зменшення ударного об’єму. Його роль у регулюванні
артеріального тиску описана у Розділі 14.
Норадреналін має системну судинозвужувальну дію,
тоді як адреналін розширює судини скелетних м’язів і
печінки. У Розділі 20, де детально описано вплив катехо-
ламінів на серцево-судинну систему, зазначено про порів-
няно неважливу роль норадреналіну, що циркулює, на
відміну від норадреналіну, який виділяють вазомоторні
нерви.
Октапептид ангіотензин II зумовлює системну судино-
звужувальну дію. Він утворюється з ангіотензину І, який
відщеплюється від ангіотензиногену, що постійно цирку-
лює в крові, під впливом реніну (див. Розділ 24). Утворення
ангіотензину II стимульоване посиленим виділенням рені-
ну, що зумовлене зниженням артеріального тиску або змен-
шенням об’єму позаклітинної рідини. Це сприяє підтри-
манню рівня артеріального тиску. Ангіотензин II також
спричинює затримку води і стимулює виділення альдосте-
рону. Посилене утворення ангіотензину II є частиною
гомеостатичного механізму, спрямованого на підтримання
об’єму ПКР (див. Розділ 20). Крім того, ренін-ангіотензи-
нові системи є у багатьох інших органах, можливо, одна з
них - у стінках кровоносних судин. Ангіотензин II, який
утворюється у судинній стінці, може відігравати важливу
роль у разі деяких форм артеріальної гіпертензії.
Уротензин-ІІ - поліпептид, уперше виділений зі спин-
ного мозку риб, який міститься у серці і судинній стінці.
Це найсильніший відомий сьогодні вазоконстриктор у
ссавців. Однак його фізіологічна роль наразі остаточно
не з’ясована.
550 / РОЗДІЛ 31
МЕХАНІЗМИ СИСТЕМНОГО НЕРВОВОГО
РЕГУЛЮВАННЯ
Нервові механізми регулювання
Хоча артеріоли та інші судини опору мають найщіль-
нішу іннервацію, усі кровоносні судини, за винятком капі-
лярів і венул, містять гладкі м’язи й іннервовані руховими
волокнами із симпатичного відділу автономної нервової
системи. Волокна, що проходять до судин опору, регулю-
ють тканинний кровообіг і рівень артеріального тиску; во-
локна, що проходять до ємнісних судин, регулюють об’єм
крові, яка депонується у венах. Більшість вен має незначну
іннервацію, однак вени внутрішніх органів - багату. Зву-
ження вен відбувається під дією тих самих подразників,
які активують судинозвужувальні нерви артеріол. Унаслі-
док цього зменшується ємність венозних судин, збільшу-
ється кількість крові, яка надходить до серця, і кров пере-
розподіляється в артеріальний відділ системи кровообігу.
Іннервація кровоносних судин
Норадренергічні волокна закінчуються в судинах усіх
ділянок організму (рис. 31-5). За функцією вони судино-
звужувальні. Крім вазоконстрикторної іннервації, судини
опору скелетних м’язів мають судинорозширювальні
волокна, які хоча й проходять з симпатичними нервами,
належать до холінергічних (симпатична судинорозши-
рювальна система). Є дані, які свідчать про наявність
холінергічної іннервації у кровоносних судинах серця,
легень, нирок і матки. Пучки норадренергічних і холінер-
гічних волокон утворюють сплетення у зовнішньому шарі
стінки артеріол. Волокна з численними варикозними роз-
ширеннями поширюються від цих сплетень до середньої
оболонки і закінчуються на зовнішній поверхні гладких
м’язів, не проникаючи в них. Трансмітери проникають у
внутрішні ділянки середньої оболонки шляхом дифузії, і
біопотенціал поширюється від однієї гладком’язової клі-
тини до іншої через щілинні контакти.
Тонічні імпульси не характерні для судинорозширю-
вальних волокон, однак вазоконстрикторним волокнам
більшості судинних лож притаманна деяка тонічна актив-
ність. У випадку перерізання симпатичних нервів (сим-
патектомїї) кровоносні судини розширюються. У біль-
шості тканин розширення судин зумовлене зменшенням
рівня тонічної активності вазоконстрикторних нервів.
Однак у скелетних м’язах судини можуть розширюватися
також унаслідок активування симпатичної судинорозши-
рювальної системи (табл. 31-3).
Багато кровоносних судин іннервовані волокнами, в
яких утворюються поліпептиди. Холінергічні нерви міс-
Рис. 31-5. Норадренергічні нервові волокна, що іннервують
кровоносні судини очеревини щурів. Стрілками позначено
напрям плину крові (відтворено за дозволом з Еигпезз ЗВ,
МагзіїаІІ ЗМ: Соггеїаііоп ої йіе сіігесіїу оЬзеп/есІ гевропвез ої
тезепігіс УЄ88ЄІ8 ої Йіе гаї іо пеп/е зіітиіаііоп апсі погасігепа-
Ііпе \л/ііїі Йіе сІізігіЬиііоп ої асігепеііс пеп/ез. З РґіузіоІ 1974;75:
239).
Таблиця 31-3. Фактори, які впливають на діаметр артеріол
Звуження Розширення
Місцеві фактори Місцеве зниження температури Авторегулювання Збільшення вмісту СО2 і зменшення О2 Збільшення вмісту К+, аденозину, лактату та ін. Місцеве зниження рН Місцеве підвищення температури
Ендотеліальні фактори Ендотелін-1 Місцево виділений серотонін тромбоцитів Тромбоксан А2 N0 Кініни Простациклін
Гормони, що циркулюють у крові Адреналін (за винятком скелетних м’язів і печінки) Норадреналін Аргініновий вазопресин (АВП) Ангіотензин II Циркулювальний інгібітор І\Іа+-К+-АТФ-ази Нейропептид У Адреналін у скелетних м’язах і печінці СбКРос Речовина Р Гістамін АМР ВІП
Нервові фактори Посилена імпульсація норадренергічних вазомоторних нервів Послаблена імпульсація норадренергічних вазомоторних нервів Активування холінергічних судинорозширювальних волокон, що проходять до скелетних м’язів
РЕГУЛЮВАННЯ СЕРЦЕВО-СУДИННОЇ СИСТЕМИ / 551
тягь також ВІП, який спричинює розширення судин. У
норадренергічних носігангліонарних симпатичних волок-
нах формус і вся також нейропептид ¥, який є вазоконст-
рикгором. У чутливих нервах, які закінчуються біля крово-
носних судин, містяться речовина Р і ССКРос, які зумов-
люють розширення судин.
Аферентні імпульси в чутливих нервах від шкіри пере-
ходять ашидромно вниз по гілках чутливих нервів, які
іннервують кровоносні судини. Ці імпульси призводять до
виділення речовини Р з нервових закінчень. Речовина Р
спричинює розширення судин і підвищення проникності
капілярів. Цей місцевий нервовий механізм називають
аксонним рефлексом (див. рис. 32-17). Інші серцево-
судинні рефлекси відбувают ься за участю центральної нер-
вової системи.
Іннервація серця
Імпульси, що над ход я і ь но норадренергічних нервах до
серця, зумовлюю і ь збільшення частоти (хронотропний
ефект) і сили серцевих скорочень (інотропний ефект). Вони
пригнічую і ь також сфскіи стимулювання блукаючих нер-
вів, можливо, завдяки виділенню нейропептиду ¥, який є
ко трансмітером у симпатичних нервових закінченнях.
Імпульси, які надходять до серця по холінергічних волок-
нах блукаючих нервів, зменшують частоту серцевих ско-
рочень. У стані спокою для симпатичних нервів серця
характерна помірна топічна активність. У людей та вели-
ких тварин їй протидіє більше виражена тонічна імпуль-
сація блукаючих нервів (тонус блукаючих нервів). У тва-
рин в експерименті з перерізаними блукаючими нервами
часто і а серцевих скорочень збільшується. Після введення
парасимпаїолііичних препаратів, таких як атропін, частота
серцевих скорочень у людей збільшується з 70 (у стані спо-
кою в нормі) до 150-180 ударів за 1 хв^ Це пояснюють
тим, що парасимпаїичний тонус перестає протидіяти сим-
патичному. У людей в ран одночасної блокади норадре-
нерпчної і холінері ічної систем часіота серцевих скоро-
чень становить приблизно 100 ударів за 1 хв.
Вазомоторний контроль
Симнаї ичш нерви, які спричинюю! ь звуження артеріол
і вен, а іакож збільшуюіь ударний об’єм, мають тонічну
акт ивнісіь (постійно посилюють нервові імпульси). Регу-
лювання рівня артеріальною тиску відбувається внаслідок
зміни цієї тонічної активності (рис. 31-6). Артеріальний
іиск залежить від активності рефлексів спинного мозку,
однак передусім йоі о копт ролює група нейронів довгастого
мозку, яку називають вазомоторною ділянкою, або вазо-
моторним цепі ром.
Нейрони, які забезпечують посилення симпатичного
впливу на кровоносні судини і серце (рис. З 1 -7), проходять
до симпатичних преганглюнарних нейронів у складі нро-
міжнобічного (ПБ) стовпа спинного мозку. З обох боків
тіла цих нейронів містяться ближче до м’якої оболонки в
ростральній вентролагеральній ділянці довгастого мозку
(РВЛД). їхні аксони проходять дорсально і медтально, а
по і їм опускаються в складі бічного еювпа спинного мозку
до 11Б еювпа. Вони місія і ь РNМТ (див. Розділ 4), однак
збуджувальний ірансмпер, який вони виділяють, - це
швидше ілуїамаї, ніж адреналін.
х—► Барорецептори-----х
Артеріальний
тиск
Стовбур
мозку
ч__Частота серцевих у
скорочень
Діаметр судин
Ударний об’єм
Рис. 31-6. Контроль рівня артеріального тиску за принципом
зворотного зв’язку
Імпульси, які надходять із довгастого мозку, діють також
на частоту серцевих скорочень через блукаючі нерви. Ней-
рони, від яких починаються волокна блукаючих нервів,
містяться у дорсальному ядрі блукаючого нерва і подвій-
ному ядрі (рис. ЗІ-8).
З посиленням вазоконстрикторного впливу простежу-
ється звуження артеріол і підвищення артеріального тиску.
Здебільшого ці зміни супроводжуються звуженням вен 1
зменшенням об’єму депонованої венозної крові, хоча не
завжди у ємнісних судинах відбуваю) ься зміни, аналогічні
до змін у судинах опору. Частота серцевих скорочень і
ударний об’єм крові теж збільшуються з посиленням
активності симпатичного відділу. Одночасно збільшується
хвилинний об’єм серця. У цьому разі, як звичайно, послаб-
люється тонічна активність волокон блукаючих нервів, що
іннервують серце. І навпаки, у випадку послаблення
активності вазомоторного центру судини розширюються,
артеріальний тиск знижується, депонування крові у ємніс-
них судинах посилюється. Здебільшого одночасно змен-
шується частота серцевих скорочень. Однак цей ефект
головно зумовлений посиленням впливу блукаючих нервів
на серце.
Аферентні шляхи до вазомоторного центру
Аферентні волокна, які сходяться у вазомоторному
центрі, наведені у табл. 31-4. До них належаїь не тільки
дуже важливі волокна, що проходять від барорецепторів
артерій і вен, а й волокна від інших ділянок нервової сис-
іеми, а також від кароїидних та аортальних хеморецеп-
торів. Крім того, деякі сіимули діють безпосередньо на
вазомоторний центр.
Є низхідні шляхи до вазомоторного центру, які прохо-
дять від кори головного мозку (зокрема, лімбічної кори) 1
прямують до гіпоталамуса. Ці волокна беруть участь у під-
вищенні артеріального тиску і розвит ку тахікардії під впли-
вом емоційних факторів, іаких як статеве збудження та
гнів. Зв’язки між гіпоталамусом і вазомоторним центром
є реципрокними, а аферентні імпульси зі стовбура мозку
замикають петлю.
552 / РОЗДІЛ 31
Довгастий
Рис. 31-7. Головні шляхи, які беруть участь у регулюванні довгастим мозком рівня артеріального тиску Показані еферентні
шляхи блукаючого нерва, які сповільнюють роботу серця У круглих дужках зазначені можливі нейротрансмітери нервових
шляхів; Глу - глутамат; ГАМК - у-аміномасляна кислота; Ах - ацетилхолін; НА - норадреналін; ПБ - проміжнобічний стовп;
ПоЯ - поодиноке ядро; КВЛД, ПВЛД, РВЛД - каудальна, проміжна і ростральна вентролатеральні ділянки довгастого мозку;
IX і X - язикогорловий і блукаючий нерви.
Наповнення легень повітрям приводить до розширення
судин і зниження артеріального тиску. Ця реакція відбу-
вається за участю аферентних волокон блукаючого нерва,
що проходять від легень і спричинюють послаблення
активності вазомоторного центру. Біль, як звичайно, зумов-
лює підвищення артеріального тиску завдяки аферентним
імпульсам, що переходять від ретикулярної формації до
вазомоторного центру. Однак тривалий біль може спричи-
няти розширення судин і запаморочення.
Соматосимпатичний рефлекс
Біль зумовлює підвищення артеріального тиску. Афе-
рентні імпульси від скелетних м’язів, що працюють, мож-
ливо, спричинюють подібний пресорний ефект. Ця реакція
відбувається за участю СІ нейронів ростральної вентрола-
теральної ділянки довгастого мозку. Звуження судин у
відповідь на стимулювання соматичних аферентних нервів
називають соматосимпатичним рефлексом. Нервові шля-
хи, які беруть участь у цій реакції, зображено на рис. 31 -9.
Барорецептори
Барорецептори - це рецептори, подразнення яких
відбувається під час розтягування стінок серця і кровонос-
них судин. Рецептори сонної пазухи (каротидного сину-
са) і дуги аорти беруть участь у регулюванні артеріального
кровообігу. Барорецептори містяться також у стінках пра-
вого і лівого передсердь у місцях впадіння верхньої та ниж-
ньої порожнистих і легеневих вен, а також у судинах легень,
їх у відділах малого кола кровообігу з низьким тиском
називають кардіопульмональними рецепторами. Оскільки
подразнення барорецепторів відбувається в разі розтягу-
вання ділянок, у яких вони локалізовані, то підвищення
РЕГУЛЮВАННЯ СЕРЦЕВО-СУДИННОЇ СИСТЕМИ / 553
Рис. 31-8. Головні шляхи, які беруть участь у регулюванні
довгастим мозком частоти серцевих скорочень за допомогою
блукаючих нервів. Нейрони ЯПШ (штрихова лінія) проходять
до прегангліонарних парасимпатичних нейронів дорсального
моторного ядра блукаючого нерва і подвійного ядра. Пост-
гангліонарні холінергічні нейрони іннервують передсердя і
шлуночки; Пір - піраміда; XII - ядро під’язикового нерва (моди-
фіковано з 81апсІізН Р, Епциізі 1_Н, 8сК\л/аЬег 38: Іппеп/аііоп
ої іїіе Гіеагї апсі ііз сепігаї тесіиііагу огідіп сІеТіпес! Ьу уігаї ігас-
іпд. Зсіепсе 1994;263:232).
тиску у цих структурах призводить до сильнішої імпуль-
сації від барорецепторів. Імпульси від барорецепторів над-
ходять по аферентних волокнах язикогорлового і блукаю-
чого нервів до довгастого мозку. Більшість цих волокон
закінчується у ядрі поодинокого шляху (ЯПШ), збуджу-
вальним трансмітером названих волокон є, можливо,
глутамат. Від ЯПШ відходять збуджувальні глутамінергічні
волокна до каудальної і проміжної вентролатеральних
Таблиця 31-4. Фактори, що впливають на активність
вазомоторного відділу довгастого мозку
Пряме стимулювання
С02
ГІПОКСІЯ
Збуджувальні впливи
Від кори через гіпоталамус
Від больових шляхів і м’язів
Від каротидних і аортальних хеморецепторів
Пригнічувальні впливи
Від кори через гіпоталамус
Від легень
Від каротидних, аортальних і кардіопульмональних
барорецепторів
Рис. 31-9. Соматосимпатичний рефлекс. Імпульси від ре-
цепторів шкіри та м’язів проходять до РВЛД довгастого мозку,
аксони клітин РВЛД - безпосередньо до проміжнобічного
стовпа (ПБ), де вони закінчуються на прегангліонарних
симпатичних нейронах; НМН - нижня мозочкова ніжка; НОЯ
- нижнє оливне ядро; ППП - присередній поздовжній пучок;
ПЯ - подвійне ядро; ПоЯ - поодиноке ядро; П - піраміда;
ЯСШТН - ядро спинномозкового шляху трійчастого нерва
(відтворено за дозволом з Кеіз 03, Киддегіо ОА, Моггізоп 8Е:
ТГіе С, агеа ої Ніе гозіаі уепігоіаіегаї тесіиііа оЬІопдаіа- А сгіїі-
саі Ьгаіпзіет гедіоп їог сопїгої ої гезііпд апсі геїіех іпїедгаііоп
ої агіегіаі ргеззиге. Ат 3 Нурегїепз 1989;2:3638).
ділянок довгастого мозку, де вони стимулюють гальмівні
нейрони, які виділяють ГАМК. Ці нейрони надходять у
ростральну вентролатеральну ділянку. Є також збуджуваль-
ні, можливо багатонейронні, шляхи від ЯПШ до моторних
нейронів блукаючого нерва у дорсальному ядрі і до подвій-
ного ядра. Отже, посилення імпульсації від барорецепторів
пригнічує тонічну активність судинозвужувальних симпа-
тичних нервів і стимулює дію блукаючих нервів на серце,
розширення артеріол і вен, що призводить до зменшення
хвилинного об’єму і зниження артеріального тиску.
Сонна пазуха і дуга аорти
Сонна пазуха - це незначне розширення внутрішньої
сонної артерії відразу над місцем біфуркації загальної
сонної артерії на зовнішню і внутрішню гілки (рис. 31-
10). У ділянці цього розширення містяться барорецептори,
що локалізовані також у стінці дуги аорти. Рецептори роз-
міщені у зовнішньому шарі судинної стінки. Вони є дуже
розгалуженими, шишкоподібними, закрученими закінчен-
554/РОЗДІЛ 31
нями мієлінових нервових волокон, які нагадують сухо-
жильний орган Ґольджі. У деяких видів подібні рецептори
містяться у різних ділянках великих артерій грудної клітки
і шиї. Аферентні волокна, які проходять від сонної пазухи
і сонного клубочка, утворюють окрему гілку язикогорло-
вого нерва - гілку сонної пазухи. Однак волокна від дуги
аорти формують окрему гілку блукаючого нерва лише у
кролів. Нерви сонної пазухи і гілки блукаючого нерва, які
проходять від дуги аорти, часто називають буферними
нервами.
Активність буферних нервів
За нормального артеріального тиску волокна буферних
нервів мають низький рівень імпульсації (рис. 31-11). Під-
вищення тиску в сонній пазусі та дузі аорти призводить до
посилення імпульсації, а зниження - до її послаблення.
Якщо одну сонну пазуху мавпи ізолювати і підтримувати
її перфузію та одночасно виконати денервацію інших баро-
рецепторів, то в разі перфузійного тиску до ЗО мм рт. ст.
імпульси в аферентних волокнах від сонної пазухи не вини-
кають, і артеріальний тиск та частота серцевих скорочень
не знижуються. При перфузійному тиску 70-110 мм рт. ст.
є лінійна залежність між перфузійним тиском і зниженням
артеріального тиску й частоти серцевих скорочень. Якщо
перфузійний тиск понад 150 мм рт. ст., то подальшого сут-
тєвого посилення реакції не відбувається (рис. 31-12), оче-
видно, тому, що імпульсація від барорецепторів і пригні-
чення вазомоторного центру досягають максимального
рівня.
(вигляд збоку)
Рис. 31-10. Барорецепторні ділянки каротидного синуса і дуги
аорти. Локалізацію рецепторів позначено через X.
Рис. 31-11. Імпульси (вертикальні лінії) в одному аферент-
ному нерві, які надходять від каротидного синуса, за різних
значень артеріального тиску; співвіднесені зі змінами аор-
тального тиску в часі (відтворено за дозволом з Вегпе НМ,
І_еуу ММ: Сагсііоуазсиїаг РІтузіоІоду, ЗгсІ есі МовЬу, 1977).
Рецептори сонної пазухи реагують як на підтримуваль-
ний, так і на пульсовий тиск. Зниження пульсового тиску в
сонних артеріях без будь-яких змін середнього тиску веде
до меншої імпульсації від барорецепторів і зумовлює під-
вищення артеріального тиску й тахікардію. Рецептори реа-
гують також як на зміни тиску, так і на стабільний тиск. У
випадках коливання тиску деколи за його підвищення
імпульси виникають, а в разі зниження - не виникають (див.
рис. 31-11). У цьому випадку середній тиск без коливань
спричиняв би постійну імпульсацію.
Рецептори дуги аорти вивчали не настільки детально,
однак немає підстав уважати, що їхня відповідь суттєво
відрізняється від відповіді рецепторів сонної пазухи.
Зі сказаного стає очевидним, що барорецептори арте-
ріального відділу кровообігу, їхні аферентні зв’язки з вазо-
моторним і кардіоінгібіторним відділами, а також еферент-
ні шляхи від цих відділів утворюють рефлекторний меха-
нізм зворотного зв’язку, спрямований на стабілізацію ар-
теріального тиску і частоти серцевих скорочень. Будь-яке
зниження системного артеріального тиску послаблює при-
гнічувальну імпульсацію в буферних нервах і спричинює
компенсаторне підвищення артеріального тиску та хвилин-
ного об’єму. Будь-яке підвищення тиску зумовлює розши-
рення артеріол і зменшення хвилинного об’єму до того мо-
менту, доки артеріальний тиск не досягне нормального
рівня.
Переустановлення барорецепторів
У випадку хронічної гіпертензії барорецепторний реф-
лекс переустановлюється на підтримку не нормального, а
підвищеного тиску. Під час перфузійних досліджень на екс-
периментальних тваринах з гіпертензією з’ясовано, що під-
РЕГУЛЮВАННЯ СЕРЦЕВО-СУДИННОЇ СИСТЕМИ / 555
Рис. 31-12. Суцільна лінія: зниження системного артеріаль-
ного тиску з підвищенням тиску в ізольованому каротидному
синусі нормальної мавпи. Штрихова лінія: реакція гіпертен-
зивної мавпи, яка свідчить про переустановлення бароре-
цепторів (стрілка).
вищення тиску в ізольованій сонній пазусі призводить до
зниження підвищеного системного артеріального тиску.
Зниження перфузійного тиску веде до зростання підвище-
ного тиску (рис. ЗІ-12). Переустановлення швидко роз-
вивається в експериментальних тварин, однак мало відомо
про те, як і чому це відбувається. Як в експериментальних,
так і в клінічних умовах це зворотний процес.
Наслідки перетискання сонних артерій і
перерізання буферних нервів
Двобічне перетискання сонних артерій ближче до сон-
них пазух зумовлює підвищення артеріального тиску і
частоти серцевих скорочень, оскільки в цьому разі зни-
жується тиск у сонних пазухах. Перерізання з кожного боку
нервів сонних пазух веде до аналогічного ефекту. В обох
випадках підвищення артеріального тиску є помірним,
оскільки продовжують нормально діяти барорецептори
дуги аорти. Якщо перерізати також аферентні волокна, що
проходять від барорецепторів у складі блукаючого нерва,
то артеріальний тиск підвищується до 300/200 мм рт. ст.
або вище і є нестабільним. Двобічне ушкодження ЯПШ,
місця закінчення барорецепторних аферентних волокон,
зумовлює виражену гіпертензію, яка може бути летальною.
Ці форми експериментальної гіпертензії називають нейро-
генною гіпертензією.
Барорецептори передсердь, які реагують
на розтягування
Є два типи рецепторів передсердь, що реагують на роз-
тягування: одні, в яких імпульси виникають протягом сис-
толи передсердь (тип А), інші, у яких імпульси виникають
наприкінці діастоли, в момент максимального наповнення
передсердь (тип В). Імпульсація від барорецепторів типу
В посилюється зі збільшенням венозного повернення крові
і послаблюється під впливом позитивного тиску під час
дихання. Отже, ці барорецептори передусім реагують на
розтягування стінок передсердь. Посилення імпульсації від
більшості (якщо не всіх) цих рецепторів зумовлює реф-
лекторні зміни кровообігу і, зокрема, розширення судин
та зниження артеріального тиску. Однак у цьому разі часто-
та серцевих скорочень не збільшується, а зменшується.
Роль барорецепторів у гормональному
регулюванні об’єму ПКР
Зі зменшенням об’єму ПКР знижується центральний
венозний тиск, і послаблення імпульсації від барорецеп-
торів передсердь зумовлює посилене виділення вазопре-
сину (див. Розділ 14). Водночас посилюється активність
симпатичного відділу, що призводить до посиленого про-
дукування реніну. Виділення реніну спричинює продуку-
вання альдостерону. За значного зменшення об’єму ПКР
простежується зниження артеріального тиску і послаблен-
ня імпульсації від барорецепторів сонної пазухи та дури
аорти, що теж сприяє посиленню виділення гормонів.
Характеристика інших факторів, які посилюють продуку-
вання вазопресину і реніну, наведена у Розділах 20, 24 і
39. Кінцевим результатом описаних процесів є затримка
води і натрію, спрямована на відновлення об’єму ПКР.
Рефлекс Бейнбріджа
Швидка інфузія крові або фізіологічного розчину анес-
тезованим тваринам деколи зумовлює збільшення частоти
серцевих скорочень, якщо попередньо частота серцевих
скорочень була малою. Цей ефект описав Бейнбрідж
1915р., відтоді він відомий як рефлекс Бейнбріджа. Вва-
жають, що це справжній рефлекс, а не місцеве реагування
на розтягування, оскільки він блокований двобічною ваго-
томією. Інфузія рідин тваринам з трансплантованим серцем
збільшує частоту скорочення культі передсердь реципієнта,
однак не впливає на частоту скорочень трансплантованого
серця. У цьому, можливо, задіяні рецептори передсердь,
які спричинюють тахікардію (описані раніше). Цей реф-
лекс протидіє опосередкованому барорецепторами змен-
шенню частоти серцевих скорочень у відповідь на збіль-
шення об’єму. Рефлекс послаблюється або взагалі не про-
стежується, якщо початкова частота серцевих скорочень
була високою. Було багато дискусій про важливість цього
рефлексу, однак його остаточна фізіологічна роль не з’я-
сована.
Рецептори лівого шлуночка
Унаслідок розтягування лівого шлуночка в експеримен-
тальних тварин відбувається зниження системного арте-
ріального тиску і частоти серцевих скорочень. Розтягуван-
ня шлуночка в цьому разі повинно бути значним, і вирі-
шальна фізіологічна роль цієї реакції до кінця не з’ясована.
Можливо, рецептори лівого шлуночка, що реагують на роз-
тягування, відіграють роль у підтриманні тонусу блукаю-
чого нерва, який забезпечує низьку частоту серцевих ско-
рочень у стані спокою.
Якщо експериментальним тваринам уводити серотонін,
вератридин, капсаїцин, фенілдигуанід і деякі інші речовини
у вінцеві артерії, що постачають кров’ю лівий шлуночок
серця, то розвивається апное, після чого настає часте
дихання, гіпотензія і брадикардія (вінцевий хеморефлекс,
або рефлекс Безольда-Яріша). Рецептори, очевидно, є
556 / РОЗДІЛ 31
закінченнями С-волокон, а еферентні волокна проходять
у складі блукаючого нерва. Ця реакція не виникає після
ін’єкцій у судини, що постачають кров’ю передсердя й
правий шлуночок. Її фізіологічна роль остаточно нез’я-
сована. Можливо, у хворих з інфарктом міокарда речовини,
що виділяються з ділянок інфаркту, стимулюють рецептори
шлуночка, сприяючи гіпотензії, яка нерідко ускладнює це
захворювання.
Легеневі рецептори
У випадку введення в легеневу артерію серотоніну, кап-
саїцину, вератридину та споріднених речовин відбувається
активування закінчень С-волокон, що розташовані близько
до капілярів легень, унаслідок чого розвивається апное, а
потім настає часте дихання, гіпотензія та брадикардія
(легеневий хеморефлекс). Цю реакцію (описана в Розділі
36) блокує ваготомія. За суттю вона аналогічна до вінце-
вого хеморефлексу, який виникає у разі введення речовин
в артерії, що постачають кров’ю лівий шлуночок. Реакція
розвивається занадто швидко - раніше, ніж речовини
досягнуть рецепторів лівого шлуночка.
Клінічні дослідження і стимулювання
Зміни частоти пульсу і рівня артеріального тиску, що
простежуються в людей, які встають або лягають (див.
Розділ 33), відбувається насамперед за допомогою бароре-
цепторних рефлексів. Про роль рецепторів свідчать зміни
частоти серцевих скорочень у відповідь на підвищення
артеріального тиску, спричинені введенням а-адрености-
мулятора фенілефрину. Нормальна відповідь відображена
на рис. 31-13. За значень систолічного тиску від 120—
150 мм рт. ст. є лінійна залежність між рівнем тиску і
зменшенням частоти серцевих скорочень (збільшення
інтервалу К.К).
Функцію рецепторів можна також підтвердити, вивча-
ючи зміни пульсу та артеріального тиску у відповідь на
короткі періоди навантаження (форсоване видихання в разі
закритої голосової щілини: маневр Вальсальви). На по-
Рис. 31-13. Опосередковане барорефлексом зменшення час-
тоти серцевих скорочень у разі введення фенілефрину
людині Зверніть увагу на те, що значення інтервалу КН на
ЕКГ, відкладені на вертикальній осі, обернено пропорційні
до частоти серцевих скорочень (відтворено за дозволом з
Коїгіу К еі аі: Еїїесіз ої їепїапуі-сііагерагп-піігоііз охісіе апаез-
їїіезіа оп агїегіаі Ьагогеїіех сопігої ої Гіеагї гаїе іп тап. Вг З
Апаезіґі 1986; 58:406).
чатку навантаження артеріальний тиск підвищується (рис.
31-14) тому, що підвищення тиску у грудній порожнині
сприяє підвищенню тиску в аорті. Потім артеріальний тиск
знижується, оскільки високий тиск у грудній порожнині
зумовлює звуження вен, зменшення венозного повернення
до серця і зменшення хвилинного об’єму. Зниження арте-
ріального і пульсового тиску призводить до послаблення
імпульсації від барорецепторів і спричинює тахікардію та
збільшення периферійного опору судин. У випадку відкри-
тої голосової щілини тиск у грудній порожнині нормалізу-
ється, хвилинний об’єм відновлюється, однак периферійні
судини звужені. Простежується підвищення артеріального
Тиск
у стравоході,
см Н2О
Артеріальний
тиск,
мм рт. ст
Рис. 31-14. Діаграма відповіді на маневр Вальсальви у здорової людини, записана за допомогою голки, введеної у плечову
артерію (за згодою М МсІІгоу).
РЕГУЛЮВАННЯ СЕРЦЕВО-СУДИННОЇ СИСТЕМИ / 557
тиску понад нормальні показники, що призводить до сти-
мулювання барорецепторів і зумовлює брадикардію та зни-
ження артеріального тиску до нормального рівня.
Описані зміни частоти серцевих скорочень простежу-
ються також у хворих після симпатектомії, оскільки баро-
рецептори і блукаючі нерви у них є інтактними. Однак у
хворих з вегетативною недостатністю - синдромом, за
якого виникає значне порушення функцій автономної
нервової системи, - частота серцевих скорочень не зміню-
ється. З незрозумілих причин частота серцевих скорочень
і артеріальний тиск не змінюються також у разі нормалі-
зації тиску в грудній порожнині у хворих з первинним
гіперальдостеронізмом. їхнє реагування на маневр Валь-
сальви нормалізується після видалення пухлини, що вироб-
ляє альдостерон.
Вплив стимулювання хеморецепторів на
вазомоторний центр
Аферентні волокна, що проходять від хеморецепторів
каротидних та аортальних клубочків, передусім беруть
участь у регулюванні дихання, їхня функція описана в
Розділі 36. Проте ці волокна доходять також до вазомо-
торного центру. Вплив стимулювання хеморецепторів на
серцево-судинну систему полягає у звуженні периферійних
судин і брадикардії. Однак гіпоксія, крім цього, спричинює
гіперпноє і посилене виділення катехоламінів із наднир-
кових залоз, зміни, які, відповідно, зумовлюють тахікардію
та збільшення хвилинного об’єму крові. У разі кровотечі
розвивається гіпотензія, і це призводить до стимулювання
хеморецепторів. Цей ефект пояснюють послабленням пли-
ну крові у ділянках локалізації хеморецепторів і застійною
аноксією цих ділянок (див. Розділ 37). У тварин з гіпотен-
зією імпульсація від барорецепторів послаблюється (див.
нижче), і перерізання язикогорлового та блукаючого нервів
зумовлює не підвищення, а зниження артеріального тиску.
Це пояснюють тим, що нема впливу хеморецепторів на
вазомоторний центр. Імпульсація від барорецепторів, імо-
вірно, відіграє деяку роль і у виникненні хвиль Майєра. Ці
хвилі не треба плутати з хвилями Траубе-Герінґа - коли-
ванням артеріального тиску, що синхронізоване з дихан-
ням. Хвилі Майєра - це повільні регулярні коливання арте-
ріального тиску з частотою одне за 2СС40 с під час гіпо-
тензії. За цих умов унаслідок гіпоксії відбувається стимулю-
вання хеморецепторів, що, відповідно, веде до підвищення
артеріального тиску. Наслідком підвищення артеріального
тиску є посилення плину крові у ділянках локалізації хемо-
рецепторів і послаблення імпульсації від них. Після зни-
ження тиску починається новий цикл. Хвилі Майєра
послаблюються, проте повністю не зникають у разі денер-
вації хеморецепторів. Вони деколи простежуються у хре-
бетних тварин. Отже, в розвитку цих хвиль певну роль віді-
грають спінальні вазопресорні рефлекси.
Прямі впливи на вазомоторний центр
Як гіпоксія, так і гіперкапнія стимулюють вазомоторний
центр, діючи прямо на РВЛД, хоча прямий вплив гіпоксії
виражається у незначному підвищенні внутрішньочереп-
ного тиску, погіршенні кровопостачання вазомоторного
центру, а місцева гіпоксія та гіперкапнія посилюють ім-
пульсацію в ньому. Підвищення артеріального тиску, яке в
Таблиця 31-5. Фактори, які впливають на частоту серцевих
скорочень1
Частоту серцевих скорочень збільшують
Знижена активність барорецепторів артерій, лівого
шлуночка і легеневих судин
Підвищена активність барорецепторів
Вдихання
Збудження
Гнів
Більшість больових подразників
Гіпоксія
Фізичне навантаження
Адреналін
Тиреоїдні гормони
Гарячка
Рефлекс Бейнбріджа
Частоту серцевих скорочень зменшують
Норадреналін1
Підвищена активність барорецепторів артерій, лівого
шлуночка і легеневих судин
Видихання
Страх
Смуток
Стимулювання больових волокон трійчастого нерва
Підвищений внутрішньочерепний тиск
1 Норадреналін має пряму хронотропну дію на серце. Проте
в інтактних тварин його вазопресорна дія зумовлює стиму-
лювання барорецепторів і рефлекторне посилення тонусу
блукаючого нерва, достатнє для того, щоб перевищити пряму
дію і спричинити брадикардію.
цьому разі розвивається (рефлекс Кушінґа), спрямоване на
відновлення плину крові до довгастого мозку. Воно зумов-
лює рефлекторне зменшення частоти серцевих скорочень
через барорецептори артерій (див. нижче). Саме тому у
хворих з підвищеним внутрішньочерепним тиском харак-
терний симптом не тахікардія, а брадикардія.
Підвищення артеріального Рсо2 стимулює вазомотор-
ний центр, однак прямим периферійним ефектом гіпер-
капнії є розширення судин. Отже, периферійний і цент-
ральний ефекти протидіють один одному. Помірна гіпер-
вентиляція, яка суттєво зменшує напруження СО2 у крові,
зумовлює звуження судин шкіри та мозку, артеріальний
тиск у цьому випадку практично не змінюється. Під впли-
вом високих концентрацій СО2 простежується виражене
розширення судин шкіри та мозку, судини ж інших ділянок
звужуються, і артеріальний тиск дещо підвищується.
Симпатична судинорозширювальна система
Холінергічні симпатичні судинорозширювальні волокна
є частиною регулювальної системи, яка розпочинається у
корі головного мозку, проходить до гіпоталамуса і серед-
нього мозку, а звідти, не перериваючись, через довгастий
мозок прямує до ПБ сірого стовпа спинного мозку. Пре-
гангліонарні нейрони цієї системи активують постгангліо-
нарні нейрони, які проходять до скелетних м’язів і анато-
мічно належать до симпатичних, проте виділяють ацетил-
холін. Стимулювання цієї системи зумовлює розширення
судин скелетних м’язів. Однак посилення плину крові, яке
внаслідок цього виникає, супроводжується не збільшенням,
558 / РОЗДІЛ 31
а зменшенням споживання О2. Це свідчить про те, що кров
тече в обхід капілярів. У випадку стимулювання цієї сис-
теми посилюється виділення адреналіну й норадреналіну
з мозкової речовини надниркових залоз. Виділений адре-
налін посилює розширення судин скелетних м’язів. У собак
і котів систему активує дія емоційних факторів, таких як
страх, тривога і гнів. Її роль у людей детально не вивчена.
Вважають, що симпатична судинорозширювальна система
бере участь у розвитку запаморочення під дією емоцій. Є
прямі докази того, що існує холінергічно опосередкована
вазодилатація у скелетних м’язах протягом або навіть на
початку фізичного навантаження (див. Розділ 33), хоча
відомо, що розширення судин перед фізичним наванта-
женням не дуже виражене і простежується не завжди.
Регулювання частоти серцевих скорочень
Симпатична і парасимпатична іннервація серця, а також
рефлекторні зміни, опосередковані барорецепторами,
детально описано у попередніх розділах. Однак у табл. 31 -
5 наведено і систематизовано головні фактори, що впли-
вають на частоту серцевих скорочень. Загалом, подраз-
ники, які збільшують частоту серцевих скорочень, одночас-
но підвищують також рівень артеріального тиску.
Фактори, які зменшують частоту серцевих скорочень,
знижують артеріальний тиск, хоча є винятки, наприклад,
гіпотензія і тахікардія в разі стимулювання барорецеп-
торів передсердь; а також гіпертензія і брадикардія у ви-
падку підвищення внутрішньочерепного тиску (див.
вище).
Кровообіг в окремих ділянках
організму
32
ВСТУП
Розподіл серцевого викиду між різними частинами тіла
у нормальної людини в стані спокою наведено у табл. 32-
1. Головні принципи кровообігу, описані у попередніх роз-
ділах, можна застосовувати до всіх цих частин тіла, хоча у
більшості органів простежуються специфічні риси. Пор-
тальний кровообіг передньої частки гіпофіза розглянуто у
Розділі 14, легеневий - у Розділі 34, а нирковий - у Розділі
38. Кровообіг у скелетних м’язах описано у Розділі 33
разом з фізіологією скорочення. У цьому розділі ми зосе-
редимось на кровообігу у головному мозку, серці, органах
черевної порожнини, шкірі, плаценті та плоду.
ЦЕРЕБРАЛЬНИЙ КРОВООБІГ
АНАТОМІЧНІ ОСОБЛИВОСТІ
Судини
Головний притік артеріальної крові до головного мозку
відбувається через чотири артерії: дві внутрішні сонні та
дві вертебральні. Вертебральні артерії об’єднуються, утво-
рюючи базилярну артерію, яка разом із сонними формує
під гіпоталамусом коло Віллізія. Це коло дає початок шес-
ти великим артеріям, які постачають кров до кори голов-
ного мозку. У деяких тварин вертебральні артерії є велики-
ми, а внутрішні сонні - дрібними, однак у людей порівняно
невелика частка загального артеріального кровоплину над-
ходить через вертебральні артерії. У випадку ін’єкції речо-
вин в одну із сонних артерій простежується відповідне
однобічне надходження у велику півкулю. В нормі пере-
хрест не фіксують, ймовірно, з огляду на тиск, який є одна-
ковим з обох боків. Та навіть якщо тиск різний, анастомози
не пропускають значної кількості крові. Закупорення однієї
із сонних артерій, зокрема у людей похилого віку, часто
призводить до серйозних симптомів церебральної ішемії.
У людей та деяких інших видів є прекапілярні анастомози
між церебральними артеріолами та іншими судинами,
проте кровоплин через ці судини переважно недостатній
для підтримки кровообігу та запобігання інфаркту внаслі-
док закупорення мозкової артерії.
Венозний відтік від мозку у людини відбувається через
глибокі вени та порожнини синусів твердої мозкової обо-
лонки головно у внутрішню яремну вену, хоча невелика
кількість венозної крові проходить через очне та венозне
Таблиця 32-1. Кровоплин у стані спокою та поглинання О2 у різних органах (дорослий чоловік масою 63 кг,
середнім артеріальним тиском 90 мм рт ст. та поглинанням О2 250 мл/хв)1
Ділянка Маса, кг Кровоплин Артеріо- венозна різниця вмісту О2, мл/д Поглинання О2 Опір, К-одиниці1 Відношення до загального, %
мл/хв мл/100 г/хв мл/хв мл/100 г/хв абсо- лютні на кг серцевого викиду поглинання кисню
Печінка 2,6 1500 57,7 34 51 2,0 3,6 9,4 27,8 20,42
Нирки 0,3 1260 420,0 14 18 6,0 4,3 1,3 23,3 7,2
Мозок 1,4 750 54,0 62 46 3,3 7,2 10,1 13,9 18,4
Шкіра 3,6 462 12,6 25 12 0,3 11,7 42,1 8,6 4,8
Скелетні м’язи 31,0 840 2,7 60 50 0,2 6,4 198,4 15,6 20,0
Серцевий м’яз 0,3 250 84,0 114 29 9,7 21,4 6,4 4,7 11,6
Решта тіла 23,8 336 1,4 129 44 0,2 16,1 383,2 6,2 17,6
Цілий організм 63,0 5400 8,6 46 250 0,4 1,0 63,0 100,0 100,0
1 Відтворено за дозволом з ВагсІ Р [есіііог]: МесІісаІ Рйувіоіоду. 11 їй есі. МозЬу, 1961.
2 П-одиниці - це тиск (мм рт. ст.) розділений на кровоплин (мл/с).
560 / РОЗДІЛ 32
сплетення обличчя, через емісарні вени у скальп, а також
вниз по системі паравертебральних вен у спинномозковий
канал. У інших видів внутрішня яремна вена невелика, і
венозна кров від головного мозку змішується з кров’ю, що
відтікає від інших структур.
Мозкові судини мають певні специфічні анатомічні
особливості. У судинному сплетенні є проміжки між ендо-
теліальними клітинами капілярної стінки, однак ворсин-
часті епітеліальні клітини, що відокремлюють їх від спин-
номозкової рідини (СМР) з’єднані між собою щільними
контактами. Капіляри у тканині мозку нагадують нефенест-
ровані капіляри скелетного м’яза (див. Розділ ЗО), проте
між ендотеліальними клітинами є щільні зв’язки, які обме-
жують проходження речовин. Крім того, у цитоплазмі
ендотелію міститься порівняно невелика кількість міхур-
ців, що відображає незначне везикулярне транспортування.
Капіляри мозку оточені кінцевими відростками астроцитів
(рис. 32-1). Ці відростки щільно зв’язані з базальною
пластинкою капілярів, однак не вкривають капілярну стінку
повністю. Між відростками є проміжки розміром близько
20 нм. Відростки забезпечують щільні контакти у капілярах
(див. Розділ 2). Протоплазма астроцитів виявлена також
навколо синапсів, де вона ізолює синапси мозку один від
одного.
Іннервація
Три системи нервів іннервують мозкові кровоносні
судини. Тіла постгангліонарних симпатичних нейронів
розміщені у верхніх шийних гангліях, їхні закінчення
містять норадреналін та нейропептид ¥. Холінергічні ней-
рони, які, ймовірно, починаються у гангліях, теж іннер-
вують мозкові судини, і постгангліонарні холінергічні ней-
рони кровоносних судин містять ацетилхолін, ВІП та РНМ-
Рис. 32-1. Мембрана кінцевого відростка (1) фіброзного астро-
цита навколо мозкового капіляра (2). Ліворуч відростки астро-
цита (3) охоплюють також частину дендритів сусідніх нейронів
(4) (відтворено за дозволом з Кгзііс К\/: Оіе Се\л/еЬе сіез
Мепзсїіеп ипсі сіег 8аидеііеге Зргіпдег, 1978).
27 (див. Розділ 26). Ці нерви закінчуються переважно на
великих артеріях. Чутливі нерви виявляються на дисталь-
них артеріях. їхні клітинні тіла розташовані у трійчастому
вузлі і містять речовину Р, нейрокінін А та СОКР. Речо-
вина Р, ССЖР, ВІП та РНМ-27 спричинюють вазодила-
тацію, тоді як нейропептид ¥ - вазоконстрикцію. Натягу-
вання мозкових судин або дотик до них супроводжуються
болем.
СПИННОМОЗКОВА РІДИНА
Утворення та абсорбція
СМР заповнює порожнини шлуночків та субарахної-
дального простору. У людини об’єм СМР становить
150 мл. Щодня утворюється близько 550 мл СМР, отже,
кожного дня склад рідини повністю поновлюється 3,7 раза.
В експериментах з тваринами було з’ясовано, що 50-70%
СМР утворюється у судинному сплетенні, а решта - дов-
кола судин та стінок шлуночків. В організмі людини ці про-
цеси не мають принципових відмінностей. СМР із шлу-
ночків рухається через отвори Маженді та Люшка у суб-
арахноїдальний простір, де її абсорбують арахноїдальні
ворсинки у вени, переважно мозкових венозних синусів.
Ворсинки - це виступи, що утворюються після злиття
павутинної оболонки та ендотелію синусів у венозні
синуси. Подібні, однак менші ворсинкоподібні виступи у
вени простежуються довкола корінців спинномозкових
нервів. Остаточно не зрозуміло, як ці виступи відіграють
роль клапанів, що забезпечують основний потік (спрямо-
ваний плин) СМР у венозну кров. Основний потік через ці
ворсинки становить близько 500 мл/день, крім додаткової
невеликої кількості СМР, що абсорбується шляхом дифузії
у мозкові кровоносні судини.
Склад СМР (табл. 32-2) такий же, як і склад ПКР голов-
ного мозку, яка за життя людини становить 15% від об’єму
мозку. У дорослих є вільні зв’язки між інтерстиційною
рідиною та СМР, хоча відстань дифузії від деяких ділянок
мозку до СМР значна. З огляду на це досягнення рівноваги
потребує деякого часу, а отже, можуть виникати ситуації,
коли склад позаклітинної речовини цього мікрооточення
тимчасово відрізняється від складу СМР. Інтерстиційна
рідина мозку - це ультрафільтрат плазми (див. табл. 32-2),
склад якого дещо модифікований завдяки транспортним
процесам в ендотеліальних клітинах капілярів мозку та
ворсинчастому епітелії. Простежуються активне транспор-
тування та посилена дифузія в обох напрямах - з мозку та
у мозок. Є також деякі відмінності у транспортуванні через
ендотеліальні клітини та ворсинчастий епітелій (рис. 32-
2), та внаслідок змішування ці відмінності не спричинюють
стійких локальних змін у складі рідини мозку.
Тиск СМР у люмбальному відділі в нормі становить 70-
180 мм СМР. Навіть за тиску, що значно перевищує цей
рівень, кількість утвореної СМР не залежить від внуштріш-
ньошлуночкового тиску. Проте абсорбція, яка відбувається
переважно завдяки основному потоку, пропорційна до
тиску (рис. 32-3). За тиску 112 мм СМР, який є середнім
нормальним тиском СМР, фільтрація та абсорбція врівно-
важені. Зі зниженням тиску менше 68 мм СМР абсорбція
припиняється. Значна кількість рідини може нагромаджу-
КРОВООБІГ В ОКРЕМИХ ДІЛЯНКАХ ОРГАНІЗМУ / 561
Таблиця 32-2. Вміст різноманітних речовин у СМР та
плазмі людини
Речовина СМР Плазма Відношення СМР/плазма
І\Іа+, мекв/кг Н2О 147,0 150,0 0,98
К+, мекв/кг Н2О 2,9 4,6 0,62
Мд2+, мекв/кг Н2О 2,2 1,6 1,39
Са2+, мекв/кг Н2О 2,3 4,7 0,49
СІ-, мекв/кг Н2О 113,0 99,0 1,14
НСОЗ", мекв/л 25,1 24,8 1,01
РСо2, мм рт. ст. 50,2 39,5 1,28
рн 7,33 7,40
Осмоляльність, мосмоль/кг Н2О 289,0 289,0 1,00
Білок, мг/дл 20,0 6000,0 0,003
Глюкоза, мг/дл 64,0 100,0 0,64
Неорганічний Р, мг/дл 3,4 4,7 0,73
Сечовина, мг/дл 12,0 15,0 0,80
Креатинін, мг/дл 1,5 1,2 1,25
Сечова кислота, мг/дл 1,5 5,0 0,30
Молочна кислота, мг/дл 18,0 21,0 0,86
Холестерол, мг/дл 0,2 175,0 0,001
ватись у випадку зменшення здатності до реабсорбції в
арахноїдальних ворсинках (зовнішня гідроцефалія, кому-
нікативна гідроцефалія). У разі блокади отворів Маженді
та Люшка або обструкції у системі шлуночків рідина
скупчується у відділах, проксимальних до місця блокади,
та розтягує шлуночки (внутрішня гідроцефалія, некому-
нікативна гідроцефалія).
Захисна функція
Мозкові оболонки та СМР захищають головний мозок.
Тверда мозкова оболонка щільно зв’язана із кісткою. В нор-
мі “субдурального простору44 немає. Павутинна оболонка
зв’язана із твердою завдяки поверхневому натягу тонкого
шару рідини між двома оболонками. Як показано на рис.
32-4, сам мозок охоплений павутинною оболонкою з судин,
нервових стовбурів та множинних фіброзних трабекул
павутинної оболонки. Маса мозку у повітрі дорівнює
1400 г, а у “водяній ванні” СМР він важить лише 50 г. Пла-
вучість мозку у СМР дає змогу порівняно тонким струк-
турним з’єднанням ефективно підтримувати орган. Під час
удару в голову павутинна оболонка ковзає по твердій обо-
лонці, і мозок рухається, однак цей рух пом’якшує подушка
з СМР і трабекули павутинної оболонки.
Важливість СМР для підтримання мозку підтверджують
больові відчуття, які виникають за нестачі СМР. Видалення
частини СМР під час люмбальної пункції може спричинити
сильний біль голови після процедури, оскільки мозок “ви-
сить” на судинах та нервових корінцях, і їхнє розтягнення
стимулює больові відчуття. Біль можна полегшити внут-
рішньотекальним уведенням стерильного ізотонічного
фізіологічного розчину.
я7 367-2
Хороїдальний епітелій
амінокислоти тощо)
Рис. 32-2. Угорі: транспортування через мозкові капіляри.
Внизу: транспортування через клітини хороїдального спле-
тення (модифіковано з Еізізтап ПА: СегеЬгозріпаІ ЕІиісІ іп Оіз-
еазез оТіііе ІМеп/оиз 8узіет, 2псІ есі. Заипсіегз, 1992).
Травми голови
Без захисного впливу СМР та мозкових оболонок мозок
не зміг би протистояти щонайменшим щоденним побу-
товим травмам. За такого ефективного захисту потрібні
досить таки значні сили для того, щоб спричинити ушкод-
ження.
Найчастіше ушкодження мозку простежуються внаслі-
док переломів черепа, коли кістка проникає у тканину
(вбитий перелом черепа) або коли мозок зміщується
достатньо для розриву тонких з’єднувальних вен від кори
до кістки або ж тоді, коли мозок із прискоренням, що вини-
кає під час удару в голову ударяється до кісток черепа або
з боку, протилежного до основного удару (ушкодження в
разі контрудару).
562 / РОЗДІЛ 32
Рис. 32-3. Утворення й абсорбція СМР у людини за різних
тисків. Зверніть увагу, що у разі тиску 112 мм утворення СМР
дорівнює її абсорбції, а у разі тиску 68 мм абсорбція дорівнює
нулю (модифіковано та відтворено за дозволом з Сіїїіег Р\Л/Р
еі аі: Еогтаїіоп апсі аЬзогрІіоп ої сегеЬгозріпаї ТІиісІ іп тап.
Вгаіп 1968,91:707).
ГЕМАТОЕНЦЕФАЛІЧНИЙ БАР’ЄР
Наявність щільних контактів між ендотеліальними клі-
тинами капілярів мозку та епітеліальними клітинами судин-
ного сплетення ефективно запобігає проникненню білків
у мозок дорослих та сповільнює пенетрацію менших за
розміром молекул. Прикладом може бути повільне про-
никнення сечовини (рис. 32-5). Рівень проходження моле-
кул обернено пропорційний до її розміру та прямо пропор-
ційний їхній розчинності у жирах. Цей унікальний обмеже-
ний обмін речовин називають гематоенцефалічним бар’є-
ром. Деякі фізіологи використовують цей термін лише для
опису бар’єру в капілярній стінці, тоді як для опису бар’єру
у судинному сплетенні застосовують термін гемато-СМР
бар’єр. Та оскільки обидва бар’єри мають багато спіль-
ного, то доцільно використовувати один термін до обох
структур. Крім того, незважаючи на те, що везикулярне
транспортування через мозкові капіляри порівняно невели-
ке, є багато транспортних систем із залученням носіїв. От-
же, говорячи про ступінь проходження будь-якої речовини
через гематоенцефалічний бар’єр, мають на увазі проник-
нення через описані бар’єри і транспортування за допомо-
гою систем ендотеліальних клітин.
Проходження речовин з головного мозку у кров відріз-
няється від руху у протилежному напрямі і є набагато віль-
нішим завдяки основному потоку СМР у венозне русло че-
рез ворсинки павутинної оболонки (див. вище). До того ж, у
стінці капілярів є трансферні системи, опосередковані носія-
ми, які забезпечують переважний рух речовин з мозку у кров.
Проникнення речовин у головний мозок
Вода, СО2 та О2 легко проникають у мозок. Те ж можна
сказати про вільні жиророзчинні сполуки та стероїдні гор-
мони, тоді як їхні форми, зв’язані з білками, та загалом усі
білки і поліпептиди не можуть туди проникнути. Легка
пенетрація СО2 протистоїть повільному проникненню Н+
Периваскулярні
проміжки
Мозок
Внутрішня
пластинка черепа
Тверда мозкова
оболонка
Артерії
М’яка оболонка
Субдуральний
(потенційний)
простір
Павутинна
оболонка
Зовнішня
пластинка черепа
Трабекулярна
кістка
Субарахноідний
простір
Арахноїдальні
трабекули
Рис. 32-4. Розміщення оболонок головного мозку та їхнє спів-
відношення з черепом і тканиною мозку (відтворено за доз-
волом з Мізеаіег РК еі аі: РипсііопаІ Нівіоіоду. СіїигсІзіІІ І_мпд-
8ЇОПЄ, 1979).
та НСО3 , що має фізіологічне значення для регулювання
дихання (див. Розділ 36).
Глюкоза є головним джерелом енергії для нервових клі-
тин. Вона повільно проходить через гематоенцефалічний
бар’єр, водночас її транспортує через капілярні стінки
транспортна молекула 6ЕГГГ 1. У головному мозку міс-
титься дві молекули 6ПЛ 1: 6ШТ 1 55 К та ОЬІ}Т 1 45 К.
Обидві вони кодовані тим самим геном, однак відрізня-
ються за ступенем глюкозування. 6ПЯ 1 55 К є у високій
концентрації в мозкових капілярах (рис. 32-6). У дітей з
вродженою недостатністю ОШІТ 1 простежується низь-
кий рівень глюкози в СМР за нормального її рівня в плазмі,
що супроводжується судомами та сповільненим розвитком.
Іншою транспортною системою у мозкових капілярах
є унікальні Ка’-К?-2С1 -котранспортери, стимульовані ЕТ-
1 і ЕТ-3 та, імовірно, індуковані гуморальними факторами
астроцитів. Це допомагає підтримувати концентрацію К+
у мозку на низькому рівні. Крім того, є транспортери для
тиреоїдних гормонів, декількох органічних кислот, холіну,
попередників нуклеїнових кислот та нейтральних, лужних
і кислих амінокислот.
КРОВООБІГ В ОКРЕМИХ ДІЛЯНКАХ ОРГАНІЗМУ / 563
Рис. 32-5. Проникнення сечовини у м’яз (1), головний мозок
(2), спинний мозок (3) та спинномозкову рідину (4). Сечовину
вводили шляхом постійної інфузії (модифіковано та відтво-
рено за дозволом з КІеетап СК, Оаузоп Н, і_єуіп Е: ІІгеа
(гапзрогі іп Фе сепігаї пеп/оиз зузіет. Ат 3 РЬузіоІ 1962;203:
739).
Олігодендроглія
0ШТ1
45К
• 6ШТ З
□ 6ШТ 1 55К
6ИЯ 1 45К
Нейрон
Мікроглія
ОЬІІТЗ
СШТ5
Просвіт
капіляра
Рис. 32-6. Розміщення різних транспортерів 6І_ІІТ у голов-
ному мозку (відтворено за дозволом з Магіег Р, \/апписсі 83,
Зітрзоп ІА: ОІисозе ігапзрогіег ргоіеіпз іп Ьгаіп. РА8ЕВ З
1994;8:1003).
Астроглія
6ШТ 1
55К (
Ендотеліальна
клітина
Навколошлуночкові органи
Після введення у плазму білків, зв’язаних з барвниками,
забарвлюється багато тканин, однак речовина головного
мозку не є забарвленою. Це спостереження, зроблене
багато років тому, стало основою для створення концепції
гематоенцефалічного бар’єру. Однак чотири невеликі
ділянки у стовбурі мозку або біля нього забарвлюються
так само, як і тканини поза мозком. До них належать задня
частка гіпофіза (нейрогіпофіз) та прилегла вентральна
частина серединного горба гіпоталамуса, задня ділянка,
судинний орган кінцевої пластинки (СОКП, супраоп-
тичний перехрест) та субфорнікальний орган (СФО).
Ці відділи разом утворюють навколошлуночкові орга-
ни (рис. 32-7). Всі вони містять фенестровані капіляри і з
огляду на їхню проникність уважають, що вони перебу-
вають “поза гематоенцефалічним бар’єром”. Деякі з них
діють як нейрогемальні органи, тобто ділянки, де полі-
пептиди, секретовані нейронами, потрапляють у крово-
плин. Наприклад, окситоцин та вазопресин виділяються у
системний кровообіг у задній частці гіпофіза, а гіпофізо-
тропні гормони гіпоталамуса секретують у портальну гіпо-
фізарну систему у серединному горбі. Інші навколошлу-
ночкові органи містять рецептори для різних пептидів та
інших речовин і діють як хеморецепторні зони, тобто
ділянки, де речовини із крові, що циркулює, можуть зумо-
вити зміни функції мозку, обминаючи гематоенцефалічний
бар’єр. Задня ділянка є хеморецепторною зоною, що спри-
чинює блювання у відповідь на зміни хімічного складу
плазми (див. Розділ 14). Вона також пов’язана з регулю-
ванням серцево-судинної системи, і у багатьох випадках
циркулювальний ангіотензин II діє на задню ділянку, зумов-
люючи підвищення артеріального тиску. Ангіотензин II діє
також на СФО та, можливо, на СОКП, посилюючи спожи-
вання води. Крім того, виявилось, що СОКП є ділянкою
розміщення осморецепторів, які контролюють секрецію
вазопресину (див. Розділ 14); є дані про те що ІЛ-1 крові
спричинює гарячку, впливаючи на навколошлуночкові
органи.
Субкомісуральний орган (див. рис. 32-7), щільно зв’яза-
ний з епіфізом, за гістологічною будовою нагадує навко-
Рис. 32-7. Навколошлуночкові органи. Нейрогіпофіз (НГ); су-
динний орган кінцевої пластинки (СОКП, супраоптичний
перехрест), субфорнікальний орган (СФО), та задня ділянка
(ЗД) показані у сагітальному перерізі мозку людини; СКО -
субкомісуральний орган; Е - епіфіз.
564 / РОЗДІЛ 32
лошлуночкові органи. Однак у ньому нема фенестрованих
капілярів, не зафіксовано високої проникності, і основна
функція не визначена. Шишкоподібна залоза та передній
гіпофіз містять фенестровані капіляри та перебувають поза
гематоенцефалічним бар’єром, однак обидва органи нале-
жать до ендокринних залоз і не є частиною головного
мозку.
Функція гематоенцефалічного бар’єру
Гематоенцефалічний бар’єр, імовірно, забезпечує ста-
більність мікрооточення нейронів у центральній нервовій
системі. Ці нейрони настільки залежать від концентрації
К+, Са2+, М§2+, Н+ та інших йонів у рідині, яка оточує їх, що
навіть незначні зміни ведуть до серйозних наслідків. Ста-
лий склад ПКР у всіх частинах тіла підтримують множинні
гомеостатичні механізми (див. Розділи 1 та 39), однак з
огляду на чутливість кіркових нейронів до змін йонного
складу немає нічого дивного у наявності додаткового
захисного механізму для їхнього збереження. Аналогічно,
гематотестикулярний бар’єр захищає склад рідини, що ото-
чує гермінативний епітелій, а плацентарний бар’єр - склад
тканинної рідини плоду.
До інших можливих функцій гематоенцефалічного
бар’єру можна зачислити захист мозку від ендо- та екзо-
генних токсинів у крові та запобігання потраплянню ней-
ротрансмітерів у загальний кровообіг.
Розвиток гематоенцефалічного бар’єру
В експериментальних тварин багато дрібних молекул
проникають у мозок легше в пери- та неонатальний періо-
ди, ніж у зрілої особини. На цьому ґрунтується твердження
про те, що гематоенцефалічний бар’єр у новонародженого
є незрілим. Люди під час народження є зрілішими, ніж щурі
та інші види експериментальних тварин, проте точних
даних про пасивну проникність гематоенцефалічного бар’-
єру у людини немає. Однак у дітей з вираженою жовтяни-
цею, високим рівнем вільного білірубіну у плазмі та незрі-
лою системою кон’югації білірубіну у печінці вільний білі-
рубін проникає в мозок і за наявності асфіксії вражає
базальні ганглії (керніктерус, ядерна жовтяниця). Еквіва-
лентом цього стану у пізнішому періоді життя є синдром
Криглера-Найяра, за якого простежується вроджена недос-
татність глюкуронілтрансферази. У таких осіб може бути
дуже високий рівень вільного білірубіну у крові з наступ-
ним розвитком енцефалопатії. У разі інших станів рівень
вільного білірубіну недостатньо високий для спричинення
ушкоджень тканини мозку.
Клінічне значення
Лікарі повинні знати ступінь проникнення ліків у голов-
ний мозок для того, щоб лікувати захворювання нервової
системи грамотно. Проникнення медикаментів, як і інших
речовин, залежить від багатьох факторів. Наприклад, деякі
антибіотики проникають у мозок дуже обмежено, тоді як
інші - досить легко. З клінічних спостережень відомо, що
аміни дофамін та серотонін проникають у тканину мозку
незначно, а їхні кислотні попередники - Ь-ДОФА та 5-гід-
рокситриптофан - порівняно легко (див. Розділи 12 та 15).
Інше важливе клінічне спостереження таке: гематоен-
цефалічний бар’єр може руйнуватись у зонах інфекційного
та іншого ушкодження. Пухлинний ріст супроводжується
утворенням нових судин, і новоутворені капіляри не мають
контактів з нормальними астроцитами. Тому не форму-
ються щільні контакти, і судини можуть бути навіть фене-
строваними. Відсутність бар’єру допомагає визначити
локалізацію пухлини; такі сполуки, як значений йодом аль-
бумін, проникають у нормальну тканину мозку дуже повіль-
но, а у пухлинну - швидко. Тому пухлина є ніби “островом
радіоактивності” серед навколишньої нормальної тканини
мозку. Гематоенцефалічний бар’єр може бути також тим-
часово зруйнований у разі раптового значного підвищення
артеріального тиску або внутрішньовенного введення
гіпертонічних розчинів.
МОЗКОВИЙ КРОВОПЛИН
Метод Кеті
Згідно із принципом Фіка (див. Розділ 29) кровоплин у
будь-якому органі можна виміряти шляхом визначення
кількості конкретної речовини (рх), видаленої з кровопли-
ну органом за одиницю часу, поділеної на різницю між
концентрацією речовини в артеріальній та венозній крові
з цього органа (Ах - Ух). Отже,
Мозковий кровоплин (МК) = —.
Ах _ Чс
Це можна виміряти клінічно, застосовуючи вдихання
1Ч2О (метод Кеті). Середній мозковий кровоплин у молодих
осіб становить 54 мл/100 г/хв. У середньому маса мозку
дорослої людини - близько 1400 г, тому кровоплин через
весь мозок становить 756 мл/хв. Важливо зазначити, що
метод Кеті дає змогу визначити середні показники для
ділянок з нормальною перфузією, однак він не дає інфор-
мації про різницю кровоплину і, оскільки він залежить від
поглинання М2О, то вимірюється кровоплин тільки у ділян-
ках перфузії головного мозку. Якщо ж притік крові до
певної ділянки порушений (оклюзія), то змін у вимірю-
ваннях кровоплину не буде, бо у ділянках, де немає перфу-
зії, ЬЇ2О не поглинається.
Кровоплин у різних частинах головного
мозку
Значним досягненням останніх років була розробка
техніки моніторингу регіонального плину крові у живому
організмі зі збереженою свідомістю. Серед найдорожчих
методів є позитронна емісійна томографія (ПЕТ) та спо-
ріднені технології, за яких використовують короткоживучі
ізотопи для позначення сполуки, яку визначають, та спо-
луки, яку вводять. Надходження та виведення позначеної
сполуки фіксують батареєю сцинтиляційних детекторів,
розміщених на голові. Дані з детекторів переходять до ком-
п’ютера і можуть бути зображені на дисплеї або кольоро-
вому телевізійному екрані так, що колір, який відповідає
розміщенню певного детектора, є пропорційним до плину
крові, який визначають. Оскільки плин крові залежить від
рівня метаболізму, то місцеве поглинання 2-деоксиглюкози
теж є добрим показником кровоплину (див. далі та Розділ
8). Якщо 2-деоксиглюкозу позначити позитронним еміте-
КРОВООБІГ В ОКРЕМИХ ДІЛЯНКАХ ОРГАНІЗМУ / 565
ром з коротким періодом півжиття, таким як 18Е, ИО або
І5О, то її концентрацію можна виміряти у будь-якому відділі
головного мозку. Іншим важливим методом є ядерно-
магнітний резонанс (ЯМР). ЯМР ґрунтується на визначенні
резонансних сигналів із різних тканин у магнітному полі.
Оскільки відновлений гемоглобін стає парамагнітним, то
він збуджує сигнали, що надходять від крові. Отже, можна
визначити рівень оксигенованого та неоксигенованого
гемоглобіну з наступним показником кровоплину (функцій-
ний ядерно-магнітний резонанс; фЯМР). Розділення за
фЯМР сьогодні є ліпшим, ніж у разі ПЕТ.
У стані спокою середній кровоплин у сірій речовині
становить 69 мл/100 г/хв порівняно з 28 мл/10 г/хв у білій
речовині. Цікавою особливістю функції головного мозку
є значна варіабельність локального кровоплину у разі змін
активності мозку. Приклади показані на рис. 16-1 та 32-8.
В осіб, що прокинулись, однак перебувають у стані спокою,
найбільший кровоплин простежується у премоторній та
лобовій ділянках. Це відділи мозку, що пов’язані з коду-
ванням та аналізом зовнішньої інформації та з інтелекту-
альною активністю. Під час свідомого стискання правої
руки кровоплин збільшується у відділах лівої моторної
кори, що відповідають за руку, та у відповідних чутливих
ділянках постцентральної звивини. Якщо ж рухи, які
потрібно виконати, є послідовними, то кровоплин збіль-
шується у додаткових моторних ділянках. Коли людина
розмовляє, фіксують двобічне посилення кровоплину у
чутливих та моторних відділах, що відповідають обличчю,
язику та ротовій порожнині, а також у верхній премоторній
корі у категорійній (звичайно лівій) півкулі. Якщо мова
стереотипна, то у центрах Брока та Верніке не буде поси-
леного кровоплину, а якщо вона буде з елементами твор-
чості, тобто новими ідеями, то кровоплин посилиться в
обох ділянках. Читання зумовлює поширене посилення
кровоплину. Вирішення завдань, пошук причин та моторні
уявлення без рухів зумовлюють посилений кровоплин в
окремих ділянках премоторної та фронтальної кори. Під
час виконання завдань, пов’язаних з пізнанням, багато діля-
нок мозку активуються попередньо, так ніби мозок ство-
рює внутрішню модель запланованого завдання. У правшів
кровоплин до лівої півкулі буде більшим, якщо відбувається
виконання словесного завдання, і відповідно, - до лівої,
якщо завдання просторове.
ПЕТ та фЯМР використовують для вивчення різних за-
хворювань. Гіперемія охоплює епілептичні вогнища під
час судом, тоді як в інших відділах кровоплин послаблений.
Між судомами кровоплин у вогнищах інколи послаблю-
ється, що спричинює судоми. У хворих із симптомами
агнозії (див. Розділ 16) простежується послаблений крово-
плин у тім’яно-потиличних ділянках. У разі хвороби Альц-
геймера найбільш ранніми ознаками є зниження рівня
метаболізму та кровоплину у верхніх відділах кори тім’яної
частки з наступним поширенням на кору скроневої та лобо-
вої часток. Простежується відносне збереження пре- та
постцентральних звивин, базальних гангліїв, таламуса, стов-
бура мозку і мозочка. У випадку хореї Гентінґтона фіксу-
ють двобічне послаблення притоку крові до хвостатого яд-
ра, і ці зміни розвиваються на ранніх стадіях захворюван-
ня. У разі маніакально-депресивних станів (біполярних
афективних станів), на відміну від уніполярної депресії,
простежується загальне послаблення кровоплину в корі у
стадії депресії. Є дані про те, що у випадку шизофренії кро-
воплин послаблюється у лобових та скроневих частках і
базальних гангліях. У хворих на мігрень під час аури дво-
бічне послаблення плину крові починається у корі потилич-
них часток і поширюється на скроневі та тім’яні частки.
Мозковий судинний опір
Мозковий судинний опір (МСО) дорівнює мозковому
перфузійному тиску, поділеному на мозковий кровоплин.
МСО у лежачому стані, ймовірно, можна обчислити на
підставі середнього тиску плечової артерії (не враховуючи
порівняно низького мозкового венозного тиску) без значної
похибки. Визначений таким способом нормальний МСО
становить приблизно 10 К-одиниць на 1 кг мозку (7,2 Я-
одиниці на весь мозок) (див. табл. 32-1).
РЕГУЛЮВАННЯ МОЗКОВОГО КРОВООБІГУ
Незважаючи на значні зміни мозкового кровоплину
залежно від нервової активності, мозковий кровообіг регу-
Рис. 32-8. Активність головного мозку людини відображена на п’яти різних горизонтальних рівнях тоді, коли суб’єкт підбирав
відповідні дієслова до іменників, запропонованих дослідником. Інтелектуальне завдання привело до активування лобової
частки кори (рівні 1-4), передньої частини поясної закрутки (рівень 1) та задньої частини скроневої частки (рівень 3) з лівого
боку та мозочка (рівні 4 і 5) з правого боку. Світлий колір - помірне активування; темний колір - значне активування.
566 / РОЗДІЛ 32
льований так, що загальний кровоплин є порівняно ста-
більним. Фактори, задіяні у регулюванні плину крові, пока-
зані на рис. 32-9.
Роль внутрішньочерепного тиску
У дорослих головний і спинний мозок та спинномозкова
рідина разом із мозковими судинами розміщені у щільній
(ригідній) кістковій структурі. Порожнина черепу в нормі
містить мозок масою близько 1400 г, 75 мл крові та 75 мл
спинномозкової рідини. Оскільки тканина мозку та СМР
не можуть стискатись, об’єм крові, спинномозкової рідини
та мозку весь час повинні бути незмінними (доктрина
Монро-Келльє). Важливо, що мозкові судини стискаються
у всіх випадках підвищення внутрішньочерепного тиску.
Будь-які зміни венозного тиску одразу зумовлюють такі ж
зміни внутрішньочерепного. Отже, підвищення венозного
тиску послаблює мозковий кровоплин шляхом зниження
ефективного перфузійного тиску та стискання мозкових
судин. Ці взаємодії допомагають компенсувати зміни
артеріального тиску на рівні голови. Наприклад, якщо тіло
рухається догори з прискоренням (позитивне £), то кров
рухається до ніг, і артеріальний тиск на рівні голови
знижується. Однак венозний та внутрішньочерепний тиски
також знижуються, внаслідок чого тиск на судини
зменшується і плин крові змінюється набагато слабше, ніж
можна було б передбачити. І навпаки, під час прискореного
руху донизу сила, що діє на голову (негативне £), підвищує
артеріальний тиск на рівні голови, однак водночас
підвищується й внутрішньочерепний тиск, тому судини не
розриваються. Мозкові судини підтримуються напруже-
ними під час дефекації та пологів таким же способом.
Вплив змін внутрішньочерепного тиску на
системний тиск крові
Якщо внутрішньочерепний тиск підвищується більше
ніж на 33 мм рт. ст. за короткий період, то мозковий кро-
Внутрішньо-
черепний
тиск
/ Череп
Місцева
констрикція
та дилятація
мозкових
артеріол
Середній
артеріальний тиск на
рівні головного мозку
В’язкість крові
Середній венозний тиск
на рівні головного мозку
Хребетний
стовп
Головний мозок,
спиннии мозок та
спинномозкова рідина
Рис. 32-9. Схематичний підсумок чинників, що впливають на
мозковий кровообіг.
воплин значно послаблюється. Ішемія, що виникає внас-
лідок цього, стимулює вазомоторний центр (див. Розділ
31), і системний тиск крові підвищується. Механізми регу-
лювання, забезпечувані блукаючим нервом, спричинюють
брадикардію. Простежується також сповільнене дихання.
Підвищення тиску крові, описане Кушінгом (інколи його
називають рефлексом Кушінґа) допомагає підтримувати
мозковий кровоплин. У широких межах підвищення сис-
темного тиску крові пропорційне до підвищення внутріш-
ньочерепного тиску, хоча досягається рівень, після якого
зміни внутрішньочерепного тиску випереджають зміни
артеріального, й інтенсивність мозкового кровообігу змен-
шується.
Авторегулювання
Авторегулювання мозку є важливим (рис. 32-10). Цей
процес, за допомогою якого плин крові до багатьох тканин
підтримується на порівняно сталому рівні, незважаючи на
різний перфузійний тиск, описаний у Розділі 31. У мозку
шляхом авторегулювання підтримується нормальний моз-
ковий кровоплин, якщо артеріальний тиск становить 65-
140 мм рт. ст.
Роль вазомоторних та чутливих нервів
Іннервація великих мозкових кровоносних судин пост-
гангліонарними симпатичними та парасимпатичними нер-
вами та додаткова дистальна іннервація чутливими нер-
вами описана вище. Роль цих нервів є темою дискусій.
Суперечливі погляди й щодо генерування потенціалу дії у
норадренергічних нервах за значного підвищення тиску
крові. Це послаблює остаточне пасивне збільшення плину
крові, що виникає в такій ситуації та допомагає захистити
гематоенцефалічний бар’єр від можливого ушкодження
(див. вище).
Отже, вазомоторні механізми впливають на авторегу-
лювання. У випадку симпатичного стимулювання ділянка
однакових показників, або плато, показаних на рис. 32-10,
зміщується праворуч, тобто значне підвищення тиску може
відбуватись без посилення кровоплину. З іншого боку, вазо-
дилататор гідралазин та інгібітор АСЕ каптоприл зменшує
довжину плато.
100
50
______________І_____________і____________
70 140
Атреріальний тиск, мм рт. ст.
Рис. 32-10. Авторегулювання мозкового кровоплину (МК) у
стані спокою. Штрихова лінія відображає ушкодження, зу-
мовлене симпатичним стимулюванням під час авторегулю-
вання.
КРОВООБІГ В ОКРЕМИХ ДІЛЯНКАХ ОРГАНІЗМУ / 567
МЕТАБОЛІЗМ У ГОЛОВНОМУ МОЗКУ І
ПОТРЕБИ КИСНЮ
Поглинання та виділення речовин
головним мозком
Якщо відомий мозковий кровообіг, то можна обчислити
поглинання чи виділення мозком О2, СО2, глюкози або будь-
якої іншої речовини, що міститься у крові. Для цього по-
трібно помножити значення мозкового кровоплину на різ-
ницю концентрацій речовини в артеріальній крові та у
мозковій венозній крові (табл. 32-3). Негативне значення
означає, що головний мозок виділяє цю речовину.
Поглинання кисню
Поглинання кисню мозком людини (мозковий метабо-
лічний рівень О2; ММР О2) коливається близько 3,5 мл/
100 г мозку/хв (49 мл/хв для всього мозку) у дорослого. Ці
цифри становлять приблизно 20% від загального погли-
нання кисню організмом у стані спокою (див. табл. 32-1).
Мозок надзвичайно чутливий до гіпоксії, і зупинка крово-
постачання призводить до втрати свідомості протягом 10 с.
Вегетативні структури у стовбуровій частині є стійкішими
до гіпоксії, ніж кора, і хворі можуть одужувати, наприклад,
після серцевих нападів та інших станів, що спричинюють
тривалу гіпоксію, зі збереженням вегетативних функцій
та значною незворотною втратою інтелектуальних мож-
ливостей. У базальних гангліях рівень поглинання кисню
дуже високий, і симптоми хвороби Паркінсона з порушен-
нями функції мислення можуть бути зумовлені хронічною
гіпоксією. Таламус та нижні горбки теж дуже чутливі до
гіпоксичного ушкодження.
Джерела енергії
Глюкоза є найважливішим джерелом енергії для мозку;
у нормальному стані 90% енергії, потрібної для підтримки
йонних градієнтів біля мембран та передавання електрич-
них імпульсів, надходять із цього джерела. Глюкоза потрап-
ляє у мозок за допомогою ОЬСГТ 1 у мозкових капілярах
(див вище). Інші транспортні молекули розподіляють її між
нейронами та гліальними клітинами.
Глюкоза захоплюється із крові у значній кількості, і
дихальний коефіцієнт (див. Розділ 17) у тканині мозку
становить 0,95-0,99 у нормі. Загалом споживання глюкози
у стані спокою відповідає кровоплину та споживанню кис-
ню. Це не означає, що глюкоза є єдиним джерелом енергії.
Під час тривалого голодування простежується значне
поглинання інших речовин. Справді, є дані, що 30% глю-
кози, спожитої у нормальних умовах, перетворюється в
амінокислоти, жири та білки, а інші речовини метаболі-
зують задля енергії під час конвульсій. Можливе також
поглинання амінокислот крові, незважаючи на те, що арте-
ріовенозна різниця кількості амінокислот у мозку міні-
мальна. Більшість клітин мозку не потребують інсуліну для
поглинання глюкози.
Наслідки гіпоглікемії для функції нервової системи опи-
сані у Розділі 19.
Видалення глютамату й аміаку
Поглинання мозком глютамату приблизно врівноважене
виділенням глютаміну. Глютамат, потрапляючи у мозок,
Таблиця 32-3. Поглинання та виділення речовин у
головному мозку дорослої людини іп УІУО
Речовина Поглинання (+) або виділення (-) на 100 г мозку/хв Загальний/хв
Речовини, що поглинаються Кисень +3,5 мл +49 мл
Глюкоза +5,5 мг +77 мг
Глутамат +0,4 мг +5,6 мг
Речовини, що виділяються Двоокис вуглецю -3,5 мл -49 мл
Глютамін -0,6 мл -8,4 мг
Речовини, що не використовуються та не утворюються
у стані ситості: лактат, піруват, загальні кетони, ос-кетоглю-
тарат
сполучається з аміаком та виділяється у вигляді глютаміну
(див. Розділ 17). Перетворення глютамат-глютамін у мозку
- протилежне до процесу у нирках, де утворений аміак
проникає у канальці - ймовірно, слугує детоксикаційним
механізмом для вивільнення мозку від аміаку. Аміак дуже
токсичний для нервових клітин, і отруєння аміаком є основ-
ною причиною різноманітних неврологічних симптомів у
разі печінкової коми.
Інсульт
За порушеного кровопостачання у ділянці мозку ішемія
призводить до ушкодження або загибелі клітин у цій зоні,
спричинюючи симптоми інсульту. Розрізняють два головні
типи інсультів: геморагічний та ішемічний. Геморагічний
інсульт виникає внаслідок розривання мозкової артерії або
артеріоли, іноді, однак не завжди, у місці розташування
невеликої аневризми. Ішемічний інсульт буває, коли плин
крові у судині зменшується з огляду на наявність атеро-
склеротичної бляшки, ускладненої тромбозом. Тромби,
крім того, можуть утворюватись і в інших місцях (у перед-
серді в хворих з фібриляцією передсердь) та проникати у
мозок як емболи.
Донедавна мало що можна було зробити для поліпшен-
ня перебігу інсульту та його наслідків. Однак сьогодні вже
зрозуміло, що у ділянці, яка оточує зону найбільшого
ушкодження, ішемія послаблює поглинання глютамату, а
локальне збільшення кількості спричинює ексцитоток-
сичне ушкодження та загибель нейронів (див. Розділ 4).
Препарати, що попереджують ексцитотоксичне ушкоджен-
ня, значно зменшують наслідки інсульту. Крім того, тром-
болітичні медикаменти, такі як і-РА (див. Розділ 27), є
ефективними. Обидва види лікування - ексцитотоксичне
та і-РА - потрібно застосовувати якнайшвидше для забез-
печення максимального ефекту, тому інсульт сьогодні роз-
цінюють як стан, за якого вчасна діагностика та лікування
особливо важливі. Крім того, звичайно, потрібно визна-
чити характер інсульту - ішемічний чи геморагічний,
оскільки в разі геморагічного тромболізис протипоказа-
ний.
568 / РОЗДІЛ 32
КРОВООБІГ У ВІНЦЕВИХ СУДИНАХ
Анатомічні особливості
Обидві вінцеві артерії, що постачають кров у міокард,
відходять від синусів позаду двох стулок аортального
клапана в корені аорти (рис. 32-11). Вихрові потоки три-
мають клапани на відстані від ділянок відходження артерій,
і вони є доступними протягом усього серцевого циклу. У
50% осіб кровоплин є більшим у правій вінцевій артерії, у
20% - у лівій, а в 30% він однаковий в обох судинах. Більша
частина венозної крові відтікає до серця через вінцевий
синус та передні серцеві вени (рис. 32-12), які дренують у
праве передсердя. Крім того, є інші судини, що випорож-
нюються прямо у камери серця. До цієї групи належать
артеріосинусоїдні судини, синусоїдні капіляроподібні
судини, що з’єднують артеріоли з камерами, тебезієві вени,
що з’єднують капіляри і камери, та декілька артеріо-
люмінальних судин, які є дрібними артеріями, дренова-
ними прямо у камери. Між вінцевими та позасерцевими
артеріолами є декілька анастомозів, особливо біля входу
великих артерій. Анастомози між вінцевими артеріями у
людини пропускають часточки, діаметр яких до 40 мкм,
однак є дані про те, що у хворих з коронарною хворобою
ці канали розширюються.
Градієнт тиску та плин крові
у вінцевих судинах
У серцевому м’язі, як і в скелетному, під час скорочення
відбувається перетискання судин. Тиск у лівому шлуночку
є дещо вищим, ніж в аорті під час систоли (табл. 32-4).
Отже, плин крові відбувається в артеріях, що постачають
субендокардіальні ділянки лівого шлуночка, тільки під час
діастоли, хоча у поверхневих ділянках міокарда лівого
шлуночка сила досить розсіяна для того, щоб забезпечити
проходження крові через цю зону протягом серцевого цик-
лу. Оскільки діастола стає коротшою за вищої частоти
серцевих скорочень, то вінцевий кровоплин через ліву
вінцеву артерію послаблюється в разі тахікардії. З іншого
боку, різниця тиску між аортою та правим шлуночком, а
також різниця між аортою та передсердям є дещо біль-
шими під час систоли, ніж під час діастоли. Отже, вінцевий
кровоплин у цих частинах серця не буде значно послаб-
люватись під час систоли. Кровоплин у правій та лівій він-
цевих артеріях показаний на рис. 32-13. Відсутність кро-
воплину у субендокардіальних відділах лівого шлуночка
Таблиця 32-4. Тиск в аорті, лівому та правому шлуночках
під час ситоли та діастоли
Тиск, мм рт. ст. Різниця тиску, мм рт. ст., між аортою і
Аорта ЛШ1 ПШ1 ЛШ ПШ
Систола 120 121 25 -1 95
Діастола 80 0 0 80 80
1 ЛШ - лівий шлуночок, ПШ - правий шлуночок.
Права вінцева Ліва вінцева
Рис. 32-11. Вінцеві артерії та їхні головні гілки у людини (від-
творено за дозволом з Возз 6: ТІзе сагсііоуазсиїаг зузіет. Іп:
Еззепііаіз ої Нитап РІіузіоІоду. Возз 6 [есіііог]. ¥еаг Воок
МебісаІ РиЬІізїіегз, 1978).
під час систоли спричинює чутливість до ішемічного
ушкодження. Ця ділянка найчастіше є місцем розвитку
інфаркту міокарда. Приплив крові до лівого шлуночка
послаблений у хворих зі стенозом отвору аортального кла-
пана, оскільки в разі цього захворювання тиск у лівому
шлуночку для виштовхування крові повинен бути набагато
вищим, ніж тиск у аорті. Отже, вінцеві судини є значно
стиснутими під час систоли. Хворі на таке захворювання
дуже чутливі до розвитку симптомів ішемії міокарда, част-
ково внаслідок цієї компресії, а частково тому, що міокард
потребує більше енергії для проштовхування крові через
звужений аортальний клапан. Вінцевий кровоплин також
послаблений, коли аортальний діастолічний тиск знижу-
ється. Підвищення венозного тиску за таких станів, як
Позавінцеві Вінцеві
Коронарний синус Тебезія
або передні /
серцеві вени /
Камери серця
Рис. 32-12. Схема вінцевого кровообігу.
КРОВООБІГ В ОКРЕМИХ ДІЛЯНКАХ ОРГАНІЗМУ / 569
Рис. 32-13. Плин крові у лівій та правій вінцевих артеріях під
час різних фаз серцевого циклу. Систола показана між двома
штриховими лініями (відтворено за дозволом з Вегпе РМ,
І_еуу МИ: РїіузіоІоду. МозЬу, 1983).
застійна серцева недостатність, послаблює вінцевий крово-
плин, оскільки він зменшує ефективний тиск вінцевої пер-
фузії.
Вінцевий кровоплин вимірюють шляхом уведення кате-
тера у вінцевий синус та застосування методу Кеті до серця
з урахуванням того, що вміст N20 у вінцевій венозній крові
є типовим для всієї крові, що проходить через міокард. У
людини в стані спокою він становить 250 мл/хв (5% від
серцевого викиду). Різні методи із застосуванням радіо-
нуклідів, радіоактивних міток, які можна виявити детек-
торами радіації поверх грудної клітки, використовують для
вивчення регіонарного кровоплину у серці та для вияв-
лення ділянок ішемії й інфаркту, а також для оцінки функції
шлуночків. Такі радіонукліди, як талій 201 (* 201Т1), потрап-
ляють у серцевий м’яз завдяки №+-К+-АТФ-азі та врівно-
важуються з внутрішньоклітинним пулом К+. Протягом
перших 10-15 хв внутрішньовенного введення розподіл
201Т1 прямо пропорційний до кровоплину в міокарді, і
ділянки ішемії можна виявити завдяки їхньому низькому
поглинанню. Поглинання ізотопу часто визначають одразу
після навантаження і через декілька годин після нього для
того, щоб виявити ділянки, де напруження спричинило
найвираженіші зміни кровоплину. На відміну від цього,
радіофармацевтичні сполуки, такі як олов’яний пірофосфат
технеціуму 99т (99тТс-Р¥Р), селективно поглинаються у
зоні інфаркту завдяки незрозумілим механізмам і дають
змогу виявляти інфаркт як “гарячі плями” на сцинтіоска-
нограмах грудної клітки. Вінцеву ангіографію можна ком-
бінувати з вимірюванням вимивання 133Хе (див. вище) для
детального аналізу вінцевого кровоплину. Радіонепроник-
ний контраст спочатку вводять у вінцеві артерії, після чого
застосовують рентгенівське опромінення для виявлення
його розподілу. Ангіографічну камеру можна заміняти
багатокристалічною сцинтиляційною камерою для подаль-
шого вимірювання вимивання 133Хе. Приклад нормального
розподілу крові після введення сполуки у ліву вінцеву арте-
рію показано на рис. 32-14.
Варіанти вінцевого кровоплину
У стані спокою серце споживає 70-80% кисню з кожної
одиниці крові, що надходить (див. табл. 32-1). Значно під-
вищити споживання кисню можна тільки у разі збільшен-
ня кровоплину. Тому не дивно, що плин крові посилю-
ється з підвищенням рівня метаболізму в міокарді. Роз-
мір просвіту вінцевих судин та залежний від нього він-
цевий кровоплин пов’язані не тільки зі змінами тиску в
аорті, а й з хімічними та нервовими факторами. Крім того,
вінцевий плин крові значно зумовлений авторегулюван-
ням.
Рис. 32-14. Схема нормальної перфузії міокарда людини після
ін’єкції 133Хе у ліву головну вінцеву артерію. Гілки артерії
показані кольором, а їхня кількість та площа відповідають
показникам кровоплину (мл/100 г/хв) у ділянках під кожним
сцинтиляційним детектором; Огин - гілка, що огинає; ЛПН -
ліва передня низхідна артерія; ЛШ - лівий шлуночок (відтво-
рено за дозволом з Саппоп РЗ, еі аі: Еуаіиаііоп ої туосагсііаі
сігсиїаііоп \л/ііН гасііописіісіез. СагсІіоуазс Месі 1978;2:371).
570 / РОЗДІЛ 32
Хімічні фактори
Тісний взаємозв’язок між вінцевим плином крові та
споживанням О2 у міокарді свідчить про те, що один або
декілька продуктів метаболізму спричинює вінцеву вазо-
дилатацію. Факторами, які, ймовірно, причетні до цього,
є недостатність О2, підвищена локальна концентрація СО2,
Н , К4, лактату, простагландинів, аденінових нуклеотидів
та аденозину Можуть бути задіяні декілька вазодилата-
торних метаболітів. Асфіксія, гіпоксія та внутрішньовін-
цеві введення ціанідів посилюють вінцевий кровоплин на
200-300% як у денервованому, так і в інтактному серці.
Для всіх трьох станів спільним є наявність гіпоксії волокон
серцевого м’яза. Подібне посилення плину крові просте-
жується у ділянці міокарда, де просвіт відповідної вінцевої
артерії був спочатку обтурований, а потім вивільнений. Ця
реактивна гіперемія нагадує процес у шкірі (див. далі).
Вважають, що у серці це пов’язано із вивільненням аде-
нозину. Аденозин додатково з’являється для поліпшення
у разі ушкодження, зумовленого відновленням кровопли-
ну (див. Розділ 33).
Нервові фактори
Вінцеві артеріоли містять а-адренергічні рецептори, які
зумовлюють вазоконстрикцію, та (3-адренергічні рецеп-
тори, які забезпечують вазодилатацію. Активування норад-
ренергічних нервів серця та введення норадреналіну спри-
чинює вінцеву вазодилатацію. Однак норадреналін підви-
щує частоту та силу серцевих скорочень, а вазодилатація
розвивається вторинно завдяки утворенню вазодилататор-
них метаболітів у міокарді у відповідь на посилення їхньої
активності. Після того, як іно- та хронотропний ефекти
внаслідок імпульсації у норадренергічних нервах блоковані
р-адренергічними блокаторами, стимулювання норадре-
нергічних нервів або введення норадреналіну у неанестезо-
ваних тварин зумовлює вінцеву вазоконстрикцію. Отже,
прямим ефектом норадренергічного стимулювання є швид-
ше спазм, ніж розширення вінцевих судин. Подразнення
волокон блукаючого нерва призводить до розширення він-
цевих судин.
Зі зниженням системного тиску крові загальним ефек-
том від рефлекторного посилення імпульсації у норадре-
нергічних синапсах буде посилення вінцевого кровоплину
внаслідок метаболічних змін у міокарді тоді, коли судини
шкіри, нирок та внутрішніх органів скорочуються. Отже,
кровообіг у серці, подібно до мозку, підтримується,тоді як
в інших органах він послаблюється.
Захворювання вінцевих артерій
З послабленням плину крові через вінцеві артерії до
рівня, коли в міокарді розвивається гіпоксія, нагромаджу-
ється Р-фактор та розвивається стенокардія (див. Розділ
7). Якщо ішемія міокарда виражена і тривала, то у сер-
цевому м’язі настають незворотні зміни і внаслідок цього
- інфаркт міокарда. Інфаркт міокарда є частою причиною
смерті, особливо у розвинених країнах, з огляду на атеро-
склероз та гіперхолестеролемію. Ці взаємозв’язки описано
у Розділі 17. Причиною стенокардії звичайно є закупорення
щонайменше 75% просвіту вінцевої артерії. Кровоплин у
стані спокою нормальний, однак рівень, до якого він може
посилитись під час навантаження, обмежений. Якщо ж сте-
ноз досягає 85%, то простежується також зниження тиску
крові у стані спокою і схильність до тромбоутворення в
ділянці звуження. У разі тромбозу виникають такі процеси:
- спазм вінцевих артерій, транзиторна агрегація тромбо-
цитів у ділянці склерозу судини, а також розрив або гемо-
рагія в атеросклеротичну бляшку. Важливо зазначити, що
введення ацетилхоліну спричинює швидше констрикцію,
ніж дилатацію у ділянках стенозу вінцевих артерій, оскіль-
ки ушкодження ендотелію у стенозованих ділянках запо-
бігає утворенню N0, і простежується прямий констрик-
торний ефект ацетилхоліну на гладкі м’язи судин.
Крім високого рівня холестеролу у крові, фіксують
позитивну кореляцію між атеросклерозом вінцевих артерій
та рівнем циркулювального ліпопротеїну (а) (Ьр(а)). Ліпо-
протеїн Ьр(а) впливає на фібриноліз, пригнічуючи утво-
рення плазміну (див. Розділ 27). Виявлено також чіткі
корелятивні зв’язки з рівнем гомоцистеїну, що циркулює у
крові. Ця сполука ушкоджує ендотеліальні клітини. Вона
перетворюється у нетоксичний метіонін за наявності фола-
ту та вітаміну В12. Сьогодні тривають клінічні дослідження
з виявлення впливу забезпеченості фолатами та вітаміном
В12 на частоту коронарної хвороби.
Останнім часом значну увагу приділяють можливій ролі
запального компонента у розвитку атеросклерозу. У ділян-
ках атеросклеротичних змін міститься запальний інфільт-
рат і простежується цікава кореляція між антитілами, що
циркулюють у крові, до СкІатШіарпеитопіа та атероскле-
ротичних бляшок. Названий мікроорганізм містить у складі
плазматичної мембрани амінокислоти, послідовність яких
нагадує послідовність в а-міозинових тяжких ланцюгах
серця. Введення цих послідовностей спричинює авто-
імунне запалення та фіброз вінцевих артерій у мишей, при-
клад молекулярної мімікрії (див. Розділ 27).
Електричні зміни, що виникають у разі ішемії чи інфарк-
ту міокарда, та відповідні ознаки, які фіксують під час ЕКГ,
розглянуто у Розділі 28. Ішемізовані клітини, перш ніж
загинути, припиняють скорочення, і це припинення має»
гомеостатичний ефект - незворотні зміни виникають піз-
ніше. Причина втрати скоротливої активності не зрозуміла.
У собак, у яких кровоплин до ділянки міокарда був при-
пинений, через 20 хв починався некроз, однак він був неза-
вершеним через 3-6 год.
З ушкоджених клітин у кровообіг виділяються ензими.
Визначення підвищеної кількості ензимів та ізоензимів, що
їх виводять клітини в разі інфаркту міокарда, відіграють
важливу роль у діагностиці цього захворювання. До ензи-
мів, які найчастіше визначають сьогодні, належать МВ ізо-
мер креатинкінази (СК-МВ), тропонін Т та тропонін І.
Нітрати, наприклад нітрогліцерин, часто допомагають
припинити біль у випадку стенокардії. Ці сполуки при-
водять до утворення N0 та розширюють нормальні арте-
ріальні судини. Як зазначено вище, виділення N0 пору-
шується внаслідок атеросклеротичних змін судин. Однак
головним ефектом нітратів є розширення периферійних
ємнісних судин і, як наслідок, зменшене повернення веноз-
ної крові до серця. Це зменшує об’єм серцевого викиду,
внаслідок чого зменшується споживання О2 міокардом.
Окремі ділянки звуження вінцевих артерій виявляють
у разі артеріографії, їхню роль у порушеннях плину крові
можна послабити завдяки імплантації трансплантата (аор-
КРОВООБІГ В ОКРЕМИХ ДІЛЯНКАХ ОРГАНІЗМУ / 571
токоронарне шунтування). Ця процедура часто приво-
дить до стійкого припинення стабільної стенокардії. Остан-
ні дослідження свідчать, що така реваскуляризація поліп-
шує виживання клітин, частково шляхом відновлення ско-
рочень у нефункційному міокарді. Такий термін вико-
ристовують для опису ділянок міокарда з хронічними іше-
мічними змінами, які не є мертвими, проте не скорочу-
ються нормально, доки кровоплин не відновлений. Ці
зміни треба відрізняти від міокардіального приголом-
шення - короткочасної транзиторної постішемічної міо-
кардіальної дисфункції за нормального плину крові.
Під час лікування інфаркту міокарда головний акцент
сьогодні роблять на припиненні обструкції та/або лізисі
тромбу якомога швидше після початку болю для того, щоб
забезпечити реперфузію та запобігти незворотним змінам.
За однією із методик уводять катетер в уражену артерію,
де його використовують для розширення в ділянці конст-
рикції та формування тромбу (вінцева ангіопластика).
Однак цей метод має високу частоту повторних оклюзій у
віддалені терміни (понад 30% протягом року), що пов’я-
зано зі схильністю до утворення тромбу та гіперплазією
гладких м’язів у ділянці ушкодження ендотелію.
Іншим шляхом є лізис внутрішньовінцевого тромбу
внаслідок внутрішньовенного або внутрішньовінцевого
введення сполук, що продукують плазмін (див. Розділ 27).
Один із препаратів, який часто застосовують, - стрепто-
кіназа, білок із гемолітичного стрептокока, що перетворює
плазміноген у плазмін (див. Розділ 27). Інший літичний
фактор, що перетворює плазміноген у плазмін у тромбі, -
активатор плазміногена тканинного типу (і-РА), при-
родна протеаза, яку виробляють для використання у
медицині методами рекомбінантної ДНК. Перевага і-РА в
тому, що він переважно активує плазміноген, зв’язаний із
фібрином і, отже, спричинює фібринолізис у тромбі й
обмежує активування плазміногена в інших ділянках тіла.
Однак все ще нез’ясовано чи і-РА є ефективнішим, ніж
стрептокіназа, крім того, стрептокіназа значно дешевша.
В будь-якому випадку, якщо в разі розвитку інфаркту
міокарда літичний препарат уведено протягом перших
декількох годин після початку больового приступу, то
вінцева перфузія може бути поліпшена у більшості хворих.
У решти стан підтримують уведенням антитромботичних
та інших препаратів.
КРОВООБІГ У ВНУТРІШНІХ ОРГАНАХ
Кров з кишки, підшлункової залози та селезінки перехо-
дить через портальну вену у печінку, а з печінки через пе-
чінкові вени до нижньої порожнистої вени. Внутрішні ор-
гани та печінка одержують 30% об’єму серцевого викиду
через черевний стовбур, верхню та нижню мезентеріальні
артерії (рис. 32-15). Печінка одержує близько 1000 мл/хв з
портальної вени та 5000 мл/хв з печінкової артерії.
Кровообіг у кишці
До кишки надходить кров через декілька паралельних
шляхів з гілок верхньої та нижньої мезентеріальних артерій
вена
Аорта
Рис. 32-15. Кровообіг у внутрішніх органах. Зверніть увагу,
що до більшості внутрішніх органів кров надходить з пара-
лельних кіл, тоді як печінка отримує кров із печінкової артерії
та портальної вени. Показано середній кровоплин (мл/хв); Ч
- черевний стовбур; В - верхня мезентеріальна артерія; Н -
нижня мезентеріальна артерія.
(див. рис. 32-15). Між цими судинами є багато анастомозів,
однак блокада великої кишкової артерії все одно призво-
дить до інфаркту кишки. Приплив крові до слизової є
більшим, ніж до інших відділів стінки кишки, і залежить
від змін метаболічної активності. Отже, кровоплин у тонкій
кишці (і, відповідно, у портальній вені) подвоюється після
їжі, і це триває близько 3 год. Кровообіг у кишках має
розвинуте авторегулювання.
Кровообігу печінці
Між ендотеліальними клітинами у печінкових синусо-
їдах є великі проміжки, тому проникність у них висока.
Шлях, яким у печінці внутрішньопечінкові гілки печінкової
артерії та портальної вени переходять у синусоїди, а далі
- у центрочасточкові вени, показано на рис. 26-20 та 32-
16. Функційною одиницею печінки є ацинус. Кожний аци-
нус розміщений на кінці судинної ніжки, що містить кінцеві
гілки портальної вени, печінкових артерій та жовчних
проток. Кров рухається з центру цієї функційної одиниці
до кінцевих відділів печінкових вен на периферії (див. рис.
32-16). Ось чому центральні відділи ацинусів, які інколи
називають зоною 1, є добре оксигенованими, проміжна
зона (зона 2) помірно оксигенована, а периферійна зона
(зона 3) найменш оксигенована і найчутливіша до аноксич-
ного ушкодження. Печінкові вени переходять у нижню
порожнисту вену. Ацинуси формують гроноподібні утвори,
кожний на окремій ніжці. У печінці людини є близько
100 000 ацинусів.
У людини венозний тиск у портальній вені в нормі ста-
новить близько 10 мм рт. ст., а тиск у печінкових венах -
близько 5 мм рт. ст. Середній тиск у гілках печінкових арте-
рій, що переходять у синусоїди, приблизно 90 мм рт. ст.,
однак тиск у синусоїдах є нижчим, ніж у портальній вені,
тому простежується значне зниження тиску у печінкових
артеріолах. Таке зниження тиску забезпечене зворотною
572 / РОЗДІЛ 32
Рис. 32-16. Концепція ацинуса, як функційної одиниці печінки.
У кожному ацинусі кров по портальній вені та печінковій
артеріолі потрапляє у центр ацинуса та виходить назовні до
печінкової венули (відтворено за дозволом з І_аиЙ \ААА/, бгееп-
\л/ау СУ: СопсеріїїаІ гєуіє\л/ оїіКе ґіераііс уазсиїаг ЬесІ. Нераіо-
Іоду 1987;7:952).
Резервуарна функція кровообігу у
внутрішніх органах
У собак та інших ссавців у капсулі селезінки міститься
велика кількість гладких м’язів. У селезінці затримується
кров, і за допомогою ритмічних скорочень капсули плазма
переходить у лімфатичні судини. Тому у селезінці міститься
резервуар крові, багатої на клітини. Імпульсація у нор-
адренергічних нервах та адреналін призводять до сильних
скорочень селезінки і викиду крові у кровообіг. Ця функція
селезінки кількісно не є важливою у людини. Однак резер-
вуарна функція всього вісцерального кровообігу в цілому
важлива. Наприклад, 25-30% від об’єму печінки становить
кров. Скорочення ємнісних судин у внутрішніх органах
може забезпечити нагнітання літра крові в артеріальну
систему менш ніж за хвилину.
До інших резервуарів, що містять значний об’єм крові
в стані спокою, можна зачислити шкіру та легені. Під час
значного навантаження констрикція судин у цих органах
та зменшення “запасів” крові у печінці й інших відділах
внутрішніх органів, шкірі та легенях може збільшити об’єм
активної перфузії крові, що циркулює, на 30%.
КРОВООБІГ У ШКІРІ
залежністю між кровоплином у печінкових артеріях та
портатальних венах. Зворотна залежність простежується
завдяки підтриманню рівня кровоплину, за якого аденозин
виводиться з ділянок, що оточують артеріоли. Згідно з цією
гіпотезою аденозин виділяється у сталій кількості; зі змен-
шенням портального кровоплину він виводиться повіль-
ніше, а місцеве нагромадження аденозину веде до розши-
рення термінальних артеріол.
У стінках внутрішньопечінкових розгалужень порталь-
ної вени містяться гладкі м’язи, іннервовані норадренер-
гічними вазоконстрикторними нервовими волокнами, які
потрапляють у печінку через грудні вентральні корінці
(ТЬ3-ТЬИ) та вісцеральні нерви. Вазоконстрикторна іннер-
вація печінкової артерії пов’язана з печінковим симпатич-
ним сплетенням. Вазодилататорних волокон, що досягали
б печінки, не виявлено. В стані спокою кровообіг у перифе-
рійних відділах печінки сповільнений, і тільки в частині
органа простежується активна перфузія. З підвищенням
системного венозного тиску розгалуження портальної вени
пасивно розширюються і кількість крові у печінці збіль-
шується. У разі застійної серцевої недостатності застій у
печінкових венах може бути дуже вираженим. І навпаки, у
випадку дифузної імпульсації в норадренергічних волокнах
у відповідь на зниження системного тиску крові внутріш-
ньопечінкові розгалуження портальної вени звужуються,
портальний тиск підвищується і кровоплин через печінку
стає швидким, обминаючи більшу частину органа. Основна
частина крові з печінки потрапляє у системний кровообіг.
Констрикція печінкових артеріол відводить кров від печін-
ки, тоді як констрикція мезентеріальних артеріол послаб-
лює приплив портальної крові. Унаслідок вираженого шоку
кровоплин у печінці може бути послабленим до такого
рівня, що виникають вогнищеві некрози тканини.
Кількість тепла, яке втрачає організм, значно регульо-
вана різним кровоплином через шкіру (див. Розділ 14). У
пальцях, ступнях, долонях та мочках вух містяться добре
іннервовані анастомози між артеріолами та венулами (арте-
ріовенозні анастомози; див Розділ ЗО). Плин крові у відпо-
відь на терморегуляторні подразнення можуть змінюватись
у межах від 1 до 150 мл/100 г шкіри за 1 хв. Уважають, що
ці зміни можливі, оскільки кров шунтується через анасто-
мози. Субдермальні капіляри та венозне сплетення є важ-
ливим резервуаром крові, а шкіра - одним з декількох
місць, де реакції кровоносних судин можна спостерігати
візуально.
Білий дермографізм
Якщо гострим кінцем якогось предмета злегка провести
по шкірі, утворені лінії будуть блідими (білий дермогра-
фізм). Механічний подразник спричинює скорочення
прекапілярних сфінктерів, і кров виходить із капілярів та
дрібних вен. Відповідь з’являється протягом 15 с.
Потрійна відповідь
Якщо по шкірі провести предметом з гострим кінцем
сильніше, то замість білого дермографізму приблизно
через 10 с з’явиться ділянка почервоніння (червоний дер-
мографізм). Через декілька хвилин у цьому місці можна
виявити ознаки набряку та плямистого почервоніння
довкола ушкодження. Швидке почервоніння пов’язане з
дилатацією капілярів - пряма відповідь капілярів на тиск.
Набухання (пухир) - місцевий набряк, зумовлений підви-
щеною проникністю капілярів та посткапілярних венул з
наступною екстравазацією рідини. Почервоніння, що
поширюється від зони ушкодження (артеріальна гіпере-
мія), є наслідком розширення артеріол. Таку трикомпо-
КРОВООБІГ В ОКРЕМИХ ДІЛЯНКАХ ОРГАНІЗМУ / 573
нентну відповідь називають потрійною відповіддю, вона
є частиною нормальної реакції на ушкодження (див. Розділ
20) і простежується після повної симпатектомії. Артері-
альної гіперемії нема у разі місцевої анестезії та у денер-
вованій шкірі після дегенерації чутливих нервів. Однак її
фіксують одразу після блокади нерва чи його частини вище
місця ушкодження. Ці спостереження разом з іншими
даними підтверджують, що описана реакція зумовлена
аксон-рефлексом - відповіддю, за якої імпульси, генеро-
вані після ушкодження у чутливих нервах, поширюються
антидромно (у протилежному напрямі по інших розгалу-
женнях волокон чутливих нервів) (рис. 32-17). Це єдина
ситуація в організмі, за якої простежується фізіологічний
ефект завдяки антидромному проведенню. Збільшення
проникності судин у випадку утворення набряку пов’язане
частково з гістаміном або з гістаміноподібними сполуками,
що виділяються з місцевих мастоцитів та діють через Н]-
рецептори. Трансмітером, що виділяється у центральних
закінченнях чутливих С-волокон нейронів, є речовина Р
(див. Розділ 4). Речовина Р та СОКР наявні у всіх відділах
нейронів. Обидві сполуки розширюють артеріоли, а крім
того, речовина Р спричинює екстравазацію рідини. Сьо-
годні розроблено ефективні непептидні антагоністи речо-
вини Р, які зменшують вихід рідини із судини. Отже, у
розвитку набряку можна виділити пептидергічний та гіста-
мінергічний компоненти.
Реактивна гіперемія
Реакція кровоносних судин, що виникає у багатьох
органах, однак видима у шкірі, яку називають реактивною
гіперемією, - це збільшення кількості крові у ділянці, де
кровообіг є відновленим після періоду оклюзії. Якщо
порушується надходження крові до кінцівок, то артеріоли
шкіри нижче місця оклюзії розширюються. Після віднов-
лення кровообігу надходження крові у розширені судини
призводить до того, що шкіра стає вогняно-червоною. У
разі дифузії кисень проходить коротку відстань через шкіру,
і реактивна гіперемія не розвивається, якщо кровоплин у
кінцівці припиняється в атмосфері з 100% вмістом кисню.
Отже, дилатація артеріол пов’язана з місцевим впливом
гіпоксії.
Генерал ізовані реакції
Норадренергічне нервове стимулювання, адреналін та
норадреналін, що циркулюють, зумовлюють скорочення
кровоносних судин шкіри. Вазодилататорних нервів для
судин шкіри не виявлено, і вазодилатація відбувається
завдяки зниженню тонусу констрикторів, а також унаслідок
утворення брадикініну у потових залозах та вазодилата-
торних метаболітів. Колір шкіри і температура також зале-
жать від стану капілярів та венул. У холодній синій або
сірій шкірі скорочуються артеріоли та розширюються капі-
ляри, у теплій - розширюються і артеріоли, і капіляри.
Оскільки больовий подразник спричинює дифузну
імпульсацію у норадренергічних нервах, то больове ушкод-
ження у шкірі, крім потрійної відповіді, зумовлює генера-
лізовану вазоконстрикцію. Якщо під час фізичного наван-
таження температура тіла підвищується, то кровоносні
судини шкіри розширюються, незважаючи на продовження
імпульсації дії у норадренергічних синапсах інших частин
тіла. Дилатація судин шкіри у відповідь на підвищення
гіпоталамічної температури (див. Розділ 14) є потужною
рефлекторною відповіддю, що переважає іншу рефлек-
торну активність. Холод зумовлює вазоконстрикцію у шкі-
рі, однак за вираженого холоду поверхнева вазодилатація
може переважати. Така вазодилатація є причиною рум’ян-
ців на обличчі у холодну погоду.
Перебіг шоку є важчим у хворих з підвищеною темпе-
ратурою внаслідок вазодилятацїї у шкірі, таких пацієнтів
не треба зігрівати до рівня, після якого їхня температура
підвищується. Іноді це проблематично, оскільки сумлінна
людина, що доглядає хворого, чітко знає з книжок, що
“хворі з ушкодженнями повинні перебувати у теплі”, і вони
накривають ковдрами жертв нещасних випадків, що є у
шоковому стані.
КРОВООБІГ У ПЛАЦЕНТІ ТА ПЛОДІ
Кровообіг у матці
Кровоплин у матці відбувається паралельно до метабо-
лічної активності міометрія та ендометрія і підлягає цик-
лічним змінам, що добре корелюють з місячним циклом у
невагітних жінок. Функції спіральних та базилярних арте-
рій ендометрію під час місячної описані у Розділі 23. Під
час вагітності кровоплин швидко посилюється зі збільшен-
ням розміру матки (рис. 32-18). Продукування вазодила-
таторних метаболітів, без сумніву, відбувається у матці так
само, як і в інших активних тканинах. На ранніх термінах
вагітності різниця артеріовенозного О2 у матці невелика, з
огляду на що була запропонована гіпотеза, згідно з якою
естрогени спричинюють збільшення маткового кровопли-
574 / РОЗДІЛ 32
Рис. 32-18. Зміни кровообігу та кількості кисню у венозній
крові в матці під час вагітності (за Вагсгоїі Н. Модифіковано
за дозволом з Кееіе СА, МеіІ Е: Затзоп \Л/гідНґз Аррііеб Рїіузі-
оіоду, 12Ф еФ ОхїогсІ Сіпіу Ргезз, 1971).
ну в умовах підвищеної потреби тканини в О2. Однак навіть
зі збільшенням маткового кровоплину у 20 разів під час
вагітності розмір зародка збільшується набагато більше,
проходячи етапи розвитку від однієї клітини до плоду та
плаценти, які на момент пологів мають масу 4—5 кг. Унас-
лідок цього більше О2 поглинається з крові матки у пізніх
термінах вагітності, і насичення О, крові у матці зменшу-
ється. Безпосередньо перед пологами простежується різке
зменшення плину крові у матці, однак значення цього
процесу остаточно не з’ясоване.
Плацента
Плацента є “легенями плоду”. Її материнська частина
відіграє роль великого кров’яного синуса. У неї виступають
ворсинки фетальної частини, які містять дрібні гілки пуп-
кових артерії та вени плоду (рис. 32-19). Через кров плід
поглинає О„ а СО2 викидає у материнську систему крово-
обігу через стінки ворсинок подібно до обміну О2та СО, у
легенях. Та оскільки клітинний шар, що вкриває ворсинки,
товстіший та менш проникний, ніж альвеолярні перетинки
у легенях, то обмін значно менш ефективний. Плацента є
також шляхом, по якому поживні речовини потрапляють у
плід, а продукти обміну виходять у материнську кров.
Кровообіг плоду
Шляхи крообігу у плоду схематично показані на рис.
32-20. Близько 55 % серцевого викиду плоду проходить
через плаценту. Вважають, що кров у пупковій вені в
людини на 80% насичена О2 порівняно з 98% насиченням
в артеріальній системі дорослих. Венозна протока (рис.
Пупковий тяж
Пупкова
вена
Хоріон
Ворсинки
Хоріальна
пластинка
Ендометрій -
Міометрій
Рис. 32-19. Схема розрізу через плаценту людини, що відоб-
ражає шлях проникнення ворсинок плоду у материнські си-
нуси (відтворено за дозволом з Вепзоп КС: НапсІЬоок ої ОЬ-
зїеігісз апсі бупесоіоду, 811т еФ Мсбгам-НІІІ, 1983).
Амніон-----
Септа
Пупкові артерії
Міжворсинковий
простір
Спіральні —
артеріоли
Базальна —
пластинка
32-21) постачає частину цієї крові прямо у нижню
порожнисту вену, а решта змішується з портальною кров’ю
плоду. Портальний та системний кровообіг венозної крові
у плоду тільки на 26% насичений киснем, а насичення
змішаної крові у нижній порожнистій вені становить
близько 67%. Більша частина крові, що надходить у серце
через нижню порожнисту вену, одразу потрапляє у ліве
передсердя через відкрите овальне вікно. Основна частина
крові з верхньої порожнистої вени надходить у правий
шлуночок, а потім - у легеневу артерію. Опір у нерозправ-
лених легенях є високим, і тиск у легеневій артерії дещо
вищий, ніж в аорті, тому більша частина крові у легеневій
артерії проходить через артеріальну протоку в аорту. Цим
шляхом порівняно ненасичена киснем кров з правого
шлуночка надходить до тулуба та нижньої частини тіла
плоду, тоді як голова одержує більш оксигеновану кров з
лівого шлуночка. З аорти частина крові переходить у пуп-
кові артерії та назад у плаценту. Насичення О2 крові у ниж-
ній частині аорти та пупкових артерій плоду - приблизно
60%.
Газообмін плоду
Тканини плоду та новонародженого у ссавців мають
чудову, однак не дуже зрозумілу резистентність до гіпоксії.
Однак насичення О2 материнської крові у плаценті є
КРОВООБІГ В ОКРЕМИХ ДІЛЯНКАХ ОРГАНІЗМУ / 575
ПЛІД НОВОНАРОДЖЕНИЙ ДОРОСЛИЙ
Рис. 32-20. Схема кровообігу у плоду, новонародженого та дорослої людини; АП - артеріальна протока; ОВ - овальне вікно
(модифіковано і відтворено за дозволом з Вогп 6\/Р еі аі: Сґіапдез іп ІКе ґіеагі апсі Іипдз аі Ьігіїї. СоїсІ Зргіпд НагЬог 8утр Оиапі
ВіоІ 1954;19:102).
настільки низьким, що у плоду може розвинутись гіпо-
ксичне ушкодження, якщо фетальні еритроцити не будуть
мати більшу афінність до кисню, ніж еритроцити дорос-
лого (рис. 32-22). Фетальні еритроцити містять фетальний
гемоглобін (гемоглобін Р), тоді як у дорослих міститься
гемоглобін дорослих (гемоглобін А). Причиною різної
афінності у цих двох формах є те, що гемоглобін Р при-
єднує 2,3-ДФГ менш ефективно, ніж гемоглобін А. Змен-
шення афінності до кисню, зумовлене приєднанням до 2,3-
ДФГ, описане у Розділі 35. Кількісні аспекти газообміну
через плаценту, що ґрунтуються на експериментах, вико-
наних на коровах, наведені у табл. 32-5.
Певна кількість гемоглобіну А простежується у феталь-
ному періоді (див. рис. 27-19). Після народження гемо-
глобін Р у нормі не утворюється, а у віці чотири місяці
90% гемоглобіну, що циркулює, - це гемоглобін А.
Таблиця 32-5. Газообмін через плаценту корови1
Судина Насичення гемоглобіном, % Парціальний тиск, мм рт. ст.
О2 со2
Материнська артерія 90 70 41
Маткова вена 70 41,5 46,5
Пупкова вена 11,5 48
Пупкова артерія 5,5 50
1 Дані з Вооз 3, Вотуп С: 3 РЬузіоІ (ЬопсІ) 1938;92:261.
Зміни кровообігу та дихання після
народження
Унаслідок того, що артеріальна протока та овальне вікно
відкриті (див. рис. 32-21), ліві та праві відділи серця плоду
працюють паралельно, а не по черзі, як у дорослого. Після
народження плацентарний кровообіг припиняється і пери-
ферійний опір раптово збільшується. Тиск в аорті підви-
щується доти, доки не досягне рівня тиску у легеневій
артерії. Водночас, оскільки плацентарний кровообіг при-
пиняється, у дитини розвивається стан вираженої асфіксії.
Після цього дитина робить декілька вдихань, і легені роз-
правляються. Від’ємний внутрішньоплевральний тиск
(-30 (до -50) мм рт. ст.) під час вдихань відіграє роль у
розправленні легень, однак, крім цього, задіяні й інші,
менш зрозумілі фактори. Відсмоктувальний ефект першого
вдихання та спазм пупкових вен призводить до виходу
близько 100 мл крові з плаценти (плацентарна трансфузія).
Після того, як легені розправились, судинний опір у
легенях зменшується до 20% від опору у внутрішньоут-
робному періоді, і легеневий кровоплин значно збільшу-
ється. Повернення крові з легень підвищує тиск у лівому
передсерді, закриваючи овальне вікно шляхом виштов-
хування клапана, що прикриває його у міжпередсердній
перетинці. Артеріальна протока спадається через декілька
хвилин після народження, та, наприклад, в овець, не закри-
вається повністю протягом 24^18 год. Зрештою овальне
вікно та артеріальна протока закриваються у нормальних
дітей, і наприкінці перших декількох днів формується сис-
тема кровообігу дорослого типу. Механізми, що відпові-
576 / РОЗДІЛ 32
Ро2, мм рт. ст.
Рис. 32-22. Криві дисоціації гемоглобіну крові матері та плоду
(людини).
Правий
шлуночок
Овальне
вікно
Верхня порожниста
вена \
Ліве передсердя А
г г Артеріальна
Аорта
До плаценти
Легенева
артерія
Пупкова
вена
Від
плаценти
Нижня
порожниста
вена
Портальна
вена
Лівий
шлуночок
Рис. 32-21. Кровообіг у плоду. Більша частина оксигенованої
крові, досягаючи серця через пупкову та нижню порожнисту
вени, проходить через овальне вікно та з аорти до голови,
тоді як кров, бідна на кисень, повертаючись через верхню
порожнисту вену, переважно перепомповується через леге-
неву артерію та артеріальну протоку до ніг та пупкових ар-
терій.
Праве
передсердя
Венозна протока
Пупкові
артерії
дають за облітерацію артеріальної протоки, як і за роз-
правляння легень, остаточно незрозумілі, хоча є дані про
те, що підвищення РО2 в артеріях після народження
відіграє важливу роль. Доведено, що брадикінін звужує
пупкові судини та артеріальну протоку, розширюючи
судинне русло легень. Простациклін відіграє роль у під-
тримці прохідності артеріальної протоки до народження.
Введення рег гесіит однієї або двох невеликих доз індо-
метацину - препарату, що пригнічує утворення проста-
цикліну та простагландинів (див. Розділ 17), - зумовлює
закриття протоки у багатьох дітей, даючи змогу уникнути
хірургічної корекції. З іншого боку, закриття протоки
перед народженням спричинює легеневу гіпертензію.
Деяка схильність до розвитку легеневої гіпертензії про-
стежується у дітей, матері яких вживали простагландини
для відкладання терміну пологів. Постійні внутрішньо-
венні введення простацикліну мають значення у лікуванні
легеневої гіпертензії у дорослих.
Серцево-судинний гомеостаз
у нормі та в разі патології
33
ВСТУП
Компенсаторне пристосування серцево-судинної систе-
ми до впливів, з якими людина постійно стикається в
щоденному житті іа в разі патології, відображає інтеграцію
регулювальних механізмів, описаних у попередніх роз-
ділах. У цьому розділі розглянуто процеси адаптації в умо-
вах дії сили тяжіння, фізичного навантаження, запалення,
шоку, втрати свідомості, гіпертензії та серцевої недостат-
ності.
пристосування до Гравітаційних
впливів
Унаслідок дії сили тяжіння на кров (див. Розділ ЗО), коли
людина стоїть, середній артеріальний тиск на стопах у здо-
рової дорослої особи становить 180-200 мм рт. ст., а веноз-
ний - 85-90 мм рт. ст. Артеріальний тиск на рівні голови
дорівнює 60-75 мм рт. ст, а венозний - нулю. Якщо людина
не рухається, то близько 300-500 мл крові нагромаджу-
ється у ємнісних венах нижніх кінцівок. Рідина починає
накопичуватись у інтерстиційному просторі, що пов’язане
з підвищенням гідростатичного тиску у капілярах та змен-
шенням серцевого викиду на 40%. Якщо ж мозковий кро-
воплин становить менше 60% від його рівня у стані лежачи,
то з’являються ознаки церебральної ішемії. Без компенса-
торних серцево-судинних реакцій зменшення серцевого
викиду, пов’язане із застоєм крові внаслідок стояння, спри-
чинить зменшення мозкового кровоплину до 60% і менше
від його рівня й втрати свідомості.
Головним пристосувальним механізмом для підтриман-
ня вертикального стану є зниження тиску крові у каротид-
ному синусі та дузі аорти. Щоб зберегти серцевий викид,
посилюється частота серцевих скорочень. Порівняно
незначний спазм периферійних вен простежується за
вираженого підвищення рівня реніну та альдостерону у
крові. Констрикція артеріол дає змогу підтримувати рівень
артеріального тиску. Фактичні зміни тиску крові на рівні
серця є варіабельними, оскільки вони залежать від співвід-
ношення між вираженістю спазму артеріол та зменшенням
серцевого викиду (рис. 33-1).
Для підтримання мозкового кровоплину є додаткові
пристосувальні механізми. Артеріальний тиск на рівні
голови знижується на 20 40 мм рт. ст., а тиск у яремних
венах - на 5-8 мм рт. ст., що призводить до зниження пер-
фузійного тиску (різниця між артеріальним та венозним
тиском). Опір мозкових судин є меншим тому, що зниження
венозного тиску зумовлює зниження внутрішньочерепного
тиску. Зменшення мозкового кровоплину веде до підвищен-
ня парціального тиску СО2 (РСо2) та зниження РО2 і рН у
тканині мозку з наступним розширенням мозкових судин.
Завдяки цим авторегуляторним механізмам, коли людина
стоїть, мозковий кровоплин зменшується тільки на 20%.
Крім того, кількість О2, що використовується з кожної оди-
ниці крові, збільшується, внаслідок чого загальне захоп-
лення О2 є однаковим у горизонтальному та вертикальному
положеннях.
Тривале стояння створює додаткові проблеми внаслідок
збільшення об’єму інтерстиційної рідини на нижніх кін-
цівках. Доки людина рухається, скорочення м’язів (див.
Розділ 30) підтримує венозний тиск на стопах нижче рівня
30 мм рт. ст., що забезпечує адекватний венозний відплин.
Однак у випадку тривалого нерухомого стояння (наприк-
лад, довготривалий військовий патруль) може виникнути
втрата свідомості. В певному розумінні непритомність є
“гомеостатичним механізмом”, оскільки горизонтальне
положення дає змогу швидко відновити венозне повернен-
ня крові, серцевий викид та мозковий кровообіг до адекват-
ного рівня.
Впливи гравітації на кровообіг у людини дещо залежать
від об’єму крові. Якщо об’єм крові зменшений, то описані
ефекти будуть вираженими, якщо ж високий, - то міні-
мальними.
Компенсаторні механізми, задіяні тоді, коли людина
стоїть, розвинені у неї ліпше, ніж у ссавців (чотириногих),
навіть з урахуванням того, що ці тварини мають чутливі
рецептори каротидного синуса та пов’язані з ними присто-
сувальні реакції. Чотириногі погано переносять перемі-
щення у вертикальне положення. Звичайно, жирафи є
винятком. У цих довгоногих тварин не виникає набряк у
ділянці скакових суглобів, незважаючи на високий тиск у
судинах нижніх кінцівок, пов’язаний із впливом гравітації.
Це можна пояснити наявністю щільної шкіри та фасцій на
нижніх кінцівках - своєрідна антигравітаційна будова (див.
нижче) - і дуже ефективною діяльністю м’язів. Перфузію
у голові підтримують високий рівень середнього артеріаль-
ного тиску та наявність клапанів, що запобігають зворот-
ному напряму плину крові в яремній вені. Якщо жирафи
нахиляють голову для пиття, то кров нагнітається з яремної
578 / РОЗДІЛ 33
Рис. 33-1. Зміни у серцево-судинній системі у разі переходу
з горизонтального положення у вертикальне. Показано серед-
ні зміни. Зміни опору та артеріального тиску у черевній порож-
нині та кінцівках є відмінними у різних осіб (відтворено за
дозволом з ВгоЬеск [есІИог]: Везі апсі Тауіог’з РИузіоІодісаІ
Вазіз ої МебісаІ Ргасіісе, 9Йі есі. ХЛ/іІІіатз & ХЛЛІкіпз, 1973).
вени до грудної клітки переважно завдяки ритмічним
скороченням м’язів щелеп.
Гіпотензія положення
У деяких осіб раптове вставання спричинює зниження
артеріального тиску, запаморочення голови або навіть
непритомність. Є багато причин такої ортостатичної гіпо-
тензії. Вона часто виникає в разі лікування симпатолітич-
ними препаратами. Може простежуватись у випадку таких
захворювань, як діабет, сифіліс, хвороба Паркінсона, які
супроводжуються ураженнями симпатичної нервової сис-
теми. Наведені дані свідчать про важливість симпатичних
вазоконстрикторних волокон у компенсації гравітаційних
впливів на систему кровообігу. Іншою причиною гіпотензії,
зв’язаною зі швидкою зміною положення є первинна авто-
номна недостатність (табл. 33-1). Автономна недостат-
ність виникає внаслідок різноманітних захворювань. Одну
з форм спричинює вроджений дефіцит дофамін-р-гідро-
ксилази (див. Розділ 4) з незначною або повною відсутніс-
тю секреції норадреналіну та адреналіну. У хворих з пер-
винним гіперальдостеронізмом барорецепторні рефлекси
теж змінені. Однак загалом у них не фіксують гіпотензії,
зв’язаної зі зміною положення, оскільки об’єм їхньої крові
може збільшуватися достатньо для того, щоб підтримувати
серцевий викид незалежно від зміни положення. Зазначи-
мо, що мінералокортикоїди використовують для лікування
ортостатичної гіпотензії.
Ефекти прискорення
Вплив гравітації на кровообіг посилюється під час
прискорення та гальмування у транспортних засобах, які
в сучасній цивілізації відображені найрізноманітнішими
пристроями - від ліфта до ракет. Силу, яка діє на організм
унаслідок прискорення, звичайно виражають в одиницях
причому 1 § означає силу тяжіння на поверхні Землі.
Позитивне % є силою, що виникає внаслідок прискорення,
напрямленого вздовж довгої осі тіла, від голови до ніг;
негативне £ - це сила, зумовлена прискоренням з проти-
лежним напрямом. Під впливом позитивного % кров нагні-
тається у нижні частини тіла. Мозковий кровообіг захи-
щений завдяки зниженню венозного та внутрішньочереп-
ного тиску. Хвилинний об’єм крові підтримує підвищений
відтік крові із системи легеневих вен, а також збільшення
сили серцевих скорочень. Однак за прискорення понад 5 §
через 5 с темніє в очах і майже одразу людина непритомніє.
Ефектів позитивного § можна уникнути, використовуючи
антиґравітаційні “^-костюми”. Такі костюми мають подвій-
ні стінки, між якими міститься вода або повітря під тиском,
що дає змогу стискати живіт і ноги із силою, пропорційною
до позитивного Ці заходи зменшують застій крові у венах
Таблиця 33-1. Головні форми первинної недостатності
автономної нервової системи1
Синдром Бредбюрі-Іґлстона (ідіопатична орто-
статична гіпотензія)
Починається у старшому віці
Симпатична та парасимпатична недостатність
Неврологічних розладів нема або вони мінімальні
Відношення норадреналін/дофамін у плазмі понад 1
Синдром Шай-Драгера (множинна системна атрофія)
Починається в середньому чи старшому віці
Симпатична та парасимпатична недостатність
Інші неврологічні розлади (екстрапірамідні, мозочкові
тощо)
Відношення норадреналін/дофамін у плазмі понад 1
Синдром Рілея-Дая (родинна дисавтономія)
Вроджений; передчасна смертність
Характерний для євреїв Ашкеназі
Симпатичні та парасимпатичні зміни
Емоційна лабільність
Відношення норадреналін/дофамін у плазмі понад 1
Недостатність дофамін-р-гідроксилази
Вроджена
Симпатоадреномедулярна недостатність (ортоста-
тична гіпотензія)
Інтактне потовиділення
Збереження парасимпатичних реакцій
Відношення норадреналін/дофамін у плазмі значно
менше 1
1 Відтворено за дозволом з КоЬегїзоп О еі аР Ооратіпе Ь-
ІіусІгохуІазе беїісіепсу: А депеііс сіізогсіег ої сагсііоуазсиїаг
гедиіаііоп. Нурегіепііоп 1991; 18:1)
СЕРЦЕВО-СУДИННИЙ ГОМЕОСТАЗ У НОРМІ ТА В РАЗІ ПАТОЛОГІЇ / 579
та допомагають підтримувати венозний відплин (див. рис.
33-1).
Негативне £ спричинює збільшення серцевого викиду,
підвищення артеріального тиску у мозкових судинах, вира-
жений застій у судинах голови та шиї, екхімози (крово-
виливи) біля очей, виражений пульсуючий біль голови,
іноді сплутаність свідомості (приплив крові до голови).
Незважаючи на значне підвищення церебрального арте-
ріального тиску, судини мозку не розриваються, оскільки
простежується відповідне підвищення внутрішньочереп-
ного тиску, і їхні стінки підтримуються, як під час напру-
ження (див. Розділ 32). Толерантність до £-сил, напрям-
лених через тіло, є значно вищою, ніж для аксіальних
Людина витримує 11 що діють у спинно-грудному напря-
мі, протягом 3 хв і 17 що діють у грудо-спинному напря-
мі, протягом 4 хв. Тому космонавти у ракеті розміщуються
так, щоб^-сили діяли у грудо-спинному напрямі. У такому
положенні толерантність є достатньо великою для того,
щоб витримати прискорення під час виходу на орбіту або
у стан невагомості та сповільнення у разі повернення в
земну атмосферу без патологічних змін.
Впливи стану невагомості на серцево-
судинну систему
Згідно з даними, доступними сьогодні, невагомість про-
тягом 14 місяців спричинює лише тимчасові несприятливі
ефекти на систему кровообігу. Можна передбачити, що
кровообіг без дії сил гравітації буде подібним до кровообігу
в стані лежачи на рівні моря з мінімальними варіантами у
розміщенні внутрішніх органів. Після повернення на Зем-
лю космонавтів у них фіксували транзиторну гіпотензію
положення. Для повної реадаптації до звичайної сили
тяжіння потрібно чотири-сім тижнів після повернення з
польоту. Якщо нема збільшення хвилинного об’єму крові,
яке простежується в разі зусиль у звичайному щоденному
житті, розвивається атрофія міокарда. Висловлюють дум-
ки, що тривалий стан невагомості під час майбутніх косміч-
них подорожей до інших планет може призводити до “ат-
рофії від бездіяльності” серцевого м’яза, а також серцево-
судинних та соматичних рефлекторних механізмів (див.
Розділ 12), що відповідають за підтримку положення тіла.
Інші ефекти стану невагомості
М’язові зусилля значно послаблюються, якщо об’єкти,
які переміщуються, не мають ваги. Крім того, зменшення
нормальної пропріорецептивної чутливості, яку підтримує
дія сили тяжіння на тіло, теж сприяє розвитку слабості та
атрофії скелетних м’язів. Створено спеціальні програми
систематичних вправ, які сповільнюють втрату м’язових
елементів (відтискання біля стіни, розтягнення гумових
пристроїв). Однак компенсація недостатня.
З інших змін, що виникають під час космічних польотів,
важливішою, ніж раніше вважали, виявилась слабкість
рухів (див. Розділ 9). Вагомими також є втрата об’єму
плазми, можливо, пов’язана зі зміщенням рідин організму
та подальшим діурезом; втрата м’язової маси; стійка втрата
мінералів кісток з підвищеним виділенням Са2+; зменшення
кількості еритроцитів та ушкодження лімфоцитів плазми.
Щомісяця кількість Са2’ зменшується на 0,4% від загальної
кількості Са2' організму. І хоча є дані про те, що в разі
тривалого космічного польоту втрати Са2 дещо сповіль-
нюються, вони все ж достатні для виникнення проблем,
якщо тривалість польоту перевищує 14 місяців. Дієта з
високим вмістом Са2+ допомагає подолати цю проблему,
однак досі не створено повністю ефективного плану ліку-
вання. Предметом дослідження повинні бути також психо-
логічні проблеми, пов’язані з ізоляцією та монотонністю
під час довготривалих польотів.
ФІЗИЧНЕ НАВАНТАЖЕННЯ
Фізичне навантаження пов’язане зі значними змінами
серцево-судинної та дихальної систем. Пристосування сис-
теми крообігу розглянуто в цьому розділі, а адаптація рес-
піраторної системи - у Розділі 37. Однак зазначимо, що
вони розвиваються одночасно і є інтегрованими, як части-
ни єдиної гомеостатичної відповіді, що дає змогу витри-
мувати як помірні, так і значні фізичні навантаження.
Кровообіг у м’язах
Кровоплин у стані спокою в м’язах є низьким (2-4 мл/
100 г/хв). Унаслідок скорочення м’язів на 10% від макси-
мального напруження відбувається стискання судин; якщо
ж воно досягає 70%, то кровоплин припиняється (рис. 33-
2). Однак між скороченнями простежується значне поси-
лання кровоплину: під час ритмічного скорочення м’язів
за одиницю часу кровоплин збільшується у 30 разів. Іноді
кровоплин збільшується на початку або ще й до початку
фізичного навантаження. Таке ініціальне підвищення
регульоване нейрогенним шляхом, імовірно, завдяки сис-
темі симпатичних вазодилататорів. Кровоплин у м’язах у
стані спокою подвоюється після симпатектомії, а це дає
підстави припустити, що тонус зменшується завдяки роз-
слабленню вазоконстрикторів. Та якщо фізичне наванта-
ження розпочалось, то місцеві механізми підтримують
Рис. 33-2. Течія крові через ділянку м’язів гомілки під час рит-
мічного скорочення (відтворено за дозволом з ВагсгоЇЇ Н,
8\л/апп І-МС: ЗутраіІіеііс СопігоІ ої Нитап ВІоосІ Уеввеїв
АтоІсІ, 1953).
580 / РОЗДІЛ 33
кровоплин на високому рівні і він буде однаковим у звичай-
них умовах та у тварин після симпатектомії.
До місцевих механізмів підтримання кровоплину на
високому рівні належать зниження тканинного РО2, під-
вищення тканинного РСО2, нагромадження Ю та інших
метаболітів вазодилататорів (див. Розділ 31). В активних
м’язах підвищується температура, що сприяє розширенню
судин. Дилатація артеріол та прекапілярних сфінктерів
збільшує кількість відкритих (функціональних) капілярів
у 10-100 разів. Тому середня відстань між кров’ю й актив-
ними клітинами - а отже, відстань дифузії О2 та продуктів
метаболізму - значно зменшується. Розширення судин
збільшує площу поперечного перерізу судинного русла, що
призводить до зменшення ємності кровоплину. Тиск у капі-
лярах підвищується, доки не досягне рівня онкотичного
тиску по всій довжині капілярної сітки. Крім того, швидше
нагромадження осмотично активних метаболітів порівня-
но з їхнім виведенням зменшує осмотичний градієнт
уздовж капілярної стінки. Отже, транссудація рідини в
інтерстиційний простір значно збільшується. Відтік лімфи
також значно посилюється, що обмежує нагромадження
рідини в інтерстиції і прискорює лімфообіг. Зменшення
рН та підвищення температури призводить до зміщення
кривої дисоціації гемоглобіну праворуч, що означає більшу
віддачу кисню кров’ю. Концентрація 2,3-ДФГ в еритро-
цитах збільшується, і це зумовлює послаблення афінності
кисню до гемоглобіну (див. Розділи 27 та 35). Сумарним
результатом буде збільшення артеріовенозної різниці утри-
чі та прискорене транспортування СО2 з тканини. Поєд-
нання всіх цих змін уможливлює посилене поглинання
кисню скелетним м’язом під час навантаження у 100 разів.
Можливим є навіть більший короткочасний викид енергії,
за якого енергетичні запаси поповнюються завдяки анае-
робному метаболізму глюкози, і м’яз втрачає кисень (див.
Розділ 3). Загалом зміни проміжного метаболізму в разі
навантаження описано у Розділі 17.
Наявність К+ розширює артеріоли під час навантаження
м’яза, особливо на початку скорочення. Кровоплин у м’язі
під час навантаження в осіб зі зменшеним вмістом К+ збіль-
шується слабше, у цьому разі простежується тенденція до
значного ушкодження м’яза (рабдоміоліз напруження).
Системні циркуляторні розлади
Ґенерапізовані прояви реакції серцево-судинної системи
на навантаження залежать від того, яким буде первинне
скорочення м’язів під час виконання роботи - ізотонічним
чи ізометричним. Якщо процес починається з ізометрич-
ного скорочення м’язів, то серцевий ритм посилюється.
Це посилення простежується навіть тоді, коли м’язовому
спазму запобігають місцевим уведенням нервово-м’язових
блокаторів. Такі ж зміни фіксують і в разі думки про ско-
рочення м’язів, що повинно відбутись. У цьому випадку
зміни серцевого ритму є наслідком впливу психічного по-
дразника на довгастий мозок. Сповільнення ритму головно
пов’язане з посиленням впливу блукаючого нерва, хоча
генерування потенціалу дії у серцевих симпатичних нервах
теж відіграє деяку роль. Через декілька секунд після почат-
ку ізометричного скорочення м’язів різко підвищується
систолічний та діастолічний тиск крові. Хвилинний об’єм
крові змінюється порівняно мало, і плин крові до м’язів,
що перебувають у стані скорочення, зменшується внаслідок
компресії відповідних судин.
Реакція на навантаження, що починається з ізотонічного
скорочення м’язів, подібна до попередньої, якщо зважати
на швидке посилення серцевого ритму, і відрізняється від
неї значним збільшенням об’єму серцевого викиду. Унас-
лідок цього фіксують зменшення загального периферій-
ного опору (рис. 33-3), пов’язане з вазодилатацією у наван-
тажених м’язах (табл. 33-2). Систолічний тиск крові під-
вищується помірно, тоді як діастолічний зазвичай не змі-
нюється або знижується. Відмінність реакцій у разі ізомет-
ричного та ізотонічного м’язового скорочення можна
пояснити частково тим фактом, що активні м’язи тонічно
скорочені під час ізометричного навантаження, а отже,
беруть участь у загальному збільшенні периферійного
опору. Крім того, простежується системне посилення
активності м’язових симпатичних нервів, що, очевидно,
пов’язане з сигналами від скорочених м’язів. Та оскільки
в неактивних скелетних м’язах виникає холінергічна сим-
патична вазодилатація, то значення процесу (посилення
активності симпатичних нервів) не зрозуміле.
Хвилинний об’єм крові у разі ізотонічного наван-
таження збільшується і може досягати 35 л/хв; об’єм змі-
180
Частота серцевих
скорочень,
удари/хв
Ударний об’єм,
мл
Хвилинний об’єм,
л/хв
Артеріальний тиск,
мм рт. ст.
Загальний
периферійний
опір,
мм рт.ст./мл/хв
Поглинання
кисню,
мл/хв
140
100-
60-
1І6-
100
90
15
10-
5
180
140
100
60-
Артеріовенозна
різниця
кисню,
об’єм, %
0,014-
0,010
0,006-
1600
800-
о-
15-
ю-
5-
о-
Середній
Діастолічний
0 300 600 900
Робота, кгм/хв
Рис. 33-3. Впливи різного рівня ізотонічного навантаження
на функцію серцево-судинної системи (відтворено за дозво-
лом з Вегпе КМ, І_еуу ММ: Сагсііоуазсиїаг Рйузіоіоду, 51ґі есі.
МозЬу, 1986).
СЕРЦЕВО-СУДИННИЙ ГОМЕОСТАЗ У НОРМІ ТА В РАЗІ ПАТОЛОГІЇ / 581
Таблиця 32-2. Хвилинний об’єм крові та регіональний
кровоплин у чоловіка, що веде сидячий спосіб життя1
Стан спокою у вертикальному положенні Навантаження
Хвилинний об’єм крові Течія крові до: 5900 24 000
серця 250 1000
головного мозку активних скелетних 750 750
м’язів неактивних скелет- 650 20 850
них м’язів 650 300
шкіри нирок, печінки, шлунково-кишко- 500 500
вого тракту тощо 3100 600
1 Показники наведені у мл/хв у стані спокою та під час ізото-
нічного скорочення для максимального поглинання кисню.
нюється пропорційно до посиленого поглинання О2. Меха-
нізми цього процесу описані у Розділі 29. Посилення сер-
цевого ритму підтримують автономні зміни та стимулю-
вальний вплив підвищеного рівня РСО2 на довгастий мо-
зок. Максимальна частота серцевих скорочень (ЧСС) за
навантаження зменшується з віком. У дітей ЧСС збільшу-
ється до 200 і більше скорочень за хвилину; у дорослих
досягає 195, а в старших людей підвищення ще менше.
Простежується значне збільшення венозного повер-
нення крові, хоча це і не є первинною причиною збіль-
шення хвилинного об’єму. Венозне повернення крові збіль-
шується внаслідок скорочення скелетних м’язів та дії нагні-
тальної функції грудної клітки (під час вдихання тиск у
плевральній порожнині знижується, а в черевній підвищу-
ється, внаслідок чого підвищується центральний венозний
тиск), мобілізації крові із вісцеральних органів, переходу
підвищеного тиску через розширені артеріоли на вени, а
також опосередкованої норадреналіном вазоконстрикції,
яка зменшує об’єм крові у венах. Об’єм крові, мобілізованої
із внутрішніх органів та інших резервуарів під час значного
навантаження, може збільшувати кількість крові в артері-
альному руслі на 30%.
Після навантаження тиск крові може поступово знижу-
ватись до субнормальних показників переважно завдяки
нагромадженню продуктів обміну, які протягом короткого
періоду часу підтримують розширення м’язових судин.
Однак тиск крові швидше повертається до попереднього
рівня, ніж нормалізується ЧСС.
Регулювання температури
Кількісні показники підвищення температури під час
навантаження показані на рис. 33-4. До багатьох ділянок
шкіри кров надходить з гілок м’язових артерій, тому деяка
кількість крові, зігрітої у м’язах, потрапляє прямо у шкіру,
де частина тепла переходить у навколишнє середовище.
Простежується значне посилення вентиляції легень (див.
Розділ 37), внаслідок чого частина тепла втрачається з по-
вітрям під час видихання. З підвищенням температури тіла
відбувається активування центрів гіпоталамуса, що регулю-
Рис. 33-4. Обмін енергії під час фізичного навантаження м’я-
зів. Затемнена ділянка відображає переважання утворення
тепла над його втратою. Загальний вихід енергії дорівнює
сумі утворення тепла та виконаної роботи (відтворено за доз-
волом з Міеїзеп М: Оіе Недиіаііоп сіег Когрегіетрегаїиг Ьеі
МизкеІагЬеіі. ЗсапсІ Агсґі РНузіоІ 1938;79:193).
ють механізми виділення тепла. Підвищення температури
частково пов’язане із неспроможністю тепловидільних
механізмів діяти в разі значного підвищення температури.
Однак є дані про наявність ефекту термостату, тобто акти-
вування тепловидільних механізмів унаслідок підвищення
температури тіла. У таких випадках значно посилюється
виділення поту, а його випаровування є головним шляхом
виділення тепла. Простежується також розширення судин
шкіри. Така вазодилатація зумовлена переважно пригні-
ченням впливів вазоконстрикторів, хоча місцеве виділення
вазодилататорів теж може мати значення (див. Розділ 31.)
Тренування
У тренованих атлетів як у стані спокою, так і під час
навантаження простежується вищий рівень хвилинного
об’єму крові та нижчий рівень ЧСС порівняно з нетре-
нованими особами (див. Розділ 29). Крім того, у трено-
ваних осіб розміри серця збільшені. Внаслідок тренування
підвищується рівень максимального поглинання кисню
(УО2плах)- Середні рівні УО2тах можуть досягати 38 мл/кг/хв
у активних здорових чоловіків і 29 мл/кг/хв у активних
здорових жінок. Ці показники є нижчими в осіб старшого
віку. Рівень Уо2тах є наслідком максимального хвилинного
об’єму крові і максимальної екстракції кисню тканинами,
обидва ці показники збільшуються внаслідок тренування.
Зміни, що виникають у скелетних м’язах завдяки тре-
нуванню, - це збільшення кількості мітохондрій та ензимів,
задіяних в окисному метаболізмі. Простежується також
збільшення кількості капілярів та ліпше кровопостачання
м’язових волокон. Результатом сумарного ефекту буде пов-
ніша екстракція кисню і, як наслідок, менш виражене виді-
лення лактату під час навантаження. Посилення плину кро-
582 / РОЗДІЛ 33
ві до м’язів теж буде менш вираженим, а отже, зміни сер-
цевого ритму та серцевого викиду будуть не такими знач-
ними, як у нетренованих осіб. Це є одним із пояснень пози-
тивної ролі фізичних навантажень у хворих з патологією
серця.
З огляду на поширений сьогодні оздоровчий біг та інші
форми фізичних вправ варто зазначити, що однією з важ-
ливих умов успіху регламентованого навантаження є пси-
хологічний фактор. Хворі, які тренуються регулярно, почу-
ваються ліпше. Постійні фізичні навантаження збільшують
імовірність збереження активності й у пенсійному віці.
Крім того, є дані про те, що систематичне тренування,
навіть з помірним навантаженням, зменшує частоту та
полегшує перебіг інфаркту міокарда.
ЗАПАЛЕННЯ ТА ЗАГОЄННЯ РАН
Місцеве ушкодження
Запалення - це складна місцева реакція на впливи
сторонніх факторів, таких як бактерії, або іноді на сполуки,
що утворюються в організмі. Воно передбачає послідов-
ність реакцій з початковим активуванням цитокінів, ней-
трофілів, адгезивних молекул, комплементу та І§О. Деяку
роль відіграє також РАР, сполука, що посилює запальну
реакцію (див. Розділ 27). Пізніше приєднуються моноцити
та лімфоцити. В ділянці запалення простежується розши-
рення артеріол та збільшення проникності капілярної стін-
ки (див. Розділи 31 та 32). Якщо запалення розвивається у
шкірі або під нею (рис. 33-5), то типовим буде почерво-
ніння, набрякання, посилена чутливість та біль. В інших
органах запалення стає ключовим патогенетичним чинни-
ком астми, виразкового коліту та багатьох інших захворю-
вань.
Дані досліджень свідчать про те, що важливу роль у
запальній реакції відіграє фактор транскрипції - ядерний
фактор кВ (ХР- В - від англ. писіеаг Гасюг кВ). Фактор №-
вВ є гетеродимером, який у нормі міститься в цитоплазмі
клітин у комплексі з ІкВц, що дає змогу йому перебувати у
неактивному стані. Такі стимули, як цитокіни, віруси й
оксиданти, зумовлюють відділення НР-кВ від ІкВа з наступ-
ним руйнуванням їхніх Ви, ХР-кВ рухається до ядра, де
сполучається з ДНК генів, що кодують численні трансмі-
тери запалення. Внаслідок цього посилюється синтез та
виділення трансмітерів. Глюкокортикоїди пригнічують
активування ХР-вВ, зменшуючи утворення ІкВа. Напевно,
цей ефект є головним у механізмі протизапальної дії глюко-
кортикоїдів (див. Розділ 20).
Системна відповідь на ушкодження
Цитокіни, що утворюються в разі запалення та інших
ушкоджень, зумовлюють також системні прояви, до яких
належать зміни кількості білків гострої фази (білки, кон-
центрація яких збільшується або зменшується щонай-
менше на 25% після ушкодження). Значна кількість із цих
білків утворюється в печінці; вони наведені у табл. 27-10.
їхній вміст показаний на рис. 33-6. Причини змін концент-
рації цих білків остаточно не з’ясовані, однак можна зазна-
чити, що більшість з них має гомеостатичне значення. На-
приклад, збільшення кількості С-реактивного білка ак-
Рис. 33-5. Рана шкіри через три дні після ушкодження. Чис-
ленні цитокіни та фактори росту регулюють процеси загоєння;
\/Е6Р (від англ. уазсиїаг епбоіїїеііаі дгохл/ІН Гасіог) - судинний
ендотеліальний фактор росту. Інші абревіатури див. у Додат-
ку. Зверніть увагу на епітелій, що росте під згустком фібрину
для поступового відновлення шкіри (модифіковано з Зіпдіег
АЗ, Сіагк ВАР: Сійапеоиз ууоипсі Ізеаііпд. N ЄпдІ 3 Месі 1999;
341: 738).
тивує моноцити і зумовлює подальше утворення цитокі-
нів.
До інших змін, що виникають у відповідь на ушкоджен-
ня, можна зачислити сонливість, негативний баланс азоту
і гарячку.
Загоєння ран
У випадку ушкодження тканини тромбоцити прили-
пають до оголеного матриксу внаслідок взаємодії інтегри-
нів з колагеном та ламініном (див. рис. 33-5). У процесі
зсідання крові утворюється тромбін, який посилює агре-
гацію тромбоцитів та їхню дегрануляцію. Сполуки, що міс-
тяться в гранулах тромбоцитів, генерують запальну реак-
цію. Лейкоцити приваблювані селектинами і приєднуються
до інтегринів ендотеліальних клітин, що зумовлює їхню
міграцію через судинну стінку. Цитокіни, що їх виділяють
лейкоцити, стимулюють інтегрини на макрофагах, які
внаслідок цього мігрують у вогнище запалення. Активовані
також рецептори фібробластів та епітеліальних клітин, які
беруть участь у'загоєнні та формуванні рубця. Плазмін
сприяє загоєнню, видаляючи надлишок фібрину. Це при-
водить до мігрування кератиноцитів у рану та відновлення
епітелію під струпом. Відбувається синтез колагену та
утворення рубця. Рани набувають 20% їхньої кінцевої міц-
ності через три тижні. Процес триває й далі, однак міц-
ність у ділянці рани ніколи не перевищує 70% від міцності
нормальної шкіри.
СЕРЦЕВО-СУДИННИЙ ГОМЕОСТАЗ У НОРМІ ТА В РАЗІ ПАТОЛОГІЇ / 583
Час після впливу фактора запалення, дні
Рис. 33-6. Динаміка змін вмісту основних білків гострої фази;
СЗ - компонент СЗ комплементу (модифіковано і відтворено
за дозволом з СІііІіп ЗО, СоІІеп НР: Моїесиїаг Ьіоіоду ої асиїе
рїіазе ріазта ргоіеіпз. Іп Ріск Е еі аі [есіііогз]. Гугпрїюкіпез,
уоі 14, радез 123-153 Асасіетіс Ргезз, 1987).
ШОК
Загальні положення
Шок - це синдром, щодо якого завжди було багато супе-
речностей. Частково труднощі пов’язані з неадекватним
використанням терміна фізіологами та в клініках, а особ-
ливо неспеціалістами. Наприклад, електричний та спіналь-
ний шок має мало спільного зі станом, що виникає під час
кровотечі та пов’язаних з нею серцево-судинних розладів.
У вузькому розумінні гемодинамічний шок тлумачать як
сукупність різних станів, що мають певні спільні риси. Най-
типовішою ознакою для всіх станів є неадекватна тканинна
перфузія з порівняно або абсолютно недостатнім хвилин-
ним об’ємом. Хвилинний об’єм крові може бути неадекват-
ним, якщо кількість рідини у судинній системі недостатня
для заповнення цієї системи (гіповолемічний шок). Крім
того, можлива відносна недостатність хвилинного об’єму,
зумовлена збільшенням об’єму судинної системи внаслідок
вазодилатації, навіть за нормального об’єму крові (шок
перерозподілу, вазогенний, або шок низького опору).
Причиною шоку може бути неадекватна нагнітальна
функція серця, пов’язана з ураженням міокарда (кардіо-
генний шок), а також з недостатнім хвилинним об’ємом
крові внаслідок обструкції кровотоку у легенях та серці (об-
структивний шок). Ці форми шоку та приклади захво-
рювань, що можуть їх спричинити, наведені у табл. 33-3.
Гіповолемічний шок
Гіповолемічний шок називають також “холодним шо-
ком”. Його ознаки: гіпотензія, швидкий ниткоподібний
пульс, холодна, бліда, липка шкіра, виражена спрага, при-
скорене дихання, втомлюваність або, навпаки, заціпеніння.
Проте жодна з наведених ознак не є обов’язковою. Гіпо-
тензія може бути відносною. Наприклад, у хворого з гіпер-
тензією і звичайними показниками артеріального тиску
240/140 виражений шок може бути при тиску 120/90.
Гіповолемічний шок часто поділяють на декілька видів
відповідно до причини. Наприклад, використання термінів
геморагічний, травматичний, хірургічний, опіковий шок
доцільне, оскільки, незважаючи на подібність загальної
картини, є важливі риси, специфічні для окремих видів.
Геморагічний шок
Детальніше розглянемо процеси в разі геморагії, оскіль-
ки вони відображають ознаки, спільні для всіх видів гіпо-
волемічного шоку, та множинні компенсаторні реакції, що
розвиваються для підтримання об’єму ПКР. Головні реакції
наведені у табл. 33-4.
Зменшення об’єму крові, спричинене кровотечею,
послаблює венозне повернення крові та зумовлює змен-
шення хвилинного об’єму крові. У випадку помірної кро-
вотечі (5-15 мл/кг маси тіла) знижується пульсовий тиск,
а середній артеріальний тиск може бути нормальним. Зміни
тиску дуже індивідуальні навіть за однакової крововтрати.
Шкіра холодна та бліда, може мати сірий відтінок з огляду
на капілярний стаз та незначний ціаноз. Дихання стає
швидким, а у хворих, що не втратили свідомості, буває
виражена спрага.
У випадку гіповолемічного та інших форм шоку недос-
татня перфузія тканин призводить до підвищеного анаероб-
ного гліколізу з утворенням значної кількості молочної
кислоти. У виражених випадках рівень лактату крові
збільшується до 9 ммоль/л (нормальний - 1 ммоль/л). Унас-
лідок молочнокислий ацидоз пригнічує міокард, зменшує
Таблиця 33-3. Види шоку і приклади станів
та захворювань, що можуть їх спричинити
Гіповолемічний шок (зменшення об’єму крові)
Геморагія
Травма
Хірургічне втручання
Опіки
Втрата рідини внаслідок блювання та проносу
Шок перерозподілу (виражена вазодилатація; назива-
ють також вазогенним, або шоком низького опору)
Втрата свідомості (неврогенний шок)
Анафілаксія
Сепсис (також зумовлює гіповолемію, пов’язану з
підвищеною проникністю стінок капілярів і виходом
рідини у тканини)
Кардіогенний шок (неадекватний у разі патології
серця)
Інфаркт міокарда
Застійна серцева недостатність
Аритмії
Обструктивний шок (обструкції течії крові)
Напружений пневмоторакс
Емболія легеневої артерії
Пухлина серця
Тампонада серця
584 / РОЗДІЛ 33
Таблиця 33-4. Компенсаторні реакції, активовані у разі
геморагії
Вазоконстрикція
Тахікардія
Веноконстрикція
Тахіпное -> підвищення нагнітальної функції грудної
клітки
Активний стан -> підвищення нагнітальної функції
скелетних м’язів (у деяких випадках)
Збільшення руху інтерстиційної рідини у капіляри
Збільшення виділення адреналіну та норадреналіну
Збільшення виділення вазопресину
Збільшення виділення глюкокортикоїдів
Збільшення виділення реніну та альдостерону
Збільшення виділення еритропоетину
Збільшення синтезу білків плазми
чутливість периферійних судин до катехоламінів і може
бути причиною коми.
Негайні компенсаторні реакції
Зі зменшенням об’єму крові та венозного повернення
артеріальні барорецептори розтягуються менше і посилю-
ється вплив симпатичної іннервації. Навіть якщо середній
артеріальний тиск не знижується, то зниження пульсового
тиску призводить до зменшення частоти генерації потен-
ціалу дії у барорецепторах артерій, внаслідок чого розви-
вається рефлекторна тахікардія та вазоконстрикція. Цікаво,
що зі збільшенням крововтрати тахікардія переходить у
брадикардію. Це простежується, доки шок є ще оборотним
(див. внизу). З продовженням кровотечі частота серцевих
скорочень збільшується. Брадикардія переважно пов’язана
з демаскуванням депресорного рефлексу, зумовленого
впливом блукаючого нерва. Цю реакцію можна викорис-
тати як механізм припинення наступної крововтрати.
Вазоконстрикція є генералізованою, у ній не задіяні
лише судини мозку та серця. Вазоконстрикторна іннервація
мозкових артеріол, ймовірно, незначна з функційного по-
гляду, а вінцеві судини є розширеними внаслідок підви-
щеного рівня метаболізму у міокарді, відповідно, зумов-
леного збільшеною частотою серцевих скорочень (див.
Розділ 32). Вазоконстрикція найбільше виражена у шкірі,
де вона зумовлює відчуття прохолоди та блідість, у нирках
та внутрішніх органах.
Кровотеча також спричинює поширену веноконстрик-
цію - венозний ефект, що допомагає підтримувати тиск
наповнення серця кров’ю, хоча рецептори, що зумовлюють
веноконстрикцію, ще не виявлені. Виражений спазм судин
у внутрішніх органах призводить до перерозподілу крові
з вісцеральних резервуарів у системний кровоплин. Пере-
міщення крові відбувається також з підшкірних ділянок та
легеневих вен. Скорочення селезінки дає змогу виділити у
кровообіг “депоновану” кров, хоча об’єм крові, мобілізо-
ваної цим шляхом у людини, незначний.
У нирках простежується спазм як аферентних, так і ефе-
рентних артеріол, однак еферентні судини скорочуються
більше. Рівень клубочкової фільтрації знижений, проте
плин плазми зменшений ще більше, тому фільтрувальна
фракція (рівень клубочкової фільтрації, поділений на
нирковий плин плазми) збільшується; можливе шунтування
крові через мозковий шар нирки в обхід кіркових клу-
бочків; утворюється дуже мало сечі; вираженою є затримка
Ка+, а також затримка азотовмісних продуктів метаболізму
у крові (азотемія або уремія). У випадках, коли гіпотензія
тривала, можливе значне ушкодження канальців (гостра
ниркова недостатність).
Крововтрата є потенційним подразником для секретор-
ної активності кори надниркових залоз (див. Розділ 20).
Циркулювання адреналіну теж посилюється, завдяки часті-
шій імпульсації у симпатичних норадренергічних нейро-
нах. Збільшений вміст катехоламінів у крові порівняно
мало впливає на генералізовану вазоконстрикцію, однак
він може призвести до стимулювання ретикулярної фор-
мації (див. Розділ 11). Можливо, тому частина хворих з
геморагічним шоком є неспокійними та стурбованими.
Інші тихі та апатичні, а їхня свідомість затьмарена, ймо-
вірно, внаслідок церебральної ішемії та ацидозу. За неспо-
кою посилена моторна активність, а посилені дихальні ру-
хи збільшують м’язове та грудне нагнітання венозної крові.
Втрата еритроцитів зменшує можливості постачання
кров’ю О2, кровоплин у каротидних та аортальних тіль-
цях також зменшується. Анемія та застійна гіпоксія (див.
Розділ 37), як і ацидоз, призводять до стимулювання хемо-
рецепторів. Посилена активність хеморецепторів є, ймо-
вірно, головною причиною стимулювання дихання в разі
шоку. Активування хеморецепторів призводить до збуд-
ження вазомоторних центрів у стовбурі мозку, посилюючи
вазоконстрикторний ефект. Справді, в собак, у яких після
кровотечі артеріальний тиск становив до 70 мм рт. ст.,
перерізання нервів від каротидних баро- та хеморецепторів
частіше спричинює подальше зниження тиску, ніж його
підвищення. Ця парадоксальна реакція пов’язана з тим,
що за тиску до 70 мм рт. ст. у барорецепторах не відбу-
вається імпульсації, а активність у волокнах, що проходять
від каротидних хеморецепторів, передається до вазомотор-
них центрів дуже слабко на фоні посилюваного пригні-
чення барорецепторів.
Підвищений рівень ангіотензину II, що циркулює в кро-
ві, внаслідок збільшення реніну плазми під час кровотечі,
зумовлює спрагу, впливаючи на субфорнікальний орган
(див. Розділ 32); споживання рідини допомагає відновити
об’єм ПКР. Збільшення кількості ангіотензину II допомагає
також підтримувати артеріальний тиск. Зниження тиску
крові, зумовлене втратою частини об’єму крові, більше
виражене у тварин, яким уведено препарати, що блокують
рецептори ангіотензину II, порівняно з контролем. Вазо-
пресин теж спричинює підвищення тиску крові в разі вве-
дення великих доз нормальним тваринам, однак уведення
доз, що зумовлюють такий же рівень вазопресину у плазмі,
що й у випадку геморагії, призводить лише до незначного
підвищення тиску крові, оскільки простежується компен-
саторне зменшення хвилинного об’єму крові (див. Розділ
31). Водночас у разі уведення після геморагії пептидів з
ефектом, протилежним до вазопресину, тиск крові знижу-
ється. Отже, виявляється, що вазопресин теж відіграє важ-
ливу роль у підтриманні артеріального тиску. Підвищення
рівня ангіотензину II та АКТГ у крові, що циркулює, поси-
лює секрецію альдостерону, а збільшення кількості альдо-
стерону та вазопресину зумовлює затримку На4 та води,
СЕРЦЕВО-СУДИННИЙ ГОМЕОСТАЗ У НОРМІ ТА В РАЗІ ПАТОЛОГІЇ / 585
що допомагає відновити об’єм крові. Проте ефект альдо-
стерону настає через ЗО хв, і первинне зменшення об’єму
сечі та виділення N3" пов’язане переважно з гемодинаміч-
ними змінами у нирках.
У разі спазму артеріол та зниження венозного тиску
внаслідок зменшення об’єму крові простежується знижен-
ня тиску у капілярах. Рідина проникає у капіляри для під-
тримання об’єму крові, що циркулює. Це призводить до
зменшення кількості інтерстиційної рідини, що, відповід-
но, зумовлює вихід рідини з клітин.
Довготривалі компенсаторні реакції
Після помірної кровотечі об’єм плазми, що циркулює,
поновлюється через 12-72 год (рис. 33-7). Фіксують також
швидке надходження раніше синтезованих альбумінів із
позасудинних запасів, однак більша частина мобілізованої
тканинної рідини бідна на білки. Рідина розводить білки
плазми та клітини крові, проте у разі втрати цільної крові
гематокрит може не зменшуватись протягом декількох
годин після початку кротечі. Після першого надходження
попередньо синтезованих альбумінів решта втрачених
білків плазми відновлюється завдяки синтезу в печінці
протягом трьох-чотирьох днів. У крові з’являється еритро-
поетин, а також збільшується кількість ретикулоцитів,
досягаючи максимального рівня на десятий день. Кількість
еритроцитів відновлюється до норми протягом чотирьох-
восьми тижнів. Низький гематокрит добре зрівноважу-
ваний впливом різноманітних компенсаторних механізмів.
Одним з них є збільшення концентрації 2,3-ДФГ в еритро-
цитах, що поліпшує перехід кисню в тканини з гемоглобіну
(див. Розділ 27). У випадку тривалої анемії в попередньо
здорових осіб задишка під час напруження не виявляється
за концентрації гемоглобіну близько 7,5 г/дл. Слабість стає
вираженою за рівня 6 г/дл; задишка в спокої з’являється
на рівні 3 г/дл; а серцева слабість розвивається, коли рівень
гемоглобіну зменшується до 2 г/дл.
Рефрактерний шок
Відповідно до об’єму крововтрати одні хворі помирають
одразу після кровотечі, а інші одужують завдяки компен-
саторним механізмам, посиленим за допомогою відповід-
ного лікування, що приводить до поступового відновлення
нормального кровообігу. У проміжній групі хворих шок
триває протягом годин, поступово прогресуючи у стан,
коли організм не реагує на введення вазопресорних пре-
паратів, і за якого навіть у разі відновлення об’єму крові,
що циркулює в кровообігу, хвилинний об’єм крові змен-
шений. Цей стан відомий як рефрактерний шок. Він трап-
ляється не тільки у випадку геморагічного, а й інших видів
шоку. Ще його називають необоротним шоком, унаслідок
якого хворі вмирають, незважаючи на інтенсивну терапію.
Однак щораз більше хворих вдається врятувати, оскільки
розуміння патофізіологічних механізмів сприяє поліпшен-
ню лікування. Тому рефрактерний шок, напевно, - від-
повідніший термін.
Спазм прекапілярних сфінктерів та венул, особливо у
внутрішніх органах, є характерною ознакою на цій стадії.
Послаблена капілярна перфузія внаслідок констрикції
прекапілярних сфінктерів призводить до гіпоксичного
ушкодження тканини. Через 3-5 год прекапілярні сфінк-
тери розширюються, тоді як венули є спазмованими. Кров
на цьому етапі надходить у капіляри і застоюється у цих
судинах, тому тканинна гіпоксія триває. Гідростатичний
тиск у капілярах підвищується, і рідина виходить з судинної
системи у великій кількості. Гранулоцити адгезують до
ушкодженої судинної стінки і виділяють вільні радикали,
особливо О2, що спричинює наступне ушкодження тка-
нини. Є дані про те, що антитіла до білкових комплексів,
які зв’язують нейтрофіли з тканиною, значно поліпшують
виживання в разі тяжкого шоку. Ушкодження слизової
шлунково-кишкового тракту зумовлює вихід бактерій у
судинне русло.
Різноманітні позитивні механізми зворотного зв’язку
відіграють важливу роль у розвитку рефрактерного шоку.
Наприклад, значна мозкова ішемія призводить у кінцевому
підсумку до пригнічення вазомоторних та серцевих центрів
мозку, спричинюючи вазодилатацію та зменшення частоти
серцевих скорочень. Обидва процеси сприяють зниженню
тиску крові з подальшим зменшенням мозкового крово-
обігу та депресією вазомоторних і серцевих центрів.
Іншим важливим прикладом цього типу позитивного
зворотного зв’язку є депресія міокарда. В разі вираженого
Об’єм крові, л
До геморагії
Втрата 1070 мл крові
Зразу після крововтрати
0 1 2 3 4 5 6
і------1---------1--------1--------1---------1-------1
1 год після геморагії
24 год після геморагії
72 Н аЇЇег НетоггНаде
Загальний білок плазми, г
Рис. 33-7. Зміни об’єму еритроцитів (темний колір), плазми (світлий колір) та загального білка плазми після геморагії у нормальної
особи.
586 / РОЗДІЛ 33
шоку вінцевий кровоплин послаблюється внаслідок гіпо-
тензії та тахікардії (див. Розділ 32), навіть незважаючи на
розширення вінцевих судин. Недостатність міокарда погір-
шує перебіг шоку та посилює ацидоз, а це, відповідно,
інгібує функції міокарда. Якщо послаблення функцій є
значним і тривалим, то ушкодження міокарда може досягти
рівня, за якого хвилинний об’єм крові уже не відновити до
нормального рівня, незважаючи на заміщення втраченого
об’єму крові.
Пізнім ускладненням шоку, яке може бути смертельним,
є ураження легень з розвитком гострого респіраторного
дистрес-синдрому (РДС, респіраторний дистрес синдром
дорослих; див. Розділ 37). Цей синдром супроводжується
гострою дихальною недостатністю та високою смерт-
ністю, і може бути спричинений не тільки шоком, а й сеп-
сисом, ушкодженням легень, іншими травмами й тяжкими
станами. Загальною ознакою цього ураження буде ушкод-
ження ендотеліальних клітин капілярів та альвеолярних
епітеліальних клітин з виділенням цитокінів.
Інші форми гіповолемічного шоку
Травматичний шок виникає за значного ушкодження
м’язів та кістки. Цей тип шоку простежується у жертв бійок
та автомобільних катастроф. Значна кровотеча у ділянку
ушкодження є головною причиною шоку, хоча деяка кіль-
кість плазми теж проникає у тканину. Кількість крові, яка
може бути втраченою за порівняно невеликого ушкоджен-
ня, викликає подив: у м’язах стегна може нагромадитись
1 л екстравазованої крові, наприклад, у разі збільшення
діаметра стегна тільки на 1 см.
Руйнування скелетного м’яза (рабдоміоліз) є додатко-
вою проблемою у випадках, коли шок супроводжується
вираженим розчавлюванням м’яза (синдром розчавлен-
ий). Після того, як тиск на тканини знижується і перфузія
відновлюється, генеруються вільні радикали, що призво-
дить до подальшого ушкодження тканини (ушкодження
внаслідок реперфузії). Під час ішемії утворюється значна
кількість вільних радикалів, оскільки тканинна ксантин-
дегідрогеназа перетворюється у ксантиноксидазу і після
відновлення плину крові ензим сприяє утворенню О2. Про-
стежується адгезія лейкоцитів до тканинних елементів, а
це також сприяє утворенню вільних радикалів. Інгібітор
ксантиноксидази алопуринол та антитіла, що запобігають
адгезії нейтрофілів, зменшують ушкодження в разі репер-
фузії. Ще однією причиною ушкодження тканини в ділян-
ках реперфузії є надлишкове внутрішньоклітинне нагро-
мадження Са2+, яке переважно пов’язане з обміном надлиш-
кового внутрішньоклітинного Иа+на позаклітинний Са2 .
За синдрому розчавлення нерідко уражені нирки. Це пов’я-
зано з нагромадженням міоглобіну та інших продуктів
метаболізму з ділянок реперфузії у нирках, де гломерулярне
фільтрування вже послаблене внаслідок шоку. Продукти
метаболізму ушкоджують та закупорюють канальці, спри-
чинюючи анурію, яка може бути фатальною.
Хірургічний шок, як звичайно, є наслідком комбінації
зовнішньої кровотечі, крововиливів у внутрішні органи та
дегідратації. За опікового шоку найочевиднішими змінами
є втрата плазми у вигляді ексудату з ділянок опіку. Оскільки
в таких ситуаціях переважно відбувається втрата плазми,
а не цілісної крові, то гематокрит збільшується, і просте-
жується згущення крові. Опіки зумовлюють також не зов-
сім зрозумілі метаболічні зміни, що розвиваються додат-
ково до втрати рідини. Наприклад, у 50% зафіксовано
підвищення рівня метаболізму, не пов’язане з тиреоїдними
змінами, у деяких хворих розвивається гемолітична анемія.
З огляду на ці ускладнення, важкість шоку, проблеми
сепсису та ушкодження нирок рівень смертності внаслідок
опіків третього ступеня (понад 75% тіла) наближається до
100%.
Гіповолемічний шок є ускладненням різних метабо-
лічних та інфекційних захворювань. Наприклад, хоча
механізми відрізняються в кожному випадку, недостатність
надниркових залоз, діабетичний кетоацидоз та виражена
діарея супроводжуються втратою із крові. Зменшення
об’єму плазми крові, що виникає внаслідок цього, може
бути визначальним для спричинення серцево-судинного
колапсу.
Шок розподілу
Як зазначено вище, шок розподілу виникає, коли об’єм
крові нормальний, а ємність судинної системи збільшу-
ється внаслідок вираженої дилатації. Його називають також
теплим шоком, оскільки шкіра не є холодною та липкою,
як у разі гіповолемічного шоку. Прикладом є анафілак-
тичний шок - виражена алергічна реакція, що дуже
швидко розвивається й іноді виникає у випадках повтор-
ного введення антигену особам, що були попередньо сен-
сибілізовані до нього. Реакція антиген-антитіло, що вини-
кає внаслідок цього, супроводжується виділенням значної
кількості гістаміну, зумовлюючи збільшення проникності
капілярів та поширення дилатації артеріол і капілярів.
Іншою частою формою шоку розподілу є септичний
шок. У цьому випадку бактерійні токсини спричинюють
вазодилатацію. Крім того, простежується депресія міо-
карда і збільшується проникність капілярів, унаслідок чого
плазма проникає у тканини, і об’єм крові зменшується. З
огляду на це септичний шок є одночасно кардіогенним,
гіповолемічним та шоком розподілу.
У хворих з підвищеною температурою перебіг шоку
важчий, оскільки кровоносні судини шкіри часто розши-
рені (див Розділ 32), що збільшує невідповідність між єм-
ністю судинної системи та об’ємом крові, що циркулює.
Грам-негативні бактерії, що часто спричинюють сеп-
тичний шок, виділяють ендотоксин, ліпополісахарид клі-
тинної стінки мікроорганізму. Ця сполука зумовлює активу-
вання макрофагів та виділення збільшеної кількості цито-
кінів. Антитіла проти цитокінів або частин молекули ендо-
токсину можна використовувати для лікування шоку, однак
клінічні спостереження не є оптимістичними. Глюкокор-
тикоїди - ефективні лікувальні засоби для тварин, проте
не для людини.
Ще одним типом шоку розподілу є нейрогенний шок,
за якого раптова автономна активність призводить до
вазодилатації та скупчення крові у венах. Прикладом може
бути втрата свідомості в разі сильних емоцій, таких як
страх або горе.
Стан непритомності
Стан непритомності, або синкопе, є раптовою транзи-
торною втратою свідомості. Він може бути пов’язаний з
СЕРЦЕВО-СУДИННИЙ ГОМЕОСТАЗ У НОРМІ ТА В РАЗІ ПАТОЛОГІЇ / 587
метаболічними чи неврологічними порушеннями, однак
частіше виникає в разі розладів периферійного кровообігу
або серцевих порушень, що спричинюють неадекватний
плин крові у головному мозку. Перебіг, звичайно, сприят-
ливий і пов’язаний з раптовою вазодилатацією, яка веде
до гіпотензії, що переважно супроводжується брадикар-
дією. Для позначення цього стану використовують термін
вазовагальне синкопе.
Постуральним синкопе називають стан непритомності,
зумовлений нагромадженням крові у залежних від стоячого
стану частинах тіла. Синкопе з мимовільним сечовиді-
ленням - непритомність, що настає під час сечовипускан-
ня, трапляється у хворих з ортостатичною гіпотензією.
Вона пов’язана з ортостатичною та рефлекторною бради-
кардією, спричиненою випорожненням. Тиск на каротид-
ний синус, зумовлений, наприклад, тісним комірцем, може
спричинити виражену брадикардію та вазодилатацію, що
призводить до непритомності (синкопе каротидного си-
нуса). Зрідка вазодилатація та брадикардія можуть бути
пов’язані з ковтанням (синкопе ковтання). Синкопе каш-
лю виникає в разі підвищення внутрішньогрудного тиску
під час напруження чи кашлю до рівня, достатнього для
блокади венозного надходження крові до серця. Синкопе
зусилля означає стан непритомності у випадку напруження
внаслідок неспроможності збільшити хвилинний об’єм
крові відповідно до підвищених потреб тканин, і зазвичай
характерне для хворих зі стенозом аорти або легеневої
артерії.
Синкопе може бути пов’язане з серйознішими уражен-
нями. Близько 25% епізодів синкопе серцевого походження
зумовлені або тимчасовою обструкцією течії крові через
серце, або раптовим зменшенням хвилинного об’єму крові
внаслідок різноманітних видів серцевих аритмій. Непри-
томність, пов’язану з брадикардією, блокадою серця або
синусового вузла, називають нейрокардіогенниим син-
копе. Крім того, стан непритомності є початковим симп-
томом у 7% хворих з інфарктом міокарда. Тому у всіх ви-
падках синкопе потрібне обстеження для виявлення його
причини.
Кардіогенний та обструктивний шок
Якщо нагнітальна функція серця порушена настільки,
що плин крові до тканин не є адекватним для звичайних
метаболічних потреб, то виникає стан, який називають кар-
діогенним шоком. Зазвичай, він трапляється у разі обшир-
ного інфаркту лівого шлуночка, однак може бути зумов-
лений іншими захворюваннями, що супроводжуються
послабленням функції шлуночків. Виникають симптоми,
характерні для шоку, а також застій у легенях та внутрішніх
органах, оскільки серце не спроможне виштовхувати всю
кров, що надходить до нього. З огляду на це описаний стан
іноді називають застійним шоком. Частота такого шоку у
хворих з інфарктом міокарда становить близько 10%, а
смертність від нього - 60-90%.
Картина застійного шоку простежується також у разі
обструктивного шоку. Якщо обструкція пов’язана з напру-
женим пневмотораксом та перетисканням великих вен
(див. Розділ 37) або кровотечею у перикард зі стисканням
серця ззовні (тампонада серця), зо негайне хірургічне
втручання необхідне для того, щоб уникнути смерті.
Лікування шоку
Лікування шоку спрямоване на усунення причини і сти-
мулювання фізіологічних компенсаторних механізмів для
відновлення адекватного рівня тканинної перфузії. У разі
геморагічного, травматичного та хірургічного шоку, на-
приклад, головною причиною шоку є крововтрата, і ліку-
вання передбачає раннє та швидке переливання адекватної
кількості сумісної цільної крові. Фізіологічний розчин
можна використовувати обмежено - лише як тимчасовий
засіб. Найважливішим завданням є відновлення адекват-
ного об’єму крові, що циркулює, а оскільки фізіологічний
розчин розподіляється у ПКР, то тільки 25% кількості при-
значеної рідини залишається у судинній системі. У випадку
опікового шоку та інших станів, що супроводжуються зсі-
данням крові, плазма є препаратом для усунення головного
дефекту - втрати плазми. Препарати білкових фракцій
плазми крові, розчини вуглеводів високої молекулярної
маси і споріднені речовини, які не проникають через стінку
капілярів, можуть забезпечувати деякий терапевтичний
ефект. Концентрований людський альбумін плазми й інші
гіпертонічні розчини збільшують об’єм крові, що цирку-
лює, завдяки здатності забезпечувати надходження інтер-
стиційної рідини у судини. їх можна застосовувати з метою
швидкої допомоги, однак їхній недолік полягає у здатності
посилювати дегідратацію тканин.
У випадку анафілактичного шоку високоефективним і
дещо специфічним засобом є адреналін, дія якого склад-
ніша, ніж просто звуження розширених судин. За всіх видів
шоку забезпечення адекватного рівня артеріального тиску
відіграє важливу роль у підтриманні вінцевого кровообігу.
З цією метою можна застосувати такий судинозвужуваль-
ний препарат, як норадреналін, однак його введення треба
припинити якомога швидше, оскільки він забезпечує роз-
ширення судин нирок і позитивний інотропний ефект,
одночасно спричинюючи звуження інших судин (див.
Розділ 20). У разі травматичного і кардіогенного шоку ліку-
вальну дію має дофамін.
Деякі заходи з тих, що застосовують під час шоку, при-
гнічують розвиток фізіологічних компенсаторних меха-
нізмів. Седативні засоби та інші речовини, що зумовлюють
депресію центральної нервової системи, потрібно засто-
совувати з обережністю, оскільки вони пригнічують актив-
ність вазомоторної зони. Особливо небезпечним є алко-
голь, оскільки він пригнічує центральну нервову систему
і розширює судини шкіри (завдяки центральній дії). Треба
уникати перегрівання, унаслідок якого відбувається роз-
ширення судин шкіри. Небезпечні наслідки для кровообігу
може мати зміна положення хворого, якщо він встане або
сяде. Сили гравітації потрібно спрямувати на допомогу, а
не на пригнічення компенсаторних механізмів. Надання
хворому положення з дещо піднятими ногами за допо-
могою підіймання відповідного кінця ліжка на 15-30 см є
простим і важливим терапевтичним заходом, спрямованим
на збільшення венозного надходження крові з нижньої
частини тіла до серця і на поліпшення мозкового крово-
обігу. Однак положення головою вниз сприяє тому, що
органи черевної порожнини тиснуть на діафрагму, утруд-
нюючи дихання і зумовлюючи розвиток ускладнень з боку
легень. Тому цей метод не можна застосовувати протягом
тривалою періоду.
588 / РОЗДІЛ 33
ГІПЕРТЕНЗІЯ
Гіпертензія - це стійке підвищення системного артері-
ального тиску. Легенева гіпертензія також трапляється,
але тиск у легеневому стовбурі майже не залежить від
системного артеріального.
Експериментальна гіпертензія
Артеріальний тиск залежить від хвилинного об’єму кро-
ві і периферійного опору судин (тиск = плин х опір; див.
Розділ ЗО). Периферійний опір визначений в’язкістір крові
і головно, діаметром судин опору. Гіпертензія може бути
зумовлена збільшенням хвилинного об’єму крові, однак
стійка гіпертензія здебільшого спричинена збільшенням
периферійного опору. Деякі методи, за допомогою яких
можна спричинити стійку гіпертензію в експерименталь-
них тварин, наведено в табл. 33-5. Переважно вони поля-
гають у деяких втручаннях на нирках, нервовій системі
або надниркових залозах. Є також лінії щурів, у яких гіпер-
тензія розвивається спонтанно (8НК-щурі) або на фоні діє-
ти, багатої на сіль (ОаЬІ-щурі, чутливі до солі).
Гіпертензію, зумовлену звуженням ниркової артерії або
компресією нирки, називають нирковою гіпертензією. Як
зазначено в Розділі 24, у деяких тварин з нирковою гіпер-
тензією простежується підвищений рівень реніну у плазмі,
в інших він є нормальним. У загальному, гіпертензія Ґолд-
блатт (“один затискач, дві нирки”) (див. табл. 33-5) є ренін-
залежною, тоді як гіпертензія Ґолдблатт (“один затискач, од-
на нирка”) реніннезалежна. Ще один фактор, який, можливо,
сприяє розвитку ниркової гіпертензії, - послаблена здат-
ність нирки виділяти Иа+ у разі звуження ниркової артерії.
Нейрогенна гіпертензія описана у Розділі 31. На фоні
нормального або надмірного споживання солі дезоксикор-
Таблиця 33-5. Методи моделювання стійкої гіпертензії в
експериментальних тварин
Вплив на нирковий кровообіг (ниркова гіпертензія)
Звуження однієї ниркової артерії; інша нирка видалена
(один затискач, одна нирка, гіпертензія Ґолдблатт)
Звуження однієї ниркової артерії; інша нирка інтактна
(один затискач, дві нирки, гіпертензія Ґолдблатт)
Звуження аорти або обох ниркових артерій (два
затискачі, дві нирки, гіпертензія Ґолдблатт)
Компресія нирки за допомогою гумової капсули,
розвиток перинефриту тощо
Порушення аферентної імпульсації від артеріальних
барорецепторів (нейрогенна гіпертензія)
Денервація каротидного синуса і дуги аорти
Двобічне ураження поодинокого ядра
Лікування кортикостероїдами
Дезоксикортикостерон і надлишок харчової солі
Інші мінералокортикоїди
Часткова адреналектомія (гіпертензія внаслідок
реґенерації надниркової залози)
Генетичні
Спонтанна гіпертензія у різноманітних ліній щурів
Гіпертензія, зумовлена харчовою сіллю, у генетично
схильних щурів
Нокаут гена ендотеліальної N08 у мишей
Різноманітні типи трансгенних тварин
тикостерон спричинює гіпертензію, яка триває і після при-
пинення введення препарату. Важкий перебіг гіпертензії
простежується у тварин з однобічною нефректомією.
Гіпертензія у людей
У людей гіпертензія трапляється дуже часто і в разі
багатьох захворювань (табл. 33-6). Гіпертензія призводить
до низки значних порушень. У випадку довготривалого
збільшення опору, який потрібно подолати лівому шлу-
ночку (постнавантаження), простежується гіпертрофія сер-
цевого м’яза. Початкова відповідь полягає в активуванні
негайних ранніх генів м’язів шлуночків, після чого відбу-
вається активування серії генів, що беруть участь у рості
протягом фетального періоду. У разі гіпертрофії лівого
шлуночка прогноз поганий. Загальне споживання сер-
цем, що посилюється під час виштовхування серцем крові
на фоні підвищеного тиску (див. Розділ 29), ще більше зрос-
тає внаслідок збільшення об’єму серцевого м’яза. Тому
будь-яке зменшення вінцевого кровообігу у хворих з гіпер-
тензією призводить до важчих наслідків, ніж у здорових
людей. Звуження вінцевих судин, яке не спричинює жодних
симптомів за нормального розміру серця, у людей зі збіль-
шеним серцем може призвести до інфаркту міокарда. У
разі гіпертензії зростає ризик розвитку атеросклерозу, тому
тоді інфаркт міокарда часто виникає навіть за нормальних
розмірів серця. З часом здатність до компенсації високого
периферійного опору втрачається, і розвивається серцева
недостатність. Хворі з гіпертензією також схильні до тром-
бозу судин мозку і крововиливу в мозок. Ще одним усклад-
ненням є ниркова недостатність. Однак ризик серцевої
недостатності, інсульту і ниркової недостатності значно
зменшується внаслідок активного лікування гіпертензії,
навіть якщо вона помірна.
Злоякісна гіпертензія
Хронічна гіпертензія може прогресувати в разі розвит-
ку некротичних змін в артеріолах. Унаслідок цього швидко
виникають набряк сосочків очних нервів, церебральні роз-
лади і прогресуюча ниркова недостатність. Цей синдром
Таблиця 33-6. Частота різноманітних форм гіпертензії у
популяції хворих на гіпертензію1
Склад популяції, %
Есенціальна гіпертензія Ниркова гіпертензія 93
Реноваскулярна 2
Паренхіматозна Ендокринна гіпертензія 3
Первинний альдостеронізм 0,3
Синдром Кушінґа 0,1
Феохромоцитома 0,1
Інші надниркові форми 0,2
Лікування естрогенами Різні (синдром Літтла, коарктація аорти 1
тощо) 0,3
1 Модифіковано і відтворено за дозволом з МіІІіатз СН: Нурег-
ієпзіує уазсиїаг сіізеазе Іп: Наггізоп’з Ргіпсіріез ої ІпіегпаІ
Месіісіпе, 14111 есі. Еаисі А еі аі [есіііогз]. МсСга\л/-НіІІ, 1998).
СЕРЦЕВО-СУДИННИЙ ГОМЕОСТАЗ У НОРМІ ТА В РАЗІ ПАТОЛОГІЇ / 589
називають злоякісною гіпертензією; якщо його не лікувати,
то смерть настає до двох років. Однак його прогресування
можна припинити і стан хворого стабілізувати за допомо-
гою адекватної антигіпертензивної терапії.
Есенціальна гіпертензія
У 90% хворих з підвищеним артеріальним тиском при-
чина гіпертензії невідома, таку форму називають есенці-
альною гіпертензією. Перебіг нелікованої есенціальної
гіпертензії може бути різним. Зокрема, у жінок вона часто
є доброякісною, а підвищений артеріальний тиск протягом
багатьох ройів - єдиним симптомом. Однак гіпертензія
може також швидко переходити у злоякісну фазу.
Сьогодні есенціальну гіпертензію лікують, проте не
виліковують. Ефективного зниження артеріального тиску
можна досягти за допомогою ліків, що блокують ос-адре-
норецептори в периферійній або центральній нервовій
системі, та препаратів, які блокують р-адренорецептори;
речовин, які пригнічують активність ангіотензиноперетво-
рювального ензиму; блокаторів кальцієвих каналів і речо-
вин, що розслаблюють гладкі м’язи судин.
Інші типи гіпертензії
Хоча у більшості хворих гіпертензія есенціальна, збіль-
шується кількість хворих, у яких причина гіпертензії вияв-
лена. Отже, вони не належать до категорії хворих з есенці-
альною гіпертензією. Наприклад, гіпертензія у разі цукро-
вого діабету - це не захворювання, а синдром, який може
бути зумовлений багатьма причинами. Зокрема, до відомих
причин належать захворювання нирок, патологія наднир-
кових та інших ендокринних залоз, а також генетичні пору-
шення (див. табл. 33-6). Важливо знати ці причини, оскіль-
ки деякі з них не тільки лікують, а й виліковують.
Частина хворих з гіпертензією чутлива до солі, подібно
до ОаЬІ-щурів, чутливих до солі, тоді як в інших просте-
жується незначне підвищення артеріального тиску на фоні
дієти, збагаченої сіллю, аналогічно до ОаЬІ-щурів, резис-
тентних до солі. Оскільки наразі нема простих методів
виявлення людей, чутливих або резистентних до солі, то
рекомендація обмежувати споживання солі у всіх хворих
доцільна. Однак ступінь, до якого цим способом можна
запобігти гіпертензії, залежить від чутливості хворого до
солі.
У вагітних жінок гіпертензія, яка виникає в разі преек-
лампсії та еклампсії, можливо, спричинена пресорним
пептидом, що його виділяє плацента.
У людей дезоксикортикостерон і альдостерон підви-
щують артеріальний тиск, і гіпертензія є важливим симп-
томом первинного гіперальдостеронізму. Вона просте-
жується також у хворих з посиленою секрецією дезокси-
кортикостерону (див. Розділ 20). Гіпертензія особливо
виражена у випадку альдостеронізму, блокованого глю-
кокортикоїдами, вродженого захворювання, за якого
альдостеронізм зумовлений АКТГ-стимульованою альдо-
стеронсинтетазою (див. Розділ 20). Гіпокаліємія, яку спри-
чинюють ці гормони, призводить до ушкодження нирок
(гіпокаліємічна нефропатія), і гіпертензія за походжен-
ням частково може бути нирковою. Деяку роль відіграє
також збільшення об’єму крові, що циркулює, внаслідок
затримки №'.
У випадку гіпертензії, зумовленої надмірним продуку-
ванням альдостерону і дезоксикортикостерону, активність
реніну в крові низька. Вона також низька, з незрозумілих
причин, за нормального або низького продукування альдо-
стерону і дезоксикортикостерону у 10-15% хворих, а в
інших випадках гіпертензія есенціальна (гіпертензія з
низьким вмістом реніну).
Гіпертензія простежується також у випадку синдрому
Кушінґа, за якого рівень альдостерону здебільшого нор-
мальний. Причина гіпертензії в цьому разі незрозуміла.
Можливо, вона зумовлена посиленим продукуванням дезо-
ксикортикостерону, що спричинено збільшеним вмістом
АКТГ крові; посиленим продукуванням ангіотензиногену
завдяки збільшеній концентрації циркулювальних глю-
кокортикоїдів; прямою дією глюкокортикоїдів на артеріоли
або комбінацією перелічених факторів.
Феохромоцитома - пухлина мозкової речовини над-
ниркових залоз або катехоламінопродукувальної тканини
іншої локалізації - теж зумовлює розвиток гіпертензії. Фео-
хромоцитома описана у Розділі 20.
Ниркова гіпертензія, спричинена звуженням ниркових
артерій, описана вище і в Розділі 24. У разі синдрому Літ-
тла внаслідок активування епітеліальних №*-каналів від-
бувається затримка солі в організмі, що призводить до роз-
витку гіпертензії (див. Розділ 38).
Коарктація аорти - це вроджене звуження ділянки
грудної аорти, яке спричинює збільшення опору плину
крові і зумовлює виражену гіпертензію у верхній частині
тіла. Артеріальний тиск у нижній частині тіла здебільшого
є нормальним, хоча можливе його підвищення внаслідок
посиленого виділення реніну.
Довготривале застосування оральних контрацептивів,
які містять естрогени, у деяких жінок спричинює розвиток
вираженої гіпертензії. Гіпертензія зумовлена збільшеним
вмістом ангіотензиногену у крові, продукування якого сти-
мулюють естрогени (див. Розділ 24). У нормі збільшення
вмісту ангіотензину II у крові, спричинене збільшеною
концентрацією ангіотензиногену у крові, пригнічує виді-
лення реніну. Зниження рівня реніну сприяє нормалізації
вмісту ангіотензину II крові. Однак у деяких жінок механізм
зворотного зв’язку недосконалий і в них розвивається “гі-
пертензія таблеток”. Звичайно, спорадична гіпертензія у
жінок з нормальним артеріальним тиском не є підставою
для відмови від оральних контрацептивів, однак доцільно
рекомендувати їм перевіряти рівень артеріального тиску
кожні шість місяців.
СЕРЦЕВА НЕДОСТАТНІСТЬ
Патогенез
Реагування серця на посилене навантаження, зумовлене
хронічною гіпертензією, описане вище. Навантаження
зростає також у разі інфаркту міокарда внаслідок змен-
шення кількості працездатних м’язових волокон та за
деяких інших патологічних процесів. У випадку всіх цих
станів відбувається активування генів серця. Перше реагу-
вання на підвищення навантаження полягає у гіпертрофії
серцевих міоцитів. Гіперплазія тоді практично не відбува-
ється, оскільки міоцити мають обмежену здатність до про-
590 / РОЗДІЛ 33
ліферації. Гіпертрофія супроводжується дилатацією серця,
а в деяких випадках перебудовою шлуночків у відповідь
на патологічні зміни. Спочатку ці реакції є компенсатор-
ними, однак з прогресуванням основного захворювання
серце стає неспроможним забезпечити адекватний серце-
вий викид і повернення крові до нього. У цьому разі роз-
різняють два процеси: систолічну дисфункцію, за якої ско-
рочення шлуночків послаблюються, а ударний об’єм змен-
шується; діастолічну дисфунцію, за якої зменшується
еластичність шлуночків, що перешкоджає їхньому напов-
ненню протягом діастоли. Систолічна дисфункція зумов-
лює збільшення кінцевосистолічного об’єму шлуночків.
У цьому випадку фракція викидання, тобто частина крові
шлуночків, яка викидається протягом систоли, зменшу-
ється з 65% у нормі до 20%. Діастолічна дисфункція приз-
водить до зменшеного наповнення шлуночків протягом
діастоли і спричинює венозний застій. Спочатку хвилинний
об’єм крові неадекватний лише під час фізичного наван-
таження, та з часом він стає неадекватним і в стані спокою
(рис. 33-8).
Неадекватне наповнення артеріальної системи призво-
дить до опосередкованого барорецепторами активування
симпатичної нервової системи з подальшим звуженням
ниркових судин, посиленим виділенням реніну, а отже, і
альдостерону (див. Розділ 31). Унаслідок цього відбува-
ється виражена затримка і води, що сприяє венозному
застою і набрякам. Продукування АМР і НПМ посилю-
ється, однак їхню дію послаблюють механізми, що спри-
чинюють затримку Ка\
У разі серцевої недостатності може бути уражений пе-
реважно правий шлуночок (легеневе серце), та здебіль-
шого зміни відбуваються у більшому з товстішими стін-
ками лівому шлуночку. Крім того, зменшення хвилинного
об’єму може бути не абсолютним, а відносним. За наяв-
ності вираженого артеріовенозного анастомозу або тирео-
токсикозу чи дефіциту тіаміну абсолютне значення хви-
М Скелетним м'яз
□ Решта тіла
Застійна серцева
недостатність
Помірна Важка
Рис. 33-8. Зменшення хвилинного об’єму крові у разі застійної
серцевої недостатності; С - спокій; Н - максимальне наванта-
ження. Зверніть увагу, що у разі помірної недостатності хви-
линний об’єм крові у стані спокою є нормальним, зменшується
лише та частина, яка йде до скелетних м’язів під час наван-
таження Прогресування серцевої недостатності зменшує
хвилинний об’єм викид у стані спокою (модифіковано та від-
творено за дозволом з 2єіі8 К еі аі. Уазосопзігісіог тесїіа-
ПІ8ГП8 іп сопдезііуе Гіеагі Таііиге, Рагі І. МосІ Сопсеріз Сагсііо-
7азс 0І8 1989;58:7).
линного об’єму крові може збільшуватися. Однак якщо
хвилинний об’єм є неадекватним щодо потреб тканин, то
виникає серцева недостатність (недостатність зі значним
хвилинним серцевим об’ємом).
Прояви
Серцева недостатність може виявлятися раптовою смер-
тю (наприклад, унаслідок фібриляції шлуночків або повіт-
ряної емболії), кардіогенним шоком, хронічною застійною
серцевою недостатністю залежно від вираженості та
Таблиця 33-7. Спрощена схема патогенезу головних проявів застійної серцевої недостатності
Порушення Причина
Слабість, неможливість виконання фізичного навантаження Рання недостатність лівого шлуночка; хвилинний об’єм крові недостатній для перфузії м’язів, особливо неспроможність збільшувати хвилинний об’єм під час навантаження
Набряк крижів, литок Відтермінована недостатність правого шлуночка -> підвищення венозного тиску посилення трансудації рідини
Гепатомегалія Підвищення венозного тиску —> збільшення опору у системі портального кровообігу
Застій у легенях Відтермінована недостатність лівого шлуночка підвищення тиску у легеневих венах розтягування легеневих вен і трансудація рідини в альвеоли
Задишка під час навантаження Неспроможність лівого шлуночка збільшувати викид під час навантаження -» підвищення тиску у легеневих венах
Пароксизмальна задишка, набряк легень Можлива раптова невідповідність між хвилинним об’ємом крові лівого і правого шлуночка -> різке підвищення тиску у легеневих венах і капілярного тиску трансудація рідини в альвеоли
Ортопное Нормальне депонування крові у легенях в положенні лежачи посилюється застоєм крові у судинах легень; збільшення венозного надходження крові, не компенсо- ване лівим шлуночком (послаблюється у положенні сидячи, у разі піднімання голови на спеціальному ліжку або за допомогою подушок)
Дилатація серця Збільшення кінцеводіастолічного об’єму шлуночків
СЕРЦЕВО-СУДИННИЙ ГОМЕОСТАЗ У НОРМІ ТА В РАЗІ ПАТОЛОГІЇ / 591
швидкості розвитку гемодинамічних розладів. До найваж-
ливіших симптомів серцевої недостатності належать збіль-
шення розмірів серця, а також симптоми, наведені у табл.
33-7. Терміни рання недостатність та відтермінована
недостатність деколи використовують для позначення змін,
зумовлених, відповідно, систолічною або діастолічною
дисфункцією. Ці терміни не зовсім коректні, оскільки опи-
сані процеси відбуваються одночасно і зумовлені розла-
дами, які не можна відокремити один від одного. Проте ці
терміни корисні з погляду розуміння головних проявів сер-
цевої недостатності, тому їх використано в таблиці. Прояви
охоплюють набряк, зокрема відповідних ділянок тіла;
збільшення тривалості кровообігу; збільшення печінки
(гепатомегалія); задишка (диспное); набухання вен шиї.
Задишка сильно виражена в разі фізичного навантаження.
У важких випадках характерним симптомом є задишка,
яка посилюється, якщо людина лежить, і послаблюється,
якщо вона сидить (ортопное). Задишка може бути пара-
ксизмальною і деколи переходить у справжній набряк
легень.
У хворих з важкими змінами у міокарді, які здебільшого
мають серцеву недостатність, може виникати альтерну-
вальний пульс - стан, за якого ударний об’єм зменшується
з кожним другим ударом (рис. 33-9). Унаслідок цього з кож-
ним другим ударом систолічний тиск зменшується. При-
чина цих розладів не з’ясована. •
Лікування
Лікування застійної серцевої недостатності спрямоване
на підвищення скоротливості серця, усунення симптомів і
зменшення навантаження на серце. Сьогодні найефек-
тивнішим і поширеним методом лікування є пригнічення
утворення ангіотензину II за допомогою інгібіторів ангіо-
тензиноперетворювального ензиму. Лікувальний ефект
забезпечує також пригнічення дії ангіотензину II на Аіу
рецептори за допомогою непептидних антагоністів цих
рецепторів. Ці засоби зменшують концентрацію альдосте-
рону крові і знижують артеріальний тиск, зменшуючи пост-
навантаження на серце. Ефекти альдостерону можна
послабити застосуванням блокаторів альдостеронових
50
Рис. 33-9. Альтернувальний пульс у 51-річної жінки з гіпер-
тензією та застійною серцевою недостатністю (відтворено за
дозволом з МсЬаидЬІіп ОР Ітадез іп сііпісаі тесіісіпе. N ЕпдІ
0 Месі 1999;341:955).
рецепторів. Останні дослідження цих речовин свідчать про
позитивні результати. Послаблення тонусу венозних судин
за допомогою нітратів або гідралазину дає змогу збільшити
венозну ємність і, отже, зменшити кількість крові, що
надходить до серця, та послабити пренавантаження. У разі
застосування діуретиків зменшується затримка рідини.
Доведено, що речовини, які блокують Р-адренорецептори,
знижують захворюваність і смертність. Раніше для ліку-
вання застійної серцевої недостатності традиційно застосо-
вували препарати наперстянки, такі як дигоксин, оскільки
вони підвищують внутрішньоклітинну концентрацію Са2+
і спричинюють позитивний інотропний ефект (див. Розділ
3). Однак сьогодні їх розцінюють як препарати другого
ряду для лікування систолічної дисфункції і сповільнення
частоти серцевих скорочень у разі фібриляції передсердь
(див. Розділ 28).
ЛІТЕРАТУРА ДО ЧАСТИНИ VI: КРОВООБІГ
Аппйа§е ЗО: Воле тагго\у ігаизріапіабоп. N Еп&1 3 Мед
1994;330:827.
ВаЬіог ВМ, ЕЬоеззеї ТР: Нетаїоіоуу: А РаїИорИуЕюІоуісаІ
АрргоасИ, Згд ед. СЬигсЬіІІ Еіуіп^зіопе, 1994.
Вате8 ОМ, Кагіп М: Мисіеаг Гасіог-кВ - а ріуоіаі ігапзсгір-
боп Гасіог іп сЬгопіс іпЛаттаіогу дізеазез. N Еп^І 3 Мед
1997;336:1066.
Ваіїе^ау ЕЗ: Ап§іо§епезіз: МесЬапізбс іпзі^Ьіз, пеоуазсиїаг
дІ8еа8Є8, апд іЬегареиііс ргозресіз. З Мої Мед 1995;73:
333.
Віггег КВ (едйог): Врогії Месіісіпе/ог іИе Ргітагу Саге Рііу-
хісіап. АррІеіоп-Сепкігу-СТоЙз, 1984.
Випп НР: МесЬапізтз оГдізеазе: РаіЬо§епезіз апд ігеаітепі
о£зіскіе сеіі апетіа. N Еп§1 3 Мед 1997;337:762.
Саііїї КМ, Веп§8іоп ЗК: Сагдіо§епіс зЬоск. N Еп§1 3 Мед
1994;330:1724.
СЬої О XV, КоЬ 3¥: 7іпс апд Ьгаіп іп)игу. Аппи Кєу Кеи-гозсі
1998;21:347.
Оатрпеу КАЕ: ЕипсйопаІ ог§апіхаііоп о£ сепігаї раіЬ\уауз
ге§и1аіїп£ іЬе сагдіоуазсиїаг зузіет. РЬузіоІ Кєу 1994;74:
323.
Оєіуєз РЗ, Коід ІМ: ТЬе іттипе зузіет. (Т\уо рагіз.) N Еп^І
З Мед 2000;343:37,108.
Ое Угіез НЕ еі аі: ТЬе Ьіоод-Ьгаіп Ьаггіег іп пеигоіпЛат-
таіогу дізеазе. РЬагт Кез 1997:49:143.
ОиЬіп О: Карісі Іпіегргеіаііоп о]ЕКС’у 5іЬ ед. Соуєг, 1996.
Едуіпзоп Ь, МасКепхіе ЕТ, МсСиїїосЬ 3 (едйогз): СегеЬгаІ
Віоосі Е1о\м апсі МеІаЬоІізт. Кауеп Ргезз, 1992.
592 / РОЗДІЛ 33
Реггага М, Аііі^аіо К: Сііпісаі арріісаііопз о£ ап^іо^епіс
§го\уіЬ Гасіогз апд іЬеіг іпЬіЬііогз. №і Мед 1999;5:1359.
Ро1ко\у В, 8уапЬег§А: РЬузіоІо^у оГ сагдіоуазсиїаг а§іп§.
РЬузіоІ Кеу 1993;73:725.
Оаііі 85: №\у сопсеріз аЬоиі іЬе тазі сеІІ. N Еп§1 І Мед
1993 ;328:257.
ОгеепЬег§ РВ, Кіддеї 18К: ВеГісіепі сеііиіаг іттипііу— їїпд-
іп§ апд Гіхіп§ діє деїесіз. 8сіепсе 1999;285:546.
Огоззтап \УВ: Віазіоііс дузРипсііоп іп соп§езііуе Ьеагї Гаіі-
иге. N Еп§1 5 Мед 1991 ;325:1557.
НіЬі М, \ака]іта К, Нігапо Т: ІЕ-6 суіокіпе Ратіїу апд 8І£-
паї ігапздисііоп: А тодеї оГ іЬе суіокіпе зузіет. 5 Мої
Мед 1996;74:1.
Ноіїтап 51, 8раап 5А: Ргеззиге-Ноху геїаііопз іп согопагу
сігсиїаііоп. РЬузіоІ Кеу 1990;70:331.
Ноїїтапп 5 А еі аі: РЬу1о§епеііс регзресііуез іп іппаіе ітти-
пііу. 8сіепсе 1999;284:1313.
Ногі М, Кііахаке М: Адепозіпе, діє Ьеагї, апд согопагу сіг-
сиїаііоп. Нурегїепзіоп 1991 ;18:565.
Ноуег Ь\¥: НеторЬІІІаА. N Еп§1 5 Мед 1994;330:38.
Нипі 58, Огг НТ: НЕА апд таіетаї-РеіаІ гесо^піііоп. ЕА8ЕВ
5 1992;6:2344.
Нипіег 55, СЬіеп КК: 8І£па1іп§ раіЬ\уауз Гог сагдіас Ьу-
регїгорЬу апд Раііиге. N Еп§1 5 Мед 1999;341:1276.
КаизЬапзку К: ТЬготЬороіеііп. N Еп§15 Мед 1998;339:746.
Кігкепдаїї \¥М еі аі: Кесоттепдаіїопз Гог Ьитап Ьіоод ргез-
зиге деіегтіпаііоп Ьу зрЬу^тотапотеіегз. Нурегїепзіоп
1981;3:510А.
Еапдаи С, Еап^е КА, Нііііз ЕВ: Регсиіапеоиз ігапзіитіпаї
согопагу ап^іоріазіу: А регзресііуе Гог іЬе 1990’8. №іиге
1994;330:981.
ЕеЬгег КІ, Оапх Т, 8е1зіед МЕ: Веіепзіпз: Епдо^епоиз ап-
ІіЬіоііс реріідез іп апітаї сеііз. СеІІ 1991;654:229.
Еєуі М, іеп Саіе Н: Віззетіпаіед іпігауазсиїаг соа^иіаііоп.
N Еп§1 5 Мед 1999;341:586.
Еєуіп ЕК: ЕпдоіЬеІіпз. N Еп§1 5 Мед 1995;333:356.
ЬіГіоп КР: Моїесиїаг §епеіісз о£ Ьитап Ьіоод ргеззиге уагі-
аііоп. 8сіепсе 1996,272:676.
Еіи С-С, ¥оип§ ЕН¥, ¥оип§ 5В-Е: ЬутрЬосуіе-тедіаіед
суіоіузіз апд дізеазе. N Еп^і 5 Мед 1996;335:1651.
Еизсіпзказ Р\У, Еахуіег 5: Іпіе^гіпз аз дупатіс ге§и1аіог8 о£
уазсиїаг їипсііоп. РА8ЕВ 5 1994;8:929.
Еизіег АВ: СЬетокіпез - сЬетоіасііс суіокіпез іЬаі тедіаіе
іпЛаттаііоп. N Еп§1 5 Мед 1998;338:436.
Маг^оііиз Н8: Каїїікгеіпз апд кіпіпз. Нурегїепзіоп
1995;26:221.
МепдеїзоЬп МЕ, Кагаз КН: ТЬе ргеуепііуе еЛесіз о£езіго^еп
оп іЬе сагдіоуазсиїаг зузіет. N Еп§15 Мед 1999;300:1801.
Мотду Р: Кадіо£гециепсу аЬІаііоп аз ігеаітепі Гог сагдіас
аггЬуіЬтіаз. N Еп§1 5 Мед 1999;340:534.
Місо£оззіап АЕ, ЕеасЬ-Нипіооп С8 (едііогз): Врасе Ркузі-
оіоуу апсі Месіісіпе, 2пд ед. Ееа & РеЬі^ег, 1989.
Міетапп 5Т: Сагдіориїтопагу гезизсііаііоп. N Еп§1 5 Мед
1992,327:1075.
ОдеЬ М: ТЬе гоїе о£ герегїизіоп-іпдисед іп]игу іп іЬе раіЬо-
£епезіз о£ іЬе сгизЬ зупдготе. N Еп§1 5 Мед 1991,324:
1417.
О§а\уа М: ВіЛегепііаііоп апд ргоііїегаііоп о£ Ьетаіороіеііс
зіет сеііз. Віоод 1993;81:2844.
Оріе ЬН: Тке Неагі: Рку8ІоІоуу Ргот СеІІ іо Сігсиїаііоп,
Згд ед., Еірріпсоіі-Кауеп, 1998.
Рагіїїо 5Е: РаіЬо^епеііс тесЬапізтз о£ зерііс зЬоск. N Еп§1
5 Мед 1993;328:1471.
Р1о\у ЕР еі аі: ТЬе сеІІ Ьіоіо^у о£ іЬе ріазтіпо^еп зузіет.
РА8ЕВ 5 1995:9:939.
Рорр КЬ: ЕсЬосагдіо^гарЬу. N Еп§1 5 Мед 1990;323:101.
Ргетаск В А, 8сЬа11 Т5: СЬетокіпе гесеріогз: 6аіе\уауз іо
іпЛаттаііоп апд іпіесііоп. \аі Мед 1996;2:1174.
Ргузіо\узку Е1Ч, Кеііп 05: Сатсііас Аггкуіктіаз: Ап Іпіеугаіесі
Арргоаск /ог іке Сііпісіап. МсОга\у-Ні11, 1994.
КапзоЬоіТ КМ: Сеііиіаг гезропзез іо іпіегїегопз апд оіЬег
суіокіпез: іЬе 5АК-8ТАТ рагаді^т. N Еп§1 5 Мед 1998;
338:616.
КеісЬІіп 8: №игоепдосгіпе-іттипе іпіегасііопз. N Еп§1 5
Мед 1993 ;329:1246.
Коїапд РЕ: Вгаіп Асііуаііоп. \¥і1еу, 1993.
КозепЬег^ КВ, Аігд \УС: Уазсиїаг-Ьед-зресіЛс Ьетозіазіз
апд Ьурегсоа^иІаЬІе зіаіез. N Еп^і 5 Мед 1999;340:1555.
Козз К: АіЬегозсІегозіз - ап іпЛаттаіогу дізеазе. N Еп§1 5
Мед 1999;340:115.
Кохуєіі ЕВ: Нитап Сагсііоуазсиїаг Сопігоі. ОхГогд ііпіу
Ргезз, 1993.
8сЬгіеЬег 8Е: СЬетізігу апд Ьіоіо^у оГ іЬе іттипорЬіІіпз
апд іЬеіг іттипозирргеззіуе Іі^апдз. 8сіепсе 1991 ;251:
283.
8Ьерго В, Могеї NМ^: Регісуіе рЬузіо1о§у. РА8ЕВ 5 1993;9:
1031.
8іп§ег А5, Сіагк КАР: Сиіапеоиз \уоипд Ьеа1іп§. N Еп£І 5
Мед 1999;341:738
8іат1ег 58, 8іп§ег В5, Ьозсаіхо 5: ВіосЬетізігу о£піігіс ох-
іде апд іі8 гедих-асііуаіед Рогтз. 8сіепсе 1993;258:1848.
8\уа1ез 5В (едііог): ТехіЬоок о/Нурегіепзіоп. В1аск\уе11,1994.
Теддег ТР еі аі: ТЬе зеїесііпз: Уазсиїаг адЬезіоп тоїесиїез.
РА8ЕВ 5 1995;9:866.
ХУаІдтап ТА: Мопосіопаї апііЬодіез іп діа^позіз апд іЬегару.
8сіепсе 1991 ;252:1657.
ХУеІІег РР: ТЬе іттипоЬіо1о§у о£еозіпорЬіІз. N Еп§1 5 Мед
1991;324:1110.
\Угі§Ьі 85: Нитап етЬгуопіс зіет-сеїі гезеагсЬ: зсіепсе апд
еіЬісз. Ат 8сіепіізі 1999;87:352.
7агеі ВЬ, ХУаскегз Р5: Мисіеаг сагдіо1о§у. N Еп§1 5 Мед
1993;329:855.
Частина VII
Дихання
Функції легень
ВСТУП
Термін дихання використовують для означення двох
процесів: зовнішнього дихання - абсорбції О21та вида-
лення СО2 з організму; та внутрішнього дихання - ути-
лізації О2 та продукування СО2 клітинами і газообмін між
клітинами та їхнім рідинним середовищем. Особливості
утилізації О2 та продукування СО2 описано у Розділі 17.
Тут розглянемо функції дихальної системи у зовнішньому
диханні, тобто в процесах, що відповідають за транспор-
тування О, до легень та видалення СО2 з них. У Розділі 35
описано транспортування О2та СО2до та від тканин.
Дихальна система складається з органа газообміну (ле-
гені) та системи, що виконує вентиляцію легень. Ця сис-
тема утворена грудною кліткою; дихальними м’язами, які
збільшують чи зменшують розмір грудної клітки; ділянка-
ми головного мозку, що регулюють роботу мозку; шляхами
та нервами, що поєднують головний мозок з м’язами. У
спокої за норми частота дихання людини 12-15 разів за
І хв. Близько 500 мл повітря за один дихальний акт, або 6-
8 л/хв вентилюється під час вдихань та видихань. Повітря,
яке вдихають, змішується з газом, що міститься в альвео-
лах, і простою дифузією О2 потрапляє у кров легеневих
капілярів, тоді як СО, надходить в альвеоли. Отже, що-
хвилини 250 мл О2 надходить, а 200 мл СО2 вивільнюється
з організму людини.
Сліди інших газів, наприклад метан з кишки, теж є у
повітрі, яке видихають Алкоголь та ацетон видихають,
якщо вони наявні в організмі у певній концентрації. Зага-
лом можна визначити 250 різних летких речовин у повітрі,
яке видихає людина.
ВЛАСТИВОСТІ ГАЗІВ
Відомо, що тиск газу пропорційний до його температури
та кількості молів в об’ємі:
_ пЯТ . .
Р = у (з рівняння про стан ідеального газу),
де Р - тиск; п - кількісі ь молів; К - стала газу; Т - абсолют-
на температура; V - об’єм.
Парціальний тиск
На відміну від рідин, гази намагаються заповнити весь
доступний для них об’єм. Об’єм, зайнятий деякою кількіс-
тю молекул газу за певної температури і тиску (ідеальний),
не залежить від складу газу. Тому тиск, що його чинить
один газ у суміші газів (парціальний тиск Р), залежить
від частки цього газу в суміші, яка формує загальний тиск.
У сухому повітрі О2 становить 20,98%; СО2 - 0,04%; И2
- 78,06%; інші інертні гази (як аргон та гелій) - 0,92%.
Барометричний тиск Рв на рівні моря - 760 мм рт. ст.
(1 атмосфера). Парціальний тиск О, у сухому повітрі - 0,21
х 760, або 160 мм рт. ст. на рівні моря. Парціальний тиск
та інших інертних газів - 0,79 х 760 мм рт. ст.. а РСо2 -
0,0004 х 760, або 0,3 мм рт. ст. Відсотковий вміст водяної
пари в повітрі найбільше залежить від клімату, а парціальні
ж тиски окремих газів змінюються незначно Повітря
вдихання насичується водяною парою проходячи до ле-
гень. Оскільки Рн2о ПРИ температурі тіла 37°С становить
47 мм рт. ст., то парціальний тиск газів у повітрі, яке
досягло легень, Ро2 = 149, РС()2 = 0,3 мм рт. сг., (включно з
іншими інертними газами). Ри2 = 564 мм рт. ст. (включно з
іншими газами).
Газ дифундує з ділянок високого тиску до ділянок низь-
кого, рівень дифузії залежить від концентраційного граді-
єнта і природи бар’єра між цими ділянками. Якщо суміш
газів контактує з якоюсь рідиною, то кожний газ із цієї су-
міші дифундує залежно від його парціального тиску та роз-
чинності. Парціальний тиск газу в рідині - це той тиск, за
якого газова складова врівноважена з рідиною і залежить
від концентрації молекул цього газу в рідині
Методи кількісного вимірювання дихання
Дихальні рухи можна визначати за допомогою запису-
вання зміни розмірів грудної клітки або спірометрів (див.
табл. 17-1), які також даюіь змогу виміряти об’єми газу,
які видихають або вдихають. Оскільки об’єми газу зале-
жать від температури, тиску і кількості води, що насичує
їх, то важливо скоректувати ці вимірювання щодо стан-
дартних умов. Чотири найважливіші стандарти і а іхні абре-
віатури наведено у табп. 34-1. Сучасні засоби і азової о ана-
лізу дають змогу швидко і надійно визначити склад газових
сумішей та вміст газів у рідинах тіла. Наприклад, детектори
О, та СО2 - чутливі до змін невеликих кількостей О, та
39 367-2
594 / РОЗДІЛ 34
Таблиця 34-1. Стандартні правильні умови вимірювання
газових об’ємів
СТТС 0°С, 760 мм рт. ст., сухість (стандартна температура і тиск, сухість)
тттнвп Температура тіла і тиск, насиченість водяною парою
нттс Навколишня температура, тиск і сухість
нттн Навколишня температура, тиск, насиченість водяною парою
СО2, можуть бути інстальовані в дихальні шляхи чи без-
посередньо у судини та тканини. Це забезпечує постійне
вимірювання РО2 та Рсо2- Довготривале дослідження окси-
генації провадять неінвазивним методом з використанням
оксигемометра, який звичайно прикріплюють до вуха. По-
глинання світла, що проходить через тканину, прямо про-
порційне до вмісту оксигемоглобіну в цій тканині, крім
того, оксигемометр самостійно обчислює сталу абсорбції
самої тканини та інших компонентів, вимірюючи тільки
абсорбцію артеріальної крові. За допомогою полум’яного
абсорбційного спектроскопа швидко вимірюють СО,,
монооксид вуглецю (СО) та низку газів, які використовують
в анестезії. Крім цього, гази можна визначати за допомо-
гою методів газової хроматографії та мас-спектрометрії.
АНАТОМІЯ ДИХАЛЬНОЇ СИСТЕМИ
Повітроносні шляхи
Повітря, яке вдихають, проходячи через носову порож-
нину та глотку, нагрівається та зволожується. Далі воно
проходить через трахею, бронхи, бронхіоли, дихальні
бронхіоли, альвеолярні протоки та досягає альвеол (рис.
34-1).
У проміжку між трахеєю та альвеолами дихальні шляхи
діляться 23 рази. Перші 16 генерацій утворюють провідний
відділ дихальних шляхів, який тільки транспортує газ від і
до навколишнього середовища. Цей відділ формують брон-
хи, бронхіоли та термінальні бронхіоли. Решту сім гене-
рацій - це перехідний та власне дихальні відділи, де й від-
бувається газообмін. До них належать дихальні бронхіоли,
альвеолярні протоки та альвеоли. Цей структурний мно-
жинний поділ надзвичайно збільшує сумарний переріз
дихальних шляхів: з 2,5 см2 у трахеї до 11 800 см2 в аль-
Рис. 34-1. Структура легені: А - альвеола; АП - альвеолярна протока; ДБ - дихальна бронхіола; ТБ - термінальна бронхіола
(модифіковано з ЗіаиЬ МС: Тїіїіе раІНорНузіоІоду ої риїтопагу едета. Нит РаііюІ 1970;1:419).
ФУНКЦІЇ ЛЕГЕНЬ/595
Рис. 34-2. Залежність між загальною площею поперечного
перерізу та Генераціями дихальних шляхів. Зверніть увагу,
як надзвичайно швидко збільшується загальна площа попе-
речного перерізу в дихальній зоні. Як наслідок, швидкість по-
ширення газу під час вдихання у цій зоні зменшується до
дуже низького рівня (відтворено за дозволом з Мезі ЗВ: Яез-
рігаіогу РКузіоІоду: ТЬе Еззепііаіз, 4іГі есі. \Л/іІІіатз & \Л/іІкіпз,
1990).
веолах (рис. 34-2). Ось чому швидкість плину повітря на-
віть у дихальних шляхах малого діаметра зменшується
незначно.
Альвеоли оточені легеневими капілярами. Отже, по-
вітря та кров розділені тільки альвеолярним епітелієм і
капілярним ендотелієм сумарною товщиною десь 0,5 мкм
(рис. 34-3). В організмі людини є 300 мільйонів альвеол, а
загальна площа їхніх стінок, що контактує з капілярами,
становить в обох легенях понад 70 м2.
Альвеоли складаються з двох типів епітеліальних клі-
тин. Альвеолоцити типу І - це плоскі епітеліальні клітини
з великою видовженою цитоплазмою, що прилягають до
капілярів. Альвеолоцити типу II (зернисті пневмоцити)
тонші та містять нерівні цитоплазматичні включення. Ці
клітини продукують сурфактант (див. нижче). В альвеолах
можна визначити й інші типи епітеліальних клітин; як
звичайно, це альвеолярні макрофаги легень (АМЛ), лімфо-
цити, плазматичні клітини, АРІЮ-клітини (див. Розділ 26)
та мастоцити.
Мастоцити (див. Розділ 27) містять гепарин, ліпіди,
гістамін та протеази, які беруть участь в алергічних реак-
ціях.
Рис. 34-3. Ділянка міжальвеолярної перегородки у легені до-
рослої людини. Легеневий капіляр (кап) у перегородці вміщує
плазму й еритроцити. Зверніть увагу на близько розташовану
ендотеліальну стінку і легеневий епітелій, відділений на міс-
цях волокнами сполучної тканини (вст); ея - ядро ендотелі-
альної тканини; яаі - ядро альвеолоцита типу І; а - альвео-
лярний простір; ам - альвеолярний макрофаг (відтворено за
дозволом з Виггі РА: Оеуеіортепі апсі дго\л4Н ої Ьитап Іипд.
Іп: НапсіЬоок ої Рґіузіоіоду, Зесїіоп 3, ТЬе Везрігаіогу 8узіет.
Еізїітап АР, ЕізЬег АВ [есіііогз]. Атегісап РЬузіоІоду Зосіеіу,
1985)
Бронхи та їхня іннервація
Стінка трахеї та бронхів складається з хрящової тканини
та порівняно невеликого об’єму гладких м’язів. Її внутріш-
ня поверхня вкрита війчастим епітелієм, а також містить
слизові та серозні залози. Війки доходять аж до респіра-
торних бронхіол. Проте залоз, як і хрящової тканини, вже
нема серед епітелію бронхіол та термінальних бронхіол.
Однак тут міститься значно більше гладких м’язів, особ-
ливо якщо врахувати кількість м’язів, причетних до витон-
чення стінок бронхіол. Стінки бронхів та бронхіол іннервує
автономна нервова система. Тут розміщена велика кіль-
кість мускаринових рецепторів, і імпульсація від холіноре-
цепторів зумовлює бронхоконстрикцію. У бронхіальному
епітелії та гладких м’язах наявні |32-адренорецептори.
Певна частина м’язів бронхів взагалі не іннервується. Деякі
з них, розміщені у холінових закінченнях, нейтралізують
ацетилхолін. Бронходилатацію з одночасним збільшенням
бронхосекреції спричинює подразнення р2-адренорецеп-
торів (див. табл. 13-2), тоді як о^-адренорецептори галь-
596 / РОЗДІЛ 34
Рис. 34-4. Тиск крові (мм рт. ст.) у малому (легеневому) та
великому (системному) колах кровообігу (модифіковано і
відтворено за дозволом з Сотгое ЛЧ Л: РЬузіоІоду ої Резрі-
гаїіоп, 2псІ есі. Уваг Воок МесІісаІ РиЬІізґіегз, 1974).
Рис. 34-5. Співвідношення між бронхіальним та легеневим
кровопостачанням. Легеневі артерії створюють легеневу ме-
режу капілярів. Бронхіальна артерія А забезпечує кров’ю ме-
режу капілярів В, С, О. Мережа В - це бронхіальні капіляри,
що забезпечують бронхіоли, які анастомозують з легеневими
капілярами і впадають у легеневі вени. Мережа С - бронхі-
альні капіляри, що проходять до більшості бронхів; ці судини
утворюють бронхолегеневі вени, які переходять у легеневі
вени. Мережа капілярів О - це бронхіальні капіляри, що забез-
печують кров’ю часткові та сегментарні бронхи. Вони утво-
рюють справжні бронхіальні вени, які впадають у непарну
або міжреберні вени. Ділянки, позначені темним кольором,
мають низький вміст О2 (відтворено за дозволом з Миггау ЗЕ:
ТЬе Могтаї і_ипд. Заипсіегз, 1986).
мують цей процес. Крім того, простежується додаткова
нехолінергічна неадренергічна іннервація бронхіол, що
теж зумовлює бронходилатацію; є докази й того, що ВІП -
це трансмітер, що спричинює бронходилатацію.
Легеневий кровообіг
Майже вся кров людського тіла проходить через леге-
неві артерії та легеневе капілярне ложе, де вона насичу-
ється киснем, і через легеневі вени повертається до лівого
передсердя (рис. 34-4). Особливі, значно меншого діа-
метра, бронхіальні артерії відходять від системних артерій
та формують капіляри, поєднані з бронхіальними венами
чи анастомозують з легеневими капілярами або легеневими
венами (рис. 34-5). Бронхіальні вени впадають у непарну
вену. Бронхіальний кровообіг забезпечує поживними речо-
винами бронхи і плевру. Насиченість лімфатичними суди-
нами найбільша порівняно з будь-яким іншим органом
(див. рис. 34-1).
Інші аспекти легеневого кровообігу описані нижче.
МЕХАНІКА ДИХАННЯ
Вдихання та видихання
Легені та грудна стінка мають еластичну будову. У нормі
між ними є тільки тонкий прошарок рідини. Легені легко
ковзають по грудній стінці, однак протидіють відділенню
від неї, як, наприклад, два зволожені кусники скла легко
ковзають один по одному, проте роз’єднати їх доволі склад-
но. Тиск у просторі між легенями і грудною стінкою (внут-
рішньоплевральний тиск) є субатмосферним (див. рис. 34-
3). Легені під час дихання розтягуються, наприкінці кож-
ного видихання зусилля легень віддалитись від грудної
стінки урівноважені здатністю грудної стінки відхилитись
у протилежному напрямі. У випадках розгерметизації груд-
ної клітки (наприклад, отвір у грудній стінці) легені колап-
сують (спадаються); коли вони втрачають свою елас-
тичність, то грудна стінка розширюється і стає бочкопо-
дібною.
Акт вдихання є активним процесом. Скорочення ди-
хальних м’язів збільшує об’єм грудної порожнини. Внут-
рішньоплевральний тиск в основі легень, який звично ста-
новить близько -2,5 мм рт. ст. (щодо атмосферного) на
початку вдихання, знижується до -6 мм рт. ст. Легені пере-
ходять у стан більшого об’єму. Тиск у дихальних шляхах
стає дещо негативним, і повітря надходить до легень (рис.
34-6). Наприкінці вдихання від моменту, коли сили роз-
тягнення легень та грудної стінки втрачають урівноваже-
ність, сила розтягнення легень спрямовує грудну стінку в
положення видихання. Тиск у дихальних шляхах стає
незначно позитивним, і повітря виходить з легень. У цілому
дихальні м’язи в акті видихання не задіяні, тому його вва-
жають пасивним процесом. Тільки на початку вдихання
простежується скорочення деяких дихальних м’язів, що
уповільнює видихання.
Сильне зусилля вдихання може знизити внутрішньо-
плевральний тиск до -ЗО мм рт. ст. і більше, зумовлюючи
значний ступінь наповнення легень. Якщо вентиляція
ФУНКЦІЇ ЛЕГЕНЬ / 597
Рис. 34-6. Зміни внутрішньоплеврального (внутрішньогрудного) та внутрішньолегеневого тисків щодо атмосферного тиску під
час вдихання та видихання. Зверніть увагу: якби не було повітряної та тканинної резистентності, то внутрішньоплевральний
тиск відображала б штрихова лінія, тоді як справжня крива тиску зміщена ліворуч унаслідок цих резистентностей (див. також
рис. 34-15).
збільшується, то об’єм видихання легень теж збільшується
шляхом скорочення експіраторних м’язів і зменшення
об’єму внутрішньогрудного простору.
Легеневі об’єми
Об’єм повітря, що надходить до легень під час кожного
вдихання (або об’єм повітря, що виходить з легень під час
кожного видихання) називають дихальним об’ємом.
Об’єм повітря, який можна вдихнути під час максимально-
го вдихання понад дихальний об’єм, називають резервним
об’ємом вдихання.
Об’єм повітря, який можна видихнути під час макси-
мального видихання понад дихальний об’єм, називають
резервним об’ємом видихання.
Об’єм повітря, що залишається в легенях після макси-
мального видихання, є залишковим. На рис. 34-7 показані
легеневі об’єми за умов норми та їхні комбінації. Простір
повітроносних шляхів, заповнений газом, який не перехо-
дить у кров легеневих судин, називають об’ємом мертвого
простору.
Життєва ємність - це найбільший об’єм повітря, який
можна вдихнути після максимального вдихання, часто він
є клінічним показником функції легень, даючи корисну
інформацію як про силу дихальних м’язів, так і про інші
аспекти акту дихання. Частина життєвої ємності, яку види-
хають під час першої секунди форсованого видихання
(ЕЕУр з англ. Гогсесі ехрігаїіоп уоіите - об’єм форсованого
видихання першої секунди) (рис. 34-8) дає важливу додат-
кову інформацію. Інколи життєва ємність є в межах норми,
а РЕУ] знижується завдяки підвищеному опору дихальних
шляхів, наприклад, під час бронхоспазму в разі бронхіаль-
ної астми. Об’єм повітря, який вдихають за 1 хв (легенева
вентиляція, хвилинний дихальний об’єм), у нормі сягає
6 л (500 мл кожного вдихання х 12 вдихань/хв). Макси-
мально можлива вентиляція (ММВ), яку часто назива-
ють максимальною дихальною ємністю, є тим найбіль-
шим об’ємом газу, який може ввійти в легені або вийти з
них за 1 хв у разі максимально напруженого дихання. У
нормі ММВ становить 125-170 л/хв.
Дихальні м’язи
Рух діафрагми спричинює зміну внутрішньогрудного
об’єму в межах 75%. Охоплюючи дно грудної порожнини,
діафрагма нависає над печінкою і рухається донизу під час
вдихання як поршень. Хода руху діафрагми виносить від
1,5 до 7,0 см під час глибокого вдихання (рис. 34-9).
Діафрагма складається з трьох частин: реберної, що
створена волокнами, дотичними до зв’язок хребців; цент-
рального сухожилля, до якого прикріплені волокна ребер-
ної частини; ніжки діафрагми. Центральне сухожилля вод-
ночас є внутрішньою частиною перикарда. Волокна ніжок
охоплюють з обох боків стравохід і можуть перетискати
його в разі скорочення. Оскільки реберна частина та ніжки
діафрагми іннервовані різними волокнами діафрагмаль-
ного нерва, то, відповідно, можуть скорочуватись незалеж-
но. Наприклад, під час блювання та відригування внутріш-
598 / РОЗДІЛ 34
^ІІІДІДШіІДІІдІЖМ
1111
Об’єм, л
1,2
у спокої
2,7
2,2
РОВд - резервний об’єм вдихання ДО - дихальний об'єм
РОВид - резервний об’єм видихання ЗО - залишковий об'єм
0
Об’єм, л
Чоловіки Жінки
Г РОВд 3,3 1,9 | Ємність вдихання
Життєва ємність ДО 0,5 0,5
І* РОВид 1,0 0,7 | Функційна ємність
ЗО 1,2 1,1
Загальна легенева ємність 6,0 4,2
Дихальний хвилинний об’єм (у спокої) - 6 л/хв
Альвеолярна вентиляція (у спокої) - 4,2 л/хв
Максимальна форсована вентиляція - 125-170 л/хв
Часова життєва ємність - 83% від загальної за 1 с; 97% за 3 с
Робота стокійного дихання - 0,5 кгм/хв
Максимальна робота дихання - 10 кгм/дихання
Рис. 34-7. Об’єми легень та деякі динамічні показники дихання. Діаграма вгорі праворуч відтворює покази спірометра у часі.
ньочеревний тиск збільшується завдяки скороченню ребер-
них волокон. У період, коли волокна ніжок розслаблені,
відбувається переміщення вмісту шлунка в стравохід. Зна-
чення волокон ніжок діафрагми в акті ковтання описане в
Розділі 26.
Рис. 34-8. Об’єм газу, що його вдихає нормальний дорослий
чоловік під час форсованого вдихання, демонструючи ФОВд1
і життєву ємність (ЖЄ) (відтворено за дозволом з Сгаро ЕЮ:
Риїтопагу-їипсііоп Іеєііпд. N ЕпдІ 3 Месі 1994;331:25. Мазза-
сїіизеіїз МесІісаІ Зосіеїу, 1994).
іншими важливими інспіраторними м’язами (вдихан-
ня) є зовнішні міжреберні м’язи, які проходять косо, впе-
ред і вниз від ребра до ребра. Точка опори ребер міститься
на хребті, тому під час скорочення міжреберних м’язів під-
німаються ребра, розташовані нижче. Це штовхає грудину
допереду та збільшує передньо-задній діаметр грудної кліт-
ки. Поперечний діаметр теж збільшується, однак не настіль-
ки. Як діафрагма, так і зовнішні міжреберні м’язи в змозі
самотужки підтримувати достатню вентиляцію легень.
Перетин спинного мозку над третім шийним сегментом
призводить до фатальних наслідків, якщо не задіяна штучна
вентиляція легень, тоді як перетин нижче п’ятого шийного
сегмента - ні, бо діафрагмальний нерв, що відходить від
шийних сегментів С3-С5, залишається неушкодженим.
Навпаки, у хворих з білатеральним паралічем діафрагмаль-
ного нерва, проте зі збереженням іннервації міжреберних
м’язів дихання затруднене, та достатнє для підтримання
життя. Драбинчасті й грудинно-ключично-соскоподібні
м’язи шиї є допоміжними м’язами вдихання і допомагають
підняти грудну клітку в разі посиленого дихання.
Зменшення внутрішньогрудного об’єму та посилене
вдихання простежуються під час скорочення експіраторних
м’язів (видихання). Внутрішні міжреберні м’язи діють саме
так, тому що проходять косо вниз і назад від ребра до ребра
й штовхають реберну клітку донизу під час скорочення.
Скорочення м’язів передньої черевної стінки теж допома-
гає видиханню, тягнучи грудну клітку донизу і всередину,
ФУНКЦІЇ ЛЕГЕНЬ/599
Рис. 34-9. Рентгенографія грудної клітки у випадку максимального видихання (ліворуч) і максимального вдихання (праворуч).
Штрихова біла лінія відображає межі легень у разі максимального видихання (відтворено за дозволом з Согпгое ЗН Зг: РЬузі-
оіоду ої Реврігаїіоп, 2псІ есі. Уеаг Воок МесІісаІ РиЬІівЬегв, 1974).
а в разі збільшення внутрішньогрудного тиску ще й
піднімаючи діафрагму.
Голосова щілина
Під час вдихання дещо скорочуються відвідні м’язи
гортані. Це приводить до відведення голосових зв’язок та
відкривання голосової щілини. Під час ковтання привідні
м’язи рефлекторно скорочуються, голосова щілина закри-
вається, що попереджує потрапляння їжі, рідин чи блюво-
тиння у легені. У хворих, що втратили свідомість або пере-
бувають під анестезією, закриття голосової щілини може
бути неповним, тому блювотиння може досягти трахеї і
спричинити запальну реакцію легень (аспіраційна пнев-
монія).
М’язи гортані іннервовані гілками блукаючого нерва.
Якщо відвідні м’язи паралізовані, то виникає інспіраторний
стридор. Якщо ж паралізовані привідні м’язи, то їжа і ріди-
на мають змогу потрапити в трахею, спричинюючи аспі-
раційну пневмонію та набряк легень. Двобічна ваготомія
в шийному відділі спинного мозку, проведена на експери-
ментальних тваринах, зумовлює повільний розвиток
фатальної легеневої недостатності та набряк легень. На-
бряк легень настає у кінцевій стадії аспірації, проте інколи
виникає в разі трахеотомії, проведеної перед ваготомією.
Тонус бронхів
У цілому гладкі м’язи бронхіальної стінки допомагають
диханню. Бронхи під час вдихання розширюються, а під
час видихання звужуються. Розширення (бронходилата-
цію) регулює симпатична, а звуження (бронхоконстрикцію)
- парасимпатична іннервація. Стимулювання чутливих
рецепторів дихальних шляхів подразниками та хімічними
речовинами (такими як сульфурдіоксид) зумовлює реф-
лекторну бронхоконстрикцію через холінергічну іннерва-
цію. Холодне повітря теж спричинює бронхоконстрикцію;
подібно діють і фізичні вправи, бо форсоване дихання, що
характерне для них, супроводжується охолодженням
дихальних шляхів. У додаток, м’язи бронхів оберігають
бронхи від кашлю. Зафіксовано циркадний ритм тонусу
бронхів з максимальною схильністю до констрикції близь-
ко 6 год ранку та властивістю до максимальної дилатації о
18 год вечора. Як зазначено вище, бронходилатацію зумов-
лює ВІП. З іншого боку, речовина Р спричинює бронхо-
констрикцію, подібно до дії аденозину через вплив на А(-
рецептори (див. Розділ 4), як і інші цитокіни та модулятори
запалення. Роль цих субстанцій у патогенезі астми розгля-
нута в Розділі 37, однак значення їх у фізіології регулю-
вання бронхіального тонусу остаточно не з’ясоване.
Еластичність легень і грудної стінки
Зв’язок між рухом легень і грудної клітки можна роз-
глянути на прикладі живих об’єктів. В експерименті ніздрі
обстежуваному закривають спеціальною прищіпкою, і
людина дихає тільки ротом через спірометр, у якому є спе-
ціальний клапан для вимірювання тиску. Як тільки людина
вдихне деякий об’єм повітря, клапан спрацьовує і пере-
криває подальше його надходження. Потім відбувається
записування тиску повітря в дихальних шляхах; дихальні
м’язи в цьому разі розслаблені. Записування тиску повто-
рюють під час кожного вдихання і видихання різних об’є-
мів повітря. Криву співвідношення тиску в дихальних
шляхах до об’єму повітря називають кривою релаксації
600 / РОЗДІЛ 34
тиску (рис. 34-10) для всієї дихальної системи. За об’єму
газу в легенях наприкінці кожного видихання тиск дорів-
нює нулю (об’єм релаксації, що дорівнює об’єму функцій-
ного залишкового простору). Тиск позитивний у разі біль-
шого об’єму повітря в легенях і негативний у випадку мен-
шого. Співвідношення зміни об’єму легень до зміни тиску
в дихальних шляхах (ДУ/ДР) відображає здатність легень
і грудної клітки до розтягу (еластичність). У нормі ця за-
лежність простежується за такого тиску, коли крива релак-
сації найкрутіша, а об’єм наближається до 0,2 л/см Н2О.
Важливе значення в цьому разі має об’єм повітря в легенях.
Наприклад, особи з одною легенею мають приблизно поло-
вину ДУ за деякого ДР. Співвідношення дещо збільшується
у випадку вимірювань під час видихання, на відміну від
вдихання. Тому інформативніше вивчати криву тиск-об’єм
під час усього акту дихання. Крива зміщується донизу і
праворуч (еластичність зменшується) унаслідок легеневої
недостатності та інтерстиційного легеневого фіброзу (рис.
34-11) і догори та ліворуч (еластичність зростає) у разі
емфіземи (див. Розділ 37). Отже, це співвідношення є
статистичним мірилом взаємодії легень і грудної стінки.
Резистентність легень і грудної стінки зумовлена різницею
тисків та залежить від об’єму потоку повітря. Вимірювання
її є динамічнішим і залежить від опору повітря в дихальних
шляхах.
Поверхневий натяг альвеол
Еластичність легень суттєво залежить від поверхневого
натягу плівки рідини, що вкриває стінку альвеол. Значення
цієї складової за різних дихальних об’ємів можна виміряти
в разі видалення легень з тіла експериментальних тварин
та почергового наповнення їх фізіологічним розчином і
повітрям, одночасно вимірюючи внутрішньоплевральний
тиск. Оскільки фізіологічний розчин знижує поверхневий
натяг альвеол до нуля, то крива тиск-об’єм визначить
тільки еластичність легеневої тканини (рис. 34-12). Крива,
отримана внаслідок надування легень повітрям, сумарно
визначає еластичність легеневої тканини та поверхневий
натяг альвеол. Різниця між двома кривими значно змен-
шується зі збільшенням легеневих об’ємів. Поверхневий
натяг альвеол є також меншим, ніж очікуваний поверх-
невий натяг у випадку застосування водно-повітряної су-
міші.
Сурфактант
Зниження поверхневого натягу зі зменшенням об’єму
альвеол зумовлене наявністю сурфактанту (речовини
ліпідної природи) у рідині, що покриває поверхню альвеол.
Сурфактант - це суміш дипальметилфосфатидилхоліну
(ДПФХ) та інших ліпідів і білків (табл. 34-2). Якби по-
верхневий натяг у разі зменшення об’єму альвеол під час
видихання не знижувався, то згідно з законом Лапласа
альвеоли просто б колабували (див. Розділ ЗО). В альвеолах,
як у сферичних структурах, сила тиску розтягнення відпо-
відає подвійній силі натягу, поділеній на радіус (Р=2Т/г).
Якщо Т не зменшується під час зменшення г, то сила напру-
ження перевищує тиск розтягнення. Отже, сурфактант дає
змогу уникнути набряку легень. З’ясовано, що без сур-
фактанту тиск поверхневого натягу альвеол знизився б до
20 мм рт. ст., унаслідок чого розпочалась би вільна трансу-
дація плазми і крові в альвеоли.
Фосфоліпіди складаються з гідрофільної “головної”
частини і двох паралельних гідрофобних “хвостових”
частин з жирних кислот (див. Розділ 1). Хвостовими
Рис. 34-10. Взаємозв’язок між внутрішньоплевральним тиском та об’ємом. Середня крива є кривою тиску релаксації дихальної
системи, тобто крива статичного тиску, отримана для різного ступеня роздутих чи стиснутих легень; внутрішньолегеневий
тиск (тиск еластичного натягу) вимірюють, коли дихальні шляхи закриті. Об’єм релаксації визначає точка, коли натяг грудної
клітки і легень урівноважений. Нахил кривої відповідає натягу легень та грудної стінки. Криві максимального вдихання та
видихання свідчать про тиск у дихальних шляхах, який утворюється під час максимального вдихання та видихання.
ФУНКЦІЇ ЛЕГЕНЬ / 601
Міжлегеневий тиск, см водяного стовпа
Рис. 34-11. Криві статичних співвідношень тиск-об’єм для
видихання у нормальних осіб та осіб з тяжкою емфіземою і
легеневим фіброзом (модифіковано та відтворено за дозво-
лом з Ргісіе N6, Маскіет РТ: І_ипд тесИапісз іп сіізеазе. Іп:
НапсІЬоок ої Рііузіоіоду. Зесііоп 3, ТИе Резрігаіогу Зузіет.
УоІ. III, рагі 2. ЕізИтап АР [есіііог]. Атегісап РИузіоІоду Зосі-
еіу, 1986).
частинами вони спрямовані у просвіт альвеол. Поверхне-
вий натяг альвеол прямо пропорційний до концентрації
сурфактанту в одиниці площі. Молекули фосфоліпідів від-
штовхуються одна від одної зі збільшенням об’єму альвеол
під час вдихання та зі збільшенням поверхневого натягу. І
навпаки, ці ж молекули щільно об’єднуються, якщо поверх-
невий натяг зменшується під час видихання.
Сурфактант виробляють альвеоцити типу П (рис. 34-
13). Типові пластинчасті тільця, - мембранозв’язані
органели, - містять веретена фосфоліпідів, які утворюють-
ся в цих клітинах і секретуються в просвіт альвеол шляхом
екзоцитозу. Ліпідні трубочки, які називають тубулярним
мієліном, формуються з використаних тілець, а сам тубу-
лярний мієлін утворює плівку фосфоліпідів. Деякі про-
теїноліпідні комплекси сурфактанту синтезуються в альвео-
лоцитах типу II шляхом ендоцитозу і рециклізують.
Будова фосфоліпідної плівки сурфактанту значно
зумовлена наявністю білків, провідну роль у цьому віді-
грають чотири унікальні білки 8Р-А, 8Р-В, 8Р-С, 8Р-Б.
Наприклад, 8Р-А є великим глікопротеїном, що містить у
структурі домен, подібний за будовою до колагену. Він
виконує різноманітні функції, у тім числі регулює синтез
та секрецію сурфактанту альвеоцитами типу II за меха-
нізмом зворотного зв’язку. Білки 8Р-В і 8Р-С менші, вони
сприяють утворенню мономолекулярної плівки фосфо-
ліпідів. Подібно до 8Р-А, 8Р-П теж є глікопротеїном, хоча
функція його ще не визначена. Однак 8Р-А і 8Р-В нале-
жать до групи білків, задіяних у формуванні вродженого
імунітету.
Сурфактант відіграє важливу роль під час народження
людини. Хоча плід виконує дихальні рухи внутрішньо-
Рис. 34-12. Зв’язок тиск-об’єм у легенях кота після видалення
їх з організму. Повітря - легені роздуті повітрям (роз) і без
повітря (сп). Фізіологічний розчин - легені роздуті фізіоло-
гічним розчином і без нього (відтворено за дозволом з Могдап
ТЕ: Риїтопагу зигїасіапі. N ЕпдІ З Месі 1971 ;284:1185).
утробно, та все-таки легені до пологів колабовані. Після
народження дитина робить декілька потужних рухів вдихан-
ня, і легені розправляються. Сурфактант оберігає легені від
повторного колапсу. Дефіцит сурфактанту є важливою при-
чиною респіраторного дистрес-синдрому новонарод-
жених (РДСН; хвороби гіалінових мембран) - важкого
захворювання легень, яке виникає у немовлят, народжених
перш, ніж почала діяти їхня система сурфактанту. Поверх-
невий натяг легень у таких немовлят настільки високий, що
в багатьох ділянках альвеоли зазнали спадіння (ателектаз).
Додатковим фактором формування РДСН є затримка рідини
в легенях. У пренатальному періоді епітеліальні клітини
легень виділяють рідину, у якій міститься С1“. Під час
народження відбувається абсорбція цими клітинами №+
через натрієвий канал епітеліальних клітин (ТЧаЕК), і рідина
повторно абсорбується з №+. Довготривала недорозвину-
тість №ЕК спричинює легеневі аномалії в разі РДСН.
Призначення в інгаляціях тільки фосфоліпідів дає не-
значний ефект у випадку лікування РДСН. Однак сьогодні
можна використати для інгаляцій синтетичний сурфактант
або сурфактант, добутий з бичачих легень. їхнє застосу-
вання під час пологів з профілактичною і замісною метою
значно знизило важкість перебігу РДСН та, на жаль, не
знизило частоти хронічних легеневих захворювань у
немовлят, які вижили.
Таблиця 34-2. Склад сурфактанту
Складова Вміст, %
Дипальмітолфосфатидилхолін 62
Фосфатидилгліцерин 5
Інші фосфоліпіди 10
Нейтральні ліпіди 13
Білки 8
Вуглеводи 2
602 / РОЗДІЛ 34
Таблиця 34-3. Складові роботи дихання під час спокійного
вдихання і внесок кожної у відсотках
Нееластична робота
Віскозна резистентність (7%)
Повітряна резистентність (28%)
Еластична робота (65%)
Рис. 34-13. Утворення і метаболізм сурфактанту. Пластин-
часті тільця (ПТ) утворені альвеолоцитами типу II і секретовані
екзоцитозом. Вивільнений з пластинчастих тілець матеріал
перетворюється у тубулярний мієлін (ТМ) і є ймовірним дже-
релом фосфоліпідної поверхневої плівки (ПП). Частину сур-
фактанту поглинають альвеолярні макрофаги, проте біль-
шість - ендоцитоз альвеолоцитами типу II; Я - ядро; ГЕС -
ґранулярна ендоплазматична сітка; КТ - композитні тільця
(відтворено за дозволом з УА/гідНІ ЗР: МеіаЬоІізт апсі іигпоуег
ої Іипд зигїасіапї Ат Яєу Резріг Оіз 1987; 136:426).
Сформованість системи сурфактанту часто спричинює
виникнення часткових (сегментарних) ателектазів у паці-
єнтів, які зазнали кардюхірургічного втручання з викорис-
танням штучної вентиляції легень та зупинкою само-
стійного дихання. Крім того, дефіцит сурфактанту є чин-
ником деяких патологій, що супроводжуються непрохід-
ністю головного бронха, оклюзією однієї легеневої артерії
чи довготривалою інгаляцією 100% О2. Виявлено змен-
шення вмісту сурфактанту в легенях курців. Цікаві резуль-
тати дослідження щодо надлишку ліпідів і білків сурфак-
танту в експериментальних мишей з нокаутом гена 6М-
С8Г. Значення СМ-С8Р в гемопоезі описане у Розділі 27.
Важливо, що патологічні зміни, виявлені в легенях мишей
з нокаутом гена, подібні до змін у легенях людей з легене-
вим альвеолярним прогеїнозом.
Робота під час дихання
Завдяки роботі дихальних м’язів еластичні тканини
грудної стінки і легень розтягуються (еластична робота).
Під час руху нееластичних тканин (віскозна резистент-
ність) дихальними шляхами проходить повітря (табл. 34-
3). Оскільки добуток тиску на об’єм (г/см2 х см3 = г х см)
має те саме значення, що й робота (сила х відстань), то
роботу під час дихання визначають за допомогою кривої
релаксації тиску (рис. 34-10 і 34-14). Нарис. 34-14 загальна
еластична робота, що відповідає вдиханню, є в ділянці
АВСА. Зазначимо, що крива тиску релаксації всієї дихаль-
ної системи відмінна тільки для легень. Ділянка АВВЕА
відображає фактичну еластичну роботу, затрачувану на
збільшення об’єму самих легень. Значення еластичної
роботи, витраченої на наповнення всієї дихальної системи,
менше порівняно з затраченим на наповнення тільки
легень, тому частково ця робота відбувається завдяки елас-
тичній енергії, збереженій у грудній стінці. Еластична енер-
гія грудної клітки (ділянка АРСВА) дорівнює енергії, яку
отримують легені (ділянка АЕВСА).
Резистентність тертя під час руху повітря порівняно
мала в разі спокійного дихання, однак зі зміною об’єму
легень у період вдихання й видихання та зміною внутріш-
ньоплеврального тиску ця резистентність суттєво зміню-
ється (див. рис. 34-6). Ось чому гістерезисна крива відріз-
няється від прямої лінії залежності тиску від об’єму легень
(рис. 34-15). На схемі зона АХВ¥А відображає роботу,
витрачену на подолання резистентності дихальних шляхів
і легеневої тканини. Енергія, затрачувана на рух повітря в
дихальних шляхах, збільшується в разі турбулентності руху
під час швидкого дихання порівняно з тим, коли повітряний
потік ламінарний.
Загальна робота дихання в спокої є в межах від 0,3 до
0,8 кгм/хв. Вона суттєво зростає у випадку фізичного
навантаження, проте в будь-якому разі кожна особа витра-
чає під час фізичного навантаження на саме дихання лише
3% від усієї затрачуваної енергії. Робота, потрібна для
Трансмуральний тиск, см водяного стовпця
Рис. 34-14. Крива тиску релаксації у загальній дихальній сис-
темі (Р ) і криві релаксації тиску для легень (Рл) та в грудній
клітці (Р ). Трансмуральний тиск для легень визначено як
внутрішньолегеневий мінус внутрішньоплевральний, для
стінки грудної клітки - як внутрішньоплевральний мінус зов-
нішній (барометричний), для загальної дихальної системи -
як внутрішньолегеневий мінус барометричний тиск (модифі-
ковано з Міпез АН: Резрігаіогу РЬузіоІоду, Згсі есі. Рауеп
Ргезз).
ФУНКЦІЇЛЕГЕНЬ / 603
Внутрішньоплевральний тиск,
мм рт. ст
Рис. 34-15. Схематичне зображення змін тиску та об’ємів під
час спокійного вдихання (лінія АХВ) та видихання (лінія В2А).
АУВ - лінія натягу.
Внутрішньоплевральний тиск,
см водяного стовпа
дихання, значно зростає за таких хворіб, як емфізема, аст-
ма, набуті вади серця із задишкою та ортопное. Співвід-
ношення еластичності до напруги у дихальних м’язах май-
же таке, як у скелетних та серцевому м’язах, і коли м’язи
перерозтягнуті, то вони скорочуються з меншою силою,
їхня втома та недостатність (нагнітальна недостатність)
супроводжуються неадекватною вентиляцією легень (див.
Розділ 37). З невідомих причин амінофілін збільшує силу
скорочення діафрагми людини, тому його використовують
для лікування недостатності вентиляції легень.
Відмінності вентиляції та кровопостачання у
різних частинах легень
У вертикальному положенні вентиляція одиниці об’єму
легень ліпша в базальних відділах, а не у верхівці. Причина
полягає в тому, що на початку вдихання внутрішньоплев-
ральний тиск менш негативний у базальній частині легень
порівняно з верхівкою (рис. 34-16). Якщо різниця між внут-
рішньолегеневим та внутрішньоплевральним тиском стає
меншою, ніж на верхівці, то легені менше розтягуються. І
навпаки, якщо легені розтягуються більше, то максималь-
ний об’єм легені зростає. З огляду на жорсткість легень
збільшення їхнього об’єму на одиницю супроводжується
меншим підвищенням тиску, ніж тоді, коли легені були
попередньо більше розтягнуті і вентиляція збільшується в
базальній частині легень. Кровопостачання теж більше у
цій ділянці порівняно з верхівкою (див. нижче). Зміна кро-
воплину від верхівки до базальних відділів є значиміша
від відповідних змін вентиляції легень. Тому співвідношен-
ня вентиляції-перфузії є менше в основі легень і більше
на верхівці.
Деякі відмінності вентиляції та перфузії від верхівки
до основи легень приписують земному тяжінню. Ці зміни
нівельовані в положенні лежачи, і маса легень у положенні
стоячи робить внутрішньоплевральний тиск нижчим у
базальному відділі. Проте нещодавні космічні польоти
засвідчили невідповідність вентиля ції та кровопостачання
Рис. 34-16. Внутрішньоплевральні тиски у положенні стоячи
та їхній вплив на вентиляцію. Зверніть увагу, оскільки внут-
рішньоплевральний тиск є атмосферним, то більший від’єм-
ний внутрішньоплевральний тиск на верхівці утримує легені
у більш розтягнутому положенні на початку вдихання. Подаль-
ше збільшення об’єму на одиницю збільшення внутрішньо-
плеврального тиску менше, ніж на початку, бо розширення
легень є важчим (відтворено за дозволом з \А/езі ЗВ: Х/епііІа-
ііоп/ВІоосІ Яо\л/ апсі баз Ехсґіапде, ЗгсІ есі. ВІаск\л/еІІ, 1977).
в різних частинах легень, що простежуються в стані нева-
гомості у космонавтів. Очевидно, є ще й досі невідомі фак-
ти, які також беруть участь у створенні такої відмінності.
З’ясовано, що в разі дуже малих об’ємів легень, особ-
ливо після форсованого видихання, внутрішньоплевраль-
ний тиск в основі легень може перевищувати атмосферний
тиск у дихальних шляхах, що призведе до колапсу дихаль-
них шляхів малого діаметра, наприклад респіраторних
бронхіол (закриття дихального шляху). У старших лю-
дей та пацієнтів з хронічними легеневими захворюваннями
еластичні властивості легень послаблені, що веде до зни-
ження внутрішньоплеврального тиску. Тому перекриття
дихального шляху може виникнути в основі легень у поло-
женні стоячи і без форсованого видихання за об’ємів, біль-
ших від залишкової функційної ємності легень.
Клінічне значення впливу гравітації на вентиляцію вияв-
ляється у поліпшенні артеріальної оксигенації у хворих з
одностороннім легеневим захворюванням, що лежать на
боці здорової легені. У випадку з немовлятами ця залеж-
ність обернена, хоча й досі не з’ясовано, з яких причин.
Мертвий простір та нерівномірна вентиляція
Оскільки газообмін у дихальній системі відбувається
тільки в термінальній частині дихальних шляхів, то газ,
який міститься в решті дихальних шляхів, вилучений з
газообміну кров’ю легеневих капілярів. У нормі об’єм
цього мертвого простору приблизно відповідає масі тіла у
604 / РОЗДІЛ 34
фунтах. Наприклад, якщо людина має масу 68 кг (150 фун-
тів), то тільки перші 350 з 500 мл повітря вдихання над-
ходять в альвеоли. І навпаки, з кожним видиханням перші
150 мл становить газ мертвого простору і тільки наступні
350 мл надходять з альвеол. Отже, альвеолярна вентиля-
ція - це об’єм повітря, що надходить до альвеол за 1 хв.
Звісно, альвеолярна вентиляція менша, ніж хвилинний
дихальний об’єм. Зверніть увагу, що через мертвий простір
поверхневе швидке дихання зумовлює меншу альвеолярну
вентиляцію, ніж повільне глибоке дихання за однакових
хвилинних дихальних об’ємів (табл. 34-4).
Важливо розрізняти анатомічний мертвий простір
(об’єм дихальної системи, за винятком альвеол) та загаль-
ний (фізіологічний) мертвий простір (об’єм газу, який
не обмінюється з кров’ю, так звана втрачена вентиляція).
У здорових осіб ці два мертві простори ідентичні, проте
під час хворіб частина альвеол вилучена з газообміну, а
частина гіпервентильована. Об’єм газу в неперфузованих
та гіпервентильованих альвеолах, потрібний для артеріалі-
зації в альвеолярних капілярах, є частиною газового об’єму
мертвого простору (неврівноваженого). Анатомічний
мертвий простір можна виміряти, аналізуючи криву оди-
ничного дихання N2 (рис. 34-17). Після звичайного вди-
хання особа якнайглибше вдихає чистий О2, потім видихає
рівномірно так, щоб вміст N2 можна було виміряти. Почат-
ковий газ, який видихають (фаза І), - це газ, що заповнював
мертвий простір і який не вміщує N2- Далі йде суміш газів
мертвого простору та альвеолярного газу (фаза II), а потім
альвеолярний газ (фаза III). Об’єм мертвого простору - це
об’єм газу, який видихають від пікового вдихання до сере-
дини фази II (див. рис. 34-17).
Фазу III на кривій N2 одиничного акту дихання позна-
чають як кінцевий об’єм (КО), вона проходить у фазу
IV, під час якої вміст И2 у газі, що його видихають, збіль-
шується. Показник КО - це об’єм у легенях понад
залишковий, за якого дихальні шляхи зменшуються. Він
залежить від частин легень, що починають змикатися,
оскільки трансмуральний тиск у цих ділянках знижується
(див. вище). Газ у верхніх ділянках легень більше збага-
чений N2, ніж газ у нижніх залежних частинах, бо альвеоли
у верхніх частинах розтянуні на початку вдихання О2 (див.
вище), тому N2 у них менше змішується з О2. Також вияв-
лено, що у більшості нормальних осіб крива фази III має
легко позитивний нахил перед досяганням фази IV. Це
свідчить, що саме під час фази III відбувається поступове
пропорційне збільшення газу, що його видихають і який
надходить з порівняно збагачених N2 верхніх частин
легень.
Характер вентиляції в легенях також можна оцінити за
допомогою інгаляції радіоактивного ізотопу інертного газу
Таблиця 34-4. Вплив зміни частоти і глибини дихання на
альвеолярну вентиляцію
Частота дихання 30/хв 10/хв
Дихальний об’єм 200 мл 600 мл
Хвилинний об’єм 6 л 6 л
Альвеолярна вентиляція (200-150)х30 =1500 мл (600-150)х 10 =4500 мл
Рис. 34-17. Крива одиничного дихання КІ2. Після звичайного
вдихання особа глибоко вдихає чистий О2, потім повільно
видихає. Наведено зміни концентрації КІ2у газі, який видих-
нули; різні фази відображені на кривій римськими цифрами;
МП - мертвий простір; КО - кінцевий об’єм; РО - резервний
об’єм.
ксенону (1ІЗХе) та моніторингу органів грудної клітки з
визначенням рівня радіації. Ділянки, у яких простежується
низька радіоактивність, відповідають поганій вентиляції.
Загальний мертвий простір можна обчислити з Рсо2 У
повітрі, яке видихають, РСо2 артеріальної крові та дихаль-
ного об’єму (рівняння Бора)
РбСО2 х Удо “ РаСО2 X (Удо — Умп) + РІСО2 х ^мп’
де РеСо2 - експіраторний газ (який видихають); ДО -
дихальний об’єм; Расо2 - артеріальний газ; Vмп - мертвий
простір; РіСо2 - інспіраторне повітря (яке вдихають).
Значення РіСо2 х Умп таке мале, що ним можна знехту-
вати, і рівняння обчислюють для Vмп. Якщо, наприклад:
РеСо2 = 28 мм рт. ст.; РаСО2 = 40 мм рт. ст.; VД():=: 500 мл; то
Ум||=150 мл.
За цим рівнянням можна також визначити мертвий ана-
томічний простір, якщо замінити РаСо2 на альвеолярний
Рсо2 (РаСо2), який є значенням РСо2 в останні 10 мл у експі-
раторному газі (див. нижче). Значення РаСо2 є середнім для
газу з різних альвеол, пропорційним до їхньої вентиляції,
без урахування перфузованості. Він є протилежним до
Расо2, який урівноважений тільки з перфузованими альвео-
лами і, отже, в осіб з неперфузованими альвеолами біль-
ший, ніж РаСо2
Хоча можна перебувати під водою і дихати за допомо-
гою трубки, виведеної над поверхнею води, та зазначимо,
що трубка впливає на збільшення об’єму мертвого прос-
тору. З кожним мілілітром об’єму трубки глибина вдихання
буде збільшуватись на 1 мл для забезпечення однакового
об’єму повітря в альвеолах. Отже, якщо об’єм трубки буде
великим, то дихання може стати занадто обтяженим. Крім
того, потрібні додаткові зусилля проти тиску навколишньої
води для розтягнення (збільшення об’єму) грудної клітки.
ГАЗООБМІН У ЛЕГЕНЯХ
Забір альвеолярного повітря
Теоретично все, крім перших 150 мл, які видихають
кожного разу, - це газ, який був в альвеолах (альвеолярне
ФУНКЦІЇ ЛЕГЕНЬ/605
повітря), однак тут є також деяка кількість газової суміші,
утвореної на межі між мертвим простором та альвеоляр-
ним повітрям (див. рис. 34-17). Тому саме останню порцію
експіраторного повітря беруть для аналізу. Використання
сучасної апаратури з пристосованим автоматичним клапа-
ном дає змогу зібрати останні 10 мл газу, видихнутого під
час дихання у спокої. На рис. 34-18 зображено порівнян-
ня складу альвеолярного газу з інспіраторним та експіра-
торним повітрям.
З рівняння альвеолярного газу можна також обчис-
лити Рао2:
Рао2 = Рю2 - Расо2 ( РЮ2 + (1 ~ РЮ2) / Р ),
де Гіо - частка молекул у сухому газі; Ріо2~ частка молекул
в інспіраторному повітрі; К - дихальний коефіцієнт (див.
Розділ 17).
Склад альвеолярного повітря
Кисень продовжує дифундувати з газу, що міститься в
альвеолах, у кров’яне русло, а СО2 дифундує до альвеол з
крові. У стані рівноваги повітря, яке вдихають, змішується
з альвеолярним газом, заміщаючи О2, що є у крові, на СО2,
який потрапляє до альвеол. Частину такої суміші видиха-
ють. Вміст О2 в альвеолярному газі згодом зменшується, а
вміст СО2 збільшується до наступного вдихання. Якщо
об’єм газу в альвеолах близько 2 л наприкінці видихання
(функційний залишковий об’єм, див. рис. 34-7), то кожний
350 мл приріст повітря, який вдихають або видихають,
Повітря, яке
вдихають
Газ, який
видихають
Тканини
Рис. 34-18. Парціальний тиск газів (мм рт. ст.) у різних части-
нах дихальної системи і кровообігу.
порівняно мало впливає на Ро2 та РСо2- Крім того, склад
альвеолярного газу сталий не тільки у спокої.
Дифузія через альвеолокапілярну мембрану
Гази дифундують з альвеол у кров легеневих капілярів
і протилежному напрямі через тоненьку альвеолокапілярну
мембрану, що складається з легеневого епітелію, капіляр-
ного ендотелію та їхніх зрощених базальних мембран (див.
рис. 34-3). Ті чи інші сполуки надходять з альвеол у капі-
лярну кров, досягаючи рівноваги за 0,75 с, - час, протягом
якого кров переходить у легеневі капіляри в спокої, що
також залежить від реакції сполук з речовинами у крові.
Наприклад, оксид азоту, який використовують як газ для
анестезії, не взаємодіє, і М2О досягає рівноваги за 0,1 с
(рис. 34-19). У такому випадку кількість N20, що надхо-
дить, не є обмежена дифузією, а лише кількістю крові, що
протікає через легеневі капіляри, тобто лімітована пли-
ном крові. З іншого боку, гемоглобін еритроцитів поглинає
монооксид вуглецю на такому високому рівні, що парці-
альний тиск СО у капілярах стає дуже низьким, і рівновага
не досягається за 0, 75 с у крові легеневих капілярів. Тому
перехід СО не обмежений перфузією у спокої, а стабільно
лімітований дифузією. Кисень є посередині між \2О та
СО, його поглинає гемоглобін, тому він має меншу
авідність, ніж СО, і в рівновазі з капілярною кров’ю лише
упродовж 0,3 с. Отже, його поглинання також лімітоване
перфузією.
Дифузійна ємність легень для газу, що потрапляє в
середину дихальної системи, прямо пропорційна до площі
поверхні альвеолокапілярної мембрани й обернено про-
порційна до її товщини. Дифузійну ємність для СО (Вьсо)
вимірюють як показник дифузійної ємності, бо його погли-
нання лімітоване дифузією. Значення Вьсо пропорційне
Рис. 34-19. Поглинання різноманітних сполук у разі проход-
ження через легеневі капіляри (за 0,75 с); І\І2О не зв’язується
у крові, тому його парціальний тиск у крові підвищується
швидше, ніж в альвеолах. Натомість, СО швидко поглинають
еритроцити, тому його парціальний тиск досягає лише час-
тини від того ж тиску в альвеолах. Показники для О2 посере-
дині.
606 / РОЗДІЛ 34
до кількості СО, що надходить у кров (УСо), розділеній на
парціальний тиск СО у крові, що надходить у легеневі капі-
ляри. Виняток простежується для давніх курців: у них пар-
ціальний тиск дорівнює майже нулю, тому ним можна знех-
тувати, і рівняння стане таким:
Нормальний рівень для Оьсо У стані спокою дорівнює
25 мл/хв/мм рт. ст. Він підвищується втричі під час фізич-
ного навантаження, оскільки відбувається дилатація капі-
лярів, і збільшується кількість активних капілярів.
В альвеолярному газі Ро2 у нормі становить 100 мм рт. ст.
(див. рис. 34-18), а Р(>2 крові, що потрапляє в капіляри, -
40 мм рт. ст. Дифузійна ємність для О2, подібна до такого
ж показника СО у спокої, дорівнює 25 мл/хв/мм от. ст., і
Ро2 крові підвищується до 97 мм рт. ст., що нижче від
альвеолярного Ро2. Зниження Ро2 до 95 мм рт. ст. в аорті
відбувається завдяки фізіологічному шунту (див. нижче).
Значення Оьо2 збільшується до 65 мл/хв/мм рт. ст. або й
більше під час навантаження і зменшується в разі захво-
рювань, таких як саркоїдоз і бериліоз (отруєння берилієм),
що спричинюють фіброз стінок альвеол. Іншою причиною
легеневого фіброзу є надлишок секреції РОСЕ (див. Розділ
27) альвеолярними макрофагами з остаточним стимулю-
ванням сусідніх мезенхіальних клітин.
Значення РСо2 венозної крові 46 мм рт. ст., тоді як у аль-
веолярному повітрі - 40 мм рт. ст., і СО2 за градієнтом тис-
ків дифундує з крові у альвеоли. РСо2 крові, що відтікає від
легенів, дорівнює 40 мм рт. ст.; СО2 вільно проходить через
біологічні мембрани, тому дифузійна ємність легень для
СО2 є вища, ніж ємність для О2. З цього огляду ретенція
СО2 є рідкісною проблемою для хворих з альвеолярним
фіброзом, тоді як саме зменшення дифузійної ємності для
О2 є важким для них.
КРОВООБІГ У ЛЕГЕНЯХ
Кровоносні судини легень
Кровоносні судини легень подібні до системних (див.
Розділ 30), за винятком того, що стінки легеневої артерії
та її великих відгалужень на 30% товстіші, ніж стінка аорти.
Дрібні артеріальні судини легень не подібні до системних
артеріол, бо їхні ендотеліальні трубки мають у стінках
порівняно малу кількість гладких м’язів. У стінках пост-
капілярних судин гладкі м’язи є у незначній кількості.
Легеневих капілярів багато, вони множинно анастомозують
так, що кожна альвеола оточена капілярним кошиком.
Тиск, об’єм та кровоплин
За винятком двох незначних кількісно випадків, кров,
вигнана з лівого шлуночка, потрапляє до правого перед-
сердя, далі її виштовхує правий шлуночок, роблячи м’язи
легеневих судин унікальними. Вони нагромаджують кров
у руслі такою мірою, що плин стає таким же, як у всіх інших
органах організму. Один з винятків - частина бронхіаль-
ного кровоплину. Як зазначено вище, тут є анастомози між
бронхіальними капілярами та легеневими капілярами й
венами, і, отже, частина бронхіальної крові потрапляє у
бронхіальні вени, а частина - у легеневі капіляри та вени,
обходячи правий шлуночок. Іншим винятком є кров, що
тече від вінцевих артерій у камери лівої половини серця
(див. Розділ 32). Оскільки дрібні фізіологічні шунти ство-
рюються з огляду на такі два винятки, то кров у системних
артеріях має Ро2на 2 мм рт. ст. нижчий, ніж кров, що врів-
новажена з альвеолярним повітрям і, отже, насичення гемо-
глобіну є меншим на 0,5% (див. Розділ 35).
У цілому судинну систему легень розтягує низький тиск.
Легеневий артеріальний тиск - близько 24/9 мм рт. ст.,
середній тиск - близько 15 мм рт. ст., тиск у лівому перед-
серді - 8 мм рт. ст. під час діастоли, так що градієнт тиску
у легеневій системі досягає 7 мм рт. ст. порівняно з
90 мм рт. ст. у системному кровообігу (див. рис. 34-4). Ціка-
во, що зниження тиску від легеневих артерій до капілярів
порівняно мале, а зниження тиску у венах - помітне.
Об’єм крові у легеневих судинах постійно дорівнює 1 л,
з якого менше 100 мл є у капілярах. Середня швидкість
крові у корені легеневої артерії така ж, як в аорті (близько
40 см/с). Вона зменшується швидко, потім незначно
збільшується у великих легеневих венах. Для переходу
еритроцитів легеневих капілярів потрібно близько 0,75 с
у спокої і 0,3 с або менше під час навантаження.
Капілярний тиск
Тиск у легеневих капілярах становить 10 мм рт. ст, тоді
як онкотичний тиск - 25 мм рт. ст., так що градієнт тиску
спрямований досередини і дорівнює 15 мм рт. ст., утри-
муючи альвеоли вільними від рідини. Коли тиск у леге-
невих капілярах перевищує 25 мм рт. ст., наприклад, це
може відбутися в разі “недостатності у зворотному напря-
мі” лівого шлуночка - з’являються застійні явища у легенях
і як наслідок - набряк легень. У хворих зі стенозом мит-
рального отвору простежується хронічне прогресувальне
збільшення тиску в легеневих капілярах і поширені фіб-
ротичні зміни у легеневих судинах.
Вплив ґравітації
Земне тяжіння теж частково впливає на кровообіг у леге-
нях. У положенні стоячи верхні частини легень людини
перебувають над рівнем серця, а базальні - на цьому рівні
або нижче. Очевидно, це дещо впливає на градієнт тиску у
легеневих артеріях від верхівки до нижніх відділів легень,
оскільки діє гравітація і кінцево лінійно збільшується леге-
невий кровоплин від верхівок до базальних відділів легень
(рис. 34-20). Тиск у капілярах на верхівці легень близький
до атмосферного тиску в альвеолах. Легеневий артеріаль-
ний тиск у нормі вже достатній для підтримки перфузії,
однак якщо він зменшується або альвеолярний тиск збіль-
шується, то деякі капіляри колабують; тому не відбувається
газообмін в уражених альвеолах, і вони стають частиною
фізіологічного мертвого простору.
У середній частині легень легеневий артеріальний та
капілярний тиск перевищує альвеолярний, проте тиск у
легеневих венулах може стати нижчим, ніж альвеолярний
тиск під час нормального вдихання, тому вони колабують.
З огляду на це кровоплин визначений швидше різницею
легеневого артеріоальвеолярного тиску, ніж різницею леге-
невого артеріовенозного. Поза констрикцією кров “падає”
ФУНКЦІЇ ЛЕГЕНЬ/607
150
100
50
о ь і---------------------------1
Верхівка Нижній відділ
Вертикальна відстань уздовж легень
Рис. 34-20. Порівняння кровопостачання від верхівки до ниж-
ніх частин легені у положенні стоячи. Значення кровоплину
масштабовані так, що сталому кровоплину відповідає зна-
чення 100.
у легеневі вени, які і збирають ту кількість крові, що плине
через звужені судини. Це називають ефектом водоспаду.
Очевидно, якщо ступінь констрикції зменшується, і леге-
невий кровообіг збільшується, то артеріальний тиск збіль-
шується щодо базальних відділів легень.
У нижніх ділянках легень альвеолярний тиск є нижчим,
ніж тиск у всіх частинах легеневого кровообігу, і плин крові
визначений різницею артеріовенозних тисків.
Вентиляційно-перфузійне співвідношення
Співвідношення легеневої вентиляції до легеневого
кровоплину для цілої легені-у стані спокою становить 0,8
(4,2 л/хв вентиляції поділено на 5,5 л/хв швидкості крово-
плину). Очевидно, що порівняно вагомі відмінності в тако-
му вентиляційно-перфузійному співвідношенні у різних
частинах нормальної легені є наслідком впливу гравітації,
а місцеві зміни часті під час хвороби. Якщо вентиляція в
альвеолах зменшується щодо її перфузії, то Ро2 в альвеолах
знижується, бо до них надходить менше О2, і Рсо2 підви-
щується, оскільки менше СО2 видихають. Протилежно,
якщо перфузія зменшується щодо вентиляції, то РСо2 зни-
жується, бо менше СО2 надходить, і Ро2 підвищується,
оскільки менше О2 потрапляє у кров. Такі впливи показані
на рис. 32-21.
Як зазначено вище, вентиляція, як і перфузія, у поло-
женні стоячи зменшується лінійно від базальних відділів
до верхівки легень. Крім того, співвідношення вентиляція-
перфузія є високим у верхніх відділах легень. Про це свід-
чать факти ураження легень туберкульозом. Високе венти-
ляційно-перфузійне співвідношення на верхівках легень
створює умови для схильності появи туберкульозу у цих
ділянках, оскільки порівняно високий альвеолярний Ро2
забезпечує прекрасне середовище для росту туберкульоз-
них бактерій.
Поширена неоднорідність вентиляції та перфузії у леге-
нях може сприяти ретенції СО2 і зниженню системного
артеріального Ро2. Наслідки неоднорідності в разі хвороб-
ливих станів описані у Розділі 37.
Депонація крові у легенях
Завдяки розтяжності легеневі вени є важливим резер-
вуаром для депонації крові. У нормі, коли особа лягає,
легеневий об’єм крові збільшується на 400 мл, а коли встає,
- ця кров надходить у загальний кровообіг. Така зміна є
причиною зменшення життєвої ємності у лежачих хворих
і відповідальна за появу ортопное в разі серцевої недостат-
ності (див. Розділ 33).
Регулювання легеневого кровоплину
Досі остаточно не з’ясовано, чи легеневі вени та артерії
регульовані відокремлено, хоча констрикція вен збільшує
легеневий капілярний тиск, а констрикція легеневих арте-
рій збільшує навантаження на праву половину серця. Малі
артерії з діаметром у декілька сотень мікрометрів є голов-
ним місцем для судинної резистентності.
На легеневий кровоплин впливають як активні, так і
пасивні фактори. Тут відбувається автономна іннервація
легеневих судин, і подразнення шийного симпатичного
ганглія зменшує кровопостачання майже на 30%. Судини
також відповідають на гуморальні фактори, що циркулю-
ють. Рецептори, що реагують і кодують відповідь, наведені
у табл. 34-5. Багато дилататорних відповідей є ендотелій-
залежними, уважають, що вони впливають через вивіль-
нення N0 (див. Розділ 31). У разі легеневої гіпертензії
наявна недостатність ендотеліальної N08.
Пасивні фактори, такі як хвилинний серцевий об’єм та
сила земного тяжіння, також суттєво впливають на леге-
невий кровоплин. Місцеві пристосування перфузії до вен-
тиляції визначені місцевим впливом О2 або його недос-
татністю. У випадку навантаження хвилинний серцевий
викид збільшується, і легеневий артеріальний тиск пропор-
ційно поволі підвищується, однак не завдяки вазодилатації.
Рис. 34-21. Вплив зменшення або збільшення співвідношення
ветиляція-перфузія (Х/А/О) на РС02і Р02 у альвеолах. Малюнки
над кривою відображають альвелу і легеневий капіляр, чорні
ділянки - місця блокади. У разі повної обструкції повітряних
шляхів до альвеол Рсо і Р02 наближаються до значень у змі-
шаній венозній крові (\/) У разі повної блокади перфузії РС02
і Р02 наближаються до значень у газі, який видихають (від-
творено за дозволом з \А/езі ЗВ: Х/епШаІіоп/ВІоосІ ЕІо\л/ апсі
баз Ехсґіапде, ЗгсІ есі. ВІаск\л/еІІ, 1977).
608 / РОЗДІЛ 34
Таблиця 34-5. Рецептори гладких м’язів легеневих артерій і вен1
Рецептори Підтип Реакція Залежність від ендотелію
Автономної нервової системи Адренергічні «1 Скорочення Ні
а2 Розслаблення Так
р2 Розслаблення Так
Мускаринові Розслаблення Так
Пуринові Р2х Скорочення Ні
р2у Розслаблення Так
Тахікінін ІЧК, Розслаблення Так
мк2 Скорочення Ні
ВІП ? Розслаблення ?
С6КР ? Розслаблення Ні
Гуморальні Аденозин А, Скорочення Ні
а2 Розслаблення Ні-
Ангіотензин II АТ, Скорочення Ні
АМР АМРа Розслаблення Ні
АИРВ Розслаблення Ні
Брадикінін В,? Розслаблення Так
в2 Розслаблення Так
Ендотелій ЕТД Скорочення Ні
ЕТВ Розслаблення Так
Гістамін н, Розслаблення Так
н2 Розслаблення Ні
5-НТ 5-НТ, Скорочення Ні
5-НТ,с Розслаблення Так
Тромбоксан ТР Скорочення Ні
Вазопресин V, Розслаблення Так
1 Модифіковано та відтворено за дозволом з Вагпев Рф І_іп 8Е: Редиіаііоп оТриїтопагу уазсиїагіопе. РґіагтасоІ Рєу 1995;47:88.
У цьому разі більше еритроцитів рухається через легені
без будь-якого зменшеного насичення О2 гемоглобіну і,
очевидно, загальна кількість О2, що надходить у системний
кровообіг, збільшується. Капіляри розширюються, і спо-
чатку неперфузовані капіляри беруть участь у постачанні
крові. Кінцевий ефект - відчутно збільшений легеневий
кровоплин.
Ізотоп ІЗЗХе можна використовувати для визначення міс-
цевого легеневого кровоплину, вводячи фізіологічний роз-
чин з газом внутрішньовенно та проводячи моніторинг
органів грудної клітки. Газ швидко надходить в альвеоли,
які перфузовані нормально, проте недостатньо входить у
такі, що погано перфузовані. Іншою технікою для визна-
чення місцевих погано перфузованих ділянок є введення
макроаґреґатів альбуміну, що помічені радіоактивним
йодом. Такі агрегати досить великі, щоб заблокувати капі-
ляри та малі артеріоли, і вони депонують лише в судинах,
через які кров буде протікати, коли вони досягнуть легень.
Хоча, це виглядає парадоксально в разі вивчення хворих з
порушенням легеневого кровотоку внаслідок судинної
обструкції. Ця методика безпечна, оскільки вводять порів-
няно мало частинок, які блокують лише невелику кількість
легеневих судин і швидко виходять з організму.
Унаслідок обструкції бронхів чи бронхіол у гіповенти-
льованих альвеолах розвивається гіпоксія. У такій ділянці
недостатність О2, безперечно, впливає безпосередньо на
гладкі м’язи судин, створюючи констрикцію, і кров іде в
обхід на відстані від гіпоксичної ділянки. Нагромадження
СО2 приводить до місцевого зменшення рН, що, відповідно,
сприяє вазоконстрикції у легенях на противагу вазодила-
тації, яка виникає в інших тканинах. І навпаки, зменшення
кровоплину у частині легені знижує альвеолярний РСо2 У
такій ділянці, а це приводить до констрикції бронхів, що
підходять до неї, і як наслідок, змінюється вентиляція на
відстань від ділянки з погіршеною перфузією.
Системна гіпоксія також спричинює констрикцію леге-
невих артеріол і, отже, збільшення легеневого артеріаль-
ного тиску.
Легенева гіпертензія
Підтверджене підвищення легеневого артеріального
тиску простежується у новонароджених (див. Розділ 32)
та дорослих. У дорослих причина здебільшого невідома.
Підвищення легеневого артеріального тиску може бути у
людей, які вдихають кокаїн, і в осіб, що вживають декс-
фенфлюрамін та споріднені препарати для пригнічення
апетиту, що збільшують рівень позаклітинного серотоніну
Підвищення тиску безпосередньо призводить до розвитку
симптомів серцевої недостатності (правої половини) і смер-
ті. Доцільне лікування вазодилататорами, у тім числі з
простацикліном (епопростенол). Є випадки, коли цілющий
вплив простацикліну виявлявся не тільки у вазодилатації, а
й у судинному ремоделюванні. Проте його складно вико-
ристовувати, оскільки треба вводити внутрішньовенно.
Емболія легень
Однією з функцій легень у нормі є відфільтровування
маленьких кров’яних тромбів, це відбувається без будь-
ФУНКЦІЇ ЛЕГЕНЬ / 609
яких симптомів. Коли емболи блокують велику гілку леге-
невої артерії, то провокують підвищення артеріального
легеневого тиску і швидке поверхневе дихання (тахіпное).
Підвищення легеневого артеріального тиску, безумовно,
приводить до рефлекторної вазоконстрикції через симпа-
тичні нервові волокна. Хоча є й інший погляд: рефлек-
торної вазоконстрикції не буде, коли великі гілки легеневих
артерій блоковані. Тахіпное - це рефлекторна відповідь
на активування легеневих рецепторів з вагусною іннерва-
цією, що закривають стінки судин (див. табл. 36-2), бо вияв-
ляється вплив серотоніну, який вивільняється з тромбо-
цитів на місці утворення ембола.
ІНШІ ФУНКЦІЇ ДИХАЛЬНОЇ СИСТЕМИ
Захисні механізми у легенях
Дихальні шляхи, що проходять від зовнішнього сере-
довища до альвеол, виконують багато різних функцій,
окрім транспортування газів. Вони зволожують і охолод-
жують або зігрівають повітря, яке вдихають так, щоб воно
не було ні дуже гарячим, ні холодним, а наближалося до
температури тіла у момент, коли досягне альвеол. Бронхі-
альний секрет містить секреторні імуноглобуліни (І§А; див.
Розділ 27) та інші речовини, що допомагають протистояти
інфекції і підтримують цілісність слизової. Крім того, епі-
телій приносових пазух продукує N0, який є бактеріоста-
тичним і допомагає уникнути інфікування.
Легеневий епітелій містить цікаву групу протеаз актив-
них рецепторів (РАКз - від англ. ргоіеазе-асііуаіед гесер-
ІОГ8), які, якщо вони активовані, вивільняють ПГЕ2, а той,
відповідно, захищає епітеліальні клітини. Такі рецептори
також наявні у шлунко-кишковому тракті; вони активовані,
коли тромбін або трипсин частково перетравлює ліґанди,
прив’язані до них. Ізоформи РАК2 є формою рецепторів у
дихальних шляхах.
Альвеолярні макрофаги легень (АМЛ; пилові клітини)
є іншим важливим компонентом захисних механізмів у
легенях. Подібно до інших макрофагів (див. Розділ 27),
такі клітини походять з кісткового мозку. Вони є активними
фагоцитами і перетравлюють бактерії, що їх вдихають, і
дрібні частинки. АМЛ також допомагають руху антигенів
для імунологічної атаки і секретують речовини, що при-
тягують гранулоцити до легень, як і такі речовини, що сти-
мулюють утворення гранулоцитів та моноцитів у кістко-
вому мозку. їхня роль у патогенезі емфіземи описана у Роз-
ділі 27. Макрофаги поглинають велику кількість речовин,
що містяться у цигарковому димі, і можуть вивільняти
лізосомальні продукти у позаклітинний простір. Це запо-
чатковує запальну реакцію. Частинки кремнезему та асбес-
ту також зумовлюють вивільнення лізосомальних ензимів.
Різноманітні механізми дають змогу уникнути потрап-
ляння сторонніх тіл у альвеоли. Волосся у ніздрях від-
фільтровує частинки понад 10 мкм у діаметрі. Більшість
із частинок такого розміру залишаються на слизових обо-
лонках носа і глотки, оскільки вони не йдуть за потоком
повітря, що прямує вниз до легень. Вони закріпляються
на або біля мигдаликів і аденоїдів - великих нагромад-
жень імунологічно активної лімфоїдної тканини на стінці
глотки. Частинки діаметром 2-10 мкм здебільшого пада-
40 367-2
ють на стінки бронхів, коли повітря плине уповільнено
через дрібні повітроносні шляхи. Вони зумовлюють реф-
лекторну бронхоконстрикцію та кашель (див. Розділ 14).
Такі частинки виводять назовні з легень також війковий
“ескалатор”. Епітелій дихальних шляхів від передньої тре-
тини носа до початку дихальних бронхіол є війковим, і
війки, що вкривають слизову, ритмічно координовано
рухаються з частотою 1000-1500 циклів за 1 хв. Війковий
механізм здатний виводити частинки зі швидкістю 16 мм/
хв. Частинки до 2 мкм у діаметрі переважно досягають
альвеоли, де їх поглинають макрофаги. Важливість таких
захисних механізмів є очевидною, коли пригадати, що у
сучасних містах кожний літр повітря може містити
декілька мільйонів часточок пилюки та подразнювальних
речовин.
У випадку ураження скоротливості війок переміщення
слизовою фактично не відбувається. Це призводить до хро-
нічних синуситів, повторних легеневих інфекцій та брон-
хоектазіє. Війкову нерухомість можуть зумовити різнома-
нітні забруднювачі повітря або ж вона може бути врод-
женою. Одна з вроджених форм - синдром Картаґенера,
за якого нема аксонемального димеїну - АТФ-азного моле-
кулярного двигуна, що започатковує циліарні рухи (див.
Розділ 1). Такі хворі також є безплідними, оскільки їхні
сперматозоїди втрачають рухомість і часто мають 8ІШ§ іп-
уегзиз (зворотне розташування внутрішніх органів), тому
вважають, що війки, потрібні для ротації внутрішніх орга-
нів, не функціонують під час ембріонального розвитку.
Метаболічні та ендокринні функції легень
Крім газообмінних, легені виконують декілька метабо-
лічних функцій. Вони виробляють сурфактант для місце-
вого використання, як зазначено вище. Легені також міс-
тять фібринолітичну систему, яка розчиняє тромби у леге-
невих судинах. Вони вивільняють декілька речовин, які
потрапляють у системну артеріальну кров (табл. 34-6) і
виводять інші речовини, що досягають їх через легеневі
артерії. Простагландини виходять з кровообігу, проте їх
також синтезують легені і вивільняють у кров, коли роз-
тягнута легенева тканина.
Таблиця 34-6. Біологічно активні речовини, що іх
метаболізують легені
Синтезовані і використовувані у легенях
Сурфактант
Синтезовані або депоновані і вивільнювані у кров
Простагландини
Гістамін
Калікреїн
Частково виводяться з крові
Простагландини
Брадикінін
Аденін нуклеотиди
Серотонін
Норадреналін
Ацетилхолін
Активовані у легенях
Ангіотензин І ангіотензин II
610/РОЗДІЛ 34
Легені активують один гормон. Фізіологічно неактив-
ний декапептид ангіотензин І перетворюється у судинозву-
жувальний альдостероностимулювальний октапептид
ангіотензин II у легеневому кровообігу (див. Розділ 24).
Великі кількості ангіотензиноперетворювального ензиму,
відповідального за таке активування, розміщені на поверх-
ні ендотеліальних клітин легеневих капілярів. Перетво-
рювальний ензим також інактивований брадикініном. Час
кровообігу через легеневі капіляри - менше 1 с, проте
70% ангіотензину І, що досягає легені, конвертується у
ангіотензин II за одиничне проходження через капіляри.
На поверхні легеневих ендотеліальних клітин ідентифі-
ковано інші чотири пептидази, однак їхня фізіологічна
роль не з’ясована.
Виведення серотоніну або норадреналіну зменшує кіль-
кість таких вазоактивних речовин, що потрапляють у сис-
темний кровообіг. Багато інших вазоактивних гормонів
проходять через легені, не метаболізуючись. До них нале-
жить адреналін, дофамін, окситоцин, вазопресин і ангіо-
тензин II. Крім того, як зазначено у Розділі 26, різноманітні
аміни та поліпептиди секретовані нейроендокринними клі-
тинами у легенях.
Транспортування газів
між легенями і тканинами
35
ВСТУП
Градієнти парціальних тисків для О2 і СО2 позначені
на графіку (рис. 35-1), відіграють вирішальну роль у
транспортуванні газів і визначають потік донизу О2 з повіт-
ря через альвеоли і кров у тканини, тоді як для СО2- потік
донизу від тканин до альвеол. Кількість транспортованих
газів може бути валово неадекватною, бо понад 99% О2,
розчиненого у крові, сполучається з гемоглобіном - білком,
що переносить кисень, і понад 94,5% СО2, який розчиня-
ється у крові, беручи участь у серії зворотних хімічних
реакцій, перетворюється в інші сполуки. Тому наявність
гемоглобіну збільшує кисневу ємність крові у 70 разів, а
реакції з СО2 - вміст у крові СО2 в 17 разів. У цьому розділі
розглянуто механізми, що виконують транспортування О2
і СО2.
ТРАНСПОРТУВАННЯ КИСНЮ
Постачання кисню у тканини
Система організму з постачання О? у тканини охоплює
легені і серцево-судинну систему. Ступінь постачання О2
Рис. 35-1. Сумарні рівні РОг і РОг у повітрі, легенях і тканинах
графічно відображають факт, що О2 і СО2 дифундують донизу
уздовж знижувальних ґрадієнтів парціального тиску (відтво-
рено за дозволом з Кіппеу ЛМ: Тгапзрогі ої сагЬоп сііохісіе іп
ЬІоосІ Апезіїїезіоіоду 1960,21:615).
у певні тканини залежить від кількості О2, що потрапляє в
легені, адекватності газообміну в легенях, кровопостачан-
ня тканини і спроможності крові переносити О2. Плин кро-
ві визначений ступенем звуження судинного русла у тка-
нинах та серцевим викидом. Кількість О2 у крові зумовлена
кількістю розчиненого О2, кількістю гемоглобіну в крові і
спорідненістю гемоглобіну до О2.
Реакції гемоглобіну і кисню
Динаміка реакції гемоглобіну з О2 перетворює його в
особливу відповідну сполуку - оксигемоглобін, носій 02.
Гемоглобін (див. Розділ 27) є білком, що складається з
чотирьох субодиниць - поліпептидних ланцюгів, кожний
з яких приєднується до небілкової частини - гему. У нормі
в дорослих більшість гемоглобіну містить два а- і два р-
ланцюги. Гем (див. рис. 27-17) - це комплекс, створений
порфірином і одним атомом двовалентного заліза. Кожний
з чотирьох атомів заліза може приєднати або віддати одну
молекулу О2. Залізо залишається у двовалентному стані,
тому цю реакцію називають оксигенацією, а не окиснен-
ням. Записують реакцію гемоглобіну з О2 так: НЬ + О2
НЬО2. Утворену сполуку називають оксигемоглобін.
Оскільки він містить чотири НЬ-одиниці, то молекулу гемо-
глобіну можна також записувати як НЬ4; він справді реагує
з чотирма молекулами О2 для утворення НЬ4О8:
НЬ4+О2^НЬ4О2;
НЬ4О2+О2^НЬ4О4;
НЬ4О2 + О2 НЬ4О6;
НЬ4О2+О2^ НЬ4О8.
Реакція є стрімкою, триває до 0,01 с. Деоксигенація (від-
новлення) НЬ4О8 теж дуже швидка.
Четвертинна структура гемоглобіну визначає його спо-
рідненість до О2. У дезоксигемоглобіні глобінові одиниці
щільно зв’язані у напружену (Н) конфігурацію, яка змен-
шує спорідненість молекули до О2. Якщо першим приєд-
нується О2, то зв’язки, що утримують глобінові одиниці,
вивільняються, утворюючи розслаблену (Р) конфігура-
цію, яка експонує більше сайтів для зв’язування. Оста-
точним наслідком є посилення спорідненості до О2 у 500
разів. У тканинах ці реакції оборотні (змінюють напрям),
унаслідок чого вивільнюється О2. Відомо, що перехід від
612/РОЗДІЛ 35
одного стану до іншого за час існування еритроцита відбу-
вається близько І О8 разів.
Крива дисоціації оксигемоглобіну - нелінійне співвід-
ношення у відсотках О2-транспортувальної сили насичення
гемої юбіну киснем до РО2 (рис. 35-2) - має 8-подібну форму,
що залежить від Н-Р-взаємозаміни. Комбінація першого гему
в молекулі НЬ з О2 посилює спорідненість другого гему для
О2, а оксигенація другого посилює спорідненість третього і
так далі, отже, спорідненість НЬ для четвертої молекули О2
у декілька разів більша, ніж для першої.
Якщо кров урівноважується на 100% О2 (Р02 дорівнює
760 мм рт. ст.), то нормальний гемоглобін стає 100% наси-
чений. У разі повного насичення кожний 1 г нормального
гемоглобіну вміщує 1,39 мл О2, хоча кров у нормі містить
невелику кількість неактивних похідних гемоглобіну, і
рівень, який вимірюють іп уіуо, є нижчий: традиційно він
становить 1,34 мл О2. У нормі концентрація гемоглобіну
крові в середньому 15 г/дл (14 г/дл для жінок і 16 г/дл у
чоловіків; див. Розділ 27). Отже, 1 дл крові містить 20,1 мл
(1,34 мл х 15) О2, зв’язаного з гемоглобіном за 100% наси-
чення гемоглобіну. Кількість розчиненого О2є в лінійному
співвідношенні до РО2 (0,003 мл/дл крові/мм рт. ст.)
На закінченнях легеневих капілярів іп уіуо гемоглобін
крові на 97,5% насичений О2 (РО2 = 97 мм рт. ст.). Однак
невелика частка венозної крові, що обходить легеневі капі-
ляри (фізіологічний шунт), зумовлює лише 97% насиченос-
ті гемоглобіну крові у великому колі кровообігу. Тому арте-
ріальна кров містить 19,8 мл О2 на 1 дл: 0,29 мл у розчині
і 19,5 мл, зв’язаного з гемоглобіном. За стану спокою у
венозній крові гемоглобін на 75% насичений, і загальний
вміст О2 становить близько 15,2 мл/дл: 12 мл у розчині і
15,1 мл зв’язаного з гемоглобіном. Як бачимо, у спокої
тканина вилучає 4,6 мл О2 з кожного декалітра крові, що
проходить через неї (табл. 35-1); 0,17 мл цієї загальної кіль-
кості належить О2, що був у розчинений у крові, а решта -
звільнена гемоглобіном. Отже, у стані спокою щохвилини
250 мл О2 транспортується з крові у тканини.
Рис. 35-2. Крива дисоціації оксигемоглобіну при рН 7,40 і
температурі 38°С.
Чинники, що впливають на спорідненість
гемоглобіну до кисню
Три важливі чинники впливають на криву дисоціації
гемоглобіну: рН, температура і концентрація 2,3-дифос-
фогліцерату (2,3-ДФГ). Підвищення температури або
зменшення рН зміщує криву праворуч (рис. 35-3). Якщо
крива зміщується у цьому напрямі, то підвищений Р(^
потрібний, щоб гемоглобін зв’язувався з оптимальною
кількістю О2. Натомість зниження температури або збіль-
шення рН зміщує криву ліворуч, і знижений РО2 необхідний
для зв’язування отриманої кількості О2. Зручним показни-
ком для таких зміщень є Р50- РО2, за якого гемоглобін наси-
чується О2 наполовину. Чим вищий Р50, тим нижча спорід-
неність гемоглобіну до О2.
Зменшення спорідненості О2 до гемоглобіну, КОЛИ рн
крові зменшується, називають ефектом Бора; воно тісно
пов’язане з фактом, що деоксигенований гемоглобін (дез-
оксигемоглобін) зв’язує Н+ активніше, ніж оксигемоглобін.
Показник рН у крові зменшуватиметься зі збільшенням
вмісту в ній СО2 (див. нижче), тому, коли зростатиме РС02,
крива зміщуватиметься праворуч, і зростатиме Р50. Біль-
шість ненасиченого гемоглобіну, що трапляється у ткани-
нах, є вторинним для зниження Р02, однак додаткові 1-2%
ненасичення зумовлюють зростання РСО2 і послідовне змі-
щення кривої дисоціації праворуч.
Еритроцити багаті на 2,3-ДФГ, що формується (рис. 35-
4) з 3-фосфогліцеральдегіду, який є продуктом гліколізу за
шляхом Ембдена-Мейєргофа (див. Розділ 17). Це високо-
обмінний аніон, який приєднується до Р-ланцюгів дезокси-
гемоглобіну. Один моль дезоксигемоглобіну зв’язує 1 моль
2,3-ДФГ:
НЬО2+ 2/3-ДФГ НЬ - 2,3-ДФГ + О2.
У цьому рівнянні збільшення концентрації 2,3-ДФГ
зміщує реакцію праворуч, зумовлюючи вивільнення біль-
шої кількості О2. АТФ приєднується до дезоксигемоглобіну
і поширюється менше; деякі органічні фосфати зв’язують-
ся меншою мірою.
До чинників, які впливають на концентрацію 2,3-ДФГ
в еритроцитах, належить рН. Оскільки ацидоз інгібує гліко-
ліз в еритроцитах, то концентрація 2,3-ДФГ зменшується,
якщо рН низький. Тиреоїдні гормони, гормон росту й
андрогени збільшують концентрацію 2,3-ДФГ і Р50.
Таблиця 35-1. Газовий склад крові
Кров, мл/дл, що вміщує 15 г гемоглобіну
Газ Артеріальна кров, Ро2 95 мм рт. ст.; Рсо2 40 мм Рт- ст-» НЬ 97% насичення Венозна кров, Ро2 40 мм рт. ст.; Рсо2 46 мм рт. ст,> НЬ 75% насичення
Розчинений Сполучений Розчинений Сполучений
О2 0,29 19,5 0,12 15,1
со2 2,62 46,4 2,98 49,7
И2 0,98 0 0,98 0
ТРАНСПОРТУВАННЯ ГАЗІВ МІЖ ЛЕГЕНЯМИ І ТКАНИНАМИ / 613
[НСО3 ]
Рн = 6’10 + ІО9 оїбзоїіи
рН артеріальної крові = 7,40
рН венозної крові = 7,36
Рис. 35-3. Вплив температури та рН на криву дисоціації оксигемоглобіну. Осі координат такі, як на рис. 35-2 (відтворено за
дозволом з Сотгое ЛЧ еі аі: ТГіе І_ипд: СІіпісаІ РГіузіоІоду апсі Риігпопагу Рипсііоп Тезіз, 2пс! есі. Уеаг Воок, 1962).
Як зазначено, фізичне навантаження збільшує утворен-
ня 2,3-ДФГ через 60 хв, хоча у тренованих атлетів збіль-
шення може не виникати. Підвищення Р50 у разі фізичного
навантаження настає тому, що температура підвищується
в активних тканинах і СО2, а метаболіти нагромаджуються,
зменшуючи рН. Крім того, щораз більше О2 виводиться з
кожної одиниці крові, що протікає через активні тканини,
бо РСО2 у тканинах знижується. Остаточно при низьких зна-
ченнях РО2 крива дисоціації гемоглобіну стає крутою, і знач-
на кількість О2 вивільняється на одиницю зниження РО2.
Глюкоза 6-РО,
З-Фосфогліцеральдегід
1,3-Дифосфогліцерат
2,3-ДФГ-мутаза
СОО
О
Фосфо-
гліцерат-
кіназа
Н+ + НС -О-Р-ОН
ОН
О
II
Н2С -О-Р-ОН
І
он
2,3-Дифосфогліцерат
(2,3-ДФГ)
2,3-Д Ф Г-фосфатаза
З-Фосфогліцерат
І
Піруват
Рис. 35-4. Утворення і катаболізм 2,3-ДРГ.
Стрімке піднімання вгору зумовлює суттєве збільшення
концентрації 2,3-ДФГ в еритроцитах з послідовним під-
вищенням Р50 за наявності О2 у тканинах. Збільшення 2,3-
ДФГ, який має період напівжиття 6 год, є вторинним для
збільшення рН крові (див. Розділ 37). Рівень 2,3-ДФГ зни-
жується до норми внаслідок повернення до рівня моря.
Більша спорідненість фетального гемоглобіну (гемогло-
біну Р), на відміну гемоглобіну дорослих (гемоглобіну А),
до О2 полегшує надходження О2 від матері до плоду (див.
Розділ 27 і 32). Причиною такої збільшеної спорідненості
є погане з’єднання з 2,3-ДФГ у-поліпептидних ланцюгів,
які замінюють Р-ланцюги у фетальному гемоглобіні. Деякі
аномальні гемоглобіни у дорослих мають низький рівень
Р5(), і кінцева висока спорідненість гемоглобіну до О2 зумов-
лює виражену тканинну гіпоксію, яка стимулює збільшене
утворення еритроцитів, що спричинює поліцитемію (див.
Розділ 24). Цікавим є міркування, що такі гемоглобіни не
можуть зв’язувати 2,3-ДФГ.
Концентрація 2,3-ДФГ в еритроцитах збільшується в
разі анемії та різноманітних хвороб, що супроводжуються
хронічною гіпоксією. Це полегшує постачання О2 до тка-
нин у випадку підвищення РО2, коли О2 вивільняється у
периферійних капілярах. Зберігання крові у спеціальних
банках зумовлює зниження рівня 2,3-ДФГ, і спорідненість
такої крові для вивільнення О2 у тканини зменшується. Це
зниження, яке, очевидно, обмежує доцільність використан-
ня такої крові для переливання хворому з гіпоксією, є
меншим, якщо кров зберігають у цитрат-фосфат-декстроз-
ному розчині, а не у звичайному кислотно-цитрат-декст-
розному.
Транспортування гемоглобіном
оксиду азоту
Сайти двовалентного заліза, що зв’язують у гемоглобіні
О2, також приєднують оксид азоту (N0), однак є один
додатковий \О-зв’язувальний сайт на р-ланцюгах. Спо-
рідненість цього сайту збільшується за допомогою О2, тому
гемоглобін зв’язує N0 у легенях і вивільнює його в тка-
нинах, зумовлюючи вазодилатацію (див. Розділ 31).
Отже, гемоглобін виконує чотири функції: сприяє транс-
портуванню О2, полегшує транспортування СО2, відіграє
важливу роль як буфер (див. Розділ 39) і транспортує N0.
614/РОЗДІЛ 35
Інші аспекти хімії гемоглобіну описані у Розділі 27. Феталь-
ний гемоглобін та трансплацентарний обмін О2 розглянуто
у Розділі 32.
Міоглобін
Міоглобін - це залізовмісний піґмент, який є у скелетних
м’язах. Він подібний до гемоглобіну, однак зв’язує 1, а не
4 молі О2. Його крива дисоціації - це прямокутна гіпербола,
а не 8-подібна крива. Оскільки вона розташована лівіше,
ніж гемоглобінова (рис. 35-5), то міоглобін бере О2 від
гемоглобіну в крові, вивільнюючи О2 тільки за низького
рівня Ро2, однак Ро2 у м’язах під час фізичного наванта-
ження близький до нуля. Вміст міоглобіну найбільший у
м’язах, що витримують скорочення. Скорочення м’язів
перетискають судини, по яких тече кров, і міоглобін
забезпечує О2, коли кровоплин припинений. Є також дока-
зи, що міоглобін полегшує дифузію О2 з крові у мітохондрії,
де відбуваються реакції окиснення. Хоча у мишей з нокау-
том гена, відповідального за синтез міоглобіну, просте-
жується нормальна спроможність до фізичних наванта-
жень. Отже, додаткові дослідження фізіологічної ролі міо-
глобіну потрібні.
ТРАНСПОРТУВАННЯ ОКСИДУ ВУГЛЕЦЮ
Буферні системи
Для того, щоб зрозуміти процеси буферування в орга-
нізмі з моменту утворення СО2 із вугільної кислоти у крові,
потрібно з’ясувати, як відбувається транспортування СО2.
Буферні системи описані у Розділі 1 і детально розглянуті
у Розділі 39.
Рух оксиду вуглецю в крові
Розчинність СО2 у крові в 20 разів більша, ніж розчин-
ність О2, тому вважають, що за однакових парціальних
тисків СО2 є більше, ніж О2 у простому розчині. У випадку
дифузії в еритроцити СО2 швидко гідратується до Н2СО3,
оскільки наявна карбоангідраза. Внаслідок дисоціації
Н2СО3 утворюються Н+ і НСО3. Йон Н+ буферує головно
гемоглобін, а НСО3 потрапляє у плазму. Частина СО2 в
еритроцитах реагує з аміногрупами білків, насамперед з
гемоглобіном, і утворює карбаміносполуки.
Н Н
/ /
СО, + К-М к-м
\ \
н соон
Як тільки деоксигенований гемоглобін зв’яже більше
Н+, ніж це робить оксигемоглобін, розпочинається швидке
утворення карбаміносполук, зв’язуючи О2 з гемоглобіном
і зменшуючи його спорідненість з СО2 (ефект Галдана).
Венозна кров переносить більше СО2, аніж артеріальна, і
поглинання СО2 полегшується у тканинах, а СО2 вивіль-
нюється у легенях. Понад 11% СО2 долучається у капілярну
кров великого кола кровообігу і переноситься до легень
як карбаміно-СО2
У плазмі СО2 реагує з білками плазми, утворюючи неве-
лику кількість карбаміносполук, незначна частина СО2 гід-
ратує. Реакція гідратації відбувається повільно без карбо-
ангідрази.
Переміщення хлору
Унаслідок збільшення вмісту НСО3 в еритроцитах по-
рівняно з плазмою під час проходження крові через капі-
ляри понад 70% цього НСО3 переходить у плазму. Рух
надлишку НСО3, що виходить з еритроцитів в обмін на
СІ (рис. 35-6), контрольований білком смужки 3, голов-
ним мембранним білком. Цей обмін називають переміщен-
ням хлору, оскільки завдяки йому вміст СІ в еритроцитах
венозної крові значно більший, ніж в артеріальній. Пере-
міщення хлору відбувається швидко і повністю закінчу-
ється за 1 с.
Зверніть увагу, що кожна молекула СО2, яка надходить
в еритроцити, збільшує їх на одну осмотично активну
частинку: або НСО3 , або СІ (див. рис. 35-6). Внаслідок
цього еритроцити набирають воду і збільшуються у роз-
мірі. З цього погляду, а також беручи до уваги, що невелика
кількість рідини в артеріальній крові повертається через
лімфатичні судини швидше, ніж через вени, гематокрит
венозної крові у нормі на 3% більший, ніж артеріальної. У
легенях СІ виводиться з клітин і вони зморщуються.
Рис. 35-5. Криві дисоціації гемоглобіну і міоглобіну.
Рис. 35-6. Зміни, що відбуваються в еритроцитах у разі до-
давання СО2 у кров. Зверніть увагу, що кожна молекула СО2,
яка входить у еритроцити, - це додатковий йон НСО3~ або
СІ~ у клітину.
ТРАНСПОРТУВАННЯ ГАЗІВ МІЖ ЛЕГЕНЯМИ І ТКАНИНАМИ / 615
Підсумок
З огляду на різноманітність функцій СО2 у плазмі та
еритроцитах їх систематизовано у табл. 35-2. З рис. 35-7
видно, що збільшення ємності крові переносити СО2 визна-
чене різницею між лініями, що позначають розчинений
СО2 і загальний СО2 у кривій дисоціації для СО2.
У кожному декалітрі артеріальної крові є близько 49 мл
СО2 (див. табл. 35-1): 2,6 мл розчиненого, 2,6 мл утворює
карбаміносполуки і 43,8 мл - у НСО3 . У тканинах на
кожний декалітр крові припадає 3,7 мл СО2,0,4 мл залиша-
ється у розчині, 0,8 мл утворює карбаміносполуки і 2,5 мл
- НСО3 .
Показник рН крові з 7,4 зменшується до 7,36. У легенях
відбувається протилежний процес, і 3,7 мл СО2 вивіль-
няється через альвеоли. У такий спосіб у спокої 200 мл
Таблиця 35-2. СО2 у крові
У плазмі
1. Розчинений
2. Утворює карбаміносполуки з білком плазми
3. Гідратація, буферування Н+ у плазмі НСО3~
В еритроцитах
1. Розчинений
2. Утворення карбоміно-НЬ
3. Гідратація, буферування Н+, 70% НСО3~ входить у
плазму
4. СГ входить у клітини, збільшуючи мосмоль в клітинах
Рсо2, мм рт. ст.
Рис. 35-7. Крива дисоціації СО2. Артеріальна (а) і венозна
точки (V) відображають загальний вміст СО2 в артеріальній і
венозній крові людини у нормі в стані спокою (модифіковано
та відтворено за дозволом з ЗсГітісК КЕ, ТГієууз 6 [есіііогз]:
Нитап РГіузіоІоду. Зргіпдег, 1983).
СО2 за 1 хв і значно більше під час навантаження транс-
портується від тканин до легень і виводиться. Це заслу-
говує на увагу, бо така кількість СО2 еквівалентна надо-
лужити 12 500 мекв Н+ за 24 год.
36
Регулювання дихання
ВСТУП
Дихання відбувається спонтанно внаслідок ритмічної
імпульсації у мотонейронах, які іннервують дихальні м’язи.
Реалізація такої активності повністю залежить від нерво-
вих імпульсів головного мозку. Дихання припиниться,
якщо спинний мозок перетнути вище від місця виходу діаф-
рагмальних нервів.
Ритмічну імпульсацію головного мозку, яка спричинює
спонтанне дихання, регулюють зміни артеріального Р02,
РСО2 та концентрації Н+. Таке регулювання за допомогою
хімічних чинників доповнене численними нехімічними
впливами.
НЕРВОВЕ РЕГУЛЮВАННЯ ДИХАННЯ
Системи регулювання
Нервове регулювання дихання забезпечують дві окремі
системи механізмів. Одна відповідає за довільне, а інша -
за мимовільне (автоматичне) регулювання. Довільна сис-
тема охоплює в себе структури, розташовані у корі великих
півкуль, і надсилає імпульси у дихальні мотонейрони через
кортикоспінальні провідні шляхи. Автоматична система
міститься у мості та довгастому мозку, еферентні вихідні
імпульси з неї прямують до дихальних мотонейронів через
білу речовину, що розташована між латеральним і вент-
ральним кортикоспінальними шляхами. Нервові волокна,
завдяки яким розпочинається вдихання, конверґують на
діафрагмальних мотонейронах, що розміщені у задніх
рогах від СЗ до С5, а зовнішні міжреберні мотонейрони -
у передніх рогах грудного відділу спинного мозку. Нервові
волокна, що пов’язані з видиханням, конверґують перш за
все на міжреберних мотонейронах у грудному відділі спин-
ного мозку.
Мотонейрони, що йдуть до експіраторних дихальних
м’язів, гальмуються, коли такі, що забезпечують інспіра-
торні м’язи, активні і навпаки. Хоча, спінальні рефлекси
сприяють реципрокній іннервації (див. Розділ 6), та вона
виникає загалом унаслідок активності в низхідних про-
відних шляхах. Імпульси у низхідних шляхах збуджують
агоністи та гальмують антагоністи. Винятком у реципрок-
ному гальмуванні є короткотривала незначна активність
у діафрагмальних аксонах після вдихання. Значення
такого постінспіраторного вихідного імпульсу полягає у
перериванні еластичної тяги легень і створенні дихання
плавним.
Система довгастого мозку
Ритмічна імпульсація нейронів довгастого мозку та мос-
ту забезпечує автоматичність дихання. Перетинання стов-
бура мозку нижче від довгастого мозку (розтин Б на рис.
36-1) припиняє дихання, а в разі рострального перетинання
мосту (розтин А на рис. 36-1) автоматичне дихання є
нормальним. Дихальні нейрони стовбура головного мозку
бувають двох типів: одні виявляють активність під час вди-
хання (інспіраторні, І-нейрони), а інші - під час видихання
(експіраторні, Е-нейрони). Більшість активної імпульсації
посилює частоту під час вдихання, у випадку І-нейронів,
або під час видихання у випадку Е-нейронів. Деяка імпуль-
сація послаблює частоту, а інша імпульсація перебуває на
однаковому високому рівні під час вдихання або видихання.
Однак видихання є пасивним під час спокійного дихання,
і Е-нейрони тоді перебувають у стані спокою; вони стають
активними, якщо легенева вентиляція збільшується.
Ділянку довгастого мозку, пов’язану з диханням, нази-
вають дихальним центром; у ньому розрізняють дві
окремі групи нейронів (див. рис. 36-1). Дорсальна група
нейронів міститься у або біля ядра поодинокого шляху.
Вентральна група - це довгий стовпець нейронів, що
простягається через подвійне та задньоподвійне ядро у
вентролатеральній частині довгастого мозку. Дорсальну
групу, головно, утворюють І-нейрони, деякі з яких висту-
пають і моносинаптично поєднуються з діафрагмальними
мотонейронами. До них, вірогідно, проектуються від ди-
хальних шляхів та каротидних і аортальних клубочків афе-
рентні шляхи, які закінчуються у ядрі поодинокого шляху.
Вентральна група містить Е-нейрони у каудальній частині
дихального центру, І-нейрони - у його середній частині,
та Е-нейрони - на ростральному кінці. Деякі з цих нейронів
проникають у дихальні мотонейрони; ті ж, що містяться
на ростральному кінці групи, відповідають за гальмування
І-нейронів під час видихання.
Головні компоненти ґенераторного комплексу регу-
лювання дихання, відповідального за автоматичність
дихання, містяться у довгастому мозку, тому спонтанне
дихання триває, хоча деколи нерегулярно і з затрудненями,
після перетинання стовбура головного мозку по нижньому
краю мосту (розтин С на рис. 36-1).
Ні дорсальна, ні вентральна групи дихальних нейронів
не є обов’язковою частиною ґенераторного комплексу,
оскільки вибіркове ураження однієї або іншої зменшує
амплітуду дихання, однак не припиняє його. Хоча після
цього дихання буде ритмічним, ініційованим невеликою
групою синаптично поєднаних пейсмейкерних клітин у
РЕГУЛЮВАННЯ ДИХАННЯ / 617
Рис. 36-1. Респіраторні нейрони у стовбурі головного мозку. Дорсальний вигляд стобура головного мозку; мозочок видалений.
Зображені також впливи різноманітних уражень та перетини стовбура головного мозку. Записи спірометрії праворуч відобра-
жають глибину і частоту дихання. ДРН - дорсальна група респіраторних нейронів; ВРН - вентральна група респіраторних
нейронів; ПБЯ - парабрахіальне ядро (пневмотаксичний центр); 4-й шлун. - четвертий шлуночок; НГ - нижній горбик, МИ -
середні мозкові ніжки. Римські цифри позначають черепні нерви (модифіковано та відтворено за дозволом з МКсГіеІІ РА,
Вегдег А: Зіаіе ої ІГіе агі: Яєуієуу ої пемгаї гедиіаііоп ої гезрігаііоп. Ат Яєу Яезріг Віз 1975; 111:206).
комплексі пре-Буттзінґера на одному з двох боків довгас-
того мозку між подвійним і латеральним ретикулярним
ядром (рис. 36-2). Ці нейрони імпульсують ритмічно й
утворюють ритмічну імпульсивну активність у діафраг-
мальних мотонейронах, яка зникає в разі перетинання між
комплексом пре-Буттзінґера і цими мотонейронами.
Впливи мосту і блукаючих нервів
Ритмічна імпульсація нейронів довгастого мозку сто-
сується спонтанності дихання, проте її змінюють нейрони
мосту й аферентні волокна блукаючого нерва від рецеп-
торів у дихальних шляхах та легенях. У ділянці, відомій
як пневмотаксичний центр, у медіальних і парабрахі-
альних ядрах та ядрі Куллікера-Фузе у дорсолатеральному
мості містяться І- та Е-нейрони, і нейрони, активні у обох
фазах дихання. Якщо зруйнувати цю ділянку (розтин В на
рис. 36-1), то дихання стане повільнішим, а дихальний
об’єм збільшиться; у разі перетинання блукаючого нерва
в анестезованих тварин настає пролонгований інспіратор-
ний спазм, подібний до затримки дихання. Дихання при-
пиняється на фазі вдихання (апнейзис). Функція пневмо-
таксичного центру у нормі досі остаточно не з’ясована,
однак він може відігравати роль перемикача між вдиханням
та видиханням, регулятора оптимального співвідношення
тривалості вдихання, видихання і дихальної паузи.
Розтягнення легень під час вдихання ініціює імпульса-
цію в аферентних легеневих вагусних волокнах. Ці імпуль-
си гальмують інспіраторну імпульсацію. Власне тому збіль-
шується глибина вдихання після ваготомії (див. рис. 36-
1); апнейзис же виникає, якщо блукаючі нерви перетято
після руйнування пневмотаксичного центру. Як зображено
Рис. 36-2. Ритмічна імпульсація (унизу) нейронів комплексу
пре-Буттзінґера (затемнена ділянка, пре-БУТТЗ) у препараті
головного мозку щура в неонатальному періоді; НО - нижні
оливи; ЛРЯ - латеральне ретикулярне ядро; ПЯ - подвійне
ядро; XII - ядро дванадцятого черепного нерва; 5СМ - спин-
номозкове ядро трійчастого нерва (модифіковано з ЗтііГі ЗС
еі аі: Рге-Вцйгіпдег сотріех: А Ьгаіпзіет гедіоп іїіаі тау дел-
егате гезрігаіогу гііуііїт іп таттаїз. Зсіепсе 1991;254:726).
618/ РОЗДІЛ 36
на рис. 36-3, активність вагусного зворотного зв’язку не
змінює рівня зростання нейрональної активності у дихаль-
них мотонейронах, проте без них активність триває.
В інтактних тварин зі збільшенням активності інспіра-
торних нейронів частота і глибина дихання зростають.
Глибина дихання збільшується, оскільки легені розтягу-
ються до більшого ступеня, перш ніж потужність інгібітор-
ної активності вагусного та пневмотаксичного центру ста-
не достатньою для подолання інтенсивнішої імпульсації в
інспіраторних нейронах. Частота дихання посилюється
тому, що післяімпульсація у блукаючих нервах та, віро-
гідно, в пневмотаксичних аферентних волокнах до дов-
гастого мозку швидко переважає.
РЕГУЛЮВАННЯ ДИХАЛЬНОЇ АКТИВНОСТІ
Збільшення Р( о2або концентрації Н+ в артеріальній кро-
ві або зменшення її РО2 збільшує рівень дихальної нейро-
нальної активності у довгастому мозку, а зміни у зворот-
ному напрямі зумовлюють незначний гальмівний вплив.
На вентиляцію легень впливають зміни хімічних власти-
востей крові, що сприймаються дихальними хеморецеп-
торами - каротидними й аортальними клубочками та
накопиченнями у довгастому мозку і де-небудь ще клітин,
які є чутливими до змін хімічних властивостей крові. Вони
ініціюють імпульси, які подразнюють дихальний центр. На
цій основі відбувається хімічне (гуморальне) регулю-
вання дихання, інші аферентні шляхи забезпечують
нехімічне регулювання дихання, яке впливає на дихальні
рухи в особливих випадках (табл. 36-1).
ХІМІЧНЕ РЕГУЛЮВАННЯ ДИХАННЯ
Хімічні регулювальні механізми пристосовують венти-
ляцію легень у такому напрямі, що у нормі альвеолярний
Рс()2 є сталим, впливи надлишку Н+ у крові подолані, і РО2
підвищується, якщо його зниження досягає потенційно
небезпечного рівня. Дихальний хвилинний об’єм пропор-
ційний до рівня обміну речовин, проте зв’язок між обміном
речовин і диханням визначений СО2, а не О2. Рецептори у
Таблиця 36-1. Подразники, що впливають на
респіраторний центр
Хімічне регулювання
СО2 (через СМР і концентрацію Н+ інтестиційної рідини
головного мозку)
у (через каротидні та аортальні клубочки)
п -і
Нехімічне регулювання
Вагусні аферентні волокна у дихальних шляхах і
легенях
Аферентні волокна від мосту, гіпоталамуса і лімбічної
системи
Аферентні волокна від пропріорецепторів
Аферентні волокна від барорецепторів: артеріальних,
пульмональних та від передсердь і шлуночків серця
Рис. 36-3. Графічний запис двох варіантів дихання з рецеп-
торів розтягу легень: з (А) та без (В) зворотного зв’язку впливу
вагусної активності. Зверніть увагу, що рівень зростання
активності діафрагмального нерва на діафрагму є незмінним,
однак імпульсація триваліша без вагусного впливу.
каротидних та аортальних клубочках подразнювані підви-
щенням РСО2 або концентрацією Н+ в артеріальній крові чи
зниженням РО2. Після денервації каротидних хеморецеп-
торів відповідь на зниження РО2 неможлива. Предомінант-
ним впливом гіпоксії після денервації каротидних клубоч-
ків є безпосередня депресія дихального центру. Відповідь
на зміни концентрації Н+ в артеріальній крові у межах рН
7,3-7,5 також нівельовані, хоча більші зміни впливають
частково. З іншого боку, відповідь на зміни артеріального
РСо2, виникають, однак повільніше; він зменшується не
більше ніж на 30-35%.
Каротидні та аортальні клубочки
Каротидні клубочки розташовані у місці каротидної
біфуркації з кожного боку, і звичайно два або більше аор-
тальні клубочки - біля дуги аорти (рис. 36-4). Кожен каро-
тидний або аортальний клубочок (гломус) містить острівці
двох типів клітин: тип І або тип II, оточені фенестрованими
синусоїдними гемокапілярами. Біля типу І, або гломусних
клітин, близько є кубкоподібні закінчення аферентних
нервів (рис. 36-5). Гломусні клітини подібні до хромато-
фінних клітин надниркових залоз, у них є щільні ґранули,
що містять катехоламіни, які вивільняються під впливом
гіпоксії або ціанідів (див. нижче). Клітини стимулює гіпо-
ксія і головний трансмітер, що з’являється, є дофамін, який
збуджує нервові закінчення через Б2-рецептори. Тип II -
це гліоподібні клітини, кожна з яких оточена чотирма або
шістьма клітинами типу І. Функції клітин типу II остаточно
не з’ясовані.
Поза капсулою кожного клубочка нервові волокна ма-
ють мієлінову оболонку. Діаметр цих волокон 2-5 мкм,
швидкість проходження через них - 7-12 м/с. Аферентні
волокна від каротидних клубочків піднімаються до довгас-
того мозку через каротидний синус і язикогорлові нерви,
а волокна від аортальних клубочків - через блукаючі нерви.
Під час записування досліджень, за яких один з каротидних
РЕГУЛЮВАННЯ ДИХАННЯ / 619
клубочків був ізольований і перфузований, в аферентних
нервових волокнах, які працювали, простежувалося сту-
пінчасте збільшення імпульсного потоку, якщо Ро2 у пер-
фузованій крові знижувався (рис. 36-6) або РС02 підвищу-
вався.
Гломусні клітини типу І мають О2-чутливі К+-канали, у
яких швидкість проходження зменшується пропорційно до
ступеня гіпоксії, якій вони піддаються. Це зменшує виті-
кання К+, деполяризує клітину і спричинює надходження
Са2+ головно через Ь-тип Са2+-каналів. Надходження Са2+
є початковим моментом для утворення потенціалів дії та
вивільнення трансмітера з послідовним збудженням афе-
рентних нервових закінчень. Гладкі м’язи легеневих арте-
рій містять подібні О2-чутливі К+-канали, які започаткову-
ють вазоконстрикцію, зумовлену гіпоксією (див. Розділ 37).
Це є відмінним від загальних артерій, які містять АТФ-
залежні К’-канали, що сприяють більшому витіканню К+ в
разі гіпоксії і послідовно зумовлюють вазодилатацію за-
мість вазоконстрикцїї.
Кровоплин у кожному 2 мг каротидному клубочку ста-
новить близько 0,04 мл/хв, або 2000 мл/100 г тканини/хв,
що можна зіставити з аналогічним кровоплином у 100 г/хв
і становитиме 54 мл у головному мозку і 420 мл у нирках
(див. табл. 32-1). Оскільки кровоплин через одиницю тка-
Рис. 36-5. Організація каротидного тільця. Клітини типу І (гло-
мус) містять катехоламіни. Після впливу гіпоксії вони вивіль-
няють ці катехоламіни, які подразнюють у каротидному сину-
сі кубкоподібні закінчення нервових волокон, що є у складі
язикогорлового нерва. Гліоподібні клітини типу II оточують
клітини типу І і, ймовірно, виконують функцію підтримки.
нини відповідає нормі, то О, клітини потребують більше,
ніж окремо розчиненого О2. Тому подразнення рецепторів
не відбувається за таких станів, як анемія або отруєння
карбон монооксидом, коли кількість розчиненого кисню в
крові, що досягає рецепторів, є нормальною, а вміст О, у
сполуках суттєво зменшений. Подразнення рецепторів
виникає, коли артеріальний Ро, низький або за наявності
Рис. 36-6. Зміни рівня імпульсації в окремому аферентному
волокні, що проходять від каротидного клубочка зі зниженням
Ро2(з дозволу 8 Батрвоп).
620 / РОЗДІЛ 36
судинного стазу; кількість О2, що надходить до рецепторів
за 1 хв, зменшується. Сильне подразнення також зумов-
люють препарати, зокрема, такі як ціанід, які блокують
утилізацію О2 на тканинному рівні. У достатніх дозах ніко-
тин і лобелін активують хеморецептори. Також зафік-
совано, що інфузійне введення Ю збільшує рівень імпуль-
сації в аферентних волокнах хеморецепторів, тому рівень
К у плазмі збільшується під час фізичного навантаження,
збільшення може відповідати за спричинену навантажен-
ням гіпервентиляцію.
Завдяки анатомічній локалізації аортальні клубочки не
можна так детально вивчати, як каротидні. їхні реакції,
ймовірно, подібні, проте з меншою амплітудою. У людей,
в яких обидва каротидні клубочки видалені, однак інтакт-
ними є аортальні клубочки, реакції однакові, що важливо
(як і у тварин з послідовно денервованими обома каторид-
ними та аортальними клубочками). У них наявні невеликі
зміни у легеневій вентиляції у разі спокою, проте вентиля-
ційна відповідь на гіпоксію буде втрачена, і на 30% змен-
шені вентиляційні відповіді на СО2.
Нейроепітеліальні тільця, створені з іннервованих клас-
терів аміновмісних клітин, містяться у дихальних шляхах
людей і тварин. Ці клітини мають назовні спрямований
К+-струм, який зменшується в разі гіпоксії, і це може спри-
чинювати деполяризацію. Отже, функція цих чутливих до
гіпоксії клітин повністю не з’ясована, оскільки, як описано
вище, видалення одного з каротидних клубочків зумовлює
зникнення респіраторної відповіді на гіпоксію.
Хеморецептори у стовбурі головного мозку
Хеморецептори, що започатковують гіпервентиляцію,
спричинену збільшенням артеріального РСО2 після денер-
вації каротидних та аортальних клубочків, містяться у
довгастому мозку, тому їх називають хеморецепторами
довгастого мозку. Вони відокремлені від дорсальних та
вентральних дихальних нейронів і локалізовані на вент-
ральній поверхні довгастого мозку (рис. 36-7).
Моніторинг концентрації Н+ у СМР, а також в інтерсти-
ційній рідині головного мозку, виконують хеморецептори;
СО2 швидко проникає через мембрани, зокрема, гематоен-
цефалічний бар’єр, тоді як Н+ і НСО3 - повільно. Потрап-
ляючи у головний мозок та СМР, СО2 швидко гідратується.
Унаслідок дисоціації Н 2СО3 збільшується місцева концент-
рація Н+. В інтерстиційній рідині головного мозку концент-
рація Н+ зіставна з артеріальним РСГ)2. Експериментально
створені зміни у РСо2 СМР незначно вливають на дихання
стільки часу, скільки концентрація Н+ є сталою, однак будь-
яке збільшення концентрації Н+ у спинномозковій рідині
стимулює дихання. Стимулювання пропорційне до збіль-
шення концентрації Н+. Отже, впливи СО2 на дихання го-
ловно залежать від його переміщення у СМР та інтерсти-
ційну рідину головного мозку, унаслідок чого СО2 збільшує
концентрацію Н+ і стимулює рецептори, чутливі до Н .
Вентиляційні реакції-відповіді на зміну
кислотно-лужної рівноваги
За метаболічного ацидозу, зумовленого, наприклад,
нагромадженням у кровообігу кетоацетонових продуктів
у разі цукрового діабету, відбувається респіраторне стиму-
лювання (дихання Куссмауля; див. Розділ 39). Натомість
Рис. 36-7. Ростральна (Р) та каудальна (К) хемочутливі ді-
лянки на вентральній поверхні довгастого мозку.
за метаболічного алкалозу спричиненого, наприклад,
довготривалим блюванням з втратою НС1, вентиляція
легень пригнічується й артеріальний РСО2 підвищується,
завдяки чому концентрація Н+ нормалізується (див. Розділ
39). Якщо ж посилюється вентиляція легень, що не є
вторинною до збільшення артеріальної концентрації Н+,
то зниження РСО2 зменшує артеріальну концентрацію ІТ
нижче норми (респіраторний алкалоз), і навпаки, гіпо-
вентиляція, що не є вторинною до зменшення у плазмі кон-
центрації Н+, спричинює респіраторний ацидоз.
Вентиляційні реакції-відповіді на СО2
У нормі артеріальний РСО2 є на рівні 40 мм рт. ст. Якщо
внаслідок пришвидшення обміну речовин у тканинах його
рівень підвищується, то вентиляція легень посилюється, і
рівень легеневої екскреції СО2 збільшуватиметься, доки
артеріальний РСО2 не стане нормальним. Процес механізму
цього зворотного зв’язку утримує екскрецію та утворення
СО2 у рівновазі.
Коли вдихають газову суміш, що містить СО2, то підви-
щуються альвеолярний та артеріальний РСО2, і стимулюван-
ня вентиляції легень розпочинається, як тільки кров, що
вміщує більшу кількість СО2, досягне довгастого мозку.
Елімінація СО2 збільшується, і альвеолярний РСО2 знижується
до норми. Ось чому порівняно великі прирости Рсс>2 у повітрі,
яке вдихають (наприклад, 15 мм рт. ст.) зумовлюють незначне
підвищення альвеолярного РСО2 (наприклад, 3 мм рт. ст).
Отже, РС02 не нормалізується, і нова рівновага настане, коли
альвеолярний РСО2 незначно підвищиться, а гіпервентиляція
триватиме стільки, скільки вдихатимуть СО2. Істинне лінійне
співвідношення між дихальним хвилинним об’ємом і альвео-
лярним Рсс>2 зображене на рис. 36-8.
Проте є обмеження такої лінійності. Коли РСО2 газової
суміші, яку видихають, близький до альвеолярного Рсо,,
то елімінація СО2 утруднена. Якщо ж вміст СО2 у газовій
суміші, яку видихають, понад 7%, то альвеолярний та
артеріальний РСО2 починають збільшуватись раптово,
РЕГУЛЮВАННЯ ДИХАННЯ / 621
Альвеолярний Рсо2, ММ рт. ст.
Рис. 36-8. Реакції відповіді здорових осіб, що вдихали О2 та
близько 2, 4 і 6% СО2. Хвилинний дихальний об’єм збільшу-
ється внаслідок збільшення частоти і глибини дихання (відтво-
рено за дозволом з ЬатЬегізеп СЗ іп: МесІісаІ Рїіузіоіоду, 1Зіґі
есі. Моипісазіїе УВ [есіііог]. МозЬу, 1974).
40-
30-
20-
10-
0 -1—।—।---------1---------1---------1—
21 20 15 10 5
О2 у видихуваному газі, %
160 152 114 76 38
Ро2 у видихуваному газі
120-
100-
80-
60-
40-
20-
Альвеолярний Ро2
Альвеолярний Рсо2
0-1—і---1---1------1-----1----1-----г
760 700 600 500 400 300 200
Барометричний тиск, мм рт. ст.
Рис. 36-9. Угорі: середні значення хвилинного дихального
об’єму після впливу газових сумішей з різним вмістом О2.
Горизонтальна лінія у кожному випадку відповідає середньо-
му значенню, вертикальна шкала - одному стандартному від-
хиленню. Внизу: значення альвеолярного Ро2 і Рсо2 під час
вдихання повітря та за різних барометричних тисків. Два
графіки вирівнюються, так що Ро2 у газових сумішах, які
вдихають (верхній графік), узгоджується з Ро2 для різних
барометричних тисків (нижній графік) (дані надані РН КеІІодд).
незважаючи на гіпервентиляцію. Наслідком стає нагромад-
ження СО2 в організмі (гіперкапнія), що пригнічує цент-
ральну нервову систему, у тім числі дихальний центр, і
спричинює біль голови, неспокій і, зрештою, кому (СО2-
наркоз).
Вентиляційні реакції-відповіді на втрату
кисню
Коли вміст О2 у повітрі, яке вдихають, зменшується, то
це спричинює збільшення хвилинного об’єму дихання.
Стимулювання є незначне, доки РО2 у повітрі, яке вдихають,
становить понад 60 мм рт. ст., і посилюється тільки у разі
нижчих значень РО2 (рис. 36-9). Отже, будь-яке зниження
артеріального Р02 до 100 мм рт. ст. зумовлює збільшення
імпульсації в нервах від каротидних та аортальних хемо-
рецепторів. Є два погляди на те, чому у здорових осіб у
нормі таке збільшення імпульсного потоку не спричинює
збільшення легеневої вентиляції доти, доки РОо не стане
меншим 60 мм рт. ст. Оскільки НЬ є слабшою кислотою,
ніж НЬО2 (див. Розділ 35), то простежується незначне
збільшення концентрації Н+ в артеріальній крові, коли РО2
знижується, і гемоглобін стає менш насиченим О2.
Унаслідок зменшення концентрації Н+ виникає схильність
до гальмування дихання. Додатково будь-яке збільшення
легеневої вентиляції, що знижує альвеолярний РСО2, також
зумовлює пригнічення дихання. Тому стимулювальні впли-
ви гіпоксії на легеневу вентиляцію не повністю з’ясовані,
доки вони не стають вираженими, і достатньо знехтувати
протилежними до врівноваження пригнічувальними впли-
вами на зменшення артеріальної концентрації Н+ і РС02.
Вплив зниження альвеолярного Р02 за сталого альвео-
лярного РСо2 на вентиляцію зображено на рис. 36-10. Якщо
альвеолярний РС02 стабілізований на рівні 2-3 мм рт. ст.
понад норму, то взаємовідношення між вентиляцією легень
і альвеолярним РО2 у межах 90-100 мм рт. ст. стають проти-
лежними. Проте в разі нижчих від норми значень альвео-
лярного РС02 стимулювання гіпоксією вентиляції легень не
відбуватиметься, доки альвеолярний РО2 не знизиться до
60 мм рт. ст. і менше.
Вплив гіпоксії на криву відповіді СО2
У випадку протилежного експерименту, коли альвеоляр-
ний РО2 є сталим, реакції відповіді на різноманітні кількості
СО2 визначені лінійними співвідношеннями (рис. 36-11).
Коли реакції-відповіді на СО2 мають різні значення РО2, то
нахил кривої відповіді змінюється: збільшується зі зни-
женням альвеолярного РО2. Іншими словами, гіпоксія робить
особу чутливішою до підвищення артеріального РСО2, хоча
622 / РОЗДІЛ 36
Рис. 36-10. Вентиляція легень для різних значень альвео-
лярного Ро2 за стійкого утримування РСо2на рівні 49, 44, або
37 мм рт. ст. (дані надані Іоезсґіке НН і (Зегіг КН).
Расо2, мм рт. ст.
Рис. 36-11. Графічне лінійне зображення (“віяло”) відповідей
СО2 у разі різних незмінних рівнів альвеолярного Ро2.
рівень альвеолярного Рсс>2, за якого криві на рис. 36-11
перетинаються, є незмінним. У нормі в осіб таке порогове
значення є нижчим від нормального альвеолярного Рсо , і
це свідчить, що у нормі є дуже мале, однак відчутне “змі-
щення СО2” для дихального центру.
Вплив І-Г на відповідь СО2
Стимулювальні впливи Н+ і СО2 на дихання виявляють-
ся, подібно як СО2 і О2, що повністю взаємовідносно. У
разі метаболічного ацидозу крива відповіді СО2 подібна
до кривих на рис. 36-11, за винятком того, що ці криві
зміщені ліворуч. Іншими словами, дихальне стимулювання
однаково виникає і за нижчих артеріальних рівнів РСО2.
Обчислено, що зміщення кривої відповіді СО2 на
0,8 мм рт. ст. ліворуч на кожний наномоль збільшуватиме
артеріальний вміст Н+. Понад 40% вентиляційної відповіді
на СО2 скасовуватиметься, якщо завадити збільшенню
артеріального Н+, створеного СО2. Як зазначено вище, реш-
та 60%, можливо, відповідають за вплив СО2 на концент-
рацію Н+ у спинномозковій або інтерстиційній рідині
головного мозку.
Затримка дихання
Дихання можна свідомо затримувати на деякий час, про-
те остаточно довільне регулювання обмежене і його не
беруть до уваги. Межа, коли дихання не можна більше
утримувати затриманим, називають точкою розриву. Вона
залежить від підвищення артеріального РС02 і зниження РО2.
Особи можуть затримувати дихання довше після видалення
каротидних клубочків. Дихання 100% киснем перед за-
тримкою дихання зумовлює підвищення альвеолярного
Р()2, завдяки чому точка розриву настає пізніше. Це одна-
ково справджується в разі гіпервентиляції повітрям кім-
нати, оскільки СО2 вивітрюється назовні й артеріальний
РСО2 є низьким на початку. Рефлекторно або завдяки меха-
нічним факторам розпочинається вплив на точку розриву,
тому особи, які затримують дихання якомога довше, а по-
тім вдихають газову суміш з низьким вмістом О2 і високим
СО2, можуть затримати дихання на додаткових 20 с або біль-
ше. Психологічні фактори також відіграють роль, і особи,
які можуть утримувати дихання довше, коли вони говорять,
своїм виступом свідчать про добрий стан, ніж коли ні.
Гормональні впливи на дихання
Вентиляція легень збільшується під час лютеїнової фази
місячного циклу, а також вагітності (див. Розділ 23). Експе-
рименти з тваринами свідчать, що це залежить від активу-
вання естрогенозалежних прогестеронових рецепторів у
гіпоталамусі. Однак фізіологічне значення такого збіль-
шення остаточно не з’ясоване.
НЕХІМІЧНІ ВПЛИВИ НА ДИХАННЯ
Реакції-відповіді, зумовлені рецепторами
дихальних шляхів та легень
Рецептори в дихальних шляхах та легенях іннервовані
мієліновими та безмієліновими волокнами блукаючого
нерва. Безмієлінові волокна утворені С-волокнами. Рецеп-
тори, іннервовані мієліновими волокнами, часто поділяють
на дві групи: рецептори, що повільно адаптуються, і ре-
цептори, що швидко адаптуються. Такий поділ підтверд-
жують подразнення, що приводять до тривалої або корот-
кочасної імпульсації у своїх аферентних нервових волок-
нах (табл. 36-2). Інша група рецепторів переважно скла-
дається із закінчень С-волокон; їх відповідно до локалі-
зації поділяють на легеневі та бронхіальні.
Зменшення тривалості вдихання, спричинюване вагус-
ною аферентною активністю (див. рис. 36-3), розпочина-
ють рецептори, що повільно адаптуються. Таке зменшення
РЕГУЛЮВАННЯ ДИХАННЯ / 623
Таблиця 36-2. Рецептори дихальних шляхів та легень1
Вагусна іннервація Тип Розташування Подразник Реакція
Мієлінові Повільно адаптуються Швидко адаптуються Серед гладких міоцитів дихальних шляхів (?) Серед епітеліоцитів дихальних шляхів Роздування легень Гіпервентиляція легень Екзо- та ендогенні речовини (наприклад, гістамін, простагландини) Зменшення тривалості вдихання Роздування Герінґ- Брайєра або рефлекторне спадання легені Бронходилатація Тахікардія Гіперпное Кашель Бронхоконстрикція Секреція слизу
Безмієлінові С-волокна Легеневі С-волокна Бронхіальні С-волокна Ближче до кровоносних судин Легенева гіпервентиляція Екзо- та ендогенні речовини (наприклад, капсаї- цин, брадикінін, серотонін) Апное з наступним прискореним диханням Бронхоконстрикція Брадикардія Гіпотензія Секреція слизу
1 Модифіковано та відтворено за дозволом з Вегдег Аф НогпЬеіп ТЕ: СопігоІ ої гезрігаііоп. Іп: ТехІЬоок ої Рґіувіоіоду, 21 зі есі.
УоІ. 2. Раїїоп НО еі аі [есіііогз]. Заипсіегз, 1989.
називають рефлексом Герінґа-Брайєра. Цей рефлекс -
збільшення тривалості видихання у разі роздування легень
і рефлекс випускання повітря Герінґа-Брайєра - зменшує
тривалість видихання, створену відповідним випусканням
повітря з легень.
Оскільки рецептори, що швидко адаптуються, подраз-
нювані хімічними агентами, такими як гістамін, то їх нази-
вають іритантними рецепторами. Активування цього
типу рецепторів у трахеї спричинює кашель, бронхоконст-
рикцію та секрецію слизу, а в легенях може зумовлювати
гіпервентиляцію.
Закінчення С-волокон, які розміщені близько біля леге-
невих судин, називають 5-рецепторами (від англ. )ихїасарі-
Пагу - юкстакапілярні). їх подразнює гіпервентиляція у
легенях, однак вони також реагують на внутрішньовенозне
або внутрішньокардіальне введення хімічних речовин,
таких як капсаїцин. Рефлекторною відповіддю є апное з
наступними швидким диханням, брадикардією та гіпотен-
зією (пульмональний хеморефлекс). Подібну відповідь
спричинюють рецептори в серці (рефлекс Бецольда-Ярі-
ша або вінцевий хеморефлекс; див. Розділ 31). Фізіоло-
гічна роль цього рефлексу остаточно не з’ясована, однак
він частково простежується під час патологічних станів,
таких як набряк легень або емболізація легеневих артерій,
і розвивається в разі вивільнення ендогенних речовин.
Кашель та чхання
Кашель розпочинається глибоким вдиханням і продов-
жується наступним форсованим видиханням проти закри-
того голосника. Це збільшує внутрішньоплевральний тиск
до 100 мм рт. ст. чи й більше. Потім голосник раптово від-
кривається, утворюючи своєрідний подібний до вибуху
викид повітря назовні зі швидкістю до 965 км/год. Чхання
є подібною експіраторною спробою з тривалим відкритим
голосником (див. Розділ 14). Ці рефлекси допомагають поз-
бутися іритантних речовин і утримувати повітроносні шля-
хи чистими.
Реакції-відповіді хворих з серцево-
легеневими трансплантатами
Трансплантація серця і легень завершила експеримен-
тальний етап і тепер це визнаний метод лікування для важ-
ких пульмонологічних хвороб і деяких інших станів. Зокре-
ма в осіб з трансплантатами праве передсердя реципієнта
приєднане до донорського серця; донорське серце не реін-
нервоване, так що серцебиття у спокої частіше. Донорську
трахею приєднують до реципієнтської саме до кіля трахеї,
і аферентні волокна від легень не відновлюються. Отже,
спостереження за хворими із серцево-легеневим транс-
плантантом дає змогу оцінити роль іннервації легень у
нормальній фізіології. Кашльові відповіді, зумовлені
подразненням, відбуваються в них нормально, бо трахея
іннервована, проте в разі подразнення дрібних повітряних
шляхів кашлю не буде. У хворих із серцево-легеневим
трансплантатом бронхи мають схильність бути дилатова-
ними більше, ніж у нормі. Крім того, у них простежується
нормальна кількість позіхань і зітхань, а це свідчить, що
ці дії не залежать від іннервації легень. Для хворих з
трансплататами характерна втрата рефлексів Герінга-Бра-
йєра, проте дихання у спокої відповідає нормі, отже, ці
рефлекси не відіграють важливої ролі у регулюванні дихан-
ня під час спокою.
Аферентні шляхи до вищих центрів
Больові та емоційні подразники впливають на дихання,
тому повинні бути аферентами від лімбічної системи та
624 / РОЗДІЛ 36
гіпоталамуса до дихальних нейронів стовбура мозку. Крім
того, рівне дихання не завжди є усвідомленим актом. Як
вдихання, так і видихання перебувають під вольовим конт-
ролем. Провідні шляхи вольового регулювання проходять
від нової кори до мотонейронів, що іннервують дихальні
м’язи, оминаючи нейрони довгастого мозку.
Оскільки вольовий та автономний контроль за диханням
відокремлені, то автономний контроль деколи перериваєть-
ся без втрати вольового. Клінічний стан, який виникає в
цьому разі, називають прокляттям Ондін. У німецькій
легенді Ондін була водяною німфою і мала підступного
коханця з простих смертних людей. Король водяних німф
жорстоко покарав коханця, забравши в нього всі автономні
функції. Унаслідок цього він міг бути живим лише в стані
бадьорості, пам’ятаючи про дихання, однак від цілковитого
виснаження заснув, і його дихання припинилось. Такий
стан мають хворі на бульбарний енцефаліт унаслідок поліо-
мієліту або декомпресії довгастого мозку.
Аферентні волокна від пропріорецепторів
Завдяки високоточним дослідженням з’ясовано, що
активні та пасивні рухи у суглобах стимулюють дихання,
оскільки імпульси в аферентних провідних шляхах від про-
пріорецепторів у м’язах, сухожилках та суглобах подраз-
нюють інспіраторні нейрони. Цей вплив, вірогідно, збіль-
шує вентиляцію легень під час фізичного навантаження.
Респіраторні складові вісцеральних
рефлексів
Пристосування дихання у разі блювання, ковтання та
кашлю описано у Розділах 14 і 26. Гальмування дихання
та закриття голосника під час цих дій не тільки попереджує
аспірацію їжі або блювотних мас у трахею, а й під час блю-
вання зупиняє рухи грудної клітки так, щоб скорочення
черевних м’язів збільшувало внутрішньочеревний тиск.
Подібно відбувається закривання голосника і гальмування
дихання під час вольового та мимовільного напруження.
Гикавка - це спазматичне скорочення діафрагми та
інших інспіраторних м’язів, що спричинюють вдихання,
під час якого голосник раптово закривається. Закриття
голосника відповідає за характерні відчуття і звук. Гикавка
буває в плоду під час внутрішньоутробного розвитку і може
виникнути упродовж усього життя людини. Її функція
остаточно не з’ясована. Більшість приступів короткотри-
валі і часто відповідають за затримку дихання або інші
критерії, що сприяють підвищенню РСО2. Тривала гикавка
може бути виснажливою.
Позіхання є своєрідним заразним дихальним актом,
фізіологічна основа та значення якого досі не відомі. Подіб-
но до гикавки, позіхання простежується у внутрішньо-
утробному періоді, а також властиве рибам, черепахам та
ссавцям. Невентильовані альвеоли схильні до колапсу, тому
вважають, що глибокі вдихання відкривають їх і поперед-
жують розвиток ателектазу. Позіхання також збільшує над-
ходження венозної крові до серця. Зітхання виконує подібні
функції. Крім того, теперішні експерименти доводять анти-
ателектичний вплив зітхання. Є також думка, що зітхання
- це невербальний сигнал для спілкування звірів у групі, і
дехто запевняє, що це ж справджується у людей, лише на
іншому рівні.
Респіраторні впливи подразнення
барорецепторів
Аферентні волокна від барорецепторів каротидного
синуса, дуги аорти, передсердь та шлуночків передають
імпульси як від респіраторних нейронів, так і від вазо-
моторних та кардіоінгібіторних нейронів у довгастому моз-
ку. Імпульси від них гальмують дихання, однак такий вплив
невеликий і фізіологічне значення його неважливе. Гіпер-
вентиляція під час шоку спричинена ацидозом унаслідок
подразнення хеморецепторів і вторинної гіпоксії завдяки
місцевому застою кровоплину (це відбувається без участі
барорецепторів). Активність інспіраторних нейронів впли-
ває на артеріальний тиск та серцебиття (див. Розділ 28 та
31), а активність у вазомоторній та кардіальній зонах у дов-
гастому мозку можуть лише незначно впливати на дихання.
Вплив сну
Дихання під час сну контрольоване не так чітко, як під
час неспання, і короткі періоди апное трапляються в нормі
у сплячих дорослих. Тоді формуються різні зміни венти-
ляції легень, спричинені гіпоксією. Якщо РС02 знижується
під час періоду неспання, то різноманітні подразники від
пропріорецепторів та зовнішнього середовища підтриму-
ють дихання, однак під час сну дія цих подразників послаб-
лена, і зниження РСО2 може спричинити апное. Під час
періоду сну ШРО дихання нерегулярне, і відповідь на СО2
дуже різноманітна.
Пристосувальні зміни дихання
у нормі та патології
37
ВСТУП
У цьому розділі описані пристосувальні зміни дихання
в разі навантаження, гіпоксії (у тім числі впливу підіймання
на височину), гіперкапнії та хвороб дихальної системи.
Подібно до компенсаторних пристосувальних механізмів
серцево-судинної системи, які реагують на зміни середо-
вища, та хворобах, що ілюструють інтегративну взаємодію
серцево-судинних механізмів регулювання (див. Розділ 33),
у пристосувальних змінах дихання чільне значення нале-
жить впливу респіраторних механізмів регулювання, опи-
саних у Розділах 34-36.
ВПЛИВ НАВАНТАЖЕННЯ
Численні серцево-судинні та дихальні механізми повин-
ні інтегрувати свою діяльність, коли під час навантаження
виникає потреба в О2 для активних тканин, а надлишок
СО2 і тепла виводиться з організму. Зміни судин збіль-
шують кровоплин у м’язах, тоді як у решті частин організ-
му утримується адекватний кровообіг (див. Розділ 33). Крім
того, додатково збільшується надходження О2 з крові у
м’язи, що працюють за умов навантаження, та вентиляція,
що забезпечує виведення деякої кількості тепла і надлишку
со2.
Зміни у вентиляції
Під час навантаження кількість О2, що потрапляє у кров
з легень, збільшується, оскільки О2 захоплює кожна оди-
ниця крові, і легеневий кровоплин за хвилину збільшу-
ються. Зниження РО2 у крові, що протікає через легеневі
капіляри, з 40 до 25 мм рт. ст. або менше, зумовлює збіль-
шення альвеоло-капілярного градієнта РО2, і більше О2
потрапляє у кров. Одночасно збільшується швидкість
протікання крові з 5,5 до 20-35 л/хв і більше. Внаслідок
цього загальна кількість О2, що потрапляє у кров, збіль-
шується від 250 мл/хв у спокої до понад 4000 мл/хв. Кіль-
кість виведеного СО2 з кожної одиниці крові зростає з 200
до 8000 мл/хв. Збільшення поглинання О2 пропорційне до
робочого навантаження найвищого ступеня. З цього мо-
менту рівень споживання О2 припиняється, а вміст лактату
крові збільшується (рис. 37-1). Лактат надходить з м’язів,
у яких аеробний ресинтез запасання енергії не може
втримати темп їхньої утилізації, і кисневий борг енергії
починає збільшуватися (див. Розділ 3).
На рис. 37-2 показане раптове збільшення вентиляції з
початком навантаження, що настає після короткої паузи, з
поступовішим збільшенням у майбутньому. У випадку
середнього навантаження збільшується глибина дихання,
що супроводжується збільшенням частоти дихання, коли
навантаження стає енергійнішим. Припинення наванта-
ження раптово зменшує вентиляцію після короткої паузи
до такої, яка була перед навантаженням. Уважають, що рап-
тове збільшення на початку навантаження виникає внас-
лідок психічного подразника та аферентних імпульсів від
пропріорецепторів м’язів, зв’язок та суглобів. Також визна-
ють, що поступовіше збільшення буває у випадку гумо-
рального впливу, коли артеріальний рН, Рсс>2 і Р02 є сталими
під час середнього навантаження. Збільшення вентиляції
пропорційне до збільшення споживання О2, однак меха-
нізми, відповідальні за стимулювання дихання, все ще є
темою для обговорення. Збільшення температури тіла
також може впливати на дихання. Як зазначено у Розділі
36, навантаження збільшує рівень К+ у плазмі, а таке
збільшення може стимулювати периферійні хеморецепто-
Рис. 37-1. Взаємозв’язок між робочим навантаженням, рівнем
лактату у крові і поглинанням О2.1-\/І - збільшення робочого
навантаження завдяки збільшенню швидкості та нахилу рухо-
мої доріжки, на якій виконується навантаження (відтворено
за дозволом з МйсїіеІІ ЛЧ, ВІотдуізі 6: МахітаІ охудеп ир-
іаке. N ЕпдІ 3 Месі 1971 ;284:1018).
41
367-2
626 / РОЗДІЛ 37
Рис. 37-2. Схематичне зображення змін вентиляції у разі на-
вантаження.
ри. Крім того, це може зумовлюватись збільшенням чут-
ливості дихального центру до СО2 або тим, що дихальні
зміни в артеріальному Р(()7 збільшуються внаслідок збіль-
шення середнього артеріального РСС)2 і СО2 стає відпові-
дальним за збільшення вентиляції. Також деяку роль віді-
грає О2 незважаючи на те, що артеріальний Р()2 не знижу-
ється. Ще під час виконання роботи збільшення вентиляції
в разі дихання 100% О2 на 10-20% менше, ніж у випадку
дихання повітрям (рис. 37-3). Тому постійно виявляється
вплив численних різноманітних факторів, що комбінують-
ся для збільшення вентиляції під час помірного наванта-
ження.
Коли навантаження стає енергійнішим, то буферування
молочної кислоти кількісно збільшується, тому вивільня-
ється більша кількість СО2, і це у майбутньому збільшує
вентиляцію. Відповідь на поступове навантаження пока-
зано на рис. 37-4. Зі збільшенням утворення кислоти поси-
люється вентиляція, а утворення СО2 є пропорційним, тому
альвеолярні та артеріальні зміни СО2 порівняно малі (ізо-
капнічне буферування). Оскільки є гіпервентиляція, то
альвеолярний РС() підвищується. З майбутнім нагромад-
женням молочної кислот и збільшення вентиляції виперед-
Рис. 37-3. Вплив 100% О2 на вентиляцію під час тренування
за допомогою велоергометра з різним навантаженням (відтво-
рено за дозволом з Азігапсі Р-О: ТНе гезрігаіогу асіміу іп тап
ехрозесі іо ріоіопдесі Ьурохіа Асіа РЬузіоІ Зсапсі1954,30:343)
жує продукування СО2, і альвеолярний Р((>2 знижується,
як і артеріальний РС()2. Зниження артеріального Рс()2 забез-
печує дихальну компенсацію (див. Розділ 39) для метабо-
лічного ацидозу, створеного доданою молочною кислотою.
Додаткове збільшення вентиляції внаслідок ацидозу спри-
чинюють каротидні клубочки, бо в разі їхнього видалення
такого не простежується.
Частота дихання після навантаження не перевищу<
базального рівня до відновлення кисневого боргу. Це може
тривати до 90 хв. Подразником для вентиляції після наван-
таження є не артеріальний Рсо який у нормі чи знижений,
або артеріальний Р(()2, який є в нормі або підвищений, а
підвищена артеріальна концентрація Н+ внаслідок лакто-
ацидемії. Розмір кисневого боргу кількісно перевищує
базальне споживання О2 від закінчення напруження в разі
повернення до базального рівня перед навантаженням. Під
час відшкодування кисневого боргу простежується неве-
лике збільшення концентрації О2 у міоглобіні м’язів. Від-
бувається ресинтезування АТФ та фосфорилкреатину, і
молочна кислота виводиться. Близько 80% молочної кис-
лоти перетворюється в глікоген і 20% метаболізується у
СО2 і Н2О.
Продуктивність роботи, Вт
Рис. 37-4. Зміни в альвеолярному РС02, альвеолярному Ро ,
вентиляції (\/0 ), утворення СО2 (\/СО2),2споживання О2 (V
артеріального НСО3~ й артеріального рН у випадку поступо-
вого збільшення навантаження на велоергометрі у нормаль-
ного дорослого чоловіка (відтворено за дозволом з УЛ/аззег-
гпап К, \Л/Нірр В3, СазаЬигі К Резрігаіогу сопігої сіигіпд ехег-
сізе Іп НапсІЬоок ої РКузіоІоду Зесііоп 3, ТЬе Резрігаіогу
Зузіет \/оІ II, рагї 2 Різйтап АР [есіііог]. Атегісап Рїіузіоіоді-
саі Зосіеіу, 1986)
ПРИСТОСУВАЛЬНІ ЗМІНИ ДИХАННЯ У НОРМІ ТА ПАТОЛОГІЇ / 627
Оскільки під час енергійних навантажень утворюється
надлишкове СО2 внаслідок буферування молочної кислоти,
то ДК збільшується до 1,5-2,0. Після навантаження, коли
кисневий борг відшкодовано, ДК зменшується до 0,5 або
менше.
Зміни у тканинах
Під час навантаження максимальне поглинання О2
обмежене максимальним рівнем транспортування О2 до
мітохондрій м’язів, що навантажуються. Крім того, таке
обмеження у нормі не є залежним від недостатності погли-
нання О2 легенями, і гемоглобін артеріальної крові є наси-
ченим навіть під час найважчого навантаження.
У випадку навантаження м’язи, що скорочуються, вико-
ристовують більше О2, тому тканинний РО2 і РО2 венозної
крові м’язів, що є під навантаженням, знижуються майже
до нуля. Більше О2 дифундує з крові, і Р()2 крові, що поста-
чає м’язи, знижується, тому більше О2 вивільняється від
оксигемоглобіну. Оскільки, капіляри м’язів, що скорочу-
ються, дилатують, і численні капіляри, що попередньо були
закриті, відкриваються, то середня відстань від кров’яного
русла до клітини тканини значно зменшується. Це полег-
шує рух О2 з крові до клітин. Крива дисоціації оксигемо-
глобіну закруглюється при РО2, нижчому 60 мм рт. ст., і
порівняно велика кількість О2 забезпечує кожне зниження
1 мм рт. ст. у Р(>2 (див. рис. 35-2). Постачання додаткового
О2 є наслідком нагромадження СО^ і підвищення темпера-
тури в активних тканинах: можливо, тому збільшується 2,3-
ДФГ в еритроцитах, і крива дисоціації зміщується пра-
воруч (див. рис. 35-3). Кінцевий ефект - утричі збільшу-
ється вилучення О2 з кожної одиниці крові. З моменту
такого збільшення, що супроводжується тридцятиразовим
або й більшим посиленням кровопостачання, рівень мета-
болізму у м’язах збільшується у 100 разів під час наван-
таження (див. Розділ 3).
Втома
Втома - це незрозумілий феномен, який є наслідком
інтенсивного навантаження або розумових зусиль. Крім
того, це симптом багатьох різноманітних хвороб. Під час
навантаження виникненню втоми сприяють ацидоз та інші
фактори. У цьому разі навантаження виконувати важко,
простежується суб’єктивна втрата сили, що відповідає
рівню поглинання О2, а не реальній роботі, вираженій в
кгм/хв. Перешкоди для імпульсів у аферентних шляхах
від пропріорецепторів м’язів створюють відчуття “пере-
втоми”. Відповідальними за відчуття втоми можуть бути
впливи ацидозу на головний мозок. Тривалі навантаження
створюють гіпоглікемію у нормальних осіб, однак запобі-
гання гіпоглікемії не впливає на витривалість або відтер-
мінування появи виснаження. З іншого боку, у людей є
співвідношення між виснаженням і ступенем вичерпання
глікогену з м’язів, що називають біопсією м’язів. Витри-
мані м’язові скорочення стають болючими, оскільки м’язи
ішемічні, і нагромаджується речовина, що подразнює
больові закінчення (Р-фактор; див. Розділ 7). Проте рит-
мічні скорочення не є болючими, бо Р-фактор вимивається
назовні. Ригідність м’язів може розвиватись унаслідок
нагромадження інтерстиційної рідини у м’язах під час
напруження.
Розсіювання тепла під час навантаження описане в Роз-
ділі 33 і зображене на рис. 33-4, а зміни у кислотно-лужній
рівновазі, поєднані з диханням, - у Розділі 39.
ГІПОКСІЯ
Гіпоксія - це недостатність О2 в тканинах. Хоча пра-
вильніше використовувати термін аноксія, однак зрідка
О2 повністю виходить з тканини.
Традиційно гіпоксію поділяють на чотири типи. Вико-
ристовують численні інші класифікації, проте така система
все ж є важливою та вигідною, оскільки визначення тер-
мінів зрозуміліше. Розрізняють гіпоксичну гіпоксію (ано-
ксичну аноксію), за якої РО2 артеріальної крові знижений;
анемічну гіпоксію, за якої артеріальний Р()2 є нормальним,
проте кількість гемоглобіну для транспортування О2 змен-
шена; застійну, або ішемічну, гіпоксію, за якої крово-
постачання тканин є таким низьким, що адекватна кількість
О2 не доходить до них, незважаючи на нормальні Р()2 і кон-
центрації гемоглобіну; гістотоксичну (тканинну) гіпо-
ксію, за якої кількість О2, що надходить до тканин, є
адекватною, та оскільки впливає токсичний агент, то клі-
тини тканин не можуть використовувати О^, що надходить
до них.
Вплив гіпоксії
Вплив застійної гіпоксії залежить від ураження тканини.
У випадку гіпоксичної гіпоксії та інших форм ґенералізо-
ваної гіпоксії головний мозок уражений першим. Раптове
зниження на 20 мм рт. ст. РО2 повітря, яке вдихають, що,
наприклад, відбувається, коли тиск у кабіні літака раптово
знижується під час польоту на висоті 16 000 м, спричинює
втрату свідомості через 10-20 с (рис. 37-5) і смерть - через
4-5 хв. Менш важка гіпоксія зумовлює різноманітні пору-
шення психіки, не подібні до тих, що виникають під впли-
вом алкоголю: ослаблена розсудливість, сонливість, при-
туплення больової чутливості, перезбудження (ейфорія),
дезорієнтація, втрата відчуття часу і біль голови. До інших
симптомів належать анорексія, нудота, блювання, тахі-
кардія і, якщо гіпоксія є важкою, гіпертензія. Швидкість
вентиляції збільшується пропорційно до важкості гіпоксії
у каротидних хеморецепторних клітинах.
Стимулювання дихання
Диспное- стан, який супроводжується утрудненим або
вимушеним диханням, у разі прискорення дихання. Гіпер-
капнія - загальний термін для означення збільшення
частоти або глибини дихання без урахування суб’єктивних
відчуттів хворого. Тахіпное- швидке, поверхневе дихання.
У нормальних осіб дихання є переважно автоматичним
процесом до моменту, доки вентиляція подвоїться, і дихан-
ня стає неспокійним, якщо вентиляція збільшується в три
або чотири рази. Внаслідок відсутності необхідного рівня
вентиляції дихання стає неспокійним і також з’являється
залежність від різноманітних інших факторів. Гіперкапнія
і гіпоксія дещо менше спричинюють диспное. Сучасна
гіпотеза твердить, що диспное виникає, коли є незбіжність
між вхідною аферентною інформацією та вихідними
моторними сигналами з головного мозку до дихальних м’я-
628 / РОЗДІЛ 37
Рис. 37-5. Тривалість свідомості у разі раптової експозиції
до навколишнього тиску на різних висотах. Час кровообігу
від легень до головного мозку -10с.
зів, однак важко це довести. Додатковим фактором стають
зусилля, що виконуються під час руху повітря у легені та з
легень (робота під час дихання). Наприклад, у разі астми з
бронхоконстрикцією, особливо під час вдихання, долання
збільшеного повітряного опору є недостатньою роботою
для дихання.
Ціаноз
У випадку зниженого рівня гемоглобіну колір тканин
змінюється. Таку темно-синювату зміну називають ціано-
зом, вона виявляється, коли концентрація гемоглобіну
крові у капілярах зменшується до 5 г/дл. Поява ціанозу
залежить від загальної кількості гемоглобіну в крові, сту-
пеня ненасиченості гемоглобіну і стану кровообігу в капі-
лярах.
Ціаноз найпростіше побачити на нігтьових ложах та
слизових оболонках і в місцях, де шкіра є тоненькою -
вушних раковинах, губах та пальцях. Ціаноз не простежу-
ється в разі анемічної гіпоксії, бо загальний вміст гемогло-
біну низький; у випадку отруєння чадним газом, оскільки
забарвлення гемоглобіну набуває темно-вишневого кольо-
ру завдяки карбоксигемоглобіну (див. нижче); у разі гісто-
токсичної гіпоксії, оскільки склад газів крові в нормі. Зміна
кольору шкіри та слизових оболонок, що подібна до ціа-
нозу, виникає у випадку високого рівня метгемоглобіну, що
циркулює у крові (див. Розділ 27).
ГІПОКСИЧНА ГІПОКСІЯ
Гіпоксична гіпоксія - це проблема багатьох осіб, що
перебувають на значній висоті, а також ускладнення пнев-
монії та різноманітних інших захворювань дихальної сис-
теми.
Вплив зниженого барометричного тиску
Склад повітря є однаковим, проте загальний баромет-
ричний тиск знижується зі збільшенням висоти (рис. 37-
6). Саме тому РО2 також знижується. На висоті 3000 м над
рівнем моря альвеолярний РО2 близько 60 мм рт. ст., і цього
достатньо для гіпоксичного подразнення хеморецепторів
та збільшення вентиляції. У разі підіймання вище альвео-
лярний РО2 знижується повільніше, альвеолярний РСО2 зни-
жується незначно, оскільки гіпервентиляція внаслідок зни-
ження артеріального РСО2 створює дихальний алкалоз.
Гіпоксичні симптоми в разі дихання
повітрям
У випадку дії численних компенсаторних механізмів для
збільшення толерантності до висоти (акліматизації)
потрібний час, бо в неаклімітизованих осіб симптоми ура-
ження психіки, такі як роздратованість, з’являються на
висоті 3700 м. На рівні 5500 м гіпоксичні симптоми стають
важчими, а на висоті понад 6100 м свідомість у більшості
випадків втрачена (рис. 37-7).
Гіпоксичні симптоми в разі дихання киснем
Загальний атмосферний тиск стає фактором обмеження
для толеранції висоти, якщо дихають 100% О2. Парціаль-
ний тиск водяної пари в альвеолярному повітрі є незмінним
- 47 мм рт. ст., і якщо СО2 у нормі становить 40 мм рт. ст.,
то нижній барометричний тиск, за якого альвеолярний РО2
у нормі 100 мм рт. ст., може стати 187 мм рт. ст., що відпо-
відає тиску на рівні 10 400 м. Вище збільшена вентиляція,
що настала внаслідок зниження альвеолярного РО2, змен-
шує РСО2 незначно.
Проте максимальний альвеолярний РО2, що може бути
досягнутий у разі дихання 100% О2 за навколишнього баро-
метричного тиску 100 мм рт. ст. на висоті 13 700 м стано-
вить 40 мм рт. ст.
На висоті 14 000 м людина непритомніє, не зважаючи
на введення 100% О2 (див. рис. 37-5). Однак штучну атмо-
сферу можна створити навколо особи у скафандрі або кабі-
ні з відповідним тиском і забезпеченням О2 та системою
виведення СО2, тоді можливий підйом на будь-яку висоту
та життя у вакуумі в міжпланетному просторі.
На висоті 19 200 м барометричний тиск становить
47 мм рт. ст. За такого тиску (або нижче) рідини організму
“закипають” при температурі тіла: утворюються бульбаш-
ки газу внаслідок зниженої розчинності газів. Цей погляд
здебільшого академічний, бо будь-яка особа, піддана впли-
ву низького тиску, могла б померти від гіпоксії перш ніж
смерть спричинили б бульбашки у кров’яному руслі.
ПРИСТОСУВАЛЬНІ ЗМІНИ ДИХАННЯ У НОРМІ ТА ПАТОЛОГІЇ / 629
10 400 м)
Рис. 37-6. Склад альвеолярного повітря в осіб, що дихають повітрям (0-6100 м) і 100% О2 (6100-13 700 м). Мінімальний
альвеолярний Р02, який неакліматизована особа може витримувати без втрати свідомості, - 35-40 мм рт. ст. Зверніть увагу,
що зі збільшенням висоти альвеолярний РС02 знижується, оскільки гіпервентиляція є наслідком гіпоксичного стимулювання
каротидних та аортальних хеморецепторів. Зниження барометричного тиску зі збільшенням висоти не є лінійним, оскільки
повітря стискальне.
0 1000 2000 3000 4000 5000 6000 * м
І----—І—1 11 'і
0 5000 10 000 15 000 20 000 ФУ™
Висота над рівнем моря
Рис. 37-7. Гострі ефекти гіпоксії в осіб, що дихають повітрям
на різній висоті.
Відтерміновані ефекти значної висоти
Коли вперше люди приїжджають у високогір’я, то в
багатьох розвивається короткочасна гірська хвороба. Такий
синдром настає через 8-24 год після приїзду і триває чоти-
ри-вісім днів. Він супроводжується болем голови, роздра-
тованістю, безсонням, задишкою, нудотою та блюванням.
Причини, що спричинюють такий симптомокомплекс,
остаточно не з’ясовані, однак його появу пов’язують з
набряком мозку. Низький Р02 на височині спричинює арте-
ріолярну дилатацію, і якщо церебральне авторегулювання
не компенсоване, то підвищується капілярний тиск, який
сприяє збільшенню трансудації рідини у тканини головного
мозку.
Особи, у яких не виникає гірської хвороби, мають діу-
рез у нормі на височині, а зменшення об’єму сечі харак-
терне для осіб, у яких розвивається такий стан. Крім того,
лікування діуретиками, відмінними від ацетазоламіду, не
запобігає гірській хворобі. Симптоми послабляться, якщо
алкалоз зменшиться внаслідок лікування ацетазоламідом
або якщо набряк мозку зменшити призначенням великих
доз глюкокортикоїдів.
Набряк легень на височині є серйозною формою гірсь-
кої хвороби. Схильність до такого стану властива особам,
які піднімаються швидко на висоту 2500 м і займаються
важкою фізичною працею у перші три дні після приїзду.
630 / РОЗДІЛ 37
Набряк легень може виникнути і в осіб, акліматизованих
до височини, однак які провели два або більше тижні на
рівні моря і потім знову піднялися на височину. Він трап-
ляється, якщо нема серцево-судинних або легеневих захво-
рювань, і супроводжується вираженою легеневою гіпер-
тензією, проте ліві персдсердні тиски у нормі. Рідина, що
утворюється в разі набряку, належить до типу рідин з доб-
рою проникністю, високим вмістом білка та формених еле-
ментів крові. Можна припустити таке: ця рідина утворю-
ється тому, що не всі легеневі артерії мають достатньо
гладких м’язів для скорочення у відповідь на гіпоксію, і в
капілярах, що забезпечують такі артерії, загальне підви-
щення легеневого артеріального тиску спричинює збіль-
шення капілярного тиску, який порушує ЦІЛІСНІСТЬ ЇХНІХ
стінок (стрес-недостатність). В інших випадках блокатор
Са2 -каналів ніфідспін, який знижує легеневий артеріаль-
ний тиск, є корисним для лікування та попередження такого
стану. На набряк легень позитивно впливає спокій та ліку-
вання О9, і переважно він не розвивається в осіб, які підні-
маються на височину поступово й уникають фізичного
навантаження у перші декілька днів перебування на висо-
когір’ї.
Акліматизація
Акліматизація до височини настає внаслідок взаємодії
різноманітних компенсаторних механізмів. Дихальний
алкалоз утворюється завдяки гіпервентиляційним зміщен-
ням кривої дисоціації оксигемоглобіну ліворуч з одночас-
ним супутнім збільшенням кількості 2,3-ДФГ в еритроци-
тах, що зумовлює зменшення афінності О2 до гемоглобіну.
Кінцевий ефект полягає у зниженні Р5() (див. Розділ 35).
Зменшення афінності О2 сприяє доступності О2 для тканин.
Крім того, підвищення Р5() є обмеженим, бо якщо артеріаль-
ний Р(>2 відчутно підвищується, то зменшення афінності
також перешкоджає поглинанню О2 гемоглобіном у
легенях.
Початкова відповідь вентиляції у разі підіймання на
висоту є порівняно невеликою, оскільки алкалоз нейтра-
лізує стимулювальний ефект гіпоксії. Однак стійке збіль-
шення вентиляції настає через чотири дні (рис. 37-8).
Активне транспортування Н+ у СМР або розвиток лак-
тоацидозу у головному мозку зумовлює зменшення рН у
СМР, що збільшує реакцію на гіпоксію. Після чотирьох
днів вентиляційна відповідь починає поступово сповільню-
ватись, проте потрібні роки для перебування на височинах
для зниження до початкового рівня. Супутньою до такого
зниження є поступова десенситизація на стимулювальні
впливи гіпоксії.
З підійманням на височину швидко збільшується сек-
реція еритропоетину (див. Розділ 24), а потім через наступ-
ні чотири дні незначно зменшується, коли вентиляційна
відповідь посилюється й артеріальний Рсь підвищується.
Збільшення кількості еритроцитів, що циркулюють, зумов-
лене еритропоетином, розпочинається через два-три дні і
триває стільки, скільки особа перебуває на височині.
У тканинах також відбуваються пристосувальні зміни.
Кількість мітохондрій, які є місцем оксидативних реакцій,
збільшується, і рівень міоглобіну підвищується (див. Розділ
35), що сприяє рухові О2 у тканини. Одночасно в тканинах
збільшується вміст цитохромоксидази.
0 1000 2000 3000 4000 5000 6000
Висота, м
Рис. 37-8. Вплив акліматизації на вентиляційні реакції на різ-
них висотах УеЛ/02- вентиляційна рівновага - співвідношення
експіраторного хвилинного об’єму (\/Е) до споживання О2 (\/0 )
(відтворено за дозволом з Ьепїапі С, Зиіііуап К- Асіаріаііоп іо
ЬідЬ аііііиіисіе N ЕпдІ Ц Месі 1971 ;284‘1298)
Ефективність процесу акліматизації визначає факт, що
в Андах та Гімалаях довгочасне людське житло розташо-
ване на висоті 5500 м. Тубільці, що проживають у таких
поселеннях, мають бочкоподібну грудну клітку і виражену
поліцитемію. Значення альвеолярного Ро^ у них є низь-
кими, проте інші показники нормальні.
Хвороби внаслідок гіпоксичної гіпоксії
Гіпоксична гіпоксія є найпоширенішою формою гіпо-
ксії, яку фіксують у клініці. Хвороби, що спричинюють її,
можна класифікувати як перші, за яких настає недостат-
ність газообмінного апарату (наприклад, вроджені вади
серця, у яких великі кількості крові потрапляють з венозної
частини кровообігу відразу в артеріальну, минаючи мале
коло кровообігу), і другі, в яких простежується вентиля-
ційна недостатність (порушення нагнітальної функції
дихальної системи, табл. 37-1). Легенева недостатність
трапляється, коли за таких станів, як легеневий фіброз,
виникає блокада альвеолярно-капілярного бар’єру і пору-
шення співвідношення між вентиляцією та перфузією. Вен-
тиляційна недостатність може бути зумовлена слабістю
дихальних м’язів у станах, коли робота з виконання дихан-
ня збільшується, або в разі різноманітних механічних пору-
Таблиця 37-1. Порушення, що спричинюють гіпоксичну
гіпоксію
Легенева недостатність (недостатність газообміну)
Легеневий фіброз
Дисбаланс між вентиляцією-перфузією
Шунт
Вентиляційна недостатність (порушення нагнітальної
функції*)
Втома
Механічні порушення
Депресія респіраторних центрів у головному мозку
ПРИСТОСУВАЛЬНІ ЗМІНИ ДИХАННЯ У НОРМІ ТА ПАТОЛОГІЇ / 631
шень, наприклад пневмотораксу або бронхіальної недос-
татності, що обмежує вентиляцію. Також її можуть спричи-
нювати аномалії нейрональних механізмів, що регулюють
дихання, такі як депресія дихальних нейронів у довгастому
мозку морфієм та іншими ліками.
Порушення співвідношення між
вентиляцією та перфузією
Відновлення порушення між співвідношенням вентиля-
ція-перфузія, що є найчастішою причиною гіпоксичної
гіпоксії, головне завдання у клінічній практиці. Фізіологічні
впливи на порушення вентиляційно-перфузійної рівноваги
та їхня роль у створенні змін альвеолярного газу внаслідок
земного тяжіння описані у Розділі 34.
У разі розвитку хвороби, яка заважає вентиляції в деяких
альвеолах, співвідношення вентиляція-кровоплин у різних
частинах легень визначене відхиленням системного арте-
ріального РОг Якщо невентильовані альвеоли перфузувати,
то у невентильованій, але перфузованій частині легені
виникає ефект шунта справа наліво: скидання неоксиге-
нованої крові у ліву половину серця. Переважно поширені
менші ступені порушень вентиляційно-перфузійного спів-
відношення. У прикладі, що показаний на рис. 37-9, невен-
тильовані альвеоли (В) мають низький РО2, тоді як надмірно
вентильовані (А) - високий альвеолярний РО2. Крім того,
ненасичений гемоглобін крові, що надходить з В, не є пов-
ністю компенсований більшим насиченням крові, що над-
ходить з А, оскільки гемоглобін у нормі майже повністю
насичується у легенях. Підвищення альвеолярного РО2
додає лише трошки більше О2 до гемоглобіну, ніж той зви-
чайно може переносити. Як наслідок, артеріальна кров
ненасичена. З іншого боку, вміст СО^ в артеріальній крові
здебільшого нормальний у тих випадках, коли надлишкова
втрата СО2 у надмірно вентильованих ділянках може врів-
новажувати зменшені втрати у невентильованих ділянках.
Венозно-артеріальні шунти
Коли серцево-судинні вади, такі як міжпередсердний
дефект перегородки, дають змогу великій кількості неок-
сигенованої крові обходити легеневі капіляри і розводити
оксигеновану кров у системних артеріях (шунт справа
наліво), то розвивається хронічна гіпоксична гіпоксія і
ціаноз (ціанотична застійна хвороба серця). Уведення
100% О2 збільшує вміст О2 в альвеолярному повітрі,
А В А + В А В А + В
Альвеолярна вентиляція, л/хв 2,0 2,0 4,0 Альвеолярна вентиляція, л/хв 3,2 0,8 4,0
Легеневий кровоплин, л/хв 2,5 2,5 5,0 Легеневий кровоплин, л/хв 2,5 2,5 5,0
Відношення вентиляція-кровоплин 0,8 0,8 0,8 Відношення вентиляція-кровоплин 1,3 0,3 0,8
Змішане венозне насичення О2, % 75,0 75,0 75,0 Змішане венозне насичення О2, % 75,0 75,0 75,0
Артеріальне насичення О2, % 97,4 97,4 97,4 Артеріальне насичення О2, % 98,2 91,7 95,0
Змішаний венозний тиск О2, мм рт. ст. 40,0 40,0 40,0 Змішаний венозний тиск О2, мм рт. ст. 40,0 40,0 40,0
Альвеолярний тиск О2, мм рт. ст. 104,0 104,0 104,0 Альвеолярний тиск О2, мм рт. ст. 116,0 66,0 106,0
Артеріальний тиск О2, мм рт. ст. 104,0 104,0 104,0 Артеріальний тиск О2, мм рт. ст. 116,0 66,0 84,0
Рис. 37-9. Ліворуч: “ідеальний” взаємозв’язок між вентиляцією і кровоплином Праворуч: некомпенсовані неоднорідна
вентиляція й однорідний кровоплин \/А- альвеолярна вентиляція; ХОД - хвилинний об’єм дихання (відтворено за дозволом
з Сотгое ЛЧ Чг еі аі: Тїіе Іипд. СІіпісаІ Рііузіоіоду апсі Риїтопагу Рипсііоп Тезіз, 2псІ есі. ¥еаг Воок, 1962).
632 / РОЗДІЛ 37
послаблює дифузію або порушує вентиляційно-перфузійну
рівновагу (короткочасна перфузія у загально невентильо-
ваних сегментах), збільшуючи вміст О2 у крові, що вихо-
дить з легень. Крім того, у хворих з венозно-артеріальним
шунтами і нормальними легенями будь-який корисний
вплив 100% О2 є незначним і зумовлений єдиним збіль-
шенням кількості нерозчиненого О2 у крові.
Колапс легень
У випадку, коли бронхи або бронхіоли обструктують,
то газ в альвеолах поза обструкцією абсорбується, і сегмент
легені колабує. Колапс альвеол називають ателектазом.
Ділянка ателектазу може мати розміри від невеликого клап-
тика до цілої легені. Частина крові відходить від ділянки
колапсу до ліпше вентильованих частин легені, і це змен-
шує відхилення РО2.
Коли велика частина легені колабує одночасно, то поміт-
но зменшується об’єм легені. Тому внутрішньоплевраль-
ний тиск стає негативнішим і тягне середостіння, яке у
людей є достатньо рухомою структурою, до ураженої час-
тини.
Іншою причиною ателектазу є відсутність або інакти-
вація сурфактанту - речовини, що зменшує поверхневий
натяг і в нормі міститься у тоненькому прошарку рідини,
яка вистеляє альвеоли (див. Розділ 34). Таке порушення є
головною причиною недостатності легень у разі їхнього
розширення у нормі під час народження. Колапс легень
може також бути наслідком наявності у плевральному прос-
торі повітря (пневмоторакс), тканинної рідини (гідро-
торакс, хілоторакс) або крові (гемоторакс).
Пневмоторакс
Якщо повітря надходить у плевральний простір через
розрив легень або отвір у грудній стінці, то легеня на ура-
женому боці колабує внаслідок еластичної тяги. З моменту,
коли внутрішньоплевральний тиск на ураженій стороні стає
знову атмосферним, середостіння зміщується у нормаль-
не положення. Якщо взаємозв’язок між плевральним прос-
тором та зовнішнім середовищем відкритий (відкритий,
або аспіраційний, пневмоторакс) то більше повітря ру-
хається у плевральний простір або від нього кожного разу,
коли хворий вдихає. Якщо ж отвір великий, то опір для
потоку повітря у плевральний простір менший, ніж опір
для потоку повітря в інтактну легеню, і невелика кількість
повітря потрапляє у легені. Під час вдихання середостіння
зміщується у неуражений бік, вигинаючи великі судини,
зміщуючи серце й утруднюючи його діастолічне наповнення
під час видихання. Також відбувається значне стимулювання
дихання через гіпоксію, гіперкапнію й активування ле-
геневих рецепторів спадіння. Дихальний дистрес є важким.
У разі якщо над отвором у легенях або грудній клітці є
тканина, що її закриває, то вона працює як рухомий клапан,
що перешкоджає руху повітря: входженню під час вди-
хання, і затримує його вихід під час видихання, і тиск у
плевральному просторі підвищується понад атмосферний
(пневмоторакс напруження). Якщо гіпоксичний подраз-
ник для дихання спричинює глибші зусилля під час
вдихання, які у подальшому збільшують тиск у плевральній
порожнині, то відхиляються великі вени і виникає гіпоксія
та шок. Внутрішньоплевральний тиск у таких випадках
може збільшуватись до 20-30 мм рт. ст. Периферійні вени
стають розтягнутими, розвивається інтенсивний ціаноз, і
стан стає потенційно небезпечним, якщо пневмоторакс не
декомпресувати виведенням повітря.
З іншого боку, якщо отвір, через який повітря потрапляє
у плевральний простір, герметично закритий (закритий
пневмоторакс), то дихальний дистрес не є великим, бо з
кожним вдиханням повітря плине в легені на неуражену
сторону швидше, ніж у плевральний простір; оскільки
судинна резистентність збільшується у колабованій легені,
то кров відводиться до іншої легені. Отже, якщо пневмо-
торакс є не дуже великим, то він не спричинить важкої
гіпоксії.
Повітря у закритому пневмотораксі абсорбується. З того
часу як воно дорівнює атмосферному тиску, його загаль-
ний тиск, Ро2 і є ВИЩИМ, ніж у венозній крові (порівняйте
значення для повітря і венозної крові на рис. 34-18). Газ
дифундує вниз за такими градієнтами у крові і після одного-
двох тижнів зникає.
Астма
Астму характеризує епізодичне або хронічне дихання з
присвистом, кашлем і відчуттям стискання у грудях унаслі-
док бронхоконстрикції. Захворювання на астму та смерт-
ність від неї збільшується, проте її фундаментальна причи-
на остаточно не з’ясована, незважаючи на інтенсивні до-
слідження. У разі астми виникають три порушення: повіт-
ряна обструкція, яку найважче унормувати; запалення
дихальних шляхів і гіперчутливість до різних подразників.
Давно визначений зв’язок астми з алергією; рівень І§Е у
плазмі часто підвищений. Білки, що вивільняються з еози-
нофілів унаслідок запальних реакцій, можуть уражувати
епітелій дихальних шляхів і відповідають за гіперчут-
ливість. Лейкотрієни (див. Розділ 17), що вивільняються з
еозинофілів і мастоцитів, зумовлюють бронхоконстрикцію.
Численні інші аміни, нейропептиди, хемокіни та інтерлей-
кіни впливають на гладкі м’язи бронхів або створюють
запалення.
Асматичні приступи найважчі у пізні нічні або ранні
ранкові години, оскільки, як зазначено вище, це періоди
максимальної констрикції у циркадних ритмах бронхіаль-
ного тонусу. Холодне повітря та навантаження, які у нормі
спричинюють бронхоконстрикцію, також зумовлюють аст-
матичні приступи. У 5% осіб астматичні приступи спри-
чинює аспірин. Інгібітори лейкотрієнового синтезу, такі
як зілеутон, і блокатори СузЬТ]-рецепторів, такі як монте-
лукаст, є ефективними в лікуванні цих форм астми (і, віро-
гідно, інших). Стимулювання Р-адренорецепторів зумов-
лює бронходилатацію, тому лікування інгаляціями Р-
адреноергічних агоністів є стандартною терапією для аст-
ми. Посередництво мускаринових рецепторів створює
бронхоконстрикцію, і ліки, що належать до мускаринових
холіноблокаторів, також використовують у лікуванні.
Додатковими препаратами, що часто застосовують, є кро-
молін, який інгібує вивільнення продуктів з мастоцитів, і
глюкокортикоїди, які гальмують запальну реакцію.
Емфізема
У разі дегенеративної і потенційно небезпечної леге-
невої хвороби, яку називають емфізема, легені втрачають
ПРИСТОСУВАЛЬНІ ЗМІНИ ДИХАННЯ У НОРМІ ТА ПАТОЛОГІЇ / 633
еластичність, а унаслідок руйнування еластичної тканини
і стінок між альвеолами альвеоли заміщуються великими
повітряними мішками. Фізіологічний мертвий простір
значно збільшується, і з огляду на неадекватну та нерівну
альвеолярну вентиляцію і перфузію у погано вентильо-
ваних альвеолах виникає важка гіпоксія. За подальшого
перебігу хвороби виникає гіперкапнія. Вдихання та види-
хання утруднені, і робота для виконання дихання значно
збільшується. Зміни у кривій тиск-об’єм у легенях показані
на рис. 34-11. Грудна клітка збільшується і стає бочкоподіб-
ною. Оскільки грудна стінка розтягується, то протилежно
до цього еластична тяга зменшується. Гіпоксія призводить
до поліцитемії. Виникає легенева гіпертензія, і права
половина серця збільшується (легеневе серце, сог риішо-
паїе), а потім унаслідок виснаження резервів міокарда
настає слабкість його скоротливої здатності.
У більшості випадків причиною емфіземи є куріння тю-
тюну. Дим цигарок спричинює збільшення кількості леге-
невих альвеолярних макрофагів, які вивільняють хімічні
речовини, що притягують лейкоцити до легень. Лейкоцити,
відповідно, вивільняють протеази включно з еластазою,
які ушкоджують еластичну тканину в легенях. Водночас
о^-антитрипсин інактивують кисневі радикали, що їх
вивільняють лейкоцити. Наслідком є порушення співвід-
ношення між протеазами та антипротеазами зі збільшен-
ням деструктивних змін у легеневій тканині.
У 2% причин емфіземи є вроджена недостатність актив-
ного о^-антитрипсину. В осіб, які гомозиготні на таку ваду
і курять, швидко виникає емфізема, і в них на 20 років змен-
шена тривалість життя. У некурців з недостатністю о^-
антитрипсину теж може виникнути емфізема, однак три-
валість життя набагато довша і якість його поліпшується.
Наприклад, у формуванні хвороби недостатність о^-анти-
трипсину забезпечує взаємовплив генетичних факторів і
факторів зовнішнього середовища.
Муковісцидоз (кістозний фіброз)
Муковісцидоз є іншим станом, який призводить до
повторних легеневих інфекцій з прогресивною, фактично
небезпечною деструкцією легень. За такого вродженого
рецесивного порушення СГ -канали в апікальних мембра-
нах епітеліальних клітинах дихальних шляхів не активовані
нормальним способом цАМФ. Додаткові СГ-канали у мем-
брані є нормальними, однак можливе пригнічення їхньої
функції. У будь-якому випадку втрата цАМФ-активованих
каналів відображається у зменшенні транспортування СГ
у дихальні шляхи. Подальші події остаточно не з’ясовані.
Проте СІ з’являється, тому ИаЕК-канали у дихальних шля-
хах активовані і більше Иа+, ніж у нормі, абсорбується.
Вода рухається назовні з дихальних шляхів, а їхня слизова
стає товстішою й ущільненою, полегшуючи появу обструк-
ції та інфікування. Серед кавказців муковісцидоз є одним
з найпоширеніших генетичних захворювань: 5% у популя-
ції є носіями дефективного гена, і хвороба виникає у кож-
ного одного на 2000 народжень.
Ген, який є анормальним у разі муковісцидозу, розміще-
ний на довгому плечі 7-ї хромосоми й енкодах СІ -каналу
називають регуляторами трансмембранної провідності
в разі муковісцидозу, які мають 12-інтервальні мембранні
домени, два АТФ-зв’язувальні сайти і ділянку, що вміщує
фосфориляційні сайти для цАТФ-залежної протеїнкінази
(протеїнкіназа А) (див. Розділ 1). Такий канал є членом
надродини транспортерів, що опосередковують серед
іншого експорт а-фактора феромону у дріжджах, і, мож-
ливо, секретує білки, яких бракує в сигнальній послідов-
ності у ссавців. Численних повідомлень про мутації гена
СГТК, що спричинює муковісцидоз, є багато; важкість
порушень змінюється з мутаціями, тому зрозуміло, що
енкодувальний ген має властивості комплексного білка.
Здебільшого мутації перешкоджають АТФ-зв’цзуванню,
або виникає конформаційна зміна, яка переважно про-
дукована зв’язуванням.
У чоловіків з міковісцидозом згущення секретів трап-
ляється у протоках, якими проходять сперматозоїди, і це
може спричинювати обструкцію і безпліддя. Хронічні
панкреатити в обох статей є наслідком анормального функ-
ціювання панкреатичних проток (див. Розділ 26). У пото-
вих залозах транспортування Ма+ і СЕ з просвіту недостат-
нє, і характерний високий вміст у поті цих електролітів.
ІНШІ ФОРМИ ГІПОКСІЇ
Анемічна гіпоксія
Гіпоксія, опосередкована анемією, за якої визначена
недостатність гемоглобіну, не є вираженою у спокої, бо
збільшується 2,3-ДФГ в еритроцитах. Проте в разі наван-
таження в анемічних хворих виникають труднощі, оскільки
обмежена здатність до збільшення постачання О2 в активні
тканини (рис. 37-10).
Отруєння чадним газом
Невеликі кількості чадного газу (СО) утворюються в
організмі; він виконує функції хімічного месенджера у
головному мозку та інших місцях (див. Розділ 4 і 27). У
0 20 40 60 80 100 120 140 160
Парціальний тиск кисню, мм рт. ст.
Рис. 37-10. Порівняння кривої дисоціації оксигемоглобіну у
нормі (угорі вміст гемоглобіну 14 г/дл) з кривою дисоціації
оксигемоглобіну у випадку отруєння СО (50% карбоксигемо-
глобін) й анемії (вміст гемоглобіну 7 г/л). Зверніть увагу, що
крива у випадку отруєння СО зміщена ліворуч від кривої анемії
(відтворено за дозволом з І_егї АК, ЗсІїитаскег РТ: Кевріга-
іогу Рііувіоіоду: Вавісв апсі Арріісаііопв. Заипсіегз, 1993).
634 / РОЗДІЛ 37
великих кількостях цей газ отруйний. Поза організмом СО
утворюється внаслідок неповного спалювання вуглецю.
Стародавні греки та римляни використовували його для
страти злочинців, проте й сьогодні СО спричинює більше
смертельних випадків, ніж будь-який інший газ. Отруєння
СО менш поширене в Україні, європейських країнах та
США, відколи почали використовувати натуральний газ,
який не містить СО, замість штучних газів та вугілля, під
час згоряння яких утворюється велика кількість СО. Однак
під час роботи бензинових двигунів підвищення СО сягає
6% або й більше.
Токсичність СО зумовлює взаємодія з гемоглобіном для
утворення карбоксигемоглобіну (карбомонооксигемо-
глобіну, СОНЬ), а СОНЬ не поглинає О2 (див. рис. 37-10).
Отруєння чадним газом часто трактують як форму анеміч-
ної гіпоксії, бо тут наявна недостатність гемоглобіну, який
переносить О2, проте загальний вміст гемоглобіну у крові
не уражений СО. Спорідненість гемоглобіну до СО у 210
разів перевищує його спорідненість до О2, і СОНЬ вивіль-
нює СО дуже повільно. Додатковою проблемою є те, що
за наявності СОНЬ крива дисоціації НЬО2, що залишився,
зміщується ліворуч, що свідчить про зменшення вивіль-
неного О2. Саме тому анемічні особи, які мають 50% нор-
мальної кількості НЬО2, можуть виконувати помірну робо-
ту, тоді як особи, у яких НЬО2 зменшений до такого ж рівня,
проте утворився СОНЬ, стають серйозно непрацездатними.
Унаслідок спорідненості СО до гемоглобіну простежу-
ється пришвидшене утворення СОНЬ з підвищенням аль-
веолярного Рсо більше ніж на 0,4 мм рт. ст. Отже, кількість
утворення СОНЬ залежить від тривалості експозиції до СО,
тобто концентрацї СО у повітрі, яке вдихають, і альвео-
лярної вентиляції.
Газ СО є токсичним для цитохромів у тканинах, проте
кількість СО, що відповідає за отруєння цитохромів, у 1000
разів перевищує летальну дозу. Тканинне отруєння не віді-
грає суттєвої ролі для клініки отруєння СО.
Симптоми отруєння СО подібні до симптомів будь-яко-
го типу гіпоксії: біль голови і нудота, хоча є незначне сти-
мулювання дихання з моменту, коли в артеріальній крові
Р(>2 нормальний, і каротидні та аортальні хеморецептори
не подразнені (див. Розділ 36). Темно-вишневий колір
СОНЬ видно у шкірі, нігтьових ложах та слизових обо-
лонках. Смерть настає, коли 70-80% гемоглобіну крові
перетворюється у СОНЬ. Симптоми, утворені хронічною
експозицією до сублетальних концентрацій СО, відпові-
дальні за ураження головного мозку, у тім числі з розу-
мовими змінами й інколи паркінсоноподібним станом (див.
Розділ 32).
Лікують отруєння СО, починаючи з негайного припи-
нення експозиції до СО й адекватної вентиляції штучним
диханням, якщо потрібно. Перевагу надають вентиляції
О2, а не свіжому повітрю, оскільки О2 дисоціюватиме у
СОНЬ. За такого стану використовують і гіпербаричну
оксигенацію (див. нижче).
Застійна гіпоксія
Гіпоксія внаслідок повільного кровообігу виникає в
таких органах, як нирки та серце під час шоку (див. Розділ
33). Печінка і, можливо, головний мозок застійна гіпоксія
ушкоджує в разі застійної недостатності серця.
У нормі плин крові до легень достатньо великий, і за
тривалої гіпотензії утворюються характерні ураження.
Тому гострий респіраторний дистрес-синдром у дорослих
(див. Розділ 33) може розвинутись унаслідок тривалого
циркуляторного колапсу.
Гістотоксична гіпоксія
Гіпоксія внаслідок пригнічення тканинних окисних
процесів найпоширеніша в разі отруєння ціанідами.
Ціаніди інгібують цитохромоксидазу і, можливо, інші ензи-
ми. Метиленову синьку або нітрити використовують для
лікування отруєнь ціанідами. Вони діють з утвореним мет-
гемоглобіном, який потім реагує з ціанідами для форму-
вання ціанметгемоглобіну - нетоксичної сполуки. Кри-
терії лікування такими сполуками, відповідно, обмежені
кількістю метгемоглобіну, який може безпечно утворюва-
тись. Для лікування також застосовують гіпербаричну
оксигенацію.
ЛІКУВАННЯ КИСНЕМ
Цінність
Уведення газових сумішей, збагачених киснем, обме-
жено діє в разі застійної, анемічної та гістотоксичної гіпо-
ксії, оскільки лише збільшує кількість нерозчиненого О2 в
артеріальній крові. Це відбувається й у випадку гіпоксичної
гіпоксії, коли внаслідок шунтування неоксигенована веноз-
на кров проходить повз легені. За інших форм гіпоксе-
мічної гіпоксії лікування О2 є корисним. Лікувальні режи-
ми, які постачають до 100% О2, цінні в разі гострої та хро-
нічної форм гіпоксемічної гіпоксії, уведення О2 24 год на
день протягом двох років дає змогу зменшити смертність
від хронічних обструктивних легеневих захворювань.
У разі першої інгаляції О2 можливе незначне послаб-
лення дихання у нормальних осіб, спричинене нормальним
впливом деяких гіпоксичних хеморецепторів. Однак цей
вплив малий, його можна виявити лише за допомогою
спеціальної техніки. Крім того, є позитивним вплив незнач-
ної акумуляції йонів Н+ з моменту, коли концентрація дезо-
ксигенованого гемоглобіну у крові зменшується і НЬ стає
потужнішим буфером, ніж НЬО2(див. Розділ 35).
Потрібно пам’ятати, що у гіперкапнічних хворих з вира-
женою легеневою недостатністю рівень СО2 може бути
високим, тому він швидше пригнічує, ніж стимулює дихан-
ня. Деякі з таких хворих утримують дихання тільки тому,
що каротидні та аортальні хеморецептори впливають на
дихальний центр. Якщо гіпоксичний вплив вилучений уве-
денням О2, то дихання може зупинитись. Під час апное
артеріальний Ро знижується, однак дихання не почина-
ється знову, оскільки підвищення РСО2 у майбутньому при-
гнітить дихальний центр. Тому терапію О2 у такій ситуації
потрібно розпочати уважно.
Токсичність кисню
Цікавим є питання, чому кисень, що так потрібний для
життя аеробних організмів, є також токсичним. Насправді
100% кисень токсично впливає не тільки на тварин, а й на
бактерії, грибки, культури тваринних клітин і рослин. Ток-
сичність виникає унаслідок утворення супероксидного ані-
ПРИСТОСУВАЛЬНІ ЗМІНИ ДИХАННЯ У НОРМІ ТА ПАТОЛОГІЇ / 635
она (О2 ), який є вільним радикалом, і Н2О2. Коли 80-100%
О2 вводити людям упродовж восьми годин і більше, то ди-
хальні шляхи стануть ураженими, спричинюючи загру-
динні болі, закладеність носа, сухість у горлі та кашель.
У деяких новонароджених, яких лікували О2 в разі рес-
піраторного дистрес-синдрому виникає хронічний стан, за
якого наявні легеневі кисти і затемнення (бронхопуль-
мональна дисплазія). Такі випадки, як цей синдром, є
свідченням токсичності О2. Іншим ускладненням у таких
новонароджених є ретинопатія недоношених (ретролен-
тальна фіброплазія) - утворення світлонепроникної
судинної тканини в очах, що може привести до серйозних
вад зору. Рецептори сітківки дозрівають від центра до пери-
ферії сітківки, і вони використовують значну кількість О2.
Це сприяє тому, що сітківка стає васкуляризованою, як у
дорослих. Лікування киснем перед дозріванням повністю
забезпечує погреби фоторецепторів і, отже, нормальна
васкуляризація не відбудеться. Є докази, що такий стан
можна попередити або поліпшити за допомогою лікування
вітаміном Е, який дає антиоксидантний ефект, а у тварин
- інгібіторами гормону росту.
Лікування гіпербаричною оксигенацією
Уведення 100% О2 за збільшеного тиску прискорює на-
стання токсичності О2 з утворенням не тільки трахеоброн-
хіального подразнення, а й м’язового посіпування, дзвенін-
ня у вухах, запаморочення, судом і коматозного стану. Швид-
кість, з якою такі симптоми настають, пропорційна до тиску,
з яким О2 вводять; наприклад, за тиску в 4 атмосфери
симптоми виникають у половини осіб через 30 хв, тоді як
затиску 6 атмосфер судоми настають через декілька хвилин.
Уведення інших газів у разі збільшеного тиску також
зумовлює симптоми з боку ЦНС (див. нижче). Уведення О,
за підвищених тисків у щурів збільшує вміст ГАМК (див.
Розділ 4) і АТФ у головному мозку, печінці та нирках.
З іншого боку, експозиція до 100% О2 при 2-3 атмо-
сферах може збільшити розчинність О2 в артеріальній крові
з того огляду, що артеріальний тиск (\ є більшим, ніж
2000 мм рт. ст., а тканинний тиск О - 400 мм рт. ст. Якщо
експозиція обмежена до 5 год або менше за таких тисків,
то токсичність О2 не виникає. Тому лікування у гіперба-
ричній кисневій камері використовують у випадку тих хво-
роб, коли потрібно поліпшити оксигенацію тканин, і цього
не можна досягти іншим способом. Таке лікування ефек-
тивне в разі отруєння чадним газом, радіаційного ураження
тканин, газової гангрени, анемій унаслідок вираженої
крововтрати, трофічних виразок на тлі цукрового діабету
та інших поранень, які повільно загоюються, рваних пора-
нень, у випадку трансплантації шкіри, коли кровообіг є
маргінальним (гранично допустимим/. Гіпербарична окси-
генація є головним методом лікування декомпресійної хво-
ГІПЕРКАПНІЯ ТА ГІПОКАПНІЯ
Пперкапнія
Затримання СО2 в організмі (гіперкапнія) початково
стимулює дихання. Затримання його у великих кількостях
зумовлює симптоми депресії ЦНС: дезорієнтацію в часі
та просторі, затьмарену свідомість, зменшення сенсорних
відчуттів, кому з пригніченням дихання та смерть. У хво-
рих з такими симптомами РС(Ь значно підвищений, тому
виражений респіраторний ацидоз і НСО3 у плазмі може
перевищувати 40 мекв, проте більшість НСО3 реабсор-
бується, підвищуючи НСО, у плазмі і частково компенсу-
ючи ацидоз (див. Розділ 39).
Розчинність СО2 набагато більша, ніж О2, тому гіпер-
капнія є рідкісною для хворих з легеневим фіброзом. Однак
вона трапляється в разі неадекватності співвідношення
вентиляції-перфузії і коли з інших оглядів альвеолярна
вентиляція є неадекватною за різноманітних форм недос-
татності дихання (див. табл. 37-1). Стан ускладнюється,
коли утворення СО2 збільшується, наприклад у хворих з
фібрильною гарячкою утворення СО^ збільшується на 13%
з підвищенням температури на кожний 1 °С. Високе спо-
живання вуглеводів збільшує утворення СО2, оскільки
збільшується ДК (див. Розділ 17). У нормі альвеолярна вен-
тиляція збільшується, і надлишок СО^ виводиться під час
дихання, проте він нагромаджується, коли вентиляція дис-
кредитована.
Гіпокапнія
Гіпокапнія настає внаслідок гіпервентиляції. Під час
вольової гіпервентиляції артеріальний РС(Ь знижується від
40 до 15 мм рт. ст., тоді як альвеолярний РО2 підвищується
до 120-140 мм рт. ст.
Хронічні впливи гіперкапнії простежуються у хворих з
неврозами, які хронічно гіпервентилюють. Церебральний
кровообіг може послаблюватись на 30% і більше внаслідок
безпосереднього констрикторного впливу гіпокапнії на
судини головного мозку (див. Розділ 32). Церебральна іше-
мія спричинює біль голови, запаморочення і парастезії.
Гіпокапнія також збільшує хвилинний об’єм крові. Вона
безпосередньо констрикторно впливає на більшість пери-
ферійних судин, проте пригнічує вазомоторний центр, тому
артеріальний тиск здебільшого незмінний або незначно
підвищений.
Інші прояви гіпокапнії виникають унаслідок супровід-
ного респіраторного алкалозу (рН = 7,5-7,6). Рівень НСО^
у плазмі є низьким, проте реабсорбція зменшується,
оскільки загальмована ниркова секреція кислоти за низь-
кого Р( о,. Рівень загального Са2 знижується, і в осіб з гіпо-
капнією розвивається спазмофілія, позитивний симптом
Хвостека та інші ознаки тетанії (див. Розділ 21).
ІНШІ РЕСПІРАТОРНІ АНОМАЛІЇ
Асфіксія
У випадку асфіксії внаслідок оклюзії повітроносних
стимулює процес дихання з величезними дихальними
зусиллями. Артеріальний тиск та серцебиття різко поси-
люються. Секреція катехоламінів збільшується, а рН крові
зменшується. З часом дихальні зусилля припиняються,
артеріальний тиск знижується, серцебиття сповільнюється.
Тварин, які перебували в асфіксії, можна все ж оживити за
допомогою штучного дихання, хоча вони схильні до фіб-
риляції шлуночків, ймовірно внаслідок поєднання гіпо-
636 / РОЗДІЛ 37
ксичного ураження міокарда і високого вмісту катехола-
мінів у крові. Якщо не розпочати штучне дихання, то зупин-
ка серця настане через 4-5 хв.
Утоплення
Утоплення - це задушення під час занурення здебіль-
шого у воду. У 10% утоплеників після втрати всіляких нама-
гань до вдихання перше захоплення води започатковує
ларингоспазм, і смерть настає унаслідок асфіксії без будь-
якої води в легенях. В інших випадках м’язи голосника
розслаблені, і рідина потрапляє у легені. Свіжа вода швидко
абсорбується, розчиняючись у плазмі й спричинюючи внут-
рішньосудинний гемоліз. Вода океану достатньо гіперто-
нічна і притягує рідину із судинної системи у легені, змен-
шуючи об’єм плазми. Найважливішим завданням у разі
лікування осіб після утоплення є звичайно реанімаційні
заходи, проте у довготривалому лікуванні потрібно брати
до уваги впливи води у легенях на кровообіг.
Періодичне дихання
Гострі впливи вольової механічної гіпервентиляції
відображають взаємодію з хімічними респіраторними регу-
лювальними механізмами. Якщо в нормальних осіб гіпер-
вентиляція триває 2-3 хв, потім припиняється, і можна
продовжувати дихання без будь-якого напружувального
вольового регулювання; настає період апное. Це відбува-
ється коли після декількох поверхневих подихів знову на-
стає інший період апное, що повториться через декілька
наступних подихів (періодичне дихання). Цикли можуть
тривати деякий час, доки нормальне дихання не відно-
виться (рис. 37-11). Апное, очевидно, настає внаслідок
нестачі СО2, тому воно не простежується в разі гіпервен-
тиляції газовою сумішшю, що містить 5% СО2. Під час
Час після припинення гіпервентиляції, хв
Рис. 37-11. Зміни в диханні і склад альвеолярного повітря
після форсованої гіпервентиляції протягом 2 хв.
апное альвеолярний РО2 знижується, а Рсо підвищується.
Дихання поновлюється внаслідок гіпоксичного стимулю-
вання каротидних та аортальних хеморецепторів перш ніж
рівень СО2 набуде норми. Декілька подихів зумовлює зник-
нення гіпоксичного подразника, і дихання зупиняється, перш
ніж альвеолярний РО2 знову знизиться. Поступово Р повер-
неться до норми, і нормальне дихання продовжується.
Дихання Чейна-Стокса
Періодичне дихання простежується в разі різноманіт-
них хворобливих станів, часто його називають диханням
Чейна-Стокса. Найхарактерніший такий тип дихання для
хворих з декомпенсованою серцевою недостатністю та
уремією, проте трапляється і в хворих з ураженням голов-
ного мозку і також під час сну у нормі в деяких осіб (рис.
37-12). Інколи в хворих з диханням Чейна-Стокса підви-
щена чутливість до СО2. Збільшена реакція є безперечно
наслідком руйнування нервових провідних шляхів, які у
нормі гальмують дихання. У деяких осіб СО2 спричинює
відносну гіпервентиляцію, знижуючи артеріальний РС02,
після чого настає апное, і артеріальний РС02 знову підви-
щується до норми, проте дихальний механізм повторно є
надреактивним до СО2. Дихання припиняється, і цикл
повторюється.
Інша причина періодичного дихання у хворих з сер-
цевими хворобами - продовження часу кровообігу від
легень до головного мозку, тому зміна артеріальних газо-
вих тисків триває довше і відтерміновує вплив на дихальні
центри у довгастому мозку. Якщо в осіб з повільним кро-
вообігом є гіпервентиляція, то в них низький Р( о2 у крові в
легенях, тому потрібно більше часу, ніж у нормі, для крові
з низьким РСО2, щоб досягти головного мозку. Під час цього
періоду Рсс,2 у легеневій капілярній крові продовжує зни-
жуватись, і коли кров досягне головний мозок, низький
РСО2 інгібує дихальний центр, створюючи апное. Іншими
словами, дихальні системи регулювання гнучко змінюють-
ся, оскільки негативний зворотний зв’язок від легень до
мозку є анормально довгим.
Апное під час сну
Випадки апное під час сну можуть бути центрального
походження, наприклад, слабкість імпульсації у нервових
волокнах, що забезпечують дихання, або внаслідок об-
струкції повітроносних шляхів (обструктне апоное у сні).
Такий стан простежується у будь-якому віці і трапляється,
коли м’язи глотки розслаблені у сні. У деяких випадках
----атулАММАДДдЛл--
100с _
Рис. 37-12. Дихання Чейна-Стокса під час сну Два періоди
апное відокремлені збільшенням, а згодом зменшенням
дихального об’єму \/т (відтворено за дозволом з Сїіегпіаск
N8: Кезрігарогу сіузгіїуііітіаз сіигіпд зіеер. N З Месі 1981 ;305*
325)
ПРИСТОСУВАЛЬНІ ЗМІНИ ДИХАННЯ У НОРМІ ТА ПАТОЛОГІЇ / 637
слабка здатність підборідно-під’язикових м’язів скоро-
чуватись під час сну відповідає за блокаду. Ці м’язи від-
тягують язик допереду, і коли вони не скорочуються, то
язик западає дозаду, створюючи обструкцію у повітро-
носних шляхах, тому після декількох виражених зусиль
хворий прокидається, робить декілька нормальних дихань
і знову засинає. Не є несподіванкою, що випадки апное
найпоширеніші під час сну ШРО, коли м’язи найбільш
гіпотонічні (див. Розділ 11). До симптомів апное належить
гучне хропіння, ранкові болі голови, втомленість і сон-
ливість удень. Коли вони стають вираженими і тривалими,
то це ознака випадків легеневої гіпертензії, серцевої недос-
татності, інфаркту міокарда та інсульту. Крім того, випадки
автомобільних аварій у хворих з апное у сні трапляються
у сім разів частіше, ніж серед інших водіїв.
Синдром раптової смерті у грудних дітей
Доведено, що синдром раптової дитячої смерті (СРДС)
може бути формою апное у сні. Таке порушення, за якого
здорових малюків знаходять мертвими у їхніх ліжечках,
привертає значну увагу. Періоди апное поширені у недо-
ношених дітей. Однак періоди тривалого апное не коре-
люють з подальшими випадками смерті, і ніякий із відомих
попередньо виконаних тестів з хемореактивності не є на-
дійним для визначення того, які діти матимуть схильність
до СРДС у подальшому. Деякі випадки зумовлені кар-
діальними аритміями, що ускладнені синдромом врод-
женого продовження інтервалу РТ (див. Розділ 28). Крім
того, є докази, що ймовірність СРДС збільшується для ді-
тей, матері яких курять. До іншого фактора належить сон
у положенні долілиць. Навчання матерів вкладати для сну
дітей на спину дає змогу значно зменшити випадки СРДС.
ВПЛИВИ ЗБІЛЬШЕНОГО
БАРОМЕТРИЧНОГО ТИСКУ
Навколишній тиск збільшується на 1 атмосферу через
кожні 10 м глибини у морі і кожні 10,4 м глибини у свіжій
воді. Тому на глибині 31 м в океані на водолаза діє тиск
4 атмосфери. Ті, хто копають під водою тунелі, також під-
даються ризику, бо тиск у камерах (кесонах), де вони пра-
цюють, підвищується у разі виходу з води.
Ризик піддатися дії збільшеного барометричного тиску
характерний для спеціалістів, які перебувають і допомага-
ють глибоководним водолазам та працівникам, що будують
підводні тунелі. Однак відкриття апарата 8СІЛЗА (від англ.
8ЄІГ-сопІаіпеб ипбепуаіег ЬгеаШіп£ аррагаШв - автономний
апарат для дихання під водою) перетворило підводне пла-
вання з бізнесу у спорт. Популярність підводного плавання
величезна, тому всі лікарі повинні знати про його потен-
ційну небезпечність.
Наркотичний ефект азоту і синдром
ураження нервової системи гіпербарією
Водолаз повинен дихати повітрям або іншими газами в
разі гіпербарії для урівноваження підвищеного тиску на
грудну стінку та живіт. Виведення СО2 попереджує його
нагромадження. При збільшеному тиску 100% О2 зумовлює
симптоми отруєння киснем з боку ЦНС (табл. 37-2). Коли
токсичні впливи дихання О2 (див. вище) є пропорційними
до РОз, то їх можна попередити зменшенням концентрації
О2 у газовій суміші до 20% або менше.
Якщо водолаз дихає стиснутим повітрям, то підвищення
Ри2 може спричинити наркотичний ефект азоту - стан,
також відомий як “розрив від глибини” (див. табл. 37-2).
При тиску 4-5 атмосфер (наприклад, глибина 30—40 м в
океані) 80% М2 створює справжню ейфорію. У разі біль-
шого тиску симптоми нагадують алкогольну інтоксикацію.
Мануальна спритність не змінюється, проте інтелектуальні
функції порушені.
Проблеми наркотичного ефекту азоту можна уникнути,
дихаючи газовою сумішшю з О2 та гелію, що й роблять
водолази на глибині. Крім того, під час глибоководного
занурення виникає синдром ураження нервової системи
гіпербарією (СУНСГ). Такий стан супроводжується тре-
мором, запамороченням та пригніченням а-активності на
ЕЕГ. На відміну від наркотичного ефекту азоту, інтелекту-
альні функції не так важко уражені, проте мануальна сприт-
ність порушена. Причина СУНСГ досі остаточно не з’ясо-
вана, однак зафіксовано, що різноманітні гази, які фізіо-
логічно інертні за атмосферного тиску, стають анестети-
ками в разі гіпербарії. Це справджується для ЬІ2 і також
для ксенону, криптону, аргону, неону та гелію. їхня анес-
тетична активність паралельна до їхньої ліпідної розчин-
ності і може впливати на мембрани нервових клітин.
Декомпресійна хвороба
Якщо водолаз, дихаючи 80% М2, піднімається на поверх-
ню, то підвищений альвеолярний знижується. З тканин
М2 дифундує у легені за градієнтом парціального тиску.
Тому коли повернення до атмосферного тиску (декомпре-
сія) є поступовим, то ушкоджувальні впливи не простежу-
ються; проте якщо підіймання швидке, то 1Ч2 вилучається
з розчину. Бульбашки газу утворюються в тканинах та
крові, спричинюючи симптоми декомпресійної хвороби
(висотні болі, кесонову хворобу). Бульбашки в тканинах
зумовлюють виражені болі, особливо навколо суглобів, і
неврологічні симптоми з парастезією та свербінням. Буль-
башки у кров’яному руслі, які бувають у важчих випадках,
обструктують артерії головного та спинного мозку. Симп-
томи з’являються через 10-30 хв після підіймання водолаза
Таблиця 37-2. Потенційні ускладнення, що супроводжують
вплив збільшеного барометричного тиску
Токсичність кисню
Ураження легень
Судоми
Наркотичний ефект азоту
Ейфорія
Ослаблення виконання
Синдром ураження нервової системи
Тремор
Напівсвідомий стан
Декомпресійна хвороба
Біль
Параліч
Емболія повітрям
Раптова смерть
638 / РОЗДІЛ 37
на поверхню води і прогресують. Аномалії внаслідок
ураження спинного мозку досить поширені, однак можуть
також бути різні види паралічів і дихальна недостатність.
Бульбашки у легеневих капілярах відповідальні за диспное,
яке водолази називають приступами ядухи, у вінцевих
артеріях - за ураження міокарда.
Лікування цієї хвороби - рекомпресія у барокамері і
наступна поступова декомпресія. Рекомпресія часто рятує
життя. Виздоровлення здебільшого утруднене, можливі
залишкові неврологічні наслідки внаслідок незворотного
ураження нервової системи
Потрібно брати до уваги, що підіймання в літаку еквіва-
лентне підійманню з підводного занурення. Декомпресія
під час підіймання з рівня моря до 8550 м у кабіні літака
без тиску (тиск знижується від 1 до 0,33 атмосфер) є такою
ж, як під час підіймання на поверхню моря після пере-
бування на глибині 20 м (тиск знижується від 3 до 1 атмо-
сфери). Швидке підіймання у тій чи іншій ситуації може
зумовити декомпресійну хворобу.
Повітряна емболія
Якщо водолаз, дихаючи з балона зі збільшеним тиском,
під час підводного плавання затримує дихання і зненацька
підніме голову над поверхнею (це може трапитись під час
паніки чи яких-небудь проблем), то газ може швидко роз-
ширити легені з силою, достатньою для розриву легеневих
вен. Таке надходження повітря у судини спричинює повіт-
ряну емболію. Фатальна повітряна емболія трапляється під
час швидкого підіймання на поверхню моря з глибини 5 м.
Наслідки наявності повітря у системі кровообігу описані
у Розділі ЗО. Звичайно, таке ніколи не станеться в осіб, що
затримують дихання на поверхні, пірнають і повертаються
на поверхню, все ще утримуючи дихання, незалежно від
того, як глибоко вони занурювались.
Повітряна емболія також трапляється внаслідок швид-
кого розширення газом легень, коли зовнішній тиск рап-
тово зменшився щодо атмосферного до субатмосферного,
наприклад, якщо стінка кабіни з тиском у літаку або ракеті
на висоті є порушеною (вибухова декомпресія).
ШТУЧНЕ ДИХАННЯ
Використання в разі гострої асфіксії внаслідок утоп-
лення, отруєння СО чи іншими газами, ураження елект-
ричним струмом, випадків під час анестезії та інших подіб-
них причин штучного дихання після припинення звичай-
ного дихання для оживлення потерпілого може стати реані-
маційним. Його завжди потрібно намагатися виконати,
оскільки дихання припиняється перед зупинкою серця. Є
численні методи невідкладного штучного дихання. Проте
методом, що сьогодні рекомендований і створює адекватну
вентиляцію у всіх випадках, є метод дихання рот у рот. До
переваг такого методу належить не тільки його простота
виконання, а й факт, що в цьому разі достатньо розширю-
ються легені.
Дихання рот у рот
Під час такого реанімаційного заходу людина, що надає
допомогу, повинна покласти особу, що потерпіла, на рівну
Рис. 37-13. Правильне виконання дихання “рот в рот”. А: від-
крити повітроносні шляхи, розміщуючи шию допереду і роз-
гинаючи Вставка показує обструкцію повітроносних шляхів,
коли шия є зігнутою у спокої та їхнє відкриття в разі розгинання
шиї. В: закрити ніздрі потерпілого пальцями, щільно приту-
литись ротом до рота потерпілого, енергійно вдихати під час
видихання повітря. С: дозволяйте потерпілому видихати
пасивно через вільний рот чи ніс. Вивільнення повітря можна
почути і відчути експіраторний потік повітря. Повторіть В і С
12 разів за 1 хв (відтворено за дозволом з Зсіїгоесіег 8А, Кгирр
МА, Тіегпеу І_М Зг [есіііогз]: Сиггепі МебісаІ Оіадпозіз & Тгеаі-
гпепі 1990. Мсбгауу-НіІІ, 1990).
ПРИСТОСУВАЛЬНІ ЗМІНИ ДИХАННЯ У НОРМІ ТА ПАТОЛОГІЇ / 639
поверхню, відкрити рот, утримуючи одну руку під шиєю
потерпілого і піднімаючи її, а іншу - на голові для фіксації
отриманого тиску. Це розширює шию потерпілого і запо-
бігає потраплянню язика у задню частину горла. Рот реані-
матора повинен покривати рот потерпілої особи, а пальці
руки, що фіксує голову, - закрити ніздрі потерпілого (рис.
37-13). З частотою 12 разів на хвилину реаніматор вдихає
повітря об’ємом, удвічі більшим від дихального об’єму,
що дає змогу завдяки еластичній тязі легень робити пасив-
не дихання потерпілому. Необхідно звертати увагу на пра-
вильне положення шиї: вона повинна бути розширена.
Будь-який газ, що потрапив у шлунок може бути видихну-
тим нагору тиском з черева від часу до часу. Для осіб з
апное, у яких не визначене серцебиття, дихання рот у рот
потрібно чергувати з масажем серця (див. Розділ 28).
Механічне дихання
Для лікування хронічної дихальної недостатності внас-
лідок неадекватної вентиляції потрібне механічне дихання.
Його виконують за допомогою герметичних металевих або
пластикових контейнерів, які використовують для відго-
родження тіла, за винятком голови, проте тепер вони пор-
тативні і вкривають лише грудну клітку. Завдяки двигуну
створений негативний тиск безпосередньо у грудях через
регулярні інтервали рухає грудну стінку подібно до нор-
мального дихання. Апарати штучного дихання, що чинять
переривчастий позитивний тиск, також застосовують. Такі
апарати створюють переривчасте збільшення внутрішньо-
легеневого тиску у спосіб пульсування повітря, яке поста-
чають через маску на лиці. Дихаючи проти позитивного
кінцевого експіраторного тиску, оцінюють набряк легенів,
ймовірно тому, що за таких умов відбувається залучення
попередньо невентильованих альвеол.
У разі відлучення хворих від механічного штучного
дихання виникають деякі труднощі. Часто такі особи
ослаблені. Крім того, коли дихання через апарат штучного
дихання надмірно довге, то дихальні м’язи атрофуються, і
потрібен час, щоб відновити силу.
ЛІТЕРАТУРА ДО ЧАСТИНИ VII: ДИХАННЯ
ВагіессЬі СЕ, МасКепхіе ТО, 8сЬпег К\¥: ТЬе Ьитап со8І8
о£ іоЬассо П8е. N Еп§1 3 Мед 1994;930:907.
ВескеН \У8: Оссираїїопаї гезрігаїогу дІ8еа8Є8. N Еп§13 Мед
2000;342:406.
Воує АА, ОауІ8 ЗС (едїїог8): Оіуіп% Месіісіпе, 2пд ед.
\Уі11іат8 & \Уі1кіп8, 1990.
СатрЬеІІ Р, \УеІ88 V (едіїогз): А11ег§у апд а8діта. №Шге
1999;402(8ирр1):В1.
Сгаро КО: Риїтопагу Гипсїїоп ІЄ8ЇЇП£. N Еп§1 3 Мед 1994;
331:25.
Сгу8іа1 КО, \¥е8і З В (едИог8): Тке Тип&: $сіепіі]їс Еоипсіа-
іїопх. 2 уоі8. Кауеп Рге88, 1991.
Егп8і А, 7іЬгак ЗО: СагЬоп топохіде роі8опіп§. N Еп§1 З
Мед 1998;339:1603.
РеІ8 АО8, СоЬп 7А: ТЬе аіуеоіаг тасгорЬа^е. З Аррі РЬузіоІ
1986;60:353.
ЕІ8Йтап АР еі аі (едііогз): Еіхктапя Риїтопагу Оізеазез
апсі Оіаогсіегх, Згд ед. Мс6га\у-Ні11, 1998.
ОоІдЬаЬег 87: Риїтопагу етЬо1І8т. N Еп§1 3 Мед 1998;
339:93.
6го88 І: Ке^иіадоп оГ Реіаі 1ип§ таШгадоп. Ат 3 РЬуаіоІ
1990;259:Ь337.
НщепЬодат Т, ОШІапа В А, \¥а11\уогк 3: ТЬе рЬу8Іо1о§у оЕ
Ьеаі1-1ип£ 1гап8р1апіаїїоп іп Ьитап8. \е\¥8 РЬузіоІ 8сі
1990;5:71.
Н8Іе СС\У: Ке8рігаіогу Гипсїїоп оЕЬето^ІоЬіп. N Еп§13 Мед
1998:338:239.
НиЇЇ£геп Н: Ніук Аііііисіе Месіісіпе. НиЬ^геп РиЬ1ісадоп8,
1997.
ЬаипоІ8 8 еі аі: Ніссир іп адиЇЇ8: Ап оуєгуієху. Еиг Ке8ріг З
1993;6:563.
Маскіет РТ: ТЬе асі о£ЬгеаіЬіп§. №\¥8 РЬу8Іо1 8сі 1990;
5:233.
М১і СА еі аі: \еигорерііде8 а8 ге§и1аіог8 о£ аіпуау їїтс-
їїоп: Уазоасііуе Іпіе8йпа1 рерїїде апд іЬе ІасЬукіпіп8.
РЬузіоІ Кєу 1995;75:277.
Маппіп£ НЕ, 8сЬ\уаї1х8іеіп КМ: РадюрЬу8І0І0£у оГдузрпеа.
N Еп§1 3 Мед 1995;333:1547.
Магсіаі 33, 81иі8ку Н8 (едііогв): Ркухіоіоуу о/ Уепіііаіогу
Зиррогі. Магсеї Оеккег, 1997.
Магіп М6: ІЗрдаіе: РЬагтасо1о§у о£ аігхуау 8есгеііоп.
РЬагтасої Кєу 1994,46:36.
Модеіі ЗН: Ого\упіп£. N Еп§1 3 Мед 1993:328:253.
Моїїаі К, ОеаіЬега^е ЗЕ, 8еуЬегі О\¥: А 8ігисіига1 тодеї Гог
(Ье кіпеїїс ЬеЬауіогоГЬето£ІоЬіп. 8сіепсе 1979;206:1035.
Мооп КЕ, Уапп КО, ВеппеК РВ: ТЬе рЬу8Іо1о§у о£ десот-
рге88Іоп І1ІПЄ88. 8сі Ат (Аи§) 1995;273:70.
Миггау ЗЕ: Тке іїогтаї Ілт%: Тке Вазіз /ог Оіаупохіх апсі
Тгеаітепі о/Риїтопагу Оіхеахе, 2пд ед. 8аипдег8, 1985.
Регітиіїег ОН, Ріегсе ЗА: ТЬе а1-апдігур8Іп §епе апд ет-
рЬузета. Ат 3 РЬузіоІ 1989;257:Е 147.
Ріегсе Е\В: Сиісіе іо Мескапісаі Уепіііаііоп апсі Іпіепхіче
Резрігаіогу Саге. 8аипдег8, 1995.
Кек1іп£ ЗС, Ееідтап ЗЬ: Рге-ВоКхіп^ег сотріех апд расе-
такег пеигоп8: Е1уроіЬе8Іхед 8Ііе апд кетеї Гог гезріга-
іогу гЬуіЬт §епегадоп. Аппи Кєу РЬузіоІ 1998;60:885.
Кеупо1д8 Н¥: Іттипоіо^іс 8у8іет іп діє ге8рігаіогу (гасі.
РЬузіоІ Кєу 1991 ;71:1117.
Кі^аіїо Н: Сопігої оГ уепїїіаїїоп іп діє пехуЬот. Аппи Кєу
РЬу8Іо1 1984;46:661.
Коопеу 8А, ¥оип§ 8Ь, МепдеІ8оЬп СК: Моїесиїаг апд сеі-
Іиіаг ргосе88Іп§ о£1ип£ зшТасіапЕ ЕА8ЕВ 3 1994;8:957.
КиЬіп ЕЗ: Ргітагу риїтопагу Ьурегіеп8Іоп. N Еп§1 3 Мед
1997;336:111.
Куап 3\У: Рерддазе епхуте8 оГ діє риїтопагу уазсиїаг 8иг-
Гасе. Ат 3 РЬу8Іо1 1989;271 :Е53.
640 / РОЗДІЛ 37
8іго11о Р11г, Колега КМ: ОЬзігискуе зіеер арпеа. N Еп§11
Мед 1995;334:99.
8и§аг О: Іп зеагск о£ Опдіпе’з сигзе. 1АМА 1978;240:236.
Тагру 8Р, Сеііі ВК: Ьоп£-іегт оху£еп іЬегару. N Еп§11 Мед
1995;333:710.
ТіЬЬіез РМ, Еде1зЬег£ 18: НурегЬагіс-оху^еп діегару. N Еп§1
1 Мед 1996;334:1642.
ХУа§пег РВ: Віїїизіоп апд сЬетісаІ геасдоп іп риїтопагу
§аз ехсЬап^е. РЬузіоІ Кєу 1977;57:257.
ХУаге ЕВ, Мадкау МА: Тке асиіе гезрігаіогу дізігезз зуп-
дготе. N Еп£І 1 Мед 2000;342:1334.
ХУаззегтап К: Соир1іп£ о£ехіетаї іо сеііиіаг гезрігадоп диг-
іп§ ехегсізе: Тке іуіздот оГ діє коду геуізіїед. Ат 1
РЬузіоІ 1994;266:Е519.
ХУаззегтап К еі аі: Ргіпсіріез о/Ехегсізе Тезііпу апсі Іпіег-
ргеіаііоп, Згд ед. Еірріпсоії ХУіІІіатз & ХУіІкіпз, 1999.
ХУеіЬеІ ЕК: Тке Раіїгмау/ог Охууеп: Зітисіиге апсі Еипсііоп
іп Іїіе Маттаїіап Кезрігаіогу Зузіет. Нагуагд ііпіу Ргезз,
1984.
ХУеіг ЕК, Агскег 8Е: Тке тескапізт оГ асиіе курохіс риї-
топагу уазосопзігісдоп: Тке іаіе оГ 2 скаппеїз. ЕА8ЕВ 1
1995;9:183.
ХУеіг ЕК, Кєєуєз 1Т (едііогз): Риїтопагу Есіета. ЕиШга,
1997.
ХУезІ 1В: Кезрігаіогу Ркузіоіо^у: Тке Еззепііаіз, 4ді ед.
ХУіІІіатз & ХУіІкіпз, 1991.
ХУезі 1В еі аі: Радіо§епезіз о£кі§к-аккиде риїтопагу оедета:
Вігесі еуідепсе о£ зігезз Гаііиге о£ риїтопагу саріїїагіез.
ЕигКезрігІ 1995;8:523.
ХУгі^кІ ІК: Іттипотодиіаіогу іипсдопз о£зиїТасІапі. РЬузіоІ
Кєу 1997;77:931.
Частина VIII
Утворення і виділення сечі
Функція нирок і сечовипускання
38
ВСТУП
У нирках відбувається процес фільтрування через клу-
бочкові капіляри у ниркові канальці рідини, що нагадує за
складом плазму крові (клубочкова фільтрація). Під час
проходження клубочкового фільтрату через канальці його
об’єм зменшується, а хімічний склад суттєво змінюється
завдяки процесам канальцевої реабсорбції (зворотного
всмоктування води і розчинених у ній речовин) та каналь-
цевої секреції (секреції речовин у канальцеву рідину),
внаслідок яких утворюється сеча, що надходить до нирко-
вої миски. Порівняльна характеристика складу плазми кро-
ві та сечі відображає ці процеси, що полягають в елімінації
шлаків та збереженні води, електролітів і деяких важливих
продуктів обміну речовин (табл. 38-1). Крім того, склад
сечі може значно змінюватись, що дає змогу багатьом меха-
нізмам гомеостазу підтримувати сталість складу ПКР. Кіль-
кість води та різноманітних речовин у сечі коливається в
значних межах. З ниркової миски сеча потрапляє в сечовий
міхур, а звідти виводиться завдяки акту сечовипускання.
Нирки також відіграють роль ендокринних органів. Вони
продукують кініни (див. Розділ 31) і 1,25-дигідроксихоле-
кальциферол (див. Розділ 21), а також утворюють і секре-
тують ренін та еритропоетин (див. Розділи 24 і 27).
ФУНКЦІЙНА АНАТОМІЯ
Нефрон
Кожна структурна одиниця нирки (нефрон) утворена
окремим нирковим канальцем і відповідним йому клу-
Таблиця 38-1. Концентрація деяких фізіологічно важливих
речовин у сечі та плазмі крові
Речовина Концентрація в Відношення С/П
сечі (С) плазмі (П)
Глюкоза, мг/дл 0 100 0
І\1а+, мекв/л 90 150 0,6
Сечовина, мг/дл 900 15 60
Креатинін, мг/дл 150 1 150
42 367-2
бочком. Розмір нирок у представників різних біологічних
видів визначений кількістю нефронів, які вони містять. У
кожній нирці людини є близько 1,3 мільйона нефронів.
Складові частини нефрона схематично показані на рис. 38-
1. З правого боку рис. 38-2 зображено довгасту і тонку
будову нефронів.
Клубочок, який має близько 200 мкм у діаметрі, утво-
рюється внаслідок інвагінації капілярних петель у розши-
рений сліпий кінець нефрона (капсулу Шумлянського-
Боумена). Капіляри є розгалуженням аферентної (при-
носної) артеріоли; кров з них збирається в еферентну (ви-
носну) артеріолу, яка має дещо менший діаметр (див. рис.
38-1 і 38-2). У капсулі Шумлянського-Боумена кров від-
окремлена від клубочкового фільтрату двома шарами
клітин: ендотелієм капілярів та особливим епітелієм
капсули, що складається з подоцитів (див. нижче), які
огортають клубочки. Ці прошарки відокремлені один від
одного базальною мембраною. Між базальною мембраною
та ендотелієм містяться зірчасті за формою клітини, що
одержали назву мезангіальних клітин. Вони подібні до
перицитів - клітин, що виявляються в стінках капілярів
по всьому організму. Мезангіальні клітини особливо часто
трапляються в проміжках між двома сусідніми капілярами,
у цих ділянках базальна мембрана утворює спільну для
обох капілярів оболонку (рис. 38-3). Мезангіальні клітини
мають скоротливу здатність і беруть участь у регулюванні
клубочкової фільтрації (див. нижче). Вони також вико-
нують секрецію різноманітних речовин, зв’язують цирку-
лювальні імунні комплекси, чим зумовлюють захворюван-
ня клубочків.
Ендотелій клубочкових капілярів фенестрованої будови,
пори - діаметром 70-90 нм.
Клітини епітелію (подоцити) мають численні псевдо-
події, які переплітаються (див. рис. 38-3), утворюючи
фільтраційні щілини вздовж стінки капілярів. Ці щілини
мають розмір близько 25 нм і кожна з них вкрита тонкою
мембраною. Базальна мембрана не містить видимих щілин
або пор.
У нормі клубочкова мембрана без перешкод пропускає
незаряджені молекули діаметром до 4 нм, проникнення
молекул діаметром понад 8 нм практично неможливе.
Однак на здатність молекул проникати в капсулу Шум-
лянського-Боумена впливає не лише їхній розмір, а й
642 / РОЗДІЛ 38
тонке низхідне коліно
Рис. 38-1. Схема юкстамедулярного нефрона. Зображено
головні гістологічні характеристики клітин, що утворюють
кожну частину нефрона.
електричний заряд (див. нижче). Загальна площа ендотелію
клубочкових капілярів у людини становить 0,8 м2.
Головні характеристики клітин, що утворюють стінки
канальців, відображені на рис. 38-1. Проте у всіх сегментах
канальців наявні певні підтипи клітин і анатомічні відмін-
ності між ними корелюють з відмінністю у функції (див.
нижче).
Проксимальний звивистий каналець у людини має
довжину близько 15 мм і діаметр 55 мкм. Його стінки утво-
рені одним шаром клітин, які переплітаються між собою і
сполучені апікальними щільними з’єднаннями. Між осно-
вами клітин є розширення позаклітинного простору, які
називають латеральними міжклітинними проміжками.
Стінки клітин, повернені у просвіт канальця, містять так
звану щіточкову облямівку, названу так завдяки наявності
численних мікроворсинок розміром 1,0x0,7 мкм.
Звивиста частина проксимального канальця (раг8 соп-
уиіаіа) переходить у пряму (раг8 гесіа), яка утворює першу
частину петлі Генле (див. рис. 38-1 та 38-2). Прокси-
мальний каналець закінчується у тонкому сегменті низхід-
ного коліна петлі Генле, яке містить плоский епітелій, що
складається з розріджених плоских клітин. Нефрони,
клубочки яких розміщені в зовнішній частині кіркового
шару нирки (кіркові нефрони), мають короткі петлі Генле,
тоді як нефрони, клубочки яких розташовані в юкстагломе-
рулярній частині кіркового шару нирки (юкстагломеру-
лярні нефрони), мають довгі петлі, що проходять вниз до
ниркових пірамід. У людини лише 15% нефронів мають
довгі петлі. Загальна довжина тонкого сегмента петлі коли-
вається в межах 2-14 мм. Вона закінчується товстим сег-
ментом висхідної петлі, довжина якого близько 12 мм. Клі-
тини товстого висхідного коліна мають кубічну форму.
Вони багаті на мітохондрії, у базальній пластинці клітинної
мембрани цих клітин численні інвагінації.
Товсте висхідне коліно петлі Генле досягає клубочка
нефрона, з якого починається каналець, і проходить близь-
ко до його аферентної й еферентної артеріол. Стінки при-
носних артерій містять юкстагломерулярні клітини, які
продукують ренін. У цій ділянці епітелій клубочка гісто-
логічно модифікований. Він утворює щільну пляму
(тасиїа сіеп8а). Юкстагломерулярні клітини, щільна пляма
і мезангіоцити, розташовані біля них, одержали загальну
назву юкстагломерулярного апарату (див. рис. 24-4).
Довжина дистального звивистого канальця близько
5 мм. Його епітелій має меншу товщину, ніж епітелій
проксимального канальця і, хоч тут наявна деяка кількість
мікроворсинок, та нема чітко вираженої щіточкової обля-
мівки. Дистальні канальці зливаються, утворюючи збірні
трубочки, які мають довжину близько 20 мм і проходять
через кірковий та мозковий шари нирки й відкриваються
у ниркову миску через верхівки ниркових пірамід. Епітелій
збірних трубочок складається з головних клітин (Р-клі-
тини, від англ. ргіпсіраї се1І8) і вставних клітин (І-клі-
тини, від англ. іпїегсаіаіесі се1І8). Головні клітини, які пере-
важають за кількістю, порівняно високі та містять мало
органел. Вони беруть участь у реабсорбції №+ та води
під впливом вазопресину. Вставні клітини, що наявні у
невеликій кількості в збірних трубочках, а також у дис-
тальних канальцях, містять більше мікроворсинок, цито-
плазматичних міхурців та мітохондрій. Вони виконують
секрецію йонів Н+ і транспортування НСО3 . Загальна дов-
жина нефронів зі збірними трубочками коливається від
45 до 65 мм.
До клітин нирки, що мають секреторну функцію, нале-
жить не лише юкстагломерулярні клітини, а й деякі клітини
в інтерстиційній тканині мозкової речовини нирки. Ці
клітини називають мозковими інтерстиційними клітина-
ми типу І. Вони містять ліпідні включення і, можливо,
секретують простагландини, переважно ПГЕ2 (див. Розділ
17). Крім того, ПГЕ2 також секретують клітини збірних
трубочок, а простациклін (ПГІ2), як і інші простагландини,
- артеріоли та клубочки.
Кровоносні судини
Нирковий кровообіг схематично показаний на рис. 38-
2. Аферентні артеріоли - це короткі прямі гілки міжчас-
точкових артерій. Кожна з них поділяється на множинні
капілярні гілочки, які формують пучок клубочкових судин.
Капіляри зливаються, утворюючи еферентну артеріолу, яка,
відповідно, розгалужується на капіляри, що постачають
кров’ю канальці (перитубулярні капіляри). Капіляри в
подальшому утворюють міжчасточкові вени. Отже, арте-
ріальні сегменти між клубочками та канальцями станов-
лять портальну систему. Клубочкові капіляри - це єдині
капіляри в організмі людини, що дренують в артеріоли.
ФУНКЦІЯ НИРОК І СЕЧОВИПУСКАННЯ / 643
Рис. 38-2. Нирковий кровообіг у собаки. У загальних рисах він ідентичний до кровообігу у нирках людини. Структура судинного
русла зображена у спрощеному вигляді. Ліворуч у збільшеному вигляді зображено деталі будови нефрона. ГІравовуч показано
складові частини нефрона зі збереженням геометричних співвідношень між ними; АА - аферентні артеріоли; КШ - кірковий
шар; ЗТ - збірна трубочка; ЕА - еферентна артеріола; К - клубочок; ВМШ - внутрішній мозковий шар; ЗМШ - зовнішній
мозковий шар; ПВЗК - проксимальний відділ звивистого канальця; ПС - прямі судини. Дистальні звивисті канальці та збірні
трубочки виокремлені кольором (відтворено за дозволом з Веешл/кез К III: ТІте уазсиїаг огдапігаїіоп ої Фе кібпеу. Аппи Кєу
РзузіоІ 1980;42:531).
644 / РОЗДІЛ 38
А
Мезангіальна
клітина
Відростки
подоцита
Еферентна
артеріола
Проксимальний
каналець
Капсула
/ Еритроцити
Нервові волокна
Гладкі м’язи
Дистальний каналець
Аферентна
артеріола
Базальна
мембрана клубочка
Юкстагломерулярні
клітини
Щільна пляма
Простір Боумена
Рис. 38-3. Структурні деталі клубочка: А - зріз через судинний полюс, що показує капілярні петлі; В - співвідношення між
мезангіальними клітинами і подоцитами в клубочкових капілярах; С - фільтраційні щілини у базальній мембрані, що утворені
подоцитами, і співвідношення між нею та ендотелієм капілярів; 0 - збільшений рис. С, де показано відростки подоцитів.
Розмита субстанція на їхній поверхні - клубочковий поліаніон
Крім того, еферентні артеріоли містять мало гладких м’язо-
вих волокон.
Капіляри, які збирають кров від кіркових нефронів,
утворюють перитубулярну мережу, тоді як еферентні арте-
ріоли, які відходять від юкстамедулярних клубочків, впа-
дають не лише в перитубулярну мережу, а також у судини,
що формують шпилькоподібні петлі (прямі судини). Ці
петлі заглиблюються в ниркові піраміди разом з петлями
Генле (див. рис. 38-2).
Низхідні прямі судини мають нефенестрований ендо-
телій, у якому містяться системи транспортування сечо-
вини, а висхідні прямі - фенестрований ендотелій, що від-
повідає їхній функції, тобто збереженню розчинених речо-
вин (див. нижче).
Еферентна артеріола кожного клубочка поділяється на
капіляри, які постачають кров’ю велику кількість різних
нефронів. Отже, каналець кожного нефрона отримує кров
не лише винятково від еферентної артеріоли цього неф-
рона. У людей загальна площа ниркових капілярів при-
близно відповідає загальній площі канальців, тобто близько
12 м2. Об’єм крові, що міститься в ниркових капілярах у
будь-який момент часу, становить ЗСМ-0 мл.
ФУНКЦІЯ НИРОК І СЕЧОВИПУСКАННЯ / 645
Лімфатичні судини
Нирки мають добре розвинену лімфатичну мережу. Від-
тік лімфи відбувається через грудну лімфатичну протоку у
вени грудної клітки.
Капсула
Ниркова капсула тонка, але щільна. Якщо нирка набря-
кає, то капсула обмежує поширення об’ємного процесу,
внаслідок чого збільшується тканинний тиск (нирковий
інтерстиційний тиск). Це призводить до зменшення швид-
кості клубочкового фільтрування, а також, як уважають,
сприяє посиленню та збільшенню тривалості анурії в разі
гострої ниркової недостатності (див. Розділ 33).
Іннервація ниркових судин
Ниркові нерви супроводжують ниркові судини до їхньо-
го входження у нирку. Вони містять велику кількість пост-
гангліонарних симпатичних нервових і багато аферентних
волокон. Деяке значення має і холінергічна іннервація, яку
виконує блукаючий нерв, однак її функція ще детально не
з’ясована. Симпатичну прегангліонарну іннервацію забез-
печують переважно нижні грудні та верхні поперекові сег-
менти спинного мозку. Тіла постгангліонарних нейронів
містяться у симпатичному гангліонарному ланцюгу, у верх-
ньому брижевому ганглії та вздовж ниркової артерії. Сим-
патичні волокна проходять передусім до аферентних та
еферентних артеріол, проксимальних та дистальних ка-
нальців та юкстагломерулярних клітин (див. Розділ 24).
Крім того, простежується добре виражена норадренерґічна
іннервація товстого висхідного коліна петлі Генле.
Волокна від больових рецепторів, які зумовлюють біль
у разі захворювань нирок, проходять паралельно до сим-
патичних еферентних волокон і входять у спинний мозок
у складі грудних та верхніх поперекових дорсальних корін-
ців. Уважають, що інші аферентні ниркові нерви зумов-
люють так званий реноренальний рефлекс, який полягає
у послабленні активності еферентних нервів в одній нирці
з підвищенням тиску в сечоводі іншої. Це призводить до
посилення екскреції ІЧаЧ води.
НИРКОВИЙ КРОВООБІГ
Кровоплин
У дорослої людини в стані спокою нирки одержують
близько 1,2-1,3 л крові за 1 хв, що становить майже 25%
від хвилинного об’єму (див. табл. 32-1). Нирковий крово-
плин можна виміряти за допомогою електромагнітних
флоуметрів або застосування до нирки принципу Фіка (див.
Розділ 29). Цей принцип полягає у вимірюванні кількості
певної речовини, що надходить за одиницю часу, поділеної
на черезнирковий артеріовенозний градієнт концентрації
цієї речовини. Оскільки нирка фільтрує плазму крові, то
нирковий плин плазми дорівнює кількості речовини, що
екскретується за одиницю часу, поділеній на артеріо-
венозний градієнт концентрації цієї речовини, бо під час
проходження через нирки кількість еритроцитів практично
не змінюється. Як еталон можна використовувати будь-яку
речовину, якщо технічно можливо виміряти її концентра-
цію в плазмі артеріальної крові та плазмі ниркової венозної
крові, і вона не метаболізує, не накопичується в нирці і
нирка її не синтезує, а також якщо ця речовина сама по
собі не впливає на кровоплин.
Нирковий плин плазми можна визначити в разі довен-
ного введенняр-аміногіпурової кислоти (ПАГК) та визна-
чення її концентрації в сечі й плазмі крові. ПАГК фільтру-
ється через клубочки і секретується клітинами канальців
так, що її екстракційний показник (різниця концентрації
в артеріальній крові і концентрації в венозній крові нирки,
поділена на концентрацію в артеріальній крові) є високим.
Наприклад, якщо ПАГК уводять у невеликих дозах, то 90%
ПАГК, розчиненої в артеріальній крові, виводиться за один
цикл проходження крові через нирку. Отже, набув поши-
рення метод, згідно з яким нирковий плин плазми обчис-
люють просто діленням концентрації ПАГК у сечі на кон-
центрацію ПАГК у плазмі крові, нехтуючи її рівнем у веноз-
ній крові нирки. Замість плазми артеріальної крові можна
використовувати плазму венозної крові, яку технічно знач-
но легше визначити, адже концентрація ПАГК у венозній
крові практично така ж, як і в плазмі артеріальної крові,
що надходить до нирки. Значення, яке одержують у цьому
разі, треба називати ефективним нирковим плином плаз-
ми (ЕНПП), наголошуючи, що рівень контрольної речо-
вини в плазмі ниркової венозної крові не визначали. У
людей ЕНПП становить у середньому 625 мл/хв:
Спагіс х V
ЕНПП = —,
ППАГК
де СПАГК - концентрація ПАГК у сечі; ППАГК - концентрація
ПАГК у плазмі крові; V - нирковий кровоплин, мл/хв; ЕНПП
- ефективний нирковий плин плазми (кліренс ПАГК).
Наприклад,
14x0,9 ___ ,
ЕНПП = =630 мл/хв.
0,02
Зазначимо, що ЕНПП, визначений таким способом,
фактично є кліренсом ПАГК. Поняття кліренсу детально
розглянуто нижче.
ЕНПП можна перевести у нирковий плин плазми:
иг1г1 ЕНПП 630 _,лл
НПП = = =700 мл/хв,
ЕП 0,9
де НПП - нирковий плин плазми; ЕНПП - ефективний нир-
ковий плин плазми; ЕП - екстракційний показник (для
ПАГК він становить у середньому 0,9).
Знаючи нирковий плин плазми, можна легко обчислити
нирковий кровоплин за такою формулою:
1 1
НКП = НППх =700х =1273 мл/хв,
1-Нсі 0,55
де НКП - нирковий кровоплин; НПП - нирковий плазмо-
плин; Неї - гематокрит (45%).
Тиск у ниркових судинах
Тиск у клубочкових капілярах було виміряно прямо в
дослідах на щурах, він виявився значно нижчим, ніж
646! РОЗДІЛ 38
передбачали на підставі непрямих вимірювань. Середній
системний артеріальний тиск становить 100 мм рт. ст.,
тиск у капілярах клубочків - близько 45 мм рт. ст. Різниця
артеріального тиску по різні боки клубочка становить
лише 1-3 мм рт. ст., проте в еферентній артеріолі про-
стежується подальше зниження тиску, отже, тиск у пери-
тубулярних капілярах становить близько 8 мм рт. ст. Тиск
у нирковій вені дорівнює приблизно 4 мм рт. ст. Значення
градієнтів тиску у людини і в приматів практично одна-
кові, в обох цих біологічних видів тиск у клубочкових капі-
лярах становить близько 40% від центрального артері-
ального тиску.
Регулювання ниркового кровоплину
Норадреналін звужує ниркові судини, у разі довенного
введення він найвираженіше впливає на міжчасточкові
артерії й аферентні артеріоли. Дофамін синтезується в нир-
ках і зумовлює розширення ниркових судин та посилене
виділення натрію з сечею. Ангіотензин II має судинозву-
жувальну дію, яка на еферентних артеріолах виявляється
яскравіше, ніж на аферентних. Простагландини посилю-
ють кровоплин у кірковій речовині нирки і послаблюють
- у мозковій речовині. Ацетилхолін також має здатність
розширювати ниркові судини. Дієта з високим вмістом біл-
ка теж сприяє підвищенню тиску в клубочкових капілярах,
що призводить до посилення ниркового кровоплину.
Функції ниркових нервів
Стимулювання ниркових нервів посилює продукування
реніну шляхом прямого впливу норадреналіну на р]-адре-
нергічні рецептори юкстагломерулярних клітин (див.
Розділ 24) і збільшує реабсорбцію натрію, можливо, внаслі-
док прямої дії норадреналіну на клітини ниркових каналь-
ців. Проксимальні та дистальні канальці і товсте висхідне
коліно петлі Генле мають багату іннервацію. Якщо у дослі-
дах на тваринах ниркові нерви посилено подразнювати,
то першою реакцією-відповіддю буде підвищення чут-
ливості юкстагломерулярних клітин (табл. 38-2), за яким
настає посилення секреції реніну, потім підвищується
рівень реабсорбції і, зрештою, - ниркова вазоконстрик-
ція, яка призводить до зменшення швидкості клубочкової
фільтрації і ниркового кровоплину. Все ще не з’ясоване
питання, через які рецептори відбувається вплив на реаб-
сорбцію натрію: а- чи р-адренергічні або, можливо, через
обидва типи рецепторів. Невідома ще фізіологічна роль
ниркових нервів у метаболізмі №+, хоча відомо, що
більшість ниркових функцій у пацієнтів, яким пересадили
нирки, є нормальними, незважаючи на те, що трансплан-
товані нирки набувають функційної іннервації лише через
досить тривалий проміжок часу.
Посилене стимулювання симпатичних норадренергіч-
них нервів нирок призводить до значного послаблення нир-
кового кровоплину. Цей ефект відбувається через 0^-адре-
нергічні рецептори і менше - через постсинаптичні а2-
адренергічні рецептори. У стані спокою в ниркових нервах
людини та лабораторних тварин підтримується певний ста-
лий тонічний рівень імпульсів. Коли центральний артері-
альний тиск знижується, то активність барорецепторних
нервів призводить до вазоконстрикції, у тому числі і в нир-
ках. Нирковий кровоплин також зменшується під час фізич-
Таблиця 38-2. Реагування нирки на дозоване подразнення
ниркових нервів1
Частота електрости- мулювання ниркових нервів, Гц Рівень секреції реніну Екскреція натрію з сечею видкість іубочкового фільтрування >5 5 Я ' & о
3 5 т о.
0,25 Немає впливу на базальні показники; підвищення секреції реніну спричинене подразниками нервової природи 0 0 0
0,50 Без впливу на екскрецію натрію з сечею підвищується швидкість клубоч- кового фільтру- вання, нирковий кровоплин 0 0 0
1,0 Підвищується зі зни- женням екскреції натрію з сечею та без зміни швидкості клубочкового фільт- рування чи нирко- вого кровоплину 4 0 0
2,50 Підвищується зі зни- женням екскреції натрію, швидкості клубочкового фільт- рування та нирко- вого кровоплину 4 4 4
1 Відтворено за дозволом з ОіВопа 6Е: ІЧеигаІ сопігої ої гепаї
їипсііоп: Сагсііоуазсиїаг ітріісаііопз. Нурегїепііоп 1989; 13:539)
них навантажень і менше - під час переходу з горизон-
тального положення у вертикальне.
Авторегулювання ниркового кровоплину
У випадку середніх значень артеріального тиску (90-
220 мм рт. ст. у собак) опір ниркових судин змінюється
так, що нирковий кровоплин є порівняно незмінним (див.
рис. 38-4). Авторегулювання за цим типом простежується
також і в інших органах, причиною цього є декілька фак-
торів (див. Розділ 31). Ниркове авторегулювання також
характерне для денервованих та ізольованих нирок, які
піддають штучній перфузії, однак хімічні речовини, що
паралізують гладку мускулатуру судин, пригнічують її.
Безсумнівно, частковою причиною цього є скоротлива
реакція гладкої мускулатури стінки аферентних артеріол,
що піддаються розтягненню. Деяку роль, ймовірно, віді-
грає також N0. За низького перфузійного тиску важли-
вішим стає ангіотензин II, який звужує просвіт еферентних
артеріол, підтримуючи сталість швидкості клубочкового
фільтрування. Це вважають причиною ниркової недостат-
ності, що інколи виникає у пацієнтів з послабленим крово-
постачанням нирки, які приймають медикаменти з групи
інгібіторів ангіотензиноперетворювального ензиму.
ФУНКЦІЯ НИРОК І СЕЧОВИПУСКАННЯ / 647
800
600
Нирковий кровоплин.
СО
400
одиницю часу надходити в сечу лише внаслідок фільтру-
вання конкретного об’єму плазми крові, що містить цю
речовину. Отже, якщо позначити цю речовину літерою X,
то ШКФ буде дорівнювати концентрації X у сечі (Сх), по-
множеній на нирковий кровоплин за одиницю часу V і
поділеній на концентрацію X у плазмі крові Пх:
іііі/а Сх х V
ШКФ = —-----
пх
200
0
Клубочкова фільтрація
70 140 210
Артеріальний тиск, мм рт ст
Рис. 38-4. Авторегулювання у нирках
Нирковий кровоплин та поглинання кисню
Головною функцією кіркового шару нирок є фільтру-
вання значних об’ємів крові через клубочки, саме тому
кровоплин через кірковий шар нирок порівняно інтенсив-
ний і з крові в цьому разі поглинається мало кисню. Нир-
ковий кровоплин становить близько 5 мл/хв на 1 грам нир-
кової тканини (порівняно з 0,5 мл/хв на 1 грам речовини
мозку), а артеріовенозний градієнт концентрації кисню для
нирки в цілому - лише 14 мл/л крові порівняно з 62 мл/л
для мозку і 114 мл/л для серця (див. табл. 32-1). Значення
Р()2 у кірковому шарі нирки - близько 50 мм рт. ст. З іншого
боку, для підтримання осмотичного градієнта в мозковому
шарі нирки достатньо порівняно низького кровоплину.
Отже, немає нічого дивного в тому, що кровоплин у зов-
нішній частині мозкового шару нирки становить близько
2,5 мл/г/хв, а у його внутрішній частині - 0,6 мл/г/хв.
Однак тут постійно відбуваються складні метаболічні
процеси, зокрема, реабсорбція натрію у товстому висхід-
ному коліні петлі Генле (див. нижче), отже, у мозковому
шарі нирки поглинається порівняно велика кількість кисню
крові. Значення РО2 у мозковому шарі нирки становить
близько 15 мм рт. ст. Це зумовлює чутливість мозкового
шару до гіпоксії, якщо кровоплин зменшується. Регулю-
вання за допомогою N0, простагландинів та великої кіль-
кості пептидів серцево-судинної системи завдяки пара-
кринному впливу підтримує баланс між зниженням рівня
кровообігу та метаболічними потребами конкретної ділян-
ки тканини.
КЛУБОЧКОВЕ ФІЛЬТРУВАННЯ
Вимірювання швидкості клубочкового
фільтрування
Швидкість клубочкового фільтрування (ШКФ) у лю-
дей і тварин можна виміряти, визначаючи екскрецію та
рівень у плазмі крові конкретної речовини, яка вільно
фільтрується через клубочки, не секретується і не реабсор-
бується у канальцях. Кількість такої речовини повинна за
Цю величину називають також кліренсом речовини X.
Значення Пх, звичайно, однакове в усіх відділах арте-
ріального кола, і якщо речовина X не метаболізується у
тканинах, то рівень речовини X у плазмі артеріальної крові
можна замінити її рівнем у плазмі периферійної венозної
крові.
Речовини, які використовують для
вимірювання ШКФ
Головні вимоги до таких речовин: вони повинні вільно
фільтруватись у клубочках, не реабсорбуватись і не секре-
туватись у канальцях, не бути токсичними і не метаболі-
зуватись в організмі. Інулін, полімер фруктози з молеку-
лярною масою 5200 Да, що міститься в екстрактах деяких
сортів жоржин, повністю відповідає цим критеріям, його
широко застосовують для визначення ШКФ як у людини,
так і в лабораторних тварин. Застосовують також різно-
манітні радіоізотопи, такі як 5ІСг-ЕВТА, однак інулін є
стандартною речовиною для таких досліджень. У прак-
тичній медицині спочатку довенно струминно вводять
навантажувальну дозу інуліну, а потім інулін уводять кра-
пельно для підтримання сталості його рівня в плазмі
артеріальної крові. Після того, як інулін рівномірно роз-
поділиться в рідких середовищах організму, за чітко вимі-
ряний проміжок часу збирають сечу а також беруть на
дослідження кров пацієнта. Визначають концентрації іну-
ліну в сечі і плазмі та обчислюють значення кліренсу (КІН).
Приклад. Для С|Н = 35 мг/мл; V = 0,9 мг/мл; ПІН =
0,25 мг/мл маємо
„ СіН х V 35x0,9 ,
КіН = —Щ---=------— = 126 мл/хв.
П|Н 0,25
У собак, котів, кролів та багатьох інших ссавців для
визначення ШКФ можна також використовувати кліренс
креатиніну, однак у приматів, зокрема людини, деяка кіль-
кість креатиніну секретується в канальцях і може бути під-
дана реабсорбції. Крім того, методика визначення креа-
тиніну в плазмі крові за низьких рівнів креатиніну дає знач-
ні похибки тому, що в цьому разі, крім самого креатиніну,
враховують невеликі кількості інших складників плазми
крові. Незважаючи на це, визначення кліренсу ендогенного
креатиніну широко застосовують у клінічній практиці. Ці
значення є досить близькі до значень ШКФ, одержаних з
застосуванням інуліну, бо хоча значення С|нх V завищені
внаслідок канальцевої секреції, значення П)Н також зави-
щені завдяки неспецифічним хромогенам, і похибки взаєм-
но нівельовані. Кліренс ендогенного креатиніну легко
визначати, він є важливим показником функції нирок, однак
у тих випадках, коли потрібне точне визначення ШКФ,
648 / РОЗДІЛ 38
недоцільно покладатись на метод з взаємним компенсу-
ванням похибок.
Нормальні показники ШКФ
ШКФ у нормальної людини середньої маси тіла стано-
вить близько 125 мл/хв. Це значення досить чітко корелює
з площею поверхні тіла, проте у жінок воно на 10% нижче,
ніж у чоловіків, незважаючи на поправку щодо площі
поверхні тіла. Значення 125 мл/хв відповідає 7,5 л/год, або
180 л/добу, тоді як нормальний об’єм сечі становить близь-
ко 1 л/добу. Отже, в нормі понад 99% фільтрату реаб-
сорбується. За швидкості клубочкового фільтрування
125 мл/хв нирки за добу відфільтровують об’єм рідини,
що в чотири рази перевищує загальний об’єм рідини в орга-
нізмі, у 15 разів - об’єм позаклітинної рідини і в 60 разів -
об’єм плазми крові.
Регулювання ШКФ
Фільтрування через капіляри клубочків визначають ті
ж фактори, що впливають на фільтрування через будь-які
інші капіляри (див. Розділ ЗО), тобто площа капілярного
ложа, проникність капілярів та різниця гідростатичного
та осмотичного тисків по різні боки стінки капіляра. Для
кожного нефрона справджується закон:
ШКФ = Кф[(Ркк -РкМлкк -*к)Ь
де Кф - коефіцієнт клубочкового фільтрування (добуток
гідравлічної провідності стінки капіляра (тобто його про-
никності) на площу ефективної фільтраційної поверхні);
Ркк - середній гідростатичний тиск у клубочкових капіля-
рах; Рк - середній гідростатичний тиск у канальці; якк -
осмотичний тиск плазми в клубочкових капілярах; лк -
осмотичний тиск плазми у канальцевому фільтраті.
Проникність
Проникність клубочкових капілярів приблизно в 50
разів більша, ніж проникність капілярів скелетних м’язів.
Електрично незаряджені речовини з діаметром молекули
до 4 нм вільно проходять через капілярні мембрани, а
ступінь фільтрування електрично незаряджених молекул
діаметром понад 8 нм близький до нуля (рис. 38-5). Для
молекул з проміжними значеннями діаметра швидкість
фільтрування обернено пропорційна до діаметра молекули.
Однак сіалопротеїни в стінці капілярів клубочка мають
негативний заряд, а дослідження негативно та позитивно
заряджених декстранів свідчать про те, що негативний
заряд сприяє відштовхуванню негативно заряджених
молекул у крові; унаслідок цього фільтрування негативно
заряджених молекул діаметром до 4 нм більш ніж удвічі
повільніше, аніж нейтральних молекул такого ж розміру.
Це, мабуть, пояснює той факт, що концентрація в клубоч-
ковому фільтраті альбуміну (ефективний діаметр молекули
близько 7 нм) становить лише 0,2% його концентрації в
плазмі, хоча на підставі одного лише розміру молекули
можна було б сподіватись значно більшого значення (моле-
кула альбуміну в крові має негативний заряд). Фільтрування
позитивно заряджених речовин дещо швидше, ніж ней-
трально заряджених. Кількість білка у сечі в нормі - до
1000 мг/л, і його джерелом переважно є не клубочковий
Ефективний діаметр молекули, нм
Рис. 38-5. Вплив електричного заряду на кліренс декстранів
з різним розміром молекули. Негативний заряд кпубочкової
мембрани сповільнює проходження негативно заряджених
молекул (аніонні декстрани) та полегшує проходження пози-
тивно заряджених (катіонні декстрани) (відтворено за дозво-
лом з Вгеппег ВМ, Вееімкез В: Тїіе гепаї сігсиїаііопз. Нозр
Ргасі [Зиіу] 1978;13:35).
фільтрат, а клітини канальців, що злущуються в їхній
просвіт. Наявність значної кількості альбуміну в сечі нази-
вають альбумінурією. У разі нефритів різноманітної етіо-
логії в стінках клубочків виникають множинні негативні
заряди, і в цьому випадку альбумінурія простежується
навіть без зміни розміру пор у мембранах.
Неспроможність білків плазми до дифузії через капіляр-
ні мембрани зумовлює так званий ефект Доннана (див.
Розділ 1), що полягає у розподілі полівалентних катіонів:
концентрація аніонів у клубочковому фільтраті на 5% біль-
ша, ніж у плазмі крові, а концентрація полівалентних катіо-
нів, відповідно, - на 5% менша. Однак у більшості випадків
цим ефектом можна знехтувати і вважати склад фільтрату
ідентичним до плазми крові.
Регулювання просвіту капілярів
Сьогодні з’ясовано, що на Кф можуть впливати мезан-
гіальні клітини, скорочення яких спричинює зменшення
Кф, що значно зумовлено зменшенням фільтраційної
поверхні. За допомогою скорочення капілярних петель у
ділянках їхньої біфуркації відбувається перерозподіл кро-
воплину між петлями. Розширюється і звужується просвіт
капілярів завдяки скороченню мезангіальних клітин. Речо-
вини, що впливають на мезангіальні клітини, наведені в
табл. 38-3. Важливим фактором, що регулює скорочення
мезангіальних клітин, є ангіотензин II. Ниркові клубочки
містять рецептори до нього. Є також дані про те, що мезан-
гіальні клітини синтезують ренін.
Гідростатичний і осмотичний тиск
Тиск у капілярах клубочків вищий, ніж в інших капі-
лярах. Причина цього та, що аферентні артеріоли - це
короткі, прямі гілки міжчасточкових артерій. Крім того,
еферентні артеріоли мають порівняно великий опір. Гід-
ростатичному тиску в капілярах протидіє гідростатичний
ФУНКЦІЯ НИРОК І СЕЧОВИПУСКАННЯ / 649
Таблиця 38-3. Фактори, що впливають на скорочення чи
розслаблення мезангіальних клітин
Скорочення Розслаблення
Ендотєліни Ангіотензин II Вазопресин Норадреналін Фактор активування тромбоцитів Фактор росту попередників тромбоцитів Тромбоксан А2 ПГФ2 Лейкотрієни С4 і О4 Гістамін АІХІР Дофамін пге2 цАМФ
тиск у капсулі Шумлянського-Боумена. На противагу йому
діє також Градієнт осмотичного тиску через клубочкові
капіляри (лкк - лк). Значення лк, як звичайно, нехтувано
мале, отже, цей градієнт дорівнює онкотичному тиску біл-
ків плазми крові.
Значення цих тисків, одержані в дослідах на щурах,
показані нарис. 38-6. Середній фільтраційний тиск (СФТ)
на аферентному кінці клубочкового капіляра становить
15 мм рт. ст., однак ближче до еферентного кінця знижу-
ється до нуля, тобто в цій ділянці досягається фільтраційна
рівновага. Це відбувається внаслідок того, що з плазми
крові вилучається рідина, і під час проходження крові через
клубочкові капіляри збільшується онкотичний тиск. Зміни
Дл, обчислені для моделі “ідеального” клубочкового капі-
ляра, відображені на рис. 38-6. Очевидно, що окремі
ділянки клубочкових капілярів не беруть участі в утворенні
клубочкового фільтрату; тобто транспортування речовин
через мембрану клубочкових капілярів залежить більше
від кровоплину, ніж від дифузії (див. Розділ ЗО). Також
очевидним є те, що зменшення швидкості підіймання
кривої Дл внаслідок посилення ниркового плину плазми
посилює фільтрування, не змінюючи Дл, бо в цьому разі
збільшується довжина капіляра, через який відбувається
фільтрування.
Щодо досягнення фільтраційної рівноваги, то між різ-
ними біологічними видами простежуються значні відмін-
ності, крім того, сама методика вимірювання Кф має певні
недоліки. Наразі невідомо, чи у людини стан фільтраційної
рівноваги є практично досяжним.
Зміни ШКФ
Величезна кількість чинників, наведених у попередніх
розділах, безпосередньо впливають на швидкість клубоч-
кового фільтрування (табл. 38-4). Зміни опору судин нирки
внаслідок процесів авторегулювання спрямовані на ста-
білізування фільтраційного тиску, однак коли центральний
артеріальний тиск нижче 90 мм рт. ст., то простежується
різке зменшення швидкості клубочкового фільтрування.
ШКФ підтримується на сталому рівні доти, доки скоро-
чення в еферентних артеріолах переважають над скоро-
ченнями аферентних артеріол, однак треба пам’ятати, що
скорочення і тих, і інших зменшує притік крові до каналь-
ців.
Фільтраційна фракція
Співвідношення ШКФ до ниркового плину плазми
(НПП), яке називають фільтраційною фракцією, в нормі
становить 0,16-0,20. ШКФ піддається змінам значно мен-
ше, ніж НПП. Зі зниженням центрального артеріального
тиску ШКФ знижується менше, ніж НПП внаслідок конст-
рикції еферентних артеріол, і, отже, підвищується фільтра-
ційна фракція.
ФУНКЦІЯ КАНАЛЬЦІВ
Загальні положення
Кількість будь-якої речовини, що пройшла клубочкові
фільтри, дорівнює добутку швидкості клубочкового фільт-
рування на концентрацію цієї речовини в плазмі крові (КІН
х Пх). Клітини канальців можуть додавати речовини до
фільтрату (канальцева секреція), повністю чи частково
видаляти певну речовину з фільтрату (канальцева реаб-
сорбція) чи виконувати обидва процеси. Кількість речо-
вини, що екскретується за одиницю часу (Сх х V), дорівнює
сумі відфільтрованої і сумарної кількості речовини, пере-
несеної через стінки канальців (її значення може бути і
від’ємним). Цю величину часто позначають Тх (рис. 38-
7). Кліренс речовини дорівнює ШКФ, якщо в канальцях
не відбувається ані секреції, ні реабсорбції; перевищує
ШКФ, якщо простежується канальцева секреція; і менший
від ШКФ, якщо в канальцях відбувається реабсорбція.
мм рт. ст.
Аферентний Еферентний
кінець кінець
Ркк 45 45
РК 10 10
лкк 20 35
РсФ ~Ї5~ —0~
Рсф Ркк Рк ТГкк
Безрозмірна відстань уздовж
ідеалізованого капіляра клубочка
Рис. 38-6. Гідростатичний (Ркк) та осмотичний (лкк) тиск у
клубочкових капілярах щурів. Рк - тиск у капсулі Шумлянсь-
кого-Боумена; РСФ-середній фільтраційний тиск. Значення
тск, звичайно, нехтувано мале. Отже, Ар = лкк. ДР = Ркк- Рк
(відтворено за дозволом з Мегсег РЕ, Мабсіох БА, Вгеппег
ВМ: Сиггепі сопсеріз оТ зосііит сНІогісІе апсі ууаіег ігапзрогї Ьу
ІЬе таттаїіап перЬгоп. З \Л/езі Месі 1974; 120:33).
650 / РОЗДІЛ 38
Таблиця 38-4. Чинники, що впливають на швидкість
клубочкового фільтрування
Зміни ниркового кровоплину
Зміни гідростатичного тиску в клубочкових капілярах:
зміни системного артеріального тиску
звуження аферентних чи еферентних артеріол
Зміни гідростатичного тиску в капсулі Шумлянського-
Боумена:
обструкція сечоводу
набряк нирки під щільною нирковою капсулою
Зміни концентрації білків плазми крові:
дегідратація, гіпопротеінемія тощо (незначні фактори)
Зміни фільтраційного коефіцієнта:
зміни проникності клубочкових капілярів
зміни ефективної фільтраційної поверхні
Більшу частину сучасних відомостей про клубочкове
фільтрування і функцію канальців одержано завдяки мето-
диці мікропункцій. Мікропіпетки вводять у канальці живої
нирки і визначають хімічний склад аспірованої канальцевої
рідини за допомогою мікрохімічних методик. Крім того,
за допомогою цих піпеток можна промивати канальці іп
уіуо. Альтернативно іп уйго можна досліджувати доступні
для вирощування і дослідження культури клітин канальців
та ізольовані сегменти канальців.
Механізми канальцевої реабсорбції та
секреції
Невеликі за розміром білки та деякі пептидні гормони
легко реабсорбуються в проксимальних відділах канальців
шляхом ендоцитозу. Інші речовини секретуються або
реабсорбуються в канальцях шляхом пасивної міжклі-
тинної дифузії та полегшеної дифузії в напрямі хімічних
та електричних градієнтів чи активного транспортування
проти цих градієнтів (див. Розділ 1). Рух відбувається за
допомогою йонних каналів, обмінників, котранспортерів
і помп. Багато з них було клоновано, проте їхній регу-
ляторний вплив ще вивчають. Мутації окремих генів, що
відповідають кожному з цих білків, зумовлюють специ-
фічні синдроми, такі як хвороба Дента, синдром Барттера
і синдром Ліддла, а також багато інших мутацій. Цікавим
прикладом є білки поліцистин-1 (РКО-1) і поліцистин-2
(РКО-2). РКО-1, ймовірно, є рецептором до Са2+, що акти-
вує неспецифічний йонний канал, поєднаний з РКО-2.
Функція цього йонного каналу ще невідома, однак обидва
білки мають аномальну структуру в разі полікистозу
нирок (захворювання, за якого ниркова паренхіма посту-
пово заміщується множинними рідинними кистами аж до
розвитку термінальної ниркової недостатності). Дуже важ-
ливо зазначити, що помпи та інші складові частини мемб-
рани, яка контактує з просвітом, відрізняються від анало-
гічних складників базолатеральної мембрани. Саме ця
особливість уможливлює рух через епітелій розчинених
речовин.
Подібно до будь-яких транспортних систем в організмі
активні транспортні системи нирок мають транспортний
максимум (Тм), або максимальну швидкість, з якою вони
можуть транспортувати ті, чи інші речовини. Отже, про-
порційність залежності між швидкістю транспортування
речовини та її концентрацією в розчині зберігається доти,
доки концентрація не перевищує значення Тм для цього
розчину, а за більших концентрацій транспортний механізм
насичується повністю, і подальшого збільшення швидкості
транспортування не простежується. Однак для деяких
систем значення Тм є високими і, отже, їх важко наситити
повністю.
Зазначимо також, що епітелій канальців, подібно до
епітелію тонкої кишки і жовчного міхура, є високопро-
никним епітелієм, у якому через щільні з’єднання між
клітинами (рис. 38-8) можуть проходити вода і деякі
електроліти. Яку частку в загальному водно-електроліт-
ному транспортуванні становить параклітинний шлях,
- питання суперечливе, оскільки це важко практично
визначити. Сучасні дослідження свідчать, що він є досить
значним фактором. Один з доказів цього той, що мутація
гена білка парацеліну-1, який міститься в ділянках щільних
з’єднань та бере участь у реабсорбції М§2', спричинює
втрату функцій цього гена і значні втрати М§2+ і Са2 з
сечею.
Вплив канальцевої реабсорбції та секреції на головні
важливі фізіологічно речовини відображає табл. 38-5.
Реабсорбція натрію
Реабсорбція №+ і СІ відіграє важливу роль у водно-
електролітному балансі організму. Крім того, транспор-
тування №+ поєднується з рухом через стінки канальців
йонів Н+, інших електролітів, глюкози, амінокислот, орга-
нічних кислот, фосфатів тощо. Головні котранспортні й
обмінні системи в різних частинах нефрона наведені в табл.
38-6. У проксимальних відділах канальців, товстій частині
висхідного коліна петлі Генле, дистальних відділах каналь-
ців і збирних трубочках Иа+ пересувається шляхом котранс-
портування або обміну між канальцевою рідиною й епіте-
ліальними клітинами канальців за спаданням концентрації
ШКФ х Пх + Тх = СХУ
Приклад Інулін Приклад: Глюкоза Приклад ПАГК
Рис. 38-7. Функція канальців. Пояснення символів див. у тесті
підручника.
ФУНКЦІЯ НИРОК І СЕЧОВИПУСКАННЯ / 651
Рис. 38-8. Механізм реабсорбції І\Іа+ у проксимальному відділі
канальця. Суцільними лініями показано активне транспорту-
вання, штриховими - котранспортування або дифузію. Звер-
ніть увагу, що І\Іа+ переходить з просвіту канальця всереди-
ну клітин шляхом котранспортування, і що І\Іа+ і Н2О пере-
ходять у просвіт канальця в ділянках щільних з’єднань. Біо-
електричні потенціали клітинної мембрани позначені знаками
+ та -.
та електричними градієнтами й активно переходить з цих
клітин в інтерстиційний простір. Отже, N3' активно транс-
портується зі всіх відділів ниркових канальців, окрім тонкої
частини петлі Генле; а переходить в інтерстиційний простір
за допомогою ензиму № -К -АТФ-ази. Механізм дії цієї
йонної помпи детально розглянуто в Розділі І. Вона виво-
дить три йони На в обмін на два йони КГ, що надходять у
клітину.
Клітини канальців у ділянці стінок з’єднані щільно з
боку, оберненого в просвіт канальця, однак уздовж зов-
нішніх країв між ними є проміжки. Велика кількість На"
виводиться внаслідок активного транспортування в ці від-
галуження інтерстиційного простору, які названо лате-
ральними міжклітинними проміжками (див. рис. 38-8).
Рідина, що утворюється внаслідок канальцевої реаб-
сорбції, помірно гіпертонічна, і вода пасивно рухається за
осмотичним градієнтом, що утворився після її абсорбції в
епітеліальні клітини канальців. Сьогодні з’ясовано, що
апікальні мембрани проксимальних клітин канальців міс-
тять водні канали, які полегшують рух рідини (див. нижче).
З клітин вода переміщається у латеральні міжклітинні
проміжки. Швидкість, з якою вода і розчинені в ній речо-
вини рухаються з латеральних міжклітинних проміжків та
інших відділів інтерстицію в просвіт капілярів, визначає
закон Старлінґа, що описує рух через стінки будь-яких капі-
лярів, тобто зміни гідростатичного й осмотичного тиску в
міжклітинній рідині та в капілярах (див. Розділ ЗО). Речо-
вини На* і Н2О зворотно проникають у просвіт канальців
через міжклітинні з’єднання, особливо в тому випадку,
якщо латеральні міжклітинні проміжки розширені.
Реабсорбція глюкози
Глюкоза, амінокислоти і НСО3 у початкових відділах
проксимальних канальців піддаються реабсорбції разом з
Иан (рис. 38-9). В інших відділах канальців реабсор-
бується в парі з СІ . Глюкоза є типовим представником
речовин, які виходять з сечі шляхом вторинного активного
Таблиця 38-5. Транспортування у нирках різноманітних складників плазми крові у здорової дорослої людини, що
застосовує звичайну дієту
Речовина За 24 години Реабсорбція, % Локалізація
фільтрація реабсорбція секреція есксреція
І\Іа+, мекв 26 000 25 850 150 99,4 П, г, д, т
К+, мекв 600 5602 502 90 93,3 п, г, д, т
СГ, мекв 18 000 17 850 150 99,2 п, г, д, т
НС03 , мекв 4 900 4 900 0 100 п.д
Сечовина, ммоль 870 4603 410 53 П, г, д, т
Креатинін, ммоль 12 14 14 12
Сечова кислота, ммоль 50 49 4 5 98 п
Глюкоза, ммоль 800 800 0 100 п
Всі складники, мосм 54 000 53 400 100 700 98,9 п, г, д, т
Вода, мл 180 000 179 000 1000 99,4 п, г, д, т
1 П - проксимальні відділи канальців; Г - петлі Генле; Д - дистальні відділи канальців; Т - збірні трубочки.
2 К+ реабсорбується і секретується.
3 Сечовина рухається як у нефрон, так і з нього.
4 Секреція креатиніну у людини є варіабельною, і він, можливо, реабсорбується
652 / РОЗДІЛ 38
Таблиця 38-6. Транспортні білки, які переміщують І\1а+ і СГ через апікальні мембрани клітин ниркових канальців1
Ділянка Апікальний транспортний білок Функція
Проксимальний відділ канальця КТ І\1а7глкжози КТ І\Іа7Рі КТ 1\1а7амінокислот КТ 1\1а7лактату Обмінник І\Іа7НР Обмінник СІ7ОН Захоплення І\1а+, глюкози, Рі, амінокислот, лактату, СГ Звільнення від Н+
Товста частина висхідної петлі КТ І\1а+, 2СГ, К+ Обмінник І\Іа7ІТ К+-канали Захоплення І\1а+, СГ, К+ Звільнення від К+ і Н+
Дистальний звивистий каналець КТ МаСІ Захоплення І\1а+ і СГ
Збірна трубочка І\1а+-канал (ІЧаЕК) Захоплення І\1а+
1 Поглинання відповідає руху речовин з просвіту канальця всередину клітини; КТ - котранспортер; Рі - неорганічний фосфат
(відтворено за дозволом з ЗсИпегтапп ЛЗ, Зауедґі ЕІ: Кісіпеу РИузіоІоду. І_ірріпсоіЬРауеп, 1998).
транспортування. Вона фільтрується зі швидкістю близько
100 мг/хв (80 мг/дл плазми х 125 мл/хв). Практично вся
глюкоза реабсорбується, і за добу з сечею виділяється не
більше декількох міліграмів. Кількість реабсорбованої
глюкози пропорційна до відфільтрованої і, отже, дорівнює
добутку концентрації глюкози в плазмі крові Пг на ШКФ,
якщо цей добуток не перевищує транспортного максимуму
Рис. 38-9. Реабсорбція різних речовин у проксимальній
частині канальця; КР/П - відношення концентрації речовини
у канальцевій рідині до її концентрації в плазмі крові (з дозволу
ЕС Кесіог Л).
Тмг; однак якщо Тмг перевищено, то кількість глюкози в
сечі збільшується (рис. 38-10). Значення ТмІ становить
близько 375 мг/хв у чоловіків і 300 мг/хв у жінок.
Нирковий поріг для глюкози - це такий рівень глюкози
в плазмі крові, за якого вона з’являється в сечі в більш ніж
нормальних - слідових кількостях. Логічно було б очіку-
вати, що нирковий поріг для глюкози повинен становити
близько 300 мг/дл, тобто 375 мг/хв (Тмг), поділене на
125 мл/хв (ШКФ). Однак реальний нирковий поріг для глю-
кози - близько 200 мг/дл плазми артеріальної крові, що
відповідає близько 180 мг/дл у венозній крові. На рис. 38-
10 пояснено, чому реальний нирковий поріг для глюкози
менший від теоретично розрахованого. Ідеальну криву
можна було б одержати, якби Тмг у всіх клубочках був од-
наковим і глюкоза повністю вилучалась з кожного каналь-
ця (за умови, що відфільтрована кількість є меншою від
Тм(). Та насправді у людини реальна крива заокруглена і
значно відхиляється від ідеальної. Це відхилення нази-
вають сплай (з англ. зріау - сплющення). Значення сплаю
обернено пропорційне до значення активності, з якою транс-
портний механізм зв’язує ту речовину, яку переносить.
Механізм транспортування глюкози
Процес реабсорбції глюкози у нирках нагадує анало-
гічний процес у кишці (див. Розділ 25). Глюкоза і
зв’язуються зі спільним носієм - 8ОГТ 2, що міститься у
внутрішній мембрані канальця (рис. 38-11), глюкоза пере-
ходить усередину клітини під час руху №’ за його елект-
ричним та хімічним градієнтами. У подальшому №+ вихо-
дить з клітин у латеральні міжклітинні проміжки, а глюкоза
за допомогою 6ШТ 2 переходить в інтерстиційну рідину.
В дослідах на щурах з’ясовано, що 86ЬТ 1 і 6ШТ 1 також
беруть деяку участь у транспортуванні глюкози. Отже,
транспортування глюкози у нирках і в кишці є прикладом
вторинного активного транспортування.
Зазначимо, що сі-ізомер глюкози специфічно зв’язується
спільним носієм, унаслідок цього швидкість транспортуван-
ня сі-глюкози в кілька разів перевищує швидкість транспор-
тування 1-глюкози. Рослинний глікозид флоризин здатний
інгібувати транспортування глюкози як у нирках, так і у киш-
ці шляхом конкуренції з глюкозою за зв’язування з носієм.
ФУНКЦІЯ НИРОК І СЕЧОВИПУСКАННЯ / 653
Інтерстиційна
рідина К+
Глюкоза 6І_ЦТ ЇЇ}-
Г Клітини початку
проксимального
канальця
Просвіт
канальця
Глюкоза
Концентрація глюкози
в плазмі крові, Пг
Рис. 38-10. Угорі: зв’язок між концентрацією в плазмі крові П
та екскрецією глюкози й інуліну. Унизу: зв’язок між концент-
рацією в плазмі крові Пг та реабсорбцією Рг глюкози.
І\Іа
Глюкоза 6ШТ ^"| 861Т 2а+
Г Клітини кінця
проксимального
X, канальця )
Рис. 38-11. Реабсорбція глюкози. У початковому відділі
проксимальної частини канальця відбувається котранс-
портування глюкози і №+ з просвіту канальця за допомогою
86І_Т 2; Ма+ виводиться з клітин канальця Ма+-К+-АТФ-азою,
що міститься в базолатеральних мембранах, глюкоза пере-
ходить в міжклітинну рідину за допомогою 6І_0Т 2. У щурів
деяка кількість глюкози виводиться за допомогою 86І_Т 1 і
6І_0Т 1 у кінцевому, прямому відрізку проксимальної частини
канальця. 86І_Т 1 переносить два йони №+ на кожну молекулу
глюкози, тоді як 86І_Т 2 - один йон №+.
К
Додаткові приклади вторинного активного
транспортування
Шляхом вторинного активного транспортування відбу-
вається перенесення величезної кількості інших речовин.
Потрібну для цього енергію забезпечує активне транспор-
тування №+ за межі клітин ниркових канальців. До таких
речовин належать деякі амінокислоти, лактат, фосфат (Рі),
Н+іС1 .
Реабсорбція амінокислот і глюкози найінтенсивніша в
початковому відділі проксимального звивистого канальця.
Процес реабсорбції відбувається тут так само, як і в кишці
(див. Розділ 25). Головні носії у внутрішній мембрані
канальця виконують транспортування Иа+, тоді як носії
базолатеральних мембран не беруть участі в транспорту-
ванні Иа+. Йони №' виходять з клітин за допомогою ензиму
№ -К -АТФ-ази, а амінокислоти переходять в інтерсти-
ційну рідину шляхом пасивної чи полегшеної дифузії.
У товстій частині висхідного коліна петлі Генле разом
з №' і К' реабсорбується невелика кількість С1 (див. ниж-
че). Крім цього, у нирці було виявлено два представники
родини СГ-каналів. Ця родина має 12 трансмембранних
доменів і також наявна в м’язах та інших тканинах. Мутації
гена одного з ниркових каналів призводять до утворення
кальційвмісних каменів нирок та гіперкальцинурії (хво-
роба Дента), однак ще не з’ясовано, як пов’язані транспор-
тування Са+ і СІ .
Транспортування ПАГК
Процес транспортування ПАГК наочно відображає
роботу активних транспортних систем, які секретують
речовини у канальцеву рідину. Залежність швидкості
фільтрування ПАГК від її концентрації в плазмі крові є
лінійною, проте швидкість секреції ПАГК збільшується
відповідно до зростання ППАГК лише доти, доки ППАГК не
перевищує максимальної швидкості секреції (ТмПАГК) (рис.
38-12). Якщо ППАГК низька, то КПАГК високий; однак якщо
ППАгк збільшується понад ТмПАГК, то КПАГК різко зменшу-
ється. У цьому разі КПАГК фактично наближається до клі-
ренсу інуліну (КІН) (рис. 38-13), оскільки частка секреції у
загальному об’ємі екскреції стає щораз меншою. І навпаки,
якщо концентрація глюкози в плазмі крові Пг нижче нирко-
вого порогу, то кліренс глюкози практично дорівнює нулю,
та зі збільшенням Пг вище ниркового порогу Кг поступово
наближається до К|Н.
Рис. 38-12. Зв’язок між концентрацією в плазмі крові П й
екскрецією ПАГК та інуліну.
654 / РОЗДІЛ 38
Глюкоза, мг/дл
200 400 600
600
500-
400-
300-
200
100
0
і І І-----1 і-------1 І
— 20 40 60 80
| ПАГК, мг/дл
Інулін
Концентрація в плазмі крові
Рис. 38-13. Кліренс інуліну, глюкози та ПАГК за різних кон-
центрацій кожної з речовин у плазмі крові людини.
Застосування К|ІЛІК для визначення ефективного нир-
кового плину плазми описано вище.
Канальцева секреція інших речовин
Крім ПАГК, у канальцеву рідину активно секретують
похідні гіпурової кислоти, фенол червоний та інші суль-
фафталеїнові барвники, пеніцилін та велика кількість йодо-
ваних барвників. До речовин, які синтезуються в організмі
і піддаються канальцевій секреції, належать також різно-
манітні ефірні сульфати, глюкуроніди, 5-гідроксиіндол-
оцтова кислота - головний метаболіт серотоніну (див. Роз-
діл 4).
Канальцево-клубочковий зворотний зв’язок
та клубочково-канальцевий баланс
Сигнали, що надходять від ниркових канальців, за меха-
нізмом зворотного зв’язку впливають на клубочкове фільт-
рування. Якщо швидкість проходження рідини через вис-
хідне коліно петлі Генле і початкову частину дистального
відділу канальця збільшується, то сповільнюється клу-
бочкове фільтрування у відповідному нефроні, і навпаки,
зі зменшенням швидкості потоку рідини простежується
збільшення ШКФ (рис. 38-14). За допомогою цього явища,
яке називають канальцево-клубочковим зворотним
зв’язком, забезпечена сталість навантаження на дистальні
відділи канальців. Роль рецептора в цьому разі відіграє
щільна пляма; ШКФ регульоване шляхом констрикції або
дилатації аферентної артеріоли. Можливим трансмітером
констрикції вважають тромбоксан А2.
Навпаки, збільшення ШКФ зумовлює посилення реаб-
сорбції води і розчинених у ній речовин, головно це від-
бувається у проксимальних відділах канальців, отже, частка
реабсорбованих речовин є на сталому рівні. Цей процес
називають клубочково-канальцевим балансом; він най-
яскравіше виявляється під час транспортування №'. Зі
зміною швидкості фільтрування упродовж декількох се-
кунд відбувається відповідна зміна швидкості реабсорбції
На*, отже, малоймовірно, що в цьому процесі беруть участь
екстраренальні гуморальні фактори. Одним з чинників є
онкотичний тиск у перитубулярних капілярах. За високої
ШКФ, доки кров досягне еферентних артеріол та їхніх капі-
лярних гілок, досить значно підвищується онкотичний тиск
її плазми. Внаслідок цього посилюється реабсорбція На4 з
просвіту канальця.
Однак відомо, що в цьому процесі також беруть участь
ще не з’ясовані внутрішньониркові механізми.
Синдром Фанконі
Унаслідок дії різноманітних токсичних речовин, набу-
тих захворювань, таких як дефіцит вітаміну О, або спад-
кових аномалій, наприклад, вродженого несприйняття глю-
кози, кількість АТФ у клітинах проксимальних відділів
канальців різко зменшується. У цьому разі послаблюється
виведення йонів №+ за межі клітини за допомогою
К+-АТФ-ази і, як наслідок, виникають генералізовані пору-
шення вторинного активного транспортування глюкози,
амінокислот, Н+ і фосфату. Результатом цього є синдром
Фанконі, який супроводжується метаболічним ацидозом,
глюкозурією, аміноацидурією і фосфатурією.
ЕКСКРЕЦІЯ ВОДИ
У нормі клубочки за добу фільтрують 180 л рідини, а
середній добовий діурез становить у середньому 1 л. Така
ж кількість розчинених речовин може за добу виводитись
в об’ємі сечі 500 мл з концентрацією 1400 мосм/кг чи в
об’ємі сечі 23,3 л з концентрацією 30 мосм/кг (табл. 38-7).
Тиск у ниркових
артеріолах
▼
Тиск у ниркових
капілярах
---- ШКФ
Канальцево-
клубочковий
зворотний
зв’язок
Реабсорбція речовин
у проксимальному канальці
Клубочково-
канальцевий
баланс
Надходження ______х
рідини до петлі Генле
І
Реабсорбція речовин
► у товстій частині
висхідного коліна
Рис. 38-14. Механізми клубочково-канальцевого балансу та
канальцево-клубочкового зворотного зв’язку.
ФУНКЦІЯ НИРОК І СЕЧОВИПУСКАННЯ / 655
Таблиця 38-7. Зміни метаболізму води, спричинені дією вазопресину в людей. У всіх випадках осмотичне навантаження
екскретованої рідини становить 700 мосм/день
ШКФ, мл/хв Відсоток реабсорбції води Діурез, л/добу Концентрація сечі, мосм/кг Н2О Втрата або надлишок рідини, л/добу
Ізотонічна плазмі сеча 125 98,7 2,4 290
Вазопресин (максимальний антидіурез) 125 99,7 0,5 1400 +1,9
Відсутність дії вазопресину (нецукровий діабет) 125 87,1 23,3 ЗО -20,9
Наведені цифри свідчать про два важливі факти: по-перше,
реабсорбується принаймні 87% води, навіть якщо добовий
діурез становить 23 л; по-друге, реабсорбція води може
коливатись у широких межах без впливу на екскрецію
розчинених у ній речовин. Отже, якщо сеча концентрована,
то вода затримується в організмі, якщо ж сеча низької кон-
центрації, то вода виходить. Обидва ці факти мають важ-
ливе значення для раціонального використання води і
підтримання сталості осмотичного тиску рідких середо-
вищ організму. Водний баланс регулює здебільшого вазо-
пресин, який впливає на збірні трубочки.
Проксимальний відділ канальця
У проксимальному відділі канальця відбувається транс-
портування багатьох речовин, проте, за даними мікро-
пункцій, осмотичний тиск рідини вздовж усього прокси-
мального відділу канальця дорівнює осмотичному тиску
плазми крові (див. рис. 38-9). Отже, в проксимальному
відділі канальця вода реабсорбується пасивним шляхом за
осмотичними градієнтами, що утворилися внаслідок актив-
ного транспортування розчинених речовин, і таким спосо-
бом, підтримується ізотонічність рідини. Рух води полег-
шує наявність водних каналів в апікальних мембранах епі-
теліальних клітин проксимального відділу канальця; Н§С12
зворотно інгібує водні канали. Ці канали в проксимальному
відділі канальця складаються з білка аквапорину-1. Сьо-
годні виділено чотири додаткові представники цієї родини
білків. Вони забезпечують рух води шляхом простої дифу-
зії. Аквапорин-2, який на 42% гомологічний аквапорину-
1, локалізований у клітинах збірних трубочок. Він є транс-
мітером відповіді цих клітин надію вазопресину (див. ниж-
че і Розділ 14). Аквапорин-3 локалізований у базолате-
ральній частині мембран збірних трубочок і бере участь у
транспортуванні сечовини, гліцерину і води. Аквапорин-
4 виявляють у мозку, а аквапорин-5 - у слинних і слізних
залозах, а також у дихальній системі.
Хоча вазопресин не впливає на аквапорин-1, цей білок
відіграє важливу роль у збереженні води. У разі його нока-
уту в дослідах на мишах проникність проксимального від-
ділу канальця для води знижується на 80%, тварини втра-
чають до 35% маси тіла; у разі збезводнення осмотичний
тиск плазми у них підвищується до 500 мосм/кг Н2О,
незважаючи на те, що аквапорини-2, -3, і -4 є інтактними.
Концентрація інуліну (який не реабсорбується) в рідині
у кінці проксимального відділу канальця в 2,5-3,3 раза
більша, ніж у плазмі крові. З цього випливає, що під час
проходження через проксимальний відділ канальця реаб-
сорбується 60-70% води і розчинених у ній речовин (рис.
38-15).
Петля Генле
Як зазначено вище, петлі юкстамедулярних нефронів
значно заглиблюються в мозкові піраміди, перш ніж впа-
дають у дистальні звивисті канальці в кірковому шарі, і
всі збірні трубочки знову проходять скрізь ниркові піра-
міди, впадаючи через верхівки пірамід у ниркову миску. В
міжклітинній рідині пірамід простежується поступове
збільшення осмоляльності: осмоляльність у ділянці верхі-
вок пірамід становить близько 1200 мосм/кг Н2О, що май-
же в чотири рази перевищує осмоляльність плазми. Низ-
хідне коліно петлі Генле проникне для води, а висхідне -
ні (табл. 38-8). Йони №', К+ і СІ реабсорбуються з товстого
сегмента висхідного коліна шляхом котранспортування
(див. нижче). Отже, якщо вода переходить у гіпертонічну
міжклітинну рідину, то рідина у низхідному коліні петлі
Рис. 38-15. Зміни відсоткової частки відфільтрованої кількості
речовин, що залишаються у канальцевій рідині уздовж неф-
рона (відтворено за дозволом з Зиіііуап І_Р, бгапіііат 33: Рііу-
зіоіоду оїіііе Кібпеу, 2псі еб. Ьеа&ЕеЬідег, 1982).
656 / РОЗДІЛ 38
Таблиця 38-8. Проникність і транспортування різних
сегментів нефрону1
Проникність Активне транспор- тування Ма+
Н2О сечовина МаСІ
Петля Генле Тонке низхідне 4+ + + 0
коліно Тонке висхідне 0 + 4+ 0
коліно Товсте висхідне 0 ± ± 4+
коліно Дистальний зви- ± ± ± 3+
вистий каналець Збірна трубочка Кіркова частина 3+* 0 ± 2+
Зовнішня моз- 3+* 0 + 1 +
кова частина Внутрішня моз- 3+* 3+ + 1 +
кова частина
1 Результати отримані з досліджень нирок кроля і людини.
Дані, позначені *, отримані під впливом вазопресину; +1 - за
відсутності вазопресину (модифіковано та відтворено за до-
зволом з Кокко ЗР: РелаІ сопсепігаііпд .апсі бііиііпд гпесіїа-
ПІ5ГТ15. Нозр Ргасі [ЕеЬ] 1979;110:14).
Генле також стає гіпертонічною. У висхідному коліні вона
більше розведена і, якщо вона досягає верхівки, то вже
має осмотичний тиск, нижчий від плазми внаслідок руху
№' і СІ за межі просвіту канальця. Під час проходження
через петлю Генле реабсорбується ще близько 15% води,
тому в дистальний відділ канальця надходить лише 20%
від попередньої кількості води, і концентрація інуліну тут
уже в п’ять разів переважає його концентрацію в плазмі
крові.
Функція транспортного механізму у товстому висхід-
ному коліні петлі Генле залежить від носія, який з просвіту
канальця переносить всередину клітин один йон №’, один
йон К і два йони СІ (рис. 38-16). Крім того, № -К’-АТФ-
аза активно виводить №‘ з клітин у міжклітинний простір;
у цій ділянці ниркового канальця вміст цього ензиму є най-
вищим; К переміщається назад у просвіт канальця шля-
хом простої дифузії. Один йон СІ пасивно дифундує в між-
клітинний простір, а ще один переміщається разом з К+.
Білок, що виконує транспортування Ка+-К+-2С1 у тов-
стій частині висхідного коліна петлі Генле, має 12 транс-
мембранних доменів. їхні амінові і карбоксильні кінці
повернуті досередини клітини. Цей білок належить до
родини транспортерів, які містяться в багатьох інших орга-
нах, у тім числі слинних залозах, шлунково-кишковому
тракті і дихальних шляхах.
Дистальний відділ канальця
Дистальний відділ канальця, особливо його початкова
частина, є, фактично, продовженням товстого сегмента
висхідного коліна петлі Генле. Він порівняно непроникний
до води, і подальша реабсорбція розчинених речовин зі
збереженням розчинника призводить до ще більшого
Рис. 38-16. Котранспортування Ма+, К+ і СІ~ шляхом вторин-
ного активного транспортування в клітинах товстої частини
висхідного коліна петлі Генле. Суцільними лініями позначено
активне транспортування або вторинне активне транспорту-
вання, штриховими - дифузію. Активне транспортування за
допомогою Ма+-К+-АТФ-ази позначено стрілками у колі.
розведення канальцевої рідини. Ця ділянка канальця дає
всього 5% у загальну реабсорбцію води.
Збірні трубочки
Збірні трубочки складаються з двох частин: кіркової і
мозкової, через які фільтрат переходить з кори у ниркову
миску. Осмотичний тиск і об’єм рідини, що міститься в
збірних трубочках, залежить від кількості вазопресину, що
впливає на трубочки. Цей антидіуретичний гормон, що
його виділяє задня частка гіпофіза, збільшує проникність
збірних трубочок до води. Цього ефекту досягають швид-
кою появою водних каналів з аквапорину-2 на люмінальній
мембрані головних клітин (див. Розділ 14). За наявності
вазопресину, достатнього для максимального антидіурезу,
вода виходить з гіпотонічної рідини і надходить через
кіркові збірні трубочки у міжклітинний простір кіркового
шару, а рідина у збірних трубочках стає ізотонічною. За
цим механізмом виходить до 10% відфільтрованої води.
Далі ця ізотонічна рідина надходить у мозкові збірні
трубочки; концентрація інуліну в ній у 20 разів перевищує
його концентрацію в плазмі. В гіпертонічному міжклітин-
ному просторі мозкового шару реабсорбується ще 4,7%
фільтрату, внаслідок чого утворюється концентрована сеча,
де концентрація інуліну перевищує його концентрацію в
плазмі вже в 300 разів. Осмотичний тиск сечі у людини
може досягати 1400 мосм/кг Н2О, що майже в п’ять разів
перевищує осмотичний тиск плазми крові; у цьому разі
реабсорбується 99,7% відфільтрованої води і лише 0,3% її
з’являється в сечі (див. табл. 38-7). У інших біологічних
видів здатність концентрувати сечу є навіть більшою. Мак-
симальний осмотичний тиск сечі у собак становить близь-
ко 2500 мосм/кг, у лабораторних щурів - 3200 мосм/кг, а в
деяких видів пустельних плазунів - до 5000 мосм/кг.
Без вазопресину епітелій збірних трубочок порівняно
непроникний для води. Отже, рідина є гіпотонічною, і
великі її кількості надходять у ниркову миску. У людини
осмоляльність сечі може становити 30 мосм/кг Н2О. Не-
проникність дистальних відділів нефрона не є абсолют-
ФУНКЦІЯ НИРОК І СЕЧОВИПУСКАННЯ / 657
ною; навіть якщо вазопресину нема, то разом з електролі-
тами виводиться близько 2% відфільтрованої рідини. У
будь-якому разі екскретується до 13% відфільтрованої ріди-
ни і діурез у цьому випадку може сягати понад 15 мл/хв
(21,6 л/добу). Дані про вплив наявності і відсутності дії
вазопресину на метаболізм води наведені в табл. 38-7.
Причини нецукрового діабету - захворювання, спричи-
нюваного дефіцитом вазопресину чи недостатньою чутли-
вістю органів-мішеней до цього гормону, - описані у Роз-
ділі 14. Наприклад, у разі нефрогенного нецукрового діа-
бету нема реакції збірних трубочок на вазопресин. Описано
дві форми цього захворювання. Перша зумовлена мутацією
гена У2-рецептора, що робить його нечутливим. Ген V,-
рецептора розміщений в Х-хромосомі, тип успадкування
- зчеплений зі статтю, рецесивний. Друга форма спричи-
нена мутацією аутосомного гена аквапорину-2.
Течійно-протитечійний механізм
Ефективна робота концентраційного механізму зале-
жить від підтримання збільшуваного градієнта осмотич-
ного тиску вздовж мозкових пірамід. Цей градієнт ство-
рюють петлі Генле, які діють як течійно-протитечійний
множинний механізм, і прямих судин, що відіграють роль
течійно-протитечійних обмінників.
Течійно-протитечійний механізм - це система, у якій
вхідний потік на деякій відстані рухається паралельно до
вихідного потоку в безпосередній близькості від нього,
однак у протилежному напрямі.
Цей процес відбувається як у петлях Генле, так і в пря-
мих судинах у мозковій речовині нирки (див. рис. 38-2).
Функція кожної петлі Генле як протитечійного помножу-
вача залежить від активного транспортування йонів №’ і
СГ за межі товстої частини висхідного коліна (див. вище),
високої проникності тонкої частини низхідного коліна для
води (див. табл. 38-8), надходження рідини від прокси-
мального відділу канальця та її відтікання у дистальний
відділ канальця. Найліпше цей процес можна зрозуміти
на підставі гіпотетичної моделі послідовних кроків для
досягнення рівноваги. Щоправда, іп уіуо ці кроки не про-
стежуються, і рівновага підтримується в будь-який момент
часу (якщо осмотичний градієнт не “вимивається”). Ці
кроки відображені на рис. 38-17 для моделі кіркового неф-
рона без тонкої частини висхідної петлі. Спочатку уявимо
ситуацію, коли осмотичний тиск уздовж низхідної та вис-
хідної петель, а також у міжклітинному просторі становить
300 мосм/кг Н2О (див. рис. 38-17А). Тепер припустимо,
що помпи у товстій частині висхідної петлі можуть
випомпувати з канальцевої рідини в міжклітинну рідину
100 мосм/кг На’ і СІ , збільшивши осмотичний тиск між-
клітинної рідини до 400 мосм/кг Н2О. У відповідь на це
вода з тонкої частини низхідної петлі переходить у між-
клітинну рідину, зрівноважуючи осмотичний тиск між-
клітинної рідини і рідини у тонкій частині висхідної петлі
(див. рис. З8-17В). Проте в тонку частину висхідної петлі
постійно надходить рідина з проксимального відділу
канальця, осмотичний тиск якої становить 300 мосм/кг
Н2О (див. рис. 38-17С), отже, зменшується градієнт, проти
якого відбувається викачування №’ і СЕ, і ще більше цих
йонів надходить у міжклітинну рідину (див. рис. 38-17).
Водночас до дистального відділу канальця надходить гіпо-
43 367-2
тонічна рідина, а ізотонічна, та в подальшому гіпертонічна
рідина надходить у товсту частину висхідного коліна. Цей
процес багаторазово повторюється, що призводить у кін-
цевому підсумку до створення градієнта осмотичного тиску
між верхньою та нижньою частинами петлі.
У юкстамедулярних нефронах, які мають значну дов-
жину петель і тонких висхідних колін, осмотичний градієнт
простежується на значній довжині, і осмотичний тиск на
верхівці петлі є найбільшим. Причина цього та, що тонка
частина висхідного коліна порівняно непроникна для води,
але проникна для йонів На' та СІ . Отже, Иа+ і СІ пере-
міщаються за концентраційними градієнтами в міжклі-
тинний простір, що зумовлює додаткове пасивне протите-
чійне помноження. Чим більша довжина петлі Генле, тим
вищий осмотичний тиск виникає на верхівці піраміди.
Осмотичний градієнт у мозкових пірамідах не був би
довго, якби N3^ і сечовина, які містяться в міжклітинних
проміжках, потрапляли у кровообіг. Ці речовини є в піра-
мідах тому, що прямі судини відіграють роль протите-
чійних обмінників (рис. 38-18). Вони дифундують з кро-
воносних судин, які проходять до кіркового шару, у судини,
що опускаються в піраміди. На противагу цьому вода
дифундує з низхідних судин у фенестровані висхідні суди-
ни. Отже, електроліти та інші розчинені речовини мають
тенденцію повертатись до кровоносного русла кіркового
шару, а вода оминає його, внаслідок чого підтримується
підвищений осмотичний тиск. Вода зі збірних трубок,
також виходить по прямих судинах і вливається в загальний
кровообіг. Протитечійний обмін - це пасивний процес,
який залежить від руху води, і він не зміг би забезпечити
Градієнт осмотичного тиску вздовж пірамід, якби процес
протитечійного помноження в петлях Генле припинився.
Варто зазначити, що в петлі Генле і збірних трубочках
(під впливом вазопресину) створюється дуже значний
осмотичний градієнт. Власне протитечійна система умож-
ливлює це, розподіляючи градієнт уздовж сукупності
канальців загальною довжиною понад 1 см, ніж створюючи
його по різні боки шару клітин лише декілька мікрометрів
завтовшки. У тварин є інші приклади протитечійних сис-
тем. Один з них - теплообмін між артеріальними та веноз-
ними судинами кінцівок. Цей процес незначно просте-
жується і в людини, однак найбільше виражений у ссавців,
які живуть у холодній воді. Тепло передається з артеріаль-
ної крові, що йде до кінцівок, у венозну, яка надходить до
тулуба, внаслідок чого дистальні частини кінцівок є холод-
ними, а організм у цілому економить тепло.
Роль сечовини
Сечовина також бере участь у створенні осмотичного
градієнта в мозкових пірамідах і концентруванні сечі в
збірних трубочках. Її транспортують специфічні транспор-
тери; найвірогідніше, це відбувається шляхом полегшеної
дифузії. Є принаймні чотири ізоформи транспортного білка
в нирках: ПТ-А (від ГІТ-А1 до ЦТ-А4), і ІІТ-В, що містяться
в еритроцитах. Сечовина рухається за межі проксималь-
ного канальця, однак, за винятком внутрішньої частини
збірної трубочки, решта канальцевого епітелію непроникна
для цієї речовини. Отже, внаслідок видалення води з петлі
Генле та дистального відділу канальця концентрація
сечовини у канальцевій рідині збільшується. Проте на рівні
658 / РОЗДІЛ 38
ТЧНК МРМ ТЧВК
А I І
В
300 300 300
300 300 300
300 300 300
300 300 300
300 300 300
300 300 300
300 300 300
300 к 300 , 300
о
Рис. 38-17. Механізм дії петлі Генле як потокового помножувача, який створює ґрадієнт осмотичного тиску в міжклітинній
рідині мозкового шару нирки (МРМ); ТЧНК - тонка частина низхідного коліна петлі Генле; ТЧВК - товста частина висхідного
коліна петлі Генле. Процес створення ґрадієнта зображено у вигляді гіпотетичної послідовності кроків, починаючи з А, де
осмотичний тиск в обох колінах і міжклітинній рідині становить 300 мосм/кг. Помпи, що містяться в товстій частині висхідного
коліна петлі Генле, переміщають Иа+ та СГ у міжклітинну рідину, збільшуючи осмотичний тиск до 400 мосм/кг. Таким способом
досягається рівновага з рідиною в тонкій частині низхідного коліна петлі Генле. Водночас продовжує надходити ізотонічна
рідина в тонку частину низхідного коліна та виводиться гіпотонічна рідина за межі товстої частини висхідного коліна. Внаслідок
циклічного повторення цього процесу рідина, що виходить з товстої частини висхідного коліна, стає щораз гіпотонічнішою,
тоді як на верхівці петлі Генле накопичується рідина з надзвичайно високим осмотичним тиском (модифіковано та відтворено
за дозволом з Зоґіпзоп І_К, ЕззепііаІ МебісаІ РГіузіоІоду, Рауеп Ргезз, 1992).
внутрішнього мозкового отвору збірної трубочки сечовина
переходить у міжклітинну рідину ниркових пірамід, що
збільшує осмотичний тиск цієї рідини. Сечовину в тій
частині збірної трубочки транспортує транспортний білок
ПТ-А1, функція якого регульована вазопресином. Із клітин
нирок кролів виділено інший вазопресинозалежний транс-
портний білок сечовини з 10 трансмембранними домена-
ми. Коли без впливу вазопресину осмотичний тиск каналь-
цевої рідини на рівні внутрішньої частини збірної трубочки
у мозковій речовині знижується, то сечовина переходить з
міжклітинної рідини у просвіт канальця, і ґрадієнт осмо-
тичного тиску зменшується. Кількість сечовини в інтер-
стиції мозкової речовини і, відповідно, в сечі, залежить
від її надходження, що, відповідно, пов’язане із кількістю
спожитого білка. Отже, дієта із високим вмістом білка під-
вищує здатність нирок концентрувати сечу.
Водний діурез
Механізм зворотного зв’язку, що регулює секрецію вазо-
пресину залежно від осмотичного тиску плазми, розгля-
нутий у Розділі 14. Після вживання значної кількості гіпо-
тонічної рідини виділення води починається через 15 хв і
досягає максимуму упродовж 40 хв. Акт ковтання рідини
сам по собі призводить до незначного зменшення секреції
вазопресину, однак головною причиною її зменшення є
зниження осмотичного тиску плазми крові внаслідок
всмоктування води.
Водне отруєння
Максимальна швидкість сечовиділення - 16 мл/хв.
Якщо всмоктування рідин відбувається зі швидкістю, що
перевищує це значення, то вода з гіпотонічної ПКР починає
надходити у клітини, що призводить до їхнього набряку і в
рідкісних випадках-до клінічно вираженого водного отру-
єння. Набряк клітин мозку спричинює судоми і кому, що в
кінцевому підсумку призводить до смерті. Водне отруєння
може виникати, якщо після введення препаратів вазопресину
не було відповідно зменшено приймання рідини, або внас-
лідок посилення секреції вазопресину у відповідь на неос-
мотичні чинники, такі, наприклад, як хірургічна травма.
ФУНКЦІЯ НИРОК І СЕЧОВИПУСКАННЯ / 659
Рис. 38-18. Прямі судини і потоковий помножувач у нирці;
МаСІ і сечовина шляхом дифузії переходять з висхідного
коліна у низхідне, тоді як вода - з низхідного коліна у висхідне.
Осмотичний діурез
Наявність у ниркових канальцях великої кількості речо-
вин, які не піддались абсорбції, призводить до збільшення
об’єму сечі, яке називають осмотичним діурезом. Речо-
вини, які не реабсорбуються в проксимальних канальцях,
чинять значний осмотичний вплив, оскільки зі зменшен-
ням об’єму рідини їхня концентрація збільшується. Отже,
вони “затримують воду” в канальцях. Треба також зазна-
чити, що йони не можуть необмежено виводитись за
межі канальця, є певний ліміт градієнта їхньої концент-
рації. В нормі реабсорбція води з проксимального канальця
перешкоджає будь-яким відчутним змінам концентрацій-
них градієнтів, та коли швидкість реабсорбції води змен-
шується, то зменшується також і концентрація Ка+. Це від-
бувається внаслідок наявності в канальцевій рідині значної
кількості різноманітних нереабсорбованих сполук. У разі
досягнення граничного значення концентраційного гра-
дієнта подальша реабсорбція Иа+ припиняється, і в каналь-
ні залишається більша кількість №+ та, відповідно, затри-
мується рідина. Внаслідок описаних вище процесів збіль-
шується об’єм ізотонічної рідини в петлі Генле. Ця рідина
має меншу концентрацію №', ніж вихідна, однак загальна
кількість йонів №’, що надходять у петлю Генле за одини-
цю часу, збільшується. В петлі Генле реабсорбція води і
№‘ послаблюється, бо знижується осмотичний тиск рідини
в мозковому шарі нирки. Це зниження зумовлене перед-
усім, послабленням реабсорбції 1Ча+, К+, і СІ у висхідному
коліні петлі Генле, бо граничний концентраційний градієнт
№’ уже досягнутий. Через дистальний від діл канальця про-
ходить більший об’єм рідини. Внаслідок зменшення гра-
дієнта осмотичного тиску вздовж ниркових пірамід у збір-
них трубочках реабсорбується менше води. Завдяки цьому
значно збільшується об’єм сечі і виведення з нею та
інших електролітів.
Осмотичний діурез зумовлюють такі речовини, як мані-
тол (препарат групи осмотичних діуретиків) та інші полі-
сахариди, які піддаються фільтрації, але не реабсорбу-
ються. Це явище можуть спричинювати і деякі природні
сполуки, якщо вони надходять у кількостях, що переви-
щують реабсорбційну здатність канальців. Наприклад, у
разі цукрового діабету глюкоза, що затримується в каналь-
цях, зумовлює поліурію, коли її фільтраційне навантаження
перевищує Тмг. Осмотичний діурез можна спричинити
довенним уведенням великої кількості ИаСІ або сечовини.
Важливо розрізняти осмотичний і водний діурез. У
випадку водного діурезу об’єм рідини, що реабсорбується
в проксимальній частині нефрона, нормальний; максималь-
на швидкість сечовиділення становить близько 16 мл/хв.
У разі осмотичного діурезу посилене сечовиділення від-
бувається внаслідок зменшення реабсорбції води в про-
ксимальній частині канальця і в петлі Генле; у цьому разі
може простежуватись виділення дуже великої кількості
сечі. Незважаючи на максимальну здатність секреції вазо-
пресину, концентрація сечі наближається до концентрації
плазми крові (рис. 38-19), оскільки щораз більшу частину
сечі становить ізотонічна рідина проксимального канальця.
Якщо осмотичний діурез створюється у піддослідної тва-
рини, яка має нецукровий діабет, то концентрація сечі,
навпаки, збільшується з тієї ж самої причини.
Зв’язок концентрації сечі та швидкості
клубочкового фільтрування
Значення осмотичного Градієнта вздовж мозкових піра-
мід збільшується, якщо швидкість плину рідини через петлі
Генле зменшується. Зменшення ШКФ, наприклад, унаслі-
док збезводнення, призводить до зменшення об’єму ріди-
ни, що надходить до течійно-протитечійного механізму,
внаслідок чого зменшується швидкість плину рідини через
петлі Генле і сеча стає концентрованішою. Якщо ШКФ
значно зменшується, то сеча стає досить концентрованою
навіть без впливу вазопресину. Якщо ж у піддослідної
тварини з нецукровим діабетом частково перетиснути одну
ниркову артерію, то сеча, що виділяється з цієї нирки, буде
гіпертонічною внаслідок зменшення ШКФ, тоді як сеча з
протилежного боку - гіпотонічною.
Кліренс ВІЛЬНОЇ рідини
З метою оцінити втрати чи, навпаки, зберегти рідину
внаслідок екскреції концентрованої чи розведеної сечі
часто обчислюють кліренс вільної рідини (КН2О). Це різ-
ниця між об’ємом сечі та кліренсом розчинених у ній речо-
вин (К ):
у осм7
К -V Сосмх V
Нг° —п------•
1 ’осм
де V - швидкість сечовиділення; і Посм - відповідно,
осмотичні тиски сечі і плазми. Отже, Косм - це кількість
води, що потрібна для екскреції осмотичного навантажен-
ня, яке міститься в сечі, ізотонічної до плазми крові. Зна-
660 / РОЗДІЛ 38
Осмотичне навантаження, мосм/хв
1400
о 1200
О
5
~ 1000
ф
й 800
>| 600
х
* 400
о
Д 200
3 6 9 12 15 18 21
Діурез, мл/хв
Рис. 38-19. Приблизний зв’язок між концентрацією сечі та її
плином у разі осмотичного діурезу в людини. Штрихова лінія
на нижньому графіку показує концентрацію, за якої осмотич-
ний тиск сечі та плазми крові вирівнюється (відтворено за
дозволом з Вегііпег Р\Л/, біеЬізсґі 6: Везі апсі Тауіог’з Рїіузі-
оіодісаі Вазіз ої МебісаІ Ргасіісе, 91Ь есі. МіІІіатз & ХЛ/іІкіпз,
1979).
чення, КН2о від’ємне, якщо сеча гіпертонічна, і додатне,
якщо вона гіпотонічна. У табл. 38-8, наприклад, наведені
такі дані: за максимального антидіурезу значення КН20
становить -1,3 мл/хв (-1,9 л/добу), а без дії вазопресину
14,5 мл/хв (20,9 л/добу).
ОКИСНЮВАННЯ СЕЧІ ТА ЕКСКРЕЦІЯ
БІКАРБОНАТУ
Секреція І-Г
Клітини проксимальних і дистальних відділів ниркових
канальців, подібно до клітин шлункових залоз, виконують
секрецію йонів Н+ (див. Розділ 26). Ацидифікація відбу-
вається також у збірних трубочках. Головним процесом,
за допомогою якого секретуються Н+ у проксимальних
канальцях, є №-Н ’ обмін (рис. 38-20). Це приклад вторин-
ного активного транспортування; Ка+-К+-АТФ-аза витісняє
йони №+ з клітин у міжклітинну рідину, що призводить до
зменшення внутрішньоклітинної концентрації Ма+. Завдяки
Інтерстиційна і Клітина ниркового канальця І Просвіт
рідина у ] канальця
К+
Ма+
Кц
СО2 + Н2О
Карбан-
гідраза
№+
н2со3
-- НСО3“
НСО3“
н+
Рис. 38-20. Секреція кислот клітинами проксимального відділу
ниркового канальця; Н+ переходить у просвіт канальця за
допомогою антипорта в обмін на йон Иа+. Активне транспор-
тування за допомогою І\Іа+-К+-АТФ-ази позначено стрілками
у колі. Штриховими лініями позначено дифузію. Порівняйте з
рис. 26-10.
цьому №+ починає надходити всередину клітин із каналь-
цевої рідини; у цьому разі відбувається витіснення одного
йона Н+. Йони Н+ утворюються внаслідок внутрішньо-
клітинної дисоціації Н2СО3, а НСО3~, що виникає в цьому
випадку, шляхом дифузії потрапляє в міжклітинну рідину.
Отже, в обмін на секрецію кожного йона Н+ у міжклітинну
рідину надходить один йон і один йон НСО3 .
Каталізатором реакції утворення Н2СО3є ензим карбан-
гідраза. Медикаментозні лікарські препарати, які інгібують
його, водночас пригнічують секрецію Н+ у проксимальних
відділах ниркових канальців і всі пов’язані з цим біохімічні
реакції.
Уважають, що в секреції Н+ у проксимальній частині
канальця беруть участь також інші нагнітальні системи,
однак їхнє існування однозначно не доведено. В будь-якому
випадку, вони відіграють незначну роль порівняно з Ка+-
Н+-обмінним механізмом. У дистальній частині канальця
та збірних трубочках простежується цілком протилежна
ситуація, адже там секреція Н+ практично не залежить від
концентрації №+ в канальцевій рідині. У цих ділянках
канальця більшу частину Н+ секретує АТФ-залежна про-
тонна помпа. Альдостерон діє на цю помпу, збільшуючи
секрецію ГГ у дистальній частині канальця. Вставні клі-
тини (І-клітини) в цій ділянці ниркового канальця секре-
тують Н+ і, подібно до парієтальних клітин слизової шлун-
ка, містять значну кількість карбангідрази та численні ту-
буловезикулярні структури. В літературі є дані про те, що
в цих пухирцях і у внутрішній мембрані епітеліальних клі-
тин канальців міститься так звана Н+-транслокувальна
АТФ-аза, яка, власне, і продукує Н+. У разі ацидозу кіль-
кість протонних помп збільшується внаслідок вставлення
цих тубуловезикул в повернений до просвіту канальця бік
клітинної мембрани. Деяку кількість Н+ секретує Н+-К+-АТФ-
ФУНКЦІЯ НИРОК І СЕЧОВИПУСКАННЯ / 661
іза. У базолатеральній мембрані І-клітин міститься так
шаний Ваімі 3 - аніоно-обмінний білок, який, імовірно,
відіграє роль СІ -НСО3 -обмінника в процесі перенесення
4СО3' у міжклітинну рідину
Метаболізм Н+ у сечі
Інтенсивність секреції кислот залежить від процесів,
иіисаних нижче. Для нирок кожного біологічного виду
характерний максимальний ґрадієнт концентрації Н+, за
ікого транспортні механізми ще здатні виконувати активне
[ ранспортування. У людини цей ґрадієнт відповідає рН сечі
близько 4,5, тобто концентрації йонів Н+, яка в 1000 разів
іеревищує їхню концентрацію в плазмі крові. Отже, рН
1,5 - це граничне значення рН сечі. В нормі саме таким є
)Н рідини у збірних трубочках. Якби не було буферних
систем, які “зв’язують” Н+ у сечі, то граничне значення рН
юсягалось би дуже швидко, і секреція Н+ припинялась би.
Зднак є три важливі хімічні реакції, за допомогою яких
іадлишок вільних йонів Н+легко виходить з канальцевої
)ідини, що дає змогу виконувати подальшу секрецію кис-
ют (рис. 38-21). Це реакції з НСО3 із утворенням СО2 і
-І2О, із НРО42 з утворенням Н2РО4, та з МН3 із утворенням
<н4\
Зеакції з буферними системами
Механізм роботи буферних систем розглянутий у Роз-
цлах 1 та 39. Значення рІС бікарбонатної системи ста-
ювить 6,1, фосфатної - 6,8, аміачної - 9,0. Концентрація
<СО3 у плазмі, і, як наслідок, у клубочковому фільтраті в
юрмі становить 24 мекв/л, тоді як концентрація фосфату
лише 1,5 мекв/л. Отже, у проксимальній частині канальця
йльша частина ЬГ реагує із НСО3 з утворенням Н2СО3
див. рис. 38-21). Відповідно, Н2СО3 розпадається на СО2
Н2О. Щіточкова облямівка клітин проксимального (але
іе дистального) канальця містить карбангідразу, це полег-
цує утворення СО2 і Н2О в канальцевій рідині. Водночас
/О2, який легко дифундує через усі біологічні мембрани,
іадходить у канальцеві клітини, де він поповнює пул СО2,
іикористовуваний для синтезу Н2СО3. Оскільки переважна
більшість Н" виходить із канальця, то рН канальцевої рідн-
ій помітно не змінюється. Власне цей процес є механізмом,
а допомогою якого відбувається реабсорбція НСО3: на
ожен моль НСО3, що виходить з канальцевої рідини, шля-
ом дифузії 1 моль НСО3 переходить з канальцевих клітин
кров, хоч це не є той самий моль, який перейшов від
анальцевої рідини.
Виділений РР взаємодіє з двоосновним фосфатом
НРО42 ), унаслідок чого утворюється одноосновний фос-
)ат (Н2РО4). Цей процес найбільше виражений у дис-
альній частині канальця і у збірних трубочках, бо власне
ут унаслідок реабсорбції води накопичується найбільша
ількість йонів фосфату, які не були реабсорбовані в про-
симальній частині канальця. Реакція з КІН3 відбувається
к у дистальній, так і в проксимальній частинах канальця:
он Н з’єднується й з іншими буферними аніонами, та
начно менше.
Кожен йон Н+, що реагує з буферними системами, є
неском до так званої титраційної кислотності сечі, яку
изначають як кількість лугу, який треба додати до сечі,
іоб її рН становив 7,4, що відповідає рН клубочкового
фільтрату. Проте очевидно, що титраційна кислотність
відображає лише частину Н+, яка була секретована, оскіль-
ки в цьому разі не врахована Н2СО3, що перетворилась на
Н2О і СО2. Крім цього, рК' амонійної системи становить
9,0, а вона титрується тільки від рН сечі до 7,4, отже, її
внесок до титраційної кислотності сечі є дуже незначним.
Секреція аміаку
Унаслідок хімічних реакцій у клітинах ниркових каналь-
ців утворюються МН4+ і НСО3 . Йон N44+ перебуває у стані
рівноваги із системою МН3 + Н+ усередині клітин. Оскільки
рК' цієї реакції дорівнює 9,0, то співвідношення між МН3
і МН4+ при рН 7,0 становить 1:100 (рис. 38-22). Крім того,
МН3 є жиророзчинною сполукою і тому за концентрацій-
ними ґрадієнтами легко переходить через клітинні мемб-
рани у міжклітинну рідину і канальцевий фільтрат. У сечі
він реагує з Н+, утворюючи МН4+, який залишається в сечі.
Головною реакцією, унаслідок якої в клітинах утворю-
ється МН4+, є перетворення глутаміну у глутамат. Каталі-
затор цієї реакції - ензим глутаміназа, наявний у значній
кількості в клітинах ниркових канальців (див. рис. 38-22).
Глутамінова дегідрогеназа каталізує перетворення глута-
мату в а-кетоглутарат з утворенням додаткової кількості
МН4+. З подальшим перетворенням а-кетоглутарату спо-
живається 2 Н+, унаслідок чого вивільнюється 2 НСО3~.
Інтерстиційна
рідина
Клітина ниркового і Просвіт
канальця їканальця
І\Іа
№+ + НСО3
Н+)+ НСО3
нсо3-
нсо3
со2 + Н2О
Ма+ Ма+ НРО,
Ма"
НСО3
І\Іа
нсо;
МН4+А
Рис. 38-21. Метаболізм Н+, секретованого у канальцеву рідину
в обмін на №+. Угорі: реабсорбція бікарбонатів за допомогою
СО2. У центрі: утворення одноосновного фосфату. Унизу:
утворення аміаку. Зверніть увагу, що на кожен секретований
йон Н+ виділяється один Ма+ і один НСО3~; А- - аніон.
Иа+ Н2РО4
НСО3~
№+ А
662 / Р03ДІЛ38
ИН4+ МН3 + Н+
[мн3]
рН = рК' + І09Ігй?1
Глютаміназа
Глютамін ----------► Глютамат + МН4
Глютамін-
дегідрогеназа
Глютамат--------------► а-Кетоглютарат + N14/
Рис. 38-22. Головні реакції утворення аміаку в нирках. Див.
також Розділ 17.
У разі хронічного ацидозу екскреція МН4+ посилюється.
Це простежується за будь-якого значення рН, оскільки біль-
ша кількість МН3 надходить у канальцеву рідину. Це явище
отримало назву адаптації секреції МН3, його причину ще
остаточно не з’ясовано. Адаптація секреції МН3 призводить
до посилення секреції Н+.
Процес, завдяки якому МН3 секретує у сечу і в подаль-
шому перетворюється на МН4+, унаслідок чого підтриму-
ється концентраційний градієнт МН3, називають нейонною
дифузією (див. Розділ 1). Секреція саліцилатів та деяких
інших медикаментів, які є слабкими основами чи слабкими
кислотами, відбувається також шляхом нейонної дифузії.
Швидкість їхнього екскретування залежить від рН сечі.
Зміни рН у різних відділах нефрона
У проксимальному канальці простежується незначне
зменшення рН, та, як зазначено вище, екскреція Н+ не має
значного впливу на рН канальцевої рідини з причини утво-
рення СО2 і Н2О з Н2СО3. На противагу цьому, клітини дис-
тальної частини канальця значно менше здатні до секреції
Н\ однак секреція саме на цьому відрізку найбільше впли-
ває на рН сечі.
Фактори, що впливають на секрецію Н+
Секреція кислот з сечею ЗМІНЮЄТЬСЯ ПІД ВПЛИВОМ РСО2
всередині клітини, концентрації К+, рівня карбангідрази і
концентрації гормонів кори надниркових залоз. Якщо Рс 02
високий (респіраторний ацидоз), то більше Н2СО3 доступ-
но для зв’язування гідроксильних йонів і секреція кислот
посилюється, тоді як зі зниженням РСо2 простежуються
протилежні явища. Нестача К+ зумовлює посилення екс-
креції кислоти, очевидно, тому, що втрата К+ призводить
до внутрішньоклітинного ацидозу навіть у випадку, коли
рН плазми крові збільшене. Навпаки, надлишок К+ всере-
дині клітини пригнічує секрецію кислот. Під час інгібу-
вання карбоангідрази секреція кислот також зменшена,
оскільки зменшується утворення Н2СО3. Альдостерон, а
також інші гормони кори надниркових залоз, які посилю-
ють канальцеву реабсорбцію №+, паралельно підвищують
секрецію Н+ і К4.
Екскреція бікарбонатів
Хоча в процесі реабсорбції НСО3 не відбувається транс-
портування цього йона в канальцеві клітини, реабсорбція
НСО3 пропорційна до його фільтрації. Нема чітко визна-
ченого Тм, проте реабсорбція НСО3 послаблюється за
допомогою невідомого механізму у випадках, коли збіль-
шується об’єм ПКР (рис. 38-23). Якщо концентрація НСО3
у плазмі крові мала, то НСО3 реабсорбується повністю.
Однак якщо концентрація НСО3 перевищує 26-28 мекв/л
(нирковий поріг для НСО3 ), то НСО3 з’являється в сечі, і
сеча стає більш лужною. Навпаки, коли концентрація
НСО3 в плазмі крові менше 26 мекв/л (значення, за якого
всі секретовані йони Н+ використовуються для реабсорбції
НСО3‘), то вивільняється більше Н+, які можуть зв’язува-
тися з аніонами інших буферних систем. Отже, чим менша
концентрація НСО3 у плазмі крові, тим кислішою стає
реакція сечі і тим більший вміст у ній 1ЧН4+.
Фізіологічне значення змін рН сечі
Залежно від тісно взаємнопов’язаних процесів секреції
Н4, продукування МН4+ і екскреції НСО3 рН сечі у людини
коливається в широких межах - від 4,5 до 8,0. Екскреція
сечі, рН якої значно відрізняється від рН рідких середовищ
організму, має важливе значення для електролітного та
кислотно-лужного балансу організму, що детально розгля-
нуто в Розділі 39. Кислоти зв’язуються в плазмі крові і
клітинах, рівняння хімічної реакції виглядає так: НА +
КаНСО3—> №А + Н2СО3. Відповідно, Н2СО3 розпадається
на СО2 і Н2О; СО2 всмоктується в кров і виходить під час
видихання, як ИаА з’являється в клубочковому фільтраті.
Та кількість Ка+, яка заміщується в сечі на Н+, надходить
назад в організм. На кожен йон Н4, що піддався екскреції з
фосфатом або у вигляді МН44, організм отримує один йон
Концентрація НСО3 у плазмі крові, мекв/л
Рис. 38-23. Вплив об’єму ПКР на фільтрацію, реабсорбцію
та екскрецію НСО3 у дослідах на щурах. У людей екскреція
НСО3~ відбувається подібно. В нормі концентрація НСО3 у
плазмі крові становить близько 24 мекв/л (відтворено за
дозволом з Х/аІІіп Н: ПепаІ Еипсйоп, 2лсІ есі. 1_іШе, Вгоууп апсі
Со., 1983)
ФУНКЦІЯ НИРОК І СЕЧОВИПУСКАННЯ / 663
НСО3 , завдяки чому поповнюються запаси цього важли-
вого буферного аніона. Натомість, коли до рідких середо-
вищ організму надходить луг, то йони ОН зв’язуються з
утворенням додаткової кількості НСО3 . Якщо ж концент-
рація НСО3 в плазмі крові перевищує 28 мекв/л, то сеча
стає лужною і надлишок НСО3 виходить з нею. Оскільки
ж максимальна швидкість секреції Н+в канальцях напряму
залежить від РС()2 в артеріальній крові, то на реабсорбцію
НСО3 значно впливає РСОг Детальніше про ці взаємовідно-
шення описано у Розділі 39.
РЕГУЛЮВАННЯ ЕКСКРЕЦІЇ Ма+ ТА СГ
У клубочках відбувається значне фільтрування Иа+,
однак він активно виводиться зі всіх частин канальця, окрім
тонкої частини петлі Генле. В нормі 96-99% №' реабсор-
бується. Переважна кількість На4- реабсорбується разом з
СІ (табл. 38-9), та деяка його кількість реабсорбується в
реакціях, під час яких один йон №+ надходить у кров в
обмін на кожен йон Н\ секретований у канальцях, а в
дистальній частині канальця невелика кількість Иа+ актив-
но реабсорбується в поєднанні з секрецією К+.
Регулювання екскреції Ма+
Оскільки №' є найпоширенішим катіоном у ПКР, і солі
\а+ становлять 90% від осмотично активних сполук плазми
крові та міжклітинної рідини, то зрозуміло, що кількість
\а+ в організмі є головним фактором, що визначає об’єм
ПКР. Отже, не випадково у сухопутних тварин екскрецію
цього йона контролюють численні регуляторні механізми.
Внаслідок дії цих механізмів кількість що піддається
екскреції, починає відповідати тій кількості, що надходить
і, таким способом в організмі підтримується натрієвий ба-
ланс. Отже, втрата з сечею коливається від 1 мекв/добу
у разі безсольової дієти до 400 мекв/добу у випадку дієти з
високим вмістом Крім того, активне виділення Иа+ з
сечею починається, коли розчин №С1 уводять довенно.
Коливання швидкості екскреції очевидно, залежать і
від змін фільтрації (табл. 38-10) та канальцевої реабсорбції.
Чинники, які впливають на ШКФ: канальцево-клубочковий
зв’язок, клубочково-канальцевий баланс та вплив онкотич-
ного тиску в перитубулярних капілярах, розглянуті вище.
До інших чинників, які впливають на реабсорбцію Иа+,
належать концентрація у плазмі крові альдостерону та
інших гормонів кори надниркових залоз, рівень А\Р та
інших натрійуретичних гормонів у крові, що циркулює,
кількість ангіотензину II і ПГЕ2 в нирці та швидкість ка-
нальцевої секреції Н та КГ
Таблиця 38-9. Кількісні аспекти реабсорбції №+ здорової
людини у разі дієти з нормальним вмістом №+
ШКФ = 125 мл/хв
[НСО3~] у плазмі крові = 27 мекв/л
[І\Іа+] = 145 мекв/л
Фільтрація Ма+ за 1 хв................ 18 125 мкекв
Реабсорбовано з СГ.................... 14 585 мкекв
Реабсорбовано під час реабсорбції
3375 мкекв НСО3".....................З 375 мкекв
Реабсорбовано в поєднанні з утворенням
титраційної кислотності сечі й аміаку..50 мкекв
Реабсорбовано в поєднанні із
секрецією К+..............................50 мкекв
Загальна реабсорбція №+ за 1 хв........ 18 060 мкекв
Вплив кортикостероїдів
Мінералокортикоїди, що їх синтезує кора надниркових
залоз, такі як альдостерон, посилюють канальцеву реаб-
сорбцію №' в поєднанні з секрецією К+ і Н+, а також реаб-
сорбцію \а+ з СГ (див. Розділ 20). Якщо ці гормони вводити
тваринам, яким видалено наднирники, то простежується
латентний період тривалістю 10-30 хв, перш ніж виявити
їхній вплив на реабсорбцію №+, оскільки для того, щоб
стероїди внесли зміни у процес синтезу білка шляхом впли-
ву на ДНК, потрібний деякий час.
Мінералокортикоїди можуть спричинити й негайні
мембранні ефекти, однак вони помітно не впливають на
загальну екскрецію організмом піддослідної тварини.
Мінералокортикоїди діють передусім на збірні трубочки у
кірковому шарі нирки. Як зазначено в Розділі 20, ці
гормони діють на головні клітини (Р-клітини), збільшуючи
кількість активних №ЕК в апікальних мембранах цих
клітин (рис. 38-24).
У випадку синдрому Ліддла мутації генів, які кодують
р-субодиницю і, рідше, у-субодиницю №ЕК, спричинюють
їхню конституційно посилену активність. Це призводить
до затримки Иа+ в організмі й артеріальної гіпертензії.
Інші гуморальні чинники
Зменшене приймання солі з їжею збільшує секрецію
альдостерону (див. рис. 20-27), що призводить до значного,
однак досить повільного зменшення екскреції Иа+. На ре-
абсорбцію Иа+ впливає низка інших гуморальних факторів.
ПГЕ2 посилює виділення Иа+ з сечею, ймовірно, шляхом
інгібування Иа+-К+-АТФ-ази і збільшення внутрішньоклі-
тинного вмісту Са2+, що, відповідно, гальмує транспорту-
вання Иа+ через №ЕК. Ендотелій та ІЛ-2 також посилюють
Таблиця 38-10. Зміни екскреції №+ внаслідок змін ШКФ, якщо паралельно не
відбувалось змін реабсорбції №+
ШКФ, мл/хв Ма* у плазмі крові, мкекв/мл Відфільтрована кількість, мкекв/мл Реабсорбована кількість, мкекв/мл Екскретована кількість, мкекв/мл
12 145 18,125 18,000 125
127 145 18,415 18,000 415
124,1 145 18,000 18,000 0
664 / РОЗДІЛ 38
Рис. 38-24. Ниркова Р-клітина. Йон №+ надходить через ИаЕК
в апікальній мембрані і потрапляє в міжклітинну рідину за
допомогою І\Іа+-К+-АТФ-ази в базолатеральній мембрані.
Альдостерон активує геном, який продукує 8дК та інші білки,
кількість активних МаЕК у цьому разі зростає.
виділення №’ з сечею, можливо, стимулюючи синтез ПГЕ2.
або інші подібні речовини збільшують внутрішньо-
клітинний вміст цГМФ, що пригнічує транспортування
через ИаЕК. Інгібування № -К -АТФ-ази іншим натрійуре-
тичним гормоном, яким, імовірно, є ендогенний стероїд
оубаїн (строфантин) (див. Розділ 24), теж сприяє поси-
ленню екскреції №+.
Ангіотензин II збільшує реабсорбцію На4- і НСО3, впли-
ваючи на проксимальні відділи канальців. У нирках міс-
титься значна кількість ангіотензиноперетворювального
ензиму (АПЕ), саме тут 20% ангіотензину І, що циркулює,
перетворюється в ангіотензин II. Крім того, ангіотензин І
синтезується в нирках.
Зв’язок із секрецією кислот і К+
Екскрецію посилюють медикаментозні препарати,
які зменшують секрецію кислот нирками, інгібуючи кар-
бангідразу. Після зв’язування СО2 або Н+у крові На", який
фільтрується разом з кислотними аніонами, виходить з
сечею, якщо об’єм фільтрату переважає здатність каналь-
ців виконувати обмін На' на Н+. Зміни екскреції Иан внас-
лідок змін швидкості секреції К є незначними (див. табл.
38-10).
Екскреція хлориду
Реабсорбція хлориду посилюється, коли реабсорбція
НСО3 зменшується, і навпаки. Отже, концентрація СІ у
плазмі крові обернено пропорційна до концентрації НСО3,
завдяки чому підтримується сталість аніонного балансу.
В деяких ситуаціях рух СІ можна пояснити пасивною
дифузією. Проте, крім того, СІ також транспортується за
межі ниркових канальців.
РЕГУЛЮВАННЯ ЕКСКРЕЦІЇ К+
Значна частина К+ виходить з канальцевої рідини шля-
хом активної реабсорбції в проксимальних канальцях (див.
табл. 38-5). У подальшому К+ секретується в канальцеву
рідину за допомогою клітин дистальної частини канальця
нефрона. Швидкість секреції К+ пропорційна до швидкості
плину канальцевої рідини через дистальні ділянки неф-
рона, оскільки в разі швидкого проходження рідини через
канальці менш імовірно, що концентрація К+ в канальцевій
рідині збільшиться до рівня, коли подальша секреція
припиняється. Без перешкоджувальних чинників секрето-
вана кількість К4 приблизно дорівнює зовнішньому над-
ходженню К+, і таким способом, підтримується калієвий
баланс. У дистальній частині канальця Хач здебільшого
всмоктується, а К - секретується. Тут не простежується
чіткого обміну за принципом один на один, і більша час-
тина К+ рухається за допомогою пасивних механізмів.
Однак переміщення К+ всередину клітин зменшує різницю
біоелектричних потенціалів по різні боки мембрани ка-
нальцевої клітини, і це сприяє переміщенню йонів Ю у
зворотний бік, тобто у просвіт канальця. Оскільки реаб-
сорбція Ха+ також пов’язана із секрецією Н\ то в каналь-
цевій рідині відбувається щось на зразок захоплення №
за конкурентним механізмом. Екскреція К+ сповільнюється,
коли зменшується кількість N3" у канальцевій рідині на
рівні дистальної частини канальця, а також тоді, коли збіль-
шується секреція Н\ Коли загальний вміст К в організмі
високий, то секреція Н+ пригнічена, очевидно, внаслідок
внутрішньоклітинного алкалозу; секреція і екскреція К+ в
цьому разі значно полегшені. ЕІатомість, у разі дефіциту
К+ виникає внутрішньоклітинний ацидоз, і секреція К
припиняється. Механізм секреції К+ має здатність адап-
туватись, про що свідчить той факт, що у випадку тривалого
введення значних доз солей калію екскреція К поступово
збільшується.
Гіпокаліємія трапляється досить часто і може мати сер-
йозні наслідки. Крім надмірної втрати К+ з сечею, причи-
ною цього стану деколи є втрати К зі стільцем унаслідок
тривалих проносів, а також перехід К+ з плазми крові все-
редину клітин у пацієнтів, які приймають інсулін (див.
Розділ 19) або р-адреноблокатори, і, звичайно, у разі
тривалого низького надходження К? з їжею. Гіперкаліємія
- це набагато небезпечніший стан, ніж гіпокаліємія, з
огляду на можливі ускладнення з боку серцево-судинної
системи, які загрожують життю (див. Розділ 28). Однак за
умови нормальної функції нирок гіперкаліємія просте-
жується зрідка.
ДІУРЕТИКИ (СЕЧОГІННІ ЗАСОБИ)
Хоча детальний розгляд діуретиків не є нашою метою,
та ознайомлення з механізмами їхньої дії дає чудову змогу
переглянути фактори, що впливають на об’єм сечі та екс-
крецію електролітів. Ці механізми коротко наведені в табл.
38-11. Вода, алкоголь, осмотичні діуретики, ксантини й
окиснювальні солі мають обмежену клінічну цінність, а
антагоністи вазопресину застосовують лише з дослідниць-
кою метою.
ФУНКЦІЯ НИРОК І СЕЧОВИПУСКАННЯ / 665
Таблиця 38-11. Механізм дії різноманітних діуретиків
Чинник Механізм дії
Вода Пригнічує секрецію вазопресину
Етанол Пригнічує секрецію вазопресину
Антагоністи \/2-рецепторів до вазопресину Пригнічує дію вазопресину на збірні трубочки
Осмотично активні речо- вини (манітол, глюкоза) у великій кількості Зумовлюють осмотичний діурез
Ксантини (кофеїн, теофілін) Зменшують канальцеву реабсорбцію Ма+ і збільшують ШКФ
Окиснювальні солі (СаСІ2 і МН4СІ) Створюють кислотне навантаження, зв’язують Н+, та коли здатність нирок заміщувати №+ на Н+ перевищена, разом з №+ виводяться аніони
Інгібітори карбангідрази (ацетазоламід) Зменшують секрецію Н+, і, як наслідок, збільшують екскрецію Ма+ і К+
Метолазон, тіазидні діуретики (хлортіазид) Інгібують №+-К+-котранс- портер на початку дис- тального відділу канальця
Петлеві діуретики (фуросемід, етакринова кислота, буметанід) Інгібують №+-К+-2СГ-ко- транспортер у товстій частині висхідного коліна петлі Генле
К+-збережні діуретики (спіронолактон, тріамтерен і амілорід) Послаблюють №+-К+-обмін у збірних трубочках шля- хом інгібування альдо- стерону (спіронолактон) або №ЕК (амілорід)
Інгібітори карбангідрази мають лише помірний сечо-
гінний ефект, та оскільки вони пригнічують секрецію кис-
лоти (зменшуючи надходження вугільної кислоти), то їм
притаманна довготривала дія. Внаслідок зменшення сек-
реції Н4 не тільки посилюється екскреція №+, а й пригні-
чується реабсорбція НСО3 . Оскільки йони Н+ і К+ конку-
рують один з одним і з то зниження секреції Н+ полег-
шує секрецію та екскрецію К+.
Іншим фактором, який визначає швидкість секреції К+,
є кількість ІЧа’, яка надходить до обмінного Иа+-К+-сайту
дистального відділу канальця. Тіазидні діуретики, фуро-
семід, етакринова кислота і буметанід діють проксималь-
ніше від цього сайту; унаслідок збільшення надходження
N3' посилюється секреція К+. Значна втрата К+ із сечею є
одним з небажаних побічних ефектів цих сечогінних засо-
бів. Тіазиди пригнічують № -К -котранспортер у прокси-
мальному відрізку дистальної частини канальця (рис. 38-
25). Фуросемід, етакринова кислота і буметанід пригнічу-
ють реабсорбцію №+ і СГ у товстій частині висхідного
коліна петлі Генле шляхом інгібування № -К -2С1 -ко-
транспортера (див. рис. 38-16). Спіронолактон, тріамте-
рен і амілорид діють безпосередньо на механізм Ка-К+-
обміну, зумовлюючи затримку К+, і, в деяких випадках,
незначну гіперкаліємію.
РОЗЛАДИ ФУНКЦІЙ НИРОК
Для різноманітних захворювань нирок характерна
велика кількість розладів їхньої функції. Секреція реніну
нирками і зв’язок реніну з розвитком артеріальної гіпер-
тензії розглянуто в Розділах 24 та 33. У випадку різних
захворювань нирок у сечі часто виявляють білок, лейко-
цити, еритроцити і циліндри - спресовані фрагменти біл-
кового матеріалу, які накопичуються в канальцях і в подаль-
шому з сечею виходять у сечовий міхур. Іншими важли-
вими наслідками захворювань нирок є втрата концентра-
ційної або дилюційної здатності нирок, уремія, ацидоз і
надлишкова затримка №+.
Протеїну рія
Унаслідок багатьох захворювань нирок проникність
клубочкових капілярів збільшується і в сечу потрапляє
білок у більших, ніж нормальні слідові, кількостях. Це яви-
ще називають протеїнурією. Якщо цим білком є альбумін,
то йдеться про альбумінурію. Зв’язок між альбумінурією
та зарядом мембрани клубочкових капілярів розглянутий
вище. Кількість білка в сечі може бути дуже великою, особ-
ливо в разі різноманітних нефрозів. У цьому випадку втрата
білка може відбуватись швидше, ніж організм здатний син-
тезувати білки плазми крові. Як наслідок, виникає гіпо-
протеїнемія, знижується онкотичний тиск плазми й об’єм
крові, що циркулює, тоді як у тканинах інтенсивно нако-
пичується набрякова рідина.
Рис. 38-25. Точки дії різноманітних діуретиків. 1 - фуросемід
та інші петлеві діуретики діють на товсту частину висхідного
коліна петлі Генле; 2-тіазидні діуретики діють на початковий
відділ звивистого канальця; 3 - антагоністи альдостерону,
тріамтерен та амілорид впливають переважно на збірні
трубочки; 4-антагоністи М2-рецепторів до вазопресину діють
на збірні трубочки.
666 / РОЗДІЛ 38
Протеїнурія простежується і в разі одного доброякіс-
ного стану, який хворобою в звичайному сенсі не вважа-
ють. У деяких цілком здорових людей у положенні стоячи
в сечі з’являється альбумін. Цей стан отримав назву орто-
статична альбумінурія. Сеча цих осіб, що утворюється,
коли вони лежать, не містить білка.
Втрата концентраційної і дилюційної
здатності нирок
У випадку захворювання нирок сеча стає менш концент-
рованою і часто збільшується її добовий об’єм, з’являються
такі симптоми, як поліурія (надмірна кількість сечі) та
ніктурія (потреба прокидатись вночі, щоб випорожнити
сечовий міхур). Здатність утворювати розведену сечу збе-
рігається, проте в разі прогресування захворювань осмо-
тичний тиск сечі стає фіксованим на одному рівні, який
приблизно відповідає осмотичному тиску плазми крові. Це
свідчить про втрату не лише концентраційної, а й дилю-
ційної здатності нирок. Одна з причин цього - розлади
течійно-протитечійного механізму, однак більше ці пору-
шення зумовлені втратою значної частини функційних неф-
ронів. Якщо одну нирку видаляють хірургічним способом,
то кількість функційних нефронів зменшується вдвічі. Неф-
рони єдиної нирки повинні фільтрувати та екскретувати
більшу кількість осмотично активних сполук, фактично
створюючи осмотичний діурез. У випадку осмотичного
діурезу концентрація сечі наближається до концентрації
плазми крові (див. вище). Те ж саме відбувається, коли
кількість функційних нефронів зменшується внаслідок
різноманітних захворювань. На ті нефрони, що залиши-
лись, припадає більше навантаження, що врешті-решт
призводить і до їхнього ураження. Вважають, що морфоло-
гічним субстратом ушкодження нефронів унаслідок три-
валого посиленого фільтрування є фіброз клітин прокси-
мальної частини канальця, однак це ще остаточно не з’ясо-
вано. Внаслідок такого позитивного зворотного зв’язку
відбувається прогресувальна втрата функційної активної
ниркової паренхіми та поглиблення проявів ниркової
недостатності аж до олігоурії та навіть анурії.
Уремія
Коли в крові у значній кількості накопичуються про-
дукти розпаду білка, то виникає такий синдром, як уремія.
Його проявами є млявість, сонливість, апатичність, втрата
апетиту, нудота і блювання, свербіння шкіри, психічні роз-
лади, посмикування м’язів, судоми і в кінцевому підсумку
- кома. Рівень сечовини та креатиніну в сироватці крові
дуже високий. Показники концентрації цих речовин у крові
використовують як показники важкості стану в разі уремії.
Симптоми уремії зумовлені не стільки самою сечовиною
та креатиніном, скільки прогресувальним накопиченням
інших токсичних сполук, найімовірніше - органічних кис-
лот та фенолів.
Токсичні сполуки, які спричинюють симптоматику
уремії, можна видалити з крові за допомогою апарату
“штучна нирка” (гемодіалізу). Іншою ефективною мето-
дикою є гемофільтрація, за якої кров під тиском фільтру-
ють через мембрану, а втрачені рідини поповнюють згодом.
За допомогою цих методик можна підтримувати життя і
задовільний стан пацієнтів упродовж багатьох місяців,
навіть якщо у них повна анурія або вони позбавлені обох
нирок.
До інших ознак хронічної ниркової недостатності нале-
жать анемія, спричинена передусім втратою здатності
нирок продукувати еритропоетин (див. Розділ 24), і вто-
ринний гіперпаратиреоїдизм як наслідок дефіциту 1,25-
дигідроксихолекальциферолу (див. Розділ 21).
Ацидоз
Ацидоз часто простежується в разі хронічних захворю-
вань нирок унаслідок їхньої неспроможності виконувати
адекватну секрецію кислих продуктів обміну речовин (див.
Розділ 39). За рідкісного синдрому - ниркового тубуляр-
ного ацидозу фіксують специфічне порушення здатності
нирок окиснювати сечу; інші ж функції нирок не порушені.
Однак у більшості випадків захворювань нирок сеча мак-
симально кисла, ацидоз розвивається через обмеження
загальної секреції Н+, яке є наслідком порушеного утворен-
ня 1ЧН4+ у канальцях.
Порушення метаболізму Ма+
У багатьох пацієнтів із захворюваннями нирок в орга-
нізмі затримується надлишкова кількість №+ і у них з’яв-
ляються виражені набряки. Є принаймні три причини поси-
леної затримки внаслідок захворювань нирок. У разі
гострого гломерулонефриту - захворювання, що уражає
переважно лише клубочки, - значно зменшується фільт-
рація 1Ма\ У випадку нефротичного синдрому посилення
секреції альдостерону призводить до затримки солей. Це
захворювання супроводжується низьким рівнем білка плаз-
ми крові, отже, рідина переходить з плазми у міжклітинні
проміжки і загальний об’єм плазми зменшується. Це впли-
ває на ренін-ангіотензинову систему, яка, відповідно, спри-
чинює посилення секреції альдостерону. Третьою причи-
ною затримки Иа+ та набряків у разі захворювання нирок
є серцева недостатність (див. Розділ 33). Патологія нирок
сприяє розвитку серцевої недостатності частково внаслі-
док артеріальної гіпертензії, яку вона часто спричинює.
Різні реакції на альдостерон
Як зазначено в Розділі 20, нормальні особи в разі вве-
дення надмірних кількостей мінералокортикоїдів непри-
томніють. Вони перестають утримувати №' і втрачають
велику кількість К+. З іншого боку, пацієнти з вираженими
набряками у випадку нефротичного синдрому, цирозу
печінки чи серцевої недостатності продовжують ефектив-
но втримувати №* і не втрачають К+. Однією з причин цьо-
го є зменшення кількості , що досягає дистальної части-
ни нефрона; №' в канальцевій рідині допомагає підтриму-
вати різницю потенціалів між канальцевою рідиною та клі-
тинами канальців, це сприяє посиленню секреції Ю. Змен-
шення вмісту №+ в дистальній частині канальця досягаєть-
ся завдяки посиленій затримці №" у проксимальній частині
канальця і зменшенню фільтрації
НАПОВНЕННЯ СЕЧОВОГО МІХУРА
Стінки сечоводів містять м’язові волокна, розташовані
у вигляді спіральних, поздовжніх та циркулярних пучків,
ФУНКЦІЯ НИРОК І СЕЧОВИПУСКАННЯ / 667
хоч макроскопічно жодних м’язових шарів не простежу-
ється. Сеча рухається з ниркової миски в сечовий міхур за
допомогою регулярних перистальтичних скорочень, що
відбуваються один-п’ять разів за хвилину. Сеча у вигляді
поштовхоподібних сплесків із кожною перистальтичною
хвилею надходить у сечовий міхур. Сечоводи перетинають
стінку сечового міхура під кутом. У сечоводах немає сфінк-
терів, і їхнє косе розташування сприяє перекриттю їхнього
просвіту за винятком моментів проходження перисталь-
тичної хвилі. Цей механізм запобігає рефлюксу сечі з сечо-
вого міхура.
ВИПОРОЖНЕННЯ СЕЧОВОГО МІХУРА
Анатомічні відомості
Гладка мускулатура сечового міхура, як і мускулатура
сечоводів, розташована у вигляді спіральних, поздовжніх
та циркулярних пучків. Скорочення цього м’яза, який нази-
вають детрузором, є головним механізмом, що забезпечує
випорожнення сечового міхура під час акту сечовипус-
кання. М’язові пучки проходять з обох боків уретри, ці
волокна деколи називають внутрішнім сфінктером урет-
ри, хоча насправді вони не охоплюють окружність уретри.
Дистальніше від нього розміщений сфінктер, який є довіль-
ним скелетним м’язом - сфінктер перетинчастої частини
уретри (зовнішній сфінктер уретри). Епітелій сечового
міхура складається з поверхневого шару плоских і глибо-
кого шару кубоїдних клітин. Іннервація сечового міхура
схематично показана на рис. 38-26.
Сечовипускання
Фізіологія сечовипускання та патофізіологічні механіз-
ми його порушення є питаннями, навколо яких триває
чимало дискусій. Сечовипускання - це спинномозковий
рефлекс, регульований вищими мозковими центрами і,
подібно до дефекації, може довільно пригнічуватись. Сеча
надходить до сечового міхура поступово, не спричинюючи
різкого підвищення внутрішньоміхурового тиску. Як і інші
види гладком’язової тканини, детрузор має виражені
еластичні властивості: під час розтягу натяг його стінки
довго не утримується. Співвідношення між внутрішньо-
міхуровим тиском та об’ємом сечі в сечовому міхурі можна
дослідити, вставивши в міхур катетер і випорожнивши
його, а потім реєструючи зміни тиску у процесі поступо-
вого наповнення порціями води або повітря по 50 мл кожна
(цистометрія). Графік співвідношення між внутрішньо-
міхуровим тиском і об’ємом рідини в сечовому міхурі
називають цистометрограмою (рис. 38-27). Крива відоб-
ражає початкове незначне підвищення тиску в разі вве-
дення перших порцій рідини або повітря. Внаслідок вве-
дення наступних порцій простежується довгий, майже
паралельний до горизонтальної осі сегмент кривої. За
певного значення об’єму введеної рідини настає раптове
різке збільшення внутрішньоміхурового об’єму, що відпо-
відає моменту, коли спрацював рефлекс сечовипускання.
Ці три ділянки кривої часто називають сегментами Іа, ІЬ і
II. Перші поклики на сечовипускання з’являються в разі
наповнення міхура до 150 мл, а інтенсивне відчуття його
“переповнення” - за наповнення до 400 мл. Плоский сег-
мент ІЬ відображає закон Лапласа (див. Розділ ЗО). За цим
законом тиск у сферичному контейнері дорівнює натягу
стінок, помноженому на два і поділеному на його радіус.
Унаслідок наповнення сечового міхура натяг стінок поси-
Рис. 38-26. Іннервація сечового міхура. Штриховими лініями
позначено чутливі нерви. Парасимпатичну інервацію зобра-
жено з лівого боку, симпатичну - у верхньому правому куті,
соматичну - у нижньому правому куті.
Рис. 38-27. Цистометрограма здорової людини. Цифри
позначають три компоненти кривої, описаної в тексті. Штрихо-
ва лінія позначає характер зв’язку між тиском та об'ємом,
який був би, якби не відбувся акт сечовипускання, що відпо-
відає сегменту II кривої (модифіковано та відтворено за дозво-
лом з Тападбо ЕА, МсАпісб Л\Л/: Згпііїїз СепегаІ Огоіоду, 14іЬ
еф Мс6гаи/-НІІІ, 1995).
668 / РОЗДІЛ 38
люється, проте одночасно збільшується й радіус. Отже,
тиск у сечовому міхурі в разі його наповнення є сталим.
Під час акту сечовипускання м’язи промежини і зовніш-
ній сфінктер уретри розслаблені, детрузор скорочується і
сеча виштовхується з уретри. Смужки гладкої мускулатури
по боках уретри не відіграють жодної ролі в цьому акті,
їхня головна функція - попередити закидання сперми в
сечовий міхур під час еякуляції.
Механізм довільного сечовипускання досі повністю не
з’ясований. Першим кроком є розслаблення м’язів тазового
дна. Це саме по собі може виявитись досить сильним сти-
мулюванням детрузора, щоб почалось його скорочення. М’я-
зи промежини і зовнішній сфінктер уретри можуть довільно
скорочуватись, у цьому разі вони запобігають проходженню
сечі по уретрі або переривають акт сечовипускання, коли
він почався. У дорослих здатність втримувати зовнішній
сфінктер уретри в скороченому стані доти, доки не з’явиться
змога випорожнити сечовий міхур, є наслідком виховання в
ранньому віці. Жіноча уретра після акту сечовипускання ви-
порожнюється під впливом сили земного тяжіння. Сеча, що
залишається в чоловічій уретрі після закінчення акту сечо-
випускання, виштовхується назовні декількома перей-
моподібними скороченнями цибулино-печеристого м’яза.
Рефлекторне регулювання
Гладка мускулатура сечового міхура має певну скорот-
ливу здатність. За умови нормальної іннервації міхура
рецептори розтягу стінки міхура спричинюють рефлек-
торне скорочення, яке має нижчий поріг збудливості, ніж
притаманні детрузору автономні скорочення. Волокна
тазових нервів є аферентною дугою рефлексу сечовипус-
кання. Парасимпатичні волокна сечового міхура утворю-
ють еферентну дугу рефлексу, вони також проходять у
тазових нервах. Інтеграція рефлексу відбувається в крижо-
вих сегментах спинного мозку. В дорослих людей об’єм
рідини в сечовому міхурі, що запускає цей рефлекс, ста-
новить близько 300-400 мл. Симпатичні нерви сечового
міхура не відіграють жодної ролі в акті сечовипускання,
однак вони ініціюють скорочення детрузора, які запобі-
гають потраплянню сперми в сечовий міхур під час еяку-
ляції (див. Розділ 23).
До рецепторів розтягу в стінці міхура рухові волокна
не проходять, однак поріг рефлексу сечовипускання, подіб-
но до всіх рефлексів розтягу, залежить від стимулювальних
та гальмівних центрів у стовбурі головного мозку. В ділянці
моста міститься стимулювальний центр, а в середньому
мозку - гальмівний центр. Після перерізу стовбура мозку
відразу ж над мостом поріг рефлексу знижується, і вже
значно менша кількість рідини в міхурі зумовлює рефлекс
сечовипускання, тоді як у разі перерізання вище від рівня
середнього мозку рефлекс сечовипускання не змінюється.
В задній ділянці гіпоталамуса є інший стимулювальний
центр. У людей з ураженнями верхньої лобної закрутки
зменшується бажання випорожнити сечовий міхур, а також
простежується неспроможність припинити акт сечови-
пускання, коли він уже почався. Експерименти на тваринах
з електричним стимулюванням різних ділянок мозку
засвідчили, що є й інші кіркові центри, які впливають на
процес сечовипускання. Сечовий міхур можна примусити
скорочуватись за допомогою довільного стимулювання
спинномозкового рефлексу, навіть коли він містить декіль-
ка мілілітрів сечі. Довільне скорочення м’язів черевної
стінки допомагає виштовхуванню сечі завдяки збільшенню
внутрішньочеревного тиску, проте акт сечовипускання
може початись і без натужування, навіть якщо сечовий
міхур майже порожній.
Порушення сечовипускання
Є три головні види порушень сечовипускання внаслідок
уражень нервової тканини: внаслідок порушення провід-
ності аферентних нервів, що проходять від сечового міху-
ра; внаслідок порушення провідності як аферентних, так і
еферентних нервів; унаслідок порушення провідності сти-
мулювальних і гальмівних провідних шляхів, що проходять
від мозку. За кожного виду розладів сечовипускання сечо-
вий міхур скорочується, однак його скорочення недостатні
для повного випорожнення сечового міхура, і в ньому є
деяка кількість залишкової сечі.
Вплив позбавлення аферентної іннервації
Коли у піддослідних тварин перетято дорсальні корінці
крижових нервів або їхня провідність порушена внаслідок
різноманітних захворювань, таких як спинна сухотка (Са-
Ье8 сіогзаїк), всі рефлекторні скорочення міхура припиня-
ються. Сечовий міхур перетворюється на перерозтягнутий
тонкостінний тканинний мішок, практично позбавлений
м’язового тонусу, проте внаслідок автономних реакцій мі-
хура на розтягнення простежуються деякі слабкі скорочення.
Вплив денервації
Коли руйнуються не лише аферентні, а й еферентні нер-
ви, як, наприклад, у разі пухлин кінського хвоста або кінце-
вої нитки, упродовж деякого часу міхур стає млявим і
перерозтягненим. Однак поступово м’яз “децентралізова-
ного” міхура стає активнішим. Численні скоротливі хвилі
виштовхують сечу з уретри по краплях. Сечовий міхур
зморщується, його стінки стають гіпертрофованими. При-
чини такої разючої відмінності між повною денервацією
та перетинанням лише аферентних волокон невідомі.
Гіперактивний стан міхура дає підстави думати, що денер-
вація призводить до надмірної чутливості стінки міхура,
хоч перетинаються волокна прегангліонарних, а не пост-
гангліонарних нейронів.
Вплив перетинання спинномозкових
волокон
Унаслідок спинномозкової травми сечовий міхур стає
млявим. Він переповнюється, і сеча виходить з уретри по
краплях (нетримання переповнення). Після того, як шок
минув, рефлекс сечовипускання відновлюється, хоча, зви-
чайно, вже немає довільного контролю сечовипускання і
стимулювального та гальмівного впливів вищих мозкових
центрів. Деякі паралізовані пацієнти навчаються викликати
сечовипускання, щипаючи або погладжуючи себе по стегну
(див. Розділ 12). Інколи рефлекс сечовипускання стає
надмірно вираженим. Ємність міхура знижується, і його
стінка стає гіпертрофованою. Цей тип міхура деколи нази-
вають нейрогенним сечовим міхуром. Гіперактивність
сечового міхура може посилюватися внаслідок інфекційно-
запальних процесів у сечовидільній системі.
Регулювання складу та об’єму
позаклітинної рідини
39
ВСТУП
У цьому розділі розглянуто головні механізми гомео-
стазу, які, за допомогою передусім нирок та легенів під-
тримують сталість об’єму, осмотичного тиску та специ-
фічного йонного складу позаклітинної рідини, зокрема
концентрацію в ній йонів Н+. Інтерстиційна складова цієї
рідини - це рідинне середовище, в якому перебувають
клітини. Життя організму безпосередньо залежить від ста-
лості складу цього “внутрішнього моря” (див. Розділ 1).
РЕГУЛЮВАННЯ ОСМОТИЧНОГО ТИСКУ
Регулювання осмотичного тиску відбувається переваж-
но за допомогою механізмів спраги та секреції вазопресину.
Загальний осмотичний тиск рідин організму прямо про-
порційний до суми загального вмісту Иа+ та К+, поділеній
на загальний об’єм рідини. Отже, осмотичний тиск рідин
організму змінюється внаслідок порушення балансу між
вмістом цих важливих електролітів та кількістю рідини,
що надходить або втрачається (див. Розділ 1). Якщо під-
вищується ефективний осмотичний тиск плазми крові, то
посилюється секреція вазопресину, яка стимулює механіз-
ми виникнення спраги. Вода затримується в організмі,
розчиняє гіпертонічну плазму крові, якщо можливо, збіль-
шується приймання рідини (рис. 39-1). Натомість, якщо
плазма крові стає гіпотонічною, то секреція вазопресину
зменшується і посилюється екскреція надлишкової кіль-
кості рідини. Таким способом осмотичний тиск рідин орга-
нізму підтримується у досить вузькому діапазоні нор-
мальних показників. У нормі осмотичний тиск плазми кро-
ві становить 280-295 мосм/кг Н2О; за осмотичного тиску
плазми 285 мосм/кг секреція вазопресину максимально
пригнічена, а за вищих значень поступово посилюється
(див. рис. 14-14). Функція цих регуляторних механізмів та
патологічні стани, що виникають у разі їхнього порушення,
детально розглянуті в Розділах 14 та 38.
РЕГУЛЮВАННЯ ОБ’ЄМУ
Об’єм ПКР залежить, передусім, від загального вмісту
осмотично активних сполук у ПКР. Склад ПКР розглянуто
в Розділі 1. Оскільки та СІ - найважливіші осмотично
активні сполуки ПКР, а зміни концентрації СІ значно вто-
ринні до вмісту № \ то зрозуміло, що йон є головним
фактором, який визначає об’єм ПКР. Отже, механізми Иа+-
балансу - це водночас головні механізми регулювання
об’єму ПКР. Однак інтенсивність екскреції води залежить
також від об’єму - збільшення об’єму ПКР пригнічує сек-
рецію вазопресину, а його зменшення, навпаки, стимулює
виділення цього гормону. Фактор об’єму відіграє важливу
роль у регулюванні секреції вазопресину, ніж осмотичні
чинники. Ангіотензин II стимулює секрецію альдостерону
і вазопресину; зумовлює почуття спраги і звуження про-
світу судин (вазоконстрикцію), завдяки чому підтриму-
ється сталість артеріального тиску. Отже, ангіотензин II
відіграє ключову роль у реагуванні організму на гіпово-
лемію (рис. 39-2). Крім того, збільшення об’єму ПКР при-
зводить до посилення секреції у серці АИР та ВИР, що
зумовлює посилення діурезу та виділення №‘ з сечею
(див. Розділ 24).
За різноманітної патології втрата рідини організмом
(дегідратація) призводить до незначного зменшення
об’єму ПКР, оскільки вода виходить як з внутрішньоклі-
тинної, так і з позаклітинної рідини. Проте втрата Иа+ із
випорожненнями (пронос), сечею (важкий ацидоз, недос-
татність надниркових залоз) або потом (тепловий удар)
призводить до значного зменшення об’єму ПКР і в кінце-
вому підсумку - до розвитку шоку. Заходи з подолання
шоку передусім повинні бути спрямовані на підтримання
Збільшення осмоляльності ПКР ---------
Збільшення
Спрага секреції
і вазопресину
І І
Збільшення ▼
споживання Затримка
рідини води
Розведення ПКР-------------------1
Рис. 39-1. Механізми регулювання осмотичного тиску ПКР.
Штриховими лініями позначено процеси інгібування (з доз-
волу 3 РіІ28іттоп8).
670 / РОЗДІЛ 39
Рис. 39-2. Регулювання об’єму ПКР ангіотензином II; АПЕ -
ангіотензиноперетворювальний ензим.
внутрішньосудинного об’єму рідини (див. Розділ 33), однак
вони також впливають і на баланс №‘. За недостатності
надниркових залоз зменшення об’єму ПКР відбувається
не лише внаслідок втрат із сечею, а й через його перехід
усередину клітин (див. Розділ 20).
Оскільки N3* відіграє ключову роль у підтриманні ста-
лого об’єму ПКР, то зрозуміло, що екскрецію цього йона
регулюють численні механізми. Фільтрація та реабсорбція
нирками та вплив цих процесів на екскрецію N3" роз-
глянуто в Розділі 38. Якщо об’єм ПКР зменшується, то зни-
жується артеріальний тиск. У цьому разі знижується тиск
у капілярах клубочків, унаслідок чого зменшується ШКФ
та, відповідно, фільтрація Иа+. З іншого боку, посилюється
канальцева реабсорбція зокрема, завдяки збільшенню
секреції альдостерону. Секреція альдостерону регульована,
зокрема, за допомогою механізму зворотного зв’язку, з
огляду на це посилення секреції цього гормону досягається
внаслідок зниження середнього внутрішньосудинного
тиску (див. Розділи 20 та 24). Інші зміни екскреції Иа+
відбуваються надто швидко, щоб бути зумовленими лише
змінами секреції альдостерону. Наприклад, перехід з гори-
зонтального положення у вертикальне приводить до поси-
лення секреції альдостерону. Однак екскреція Иа+ змен-
шується упродовж декількох хвилин; ця раптова зміна
екскреції №‘ простежується в осіб, яким з певних причин
було зроблено адреналектомію (видалення надниркових
залоз). Ймовірною причиною цього є гемодинамічні зміни
та зменшення секреції АКР.
РЕГУЛЮВАННЯ СПЕЦИФІЧНОГО ЙОННОГО
СКЛАДУ
Рівень певних специфічних йонів у ПКР, як і глюкози
та інших нейонізованих сполук, що мають важливе значен-
ня для метаболізму, підтримується завдяки специфічним
регуляторним механізмам (Розділ 17). Концентрація йонів
Са2+ у ПКР регульована завдяки механізму зворотного
зв’язку між рівнем Са2+ та секрецією паращитоподібних
залоз і кальцитоніносекретувальних клітин (див. Розділ 21).
Концентрація М§24 також підлягає жорсткому регулю-
ванню, однак механізми що регулюють метаболізм М§2+,
вивчені ще недостатньо.
Механізми, що визначають вміст Ка+ та К+, є складовою
частиною розглянутих вище систем, які регулюють об’єм
ПКР. Концентрація цих йонів залежить також від концент-
рації Н+, і рН є одним з головних факторів, що впливають
на аніонний склад ПКР.
РЕГУЛЮВАННЯ КОНЦЕНТРАЦІЇ Н+
Оскільки механізми кислотно-лужної рівноваги часто
вважають “загадковими”, то важливо зазначити, що ця рів-
новага визначена не “буферними основами” чи “зв’язаними
катіонами”, а лише концентрацією Н+ у ПКР. Механізми,
що регулюють склад ПКР, особливо важливі тому, що клі-
тини організму дуже чутливі до змін концентрації йонів
Н+. Концентрація Н+ всередині клітини, яку можна визна-
чити за допомогою мікроелектродів, рН-чутливих флу-
оресцентних барвників та фосфорного магнітного резо-
нансу, відрізняється від рН позаклітинної рідини і, ймо-
вірно, впливає на численні процеси всередині клітини.
Однак вона чутлива до змін концентрації Н4 у ПКР.
Значення рН - це зручний спосіб відображення кон-
центрації Н+ в рідинних середовищах організму, оскільки
концентрація Н+ низька порівняно із концентрацією інших
катіонів. За нормальних умов концентрація Иа+ в плазмі
артеріальної крові, що перебуває у стані рівноваги з
еритроцитами, становить близько 140 мекв/л, тоді як
концентрація Н+-лише 0,00004 мекв/л (табл. 39-1). Отже,
рН - це від’ємний десятковий логарифм, тому від 0,00004
Таблиця 39-1. Концентрація йонів Н+ та рН у різних рідких
середовищах організму
Концентрація Н* рН
мекв/л моль/л
Шлунковий сік 150 0,15 0,8
Максимальна кислотність сечі 0,03 ЗхЮ'5 4,5
Термінальний ацидоз 0,0001 1 х 10-7 7,0
Плазма Норма 0,00004 4х 10-8 7,4
крові Термінальний алкалоз 0,00002 2х 10-8 7,7
Сік підшлункової залози 0,00001 1 х 10^ 8,0
РЕГУЛЮВАННЯ СКЛАДУ ТА ОБ’ЄМУ ПОЗАКЛІТИННОЇ РІДИНИ / 671
- дорівнює 7,4. Зрозуміло, що зниження рН на одну одини-
цю, тобто з 7,0 до 6,0, відповідає збільшенню концентрації
Н4 у десять разів. Важливо пам’ятати, що рН крові - це рН
справжньої плазми, тобто плазми, що перебуває у стані
рівноваги з еритроцитами, оскільки еритроцити містять
гемоглобін, який за кількісними показниками є одним з
найважливіших буферних систем крові (див. Розділ 35).
Рівновага Н+
Значення рН плазми артеріальної крові в нормі стано-
вить 7,40, а венозної - дещо менше. Вважають, що про
ацидоз треба говорити, коли рН артеріальної крові - понад
7,40, а про алкалоз - коли це значення перевищує 7,40 хоча
коливання рН у межах 0,05 не призводять до жодних неба-
жаних наслідків. Граничні концентрації Н+, сумісні з жит-
тям, відрізняються у п’ять разів - від 0,00002 (рН 7,7) до
0,0001 мекв/л (рН 7,0).
У печінці в процесі глюконеогенезу відбувається мета-
болізм амінокислот, побічними продуктами якого є йони
1МН44 та НСО3 , тобто їхні амінні та карбоксилові групи
(рис. 39-3). Йони МН4' виводяться у вигляді сечовини, а
йони Н4 в середині клітин зв’язуються з утворенням НСО3 .
Отже, у кровоплин потрапляє лише незначна кількість
1МН44 та НСО3 . Проте внаслідок метаболізму сірковмісних
амінокислот утворюється Н2$О4, а в процесі метаболізму
фосфоровмісних амінокислот, таких як фосфосерин, -
Н3РО4. Ці сильні кислоти, надходячи у кровоплин, спри-
чинюють значне кислотне навантаження на буферні сис-
теми ПКР. Унаслідок метаболізму амінокислот у нормі за
добу утворюється близько 50 мекв Н+. Газ СО2, що є кін-
цевим продуктом тканинного метаболізму, значно пов’я-
заний з утворенням Н2СО3 (див. Розділ 35), а загальне над-
ходження Н+ з цього джерела перевищує 12 500 мекв/добу.
Однак більша частина СО2 піддається екскреції в легенях,
Рис. 39-3. Роль печінки та нирок у виведенні надлишку кислот.
Ділянки, на яких відбувається регулювання, позначені зіроч-
ками (модифіковано та відтворено з Кперрег МА еі аі. Ат-
топіит, игеа, апсі зузіетіс рН гедиіаііоп. Ат 3 РІіузіоІ 1987;
235:Е199).
і лише незначну частину Н+ екскретують нирки. Найпоши-
ренішими джерелами додаткового кислотного навантажен-
ня є інтенсивне фізичне навантаження (посилене надход-
ження молочної кислоти), діабетичний кетоацидоз (ацето-
оцтова кислота та р-гідроксибутират) та приймання ациди-
фікувальних солей, таких як МН4С1 та СаС12, які фактично
збільшують надходження в організм НС1. Неспроможність
уражених патологічним процесом нирок секретувати нор-
мальну кількість Н+ також може бути причиною ацидозу.
Фрукти є головним харчовим джерелом лугів. Вони містять
натрієві та калієві солі слабких органічних кислот, аніонні
яких метаболізуються до СО2, забезпечуючи надходження
в організм ИаНСО3 та КНСО3. Сіль \аНСО3 та інші алка-
лінізувальні солі часто надходять у великих кількостях, та
найчастішою причиною алкалозу є втрата Н4, яка виникає
внаслідок тривалого інтенсивного блювання, коли втрача-
ється шлунковий сік, що містить значну кількість ПСІ. Це,
звичайно, еквівалентне введенню в організм відповідної
кількості лугу.
Буферні системи
Буферні системи детально розглянуто в Розділі 1 та част-
ково в Розділі 35 у контексті механізмів транспортування
СО2 в організмі. Вони відіграють ключову роль у підтри-
манні гомеостазу Н4.
Рівняння Гендерсона-Гассельбальха
Загальне рівняння, що описує будь-яку буферну систему,
має такий вигляд:
НА < > Н+ + А ,
де А відповідає будь-якому аніону, а НА - це недисоційо-
вана кислота. Якщо у розчин, що місить цю буферну сис-
тему, потрапляє сильніша кислота, ніж НА, то рівновага
зміщується ліворуч. Йони Н+ зв’язуються з утворенням
додаткової кількості недисоційованої НА, отже, концент-
рація Н+ збільшується значно менше, ніж без цієї буферної
системи. Натомість, якщо до системи додати луг, то йони
Н4 та ОН реагують з утворенням Н2О; однак у цьому разі
відбувається посилена дисоціація НА, що компенсує втрату
йонів Н4. Згідно з законом дії мас, у рівноважному стані
добуток концентрацій продуктів хімічної реакції, поділе-
ний на добуток концентрацій речовин, що реагують, є
сталим:
[Н+][А]
“(НАГ^
Якщо цей математичний вираз записати для рН (від’-
ємного десяткового логарифму концентрації Н4), то одер-
жимо рівняння, виведене Гендерсоном та Гассельбальхом,
яке описує зміни рН унаслідок додавання до будь-якої
буферної системи Н4 чи ОН (рівняння Гендерсона-Гас-
сельбальха):
рН = рК+ІО9[на!
З цього рівняння чітко видно, що буферна ємність сис-
теми найбільша, коли кількість вільних аніонів дорівнює
672 / РОЗДІЛ 39
кількості недисоційованої НА, тобто коли (А ]/[НА] = 1,
тоді 1о§ [А ]/[НА] = 0 і рН = рК. Тому природно очікувати,
що найпотужнішими буферними системами організму є
ті, що мають рК, яке наближається до рН, за якого вони
діють. Значення рН крові у нормі становить 7,4; рН внут-
рішньоклітинного середовища - 7,2; рН сечі - від 4,5 до
8,0.
Важливо зазначити, що стала рівноваги К стосується
лише ідеальних розчинів, тобто тих, у яких можна нех-
тувати силами електричної взаємодії між йонами. Стосовно
рідких середовищ організму доцільніше користуватись так
званою сталою йонізації К\
ммоль
Кількість
ммоль Н+,
доданих до
1 ммоль +0,5
НЬО2 або НЬ
Кількість
ммоль Н+,
усунутих з
1 ммоль _л 5
НЬО2 або НЬ ’
2 V
7,30 7,40 7,50 7,60 7,70
РН
Рис. 39-4. Титраційні криві НЬ та НЬО2. Стрілка від а до с
відображає кількість ммоль Н+, яке повинно бути додане без
зсуву рН. Стрілка від а до Ь позначає .зміну рН у випадку
деоксигенації.
Буферні системи крові
Білки крові, зокрема, білки плазми, є ефективними
буферними системами оскільки здатність до дисоціації
мають як карбоксилові, так і амінні вільні групи:
КСООНоКСОО +н+
рН = рК'КСоон +І°9
[КСОО ]
[КСООН]
<^кмн2 + н+
рН = рК'РМНз +1од
[НМН2]
[КМНз]‘
Інша важлива буферна система забезпечена дисоціацією
імідазольних груп залишків гістидину у молекулі гемогло-
біну:
У діапазоні значень рН 7,0-7,7 вільні карбоксилові та
амінні групи гемоглобіну роблять лише незначний внесок
у його буферну ємність. Та оскільки молекула гемоглобіну
містить 38 залишків гістидину і гемоглобін міститься в кро-
ві у значній кількості, то цей білок має буферну ємність, у
шість разів потужнішу, ніж у білків плазми крові. Крім того,
дія гемоглобіну дещо унікальна тому, що імідазольні групи
деоксигемоглобіну дисоціюють значно менше, ніж оксиге-
моглобіну. Отже, НЬ є слабкою кислотою і тому ліпшим
буфером, ніж НЬО2. Титраційні криві для НЬ і НЬО2 пока-
зані на рис. 39-4.
Третім важливим буферним механізмом є карбонат-
бікарбонатна система:
Н2СО3 НЧ НСО3.
Рівняння Гендерсона-Гассельбаха для цієї системи буде
виглядати так:
рН = рК + Іод
[НСО3]
[Н2СО3]'
Значення рК для цієї системи за умови ідеального роз-
чину є малим (близько 3), і кількість Н2СО3 теж мала, тому
її важко достатньо точно визначити. Однак в організмі
Н2СО3 перебуває в стані рівноваги з СО2:
Н2СО3 <=> СО2 + Н2О.
Якщо рК замінити на рКх (див. вище), а [СО2] - на
[Н2СО3], то рІС становитиме 6,1.
Наведена нижче форма цього рівняння має деяке клініч-
но-діагностичне значення:
рН = 6,10 + Іод [НС°з]
я 0,0301 РСо2
бо кількість розчиненого СО2 пропорційна до парціального
тиску СО2 у міліметрах ртутного стовпчика, а коефіцієнт
розчинності СО2 становить 0,0301 ммоль/л. Значення
[НСО3 ] неможливо виміряти прямо, однак рН і РСО2 можна
достатньо точно визначити за допомогою скляних елект-
родів. Значення [НСО3 ] одержують розрахунковим спо-
собом.
Значення рК' цієї системи все ж таки набагато менше,
ніж рН крові, однак ця система є однією з найефективніших
буферних систем організму, бо кількість розчиненого СО2
визначена процесами дихання. Крім того, концентрація
НСО3 в плазмі крові регульована нирками. Якщо до крові
додати деяку кількість Н+, то концентрація НСО3 змен-
шується, оскільки утворюється більше Н2СО3. Якби над-
лишкова кількість Н2СО3 не розпадалась на Н2О і СО2, який
згодом виходить через легені, то концентрація Н2СО3 не-
впинно зростала б. Якщо до плазми крові додати таку кіль-
кість йонів Н+, яка зв’язала б половину йонів НСО3 у плазмі
крові, то її рН миттєво зменшився б з 7,4 до 6,0. Та, окрім
видалення надлишкової кількості Н2СО3, збільшення вміс-
ту Н+ стимулює дихання, що призводить до зменшення РС()2
і видалення додаткової кількості Н2СО3. Отже, рН змен-
шується лише до 7,2-7,3 (рис. 39-5).
Без специфічного ензиму карбоангідрази хімічна
реакція СО2 + Н2О & Н2СО3 відбувається повільно в обох
напрямах. Плазма крові не містить карбоангідрази, проте
вона у великій кількості є в еритроцитах. Значний її вміст
характерний також для кислотосекретувальних клітин
РЕГУЛЮВАННЯ СКЛАДУ ТА ОБ’ЄМУ ПОЗАКЛІТИННОЇ РІДИНИ / 673
мекв/л
[НСО3]
мекв/л
[Н2СО3]
[НСО3]
Відношення 20 0,9 10 16
|Н2ЬО3]
рН 7,4 6,0 7,1 7,3
Рис. 39-5. Механізм дії бікарбонатної буферної системи крові.
Стовпчики показують емпірично покроковий порядок, щоб
відобразити вплив первинної реакції, зменшення вмісту Н2СО3
щодо попередніх значень і подальше його зменшення
внаслідок посилення вентиляції легень; [Н2СО3] - це фактич-
но концентрація розчиненого СО2. Значення в мекв/л є до-
вільними.
шлунка (див. Розділ 26) та клітин ниркових канальців (див.
Розділ 38). Карбоангідраза - це білок із молекулярною
масою ЗО 000, що містить один атом цинку в кожній моле-
кулі. Його інгібують ціаніди, азиди та сульфіди. Сульфані-
ламіди також інгібують цей ензим, і тому їхні похідні засто-
совують у клінічній практиці як сечогінні засоби, завдяки
їхній здатності чинити інгібіторний вплив на карбоангід-
разу нирок (див. Розділ 38).
Система Н2РО4 #Н+ + НРО42 має значення рК, що
дорівнює 6,80. Концентрація фосфатів у плазмі крові занад-
то мала для того, щоб ця система відігравала кількісно
значну роль, однак вона має важливе значення для підтри-
мання внутрішньоклітинного гомеостазу та рН сечі (див.
Розділ 38).
Буферні системи ІП УІУО
Буферні системи живого організму, звичайно, не зво-
дяться лише до крові. Головні буферні системи крові, інтер-
стиційної та внутрішньоклітинної рідини наведені в табл.
39-2. У спинномозковій рідині та сечі провідну роль віді-
грають бікарбонатна та фосфатна буферні системи. У разі
метаболічного ацидозу лише 15-20% кислотного наванта-
ження зв’язує бікарбонатна система; решта Н* здебільшого
зв’язується всередині клітин. У випадку метаболічного
Таблиця 39-2. Головні буферні системи організму
Кров н,со3 н* + нсо3-
НБілок ННЬє2 Н+ + Білок- Н+ + нь-
Інтерстиційна рідина Н2СО3? =2 Н+ + НСО3-
Внутрішньоклітинна рідина НБілок Н* + Білок-
Н2РО4< =* Н‘ + НРО42-
44 367-2
алкалозу близько 30-35% надлишку ОН- зв’язується все-
редині клітин, тоді як у разі респіраторного ацидозу та
алкалозу практично все буферне навантаження беруть на
себе саме внутрішньоклітинні механізми.
Головними регуляторами рН внутрішньоклітинного
середовища у тварин є транспортери НСО3 . Найліпше
вивчені сьогодні СІ -НСО3 -обмінник смуги 3 (див. Розділ
35), три різновиди Ка+-НСО3 -котранспортерів і один Ю-
НСО3 -котранспортер.
Висновок
Якщо до крові додати сильну кислоту, то головні буфер-
ні реакції зсуваються ліворуч. Концентрація в крові трьох
“буферних аніонів” - НЬ (гемоглобіну), Білок та НСО3 -
значно зменшується. Аніони кислоти, що надійшла до
організму, піддаються фільтрації у ниркових канальцях. їх
супроводжують (“покривають”) катіони, зокрема Ка+,
оскільки в цьому разі підтримується електрохімічна ней-
тральність. За допомогою процесів, які описано у Розділі
38, у канальцях відбувається процес заміщення Ка+ на Н+ з
одночасною реабсорбцією еквімолярної кількості №+ та
НСО3, завдяки чому зберігаються катіони, виводиться над-
лишкова кількість кислот, а запас буферних аніонів понов-
люється. Якщо до плазми крові додати деяку кількість СО2,
то відбуваються аналогічні хімічні реакції, за винятком
того, що внаслідок утворення Н2СО3 концентрація НСО3
у плазмі крові збільшується, а не зменшується.
Респіраторний ацидоз та алкалоз
Підвищення РСо2 артеріальної крові внаслідок гіповен-
тиляції називають респіраторним ацидозом. Газ СО2
перебуває у стані рівноваги з Н2СО3, який, відповідно, є у
стані рівноваги з НСО3 , отже, рівень НСО3 збільшується,
і настає новий рівноважний стан уже за меншого рН.
Графічним відображенням цього є крива залежності кон-
центрації НСО3 від рН (рис. 39-6). Натомість, зниження
РСО2 призводить до респіраторного алкалозу.
Початкові зміни, відображені нарис. 39-6, відбуваються
незалежно від будь-яких компенсаторних механізмів, тобто
виникають у разі декомпенсованого респіраторного аци-
дозу чи алкалозу. У будь-якому випадку, ці зміни створюють
нирки, які намагаються компенсувати ацидоз чи алкалоз,
змінюючи рН у бік норми.
Ниркова компенсація
Реабсорбція НСО3" у ниркових канальцях залежить не
лише від фільтраційного навантаження НСО3 , яке ариф-
метично виражене добутком ШКФ та рівня НСО3 у плазмі
крові, а й від швидкості секреції нирковими канальцями
Н+, оскільки йони НСО3 реабсорбуються в обмін на Н+.
Швидкість секреції Н+, а, отже, і реабсорбції НСО3 , зале-
жить від РСо2 артеріальної крові. Ймовірна причина цього
та, що чим більший вміст у клітинах СО2, з якого утворю-
ється Н2СО3, тим більше Н+ може секретуватись (див. Роз-
діл 35). У випадку респіраторного ацидозу канальцева сек-
реція Н+ в нирках посилюється, внаслідок чого надлишок
Н+ виходить з організму. У цьому разі навіть якщо рівень
НСО3 в плазмі крові підвищений, то реабсорбція НСО3
посилюється, внаслідок чого концентрація НСО3 в плазмі
крові збільшується. Отже, ниркова компенсація респіра-
674 / РОЗДІЛ 39
рН артеріальної крові
Рис. 39-6. Номограма кислотно-лужного стану, яка показує
зміни РСо2 (криві на графіку), концентрації НСО3~ у плазмі
крові та рН артеріальної крові у разі респіраторного та метабо-
лічного ацидозу Зверніть увагу на зсуви концентрації НСО3~
та зміни рН у разі компенсації гострого респіраторного аци-
дозу та алкалозу, що призводить, відповідно, до хронічних
ацидозу та алкалозу (відтворено за дозволом з Содап МС,
Кесіог ЕС АсісІ-Ьазе сіізогсіегз. Радез 457-517 Іп: Тґіе КісІ-
пеу, 4іґі есі. Вгеппег ВМ, Несіог ЕС [есіііогз]. Заипсіегз, 1991).
торного ацидозу зводиться до переходу ацидозу з гострої
у хронічну форму, що графічно показано рис. 39-6. Поси-
люється екскреція СІ , отже, зі збільшенням вмісту НСО3
концентрація СІ в плазмі крові зменшується. Натомість, у
разі респіраторного алкалозу зниження Рсо2 призводить
до сповільнення секреції Н+ нирками, реабсорбції НСО3
та посилення екскреції НСО3 , що призводить до ще
більшого зменшення концентрації НСО3 в плазмі крові,
внаслідок чого рН зменшується до нормальних показників
(див. рис. 39-6).
Метаболічний ацидоз
Коли у кров потрапляють кислоти, сильніші від ННЬ та
інших буферних кислот, то виникає метаболічний ацидоз;
а якщо концентрація вільних йонів Н+ зменшується внас-
лідок надлишкового надходження лугів або втрати кислот,
- то метаболічний алкалоз. Якщо ж, наприклад, уводять
Н28О4, то Н+ зв’язуються з буферами, а вміст у плазмі крові
НЬ , Білок і НСО3 , відповідно, зменшується. Унаслідок
утворена Н2СО3 розпадається на Н2О та СО2; вуглекислий
газ досить швидко виходить через легені. Це трапляється
у разі декомпенсованого метаболічного ацидозу (рис. 39-
7). Збільшення концентрації йонів Н+ фактично стимулює
процеси дихання, внаслідок чого РСО2, не зростає чи навіть
не змінюється, а навпаки, знижується. Отже, респіраторна
компенсація ацидозу призводить до ще інтенсивнішого
збільшення рН. Екскрецію надлишку йонів Н+ забезпе-
чують ниркові компенсаторні механізми, які повертають
буферні системи організму до їхнього нормального стану.
Ниркова компенсація
Аніони, які заміщають НСО3 в плазмі крові в разі мета-
болічного ацидозу, піддаються фільтрації, причому кож-
ного з них супроводжує катіон (переважно Иа+), що забез-
печує незмінно нейтральний загальний електричний заряд
плазми крові. Клітини ниркових канальців секретують Н
у канальцеву рідину в обмін на йони №+, у цьому разі на
кожен йон Н+, що його виділили нирки, припадає один йон
№+ та один йон НСО3 (див. Розділ 38). Якби в сечі не було
буферних сполук, які зв’язують Н+, то її рН швидко б дося-
гав гранично можливого значення 4,5, і виділення йонів
Н+ із сечею було б нехтувано малим. Однак Н+, що підда-
ється секреції, реагує із НСО3 з утворенням СО2 та Н2О
(реабсорбція бікарбонату); із НРО42 з утворенням Н2РО4 ;
із МН3 з утворенням ТЧН4+. Отже, відбувається секреція
значної кількості Н4 із надходженням у рідинні середовища
організму відповідного об’єму НСО3 , який поповнює
резерви буферних систем, та реабсорбція багатьох фізіоло-
гічно важливих катіонів. Лише у випадку надходження
ззовні дуже великої кількості кислоти катіони втрачаються
разом з аніонами, що спричинює посилене сечовиділення
та виснаження катіонних запасів організму. У разі хроніч-
ного ацидозу посилюється синтез глютамінової кислоти в
печінці, у процесі якого використовується певна частина
йонів МН4+, які зазвичай зв’язуються під час синтезу сечо-
вини (див. рис. 39-3), а глютамат, відповідно, є додатковим
джерелом МН4+ у нирках (див. Розділ 38). Секреція МН3
посилюється упродовж декількох днів (адаптація секреції
МН3, див. Розділ 38), що поліпшує ниркову компенсацію
ацидозу. Крім того, внаслідок метаболізму глютаміну в нир-
ках утворюється ос-кетоглутарат, що, відповідно, декарбо-
ксилює з утворенням НСО3 , який, надходячи у кровоплин,
зв’язує надлишкові йони Н+(див. рис. 39-3).
Компенсований Декомпенсований
РН
Рис. 39-7. Зміни рН справжньої плазми, концентрації НСО3
та Рсо2 У разі метаболічного ацидозу та алкалозу (діаграма
Давенпорта) (Оауепрогї Н\А/: Тґіе АВС ої АсісІ-Вазе Сґіетіз-
Ігу, бід есі. ііпіу ої Сґіісадо Ргезз, 1974).
РЕГУЛЮВАННЯ СКЛАДУ ТА ОБ’ЄМУ ПОЗАКЛІТИННОЇ РІДИНИ / 675
Унаслідок додавання сильної кислоти, наприклад Н98О4,
у крові відбувається така хімічна реакція:
2МаНСО3 + Н28О4 -> Иа28О4 + 2Н2СО3.
На кожен моль Н , що надходить, втрачається 1 моль
ИаНСО3. У ниркових канальцях ця хімічна реакція відбу-
вається у зворотному напрямі:
Ма2ЗО4 + 2Н2СО3 -> 2МаНСОз + 2Н+ +80^,
Н та 8О42 у цьому разі екскретуються. Звичайно, Н28О4
не екскретується в незміненому вигляді; йони Н+ з’явля-
ються в сечі у вигляді її кислотності та ІЧН4+.
У випадку метаболічного ацидозу дихальна компенсація
зумовлює пригнічення ниркових механізмів регулювання
кислотно-лужної рівноваги, оскільки значне зниження РСО2,
що простежується тоді, гальмує секрецію кислот. Проте, з
іншого боку, дихальна компенсація зменшує фільтрацію
НСО3 , і, отже, загальний інгібіторний ефект не є значно
вираженим.
Метаболічний алкалоз
У випадку метаболічного алкалозу рівень НСО3 та С02
в плазмі крові підвищується (див. рис. 39-7). Дихальна
компенсація відбувається шляхом послаблення вентиляції
легень у відповідь на зменшення концентрації Н+ в плазмі
крові і, відповідно, підвищення РС.О2. Унаслідок цього рН
набуває нормальних значень, тоді як концентрація НСО3
в плазмі крові значно збільшується. Цей компенсаторний
механізм регулюють хеморецептори аорти та каротидної
зони, які активують центр дихання, якщо відбувається
помітне зниження РО2 артеріальної крові. У випадку мета-
болічного алкалозу посилюється секреція Н+ нирками та
реабсорбція НСО3 . Якщо концентрація НСО3 у плазмі
крові перевищує 26-28 мекв/л, то НСО3 з’являється в сечі.
Підвищення РСО2 пригнічує ниркову компенсацію, полег-
шуючи секрецію кислот, однак кінцевий ефект цього порів-
няно незначний.
Клінічна оцінка кислотно-лужної рівноваги
У комплексі показників кислотно-лужної рівноваги
важливе клінічне значення мають рН артеріальної крові
та вміст НСО3 у її плазмі. Надійне значення рН можна
отримати за допомогою рН-метра та скляних рН-елект-
родів. Вміст НСО3 у плазмі крові неможливо визначити
прямо, однак натомість можна визначити РСО2 за допомо-
гою С02 електродів, а концентрацію НСО3 отримати роз-
рахунковим способом, як це описано вище. У плазмі веноз-
ної крові порівняно з артеріальною РСО2 на 7-8 мм рт. ст.
вищий, а рН на 0,03-0,04 одиниці більше. Це зумовлене
тим, що венозна кров містить СО2, який вона переносить
до легень. Отже, розрахункова концентрація НСО3 у веноз-
ній крові більша майже на 2 ммоль/л. З огляду на це зде-
більшого можна, замість артеріальної, брати на досліджен-
ня венозну кров.
У диференційній діагностиці метаболічного ацидозу
цінним є такий показник, як аніонний проміжок (від англ.
апіоп §ар). Хоча цей термін - один з прикладів лінгвістич-
ної неточності у науковій термінології, його широко засто-
совують. Чисельно цей показник дорівнює різниці між
концентрацією катіонів (окрім №') та концентрацією
аніонів (окрім СІ та НСО3) у плазмі крові. Його значення
визначають здебільшого білки в аніонній формі, НРО42 ,
8О42 та органічні кислоти. У нормі він становить близько
12 мекв/л. Аніонний проміжок збільшується зі зменшенням
концентрації К+, Са2+ та М§2+, збільшенням концентрації
або електричного заряду білків плазми крові, або коли в
крові накопичуються органічні аніони, наприклад лактат.
Він зменшується зі збільшенням вмісту катіонів або змен-
шенням вмісту альбуміну в плазмі крові. Аніонний промі-
жок збільшується у випадку метаболічного ацидозу внас-
лідок надлишкового вмісту кетонових тіл, лактату та в разі
інших форм ацидозу, що зумовлені надлишком органічних
аніонів. Він не змінюється в разі гіперхлоремічного аци-
дозу, що виникає внаслідок приймання МН4С1 або інгібі-
торів карбоангідрази.
Крива Сіґґаарда-Андерсена
Коли в клініці виникає потреба визначити кислотно-
основні характеристики артеріальної крові, то це можна
швидко і легко зробити за допомогою кривої або номо-
грами Сіґґаарда-Андерсена. Ця номограма має вигляд лога-
рифмічної кривої; по осі абсцис відкладено рН, по осі орди-
нат - РСО2. Отже, ділянка кривої ліворуч від вертикальної
лінії, проведеної через значення рН 7,40, стосується аци-
дозу, а праворуч - алкалозу. Ділянка кривої нижче горизон-
тальної лінії, проведеної через значення РСО2 40 мм рт. ст.,
відповідає гіпервентиляції, вище - гіповентиляції.
Якщо розчин, у якому є ИаНСО3 і нема буферних сис-
тем, урівноважувати з газовими сумішами, що мають різ-
ний вміст СО2, то значення рН та СО2 змінювалися б так,
що утворили криву, яка показана у лівій частині графіка
на рис. 39-8 або вздовж лінії, що паралельна до неї. За
наявності буферних речовин ухил кривої був би більшим;
чим більша буферна ємність розчину, тим крутішою буде
крива. Для нормальної крові, 1 дл якої містить 15 г гемо-
глобіну, лінія титрування СО2 проходить через відмітку
15 г/дл на гемоглобіновій шкалі (з внутрішнього боку верх-
ньої викривленої шкали) і точку, де перетинаються зна-
чення Рсс>2 40 мм рт. ст. та рН 7,40, як це показано на рис.
39-8. Коли вміст гемоглобіну у крові низький, то просте-
жується значна втрата буферної ємності, і ухил лінії титру-
вання СО2 зменшується. Та оскільки, крім гемоглобіну,
кров містить інші буферні системи, то лінія, проведена
через нульову відмітку гемоглобінової шкали через перетин
нормальних значень рН та РСО2, є крутішою, ніж крива для
розчину, що не містить жодних буферних сполук.
На практиці в анаеробних умовах забирають артеріаль-
ну або артеріалізовану капілярну кров та вимірюють її рН.
Визначають також рН того ж зразка крові після зрівнова-
жування з двома газовими сумішами, які мають різний
відомий вміст СО2. Значення рН за різних показників РСО2
наносять на графік і з’єднують, унаслідок чого утворю-
ється лінія титрування СО2 цього зразка крові. Значення
рН цього зразка крові до зрівноважування з газами також
наносять на графік, і РСО2, що відповідає йому, зчитують з
вертикальної шкали. Стандартний вміст бікарбонату в
зразку крові відповідає точці, де лінія титрування СО2 пере-
тинає бікарбонатну шкалу, яка проходить через значення
676 / РОЗДІЛ 39
Рис. 39-8. Номограма Сіїїаарда-Андерсена (з дозволу О ЗіддаагсІ-АпсІегзеп апсі Касііотеіег, Сорепйадеп, Оептагк).
РСО2 паралельно до горизонтальної осі. Стандартний вміст
бікарбонату - це не є фактична концентрація бікарбонату
в зразку, а, радше, така його концентрація, яка була б у разі
усунення будь-якого впливу дихання на кислотно-лужну
рівновагу. Цей показник відображає лужні резерви крові,
хоч його і визначають за рН, а не за повним вмістом СО2 у
зразку крові після зрівноваження. Подібно до лужного
резерву, він є показником вираження наявного метабо-
лічного ацидозу чи алкалозу.
Додаткові позначки на верхній викривленій шкалі номо-
грами (див. рис. 39-8) слугують для визначення вмісту
буферних основ; точка, де лінія калібрування СО2 артері-
альної крові перетинає цю шкалу, відображає вміст буфер-
них основ у крові (мекв/л). Термін “буферні основи” екві-
валентний кількості буферних аніонів (здебільшого - Бі-
лок , НСО3 та НЬ ; див. Розділ 35), які можуть зв’язувати
йони Н+ у крові. Нормальне значення цього показника у
людини з вмістом гемоглобіну 15 г/дл становить 48 мекв/л.
Точка, у якій крива калібрування СО2 перетинає нижню
викривлену шкалу номограми, відповідає надлишку основ.
Це значення, яке є додатним у разі алкалозу та від’ємним у
випадку ацидозу, відповідає кількості кислоти або основи,
яка може відновити нормальний кислотно-лужний стан 1 л
крові при РСО2, що дорівнює 40 мм рт. ст. Важливо зазна-
чити, що дефіцит основ неможливо повністю відновити,
просто обчисливши різницю між нормальним рівнем стан-
дартного бікарбонату (24 мекв/л) і його фактичним рівнем
та ввівши довенно відповідну кількість №НСО3 У цьому
разі деяка кількість НСО3 перетворюється на СО2 та Н2О,
а СО2 виходить через легені. Кількість №НСО3, яку на-
справді треба ввести, у 1,2 раза перевищує дефіцит стан-
дартного бікарбонату, однак точніші дані можна одержати,
використовуючи нижню викривлену шкалу, яку розроблено
емпіричним способом як результат аналізу великої кіль-
кості зразків артеріальної крові.
Деякі приклади розладів кислотно-лужної рівноваги
наведені в табл. 39-3.
У разі коригування розладів кислотно-лужної рівноваги
треба пам’ятати не лише про кров, а й про інші рідинні
середовища організму. Концентрації буферних речовин в
РЕГУЛЮВАННЯ СКЛАДУ ТА ОБ’ЄМУ ПОЗАКЛІТИННОЇ РІДИНИ / 677
Таблиця 39-3. Концентрація НСО3-, рН та РС02 плазми крові для різних типових розладів кислотно-лужної рівноваги1
Стан Показники Причини
рн НСО3-, мекв/л Рсо2, мм рт. ст.
НОРМА 7,40 24,1 40 Приймання МН4СІ
Метаболічний ацидоз 7,28 18,1 40 Діабетичний ацидоз
6,96 5,0 23 Приймання І\ІаНСО3
Метаболічний алкалоз 7,50 30,1 40 Тривале блювання
7,56 49,8 58 Дихальний ацидоз
Дихальний ацидоз 7,34 25,0 48 Вдихання 7% СО2
7,34 33,5 64 Емфізема легень
Дихальний алкалоз 7,53 22,0 27 Гіпервентиляція
7,48 18,7 26 Перебування упродовж трьох тижнів на висоті 4000 м над рівнем моря
1 У разі діабетичного кетоацидозу і тривалого блювання виникає дихальна компенсація первинного метаболічного ацидозу та
алкалозу, і РСо2 відхиляється від нормального значення (40 мм рт. ст.). У випадку емфіземи легень і перебування на великій
висоті виникає ниркова компенсація первинного дихального ацидозу та алкалозу, і тому відхилення концентрації НСО3~ у
плазмі крові є більшим, ніж без ниркової компенсації.
інших середовищах помітно відрізняються від значень,
характерних для крові. Емпіричним способом з’ясовано,
що введення кількості кислоти (в разі алкалозу) чи лугу
(у випадку ацидозу), яка дорівнює добутку 50% маси тіла
(кг) на надлишок основ (на 1 л), цілком достатньо для
повного коригування кислотно-лужного стану організму
Якщо ж є глибокі розлади кислотно-лужної рівноваги, то
небезпечно домагатись швидкого й одноразового їх кори-
гування. Тоді доцільніше ввести половину належної кіль-
кості кислоти чи лугу та знову через деякий час визначити
стан кислотно-лужної рівноваги і буферних систем. Після
цього треба розрахувати кількість кислоти чи лугу, необ-
хідну для остаточного коригування. Важливо також зазна-
чити, що в разі ацидозу, спричиненого надлишком лактату,
№НСО3 має властивість зменшувати хвилинний об’єм та
знижувати артеріальний тиск, отже, його треба застосо-
вувати обережно.
Співвідношення між метаболізмом калію та
кислотно-лужною рівновагою
Концентрації К+ та Н+ у спинномозковій рідині збіга-
ються, частково тому, що К+ впливає на екскрецію Н нир-
ками (див. Розділ 38). Внаслідок цього за метаболічного
алкалозу практично завжди наявна гіпокаліємія. Дефіцит
К*’ призводить до внутрішньоклітинного ацидозу, сприя-
ючи виділенню йонів Н+ із сечею. Згодом Н+ виходить з
організму та посилюється реабсорбція НСО3 , що призво-
дить до виникнення алкалозу позаклітинної рідини. Нато-
мість, надлишок К+ призводить до посилення його секреції
клітинами ниркових канальців.
ЛІТЕРАТУРА ДО ЧАСТИНИ VIII: УТВОРЕННЯ І ВИДІЛЕННЯ СЕЧІ
Адго^ие Ш, Мадіиз НЕ: Мапа§етепі о£1іГе-іЬгеаіетп§ асід-
Ьазе дізогдегз. N Еп£і 3 Мед 1998;338:26.
Апдегзоп К-Е: РЬагтасоІо^у о£ іохуєг игіпагу (гасі зтооіЬ
тизсіез апд репііе егесіііе Ііззие. РЬагтасої Кєу 1993;45:
253,
Ваит М: ТЬе сеііиіаг Ьа8І8 оГ іЬе Еапсопі 8упдготе. Нозр
Ргасі 1993;Моу 15:91.
Вауіізз С, Віапіх КС: СИотегиІаг Ьетодупатіс8. №\уз
РЬузіоІ 8сі 1986; 1:86.
Вгеппег ВМ, КесЮг ЕС 5г (едііогз): Тке Клсіпеу, 6іЬ ед. 2
уоі8. 8аипдег8, 1999.
Вгехіз М, Козеп 8: Нурохіа оГ Фе гепаї тедиііа - Ііз ітріі-
саііопз Гог дізеазе. N Еп§1 5 Мед 1995;332:647.
Вгохуп В, 8іоху 5Ь: Ргоіеіп 1гаїїїскіп§ апд роїагіїу іп кідпеу
ерЬЬеІіит: Ггот сеіі Ьіо1о§у (о рЬузіо1о§у. РЬузіоІ Кєу
1996;76:245.
Вауепрогі Н\¥: Тке АВСо/АсШ-Вазе Скетізігу, 6іЬ ед. Ипіу
оГ СЬіса§о Ргезз, 1974.
ВіВопа СЕ, Корр ОС: Кеигаї сопігої о£ гепаї Гипсдоп. РЬузіоІ
Кєу 1997;77:75.
ЕуГе СЕ, Риіпп А, Сапезза СМ: Зігисіиге апд Гипсііоп оГдіє
Мес-ЕКаС Гатіїу оГ іоп сЬаппеїз. 8етіп ЖрЬгоІ 1998:
18:138.
Сагсіа ЕІН, Катзеу СК, Кпох ЕС: Спдегзіапдіп§ Фе гоїе оГ
рагасеїіиіаг Ігапзроіі іп діє ргохітаї ШЬиІе. №хуз РЬузіоІ
8сі 1998;13:38.
678 / РОЗДІЛ 39
СієЬоху РА: Оізогдегз аззосіаіед хуіді ап акегед апіоп §ар.
Кідпеу Іпі 1985;27:472.
Оеппагі ЕР Нурокаїетіа. N Еп§11 Мед 1998:339:451.
Наа8 М: Тке \а-К-С1 соігапзроііегз. Ат 5 РЬузіоІ 1994;256:
С869.
Наїрегіп МЕ: Еіиісі, Еіесігоіуіе, апсі АсШ-Вазе Ркухіоіоуу,
Згсі ед. Заипдегз, 1998.
Наузіеії ЗР: Еипсдопаї адаріаііоп Іо гедисдоп іп гепаї тазз.
РЬузіоІ Кєу 1979;59:137.
Неутапп 3, Еп§е1 А: Ациарогіпз: рЬу1о§епу, зігисШге, апд
рЬузіо1о§у оЕ хуаіег скаппеїз. №хуз РЬузіоІ 8сі 1999; 14:
187.
НиІсЬ ЗА: Апаіоту апсі Ркуйоїоуу о/іке Віасісіег, Тгіуопе
апсі Егеїкга. АррІеІоп-СепШгу-СгоЇЇз, 1972.
ко 8: Коїе оЕпкгіс охіде іп §1отеги1аг аііегіоіез апд тасиїа
депза. Иєхуз РЬузіоІ 8сі 1994;9:115.
КІаЬг 8, Міііег 8В: Асиіе о1і§игіа. N Еп§1 3 Мед 1998;338:
671.
Кперрег МА, Раскег К, Ооод О\У: Аттопіит ігапзрогї іп
іЬе кідпеу. РЬузіоІ Кєу 1989;69:179.
ЬоеЬ 314: ТЬе Ьурегозтоіаг 8Ше. N Еп§1 3 Мед 1974,290:
1184.
Мадзеп КМ, ТізЬег СС: 8ігисІига1-Еипсдопа1 геІаїіопзЬірз
а1оп£ діє дізіаі перЬгоп. Ат 3 РЬузіоІ 1986;250:Е1.
Мепе Р, 8ітопзоп М8, Оипп МЗ: РЬузіо1о§у оЕІЬе тезап§іа1
сеіі. РЬузіоІ Кєу 1989; 19:1347.
Могеї Р: 8і1ез оЕ Ьогтопе асдоп іп діє таттаїіап перЬгоп.
Ат 3 РЬузіоІ 1981 ;240:Р 159.
Разіап 8, Ваііеу 3: Оіаіузіз діегару. N Еп§1 3 Мед 1998;338:
1428.
КоЬіпзоп АО, УегЬаІіз ЗО: ОіаЬеІез тзірідиз. Сигг ТЬег
Епдосгіпої МеіаЬ 1997;6:1.
Кооз А, Вогоп \УЕ: ІпІгасеІІиІагрН. РЬузіоІ Кєу 1981;61:296.
8сЬеіптап 83 сі аі: (Зепедс дізогдегз оЕгепаі еіесігоіуіе (гапз-
рогі. N Еп§1 3 Мед 1999;340:1177.
8сЬі1д Ь: ТЬе ЕІМаС сЬаппеї аз діє ргітагу деіегтіпапі оЕ
і\уо Ьитап дізеазез: Еіддіе зупдготе апд рзеидоЬуро-
аідозіегопізт. 14срЬго1о§іе 1996; 17:395.
8сЬтіді-?4іеІ8оп К: Соипіегсиггепі зузіетз іп апітаїз. 8сі
Ат (Мау) 1981 ;244:118.
8е1діп О\¥, (ЗіеЬізсЬ 6 (еддогз): Тке Кісіпеу: Ркухіоіоуу апсі
Раікоркухіокуу, 2пд ед. З уоіз. Кауеп Ргезз, 1991.
8ргіп§ КК: Ерідіеііаі Еіиід ігапзроіі - а сепіигу оЕ іпуезд§а-
доп. №\уз РЬузіоІ 8сі 1999; 14:92.
8іе11а А, 7апсЬекі А: Рипсдопаї гоїе оЕгепаї аЕЕегепіз. РЬузіоІ
Кєу 1991 ;71:659.
8идіапдіігап М, 8ігот ТВ: Кепаї ігапзріапіадоп. N Еп§1 З
Мед 1994;331:365.
\¥о!ЕО, ІМеіІзоп Е6: Ап§іоіепзіп II аз а гепаї суіокіпе. ІМєхуз
РЬузіоІ 8сі 1994;9:40.
\Угі§Ьі Е8: Іпігагепаї ге§и!адоп оЕ§1отеги1аг піігадоп гаіе. З
Нурегїепз 1984;2(8ирр1 І): 105.
7еіде1 МЬ: Ногтопаї ге§и1адоп оЕ іппег тедиііагу соїіесі-
іп§ дисі зодіит ігапзроіі. Ат 3 РЬузіоІ 1993;265:Р 159.
Додаток
ГОЛОВНІ ДЖЕРЕЛА
Для вивчення фізіології доцільно користуватися фун-
даментальними вичерпними підручниками. До найліпших,
виданих за останні десять років, належать:
Вете КМ, Ьеуу М\ (есійогв): Ркузіоіоуу, Згд ей. МозЬу,
1993.
Сіиуіоп АС, Наїї ДЕ: ТехіЬоок о] Месіісаі Ркузіоіоуу, 9Й1 ед.
8аипдег8, 1996.
•ІОІ1П8ОП ЕВ. (едйог): Еззепііаі Месіісаі Ркузіоіоуу, Кауеп-
Рге88, 1992.
\¥е8і ЗВ (едйог): Везі апсі Тауіогз Ркузіоіоуісаі Вазіз о/
Месіісаі Ргасіісе, 12ІЇ1 ед. \¥і11іагп8 & \Уі1кіп8, 1990.
МсРйее, Ьіп§арра, 6апоп§, апсі Ьап§е нещодавно опуб-
лікували третє видання підручника з патофізіології для
студентів, які вивчають клінічну медицину:
МсРйее 83 еі аі: Раїкоркузіоіоуу о{ Оізеазе: Ап Іпігосіис-
ііоп іо Сііпісаі Месіісіпе, Згд ед. Мс6га\у-Ні11, 2000.
Зазначимо ще такі підручники патофізіології:
ЕгоЬІісй ЕО (едйог): Раікоркузіоіо^у, Згд ед. Еірріпсой,
1984.
Зосіетап \¥А Зг, Зодетап \¥А: Раікоіоуіс Ркузіоіоуу, б1*1 ед.
8аипдег8, 1979.
Класичним підручником з анатомії є:
ВаппІ8іег ЬН еі аі (ебііог8): Сгау'з Апаіопгу: Тке Апаіопг-
ісаі Вазіз о] Месіісіпе апсі Виг§егу, 38іЬ ед. СйигсЬіІІ
Еіуіп£8іопє, 1995.
Сучасні візуальні методи досліджень, що стали ключо-
вою частиною сучасної фізіології та медицини, викладені в:
Наа§а ЗК, Айїді КЗ (ебііог8): Сотриіесі Тотоугарку о/іке
УУкоІе Восіу, 2пд ед. Мо8Ьу, 1988.
Уоп 8сйи1іге88 ОК: Сііпісаі Розіігоп Етіззіоп Тотоугарку.
Ьірріпсоіі \УіШагп8 & \¥і1кіп8, 1999.
Чудові огляди сучасних досліджень у різних ділянках
фізіолог її дібрані у розділах новин, оглядів та перспектив
у журналах Наіиге і Всіепсе. Проблемні статті та різні
огляди з’являються в Аєїу ЕпуІапсІАоигпаї о] Месіісіпе. Це,
зокрема, оглядові статті про сучасні дослідження у фізіо-
логії та біохімії, які дають найновішу інформацію для
лікарів-практиків. Найдоречнішими є серії оглядових
публікацій у РкузіїоуісаіКєуієууз, Ркагтасіїоуісаі Кєуієууз,
АппиаІ Яєуіууз о/Ркузіоіоуу та в журналах інших серій.
Нещодавно виданий підручник НапсІЬоок о/РкузіоІоуу,
ОхГогд Цпіуегзйу Рге88, \е^ ¥огк складається з окремих
томів, які покривають усі розділи фізіології. Розділи є нау-
ково цінними, проте надзвичайно деталізовані.
ПОКАЗНИКИ НОРМИ ТА СТАТИСТИЧНЕ
ОПРАЦЮВАННЯ ДАНИХ
Межі показників людей у нормі для деяких загально-
вимірюваних складників плазми наведені у таблицях, роз-
міщених на внутрішньому боці обкладинки книги. У ціло-
му світі триває спроба перейти до єдиної стандартизованої
номенклатури на базі системи СІ. Система побудована на
семи незалежних фізичних величинах (див. табл. 1). Похід-
ні одиниці наведені у табл. 2, а префікси, що уживаються
- у табл. 3. Трапляються труднощі під час уживання таких
одиниць - наприклад, проблема вираження одиниці ензи-
мів -їх мало обговорюють в медичній літературі. У нашій
книзі значення величин у тексті наведені в традиційних
одиницях, однак у більшості випадків супроводжуються
значеннями у системі СІ.
Точність методів, які використовують для лаборатор-
них досліджень, різна. Важливо для оцінки будь-якого
окремого вимірювання знати можливі похибки вимірю-
вань. Для хімічного визначення рідин організму вони
складаються з похибки, що виникає під час проб, та похиб-
ки хімічного методу. Однак, навіть застосовуючи найточ-
ніші методи, результати, отримані для різних нормальних
осіб, відрізнятимуться внаслідок так званої біологічної
варіації. Варіаційність результатів виникає тому, що у будь-
якій системі - живому організмі чи тканині - є багато
особливостей, які впливають на конкретне вимірювання.
Такі показники, як вік, стать, час вимірювань, час після
споживання їжі тощо треба брати до уваги.
Показники меж у нормі для будь-якого фізіологічного
або клінічного вимірювання можна визначити за допо-
могою стандартного статистичного аналізу, якщо вимірю-
вання виконано на належній вибірці у нормальній популяції
(найліпше понад 20 осіб). Важливо знати не тільки середнє
значення для такої вибірки, а й межі розкиду значень осіб
від середнього значення.
680 / ДОДАТОК
Таблиця 1. Головні одиниці СІ
Величина Назва Скорочення
Довжина метр м
Маса кілограм кг
Час секунда с
Електричний струм ампер А
Термодинамічна температура кельвін К
Інтенсивність світла кандела кд
Кількість речовини моль моль
Середнє значення (середнє арифметичне, М) показ-
ників обчислюють за формулою
Ух
М = ^=—,
п
де X - окремі заначення; п - кількість окремих показників
у серії.
Середнє відхилення - це середнє значення відхилень
кожного з показників від середнього арифметичного зна-
чення. З математичного погляду найліпше визначити від-
хилення за допомогою середнього геометричного значен-
ня відхилень від М, що називають стандартним відхи-
ленням вибірки ($):
Ум-х?
5 = 1
V п-1
З математичних міркувань використовують п-1, а не п.
Значення 8 може відрізнятися від стандартного відхилення
середнього значення для всієї популяції, яке позначають
о. Однак якщо вибірка є справді репрезентативною, то 8 і
о будуть сумірними.
Іншим уживаним показником розкиду значень є стан-
дартна похибка середнього значення (СПСЗ):
СПСЗ = -^.
ч/П
СПСЗ відображає надійність середнього значення вибір-
ки як представника справжнього середнього значення для
загальної популяції, від якої вибірка була зроблена.
Крива частотного розподілу може бути побудована з
окремих значень популяції з нанесенням частоти, з якою
будь-яке окреме значення трапляється у серії стосовно
інших значень. Якщо група осіб, яку тестують, гомогенна,
то крива розподілу є симетричною (рис. 1) з найбільшою
частотою для середнього значення і ширина кривої зале-
жить від о (крива нормального розподілу). В межах іде-
альної кривої нормального розподілу відсоток спостере-
жень, що належать до різних меж, наведений у табл. 4.
Середнє значення і 8 у репрезентативній вибірці наближа-
ються до середнього значення і о цілої популяції. Тому
можна передбачити на підставі середнього значення і 8
вибірки ймовірність того, що будь-яке окреме значення у
загальній популяції є нормальним. Наприклад, якщо розкид
між таким значенням і середнім дорівнює 1,968, то ймо-
вірність того, що воно є нормальним становить 1 з 20 (5 зі
Таблиця 2. Похідні одиниці СІ
Величина Назва одиниці Скорочення
Площа Кліренс Концентрація Маси Речовини Густина Електричний потенціал Енергія Сила Частота Тиск Температура Об’єм квадратний метр літр/секунда кілограм/літр моль/літр кілограм/літр вольт джоуль ньютон герц паскаль градус Цельсія кубічний метр літр м2 л/с кг/л моль/л кг/л в Дж н гц Па °С м3 л
100). Звичайно, ймовірність того, що значення є анормаль-
ним, становить 19 з 20.
Статистичний аналіз використовують також для визна-
чення різниці між двома середніми значеннями. У фізіо-
логічних та клінічних дослідженнях вимірювання часто
виконують на групі тварин чи хворих, які отримують ліку-
вання. Такі вимірювання порівнюють з такими ж вимірю-
ваннями, зробленими на контрольній групі, що ідеально
була піддана тотожному впливу, і має однакові стани, окрім
того, що лікування не проводилось. Якщо середнє зна-
чення для групи, що отримувала лікування відрізняється
від відповідного середнього значення для контрольної
групи, то постає питання, чи отримана різниця є наслідком
лікування чи розкиду значень. Ймовірність того, що різ-
ниця репрезентує розкид значень, можна визначити у бага-
тьох випадках за допомогою показника Стюдента і. По-
казник і є відношенням різниці між середніми значеннями
Таблиця 3. Стандартні префікси1
Префікс Абревіатура Значення
екса- Е 1018
пета- П 1015
тера- т 1012
гіга- г 109
мега- м 106
кіло- к 103
гекто- г 102
дека- Да 101
деци- деци 10-1
санти- санти 10-2
мілі- мл 10-3
мікро- мк ю-6
нано- н 10-9
піко- пк 10-12
фемто- Ф 10-15
атто- а 10-18
1 Такі префікси використовують для одиниць СІ та інших.
Наприклад, мікрометр (мкм) - це 106 метра (також називають
мікрон); піколітр (пл) - 10-12 літра; кілограм (кг) - 103 грама
ДОДАТОК / 681
Рис. 1. Крива нормального розподілу (крива частотного роз-
поділу значень для гомогенної популяції).
двох серій (Маі Мь) і похибки цих середніх. Формула, яку
використовують для розрахунків, має вигляд
Ма-Мь
| (Па + Пь )[(Па ~ 1>а + (ПЬ ~ 1)^6
V папь(па + ПЬ -2)
де па і пь - кількість окремих показників у серіях а і Ь, від-
повідно. Якщо па = пь, то формула для визначення 1: стає
простішою:
Ма-Мь
^(СПСЗа)2 + (СПСЗь)2
Чим більше значення і, тим менша ймовірність, що
різниця репрезентує розкид значень. Ця ймовірність
зменшується, якщо кількість осіб п у кожній групі зростає,
оскільки чим більша кількість вимірювань, тим менша
похибка вимірювань. Математичний вираз ймовірності Р
для будь-якого значення і за різних значень п можна від-
шукати у таблицях, наведених у більшості книжок зі статис-
тики. Величина Р - це дробове число, яке відображає
Таблиця 4. Відсоток значень популяції, які відповідають
різним межам для кривої нормального розподілу
Середнє значення ± з 68,27%
Середнє значення ± 1,96 з 95,00%
Середнє значення ± 2 з 95,45%
Середнє значення ± 3 з 99,73%
ймовірність того, що різниця між двома середніми значен-
нями є наслідком розкиду значень. Наприклад, якщо Р
дорівнює 0,10, то ймовірність того, що різниця є наслідком
розкиду значень, становить 10% (1 шанс на 10). Показник
Р < 0,001 свідчить, що ймовірність того, що різниця виник-
ла внаслідок розкиду значень, є меншою, ніж 1 до 1000.
Якщо Р<0,05, то більшість дослідників називають різницю
“статистично достовірною”; тобто уважають, що різниця
є наслідком дії певного чинника, а не випадковістю. Вико-
ристання 1-тесту має сенс лише для порівняння двох груп.
У випадку експериментів, що налічують більше двох груп,
з’явиться систематична похибка, яка спричинить завищене
значення ймовірності. У таких випадках застосовують дис-
персійний аналіз. Ця та інші методики описані у книгах
зі статистики.
Згадані елементарні методи та багато інших, придатних
для статистичного аналізу в дослідних лабораторіях та клі-
ніках, забезпечують визначення об’єктивних середніх зна-
чень. Статистична значимість не є свавільною для серед-
нього фізіологічного значення і протилежне є інколи пра-
вильним; проте заміна суб’єктивних вражень результатами
статистичного аналізу є важливою метою у медицині.
До корисних книг зі статистики належать:
Оа\¥8оп-8аипс1ег8 В, ТгаррКС: Вазіс апсі Сііпісаі Віозіа-
ІІ8ІІС8, 2пд ед. Арріеіоп & Ьап£е, 1994.
Ко8ПЄґВ: Гип(1атепіаІ8 о/Віо8іаіІ8ііс8. ПпхЬигу, 1982.
Тке 81/ог іке Неаіік Рго/е88Іоп8: \¥ог1д НеаЙЬ Ог§апіха-
ііоп, 1977.
2аг ЛЧ: Віо8ІаіЇ8ІісаІ АпаІу8І8. Ргепйсе-Наїї, 1974.
682/ДОДАТОК
Стандартні респіраторні позначення
(див. НапсІЬоок ої Рґіузіоіоду, Зесііоп 3: ТЬе Резрігаїогу Зузіет. Атегісап РґіузіоІодісаІ Зосіеіу, 1986)
Головні змінні А Альвеолярний газ
V Об’єм газу Д Дихальний газ
V Об’єм газу/одиницю часу. (Крапка зверху - позначка, М Газ мертвого простору
що означає швидкість) Р Тиск газу В Барометричний а Артеріальна кров
Р Середній тиск газу к Капілярна кров
ЧДР Частота дихання (кількість дихальних рухів/одиницю в Венозна кров
часу) О Дифузійна ємність Молекулярні різновиди
Е Фракційна концентрація у фазі сухого газу Позначають хімічними формулами, надрукованими у
Н Співвідношення респіраторного газообміну= Х/Со2/Уо2 індексі
О Об’єм крові Локалізація (букви для нижніх індексів) І Інспіраторний газ Приклади Ріо2 - Тиск кисню у інспіраторному газі
Е Експіраторний газ \/м - Об’єм газу у мервому просторі
Еквіваленти метричних, американських та англійських вимірювань
(значення заокруглені до двох цифр після десяткової коми)
Довжина
1 кілометр = 0,62 милі
1 миля = 5280 футів = 1,62 кілометри
1 метр = 39,37 дюймів
1 дюйм = 1/12 фута =2,54 сантиметра
Об’єм
1 літр = 1,06 американської кварти
1 американська кварта = 32 унції = 1/4 американського галону = 0,95 літра
1 мілілітр = 0,03 унції
1 унція = 29, 57 мілілітрів
1 американський галон = 0,83 англійського галону
Маса
1 кілограм = 2,2 фунта (британського) = 2,68 фунта (аптекарського)
1 фунт (британський) = 16 унцій = 453,60 грама
1 гран = 65 міліграма
Енергія
1 кілограм-метр = 7,25 футів-фунтів
1 фут-фунт = 0,14 кілограм-метрів
Температура
Для перетворення градусів Цельсія у градуси Фаренгейта помножте на 9/5 і додайте 32
Для перетворення градусів Фаренгейта у градуси Цельсія віднімінь 32 і помножте на 5/9
Грецький алфавіт
Символ Назва Символ Назва
А а Альфа N V Ню
В Р Бета 22 Ксі
Г У Гамма О 0 Омікрон
А 8 Дельта п л Пі
Е є Епсилон р р Ро
2 Зета X Сигма
Н Т| Ета Т т Тау
0 0,0 Тета У в Іпсілон
І і Йота Ф Ф,ф Фі
к к Каппа X X Хі
А X Ламбда т V Псі
М Ц Мю £1 (0 Омега
Самооцінка навиків
Предметні завдання та запитання,
тестування набутих знань
РОЗДІЛ 1
Цей розділ сюсусіься клітинних,
молекулярних іа заіальних оенов ме-
дичної фізюлої її. Після вивчення цьо-
і о ро зділу еіуден і повинен умп и:
• названі різні водні середовища ор-
іашзму, їхні значення і методи,
якими можна їх вимірювані;
• даі и о значення моля, еквівален іа й
оемомолів,
• павесіи іа порівняю різноманітні
пасивні іі акіивні сили, що сгво-
рююіь рух речовин через клітинну
мембрану,
• поясииіи оемое і навееіи прикла-
ди йоі о впливу на рух рідини і од-
ною місця в оріанізмі людини в
НІІІІС,
• описані іа навесні приклади вю-
ринноїо акіивної о ірансноріуван-
ня,
• дані означення і а поясни їй мем-
бранний ноіенціал спокою,
• шані різноманнш оріансли в клі-
пни і а функціі кожної’,
• шані хімічну природу іа фізюло-
і ічнс значення комноненнв клі пін-
ної мембрани,
• розумнії юловні ісрміни будови
ДІ ІК іа РНК і роль цих нуклеоіидів
і а інших речовин клі і ини у процесі
сіпнезу білка,
• поясни і и процес ск зони ю зу і а ен-
доциюзу й описані внесок кожно-
і о у нормальну діяльнісіь клі і ини,
• описані юловні шляхи, через які
хімічні месенджери позаклі і инної
рідини сі ворююіЬ ЗМІНИ всередині
КЛІ І ини, у нм числі зміни експресії
І снів.
• описати роль Сї-білків як молекул
внутрішньоклітинної сигналізації;
• назвати головні ісорії, що поясню-
ють старіння;
• дати означення гомеостазу іа на-
вести приклади гомеостатичних
механізмів
ГОЛОВНІ ПИТАННЯ
І. Чому с важливою для фізюлої п
№ -К -АТФ-аза9
2. Порівняйте склад плазми, ініер-
сгиційної рідини та внутрішньо-
клітинної рідини. І Іояснпь ВІДМІН-
НОСТІ.
3. Що стансіься з мембранним но-
іенціалом спокою, якщо позаклі-
тинна концен і рація К збільши і ь-
ея і 5 до 10 мекв/л? Що сганеї ься,
якщо позаклітинна концентрація
На збільшишся т 142 до 155 мекв/л?
Чому?
4. Чому ери і роци і и набухаю і ь і зі о-
дом розриваюі ься, якщо їх номіс-
іиіи у 0,3% розчин натрію хлори-
ду9
5. Гени визначаюіь уїворення специ-
фічних білків Яка нослідовнісіь
процесів, іцо відбуваю і ься між
ДІ 1К і а у і воронням білка, сскре-
іованою клниною?
6. Опиши ь будову і а функції білків,
що місія іься у кліінший мембра-
ні9
7. Які функції кальмодуліну? У чому
йою фізюлої ічне шачсння9
8. Які рецепюри іраиемііуюіьендо-
ци ю т9
9. Опишпьсіаршня з иоіляду на клі-
іиіпн і а молекулярні механізми,
що ( йоі о під] рун і ям
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-19 виберіть одне
відповідь.
1. Клітинні мембрани
(А) містять декілька споріднених
білкових молекул;
(В) непроникні для жиророзчин-
них речовин;
(С) у деяких тканинах забезпечу-
ють транспортування і люко зи
з більшою швидкістю за наяв-
ності глюкози;
(В) т вільнонроникні для елекі ро-
лпів, але не для білків,
(Е) мають сталий склад упродовж
жити діяльності КЛІТИНИ
2. Головним рушим молекули з плаз-
ми крові в інтсрс і шийний проепр,
(
(А) активне транспортування
(В) коїранеіюріування з Н
(С) полеї пісна дифузія
(В) котранспортування з №
(Е) фільтрування.
3. Вюринні месенджери
(А) речовини, що вза< модної ь з
первинними месенджсрами
поза клпинами
(В) речовини, що зв’язуюіься з
первинними мсеснджерами \
кліінший мембрані
(С) гормони, еекреїовалі у відпо-
відь на подразнення інших
гормонів.
(В) мсдіююіь внуїрпнньоклі І ІІІІІІІ
відповіді до рі зномаш і них
юрмошв іа нейроїрансмііс-
рів.
(Е) не уїворююіься у юловномх
мозку
684 / САМООЦІНКА НАВИКІВ
4. Мембранний потенціал спокою
клітини
(А) знижується до нуля, якщо в
мембрані відбувається інгібу-
вання \а+-К+-АТФ-ази.
(В) у нормі відповідає потенціалу
рівноваги для СІ .
(С) у нормі відповідає потенціалу
рівноваги для К\
(В) у нормі відповідає потенціалу
рівноваги для
(Е) суттєво зміниться, якщо поза-
клітинна концентрація Ка+
збільшиться.
5. Білки, що їх секретують клітини,
(А) не синтезуються рибосомами,
пов’язаними з мембраною.
(В) початково синтезуються з сиг-
нального пептиду або лідерної
послідовності на С-закінченні.
(С) містяться у пухирцях і секре-
торних гранулах.
(В) проходять через клітинну мем-
брану ендоцитозом.
(Е) секретуються у збільшеній
формі, ніж наявна в ендоплаз-
матичній сітці.
6. Осмос - це рух
(А) розчинної речовини через на-
півпроникну мембрану з ді-
лянки, у якій гідростатичний
тиск вищий, до ділянки, де гід-
ростатичний тиск нижчий.
(В) розчиненої речовини через на-
півпроникну мембрану з ді-
лянки низької до ділянки висо-
кої концентрації.
(С) розчиненої речовини через на-
півпроникну мембрану з ді-
лянки високої до ділянки низь-
кої концентрації.
(В) розчиненої речовини через на-
півпроникну мембрану з ді-
лянки низької до ділянки висо-
кої концентрації.
(Е) розчинної речовини через на-
півпроникну мембрану з ді-
лянки високої до ділянки низь-
кої концентрації.
7. Дейтерію оксид та інулін увели
здоровому 30-річному чоловіку.
Об’єм поширення дейтерію окси-
ду становить 42 л, а інуліну -14 л.
(А) Об’єм внутрішньоклітинної
рідини - 14 л.
(В) Об’єм внутрішньоклітинної
рідини - 28 л.
(С) Об’єм плазми -7 л.
(В) Об’єм інтерстиційної рідини -
9 л.
(Е) об’єм загального вмісту води
за цими показниками визначи-
ти не можна.
8. Які хвороби пов’язані з мутацією
у мітохондріальному геномі?
(А) муковісцидоз.
(В) спадкова зорова нейропатія
Лебера.
(С) нефрогенний нецукровий діа-
бет.
(В) родинне передчасне дозріван-
ня чоловіків.
(Е) хвороба Гіршпрунга.
9. Які рецептори не пронизують мем-
брану клітини сім разів?
(А) р-Адренергічні рецептори.
(В) Родопсин.
(С) 5-НТ1с-рецептор.
(В) Мінералокортикоїдний рецеп-
тор.
(Е) ЛГ-рецептор.
10. Які речовини впливають безпосе-
редньо на ядро, спричинюючи фі-
зіологічні ефекти?
(А) ІЛ-1р.
(В) Гормон росту.
(С) Кортизон.
(В) Дофамін.
(Е) Естрадіол.
У питаннях 11-14 утворіть пари
з хвороби, що наведена в кожному пи-
танні, та характеристик, позначе-
них літерами, які найтісніше пов ’я-
зані з нею.
(А) Анормальні рецептори для ка-
техоламінів.
(В) Анормальний О-білок.
(С) Антитіла проти рецепторів.
(В) Недостатність рецепторів для
позаклітинного білка.
(Е) Анормальний рецептор для
позаклітинного білка.
11. Багато випадків хвороби Ґрейва.
12. Деякі випадки псевдогіпопарати-
реоїдизму.
13. Деякі випадки родинної гіперхо-
лестеролемії.
14. Деякі випадки акромегалії.
Утворіть пари з висловів 15-19,
які означають функцію, та позначе-
них літерами структур (рис. 1-А), що
найтісніше стосуються їх. Кожну по-
значену літерою відповідь можна ви-
користовувати один або декілька ра-
зів або не використовувати взагалі.
15. Видалення сигнальних пептидів.
16. Гідроліз прогормонів.
17. Рециклінг рецепторів клітинної
мембрани.
18. Глікозиляція білків.
Рис. 1-А.
19. Конститутивна секреція.
У питаннях 20-25 визначте, чи ве-
личина, наведена у першому вислові,
є більшою (Є), однаковою (8) або мен-
шою (ІД ніж величина, наведена у
другому.
20. Концентрація йонів гідрогену у лі-
зосомах.
С8Ь
Концентрація йонів гідрогену у
цитоплазмі клітин.
21. Внесок нормальної концентрації
глюкози плазми у загальну осмо-
ляльність плазми.
С8Ь
Внесок нормальної концентрації
№’ плазми у загальну осмоляль-
ність плазми.
22. Об’єм плазми обчислюють, коли
частина барвника, використана
для його вимірювання, введена
підшкірно замість внутрішньовен-
но.
С8Ь
Об’єм плазми обчислюють, коли
частина барвника, використана
для його вимірювання, введена
внутрішньовенно.
23. Концентрація К+ у внутрішньоклі-
тинній рідині.
САМООЦІНКА НАВИКІВ / 685
С8Ь
Концентрація ІС в інтерстиційній
рідині.
24. Концентрація Са2+ у внутрішньо-
клітинній рідині.
С8Ь
Концентрація Са2+ в інтерстицій-
ній рідині.
25. Розмір мітохондріального геному.
С8Ь
Розмір нуклеарного геному.
РОЗДІЛ 2
Це перший з чотирьох розділів, що
стосуються нервів і м’язів, а також вза-
ємозв’язку між ними. В ньому розгля-
нуто питання морфології нейронів,
електричні та йонні явища, що є осно-
вою їхнього збудження і здатності пе-
редавати імпульси. Після вивчення
цього розділу студент повинен уміти:
• назвати різні частини нейрона і
їхнє функційне призначення;
• схарактеризувати безмієлінові та
мієлінові нейрони, описати хіміч-
ну природу мієліну і з’ясувати від-
мінності передавання імпульсів
безмієліновими та мієліновими
нейронами;
• пояснити значення явищ ортоград-
ного та ретроградного аксоплазма-
тичного транспортування і дегене-
рації Валлєра;
• дати означення явищ збудження і
провідності, описати зміни, що є
в основі виникнення електротоніч-
них потенціалів і потенціалів дії;
• розтлумачити такі властивості по-
ширення нервового імпульсу: ла-
тентний період, критичний період
деполяризації, пік-потенціал, слі-
дова деполяризація і гіперполяри-
зація;
• описати і пояснити явище склад-
ного потенціалу дії в змішаних
нервах;
• назвати різні типи нервових воло-
кон, що є в організмі, і пояснити
їхнє значення в умовах нормаль-
ного й анормального функціюван-
ня периферійних нервів;
• описати різні типи клітин глії і
функційне призначення кожного;
• назвати відомі нейротрофіни, а та-
кож типи нейронів, на які вони
діють. Описати їхні впливи та ме-
ханізми цих впливів.
ГОЛОВНІ ПИТАННЯ
1. Яке значення для тваринних орга-
нізмів має еволюція мієлінових
нейронів?
2. Порівняйте функцію дендритів з
функцією нейронів.
3. Опишіть і поясніть вплив тетра-
доксину на мембранний потенціал
спокою і потенціал дії в нервових
клітинах.
4. Які типи нервових волокон міс-
тяться в складі симпатичного нер-
ва, що прямує від черевного вузла
до кишки? Відповідь поясніть.
5. Як абсолютний і відносний ре-
фрактерні періоди корелюють у
часі з різними фазами потенціалу
дії? Чому під час цих періодів
зменшується збудливість нерва?
6. Порівняйте електричні та йонні
явища в нейронах з такими ж яви-
щами у скелетних, серцевому та
гладких м’язах.
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-6 виберіть одну від-
повідь.
1. Потенціал дії нерва
(А) започатковується витіканням
йонів N3?
(В) завершується внаслідок виті-
кання йонів К+.
(С) поширюється нейроном зі
зниженням амплітуди.
(В) зумовлений швидкоплинними
змінами градієнта концентра-
ції йонів На" у клітинній мем-
брані.
(Д) не пов’язаний з будь-яким пе-
реміщенням йонів №' або К+
через клітинну мембрану.
2. До аксона приєднані подразню-
вальні електроди, а внутрішньо-
клітинний електрод сполучений
через катодно-променевий осци-
лоскоп (КО) з індиферентним
електродом (рис. 2-А). У разі по-
дразнення аксона латентний пері-
од становив 1,5 мс. Внутрішньо-
клітинний електрод розміщений
на відстані 6 см від анода і 4,5 см
Мікроелектрод
усередині аксона
Рис. 2-А.
від катода подразника. Яка швид-
кість передавання в аксоні?
(А) 15 м/с.
(В) ЗО м/с.
(С) 40 м/с.
(В) 67,5 м/с.
(Е) Неможливо визначити на під-
ставі наведених даних.
3. Яким з перелічених волокон влас-
тива найменша швидкість переда-
вання?
(А) Аос-волокна.
(Б) Ар-волокна.
(В) Ау-волокна.
(Г) В-волокна.
(Д) С-волокна.
4. Підклавши руку під голову, чоло-
вік глибоко заснув. Після пробуд-
ження він виявив, що його кінцівка
паралізована, однак больова чут-
ливість у ній збережена. Причи-
ною втрати рухової функції зі збе-
реженням відчуття болю є те, що
в нервах верхньої кінцівки
(А) А-волокна вразливіші до гіпо-
ксії, ніж В-волокна.
(Б) А-волокна чутливіші до стис-
кання, ніж С-волокна.
(В) С-волокна чутливіші до стис-
кання, ніж А-волокна.
(Г) чутливі нерви розмішені ближ-
че до кісток, ніж рухові, внас-
лідок чого їх менше ушкоджує
холод.
(Д) чутливі нерви розміщені ближ-
че до кісток, ніж рухові, внас-
лідок чого їх менше ушкоджує
стискання.
5. Яка частина нейрона має вищу
концентрацію Ка+-каналів на один
квадратний міліметр клітинної
мембрани?
(А) Дендрити.
(В) Ділянки тіла клітини біля ден-
дритів.
(С) Початковий сегмент.
(В) Мембрана аксона під міє-
ліном.
(Е) Жодна з наведених вище час-
тин.
686 / САМООЦІНКА НАВИКІВ
6. Яке з наведених тверджень, що
стосуються фактора росту нервів,
є хибним!
(А) Він утворений трьома полі-
пептидними субодиницями.
(В) Він у високих концентраціях
міститься в підщелепних слин-
них залозах самки миші.
(С) Він потрібний для росту і роз-
витку симпатичної нервової
системи.
(В) Його захоплюють нерви з ор-
ганів, іннервованих цими нер-
вами.
(Е) Він є у головному мозку.
У питаннях 7 10 визначте, чи ве-
личина, наведена у першому вислові,
с більшою (Є), однаковою (8) або мен-
шою (Ь), ніж величина, наведена у
другому
7. Кількість гліальних клітин у голов-
ному мозку.
С 8 Е
Кількість нейронів у головному
мозку.
8. Швидкість передавання в аксонах
малого діаметра.
С8Ь
Швидкість передавання в аксонах
великого діаметра.
9. Збудливість у нейроні в разі збіль-
шення мембранного потенціалу
спокою до -80 мВ.
С8Ь
Збудливість у нейроні в разі змен-
шення мембранного потенціалу
спокою до -60 мВ.
10. Загальна тривалість складного по-
тенціалу дії змішаного нерва на
відстані 5 мм від подразнюваль-
ного електрода.
С8Ь
Загальна тривалість складного по-
тенціалу дії змішаного нерва на
відстані 50 мм від подразнюваль-
ного електрода.
РОЗДІЛ з
У цьому розділі описані морфо-
логічні та фунційні характеристики
трьох типів м’язів, що є в організмі
людини: скелетного, серцевого та
гладкого. Після вивчення цього роз-
ділу студент повинен уміти:
• описати макро- та мікроскопічну
анатомію скелетних м’язів, у тім
числі поперечну посмугованість,
стосунок актину до міозину і сар-
котубулярну систему;
• описати та пояснити взаємодію
між актином та міозином;
• порівняти морфологію серцевого,
вісцерального гладкого та поліеле-
ментного гладкого м’яза зі скелет-
ним;
• навести послідовність електрич-
них та йонних процесів, що відбу-
ваються від появи потенціалу дії у
моторному нерві до скорочення
скелетного м’яза, і описати значен-
ня кожного;
• порівняти ізометричне та ізотоніч-
не скорочення;
• характеризувати дистрофін, його
функції у нормі та описати хворо-
би, які виникають, коли він анор-
мальний або його нема;
• описати джерела енергії для м’я-
зових скорочень та пояснити, як
енергія переміщує скоротливий
апарат;
• характеризувати кисневий борг та
описати його роль у діяльності
м’язів під час фізичного наванта-
ження;
• описати різницю між швидкими та
повільними скелетними м’язами;
• характеризувати термін рухова
одиниця й описати вплив денер-
вації на скелетні м’язи;
• описати йонні явища, що виника-
ють під час потенціалу дії у серце-
вому м’язі;
• описати відхилення у мембранно-
му потенціалі, що простежується
у пейсмейкерній тканині, та йонні
зміни, що відповідають за препо-
тенціал;
• порівняти електричні та механічні
явища у гладких м’язах з такими
ж у скелетних м’язах та з’ясувати
вплив ацетилхоліну і норадрена-
ліну на електричну й механічну ак-
тивність вісцеральних гладких
м’язів.
ГОЛОВНІ ПИТАННЯ
1. Наведіть визначення загального
напруження, пасивного напружен-
ня, активного напруження, довжи-
ни в стані спокою та довжини рів-
новаги. Як взаємозв’язок актину з
міозином пояснює криву довжи-
на-напруження у скелетних м’я-
зах?
2. М’яз - це пристрій для конверту-
вання хімічної енергії у механіч-
ну. Проаналізуйте та опишіть це
твердження.
3. Яка мінімальна частота подраз-
нення, за якої тетанус відбувається
у швидких м’язах з тривалістю
м’язового скорочення 7,5 мс і у по-
вільних м’язах - з 100 мс.
4. Опишіть чинники, що визначають
градацію відповідей скелетних
м’язів у живих інтактних тварин.
5. Опишіть співвідношення між дов-
жиною м’язового волокна та на-
пруженістю у серцевому м’язі в
нормі та в разі гіпертрофії міокар-
да.
6. Порівняйте молекулярні події, що
розпочинають скорочення у глад-
ких та скелетних м’язах. Що є по-
дібним, а що відмінним?
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1—10 виберіть одну
відповідь:
1. Потенціал дії скелетних м’язів
(А) має продовжену фазу плато.
(В) поширюється всередині до
всіх частин м’яза через Т-тру-
бочки.
(С) спричинює негайне засвоєння
Са2+ з бокових цистерн сарко-
плазматичної сітки.
(В) є довшим, ніж потенціал дії у
серцевому м’язі.
(Е) не є важливим для скорочення.
2. До фунцій тропоміозину в скелет-
них м’язах належить
(А) ковзання вздовж актину для за-
безпечення скорочень.
(В) вивільнення Са2^ після ініціації
скорочення.
(С) зв’язування з міозином під час
скорочення.
(В) дія, як “білка розслаблення” у
спокої - накривання сайтів, де
міозин зв’язується з актином.
(Е) генерування АТФ, який пере-
дається до скоротливого меха-
нізму.
3. Поперечні містки у саркомері ске-
летних м’язів утворені з
(А) актину.
(В) міозину.
(С) тропоніну.
САМООЦІНКА НАВИКІВ / 687
(В) тропоміозину.
(Е) мієліну.
4. Скоротлива відповідь у скелетних
м’язах
(А) розпочинається після закін-
чення потенціалу дії.
(В) не є кінцевою, доки триває по-
тенціал дії.
(С) виконує більше напруження,
коли м’яз скорочується ізомет-
рично, ніж тоді, коли м’яз ско-
рочується ізотонічно;
(В) виконує більшу роботу в разі
ізометричного м’язового ско-
рочення, ніж у випадку ізото-
нічного;
(Е) зменшується в разі повторного
подразнення.
5. Щільні контакти
(А) є у серцевому м’язі.
(В) є, але з невеликою функцій-
ною значимістю, у серцевому
м’язі.
(С) є, однак забезпечують шлях
для швидкого поширення збуд-
ження від одного волокна сер-
цевого м’яза до іншого.
(В) не виявлені у гладких м’язах.
(Е) з’єднують саркотубулярну сис-
тему з окремими скелетними
м’язовими клітинами.
У питаннях 6-10 виберіть
А, якщо вислів пов’язаний з (а);
В, якщо вислів пов’язаний з (Ь);
С, якщо вислів пов’язаний з (а) та
(Ь);
В, якщо вислів не пов’язаний ні з
(а), ні з (Ь).
(а) сила скорочення в м’язі;
(Ь) тривалість скорочення в м’язі.
6. Довжина м’яза на початку скоро-
чення.
7. Тип ізоформ міозинових важких
ланцюгів у м’язі.
8. Ступінь, до якого нагрівається в
руховому нерві м’яз, є асинхрон-
ним.
9. Вміст колагену в м’язі.
10. Вміст дистрофіну в м’язі.
До висловів 11—13 підберіть речо-
вину, позначену літерами, яка най-
ближче з ними пов ’язана. Кожну ре-
човину можна використати кілька
разів або не використати жодного.
(А) Адреналін.
(В) Інгібін.
(С) Тестостерон.
(В) Тиреоїдні гормони.
(Е) Кортизон.
11. Зменшення вмісту в м’язах гліко-
гену.
12. Збільшення маси м’язів.
13. Збільшення швидкості скорочен-
ня.
У питаннях 14-І 6 визначте, чи
величина, наведена у першому вислові,
с більшою (С), однаковою (8) або
меншою (Ь), ніж величина, наведена
у другому.
14. Тривалість збільшення притоку
Са2+ під час потенціалу дії у серце-
вому м’язі.
С8Ь
Тривалість збільшення надход-
жень Са2+ під час потенціалу дії у
скелетному м’язі.
15. Кількість дистрофіну у нервово-
м’язовому з’єднанні.
С8Ь
Кількість утрофіну у нервово-м’я-
зовому з’єднанні.
16. Збудливість гладких м’язів матки
після введення прогестерону.
Збудливість гладких м’язів матки
після введення естрогену.
РОЗДІЛ 4
Цей розділ стосується синаптичних
контактів між нейронами, нервово-
м’язового синапсу, а також нейро-
трансмітерів і рецепторів, що забез-
печують передавання в цих сполучен-
нях. Після вивчення цього розділу сту-
дент повинен уміти:
• описати головні особливості мор-
фології синапсів;
• пояснити характер хімічного та
електричного передавання в си-
напсах;
• описати швидкий і повільний збуд-
жувальні та гальмівні потенціали,
а також йонні потоки, що їх спри-
чинюють. Пояснити, як ці потен-
ціали взаємодіють з генерованими
потенціалами дії;
• характеризувати і дати приклади
прямого, опосередкованого, пре-
синаптичного та постсинаптично-
го гальмування;
• характеризувати синаптичну плас-
тичність і з’ясувати її стосунок до
процесів навчання;
назвати 12 нейротрансмітерів і го-
ловні ділянки нервової системи, де
вони вивільнюються;
дати означення опіоїдного пепти-
ду, назвати головні опіоїдні пеп-
тиди організму, а також молекули-
попередники, з яких вони похо-
дять;
описати рецептори катехоламінів,
ацетилхоліну, 5-НТ та опіоїдів;
характеризувати етапи біосинтезу,
вивільнення, дії та видалення з си-
наптичної щілини ацетилхоліну,
дофаміну, адреналіну, норадрена-
ліну і серотоніну;
пояснити суть явищ звикання, сен-
сибілізації, довготривалої потен-
ціації і довготривалої депресії;
описати структуру нервово-м’язо-
вого синапсу і пояснити, як потен-
ціали дії, що надходять руховим
нейроном до синапсу, зумовлюють
скорочення скелетного м’яза;
пояснити суть явища денервацій-
ної підвищеної чутливості.
ГОЛОВНІ ПИТАННЯ
1. Аксон може забезпечувати провід-
ність у будь-якому напрямі, однак
у хімічному синапсі провідність
лише однонапрямлена. Чому?
2. Які типи хімічних сполук викону-
ють функцію синаптичних транс-
мітерів?
3. Один із записів на рис. 4-А зумов-
лений дією ацетилхоліну як збуд-
жувального трансмітера, а інший
- у-аміномасляної кислоти як галь-
мівного трансмітера. Ідентифікуй-
те записи. Відповідь поясніть.
Рис. 4-А. Запис за допомогою техніки
петч клемп двох різних нейронів. Відхи-
лення донизу свідчить про наявність
вхідних, а відхилення угору - вихідних
імпульсів.
688 / САМООЦІНКА НАВИКІВ
4. Яку роль у метаболізмі нейро-
трансмітерів відіграє зворотне по-
глинання? Як воно відбувається?
Які фармакологічні засоби його
блокують?
5. Підраховано, що в передньому
мозку людини співвідношення
кількості синапсів до кількості
нейронів становить 40 000 до 1.
Поясніть це явище і його фізіоло-
гічне значення.
6. Що таке синаптична затримка?
Поясніть її значення стосовно фун-
кцій головного мозку.
7. З’ясуйте функцію глютаматних ре-
цепторів у головному мозку.
8. Одні нейрони продукують ней-
ротрансмітери, а інші - гормони,
тобто хімічні месенджери, що по-
ширюються кров’яним руслом.
Назвіть гормони, що утворюють
нейрони і назвіть локалізацію цих
нейронів.
9. Гази нервово-паралітичної дії, які
були синтезовані для можливої хі-
мічної війни, головно гальмують
активність ацетилхолінестерази.
Чому таке гальмування зумовлює
смерть?
10. Порівняйте структуру та функцію
закінчень соматичних мотоней-
ронів у скелетному м’язі і закін-
чень автономних рухових нервів у
серцевому і гладких м’язах.
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1—17 виберіть одну
відповідь.
Утворіть пари з висловів 1-5 та
позначених літерами структур, що їх
стосуються. Кожна з цих структур
може бути використана один раз,
декілька разів або жодного разу.
(А) Мікротрубочки.
(В) Активні зони.
(С) Ядра.
(Л) Світлі пухирці.
(Е) Зернисті пухирці.
1. Містять ацетилхолін.
2. Містять катехоламіни.
3. Містять стероїдні рецептори.
4. Містять синтаксин.
5. Зв’язані з кінезином.
У питаннях 6-8утворіть пари з ре-
цепторів, наведених у кожному з пи-
тань, та характеристик, позначених
літерами, які пов ’язані з ними. Кожен
вислів може бути використаний один
раз, декілька разів або жодного разу.
(А) Утворений багатьма субоди-
ницями.
(В) Блокований 7п2+.
(С) Зв’язаний з 65.
(Л) У високій концентрації міс-
титься в смугастому тілі.
(Е) Гальмований стрихніном.
6. р!-Адренергічний рецептор.
7. Л2-Дофаміновий рецептор.
8. Т4-метил Л-аспартатний рецептор.
9. Яку з речовин не продукують пост-
гангліонарні симпатичні нейрони?
(А) Б-ДОФА.
(В) Дофамін.
(С) Норадреналін.
(Л) Гістамін.
(Е) Ацетилхолін.
10. Швидкі гальмівні постсинаптичні
потенціали
(А) є наслідком пресинаптичного
гальмування.
(В) взаємодіють з іншими швид-
кими і повільними потенціала-
ми, зумовлюючи зміни мем-
бранного потенціалу, набли-
жаючи або віддаляючи його
значення від критичного рівня
деполяризації.
(С) можуть бути спричинені зрос-
танням провідності йонів Ка+.
(Л) можуть бути спричинені зрос-
танням провідності йонів Са2+.
(Е) виникаютьу скелетному м’язі.
11. Започаткування потенціалу дії в
скелетному м’язі шляхом подраз-
нення його рухового нерва
(А) залежить від просторового
підсилення.
(В) залежить від часового підси-
лення.
(С) гальмоване високою концент-
рацією Са2+ у цервово-м’язо-
вому синапсі.
(Л) залежить від вивільнення нор-
адреналіну.
(Е) залежить від вивільнення аце-
тилхоліну.
12. Який з названих йонних каналів є
ліґандозалежним?
(А) ВІП-рецептор.
(В) Норадреналіновий рецептор.
(С) ГАМКА-репептор.
(Л) ГАМКв-рецептор.
(Е) Метаботропний глютаміно-
вий рецептор.
13. Що з наведеного, найвірогідніше,
не пов’язане з виникненням дов-
готривалої потенціації?
(А) N0.
(В) Са24.
(С) М-метил-Л-аспартатні рецеп-
тори.
(Л) Мембранна гіперполяризація.
(Е) Мембранна деполяризація.
14. Який з наведених синаптичних
трансмітерів не є пептидом, полі-
пептидом чи білком?
(А) Речовина Р.
(В) Метенкефалін.
(С) р-Ендорфін.
(Л) Серотонін.
(Е) Динорфін.
15. Активування яких з перелічених
рецепторів може, вірогідно, змен-
шувати відчуття тривоги?
(А) Нікотинові холінергічні ре-
цептори.
(В) Глютаматні рецептори.
(С) ГАМКА-рецептори.
(Л) Глюкокортикоїдиі рецептори.
(Е) ОС]-Адренергічні рецептори.
16. Який з наведених рецепторів зв’я-
заний з гетеродимерним О-біл-
ком?
(А) Гліциновий рецептор.
(В) ГАМКв-рецептор.
(С) Нікотиноподібний ацетилхолі-
новий рецептор нервово-м’я-
зового синапсу.
(Л) 5-НТ3-рецептор.
(Е) АКР-рецептор.
17. Який з наведених засобів, віро-
гідно, не підсилюватиме норадре-
нергічне передавання?
(А) Засіб, що збільшує проник-
ність аргініну всередину ней-
рона.
(В) Засіб, що підсилює активність
тирозингідроксилази.
(С) Засіб, що підсилює активність
дофамін-р-гідроксилази.
(Л) Засіб, що гальмує активність
моноамінооксидази.
(Е) Засіб, що гальмує зворотне по-
глинання норадреналіну.
У питаннях 18-20 визначте, чи ве-
личина, наведена у першому вислові,
є більшою (С), однаковою (8) або мен-
шою (Ь), ніж величина, наведена у
другому.
18. Кількість норадреналіну, що ви-
вільняється в норадренергічному
синапсі під час стимулювання пре-
синаптичних ос2-адренергічних ре-
цепторів.
С 8Ь
Кількість норадреналіну, що ви-
вільняється в норадренергічному
САМООЦІНКА НАВИКІВ / 689
синапсі під час стимулювання
постсинаптичних (^-адренергіч-
них рецепторів.
19. Афінність СВ]-рецептора до анан-
даміду.
С8Ь
Афінність СВ2-рецептора до анан-
даміду.
20. Кількість пронизувань р2-адренер-
гічним рецептором клітинної мем-
брани.
С8Ь
Кількість пронизувань М1 муска-
риноподібним ацетилхоліновим
рецептором клітинної мембрани.
РОЗДІЛ 5
Цей розділ стосується механізмів
утворення потенціалів дії у сенсорних
нервах, сенсорних систем і узагальне-
них засад та законів, згідно з якими
кодована сенсорна інформація. Після
вивчення цього розділу студент пови-
нен уміти:
• дати означення терміна сенсорний
рецептор;
• дати означення адекватного по-
дразника і навести приклади;
• пояснити різні класифікації орга-
нів чуття;
• назвати типи сенсорних рецепто-
рів, розміщених у шкірі, та описа-
ти їхній зв’язок з чотирма шкірни-
ми відчуттями: дотику, холоду, теп-
ла й болю;
• розуміти механізм генерування ре-
цепторного потенціалу й описати
взаємозв’язок його значення у сен-
сорному рецепторі з кількістю ім-
пульсів, що генеровані у сенсор-
ному нерві;
• дати означення процесу адаптації,
пояснити доктрину специфічних
нервових енергій та закони проек-
ції;
• пояснити як відбувається кодуван-
ня інтенсивності, локалізації та
якості подразника.
ГОЛОВНІ ПИТАННЯ
1. Опишіть сенсорні одиниці та їхні
складові, якщо інтенсивність по-
дразників збільшується.
45 367-2
2. Яка відмінність між тонічними та
фазовими рецепторами? Які фізіо-
логічні функції забезпечує кожний
тип?
3. Яка частина тільця Пачіні утворює
свій генераторний потенціал? Де
утворюється потенціал дії у сен-
сорному нерві? Яку функцію за-
безпечують множинні пластинки у
сполучній тканині капсули, що
вкриває закінчення сенсорних нер-
вів?
4. Чому людина спочатку бачить блис-
кавку, а потім чує грім?
5. Люди з ампутованими кінцівками
можуть відчувати біль у кінцівці,
якої вже немає тривалий час, і це
може стати складною медичною
проблемою. Поясніть чому наявні
болі у кінцівці, яка ампутована? Як
можна лікувати хворого з такими
“фантомними болями”?
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-7 виберіть одну від-
повідь.
1. Тільця Пачіні - це
(А) тип температурного рецептора.
(В) у нормі іннервовані Аб-нерво-
вими волокнами.
(С) рецептори дотику, що швидко
адаптуються.
(Л) рецептори дотику, що повіль-
но адаптуються.
(Е) рецептори болю.
2. Адаптація до сенсорних подразни-
ків продукує
(А) послаблення відчуття у разі за-
стосування разом з первинним
подразником сенсорних по-
дразників іншого типу.
(В) інтенсивніше відчуття, якщо
уживаний подразник застосо-
вують повторно.
(С) відчуття, що локалізуються у
руці, якщо подразнюють нер-
ви плечового сплетення.
(Л) зменшення відчуття, якщо
уживаний подразник застосо-
вують постійно.
(Е) зменшення рівня порогу збуд-
ження у сенсорних нервах
внаслідок того, що на рецеп-
тори безпосередньо впливає
інша речовина.
3. Які з наведених відчуттів не гене-
руються імпульсами ініційовани-
ми вільними нервовими закінчен-
нями?
(А) Дотик.
(В) Біль.
(С) Холод.
(Л) Лоскотання.
(Е) Смак.
4. Відчуття, що сприймаються пра-
вою рукою, не можуть бути спри-
чинені подразненням
(А) аферентних нейронів руки то-
ді, коли вони входять у спин-
ний мозок.
(В) нейронів спіноталамічного
шляху, на якому закінчуються
аферентні нейрони руки.
(С) ділянки руки у таламусі на лі-
вому боці організму.
(Л) ділянки руки сенсорної кори
на лівому боці організму.
(Г) ділянки руки сенсорної кори
на правому боці організму.
5. Які з наведених рецепторів та ор-
ганів чуття є неправильно спаро-
вані?
(А) Пал очки та колбочки : око.
(В) Тільця Мейснера : нюховий
епітелій.
(С) Волоскові клітини : внутрішнє
вухо.
(Л) Рецептори, чутливі до розтягу
: каротидний синус.
(Г) Гломусні клітини : каротидний
клубочок.
6. Які з наведених відчуттів найбіль-
ше підпорядковані збудженню та
гальмуванню у ЦНС?
(А) Дотик.
(В) Тепло.
(С) Біль.
(Л) Слух.
(Е) Смак.
7. Які з наведених структур не міс-
тять катіонних каналів, активо-
ваних механічним зміщенням,
утворюючи деполяризацію?
(А) Колбочка.
(В) Тільця Пачіні.
(С) Волоскові клітини у завитці.
(Л) Волоскові клітини у напів-
кружних каналах.
(Е) Волоскові клітини в маточці.
У питаннях 8-10 визначте, чи ве-
личина, наведена у першому вислові,
є більшою (С), однаковою (8) або мен-
шою (Ь), ніж величина, наведена у
другому.
8. Величина ґенераторного потенці-
алу після дії слабкого подразника.
С8Ь
690 / САМООЦІНКА НАВИКІВ
Величина генераторного потенці-
алу після дії сильного подразника.
9. Амплітуда потенціалу дії у сенсор-
них нервах після дії слабкого по-
дразника.
С8Е
Амплітуда потенціалу дії у сенсор-
них нервах після дії сильного по-
дразника.
10. Відчуття болю, коли рецептори хо-
лоду є під впливом слабких по-
дразників.
С8Ь
Відчуття болю, коли рецептори хо-
лоду є під впливом сильних по-
дразників.
РОЗДІЛ 6
У цьому розділі описані структури,
що утворюють рефлекторну дугу, мо-
носинаптичні і полісинаптичні спі-
нальні рефлекси, а також властивості
і функції м’язових веретен. Після ви-
вчення цього розділу студент повинен
уміти:
• сформулювати закон Белла-Ма-
жанді і його фізіологічне значення;
• характеризувати моносинаптичні
та полісинаптичні рефлекси і по-
рівняти їх;
• навести приклади рефлексів роз-
тягування, зокрема таких, які час-
то використовують у клінічній
практиці;
• описати будову м’язових веретен і
проаналізувати їхнє функційне
призначення як частини системи
зворотного зв’язку регулювання
довжини м’яза;
• описати структуру сухожилкових
органів Ґольджі і проаналізувати
їхнє функційне призначення як
частини системи зворотного зв’яз-
ку забезпечення м’язової сили;
• з’ясувати явища реципрокної ін-
нервації, зворотного рефлексу роз-
тягування, клонуса і реакції видов-
ження;
• з’ясувати і пояснити явища фрак-
ціювання й оклюзії.
ГОЛОВНІ ПИТАННЯ
1. Що називають ознакою місця, по-
ясніть її значення.
2. Що таке кінцевий спільний шлях?
З’ясуйте його фізіологічні підста-
ви і значення.
3. Чому сильний шкідливий подраз-
ник спричинює тривалу реакцію
відсмикування?
4. Виявлено, що в нормальному стані
центральна затримка певної ре-
флекторної реакції становила
0,9 мс. Яким шляхом поширюєть-
ся ця реакція - моносинаптичним
чи полісинаптичним? Відповідь
поясніть.
5. Як рефлекторні реакції вдоско-
налюються і модифікуються?
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-4 виберіть одну від-
повідь.
1. Зворотний рефлекс розтягування
(А) має нижчий поріг, ніж рефлекс
розтягування.
(В) є моносинаптичним рефлек-
сом.
(С) є двосинаптичним рефлексом,
у рефлекторній дузі якого один
інтернейрон уставлений між
аферентним і еферентним ней-
ронами.
(Л) є полісинаптичним рефлексом
з багатьма інтернейронами,
що розміщені між аферентним
і еферентним нейронами.
(Е) потребує імпульсації з боку
центральних нейронів, унаслі-
док чого відбувається вивіль-
нення ацетилхоліну.
2. Коли одночасно з посиленням
збудження в у-мотонейронах поси-
люється імпульсація ос-мотонейро-
нів до м’яза, то
(А) виникає швидке гальмування
імпульсації у веретені Іа афе-
рентів.
(В) пролонгується м’язове скоро-
чення.
(С) м’яз не скорочуватиметься.
(Л) кількість імпульсів у веретені
Іа аферентів буде меншою, ніж
коли збільшуватиметься лише
ос-імпульсація.
(Е) кількість імпульсів у веретені
Іа аферентів буде більшою,
ніж коли збільшуватиметься
лише а-імпульсація.
3. Що не є характерним для рефлек-
торної діяльності?
(А) Модифікація імпульсами, що
надходять з різних частин
центральної нервової системи.
(В) Може одночасно забезпечува-
ти скорочення одних м’язів і
розслаблення інших.
(С) Може забезпечувати соматич-
ні або вісцеральні реакції, але
не одночасно обидві.
(Л) Передавання в межах рефлек-
торної дуги відбувається за
участю принаймні одного си-
напсу.
(Е) Часто відбувається підсвідо-
мо.
4. Рефлекси відсмикування не є
(А) ініційованими шкідливими по-
дразниками.
(В) домінуючими.
(С) пролонгованими у разі силь-
ного подразника.
(Л) відсутні декілька місяців після
перетинання спинного мозку.
(Е) залежними від ознаки місця.
Питання 5-7 стосуються рис. 6-А.
На рис. 6-А А, В та С є записами
потенціалів дії в аферентних нервових
волокнах, що поширюються від м’яза
до і після м’язового розтягування, що
відображає крива м’язового розтягу-
вання.
5. Який запис виконано з нервового
волокна, що іннервує волокно
ядерного мішка?
6. Який запис виконано з нервового
волокна, що іннервує волокно
ядерного ланцюжка?
7. Який запис виконано з нервового
волокна, що іннервує сухожилко-
вий орган Ґольджі?
У питаннях 8-10 визначте, чи ве-
личина, наведена у першому вислові,
є більшою (С), однаковою (8) або мен-
шою (ІД ніж величина, наведена у
другому.
8. Реакція скелетного м’яза на розтя-
гування після перетинання чутли-
вого нерва, що іннервує цей нерв.
С8Ь
Час
Рис. 6-А.
САМООЦІНКА НАВИКІВ / 691
Реакція скелетного м’яза на розтя-
гування після перетинання рухо-
вого нерва, що іннервує цей м’яз.
9. Рівень імпульсації в руховому нер-
ві м’яза-протагоніста під час ре-
флексу розтягування.
С8Ь
Рівень імпульсації в руховому нер-
ві м’яза-антагоніста під час ре-
флексу розтягування.
10. Ритмічні скоротливі реакції на
тривале розтягування м’яза у разі
високого рівня у-еферентної ім-
пульсації.
С8Ь
Ритмічні скоротливі реакції на
тривале розтягування м’яза у разі
низького рівня у-еферентної ім-
пульсації.
РОЗДІЛ 7
Цей розділ стосується механізмів
функціювання сенсорних систем, що
відповідають за дотик, пропріорецеп-
цію, відчуття холоду та тепла, болю,
свербіння та відчуття, що виникають
унаслідок комбінації цих головних від-
чуттів. Детально описано біль включ-
но з характеристиками так званого
швидкого та повільного болю, пост-
травматичного та невропатичного бо-
лю, глибокого та вісцерального болю.
Схарактеризовані також хронічні бо-
льові синдроми. Після вивчення цьо-
го розділу студент повинен уміти:
• розуміти нейрональні зв’язки та
шляхи, що забезпечують переда-
вання сенсорних вхідних імпульсів
зі шкіри, глибоких тканин та віс-
церальних органів до кори голов-
ного мозку;
• описати структури та функції же-
латинозної речовини;
• описати ділянки, в яких сенсорні
проекції нейронів від таламуса
закінчуються у сенсорній корі;
• назвати рецептори, що відповіда-
ють за біль, та пояснити відмін-
ність між швидким та повільним
болем;
• порівняти поверхневий, глибокий
та вісцеральний біль;
• дати означення гіпералгезії;
• описати та пояснити іррадійова-
ний біль;
• навести головні лікарські засоби та
маніпуляції, які використовують
для зменшення болю. Для кожного
прикладу визначити раціональ-
ність застосування та прокомен-
тувати їхню клінічну ефектив-
ність;
• пояснити вібраційну чутливість,
природу розрізнення двох точок та
стереогнозис.
ГОЛОВНІ ПИТАННЯ
1. Що є адекватним подразником для
відчуття холоду, тепла та болю? Чи
больові рецептори специфічні?
Які хімічні агенти можуть ініцію-
вати імпульси у больових волок-
нах?
2. Чому пухлина, що виникає у верх-
ній частині спинного мозку, спри-
чинює втрату болю та температур-
ної чутливості спочатку у верхніх
сегментах тіла людини і тільки піз-
ніше - у нижніх. Що станеться з
кореспондентним порядком втра-
ти пропріорецепції?
3. Опишіть локалізацію двох про-
відних шляхів у спинному мозку,
які стосуються дотику. Інформа-
цію якого типу стосовно дотику
передає кожний шлях?
4. Опишіть фактор Р і роль, яку він
відіграє у м’язових болях.
5. Чому вісцеральні болі погано ло-
калізовані? Чому вони особливо
пронизливі?
6. Що таке опіатні пептиди? Як вони
змінюють больові відчуття?
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1—12 виберіть одну
відповідь.
1. Відстань, за якої два дотикові по-
дразники можуть бути сприйняті
як окремі, найбільша
(А) на губах.
(В) на долоні руки.
(С) на спині в околі лопатки.
(В) на дорсальній поверхні кисті.
(Е) на кінчиках пальців.
2. У 49-річної жінки зі світлим волос-
сям виражена дифузна втрата віб-
раційної чутливості. Які з наведе-
них досліджень були б найінфор-
мативнішими для визначення при-
чини цієї втрати?
(А) Рентгенологічне дослідження
спинного мозку.
(В) Визначення тривалості ре-
флексу.
(С) Вимірювання вмісту білка у
спинномозковій рідині.
(В) Біопсія слизової шлунка.
(Е) Повне дослідження сечі.
3. Подразнення яких з наведених
структур могли б спричинити по-
яву свербіння?
(А) Задні корінці С-волокон.
(В) В-волокна у периферійних
нервах.
(С) Дорсальні стовпи у спинному
мозку.
(В) Рецептори дотику.
(Е) Моторні волокна у передніх
корінцях спинних нервів.
4. Вісцеральні болі
(А) порівняно швидко адаптують-
ся.
(В) медіюють В-волокнами у зад-
ніх корінцях спинномозкових
нервів.
(С) іноді можуть змінюватись у ра-
зі подразнень шкіри.
(В) дуже подібні до швидких болів,
що виникають у разі ушкод-
жувального подразнення шкі-
ри.
(Е) можуть бути спричинені ви-
значеними та тривалими по-
дразненнями рецепторів доти-
ку.
5. Передньолатеральна хордотомія
виконана для полегшення болю у
правій нозі. Це ефективно з огляду
на те, що вона перетинає
(А) лівий дорсальний стовп.
(В) лівий вентральний спінотала-
мічний шлях.
(С) правий латеральний спінота-
ламічний шлях.
(В) лівий латеральний спінотала-
мічний шлях.
(Е) правий кортикоспінальний
шлях.
6. Які з наведених лікарських засобів
не спричинюють анальгезаційного
ефекту?
(А) Тетрагідроканабінол.
(В) Антагоністи речовини Р.
(С) Холінергічні агоністи.
(В) Гістамін.
(Е) Морфій.
7. Унаслідок виробничої травми
чоловік втратив праву кисть. Через
692 / САМООЦІНКА НАВИКІВ
чотири роки він мав епізоди не-
стерпних болей у ділянці, якої не
було (фантомні болі). Детальне до-
слідження сканограми ПЕТ кори
головного мозку виявило
(А) розширення ділянки правої
кисті у правій соматичній сен-
сорній ділянці.
(В) розширення ділянки правої
кисті у лівій соматичній сен-
сорній ділянці (81).
(С) метаболічну неактивну пляму
у ділянці кисті у лівій 81, яка
повинна бути у нормі.
(В) проекцію волокон з сусідніх
сенсорних ділянок у правій ді-
лянці кисті у правій 81.
(Е) проекцію волокон з сусідніх
сенсорних ділянок у правій ді-
лянці кисті у лівій 81.
8. Каузалгію
(А) супроводжує втрата волосся в
ураженій ділянці.
(В) скасовує перетинання сенсор-
них нервів в ураженій ділянці.
(С) полегшують за допомогою лі-
карських препаратів, що бло-
кують гліцинові рецептори.
(В) полегшують за допомогою лі-
карських препаратів, що бло-
кують с^-адренорецептори.
(Е) полегшують за допомогою
лікарських препаратів, що бло-
кують мускариночутливі холі-
норецептори.
У питаннях 9-13 виберіть
А, якщо вислів пов’язаний з (а);
В, якщо вислів пов’язаний з (Ь);
С, якщо вислів пов’язаний з (а) і
(Ь);
В, якщо вислів не пов’язаний ні з
(а), ні з (Ь).
(а) Капсаїциновий рецептор.
(Ь) Аа-нервові волокна.
9. Холод.
10. Тепло.
11. Біль.
12. Дотик.
13. Сила м’яза.
У питаннях 14 і 15 визначте, чи ве-
личина, наведена у першому вислові,
є більшою (С), однаковою (8) або мен-
шою (Ь), ніж величина, наведена у
другому
14. Швидкість передавання в аферент-
них нейронах від теплових рецеп-
торів.
С8Ь
Швидкість передавання в аферент-
них нейронах від рецепторів тиску.
15. Впливи ураження тім’яної частки
на стереогнозис.
С8Ь
Впливи ураження лобової частки
на стереогнозис.
РОЗДІЛ 8
У цьому розділі розглянуто функ-
ційну анатомію зорової системи, про-
аналізовано процеси формування зо-
рового зображення у сітківці, перетво-
рення світлової енергії в електричну
відповідь у колбочках та палочках,
утворення імпульсів у сітківці та пере-
давання їх через бічні колінчасті тіла
у зорову кору, процеси у зоровій корі
й інших частинах кори головного моз-
ку. Після вивчення цього розділу сту-
дент повинен уміти:
• характеризувати різні частини ока
та знати їхні функції;
• простежувати нейрональні шляхи,
якими передається зорова інфор-
мація від колбочок та палочок до
зорової кори;
• пояснити як світлові промені з дов-
кілля потрапляють у фокус на сіт-
ківці та значення акомодації;
• пояснити гіперметропію, міопію,
астигматизм, пресбіопію та косо-
окість (страбізм);
• описати електричні відповіді у бі-
полярних, горизонтальних, ама-
кринових та гангліонарних кліти-
нах, пояснити функцію кожного
типу клітин;
• описати відгуки клітин зорової ко-
ри та функційну організацію діля-
нок кори головного мозку, які
опрацьовують зорову інформацію;
• дати означення та пояснити тем-
пову адаптацію та гостроту зору;
• описати функції колбочок та їхні
нейрональні шляхи до зорової кори;
• описати нейрональні шляхи, які
забезпечують кольорове світло-
сприйняття;
• назвати чотири типи очних рухів
та пояснити функції кожного.
ГОЛОВНІ ПИТАННЯ
І.Який тип порушення поля зору
простежується у наведених ура-
женнях і чому?
а. Ураження одного зорового нер-
ва.
Ь. Ураження одного оптичного
шляху.
с. Ураження оптичного перехрес-
ту.
б. Ураження різноманітних час-
тин колінчасто-шпорного шля-
ху.
е. Білатеральні ураження, що по-
рушують первинну зорову кору
(ділянка 17).
2. Яка найближча точка бачення?
Чому вона віддаляється з віком?
3. Скільки різних видів світлочутли-
вих пігментів є у сітківці людини?
Опишіть їхню хімічну будову; як
вони утворюють електричну від-
повідь у сітківці та їхній зв’язок з
кольоровим зором?
4. Що означає “у центрі” та “поза
центром” клітин? Дайте означення
латерального гальмування та пояс-
ніть його головне фізіологічне при-
значення.
5. Що таке орієнтаційні колонки і
колонки домінування очей?
6. Опишіть паралельне опрацювання
зорової інформації у корі голов-
ного мозку.
7. Що таке бінокулярний зір? Чому
він має обмежену частину поля
зору? Опишіть його значення та
роль монокулярного зорового пе-
ретворення у сприйнятті глибини
зображення?
8. Що таке амбліопія без анопсії?
Поясніть її патогенез.
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-12 виберіть одну
відповідь.
1. Якщо головна фокусна відстань у
кришталику 0,75 м, то його ре-
фрактерна сила -
(А) 0,25 діоптрії.
(В) 0,75 діоптрії.
(С) 1,0 діоптрія.
(В) 1,33 діоптрії.
(Е) 10,3 діоптрії.
2. Зорова акомодація передбачає
(А) збільшення напруження у зв’яз-
ках кришталика.
(В) зменшення кривини кришта-
лика.
(С) розслаблення м’яза звужувана
зіниці.
САМООЦІНКАНАВИКІВ / 693
(В) скорочення війкових м’язів.
(Е) збільшення внутрішньоочного
тиску.
3. Центральна ямка в оці
(А) має найнижчий світловий по-
ріг.
(В) ділянка з найбільшою гостро-
тою зору.
(С) містить лише червоні та зеле-
ні колбочки.
(В) містить лише пал очки.
(Е) розміщена попереду зорового
нерва.
4. Які з перелічених частин ока ма-
ють найбільшу концентрацію па-
личок?
(А) Війкове тіло.
(В) Райдужка.
(С) Оптичний диск.
(В) Центральна пляма.
(Е) Позаямкова ділянка.
5. У відповідь на світло у палочках
відбуваються явища, які наведені
у випадковій послідовності.
1. Активування трансдуцину.
2. Зменшення вивільнення синап-
тичного трансмітера.
3. Структурні зміни родопсину.
4. Закриття Ка+-каналів.
5. Зменшення внутрішньоклітин-
ного цГМФ.
Виберіть послідовність, яка харак-
терна у нормі:
(А) 2, 1,3, 5,4.
(В) 1,2, 3, 5,4.
(С) 5,3, 1,4, 2.
(В) 3, 1,5,4, 2.
(Е) 3, 1,4, 5, 2.
6. Вітамін А - це попередник синтезу
(А) соматостатину.
(В) ретиненуґ
(С) пігменту райдужки.
(В) скотопсину.
(Е) водянистої вологи.
7. Аномалія кольоросприймання у 20
разів поширеніша у чоловіків, ніж
у жінок, оскільки більшість випад-
ків спричинена анормальним
(А) домінантним геном на ¥-хро-
мосомі.
(В) рецесивним геном на ¥-хро-
мосомі.
(С) домінантним геном на Х-хро-
мосомі.
(В) рецесивним геном на Х-хро-
мосомі.
(Е) рецесивним геном на 22-й
хромосомі.
8. Яка з наведених структур не бере
участі у кольоровому зорі?
(А) Активування провідного шля-
ху, яким сигналізується відмін-
ність відповідей 8-колбочок і
сумарної відповіді Ь- та М-
колбочок.
(В) Колінчастий шар 3-6.
(С) Р-шлях.
(В) Ділянка УЗ А зорової кори.
(Е) Ділянка У8 зорової кори.
У питаннях 9-12 позначне пато-
логічний стан літерою пов ’язаної з
ним аномалії зору. Кожна позначена
літерою аномалія зору може бути
використана один раз, декілька разів
або жодного разу
(А) Гіперметропія.
(В) Міопія.
(С) Гетеронімна геміанопія.
(В) Страбізм.
(Е) Нікталопія.
9. Пухлина у передній частці гіпо-
фіза.
10. Дефіцит вітаміну А.
11. Порушення потрапляння зорових
зображень на відповідні місця сіт-
ківки.
12. Подовжений передньо-задній діа-
метр очного яблука.
У питаннях 13-15 визначте, чи ве-
личина, наведена у першому вислові,
є більшою (С), однаковою (8) або мен-
шою (Ь), ніж величина, наведена у
другому.
13. Мембранний потенціал синаптич-
ного закінчення зорового рецеп-
тора на світло.
С8Ь
Мембранний потенціал синаптич-
ного закінчення зорового рецеп-
тора на темноту.
14. Кількість потенціалів дії у правій
зоровій корі після подразнення ме-
діальної половини правої сітківки.
С8Ь
Кількість потенціалів дії у лівій зо-
ровій корі після подразнення ме-
діальної половини правої сітківки.
15. Гострота зору у людей з 20/15 зо-
ром.
С8Ь
Гострота зору у людей з 15/20 зо-
ром.
РОЗДІЛ 9
У цьому розділі розглянуто слухову
та вестибулярну системи. Після ви-
вчення цього розділу студент повинен
уміти:
• описати шлях, яким рухи молекул
у повітрі перетворюються в ім-
пульси, що їх генерують волоско-
ві клітини у завитці;
• простежити шлях слухових ім-
пульсів у нейрональних шляхах від
волоскових клітин завитки у слу-
хову кору та описати функцію слу-
хової кори;
• пояснити як амплітуда, гучність та
тембр тону кодується у слухових
провідних шляхах;
• описати різноманітні форми глу-
хоти;
• пояснити як рецептори у напів-
колових каналах визначають рота-
ційне прискорення і як рецептори
мішечка та маточки визначають
лінійне прискорення;
• назвати головні вхідні сенсорні ім-
пульси, що забезпечують інформа-
цією про орієнтацію тіла у прос-
торі, яка синтезується у головному
мозку.
ГОЛОВНІ ПИТАННЯ
1. Отосклероз - це хвороба, за якої
основа стремінця приєднується
ригідно до овального вікна. Чому
це спричинює глухоту?
2. Яку функцію виконує покривна
мембрана у завитці?
3. Які звукові частоти чує людина? За
якої звукової частоти слуховий
поріг найнижчий?
4. Що таке маскування?
5. Що таке барабанний рефлекс і яка
його функція?
6. Порівняйте кісточкову, повітряну
та кісткову провідність.
7. Порівняйте і зіставте перетворен-
ня зорової та слухової інформації
у корі головного мозку.
8. Назвіть п’ять генетичних мутацій,
що спричинюють вроджену глухо-
ту. Для кожного випадку поясніть,
як генетична аномалія спричинює
втрату слуху.
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-14 виберіть одну
відповідь.
694 / САМООЦІНКА НАВИКІВ
1. Інтенсивність звуку вимірюють у
(А) діоптріях.
(В) дальтонах.
(С) торах.
(В) децибелах.
(Е) грамах.
2. У людей первинна слухова кора
розташована у
(А) лімбічній системі.
(В)задній частині потиличної
частки.
(С) задній частині тім’яної частки.
(В) зацентральній закрутці.
(Е) верхній частині вискової част-
ки.
3. Постротаційний ністагм спричи-
нюваний тривалим рухом
(А) водянистої вологи над війко-
вим тілом в оці.
(В) спинномозкової рідини над
частинами мозкового стовбу-
ра, що містить присінкові яд-
ра.
(С) ендолімфи в напрямі до гелі-
котреми.
(В) ендолімфи у півколових кана-
лах з послідовним згинанням
купола і подразненням волос-
кових клітин.
(Е) перилімфи над волосковими
клітинами, які мають занурені
відростки у покривну мембра-
ну
4. Базилярна мембрана завитки
(А) не уражується рухом рідини у
присінкових сходах.
(В) покриває овальне і кругле вік-
но.
(С) вібрує за зразком, визначеним
формою хвилі, що переміща-
ється по завитці.
(В) є під тиском.
(Е) вібрує, коли організм підданий
лінійному прискоренню.
5. Які фрази хибно спаровані?
(А) Тембр (якість) звуку : гармо-
нійні вібрації.
(В) Напрям звуку : різниця між
частотою імпульсів у слухових
нервових волокнах.
(С) Амплітуда звуку : точка най-
більшого зміщення базилярної
мембрани.
(В) Амплітуда звуку : частота зву-
кової хвилі.
(Е) Гучність звуку: амплітуда зву-
кової хвилі.
6. Які фрази хибно спаровані?
(А) Барабанна мембрана : ручка
молоточка.
(В) Гелікотрема : верхівка завит-
ки.
(С) Основа стремінця : овальне
вікно.
(В) Отоліти : півколові канали.
(Е) Базальна мембрана : завитка.
7. Напрям ністагму є вертикальним,
якщо особу обертати
(А) після потрапляння теплої води
в одне вухо.
(В) із закинутою дозаду головою.
(С) після потрапляння холодної
води в обидва вуха.
(В) із закинутою убік головою.
(Е) після перерізу одного присін-
кового нерва.
8. Скронева площина у людини
(А) стосується слухової та зорової
координації.
(В) стосується визначення ліній-
ного прискорення.
(С) стосується локалізації звуку.
(В) більша у правій півкулі голов-
ного мозку.
(Е) звичайно більша у музикантів
з досконалим слухом, ніж у му-
зикантів без такого слуху.
9. У маточці верхівкові з’єднання з
волосковими клітинами залучені
до
(А) утворення перилімфи.
(В) деполяризації судинної смуж-
ки.
(С) рухів базилярної мембрани.
(В) слухосприйняття.
(Е) регулювання деформованих
активованих каналів.
У питаннях 10-14, які стосуються
рис. 9-А, виберіть
А, якщо вислів пов’язаний з (а);
В, якщо вислів пов’язаний з (Ь);
С, якщо вислів пов’язаний з (а) і
(Ь);
В, якщо вислів не пов’язаний ні з
(а), ні з (Ь).
(а) Передавання звуку.
(Ь) Лінійне прискорення.
10. Структура V.
11. Структура \¥.
12. Структура X.
13. Структура ¥.
14. Структура 2.
У питаннях 15—17 визначте, чи ве-
личина, наведена у першому вислові,
є більшою (С), однаковою (8) або мен-
шою (ІД ніж величина, наведена у
другому.
15. Концентрація К+ у перилімфі.
С8Ь
Концентрація К+ в ендолімфі.
Рис. 9-А. Вухо людини.
16. Максимальна частота звуку, який
чують люди.
С8Ь
Максимальна частота звуку, який
чують собаки.
17. Зміни в мембранному потенціалі
у разі зміщення стереоцилій волос-
кових клітин мішечка у напрямі до
кіноцилія.
С8Ь
Зміни в мембранному потенціалі,
у разі зміщення стереоцилій волос-
кових клітин мішечка у правий кут
до кіноцилія.
РОЗДІЛ 10
Цей розділ стосується нюхової та
смакової систем: передавання сигна-
лів, провідні шляхи до центральної
нервової системи та центральне пред-
ставництво. У випадку нюху розгля-
дають молекулярні та неврональні ме-
ханізми, які уможливлюють розпізна-
вання різноманітних запашних речо-
вин. Після вивчення цього розділу сту-
дент повинен уміти:
• описати нюхові рецептори і ме-
ханізм, яким утворюються імпуль-
си в них;
• виокремити провідні шляхи, яки-
ми генеровані у нюховій слизовій
оболонці імпульси передаються у
кору головного мозку;
• описати та проаналізувати нюхову
чутливість, розрізнення та адапта-
цію;
• описати смакові бруньки та їхні ха-
рактеристики; поширення та взає-
мозв’язок зі смаковими бруньками;
• виокремити смакові провідні шля-
хи;
• характеризувати речовини, що зу-
мовлюють солодкий, кислий, гір-
САМООЦІНКА НАВИКІВ / 695
кий та солоний смаки і пояснити,
як перетворюються сигнали від
них.
ГОЛОВНІ ПИТАННЯ
1. Порівняйте та зіставте нюхову та
смакову сенсорну системи. Як во-
ни взаємодіють?
2. Люди можуть розрізняти багато
різних запашних речовин. За допо-
могою яким механізмів це відбу-
вається?
3. Опишіть взаємозв’язок між нюхом
та сексуальною поведінкою.
4. Яка частина больових волокон у
трійчастому нерві відповідає за
нюх?
5. Назвіть хеморецептори в організ-
мі.
6. Деякі речовини, що не належать до
цукрів, дають уявний солодкий
смак. Схарактеризуйте деякі з цих
сполук і поясніть їхнє застосуван-
ня у різних станах та хворобах.
7. Опишіть смакові відчуття як осно-
ву для мотивації відрази.
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-8 виберіть одну
відповідь.
1. Імпульси, що їх генерують нюхові
рецептори у носовій слизовій обо-
лонці
(А) передаються до таламуса.
(В) проходять через внутрішню
капсулу.
(С) передаються у нюхову кору
через гіпоталамус.
(В) проходять до митральних клі-
тин і звідси безпосередньо до
нюхової кори.
(Е) проходять до митральних клі-
тин і звідси безпосередньо до
нюхової кори через ділянку
смаку.
2. Імпульси, генеровані у смакових
бруньках на язику, прямують до
кори головного мозку через
(А) таламус.
(В) внутрішню капсулу.
(С) задні корінці першого ший-
ного спинномозкового нерва.
(В) блоковий нерв.
(Е) під’язиковий нерв.
3. Які з наведених відчуттів найсиль-
ніше пов’язані зі станом відрази?
(А) Тиск.
(В) Зір.
(С) Лінійне прискорення.
(В) Нюх.
(Е) Смак.
4. Який з наведених чинників не
збільшує здатності розрізнення ба-
гатьох різних запашних речовин?
(А) Багато різноманітних рецеп-
торів.
(В) Різновид первинних нюхових
рецепторів, активованих пев-
ною запашною речовиною.
(С) Проектування аксонів різно-
манітних митральних клітин у
різні частини головного мозку.
(В) Високий вміст Р-арестину у
нюхових нейронах.
(Е) Принюхування.
У питаннях 5-8 позначте смакове
відчуття літерою пов ’язаного з ним
механізму сигнального передавання.
Кожен позначений літерою механізм
може бути використаний один раз,
декілька разів або жодного разу.
(А) 6-білок-аденілат циклаза.
(В) Гуанілатциклаза.
(С) Тирозинкіназа.
(В) Епітеліальні Иа+-канали.
(Е) Н+-відкриті катіонні канали.
5. Солоний смак.
6. Гіркий смак.
7. Кислий смак.
8. Солодкий смак.
У питаннях 9 і 10 позначне вислів
у кожному питанні літерою пов’я-
заної з ним структури. Кожна позна-
чена літерою структура може бути
використана один раз, декілька разів
або жодного разу.
(А) Сенсорне ядро трійчастого
нерва.
(В) Нюхова слизова оболонка.
(С) Жолобчасті сосочки.
(В) Лемешево-носовий орган.
(Е) Ниткоподібні сосочки.
9. Феромони.
10. Гіркий смак.
У питаннях 11 та 12 визначте, чи
величина, наведена у першому вислові,
с більшою (С), однаковою (8) або мен-
шою (ІД ніж величина, наведена у
другому.
11. Нюхова чутливість у 20-літньої
жінки.
С8Е
Нюхова чутливість у 70-літньої
жінки.
12. Кількість різноманітних 6-білків,
задіяних у передаванні смакових
подразників.
С8Ь
Кількість різноманітних 6-білків,
задіяних у передаванні нюхових
подразників.
РОЗДІЛ 11
Цей розділ стосується стану три-
воги і сну, механізмів, що забезпечу-
ють ці стани, взаємозв’язків між ними
та електричної активності головного
мозку. Після вивчення цього розділу
студент повинен уміти:
• описати первинні типи ритмів, які
записуються на ЕЕГ, і механізми,
відповідальні за їхнє утворення;
• характеризувати поведінкові та ЕЕГ
характеристики кожної стадії по-
вільнохвильового сну та механізми,
відповідальні за їхнє утворення;
• характеризувати електроенцефа-
лічні та інші характеристики сну
у разі швидкого руху очей та опи-
сати механізми, відповідальні за
його утворення;
• описати нормальний нічний сон
дорослої особи і зміни його від
народження до старості;
• перелічити головні клінічні мож-
ливості ЕЕГ.
ГОЛОВНІ ПИТАННЯ
1. Дайте означення таламокорти-
кальних коливань, ретикулярної
активації та зон сну. Яка їхня роль,
а також інтракортикальної актив-
ності в утворенні ЕЕГ?
2. Дайте означення сомнабулізму і
нарколепсії та опишіть їхній взає-
мозв’язок з нормальним сном.
3. Порівняйте ШРО і НШРО сон.
4. Яка відмінність між специфічними
сенсорними релейними ядрами та
неспецифічною проекцією ядер
таламуса?
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-12 виберіть одну
відповідь.
696 / САМООЦІНКА НАВИКІВ
1.У практично здорової дорослої
людини в стані тривоги, яка си-
дить із заплющеними очима, пере-
важним ритмом на ЕЕГ від елект-
родів над потиличною часткою є
(А) дельта (0,5-4 Гц).
(В) тета (4 -7 Гц).
(С) альфа (8 -13 Гц).
(Л) бета (18-ЗО Гц).
(Е) швидка, нерегулярна низько-
вольтажна активність.
2. Запис ЕЕГ на рис. 11-А характер-
ний для
(А) глибокого сну.
(В) завченої відповіді на больове
подразнення.
(С) ШРО сну.
(В) психомоторної епілепсії.
(Е) відсутності епілепсії.
3. Запис електричної активності на
рис. 11-В характерний для
(А) глибокого сну.
(В) глобальних приступів епілеп-
сії.
(С) ШРО сну.
(В) психомоторної епілепсії.
(Е) відсутності епілепсії.
4. Високочастотне подразнення од-
нієї з наведених структур не викли-
кає стану тривоги.
(А) Сідничий нерв.
(В) Бічний спіноталамічний шлях.
(С) Ретикулярна формація серед-
нього мозку.
(В) Присередня петля середнього
мозку.
(Е) Внутрішньопластинчасті ядра
таламуса.
5. Локалізоване ураження якої з наве-
дених структур може спричинити
пролонговагий коматозний стан?
(А) Ядра поодинокого шляху.
(В) Ьосиз сегиіеиз.
(С) Права частина лобової частки.
(В) Лобові частки.
(Е) Центральна частина верхівки
середнього мозку.
6. Регулярні ритмічні коливання елект-
ричної активності простежуються
у корі головного мозку та таламусі.
Додатково їх можна побачити у
(А) медіобазальній частині гіпота-
ламуса.
Рис. 11-А.
Електорокулограма
чи... <. Електроміограма
Електроенцефалограма
Рис. 11-В. Відтворено за дозволом з
Каїез А еі аі: 8Іеер апсі сігеатз. Песеті
гезеагсґі оп сііпісаі авресів. Апп Іпіегп
Месі 1968;68:1078.
(В) корі мозочка.
(С) ретикулярній формації серед-
нього мозку.
(В) мигдалеподібному тілі.
(Е) мості.
7. У яких з наведених структур не
простежується збільшення крово-
постачання під час ШРО сну?
(А) Міст.
(В) Передня поясна закрутка.
(С) Первинна зорова кора.
(В) Зорова асоціативна кора.
(Е) Мигдалеподібне тіло.
У питаннях 8-13 виберіть
А, якщо вислів пов’язаний з (а);
В, якщо вислів пов’язаний з (Ь);
С, якщо вислів пов’язаний з (а) і
(Ь);
В, якщо вислів не пов’язаний ні з
(а), ні з (Ь).
(а) Повільнохвильовий сон.
(Ь) ШРО.
8. Сновидіння.
9. “Веретена сну”.
10. Сомнабулізм.
11. Нічний енурез.
12. Ерекція прутня.
13. МКП піки.
У питаннях 14 та 15 визначте, чи
величина, наведена у першому вислові,
є більшою (Є), однаковою (8) або мен-
шою (Ь), ніж величина, наведена у
другому.
14. Частота епізодів ШРО сну після
першого переривання сну.
С8Ь
Частота епізодів ШРО сну після
шести годин сну.
15. У загальному часі сну новонарод-
жених відсотковий вміст ШРО сну.
С8Ь
У загальному часі сну дорослих
відсотковий вміст ШРО сну
РОЗДІЛ 12
У цьому розділі розглянуто сома-
тичні нервові функції, особливо роль
спинного, довгастого, середнього моз-
ку, базальних гангліїв, кори головного
мозку та мозочка. Після вивчення цьо-
го розділу студент повинен уміти:
• описати механізми регулювання
постави і рухів;
• характеризувати функції кори го-
ловного мозку, мозочка, базальних
гангліїв, кірково-спинномозкового
та кірково-ядерного шляхів у ви-
конанні довільної рухової діяль-
ності;
• дати означення терміна спіналь-
ний шок та описати початкові й
відтерміновані зміни спінальних
рефлексів, які настають після пере-
тинання спинного мозку;
• назвати та пояснити відтермінова-
ні ускладнення, які виникають у
хворих з ураженням спинного моз-
ку;
• дати означення децеребраційної та
декортикаційної ригідності, пояс-
нити причини їхнього виникнення
та фізіологічне значення;
• описати рефлекси постави, що
інтегруються у довгастому мозку,
мості, середньому мозку та корі го-
ловного мозку;
• описати базальні ганглії та назвати
провідні шляхи, що з’єднуються з
ними, і відповідні нейротрансмі-
тери;
• описати та пояснити симптоми
хвороб Паркінсона та Гантінгтона;
• назвати провідні шляхи до та від
мозочка і нервові зв’язки всереди-
ні мозочка;
• описати функції мозочка та нев-
рологічні аномалії, що утворю-
ються у разі хвороб цієї частини
головного мозку.
ГОЛОВНІ ПИТАННЯ
1. Що означає термін верхній та ниж-
ній мотонейрони? Порівняйте вплив
ураження нижніх мотонейронів з
аналогічними ураженнями кож-
ного типу верхніх мотонейронів.
2. Що таке симптом Бабінського? Яке
його фізіологічне та патологічне
значення?
3. Що таке рефлекс маси? Чому він
простежується після перетину
спинного мозку?
4. Дайте означення атетозу, балізму і
хореї. За яких хвороб вони просте-
жуються?
САМООЦІНКА НАВИКІВ / 697
5. Назвіть три лікарські засоби, які
використовують для лікування хво-
роби Паркінсона і поясніть значен-
ня кожного.
6. Назвіть шість типів нейронів, що
містяться у корі мозочка, та опи-
шіть морфо-функційні особливос-
ті кожного типу
7. Що таке тремор наміру? Чому він
простежується у разі захворюван-
ня мозочка? Опишіть сенсорні оди-
ниці та їхні складові, якщо інтен-
сивність подразників збільшуєть-
ся.
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-20 виберіть одну
відповідь.
Питання 1-4 стосуються рис. 12-
А. Структури, позначені літерою,
можна використовувати один або де-
кілька разів, або не використовувати
взагалі.
1. Які з позначених структур, що по-
в’язані зі стовбуром головного
мозку, відповідають за регулюван-
ня постави?
2. Які з позначених структур відпо-
відають за розвиток соматичної
сенсорної перцепції?
3. Які з позначених структур відпові-
дають за розвиток первинної пер-
цепції на смаковий подразник?
4. Які з позначених структур нале-
жать до додаткового моторного
поля?
5. Головною функцією базальних
гангліїв є
(А) сенсорна інтеграція.
(В) короткотривала пам’ять.
(С) планування довільних рухів.
(Л) участь у нейроендокринному
регулюванні.
(Е) повільнохвильовий сон.
6. Розрив моторних провідних шля-
хів у внутрішній капсулі з одного
боку спричинює в організмі:
(А) спастичний параліч з того са-
мого боку.
(В) спастичний параліч з проти-
лежного боку.
(С) втрату відчуття дотику та тис-
ку з протилежного боку.
(Л) млявий параліч з того самого
боку.
(Е) млявий параліч з протилежно-
го боку.
Рис. 12-А. Латеральний вигляд кори го-
ловного мозку людини.
7. Збільшення невральної активності
перед початком довільних рухів
спершу простежується в
(А) мотонейронах спинного моз-
ку.
(В) прецентральній моторній корі.
(С) базальних гангліях.
(Л) мозочку.
(Е) кірковому асоціативному полі.
8. Після падіння зі сходів у молодої
жінки простежується часткова
втрата довільних рухів у правій
частині та втрата відчуття болю й
температури у лівій частині ниж-
ньосередньої частини грудного
відділу. Ймовірно, що в жінки таке
ураження:
(А) розрив лівої половини спин-
ного мозку у поперековому
відділі.
(В) розрив лівої половини спин-
ного мозку у верхньогрудному
відділі.
(С) розрив сенсорних та моторних
провідних шляхів праворуч у
мості.
(Л) розрив правої половини спин-
ного мозку у верхньогрудному
відділі.
(Е) розрив дорсальної половини
спинного мозку у верхньо-
грудному відділі.
9. Хворі з порушенням спинного
мозку часто мають від’ємний азот-
ний баланс, оскільки
(А) у них розвивається гіперкаль-
ціємія і це зумовлює розпад
білків у кістках.
(В) вони паралізовані нижче рівня
ураження.
(С) вони втрачають аферентні вхід-
ні імпульси, що у нормі підтри-
мують секрецію гормону росту.
(Л) у них проблеми з випорожнен-
ням і це спричинює нагромад-
ження азоту в сечі й сечовому
міхурі.
(Е) їхня відповідь АКТГ на стрес
зменшена.
10. Яка з наведених хвороб не спри-
чинена збільшенням кількості три-
нуклеотидних послідовностей?
(А) Хвороба Альцгеймера.
(В) Слабість Х-хромосоми.
(С) Атаксія типу 3, пов’язана з
ураженням спинного мозку і
мозочка.
(Л) Хвороба Гантінґтона.
(Е) Атаксія Фрідрейха.
У питаннях 11—20 позначте зав-
дання у кожному питанні літерою
структури, що пов ’язана з ним. Кож-
на позначена літерою структура мо-
же бути використана один раз, де-
кілька разів або жодного разу.
(А) Спинний мозок.
(В) Мозочок.
(С) Гіпоталамус.
(Л) Морський коник.
(Е) Смугасте тіло.
11. Емоційні відповіді.
12. Гіпертермія.
13. Хвороба Паркінсона.
14. Тремор наміру.
15. Хвороба Гантінґтона.
16. Хвороба Альцгеймера.
17. Амілотрофічний латеральний
склероз.
18. Атаксія.
19. Сексуальна поведінка.
20. Вестибуло-очний рефлекс.
РОЗДІЛ 13
У цьому розділі розглянута спе-
цифіка моторної складової периферій-
ної автономної нервової системи, що
іннервує внутрішні органи. Вісцераль-
ні аферентні сигнали описані у Розді-
лах 5 і 7, а центральне регулювання
вісцеральних функцій - у Розділі 14.
Після вивчення цього розділу студент
повинен уміти:
• описати розташування прегангліо-
нарних симпатичних та парасим-
патичних нейронів у центральній
нервовій системі та ідентифіку-
вати нерви, аксони яких виходять
з центральної нервової системи;
• характеризувати розташування
постгангліонарних симпатичних
та парасимпатичних нейронів і
провідні шляхи до вісцеральних
структур, які вони іннервують;
698 / САМООЦІНКА НАВИКІВ
• назвати нейротрансмітери або гор-
мони, що секретують наведені
нижче структури:
а. Прегангліонарні автономні ней-
рони.
Ь. Постгангліонарні симпатичні
нейрони, що іннервують гладкі
м’язи кишки.
с. Постгангліонарні симпатичні
нейрони, що іннервують потові
залози.
сі. Постгангліонарні парасимпа-
тичні нейрони.
е. Малі, інтенсивно флюорес-
центні клітини (ЗІР).
Г. Клітини кори надниркових за-
лоз;
• описати функції автономної нерво-
вої системи;
• характеризувати шляхи впливу лі-
карських засобів, які збільшують
або зменшують активність складо-
вих частин автономної нервової
системи.
ГОЛОВНІ ПИТАННЯ
1. Кеннон назвав появу імпульсації в
симпатичній системі приготуван-
ням до реакції “втікати чи воюва-
ти”. Як в особи відбувається ця ре-
акція? Які ще функції забезпечує
симпатична нервова система?
2. Холінергічний відділ автономної
нервової системи називають ана-
болічною нервовою системою.
Схарактеризуйте впливи холінер-
гічного відділу, які підтверджують
це означення.
3. Де розташовані тіла постгангліо-
нарних симпатичних нейронів, що
забезпечують черепну іннерва-
цію? Як вони простягаються до
вісцеральних ефекторних органів,
що іннервують?
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1 і 2 виберіть одну
відповідь.
1. Повна денервація тонкої кишки
може привести до
(А) збільшення рівня інтестиналь-
ної перистальтики у спокої.
(В) зменшення рівня інтестиналь-
ної перистальтики у спокої.
(С) незначного впливу на рівень
збільшення рівня інтестиналь-
ної перистальтики у спокої.
(В) інтестинальної обструкції.
(Е) перистальтики, яка стає хао-
тичною та нерегулярною.
2. Які з наведених лікарських засобів
не здатні збільшувати симпатичну
імпульсацію або повторювати
впливи збільшеної симпатичної
імпульсації?
(А) Празосін.
(В) Неостигмін.
(С) Амфетамін.
(В) Ізопротеренол.
(Е) Метоксамін.
У питаннях 3—8 одна або більше
відповідей правильні. Виберіть
А, якщо (1), (2), (3) є правильними;
В, якщо (1) і (3) є правильними;
С, якщо (2) і (4) є правильними;
Л, якщо лише (4) є правильною;
Е, якщо всі правильні.
3. Уведення фізостигміну - препара-
та, що інгібує ацетилхолінестеразу,
- може зумовити
(1) збільшення секреції шлунко-
вого соку.
(2) збільшення рівня синтезу ме-
латоніну і секреції його з епі-
фізу.
(3) збільшення рівня секреції ад-
реналіну мозковою речови-
ною надниркової залози.
(4) зменшення секреції глюкагону.
4. У малих дозах нікотин
(1) впливає безпосередньо на глад-
кі м’язи кишки, спричинюючи
їхні скорочення.
(2) збільшує рівень імпульсації у
постгангліонарних парасим-
патичних нейронах.
(3) зменшує вивільнення ацетил-
холіну у симпатичних гангліях.
(4) збільшує рівень імпульсації
постгангліонарних симпатич-
них нейронів.
5. У парасимпатичній нервовій сис-
темі
(1) аксони прегангліонарних ней-
ронів є у дорсальних корінцях
спинномозкових нервів у кри-
жовому відділі.
(2) аксони прегангліонарних ней-
ронів є у вентральних корінцях
спинномозкових нервів у ниж-
ньогрудному та поперековому
відділах.
(3) дофамін - нейротрансмітер,
відповідальний за передаван-
ня імпульсів з прегангліонар-
ного до постгангліонарного
нейронів.
(4) аксони постгангліонарних ней-
ронів, звичайно, коротші, ніж
прегангліонарних.
6. Уведення препарату, що блокує пе-
ретворення Ь-ДОФА у дофамін,
може призвести до
(1) збільшення діаметра трахеї та
бронхів.
(2) припинити функціювання 8ІР-
клітин у симпатичних ганглі-
ях.
(3) зменшення перистальтичної
активності у тонкій кишці.
(4) зменшення кількості норадре-
наліну у крові.
7. Уведення препаратів, що блокують
р-адренорецептори, може зумови-
ти
(1) зменшення серцебиття.
(2) зменшення сили серцевого
скорочення.
(3) зменшення секреції реніну
нирками.
(4) зменшення секреції інсуліну
В-клітинами острівців під-
шлункової залози.
8. До поліпептидів, що є в автоном-
ній нервовій системі належить
(1) гонадотропін-рилізинг гор-
мон.
(2) нейропептид У.
(3) гастрин-рилізинг пептид.
(4) вазоактивний інтестинальний
пептид.
У питаннях 9 і 10 визначте, чи ве-
личина, наведена у першому вислові,
є більшою (С), однаковою (8) або мен-
шою (Ь), ніж величина, наведена у
другому.
9. Секреція шлункового соку після
видалення черевного вузла.
С8Ь
Секреція шлункового соку після
ваготомії.
10. Кількість В-волокон у білих спо-
лучних гілках.
С8Ь
Кількість В-волокон у сірих спо-
лучних гілках.
РОЗДІЛ 14
У цьому розділі розглянута цент-
ральна інтеграція автономних і спо-
САМООЦІНКА НАВИКІВ / 699
ріднених вісцеральних функцій на рів-
ні спинного та довгастого мозку і гіпо-
таламуса. Після вивчення цього роз-
ділу студент повинен уміти:
• описати автономні рефлекси, інте-
гровані на рівні спинного мозку;
• описати блювання, включно з ав-
тономним та моторним компонен-
тами і схарактеризувати започат-
кування рефлексу блювання афе-
рентними сигналами зі шлунково-
кишкового тракту та заднього поля;
• характеризувати анатомічні зв’яз-
ки між гіпоталамусом та гіпофізом
і фізіологічне значення кожного
зв’язку;
• описати циклічні процеси в живих
організмах, включно зі значенням
надперехрестних ядер у їхньому
регулюванні та генетичному конт-
ролі;
• пояснити значення гіпоталамуса
та роль інших факторів у регулю-
ванні споживання їжі;
• назвати фактори, що регулюють
споживання води, та схарактери-
зувати шляхи реалізації їхніх впли-
вів;
• описати синтез, утворення і секре-
цію гормонів задньої частки гіпо-
таламуса;
• характеризувати вплив вазопре-
сину та рецептори, на які він впли-
ває, знати як відбувається регулю-
вання його секреції;
• описати вплив окситоцину та ре-
цептори, на які він впливає, знати
як відбувається регулювання його
секреції;
• назвати гіпофізотропні гормони та
ефекти, що впливають на функцію-
вання передньої частки гіпофіза;
• назвати механізми терморегулю-
вання і пояснити різницю темпе-
ратур у гіпоталамусі, прямій киш-
ці, ротовій порожнині та шкірі;
• назвати механізми терморегулю-
вання й описати шлях їхньої інте-
грації з гіпоталамічним контролем
для підтримки нормальної темпе-
ратури тіла;
• описати патогенез гарячки.
ГОЛОВНІ ПИТАННЯ
І.Що таке поведінкові механізми
терморегулювання. Наведіть'при-
клади і опишіть, як вони підтри-
мують температуру тіла.
2. Які функції виконують гіпофізо-
тропні гормони додатково до регу-
лювання секреції передньої частки
гіпофіза?
3. Які ендокринні зміни можна спо-
стерігати після перетинання гіпо-
фізарної ніжки і чому?
4. Нарисуйте графіки співвідношен-
ня спраги до осмоляльності плаз-
ми, вмісту вазопресину плазми до
осмоляльності плазми, вмісту ва-
зопресину плазми до об’єму поза-
клітинної рідини.
5. Нарисуйте криву співвідношення
рівня метаболізму і температури
тіла (35-41 °С), поясніть форму
криво і.
6. Деякі особи випивають великі
кількості води з причини порушен-
ня психіки (психогенна полідип-
сія). Інші мають нецукровий діабет
у зв’язку з ураженням задньої част-
ки гіпофіза та гіпоталамуса. Ще
інші - мають одну з двох форм
нефрогенного діабету, коли нирки
не відповідають на вплив вазопре-
сину. В усіх випадках наявна по-
ліурія (збільшення сечовиділення)
і полідипсія (збільшене споживан-
ня води). Продиференціюйте при-
чини чотирьох випадків?
7. Який вплив білатерального ура-
ження пришлуночкових ядер на
відповідь кори надниркових залоз
на стрес?
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-23 виберіть одну
відповідь.
1. Спрагу стимулює
(А) збільшення осмоляльності та
об’єму плазми.
(В) збільшення осмоляльності
плазми та зменшення об’єму
плазми.
(С) зменшення осмоляльності
плазми та збільшення об’єму
плазми.
(В) зменшення осмоляльності та
об’єму плазми.
(Е) ін’єктування вазопресину у гі-
поталамус.
2. Мутації якого з наведених генів
можна очікувати у разі опасистості
людей?
(А) Лептину.
(В) Рецепторів лептину.
(С) ^-Субодиниці тиротропіну.
(В) Проопіомеланокортину.
(Е) Меланіноконцентрувального
гормону.
3. Коли особа без одягу перебуває у
кімнаті з температурою повітря
21 °С і вологістю 80%, то найбіль-
ша кількість тепла втрачається на
(А) збільшення обміну речовин.
(В) дихання.
(С) сечовиділення.
(В) випаровування поту.
(Е) випромінення і провідність.
4. Секреція, яких з наведених гормо-
нів не збільшується вночі?
(А) Гормону росту.
(В) АКТГ.
(С) Мелатоніну.
(В) Інсуліну.
(Е) Пролактину.
Питання 5-10 стосуються рис.
14-А. Структури, позначені літерою,
можна використати один раз, декіль-
ка разів або жодного разу.
5. Які з позначених стуктур мають
найбільшу концентрацію рецепто-
рів ангіотензину II?
6. Які з позначених стуктур мають
найбільшу концентрацію кортико-
тропін-рилізинг гормону?
7. Які з позначених стуктур мають
найбільшу концентрацію тиротро-
пін-рилізинг гормону?
8. Які з позначених стуктур мають
найбільшу концентрацію дофамі-
ну?
9. Які з позначених стуктур мають
найбільшу концентрацію сомато-
тропін-рилізинг гормону?
700 / САМООЦІНКА НАВИКІВ
10. Які з позначених стуктур найбіль-
ше залучені до регулювання цир-
кадних ритмів?
У питаннях 11—17 позначте функ-
цію у кожному питанні літерою по-
в'язаного з нею відділу центральної
нервової системи. Кожний позначе-
ний літерою відділ ЦНС може бути
використаний один раз, декілька разів
або жодного разу.
(А) Спинний мозок.
(В) Довгастий мозок.
(С) Середній мозок.
(Б) Гіпоталамус.
(Е) Мигдалеподібне тіло.
11. Регулювання кров’яного тиску.
12. Насичення.
13. Примітивні статеві рефлекси.
14. Ковтання.
15. Страх.
16. Споживання води.
17. Тремтіння.
У питаннях 18-23 виберіть
А, якщо відповідь пов’язана з (а);
В, якщо відповідь пов’язана з (Ь);
С, якщо відповідь пов’язана з (а) і
(Ь);
В, якщо відповідь не пов’язана ні
з (а), ні з (Ь).
(а ) У1А-рецептори вазопресину.
(Ь ) У2-рецептори вазопресину.
18. Активування 6...
19. Вазоконстрикція.
20. Збільшення внутрішньоклітин-
ного інозитолтрифосфату.
21. Антидіурез.
22. Протеїнурія.
23. Виділення молока.
РОЗДІЛ 15
У цьому розділі розглянуто лімбіч-
ну систему і нейрональне циркулюван-
ня, що відбувається в разі мотивації,
емоційних реакцій, таких як страх,
гнів; статевої та інших інстинктивних
і стереотипних поведінок. Після ви-
вчення цього розділу студент повинен
уміти:
• описати структури та функції лім-
бічної системи;
• назвати ділянки головного мозку і
гормони, що беруть участь у регу-
люванні статевої поведінки осіб
обох статей;
• підсумувати вплив статевих гор-
монів на головний мозок у внут-
рішньоутробному та ранньому
неонатальному періодах;
• описати системи головного мозку,
що медіюють повторну самости-
муляцію і уникнення стимуляції;
• характеризувати зв’язок системи
винагороди головного мозку із за-
лежністю;
• описати анатомію норадренергіч-
них (що секретують норадреналін)
шляхів у головному мозку і на-
звати їхні відомі та прогнозовані
функції;
• описати анатомію адренергічних
(що секретують адреналін) шляхів
у головному мозку та назвати їхні
відомі та прогнозовані функції;
• описати анатомію дофамінергіч-
них (що секретують дофамін) шля-
хів у головному мозку і назвати
їхні відомі та прогнозовані функ-
ції;
• описати анатомію гістамінергіч-
них (що секретують гістамін) шля-
хів у головному мозку і назвати
їхні відомі та прогнозовані функ-
ції;
• описати шляхи секреції опіоїдних
пептидів у головному мозку і на-
звати їхні відомі та прогнозовані
функції.
ГОЛОВНІ ПИТАННЯ
1. Що надсилає холінергічна нейро-
нальна система від базального пе-
реднього мозку до кори головного
мозку і, особливо, до медіальної
частини скроневих часток? Які
функції цієї системи?
2. Опишіть удавану лють. Як можна
її створити? Які докази того, що
словесний термін удавана лють є
недоречним?
3. Що таке феромони? Які факти
свідчать, що феромони впливають
на поведінку людей?
4. Деякі науковці говорять про ”жіно-
чий” і “чоловічий” гіпоталамус;
які відмінності простежуються у
гіпоталамусах обох статей і як такі
відмінності виникають?
5. Які фармакологічні агенти вико-
ристовують для лікування депресії
і чому?
6. Які ліки спричинюють галюцина-
ції і які механізми їхнього впливу?
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1—17 виберіть одну
відповідь.
Питання 1-6 складаються з тверд-
ження та пояснення. Виберіть
А, якщо твердження і пояснення
правильні і пов’язані;
В, якщо твердження і пояснення є
правильні і непов’язані;
С, якщо твердження є істинним, а
пояснення - хибним;
Л, якщо твердження є хибним, а
пояснення - правильним;
Е, якщо твердження і пояснення є
хибними.
1. Ь-ДОФА є корисною для лікуван-
ня хвороби Паркінсона, оскільки
збільшує вміст дофаміну у дофа-
мінергічних нейронах горбово-
лійкової системи.
2. Ліки, що зменшують зворотне по-
глинання серотоніну, корисні для
лікування деяких депресивних за-
хворювань, оскільки збільшують
кількість позаклітинного норадре-
наліну у головному мозку.
3. Процедури, що збільшують вивіль-
нення опіоїдних пептидів у цент-
ральній нервовій системі, змен-
• шують вплив больових подраз-
ників, оскільки центральна сіра
речовина і споріднені ділянки
містять опіоїдні рецептори, до яких
пептиди можуть приєднуватись.
4. Антипсихотична активність голов-
них транквілізаторів співвідносна
з їхньою здатністю блокувати се-
ротонінові рецептори, оскільки се-
ронінергічна нейрональна система
у головному мозку зацікавлена,
поміж іншого, нормальними пси-
хічними функціями.
5. Жінка з вродженою недостатністю
адренокортикального ензиму, що
спричинює секрецію великої кіль-
кості андрогенів, має сформовану
поведінку чоловічого типу, на від-
міну від нормальних жінок, оскіль-
ки андрогени впливають на мозок
під час внутрішньоутробного роз-
витку.
6. Удавана лють інколи простежуєть-
ся у хворих після енцефаліту або
нейрохірургічних втручань, оскіль-
ки можуть бути уражені провідні
шляхи від нової кори до лімбічної
системи.
У питаннях 7—12 виберіть
САМООЦІНКА НАВИКІВ / 701
А, якщо відповідь пов’язана з (а);
В, якщо відповідь пов’язана з (Ь);
С, якщо відповідь пов’язана з (а) і
(Ь);
Л, якщо відповідь не пов’язана ні
з (а), ні з (Ь).
(а) Збільшення позаклітинного до-
фаміну у напівлежачому ядрі.
(Ь) Заспокоює.
7. Героїн.
8. Алкоголь.
9. Кокаїн.
10. Нікотин.
11. Амфетамін.
12. Епібатидин.
13. Бензодіазепани, такі як діазепам
(валіум), послаблюють відчуття
страху, оскільки вони
(А) інгібують зв’язування дофамі-
ну у стовбурі головного мозку.
(В) інгібують зв’язування глюта-
мату у лімбічній системі.
(С) полегшують вивільнення нор-
адреналіну у гіпоталамусі.
(В) послаблюють впливи ГАМК у
нервовій системі.
(Е) блокують мускаринові ацетил-
холінові рецептори у лімбічній
системі.
14. Що призводить до зменшення ха-
рактерних особливостей мате-
ринської поведінки?
(А) Ураження кори потиличної
частки.
(В) Ураження медіобазальної ді-
лянки гіпоталамуса.
(С) Втрата експресії гена /ох В.
(В) Оварієктомія.
(Е) Гістеректомія.
15. Тіла головних гістамінергічних
нейронів у головному мозку розта-
шовані у
(А) передоптичній ділянці.
(В) центральному ядрі мигдале-
подібного тіла.
(С) підсклепінному органі.
(В) голубій плямі.
(Е) медіобазальній частині гіпота-
ламуса.
16. Які з наведених ліків є транквіліза-
торами?
(А) ДЛК.
(В) Атропін.
(С) Екстазі (МДМА).
(В) Літій.
(Е) Хлорпромазин.
17. У разі якої з наведених хвороб
мезокортикальна система дофа-
мінергічних нейронів гіперактив-
на?
(А) Хвороба Паркінсона.
(В) Маніякально-депресивні пси-
хози.
(С) Шизофренія.
(В) Гіперпролактемія.
(Е) Мігрень.
У питаннях 18-20 визначте, чи
величина, наведена у першому вислові,
є більшою (С), однаковою (8) або мен-
шою (Ь), ніж величина, наведена у
другому.
18. Зона головного мозку, коли твари-
ни будуть уникати стимулювання
через імплантовані електроди.
С8Ь
Зона головного мозку, коли тва-
рини будуть працювати і передава-
ти повторне стимулювання через
імплантовані електроди.
19. Кількість норадреналіну у ядрах
шва.
С8Ь
Кількість серотоніну у ядрах шва.
20. Кількість норадреналіну у чор-
носмугастому шляху.
С8Ь
Кількість дофаміну у чорносму-
гастому шляху.
РОЗДІЛ 16
У цьому розділі описано вищі
функції нервової системи, визначено
поняття навчання, пам’яті, мислення,
мовні та інші розумові функції люди-
ни. Після вивчення цього розділу сту-
дент повинен уміти:
• описати різноманітні типи пам’яті;
• дати приклади набування навичок
і сенсибілізації, що простежують-
ся у людей, описати молекулярні
засади таких явищ;
• дати означення умовних рефлек-
сів, описати їхні властивості та
проаналізувати засади таких ре-
флексів;
• назвати відділи головного мозку,
відповідальні за пам’ять у ссавців,
і пояснити роль кожної структури
головного мозку у формуванні па-
м’яті та зберіганні інформації;
• описати та пояснити терміни: кате-
горична і репрезентативна півкулі
головного мозку; назвати відмін-
ності між півкулями та їхній зв’я-
зок з переважним використанням
однієї руки;
• дати означення та пояснити агно-
зію, односторонню неуважність та
недбальство, дислексію, прозопаг-
нозію;
• сформулювати відмінності між
афазією зі здатністю вільно гово-
рити і афазією без здатності вільно
говорити та пояснити причини їх-
ньої появи;
• описати аномалії структур голов-
ного мозку та їхніх функцій у разі
хвороби Альцгеймера.
ГОЛОВНІ ПИТАННЯ
І.Які методи використовують для
вивчення природи навчання і па-
м’яті у людей та експерименталь-
них тварин?
2. Чому мати, сну якої не заважають
різноманітні шуми, одразу проки-
дається від плачу своєї дитини?
3. Що таке біологічний зворотний
зв’язок? Поясніть його фізіологіч-
не значення.
4. Назвіть і поясніть аномалії функ-
ціювання головного мозку, що ви-
никають у разі перетинання мозо-
листого тіла.
5. Дайте означення та поясніть від-
мінності між свідомою та підсві-
домою пам’яттю.
6. Опишіть функції зон Верніке, Бро-
ка, дугоподібного пучка і базаль-
них гангліїв у формуванні мови.
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-20 виберіть одну
відповідь.
1. Ретроградна амнезія
(А) буде скасована префронталь-
ною лобектомією.
(В) реагує на ліки, що блокують
дофамінергічні рецептори.
(С) найчастіше виникає внаслідок
травми голови.
(Л) збільшується у разі введення
вазопресину.
(Е) спричинена ураженням стов-
бура головного мозку.
2. Репрезентативна півкуля - це
(А) права півкуля головного мозку
у більшості правшів.
(В) ліва півкуля головного мозку
в більшості лівшів.
702 / САМООЦІНКА НАВИКІВ
(С) частина головного мозку, що
відповідає за мову.
(В) місце ураження у більшості
пацієнтів з афазією.
(Е) морфологічно ідентична до
протилежної категоричної пів-
кулі головного мозку.
3. Собаку, в якої перетяте зорове пе-
рехрестя і закрите праве око, тре-
нують гавкати, коли вона бачить
червоний квадрат. Згодом праве
око залишають відкритим, а ліве
- закритим. Тварина
(А) не реагуватиме на червоний
квадрат, оскільки він не ство-
рюватиме імпульсів, що дося-
гають правої потиличної част-
ки кори головного мозку.
(В) не реагуватиме на червоний
квадрат, оскільки у тварини є
бітемпоральна геміанопія.
(С) не реагуватиме на червоний
квадрат, якщо задня спайка та-
кож перерізана.
(В) реагуватиме на червоний квад-
рат тільки після ретренування.
(Е) реагуватиме швидко на черво-
ний квадрат, незважаючи на
неможливість потрапляння
імпульсації у ліву потиличну
частку кори головного мозку.
4. До ефектів білатеральної втрати
функцій морського коника нале-
жить
(А) зникнення віддаленої пам’яті.
(В) втрата робочої пам’яті.
(С) втрата здатності кодувати не-
давні події у разі довготри-
валого запам’ятовування.
(В) втрата здатності розпізнавати
обличчя та форми зі збереже-
ною здатністю розпізнавати
надруковані або виголошені
слова.
(Е) утворення невідповідних емо-
ційних реакцій, коли згадують
недавні події.
5. Які з наведених тверджень хибно
поєднані:
(А) ураження тім’яної частки у ре-
презентативній півкулі: одно-
стороння неуважність та не-
дбальство;
(В) втрата холінергічних нейронів
у базальному ядрі Мейнерта і
споріднених ділянках перед-
нього мозку : втрата пам’яті на
недавні події;
(С) ураження сосочкових тіл :
втрата пам’яті на недавні події;
(В) ураження дугоподібного пучка
у категоричній півкулі: афазія
без здатності вільно говорити;
(Е) ураження зони Брока у катего-
ричній півкулі: повільна мова.
6. Репрезентативна півкуля є ліп-
шою, ніж категорична у
(А) виконанні мовних функцій.
(В) розпізнаванні об’єктів за їхні-
ми формами.
(С) розумінні надрукованих слів.
(В) розумінні вимовлених слів.
(Е) математичних обчисленнях.
7. Яке з наведених тверджень не є ха-
рактерним для умовних рефлек-
сів?
(А) Порушене утворення умовних
рефлексів, якщо дія умовного і
безумовного подразників є
окремою більше ніж через 2 хв.
(В) Зникнення умовного рефлексу,
якщо його не підкріплювати
від часу до часу.
(С) Швидке утворення умовного
рефлексу, коли умовний по-
дразник є приємним для тва-
рини.
(В) Порушене утворення умовно-
го рефлексу, якщо умовний по-
дразник є неприємним для тва-
рини.
(Е) Порушене утворення умовно-
го рефлексу, коли після дії
умовного подказника діє від-
волікальний подразник перед
дією безумовного подразника.
7. Ураження зони Верніке (ділянка в
задній частині верхньої скроневої
закрутки) у категоричній півкулі
спричинює у хворих
(А) втрату короткотривалої пам’я-
ті.
(В) повільне з зупинками мовлен-
ня.
(С) явище сіє)а уи.
(В) швидке малозмістовне мов-
лення.
(Е) втрату здатності розпізнавати
обличчя.
У питаннях 9-15 позначте функ-
цію у кожному питанні літерою по-
в ’язаної з нею структури. Кожна по-
значена літерою структура може бу-
ти використана один раз, декілька ра-
зів або жодного разу.
(А) Мозолисте тіло.
(В) Лобова частка кори великих
півкуль.
(С) Міст.
(В) Мигдалеподібне тіло.
(Е) Скронева частка кори великих
півкуль.
9. Сон ШРО.
10. Міжкіркове переміщення навчання
11. Емоційна пам’ять.
12. Аудіювання.
13. Експериментальний невроз.
14. Зорові асоціації.
15. Регулювання моторних функцій.
У питаннях 16-20 виберіть
А, якщо відповідь пов’язана з (а);
В, якщо відповідь пов’язана з (Ь);
С, якщо відповідь пов’язана з (а) і
(Ь);
В, якщо відповідь не пов’язана ні
з (а), ні з (Ь).
(а) Хвороба Альцгеймера.
(Ь) Хвороба Гантінгтона.
16. Ураження базальних гангліїв.
17. Ураження свідомої пам’яті.
18. Асоціюється зі збільшенням кіль-
кості САСг тринуклеотидних по-
вторень.
19. Ураження р-амілоїдом.
20. Може бути вилікованою, якщо лі-
кування розпочати за перших про-
явів хвороби.
РОЗДІЛ 17
У цьому розділі розглянуто баланс
енергії та метаболізм, як підґрунтя
функціювання ендокринних залоз.
Предметом обговорення є також ін-
тенсивність обміну, утворення і функ-
ції АТФ, обмін вуглеводів, білків і жи-
рів, важливі похідні жирів, включно з
лейкотрієнами і простагландинами та
фізіологічні основи живлення. Після
вивчення цього розділу студент пови-
нен уміти:
• дати означення інтенсивності об-
міну, калорії та дихального коефі-
цієнта;
• знати калоричний еквівалент для
вуглеводів, білків і жирів;
• описати біосинтез і функції АТФ;
• назвати головні харчові гексози і
підсумовувати головні механізми,
що регулюють синтез і розпад
глюкози;
• описати функцію циклу лимонної
кислоти у метаболізмі глюкози,
амінокислот і жирних кислот;
• дати означення глюкостатичної
функції печінки і пояснити, як пе-
чінка виконує цю функцію;
САМООЦІНКА НАВИКІВ / 703
• знати функції амінокислот, полі-
пептидів і білків;
• назвати головні джерела сечової
кислоти в організмі та головні ме-
таболічні продукти, що утворю-
ються з сечової кислоти;
• описати зміни в обміні речовин у
разі голодування;
• назвати найважливіші класи ліпі-
дів у організмі людини й описати
головні характеристики для кож-
ного класу;
• назвати кетонові тіла й описати їх-
нє утворення та метаболізм;
• описати джерела вільних жирних
кислот у плазмі, їхній метаболіч-
ний рівень і головні фактори, що
регулюють рівень жирних кислот
у плазмі;
• описати екзогенний та ендогенний
шляхи транспортування ліпідів у
організмі та процеси, що задіяні в
метаболізмі холестеролу;
• назвати головні шляхи утворення
лейкотрієнів, ліпоксинів, тромбок-
синів, простагландинів та їхні
функції;
• характеризувати складові харчу-
вання людини у нормі, що забез-
печуватимуть підтримку здоров’я
і масу;
• дати означення терміна вітамін і
назвати ефекти нестачі чи надлиш-
ку кожного вітаміну.
ГОЛОВНІ ПИТАННЯ
1. Споживання кисню у спокої тва-
риною, що постить, становить
ЗО мл/кг маси тіла за хвилину.
Який рівень основного обміну (у
ккал/кг/добу)? Які приблизно роз-
міри цих тварин?
2. Що таке специфічна динамічна
дія? Як вона виникає?
3. Що таке спрямовувальні клапани
у метаболізмі? У чому полягає їхня
важливість?
4. Які зміни в обміні вуглеводів про-
стежуються у разі навантаження?
5. Порівняйте метаболізм фруктози
і глюкози. Як вони взаємодіють?
6. Що таке подагра?
7. Що таке незамінні амінокислоти?
8. Яке лікування Ви б призначили для
зменшення рівня холестеролу у
плазмі? Чому зменшення холес-
теролу важливе? Опишіть зв’язок
холестеролу з ліпопротеїнами
низької щільності і ліпопротеїна-
ми високої щільності.
9. Які метаболіти арахідонової кис-
лоти важливі для організму? Чому
затрачено великі зусилля для ство-
рення ліків, що модифікують мета-
болізм арахідонової кислоти?
10. Опишіть патогенез ожиріння. Яке
значення факту, що майже у всіх
людей з ожирінням рівень лептину
корелює з індексом їхньої маси ті-
ла, тобто ступенем надлишку маси,
хоча відомо, що лептин зменшує
апетит у нормальних осіб без ожи-
ріння?
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-20 виберіть одну
відповідь.
1. В організмі під час метаболізму
10 г білка може виділитися при-
близно
(А) 1 ккал.
(В) 41 ккал.
(С) 410 ккал.
(Б) 4100 ккал.
(Е) 41 кал.
2. У чоловіка з дихальним коефіці-
єнтом 70
(А) харчовий раціон - дієта з
низьким вмістом жирів.
(В) харчовий раціон - дієта з ви-
соким вмістом білків.
(С) піст тривав 24 год.
(Б) нічого не їв, крім вуглеводів,
упродовж 24 год.
(Е) дегідратація.
3. Яке з наведених співвідношень
спожитих білків (Б), вуглеводів (В)
і жирів (Ж) (у грамах) є найліпшим
для чоловіка масою 80 кг (за фа-
хом - будівельника) у нормі?
(А) Б-80; Ж - 125; В-420.
(В) Б - 130; Ж - 100; В-420.
(С) Б-80; Ж-65; В-325.
(Б) Б-80; Ж-65; В-550.
(Е) Б-50; Ж-65; В-340.
4. Головним джерелом ліпопротеїнів
для холестеролу у клітинах є
(А) хіломікрони.
(В) ліпопротеїни середньої щіль-
ності.
(С) альбумінозв’язані вільні жирні
кислоти.
(Б) ліпопротеїни низької щільнос-
ті.
(Е) ліпопротеїни високої щіль-
ності.
5. У якому з наведених випадків ви-
робляються найважливіші високо-
енергетичні фосфатні сполуки?
(А) Аеробний метаболізм 1 моля
глюкози.
(В) Анаеробний метаболізм 1 мо-
ля глюкози.
(С) Метаболізм 1 моля галактози.
(Б) Метаболізм 1 моля галактози.
(Е) Метаболізм 1 моля довголан-
цюгової амінокислоти.
6. Яка з наведених сполук утворює
найбільше глюкози під час мета-
болізму в організмі?
(А) 1 моль серотоніну.
(В) 1 моль аланіну.
(С) 1 моль олеїнової кислоти.
(Б) 1 моль Т4.
(Е) 1 моль ацетооцтової кислоти.
7. Який з наведених лікарських пре-
паратів не призводить до збіль-
шення у плазмі рівня вільних жир-
них кислот?
(А) Препарат, що збільшує рівень
внутрішньоклітинного цАМФ.
(В) Препарат, що активує р3-адре-
норецептори.
(С) Препарат, що інгібує гормоно-
чутливу ліпазу.
(Б) Препарат, що зменшує мета-
болічний кліренс глюкагону.
(Е) Препарат, що інгібує фосфо-
діестеразу.
8. Коли ЛПНЩ входять у клітину ре-
цептор-опосередкованим ендоци-
тозом, які з перелічених процесів
не відбудуться?
(А) Зменшення утворення холе-
стеролу з мевалонової кисло-
ти.
(В) Збільшення внутрішньоклі-
тинної концентрації холесте-
ролових ефірів.
(С) Збільшення перетворення хо-
лестеролу з клітини у ЛПВЩ.
(Б) Зменшення швидкості синтезу
ЛПНЩ рецепторів.
(Е) Зменшення холестеролу в ен-
досомах.
9. Які з наведених чинників не збіль-
шують утворення глюкози печін-
кою?
(А) Індукція фосфорилази.
(В) Інсулін.
(С) Глюкагон.
(Б) Збільшення внутрішньоклі-
тинної протеїнкінази А.
(Е) Адреналін.
704 / САМООЦІНКА НАВИКІВ
У питаннях 10—15 виберіть
А, якщо відповідь пов’язана з (а);
В, якщо відповідь пов’язана з (Ь);
С, якщо відповідь пов’язана з (а) і
(Ь);
В, якщо відповідь не пов’язана ні
з (а), ні з (Ь).
(а) Циклооксигеназа.
(Ь) 5-Ліпоксигеназа.
10. Арахідонова кислота.
11. Пальмітинова кислота.
12. Лейкотрієни.
13. Тромбоксани.
14. Аспірин.
15. Ліпоксини.
У питаннях 16-20 позначне хворо-
бу або стан літерою пов ’язаноїз ним
речовини. Кожна позначена літерою
речовина може бути використана
один раз, декілька разів або жодного
разу.
(А) Фолієва кислота.
(В) Вітамін С.
(С) Вітамін Вґ
(В) Вітамін К.
(Е) Сечова кислота.
16. Первинна подагра.
17. Вторинна подагра.
18. Цинга.
19. Хвороба бері-бері.
20. Щілина хребта.
РОЗДІЛ 18
У цьому розділі описана структура
і функції щитоподібної залози, її гор-
мони Т, і Т,, а також головні захво-
рювання щитоподібної залози. Після
вивчення цього розділу студент пови-
нен уміти:
• описати макро- та мікроструктуру
щитоподібної залози;
• дати означення особливостей ме-
таболізму йоду;
• порівняти структуру Т4,Т3 і ОТ3;
• назвати послідовно кроки біосин-
тезу тиреоїдних гормонів, їхнє де-
понування у колоїд і перетворення
з колоїду у тиреоїдні гормони у
кров’яному руслі;
• назвати білки, що зв’язують тире-
оїдні гормони у плазмі, описати
взаємозв’язок між зв’язаними та
вільними тиреоїдними гормонами
і механізми регулювання їхнього
зв’язування;
• описати головні шляхи метаболі-
зму тиреоїдних гормонів;
• назвати найважливіші фізіологічні
ефекти тиреоїдних гормонів;
• описати механізми впливу тирео-
їдних гормонів;
• пояснити процеси, задіяні у регу-
люванні секреції тиреоїдних гор-
монів;
• назвати препарати, що впливають
на функціювання щитоподібної
залози, й описати механізми реа-
лізації їхнього впливу;
• назвати важливі захворювання щи-
топодібної залози, їхні головні
симптоми й ознаки.
ГОЛОВНІ ПИТАННЯ
1. Криві на рис. 18-А відображають
зміни основного обміну, спричи-
нені введенням разової дози Т3 чи
Т4 особі, яка попередньо не ліку-
вала гіпотиреоїдизм. Яка крива
стосується Т3, а яка - Т4? Поясніть
відмінності між ними.
2. Яке значення ТРГ у повсякден-
ному регулюванні функції щито-
подібної залози?
3. Опишіть причини та патогенез зо-
бу. Чому у людей, які споживають
капусту у великих кількостях, ви-
никає зоб?
4. Чому діти з кретинізмом мають
невисокий зріст і розумову непов-
ноцінність?
5. Хворі з тиреотоксикозом часто ма-
ють ремісію багатьох симптомів та
ознак у разі застосування препа-
ратів Р-адреноблокаторів, наприк-
лад пропранололу. Які ознаки і
симптоми зникають, а які ні? По-
ясність чому?
6. Які гормони сприяють збільшен-
ню швидкості метаболізму? Чому
саме такі ефекти виникають?
7. Яке ембріологічне походження
щитоподібної залози, паращито-
подібних залоз і парафолікулярних
клітин щитоподібної залози? Яке
клінічне застосування знань про
ембріогенез цих тканих?
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-12 виберіть одну
відповідь.
+5
ОС 1—1--1--1 1----1----1--1---1---1--1---и
0 2 4 6 8 10 12 14 16 18 20
Дні після введення препарату
хворому на гіпотиреоїдизм
Рис. 18-А.
1. У якому з наведених станів менш
за все відповідь ТТГ на ТРГ буде
більшою, ніж у нормі?
(А) Гіпотиреоїдизм унаслідок тка-
нинної резистентності до ти-
реоїдних гормонів.
(В) Гіпотиреоїдизм унаслідок хво-
роби, що порушує структуру
щитоподібної залози.
(С) Гіпертиреоїдизм унаслідок по-
яви циркулювальних антити-
реоїдних антитіл з ТТГ актив-
ністю.
(В) Гіпертиреоїдизм унаслідок ди-
фузної гіперплазії тиреотропі-
нів передньої частки гіпофіза.
(Е) Дефіцит йоду.
2. Пропілтіоурацил спричинює
(А) зменшення розмірів щитопо-
дібної залози і збільшення рів-
ня Т4у плазмі.
(В) зменшення розмірів щитопо-
дібної залози і рівня Т4 у плаз-
мі.
(С) збільшення розмірів щитопо-
дібної залози і рівня Т4 у плаз-
мі.
(В) збільшення розмірів щитопо-
дібної залози і зменшення рів-
ня Т4у плазмі.
(Е) незмінність розмірів щитопо-
дібної залози і зменшення рів-
ня Т4у плазмі.
3. Молода жінка має набрякле лице і
хриплий голос. Концентрація ТТГ
у плазмі низька, однак відчутно
збільшується у разі отримання
ТРГ. У неї
(А) гіпертиреоїдизм, спричинений
пухлиною щитоподібної залози.
(В) гіпотиреоїдизм, спричинений
аномалією щитоподібної зало-
зи.
(С) гіпотиреоїдизм, спричинений
первинною аномалією у гіпо-
фізі.
САМООЦІНКА НАВИКІВ / 705
(В) гіпотиреоїдизм, спричинений
первинною аномалією у гіпо-
таламусі.
(Е) гіпертиреоїдизм, спричинений
первинною аномалією у гіпо-
таламусі.
4. Реакція сполучення монойодоти-
розину з дийодотирозином та йо-
дування тиреоглобуліну блокована
(А) дивалентними катіонами.
(В) моновалентними аніонами, та-
кими як перхлорат.
(С) ТТГ.
(В) ТРГ.
(Е) тіоуриленами, такими як про-
пілтіоурацил.
5. Поглинання щитоподібною зало-
зою радіоактивного йоду не спри-
чинюване
(А) кальциотоніном.
(В) т3.
(С) ТТГ.
(В) пропілтіоурацилом.
(Е) вмістом йоду у харчовому ра-
ціоні.
6. Швидкість метаболізму менш за
все залежить від збільшення у
плазмі рівня
(А) ТТГ.
(В) ТРГ.
(С) ГЗТ.
(В) вільного Т4.
(Е) вільного Т3.
7. Які з наведених чинників не є не-
обхідними для нормального біо-
синтезу тиреоїдних гормонів?
(А) Йод.
(В) Феритин.
(С) Тиреоглобулін.
(В) Синтез білка.
(Е) ТТГ.
8. Які з наведених чинників менш за
все зміняться у разі введення ТТГ?
(А) Поглинання щитоподібною
залозою йоду.
(В) Синтез тиреоглобуліну.
(С) Циклічний АМФ у тиреоїдних
клітинах.
(В) Циклічний ГМФ у тиреоїдних
клітинах.
(Е) Розмір щитоподібної залози.
9. Гіпотиреоїдизм унаслідок захво-
рювання щитоподібної залози асо-
ціюється зі збільшеним рівнем у
плазмі
(А) холестеролу.
(В) альбуміну.
(С) от3.
(В) йоду.
(Е) ГЗТ.
10. Який з наведених засобів найімо-
вірніше полегшить симтоматику
екзофтальму?
(А) Призначення Т4.
(В) Призначення препаратів, що
інгібують утворення Т-лімфо-
цитів.
(С) Призначення тестостерону.
(В) Гіпофізектомія.
(Е) Тиреоїдектомія.
11. Які фрази хибно спаровані?
(А) Цукровий діабет типу І (інсу-
лінозалежний): антитіла про-
ти В-клітин.
(В) Міастенія гравіс : антитіла
проти нікотиночутливих холі-
норецепторів.
(С) Розсіяний склероз : антитіла
проти мієліну.
(В) Тироїдит Хашімото : антитіла
проти ТТГ.
(Е) Хвороба Ґрейва : антитіла, що
стимулюють ТТГ рецептори.
12. У якій з наведених форм рецеп-
тори тиреоїдних гормонів зв’язу-
ються з ДНК?
(А) Гетеродимер з рецептором
пролактину.
(В) Гетеродимер з рецептором
гормону росту.
(С) Гетеродимер з Х-рецептором
сітківки.
(В) Гетеродимер з інсуліновим ре-
цептором.
(Е) Гетеродимер з прогестероно-
вим рецептором.
У питаннях 13—15 визначте, чи
величина, наведена у першому вислові,
є більшою (Є), однаковою (8) або мен-
шою (ІД ніж величина, наведена у
другому.
13. Споживання їжі у разі мікседеми.
С8Ь
Споживання їжі у разі тиреотокси-
козу.
14. Кількість р-рецепторів у серці у
разі мікседеми.
С8Ь
Кількість Р-рецепторів у серці у
разі тиреотоксикозу.
15. Ендоцитоз біля країв тиреоїдних
клітин, що містять колоїд, після
введення ТСГ.
С8Ь
Ендоцитоз біля країв тиреоїдних
клітин, що містять колоїд, після
введення Т4.
РОЗДІЛ 19
У цьому розділі описано інсулін та
інші гормони острівців підшлункової
залози, а також інші гормони організ-
му, що беруть участь у метаболізмі вуг-
леводів. Цукровий діабет детально
схарактеризовано як захворювання,
що пов’язане з порушенням обміну
вуглеводів. Після вивчення цього роз-
ділу студент повинен уміти:
• назвати гормони, що впливають на
концентрацію глюкози у крові, і
коротко описати дію кожного;
• описати структуру острівців під-
шлункової залози, назвати гор-
мони, секретовдні кожним типом
клітин у острівцях;
• описати структуру інсуліну і назва-
ти етапи його біосинтезу та вивіль-
нення у кров’яне русло;
• назвати наслідки нестачі інсуліну та
пояснити причини таких аномалій;
• описати інсулінові рецептори, ме-
ханізм, яким вони опосередкову-
ють вплив інсуліну, та механізм,
який регулює їхнє функціювання;
• описати ефекти гіпоглікемії та пе-
релічити гомеостатичні механіз-
ми, що долають гіпоглікемію;
• описати типи носіїв глюкози в ор-
ганізмі та їхні функції;
• назвати найважливіші фактори, що
впливають на секрецію інсуліну;
• описати структуру глюкагону та
його зв’язок з гліцентином;
• описати фізіологічне значення дії
глюкагону;
• назвати головні фактори, що впли-
вають на секрецію глюкагону;
• описати можливі фізіологічні дії со-
матостатину на підшлункову залозу;
• перелічити механізми, якими ти-
реоїдні гормони, глюкокортикоїди,
катехоламіни надниркових залоз
та гормон росту впливають на ме-
таболізм вуглеводів;
• дати означення інсулінозалежного
та інсулінонезалежного цукрового
діабету, описати головні власти-
вості та можливі причини кожного
типу діабету.
ГОЛОВНІ ПИТАННЯ
1. У хворого гіпоглікемія, спричине-
на, можливо, інсуліносекретуваль-
45 367-2
706 / САМООЦІНКА НАВИКІВ
ною пухлиною або функційною
гіпоглікемією. Проте є докази, що
хворий таємно вводить собі інсу-
лін. На підставі яких фактів мож-
на виконати диференційну діа-
гностику? Які обстеження Ви при-
значили б і яка їхня діагностична
цінність?
2. Які з кривих на рис. 19-А харак-
терні для осіб у нормі (1), для осіб
з цукровим діабетом першого типу
(2) і для осіб з цукровим діабетом
другого типу (3)? Поясніть відмін-
ності між цими кривими.
3. Чому кетоацидоз поширений біль-
ше і складніший у хворих на цу-
кровий діабет першого типу, ніж
на цукровий діабет другого типу?
4. У мишей з нокаутом гена субстра-
та-1 інсулінового рецептора помір-
на затримка росту й інсулінова
резистентність. Проте у мишей з
нокаутом гена інсулінового рецеп-
тора виражена затримка росту і во-
ни часто помирають після народ-
ження. Як пояснити механізми
впливу інсуліну?
5. Які гормони утворюються з моле-
кули препроглюкагону? Де саме
утворюється кожний з них і які їхні
функції?
6. Інсулін інколи описують як гормон
достатку, а глюкагон як гормон
голоду. Поясніть відповідність цих
термінів у контексті їхньої фізіо-
логічної дії та взаємодії.
7. Що таке проінсулін? Який його
зв’язок з препроінсуліном та інсу-
ліном і що відбувається з ним в
організмі.
Хвилини після перорального
приймання глюкози
Рис. 19-А.
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-11 виберіть одну від-
повідь.
1. Які фрази хибно спаровані?
(А) В-клітини : інсулін.
(В) В-клітини : соматостатин.
(С) А-клітини : глюкагон.
(Б) Екзокринні клітини підшлун-
кової залози : хімотрипсино-
ген.
(Е) Р-клітини : гастрин.
2. Які фрази хибно спаровані?
(А) Адреналін : збільшує глікоге-
ноліз у скелетних м’язах.
(В) Інсулін : збільшує синтез білка.
(С) Глюкагон : збільшує глюко-
неогенез.
(В) Прогестерон : збільшує рівень
глюкози у плазмі.
(Е) Гормон росту : збільшує рі-
вень глюкози у плазмі.
3. Які з наведених процесів менш за
все простежуватимуться у щурів
через 14 днів після введення пре-
парату, що вражає всі В-клітини
підшлункової залози?
(А) Збільшення концентрації Н+ у
плазмі.
(В) Збільшення концентрації глю-
кагону у плазмі.
(С) Зменшення концентрації
НСО3 у плазмі.
(В) Зменшення концентрації амі-
нокислот у плазмі;
(Е) Збільшення осмоляльності
плазми.
4. Глюкагону у нормі нема у
(А) головному мозку.
(В) підшлунковій залозі.
(С) шлунково-кишковому тракті.
(В) плазмі.
(Е) надниркових залозах.
5. У разі зменшення рівня глюкози у
плазмі інші гормони допомагають
подолати гіпоглікемію. Після внут-
рішньовенного введення великих
доз інсуліну повернення низького
рівня глюкози до норми відтермі-
новане у разі
(А) недостатності мозкової речо-
вини надниркових залоз.
(В) недостатності глюкагону.
(С) поєднання недостатності моз-
кової речовини надниркових
залоз і недостатності глюкаго-
ну.
(В) тиреотоксикозу.
(Е) акромегалії.
6. Після тотальної панкреатектомії не
(А) утвориться стеаторея.
(В) збільшиться рівень вільних
жирних кислот у плазмі.
(С) знизиться РСО2 плазми.
(В) зміниться або підвищиться рі-
вень інсуліну у плазмі.
(Е) зміниться або підвищиться рі-
вень глюкагону у плазмі.
7. Інсулін збільшить надходження
глюкози у
(А) всі тканини.
(В) клітини канальців нирки.
(С) слизову тонкої кишки.
(В) більшість нейронів кори го-
ловного мозку;
(Е) скелетні м’язи.
8. Механізм, яким глюкагон спричи-
нює збільшення концентрації глю-
кози у плазмі, забезпечує
(А) зв’язування глюкагону з ДНК
у ядрі клітин-мішеней.
(В) зв’язування глюкагону з ре-
цепторами цитоплазми клі-
тин-мішеней.
(С) активування 6 у клітинах-мі-
шенях.
(В) збільшене зв’язування глюка-
гону Са2+ у цитоплазмі клітин-
мішеней.
(Е) гальмування секреції інсуліну.
9. Глюкагон збільшує глюкогеноліз у
клітинах печінки, тоді як АКТГ -
ні, оскільки
(А) кортизон збільшує рівень глю-
кози у плазмі.
(В) клітини печінки мають адені-
латциклазу, відмінну від такої,
як у клітинах кори наднирко-
вих залоз.
(С) АКТГ не проникає у ядро клі-
тин печінки.
(В) мембрани клітин печінки міс-
тять рецептори, відмінні від
таких, як у клітинах кори над-
ниркових залоз.
(Е) клітини печінки містять білок,
який інгібує дію АКТГ.
10. їжа, багата на білки, вміщує аміно-
кислоти, які стимулюють секрецію
інсуліну, проте низький вміст вуг-
леводів не спричинює гіпоглікемії,
оскільки
(А) їжа спричинює компенсаторне
збільшення секреції Т4.
(В) кортизон у кровообігу попе-
реджує надходження глюкози
в м’язи.
(С) секреція глюкагону також сти-
мульована їжею.
САМООЦІНКА НАВИКІВ / 707
(В) амінокислоти у їжі швидко
конвертуються у глюкозу.
(Е) інсулін не зв’язується з інсулі-
новими рецепторами, якщо
концентрація амінокислот у
плазмі підвищена.
11. Рух якого носія глюкози через
клітинні мембрани у скелетних
м’язових клітинах збільшує інсу-
лін?
(А)ОШТ 1.
(В) 6ШТ 2.
(С) 6ШТ 3.
(О) скит 4.
(Е) НЗПГ 1.
У питаннях 12-15 позначте ознаку
або симптом літерою пов ’язаного з
ним вислову. Кожен позначений літе-
рою вислів може бути використаний
один раз, декілька разів або жодного
разу.
(А) Мікросудинні ушкодження
цукрового діабету.
(В) Макросудинні ушкодження
цукрового діабету.
(С) Неврологічна патологія цук-
рового діабету.
(В) Рідкісна для цукрового діабету
першого типу.
(Е) Зумовлена хронічною гіпоглі-
кемією.
1. Прогресуюче погіршення зору.
2. Збільшення креатиніну плазми,
поліпшення стану у разі застосу-
вання інгібіторів ангіотензинопе-
ретворювальних ензимів.
3. Імпотенція та болі в черевній по-
рожнині.
4. Виражені грудні болі та нудота.
У питаннях 13—15 визначте, чи ве-
личина, наведена у першому вислові,
с більшою (С), однаковою (8) або мен-
шою (ІД ніж величина, наведена у
другому.
16. Секреція інсуліну після внутріш-
ньовенного введення глюкози.
С8Е
Секреція інсуліну після перораль-
ного введення такої ж дози глюко-
зи.
17. Рівень глюкози у плазмі після хі-
рургічної панкреатектомії.
С8Ь
Рівень глюкози у плазмі після вве-
дення токсину, наприклад алокса-
ну, який вибірково вражає В-клі-
тини.
18. Концентрація С-пептиду у плазмі
в осіб, які постять.
С8Ь
Концентрація С-пептиду в осіб, які
харчуються.
РОЗДІЛ 20
У цьому розділі описані функції
надниркових залоз: секреція катехо-
ламінів мозковою речовиною, глюко-
кортикоїдів та статевих гормонів пуч-
ковою і сітчастою зонами кори та
альдостерону клубочковою зоною ко-
ри надниркових залоз. Тут також є
короткий огляд клінічних аномалій,
що розвиваються внаслідок надлишку
або нестачі кожного з цих горомонів.
Після вивчення цього розділу студент
повинен уміти:
• назвати три види катехоламінів,
що їх секретує мозкова речовина
надникових залоз, і описати їхній
біосинтез, метаболізм та функції;
• схарактеризувати подразники, що
збільшують секрецію кори над-
ниркових залоз та описати шлях,
яким вона збільшується;
• розрізняти С18-, С19- і С21 -стероїди
і навести приклади кожного;
• описати послідовність етапів біо-
синтезу стероїдів і їхню роль у
фізіології надниркових залоз;
• назвати головні місця метаболізму
адренокортикальних гормонів і
головні метаболіти, що утворю-
ються з глюкокортикоїдів, андро-
генів надниркових залоз та альдо-
стерону;
• описати механізми, за допомогою
яких глюкокортикоїди та альдо-
стерон змінюють функціювання
клітини;
• назвати та коротко описати фізіо-
логічні та фармакологічні ефекти
впливу глюкокортикоїдів;
• зіставити фізіологічні та патоло-
гічні ефекти андрогенів наднир-
кових залоз;
• описати механізми регулювання
секреції глюкокортикоїдів і стате-
вих гормонів надниркових залоз;
• перелічити дії альдостерону;
• описати механізми регулювання
секреції альдостерону;
• описати головні симптоми хвороб,
спричинених надлишком чи неста-
чею кожного з гормонів наднир-
кових залоз.
ГОЛОВНІ ПИТАННЯ
І.Який з метаболітів Ви б вимірю-
вали, щоб визначити, чи пацієнт з
феохромоцитомою має норадрена-
ліно- або адреналіносекретуваль-
ну пухлину?
2. Який ензим є унікальним для кож-
ної з трьох зон кори надниркових
залоз, однак є лише в особливій
зоні? Які фізіологічні наслідки та-
кого унікального представництва?
З. Які функції надниркових залоз
плоду людини?
4. Як можна стверджувати про недос-
татність 17а-гідроксилази? Від-
повідь обґрунтуйте.
5. Чому деякі пацієнти із вродженою
гіперплазією надниркових залоз і
вірилізацією мають високий арте-
ріальний тиск, а інші мають над-
мірну втрату натрію та гіпотензію?
Відповідь обґрунтуйте.
6. Пацієнти з нефрозами інколи ма-
ють низькі рівні 17-гідроксикорти-
коїдів, проте в них не розвивають-
ся ознаки чи симптоми надниркової
недостатності. Поясніть чому?
7. Назвіть можливі причини синд-
рому Кушінґа. Яка тактика ліку-
вання у кожному випадку?
8. Які переваги та недоліки дов-
готривалого лікування високими
дозами глюкокортикоїдів таких
хвороб, як ревматоїдний артрит і
астма? Які проблеми виникають у
разі раптового припинення ліку-
вання стероїдами?
9. Після гіпофізектомії здатність до
відповіді кори надниркових залоз
на АКТГ зменшилась. Поясніть
причини цього і як можна відно-
вити норму?
10. Яким є сучасний погляд на меха-
нізм дії альдостерону?
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1 — 18 виберіть одну
відповідь.
У питаннях 1-6, що стосуються
рис. 20-А, виберіть літеру, яка позна-
чає частину стероїдосекретувальної
клітини і містить велику концент-
рацію речовини. Кожна позначена лі-
терою частина клітини може бути
вибрана один раз, декілька разів або
жодного разу.
708 / САМООЦІНКА НАВИКІВ
1. Холестеролестергідролаза.
2. АКТГ-рецептор мРНК.
3. АКТГ-рецептори.
4. З Р-Гі дроксистероїдодегідрогеназа.
5.СУР11В1.
6. ЛПНШ-рецептори.
7. Який з наведених ефектів виникає
лише внаслідок дії великої кіль-
кості глюкокортикоїдів?
(А) Нормальна здатність до від-
повіді жирових депо на нор-
адреналін.
(В) Підтримка нормальної судин-
ної реактивності.
(С) Збільшення екскреції у разі
навантаження водою.
(В) Гальмування запальної відпо-
віді.
(Е) Гальмування АКТГ секреції.
8. Які фрази хибно спаровані?
(А) Глюконеогенез : кортизол.
(В) Мобілізація вільних жирних
кислот : дегідроепіандросте-
рон.
(С) Глікогеноліз у м’язах : адрена-
лін.
(В) Калійурез : альдостерон.
(Е) Печінковий глікогенез : інсу-
лін.
9. Який з наведених гормонів має
найкоротший період півжиття?
(А) Кортикостерон.
(В) Ренін.
(С) Дегідроепіандростерон.
(В) Альдостерон.
(Е) Норадреналін.
10. Який з наведених гормонів має
найбільший ефект на екскрецію
№+ (в сенсі моль на моль)?
(А) Прогестерон.
(В) Кортизол.
(С) Вазопресин.
(В) Альдостерон.
(Е) Дегідроепіандростерон.
11. Який з наведених гормонів має
найбільший ефект на осмоляль-
ність плазми (в сенсі моль на
моль)?
(А) Прогестерон.
(В) Кортизол.
(С) Вазопресин.
(В) Альдостерон.
(Е) Дегідроепіандростерон.
12. Секреція якого з наведених гормо-
нів найменше впливає на зменшен-
ня об’єму позаклітинної рідини?
(А) КРГ.
(В) Аргініновий вазопресин.
(С) Дегідроепіандростерон.
(В) Естрогени.
Рис. 20-А. Клітина, що секретує стероїди (відтворено за дозволом з Еа\л/сей О\А/,
І_опд ЗА, Зопез АЬ: ТЬе иіігазїгисіиге ої епсіосгіпе діапсіз. Веселі Ргод Ногтопе Вез
1969;25:315).
(Е) Альдостерон.
13. У молодого чоловіка артеріальний
тиск 175/110 мм рт. ст. У нього в
крові виявлено високий рівень аль-
достерону і низький - кортизолу.
Лікування глюкокортикоїдами
знизило рівень альдостерону в
крові й артеріальний тиск до 140/
85 мм рт. ст. У нього, можливо,
анормальна
(А) 17а-гідроксилаза.
(В) 21 р-гідроксилаза.
(С) 3 р-гідроксистероїдодегідроге-
наза.
(В) альдостеронсинтаза.
(Е) холестеролдесмолаза.
14. У 32-річної жінки артеріальний
тиск 155/96 мм рт. ст. Під час опи-
тування виявлено, що вона любить
лакрицю і їсть її щонайменше
тричі на тиждень. Вона, можливо,
має низький рівень
(А) активності типу 2 11 Р-гідро-
ксистероїдод егі дрогенази.
(В) АКТГ.
(С) активності 11 р-гідроксилази.
(В) глюкуронилтрансферази.
(Е) норадреналіну.
У питаннях 15-18 позначте твер-
дження у кожному питанні літерою
пов ’язаної з ним стероїдної транс-
формації. Кожна позначена літерою
трансформація може бути викорис-
тана один раз, декілька разів або
жодного разу.
(А) Прогестерон —> кортикосте-
рон.
(В) Кортикостерон —> альдосте-
рон.
(С) 17-Гідроскипрегненолон —>
дегідроксиепіандростерон.
(В) 17-Гідроксипрогестерон -»
11 -деоксикортизол.
(Е) Холестерол —> прегненолон.
15. Первинний сайт дії АКТГ.
16. Блокована у разі вродженої недос-
татності 17а-гідроксилази.
17. Утворюється з 17-кетостероїдів.
18. Інгібована у разі вродженої недос-
татності 21-гідроксил ази.
РОЗДІЛ 21
У цьому розділі описані метаболізм
кальцію та фосфору, фізіологія кістко-
вої тканини, а також три гормони, що
є головними регуляторами метаболіз-
му кальцію після народження: 1,25-ди-
гідроксикальциферол, паратгормон та
кальцитонін. Тут також є короткий
огляд дії інших гормонів на метабо-
лізм кальцію. Після вивчення цього
розділу студент повинен уміти:
• описати поширення кальцію і фос-
фору в організмі та форми, в яких
вони є у плазмі;
САМООЦІНКА НАВИКІВ / 709
• назвати фактори, що впливають на
концентрацію Са2+ у плазмі та опи-
сати механізм дії кожного фактора;
• назвати типи клітин кісткової тка-
нини та описати їхні функції;
• описати утворення вітаміну О у
шкірі, його подальше гідроксилю-
вання у печінці та нирках і дію йо-
го активних метаболітів;
• назвати фактори, які впливають на
1 а-гідроксилазу, що утворює 1,25-
дигідроксикальциферол у нирках,
та описати їхню дію;
• описати біосинтез, дії та метабо-
лізм паратгормону;
• визначити джерело кальцитоніну,
його хімічну природу та його го-
ловні дії;
• перелічити ефекти глюкокортико-
їдів, гормону росту та факторів
росту на метаболізм Са2+.
ГОЛОВНІ ПИТАННЯ
І. Як можна визначити клітини, в
яких утворюється паратгормон та
кальцитонін?
2. Назвіть клітини в організмі, на які
діють 1,25-дигідроксикальцифе-
рол, паратгормон і кальцитонін та
опишіть дію цих гормонів на
клітини кожного типу.
3. Які впливи 1,25-дигідроксикаль-
циферолу на організм, окрім впли-
ву на Са2+, яке їхнє клінічне зна-
чення?
4. Як ростуть кістки? Що таке епіфі-
зарне замикання і як воно відбува-
ється?
5. Які ознаки та симптоми гіперпара-
тиреоїдизму і що сприяє їхній по-
яві?
6. Нанесіть на графік, що на рис. 21-
А, криву співвідношення між кон-
центраціями кальцитоніну та Са2+
у плазмі.
7. Дайте означення остеомаляції,
недосконалого кісткоутворення,
остеопетрозу та остеопорозу. Опи-
шіть причини і тактику лікування
остеопорозу.
8. З початком індустріальної револю-
ції у XIX ст. простежувалось знач-
не збільшення випадків хвороб
кісток, проте з часом ця кількість
зменшилась. Які хвороби кісток
стали частішими і чому? Чому
кількість випадків хвороб кісток у
XX ст. зменшилась?
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1—11 виберіть одну
відповідь.
1. У хворого з недостатністю парат-
гормону протягом 10 днів після не-
навмисного ураження паращито-
подібних залоз під час оператив-
ного втручання на щитоподібній
залозі можливий
(А) низький рівень фосфору і Са2+
у плазмі та тетанія.
(В) низький рівень фосфору і Са2+
у плазмі та тетанус.
(С) низький рівень Са2+ у плазмі,
збільшення збудливості м’язів
та характерний спазм м’язів
верхньої кінцівки (симптом
Труссо).
(Б) високий рівень фосфору і Са2+
у плазмі та демінералізація
кісток;
(Е) збільїпснння подразливості м’я-
зів, високий рівень Са2+ у плаз-
мі та демінералізація кісток.
2. Високий рівень Са2+ у плазмі спри-
чинює
(А) демінералізацію кістки.
(В) збільшене утворення 1,25-ди-
гідроксикальциферолу.
(С) зменшення секреції кальцито-
ніну.
(В) зменження здатності до зсі-
дання крові.
(Е) збільшене утворення 24,25-
дигідроксикальциферолу.
3. Який з наведених органів не бере
участі в регулюванні рівня Са2+ у
плазмі?
(А) Нирки.
(В) Шкіра.
(С) Печінка.
(В) Легені.
(Е) Кишка.
4. Який з наведених чинників най-
більше впливає на секрецію парат-
гормону?
(А) Концентрація фосфору у плаз-
мі.
(В) Кальцитонін.
(С) 1,25-Дигідроксикальциферол.
(В) Загальна концентрація каль-
цію у плазмі.
(Е) Концентрація Са2+ у плазмі.
5. 1,25-Дигідроксикальциферол впли-
ває на всмоктування Са2+ у кишці
завдяки механізму, що
(А) забезпечує зміну активування
генів.
______________________і_
2,5 3,8
Са* 2 * * * 6 7 8 9* у плазмі, ммоль/л
Рис. 21-А.
(В) активує аденілатциклазу.
(С) зменшує обертання клітин.
(В) змінює секрецію шлункового
соку.
(Е) подібний до дії поліпептидних
гормонів.
6. Що з наведеного може виявитись
у хворого, який перебував упро-
довж двох місяців на дієті з низь-
ким вмістом кальцію?
(А) Збільшене утворення 24,25-
дигідроксикальциферолу.
(В) Зменшення вмісту кальцій-
зв’язаних білків у інтестиналь-
них епітеліальних клітинах.
(С) Зменшення секреції паратгор-
мону.
(В) Висока концентрація кальци-
тоніну у плазмі.
(Е) Збільшення фосфору у плазмі.
7. Що з наведеного зумовить збіль-
шення рівня Са2+ у плазмі?
(А) Зменшення всмоктування Са2+
у кишці.
(В) Збільшення рівня білка у плаз-
мі.
(С) Високий рівень рН у плазмі.
(В) Деякі типи раку.
(Е) Важкі захворювання нирок.
8. У разі якого з наведених захворю-
вань часто збільшується паратгор-
мон плазми?
(А) Псевдогіпопаратиреоїдизм.
(В) Недостатність надниркових
залоз.
(С) Рак.
(В) Застійна серцева недостат-
ність.
(Е) Передчасне статеве дозріван-
ня.
9. У разі недосконалого кісткоутво-
рення є недостатність
(А) депонації фосфору у губчастій
кістці.
710 / САМООЦІНКА НАВИКІВ
(В) структури РТНгР.
(С) остеобластів.
(В) остеокластів.
(Е) колагену кістки.
11. ПТГ та РТНгР активують однакові
рецептори, однак їхні ефекти від-
мінні. Чому це можливе?
(А) 3 невідомої причини РТНгР
діє більше на тканини плоду,
тоді як ПТГ - на тканини до-
рослої людини.
(В) Рівень ПТГ у плазмі високий,
коли РТНгР низький, і навпа-
ки.
(С) ПТГ діє на головний мозок,
тоді як РТНгР не діє.
(В) Коли ПТГ зв’язується зі зви-
чайними рецепторами, він ак-
тивує аденілатциклазу, тоді як
РТНгР - фосфоліпазу С.
(Е) В організмі є додатковий ре-
цептор, який відповідає на
ПТГ, а не на РТНгР.
У питаннях 12 і 13 визначте, чи
величина, наведена у першому вислові,
є більшою (С), однаковою (8) або мен-
шою (ІД ніж величина, наведена у
другому.
12. Відсоток спожитого Са2’ абсорбу-
ється з кишки в особи, що дотри-
мується дієти з високим вмістом
кальцію.
С8Ь
Відсоток спожитого Са2+ абсорбу-
ється з кишки в особи, що дотри-
мується дієти з низьким вмістом
кальцію.
13. Випадки остеопорозу у чоловіків.
С8Ь
Випадки остеопорозу у жінок.
РОЗДІЛ 22
У цьому розділі описана морфоло-
гія гіпофіза, значення проопіомела-
нокортину та його перетворення,
функції проміжної частки гіпофіза,
гормон росту, соматомедини ІФР-І і
ІФР-ІІ та фізіологія росту. Після ви-
вчення цього розділу студент повинен
уміти:
• назвати гормони, що їх секретує
гіпофіз у людини, і описати голов-
ні функції кожного гормону;
• описати ембріогенез часток гіпо-
фіза та особливості структури у
дорослих;
• пояснити механізми, що відповіда-
ють за колір шкіри у різних біоло-
гічних видів, де такі зміни наявні,
і назвати гормони, що причетні до
цього;
• описати молекулу проопіомелано-
кортину та її перетворення у пе-
редній та проміжній частках гіпо-
фіза;
• описати структуру гормону росту
та перелічити його головні дії;
• описати стосунок ІФР-І і ІФР-ІІ до
дії гормону росту;
• назвати гіпоталамічні гіпофізо-
тропні гормони, що регулюють
секрецію гормону росту, і головні
подразники, які зумовлюють змен-
шення або збільшення секреції
гормону росту;
• описати рецептори гормону росту,
механізми функціювання та стосу-
нок до зв’язувального білка гор-
мону росту;
• назвати чинники, необхідні для
нормального росту, та описати
внесок кожного під час пре- та
постнатального розвитку;
• описати та пояснити головні про-
яви гіпофізарної недостатності,
акромегалії та синдрому Нельсо-
на.
ГОЛОВНІ ПИТАННЯ
1. Які ендокринні хвороби сприяють
зміні пігментації шкіри людей? Які
гормони задіяні?
2. Хоча у передній та проміжній
частках гіпофіза, нейронах голов-
ного мозку є однакові молекули
проопіомеланокортину, проте з
них у кожному місці утворюються
різні похідні. Чому утворюються
різні похідні з тієї ж самої молеку-
ли? Які процеси тут задіяні?
3. Чи збільшиться секреція гормону
росту внаслідок зменшення сек-
реції соматостатину або збільшен-
ня секреції СРГ-РГ?
4. Чому деструкція задньої частки гі-
пофіза спричинює усталену полі-
урію, тоді як деструкція всього гі-
пофіза спричинює транзиторну
поліурію?
5. Як харчування пов’язане з ростом?
6. Які ендокринологічні причини
зумовлюють нанізм і як кожна з
них приводить до низькорослості?
7. Як гормон росту людини пов’яза-
ний з хоріонічним соматотропіном?
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-8 виберіть одну
відповідь.
1. Які з наведених гормонів наймен-
ше впливають на ріст?
(А) Гормон росту.
(В) Тестостерон.
(С) т4.
(В) Інсулін.
(Е) Вазопресин.
2. Які фрази хибно спаровані?
(А) Проміжна частка : кортико-
тропіноподібний пептид про-
міжної частки.
(В) Гіпотиреоїдизм : низька кон-
центрація гормону росту у
плазмі.
(С) Гігантизм : збільшення секре-
ції гормону росту перед підліт-
ковим періодом.
(В) Африканські пігмеї : низький
вміст гормону росту у плазмі.
(Е) Акромегалія : висока концент-
рація ІФР-І.
З.Який з наведених гіпофізарних
гормонів є опіоїдним пептидом?
(А) а-Меланостимулювальний
гормон (а-МСГ).
(В) р-мсг.
(С) АКТГ.
(В) Гормон росту.
(Е) р-Ендорфін.
4. Який з наведених гормонів не
утворюється з а- і р-субодиниць?
(А) ТСГ
(В) ЛГ.
(С) ФСГ.
(В) ЬС8.
(Е) Пролактин.
5. Яка з наведених ознак не характер-
на для гіпопітуїтаризму?
(А) Кахексія.
(В) Неплідність.
(С) Блідість.
(В) Низький рівень основного об-
міну.
(Е) Непереносимість стресів.
6. Які з наведених речовин не син-
тезуються як в ендокринних зало-
зах, так і в головному мозку?
(А) Соматостатин.
(В) Кортизол.
(С) Дофамін.
(В) АКТГ.
САМООЦІНКА НАВИКІВ / 711
(Е) Окситоцин.
7. Науковець виявив, що інфузія гор-
мону росту у серединне підвищен-
ня гіпоталамуса експерименталь-
них тварин інгібує секрецію гор-
мону росту, і робить висновок, що
гормон росту зворотним зв’язком
гальмує секрецію СТР-РГ. Чи Ви
згідні з таким висновком?
(А) Ні, оскільки гормон росту не
проходить через гематоенце-
фалічний бар’єр.
(В) Ні, оскільки інфузія гормону
росту не стимулює секрецію
дофаміну.
(С) Ні, оскільки речовини з сере-
динного підвищення не транс-
портуються у передню частку
гіпофіза.
(В) Так, оскільки систематичне
введення гормону росту галь-
мує секрецію гормону росту.
(Е) Так, оскільки гормон росту
зв’язує СТР-РГ, інактивуючи
його.
8. Рецептор гормону росту
(А) активований 65.
(В) вимагає демінералізації для
здійснення своїх ефектів.
(С) повинен інтерналізуватись для
здійснення свого впливу.
(В) подібний на рецептор ІФР-І;
(Е) подібний на рецептор АКТГ.
У питаннях 9-12 позначне назву
синдрому у кожному питанні літерою
пов ’язаної з ним аномалії. Кожна по-
значена літерою аномалія може бути
використана один раз, декілька разів
або жодного разу.
(А) Вада гена фібробластного
фактору росту 3.
(В) Хронічне зловживання або
зневажання.
(С) Вада рецепторів гормону рос-
ту.
(В) Недостатність тиреоїдних гор-
монів.
(Е) Збільшення гонадних стеро-
їдів у крові.
9. Нанізм Ларона.
10. Кретинізм
11. Ахондроплазія.
12. Синдром Каспера Гаузера.
У питаннях 13—15 визначте, чи
величина, наведена у першому вислові,
є більшою (С), однаковою (8) або мен-
шою (Ь), ніж величина, наведена у
другому.
13. Рівень гормону росту у плазмі піс-
ля ЗО хв сну.
С8Ь
Рівень гормону росту у плазмі піс-
ля 8 год сну.
14. Інсулінова чутливість у разі гіпопі-
туітаризму.
С8Ь
Інсулінова чутливість у разі акро-
мегалії.
РОЗДІЛ 23
У цьому розділі описана фізіологія
репродуктивної системи у дорослих
чоловіків та жінок. Тут також є огляд
вагітності, лактації, статевої диферен-
ціації та розвитку в ембріональному
періоді, періоді статевого дозрівання
та менопаузи. Після вивчення цього
розділу студент повинен уміти:
• назвати важливі гормони, що сек-
ретують клітини Лейдіга та Сер-
толі яєчок, а також фолікулів Ґра-
афа та жовтого тіла яєчників;
• описати роль хромосом, гормонів
та споріднених факторів у статевій
диференціації та розвитку;
• назвати гормональні та інші зміни,
що відбуваються у чоловіків та жі-
нок;
• назвати гормональні та інші зміни,
що спостерігаються під час мено-
паузи;
• описати головні стимулятори та лі-
ки, які спричинюють секрецію
пролактину;
• назвати послідовність процесів у
сперматогенезі: від первинної за-
родкової клітини до зрілого рухо-
мого сперматозоїда;
• описати процеси, які відбуваються
під час регулювання секреції тес-
тостерону;
• описати зміни, що відбуваються у
яєчниках, матці, шийці матки,
піхві та молочних залозах під час
місячного циклу;
• знати загальну структуру 17р-
естрадіолу та прогестерону і опи-
сати їхній біосинтез, транспорту-
вання, метаболізм та дії;
• описати роль гіпофіза та гіпота-
ламуса у регулюванні функцію-
вання яєчників та значення зво-
ротного зв’язку у такому процесі;
• описати гормональні зміни, що
простежуються під час вагітності
та пологів;
• описати процеси, що відбуваються
під час розвитку молочих залоз,
утворення молока, виділення мо-
лока та закінчення лактації.
ГОЛОВНІ ПИТАННЯ
1. Як впливає на подальший стате-
вий розвиток плоду людини жіно-
чої статі внутрішньоутробний над-
лишок андрогенів?
2. Як впливає на подальший статевий
розвиток плоду людини чоловічої
статі неповноцінність ембріональ-
них яєчок?
3. Який вплив гіпофізектомії на мат-
ку? Які інші впливи можуть дава-
ти однакові результати?
4. Які фізіологічні зміни простежу-
ються у жінок під час статевих зно-
син?
5. Які функції акросоми?
6. Використовуючи осі на рис. 23-А,
позначте зміни ЛГ, ФСГ, естро-
гену, прогестерону та інгібінів А і
В у плазмі під час місячного циклу
жінки.
7. Що таке тестикулярний синдром
фемінізації і чим він спричинений?
8. Які свідчення вказують на те, що
початок періоду статевого дозрі-
вання регульований нервовою сис-
темою?
9. Використовуючи свої знання з фі-
зіології репродуктивної системи,
назвіть можливі способи контра-
цепції. Які з них найпоширеніші
серед населення? Прокоментуйте
позитивні та негативні наслідки
п’яти способів, які, на Ваш погляд,
найпоширеніші.
10. Опишіть вплив гормонів на появу
раку.
1 28
День місячного циклу
Рис. 23-А.
712 / САМООЦІНКА НАВИКІВ
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1—17 виберіть одну
відповідь.
Питання 1-5 стосуються рис. 23-В.
І.Які з наведених структур мають
більшу концентрацію ангіотензи-
ну, ніж плазма крові?
2. Які з наведених структур продуку-
ють найбільше андростендіону?
3. Які з наведених структур продуку-
ють естрадіол, що входить у фолі-
кулярну рідину?
4. Які з наведених структур містять
найменшу кількість ДНК на клі-
тину?
5. Які з наведених структур під час
клітинного поділу зупиняють до-
зрівання у профазі?
6. Якщо молода жінка має високий
рівень Т3, кортизону у плазмі і ак-
тивність реніну, однак її артері-
альний тиск лише трохи підвище-
ний і вона немає симптомів чи
ознак тиреотоксикозу або синдро-
му Кушінґа, найбільш ймовірно
пояснити її стан тим, що вона
(А) пройшла лікування ТСГ і АКТГ
(В) лікувалась Т3 і кортизоном.
(С) на третьому триместрі вагіт-
ності.
(В) має пухлину кори наднирко-
вих залоз.
(Е) має хронічний стрес.
7. Для повного розвитку і функцію-
вання сім’яних звивистих каналь-
ців потрібний
(А) соматостатин.
(В) ЛГ.
(С) окситоцин.
(В) ФСГ.
(Е) андрогени і ФСГ.
8. У людей запліднення, звичайно,
відбувається у
(А) піхві.
(В) шийці матки.
(С) порожнині матки.
(В) маткових трубах.
(Е) черевній порожнині.
9. У чоловіків тестостерон утворю-
ється найбільше у
(А) клітинах Лейдіґа.
(В) клітинах Сертолі.
(С) сім’яних звивистих канальцях.
(В) над’яєчку.
(Е) сім’явиносній протоці.
10. Тести для визначення у домашніх
умовах періоду запліднення у жін-
Рис. 23-В. Фолікул яєчника.
ки, аналізують один з гормонів у
сечі. Цим гормоном є
(А) ФСГ.
(В) Прогестерон.
(С) Естрадіол.
(В) ХГл.
(Е) ЛГ.
11. Період статевого дозрівання люди-
ни вважають анормальним, якщо
він починається з 8 років, оскіль-
ки в такому віці
(А) тканини не реагують на стеро-
їди, продуковані гонадами.
(В) яєчники та яєчка не реагують
на вплив гонадотропінів.
(С) гіпофіз не виробляє адекватну
кількість гонадотропінів.
(В) головний мозок секретує речо-
вину, яка інгібує відповідь го-
над на гонадотропіни.
(Е) гіпоталамус нездатний секре-
тувати ГнРГ у пульсаційному
режимі.
12. Клітини кастрації наявні у
(А) матці.
(В) простаті.
(С) плаценті.
(В) передньому гіпофізі.
(Е) гіпоталамусі.
13. Децидуальні клітини наявні у
(А) матці.
(В) простаті.
(С) плаценті.
(В) передньому гіпофізі.
(Е) гіпоталамусі.
14. Які з наведених речовин не є сте-
роїдами?
(А) 17 ос-Г і дроксипрогестерон.
(В) Естрон.
(С) Релаксин.
(В) Прегнонолон.
(Е) Етіохоланолон.
15. Яка з наведених ознак не належить
до вторинних чоловічих статевих
ознак?
(А) Борода.
(В) Збільшена поява акне.
(С) Грубий голос.
(В) Збільшені жирові відкладення
на сідницях.
(Е) Збільшений прутень.
16. Віагра (сілденефіл) спричинює
транзиторні труднощі з розрізнен-
ням кольорів тому, що
(А) розширює кровоносні судини
сітківки.
(В) звужує кровоносні судини сіт-
ківки.
(С) споріднені ізоформи гуанілат-
циклази є у сітківці та прутні.
(В) споріднені ізоформи фосфоді-
естерази є у сітківці та прутні.
(Е) сітківка і прутень розвивають-
ся з однакової ембріональної
структури.
17. Яка з наведених речовин не спри-
чинює початку пологів?
(А) АКТГ у ембріона.
(В) АКТГ матері.
(С) Простагландини.
(В) Окситоцин.
(Е) Плацентарний ренін.
У питаннях 18-22 визначте, чи ве-
личина, наведена у першому вислові,
є більшою (С), однаковою (8) або мен-
шою (Ь), ніж величина, наведена у
другому.
18. Розміри клітора у жінки з врод-
женою недостатністю 17а-гідро-
ксилази.
С8Е
Розміри клітора у жінки з врод-
женою недостатністю 21р-гідро-
ксилази.
19. Розміри клітора у жінки з врод-
женою недостатністю 11 р-гідро-
ксилази.
С8Ь
Розміри клітора у жінки з врод-
женою недостатністю 21р-гідро-
ксилази.
20. Концентрація ЛГ у 59-річного чо-
ловіка.
С8Ь
Концентрація ЛГ у 59-річної жін-
ки.
21. Утворення ХГл у першому три-
местрі вагітності.
С8Ь
Утворення ХГл у третьому три-
местрі вагітності.
САМООЦІНКА НАВИКІВ / 713
22. Утворення ЬС8 у першому три-
местрі вагітності.
С8Ь
Утворення ЬС8 у третьому три-
местрі вагітності.
РОЗДІЛ 24
У цьому розділі описані ренін та
еритропоетин - два з трьох гормонів,
що утворюються у нирці; А№, ВКР,
СКР - натрійуретичні пептиди, що
виділяються серцем, головним мозком
та іншими тканинами; мелатонін -
гормон епіфізу. Після вивчення цього
розділу студент повинен уміти:
• характеризувати каскад реакцій,
що призводять до виділення ангіо-
тензину II та його метаболітів у
кровообіг;
• описати юкстагломерулярний
апарат та назвати фактори, що
регулюють його секрецію;
• назвати функції ангіотензину II та
рецептори, на які він діє для реа-
лізації своїх функцій;
• описати місце та механізм дії ерит-
ропоетину і регулювання його сек-
реції зворотним зв’язком;
• описати структуру та функції АКР,
ВКР, СКР, а також рецептори, на
які вони впливають;
• зобразити схематично послідов-
ність утворення мелатоніну з се-
ротоніну у епіфізі, характеризу-
вати функції мелотоніну і описати
регулювання секреції мелатоніну.
ГОЛОВНІ ПИТАННЯ
1. Описати ренін-ангіотензинову
систему з погляду подібності та
відмінності її з калікреїновою
системою.
2. Чому у хворих з хронічною нир-
ковою недостатністю розвиваєть-
ся анемія? Яке лікування Ви приз-
начили б для них?
3. Використовуючи осі на рис. 24-А,
нанесіть криву взаємовідношення
між харчовим споживанням кухон-
ної солі і (1) активністю реніну
плазми, (2) концентрацією АКР у
плазмі і (3) концентрацією корти-
зону у плазмі.
І_
0 200
Споживання солі, мекв/добу
Рис. 24-А.
4. Опишіть взаємозв’язок ренін-ан-
гіотензинової системи з клінічною
гіпертензією. Як пояснити змен-
шення артеріального тиску інгібі-
торами ангіотензиноперетворю-
вального ензиму у хворих з гіпер-
тензією, хоча активність реніну
плазми у нормі або низька?
5. Схарактеризуйте гіпертензію
Ґольдблатта, синдром Барттера і
вторинний гіперальдостеронізм.
6. На рис. 24-В зображено дві криві:
одна - у середовищі без, а друга -
з 10 6М-лозартаном. Ідентифікуй-
те криві, поясність їхню форму та
горизонтальне зміщення однієї
відносно іншої. Як пояснити на
підставі графіків тип ангіотензи-
нових рецепторів, що забезпечу-
ють регулювання альдостеронової
секреції?
7. Опишіть концепцію кліренсних
рецепторів стосовно АКР і спорід-
нених поліпептидів.
8. Секреція мелатоніну велика вночі
і мала вдень. Як епіфіз “ знає”, коли
є день чи ніч?
Рис. 24-В. Секреція альдостерону адре-
нокортикальною тканиною іп уііго.
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-8 виберіть одну
відповідь.
1. Ренін секретований
(А) клітинами щільної плями.
(В) клітинами проксимальних ка-
нальців.
(С) клітинами дистальних каналь-
ців.
(В) юкстагломерулярними кліти-
нами.
(Е) навколосудинними клітинами.
2. Еритропоетин секретований
(А) клітинами щільної плями.
(В) клітинами проксимальних ка-
нальців.
(С) клітинами дистальних каналь-
ців.
(В) юкстагломерулярними кліти-
нами.
(Е) навколосудинними клітинами.
3. Секреція мелатоніну ймовірно не
збільшиться у разі
(А) стимулювання верхнього ший-
ного вузла.
(В) внутрішньовенного введення
триптофану.
(С) внутрішньовенного введення
адреналіну.
(В) стимулювання зорового нерва.
(Е) уведення в епіфіз гідроксиін-
дол-О-метилтрансферази.
4. Якщо жінці, яка дотримується ма-
лосольової дієти упродовж 8 днів,
увести внутрішньовенно капто-
пріл, препарат, що інгібує ангіо-
тензиноперетворювальний ензим,
то можна очікувати, що
(А) її артеріальний тиск підви-
щиться, оскільки серцевий ви-
кид зменшиться.
(В) її артеріальний тиск підви-
щиться, оскільки периферійна
резистентність судин змен-
шиться.
(С) її артеріальний тиск знизиться,
оскільки серцевий викид змен-
шиться.
(В) її артеріальний тиск знизиться,
оскільки периферійна резис-
тентність судин зменшиться.
(Е) активність реніну плазми
зменшиться, оскільки рівень
ангіотензину І у плазмі, мож-
ливо, підвищиться.
5. Який з наведених чинників є від-
повідальним за збільшення сек-
реції А№ серцем?
714 / САМООЦІНКА НАВИКІВ
(А) Пролактин.
(В) Гормон росту.
(С) Еритропоетин.
(В) Звуження висхідної аорти.
(Е) Звуження нижньої порожнис-
тої вени.
6. Який з наведених чинників не є
відповідальним за збільшення сек-
реції реніну?
(А) Уведення ліків, що блокують
ангіотензиноперетворюваль-
ний ензим.
(В) Уведення препаратів, що бло-
кують АТ]-рецептори.
(С) Уведення препаратів, що бло-
кують р-адренорецептори;
(В) Звуження аорти між черевною
та нирковими артеріями.
(Е) Уведення препарату, що змен-
шує об’єм ПКР.
7. Активування рецепторів до АКР
збільшує у клітинах-мішенях
(А) цАМФ.
(В) ІФ3.
(С) активність протеїнкінази А.
(В) активність гуанілатциклази.
(Е) ГТФ.
8. Еритропоетин
(А) містить цинк.
(В) містить залізо.
(С) є важливим лігандом для залі-
за у тканинах.
(В ) стимулює секрецію реніну.
(Е) впливає на частину стовбуро-
вих клітин у кістковому мозку,
однак не на всі.
У питаннях 9-15 позначне тверд-
ження у кожному питанні літерою
пов ’язаного з ним гормону. Кожен по-
значений літерою гормон може бути
використаний один раз, декілька разів
або жодного разу
(А) Тироксин.
(В) Еритропоетин.
(С) Вазопресин.
(В) Мелатонін.
(Е) Альдостерон.
9. Збільшення у разі ін’єкції АКТГ.
10. Головний у регулюванні об’єму
позаклітинної рідини.
11. Головний у регулюванні осмоляль-
ності позаклітинної рідини.
12. Прогормон.
13. Головний у регулюванні рівня ме-
таболізму.
12. Індол.
13. Впливає на порушення метаболіз-
му заліза.
РОЗДІЛ 25
Цей розділ стосується травлення та
абсорбції, а в Розділі 26 детально роз-
глянуті інші функційні можливості
шлунково-кишкового тракту та пов’я-
заних з ним залоз. Після вивчення цьо-
го розділу студент повинен уміти:
• характеризувати головні травні
ензими, їхні попередники та суб-
стракти, а також продукти впливу
ензимів;
• описати щіточкову облямівку, не-
рухомий шар і глікокалікс;
• описати процеси перетворення
харчових вуглеводів у глюкозу та
інші гексози у кишці;
• характеризувати процеси абсорб-
ції гексоз з кишки у кров’яне рус-
ло;
• описати перетворення харчових
білків у амінокислоти та малі пеп-
тиди з кишки у кров’яне русло;
• характеризувати послідовність
процесів, що відбуваються під час
всмоктування жирів;
• описати процеси абсорбції жир-
них кислот та інших ліпідів у кро-
в’яне русло;
• назвати процеси, що регулюють
всмоктування з шлунково-киш-
кового тракту води, №+, К+, НСО ,
Са2+ і заліза.
ГОЛОВНІ ПИТАННЯ
1. Багато дорослих європейців, які
походять не з півночі чи заходу,
мають абдомінальну симтоматику
після уживання молока. Чим вона
спричинена, які симптоми і яке
можливе лікування?
2. Що таке вторинне активне транс-
портування і чому воно важливе
для шлунково-кишкового тракту?
Чому назва “вторинне” правиль-
ніша, ніж “первинне активне
транспортування”?
3. Після приймання їжі у просвіті
шлунку та кишки містяться висо-
коактивні протеолітичні ензими.
Чому ці ензими не перетравлють
підшлункову залозу, яка продукує
їх, або стінку кишки?
4. Інтестинальне всмоктування каль-
цію та заліза регулюється зворот-
ним зв’язком, однак різними меха-
нізмами. Порівняйте та зіставте ці
механізми.
5. Опишіть М-клітини? Які їхні
функції?
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-12 виберіть одну
відповідь.
1. Шлях з інтестинального просвіту
у кров’яне русло для коротколан-
цюгових жирних кислот (менше
10 атомів карбону) такий:
(А) інтестинальні мукоцити хі-
ломікрони —> лімфатична су-
дина венозна кров системи
кровообігу.
(В) інтестинальні мукоцити —>
кров портальної вени печінки
—» венозна кров системи кро-
вообігу.
(С) простір між мукоцитами
лімфатична судина —> венозна
кров системи кровообігу.
(В) простір між мукоцитами —>
хіломікрони —> лімфатична
судина —> венозна кров сис-
теми кровообігу.
(Е) інтестинальні мукоцити
НЩЛ кров портальної вени
печінки венозна кров сис-
теми кровообігу.
2. Максимальну абсорбцію коротко-
ланцюгових жирних кислот забез-
печують бактерії у
(А) шлунку.
(В) дванадцятипалій кишці.
(С) голодній кишці.
(В) клубовій кишці.
(Е) ободовій кишці.
3. Вода всмоктується у голодній, клу-
бовій та ободовій кишці і виво-
диться з каловими масами. Пра-
вильний порядок кількісного
всмоктування води від найбіль-
шого до найменшого такий:
(А) ободова, голодна, клубова
кишки, калові маси.
(В) калові маси, ободова, клубова,
голодна кишки.
(С) голодна, клубова, ободова
кишки, калові маси.
(В)ободова, клубова, голодна
кишки, калові маси.
(Е) калові маси, клубова, голодна,
ободова кишки.
4. Лікарські препарати та токсини,
які збільшують вміст цАМФ у сли-
САМООЦІНКА НАВИКІВ / 715
зовій кишки, спричинюють діа-
рею, оскільки
(А) збільшують котранспортуван-
ня №'-К' у тонкій кишці.
(В) збільшують секрецію К+ у обо-
довій кишці.
(С) гальмують абсорбцію К у
криптах Ліберкюна.
(В) збільшують абсорбцію На* у
тонкій кишці.
(Е) збільшують секрецію СІ у
просвіт кишки.
5. Які фрази хибно спаровані?
(А) Панкреатична сх-амілаза :
крохмаль.
(В) Еластаза : тканини, багаті на
еласіин.
(С) Ентеропегпидаза : поліпепти-
ди.
(В) Ренін : коагуляція молока.
(Е) Лінгвальна ліпаза : травлення
в шлунку.
6. Всмоктування кальцію збільшу-
ється у разі
(А) і іпсркальціємії.
(В) споживання оксалатів у харчо-
вих продуктах.
(С) надлишку заліза.
(В) 1,25-дигідроксихолекальци-
феролу.
(Е) збільшення абсорбції Иа+.
У питаннях 7—12 виберіть
А, якщо вислів пов’язаний з (а);
В, якщо вислів пов’язаний з (Ь);
С, якщо вислів пов’язаний з (а) і
(Ь);
В, якщо вислів не пов’язаний ні з
(а), ні з (Ь).
(а) Абсорбція глюкози.
(Ь) Абсорбція амінокислот.
7. К4 плазми.
8. N3* у кишковому просвіті.
9. Інсулін плазми.
10. Флоридзин.
11. Трипсин у інтестинальному про-
світі.
12. Феритин у слизовій кишки.
РОЗДІЛ 26
Цей розділ стосується функцій
шлунково-кишкового тракту, включно
зі слинними залозами, печінкою, під-
шлунковою залозою, їхньої участі у
травленні та абсорбції їжі. Після ви-
вчення цього розділу студент повинен
уміти:
• описати структуру та функції енте-
ричної нервової системи;
• характеризувати базальний елект-
ричний ритм та міграційний мо-
торний комплекс, описати їхні
функції у регулюванні шлунково-
кишкової моторики;
• назвати головні шлунково-кишкові
гормони, місця, де вони секрету-
ються, і головні фізіологічні функ-
ції кожного з цих гормонів;
• характеризувати функції ротової
порожнини, слинних залоз та стра-
воходу;
• знати функційну анатомію і гісто-
логію шлунка;
• описати, як секретують кислоту
клітини слизової шлунка;
• описати механізми регулювання
секреції та моторики шлунка;
• характеризувати співвідношення
між ціанокоболаміном та внутріш-
нім фактором;
• назвати головні компоненти під-
шлункового соку і характеризува-
ти механізми, які регулюють його
секрецію;
• описати функційну анатомію пе-
чінки та механізм утворення жов-
чі;
• описати функції жовчного міхура
і процеси, що регулюють пасаж
жовчі в інтестинальний просвіт;
• назвати типи рухової активності у
тонкій кишці та функційне призна-
чення кожного;
• описати послідовність процесів у
ободовій кишці, що спричинюють
дефекацію, та характеризувати
вплив нервової системи на цей ре-
флекс.
ГОЛОВНІ ПИТАННЯ
1. Які чинники регулюють секрецію
екзокринної частини підшлунковбї
залози?
2. Опишіть аномалії шлункової сек-
реції у разі хворобливих станів.
3. Які аномалії може спричинити ре-
зекція термінальної частини клу-
бової кишки?
4. Що таке печія? Опишіть її пато-
генез та шляхи можливого ліку-
вання.
5. Що спричинює утворення жовчних
каменів? Як це можна лікувати?
6. Складні оперативні втручання ре-
комендують для лікування вираже-
ного ожиріння, коли інші методи
лікування неефективні. Які опера-
тивні втручання застосовують? Як
вони спричиняють втраті маси?
Які можливі довготривалі
ускладнення?
7. Бактерії у ободовій кишці перебу-
вають у симбіозі з організмом лю-
дини. Яку користь вони дають ор-
ганізму? Які шкідливі чи потенцій-
но шкідливі ефекти вони можуть
зумовити?
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-25 виберіть одну
відповідь.
Питання 1-4 стосуються рис. 26-А.
1. Які з позначених структур містять
мальтазу?
2. Які з позначених структур стосу-
ються інтегрування перистальти-
ки?
3. Які з позначених структур мають
клітини, що найшвидше зміню-
ються?
4. Які з позначених структур містять
клітинні тільця хеморецепторів?
Питання 5-8 стосуються табл.
2 6-А.
5. Які результати обстежень харак-
терні для хворого з жовчним каме-
нем, що спричинює обструкцію
загальної жовчної протоки?
6. Які результати обстежень харак-
терні для хворого з внутрішньо-
судинним гемолізом?
Рис. 26-А. Поперечний зріз тонкої кишки
(відтворено за дозволом з ВеІІ (ЗН,
ЕтзІіе-ВтИІз □, Раіегзоп СП: ТехФоок
ої Рйузіоіоду апсі Віосїіетізігу, 9Ф есі.
СНигсґііІІ Ьмпдзїопе, 1976).
716/САМООЦІНКА НАВІИ КІВ
Таблиця 26-А.
Варіант Білірубін плазми Лужна фосфатаза плазми Гематокрит Жовчні кислоти плазми
прямий непрямий
А - - - - і
В т тт - - -
с тт т т - т
0 т тт - -
Е т тт т - т
Позначення' — без змін; Т - збільшення; ?Т - значне збільшення; .-зменшення.
7. Які результати обстежень харак-
терні для хворого з інфекційним
гепатитом?
8. Які результати обстежень харак-
терні для хворого з резекцією клу-
бової кишки?
9. Виведення назовні ободової киш-
ки може спричинити
(А) смерть.
(В) мегалобластичну анемію.
(С) виражену недостатність хар-
чування.
(В) збільшення вмісту аміаку у
крові хворих на цироз печінки.
(Е) зменшення уробіліногену сечі.
10. У новонароджених дефекація час-
то настає після споживання їжі. У
цих випадках причиною скорочень
ободової кишки є
(А) гастроілеальний рефлекс.
(В) збільшення рівня ХЦК у крові.
(С) шлунково-кишковий рефлекс.
(В) збільшення рівня соматоста-
тину.
(Е) ентерогастральний рефлекс.
11. Після споживання їжі, багатої на
вуглеводи, секрецію інсуліну мо-
же стимулювати
(А) ОЬР-1 (7-36) амід.
(В) ХЦК.
(С) серотонін.
(В) ВІП.
(Е) гастрин.
12. Симптоми демпінг-синдрому (дис-
комфорт після споживання їжі у
хворих з коротким кишковим анас-
томозом з голодної кишки у шлу-
нок) спричинені частково
(А) підвищенням артеріального
тиску.
(В) збільшенням секреції глюка-
гону.
(С) збільшенням секреції ХЦК.
(В) гіпоглікемією.
(Е) гіперглікемією.
13. У якому з секретів простежується
найбільше значення рН?
(А) Шлунковий сік.
(В) Міхурова жовч.
(С) Підшлунковий сік.
(В) Слина.
(Е) Секрети кишкових залоз.
14. Повна гепатектомія могла б спри-
чинити збільшення в крові
(А) глюкози.
(В) фібриногену.
(С) 25-гідроксихолекальциферолу.
(В) кон’югованого білірубіну.
(Е) естрогенів.
15. Який з станів не спричинений то-
тальною панкреатотомією?
(А) Дефіцит вітаміну Е.
(В) Гіперглікемія.
(С) Метаболічний ацидоз.
(В) Надлишок маси.
(Е) Зменшене всмоктування амі-
нокислот.
Численні різноманітні аномальні
стани спричинюють діарею. У пи-
таннях 16—20 порушення, що спричи-
нюють діарею, позначте у кожному
питанні літерою пов ’язаної з ним
аномалії. Кожна позначена літерою
аномалія може бути використана
один раз, декілька разів або жодного
разу.
(А) Збільшення цАМФ у ентеро-
цитах.
(В) Збільшення секреції шлунко-
вої кислоти.
(С) Збільшення жовчних кислот у
ободовій кишці.
(В) Порушення складу інтести-
нального муцину.
(Е) Аномальне травлення вуглево-
дів.
16. Виразковий коліт.
17. Оперативні втручання з обхідним
анастомозом клубової кишки.
18. Певні штами Е.соїі.
19. Дефіцит лактази.
20. Синдром Золлінґера-Еллінсона.
У питаннях 21-25 позначне вислів
у кожному питанні літерою пов ’яза-
ної з ним структури шлунково-киш-
кового тракту. Кожна позначена лі-
терою структура може бути вико-
ристана один раз, декілька разів або
жодного разу.
(А) Шлунок.
(В) Дванадцятипала кишка.
(С) Голодна кишка.
(В) Клубова кишка.
(Е) Ободова кишка.
21. Місце абсорбції вітаміну В12.
22. Головне місце реалізації впливу
гастрину.
23. Місце дії альдостерону.
24. Місце частого запалення у хворих
з диверкулітами.
25. Місце найвищого рівня БЕР.
РОЗДІЛ 27
Цей розділ стосується функцій кро-
ві та лімфи, а також складових елемен-
тів крові: лейкоцитів, еритроцитів і
тромбоцитів. Також описана імунна
система. Після вивчення цього розділу
студент повинен уміти:
• характеризувати клітини різного
типу, що є у крові, та їхні клітини-
попередники;
• описати функції нейтрофільних
лейкоцитів;
• описати функції моноцитів;
• описати головні складові імунної
системи людини, включно з кліти-
нами, шо беруть участь у вродже-
ному та набутому імунітеті, а та-
кож механізми їхнього формуван-
ня;
• описати структури та функції
тромбоцитів та механізм вивіль-
нення їхніх гранул.
• знати функції еритроцитів;
• назвати головні групи крові та опи-
сати методики їхнього визначення;
• описати системи зсідання і про-
тизсідання крові та їхнє клінічне
значення.
ГОЛОВНІ ПИТАННЯ
1. Порівняйте і зіставте складові
плазми крові та лімфи.
САМООЦІНКА НАВИКІВ / 717
2. Який механізм пристосування
утворення лейкоцитів, тромбоци-
тів та еритроцитів до різних функ-
ційних станів організму? Назвіть
гуморальні фактори, залучені до
цих процесів.
3. Опишіть клітинні макрофаги, їхнє
походження і як вони забезпечу-
ють захист організму.
4. Що таке теорія клональної селек-
ції утворення антитіл? Які головні
положення цієї теорії?
5. Які функції клітин-убивць? Як від-
різнити ці клітини від СО4 і СО8
лімфоцитів?
6. Унаслідок мутації генів утворю-
ються аномальні гемоглобіни у
людей. Що свідчйть про те, чи му-
тація гемоглобіну є шкідливою або
ні для організму?
7. Чому зсідання крові аномальне у
хворих з недостатністю вітаміну
К?
У питаннях 1—17 виберіть одну
відповідь.
У питаннях 1-5 позначне імуногло-
булін у кожному питанні літерою по-
в ’язаної з ним характеристики. Кож-
на позначена літерою характеристи-
ка може бути використана один раз,
декілька разів або жодного разу.
(А) Фіксація комплементу.
(В) Секреторний імунітет.
(С) Вивільнення гістаміну з базо-
фільних лейкоцитів і мастоци-
тів.
(Б) Тетрамер.
(Е) Розпізнавання антигену В-клі-
тинами.
1. І&А.
2. Ш
3. І§Е.
4.
5. І§М.
Питання 6-9 стосуються рис. 27-А.
6. Який можливий результат у разі
неправильного вибору і змішуван-
ня донорських еритроцитів з плаз-
мою реципієнта?
7. Який можливий результат, якщо
плазму особи з групою крові III (В)
змішати з еритроцитами особи з
групою крові І (О)?
8. Який можливий результат, якщо
плазму особи з групою крові І (О)
змішати з еритроцитами особи з
групою крові III (В)?
9. У якому випадку може бути най-
вищий рівень гемоглобіну у плаз-
мі?
Рис. 27-А. Еритроцити у плазмі.
10. Яка з наведених функцій не є го-
ловною для плазми крові?
(А) Транспортування гормонів.
(В) Підтримка розмірів еритроци-
тів.
(С) Транспортування хіломікро-
нів.
(В) Транспортування антитіл.
(Е) Транспортування О2.
11. Гематокрит 41% означає, що в
одиниці об’єму крові
(А) 41% гемоглобіну є у плазмі.
(В) 41% від загального об’єму
крові становить плазма крові.
(С)41% від загального об’єму
крові становлять еритроцити,
лейкоцити і тромбоцити.
(В) 41% гемоглобіну міститься у
еритроцитах.
(Е) 41% елементів крові станов-
лять еритроцити.
12. У нормі в крові людини
(А) еозинофіли є найпоширені-
шим типом лейкоцитів.
(В) лімфоцитів більше, ніж ней-
трофільних лейкоцитів.
(С) заліза найбільше у гемоглобіні.
(В) лейкоцитів більше, ніж ери-
троцитів.
(Е) тромбоцитів більше, ніж ери-
троцитів.
13. Лімфоцити
(А) після народження утворюють-
ся у кістковому мозку.
(В) не відповідають на дію гормо-
нів.
(С) перетворюються у моноцити
під дією антигенів.
(В) взаємодіють з еозинофільни-
ми лейкоцитами для утворен-
ня тромбоцитів.
(Е) є складовою системи проти-
пухлинного захисту.
14. Утворення клітин, тип яких пока-
заний на рис. 27-В, збільшується
під дією
(А) інтерлейкіну-2.
(В) колонієстимулювального фак-
тора гранулоцитів.
(С) еритропоетину.
(В) інтерлейкіну-4.
(Е) інтерлейкіну-5.
15. На рис.27-В показано клітину, яка
не містить
(А) актину.
(В) вільних радикалів.
(С) мієлопероксидази.
(В) катепсинів.
(Е) ¥-хромосоми.
16. У якій з наведених хвороб струк-
тура гемоглобіну, що утворюється,
нормальна, однак кількість змен-
шена?
(А) Хронічна втрата крові.
(В) Серпоподібноклітинна анемія.
(С) Гемолітична анемія.
(В) Таласемія.
(Е) Трансфузійні ускладнення.
17. Який з наведених білків плазми не
синтезується у печінці?
(А) Ангіотензин.
(В) ІФР-1.
(С) Ангіотензин ІІ-перетворю-
вальний ензим.
(В) а2-Макроглобулін.
(Е) Фібриноген.
У питаннях 18-20 визначте, чи ве-
личина, наведена у першому вислові,
є більшою (С), однаковою (8) або мен-
шою (ІД ніж величина, наведена у
другому.
18. Кількість легких ланцюгів у голов-
ній молекулі імуноглобуліну.
С8Ь
Кількість важких ланцюгів у го-
ловній молекулі імуноглобуліну.
19. Відсоток загальної осмоляльності
плазми залежить від альбуміну, що
циркулює у крові.
С8Ь
Відсоток загальної осмоляльності
плазми залежить від натрій хлори-
ду, що циркулює у крові.
Рис. 27-В.
718 / САМООЦІНКА НАВИКІВ
20. Кількість СО4 глікопротеїну на
поверхні клітин Т-хелперів.
С 8 Ь
Кількість СО4 глікопротеїну на по-
верхні цитотоксичних Т-клітин.
РОЗДІЛ 28
У цьому розділі описано провідну
систему серця, виникнення і поши-
рення імпульсів, які задають частоту
серцевих скорочень серця, від СА-вуз-
ла через АВ-вузол, пучок Гіса і волок-
на Пуркіньє до всіх частин шлуночків.
Також описана ЕКГ, деякі її аномалії і
серцеві аритмії. Після вивчення цьо-
го розділу студент повинен уміти:
• описати структуру та функціюван-
ня провідної системи серця і по-
рівняти потенціали дії у кожній її
частині з такими ж у серцевому
м’язі;
• описати спосіб записування ЕКГ,
інтерпретувати зубці та інтервали
в ЕКГ; знати взаємозв’язок ЕКГ з
електричною віссю серця;
• назвати найпоширеніші серцеві
аритмії й описати процеси, що їх
спричинюють;
• знати, як і коли виконувати масаж
серця;
• характеризувати головні ранні та
пізні ознаки на ЕКГ інфаркту міо-
карда і пояснити ранні біоелект-
ричні зміни в міокарді в термінах
йонних процесів;
• описати та пояснити зміни на ЕКГ
та зміни функціювання серця, які
виникають у разі порушення йон-
ного складу крові.
ГОЛОВНІ ПИТАННЯ
1. Що таке синусова аритмія? Чому
вона утворюється? Яке клінічне
значення появи синусової аритмії?
2. Що таке ектопічні вогнища збуд-
ження? Яке їхнє значення в пато-
генезі розвитку аритмій?
3. Назвіть і поясніть вплив на серце
лікарських препаратів блокаторів
повільних Са2+-каналів. Для яких
клінічних станів вони є ефектив-
ними?
4. Порівняйте та зіставте синдроми
Вольфа-Паркінсона-Уайта і Лау-
на-Ґанонґа-Левіне. Що є підґрун-
тям розвитку цих порушень, унас-
лідок чого виникають такі стани?
5. Чому зупиняється серце у фазі сис-
толи внаслідок гіперкальціємії
(кальцієвий ріґор)?
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-8 виберіть одну від-
повідь.
Питання 1-4 стосуються рис. 28-А.
1. Яка з позначок на ЕКГ стосується
шлуночкової реполяризації?
2. Яка з позначок стосується зубця
9?
3. Яка з позначок стосується частини
ЕКГ, що відображає максимальне
відкриття № -каналів у шлуноч-
ках?
4. Яка з позначок стосується частини
ЕКГ, що відображає максимальне
відкриття Са2+-каналів?
5. Для якої з наведених структур ха-
рактерний у нормі найбільший
передпотенціал?
(А) Синоатріальний вузол.
(В) Атріовентрикулярний вузол.
(С) Пучок Гіса.
(В) Волокна Пуркіньє.
(Е) М’язові волокна шлуночків.
6. У разі блокади серця другого сту-
пеня
(А) частота скорочень шлуночків
менша, ніж передсердь.
(В) шлуночкові комплекси на ЕКГ
деформовані.
(С) часто простежується шлуноч-
кова тахікардія.
(В) ударний об’єм зменшений.
(Е) хвилинний об’єм крові збіль-
шений.
7. Масаж каротидного вузла інколи
х припиняє надшлуночкову тахікар-
дію, оскільки
(А) зменшується симпатична ім-
пульсація у СА-вузлі.
(В) збільшується вагусна імпуль-
сація у СА-вузлі.
(С) збільшується вагусна імпуль-
сація у провідній тканині між
передсердями і шлуночками.
(В) збільшується симпатична ім-
пульсація у провідній тканині
між передсердями і шлуночка-
ми.
(Е) збільшується рефрактерний
період у міокарді шлуночків.
8. По яких каналах, що відкривають-
ся, протікають струми, відпові-
дальні за фазу реполяризації у по-
тенціалі дії м’язових волокон шлу-
ночків?
(А) Иа+.
(В) СІ .
(С) Са2+.
(В) к+.
(Е) НСО3 .
У питаннях 9-11 одна або більше
відповідей правильні. Виберіть
(А), якщо (1), (2), (3) правильні;
(В), якщо (1) і (3) правильні;
(С), якщо (2) і (4) правильні;
(В), якщо лише (4) правильна;
(Е), якщо всі правильні.
9. У разі повної блокади серця
(1) недостатність може просте-
жуватися, оскільки передсердя
не здатні нагнітати кров до
шлуночків.
(2) звичайно є фібриляція шлу-
ночків.
(3) частота скорочення перед-
сердь менша від частоти ско-
рочення шлуночків.
(4) недостатність може просте-
жуватися внаслідок пролонго-
ваних періодів, під час яких
шлуночки не здатні скорочу-
ватись.
10. Повторний вхід є поширеною при-
чиною
(1) пароксизмальної передсердної
тахікардії.
(2) пароксизмальної вузлової та-
хікардії.
(3) фібриляції передсердь.
(4) синусової аритмії.
11. У пацієнта з синдромом довгого
інтервалу РТ можна спостерігати
(1) мутації у функціюванні
каналів серця.
САМООЦІНКА НАВИКІВ / 719
(2) анормальну ендолімфу у се-
редньому вусі.
(3) мутації втрати функціювання
К -каналів серця.
(4) анормальне котранспортуван-
ня №* *-Са2+.
У питаннях 12-15 визначте, чи ве-
личина, наведена у першому вислові,
є більшою (С), однаковою (8) або мен-
шою (Ь), ніж величина, наведена у
другому.
12. Висота зубця Т, якщо рівень К+
дорівнює 5,5 мекв/л.
С8Ь
Висота зубця Т, якщо рівень К+
дорівнює 8,5 мекв/л.
13. Висота зубця К у відведенні V] на
ЕКГ в дорослих у нормі.
С8Ь
Висота зубця В. у відведенні У5 на
ЕКГ в дорослих у нормі.
14. Інтервал між початком скорочень
передсердь і наступним нормаль-
ним скороченням.
С8 Ь
Інтервал між початком скорочень
шлуночків і наступним нормаль-
ним скороченням.
15. Нахил передпотенціалу у СА-вузлі
після стимулювання блукаючого
нерва.
С8Ь
Нахил передпотенціалу у СА-вузлі
після стимулювання симпатичних
нервів, що проходять до серця.
РОЗДІЛ 29
У цьому розділі описані механічні
зміни, що відбуваються під час сер-
цевого циклу, коли серце нагнітає кров
у систему кровообігу. Також описані
тони й шуми серця; методи вимірю-
вання та регулювання хвилинного
об’єму. Після вивчення цього розділу
студент повинен уміти:
• описати послідовність подій, що
відбуваються у серці під час серце-
вого циклу;
• назвати зміни тривалості систоли
і діастоли внаслідок зміни частоти
серцевих скорочень і описати їхнє
фізіологічне значення;
• характеризувати артеріальний
пульс і пульс у яремних венах;
• описати та пояснити походження
першого та другого серцевих то-
нів, а також уловлюваних третього
та четвертого тонів серця.
• сформулювати причини появи шу-
мів у разі стенозу аортального чи
митрального отвору, недостатнос-
ті аортального чи митрального
клапана;
• назвати фактори, що впливають на
хвилинний об’єм і описати вплив
кожного.
• назвати фактори, що впливають на
споживання кисню серцем.
ГОЛОВНІ ПИТАННЯ
І.Які методи вимірювання викорис-
товуються для визначеня хвилин-
ного об’єму крові? Які переваги та
недоліки кожного методу?
2. Для відновлення іннервації серця
у пацієнтів з трансплантованим
серцем потрібно декілька місяців.
Однак у таких пацієнтів до віднов-
лення іннервації серця фізичне
навантаження збільшує хвилин-
ний об’єм крові. Який механізм
сприяє цьому і як він реалізується?
3. Поясніть постекстрасистолічне
потенціювання.
4. Що таке фракція викидання? У
яких станах вона збільшується або
зменшується? Чому?
5. Використовуючи осі на рис. 29-А,
нанесіть криву залежності хвилин-
ного об’єму серця від частоти сер-
цевих скорочень. Графік поясніть.
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-15 виберіть одну
відповідь.
Частота серцевих скорочень
Рис. 29-А.
Питання 1-5 стосуються рис. 29-
В. Виберіть літеру на рисунку, яка
означає:
1. Ударний об’єм.
2. Місце, де відкривається аорталь-
ний клапан.
3. Місце, де закривається аортальний
клапан.
4. Місце, де відкривається митраль-
ний клапан.
5. Місце, де закривається аортальний
клапан.
6. Другий тон серця спричинений
(А) закриттям аортальних та леге-
невих клапанів.
(В) вібруванням стінок шлуночків
під час систоли.
(С) наповненням шлуночків.
(Л) закриттям митрального та
тристулкового клапанів.
(Е) ретроградним плином до по-
рожнистої вени.
7. Четвертий тон серця спричинений
(А) закриттям аортального та ле-
геневих клапанів.
(В) вібруванням стінок шлуночків
під час систоли.
(С) наповненням шлуночків.
(Л) закриттям митрального та три-
стулкового клапанів.
(Е) ретроградним плином до по-
рожнистої вени.
8. Дикротичний підйом на кривій
тиску в аорті спричинений
(А) закриттям митрального кла-
пана.
(В) закриттям тристулкового кла-
пана.
(С) закриттям аортального клапа-
на.
(Л) закриттям легеневих клапанів.
(Е) швидким наповненням лівого
шлуночка.
Об’єм, мл
Рис. 29-В. Крива співвідношення між
тиском і об’ємом у лівому шлуночку.
720 / САМООЦІНКА НАВИКІВ
9. Під час навантаження людина спо-
живає 1,8 л кисню за хвилину; вміст
О2 у артеріальній крові 190 мл/л, у ве-
нозній - 134 мл /л. Хвилинний об’єм
крові у цьому випадку становить
(А) 3,2 л/хв.
(В) 16 л/хв.
(С) 32 л/хв.
(В) 54 л/хв.
(Е) 160 мл/хв.
10. Робота, яку виконує лівий шлу-
ночок, є більшою від роботи, яку
виконує правий, оскільки лівий
шлуночок
(А) скорочується повільніше.
(В) має товстіші стінки.
(С) має більший ударний об’єм.
(В) має більше переднавантаження.
(Е) має більше післянавантаження.
11. Закон Старлінґа для серця
(А) не справджується у разі сер-
цевої недостатності.
(В) не справджується у разі наван-
таження;
(С) пояснює збільшення серцевих
скорочень у разі навантаження.
(В) пояснює збільшення хвилин-
ного об’єму, що простежуєть-
ся у разі збільшення венозного
повернення крові.
(Е) пояснює збільшення хвилин-
ного об’єму внаслідок стиму-
лювання симпатичних нервів,
що іннервують серце.
У питаннях 12-15 позначте пору-
шення, що виникають, літерою пов ’я-
заної з ними хвороби. Кожна позна-
чена літерою хвороба може бути ви-
користана один раз, декілька разів
або жодного разу.
(А) Стеноз аортального отвору.
(В) Недостатність аортального
клапана.
(С) Стеноз митрального отвору.
(В) Відкрита артеріальна протока.
(Е) Легенева гіпертензія.
12. Колапсувальний пульс Корріґана.
13. Голосний різкий другий тон серця.
14. Виражений діастолічний шум над
верхівкою серця.
15. Збільшення перфузії вінцевих ар-
терій.
РОЗДІЛ зо
У цьому розділі описані особли-
вості будови кровоносних та лімфа-
тичних судин і рух рідин по них. Тут
висвітлені питання функційної ана-
томії судин, засади і сили, які створю-
ють тиск і плин по них, а також фак-
тори, що впливають на транскапіляр-
ний обмін. Після вивчення цього роз-
ділу студент повинен уміти:
• описати діаметр, товщину стінки
і загальну площу поперечного пе-
рерізу аорти, дрібних артерій, ар-
теріол, капілярів, венул та вен;
• описати зв’язок між плином, тис-
ком та опором у судинній системі;
• дати означення ламінарній течії і
критичного тиску закриття;
• навести формулу Пуазейля-Хаґе-
на пре течію у кровоносних суди-
нах і на її підставі пояснити, чому
діаметр судини є таким важливим
для визначення течії;
• сформулювати закон Лапласа і на-
вести три приклади його дії в ор-
ганізмі людини;
• детально описати методи вимірю-
вання кров’яного тиску аускуль-
тативним і пальпаторним мето-
дом;
• описати сили Старлінґа, які визна-
чають кінцевий рух рідини через
капілярну стінку. Дати означення
обмінам, що залежать від плину і
дифузії; описати різновиди капі-
лярної проникності й особливості
структури у різних частинах орга-
нізму людини.
ГОЛОВНІ ПИТАННЯ
1. Що таке ефект Віндкесселя? Чому
аорта і великі артерії називають
судинами Віндкесселя? Яке фізіо-
логічне значення ефекту Віндкес-
селя?
2. Що таке принцип Бернуллі? Опи-
шіть його значення для серцево-
судинної фізіології.
3. У молодого чоловіка кров’яний
тиск 130/73 мм рт. ст. Який у нього
пульсовий та середній тиск? Як
обчислити кожен з цих тисків?
4. Тиск у великій артерії становить
60 000 дин/см2; радіус артерії -
0,5 см. Яке напруження стінки
артерії? Яке буде напруження стін-
ки, якщо діаметр 1 см?
5. Що таке звуки Короткова і як вони
утворюються?
6. У яких частинах серцево-судинної
системи турбулентна течія у нор-
мі? Які фактори змінюють ліній-
ний плин на турбулентний?
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-12 виберіть одну
відповідь.
Питання 1-4 стосуються табл.
30-А.
В експериментальної тварини під
анестезією денервовано одну задню
кінцівку і прикріплено до приладів
так, що можна вимірювати тиск на
артеріальному та венозному кінцях ка-
пілярів кінцівки, її масу, кровоплин,
артеріовенозну кисневу різницю. Тва-
рині вводили різні речовини. Резуль-
тати досліджень наведені у табл. 30-А.
1. Який варіант змін простежується,
якщо ввести речовину, що спри-
чинює артеріальну дилатацію?
2. Який варіант змін простежується,
якщо ввести речовину, що спричи-
нює збільшення капілярної про-
никності?
3. Який варіант змін простежується,
якщо ввести речовину, що спричи-
нює констрикцію вен?
4. Який варіант змін простежується,
якщо ввести речовину, що спри-
чинює зменшення системного кро-
в’яного тиску?
5. У яких з наведених судин найбіль-
ша загальна площа поперечного
перерізу?
(А) Артеріях.
(В) Артеріолах.
(С) Капілярах.
(Л) Венулах.
(Е) Венах.
6. Течія лімфи від ніг
(А) збільшиться, якщо особа пере-
ходить від горизонтального до
вертикального положення.
(В) збільшиться під час масажу
ніг.
(С) збільшиться, якщо капілярна
проникність зменшиться;
(Л) зменшиться, якщо клапани у
венах ніг є слабкими (непов-
ноцінними);
(Е) зменшиться під час фізичного
навантаження.
7. Тиск у капілярах скелетних м’язів
становить 35 мм рт. ст. на артеріо-
лярному кінці і 14 мм рт. ст. - на
венулярному. Інтерстиційний тиск
- 0 мм рт. ст. Колоїдний осмотич-
САМООЦІНКА НАВИКІВ / 721
Таблиця 30-А.
Варіант Тиск на кінці капіляра Маса кінцівки Кровоплин у кінцівці Артеріовенозна киснева різниця
артеріальному венозному
А - - т - -
В - т - г -
С і і - ; т
0 ? т і
Е т т т і -
Позначення: — без змін; Т - збільшення; >1 - зменшення.
ний тиск - 25 мм рт. ст. Сила, що
забезпечує рух рідини через капі-
лярну стінку у артеріолярному кін-
ці становить
(А) 3 мм рт. ст. зовні капіляра.
(В) 3 мм рт. ст. усередині капіляра.
(С) 10 мм рт. ст. зовні капіляра.
(В) 11 мм рт. ст. зовні капіляра.
(Е) 11 мм рт. ст. усередині капіляра.
8. Яке з наведених явищ не відбува-
ється, якщо кров проходить через
капіляри великого кола кровообі-
гу?
(А) Гематокрит збільшується.
(В) Крива дисоціації гемоглобіну
зміщується ліворуч.
(С) Збільшується вміст білків.
(В) рН зменшується.
(Е) Еритроцити збільшуються у
розмірах.
9. Швидкість плину крові
(А) більша у капілярах, ніж у арте-
ріолах.
(В) більша у венах, ніж у венулах.
(С) більша у венах, ніж в артеріях.
(В) зменшується до нуля у низхід-
ній аорті під час діастоли.
(Е) зменшується у звуженій ділян-
ці кровоносної судини.
10. Якщо радіус судин опору збільшу-
ється, то який з наведених показ-
ників збільшується?
(А) Систолічний тиск крові.
(В) Діастолічний тиск крові.
(С) В’язкість крові.
(В) Гематокрит.
(Е) Кровоплин у капілярах.
11. Який з наведених показників збіль-
шується, якщо збільшується в’яз-
кість крові?
(А) Середній кров’яний тиск.
(В) Радіус судин опору.
(С) Радіус ємнісних судин.
(В) Центральний венозний тиск.
(Е) Кровоплин у капілярах.
12. Фармакологи винайшли лікарсь-
кий препарат, який стимулює утво-
рення УЕСР-рецепторів. Такий
препарат буде корисним для ліку-
вання
(А) хвороб вінцевих артерій.
(В) раку.
(С) цукрового діабету.
(В) нецукрового діабету.
(Е) дисменореї.
У питаннях 13-16 яка з позначе-
них на рис. 30-А структур
13. є місцем внутрішнього видимого
ураження атеросклерозом?
14. є зменшеного розміру у разі наяв-
ності ангіотензину II?
15. є відповідальною за підтримку кро-
воплину під час діастоли?
16. відповідає на стрес зрізання через
залучення рецепторів розтягнен-
ня?
У питаннях 17-18 визначте, чи ве-
личина, наведена у першому вислові,
є більшою (С), однаковою (8) або мен-
шою (Ь), ніж величина, наведена у
другому.
17. Гідростатичний тиск у венулах на
рівні серця.
С8Ь
Гідростатичний тиск у венах на
рівні серця.
Рис. 30-А. Поперечний переріз малої
артерії.
18. Проникність капілярів у легенях.
С8Ь
Проникність капілярів у печінці.
РОЗДІЛ 31
У цьому розділі описана взаємодія
місцевих, гуморальних, системних
нервових регуляторних механізмів
підтримки артеріального тиску та кро-
воплину у різних органах у спокої та
під час дії різних подразників. Після
вивчення цього розділу студент пови-
нен уміти:
• характеризувати значення меха-
нізмів авторегулювання, описати
теорії, що пояснюють їхню реалі-
зацію та значення для фізіології;
• назвати важливі вазодилататорні
метаболіти та описати їхню роль
у регулюванні перфузії тканин;
• назвати головні фактори вазодила-
тації, що їх секретують ендотелі-
альні клітини, і описати функції
кожного;
• назвати головні гормони, що впли-
вають на артеріальний тиск, і знати
фізіологічне значення кожного;
• перелічити нервові механізми, що
контролюють артеріальний тиск і
частоту серцевих скорочень, у то-
му числі рецептори, аферентні та
еферентні шляхи, центральні інте-
гративні шляхи й еферентні меха-
нізми регулювання;
• описати прямі ефекти СО2 і гіпо-
ксії на вазомоторну ділянку у дов-
гастому мозку, утворення й аб-
сорбцію спинномозкової рідини та
пояснити її функції.
ГОЛОВНІ ПИТАННЯ
1. Чому збільшення симпатичної ак-
тивності спричинює збільшення
тиску в правому передсерді?
2. Як впливають внутрішньовенні
ін’єкції вазодилататора нітропру-
сиду на інтервал КК на ЕКГ? Яка
тривалість впливу?
3. Порівняйте функції каротидних та
аортальних барорецепторів з функ-
ціями барорецепторів у перед-
сердях та великих венах.
4. Які гормони впливають на частоту
серцевих скорочень?
47 367-2
722 / САМООЦІНКА НАВИКІВ
5. Які пептиди є у нервах, що іннер-
вують кровоносні судини? Які
функції цих пептидів?
6. Які ефекти спричинює денервація
барорецепторів?
7. Фармаколог уводить лікарський
препарат собаці і реєструє швидке
збільшення середнього артеріаль-
ного тиску. Назвіть можливі меха-
нізми збільшення тиску і серії екс-
периментів, які могли б пояснити
механізми впливу цього препарату.
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-10 виберіть одну
відповідь.
1. Які фрази хибно спаровані?
(А) Ангіотензин П-перетворюваль-
ний ензим : метаболізм кінінів.
(В) Стимулювання блукаючого
нерва на шиї: брадикардія.
(С) Простациклін : вазодилатація.
(В) Збільшецня тиску у сонних па-
зухах : зменшення симпатич-
ної імпульсації до артеріол.
(Е) Збільшення Н2 у тканинах : ва-
зоконстрикція у тканинах.
2. Якщо феохромоцитома (пухлина
кори надниркових залоз) раптово
вивільнює велику кількість адре-
наліну у кровообіг, то у пацієнта
частота серцевих скорочень буде
(А) збільшуватись, оскільки збіль-
шення артеріального тиску
стимулює каротидні й аор-
тальні барорецептори.
(В) збільшуватись, оскільки адре-
налін дає прямий хронотроп-
ний вплив на серце.
(С) збільшуватись, оскільки збіль-
шена тонічна парасимпатична
імпульсація до серця.
(В) зменшуватись, оскільки збіль-
шення артеріального тиску
стимулюватиме каротидні й
аортальні хеморецептори.
(Е) зменшуватись, оскільки збіль-
шена тонічна парасимпатична
імпульсація до серця.
3. Секреція вазопресину збільшена
тому, що
(А) збільшений тиск у правому
шлуночку.
(В) зменшений тиск у правому
шлуночку.
(С) збільшений тиск у правому
передсерді.
(В) зменшений тиск у правому
передсерді.
(Е) збільшений тиск в аорті.
4. Катехоламіни, впливаючи на ос-ад-
ренорецептори,
(А) збільшують скоротливість сер-
цевого м’яза.
(В) збільшують частоту імпульса-
цій у синоатріальному вузлі.
(С) збільшують хвилинний об’єм.
(В) звужують вінцеві судини внас-
лідок прямої дії на них.
(Е) розширюють кровоносні суди-
ни у скелетних м’язах.
5. Який з наведених лікарських пре-
паратів підвищує артеріальний
тиск?
(А) Простациклін.
(В) Ліки, що інгібують ангіотен-
зин ІІ-перетворювальний ен-
зим.
(С) Ліки, що інгібують МО-синта-
зу:
(В) ЛІКИ, ЩО Інгібують У]-рЄЦЄП-
тори вазопресину.
(Е) Ліки, що інгібують ендотелін-
перетворювальний ензим.
Багато вазоактивних речовин, що
їх утворюють ендотеліальні клітини,
утворювані також іншими клітина-
ми і виконують різноманітні функції
у інших частинах організму. У питан-
нях 6-10 виберіть
А, якщо відповідь пов’язана з (а);
В, якщо відповідь пов’язана з (Ь);
С, якщо відповідь пов’язана з (а) і
(Ь);
В, якщо відповідь не пов’язана ні
з (а), ні з (Ь).
(а) Ендотелій-1.
(Ь) N0.
6. Головний мозок.
7. Кишка.
8. Нирки.
9. Легені.
10. Клітини імунної системи.
У питаннях 11-16 позначте вазо-
активні сполуки літерою пов ’язаного
з нею механізму дії. Кожен позначений
літерою механізм дії може бути ви-
користаний один раз, декілька разів
або жодного разу.
(А) Активування гуанілатциклази.
(В) Активування протеїнкінази А.
(С) Активування фбсфоліпази С.
(В) Активування протеїнкінази А2.
(Е) Активування тирозинкінази.
11. Ангіотензин II.
12. Ендотелій 1.
13. Оксид азоту.
14. Брадикінін.
15. ВІП.
16. Речовина Р.
17. Які з наведених вище (11-16) ва-
зоактивних сполук спричинюють
вазоконстрикцію іп уіуо?
18. Які з наведених вище (11-16) ва-
зоактивних сполук спричинюють
вазодилатацію іп уіуо?
РОЗДІЛ 32
У цьому розділі описані особливос-
ті кровообігу головного мозку і роль
гематоенцефалічного бар’єру, крово-
обігу у вінцевих судинах, внутрішніх
органах, включно з печінкою, шкірі,
плаценті та плоді. Після вивчення цьо-
го розділу студент повинен уміти:
• назвати зміни показників крово-
плину на одиницю маси, особли-
вості кровоплину у більшості ор-
ганів;
• характеризувати макро- та мікро-
скопічні особливості церебраль-
ного кровообігу;
• описати утворення й абсорбцію
спинномозкової рідини та пояс-
нити її функції;
• характеризувати гематоенцефаліч-
ний бар’єр і пояснити його клініч-
не значення;
• описати навколошлуночкові ор-
гани і назвати їхні головні функції;
• характеризувати анатомічні особ-
ливості вінцевого кровообігу;
• назвати хімічні та нервові факто-
ри, що впливають на регулювання
вінцевого кровообігу, і описати
роль кожного з них;
• назвати унікальні особливості кро-
вообігу печінки та внутрішніх ор-
ганів і пояснити резервуарну функ-
цію кровообігу у внутрішніх орга-
нах;
• описати трикомпонентну відпо-
відь шкіри на ушкодження і пояс-
нити значення кожного компонен-
та;
• пояснити значення плаценти як
“легень плоду”;
• описати кровообіг плоду перед на-
родженням і зміни після народ-
ження.
САМООЦІНКА НАВИКІВ / 723
ГОЛОВНІ ПИТАННЯ
І.Що таке аксон-рефлекс? У яких
випадках він відбувається? Який
нейротрансмітер, ймовірно, вико-
ристовуваний?
2. Що таке реактивна гіперемія? Де
вона можлива?
3. Що таке нейрогемальний орган?
Що є головним нейрогемальним
органом в організмі?
4. Як можна використовувати ПЕГ і
функційний ЯМР для вивчення
метаболізму і кровоплину в орга-
нізмі і які ліки впливають на них?
5. Опишіть використання радіоізото-
пів для вивчення вінцевого крово-
обігу.
6. Що таке доктрина Монро-Келлі і
яка її фізіологічна послідовність?
7. Що таке печінковий ацинус? Чому
важлива ацинарна організація кро-
обігу у печінці та яке значення в
патогенезі захворювань?
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-13 виберіть одну
відповідь.
Питання 1-5 стосуються рис. 32-А.
1. Яка з позначених структур є голов-
ною для видалення гіпоталаміч-
них гормонів з головного мозку?
2. Яка з позначених структур є голов-
ною для впливу вазопресину на
зменшення хвилинного об’єму
крові?
3. Яка з позначених структур є хемо-
рецепторною зоною, пусковою
для блювання?
4. Яка з позначених структур є голов-
ною для альтерації секреції вазо-
пресину внаслідок зміни осмо-
ляльності плазми?
5. Яка з позначених структур є голов-
ним місцем впливу ангіотензину II
для збільшення споживання води?
6. У якій з наведених судин у нормі є
НИЗЬКИЙ РО2?
(А) Артерія матері.
(В) Маткова вена матері.
(С) Стегнова вена матері.
(В) Пупкова артерія.
(Е) Пупкова вена.
7. Різниця тисків між серцем і аор-
тою є найменшою у
(А) лівому шлуночку під час сис-
толи.
Рис. 32-А. Сагітальний вигляд головного
мозку.
(В) лівому шлуночку під час діас-
толи.
(С) правому шлуночку під час сис-
толи.
(В) правому шлуночку під час ді-
астоли.
(Е) лівому передсерді під час сис-
толи.
8. Ін’єктування активатора плазмі-
ногену тканинного типу може бути
найкориснішим
(А) через рік у разі виздоровлення
без ускладнень після оклюзії
вінцевої судини.
(В) через два місяці після відпо-
чинку та відновлення після
оклюзії вінцевої судини.
(С) на другий тиждень після ок-
люзії вінцевої судини.
(В) на другий день після оклюзії
вінцевої судини.
(Е) через дві години після оклюзії
вінцевої судини.
9. Який з наведених органів має най-
більший кровоплин на 100 г маси
тканини?
(А) Головний мозок.
(В) Серцевий м’яз.
(С) Шкіра.
(В) Печінка.
(Е) Нирки.
10. Який з наведених органів має най-
проникніші капіляри?
(А) Головний мозок.
(В) Задній гіпофіз.
(С) Печінка.
(В) Тонка кишка.
(Е) Нирки.
11. Що з наведеного не спричинює
дилатації артеріол у шкірі?
(А) Підвищена температура тіла.
(В) Адреналін.
(С) Брадикінін.
(В) Речовина Р.
(Е) Вазопресин.
12. Хлопчик потрапив у лікарню з су-
домами. Під час обстежень вияв-
лено, що температура тіла і рівень
глюкози у плазмі у нормі, однак рі-
вень глюкози у спинномозковій рі-
дині - 12 мг/дл (у нормі 65 мг/дл).
Можливим поясненням такого ста-
ну є
(А) конституційне активування
6ПІТ 3 у нейронах.
(В) недостатність 8СгГТ 1 у астро-
цитах.
(С) недостатність 6ГПТ 5 у це-
ребральних капілярах.
(В) недостатність ОПІТ 1 55К у
церебральних капілярах.
(Е) недостатність ОЕІІТ 1 у мік-
роглії.
13. Яка з наведених речовин буде ко-
рисною у разі введення у перші 2-
3 год після початку ішемічного ін-
сульту?
(А) Проінсулін.
(В) Трансфузія крові.
(С) Антагоністи гліцинових ре-
цепторів.
(В) Ліки р-адреноблокатори.
(Е) ГРА.
У питаннях 14-16 визначте, чи ве-
личина, наведена у першому вислові,
є більшою (С), однаковою (8) або мен-
шою (ІД ніж величина, наведена у
другому.
14. Кількість активно транспортова-
ної води у спинномозкову рідину.
С8Ь
Кількість активно транспортова-
ної води зі спинномозкової рідини.
15. Кровоплин в ендокардіальній час-
тині міокарда під час систоли.
С8Ь
Кровоплин в епікардіальній час-
тині міокарда під час систоли.
16. Кількість крові, що надходить у
печінку через печінкову артерію.
С8Ь
Кількість крові, що надходить у пе-
чінку через портальну артерію.
РОЗДІЛ 33
У цьому розділі описані адаптації
системи, що відбуваються у разі зміни
724 / САМООЦІНКА НАВИКІВ
положення, під час фізичного наван-
таження, космічного польоту. Опи-
сано також зміни кровообігу у разі за-
палення, шоку, зокрема синкопе. Роз-
глянуто гіпертензію, серцеву недос-
татність та серцево-судинні компенса-
торні механізми. Після вивчення цьо-
го розділу студент повинен уміти:
• назвати компенсаторні механізми,
які забезпечують підвищення арте-
ріального тиску у разі зміни поло-
ження тіла (з лежачого стану до
стоячого);
• описати впливи позитивного та не-
гативного гравітаційного приско-
рення § на організм людини;
• описати та пояснити зміни у кро-
вообігу, що настають під час фі-
зичного навантаження;
• характеризувати позитивну роль
атлетичних тренувань на серцево-
судинну систему та інші системи
організму;
• дати означення шоку, назвати го-
ловні його причини та описати
аномалії, спричинені кожним ти-
пом шоку. Схарактеризувати не-
гайні та довготривалі компенса-
торні реакції, що відбуваються,
для кожного типу;
• описати найпоширеніші причини
непритомності;
• назвати найпоширеніші причини
високого артеріального тиску у
людей і розділити їх на виліковні
й невиліковні;
• назвати головні симптоми серце-
вої недостатності й описати, як ко-
жен з них виникає.
ГОЛОВНІ ПИТАННЯ
1. Порівняйте склад крові, що відті-
кає від скелетних м’язів після на-
вантаження й у спокої та поясніть
відмінності.
2. Які спільні та відмінні ознаки між
гіповолемічним шоком та шоком
низького опору?
3. Що таке рефрактерний шок? Як
можна попередити його розвиток?
4. Які фізіологічні переваги та недо-
ліки лікування шоку наданням хво-
рому положення з дещо піднятими
ногами?
5. Чому деякі особи втрачають сві-
домість під час швидкої зміни по-
ложення тіла (з лежачого до сидя-
чого)?
6. “Гіпертензія - це синдром, а не
хвороба”. Обговоріть цей вислів та
його суть.
7. Назвіть п’ять методів моделюван-
ня хронічної гіпертензії в експери-
ментальних тварин. Як збільшу-
ється артеріальний тиск у кожному
випадку?
8. Чому життєва ємність зменшу-
ється у разі серцевої недостатнос-
ті? Як впливає положення тіла на
таке зменшення?
9. Чому інгібітори антіотензинопе-
ретворювального ензиму корисні
для лікування застійної серцевої
недостатності?
10. У 55-річного чоловіка, що важить
71 кг, з’явилось відчуття втоми піс-
ля відносно невеликого напружен-
ня. Під час лікарського огляду у
нього виявлено помірний інтен-
сивний базальний систолічний
шум. Під час серцевої катетери-
зації зареєстровано такі показни-
ки:
Частота серцевих скорочень -
64 удари/хв.
Вентиляція - 4, 98 л/хв.
Поглинання О2 - 246 мл/хв.
Легеневий артеріальний О2 -
137 мл О2/л крові.
Легеневий венозний О2 -
189 мл О2/л крові.
Тиск у правому шлуночку -
27/2 мм рт. ст.
Тиск у лівому шлуночку -
169/0 мм рт. ст.
Тиск в аорті - 108/72 мм рт. ст.
Який у цього чоловіка хвилинний
об’єм крові? Який ударний об’єм?
Який найвірогідніший діагноз?
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1—12 виберіть одну
відповідь.
Кожен з пацієнтів, які описані у пи-
таннях 1-5, має артеріальний тиск
85/40 мм рт. ст. Позначте стан ор-
ганізму у кожному питанні літерою
пов ’язаного з ним негайного лікування.
Кожне позначене літерою лікування
може бути використане один раз, де-
кілька разів або жодного разу.
Питання 1-5 стосуються рис. З 2-А.
(А) Ін’єкція дофаміну.
(В) Інфузія концентрованого аль-
буміну людини.
(С) Інфузія ізотонічного розчину
солі.
(Б) Ін’єкція адреналіну.
(Е) Інфузія крові в цілому.
1. Дівчину вжалила бджола.
2. У чоловіка кровотеча внаслідок
колотого (різаного) поранення.
3. У жінки опікове ураження 35% по-
верхні тіла внаслідок порання на
кухні.
4. Жінка через 24 години після ін-
фаркту міокарда.
5. Чоловік з тяжким проносом.
6. Активність реніну у плазмі нижча
норми у разі
(А) застійної серцевої недостат-
ності.
(В) геморагічного шоку.
(С) септичного шоку (інфікування
грам-негативними бактерія-
ми).
(Б) есенціальної гіпертензії.
(Е) спокійного стояння.
7. Який з наведених чинників най-
менш відповідальний за підтверд-
ження гіпертензії?
(А) Хронічно збільшена секреція
надниркових залоз.
(В) Хронічно збільшена секреція
пучкової і сітчастої зон кори
надниркових залоз.
(С) Хронічно збільшена секреція
клубочкової зони кори наднир-
кових залоз.
(В) Хронічно збільшена секреція
заднього гіпофіза.
(Е) Хронічне уживання оральних
контрацептивних засобів.
9. Що з наведеного не збільшується
під час ізотонічного навантаження?
(А) Частота дихання.
(В) Ударний об’єм.
(С) Частота серцевих скорочень.
(В) Загальний периферійний опір.
(Е) Систолічний тиск крові.
10. Які фрази хибно спаровані?
(А) Втрата крові : гіпотензія.
(В) Негативне §: втрата свідомос-
ті.
(С) Збільшення хвилинного об’є-
му крові: фізичне навантажен-
ня.
(В) Констрикція ниркової артерії
: збільшення артеріального
тиску.
(Е) Зменшення загального пери-
ферійного опору : втрата сві-
домості.
11. Який з наведених параметрів змен-
шиться в нормальної особи, яка
САМООЦІНКА НАВИКІВ / 725
спокійно стоїть в одному положен-
ні упродовж години?
(А) Гематокрит.
(В) Діаметр стегна.
(С) Активність реніну плазми.
(В) Концентрація вазопресину
плазми.
(Е) Центральний венозний тиск.
12. Який з наведених чинників най-
менше спричинює втрату свідо-
мості?
(А) Тиск на сонну пазуху.
(В) Пароксизмальна фібриляція
передсердь.
(С) Автономна недостатність.
(В) Виражені емоції.
(Е) Інфаркт міокарда.
У питаннях 13—15 визначте, чи ве-
личина, наведена у першому вислові,
є більшою (С), однаковою (8) або мен-
шою (ІД ніж величина, наведена у
другому.
13. Кількість №-кВ у клітинному ядрі
після інфузії адреналіну.
С8Ь
Кількість МГ-кВ у клітинному ядрі
після інфузії кортизону.
14. Загальний кровоплин до головно-
го мозку під час фізичного наван-
таження.
С8Ь
Загальний кровоплин до головно-
го мозку під час відпочинку.
15. Кровоплин до нирок під час фізич-
ного навантаження.
С8Ь
Кровоплин до нирок під час відпо-
чинку.
РОЗДІЛ 34
У цьому розділі описані функції
дихальної системи, а також властивос-
ті газів і механізми, якими легені і
грудна клітка забезпечують вдихання,
видихання та газообмін у легенях; сха-
рактеризовано особливості легенево-
го кровообігу, захисні механізми та ме-
таболічні функції легень. Після ви-
вчення цього розділу студент повинен
уміти:
• дати означення парціального тис-
ку і обчислити парціальний тиск
для кожного з важливих газів по-
вітря на рівні моря;
• нарисувати графік змін у внутріш-
ньолегеневому та внутрішньо-
плевральному тисках та легеневих
об’ємах, що відбуваються під час
вдихання та видихання;
• назвати головні дихальні м’язи і
схарактеризувати роль кожного;
• описати дихальний об’єм, резервні
об’єми вдихання та видихання,
залишковий об’єм і дати наближе-
ні значення кожного для дорослої
людини у нормі;
• дати означення еластичності й на-
вести приклади хворіб, у разі яких
вона є анормальною;
• описати хімічний склад та функції
сурфактанту;
• назвати фактори, які визначають
альвеолярну вентиляцію;
• характеризувати дифузійну єм-
ність; порівняти дифузію О2 і СО2
у легенях;
• порівняти легеневий і системний
кровообіг, назвати головні відмін-
ності між ними;
• описати метаболічні функції легень.
ГОЛОВНІ ПИТАННЯ
1. Прокоментувати закон Лапласа в
сенсі функціювання легень.
2. Як відбувається кровоплин у поло-
женні стоячи на верхівці легень
порівняно з базальними відділа-
ми? Як це пов’язано з вентиля-
цією? Поясніть відмінності.
3. Що таке гістерезисна петля? Наве-
діть приклад з фізіології дихання і
поясніть, чому вона виникає.
4. Які функції епітеліальних клітин
та легеневих макрофагів?
5. Яка відмінність між анатомічним
та фізіологічним мертвим просто-
ром? Яку роль вони відіграють у
разі хвороб легень?
6. Які чинники впливають на дифу-
зійну ємність легень щодо О2?
7. Чому РО2 крові в аорті дещо мен-
ший, ніж Ро у крові легеневих вен?
8. Які складові роботи, що викону-
ється під час дихання? Опишіть
нормальні та патологічні стани, які
спричиняють зміни окремих скла-
дових?
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1—10 виберіть одну
відповідь.
1. На вершині гори Еревест, де баро-
метричний тиск 250 мм рт. ст., пар-
ціальний тиск О2 близький до
(А) 0,1 мм рт. ст.
(В) 0,5 мм рт. ст.
(С) 5 мм рт. ст.
* (В) 50 мм рт. ст.
(Е) 100 мм рт. ст.
2. Приблизний об’єм газу, що вихо-
дить з легень жінки в нормі після
максимального форсованого види-
хання, становить
(А) 0 л.
(В) 0,1 л.
ДС) 1,1 л.
(В) 3,1 л.
(Е) 4,2 л.
3. Дихальний об’єм чоловіка в нормі
у спокої становить
* (А) 0,5 л.
(В) 1,2 л/
(С) 2,5 л.
(В) 4,9 л.
(Е) 6, 0 л.
4. Який мертвий простір чоловіка
масою 70 кг у нормі, який дихає
через трубку радіусом 5 мм і дов-
жиною 100 см?
(А) 150 мл.
(В) 180 мл.
- (С) 230 мл.
(В) 280 мл.
(Е) 350 мл.
5. Яке транспортування з наведених
відповідає за рух О2 з альвеол у
кров легеневих капілярів?
(А) Активне транспортування.
(В) Фільтрування.
(С) Вторинне активне транспор-
тування.
(В) Полегшена дифузія.
« (Е) Пасивна дифузія.
Питання 6-8 стосуються рис. 34-А.
6. Яка з наведених кривих характер-
на для особи у нормі? р,
7. Яка з наведених кривих характер-
на для хворого з вираженим леге-
невим фіброзом? С
8. Яка з наведених кривих характер-
на для хворого з прогресуючою
емфіземою? -
9. Який з наведених чинників спри-
чинює розслаблення гладких м’я-
зів бронхів?
(А) Лейкотрієни.
* (В) Вазоактивний інтестинальний
поліпептид (ВІП).
(С) Ацетилхолін.
(В) Холодне повітря.
(Е) Сульфур діоксид.
726 / САМООЦІНКА НАВИКІВ
Рис. 34-А. Об’єм легень у разі різних
внутрішньолегеневих тисків.
10. Повітряна резистентність
(А) збільшується, якщо легені ви-
далити і наповнити фізіоло-
гічним розчином.
(В) не впливає на роботу дихання;
(С) збільшується у параплегічних
хворих;
* (В) збільшується у разі астми;
(Е) становить 80% роботи дихан-
ня.
У питаннях 11—13 одна або більше
відповідей правильні. Виберіть
А, якщо (1), (2), (3) правильні;
В, якщо (1) і (3) правильні;
С, якщо (2) і (4) правильні;
В, якщо лише (4) правильна;
Е, якщо всі правильні.
11. Вистилання альвеоли сурфактан-
том
(1) запобігає альвеолярному кола-
буванню.
(2) зменшене у разі хвороб гіалі-
нових мембран.
(3) зменшене у легенях осіб, що
багато курять;
(4) є сумішшю білків та ліпідів.
12. Активування яких з наведених ре-
цепторів спричинює констрикцію
легеневих артерій?
(1) Адренергічні ос2-рецептори.
(2) Мускаринові М3-рецептори.
(3) Гістамінові Н2-рецептори.
(4) Ендотелінові ЕТд-рецептори.
13. Що з наведеного може спричини-
ти зменшення легеневої вентиля-
ції?
(1) Перетинання обох діафраг-
мальних нервів.
(2) Перетинання спинного мозку
на рівні Тг
(3) Великі дози морфію.
(4) Легеневий фіброз.
У питаннях 14 і 15 визначте, чи ве-
личина, наведена у першому вислові,
с більшою (С), однаковою (8) або мен-
шою (ІД ніж величина, наведена у
другому.
14. РЕУ] у особи в нормі.
С8Ь
РЕУ] у хворого на астму.
15. Концентрація ангіотензину II у
крові легеневих вен.
С 8 Ь
Концентрація ангіотензину II у
крові ниркових вен.
РОЗДІЛ 35
У цьому розділі описані механізми
газообміну О2 з легень до тканин та
СО2 з тканин до легень; акцентовано
увагу на фізичних та хімічних меха-
нізмах, які забезпечують транспорту-
вання О2 і СО2 кров’ю. Після вивчен-
ня цього розділу студент повинен умі-
ти:
• описати механізм потрапляння О2
з легень у тканини та СО2 з тка-
нин у легені;
• описати реакції О2 з гемоглобіном
та криву дисоціації оксигемогло-
біну;
• назвати найважливіші фактори, що
впливають на афінність гемогло-
біну для О2 і фізіологічне значення
кожного;
• описати міоглобін, визначити його
фізіологіну роль;
• назвати реакції, що збільшують
кількість СО2 у крові і нарисувати
криву дисоціації СО2 для артері-
альної та венозної крові.
ГОЛОВНІ ПИТАННЯ
1. Чому концентрація СІ усередині
еритроцита венозної крові більша
ніж у еритроцита артеріальної кро-
ві. Опишіть механізми, що відпо-
відальні за таку відмінність.
2. Чому оксигемоглобін зв’язує мен-
ше Н+ ніж відновлений гемогло-
бін?
3. Що таке ефект Бора? Як він вини-
кає і яке його фізіологічне значен-
ня?
4. Яке значення 2,3-дифосфогліце-
рату? Дайте означення Р50 і опи-
шіть, як 2,3-ДФГ впливає на Р$оу
крові.
5. Яка роль карбоангідрази у еритро-
цитах?
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-7 виберіть одну
відповідь.
1. Більшість СО2, що транспортуєть-
ся у крові,
(А) розчинена у плазмі.
(В) є у карбаміносполуках, утво-
рених білками плазми.
(С) є у карбаміносполуках, утво-
рених з гемоглобіну.
(Л) зв’язана з СГ;
* (Е) є у НСО3 .
2. Що з наведеного має найбільший
вплив на здатність крові транспор-
тувати кисень?
(А) Спроможність крові розчиня-
ти кисень.
* (В) Кількість гемоглобіну у крові.
(С) рН плазми.
(Л) Вміст СО2 в еритроцитах.
(Е) Температура крові.
3. Яке з наведених тверджень є хиб-
ним для системи
со2 + н2о 4 н2со3 4 н++ нсо3-.
(А) Реакцію 1 каталізує карбоан-
гідраза.
(В) Оскільки наявна реакція 2, то
рН у крові зменшується під час
затримки дихання.
(С) Реакція 1 відбувається у нир-
ках.
(Л) Реакція 1 відбувається пере-
важно у плазмі.
(Е) Реакція зміщується ліворуч, як-
що є надлишок Н у тканинах.
У питаннях 4-7 виберіть
А, якщо вислів пов’язаний з (а);
В, якщо вислів пов’язаний з (Ь);
С, якщо вислів пов’язаний з (а) і
(Ь);
Л, якщо вислів не пов’язаний ні з
(а), ні з (Ь).
(а) Абсорбція глюкози.
(Ь) Абсорбція амінокислот.
4. Карбаміносполуки.
5. Міоглобін.
6. Йони водню.
7. Білки плазми.
У питаннях 8 і 9 визначте, чи ве-
личина, наведена у першому вислові,
САМООЦІНКА НАВИКІВ / 727
є більшою (С), однаковою (8) або мен-
шою (Ь), ніж величина, наведена у
другому.
8. Афінність гемоглобіну плоду (ге-
моглобін Р) для О .
С8Ь
Афінність гемоглобіну дорослих
(гемоглобін А) для О2.
9. Кількість осмотично активних час-
тинок в еритроцитах артеріальної
крові.
С8Ь
Кількість осмотично активних час-
тинок в еритроцитах венозної кро-
ві.
РОЗДІЛ 36
У цьому розділі описані механізми
регулювання дихання: фундаменталь-
ний генераторний комплекс регулю-
вання ритму у довгастому мозку; хі-
мічне регулювання через каротидні та
аортальні хеморецептори та хемо-
рецептори, розміщені на вентральній
поверхні довгастого мозку; нехімічне
регулювання через вхідні імпульси з
інших центрів та рецепторів легень,
м’язів, сухожилків і суглобів. Після ви-
вчення цього розділу студент повинен
уміти:
• назвати місцерозташування комп-
лекса пре-Буттзінґера й описати
його роль у створенні спонтанного
дихання;
• ідентифікувати місцезнаходження
та функції дорсальних та вент-
ральних груп респіраторних ней-
ронів, пнемотаксичного центру і
центру апнейзису у стовбурі мозку;
• дати означення специфічним ди-
хальним функціям блукаючого нер-
ва і дихальним рецепторам у каро-
тидних й аортальних тільцях та вен-
тральній поверхні довгастого мозку;
• описати та пояснити вентиляторні
реакції-відповіді на збільшення
концентрації СО2 у повітрі, яке
вдихають;
• описати впливи кожного з голов-
них нехімічних факторів, що впли-
вають на дихання.
ГОЛОВНІ ПИТАННЯ
1. Що таке рефлекс Герінґа-Брайєра?
2. Яка роль гематоенцефалічного ба-
р’єру у регулюванні дихання?
З. Який клінічний стан називають
прокляттям Ондін?
4. Що таке точка розриву дихання?
Опишіть фактори, що впливають
на неї.
5. Як гіпоксія генерує збільшення
кількості імпульсів у аферентних
нервах від каротидних хеморецеп-
торів? Опишіть клітинні та моле-
кулярні механізми, що беруть
участь у цьому процесі.
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-8 виберіть одну
відповідь.
1. Головні респіраторні нейрони, що
беруть участь у регулюванні,
(А) посилають регулярні імпульси
до експіраторних м’язів під
час спокійного дихання.
(В) не реагують на подразнення
рецепторів болю.
(С) розташовані у мості.
< (Л) посилають регулярні імпульси
до інспіраторних м’язів під час
спокійного дихання.
(Е) не реагують на імпульси з кори
великих півкуль.
2. Внутрішньовенна молочна кисло-
та збільшує вентиляцію. Рецеп-
тори, що відповідають за такий
ефект, розташовані у
(А) довгастому мозку.
« (В) каротидних клубочках.
(С) паренхімі легень.
(Л) аортальних барорецепторах.
(Е) трахеї та великих бронхах.
3. Спонтанне дихання припиняється
після
(А) перетинання стовбура голов-
ного мозку вище моста.
„ (В) перетинання стовбура голов-
ного мозку на рівні каудаль-
ного кінця довгастого мозку.
(С) білатеральної ваготомії.
(Л) білатеральної ваготомії, поєд-
наної з перетинанням стовбура
головного мозку по верхній
межі мосту;
(Е) перетинання спинного мозку
на рівні першого грудного сег-
мента.
4. Наведені у випадковому порядку
фізіологічні явища простежують-
ся іп УІУО.
(1) Зменшення рН спинномозко-
вої рідини.
(2) Збільшення артеріального
рС02;
(3) Збільшення спинномозкового
Рсо2;
* (4) Подразнення хеморецепторів
довгастого мозку.
(5) Збільшення альвеолярного
Рсо2.
Яка звичайна послідовність явищ,
що спричинює вплив на дихання?
(А) 1,2, 3,4, 5.
(В) 4, 1,3, 2, 5.
(С) 3,4,5, 1,2.
(Л) 5,2,3, 1,4.
(Е) 5,3,2, 4, 1.
5. Наведені у випадковому порядку
події відбуваються у каротидних
клубочках, коли вони піддані гіпо-
ксії.
(1) Деполяризація гломусних клі-
тин типу І.
(2) Збудження у закінченнях афе-
рентних нервів.
(3) Зменшення провідності чут-
ливих до гіпоксії К+-каналів у
гломусних клітинах типу І;
(4) Надходження Са2+ у гломусні
клітини типу І;
(5) Зменшення відтоку К+.
Яка звичайно послідовність подій
виникає у разі гіпоксії?
(А) 1,3,4, 5, 2.
(В) 1,4, 2, 5,3.
(С) 3,4,5, 1,2.
(Л) 3, 1,4, 5, 2.
* (Е) 3,5, 1,4,2.
6. Подразнення центрального (про-
ксимального) кінця блукаючого
нерва спричинить
(А) збільшення частоти серцевих
скорочень.
(В) стимулювання дихання.
(С) гальмування кашлю.
(Л) підвищення артеріального
тиску.
* (Е) апное.
У 6. Уведення препарата, що подраз-
нює каротидні клубочки, може
призвести до
(А) зменшення рН артеріальної
крові.
(В) зниження РСО2 у артеріальній
крові.
(С) збільшення концентрації
НСО3 в артеріальній крові.
(Л) збільшення екскреції №’ у се-
чі.
(Е) збільшення у плазмі СІ .
728 / САМООЦІНКА НАВИКІВ
7. Зміни яких компонентів крові чи
спинномозкової рідини не впли-
вають на дихання?
(А) Артеріальна концентрація
НСО3 .
< (В) Артеріальна концентрація Н+.
/ (С) Артеріальна концентрація Ка+.
(Б) Концентрація СО2 у спинно-
мозковій рідині.
(Е) Концентрація Н+ у спинномоз-
ковій рідині.
У питаннях 9-11 визначте, чи ве-
личина, наведена у першому вислові,
є більшою (С), однаковою (8) або мен-
шою (ІД ніж величина, наведена у
другому.
9. Частина змін вентиляції внаслідок
змін артеріального РСО2, спричине-
них хеморецепторами довгастого
мозку.
* С8Ь
Частина змін вентиляції внаслідок
змін артеріального РСО2, спричине-
них периферійними хеморецепто-
рами.
10. Кровоплин на грам тканини у ка-
ротидних клубочках.
‘С8Ь
Кровоплин на грам тканини у тка-
нині головного мозку.
11. Гальмівний вплив збільшення ар-
теріального РСО2 на гикання.
4 С8Ь
Гальмівний вплив зменшення ар-
теріального РСо2 на гикання.
РОЗДІЛ 37
У цьому розділі описані зміни ди-
хання у разі навантаження, підіймання
на висоту, різних форм гіпоксії та внас-
лідок різноманітних хвороб. Також
описані гіперкапнія та гіпокапнія у
разі збільшення барометричного тис-
ку, утоплення та штучного дихання.
Після вивчення цього розділу студент
повинен уміти:
• описати вплив навантаження на
вентиляцію та обмін О2 у тканинах;
• дати означення гіпоксії та описати
чотири головні її форми;
• описати гострі ефекти на дихання
у разі підіймання на висоту і про-
цес акліматизації до висоти;
• дати означення та навести при-
клади порушення співвідношення
вентиляція-перфузія;
• назвати та пояснити впливи чад-
ного газу на організм;
• підсумувати аномалії, що просте-
жуються під час емфіземи та аст-
ми;
• назвати та пояснити ефекти над-
лишку О2;
• описати впливи гіперкапнії та гі-
покапнії та навести приклади ста-
нів, які можуть їх спричинити;
• ідентифікувати періодичне дихан-
ня та пояснити його появу у разі
різних хворобливих станів;
• описати детально техніку дихання
рот у рот і пояснити, як таке штуч-
не дихання відновлює життєдіяль-
ність.
ГОЛОВНІ ПИТАННЯ
1. Засобами діаграми проілюструйте
взаємозв’язок між парціальним
тиском О2 у крові і відсотком наси-
чення гемоглобіну у спокої та
вплив на взаємозв’язок наванта-
ження.
2. Який механізм появи кисневого
боргу? Як можна виміряти кисне-
вий борг? Який він у людини?
3. Опишіть втому з погляду її при-
чин, попередження та фізіологіч-
ного значення.
4. Що таке дихання Чейна-Стокса?
Поясніть його появу.
5. У хворих з вираженою дихальною
недостатністю, що мають гіпер-
капнію та гіпоксію, введення О2
може припинити дихання і навіть
призвести до смерті, якщо не роз-
почати штучного дихання. Чому?
6. Пірнання на глибину завдяки удос-
коналенню обладнання 8СИВА
стало не лише професійним занят-
тям, а й популярним спортом. Які
медичні проблеми можуть виник-
нути унаслідок пірнання на гли-
бину і як можна їх лікувати?
Таблиця 37-А. Рр2, мм рт. ст.
Верхня порожниста вена Правий шлуночок Альвеолярний газ Лівий шлуночок
А 45 40 104 94
В 40 35 105 94
С 40 35% 60 55
0 40 35 104 55
Е 45 80 104 94
7. Опишіть патогенез астми.
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-16 виберіть одну
відповідь.
Питання 1-5 стосуються табл.
З 7-А.
І. Які показники належать особі у
нормі?
2. Які показники належать особі, що
спокійно дихає на висоті 3000 м (ба-
рометричний тиск 520 мм рт. ст.)?
3. Які показники належать хворому
з вираженим шунтом зліва напра-
во?
4. Які показники належать хворому
з колабованою легенею?
5. Які показники належать особі у
нормі, що спокійно дихає 100% не-
компресованим О2 у кабіні літака
на висоті 10 000 м (барометричний
тиск 180 мм рт. ст.)?
Питання 6 і 7 стосуються табл.
З 7-В.
6. Які показники належать чоловіку,
що дихає через трубку, якщо знач-
но збільшився його мертвий про-
стір?
7. Які показники належать жінці, яка
летить на висоті 4500 м у відкритій
кабіні літака?
8. За яких з наведених умов найімо-
вірніше виникає утримання СО2?
(А) Піднімання на високу гору.
(В) Вентиляційна недостатність.
(С) Отруєння чадним газом.
(Л) Легенева недостатність.
(Е) Істерична гіпервентиляція.
9. Легеневий фіброз може спричи-
няти
(А) гістотоксичну гіпоксію.
(В) застійну гіпоксію.
(С) зменшення життєвої ємності.
(Л) ціаноз.
(Е) емфізему.
САМООЦІНКА НАВИКІВ Г729
Таблиця 37-В. Параметри
артеріальної крові
Рсо2, мм рт. ст. рН нсо3-, мекв/л
А 60 7,25 29
В 25 7,30 12
С 42 7,55 35
0 25 7,50 20
Е 60 7,05 15
10. Які з наведених руйнівних впливів
не пов’язані з хронічним курінням
цигарок?
(А) Ділянки ателектазу.
(В) Міокардіальна ішемія.
(С) Втрата еластичної тканини у
легенях.
(В) Збільшення анатомічного мерт-
вого простору.
(Е) Збільшення карбонмоноокси-
гемоглобіну у крові.
11. Надходження О2у тканини може
зменшуватися до граничної межі
в
(А) особи у нормі, що вдихає 100%
О2 на вершині гори Еверест.
(В) особи у нормі, яка виконує ма-
рафонський забіг на рівні мо-
ря.
(С) хворого з отруєнням чадним
газом.
(В) хворого, що вживав ціанід.
(Е) хворого з ацидозом середньої
важкості.
12. Що з наведеного не є ознакою ін-
токсикації киснем?
(А) Подразнення дихальних шля-
хів.
(В) Проблеми з зором унаслідок
ретролентальної фіброплазії.
(С) Конвульсії.
(В) Легеневі кисти у новонарод-
жених.
(Е) Розрив на глибині.
У питаннях 13-16 позначте тверд-
ження літерою пов ’язаної з ним хво-
роби. Кожна позначена літерою хво-
роба може бути використана один
раз, декілька разів або жодного разу.
(А) Астма.
(В) Легеневий фіброз.
(С) Емфізема.
(В) Хвороба гіалінових мембран.
(Е) Гострий респіраторний ди-
стрес-синдром.
13. Шок.
14. Куріння цигарок.
15. Недоношеність.
16. Оголення епітелію повітряносних
шляхів.
РОЗДІЛ 38
У цьому розділі описані функції ни-
рок, зокрема клубочкова фільтрація, та
чинники, які змінюють її, канальцева
реабсорція і секреція та механізми їх-
нього регулювання, а також функції
сечоводів та сечового міхура. Після
вивчення цього розділу студент пови-
нен уміти:
• описати морфологію типового неф-
рону та його кровопостачання;
• дати означення авторегулювання
та назвати головні теорії, що пояс-
нюють авторегулювання у нирках;
• характеризувати функції ниркових
нервів;
• дати означення швидкості клубоч-
кової фільтрації, описати методи
вимірювання і назвати головні
чинники, що впливають на цей по-
казник;
• дати означення та описати каналь-
цево-клубочковий зворотний зв’я-
зок та клубочково-канальцевий
баланс.
• описати канальцеву реабсорбцію
та секрецію глюкози і К+;
• описати канальцеву екскрецію
Иа+;
• характеризувати канальцеву екск-
рецію СЕ, НСО3 у величинах
фільтрації, секреції, реабсорбції та
екскреції в сечі.
• описати, як течійно-протитечій-
ний механізм нирок утворює гі-
пертонічну або гіпотонічну сечу;
• характеризувати процеси, що за-
діяні у секреції Н+ у канальці, і опи-
сати їхнє значення для регулю-
вання кислотно-лужої рівноваги;
• назвати головні класи діуретиків і
описати механізми дії кожного з
них;
• описати рефлекс сечовипускання
і нарисувати цистометрограму.
ГОЛОВНІ ПИТАННЯ
1. Чому і коли речовина, яка секре-
тується канальцями, досягає рівня
Тм, тоді як кліренс речовини змен-
шується, а її концентрація у плазмі
збільшується?
2. Чому мозковий шар нирки особ-
ливо чутливий до гіпоксичного
ураження?
3. Яка фізіологічна роль мезангіаль-
них клітин у клубочку і як вони
діють?
4. Порівняйте клітинні механізми,
відповідальні за секрецію Н+ у про-
ксимальному канальці, з такими ж
у дистальному канальці і слизовій
оболонці шлунка.
5. Опишіть механізми адаптації екс-
креції МН4+ у разі хронічного аци-
дозу.
6. Чому ацидоз є типовим усклад-
ненням хронічних захворювань
нирок? Як можна його лікувати?
7. Результати обстеження хворого
такі:
[НСО3 ] у плазмі - 20 мекв/л;
ШКФ - 125 мл/хв;
добовий діурез - 1500 мл;
[НСО3 ] у сечі - 25 мекв/л;
титрована кислотність сечі -
50 мекв/л.
(а) Яка приблизна кількість НСО3
абсорбуватиметься за добу?
(Ь) Яка кількість Ка+ реабсорбува-
диметься з НСО3 ?
(с) Яка кількість Н+ реабсорбува-
тиметься нирковими каналь-
цями за добу?
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1—17 виберіть одну
відповідь.
У питаннях 1-5, що стосуються
табл. 38-А, позначте хворобу чи стан
організму літерою пов ’язаних з ним
даних лабораторних досліджень з
табл. 38-А. Кожен позначений літе-
рою набір даних може бути викорис-
таний один раз, декілька разів або
жодного разу.
1. Нецукровий діабет.
2. Нефроз.
3. Голодування.
4. Дегідратація.
5. Цукровий діабет.
6. За наявності вазопресину найбіль-
ша фракція фільтрованої води аб-
сорбується у
(А) проксимальному канальці.
(В) петлі Генле.
(С) дистальному канальці.
730 / САМООЦІНКА НАВИКІВ
Таблиця 38-А.
Об’єм сечі за добу, л Кетони Глюкоза Білок
А 1,4 + 0 0
В 6,2 2+ 4+ 0
С 1,6 0 0 4+
0 6,4 0 0 0
Е 0,4 0 0 0
(В) кірковій збірній трубочці.
(Е) мозковій збірній трубочці.
7. За відсутності вазопресину най-
більша фракція фільтрованої води
абсорбується у
(А) проксимальному канальці.
(В) петлі Генле.
(С) дистальному канальці.
(В) кірковій збірній трубочці.
(Е) мозковій збірній трубочці.
8. Якщо кліренс речовини, що вільно
фільтрується, менший ніж у інулі-
на, то
(А) є кінцева реабсорбція речови-
ни у канальцях.
(В) є кінцева секреція речовини у
канальцях.
(С) речовина не є ні секретова-
ною, ні реабсорбованою у ка-
нальцях.
(В) речовина зв’язана з білком у
канальцях.
(Е) речовина секретована у про-
ксимальному канальці більше,
ніж у дистальному.
9. Реабсорбція глюкози відбувається у
(А) проксимальному канальці.
(В) петлі Генле.
(С) дистальному канальці.
(В) кірковій збірній трубочці.
(Е) мозковій збірній трубочці.
10. У якій з наведених структур аль-
достерон діє найефективніше?
(А) Клубочок.
(В) Проксимальний каналець.
(С) Тонка частина петлі Генле.
(В) Товста частина петлі Генле.
(Е) Кіркова збірна трубочка.
12. Який кліренс речовини, якщо кон-
центрація її у плазмі 10 мг/дл, у
сечі - 100 мг/дл; сечовипускання
- 2 мл/хв?
(А) 2 мл/хв.
(В) 10 мл/хв.
(С) 20 мл/хв.
(В) 200 мл/хв.
(Е) Кліренс неможливо визначити
з наявної інформації.
12. Якщо сечовипускання збільшу-
ється у разі осмотичного діурезу,
то
(А) рівень осмоляльності сечі
зменшується нижче рівня плаз-
ми.
(В) рівень осмоляльності сечі
збільшується, оскільки збіль-
шується кількість нереабсор-
бованої солі у сечі.
(С) рівень осмоляльності сечі
наближується до рівня плазми,
оскільки плазма просочується
у канальці.
(О) рівень осмоляльності сечі
наближується до рівня плазми,
оскільки у екскретованій сечі
збільшується велика фракція,
яка є ізотонічною рідиною у
проксимальному канальці.
(Е) вплив вазопресину на ниркові
канальці інгібований.
Питання 13-15 стосуються по-
казників з табл. 38-В, які простежу-
вались у жінки в нормі.
13. Швидкість клубочкової фільтрації
в межах експериментального пе-
ріоду
(А) у чотири рази більша, ніж у
межах контрольного періоду.
(В) у два рази більша, ніж у межах
контрольного періоду.
Таблиця 38-В.
Об’єм сечі Період контролю Період експерименту
Артеріальна плазма Інулін, мг/мл 0,004 0,004
Глюкоза, мг/дл 100 (1 мг/мл) 300 (3 мг/мл)
Сечовина, мкмоль/мл 5 5
Сеча Інулін, мг/мл 0,4 0,2
Глюкоза, мг/мл 0 5
Сечовина, мкмоль/мл 300 160
Плин сечі, мл/хв 1 2
(С) така ж, як у межах контроль-
ного періоду.
(В) дорівнює половині швидкості
у межах контрольного періоду.
(Е) дорівнює одній четвертій
швидкості у межах контроль-
ного періоду.
14. Кліренс сечовини у межах експе-
риментального періоду
(А) збільшується, можливо, тому,
що сечовипускання збільшене.
(В) збільшується, можливо, тому,
що концентрація глюкози у
сечі збільшена.
(С) такий, як у межах контроль-
ного періоду.
(В) зменшується, можливо тому,
що сечовипускання збільшу-
ється.
(Е) зменшується, можливо, тому,
що кількість фільтрованої се-
човини зменшується.
15. Тм глюкози у жінки становить
(А) 100 мг/хв.
(В) 130 мг/хв.
(С) 200 мг/хв.
(В) 290 мг/хв.
(Е) неможливо визначити з наяв-
них данних.
16. Нефрогенний нецукровий діабет
пов’язаний з мутацією втрати
функції гена, відповідального за
білок
(А) аквапорин-1.
(В) аквапорин-2.
(С) аквапорин-3.
(В) аквапорин-4.
(Е) аквапорин-5.
17. Затримка №' і гіпертензія за нор-
мального або низького рівня аль-
достерону у плазмі (синдромчЛід-
дла) пов’язана з мутацією ланцюга
фунцій гена, відповідального за
білок
САМООЦІНКА НАВИКІВ / 731
(А) альдостеронсинтетази.
(В) внутрішньонапрямлених К+-
каналів.
(С) 11 р-гідроксилази.
(В) У2-рецептора.
(Е) натрієвого епітеліального ка-
налу.
Питання 18-22 стосуються рис.
38-/1. Виберіть літеру або літери, що
вказують на відповідні частини неф-
рону. Кожна позначена літерою час-
тина може бути вибрана один раз,
декілька разів або жодного разу.
18. Місце(я) впливу фуросеміду.
19. Місце(я) впливу тріазидів.
20. Місце(я), де рівень осмоляльності
канальцевої рідини значно пере-
вищує рівень плазми.
21. Місце(я), де На" активно реабсор-
бується.
22. Місце(я), де К* активно секрету-
ється.
РОЗДІЛ 39
У цьому розділі описані гомеоста-
тичні механізми регулювання осмо-
ляльності, об’єму та йонного складу
позаклітинної рідини у нормі, зокре-
ма концентрація Н4, дихальний і мета-
болічний ацидоз та алкалоз. Після ви-
вчення цього розділу студент повинен
уміти:
• описати підтримку сталої тоніч-
ності (осмоляльності) позаклітин-
ної рідини у разі зміни секреції
реніну і альдостерону;
Рис. 38-А. Юкстамедулярний нефрон.
• описати підтримку сталого об’єму
позаклітинної рідини у разі зміни
секреції реніну і альдостерону;
• назвати механізми підтримки ста-
лої концентрації глюкози і Са2+ у
плазмі;
• дати означення ацидозу й алкалозу
і знати середні значення (у мекв/л
і рН) концентрації Н+ у крові в
нормі.
• назвати головні буферні системи у
крові, інтерстинальній і внутріш-
ньоклітинній рідинах і, на підставі
рівняння Гендерсона-Гассельба-
ха, описати унікальність бікарбо-
натної буферної системи;
• описати зміни хімічного складу
крові у разі метаболічного ацидозу
й алкалозу, дихальну і ниркову
компенсацію цих станів;
• описати зміни хімічного складу
крові у разі дихального ацидозу й
алкалозу і механізми ниркової ком-
пенсації цих станів.
ГОЛОВНІ ПИТАННЯ
1. Які головні джерела навантаження
організму людини кислотою у що-
денному житті? Які поширені за-
хворювання спричинюють збіль-
шення кислотного навантаження в
організмі і як воно утворюється у
кожному випадку захворювання?
2. Порівняйте і зіставте метаболіч-
ний ацидоз і алкалоз.
3. Опишіть та поясніть зміни об’єму
позаклітинної рідини, кислотно-
лужної рівноваги у пацієнтів з хро-
нічно збільшеною концентрацією
альдостерону у разі первинного
гіперальдостеронізму?
4. Опишіть за допомогою діаграми
Давенпорта зміни концентрації
НСО3 стосовно рН у разі негай-
них та довготривалих змін кислот-
но-лужного балансу у нормальних
осіб, що гіпервентилюють упро-
довж 5 хвилин.
ТЕСТОВИЙ КОНТРОЛЬ
ЗНАНЬ
У питаннях 1-10 виберіть одну
відповідь.
Питання 1-4 стосуються перену-
мерованих крапок номограми на рис.
39-А. Позначте у питаннях перенуме-
ровану крапку літерою пов ’язаного з
нею стану організму. Кожен позначе-
ний літерою стан може бути вико-
ристаний один раз, декілька разів або
жодного разу.
(А) Значення простежується у аль-
пініста після кількох тижнів
перебування на висоті.
(В) Значення простежується у разі
довготривалої вираженої ем-
фіземи.
(С) Значення простежується у разі
діабетичної коми.
(Л) Значення простежується після
5 хв гіпервентиляції.
(Е) Значення простежується після
тривалого блювання.
1. Крапка 1.
2. Крапка 2.
3. Крапка 3.
4. Крапка 4.
5. Дегідратація збільшує концентра-
цію всіх гормонів крім
(А) вазопресину.
(В) ангіотензину.
(С) альдостерону.
(Л) норадреналіну.
(Е) атріального натрійуретичного
поліпептиду.
6. Який з перелічених буферів є най-
важливішим для інтерстиційної
рідини?
(А) Гемоглобін.
(В) Інші білки.
(С) Вугільна кислота.
(О) н2РО4.
(Е) Сполуки, що містять гістидин.
7. Збільшення альвеолярної венти-
ляції збільшує рН крові, оскільки
(А) активуються нервові механізми,
що виводять кислоту з крові.
(В) гемоглобін перетворюється у
сильнішу кислоту.
(С) збільшується РСО2У крові.
(Л) зменшується РС02 у альвеолах.
(Е) виконання великої м’язової
роботи з форсованим дихан-
ням спричинює утворення
більшої КІЛЬКОСТІ СО2.
8. У разі некомпенсованого метабо-
лічного алкалозу
(А) рН плазми, концентрація НСО3
і артеріальний РС02 низькі.
(В) рн плазми високе, концент-
рація НСО3 і артеріальний
РСО2 низькі.
(С) рН плазми, концентрація
НСО3“ низькі, артеріальний
Рсо2У нормі.
732 / САМООЦІНКА НАВИКІВ
РН
Рис. 39-А. Номограма Сіїїаарда-Андерсена (з дозволу О ЗіддаагсІ-АпсІегзеп апсі Расііотеїег, Сорепґіадеп, Оептагк).
(В) рН плазми, концентрація 9. Якщо у пацієнта рН плазми 7,10, 10. У пацієнта з дегідратацією вода
НСО3 високі, артеріальний то співвідношення [НСО3]/ організму буде замінена внутріш-
Рсо2є у НО0МІ; [Н2СО3] у плазмі становить ньовенним уведенням
(Е) рН плазми низьке, концент- (А) 20. (А) дистильованої води.
рація НСО3 висока, артеріаль- (В) 10. (В) 0,9% розчину натрій хлориду.
ний РСо2У нормі. (С) 2. (С) 5% розчину глюкози.
(О) 1. (В) гіперонкотичного розчину аль-
(Е) 0,1. буміну.
(Е) 10% розчину глюкози.
Відповіді до
тестових запитань
РОЗДІЛ 1 РОЗДІЛ 3 16. В 17. А 18. Ь 3. А 4. С 5. О
19. 6 6. О
1. с Головне питання 3. 20. 8 7. Е
2. Е Швидкі м’язи > 133; 8. О
3. О повільні м’язи > 10. 9. О
4. В 10. А
5. С 1. В РОЗДІЛ 5 11. А
6. Е 2. О 12. В
7. В 3. В 13. В
8. В 4. С 1. с 14. Ь
9. О 5. С 2. О 15. 6
10. Е 6. С 3. Е
11. С 7. С 4. Е
12. В 8. С 5. В
13. Е 9. А 6. С РОЗДІЛ 8
14. В 10. С 7. А
15. Е 11. А 8. Ь
16. В 12. С 9. 8 1. о
17. А 13. О 10. 8 2. О
18. С 14. 6 3. В
19. О 15. Ь 4. Е
20. О 16. Ь 5. О
21. Ь РОЗДІЛ 6 6. В
22. 6 7. О
23. 6 8. О
24. Ь РОЗДІЛ 4 1. с 9. С
25. Ь 2. Е 10. Е
3. С 11. О
1. о 4. О 12. В
2. Е 5. С 13. О
РОЗДІЛ 2 3. с 6. В 14. Ь
4. В 7. А 15. О
5. А 8. 8
1. в 6. С 9. О
2. В 7. О 10. 6
3. Е 8. А РОЗДІЛ 9
4. В 9. О
5. С 10. В
6. В 11. Е РОЗДІЛ 7 1. о
7. 6 12. С 2. Е
8. Ь 13. О 3. О
9. Ь 14. О 1. с 4. С
10. ь 15. С 2. О 5. В
734 / САМООЦІНКА НАВИКІВ
6. 0 4. В 22. О
7. О 5. С 23. О РОЗДІЛ 17
8. Е 6. В
9. Е 7. Е
10. А 8. О Головне питання 1.
11. □ 9. В РОЗДІЛ 15 ОО - 208 ккал/кг/добу;
12. В 10. А тварини є малими.
13. А 11. С
14. А 12. С 1. в 1. В
15. Ь 13. Е 2. С 2. А
16. Ь 14. В 3. А 3. О
17. 6 15. Е 4. О 4. О
16. О 5. А 5. Е
17. А 6. В 6. В
18. В 7. С 7. С
РОЗДІЛ 10 19. С 8. С 8. Е
20. В 9. А 9. В
10. А 10. С
1. □ 11. А 11. О
2. А 12. О 12. В
3. Е РОЗДІЛ 13 13. о 13. А
4. О 14. С 14. А
5. О 15. Е 15. О
6. А 1. с 16. Е 16. Е
7. Е 2. А 17. С 17. Е
8. А 3. А 18. Ь 18. В
9. О 4. С 19. Ь 19. С
10. С 5. О 20. Ь 20. А
11. 6 6. С
12. Ь 7. Е
8. Е
9. 6 РОЗДІЛ 16 РОЗДІЛ 18
10. 6
РОЗДІЛ 11
1. с 1. с
2. А 2. О
1. с РОЗДІЛ 14 3. Е 3. О
2. Е 4. С 4. Е
3. С 5. О 5. А
4. О 1. в 6. В 6. С
5. Е 2. Е 7. О 7. В
6. В 3. Е 8. □ 8. О
7. С 4. О 9. С 9. А
8. В 5. А 10. А 10. В
9. А 6. С 11. О 11. О
10. А 7. С 12. Е 12. С
11. А 8. Е 13. В 13. Ь
12. В 9. Е 14. Е 14. Е
13. В 10. В 15. В 15. 6
14. Г 11. В 16. В
15. О 12. О 17. А
13. А 18. В
14. В 19. А РОЗДІЛ 19
15. Е 20. О
РОЗДІЛ 12 16. О
17. О 1. Е
18. В 2. О
1. в 19. А 3. О
2. Е 20. А 4. Е
3. О 21. С 5. С
САМООЦІНКА НАВИКІВ / 735
6. 0 9. Е
7. Е РОЗДІЛ 22 10. Е РОЗДІЛ 27
8. С 11. С
9. 0 12. А
10. с 1. Е 13. А 1. в
11. 0 2. О 14. О 2. Е
12. А 3. Е 15. В 3. С
13. А 4. Е 4. А
14. С 5. А 5. А
15. В 6. В 6. А
16. Е 7. С РОЗДІЛ 25 7. В
17. Ь 8. В 8. А
18. Ь 9. С 9. А
10. О 1. в 10. Е
11. А 2. Е 11. С
12. В 3. С 12. С
РОЗДІЛ 20 13. О 4. Е 13. Е
14. 6 5. С 14. В
6. О 15. Е
1. 0 7. О 16. О
2. А 8. С 17. С
3. Е РОЗДІЛ 23 9. С 18. 8
4. В 10. А 19. Ь
5. С 11. В 20. 6
6. Е 1. с 12. О
7. □ 2. А
8. В 3. В
9. Е 4. О РОЗДІЛ 28
10. О 5. О РОЗДІЛ 26
11. С 6. С
12. О 7. Е 1. Е
13. □ 8. О 1. о 2. В
14. А 9. А 2. Е 3. С
15. Е 10. Е 3. О 4. О
16. С 11. Е 4. С 5. А
17. С 12. О 5. С 6. А
18. О 13. А 6. О 7. С
14. С 7. В 8. О
15. О 8. А 9. О
16. О 9. О 10. А
РОЗДІЛ 21 17. Е 10. с 11. А
18. Ь 11. А 12. Ь
19. 8 12. О 13. Ь
1. с 20. Ь 13. с 14. Е
2. Е 21. 6 14. Е 15. Ь
3. О 22. Ь 15. О
4. Е 16. О
5. А 17. С РОЗДІЛ 29
6. С 18. А
7. О РОЗДІЛ 24 19. Е
8. А 20. В
9. Е 21. О 1. Е
10. О 1. о 22. А 2. С
11. Е 2. Е 23. Е 3. О
12. Ь 3. О 24. Е 4. А
13. Ь 4. О 25. Е 5. В
5. О 6. А
6. С 7. С
7. О 8. С
8. Е 9. С
736 / САМООЦІНКА НАВИКІВ
10. Е 17. 11,12 4. С 10. О
11. О 18. 13, 14, 15, 16 5. Е 11. С
12. В 6. В 12. Е
13. Е 7. С 13. Е
14. С 8. А 14. С
15. А РОЗДІЛ 32 9. В 15. О
10. О 16. А
11. Е
1. с 12. О
РОЗДІЛ зо 2. О 13. А
3. О 14. 6 РОЗДІЛ 38
4. В 15. 6
Головне питання 3. 5. А
Пульсовий тиск - 57 мм рт. 6. О 1. о
ст.; середній артеріальний 7. А 2. С
тиск - 92 мм рт. ст. 8. Е РОЗДІЛ 35 3. А
Головне питання 4. 9. Е 4. Е
ЗО 000 дин/см; 60 ОООдин/см. 10. С 5. В
11. Е 1. Е 6. А
1. О 12. О 2. В 7. А
2. А 13. Е 3. П 8. А
3. Е 14. 8 4. В 9. А
4. С 15. Ь 5. О 10. Е
5. С 16. Ь 6. С 11. С
6. В 7. С 12. О
7. О 8. 6 13. с
8. В 9. Ь 14. А
9. В РОЗДІЛ 33 15. О
10. Е 16. В
11. А 17. Е
12. А Головне питання 10. РОЗДІЛ 36 18. С
13. О Хвилинний об’єм -4,73 л/хв; 19. О
14. Е ударний об’єм - 73,9 мл. 20. В
15. А Діагноз: стеноз аорти. 1. о 21. А, С, П, Е
16. О 2. В 22. О, Е
17. 6 1. П 3. В
18. Ь 2. Е 4. О
3. В 5. Е
4. А 6. Е РОЗДІЛ 39
5. С 7. В
РОЗДІЛ 31 6. О 8. С
7. Е 9. 6 Головне питання 7.
8. О 10. О (а) 3562,5 мекв НСО3 ;
1. Е 9. П 11. 6 (Ь) 3562, 5 мекв
2. В 10. В (с) 3562,5+105+75=3742,5
3. О 11. Е мекв Н+.
4. О 12. В
5. С 13. 6 РОЗДІЛ 37 1. О
6. С 14. 8 2. С
7. В 15. Ь 3. В
8. С 1. в 4. А
9. В 2. С 5. Е
10. В 3. Е 6. С
11. С РОЗДІЛ 34 4. О 7. О
12. О 5. А 8. О
13. А 6. А 9. В
14. С 1. о 7. О 10. С
15. В 2. С 8. В
16. С 3. А 9. О
Перелік уживаних скорочень
1,25-(ОН)203 - 1,25-дигідроксихолекальциферол
16-ОГДГЕАС - 16-гідроксидегідроепіандростерон сульфат
2,3-ДФГ - 2,3-дифосфогліцерат
25-ОН03- 25-гідроксихолекальциферол
5-Ої - йодотироніндейодаза першого типу
5'-ОІІ - дейодаза другого типу
5-Ої - дейодаза третього типу
5-НТ - рецептори серотоніну
5-ГІАК - 5-гідроксиіндолацетатна кислота
5-ГПЕТЄ - 5-гідропероксиейкозатетраєнова кислота
5-ФРПФ - 5-фосфорибозилпірофосфат
а-ВЛМ - а-ізоформа важких ланцюгів міозину
а-МСГ - а-меланоцистостимулювальний гормон
р-АКК - р-адренергічний рецептор
0-ІЕИ - р-інтерферон
Р-ВЛМ - р-ізоформа важких ланцюгів міозину
р-лтп- Р-ліпотропін поліпептид
у-ІЕМ - у-інтерферон
АА8Н - гормон, який стимулює виділення андрогенів над-
нирковими залозами
АВР - андрогенозв’язувальний білок
АС - аденілатциклаза
АСЕ - ангіотензиноперетворювальний ензим
АМР - передсердний натрійуретичний пептид
АРО - апопротеїн
АРІЮ - накопичення та декарбоксилювання попередників
амінів
ВОМЕ - нейротрофний фактор
В6Р - білок 6Іа кістки
ВМР - кістковий морфогенний білок
ВМР - мозковий натрійуретичний пептид
САО - цитозин-аденін-гуанін
САНТ - кокаїн- і амфетамінрегулювальний транскрипт
СаЗБ - кальційзв’язувальний білок
СВ1 - канабіноїдний рецептор 1
СВ2 - канабіноїдний рецептор 2
СВО - кортикостероїдозв’язувальний глобулін
СбНР - пептид, залежний від гену кальцитоніну
СО - кластер диференціації
СЕТК - регулятор муковісцидозної трансмембранної
провідності
СбКРа - пептид а, залежний від гена кальцитоніну
СбНРр - пептид р, залежний від гена кальцитоніну
СМР - натрійуретичний пептид С-типу
СМТР - циліарний нейротрофний фактор
СОНЬ - карбоксигемоглобін
СОХ-1 - циклооксигеназа-1
СОХ-2 - циклооксигеназа-2
СКЕВ - цАМФ-чутливий елементозв’язувальний білок
СУР - цитохром Р450
СУР11А - ензим відщеплення бокового ланцюга
СУР19 - ароматаза
ООАУР - десмопресин
ЕСЬ - ентерохромафіноподібний
ЕОР - фактор росту епідермісу
ЕР^ - цитокіни, ендогенні пірогени
ЕКа - естрогеновий рецептор а
ЕКР - естрогеновий рецептор Р
ЕЕУ1 - об’єм форсованого видихання першої секунди
ЕОР - фібробластний фактор росту
6АО - глютаматдекарбоксилаза
6В6 - глобулін, що зв’язує гонадні стероїди
СОМЕ - нейротрофний фактор, продукований лінією
гліальних клітин
біа - глутамінова кислота
би - гліцентин
6ЬР-1 - глюкагоноподібний пептид 1
6ЬР-1 [7-36] - глюкагоноподібний пептид 1 (7-36)
бЬР-2 - глюкагоноподібний пептид 2
бЬІІТ - транспортер глюкози
6КРР - гліцентинозв’язаний поліпептид
НЬ - деоксигенований гемоглобін
НЬО2 - оксигемоглобін
ЬС8 - хоріонічний соматотропін людини
Неї - гематокрит
НЬА - лейкоцитарні антигени людини
Н8В - білки теплового шоку
Н8-КоА - відновлений КоА
ІСА - внутрішньосерцеві адренергічні клітини
ІЕИ - інтерферон
Ід - імуноглобулін
ІК8 - субстрати інсулінового рецептора
□АК - янус-тирозинкіназа
ЬСК - ділянка локусного контролю
□Е - інгібувальний фактор лейкемії
І_р - ліпопротеїн
І_Т - лейкотрієни
Ь-ДОФА - 3,4-діоксифенілаланін
МАР - білки-супутники мікротрубочок
МбР - білок 6Іа матриксу
МНС - основний комплекс гістосумісності
МЬ1 - високоафінний сайт мелатоніну
МЬ2 - низькоафінний сайт мелатоніну
ММС - тучна клітина слизової оболонки
МОВУ - діабет дорослих, що трапляється в молодих осіб
МРбЕ - головний проглюкагоновий фрагмент
Ми8К - м’язово-специфічна кіназа
Ма+-К+-АТФ-аза - натрій-калій-активована аденозинтри-
фосфатаза
МаЕК - натрієвий канал епітеліальних клітин
МЕ-кВ - ядерний фактор КВ
ИК - природна клітина-вбивця
ИМОА - М-метил-О-аспарат
N08 - синтаза оксиду азоту
МРИ - натрійуретичний пептид
Ро-нульовий білок
48 367-2
738 / ПЕРЕЛІК УЖИВАНИХ СКОРОЧЕНЬ
Р450 - цитохром Р450
Р4508СС - ензим відщеплення бокового ланцюга
Рад - парціальний тиск О2, за якого гемоглобін наполовину
насичений О2
РАР - фактор активування тромбоцитів
РАКз - протеазоактивні рецептори
РОЕ - фосфодіестераза
РООР - фактор росту тромбоциту
рН - покажчик кислотності середовища, від’ємний лога-
рифм концентрації йонів Н у середовищі
Рі - неорганічний фосфор
рК - показник рівноваги у хімічних реакціях
РКО-1 - білок поліцистин-1
РКО-2 - білок поліцистин-2
РММТ - фенілетаноламін-М-метилтрансфераза
РРАК - проліферативно-активований рецептор пероксисом
РРАКу- проліферативно-активований рецептор
пероксисом у
РКА - прогестероновий рецептор А
РКВ - прогестероновий рецептор В
Р8А - простатоспецифічний антиген
РТНгР - пептид, подібний до паратгормону
Р¥У - поліпептид УУ
ОК8 - шлуночковий комплекс на ЕКГ
О82 - повна електромеханічна систола
КІІ486 - міфепристон
8Р-1 - стероїдний фактор-1
8дК - натрій- і глюкокортикоїдорегулювальна кіназа
8бІ_Т - натрійзалежне транспортування глюкози
8ІА0Н - синдром “невідповідної” гіперсекреції антидіуретич-
ного гормону
8ІЕ - малі інтенсивно флуоресцентні клітини у симпатич-
них вузлах
8РР - частинка розпізнавання сигналу
8МАР - розчинний зв’язувальний М8Е-білок
8КУ - ділянка У-хромосоми, яка визначає стать людини
81АК - білок негайного регулювання стероїдогенезу
8ТАТ - активатор білків транскрипції
Т3 - трийодотиронін
Т4 - тироксин
ТР - фактор транскрипції
Тд АЬ - антитіло проти тироглобуліну
ТОР - трансформувальний фактор росту
і-РА - тканинний активатор плазміногена
ТРО АЬ - антитіло проти тиропероксидази
Т8Р - тромбопоетичний стимулювальний фактор,
тромбопоетин
Т8Н-Я [ЬІоск] АЬ - ТТГ-рецепторогальмувальне антитіло
Т8Н-К [зііт] АЬ - ТТГ-рецепторостимулювальне антитіло
ІІСР - роз’єднувальний білок
и-РА - плазміноген урокіназного типу
V - уніполярне грудне електрокардіографічне відведення
УҐ6- уніполярне електрокардіографічне відведення з лівої
ноги
VI- - уніполярне електрокардіографічне відведення з лівої
руки
УК - уніполярне електрокардіографічне відведення з
правої руки
УЕбР - судинний ендотеліальний фактор росту
Ар - р-амілоїд
АБС - активований білок С
АВ-вузол - атріовентрикулярний вузол
АВП - аргініновий вазопресин
АДГ - антидіуретичний гормон
АДФ - аденозиндифосфат
АКТГ - адренокортикотропний гормон
АпАТ - аланінамінотрансфераза
АМ - адреномедулін
АМЛ - альвеолярні макрофаги легень
АМФ - аденозинмонофосфат
АПБ - амілоїдний прекурсорний білок
АПЕ - ангіотензиноперетворювальний ензим
АПК - антигено-презентувальна клітина
АПО - аполіпопротеїн
АПО Е - аполіпопротеїн Е
АРП - абсолютний рефрактерний період
АСК - азот сечовини крові
АСТ - аспартатамінотрансфераза
АТ - артеріальний тиск
АТБ - ацилтранспортний білок
АТФ - аденозинтрифосфат
АТФ-аза - аденозинтрифосфатаза
АХ - ацетилхолін
АХЕ - ацетилхолінестераза
БАС - боковий аміотрофічний склероз
БЕР - базальний електричний ритм
БП - безумовний подразник
ВЖК - вільна жирна кислота
ВІЛ - вірус імунодефіциту людини
ВІП - вазоактивний інтестинальний поліпептид
ВКР - внутрішньоклітинна рідина
ВЛМ - важкий ланцюг міозину
ВМК - ванілілманделова кислота
ВМС - внутрішньоматкова спіраль
ВНМ - видимий надлишок мінералокортикоїдів
ВОР - вестибулоочний рефлекс
ВРП - відносний рефрактерний період
Г6ФДГ - глюкозо-6-фосфатдегідрогеназа
ГАБ - ГТФ-аза-зв’язувальний білок
ГАМК - у-аміномасляна кислота
ГАМКа-у-аміномасляна кислота А
ГАМКВ-у-аміномасляна кислота В
ГАМК-Т - ГАМК-трансаміназа
гвк - голованілінова кислота
ГДФ - гуанозиндифосфат
ГЕТЄ - гідроксиейкозатетраєнова кислота
ГЗТ - глобулін, що зв’язує тироксин
ГМГ-КоА - З-гідрокси-З-метилглутарил
ГМФ - гуанозинмонофосфат
ГнРГ - гонадотропін-рилізинг гормон
ГПА - глюкокортикоїдноподібний альдостеронізм
ГПЗ - гальмівний потенціал з’єднання
ГПСП - гальмівний постсинаптичний потенціал
ГРІ - гормон росту-інгібувальний гормон
ГРл-В - гормон росту людини варіантний
ГРл-Н - гормон росту людини нормальний
ГРП - гастрин-рилізинг поліпептид
ГР-РГ - гормон росту-рилізинг гормон
ГТФ - гуанозинтрифосфат
ГФІ - глікозильована форма фосфатидилінозиту
ДА - дофамін
ДАГ - діацилгліцерол
ДГЕА - дегідроепіандростерон
ДГЕАС - дегідроепіандростерон сульфат
дгмк - 3,4-дигідроксиманделова кислота
ДГТ - дигідротестостерон
ДГФГ - 3,4-дигідроксифенілгліколь
ДІТ - дийодотирозин
ДК - дихальний коефіцієнт
ДЛК - діетиламідлізергінова кислота
ДМТ -Л/,ААдиметилтриптамін
ДНК - дезоксирибонуклеїнова кислота
ПЕРЕЛІК УЖИВАНИХ СКОРОЧЕНЬ / 739
ДОК - дезоксикортикостерон
ДОМ - 2,5-диметокси-4-метиламфетамін
ДОФА - диоксифенілаланін
ДОФОК - дигідрооксифенілоцтова кислота
ДПФХ - дипальметилфосфатидилхолін
ДТД - довготривала депресія
ДТП - довготривала потенціація
ДФГ - 2,3-дифосфогліцерат
Е1 - естроген
Е2 - естрадіол
ЕЕГ - електроенцефалограма
ЕЕТ - епоксиейкозатриєнова кислота
ЕКГ - електрокардіограма
ЕкоГ - електрокортикограма
ЕКП - ентеротоксин кишкової палички
ЕМГ - електроміограма
ЕНПП - ефективний нирковий плин плазми
ЕП - ендогенний піроген
ЕПГ - електрограма пучка Гіса
ЕРФ - ендотеліальнорозширювальний фактор
ЕС - ендоплазматична сітка
ЕТ-1 - ендотелін-1
ЕТ-2 - ендотелін-2
ЕТ-3 - ендотелін-3
ЗВО - загальна вода організму
ЗЗК - запрограмована загибель клітини
ЗПЗ - збуджувальний потенціал з’єднання
ЗПСП - збуджувальний постсинаптичний потенціал
ІВТ3 - індекс вільного трийодтироніну
ІВТ4 - індекс вільного тироксину
ІЗЦД - інсулінозалежний цукровий діабет
ІЛ - інтерлейкін
ІМФ - інозин-5'-монотрифосфат
ІНЗЦД - інсулінонезалежний цукровий діабет
ІПСП - інгібувальний постсинаптичний потенціал
ІРМ - інгібіторна речовина Мюллера
ІСР - інтерстиційна рідина
ІФ3- інозитолтрифосфат (інозитол 1,4,5-трифосфат)
ІФР-І - інсуліноподібний фактор росту І
ІФР-ІІ - інсуліноподібний фактор росту II
ІФРЗБ-З - ІФР-зв’язувальний білок-3
КДО - коефіцієнт дихального обміну
КЛЖК - коротколанцюгові жирні кислоти
КО - кінцевий об’єм
КоА - ацетил коензим А
КОМТ - катехол-О-метилтрансфераза
КППП - кортикотропіноподібний пептид проміжної частки
КРГ - кортикотропін-рилізинг гормон, кортиколіберин
КРП - концентрація реніну в плазмі
КСФ - колонієстимулювальний фактор
КСФ-Ґ - КСФ ґранулоцитів
КСФ-ҐМ - КСФ ґранулоцитів та макрофагів
КСФ-М - КСФ макрофагів
КТ - комп’ютерна томографія
КФ - креатинфосфат
ЛГ - лютеїнізувальний гормон
ЛГРГ - лютеїнізувальний гормон-рилізинг гормон
ЛПВЩ - ліпопротеїни високої щільності
ЛПГ - ліпотропний гормон
ЛПДНЩ - ліпопротеїни дуже низької щільності
ЛПНЩ - ліпопротеїни низької щільності
ЛПСЩ - ліпопротеїни середньої щільності
ЛПС - ліпополісахарид
ЛТ - лейкотрієн
ЛХАТ - лецитинхолестеролацилтрансфераза
МАО - моноамінооксидаза
МГМК - ванілілманделова (З-метокси-4-гідроксиманделова)
кислота
МГФГ - З-метокси-4-гідроксифенілгліколь
МДМА - 3,4-метилендіоксиметамфетамін
МІТ - монойодтирозин
МКА - молекула клітинної адгезії
ММВ - максимально можлива вентиляція
ММК - міґрувальний моторний комплекс
ММР О2- мозковий метаболічний рівень О2
МПС - мембранний потенціал спокою
мРНК - матрична РНК
МСГ - меланоцитостимулювальний гормон
МСК - м’язово-специфічна кіназа
МСО - мозковий судинний опір
МТ - мікротрубочка
МФ - мікрофіламент
МФР - маноло-6-фосфат рецептор
НА - недисоційована кислота
НАД*- нікотинамідаденіндинуклеотид
НАДН - дигідронікотинамідаденіндиклеотид
НАДН-ДГ - НАДФ дегідрогеназа
НАДФ* - нікотинамідаденіндинуклеотидфосфат
НЕП - нейтральна ендопептидаза
НКП - нирковий кровоплин
нмя - ніжно-мостове ядро
НПП - нирковий плин плазми
НПЯ - надперехресні ядра
НСІПА - несупресорна інсуліноподібна активність
НСПЗЗ - нестероїдні протизапальні засоби
НСР - нормальний синусовий ритм
НСС - нижній стравохідний сфінктер
НТ - нейротрансмітер
ОО - основний обмін
ОТ3 - обернений трийодотиронін
ПАГК - парааміногіпурова кислота
ПАЗТ - преальбумін, що зв’язує тироксин
ПАМП - проадреномедулін амінокінцевий 20 пептид
ПГ - простагландин
ПГКП - підвищене глікозилювання кінцевих продуктів
ПДРФ - поліморфізм довжин рестрикційних фрагментів
ПЕА - пальмітоїлетаноламід
ПЕГ - поліетиленгліколь
ПЕТ - позитронна емісійна томографія
ПІГ - пролактинінгібувальний гормон
ПКР - позаклітинна рідина
ПКС - протеїнкіназа С
ПЛАБ - 5-ліпоксигеназоактивувальний білок
ПЛл - плацентарний лактоген людини
ПЛР - полімеразно-ланцюгова реакція
ПМН - поліморфонуклеарні лейкоцити
ПМС - передмісячний синдром
ПНП - передсердний натрійуретичний пептид
ПОМК - проопіомеланокортин
ППВ - період передвикидання
ППП - потенціал, пов’язаний із подією
ПРГ - пролактин-рилізинг гормон
ПРФ - продукти розпаду фібриногену
ПТГ - паратгормон
РАП - ренінова активність плазми
РАС - ретикулярна активаційна система
РДС - гострий респіраторний дистрес-синдром
РДСН - респіраторний дистрес-синдром новонароджених
РНК - рибонуклеїнова кислота
рРНК - рибосомна РНК
РРХ - рецептор ретиноїду X
РФМ - регресійний фактор Мюллера
740 / ПЕРЕЛІК УЖИВАНИХ СКОРОЧЕНЬ
СА-вузол - синоатріальний вузол
СДГ - сукцинатдегідрогеназа
СДД - специфічна динамічна дія
СК - секреторний компонент
СК-МВ - МВ ізомер креатинкіназа
СМР - спинномозкова рідина
СНІД - синдром набутого імунодефіциту
СОД-1 - супероксиддисмутаза
СОКП - судинний орган кінцевої пластинки
СРДС - синдром раптової дитячої смерті
СРЧ - сигнальна розпізнавальна частина
СС 14 - соматостатин 14
СС 28 - соматостатин 28
СТГ-РГ - соматотропін-рилізинг гормон
СТЯ - субталамічне ядро
СУНСГ - синдром ураження нервової системи гіпербарією
СФО - субфорнікальний орган
СФТ - середній фільтраційний тиск
ТГл - тиреоїдний гормон людини
ТР - тиреоїдний рецептор
ТРГ - тиреотропін-рилізинг гормон (тиреоліберин)
тРНК - транспортна РНК
ТТГ - тиреотропний гормон (тереотропін)
ТФРа - трансформувальний фактор росту а
ТФРр - трансформувальний фактор росту Р
УДФ - уридиндифосфат
УДФГ - уридиндифосфоглюкоза
УДФГК - уридиндифосфоглюкуронова кислота
УП - умовний подразник
УТФ - уридинтрифосфат
ФАД - флавінаденіндинуклеотид
ФІФ2 - фосфатидилінозиту 4,5-дифосфат
ФЛ - фосфоліпаза
ФЛС - фосфоліпаза С
ФМН - флавінмононуклеотид
ФНП - фактор некрозу пухлини
ФРЕ - фактор росту епідермісу
ФРН - фактор росту нервів
ФСВ - фактор сироваткової відповіді
ФСГ - фолікулостимулювальний гормон (фоліберин)
ФФРЗ - рецептор 3 фібробластичного фактора росту
ФЧК - фактор четвертинного комплексу
фЯМР - функційний ЯМР
ХГл - хоріонічний гонадотропін людини
ХРП - хоріонічний гормон росту - пролактин
ХСл - хоріонічний соматомамотропін людини
ХЦК - холецистокінін
ХЦК-ПЗ - холецистокінін-панкреозимін
цАДФР - циклічна аденозиндифосфатрибоза
цАМФ - циклічний АМФ
цГМФ - циклічний гуанозинмонофосфат
ЦДФ - цитозиндифосфат
ЦНС - центральна нервова система
ЦОК - цитохромоксидаза
ЦОМ - центр організації мікротрубочок
ЦТФ - цитидинтрифосфат
ЧСС - частота серцевих скорочень
ШІП - шлунковий інгібувальний поліпептид
ШКФ - швидкість клубочкового фільтрування
ШРО - швидкий рух очей
ЯМР - ядерно-магнітний резонанс
ЯПШ - ядро поодинокого шляху
Покажчик
1,25-Дигідроксихолекальциферол 33, 350,
351, 355, 357, 359, 361, 362, 416, 438
Іа-Гідроксилаза 357
2-Дезоксиглюкоза 318,371
радіоактивна 151
2-Деоксиглюкоза 564
2,3-Дифосфогліцерат 297, 490, 612
2,5-Диметокси-4-метиламфетамін 243
З-Гідрокси-З-метилглутарил-КоА 276
З-Гідроксипроліні 270
3,3',5'-Трийодотиронін 292
Зр-Гідроксистероїдодегідрогеназа 335, 335
4-Гідроксипролін 270, 369
5-Гідрокситриптофан 94, 270, 564
5-Дейодаза 296
5-Ліпоксигеназа 285
5-Фосфорибозилпірофосфат 274
5 '-Дейодаза 296, 298
5а-Редуктаза 394
6-Фосфоглюконат 264
7-Дегідрохолестерол 356
9а-Флюорокортизон 333
11-Дезоксикортизол 334,336
11-Дезоксикортикостерол 334,336
11 -Окси-17-кетостероїди 338
11 Р-Гідроксилаза 334,336,346
11 р-Гідроксистероїдодегідрогеназа 337
типу 2 345
1 ір-Гідролаза 335
16-Гідроксидегідроепіандростеронсульфат
412
17-Гідроксикортикоїди 332
17-Кетостероїди 332, 338
17-Кортикостероїди 332
17,20-Ліаза 334
17а-Гідроксилаза 334, 335
17а-Гідроксипрогестерон 334
17Р-Естрадіол 401
18-Гідроксикортикостерон 335
21 р-Гідроксилаза 334, 335
21р-Гідролаза 336
24,25-Дигідроксихолекальциферол 356, 357
25-Гідроксихолекальциферол 356, 357
а-Декстрин 429
а-Декстриназа 430, 431
а-Дистроглікан 60
а-Епоетин 421
а-Гусдуцин 177
а-Синуклеїн 202
а-Тектин 170
а-Фетопротеїн 496
а2-Макроглобулін 396, 496
Р-Адреноблокатор 138
р-Амілоїд 252
Р-Арестин 87
р-Гідрокси-у-триметиламоній бутират 275
р-Гідроксибутират 276, 314, 315
Р-Дистроглікан 60
Р-Ендорфін 135, 148, 364, 407
Р-Енкефалін 246
р-Кетокислота 276,318
Р-Ліпотропін 228, 363
р-Мотонейрон 118
у-Інтерферон 300, 482
у-Коливання 181
у-Мотонейрон 118
Ь-Диоксифенілаланін 195, 201, 270, 372,
388, 564
МО-синтаза 104
рН 614
рН-електрод 675
рН-метр 675
рН розчину З
рН сечі 66
рН крові 612
Абсорбція у товстій кишці 468
Абстиненція 242
Авітаміноз А 155
Автоматичність дихання 616
Авторегулювання 547, 566
Авторецептор 87
Автофосфорилювання 34, 311
Агенезія яєчників 381
Аглютинація еритроцитів 493
Аглютиноген 493
Агнозія 253, 565
зорова 240
Агоніст 225
бета-адренергічний 319,361
Агрегація 488
тромбоцитів 488, 498, 546, 582
Агрин 109
Адаптація 113, 175, 466, 579
ока 142
світлова 155
секреції ТЧН3 662
темнова 154, 155
Адвентиція 528
Адгезин фокальний 13
Адгезія
лейкоцитів 586
тромбоцитів 488
фокальна 14
адезинмонофосфат циклічний 503, 524
Аденілатциклаза 39, 177, 267, 320, 335, 359,
466
Аденін 16
Аденозилметіонін 8- 271
Аденозин 103, 104, 185, 421, 545, 546, 570,
572
ендогенний 513
Аденозиндифосфат 261
Аденозиндифосфатрибоза циклічна 36
Аденозинмонофосфат 261
циклічний 29, 31, 39, 87, 104, 174, 177,
228, 250, 266, 282, 320, 321, 323, 330,
335, 359, 425, 436, 453, 458
Аденозинтрифосфат 10, 212, 213, 261, 278,
319, 329,441
Аденозинтрифосфатаза 28, 62, 65, 262
Са2+-залежна 351
Са2+-Н+ 438
Са2+-М§2+ 62
Н‘-залежна 352
Н+-К+ 452, 456
Н+-транслокувальна 660
№-К? 28, 31, 53, 73, 163, 293, 298, 310,
325, 331, 344, 416, 424, 436, 526, 569,
651, 656, 660, 664
Аденоїди 609
Аденома
гіпофіза 42
клубочкової зони кори надниркової
залози 349
передньої частки гіпофіза хромофобна
388
Адинамія клубової кишки 467
Адіадохокінез 206
Адреналектомія 329, 338, 339, 345
Адреналін 92, 209, 211,216, 220, 232, 245,
267, 271, 298, 317, 319, 323, 327, 329-
331, 339, 343, 441, 549, 558, 587
Адреналсульфокіназа 335
Адренархе 384
Адренокортикоїди 373
Адренолейкодистрофія Х-зчеплена 11
Адреномедулін 330, 549
Адренорецептор а 94, 330
Адренорецептор р 94, 330, 319, 321, 591
Адренорецептор Р| 330, 503, 524
Адренорецептор Р2 266, 330
Адренорецептор р3 279, 330
Аерофагія 451
Азатіоприн 487
Азот сечовини крові 271
Азотемія 584
Акалькулія 255
Аквапорин 225
Аквапорин-1 655
Аквапорин-2 655, 656
Аквапорин-3 655
Аквапорин-4 655
Аквапорин-5 655
Акінезія 200
Акліматизація 628
до височини 630
Акне 405
Акомодація 49, 113, 144, 145
Акрозин 410
Акромегалія 42, 312, 368, 369, 376
Акросома 390
Аксон 45, 47, 48, 77, 106
веретеномоторний
динамічний 118
статичний 118
мієлінізований 46
Акт статевий 238
Активатор плазміногена тканинного типу
499, 571
Активін 40, 396
742 / ПОКАЖЧИК
Активність
мозку електрична 179
рухова соматична 188
Активування
№*-каналів 52,511
системи комплемента
альтернативним шляхом 479
класичним шляхом 479
тромбоцитів 488
шляхом пропердину 479
Актин 13,62,74,476,487
Г 13
6 13,31,356
Актинін 60
Акумуляція К+ 437
Акупунктура 134, 135
Аланін 270,314,322
Алантоїн 274
Алергія харчова 433
Алкалоз 629, 635, 664
метаболічний 673-675
респіраторний 620, 628, 630, 673
декомпенсований 673
Алкоголь 226, 283, 455, 587, 664
етиловий 242
Алкогольдегідрогеназа 148
Алодинія 131
Алокортекс 238
Алоксан 320
Алопеція гніздова 290
Алопуринол 274
Алюміній 287
Альбінізм неповний 366
Альбінос 366
Альбумін 279, 281, 295, 296, 462, 495, 496,
585, 587, 648
Альбумінурія 648, 665
ортостатична 666
Альвеола 633
невентильована 631
Альвеолоцит типу І 595
Альвеолоцит типу II 595, 601
Альдозоредуктаза 325
Альдостерон ЗІ, 328, 332, 334, 338, 341,
344-348, 374, 406, 418, 420, 424, 437,
449, 555, 577, 589, 660, 662, 663, 666,
669, 670
Альдостеронізм глюкокортикоїдноподібний
346, 349
Альдостеронсинтаза 334, 346
АКТГ-стимульована 589
Амбліопія без анопсії 158
Аменорея 409
вторинна 389,410
гіпоталамічна 410
первинна 409
Амілаза 429
а-панкреатична 430
а-слинна 429, 430, 448
Амілопектин 429
Амілорид 177,665
Амін 632
Аміноацидурія 654
Амінокислота 260,270,271,653
активована 21
глюкогенна 271
кетогенна 271
незамінна 270
Аміноліпід 285
Амінопептидаза 102, 417, 430, 548
Амінопирин З
Амінування 271
Амнезія ретроградна 249
Амніоцентез 382, 495
Амплітуда звукової хвилі 165
Ампула 162
Фатера 457
Амфітамін 245
Анаболізм 257
Аналіз
газовий 593
імунохімічний 418
радіоімунологічний 295,321,322
Анальгезія стресова 134
Анандамід 104
Анастомози артеріовенозні 531
Ангіогенез 531
Ангіографія
вінцева 569
радіоізотопна рівноважна 518
Ангіопластика вінцева 571
Ангіотензин І 346, 416, 418, 551, 612
Ангіотензин II 102, 222, 226, 266, 327, 328,
335, 341, 345-348, 416-418, 420, 423,
547, 549, 563, 584, 589, 591, 610, 646,
648, 669
Ангіотензин III 417, 418
Ангіотензин IV 417, 418
Ангіотензиноген 340, 346, 416, 418, 496,
589
Ангіотонін 418
Андроген 240, 241, 296, 335, 338, 372, 373,
377,380, 382, 421,612
Андростендіон 332, 334, 338, 393, 401
Анексин 499
Анемія 287, 289, 290, 421, 438, 456, 495,
533, 535, 585, 619, 633, 635, 666
гемолітична спадкова 489
залізодефіцитна 438, 492
злоякісна 291
макроцитарна 469
мегалобластна 287
перніціозна 361,445,456
серпоподібноклітинна 492
Анестезія 100
місцева 134
Анеуплоїдія 18
Аніон супероксидний 634
Анкірин 489
Аноксія 627
аноксична 627
застійна 557
Аномалія
в мітохондріальній ДНК 24
генетична 24
кумулятивна 43
метаболізму жирів 314
смаку 178
ЦНС 311
шкіри 311
Анопія 154
Анорексія 231,290,375,629
нервова 385
Аносмія 175,231
Антагоніст 225
Антацид 456
Антиген
А 494
В 494
С 494
О 494
Е 494
Тас 479
простатоспецифічний 392
Антигени
групи крові 493, 494
лейкоцитарні людини 483
Антидепресант 243
Антикоагулянт 499
Антиоксидант 281
Антиперистальтика 466
Антипорт 29, 79
Антипротеаза 633
Антипротеаза а( 496
Антитіло 301, 325
антиінсулінове 307
моноклональне 486
рецепторостимулювале ТТГ 301
антитрипсин а! 633
Антитромбін III 496, 498-500
Антитромбін С 496
Анурія 645, 666
Аорта 528
Апарат
вестибулярний 196
Ґольджі 24, 307, 357, 358, 435, 453
штучного дихання 639
юкстагломерулярний 419, 642
Апетит 218, 221
Апнейзис 617
Апное 555,623,636
під час сну 636
ШРО 637
Аполіпопротеїн
В 496
Е 281
С-ІІ 279
Апоморфін 215, 372
Апоплексія 99
Апопротеїн 279
АРОЕ 281
Апоптоз 22, 23, 54, 80, 200, 411, 421, 482,
483
Апоферитин 438
Арахідонат 283
Аргінін 271, 318, 322, 369, 372, 373, 546
2 270
Ь 318
Аргон 637
Аритмія 587
передсердна 509
серцева 216
синусова 507
шлуночкова 170, 510, 515
Аромат 172, 177
Ароматаза 391, 401
Артеріола 528, 550, 554, 559, 572, 577, 582
аферентна 641, 648
виносна 641
еферентна 641, 648
Артеріосклероз 282
Артерія 528
базальна 399
базилярна 559
бронхіальна 596
вертебральна 559
вінцева 500, 568
легенева 607
міжчасточкова 642
мозкова 500
сонна 559
спіральна 399
Артефакт подразника 48
Артрит 285, 466
подагричний 275
Аспарагін 270,417
Аспарагіназа Ь 296
Аспартат 97
Аспартатамінотрансферада 271
Аспартатглікозамінурія 11
Аспірація 624
Аспірин 285, 456, 546, 632
ПОКАЖЧИК / 743
Астереогноз 253
Астигматизм 145
Астма 584,634
Астроцит 57, 548, 560, 562, 564
волокнистий 57
протоплазматичний 57
Асфіксія 331, 350, 564, 570, 575, 635, 638
усні 187
Атаксія 130,206,291
Фрідрейха 290
Ателектаз 601, 602
Атеросклероз 281, 282, 285, 316, 325, 405,
570
Атетоз 200
Атрезія 399
Атропін 246,319,445,449
Атрофія
клубочкової зони кори надниркових залоз
346
міокарда 581
м’язова 189
слизової 469
щитоподібної залози 305
Аудіометр 169
Аудіометрія 169
Ауротіоглюкоза 220
Аутогемотрансфузія 421
Аутосома 377
Афазія 254
амнестична 255
аномічна 254
без здатності вільно говорити 254
Верніке 200
дисартикуляційна 200
зі здатністю вільно говорити 254
провідникова 254
Афект 131,237
Афібриногенемія 496
Афінність 295
О2 до гемоглобіну 630
Ахалазія 450
Ахондроплазія 374
Ахроматопсія 154
Ацетат 333
Ацетилкоензим А 91, 261, 264, 275, 276,
314, 316
карбоксилаза 314
Ацетилхолін 78, 87, 90, 106, 135, 148, 209,
211, 245, 246, 319, 441, 447, 450, 454,
455, 501, 546, 557, 560, 646
Ацетилхолінестераза 91, 106,213,246
Ацетоацетат 276,314,315,318
Ацетоацетил-КоА 276,314
Ацетогексамід 318
Ацетон 276,314
Ацидифікація жовчі 463
Ацидоз 312, 315, 316, 340, 528, 584, 586,
624, 627, 660, 664, 666, 669
діабетичний 310
метаболічний 349, 357, 620, 622, 626,
654, 673-675
декомпенсований 674
респіраторний 635, 673
декомпенсований 673
тубулярний нирковий 666
Ацилювання гліцерофосфату 435
Ацинус 291, 571
Базофіл 339,474,476
тканинний 476
Баклофен 195
Бактерія
НеІісоЬасіег руїогі 456
кишкова 468
Баланс
азотний 274
негативний 193,275,314,582
позитивний 275, 298
водний 222
водно-електролітний 650
енергетичний 232, 257, 260
клубочково-канальцевий 654
сольовий 348
Балізм 200
Барбітурат 526
Бар’єр
гематоенцефалічний 57, 195, 220, 548,
562-564, 566
гематотестикулярний 389, 564
плацентарний 564
слизовий 452
Барвник Еванса синього (Т-1824) 2
Барорецептор 222, 551-554, 584, 590, 624
артеріальний 584
Бацила газової гангрени 468
Безпліддя 635
Безсоння 187
родинне фатальне 187
Бел 165
Бензодіазепіни 100, 187, 215, 246, 410
Бензопірон 543
Бериліоз 606
Біг оздоровчий 582
Бігуанідин 319
Бійодат 304
Білівердин 492
Білірубін 462, 492
вільний 462, 564
загальний 462
кон’югований 462
Білки плазми крові 495
Білок 193,258,269
С 496,499
В-зв’язувальний 356
О 36, 87, 104, 335, 359, 419, 447, 488,
547
гетеротримерний 37
малий 36
Ос 356
Оіа
кістки 354
матриксу 354
Оч 419
Р() 45
р53 24
РЕК 217
рр39то§ 399
Кап 16
8 499, 500
8К¥ 377
андрогенозв’язувальний 391
гострої фази 460, 582
другого класу 287
інтегральний 9
кальційзв’язувальний 36
КРГ-зв’язувальний 231
ліпідизований 9
міристильований 9
морфогенний кістковий 354
негайного регулювання стероїдогенезу
335
опіоїдний 329
пальмітильований 9
периферійний 9
першого класу 287
плазми 672
поліцистин-1 650
поліцистин-2 650
пренильований 9
РВ2-зв’язувальний 87
рецепторний - 1ОІ1 482
смужка 3 614
С-реактивний 496, 582
стресорний 35
теплового шоку Нзр90 35
транспортний 27, 657
цАМФ-чутливий елементозв’язувальний
39
Білок-модифікатор смаку 178
Білок-опікун 22
Біль 285,584
висотний 637
вісцеральний 132, 134
глибокий 132
іррадійований 133
м’язовий 132
нейропатичний 131
повільний 131
посттравматичний 131
швидкий 131
Біопсія м’язів 627
Біосинтез 223
естрогенів 403
інсуліну 307
сечовини 271
стероїдів 333
тестостерону 393
Біотин 289, 438
Бісфосфонати 355
Блобси 150
Блокада
АВ-вузлова 508
К+-каналів 511
альвеолярно-капілярного бар’єру 630
альфа-ритму 182
біфасцикулярна 509
інфранодальна 508
правої або лівої ніжки 509
серця 587
неповна 509
першого ступеня 509
повна третього ступеня 508
трифасцикулярна 509
фасцикулярна 509
Блокатор
р-адренорецепторів 299
СузЕТІ -рецепторів 632
Н2-рецепторів 451, 456
Блювання 214, 563, 620, 624, 627, 671
Бляшка
атеросклеротична 500
синаптична 106
стареча 252
Бомба калориметрична 258
Бомбезин 448
Борг кисневий 625-627
Борозна Сильвієва 161,190
Брадикардія 507, 584, 587, 623
Брадикінезія 200
Брадикінін 102, 541, 546, 548, 549, 576, 610
Бронх 594, 595
позалегеневий 214
Бронхіола 594, 595
термінальна 594
Бронходилатиція 595, 596, 599
Бронхоконстрикція 595, 599, 628, 632
Бруксизм 185
Брунька смакова 175,176,178
Буметанід 665
Бурса Фабріціуса 478
Буфери 4
Буферування ізокапнічне 626
В’язкість крові 534, 588
744 / ПОКАЖЧИК
Вагітність 239,240,410
Ваготомія 455, 556, 617
двобічна 555
Вада міжшлуночкової перегородки вроджена
509
Вазектомія 393
Вазодилататор 579, 580
Вазодилатація 545, 560, 570, 573, 580, 587,
610
вінцева 570
шкірна 303
Вазоконстрикція 496, 545, 546, 570, 573,
584, 610
рефлекторна генералізована 539
Вазопресин 102, 216, 223-226, 230, 266, 312,
339, 341, 363, 375, 418, 420, 549, 555,
563, 584, 642, 656, 669
аргініновий 223
лізиновий 223
Вакуоля 10
автофагічна 11
фагоцитарна 10
Валін 270
Ванадій 287 •
Варикозність 108
Варфарин 499
Васкулогенез 533
Введення ціанідів внутрішньовінцеве 572
Вдихання 598
Вектор
(Ж$-середній 505
серця 505
Векторокардіографія 505
Вена
бронхіальна 596
легенева 517, 596, 607
міжчасточкова 642
паравертебральна 560
периферійна 632
порожниста 517
серцева передня 568
тебезієва 568
яремна 577
внутрішня 559
Венепункція 531
Вени 473,531
Вени-супутниці 234
Венодилатація 545
Веноконстрикція 545, 584
Вентиляція 581,607,625
альвеолярна 604, 633, 635
легень 597, 622
неадекватна 603
максимально можлива 597
Венула 473,531
Вератридин 555, 556
Веретено 161
м’язове 118, 122, 188
гіперактивне 122
“сну” 182
Верхівка серця 521
Вибух респіраторний в лейкоцитах 476
Видихання 596
Виділення
місячні 400
молока 228,413
Викид серцевий 523, 577
Вимірювання тиску крові 538
Вимірювач крові
доплерівський 532
електромагнітний 532
Випаровування води 233
Випромінювання 233
Виразка
дуоденальна 456
пептична 456
трофічна 635
хронічна 325
шкірна 287
шлункова 456
Виснаження В-клітин 319
Високогір’я 630
Висота тону 165,168
Віагра 154,392
Вібріон холерний 436
Відведення електрокардіографічне
біполярне 504
підсилене 504
стандартне 503, 504
уніполярне 504
Відділ автономної нервової системи
симпатичний 221, 420, 552
парасимпатичний 209
Відклади жирові 276
Відповідь
запальна 474
кашльова 623
локальна 50
на наближення 144
Відрижка 451
Відстань фокусна головна 143
Відсутність секреції норадреналіну та
адреналіну 578
Відтінок 152
Відторгнення трансплантата 482
Відхилення електричної осі серця
ліворуч 505
праворуч 505
Відчуття
болю 126
дотику 129
температури 126
Відшарування слизової оболонки матки 404
Війка 14
Вікно
кругле 161
овальне 159, 160, 166, 575
Вірилізація 335, 383
Вірус імунодефіциту людини 487, 500
Вісцерорецептор 111
Вісь
оптична головна 143
серця 505
Вітамін 287
А 155,287,290,298,437
А, 148
В 287
В, 289
В2 289
В6 289, 290
В12 287,291,437,438,456
С 287,291
Е 281,287,290,437,635
О 287, 290, 332, 350, 355, 437, 438, 460,
474
О, 356
К 287, 354, 437, 468, 499
водорозчиний 287
жиророзчинний 287, 466
Вітиліго 366
Вогнище ектопічне 509
‘ Вода 435, 467, 562, 590, 664
організму загальна 1
Водій ритму 501
ектопічний 507
імплантований 509
Водянка плоду 495
Волога склиста 138
Волокна у-еферентні Лекселя 118
Волокно 126
С 208
альфа 54
бета 54
безмієлінове 622
гамма 54
групи Іа 118
групи II 118
дельта 54
зовнішньовере генне 117
ліаноподібне 204-206
мієлінове 622
мозочка ліаноподібне 77
мохоподібне 204-206
м’язове 58, 65
нервове 54
паралельне 204
Пуркіньє 501,503,509
ядерного ланцюжка 118
ядерної сумки 118
Ворота
№+-потенціалозалежні 30
потенціалозалежні 27
Са2+-каналів 35
Ворсинка 464
арахноїдальна 560
павутинної оболонки 562
Вплив
автономної нервової системи 319
на шлункову секрецію
кишковий 455
мозковий 455
шлунковий 455
температури 391
Вправа фізична 582
Всмоктування 429, 440
амінокислот 433
вітамінів 437
води 435
глюкози 267
електолітів 435
мінералів 437
стеролів 435
холестеролу 435
Втеча 240
Втома 627
Втрата
диференціації реакцій 192
здатності розрізняти кольори транзи-
торна 392
маси за поліфагії 312
регулювання дистальної мускулатури
192
рефлексу 189
свідомості 567
смаку тимчасова 178
солі 336, 349
Вуглеводи 258, 263, 287
антикетогенні 278
Вугрі 405
Вузлик лімфатичний
поодинокий 464
скупчений 464
Вузол
атріовентрикулярний 501, 519
лімфатичний 339
Ранв’є 53, 112, 113
симпатичного стовбура
верхній 209
зірчастий 209
середній 209
синоатріальний 501,509-511
чутливих корінців 548
ПОКАЖЧИК / 745
Вухо 159
внутрішнє 160
зовнішнє 159, 169
середнє 159, 169
Газ
альвеолярний 631
кишковий 451
чадний 633
Галактоза 260, 263, 269
Галактоземія 269
Галактозо-1 -фосфатуридилтрансфераза 269
Галакторея 389,414
Галанін 319
Галоперидол 215
Галуження регенераційне 109
Галюцинація 246
Гальмування
автогенне 121
аферентне 149
внутрішнє 249
зовнішнє 249
латеральне 149
непряме 84
постсинаптичне 82, 84, 85
пресинаптичне 84, 85, 99, 131
пряме 82, 84
центральне 134
Гаметогенез 377, 389
Ганглії базальні 179, 564
Ганглій
колатеральний 209
паравертебральний 208, 209
превертебральний 209
спіральний 161
Гангрена 282, 325
газова 635
Гантінгтин 200
Гаптоглобін 496
Гарячка 235, 582
Гастректомія 325
тотальна 457
Гастрин 319, 321, 361, 442, 443, 446-448,
455
614 443
617 443
634 443
Гастринома 435, 443, 448, 456
Гаустра 467
Гексоза 431, 432
Гексокіназа 263, 269
Гелій 637
Гелікотрема 160
Гем 490,611
Гемангіома 405
Гематокрит 2, 535, 585
Гематома субдуральна 187
Геміанопія 156, 157
гетеронімна 156
Геміблокада 509
Геміплегія 198
Геміцелюлоза 469
Гемоглобін 421, 462, 489, 490, 585, 611, 627,
628, 631, 672
А 313,490,575,613
А2 490
А1С 490
Г 491,575,613
6о\уєґ-1 491
6о\уєг-2 491
аномальний 273, 492
дорослих 575
у крові 634
фетальний 491, 575, 613
Гемоглобінопатія 491
спадкова 273
Гемодіаліз 421, 666
Гемоліз 489, 495
внутрішньосудинний 636
Гемопексин 496
Гемопоез екстрамедулярний 473
Геморагія внутрішньомозкова 198
Гемосидерин 438
Гемосидероз 438, 439
Гемостаз 496
Гемоторакс 632
Гемофілія А 499
Гемофільтрація 666
Гемохроматоз 287, 438
Ген 16, 18
с-Го8 354
£о8В 240
Н 493
ІК.8-1 320
МАО типу А 244
РТНгР 360
асі 477
білоккодувальний 16
ендотеліальних клітин 534
інсулінового рецептора 311
лептинового рецептора 220
негайного реагування 19, 217
нейрокініну В 101
релаксину 407
речовини Р 101
Гени
глюкокінази 326
тиреоїдних рецепторів 297
Геніталії зовнішні 379
Геном людини гаплоїдний 16
Генотип 494
Гентаміцин 169
Гепарин 279, 476, 498, 499
Гепатектомія 274, 330
Гепатомегалія 591
Гепатоспленомегалія 290
Гепатоцит 459
Гермафродитизм справжній 381
Героїн 242
Гестаген 407
Гетеротаксія 15
Гефірин 87
Гикавка 624
Гібридизація гістохімічна іп 8ІШ 86
Гібридома 486
Гігантизм 368, 376
Гідралазин 564, 591
Гідроксилізині 270
Гідроксилювання 21
Гідроксихолекальциферол 355
Гідроксіапатит 352
Гідролаза кисла 369
Гідроліз АТФ 31,453
Гідроторакс 632
Гідроцефалія
внутрішня 561
зовнішня 561
комунікативна 561
некомунікативна 561
Гілка сонної пазухи 554
Гілки сполучні
білі 208
сірі 209
Гінекомастія 384, 414
Гіперактивність 192
Гіпералгезія 131
первинна 132
Гіперальдостеронізм 319,345,349
вторинний 349, 420
первинний 349, 557, 578, 589
Гіперамоніємія 469
Гіпербарія 637
Гіпервентиляція 350, 624, 626, 628, 635, 636
Гіпервітаміноз О 290
Гіпервітаміноз А 290
Гіпервітаміноз К 290
Гіперглікемія 310, 312, 313, 323-325, 340
Гіперглюкагонемія 313, 314
Гіперексплексія 100
Гіперемія реактивна 570, 573
Гіперестезія 109
Гіперкаліємія 349,516,666
Гіперкальцинурія 360, 655
Гіперкальціємія 193, 360-362, 516
гіпокальцинурична м’яка родинна 360
злоякісна 360
гуморальна 361
остеолітична місцева 361
родинна 360
Гіперкальціурія 193
Гіперкапнія 526, 545, 621, 627, 632, 635
Гіперліпемія 314,340
Гіперметропія 145
Гіпернатріємія 222
Гіперосмоляльність 5
крові 313
Гіперостоз 290
Гіперпаратиреоз 359
Гіперпаратиреоїдизм 360
вторинний 360, 666
неонатальний важкий первинний 360
Гіперпіґментація 365, 376
Гіперплазія 349
надниркових залоз
двобічна 376
ліпоїдна вроджена 335
Гіперпное 557
Гіперполяризація слідова 49
Гіперпролактинемія 388
Гіперрефлексія 193
Гіперсекреція
вазопресину 227
соляної кислоти 435
Гіперсексуальність 240
Гіпертензин 418
Гіпертензія 539, 588, 589, 627
артеріальна 420
“білих халатів” 541
Ґольдблатта 420, 590
експериментальна 588
есенціальна 589
з низьким вмістом реніну 589
легенева 576, 588, 608, 637
ниркова 420, 588, 589
хронічна 588
Гіпертермія 231,236
злоякісна 236
Гіпертиреоїдизм 292, 297-299, 301, 303, 357,
539
Гіпертонія 349
Гіпертрофія
лівого шлуночка 505
міокарда 73
передміхурової залози доброякісна 392
правого шлуночка 505
серцевих міоцитів 589
серцевого м’яза 588
шлуночкова 521
Гіперурикемія 466
Гіперфагія 231,238,301,314
Гіперфункція яєчок 397
Гіперхолестеринемія родинна 283
Гіперхолестеролемія 570
746 / ПОКАЖЧИК
Гіперчутливість 632
негайного типу 476
Гіпоальдостеронізм 346
гіпореніновий 349
Гіповентиляція 620
Гіповолемія 222,226,316,339
Гіпогевзія 178
Гіпоглікемія 268, 306, 317, 321, 323, 324,
331, 369, 371, 455
безсимптомна 324
гіперінсулінемічна новонароджного
тривала 318
гіпогонадна гіпокетонічна 275
неусвідомлена 317
функційна 324
Гіпогонадизм 175, 389
ппергонадотропний 397
гіпогонадотропний 397
чоловічий 397
Гіпокаліємія 310, 466, 471, 516, 589, 664
Гіпокальціємія 516
родинна 42, 43, 360
гіперкальцинурична 360
Гіпокамп 78, 98, 237, 238, 243, 250, 253
Гіпокапнія 637
Гіпоксія 331, 421, 526, 545, 557, 567, 570,
618, 619, 627, 632, 633, 635
анемічна 627, 628, 633
гіпоксична 627, 628, 630, 634
хронічна 631
пстотоксична 627, 628, 634
генералізована 627
застійна 627, 634
ішемічна 627
плоду 495
системна 610
Гіпоменорея 410
Гіпонатріємія 226
дилюційна 227
Гіпопітуїтаризм 328, 341, 346, 365, 374, 375
Гіпопротеїнемія 349, 496, 665
Гіпосмія 175,231
Гіпоспадія 335
Гіпоталамус 102, 214-216, 231, 233, 235,
237, 239-243, 247, 339, 343, 407, 416,
423, 443, 454, 551, 557, 581, 624
задній 185
Гіпотеза
глюкосіатична 220
кишково-пептидна 220
ліпостатична 220
термостатична 220
Гіпотензія 226, 316, 349, 557, 583, 584, 586, 623
орюстаїична 578, 587
положення гранзиторна 579
постуральна 275
хронічна 349
Гіпотермія 236
Гіпотиреоз 43,297-299,301,373
вроджений 301, 303
гіпоталамічний 301
ипофізарний 301
Гіпотонічнісіь 121
Гіпотонія 196
Гіпофіз 215, 298, 300, 303, 341, 343, 345,
363, 375, 385, 443
Гіпофізектомія 324, 329, 339, 346, 368, 374,
373, 415
Гіпофосфатемія 360
Гістамін 96, 136, 245, 27'1,340, 341,469,
476, 541, 545, 546, 573
Гістаміназа 96
Гістидин 96, 270
Гістон 15
Глаукома 138
відкритого кута 138
закритого кута 138
Глібурид 318
Глікоген 263, 266, 267-269, 275, 311, 313,
314, 320, 323, 324, 429, 487, 626, 627
Глікогенез 263, 324, 338
Глікогеноліз 263,266,268,317,323
міофосфорилазодефіцитний 267
Глікогенсинтаза 266, 311
Глікозид наперстянки 73
Глікозилювання 21
білків 25
підвищене 325
Глікокалікс 429, 464
Гліколіз 263,271,612
аеробний 66
анаеробний 66, 264
підвищений 583
Гліколіпід 269
Глікопротеїн 269, 493
СО4 483
Глікосфінголіпід 493
Гліоз 187
Гліпізид 318
Гліцентин 320, 442
Гліцеральдегід 269
Гліцерин 279,314
Гліцерофосфат 435
Гліцерофосфоліпід 435
Гліцин 78, 84, 87, 98, 100, 148, 270, 271, 492
Глія 57
Глобін 490
Глобулін 495
6с 474
кортикостероїдозв’язувальний 333-336
тироксинозв’язувальний 496
, що зв’язує статеві стероїди 393
, що зв’язує стероїдні гормони 496
, що зв’язує тироксин 295
Гломерулонефрит гострий 666
Гломус 618
Глосит 289
Глутамін 270,661
Глутаміназа 661
Глухонімота 298, 301
Глухота 169, 511
кондуктивна 169
несиндромна 170
передавання 169
сенсоневральна 169
синдромна 170
стареча 170
Глюкагон 148, 221, 269, 306, 312, 314,
317,319-323, 330, 331, 339, 361, 371,
442, 446-448, 524
Глюкогенез 313
Глюкоза 66, 221, 260, 263, 267, 276, 278,
317, 319, 321, 323, 330, 338, 369, 431,
432, 567, 651
Глюкозо-1-фосфат 266
Глюкозо-6-фосфат 261, 263, 264, 313, 314,
320,321, 323, 371
Глюкозо-6-фосфатаза 266, 323, 338
глюкозо-6-фосфатдегідрогеназа 489
Глюкозурія 267,313,313,316,654
Глюкокіназа 263,310,317
Глюкокортикоїди 194, 282, 296, 312, 314,
323, 327, 329, 332, 335, 337-343, 345,
3<1<Г тез 3-33 ЗД4. <Н< ОП «П'І
346, 362, 372, 374, 416, 487, 582, 632
Глюконеогенез 264, 267-269, 275, 316, 319,
321, 324, 338, 671
Глюкостат 267
Глюкуронід 462, 656
білірубіну 337
Глюкуронілтрансфераза 462, 463
Глютамат 57, 87, 97, 117, 130, 148, 176, 567
натрію 176
Глютаматдекарбоксилаза 99
Глютамін 57, 78, 567
Гнів 238
Годинник біологічний 217
Гойтрин 305
Голод 217,317
Голодування 273, 275, 276, 316, 324, 369,
371, 469
гіпоглікемічне 349
Голосник 623, 636
Гомеостаз 42
вуглеводів 268
Гонадотропін 376, 377, 385
гіпофізарний 397,411
людини хоріонічний 411
Горб серединний гіпоталамуса 563
Горбик
аксона 45
нижній 161
Гормон 257, 446
А\Р 423
В\Р 423
С\Р 423
Т4 301
адренокортикоїдний 228
адренокортикотропний 228, 363, 327,
328, 335-338, 340, 342, 346, 348, 365,
368,418, 448,584, 589
антидіуретичний 225
гастрин-рилізинг 221
гіпофізотропний 229
глікопротеїновий 37
гонадотропін-рилізинг 148, 211, 229, 240,
385
кортикотропін-рилізинг 229
лютеїнізувальний 228, 363, 364
гормон-рилізинг 229
меланінконцентрувальний 220
меланоцитостимулювальний 375
передньої частки гіпофіза 245
плаценти 412
пролактинінгібувальний 229, 387
пролактин-рилізинг 229
росту 228, 282, 299, 310, 313, 317, 323,
324, 341, 362, 363, 366-369, 371-373,
375, 479,612
хоріонічний 411
росту-інгібувальний гормон 229
росту-рилізинг гормон 229
соматотропін-рилізині 370, 373
тиреотропний 228, 291, 363
тиротропін-рилізинг 148, 229, 448
ппофізіотропний 299
фолікулостимулювальний 228, 363
, який стимулює виділення андрогенів
надниркових залоз 385
Гормони
контрінсулярні 317
статеві 327, 328, 346, 377
стероїдні 275, 327
тиреоїдні 72, 260, 271,282, 298, 299,
323, 362, 372, 373, 416, 562, 612
Гострота зору 155
Грам-калорія 258
Гребінь ампульний 162
їрип
Груди есгрогенозалежні 415
Грудка харчова 448
Група
Ерлянгсра і Гассера 118
ПОКАЖЧИК / 747
крові 493
нейронів вентральна 616
нейронів дорсальна 616
Гуанілатциклаза 40, 104, 148, 423, 448, 647
Гуанілін 448
Гуанін 16
Гуанозинмонофосфат циклічний 40, 147,
448
Гуанозинтрифосфат 261
Гурчання 451
Генератор
програмний центральний 214
руховий 195
Генерування енергії 264
Гравітація 578, 606, 607
Градієнт
гідростатичний 540
електричний 6, 28, 453
концентрації 4, 6, 453
осмотичного тиску 540, 651, 657
парціального тиску 611
Ро2 альвеоло-капілярний 625
термічний 233
хімічний 4, 28
Гранула
альфа 488
базальна 14
зимогенна 448, 457
секреторна 357, 448
щільна 487
Гранулоцит 474,587
Ґудзик кінцевий 45
Дальтон З
Двигун молекулярний 13
Дегенерація
Валлєра 47, 108
волоскових клітин 169
колбочок 155
чорноречовинно-смугастої системи 200
Дегенерином-1 ссавців 177
Дегідратація 222,228,313,316,669
Дегідрогеназа
глутамінова 661
НАДН 10
Деґрануляція 475, 476, 582
Дезамінування 264, 271
окиснювальне 271
Дезоксигемоглобін 612
Дезоксикортикостерон 332, 340, 345, 346,
588, 589
Дезоксирибонуклеаза 430
Дейодаза 296
Дейтераномалія 154
Дейтеранопія 154
Дейтерій оксид З
Декомпозиція рухів 206
Декомпресія 637, 638
Декортикація 198
Дексаметазон 333
Делеція
клональна 486
основи гена 493
Демеклоциклін 227
Деменція стареча 251
Демінералізація кісток 360
Демпінг-синдром 457
Дендрит 45, 83
верхівковий пірамідних клітин кори
головного мозку 77
Денервація 67
Деоксигенація 611
Деоксикортикостерон 100
Деполяризація 51
слідова 49
Депресія 243, 565
дихальних нейронів 631
довготривала 106, 250
Депривація 185
Дерматит 289
лусковий 290
Дермографізм
білий 572
червоний 572
Десенсибілізація 33, 87
гетерологічна 87
гомологічна 87
Десенситизація 113, 175
Десинхронізація 182
Десмосома 14
Деструкція мозочка 196
Детектор ознак 151
Детермінація статева 381
Детрузор 667
Дефекація 469
Дефект
У2-рецептора 228
міжшлуночкової перегородки вроджений
523
нервової трубки в дітей 289
поля зору частковий 156
Дефензин 476
Дефібрилятор електронний 511
Дефіцит
вітаміну В 654
дофамін-р-гідроксилази вроджений 578
заліза 287
інсуліну 316
панкреатичної ліпази 435
селену 296
сурфактанту 602
тіаміну 590
утилізації глюкози 314
Деформування судин 282
Дефосфорилювання 351
Дефосфофосфорилаза 266
Дивергенція 79, 128, 142
Дигідроепіандростерон 332, 334, 338, 393,
412
Дигідропіридин 63
Дигідротестостерон 335, 379, 394
Дигоксин 591
Дизгенезія гонад 386
Дизопропілфлюорофосфат 213
Дизосмія 175
Дийодтирозин 293
Дикумарол 499
Дилатація
артеріол 580, 586
аферентних 423
капілярів 586
прекапілярних сфінктерів 580
Динамін 25
Динеїн 13
аксонемний 13
цитоплазматичний 13
Дипептид 433
Дипептидаза 430
Диплопія 156
Диполь кори 183
Дисахарид 429
Дисбактеріоз кишковий 469
Дисгевзія 178
гонад 373, 381
Дисгенезія сім’яних канальців 381
Диск
анізотропний 58
вставний 70
зоровий 140
ізотропний 58
Меркеля 111, 129
Дислексія 253
Дисменорея 410
Дисметрія 206
Дисплазія бронхопульмональна 637
Диспное 591,627,638
Дистрес дихальний 632
Дистрофін 60, 69
Дистрофія
м’язова 69
Бекера 69
Дюшена 69
симпатична рефлекторна 13 5
сітківки вроджена 149
Дисфункція
систолічна 590
діастолічна 590
Дифузія 4, 540
міжклітинна пасивна 650
нейонна 6, 662
пасивна 653
полегшена 28, 309, 650, 653
проста 432
Дихання 193
внутрішнє 593
зовнішнє 593
Куссмауля 315, 620
механічне 639
періодичне 636
плоду 574
рот у рот 510,639
спонтанне 616
Чейна-Стокса 636
штучне 634-636
Дихромати 153, 154
Діабет 578
бронзовий 438
вторинний 325
метагіпофізарний 320
метатиреоїдний 320, 323
нецукровий 227,228,312,657
нефрогенний 42, 228
цукровий 221, 267, 276, 285, 306, 312,
314, 323, 325, 326, 338, 349, 374, 589,
635
другого типу 325, 326
інсулінозалежний 100, 325
інсулінонезалежний 325
інсуліностійкий 340
некомпенсований 273
першого типу 318, 325, 486
ювенільний 325
Діазепам 100
Діазоксид 319
Діаметр судин опору 588
Діамінооксидаза 96
Діапедез 474, 476
Діарея 290, 436, 470
Діастола 517, 518, 568
пізня 517
рання 518
Діафораза НАДФН 104
Діафрагма 450, 597
Діацилгліцерол 31,37,38
Діетилстильбестрол 405
Дієта
з високим вмістом Са2+ 579
низьковуглеводна високожирова 276
низькофенілаланінова 94
Ділянка
асоціативна 252
переднього мозку 252
скронева 252
748 / ПОКАЖЧИК
тім’яно-скронево-потилична 252
вазомоторна 551
гіперваріабельна 486
кори головного мозку слухова 254
передоптична 185
сенсорна 128
слухова 128
середнього мозку дорсальна 242
соматосенсорна І 127
соматосенсорна II 127
субендокардіальна 518
ТАТА 18
тім’яної частки 137
Діоксіацетонфосфат 264, 269
Діоптрія 143
Діурез
водний 658, 659
осмотичний 222,313,659
дегідратаційний 316
Діуретик 591
осмотичний 659
тіазидний 665
Дія
динамічна специфічна 218, 232, 259
дозвільна 339
інотропна 525, 553
інсуліну 308
мускариноподібна 91
теплоутворювальна 297
трофічна 445
фосфатурична 359
хронотропна 525, 553
Діяльність
м’язова 188
рухова довільна 188
ДНК 15,273,338,343,344,421,500
геліказа 43
генів 582
мітохондріальна 10
ДНК-полімераза 18
ДНК-фінгерпринту 494
Довжина спокою 64
Доза відстежувальна 293
Дозрівання
передчасне гонадотропінонезалежне 386
статеве 385, 426
передчасне 373, 385
Доктрина
Монро-Келльє 566
специфічних нервових енергій 114
Донор 487
Дослідження радіоімунологічне 308, 317
Дотик 129
ДОФА декарбоксилаза 92
Дофамін 31, 87, 90, 94, 96, 148, 149, 211,
215, 216, 242, 245, 253, 301, 327, 329,
331,361,387, 564, 587,646
дофамін Р-гідроксилаза 92, 93
Дратівливість 290
Дренаж лімфатичний 532
Дуга
аорти 552, 577
моносинаптична 117
полісинаптична 117
рефлекторна 117
Ейкозаноїди 283
Еквівалент З
бурси 482
Еквівалентність електрична З
Екзон 16, 18
Екзопептидаза 433
Екзофтальм 301, 303
Екзоцитоз 11, 25, 26, 78, 250, 307, 317, 433,
475, 529
Еклампсія 589
Екскреція
азоту 298
білірубіну 462
Експортер 16
Екстаз 242
Екстазі 243
Екстерорецептор ПО, 171
Екстирпація
лімбічних структур 240
нової кори 239
Екстракція кисню 581
Екстрасистола
передсердна 511
шлуночкова 511
Екстрасистолія 509
Ектоензим 416
Екхімози 579
Еластаза 430, 433, 476
Еластичність легень 599, 600
Електрогенез потенціалу дії 51
Електрограма пучка Гіса 506
Електрод
СО2 675
активний 501
Електроенцефалограма 179, 181, 187
Електрокардіограма 502, 503, 507, 513
Електрокортикограма 181
Електроліти 347
Електроміограма 68
Електроміографія 68
Електроретинограма 149
Електрошок 187
Елемент регуляторний 18
Елімінація СО2 620
Емаль зубів 354
Ембол 500
Емболія
легеневої артерії 500
легень 608
повітряна 544, 590, 635, 638
Емісія 392
Емоції 214,237
Емфізема 601,632,633
Еналаприл 420
Еналкірен 420
Ендокард 500
Ендолімфа 160, 161, 163, 164, 167, 170, 171
Ендоморфін 1 102
Ендоморфін 2 102
Ендопептидаза 430, 433
нейтральна 424
Ендорфіни 363
Ендосома
пізня 25
рання 25
Ендотелій 498, 529, 531, 533, 571
лімфатичних судин 531
Ендотелій 102, 531, 546-548
Ендотелій-1 547
Ендотелін-2 547
Ендотелін-3 547
Ендотоксин 586
Ендоцитоз 25, 26, 33, 78, 281, 294, 308, 311,
433, 457, 529, 650
клатрин-опосередкований 25
конститутивний 25
рецепторопосередкований 281
Ензим 9,28,429,581
ангіотензин-ІІ-перетворювальний
зародковий 391
ангіотензиноперетворювальний 416,
420, 610, 646
термінальний 417
соматичний 417
відщеплення бокового ланцюга 333
ендотеліноперетворювальний 547
Енкефалін 101, 134, 148, 246, 363, 407
Енкефаліназа 102
Ентерит 289
Ентерогастрон 455
Ентерокіназа 458
Ентеропептидаза 430, 458
Ентероцит 429, 432, 435, 457, 465
Енурез нічний 187
Енцефаліт 241
Енцефалопатія 187,560,564
гепатична 469
Еозинофіл 339, 474, 476, 632
Епібатидин 135
Епікард фіброзний 520
Епілепсія 187,242
Епіневрій 53
Епіталамус 179
Епітелій
високопроникний 650
гермінативний 564
пігментний 139
Епіфіз 352, 368, 424, 426, 563
Ерадикація НеІісоЬасіег руїогі 456
Ерекція 195, 392
прутня 547
Еритробластоз плоду 495
Еритроміцин 447
Еритропоез 421
Еритропоетин 416, 421, 477, 478, 585, 630,
666
Еритроцит 339, 473, 489, 579
Ерозія 456
Естрадіол 405
Естріол 401
Естроген 34, 228, 239, 271, 328, 332, 336,
338, 355, 361, 362, 372, 373, 377, 400,
401,404, 405,416, 589
синтетичний 405
Естрон 401
Еструс 239, 240, 401
Етерифікація 435
Етидронат 355
Етіохоланолон 338, 394
Етрадіол 335
Еукаріот 9
Ефект
білкового резервування 275
Віндкесселя 536
водоспаду 607
Вольффа-Чайкоффа 304
Галдана 614
Доннана 6, 648
Доплера 532
інсуліну
анаболічний 311
фізіологічний 308
калорійного обмеження 43
кінцевий 627
лавини імпульсів 168
наркотичний 637
осмотичний 542
“свідка” 486
сили тяжіння 537
складаного ножа 121
Ехокардіографія 521
Еякуляція 195,228,389,391,392
Євнухоїдизм 397
Ємність
буферна рідин 4
легень
дифузійна 605
ПОКАЖЧИК / 749
дихальна максимальна 597
життєва 599
Жах 242
Желатин 433
Желатиназа 433
Живлення 257
Жир 258,287,435
білий 278
бурий 233, 278
нейтральний 275, 276, 278
Жовтяниця 462, 564
каротинова 298
механічна 500
ядерна 495, 564
Жовч 281,287,440,457-460,463
Жорсткість легень 603
Жування 159, 448
Завитка 159-161
Загасання 249
критичне 166
Загибель клітини запрограмована (апоптоз)
22, 54, 80, 200, 411, 421, 482, 483
Заїкання 255
Закінчення
аксо-аксонне 77
вторинне 118
дифузного типу із повільною адаптацією
130
нервове больове 175
еферентного волокна
пластинчасте 118
протяжне 118
Руффіні 111,129
чутливе
гроноподібне 118
кільцево-спіральне 118
Заклякання 67
Закон
Белла-Мажанді 117
Вебера-Фехнера 114
дифузії Фіка 4
Лапласа 527, 535, 545, 600, 667
Ома 534
“усе або нічого” 49, 77, 82, 117
Франка-Старлінґа 72, 525, 528, 653
Закреп 470, 471
Закриття
дихального шляху 603
епіфізів 372, 373
Закрутка
веретеноподібна 255
зацентральна 128, 130, 137, 176, 179,
190
морського коника 253
поясна 131
присередня лобова 131
скронева верхня задня 253
Залежність 242
Залишок хіломікронний 280
Залізо 438
Залоза
Боумена 172
Брюннера 464-466
дуоденальна 464
загрудинна 225
кишкова 464
Купера 389
Ліберкюна 464
молочна 400,404,413
надниркова 329, 330, 424
паращитоподібна 350, 357, 359
передміхурова 283, 389, 394
підшлункова 321, 430, 448
слинна 429, 430, 448
сльозова 142
фон Ебнера 434
шишкоподібна 424
щитоподібна 291, 301
язикова 429, 430
Залучення рухових одиниць 68
Запалення 285, 582
дихальних шляхів 632
Запаморочення 171
Запис електроенцефалограми
двополярний 181
однополярний 181
Записування ЕКГ
біполярне 503
уніполярне 503
Запліднення 228, 410
іп уііго 411
Засіб
гіпоглікемічний пероральний 318
контрацептивний 397
оральний 407
лікувальний
антихолінергічний 201
відволікальний 134
протимігренний 243
послаблювальний мінеральний 437
протизапальний нестероїдний 285
седативний 587
Заслона клубово-сліпокишкова 464, 467
Застій
жовчі 463
крові 579
Затримка
в АВ-вузлі 503
води 542
дихання 622
розумового розвитку 291, 298
росту 311
сечовиділення 193
синаптична 82, 122
центральна 118
Захворювання
автоімунне 301,486
легеневе обструктивне хронічне 636
нирок 591
Заціпеніння м’язів 132
Защіпка лейцинова 20
Збентеження 317
Збільшення проникності капілярів 586
Збудження 47, 182
пресинаптичне 85
Зв’язка
кришталика 138, 144
Трайтца 464
Зв’язок
автокринний 33
аферентний 238
головний лімбічної системи 238
ендокринний 32
еферентний 238
зворотний 408
біологічний 249
канальцево-клубочковий 654
міжклітинний 14, 32, 33
нервовий 32
паракринний 32, 323
пептидний 269
фетоплацентарний 412
юкстакринний 33
Зв’язування
білкове 295
гетерофільне 14
гомофільне 14
Звикання 105, 113
Звук 164
Звуки Короткова 533, 538, 539
З’єднання
верхівкове 164
міжендотеліальне 530
нервово-м ’ язове 106
Зигота 16
Зимоген 452
Зілеутон 632
Зіниця 138, 142, 212
Арджилл-Робертсона 144
Зір
бінокулярний 156
денний 143
кольоровий 152
нічний 143
скотопічний 143
сліпого 157
фотопічний 143
Злиття 156
Зміна фізична 237
Знебарвлення емалі 354
Зниження температури 546
Зоб 303
екзофтальмічний 301
йододефіцитний 303
Зобоген природний 305
Зображення ядерно-магніторезонансне 127
Зона
17-та 140
адгезії 14
Брока 253, 254
вазомоторна 587
Верніке 253, 254
замикальна 352
злипання 14
клубочкова 328, 334, 348
медулярна синхронізувальна 185
проекційна 176
прозора 410
пускова хеморецепторна 215
пучкова 328, 334
сітчаста 328, 334
сну 217
передньомозкова базальна 185
сонна проміжного мозку 185
хеморецепторна 563
Зрілість псевдостатева швидкозріла 338
Зріст 260
Зсідання крові 496-498
внутрішньосудинне дисеміноване 500
Зубець
А 506
Н 506
Р 503-505,509,511
9 505, 515
Я 505,515
8 505
Т 504,505
Зупинка серця 638
Ізолейцин 270, 271
Ізомальтаза 431
Ізоформа
важких ланцюгів міозину 65, 72, 299
моноамінооксидази 94
Ілеостомія 470
Імплантація 410, 411
дофамінопродукувальної тканини 201
Імпортер 16
Імпульс нервовий 47
Імпульсація нейронів довгастого мозку 616
Імунітет 477
вроджений 478
гуморальний 482
750 / ПОКАЖЧИК
клітинний 482
набутий 478, 482
секреторний 434, 485
Імуноглобулін 474, 484
КЬ- 495
секреторний 433, 485
Імуносимпатектомія 55
Інгаляція 604
Інгібін 40,377,391,396,397
Інгібітор
ангіотензиноперетворювального ензиму
591
гормону росту 635
карбоангідрази 13 8
натрійуретичний 549
Інгібування рефлексів розтягування 198, 201
Індекс
вільного тироксину 295
вільного трийодотироніну 295
маси тіла 285
серцевий 525
Індол 271, 469
Індоламін 243
Індометацин 285, 420, 576
Ініціатива 193
Іннервація
неадренергічна нехолінергічна 596
реципрокна 84, 120,616
серця 553
Інозитолтрифосфат 37, 261
Інсулін 31, 275, 282, 306, 307, 309, 313, 317,
318, 322-324, 330, 362, 372, 373
Інсулінома 324
Інсульт 325, 355, 488, 546, 567, 637
геморагічний 567
ішемічний 567
Інтеграція
нервових імпульсів 45
спінальна 192
Інтегрин 474, 476, 582
Інтенсивність 152
обміну 257
Інтервал
АН 506
НУ 506
РА 506
РІ 512
РН 509,512
Інтерлейкін 22, 416, 479, 634
Інтернейрон 79, 84, 188
гальмівний 85
Інтерорецептор 110
Інтерферон 478
Інтима 528
Інтоксикація 290
водна 339, 349, 468
Інтрегрин 14
Інтрон 18
Інулін 647, 655
Інфантилізм 373
Інфаркт 99
гіпофіза 376
кишки 571
лівого шлуночка 587
міокарда 282, 296, 325, 355, 488, 499,
513, 546, 547, 556, 570, 588, 589, 637
гострий 515
міжшлуночкової перегородки 515
Інфекція
вірусна 236
грибкова 236
Інфікування сечовивідних шляхів 193
Інфільтрація печінки жирова 466
Інформація генетична 16
Іррадіація 133
подразника 123
Ішемія 586
головного мозку 508
міокарда 568
мозкова 585
церебральна 584
їжа 372
Йод 293, 303
Йодид 293, 305
Йодотирозиндейодаза 294, 296
Кавеолі 25
Кавеолін 25,419
Кадгерин 14
Калитка 389, 391
Калідин 548
Калій 316,435
Калікреїн 498, 549
плазми 549
тканинний 549
Калориметр 258
Калориметрія 258
непряма 258
пряма 258
Калорія 258
мала 258
стандартна 258
Калпаїн 399
Кальбіндин 36
О 356
О28К 356
О9К 356
08 356
Кальмодулін 36, 106, 487
Кальцидіол 356
Кальциневрин 36
Кальцинеурин 487
Кальцитонін 291, 50, 361, 362
Кальцитріол 356, 438
Кальцифікація 354
Кальцій 350,369,438
Камера
ока передня 138
сцинтиляційна багатокристалічна 569
Камертон 167, 169
Камінь
жовчний 322, 463
кальційвмісний 653
Канабіноїд 104, 135, 215
Канал
Са2+ 30, 105
Ь-типу 502,619
Т-типу 502
повільний 70
потенціалозалежний 317
СІ- 31,633,653
К+ 53,317,419
О2-чутливий 619
внутрішньоспрямований ректифіка-
ційний 29
АТФ-інгібований 318
АТФ-чутливий 318,619
№+ 53
амілоридинінгібований 31
епітеліальний 30,113,589,601
водний 656
гаверсовий 351
йонний 9, 27, 29
перетинчастий 162
півколовий 159, 162, 171
слуховий зовнішній 159,171
Шлемма 138
, що відкривається/закривається лігандом
27
Канадець
дистальний звивистий нефрону 351, 642
проксимальний звивистий 267, 642
сім’яний звивистий 389
Капіляр 528, 596
активний 541
жовчний 459
лімфатичний 541
мозку 560
неактивний 541
перитубулярний 642
фенестрований 307
Капсаза-1 200
Капсаїцин 131,555,556
Капсула
внутрішня 198
ниркова 645
Шумлянського-Боумена 641,649
Каптоприл 178, 420, 568
Карбаміносполука 614
Карбамоїлтрансфераза 271
Карбамоїлфосфат 271
Карбоангідраза 453, 614, 660, 661, 672
Карбоксигемоглобін 491, 628, 634
Карбоксилювання 21
Карбоксипептидаза 430, 433
Карбомонооксигемоглобін 634
Кардіоміопатія гіпертрофічна 73
Карієс 287, 354, 449
Каріотип 378
хромосом чоловіка нормальний 379
Карликовість 291,301,360
гіпогонадна 287
Карнітин 275
Каротинемія 298
Карта
ДНК характерна 17
сенсорних зон кори 127
соматосенсорна 128
Карцинома
грудей 415
естрогенозалежна 415
простати 415
андрогенозалежна 415
щитоподібної залози 362
Каспаза 23
Кастрація 241, 396
Катаболізм 193,257
білків 372
гемоглобіну 492
глюкози 263
жирів 316
катехоламінів 94
Кагал аза 476
Катепсин К 11
Катетер серцевий 522
Катехоламіни 73, 220, 260, 271, 282,313,
323, 327, 329-331, 339, 340, 420, 423,
523, 524, 584
Катехол-О-метилтрансфераза 94
Каузалгія 135
Кахексія 375
Кашель 214,623,624
Квадриплегія 193
Кеп-сайт 20
Кератиноцит 582
шкіри 356
Керніктерус 564
Кетамін 98
Кетоацидоз 316
діабетичний 316,321,671
Кетогенез 324
Кетоз 340
Кетонемія 276,312,314,316,324
ПОКАЖЧИК / 751
Кислота
З-метокси-4-гідроксиманделова 93, 329
3,4-дигідроксиманделова 94
5-гідроксиіндолоцтова 94, 654
5-гідропероксиейкозатетраєнова 285
р-гідроксимасляна 276
у-аміномасляна 57, 99, 78, 87, 104, 148,
173, 205,441
у-карбоксиглутамінова 270
р-аміногіпурова 645
арахідонова 106,283,284,341,546
аскорбінова 438, 468
аспарагінова 270,416
ацетатна 261
ацетооцтова 276
ванілілманделова 94
гліцирхітинова 345
глутамінова 270
глюкуронова 337
дезоксирибонуклеїнова 15
дезоксихолева 461
діетиламідлізергінова 243
ейкозатетриєнова 285
етакринова 665
жирна 275, 276, 283
вільна 67, 278, 279, 281, 314, 316,
321,323, 324, 369, 372
коротколанцюгова 435
жовчна 332,460,461,469
ліноленова 283
літохолева 461
мевалонова 282
нуклеїнова 274, 434
пантотенова 289
ретинова 35
рибонуклеїнова 16
сечова 274
соляна 447,451,452,455
уридиндифосфоглюкуронова 462
фолієва 289,271,466,468
фосфорна 434
хенодезоксихолева 461
холієва 461
Кислотність титраційна 661
Киста над турецьким сідлом 375
Кишеня Ратке 364, 375
Кишка
голодна 447, 464
дванадцятипала 447, 454, 459
клубова 431,435,464
нерухома 467
ободова 431
товста 467
тонка 464
Кілодальтон З
Кілокалорія 258
Кіназа
білкова 436
глюкокортикоїдорегулювальна 344
кальмодул і незалежна легких ланцюгів
міозину 75
м’язово-специфічна 109
натрійрегулювальна 344
серинова 421
тирозинова 368, 419
треонінова 421
фосфорилази 36, 266
Кінезин 13
Кінець
гідрофільний 8
гідрофобний 8
Кінін 548
Кініназа І 548
Кініназа II 548
Кініноген високомолекулярний 498, 549
Кіноцилія 163
Кістка
губчаста 351
компактна 351
трабекулярна 351
Кісткоутворення недосконале 354
Кісточки слухові 159
Кіфоз 355
Клапан
аортальний 517, 521, 568
атріо-вентрикулярний 518, 520
венозний 531, 543
легеневого стовбура 517, 521
митральний 517, 521
тристулковий 506, 517, 521
Класифікація
органів чуття 110
факторів зсідання крові 497
Клатрин 26
Кліренс
р-аміногіпурової кислоти 532
креатиніну 647
речовини 647
Клітина 1,7-16
А 306,320
АРШ 443, 595
В 306, 308, 312, 317, 369, 448, 483, 484
пам’яті 482, 484
О 306,448
Р 306
О 443, 448
І 446
ІСА 209, 329
К 447
Ь 320
М 149,434,485
Мо 447
МК 481
Р 344,501
8 446
Т6 443
Т пам’яті 482
Т хелпер 482, 483
Т цитотоксична 481-483
агранулярна 419
адреналіновмісна 329
адреналінопродукувальна 327
адренергічна внутрішньосерцева 209
амакринна 139, 148, 149
антигенопрезентувальна 483
біполярна 139, 140
волоскова 159, 167
внутрішня 161
внутрішнього вуха 162
зовнішня 161
органа слуху 113
вставна 642, 660
гангліонарна 139, 140, 154
велика 149
мала 149
сітківки 138
гліальна 45
гломусна 618
типу І 619
головна 344, 357, 451, 642
гонадотропна 364
горизонтальна 139, 149
Ґольджі 204, 205
дендритна 474, 483
диплоїдна 18
ендотеліальна 488, 499, 529-531, 560,
586
ворсинчаста 560
капілярів мозку 562
ентероендокринна 442
ентерохромафінна 215,443,454
епітеліальна 582
альвеолярна 586
еуплоїдна 18
зерниста 173
зерноподібна 204
зимогенна 451
зірчаста 204, 205, 364
Кажала інтестинальна 441
келихоподібна 465
кортикотропна 364
кошикова 77, 85, 204, 205
Купфера 235, 358, 459, 474, 477
лактотропна 364
Лангерганса 474
дендритна 483
Лейдіґа 378, 387, 393, 395
лютеальна 399
мамотропна 364
мезангіальна 423, 548, 641, 648
митральна 173
мікроглії 57
міоепітеліальна 228
Мюллера 139
м’язова 58
гладка 282
норадреналінопродукувальна 327
оксинтна 451
оксифільна 357
опорна 163
пам’яті 478
парафолікулярна 361
парієтальна 445,451-453,456
Пейнета 448
пептична 451
пилова 609
підтримувальна 163
піниста 282
пірамідальна 179
плазматична 482, 484, 487
плоска полярна 142
плюрипотентна 477
стовбурова 474
повна 96
поляризована 9
постсинаптична 77
пресинаптична 77
приклубочкова 173
проста 150
Пуркіньє 85, 204-206, 250, 548
пучкова 173
Реншоу 85
рецепторна нюхова 172
рецепторна смакова 177
секреторна 364
Сертолі 378,387,389,391,395
складна 150
соматотропна 364, 372
стовбурова 352,421
тетраплоїдна 18
тиреотропна 364
тотипотентна стовбурова 474
хеморецепторна 215
каротидна 627
цитотоксична природна 481
Шванна 45, 47
юкстагломерулярна 347, 419, 420, 646
Клітина-мішень 482
Клітина-попередник 474, 478
Клітини острівців Лангерганса 306
Клітка грудна бочкоподібна 632
Клітковина 469
752 / ПОКАЖЧИК
Клон 483
Клонус 122
Клофібрат 282
Клубочок 204
аортальний 618-620
каротидний 618, 620
нейрофібрилярний 252
нюховий 173, 174
Коарктація аорти 589
Кобальт 287,421
Коваделко 159, 166
Ковтання 159, 214, 449, 624
Код генетичний 21
Кодон 21
Кодування 114
пам’яті підсвідомої 250
пам’яті свідомої 250
Коензим А 261,271
Коефіцієнт
дихальний 258, 567
клубочкового фільтрування 648
корисної дії скелетних м’язів 67
Кокаїн 90, 242
Колаген 10, 352, 369, 488, 582
першого типу 352
Колапс 324, 349
легень 632
судинний 339
Колатераль підтримувальна 108
Колба Краузе 111
Колбочка 139,141,146,217
Коліка кишкова 467
Коліпаза 430, 434
Колір
комплементарний 152
первинний 152
Коліт виразковий 582
Коло
Віллізія 559
кровообігу
велике (системне) 473
мале (легеневе) 473
ревербераційне 123
Колоїд 291,294
Колонектомія 469
Колонка
домінування очей 151
орієнтаційна 150, 151
Колхіцин 274
Кома 185,312,315-317
гіперосмолярна 316
печінкова 567
Компенсація 206
ацидозу респіраторна 674
ниркова 673
Комплекс
(Ж8 504,505,509,510,512
адгезії фокальний 13
вітамінів В 468
гістосумісності основний 483
Ґольджі 79
дистрофінглікопротеїновий 60
моторний мігрувальний 442
пре-Буттзінґера 617
регулювання дихання генераторний 616
стероїднорецепторний 338
тканинної сумісності головний 335
ядерних пор 16
Комплемент 582
Компонент
дієти незамінний 287
секреторний 485
Конвекція 233
Конверґенція 79, 128, 134, 139
Конвертаза 481
Конвульсія 289, 317, 324
Конексин 26 170
Конексон 15
Коник морський (гіпокамп) 78, 98, 237, 238,
243, 250, 253
Контакт
нервово-м’язовий 77
щілинний 14, 15, 77
щільний 14
Контрактура 63
Контрацептив оральний 589
Контрацепція 409
Контроль вазомоторний 551
Конус наростання 80
Конфабуляція 251
Концентрація
міцел критична 461
молярна еквівалента З
плазми осмоляльна 5
Концепція “домінування головного мозку”
253
Координація
збудливо-скоротлива 62
рухів 206
Копуляція 401
Кора 179, 188
великого мозку. 185
внутрішньонюхова 242
головного мозку 179,247,551
задня тім’яна 192
задньо-нижня тім’яна 140
зорова 128, 129, 150, 179
первинна 140, 151
лімбічна 179
лобова 140
мозку 158
мозочка 203
моторна 179, 188, 190, 191,206
ліва 191
права 191
надниркових залоз 327, 328, 332, 584
ембріональна 328
нижня скронева 140
нова 179,238,243,252
нюхова 173
передлобова присередня 243
передмоторна 188, 190, 191
поясної закрутки 238
рухова 129
слухова 129, 161, 169, 179
первинна 161, 168
соматосенсорна 150
Кордотомія передньолатеральна 136
Корінець спинномозкового нерва 560
Короткозорість 145
Кортизол 285, 310, 313, 317, 328, 332, 334-
339, 342, 345, 372
Кортикостероїд 215
Кортикостерон 328, 332, 334-336, 345, 346,
348
Кортикотропін 228
Косоокість 145, 158
Котранспортер
ІЧа7глюкоза 436
Иа+-К+-2СІ 436, 562
Ка+-І~ 293
Котранспортування 432
Иа+ 433
глюкози 433
Кофеїн 39, 177, 185, 455
Крадриплегія 194
Креатин 271, 275
Креатинін 271
Креатинурія 272
Креатинфосфат 261
Кремній 287
Кретинізм 301, 373
Крива
венозного пульсу 543
гістерезисна 602
дисоціації
СО2 617
гемоглобіну 580
міоглобіну 614
оксигемоглобіну 627
релаксації тиску 599
Сіґґаарда-Андерсена 675
толерантності до глюкози 323
Франка-Старлінґа 523, 526
Кривина кришталика 144
Криз тироїдний 299
Аддісона 349
Крипта
кишкова 464
Люберкюнова 448
Криптон 637
Крипторхізм 397
Криптохрома 217
Кристал
кістковий 352
сечової кислоти 11
Кристи 10
Кришталик 138, 144, 145
Кров 473, 532
артеріальна 567
Крововилив 579
у мозок 589
Крововтрата 225, 496, 584, 635
Кровообіг 528, 545, 578
бронхіальний 596
вінцевий 587, 588
легеневий 596
плоду 574
у печінці 571
у тракті шлунково-кишковому 440
церебральний 559
Кровоплин 533,579, 619, 624
вінцевий 568
легеневий 607
мозковий 577
нирковий 645
турбулентний 539
у матці 573
Кровотеча 557
Кромолін 632
Кропивниця 476
Крохмаль 429
Ксантиндегідрогеназа тканинна 586
Ксантиноксидаза 586
Ксенон 637
Ксеростомія 449
Куля бліда 198
Кульгавість переміжна 132
Купол 162
Куріння тютюну 633
Кут
зоровий 145
несучий 404
Лабіринт 160
кістковий 160
перетинчастий 160
Лабіринтектомія двостороння 196
Лаксатин 469
Лактаза 430, 431
Лактат 263, 330, 545, 582, 582, 625
Лактація 240, 388, 400, 413, 414
Лактоацидоз 630
ПОКАЖЧИК / 753
Лактоген плацентарний людини 411
Лактоза 429
Лактоферин 448
Лактоцидоз 316
Ламінін 10, 14, 488, 582
Ланцюг
імуноглобуліну важкий 485
імуноглобуліну легкий 485
флавопротеїнцитохромний 264
Ларингоспазм 350, 636
Леводопа 94
Лейкоз лімфоїдний
гострий 487
хронічний 487
Лейкотрієн 283, 285, 341, 474, 476, 632
Лейкоцит 473, 474
базофільний 474, 476
еозинофільний 474, 476
нейтрофільний 474, 582
поліморфонуклеарний 474
Лейцин 270,271,318,322
Лептин 219,220,385,412
Летаргія 317
Леуенкефалін 329
Лецитин 434
Лецитинхолестерин ацилтрансфераза 280
Лихоманка 285
глюкозна 339
етіохоланолонова 338
Лібідо 239,394,395
Ліганд 33
Лігнін 469
Лізилбрадикінін 548, 549
Лізин 270,275
Лізис
бактерій 481
осмотичний 481, 482
Лізоцим 448
Лізосома 10,25,294,312,487
Лікування
гіпербаричною оксигенацією 635
киснем 634
подагри 274
Лімфа 429, 473, 500, 541, 580
Лімфедема 543
Лімфовузол 478, 482
Лімфогог 542
Лімфообіг 473, 528
Лімфоплин 542
Лімфоцит 339, 474, 477, 478, 500, 579, 582
В 478,482,486
Т 476-478,482,487
цитотоксичний 482
Лінза 143
двоввігнута 143, 145
циліндрична 145
Лінія
М поперечної смуги м’язового волокна
58
X поперечної смуги м’язового волокна
58, 62, 70
росту волосся 395
титрування СО2 677
Ліпаза 281
гормоночутлива 281,314
лінгвальна 430, 434, 448
панкреатична 290, 430, 434
шлункова 430, 434
, активована жовчними кислотами 434
Ліпемія 279, 314
Ліпіди 275, 434
клітинні 278
плазми 279
структурні 278
49 367-2
Ліпогенез 314
Ліпоксин 283, 285
Ліполіз 279,312
Ліпопротеїн 269, 279
високої щільності 280
дуже низької щільності 279
низької щільності 280
середньої щільності 280
Ліпопротеїнліпаза 279,281,314
Літохолати 461
Лобелін 620
Лоботомія префронтальна 136
Лозартан 420
Локалізація звуку 169
Лоскіт 136
Лушпина 198, 200
ядра сочевицеподібного 200
Лютеолізис 408
Лють 240, 241
Мелатонін 425
Макрогетерогенність 443, 446
Макроглосія 301
Макросомія 325
Макрофаг 235, 281, 282, 356, 483, 543, 586
альвеолярний 477, 633
легеневий 356, 595, 609
тканинний 476, 477
Максимум транспортний 652
Малоніл-КоА 314,321
Малярія 490, 492
Мальабсорбція 461,466
ціанокобаламіну 469
Мальтаза 430, 431, 429, 431
Мальтотріоза 429, 431
Маневр Вальсальви 556, 557
Манжета Ріва-Роччі 538
Манітол 659
Маногептулоза 318
Маноза 317
Манозо-6-фосфат 369
Манометр ртутний 538
Марганець 287
Мармуровість емалі 354
Маса 260
речовини молекулярна З
тіла 221,222
Масаж серця 511,512
Маси калові 468
ахолічні 468
Маскування 166
Маскулінізація 394
Мас-спектрометрія 594
Мастектомія радикальна 543
Мастоцит 476, 595, 632
Матеріал перицентріолярний 14
Матка 209, 398
Маточка 159, 162
Матрикс
кістки 352, 354, 368
білковий 193
міжклітинний 10
Мегакаріоцит 487, 488
Мегаколон 468, 470, 548
Медроксипрогестерон 372
Мезентерій 440
Мейоз 16,18,384
Меланін 365, 366
Меланосома 365
Меланотропін 1 365
Меланофор 365, 425
Меланоцит 365
Мелатонін 217,271,424-426
Мембрана
альвеолокапілярна 607
базилярна 9, 160, 167,168
біологічна 9
клітинна 7, 27
люмінальна 429, 435
мітохондріальна 9
плазматична 8
покривна 161, 167
присінкова 160
Рейсснера 160, 167
ядерна 16
Менархе 384
Менопауза 355, 386
Менорагія 410
Месенджер
вторинний 33, 36
первинний 33
хімічний 32
Мескалін 243
Метаболізм 225,257,269,321,581
АКТГ 341
анаеробний 73
ангіотензину II 417
базальних ядер 199
білірубіну 462
білків 269
вільних жирних кислот 281
води 375
вуглеводів 299
глюкози анаеробний 582
естрогенів 403
жирів 275,314
йоду 293
кальцію 350
паратгормону 358
ТТГ 299
фосфору 350
холестеролу 282,299,316
Метаболіт вазодилататорний 570, 573
Металопротеїназа 476
Метанефрин 94
Метартеріола 528
Метгемоглобін 490, 634
Метгемоглобінемія спадкова 491
Метенкефалін 329
Метилксантин 39
Метил меркаптан 173
Метимазол 304
Метионін 270, 271, 275
Метод
вимірювання
артеріального тиску
аускультативний 538
пальпаторний 539
течії крові 532
генного нокауту 20
імуноцитохімічний 86, 246
Кеті 532,564,569
радіоімунологічний 367
рекомбінантної ДНК 571
розведення 521, 522
термодилюції 522
Фіка прямий 521
Форсмана 522
функційного ядерно-магнітного
резонансу 565
Методика мікропункцій 650
Метрорагія 410
Метформін 319
Механізм
аферентного впливу 220
війковий 609
децеребраційної ригідності 195
“кисневого боргу” 66
компенсаторний нирковий 674
754 / ПОКАЖЧИК
концентрування йодиду 293 Модифікація мітохондріальної ДНК 10
негативного зворотного зв’язку 419 посттранскрипційна 20, 21 рецепторна 41
позитивного зворотного зв’язку 419 посттрансляційна 20-22 статевих клітин 303
регулювання постави 192 Модуляція 86 Муцин 448,452,465
регулювання приймання їжі 260 Мозаїцизм ХХ/ХУ 381 Мушля вушна 159
теплорегулювання 234 Мозок М’яз 282
Механорецептор 126 головний 181,374 білий 65
Мигдалик 609 довгастий 189, 214, 443, 551-553, 581, війковий 144
Мислення 247 624 гіпертонічний 121
Миш’як 287 кістковий 421,473,482 гладкий 58, 74, 545, 572
Міастенія 42, 486 жовтий 473 вісцеральний 74
важка 107 червоний 473 поліелементний 74
Мігрень 243, 565 передній 241 окоруховий 157
Мідь 287 проміжний 241 очний 142
Мієлін 45 середній 185, 197, 242, 557 промежини 668
тубулярний 601 спинний 77, 126, 234, 243-245, 551 серцевий 519,579
Мієлома 337, 486 Мозочок 131, 179,188, 189, 202, 206, 244, скелетний 60
Мієлопероксидаза 476 250 спастичний 121
Мікроаденома 376 вестибулярний 202 стремінця 159, 166
Мікроворсинка 175,291,464 новий 188,202 цибулино-печеристий 668
Мікрогетерогенність 443, 446 присінковий 202 червоний 65
Мікроглія головного мозку 477 спінальний 188, 202 черевної стінки 214
Мікроелемент 287 Молекула М’язи
Мікройонофорез 86 Са2+-Н+-АТФ-ази 357 експіраторні 597
Мікропіпетка 86 адгезивна 582 інспіраторні 598
Мікросома 7, 276 адгезії 9 міжреберні зовнішні 598
Мікротрубочка 11, 14, 307, 476 клітинної адгезії 14 М’яз-натягач барабанної перетинки 159, 166
Мікрофіламент 12, 476 Молібден 287 Набір
Мікрофлора 469 Молозиво 413,433 гаплоїдний 16
Мікседема 301, 303 Молоточок 159 хромосом диплоїдний 16
Мілімоль 3 Моль-еквівалент 3 хромосомний
Мімікрія молекулярна 486 Монголізм 381 ХО 380,386
Мінерал 287 Монелін 177 XX 377
Мінералокортикоїди 327, 332, 344, 348, 274, Монітор Холтера 507 XXX 381
578 Моніторинг ХХУ 381
Мінімум роздільний 155 за станом плоду 412 ХУ 377
Міогенін 69 органів грудної клітки 610 УО 381
Міоглобін 491,614,630 Моноамінооксидаза 94, 201 Набряк 542,666
м’язів 626 Моногліцерид 434 легень 591, 599, 629.
Міозин 13, 58, 62, 487 Монойодтирозин 293, 304 мозку 316,629,658
легколанцюгова кіназа 36 Моносахарид 429 щиколоток 542
Міозин-І 13,476 Монохромат 154 Набуття навичок 250
Міозин-ІІ 13,58,74 Моноцит 235, 474, 476 Навантаження фізичне 579
Міозин-фосфатаза 75 Монтелукаст 632 Навичка 248
Міокард 70, 586, 633 Моргання 142 Навігація 255
нефункційний 571 Морфій 631 Навчання 206, 247
Міопатія 273 Морфін 101,134,177,242 асоціативне 248
метаболічна 69 Мотивація 238, 242 неасоціативне 248
тиреотоксична 299 до споживання їжі 221 Над’яєчко 389, 391
Міопія 145 Мотилін 447, 448 Надлишок
Міотомія 451 Мотонейрон 88,188,618 інсуліну 316
Міотонія 69 верхній 189 мінералокортикоїдів видимий 345
вроджена 31 нижній 189 Надподразливість 289
Міофібрил 58 Моторика Накопичення лізосомних хвороб 11
Міофіламент 58 кишки 465 Нанізм 373
Міракулін 178 шлунка 454 психосоціальний 374
Місток поперечний 75 Муковісцидоз 24, 31, 458, 633 Напад ішемічний транзиторний 488
Місячні 397 Мукопротеїн 269 Наперстянка 503, 526
Мітоз 16, 18 Мукоцит 451 Напівдесмосома 14
Мітотан 296 Мускулатура осьова 189 Напруженість внутрішньоміокардіальна 527
Мітохондрія 10, 275, 276, 278, 328, 453, 581 Мутація 16 Напруження війкових м’язів 145
Міфепристон 407 аутосомного гена аквапорину-2 657 Наркоз СО2 623
Міхур вКАЬІО 1 гені 231 Нарколепсія 187
жовчний 322, 434, 463 в гені препропресофізину 227 Насиченість кольору 152
сечовий нейрогенний 668 втрати чи набуття функції рецепторів та Насичення 217
Міхурець сім’яний 382, 394 6-білків 43 Натаскування 247
Міцела 434,461,463 гена У2-рецептора 657 Натиск перистальтичний 465
Мішечок 159, 162 гена лептину 221 Натрій хлорид 422, 435
Мобілізація Са2+ 357 гена рецептора 1,25-дигідроксихоле- Натрійурез 331
Мова 247, 253 кальциферолу 357 Натяг альвеол поверхневий 600
нерозбірлива 324 генів 41 Невагомість 579
неузгоджена 324 інактивувальна 357 Неврит 289
скандована 206 конексонів 15 Недбальство 253
Модель білка стрічкова 270 міозинів нем’язових 170 Недостаність
ПОКАЖЧИК / 755
надниркових залоз 289, 338-340, 342,
345
5а-редуктази 383
вроджена 395
а(-антитрипсину 633
автономна первинна 578
адренокортикального ензиму вроджена
380
аортального клапана 527, 539
бронхіальна 631
вегетативна 557
вентиляційна 630
газообмінного апарату 630
гіпофізарна 374
глюкозо-6-фосфатдегідрогена вроджена
478
глюкуронілтрансферази вроджена 564
дихальна гостра 586
клапанів 521
кори надниркових залоз гостра 349
легенева 600
лейкоцитарних інтегринів вроджена 478
мієлопероксидази вроджена 478
надниркових залоз 312, 323, 366, 669
вторинна 349
первинна 349
третинна 349
ниркова 588, 646
гостра 584, 645
серцева 303, 349, 544, 588, 591, 666
застійна 543, 547, 572, 590, 591
Нейрогіпофіз 563
Нейроглія 57, 424
Нейрокінін А 560
Нейромодуляція 86-89
Нейрон 45, 46, 77, 80, 86, 548
адреналінопродукувальний 245
адренергічний 92
безмієліновий 45
великоклітинний 223
гістамінергічний 245
ГнРГ-продукувальний 231
Ґольджі пляшкоподібний 121
дофамінергічний 92
експіраторний 616
інспіраторний 616
командний 69
норадренергічний 92
короткий 209
постгангліонарний 207, 209
прегангліонарний 207, 209
руховий 46
холінергічний 90
Нейропатія
діабетична 325
спадкова оптична Лебера 24
Нейропептид 632
¥ 93, 103, 212, 213, 219, 322, 501, 551,
560
Нейросекреція 223
Нейростероїд 104
Нейротензин 148, 447, 448
Нейротрансмітер 37, 77, 88, 89, 441, 564
Нейротрофін 54, 55, 57
Нейрофізин 223
Нейрофілін 80
Нейтрофіл 339, 474, 582
Неоваскуляризація 325
Неокортекс 238
Неоміцин 468
Неон 637
Неплідність 411
Непритомність 578
Нерв
симпатичний постгангліонарний 209
блоковий 142
блукаючий 132, 176, 216, 226, 319, 441,
443, 454, 458, 463, 466, 501, 507, 515,
551,553, 566, 580,617
правий 325
буферний 554
відвідний 142
зоровий 140
лицевий 132,209
окоруховий 142, 209
присінково-завитковий 162
симпатичний серця 216
симпатичний підшлункової залози 319
сідничий 443
слуховий 161
соромітний 471
трійчастий 214
холінергічний 550
язикогорловий 132,176,209,553
Нерви черепні 188
Нервозність 291
Нерозходження хромосом 380
Неспання 179,247
Несприйняття
лактози 431
молока 431
Нестача
6ЬиТ 1 325
інсуліну 312
йоду 287, 303
Несумісність груп крові 494
Нетримання 668
Неуважність одностороння 253
Нефректомія 416
Нефрит 648
Нефроз 337, 349, 402, 543, 665
Нефрон
кірковий 642
юкстагломерулярний 642
Нефропатія
гіпокаліємічна 589
діабетична 325
Нирка 421
Ніацин 282, 289, 438
Ніжка
гіпофізарна 215
мозочкова
верхня 202
мостова 202
нижня 202
середня 202
Нізатидин 456
Нікель 287
Нікотин 177,242,246,620
Нікотинамідаденіндинуклеотид 261
відновлений 261
Нікотинамідаденіндинуклеотидфосфат 261
Нікталопія 155
Ніктурія 666
Ністагм 171, 197
постротаційний 171
Нітрат 304, 591
Нітрит 634
Нітровазодилататор 547
Нітрогліцерин 547
Ніфідепін 630
Новокаїнамід 526
Нокаут 360
Номограма 260
Сіґґаарда-Андерсена 675
Норадреналін 87, 92, 209, 212, 220, 232, 244,
245, 279, 298, 299, 319, 327, 329-331,
339, 343,420,425,441, 545, 549, 587, 646
Норметанефрин 94
Носій 9
Ноцицептор 111, 126
Ноцистатин 135
Ноцицептин 135
Нудота 214,627
Нуклеаза 430
панкреатична 434
Нуклеозид 273, 274, 434
Нуклеопротеїн 274
Нуклеосома 15
Нуклеотид 15, 274
Нюх 172
Оберт 165
Об’єм
вдихання 597
видихання резервний 597
внутрішньоклітинної рідини З
дихальний 597
хвилинний 597,618
еритроцитів 2
залишковий 597
інтерстиційної рідини 3, 542, 576
кінцевий 604
кінцеводіастолічний шлуночків 518, 523,
524
кінцевосистолічний шлуночків 518, 526,
527
крові загальний 1, 2
крові, що циркулює 587
мертвого простору 597
плазми 2
позаклітинної рідини 2, 669
поширення сахарози 1
релаксації 600
серцевий хвилинний 298, 299
ударний 523, 526
форсованого видихання першої секунди
597
хвилинний 521, 523, 554, 578
Обіг ендогенних білків 270
Облисіння 289
спадкове 394
Обличчя
акромегалічне 376
місяцеподібне 348
Облітерація артеріальної протоки 576
Облямівка
посмугована 458, 464
щіточкова 429, 433, 434, 642
Обмін
№-Н+ 660
білковий 338
водний 338, 339
вуглеводний 263, 338
жировий 338
основний 259
проміжний 265,338,306,314
протиходу 234
речовин основний 297
стандартний 259
Обмінник
аніонний 435
течійно-протитечійний 657
Оболонка
кишки слизова 430
мозкова 561
тверда 559
павутинна 560, 561
райдужна 138
серозна 440
слизова 440
нюхова 172, 174, 175
судинна 138
756 / ПОКАЖЧИК
ядерна 16
Обструкція 633
верхньої порожнистої вени 544
жовчних проток 463
повітряна 632
тонкої кишки 467
Оварієктомія 411
Овершут 49, 70
Овуляція 175, 231, 398, 400, 401, 406, 408,
499
рефлекторна 401,409
Одиниця
К 532
рухова 68
сенсорна 114
Ожиріння 221,222,285,312
шиї 348
Ознака місця 124
Ознаки статеві вторинні 394, 404
Окиснення 261
жирів 257
білків 257
біологічне 261
вуглеводів 257
Оклюзія 85, 124, 564
Око 138, 146
Окостеніння 287
Оксалоацетат 264,314
Оксигемоглобін 490, 611,612
Оксигенація 611
гіпербарична 544, 634
Окси гемометр 594
Оксид
азоту 104
азоту-синтаза 546
вуглецю 104
Оксинтомодулін 320
Окситоцин 102, 216, 223, 225, 228, 230, 363,
412,413, 563
Олігодендроцит 45, 57
Олігоменорея 410
Олігонуклеотид антисенсовий 21
Олхгоурія 666
Олігофренія фенілпіруватна 93
Омепразол 451, 456
Ондансетрон 215
Онкоген 24
Ооцит вторинний 399
Опіат 242
Опік 296
Опіоїд 135
ендогенний 135
Опір
крові 534, 536
периферійний загальний 580
судин периферійний 535, 588
судинний мозковий 565
Опромінення 215
Опсин 146, 148
Опсонізація 474
Опускання яєчок 397
Орган
вомероназальний 174
Ґольджі сухожилковий 121,122,130
ендокринний 404
Корті 110,161,167,168
лемешево-носовий 174,239
навколошлуночковий 215, 226, 563
нейрогемальний 563
отолітовий 162
субфорнікальний 222, 418, 584
судинний кінцевої пластинки 222, 418,
563
чуття 110, 138
шкірний 111
Органела 7
Організація структурна автономних
відцентрових шляхів 207
Орексин А 220
Орексин В 220
Орієнтація у просторі 171,255
Орнітин 270, 271
Орнітинкарбомоїлтрансфераза 271
Орозомукоїд 496
Ортопное 591, 607
Осмоляльність 4
плазми 222, 227
загальна 5
сечі 656
Осмолярність 4
Осморецептор 222, 455, 593
Осмос 4
Основа серця 521
Остеоартрит 376
Остеобласт 352, 354, 355, 357
Остеокальцин 354
Остеокласт 352, 354, 355, 474
дефективний 354
Остеомаляція 354, 357
Остеон 352
Остеонектин 354
Остеопетроз 354, 355, 357
Остеопонтин 354
Остеопороз 340, 349, 405, 487
дифузний 355
інволюційний 355
Остеофіброма 360
Остеоцит 351,352
Острівець підшлункової залози 443, 448
Острівці Лангерганса 306
Осцилоскоп катодний 48
Отвір
Люшка 560
Маженді 560
Отоконія 162
Отоліт 162
Отруєння
водне 658
ціанідами 634
чадним газом 628, 633, 635
Оубаїн 424
ендогенний 549
Офтальмоскоп 140
Пазуха сонна 552, 553, 577
Паклітаксел 12
Паличка 139,141,146,217
Корті 161
нюхова 172
Пальмітоїлетаноламід 104
Пальці цинкозв’язані 20
Пам’ять 247
довготривала 247, 251
епізодична 247
короткочасна 247
підсвідома 247
робоча 247, 250
свідома 247
семантична 247
Пангіпопітуїтаризм 373, 386
Панкреатектомія 312,318
повна 325
Панкреатит
гострий 458
хронічний 325
Пантотенат 438
Параганглія 327
Параліч
діафрагмального нерва білатеральний 598
клубової кишки 467
млявий 189
спастичний 189
тремтячий 200
Параплегія 193
Паратгормон 350, 351, 355, 357-359, 362
Паратиреоїдектомія 360
Паратіон 213
Паркінсонізм 200
Пастка
V білків 26
Т білків 26
Патогенез гарячки 235
Пауза компенсаторна 511
Пелагра 289
Пеніциламін 178
Пентоза 264, 431, 432
Пепсин 430, 433
Пепсиноген 432, 452
Пепсиноген І 432
Пепсиноген II 432
Пепстатин 420
Пептид 269
С 307,308
РТНгР 360
¥¥ 447, 455
гастрин-рилізинг 455, 448
гідрофобний сигнальний 16
глюкагоноподібний 1 320
глюкагоноподібний 2 320
, залежний до паратгормону 350, 359,
360
з’єднувальний 307
кальцитонінгензалежний 361
кишковий 221
натрійуретичний 422, 423
С-типу 422
мозковий 422
передсердний 549
опіоїдний 101, 102, 246, 407
пресорний 589
проміжної частки кортикотропіно-
подібний 364
сигнальний 21
трефоїловий 452
Пептидаза 430
Передавання
звуків 166
однонапрямлене 79
Переднавантаження 523
Передпотенціал 502
Перелом
Колліса 355
черепа 561
Переміщення
пам’яті міжкіркове 249
хлору 616
Перенесення енергії 261
Переносник глюкози 309
натрійзалежний 309
Перерозподіл крові 584
Перетинка барабанна 159,164,166
вторинна 161
Перетяжка Ранв’є 51
вузлова 45
Перехрестя зорове 140,156
перерізане 249
Перешийок щитоподібної залози 291
Перешкода судинна 534
Перикард 518
Перилімфа 160, 163, 166, 167
Периметр 156
Периметрія 156, 157
Перистальтика 441,465
ПОКАЖЧИК / 757
кишкова 467
Перицит 530, 641
Період
абсолютної рефрактерності 50, 71
відносної рефрактерності 50
дозрівання статевого 373, 384, 424
латентний 48
“наздоганяння росту” 373
передвикидання 520
півжиття 299
біологічного 226
підлітковий 384
пренатальний 601
пубертатний 372, 384
рефрактерний 50
росту 372
уразливий 511
фертильний 401
швидкого наповнення шлуночків 521
Перйодат 304
Пероксид водню 293
Пероксисома 11
Пертехнетат 304
Перфорин 481,482
Перфузія 603, 607, 608
капілярна 585
тканинна 587
Перхлорат 293, 304
Петля
Генле 351,542,655,657
присередня 176
Печера фолікулярна 397
Печінка 267, 271, 276, 281, 421, 459, 460,
473, 582
Пил вушний 162
Пипка дуоденальна 457
Пиття обіднє 222
Півкуля
домінуюча 253
категорична 253, 565
мозочка 202
репрезентативна 253
Піґмент
довгохвильовий 153
жовчний 460
зеленочутливий 153
короткохвильовий 153
світлочутливий 153
середньохвильовий 153
синьочутливий 153
червоночутливий 153
Пігментація 349
плямиста 349
шкіри 365
Підвищення
альвеолярного Ро2 631
артеріального тиску 564
здатності до автоматії 509
серединне 215
серединне гіпоталамуса 230
температури 545,580,581
центрального венозного тиску 424
Підгрупа крові 493
Підйом дикротичний 520
Підсилення
негативне 249
позитивне 249
Пізнання 237
Пікнодисостоз 11
Пік-потенціал 49
Пінказа 25
Піноцитоз 25
Піраміда ниркова 225
Піридоксин 289, 438
Піримідин 273
Піроген ендогенний 235
Піруват 66, 263, 314, 321, 323
Піруваткарбоксилаза 314
Післянавантаження 523
Пісок епіфізарний 424
Пітуїтоцит 364
Піхва 398
Плазма 1,473,495,535,579
Плазмін 499, 571, 582
Плазміноген 571
урокіназного типу 499
Пластина базальна 9
Пластинка
волокниста 161
епіфізарна 352
кінцева рухлива 61, 106
І-УІ 126
Пластичність 76, 130, 191
дендритних шипів 78
кіркова 128, 169
слухова 169
Плато 70, 501
Плацебо 135
Плацента 356, 574, 589
Плетизмограф 533
Плетизмографія 532
оклюзійна венозна 533
Плин
венозний 543
крові 521
ламінарний 521
плазми нирковий 645
ефективний 645, 654
турбулентний 521
Плід 564
Плідність 417
Площа поверхні тіла 260
Площина скронева 169, 253
Пляма 162
жовта 140, 156
збереження 157
сліпа 140
щільна 419, 420, 642
Плямка 150
Пеєра 434, 464
Пневмонія
аспіраційна 599
пневмококова 236
Пневмоторакс 631,632
аспіраційний 632
відкритий 632
закритий 632
напружений 587, 632
Пневмоцит зернистий 595
Поведінка
емоційна 247
інстинктивна 214, 247
материнська 240
статева 238-240, 245, 377
Повернення
венозне 526
крові венозне 581
Повітря альвеолярне 604, 605
Повтор тринуклеотидний 24
Поглинання
зворотне 87, 94
кисню скелетним м’язом 580
радіоактивного йоду 303
Подагра 11, 274
вторинна 274
первинна 274
Подоцит 641
Подразнення 75
Подразник 47
адекватний 110, 124
безумовний 248
больовий 123
максимальний 53
надмаксимальний 54
осмотичний 226
умовний 248
Позіхання 159, 624
Показник екстракційний 645
Поле
гіпоталамуса передзорове 235
заднє 215
зору 156
кіркове головного мозку
моторне додаткове 190, 191
слухове асоціативне 161
соматосенсорне 190
рецептивне 114
Полідипсія 228,312,313,316
Поліморфізм довжин рестрикційних
фрагментів 17
Поліпептид 228, 269, 447
6ЬР-1 221
¥У 322
вазоактивний інтестинальний 148, 442,
446, 448, 449
гліцентинзв’язаний 320
глюкозозалежний інсулінотропічний 447
інгібувальний шлунковий 319, 442, 446-
448
інтестинальний вазоактивний 447, 546,
560, 596, 599
панкреатичний 306, 322
пролактин-рилізинг 388
Полірибосома 21
Полісахарид 429
Полісома 21
Поліурія 228,312,375,666
Поліфагія 221
Поліцитемія 535, 630, 633
Пологи 412
Помпа 9
№'-К‘ 28
йодидна 293, 294
м’язова 543
потенціалозалежна 31
протонна 352
торакальна 543
Поповнення сенсорних одиниць 115
Пора смакова 175
Поріг
болю 245
вібраційної чутливості 136
двоточковий 137
деполяризації 49
зоровий 155
нирковий 652
для глюкози 267
нюхового відчуття 173
Порушення
гіперкінетичне 200
гіпокінетичне 200
місячного циклу 409
нагнітальної функції дихальної системи
630
статевої диференціації у людини 381
стереогнозису 137
транспортування глюкози 325
функцій осьових м’язів 192
Послаблення рухової активності нейтрофілів
478
Послідовність
лідерна 21, 223
758 / ПОКАЖЧИК
тринуклеотидна 200
Постава 188-192
Постпотенціація 124
Потенціал
анелектротонічний 50
біоелектричний кори головного мозку
180
генераторний 112
дії 47-49, 52, 70, 146
двофазовий 52
монофазовий 49
складний 54
електротонічний 47, 50
збудженння первинний 180
збудження постсинаптичний 117
повільний 209
швидкий 209
з’єднання
гальмівний 108
збуджувальний 108
кателектротонічний 50
кінцевої пластинки 106
мініатюрний 106
мембранний 163
спокою 48, 52, 70, 74
пейсмекерний 502
піковий 49,441
постсинаптичний гальмівний 82
рецепторний 112
рівноваги 6
спокою 501
Потенціація
довготривала 98, 105, 250
посттетанічна 105
Потенціювання постекстрасистолічне 524
Потік
йонний 52
лінійний 533
основний 560
Потовиділення 299
Потовщення синаптичне 45
Потуги 413
Потяг статевий 238, 239
Похідні
андрогенів 328
арахідонової кислоти 31, 37
Правило дерматома 134
Преальбумін 295, 296
тиреоїдозв’язувальний 496
Прегненолон 334-346, 348
Прегормон 22
Преднізолон 333
Прееклампсія 589
Презентування антигену 483
Прекалікреїн 549
Препарат
антиаритмічний класу І 513
антитиреоїдний 293
білкових фракцій 587
інсуліну 310
наперстянки 591
протизапальний нестероїдний 274, 452,
456
Препрогастрин 443
Препроглюкагон 320
Препроенкефалін 329
Препроінсулін 307
Препропаратгормон 358
Препропресофізин 223
Препроренін 416
Препросоматостатин 102
Пресбіопія 144, 145
Пресенілін 1 252
Пресенілін 2 252
Пригнічення імунних відповідей 287
Приголомшення міокардіальне 571
Принцип
Бернуллі 538
точкового представництва 129
Фіка 522,564,645
Припадок епілептичний 187
Приплив
жару 386
Са2+ пул-керований 36
Прискорення
кутове 159, 170
лінійне 159, 170
Приступ
глобальний 187
локальний 187
частковий 187
ядухи 638
Пріон 187
Проадреномедулін амінокінцевий 20 пептид
549
Пробенецид 274
Пробудження 245
Провідник об’ємний 52
Провідність
АВ прискорена 512
антидромна 51
кісткова 167
кісточкова 167
ортодромна 51
повітряна 167
стрибкоподібна (сальтаторна) 51
Провітамін В3 356
Прогестерон 100, 228, 333-335, 377, 400,
406
Прогестин 355, 407, 409
Прогнатія 376
Прогойтрин 305
Продинорфін 102
Продукт
Амадорі 325
гена супресора пухлин Р 53 23
розпаду фібриногену 499
Проеластаза 430
Проензим 432
Проенкефалін 102
Прозак 243, 410
Прозопагнозія 255
Проінсулін 307
Проказа 236
Прокаїнамід 526
Прокарбоксипептидаза В 430
Прокаріот 8
Прокляття Ондін 624
Проколіпаза 430
Пролактин 228, 240, 243, 245, 363, 368, 375,
387, 388, 399,411
гіпофізарний 387
Пролежень 193
Пролін 270
Проліфератор пероксидний 11
Проліферація хондроцитів 360
Проміжок
аніонний 675
міжклітинний латеральний 642, 651
Промотер 18
Проникність
капілярів 549
капілярної стінки 582
клубочкових капілярів 648
Проопіомеланокортин 102, 220, 341, 363,
364
Пропанолол 299
Пропаратгормон 358
Пропердин 481
Пропілтіоурацил 293, 304
Пропорція Рейлі 153
Пропранолол 420
Пропріорецептор 110,171,194,625
м’язів 627
Пропріорецепція 110, 130
Проренін 412,416
Простагландин 104, 235, 283, 284, 341, 361,
392, 413, 420, 452, 453, 476, 546, 609,
646
О2 185
Е 282
Е2 185
Простатит 392
Простациклін 283, 285, 341, 420, 488, 498,
546
Простір
інтерстиційний 580
матриксовий 10
мертвий 603
анатомічний 604
загальний (фізіологічний) 604
фізіологічний 633
сахарозний 2
субарахноїдальний 560
Протаномалія 154
Протанопія 154
Протеаза 294, 476, 633
активних рецепторів 609
інсулінова 308
панкреатична 431
Протеасома 481
268 273
Протеїнкіназа 34, 87, 269
А 266,282,320,335,633
С 39
цАТФ-залеж на 633
циклінозалежна 18
Протеїноз легеневий альвеолярний 602
Протеїнурія 665, 666
Протеоглікан 10
Протодіастола 518
Протока
артеріальна 574, 575
венозна 574
Вірсунга 457
Вольфа
грудна 500
жовчна 459
загальна 457
міхурова 459
печінкова загальна 459
Санторіні 457
сім’явиносна 228, 389
сім’явипорскувальна 389
сльозова 142
щитоподібно-язикова 291
Протоонкоген 24
Протромбін 499
Профосфоліпаза А2 430
Проходження нервових імпульсів 45
Процес
оклюзії 79
підсилення 79
реверберації 79
Процесинг посттранскрипційний 18
Прутень 392
Псевдогермафродитизм
жіночий 336, 338
чоловічий 383, 384, 395
Псевдогіпоальдостеронізм 349
Псевдогіпопаратиреоз 359
Псевдогіпопаратиреоїдизм 42
ПОКАЖЧИК / 759
Псевдопубертат передчасний 385, 397
Псевдохолінестераза 91,245
Псилоцин 243
Психоз 245
Пубархе 384
Пубертат пізній 386
Пул
альбуміну загальний 496
амінокислот 270
метаболічний спільний 260
Пульс 520
альтернувальний 591
артеріальний 520
колапсуючий 520
Коррігана 520
яремний 520
Пурин 273
Пурпур зоровий 146
Пурпура
тромбоастенічна 489
тромбоцитопеній на 489
Пухирець синаптичний 77, 78
Пухлина
ВІП-секретувальна 447
гастриносекретувальна 435
гіпофіза АКТГ-секретувальна 376
епіфіза 386
естрогенозалежна 415
клітин Лейдіґа 397
медулярна надниркова 323
передньої частки гіпофіза 375
соматостатинсекретувальна підшлун-
кової залози 322
Пухлини легень 227
Пучок
Бахмана міжвузловий передній 501
Венкебаха міжвузловий середній 501
вентральний норадренергічний 244
Гіса 501,509,506,510
дорсальний норадренергічний 244
дугоподібний 253, 254
Кента 512
міжвузловий передній 501
оливо-завитковий 161
таламічний 198
Тореля міжвузловий задній 501
Рабдоміоліз 586
напруження 582
Радикал вільний 476, 585, 586
Радіоімуноаналіз 33
Радіонукліди 569
Радість 242
Рак
ендометріальний 355
легень 227
матки 406
молочної залози 355, 406, 543
надниркової залози 349
передміхурової залози 392
щитоподібної залози 292
Раковина носова 175
Ралоксифен 406
Ранітидин 456
Рахіт 291,354,357
вітамін-О-резистентний тип І 357
вітамін-О-резистентний тип II 357
Реабсорбція 267, 313
СГ 650
Иа^ 418,642,650
води 642
канальцева 641, 649
НСО3 635
Са2+ в дистальних канальцях 359
Реактивність
надниркових залоз 341
судинна 339
Реакція
акросомальна 410
вегетативна 238
вентиляційна 621
вестибулярна положення 197
видовження 121
відторгнення 487
генераторна 47
динамічна 119
дифузна вторинна 180
емоційна 193
запальна 632
згинальна 124
імунна неспецифічна 476
“магнітна” 194
на холод місцева 546
нападу 240
опори негативна 194
опори позитивна 194
полімеразно-ланцюгова 17
пристосувальна терморегуляторна 234
розгинальна перехресна 123
розміщення 194, 198
сполучення 293
статична 119
стрибання 194, 198
трансфузійна гемолітична 493
тривоги 182, 186
уникання 240, 242
“що це?” 248
Регенерація нерва 109
Регулювання
апетиту 221, 222
дихання 214
нервове 616
хімічне (гуморальне) 618
клітинного циклу 273
мимовільне (автоматичне) 616
низхідне 312
постави 188, 192
рецепторів 33
секреції слини 449
серцевої діяльності
гетерометричне 523
гомометричне 523
супраспінальне 195
Регулятор
глюкози нирковий 267
муковісцидозний трансмембранної
провідності 22
Регургітація крові 517,521
Режим харчування Аллена 316
Резерв крові лужний 676
Резерпін 87, 93, 186
Резистентність 600
андрогенова 414
віскозна 602
до інсуліну 287
до тиреоїдних гормонів 303
еритроцитів 489
осмотична 489
периферійна 303
повітряна 602
слизової 456
Резонанс ядерно-магнітний 190, 191, 565
функційний 131, 152, 168, 191, 247, 254,
255
Резонатор 166
Резорбція 353
Резорбція кістки 350
Резулін 319
Резус-належність 494
Рекомбінація 16
хромосом 16
Рекомпресія 638
Релаксація адаптивна 454
Релаксин 369, 377, 407
Ремоделювання кістки 350
Ренін 222, 327, 345-349, 416, 418, 420, 423,
424, 433, 549, 555, 577, 584, 588, 589,
642, 646, 648, 665
Реперфузія 571
Ресинтез
аеробний 625
цГМФ 148
Ресинтезування АТФ 626
фосфорилкреатину 626
Ретенція СО2 606
Ретикулоцит 585
Ретиналь 146
Ретинальї 147, 148, 155
Ретинені 146
Ретиніт пігментний 43
Ретиноїд 33
Ретинол 146
Ретинопатія 325
діабетична 325
недоношених 635
Рефлекс
автономний 195
аксон 551,573
антигравітаційний 193
ахіллів 298
барабанний 166
Безольда-Яріша 555, 623
Бейнбріджа 555
вестибулоочний 206, 250
виділення молока 228, 413
випрямлення 193, 194, 197
зоровий 194, 197
“з тулуба на голову” 197
“з тулуба на тулуб” 197
лабіринтний 194, 197
шийний 194, 197
відрази до їжі умовний 249
відсмикування 123, 124, 194
гастроезофагальний 451
Герінґа-Брайера 623
гіперактивний 189
дефекації 467
динамічний 192
ентерогастральний 455
захисний 298
зіничний світловий 197
колінний 117, 118
короткочасний 192
Кушінга 557, 566
лабіринтний тонічний 196
локомоторний 193
маси 195
міотатичний 117
моносинаптичний 117
набутий 248
око-серцевий 510
орієнтувальний 248
переляку 100
полісинаптичний 122
почухування 124
присінково-очний 171
реноренальний 645
розтягування 117, 192, 194-196
зворотний інверсний 121
світловий зіничний 144
світловий поєднаний 144
соматосимпатичний 552
спінальний 192, 193
760 / ПОКАЖЧИК
статевий 195
статичний 192
умовний 193, 248
уникнення умовний 249
фазовий 192
хапальний 197
шийний тонічний 194,197
шлунково-клубовий 467, 469
Рефлюкс 450, 451, 467
сечі 667
Рецептор 9, 33, 54, 87, ПО, 126, 141
1,25-дигідроксихолекальциферолу 357
фібробластичного фактора росту 3 374
5-НТЗ 215
а-адренергічний 94, 330
а2-адренергічний 319
а2-пресинаптичний 441
р-адренергічний 94,330,319,321
Р, 330,503,524
Р2 266,330
р3 279,330
у проліфератор-активований перо-
ксисомний 319
АТ, 419,591
АТ2 419,420
В ендотеліальний 470
П2 372
ЬРТН/РТНгР 359, 360
І§Е 476
МЬІ 425
МЬ2 425
ИМОА 98, 131
РТН2 (КРТН2-Я) 359
Тгк 54
активіновий 396
АМПА 98
ангіотензину II 419
ацетилхоліновий 91
бензодіазепіновий периферійний 100
больовий 130-132
брадикініновий 549
вазопресину 225
високоафінний 54
високого тиску 226
ГАМК 100,241
ГАМКД 84,205,245,321
ГАМКВ 84
гангліозидний СМ-1 436
гістаміновий 97
гладких м’язів легеневих артерій 608
гладких м’язів легеневих вен 608
глюкокортикоїдний 338, 344
гормону росту 367
гуаніліновий 448
дигідропіридиновий 63
дотику 129,136,171,228
дуги аорти 552, 554
ендотеліновий 547
естрогеновий 405
ІЛ-2-ІЛ-7 479
інсуліновий 308,311,312
іритантний 623
йонотропний 97, 98
каїнатний 98, 148
капсаїциновий 130, 131
каротидного синуса 552
ЛГ 387
легеневий 556
лейкотрієну В4 285
лептиновий 220
лівого шлуночка 555
ЛПНЩ 281
М, 91,92
М2 мускариновий 211, 245
М3 мускариновий 453
М4 319
метаболотропний 97
мінералокортикоїдний 344
мішечка 159
Н, 573
Н2 453,456
натрійуретичних пептидів 423
низького тиску 226
нікотиновий 245
НЩЛ 333
нюховий 173
окситоциновий 228
опіатний 135, 363
орфановий 135
очисний 281
передсердя 553
пероксисом проліферативно-активу-
вальний 11
плазміногену 499
пресинаптичний 87
пролактину 387, 479
пуринергічний 104
ретиноїду X 297
ріанодиновий 63, 236
рівноваги 159
розтягування передсердь і великих вен
227
серпентиновий 37
сітківки 637
слуху 159
сонної пазухи 552, 554
тактильний 112
температурний 130
тепловий 130
тиреоїдний 297
тиску 171
Т-клітин 484
тонічний 113
ТТГ 300
фазовий 113
фібробластів 586
фібробластний 374
ФСГ 387
холодовий 126, 130
ХЦК-А 221
ХЦК-В 221
Реципієнт 487
Речовина
Р 100, 101, 103, 130, 132, 135, 148, 244,
441, 448, 541, 546, 560, 573, 599
галюциногенна 243
губчаста 127
драглиста 126
запашна 173, 174
мозкова надниркових залоз 209, 216,
327, 378, 331
Мюллера інгібувальна 379
Ніссля 108
органічна осмолітична 5
світлочутлива 146
сіра центральна 245
солодка 177
чорна 198
сітчаста 198
щільна 198
Рибонуклеаза 430
Рибосома 16, 21
Рибофлавін 289, 438
Риґідність 67, 196, 201, 301
декортикаційна 196, 198
децеребраційна 195, 196
зубчастого кола 201
моторна 298
м’язів 627
свинцевої трубки 201
Рикетсіоз 236
Рилізинг-фактори 228-231
Ритансерін 185
Ритм
добовий 342
електричний базальний 441
ідіовентрикулярний серцевий 508
тонусу бронхів циркадний 599
циркадний 217,243,342,425
Ріанодин 63
Рівень
деполяризації критичний 49, 50
екскреції креатиніну 272
загального обміну 260
збудження 248
конкордантності 326
ліпідів 339
максимального поглинання кисню 583
обміну
максимальний 260
мінімальний 259
робочий 260
смертності 283
утилізації кетонів 315
холестеролу 287
Рівновага 192
Рівняння
альвеолярного газу 605
Гендерсона-Гассельбальха 671
Ґіббса-Доннана 6
Нернста 6, 52
сталого поля Ґолдмана 7
Ріґор кальцієвий 516
Рідина
амніотична 418
внутрішньоклітинна 1
інтерстиційна 1, 429, 585, 587, 622
мозку 560
міжклітинна 2
позаклітинна 1, 420, 422, 423
ротової порожнини 177
спинномозкова 560, 561, 622
Різниця артеріовенозного О2 573
Ріст 299, 372
внутрішньоутробний 372
лінійний 368
РНК 273
матрична 18,20,21,33,338,344,356,
417
рибосомна 18
транспортна 18,21
РНК-полімераза 18
Робота
еластична 602
м’язова 259
нееластична 602
Рогівка 138
Родопсин 146, 148
Розвиток
гонад 378
ембріональний 531
мозку 298
яєчка 380
яєчника 380
Роздвоєння другого тону серця фізіологічне
521
Розділення мозолистого тіла 249
Розкриття шийки матки 228
Розлад
геморагічний 499
ішемічний 546
мовлення 254
ПОКАЖЧИК / 761
поведінки у разі швидкого сну 187
сну 187
шлунко-кишковий 290
Розмір лінійний 372
Розміщення 198
Розпад білків 273
Розпізнавання
антигену 483
облич 255
Розслаблення
ізоволюметричне 518
рецептивне 454
Розчин
вуглеводів високої молекулярної маси
587
гіпертонічний 5, 564, 587
гіпотонічний 5
ідеальний 4
ізотонічний 5
фізіологічний 587
Розчинник 4
Розчинність СО2 614
Розширення
вен варикозне 543
термінальне 77
Розщеплення глюкози анаеробне 66
Росток
еритроїдний 489
мієлоїдний 473
Рубець 582
Рух 188
вестибулярний 157
коловий 509
комбінований 201
конвергентний 157
координований 188
очний 157
плавного стеження 157
сакадований 157
Сайт залізозв’язувальний 438
Саліцилат 296
Самосплайсинг 18
Самостимуляція 242
Саралазин 420
Сарафотоксин 547
Саркоїдоз 227, 356, 606
Сарколема 58
Саркомера 60
Сахараза 429-431
Свербіння 136
Свинець 354
Сегмент
ОТ 514
8Т 513,514
початковий 45, 83
спинномозковий 188
Секрет бронхіальний 609
Секретин 319, 321, 361, 442, 446-448, 454,
457, 458, 463
Секреція 223
Н+ 660
АКТГ 339
аміаку 661
ацетилхолінова 441
вазопресину 226
глюкагону 321
інсуліну 307, 319, 320, 445
базальна 317
канальцева 337,641,649
катехоламінів 234
молока 413
пепсиногену 452
реніну 420
соляної кислоти 452
ТТГ 295,341
у товстій кишці 467
шлункова 452, 454
Селезінка 473, 478, 490
Селектин 14, 474, 476
Селекція клональна 483
Селен 287
Селеноцистеїн 296
СеленоцистеїнЗ 270
Селіакія 466
Семифорин 80
Сенсибілізація 105, 248
Сепсис 586
Серин 270
Серинтреонінпротеїнкіназа 344
Серотонін 87, 94, 148, 216, 234, 243, 245,
271, 341, 425, 441, 443, 495, 496, 555,
556, 564, 609, 610
Серце 299
донорське 623
легеневе 590, 633
трансплантоване 526
Серцебиття 520
Сечівнцк 228, 389, 398
Сечовиділення мимовільне 587
Сечовина 177,271,562,657,658,671
Сечовипускання 667, 658
Сибірка 236
Сила
гравітаційна 543
заломлювальна кришталика 144
звуку 165
порогова 49
Старлінґа 542, 541
тяжіння 577
Симпатектомія 340, 550, 557, 580
Симпорт 29, 432
Бабінського 192
Симптом
нейроглікопенічний 316
нестачі йоду 294
Труссо 360
Хвостека 360, 635
Синапс 77, 79, 80
аксо-аксонний 84
м’язово-нервовий 106
непровідний 108
нервово-м’язовий 106
Шаффера 105
Синаптобревін 79
Синдом
адреногенітальний 335, 338, 348, 349,
380
Барттера 650
Вернера 43
відміни 404
Вольфа-Паркінсона-Уайта 512, 513
вродженого продовження інтервалу рТ
637
вродженої гіперплазії надниркової залози
335
гіпоталамічного ожиріння 219
Дауна 252,381
дистрес респіраторний 635
гострий 586
новонароджених 601
довгого інтервалу РТ 511
Елерса-Данлоса 354
Зеллвегера 11
Золлінгера-Еллінсона 361,456
імунодефіциту 487
Калеманна 231
Кальмана 175,397
Картагенера 609
Каспера Гаузера 374
Кляйнфельтера 381
Конна 349
Криглера-Найяра 564
крихкої Х-хромосоми 24
Кушінґа 323, 325, 355, 340, 349, 376,
487, 591
АКТГ-залежний 340
АКТГ-незалежний 340
Ламберта-Ітона 107
Лауна-Ґанонга-Левіне 512
Ліддла 589, 650, 663
Мак-Кардля 69
Мак-Кюна-Олбрайта 43, 410
мальабсорбції 466, 496
глюкози/галактози 432
набутого імунодефіциту 487, 494
“невідповідної” гіперсекреції антидіуре-
тичного гормону 227
Нельсона 230, 376
нефротичний 666
Пендреда 170
передмісячний 410
подовженого інтервалу РТ 70, 170
раптової дитячої смерті 637
ригідності 100
розчавлення 586
слабкості синусового вузла 507
сліпої петлі 469
спастичного паралічу 189
Стокса-Адамса 508
таламічний 135
Тернера 381
ураження нервової системи гіпербарією
637
Фанконі 654
фемінізації тестикулярний 384
хронічного болю 135
Чієрі-Фроммеля 414
Шигена 376
Синкопе 586
вазовагальне 587
зусилля 587
каротидного синуса 587
кашлю 587
ковтання 587
нейрокардіогенне 587
Синтаза N0 392
Синтаксин 79
Синтез
ацетилхоліну 90
білка 20
білків плазми 460
гемоглобіну 492
глікогену 266
жирних кислот 314
колагену 582
паратгормону 358
тригліцеридів 314
Синус
венозний мозковий 560
вінцевий 568
каротидний 552, 553, 577
молочний 228
Синхронізація 182
Синцитіотрофобласт 411
Синька метиленова 634
Сироватка 495
анти-В 494
Система
у-еферентна 119
АВО 493
активаційна ретикулярна 179
аміноергічна 243
762 / ПОКАЖЧИК
АМК-ергічна 200
антигенів КИ 494
бікарбонатна 661, 672
біліарна 459
вербальна 250
виконавча центральна 250
винагороди 242
мозку 249
візуоспатична 250
гаверсова 352
гіпофізарно-щитоподібна 305
глюкуронілтрансферазна 337
голубої плями 244
горбово-лійкова 245
дихальна 593
дофамінергічна чорноречовинно-
смугаста 200
екстрапірамідна 189
ендокринна 257
ентерична нервова 440
задоволення 242
кірково-спинномозкова 188
кірково-ядерна 188
коагуляції
внутрішня (кров’яна) 498, 549
зовнішня (тканинна) 498
комплементу 474, 478, 479
кровообігу 473
лімбічна 179,214,216, 237,238,243,
245, 247, 626
лімфатична 473
множильна течійно-протитечійна 657
моноаміноергічна 246
Мюллера протокова 379
невизначено-таламічна 245
нервова
автономна 132, 207, 322
анаболічна 212
ентерична 208
неадренергічна 209
нехолінергічна 209
парасимпатична 209
рухова мала 118
симпатична 221, 420, 550
центральна 45, 77, 117, 188-206, 214-
216, 235, 404, 441,564, 587
неспецифічна 180
“низького тиску” 538
норадренергічна 243
передньолатеральна 126
петельна 126
пірамідна 189
плазміногену 499
поглинання СО2 259
покарання 242
покриву латеральна 244
портальна гіпофізарна 215
регулювання постави 188, 192
ренін-ангіотензинова 222, 416, 418, 420,
421
репарації ДНК 10
ретикулоендотеліальна 477
ретикулярна 131
активаційна 126
саркотубулярна 60
середньомозкова-кіркова 245
серотонінергічна 243
серцево-судинна 577
статева жіноча 397, 398
статева чоловіча 389
тканинна ренін-ангіотензина 418
тканинних макрофагів 477
травна 429
транспортна еритроцитів 433
уникання 242, 249
фібринолітична 499
флавопротеїнцитохромна 261
холінергічна внутрішньосмугаста 200
чорноречовинно-смугаста 245
Систола 518, 568
антральна 454
електромеханічна повна 520
передсердна 501,517
шлуночкова 501,517
Сифіліс 578
Сіалопротеїн 648
Сік
кишковий 457
підшлунковий 457
шлунковий 452
Сілденефіл 392
Сіль 542
йодована 303
Сітка
ендоплазматична 16, 47, 223, 291, 307,
333, 357
гладка 328, 334, 462, 463
гранулярна 307, 334, 435
саркоплазматична 60, 62, 63
Сітківка ока 138-140, 148, 245
Скатол 469
Склепіння 238, 251
Склера 138
Склероз
аміотрофічний боковий 252, 476
розсіяний 45, 486
Скополамін 246
Скоротливість міокарда 529
Скорочення
внаслідок дії маси 467
голодне 454
голодове 221
ізометричне 63
ізотонічне 63
м’язів 63, 66
ізометричне 580
ізотонічне 580
поодиноке 61
маткове 413
позачергове 509
сегментарне 465, 467
селезінки 584
скелетних м’язів 232
тетанічне 64
тонічне 465
Скотома
геміанопічна 156
об’єктивна 156
пригнічення 158
Скотопсин 146
Скринінг-тест 392
Слабість розумова 349
Слабоумство 287
Слиз 452
кишковий 465
Слина 448, 449
Слиновиділення 214, 449
Сліпота 157
кольорова 154
куряча 289
нічна 155
Слух 164
Смак 172, 176
кислий 177
солодкий 177
солоний 177
Смерть раптова 170, 590
Смуга
З 673
А скелетних м’язів 58, 62
Н скелетних м’язів 58
І скелетних м’язів 58
діагональна зони Брока 185
медіальна 242
нюхова латеральна 173
нюхова проміжна 173
супресорна 198
Смугастість м’язів 58
Смужка судинна 163
Сновидіння 185
Солі жовчних кислот 434, 460, 463
Соматомамотропін людини хоріонічний 411
Соматомедин 369, 372
С 369
Соматостатин 102, 148, 221, 229, 231, 301,
306, 312, 322, 323, 370, 445, 448, 454
Соматостатин 14 322, 448
Соматостатин 28 322, 448
Сомнабулізм 187
Сон 179,247
з швидкими рухами очей 182, 243
повільнохвильовий 182
швидкий 186
Сосочок
грибоподібний 176
дуоденальний 459
жолобчастий 176
ниткоподібний 176
Спазм 132
артеріол 584
прекапілярних венул 585
прекапілярних сфінктерів 585
Спазмофілія 635
Спайк 441
мосто-колінчасто-потиличний 182
Спайка задня 424
повідцева 424
Спалах фазовий 224
Спастичність 195
Спектрин 489
Спектроскоп абсорбційний полум’яний 594
Сперма 228, 391
Сперматид 390
Сперматогенез 389-391, 394
Сперматогонія 390
Сперматозоїд 16, 228, 389-391,417
Сперматоцит
вторинний 390
первинний 390
Спеціалізація півкуль 253
Співвідношення
ветиляція-перфузія 607
інсулін-глюкагон молярне 321
Спікул 351
Спіраль внутрішньоматкова 409
Спірометр 259
Спіронолактон 665
Сплайсингосома 18
Сплетення
Ауербахівське 440
Мейснерівське 440
міентеричне 440
первинне 215
підслизове 440
судинне 562
Сплутаність свідомості 579
Сповільнення внутрішньоутробного росту
311
Споживання
води 245
їжі 217
міокардом О2 527
ПОКАЖЧИК / 763
базальне 526
Спокій 241
Сполука
амфіпатична 461
проміжна 271
хелатоутворювальна 499
Спонукання до дії 237
Спорідненість 295
Спрага 222, 223, 583, 669
Сприйняття підкіркове 131
Спру 289
тропічний 466
Стаз капілярний 583
Стала часова 82
Стан
гальмівний центральний 125
еутиреоїдний 295
збуджувальний центральний 125
інактивації 52
коми 185
лихоманковий 296
маніакально-депресивний 565
міхура сечового гіперактивний 668
непритомності 586
неспання 185
підпороговий 86
тривоги 179
Старіння 43
Статин 282
Стать жіноча генетично 377
Стать чоловіча генетично 377
Стеаторея 434, 466, 469
ентерогенна 435
панкреатична 435
Стеноз
аорти 527
атріовентрикумерного отвору 521
Стенокардія 547, 570
нестабільна 488, 546
стабільна 571
Стереогнозис 137
Стереоцилія 163, 164
Стерин 275
Стероїд 35
адренокортикальний 332
гонадний 332
протизапальний 285
синтетичний 333
тестикулярний 332
Стетоскоп 521
Стимулювання
температурне 171
теплове 171
транскрипції 34
Стінка капілярна 32
Стовбур
головного мозку 205
мозку 423
симпатичний 209
Стовп
дорсальний 126
проміжнолатеральний 207
Стовпець нейронів 191
Страбізм 145, 158
Стравохід 214
Страх 238,240-242
Стремінце 159, 166
Стрептокіназа 499, 57
Стрептоміцин 169
Стрес 231, 338, 339, 342, 349, 369
емоційний 331
зрізання механічний 533
Стрес-недостатність 630
Стрибання 198
Стридор інспіраторний 601
Стрихнін 100
гідрохлорид 177
Стріосома 198
Стрічка ободової кишки 467
Стрія 340
черевна фіолетова 349
Строфантин ендогенний 549
Структура
білка
вторинна 270
первинна 269
третинна 270
четвертинна 270
інсуліну 307
кісткова ригідна 566
Ступінь ненасиченості гемоглобіну 628
Субстрат
інсулінового рецептора в клітинах 311
реніну 416
Судина 530
артеріолюмінальна 568
артеріосинусна 568
вінцева 527, 586
ємнісна 536, 550
капілярна головна 528
кровоносна 528, 606
лімфатична 645
люмінальна 568
молочна 464
опору 536, 550
портальна
гіпофізарна 215
серединного підвищення 216
пряма 644
Судина-колектор лімфатична 541
Судома 635
Сукральфат 456
Сукцинатдегідрогеназа 10
Сукциніл-КоА 264, 276, 492
Сульфоефір 271,275,654
Сульфонілсечовина 318,319
Сульфурдіоксид 599
Сумація 85
просторова 82
скорочень 64
часова 82
Супероксиддисмутаза 43, 476
Суперродина І §6 14
Супресор пухлин 24
Сурфактант 341, 478, 536, 595, 600-602, 608,
632
Сухість шкіри 289
Сухотка спинна 668
Сфероцитоз спадковий 489
Сфігмоманометр 538
Сфінктер
Одді 457,459,463
прекапілярний 528
стравохідний нижній 450
уретри внутрішній 667
уретри зовнішній 667, 668
Сходи 160
барабанні 160
вестибулярні 167
присінкові 160
середні 161
Сцинтіосканограма грудної клітки 569
Таблиця
Ішігара 154
Рабкіна поліхроматична 154
Такролім 487
Таксол 12
Таламус 179, 184, 185, 187, 188, 199, 205, 245
вентральний 179
дорсальний 179
Таласемія 491
Тамоксифен 406
Тампонада серця 587
Тауматин 177
Таурин 270, 271
Тахікардія 291, 555, 556, 557, 586, 627
надшлуночкова 511
пароксизмальна 509, 519
вузлова 511
передсердна 510
з блокадою 510
пароксизмальна 510
рефлекторна 584
шлуночкова пароксизмальна 511
Тахікінін 37, 101, 102
Тахіпное 609, 627
Тварина
Клювер-Бюсі 240
мезенцефалічна 197
спінальна 123, 194
Телархе 384
Телерецептор 110
Телодендрон аксонний 45
Теломер 18
Теломераза 18
Тембр 165
Температура 612
оточення 235
тіла 245
Тензин І 420
Теорія
авторегулювання метаболічна 545
авторегулювання міогенна 545
драйв-блокувальна 242
кольорового зору Юнга-Гельмгольца 153
подвоєння 143
Теофілін 39,319,421
Тепло
активації 67
відновлення 67
релаксації 67
спокою 67
укорочення 67
Тепловіддача 231, 233
Теплопровідність 233, 234
Теплоутворення 231,232,258
Терапія
глюкокортикоїдна 336
радіоактивним йодом 303
Термогенез тиреоїдний 301
Терморегулювання 231
Тест
Вебера 169
на толерантність до глюкози 313, 376
Швабаха 169
Тестостерон 239, 335, 338, 377, 393, 396,
397
Тетанія 360, 635
гіпокальціємічна 350, 360
Тетанус 64,71,76
неповний (зубчатий) 64
повний (суцільний) 64
Тетрагідробіоптерин 94
Тетрагідрокортизон глюкуронід 337
Техніка петч клемп 27
Течія
крові 532
ламінарна 533
турбулентна 533
Тимін 16
Тимус 339,478,482
Тирамін 469
764 / ПОКАЖЧИК
Тиреоглобулін 291,292,304
Тиреоїдит Хашімото 302, 303
Тиреопероксидаза 293
Тиреотоксикоз 273, 301, 303, 323, 325, 590
Тиреотропін 291, 363
Тирозин 270, 271, 292, 293, 322, 329, 433,
445
Тирозингідроксилаза 92-94
Тирозинкіназа 41,479
Тироксин 270, 292
Тироліберин 228,231
Тиск
артеріальний 416,532,537,551,552,
554, 563, 567, 577, 584, 588
легеневий 606
середній 584
барометричний збільшений 637
бічний 538
венозний 543, 566, 577
периферійний 544
центральний 420, 543, 544
внутрішньобіліарний 463
внутрішньоплевральний 596, 603, 632
внутрішньочерепний 557, 558
внутрішньошлуночковий 518, 527
діастолічний 517,521,537,580
закриття критичний 535
інтерстиційний нирковий 645
капілярний 540, 606
кінцевий 538
онкотичний 32, 495
осмотичний 4, 489
парціальний 593
газів 605
перфузії ефективний 532
перфузійний 577
плазми осмотичний 669
позаклітинної рідини осмотичний 669
пульсовий 298, 301, 520, 537, 556, 584
середній 520, 537, 565
систолічний 517,537,539,580
трансмуральний 536
у грудній порожнині 556
у капілярах клубочків 648
у легеневих капілярах 606
фільтраційний середній 649
яремний 520
Титін 60
Тіазолідиндіон 319
Тіамін 289, 438
Тіло
білувате 398
війкове 138, 139, 144
геморагічне 399
жовте 398, 399, 411
кетонове 276, 278, 314, 321, 339
колінчасте 149, 150
бічне 140
медіальне 161
Люїса 198
мигдалеподібне 140, 173, 237, 241, 243,
251, 253
мозолисте 424
склисте 138, 140
смугасте 198, 242, 250
сосочкове 238,251
сосочкоподібне 179
Тільце
Барра 379
Геррінга 223
Леві 202
Мейснера 111, 129
Пачіні 111-113,129,130,136
пластинчасте 601
полярне друге 399
полярне перше 399
ультимобранхіальне 361
щільне 74
Тіоефір 261
Тіоурилен 304
Тіоціанат 304, 305
Тканина
безсудинна 2
жирова 221
бура 222
кісткова 351
м’язова гладка поліелементна 76
нервова 45, 46, 77, 80
хрящова 2, 374
щільна сполучна 2
Токсин
ботулінічний 79
коклюшу 40
правцевий 79
холери 40
Толазамід 318
Толбутамід 318
Томографія позитронна емісійна 127, 131,
140, 152, 168, 190, 191, 245, 247, 255,
564
Тон
базовий 168
серця
другий 521
перший 521
третій 521
четвертий 521
Тональність звуку 168
Тонічність 5
Тонус 74
активний 64
блукаючих нервів 551
кволий 121
м’яза 64, 121
пасивний 64
повний 64
розслаблений 121
Точка
бачення найближча 144
відповідності 156
вузлова 145
розриву 624
Трабекула 351
Травлення 429, 440
білків 432
вуглеводів 258, 263, 287
жирів 434
Транквілізатор 243
Трансаміназа 271
ГАМК 99
Трансамінування 271
Трансдуцин 147
Транскобаламін II 457
Транскортин 336
Транскриптаза зворотна 18
Транскрипція 18, 20
РІГ1 354
Транслоказа 275
Транслокон 21
Трансляція 18, 20, 21
Трансмітер 223
пуринергічний 103
Трансплантант 201
серцево-легеневий 623
Трансплантація
кісткового мозку 492
серця і легень 623
тканин 487
тканини смугастого тіла 201
Транспортер 87, 633
СЬиТ- 432
86ГТ 1 432
86ЬТ 2 432
АТФ-залежний мембранний 22
Транспортування
аксоплазматичне 47
активне 28, 434, 562
№' 432, 435, 657
вторинне 25,31,309
первинне 25
антероградне 47
в межах клітини 26
везикулярне 527, 558, 560
внутрішньонейронне 223
галактози 432
глюкози 432
йонів СГ 657
ліпідів 279
пухирцеве 32
ретроградне 47
Транстиретин 295, 496
Трансфераза 493
Трансферин 496
Трансферитин 438
Трансфузія
автологічна 494
плацентарна 575
Трансцитоз 32
Траскрибування 19
Трахея 214, 595
донорська 623
Трегалаза 430, 431
Тремор 209,291,299
наміру 206
фізіологічний 119
Тремтіння 234, 259
Треонін 270
Треп 64
Тривалість сну 187
Тривога 241,247
Тригліцерид 275,279,316,435
Трийодотиронін 34, 292
обернений 292
Трикутник Ейнтховена 503, 505
Трипептиди 433
Триплет 21
Трипсин 430, 433, 458
Трипсиноген 458
Триптофан 94, 270, 424, 445
Триптофангідроксилаза 94
Трисомія21 381
Тританомалія 154
Тританопія 154
Тритій оксид З
Трихромат 154
Тріада 60
Тріамтерен 665
Тріоз 263
Тріпотіння передсердь 509, 510, 513
Троглітазон 11,319
Тромб 285
гемостатичний 496
тромбоцитарний 496
Тромбін 488, 497
Тромбоз 489, 500
пристінковий 500
судин мозку 588
церебральний 282
Тромбоксан 283, 341, 476, 488, 546
А2 284,656,498,546
В2 285
Тромбомодулін 498
ПОКАЖЧИК / 765
Тромбопластин 498
Тромбопоетин 488
Тромбоцит 282, 339, 473, 487, 582
Тромбоцитоз 487, 489
Тропоміозин 58, 60, 62
Тропонін 36, 58
І 58,62
С 58,62,64,356
Т 58
Трофобласт плацентарний 411
Труба
євстахієва 159
маткова 228, 382, 398
слухова 159
Трубочка нирки збірна 225, 642, 657
Туберкульоз 607
Уабаїн 31
Убіквітин 202, 273
Убіквітинація
мембранних білків 273
цитоплазматичних білків 273
Увага 179
Удар тепловий 669
Укладання білка 22
Ультрасонографія 463
Уніпорт 29
Ураження
внутрішньої капсули 195
гіпоталамуса вторинне 386
ендокарда 515
радіаційне 469
стовбура головного мозку 195
Уремія 215,584,636,666
Уридиндифосфогалактоза 269
Уридиндифосфоглюкоза 266
Уридинтрифосфат 261
Урогастрон 448
Уропепсиноген 452
Уротензин-П 549
Усвідомлення відчуття 237
Ускладнення після перетинання спинного
мозку 193
Утворення
кістки 353
внутрішньомембранне 352
рубця 582
Утилізація
глюкози 321
периферійна 323, 324
периферійна зменшена 313
Утоплення 636
Утрофін 69
Ушкодження
в разі контрудару 561
внаслідок реперфузії 586
легень 586
лімбічної частки 239
оливного комплексу 206
потиличної частки головного мозку 156
тканини гіпоксичне 585
ядер мозочка 206
Фагоцит 490
Фагоцитоз 25,475,478,481
Фаза
викидання крові 518
лютеїнова 399
плато 501
повільної реполяризації 501
проліферазивна 399
секреторна 399
фолікулярна 397
швидкої деполяризації 501
Фази ендометрію 399
Фактор
КЬ 494
агрегації тромбоцитів 476
активування тромбоцитів 488
Віллебранда 487, 488, 498, 500
внутрішній 451,456
гальмівний 228
гіпофізний 328
диференціювання В-клітин 479
ДНК-зв’язувальний 20
емоційний 558
зсідання 477, 488
крові І 495, 496
крові II 495, 499
крові III 498
крові V 495, 499, 500
крові VII 499
крові VIII 495,498-500
крові ЇХ 498, 499
крові X 498, 499
крові XI 498
крові XII 498
крові XIII 497
колонієстимулювальний 477, 488
лейкемії інгібувальний 56
мультиколонієстимульований 477
нейротрофний 55
циліарний 55
некрозу пухлин 23, 300
Р 570,627
РзаЛевісом 132
релаксації ендотелію 40, 546
росту 40, 172,282,399,416
І інсуліноподібний 40, 56, 323, 362,
369, 373, 496
II інсуліноподібний 323, 369
а транс формувальний 33
Р трансформувальний 41
гемопоезу 479
епідермальний 281, 448
епідермісу 40
нервів 40, 55
судинний ендотеліальний 532
трансформований 56
тромбоцитарний 56, 488
фібробластний 56
стероїдний 1 336
сульфатації 369
транскрипції Т4Г-АТ 487
Фактори транскрипції 19
Фамотидин 456
Фасцикуляція 68
Фенестра 531
Фенілаланін 270,271,433,445
Фенілаланінгідроксилаза 92, 94
Фенілбутазон 274
Фенілдигуанід 555
Фенілетаноламін-М-метилтрансфераза 93,
245
Фенілетиламін 243
Фенілефрин 556
Фенілкетонурія 93
Фенілтіокарбамід 178
Фенітоїн 296
Фенобарбітурат 463
Фенол 271
Феномен
Венкебаха 509
вивільнення 109
Єндрасіка 120
рикошета 206
сходів 64
фантомної кінцівки 114
Фенотип 494
Фенформін 319
Фенциклідин 98
Феохромоцитома 323,331,589
Феритин 438
Феромони 174, 239
Фертилін 410
Фібриляція 67
передсердь 567, 591
пароксизмальна 513
шлуночків 511, 590, 635
Фібрин 497, 571
Фібринмономер 497
Фібриноген 495, 496
Фібринолізин 499
Фібринолізис 571
Фіброз
альвеолярний 608
кісткового мозку 473
кістозний (муковісцидоз) 24, 31, 633
легеневий 601,604,630,635
інтерстиційний 602
Фібронектин 10
Фіброплазія ретролентальна 635
Фіксація зорова 171
Філамент проміжний 12
Філяріатоз 543
Фільтрація 540
клубочкова 339, 641
Фільтрування 32
Фінґерпринт ДНК 17
Фінестерид 395
Фістула шлунка 454
Флавінаденіндинуклеотид 261
Флавінмононуклеотид 261
Флоризин 652
Флюоксетин 243, 410
Фокус головний 143
Фолати 289, 438
Фолікул
антральний 398
атретичний 397, 398
волосяний 129
граафовий 397
домінантний 397
зрілий 398
примордіальний 397, 398
яєчника 239
Фолікула 291
Фолістатин 396
Форма
термінальна 416
соматична 416
Формація ретикулярна 179, 195, 584
Формування скелета 299
Формула Пуазейля-Хаґена 534, 535
Форсколін 40
Фосфат 351
Фосфатаза 34, 40, 419
Фосфатидилінозитол 488
Фосфатурія 654
Фосфогліцеральдегід 264
Фосфодіестераза 39, 148, 177, 392
Фосфоенолпіруват 314,321
Фосфоенолпіруваткарбоксикіназа 314
Фосфоінозитол-З-кіназа 310
Фосфокреатин 261, 271
Фосфоліпаза 104
А2 285,341,430,458,488
С 38,319,335,419,423,458,488,547
Фосфоліпід 275, 279
Фосфор неорганічний 351
Фосфорилаза 266, 323, 330
Фосфорилкреатин 66
Фосфорилювання 21, 269, 278, 351, 368
глюкози 310,324
766 / ПОКАЖЧИК
на субстратному рівні 262
окисне 10,261,263,271
Фосфофосфорилаза 266
Фоторецептор 148
Фототерапія 492
Фрагмент проглюкагоновий головний 320
Фракціонування 124
Фракція
викидання 518,523,590
клітини мікросомна 11
фільтраційна 649
Фруктоза 260,263,318,394,431,432
Фруктозо-1,6-дифосфат 269, 314, 321
Фруктозо-2,6-дифосфат 269
Фруктозо-6-фосфат 269,314,321
Фруктокіназа 269
Фтор 287
Фторид 354, 355
Фундоплікація 451
Функція
вестибулярних ядер 171
гіпоталамуса 231
коґнітивна 251
статева 238
Фуросемід 667
Харчування 286, 372
малооб’ємне 469
парентеральне 469
Хвиля
а 520, 543
с 520,543
V 520,543
дельта 181
звукова 164,165
Майєра 557
пересувна в ендолімфі 167
перистальтична 465, 467
повільна 185
Траубе-Герінга 557
ударна 520
Хвіст полі(А) 20
Хвороба 41
Аддісона 349, 449
Альцгеймера 246,250,251,281,287,
404, 565
базедова 301,486
бері-бері 289
Віллебранда 500
Вільсона 199, 287
Гантінґтона 24, 200
гемолітична 495
новонароджених 494, 495
Ґерстмана-Штройслера-Шайнкера 187
гіалінових мембран 601
гіпертонічна 420
гірська короткочасна 629
Гіршспрунґа 43, 470, 548
Грейвса 42,301,302,411
декомпресійна 635, 637, 638
Дента 650, 653
жовчного міхура 285
імуноглобулінозалежна 341
кесонова 637
Крейтцфельда-Якоба 187
куру 187
Кушінґа 340
Лу Ґеріґа 252
Мак-Ардла 267
морська 171
космічна 171
Паркінсона 200, 252, 567, 578
Педжета 362
серологічна 341
серця застійна ціанотична 631
серця ішемічна 283
Тей-Сакса 11
Хартнупа 433
Шарко-Марі-Тута 15
Хейлоз 289
Хемокін 632
Хеморефлекс
вінцевий 555, 623
легеневий 554
пульмональний 623
Хеморецептор 551, 584, 618, 620
аортальний 634, 636
гіпоксичний 634
довгастого мозку 620
каротидний 634, 636
периферійний 625
Хеморецептори 111, 172
Хемотаксис 285, 474
Хемотрипсин 433, 458
Хемотрипсиноген 458
Хід слуховий зовнішній 159
Хіломікрон 279,281,435
Хілоторакс 632
Хімозин 433
Хімотрипсин 430
Хімус 464, 465
Хінідин 526
Хлор 435
Хлорат 304
Хлорпромазин 215
Холекальциферол 356
Холекінетик 463
Холелітіаз 463
Холера 436
Холеретик 463
Холестерол 275, 279, 281, 282, 316, 332, 333,
335, 346, 348, 369, 434, 435, 460, 463
Холестеролдесмолаза 333, 335
Холестеролестергідролаза 335, 430
Холестиролгідролаза 333
Холецистографія
оральна 463
ядерна 463
Холецистоектомія 463
Холецистокінін 148, 221, 319, 361, 442, 446,
447, 454, 457, 458
Холін 91,468,562
Холінацетилтрансфераза 91,246
Холінестераза 91
неспецифічна 91
специфічна 91
справжня 91
Холінорецептор
мускариноподібний 91,92
нікотиноподібний 91, 98
Хондрогенез 368
Хондроцит 360
Хорея 200
Гантінґтона 567
Хоріоцентез 382
Хром 287
Хроматин 15
статевий 378
Хроматогранін А 93
хроматогранін В 93
Хроматографія газова 594
Хромосома 15, 16
X 154,377,378,419
людини 378
соматична 377
статева 377
Целюлоза 469
Центр
Брока 565
вазомоторний 551,584,585
Верніке 565
дихальний 315,616,626,634,636
насичення 219
організації мікротрубочок 14
пневмотаксичний 617
серцевий 585
харчовий 218,219
Центри життєво важливі 214
Центріоль 14
Центросома 14
Церулоплазмін 199,496
Цибулина нюхова 173
додаткова 174
Цикл
ановуляторний 400, 409
гіпофізарно-яєчниковий 240
еструс 239,401
зміни світла і темряви 425
клітинний 18
Кребса 97, 264
лимонної кислоти 66, 97, 261, 264, 275,
276, 314
лімбічний 238
матковий 399
місячний 385, 397
Пейпеца 238
піхвовий 400
сечовини 271
спання-неспання 217
трикарбонових кислот 264
яєчниковий 397
Циклін 18
Циклооксигеназа 284, 285, 548
Циклоспорин 487
Циліндр 665
Циметидин 456
Цинга 291
Цинк 287
Циркуляція ентерогепатична 293, 403, 460-
463
Цироз печінки 296, 337, 349, 420, 466, 543,
666
Цистеїн 270,271,285,422
Цистерна
перинуклеарна 16
термінальна 60
Цистинурія 433
Цистометрія 667
Цистометрограма 667
Цитидинтрифосфат 261
Цитозин 16
Цитокіни 220, 235, 339, 354, 355, 416, 476,
478, 479, 482, 484, 582, 586
Цитопемпсис 32
Цитоплазма слизових клітин 430
Цитоскелет 11
Цитотрофобласт 411
Цитохром Ьс1 10
Цитохром Р450 285, 333, 334, 336, 356
(С¥Р) монооксигеназа 285
Цитохром с 491
Цитохромоксидаза 10,261,630,634
Цитрулін 271
Ціанід 620
Ціанметгемоглобін 634
Ціаноз 583,628,631,632
Ціанокобаламін 291,456,457,468
Час
викидання лівого шлуночка 520
кровоплину середній 534
реакційний 166
рефлексу 118
темпової адаптації 155
ПОКАЖЧИК / 767
Частка
гіпофіза задня 96, 215, 223, 226, 563
гіпофіза передня 96,215,363,416
жмутково-вузликова 202, 205
кори головного мозку
лобова 200
потилична 140, 149
скронева 161,168,241
ліва 253, 255
медіальна 250
права 255
кори лобова 242
медіальна 250
острівцева 131
лімбічна 237
пірамідна 291
потилична 140
Частота 165
злиття критична 156
серцевих скорочень 518, 523, 526, 551,
558, 581, 591
Черв’як 202
Число Рейнольдса 533
Чутливість
больова 130
вібраційна 136
до інсуліну 323
до солі 589
підвищена 109
денерваційна 108
сповільненого типу 482
температурна 130
Чхання 214, 623
Шаперон 22
Шар
базальний 399
нерухомий 429
функціональний 399
Швидкість
клубочкового фільтрування 375, 418,
646, 647
критична 533
руху рідини середня 534
Шизофренія 242, 245, 253, 565
Шийка матки 400
Шипик дендритний 45, 77
Шкала децибельна 165
Шкіра 349
Шлунок 430, 451
Шлуночок четвертий 245
Шлях
ЗАК2-8іаі 368
аферентний 214, 392
вентральний 152, 189
гіпоталамо-гіпофізарний 215
дихальний 594, 609
дорсальний 152
екзогенний 279
Ембдена-Мейєргофа 264, 267
ендогенний 279
задній спинномозочковий 206
зоровий 140
кірково-спинномозковий 189
латеральний 189
кірково-ядерний 189
класичний 479
клиномозочковий 206
колінчасто-шпорний 140
конститутивний 25
мосто-мозочковий 206
неконститутивний 25
окиснення пентозофосфатний 264
оливо-мозочковий 206
параклітинний 650
пентозомонофосфатний 264
передній 189
спинномозочковий 206
передньолатеральний 130
передсердний міжвузловий 501
петельний 130
покришко-мозочковий 206
покришко-спинномозковий 189
присінково-мозочковий 206
присінково-спинномозковий 189, 196
ретикуло-спинномозковий 189
скроневий 152
сосочково-таламічний 238
спільний кінцевий 125
спіноталамічний 131
тім’яний 152
червоноядерно-спинномозковий 189
Шок 349, 376, 572, 573, 583, 624
анафілактичний 476, 586
больовий шкіри 249
вазогенний 583
геморагічний 583, 587
гіповолемічний 583, 586
застійний 587
кардіогенний 583, 587, 590
нейрогенний 586
необоротний 585
низького опору 583
обструктивний 583, 587
опіковий 583, 586, 587
перерозподілу 583
рефрактерний 585
розподілу 586
септичний 586
спінальний 193
травматичний 583, 586, 587
хірургічний 583, 586, 587
Шуми
серцеві 521
систолічні 533
м’які 521
Шунт 531
венозно-артеріальний 631
фізіологічний 606
Шунтування аортокоронарне 571
Щілина
голосова 599
залишкова 364
фільтраційна 641
Юксталокортекс 238
Юмамі 176
Яблуко очне 140,145,217
Явище
сіфа уц 251
виходу 345
Ядерце 16
Ядра
, задіяні в еферентних (регулювальних)
механізмах 179
основи переднього мозку. 245
специфічні сенсорні релейні 179
стовбура головного мозку 189
черепних нервів 207
Ядро 15, 16
базальне 188, 195, 198-200, 245, 246, 250
вентромедіальне 219, 241
внутрішньоламінарне 179
гіпоталамуса 244, 342
надперехресне 243
супрахіазматичне 140, 185
горбово-сосочкове 185,245
Дейтерса 162
дорсальне блукаючого нерва 551
дугоподібне 216,220
завиткове вентральне 161
завиткове дорсальне 161
зубчасте 203
кіркоподібне 203
клиноподібне 126
Куллікера-Фузе 617
кулясте 203
медіальне 617
медіального пучка переднього мозку 219
Мейнерта 251
базальне 246, 251
мигдалеподібне 238, 240, 241
мозочка 203
надзорове 215,223,228
надперехресне 217, 224, 425
напівлежаче 242
ніжне 126
оливи 204
парабрахіальне 617
перегородкове 237,241,245
підталамічне 198
подвійне 449,551,553
покришки заднього мозку 216
покришки середнього мозку 216
поодинокого шляху 176,226,449,553
присерединне 179
присінкове 162
пришлуночкове 216, 224
проміжне 203
середнього мозку 197
середньої лінії 126
сочевицеподібне 198, 199
таламуса 179,238,244
вентролатеральне 203
внутрішньоламінарне 185
перемикальне 176
хвостате 198, 200, 255
циклопентанпергідрофенантренове
гормонів 332
шатра 203
шва 217
моста 216
стовбура головного мозку 243
Яєчко 377, 390
Яєчник 377, 398
Яйцеклітина 16
Якірець глікозилфосфатидилінозитний 9
Ямка
клатриноблямована 281
центральна 140
Ямочка шлункова 451
Янус-тирозинкіназа 41
Навчальне видання
Вільям Ф. ҐАНОНҐ
ФІЗІОЛОГІЯ ЛЮДИНИ
Підручник
Наукові редактори перекладу:
М.Гжегоцький, заслуж. діяч науки і тех. України, д-р мед. наук, проф.,
В.Шевчук, член-кор. АПН України, д-р мед. наук, проф.,
О.Заячківська, доц., канд. мед. наук.
Редактор М. Мартиняк
Коректор М. Маньковська
Підписано до друку 06.08.2002
Формат 84x108/16. Папір офсетний. Гарн. Тайме.
Друк офсетний. Умови, друк. арк. 82,32.
Зам. 367-2
Видавництво «БаК»
а/с 9009, Львів 79011
тел.: (0322) 72 67 50
тел./факс: (0322) 72 26 29
Ьіір:/Лу\¥\у.Ьак.ІУІУ.иа
Надруковано з готових діапозитивів
на ВАТ „Львівська'книжкова фабрика „Атлас“,
79005, м. Львів, вул. Зелена, 20
Межі значень показників у крові (К), плазмі (П) або сиворотці (С)1
Означення Показники у нормі
Традиційні одиниці Одиниці системи 01
Ацетоацетат з ацетоном (С) Альдостерон (у положенні лежачи) (П) Альфа-аміно азот (П) Амінотрансферази Аланінамінотрансфераза Аспартатамінотрансфераза Аміак (К) Амілаза (С) Аскорбінова кислота (К) Білірубін (С) 0,3-2,0 мг/дл 3,0-10 нг/дл 3,0-5,5 мг/дл 3-48 одиниць/л 0-55 одиниць/л 12-55 мкмоль/л 53-123 одиниць/л 0,4-1,5 мг/дл (натще) Кон’югований (прямий): до 0,4 млг/дл Загальний (кон’югований разом з прямим): до 1,0 млг/дл 3-20 мг/л 83-227 пмоль/л 2,1-3,9 ммоль/л 12-55 мкмоль/л 884-2050 пмоль с~1/л 23-85 мкмоль/л до 7 мкмоль/л до 17 мкмоль/л
Кальцій (С) Діоксид карбону (вуглекислий газ) (С) Каротеноїди (С) Церулоплазмін (С) Хлорид (С) Холестерол (С) Холестеролові ефіри (С) 8,5-10,5 мг/дл; 4,3-5,3 млекв/л 24-30 мекв/л 0,8-4,0 мкг/мл 23-43 мг/дл 100-108 мекв/л < 200 мг/дл 60-70% від загального холестеролу 2,1-2,6 ммоль/л 24-30 ммоль/л 1,5-7,4 ммоль/л 240-430 мг/л 100-108 ммоль/л <5,17 ммоль/л
Мідь (загальний вміст) (С) Кортизол (П) (зранку натще) Креатинін (П) Глюкоза, натще (П) Залізо (С) Молочна кислота (К) 70-155 мкг/дл 5-25 мкг/дл 0,6-1,5 мг/дл 70-110 мг/дл 50-150 мкг/дл 0,5-2,2 мекв/л 11,0-24,4 мкмоль/л 0,14-0,69 мкмоль/л 53-133 мкмоль/л 3,9-6,1 ммоль/л 9,0-26,9 мкмоль/л 0,5-2,2 ммоль/л
Ліпаза (С) Ліпіди, загальний вміст (С) Маґній (С) Осмоляльність (С) РСо2 (артеріальної крові) (К) ГІепсиноген (П) 3-19 одиниць/л 450-1000 мг/дл 1,4-2,0 мекв/л 280-296 млосм/кг Н2О 35-45 мм рт. ст. 200-425 одиниць/мл 4,5-10 г/дл 0,7-1,0 ммоль/л 280-296 ммоль/кг Н2О 4,7-6,0 кПа
РН (К) Фенілаланін (С) Фосфатаза кисла (С) Фосфатаза лужна (С) Фосфоліпіди (С) Фосфор неорганічний (С) 7,35—7,45 0-2 мг/дл чоловіки: 0-0,8 сігма одиниць/мл жінки: 0,01-0,56 сігма одиниць/мл 13-39 одиниць/л (дорослі) 9-16 мг/дл як фосфор ліпідів 2,6-4,5 мг/дл (діти першого року життя: до 6,0 мг/дл) 0-120 мкмоль/л 0,22-0,65 мкмоль с~1/л 2,9-5,2 ммоль/л 0,84-1,45 ммоль/л
Ро2 (артеріальної крові) (К) Калій (С) Білок Загальний вміст (С) Альбумін (С) Глобулін (С) Піровиноградна кислота (П) 75-100 мм рт. ст. 3,5-5,0 мекв/л 6,0-8,0 г/дл 3,1-4,3 г/дл 2,6-4,1 г/дл 0-0,11 мекв/л 10,0-13,3 кПа 3,5-5,0 ммоль/л 60-80 г/л 31^3 г/л 26-41 г/л 0-110 мкмоль/л
Натрій (С) Азот сечовини (С) Сечова кислота (С) Жінки Чоловіки 135-145 мекв/л 8-25 мг/дл 2,3-6,6 мг\дл 3,6-8,5 мг/дл 135-145 ммоль/л 2,9-8,9 ммоль/л 137-393 мкмоль/л 214-506 мкмоль/л
1 Укладена частково на підставі Кгаіг А, І_е\л/апсіго\л/8кі КВ: Могтаї геїегепсе ІаЬогаіогу уаіиез. N ЕпдІ З Месі 1998;339:1063.
Див. також табл. 27-1: Показники кількості клітинних елеметів у крові людини в нормі і табл. 32-2: Концентрації речовин у
плазмі та спинномозковій рідині людини. Значення показників різних лабораторій можуть відрізнятися між собою, що зумовлено
особливостями методів, які застовують. У деяких лабораторіях визначають специфічні показники, що наводять з відповідними
нормативами.