Автор: Філімонов В.І. Наливайко Д.Г. Райцес В.С. Шевчук В.Г.
Теги: медицина фізіологія
ISBN: 5-311-00736-2
Год: 1994
Текст
ші<зі:олагіґя
НОРМАЛЬНА
За редакцією професора В. І. ФІЛІМОНОВА
Затверджено Головним Управлінням навчальних закладів, кадрів і науки Міністерства охорони здоров'я України як підручник для студентів медичних вузів
КИЇВ «ЗДОРОВ'Я» 1994
ББК 28.903я73
Н83
УДК 612
Авторський колектив: проф. В І. Філімонпв, проф. Д. Г. Наливайко, проф. | В. С. Райцес |, проф. В. Г. Шевчук.
Підручник підготовлено відповідно до діючої програми з курсу нормальної фізіології, написаний він за системним принципом.
З метою підготовки лікаря широкого профілю особливу увагу приділено фізіології вісцеральних систем. Введено деякі нові розділи, а саме: «Фізіологія мембран», «Гомеостаз і гомеокінез», «Фізіологічні аспекти адаптації» тощо.
У «Додатку» наведено головні фізіологічні показники.
Для студентів медичних вузів і медичних факультетів університетів.
Рецензент
д-р мед. наук проф. Е. М. Панасюк
1910000000-036 і46.93
Н 209-94
I$ВN 5-311-00736-2
© В. І. Філімонов, Д. Г. Наливайко, В. С. Райцес, В. Г. Шевчук, 1994
Передмова
Нормальна фізіологія — одна з основних фундаментальний дисциплін, знання якої конче потрібне лікарю будь-якої спеціальності.
Цей підручник написано відповідно до нової програми з нормальної фізіології для студентів медичних інститутів України. У зв’язку з цим змінено послідовність розташування деяких розділів, написано кілька нових, а саме: «Фізіологія біологічних мембран», «Фізіологія процесів адаптації», «Розмноження».
Наукові дані, одержані протягом останніх років, дозволили істотно переглянути погляди на функції деяких органів та систем, механізми їх регуляції. Особливістю підручника є системний підхід до вивчення функцій організму людини, значну увагу приділено розгляду вегетативних його реакцій та механізмам їх регуляції, взаємодії організму з навколишнім світом. Описано вікові зміни не лише в процесі росту та розвитку дитини, але й під час старіння.
У наявних підручниках цим проблемам приділяється мало уваги, хоча лікарю досить часто доводиться спілкуватись з літніми людьми та пацієнтами похилого віку.
При написанні підручника використано досвід викладання на кафедрах нормальної фізіології Українського медичного університету ім. акад. О. О. Богомольця, Запорізького та Івано-Франківського медичних інститутів, матеріали підручників та монографій, що вийшли в світ протягом останніх років. Особливо це стосується таких видань, як А. С. Оиуіоп «ТехІЬоок ої Месіісаі Рііузіоіо^у» (1991), XV. Е. Сапоп£ «Кеуіщу ої Месіісаі Рйузіоіо^у» (1991),«Фи-зиодогия человека» за ред. Р. Шмідта та Г. Тевса (1986); А. Оез-ророиіоз, 8і. ЗіІЬегпа^І «Соїог Аііаз ої Рйузіоіо^у» (1936) та деяких інших.
Підручники з фізіології друкувались в Україні й раніше (Д. С. Воронцов, А. І. Ємченко «Фізіологія тварин і людини», 1952; І. С. Кучеров «Фізіологія людини», 1981, 1991, та ін.), але всі вони призначались для студентів університетів та педагогічних інститутів. Підручник для студентів медичних інститутів України виходить вперше, і тому зрозумілі труднощі, що виникли при його написанні.
Автори будуть щиро вдячні за критичні зауваження, які виникнуть у процесі користування цим підручником.
Вважаю за обов’язок висловити подяку акад. АН України, проф. М. Ф. Шубі, проф. Є. М. Панасюку та колективу очолюваної ним кафедри нормальної фізіології Львівського медичного інституту за критичні зауваження, висловлені при рецензуванні підручника.
Проф. В. І. Філімонов
РОЗДІЛ 1
Загальна фізіологія
ОСНОВНІ поняття
ФІЗІОЛОГІЇ
Нормальна фізіологія — наука про об’єктивні закономірності функцій живого організму, про взаємозв’язок цих функцій, їх зміни під впливом зовнішнього середовища. Завданням нормальної фізіології є глибоке вивчення механізмів життєдіяльності здорової людини з метою виявлення причин та характеру порушень цих механізмів при різних захворюваннях. Тому фізіологія є теоретичною основою медицини.
Багато розділів фізіології виділилось в окрему науку, наприклад, фізіологія праці, фізіологія спорту, вікова фізіологія, авіа-космічна фізіологія, клінічна фізіологія тощо. Для аналізу функцій організму потрібне знання основ хімії та фізики, генетики та біології, анатомії та гістології тощо.
Функцію вивчають на різних рівнях: субклітинному (наприклад, фізіологія плазматичних мембран чи мітохондрій); клітинному (наприклад, фізіологія нервових чи секреторних клітин); органному (наприклад, фізіологія серця чи нирок); системному (наприклад, система терморегуляції або травлення). Під фізіологічною системою розуміють сукупність органів, які виконують певну функцію і мають спільні механізми регуляції. Наприклад, до системи виділення належать нирки, легені, органи травлення, шкіра і нейрогуморальні механізми регуляції діяльності цих органів у процесі виведення з організму різних речовин. Метою діяльності кожної системи є досягнення кінцевого результату.
Фізіологія належить до експериментальних наук. Вона користується рядом методів дослідження функцій.
1. Спостерігаючи за тваринами, фахівець не втручається в перебіг життєвих процесів. Це метод спостереження.
2. Дослідження ділять на гострі та хронічні. Гострі дослідження проводять під наркозом. Вони можуть супроводжуватись перерізуванням нервів, уведенням різних речовин. У таких умовах не можна вивчати функції здорового організму, але за допомогою цього методу одержано багато цінних даних. У хронічних дослідах (І. П. Павлов) операція і спостереження функцій не проводяться одночасно.
Операція є лише підготовчим етапом (наприклад, уведення фі-
стули у шлунок), а власне дослідження проводять після одужання тварин. Цей метод дозволяє дослідити функції в умовах, що максимально наближені до природних.
3. Спостереження функцій. Сучасні методи (електрофізіологічні, ультразвукова діагностика, комп’ютерна томографія та ін.) дають змогу без шкоди для здоров’я людини дослідити різні функції.
4. За допомогою застосування штучної моделі, яка функціонально близька до певного органа чи системи (наприклад, штучна нирка, штучне серце, модель системи кровообігу), вивчають функції певних органів і систем. Це метод моделювання.
Усі живі клітини здатні реагувати на подразник і під його впливом переходити зі стану спокою в стан збудження. Подразники можуть бути механічними, хімічними, термічними, електричними, біологічними тощо. У процесі еволюції в нервових, м’язових, залозистих клітинах виробилась здатність реагувати на подразник збудженням. Такі клітини називають збудливими, а їх здатність відповідати на подразнення — збудливістю.
Збудження — складний процес переходу зі стану відносного спокою в стан діяльності, тобто в активний стан. Збудження проявляється біохімічними, структурними, біофізичними, функціональними змінами. Найчастіше збудження характеризується зміною електричних потенціалів клітинних мембран. Воно має специфічні, характерні для певних клітин (скорочення, секреція, проведення нервового імпульсу), а також неспецифічні (зміни обміну речовин, виділення тепла тощо) ознаки.
Після періоду діяльності звичайно настає період відпочинку. Таким чином, основними функціональними станами клітини, органа чи системи є такі періоди: відносного спокою, діяльності та період відпочинку.
ФІЗІОЛОГІЯ МЕМБРАН
Будова клітини, наявність у ній великої кількості органел (ядро, ендоплазматична сітка, комплекс Гольджі, мітохондрії, рибосоми та ін.) тісно пов’язані з її функцією. Кожна клітина (нервова, м’язова, секреторна тощо) відзначається особливостями структури та функції. Обов’язковою для всіх клітин є наявність мембран. Розрізняють клітинні мембрани, що відокремлюють клітину від навколишнього середовища, і мембрани органел.
БУДОВА І ФУНКЦІЇ КЛІТИННОЇ
МЕМБРАНИ [ПЛАЗМОЛЕМИ]
Плазмолема складається з двох шарів молекул ліпідів (переважно фосфоліпідів) — ліпідного бішару та білків, які пронизують бішар ліпідів наскрізь — інтегральні білки — або виступають з
Мал. 1. Схема будови клітинної мембрани (за даними В. XV. Езаусєіі, 1981): / — бішар ліпідів; 2 — білкові молекули, що проникають через бішар ліпідів; 3 — білкові молекули, що містяться із зовнішнього боку; 4 — білкові молекули, що містяться з внутрішнього боку; 5 — глікопротеїди з полісахаридиими ланцюжками
нього назовні чи в середину клітини — периферичні білки (мал. 1). Більшість із цих білків, що ніби плавають у ліпідах,— глікопро-теїни. На поверхні білків, що виступають назовні, можуть бути фіксовані молекули вуглеводів.
Плазмолема дуже тонка (завтовшки 7,5—10 нм) і еластична. Основні її функції: створення бар’єру між середовищем клітини та навколишньою міжклітинною рідиною; участь у підтриманні внутрішньої структури клітини, її цитоскелета; рецепція різних медіаторів, гормонів та інших фізіологічно
Таблиця 1. Вміст деяких речовин у клітинній та позаклітинній рідинах
Речовина Позаклітинна рідина Клітинна рідина Концентрація в клітині
N3+ 142 мекв/л 10 мекв/л Менша в 14 разів
к+ 4 мекв/л 140 мекв/л Більша в 35 разів
Са2+ 2,4 мекв/л 0,0001 мекв/л Менша в 24 000 разів
сі- 103 мекв/л 4 мекв/л Менша в 25 разів
НСО3- 28 мекв/л 10 мекв/л Менша в 2,8 разу
Фосфати 4 мекв/л 75 мекв/л Більша в 19 разів
Глюкоза 90 мг % 0—20 мг % Менша в багато разів
Амінокислоти ЗО мг % 200 мг % Більша в 7 разів
Білки 2 мг % 16 мг % Більша в 8 разів
активних речовин; зміна проникності мембрани для різних речовин; створення електричних потенціалів по обидва боки мембрани. Важливі також антигенні властивості цих мембран.
Завдяки бар’єрній функції створюється різниця у складі рідини як у власне клітині, так і за її межами (табл. 1).
Таким чином, існує градієнт концентрації іонів та молекул по обидва боки плазмолеми. Цей градієнт пояснюється тим, що транспортуються іони та молекули через мембрану по-різному.
ТРАНСПОРТ ІОНІВ ТА МОЛЕКУЛ
ЧЕРЕЗ МЕМБРАНУ
Розрізняють пасивний та активний транспорт. Пасивний транспорт відбувається без затрат енергії за електрохімічним градієнтом. До пасивного належать дифузія (проста та полегшена), осмос, фільтрація. Активний транспорт потребує енергії і відбувається всупереч концентраційному або електричному градієнту.
Пасивний транспорт
Дифузія може відбуватись або через ліпідний бішар, або за участю білків (мал. 2). Дифузія через ліпідний бішар — це проста дифузія, що залежить від концентрації речовин по обидва боки мембрани та температури. Так переходять через мембрану речовини, що розчиняються в ліпідах (Ог, СО2, азот, алкоголь). Кисень проходить так легко, ніби мембрани і не існує. Через мембрану легко проходить і вода завдяки невеликому розміру її молекул.
Проста дифузія відбувається не тільки через ліпідний бішар, але й через білкові канали та «ворота» в них. Ці канали високо-селективні, транспорт через них залежить від виду іонів чи молекул, їх діаметра, форми, електричного заряда. Натрієві канали мають діаметр 0,3—0,5 нм, їх внутрішня поверхня негативно заряджена (мал. 3). К+-канал має діаметр 0,3 нм, електричного заряду не має. Конформаційні зміни форми білкових молекул впливають на стан «воріт» (відкриті чи закриті), в Ца+-каналах вони розташовані на зовнішній, а в К+-каналах — на внутрішній поверхні каналу.
Стан «воріт» контролюється двома принципово відмінними механізмами: 1) стан «воріт» залежить від різниці електричних потенціалів по обидва боки мембрани, це потенціалзалежні канали;2)хемочутливі канали ті, білкові сполуки яких здатні зв’язуватись із деякими речовинами—лігандами. Це викликає конформаційні зміни білкової молекули і реакцію «воріт». До ліганд належить ацетилхолін.
Потенціалчутливі канали реагують за законом, що формулює
Псзаклі' ине середовище
Мал. 2. Пасивний транспорт через клітинну мембрану:
і — дифузія через мембра-ну; 2 — дифузія через канал; 3 — полегшена дифузія Мал. 3. Транспорт Иа++ +К+ через білкові канали:
/ — «ворота» зачинені; 2 -«ворота» відчинені (А. Сиу-іоп, 1991)
Внутрішнє середодище клітини
ться словосполученням «все або нічого». Стан «воріт» змінюється дуже швидко (мільйонні частки секунди). Зараз є точні методики дослідження потоку іонів через одиночні канали (за допомогою мікропіпеток, діаметр кінчика яких становить 1—2 мкм).
Полегшена дифузія відбувається за участю специфічного білка-переносника, що сприяє дифузії. Від простої дифузії відрізняється тим, що швидкість її збільшується тільки до певної міри, а потім залишається постійною. Таким чином транспортуються глюкоза та більшість амінокислот.
На швидкість дифузії впливають концентрація речовини по обидва боки мембрани, її проникність та ряд інших факторів. А проникність залежить від товщини мембрани, кількості каналів на одиницю площі, молекулярної маси речовини, температури.
Осмос має значення для транспорту води через мембрани, які
проникні для води, але не для іонів (напівпроникні мембрани). Якщо концентрація речовини по обидва боки мембрани різна, то вона буде переходити туди, де концентрація вища (мал. 4). Це спостерігається доти, доки концентрація не вирівняється.
Для створення осмотичного тиску має значення не молекулярна маса речовини, а кількість молекул
Мал. 4. Приклад осмосу — перехід води через напівпроникну мембрану б розчин №СІ:
І —. молекули води; 2 — молекули МаСІ
Портал бесплатной медицинской литературьі МесІШесІі«ги
Уважаемий читатель!
Если ви скопируете данньїй файл, Вьі должньї незамедлительно удалить его сразу после ознайомлення с содержанием.
Копируя и сохраняя его Ви принимаете на себя всю ответственность, согласно действующему международному законодательству.
Все авторские права на данньїй файл сохраняются за правообладателем. Любое коммерческое и иное использование кроме предварительного ознайомлення запрещено.
Публикация данного документа не преследует никакой коммерческой ВЬІГОДЬІ.
Но такие документи способствуют бьістрейшему профессиональному и духовному росту читателей и являются рекламой бумажньїх изданий таких документов.
Все авторские права сохраняются за правообладателем. Если Ви являєтесь автором данного документа и хотите доповнить его или изменить, уточнить реквизитьі автора или опубликовать другеє документи, пожалуйста свяжитесь с нами - мьі будем ради услишать ваши пожелания.
Данний файл скачан с портала МесІШесІі (ННр://тес1ше<1і.ги) **★ Заходите - будем радьі:-)
на одиницю об’єму розчину. Перехід води за законами осмосу відбувається дуже швидко. Визначається величина осмотичного тиску в атмосферах, у міліметрах ртутного стовпа або в міліосмолях. Ця величина у клітинній та позаклітинній рідині дорівнює 7,6 атм, або 300 мосм/кг.
Активний транспорт
Це транспорт речовин всупереч концентраційному або електричному градієнту, що відбувається із затратами енергії. Розрізняють первинний активний транспорт, що потребує енергії АТФ, та вторинний (створення за рахунок АТФ іонних концентраційних градієнтів по обидва боки мембрани, а вже енергія цих градієнтів використовується для транспорту).
Первинний активний транспорт широко використовується в організмі. Він бере участь у створенні різниці електричних потенціалів між внутрішнім та зовнішнім боками мембрани клітини. За допомогою активного транспорту створюються різні концентрації Ца+, К+, Н+, С1~ та інших іонів у середині клітини та в позаклітинній рідині.
Найкраще досліджено транспорт Ца+ та К+ — Ца+,-К+-насос. Цей транспорт відбувається за участю глобулярного білка з молекулярною масою близько 100 000. Білок має три ділянки для зв’язування Ца+ на внутрішній поверхні та дві ділянки для зв’язування К+ на зовнішній поверхні (мал. 5). Спостерігається висока активність АТФ-ази на внутрішній поверхні білка. Енергія, що утворюється при гідролізі АТФ, зумовлює конформаційні зміни білка і при цьому виводиться три іони ІЧа+ з клітини і вводиться у неї два іони К+. За допомогою такого насоса створюються висока концентрація N3+ в позаклітинній рідині і висока концентрація К+ — в клітинній.
Останнім часом інтенсивно вивчаються Са2+-насоси, завдяки яким концентрація Са2+ у клітині в десятки тисяч разів нижча, ніж поза нею. Розрізняють Са2+-насоси у клітинній мембрані і в органелах клітини (саркоплазматична сітка, мітохондрії). Са2+-на-соси теж функціонують за рахунок білка-переносника в мембранах. Цей білок має високу АТФ-азну активність.
Вторинний активний транспорт. Завдяки первинному активному транспорту створюється висока концентрація Ца+ за межами клітини, виникають умови для дифузії Ца+ в клітину, але разом з Ца+ інші речовини можуть увійти в неї. Цей транспорт, спрямований у один бік, називається симпортом. У іншому випадку вхід №+ стимулює вихід іншої речовини з клітини, це два потоки, спрямовані в різні боки,— антипорт.
Прикладом симпорту може бути транспорт глюкози або аміно-
Позаклітинне середовище З На*
Мал. 5. N3+-, К+-насос клітинної мембрани
0 0 0 0 2
Мал. 6. Схема піноцитозу:
1 — рецептори клітинної мембрани; 2 — макромолекули; 3 — актин та міозин; 4— ферменти, що виділяються у вакуоль
кислот разом з N3+. Білок-переносник має дві ділянки для зв’язування ІЧа+ і для зв’язування глюкози або амінокислоти. Ідентифіковано п’ять окремих білків для зв’язування п’яти типів амінокислот. Відомі й інші види симпорту — транспорт разом з С1~ у клітину, К+ і С1~ з клітини та ін.
Майже в усіх клітинах існує механізм антипорту — N3+ переходить у клітину, а Са2+ виходить з неї, або N3+—у клітину, а Н+ — з неї.
Активно транспортуються через мембрану М^2+, Ре2+, НСОГ та багато інших речовин.
Піноцитоз— це один із видів активного транспорту. Він полягає в тому, що деякі макромолекули (переважно білків, макромолекули яких мають діаметр 100—200 нм) приєднуються до рецепторів мембрани. Ці рецептори специфічні для різних білків. Приєднання їх супроводжується активізацією скоротливих білків клітини — актину та міозину, які утворюють і закривають порожнину з цим позаклітинним білком і невеликою кількістю позаклітинної рідини. При цьому утворюється піноцитозний пухирець (мал. 6). У нього виділяються ферменти, що гідролізують цей білок. Продукти гідролізу засвоюються клітиною. Піноцитоз потребує енергії АТФ та наявності Са2+ в позаклітинному середовищі.
Таким чином, є багато видів транспорту речовин через клітинні мембрани. На різних боках клітини (на апікальній, базальній, латеральній мембранах) можуть відбуватись різні види транспорту. Прикладом цього можуть бути процеси, що відбуваються в нирках при реабсорбції, а також процеси всмоктування в тонкій кишці.
МЕМБРАННИЙ ПОТЕНЦІАЛ СПОКОЮ ТА ПОТЕНЦІАЛ Дії
Усі живі клітини мають різний електричний заряд на зовнішній і внутрішній поверхнях мембрани. Таким чином, мембрана поляризована. У стані спокою зовнішня поверхня має позитивний, а внутрішня — негативний заряд. Ця різниця потенціалів називається мембранним потенціалом спокою (МПС).
Мембранний потенціал спокою
Наявність МПС можна довести шляхом введення в клітину чи в нервове волокно тонкого скляного мікроелектрода, заповненого розчином КС1. Кінчик такого мікроелектрода дуже тонкий (діаметр його становить 0,5—1 мкм). Інший, індиферентний, електрод міститься в позаклітинному середовищі (мал. 7). Коли мембрана ще не проколота, осцилограф не фіксує струму, але як тільки мік-роелектрод пройде через мембрану, прилад засвідчить зміну напруги.
Мембранний потенціал спокою характеризується певними параметрами: 1) постійністю; 2) полярністю (зовнішня поверхня мембрани позитивна, внутрішня — негативна); 3) величиною, що виражається в мілівольтах (мВ).
Величина МПС залежить від концентрації іонів по обидва боки мембрани. Електрорушійну силу (ЕРС) можна визначити за формулою Нернста:
ЕРС (у мВ) = ± 61 1о£-9~,
С2
де Сі — концентрація іона в клітині; С2 — концентрація іона за її межами. Але дифундують різні іони, тому на цей показник впливають їх заряд і стан проникності мембрани для кожного з них.
Проникність мембрани для К+ майже в 100 раз більша, ніж для Йа+, тому основну роль у генерації мембранного потенціалу відіграє дифузія К+ — калієвий дифузійний потенці-а л. К+ дифундує з клітини, але завдяки негативному заряду в ній ці іони затримуються^на зовнішній поверхні мембрани (мал. 8).
На величину МПС впливають невелика дифузія Ца+ в протилежному напрямку, наявність у клітині негативно заряджених білків, аніонів фосфатів-тд інших речовин.
Істотну роль у механізмі генерації МПС грає також М+,-К+-на-сос, що виводитй.із клітини три іони Ца+ на кожні два іони К+, що вводяться в неї. Це ключовий процес, який створює іонну асиметрію. Робота цього насосу залежить від метаболізму клітини і, зокрема, від його енергопостачання.
Таким чином, МПС формується завдяки різним механізмам,
Мал. 7. Внутрішньоклітинний метод реєстрації мембранного потенціалу спокою нервового волокна:
] — обидва електроди на зовнішній поверхні мембрани; 2 — мікроелектрод проколов мембрану
Мал. 8. Дифузійний потенціал мембрани нервового волокна, причиною якого є дифузія К+ з волокна
але основним серед них є дифузія К+ (мал. 9). Підтримання МПС на певному рівні— один із основних показників стану відносного фізіологічного спокою клітини.
Потенціал дії
Потенціал дії (ПД) — це короткочасні високо амплітуди і зміни МПС, що виникають при збудженні. Основною причиною ПД е зміна проникності мембрани для іонів.
Розглянемо розвиток ПД на прикладі нервового волокна. Реєструвати ПД можна при введенні одного з електродів у волокно або розташовуючи обидва електроди на його поверхні. Простежимо процес формування ПД при внутрішньоклітинному методі (мал. 10).
1. У стані спокою мембрана поляризована і МПС дорівнює 90 мВ.
2. Як тільки починається збудження, величина цього потенціалу зменшується (це зменшення називається деполяризацією). У ряді випадків потенціал боків мембрани змінюється на протилежний (так званий овершут). Це перша стадія ПД — деполяризація.
3. Стадія реполяризації, під час якої величина різниці потенціалів падає майже до початкового рівня. Ці дві фази є піком ПД.
4. Після піку спостерігаються слідові потенціали — слідова деполяризація та слідова гіперполяризація (гіперполяри-зація — збільшення різниці потенціалів між боками мембрани). Наприклад, було 90 мВ, а стає 100 мВ.
На1' + _ На* 1Ь2мекв!г> — ~ /4. меквМ
ІЬОмекМл
Мал. 10. Фази потенціалу дії:
/ — фаза деполяризації; 2 — фаза реполяри-зації; 3 — слідовий деполярнзаційннй потенціал; 4 — слідовий гіперполяризаційний потенціал; 5 — овершут і
Мал. 9. Фактори, що впливають на величину МП нервового волокна:
/ — дифузія через мембрану; 2 — дифу&ія N3^" через мембрану; 3 — робота N3-7-., к+ -насоса (А. Оиуіоп, 1991)
Розвивається ПД дуже швидко — за кілька мілісекунд. Параметри ПД: 1) змінний характер, бо змінюється напрямок руху струму; 2) величина, яка завдяки овершуту може перевищувати МПС; 3) час, протягом якого розвиваються ПД і окремі його стадії — деполяризація, реполяризація, слідова гіперполяризація.
Як формується ПД. У стані спокою «ворота» потенціалзалеж-них N2+-каналів закриті. Закриті також «ворота» потенціалзалеж-них К+-каналів.
1. Під час фази деполяризації відбувається активізація №+-ка-налів. При цьому змінюється конформаційний стан білків, що входять до складу «воріт». Ці «ворота» відкриваються, і проникність мембрани для 1Ча+ збільшується в кілька тисяч раз. N3+ лавопо-дібно входить у волокно нерва (мал. 11). У цей час К+-канали відкриваються дуже повільно. Отже, у волокно надходить значно більше N3+, ніж виводиться з нього К+.
2. Реполяризація характеризується закриттям Ца+-каналів. «Ворота» на внутрішній поверхні мембрани закриваються — спостерігається інактивація каналів під впливом електричних потенціалів. Інактивація відбувається повільніше, ніж активація. В цей час прискорюється активація К+-каналів і зростає дифузія К+ назовні.
Таким чином, деполяризація пов’язана переважно зі входом N3+ у волокно, а реполяризація — з виходом із нього К+. Співвідношення між входом Ца+ і виходом К+ змінюється в процесі роз-
Знактибаційні „ворота” Стан
Внутрішнє середовище
спокою
Мі \Укі . к+ Стан спокою
Подільна активація Внутрішнє середовище
Мал. 11. Характеристика потенціалзалежних №+- та К+-каналів під час розвитку ПД (пояснення у тексті)
витку ПД (мал. 12): на початку ПД входить Иа+ в'кілька тисяч раз більше, ніж виходить К+, а потім виходить більше К+, ніж входить №+.
Причиною слідових потенціалів є подальші зміни співвідношення між цими двома процесами. Під час слідової гіперполяризації багато К+-каналів ще залишаються відкритими й К+ продовжує виходити назовні.
Відновлення іонних градієнтів після ПД. Одиночні ПД змінюють різницю концентрацій іонів у нервовому волокні і за його межами дуже мало. Але в тих випадках, коли проходить значна кількість імпульсів, ця різниця може бути досить істотною.
Відновлення іонних градієнтів відбувається тоді за рахунок посилення роботи Па+/К+-насосів — що більшою мірою порушується цей градієнт, то інтенсивніше працюють насоси. При цьому використовується енергія АТФ. Частина її виділяється у вигляді тепла, тому в цих випадках спостерігається короткочасне підвищення температури волокна.
Умови,- потрібні для виникнення ПД. ПД виникає лише за певних умов. Подразники, які діють на волокно, можуть бути різними. Частіше використовується постійний електричний струм. Він легко дозується, мало травмує тканину і найближчий до тих подразників, які існують у живих організмах. \
За яких умов постійний струм може зумовитк появу ПД? Струм має бути досить сильним, діяти певний час, йоію наростання по-
Мал. 12. Співвідношення фаз ПД (вгорі) та проникності мембрани для 1Ча+ та К+ (внизу)
Мал. 13. Вплив електричного струму на розвиток ПД:
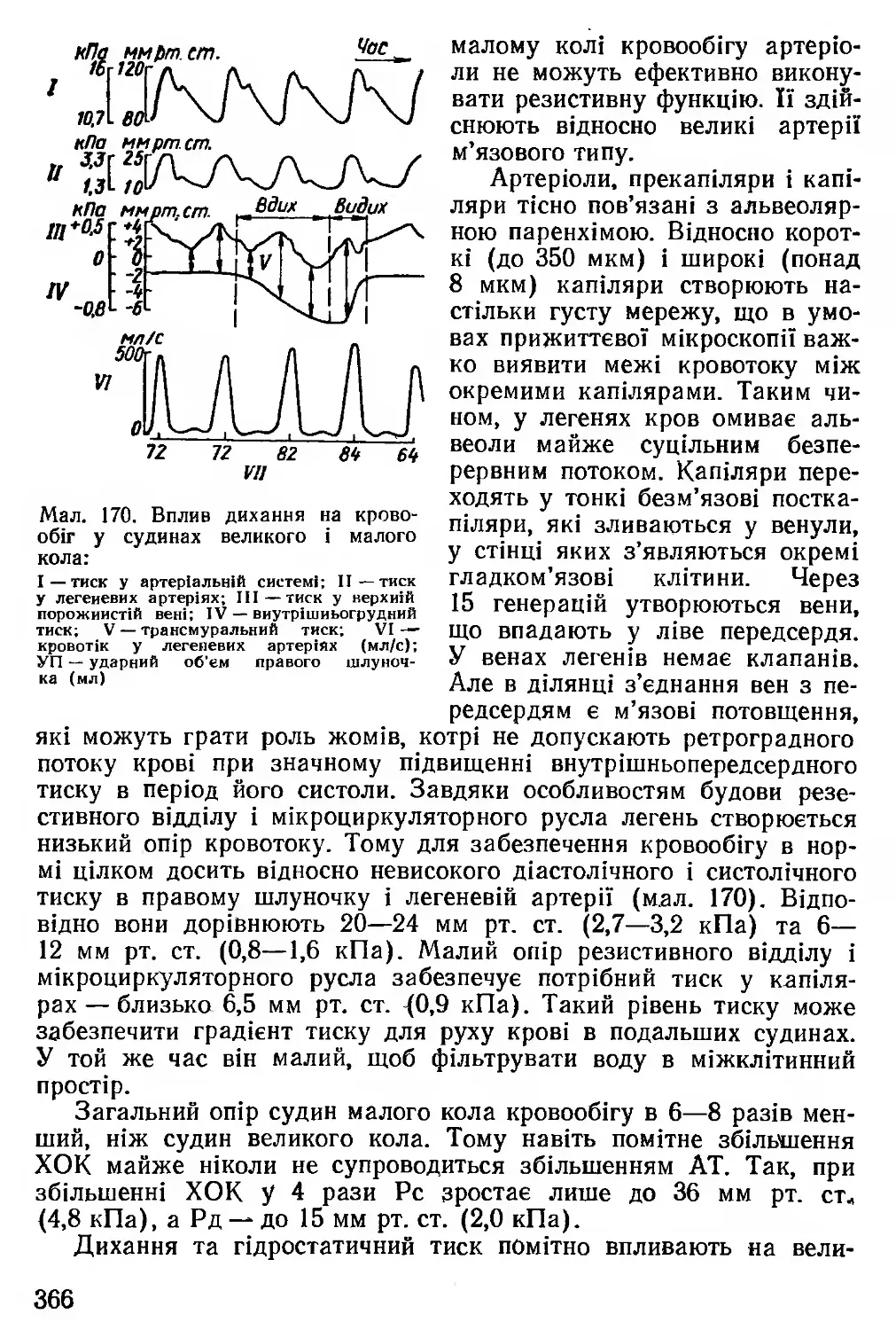
1 — підпороговий струм викликає лише місцеве збудження; 2 — пороговнй струм спричиняє розвиток ПД
винно бути швидким. Нарешті, має значення і напрямок струму (дія аноду чи катоду).
Залежно від сили розрізняють підпороговий (недостатній для виникнення збудження), пороговий (достатній) і надпороговий (надмірний) струм.
Незважаючи на те що підпороговий струм не зумовлює збудження, він усе ж таки деполяризує мембрану, і ця деполяризація тим більша, чим вища його напруга (мал. 13).
Деполяризація, що розвивається при цьому, називається локальною відповіддю і є видом місцевого збудження. Воно характеризується тим, що не поширюється, величина його залежить від сили подразнення (закон силових стосунків: що більша сила подразнення, то активніша відповідь). Під час локальної відповіді збудливість тканини підвищується. Збудливість — це здатність відповідати на подразнення і переходити в стан збудження.
Якщо сила подразника достатня (порогова), то деполяризація досягає певної величини, що називається критичним рівнем деполяризації (Ек). Для нервового волокна, вкритого мієліном, Ек становить близько 65 мВ. Таким чином, різниця між МПС (Ео), що дорівнює в даному випадку 90 мВ, і Ек становить 25 мВ. Ця величина (ДЕ = Е0—Ек) дуже важлива для характеристики збудливості тканини.
Коли Ео збільшується при деполяризації, збудливість вища і, навпаки, зниження Ео при гіперполяризації призводить до її змен
шення. ДЕ може залежати не тільки від величини Ео, але й від критичного рівня деполяризації (Ек).
При пороговій силі подразника виникає ПД. Це вже не місцеве збудження, воно здатне поширюватись на далекі відстані, підлягає закону «все або нічого» (при збільшенні сили подразника амплітуда ГІД не зростає). Збудливість під час розвитку ПД відсутня або значно знижена.
ПД є одним із показників збудження — активного фізіологічного процесу, яким живі клітини (нервові, м’язові, залозисті) відповідають на подразнення. Під час збудження змінюються метаболізм, температура клітин, порушується іонна рівновага між цитоплазмою та зовнішнім середовищем, відбувається ряд інших процесів.
Крім сили постійного струму, виникнення ПД залежить також від тривалості його дії. Існує зворотна пропорційна залежність між силою струму та тривалістю його дії. Підпороговий струм навіть при дуже тривалій дії не зумовить збудження. Надпороговий струм при надто короткій дії також не призведе до збудження.
Для виникнення збудження потрібна також певна (крутизна) наростання сили струму.
Якщо підвищувати силу струму дуже повільно, то буде змінюватись Ек і Ео може не досягти його рівня.
Має значення й напрям струму: ПД виникає при
струму лише тоді, коли катод міститься на зовнішній поверхні мембрани, а анод — у клітині чи волокні. При проходженні струму змінюється МП. Якщо на поверхні лежить катод, то розвивається деполяризація (збудливість підвищується), а якщо анод — гіпер-поляризація (збудливість знижується). Знання механізмів дії електричного струму на живі об’єкти конче потрібне для розробки і застосування в клініці методів фізіотерапії (діатермія, УВЧ, діа-форез і ін.).
Зміна збудливості під час ПД. Під час локальної відповіді збудливість підвищується (ДЕ зменшується). Зміни збудливості під час самого ПД можна помітити, якщо подразнювати повторно в різні стадії розвитку ПД^-Вшшляється^. що під час піку навіть дуже сильне повторне подр ізнення залишається без відповіді (п е -ріод абсолютної р е ф у ~ ~ " Л ~ гт'-'‘’
поступово нормалізується, (період відносної р
При вираженій слідовії і деполяризації збудливість виЦа, ніж початкова, а під час позиті вного сЛідового потенціалу збудливість знову знижується (мал. І2). АбеЬййтйа рефракл ться інактивізацією налів і підвищенням п^ налів. Г' канали_____________ ..._______ ___________________.______
Двофазовий характер ПД. Звйчайнс^в умовах, коли мікроелек-
швидкість
при цьому
замиканні
: ф £ ЙФт е р нбсті). Потім збудливість іде вонй все-таки нижча, ніж початкова еф^актерності).
тй пояснює-ності К+-ка-Ца+-
Під час відносної р г^ірщктерності знов активізуються І І знижується ПрОВІ.1Й.1/?тл,^+-ТГ7ГТТЯдГв,_______________________]
Мал. 14. Співвідношення фаз ПД (вгорі) та збудливості (внизу).
Вгорі: 1 — момент подразнення; 2 — місцеве збудження; 5 — фаза деполяризації ПД; 4 — фаза реполяризації; 5 — слідовий деполя-ризаційний потенціал; 6 — слідовий гіперполя-ризаційннй потенціал; 7 — овершут
Внизу: 1 — підвищена збудливість; 2 — фаза абсолютної рефрактернос.ті; 3 —фаза відносної рефрактерності; 4 — підвищена збудливість; 5 — зннжеиа збудливість
Мал. 15. Двофазовий характер ПД нервового волокна при розташуванні обох електродів на зовнішній поверхні мембрани
трод міститься в середині клітини чи волокна, спостерігається однофазний ПД. Інша картина буває в тих випадках, коли обидва електроди лежать на зовнішній поверхні мембрани — біполярна реєстрація (мал. 15). Збудження, яке являє собою хвилю електро-негативності, переміщуючись по мембрані, доходить спочатку до одного електрода, потім міститься між електродами, нарешті досягає другого електрода, а тоді поширюється далі. В цих умовах ПД має двофазовий характер. Реєстрація ПД широко використовується в клініці для діагностики захворювань серця, мозку, опорно-рухового апарата, шлунка тощо.
РЕЦЕПТОРНА ФУНКЦІЯ
КЛІТИННО! МЕМБРАНИ
Деякі білки клітинної мембрани виконують рецепторну 1 функцію. Вони сприймають і передають клітині інформацію про дію на клітину лігандів — нейромедіаторів, гормонів та інших фізіологічно активних речовин. Розрізняють білки, що реагують на дію ліганда (його «пізнають»), білки, що утворюють комплекс ліганд — рецептор, і білки, які трансформують цю дію в певний ефект. Ефектор — це іонний канал, фермент чи транспортна система. Утворення комплексу рецептор — ліганд служить початком каскаду реакцій у клітині. Кожний наступний їх етап зумовлює більший ефект, ніж попередній. Таким чином, початкова реакція може бути незначна, а заключна — дуже велика.
Клітинні рецептори — великі білкові молекули, до складу яких входять вуглеводи. На мембрані кожної клітини міститься -велика кількість (до 100 000) рецепторів. Це високоспеціалізовані, селективні структури. Відома ведика кількість рецепторів, що сприймають дію різних нейромедіаторів чи гормонів (адренергічні, холін-ергічні, гістамінергічні, серотонінергічні та ін.). Деякі з цих видів діляться на підгрупи. Кількість рецепторів та їх чутливість змінюються під впливом багатьох факторів.
Взаємодія ліганда з рецептором може зумовити зміну проникності мембрани для іонів або стати причиною утворення внутрішньоклітинних медіаторів (вторинних месенджерів), завдяки яким реалізуються різні функції клітини.
1. Вплив ліганда на зміну проникності клітинної мембрани. Фактично всі нейромедіатори взаємодіють з білковою структурою мембрани і спричинюють конформаційні зміни в її молекулі. Це призводить до відкриття чи закриття одного або кількох каналів — для ІЧ+, К+, Са2+, С1~ та ін. (мал. 16).
2. цАМФ як вторинний медіатор. У цьому випадку первинний медіатор взаємодіє з білковим рецептором клітинної мембрани (мал. 17), унаслідок чого на внутрішній поверхні цієї мембрани активізується фермент аденілатциклаза. Цей фермент дієнаАТФ (у присутності Са2+ та М^2+). Унаслідок гідролізу утворюється цАМФ (циклічний аденозинмонофосфат) — вторинний медіатор, який активізує клітинну протеїнкіназу. Остання бере участь у фосфорилюванні білків. Кінцевим результатом цих процесів є перехід клітини зі стану спокою у стан діяльності, специфіч-
1 Термін «рецептор» застосовується в фізіології у двох розуміннях: 1) спеціалізовані структури, що сприймають, трансформують і передають у ЦНС енергію подразника (з них починається будь-яка рефлекторна реакція); 2) спе-
ціалізовані білкн мембрани, що сприймають дію подразника і передають її в середину клітини.
Внутрішнє середовище клітини
онутриине середовище клітини •
Мал. 16. Вплив ліганда на зміну проникності клітинної мембрани:
/ — іонний канал закритий; 2 — Іонний канал відкритий
цію. Кальцій зв’язується з білком
ний для кожної клітини (скорочення, якщо це м’язове волокно; секреція, якщо це секреторна клітина, тощо).
Для деяких гормонів і ней-ромедіаторів вторинним медіатором є не цАМФ, а цГМФ (циклічний гуанозинмонофос-фат). Це мускаринові холіно-рецептори, гістамінові Нгре-цептори.
3. Са2+ як вторинний медіатор. Вхід Са2+ залежить від зміни МПС, що відкриває Са2+-канали, або від взаємодії деяких гормонів з мембранним рецептором. У клітині після відкриття цих каналів значно (у тисячі разів) підвищується концентрація каль-кальмодуліном, активізує його
(мал. 18). Активний кальмодулін у свою чергу переводить в активну форму багато ферментів, що супроводжується різними клітинними ефектами.
4. Діацилгліцерол та інозитолтрифосфат як вторинні медіатори. Деякі гормони реагують з мембранними рецепторами, які активізують фосфоліпазу С. Цей фермент розщеплює деякі фосфоліпіди мембрани, які утворюють діацилгліцерол та інозитолтрифосфат — вторинні медіатори в цих клітинах (мал. 19).
Діацилгліцерол за участю С-кінази фосфорилює білки, які беруть участь у специфічних реакціях клітин. Крім того, ліпідна частина діацилгліцеролу (арахідонова кислота) є попередницею простагландинів, що беруть участь в утворенні цАМФ та цГМФ, які впливають на специфічні функції клітин.
Інозитолтрифосфат мобілізує Са2+ із клітинних депо (ендоплазматичних сіток, мітохондрій), а Са2+ у свою чергу впливає на ці функції. Таким чином, існує ряд механізмів, які реалізують дію позаклітинних подразників на функції клітин.
Вікові зміни клітинних мембран. Рівень поляризації мембран м’язових і нервових клітин у різні вікові періоди значно змінюється. Наприклад, МПС м’язових волокон у новонароджених тварин менший, ніж у дорослих, майже в 4 рази. У процесі старіння організму в клітині відбуваються поступові й необоротні зміни. Насамперед істотно порушується мембранна будова клітини. Пошкоджується як зовнішня клітинна мембрана, так і
їм
Первинний медіатор
Аденілатциклаза
АТФ ^4 * 4X140 + р
Мб + Са г*
Протеїнкіназа-І->Протеїнкіназа неактивна ' активна
Білок-А-Білок-Р
Ферменти неактивні—к*.Ферменти активні 4
Функції клітин (зміна проникності мембран, скорочення, секреція, синтез білків та ін.)
Мал. 17. цАМФ як вторинний медіатор (пояснення у тексті)
мембрана ендоплазматичних структурних елементів клітини. Руйнування мембран лізосом призводить до виходу ферментів у цитоплазму, підвищення активності гідролаз, що зумовлює руйнування структур ДНК і загибель клітини. Значно змінюється проникність клітинних мембран для різноманітних речовин, передусім порушуються механізми активного транспорту, полегшеної і обмінної ди-фузій. Сповільнюються процеси енерготворення в мітохондріях, знижуються МПС, збудливість клітини.
ПРОВЕДЕННЯ ІМПУЛЬСІВ
НЕРВОВИМИ ВОЛОКНАМИ
Залежно від структури розрізняють м’якотні та безм’якотні нервові волокна. Швидке передавання інформації в організмі відбувається за допомогою ПД, що йдуть по нервових волокнах. Волокна, які передають інформацію від рецепторів у центр, називаються аферентними, а від центра до різних ефекторів — еферентними. Нервові волокна також зв’язують між собою різні відділи ЦНС. Нерв складається з великої кількості волокон обох типів.
ОСНОВНІ ВЛАСТИВОСТІ
НЕРВОВИХ волокон
Усі волокна здатні збуджуватись (збудливість) та проводити імпульси (провідність). У різних волокон ці властивості неоднакові, що залежить від їх будови та функціонального стану.
Ліганд
рецептор менврани
Сае-канал закритий
Са
Концентрація Ссіг* у клітин!*іО'7 ~іо'емоль/л
Комплекс • ’ „
ліганд-рецептор
—та Сар—Канал відкритий
Неактивний •*.* Активний , Концентрація Саг* = кальмовулін 1 кальмодулін ІО'Є Ю~Б моль/л
Неактивні ферменти
Активні срерменти
Різні клітинні реакції
Мал. 18. Са2+ як вторинний медіатор (пояснення у тексті)
Первинний медіатор
Фосіроліпіди менврани ^Фосфоліпаза
Діацилгліцерол
П-кіназа Білок
Інозитолтриросірат
Білок - Р
Арахідонова кислота
цГМФ Простагландини
Мобілізація Са2* з ендоплазматичного ретц-кулуму і мітохондріц
цАМФ
Функції клітин (ріст, секреція, імунні, алергічні реакції таін.)
Мал. 19. Діацилгліцерол та інозитолтрифосфат як вторинні медіатори (пояо< нення у тексті)
Мал. 20. Поширення збудження міелінізованим 4 х ' 1 /
нервовим ВОЛОКНОМ 4- >--—/|?----—-
Для нервових волокон характерна фізіологічна цілісність. Хоча нерв і не перерізаний (в анатомічному розумінні цілий), але своїх властивостей (збудливості і провідності) може не мати. Це спостерігається при механічній травмі, висиханні нерва, перегріванні чи переохолодженні, при стійкій деполяризації, дії анестетичних засобів (наприклад, новокаїну) тощо.
Нервові волокна здатні проводити збудження в обох напрямках (двобічна провідність). Якщо нанести подразнення в середині нерва, то ГІД можна виявити по обидва боки від місця подразнення. Але звичайно в організмі імпульси поширюються лише в одному напрямку, що пояснюється однобічним проведенням збудження в синапсах.
Проведення імпульсів по волокну ізольоване, тобто імпульси поширюються лише по певному волокну, не переходячи на сусідні. Тому збудження в змішаному нерві, що складається з аферентних та еферентних волокон, не переходить з одного волокна на інше. Ця властивість пояснюється тим, що опір рідини, яка заповнює проміжок між волокнами, значно нижчий, ніж опір мембран нервових волокон. Тому струм, що виникає між збудженою і незбудженою ділянками мембран, йде по цьому проміжку і не збуджує сусідні волокна. Має значення і оболонка волокна, особливо мієлінова.
Збудження по нервових волокнах проводиться без затухання (без зниження амплітуди ПД), тобто бездекрементно. Цим забезпечується надійність проведення імпульсів. Важливе значення має фактор надійності, що гарантує збудження сусідніх ділянок волокна. Це співвідношення величин ПД і ДЕ. Для
Таблиця 2. Класифікація нервових волокон
Тип Характеристика Діаметр, мкм Швидкість проведення імпульсів, м/с
Аа Аферентні (від м’язових веретен), еферентні (іннервація скелетних м’язів) 15 70—120
АР Аферентні (від рецепторів, що сприймають дотик) 8 30—70
А? Еферентні (до інтрафузальних волокон м’язових веретен) 5 15—30
Аб Аферентні (від рецепторів, що сприймають температуру, больові подразнення) 3 12—30
В Симпатичні прегангліонарні 3 3—15
С Симпатичні постгангліонарні 1 0,5—2
збудження мієлінового волокна треба змінити МПС приблизно на 25 мВ (ДЕ), а амплітуда ПД більша від 100 мВ, тобто в 4 рази вища, ніж треба для збудження.
Нервові волокна здатні проводити імпульси багато годин підряд при безперервному подразненні. Це свідчить про те, що вони практично не стомлюються.
Усі нервові волокна проводять імпульси швидко, але ця швидкість різна. Вона залежить від наявності мієлінової оболонки та діаметра волокна. Що більший діаметр, то вища швидкість. Існує класифікація волокон залежно від діаметра волокна і швидкості проведення імпульсів: Аа, Ар, Ау, А6, В та С (табл. 2).
Механізм поширення ПД нервовим волокном. Встановлено, що в мієлінових волокнах ПД виникає лише в перехватах Ранв’є, а ділянки між ними незбудливі. У перехватах є велика кількість Па+-каналів. У стані спокою зовнішйя поверхня перехватів має позитивний заряд і між ними не існує різниці потенціалів. Під час збудження поверхня перехвату А/(мал. 20) стає електронегативною щодо поверхні перехвату Б/Між ними виникає місцевий електричний струм, що йде через^й^жтканинну рідину. Струм, що виходить із перехвату Б, збурХує його, створюючи умови для входу Йа+ у цій ділянці. Вхщ-4<Га+ деполяризує мембрану вже в перехваті Б, і тут виникає^гіегативний заряд. Назад збудження не поширюється, бо в перехваті А ще триває рефрактерний період.
Амплітуда ПД у 4—5 раз більша, ніж треба для збудження (фактор надійності), тому ПД може збудити не тільки сусідній перехват, але й «перестрибнути» через нього і збудити другий або й третій. Проведення збудження в мієліновому волокні відбувається стрибками, лише через перехвати — сальтаторно.
Проведення збудження в безм’якотних волокнах відбувається повільніше. Місцеві струми виникають у даному випадку між сусідніми ділянками волокна.
АКСОННИЙ ТРАНСПОРТ
Аксон, крім проведення ПД, може транспортувати різні фізіологічно активні речовини, переважно пептиди. Вони синтезуються в сомі нейрона, а звідти волокном — до синаптичних структур. Розрізняють швидкий аксонний транспорт (близько 40 см за 1 добу) і повільний (близько 20 см за 1 добу). В процесі транспорту по аксону речовини перетворюються на більш прості пептиди.
Деякі речовини можуть транспортуватись у зворотному напрямку — ретроградно. До них належить ацетилхолінестераза. Можливо, цей транспорт має значення для синтезу білка в сомі нейрона, бо після перерізування аксону цей транспорт порушується.
НЕРВОВО-М'ЯЗОВА ПЕРЕДАЧА
Нервове волокно безпосередньо не контактує з м’язовим. Між ними є дуже вузька щілина (20—50 нм). Нервове закінчення, частина м’язового волокна, до якої прилягає це закінчення, та щілина між ними складають нервово-м’язовий синапс. Нервове волокно закінчується синаптичною бляшкою (мал. 21), у якій містяться їгітохондрії та значна кількість (близько 300 тис.) пухирців, де концентрується медіатор — речовина, за допомогою якої збудження поширюється з нерва на м’яз. У нервово-м’язовому синапсі цим медіатором є ацетилхолін. Синтез ацетилхоліну відбувається в си-наптичній бляшці і потребує енергетичних затрат. Частина бляшки, що прилягає до щілини, називається пресинаптичною мембраною. З іншого боку щілини розташована постсинаптична мембрана, яка належить м’язовому волокну. Частина цієї мембрани, котра безпосередньо прилягає до бляшки, називається кінцевою пластинкою.
До складу постсинаптичної мембрани входять рецепторні білки (молекулярна маса — близько 275 000), які реагують на ацетилхолін і називаються холінорецепторами. Вони реагують також на нікотин, звідси їх назва — Н-холінорецептори. Реакція ацетилхоліну з Н-холінорецептором зумовлює конформаційні зміни молекули рецептора. Це впливає на поруч розташований хемочутливий іонний канал, який може пропускати ЬІа+, К+, Са2+. Білкові структури цих каналів мають негативний заряд, і тому аніони через них не проходять.
Передача інформації через нервово-м’язовий синапс відбувається у такій послідовності.
1. Нервовим волокном до бляшки приходить ПД.
2. Унаслідок дії ПД на мембрану нервового закінчення відкриваються Са2+-канали і ці іони заходять у бляшку.
3. Підвищення в бляшці концентрації Са2+ призводить (за участі кальмодуліну) до виходу медіатора з пухирців у синаптичну щілину. Унаслідок дії одиничного ПД медіатор виходить приблизно з 300 пухирців.
4. Ацетилхолін дифундує через щілину.
5. Ацетилхолін реагує з Н-холінорецептором.
6. Відкриваються «ворота» хемочутливих каналів і за концентраційним градієнтом На+ переходить у м’язове волокно, а К+ — назовні.
7. Відбувається деполяризація кінцевої пластинки і розвивається її потенціал (ПКП). ПКП— один із видів місцевого збудження. Що більше виділяється ацетилхоліну, то більшою мірою виражений цей потенціал (мал. 22).
8. Коли ПКП досягає критичної величини (Екр), деполяризує-ться колосинаптична електрозбудлива мембрана і розвивається
Мал. 21. Схема нервово-м’язового синапсу:
/ — аксон мотонейрона; 2 — синаптична бляшка; 3 — пухирці медіатора^ 4 — пресинаптнчна мембрана; 5 — кінцева пластинка; 6 — Н-холІ-норецептори; 7 — м’язове волокно; 8— міто-хондрії
Мал. 22. Мініатюрні ПКП (/), ПКП (2). При досягненні Екр ПКП перетворюються в ПД м’язового волокна (3)
ПД м’язового волокна, що поширюється по обидва боки від синапсу. У цьому процесі беруть участь потенціалзалежні іонні канали.
Ацетилхолін виділяється у незначній кількості навіть тоді, коли ПД нервовими волокнами не надходить. Навіть у такій кількості (кванти медіатора) він зумовлює незначну деполяризацію постси-наптичної мембрани (частки мВ), яка має назву мініатюрних потенціалів кінцевої пластинки (МПКП).
Ацетилхолін, що виділився в синаптичну щілину, дуже швидко руйнується ферментом ацетилхолінестеразою. Внаслідок цього утворюється холін, який потрапляє в синаптичну бляшку і бере участь у творенні нових порцій ацетилхоліну.
Передача інформації в нервово-м’язовому синапсі відбувається в одному напрямку, з певного затримкою (близько 0,5 мс). При дуже частих та тривалих подразненнях можуть наставати висна-Ження’запасів ацетилхоліну і втома. Є методи посилення "абсНГО'--сжголений ІіергідаОҐімиульсів Йєрвово-м’язовим синапсом. Так, посилити передачу їх можна за допомогою замінників ацетилхоліну — холіноміметичних засобів (наприклад, карбахоліну) або шляхові інактивації ацетилхолінестерази (езерин, фізостигмін). У цьому разі медіатор не руйнується, його дія посилюється та подовжується.
Ослабити або припинити передачу можна при введенні к у р а •< реподібних речовин — міорелаксантів (наприклад, тубоку-рарину, диплацину). Ці препарати зв’язуються з холінорецептора’ ми і блокують дію ацетилхоліну.
ФІЗІОЛОГІЯ СКЕЛЕТНИХ М'ЯЗІВ
У людини розрізняють скелетні м’язи, серцевий м’яз (міокард) та гладкі м’язи. Всі вони мають властивість збуджуватись, проводити це збудження та скорочуватись.
Скелетні м’язи підтримують тіло людини у певній позі, протидіють силам гравітації і беруть участь у реалізації різних локомоторних актів (ходьба, біг, стрибки, плавання тощо).
Морфо-функціональна структура. Скелетні м’язи складаються з окремих волокон, які містять два види білка — актин та міозин. Міозинові нитки вдвічі товщі, ніж актинові. У стані спокою м’яза тонкі довгі актинові нитки входять у проміжки між товщими та коротшими міозиновими нитками. Ізотропні диски (мал. 23) складаються лише з актинових протофібрил, а анізотропні — з акти-нових та міозинових.
Світла центральна зона (Н) не має актинових ниток. Пластинка 7 лежить посередині диска І, скріплюючи між собою ці нитки. Ділянки міофібрил між пластинками називаються саркомерами. Пучок ниток міозину в середині саркомера має вигляд темної зони (А-диск). По обидва боки від нього розташовані світлі смуги (диски І). Завдяки такому чергуванню світлих та темних смуг волокна скелетного та серцевого м’язів мають поперечносмугастий вигляд. Міозинові та актинові нитки сполучені між собою містками, що мають головку та шийку. Ці містки розташовані в кілька рядів уздовж міозинових протофібрил.
На підставі фізіологічних, біохімічних та структурних особливостей виділяють три типи м’язових волокон — швидкі (білі), повільні (червоні) та проміжні. їх характеристика наведена в табл. 3. Співвідношення цих типів волокон у різних м’язах неоднакове. В одних м’язах переважають швидкі, в інших — повільні волокна. Це обумовлює різний характер скорочення: одні
Таблиця 3. Характеристика швидких та повільних м'язових волокон
Характерні ознаки Швидкі " Повільні
Колір Білий Червоний
Розмір Більші Менші
Вміст глікогену Багато Мало
Кількість мітохондрій Мало Багато
КІЛЬКІСТЬ міоглобіну Мало Багато
Кровопостачання Невелике Добре
Характер обміну Анаеробний Аеробний
Збудливість Висока Нижча
Скорочення Швидке Повільне
Стомлюються Раніше Пізніше
Мал. 23. Схема структури м’яза.
М’яз (а) складається з волокон (б), кож-__ _ не з них — з міофібрил (в). Кожна міо-— фібрила (а) збудована з міози нових і актиновнх протофібрил (б). Показано один саркомер, що складається з ізотропних (/), анізотропних (2) дисків, зони Н (3), пластинок " ‘ ' зріз
2 (4), в — поперечний
міофібрили
Мал. 24. Нейромоторні одиниці фазні (Ф), тонічні (І) та перехідні (77)
м’язи скорочуються дуже швидко, але короткий час, Інші — повільно, але довго і без ознак утоми.
Енергетичні процеси істотно відрізняються. Для скорочення волокон потрібна АТФ, але її вистачає для скорочення лише протягом 1—2 с. За рахунок фосфокреатину, який бере участь у ре-синтезі АТФ, період скорочення триває довше — 7—8 с, а за рахунок анаеробного гліколізу — до 1 хв.
Для тривалішого скорочення м’язів потрібен кисень, оскільки відбувається окислення вуглеводів, ліпідів та білків і за рахунок окисного фосфорилювання ресинтезується потрібна кількість АТФ. У різних людей співвідношення між повільними та швидкими волокнами в одних і тих же м’язах може бути неоднаковим. Тому одні люди здатні долати короткі, спринтерські дистанції, а інші — довгі, стайєрські.
Нейромоторні одиниці. Аксони мотонейронів спинного чи довгастого мозку іннервують різну кількість м’язових волокон. Один нейрон і м’язові волокна, що ним іннервуються, називаються ней-ромоторною одиницею. Що точніші рухи виконує м’яз, то менше співвідношення між нейроном і м’язовими волокнами. Наприклад, мотонейрони, що іннервують м’язи гортані чи ока, закінчуються біля 2—3 волокон (співвідношення 1 :2 або 1 : 3), а мотонейрони, що іннервують литковий м’яз, іннервують кілька сотень м’язових волокон (мал. 24).
Види скорочень залежно від режиму навантаження. Розрізняють ізометричні, ізотонічні та змішані скорочен-н я. Ізометричні скорочення відбуваються при незмінній довжині м’яза (наприклад, при спробі підняти дуже важкий предмет). У експерименті цей вид скорочень можна одержати, закріпивши м’яз з обох боків та подразнюючи його. Ізотонічне скорочення — це скорочення без навантаження. В організмі людини м’язи рідко скорочуються в ізотонічному або ізометричному режимі. Звичайно спостерігаються змішані скорочення з перевагою того чи того виду.
Види скорочень залежно від частоти подразнення. У відповідь на одиночне порогове подразнення виникає одиночне скорочення м’яза (мал. 25), що складається з трьох періодів: латентного, скорочення і розслаблення. Латентний період лежить між моментом подразнення і початком скорочення. У цей час відбуваються в м’язі біохімічні та біофізичні процеси, одним із проявів яких є ПД. Таким чином, ПД з’являється раніше, ніж скорочується м’яз. Період скорочення триває від його початку до максимуму, а період розслаблення — від максимуму до початкового рівня. Тривалість одиночного скорочення неоднакова у різних м’язів людини. Наприклад, у м’яза, який рухає очне яблуко, вона становить 0,01 с, у гомілкового — 0,05 с, у камбаловидно-го — 0,1 с. У різних тварин тривалість скорочення м’язів неоднако-
Мал. 25. Одиночне скорочення м’яза:
1 — момент подразнення; 2 — латентний період; 3 — період скорочення; 4 — період розслаблення
Мал. 26. Сумація одиночних скорочень:
1 — одиночне скорочення; 2 — утворення зубчастого тетануса; З — утворення суцільного т^та-нуса; N — сила скорочень (ньютони)
ва. Крім того, вона залежить від температури, ступеня стомлення м’яза тощо.
Одиночні скорочення можуть додаватись (мал. 26), і тоді розвиваються тетанічні скорочення — тривалі скорочення м’яза.
Розрізняють зубчастий та суцільний тетанус. Зубчастий т е т а н у с буває тоді, коли наступне подразнення діє в період розслаблення, а суцільний — коли наступне подразнення надходить у період скорочення (мал. 27). Амплітуда скорочень під час тетануса більша, ніж при одиночних скороченнях.
У природних умовах спостерігаються асинхронні скорочення м’язових волокон. Це означає, що імпульси від різних мотонейро-нів досягають своїх м’язових волокон неодночасно, спочатку скорочується одна їх група, потім друга, потім третя і т. д. А перша група у цей час вже встигає розслабитись. Таким чином, хоча м’язові волокна скорочуються неодночасно, м’яз весь час перебуває у стані скорочення. Сила скорочень залежить від числа волокон, що одночасно скорочуються.
Зв’язок між збудженням та скороченням м’яза. ПД м’язового волокна поширюються в обидва боки від нервово-м’язового синап-су. Важливу роль відіграють поперечні трубки мембрани волокна (Т-трубки), що становлять собою заглиблення мембрани. Мембрана цих трубок теж має потенціалзалежні натрієві канали. Поряд з Т-трубками у волокні розташовані цистерни ендоплазматичної сітки, в яких депонується Са2+.
Під час збудження ПД поширюється в глиб Т-трубок, зумовлюючи вихід Са2+ із цистерн. Концентрація Са2+ у волокні значно
Мал. 28. Схема діяльності поперечних містків (/) міозинових протофібрил (2): а — поперечні містки у стані розслаблення м‘язового волокна; б — під час скорочення; стрілками вказано напрям руху актннових протофібрил (3) двох половин саркомера; в — модель розвитку напруження у поперечних містках під час їх скорочення (зліва — у стані розслаблення, справа — під час скорочення м’язового волокна); 4 — шийка поперечного містка; 5 — головка поперечного містка
Мал. 27. Форми тетануса при підвищенні частоти подразнень:
І — одиночні скорочення; II, III — зубчастий тетанус; IV — суцільний тетанус
підвищується, і він дифундує до міофібрил. Са2+ — це основна ланка зв’язку між збудженням та скороченням м’яза.
Механізм скорочення. ПД м’язового волокна — початковий етап, потрібний для скорочення м’яза. Скорочення пояснюється теорією ковзання. Спостерігається взаємне переміщення (ковзання) товстих міозинових та тонких актинових протофібрил при незмінній їх довжині. Актинові протофібрили втягуються у проміжки між міозиновими (мал. 28). Причиною цього є рух головок поперечних актоміозинових містків. Кожен місток то приєднується, то від’єднується від сусідньої протофібрили.
У стані спокою місток не може приєднатись до актину, бо між ними містяться білки тропонін татропоміозин, які блокують місце приєднання. При підвищенні концентрації іонів Са2+ (у присутності АТФ) тропонін змінює свою конфігурацію і відсовує молекулу тропоміозину, створюючи умови для з’єднання головки містка з актином. Це супроводжується зміною положення головки і переміщенням нитки актину з наступним розриванням
містка. Амплітуда кожного такого переміщення становить близько 20 нм, а частота — 5—50 за 1 с.
Розслаблення волокна відбувається внаслідок діяльності Са2+-насоса, який накачує ці іони назад у цистерни саркоплазматичної сітки. Концентрація Са2+ у міоплазмі знижується, і тропоміозин знову блокує активні ділянки актину. Важливе значення для розслаблення м’яза має АТФ: зменшення її концентрації призводить до утворення постійного зв’язку між поперечними містками і акти-новими протофібрилами, тобто настає контрактура м’яза. Таке явище спостерігається і при трупному закляканні.
На скорочення чи напруження скелетних м’язів впливає ряд факторів: кількість та вид волокон, що беруть участь у скороченні, частота ПД волокон, функціональний стан м’яза (рівень збудливості, вміст АТФ, вуглеводів, ліпідів, іонів Са2+, напруга кисню, кількість діючих поперечних містків тощо), ступінь втоми м’яза. На функціональний стан м’яза істотно впливає його кровопостачання.
Еластичність і розтяжність скелетного м’яза. Під еластичністю розуміють властивість деформованого тіла повертатись до початкового стану після усунення впливу сили, яка зумовила деформацію. Якщо до м’яза підвісити тягар, він розтягнеться. Після зняття цього тягара він набуде початкової довжини. Здатність м’яза під впливом навантаження розтягуватись називається розтяжністю, величина якої залежить від маси тягара, часу його дії, в’язкості і пластичності м’яза. Розтяжність м’яза з паралельними волокнами більша, ніж м’яза із перистою структурою. Червоні м’язи розтягуються більшою мірою, ніж білі.
Після припинення навантаження м’яз повертається в початковий стан, але деякий час ще залишається видовженим (залишкова деформація). У цьому виявляється інша властивість м’яза — його пластичність. Вона виражена тим сильніше, чим більша сила, яка його розтягує, і чим триваліша її дія. Пластичність проявляється в залишковому видовженні не тільки після пасивного розтягування, але й після тривалого активного скорочення.
При скороченні м’яза хімічна енергія макроергів перетворюється на теплову і механічну. Сума теплової і механічної енергії повинна дорівнювати хімічній енергії. При скороченні м’яза виділяється тепло. Розрізняють дві фази теплопродукції — початкову (під час скорочення) і затримане теплотворення. Початкова фаза залежить від хімічних процесів, які переводять м’яз із стану спокою в активний стан. Відбувається вона в анаеробних умовах. Друга фаза пов’язана з процесами, які забезпечують ресинтез АТФ (переважно гліколіз та окисне фосфо-рилювання). Тривала активність м’язів (протягом кількох годин) забезпечується за рахунок окислення ліпідів. Ефективність м’язової роботи (коефіцієнт корисної дії) — частина загаль
ної енергії, яка використовується для корисної механічної праці. Становить вона 20—ЗО %.
Сила та робота м’язів. Розрізняють максимальну та абсолютну силу. Максимальна сила визначається тим максимальним вантажем, який м’яз ще здатний підняти. Ця величина залежить від будови м’яза, його функціонального стану, впливу центральної нервової системи та інших факторів. Сила тим більша, чим більший діаметр і «фізіологічний» поперечний переріз м’яза. Сила м’язів з косим розташуванням волокон більша, ніж з поздовжнім.
Абсолютна сила — це відношення максимальної сили до площі поперечного перерізу м’яза. Ця величина дає змогу порівняти силу різних м’язів одного організму і силу м’язів різних тварин. Наприклад, абсолютна сила литкового м’яза людини становить 5,9 кг/см2, жувального—10 кг/см2, триголового м’яза плеча — 16,8 кг/см2. При тренуванні м’язів, яке супроводжується їх робочою гіпертрофією, сила м’яза значно зростає.
Робота м’язів може бути динамічною та статичною. Динамічна робота визначається так: величину піднятого вантажу множать на показник скорочення м’яза. Вимірюється ця робота в кілограмометрах, джоулях та калоріях. Максимальною робота буває при середніх навантаженнях. При надто великому або замалому вантажі величина роботи зменшується. Робота, при якій м’язи майже не скорочуються (ізометричні скорочення), називається статичною. Прикладом її може бути робота при утриманні (але не переміщенні) вантажу в певному положенні. Статична робота вимірюється величиною вантажа, помноженою на час його утримання. При статичній роботі втома розвивається швидше, ніж при динамічній.
ФІЗІОЛОГІЯ ГЛАДКИХ М'ЯЗІВ
Гладкі м’язи входять до складу внутрішніх органів. Завдяки скороченню вони забезпечують рухову (моторну) функцію цих органів (травний канал, сечостатева система, кровоносні судини тощо). На відміну від скелетних м’язів, гладкі м’язи є мимовільними.
Морфо-функціональна структура гладких (непосмугованих) м’язів. Основною структурною одиницею гладких м’язів є м’язова клітина, яка має веретеноподібну форму і вкрита ззовні плазматичною мембраною. Під електронним мікроскопом у мембрані можна помітити численні заглибини — кавеоли, які значно збільшують загальну поверхню м’язової клітини. Сарколема непосмуго-ваної м’язової клітини включає в себе плазматичну мембрану разом із базальною мембраною, яка вкриває її ззовні, і прилеглими колагеновими волокнами. Основні внутрішньоклітинні елементи:
ядро, мїтохондрії, лізосоми, мікротрубочки, саркоплазматична сітка і скоротливі білки.
М’язові клітини утворюють м’язові пучки та м’язові шари. Міжклітинний простір (в 100 нм і більше) заповнений еластичними і колагеновими волокнами, капілярами, фібробластами та ін. У деяких ділянках мембрани сусідніх клітин лежать дуже щільно (щілина між клітинами складає 2—3 нм). Припускають, що ці ділянки (н е к с у с и) служать для міжклітинного зв’язку, передавання збудження. Доведено, що одні гладкі м’язи містять велику кількість нексусів (сфінктер зіниці, циркулярні м’язи тонкої кишки тощо), у інших їх мало або зовсім немає (сім’явиносна протока, поздовжні м’язи кишок). Між непосмугованими м’язовими клітинами існує також проміжний, або десмоподібний, зв’язок (через потовщення мембрани і за допомогою відростків клітин). Очевидно, ці зв’язки мають значення для механічного сполучення клітин і передавання механічної сили клітинами.
Завдяки хаотичному розподілу міозинових і актинових протофібрил клітини гладких м’язів не поперечносмугасті, як скелетні і серцевий. На відміну від скелетних м’язів; у гладких м’язах немає Т-системи, а саркоплазматична сітка складає тільки 2—7 % об’єму міоплазми і не має зв’язків із зовнішнім середовищем клітини.
Фізіологічні властивості гладких м’язів. Гладком’язові клітини, як і. поперечносмугасті, скорочуються внаслідок ковзання актинових протофібрил між міозиновими, проте швидкість ковзання і гідроліз АТФ, а отже, й швидкість скорочення, в 100—1000 разів менші, ніж у поперечносмугастих м’язах. Завдяки цьому гладкі м’язи добре пристосовані для тривалого ковзання з невеликою затратою енергії і без втоми.
Гладкі м’язи з урахуванням здатності генерувати ПД у відповідь на порогове або надпорогове подразнення умовно ділять на фазні й тонічні. Фазні м’язи генерують повноцінний ПД, тонічні — лише місцевий, хоча їм притаманний і механізм генерації повноцінних потенціалів. Нездатність тонічних м’язів до ПД пояснюється високою калієвою проникністю мембрани, яка перешкоджає розвитку регенеративної деполяризації.
Величина мембранного потенціалу гладком’язових клітин непо-смугованих м’язів варіює від —50 до —60 мВ. Як і в інших м’язах, в тому числі й у нервових клітинах, в його утворенні беруть участь головним чином К+, Иа+, С1~. В гладких м’язових клітинах травного каналу, матки, деяких судинах мембранний потенціал нестабільний, спостерігаються спонтанні коливання у вигляді повільних хвиль деполяризації, на вершині яких можуть з’являтися розряди ПД. Тривалість ПД гладких м’язів коливається від 20—25 мс до 1 с і більше (наприклад, у м’язах сечового міхура), тобто вона
довша, ніж тривалість ПД скелетних м’язів. У механізмі ПД гладких м’язів поряд із N3+ велику роль відіграє Са2+.
Спонтанна міогенна активність. На відміну від скелетних м’язів, гладкі м’язи шлунка, кишок, матки, сечоводів мають спонтанну міогенну активність, тобто розвивають спонтанні тетаноподібні скорочення. Вони зберігаються в умовах ізоляції цих м’язів і при фармакологічному виключенні інтрафузальних нервових сплетінь. Отже, ПД виникає у власне гладких м’язах, а не зумовлений передаванням до м’яза нервових імпульсів.
Ця спонтанна активність має міогенне походження і виникає у м’язових клітинах, які виконують функцію водія ритму. У цих клітинах місцевий потенціал досягає критичного рівня і переходить у ПД. Але за реполяризацією мембрани спонтанно виникає новий місцевий потенціал, який викликає ще один ПД, і т. д. ПД, поширюючись через нексуси на сусідні м’язові клітини зі швидкістю 0,05—0,1 м/с, охоплює увесь м’яз, спричинюючи його скорочення. Наприклад, перистальтичні скорочення шлунка виникають із частотою 3 рази за 1 хв, сегментарні і маятникоподібні рухи товстої кишки — до 20 разів за 1 хв у верхніх відділах і 5—10 за 1 хв — у нижніх. Таким чином, гладкі м’язові волокна названих внутрішніх органів володіють автоматизмом, який проявляється їх здатністю ритмічно скорочуватися за відсутності зовнішніх подразнень.
Яка причина виникнення потенціалу в клітинах гладких м’язів водія ритму? Очевидно, він виникає внаслідок зменшення калієвої і збільшення натрієвої й (або) кальцієвої проникності мембрани. Що стосується регулярного виникнення повільних хвиль деполяризації, найбільше виражених у м’язах травного каналу, го немає достовірних даних про їх іонне походження. Можливо, певну роль відіграє зменшення початкового інактивуючого компоненту калієвого струму при деполяризації м’язових клітин унаслідок інактивації відповідних іонних калієвих каналів. Завдяки цьому стає можливим виникнення повторних ПД.
Еластичність і розтяжність гладких м’язів. На відміну від скелетних м’язів, гладкі при розтягуванні поводяться як пластичні, еластичні структури. Завдяки пластичності гладкий м’яз може бути цілком розслаблений як у скороченому, так і в розтягненому стані. Наприклад, пластичність гладких м’язів стінки шлунка або сечового міхура в міру наповнення цих органів запобігає підвищенню внутрішньопорожнинного тиску. Надмірне розтягання часто призводить до стимулювання скорочення, яке зумовлене деполяризацією клітин водія ритму, що виникає при розтяганні м’яза, і супроводжується підвищенням частоти ПД, а внаслідок цього — посиленням скорочення. Скорочення, яке активізує процес розтягання, відіграє велику роль у саморегулюванні базального тонусу кровоносних судин.
Механізм скорочення гладких м’язів. Обов’язковою умовою виникнення скорочення гладких м’язів, як і скелетних, є збільшення концентрації Са2+ в міоплазмі (до 10-5 М). Вважається, що процес скорочення активізується переважно позаклітинним Са2+, що надходить у м’язові клітини через потенціалзалежні Са2+-ка-нали.
Особливість нервово-м’язової передачі в гладких м’язах полягає у тому, що іннервація здійснюється вегетативною нервовою системою і вона може справляти як збуджувальний, так і гальмівний вплив. За типом розрізняють холінергічні (медіатор ацетилхолін) і адренергічні (медіатор норадреналін) медіатори. Перші звичайно містяться у м’язах травної системи, другі — у м’язах кровоносних судин.
Один і той же медіатор в одних синапсах може бути збуджувальним, а в інших — гальмівним (залежно від властивостей цито-рецепторів). Адренорецептори ділять на а- та р-. Норадреналін, впливаючи на а-адренорецептори, звужує кровоносні судини і гальмує моторику травного каналу, а впливаючи на р-адренорецепто-ри, стимулює діяльність серця і розширює кровоносні судини деяких органів, розслаблює м’язи бронхів. Описано нервово-м’язо-. ву передачу в гладких м’язах за допомогою й інших медіаторів.
У відповідь на дію збуджувального медіатора відбувається деполяризація клітин гладких м’язів, яка проявляється у вигляді збуджувального синаптичного потенціалу (ЗСП). Коли він досягає критичного рівня, виникає ПД. Це відбувається тоді, коли до нервового закінчення один за одним підходять кілька імпульсів. Виникнення ЗСП є наслідком збільшення проникності постсинап-тичної мембрани для №+, Са2+ і Сі-.
Гальмівний медіатор спричинює гіперполяризацію постсинап-тичної мембрани, що проявляється в гальмівному синаптичному потенціалі (ГСП). В основі гіперполяризації лежить підвищення проникності мембрани в основному для К+. Роль гальмівного медіатора в гладких м’язах, які збуджуються ацетилхоліном (наприклад, м’язи кишки, бронхів), відіграє норадреналін, а в гладких м’язах, для яких збуджувальним медіатором є норадреналін (наприклад, м’язи сечового міхура),— ацетилхолін.
Клініко-фізіологічний аспект. При деяких захворюваннях, коли порушується іннервація скелетних м’язів, їх пасивне розтягання або зміщення супроводжується рефлекторним підвищенням їх тонусу, тобто опірності до розтягання (еластичність або ригідність).
При порушенні кровообігу, а також під дією деяких продуктів метаболізму (молочної і фосфорної кислот), отруйних речовин, алкоголю, втоми, зниження температури м’язів (наприклад, при тривалому плаванні в холодній воді) після тривалого активного скорочення м’яза може виникати контрактура. Чим більше порушується функціональний стан м’яза, тим сильніше виражена контр-
актурна післядія (наприклад, контрактура жувальних м’язів при патології щелепно-лицьової ділянки). Яке походження контрактури? Вважається, що контрактура виникла внаслідок зменшення в м’язі концентрації АТФ, що призвело до утворення постійного зв’язку між поперечними містками і актиновими протофібрилами. При цьому м’яз втрачає гнучкість і поступово стає твердим. Контрактура минає, м’яз розслаблюється, коли концентрація АТФ досягає нормального рівня.
При захворюваннях типу міотонії клітинні мембрани м’язів збуджуються так легко, що навіть незначне подразнення (наприклад, введення голчастого електрода при електроміографії) зумовлює розряд м’язових імпульсів. Спонтанні ПД (потенціали фібриляції) реєструються також на першій стадії після денервації м’яза (поки бездіяльність не призведе до його атрофії).
Тонічні скорочення деяких гладких м’язів, особливо м’язів судинних стінок (базальний, або міогенний, тонус) активізуються переважно позаклітинним Са2+. Фізіологічно активні речовини і медіатори можуть спричинити зниження тонусу гладких м’язів шляхом закриття хемочутливих Са2+-каналів (через активізацію хеморецепторів) або гіперполяризації, яка зумовлює пригнічення спонтанних ПД і закриття потенціалзалежних Са2+-каналів.
ВІКОВІ ЗМІНИ М'ЯЗІВ
У процесі онтогенезу значно збільшується маса м’язової тканини. Наприклад, у новонародженого вона становить 23,3 % маси тіла, а у віці 17—18 років — 44,2%. Розвиток різних груп м’язів людини відбувається нерівномірно. На цей процес впливають сили гравітації, час і простір. Росте м’язова тканина за рахунок видовження і потовщення м’язових волокон, а не збільшення їх кількості. Рухові нервові закінчення з’являються в скелетних м’язах на 13—14-му тижні внутрішньоутробного розвитку, проте навіть до 6—7 років вони не досягають характерного для дорослого рівня. Рецепторний апарат м’язів розвивається швидше, ніж формуються рухові нервові закінчення.
У процесі онтогенезу значно змінюються функції м’язів. Так, лабільність м’язів у період внутрішньоутробного розвитку низька, з віком вона збільшується, що пояснюється зростанням пропускної здатності нервово-м’язового синапсу. Скорочення м’яза все більше набуває рис тетанусу. Тривалість ПД моторних одиниць з віком скорочується і до 15—18 років становить 3,5—5,5 мс. Поліпшуються також фізико-хімічні характеристики м’язової тканини (удосконалюється співвідношення АТФ з білками м’язів та ін.). У процесі старіння лабільність м’яза зменшується, змінюється величина мембранного потенціалу, стає тривалішим ПД (на 10— 15 мс). Це зумовлюється зміною інтенсивності процесів обміну та транспортом К+ у м’язових клітинах.
РОЗДІЛ 2
Механізми регуляції фізіологічних процесів
ЗАГАЛЬНІ ЗАКОНОМІРНОСТІ
ДІЯЛЬНОСТІ цнс
Діяльність ЦНС найчастіше називають координаційною, або узгоджувальною. Це пояснюється тим, що ЦНС сформувалась у процесі еволюції як механізм, який забезпечує узгодження функцій організму з навколишнім середовищем і між собою. Таким чином ЦНС ніби об’єднує (інтегрує) їх у єдине ціле. Тому функцію ЦНС також називають «інтегративною» (об’-єднувальною).
Координаційна (інтегративна) функція ЦНС зводиться до аналізу аферентних нервових сигналів, що надходять до неї в даній ситуації від усіх рецепторів організму, і до синтезу адекватного еферентного нервового сигналу, адресованого органам-ефекторам (тобто до аналізу подразників, що діють на організм, і до синтезу реакції організму, адекватної даній ситуації). І. П. Павлов часто називав функції ЦНС «аналітико-синтетичними».
Координаційна функція ЦНС (аналіз і синтез нервових сигналів) здійснюється за рахунок взаємодії в ній процесів збудження і гальмування. Ця взаємодія зрештою зводиться до додавання збудження і гальмування центральними нейронами.
СТРУКТУРА І ФУНКЦІЇ НЕЙРОНА
ЦНС має нейронний тип будови, тобто складається з окремих нервових клітин, або нейронів, які не переходять безпосередньо один в одного, а лише контактують між собою. Мозок людини містить близько 25 млрд нейронів, приблизно 25 млн з них локалізуються на периферії або з’єднують периферію з ЦНС.
Нейрон є основною структурною і функціональною одиницею ЦНС. Він складається з тіла (соми) і великої кількості відростків, які мають переважаюче спрямування і спеціалізацію (мал. 29). Довгий відросток (аксон) у процесі онтогенетичного розвитку досягає другої клітини, з якою встановлюється функціональний зв’язок. Місце відходження аксона від тіла нервової клітини називається початковим сегментом, або аксонним горбиком; ця ділянка аксона не має мієлінової оболонки і синаптичних контактів. Головна функція аксона полягає у проведенні нервових імпульсів до клітин — нервових, м’язових, секреторних. Ближче до
закінчення аксон галузиться і утворює тонку китицю з кінцевих гілок— аксонних терміналей. На кінці кожна термінали утворює синапс із постсинаптичною клітиною, її со-мою або дендритом. Спеціальна функція синапса полягає в передачі імпульсів від однієї клітини до іншої (див. с. 41).
Крім аксона нейрон мдє велику кількість коротких деревовидно розгалужених відростків — дендритів, які розміщені переважно в межах сірої речовини мозку. Функція дендритів полягає в сприйнятті си-наптичних впливів. На дендритах закінчуються терміналі аксонів, які вкривають всю поверхню дендриту.
Поверхня соми та дендритів, вкрита синаптичними бляшками аферентних нейронів, утворює рецепторну поверхню («дендритну зону») нейрона, яка приймає і передає імпульси. У тіл більшості нейронів ця функція поєднується з функцією отримання і використання поживних речовин, тобто з трофічною функцією. У деяких нейронів ці
функції морфологічно розрізнені і тіло клітини не має стосунку до сприйняття і передачі сигналів. Ріст відростків спостерігається не тільки в ембріональний період, але і в дорослому організмі за умови, що власна клітина не пошкоджена.
Основними функціями нейрона є сприймання та переробка інформації, проведення її до інших клітин. Нейрони виконують ще й трофічну функцію, спрямовану на регуляцію обміну речовин і живлення як в аксонах і дендритах, так і при дифузії через синапси фізіологічно активних речовин у м’язах і залозистих клітинах.
Нейрони залежно від форми своїх відростків, їх напрямку, довжини і розгалуження діляться на аферентні, або чутливі, проміжні, або інтернейрони, та еферентні, що проводять імпульси на периферію.
Аферентні нейрони мають просту округлу форму соми з одним відростком, який потім ділиться Т-подібно: один відросток (видозмінений дендрит) спрямовується на периферію і утворює там чутливі закінчення (рецептори), а другий — у ЦНС, де розгалу
жується на волокна, які закінчуються на інших клітинах (є власне аксоном клітини).
Велика група нейронів, аксони яких виходять за межі ЦНС, утворюють периферичні нерви і закінчуються у виконавчих структурах (ефекторах) або периферичних нервових вузлах (гангліях), позначаються як еферентні нейрони. Вони мають аксони великого діаметра, вкриті мієліновою оболонкою і розгалужуються тільки в кінці, при підході до органу, який іннервують. Невелика кількість розгалужень локалізується і в початковій частині аксона ще до виходу його з ЦНС (так звані аксонні колатералі).
У ЦНС є також велика кількість нейронів, які характеризуються тим, що їх сома міститься в середині ЦНС і відростки не виходять з неї. Ці нейрони встановлюють зв’язок тільки з іншими нервовими клітинами ЦНС, а не з чутливими або еферентними структурами. Вони ніби вставлені між аферентними і еферентними нейронами і «замикають» їх. Це проміжні нейрони (інтернейрони). їх можна поділити на короткоаксонні, які встановлюють короткі зв’язки між нервовими клітинами, і довгоаксонні — нейрони провідних шляхів, які сполучають різні структури ЦНС.
ФУНКЦІЇ НЕЙРОГЛІЇ
Крім нейронів ЦНС містить гліальні клітини, які, як і нервові, утворюються з первинної ектодермальної закладки. Існує три типи гліальних клітин: астроцити, олігодендрити і мікрогліоцити. Астроцити контактують із нейронами і капілярами, а олігодендрити формують мієлін навколо товстих аксонів. На сьогодні сформована концепція, що глія — це сукупність клітин-сателітів, асоційованих із нейронами.
Гліальна клітина за своєю будовою подібна до нервової: в неї є тіло і велика кількість відростків, які, однак, не мають переважаючого спрямування і спеціалізації. Вони переплітаються і спрямовуються в різні боки, утворюючи густе сплетіння. В петлях цього сплетіння розташовані нейрони та їх відростки. Відростки гліальних клітин утворюють основну частину маси мозку. Вони дуже близько підходять до нейронів і нерідко щільно прилягають до стінок капілярів.
На відміну від нейронів, гліальні клітини не мають синапсів, але здатні утворювати буферні зони навколо нейронів. Вони справляють генералізований вплив на ЦНС, діють на сигнали сусідніх нейронів. Глія відіграє важливу роль резервуара електролітів і вбирача калію із міжклітинного простору, що конче потрібно для збереження постійного стану внутрішнього середовища. Гліальні клітини виконують роль опорних елементів мозку, а також реалізують окремі трофічні функції. Вони містяться у всіх відділах ЦНС.
Поруч із опорною і трофічною функціями гліальні клітини беруть участь у психічній діяльності, наприклад, у активізації пам’яті. В системі нейрон — гліальна клітина — капіляр названа клітина виконує функцію оптимізації діяльності нейрона.
Крім ізоляційної функції (розділення відростків нейронів один від одного) глія зумовлює появу захисних імунологічних реакцій у ЦНС. Вона є однією із наймобільніших елементів мезенхімної строми мозку і розглядається як одна із структур гематоенцефа-лічного бар’єру, який локалізується за межами судинної стінки.
Глія потрібна для синтезу медіаторів ЦНС. Вона відіграє важливу роль і в синаптичній передачі. Нейрон у свою чергу впливає на гліальні клітини через нейрогліальні синапси, а також за допомогою зміни іонного складу середовища, місцевих струмів та електромагнітного поля, що виникає навколо аксона і до якого глія дуже чутлива. Глія бере участь у білковому і нуклеїново-кислотному забезпеченні нейрона, видаленні з нього продуктів метаболізму. Таким чином, між нейронами та гліальними клітинами існують різноманітні морфофункціональні зв’язки, через які здійснюється взаємокоригуючий вплив. Тому є підстави говорити про те, що до структурно-функціональних одиниць ЦНС належать нейрогліальні комплекси.
СТРУКТУРА І ФУНКЦІЇ
ЦЕНТРАЛЬНИХ СИНАПСІВ
За допомогою електронної мікроскопії та мікроелектрофізіоло-гічного методу дослідження встановлено, що нейрони не переходять безпосередньо один в одного, а лише контактують між собою через синапси, яких у тисячі разів більше, ніж нервових клітин. Наприклад, число синапсів на одній тільки сомі великого мото-нейрона спинного мозку може досягати 2000, а на тілі пірамідної клітини кіркової речовини великих півкуль — кількох тисяч. Великі нейрони, як правило, мають більше синапсів. Синапси є також між розгалуженнями аксона і рецепторами або ефекторами (наприклад, м’язові або залозисті клітини).
Розрізняють такі види синапсів: аксо-соматичні, а ксо-дендритнчні, аксо-аксбнальні, дендро-дендри-тичні (мал. ЗО). Більшість синаптичних контактів належить до аксо-дендритичних. Крім того, за функціональними особливостями центральні синапси поділяються на збуджувальні та гальмівні.
Для відповідних відділів синаптичного сполучення в даний час прийнято такі терміни: закінчення відростка одного нейрона називають пресинаптичною частиною синапсу (синаптосомою), простір між мембранами, які вкривають пре- і постсинаптичну клітину,— синаптичною щілиною (кілька десятків нанометрів), а ту частину другої клітини, до якої близько підходить закінчення,—
Мал. ЗО. Види синапсів у ЦНС:
/ — аксо-соматичний синапс; 2— аксо-дендритичний сииапс; 3 — аксо-аксональ-иий синапс; 4 — дендро-деидритичний синапс
постсинаптичною ділянкою. Форма синаптичних сполучень може бути різною — як невеличкі гудзики, «кінцеві ніжки», неправильної форми розширення, що містять сітку нейрофібрил, тощо. Найчастіше зустрічається гудзикоподібний тип.
Одна з головних функцій пресинаптичного закінчення (синап-тосоми) полягає у виділенні медіатора під впливом ПД, що поширюється нервовим волокном. У пресинаптичних закінченнях помітні округлі утворення 20—50 мкм у діаметрі. Це везикули, або міхурці, які в різній кількості «нагромаджуються» в нервових закінченнях. Везикули розподіляються по всьому пресинаптичному закінченні, причому їх розподіл і кількість можуть змінюватися залежно від нервової активності. Вони скупчуються біля преси-наптичної мембрани. Везикули містять тисячі молекул хімічного медіатора. Вважають, що везикули лопаються і їхній вміст виливається в синаптичну щілину, здійснюючи «квантове» звільнення медіатора і перехід збудження з однієї клітини в іншу, як це описано вище (див. с. 25). Є дані, що переміщення везикул у бік синаптичної щілини і виділення медіатора відбуваються під впливом Са2+, що входить у нервове закінчення.
У відповідь на виділення медіатора з пресинаптичного закінчення та його взаємодію з білковими макромолекулами (хеморецепторами) постсинаптичної мембрани остання змінює про-
яикність для всіх низькомолекулярних іонів, які входять до складу поза- і внутрішньоклітинного середовища. Інактивація нейро-медіатора в синаптичній щілині здійснюється шляхом зворотного надходження в пресинаптичне закінчення або ферментативного руйнування. Проникність постсинаптичної мембрани змінюється неоднаковою мірою при збудженні і гальмуванні, внаслідок чого іонні механізми цих двох основних нервових процесів істотно відрізняються.
Крім описаних медіаторних механізмів, встановлено механізми н е й р о м о д у л я ц і ї, які регулюють міжнейронні зв’язки. Ней-ромодуляторну функцію можуть виконувати нейропептиди та ней-рогормони, а також нейромедіатори-супутники, які змінюють спорідненість рецепторів постсинаптичної мембрани до основного медіатора. Нейромодулятори впливають на вивільнення нейромеді-атора (пресинаптична модуляція) або на постсинаптичні ефекти медіатора чи на електроґенез постсинаптичного нейрона (постси-наптична модуляція).
Пре- і постсинаптичний модулюючий ефект, як правило, здійснюється вторинними внутрішньоклітинними посередниками. Для пресинаптичної модуляції має значення наявність у пресинаптичних закінченнях рецепторів, які взаємодіють як з власним медіатором, так і з іншими медіаторами (наприклад, з медіатором-супутником).
МЕДІАТОРИ ЦНС
Медіаторами, або нейротрансмітерами, нейронів ЦНС є різні біологічно активні речовини. Залежно від хімічної природи їх можна поділити на 4 групи: 1) аміни (ацетилхолін, норадреналін, дофамін, серотонін); 2) амінокислоти (гліцин, глутамінова, аспарагінова, гамма-аміномасляна — ГАМК); 3) пуринові і нуклеотиди (АТФ); 4) нейропептиди (речовина Р, вазопресин, опоїдні пептиди та ін.).
Раніше вважали, що у всіх закінченнях одного нейрона" виділяється один медіатор (за принципом Дейла). За останні роки з’ясували, що в багатьох нейронах може міститися 2 медіатори або більше.
За дією медіатори можна поділити на іонотропні і ме-таболотропні. Іонотропні медіатори після взаємодії з цито-рецепторами постсинаптичної мембрани змінюють проникність іонних каналів. Метаболотропні медіатори постсинаптичну дію проявляють шляхом активації специфічних ферментів мембрани. Внаслідок цього в мембрані або (найчастіше) у цитоплазмі клітини активуються так звані вторинні посередники (вторинні месен-джери), які в свою чергу запускають каскади внутрішньоклітинних процесів, тим самим впливаючи на функції клітин.
До основних месенджерів систем внутрішньоклітинної сигналізації зараховують аденілатциклазну та поліфосфоінозитид-ну. В основі першої лежить аденілатциклазний механізм. Центральною ланкою другої системи є кальціймобілізуючий каскад поліфосфоінозитидів, який контролюється фосфоліпазою С. Фізіологічний ефект цих систем здійснюється шляхом активації специфічних ферментів — протеїнфосфокіназ, кінцевим підсумком чого є широкий спектр впливу на білкові субстрати, які можуть піддаватися фосфорилюванню. Внаслідок цього змінюється проникність мембран для іонів, синтезуються і виділяються медіатори, регулюється синтез білків, здійснюється енергетичний обмін тощо. Мета-болотропним ефектом володіють більшість нейропептидів. Метаболічні зміни, які відбуваються в клітині або на її мембрані під впливом метаболотропних медіаторів, триваліші, ніж при дії іоно-тропних медіаторів. Вони можуть зачіпати навіть геном клітини.
За функціональними властивостями медіатори ЦНС поділяються на збуджувальні, гальмівні і модулюючі. Збуджувальними медіаторами можуть бути різні речовини, які спричинюють деполяризацію постсинаптичної мембрани. Найважливіше значення мають похідні глутамінової кислоти (глутамати), субстанція Р. Деякі центральні нейрони мають холінорецептори, тобто містять на постсинаптичній мембрані рецептори, які реагують з холіновими сполуками, наприклад, ацетилхолін у клітинах Рен-шоу..Збуджувальними медіаторами можуть бути також моноаміни (норадреналін, дофамін, серотонін). Є підстави вважати, що тип медіатора, який утворюється в синапсі, обумовлений не тільки властивостями закінчення, але й загальним спрямуванням біохімічних процесів у всьому нейроні.
Природа гальмівного медіатора до кінця не встановлена. Вважають, що в синапсах різних нервових структур цю функцію можуть виконувати амінокислоти — гліцин і ГАМК.
ЗБУДЖЕННЯ В ЦНС
Збудження пов’язане з розвитком у нейроні тимчасової деполяризації. Деполяризаційна відповідь нейрона на збудження отримала назву збуджувального постсииаптичного потенціалу (ЗПСП). Внутрішньоклітинно ЗПСП у нейронах ссавців був уперше зареєстрований Д. Екклсом зі співробітниками (1966) за допомогою мікроелектронної техніки.
На відміну від збудження, що поширюється (ПД), ЗПСП є місцевим. Воно локальне, градуальне (залежить від сили подразнення, тобто не підпорядковується закону «все або нічого»), здатне до сумації з попередньою деполяризацією, не залишає після себе рефрактерності. За своїми характеристиками ЗПСП є ідентичним потенціалу кінцевої пластинки (ПКП) у нервово-м’я-
Мал. 31. Вплив сили подразнення на виникнення ПД у нейроні:
1, 2 — підпорогова сила, що викликає лише ЗПСП; 3 — порогова сила, що зумовлює ПД (МП-=—70 мВ-ЕКр— бОмВ)
-20
зовому сполученні (див. с. 25). Проте, якщо ПКП є наслідком активації одного синапса, то ЗПСП переважно виникає при одночасній активації кількох синапсів.
ЗПСП досягає максимуму протягом 1,5—2 мс, після чого повільно затухає за експонентою. Загальна тривалість ЗПСП багатьох нейронів ЦНС складає близько 15 мс, а амплітуда може досягати —20—ЗО мВ при величині мембранного потенціалу —70 мВ (мал. 31).
Місцем первинної генерації ПД у нейроні в більшості випадків є початкова частина аксона (аксонний горбик). Висока збудливість цього горбика пояснюється тим, що поріг його деполяризації удвічі менший (15 мВ), ніж у сомі нейрона (ЗО мВ). Це пояснюється тим, що у мембрані аксонного горбика значно більше іонних каналів. То найбільш збудлива ділянка нейрона (так звана тригерна зона), і лише після її збудження імпульс поширюється, з одного боку, на аксон, а з другого — на сому і дендрити. ПД нейрона, що реєструється внутрішньоклітинно, має два компоненти: спочатку реєструється потенціал початкового сегмента, або ПС-потенціал, а потім потенціал соми і дендритів — СД-потен-ціал.
В основі виникнення збудження лежить трансмембранний рух іонів, серед яких домінуюча роль належить Са2+. Збільшення вмісту кальцію в середовищі і цитоплазмі, вплив антагоністів кальцієвої провідності (ВА¥К 8644) призводять до збудження, у той час як блокатори Са2+-каналів (верапаміл, Д-600) гальмують його'розвиток. Є вказівки і про можливу участь у генерації ЗПСП Ца+ та СІ- ф
Збудження нейрона супроводжується змінами метаболізму, зокрема синтезу РНК, та іншими зрушеннями в процесі білкового синтезу, посиленням теплопродукції, поглинанням кисню, які відображають інтенсифікацію життєдіяльності клітини.
ОСОБЛИВОСТІ ПЕРЕДАЧІ ЗБУДЖЕННЯ В ЦЕНТРАЛЬНИХ СИНАПСАХ
Однобічне проведення. На відміну від нервового волокна, здатного проводити збудження в обох напрямках (див. с. 21), в центральному синапсі воно поширюється тільки в одному: від рецептора через вставні нейрони до ефектора.
Це зумовлено тим, що медіатор, звільнений пресинаптичним закінченням,. надходить у синаптичну щілину, діє на рецептори постсинаптичної мембрани, викликаючи там ЗПСП, а потім ПД у постсинаптичній структурі, тобто синапс функціонує як клапан.
Сповільнене проведення збудження. У синапсах ЦНС збудження проводиться повільніше, ніж у нервових волокнах. Це пояснюється особливостями синаптичної передачі (так звана синаптична затримка), а саме дифузією медіатора до постсинаптичної мембрани, виникненням ЗПСП, наростанням його до критичної величини, генерацією ПД. Точні вимірювання дозволили встановити, що для проведення збудження через один синапс потрібно 2—3 мс. Виходячи з цього, можна визначити кількість синапсів у нейронній сітці, через які проходить імпульс у ЦНС.
Трансформація ритму збудження. Здатність нервових центрів змінювати (переробляти) ритм імпульсів, які надходять до них, називається трансформацією ритму. Найчастіше трансформація ритму проявляється в тому, що у відповідь на поодинокий стимул-подразнення нервові центри надсилають до виконавчого органа
Мал. 32. Схема нейронних механізмів трансформації ритму і полегшення в спинному мозку:
/ — електроди, які подразнюють; 2 — серія ПД, що надходить у спинний мозок; 3 — серія ПД, що виходить із спинного мозку кількома еферентними нервовими волокнами у відповідь на подразнення одного аферентного волокна
Мал. 33. Сумація у нервовій системі:
А — часова сумація. Одноразовий стимул (одна стрілка) і подвоєні стимули (дві стрілки) викликають підпороговий ЗПСП; третій стимул (три стрілки) зумовлює ПД. Міжстимульиий інтервал становить 4 мс; Б — просторова сумація. Стимул, який подається окремо через електроди 1 і 2, викликає підпорогові ЗПСП, але одночасне подразнення обох аксонів призводить дО генерації ПД
(ефектора) цілий ряд імпульсів, які надходять один за одним з певною частотою (мал. 32). Цим пояснюється й виникнення тетанічного скорочення скелетного м’яза (див. с. ЗО) у відповідь на поодиноку стимуляцію відповідного аферентного нерва. Образно кажучи, у відповідь на поодинокий постріл центр відповідає кулеметною чергою. В основі цього явища лежать головним чином слідові коливання мембранного потенціалу, особливо тривалість слідового негативного потенціалу (див. с. 13). Якщо слідовий негативний потенціал, який супроводжує ПД, великий, то він може досягнути критичного рівня деполяризації мембрани і зумовити появу другого імпульсу. У ряді випадків трансформація спричинюється збільшенням тривалості ЗПСП, і після закінчення першого ПД розвиваються наступні.
Сумація збуджень. Під сумацією збуджень на тілі нейрона розуміють сумацію ЗПСП як місцевого потенціалу. Додавання — процес складання двох або більше однакових реакцій, унаслідок якого результуюча реакція буде більшою за своєю величиною, ніж кожна із її складових.
Інтенсивність сумації ЗПСП на тілі нейрона визначає, чи буде цей нейрон збудженим, чи полегшеним (полегшення — тривале підвищення збудливості нейрона в кірковій речовині великого мозку), а також частоту розрядів збудженого нейрона. Частота роз
рядів нейрона, тобто частота ПД в серії, яку генерує нейрон, є найважливішою його функціональною характеристикою. Вона дозволяє судити про інтенсивність збудження конкретного нейрона. Що більша частота розрядів, то сильніше збуджений нейрон.
Розрізняють часову і просторову сумацію збуджень. Якщо ЗПСП швидше (з інтервалом близько 15 мс) надходять один за одним аксоном, то вони додаються в нейроні, досягаючи зрештою порогового рівня деполяризації, потрібного для генерації ПД (мал. 33). Така сумація називається часовою або послідовною. Якщо окремо подразнювати кожний з двох аксонів, то виникають лише порогові ЗПСП. Одночасне подразнення обох аксонів зумовлює сумацію цих ЗПСП і появу повноцінного ПД, здатного до поширення. Це явище називають просторовою сумацією.
Проте аферентні шляхи, які підходять до нейрона, є не тільки збуджувальними, а й гальмівними. Імпульси, що надходять цими шляхами, на тілі нейрона перетворюються на гальмівні постсинап-тичні потенціали (ГПСП), які сумуюгься як один до другого, так і до ЗПСП (алгебраїчна дія). Таким чином, у процесі життєдіяльності на тілі кожного центрального нейрона завжди одночасно здійснюється додавання ЗПСП (додавання збуджень) і ГПСП (додавання гальмування). Стан нейрона, незалежно від того, буде він загальмованим чи збудженим (і наскільки), завжди визначається сумацією не лише ЗПСП, а ЗПСП і ГПСП.
ГАЛЬМУВАННЯ В ЦНС
Гальмування — особливий нервовий процес, який зумовлюється збудженням і зовнішньо проявляється пригніченням іншого збудження. Воно здатне активно поширюватися нервовою клітиною і її відростками. Започаткував вчення про центральне гальмування І. М. Сєченов (1863), який помітив, що згинальний рефлекс жаби гальмується при хімічному подразненні середнього мозку. Гальмування відіграє важливу роль у діяльності ЦНС, а саме: у координації рефлексів; у поведінці людини і тварин; у регуляції діяльності внутрішніх органів і систем; у здійсненні захисної функції нервових клітин.
Типи гальмування в ЦНС. Центральне гальмування розподіляється за локалізацією на пре- та постсинаптичне; за характером поляризації (зарядом мембрани) —на гіпер- та деполяризаційне; за будовою гальмівних нейронних ланцюгів — на реципрокне, або поєднане, зворотне та латеральне (мал. 34).
Пресинаптичне гальмування, як свідчить назва, локалізується в пресинаптичних елементах і пов’язане з пригніченням проведення нервових імпульсів у аксональних (пресинаптичних) закінченнях. Гістологічним субстратом такого гальмування є аксональні синапси. До збуджувального аксона підходить встав-
Мал. 34. Схематичне зображення нейронних механізмів розвитку гальмування в ЦНС.
А — постсинаптичне гальмування: 1 — закінчення гальмівного вставного нейрона; 2 — дифузія гальмівного медіатора; 3 — синаптична щілина; 4 — гіперполяризація постсииаптичної мембрани (виникнення ГПСП). Стрілками вказано напрям струму, за допомогою якого поширюється ГПСП.
Б — зворотне гальмування; 1 — мотоней-рон; 2 — серія ПД, що генерується мото-нейроном; 3 -* колатераль аскона мотоней-рона, який контактує з тілом гальмівної клітини Реншоу; 4 — дифузія гальмівного медіатора.
В — пресинаптичие гальмування: 1 — аксон гальмівного інтернейроиа, який спричинює гальмування в ділянці аксо-аксоиального сннапса (3); 3 — стійка деполяризація, яка призводить до збільшення порога деполяризації (пресинаптичие гальмування); 4 — тіло иейроиа
ний гальмівний аксон, який виділяє гальмівний медіатор ГАМК. Цей медіатор діє на постсинаптичну мембрану, яка є мембраною збуджувального аксона, і спричиняє в ній деполяризацію. Виникла деполяризація гальмує вхід Са2+ із си-наптичної щілини в закінчення збуджувального аксона і таким чином призводить до пригнічення викидання збуджувального медіатора в синап-тичну щілину, гальмування реакції. Пресинаптичие гальмування досягає максимуму через
15—20 мс і триває близько 150 мс,
тобто набагато довше, ніж постсинаптичне гальмування. Пресинап-тичне гальмування блокується судомними отрутами — бікулгном та пікротоксином, які є конкурентними антагоністами ГАМК.
Постсинаптичне гальмування (ГПСП) обумовлене
виділенням пресинаптичним закінченням аксона гальмівного медіатора, який знижує або гальмує збудливість мембран соми і дендритів нервової клітини, з якою він контактує. Воно пов’язагіе з існуванням гальмівних нейронів, аксони яких утворюють на сомі та дендритах клітин нервові закінчення, виділяючи гальмівні медіатори — ГАМК і гліцин. Під впливом цих медіаторів виникає гальмування збуджувальних нейронів. Прикладами гальмівних нейронів є клітини Реншоу в спинному мозку, нейрони грушовидні (клітини Пуркіньє мозочка), зірчасті клітини кіркової речовини великого, мозку та ін.
Дослідженням П. Г. Костюка (1977) доведено, що постсинап-тичне гальмування пов’язане з первинною гіперполяризацією мембрани соми нейрона, в основі якої лежить збільшення проникності постсинаптичної мембрани для К+. Внаслідок гіперполяризації рівень мембранного потенціалу віддаляється від критичного (поро-гового) рівня. Тобто відбувається його збільшення — гіперполяри-зація. Це призводить до гальмування нейрона. Такий вид гальмування називається гіперполяризаційним.
Амплітуда і полярність ГПСП залежать від висхідного рівня мембранного потенціалу самого нейрона. Механізм цього явища пов’язаний із СІ-. З початком розвитку ГПСП СІ- входить у клітину. Коли в клітині стає його більше, ніж зовні, гліцин конфор-мує мембрану і через відкриті її отвори Сі- виходить із клітини. У ній зменшується кількість негативних зарядів, розвивається деполяризація. Такий вид гальмування має назву деполяризація н о г о.
Постсинаптичне гальмування локальне. Розвивається воно гра-дуально, здатне до. сумації, не залишає після себе рефрактерності. Є більш оперативним, чітко адресованим та універсальним гальмівним механізмом. За своєю суттю це «центральне гальмування», яке було описане у свій час СЬ. 8. ЗНеггіп^іоп (1906).
Залежно від структури гальмівного нейронного ланцюжка, розрізняють такі форми постсинаптичного гальмування: реципрокне, зворотне та латеральне, яке є власне різновидом зворотного.
Реципрокне (поєднане) гальмування характеризується тим, що у тому випадку, коли при активізації аферентів збуджуються, наприклад, мотонейрони м’язів-згиначів, то одночасно (на цьому боці) гальмуються мотонейрони м’язів-розгиначів, які діють на цей же суглоб. Відбувається це тому, що аференти від м’язових веретен утворюють збуджувальні синапси на мотонейро-нах м’язів-агоністів, а через посередництво вставного гальмівного нейрона — гальмівні синапси на мотонейронах м’язів-антагоністів. З фізіологічної точки зору таке гальмування дуже вигідне, оскільки полегшує рух суглоба «автоматично», без додаткового довільного або недовільного контролю.
Зворотне гальмування. У цьому випадку від аксонів мотонейрона відходить одна або кілька колатералей, які прямують до вставних гальмівних нейронів, наприклад, клітин Реншоу. В свою чергу, клітини Реншоу утворюють гальмівні синапси на мотонейроні. У разі збудження мотонейрона активізуються і клітини Реншоу, внаслідок чого відбувається гіперполяризація мембрани мотонейрона і гальмується його діяльність. Що більше збуджується мотонейрон, то відчутніші гальмівні впливи через клітини Реншоу. Таким чином, зворотне постсинаптичне гальмування функціонує за принципом негативного зворотного зв’язку. Є припущення, що цей вид гальмування потрібен для саморегуляції
збудження нейронів, а також для запобігання їх перезбудженню та судомним реакціям.
Латеральне гальмування. Гальмівний ланцюг нейронів характеризується тим, що вставні гальмівні нейрони впливають не тільки на збуджену клітину, але й на сусідні нейрони, в яких збудження є слабшим або зовсім відсутнє. Таке гальмування називається латеральним, позаяк ділянка гальмування, яка утворюється, міститься збоку (латерально) від збудженого нейрона. Воно відіграє особливо важливу роль у сенсорних системах, створюючи явище контрасту.
Постсинаптичне гальмування переважно легко знімається при введенні стрихніну, який конкурує з гальмівним медіатором (гліцином) на постсинаптичній мембрані. Правцевий токсин також пригнічує постсинаптичне гальмування, порушуючи вивільнення медіатора з гальмівних пресинаптичних закінчень. Тому введення стрихніну або правцевого токсину супроводжується судомою, яка виникає внаслідок різкого посилення процесу збудження в ЦНС, зокрема, мотонейронів.
У зв’язку з розкриттям іонних механізмів постсинаптичного гальмування з’явилася можливість і для пояснення механізму дії Вг. Натрію бромід у оптимальних дозах широко застосовується в клінічній практиці як седативний (заспокійливий) засіб. Доведено, що такий ефект натрію броміду пов’язаний з посиленням постсинаптичного гальмування в ЦНС. .
Роль різних видів центрального гальмування. Головна роль центрального гальмування полягає в тому, щоб у взаємодії з центральним збудженням забезпечувати можливість аналізу і синтезу в ЦНС нервових сигналів, а отже, можливість узгодження всіх функцій організму між собою і з навколишнім середовищем. Цю роль центрального гальмування називають координаційною. Деякі види центрального гальмування виконують не тільки координаційну, а й захисну (охоронну) роль. Припускають, що основна координаційна роль пресинаптичного гальмування полягає в пригніченні в ЦНС малосуттєвих аферентних сигналів. За рахунок прямого постсинаптичного гальмування узгоджується діяльність антагоністичних центрів. Зворотне гальмування, обмежуючи максимально можливу частоту розрядів мотонейронів спинного мозку, виконує й координаційну роль (узгоджує максимальну частоту розрядів мотонейронів зі швидкістю скорочення м’язових волокон, які вони іннервують) та захисну (запобігає збудженню мотонейронів). У ссавців цей вид гальмування поширений в основному в спинномозкових аферентних системах. У вищих відділах мозку, а саме в кірковій речовині великого мозку, домінує постсинаптичне гальмування.
Яке функціональне значення пресинаптичного гальмування? За його рахунок здійснюється вплив не лише на власний рефлек
торний апарат спинного мозку, а й на синаптичні переключення ряду висхідних щодо головного мозку трактів. Відомо також про низхідне пресинаптичие гальмування первинних аферентних волокон групи Аа і шкірних аферентів. У цьому випадку пресинаптич-не гальмування є, очевидно, першим «ярусом» активного обмеження інформації, що надходить ззовні. У ЦНС, особливо в спинному мозку, пресинаптичие гальмування часто виступає в ролі своєрідного негативного зворотного зв’язку, який обмежує аферентну імпульсацію при сильних (наприклад, патологічних) подразненнях і таким чином певною мірою виконує захисну функцію стосовно спинномозкових та вище розташованих центрів.
Функціональні властивості синапсів не є постійними. У деяких умовах ефективність їх діяльності може зростати або зменшуватися. Звичайно при високих частотах подразнення (кілька сот за 1 с) протягом кількох секунд і навіть хвилин полегшується синаптична передача. Це явище дістало назву синаптичної потенціа-ції. Така синаптична потенціація може спостерігатися і по закінченню тетанічної стимуляції. Тоді вона називатиметься посттета-нічною потенціацією (ПТП). У основі ПТП (довготривалого збільшення ефективності зв’язку між нейронами), цілком імовірно, лежать зміни функціональних можливостей пресинаптичного волокна, а саме його гіперполяризація. У свою чергу, це супроводжується підвищенням виходу медіатора в синаптичну щілину і появою збільшеного ЗПСП у постсинаптичній структурі. Є дані і про структурні зміни при ПТП (набрякання і ріст пресинаптичних закінчень, звуження синаптичної щілини тощо).
ПТП набагато краще виражена у вищих відділах ЦНС (наприклад, у гіпокампі, пірамідних нейронах кіркової речовини великого мозку) порівняно із спинномозковими нейронами. Поряд з ПТП у синаптичному апараті може виникати постактиваційна депресія, яка виражається зменшенням амплітуди ЗПСП. Цю депресію багато дослідників пов’язують із ослабленням чутливості до дії медіатора (десенсибілізацією) постсинаптечної мембрани або різним співвідношенням витрат і мобілізації медіатора.
З пластичністю синаптичних процесів, зокрема з ПТП, можливо, пов’язані формування нових міжнейронних зв’язків у ЦНС та їх закріплення, тобто механізми навчання і пам’яті. Разом з тим слід визнати, що пластичні властивості центральних синапсів вивчені поки що недостатньо.
ІНТЕГРАТИВНА ФУНКЦІЯ
ЦЕНТРАЛЬНОГО НЕЙРОНА
Залежно від сумарного постсинаптичного ефекту, який викликається імпульсацією, що надходить до нейрона в даний момент, у ньому виникає або не виникає збудження, що поширюється
(ПД). Будь-який нейрон є своєрідним «оцінювачем» усіх конвертованих на ньому сигналів. Він ніби «вирішує», що передавати наступним ланкам нейронного ланцюга і чи передавати що-небудь взагалі. Якщо розглядати відносно простий приклад інтегративної діяльності, коли нейрон «відповідає» за принципом «так — ні», то, по суті, на рівні цього нейрона (наприклад, спинного мозку) вирішується питання, чи візьмуть нейрони вищих рівнів участь у подальшому «розгляді» інформації, котра надходить із периферії.
При характеристиці властивостей центральних нейронів важливо враховувати також загальний стан кожного нейрона окремо, який визначає характер його участі у взаємодії багатьох нейронів мозку людини (збудження або гальмування, полегшення або депресія, позитивна чи негативна післядія тощо).
Стан кожного нейрона залежить від кількості синапсів (збуджувальних чн гальмівних) на його поверхні, а також від того, яка кількість цих синапсів функціонує в даний момент і яка інтенсивність їх функціонування. Сумарний результат цих впливів визначають МПС нейрона і його зміни в напрямку де- або гіпер-поляризації, які зрештою призведуть до генерації цим нейроном ПД певної частоти або до відсутності цієї генерації ПД.
Якщо ж взяти за вихідну кількість нейронів кіркової речовини великого мозку людини 14 млрд і врахувати, що кожний нейрон має в середньому по 5 тис. синаптичних контактів з іншими нейронами мозку, то важко, навіть маючи багату уяву, підрахувати кількість комбінацій взаємодії нейронів у мозку. Зроблені в цьому напрямку математиками розрахунки дали фантастичну цифру. Виявилося, що число таких комбінацій стану нейронів (тобто ступенів свободи) з урахуванням усіх тих змінних, які було розглянуто вище, може бути виражено одиницею з такою кількістю нулів, що вони можуть вписатися на стрічці завдовжки 9 500 000 км (1). Досить тільки уявити цю «множину», щоб оцінити грандіозні резерви мозкової діяльності людини. Таким чином, кожний окремий нейрон потенційно має величезну кількість ступенів свободи як об’єкт взаємодії з іншими нейронами.
Універсальним чинником інтегративної діяльності нейрона є конвергенція збуджень на ньому. Завдяки цьому явищу в один і той же нейрон одночасно надходять чисельні потоки збуджень різної сенсорної і біологічної модальності, які потім підлягають складній обробці й перекодуванню і формуються в єдине збудження, яке надходить на аксон.
Останнім часом досить часто роблять спроби проводити аналогію між діяльністю ЦНС і роботою ЕОМ. Нейрон зі своїм синап-тичним апаратом розглядається як комірка, в якій можуть здійснюватися логічні операції, арифметичні дії, математичне інтегрування і диференціювання.
Обробка інформації, що надійшла на нейрон, пов’язана як з синаптичними процесами, так і з комплексом хімічних процесів, що відбуваються в нейроні (хімічною інтеграцією), а також з активізацією ядерного генетичного апарата (генома) нейрона. У відповідь на надходження нервового імпульсу і дію медіатора в нейронах збільшується синтез РНК і так званих мозкоспецифічних білків, які модулюють чутливість нейронів, підвищуючи або знижуючи як до нервових імпульсів, що надходять, так і до хімічних регуляторів (медіатори, гормони, іони, простагландини та ін.).
Слід зазначити, що в нейронах генетична активність виражена ширше, ніж у більшості інших клітин організму (зокрема, печінки, селезінки, нирок та ін.). Причому складніше організована активність генетичного апарата тих відділів мозку, які більшою мірою відповідають за інтегративну функцію ЦНС (наприклад, об’єм гібридизації ДНК/РНК у лобних ділянках мозку найвищий). В онтогенезі у міру дозрівання мозку та навчання генетична активність нейронів поступово підвищується.
Різні типи нейронів наділені різною інтегративною здатністю. У деяких з них переважає передавальна функція, тобто інформація передається нервовими каналами без змін. Це особливо стосується так званих релейних нейронів з довгими аксонами та асоціативних нейронів різних відділів ЦНС. Разом з тим механізми, які регулюють збудливість нейронів, можуть брати участь і в системній інтегративній діяльності, коли інформація переробляється в процесі її передавання від однієї ланки нейронної сітки до іншої.
Усі види складної інтегративної діяльності ЦНС (обмеження аферентного потоку імпульсації, що йде від рецепторів; зворотні позитивні і негативні зв’язки, які посилюють або обмежують активність попередньої ланки системи нейронів; пре- і постсинаптичне гальмування, яке уточнює аферентний потік; полегшення або блокування синаптичної передачі тощо) здійснюється за допомогою різноманітних механізмів регуляції збудливості і пропускної спроможності каналів нервового зв’язку.
ФОНОВА АКТИВНІСТЬ НЕЙРОНА
Нейрони деяких структур головного мозку мають здатність до «с п о н т а н н ої» деполяризації. Вони генерують ПД без нанесення зовнішніх стимулів. Це явище отримало назву «фонової», або спонтанної, імпульсної активності нейронів. Причиною виникнення фонової активності можуть бути різні фізіологічні явища: випадкове виділення квантів медіатора в синаптичну щілину, хаотичне порушення іонних потоків та метаболічних процесів, зміна рівня мембранного потенціалу та ін. Фонова активність дає можливість нейронам як підсилювати, так
і гальмувати збудження. Наприклад, при глибокому наркозі знижується рівень фонової активності мозку, а в епілептичному осередку вона різко посилюється.
ТРОФІЧНА ФУНКЦІЯ НЕЙРОНА
Трофічна функція (грецьк. ІгорЬе — живлення) проявляється у регулювальному впливі на метаболізм і живлення клітини (нервової або ефекторної). Вчення про трофічну функцію нервової системи було розвинено І. П. Павловим (1920) та іншими вченими.
Основні дані про наявність цієї функції одержано в дослідах з денервацією нервових або ефекторних клітин, тобто перерізуванням тих нервових волокон, синапси яких закінчуються на досліджуваній клітині. Виявилося, що клітини, позбавлені значної частини синапсів, які їх вкривають, стають набагато чутливішими до хімічних чинників (наприклад, до впливу медіаторів). При цьому істотно змінюються фізико-хімічні властивості мембрани (опір, іонна провідність тощо), біохімічні процеси в цитоплазмі, виникають структурні зміни (хроматоліз), зростає кількість хеморецепторів мембран.
У чому ж причина цих змін? Значним фактором є постійне надходження (в тому числі й спонтанне) медіатора до клітини, який регулює мембранні процеси в постсинаптичній структурі; підвищує чутливість рецепторів до хімічних подразників. Причиною змін може бути виділення з синаптичних закінчень речовин («трофічних» факторів), які проникають у постсинаптичну структуру і впливають на неї.
Є дані про переміщення деяких речовин аксоном (аксонний транспорт). Білки, котрі синтезуються в тілі клітини, продукти метаболізму нуклеїнових кислот, нейромедіатори, нейросекрети та інші речовини переміщуються аксоном до нервового закінчення разом із клітинними органелами, зокрема мітохондріями, які несуть, очевидно, повний набір ензимів. Експериментально доведено, що швидкий аксонний транспорт (410 мм за 1 добу) і повільний (175—230 мм за 1 добу) є активними процесами, які вимагають затрати енергії метаболізму. Допускають, що транспортний механізм здійснюється за допомогою мікротрубочок і нейрофіламентів аксона, якими відбувається ковзання актинових транспортних ниток. При цьому розчеплюється АТФ, чим забезпечується енергія для транспорту.
Виявлено також ретроградний аксонний транспорт (від периферії до тіла клітини). Віруси і бактеріальні токсини можуть проникати в аксон на периферії і переміщуватися по ньому до тіла клітини. Наприклад, правцевий токсин, який продукують бактерії, що потрапили в рану на шкірі, потрапляє в організм шляхом ретроградного транспорту аксоном у ЦНС і стає при
чиною м’язових судом, які можуть зумовити смерть. Введення в ділянку перерізаних аксонів деяких речовин (наприклад, ферменту пероксидази) супроводжується надходженням їх у аксон і поширенням аж до соми нейрона.
Вирішення проблеми трофічного впливу нервової системи дуже важливе для розуміння механізму тих трофічних розладів (трофічні виразки, випадання волосся, ламкість нігтів тощо), які нерідко спостерігаються у клінічній практиці.
ЗАГАЛЬНІ ПРИНЦИПИ
РЕФЛЕКТОРНОЇ ДІЯЛЬНОСТІ
Основним і специфічним проявом діяльності нервової системи € здійснення рефлексів. За висловлюванням І. П. Павлова, у житті складного організму рефлекс є суттєвим і найбільш частим нервовим явищем. За його допомогою встановлюється постійне, правильне і точне співвідношення частин організму між собою і відношення цілого організму до навколишніх умов.
Рефлекс — це закономірна реакція організму на зміни внутрішнього або зовнішнього середовища, що здійснюється за участю ЦНС у відповідь на подразнення рецепторів. Завдяки рефлексам організм здатний швидко і точно реагувати на зміни зовнішнього та внутрішнього середовищ і пристосовуватися до цих змін.
Основи вчення про рефлекторну діяльність організму були закладені французьким вченим Р. Декартом (1596—1650). Сам термін «рефлекс» було введено значно пізніше — в основному після появи праць Т. АУШіз (1672) і 3. РгосЬазка (1780).
І. М. Сєченов першим використав рефлекторний принцип стосовно психічної діяльності людини і тварин. У книзі «Рефлекси головного мозку» (1863) він зазначав, що всі акти свідомого і несвідомого життя є не що інше, як рефлекси. Основу експериментального вивчення рефлекторної діяльності кіркової речовини великого мозку заклав на початку нашого століття І. П. Павлов, який розробив метод умовних рефлексів і відкрив тим самим можливість об’єктивно вивчати вищу нервову діяльність людини і тварин. У галузі фізіології ЦНС велика роль відводиться працям СЬ. 8. ЗЬеггіп^іоп (1906), якому нейрофізіологія зобов’язана конкретними даними про основи рефлекторних процесів (особливо тих, які відбуваються в спинному мозку). Серед вчених, котрі внесли вагомий внесок у розвиток рефлекторної теорії, слід назвати П. К- Анохіна (1945). Він підкреслив роль зворотного зв’язку в рефлекторній діяльності.
РЕФЛЕКТОРНА ДУГА
Рефлекторна дуга (шлях рефлексу) — це нейронний ланцюг від периферичного рецептора через ЦНС до периферичного ефектора (робочого органа).
Компонентами рефлекторної дуги є сприймальні рецептори, аферентний шлях, «нервовий «центр» (центральні нейрони), еферентний шлях та ефектор (мал. 35).
Рецептори становлять собою сенсори, які сприймають різноманітні зміни, що-відбуваються в організмі або в навколишньому середовищі. Розрізняють екстеро-, пропріо- і вісцерорецептори (детальніше див. с. 81). Сукупність рецепторів, подразнення яких зумовлює даний тип рефлексу, називають рецептивним полем рефлексу (рефлекторна зона). Рецептори, однакові за своєю будовою, можуть належати до різних рецепторних полів. З іншого боку, в рецептивне поле певного рефлексу можуть входити і різні за будовою рецептори. Наприклад, подразнення одних і тих самих рецепторів, розташованих у різних ділянках шкіри жаби, може призводити до появи різних рефлексів (згинального, розгинального, потирання).
Чутливі (центрострімкі) нерви, що приносять збудження в ЦНС, складають аферентний шлях. Центром рефлекторної дуги є структури, розташовані в ЦНС, які отримують, обробляють інформацію, що надходить, і передають її на периферію. Еферентний шлях складається з рухових, або вегетативних, волокон нервової системи. Ефекторами є різні органи (скелетні та гладкі м’язи, залози, серце тощо). У зв’язку з наявністю зворотного зв’язку (зворотної аферентації) рефлекторні
дуги, власне, «замикаються» в кільце, тому іноді вживають термін «рефлекторне кільце».
Рефлекторна реакція відбувається в часі. Час рефлексу (латентний період) — це час від початку подразнення рецепторів до настання відповідної реакції ефектора. Він визначається часом проведення збудження аферентним і еферентним шляхами і в центральній частині рефлекторної дуги (так званий центральний час рефлексу). Крім того, в час рефлексу входять час переробки в рецепторі стимулу в імпульс, який по-
Мал. 35. Схема рефлекторної дуги:
1 — рецептор; 2 — аферентний нейрон; 3 — центральні нейрони (центр); 4 — еферентний нейрон; 5 — ефектор; 6— зворотний зв’язок (зворотна аферентація)
піирюється, час активізації робочого органа. Таким чином, час рефлексу є сумарним виразом тривалості цих інтервалів.
Час рефлексу залежить від складності рефлекторної дуги (тобто кількості центральних синапсів), сили подразнення та рівня збудливості ЦНС (наприклад, при сильному подразненні він коротший, ніж при слабкому, при підвищенні збудливості нервових центрів він скорочується, а при втомі — подовжується тощо). У людини найменшу тривалість має час сухожильних рефлексів (наприклад, час сухожильного колінного рефлексу складає 0,01— 0,02 с, а його «центральний» час — 0,003 с).
Дослідження часу рефлексу в людини (наприклад, сенсомотор-них реакцій) має практичне значення для професійного відбору водіїв транспорту, вивчення перебігу нервових захворювань тощо.
КЛАСИФІКАЦІЯ РЕФЛЕКСІВ
Рефлекси відзначаються великою різноманітністю. За ознаками їх умовно ділять на групи та типи.
Рефлекс, дуга якого має тільки один центральний синапс (між аферентним і еферентним нейронами), називається моносинап-ти ч н и м (мал. 36, І). Це найпростіший вид рефлекторної дуги. Такими рефлексами є м’язові рефлекси розтягування (міотатичні). До них належать сухожильні рефлекси (колінний, ліктьовий, ахі-ловий), які мають важливе клінічне значення (див. с. 147). За винятком моносинаптичного рефлексу розтягування, всі рефлекторні дуги включають кілька послідовних центральних (вставних) нейронів. Такі рефлекси називаються полісинаптичними (мал. 36, II). Вони можуть виникати при подразненні м’язових, шкірних або вісцеральних рецепторів.
За характером реакції, залежно від того, які органи в ній беруть участь, рефлекси ділять на рухові (якщо їх ефектором •е скелетні м’язи) і вегетативні (якщо їх ефектором є залози, кровоносні судини, внутрішні органи). Рефлекси ділять також на екстеро-, інтеро- та п р о п р і о р е це т и в н і — залежно від того, де розташовані рецептори, подразнення яких зумовлює даний рефлекс (на зовнішній поверхні тіла або у внутрішніх органах, у скелетних м’язах, сухожиллі, суглобах).
Усі вищеназвані рефлекси можуть бути природженими. Вони обумовлені (генетично) структурною організацією нервової системи. їх рефлекторні дуги замикаються звичайно у філогенетично давніх відділах ЦНС — спинному мозку, стовбурі мозку, підкіркових структурах. Поряд з цими рефлексами кожний організм здатний виробляти рефлекторні реакції протягом життя. Це допомагає йому краще і точніше пристосовуватися до змінних умов навколишнього середовища. Такі рефлекси називають набути
м и, або умовними. Дуги цих рефлексів звичайно замикаються у вищих відділах ЦНС, головним чином у кірковій речовині великого мозку.
ВЛАСТИВОСТІ НЕРВОВИХ ЦЕНТРІВ
Досі йшлося про діяльність поодиноких нейронів. Тепер доцільно розглянути, як функціональні властивості окремих нейронів позначаються на діяльності сукупності нейронів, так званого
нервового центру.
Виходячи з фізіологічних уявлень, нервовий «центр» може розташовуватися на різних рівнях ЦНС і брати участь у регуляції якої-небудь фізіологічної функції (дихання, травлення тощо) або в здійсненні якого-небудь реф
I—І__І__І__І І І І І І І І І І І
кс
Мал. 36. Схема моиосинаптичиого (І) та гюлісинаптичиого (II) проведення збудження.
Внизу: при подразненні заднього корінця від переднього корінця реєструється МОнО-синаптнчний потенціал (І), за яким ідуть полісинаптичні розряди (II)
лексу.
До функціональних властивостей рефлекторних центрів належать: іррадіація збудження; конвергенція і дивергенція; сумація; синаптичне полегшення і оклюзія; трансформація ритму, реверберація збудження; тонічний стан центрів; їх швидка стомлюваність; велика чутливість до нестачі кисню і до дії деяких отрут.
Іррадіація збудження. Активне поширення збудження в ЦНС, особливо при сильному і тривалому подразненні, отримало назву іррадіації. Можливість іррадіації в ЦНС обумовлена наявністю в ній чисельних відгалужень відростків (аксонів, дендритів) нервових клітин і ланцюгів інтернейронів, які з’єднують між собою різні нервові центри (завдяки цьому збудження поширюється певними шляхами і з певною послідовністю). Важливу роль у іррадіації збудження в структурах мозку відіграє ретикулярна формація.
Посилення подразнення або підвищення збудливості ЦНС супроводжується посиленням іррадіації збудження в ній. Гальмівні нейрони і синапси перешкоджають іррадіації збудження або обмежують її. При введенні стрихніну, що блокує постсинаптичне гальмування (див. 49), виникає сильне збудження ЦНС, яке супроводжується судомою всіх скелетних м’язів. Іррадіація може стати патологічною в зв’язку з виникненням сильного осередку збудження та зі зміною властивостей нервової тканини, що посилює поширення збудження. Це буває при епілепсії. .
Мал. 37. Схематичне зображення конвергенції (Д) та дивергенції (Б) у ЦНС
збудження — хо наступної и. Конверген-
Конвергенція збудження. На кожному з нейронів ЦНС кон-вергують (сходяться) різні аферентні волокна (мал. 37, Л). Таких аферентних входів для більшості нейронів багато десятків і навіть тисяч. Так, на мотонейро-ні закінчується в середньому 6000 колатералей аксонів, які надходять від периферичних рецепторів і різних структур мозку, утворюючи збуджувальні й гальмівні синапси. Це таке універсальне явище, що можна говорити про принцип конвергенції в нейронах та їх зв’язках. Завдяки цьому явищу в один і той же нейрон одночасно надходять чисельні й різноманітні потоки збуджень, які потім підлягають складній обробці і перекодуванню і формуються в єдине аксонне, що йде ланки нервової сіт
ція збудження на нейроні є універсальним чинником його інтегративної діяльності.
Розрізняють мультисенсорну, мультибіологічну і сенсорно-біологічну форми конвергенції. У першому випадку на нейрон надходять сигнали різної сенсорної модальності (зорові, слухові, больові тощо), у другому — потоки збуджень різної біологічної модальності (харчові, статеві тощо), в третьому — сигналізація (зорова, харчова) та ін.
Дивергенція (розходження) збудження — здатність поодинокого нейрона встановлювати численні синаптичні зв’язки з різними нервовими клітинами (мал. 37, Б). Наприклад, аферентні волокна периферичних рецепторів, входячи в спинний мозок у складі задніх корінців, далі розгалужуються на численні колатералі, які йдуть до спінальних нейронів. Завдяки дивергенції одна і та ж нервова клітина може брати участь в організації різних реакцій і контролювати велику кількість нейронів. Одночасно кожен нейрон може забезпечувати широкий перерозподіл імпульсів, що веде до іррадіації збудження. Конвергенція і дивергенція взаємо пов’язані.
Реверберація збудження. Циркуляція збудження замкнутими нейронами і їх ланцюгами в ЦНС називається реверберацією. На мал. 38 схематично зображено подібний замкнутий ланцюг нейро-
Мал. 38. Схема конвергенції (Д), реверберуючого ланцюга (Б) і рефлекторної післядії (пролонгованого збудження — В).
Центральний нейрон Н дістає одночасно і послідовно по всіх пресичаптичних закінченнях збудження від клітин а — г, що викликає в ньому просторову і часову сумацію (полегшення)
Мал. 39. Схема нервових центрів з високим (Д) і низьким (Б) тонусом. Чорна зона «виходу» показує відносну кількість еферентних волокон (пояснення у тексті)
нів. Збудження одного із нейронів, які входять у цей ланцюг, передається на інший (або інші), а колатераляміг аксонів знову повертається до нервової клітини і т. д. Завдяки існуванню таких зв’язків, які, власне, є ланцюгами позитивного зворотного зв’язку, збудження може довго циркулювати (зберігатися) в ЦНС — доки не стомляться синапси або не виникне гальмування.
Реверберація збудження спостерігається у так званій рефлекторній післядії, коли рефлекторний акт закінчується не одразу після припинення, а через деякий (іноді тривалий) період, а також відіграє певну роль у механізмах короткочасної (оперативної) пам’яті (див. с. 529). Сюди ж належить кірково-підкіркова реверберація, яка відіграє важливу роль у вищій нервовій діяльності (поведінці) людини і тварин.
Тонус нервових центрів. Багато центрів, тобто нейронів, які їх складають, постійно генерують нервові імпульси. Вони надходять до ефекторів, що свідчить про існування деякого постійного тонічного збудження, тобто тонусу нервових центрів.
Вказану властивість нервового центру найпростіше розглянути на прикладі поєднання мотонейронів (мотонейронного пулу).
При подразненні аферентного м’язового нерва надпороговим поодиноким стимулом у мотонейронах, які іннервують відповідні м’язи, виникають моносинаптичні ЗПСП. Залежно від числа си-наптичних контактів і рівня поляризації частина мотонейронів деполяризується до порогового рівня, і в них відбувається імпульсивний розряд. Ці мотонейрони складають так звану зону розряду. Друга (звичайно значно більша) частина мотонейронів цього пулу не досягає критичного рівня деполяризації і не розряджається, але на час розвитку ЗПСП, як правило, збільшується збудливість цих «мовчазних» нейронів. Ці нейрони складають так звану під-порогову зону нервового центра.
Підпорогова зона збільшується при посиленні аферентного подразнення набагато швидше, ніж зона розряду. Причому при будь-якій інтенсивності подразнення підпорогового збудження нейронів завжди більше, ніж тих, що розряджаються, тобто відповідають імпульсною активністю (співвідношення приблизно 80:20).
Як у світлі цих даних уявити собі тонус нервових центрів? Очевидно, що тонус центрів визначається співвідношенням нейронів, які «мовчать», і нейронів, які розряджаються, тобто нейронів підпорогової зони і зони розряду. Якщо схематично зобразити нервовий центр, який складається з 50 нейронів, то тонус такого центра набагато вищий тоді, коли імпульсна активність спостерігається у 25 нейронах із 50 (мал. 39, Л), ніж тоді, коли подразнюються лише 10 клітин (мал. 39,5).
Можна допустити, що чим вища тонічна активність центра, тобто чим більше нейронів генерує потенціали дії в даний момент, тим менші можливості центра розвивати рефлекторну діяльність
у відповідь на додаткові подразнення. Центр зліва перебуває у стані вищого тонусу, але в нього лише половина нейронів може «включитися» у відповідь на будь-які додаткові стимули. Центр справа має нижчу тонічну активність, але в нього більше резервів для «включення» в рефлекторні реакції. Справді, центри з постійним тонусом (наприклад, ядро блукаючого нерва) мають тим меншу рефлекторну збудливість, чим вища їх тонічна активність.
Нервові центри легко стомлюються. Це проявляється поступовим зниженням і навіть повним припиненням імпульсних розрядів при тривалому подразненні аферентних волокон. У той же час подразнення еферентного нерва (наприклад, м’язового) ще продовжує викликати скорочення м’яза. Якщо врахувати, що нерв практично не стомлюється (див. с. 21), то втома, яка розвивається, насамперед локалізується в нервовому центрі. Втома центрів пов’язана головним чином із різким порушенням синаптичної передачі (зменшення запасів і синтезу медіатора, зниження чутливості до медіатора постсинаптичної мембрани, зменшення енергетичних резервів нервової клітини тощо).
Чутливість нервових центрів до гіпоксії. Функції нервових центрів залежать від постачання їх киснем. Потребуючи велику кількість кисню (мозок людини споживає приблизно 40—50 мл кисню за 1 хв, тобто 1/6—1/8 частину кисню, потрібного організму в стані спокою), нервові клітини, особливо вищих відділів ЦНС, дуже чутливі до його нестачі (гіпоксії). Повне або часткове припинення кровообігу мозку веде до тяжких порушень його діяльності і до загибелі нервових клітин. Навіть короткочасне різке падіння кров’яного тиску в мозку викликає у людини негайну втрату свідомості. Клітини кіркової речовини великого мозку підлягають необоротним змінам і гинуть уже через 5—6 хв після повного припинення кровообігу, при температурі 37 °С функції клітин стовбура головного мозку та спинного мозку порушуються відповідно через 15 і ЗО хв.
Нервові клітини і синапси володіють вибірковою чутливістю до деяких отрут, зокрема до стрихніну, морфіну, алкоголю, наркотичних речовин (ефір, хлороформ, барбітурати) та ін. їх вивченням займається нейрофармакологія.
ПРИНЦИПИ КООРДИНАЦІЇ РЕФЛЕКСІВ
Взаємодія нейронів і нервових процесів (збудження і гальмування) у ЦНС, яка забезпечує її узгоджену діяльність, носить назву координації (узгодження).
Завдяки координації можливе точне виконання в даний момент різних складних рефлекторних актів, до яких належать рухові, секреторні, судинні та інші компоненти. Координація відбувається у всіх відділах ЦНС, у будь-якому нервовому центрі.
Мал. 40. Схема нейроиних механізмів реципрокної іннервації:
1 — мотонейрон м’яза-згинача; 2 — мотоней-рон м’яза-розгннача; 3 — гальмівний інтерней-рон. Знаком <4-> позначено збудження мото-нейрона, знаком «—» — гальмування
Основні принципи координації рефлексів: реципрокна (поєднана) іннервація; загальний кінцевий шлях; принципи зворотного зв’язку і домінанти. В координації рефлексів беруть участь також процеси іррадіації збудження, конвергенції і дивергенції, явища полегшення і оклюзії.
Реципрокна іннервація. В основі цього явища лежить уявлення про те, що збудження центра однієї групи м’язів (наприклад, мо-тонейронного «пулу» м’язів-згиначів) супроводжується на цьому боці реципрокним (поєднаним) гальмуванням центрів м’язів-анта-гоністів (розгиначів). Одночасно на протилежному боці (в симетричних кінцівках) збуджуються центри розгиначів і гальмуються мотонейрони м’язів-згиначів (мал. 40). Ясна річ, лише за цієї умови можливий точний рух згинання чи розгинання. Реципрокні взаємовідносини між групами мотонейронів і вставних нейронів лежать в основі так званих ритмічних рефлексів, які характеризуються правильним чергуванням протилежних за своїм функціональним значенням м’язових скорочень, наприклад-згинання і розгинання. Прикладом таких ритмічних рефлексів у ссавців можуть бути рефлекси чухання та кроковий, які виникають загалом при подразненні рецепторних полів довгим і слабшим подразненням.
Механізм реципрокних взаємовідносин полягає в тому, що аферентні нервові волокна (наприклад, групи Аа від м’язових веретен) дають у спинному мозку розгалуження. Одні з гілок утворюють збуджувальні синапси на мотонейронах м’язів-згиначів, а інші за допомогою вставних нейронів — гальмівні синапси на мотонейронах м’язів-розгиначів. Тому подразнення аферентного нерва викликає одночасне збудження мотонейронів м’язів-згиначів і гальмування мотонейронів м’язів-розгиначів. Реципрокне гальмування має найкоротшу рефлекторну дугу серед відомих.
Проте було б помилкою вважати, що між центрами існують назавжди фіксовані антагоністичні відносини. Вони мають динамічний характер, можуть визначатися різними умовами. Немає також підстав обмежувати реципрокні відносини ділянкою іннервації анатомічних анастомозів. У такі ж реципрокні відносини можуть вступати й інші, відокремлені один від одного центри, коли вони регулюють певні стани якого-небудь органа або системи.
Подібні реципрокні взаємовідносини спостерігаються між центрами вдиху і видиху, голоду і насичення, дихання і ковтання тощо. Однак реципрокні відносини між різними центрами не є постійними, вони можуть змінюватися (припинятися) під впливом кіркової і підкіркових структур великого мозку.
Принцип загального кінцевого шляху. СЬ. 8. ЗЬеггіп^іоп (1906) увів-поняття про мотонейрон як загальний кінцевий шлях рухової системи, тобто шлях, яким здійснюється переробка й інтегрування всіх численних і різнорідних збуджень, що одночасно надходять до нього, в єдине (аксонне) збудження, яке йде до ефектора (м’яза). Структурною основою загального кінцевого шляху є значне перевищення в більшості нейронів ЦНС кількості аферентних «входів» над еферентним «виходом»—наявність своєрідної «лійки», розширена частина якої символізує кількість аферентних волокон, розгалуження яких конвертуються на мо-тонейроні, а звужена частина — загальний кінцевий шлях, яким є аксон мотонейрона (мал. 41).
Позаяк нейрон інтегрує як збуджувальні, так і гальмівні про- цеси, ПД виникає лише в тому разі, коли переважають збуджувальні явища, тобто коли ЗПСП у ділянці аксонного горбика внаслідок сумації досягає критичного рівня. Інакше кажучи, ці впливи конкурують за оволодіння загальним кінцевим шляхом. Результат цієї «боротьби» за загальний кінцевий шлях залежить від сили діючих подразнень, їх біологічного значення в даній ситуації, від стану нервових центрів, особливо домінантного. Рефлекси, дуги яких мають загальний кінцевий шлях, можуть взаємно підсилюватися (у разі так званих союзних рефлексів) або послаблюватися (у разі антагоністичних рефлексів).
Принцип домінанти. Відомий російський фізіолог О. О. Ухтом-ський (1875—1942) сформулював принцип домінанти, який є одним з основних принципів діяльності ЦНС;
Домінанта (від лат. ботіпаге — панувати) — це панівні в ЦНС осередки збудження, які змінюють і «підпорядковують» собі в даний момент діяльність інших центрів.
Домінанта формується під впливом різноманітних адекватних стимулів зовнішнього і внутрішнього середовищ організму (виснаження поживних речовин, нагромадження в крові статевих гор
монів тощо). Всі ці стимули підвищують збудливість відповідних нервових центрів (харчового, статевого тощо). За рахунок сумації зі сторонніми (індиферентними) стимулами різної модальності в даному центрі формується стійке й тривале збудження, поєднане з гальмуванням інших, пов’язаних з ним, центрів. Так виникають харчова, статева, оборонна та інші домінанти, які значною мірою визначають здійснення саме даного рефлексу, поведінку людини і тварин у даний момент.
Чи можна будь-який осередок збудження, що виникло в ЦНС, розглядати як домінантний? Які характерні риси домінанти? Домінантний осередок збудження (будь-який центр) характеризується такими властивостями: 1) підвищення збудливості; 2) стійкість збудження; 3) здатність до сумації збудження (накопичувати збудження за рахунок сторонніх подразнень); 4) здатність гальмувати інші нервові центри і системи рефлексів; 5) здатність тривалий час утримувати збудження по закінченню подразнення, яке його зумовило (іннерція домінанти).
Прикладами домінанти можуть бути наступні спостереження. Подразнення у тварин деяких ділянок кіркової речовини великого мозку, яке звичайно супроводжується згинанням кінцівок, під час акту дефекації або сечовипускання такої реакції не спричиняє. Навпаки, відбувається посилення цих рефлекторних актів. Це зумовлюється тим, що в даний момент центри дефекації або сечовипускання перебувають у стані домінантного збудження, який «притягує» до себе сторонні збудження і виявляє поєднане гальмування інших нервових центрів.
Домінантний стан може виникати і під впливом гормонів, які підвищують збудливість відповідних центрів. Наприклад, у жаб-самців у весняний період відчутно посилюється статевий (охоп-лювальний) рефлекс під впливом сторонніх (для статевого центра) подразнень (наприклад, при щипанні лапки). У той же час не виникає захисного згинального рефлексу цієї кінцівки.
Явища, які нагадують домінанту, доводиться спостерігати і в клінічній практиці, коли джерела збудження, які виникли в ЦНС, подібно до магніту, «притягують» до себе різноманітні сторонні подразнення, посилюючись за їх рахунок. Так, при виразковій хворобі шлунка та дванадцятипалої кишки в стадії домінантного збудження перебуває харчовий центр, при гіпертонічній хворобі — судиноруховий, внаслідок чого різноманітні збудження (особливо емоційні) призводять до підвищення шлункової секреції або рівня системного кров’яного тиску. Після травми нервових стовбурів нерідко в стані домінантного збудження перебувають центри больової чутливості в таламокортикальних структурах мозку, внаслідок чого посилюється біль у пораненій кінцівці (каузалгія) при різних сторонніх подразненнях (сильному свербінні, доторкуванні до будь-якої частини тіла тощо).
Мал. 42. Схема полегшення (Д) і оклюзії (£) у нервовому центрі.
Білі кружальця — незбуджені нейрони, чорні — нейрони, що розряджаються, кружальця з хрестиками — нейрони в стані підпорогового збудження, заштриховані кружальця — нейрони, які генерують ПД при одночасному подразненні двох аферентів (а, б). Показано лише аферентні «входи» центра, еферентний «вихід» не показано. Пояснення у тексті
Припинятись домінанта може різними шляхами: 1) унаслідок усунення подразнення або задоволення потреб (біологічної, соціальної), на підставі яких сформувалась домінанта; 2) при виникненні в ЦНС сильнішої домінанти, що гальмує ту, яка є; 3) внаслідок розвитку в домінантному центрі вторинного гальмування.
Завдяки домінанті в ЦНС створюються не стабільні, а динамічні координаційні відносини між нервовими центрами і системами рефлексів. Домінанта відіграє важливу роль у психічній діяльності людини і тварин, значною мірою визначає поведінкові акти в певний момент.
Полегшення рефлексів. Якщо подразнення двох рецепторних полів настільки слабке, що кожне з них (хоч і збуджує еферентні волокна) все-таки не викликає розряд нейронів і рефлекторну відповідь, то при одночасному їх подразненні може виникнути чітка рефлекторна реакція, яка перевищить за інтенсивністю відповіді на кожний з окремих подразників. Це явище отримало назву полегшення рефлексів (мал. 42, Л). У його основі лежить сумація ЗПСП, яка відбувається в нейронах підпорогової зони нервового центра і спричиняє виникнення в них ПД.
Оклюзія рефлексі). При одночасному сильному подразненні двох аферентів рефлекторна відповідь може бути значно меншою, ніж сума таких відповідей на кожне з подразнень, або однаковою з нею. Це явище зменшення відповіді отримало назву оклюзії (закупорювання) і нічого спільного з гальмуванням не має. В основі цього явища лежить спільність (перекриття) зон розряду двох або кількох аферентних входів нервового центра. Так, при подразненні джерела А розраджуються 11 нейронів, а при подразненні джерела Б — 9 нейронів, 5 з яких уже втягнулися в імпульсну реакцію при подразненні джерела А (мал. 42, Б). Тому загаль
не число нейронів, які розряджуються, буде при одночасному подразненні двох аферентних входів меншим від арифметичної суми нейронів, які генерують ПД на кожне з подразнень окремо. Так, нанесення подразнень на два джерела (А і Б) спричиняє імпульсну реакцію тільки у 16 нейронів, а не у 20, як це повинно бути при простій сумації активності нейронів, що розряджаються на кожне з подразнень (А або Б).
Принцип зворотного зв’язку. Вивченням ролі «зворотного зв’язку» або «зворотної аферентації» у механізмах координації рефлекторної діяльності займались П. К. Анохін (1945), Н. О. Берн-штейн (1966), Сії. 8. СЬеггіп£іоп (1906).
Суть принципу зворотного зв’язку полягає в тому, що при здійсненні будь-якого рефлекторного акту процес не обмежується робочим ефектом (наприклад, м’язовим рухом), а супроводжується збудженням рецепторів робочого органа (м’яза тощо), від яких інформація про наслідки дії надходить аферентними провідниками в ЦНС. Там вона співставляється, порівнюється із запрограмованим, очікуваним результатом. Тому аферентні сигнали, які надходять у ЦНС від рецепторів виконавчих органів, що належать до тієї чи тієї рефлекторної дуги, отримали назву зворотної, або вторинної, аферентації (на відміну від тих сигналів, які первинно'викликали рефлекторний акт).
Роль зворотної аферентації в механізмах координації дуже велика. Завдяки зворотному зв’язку інтенсивність і послідовність включення різних груп нейронів стають суворо узгодженими, координованими з результатом дії (м’язовий рух, зміна рівня кров’яного тиску, виділення секрету тощо), тобто здійснюється контроль за ефективністю реакції. Тим самим створюється можливість для внесення поправок, корекції здійснення рефлекторного акту. Тому не дивно, що при ушкодженні м’язової чутливості рухи, особливо при ходьбі, стають неточними, некоординованими, поривчастими. Це відбувається внаслідок втрати контролю над рухами з боку ЦНС, що зумовлено ушкодженням каналів зворотної аферентації.
НАДІЙНІСТЬ МОЗКУ.
КОМПЕНСАТОРНІ ПРИСТОСУВАННЯ
Мозок функціонує безперебійно протягом багатьох років. Нерідко він ушкоджується (травма, крововиливи, інфекційний процес). Але і в цих надзвичайних умовах мозок забезпечує життєдіяльність організму, а через деякий час — повне або часткове відновлення (компенсацію) порушених функцій. Компенсаторні можливості ЦНС, особливо вищих її відділів, надзвичайні.
Які ж механізми забезпечують надійність роботи мозку, ком
пенсацію його функцій, біологічний захист ЦНС від шкідливих впливів?
До основних принципів надійності роботи ЦНС належать: 1) захисно-компенсаторна функція гальмування, використання кожного випадку переходу нервових клітин у гальмівний стан для «профілактичного ремонту», відновлення їх працездатності; 2) поєднання високої спеціалізації нервових центрів з їх пластичністю, здатність до динамічної'перебудови своїх функцій, заміщення пошкоджених або зруйнованих структур, надлишковість функціональних одиниць (нейронів), наявність резервних елементів, провідних шляхів; 3) поєднання відносної самостійності вищих регуляторних центрів (аж до механізмів саморегуляції органів) з їх постійним підпорядкуванням вищим відділам ЦНС; 4) використання в процесах компенсації порушених функцій ЦНС механізму умовнорефлекторних нервових зв’язків, органом яких у людини і вищих тварин є головним чином кіркова речовина великого мозку (див. с. 159). Як правило, для відновлення функцій мозку після руйнування окремих його ділянок людині потрібно багато місяців або навіть років.
ФУНКЦІЇ РЕТИКУЛЯРНОЇ ФОРМАЦІЇ
Ретикулярна формація стовбура мозку розглядається як один із важливих інтегративних апаратів мозку. До власне інтегративних функцій ретикулярної формації належать: 1) контроль над станами сну і бадьорості; 2) м’язовий (фазний і тонічний) контроль; 3) обробка інформаційних сигналів навколишнього і внутрішнього середовищ організму, які надходять різними каналами.
Ретикулярна формація об’єднує різні ділянки стовбура мозку (ретикулярну формацію довгастого мозку, варолієвого моста та середнього мозку)>. У функціональному відношенні в ретикулярній формації різних відділів мозку є багато спільного, тому доцільно розглядати її як єдину структуру. Ретикулярна формація становить собою дифузне нагромадження клітин різного виду і величини, які розділені багатьма волокнами. Крім цього, в середині ретикулярної формації виділяють близько 40 ядер і під’ядер. Нейрони ретикулярної формації мають широко розгалужені дендрити і довгасті аксони, частина яких ділиться Т-подібно (один відросток спрямований униз, утворюючи ретикулярно-спінальний шлях, а другий — у верхні відділи головного мозку).
У ретикулярній формації сходиться велика кількість аферентних шляхів з інших мозкових структур: з кори великого мозку — колатералями кортико-спінальних (пірамідних) шляхів, з мозочка та інших структур, а також колатеральні волокна, які підходять через стовбур мозку, волокна сенсорних систем (зорові, слухові тощо). Усі вони закінчуються синапсами на нейронах ретикуляр
ної формації. Отже, завдяки такій організації ретикулярна фор-мація пристосована до поєднання впливів з різних структур мозку і здатна впливати на них, тобто виконувати інтегративні функції в діяльності ЦНС, визначаючи значною мірою загальний рівень її активності.
Властивості ретикулярних нейронів. Нейрони ретикулярної формації здатні до стійкої фонової імпульсної активності. Більшість із них постійно генерує розряди частотою 5—10 Гц. Причиною такої постійної фонової активності ретикулярних нейронів є: по-перше, масивна конвергенція різноманітних аферентних впливів (від рецепторів шкірних, м’язових, вісцеральних, ока, вуха та ін.), а тйкож впливів з мозочка, кори великого мозку, вестибулярних ядер та інших мозкових структур на один і той же ретикулярний нейрон. При цьому найчастіше у відповідь на це виникає збудження. По-друге, активність ретикулярного нейрона може бути змінена гуморальними чинниками (адреналін, ацетилхолін, напруга СО2 у крові, гіпоксія та ін.). Ці безперервні імпульси і хімічні речовини, що містяться в крові, підтримують деполяризацію мембран ретикулярних нейронів, їх здатність до стійкої імпульсної активності. У зв’язку з цим ретикулярна формація теж справляє на інші мозкові структури постійний тонічний вплив.
.Характерною особливістю ретикулярної формації є також висока чутливість її нейронів до різних фізіологічно активних речовин. Завдяки цьому діяльність ретикулярних нейронів може бути порівняно легко блокована фармакологічними препаратами, які зв’язуються з циторецепторами мембран цих нейронів. Особливо активними щодо цього є сполуки барбітурової кислоти (барбітурати), аміназин та інші лікарські препарати, які широко застосовуються в медичній практиці.
Характер неспецифічних впливів ретикулярної формації. Ретикулярна формація стовбура мозку бере участь у регуляції вегетативних функцій організму (див. с. 167). Проте ще в 1946 р. американський нейрофізіолог Н. XV. Ме^оип і його співробітники виявили, що ретикулярна формація має безпосереднє відношення до регуляції соматичної рефлекторної діяльності. Було доведено, що ретикулярна формація справляє дифузний неспецифічний, низхідний і висхідний вплив на інші мозкові структури.
Низхідний вплив. При подразненні ретикулярної формації заднього мозку (особливо гігантоклітинного ядра довгастого мозку і ретикулярного ядра моста, де беруть початок ретикуло-спінальні шляхи), виникає гальмування всіх спінальних рухових центрів (згинальних і розгинальних). Це гальмування дуже глибоке і тривале. Такий стан у природних умовах може спостерігатись при глибокому сні.
Поруч із дифузними гальмівними впливами, при подразненні певних ділянок ретикулярної формації виявляється дифузний
Мал. 43. Схема висхідних впливів ретикулярної системи. Висхідна ретикулярна система (/) одержує колатералі від специфічних аферентних шляхів (2). Кор-тико-фугальиі зв’язки до Проксимальних структур стовбура мозку позначено цифрою З
вплив, який полегшує діяльність спі-нальної рухової системи.
Ретикулярна формація відіграє важливу роль у регуляції діяльності м’язових веретен, змінюючи частоту розрядів, які надходять гамма-ефе-рентними волокнами до м’язів. Таким чином модулюється зворотна ім пульсація в них.
Висхідний вплив. Дослідження Н. XV. Ме^оип, С. Могнггі (1949) засвідчили, що подразнення ретикулярної формації (заднього, середнього і проміжного мозку) позначається на діяльності вищих відділів
головного мозку, зокрема кори великого мозку, забезпечуючи перехід її в активний (неспання) стан (мал. 43). Це положення підтверджується даними численних експериментальних досліджень і клінічних спостережень. Так, якщо тварина перебуває в стані сну, то пряме подразнення ретикулярної формації (особливо вароліє-вого моста) через введені в ці структури електроди викликає по-ведінкову реакцію пробудження тварини. При цьому на ЕЕГ виникає характерне зображення — зміна альфа-ритму бета-рит-мом, тобто фіксується реакція десинхронізації, або активізації. Вказана реакція не обмежується певною ділянкою кори великого мозку, а охоплює великі її масиви, тобто носить генералізований характер. При руйнуванні ретикулярної формації або вимиканні її висхідних зв’язків з корою великого мозку тварина впадає в со-ноподібний стан, не реагує на світлові і нюхові подразники, фактично не вступає в контакт із зовнішнім світом. Тобто кінцевий мозок припиняє активно функціонувати.
Таким чином, ретикулярна формація стовбура головного мозку виконує функції висхідної активуючої системи мозку, яка підтримує на високому рівні збудливість нейронів кори великого мозку.
Крім ретикулярної формації стовбура мозку, у висхідну активуючу систему головного мозку входять також неспецифічні ядра таламуса (дим. с. 89), задній гіпоталамус, лімбічні структури. Будучи важливим інтегративним центром, ретикулярна формація, в свою чергу, є частиною більш глобальних інтегративних систем мозку, які включають гіпоталамо-лімбічні і неокортикальні структури. Саме у взаємодії з ними й формується доцільна поведінка, спрямована на пристосування організму до змінних умов зовнішнього і внутрішнього середовищ.
Одним із основних проявів ушкодження ретикулярних структур у людини є втрата свідомості. Вона буває при черепномозкових травмах, порушенні мозкового кровообігу, пухлинах та інфекцій
них процесах у стовбурі мозку. Тривалість стану непритомності залежить від характеру і вираженості порушень функції ретикулярної активізуючої системи і коливається від кількох секунд до багатьох місяців. Дисфункція висхідних ретикулярних впливів проявляється теж втратою бадьорості, постійною патологічною сонливістю або частими приступами засинання (пароксизмальна гіперсомія), неспокійним нічним сном. Спостерігаються також порушення (найчастіше підвищення) м’язового тонусу, різноманітні вегетативні зміни, емоційно-психічні розлади та ін.
МОНОАМІНЕРГІЧНІ СИСТЕМИ МОЗКУ
Останнім часом одержано багато експериментальних даних, які свідчать про те, що моноамінергічні системи мозку відіграють велику роль у здійсненні його інтегративних функцій, у чергуванні сну й бадьорості, в загальній регуляції поведінки людини і тварин. До них належать дофамінергічні, норадренергічні і серотонінер-гічні системи, які беруть початок у ділянці стовбура мозку і ін-нервують практично всі відділи головного мозку (мал. 44). Клітинні тіла норадренергічних нейронів розташовані окремими групами в довгастому мозку і мості, особливо в голубій плямі. Висхідні аксони належать головним чином до складу медіального пучка переднього мозку і іннервують різні структури середнього мозку, таламуса, лімбічної системи, мозочок і нову кору, а також желатинозну субстанцію спинного мозку.
Тіла дофамінергічних нейронів лежать у різних відділах середнього мозку (чорна субстанція та ін.) й іннервують неостріатум, ядра лімбічної системи і нову кору, в основному лобні частки. Дофамінергічні нейрони виявлено також у гіпоталамусі і довгастому мозку.
Тіла серотонінергічних нейронів локалізуються головним чином в ядрах серединного шва заднього мозку і низхідних відділах середнього мозку. Відростки цих нейронів підходять практично до всіх структур проміжного мозку; виявлені вони також у мозочку і спинному мозку.
Норадренергічні нейрони голубої плями гальмують майже всі іннервовані ними утворення ЦНС, беруть участь у регуляції кровообігу в корі великого мозку. їх можна розглядати як центральний відділ симпатичної нервової системи.
Вважають, що моноамінергічні (переважно катехоламінергічні) нейрони відіграють важливу роль в організації емоцій — як позитивних, так і негативних. '
Дослідження останніх років свідчать про участь моноамінергіч-них (особливо дофамінергічних) систем мозку у виникненні деяких психічних захворювань людини (шизофренії, депресії та ін.). Психотропні препарати, які впливають на функції центральних моноамінергічних систем (транквілізатори, антидепресанти, ней-
Мал. 44. Схема центральних моноамінер-гічних систем:
Д — дофамінергічнї; Н — норадренергічні; С — се-ротонінергічні нейрони: І — неокортекс; 2 — лім-<5ічна система; 3 — неостріатум; 4— палеостріа-тгум; 5 — таламус; 6 — гіпоталамус; 7 — медіальний пучок переднього мозку; 8 — середній мозок; 9— міст; 10 — довгастий мозок; 11— спинний мозок.
ролептичні засоби), застосовуються для лікування ряду психічних захворювань. У інтегративній діяльності мозку велику роль відіграє взаємодія нейромедіаторних систем, зокрема модулюючі впливи одних моноамінергічних систем на інші.
ЕЛЕКТРОЕНЦЕФАЛОГРАФІЯ
Генерація в корі великого мозку живих організмів електричних коливань була помічена Р. Кенноном (1875) і В. Я. Данилевським (1876). Можливість реєстрації електричних коливань потенціалу від поверхні голови була доведена вперше в 1925 р. В. В. Правдич-Неминським у дослідах на тваринах і німецьким психіатром Н. Вег£ег (1929) у людей.
У людей електрична активність кори великого мозку відводиться звичайно від шкіри на черепі (мал. 45). Метод реєстрації постійної електричної активності кори великого мозку отримав назву електроен-цефалографії. Для одержання електроенцефалограми (ЕЕГ) можна
застосовувати або біполярний запис від двох активних електродів, розташованих на шкірі голови, або монополярний запис, при яко-
му реєструвальний (активний) електрод фіксують на шкірі голови, а індиферентний — на деякій відстані від нього (наприклад, на мочці вуха). Запис ЕЕГ проводять за допомогою електроенце-фалографів. При аналізі ЕЕГ враховують насамперед частоту, амплітуду, форму, тривалість, характер розподілу її хвиль. Аналіз можна проводити візуально і за допомогою спеціальних електрон-
них аналізаторів (аналогових і цифрових приладів).
Детально описано характеристики ЕЕГ для різних станів кори
Мал. 45. Схема відведень ЕЕГ:
а — монополярна реєстрація; б — біполярна полярам каналів підсилювача
реєстрація. Цифрові позначення відповідають
великого мозку, точно виміряно і проаналізовано коливання по-тенціалів, які її складають. Такі коливання мають ритмічний характер, їх частота коливається від 0,5 до 50 Гц, а амплітуда становить приблизно 50—100 мкВ або більше (мал. 46). У не-сплячої людини в розслабленому стані за відсутності яких-небудь зовнішніх подразників переважають хвилі частотою 8—13 Гц, виражені більшою мірою в потиличних частках кори. Такі хвилі називають альфа-хвилями (або основним ритмом). Це так звана синхронізована ЕЕГ.
Коли людина розплющує очі, альфа-хвилі зникають (так звана блокада альфа-ритму, або реакція десинхронізації) і замість них виникають бета-хвилі, які характеризуються більшою частотою (14—ЗО Гц) і меншою амплітудою. Вони відображають стан активності мозку.
Під час сну ЕЕГ характеризується повільними і великохвильо-вими ритмами: тета-ритм (частота 4—7 Гц) і дельта-ритм (0,5— 3,5 Гц). її амплітуда перевищує 100 мкВ. У нормі в несплячих дорослих людей такі ритми не виявляються. Для дітей і підлітків характерні дещо повільніші і нерегулярні ритми. У них навіть у несплячому стані спостерігаються дельта-ритми.
При вивченні міжпівкулевих різниць ЕЕГ у стані спокою деякі дослідники відзначають більшу вираженість блокади альфа-ритму в лівій півкулі порівняно з правою. Проте при розумовій діяльності міжпівкулева асиметрія за показниками альфа-ритму зменшується.
Походження ЕЕГ. ЕЕГ відображає головним чином постсинап-тичні потенціали нейронів кори великого мозку. Про це свідчать результати одночасної реєстрації ЕЕГ за допомогою поза- і внутрішньоклітинного запису активності кортикальних нейронів. Припускають, що позитивні коливання потенціалів на поверхні кори великого мозку пов’язані із ЗПСП, який виникає в нейронах глибинних шарів кори, або ГПСП у поверхневих її шарах. Негативні
*~Рцтм
/
Б
Мал. 46. Головні ритми ЕЕГ (А) і реакція десинхронізації (Б). Стрілками вказано вмикання та вимикання світла
коливання потенціалів на ЕЕГ зумовлені зворотними процесами в цих шарах. Ритмічна активність кори великого мозку, зокрема альфа-ритм, зумовлена головним чином впливами підкіркових структур, особливо таламуса, в якому виявлено особливі нейрони — «водії ритму» (пейсмекери), котрі через відповідні збудливі і гальмівні зв’язки здатні генерувати і підтримувати ритмічну активність кори великого мозку.
Викликані потенціали. При подразненні різних рецепторів і аферентних шляхів у ЦНС, зокрема в корі великого мозку, виникають коливання електричного потенціалу, які називаються викликаними потенціалами.
Розрізняють первинні і вторинні викликані потенціали. Первинні характеризуються коротким латентним періодом, початковим коливанням, на зміну якому приходить негативна фаза (мал. 47). Ця відповідь є електрофізіологічним показником збудження відповідних аферентних (зорових, слухових, соматосенсор-
І Мал. 47. Електричні реакції кіркової ре-
човини великих півкуль при поодиноких
і периферичних подразненнях. Показано
Л первинні потенціали (відповіді). Калібру-
II вання—1 мс, 100 мкВ
/ | них та *н) зон У КОР* великого моз-
II І І і ку і переважно реєструється у від-
I і і// повідних первинних проекційних її
І у зонах. Наприклад, після подразнен-
і ня рецепторів шкіри, м’язів або
’ внутрішніх органів у первинних со-
Іматосенсорних ділянках кори великого мозку можна зареєструвати коротколатентні позитивно-негативні коливання електричного потенціалу, тобто первинні викликані потенціали.
Вторинні потенціали виникають жг - г і -і ! » / Зі значно більшим латентним періо-
I Г дом, ніж первинні (кілька десятків
І \І мілісекунд), мають складну форму
I і дуже змінюються (зменшуються)
при повторних подразненнях. Ці ре-/Чі акції пов’язані з надходженням
/ 1 аферентних сигналів складнішими
/ 1 неспецифічними висхідними шляха-
1 ми (ретикулярної системи, неспеци-
V фічних ядер таламуса та ін.).
І Реєстрацію первинних виклика-
I них потенціалів широко використо-
I вують для вивчення локалізації
І функцій у корі великого мозку та
У інших відділах головного мозку, ви-
’ явлення зв’язків між різними струк-
турами ЦНС.
Клінічне значення. Запис ЕЕГ — діагностична процедура, яка використовується в неврологічній практиці. Так, при дифузних органічних пошкодженнях головного мозку, черепно-мозкових травмах спостерігаються сповільнені і нерегулярні хвилі. При пухлинах мозку часто виникають місцеві зміни ЕЕГ (у ділянці пухлин). У хворих на епілепсію на ЕЕГ спостерігаються пароксизмальні потенціали, судомні розряди, гострокінцеві хвилі та інші зміни. Запис ЕЕГ широко використовується в хірургічній практиці для контролю глибини наркозу: під час глибокої стадії наркотичного сну на ЕЕГ переважають дельта-хвилі.
При констатації смерті в сумнівних випадках, особливо при
реанімації хворого, часто орієнтуються на зникнення коливань на ЕЕГ («плоска» ЕЕГ). У клінічній практиці також використовують метод реєстрації викликаних потенціалів для одержання об’єктивних даних про характер і динаміку деяких порушень сенсорних функцій.
Наведені дані про загальні закономірності діяльності ЦНС мають не тільки теоретичне значення, але використовуються і в медичній практиці. Так, розкриття механізмів виникнення і проведення ПД — основної форми активної реакції збудливої клітини, хеморецептивних властивостей клітинної мембрани і її іонних каналів, механізму міжклітинної передачі збудження лягло в основу розробки нових методів діагностики і лікування багатьох захворювань у психоневрологічній, кардіологічній та інших галузях клінічної медицини.
Знання медіаторних (адренергічних, холінергічних, серотонін-ергічних та ін.) систем ЦНС дозволило створити нові лікарські препарати — нейротропні засоби, які знайшли широке застосування в клініці при лікуванні нервово-психічних і соматичних захворювань.
Експериментальні дані про фізіологічні властивості нервових центрів використовуються в процесі реанімації і при проведенні найскладніших операцій.
Важливе значення мають дані про захисну і регуляторну функції ГЕ Б: їх використовують при лікуванні деяких захворювань ЦНС і внутрішніх органів уведенням хімічних речовин у шлуночки мозку (наприклад, протиправцевої сироватки в цереброспінальну рідину). Так само виявився ефективним метод лікування туберкульозного менінгіту введенням антибіотиків у шлуночки мозку.
Доведено, що залежно від шляху введення (внутрішньовенне, підшкірне або субокципітальне, тобто минаючи ГЕБ) лікарські препарати здійснюють різноманітний вплив на організм.
Дані, отримані за допомогою вживлених електродів і мікро-електродної техніки, дали змогу створити комплексний метод вивчення функцій мозку людини в нормі і при деяких захворюваннях ЦНС. Наведені в розділі дані про діяльність мозку мають також важливе значення для глибшого розуміння центральних механізмів деяких рухових, вегетативних і емоційно-психічних розладів у людини.
ВІКОВІ ЗМІНИ ФУНКЦІЙ ЦНС
Для функціональної зрілості ЦНС важливе значення мають мієлінізація і диференціація нейрофібрил, дозрівання нервових клітин, синапсів та інших елементів ЦНС.
Спінальні рефлекторні дуги починають формуватись не раніше 8-го тижня періоду внутрішньоутробного розвитку. На цьому етапі
розвитку при подразненні шкіри плода можна спостерігати швидкі рухи рук, тулуба. В цей же період при сильнішому подразненні можна одержати не ізольовану рухову реакцію, а генералізовану. Цей факт свідчить -про те, що навіть на такому ранньому етапі розвитку ЦНС плода існує аналіз подразнення, виникає іррадіація цього подразнення в ЦНС.
На 9—10-му тижні життя плода можна спостерігати рухові реакції при подразненні пропріорецепторів, тобто при розтягненні м’язів і сухожиль. У 11,5 тиж у плода виявляються хапальні реакції, на 14-му тижні починаються ритмічні рухи м’язів, якими після народження здійснюється акт дихання. У плода відзначається підвищений тонус м’язів флексорної групи, внаслідок чого з’являється характерна для плода і новонародженого ортотонічна поза (або флексорна гіпертонія новонароджених). У дітей віком 1 — 2 міс, навпаки, виникає гіпертонус м’язів-розгиначів. Гіпертонус м’язів у перші місяці життя дитини зумовлений функціональною незрілістю смугастого тіла та пірамідної системи. Функціональне дозрівання цих утворень супроводжується зниженням м’язового тонусу до 3—4 міс. У цьому віці розвиваються рухи рук, які потребують складної координації.
До природжених рефлексів новонародженого належить орієнтувальний (повертання голови у бік яскравого світла), автоматичного зорового стеження (дитина стежить за руховим і світловим сигналами). Цей рефлекс з’являється з середини 3-го місяця і приблизно через 1 міс зникає. Встановлення цього рефлексу є достовірною ознакою того, що дитина бачить. У новонароджених добре виражені рухові рефлекторні реакції, які виникають при подразненні вестибулярного апарату. Чітко виражений локальний руховий рефлекс — рефлекс хапання. При подразненні долоні пальці і рука стискаються і хапають предмет. Дитина тримає його так міцно, що не випускає навіть при підніманні її, тобто може витримати масу свого тіла. До 3—6 міс цей рефлекс поступово зникає.
Названі вище рефлекси можна пояснити посиленням флексор-ного тонусу верхніх кінцівок. Типовим для новонародженого рефлексом є підошовний — розгинання пальців стопи, спричинене штриховим подразненням внутрішнього або зовнішнього краю підошви. Цей рефлекс зберігається у малюка до 5 років. Пізніше наявність зазначеного рефлексу є симптомом ушкодження пірамідного шляху.
Крім описаних природжених рефлексів, які з часом змінюють свій характер і зникають, у новонароджених досить добре виражені сухожильні рефлекси (колінний, підколінний), у дітей грудного віку, особливо в другому півріччі, вони підвищені. У новонароджених існує смоктальний рефлекс, який зникає наприкінці першого року.
Довільними рухами новонароджених є так звані масивні: коли дитина не спить, вона постійно здійснює некоординовані рухи руками, ногами, головою, тілом. Ці рухи регулюються переважно стріопалідарною системою. В 1—1,5 міс немовля набуває здатності до рефлекторних тонічних скорочень шийних м’язів. Воно вже може тримати голову у вертикальному положенні, тобто здійснювати першу антигравітаційну реакцію.
З 7 міс дитина починає сидіти, а на 10-му місяці з будь-якого положення може сісти самостійно. Це конче потрібно при переході від горизонтального до вертикального положення. Самостійно вставати більшість дітей починає у 10 міс, а приблизно в рік малюк уже вільно підтримує вертикальну позу, хоча вона ще недосконала (унаслідок того, що верхня частина тулуба важча, центр ваги розташований вище, ніж у дорослої людини). Вертикальна поза регулюється за участю пірамідного і екстрапірамідних шляхів. При цьому відбувається перерозподіл тонусу середніх різних м’язових груп, стабільність вертикальної пози значно зростає до 5—6 років життя, хоча ходити самостійно дитина починає у віці близько року.
В основі фізіологічних механізмів довільних рухів лежать умовнорефлекторні зв’язки, сформовані у даного індивідуума. Особливе значення має вироблення рухових навичок шляхом наслідування людей, що оточують дитину. Істотну роль у формуванні нових рухів відіграє взаємодія рухового і зорового аналізаторів.
У процесі старіння знижується збудливість нейронів, падає частота фонової і спонтанної імпульсної активності, зменшується об’єм інформації, яка передається на периферію. В основі цих процесів лежать нерівномірні зміни проникності Са2+- і К+-каналів мембран. При старінні знижується енергетичний обмін нейрона, падає активність аксоплазматичного току, порушується синаптична передача, зменшується кількість адренергічних, холі-нергічних та ГАМК-рецепторів.
Нервова діяльність визначає не тільки поведінку, психіку, рух, а й регуляцію обміну речовин і функцій, які забезпечують пристосування організму до змін внутрішнього та зовнішнього середовищ. Старіння позначається на процесі гальмування в ЦНС, послаблюється його координуюча роль, змінюється лабільність нервових процесів, знижуються збудливість і диференціювання зовнішніх подразників, падає працездатність нервових клітин. Це обмежує можливості для швидкого перемикання і формування нових психологічних понять. З віком знижується продуктивність розумової діяльності, слабшає пам’ять.
При старінні сповільнюється частота основних ритмів ЕЕГ. Найбільші зміни виникають у діапазоні альфа- і тета-ритму, генераторами якого є гіпокамп, ядра перегородки і окремі структури гіпоталамусу.
Інтегративна діяльність мозку, її пластичність залежать від стану підкіркових утворень. Деградація нейронів базальних гангліїв, порушення біологічних властивостей їх клітинних мембран і відповідно перебігу процесів збудження і гальмування, зміни кількості й властивостей циторецепторів та іонних каналів, кількості й структури синапсів, порушення синтезу і розкладу медіаторів призводять до рухових, вегетативних і емоційних змін старечого організму.
У центральних механізмах регуляторної й інтегративної діяльності мозку велику роль відіграє зворотний потік інформації, який надходить до його вищих відділів через таламус. При старінні розвиваються структурні і функціональні зміни в ядрах таламуса, порушується потік інформації, яка надходить через таламус у вищі відділи мозку, що призводить до виникнення неадекватних реакцій.
Істотних вікових змін зазнають лімбічна система і гіпоталамус, які координують компоненти поведінкових реакцій з біологічними вимогами організму. Порушення в гіпокампі, перегородці, мигдалині і гіпоталамусі спричиняють розрегулювання системи контролю поведінки і гомеостазу організму.
Формування з віком функціональних змін в ядрах стовбура мозку є причиною порушення регуляції пози і руху, зниження м’язової працездатності, вегетативного забезпечення організму, розходження соматичних і вегетативних компонентів реакцій поведінки.
При старінні послаблюється постсинаптичне гальмування в спинному мозку, знижується низхідний контроль над рефлекторними реакціями. Це призводить до зменшення швидкості проведення нервового імпульсу, змін рухової діяльності людини.
Фізіологія сенсорних систем
Інформацію про навколишній світ та про власне тіло ми одержуємо за допомогою органів чуття. Переробка сигналів, які надходять, відбувається за допомогою різних структур нервової системи. Вона перетворює все, що сприймають наші органи чуття, у відчуття та сприйняття, у феномени і зміст усвідомлення. Та частина функцій ЦНС, яка забезпечує сприйняття та обробку подразнень, належить до сенсорних (від лат. зепзиз — почуття, відчуття). .
Сенсорні (за І. П. Павловим,— аналізаторні) системи сприймають та обробляють подразники різної модальності. З давніх-давен виділяти п’ять основних видів відчуття: око — бачить, вухо — чує, шкіра — відчуває, язик — розрізнює смак, ніс забезпечує нюх. Але в той же час кожний із вищеназваних органів чуття
володіє певними властивостями. Наприклад, шкірний аналізатор при зіткненні з предметом здатний розрізнити, теплий він чи холодний, гладенький чи шорсткий, нерухомий чи вібруючий тощо. Треба назвати ще сенсорну систему сприйняття положення тіла і його окремих частин у просторі. Крім того, тепер стало відомим, що існують різноманітні сенсорні системи у внутрішніх органах. Ці системи сприймають тиск, розтягування, хімічне подразнення. Нарешті, потрібно вказати на наявність важливої для людини больової чутливості.
Незважаючи на відмінності подразників, принцип будови і функціонування сприймальних систем однаковий (мал. 48). Починаються вони рецепторами та висхідними, або аферентними, нейронами. Тіла цих нейронів утворюють ядерні скупчення (їх не менше трьох) у різних відділах ЦНС. У корі великого мозку виділяють первинний центр, ЩО сприймає аферентні імпуль-
У//7////////7А
Зовнішній сприй-мольний о£мн
Чутлива клітина
Рефлекторні та
—-------:----4
контрольні функції
Мал. 48. Схема найпростішого аферентного нервового ланцюга (обробка інформації в органах чуття)
си, та один або більше вторинних. На рівні кори великого мозку просторову перевагу одержали найбільш значимі для організму сенсорні системи: зорова, слухова, шкіряна, смакова, нюхова, про-
пріоцептивна.
Сигнали, що надходять до ЦНС, обробляються (аналізуються), внаслідок чого виникає суб’єктивне відображення зовнішнього світу та внутрішнього середовища організму, що служить основою для формування адекватної еферентної відповіді — поведінкова реакція. По відношенню до сенсорних стимулів поведінка складається із сприйняття і реакцій, що включають впізнавання, відчуття, мотивацію, скорочення скелетних м’язів (рух) та зміну функцій внутрішніх органів. У ЦНС інформація, крім аферентних систем, переробляється в інтегративних та еферентних. При цьому для аналізу сигналів, які надходять до ЦНС, залучаються такі ділян
ки, як асоціативні, лімбічна, рухові та вегетативні. Складна і досі мало досліджена їх взаємодія є основою нашої свідомості й поведінки.
У основі суб’єктивного феномену відчуття лежать фізіологічні процеси, які відбуваються в різних відділах нервової системи і об’єктивно реєструються за допомогою приладів. Рецептори сприймають подразнення і перетворюють їх у потоки нервових імпульсів, що посилаються провідними шляхами (нервовими клітинами та їх відростками) до ЦНС. Ці потоки імпульсів на різних рівнях, у кожному із певних нервових центрів видозмінюються під впливом імпульсів, що надходять з інших відділів ЦНС, інших сенсорних систем. Унаслідок цього частина інформації переводиться у відчуття, тобто доходить до кори великого мозку. Однак деяку частину аферентної сигналізації ми зовсім не усвідомлюємо. Це свідчить про те, що до кори великого мозку аферентна інформація не завжди доходить. Але в той же час і неусвідомлена частина аферентації служить для виникнення в багатьох структурах ЦНС викликаних ПД і для підтримання робочого стану мозку та інших ефектів, потрібних для забезпечення життєздатності організму.
Морфофізіологічною основою процесів аналізу аферентних сигналів є загальні властивості і закономірності функції нервових центрів. Нервові волокна, що передають сигнали до центрів головного мозку через ряд синаптичних перемикань, утворюють основу для розходження збудження — дивергенції. У цих нейронних структурах відбувається також конвергенція сигналів від різних рецепторів. Сигнали, що сюди надходять, можуть підсилювати збудження завдяки сумації або, навпаки, гальмувати. Цьому сприяє близькість нервових центрів різних сенсорних систем у відповідних відділах ЦНС.
Крім того, при переробці аферентних імпульсів на різних рівнях ЦНС можуть запускатися відповідні рефлекторні акти. Вони включають як руховий, так і вегетативний компоненти.
Зважаючи на подібну будову аналізаторних систем людини, можна виділити такі основні її принципи: а) багатошаровість, багато рівнів розташування нервових центрів; б) багатоканальність (наявність на кожному рівні нейронів, пов’язаних із різною кількістю нейронів, які лежать нижче або вище); в) наявність сенсорних «лійок» — неоднакової кількості нейронів у сусідніх шарах; г) диференціація по вертикалі і горизонталі, за рахунок чого кожний «поверх» виконує свої функції.
ОСНОВНІ ВЛАСТИВОСТІ СЕНСОРНИХ СИСТЕМ
Кожне відчуття характеризується певною якістю і кількістю. Людина з нормальним зором може сказати, що вона бачить перед собою (наприклад, червону суницю чи чорну ожину). Для зору якість буде виражатися в здатності розрізняти якість та колір, а для слуху — різні тони. Основною кількісною характеристикою відчуттів є їх інтенсивність. Так, для зору це буде ступінь відчуття яскравості, а для слуху — гучності тону.
Вивчення цих характеристик сенсорних систем є не простим завданням. Уперше науково обгрунтував визначення порога кількісного розрізняння подразника Е. Вебер (Е. Н. ХУеЬег, 1834). Він описав залежність між силою подразнення та інтенсивністю відчуття. Його досліди полягали в тому, що на шкіру руки накладався певний вантаж і, якщо цей вантаж дорівнював, наприклад, 100 г, то для відчуття зміни дії вантажу треба було додати 3 г, а при вантажі 200 г треба було додати вже 6 г.
Закон Вебера виражався формулою де І — подразнення, АІ — приріст подразнення, а к — постійна величина.
Г. Фехнер (О. ЕесЬпег) дещо уточнив цю залежність:
8 = а 1о§ /? + Ь,
де 8 — величина відчуття, К — величина подразнення, а та Ь — постійні величини. Таким чином, відповідно до закону Вебера— Фехнера відчуття збільшується пропорційно логарифму сили подразнення. Але ця залежність справедлива лише для подразнень середньої інтенсивності.
Пізніше С. Стівенс (8. 81ерЬепз) дійшов висновку, що співвідношення між силою подразнення та величиною відчуття доцільніше описувати за такою формулою:
8 = а (І —К)х,
де 8 — величина відчуття, І — інтенсивність подразнення, Н — порогова інтенсивність, а — постійна величина, х — показник ступеня, що змінюється залежно від модальності подразника. Не вдаючись детально в характеристику цих понять, наведемо лише зразки нахилу кривої для деяких органів чуття (мал. 49).
дб
Відносно сила Відчуття, або Відносна амплітуда потенціалів
Електричне больоВе Вібрація (50 Гц)
подразнення Синусоїдальний зВук
(1000Гц)
. І
20
10
60 100 об
Відносна сила подразнення
Мал. 49. Зміна кривизни зростання інтенсивності біострумів (суцільна лінія) при дії на сенсорні системи специфічних подразників різної інтенсивності.
Пунктиром позначено суб’єктивні результати вимірювання (за методом XV. б. КеібеІ, 1974)
Біле сВітло
ПРОСТОРОВА ТА ЧАСОВА
РОЗМІРНОСТІ ВІДЧУТТЯ
Переважна більшість сенсорних систем дозволяє оцінювати просторове перебування подразника. Це забезпечується в кожному випадку морфологічними та фізіологічними особливостями конкретної системи, а також життєвим досвідом. Серед просторових перетворень сигналів можна виділити зміну їх масштабу в цілому чи порушення співвідношення різних просторових частин. Для просторового розрізнення двох стимулів треба, щоб між збудженими рецепторами був хоча б один не збуджений елемент. Збудження двох сусідніх рецепторів буде сприйматися як єдине подразнення.
Життєво важливою характеристикою сенсорних стимулів є час. Тривалість стимуляції помітно впливає на силу відчуття. Можна виявити часові пороги впливу стимулів різної тривалості, а для періодичної стимуляції — і частоту злиття. Усі сенсорні системи мають інерційність. Треба деякий час для того, щоб збудження й відчуття розвинулись повністю. І для припинення всіх фізіологічних процесів, викликаних подразником у всіх структурах сенсорної системи, потрібен такий же час. Для часового розрізнення двох подразників важливо, щоб сигнал, викликаний наступним стимулом, не потрапив у рефрактерний період від попереднього подразника, щоб нервові процеси не зливались у часі. Для ока часовий поріг відчуття становить близько 50 мс, для вуха — 180 мс, а для рецепторів дотику він триває близько 1,2 с. Причому для деяких дотикових відчуттів тривалість його періодів розвитку і зникнення різна. Вона послідовно збільшується для відчуття положення за глибиною і змінюється від відчуття тепла до виникнення больового відчуття. Це добре відомо кожній господарці, котра може взяти гарячий чайник з плити й поставити на підставку до виникнення больового відчуття. Хоча, • несучи цей чайник, вона відчуває дотик, положення окремих частин предмета і температуру.
Інерційністю зорового сприйняття користуються кінематографісти: на кіноекрані дія нам здається безперервною, хоча відтворюється з окремих кадрів.
ФІЗІОЛОГІЯ РЕЦЕПТОРІВ
КЛАСИФІКАЦІЯ РЕЦЕПТОРІВ
Рецептори, які містяться в різних внутрішніх органах, називаються інтерорецепторами (вісцерорецепторами), а на зовнішній поверхні тіла — екстерорецепторами. Залежно від природи діючого подразника розрізняють м ех а н о •
рецептори, (сприймають дію при механічному зміщенні чи деформації рецептора), хеморецептори (активізуються різними хімічними сполуками), фоторецептори (сприймають електромагнітне випромінювання в діапазоні хвиль від 400 ДО' 750 нм), терморецептори таін.
Рецептори, які сприймають подразник при безпосередньому контакті з ним, називають контактними, а ті, що не потребують такого контакту,— дистантними.
Структура рецептора залежить від подразника, а також від значення для організму інформації, яка отримується за допомогою конкретної сенсорної системи. Це можуть бути вільні закінчення дендритів чутливих нейронів чи складні структури, які утворюють органи чуття (око, вухо), до яких, крім власне рецептора, належать тканини, які обслуговують їх. Складна морфологічна будова рецептора позначається на його функції: складно організовані рецептори здійснюють точнішу первинну обробку інформації.
ЗАГАЛЬНІ ВЛАСТИВОСТІ РЕЦЕПТОРІВ
Функціональне призначення рецепторів полягає у виявленні і розрізненні подразників з різною модальністю. Оскільки подразники зовнішнього чи внутрішнього середовища мають різноманітну природу, а нервові центри «розуміють лише одну мову», тобто нервовий імпульс (ПД), то до названих вище функцій рецептора належить ще й перетворення різної модальності подразнення в ПД, або кодування.
Незважаючи на велику варіабельність рецепторів, вони володіють багатьма загальними фізіологічними властивостями.
Механізм збудження рецепторів. За механізмом збудження рецептори ділять на первинно- і вторинночутливі. До первинночутливих рецепторів належать нервові закінчення чутливих нейронів шкіриДПід час дії подразника в рецепторі підвищується проникність мембрани для Па+, що призводить до розвитку деполяризації. Ця деполяризація носить назву рецепторного потенціалу (РП) і є місцевим процесом. Йому властиві всі властивості місцевих потенціалів, що виникають у інших збуджуваних тканинах. Однією із основних властивостей РП є сумація, внаслідок якої деполяризація може досягнути критичного рівня і РП переходить у ПД, який проходить потім аферентним нейроном (мал. 50).
гІНа відміну від первинночутливого рецептора у вторинночутли-вому між закінченням чутливого нейрона і подразником містяться спеціальні рецепторні клітин и. (РП виникає у цих клітинах. Поява РП сприяє виділенню медіатора із рецепторної кліти-
Мал. 50. Механізм сумації РП пер-винночутливими рецепторами:
а, Ь, с, (і — при збільшенні тиску, що діє яа рецептор, збільшується і величина РП; е — при досягненні порогового рівня РП переходить в ПД нерва
ни в синаптичну щілину, яка є між рецепторною клітиною і закінченням чутливого нейрона.
Медіатор, що досягає постси-наптичної мембрани, зумовлює її деполяризацію. Спочатку також виникає місцевий потенціал, який називається генераторним (ГП). Тільки потім, вже при сумації, ГП переходить у ПД, який проходить аксоном. Вторинночут-ливими рецепторами є зоровий, слуховий, вестибулярний.
Багато рецепторів мають фонову активність. Вони
постійно посилюють аферентні імпульси в нервові центри. Це дає ЦНС додаткову змогу отримувати інформацію. Якщо зменшується фонова імпульсація від рецепторів, то ЦНС таким шляхом інформується про зміни, які виникають.
Вищевказаними шляхами рецептори перетворюють різну модальність подразника в нервовий імпульс. Так відбувається кодування інформації. В основі кодування лежить подвійний код: або є ПД, або його немає.
Специфічність рецепторів. Найважливішу роль у механізмі кодування грає специфічність рецепторів. У процесі еволюції відбулася диференціація рецепторів — різко підвищилась чутливість їх до конкретного подразника. Особливо високий рівень спеціалізованої чутливості у дистантних рецепторів. «Свій», декватний подразник сприймається рецептором навіть тоді, коли він має дуже низький рівень енергії.
Так, рецептори ока в умовах абсолютної темряви можуть сприймати світло з енергією 1-Ю-17—10-18 Вт, тобто на рівні 1—2 квантів. У рецепторів слуху чутливість менша. У цьому разі поріг повинен майже в 100 разів перевищувати статичні звукові «шуми» інформації. У разі вищої чутливості з’явились би джерела помилок, пов’язані з переміщенням слухових кісточок при ходьбі, бігу тощо, а це утруднило б .орієнтацію в просторі.
У рецепторі зберігається здатність генерувати ПД і при дії інших подразників, але для цього енергія має бути набагато більшою. Так, відчуття світла виникає не тільки при попаданні кванта електромагнітного випромінення, але й при механічному або електричному подразненні ока.
Нарешті, для кодування інформації важливе значення має можливість розрізняти інтенсивність діючого подразника ще на рівні рецептора. Як правило, це робиться шляхом генерації аферентної імпульсації різної частоти. Але на рівні рецепторів цей
канал обмежений. І тоді використовується інший шлях кодування, зокрема просторовий, пов’язаний із подразненням просторово розподілених рецепторів. Декодування при цьому відбувається вже в нервових центрах.
Адаптація рецепторів. Багатьом рецепторам притаманна адаптація, або пристосування, до постійно діючого подразника. Адаптація полягає в зміні чутливості реце ітора. Вона може знижуватися, якщо на рецептор довгий час діє сильний подразник, або підвищуватись під дією слабкого. Наприклад, чутливість до світла знижується при яскравому освітленні, а в темряві, навпаки, підвищується. В основі механізму розвитку адаптації більшості рецепторів лежить зміна проникності мембрани рецепторів для №+ або К+, через що поріг деполяризації переміщується ближче до рівня мембранного потенціалу або далі від нього. Крім того, в адаптації ряду рецепторів беруть участь допоміжні механізми. Так, в око при розширенні чи звуженні зіниці потрапляє відповідно більше чи менше світлових променів.
Процес адаптації може відбуватися швидко, повільно або зовсім не розвиватися. Залежно від цього рецептори діляться на такі, що швидко адаптуються, повільно адаптуються й не адап-. туються зовсім. Процеси адаптації перебувають під ефекторним контролем вищерозташованих відділів ЦНС. Тут можна виділити мінімум два механізми дії: безпосередній вплив на нейрони або опосередкований — через зміну кровопостачання.
У певних умовах існування більшість рецепторів зазнають деякого гальмівного впливу з боку ЦНС.
Таким чином, на рівні рецептора розпочинається первинна обробка інформації, що полягає в розпізнаванні модальності подразника, оцінці його сили, тривалості дії. Ця обробка завершується формуванням ПД, що йдуть з певного частотою до вищерозташованих відділів ЦНС. Введення аферентації в ЦНС від рецепторів здійснюють біполярні нейрони або аналогічні утворення черепних нервів.
СЕНСОРНІ ФУНКЦІЇ
СПИННОГО МОЗКУ
Аксони клітин спинномозкових вузлів встановлюють синаптич-ні зв’язки з нейронами заднього рогу. Сюди надходить аферентація від різних рецепторів, а саме: дотикових рецепторів шкіри, які сприймають різні характеристики подразників, больових рецепторів, хеморецепторів, пропріорецепторів, а також від розташованих у внутрішніх органах різних інтерорецепторів. Більшість цих нейронів на рівні свого сегменту віддають колатералі, які йдуть до мотонейронів передніх рогів, до вставних нейронів. За допомогою останніх вхідна аферентація передається до вище- і нижчерозта-
шованих сегментів — до нейронів вегетативної системи в бічні роги.
Аферентні імпульси, які надходять до спинного мозку, можуть служити початком відповідних рухових (за рахунок синапсів з мотонейрона ми) або вегетативних рефлексів (за рахунок зв’язку з нейронами симпатичного і парасимпатичного відділів).
Крім того, аферентна імпульсація служить основою для формування відповідного відчуття. Для цього нервові імпульси входять через задні корінці в спинний мозок і за допомогою вставних нейронів, а частково й прямо, не перериваючись, піднімаються висхідними шляхами в різні структури головного мозку. Вже на рівні спинного мозку здійснюється контроль за висхідною імпульсацією, завдяки якому далеко не всі імпульси надходять до вищерозташо-ваних центрів. При обробці цієї інформації, як і при формуванні рефлексів спинного мозку, використовуються як відповідні механізми власне спинного мозку, так і еферентні сигнали, які надходять із різних структур головного мозку. На нейронах спинного мозку поряд зі збуджувальними міститься велика кількість гальмівних синапсів. Унаслідок цього тут можуть проявитись явища конвергенції і дивергенції, сумації та оклюзії. Це й обумовлює затухання потоку імпульсів, що надійшли до спинного мозку, або їх передачу до вищележачих відділів ЦНС.
СЕНСОРНІ ФУНКЦІЇ
СТОВБУРА МОЗКУ
Стовбур мозку, з одного боку, є таким же, як і спинний мозок, сегментарним відділом для чутливої імпульсації, яка надходить сюди відповідними черепними нервами. З другого боку, через стовбур мозку проходить висхідна аферентація від спинного мозку, частина якої тут переривається, зумовлюючи накопичення нейронів — ядер. Таким чином, до утворів стовбура мозку надходять імпульси від дотикових рецепторів шкіри тулуба і обличчя, про-пріорецепторів рухового апарату, рецепторів вестибулярного апарата. їх взаємодія дозволяє точно оцінити місце розташування організму і його окремих частин стосовно сил земного тяжіння, а також стан майже усіх утворів моторної системи (м’язів, суглобів). Завдяки широкій мережі контактів, стовбур мозку бере участь у формуванні відповідних моторних рефлексів.
До стовбура мозку надходить зорова і слухова аферентація, яка тут починає аналізуватись. Вона може брати участь як у формуванні багатьох рефлекторних відповідей, так і в їхньому контролі, утворюючи важливу ланку зворотного зв’язку.
Аферентними волокнами V, VII, IX, X пар у стовбур мозку надходить інформація від рецепторів внутрішніх органів грудної і черевної порожнини, порожнини рота, трахеї, гортані, стравоходу.
Ці аферентні рецептори беруть участь у виникненні багатьох рефлекторних реакцій внутрішніх органів у відповідь на різні подразники внутрішнього і зовнішнього середовища, забезпечуючи регуляцію дихання, кровообігу, травлення тощо. Тут різного типу реакції об’єднуються між собою. Наприклад, зміна дихання й кровообігу при виконанні м’язової роботи, зміна кровообігу в різні фази дихального циклу.
Механізм аналізу інформації, яка надходить у стовбур мозку, такий же, як і в спинному мозку. Передусім дуже важлива роль в обробці аферентації в ділянці стовбура відводиться ретикулярній формації. (У зв’язку з тим, що ретикулярна формація стовбура мозку бере участь у регуляції й інших відділів ЦНС, її функції розглянуто окремо).
СЕНСОРНІ ФУНКЦІЇ
ТАЛАМУСА
Одним із важливих утворів ЦНС, які беруть участь у здійсненні сенсорних функцій, є таламус. Він — своєрідний колектор сенсорних шляхів. Сюди надходять майже всі шляхи (виняток складає частина нюхових шляхів). У таламусі нараховують понад 40 ядер, переважна більшість яких отримує аферентацію від різних чутливих шляхів. Між нейронами таламуса існує широка мережа контактів, яка забезпечує як переробку інформації від окремих специфічних сенсорних систем, так і міжсистемну інтеграцію. У таламусі завершується підкіркова обробка висхідних аферентних сигналів. Тут відбувається часткова оцінка її значущості для організму, завдяки чому лише частина інформації звідси відправляється до кори великого мозку. Переважна частина аферентації від внутрішніх органів доходить лише до таламуса. Хоча у неокортексі і є вісцеральна зона, в якій спостерігаються так звані викликані потенціали (ВП) при подразненні будь-якого внутрішнього органу, в ній не зароджується усвідомлене відчуття про стан наших внутрішніх органів. Не завжди надходить до кори великого мозку і аферентація від соми. Завдяки цьому кора великого мозку ніби звільняється від оцінки менш значущої інформації і одержує можливість займатись розв’язанням найістотніших питань організації поведінки людини. В оцінці значущості аферентації, яка надійшла до таламуса, велика роль відводиться інтеграції інформації від різних сенсорних систем, а також тих відділів мозку, котрі відповідають за мотивацію, пам’ять тощо.
Ядерні структури таламуса можна поділити за функціональною ознакою на 4 великі групи.
1. Специфічні ядра перемикання (релейні). Ці ядра отримують аференти від основних сенсорних систем — сома-
тосенсорної, зорової та слухової — і перемикають їх на відповідні зони кори великого мозку.
2. Неспецифічні ядра отримують аференти від усіх органів чуття, а також від ретикулярної формації стовбура мозку та гіпоталамуса. Звідси посилається імпульсація в усі зони кори великого мозку (як до сенсорних відділів, так і до інших його частин), а також до лімбічної системи. Ці утвори таламуса виконують подібні з ретикулярною формацією мозку функції.
3. Ядра з асоціативними функціями (філогенетично наймолодші) отримують аферентацію від ядер власне таламуса і здійснюють вищеназвані специфічні і неспецифічні функції. Після аналізу інформація від цих ядер надходить до тих відділів кори великого мозку, які виконують асоціативні функції. Ці відділи локалізуються у тім’яній, скроневій та лобній частках. У людини вони розвинені більшою мірою, ніж у тварин. Так, таламус бере участь у інтеграції цих ділянок, які часом розташовані одна далеко від одної.
4. Ядра, що зв’язані з моторними зонами кори великого мозку, релейні несенсорні. Отримують аферентацію від мозочка, базальних ядер переднього мозку і передають її до моторних зон кори великого мозку, тобто тим відділам, які беруть участь у формуванні усвідомлених рухів.
У таламусі завдяки взаємодії сенсорних систем гальмується значна частина інформації, яка звідси не надходить до розташованих вище кіркових відділів сенсорних систем (мал. 51). Треба сказати, що зв’язки таламуса з корою великого мозку не є однобічними. Кора великого мозку постачає, низхідні еферентні імпульси різним частинам таламуса. Таким шляхом регулюється обробка інформації, яка надійшла до таламуса. За рахунок сильної гальмівної системи власне таламуса і низхідних впливів кори великого мозку утворюється своєрідний «вільний коридор» для проходження до кори великого мозку лише найважливіших сигналів.
СЕНСОРНІ ФУНКЦІЇ
КОРИ ВЕЛИКОГО МОЗКУ
Відповідні ядра таламуса сполучаються висхідними шляхами з корою великого мозку, де в різних ділянках утворюються центри аналізаторних систем. До кори великого мозку надходять також ті шляхи нюхової системи, які обминають таламус. Сприймання й аналіз нюхової інформації відбуваються в стародавній і старій корі великого мозку, фізіологію яких буде розглянуто пізніше.
Переважна більшість нейронів, які утворюють кору великого мозку, виконує аналітико-синтетичну функцію, яка забезпечує оцінку аферентної інформації і намічає програму цілеспрямованої діяльності. В корі великого мозку виділяють понад 50 полів (за
К- Вгобтапп, 1909). Безпосередньо до цих систем можна зарахувати сенсорні й асоціативні зони. -
1. Сенсорні зони кори. До них адресуються сигнали від релейних ядер таламуса. Розрізняють соматосенсорні, слухову й зорову основні зони. До соматосенсорних належать 81- та 811-зони. Зона 81 розташована на постцентральній звивині, 811 — на верхній спинці бічної борозни, яка ділить тім’яну й скроневу частки (мал. 52). Слухова зона розташована у скроневій частці, зорова — в потиличній.
2. Асоціативні зони. Сюди насамперед
Мал. 51. «Перекручення» розміру соматотопічності у центральній ланці шкірної чутливості
адресуються сигнали від асоціативних ядер
таламуса. Виділяють дві основні асоціативні зони: в ділянці лобної частки перед прецентральною звивиною і на межі між тім’яною, потиличною і скроневою частками (в ділянці тім’яної частки).
У корі великого мозку, особливо в ділянці асоціативних зон,
нейрони розташовані за типом функціональних колонок. Усі шість шарів клітин кори великого мозку, які лежать перпендикулярно до її поверхні, у певних ділянках беруть участь у переробці інформації, яка надходить від периферичних рецепторів. Анатомічну основу (діаметром від 0,2 до 1,0 мм) таких колонок складають тисячі нейронів, у яких виникає ПД при нанесенні по-
дразника на відповідний рецептор. У кожній колонці існує своєрідна ієрархія нейронів, яка грунтується на взаємодії збуджувальних і гальмівних процесів.
Залежно від конкретної сенсорної системи, її значущості для
організму в корі великого мозку зустрічаються різні за ієрархічною складністю нейрони. Прості нейрони за характером імпульсів дуже близькі до зв’язаних з ними рецепторів. У складних нейронах поділ імпульсів у відповідь на периферичні стимули може
Мал. 52. Кіркове представництво шкірної чутливості 81, 811 (Р. Шмідт, Г. Тевс, 1985)
істотно відрізнятися. Наприклад, серед тактильних можна виявити нейрони, які реагують на стимул, котрий рухається в певному напрямку.
У сенсорних зонах кори великого мозку розрізняється й ідентифікується відповідний подразник.
В асоціативні зони кори великого мозку, які найбільш розвинені у людини, адресуються імпульси від різних рецепторів. Завдяки цьому з’являється можливість для більш точної і всебічної оцінки якого-небудь сигналу,
визначення його цінності й біологічної значущості. Тут завершується формування відповідних почуттів, хоча остаточно вони формуються і, що особливо важливо, формуються на підставі даних аналізу сенсорної інформації програм цілеспрямованої поведінки лише при спільній дії сенсорних і асоціативних зон кори великого мозку і ряду підкіркових структур. З функцією асоціативних зон пов’язані процеси навчання і пам’яті. Для виконання повного об’єму усіх цих життєво важливих функцій мобілізуються також лім-бічна система (організація емоцій), вегетативна нервова (регуляція функцій внутрішніх органів, обміну речовин), моторні ділянки кори і підкірки великого мозку (регуляція рухів).
Крім того, кора великого мозку виконує ще одну важливу функцію: шляхом низхідних (еферентних) впливів вона бере участь у регуляції процесу надходження сенсорної інформації, її обробці в усіх відділах ЦНС, які лежать нижче. Унаслідок цього надходження аферентної інформації, починаючи від периферичних рецепторів і аж до таламуса, може або гальмуватися, або ж, навпаки, полегшуватися.
ШКІРНА ЧУТЛИВІСТЬ
МЕХАНОРЕЦЕПТОРИ
У шкірі і зв’язаних з нею структурах розміщуються м е х а -но-, терморецептори і рецептори болю. Вони не зібрані в окремі органи чуттів, а розсіяні по всій шкірі. Густота розташування шкірних рецепторів не скрізь однакова.
Механорецепція (дотик) має ряд властивостей, зокрема відчуття тиску, дотику, вібрації і лоскотання. Гадають, що кожен вид відчуття має свої рецептори. У шкірі вони розташовані на різній глибині і у різних її структурних утворах. Більшість рецепторів є вільними нервовими закінченнями чутливих нервів. Частина їх міститься у різного роду капсулах (мал. 53).
Тільця Мейснера є датчиками швидкості — подразнення сприймається під час руху об’єкту. Розташовані вони у позбавленій волосяного покриву шкірі (на пальцях, долонях, губах, язику, статевих органах, сосках грудей). Швидкість сприймають також вільні нервові закінчення, що лежать навколо волосяних цибулин.
Диски Меркеля сприймають інтенсивність (силу) тиску. Вони є у вкритій волоссям і позбавленій волосяного покриву шкірі.
Тільця Пачіні — рецептори тиску й вібрації. Вони виявлені не тільки у шкірі, але й у сухожиллі, зв’язках, брижі.
Усі названі утвори є закінченням дендритів мієлінових волокон групи Ар, швидкість проведення збудження у яких становить
Мал. 53. Рецептори шкірної чутливості:
а — тільця Руфіні; б — диски Меркеля; в — тільця Мейснера; а —тільця Пачіні; д —луковиця Краузе; е — вільне нервове закінчення-
ЗО—70 м/с. Поряд з ним-и у кожному нерві можна виявити і не-мієлінізовані волокна. У деяких нервах вони становлять близько 50 %• Частина їх передає імпульси від терморецепторів, інші —-реагують на слабкі тактильні стимули, але більшість волокон належить до ноцирецепторів, що сприймають біль. Точність локалізації відчуття у тактильних рецепторах вказаної групи невелика, як і швидкість проведення імпульсів нервами, що відходять. Вони сигналізують про слабкі механічні стимули. Гадають, що тактильні рецептори разом із ноцирецепторами грають значну роль у зародженні відчуття лоскотання.
МЕХАНІЗМИ ВИНИКНЕННЯ
ЗБУДЖЕННЯ
Під впливом механічної сили деформується мембрана рецепторів. При цьому збільшується проникність її для натрію. Внаслідок цього виникає рецепторний потенціал (РП), що має такі самі властивості, як і місцевий. Поширюючись на сусідні ділянки, він призводить до виникнення ПД у суміжнім перехваті Ранв’є. Ці процеси розвиваються в середині капсули. Потенціал, який виникає, поширюється доцентрово.
Серед механорецепторів є такі, які швидко або повільно адап
туються. Здатність їх до адаптації дозволяє людині через певний час після одягання не помічати на собі одягу. Але варто «нагадати» про одяг, як завдяки підвищенню чутливості рецепторів ми знову починаємо його відчувати.
У реальних умовах при дії на шкіру подразника ПД виникає у рецепторах декількох типів. Звідси збудження передається у спинний мозок, а потім через бокові і задні стовпи — до таламуса і кори великого мозку. На кожному із рівнів (спинний мозок, стовбур мозку, таламус, кора великого мозку) аферентна інформація аналізується. При цьому на кожному рівні можливе формування відповідних рефлексів. Для рефлекторної відповіді велике значення має рефлексогенна зона — місце нанесення подразника. Аференти, які входять у спинний мозок задніми корінцями, у кожному сегменті іннервують обмежені ділянки шкіри, що називаються дерматомами. У спинному мозку суміжні дерматоми значно перекриваються внаслідок перерозподілу пучків волокон у периферичних сплетіннях. Тому кожний периферичний нерв містить волокна від кількох задніх корінців, а кожний корінець — від різних нервів (мал. 54).
На рівні спинного мозку аферентні нейрони тісно взаємодіють як з мотонейронами, так і з вегетативними нервами (звичайно, у тих відділах спинного мозку, де вони є). Тому при дії подразника на шкіру можуть виникати рухові або вегетативні рефлекси. Виникнуть вони чи ні, якою мірою будуть вираженими, залежить від конкретних властивостей подразника, а також низхідних імпульсів тих відділів ЦНС, що розташовані вище.
Другий нейрон соматосенсорної аферентації лежить у спинному мозку або у стовбурі мозку. Волокна його доходять до вентро б а з альних ядер таламуса контралате-ральної половини. Тут, як і у спинному мозку, є досить чітко виражене соматотопічне представництво від конкретної ділянки периферії до відповідного відділу таламуса. Від вказаних ядер таламуса імпульси спрямовані до інших ядер таламуса або до соматосенсорних зон кори великого мозку.
У кожній половині великих півкуль мозку є дві соматосенсорні зони: одна у задній центральній звивині (81), друга — у верхньому відділі бокової борозни (811), яка відокремлює тім’яну частку від скроневої.
У 81 представлена проекція протилежного боку тіла з добре вираженою соматотопічністю. Соматотопічність шкіри характерна і для 811, хоча тут вона виражена меншою мірою. Важливо й те, що у 811 є представництво обох половин тіла у кожній півкулі. Соматотопічна карта кори великого мозку значно спотворює периферичні зв’язки: шкіра найважливіших для людини відділів — рук і органів мовлення (на периферії їх рецептори розташовані дуже щільно) — має велику площу.
Мал. 54. Схема сегментарної чутливості шкіри людини.
Літерами та цифрами позначено сегменти, аферентні нерви яких іннервують мета мери тіла (за даними Г. Н. Касіля). Тр — сегменти голови; г — грудні сегменти; п — поперекові сегменти; к — крижові сегменти
Нейрони у соматосенсорній корі згруповані у вигляді вертикальних колонок діаметром 0,2—0,5 мм. Тут можна виявити чітку спеціалізацію, яка виражається у тому, що колонки зв’язані з певним типом рецепторів. Ділянка 51 посилає безліч еферентних аксонів до інших ділянок кори великого мозку. Зв’язок із моторною зоною кори великого мозку забезпечує корекцію рухів за принципом зворотного зв’язку. В соматосенсорних зонах протилежної півкулі здійснюється білатеральна координація. Низхідний вплив на таламус, ядра спинного мозку забезпечують еферентний контроль висхідної імпульсації.
Але найістотнішим є те, що у корі великого мозку відбувається усвідомлення відчуття. Ушкодження її соматосенсорних зон призводить до того, що при дотику до шкіри людина не може точно
дати просторову та іншу характеристику подразника. Крім того, кора великого мозку разом із нижчележачими підкірковими структурами через вищевказані низхідні впливи може брати участь і в усвідомленому контролі всіх висхідних шляхів.
ТЕРМОРЕЦЕПТОРИ
У шкірі розміщені також терморецептори. Крім шкіри, вони є у різних відділах ЦНС. Терморецептори беруть участь у регуляції теплообміну організму. Розрізняють два типи терморецеп-торів — холодові й теплові. До них із деяким застереженням можна зарахувати також терморецептори, які дають відчуття болю при дії дуже низької або дуже високої температури.
Холодові рецептори лежать більш поверхнево у епідермісі і зразу під ним, а теплові — у верхніх і середніх шарах власне шкіри. Терморецепцію здійснюють вільні нервові закінчення. Розрізняють власне теплові рецептори і неспецифічні, що збуджуються під час охолодження і тиску. Площа поля терморецепторів становить близько 1 мм2.
Механізм стимуляції терморецепторів пов’язаний із змінами метаболізму залежно від дії відповідної температури (зміна температури на 10 °С у 2 рази зумовлює зміну швидкості ферментативних реакцій).
Під час тривалої дії температурного подразника терморецептори адаптуються, тобто чутливість у них поступово знижується. Тому, якщо охолодження відбувається повільно, обмороження можна й не помітити.
• Висхідні шляхи від терморецепторів спрямовані у ретикулярну формацію стовбура мозку або у вентроба-зальний комплекс таламуса. З таламуса вони можуть іти в соматосенсорні зони кори великого мозку. (Детально механізм виникнення відчуття холоду або тепла описаний на с. 435).
ПРОПРІОРЕЦЕПТОРИ
До сприйняття стану окремих частин тіла причетні й пропріо-рецептори — м’язові веретена, сухожильні органи і суглобні рецептори. За допомогою їх без участі зору можна досить точно визначити положення окремих частин тіла у просторі.
Пропріорецептори беруть участь в усвідомленні напрямку й швидкості руху кінцівок. За функцією вони нагадують рецептори вестибулярного аналізатора.
Поряд із механо- і терморецепторами шкіри, пропріорецептори дозволяють правильно оцінити не тільки положення окремих частин тіла, а й побудувати тривимірний відчуттєвий світ. Головним
джерелом інформації при цьому служить рука, якщо вона рухається, дотикаючись до предмета і обмацуючи його. Наприклад, як можна без руху і обмацування виявити такі якості, як рідкий, клейкий, твердий, еластичний, гладенький тощо?
У зв’язку з великим значенням пропріорецепції для регуляції руху детальна характеристика фізіології пропріорецепторів наведена на с. 142.
ВІДЧУТТЯ РІВНОВАГИ (ФІЗІОЛОГІЯ ВЕСТИБУЛЯРНОГО АНАЛІЗАТОРА)
Вестибулярний орган є однією із частин перетинчастого лабіринту внутрішнього вуха. Перетинчастий лабіринт заповнений ендолімфою, а занурений у перилімфу. Ендолімфа має вищу компактність: в’язкість її у 2—3 рази більша, ніж води. Вестибулярний орган складається із ст атолі тового апарата, утвореного маточкою і мішечком, і трьох напівкружних к а н а -л і в. Він виник для сприйняття складного впливу сил земного тяжіння.
Вестибулярний рецептор має складну будову. Рецептори його належать до вторинночутливих. У них перед чутливими нейронами містяться спеціальні рецепторні клітини. Рецепторний потенціал виникає у цих клітинах. На аферентний нейрон збудження передається за допомогою медіатора ацетилхоліна, який виділяється із рецепторної клітини. Причому до рецепторної клітини підходить і аферентне волокно, за допомогою якого регулюється функціональний стан клітини, а отже, її чутливість.
Рецепторні клітини війчастого типу (мал. 55) вестибулярного органа згруповані у трьох ампулах напівкружнцх каналів і макулі мішечка. Кожна клітина має одну довгу волосину— к і н о ц и л і й та 50—60 коротших — стереоцилії. Природним стимулом рецепторної клітини є зсув пучка війок у бік кіноцилії волосини. Внаслідок цього в клітині підвищується проникність мембрани для Иа+, що призводить до виникнення РП. У відповідь на його появу в синапсі, що міститься між клітиною і аферентним волокном, виділяється медіатор, під впливом якого у постсинаптичній мембрані, котра належить аферентному волокну, з’являється
Мал. 55. Будова вестибулярного апарата (А. Оевророиіоз, 51. ЗіІЬекпа^І, 1986): 1 — півкружні канали; 2 — гребінець; 3 — кі-нецілії; 4 — купула; 5 — мішечок; 6 — маточка; 7 — макула; 8 — отоліти; 9 — нервове закінчення біполярної клітини
генераторний потенціал (ГП). При сумації ГП переходить у ПД. Треба враховувати, що і у звичайних умовах від рецепторних клітин вестибулярного аналізатора з визначеною частотою постійно відводяться ПД. Але під час нахилу війок у бік довгої волосини частота ПД збільшується, а у протилежний бік — зменшується.
СТАТОЛІТОВИЙ АПАРАТ
Механізм зародження РП у обох типів рецепторів вестибулярного апарата дещо відрізняється. Так, у мішечку і маточці війки входять у структуру отолітової мембрани, що містить кришталики кальцію (див. мал. 55). Тому питома вага отолітової мембрани вдвічі вища, ніж ендолімфи, яка через більшу інертність забезпечує виникнення збудження під час руху. Ці рецептори
Система
Мал. 56. Рефлекси, що реалізуються за участю вестибулярного апарата:
1 — рефлекс згинаиня-розгинания; 2 — рефлекс підтримки балансу; 3 — вестибулярне порушення, яке призводить до втрати цих рефлексів т% перекйдання (за даними Н. Н. КогпЬиЬег, 1974)
збуджуються при зміні швидкості прямолінійного руху людини.
Сила інерції, яка виникає при лінійних прискореннях під час рухів «угору — вниз», «вперед — назад», діє на ендолімфу і отолітову мембрану по-різному. Важча, отже, й інерційніша мембрана відстає від ендолімфи на початку руху і пізніше зупиняється у разі гальмування. Тому саме у ці моменти і створюються умови для виникнення збудження.
Отолітова мембрана маточки розташована' вертикально, а мішечка — горизонтально. У зв’язку з цим початок і закінчення горизонтальних рухів сприймаються рецепторами маточки, а вертикальних — мішечка. Нахил голови також супроводжується «зіско-куванням» мембрани або згинанням волосинок і підсиленням деполяризації у відповідному відділі. Таким чином, при будь-якому положенні голови кожна із отолітових мембран, займаючи відповідне положення відносно своїх рецепторних клітин, створює умови для контролю за положенням голови.
НАПІВКРУЖНІ КАНАЛИ
Звичним стимулом для рецепторів напівкружних каналів є кутове прискорення. Тут війки рецепторних клітин у кожному каналі згруповані в сгізіае агпріїагіз, а їх війки містяться у желатинозній масі — купулі. Війки омиваються ендолімфою, питома маса якої майже така, як і желатинозної. Перепончастий лабіринт кожного каналу завдяки наявності загальної частини утворює замкнуте, але не ідеальне коло. Тіло рецепторної клітини і війки при обертальному русі голови перебувають у різних умовах. Позаяк рідина (ендолімфа) на початку руху залишається ще деякий час нерухомою стосовно твердого матриксу, а зупиняється пізніше, рух війок більшою мірою залежить від руху лімфи, ніж рух власне клітин, які міцно сполучаються з матриксом. Подразнення у цих рецепторах виникає на початку і наприкінці обертальних рухів голови. У разі рівномірної швидкості обертання тіло клітини і її війки рухаються разом, і в цей час подразнення рецепторів відсутнє. Зміна фонової імпульсації вестибулярного нерва відзначається протягом 15—20 хв після початку обертання, а закінчується через 15—20 хв після зупинки. Хоча сили, які зумовлюють реакцію купули, зв’язані з кутовим прискоренням, правильніше буде говорити, що природним стимулом рецепторних клітин є моментальна кутова швидкість. Напівкружні канали лежать у трьох площинах (хоча горизонтальний канал дещо піднятий— приблизно на 30°), і рецептори кожного з них сприймають зміну напрямку руху у відповідній площині.
ЦЕНТРАЛЬНІ ВІДДІЛИ
ВЕСТИБУЛЯРНОГО АНАЛІЗАТОРА
Центри вестибулярних нервів розташовані в ядрах стовбура мозку. Деякі волокна вестибулярних нервів ідуть до різних утворів мозочка. Нервові волокна вестибулярних ядер контактують з багатьма відділами ЦНС: з а- і у-мотонейронами м’язів-розгина-чів, ядрами окорухового нерва, мозочка, ретикулярної формації, з таламусом та гіпоталамусом. Унаслідок цього при інтенсивному подразненні рецепторів вестибулярного аналізатора виникають не тільки відповідні моторні рефлекси, ай ністагм очей, вегетативні розлади (зміна частоти серцевих скорочень, звуження судин шкіри, посилене потовиділення, нудота тощо), що характерно для так званої морської хвороби (мал. 56).
Внаслідок контакту нейронів вестибулярного нерва з руховими центрами стовбура мозку, мозочка зароджується багато моторних рефлексів, спрямованих на • підтримку пози. Проте самі собою аферентні імпульси від вестибулярних рецепторів не можуть дати точного уявлення про положення тіла у просторі, оскільки кут повороту голови через рухомість у шийному зчленуванні не завжди відповідає положенню корпуса. Тому при зародженні моторних рефлексів у центрах стовбура мозку (поряд із рецепцією вестибулярних нервів) використовується аферентація шийних пропріоре-цепторів, які інформують про положення голови (детальніше див. с. 144).
Імпульси від вестибулярного апарата надходять до таламуса, а звідти до постцентральної звивини кори великого мозку, де аналізується інформація, яка надійшла, і усвідомлюється орієнтація в просторі.
ФІЗІОЛОГІЯ СЛУХОВОЇ
СЕНСОРНОЇ СИСТЕМИ
Для людини другою після зорової за значенням і об’ємом Інформації, одержуваної із навколишнього середовища, є сенсорна слухова система. Для сприйняття слухової сигналізації сформувався ще складніший, ніж вестибулярний, рецепторний орган. Формувався він поряд із вестибулярним апаратом. У їх будові е багато схожих структур. Кістковий і перетинчастий спіральні канали утворюють у людини 2,5 витка.
Рецептори слухового аналізатора належать до вторинно-чутливих. Рецепторні волоскові клітини містяться в завитку внутрішнього вуха на середніх сходах основної мембрани, яка •складається з 20 000—30 000 волокон (мал. 57). Довжина волокон дорівнює ширині відповідної частини каналу: від основи діаметр каналу збільшується до її вершини від 0,04 до 0,5 мм.
Мал. 57. Периферичний відділ слухової сенсорної системи (А. Певророиіов, 81. ЗіІЬегпа^і, 1986)
Рецепторні клітини утворюють кортієв орган. Внутрішні рецепторні клітини кортієвого органу розташовані в один ряд, а зовнішні — в 3—4 ряди. На частині клітини, оберненої в бік текто-ріальної мембрани, біля внутрішніх рецепторних клітин міститься ЗО—40 відносно коротких (завдовжки 4—5 мкм) волосинок. На кожній клітині зовнішнього ряду є 65—120 тонких та довгих волосин. Між окремими рецепторними клітинами немає функціональної рівності. Про це свідчить і морфологічна характеристика: порівняно невелика кількість (близько 3500) внутрішніх клітин дає 90% аферентів кохлеарного нерва, у той час як від 12 000— 20 000 зовнішніх клітин відходить лише 10% нейронів. Утвір спірального (кортієвого) органа завершує текторіальна мембрана, яка розташована над волосковими клітинами.
Простір середньої драбини заповнено ендолімфою. Над вестибулярною і під основною мембранами простір відповідних каналів заповнено перилімфою. Ендолімфа відрізняється від перилімфи насамперед тим, що в ній міститься в 100 разів більше К+ і в 10 разів менше Ца+. Ці та інші відмінності ендолімфи є наслідком активної функції епітелію судинної смужки, яка міститься на боковій стінці середньої драбини. Зниження активності цих клітин призводить до погіршення слуху.
МЕХАНІЗМ ПЕРЕДАВАННЯ
ЗВУКОВИХ КОЛИВАНЬ
Перш ніж звукові коливання досягнуть внутрішнього вуха, вони проходять через зовнішнє і середнє. Зовнішнє вухо служить головним чином для сприйняття звукових коливань, підтримання вологості й температури біля барабанної перетинки на постійному рівні.
За барабанною перетинкою починається порожнина середнього вуха, яка закрита з іншого кінця мембраною з овальним отвором. Заповнена повітрям порожнина середнього вуха сполучається з порожниною носової частини глотки через євста-хієву трубу, яка служить для вирівнювання тиску з обох боків барабанної перетинки. Барабанна перетинка, сприймаючи звукові коливання, передає їх на систему кісточок, розташованих у середньому вусі (молоточок, ковадло, стремінце). Через них коливання передаються на мембрану овального отвору. Система кісточок посилює коливання звукової хвилі, але знижує її амплітуду. Це пояснюється тим, що коливання спочатку передаються довшому плечу важеля, утвореному рукояткою молоточка і відростком ковадла. Цьому ефекту сприяє й різниця площ стремінця (близько 3,2-10-6 м2) та барабанної перетинки (7,0-10-5 м2). Вже тільки через це тиск звукової хвилі на мембрану біля овального отвору посилюється у 22 рази (70:3,2). Цим пояснюється надзвичайно висока чутливість слухового аналізатора: звук сприймається вже тоді, коли тиск на барабанну перетинку перевищує 0,0001 мг/см2. При цьому мембрана завитка переміщується на відстань, яка менша від діаметра атома водню.
У порожнині середнього вуха є два м’язи (ш. іепзог іутрапі, т. зіаребіиз). Впливаючи на натяг барабанної перетинки, вони обмежують рух стремінця й тим самим беруть участь у адаптації слухового рецептора до інтенсивності звуку. Рефлекторна реакція м’язів проявляється через 10 мс після початку дії сильного (ЗО— 40 дБ) звуку. В ряді випадків повітряна хвиля, яка виникає, досить потужна, що може призвести до ушкодження барабанної перетинки. Та й власне звук може зумовити небажані наслідки для ЦНС. Тому для запобігання названим ускладненням зменшується її натяг. Унаслідок цього, з одного боку, зменшується можливість травматичного розриву барабанної перетинки, а з іншого — знижується інтенсивність коливань кісточок і розташованих за ними структур. Проте у зв’язку з деяким відставанням рефлекторної відповіді у робітників деяких галузей, які працюють в умовах інтенсивного шуму, розвивається глухота.
Коливання мембрани овального отвору передається п е рилі м ф і вестибулярних сходів і через пристінкову мембрану — е н -д о л і м ф і (мал. 58). Разом із ендолімфою коливається й основ-
Мал. 58. Схема передавання звукового сигналу на структури спірального органа (за даними А. Сиуіоп, 1991):
/ — стремінце; 2 — овальне вікно; 3 — кругле вікно; 4 — зсаіа ¥Є8ІіЬи1і та зсаіа тедіа;
5 — есаіа {утрат; 6 — базальна мембрана; 7 — гелікотрема
Мал. 59. Збудження волосків чутливих клітин (А. Вевророиіоз, 81. ЗНЬета^І.
на мембрана, на якій розташовані рецепторні клітини, що торкаються покривної мембрани. Це призводить до їх деформації і виникнення рецепторного потенціалу. З рецепторними клітинами зв’язані аференти кохлеарного нерва, передавання імпульсу на які відбувається через посередництво медіатора.
Верхній канал звивини, або вестибулярна сходина, бере початок від овального вікна і йде до вершини звивини. Тут він через отвір (гелікотрему) сполучається з нижнім каналом (барабанна сходина), який починається від круглого отвору, закритого мембраною. На мембрану надходять коливання від рідини (через перилімфу барабанної сходини). Якби мембрани не було, то коливання були б неможливі, тому що рідина не стискується.
Навіть при тиші волокнами слухового нерва проводяться до 100 імпульсів за 1с (фонова імпульсація). При деформації волосин, зумовленій доторкуванням їх до покривної мембрани (мал. 59), проникність клітин для Ца+ підвищується і зростає частота імпульсів у нервових волокнах, які відходять від даних рецепторів. Завдяки високому рівню К+ у ендолімфі створюється позитивний заряд ( + 80 мВ). Тому між вмістом рецепторної клітини у внутрішніх і зовнішніх ділянках у стані спокою мембранний потенціал становить близько 160 мВ (внутрішньоклітинний заряд — 80 мВ). Такий мембранний потенціал забезпечує високу чутливість рецепторних клітин до слабких звукових коливань.
Крім повітряного шляху, звукова хвиля до кортієвого органа може надходити і через кістки черепа. Переконатися в наявності кісткової провідності досить легко, якщо поставити на тім’я ніжку камертона. Але ефективність кісткового шляху провідності значно нижча, ніж повітряного.
РОЗРІЗНЯННЯ ВИСОТИ ТОНУ
Вухо людини може сприймати звук при коливанні повітря в діапазоні від 16 до 20 000 Гц. Висловлюють припущення, що є два механізми розрізняння тонів. Звукова хвиля, яка створюється коливанням молекул повітря, поширюється у вигляді поздовжньої хвилі тиску. Передаючись на перилімфу і ендолімору, вона між пунктами виникнення і затухання має ділянку з максимальною амплітудою коливань (мал. 60). Місце розташування цієї ділянки залежить від частоти коливань: при вищих частотах вона лежить ближче до овальної мембрани, а при низьких — ближче до гелікотреми. Внаслідок цього амплітудний максимум для кожної частоти проявляється у специфічній точці ендо-лімфатичного каналу. Розташовані тут сенсорні клітини збуджуються найсильніше. У цьому полягає так звана просторова теорія кодування висоти тону, який сприймається в самому рецепторі.
Мал. 60. Амплітудний максимум звукової хвилі
(А. Везророиіоз, 8і. 8і1Ьегпа&1, 1986):
А — поширення хвилі у завитку; Б — частотна ідентифікація у завитку
Крім того, вважають, що при невеликій частоті коливань (до 1000 Гц) може діяти телефонний принцип кодування: потенціал дії в кохлеарному нерві виникає з частотою, яка є резонансною до частоти звукових коливань. У рецепторах тільки починається розрізнення звукової інформації. Обробка завершується в нервових центрах.
РОЗРІЗНЯННЯ СИЛИ ЗВУКУ
Збудження в рецепторних клітинах виникає при деформації волосин, які доторкуються до покривної мембрани. Діапазон амплітуди коливань ендолімфи залежить від амплітуди коливання мембран. Звичайно, що вище амплітуда коливань, то більше клітин збуджується, оскільки починають реагувати клітини, які лежать глибоко. Внаслідок цього при малій інтенсивності коливань збуджуються тільки волоскові клітини, які лежать на поверхні. У разі збільшення амплітуди збільшується і кількість збуджених рецепторних клітин.
Найвища чутливість розпізнавання сили звуку перебуває в межах від 1000 до 4000 Гц. У цих межах людина чує звук, який має малу енергію,— до 1-12-9 ерг/(с-см2). У той же час в інших діапазонах звукових коливань чутливість вуха значно нижча, а на межі чутливості (при 20 і 20 000 Гц) межова енергія звуку повинна бути не нижчою за 1 ерг/(с-см2).
Максимальний рівень голосистості дорівнює 130—140 дБ над межею чутливості. Якщо на вухо тривалий час діє звук, особливо голосний, поступово орган втрачає здатність до адаптації. Зниження чутливості досягається насамперед скороченням ш. іепзог іутрапі і т. зіаребіиз, які змінюють інтенсивність коливання слухових кісточок. До багатьох відділів обробки слухової інформації, в тому числі й до рецепторних клітин, підходять еферентні нерви, які можуть змінювати їхню чутливість.
ЦЕНТРАЛЬНІ МЕХАНІЗМИ ОБРОБКИ ЗВУКОВОЇ ІНФОРМАЦІЇ
Кохлеарний нерв (мал. 61) досягає вентрального і дорсального кохлеарних ядер. Волокна від вентрального ядра прямують як до іпсі-,. так і до контралатеральних о л и -варних комплексів. Дорсальний кохлеарний тракт" переходить на протилежний бік і закінчується в ядрі латеральної петлі. Нейрони, що піднімаються із олив, також віддають колатералі ядрам латеральної петлі. Далі волокна йдуть до
нижніх горбків чотири ального колінчастого т
Мал. 61. Центральний відділ слухової сенсорної системи (А. Цеаророиіоа, 81. 8іІЬегпа§1, 1986):
/ — орган спіральний (кортіїв орган); 2 —переднє кохлеарне ядро; 3 — заднє кохлеарне ядро; 4 — олнва; 5 — додаткове ядро; 6 — латеральна петля; 7 — нижні горбики; 8 — медіальне колінчасте тіло; 9 — кіркове представництво слуху
орбкового тіла і меді-л а. Потім вони заходять у ме-таталамус, і тільки після цього звукові шляхи потрапляють до первинної звукової зони кори. Поруч із нею містяться нейрони, які належать до вторинної звукової зони кори великого мозку.
Інформація, що міститься в звуковому стимулі, проходячи через названі ядра перемикання, багато разів (як правило, не менше 5—6 разів) переписується у вигляді нейронного збудження. При цьому на кожному етапі вона аналізується, причому нерідко з підключенням сенсорних сигналів інших («неслухових») відділів ЦНС.
Унаслідок цього можуть виникнути рефлекторні відповіді, характерні для певного відділу ЦНС. Але тільки у корі великого мозку з’являється відчуття певного звуку.
Нейрони вентрального ядра ще сприймають чисті тони, тобто збудження в них виникає при дії суворо визначених тонів. У дорсальному ж ядрі лише незначна частина нейронів збуджується чистими тонами. Інші нейрони реагують на складніший стимул, наприклад, на зміну частоти, зниження звуку тощо. На вищих рівнях у окремих нейронах поступово посилюється специфічність реагування на складні звукові модуляції. Так, одні нейрони збуджуються тільки при зміні амплітуди звуку, інші — зміні частоти, ще інші — при варіюванні відстані від джерела, його переміщенні.
Таким чином, кожного разу при дії реально існуючих у природі складних звуків у нервових центрах виникає своєрідна мозаїка збудження нейронів. Відбувається запам’ятовування цієї мозаїчної карти, зумовленої надходженням відповідного звуку. Люди можуть оцінювати різні властивості звуку тільки при відповідному тренуванні. Кіркові нейрони активізуються по-різному: одні — контралатеральним вухом, інші — іпсілатеральними стимулами, ще інші — тільки при одночасній стимуляції обох вух. Збуджуються вони, як правило, цілими звуковими групами. Ушкодження цих відділів ЦНС погіршує сприйняття мови, просторову локалізацію джерела звуку.
СЛУХОВА ОРІЄНТАЦІЯ У ПРОСТОРІ
Слухова орієнтація у просторі можлива лише при бінауральному слухові. Причому велике значення має та обставина, що одне вухо перебуває далі від джерела звуку, тобто має значення чинник розділу звуку за часом та інтенсивністю. Не можна не враховувати ролі форми вушної раковини в індивідуально зумовленій зміні звукових модуляцій.
ФІЗІОЛОГІЯ ЗОРОВОЇ
СЕНСОРНОЇ СИСТЕМИ
Електромагнітне випромінювання у діапазоні хвиль від 400 до 750 нм сприймається людиною як світло. Близько 90 % інформації про зовнішній світ надходить у ЦНС через зорову сенсорну систему. Завдяки цьому вже сам рецептор (око) є складним органом, який має відповідні структури не тільки для сприймання, але й для початкової обробки інформації. Око містить сприймальні рецептори — палички і колбочки, чотири типи нейронів і складний допоміжний апарат. Дуже складну будову мають також нервові центри, які забезпечують обробку зорової інформації.
СЛІЗНА РІДИНА
Зовнішня поверхня рогівки ока вкрита тонким шаром слізної рідини, яка утворюється слізними залозами. Під час руху повік рідина рівномірно розподіляється по рогівці і кон’юнктиві. Не-випарувана рідина стікає сльозовими протоками в порожнину носа. Функції слізної рідини різноманітні. Вона служить для: а) поліпшення оптичних властивостей рогівки; б) охорони рогівки та кон’юнктиви від висихання; в) «змазки» очного яблука і повік; г) видалення чужорідних тіл при їх попаданні між повіками і очним яблуком (при цьому рефлекторно збільшується секреція слізної рідини); д) вираження емоцій (плач). Завдяки ферментам, які в ній містяться, слізна рідина має бактерицидну властивість.
Секреція слізної рідини регулюється вегетативними нервами. Центр парасимпатичного нерва розташований у стовбурі головного мозку, а симпатичного — у верхніх грудних сегментах спинного. Пускові для секреції імпульси надходять з гіпоталамуса та лім-бічної системи, куди вони посилаються різними відділами ЦНС (аж до кори великого мозку) або периферичними рецепторами ока.
ОПТИЧНА СИСТЕМА ОКА
Перед тим як світлова хвиля досягає рецепторних клітин, розташованих у сітківці, промінь світла проходить через рогівку, вологу передньої камери ока, кришталик і склоподібне тіло, які утворюють оптичну систему. Заломна сила ока людини дорівнює 59 Ц при розгляданні далеких предметів і 70,5 Ц — при розгляданні предметів, що розташовані близько (мал. 62).
Рефракція
У оці від початку рогівки і до сітківки розташовані середовища, які по-різному заломлюють промені Світла. Промінь світла проходить через рогівку, вологу передньої камери, кришталик і скловидне тіло з різною швидкістю. Якщо швидкість променя світла в повітрі дорівнює 300 000 км/с, то в середовищах ока вона знижується до 200 000 км/с. Унаслідок цього на поверхні, яка відокремлює ці середовища, відбувається заломлення світла, або рефракція. Відношення швидкості променя світла в повітрі до відповідного прозорого середовища називається рефракційним і Я дек сом. Рефракційний . індекс рогівки становить 1,38, водянистої вологи — 1,33, кришталика— 1,4, склоподібного тіла— 1,34.
Якщо одне середовище перебуває під кутом до світла, яке проходить у іншому середовищі, напрям променя світла змінюється. Кут його зміни залежить як від кута падіння світла, так і від рефракційного індексу.
Мал. 62. Оптичний апарат ока при розгляданні здалека або зблизька предметів: / — рогівка; 2 — кришталик; 3 — циліарний м’яз
У оці межі між середовищами функціонують як лінзи. Причому навіть кришталик не є-однорідним тілом, і Ігри точному обчисленні треба враховувати як передню, так і задню його поверхні. У клінічній практиці можна спостерігати різного ступеня аномалії цих поверхонь, а це неодмінно буде позначатись на їх заломній силі.
Для спрощення оцінки заломної сили ока користуються моделлю «редукованого ока», в якому всі середовища мають один і той же показник заломлювання і єдину сферичну поверхню (мал. 63). При цьому на сітківці формується зменшене, перевернуте і справжнє відображення предмета.
Завдання оптичної системи ока полягає не тільки в зведенні
Мал. 63. Схема заломлення променя у «редукованому» оці: А — предмет:
а _ зображення предмета на сітківці; Ні та Н2 —стан головних площин; Кі та Кі —стан вузлових точок; Р( та Р, —передній та задній фокуси
у фокус променів на відповідних рецепторах сітківки, але й їх фільтрації. Так, волога передньої камери ока практично не пропускає інфрачервоні промені (з довжиною хвилі понад 760 нм). Кришталик також поглинає інфрачервоне проміння. Ультрафіолетові промені поглинаються рогівкою і рештою середовищ, тому вони до сітківки не доходять.
Акомодація
Для бачення предмета потрібно, щоб промені від окремих точок його були сфокусовані на сітківці. Цю функцію й виконують заломні середовища ока. У звичайних умовах заломна сила ока молодої людини забезпечує фокусування променів, які йдуть від далеко розташованого предмета. Предмети, які лежать поруч, при цьому бачимо розпливчасто, позаяк промені від них сфокусовані за сітківкою. Для того щоб бачити чітко близько розташовані предмети, треба збільшити заломну силу ока. Звідси стає зрозумілим, чому одночасно не можна чітко бачити далеко й близько розташовані предмети. Пристосування ока до бачення різ-новіддалених предметів називається акомодацією.
Оптична система має два основних пристосувальних механізми — зіницю і кришталик, які дозволяють регулювати інтенсивність світлового потоку і його напрямок.
Акомодація забезпечується кришталиком, кривизна якого може змінюватися. У молодої людини рефракційна здатність кришталика може змінюватися від 15 до 29 С, тобто діапазон акомодації становить близько 14 С. Кришталик міститься у тонкій капсулі, яка переходить на краях у циннову зв’язку, прикріплену з іншого кінця до циліарного тіла. Кривизна кришталика залежить від взаємодії сил еластичності його структур і пружності, яка виникає у циліарному апараті і склері, до котрої прикріплена циліарна зв’язка. Механічний натяг склери у свою чергу залежить від внут-рішньоочного тиску. Оскільки звичайно волокна зв’язки натягнуті, то форма кришталика менш випукла (мал. 64).
Регуляція акомодації. У регуляції натягу циннової зв’язки головна роль відводиться циліарному м’язу. При скороченні він послаблює натяг капсули криш-
Розслаблення —М^Зона циліарного м'яза напруження „ \ \',у_ Зона Скорочення уилі-Зз^^рВзслорлєння орного м'яза Мал. 64. Механізм акомодації (А Оезророиіоз, 81. ЗіІЬегпа^І, 1986) ПО талика, і під дією еластичних сил кривизна його збільшується. Діапазон акомодації (інтервал зміни сили заломлення) кришталика найбільший у молодому віці. Максимальна заломна сила кришталика може досягти 29С. У цьому разі найближча точка чіткого бачення ока міститься на
відстані 7 см. З віком кришталик втрачає еластичність, і найближча точка чіткого бачення поступово віддаляється. Це явище носить назву пресбіопії (стареча далекозорість).
Циліарний м’яз іннервується парасимпатичними волокнами окорухового нерва, і при їх збудженні око починає чітко бачити близько розташовані предмети. Тому при тривалому читанні очі починають «стомлюватися». Якщо закапати в око лікарські препарати, які блокують медіаторне передавання сигналів парасимпатичного нерва (наприклад, атропіну сульфат), то око припиняє чітко «бачити» близько розташовані предмети.
Оптичні недоліки ока
Як і у всіх лінз, у рогівки й кришталика різні ділянки мають різну фокусну відстань: вона більша у центральній частині, нійї у периферичній. За рахунок цього виникає явище сферичної аберації, яке робить зображення нечітким. Аберація зменшується за рахунок функції зіниці. Що менший діаметр зіниці, то меншою мірою беруть участь периферичні відділи оптичної системи ока у побудові зображення, а отже, й менше спотворення його.
Діаметр зіниці змінюється ири скороченні відповідних м’язів: кільцеві м’язи звужують зіницю, радіальні — розширюють її. В регуляції зіничного рефлексу беруть участь парасимпатична (звуження зіниці при скороченні т. зНпсіег ігісііз) і симпатична (розширення зіниці при скороченні ш. (іііаіаіог ігісііз) системи. У здорової людини реакція зіниць обох очей співдружна, тобто обидні зіниці залежно від ситуації звужені або розширені. Реакція зіниць може бути непрямим показником збудження відповідного відділу вегетативної нервової системи.
М’язи райдужної оболонки, змінюючи величину зіниці, регулюють кількість світла, яке надходить до сітківки. Для чіткішого бачення потрібні тільки центральні промені. В умовах доброго денного освітлення оптимальний діаметр зіниці становить 2,4 мм. При яскравому світлі він стає ще меншим (до 1,8 мм), а у темряві розширюється до 7,5 мм. Тому при недостатньому освітленні гострота зору знижується.
Крім сферичної, оптичні середовища ока людини зумовлюють ще й хроматичну аберацію. Вона виникає внаслідок того, що най-коротші хвилі (сині кольори) заломлюються сильніше, ніж довгі (червоні кольори). Саме через це предмети синього кольору, що лежать на одній відстані з червоними, здаються віддаленішими. Художники користуються цим ефектом, зображуючи людину у червоному одязі на синьому тлі — проявляється просторова перспектива.
Аномалії рефракції
У клінічній практиці спостерігаються найчастіше два основних дефекти заломлювання променів — міопія (короткозорість) і гіперметропія (далекозорість). Для одержання чіткого зображення головний фокус ока повинен бути на сітківці. Але, якщо око у поздовжньому напрямку довше чи коротше, то, незважаючи на нормальний ступінь заломної сили оптичного апарата, паралельні головній оптичній осі промені сходитимуться точно на сітківці (мал. 65). При міопії такі промені сходяться перед сітківкою, а при -сшерметропії — за нею. Звичайно корекція повинна-проявлятися у зміні заломної сили ока. Міопія коригується розсіювальними лінзами, а гіперметропія — збиральними.
Корекція може бути виконана шляхом зміни кривизни рогівки, наприклад, за допомогою відповідної операції.
Рефракція ока може відрізнятись у різних меридіанах. Цей «стан називається астигматизмом.
ЗІНИЧНИЙ РЕФЛЕКС
Мал. 65. Оптична недосконалість очей та їх корекція за допомогою лінз:
/ — гіперметропія; 2 — міопія; З — норма
Зіничний рефлекс полягає у зміні діаметра зіниць при дії світла на сітківку, при конвергенції очних яблук та за деяких інших умов..Діаметр зіниць може змінюватись від 7,3 мм до 2 мм, а площина отвору — від 52,2 мм2 до 3,94 мм2.
Рефлекторна дуга складається з чотирьох нейронів:
1) клітин рецепторів переважно центра сітківки, аксони яких у складі зорового нерва і зорового тракта ідуть до переднього двогорбикового тіла;
2) аксони нейронів цього тіла прямують до ядер Якубовича та Вестфа-ля—Едінгера;
3) аксони парасимпатичних окору-хових нервів ідуть звідси до війкового вузла;
4) короткі волокна нейронів війкового вузла ідуть до м’яза, що звужує зіницю.
Звуження починається через 0,4— 0,5 с після дії світла. Ця реакція має захисне значення, вона обмежує надто сильне освітлення сітківки. Розширення зіниці відбувається за участю центра, розташованого в бічних рогах С8—ТЬі сегментів спинного мозку.
Аксони нервових клітин ідуть звідси до верхнього шийного вузла, а постгангліонарні нейрони в складі сплетінь внутрішньої сонної артерії — до ока.
Деякі дослідники вважають, що існує в передніх відділах лобної долі ще і кірковий центр зіничного рефлексу.
Розрізняють пряму реакцію на світло (звуження на стороні освітлення) та співдружну (звуження на протилежному боці). Зіниці звужуються при розгляданні близько (10—15 см) розташованих предметів (реакція на конвергенцію), розширюються при погляді в далину. Зіниці розширюються також при дії больових подразників (центром у цьому випадку є субталамічне ядро), при подразненні вестибулярного апарата, при переляці, стресі, люті, посиленні уваги. Зіниці розширюються також при асфіксії, це грізна ознака небезпеки. Атропіну сульфат виключає вплив парасимпатичних нервів, і зіниці розширюються.
ПОЛЕ ЗОРУ
Полем зору називається простір, який охоплюється одним оком при фіксованому стані очного яблука. Дослідження поля зору проводиться за допомогою периметра. Величина поля зору обме* жується носом, надбрівними дугами, щоками.
Поле зору дорівнює у людини: вгору — 48—60°, вниз — 65—70°, назовні — 90°, всередину — 60°. Для кольорів поле зору різне: воно менше для синього та жовтого, ще менше — для червоного і мінімальне для зеленого — лише 20—40°.
СІТКІВКА.
СПРИЙМАННЯ І ОБРОБКА СИГНАЛІВ
Сітківка є внутрішньою оболонкою ока. Тут розташовані фоторецептори (палички і колбочки), кілька видів нервових клітин і шар пігментних. У центрі сітківки містяться центральна ямка (їоуеа сепітаііз), у якій є тільки колбочки, та сліпа пляма — місце виходу зорового нерва. Сліпа пляма не має фоторецепторів (мал. 66, 67).
Пройшовши через оптичну систему ока, світло потрапляє на сітківку, де сприймається рецепторними клітинами. Шар рецепторів у оці людини складається приблизно із 120 млн паличок і 6 млн колбочок. Вони дещо відрізняються за зовнішнім виглядом, але більшою мірою їх розрізняють за розташуванням на сітківці і функціональним призначенням. Максимальної густини колбочки досягають у центрі їоуеа сепігаііз. У центральній ямці паличок немає. Найбільше їх у парафовеальній ділянці.
Кожний рецептор складається із світлочутливого зовнішнього сегмента, що містить зорові пігменти, і внутрішнього, який
Мал. 66. Схема будови рецепторних клітин сітківки:
1 — рецепторна ділянка; 1 — мітохондрії; З— ядро; 4— сииапс; 5 — мембрана з родопсином
Мал. 67. Щільність розташування рецепторних клітин у сітківці (А. Оезро-роиіоз, 81. ЗііЬегпа^І, 1986):
1 — носова ділянка; 2 — скронева ділянка; З — центральна ямка; 4 — сліпа пляма
включає ядро, мітохондрії та інші субклітинні структури. Зовнішній сегмент палички складається приблизно із 400—800 тонких дископодібних пластинок діаметром близько 6 мкм. Кожний диск має подвійну мембрану. З її молекулами білка зв’язаний зоровий пігмент — родопсин. Приблизно таку ж структуру має й зовнішній сегмент колбочок, але у них мембранні структури створюють складки. Колбочки мають три типи зорового пігменту: йодопсин, хлоролаб йеритролаб.
За структурою зорові пігменти дуже близькі один до одного, але мають різну чутливість до дії певної довжини хвилі (див. с. 116).
Діаметр зовнішнього сегмента паличок становить від 2 до 5 мкм, колбочок у периферичній частині сітківки — від 5 до 8 мкм, а у центральній ямці — близько 1,5 мкм.
ПІГМЕНТНИЙ ШАР
У пігментному шарі сітківки міститься чорний пігмент — меланін, який бере активну участь у забезпеченні чіткого бачення. Пігмент, поглинаючи світло, перешкоджає його відбиванню від стінок і потраплянню на інші рецепторні клітини. Крім того, меланін містить також велику кількість вітаміну А, який бере участь у ресинтезі зорових пігментів у зовнішніх частинах паличок та колбочок, куди він може надходити. При недостатній кількості в організмі вітаміну А може розвинутися так звана куряча сліпота — порушення гостроти зору при поганому освітленні. Роль пігменту чітко простежується у альбіносів — людей з природженою його відсутністю. У них через зіницю просвічуються кровоносні судини. При яскравому освітленні альбіноси втрачають здатність розрізняти предмети.
МЕХАНІЗМ ЗБУДЖЕННЯ РЕЦЕПТОРІВ
У фоторецепторах відбувається взаємодія кванта світла з відповідним пігментом. Розглянемо ці процеси на прикладі взаємозв’язку світла з родопсином. Родопсин — високомолекулярна сполука (молекулярна маса 270 000), яка містить альдегід вітаміну А — ретиналь — і білок опсин. Поглинання зоровим пігментом фотона світла супроводжується ізомеризацією однієї із його складових частин — ретиналю. Фотохімічні перетворення зорових пігментів починаються з поглинання ними фотона і переходу на вищий енергетичний рівень, що супроводжуються їх стереоізо-меризацією. При цьому утворюється ряд проміжних продук-
Мал. 68. Механізми виникнення рецепторного потенціалу (А. Оезророиіоз, 81. 8іі-Ьегпа^І, 1986):
А — рецепторний потенціал; Б — потенціал дії: / — рецептор; 2 — синапс; 3 — біполярна клітина; 4 — гангліозна клітина; 5 — волокно зорового нерва
тів і зрештою зміцнюється зв’язок ретиналю з опсином. Запущений цикл фотохімічних процесів за участю кальмоду-ліну активізує Са2+. Це призводить до зміни проникності мембрани для Ца+ і виникнення РП (мал. 68).
РП, що виникає у фоторецепторах під дією кванта світла, обумовлений не деполяризацією, як у інших рецепторах, а гіперполяризацією рецепторної клітини. У темряві мембрана рецепторів відносно добре пропускає Йа+, чим пояснюється низький рівень її поляризації (близько 25 мВ). Під впливом світла ПД змінюється від 25 до 40 мВ. Причому амплітуда гіперполяриза-ції росте при збільшенні освітлення.
Мал. 69. Трикомпонентна теорія кольорового бачення Юнга—Гельмгольца. Верхніми кривими позначено спектральну чутливість трьох передбачуваних сенсибілізаторів у колбочках, нижніми— спектральне поглинання хімічних сенсибілізаторів, виділених із сітківки (за даними МсК’ІІіоі).
Кольори: / — інфрачервоний; 2 — червоний;
З — оранжевий; 4 — жовтий; 5 — зелений; 6 — сниій; 7 — індиго; 8 — фіолетовий; 9 — ультрафіолетовий
РП у паличках розвивається повільніше, ніж у колбочках. Мабуть, це зумовлено тим, що у паличках Са2+ повинен подолати довшу відстань до найближчого Ца+-каналу, ніж у колбочках: у паличках більшість молекул пігменту міститься у мембрані дисків, а у колбочках — у складках клітинної мембрани. Тому при зміні освітлення система паличок інерційніша.
Припускають, що механізм передавання світлового сигналу рецепторними клітинами такий: у темряві у зв’язку з низьким рівнем мембранного потенціалу у синапсі постійно виділяється медіатор. Але цей медіатор гальмується і у постсинаптичній мембрані не зумовлює деполяризації. При генерації гіперполяризаційного РП у рецепторних клітинах зменшується виділення медіатора.
Родопсин паличок найчутливіший при дії хвилі завдовжки 505 мкм (мал. 69). Кольорочутливі пігменти колбочок складаються з ретинолю та фотопсину (білкова частина, яка дещо відрізняється від скотопсину паличок) і мають пік чутливості до блакитного— 445 мкм, зеленого — 535 мкм, червоного — 570 мкм.
ЕЛЕКТРОРЕТИНОГРАМА
Сумарний електричний потенціал, що відводиться від сітківки, називається електроретинограмою. Записати її можна, наклавши один електрод на поверхню рогівки, а другий — на шкі-
Мал. 70. Електроретинограма (за даними К. Сгапіі, 1947):
а, Ь, с, сі — хвилі ЕРГ. Стрілками вказано моменти вмикання та вимикання світла
ру біля ока. Цей потенціал відображає суму електричних потоків, які проходять через плазматичну мембрану пігментних клітин і фоторецепторів (мал. 70). Вважають, що а-хви-ля є сумою рецепторних потенціалів, Ь-хвиля відображає зміну мембранних потенціалів гліальних клітин, с-хвиля — клітин пігментного епітелію,
б-хвиля утворюється за рахунок зміни мембранних потенціалів у нейронах сітківки.
ОБРОБКА ЗОРОВОЇ ІНФОРМАЦІЇ У НЕЙРОНАХ СІТКІВКИ
Нейрони сітківки містять ^чотири типи клітин: горизонтальні, біполярні, амакринові, гангліозні. Фото-рецепторні клітини за допомогою синаптичних контактів передають сигнали на горизонтальні й біполярні клітини. Біполярні клітини у свою чергу передають імпульси на дендрити горизонтальних клітин (у цьому можуть брати участь ще й амакринові клітини). Гангліозні клітини дають початок зоровому нерву.
При передаванні сигналів у нейронах сітківки відбуваються процеси конвергенції і дивергенції. Біполярні клітини сполучають кілька рецепторів. Як правило, кожна гангліозна клітина на вході одержує імпульси від кількох біполярних клітин. Унаслідок цього виникає дивергенція зорових стимулів.
Ступінь конвергенції залежить від величини дендритного дерева і клітин, що контактують із нею. У здійсненні конвергенції головна роль належить горизонтальним і амакриновим клітинам, які відповідають за передавання сигналів латерального гальмування. Що ближче до периферії сітківки, то більше виражена конвергенція гангліозних клітин (мал. 71, 72).
У центральній ямці і поблизу неї колбочки та палички через біполярні клітини контактують з індивідуальними гангліознимй клітинами. Це забезпечує високу гостроту зору названого відділу сітківки. Інтенсифікація процесів конвергенції та дивергенції на периферії сітківки призводить до зниження гостроти зору, але в той же час підвищується чутливість гангліозних клітин. На периферії близько 300 паличок конвертують до однієї гангліозної клітини, що й забезпечує підвищення чутливості до слабкого світла. Сумарно в сітківці переважають процеси конвергенції над дивергенцією. Про це свідчить невідповідність рецепторних клітин (125 млн) аферентним нейронам (1 млн).
Мал. 71. Нервова організація сітківки: зліва — периферія, справа — центр
Мал. 72. Взаємодія клітин у сітківці:
/ — гальмування: 2 — збудження
Біполярні клітини. У сітківці є біполярні клітини, які деполя-ризуються, і ті, що гіперполяризуються. Ті, які деполяризуються, стимулюються тоді, коли рецепторна клітина поглинає квант світла. Ці клітини володіють спонтанною пейсмекерною активністю. В темряві під впливом медіатора, який виділяється рецепторною клітиною, деполяризація припиняється. Клітини, які гіперполяризуються, навпаки, пригнічуються при світлі. Тому під впливом світла біполярні клітини можуть передавати збудження або гальмування.
Горизонтальні клітини. У бокових відділах сітківки кілька рецепторних і біполярних клітин з’єднуються за допомогою горизонтальних клітин. Вони відповідають на медіатор рецепторів так, як і біполярні клітини, які деполяризуються, тобто при світлі збуджуються. Але при цьому вони виділяють інгібіруючий медіатор, який виконує функцію латерального гальмування біполярних клітин.
Амакринові клітини. Амакринові клітини збуджуються біполярними клітинами під час їх деполяризації. Більшість цих клітин також забезпечує латеральне гальмування, але вже на рівні ган-гліозних клітин. За часом цей процес є контрастним до пригнічу-вального сигналу горизонтальних клітин. Для амакринових клітин характерне короткочасне збудження, яке вони можуть передавати за допомогою місцевої деполяризації або шляхом виникнення ПД.
РЕЦЕПТИВНІ ПОЛЯ ГАНГЛІОЗНИХ КЛІТИН СІТКІВКИ
Гангліозні клітини передають сигнали у центральні відділи зорової системи за допомогою ПД. У разі відсутності стимули від біполярної клітини в гангліозній клітині виникає спонтанна деполяризація із частотою ПД близько 5 за 1 с. Стимулю-вальний сигнал підвищує імпульсацію, а гальмівний — пригнічує. Біполярні клітини, які деполяризуються, передають пряме збудження від паличок до колбочок. Клітини, які гіперполяризуються, впливають на гангліозні клітини опосередковано.
Процеси конвергенції і дивергенції складають основу виникнення рецептивних полів гангліозних клітин сітківки. Рецептивні поля — це ділянка сітківки, у межах якої зоровий стимул викликає відповідний процес у гангліозних клітинах. Процес цей може полягати у збудженні або гальмуванні. За рахунок цих процесів у гангліозній клітині вже у власне сітківці виникає просторова сумація.
У сітківці виявлено два класи гангліозних клітин з антагоністичною організацією їх рецепторних полів (мал. 73). Нейрони з оп- центром (включення) відповідають деполяризацією на освітлення центра їх рецепторних клітин, що спричиняє збільшення імпульсної активності в гангліозній клітині. У той же час освітлення периферії цих полів веде до гіперполяризації мембрани і зменшення частоти імпульсації. При одночасному освітленні центра і периферії реакція центра переважає, хоча сумарна відповідь буде зниженою.
У нейронах з оїї- центром (виключення) спостеріга-
2 2
Мал. 73. Рецептивні поля гангліозних клітин паличкового апарата:
1 — стимуляція центра; 2 — стимуляція периферії
ються інші явища. Адекватним стимулом їх є зменшення освітлення центра поля або ж збільшення освітлення периферії. У гангліоз-них клітинах збудження нейронів сітківки проявляється значно краще, якщо промінь світла потрапляє поряд із межею «темне — світле». Відповідь нейрона максимальна, якщо промені від точки надходять до нейрона з оїї-центром на кордон центр — периферія з неосвітленого боку, а до нейрона з оп-центром — з освітленого боку. Площа поля не постійна, вона може змінюватися під впливом латерального гальмування, при поліпшенні освітлення предмета рецепторне поле зменшується.
ОБРОБКА СИГНАЛІВ У ЦЕНТРАЛЬНИХ ВІДДІЛАХ ЗОРОВОЇ СИСТЕМИ
Біля основи черепа обидва зорових нерви зливаються, внаслідок чого носові половини нервових волокон переходять на конт-ралатеральний бік (мал. 74). Перехрещена частина волокон несе інформацію про ті відділи сітківки, на які падають промені від зовнішньої половини рогівки. Тому зоровий нерв, пройшовши навхрест, несе інформацію у кожну половину мозку переважно від відповідної половини зорового поля.
Зоровий тракт проходить через латеральні колінчасті тіла. Проте частина волокон перед попаданням у латеральне колінчасте тіло дає відгалуження до нейронів верхніх горбків чотиригорбкового тіла. Зоровий сигнал, пройшовши через ці структури і ядра допоміжного зорового тракту, потрапляє до нервової зорової кори. Поряд з нею лежать вторинна і третинна ділянки кори великого мозку.
ОБРОБКА ЗОРОВОЇ ІНФОРМАЦІЇ В ПІДКІРКОВИХ ЯДРАХ
На рівні нейронів підкіркових ядер також можна помітити р е -цептивні поля, які забезпечують зв’язок із конкретними рецепторами сітківки. Рецептивні поля тут також круглі, хоч і менші за розміром, ніж на рівні гангліозних клітин.
У кожному з цих ядер відповідним чином обробляється зорова інформація. Причому тут зорові нейрони активно взаємодіють із близько розташованими структурами ЦНС. Так, у верхніх горбках чотиригорбкового тіла нейрони відповідають появою ПД переважно у відповідь на стимул, що рухається. При цьому одні нейрони реагують на рух зорового стимула через рецепторне поле лише в певному напрямку, у інших спрямування виражене меншою міррю. У зв’язку з цим для виникнення реакції нейрона треба, щоб предмет рухався. Але, коли предмет нерухомий, то потрібно, щоб рухались очні яблука. У глибоких шарах горбків є
Мал. 74. Будова зорового аналізатора (А Безророиіоз, ЗіІЬегпа^І, 1986): а — переріз лівого зорового нерва перед хіазмою призводить до втрати лівого зорового поля; б — переріз лівого зорового нерва після хіазми призводить до втрати правої половини обох зорових полів; в — переріз хіазми зумовлює втрату скроневих зорових полів; г — переріз променистого пучка призводить до відсутності «кіркового» бачення
нейрони, які й забезпечують здійснення лише таких о к о -рухових рефлексів.
Поряд із зоровими сигналами нейрони верхніх горбків чотиригорбкового тіла одержують інформацію про звуки, положення голови, а також перероблену зорову інформацію, що повертається петлею зво
ротного зв’язку від нейронів первинної зорової кори. З урахуванням цього припускають, що передні горбки чотиригорбкового тіла є первинними центрами інтегрування інформації для просторової орієнтації.
У латеральному колінчастому тілі три шари нейронів пов’язані з іпсе-, а три — з контралатеральним оком. Багато нейронів згруповані так, як і в сітківці, тобто у вигляді концентричних рецептивних полів. Можна виділити два класи нейронів: нейрони, які відповідають на контраст, і нейрони, що відповідають на світло й темряву. В обох групах нейронів є поля з оп- і оїї-центрами. Деякі нейрони мають світлоспецифічні п о -л я. Система нейронів сітківки і латерального колінчастого тіла аналізує зорові стимули, оцінюючи їх кольорові характеристики, просторовий контраст і середнє освітлення різноманітних ділянок поля зору. Існує три типи гангліозних клітин сітківки. Близько 40 % клітин припадає на клітини з малим діаметром (до 10 мкм), котрі рівномірно розташовані по всій сітківці, їх нейрони проектуються безпосередньо в передні горбки й сусідні ділянки. їх імпульси надзвичайно важливі для визначення предмета, який рухається, і координації рухів ока.
Середнього розміру нейрони (10—15 мкм), яких є близько 55 °/о, одержують імпульсацію від центрально розташованих колбочок і паличок. Після перехресту їх відростки несуть інформацію у латеральне колінчасте тіло й зорову кору.
Дуже великі гангліозні клітини (діаметр близько 35 мкм) складають 5 % усіх клітин. Вони мають широкі дендритні поля в сітківці. їх відростки проектуються в обидва латеральні колінчасті тіла й верхні горбки чотиригорбкового тіла.
ЗОРОВА КОРА
Наступний етап аналізу зорових стимулів пов’язаний із функцією кори великого мозку. В кожній півкулі представлені лише контралатеральні частини полів зору обох очей. Нейрони, які надсилають інформацію від кожного ока, утворюють своєрідну смугастість. У корі великого мозку нейрони згруповані у вертикальні колонки з однаковим функціональним значенням. У їх формуванні можна виділити дві особливості: а) ділянка кори, що одержує інформацію від центральної ланки (зони найвищої гостроти зору), приблизно в 35 разів більша від ділянки такої ж величини на периферії сітківки; б) у колонці зорової кори налічується понад 12 шарів клітин. У первинній зоні кори лише незначна частина нейронів реагує на -такі прості стимули, як світло чи темрява. Друга група нейронів відповідає на порівняно прості контури відповідної орієнтації, зломи контурів.
Однак більшість нейронів кори великого мозку забезпечують розпізнавання складних і дуже складних РП. Для складних РП стимулом є межа між темним і світлим, але відповідної орієнтації, чи розриви кордонів з відповідною орієнтацією тощо. Дуже складні РП частини нейронів реагують на кордони між світлим і темним чітко визначеної орієнтації і обмеженої довжини, відповідні кути.
Унаслідок цього в корі великого мозку, наприклад, для сприймання якої-небудь літери повинні збуджуватися багато нейронів, кожний з яких реагує на відповідну частину літери. Одночасне їх збудження дає своєрідну нейронну мозаїку, яка в процесі вивчення дозволяє впізнати цю літеру як ціле. Ці процеси відбуваються у вторинній і третинній зорових ділянках кори великого мозку.
СПРИЙМАННЯ КОЛЬОРУ
Око людини розрізняє не тільки форму, поверхню чи відтінки сірого кольору. Воно може розпізнати хвилі у діапазоні від 400 до 760 нм, які складають різноманітні кольори. Безпосередньо прилеглі до них ділянки інфрачервоного і ультрафіолетового світла не викликають ніяких кольорових відчуттів, хоча при високій інтенсивності вони можуть асоціюватися із занадто слабкими (сірими) тонами. Людина може розрізняти до 7 млн кольорових відтінків. Хроматичні відтінки мають три характеристики: тон, насиченість і ясність. Уся гама кольорів від червоного до фіолетового може бути зображена за допомогою поступового переходу від одного відтінку до іншого.
Кожний колір має свою хвилю певної довжини. Так, довжина хвилі червоного кольору становить 700 нм, зеленого — 546 нм, блакитного — 435 нм. При змішуванні цих кольорів можна одержати
проміжні кольори. Вказані три кольори визнані міжнародною конвенцією як головні (первинні). Рівномірне змішування їх дозволяє одержати білий колір, а змішування червоного кольору з довжиною хвилі 617 нм і зеленого з довжиною хвилі 546 нм дає проміжний жовтий колір з довжиною хвилі 589 нм. Це лягло у основу трикомпонентної теорії кольорового зору.
Трикомпонентна теорія (Юнга—Гельмгольца). Вважають, що на рівні рецепторів кольорове бачення забезпечується завдяки тому, що у сітківці є як мінімум три типи колбочок, кожна з яких функціонує як незалежний приймач. Одні колбочки містять пігмент, котрий реагує на червоний колір, пігмент інших колбочок чутливий до зеленого, ще інших — до фіолетового. Будь-який колір впливає на всі типи колбочок, але чутливість до «свого» найвища. Комбінація збудження їх обробляється- у всіх нервових центрах ЦНС, аж до власне кори великого мозку, і тільки комплекс фізіологічних процесів сприймається нашою свідомістю як відповідний колір.
Теорія опонентних кольорів (Герінга). Було помічено, що при розгляданні кількох кольорів можна помітити появу якого-небудь Іншого кольору або зникнення якогось кольору. Таким чином, сіре коло навколо ясно-зеленого кільця виглядає як червоне. Герінг на підставі названого ефекту запропонував теорію опонентних кольорів. Він вважав, що є чотири основних кольори, на підставі яких можна виділити попарні їх кольороконтрастні поєднання, наприклад, зелено-червоне, жовто-синє. Припускають, що існує три типи колбочок, які сприймають крім вказаних двох пар ще й біло-чорну. Інші кольорові відчуття народжуються за допомогою поєднання трьох названих сполучень.
У останні роки, коли навчились відводити біопотенціали від окремих рецепторів і нервових клітин, було доведено, що правильними були обидві вищеназвані теорії. Трикомпонентна теорія доцільна для описування процесів, які відбуваються на рівні колбочок. Обробка кольорової інформації на вищих рівнях нервових зв’язків відбувається за принципом одночасного кольорового контрасту. Було виявлено гангліозні клітини, які мають рецептивні поля названих вище кольорових сполучень. Вплив на центр їх РП світлом однієї ділянки спектра збуджує такі клітини, освітлення іншим кольором — гальмує. У деяких випадках спектральна чутливість периферії їх РП є дзеркальним відображенням кривих для їх центра. Нейрони латеральних колінчастих тіл також мають вигляд кольороконтрастних рецептивних полів (мал. 75).
Про наявність кольороспецифічних колбочок свідчить той факт, що люди з природженою відсутністю колбочок нездатні сприймати той чи той колір. Найчастіше в практиці зустрічаються дальтоніки (протанотропи). Це люди, які не сприймають червоний колір. Дальтонізм спостерігається у 8 % чоловіків і зумовлений генетич-
ним дефектом у непарній Х-хромосомі. Для виявлення дефекту сприйняття кольорів користуються спеціальними поліхроматичними таблицями. Протанотропи не сприй-
мають червоний колір, а синьо-блакитний їм здається безбарвним. Значно рідше буває дейтеранопія. При такій ваді людина не відрізняє зелені кольори від темно-червоних і блакитних. Ще рідше зустрі-
Мал. 75. Рецептивні поля гангліозних клітин чаються люди з тритано-колбочкового апарата: ПІЄЮ, ЯКІ не сприймають
/ — червоний колір; 2 —зелений; 3 —центр РП; 4— СИНІЙ І фІОЛЄТОВиЙ КОЛЬО-периферія РП: 5 — жовтий колір; 6 — синій рові спектри у разі ціл.
ковитого ураження колбочкового апарата буває повна кольорова сліпота. Людина предмети бачить лише в сірих тонах. Якщо кольорові характеристики на рівні сітківки та підкіркових структур тільки починають аналізуватися, то остаточний висновок формується лише на рівні кори великого мозку. Тому людина з дефектом кольорового бачення в процесі розвитку пристосовується, частково компенсуючи цей недолік.
СВІТЛОВА І ТЕМНОВА АДАПТАЦІЯ
Чутливість рецепторних клітин ока залежить від попереднього подразника. Після дії інтенсивного світла чутливість різко знижується, а в темряві — підвищується. З процесом адаптації зв’язана поступова «поява» предметів при переході з добре освітленого приміщення у темне і, навпаки, на дуже яскраве світло при поверненні в освітлену кімнату. Причому світлова адаптація відбувається швидше, ніж темнова. Частково це пояснюється тим, що чутливість «денних» колбочок змінюється швидше (від 40 с до кількох хвилин), ніж «вечірніх» паличок (завершується через 40—50 хв).
Механізми адаптації до змін освітлення поширюються як на рецепторний, так і на оптичний апарати ока. Це пояснюється реакцією зіниці: вона звужується на світлі і розширюється у темряві. Внаслідок цього змінюється кількість рецепторів, на які падають промені світла: включення у сутінках паличок погіршує гостроту зору і сповільнює час темпової адаптації. У власне рецепторних клітинах процеси зниження і підвищення чутливості обу-
мовлені, з одного боку, зміною рівноваги між пігментом, що розпадається, і тим, що синтезований. З іншого боку, нейрон-ні механізми крім реакції зіниці регулюють також розміри рецепторних полів, перемикання з системи колбочок на си-
стему паличок (мал. 76).
Переконатися в динаміці адаптації можна при розгляданні малюнка (мал. 77). Коли спочатку фіксувати погляд на правій половині малюнка, а потім перевести його на ліву, то протягом кількох секунд можна бачити негатив правої половини. Ті ділянки сітківки, на які пада-лй промені від темних місць, стають чутливішими, ніж сусідні. Це явище називається послідовним образом. Причому зображення буває і кольоровим. За рахунок кольорової адаптації після розгля-
Широка зіниця Вузька зіниця
Мал. 76. Механізм адаптації зорового аналізатора (А. Везророиіоз, 8і. 8і1Ьег-па£І, 1986):
/ — зіничний рефлекс; 2 — просторова сумація; а — збуджується багато рецепторів; б — збуджується мало рецепторів
дання якого-небудь кольорового предмета, якщо перевести погляд на білу стінку, можна побачити той самий предмет, але у додаткових кольорах. Очевидно, це зумовлено тим, що білий колір містить комплекс світлових променів з різною
Мал. 77. Малюнок для визначення адаптації
довжиною хвиль. І коли на око падає промінь з такою ж довжиною хвилі, як і раніше, то чутливість відповідних колбочок стає нижчою і цей компонент кольору ніби виводиться із білого.
СПРИЙНЯТТЯ ПРОСТОРУ
Рух очей
Для нормального бачення предметів око повинне постійно рухатися (мал. 78). Оскільки імпульси в рецепторних клітинах виникають у момент вмикання чи вимикання світла, треба постійно переводити промінь світла на нові рецептори. При реєстрації мимовільного руху ока можна помітити, що тривалість кожного окремого елементу руху дорівнює сотим часткам секунди, а розмір його не перевищує 20°. Крім цього, око безперервно дрібно тремтить і дрейфує, зміщуючись з точки фіксації зору. Ці рухи потрібні для дезадаптації зорових нейронів. Обидва ока звичайно рухаються співдружно. Руховий апарат очей складається із шести зовнішніх м’язів, які іннервуються трьома черепними нервами. Мотонейрони їх згруповані в стовбурі мозку і перебувають під впливом ретикулярної формації його. Велике значення для виникнення рухів ока
Мал. 78. Запис рухів ока протягом 2 хв при розгляданні нерухомого предмета (за даними А. Л. Ярбуса)
мають нейрони верхніх горбків чотиригорбкового тіла в мозку. Аферентні шляхи інших сенсорних систем, що містяться в стовбурі мозку, забезпечують відповідний рух очей при їх подразненні (ністагм і рух очей при дії вестибулярних стимулів, поворот голови і очей у напрямку джерела шуму тощо). Сюди надходять команди і від кори великого мозку для виконання свідомого руху очей.
За допомогою зору можна сприймати рух предмета. При цьому відбувається оцінка положеная нерухомого до рухомого об’єкта, промені від якого переміщуються сітківкою.
Чутливість до руху зменшується при збільшенні відстані між стимульованою ділянкою сітківки і центральною ямкою. Для оцінки швидкості руху головне значення має центральний механізм зорової кори. У зв’язку з великою роллю розташованих центрально рецепторних клітин для оцінки швидкості руху треба знати локалізацію променів на сітківці і при появі об’єкта, що рухається по периферії її, око переводить його в ділянку центральної ямки. Центральні механізми переробки зорової інформації комплексно оцінюють реакцію на подразнення, які надходять на сітківку від рухомих і нерухомих предметів, і сигнали від м’язів, що здійснюють рух очей і голови.
Гострота зору
Максимальна здатність ока сприймати окремі об’єкти називається гостротою зору. Для цього треба, щоб промені від двох точок падали на дві колбочки, розділені як мінімум ще однією, не збудженою. Цю умову в нормі задовольняє хід променів під кутом 1 хв (мал. 79). Максимальна гострота зору буде при попаданні променів на жовту пляму, де густина рецепторів найбільша. На периферії вона знижується. Для вимірювання гостроти зору розроблено спеціальні таблиці, на яких деталі букв або символів видно під відповідним кутом з певної відстані.
Оцінка відстані
При оцінці відстані треба враховувати, що чим ближче до ока розташований предмет, тим більше рецепторів сітківки його сприймають. Визначення відстані значно полегшується, коли дивляться обома очима.
Бінокулярний зір
Бінокулярний зір забезпечує точне сприйняття глибини простору. Сприйняття і оцінка глибини одним оком можливі лише при відповідному тривалому тренуванні, тобто вони пов’язані з виробленням умовних рефлексів. При розгляданні обома очима відображення більшості предметів потрапляє на ідентичні ділянки сітківки і у центральній частині зорової системи сприймається як єдине ціле. Якщо при бінокулярному спостеріганні пальцем дещо змістити одне з очей, то порушиться ефект дії променів на ідентичні ділянки і предмет роздвоїться. Для оцінки відстані, величини предмета велике значення має порівняння його з іншими предметами, що стоять поруч, завдяки чому справжня форма предмета мол^е інколи спотворюватися.
НЮХОВА СЕНСОРНА СИСТЕМА
Рецептори нюхової сенсорної системи розташовані серед клітин слизової оболонки у ділянці верхніх носових ходів і мають вигляд окремих острівців у середніх ходах.
Нюховий епітелій лежить осторонь головного дихального шляху, тому при надходженні пахучих речовин людина робить глибокі вдихи і принюхується.
Товщина епітелію становить приблизно 100—150 мкм, діаметр юзташованих між опорними клітинами рецепторних клітин — 5— 10 мкм (мал. 80) .Нюхові рецептори — це первинні біполярні сенсорні клітини. Загальна їх кількість у людини близько
Мал. 79. Схема для визначення гостроти зору
100 млн. На поверхні кожної нюхової клітини є сферичне потовщення. Це нюхова булава. З неї виступає по 6—12 найтонших (0,3 мкм) волосин завдовжки 10 мкм. Нюхові волосини занурені у рідину, що виробляється нюховими залозами. Завдяки нюховим волосинам площа рецептора, який контактує з молекулами
пахучих речовин, збільшується у десятки разів. Цілком можливо, що нюхові волосини володіють і рухальною функцією, при цьому підвищується надійність захоплювання молекул пахучих речовин й контакту з ними. Нюхова булава є важливим цитохімічним центром нюхової клітини: у ній генерується РП. .
Нюхові рецептори належать до хеморецептор ів. Молекули пахучої речовини вступають у контакт зі слизовою оболонкою носових ходів, що призводить до взаємодії зі спеціалізованими рецепторними білками мембран. Унаслідок складного, поки що не досить вивченого ланцюга реакцій, у рецепторі генерується РП, а потім — імпульсне збудження, яке передається волокнами нюхового нерва у нюхову цибулину—первинний "нервовий центр нюхового аналізатора. За допомогою електродів можна отримати електроольфактограму. Електроди розташовані безпосередньо на поверхні нюхового епітелію і реєструють сумарну електричну активність їх. Монофазна негативна хвиля з амплітудою до 10 мВ та тривалістю кілька секунд виникає навіть при короткочасній дії пахучої речовини. Здебільшого на електроольфактограмі можна помітити невелику позитивність, що передуй основній негативній хвилі, а при достатній тривалості впливу реєструється велика негативна хвиля у відповідь на його припинення (оїї-реакція). Іноді на повільну хвилю електроольфактограми накладаються швидкі осциляції, які відображають синхронні імпульсні розряди значної кількості рецепторів. ч
Як свідчать результати мікроелектродних досліджень, одиничні рецептори відповідають збільшенням частоти імпульсації, яка залежить від якості та інтенсивності стимула. Кожний рецептор може реагувати на велику кількість пахучих речовин, але перевагу він віддає деяким із них. Вважають, що на цих властивостях рецепторів, які відрізняються за своїм настроєм на різні групи речовин, можуть грунтуватися шифрування нюхових подразників і їх розпізнання у центрах аналізатора нюху. Адаптація у аналізаторі нюху відбувається порівняно повільно (десятки секунд та хви-
лин) і залежить від швидкості потоку повітря над нюховим епітелієм і концентрації пахучої речовини. Існує перехресна адаптація, яка полягає в тому, що при тривалому надходженні якої-не-~будь пахучої речовини підвищується поріг чутливості не тільки до неї, а й до ійших речовин.
При електрофізіологічних дослідженнях нюхових цибулин ви-
Мал. 80. Нюховий аналізатор (А. Сез-ророиіоз, 81. 8і1Ьегпа£І, 1986):
1 — гілочка нюхового нерва; 2 — базальні клітини; 3 — біполярна клітина; 4 — опорні клітини
явлено, що параметри електрич-
ної відповіді, яка реєструється при дії запахів, залежать від виду пахучої речовини. При різних запахах змінюється і просторова мозаїка збуджених та загальмованих ділянок нюхових цибулин. Чи служить це засобом шифрування нюхової інформації, судити
важко.
Чутливість нюхового аналізатора людини надзвичайно велика: один нюховий рецептор може бути збуджений однією або кількома молекулами пахучої речовини, а збудження невеликої кількості рецепторів призводить до виникнення відчуття. У той же час зміна інтенсивності впливу речовини (межа різниці) оцінюється людиною досить грубо (найменша сприймальна різниця щодо сили запаху становить ЗО—60 % від її попередньої концентрації). У багатьох тварин, особливо у собак, ці показники у 3—6 разів менші. Однією із найхарактерніших особливостей нюхового аналізатора є те, що його аферентні волокна не перемикаються у таламусі і не переходять на протилежний бік кори великого мозку.
У нюховій цибулині при аналізі інформації, що надходить, широко використовуються явища конвергенції і гальмування. Тут же відбувається і аферентний контроль із вищерозташованих центрів або контралатеральної нюхової цибулини. Нюховий тракт складається із кількох пучків, які спрямовуються у різні відділи мозку: переднє нюхове ядро, нюховий горбок, препериформну кору, пе-ріамигдалярну кору і частину ядер мигдалевидного комплексу. Зв’язок нюхової цибулини з гіпокампом, периформною корою та іншими відділами нюхового мозку здійснюється через кілька перемикань. Електрофізіологічні дослідження і досліди на тваринах з умовними рефлексами свідчать про те, що для розпізнання запахів не потрібна значна кількість центрів нюхового мозку (гЬіпеп-серйаіоп). У зв’язку з цим більшість ділянок проекції нюхового тракту можна розглядати як асоціативні центри, котрі забезпечують зв’язок нюхової системи з іншими сенсорними системами і формування на цьому грунті ряду складних форм поведінки — харчової, захисної, статевої.
Зв’язок нюхового аналізатора з лімбічною системою забезпечує
наявність емоційного компоненту в нюховому сприйнятті.' Запах може викликати відчуття задоволення або відрази і, мабуть, грає певну роль у формуванні статевої поведінки (особливо це виражено у тварин). Чутливість нюхових нейронів перебуває під контролем статевих гормонів.
У клінічній практиці зустрічаються пацієнти з різним порушенням нюху, починаючи від зниження чутливості (гіпо- або аносмія) і закінчуючи різноманітними нюховими галюцинаціями та паросмією (неправильне сприйняття запахів).
ІНТЕРОЦЕПТИВНИЙ [ВІСЦЕРАЛЬНИЙ)
АНАЛІЗАТОР
І. М. Сєченов (1863) вказував, що для регуляції поведінки і психіки людини важливе значення має чутливість внутрішніх органів, тобто ті «темні» (невиразні) відчуття, які виникають при певних станах вісцеральної сфери організму. І. П. Павлов звернув увагу на наявність у великих півкулях особливих структур, які мають за мету розкладати величезний комплекс внутрішніх явищ, що відбуваються в організмі, і на те, що «для організму важливий аналіз внутрішнього світу». Для нього також конче потрібні сигналізування вгору і аналіз того, що відбувається в ньому самому. Одне слово, крім перерахованих зовнішніх аналізаторів, повинні -бути ще й аналізатори внутрішні.
Тепер детально вивчено морфофункціональну організацію і основні закономірності інтероцептивного (вісцерального, або внутрішнього) аналізатора. Встановлено, що периферичним відділом цього аналізатора є численні рецептори, які містяться у внутрішніх органах, серозних і слизових оболонках, стінках кровоносних і лімфатичних судин, які отримали назву інтеро-, або вісцерорецеп-торів. Вони реагують на хімічні (хеморецептори) й меха-'нічні подразнення (механорецептори), зміну температури (терморецептори), коливання гідравлічного (пресоре-ц е п т о р и) та осмотичного (осморецептори) тиску, зміну об’єму рідини (волюморецептори), біль (ноцирецепто-ри). Переважна більшість інтерорецепторів є полімодальними і забезпечує* надходження у ЦНС інформації про різноманітні подразнення. Морфологічно інтерорецептори є первинно- і вТО’ .рщ н нечутливими.
Основна функціональна роль інтерорецепторів полягає у забезпеченні надходження у ЦНС інформації про зміни внутрішнього стану організму, а також у встановленні ланцюга зворотного зв’язку, який передає інформацію про перебіг регуляторних процесів.
Різні рефлекси (вісцеро-вісцеральні, вісцерорухові, вісцеросен-сорні), які виникають у інтерорецепторах, відіграють важливу
роль у взаємодії і взаємозв’язку внутрішніх органів, у підтриманні, гомеостазу.
Подразнення інтерорецепторів спричинює розвиток біоелектричних процесів у аферентних нервових шляхах і у ЦНС, може зумовити як усвідомлені (з прямої кишки, сечового міхура), так і не-усвідомлені (із серця, селезінки, судин тощо) відчуття. Крім периферичних інтерорецепторів, інформація про зміну внутрішнього середовища організму надходить і від центральних (гіпоталаміч-них, медулярних).
Провідний відділ вісцерального аналізатора. Існують 4 основних колектори проведення аферентних сигналів від внутрішніх органів. Це блукаючі, черевні, підчеревні і тазові нерви. Черевні, підчеревні і тазові нерви містять аферентні волокна, які йдуть винятково від внутрішніх органів. Крім того, аферентні вісцеральні шляхи проходять у нервових сплетіннях кровоносних судин. Особливим типом вісцеральних аферентів є власні провідники симпатичної нервової системи. Аферентні провідники від одного органа можуть іти у складі різних нервових стовбурів.
Нервові волокна, які утворюють аферентні вісцеральні шляхи, мають різний калібр, збудливість, швидкість проведення збудження. Товсті мієлінові волокна (низькопорогові, вісцеральні аферен-ти, група А) належать до черевних і тазових нервів, зв’язані з ме-ханорецепторами внутрішніх органів. Тонкі мієлінові волокна ін-нервують серце, кровоносні судини, дихальні шляхи, органи травлення і порожнисті органи таза. Тонкі (високопорогові), волокна, волокна групи А, 6, С реагують на сильні механічні, температурні, хімічні і ноцицептивні подразнення.
Найбільша зона іннервації внутрішніх органів у черевних ї блукаючих нервів, а також у судинних сплетінь, дещо менша —• у надчеревних і тазових, найменша — у синусних та депресорних нервів.
Після впадіння у спинний мозок вісцеральні швидкопровідні аференти проходять у складі дорзальних і вентролатеральних канатиків, а тонкі (групи А) волокна йдуть до спінальних вставних нейронів. Вісцеральна сигналізація провідними шляхами спинного мозку надходить у ретикулярну формацію стовбура мозку, ядра Голля і Бурдаха, вестибулярні ядра. На рівні таламуса вісЦе-» ральні аференти переключаються у вентробазальному-комплексі ядер, причому проекції вісцеральних аферентів у релейних таламічних ядрах суворо локальні. Є дані про проекцію вісцеральних аферентних систем (блукаючого і черевного нервів) у гіпоталамусі, лімбічних структурах мозку, хвостатому ядрі.
У корі великого мозку представництво вісцеральних систем міститься у первинних проекційних ділянках шкірно-м’язової чутливості зон 81, а також у асоціативних полях (лобно-тім’яному, лобно-орбітальному і лімбічному). Виняток ста-»
5*
13Г
новлять блукаючі нерви, проекції яких виявлено і за межами вказаних зон. Площу, яку займають кіркові проекції вісцеральних аферентних систем, можна порівняти з площею проекційних соматичних полів.
Таким чином, шлях вісцеральних сигналів до кори великого мозку складається з кількох паралельних, швидко- і повільнопро-відних систем, тобто включає ті ж лемніскові й екстралемніскові системи, які використовуються для передавання соматичної чутливості.
Разом з тим, у вказаних системах мозку на усіх рівнях ЦНС відбувається взаємодія аферентних сигналів вісцерального походження і сигналів іншої модальності (соматичної та ін.), спостерігається досить тісне перекриття шляхів і зон представництв вісцеральних і соматичних функцій. Особливо наочно це виявляється у корі великого мозку.
У нормальних фізіологічних умовах ми звичайно не відчуваємо стану своїх внутрішніх органів, тобто інтероцептивні сигнали не доходять до рівня свідомості, хоча вони, судячи з біоелектричних реакцій, завжди досягають кори великого мозку. Вважають, що це відбувається тому, що сигнали, які йдуть соматичними системами, блокують вісцеральні сигнали на конвергуючих нейронах, пригнічують своєю кількістю. Тому надходження вісцеральних сигналів у таламокортикальні проекції обмежується.
Проте раптове або поступове посилення вісцеральної аферентації проявляється поступово або зразу, привертаючи нашу увагу. Це дуже помітно при заповненні сечового міхура або прямої кишки, переповненні шлунка. Ще сильніші відчуття виникають при різноманітній патології внутрішніх органів (виразковій хворобі шлунка або дванадцятипалої кишки, сечокам’яній або жовчнока-м’яній хворобі, запаленні червоподібного відростка тощо). Внаслідок таких соматовісцеральних відносин відбувається, наприклад, відображення вісцерального болю на поверхні тіла (див. с. 95). Отже, інтенсивна вісцеральна аферентація вже здатна досягти рівня свідомості, звільняючи для цього, очевидно, ті нейронні структури, які були досі завантажені соматичною інформацією. Посилена вісцеральна сигналізація може зумовити різноманітні рухові, вегетативні й сенсорні розлади (див. с. 187), зміну емоційної сфери, настрою, самопочуття, поведінки. Інтероцептивні сигнали беруть участь у формуванні умовнорефлекторних зв’язків (КГ М. Биков, 1953), у тому числі й патологічних.
Підкреслюючи роль інтероцептивної сигналізації у підтримці гомеостазу, слід вказати, що ця сигналізація забезпечує досить високу «автоматизацію» процесів підтримки сталості внутрішнього середовища.
Клініко-фізіологічний аспект. Проблема інтероцепції має важливе значення для медицини. У спостереженнях, які проводилися
у клініці, доведено участь інтерорецепторів у патогенезі «місцевих» розладів кровообігу, розвитку гіпертензії, порушень діяльності серця, розладів функції м’язів (судома, спастичні скорочення окремих груп м’язів, параліч), загостренні тактильної і больової чутливості на обмежених ділянках шкіри (зони Захар’їна—Геда) тощо.
У тих випадках, коли інтероцептивна зона втягується у патологічний (найчастіше загальний) процес, вона стає джерелом різноманітних патологічних рефлексів при дії звичайних, фізіологічних за інтенсивністю подразнень. Наприклад, у деяких хворих з ураженням органів травлення спостерігаються так звані вісцеро-кардіальні рефлекси, для яких характерне порушення діяльності серця аж до розвитку приступів стенокардії, зумовлених недостатністю коронарного кровообігу.
У процесі розвитку різних патологічних станів (кисневе голодування, гіпоглікемія, гіпо- і гіпертермія та ін.) можуть відбуватися глибокі зміни інтероцептивних рефлексів, які мають фазовий характер (спочатку посилення, а потім пригнічення або інверсія).
З давніх-давен відомо про зв’язок деяких видів емоційних станів (див. с. 515) з певними захворюваннями внутрішніх органів. Наприклад, при розладах серцевої діяльності виникає страх, функції печінки — дратливість, функції шлунка — апатія й байдужість. Виявлено також, що у патогенезі неврозу значна роль належить функціональним і органічним порушенням внутрішніх органів.
ФІЗІОЛОГІЧНІ основи
БОЛЮ ТА ЗНЕБОЛЮВАННЯ
БІОЛОГІЧНЕ ЗНАЧЕННЯ БОЛЮ
Згідно із сучасними уявленнями, біль є суб’єктивним сприйняттям системних процесів, які включають сенсорну оцінку інформації про ноцирецептивні (які порушують цілість тканин) стимули і про різноманітні рефлекторні реакції, спрямовані на захист організму від дії цих стимулів.
Біль, на відміну від інших сенсорних модальностей, інформує нас про небезпеку, яка загрожує організмові. За образним висловлюванням стародавніх греків, біль є сторожовим псом здоров’я. Справді, незважаючи на те що біль майже завжди порушує життєдіяльність, знижує працездатність людини, позбавляє її сну, він усе ж таки потрібний і до певних меж корисний.
Чи будь-яке подразнення спричинює біль? Згідно із сучасним уявленням, біль зумовлюють ноцицептивні подразнення. Отрута, наприклад, тільки тоді спричинює біль, коли порушує цілість тканини або умертвляє її.
Відчуття болю зумовлює виникнення ланцюга рефлекторних ре
акцій, спрямованих на усунення небезпеки. Больові (ноцицептив-ні) рефлекси у більшості людей супроводжуються рухами, спрямованими на захист чи усунення впливу, який зумовлює біль. При больових рефлексах спостерігаються різноманітні зміни в організмі: підвищення тонусу м’язів, прискорення серцебиття, звуження судин, підвищення кров’яного тиску, збільшення потовиділення, /зменшення діурезу, розширення зіниць, підвищення вмісту щукру і міді у крові, прискорення гемостазу тощо. Більшість із названих реакцій — наслідок збудження гіпоталамо-гіпофізарно-симпатико-адреналової системи. Вони відіграють роль мобілізації сил організму, що конче потрібно при ушкодженні тканин, яке супроводжується больовим відчуттям. Власне біль, який пс/збавляє хворого спокою, приводить його до лікаря.
Поки біль попереджує про небезпеку, хворобу, порушення цілості організму, він потрібен і корисний. Але як тільки інформація врахована і біль завдає страждань, його треба усунути. На жаль, біль далеко не завжди припиняється після того, як його захисна функція виконана. Людина не спроможна за власним бажанням позбутися болю, перебороти його. Він підкоряє її свідомість, заполоняє всі думки (за принципом домінанти), розладнує сон, дезорганізує функції всього організму (стрес, шок).
Разом з тим, багато захворювань внутрішніх органів, особливо .тяжкі (наприклад, туберкульоз легень, рак) розвиваються у організмі, не спричиняючи найменшого болю. Хвороба, за визначенням відомого французького хірурга Р. Леріша (1955), це драма на два акти, з яких перший розігрується у тканинах при погашених вогнях, у глибокій темряві. У цей період немає навіть і натяку на біль. Лише у другому акті починають загоратися свічки — провісники пожежі, погасити яку в одних випадках важко, у інших—• неможливо. Ось у цей момент і виникає біль. Р. Леріш увів у медичну практику поняття «біль-хвороба» і вважав, що біль слід теж лікувати, як і будь-яку хворобу.
ВИДИ БОЛЮ
Відчуття болю можна класифікувати за місцем виникнення або за характером. Розрізняють біль соматичний і вісцеральний. Коли біль виникає у ділянці шкіри, його називають поверхневим, коли ж він поширюється на м’язи, суглоби, кісткову або сполучну тканину, то визначається як глибокий. Прикладом глибокого болю є головний, зубний біль, м’язова судома.
Розрізняють також ранній (первинний біль, зокрема г.остре відчуття болю при уколі, його легко локалізувати) і пізній (вторинний) біль; він з’являється за раннім болем з латентним періодом 0,5—1 с. Це пекучий чи тупий (ниючий) біль. Його важко локалізувати, він триваліший порівняно з раннім.
Вважають, що ранній біль потрібний організму для орієнтації у навколишній ситуації. Це сигнал про небезпеку, своєрідне попередження. Пізній біль стійкіший, дозволяє ЦНС розібратися у походженні ноцицептивного впливу і вжити заходів до його усунення.
Вісцеральний біль подібний до глибокого. Він, як і глибокий біль, часто буває дифузним і тупим, погано локалізується і має тенденцію до іррадіації в інші ділянки. Залежно від характеру захворювання, вісцеральний біль може бути тупим, пекучим, колючим, ріжучим. Прикладом його може служити ниркова і кишкова кольки, біль при виразці шлунка та дванадцятипалої кишки, апендициті. Особливо болючі зовнішня стінка артерій, парієталь-на плевра, перикард, парієтальна очеревина, корінь брижі.
Крім того, болем супроводжуються сильні скорочення гладких м’язів, особливо коли вони супроводжуються порушенням кровообігу (ішемія), надмірне розтягнення стінок шлунка, жовчного міхура, кишок, ниркової миски, сечового міхура.
Розрізняють ще один вид болю — так званий рефлекторний. Це больове відчуття спричиняється ноцицептивними подразненнями внутрішніх органів. Локалізується воно не у даному органі (або не тільки у ньому), а й у окремих ділянках тіла. Так, при захворюваннях серця людина відчуває біль у лівій руці, лівій лопатці, надчеревній ділянці; при захворюванні шлунка — у ділянці пупка; при ураженні діафрагми — у потилиці чи лопатці; при захворюваннях гортані — у вусі; при нирковій кольці — у яєчках і ділянці грудини. Захворювання печінки, шлунка, жовчного міхура нерідко супроводжуються зубним болем. При каменях у сечовому міхурі хворі нерідко скаржаться на біль у ділянці головки статевого члена та ін.
Паралельно з відображеним болем велике значення для діагностики захворювань внутрішніх органів мають і зони підвищеної шкірної чутливості. При цьому відображеного болю може не бути. Але у певних ділянках тіла шкіра стає особливо чутливою до больових подразнень (гіпералгезія). Навіть дотик до шкірних волосків супроводжується болем. Біль поширюється і на підшкірну основу, м’язи. Це зони Захар’їна—Геда (див. с. 95). Такий біль виникає внаслідок конвергенції імпульсів від рецепторів ураженого органа й інших частин тіла, наприклад поверхні шкіри, на інтернейронах одного й того ж сегмента спинного мозку.
Своєрідним неприємним відчуттям, яке виникає при подразненні больових рецепторів, розташованих під епідермісом, є свербіж. У походженні його певну роль відіграє утворення в шкірі хімічних сполук, які подразнюють рецептори. До таких речовин належать гістамін, деякі пептидази — ферменти, які розщеплюють поліпептиди, та ін.
НЕЙРОФІЗІОЛОГІЧНІ МЕХАНІЗМИ БОЛЮ
Чи є специфічні рецептори, які реагують тільки на больові подразнення і ні на що інше? Одні вчені припускають існування самостійних больових рецепторів, інші вважають, що сильне подразнення рецепторів, які сприймають дотик, температуру, за певних обставин зумовлює відчуття болю.
Прихильники першої теорії, так званої теорії специфічності, сформульованої наприкінці XIX століття німецьким вченим М. Фреєм, визнають існування у шкірі чотирьох самостійних рецепторів — холодових, теплових, тактильних і больових, які мають окремі системи передавання імпульсів у ЦНС.
Прихильники другої теорії («теорії інтенсивності») припускають, що одні й ті ж рецептори відповідають (залежно від сили подразника) больовим і небольовим відчуттям (стискання, холоду, тепла тощо). Вони вважають, що небольове відчуття може перейти у больове, якщо інтенсивність подразника перевищила певну межу. Полеміка між прихильниками і супротивниками названих више теорій досі триває.
За допомогою електрофізіологічних досліджень було виявлено нервові волокна, у яких біоелектрична активність з’являється тільки при надмірному подразненні рецепторів, коли обстежуваний відчуває біль.
При механічному і термічному впливах, які не супроводжуються болем, ПД були відсутні. Отже, існують рецептори, які реагують тільки на особливо сильні больові (ноцицептивні) впливи. Очевидно, больову чутливість слід розглядати як самостійний вид чутливості із своїми рецепторами, провідниками, центральними утвореннями.
Згідно із сучасними уявленнями, у шкірі (епідермісі) розгалужуються вільні нервові закінчення, які сприймають больові подразнення (ноцицептори). Під ними розташовані рецептори дотику (тільця Меркеля), ще глибше — больові сплетіння, які пов’язані з кровоносними судинами, а потім — рецептори тиску (тільця Пачіні), холоду (колби Краузе). Як правило, вони тісно пов’язані з вільними нервовими закінченнями. Разом з тим, виявлено суто механочутливі, суто термочутливі і ме-хано-термочутливі (полімодальні) ноцирецептори. Пульпа, а також рогівка, барабанна перетинка містять лише вільні нервові закінчення. У цих тканинах біль виникає швидше, ніж інше відчуття. У внутрішніх органах та інших ділянках тіла вони виявлені там, де відповідними стимулами можна викликати біль.
До аферентних ноцицептивних волокон належать мієлінізовані волокна А-дельта і немієлінізовані С-волокна. Перші передають
ранній біль, другі — пізній (у останніх імпульси проводяться значно повільніше, ніж у перших).
У спинному мозку відчуття болю передається переважно спіно-таламічними трактами, а також аферентними волокнами спіноме-зенцефалічного, спіноретикулярного, спіноцервікоталамічного трактів і тракту, який іде до ядер дорсальних стовбів.
Інформація про біль, яка надходить від голови, обличчя, органів ротової порожнини, потрапляє у ЦНС також сенсорними волокнами ряду черепних нервів, зокрема трійчастого, а від внутрішніх органів — переважно блукаючого нерва.
До центральних апаратів больової рецепції зараховують ядра таламуса, гіпоталамуса, ретикулярну формацію, центральну сіру речовину, кору великого мозку (соматосенсорні зони).
Доведено, що у таламусі є спеціальні «больові ядра». Це головним чином вентропостеролатеральні ядра (УРЬ), клітини яких реагують тільки на надмірне подразнення.
У наш час таламус розглядається як головний підкірковий центр больової чутливості. Причому, якщо таламус є загалом центром грубої, нічим не пом’якшеної (протопатичної) чутливості, то кора великого мозку здатна диференціювати сигнали тонкої, епікритичної чутливості, покликаної пом’якшувати і локалізувати відчуття болю. Кора великого мозку відіграє головну роль у прийнятті й усвідомленні болю. Саме у ній формуються суб’єктивні відчуття болю. Під час больового подразнення ретикулярна формація стовбура мозку посилає у кору великого мозку незліченну кількість нервових сигналів, що призводить до різкої зміни її активності. З активізацією гіпоталамо-лімбічних структур мозку пов’язані виражене емоційне забарвлення больових відчуттів (страх, страждання, жах, відчай тощо), що виникають, а також різноманітні вегетативні реакції.
Таким чином, шлях больових імпульсів від рецепторів до кори великого мозку досить складний і багатоплановий.
Відповідно до так званої теорії ворітного контролю болю («воріт болю»), яка протягом ряду років викликала значну зацікавленість, у спинному мозку (в желатинозній субстанції задніх рогів) є своєрідні «ворота», які пропускають у головний мозок больові сигнали. їхню роль виконує пресинаптичне гальмування аферентних волокон. У присутності больових стимулів це гальмування пригнічується і «ворота» відчиняються. Справді, давно помічено, що «біль полегшується болем». Можна нерідко спостерігати, як пацієнти, сидячи у кріслі стоматолога, щоб позбавитися болю, напружують м’язи кінцівок, стискують кулаки, ручки крісла, намагаються вщипнути себе за руку чи ногу. Усе це приносить їм деяке полегшення. Нерідко звичайне погладжування шкіри пом’якшує відчуття болю. Можливо, усі ці факти можна пояс
нити з точки зору теорії «воріт болю», але вона не одержала експериментального підтвердження. Правда, її трактовка може бути й іншою.
НОЦИЦЕПТИВНА
І АНТИНОЦИЦЕПТИВНА СИСТЕМИ
Ноцицептивна нейрогуморальна система утворена нейронами медіальних ділянок проміжного і середнього мозку, моста і довгастого мозку, а також спинного мозку. її основу утворюють три ланки: нейрони вентролатеральної ділянки центральної сірої речовини середнього мозку, нейрони великого ядра шва, яке лежить у довгастому мозку, і інтернейрони поверхневих пластин сірої речовини спинного мозку.
Істотне місце у ноцицептивній системі посідають також нейрони ретикулярної формації довгастого мозку. Важливими її ланками є нейрони фронтальної кори великого мозку і ділянок гіпоталамуса.
До ноцицептивної системи належать також різні хімічні речовини, зокрема медіатори і модулятори (альгетики та ін.), які мають важливе значення для походження больових відчуттів. Це субстанція Р, кініни (брадикінін, калідин, ентеротоксин), гістамін, серотонін, простагландин Еє, нейротензин, соматостатин, тканинні метаболіти, іони калію, водню, продукти запалення тощо. Ці речовини містяться у периферичних і центральних ноцицептивних структурах, у шкірі, залозах, ексудаті. Кініни виявлено також у отруті деяких змій, бджіл, ос, скорпіонів.
До антиноцицептивної (протибольової) нейрогуморальної системи належать нервові структури, сконцентровані, очевидно, переважно у стовбурі мозку. Сигналом для їх запуску є тривале й стійке збільшення інтенсивності больових впливів (наприклад, унаслідок масивної механічної травми або опіку).
Центральне місце у антиноцицептивній системі посідають нейрони, які містять ендогенні опіати — опіоїдні пептиди (ен-дерфін, мет- і лейкефалін). Так, нейрони префронтальної кори є енкефалічними. У гіпоталамічних нейронах містяться бета-ендорфЬ ни і динорфін-альфа-неендорфін. Нейрони центральної сірої речовини є енкефалін- і динорфінергічними тощо.
Морфіноподібні (опіоїдні) пептиди вперше було виділено з мозку в 70-х роках нашого століття. Вони отримали назву ендорфінів (у перекладі з грецької мови означає «у мозку»). За дією нагадують наркотичні препарати, а саме: справляють знеболювальний і заспокійливий вплив.
Вивчення молекул ендорфінів засвідчило, що у них є частина, спільна для всіх похідних морфіну. Саме вона потрібна для зв’язку із специфічними рецепторами нейронів (опіатними рецептора
ми), які виявлено у великій кількості у спинному мозку, медіальних ядрах таламуса, гіпоталамусі, лімбічних структурах, фронтальній корі й інших відділах ЦНС. Подразнення цих ділянок ЦНС, як і введення в організм ендорфінів, зумовлює сильний знеболювальний ефект.
Механізм дії ендогенних опіатів, їх роль у організмі і можливість використання поки що вивчені недостатньо. Доведено, що опіоїдні пептиди є модуляторами (як правило, гальмівними) звільнення медіаторів у нейросекреторних структурах мозку і взаємодіють при цьому як із нейромедіаторами, так і з нейропептидами. Є дані про кальційзалежне звільнення опіоїдних пептидів при деполяризації пресинаптичних закінчень. Доведено, що опіоїдні пептиди модулюють синаптичну передачу в спинному мозку, а саме: передачу сигналів, пов’язану з больовою чутливістю, і звільнення речовин (одного із гальмівних анальгетиків) із закінчень сенсорних нервів. Можливо, цей механізм лежить у основі теорії «воріт болю».
ФІЗІОЛОГІЧНІ основи
ЗНЕБОЛЮВАННЯ
Існуючі підходи до лікування при болю передбачають фізичні, фармакологічні (медикаментозні) і нейрохірургічні заходи, а також поведінкову терапію. До фізичних заходів належать іммобілізація, зігрівання або охолодження, електрознеболювання, діатермія, масаж і вправи для ослаблення напруження. Лікарські препарати (наприклад, новокаїн, лідокаїн, анальгін та ін.) можуть діяти на багатьох рівнях — на генерацію і проведення потенціалів дії (імпульсів) у больових волокнах (місцева анестезія) або блокувати передачу активності вихідними шляхами (наприклад, люмбальна анестезія). Можна пригнітити збудливість центральних нейронів (як це буває при ефірному інгаляційному наркозі), вплинути на структури «емоційного мозку» (седативні препарати). Зараз також пригнічують біль шляхом електростимуляції через шкіру або через вживлені електроди у сенсорні шляхи і ядра.
Ефективними при болю можуть бути голковколювання (акупунктура), електропунктура та інші методи рефлексотерапії. Вважають, що знеболювальний ефект грунтується на тому, що стимулюється вироблення гіпоталамо-гіпофізарною системою бета-ен-дорфінів, які блокують больові сигнали, котрі йдуть до вищих центрів. Останнім часом набув також поширення холодовий наркоз, або гіберкація, штучна гіпотермія.
Істотну роль у боротьбі з болем відіграють психологічні моменти. Кожна людина здатна протистояти болю, хоча і не може припинити або зменшити його інтенсивність. Вона може обмежити його вплив на психіку. Легше переносити біль, коли переключити
ся на справу, що потребує напружегіої розумової діяльності, тощо. Поведінка людини під час болю, як вважають багато фахівців, не завжди є адекватною, оскільки вона визначається її реакцією на відчуття болю. Помічено, що при хронічному болю, якщо пацієнти не отримують ніякої допомоги, вони ніби звикають до нього і не звертають уваги на больові відчуття.
Зараз частіше стали використовувати «поведінкову терапію» для боротьби з хронічним болем. Людина за допомогою «біологічного зворотного зв’язку» може позбавитись його (наприклад, при мігрені). У нашій країні було запропоновано метод часткового знеболювання пологів — фізіопсихопрофілактику. Він грунтується на природному фізіологічному гальмуванні, на формуванні домінанти. Цього досягають шляхом самонавіювання і застосування деяких спеціальних засобів. Спосіб знеболювання пологів, якщо ним правильно користуватись, виявляє потрібну дію.
До хірургічних методів лікування з приводу болю належать перерізування відповідного чутливого нерва вище від місця виникнення болю (периферична невротомія), перетин болепровідних шляхів у спинному мозку (лордотомія, комісури, бульбарна трак-тотомія) тощо. Особливе місце посідають операції на великому мозку. Мета їх полягає у тому, щоб розірвати зв’язки між таламусом і корою великого мозку, де формується об’єктивне відчуття болю. До них належать стереотаксична операція на ядрах таламуса (таламектомія), розтин нервових волокон у глибині лобної частки, які зв’язують її з таламусом (лобна лейкотомія), видалення кори задньої центральної звивини і відділів тім’яної частки, які прилягають до неї, кори скроневої частки і нижніх відділів лобної. Коло операцій при больових проявах значно ширше і не обмежується втручанням тільки на нервовій системі.
Клініко-фізіологічний аспект
Лікарям нерідко доводиться спостерігати пацієнтів, у яких незначне больове подразнення, а інколи й дотик супроводжуються сильним тривалим болем. Часто надмірна больова чутливість (гі-пералгезія) обмежується певними ділянками тіла, але інколи охоплює всю шкіру і зовнішні слизові оболонки. Хворим із підвищеною больовою чутливістю важко носити одяг, оскільки він викликає больове відчуття. Частіше відзначається підвищена чутливість до температури. В основі підвищеної чутливості лежать або патологічні зміни шкірних рецепторів, або порушення ЦНС (таламуса, кори великого мозку, задніх стовпів спинного мозку).
У клінічній практиці зустрічаються також люди, позбавлені больової чутливості (аналгезія). Вони не реагують на опіки, забиття, поранення тощо. На жаль, досі ще не встановлені причини цього явища. Проте той факт, що нечутливим до болю може бути
весь організм, вказує на центральне походження названої патології. Інколи людина добре відчуває біль, але не реагує на нього. Як показали результати посмертних анатомічних досліджень, у таких людей є ділянки переродження у лобних і тім’яних відділах головного мозку.
Відомо, що припинення або різке зменшення кровопостачання, зумовлене тими чи тими причинами, спричинює у кінцівці різкий біль. З’ясувалось, що джерелом больового відчуття є власне м’язи: біль виникає внаслідок подразнення нервових закінчень продуктами метаболізму, які утворилися у м’язах у відповідь на припинення кровопостачання (субстанція Р тощо). При недостатньому постачанні кров’ю тканини м’язів з’являється біль, на який нерідко скаржаться жінки. Це менструальний біль. Він виникає при звуженні просвіту судин матки внаслідок зміни їх внутрішньої оболонки.
У лікарській практиці нерідко зустрічаються хворі, які скаржаться на нестерпний біль у неіснуючих кінцівках (фантомний), тобто після їх ампутації. Це відчуття стає домінуючим, хоча хворий добре розуміє, що це тільки ілюзія. Він може розповідати про положення відсутньої кінцівки, про рух пальців та ін. Встановлено, що причиною фантомного болю нерідко є подразнення симпатичних сплетінь великих артеріальних стовбурів. Це аферентація, яка надходить у певні ділянки кори великого мозку, підтримує ті умовнорефлекторні зв’язки, уявлення, образи, які склались у людини протягом свідомого життя. Для виникнення фантомних відчуттів і фантомного болю конче потрібні подразнення, які виникають на периферії і надходять у ЦНС. Але без включення у процес центральних (кортикальних) механізмів явище фантому виникнути не може. Перебудова вищої нервової діяльності потребує часу.
Перемогти біль не можна лише за допомогою медикаментів, хоча у цій галузі досягнуто значних успіхів. Тому треба розвивати і вдосконалювати психофізіологічні дослідження, поглиблювати знання про фізіологічні і біохімічні механізми болю.
Роль ЦНС у регуляції рухових функцій
Скелетні м’язи — основний орган взаємодії організму з навколишнім середовищем і впливу на нього. У процесі еволюції най-пристосованішими виявились ті індивіди, у кого рухова система найбільш досконала. Вона забезпечує пошуки їжі, захист від ворогів, продовження роду та інші життєво важливі процеси. Існують два види рухових функцій — власне рух (локомоції — переміщення у просторі, тобто ходьба, біг, стрибки, плавання) .і підтримка положення тіла (пози) у просторі. Тому цю систему називають
опори'о- руховою. До неї належать м’язи, сухожилля, суглоби, кістки, а також нервові і гуморальні механізми регуляції. Для скорочення м’язи отримують сигнали від рухових центрів, розташованих у різних відділах ЦНС. Умовно ці центри можна розподілити на 5 відділів: спинний мозок, задній мозок, середній мозок, проміжний мозок і кора великого мозку.
У розташуванні цих центрів простежується чітка ієрархія, яка свідчить про поступове вдосконалення регуляції рухових функцій у процесі еволюції. Нижчерозташовані центри підпорядковувались вищим структурам, філогенетично молодшим. Для чіткого виконання рухів треба, щоб рухові центри постійно одержували інформацію від рецепторів рухового апарата про положення тіла, про те, як виконується той чи той рух (зворотна аферентація). Такими рецепторами є пропріорецептори ОРС — м’язові веретена, рецептори сухожиль та суглобів. Для виконання певних рухів потрібна також інформація від тактильних та зорових рецепторів.
РОЛЬ СПИННОГО МОЗКУ
В РЕГУЛЯЦІЇ РУХОВИХ ФУНКЦІЙ
Значення цього філогенетично найстарішого відділу ЦНС полягає в тому, що тільки через нього головний мозок може керувати позою і рухами. Лише через спинний мозок надходять до головного мозку імпульси від рецепторів м’язів і шкіри. Але спинний мозок має і певну автономію — він може самостійно керувати деякими найпростішими рухами завдяки своїй рефлекторній діяльності.
ЗАГАЛЬНИЙ ПЛАН ОРГАНІЗАЦІЇ
СПИННОГО МОЗКУ
Спинний мозок розташований у хребетному каналі. Він має сегментарну будову. Розрізняють шийний, грудний, поперековий та крижовий відділи. Від кожного сегмента відходять по дві пари передніх (вентральних) і задніх (дорсальних) корінців. Якщо перерізати задні корінці, то втрачається чутливість, настає анестезія в зоні їх іннервації. Якщо ж перерізати передні корінці, то втрачається рухова функція, настає параліч відповідної ділянки. Це дало підстави зробити висновок про те, що задні корінці виконують чутливу функцію, а передні — рухову (закон Белла—Ма-жанді). Чутливих волокон у задніх корінцях значно (приблизно у 20 разів) більше, ніж рухових у передніх. Це свідчить про значення інформації, яка надходить із периферії до ЦНС.
На поперечному розрізі спинного мозку видно, що центрально розташована сіра речовина. В ній розрізняють передні й задні ро-142
ги. У грудному відділі розвинуті ще й бічні (латеральні) роги. Сіра речовина містить велику кількість (близько 107) нейронів. Це рухові й проміжні нейрони (інтернейрони). Рухові нейрони локалізуються в передніх рогах, їхні аксони іннервують скелетні м’язи. Центральна частина сірої речовини містить проміжні інтернейрони з коротшими аксонами, які утворюють безліч контактів із клітинами спинного мозку. Від цих нейронів часто залежить, той або той рух буде посилений чи загальмований.
Сіра речовина спинного мозку в задньо-передньому напрямі має пошарову будову. Виділяють 10 шарів (пластин Рекседа), у кожному із них згруповані нейрони певного типу. В передніх рогах кожного сегмента розташовано по кілька тисяч рухових нейронів — мотонейронів. Вони можуть бути двох типів — а- та у-мото-нейрони.
а-М отонейрони мають більші за розміром клітини, їх аксони швидко проводять імпульси (70—120 м/с). Вони іннервують екстрафузальні м’язові волокна, які забезпечують скорочення скелетних м’язів. Кожний аксон іннервує від кількох м’язових волокон до кількох тисяч. Мотонейрон і м’язові волокна, які він іннервує, називають нейромоторною одиницею.
За характером впливу на м’язи виділяють повільні (тонічні) і швидкі (фазичні) а-мотонейрони які іннервують різні волокна м’яза. Тонічні а-мотонейрони, забезпечують тонус м’язів, фазичні — швидке скорочення. Тонічні а-мотонейрони характеризуються тривалою імпульсацією відносно невеликої частоти (10—20 Гц), фазичні дають короткі залпи імпульсів із більшою частотою (ЗО— 60 Гц).
Клітини у-мотонейронів значно менші, ніж клітини а-мотонейронів. Є їх досить багато (близько ЗО % від загальної кількості всіх мотонейронів). Швидкість проведення імпульсів волокнами у-мотонейронів значно менша (10—40 м/с). Ці мотоней-рони іннервують інтрафузальні м’язові волокна, що містяться в середині м’язових рецепторів — веретен.
У білій речовині спинного мозку, яка локалізована по краях сірої, проходять нервові волокна, які утворюють висхідні та низхідні шляхи спинного мозку, котрі проходять у задньому (дорсальному), боковому (латеральному) і передніх (вентральних) канатиках.
ФУНКЦІЇ СПИННОГО МОЗКУ
Розрізняють дві основні функції спинного мозку — рефлекторну та провідникову. Рефлекторна функція залежить від сенсорної інформації, яка надходить від пропріорецепторів, рецепторів шкіри тулуба, кінцівок, а також від вісцерорецепторів внутрішніх органів.
Рефлекторні реакції спинного мозку різноманітні. Вони порівняно прості, мають сегментарний характер, їх функціональне значення полягає у підтриманні тонусу м’язів, виконанні рухових і вегетативних функцій. Частина з них залежить безпосередньо від діяльності спинного мозку, інші — від структур головного мозку, які посилають до мотонейронів спинного мозку командні сигнали (низхідний контроль діяльності спинного мозку).
Розрізняють тонічні (міотатичні, шийні, рефлекс опори та ін.) і ф а з и ч н і (сухожильні, черевні, розгинальні перехресні, ритмічні та ін.) рефлекси. Значною мірою рефлекторні реакції спинного мозку залежать від імпульсів, що надходять від пропріо-рецепторів.
ПРОПРІОРЕЦЕПТОРИ М'ЯЗІВ
Розрізняють три види пропріорецепторів — м’язові веретена, сухожильні органи Гольджі і рецептори суглобів. М’язові веретена складаються із центральної частини — ядерної сумки — і периферичних, у яких міститься 12—13 тонких інтрафузальних м’язових волокон. Довжина веретена досягає кількох міліметрів, а діаметр — кількох десятих часток міліметра. Прикріплюються веретена до екстрафузальних волокон паралельно. У різних м’язах кількість веретен на 1 г тканину різна — від кількох до кількох сотен. Що точніші рухи виконує м’яз, то більш у ньому веретен.
У центральній частині веретена міститься спіралеподібне нер-
Мал. 81. А — будова м’язового веретена: 1 — ядерна сумка; 2— інтрафузальні волокна; З — екстрафузальні волокна; 4 — аферентне волокно від рецепторів веретена; 5 — аксон мото-нейрона.
Б — вплив розтягування м'яза на частоту імпульсів від рецепторів веретена
Мал. 82. Схема рефлекторної дуги міостатичного рефлексу: / — м’язове веретено; 3— аферентний нерв; 3 — клітина а-мотоней-рона; 4 — еферентний нерв; б — екстрафузальні волокна м’яза
Мал. 83. Схема у-еферентної системи — у-петлі (за даними Р. Ф. Шмідта, Г. Тев-са, 1985):
/ — м’язове веретено; 2 — клітина а-мотоней-рона; 3 —клітина у-мотонейрона; 4 — аферентне волокно, ідо проводить імпульси від рецепторів веретена; 5 — вплив на а- та •у-мотонейронн вищерозташованих відділів ЦНС
вове закінчення, яке виконує ре-цепторну функцію. Звідси починається аферентне волокно (типу Аа), що проводить збудження дуже ШВИДКО. Якщо відводити ПД від цього волокна при розтяганні м’яза (мал. 81), то можна помітити, що частота імпульсів залежить від ступеня розтягання. Різні види веретен інформують ЦНС про зміни довжини м’яза, а також про швидкість, з якою вона змінюється.
Спіралеподібне нервове закінчення в ядерній сумці може збуджуватись й іншим шляхом —
при скороченні інтрафузальних м’язових волокон. На їх скорочення впливають у-мотонейрони.
Під впливом у-мотонейронів скорочуються інтрафузальні волокна. Це зумовлює розтягання спіралеподібного нервового закінчення в ядерній сумці, а отже, й посилення імпульсації в спинний мозок. Сенсорні нейрони закінчуються біля а-мотонейронів, збуджують їх, і внаслідок цього скорочуються екстрафузальні волокна. Ці реакції лежать в основі міотатичних рефлексів — рефлексів на розтягання (мал. 82). Так називається рефлекторне скорочення м’язів у відповідь на їхнє розтягання. Латентний період цих рефлексів дуже короткий, що пояснюється моносинаптичністю їх рефлекторної дуги. Рефлекс утримується доти, доки триває розтягання м’яза. Напруження м’яза тим більше, чим більше він розтягується. Міотатичні рефлекси більшою мірою виражені в антиграві-таційних м’язах — екстензорах.
Вищерозташовані відділи ЦНС можуть впливати на функції м’язів як прямо (через а-мотонейрони), так і непрямо (через у-мотонейрони). Другий механізм впливу здійснюється через у-пет-лю (мал. 83). З її допомогою довжина м’язового веретена за принципом позитивного зв’язку регулює довжину м’яза і запобігає його надмірному розтяганню.
Функції органів Гольджі в сухожиллях відрізняються від функцій м’язових веретен тим, що ці рецептори реагують на величину
і швидкість напруження м’яза. Сигнали від цих рецепторів передаються волокнами типу ір до гальмівних мотонейронів, які гальмують а-мотонейрони передніх рогів. Ці рефлекси забезпечують негативний зворотний зв’язок, який запобігає надмірному скороченню м’яза, котре може призвести до розриву сухожилля або його відриву від кістки.
Крім названих рецепторів, є ще рецептори в суглобах, які інформують ЦНС про ступінь згинання або розгинання в цьому суглобі. Таким чином, імпульси, що надходять у ЦНС, дають інформацію про довжину м’яза та швидкість зміни цієї довжини (м’язові веретена), про напруження (скорочення) м’яза та швидкість його зміни (сухожильні органи Гольджі), про процеси, які відбуваються в суглобах (рецептори суглобів).
ТОНІЧНІ РЕФЛЕКСИ
СПИННОГО МОЗКУ
Вплив спинного мозку на тонус м’язів можна продемонструвати, якщо у «спінальної» жаби перерізати сідничний нерв або задні корінці спинного мозку. На тому боці, де перерізаний нерв, задня кінцівка буде трохи довшою, що вказує на зниження тонусу в її м’язах. Є кілька видів тонічних рефлексів спинного мозку. Один з них — розглянутий вище міотатичний рефлекс. До тонічних належать також шийні рефлекси. їхні рецептори містяться у м’язах шиї, вони збуджуються при повороті або нахилі голови. Рефлекторна дуга полісинаптична, замикається на рівні І—III шийних сегментів. Імпульси від цих сегментів передаються до м’язів тулуба і кінцівок, зумовлюючи перерозподіл їхнього тонусу, підвищуючи загалом тонус м’язів-розгиначів.
ФАЗНІ РЕФЛЕКСИ
СПИННОГО МОЗКУ
Ці рефлекси зумовлюють короткочасне скорочення м’язів. До них належать сухожильні рефлекси, які виникають при швидкому розтягуванні м’яза. Наприклад, у відповідь на легенький удар молоточком по сухожиллю м’яз швидко скорочується. Ці рефлекси особливо виражені на розгиначах, зокрема, на чотирьох-головому та литковому м’язах. Прикладом може бути колінний рефлекс, який виникає при ударі молоточком по сухожиллю чо-тирьохголового м’яза (мал. 84). Подібний рефлекс виникає при ударі по ахілловому сухожиллю (ахілловий рефлекс). При цьому скорочується литковий м’яз. При ударі по сухожиллю м’яза верхньої кінцівки виникає ліктьовий рефлекс. Основні види сухожильних рефлексів описано в табл. 4.
Сухожильні рефлекси мають короткий латентний період, бо
Таблиця 4. Деякі клінічно важливі спинномозкові рефлекси людини
Рефлекс Подразнення, яке зумовлює рефлекс Характер рефлекторної відповіді Центр рефлекторної дугн
Сухожильні:
а) ліктьо- Постукування молоточ- Згинання зігнутої у лік- V—IV шийні
вий ком по сухожиллю ті руки сегменти
т. Ьісерз ЬгасЬіі
б) колін- Легенький удар по сухо- Розгинання гомілки III—IV попере-
ний жиллю нижче від колін- ковий сегмент
ної чашечки
в) ахіл- Удар по п’ятковому Підошовне згинання сто- 1—II крижовий
ловий (ахілловому) Шкірні: а) черев- Проведення ні шкірі: сухожиллю пи сегмент штриха по
верхній вище від пупка Скорочення м’язів че- VII—VIII груд- ревної стінки в ділянці ний подразнення серед- на рівні пупка » IX—X » ній нижній нижче від пупка » XI—XII »
б) яєчко- Проведення вий внутрішній (крема- в стегна стернин) штриха по Піднімання яєчка І—II попереко- поверхні вий
в) підо- Проведення штриха по Згинання усіх пальців V попереко-
шовний підошовній шкіри поверхні ноги вий — І крижо- вий
вони моносинаптичні. При сильному розтягуванні м’яза поряд із м’язовими веретенами збуджуються й сухожильні органи Гольджі. Внаслідок цього може виникати не скорочення, а розслаблення м’яза. Фізіологічне значення названих рефлексів полягає у підтриманні постійної довжини та тонусу м’язів.
Шкірні рефлекси виникають при подразненні шкіри. Це захисні рефлекси. Рефлекторна дуга такого рефлексу полісинап-Тична (мал. 85). До шкірних рефлексів належать черевні, кремас-терний. При подразненні шкіри стопи (тиском) спостерігається підошовне згинання стопи. Це підошовний рефлекс. Він забезпечує при стоянні контакт нижньої кінцівки з опорою, а також початкове притискання стопи з наступним її відштовхуванням при ходьбі.
Розгинальний перехресний рефлекс тісно пов’язаний із згинальним захисним. Рефлекторне згинання однієї кінцівки часто супроводжується скороченням м’язів-розгиначів протилежного боку, на який у природних умовах переноситься маса тіла. Такий рефлекс називається ще перехресним (контралатераль-
Мал. 84. Схема дуги колінного рефлексу:
/ — удар по сухожиллю; 2 — м’язове веретено; 3 — аферентний нерв; 4 — клітина а-мотонейрона; г5 —еферентний нерв; 6 — м’яз-розгннач коліна;
7 — гальмівний мотонейрон; 8 — м’яз — згинач коліна
Мал. 85. Схема дуги згинального рефлексу:
І — рецептор у шкірі; 2 — аферентний нейрон; З — задній ріг; 4 — інтернейрони; 5 ~ передній ріг; 6 — еферентний нейрон; 7 — міоневральні синапси
ним) розгинальним. Він здійснюється завдяки переходу імпульсів від аферентних волокон на протилежний бік, де збуджуються мо-тонейрони розгиначів і гальмуються мотонейрони згиначів.
Ритмічні рефлекси досить складні. Прикладом можуть бути рухи кінцівок під час ходьби чи бігу. Ці рефлекси виникають при тривалій дії на шкіру подразників помірної сили. Унаслідок цього протягом певного часу відбувається циклічна реципрокна взаємодія центрів згиначів і розгиначів, коли збудження в одних центрах змінюється їх наступним гальмуванням і навпаки. Основою цих рефлексів є процеси, що відбуваються у власне спинному мозку і здатні з характерною періодичністю перемикати збудження з однієї групи нейронів на іншу.
СПІНАЛЬНИЙ ШОК
Відразу після перерізування або іншої травми спинного мозку тимчасово зникають усі спінальні рефлекси. Тривалість шоку залежить від філогенетичного розвитку ЦНС. Так, у жаб він триває кілька хвилин, у хижаків— кілька годин, у мавп — кілька тижнів, у людини — кілька місяців. Причина шоку полягає головним чином у вимиканні регуляторних впливів вищерозташованих відділів ЦНС (ретикулярна формація, кора великого мозку тощо). Під час шоку спостерігається гіперполяризація постсинаптичної мембрани мотонейронів спинного мозку, що є основою гальмування. Очевидно, в природних умовах вищі відділи ЦНС збуджують, тонізують центри спинного мозку.
Після травматичного розриву спинного мозку на рівні II— XII грудних сегментів (як це буває при автомобільній катастрофі) виникає повна параплегія, яка характеризується зникненням усіх довільних рухів, що іннервуються тими сегментами, котрі лежать нижче від рівня травми (наслідок порушення пірамідних шляхів), а також тимчасовим порушенням рефлексів, дуга яких з’єднується в цих сегментах. Одночасно повністю втрачається тактильна, температурна, пропріоцептивна та больова чутливість унаслідок розриву висхідних шляхів (спіноталамічного, Голля, Бурдаха та ін.).
Недовільні рухові рефлекси поступово (протягом тижнів і місяців) відновлюються (спочатку згинальні, пізніше розгинальні). У цей період рефлекси Навіть посилюються (стадія гіперрефлексії) поряд з підвищенням тонусу м’язів та появою патологічних рефлексів (наприклад, рефлексу Бабінського).
РОЛЬ ЗАДНЬОГО МОЗКУ
В РЕГУЛЯЦІЇ РУХОВИХ ФУНКЦІЙ
До цього відділу ЦНС належать довгастий мозок та міст головного мозку. Основні функції заднього мозку в регуляції рухових функцій: 1) аналіз сенсорної інформації, що надходить в ядра заднього мозку від рецепторів шкіри та м’язів голови, і еферентна іннервація скелетних м’язів голови;
2) аналіз сенсорної інформації, що надходить від вестибулярних рецепторів, пропріорецепторів м’язів шиї, тулуба, кінцівок, та рефлекторна регуляція тонусу м’язів тіла, яка забезпечує певну позу (тонічні рефлекси пози);
3) провідникова функція — проходження нервових імпульсів, що йдуть у вищерозташовані відділи ЦНС та від них до скелетних м’язів.
Сенсорна інформація надходить від рецепторів шкіри обличчя, слизових оболонок носа, зубів, окістя кісток черепа, пропріорецепторів окорухових м’язів, смакових рецепторів, рецепторів вестибулярного апарата та слуху, глотки, рецепторів багатьох внутрішніх органів.
Еферентна іннервація забезпечує функцію жувальних, окорухових, мімічних м’язів, м’язів язика, глотки, гортані, шиї. Ці функції забезпечуються нервами, що ще зберігають здатність до сегментарної іннервації, але вона виражена менш чітко, ніж у спинному мозку.
Надзвичайно велику роль відіграє задній мозок у підтриманні пози антигравітації (забезпечується тонусом м’язів) та перерозподілі тонусу при зміні положення голови. Жаба, у якої перерізаний мозок між довгастим та спинним (так звана спінальна тварина), не може підтримувати тонус скелетних м’язів на такому рівні,
Мал. 86. Локалізація рухових ядер у стовбурі головного мозку (за даними А. Гайтона, 1991): /—ретикулярні ядра моста;
2 — вестибулярні ядра; 3 — ретикулярні ядра довгастого мозку
якого було б досить для створення пози антигравітації. Така тварина лежить розпластана на горизонтальній поверхні.
Жаба, у якої перерізаний мозок вище від заднього, має позу, яка дозволяє перебороти силу гравітації Землі. Для створення такої пози важливе значення має тонус м’язів-екстензорів. Цей тонус має рефлекторну природу, бо він зникає після перерізування задніх корінців нервів, що входять у спинний чи довгастий мозок. Центрами регуляції є три рухові ядра заднього мозку: 1) вестибулярне ядро; 2) ядра ретикулярної формації варолієвого моста; 3) ядра ретикулярної формації довгастого мозку (мал.86).
За участю цих центрів реалізуються тонічні рефлекси пози, серед яких розрізняють вестибулярні статичні та шийні.
Вестибулярні статичні рефлекси розпочинаються з рецепторів перед-двер’я — сферичного та еліптичного мішеч
ків. Вони були детально досліджені голландським фізіологом В. Ма^пиз (1924).
Існує кілька видів вестибулярних статичних рефлексів: 1) при підніманні голови підвищується тонус м’язів-екстензорів передніх кінцівок (мал. 87) і знижується тонус цих м’язів задніх кінцівок; 2) при нахилянні голови вниз спостерігається протилежний ефект; 3) при нахилянні голови вбік збільшується тонус м’язів-екстензорів з того боку, куди нахилена голова.
Значення цих рефлексів полягає в тому, що відбувається перерозподіл тонусу м’язів при зміні положення голови, і це забезпечує підтримання рівноваги. Волокна вестибулоспінального шляху йдуть своїм боком часто моносинаптично до а- та у-мотонейронів передніх рогів спинного мозку. Під впливом цих волокон збуджуються а- та у-мотонейрони екстензорів і гальмуються мотонейрони флексорів. При порушенні вестибулярного апарата чи вестибулярних ядер спостерігаються істотні зміни в регуляції тонусу скелет4 них м’язів, а у зв’язку з цим порушення і в локомоціях.
Шийні тонічні рефлекси дублюють вестибулярні статичні рефлекси. Ці рефлекси починаються з пропріорецепторів м’язів шиї. Імпульси надходять у рухові центри довгастого мозку, а звідти — до мотонейронів спинного мозку. Ці рефлекси впливають не лише на м’язи кінцівок, а й на очні м’язи (забезпечується компенсаторна установка очних яблук при зміні положення голови). Відхилення голови супроводжується рухом очних яблук у
Мал. 87. Схема рефлексів пози (за даними А. В. Коробкова та С. А. Чесно-кової, 1986). Зміна пози тварини залежно від положення голови:
1 — голова нахилена вниз; 2— голова піднесена вгору; 3 — голова повернена ліворуч; 4— голова повернена праворуч
протилежному напрямку. Таким чином зберігається правильна зорова орієнтація. У чистому вигляді шийні рефлекси можна спостерігати після руйнування вестибулярного апарата.
Вимкнути шийні рефлекси можна за допомогою перерізування задніх корінців відповідних сегментів спинного мозку або накладання гіпсової пов’язки на шию, яка робить нерухомими шийні м’язи.
Вплив ретикулярної формації стовбура головного мозку на діяльність рухових центрів спинного був відкритий І. М. Сєчено-вим у 1862 р. Механізм гальмування рефлексів спинного мозку можна пояснити постсинаптичним гальмуванням мотонейронів, впливом на проміжні інтернейрони або на терміналі аферентних волокон, які входять у спинний мозок. Зараз відомо, що локальне подразнення гігантоклітинного ядра ретикулярної формації довгастого мозку зумовлює гальмування згинальних та розгинальних рефлексів спинного мозку.
Крім гальмівних впливів інші ділянки ретикулярної формації (латеральні зони) можуть полегшувати спінальні рефлекси. При цьому знижується поріг та скорочується латентний період цих рефлексів.
Вплив ретикулярної формації здійснюється через два ретику-лоспінальні шляхи — медіальний та латеральний. Медіальний шлях розпочинається від варолієвого моста і, не перехрещуючись, йде до сегментів спинного мозку. При цьому збуджуються мото-нейрони екстензорів і гальмуються мотонейрони флексорів. Волокна цього шляху проходять у передніх відділах спинного мозку поруч із вестибулоспінальним шляхом і зумовлюють подібний ефект.
Ретикулярна формація довгастого мозку діє протилежним чином. Вона збуджує а- та у-мотонейрони флексорів і гальмує мотонейрони екстензорів. Ці впливи реалізуються через латеральний
ретикулоспінальний шлях, частина волокон якого йде по своєму боці, а частина переходить на протилежний бік.
Рухові центри ретикулярної формації стовбура головного мозку одержують численні колатералі від аферентних шляхів, що йдуть у цей відділ ЦНС, а також від еферентних шляхів моторної кори, базальних гангліїв, лімбічної системи, гіпоталамуса.
РОЛЬ СЕРЕДНЬОГО МОЗКУ В РЕГУЛЯЦІЇ РУХОВИХ ФУНКЦІЙ
До цього відділу ЦНС належать червоні ядра, чорна субстанція, ретикулярна формація середнього мозку, ядра НІ (окорухово-го) та IV (блокового) черепних нервів, чотиригорбкове тіло. Через середній мозок проходять висхідні та низхідні шляхи, які проводять імпульси до вищерозташованих центрів та від них.
Децеребраційна ригідність. Цей стан характеризується різким підвищенням тонусу м’язів — екстензорів кінцівок, голови, тулуба, хвоста (мал. 88). Якщо тварину поставити на лапи, то вона буде стояти, наче іграшкова. Децеребраційна ригідність розвивається,
Мал. 88. Децеребраційна ригідність у кішки (а). Схема (б) розташування рухових центрів у стовбурі головного мозку (за даними Р. Ф. Шмідта, Г. Тевса, 1985):
/ — червоне ядро; 2— ретикулярна формація моста; 3 — вестибулярні ядра; 4 — ретикулярна формація довгастого мозку; 5 — мозочок; 6 — спинний мозок; І — пере-різка між середнім та довгастим мозком зумовлює децеребраційиу ригідність; II—III — перерізка вище від червоного ядра або нижче від довгастого мозку ригідністю не супроводжується
якщо зробити перерізування по лінії І, відокремивши таким чином червоне ядро від структур довгастого мозку. Перерізування по лінії II, тобто више від червоного ядра, або по лінії III, тобто нижче від довгастого мозку, не спричиняє децеребраційної ригідності. Руйнування ядра Дейтерса призводить до того, що децеребрацій-на ригідність зникає. Всі ці факти свідчать про роль взаємодії червоного ядра і ядра Дейтерса у розвитку цієї ригідності. Основна її причина — усунення гальмівних впливів червоного ядра на ядро Дейтерса. У такому разі переважають реакції названого ядра на мотонейрони м’язів-екстензорів. Гальмівну дію справляє не лише червоне ядро, а й мозочок та моторна кора, що діють через нього.
Децеребраційна ригідність має рефлекторний характер, бо вона зменшується після перерізування задніх корінців спинного мозку або вестибулослухового нерва.
РЕФЛЕКСИ ВИПРЯМЛЕННЯ
Природна поза тварини — тім’ям угору. Якщо ж тварину спробувати перевернути, то вона прагнутиме набути своєї початкової природної пози. Проте «спінальна» жаба неспроможна перевернутись, вона залишається лежати на спині. «Мезенцефальна» тварина може повертатись у початкову позу. Прикладом дії рефлексу випрямлення може бути поведінка підкинутої вгору кішки — вона буде перевертатись у повітрі і приземлиться обов’язково на лапи. Рефлекс цей має ланцюговий характер. Спочатку спостерігається його лабіринтна фаза. Рецептори вестибулярного апарата сприймають інформацію про неприродне положення голови, яка надходить до ЦНС, і голова повертається в положення тім’ям угору. На це реагують м’язи шиї, імпульси від їх пропріорецепторів надходять у ЦНС. Унаслідок цього відбувається перерозподіл тонусу м’язів тулуба, кінцівок, і тварина набуває природного положення (мал. 89).
У формуванні рефлексу випрямлення беруть участь також рецептори шкіри, що контактують з поверхнею, на якій лежить чи сидить тварина, а також рецептори зорового аналізатора. Таким чином, рефлекс випрямлення досить складний і складається з кількох компонентів.
Значення рефлексу випрямлення полягає в тому, що він певним чином контролює позу, якщо вона порушується, нормалізує її.
СТАТОКІНЕТИЧНІ РЕФЛЕКСИ
Статокінетичні рефлекси спрямовані на збереження пози і підтримання рівноваги у разі прискорення. Розрізняють горизонтальне (початок чи закінчення руху в цій площині), вертикальне (на-
Мал. 89. Перевертання кішки при падінні спиною вниз (за даними Р. Магнуса, 1924).
Кінематографічна змойка свідчить, що спочатку повертається в нормальне положення голова, а потім тулуб. Після цього розгинаються передні кінцівки
приклад, так звані ліфтні реакції) та кутове (при поворотах) прискорення. При цьому подразнюються волоскові клітини напівкруж-них каналів. Звідти вестибулослуховим нервом імпульси йдуть до ядер цього нерва. Реалізуються статокінетичні рефлекси за участю рухових ядер довгастого і середнього мозку.
При кутовому прискоренні спостерігається повільний рух голови у бік, протилежний напряму обертання, а потім голова швидко повертається у нормальне положення, щоб згодом знову повторити повільний рух, і т. д. Такі рухи називаються ністагмом голови.
Очні яблука реагують на обертання аналогічно — повільний поворот їх у бік, протилежний обертанню, супроводжується швидким повертанням у початкове положення (ністагм очей). Значення ністагму полягає в тому, що завдяки йому зберігається нормальна зорова орієнтація під час руху.
Статокінетичні рефлекси досліджують під час професійного відбору осіб, праця яких за фахом супроводжується істотним збудженням вестибулярного апарата (пілоти, космонавти, моряки та ін.).
ОРІЄНТОВНІ РЕФЛЕКСИ
Орієнтовні рефлекси ще називають сторожовими, або, за влучним висловом І. П. Павлова, рефлексами «що таке?» Вони полягають у швидкому повороті голови, тулуба, очних яблук у напрямку світлового або звукового подразника. У рефлексах беруть участь передні горбки чотиригорбкового тіла (первинні зорові центри) — у відповідь на світлове подразнення виникають зорові орієнтовні рефлекси, а також задні (первинні центри слуху) — у відповідь на звукові подразники формуються слухові орієнтовні рефлекси.
Завдяки цим рефлексам організм орієнтується у нових ситуаціях, готується до захисту, нападу чи інших дій відповідно до світлових або звукових подразнень. Одночасно відбувається перерозподіл тонусу м’язів — переважно підвищується тонус флексо-рів, посилюється діяльність серця та ін. Ушкодження горбиків чотиригорбкового тіла призводить до втрати здатності визначати джерела світлових чи звукових подразників. Через первинні зорові центри замикається ряд інших рефлексів — відбувається акомодація та конвергенція очей.
ЗНАЧЕННЯ ЧЕРВОНИХ ЯДЕР
Від червоних ядер середнього мозку починається руброспі-нальний шлях, який зразу після початку переходить на протилежний бік. Шлях цей іде в бокових стовпах спинного мозку, його во
локна закінчуються переважно на інтернейронах, а частина — на мотонейронах. Основний вплив червоних ядер полягає в збудженні а- та у-мотонейронів-згиначів і в гальмуванні мотонейронів-роз-гиначів.
У червоному ядрі існує певне топографічне представництво скелетних м’язів. Локальне подразнення окремих його відділів викликає скорочення одного м’яза чи груп м’язів.
Руброспінальний шлях функціонує в тісному взаємозв’язку з пірамідним шляхом. Вони обидва йдуть у латеральних стовпах, рпливають переважно на функції дистальних груп м’язів, і тому їх називають латеральною руховою системою (на відміну від вес-тибулоретикулоспінальної медіальної рухової системи).
ЗНАЧЕННЯ ЧОРНОЇ РЕЧОВИНИ
Функція чорної речовини також пов’язана з регуляцією рухів, зокрема допоміжних, які супроводять основні (наприклад, ритмічні рухи рук при ходьбі чи бігу), а також діяльністю мімічних м’язів. Чорна речовина філогенетично давнє утворення. Функціонально вона тісно пов’язана з базальними гангліями.
Нейрони чорної речовини мають дофамінергічну природу. У разі патології чорної речовини (наприклад, при хворобі Паркінсона) міміка бідна, допоміжні рухи обмежені тощо. Для лікування таких хворих застосовують попередник дофаміну, бо останній погано Проходить через гематоенцефалічний бар’єр.
УЧАСТЬ ПРОМІЖНОГО МОЗКУ
В РЕГУЛЯЦІЇ РУХОВИХ ФУНКЦІЙ
До проміжного мозку належать таламус і гіпоталамус. До складу моторних ядер таламусу входить вентролатеральне ядро. Саме люди спрямовуються імпульси від мозочка, базальних гангліїв, .а від цих ядер — до моторної зони кори великого мозку.
Гіпоталамічна ділянка має численні аферентні та еферентні зв’язки з різними відділами ЦНС і грає головну роль у підтриманні гомеостазу, впливаючи на функції вегетативної нервової та .ендокринної систем. Гіпоталамус бере участь у регуляції обміну речовин, функцій органів травлення та кровообігу, підтриманні температури тіла на постійному рівні, а також у формуванні багатьох поведінкових реакцій, пов’язаних із голодом, насиченням, спрагою, сном, статевими реакціями тощо. Важлива роль гіпота-.ламусу в пристосуванні (адаптації) організму до різних умов існування, зокрема до фізичної праці.
РОЛЬ ПЕРЕДНЬОГО МОЗКУ В РЕГУЛЯЦІЇ РУХОВИХ ФУНКЦІЙ
До переднього мозку належать базальні ганглії та кора великого мозку.
\
РОЛЬ БАЗАЛЬНИХ ГАНГЛІЇВ
Базальні ганглії розташовані в глибині великого мозку між лобними частками і проміжним мозком. До них належать хвостате ядро, шкаралупа (разом вони складають смугасте тіло), а також бліда куля. З цими структурами тісно пов’язані функціонально субталамічне ядро і чорна речовина. Функції базальних гангліїв вивчали за методами локального їх подразнення або руйнування, реєстрації електричної активності, спостереження за проявами порушення функцій людини при ураженні базальних гангліїв.
Вони тісно пов’язані між собою, а також з різними відділами кори великого мозку, мозочком, з червоним ядром, іншими ядрами стовбура головного мозку.
Розрізняють два види циркуляції збудження в базальних гангліях — цикл шкаралупи і цикл хвостатого ядра.
Цикл шкаралупи забезпечує разом з моторними зонами кори великого мозку складні рухи. Наприклад, письмо, рухи рук хірурга, піаніста тощо. Ці рухи потребують попереднього навчання і тренування. Цикл розпочинається в премоторних і додаткових моторних зонах кори великого мозку,/ поширюється у напрямку шкаралупи (повз хвостате ядро) до внутрішньої частини блідої кулі, потім — до таламусу і знов до кори великого мозку, тобто до первинної моторної зони, премоторної та додаткової ділянок (мал. 90). Існують і допоміжні цикли циркуляції збудження (за участю субталамічного ядра та чорної речовини).
У разі ушкодження шкаралупи спостерігається спонтанне трем-тіння різних частин тіла як у стані спокою, так і під час довільних рухів. Це спостерігається у хворих на хорею. У випадку ураження блідої кулі, навпаки, буває гіпокінез.
Цикл хвостатого ядра. Під час названого циклу збудження циркулює від лобних зон мозку через парієтальну та потиличну зони у скроневу ділянку. Хвостате ядро одержує імпульси від асоціативних зон кори великого мозку, потім імпульси йдуть до шкаралупи, блідої кулі, таламусу і нарешті до рухових зон кори великого мозку (мал. 91). Роль цього циклу полягає в синтезі сенсорних впливів і інформації, що зберігається в пам’яті. Цей цикл регулює не окремі рухи, а їх моделі, що відповідають певній меті (наприклад, поведінку людини при зустрічі з небезпечним звіром). Цей цикл бере участь у процесі регуляції швидкості та
Чорна субстанція
Мал. 90. Цикл шкаралупи (за даними А. Гайтона, 1991)
Мал. 91. Цикл хвостатого ядра (за даними А. Гайтона, 1991)
Від кори
Чорна субстанція
Хіостате ядро
Дофамін
величини виконуваних рухів. У разі патології базальних гангліїв названі параметри порушуються.
Нейротрансмітери базальних гангліїв. Велика увага приділяється дослідженню механізмів передавання імпульсів у гангліях за участю різних медіаторів. Нейрони, що зв’язують чорну речовину з хвостатим ядром і шкаралупою, виділяють дофамін. Інформація від хвостатого ядра і шкаралупи передається до блідої кулі і чорної речовини за допомогою ГАМК. Через ацетилхолін реалізуються впливи від кори великого мозку до хвостатого ядра і шкаралупи (мал. 92). Нейрони стовбура головного мозку виділяють різні нейротрансмітери — норадреналін, серотонін, енкефалін та ін.
ГАМК і дофамін — гальмівні медіатори, ацетилхолін — збуджувальний. Знання нейротрансмітерів базальних гангліїв має не тільки теоретичне значення. При хворобі Паркін-сона, коли порушується функція чорної речовини, синтезується недостатня кількість дофаміну, виникає його дефіцит. Уведення хворим дофаміну не є ефективним, бо цей препарат не може подолати гематоенцефаліч-ний бар’єр. Тому вводять його попередник —
Блідий ) шар/ ГАМК
Норадреналін І ♦
Серотонін । Енкефалін
Мал. 92. Нейротрансмітери базальних гангліїв (за даними А. Гайтона, 1991)
Ь-діоксифенілаланін, який перетворюється у мозку на дофамін.
Таким чином, базальні ганглії відіграють істотну роль у регуляції рухових функцій. Вони беруть участь у створенні програми дій, які мають конкретну мету. Важливе значення при цьому має домінуюча мотивація.
РОЛЬ КОРИ ВЕЛИКОГО МОЗКУ В РЕГУЛЯЦІЇ РУХОВИХ ФУНКЦІЙ
Мал. 93. Представництво тіла людини в руховій ділянці прецент-ральної звивини кори великого мозку
Кора великого мозку — філогенетично наймолодша структура мозку. В процесі еволюції ссавців особливо швидко розвивалась нова кора, її товщина досягла 1—2 мм, а загальна її поверхня у людини становить близько 2200 см2. До складу кори великого мозку входять нейрони, які в різних її ділянках мають свої особливості. Розрізняють понад 50 цитоархітектурних полів. Багато з них беруть участь у регуляції рухових функцій.
Сенсорні зони кори великого мозку (див. с. 80) тісно пов’язані з моторними зонами, які лежать перед центральною борозною, займаючи приблизно задню частину лобної частки. У моторній корі розрізняють: первинну, премоторну та додаткову моторну ділянки.
Первинна моторна кора міститься перед центральною борозною (поле 4). Як і перша соматосенсорна зона, ділянка має топічну організацію. Подразнення електричним струмом верхньої частини ділянки у тварин чи у людей під час нейрохірургічних операцій супроводжується скороченням м’язів нижньої частини тіла на протилежному боці. Понад 50 % поверхні цієї ділянки у людини — це представництво рук та мови, що свідчить про розвиток цих функцій у людини (мал. 93.).
Премоторна зона лежить попереду первинної моторної (поле 6) і в глибині сільвієвої борозни. Більшість імпульсів із цієї зони викликає моделі рухів, вмикаються групи м’язів, які виконують певні функції. Імпульси йдуть у первинну моторну кору, до базальних ядер, а потім знову в моторну зону через таламус. Ця зона разом із базальними ядрами, таламусом, первинною моторною корою керує багатьма складними рухами.
Додаткова моторна ділянка розташована перед і над премоторною зоною. Щоб' скоротились м’язи, контрольовані цією зоною, треба застосувати електричний Струм значно більшої потужності. Ефект подразнення часто виявляється з обох боків тіла. Функція розглядуваної ділянки полягає в тому, що вона разом з премоторною ділянкою створює умови для забезпечення пози і рухів, що реалізуються вже первинною моторною корою. Нейрони кіркової моторної зони одержують численні імпульси волокнами, що йдуть від сенсомоторної ділянки парієтальної кори, зорової і слухової ділянок, моторної кори протилежного боку, таламуса, а також від базальних ядер та інших структур.
Кортико-спінальний (пірамідний) шлях розпочинається від нейронів моторної кори, проходить між хвостатим ядром та шкаралупою (внутрішня капсула). У довгастому мозку більшість волокон (80%) переходить на протилежний бік — у латеральний пірамідний шлях, а частина (20 %) —на протилежний бік нижче (у шийному та грудному відділах спинного мозку), тобто у вентральний пірамідний шлях.
У пірамідному шляху міститься близько 1 млн волокон. Лише незначна частина їх (близько 3 %) починається від гігантських пірамідних клітин Беца. Колатералі від волокон пірамідного шляху йдуть у сусідні ділянки кори великого мозку і зумовлюють гальмування (таким чином запобігають іррадіації збудження). Більшість волокон латерального пірамідного шляху закінчується на інтернейронах спинного мозку, частина — на сенсорних нейронах задніх рогів або власне на мотонейронах.
Роль пірамідного шляху в здійсненні рухової функції полягає в регуляції тонких і точних рухів, особливо дистальних частин кінцівок, тобто пальців. При порушенні кровопостачання моторної кори (крововилив, тромбоз, травма, пухлина) спостерігається параліч м’язів на протилежному боці тіла. Значна кількість волокон від моторної кори не йде безпосередньо до спинного мозку піра-. мідним шляхом, а перемикається на різних ядрах — базальних, червоному, вестибулярних, ядрах ретикулярної формації та ін.
Раніше широко користувались терміном «екстрапірамідна система». Тепер його вживають рідше, бо шляхи, що входять до його складу, мають різне функціональне призначення. Моторна кора тісно пов’язана з червоним ядром. Це кортико-руброспінальний шлях. Аксони від кори закінчуються синапсами в нижній частині червоного ядра біля великих клітин. У червоному ядрі теж є топічне представництво всіх м’язів тіла. Звідси починається рубро-спінальний шлях, що переходить на протилежний бік. Його волокна контактують із інтернейронами спинного мозку, а деякі — безпосередньо з мотонейронами, які контролюють функцію переважно дистальних м’язів тіла.
. Кортико-спінальний і руброспінальний шляхи називають ще
Мал. 95. Вплив вищерозташоваиих відділів ЦНС иа а-мотонейрони спинного мозку:
1 — моиосииаптичиий вплив; 2 — вплив за участю інтернейроиів; 3 — вплив через V-петлю; 4 — а-мотонейрон; 5 — умотоней-роа
Мал. 94. Вплив основних рухових шляхів на мотонейрони м’язів-згина-чів і м’язів-розгиначів:
1 — кортикоспінальний шлях; З — рубро-спінальиий шлях; 3 — латеральний ретику-лоспінальний шлях; 4 — вестибулос пі вальний шлях; 5—медіальний ретикулоспі-нальний шлях; 6 — а-мотонейрони м’язів-згиначів; 7 — у-мотонейрони м’язів-згина-чів; 8 — а-мотонейрони м’язів-розгиначів;
9— у-мотоиейрони м’язів-розгиначів; 10— гальмівні інтернейрони; 11 — м’язи-згииачі; 12 — м’язи-розгиначі
латеральною моторною системою, а вестибулоспі-нальний та ретикулоспінальний — медіальною моторною системою (мал. 94).
Колончаста організація зон кори складається з вертикально розташованих груп кількох тисяч нейронів, які посипають імпульси до м’яза чи м’язів-синергістів. Ці групи нейронів називають колонками.
Кожна колонка містить пірамідні клітини у V шарі, має вхід у II шар через клітини IV шару.. З іншими ділянками кори вона зв’язується через клітини VI шару. Кожна колонка одержує інформацію з багатьох джерел. Одна пірамідна клітина не може спричинити збудження м’яза, для цього треба, щоб у стан збудження прийшли 50—100 пірамідних клітин. Розрізняють динамічні та статичні сигнали цих клітин. Динамічні сигналй— імпульси, до генеруються динамічними нейронами, їх частота більша і зумовлює скорочення м’яза. Статичні сигнали — імпульси статичних нейронів, їх частота менша, але дія триваліша. Вони лише підгримують скорочення м’яза.
Таким чином, а-мотонейрони переднього рогу спинного мозку аналізують і синтезують інформацію, що надходить до них від сенсорних нейронів свого та сусідніх сегментів, від пірамідного, руброспінального, вестибулоспінального, ретикулоспінального та інших шляхів через інтернейрони чи безпосередньо (мал. 95).
РОЛЬ МОЗОЧКА В РЕГУЛЯЦІЇ
РУХОВИХ ФУНКЦІЙ
Розглянуті вище рівні регуляції рухових функцій забезпечують підтримання пози, виконання локомоторних актів, але для здійснення чітких, швидких, точних, координованих, складних рухів потрібна участь мозочка. Ця частина ЦНС формується на ранніх етапах філогенезу і розвивається у зв’язку з ускладненням рухових функцій.
ЗАГАЛЬНИЙ ПЛАН ОРГАНІЗАЦІЇ МОЗОЧКА
Найдавнішим відділом мозочка є флокулонодулярна частка, яка розвивається, функціонує разом із вестибулярною системою і має певне значення для підтримання рівноваги. У старому мозочку розташовані проекції висхідних спіномозочкових шляхів, які проводять імпульси від рецепторів м’язів. Третій відділ, тобто новий мозочок, з’являється у ссавців. Він функціонально тісно пов’язаний із моторною корою. Подразнення його не супроводжується руховими функціями, тому новий мозочок називають «мовчазною» зоною мозку. Складається мозочок із сірої речовини, яка розташована зовні, та білої, що міститься в середині його. У глибині білої речовині лежать ядра — покриття, кулясте, пробковидне, зубчасте. Ці ядра мають численні зв’язки з іншими відділами ЦНС. Проходять ці шляхи через три пари ніжок мозочка (мал. 96).
Аферентні волокна входять до складу спіноцеребелярних шляхів Флексига і Го-верса, вестибулоцеребелярного, оливоцере-белярного, а також кортико-понтоцеребе-
Мал. 96. Схема основних зв’язків мозочка з різними структурами мозку:
1 — таламус; 2 —чорна речовина; 3 — червоне ядро; 4 — церебелоталамокортикальний шлях; 5 — зубчасте ядро; б — мозочок; 7 — вентральний спіноцеребелярний шлях; 8 — дорсальний спіноцеребеляриий шлях; 9 — олива; 10 — вестибу-лоцеребеляриий шлях; 11 — понтоцеребеляриий шлях
лярного. В останньому шляху міститься дуже багато волокон (при-близько в 20 разів більше, ніж у пірамідному), що свідчить про його виняткове значення.
Еферентні волокна від ядер мозочка ідуть до кори — церебело-таламокортикальний шлях, до численних моторних центрів стовбура головного мозку (до вестибулярних ядер, червоного ядра, ретикулярної формації та ін.).
Функції мозочка вивчали переважно шляхом повної або часткової його екстирпації, за допомогою електрофізіологічних та клінічних методів дослідження.
СИМПТОМИ, ЩО СПОСТЕРІГАЮТЬСЯ
ПІСЛЯ УШКОДЖЕННЯ МОЗОЧКА
Ці симптоми залежать від локалізації, ступеня порушення, а також від часу, що минув після травми. Після ушкодження мозочка спостерігаються різноманітні порушення рухових функцій, а саме: атаксія, дисметрія, інтенційний тремор, астенія, дистонія, адіадохокінез, дизартрія, дезеквілібрація тощо.
Атаксія — порушення координації рухів, характеризується втратою узгодження між скороченням м’язів-синергістів та м’язів-антагогіістів.
Дисметрія — порушення амплітуди рухів (вони виконуються в збільшеному чи зменшеному об’ємі). Наприклад, при паль-ценосовій пробі хворий не може із заплющеними очима попасти пальцем у кінчик носа.
Інтенційний тремор проявляється тремтінням м’язів під час виконання довільних рухів. Наприклад, коли хворий хоче піднести ложку до рота, починають тремтіти руки, і, що ближче він до мети, то більшою мірою виражене тремтіння.
Астенія характеризується слабкістю і швидким настанням втоми м’язів, що є наслідком гіперкінезу.
Дистонія — порушення тонусу м’язів. Спочатку Після екстирпації мозочка підвищується тонус, а потім знижується.
Адіадохокінез — нездатність виконувати рухи синхронно, послідовно і швидко. Це спостерігається при пронації та супінації кистей обох рук.
Дизартрія — порушення мови. Дезеквілібрація — порушення здатності підтримувати рівновагу.
При ушкодженні мозочка виникають також ністагм очних яблук, запаморочення, деякі вегетативні порушення. Все це свідчить про те, що мозочок передусім впливає на рухові функції.
МЕХАНІЗМ УЧАСТІ МОЗОЧКА
В КОРЕКЦІЇ РУХІВ
У процесі виконання рухів мозочок одержує пряму інформацію від моторної кори і червоних ядер про план дій (команда про цей рух вже пішла пірамідним шляхом), а мозочок через колатералі його одержує копію цієї команди. Через дуже короткий час у мозочок надходить інформація від м’язів про реальний результат (мал. 97).
У проміжній зоні мозочка порівнюються план елементу руху і реальний результат. Якщо результат і план не збігаються, то до моторної кори (церебело-таламокортикальним шляхом) і червоного ядра ідуть імпульси, які коригують (посилюють чи гальмують) даний елемент руху. Всі шляхи, що беруть участь у цьому механізмі, мають волокна типу Аа, тому корекція загалом відбувається дуже швидко.
ФУНКЦІЇ МОЗОЧКА
Мозочок коригує і контролює діяльність рухової кори, червоного ядра та інших центрів, уточнюючи швидкість та силу рухів. Він також бере участь у формуванні й збереженні довільних та недовільних рухових програм. Мозочок відіграє певну роль у регуляції тонусу і формуванні пози, має важливе значення для узгодження функцій м’язів-агоністів та м’язів-антагонісгів, здійснення тонічних та фазичних реакцій, діяльності а- та у-мотонейронів.
Головна функція мозочка полягає в корекції діяльності інших рухових центрів, у координації цілеспрямованих рухів і регуляції тонусу м’язів.
ІНТЕГРАЦІЯ РІВНІВ РЕГУЛЯЦІЇ
РУХОВИХ ФУНКЦІЙ
Усі рівні регуляції рухових функцій становлять собою систему підпорядкування нижчих центрів вищим. Спинний мозок забезпечує можливість різноманітних рухів, взаємозв’язок між скороченням м’язів-згиначів і м’язів-розгиначів, реципрокні зв’язки між ними, здійснення порівняно простих рефлексів. Ці можливості реалізуються під впливом вищих рівнів контролю рухових функцій.
Від функцій заднього та середнього мозку залежать підтримання пози, перерозподіл тонусу м’язів залежно від інформації, що надходить від рецепторів вестибулярного апарата та від м’язів з метою підтримання рівноваги.
Проміжний мозок бере участь у забезпеченні рухових функцій
Мал. 97. Схема механізму участі мозочка в корекції
рухів: Чкх Д
І — моторна кора; 2—мозочок; 3 — спинний мозок; 4 —\ $
стовбур мозку; 5 —пірамідний шлях; 6 — кортикопонтоце- І і
ребелярний шлях; 7 — м’язове веретено; В — спіноцеребеляр- І '
ний шлях; 9 — порівняння плану елементу руху і одержа- V
ного результату; 10— церебелоталамокортикальний шлях
потрібного кількістю поживних речовин, ВИ- О 2
веденні метаболітів, отже, у вегетативному забезпеченні. /
Передній мозок створює і зберігає під- \* )}9
свідомі, а також свідомі рухові програми, ) спрямовані на. досягнення певної мети. Вра- #
ховується ситуація, що виникає в процесі ви- |
конання цих програм. Рухова кора грає особ- | .
ливу роль у регуляції тонких, точних рухів. ч І
Мозочок взаємодіє з усіма рівнями ре- ---д/
гуляції рухових функцій, координуючи та у
узгоджуючи їх впливи.
Нові рухові програми формуються за участю переднього мозку. Відбувається відбір окремих фрагментів із наявних програм природжених форм поведінки і набутих рухових автоматизмів для наступної інтеграції в нову рухову програму.
Якими механізмами забезпечується початок виконання рухових програм? Вважається, що є дві системи ініціації рухів. Одна з них — лімбічна система. Вона зв’язана з виникненням мотивацій — прагнення до досягнення мети біологічного чи соціального характеру. Важливим елементом, що з’єднує лімбічну систему з руховою корою, є прилегле та хвостате ядро. Друга система — асоціативні зони великого мозку, які забезпечують початок специфічних рухових програм, переважно рухових автоматизмів. Ці програми через таламус і мозочок досягають моторної кори. Обидві системи діють спільно.
Схематично систему керування руховими функціями можна поділити на блок ініціації рухів (лімбічна система з прилеглим ядром і асоціативною корою), блок програмування рухів (базальні ганглії, мозочок, моторна кора, моторні центри стовбура головного мозку), виконавчий блок (спінальні центри, нейромоторні одиниці).
Треба пам’ятати про зворотну інформацію, яка постійно надходить від пропріо-, інтеро- та екстерорецепторів каналами зворотних зв’язків.
Особливістю рухової діяльності людини є здатність до стояння. Конче потрібного умовою цього є збереження рівноваги. Це можливо тоді, коли центр ваги розташовується над площиною опору. Рівновага нестійка, положення тіла змінюється, воно відхиляється від вертикального положення, але рівновага швидко відновлюєть-
Мал. 98. Послідовне положення ніг при ходьбі- (за даними В. С. Гурфінкеля, 1970):
/, 2 — двоопорний період першого кроку; 6, 7 — двоопорннй період другого кроку; 3—5, З—10 — одноопорні періоди. Інтенсивність штриховки м’язів відповідає силі їх скорочень
ся. Важливу роль при цьому відіграють антигравітаційні м’язи, скорочення яких залежить від імпульсів, що надходять від вести-було-, пропріорецепторів, а також від зорових рецепторів. У разі порушення цих механізмів людина втрачає здатність до підтримки рівноваги і стояння.
Ходьба є наслідком координованої діяльності скелетних м’язів тулуба і кінцівок. Координація виробляється у дитини поступово, починаючи з річного віку, і автоматизується у процесі зміцнення рухового стереотипу. Крок складається з двох фрагментів — опору і перенесення. Тіло при ходьбі почергово опирається то на праву, то на ліву ногу. Кожна нога перебуває у фазі опору або перенесення. Доки права (опорна) нога підтримує тіло, ліва переноситься вперед. Коли занесена вперед нога торкається п’яткою опори, права ще не відірвана від неї і тулуб деякий час опирається на обидві ноги. Потім маса тіла переноситься на передню, ліву, ногу, яка тепер стає опорною. Переміщуючись з п’ятки на носок, ліва нога переносить тулуб вперед і стає на п’ятку, приймаючи на себе
масу тіла (мал. 98). У ходьбі беруть участь і верхні кінцівки, які здійснюють рухи у протилежному напрямі.
Під час ходьби робота м’язів чергується з їх відпочинком. Ходьба характеризується точністю повторення окремих її компонентів, але у різних людей спостерігаються її особливості. Людина здатна змінювати темп ходьби у межах 40—230 кроків/хв, середній темп становить (112± 10) кроків/хв. Під час бігу темп може перевищувати 300 кроків/хв. Довжина кроку залежить від довжини ніг, стопи, темпу ходьби тощо. Довжина кроку становить 0,5—1 м, в середньому — 0,7—0,8 м. Дослідження ходи має значення для діагностики і оцінки наслідків лікування ряду захворювань.
Нервова регуляція вегетативних функцій
Поняття «вегетативна нервова система» запроваджене на початку минулого століття французьким фізіологом М. ВісЬаі (1800). У його основі лежить протиставлення тваринного (анімального) життя рослинному (вегетативному), тому воно вживається для характеристики процесів, пов’язаних переважно із обміном речовин. Виявилося, що у сфері діяльності вегетативної нервової системи лежать також функції залоз, гладких м’язів внутрішніх органів. 3. Нап^есу (1921) позначив цей відділ нервової системи терміном «автономна». Він вживається поряд із терміном «соматична нервова система». Згідно з діючою Міжнародною анатомічною номенклатурою (РПА), термін «автономна» повністю замінив ті,. що існували раніше — «вегетативна», «вісцеральна», «гангліо-нарна». У вітчизняній літературі традиційно використовується переважно термін «вегетативна нервова система».
Що ж входить у поняття «вегетативна нервова система»?
Вегетативна (автономна) нервова система становить собою комплекс центральних і периферичних структур, які регулюють усі фізіологічні процеси внутрішніх органів (мал. 99).
До складу вегетативної нервової системи входять такі структурні утворення: 1) нервові волокна; 2) периферичні нервові вузли (ганглії), які складаються із нервових клітин; 3) «центри» у сірій речовині спинного мозку і стовбура головного мозку (середній і довгастий мозок), від клітин яких починаються нервові волокна; 4) вищі «центри», розташовані у проміжному мозку на рівні III мозкового шлуночка і у великому мозку.
Вегетативна нервова система іннервує гладкі м’язи всіх органів, судин, сердце, залози, а також (її симпатичні волокна) скелетні м’язи, органи чуття і ЦНС.
ФУНКЦІЇ ВЕГЕТАТИВНОЇ НЕРВОВОЇ СИСТЕМИ
Головна функція вегетативної нервової системи полягає у під-
триманні сталості складу внутрішнього середовища організму, або гомеостазу, при різних впливах на організм. Разом з тим ця систе-
ма регулює також діяльність органів і систем, які не беруть учас-
ті безпосередньо в підтриманні гомеостазу (наприклад, статевих
органів, внутрішньоочних м’язів).
Вегетативна нервова система відіграє важливу роль у присто-
сувальних реакціях організму. Зміни вегетативних функцій завжди супроводжують різні поведінкові акти (харчові, статеві, захисні тощо), будучи їх своєрідним «вегетативним відображенням». Найрізноманітніші акти поведінки, які проявляються у м’язовій діяльності, супроводжуються зміною вегетативних функцій (органів кровообігу, дихання, травлення, виділення, секреції тощо). Особливо важлива участь вегетативних рефлекторних реакцій у тих випадках, коли виникає загроза існуванню організму, і в стресових ситуаціях з якимось емоційним забарвленням (страх, лють, гнів, біль тощо), коли мобілізуються всі сили організму для переборення небезпеки, яка виникла або загрожує.
Вегетативна нервова система звичайно не перебуває під безпосереднім контролем з боку нашої свідомості, на відміну від соматичної, яка свідомо керується, забезпечує зв’язки організму з навколишнім середовищем. Але уявлення про
Мал. 99. Схема будови вегетативної нервової системи:
а — парасимпатична нервова система, б — симпатична нервова система: 1 — око; 2 — слізна залоза; 3 — вушна гілка; 4 — підщелепна залоза; 5 — під’язикова залоза; 6 — привушна залоза; 7 — серце; 8 — дихальні шляхи; 9 — стравохід і шлунок; 10 — печінка; // — підшлункова залоза; 12, /3—кишечник; 14 — нирка; 15 — сечовий міхур; 16 — матка; III, VII» IX, X — черепні нерви
автономність вегетативної нервової системи від вищих відділів ЦНС, психічної сфери е умовним. Кора великого мозку головним чином умовнорефлекторним шляхом регулює і координує всі процеси, які відбуваються в організмі відповідно до його поточних проблем.
Вегетативна і соматична нервові системи діють співдружньо. їх нервові центри, особливо на рівні стовбура головного мозку і великого мозку, неможливо відрізнити один від одного, але периферичні відділи обох систем зовсім різні.
ОСОБЛИВОСТІ БУДОВИ ВЕГЕТАТИВНОЇ
НЕРВОВОЇ СИСТЕМИ
Периферичний відділ вегетативної нервової системи є загалом еферентним і складається з двох, послідовно сполучених груп нейронів: прегангліонарних і постгангліонарних. Клітинне тіло прегангліонарних нейронів розташоване в ЦНС (наприклад, у сірій речовині спинного мозку), а аксони спрямовані до винесених за межі ЦНС вегетативних гангліїв. Тут розташовані тіла кінцевих, постгангліонарних нейронів, аксони яких виходять із гангліїв і йдуть до виконавчих органів (мал. 100). У вегетативних гангліях відбувається перемикання прегангліонарних нейронів на тілах постгангліонарних.
Ця морфологічна особливість — наявність синаптичного розриву на периферії, тобто двонейронна будова периферичного відділу вегетативної нервової системи,— є основною властивістю, яка дозволяє чітко розрізняти вегетативний еферентний шлях і соматичний.
Друга відмінність полягає у виході нервових волокон із ЦНС. Соматичні волокна залишають стовбур головного мозку, спинний мозок сегментарно і перекривають іннервовані ними ділянки меншою мірою трьох суміжних сегментів (див. с. 142). Волокна вегетативної нервової системи виходять із обмежених ділянок стовбура головного мозку (середньомозкової, бульбарної) І СПИННОГО мозку (грудинопоперекової і крижової).
Третя із основних відмінностей стосується будови вегетативної і соматичної нервової системи, зокрема розподілу їхніх волокон на периферії. Вегетативні волокна іннервують усі тканини і органи, соматичні ж—розподіляються суворо сегментарно.
Четверта відмінність закладена у функції органів, які іннерву-ються вегетативною і соматичною нервовими системами. Перетин передніх корінців призводить до повного переродження соматичних волокон і не позначається істотно на вегетативних, позаяк еферентний вегетативний нейрон винесений у один із периферичних гангліїв, і виконавчий орган у таких умовах керується активністю тільки даного нейрона (власне, автономно).
Мал. 100. Рефлекторна дуга соматичної (а) та вегетативної нервових систем (б). Схема ходу симпатичних еферентних волокон (в):
І — аферентне нервове волокно; 2 — спинномозковий ганглій; 3 — нервове волокно інтерней-рона; 4 — нервове волокно клітини, що міститься в передньому розі (соматичний відділ) і в симпатичному вузлі, локалізованому за межами спинного мозку (вегетативний відділ); 5 — симпатичний вузол; 6— спинномозковий нерв; 7 — біла сполучна гілка; 8 — прегангліо-нарний симпатичний нейрон; 9 — постгангліонарне симпатичне волокно; 10 — сіра сполучна гілка
Існують також морфологічні відмінності вегетативних волокон. Більшість їх безмієлінові, тонкі. Діаметр таких волокон не перевищує 7 мкм (групи В, С). Ці відмінності зв’язані з функціональними особливостями. Тонкими вегетативними волокнами збудження поширюється значно повільніше (1,0—15 м/с), ніж грубими мієліновими соматичними (70—120 м/с). Для виклику відповідної реакції вегетативних волокон треба застосувати подразнення значно більшої сили. Вегетативні нерви характеризуються великим рефрактерним періодом.
У організації аферентних шляхів вегетативної нервової системи можна визначити два типи. Чутливі волокна першого типу є спільними для соматичної і вегетативної систем. їх клітинні тіла лежать у спинномозкових вузлах або аналогах (наприклад, вузол блукаючого нерва). До другого типу належать чутливі шляхи, клітинні тіла яких локалізуються в периферичних вегетативних (екстра- і інтрамуральних) гангліях. Волокна, які утворюють аферентний ланцюг вегетативної рефлекторної дуги, належать до груп А, В і С (за класифікацією Л. Егіап^ег і Н. 8. Оаззег). У більшості внутрішніх органів переважають закінчення аферентних волокон групи С, рідше зустрічаються групи В і А. Інформація від
внутрішніх органів у ЦНС передається системами черевних нервів, які мають найповніший набір волокон, а також тазовими і блукаючими нервами (в них містяться головним чином волокна групи С). Мієлінізованими волокнами (А) передається інформація про дію механічних чинників, тоншими мієлінізованими і немієлІ-нізованими (В і С) — про хімічні і термічні подразнення внутрішніх органів.
ВІДДІЛИ ВЕГЕТАТИВНОЇ
НЕРВОВОЇ СИСТЕМИ
Вегетативну нервову систему на підставі структурнб-функціо-нальних властивостей прийнято ділити, за пропозицією Л. Ьап^іеу (1921), на с и м п а т и ч н у і парасимпатичну. Крім вказаних частин, ще виділяють метасимпатичну (інтрамуральну, енте-ральну) систему.
Симпатична система. Тіла прегангліонарних симпатичних нейронів розташовані у бокових рогах сірої речовини спинного мозку на відстані від І—II грудних до II—IV поперекових сегментів.
Аксони залишають спинний мозок у складі передніх корінців, відокремлюються від рухових соматичних волокон і у вигляді білих сполучних гілок вступають у вузли парних біляхребетних симпатичних ланцюгів (паравертебральні ганглії). Тут частина волокон утворює синаптичні контакти з клітинами гангліїв, частина проходить вузли транзитом і вступає у синаптичний контакт з клітинами інших гангліїв ланцюга (краніальний, зірчастий, шийний вузли) або превертебральних гангліїв (сонячне сплетіння, серцеве сплетіння, брижові вузли тощо). Більшість таких немієлінізованих постгангліонарних волокон від симпатичних стовбурів прямують до периферичних органів у складі сірих сполучних гілок або спеціальних нервів, які іннервують органи голови, грудної, черевної і тазової порожнин. Найбільшими гілками грудних вузлів і взагалі симпатичної нервової системи є великий і малий черевні нерви, які іннервують органи черевної порожнини. Від брижових вузлів відходить підчеревний нерв, який іннервує органи таза.
Для симпатичної системи характерні досить короткі прегангліо-нарні волокна і довгі постгангліонарні.
До ефекторних структур, які іннервуються симпатичною системою, належать гладкі м’язи всіх органів, судин, серце, а також залози (травні, потові), підшкірна основа. Крім того, симпатичні постгангліонарні волокна іннервують скелетні м’язи, органи чуття і ЦНС.
Парасимпатична система. Тіла прегангліонарних парасимпатичних нейронів розташовані у середньому (ядро Якубовича—Вестфа-ля—Едінгера), довгастому (VII, IX, X пари черепних нервів) мозку, в сакральних сегментах спинного мозку. Прегангліонарні во
локна (мієлінізовані і немієлінізовані) ідуть до постгангліонарних парасимпатичних нейронів, які локалізуються поблизу ефекторних органів або у їх товщі. Парасимпатичні ганглії розташовані тільки у ділянці голови і поблизу органів таза. Всі інші ганглії розкидані по поверхні або містяться в товщі органів травлення, серця і легень, утворюючи так звані інтрамуральні ганглії.
Для парасимпатичної нервової системи характерні досить довгі прегангліонарні волокна і короткі постгангліонарні.
Парасимпатична система іннервує гладкі м’язи і залози органів травлення, серце, легені, видільні і статеві органи, а також слізні залози та очні м’язи. Парасимпатичні нерви не іннервують гладкі м’язи великих судин, за винятком артерій статевих органів і, можливо, артерій мозку.
Парасимпатична система має дещо обмеженіший вплив, ніж симпатична.
До органів грудної і черевної порожнин прегангліонарні парасимпатичні волокна йдуть у складі блукаючого нерва (X черепний нерв), а до органів малого таза — у складі тазових нервів. Очні м’язи і залози, голова і органи травлення іннервуються черепними нервами: окоруховим (III пара), лицевим (VII) і язикоглотковим (IX).
Метасимпатична система. У стінках стравоходу, шлунка і кишечника залягають сполучені між собою сплетіння — підсерозні, міжм’язові і підслизові. Ці утворення складають систему, яка має певну автономію. Багато вчених розглядають її як окрему, самостійну систему. Нервові клітини названих сплетінь відрізняються за величиною, кількістю синапсів, числом і довжиною відростків. Розрізняють три типи клітин: І — моторні; II — чутливі; III — асоціативні. Але не всі дослідники вважають ці положення безперечними.
ВПЛИВ ВЕГЕТАТИВНОЇ НЕРВОВОЇ
СИСТЕМИ НА ЕФЕКТОРНІ ОРГАНИ
Багато внутрішніх органів іннервуються як симпатичними, так і парасимпатичними нервами. Вплив цих двох систем на ефектор-ні органи часто має антагоністичний характер (табл. 5).
У фізіологічних умовах діяльність усіх цих органів залежить від того, які переважають впливи — симпатичні чи парасимпатичні. При переважанні парасимпатичних регуляторних впливів, наприклад блукаючого нерва, частота і сила скорочень серця зменшується, моторика кишечника посилюється, сфінктери травного каналу ослаблюються, жовчний міхур і бронхи скорочуються тощо. Збільшення ж активності симпатичних нервів супроводжується протилежним ефектом. Разом із тим, у більшості випадків симпатична і парасимпатична системи діють співдружньо, синергічно. Так, підвищення артеріального тиску зумовлює рефлекторне (внас-
Таблиця 5. Вплив симпатичної і парасимпатичної систем на функції різних органів і структур організму
Орган Симпатична система Парасимпатична система
Око
Слинні залози
Залози шлунка
Підшлункова залоза
Гладкі м’язи травного каналу
Серце
Судини
Розширення зіниці Секреція густої слинн Незначне пригнічення секреції Те саме
Послаблення моторики
Посилення діяльності Генералізоване звуження
Гладкі м’язи бронхів
Печінка
Мозкова речовина над-
ниркових залоз
Скелетні м’язи
Нервові центри Рецептори
Розширення
Глікогеноліз і ліполіз
Стимуляція секреції адреналіну
Підвищення працездатності
Підвищення активності Те саме
Звуження зіниці
Секреція рідкої слини Стимуляція секреції
Те саме
Посилення моторики
Гальмування діяльності Розширення судин слинних залоз, язика, статевих органів (статевий член, клітор, малі статеві губи) Звуження
лідок збудження барорецепторів судин) зниження частоти і сили серцевих скорочень. Це є наслідком як збільшення активності парасимпатичних нервів (серцеві волокна блукаючого нерва), так і зниження активності симпатичних нервів.
Деякі органи постачаються тільки симпатичними або парасимпатичними нервами. До перших належать майже всі кровоносні судини, капсула селезінки, гладкі м’язи волосяних цибулин, клітини панкреатичних острівців, до других — артерії статевих органів (статевого члена, клітора, малих статевих губ), слізні залози, сфінктер зіниці та ін.
Описують два види реакцій вегетативної нервової системи — ерготропну і трофотропну. Ерготропна реакція характеризується вибірковою активізацією деяких внутрішніх органів під впливом симпатичної нервової системи і підвищенням активності соматичної системи. Так, розширення кровоносних судин у м’язах, які працюють, і одночасне скорочення судин органів травлення сприяють поліпшенню м’язового кровотоку. Ерготропні реакції розвиваються і у відповідь на надмірні, екстремальні впливи (сильні емоції, холод, спека, гіпоксія, больові подразнення тощо). При трофотропних реакціях (станах) посилюються процеси тканинного анаболізму, підвищується функція деяких внутрішніх органів, які забезпечують процеси травлення, знижуються м’язовий тонус, артеріальний тиск і частота серцевих скорочень, спо
вільнюється дихання. Такий стан розвивається звичайно під час сну і травлення, реалізується він через парасимпатичну систему.
До біологічно активних речовин, які спричинюють і регулюють ерготропні (адренергічні) реакції в організмі, належать катехол-аміни (адреналін, норадреналін, дофамін, ДОФА), до трофотроп-них — ацетилхолін, серотонін, гістамін та ін.
В умовах фізіологічної норми збільшення активності речовин ерготропного ряду за принципом зворотного зв’язку врівноважується відхиленням у вмісті речовин протилежного ряду. Тим самим регулюється динамічна сталість у крові цих біологічно активних речовин, що дуже важливо для підтримання гомеостазу.
У разі різних патологічних порушень гомеостатичних механізмів (наприклад, при ушкодженні проміжного мозку — діенцефаль-на патологія) під впливом холоду, тепла, емоцій, атмосферних явищ тощо можуть порушитись гомеостатичні реакції і виникнути так звані симпатико-адреналові і вагоінсулярні кризи.
Як свідчать дані численних експериментальних досліджень, симпатична нервова система регулює обмін речовин, трофіку (живлення) і збудливість усіх органів та тканин тіла, забезпечуючи тим самим пристосування (адаптацію) організму до наявних умов життєдіяльності (Л. А. Орбелі і співавт., 1932). Тому такі впливи було названо адаптаційно-трофічними. Зокрема, активізація симпатико-адреналової системи сприяє усуненню втоми скелетних м’язів (феномен Орбелі—Гінецинського). Можливо, цей ефект виникає у відповідь на вплив на пресинаптичні терміналі адреналіну, який виділяється закінченнями симпатичних нервів у м’язі під час їх збудження. Адреналін може впливати також на перебіг процесів у м’язових волокнах, змінюючи їхні функціональні можливості. Доведено, що подразнення симпатичних волокон, які спрямовані до скелетних м’язів, призводить до збільшення амплітуди потенціалів кінцевої рухової пластинки.
У інтрамуральних гангліях замикаються місцеві рефлекторні дуги, утворені клітинами І і II типу Догеля.
У гангліях м’язового і підслизового сплетінь є особливі нервові клітини — водії ритму, які керують міогенними ритмами гладких м’язів органів травлення.
Метасимпатична (ентеральна) частина вегетативної нервової системи представлена підсерозним, міжм’язовим і підслизовим сплетіннями. Вона є функціонально єдиною системою, наділеною автономією високого ступеня, яка забезпечується місцевими рефлекторними механізмами. Так, децентралізація шлунка і кишечника шляхом їх денервації не припиняє моторики. При цьому залишаються практично незміненими просування хімусу вздовж травного каналу, діяльність сфінктерів тощо. У цих умовах організація моторного і секреторного актів здійснюється і координується між-ентеральними сплетіннями. Місцеві рефлекси, які виникають у
ентеральних гангліях, зникають під впливом гангліоблокаторів. Порушення інтрамуральних зв’язків, яке досягається перерізуванням кишкової стінки, не тільки змінює характер їх рефлекторних впливів, але й зумовлює різноманітні зміни функції органа.
Метасимпатична система впливає (як збуджує, так і гальмує) на моторику травного каналу, його секреторну і інкреторну функції, на скоротливу функцію міокарда (внутрішньосерцева нервова система) та ін.
Серед інтрамуральних еферентних нейронів є не тільки холін-і адренергічні, але й пурин-, серотонін-, дофамін- і, можливо, гістамін-, пептид- та ГАМК-ергічні. Це створює можливість для здійснення різноманітних регуляторних впливів, внутрішньоорган-ної рефлекторної регуляції, потрібної для діяльності внутрішніх органів.
ФУНКЦІЇ ГАНГЛІЇВ ВЕГЕТАТИВНОЇ
НЕРВОВОЇ СИСТЕМИ
Вегетативні ганглії відіграють важливу роль у проведенні, розподілі та переробці імпульсів, які проходять Через них, а також у здійсненні так званих периферичних (місцевих) рефлексів. За структурою і функціями вегетативні ганглії можна вважати нервовими «центрами», винесеними на периферію. їм притаманні морфо-функціональні властивості нервових центрів; відсутність сполучної тканини, незначний позаклітинний простір, численні гліальні елементи, щільний синаптичний контакт, однобічне проведення збудження, дивергенція і конвергенція збуджень, сумація (часова і просторова), оклюзія, трансформація ритму нервових імпульсів тощо. Разом із тим вони мають і деякі особливості: довготривала синаптична затримка (1,5—ЗО мс) і ЗПСП, тривала слідова гіпер-поляризація. Внаслідок цих особливостей частота імпульсів, які можуть генерувати нейрони вегетативних гангліїв, порівняно невелика (не перевищує 10—15 імп/с).
Крім загальних з екстрамуральними гангліями властивостей, ентеральним (інтрамуральним) гангліям метасимпатичної системи притаманна високого ступеня автономія. У гангліях міжм’язового і підслизового сплетінь містяться особливі нервові клітини — водії ритму, які керують міогенними ритмами гладких м’язів органів травлення. У інтрамуральних гангліях, як і в деяких екстрамураль-них, замикаються «місцеві» рефлекторні дуги, утворені клітинами Догеля І і II типу.
Вегетативні ганглії є відділом нервової системи, який не має безпосереднього зв’язку з вищими центрами, внаслідок чого вони можуть регулювати діяльність внутрішніх органів автоматично.
У симпатичних гангліях кожне пресинаптичне волокно іннервує велику кількість (до ЗО) постгангліонарних нейронів. Тому збу-
Мал. 101. Схема розгалуження симпатичних волокон (явище мультиплікації).
Прегангліонарне волокно, вступаючи в ганглій, розгалужується і утворює синапси з кількома периферичними нейронами в ганглії. Постгангліонарні волокна розгалужуються у свою чергу і контактують із значною кількістю елементів ефектора
нього і аксони локалізованих роткі.
дження, яке надходить пре-гангліонарними волокнами із спинного мозку, після ганглію поширюється на периферію (явище мультиплікації) і носить генералізований характер (мал. 101).
У парасимпатичних гангліях кількість постгангліонарних нейронів, які іннервуються одним прегангліонарним волокном, значно менша (лише 3— 4), тому мультиплікаційна активність не є тією важливою функцією, яка властива симпатичним гангліям. Треба враховувати і ту обставину, що парасимпатичні ганглії розташовані безпосередньо в стінці певного органа або поблизу у них нейронів дуже ко-
ПЕРЕДАЧА ЗБУДЖЕННЯ В СИНАПСАХ ВЕГЕТАТИВНОЇ НЕРВОВОЇ СИСТЕМИ
Від прегангліонарних нейронів до постгангліонарних і від них до ефекторних органів збудження передається за допомогою медіаторів. Механізми медіаторної передачі у синапсах вегетативної нервової системи загалом ті ж, що і в нервово-м’язовій пластинці та центральних синапсах (див. с. 25), але характер синапсів вегетативної нервової системи, їх варіабельність і густина будуть інші. Є специфіка і щодо медіаторної передачі у гангліях. У закінченнях усіх прегангліонарних парасимпатичних волокон виділяється медіатор ацетилхолін. Ацетилхолін діє на рецептори постсинап-тичної мембрани і зумовлщє збудження постгангліонарних волокон. Оскільки гангліонарна передача була вперше відтворена за допомогою нікотину, то й відповідні рецептори було названо нікотиноподібними (Н-холінорецепторами).
У гангліях, до яких підходять прегангліонарні симпатичні волокна, медіаторна передача відтворюється за допомогою як ацетилхоліну, так і норадреналіну. Справедливість цього положення підтверджується дослідами з використанням гангліо-блокаторів. Під впливом бензогексонію, пірилену, темехіну, гігро-нію настає блокада Н-холінорецепторів, під впливом обзидану, празозину — адренорецепторів, що призводить до гальмування пе-
Мал. 102. Схема холінергічного синапсу (за даними А. Оезророиіоз, 81. 8ПЬег-па£І, 1986). АХСоА — ацетил-коензим. А. ХЕ — холінестераза
Мал. 103. Схема адренергічного синапсу (за даними А. Оезророиіоз, 81. 8і1Ьег-па^І, 1986). НА — норадреналін; МАО — моноаміноксидаза
редачі нервового збудження з прегангліонарних на постгангліо-нарні волокна вегетативних нервів.
Дія постгангліонарних нервових волокон на ефектор забезпечується виділенням у синаптичну щілину медіаторів, які впливають на постсинаптичну мембрану — мембрану клітини робочого органа. Постгангліонарні парасимпатичні волокна виділяють ацетилхолін, який зв’язується з М-холінорецепторами, тобто мускари-ноподібними рецепторами (М — ХР). Блокаторами М — ХР, які запобігають парасимпатичним ефектам, є атропін, скополамін, платифілін (мал. 202).
Постгангліонарна симпатична передача інформації здійснюється за участю двох типів рецепторів — а- і р-адренорецепторів (АР). Блокада а-АР здійснюється за допомогою фентоламіну, тро-пафену тощо; блокада р-АР — анаприліну (індералу, обзидану) тощо, які гальмують вплив симпатичної нервової системи.
Катехоламіни виділяються не тільки симпатичними нервовими закінченнями, а й мозковим шаром надниркових залоз. Надниркові залози (мозковий шар), які гомологічні симпатичним постганг-ліонарним нейронам, виділяють у кров головним чином адреналін ('приблизно 80 °/о) і норадреналін (20 %).
Катехоламіни симпатичних нервових закінчень і надниркових залоз діють на адренорецептори. Розрізняють аг і аа, Рг і Рг-адре-норецептори. Про їхню молекулярну будову відомо мало. Стимуляція а-АР викликає звуження кровоносних судин, скоро
чення сфінктерів шлунка, кишок, сечоводів, матки, розширення зіниць.
Стимуляція РгАР спричинює збільшення частоти і сили скорочень серця, стимулює ліполіз тощо.
Активація Рг-АР викликає розширення деяких судин (наприклад, коронарних), розслаблення м’язів кишок, жовчного міхура, матки, розширення бронхів, посилюється глікогеноліз (мал. 103).
Дію симпатичних адренергічних нейронів відтворюють симпато-міметичні речовини, або симпатолітичні, які блокують їх вплив.
У більшості органів, які реагують на катехоламіни, містяться як а-, так і р-адренорецептори, і реакція того чи того органа залежить від того, що переважає — а- чи р-адренорецептори. Частіше ефекти збудження цих типів рецепторів бувають протилежними. Так, збудження а-адренорецепторів призводить до звуження судин шкіри і слизових оболонок, а збудження р-адренорецепторів — до їх розширення. Норадреналін зумовлює сильне збудження р-адре-норецепторів міокарда, але незначним чином впливає на р-адрено-рецептори гладких м’язів судин бронхів і трахеї.
Крім ацетилхоліну і норадреналіну, до медіаторів вегетативної нервової системи належать також АТФ, речовина Р, ангіотензин та інші поліпептиди, простагландин Е, серотонін і гістамін. У периферичному відділі вегетативної нервової системи виявлено також пре- і постсинаптичні рецептори дофаміну, гістаміну (Ні і Нг), опіатів, ангіотензину та інших поліпептидів, простагландину Е.
Названі циторецептори мають дуже важливе значення для медикаментозної терапії. Так, лікарські препарати, які належать до р-блокаторів, широко використовують в кардіологічній практиці (для лікування ішемічної хвороби серця).
ПРЕСИНАПТИЧНА МЕДІАТОРНА РЕГУЛЯЦІЯ
ВИВІЛЬНЕННЯ МЕДІАТОРА
Медіатори вегетативної нервової системи не тільки здійснюють постсинаптичний вплив на мембрани постгангліонарних нейронів і ефекторних органів, але й стимулюють чи гальмують вивільнення медіаторів із пресинаптичних закінчень. Це відбувається внаслідок дії медіаторів на холінергічні і адренергічні рецептори пресинаптичних закінчень. Так, при дії норадреналіну на пресинаптичні аг-ад-ренорецептори вивільнення цього медіатора зменшується (негативний зворотний зв’язок), а при впливі на пресинаптичні р-адреноре-цептори зростає (позитивний зворотний зв’язок). Таким чином здійснюється саморегуляція виходу медіатора залежно від концентрації його в синаптичній щілині.
ТОНУС ВЕГЕТАТИВНИХ «ЦЕНТРІВ»
Під тонусом вегетативних «центрів» розуміють постійний стан спонтанної активності, завдяки чому органи, які ними іннервую-ться, безпосередньо отримують від цих «центрів» збуджувальні або гальмівні впливи. У цьому можна переконатися на такому прикладі. Якщо перерізати на шиї собаки обидва блукаючі нерви, різко збільшиться число серцевих скорочень. Це відбувається внаслідок вимкнення гальмівних впливів. Аналогічну картину можна спостерігати і у людини при введенні атропіну сульфату, який блокує передаваная імпульсів із волокон блукаючого нерва, зокрема, на серце.
Завдяки тонусу «центрів» симпатичних судинозвужувальних нервів гладкі м’язи судин перебувають у стані деякого скорочення. Зниження тонусу цих «центрів», порушення його за допомогою фармакологічних препаратів або хірургічного втручання спричинює пасивне розширення судин.
Тонус вегетативних «центрів» підтримується за рахунок постійного впливу аферентних сигналів, які надходять від вісцеральних і соматичних рецепторів, а також різноманітних компонентів крові і цереброспінальної рідини. Разом із тим тонус вегетативних нервів може бути обумовлений здатністю деяких нейронів ЦНС до спонтанної деполяризації.
Рівень тонічної активності вегетативних нервів нижчий у симпатичних пре- і постгангліонарних нейронах, ніж у парасимпатичних, особливо блукаючих нервів. Тонус вегетативних нервів має важливе значення для регуляції функцій внутрішніх органів. У нормі спостерігається рівновага між тонусом симпатичної і парасимпатичної систем, їх впливи на функції органів урівноважені. При переважанні тонусу однієї системи тонус другої знижується (мал. 104). Постійне підвищення тонусу симпатичної або парасимпатичної системи призводить до появи різних вегетативних розладів — так званих симпатикотонії і ваготонії, які супроводжують ті чи ті захворювання. Однак уявлення про симпатико- і пара-симпатикотонію не досить чітке. Одночасно може бути підвищеним тонус симпатичного і парасимпатичного відділів вегетативної нервової системи.
Симпатично нервова система
Парасимпатична нервова система
Медіатор Рецептор Рецептор Медіатор
Прегангпіомрні нейрони
НікотиноМ
Нікотинові
Ацетилхолін
Ганенії
Поопеангйіо'НарнІ нейрони
Ацетилхолін
НсрсдрЄИипінУ_ Нфеторні
Мускиринові
Ацетилхолін
Адрено-рецептори (а,р)
Мал. 104. Основні медіатори і рецептори вегетативної нервової системи
РОЛЬ РІЗНИХ ВІДДІЛІВ ЦНС
У РЕГУЛЯЦІЇ ВЕГЕТАТИВНИХ ФУНКЦІЙ ОРГАНІЗМУ
У регуляції вегетативних функцій організму беруть участь різні відділи ЦНС: спинний мозок, стовбур головного мозку і передній мозок.
Спинний мозок. У спинному мозку (в бокових і частково в передніх рогах) розташовані спінальні сегментні симпатичні і парасимпатичні «центри» І порядку. Вони забезпечують елементарні вегетативні рефлекторні реакції: судинорухові, потовидільні, сечовивідні, дефекації, статеві (ерекція статевого члена і клітора, еякуляція) тощо. У здійсненні спінальних вегетативних рефлеків беруть участь як симпатична, так і парасимпатична система.
Стовбур головного мозку. До вегетативних «центрів» стовбура головного мозку належать розташовані в середньому і продовгуватому мозку парасимпатичні ядра черепномозкових нервів (III, VII, IX, X пари) — парасимпатичні центри І порядку, а також спеціалізовані ділянки ретикулярної формації стовбура головного мозку (симпатичні центри її порядку). Вони забезпечують такі життєво важливі вегетативні функції організму, як дихання та кровообіг. Там же містяться й центри ковтання та ін. Ретикулярна формація сполучається із спинним мозком ретикулоспінальним шляхом. Ядра ретикулярної формації (їх близько 40) беруть участь у регуляції дихальної, серцево-судинної систем, здійснюють трофічну функцію, є частиною загальних інтегративних систем мозку, до яких входять лімбічні утворення і нова кора.
Проміжний та передній мозок. До структур переднього мозку, які беруть участь у регуляції вегетативних функцій організму, належать гіпоталамус, лімбічна система мозку, базальні ганглії, нова кора. Вони забезпечують інтеграцію вегетативних функцій організму для підтримання гомеостазу в стані спокою, під час напруженого стану (ерготропна регуляція) і для відновлення цього показника після напруженого стану (трофотропна регуляція).
Гіпоталамус є вищим центром регуляції вегетативних функцій, які відповідають за стан внутрішнього середовища організму. Він є важливим інтегративним центром вегетативних, соматичних і ендокринних функцій.
Гіпоталамус — центральний відділ проміжного мозку. Він лежить вентральніше від таламуса. Нижньою межею таламуса служить середній мозок, а верхньою — кінцева пластинка, передня спайка і зоровий перехрест. У ньому нараховується близько 48 пар ядер. У гіпоталамусі виділяють такі ділянки: 1) преоптичну; 2) передню групу; 3) середню групу; 4) зовнішню групу; 5) задню групу. Серед ядер виділяють специфічні і неспецифічні. Специфічні ядра сполучені з гіпофізом і здатні до нейрокринії, тобто синтезу і виділення ряду гормонів.
Ядра гіпоталамусу не є ні симпатичними, ні парасимпатичними, хоча прийнято вважати, що в задніх ядрах гіпоталамуса містяться групи нейронів, сполучені переважно із симпатичною системою, а в передніх його ядрах — нейрони, які регулюють функції парасимпатичної системи. Гіпоталамус регулює функції обох частин вегетативної нервової системи залежно від характеру і рівня аферентації, яка надходить до його ядер. Він утворює двобічні (аферентні і еферентні) зв’язки із різними відділами головного мозку — верхніми відділами стовбура мозку, центральною сірою речовиною середнього мозку, із структурами лімбічної системи таламуса, ретикулярною формацією, підкірковими ядрами і корою. Аферентні сигнали надходять у гіпоталамус від поверхні тіла і внутрішніх органів, а також від деяких відділів головного мозку. В медіальній ділянці гіпоталамуса є особливі нейрони (осмо-, глюко-, терморе-цептори), які контролюють важливі параметри крові (водно-електролітний склад плазми, температуру крові тощо) і спинномозкової рідини, тобто «стежать» за станом внутрішнього середовища організму. Через нервові механізми медіальна ділянка гіпоталамуса керує діяльністю нейрогіпофіза, а через гуморальні механізми — аденогіпофіза.
Гіпоталамус регулює водно-електролітний обмін, температуру тіла, функції ендокринних залоз, статеве дозрівання, діяльність серцево-судинної, дихальної систем, органів травлення, нирок. Він бере участь у формуванні харчового, статевого захисту, в регуляції циклу сон — бадьорість тощо. Тому будь-яка дія на гіпоталамус супроводжується комплексом реакцій багатьох систем організму, що виражається у вісцеральних, соматичних та психічних ефектах.
У разі ушкодження гіпоталамуса (пухлини, травматичні чи запальні ураження) спостерігаються розлади енергетичного і водного балансів, терморегуляції, функцій серцево-судинної системи, органів травлення, ендокринні порушення, емоційні реакції.
На вегетативні функції організму істотний вплив чинять лім-бічні структури мозку.
Лімбічна система, або «вісцеральний мозок», складається з філогенетично старих відділів головного мозку: мамілярних тіл гіпоталамусу, передніх ядер таламусу, мигдалеподібного тіла, септаль-них ядер, гіпокампу, поперечної звивини кори великого мозку та ін. Лімбічна система — функціонально єдиний комплекс названих нервових структур, який відповідає головним чином за механізми формування і реалізації емоційної поведінки ссавців, у прояві якої добре виражені вегетативні реакції.
Аферентні і еферентні зв’язки структур лімбічної системи різноманітні. Найбільшою мірою виражені морфофункціональні зв’язки між лімбічною системою, гіпоталамусом і ретикулярною фор
мацією. Через ці структури мозку лімбічна система впливає на вегетативні функції.
Важливу роль у регуляції вегетативних функцій відіграє ретикулярна формація стовбура головного мозку, яка підвищує активність вегетативних нервових центрів, тонізує їх.
У регуляції вегетативних функцій організму беруть також участь мозочок, підкіркові ядра (смугасте ядро) і нова кора, особливо передні її відділи (лобні частки великого мозку). Так, якщо досліджуваному дати можливість за допомогою зорових або слухових сигналів стежити за ритмом власного серця, то незначні зміни ритму в потрібному напрямі можуть відіграти роль підкріплення і стимулювати спроби ще більш його змінити. Це метод біологічного зворотного зв’язку. Він дуже перспективний, оскільки з його допомогою можна впливати на порушені функції організму без застосування лікарських препаратів. Він ефективний при лікуванні аритмії серця, головного болю, спричиненого розумовою перевтомою, мігрені тощо.
У разі ураження кори великого мозку виникають різноманітні вегетативні розлади, зокрема, регуляції функцій серцево-судинної системи, органів травлення та ін.
Таким чином, нервові механізми регуляції вегетативних функцій мають багаторівневу ієрархічну структуру, починаючи з внут-рішьноорганних периферичних рецепторів, які замикаються в інтрамуральних і позаорганних гангліях вегетативної нервової системи, і кінчаючи підкірковими ядрами та новою корою. Кожен вищий рівень регуляції забезпечує й вищий ступінь інтеграції вегетативних і соматичних функцій організму. При цьому нижчі рівні підпорядковуються вищим.
Вплив кори великого мозку на функції органів, які іннервуються вегетативною нервовою системою, здійснюється через ретикулярну формацію, гіпоталамус і гіпофіз. Є також прямі шляхи, які йдуть від лобної частки і поясної звивини до гіпоталамусу. Як свідчать численні дослідження К. М. Викова і співавторів (1942), у людини і тварин можна спостерігати умовнорефлекторні зміни вегетативних функцій (див. с. 520). Вплив кори великого мозку на вісцеральні органи доведено і в стані гіпнозу та аутотренінгу, коли навіюванням можна викликати зміну частоти серцевих скорочень, просвіту судин, потовиділення, інтенсивності обміну енергії тощо. Останнім часом намагаються впливати на вегетативні функції людини за допомогою методу оперантних (інструментальних) умовних рефлексів.
ВЕГЕТАТИВНІ РЕФЛЕКСИ
Вегетативна і соматична рефлекторні дуги збудовані за одним планом і складаються з чутливого, асоціативного та еферентного ланцюгів. Вони можуть доати спільні чутливі нейрони. Відмінності полягають у тому, що в дузі вегетативного рефлексу еферентні вегетативні клітини лежать у гангліях поза ЦНС.
Вегетативні рефлекси викликаються подразненням як і н т е -р о так і екстерорецепторів. Серед чисельних і різноманітних вегетативних рефлексів розрізняють вісцеро-вісцеральні, вісцеродермальні, дерматовісцеральні, вісцеромоторні та моторно-вісцеральні.
Вісцеро-вісцеральні рефлекси викликаються подразненням інтерорецепторів (вісцерорецепторів), розташованих у внутрішніх органах. Вони відіграють важливу роль у функціональній взаємодії внутрішніх органів і їх саморегуляції. До цих рефлексів належать вісцерокардіальні (рефлекторні зміни серцевої діяльності при подразненні рецепторів шлунка, кишечника, жовчного та сечового міхурів тощо), кардіо-кардіальні, кишково-печінкові та ін. У деяких хворих із ураженням шлунка спостерігається гастрокар-діальний синдром, одним із проявів якого є порушення діяльності серця, аж до появи приступів стенокардії, зумовлених недостатністю коронарного кровообігу.
Вісцеродермальні рефлекси виникають при подразненні рецепторів вісцеральних органів і проявляються порушенням шкірної чутливості, потовиділення, еластичності шкіри на обмежених ділянках поверхні шкіри (дерматомами). Такі рефлекси можна спостерігати в клініці. Так, при захворюваннях внутрішніх органів підвищуються тактильна (гіперестезія) і больова (гіпералгезія) чутливість у обмежених ділянках шкіри. Можливо, больові і небо-льові шкірно-аферентні волокна і вісцеральні аференти, які належать певному сегменту спинного мозку, конвертують на одних і тих'же нейронах спіноталамічного шляху. Подібні шкірні реакції (підвищеної чутливості) з’являються при захворюваннях внутрішніх органів, називаються відображеним болем, а ділянки, де він виникає,— зонами Захар’їна—Геда (табл. 105). При хворобах серця, печінки, жовчного міхура, шлунка, товстої кишки й інших внутрішніх органів пацієнти нерідко скаржаться на біль у цих зонах, що полегшує діагностику. Наприклад, хворі на стенокардію відзначають біль у ділянці серця, який віддає в ліву лопатку і ліву руку, хворі з виразкою шлунка — у надчеревну ділянку зліва тощо.
Дерматовісцеральні рефлекси проявляються в тому, що подразнення деяких ділянок шкіри супроводжується судинними реакціями і порушенням функції певних внутрішніх органів. На цьому грунтується застосування ряду лікувальних процедур (фізіо-, реф-лексотерапії). Так, подоазнення терморецепторів шкіри (нагрі-
Мал. 105. Схема розташування на тілі деяких зон Захар’їна—Геда, в яких можуть виявлятися підвищена чутливість або появлятися відображений біль при ряді захворювань внутрішніх органів:
1— зона легень та бронхів; 2 —зона серця; 8—-зона кишечника; 4 —зона сечового міхура; 5 — зона сечовода; 6— зона ннрок; 7, 9— зони печінки; 8— зони шлунка та підшлункової залози; 10— зона сечостатевих органів
ванням або охолодженням) через симпатичні центри призводить до почервоніння ділянок шкіри, гальмування активності внутрішніх органів, які іннервуються з однойменних сегментів.
Вісцеромоторні і моторно-вісцеральні рефлекси. З проявом сегментарної організації вегетативної іннервації внутрішніх органів зв’язані також вісцеромоторні рефлекси, при яких збудження рецепторів внутрішніх органів зумовлює скорочення або гальмування поточної активності скелетних м’язів.
Розрізняють «коригуючі» і «пускові» впливи з рецепторних полів внутрішніх органів на скелетні м’язи. Перші призводять до змін скорочень скелетних м’язів, які відбуваються під
впливом інших аферентних подразнень, посилюючи або пригнічуючи їх. Другі самостійно активізують скорочення скелетних м’язів. Обидва типи впливів пов’язані з посиленням сигналів, які надходять аферентними шляхами вегетативної рефлекторної дуги. Вісцеромоторні рефлекси нерідко спостерігаються і при захворюваннях внутрішніх органів. Наприклад, при холециститі або апендициті виникає напруження м’язів у ділянці, яка відповідає локалізації патологічного процесу. Таке захисне напруження м’язів черевної порожнини (дефанс) пов’язане зі збуджувальним впливом вісцеральних аферентних волокон на мотонейрони. До захисних вісцеромоторних рефлексів належать також і так звані вимушені пози, яких набуває людина при захворюваннях внутрішніх органів (наприклад, згинання і приведення нижніх кінцівок до живота).
Разом із тим напруження скелетних м’язів може позначитися і на діяльності внутрішніх органів, які іннервуються аферентами і еферентами однойменного сегмента спинного мозку (моторно-вісцеральні або соматовісцеральні рефлекси). На цьому грунтується, зокрема, застосування певних комплексів лікувальної фізкультури при захворюваннях внутрішніх органів.
У здійсненні розглянутих вище рефлекторних актів беруть участь «центри» спинного, довгастого, середнього, проміжного мозку. Вони можуть активізуватися й імпульсами відповідних зон кори великого мозку. На підставі аферентних сигналів від внутрішніх органів можуть бути вироблені будь-які умовні інтероре-цептивні рефлекси.
Аксон-рефлекс. Крім вищеназваних вегетативних рефлексів, дуги яких замикаються на різних рівнях ЦНС, є так звані периферичні, або місцеві, вісцеральні рефлекси.
Ще у минулому сторіччі Н. Соковнін довів, що можна викликати скорочення сечового міхура при подразненні тазового нерва за умови, що всі зв’язки нижнього брижового ганглію з ЦНС перервані. Таке явище отримало назву прегангліонарного аксон-рефлексу— збудження спочатку поширюється прегангліонарними волокнами в антидромному напрямку (тобто до ЦНС), а потім через розгалуження (колатералі) того ж аксона йде в ортодром-ному (тобто на периферію) до гангліонарних нейронів.
Разом із тим І. П. Разєнков (1959) і І. А. Булигін (1973) одержали дані, які свідчать про можливість безпосереднього перемикання у вегетативних гангліях збудження від аферентних волокон на гангліонарні нейрони, тобто про справжню рефлекторну функцію вегетативних гангліїв, можливість істинних периферичних рефлексів. Такі дані збігаються із даними Морфологічних досліджень про наявність у вегетативних гангліях особливих нервових клітин (клітин Догеля II типу). Розрізняють щонайменше три види місцевих рефлекторних дуг гангліонарного рівня: 1) ентеральні, коли
всі ланцюги дуги містяться в гангліях міжм’язового або підслизового сплетінь; 2) короткі дуги гангліонарного рівня із замиканням у превертебральних гангліях (сонячне сплетіння, каудальний бри-жовий вузол); 3) довгі дуги із замиканням у паравертебральних гангліях симпатичного стовбура. Що коротша вегетативна рефлекторна дуга, що нижчий її рівень, то виший ступінь її функціональної автономії.
Подібні периферичні рефлекси мають велике значення для здійснення саморегуляції внутрішніх органів і їх взаємодії.
Розглянуті у цьому розділі дані свідчать про те, що нервова регуляція вегетативних функцій організму істотно відрізняється від нервової регуляції його соматичних функцій. Це стосується будови дуг вегетативних рефлексів, ролі різних відділів ЦНС у їх забезпеченні, медіаторного механізму передачі імпульсів у синап-сах вегетативної нервової системи.
ВІКОВІ ЗМІНИ ВЕГЕТАТИВНОЇ
НЕРВОВОЇ СИСТЕМИ
Функціональне дозрівання периферичних відділів вегетативної нервової системи тісно пов’язане зі станом вищих відділів ЦНС. Після народження, на ранніх стадіях постнатального онтогенезу, в основному регулювання здійснюють центри симпатичної нервової системи. Тонус парасимпатичної системи, зокрема блукаючого нерва, відсутній. Блукаючий нерв включається в рефлекторні реакції на 2—3-му місяці життя дитини. Разом із тим відділи вегетативної нервової системи починають функціонувати в різні строки онтогенезу неоднаково стосовно різних органів і систем. Так, щодо органів травлення спочатку включається парасимпатична система!, а симпатична регуляція починає діяти в період відняття немовляти від грудей. Стосовно регуляції діяльності серця симпатична система включається раніше від вагусної. Як свідчать результати експериментальних досліджень, передавання збудження у вегетативних гангліях у новонароджених здійснюється адренергічним шляхом, а не за допомогою ацетилхоліну, як це спостерігається у дорослих.
Таким чином, симпатична передача збудження в період раннього онтогенезу характеризується великою кількістю адренергічних синапсів.
У старості симпатичні і парасимпатичні тонічні впливи на діяльність ряду органів слабшають. Це впливає на перебіг важливих вегетативних реакцій і метаболічних процесів і тим самим обмежує адаптивні можливості старіючого організму. Поряд із цим у процесі старіння знижується вміст у крові катехоламінів, але підвищується чутливість клітин і тканин до їхньої дії, а також до ряду інших фізіологічно активних речовин.
Послаблення вегетативних реакцій є однією з причин зниження працездатності при старінні.
У період старіння настають структурні і функціональні порушення у вегетативних гангліях, які можуть перешкоджати передачі імпульсів у них і впливати на трофіку тканини, яка іннервує-ться. Істотно змінюється гіпоталамічна регуляція вегетативних функцій, що є важливим механізмом старіння організму.
КЛ1Н1КО-ФІЗІОЛОГІЧНИЙ АСПЕКТ
Знання особливостей вегетативної нервової системи має не тільки теоретичне, але й практичне значення, оскільки лікарю доводиться спостерігати хворих переважно з порушенням саме вегетативних функцій організму. Так, досить частими порушеннями є різноманітні вегетативні розлади — підвищена пітливість, тахікардія, гіпертензія, зміна дихання, порушення діяльності органів травлення (пронос, запор, дискінезія жовчних шляхів та ін.), сухість у роті або гіперсалівація, порушення терморегуляції тощо. Вони можуть виникати при захворюваннях нервової системи, особливо при ураженні гіпоталамолімбічних структур мозку. При ураженні периферичного відділу вегетативної нервової системи (вегетативних нервів, гангліїв) нерідко відзначаються спазм артерій шкіри або гіперемія, потовщення, сухість і лущення шкіри, деформація нігтів, трофічні виразки, больові відчуття (симпаталгія) тощо.
Деякі вегетативні рефлекси використовують у практичній медицині для вивчення стану вегетативної нервової системи — так звані функціональні вегетативні проби. До них належать: 1) окосер-цевий рефлекс (Даніні — Ашнера) — при плановому натисканні на очні яблука сповільнюється серцебиття; 2) реакція зіниці на світло, тобто зіничний рефлекс; 3) ортостатична реакція (прискорення серцебиття і підвищення артеріального тиску під час переходу з положення лежачи у положення сидячи); 4) кліностатична реакція (сповільнення серцебиття і зниження артеріального тиску при переході з положення стоячи у положення лежачи); 5) дихально-серцевий рефлекс (зменшення частоти серцевих скорочень в кінці видиху перед початком вдиху); 6) рефлекс Чермака (натискання на ділянки каротидних синусів з двох боків супроводжується зменшенням частоти серцевих скорочень); 7) дермографізм (білий і червоний), який дозволяє судити про судинні реакції, та ін.
У людей із підвищеним тонусом симпатичної або парасимпатичної нервової системи спостерігається посилення чи послаблення вказаних вище рефлексів.
Серед фармакологічних вегетативних проб використовують реакції на пілокарпін чи адреналін. Так, у разі надмірної реакції на ваготропну речовину (пілокарпін) втрачається чутливість до адреналіну і навпаки.
При деяких захворюваннях із лікувальною метою вдаються до переривання (хірургічного, фармакологічного) вегетативної іннервації певного органа. Наприклад, при виразковій хворобі шлунка виконують селективну ваготомію, у деяких інших випадках — симпатичні або гангліонарні блокади тощо.
Знання фізіології вегетативної нервової системи має також велике значення для розуміння механізмів дії багатьох лікарських препаратів.
Гуморальна регуляція функцій організму
Гуморальна регуляція — це різновид біологічної регуляції, при якому інформація передається за допомогою біологічно активних хімічних речовин, які розносяться по організму кров’ю або лімфою, а також шляхом дифузії у міжклітинній рідині.
Гуморальна регуляція відрізняється від нервової. Так, носієм інформації при гуморальній регуляції є хімічна речовина, при нервовій — нервовий сигнал. Передача гуморальної регуляції здійснюється течією крові, лімфи, шляхом дифузії, нервова — надходить нервовими волокнами. Гуморальний сигнал поширюється повільніше (з течією крові капіляром зі швидкістю 0,05 мм/с), ніж нервовий (швидкість нервової передачі складає 130 м/с). Гуморальний сигнал не має такого точного адресата (працює за принципом «усім, усім, усім»), як нервовий (наприклад, нервовий імпульс передається скорочувальному м’язу пальця). Але ця різниця не суттєва, позаяк клітини мають різну чутливість до хімічних речовин. Тому хімічні речовини діють на чітко визначені клітини, тобто на ті, які здатні сприймати цю інформацію. Клітини, які
володіють такою високою чутливістю до будь-якого гуморального чинника, називаються клітинами-мішенями.
Серед гуморальних чинників виділяють речовини з вужчим
Мал. 106. Блок-схема гуморальної регуляції:
КЗЗ-І — канал зовнішнього зв’язку: КУ — керуючий устрій; ОЕ — орган-ефектор; РП — регульований параметр; КПЗ — канал прямого зв’язку; КЗЗ-ІІ — канал зворотного зв’язку
спектром дії, тобто спрямованою дією на обмежену кількість клітин-мішеней (наприклад, окситоцин), і ширшим (наприклад, адреналін), для яких є значна кількість клітин-мішеней.
Гуморальна регуляція використовується для забезпечен-
ня реакцій, які не потребують високої швидкості і точності виконання.
Гуморальна регуляція, як і нервова, завжди виконується
Фактори гуморальної регуляції
Метаболічні фактори
Справжні гормони
Тканинні гормони
декретуються. спеціалізованими клітинами („класичні гормони") ' декретуються спеціалізованими клітинами (ендокринними, нейроендокринними), розсіяними в різних тканинах і органах (більшість із них входить до складу „АПУД- системи") декретуються неспеціалізова -ними клітинами різного виду
Метаболіти (неспецифічні продукти метаболізму, що утворюються в усіх клітинах організму)
Хімічні порушення при напруженому метаболізмі
Гормони гіпофіза, Ліберини,статини і Простагландини, Молочна, піро- І і#
гіпоталамуса, нейропептиди гіпота- енкефаліни.ком- виноградна
надниркових, під- лам уса; гормони сис- поненти калікре- кислоти, СО^, К\Са^ііа+ шлункової, щи- теми травлення; ком- їн-кініновоїсис- аденозин
товидної.пара- понентиренін-ангіо- теми, гістамін,
щитовидних, тензивної системи серотонін
статевих залоз
Мал. 107. Фактори гуморальної регуляції
замкнутим контуром регуляції, в якому всі його елементи пов’язані між собою каналами (мал. 106).
Що стосується елемента контура приладу, який стежить (СП), то в контурі гуморальної регуляції як самостійна структура він відсутній. Функцію цієї ланки виконує, як правило, інкреторна клітина.
Гуморальні речовини, які потрапляють у кров або лімфу, дифундують у міжклітинну рідину і швидко руйнуються. У зв’язку з цим дія їх може поширюватися лише на близько розташовані клі-тини-органи, тобто їх вплив має місцевий характер. На противагу місцевій дії дистантний вплив гуморальних речовин поширюється на клітини-мішені на відстані.
Фактори гуморальної регуляції зображено на мал. 107.
ЗАГАЛЬНА ЕНДОКРИНОЛОГІЯ
Ендокринологія — наука про залози внутрішньої секреції. Залози внутрішньої секреції (від гр. епйоп — всередину, кгіпеіп — виділяти) — органи чи групи клітин, які, на відміну від залоз зовнішньої секреції (екзокринних), не мають вивідних проток і виділяють свої секрети безпосередньо у кров, лімфу або інші тканинні
ЕПІФІЗ
ГІПОФІЗ
’МЕЛАТОНІН АДРЕНОГЛОМЕ-РУЛОТРОПІН ТА ІН. ВАЗОПРЕСИН, ОКСИТОЦИН, АКТГ иГОНАДОТРОПІНИ, ПРОЛАКТИН
ЩИТОВИДНА ЗАЛОЗА
ПІДГРУДИННА ЗАЛОЗА
ПЛАЦЕНТА
ІНСУЛІН, ГЛЮКАГОН
ЕСТРОГЕНИ, ПРОГЕСТОГЕН, РЕЛАКСИН, ХОРІОНІЧНИЙ ГОНАДОТРОПІН
ОРГАНИ ^ТРАВЛЕННЯ.
ЕСТРОГЕНИ ПРОГЕСТЕРОН, РЕЛАКСИН
ПІДШЛУНКОВА ЗАЛОЗА
ГАСТРИН, СЕКРЕТИН ТА ІН.
ТИРОКСИН, ТРИЙОДТИРОНІН, ТИРЕОКАЛЬЦИ-ТОНІН
ПРИЩИТОВИДНА ЗАЛОЗА
ПАРАТИРЕ-.ОЇДНИЙ ГОРМОН
НАДНИРКОВА ЗАЛОЗА
КОРТИКОСТЕ-
РОЇДИ, АДРЕНАЛІН.
НОРАДРЕНАЛІН |
тимозин.
яєчник
НИРКА
ЕРИТРОПОЕТИН, РЕНІН, ПРОСТАГЛАНДИНИ ТА ІН.
СІМ’ЯНІ ЗАЛОЗИ
АНДРОГЕНИ
Мал. 108. Локалізація ендокринних органів у людини
рідини. Вони розташовані у різних частинах організму, мають складну морфологічну структуру і складають ендокринну систему (мал. 108). До залоз внутрішньої секреції належать: гіпоталамус, епіфіз, гіпофіз, щитовидна залоза, прищитовидні залози, пригрудинна залоза, острівцевий апарат підшлункової залози, кора і мозкова речовина надниркових залоз, яєчники, яєчка, плацента.
Крім ендокринних залоз, по різних органах і тканинах розкидані клітини, які виробляють речовини, котрі досягають органів-мішеней за допомогою дифузії, тобто не потрапляючи у. кров.
Це — паракринні клітини. До них належать нейрони (переважно гіпоталамуса), що виробляють деякі гормони і регуляторні нейропептиди — нейроендокринні чи нейросекреторні клітини. Вони входять до складу так званої дифузної нейроендокринної системи. Деякі з регуляторних поліпептидів-гормо-нів, крім головного мозку, виробляються в особливих клітинах органів травлення. Ці клітини входять також до складу системи АРЦЦ (назву дано за першими літерати англійських слів Атіпе Ргесиг8ОГ8 Цріаке апб ОесагЬохуІаііпд), або системи захоплення попередників амінів та їх декарбоксилювання. Клітини цієї системи характеризуються високим вмістом амінів, здатністю до захоплення їхніх попередників і наявністю декарбоксилази, амінів. Вони можуть виробляти пептиди і біогенні аміни (серотонін, дофамін, гістамін).
Вважається, що ці клітини походять із нейроектодерми і складають морфологічну основу так званої системи головний мозок — кишка. Ендокринними функціями володіє і нирка, яка секретує ренін, еритропоетин, простагландини та ін.
Загальна уява про гормони. Продукти життєдіяльності ендокринних залоз називають інкретами, або гормонами. Термін «гормон» (від гр. йогтао — спонукаю, збуджую) ввели англійські фізіологи XV. М. Вау1І88 і Е. Н. Зіагііп^ у 1905 р. Вони виділили із стінки дванадцятипалої кишки секретин, який стиму-ляє секрецію підшлункової залози (див. с. 456). Потім цим терміном стали називати речовини, які виділяються у кров залозами внутрішньої секреції.
Гормони виробляються в ендокринних залозах двох типів: у залозах зі змішаною функцією, які здійснюють внутрішню і зовнішню секрецію (підшлункова, статеві залози), і у залозах, що виконують лише інкреторну функцію (гіпофіз, епіфіз, щитовидна і прищитовидні, підгрудинна, надниркові залози).
Усі ендокринні залози добре оснащені кровоносними судинами, стінки яких мають високу проникність. Це полегшує надходження гормонів у міжклітинні щілини, а звідси у кров і лімфу. Залози внутрішньої секреції іннервуються головним чином вегетативною нервовою системою, добре забезпечені рецепторами.
Завдяки досягненням у галузі хімії було одержано фундаментальні дані про хімічну природу гормонів, здійснений синтез більшості з них.
Гормони за своєю хімічною будовою різнорідні і можуть бути поділені на три групи: 1) поліпептиди та білки, з наявністю вуглеводного компоненту і без нього; 2) амінокислоти і їх похідні; 3) стероїди (табл. 6).
Поняття «гормони» часто трактується душе широко. До гормонів без достатніх на те підстав зараховують різні біологічно активні речовини, що виробляються в організмі. Для встановлення
Таблиця 6. Класифікація гормонів
Гормон Клас хімічних сполук Основне джерело
Адреналін Аміни Мозковий шар надниркових залоз
Норадреналін » ЦНС, мозковий шар надниркових залоз
Дофамін в ЦНС
Мелатонін » Епіфіз
Тироксин (Т4) Щитовидна залоза
Трийодтиронін в Там же
Вазопресин (антидіуретичний Невеликі пеп- Задня частка гіпофіза, гіпо-
гормон — АДГ) тиди таламус
Окситоции Меланоцитостимулюючий гормон (МСГ) Тиреотропін-рилізинг-гормон (ТРГ) Гонадотропін-рилізинг-гормон в Там же Проміжна частка гіпофіза Гіпоталамус, ЦНС
в Там же
Соматостатии в Гіпоталамус, ЦНС, острівці підшлункової залози
Кортикотропін-рилізинг-гормон (КРГ) Соматокрииін в Гіпоталамус, ЦНС
в Там же
Ангіотензини (А 11, А ПІ) в Кров (із попередника), ЦНС
Інсулін Білки р-Клітини острівців підшлункової залози
Глюкагон В а-Клітини острівців підшлункової залози
Гормон росту, або соматотро-пін (ГР, СТГ) в Передня частка гіпофіза
Плацентарний лактоген (ПЛ) » Плацента
Пролактии (ПРЛ)' » Передня частка гіпофіза
Паратиреоїдний гормон, або паратгормон (ПТГ) в Прищитовидні залози
Р-Ліпотропін і енкефаліни в Гіпофіз, ЦНС
Кальцитонін в К-Клітини, щитовидна залоза
Адренокортикотропний гормон, або адренокортикотропін (АКТГ) в Передня частка гіпофіза
Секретин в Оргаин травлення
Холецистокінін (ХЦК) в Там же
Гастрин в В
Шлунковий іигібіруючий пептид (ШІП) в в
Фолікулостимулюючий гормон (ФСГ) Глікопротеїни Передня частка гіпофіза
Лютеїнстимулюючий гормон (ЛГ) Хоріонічний гонадотропін (ХГ) » Там же
» Плацента
Тиреотропний гормон (ТТГ) » Передня частка гіпофіза
Естрогени (Е2, Ез) Прогестерон (П) Стероїди Яєчники, плацента
» Жовте тіло, плацента
Тестостерон (Т) » Сім’яні залози
Продовження табл. 6
Гормон Клас хімічних сполук Основне джерело
Дигідротестостерон (ДГТ) Стероїди Чутливі до тестостерону тка-
иини
Глюкокортикоїди » Кора надниркових залоз
Альдостерон Там же
Метаболіти холекальциферолу (вітамін С) ь Печінка, нирки
гормональної активності тієї чи іншої біологічно активної речовини використовуються такі докази: 1) наявність чітких проявів «випадання» гормонального ефекту, що настає після видалення органа, який, секретує речовину; 2) усунення явищ «випадання» при застосуванні замісної терапії (введення екстракту з даного органа, ауто- і гомотрансплантація); 3) очищений препарат, одержаний з цього органа (якщо можливо, то й синтезований), повинен справляти специфічний гормональний вплив.
Гормони циркулюють у крові у вільному і зв’язаному з білками стані. Внаслідок сполучення з білками гормони, як правило, переходять у неактивну форму. Для всіх гормонів характерний відносно невеликий період напівжиття (звичайно близько 1 год). У процесі обміну речовин змінюються їх структура і функції. Крім того, частина гормонів використовується клітинами організму, а частина виводиться із сечею.
Інактивація гормонів відбувається за рахунок сполучення з білками, утворення парних сполук із глюкуроновою кислотою, активності ферментів печінки та процесів окислення.
Типи дії гормонів на організм. Гормони впливають на найрізноманітніші прояви життєдіяльності організму. Виділяють чотири типи впливу гормонів: 1) метаболічний — вплив на обмін речовин; 2) морфогенетичний — стимуляція формоутворення, диференціація тканин і' органів, росту, метаболізму та метаморфозу; 3) кінетичний, чи пусковий,— вплив на певний аспект діяльності ефектора; 4) коригуючий — зміна функцій організму чи окремих його органів.
Функціональне значення гормонів. Гормони виконують такі важливі функції: 1) беруть участь у механізмах регуляції та інтеграції функцій організму, забезпечують підтримання деяких фізіологічних констант на відносно постійному рівні (наприклад, рівня глюкози в крові, осмотичного тиску тощо), тобто мають «гомеостатичну» функцію (гормональна регуляція фізіологічних функцій є вищою формою гормональної регуляції); 2) пристосовують (адаптують) організм до умов внутрішнього і зовнішнього середовищ організму, які постійно змінюються); 3) роблять можливим і
забезпечують статевий, фізичний і розумовий розвиток; 4)'поряд із нервовими імпульсами гормони є носіями відповідної інформації чи сигналу.
Гормони -мають також «пермісивну» дію, яка полягає в тому, що різні біохімічні реакції відбуваються лише у присутності одного або декількох гормонів, хоча реакція й не прискорюється у разі збільшення концентрації гормонів.
Властивості гормонів. До основних властивостей гормонів належать специфічність, дистантний характер їх дії та висока біологічна активність.
1. Специфічність дії гормонів. Гормони специфічно впливають на органи-мішені, на що, як правило, нездатні інші біологічно активні речовини. Тобто кожен гормон діє лише на конкретні фізіологічні системи чи органи (ефекторні органи). Специфічність дії гормонів пояснюють існуванням гормонспецифічних рецепторів клітинних мембран.
2. Дистантний характер дії гормонів. Органи-мішені і системи, на які діють гормони, як правило, розташовані далеко від місця їх утворення в ендокринних залозах. Так, тропні гормони гіпофіза, який лежить біля основи мозку, діють на щитовидну, статеві, надниркові залози, антидіуретичний гормон гіпофіза (вазопресин) — на нирки тощо.
Тканинні гормони, які виділяються без участі спеціалізованих органів (ендокринних залоз), хоча й потрапляють у кров, найчастіше діють місцево, на невеликій відстані від місця виділення. До них належать гормони, які виділяються спеціальними клітинами слизової оболонки органів травлення і впливають на його секреторну і моторну активність (гастрин, секретин та ін.).
3. Висока біологічна активність гормонів. Гормони діють у мізерних концентраціях. Так, щоденна мінімальна потреба в гормонах для дорослої людини така: гормони щитовидної залози — 0,3 мг, інсулін—1,5 мг, мінералокортикоїди — 2 мг, глюкбкорти-коїди — 20 мг, андрогени — 5 мг, естрогени — 0,25 мг. Це треба враховувати у разі введення гормонів у організм. Наприклад, щоденна доза синтетичного аналога гормона кори надниркових залоз преднізолону, що підтримує життєдіяльність організму при недостатності функції надниркових залоз, складає 10 мг.
Механізм дії гормонів дуже складний і до кінця не вивчений. Вони безпосередньо впливають на активність клітин, тканин, органів, а також діють опосередковано через нервову систему, змінюючи її функціональний стан.
Є два шляхи дії гормонів на клітину-мішень: 1) взаємодії з рецептором плазматичної мембрани клітини; 2) зв’язування з рецепторами, розташованими в ядрі клітини.
Рецептори, які входять до складу плазматичної мембрани клі-
Мал. 109. Схематичне зображення взаємодії гормона з рецептором плазматичної мембрани клітини
Мал. 110. Схематичне зображення дії гормона з циторецептором клітини
тини, є глікопротеїдрми, причому специфічність рецептора зумовлена вуглеводним компонентом глікопротеїдів.
Унаслідок взаємодії-гормона з рецептором виникає певний ланцюг процесів (мал. 109), природа яких визначається як хімічною структурою гормона, так і типом клітини-мішені. Кожен гормон проявляє винятково високу спорідненість зі своїм специфічним рецептором. Зв’-язування з ним призводить до активізації мембранного фермента аденілатциклази (ліпонротеїд), внаслідок чого підвищується синтез внутрішньоклітинного циклічного нуклеотиду аденозинмонофосфату (цАМФ), який відіграє роль вторинного посередника, або месенджера. Первинним вважається гормон. Джерелом утворення цАМФ є внутрішньоклітинна АТФ.
цАМФ стимулює деякі внутрішньоклітинні ферменти, зокрема протеїнкіназу, що зумовлює фосфорилювання субстрату, збільшення транспорту через мембрану N3+, К+, Са2+ і врешті-решт відпо-ввдний ефект у клітинах органів-мішеней, фізіологічну реакцію. Окремі гормони (вазопресин, окситоцин, соматотропін) діють через поліфосфоінозитидну систему. Такий шлях впливу на клітину-
мішень характерний для великомолекулярних гормонів, що налеА жать до поліпептидів і білків, полімерність яких перешкоджає їх! проникненню в середину клітини.
Важливу роль у активізації аденілатциклази грає особливий білковий компонент мембрани, так званий 6-білок (М-білок). Він відповідає за функції трансдуктора, який є приміром, що складається З СЦ-, Р1- і у-субодиниць із молекулярною масою відповідно 45 000, 35 000 і 8000. Зв’язок гормона з рецептором призводить до дисоціації а- і 0-субодиниць. Встановлено, що гормони і деякі чинники здійснюють як'стимулювальні, так і інгібіторні впливи. Прикладом агоністів, які стимулюють аденілатциклазу, можуть бути гормони глюкагон, вазопресин (через ВПі-рецептори), ЛГ, ФСГ, ТТГ і АКТГ. До чинників, які здійснюють інгібіторну дію на аденілатциклазу і спричиняють зниження концентрації цАМФ, належать опіоїди (енкефаліни, ендорфіни), соматостатин, ангіотен-зин II і ацетилхолін (через Мгрецептори). Доведено, що стимулю-вальний ефект пов’язаний з. 6с-білком, а інгібіторний — з Сгбіл-ком, у яких дещо відрізняється а-субодиниця.
Для низькомолекулярних гормонів, зокрема стероїдної природи, які легко проникають у середину клітини, характерний інший шлях впливу на клітину-мішень. Це комплексування гормона з рецепторами, які містяться в ядрі клітини, активізація або гальмування її генетичного апарата (мал. ПО).
РЕГУЛЯЦІЯ УТВОРЕННЯ ГОРМОНІВ
Гормони не тільки впливають на органи-мішені, а й самі можуть бути об’єктом регуляції. Рівень їх у крові залежить як від синтезу, так і від виділення. Обидва процеси регульовані. Залежно від потреб організму вони бувають короткочасними або постійними. Інтенсифікація їх призводить до гіперфункції, сповільнення — гіпофункції.
Регуляція функції ендокринних залоз здійснюється такими механізмами: 1) прямий вплив концентрацій субстратів крові на клітини залози; 2) нервова регуляція; 3) гуморальна регуляція; 4) нейрогуморальна регуляція (гіпоталамо-гіпофізарна система}.
У регуляції діяльності ендокринної системи важливу роль відіграє принцип саморегулювання, який здійснюється за рахунок зворотних зв’язків. Розрізняють позитивну (наприклад, збільшення рівня цукру в крові призводить до підвищення концентрації інсуліну) і негативну (при зростанні кількості кортизона в крові зменшується його утворення наднирковими залозами) регуляцію.
ГІПОТАЛАМО-ГІПОФІЗАРНА СИСТЕМА
Важливу роль у регуляції функцій ендокринних залоз відіграє гіпоталамо-гіпофізарна система (мал. 111). Вона має таку будову: 1) система, яка складається із гіпоталамуса і нейрогіпофіза (задньої частки гіпофіза); 2) система, утворена гіпофізотропною зоною гіпоталамуса (міститься в серединному підвищенні), зв’язана з аденогіпофізом (передньою часткою гіпофізу) за допомогою гема-тоневральної контактної зони; 3) система нейроендокринна, відпо-
Мал. 111. Схема гіпоталамо-гіпофізарної системи (за даними Р. Ф. Шмідта, Г. Тевса, 1985):
СОЯ —* сулраоптичне ядро, ПВЯ — паравентрикулярне ядро (в них синтезуються вазопресин і окситоцнн). Стрілками вказано шлях їх стікання в нейрогіпофіз, де вони проникають у кров. РГ — ділянки, де синтезуються рнлізинг-фактори в гіпоталамусі. Штрихом вказано шлях їх проникання в аденогіпофіз, місце утворення гіпофізарних тропних гормонів
Мал. 112. Механізм екзоцитозу нейросекрету:
У--надходження ПД; 2 — вхід Са2+ в нервове закінчення; Л —сполучення Са“і~Ь а кальмодуліяом (КМ); 4 — Са — КМ (утвореная комп-лексу кальцій н-кальмодулін); 5 — вплив Са — КМ иа аденілатцикла-зу (АЦ); 6 —утворення цАМФ; 7 — активація протеїнкіназн (ПКН); 8 — вплив Са — КМ иа фосфодгагтеразу
відальна за утворення нейрорегуляторних пептидів (енкефалінів, ендорфінів, речовини Р та ін.), яким властива гипофізарна активність.
Як свідчить мал. 112, деполяризація нервових закінчень індукує вхід Са2+ у нервове закінчення. Іони кальцію зв’язуються з каль-модуліном, утворюючи комплекс кальцій — кальмодулін, який активізує аденілатциклазу. Внаслідок цього підвищується вміст цАМФ, який активізує протеїнкіназу. цАМФ-залежна протеїнкіна-за разом із Са2+ активізує кіназу фосфорилази, відбувається фос-форилювання білків. Це забезпечує злипання мембран везикул із пресинаптичною мембраною і виділення (ексоцитоз) нейросекрету.
Синтез у гіпоталамусі гормонів, зокрема антидіуретичного (вазопресину) і окситоцину, здійснюється в нейронах супраоптичного і паравентрикулярного ядер.
Ці гормони транспортуються 'у вигляді гранул із клітинних тіл їхніми аксонами, що утворюють гіпоталамо-гіпофізарний тракт
Мал. 113. Схема ядер гіпоталамуса і гі-поталамо-гіпофізарного шляху. Транспорт речовин до задньої частки гіпофіза. Вплив вищих центрів (Аі) і периферичних шляхів (А2):
1 — паравентрнкуляоне ядро; 2 — супраоптич-не ядро; 3 — зоровий перехрест; 4 — папілярне тіло: 5 — супраоптпчна артерія; 6 — горо-кова частина і гіпоталамо-гіпофізарний шлях;
7 — передня частка гіпофіза (адеиогінофіз): З — проміжна частка гіпофіза; 9 — задня частка (нейрогіпофіз); 10 — артерія; 11— вена
лійки, до капілярів нейрогіпофі-за, куди виділяються гормони після розпаду гранул. Крім великих нейросекреторних клітин, що виробляють вазопресин, оксито-цин, у гіпоталамусі є дрібні нервові клітини, розташовані в гіпо-фізарній зоні, які продукують гормони, котрі стимулюють або пригнічують вивільнення гормонів аденогіпофізом — так звані рилізинг-гормони, або рилізинг-чинники. Нещодавно запропоновано називати рилізинг-гормони, які сприяють утворенню гормонів аденогіпофізом, ліберинами, а гормони-інгібітори — статинами. За своїм хімічним складом рилізинг-гормони є пептидами. Деякі з них
уже синтезовані і їх використовують у терапевтичній практиці.
Рилізинг-гормони з гіпофізар-ної зони гіпоталамуса потрапляють до аденогіпофіза через в о -рітну систему вен гіпофіза, які несуть кров до капілярного сплетіння аденогіпофіза (мал. 113). На стінках цих судин закінчуються й аксони секреторних нейронів гіпофізарно( зони. З капілярних петель рилізинг-гормони потрапляють до своїх клі-тин-мішеней аденогіпофіза, які виробляють тропні гормони. Вважають, що рилізинг-гормони не лише регулюють виділення троп-них гормонів аденогіпофіза, але й стимулюють або пригнічують функцію нейронів у різних відділах головного мозку.
Крім рилізинг-гормонів, у гіпоталамусі синтезуються пептиди, яким властива морфіноподібна дія. Це енкефаліни і ендорфіни (ендогенні опіати). Вони відіграють важливу роль у механізмах
болю і знеболення, регуляції поведінки й вегетативних інтегративних процесів.
На функцію ендокринних залоз через гіпоталамус впливають різні структури ЦНС. Так, центральна регуляція гіпоталамо-гіпо-фізарної системи здійснюється центрами, які локалізуються в пре-оптичній ділянці, лімбічній системі, у нейронах стовбура головного мозку (довгастому, середньому і мосту), аж до кори великого мозку. Сигнали від багатьох із перерахованих центрів до ядер гіпоталамуса передаються за допомогою аміноспецифічних систем мозку. В свою чергу реакція центрів розпочинається при певному рівні гормонів периферичних ендокринних залоз і тропних гормонів гіпофіза.
ПРИНЦИПИ РЕГУЛЯЦІЇ
ЕНДОКРИННИХ ЗАЛОЗ
У регуляції діяльності ендокринної системи велику роль грає принцип саморегулювання, який здійснюється за рахунок зворотних (позитивних і негативних) зв’язків. Ці зв’язки в ендокринній системі були встановлені М. М. Завадовським і визначені ним як взаємосуперечливі («плюс — мінус взаємодія»). Так, тропні гормони аденогіпофіза активізують діяльність периферичних ендокринних залоз (щитовидної, статевих, надниркових залоз). У разі підвищення ж у крові рівня гормонір цих залоз гальмується утворення відповідних тропних гормонів у аденогіпофізі. Наприклад, якщо кров містить недостатню кількість тироксину, то. при цьому відбувається посилене утворення в аденогіпофізі тиреотропіну, який стимулює діяльність щитовидної залози. Навпаки, у надлишковій концентрації він гальмує утворення в гіпофізі тиреотропного гормон а.
Встановлено також зворотний зв’язок між гіпоталамусом і тропними гормонами гіпофіза. Наприклад, гіпоталамус стимулює секрецію передньою часткою гіпофіза тиреотропіну, а підвищення концентрації в крові цього гормона веде до гальмування нейро-секреції в нейронах гіпоталамуса, внаслідок чого зменшується продукція в них рилізинг-гормона тиреоліберина.
Зворотний зв’язок між ендокринними залозами і ЦНС здійснюється також за допомогою інтерорецепторів і аферентних нервів залоз.
ЕПІФІЗ
Епіфіз є верхнім придатком мозку. Він, як і задня частка гіпофіза, належить до проміжного мозку. Через зовнішню подібність із сосновою шишкою залоза була названа шишковидною. Думки про значення епіфіза досить неоднозначні. В останні десятиріччя
було одержано багато нових даних, що уточнюють фізіологічну роль і ендокринні функції епіфіза.
Епіфіз, чи шишковидна залоза,— конусопобідне утворення, яке нависає над верхніми горбками чотиригорбкового тіла. Залоза складається з паренхіми і сполучної тканини. До складу паренхіми входять великі світлі клітини, які називаються пінеальними. Вважають, що клітини паренхіми епіфіза гліальної природи. Кровопостачання залози здійснюється судинами м’якої мозкової оболонки. Епіфіз іннервується симпатичними нервами і, можливо, нервовими волокнами безпосередньо з ЦНС (з пластинки чотиригорбкового тіла та ін.). З віком залоза зазнає поступової інволюції, але функціональна активність її не втрачається повністю.
З тканини епіфіза виділені біологічно активні речовини м е -латонін, аденогломерулотропін, серотонін. Всі вони є похідними триптофана.
Мелатонін бере участь у регуляції пігментного обміну—знебарвлює меланофори шкіри жаб і риб (щодо цього він є антагоністом інтермедину — гормона середньої частки гіпофіза). Мелатонін гальмує розвиток статевих функцій у дитячому організмі і дію гонадотропних гормонів — у дорослому. Це зумовлено впливом мелатоніну на гіпоталамус (блокує звільнення рилізинг-гормо-на) і .аденогіпофіз (гальмує дію люліберину иа звільнення лютеїні-зуючого гормона лютропіну). В організмі, що росте, активні речовини епіфіза гальмують також вироблення соматотропіну (гормона росту) в аденогіпофізі.
Діяльність епіфіза залежить від добового ритму, зокрема, від освітлення. Інформація про освітлення надходить від сітківки ока ретиногіпоталамічним шляхом у гіпоталамус (супрахіазма-тичне ядро) і через низхідні шляхи цього ядра, модулюючи активність симпатичних нервів, які підходять до епіфіза. Це спричинює гальмування секреції мелатоніну (в темряві його синтез підвищується). Із збільшенням тривалості світлового дня наростаюче гальмування секреції мелатоніну супроводжується збільшенням виділення гонадотропінів, що зумовлює ріст статевих залоз, утворення в них статевих гормонів і стимулює статеву активнісі-ь (ці дані мають велике значення для розуміння смислу річного ритму плідності багатьох ссавців). Висловлюється припущення, що епіфіз бере участь у процесах адаптації організму до нових умов існування в ролі біологічного «годинника».
Доведено, що епіфіз гальмує вироблення гормонів практично в усіх залозах внутрішньої секреції. Це здійснюється внаслідок як безпосередньої дії на залозу-мішень, так і через гіпоталамо-гіпо-фізарну систему, з якою епіфіз контактує через ліквор III мозкового шлуночка. Таким Чином, епіфіз у ендокринній системі відіграє роль тонкого регулятора діяльності залоз внутрішньої секреції.
Епіфіз гальмує водно-електролітний, вуглеводний обмін та деякі інші показники гомеостазу в організмі ссавців.
Аденогломерулотропін бере участь у стимуляції секреції гормона кори надниркових залоз альдостерону, а отже, і в регуляції водно-електролітного обміну.
Вважають, що епіфіз, гіпофіз і проміжний мозок складають єдину функціональну систему, яка регулює діяльність статевих залоз і ріст організму.
ГІПОФІЗ
У системі ендокринних залоз гіпофіз посідає особливе місце, його називають центральною залозою внутрішньої секреції, «королем ендокринної системи». Це пов’язано з тим, що гіпофіз за рахунок своїх спеціальних тропних гормонів регулює діяльність інших, так званих периферичних залоз внутрішньої секреції.
Гіпофіз, або нижній мозковий придаток, розташований на вентральній поверхні мозку в основі черепа на дні турецького сідла. У людини цей орган має масу 0,6 г. У гіпофізі розрізняють дві головні частини: а д е н о г і п о ф і з і нейрогіпофіз, що мають різне походження і будову. Аденогіпофіз, або залозиста частка, поділяється у свою чергу на три частки: передню, туберальну і проміжну. Він розвивається з епітеліального випинання (кишені Ратке) даху ротової порожнини. Нейрогіпофіз, або мозкова частка, є похідним дна лійки проміжного мозку. В нейрогіпофіз включають ділянку середнього підвищення сірого горба, стебло лійки і задню (нервову) частку гіпофіза. Задня частка гіпофіза перебуває в тісному морфологічному і функціональному зв’язку з гіпоталамусом. У ньому закінчуються волокна гіпоталамо-гіпофізарного тракту, що йде від супраоптичного і паравентрикулярного ядер гіпоталамуса. У задній і проміжній частках гіпофіза закінчуються дофамінергічні нервові волокна аркуатного ядра. Питання про нервовий зв’язок між гіпоталамусом і аденогіпофізом залишається дискусійним. Більшість дослідників вважає, що нервові волокна, виявлені у передній частці гіпофіза, належать до симпатичної нервової системи і потрапляють у неї разом із кровоносними судинами. Аденогіпофіз має тісрий судинний зв’язок з гіпоталамусом. Система кровоносних судин називається портальною. Потік крові у ній має низхідний напрям і забезпечує дію рилізинг-гормонів на тропні гормони гіпофіза. Є ще одна капілярна сітка, потік крові в якій має висхідний напрям і може забезпечувати вплив гіпофі-зарних гормонів на гіпоталамус за механізмом зворотного зв’язку.
В аденогіпофізі можна виділити такі групи клітин: ацидофільні (альфа-клітини), базофільні (бета-клітини), що називаються хромофілами, та хромофобні (гамма-клітини). Зазначимо, що терміни «базофільний», «ацидофільний» грунтую
ться винятково на забарвленні гранулярних включень цитоплазми Крім того, є недиференційовані клітини. Основними елементами нейрогіпофіза є пітуїцити і нервові клітини.
Гормони аденогіпофіза. В аденогіпофізі виявлено 7 гормональних речовин, які є переважно білковими або пептидними похідними. їх прийнято ділити на дві групи. До першої групи належать гормони, які впливають на метаболічні процеси і регулюють ріст і розвиток організму. Це соматотропін, або гормон росту, ліпопро-теїни й пролактин. Друга група включає тропні гормони. їх основним призначенням є регуляція секреції периферичних ендокринних залоз. До них належать: адренокортикотропіи, тиреотропін, гонадотропні (лютеїнізуючий і фолікулостимулювальний) гормони.
Гормон росту (соматотропін) бере участь у регуляції росту. Це обумовлено його здатністю посилювати синтез білка в організмі. Найбільшою мірою гормон впливає на кісткову і хрящову тканини. Під його дією відбувається ріст епіфізарних хрящів у довгих кістках кінцівок, унаслідок чого кістки ростуть у довжину. Максимальна секреція гормона росту припадає на нічний час (фаза глибокого сну).
Пролактин, або лютеотропний гормон, сприяє утворенню молока в альвеолах молочної залози жінки. До настання лактації молочна залоза формується під впливом жіночих статевих гормонів і естрогени зумовлюють ріст протоків молочної залози, а прогестерон — розвиток її альвеол. Після пологів посилюється секреція гіпофізом пролактину і настає лактація — утворення і виділення молока молочними залозами. Пролактин має також лютеотропну дію, тобто забезпечує функціонування жовтого тіла і утворення прогестерону. У чоловічому організмі він стимулює ріст і розвиток передміхурової залози та сім’яних міхурців.
Ліпопротеїни, виділені з передньої частки гіпофіза, мобілізують жир із жирових депо, зумовлюють ліполіз зі збільшенням вмісту вільних жирних кислот у крові. Вони є попередниками ен-дорфінів.
Тропні гормони аденогіпофіза. Адренокортикотропіи (адрено-кортикотропний гормон — АКТГ) є стимулятором пучкової і сітчастої зон кори надниркових залоз. Це проявляється посиленням окислювального фосфорилювання у кірковій речовині, збільшенням швидкості синтезу білка, активізацією глюкогенезу і посиленням утворення і секреції кортикостероїдів. У надниркових залозах при цьому зменшується вміст аскорбінової кислоти і холестерину, які використовуються для синтезу адренокортикальних гормонів надниркових залоз. АКТГ спричинює розпад білка в організмі і гальмує його синтез (щодо цього є антагоністом соматотропіну), знижує проникність стінки капілярів (цим пояснюється протизапальна дія гормона). Під впливом гормона зменшуються лімфатичні вузли, селезінка і особливо щитовидна залоза, знижуються
рівні лімфоцитів (лімфопенія) і еозинофілів у периферичній крові (еозинопенія). Секреція гормона залежить від добових коливань: увечері вміст його в гіпофізі вищий, ніж уранці.
Тиреотропін діє винятково на щитовидну залозу, стимулюючи її функцію. Якщо видалити або травмувати гіпофіз у тварин, то настає атрофія щитовидної залози, введення ж тиреотропіну супроводжується розростанням її тканини, гіпертрофією залози. Тиреотропін активізує протеолітичні ферменти (катепсини), під впливом яких відбуваються гідроліз- тиреоглобуліну і вивільнення з нього гормонів щитовидної залози — тиреотропіну та трийодтиро-ніну. Тиреотропін стимулює також утворення білка тиреоглобуліну в клітинах фолікулів щитовидної залози і надходження його в порожнину фолікула.
Гонадотропній. До них належать фолікулостимулю-вальний (фолітропін) і лютеїнізуючий (лютропін) г о р > мони. Вказаним гормонам не властива статева специфічність, вони є як у жінок, так і у чоловіків. Загалом у організмі практично всі етапи морфологічного розвитку і функціональної активності статевих залоз є наслідком синергічної дії фолітропіну і лютро* піну..
Під впливом фолітропіну в яєчнику стимулюються ріст везикул лярного фолікула і його оболонок, секреція фолікулярної рідини. Цей гормон впливає на утворення чоловічих статевих клітин — сперматозоонів. Лютропін потрібен для росту фолікула яєчника на стадіях, які передують овуляції, і для власне овуляції, тобто для розривання оболонки дозрілого фолікула і виходу з нього яйцеклітини, а також для утворення на місці фолікула, який лопнув, жовтого тіла. Лютропін стимулює утворення жіночих статевих гормонів естрогенів, а в чоловіків — чоловічих статевих гормонів андрогенів.
У середній частці аденогіпофіза утворюється гормон мелано-тропін, або інтермедин. Він впливає на пігментний обмін. Якщо, наприклад, у жаби зруйнувати гіпофіз, то через деякий час у неї стане світлішим колір шкіри.
Гормони нейрогіпофіза. У клітинах нейрогіпофіза — пітуїци-тах — накопичуються і набувають активної форми вазопресин, або антидіуретичний гормон (АДГ), і окситоцин, які утворюються в нейронах супраоптичного і паравентрикулярного ядер гіпоталамуса і аксонами цих ядер, які складають гіпоталамо-гіпофізарний тракт, надходять у нейрогіпофіз і кров.
Вазопресин виконує в організмі дві функції: 1) стимулює вплив гормона на гладкі м’язи артеріол (через Уі-рецептори), що призводить до підвищення їх тонусу і артеріального тиску; 2) посилює реабсорбцію (зворотне всмоктування) води з дистальних відділів канальців нирок у кров, що супроводжується зменшенням продукції сечі в нирках (антидіуретична дія гормона — через Уз*
рецептори). Для пресорної дії потрібна велика концентрація гормона.
Отже, вазопресин зменшує сечовиділення і підвищує осмотичну концентрацію сечі. Ця дія гормона пов’язана головним чином із збільшенням проникності стінки ниркових канальців і збиральних трубочок для води.
Залишається дискусійним питання про механізм зміни проникності при дії АДГ. О. Г. Гінецинський (1953) висловив припущення, що АДГ сприяє активізації гіалуронідази клітинами ниркових канальців. Цей фермент, деполімеризуючи кислі мукополісахари-ди міжклітинної речовини, збільшує проникність стінки канальців для води. Ця гіпотеза аргументована даними гістохімічних, біохімічних і електронно-мікроскопічних досліджень: було виявлено розширення міжклітинних проміжків при дії АДГ. Згідно з другою гіпотезою, збільшення проникності стінки канальців для води є наслідком збільшення розмірів пор у апікальній мембрані клітини, через які й проходить вода. У дії АДГ можна виділити кілька етапів: 1) первинний зв’язок гормона з рецепторами клітин канальців і збиральних трубок; 2) активація аденілатциклази, що сприяє утворенню із АТФ циклічного аденозинмонофосфату (цАМФ); 3) активація цАМФ-залежної протеїнкінази, і зрештою,— збільшення проникності. Крім того, вазопресин сприяє підвищенню пам’яті, особливо на пізніх етапах онтогенезу.
Окситоцин вибірково діє на гладкі м’язи матки, посилюючи її скорочення, якщо вона була під впливом естрогенів, котрі збільшують чутливість матки до окситоцину. Під час пологів окситоцин стимулює скорочення матки, забезпечуючи нормальний їх перебіг. Вважають, що окситоцин збільшує проникність мембран клітин м’язів матки для №+.
Окситоцин може стимулювати виділення молока з альвеол молочної залози. При цьому посилюється, власне, виділення молока, а не його утворення. Секреція контролюється пролактином аденогіпофіза. Окситоцин вибірково діє на міо-епітеліальні клітини, що оточують альвеоли, зумовлюючи їхнє скорочення. Скорочуючись, клітини стискають альвеоли, виштовхуючи з них молоко.
Окситоцин виділяється із нейрогіпофіза рефлекторним шляхом при подразненні рецепторів матки, піхви. Акт ссання також рефлекторно сприяє цьому (рефлекс молоковіддачі). Сигнал у відповідь на ссання або подразнення рецепторів соска аферентними нервовими волокнами досягає спинного мозку, проходить через його стовбур, і стимулює діяльність нейросекреторних клітин ядер переднього гіпоталамуса. При цьому з нейрогіпофіза у кровотік виділяється окситоцин.
При гіперфункції аденогіпофіза в дитячому віці спостерігається гігантизм, а при гіпофункції його — карликовість, або тіпофізар-
Мал. 114. Порушення росту гіпо-фізарного походження; -
а — хворий на гіпофізарний нанізм; б — здоровий хлопчик; в — хворий на гіпофізарний гігантизм
ний нанізм (мал. 114). При надлишковому утворенні сомагостатину у дорослої людини відзначається збільшення тих частин тіла, які ще здатні рости. Це пальці рук і ніг, кисті і стопи, ніс і нижня щелепа, язик, органи грудної і черевної порожнини. Таке захворювання називається акромегалією.
При ураженні гіпофіза може виникати (переважно у жінок) гіпо-фізарна кахексія (хвороба Сіммонд-са). Вона проявляється надмірним схудненням, появою ознак передчасного постаріння, зменшенням розмірів внутрішніх органів, інволюцією статевих органів тощо. Це захворювання в більшості випадків швидко прогресує і завершується смертю пацієнта протягом кількох місяців. Названі розлади є наслідком припинення вироблення гормонів аденогіпофіза, які стимулюють діяль-ніть інших ендокринних залоз.
Зменшення утворення вазопреси-
ну в гіпоталамо-гіпофізарній системі є причиною розвитку нецук-рового діабету.
НАДНИРКОВІ ЗАЛОЗИ
У людини є дві надниркові залози, які розташовані над верхніми полюсами нирок на рівні XI грудного хребця. Вони складаються з поверхневого кіркового шару, на який припадає 90 % маси усієї залози, і глибокого мозкового. Кіркову речовину ділять на клубочкову, пучкову і сітчасту зони. Клубочкова зона є поверхневою і найтоншою, сітчаста складається з переплетених клітин, що, як сітка, оточують мозкову речовину. Пучкова зона складається з паралельних тяжів клітин, заключених у тонкі мембранозні трубочки, що йдуть від клубочкової до сітчастої зони. Мозковий шар надниркових залоз складається із хромафінної тканини, в якій є два види клітин: ті, що утворюють адреналін, і ті, що утворюють норадреналін. Мозкова речовина разом із симпатичними гангліями, в яких також містяться хромафінні клітини, належить до так званої адреналової системи.
Надниркові залози інтенсивно постачаються кров'ю. Іннервація їх здійснюється головним чином за рахунок гілок черевного спле
тіння і гілок великого черевного нерва. Крім того, надниркові залози ще отримують гілку від нижнього діафрагмального сплетіння. Питання про іннервацію надниркових залоз гілками блукаючого нерва ще не розв’язане.
Кірковий і мозковий шари надниркових залоз мають різне походження. їх“ можна розглядати як дві самостійні залози внутрішньої секреції, що виробляють різні гормони і виконують різні функції.
Гормони кори надниркових залоз. З кори надниркових залоз виділено понад 40 кортикостероїдів. Фізіологічно активними є лише 8із них. Кортикостероїди ділять на три групи: 1) глюкокорти-коїди (гідрокортизон, кортизон і кортикостерон); 2) мінералокор-тикоїди (альдостерон, дезоксикортикостерон); 3) статеві гормони (андрогени, естрогени, прогестерон). Вважають, що справжніми гормонами є кортикостерон і гідрокортизон, які визначають усі функції цих залоз. Решта речовин є продуктами обміну гормонів. Глюкокортикоїди утворюються в клітинах пучкової зони кори надниркових залоз, мінералокортикоїди — в клубочковій зоні, статеві гормони — в сітчастій. За складом гормони надниркових залоз є стероїдами. Процес їх утворення розпочинається від холестерину. Для їх біосинтезу потрібна також аскорбінова кислота.
Глюкокортикоїди впливають на обмін вуглеводів, білків і жирів, посилюють процеси утворення глюкози з білків (глюконеоге-нез), а також відкладання глікогену в печінці, є антагоністами інсуліну щодо регуляції вуглеводного обміну. Глюкокортикоїди зумовлюють розпад тканинних білків, затримують включення амінокислот у білки організму і прискорюють процес виділення азоту (катаболічний ефект). Глюкокортикоїди здатні виявляти протизапальну дію. Це пов’язано з тим, що названі гормони знижують проникність стінки судин за рахунок зниження активності ферменту гіалуронідази, блокують секрецію серотоніну і гістаміну, кінінів і систему плазмін — фібринолізин. Під впливом глюкокортикоїдів виробляються ліпокортини, які гальмують вплив фосфоліпази А2 і цим самим пригнічують утворення із арахідонової кислоти простагландинів і лейкотрієнів, котрі стимулюють запальний процес. Протизапальна дія глюкокортикоїдів використовується в клінічній практиці/ наприклад, для лікування хворих із ревматичними процесами.
Глюкокортикоїди здійснюють значний вплив на клітинний і гуморальний імунітет. Доведено, що вищі (фармакологічні) дози гідрокортизону зумовлюють зворотний розвиток (інволюцію) підгрудинної залози і лімфатичних вузлів, пригнічують вироблення антитіл, гальмують реакцію взаємодії чужорідного білка (антиге-на) з антитілом. При цьому у периферичній крові зменшується кількість лімфоцитів і еозинофілів. Саме імуносупресорна дія глю-
кокортикоїдів використовується для лікування алергічни’х захворювань (наприклад, бронхіальної астми).
Глюкокортикоїди разом з іншими гормонами (АКТГ) сприяють адаптації організму до нових умов існування, а також до дії різних несприятливих чинників (різко виражені холод і спЬка, кисневе голодування, травми, емоційне перенапруження тощо). Тому їх називають захисними (адаптивними) гормонами.
Мінералокортикоїди беруть участь у регуляції мінерального обміну (балансу електролітів). Найактивнішим мінералокортикої-дом є альдостерон. Під його впливом посилюється реабсорбція №+ в канальцях нирок і зменшується реабсорбція К+, що призводить до затримки №+ і С1~ в організмі і збільшення виділення К+, Н+. ,
На відміну від глюкокортикоїдів, мінералокортикоїди сприяють розвитку запальних процесів. Це пояснюється їх здатністю до підвищення проникності капілярів і серозних оболонок. Мінералокортикоїди беруть участь також у регуляції тонусу кровоносних судив. Доведено, що альдостерон збільшує тонус судин і сприяє підвищенню артеріального тиску. Надлишок альдостерону в організмі веде до підвищення вмісту натрію і зниження рівня калію, до розвитку алкалозу і збільшення об’єму позаклітинної рідини. Навпаки, недостатність альдостерону в організмі зумовлює втрату натрію, дегідратацію тканин і зниження кров’яного тиску (гіпотензію).
Вплив статевих гормонів надниркових залоз. Ці гормони мають значення для розвитку статевих органів у ранньому дитячому віці і появи вторинних статевих ознак у той період, коли, внутрішньо-секреторна функція статевих залоз ще незначна. Окрім специфічного впливу, статеві гормони (естрогени) справляють ще й антисклеротичний ефект, насамперед у жінок, завдяки високій їх концентрації. Вони (особливо андрогени) також сприяють обміну білків, стимулюючи їх синтез у організмі. Разом із цим статеві гормони впливають на емоційний статус і поведінку людини.
Регуляція секреції гормонів кори надниркових залоз. У регуляції кортикостероїдів бере участь гіпоталамус. Як уже згадувалось (див. с. 156), у ядрах переднього гіпоталамусу виробляється рилі-зинг-гормон (кортиколіберин), який надходить через ворітну систему в аденогіпофіз і сприяє там утворенню і вивільненню кортикотропіну.
Вплив кортикотропіну (АКТГ) на процес утворення глюкокортикоїдів здійснюється за принципом прямого і зворотного з в’ я з к у: кортикотропін стимулює секрецію глюкокортикоїдів наднирковими залозами, а надлишок їх у крові призводить до гальмування синтезу кортикотропіну в аденогіпофізі. Таким чином, гіпоталамус, аденогіпофіз і кора надниркових залоз перебувають
у тісному функціональному зв’язку, утворюючи єдину гіпоталамо-гіпофізарно-надниркову систему.
Стимуляція синтезу глюкокортикоїдів кори надниркових залоз кортикотропіном відбувається завдяки активності аденілатцикла-зи, утворенню цАМФ і цАМФ-залежної протеїнкінази. Цей процес відбувається в присутності Са2+, який допомагає кортикотропіну з’єднатись із рецепторами залозистої клітини і сприяє підвищенню активності протеїнкіназ.
У свою чергу процес творення АКТГ залежить від рівня глюко-кортикоїдів у крові '(негативний зворотний зв’язок), а також від гіпоталамічного рилізинг-гормона (ГР). Синтез і секреція ГР контролюється рівнем глюкокортикоїдів і АКТГ у крові. Однак при стресі (фізичне навантаження, травма, інфекція, психічні порушення) глюкокортикоїди не гальмують процес творення ГР. Окрім цього, процес творення ГР регулюється медіаторами. Так, серотонін і ацетилхолін стимулюють, а норадреналін і ГАМК пригнічують його секрецію.
Регуляція синтезу і секреції мінералокортикоїдів відбувається кількома шляхами. Перший механізм пов’язаний з дією ангіотен-зину II, під впливом якого Підвищується активність поліфосфати-дилінозитидного каскаду з виходом Са2+ із внутрішньоклітинних депо в цитоплазму, другий — з впливом АКТГ. Його дія опосередковується утворенням цАМФ у присутності Са2+, підвищення концентрації якого досягається масивним входом його в клітину. Важливу роль у стимуляції синтезу альдостерону відіграє К+. Підвищення його концентрації призводить до деполяризації мембрани, що сприяє відкриттю кальцієвих каналів, активації аденілатцикла-зи, підвищенню рівня цАМФ (подібно до дії АКТГ). Інгібіторами синтезу і секреції є дофамін, передсердний натрійуретичний гормон і №+ у високій концентрації. Механізми синтезу, секреції, впливу і регуляції дії надниркових статевих гормонів розглядаються в розділі «Статеві гормони».
Гормони мозкового шару надниркових залоз. Основний гормон мозкового шару надниркових залоз— адреналін. Другим гормоном є попередник адреналіну в процесі його біосинтезу — норадреналін. Мозкова речовина надниркових залоз у нормі виробляє приблизно 80 % адреналіну і 20 % норадреналіну. Адреналін і норадреналін мають спільну назву катехоламіни, оскільки вони є похідними катехолу.
Адреналін володіє широким спектром дії на-організм. Він впливає на вуглеводний обмін, посилює розпад глікогену, зумовлюючи зменшення його запасів у печінці та м’язах (є щодо цього антагоністом-інсуліну), що призводить до збільшення вмісту глюкози в крові (адреналова гіперглікемія). Адреналін має ліполітичну дію — підвищує вміст вільних жирних кислот у крові. Під впливом
адреналіну посилюються енергетичний обмін, у тому числі й основний, а також утворення тепла.
Адреналін спричинює прискорення і посилення серцевих скорочень, поліпшує проведення збудження в серці (особливо сильно адреналін впливає на ослаблений серцевий м’яз), звужує через сц-адренорецептори артеріоли шкіри, органів черевної порожнини, таким чином підвищуючи артеріальний тис\. Адреналін через р-адренорецептори пригнічує скорочення гладких м’язів шлунка та кишок, зумовлює при подразненні р-адренорецепторів послаблення бронхіальних м’язів, унаслідок чого просвіт бронхів і бронхіол розширюється. Разом із тим адреналін спричиняє скоррчення радіальних м’язів райдужної оболонки ока, внаслідок чого зіниці розширюються. Під впливом адреналіну через а-адренорецептори також скорочуються піломотори шкіри, що призводить до появи так званої гусячої шкіри і піднімання волосся.
Під впливом адреналіну через а-адренорецептори підвищуються працездатність скелетних м’язів (особливо, якщо вони були стомлені), збудливість рецепторів (сітківки, слухового та вестибулярного апарата тощо), завдяки чому поліпшується сприйняття організмом зовнішніх стимулів. При деяких станах організму (охолодження, емоційне збудження, крововтрата, кисневий голод, гіпоглікемія та ін.) різко збільшуються утворення й виділення адреналіну в кров. Тому адреналін образно називають «гормоном тривоги», який перешкоджає виникненню значних, небезпечних для життя змін у організмі. Збудження симпатичної нервової системи супроводжується підвищенням надходження в кров адреналіну і норадреналіну. Ці катехоламіни посилюють і подовжують ефекти симпатичної нервової системи. Отже, на функції органів і систем адреналін впливає так само, як симпатична нервова система (див. с. 171). Тому прийнято говорити про симпатико-адреналову систему.
Адреналін у крові і тканинах швидко руйнується під дією ферментів моноаміноксидази (МАО) і катехол-орто-метилтрансферази (КОМТ). При цьому утворюються продукти, які не є гормонально активними. Тому адреналін зараховують до гормонів з коротким періодом дії.
Таким чином, адреналін відіграє важливу роль у пристосувальних, захисних реакціях організму, може зумовлювати екстрену перебудову функцій, спрямовану на підвищення працездатності організму в надзвичайних умовах.
Норадреналін має ознаки гормона і медіатора (трансмітера), позаяк виконує функції передавача збудження симпатичних нервових закінчень на ефектор, а також у нейронах ЦНС.
Адреналін і норадреналін діють через специфічні циторецепто-ри клітинних мембран органів-мішеней. Як уже зазначалось (див. с. 177), розрізняють два види адренергічних рецепторів — а- і
-р. р-Рецешори, в свою чергу, діляться на Рг і Рг-рецептори. Ефект скорочення гладком'язових клітин пов’язаний з а-рецепторами, а ефект їх розслаблення (зокрема, розширення кровоносних судин) — з р-рецепторами. Метаболічні впливи і збудження серцевого м’яза здійснюються через р-рецептори. Механізм дії адреналіну пов’язаний із системою’ аденілатциклази і цАМФ-залеж-ною протеїнкіназою-А, процесами фосфорилювання різних білків клітин.
Регуляція процесу творення гормонів у мозковому шарі надниркових залоз здійснюється нервовою системою. При подразненні черевних симпатичних нервів посилюється, а при їх перетині — зменшується виділення адреналіну і норадреналіну наднирковими залозами. Синтез і секреція катехоламінів пов’язані з деполяризацією мембрани і збільшенням кількості Са2+ у клітині. Цей механізм необхідний для виділення адреналіну і норадреналіну шляхом екзоцитозу. Секреція гормонів мозкового шару контролюється гіпоталамусом, особливо задньою групою ядер. На секрецію адреналіну впливає також кора великого мозку. Про це свідчать, зокрема, досліди з виробленням умовних рефлексів виділення адреналіну в судинне русло. Виділення наднирковими залозами адреналіну посилюється при емоційному збудженні (страх, гнів, біль тощо), м’язовій роботі, переохолодженні та ін. Виділення адреналіну наднирковими залозами стимулюється також зниженням рівня глюкози в крові (гіпоглікемією), завдяки чому вміст глюкози підвищується.
При гіперфункції кори надниркових залоз, що найчастіше спостерігається у разі розвитку в ній пухлини, відзначається не тільки посилене утворення кортикоїдних гормонів, а й переважання рівня статевих гормонів кори надниркових залоз над секрецією глюкокортикоїдів і мінералокортикоїдів. У зв’язку з тим у хворих починають помітно змінюватись вторинні статеві ознаки (адрено-генітальний синдром). Наприклад, у жінок можуть з’явитися вторинні чоловічі статеві ознаки — борода, чоловічий тембр голосу, повне припинення менструацій. Спостерігаються ожиріння (особливо в ділянці шиї, обличчя, тулуба), гіперглікемія, затримка води і натрію хлориду в організмі та ін.
Гіпофункція кори надниркових залоз зумовлює аддісонову хворобу, або бронзову хворобу. Ранні ознаки цього захворювання: бронзове забарвлення шкіри, особливо обличчя, шиї та рук; втрата апетиту, нудота,, блювання; підвищена втомлюваність при фізичній та розумовій праці; підвищена чутливість до холоду й болю; висока сприйнятливість до інфекцій та ін. Аддісонова хвороба характеризується недостатністю всіх гормонів кори надниркових залоз, насамперед мінералокортикоїдів. Разом з тим унаслідок порушення ланцюга зворотного зв’язку відбувається посилене утворення
кортикотропіну аденогіпофізом, що призводить до посиленої піг* ментації шкіри (меланоподібна дія цього гормона).
При цьому захворюванні виділяється велика кількість сечі (іноді 10 л за добу). Одночасно хворі скаржаться на сильну спрагу.
Больові подразнення, психічні травми спричинюють затримку сечотворення (анурію) і виділення молока внаслідок різкого збільшення продукції гормонів задньою часткою гіпофіза (вазопресину і окситоцину).
ЩИТОВИДНА ЗАЛОЗА
Щитовидна залоза складається з двох часток, розташованих по обидва боки трахеї. Завдяки вільному сполученню з гортанню вона піднімається і опускається при ковтанні, зміщується в бік при повороті голови. Щитовидна залоза добре постачається кров’ю (вона посідає І місце серед органів за кількістю крові, яка протікає за одиницю часу на одиницю маси). Іннервується залоза симпатичними, парасимпатичними і соматичними нервовими гілками.
У залозі чимало інтерорецепторів. Тканина залози кожної частки складається з численних фолікулів, порожнини яких заповнені густою, в’язкою жовтуватого кольору масою — колоїдом, утвореним головним чином тиреоглобуліном — основним білком, який містить йод. У колоїді є також мукополісахариди і нуклеопротеї-ди — протеолітичні ферменти, які належать до катепсинів, та інші речовини. Виробляється колоїд епітеліальними клітинами фолікулів і безперервно надходить у їх порожнину, де концентрується. Кількість колоїду і його консистенція залежать від фази секреторної діяльності і можуть бути різними в різних фолікулах однієї залози.
Гормони щитовидної залози ділять на дві групи: йодовані (тироксин і трийодтиронін) та тиреокальцитонін (кальцитонін). Вміст тироксину в крові більший, ніж трийодтироніну, проте активність останнього в кілька разів вища, ніж тироксину.
Тироксин і трийодтиронін утворюються в недрах специфічного білка щитовидної залози — тиреоглобуліну, який містить найбільшу кількість органічно зв’язаного йоду. Біосинтез тиреоглобуліну, що входить до складу колоїду, здійснюється в епітеліальних клітинах фолікулів. У колоїді тиреоглобулін підлягає йодуванню. Це дуже складний процес. Йодування розпочинається з надходження йоду в організм з їжею у вигляді органічних сполук або у відновленому стані. Під час травлення органічний і хімічно чистий йод перетворюється на йодид, який дуже легко всмоктується з кишок у кров. Основна маса йодиду концентрується у щитовидній залозі. Та його частина, що лишається, виділяється з сечею, слиною, шлунковим соком і жовчю. Поглинутий
залозою йодид окислюється в елементарний йод; потім відбуваються зв’язування його у вигляді йодтирозинів і окислювальна їх конденсація в молекули тироксину і трийодтироніну в недрах тиреоглобуліну. (Співвідношення тироксину і трийодтироніну в молекулі тиреоглобуліну складає 4 : 1. Йодування тиреоглобуліну стимулюється особливим ферментом — тиреойодпероксидазою. Виведення гормонів із фолікула в кров відбувається після гідролізу тиреоглобуліну, який відбувається під впливом протеолітичних ферментів — цатепсинів. При гідролізі тиреоглобуліну звільняються активні гормони — тироксин і трийодтиронін, які надходять у кров.
Обидва гормони у крові перебувають у сполуці з білками гло-булінової фракції (тироксинзв’язуючий глобулін), а також з альбумінами плазми крові. Тироксин краще зв’язується з білками крові, ніж трийодтиронін, унаслідок чого останній легше проникає в тканини, ніж тироксин. У печінці тироксин утворює парні сполуки з глюкуроновою кислотою, які не мають гормональної активності і виводяться з жовчю в органи травлення. Завдяки процесу дезинтоксикації не відбувається збиткового насичення крові гормонами щитовидної залози,
Фізіологічні ефекти йодованих гормонів щитовидної залози. Названі гормони впливають на морфологію та функції органів і тканин: ріст і розвиток організму, на всі види обміну речовин, активність ферментних систем, на функції ЦНС, вищу нервову діяльність, вегетативні функції організму.
Вплив на ріст і диференціацію тканин. При видаленні щитовидної залози у експериментальних тварин і при гіпотиреозі у людей молодого віку спостерігаються затримка росту (карликовість) і розвитку майже всіх органів, зокрема статевих залоз, сповільнення статевого дозрівання (кретинізм). Нестача тиреоїдних гормонів у матері несприятливо позначається на процесах диференціації зародка, зокрема його щитовидної залози. Недостатність процесів диференціації всіх тканин і особливо ЦНС спричинює ряд тяжких порушень психіки.
Вплив на обмін речовин. Тиреоїдні гормони стимулюють обмін білків, жирів, вуглеводів, водний і електролітний .обмін, обмін вітамінів, теплопродукцію, основний обмін. Вони посилюють окислювальні процеси, процеси поглинання кисню, витрати поживних речовин, споживання тканинами глюкози. Під впливом цих гормонів зменшуються запаси глікогену в печінці, прискорюється окислення жирів. Посилення енергетичних і окислювальних процесів є причиною схуднення, що спостерігається при гіперфункції щитовидної залози.
Вплив на ЦНС. Гормони щитовидної залози конче потрібні для розвитку мозку. Вплив гормонів на ЦНС проявляється зміною умовнорефлекторної діяльності, поведінки. Підвищена їх секреція супроводжується підвищеною збудливістю, емоційністю, швидким
виснаженням. При гіпотиреоїдних станах спостерігаються зворотні явища — кволість, апатія, ослаблення процесів збудження.
Тиреоїдні гормони значною мірою впливають на стан нервової регуляції органів і тканин. Унаслідок підвищення активності вегетативної, переважно симпатичної, нервової системи під дією тире-оїдних гормонів прискорюються серцеві скорочення, збільшується частота дихання, посилюється потовиділення, порушуються секреція і моторика травного каналу. .Крім того, тироксин знижує здатність крові до зсідання за рахунок зменшення синтезу в печінці та інших органах чинників, які беруть участь у процесі зсідання крові. Цей гормон пригйічує функціональні властивості тромбоцитів, їх здатність до адгезії (склеювання) і агрегації.
Гормони щитовидної залози впливають на ендокринні та інші залози внутрішньої секреції. Про це свідчить той факт, що видалення щитовидної залози призводить до порушення функції всієї ендокринної системи: затримується розвиток статевих залоз, атрофується підгрудинна залоза, розростаються передня частка гіпофіза і кора надниркових залоз.
Механізм дії гормонів щитовидної залози. Вже той факт, що гормони щитовидної залози впливають на стан практично всіх видів обміну речовин, свідчить про дію цих гормонів на фундаментальні клітинні функції. Встановлено, що їх дія йа клітинному та субклітинному рівнях пов’язана із різноплановим впливом: 1) на мембранні процеси (інтенсифікується транспорт амінокислот у клітину, помітно зростає активність Ца+/К+-АТФази, яка забезпечує транспорт іонів за рахунок енергії АТФ); 2) на мітохондрії (кількість мітохондрій зростає, транспорт АТФ у них пришвидшується, підвищується інтенсивність окислювального фосфорилювання); 3) на ядро (стимулює транскрипцію специфічних генів та індукцію синтезу певного набору білка) ; 4) на білковий обмін (підвищуються обмін білків, окислювальне дезамінування); 5) на процес обміну ліпідів (підвищується як ліпогенез, так і ліполіз, а це призводить до перевитрат АТФ, збільшення теплопродукції); 6) на нервову систему (підвищується активність симпатичної нервової системи; дисфункція автономної нервової системи супроводжується загальним збудженням, неспокоєм, тремором і м’язовою втомою, діареєю).
Регуляція функції щитовидної залози. Контроль за діяльністю щитовидної залози має каскадний характер. Передусім пептидер-гічні нейрони в преоптичній ділянці гіпоталамуса синтезують і виділяють у ворітну вену гіпофіза тиреотропін-рилізинг-гор м о н (ТРГ). Під його впливом у аденогіпофізі (у присутності Са2+) секретується тиреотропний гормон (ТТГ), який заноситься кров’ю в щитовидну залозу і стимулює в ній синтез та викид тироксину (Т4) і трийодтироніну (Тз). Вплив ТРГ моделюється рядом чинників і гормонів, насамперед рівнем гормонів щитовидної
залози в крові, які за принципом зворотного зв’язку гальмують чи стимулюють утворення ТТГ в гіпофізі. Інгібіторами ТТГ також є глюкокортикоїди, гормон росту, соматостатин, дофамін. Естрогени, навпаки, підвищують чутливість гіпофіза до ТРГ.
На синтез ТРГ у гіпоталамусі впливає адренергічна система, її медіатор норадреналін, який, діючи на а-адренорецептори, сприяє виробленню і виділенню ТТГ у гіпофізі. Його концентрація також збільшується при зниженні температури тіла.
Порушення функції щитовидної залози можуть супроводжуватися як підвищенням, так і зниженням її гормоно-творчої функції. Якщо гіпотиреоз розвивається в дитячому віці, то буває кретинізм. При цьому захворюванні спостерігаються затримка росту, порушення пропорцій тіла, статевого та психічного розвитку.. Гіпотиреоз може зумовити інший патологічний стан — мікседему (слизовий набряк). У хворих відзначаються збільшення маси тіла за рахунок надмірної кількості міжтканинної рідини, одутлість обличчя, психічна загальмованість, сонливість, зниження інтелекту, порушення статевих функцій та всіх видів обміну речовин. Захворювання розвивається переважно у дитячому віці та в клімактеричний період.
При гіперфункції щитовидної залози (гіпертиреозі) розвивається тиреотоксикоз (базедова хвороба). Типовими ознаками цього захворювання є непереносність підвищеної температури повітря, дифузне спітніння, збільшення частоти серцевих скорочень (тахікардія), підвищення основного обміну і температури тіла. Незважаючи на добрий апетит, людина худне. Збільшується щитовидна залоза, з’являється витрішкуватість (екзофтальм). Спостерігаються підвищена збудливість і дратливість, аж до психозу. Для цієї хвороби характерні збудження симпатичної нервової системи, м’язова слабкість і підвищена стомлюваність.
У деяких географічних регіонах (Карпати, Волинь та ін.), де спостерігається дефіцит йоду у питній воді, населення хворіє на ендемічний зоб. Ця недуга характеризується збільшенням щитовидної залози внаслідок значного розростання її тканини. Кількість фолікулів у ній збільшується (компенсаторна реакція у відповідь на зниження вмісту тиреоїдних гормонів у крові). Ефективною мірою профілактики захворювання є йодування кухонної солі, у цих районах.
Для оцінки функції щитовидної залози в клініці використовують ряд проб: введення радіонуклідів — йоду-131, технецію; визначення основного обміну; встановлення концентрацій ТТГ, трийод-тироніну та тироксину в крові; дослідження за допомогою ультразвуку.
Фізіологічні ефекти тиреокальцитоніну. Тиреокальцитонін утворюється парафолікулярними клітинами (С-клітинами) щитовидної Залози, які розташовані за її залозистими фолікулами. Тиреокаль-
цитонін бере участь у регуляції кальцієвого обміну. Вторинним посередником дії тиреокальцитоніну є цАМФ. Під впливом гормона рівень Са2+ в крові знижується. Це пов’язано з тим, що тирео-кальцитонін активізує функцію остеобластів, які беруть участь в утворенні нової кісткової тканини, і пригнічує функцію остеоклас-тів, які її руйнують. Разом із тим гормон гальмує виведення Са2+ з кісткової тканини, сприяючи відкладанню його у ній. Крім того, тиреокальцитонін гальмує всмоктування Са2+ і фосфатів з ниркових канальців у кров, таким чином сприяючи їх виведенню із сечею з організму. Під впливом тиреокальцитоніну знижується концентрація Са2+ у цитоплазмі клітин. Це відбувається внаслідок того, шо гормон активізує діяльність Са2+-насосу на плазматичній мембрані і стимулює поглинання Са2+ мітохондріями клітини.
Вміст тиреокальцитоніну в крові підвищується під час вагітності і годування дитини груддю, а також у період відновлення цілості кістки після перелому.
Регуляція синтезу і вмісту кальцитоніну залежить від рівня кальцію в сироватці крові. При високій його концентрації кількість кальцитоніну зменшується; при низькій, навпаки, зростає. Крім того, утворення кальцитоніну стимулює гормон травного каналу-гастрин. Викид його в кров сповіщає про надходження кальцію в організм з їжею.
ПРИЩИТОВИДНІ ЗАЛОЗИ
У людини дві пари прищитовидних (паращитовидних) залоз, які розташовані на поверхні або всередині щитовидної залози. До складу залози входять так звані основні («темні» й «світлі») клітини, що мають ацидофільну протоплазму з оксифільними включеннями в протоплазмі (вони з’являються лише у віці після 20 років, розмножуючись з віком). Основну масу залози становлять «темні» клітини. У паренхімі залози є система канальців, яка містить колоїдну речовину. Залози добре оснащені кровоносними та лімфатичними судинами, одержують симпатичну (від шийних гангліїв) і парасимпатичну (блукаючий нерв) іннервацію.
Гормони прищитовидних залоз. Прищитовидні залози виробляють паратгормон (паратирин), який поруч з кальцитоніном щитовидної залози регулює обмін кальцію в організмі і підтримує його вміст у крові на певному рівні. Це досягається за допомогою: а) резорбції кальцію із кісток; б) реабсорбції із дистальних канальців нефрона; в) прискорення всмоктування із кишок під впливом метаболіту вітаміну Ц, який утворюється в нирках. Паралельно паратгормон зумовлює вивільнення фосфату із мінеральної речовини, що утворює кістку (гідрооксиапатиту) і гальмує реабсорбцію фосфатів у нирках, таким чином знижуючи їх концентрацію в крові.
При недостатності функції прищитовидних залоз значною мірою знижується вміст кальцію в крові-(у нормі цей показник дорівнює 2,25—2,75 ммоль/л). І навпаки, при гіперфункції залоз спостерігається його підвищення.
Механізм дії паратгормону на кісткові клітини пов’язаний із специфічними мембранними рецепторами. Внаслідок контакту гормона з рецептором підвищується активність аденіл-атциклази, збільшуються вміст цАМФ, надходження Са2+ у кісткові клітини.
Ріст внутрішньоклітинної концентрації кальцію призводить до-прискорення перетворення клітин-попередників у остеобласти і остеокласти з подальшим вивільненням Са2+ із кісткової тканини.
Регуляція функції прищитовидних залоз. Найважливішим регулятором рівня паратгормона є концентрація кальцію в крові. При гіпокальціємії продукція паратгормона збільшується, при гіпер-кальціємії розпочинається розпад синтезованого в клітинах гормона, зменшується його концентрація в крові. Стимуляція прищитовидних залоз відзначається і при збудженні адренергічної системи,, посередники якої діють через а-адренорецептори клітинних мембран.
Рівень кальцію в крові особливо важливий для функції збудливих структур. Його зниження супроводжується підвищенням збудливості нервово-м’язової системи, виникненням мимовільних, тонічних скорочень скелетних м’язів. Спазматичні скорочення дихальних і глоткових м’язів можуть призвести до смерті. Цей синдром носить назву тетанії і є проявом гіпопаратиреозу — стану, [порозвивається внаслідок видалення прищитовидних залоз під час операції на щитовидній залозі або автоімунного руйнування клітин, які виробляють паратгормон. При розвитку пухлин (аденом} прищитовидних залоз рівень кальцію в плазмі крові може підвищуватися до 0,17 г/л (в нормі 0,1 г/л), спричинюючи розвиток гіперпаратиреозу. У хворого спостерігаються ураження кісток, сповільнення серцевих скорочень (брадикардія), відкладання кальцію-в судинах і нирках. У багатьох випадках ниркові камені є наслідком високої активності прищитовидних залоз. Хворий з гіперпаратиреозом може померти внаслідок зупинки серця після споживання їжі, багатої на кальцій.
ПІДГРУДИННА ЗАЛОЗА
.Хоча підгрудинна залоза (тимус) відома давно, але досі залишається багато нез’ясованого і суперечливого стосовно не тільки фізіологічної ролі та клінічних проявів її патології, але й морфологічної структури цього органа. Деякі дослідники взагалі заперечують належність цієї залози до ендокринних органів. Останнім часом з’явились численні дослідження, присвячені вивченню роль
підгрудинної залози в реакціях організму, процесах імуногенезу, формуванні біологічної несумісності.
Підгрудинна залоза — парний орган, розташований у верхньому відділі переднього середостіння. Вона складається з двох часток. Кожна з них містить невеликі часточки, в яких розрізняють кірковий і мозковий шари. Кіркова речовина має паренхіму, в якій міститься велика кількість лімфоцитів. До складу мозкової речовини входять епітеліальні й ліпоїдні клітини. Підгрудинна залоза добре постачається кров’ю. Іннервація її здійснюється гілочками блукаючого і симпатичних нервів.
Гормони підгрудинної залози. Залоза утворює кілька гормонів: тимозин, гомеостатичний тимусний гормон, тимопоетин І, тимопое-тин II і тимусний гуморальний фактор. Усі вони поліпептиди.
Гормони підгрудинної залози, зокрема тимозин, відіграють велику роль у розвитку захисних імунологічних реакцій організму, стимулюючи утворення антитіл, які забезпечують реакцію на чужорідний білок. Доведено, що недиференційовані стовбурові клітини, які утворюються в кістковому мозку, виходять у кровотік і надходять у підгрудинну залозу. Тут вони розмножуються і диференціюються в лімфоцити тимусного походження (Т-лімфоцити), які становлять більшу частину лімфоцитів, які циркулюють у крові. Вважають, що саме Т-лімфоцити відповідають за розвиток клітинного імунітету.
Регуляція підгрудинної залози. Максимального розвитку підгрудинна залоза досягає в дитячому віці (до 11—15 років). Після статевого дозрівання її розвиток припиняється, і вона починає повільно атрофуватися. Але у молодих людей ця залоза має ще досить значні розміри. У зв’язку з цим вважають, що гормони підгрудинної залози стимулюють ріст організму і гальмують розвиток статевої системи. Побутує думка, що підгрудинна залоза впливає на кальцієвий і нуклеїновий обмін. Фізіологічна її дія пов’язана також із тим, що клітинні структури залози містять велику кількість аскорбінової кислоти (вітамін С).
Секреція гормонів підгрудинної залози регулюється гіпотала-мо-адено-гіпофізарною системою. Доведено, що соматотропін сприяє надходженню гормонів підгрудинної залози в кров.
При збільшенні підгрудинної залози у дітей розвивається так званий тиміко-лімфатичний статус. При цьому відбувається, крім збільшення власне залози, розростання лімфоїдної тканини. Характерний зовнішній вигляд такого хворого: пастозне, одутле обличчя, рихлість підшкірної основи, ожиріння, тонка шкіра, м’яке волосся. Клінічно тиміко-лімфатичний статус може проявлятися повторним безпричинним блюванням, зміною дихання, зниженням артеріального тиску і навіть гострою серцевою недостатністю. Висловлюють думку, що збільшення підгрудинної залози у дітей пов’язане з недостатністю функції надниркових залоз.
Можлива участь підгрудинної залози (при її гіпертрофії) у виникненні й розвитку деяких захворювань системи крові, зокрема лейкозу й анемій, а також у порушенні нервово-м’язової провідності і розвитку міастенії (різка м’язова слабкість, швидка втомлюваність переважно жувальних, ковтальних, окорухових і мімічних м’язів).
ЕНДОКРИННА ФУНКЦІЯ
ПІДШЛУНКОВОЇ ЗАЛОЗИ
Ендокринна частина підшлункової залози представлена групами «світлих» клітин», розташованих серед екзокринної тканини, які називаються острівцями підшлункової залози, або острівцями Лангерганса. Маса цієї тканини в підшлунковій залозі не перевищує 1—2 %. Найбільше містить її хвостовий відділ залози. Острівці, особливо їх центральна частина, добре оснащені капілярами. Іннервація підшлункової залози здійснюється гілками симпатичних, блукаючого і спінальних нервів. Безпосередньо в острівцях закінчуються постгангліонарні симпатичні і парасимпатичні волокна. У острівцях підшлункової залози виділяють три основних типи клітин (бета-, альфа- і дельта-), які розрізняються за характером секреторних гранул і видом продукованих гормонів. Основну масу острівців Лангерганса становлять бета-клітини.
Гормони острівців підшлункової залози. У бета-клітинах синтезується гормон інсулін (у формі проінсуліну), в альфа-кліти-нах — глюкагон, у дельта-клітинах — соматостатин. Крім того, із екстрактів тканини підшлункової залози виділено гормони ваготонін, центропнеїн, бомбезин і ліпокаїн.
Інсулін — білковий гормон, до складу якого входить цинк. Він є першим гормоном і першим білком, синтезованим штучно.
Інсулін бере участь у регуляції вуглеводного, білкового і ліпідного обміну. Під його дією зменшується концентрація цукру в крові — виникає гіпоглікемія. Це зв’язано з тим, що інсулін підвищує проникність клітинних мембран для глюкози, посилюючи надходження глюкози в середину клітини (за винятком клітин головного мозку), сприяє перетворенню глюкози на глікоген у печінці і м’язах, знижує глюконеогенез (утворення глюкози із амінокислот). Окрім впливу на вуглеводний обмін, інсулін стимулює синтез білка з амінокислот і їх активний транспорт у клітини. Він також бере участь у регуляції жирового обміну, сприяючи утворенню вищих жирних кислот із продуктів вуглеводного обміну (ліпогенез), а також посилюючи здатність жирової тканини і клітин печінки до захоплення вільних жирних кислот і накопичення їх у формі три-гліцеридів (ліпідогенез).
У механізмі дії інсуліну на вуглеводний обмін важливу роль
відіграють специфічні рецептори, розташовані на плазматичній мембрані клітин-мішеней. Взаємодія інсуліну з рецепторами реалізується через пригнічення аде-нілатциклази і активації тирозин-кінази, яка сприяє проникненню інсуліну в клітину і підвищенню активності гексокінази (перша стадія гліколізу). Крім цього, активізується пентозний шунт з наступним утворенням НАД (НАДФ)-нікотинамідних кофер-ментів, котрі потрібні для здій-
Мал. 115. Схема системи регуляції, снення ліпогенезу.
яка контролює концентрацію цукру Глюкагон посилює глікогено-в крові і рідинах тканин ЛІЗ у печінці і підвищує рівень
глюкози в крові за допомогою активації цАМФ. Щодо цього глюкагон є антагоністом інсуліну і синергістом адреналіну. Глюкагон сприяє глюконеогенезу, прискорює окислення жирних кислот у печінці.
Ваготонін підвищує тонус блукаючих нервів, їх активність. ІІентропнеїн збуджує дихальний центр, сприяє розслабленню гладких м’язів бронхів, унаслідок чого їх просвіт збільшується. Крім того, центропнеїн підвищує здатність гемоглобіну еритроцитів зв’язувати кисень і поліпшує його транспорт. Ліпокаїн бере участь у мобілізації жиру із депо. Бомбезин стимулює виділення пепсинів
шлунком і відповідає за насичення організму.
Регуляція секреції інсуліну і глюкагону. Регуляція секреції інсуліну залежить від вмісту глюкози в крові (мал. 115). Підвищення його в крові (гіперглікемія) призводить до збільшення надходження інсуліну в кров; зниження (гіпоглікемія) —до зниження продукції і надходження цього гормона в судинне русло.
Яким чином «вимірюється» рівень глюкози в крові? Встановлено, що зміна рівня глюкози в крові сприймається спеціалізованими клітинами — глюкорецепторами підшлункової залози, каротидного синусу, паравентрикулярних ядер гіпоталамуса. При підвищенні рівня глюкози в крові відбувається активізація рецепторів — клітин підшлункової залози, які відповідають на цей стимул підвищенням синтезу і виділенням інсуліну в кров. Описаний ефект відбувається лише при окисленні глюкози в бета-клітині і активації .аденілатциклази, підвищенні рівня Са2+ у цитозолі за наявності кальмодуліну і активізації поліфосфоінозитидної системи.
У разі зниження рівня глюкози в крові подразнюються рецептори альфа-клітин залози, що призводить до синтезу і секреції глюка'гону, підвищення рівня цукру. Ця реакція відбувається
лише при попередньому окисленні глюкози і підвищеній концентрації Са2+ в альфа-клітинах залози.
Глюкорецептори каротидного синуса реагують як на підвищення, так і на зниження рівня цукру в крові. Інформація від них передається дорсальним ядрам блукаючого нерва, які розташовані в довгастому мозку. Від нервових клітин ядра імпульси волокнами блукаючого нерва поширюються до гангліїв, котрі локалізуються в тканині підшлункової залози, а потім до бета-клітин острівців підшлункової залози. Попередник інсуліну, який утворюється в них (проінсулін), переноситься в клітинний комплекс Гольджі, де відбувається цАМФ-залежний процес — перетворення проінсулі-ну на інсулін. Під впливом інсуліну глюкоза, що міститься в печінці, м’язах, перетворюється на глікоген, і рівень цукру в крові відновлюється до нормальних величин. Якщо рівень глюкози в крові знижується, то відбувається гальмування активності нервових клітин паравентрикулярних ядер гіпоталамуса і як наслідок цього — зниження секреції інсуліну. Встановлено вплив різних відділів нервової системи на секрецію інсуліну. Перші результати в цьому напрямку отримано в клініці.
Добре відомо, що цукровий діабет розвивається після психічної травми. Доведено, що умовнорефлекторні подразники, які сигналізують про надходження цукру, гіпнотичне навіювання про введення цукру зумовлюють зниження глікемії (внаслідок підвищеної секреції інсуліну). Вегетативна нервова система (парасимпатична і симпатична) також має значення для регуляції ендокринної функції підшлункової залози.
Стимуляція блукаючого нерва супроводжується гіпоглікемією внаслідок підвищення секреції інсуліну. Збудження симпатичної нервової системи і введення адреналіну (або норадреналіну) призводить до підвищення рівня цукру в крові.
У регуляції секреції інсуліну бере участь ряд гормонів. Так, секрецію інсуліну стимулюють гормон росту (соматотропін) аденогіпофіза, гормони щитовидної залози, травного каналу (кишковий глюкагон, секретин, холецистокінін та ін.), простагландин Еь Утворений у дельта-клітинах острівцевого апарату та гіпоталамусі, соматотропін гальмує секрецію інсуліну.
Регуляція секреції глюкагону також здійснюється через стимуляцію глюкорецепторів у передньому гіпоталамусі, які реагують на зміну рівня глюкози в крові. Так, при його підвищенні відбувається гальмування секреції глюкагону, а при зниженні — її збільшення. На утворення глюкагону в альфа-клітинах впливають і соматотропін аденогіпофіза, який підвищує активність альфа-клітин. Соматостатин, навпаки, гальмує утворення і виділення глюкагону.
При зменшенні концентрації глюкози в крові нижче за 1,78 ммоль/л (норма — 4,44—6,66 ммоль/л) з’являються характерні
симптоми, а саме: надмірне потовиділення, тахікардія, сильний голод і збудження. Якщо рівень глюкози продовжує знижуватися, то розвивається гіпоглікемічна кома, яка супроводжується втратою свідомості і може швидко зумовити смерть. Безпосередньою причиною її є недостатнє забезпечення клітин мозку глюкозою, яка є для них єдиним енергетичним джерелом. У цих випадках ефективним засобом лікування є введення глюкози.
У разі інсулярної недостатності острівцевого апарата підшлункової залози розвивається цукровий діабет. Основними проявами цього захворювання є гіперглікемія, глюкозурія (поява цукру в сечі), підвищення кількості (до 10 л за добу) виділюваної сечі (поліурія), спрага і надмірний апетит. Причиною збільшення вмісту цукру в крові у хворих на цукровий діабет є втрата здатності печінки відкладати глюкозу у вигляді глікогену, а клітин інших органів — утилізувати її. Якщо хвороба розвивається в молодому віці, то вона зумовлена звичайно зниженням числа бета-клітин острівцевого апарата. У дорослих секреція інсуліну може бути пригніченую (особливо в початковій стадії захворювання) внаслідок стійкості (резистентності) до інсуліну, яка пов’язана з недостатністю рецепторів інсуліну на клітинах-мішенях, або утворенням комплексу білок — інсулін, котрий є неактивною формою гормона.
СТАТЕВІ ЗАЛОЗИ
Статеві залози (сім’яні залози у чоловіків і яєчники у жінок) належать до залоз, котрі мають змішану функцію. За рахунок зовнішньосекреторної функції цих залоз утворюються чоловічі й жіночі статеві клітини — сперматозоони і яйцеклітини. Інкреторна функція проявляється утворенням та виділенням чоловічих і жіночих статевих гормонів, які безпосередньо надходять у кров.
Яєчники локалізуються в порожнині малого таза, не вкриті очеревиною і зовні оточені одним шаром клітин поверхневого (або зародкового) епітелію. Основною гормонопродукуючою частиною яєчників є кірковий шар. У ньому серед сполучнотканинної строми розташовані фолікули. Основна їх маса — примордіальні фолікули, що являють собою яйцеклітину. Протягом періоду постнаталь-ного життя велика кількість примордіальних фолікулів гине, і до періоду статевої зрілості число їх у кірковому шарі зменшується в 5—10 разів. Поряд з примордіальними фолікулами в яєчниках містяться також фолікули, що перебувають на різних стадіях розвитку або атрезії, а також жовті й білі тіла. Центральну частину яєчника займає мозковий шар, в якому відсутні фолікули. В ньому серед сполучної тканини проходять основні кровоносні яєчникові судини і нерви. Репродуктивний період життя характеризується циклічними змінами в яєчниках, що зумовлюють до-
зрівання фолікулів, їх розривання з виходом дозрілої яйцеклітини (овуляція), утворення жовтого тіла з його наступною інволюцією на випадок відсутності настання вагітності (мал. Ц6).
Сім’яні залози, або яєчка, зовні вкриті щільною сполучнотканинною оболонкою — білковою капсулою. На задній поверхні вона потовщується і входить у середину сім’яної залози, утворюючи гайморове тіло. Від нього розходяться сполучнотканинні перетинки, які ділять залозу на часточки. В них розташовані сім’яні канальці, а також кровоносні судини та інтерстиціальна тканина. Звивисті сім’яні канальці є органом, де відбувається сперматогенез. їх формування завершується тільки, в період статевого дозрівання. З 10 років у сім’яних канальцях формуються епітеліальні клітини — підтримуючі клітини (клітини Сертолі). Цитоплазма цих клітин містить чисельні включення жирового, білко-
Мал. 116. Схема регуляції дозрівання фолікула і процесів зворотного зв’язку в період менструального никлу.
Знаком (+) позначено посилення секреції, знаком (—) — пригнічення секреції гормонів
вого і вуглеводного характеру, в них є також багато РНК і фер-
ментів, що свідчить про їх високу синтетичну активність. Біля ка
пілярів сім’яних залоз компактними групами розташовані інтерсти-ціальні клітини (клітини Лейдига), які мають добре розвинену ка-
пілярну мережу, а також чисельні мітохондрії. У цитоплазмі цих клітин багато включень — жирових, білкових, кристалоїдів, що свідчить про участь клітин у гормонотворенні (стероїдогенезі). Близьке розташування інтерстиціальних клітин до капілярів сприяє виділенню статевих (андрогенних) гормонів у кров’яне
русло.
Гормони статевих залоз. Статеві гормони діляться на чоловічі й жіночі. До чоловічих гормонів належать андрогени, основним представником яких є тестостерон, і незначна кількість естрогенів, які утворюються внаслідок метаболізму андрогенів. До жіночих гормонів належать естрогени, прогестини (естрадіол, естрон, прогестерон), а також андрогени в низькій концентрації. Тобто в організмі чоловіків і жінок виробляються одні й ті ж гормони, але в різних кількостях.
Естрогени та прогестини синтезуються в яєчниках клітинами
теки та жовтого тіла і в плаценті, андрогени — у яєчку інтерсти-ціальними клітинами.
Розвиток статевих залоз і надходження в кров вироблених ними статевих гормонів визначає статевий розвиток і дозрівання. Статева зрілість у людини настає у віці 12—16 років. Вона характеризується повним розвитком первинних і появою вторинних статевих ознак. До первинних статевих ознак належать статеві залози (сім’яні залози, яєчники) і статеві органи (статевий член, перед-
міхурова залоза, клітор, піхва, великі і малі статеві губи, матка, яйцеводи). Вони визначають можливість здійснення статевого акту та дітонародження.
Вторинні статеві ознаки — це ті особливості статевозрілого організму, які відрізняють чоловіка від жінки. У чоловіків вторинними статевими ознаками є: поява волосся на обличчі, на тілі, зміна тембру голосу, форми тіла, а також психіки і поведінки. У жінок до вторинних статевих ознак належать: особливе розташування волосся на тілі, зміна форми тазу, розвиток молочних залоз.
Характер впливу статевих залоз та їх гормонів на різні функції організму найчіткіше проявляється при видаленні статевих залоз, або кастрації. Зміни, що виникають при цьому, залежать від того, коли проведена кастрація — до чи після настання статевої зрілості. Якщо кастрацію було проведено до статевого дозрівання, то розвиток статевих органів зупиняється і в подальшому статевий потяг (лібідо) не проявляється. Змінюється форма скелету за рахунок видовження кінцівок у зв’язку з тим, що запізнюється окостеніння хрящів. У кастрованих, як правило, буває високий зріст з непропорційним розвитком кінцівок (євнухоїдний тип, або гіпогонадний гігантизм). У жінок спостерігається нерозвинутий таз, який’ зберігає дитячу форму, недорозвинені молочні залози. У чоловіків не ростуть вуса, борода, волосся в пахвинній впадині, голос залишається дитячим. Якщо кастрація проведена в зрілому віці, то відбувається зворотний розвиток первинних статевих ознак, хоч статевий потяг до протилежної статі зберігається. У чоловіків після видалення сім’яних залоз припиняє рости волосся на обличчі, межа волосся на лобку стає горизонтальною, тембо голосу наближається до дитячого. Спостерігаються порушення обміну речовин, передусім жирового, у зв’язку з чим розвивається схильність до ожиріння.
На ранніх етапах ембріогенезу (приблизно наприкінці 3-го місяця) чоловічі статеві залози стають гормонально активними, тобто синтезують андрогени (зокрема, тестостерон), під впливом яких статеві органи набувають будови, характерної для чоловічої статі. Утворення андрогенів припиняється після завершення ембріонального розвитку плода чоловічої статі. У період статевого дозрівання активність статевих залоз у хлопчиків відновлюється,
а у дівчаток внутрішня їх секреція виникає вперше. Під впливом андрогенів у хлопчиків та естрогенів і гестагенів у дівчаток статеві органи ростуть і дозрівають.
Андрогени потрібні також для нормального дозрівання сперма-тозоонів, збереження їх рухової активності, виявлення та здійснення статевих поведінкових реакцій. Вони значною мірою впливають на обмін речовин, мають анаболічну дію — посилюють синтез білка в різних тканинах, особливо у м’язах; зменшують вміст жиру в органах, підвищують основний обмін. Андрогени впливають на функціональний стан ЦНС, вищу нервову діяльність. Після кастрації відбуваються різні зміни в психічній та емоційній сферах.
Естрогени стимулюють ріст яйцеводів, матки, піхви, розростання внутрішнього шару матки — еидометрію, сприяють розвитку вторинних жіночих статевих ознак і прояву статевих рефлексів. Крім того, естрогени прискорюють і посилюють скорочення м’язів матки, підвищують чутливість матки до гормона нейрогіпофізу — окситоцину. Вони стимулюють розвиток і ріст грудних залоз.
Фізіологічне значення прогестерону полягає в тому, що він забезпечує нормальний перебіг вагітності. Під його дією відбувається розростання слизової оболонки (ендометрію) матки, це сприяє імплантації заплідненої яйцеклітини в матці. Прогестерон створює сприятливі умови для розвитку навколо імплантованої яйцеклітини децидуальної тканини, підтримує нормальний перебіг вагітності за рахунок гальмування скорочень м’язів вагітної матки і зменшує чутливість матки до окситоцину. Крім того, прогестерон гальмує дозрівання і овуляцію фолікулів внаслідок пригнічення творення гормона лютропіну аденогіпофізом.
До екстрагенітальних ефектів статевих гормонів належить, наприклад, анаболічна дія андрогенів, тобто посилення синтезу білка, катаболічна дія прогестерону, вплив андрогенів і гестагенів на ріст кісток, підвищення базальної температури тіла тощо.
Клітини жовтого тіла яєчників, окрім продукції стероїдних гормонів, синтезують білковий гормон релаксин. Посилена секреція релаксину розпочинається на пізних стадіях вагітності. Значення цього пептидного гормона полягає в послабленні (релаксації) зв’язку лобкового симфізу з іншими тазовими кістками, механізм якого пов’язаний із збільшенням рівня цАМФ у хондро-цитах. Це призводить до розпаду молекулярних компонентів їх зв’язок. Крім того, під впливом релаксину знижуються тонус матки і її скоротливість, особливо шийки. Таким чином, цей гормон готує материнський організм до майбутніх пологів.
Регуляція утворення статевих гормонів. Регуляція секреції жіночих статевих гормонів (прогестерону і естрадіо-лу) досягається за допомогою двох гонадотропних гормонів (мал. 117)—фолікулінстимулюючого (ФСГ) і лютеїнізуючого
Концентрація тестостерону в крові х
Мал. 117. Регуляція рівня тестостерону в крові і сперматогенезу. Знаком (+) позначено посилення процесу, знаком (—) — зниження
надотропні гормони — ФСГ і
лактин.
(ЛГ). Під впливом ФСГ розвиваються фолікули яєчників і збільшується концентрація естрадіолу, а при перетворенні розірваного фолікула (під дією ПГ) у жовте тіло — х прогестерону. Накопичені в крові статеві гормони діють на гіпоталамус або безпосередньо на гіпофіз за принципом позитивного чи негативного зворотного зв’язку. Збільшен--ня концентрації естрадіолу призводить до підвищення рівня ЛГ (позитивний зворотний зв’язок), а прогестерон у в'еликій кількості гальмує виділення ФСГ і ЛГ (негативний зворотний зв’язок, який запобігає дозріванню наступного фолікула).
Регуляція секреції чоловічих статевих гормо-н і в (тестостерону) також запускається каскадом: гіпоталамус — го-ЛГ, які заносяться в сім’яні залози
і діють відповідно на підтримуючі та інтерстиціальні клітини (див. мал. 117). Під впливом ЛГ виділяється тестостерон, під дією ФСГ—активізується сперматогенез. Накопичений у крові тестостерон гальмує секрецію ЛГ. Паралельно з цим підтримуючі клітини виділяють поліпептид інгібін,' який пригнічує секрецію ФСГ. У регуляції секреції статевих гормонів певну участь бере про-
Гормони плаценти. Плацента здійснює зв’язок материнського організму з плодом, є одночасно легенями, кишками, печінкою, нирками і ендокринною залозою для плода. Вона має три основні структури: хоріональну, базальну мембрани і розташовану між ними паренхіматозну частину, що складається з ворсин хоріона, стовбурової частини і мікроворсинчастого простору.
Плацента виконує багато різних функцій, у тому числі метаболічну (утворення ферментів, участь у розщепленні білків, жирів і вуглеводів) та гормональну (утворює дві групи гормонів — білкові і стероїдні). Білковими гормонами є хоріонічний гонадотро-пін, плацентарний лактогенний гормон (соматомамотропін) і релаксин. До стероїдних гормонів плаценти належать прогестерон та естрогени (естріол). У плаценті виявлено також гіпоталамічні рилізинг-гормони.
Хоріонічний гонадотропін — глюкопротеїд, що утворюється син-тиціальними клітинами трофобласту плаценти. Максимальна секреція спостерігається на 7—12-му тижні вагітності. Пізніше про*
дукція гормона знижується в кілька разів. Хоріонічний гонадотро-пін переходить у кров матері. Транспорт його в організм плода обмежений. Тому концентрація гормона в крові матері в _10— 20 разів перевищує його вміст у крові плода.
Фізіологічна роль хоріонічного гонадотропіну полягає в його лютеїнізуючій дії, тобто він впливає подібно до лютеїнізуючого гормона (лютропіну) аденогіпофіза. Хоріонічний гонадотропін стимулює ріст фолікулів яєчників, зумовлює овуляцію ^дозрілих фолікулів, сприяє утворенню жовтого тіла в яєчниках. Крім того, гормон дає стероїдний ефект — стимулює утворення прогестерону в жовтому тілі яєчників.
Відзначаються захисна функція гормона і його здатність запобігати відшаруванню зародка. Хоріонічний гонадотропін має також антиалегрічну дію.
Плацентарний лактогенний гормон (соматомамотропін) — білковий гормон плаценти. Його секреція розпочинається з 6-го тижня вагітності. Потім його продукція прогресивно збільшується і наприкінці вагітності досягає максимального рівня (до 1 г на добу). У невеликих кількостях гормон проникає через плацентарний бар’єр у кров плода. Фізіологічна роль гормона полягає насамперед у його здатності впливати на молочні залози вагітної (подібний вплив справляє пролактин аденогіпофіза). Крім того, плацентарний лактогенний гормон впливає на процеси метаболізму як у материнському організмі, так і в організмі плода. Метаболічна дія гормона пов’язана з його здатністю впливати на білковий обмін, що проявляється підвищенням синтезу білка і посиленням затримки азоту в організмі матері. Одночасно в крові збільшується вміст вільних жирних кислот, підвищується стійкість організму до гіпоглікемічної дії інсуліну.
Релаксин посилено секретується на пізніх стадіях вагітності. Значення цього пептидного гормона полягає в послабленні зв’язку лобкового симфізу з іншими тазовими кістками. Крім того, під впливом релаксину знижуються тонус матки (особливо шийки) і її скоротливість. Таким чином, цей гормон готує материнський організм до пологів.
Стероїдні гормони плаценти. Прогестерон активно утворюється в плаценті на 5—7-му тижні вагітності. З часом його продукція прогресивно наростає (у 10 разів). Гормон надходить у великих кількостях у кров матері і плода. Він спричинює ослаблення м’язів матки, знижує її скоротливість, чутливість до естрогенів і окситоцину, сприяє накопиченню води і електролітів (особливо натрію) у тканинах матки і в усьому організмі вагітної. Разом з естрогенами прогестерон сприяє росту і розтягненню матки, а також. розвитку молочних залоз, готуючи їх до наступної лактації.
Роль гормонів протилежної статі в регуляції функцій організму* У надниркових залозах і значно менше в яєчниках здорової жінки постійно секретується чоловічий статевий гормон тестостерон (за добу у жінок утворюється 250 мкг, а у чоловіків — 7000 мкг). Дія його спрямована на стимуляцію росту волосся на лобку і в пахових западинах. При гіперпродукції андрогенів проявляються ознаки вірилізму — ріст волосся на тілі, облисіння скронь, порушення менструального циклу.
В організмі чоловіка особливо помітну роль відіграє пролак-тин, концентрація якого в крові не набагато нижча, ніж у організмі жінки. Хоч сам собою пролактин значною мірою впливає на чоловічу статеву систему, він суттєво посилює вплив ЛГ на сте-роїдогенез у інтерстиціальних клітинах, збільшує кількість чутливих до андрогенів рецепторів у передміхуровій залозі та сім’яних пухирцях. При гіперпродукції пролактину розвивається атрофія сім’яних залоз, зменшується концентрація тестостерону в крові, наступає імпотенція.
ПОНЯТТЯ ПРО ТКАНИННІ
ГОРМОНИ
Спеціалізовані клітини різних органів і тканин виробляють біологічно активні речовини — тканинні гормони (див. с. 228). Тканинні гормони впливають не тільки на функції тих органів, де утворюються, а й на інші органи.
Велика (близько 20) група тканинних, так званих гастроінте-стинальних, гормонів синтезується клітинами травного каналу. Вони складають так звану гормональну ентеральну систему. Ці гормони впливають на утворення і виділення травних соків (шлункового, підшлункового, кишкового, жовчі), моторну та всмоктувальну функції органів травлення. Вони синтезуються спеціальними клітинами (ентероцитами — 6, 8, О, І та ін.) слизової оболонки шлунка, кишок і підшлункової залози. До поліпептидів, гормональна природа яких встановлена, належать гастрин, секретин, х о л е ц и с т о к і н ін — панкреозимін, до поліпептидів, гормональний ефект яких повністю не встановлений,— мотилі н, вазоактивний, інтестинальний поліпептид (ВІП), шлунковий інгібіруючий поліпептид (ШІП), вілікінін, субстанція П (Р) та ін. Деякі гастроінтестинальні гормони одержані в чистому вигляді і широко застосовуються в клініко-діагностичній та лікувальній практиці.
Доведено, що деякі із вказаних гормонів (соматостатин, субстанція Р, ВІП та ін.) виробляються також нервовими і ендокринними клітинами (гіпоталамус, щитовидна залоза та ін.).
У тканинах утворюються тканинні гормоноподібні речовини, які беруть участь у регуляції місцевого кровообігу. До них належать: гістамін (розширює кровоносні судини), серотонін (звужує кровоносні судини), калікреїн (під його впливом утворюється судинорозширювальний поліпептид брадикінін), простагландини А, Е, Р, І та інші (утворюються в мікросомах усіх тканин організму з арахідонової кислоти і беруть участь у регуляції секреції травних соків, зміні тонусу гладких м’язів судин і бронхів, процесах адгезії та агрегації тромбоцитів тощо).
РОЗДІЛ з
Фізіологія вісцеральних систем
ГОМЕОСТАЗ І ГОМЕОКІНЕЗ
Для ефективного перебігу біологічних процесів потрібні відповідні умови. Що стабільніші вони, то надійніше функціонує система. Насамперед до цих умов можна зарахувати ті, які сприяють обміну речовин. Для його здійснення треба постійне надходження поживних речовин, води, мінеральних солей, вітамінів, кисню і виведення кінцевих продуктів обміну. Для ефективного перебігу процесів обміну необхідна певна інтенсивність метаболізму, яка залежить від активності ферментів. У свою чергу на активність ферментів впливають зовнішні чинники, зокрема температура.
У повсякденному житті спостерігають різноманітні зміни чинників зовнішнього середовища. Проте, що складніше збудована біологічна система, то більші відхилення від стандартних умов вона витримує без істотних змін життєдіяльності. Це пов’язано з включенням комплексу процесів, спрямованих на стабілізацію метаболізму. Наприклад, у клітині активність ферментних процесів при зниженні температури на кожні 10 °С зменшується у 2—3 рази.
Гомойотермні організми завдяки механізмам терморегуляції зберігають внутрішню температуру на постійному рівні, а отже, й „умови для перебігу ферментних процесів залишаються незмінними.
У процесі еволюції сформувались пристосувальні реакції, які спрямовані на створення умов для життєдіяльності клітин. Кожна з цих умов у організмі відображає відповідні параметри. Тому системи регуляції постійності умов контролюють ці параметри.
У разі появи відхилень механізми регуляції сприяють їх нормалізації.
Уперше на універсальну властивість живого організму зберігати стабільність функцій незалежно від зовнішніх впливів звернув увагу в середині XIX сторіччя французький фізіолог Клод Бернар. Він зазначив, що постійність внутрішнього середовища забезпечує можливість для вільного, значною мірою незалежного від зовнішнього середовища життя. Американський фізіолог Уол-тер Кеннон визначав універсальну властивість живого організму активно зберігати стабільність функцій, незважаючи на зовнішні
впливи, які можуть порушити цю стабільність. Цей процес було названо гомеостазом.
Стан біологічної системи будь-якого структурно-функціонального рівня залежить від комплексу впливів. Цей комплекс обумовлений взаємодією зовнішніх стосовно неї чинників, а також тих, що містяться в середині неї, або тих, що утворюються в результаті процесів, котрі відбуваються в цій біологічній системі. Рівень впливу зовнішніх чинників багато в чому визначається відповідним станом середовища: температурою, магнітними полями та ін. Але ступінь впливу далеко не всіх зовнішніх і внутрішніх чинників організм може і повинен підтримувати на постійному рівні. У процесі еволюції залишились ті з нйх, які потрібніші для життєдіяльності, або ті, для підтримки яких було знайдено відповідні механізми.
Гомеостатичні коистаити. Умови гомеостазу мають певні параметри, що перебувають на постійному, константному рівні. Практично для всіх чинників цей рівень не суворо постійний. Можливі й деякі відхилення від певного середнього рівня («коридору») в той або той бік. Для кожного параметру межі максимально можливих відхилень свої. Відрізняються вони й тим часом, протягом якого організм може витримувати порушення конкретного параметру гомеостазу без якихось серйозних наслідків. У той же час вихід за межі «коридору» може призвести до загибелі відповідної структури — клітини або навіть власне цілого організму. Так, у нормі рН крові становить приблизно 7,4. Але цей показник може коливатися в межах 7—7,8. Крайній ступінь відхилення цього параметру організм людини може витримати без згубних наслідків лише протягом кількох хвилин. У той же час температура тіла, наприклад, при ряді інфекційних захворювань, може досягати 40 °С і більше і триматися на такому рівні протягом багатьох годин і навіть діб. Отже, одні константи організму стабільні, «жорсткі», а інші мають дещо ширший діапазон коливань — «пластичні» константи.
Контроль за параметрами гомеостазу здійснюють відповідні системи регуляції. Якщо ці параметри порушуються, то механізми регуляції, змінюючи функції відповідних органів і систем, повертають їх до норми.
Процеси метаболізму, які відбуваються в організмі, спрямовані на зміну параметрів гомеостазу і повернення системи підтримки на постійний рівень. Але, якщо в стані спокою у здорової людини ці процеси збалансованіші, механізми відновлення працюють із запасом потужності, то при різкій зміні умов існування, у разі захворювання вони вмикаються з максимальною активністю. Процес зміни функцій організму для відновлення гомеостазу називають гомеокінезом (спочатку терміном «гомеокінез» пропонували замінити термін «гомеостаз»).
Системи регуляції гомеостазу удосконалювались у процесі еволюційного розвитку. Так, одна лише відсутність системи підтримки температури. тіла на постійному рівні у пойкілотермних, обумовивши залежність життєвих процесів від зміни зовнішньої температури, різко обмежила їх еволюційний розвиток. У той же час відсутність такої залежності у гомойотермних організмів забезпечила їх розселення по всій планеті. Вони стали справді вільними істотами з високою еволюційною потенцією.
У свою чергу, кожна людина має індивідуальні функціональні можливості систем регуляції гомеостазу. Це багато в чому визначає вираженість реакції організму на різні впливи, а зрештою, позначається і на тривалості життя.
МЕХАНІЗМИ ГОМЕОКІНЕЗУ
І ЇХ РЕГУЛЯЦІЯ
Системи, які контролюють параметри гомеостазу, складаються з різноманітних за структурою механізмів. Вони містять як порівняно просто влаштовані елементи, так і дуже складні нейро-гормональні комплекси. Одним з найпростіших елементів є метаболіти, частина яких може місцево впливати на активність ферментативних процесів, на різні структурні компоненти клітин і тканин. У тканинах, як у середині клітин, так і на зовнішній мембрані, є складний комплекс місцевих регуляторів життєдіяльності, який також бере участь у регуляції гомеостазу і реакціях гомеокінезу. До них належать метаболіти арахідонової кислоти, циклічні нуклеотиди, вільний Са2+ та ін.
. Складніші компоненти регуляції підключаються тоді, коли одних простих вже не досить для того, щоб нормалізувати параметр. Складні системи регуляції є нейрорефлекторними і містять такі стандартні компоненти: 1) параметр, що регулюється; 2) апарат сприйняття цього параметру; 3) регуляторний апарат; 4) об’єкт регуляції.
Ефекторним шляхом може бути нервовий імпульс або гормон. Регуляторний апарат обов’язково має бути здатним до зворотних зв’язків.
На рівні клітини широко використовуються місцеві процеси авторегуляції з негативним зворотним зв’язком. Так, при інтенсивній м’язовій праці в скелетних м’язах у зв’язку з відносним дефіцитом О2 накопичуються недоокислені продукти обміну. Вони зменшують рН саркоплазми, що може призвести до загибелі окремих структур, всієї клітини або навіть цілого організму. При зниженні рН змінюються конформаційні властивості цитоплазматичних білків, мембранних комплексів. Це спричиняє зміни радіуса пор, збільшення проникності мембран усіх субклітинних структур, порушення іонних градієнтів. У цитоплазмі можуть з’явитися віль
ні ферменти лізосом, що зумовлює гідролітичне розщеплення білків, полісахаридів, ліпідів, нуклеїнових кислот. Унаслідок згаданих процесів руйнуються субклітинні структури і власне клітини. Щоб цього не сталося, зменшення рН до певного рівня супроводжується інактивацією ферментів, які беруть участь у створенні не-доокислених продуктів. Тим самим за рахунок місцевого зворотного зв’язку зупиняються ті процеси, які можуть призвести до порушення структури скелетного м’яза. Вслід за цим припиняється скорочення м’язів, розвивається втома.
Крім того, на рівні клітини підтримання умов забезпечується надходженням конче потрібних для обміну речовин інгредієнтів і виходом метаболітів, що утворюються внаслідок реакцій. Ці процеси забезпечуються пасивним осмосом і дифузією, а також активним транспортом. Пасивні процеси меншою мірою підкоряються механізмам регуляції. У той же час інтенсивність активного транспорту регулюється відповідними системами трансмембранного переносу.
ЗНАЧЕННЯ РІДКИХ СЕРЕДОВИЩ
ОРГАНІЗМУ ДЛЯ ГОМЕОСТАЗУ
Центральною ланкою збереження гомеостазу є рідкі середовища організму. Для більшості органів ними є кров і лімфа, а для мозку — кров і ліквор. Особливо значна роль крові. Функції рідких середовищ щодо підтримання гомеостазу різноманітні.
По-перше, рідкі середовища забезпечують процеси обміну з тканинами. Вони не тільки приносять до клітини потрібні для життєдіяльності речовини, але й транспортують від них метаболіти, які можуть нагромаджуватися тут у великій кількості.
По-друге, рідкі середовища мають власні механізми, які конче потрібні для підтримання деяких параметрів гомеостазу. Наприклад, буферні системи пом’якшують зсув КОС при надходженні у кров кислот або основ. Гематоенцефалічний бар’єр і ліквор перешкоджають проникненню з крові в мозок багатьох речовин, які можуть порушити його функцію.
По-третє, рідкі середовища (особливо кров) беруть участь в організації системи контролю гомеостазу. Щодо цього є кілька шляхів. Так, за допомогою транспорту метаболітів до підтримки гомеостазу підключаються віддалені органи і системи (нирки, легені та ін.). Крім того, метаболіти, які надходять у кров, впливаючи на структури і рецептори, що містяться часом у віддалених органах, можуть викликати складні рефлекторні відповіді, запускати гормональні механізми. Особливо велике значення належить рецепторам, які локалізуються в різних структурах мозку. Так, терморецептори реагують на «гарячу» або «холодну» кров і відповідним чином змінюють систему терморегуляції. Під впли
вом ряду метаболітів хеморецептори довгастого мозку спричинюють задишку, осморецептори гіпоталамуса регулюють утворення деяких гормонів.
Рецептори розташовуються також і в стінках кровоносних судин. Вони беруть участь у регуляції хімічного складу крові, її об’єму, тиску. З подразнення судинних рецепторів розпочинається формування рефлексів, ефекторною ланкою яких є багато органів і- систем організму. Центральне місце крові в підтриманні гомеостазу послужило основою для формування спеціальної системи гомеостазу багатьох параметрів власне крові, визначення її об’єму. Для їх збереження існують складні механізми, включені в єдину систему регуляції гомеостазу організму.
Сказане вище можна проілюструвати на прикладі інтенсивної м’язової діяльності. Під час її реалізації продукти обміну у вигляді молочної, піровиноградної, ацетооцтової та інших кислот виходять із м’язів у русло крові. Кислі метаболіти спочатку нейтралізуються основними резервами крові. Крім того, вони через рефлекторні механізми активізують процеси кровообігу і дихання. Підключення вказаних систем організму, з одного боку, поліпшує надходження Ог до м’язів, а отже, зменшує творення недоокисле-них продуктів. З другого боку, воно сприяє збільшенню виділення СО2 через легені, багатьох метаболітів — через нирки, потові залози.
Гомеокінез цілісного організму не є просто сумою реакцій, спрямованих на підтримку окремих параметрів гомеостазу. Вони перебувають у складній ієрархічній взаємодії. При цьому враховується те, що деякі чинники мають дуже важливе значення для забезпечення життєдіяльності організму, порушення їх може призвести до швидкої загибелі клітини, а у ряді випадків навіть усього організму. Зміну інших параметрів гомеостазу організм може деякий час витримати. Наприклад, у стані спокою на постійному рівні підтримуються рН крові та артеріальний тиск. Але при фізичному навантаженні насамперед виникає потреба в адекватному постачанні м’язів кров’ю. При цьому різко підвищується артеріальний тиск, тобто тимчасово під час виконання праці ніби «відміняються» механізми, спрямовані на підтримку артеріального тиску на нормальному рівні. Він нормалізується лише після закінчення праці.
Крім того, в організмі є своєрідна система біологічної значущості функцій окремих органів та систем. У реальному житті може виникнути ситуація, коли важливіші з них повинні виконуватися навіть при різкому порушенні багатьох параметрів гомеостазу. Так, для забезпечення функцій ЦНС потрібне постійне надходження великої кількості Ог та поживних речовин. І якщо з якоїсь причини надходження вказаних сполук у кров різко зменшується, кровотік перерозподіляється таким чином, щоб по мож
ливості максимально повно забезпечити насамперед нервову систему. При цьому в інших органах і власне крові гомеостаз багатьох параметрів може порушуватися.
Ще наочніше можна продемонструвати прояв ієрархії функцій при виконанні фізичної роботи. Значущість її для організму збереглася в процесі еволюції натуральної природи, де від діяльності скелетних м’язів нерідко залежить збереження власне організму. Під час інтенсивної праці можуть різко відхилитися рН крові (навіть до 7), підвищитися температура тіла (у кінці марафонської дистанції у спортсмена температура тіла досягає нерідко 40°С і більше). Оскільки певні порушення при надмірній їх вира-женості самі собою можуть призвести до загибелі організму, праця стає неможливою. Але це спостерігається лише при надмірному відхиленні параметрів від константних. Причому цід час навантаження може різко знизитися кровопостачання багатьох внутрішніх органів, що додатково зумовить порушення гомеостазу. Параметри гомеостазу починають відновлюватися під час власне праці. Але найактивніше вони відновлюються лише після її припинення. У цей час діяльність усіх систем організму спрямована головним чином на відновлення гомеостазу.
У наступних розділах при викладі фізіології вегетативних систем організму механізмам підтримки гомеостазу, а також механізмам гомеокінезу буде приділена пильна увага. Механізми гомеокінезу тісио .пов’язані з процесами компенсації функцій при патології, адаптивними процесами, котрі розвиваються при зміні дії будь-якого зовнішнього чинника (температури, складу атмосферного повітря тощо).
ВІКОВІ ОСОБЛИВОСТІ ГОМЕОСТАЗУ
І ГОМЕОКІНЕЗУ
У період раннього онтогенезу поступово формуються системи гомеостазу, але розвиваються вони нерівномірно. Вікове удосконалення їх визначається, насамперед, генетично запрограмованою етапністю вікового розвитку. Індивідуальні можливості системи гомеокінезу залежать як від генетичної схильності, так і від зовнішніх умов, «натренованості» кожної з них. І від того, як добре вони будуть розвинуті в період онтогенезу, який буде рівень функціональних та структурних резервів кожної функції, значною мірою залежить здоров’я і тривалість життя людини.
У новонароджених більшість показників, що характеризують гомеостаз, нестабільні. Наприклад, у малюків легко зсуваються параметри КОС крові, водно-електролітного балансу. Також швидко можуть змінюватись температура тіла і артеріальний тиск.
Удосконалюються гомеостатичні реакції найактивніше протягом першого року життя. Але остаточне їх становлення завершується
після статевого дозрівання, яке знаменує перехід до стабільного стану дорослих.
Під старість механізми підтримки гомеостазу поступово виснажуються, внаслідок чого при меншій інтенсивності певних ВПЛИВІВ можуть настати вираженіші його порушення. Літні люди важче переносять будь-які зміни зовнішнього середовища, а також відхилення у процесах життєдіяльності. Це призводить до того, що хвороби в цьому віці мають тяжчий перебіг, а відновлення функцій затягується.
РІДКІ СЕРЕДОВИЩА ОРГАНІЗМУ
ЗАГАЛЬНА ХАРАКТЕРИСТИКА
РІДКИХ СЕРЕДОВИЩ
Рідкі середовища беруть участь у всіх біологічних процесах. Якщо на рівні клітини вони є необхідною водною фазою перебігу біохімічних і інших реакцій, то на рівні органів рідкі середовища виконують додатково й свої специфічні функції. Так, кров та лімфа є одним із засобів сполучення органів у єдиний організм. Ліквор бере участь у створенні особливих умов функціонування мозку. Плевральна, внутрішньосуглобна рідини служать для амортизації і «змащування» поверхонь органів. Основою травних соків, сліз, рідких середовищ ока, сечі, поту, сперми, амніотичної рідини також є вода.
У різних органах і тканинах дорослої людини відносний вміст води становить 68% (печінка)—83% (кров). Винятком є лише скелет (22 %) і жирова тканина (10 %). У середньому на воду припадає близько 73 % маси тіла. В організмі жінок, як правило, жиру більше, тому в їх тканинах води приблизно на 6—10 % менше. У тканинах новонароджених вміст води приблизно на 10 % вищий, ніж у тканинах дорослої людини.
Можна виділити два основних середовища: внутрішньоклітинне і міжклітинне. Міжклітинна рідина в свою чергу поділяється на воду порожнин організму, плазми крові і власне міжклітинну рідину. В середньому у дорослої людини, яка має масу тіла 70 кг, в клітинах міститься до ЗО л води, в міжклітинному просторі — приблизно 10 Л, а у плазмі — близько 3,3 л.
МЕХАНІЗМИ ПЕРЕНОСУ ВОДИ
МІЖ ОКРЕМИМИ СЕРЕДОВИЩАМИ
У організмі постійно і з великою інтенсивністю відбувається обмін води між окремими рідинними середовищами. Він здійснюється по міжклітинних щілинах або безпосередньо через клітинні мембрани. Вода переміщується під дією різних рушійних сил.
Мал. 118. Схема впливу осмотичного тиску на перехід розчинника через напівпроникну мембрану (М)
Дифузія. Якщо мембрана ділить два розчини, що мають різну концентрацію речовини, а мембрана здатна пропускати цю речовину, то вона рухається доти, доки не вирівняється концентрація (від більшої концентрації до меншої). Таке перенесення речовин називається дифузією.
Осмос. Якщо мембрана розділяє два розчини, що мають різну концентрацію певної речовини, і при цьому непроникна для неї, то розчинник рухається у напрямку від меншої концентрації до більшої. Цей вид транспорту називається осмосом. Сила, яка в даному випадку визначає рух розчинника, називається осмотичним тиском.
Величина осмотичного тиску визначається кількістю розчинених молекул, а не їх розмірами: велика молекула білка і мала
іона мінералу мають однаковий осмотичний тиск. Для транспорту води велике значення має проникність мембран для різних сполук. Більшість мембран є напівпроникні: що більше молекула, то менша швидкість її проходження через мембрану. Як правило, біологічні мембрани погано або зовсім не пропускають великі молекули білка. Тому ту частину осмотичного тиску, яку створюють білки, виділяють окремо. Це онкотичний тиск.
Гідростатичний тиск. Якщо вода під впливом осмотичного тиску надходить у просторово обмежену порожнину, то може виникнути така ситуація, коли концентрація ще не вирівняється, а об’єм буде заповненим. У цьому випадку надлишок рідини, яка надходить, створює так званий гідростатичний тиск на стінки порожнини. Цей тиск може бути створений і активною працею якого-не-будь насосу (наприклад, серце нагнітає кров у судинне русло). Гідростатичний тиск виштовхує воду з замкнутої порожнини. Що вищий гідростатичний тиск, то з більшою силою вода виштовхується із вказаної порожнини. При гідростатичному тиску з обох боків мембрани сила, яка виштовхує воду, дорівнює різниці цих тисків.
У основі обміну води між клітинами і міжклітинним простором лежить взаємодія сил осмотичного (онкотичного) і гідростатичного тиску по обидва боки клітинної мембрани (мал. 118).
Величина осмотичного тиску в клітині залежить від активності обмінних процесів, унаслідок яких можуть утворюватися сполуки, котрі впливають на осмотичний і онкотичний тиск. Так, під час біосинтезу білків онкотичний тиск зростає. Під час окислення утворюється вода, яка знижує осмотичний тиск, робота іонних
насосів, які підтримують концентрацію іонів у клітині, також впливає на водний обмін. Велике значення має й проникність клітинної мембрани. Так, мембрана еритроцита погано пропускає аніони, і коли знижується активність №+-, К+-АТФази, в клітині зростає концентрація №+, що призводить до збільшення осмотичного тиску і надходження води в клітину. Ці ж процеси відбуваються в клітинах після смерті, що призводить до їх набрякання.
ІНТЕРСТИЦІАЛЬНА РІДИНА
У міжклітинному просторі міститься рідина, яка утворюється внаслідок фільтрації плазми крові і клітин тканини. Тут рідина головним чином зв’язана з білками і має вигляд гелю. Незначна кількість вільної рідини має вигляд найдрібніших бульбашок серед структур міжклітинної речовини. Оскільки вода перебуває переважно у зв’язаному стані, рухається вона через гель дуже повільно.
Основною рушійною силою в даному разі є дифузія. Дифундують не тільки молекули води, але й продукти клітинного обміну, гази (Ог і СОг), електроліти.
У різних органах і тканинах колоїдно-осмотичний і гідростатичний тиск у міжклітинній речовині різні. Гідростатичний тиск створюється внаслідок того, що об’єм міжклітинного простору обмежують сполучнотканинні волокна, а через наявність молекул білка та іонів створюється деяка величина осмотичного та онкотичного тиску. В більшості органів онкотичний тиск становить близько 6 мм рт. ст. (0,8 кПа).
Вільна вода, що міститься серед гелю, створює гідростатичний тиск. У щільнозапакованих органах і тканинах цей тиск вищий від атмосферного на декілька міліметрів ртутного стовпа. Так, у мозку він перебуває в межах +4...+6 мм рт. ст., у нирці — близько +6 мм рт. ст. На відміну від цього в інтерстиціальній рідині підшкірної основи тиск дещо нижчий від атмосферного: —2...—6 мм рт. ст. Через такий низький гідростатичний тиск може з’явитись набряк підшкірної основи. Цьому сприяють застій крові у венах (призводить до росту гідростатичного тиску в капілярах), зниження концентрації білків у крові (зменшується сила онкотичного тиску, яка утримує воду в руслі крові). Внаслідок цього в підшкірній основі різко збільшується вміст вільної води.
ЛІКВОР
Мозок як наймолодший еволюційний утвір для забезпечення своєї функції потребує ще суворіших гомеостатичних умов, ніж інші Органи. Він краще, ніж інші органи, захищений від імовірно-ного впливу хімічних чинників, які містяться у крові (завдяки
так званому гематоенцефалічному бар’єру — ГЕБ). ГЕБ — складний механізм, що захищає і регулює тканинне середовище мозку. Бар’єр утворюють ендотелій капілярів, гліальні клітини, що лежать між капілярами та нейронами, павутинна «болонка та судинні сплетіння, розташовані у шлуночках.
В утворенні гомеостатичних умов для мозку бере участь також спинномозкова рідина (ліквор). Ліквор утворюється головним чином судинним сплетінням шлуночків мозку. В процесі його творення беруть участь також судини менінгеальної оболонки, епендими шлуночків, паренхіми мозку. В шлуночках міститься ЗО— 40 мл, а у підпавутинному просторі— 100—120 мл прозорого безбарвного ліквору. Питома маса його дорівнює 1,005—1,007 г/мл, рН 7,4—7,6. Ліквор містить значно менше, ніж кров, білків (до 0,02 %) та гормонів; немає в ньому ферментів та імунних тіл. Неорганічних солей має майже стільки, скільки й плазма крові.
Після утворення нові порції ліквору відтісняють попередню з мозкових шлуночків — спочатку в спинномозковий канал, а потім у субарахноїдальний простір. Крізь арахноїдальні ворсини у верхньому синусі ліквор потрапляє в кров.
Поряд з утворенням внутрішнього середовища мозку ліквор виконує функцію гідравлічного амортизатора, який запобігає травмуванню мозку, робить його легшим. Крім цього, обмінюючись іонами і молекулами з міжклітинною рідиною, він підтримує осмотичний склад мозку на певному рівні, постачає різноманітні поживні речовини, виносить відходи метаболізму.
Судинне сплетіння шлуночків, синтезуючи ліквор, виконує роль нирок стосовно мозку. Анатомічною основою судинних сплетінь є листовидні відростки, в яких містяться дрібна артерія та капіляри. Відростки оточені одношаровими епітеліальними клітинами, які щільно прилягають одна до одної. Швидкість секреції ліквору така, що він повністю відновлюється протягом 3—4 год.
На 99 % ліквор складається із води. Спочатку вода надходить за осмотичним градієнтом услід за іонами всередину епітеліальних клітин. Тут вода дисоціює на Н+ та ОН-. Біля базолатеральної мембрани Н+ обмінюється на Иа+ плазми крові. На апікальній мембрані Иа+ активно за допомогою На+-, К+-насосу відкачується до спинномозкової рідини. За електрохімічним градієнтом услід за Иа+ надходять СІ- та бікарбонати. Бікарбонати у клітині утворюються з Н2О та СО2. У шлуночки для підтримання осмотичної рівноваги надходить і недисоційована вода. У спинномозковій рідині багато іонів (Иа+, К+, СІ-) мають постійний вміст, тобто регулюються.
Спинномозкова рідина містить також речовини, які використовуються для забезпечення функцій мозку. Крізь ГЕБ із кровоносних капілярів до ліквору більшість сполук надходить селективно (вибірково). Найлегше проникають ті речовини, які мозок викори-
Мал. 119. Схема гематоенцефалічного бар’єру
ШЛУНОЧОК ЦЕРЕБРО-СПІНАЛЬНА РІДИНА На; К,+ СІ. НСОз, Са?Мд* АСКОРБІНОВА КИСЛОТА ФОЛАТИ
-ЕПЕНДИМА
СУДИННОГО СПЛЕТІННЯ
О
КАПІЛЯР
стовує досить активно: глюкоза, лактат, амінокислоти, рибонуклеїнова кислота, ряд вітамінів. Для цього в ендотелії судин існують спеціалізовані переносники, що здійснюють трансмембранний транспорт речовин, як правило, без затрат енергії. Однак при низькій концентрації у крові ці речовини можуть активно надходити проти градієнта концентрації. Системи активного та пасивного транспорту із міжклітинної рідини транспортують наведені сполуки спочатку до цитоплазми епітеліальних клітин, а потім до ліквору. Внаслідок цього деякі речовини, наприклад вітамін С, фолати, накопичуються у лікворі до рівня, який у 4 рази перевищує такий у плазмі крові.
Оскільки транспортні системи обмежені кількістю переносників на мембранах, то максимальна швидкість переносу цих сполук обмежена. Відповідно обмежена й швидкість надходження речовин у разі занадто великої їх концентрації у крові (мал. 119).
Судинне сплетіння перекачує речовини не тільки із крові, але й у зворотному напрямку, очищаючи спинномозкову рідину від продуктів розпаду. Існує кілька «очисних» систем, які діють за принципом активного транспорту. Одна з них виводить іони, інші —
лікарські речовини, зокрема антибіотики типу препаратів групи пеніциліну тощо. Через це важко досягти достатньої їх концентрації у мозку під час лікування. Багато сполук, що утворюються у мозку, серед них і нейромедіатори, також виводяться завдяки активності судинного сплетіння.
Крім цього, ендотелій судинного сплетіння може брати участь і в синтезі таких білків, вміст яких у лікворі більший, ніж у крові. До них належить преальб"умін, котрий транспортує з крові до мозку такі важливі речовини, як гормони щитовидної залози, вітамін А. Припускають, що ряд білків, які синтезуються судинними сплетіннями, беруть участь у регуляції процесів розвитку мозку.
РІДИНИ ЗАКРИТИХ
ПОРОЖНИН ТІЛА
До закритих порожнин тіла належать плевральна, перикар-діальна, перитонеальна, суглобні. Ці порожнини містять по кілька мілілітрів в’язкої рідини, а при патології її кількість може різко збільшуватися. В нормі серозна оболонка названих порожнин мало проникна для електролітів та інших сполук. Основним джерелом надходження рідини в порожнини є сусідні капіляри. Механізм дифузії її подібний до описаного вище для міжклітинної рідини інших органів та тканин. Всмоктується рідина головним чином також у близько розташованих капілярах. Білки, що містяться в невеликій кількості в рідинах, всмоктуються переважно в лімфатичні судини. Разом з ними реабсорбується й частина води. Тому при збільшенні тиску в капілярах навколишніх тканин з’являється можливість для збільшення кількості рідини вказаних порожнин. Блокада лімфатичних судин також супроводжується збільшенням кількості рідини в цих порожнинах.
Порозна серозна мембрана плеври відокремлює порожнину від сусідніх капілярів та міжклітинної рідини. Плевральна рідина за своїм складом і механізмом утворення дуже близька до інтерсти-ціальної. Динаміка утворення їх суттєво відрізняється від такої у інших відділах у зв’язку з особливостями кровообігу в малому колі і потребує спеціального опису. Ця відміна грунтується на таких особливостях: а) середній тиск у капілярах становить 7 мм рт. ст. (0,9 кПа), у великому колі — 26 мм рт. ст. (3,3 кПа); б) гідростатичний тиск вільної рідини в тканині легенів нижчий, ніж у інших тканинах, і у зв’язку зі структурними особливостями паренхіми та від’ємним тиском у міжплевральній щілині він має від’ємну величину (близько —6 та —8 мм рт. ст., або —0,8 та —1,0 кЦа); в) стінка легеневих капілярів більш проникна для білків, завдяки чому онкотичний тиск інтерстиціальної тканини підвищується до 14 мм рт. ст, (1,9 кПа); г) лімфа, в яку головним чином
абсорбуються білкові сполуки та інші речовини, в легенях утворюється дуже інтенсивно.
У зв’язку з цим ефективний фільтраційний тиск (ЕФТ), який дорівнює різниці між взаємодією сил фільтрації рідини та її абсорбцією, в легенях складає лише +1 мм рт. ст. (0,1 кПа), у більшості інших тканин — близько +3 мм рт. ст. (0,4 кПа). Однак в умовах неушкодженої дренажної лімфатичної системи набряку легенів може не бути і при підвищенні ЕФТ до +23 мм рт. ст. (3,0 кПа)г
Плевральна рідина утворюється подібно до інтерстиціальної. Одним із основних джерел абсорбції її є лімфатичні судини па-рієтальної плеври. Відтоку лімфи сприяють дихальні експіраторні рухи, що підвищують внутрішньоплевральний тиск.
Інше джерело реабсорбції плевральної рідини — судини вісцеральної плеври. В капілярах вісцеральної плеври активна реабсорбція рідини відбувається у зв’язку з низьким гідростатичним тиском під впливом онкотичного тиску білків плазми крові. Внаслідок поєднання вищеназваних умов гідростатичний тиск вільної рідини у міжплевральному просторі постійно від’ємний (близько —8 мм рт. ст., або —1,1 кПа).
У природних умовах життєдіяльності,в нормі, а особливо при патології вказані умови обміну рідини в легенях та міжплевральному просторі можуть змінюватися. Найчастіше підвищується ге-модинаміка у малому колі кровообігу. Проте саме по собі зростання тиску не призводить до набряку в зв’язку з запасом так званих реабсорбційних потужностей. Набряк розвивається при порушенні лімфотоку або при різкому підвищенні проникності стінок капілярів. Останнє відбувається, наприклад, під впливом гістаміну, що утворюється у великій кількості при бронхіальній астмі. У розвитку набряку легенів та виникненні плевриту особливу роль відіграє інфекція.
Незначна кількість рідини, що є в порожнині перикарда, утворюється значною мірою так само, як і та, що є у плевральній порожнині. Гідростатичний тиск вільної води тут також від’ємний. Всмоктуванню та відтоку її з лімфатичних каналів середостіння сприяють поряд з дихальними рухами скорочення серця.
У черевній порожнині міститься невелика кількість рідини, що фільтрується та реабсорбується через серозну мембрану очеревини. Як і в інших порожнинах, у перитонеальній реабсорбція великих за розміром молекул, солей та води значною мірою відбувається в лімфатичних судинах очеревини. Найбільша кількість лімфатичних судин іде від парієтального відділу діафрагми. Причому тут не тільки можуть всмоктуватися великі молекули, але й проникати цілі клітини, наприклад, еритроцити після їх уведення в черевну порожнину.
У водному обміні черевної порожнини надзвичайну роль ві
діграє печінка. При підвищенні в синусах тиску на 5—10 мм рт. ст. (0,7—1,3 кПа) рідина, що містить велику кількість білків, починає трансфузувати в черевну порожнину через поверхню печінки, внаслідок чого розвивається асцит. Така ситуація спостерігається при багатьох захворюваннях, зокрема при цирозі печінки.
Порожнини та сумки суглобів покриті синовіальною мембраною, яка складається з фіброзної тканини й клітин. Власне, ці порожнини є різновидом міжклітинного простору. Однак суглобна рідина містить велику кількість протеогліканів, які синтезуються навколишніми клітинами. Протеоглікани створюють відносно високий онкотичний тиск, - внаслідок чого рідина надходить у порожнини. Білки та рідина всмоктуються в лімфатичних судинах. Для абсорбції рідини у близько розташовані кровоносні судини не є перешкодою й синовіальна мембрана. В суглобній порожнині постійно спостерігається від’ємний гідростатичний тиск рідини (від —4 до —8 мм рт. ст., або від —0,5 до —1,1 кПа), що забезпечує не тільки водний обмін, але й взаємне притягування кісток. При порушенні цілості суглобної сумки цей ефект зникає і кістки можуть легко роз’єднуватися.
У середині очного яблука міститься два рідинні середовища, що створюють його об’єм та відповідний тургор. Це водяниста рідина, що оточує спереду та ззаду кришталик, і скловидне тіло, яке лежить між кришталиком і сітківкою. Скловидне тіло — прозорий гель зовнішньоклітинної рідини, колоїдний розчин якого містить колаген та гіалуронову кислоту’. Між цими середовищами відбувається активна дифузія води та інших сполук, які спочатку дифундують із кровоносних судин сітківки.
Водяниста волога ока, що утворюється шляхом фільтрації та реабсорбції, є основною рідиною, яка регулює загальний об’єм рідини та внутрішньоочний тиск. Швидкість її утворення — близько 1—2 мм3/хв. Основним секреторним органом є циліарне тіло, сумарна поверхня якого в кожному оці становить близько 6 см2. Механізм секреції цієї рідини подібний до механізму секреції ліквору: активно секретується 1Ча+, СІ- та бікарбонати. Услід за ними із судин видаляється вода. Мабуть, шляхом активного та факультативного транспорту секретуються деяка кількість амінокислот, аскорбінова кислота, глюкоза.
Рідина, що утворюється, із задньої камери ока через зіницю надходить у передню камеру, де бере початок венозний синус склери. На другому кінці цей синус контактує з тонкостінними венулами, порозна мембрана яких легко пропускає навіть великі білкові молекули. Через цю мембрану реабсорбована рідина передньої камери надходить у русло крові.
Внутрішньоочний тиск (у нормі він становить близько 16 мм рт. ст., або 2,1 кПа) регулюється головним чином з передньої камери ока. Причому швидкість течії рідини через венозний синус
склери багато в чому залежить від рівня внутрішньоочного тиску. Так, при зниженні тиску ширина каналу зменшується, а при його підвищенні понад 15 мм рт. ст. (2,0 кПа) він розширюється, відповідно до цього змінюється й швидкість відтоку рідини.
Система крові
Кров є одним із різновидів сполучних тканин. Міжклітинна речовина її перебуває у рідкому стані і називається плазмою. У ній містяться формені елементи — еритроцити, лейкоцити і тромбоцити. Функції крові різноманітні, але майже усі вони пов’язані з циркуляцією її кровоносними судинами. Завдяки цьому кров виконує загальну транспортну функцію. Кожну із функцій кров виконує разом з іншими органами, будучи складовою частиною відповідних функціональних систем організму.
ФУНКЦІЇ КРОВІ
1. Дихальна функція полягає у зв’язуванні і перенесенні О2 від легень до тканини і СО2 — із тканин до легень.
2. Трофічна функція крові пов’язана із забезпеченням усіх клітин організму поживними речовинами, що надходять із органів травлення або інших органів.
3. Екскреторна функція: кров транспортує з тканин кінцеві продукти метаболізму до органів виділення.
4. Терморегуляторна функція: кров несе тепло від енергоємних органів та зігріває органи, що втрачають його.
5. Забезпечення водно-електролітного обміну: в артеріальній частині більшості капілярів рідина і електроліти надходять у тканини, у венозній — вони повертаються у кров.
6. Захисна функція: кров забезпечує захист організму від бактерій, вірусів і генетично чужорідних клітин і речовин.
7. Гуморальна регуляція: кров переносить гормони та інші біологічно активні сполуки від клітин, де вони утворюються, до інших органів та тканин. Цим самим забезпечується хімічна взаємодія між усіма частинами організму.
Перераховані функції крові спрямовані на підтримання гомеостазу організму.
Оскільки кров бере участь у здійсненні різноманітних 'функцій, багато органів впливають на склад крові. За її складом можна судити про стан цих органів.
Входячи до складу різноманітних функціональних систем Організму, кров разом з нервовою системою об’єднує їх у єдиний організм. У той же час кров можна виділити і в самостійну систему, до складу якої входять органи творення і руйнування формених
елементів, біосинтезу білків та інших компонентів плазми, а також нервові і гуморальні механізми регулювання складу крові.
Об’єм циркулюючої у судинному руслі крові (ОЦК) є однією з констант організму. Проте ОЦК не постійна величина. Він залежить від віку, статі, функціонального стану органів конкретної людини. У молодої людини ОЦК становить близько 7 % маси тіла, у новонароджених — понад 10%. Лише у період статевого дозрівання ОЦК поступово досягає такого рівня, як у дорослих. У жінок у судинному руслі циркулює трохи менше крові, ніж у чоловіків (близько 6 % маси тіла). У людей, які ведуть малорухомий спосіб життя, ОЦК нижчий, а у фізично тренованих, навпаки, вищий від середнього рівня. Так, у спортсменів, здатних витримувати велике фізичне навантаження, ОЦК досягає 10 % маси тіла.
ПЛАЗМА КРОВІ
Понад половину об’єму крові становить плазма. Якщо взяти кров із вени і відцентрифугувати її до зсідання, то рідка частина її складе 55—60 %, а формені елементи — 40—45 %. Об’єм формених елементів крові у відсотках називається гематокритом.
Основою плазми крові (91 %) є вода. Разом із іншими інгредієнтами вона постійно оновлюється. Так, за 1 хв змінюється до 72 % води, що входить до складу плазми. Обмін води між плазмою і міжклітинним простором здійснюється у мікроциркуляторно-му відділі судинного русла. У свою чергу, міжклітинна вода інтенсивно обмінюється з внутрішньоклітинною.
9 % плазми крові припадає на різні речовини, розчинені у ній. Частина з них перебуває на константному рівні, вміст інших коливається залежно від стану організму. До таких речовин належать продукти розпаду, харчові речовини, що всмоктуються у кишках, тощо.
Білки плазми
Білки становлять близько 7 % об’єму плазми. Переважна більшість їх надходить у русло з печінки — основного органу біосинтезу білків плазми. Одні білки виконують цілеспрямовану функцію, перебуваючи у крові, інші — циркулюють у ній короткий час, прямуючи до місця використання або виділення. Наявність у молекулі білків особливих ділянок, здатних приєднувати органічні або неорганічні речовини, забезпечує транспортну функцію. З білками плазми зв’язані численні іони. Так, близько 2/з Са2+ плазми неспецифічно пов’язано з білками. Цей Са2+ перебуває у рівновазі з розчиненим у крові іонізованим фізіологічно активним Са2+ Залізо переноситься за допомогою білка трансферину, а мідь -* церуЛоплазміну.
Численні біологічно активні сполуки, гормони й інші порівняно невеликі органічні молекули також транспортуються (від місця утворення, із депо, після всмоктування у кишках) до місця споживання зв’язаними з білками переносниками. Завдяки такому зв’язку невеликі молекули утримуються у судинному руслі при проходженні крові через нирки, а також не зазнають руйнування ферментами крові.
Білки плазми після їх попереднього розщеплення на амінокислоти можуть використовуватися як поживні речовини. Амінокислоти у клітинах більшості органів служать для побудови власних структур, синтезу біологічно активних сполук, а іноді й для утворення АТФ. Для цього білки повинні бути зруйнованими фагоци-туючими елементами, що містяться у крові або тканинах. Амінокислоти, які утворюються при цьому, поповнюють пул амінокислот, які всмокталися у кишках. Трофічна функція білків плазми використовується у медицині при порушенні природних шляхів харчування, так званому парентеральному харчуванні, коли білкові суспензії вводять безпосередньо у судинне русло.
Крім того, у плазмі крові можна виявити велику кількість білків-ферментів, що надходять із різних органів. Звичайно активність їх порівняно невисока, але у випадку ушкодження органу концентрація ферментів різко збільшується за рахунок виходу із клітин. Визначення їх рівня у крові є одним із доступних лабораторних методів, які допомагають встановити діагноз хвороби.
Склад білків
Більшість білків плазми (50—60 %) становлять альбуміни, що мають молекулярну масу до 69 000. У руслі крові альбуміни містяться досить тривалий час: період напівруйнування (Т */2) становить близько 10—15 діб. Маючи сумарно велику площу поверхні, альбуміни виконують транспортну функцію. Крім того, вони є резервними білками, що використовуються для одержання амінокислот. Альбуміни у плазмі є основними білками, які створюють онкотичний тиск, і тому мають велике значення для регулювання об’єму крові.
Глобуліни плазми — група білків, які при електрофорезі діляться на фракції, позначені як аг, аг-, р-, у-глобуліни. Молекулярна маса їх становить від 44 000 до 130 000. Період циркуляції глобулінів менший, ніж альбумінів: Т ‘/г — до 5 діб. Вони виконують найрізноманітніші функції, у тому числі транспортну та захисну. Так,.аі-глобулін переносить ліпіди, тироксин, гормони кіркової речовини надниркових залоз; а2-глобулін транспортує мідь, а також ліпіди; р-глобуліни транспортують залізо, гем і ліпіди; у-глобуліни є антитілами.
Має значення співвідношення кількості альбумінів та глобулі
нів — альбуміно-глобуліновий коефіцієнт. У нормі він коливається від 1,5 до 2,3. Найбільшим білком плазми є фібриноген, який бере участь у процесі зсідання крові та припиненні кровотечі. Таким чином, білки крові виконують транспортну, живильну, захисну функції, створюють онкотичний тиск, беруть участь у процесі зсідання крові, в підтриманні на постійному рівні КОС крові.
Мінеральні речовини плазми
У плазмі крові міститься велика кількість неорганічних сполук. Концентрація мінеральних речовин складає близько 0,9 % маси плазми. Тут переважно містяться №+, К+, Са2+, С1“, НСОГ, НРОІ7 Вміст деяких мінеральних речовин дуже незначний. їх називають мікроелементами (наприклад, мідь, залізо). Рівень більшості мінеральних сполук відносно постійний, що забезпечується системами регулювання. Так, наприклад, рівень Са2+ у крові регулюється гормонами щитовидної та паращитовидної залоз, вітаміном Оз.
ФІЗИКО-ХІМІЧНІ
ВЛАСТИВОСТІ КРОВІ
Осмотичний тиск крові
Різні сполуки, розчинені у плазмі і формених елементах крові, створюють у них осмотичний тиск. Мембрани формених елементів, стінок судин є напівпроникними. Усі вони добре пропускають воду, значно гірше іони і молекули різних речовин. У нормі осмотичний тиск плазми крові становить близько 7,5 атм (5700 мм рт. ст., або 762 кПа). Осмотична активність плазми становить близько 290 мосм/л.
Величина осмотичного тиску визначається концентрацією розчинених молекул, а не їх розмірами. Більша частина (приблизно 99,5%) іонів плазми — неорганічні іони. Від їх концентрації і залежить величина осмотичного тиску. На білки плазми припадає лише 0,03—0,04 атм (25—ЗО мм рт. ст.) тиску. Але тиск, створений .білками, виконує важливу роль у регулюванні розподілу води між плазмою і тканинами. Тому цю частину тиску виділяють окремо, називаючи його онкотичним тиском. Участь онкотичного тиску у регулюванні обміну води зумовлена тим, що стінки судин (капілярів) у більшості органів непроникні для білків. У тканинній рідині вільних білків мало, тому існує градієнт їх концентрації по обидва боки стінки капіляра. У крові ж і міжклітинній рідині кількість неорганчних молекул, як правило, однакова. Завдяки вищому онкотичному тиску в крові утримується вода. Осмотичний і онкотичний тиск забезпечує водний обмін між середовищами організму. Вони впливають також на обмін води між плазмою крові і форменими
елементами. !При порушенні осмотичного або онкотичного тиску у плазмі можуть змінюватися функція клітин крові і тривалість їх життя. Так, при зниженні осмотичного тиску плазми вода буде надходити у клітини крові, що при досягненні межі розтяжності призведе до розриву їх оболонки — осмотичного гемолізу. Навпаки, підвищення осмотичного тиску плазми зумовлює ВИХІД ВОДИ ІЗ клітин, втрату пружності, зморщування їх. Це також негативно позначається на життєдіяльності клітин і може призвести до руйнування їх макрофагами тканин.
Регуляція осмотичного тиску крові
Осмотичний та онкотичний тиск плазми є однією із гомеостатичних констант організму, хоч і може дещо змінюватися. Іонний склад крові залежить як від обміну з тканинами, так і від функціонування органів виділення (нирки, потові залози). Ці процеси координуються системами регуляції, в основі яких лежить гормональна регуляція. Детально механізми регуляції описані в розділі «Функція органів виділення». Стабільність онкотичного тиску білків плазми визначається активністю процесів біосинтезу білків у печінці, їх використанням або виділенням. Ці процеси при захворюванні певних органів порушуються. Наприклад, при ураженні нирок виведення із організму білків може привести до набряку тканин.
Принципи виготовлення кровозамінник розчинів
У клінічній практиці часто спостерігаються ситуації, коли конче потрібним стає переливання кровозамінників. Це буває при багатьох патологічних станах. Для цього використовують ізотонічні та ізоонкотичні розчини. Розчин, осмотичний тиск якого перевищує осмотичний тиск плазми крові, зветься гіпертонічним, аз меншим осмотичним тиском, ніж осмотичний тиск плазми,— гіпотонічним; 96% загального осмотичного тиску плазми припадає на частку неорганічних електролітів, серед яких основна роль належить №С1 (близько 60—80 %). Тому найпростішим кровозамінником є 0,9 % розчин натрію хлориду, який створює осмотичний тиск, близький до 7,5 атм. Але якщо розчин вводиться для компенсації втраченої крові, то він повинен містити збалансовану концентрацію неорганічних солей, близьку за складом до плазми крові (бути ізотонічним), і великі молекули, які досить- важко проходять через мембрани і повільно виводяться з русла крові. Такі розчини — найефективніші кровозамінники.
Щільність крові
За рахунок вмісту розчинених речовин щільність крові дещо більша, ніж води. Щільність плазми становить 1,025—1,034 г/см3, щільність еритроцитів — близько 1,09 г/см3, а нерозбавленої крові.— 1,05—1,06 г/см3.
В'язкість крові
В’язкість крові зумовлена тим, що у судинному руслі вона перебуває у постійному русі. Оскільки окремі шари її рухаються з різною швидкістю, а крайні шари плазми крові труться об стінку судні}, виникає внутрішнє тертя, що позначається поняттям в’язкість. За рахунок в’язкості кров чинить опір кровотоку. «Величину її звичайно Визначають відносно води. Розчинення різних сполук, особливо великих білкових молекул, наявність формених елементів збільшує в’язкість крові. Розчин плазми у 1,7—2,3 разу більш в’язкий, ніж вода. В’язкість крові більша, ніж в’язкість води, приблизно у 5 разів. Основну роль у збільшенні в’язкості крові грають еритроцити. Тому при зростанні концентрації їх у крові в’язкість підвищується, а при зменшенні — знижується.
Реакція крові та її регуляція
Реакція крові (рН) зумовлена співвідношенням у ній водневих та гідроксильних іонів. Цей параметр належить до гомеостатичних, що підтримуються на постійному рівні. У артеріальній крові рН складає 7,4, а у венозній вона дещо нижча — 7,36. Вказані величини характерні для плазми крові. В середині еритроцитів рН коливається від 7,27 до 7,29.
Постійність рН крові потрібна для забезпечення функцій більшості органів, їхніх внутрішньоклітинних ферментативних процесів. Багато продуктів обміну, у тому числі і СО2, надходячи у великій кількості в кров, можуть змінювати рН. У нормі ці відхилення незначні. Проте у ряді випадків (інтенсивне фізичне навантаження, деякі види патології) вони помітніші. Максимально можливі межі коливання рН — від 7,0 до 7,8. Але ці коливання не повинні бути тривалими, бо порушення рН може призвести до загибелі організму. Постійність кислотно-основної рівноваги (КОР) крові залежить від взаємодії кількох механізмів: буферних властивостей крові, газообміну у легенях, видільних та обмінних процесів. Так, участь легенів проявляється виділенням або затриманням вуглекислоти; нирки виділяють кислу або лужну сечу; потові залози можуть виділяти деякі недоокислені продукти обміну (молочну кислоту); фосфати можуть виділятися через органи травлення; печінка використовує молочну кислоту крові для
біосинтезу глікогену; серце використовує молочну кислоту як субстрат у окислювальних реакціях. У підтриманні КОР крові та організму в цілому керівна роль належить хеморецепторам, які збуджуються при відхиленні продуктами метаболізму. Внаслідок цього запускаються нервово-рефлекторні механізми, що впливають на функції органів. (Про участь легенів, системи кровообігу та органів виділення у підтримці КОР розповідається у відповідних розділах).
Буферні системи
Буферні системи крові забезпечують постійну величину рН при надходженні до неї кислих або основних продуктів. Вони є першою «межею охорони», що підтримує рН доти, доки продукти, які надійшли, не будуть виведені або використані в метаболічних процесах.
У крові є чотири буферні системи: гемоглобінова, бікарбонати а, фосфатна, білкова.<Кожна система складається з двох сполук — слабкої кислоти та солі цієї кислоти і сильної основи. Буферний ефект зумовлений зв’язуванням і нейтралізацією іонів, які надходять, відповідною сполукою буфера. У зв’язку з тим що в природних умовах організм частіше зустрічається з надходженням у кров недоокислених продуктів обміну, антикислотні властивості буферних систем переважають порівняно з антиосновними.
Бікарбонатний буфер крові досить потужний і найбільш мобільний. Роль його в підтриманні параметрів КОР крові збільшується за рахунок зв’язку з диханням. Система складається з Н2СО3 і ПаНСО3, що перебувають один з одним у відповідній пропорції. Принцип її функціонування полягає в тому, що при надходженні кислоти, наприклад молочної, яка є сильнішою, ніж вугільна, основний резерв забезпечує реакцію обміну іонами з утворенням слабкодисоційованої вугільної кислоти. Вугільна кислота поповнює пул, який вже є у крові, і зсуває реакцію Н2СО3^СО2+ + Н2О вправо.
Особливо активно цей процес здійснюється у легенях, де утворений СО2 одразу виводиться. Виникає своєрідна відкрита система бікарбонатного буфера та легенів, завдяки якій напруга вільного СО2 у крові підтримується на постійному рівні. Це в свою чергу забезпечує підтримання рН йрові на постійному рівні (мал. 120).
У випадку надходження в кров основи відбувається реакція її з кислотою. Зв’язування НСОГ призводить де/ дефіциту СО2 і зменшення виділення його легенями. При цьому збільшується основний резерв буфера, що компенсується за рахунок зростання виділення ЦаСІ нирками.
Буферна система гемоглобіну найпотужніша.
На її частку припадає понад половину буферної ємкості крові. Буферні властивості гемоглобіну обумовлені співвідношенням відновленого гемоглобіну (ННЬ) і його калієвої солі (КНЬ). У слаб-Колужному розчині, яким є кров, гемоглобін і оксигемоглобін мають властивості кислот і є донаторами Н+ або К+ Ця система може функціонувати самостійно, але у організмі вона тісно пов’язана з попередньою. Коли кров перебуває у тканинних капілярах, звідки надходять кислі продукти, гемоглобін виконує функції основи:
КНЬ + Н2СО3 ННЬ + кнсо3.
Мал. 120. Схема взаємодії бікарбо-натної та інших буферних систем крові
У легенях гемоглобін, навпаки, поводить себе як кислота, що запобігає залуговуванню крові після виділення вуглекислоти. Оксигемоглобін — сильніша кислота, ніж дезоксигемоглобін. Гемоглобін, який звільняється, у
тканинах від Ог, набуває великої здатності до зв’язування, унаслідок чого венозна кров може зв’язувати та накопичувати СО2 без істотного зсуву рН.
Білки плазми завдяки здатності амінокислот до іонізації
також виконують буферну функцію (близько 7 % буферної ємкості крові). У кислому середовищі вони поводяться як основи, зв’язуючі кислоти. У основному — навпаки, білки реагують як кислоти, зв’язуючи основи. Ці властивості білків визначаються боковими групами. Особливо виражені буферні властивості у кінцевих кар-бокси- і аміногруп ланцюгів. -
Фосфатна буферна система (близько 5 % буферної ємкості крові) утворюється неорганічними фосфатами крові. Властивості кислоти проявляє одноосновний фосфат (ЙаН2РО4), а основи — двоосновний фосфат (На2НРО4). Функціонують вони за таким самим принципом, як і бікарбонати. Проте у зв’язку з низьким вмістом у крові фосфатів ємкість цієї системи невелика.
Для характеристики КОР крові введено ряд понять. Буферна ємкість — величина, що визначається відношенням між кількістю Н+ або ОН-, доданих до розчину, ступенем зміни його рН: що менший зсув рН, то більша ємкість. Сума аніонів усіх
слабких кислот називається буферними основами (ВВ). Вміст їх- у крові становить близько 48 ммоль/л. Відхилення щодо концентрації буферних основ від норми позначається терміном «надлишок основ» (ВЕ). Тобто ідеальним є ВЕ близько 0. У нормі можливі коливання в межах від —2,3 до +2,3 ммоль/л. Зсув у позитивний бік називається алкалозом, а у негативний — ацидозом. У разі алкалозу рН крові стає вищою за 7,43, у разі ацидозу — нижчою за 7,36.
Механізм регуляції КОР крові у цілісному організмі полягає у спільній дії зовнішнього дихання, кровообігу, виділення і буферних систем. Так, якщо внаслідок підвищеного утворення Н2СО3 або інших кислот будуть з’являтися надлишки аніонів, то вони спочатку нейтралізуються буферними системами. Паралельно інтенсифікуються дихання та кровообіг, що призводить до збільшення виділення вуглекислого газу легенями. Нелеткі кислоти у свою чергу виводяться з сечею або потом.
Навпаки, при збільшенні вмісту у крові основ знижується виділення СО2 легенями (гіповентиляція) і Н+ із сечею. Підключення систем дихання, кровообігу і виділення до підтримання КОР обумовлено відповідними механізмами регуляції функції цих органів. Врешті, у нормі рН крові може змінюватися лише на короткий час. Природно, що при ураженні легень або нирок функціональні можливості організму щодо підтримання КОР на належному рівні знижуються. У разі появи в крові великої кількості кислих або основних іонів лише буферні механізми (без допомоги систем виділення) не утримають рН на константному рівні. Це призводить до ацидозу або алкалозу.
Швидкість осідання еритроцитів (ШОЕ)
У крові, яка не зсідається в судині, відбувається осідання еритроцитів. У клініці досліджують ШОЕ з метою діагнозу порушень. У нормі у чоловіків ШОЕ перебуває в межах 1—10 мм/год, у жінок— 2—15 мм/год. Величина ШОЕ залежить від властивостей плазми, вмісту в ній великомолекулярних білків: у-глобулінів та фібриногену. Гадають, що великомолекулярні білки зменшують електричний заряд еритроцитів, внаслідок чого знижується їх взаємне електровідштовхування. При різних запальних процесах, як правило, концентрація в крові високомолекулярних білків зростає, що сприяє збільшенню ШОЕ. В кінці вагітності збільшується вміст фібриногену в крові у 2 рази і ШОЕ при цьому досягає 40— 50 мм/год.
Вікові особливості фізико-хімічних властивостей крові
У новонароджених і дітей 1-го року життя кров за своїми фі-зико-хімічними властивостями відрізняється від крові дорослих. Так, у новонароджених вищі щільність і в’язкість крові, що зумовлено головним чином більшою концентрацією еритроцитів. Менша кількість амінокислот та білків, інше, ніж у дорослих, співвідношення білкових фракцій. До кінця першого місяця життя вказані показники стають близькими до таких у дорослих або навіть нижчими. ‘ .
' Плацентарний кровообіг і особливо пологи ускладнюють газообмін. Тому і у плода спостерігається виражений ацидоз (рН 7,13—7,23). При цьому ємкість буферних основ знижена. Протягом перших годин (або діб) після народження ацидоз поступово зникає.
У новонароджених нижча концентрація білків у плазмі (50— 56 г/л). Рівня дорослих цей показник досягає лише у 3—4 роки. Для новонароджених характерна висока концентрація у-глобуліну, імунних тіл, отриманих від матері. До 3 міс вміст їх знижується, але з часом за рахунок утворення власних антитіл поступово збільшується. Концентрація а- і р-глобулінів досягає рівня дорослих до кінця 1-го року життя.
У процесі старіння фізико-хімічні показники крові змінюються мало: залишаються постійними рН, осмотичний тиск, концентрація Иа+ та К+, в’язкість крові. Але підвищуються ШОЕ, осмотична резистентність еритроцитів, зменшуються показник гематокриту, абсолютна та відносна концентрація альбумінів, рівень глобулінів істотно не змінюється (або підвищується в основному за рахунок у-фракцій), коефіцієнт А/Г зменшується.
ТРАНСПОРТ ГАЗІВ КРОВ'Ю
ЕРИТРОЦИТИ
У крові чоловіків міститься 4,5—5,0-10-12/л еритроцитів, у жінок— приблизно на 0,5-10~12/л менше. Зниження концентрації еритроцитів порівняно з нормою називається еритропенією (анемією), збільшення — поліцитемією.
Систему еритрону — загальну масу еритроцитів у організмі (ті, які циркулюють, депоновані, а також ті, що містяться в органах творення та руйнування), а також механізми регуляції їх кількості можна зобразити так (мал. 121).
Еритроцит — яскравий представник вузькоспеціалізованої клітини. Свої функції він виконує в крові.
Еритроцит — округла, двовгнута клітина діаметром близько
Циркулююча крод
25 'їй '
Органи,де
еритроцити
руйнуються
Решляція
Органи
еритропоезу
Мал. 121. Схема еритрону
7,5 мкм. Завдяки такій формі вона має відносно велику поверхню. Оскільки зрілий еритроцит крові людини не має ядра, ємкість його збільшується. Відстань від мембрани до найвіддаленішої точки перебування гемоглобіну зменшується (максимум 1,2—1,5 мкм). Це забезпечує добрі умови газообміну. Крім того, оскільки еритроцит є без’ядер
ним і має еластичну мембрану, він легко змінює форму і проходить через найдрібніші капіляри, які діаметром іноді майже у 2 рази менші, ніж еритроцит.
Для забезпечення життєздатності еритроцитів та виконання їх функцій велике значення має еластична мембрана еритроцита, її товщина становить близько 10 нм. Мембрана еритроцита майже у мільйон разів більш проникна для аніонів, ніж для катіонів.
Деякі речовини здатні вступати у зв’язок із вбудованими в мембрану молекулами і проходити через неї всередину або транспортуватися на мембрані. За рахунок останнього типу зв’язку еритроцит виконує транспортну функцію. Позаяк вміст цих речовин у еритроциті може бути досить високим, ці елементи виконують також концентраційну функцію для багатьох біологічно активних речовин (наприклад, для факторів зсідання крові).
Найважливішою функцією еритроцита є транспорт газів, особливо кисню, оскільки ця функція в організмі людини виконується практично тільки еритроцитами. Він здійснюється завдяки вмісту в ньому гемоглобіну (34 % загальної і 90 % сухої маси). Віл крові міститься 140—160 г НЬ. Середній вміст НЬ в одному еритроциті у жінок — 32—33 пг, а у чоловіків — 36—37 пг.
Розташування кисиево-транспортного білка — гемоглобіну — в середині спеціалізованої клітини належить до істотного еволюційного здобутку. Якщо гемоглобін буде в плазмі крові, а не в еритроцитах, то він швидко виведеться через нирки, токсично впливатиме на них. Перебуваючи в плазмі, гемоглобін значно підвищить онкотичний тиск і в’язкість крові, а це ускладнить кровообіг.
Життєвий цикл еритроцитів
Зрілий еритроцит, який циркулює у крові, є диференційованою клітиною, нездатною до подальшої проліферації. Але й клітиною його можна назвати умовно, оскільки він позбавлений одного з головних атрибутів клітини — ядра. Ядра містять лише попередники еритроцитів — еритробласти кісткового мозку. При їх дозріванні ядро виштовхується через мембрану. Еритроцит здатний циркулювати у кровотоці протягом 100—120 діб. Після цього він гине.
Таким чином, за добу оновлюється близько 1 % еритроцитів.
Про це свідчить наявність у крові молодих еритроцитів — ретикулоцитів (від лат. геіе —
Інгібітору
У'ирки
Стимулятори
90 95%
Мстхоіїш
Синтез
б
Руйнування еритроцитів
Гормони.
рщмтоои ніЕлппоем яаінш, фактори
Селезінко
V Зруйновані*
Кров
мфс (мононуклеарнв фбеіцитиюче системи)
Мал. 122. Схема миттєвого циклу еритроцитів (А. Оезророиіоб, 8і. ЗіІЬегпадІ, 1986)
сітка, основою якої є залишки І-РНК). Після виходу із кісткового мозку у руслі крові вони зберігаються у вигляді ре-тикулоцитів близько доби. Тому їх концентрація у крові — близько 0,8—1 % усіх еритроцитів. Активізація еритропое-зу супроводжується збільшенням числа ретикулоцитів у крові. Але у будь-якому разі еритропоез може бути інтенсифікований не більш ніж у 5— 7 разів порівняно з вихідним рівнем. Тобто, якщо у звичайних умовах за добу утворюється близько 25 000 еритроцитів на 1 мкл крові, то при найін-тенсивнішому еритропоезі за добу із кісткового мозку може вийти у русло крові до 150 000
еритроцитів на 1 мкл. Істотних запасів (депо) еритроцитів в організмі людини немає. Тому ліквідація анемії (після втрати крові) відбувається лише за рахунок посилення еритропоезу. Але при цьому істотне збільшення кількості еритроцитів у кістковому мозку розпочинається лише через 3—5 діб. У периферичній крові це стає помітним ще пізніше. А тому після втрати крові або гемолізу для відновлення рівня еритроцитів до норми потрібно досить багато часу (не менш як 2—3 тиж).
Руйнування еритроцитів. Життєвий цикл еритроцитів закінчується їх руйнуванням (гемолізом). Гемоліз еритроцитів може відбуватися у руслі крові (мал. 122). Клітини, що затримались, гинуть у макрофагальній системі. Ці процеси залежать від зміни властивостей як власне еритроцита, так і плазми крові.
Для виконання газотранспортної функції еритроцит майже не витрачає енергію АТФ, тому, мабуть, АТФ у ньому утворюється лише у невеликій кількості. За відсутності мітохондрій АТФ синтезується за рахунок гліколізу. Використовується також пентозо-фосфатний шлях, побічним продуктом якого є 2,3-дифосфогліцерат (2,3-ДФГ). Ця сполука бере участь у регулюванні спорідненості гемоглобіну до С>2. АТФ, що синтезується у еритроцитах, витрачає-
Мал. 123. Еритроцит (скануюча мікроскопія):
А — інтактний еритроцит; Б — еритроцит у гіпертонічному розчині натрію хлориду
ться на: 1) підтримання еластичності мембрани; 2) підтримання іонних градієнтів; 3) забезпечення деяких біосинтетичних процесів (утворення ферментів); 4) відновлення метгемоглобіну тощо.
В середині еритроцитів вміст білків набагато вищий, а низькомолекулярних речовин, навпаки, нижчий, ніж у плазмі. Сумарний осмотичний тиск, створюваний завдяки високій концентрації білків-і низькій — солей, в середині еритроцита трохи нижчий, ніж у плазмі. Це забезпечує нормальний тургор еритроцитів. Оскільки мембрана його для білків непроникна, основним компонентом, що забезпечує обмін води між еритроцитом і плазмою, є низькомолекулярні іони. Так, при підвищенні у крові концентрації низькомолекулярних сполук, що легко проникають у еритроцити, -в середині їх осмотичний тиск збільшується. Вода надходить у середину еритроцитів, вони набрякають і можуть лопнути. Відбудеться осмотичний гемоліз. Це можна спостерігати, наприклад, при уремії, спричиненій збільшенням вмісту в крові сечовини.
У еритроциті при порушенні процесу утворення АТФ знижується швидкість викачування іонів (діяльність іонних насосів), що призводить до збільшення концентрації іонів в середині клітин, а це в свою чергу — до осмотичного гемолізу. Гемоліз відбувається і в певному гіпотонічному розчині. Мірою ОСМОТИЧНОЇ СТІЙКОСТІ (резистентності) еритроцитів є концентрація ЦаСІ в розчині, при якій відбувається гемоліз. У нормі гемоліз розпочинається при 0,4% концентрації КаСІ (мінімальна резистентність). При такій концентрації КаСІ руйнуються найменш стійкі еритроцити. У 0,34% розчині КаСІ (максимальна резистентність) руйнуються всі еритроцити. При деяких захворюваннях осмотична стійкість еритроцитів зменшується, і гемоліз відбувається при вищій концентрації розчину КаСІ,
Навпаки, у гіпертонічному розчині у зв’язку з виходом води еритроцити на певний час зморщуються (мал. 123).
При старінні еритроцитів знижується активність метаболічних процесів. Внаслідок цього мембрана клітин поступово втрачає еластичність, і, коли еритроцит проходить деякі найвужчі ділянки судинного русла, він у них може затримуватись. Однією з таких ділянок є селезінка, де відстань між трабекулами становить близько 3 мкм. Тут еритроцити руйнуються, а уламки клітин та гемоглобін фагоцитуються макрофагами.
Частина еритроцитів може руйнуватися в руслі крові. При цьому гемоглобін, що вийшов у плазму, з’єднується з а2-глікопро-теїном плазми (гаптоглобіном). Комплекс, що утворюється, не проникає крізь мембрану нирок, а надходить до печінки, селезінки, кісткового мозку. Тут він розпадається і, потрапивши в печінку, перетворюється на білірубін. При надходженні великої кількості гемоглобіну частина його фільтрується в ниркових канальцях і виводиться з сечею, руйнується або повертається у кровотік, звідки надходить до печінки.
ГЕМОГЛОБІН
У міру дозрівання у кістковому мозку вже на стадії базофіль-них еритробластів з’являється гемоглобін. Завершується біосинтез гемоглобіну в ретикулоцитах, що містяться в руслі крові. В зрілому еритроциті вміст гемоглобіну постійний. Він може лише зменшуватись при частковому гемолізі за рахунок виходу частини гемоглобіну із еритроцита, чого у нормі практично не спостерігається. Важливу роль у біосинтезі гемоглобіну грають вітамін Ві2, В6, фолієва кислота і мікроелемент Ее2+, що входить до складу просте-тичної групи (гем). У молекулі гемоглобіну міститься 1 молекула глобіну і 4 молекули гема. Гем утримує в своєму складі атом заліза, який здатний приєднувати або віддавати кисень. При цьому валентність заліза не змінюється (він залишається двохвалент-ним).
Білкова частина гемоглобіну — глобін — складається з 4 ланцюгів. Еритроцити дорослої людини містять 2а- і 20-ланцюги. Такий гемоглобін носить назву АНЬ (від англ. абиіі — дорослий). У крові плодів є ЕНЬ (від англ. іеіиз — плід), що містить 2а-' і 2у-ланцюги. ЕНЬ вирізняється кращою здатністю транспортувати кисень. Тому в крові плода, не зважаючи на нижчий РО2, утворюється досить велика кількість оксигемоглобіну. Перед народженням плода еритроцити з ЕНЬ поступово зникають з крові, замінюючись еритроцитами, що містять АНЬ.
Гемоглобін, беручи участь у транспорті газів, утворює різні сполуки. Приєднавши кисень, він перетворюється на оксигемо-гло-бін (НЬО2). Гемоглобін, який віддав кисень тканинам, називається відновленим, або дезокєигемоглобіном.
Він має темний колір. У венозній крові частина гемоглобіну сполучена з СО2 — карбгемоглобін (НЬСО2).
Під дією сильних окисників залізо перетворюється на трьох-валентне. Іноді утворюється міцна сполука з О2 — метгемоглобін (МШЬ). У нормі метгемоглобін утворюється у дуже малих кількостях. Цьому перешкоджають відповідні ферменти, що містяться у еритроцитах.
При вдиханні повітря, яке містить чадний газ, утворюється міцна сполука — карбоксигемоглобін (НЬСО). Спорідненість гемоглобіну до СО у сотні разів перевищує спорідненість його до О2, і тому можливість транспорту кисню в цих умовах різко погіршується. Але при диханні свіжим повітрям, особливо багатим на кисень, при несмертельному отруєнні СО повільно відщеплюється і киснетранспортна функція гемоглобіну відновлюється.
Структура глобіну впливає на стійкість (резистентність) еритроцитів. Наприклад, еритроцити з РНЬ менш стійкі і в руслі крові (при легеневому диханні) активно руйнуються. Змінюються стійкість мембрани і навіть форма еритроцита і при патологічних типах гемоглобіну — 8, С і т. д. Ці різновиди гемоглобіну особливо часто спостерігаються у мешканців екваторіальних країн. Еритроцити, які містять Р-гемоглобін, більші за розміром. Концентрація еритроцитів у крові новонароджених вища, ніж у дорослих (до 5,9- 10~12/л). У крові доношених дітей РНЬ становить близько 70 %. Після народження активно гемолізоваиі еритроцити замінюються новоутвореними, що містять АНЬ. Але в перші доби життя гемоліз переважає над процесом творення, тому концентрація еритроцитів знижується. Найнижча концентрація їх у віці 5—6 міс (до 4,0— 4,1 • 10-І2/л). Як правило, рівень еритроцитів у крові дітей до періоду статевого дозрівання залишається трохи нижчим, ніж у кроці дорослих. При старінні кількість еритроцитів у крові змінюється .мало.
При підніманні на висоту стимулюється еритропоез і збільшується загальна кількість еритроцитів (абсолютний еритроцитоз). При підніманні на кожний кілометр і тривалому перебуванні на такій висоті кількість еритроцитів у крові збільшується на 0,7X X 10~12/л.
ЗАХИСНІ ФУНКЦІЇ КРОВІ
Серед захисних функцій крові розрізняють неспецифічні, які вмикаються при потраплянні у організм будь-якого патогенного агента (мікроорганізму, вірусу), і специфічні, які формуються при надходженні конкретного мікроорганізму. У процесі еволюції виробилась захисна система, що складається з клітинних і гуморальних механізмів імунітету (від лат. іштипіз —вільний від...). Вона бере участь у розпізнаванні «свого — чужого».
Фагоцитоз
Із клітинних факторів захисту найбільше значення має відкритий І. І. Мечніковим фагоцитоз (від лат. рііа^оз — той, що пожирає) — здатність деяких клітин наближатись, захоплювати і перетравлювати чужорідний об’єкт. Комплекс фагоцитів крові та тканин називається мононуклеарною фагоцитуючою системою (МФС). Розрізняють порівняно невеликі клітини — мікрофаги (наприклад, нейтрофіли) і великі — макрофаги (моноцити та їх тканинні нащадки). Зближення фагоциту з мікроорганізмом обумовлено хемотаксисом. Він проявляється під час впливу на клітину специфічних факторів, що утворюються при взаємодії поверхні мікроба з системами плазми крові.
Фагоцитоз — активний процес, що супроводжується підвищенням потреби КЛІТИНИ В С>2 і глюкозі. Він посилюється під впливом утворюваних у клітинах гідропероксидів водню та інших радикалів кисню. Згадані сполуки діють токсично не тільки на мікроорганізми, але й на фагоцит. Тому при фагоцитозі ці клітини швидко гинуть.
Макрофаги беруть участь також у розпізнаванні «свого — чужого». Поглинання макрофагом чужорідного антигену служить одним із сигналів для активізації синтезу антитіл. Крім цього, макрофаги беруть участь у таких реакціях клітинного імунітету, як відшарування трансплантату, захист від пухлинних клітин. Це реакції специфічного імунітету.
Гуморальні механізми
Гуморальні механізми містять широкий спектр факторів, які є в крові та інших середовищах організму й нейтралізують патогенні фактори або їх токсини. До них належать специфічні у-глобу-ліни (імунні антитіла), лізоцим, лізини, система комплементу, інтерферон та ін.
У відповідь на надходження до організму чужорідного білка (або глікопротеїду) у лімфоїдних органах починається проліферація лімфоцитів. Якщо ці сполуки призводять до утворення антитіл, то вони звуться антигенами. Процеси розпізнавання генетично чужорідних речовин та біосинтезу антитіл пов’язані з функцією лімфоцитів та моноцитів. Так, коли фагоцити захоплюють та руйнують чужорідні речовини, то фрагменти цих речовин залишаються на плазматичній мембрані фагоцита в сполуці зі специфічними рецепторами. Одні із різновидів лімфоцитів (Т-лімфоцити) також містять на мембрані рецептори до антигенів, завдяки яким лімфоцити і розпізнають їх. Після адсорбції на вказаних клітинах інформація про антиген передається до лімфоцитів іншого різно
виду — В-лімфоцитів. Внаслідок цього починається процес анти-гензалежного розвитку В-лімфоцитів у лімфоїдних органах.
Особливо важливу роль у цьому процесі відіграють лімфатичні вузли, що містять усі потрібні для цього клітинні елементи. Лімфатичні вузли є своєрідним фільтром лімфи. Лімфа, ідо надходить по приносних судинах, потрапляє спочатку до крайового синуса, розташованого між капсулою та кірковою речовиною. Після цього вона прямує до центру і залишає лімфатичний вузол крізь ворота по виносній судині. Лімфа, проходячи крізь кіркову та мозкову речовину, за наявності мікроорганізмів або антигенів частково від них звільняється.
Подібним фільтром для крові є селезінка. Вона видаляє з кровотоку не лише чужорідні антигени, а й еритроцити, що втратили функціональну активність, лейкоцити та тромбоцити.
Більш детально тонкі механізми імунітету вивчаються в спеціальних розділах імунології та патофізіології. Тут же коротко познайомимося з загальними принципами організації захисних механізмів крові, в яких беруть участь лімфоцити.
Однією з функцій лімфоцитів є участь їх у виробленні антитіл у відповідь на антиген, що потрапив у організм. Антигеном може бути мікроорганізм або його молекули-переносники та розміщені на них детермінантні групи, які обумовлюють специфічність. Після взаємодії антигенів з макрофагами або Т-лімфоцитами інформація передається до вторинних лімфоїдних органів, де розпочинається процес біосинтезу специфічних до даного антигена антитіл — іму-ноглобулінів. Синтез антитіл виконується В-лімфоцитами, які при цьому перетворюються на плазматичні клітини. Можуть синтезуватися кілька типів імуноглобулінів: І§М, І§М, І§С, І§А, І§Е. Всі вони мають здатність з’єднуватися з антигеном і нейтралізувати його. Частина плазматичних клітин може бути в організмі тривалий час, навіть за відсутності антигенів. Це забезпечує так звану імунну пам’ять. Завдяки їй імунна відповідь, у тому числі й швидкість утворення антитіл, при першому і повторному потраплянні антигена відрізняється. Початкова реакція у відповідь на перше потрапляння антигенів розвивається порівняно повільно, тому що досить висока концентрація антитіл накопичується лише через 2—3 тиж і тримається в крові порівняно недовго (кілька тижнів). При повторному потраплянні в організм антигенів завдяки імунній пам’яті (збереження плазматичних клітин, що синтезували райіше антитіла до цього антигену) ці процеси різко прискорюються. Антитіла в досить великій кількості з’являються вже через кілька годин (діб) і швидко нейтралізують антигени. Ці антитіла можуть перебувати в організмі тривалий час.
Клітинний імунітет
Захисна функція білих клітин крові пов’язана не тільки із знешкодженням інфекційних агентів, але й із знищенням будь-яких клітин, що генетично відрізняються. Подібні клітини можуть утворюватись в організмі внаслідок порушення передачі спадкоємної інформації — мутацій. Вважають, що в організмі в кожний момент може бути близько 10 млн змінених клітин (приблизна частота мутацій в період мітозів складає одну на мільйон клітин). Більшість таких клітин нежиттєздатні і одразу гинуть. Інші, навпаки, набувають підвищеної потенції до поділу і можуть перетворюватись на пухлинні. Для боротьби з цими клітинами існують реакції клітинного імунітету. Клітинний імунітет також має значення для знешкодження деяких вірусів та мікроорганізмів.
У реакціях клітинного імунітету беруть участь різні типи лімфоцитів: клітини-кілери (від англ. кіііег — вбивця), хелпери (від англ. йеірег — помічник) і супресори (від англ. зирргезз — пригнічувати), а також макрофаги і утворені ними антитіла, які діють локально.
Важлива роль у реакціях клітинного, у тому числі й трансплантаційного, імунітету, в розпізнаванні чужорідних клітин належить антигенам гістоспорідненості (НЬА — від англ. ііи-тап Іеикосуііс апіі^епз). Ці антигени містяться на плазматичній мембрані клітин, що мають ядра, у тому числі і в лейкоцитах. Антигени НЬА є глікопротеїдами, міцно зв’язані з клітинною мембраною. Виділяють кілька основних підтипів антигенів: А, В, С, Ц, БК. Кожний з них у свою чергу має кілька підвидів. За наявності конкретного набору цих антигенів (а їх близько 100) клітини кожної людини дуже специфічні. Цю специфічність контролює клітинний імунітет. У разі появи чужорідних антигенів вмикаються реакції відторгнення, у яких бере участь згадана вище система захисту. Тому при потребі пересадити орган слід дуже ретельно підібрати донора за антигенною гістоспорідненістю (найближчі антигени у однояйцевих близнюків). Але навіть при ретельному підбиранні донора після пересадки органа слід послаблювати реакцію клітинного імунітету. Одним з найпотужніших природних інгібіторів імунітету є глюкокортикоїди.
ЗАХИСНІ ФУНКЦІЇ
ДЕЯКИХ ОРГАНІВ
У захисті органу від факторів навколишнього середовища, у формуванні його резистентності беруть участь окремі тканини, органи й цілі системи.
Печінка — важливий бар’єр організму, який знешкоджує багато токсичних продуктів, що надходять у організм ззовні (отрути,
алкоголь), а також утворюються в організмі, в процесі гниття і бродіння (у товстій кишці). Ця функція виконується завдяки системі фіксованих макрофагів (клітини Високовича— Купфера) і за рахунок ферментативних властивостей гепатоцитів. Печінка бере участь і у формуванні імунологічних реакцій. Крім того, бактерицидні властивості має жовч. Із крові через печінку разом з жовчю у кишки виводиться багато токсичних сполук.
Нирки також виводять токсичні сполуки. При деяких інфекціях у сечі можна виявити мікробні токсини.
Шкіра. Бактерицидні властивості шкіри зумовлені низькою рН (3,3—3,5), а також жирними кислотами, які містяться в секреті сальних залоз. Наприклад, черевнотифозна паличка та холерний вібріон на чистій шкірі гинуть протягом кількох годин або навіть хвилин. Крім того, шкіра звичайно є і механічним бар’єром.
Слизові оболонки очищуються від мікробів завдяки війчастому епітелію й секрету. Крім того, у верхніх дихальних шляхах цьому сприяють такі захисні рефлекси, як кашель і чхання, коли повітря у повітроносних шляхах рухається зі швидкістю до 50 м/с, захоплюючи з собою й слиз. Бактерицидні властивості слизових оболонок пов’язані з наявністю ферментів, що руйнують мікроорганізми, антитіл лейкоцитів, які постійно виходять на поверхню слизових оболонок.
Велике значення у захисних реакціях належить слизовим оболонкам органів травлення. При дії на рецептори слизових оболонок розвивається ряд захисних реакцій, наприклад, слиновидільна реакція, блювотний рефлекс.
Шлунковий сік має виражену бактерицидну дію, тому більшість мікробів, які надходять з їжею, у шлунку гине. Бактерицидна дія шлункового соку зумовлена хлористоводневою кислотою і протеолітичними ферментами, що містяться в ньому.
Лужне середовище кишок сприяє розвитку мікрофлори. Кишковий епітелій, лімфатична система кишок, а також фагоцити, антитіла і ферменти у нормальних умовах забезпечують захист від попадання у кров мікробів.
Сам процес травлення — розщеплення поживних речовин до складових елементів — також грає захисну роль. Він захищає від надходження чужорідних сполук, що можуть втручатись у гомеостатичні реакції організму. Особливо важливе значення має процес руйнування білків, протеїнів, які володіють антигенними властивостями. До захисних реакцій слід зарахувати й процес руйнування нуклеїнових кислот — носіїв інформації, ряду інших біологічно активних сполук.
ХАРАКТЕРИСТИКА ЛЕЙКОЦИТІВ
У 1 л крові людини міститься 4—9-109/л лейкоцитів. Збільшення їх кількості називається лейкоцитозом, а зменшення — лейкопенією.
Основна функція лейкоцитів захисна. На відміну від еритроцитів, що виконують свої функції безпосередньо у руслі крові, лейкоцити діють переважно у сполучній тканині різний органів. У руслі крові лейкоцити циркулюють протягом кількох годин (від 4 до 72). Потім вони виходять через стінку капілярів і розселюються по тканинах. У тканинах лейкоцити можуть перебувати протягом багатьох діб. Усі лейкоцити можуть самостійно рухатись. Амебоподібний рух виконують білки актинової та міозинової природи. Таким чином, перебування в крові лейкоцитів є проміжним етапом існування. Завдяки кровотоку лейкоцити, що утворюються у кістковому мозку, розносяться до всіх органів.
Лейкоцити є повноцінними клітинами, що містять ядро та інші клітинні структури. За формою ядра та наявністю у цитоплазмі різних включень лейкоцити діляться на 5 видів, процентне співвідношення яких у крові позначається лейкоцитарною формулою (табл. 7).
Нейтрофіли. Більшість лейкоцитів крові (40—60 %) є нейтрофілами. Діаметр нейтрофілів — 10—15 мкм. Після виходу із кісткового мозку нейтрофіли у крові циркулюють у середньому близько 8 год. Потім вони залишають русло крові і протягом кількох діб перебувають серед сполучнотканинних елементів більшості органів. Тут вони здатні захоплювати і перетравлювати (фагоцитува-ти) мікроорганізми, які можуть потрапити в тканини при ушкодженні. За цю можливість і свої відносно невеликі розміри нейтрофіли називаються мікрофагами. Травлення фагоцито-ваних мікроорганізмів відбувається під дією різних факторів, що містяться в їх гранулах. Вміст гранул може інактивувати широкий спектр мікрофлори, вірусів, мікоплазми. Особливо активні мієло-пероксидаза, активована пероксидом водню, і лізоцим, що гідролі-зує глікопротеїди бактеріальної оболонки. Фагоцитин, катіонні біл-
Таблиця 7. Вміст у крові різних видів лейкоцитів (лейкоцитарна формула}
Вид лейкоцита Нейтрофіли Еозинофіли Базофіли Лімфоцити Моноцити
метаміе-лоцити, юні паличко-ядерні сегменто-ядерні
Процент 0—1 1—5 45—70 1-5 0—1 20—40 2—10
Абсолютна кіль- До 90 50—400 2000— 50-^400 До 90 1800— 150—
кість у 1 мкл 5000 3000 500
ки гранул гідролази, поліпептидази, ДНКази та РНКази разом із згаданими вище сполуками можуть розщепити фагоцитовані бактерії будь-якої структури. Разом з іншими загиблими клітинами нейтрофіли утворюють основу гною.
Нейтрофіли беруть участь також в утворенні інтерферону — речовини, що діє на віруси.
У руслі крові міститься незначна кількість зрілих клітин. У 20— 40 разів більше їх є в органах-депо, зокрема кровотворчих — кістковому мозку, селезінці, печінці, а також у капілярах легень. Після утворення зрілий нейтрофіл ще протягом 5—7 діб залишається в кістковому мозку. Звідси Нейтрофіли можуть виходити і поповнювати пул циркулюючих клітин, що накопичилися біля місця ушкодження, у ділянці запалення.
Вміст нейтрофілів у крові може збільшуватися як за рахунок інтенсивного лейкопоезу, так і шляхом п е р е розподільної реакції, що виникає при емоціях, фізичному навантаженні, травленні, різноманітних стресах. Активний вихід лейкоцитів із кісткового мозку призводить до появи в руслі крові юних форм: паличкоядерних або навіть метамієлоцитів. Зростання їх кількості в крові свідчить про активізацію процесів творення і виходу нейтрофілів із кісткового мозку. Перерозподільний лейкоцитоз є наслідком не тільки виходу нейтрофілів з органів-депо, але й зміни засобу циркуляції. У звичайних умовах у тоці крові нейтрофіли діляться на дві частини — пул клітин, що циркулюють по центру судин, та пул пристінкових клітин. При вищезгаданих станах лейкоцити відходять від стінок і приєднуються до циркулюючих клітин.
Моноцити складають 2—7 % усіх лейкоцитів. Це масивні мо-нонуклеарні клітини крові — до 16—20 мкм у діаметрі. Моноцити крові після свого порівняно довгого періоду циркуляції (від ЗО хв до 72 год) назавжди залишають русло крові і в тканинах перетворюються на клітини мононуклеарної м а к р о фатальної системи. Крім того, макрофаги можуть трансформуватися в інші клітини, наприклад, у остеокласти. Таким чином, моноцити крові ще зберігають потенцію до подальшого розвитку.
Специфічною функцією моноцитів та макрофагів є фагоцитоз бактерій, ушкоджених та старих клітин. Моноцити здатні до хемотаксису, можуть рухатись у напрямку до певних речовин. Макрофаги беруть участь у продукції ряду компонентів комплементу, інтерферону.
Із захисною функцією макрофага пов’язана і здатність постачати у кровотік ендогенний піроген. Це білок, що синтезується під час фагоцитозу, який разом з простагландинами крові діє на терморегулюючий центр гіпоталамусу. Під його впливом змінюється рівень терморегулюючих процесів у організмі, внаслі
док чого при потраплянні у організм інфекції температура тіла підвищується.
Макрофаги беруть участь у розпізнаванні «свого — чужого» та формуванні антитіл, у здійсненні таких реакцій клітинного імунітету, як захист від пухлинних клітин, відторгнення чужорідного трансплантату.
Система макрофагів грає важливу роль також і у регулюванні процесів кровотворення.
Базофіли становлять 0,5 % лейкоцитів крові. Це клітини з сег-ментованим ядром діаметром 10—12 мкм. Вони містять велику кількість таких біологічно активних речовин, як гістамін, що підвищує проникність стінок капілярів, і гепарин, який запобігає зсіданню крові. У початковий період надходження у організм мікроорганізмів базофіли сприяють розвитку запалення, а після ліквідації патологічного процесу беруть участь у розсмоктуванні осередку запалення. Базофіли є також джерелом брадикініну, серотоніну та ряду лізосомальних ферментів. Вони беруть участь в алергічних реакціях (зміненому імунітеті). Тому базофілія є однією з ознак сенсибілізації організму при алергії.
Еозинофіли — клітини діаметром 12—17 мкм, що містять дволопатеве ядро. У міру дозрівання в їх цитоплазмі утворюються два типи гранул — малі та великі, що містять ферменти. Функціонально еозинофіли належать до мікрофагів. Фагоцитарна активність ферментів еозинофілів нижча, ніж нейтрофілів. У той же час наявність ряду факторів і ферментів дозволяє їм виконувати ще деякі досить специфічні функції. Так, арилсульфатаза дрібних гранул інактивує ряд субстанцій анафілак-с і ї, зменшуючи виразність реакцій негайної гіперчутливості.
Еозинофіли під впливом хемотаксичних факторів мігрують до місця появи невеликої кількості антигену, де відбувається реакція антиген — антитіло. Тут вони утворюють наче захисний вал у вигляді місцевого фіброзування, що затримує поширення даної реакції по організмові. Відбувається це головним чином у підслизовому і підепітеліальному шарах, де їх вміст найвищий.
Крім того, для функціонування еозинофілів важливим є основний (який забарвлюється фарбами, що містять основи) білок з молекулярною масою 9200, що міститься у великих гранулах еозинофілів. За рахунок цього білка вони мають цитотоксичний вплив на гельмінти та їх личинки.
З функцією еозинофілів тісно пов’язана кінетика їх у організмі. Виходячи з кісткового мозку, еозинофіли у крові циркулюють недовго (близько 2 год), після чого мігрують переважно у покривні тканини. Вміст їх у тканинах приблизно у 100 разів більший, ніж у кровотоці. При тривалому перебуванні у організмі гельмінтів, алергізації розвивається еозинофілія — збільшення
КіСігмічі незк
Мал. 124. Рециркуляція лімфоцитів та моноцитів (за даними М. Рбіді, 1969):
В — В-лімфоцити; Т — Т-лімфоцитн; МО — моноцити; МА — макрофаги
кількості циркулюючих еозинофілів. Вона зумовлена виходом із кісткового мозку незрілих клітин, які після короткочасного первинного перебування в крові надходять у тканини. Звідси вони знову можуть повертатися у кровотік, де циркулюють тепер вже протягом багатьох діб, створюючи ефект еозинофілії.
Лімфоцити становлять 20—40 % лейкоцитів. Ці мононуклеари, на відміну від більшості інших клітин крові, зберегли здатність до проліферації і диференціювання.
Утворившись у кістковому мозку, лімфоцити виходять у кровотік. Але більшість з них мають повторно дозріти у лімфоїдних органах. Розрізняють первинні і вторинні лімфоїдні
органи. Одним із первинних органів є загрудинна залоза (ти-мус). У період онтогенетичного розвитку вона зазнає істотних змін. Найбільших розмірів досягає у період статевого дозрівання, після чого поступово інволюціонує. Лімфоцити, як і інші клітини крові, розвиваються із загальних стовбурних клітин-попередників, частина яких ще в ембріональний період залишає кістковий мозок і осідає у загрудинній залозі. Ці клітини дають початок Т-лімфоцитам.
До первинних лімфоїдних органів у людини належить кістковий мозок, а у птахів — Вигза ЕаЬгісіі. Лімфоцити, які тут дозрівають, належать до В-лімфоцитів (від лат. Ьигза— сумка).
До вторинних органів належать лімфатичні вузли, селезінка і система лімфоепітеліальних утворень, яка об’єднує скупчення лімфоїдної тканини у слизових оболонках шлунка та кишок, дихальних та сечостатевих шляхів. У ці утворення лімфоцити надходять із кісткового мозку і загрудинної залози, тобто це В- і Т-лімфоцити. У вторинних лімфоїдних органах відбувається проліферація лімфоцитів у відповідь на надходження у організм чужорідного білка-антигена. Вказані Т-, а можливо, і В-лімфоцити здатні до рециркуляції: вони знову з’являються в крові і надходять до нових ділянок вторинних лимфоїдних органів, де утворюють колонії, що синтезують ці антитіла (мал. 124).
Лімфоцити також беруть участь у реакціях клітинного імунітету— знищують клітини, які зазнали мутації.
Вікові зміни кількості лейкоцитів у крові
Перші лейкоцити в крові з’являються в кінці 3-го місяця періоду ембріонального розвитку. Але у плодів і навіть у дітей перших років життя захисна система ще не зовсім сформована. Найпростішим показником цього може бути вікова динаміка в крові рівня нейтрофілів, що характеризує фагоцитоз, а також лімфоцитів — показника інших механізмів імунітету (мал. 125).
У новонароджених першої доби життя спостерігається лейкоцитоз (до 10—30-109/л). Потім концентрація лейкоцитів зменшується, але протягом першого року життя їх залишається ще близько 9-109/л крові. Вміст лейкоцитів у крові поступово знижується і досягає рівня дорослих у період статевого дозрівання. У перші роки життя формується система імунітету. Показником нерівномірного розвитку може бути так званий подвійний перехрест у лейкоцитарній формулі. У першу добу після народження нейтрофіли становлять близько 70%, а лімфоцити — близько 25% усіх лейкоцитів крові. Потім відносна кількість нейтрофілів зменшується, а лімфоцитів — збільшується. Значний розвиток лімфоїдної системи, міграція лімфоцитів до периферичних структур призводять до різкого збільшення числа лімфоцитів у крові. У віці 5—6 діб вміст нейтрофілів і лімфоцитів у крові вирівнюється і становить 40—45 % (перший перехрест). З часом продовжує спостерігатися незначна нейтропенія і зростає лімфоцитоз (до 60 %). У віці 5—6 років концентрація цих форм лейкоцитів знову вирівнюється (другий їіерехрест). Після цього поступово вміст нейтрофілів у крові стає вищим, ніж лімфоцитів.
У похилому віці кількість лейкоцитів та лейкоцитарна формула не змінюються.
ГРУПИ КРОВІ
Антигенна специфічність властива не тільки ядерним клітинам, але й еритроцитам. Наявність антигенної специфічності еритроцитів визначає групи крові.
Групові антигени фіксовані на глікокаліксі мембрани еритроцитів. За своєю природою це гліколіпіди або глікопротеїди. На сьогодні їх виявлено понад 400.
СИСТЕМА АВ0
Найбільше значення мають антигени системи АБО. Молекула цих антигенів складається на 75% із вуглеводів і на 15%—із амінокислот. Пептидний компонент у всіх трьох антигенів, позначених Н, А, В, однаковий. Специфічність їх визначається вугле-
%
Доба Місяці Роки
Мал. 125. Вікова динаміка нейтрофілів (І) та лімфоцитів (II) крові
водною частиною. Люди з групою 0 мають антиген Н, специфічність якого зумовлена трьома кінцевими вуглеводними залишками. Поява четвертого вуглеводного залишку у структурі Н-антигену надає йому специфічності, що позначається літерою А (якщо приєднана Ц-ацетил-Ц-галактоза) або В (якщо приєднана Б-галак-тоза).
Якщо змішати на склі кров, яку взяли від двох людей, то у
більшості випадків спостерігається склеювання (аглютинація) еритроцитів (мал. 126). Після цього настає їх гемоліз. Це ж спо-
стерігається і при переливанні несумісної крові, внаслідок чого закупорюються капіляри та виникають ускладнення, які призводять до смерті. Аглютинація відбувається внаслідок реакції антиген— антитіло. Антиген А або В взаємодіють з антитілами, які є у сироватці крові іншої людини, і позначаються як а і р. Це і призводить до аглютинації. За назвою реакції антигени і антитіла носять назву аглютиногенів і аглютинінів. Вважають, що аглюти-
ніни а і р мають два активних центри, завдяки чому відбувається зв’язування двох сусідніх еритроцитів. При цьому А взаємодіє з а, а В — з р. До аглютиногену Н у сироватці крові немає аглютиніну. Лізис еритроцитів відбувається за участю системи компле-
менте та утворюваних протеолітичних ферментів, гемоліз — за наявності високого титру антитіл. Антитіла а і р є І&М і І§0. Як правило, високий титр у І§М, які ще звуться гемолізинами.
У природних умовах у крові людини не можуть одночасно міститись однойменні антиген та антитіло, наприклад, А і а або В і
р. Це може призвести до аглютинації еритроцитів. Але за відсутності аглютиногену А або В в еритроциті у сироватці крові обов’язково є аглютинін до нього.
За співвідношенням цих факторів усі люди можуть бути розподілені на 4 групи: І — еритроцити містять 0-антиген, плазма — а- і р-ан-титіла; II — відповідно А- і р-анти-тіла; III — відповідно В- і «-антитіла; IV — відповідно АВ і 0 (табл. 8).
Антигени є спадковими, причому А і В — домінантні. Виявлено кілька підтипів цих антигенів. На
Мал. 126. Реакція аглютинації при взаємодії специфічних сироваток і еритроцитів
Таблиця 8. Аглютинація при змішуванні еритроцитів та плазми корів різних груп
Антитіла плазми Антигени еритроцитів
1 (0) | П (А) | Пі (В) IV (АВ)
І (а. Р) — + + +
II (Р) — — + +
III (а) — + —• +
IV (-) — — — * —-
знак поваги до праці їх першовідкривача Ландштейнера в сучасній назві системи залишено «0-антиген» замість «Н».
Плазма крові новонародженого, як правило, ще не має антитіл а і р. Після народження вони поступово з’являються (росте титр) до того фактору, який був відсутній. Стверджують, що продукція вказаних антитіл пов’язана з ' надходженням у кров дітей деяких речовин з їжею або тих, що виробляються кишковою мікрофлорою. Ці речовини можуть надходити в кров у зв’язку зі здатністю організму новонародженого всмоктувати неперетравлені білки та інші великі молекули. Титр аглютинінів досягає максимуму у віці 10—14 років, після чого поступово знижується (мал. 127).
ІНШІ АНТИГЕННІ ЕРИТРОЦИТИ
На мембрані еритроцитів, крім антигенів АВН, є інші антигени, які визначають їх антигенну специфічність. З них близько ЗО зустрічається досить часто. Вони можуть спричинити аглютинацію і гемоліз еритроцитів при переливанні крові. Виділяють понад 20 різних систем крові за наявністю антигенів: КЬ, М, 8, Р, А, КК та ін. Але більшість з них у природних умовах не мають антитіл.
Як і звичайні імунні антитіла, вони утворюються при надходженні у організм антигенів і зумовлюють гемоліз еритроцитів при повторному переливанні крові. То-
Мал. 127. Вікова динаміка титру а-і р-аглютннінів (за даними А. Сиу-іоп, 1991)
му при переливанні крові бажано, щоб кров була сумісною не лише за системою АВО, а й за іншими факторами. У реальних умовах повної сумісності досягти неможливо, оскільки тільки із вказаних антигенів можна скласти майже 300 млн комбінацій.
РЕЗУС-ФАКТОР
Тепер вважають, що при переливанні крові визначення її групи лише за системою АВО не
М+ериіпроцити
ЕЬ+еритроцити
Мал. 128. НЬ-фактор при вагітності та трансфузії КЬ-несумісної крові (А. Оезро-роигоз, 81. 8і1Ьегпа£е, 1986)
досить. Як мінімум, треба визначити ще й резус-належність. У більшості (до 85%) людей на мембрані еритроцита є так званий резус-фактор, який міститься і в еритроцитах одного з видів мавп — макак резус.
Але, на відміну від антигенів А і В, у сироватці крові людини з резус-негативним фактором немає антирезусних антитіл. Вони з’являються після надходження резус-позитивних еритроцитів у русло крові людей з резус-негативним фактором. їх нараховується приблизно 15 %.
Резус-належність (Кй) визначається наявністю в мембрані еритроцита кількох антигенів, що позначаються С, О, Е, С, б, Е. Найбільше значення має О-аглютиноген, тому що антитіла до нього з’являються більш активно, ніж до інших. За наявності в еритроциті О-фактора кров людини вважається резус-позитивною (КЬ+), за його відсутності — резус-негативною (НЬ_).
Переливання Р1і+-еритроцитів людині з резус-негативним фактором призводить до імунізації. Максимум титру антирезусних тіл спостерігається через 2—4 міс. Але до цього часу перелиті еритроцити зникають з організму. Присутність в організмі реципієнта антитіл при наступному переливанні КЬ+-еритроцитів призводить до їх гемолізу.
Резус-фактор має значення не тільки при переливанні крові, а й при вагітності. Так, якщо у матері з резус-негативним чинником кров плода містить резус-позитивний фактор, то у відповідь на потрапляння в її організм еритроцитів плода поступово протягом кількох місяців з’являються антирезус-антитіла. При нормальному перебігу вагітності це можливо, як правило, лише при пологах, коли порушується плацентарний бар’єр. Природні ізо-аглютиніни а і 0 належать до класу І&М. Аглютиніни проти ре-зус-позитивного фактора, як і ряду інших, що з’являються при імунізації, належать до класу І&С. Через плаценту легко проходять ^антитіла типу І^С, у той час як антитіла класу І&М не проходять. Тому при повторній резус-конфліктній вагітності саме імунні антирезус-антитіла проходять через плаценту і зумовлюють зміни еритроцитів плода, внаслідок чого спостерігаються відповідні ускладнення. Але якщо чомусь еритроцити плода потрапляють у кровоносне русло жінки під час першої вагітності, тоді гемолітична анемія новонароджених, зумовлена резус-несумісністю, може спостерігатись і при першій вагітності. Інколи гемоліз еритроцитів плода може бути наслідком проникнення і природних ізо-аглютинінів матері (мал. 128).
ОСНОВИ ПЕРЕЛИВАННЯ КРОВІ
Раніше при переливанні крові користувались виключно цілісною кров’ю. Крім того, не було широкої можливості переливати багато крові. Вважали, що при переливанні потрібно Враховувати лише групову належність еритроцитів донора. Справді, при введенні великої кількості плазми, що містить а- або 0-аглютиніни, вони розбавляються у великій кількості плазми реципієнта, і титр їх стає настільки низьким, що вони вже неспроможні активно аглютинувати еритроцити реципієнта. Тому вважалось за можливе переливати не тільки одногрупну кров, але й інші. Так, пропонували І групу крові, що не містить у еритроцитах А- і В-антигени, вводити будь-якому реципієнту. Донорів з І групою крові називали універсальними. Кров II і III груп рекомендували переливати також людям з IV групою крові, тому їх зараховували до універсальних реципієнтів.
Але цього робити не слід при введенні значних кількостей крові, тому що при цьому антитіла донора можуть зумовлювати аглютинацію еритроцитів реципієнта. Крім того, треба враховувати, що в клініці вводять великі об’єми крові (під час операції, травми), а сучасні рекомендації для переливання крові звужені, тому слід використовувати лише кров однієї групи. У крайньому разі можна скористатися еритроцитами групи 0.
Звичайно, не можна переливати еритроцити донора з резус-позитивним фактором реципієнту з резус-негативним фактором,
хоча при нехтуванні цим правилом при першому переливанні крові серйозних ускладнень і не буде, тому що до моменту появи антитіл, як правило, перелиті КЬ+-еритроцити із крові зникнуть. Виходячи з цих міркувань, не слід користуватися кров’ю одного й того ж донора при повторному переливанні, оскільки обов’язково до якої-небудь із систем відбудеться імунізація. Таким чином, уявлення про універсального донора та реципієнта застаріло. Справді, універсальний реципієнт з IV групою крові є універсальним донором плазми, позаяк у ній немає аглютинінів. Звичайно, найкращим донором може бути тільки сам хворий. Тому, якщо є можливість, слід заготувати аутокров перед операцією. Переливання крові іншої людини, навіть при дотриманні всіх вказаних вище правил, обов’язково призведе до додаткової імунізації.
ГЕМОСТАЗ
Система гемостазу забезпечує збереження крові в рідкому стані, запобігає кровотечі і відповідає за структуру стінок кровоносних судин. У разі ушкодження судин завдяки цій системі швидко зупиняється кровотеча. Виконуючи функцію збереження рідкого стану крові, система гемостазу бере участь і у підтриманні об’єму крові, що циркулює в судинах, на оптимальному рівні. Останню функцію вона виконує разом з органами кровотворення, кровообігу, виділення.
Гемостаз здійснюється завдяки взаємодії стінок кровоносних судин, формених елементів крові (еритроцитів, лейкоцитів, тромбоцитів), а також факторів, що містяться в плазмі крові. У плазмі крові є понад 40 різних факторів, які беруть участь у забезпеченні гемостазу. Ці сполуки можна розподілити на дві групи: ті, що забезпечують процес зсідання крові (коагулянти), і ті, що руйнують (антикоагулянти).
СИСТЕМА РАСИ
Рідкий стан крові в кровоносних судинах є умовою підтримання гомеостазу внутрішнього середовища. Запропоновано виділити систему регулювання агрегатного стану крові та колоїдів (РАСК) окремо. Завдяки системі РАСК кров перебуває в рідкому стані та відновлюються властивості стінок судин. Вона також підтримує на оптимальному рівні співвідношення окремих факторів коагулянтно-антикоагулянтної системи в нормі і поступово відновлює це співвідношення після використання багатьох факторів у процесі коагуляції. Певну функцію у системі РАСК виконують місцеві регулятори біологічних процесів—простагландини та кініни.
Кровотеча зупиняється у два етапи: судинно-тромбоцитарний
гемостаз, коагуляційний гемостаз. На всіх етапах відбувається взаємодія стінки судин, ушкоджених тканин і факторів системи гемостазу.
ТРОМБОЦИТИ
Значну роль у системі гемостазу виконують тромбоцити. Кількість їх становить 200—400-109/л, діаметр — близько 1,5—4 мкм, а товщина — 0,5—0,75 мкм. Тромбоцити вільно циркулюють у периферичній крові. Частина їх міститься у депо — у селезінці, печінці, кістковому мозку. При виході їх із депо збільшується пул циркулюючих клітин. Навіть протягом доби число їх непостійне: вранці зменшується, а ввечері збільшується.
Тромбоцити периферичної крові є фрагментом клітини — мегакаріоциту, яка ще у кістковому мозку розпадається на 3000— 4000 невеликих овальної форми частинок — кров’яних пластинок. Власне тромбоцит названий клітиною, оскільки він має не менше ознак, ніж без’ядерний еритроцит. Він позбавлений ядра і більшості субклітинних структур.
У тромбоцитах більшість сполук міститься в гранулах. Розрізняють 4 типи гранул: І — гранули, що містять небілкові компоненти (такі як АТФ, АДФ, серотонін, адреналін, кальцій); II — гранули, що містять низькомолекулярні білки, фактор Віллебран-да і фібриноген; III і IV — містять різноманітні ферменти.
Характерною особливістю тромбоцита є наявність на поверхні мембрани заглибин, які, як фіорди, входять у мембрану, часто пронизуючи її. На мембрані і у внутрішніх гранулах міститься велика кількість біологічно активних сполук, частина яких утворена самим тромбоцитом, а частина — надходить із плазми крові. Більшість їх бере участь у процесах зсідання крові — гемокоагу-л я ц і ї.
Важливу роль відіграє фактор росту. Під його впливом посилюється проліферація ендотеліальних та гладком’язових клітин кровоносних судин, фібробластів.
Мембрана тромбоцита виконує ряд функцій. Глікопротеїни, що містяться в ній, забезпечують прилипання тромбоцита до місця ушкодження судини. Частина гл і ко протеїді в мембрани є рецепторами, де відбуваються деякі процеси зсідання крові. Фосфоліпіди мембрани беруть участь у формуванні згустка крові. Вони ж є попередниками біологічно активних сполук — простагландинів. Один із них — тромбоксан А2 — активізує процес зсідання крові. Крім того, на внутрішньому боці мембрани міститься фермент аденілатциклаза, що активізує утворення цАМФ, який започатковує процес зміни стану пластинок при ушкодженні судини.
Значна кількість функцій тромбоцитів пов’язана з наявністю в середині їх скоротливого апарата, завдяки якому в про
цесі гемостазу безперервно змінюються форма і розміри тромбоцитів, утворюються відростки, пластинки розпластовуються по поверхні. Одночасно з цим при скороченні у позаклітинний простір виходить вміст гранул, до складу якого входять фактори зсідання та інші сполуки. В середині тромбоцитів скоротливі білки утворюють нитковидні мікрофіламенти. Ці білки тісно переплетені з мікротрубочками, які в середині тромбоцитів виконують опорну функцію, сприяючи зберіганню їх форми. Мікротрубочки складаються із полімерів білка тубуліну. Полімеризація його регулюється багатьма факторами. Найбільше значення в цьому процесі належить Са2+, вміст якого підвищується при зсіданні крові. Врешті-решт полімеризація тубуліну різко пригнічується, що створює умови для зміни форми тромбоциту. Основними скоротливими елементами тромбоциту, як і в більшості скоротливих клітин, є білки актоміозинового комплексу. Механізм скорочення цих білків у тромбоцитах нагадує процес, що відбувається в м’язах, Запускається він також вільним внутрішньоклітинним кальцієм за допомогою кальмодуліну і циклічних нуклеотидів. Скорочуючись, акто-міозиновий комплекс зумовлює зміну форми тромбоцитів. Одночасно цей же механізм забезпечує підтягування гранул до стінки і секрецію їх вмісту.
Життєвий цикл та функції тромбоцитів
Тромбоцити, що утворюються в кістковому мозку, циркулюють у крові протягом 8—12 діб. Потім вони руйнуються у селезінці, печінці, легенях або прилипають до ендотелію кровоносних судин. У ендотелії тромбоцити виконують трофічну функцію, «виливаючи» у клітини свій вміст, в тому числі й фактор росту. Завдяки цьому стінка судин, особливо капілярів, стає «міцнішою». Ця, так звана ангіотрофічна, функція тромбоцитів яскраво проявляється при їх недостатній кількості — тромбоцитопенії. Якщо ендотеліальні клітини втрачають тромбоцитарне живлення, вони зазнають дистрофії і починають пропускати через свою цитоплазму навіть цілі еритроцити. Діапедез еритроцита буває дуже інтенсивним: якщо на його шляху зустрічається ядро клітини, то воно може розколотися навпіл. Еритроцити, що виходять у тканини, утворюють незначні крововиливи. Для виконання ангіотрофічної функції за добу може використовуватись до 10 % тромбоцитів, які циркулюють у крові.
Своєрідним різновидом ангіотрофічної функції тромбоцитів є посилення проліферативних процесів гладком’язових клітин ендотелію при ушкодженні судини (після утворення згустка крові) під впливом фактора росту. Тромбоцити виконують такі функції:
1) транспортну, пов’язану з переносом на мембранах різноманітних біологічно активних сполук; 2) ангіотрофічну; 3) беруть участь у зсіданні крові; 4) беруть участь у зупинці кровотечі.
ЗУПИНКА КРОВОТЕЧІ
При ушкодженні судини кровотеча зупиняється у кілька етапів: 1) судинно-тромбоцитарний гемостаз; 2) коагуляційний гемостаз. На усіх етапах відбувається взаємодія судин, ушкоджених тканин, факторів систем гемокоагуляції і формених елементів крові.
ФАКТОРИ ЗСІДАННЯ КРОВІ
У плазмі крові у вільному стані міститься багато сполук, що беруть участь у процесі зсідання крові. Ці фактори зафіксовані у всіх формених елементах крові (тромбоцитах, еритроцитах та лейкоцитах).
За міжнародною номенклатурою плазменні фактори зсідання крові позначаються римськими цифрами з урахуванням хронології їх відкриття (для позначення активного стану додається літера «а»). Крім того, їх називають за хімічною ознакою, механізмом участі в процесі творення згустка або за прізвищем першого хворого, у крові якого їх виявили (табл. 9).
Усі ці фактори можна розділити на дві групи: ферменти (їх попередники)—фактори XII, XI, X, IX, VII, II; неферменти —
Таблиця 9. Позначення плазменних факторів зсідання крові
Цифрове позначення Назва
1 II III IV V VII VIII IX Фібриноген Протромбін Тканинний тромбопластин, тканинний фактор Іони кальцію Ас-глобулін,’ проакцелерин, лабільний фактор Проконвертин, стабільний фактор Антигемофільний глобулія (АГГ) Плазменний компонент тромбопластину (ТРС-фак-
X XI тор), фактор Кристмаса; антигемофільний фактор В . Фактор Стюарта — Прауера, протромбіназа Плазменний попередник тромбопластину (РТА-фак-
XII ХІП тор) Фактор Хагемана, контактний фактор Фібрннстабілізуючий фактор, фібриназа, плазменна трансглута мі наза
фактори І, IV, V, VIII. Причому, якщо фактор І є білком, який виконує найважливішу функцію у формуванні згустка крові, то інші (IV, V I VIII) є активаторами ферментативних процесів.
Фактори зсідання, що містяться у формених елементах крові та тканинах
Багато факторів зафіксовані на мембрані або містяться в середині формених елементів крові. В клітинах крові, особливо у тромбоцитах, є і власні фактори, які беруть участь у гемостазі. Вони можуть накопичуватись у клітині. Завдяки цьому в ділянці ушкодження судини швидко концентрується їх велика кількість. Позначаються фактори тромбоцитів арабськими цифрами. Найважливіші із них такі. ПФ-3 {фактор пластинок) — фосфоліпіди мембран. Подібним до нього є мембранний фактор еритроцитів. ПФ-4 зв’язує гепарин і прискорює процес зсідання крові. ПФ-5 — фібриноген, на частку Якого припадає до 10 % білка, що міститься у тромбоциті. ПФ-6 — тромбостенін. Він подібний до актинових та міозинових волЬкон. Скорочуючись у присутності Са2+, сприяє ущільненню стінки судини. ПФ-10 — серотонін, що сприяє звуженню судин. ПФ-11 — фактор агрегації. За хімічною природою це АДФ. У клітинах крові при утворенні тромба співвідношення АТФ: АДФ зменшується від 3:1 до 1:1. АДФ забезпечує скупчення тромбоцитів у місці ушкодження. Цю ж функцію виконує також один із простагландинів — тромбоксан А2.
Майже всі фактори зсідання крові, що містяться у тромбоцитах, виявлені і в еритроцитах та лейкоцитах. Виняток становить ПФ-6, за відсутності якого (або у разі його малої кількості) процес ретракції згустка сповільнюється. Важливу роль у пшзцесі лізису виконують ферменти лейкоцитів.
Тканини також містять субстанції, які беруть участь у процесі гемостазу. Так, фосфоліпіди ушкоджених мембран, як і фосфоліпіди формених елементів крові, беруть участь в активації ряду ферментів. Вони служать основою для утворення простагландинів. При ушкодженні тканин, кровоносних судин відкривається колаген, який запускає процеси зсідання крові, приклеювання тромбоцитів.
СУДИННО-ТРОМБОЦИТАРНИЙ ГЕМОСТАЗ
Завдяки судинно-тромбоцитарному гемостазу може самостійно припинитись кровотеча із невеликих судин. Але при ушкодженні великих судин цього механізму не досить. Тут він виступає лише первинним гемостазом, з якого розпочинаються всі фази зупинки кровотечі.
Після ушкодження судин послідовно запускаються етапи су-динно-тромбоцитарного гемостазу.
1. Рефлекторний спазм судин розпочинається одразу після ушкодження.. Він обумовлений місцевими рефлекторними механізмами і підтримується реакцією гладких м’язів судин ушкодженої ділянки на вазоактивні сполуки, що утворюються тут. Крім того, при послідовному руйнуванні із тромбоцитів виділяються судинозвужувальні речовини (серотонін, адреналін, тромбоксан). Спазм судин розвивається досить швидко, але через кілька хвилин може припинитись, і кровотеча відновиться. Тому для зупинки кровотечі потрібно, щоб підключились інші механізми гемостазу.
2. Адгезія — приклеювання тромбоцитів до місця ушкодження. В ініціації цього процесу ведуча роль належить волокнам колагену, до яких прилипають негативно заряджені тромбоцити. При цьому тромбоцит змінює свою форму і викидає довгі ниткові відростки — псевдоподії. Найважливішим плазменним фактором адгезії тромбоцитів є глікопротеїд, що синтезується ендотелієм судин, тобто фактор Віллебранда (він накопичується також і в тромбоцитах).
3. Зворотна агрегація (скупчення) тромбоцитів. Поява ниткових відростків, зміна форми тромбоцитів відбуваються ще під час підходу до місця ушкодження. Це сприяє «склеюванню» тромбоцитів один з одним (по 10—20) і прилипанню у такому вигляді до стінки судини. Процес агрегації прискорює виділення із зруйнованих тромбоцитів АДФ, адреналіну, арахідонової кислоти, простагландинів. Унаслідок цього формується первинний, так званий білий тромб, що прикриває ушкоджену ділянку. Але він ще не щільний і може пропускати плазму крові.
4. Необоротна агрегація тромбоцитів — наступний етап перетворення білого тромбу. Основним стимулятором зміцнення тромбу є тромбін, який досі (через 5—10 с після ушкодження) утворювався під час реакцій коагуляційного гемостазу, що відбуваються паралельно. Важливо те, що тромбін зумовлює агрегацію в таких дозах, які значно менші від тих, котрі потрібні для утворення справжнього тромба.
5. Ретракція тромбоцитарного тромба. Із зруйнованих тромбоцитів виходить пластинчастий фактор (ПФ-6) — тромбостенін. ПФ-6 нагадує актоміозин. Він здатний скорочуватися і тим самим зменшувати розмір і ущільнювати згусток. У агрегації тромбоцитів, крім названих факторів, беруть участь небілкові (Са2+, М§2+) і білкові плазменні кофактори (альбумін, фібриноген та ін.).
Усі ці процеси відбуваються порівняно швидко, тому кровотеча із невеликих ран зупиняється протягом кількох хвилин.
КОАГУЛЯЦІЙНИЙ ГЕМОСТАЗ
Одночасно із первинним (судинно-тромбоцитарним) гемостазом розвивається вторинний (коагуляційний), який забезпечує зупинку кровотечі із тих судин, для яких було не досить попереднього етапу. Тромбоцитарна пробка не витримує високого тиску крові і при зменшенні реакції рефлекторного спазму може вимиватися; Тому на зміну їй формується справжній тромб. Основою утворення тромба є перехід розчиненого фібриногену (Ф-І) у нерозчинний фібрин з формуванням мережі, в якій заплутуються формені елементи крові. Фібрин утворюється під впливом фермента тромбіну. У нормі тромбіну немає в крові.
В ній міститься його попередник, що має неактивну форму. Це протромбін (Ф-ІІ). Для активації протромбіну потрібен свій фермент — протромбіназа. Процес утворення активної протром-бінази складний, вимагає взаємодії багатьох факторів плазми, клітин, тканин і триває 5—7 хв.
Усі процеси коагуляційного гемостазу є ферментативни-
м и. Вони відбуваються за типом послідовного каскаду.
Найскладнішою і найдовшою є фаза формування протромбіна-зи. Основою утворення ферменту протромбінази є ліпідний фактор. Залежно від типу походження виділяють тканинний (зовніш-
ній) та плазменний (внутрішній) механізми. Тканинна протромбіназа з’являється через 5—10 с після ушкодження, а кров’яна — лише через 5—7 хв (мал. 129).
Тканинна протромбіназа. При утворенні тканинної протромбі-
Внутрішній механізм
Акігшбашя—Х1І (колаген, протеази)
Зовнішній механізм Тканинний фоктор ІФ'-Ш) ♦
VII
і
і-------
» Л „
Антитромбін!)
★гепарин
Т^Протром-біноза
а------ХНІ
Л!
/ (Фібриноген)
XIII а і Фібрин —^Фібрин З ~Фібрин!
Мал. 129. Схема коагуляційного гемостазу (за даними 3. С. Баркага-на, 1980)
нази ліпідний фактор-активатор виділяється із мембран ушкоджених тканин, стінок судин. Спочатку активується Ф-УП. Ф-УІІа разом із фосфоліпідами тканин і кальцієм утворює комплекс 1а. Під впливом цього комплексу активується Ф-Х. Ф-Ха на фосфолі-підах утворює за участю Са2+ і Ф-У комплекс 3, який і є тканинною протромбіназою. Тканинна протромбіназа активує невелику кількість тромбіну, який використовується головним чином у реакції агрегації тромбоцитів. Крім того, виявлено ще одну функцію утвореного за зовнішнім механізмом тромбіну — під його впливом на мембрані агрегованих тромбоцитів формуються рецеп-
тори, на яких може адсорбуватися Ф-Ха. Внаслідок цього Ф-Ха стає недосяжним для одного із сильних антикоагулянтів — антитромбіну III (див. с. 281). Це складає передумову для наступного формування на місці тромбоцитарного тромба справжнього.
Кров’яна протромбіназа утворюється на основі фосфоліпідів мембран ушкоджених клітин крові (тромбоцитів, еритроцитів). Ініціатором“цього процесу є волокна колагену, що з’являються при ушкодженні судини. Завдяки контакту колагену з Ф-ХП розпочинається каскад ферментативних процесів. Активований Ф-ХПа утворює перший комплекс із Ф-ХІа*на фосфоліпідах мембран еритроцитів та тромбоцитів, що руйнуються до цього часу. Це най-повільніша реакція, вона триває 4—7 хв.
Подальші реакції також відбуваються на матриці фосфоліпідів, але швидкість їх значно вища. Під впливом комплексу і формується комплекс 2, що складається із Ф-ІХа, Ф-УПІ та Са2+. Цей комплекс активує Ф-Х. І нарешті, Ф-Ха на матриці фосфоліпідів утворює комплекс 3 — кров’яну протромбіназу (Ха+У+ Ч-Са2+).
Друга фаза зсідання крові — утворення тромбіну. Через 2—5 с після утворення протромбінази майже миттєво (за 2— 5 с) відбувається утворення тромбіну. Білок плазми протромбін (аз-глобулін, що має молекулярну масу 68 700) міститься в плазмі (0,15 г/л). Кров’яна протромбіназа адсорбує на своїй поверхні п/отромбін і перетворює його на тромбін.
Третя фаза — перетворення фібриногену на фібрин. Під впливом тромбіну фібриноген плазми перетворюється на фібрин. Цей процес відбувається у 3 етапи. Спочатку фібриноген (молекулярна маса 340 000; в нормі міститься в концентрації від 1 до 7 г/л) у присутності Са2+ розщеплюється на 2 субодини-ці. Кожна із них складається з 3 поліпептидних ланцюгів — а, 0, у. Ці золевидні мономери фібрину під дією електростатичних сил стають паралельно один до одного, утворюючи фібринполімери. Для цього потрібен Са2+ та плазменний фактор фібринопептид А. Утворений гель ще може розчинятися, його називають фібрином 8. На третьому етапі за участю Ф-ХИІ та фібринази тканини, тромбоцитів, еритроцитів і Са2+ утворюються ковалентні зв’язки, і фібрин 8 перетворюється на нерозчинний фібрин І. Унаслідок цього формується ще відносно м’який клубок ниток фібрину, в які заплутуються тромбоцити, еритроцити та лейкоцити, що призводить до їх руйнування. Це сприяє місцевому збільшенню концентрацій факторів зсідання та фосфоліпідів мембран, а звільнений із еритроцитів гемоглобін надає тромбові відповідного кольору.
РЕТРАКЦІЯ ЗГУСТКА
При руйнуванні тромбоцитів виділяється ПФ-6 — тромбостенін. Під його впливом фібринові нитки зближуються і вкорочуються, утворюючи складки. Внаслідок ретракції згусток стає компактним і не пропускає навіть сироватку крові. Ретракція завершується протягом 2—3 год. За відсутності тромбоцитів згусток довгий час залишається нещільним.
Незабаром після утворення згусток починає проростати фібробластами. Це відбувається під впливом фактора росту тромбоцитів, який одночасно активізує проліферацію гладко-м’язових та ендотеліальних клітин судинної стінки. Тим самим відновлюється цілість пошкодженої ділянки.
Усі процеси, пов’язані з появою кров’яної протромбінази та утворенням згустка, відбуваються як у організмі в ділянці пошкодження, так і у пробірці. При ретракції згусток стискається майже у 2 рази і із нього виділяється рідка частина крові — сироватка. Сироватка, на відміну від плазми, не містить фібриногену.
ФІБРИНОЛІЗ
Одночасно з ретракцією розпочинається фібриноліз — розщеплення фібрину. Вважають, що в крові постійно відбуваються процеси перетворення невеликої кількості фібриногену на фібрин. Це перетворення врівноважується безперервним фібринолізом, який у нормі перешкоджає утворенню згустка в неушкодженій судині. Процес зсідання спостерігається при пошкодженні судин.
У процесі розщеплення фібрину утворюється протеолітичний фермент плазмін. Він міститься у крові у вигляді неактивного-плазміногену. Плазміноген активується під дією спеціальних механізмів. Після активації плазмін швидко зникає з кровотоку, блокуючись антиплазміном. Тому він діє місцево (у згусткові крові).
Основний внутрішній механізм активації запускається тими самими факторами, які ініціюють зсідання крові, фактором ХПа. Цей фактор взаємодіє з високомолекулярним кініноге-ном плазми та прекалікреїном (обидва ці фактори є часткою кіні-нової системи плазми), після чого набуває здатності активувати плазміноген. При такому шляху може спостерігатись самоактива-ція, внаслідок чого різко збільшується активність протеолізу фібрину.
Найважливішим стимулятором зовнішнього механізму фібринолізу є білкові активатори плазміногену, що синтезуються у судинній стінці. Вони мають високу спорідненість до фібрину. Цей механізм забезпечує і трупний фібриноліз (мал. 130). Інтенсивний викид у кров судинних активаторів буває при пору-
Внутрішній механізм Зовнішній механізм
Мал. 130. Фібринолітична система:
ВМ-кініноген — високомолекулярннй кініноген. Одинарними стрілками позначено процес активації, подвійними — перетворення (за даними 3. С. Баркагана, 1980)
шенні прохідності судин, фізичному навантаженні під впливом речовин, які звужують судини.
Висока ефективність фібринолізу обумовлена й тим, що при зсіданні крові фібрин адсорбує плазміноген. Унаслідок цього плазмін з’являється безпосередньо у згустку крові, який починає руйнуватись одразу після утворення.
Сильні активатори плазміногену містяться в усіх клітинах крові, особливо в лейкоцитах. Крім цього, лейкоцити можуть секре-тувати протеази, тим самим беручи участь у переварюванні фібрину неплазміновим шляхом. Лізис фібрину потрібен для деблокування судинного русла при внутрішньосудинному зсіданні крові.
АНТИКОАГУЛЯНТНІ МЕХАНІЗМИ
При ушкодженні судин кров зсідається лише в ділянці ушкодження. Цей процес контролює антикоагулянтна систе-м а. Вона грає провідну роль у збереженні рідкого стану крові. У звичайних умовах рідкий стан крові підтримується кількома механізмами, з яких можна виділити: 1) гладеньку поверхню ен-
Таблиця 10. Основні фізіологічні механізми антикоагулянтів (за даними 3. С. Баркагана та К. М. Бишевського)
Назва, молекулярна маса антикоагулянт а
Ведучі механізми дії
Антитромбін-III (65 000)
Гепарин (4000—9000)
«і-Антитрипсин (54 000)
Група А. Первинні
а2-Глобулін, прогресивно діючий інгібітор тромбіну, факторів Ха, ІХа, V, ХІа, XII. Основний плазменний кофактор гепарину. Дуже слабкий інгібітор плазміну і калікреїну
Сульфатований полісахарид, який утворює комплекс з А'Г-ПІ, трансформуючи його в антикоагулянт негативної дії. Активізує неферментативний фібриноліз Інгібітор тромбіну, факторів ІХа, ХІа, ХПа, плазміну, калікреїну
Група Б. Вторинні, утворювані у процесі протеолізу
Антитромбін-І Фібрин: сорбує та інактивуе тром-
бін і фактор Ха
Продукти фібринолізу (продукти Інгібірують кінцевий етап зсідання, деградації фібриногену, ПДФ) фактор ІХа, агрегацію тромбоцитів
дотелію судин; 2) негативний заряд стінки судин та формених елементів крові, за рахунок чого вони взаємовідштовхуються;
3) наявність на стінці судин тонкого шару фібрину, який активно адсорбує фактори зсідання, особливо тромбін; 4) постійна присутність у крові деякої кількості антикоагулянтних факторів; 5) синтез ендотелієм судин одного з простагландинів — простацикліну, який є потужним інгібітором агрегації тромбоцитів; 6) здатність ендотелію синтезувати і фіксувати антитромбін III.
Розрізняють 2 типи антикоагулянтів: а) первинні; б) вторинні, утворені у процесі зсідання крові (табл. 10).
З первинних антикоагулянтів найуніверсальніціим щодо дії та активності є антитромбін III (АТ-ПІ). Це один із аг-глобулінів плазми. Він інактивуе тромбін (Ф-Па) і майже всі інші активуючі фактори — ХПа, ХІа, Ха, ІХа. Інший антикоагулянт— гепарин, активний тільки разом з АТ-ПІ. Гепарин сприяє фіксації АТ-ПІ на поверхні ендотеліальних клітин, завдяки чому значно підвищується його активність.
Значна кількість прокоагулянтів та їх метаболітів у процесі зсідання крові та фібринолізу набувають антикоагулянтних властивостей. Найпотужнішим серед них є фібрин, який адсорбує та інактивуе утворений при зсіданні крові тромбін. За цю властивість фібрин називають антитромбіном-І. Внаслідок дії фібрину у згусткові крові залишається дуже мала кількість вільного тромбі-
ну. Сам тромбін також володіє антикоагулянтними властивостями. Діючи ферментативно на протромбін, він відщеплює від нього інгібітор фактора Ха. З’являються антикоагулянти і у процесі фібринолізу.
РЕГУЛЮВАННЯ ПРОЦЕСУ ЗСІДАННЯ
КРОВІ ТА ПОРУШЕННЯ ЙОГО
Понад половина людей помирають від хвороб, що пов’язані з порушенням гемостазу. Прискорення зсідання крові називається гіперкоагуляцією, а затримка — г і п о ко а гу л я ці є ю. Гіперкоагуляція спостерігається при стресових ситуаціях: час ге-мокоагуляції зменшується від 5—10 до 3—4 хв. У основі цього процесу лежить вплив катехоламінів, концентрація яких у крові у відповідь на дію стресу різко збільшується. Адреналін сприяє визволенню із стінок судини факторів утворення протромбінази. Крім того, у високій концентрації адреналін здатний активувати фактор XII безпосередньо в руслі крові. Адреналін посилює також розщеплення жирів та жирних кислот, які надходять у кров і мають протромбіназну активність. Після стресу у вигляді реакції на попередню гіперкоагуляційну активність може з’явитись вторинна гіпокоагуляція.
У процесі еволюції склалась лише одна адаптаційно-захисна реакція — гіперкоагуляція. Вона розвивається після збудження не тільки симпатичного відділу ЦНС, але й парасимпатичного. Подразнення блукаючого нерва призводить до виділення із стінок судин таких речовин, які виділяються при дії адреналіну.
Гіпокоагуляція завжди буває вторинною, відбувається після попереднього зсідання. Виняток складають випадки первинної або вторинної недостатності факторів зсідання крові. Так, гемофілія А є наслідком генетично зумовленої недостатності Ф-УПІ, гемофілія В — Ф-ІХ. Процес зсідання крові нерідко порушується при тяжких запальних та дегенеративних захворюваннях печінки — як результат зниження синтезу протромбіну та факторів VII, IX, X. Недостатня кількість вітаміну К, який бере участь у синтезі вказаних факторів, також призводить до порушення процесу зсідання.
Тромбоцитопенія супроводжується різноманітними порушеннями процесів гемостазу. При падінні рівня тромбоцитів нижче ніж 50 000 в 1 мкл підвищується проникність судин для крові (легко виникають численні крововиливи), збільшується час кровотечі, сповільнюється утворення згустка або відбувається неповна його ретракція.
ВІКОВІ ЗМІНИ СИСТЕМИ ЗСІДАННЯ КРОВІ
Концентрація тромбоцитів у крові новонароджених лише дещо нижча, ніж у крові дорослих (у середньому становить 140— 300-109/л). Незначне зниження рівня тромбоцитів може спостерігатися і у перші роки життя. В цей період у тромбоцитах відзначається менша концентрація ряду факторів зсідання.
Становлення системи зсідання крові активно відбувається ще у пренатальний період. Фактори зсідання крові та антикоагулянти починають з’являтись після 4—5 міс- ембріонального періоду. В крові новонародженого концентрація коагулянтів трохи нижча, ніж у крові дорослих. Незважаючи на це, час зсідання крові в них майже такий, як у дорослих. Пояснюється це відповідним співвідношенням окремих факторів системи гемостазу. Протягом першого року життя вміст більшості факторів зсідання крові підвищується, але рівня дорослих вони досягають лише наприкінці періоду статевого дозрівання.
У міру старіння відзначається підвищення кількості тромбоцитів, зростає концентрація фібриногену в крові, підвищується здатність до адгезії, зменшується ретракція згустка. Це свідчить про підвищену здатність до коагуляції.
КРОВОТВОРЕННЯ
ТА ЙОГО РЕГУЛЯЦІЯ
Кров, що складається із плазми та формених елементів, утворюється внаслідок взаємодії багатьох органів та систем організму. В даному розділі розглянуто механізми творення формених елементів крові (підтримання певного рівня компонентів плазми залежить від функцій печінки, нирок та інших органів і розглядається у відповідних розділах).
У дорослої людини формені елементи крові утворюються (кровотворення) в кістковому мозку. Кровотворення — багатостадійний процес клітинних диференціювань, унаслідок якого в кров виходять зрілі формені елементи — лейкоцити, еритроцити, тромбоцити. Більшість клітин крові є кінцевими, нездатними до самооновлення елементами. Постійний процес оновлення полягає в загибелі частини клітин і заміні їх новоутвореними. Схема кровотворення грунтується на гіпотезі А. А. Максимова, що була запропонована ще на початку нашого сторіччя, про унітарне (із загальної клітини) походження всіх клітин крові.
На даному етапі процес розвитку клітин у кістковому мозку, його регулювання вивчені порівняно непогано. Хоча залишаються ще білі плями, які стосуються як морфології, так і тонкощів деяких механізмів. Механізми, що забезпечують диференціювання
(регулятори кровотворення), повинні підтримувати процес творення формених елементів на такому рівні, щоб у периферичній крові не виник дефіцит клітин. Позаяк розвиток клітин у кістковому мозку триває протягом багатьох діб, то помітний приріст клітин, пов’язаний зі збільшенням кількості формених елементів крові, буде відчуватися на периферії лише через кілька діб.
У реальному житті виникають стани, що вимагають зміни активності кровотворення. Найчастіше виникає потреба в активізації творення якогось одного типу клітин. У зв’язку із відсутністю справжнього депо еритроцитів при виникненні потреби в підвищеному постачанні організму киснем (при крововтраті тощо) виникає необхідність у посиленому еритропоезі. На відміну від цього, завжди досить багато тромбоцитів, а особливо лейкоцитів міститься в депо. У разі потреби вони, виходячи із депо, швидко поповнюють пул циркулюючих клітин і доходять до місця інфекції або ділянки ушкодження судин. Тому, наприклад, інтенсифікація процесу творення лейкоцитів спостерігається лише при тривалому існуванні в організмі осередку інфекції. Вказані відмінності накладають відбиток і на швидкість зміни активності систем регулювання для червоного та інших пагонів кровотворення.
Кровотворні клітини походять від однієї к літини-попе-редниці. Це так звана стовбурна клітина. Однією із характерних властивостей її є самопідтримання. Воно полягає в тому, що при поділі одна із дочірніх клітин залишається стовбурною, а друга може стати на шлях подальшого диференціювання та проліферації. Після кількох поділів ця клітина утворює клас поліпотентних клітин, тобто здатних диференціюватись у всі клітини крові.
При вирощуванні культури клітин іп уііго помітили, що кожна клітина-попередниця утворює колонії, що складаються із дочірніх клітин, які пройшли ту чи ту стадію диференціювання та проліферації. Тому такі клітини називаються колонієтворними одиницями.
Подальший розвиток клітин пов’язаний із формуванням уніпо-тентних клітин, які перетворюються під час свого розвитку лише у відповідний тип формених елементів крові. Першою «відшнуро-вується» клітина, яка дає колонію лімфоцитів. Клітини, що залишилися, ще містять плюропотентний потенціал — вони можуть дати початок усім клітинам, за винятком лімфоцитів. Після кількох поділів і ці клітини перетворюються на попередниці суворо спеціалізованого пагона крові. З’являються попередниці колоній еритроїдного, нейтрофільного, еозинофільного, базофільного, моно-цитарного та мегакаріоцитарного рядів.
Ввважають, що в нормі для формування зрілих клітин крові клітина-попередниця повинна здійснити не менше 11---12 поділів. Тривалість кожного мітотичного циклу в середньому становить
близько доби, тому, наприклад, до виходу еритроцитів у кров минає 12 діб. Ці особливості кровотворення треба враховувати в гематологічній практиці. Так, при лейкозі тип патологічних клітин залежить від рівня «ушкодження». Процес може охоплювати один пагін кровотворення або кілька (на менш зрілому рівні).
РЕГУЛЯЦІЯ КРОВОТВОРЕННЯ
Активізація кровотворення відбувається під впливом специфічних механізмів регулювання. В основі їх лежать гуморальні фактори, які контролюють і спрямовують проліферацію та диференціювання кісткомозкових кровотворних елементів.
Тонкі механізми, що забезпечують^ підтримання пулу родоначальних стовбурних клітин та диференціювання їх, ще невідомі. У цих процесах, напевно, відповідну роль грають міжклітинні взаємодії клітин-попередниць і стромальних елементів кісткового мозку. Внаслідок поступової трансформації клітин на їх поверхні з’являються рецептори, що забезпечують відповідь їх на специфічні гормональні сигнали. Після цього через внутрішньоклітинні вторинні посередники (циклічні нуклеотиди, кальцій, простагландини та ін.) відбувається подальше диференціювання у напрямі відповідного пагона.
Виділена і досить добре вивчена значна кількість специфічних стимуляторів кровотворення, які називаються поетинами, або факторами, що стимулюють колонії (КСФ). Кожен пагін кровотворення розвивається під впливом специфічного фактора: еритропоетин (ЕП) сприяє утворенню еритроцитів; М-КСФ — фактор, що стимулює колонії моноцитів; ГС-ЕСФ — гра-нулоцитарних колоній; Г-КСФ— гранулоцитарних; інтерлейкін-3 (ІЛ-3) — плюропотентних колоній; ІЛ-2 та ІЛ-4 — лімфоцитів. Усі вони є глікопротеїнами. Місцем утворення більшості з КСФ є макрофаги та моноцити. Причому ці самі клітини виділяють речовини, які стимулюють виділення КСФ із інших клітин, наприклад, ендотелію судин. До таких речовин належать інтерлейкін-1, фактор некрозу пухлин.
Унаслідок взаємодії КСФ з клітинами кісткового мозку останні починають дозрівати та виходити в кровотік. Так, наприклад, забезпечується поява комплексу клітин білої крові, що беруть участь в імунній відповіді.
На ранніх етапах ембріонального періоду кровотворення відбувається із ендотелію судин. Потім клітини крові утворюються в печінці і лише перед народженням — у кістковому мозку. Специфічні стимулятори кровотворення з’являються ще у внутрішньо-утробний період.
Регулювання еритропоезу. Місцем утворення еритропоетин у е нирки. У нормі ЕП синтезується у невеликій кількості.
Мал. 131. Регуляція еритропоезу
При анемії, недостатності кисню в усьому організмі або тільки в нирках різко активізується процес творення ЕП. Під впливом ЕП відбуваються диференціювання та проліферація еритроїдних попередників у кістковому мозку (мал. 131). Вплив ЕП на еритробласти модулюється іншими стимуляторами кровотворення, що утворюються в макрофагальній системі, наприклад, інтерлейкі-ном-І. Внаслідок комплексної дії швидкість проліферації еритроїдних елементів та їх диференціювання прискорюються. Ці проце
си відбуваються у так званих еритробластичних острівцях. Еритроїдні елементи в кістковому мозку розвиваються у вигляді колоній, що групуються біля макрофага (колишнього моно-цита). Центральний макрофаг забезпечує еритробласти, що розвиваються, еритропоетином та іншими регуляторами кровотворення, а також речовинами, потрібними для синтезу гемоглобіну. В центрі острівців мієлопоезу містяться ретикулярні клітини, які виконують аналогічні функції. Крім специфічних гормонів, на проліферацію та диференціювання кістково мозкових клітин впливають гормони гіпофіза, щитовидної залози, статевих та надниркових залоз. Можливо, саме різницею щодо вмісту гормонів пояснюється дещо нижче число еритроцитів у крові жінок.
Система кровообігу
Кровообіг — рух крові в кровоносній системі. Система кровообігу забезпечує обмін речовин між тканинами організму і зов-. нішнім середовищем і підтримує постійність внутрішнього середовища— гомеостаз. Основні функції системи кровообігу: 1) транспорт поживних речовин до місця їх засвоєння; 2) транспорт продуктів обміну від місця їх утворення до органів виділення; 3) транспорт газів; 4) транспорт гормонів; 6) транспорт всієї суми захисних речовин; 7) транспорт теплової енергії.
ФІЗІОЛОГІЯ СЕРЦЯ
ФІЗІОЛОГІЧНА ХАРАКТЕРИСТИКА МІОКАРДА
Кров виконує численні функції тільки тоді, коли циркулює серцево-судинною системою. В організмі є два замкнутих кола кровообігу—мале (легеневе) та велике (системне). Підключені вони послідовно.
Велике коло кровообігу починається з лівого шлуночка, який викидає кров у аорту. Від аорти відходять чисельні артерії, які постачають кров окремим органам. Унаслідок розгалуження артерій і артеріол утворюються капілярні судини, які забезпечують обмін між кров’ю і клітинами. При злитті капілярів утворюються венули, котрі складають вени. Останні, об’єднавшись у нижню і верхню порожнисті вени, приносять кров у праве передсердя.
Мале коло кровообігу починається з правого шлуночка, який викидає кров у легеневий стовбур, і судинами легень вона відтікає через чотири легеневі вени у ліве передсердя.
Чотирикамерне серце об’єднує ці кола в єдину систему кровообігу. Безперервний кровотік можливий лише за умови, що праве і ліве відділення серця працюють синхронно і рівномірно: обидва шлуночки при кожнім скороченні повинні викидати у відповідні судини однакову кількість крові.
У судини кров надходить при скороченні шлуночків (систола). При їх розслаблені (діастола) всі порожнини серця заповнюються кров’ю. Розташовані перед шлуночками передсердя сприяють прийому крові із судин при скороченні шлуночків. Передсердя не тільки депонують кров, що притікає до серця, а й подають до шлуночків у. разі потреби додаткову порцію крові. Особливого значення ця додаткова «підкачка» набуває при збільшенні частоти скорочень серця, коли діастола стає коротшою і зменшується тривалість заповнення порожнин шлуночків кров’ю. Приблизно таку ж функцію для передсердь виконують їх вушка.
Кардіоміоцити. Структурною основою серця є міокард. Він має масу 250—300 г. Товщина його, розташування волокон і навіть власне волокна в різних відділах не однакові. Міокард передсердь тонший, ніж міокард шлуночків, і має два шари: циркулярний-і поздовжній. Циркулярні волокна оточують переважно судини, що впадають у передсердя, і при скороченні перетискують їх отвори. Міокард шлуночків, особливо лівого, потужніший і складається з трьох шарів. Зовнішній і внутрішній шари мають спірале-видну форму і є спільними для обох шлуночків. Середній шар складається з циркуляторно розташованих м’язових волокон. Він Ізольований у правому і лівому шлуночках (мал. 132). Волокна передсердь та шлуночків прикріплюються до фіброзного кільця.
До нього кріпляться й клапани серця. Діаметр кардіоміоцитів передсердь менший, ніж шлуночків.
Кардіоміоцити мають прямокутну форму, довжину — близько 120 мкм і ширину — 17—20 мкм. Містять усі структури, характерні для волокон поперечносмугастого скелетного м’яза: ядра, міофібрили, мі-тохондрії, пластинчастий комплекс, саркоплазматичний рети-кулум. Але саркоплазматично-го ретикулуму (депо Са2+) в ньому менше, ніж у скелетних м’язах
Між окремими кардіоміо-цитами існують численні між-мембранні контакти — не-к с у с и (вставні диски). Вони забезпечують електричні взаємодії між клітинами, утворюючи функціональний синцитій міокарда. Така структура забезпечує скорочення кардіоміоцитів з порівняно великою швидкістю і розвиває досить могутні зусилля
для викидання крові.
Провідникова система серця. Серед скоротливого міокарда розташована система клітин і відростків, які виконують функції генерації збудження і проведення його до кардіоміоцитів. Це і є провідникова система серця. Кардіоцити цієї системи згруповані у певних ділянках міокарда у вузли. Вони менші за розміром, ніж скоротливі елементи передсердь і шлуночків, з’єднуються в групи, мають велику кількість взаємнопереплетених виростів. У їхній структурі більше саркоплазми і мало міофібрил, слабковиражена Т-система саркоплазматичного ретикулуму. За своїми властивостями наближаються до ембріонального міокарда; стійкіші до гіпоксії, оскільки в них енергія утворюється в основному за рахунок анаеробного гліколізу.
Провідникова система складається з синусного і атріовентри-кулярного вузлів, міжвузлових і міжпередсердних комунікацій, передсердно-шлуночкового пучка (пучка Гіса), який ділиться на
Мал. 132. Схема напрямку розташування м’язових волокон у міокарді (за даними В. Ма{*у):
7— передсердя; 2 — поверхневий шар шлуночків; 3 —середній шар шлуночків; 4 — «спіральна головка» Маккаллума; 5 — структура передсердно-шлуночкового клапана. Стрілками вказано напрям тяги скорочення волокон мі окарда
Мал. 133. Схема провідної системи серця:
— верхня порожниста вена; 2 — синусо-передсердний вузол; 3 — передсердно-Пілу-«очковий вузол; 4 — права ніжка пучка Гіса; 5 —нижня порожниста вена; 6 — передня гілка лівої ніжки пучка Гіса
Атріовентрикулярний вузол
перегородки на межі передсердь і шлуночків. Розмір вузла — 7,5X3,5X1 мм.
Пучок Гіса має довжину 12—40 мм, ширину 1—4 мм. Він почи
праву і ліву ніжки, що йдуть по міжшлуночковій перегородці в субендокардіальну сітку міоциту серцевого провідного, або волокон ГЇуркіньє (мал. 133).
Синусовий (синусно-перед-сердний) вузол міститься біля місця впадіння верхньої і нижньої порожнистих вен у праве передсердя. Вузол має еліпсоїдну форму, довжину 10—15 мм, ширину 4—5 мм, товщину 1,5 мм. Він складається із «голівки» і «хвостової» частини. «Голівка» лежить субепікардіально. Від неї до вушка лівого передсердя відходять пучок волокон, що був описаний Л. 6. ВасЬтапп (1916), задній міжвенозний пучок (К- В- ^еІскепЬаск, 1907) та задній міжвузловий пучок (СЬ. Т11О-гіе, 1909). Ці пучки передають збудження атріовентрикулярному вузлові.
міститься в товщі міжпередсердної
нається стовбуром від атріовентрикулярного вузла і, пройшовши через міжшлуночкову перегородку, ділиться на дві ніжки, що йдуть по лівому і правому боках міжшлуночкової перегородки і переходять у волокна Пуркінье, котрі безпосередньо контактують
з клітинами скоротливого міокарда.
Електрозбудливість серця. Провідна і скоротлива функції серця запускаються за рахунок іонних переміщень, які утворюють електричні потенціали. Розвиток їх залежить головним чином від концентрації вільних іонів у середині та зовні клітинних мембран та їх проникності. Уявлення про кількість цих іонів дає табл. 11. \ Обмін іонів між зовнішнім і внутрішнім середовищами клітини в першу чергу залежить від структури і функціонального стану мембран. Мембрана кардіоцитів має ряд особливостей. Як і в інших збудливих тканинах, її інтегративні білки-канали в разі відкриття воріт пропускають за градієнтом концентрації Иа+ та К+-Крім того, тут є канали, які пропускають Са2+, СІ-. Ці та попередні канали відрізняються рядом особливостей. Так, №+ проходить не тільки через «свої», швидкі, канали, але разом із Са2+ —
через так звані повільні канали. Крім Са2+-, №а+-каналу, Са2+ проникає всередину і по власному Са2+-каналу. В мембрані міститься не менше двох К+-каналів. Відповідну функцію у структурах провідникової системи виконують і С1_-канали.
У мембрані кардіоміоцитів також багато білків, які виконують функцію іонних насосів. Щільність Ма+-, К+-насосів понад
Таблиця 11. Внутрішньо- та зовнішиьоклітинна концентрація іонів у серці (за даними К. Є. Ва«8оп, 1984)
іон Концентрація, ммоль/л
Зовнішньо клітинна Внутрішньоклітинна
Натрій 145 10
Калій 4 135
Кальцій 2 0,0001
Хлор 120 ЗО
у 100 разів вища, ніж щільність каналів для цих же іонів. їх функціональна активність і визначає концентрацію вказаних іонів у клітині, таким чином впливаючи на величину потенціалу спокою. Є тут велика кількість т Са2+-насосів. Щільність насосів, їх функціональна активність не постійні, оскільки регулюються відповідними системами.
Швидкі ІЧа+-канали є і в скоротливому міокарді. їх кінетика загалом аналогічна такій інших збудливих тканин: нервової та поперечносмугастої м’язової.
Повільні Са2+-канали розташовані як у скоротливому міокарді, так і в елементах провідникової системи. їх кінетика де в чому нагадує кінетику прудких №+-каналів, за винятком швидкості: їх активаційні та інактиваційні ворота повільно відкриваються і закриваються, а тому повільно розвивається деполяризація та відновлюється збудливість. При заряді мембрани 0 мВ повільні канали повністю втрачають активність. Пороговий потенціал повільних каналів перебуває на вищому рівні, ніж потенціал швидких: у повільних каналів він становить 35—40 мВ, а у швидких — 55 мВ.
У мембрані кардіоміоцитів є кілька видів К+-каналів. З них найзначніші швидкий і повільний. Швидкий канал активізується при деполяризації мембрани (потенціалзалежний) до —35 мВ, повільний — при підвищенні у цитоплазмі концентрації вільного кальцію (кальційзалежний).
СІ- проходить через канали пасивно. Низький вміст у клітині СІ- забезпечується їх виштовхуванням назовні негативно зарядженими іонами в стані ПС. При виникненні ПД в середині клітини зростає вміст позитивних іонів, що призводить до потрапляння С1~ в клітину. Тому внутрішньоклітинний вміст СІ- залежить від частоти та тривалості ПД. СІ- може шунтувати внутрішньоклітинний потенціал, впливаючи на рівень ПС. Якщо позаклітинний С1~ замінити менш проникним негативним іоном, то спостерігатиметься гіперполяризація мембрани.
Фізіологічні властивості міокарда
За своїми функціональними властивостями міокард перебуває між поперечносмугастими та гладкими м’язами. Міокард подібний до поперечносмугастих м’язів за здатністю швидко та інтенсивно скорочуватися. Одночасно міокард має такі характерні для гладких м’язів функціональні властивості, як здатність до мимовільної активності та зміна її під впливом вегетативних нервів і гормонів.
Міокард має такі властивості: збудливість, провідність, здатність до скорочення, рефрактерність, автоматизм. Ці властивості забезпечуються наявністю у міокарді вказаних двох типів волокон — власне скоротливих кардіоміоцитів і волокон провідної системи,
ЗБУДЛИВІСТЬ СЕРЦЕВОГО М'ЯЗА
Міокард, як і нервова тканина та скелетні м’язи, належить до збудливих тканин. Це означає, що міокардіальні волокна володіють ПС. Відповідають на порогові подразнення генерацією ҐІД, здатні проводити ці потенціали без затухання (бездекрементно). Нексуси, або вставні диски, відокремлюючи клітину від клітини, не перешкоджають проведенню збудження, тобто серцевий м’яз поводиться як функціональний синцитій; збудження, що виникло в якому-небудь відділі, поширюється на інші клітини. Завдяки цій особливості серце підкорюється закону «все або нічого», тобто на подразнення воно відповідає збудженням усіх волокон або не реагує зовсім. Цими властивостями серце відрізняється від нервових тканин і скелетних м’язів, де кожна клітина збуджується ізольовано.
Рівень ПС у скоротливих кардіоміоцитах і провідній системі відрізняється: в кардіоміоцитах він становить — 80—90 мВ, в міо-цитах провідникової системи — 90 мВ, а у вузлових клітинах провідникової системи — близько —60 мВ. Для підтримання ПС на постійному рівні потрібна врівноваженість вхідного (натрієвого) та вихідного (калієвого) току. Порушення цієї рівноваги призводить до гіперполяризації або деполяризації мембрани.
Розглянемо особливості збудливості скоротливих кардіоміоцитів. Збудження в них характеризується реверсією потенціалу — виникненням ПД. При цьому швидка деполяризація починається після досягнення критичного рівня, що дорівнює приблизно —55 мВ.
У скоротливих кардіоміоцитах виділяють п’ять фаз розвитку ПД (мал. 134): 0 — швидка деполяризація; 1—швидка рання реполяризація; 2 — плато (повільна реполяризація); 3—швидка кінцева реполяризація; 4 — фаза спокою (Р. Шмідт, Г. Тевс, 1985).
Розслаблення
5 Початок скорочення Сарколема
Вхід Саг+
Міоплазма [
Поперечна трубочка'
Поздовжня { трубочка——
Актин Міозин
Вихід Са2* Видалення Саг
Мал. 134. Розвиток ПД та іонна проникність у волокнах провідної системи (А). Іонна проникність та активація скоротливого апарата (Б).
Амплітуда ПД дорівнює 120 мВ. Однією з найсуттєвіших відмінностей збудливості кардіоміоцитів від такої скелетних волокон є тривалість деполяризації: у скелетних м’язових волокнах вона становить 1—3 мс, а у кардіоміоцитах — близько 250 мс.
Фаза швидкої деполяризації зумовлена короткочасним підвищенням проникності мембран для Ка+: спочатку відкриваються, а потім швидко закриваються електрозбудливі Ма^-канали. Щодо цього кардіоміоцити схожі з іншими збудливими структурами (скелетним м’язом, нервовою клітиною). Швидкість розвитку деполяризації у них дорівнює 100—300 В/с.
Фаза швидкої реполяризації обумовлена швидким калієвим током й СІ-, які входять у клітину.
У кардіоміоцитах одночасно з Ма+-каналами відкриваються електрозбудливі повільні Са2+-канали. Са2+, що входить, підтримує тривалу деполяризацію (плато). Треба зазначити, що тривалість плато у міокарді передсердь та шлуночків різна (мал. 135). Це зумовлено початком інактивації у них Са2+-каналів: у кардіо-
Мал. 136. Конфігурація ПД у різних структурах серця
Мал. 136. Іонні механізми зв’язку збудження та скорочення міокарда
міоцитах передсердь вони інактивуються раніше, тому тривалість плато коротша.
Поступове закриття Са2+-каналів та зниження проникності для кальцію супроводжується збільшенням проникності мембрани для калію (відкриваються кальційзбудливі К+-канали). Внаслідок цього відбувається реполяризація мембрани і повернення до рівня ПС. ПС підтримується головним чином за рахунок вихідного калієвого току.
Таким чином, для розвитку збудження в міокарді велике значення мають повільні Са2+-канали (через них можуть проходити частково також №+). Число повільних каналів на мембрані не постійне. Воно модулюється внутрішньоклітинними циклічними нуклеотидами. Так, цАМФ, фосфорилюючи білки мембран, переводить ці канали в активний стан, унаслідок чого Са2+ -інтенсивно надходить у клітину. Дефосфорильований канал не може пропускати Са2+. Використовуючи речовини, що змінюють концентрацію цАМФ у середині кардіоміоцитів, можна впливати на виникнення ПД.
Натрієвий і кальцієвий обмін. У кардіоміоцитах розкритий так званий спряжений На+-, Са2+-трансмембранний градієнтний транспорт, який виконується без затрати енергії (мал. 136). Він полягає в обміні чотирьох іонів Иа+ на один іон Са2+, який здійснюється за допомогою спеціальних переносників. Натрієвий і кальцієвий обмін проявляється двічі. Спочатку, після фази швидкої деполяризації, Йа+, що проник у середину саркоплазми, обмінюється на позаклітинний Са2+. Це відбувається одночасно з від
криттям Са2+-каналів, що прискорює надходження Са2+ в середину клітини і підтримує плато ПД. Після закриття Са2+-каналів і підвищення проникності мембран до К+ відбувається реполяризація мембрани. У цей час на допомогу Са2+-насосу, який відкачує Са2+ у СПР, знову приходить Иа+-, Са2+-транспорт. Але тепер Са2+ відкачується зовні, а Па+ за градієнтом концентрації надходить у середину. В свою чергу цей Иа+ викачується за допомогою Ца+-, К+-помпи в обмін на К+, який виходить з клітини під час реполяризації. Такйм чином, енергія витрачається лише на працю №+-, К+-насоса, який підтримує градієнт Па+ між клітиною та міжклітинною рідиною. Завдяки збереженій енергії «без-енергетично» викачується частина Иа+ та Са2+.
Описані механізми забезпечують тісну взаємодію трьох іонів, що синхронізують усі стадії переходу ПС у ПД та скорочення міоциту.
АВТОМАТИЗМ
За механізмом іонної проникності мембрана кардіоцитів провідникової системи багато в чому відрізняється від такої скоротливих кардіоміоцитів. Це відображається на характері ПС і ПД. До того ж вони дещо відрізняються і щодо структур цієї системи.
Найхарактернішою відмінністю є відсутність справжніх ПС в атипових клітинах провідної системи, які бідні на скоротливі міо-філаменти. Після попереднього виникнення ПД повертається до рівня —60 мВ, і одразу починає розвиватися наступна деполяризація— повільна діастолічна деполяризація, яка характеризується плавним переходом у фазу швидкої. Окрім цього, ПД атипових клітин притаманні повільне наростання кривої у фазу швидкої деполяризації, закругленість вершини потенціалу, відсутність овершуту, мало виражене плато і низький ПС.
Повільна діастолічна деполяризація виникає спонтанно, у разі відсутності дії якого-небудь подразника. Механізм її розвитку пов’язаний із входом у атипові клітини Па+ і Са2+ через Са2+-кана-ли. Це відбувається після реполяризації мембрани (при рівні ПС близько —60 мВ), коли закриваються К+-канали.
У зв’язку з фактичною відсутністю постійного мембранного потенціалу базальний рівень мембранної поляризації клітин вузлів провідної системи називають максимальним діастоліч-ним потенціалом (МДП). Швидкість, з якою розвивається деполяризація при відкриванні повільних каналів, набагато менша, ніж при відкриванні швидких.
ПД, що виник спонтанно, у провідній системі поширюється на міокард, зумовлюючи його скорочення. Вказаний механізм спон-ганного збудження одержав назву «автоматизм серця».
Градієнт автоматизму. Окремі структури провідної системи
ЛґЧ-—, серця мають різний рівень пей-
] X 1 1 1 А ] смекерної активності. Спонтанна
уД'лГ' І ¥^ЛГ і ¥ч. /ькі - ПРОНИКН*СТЬ мембрани щодо N3+ \ М;:/7 V?- пч---4/ V-- їй ’І У клітини синусного вузла найви-
ща‘ клітинах передсердно-'чїііх шлуночкового вузла вона у 1,5—
Мал. 137. Додаткові пучки провідної 2 рази нижча, а ще нижча у во-системи серця: локнах передсердно-шлуночково-
а — пучок Кента; б —пучок Джеймса; ГО Пучка. Внаслідок ЦЬОГО В КЛІ-в — пучок Махейма •'
тинах синусного вузла деполяризація досягає критичного рівня раніше, ніж у інших частинах провідникової системи. Тому в серці збудження спочатку виникає в синусному вузлі і волокнами пучків Бахмана, Венкенбаха та Тореля проводиться до атріовентрикулярного вузла, в якому спонтанна деполяризація ще не досягла критичного рівня, а тому клітини цього відділу збуджуються імпульсом, який надійшов від синусного вузла. Від пе-редсердно-шлуночкового вузла збудження передсердно-шлуночко-вцм пучком, а потім гілками передається до волокон Пуркінье.
У зв’язку з тим, що синусний вузол має найшвидший пейсме-керний ритм, він домінує над іншими структурами провідної системи. Його називають водієм ритму першого поряд-: ку. Якщо збудження від синусного вузла не надходить до атріовентрикулярного (як це буває при формуванні рубця сполучної тканини між цими утвореннями), то в передсердно-шлуночковому вузлі починають генеруватися власні ПД, але з меншою частотою. Цей вузол називають водієм ритму другого порядку. Ще менша частота довільних ПД пучка Гіса. Практично не мають здатності до автоматизму волокна Пуркіньє.
Таким чином, між різними утвореннями провідної системи серця існує градієнт автоматизму. Наприклад, у серці людини синусно-передсердний вузол генерує збудження з частотою близько 70 за 1 хв, передсердно-шлуночковий — 40—50, пучок Гіса — 20—ЗО за 1 хв. Йриродно, що з відповідною частотою буде виникати збудження у міокарді, скорочення якого регулюється цим відділом провідної системи.
У деяких випадках у нормі і при патології збудження із передсердь досягає міокарда шлуночків по так званих додаткових жмутиках провідної системи (Кента, Джеймса і Махейма) (мал. 137). Пучком Кента збудження проводиться швидше, ніж через передсердно-шлуночкове сполучення. Тому збудження досягає міокарда шлуночків раніше і частина волокон активізується передчасно. При функціонуванні пучка Джеймса імпульс із передсердь, минаючи атріовентрикулярний вузол, досягає пучка Гіса. Внаслідок сказаного і в цьому випадку частина міокарда шлуночків збуджується передчасно. Пучком Махейма збудження,
обминаючи пучок Гіса, спричиняє скорочення міокарда шлуночків. Таким чином, у ряді випадків може спостерігатись комбіноване збудження міокарда за участю як обов’язкових, так і додаткових шляхів.
ПРОВІДНІСТЬ
Збудження, яке виникло в синусному вузлі, проводиться передсердям зі швидкістю 0,8—1,0 м/с. При передачі збудження із передсердь на шлуночки відзначається його затримка в атріовен-трикулярному вузлі. Вона зв’язана як з особливостями геометричної структури вузла, так і зі специфікою розвитку електричних потенціалів. Має суттєве значення для послідовного скорочення передсердь, а потім шлуночків. Швидкість проведення збудження пучком Гіса і волокнами Пуркіньє становить 1—1,5 м/с. Наступна затримка проведення збудження — у місці контакту волокон Пуркіньє із скоротливими кардіоміоцитами. Вона є наслідком сумації ПД, яка спрямована на синхронізацію процесу збудження міокарда. Швидкість поширення збудження в шлуночках коливається від 0,3 до 0,9 м/с. Висока швидкість проведення збудження провідною системою пояснюється наявністю в ній швидких №+-каналів. Завдяки цьому швидкість розвитку деполяризації тут найвища.
Через відсутність швидких іонних токів у клітинах верхньої частини атріовентрикулярного вузла швидкість проведення збудження невисока (0,02 м/с). На мал. 138 показано виникнення
збудження в різних відділах серця.
Таким чином, збудження усього скоротливого міокарда визначається провідною системою, швидкістю його проведення.
РЕФРАКТЕРНІСТЬ
У міокарді, як і в інших збудливих тканинах, період збудження збігається із періодами його змін — р е ф р а к т е р н і с т ю та екзальтацією. У зв’язку з великим значенням періоду реф-рактерності для роботи серця доцільно виділити його окремо.
Виділяють періоди абсолютної і відносної рефрактерності. їх
Мал. 138. Виникнення збудження у різних відділах серця (А. Саиіоп, 1991)
тривалість залежить від тривалості ПД. Період абсолютної реф-
мВ
20
0
Розслаблення
-20
-40
< Потенціал Крива поодинокого
' СКОРОЧЕННЯ
-60-
-во-
-100
Скорочення
300
1 Час.мс
Вихідний рівень збудливості
Мал. 139. Співвідношення ПД, скорочення та фаз рефракторності міокарда:
1 — швидка деполяризація; 2 — швидка реполяризація; 3 — плато; 4 — реполяризація; 5 —• абсолютна рефрактерність; 6 — відносна рефрактерність; 7 — фаза екзальтації
150
5
рактерності, що характеризується відсутністю відповіді на дію будь-якої сили подразника, є наслідком інактивації Ма+-каналів, відкриття яких потрібне для виникнення нового ПД. Інактивація триває близько 0,25 с. Натрієвий струм починає відновлюватися лише після того, як мембрани кардіоміоцитів реполяризувалися приблизно до рівня — 40 мВ. У період відносної рефрактер-ності дія сильнішого, ніж звичайно, подразника може спричинити появу позачергового ПД. Період відносної рефрак-терності триває 0,03 с. Після нього протягом деякого часу, спостерігається супернормалька збудливість — коли серце
вий м’яз може збуджуватися також під впливом підпорогового подразника (мал. 139).
Для міокарда довготривалість періоду рефрактерності має особливе значення. Вона запобігає виникненню надто частих повторних збуджень міокарда. Такі збудження в скелетних м’язах призводять до тетанусу. Але подібна відповідь з боку міокарда зробила б неможливою нагнітальну функцію серця. Під час рефрактерності шлуночки встигають розслабитися і починають заповнюватися кров’ю. Крім того, рефрактерність «не дозволяє» збудженню безкінечно довго циркулювати по міокарду. Розпочавшись у передсердях, воно знову могло б повернутись до них, обійшовши шлуночки. Але в цей час передсердя перебувають у стадії повної рефрактерності, а це означає, що нова хвиля збудження виникнути в них не може.
ЗДАТНІСТЬ ДО СКОРОЧЕННЯ
Деполяризація мембрани кардіоміоцитів зумовлює їхнє скорочення. Тонкі механізми взаємодії актинових і міозинових волокон, що забезпечують скорочення волокон у міокарді, багато в чому аналогічні відповідним у скелетному м’язі.
Однак специфіка функції скелетних м’язів і міокарда має істотні відмінності. Скелетні м’язові волокна скорочуються поодиноко, коли до них надходить один ПД, або тетанічно, коли імпульси йдуть один за одним до м’яза, який не встигає розслаби
тися. На відміну від цього, для повноцінного вигнання крові серце повинне скорочуватись поодинокими, але тривалими рухами. Причому скорочуватися повинні не окремі волокна, а весь міокард. Це досягається за допомогою провідної системи та вставних дисків кардіоміоцитів, об’єднаних у функціональний синцитій. Завдяки цій особливості серце підлягає законові «все або нічого»: коли починає діяти підпороговий подразник, серце не скорочується або у відповідь на порогову силу скорочується максимально.
Взаємодія актинових і міозинових волокон забезпечує скорочення кардіоміоцитів тоді, коли в саркоплазмі Концентрація вільного Са2+ зростає з 10~7 М (рівень спокою) до 10-5—10-4 М. Це відбувається під час проходження ПД Са2+-каналами сарколеми та СПР. Деполяризація мембран СПР супроводжується відкриттям Са2+-пор, і Са2+ надходить у саркоплазму. Доти, поки стан збудження триває, концентрація Са2+ біля скоротливих філамен-тів є високою, і кардіоміоцити перебувають у стані скорочення. Крім того, висока концентрація цього іона в саркоплазмі підтримується за рахунок Са2+, що надходить ззовні через відкриті повільні канали саркоплазми.
Вважають, що рхідний потік Са2+ при деполяризації саркоплазми використовується не стільки для ініціації скорочення, скільки для поповнення запасів СПР. У скелетному м’язі потужний СПР, і після збудження практично весь Са2+ відкачується в нього. У кардіоміоциті ж ємкість СПР менша, менша також сумарна й питома потужність Са2+-насосів, які відкачують Са2+ в депо після збудження. Частина Са2+ виходить з волокон у міжклітинну рідину, і його кількість без надходження ззовні швидко б виснажилася.
І ще на одну обставину треба звернути увагу: процес залучення Са2+ до підтримки стану деполяризації мембрани кардіоміоци-та дуже «енергоекономічний». Якби така тривала деполяризація підтримувалась №+, то для відновлення попереднього іонного градієнту довелось би витрачати багато енергії на роботу N3+-, К+-помпи. Замість цього частина Са2+, що надійшов, взагалі не виводиться з клітини, а використовується для поповнення СПР.
Са2+ є основним іоном, що забезпечує також міжклітинні контакти: в нексусах розташовано багато повільних Са2+-каналів. Тому всі дії, спрямовані на обмін Са2+, впливають і на проведення збудження кардіоміоцитами.
Вищевказані механізми обміну Са2+ створюють потужний пристосувальний важіль регуляції скорочень. Усі обставини, що призводять до збільшення надходження Са2+ через сарколему, сприяють зростанню сили м’язового скорочення. Це зв’язано з сумацією
концентрації Са2+, який надійшов іззовні і який вийшов із СПР. Навпаки, блокада цього процесу специфічними блокаторами Са2+-каналів (верапамілом, Д-600) супроводжується зниженням і навіть припиненням скорочень.
НАГНІТАЛЬНА ФУНКЦІЯ СЕРЦЯ
Серце, що скорочується, виштовхує кров у артерії. Цю функцію виконують шлуночки. Шлуночки з обох боків (на вході і на
виході) мають клапани, які в певні періоди серцевого циклу затуляють відповідні отвори (мал. 140). Чотири клапанні отвори в серці розташовані приблизно в одній площині. Основи стулок клапанів прикріпляються до жорсткого кільця з фіброзної тканини. З’єднуючись між собою, фіброзні кільця утворюють каркас для прикріплення м’язових волокон кожної камери серця. Клапани призначені для того, щоб кров рухалась завжди в одному на-
прямі.
Атріовентрикулярні клапани (в лівому відділі двостулковий, а в правому — тристулковий) під час систоли шлуночків заважають зворотному закиданню крові в передсердя. Аортальний і легеневий клапани запобігають поверненню крові з цих судин у шлуночки при діастолі.
Перепончасті стулки атріовентрикулярних клапанів, виштовхнувши кров у шлуночки, набувають лійкоподібної форми і вільно пропускають кров із передсердь у шлуночки, коли останні перебува-ютьу стадії діастоли. Завдяки з’єднанню вільних кінців з міокардом
шлуночків за допомогою сухожильних ниток стулки клапанів не
вивертаються в порожнину передсердь під час систоли шлуночків. Кишеньки аортального і легеневого Клапанів, що мають вигляд
Мал. 140. Клапанний апарат серця і напрям кровообігу
півмісяця, оточують отвір судини. Коли атріовентрикулярні або півмісячні клапани закриті, їх стулки тісно дотикаються і щільно закривають вхід (вихід) до шлуночків. Відкриваються і закриваються клапани пасивно током крові.
Передсердя виконують функцію тимчасового депо крові. Коли шлуночки скорочуються і кров не може до них потрапити, вона безперервно притікає венами, збирається в передсердях. Під час систоли передсердь швидко розтягується міокард шлуночків, що сприяє їх наступному скороченню. У передсердях цю функцію виконують
так звані вушка передсердь. Окрім цього, доставляючи під чав систоли різну кількість крові в шлуночки, передсердя беруть участь у регулюванні викиду крові з серця в судини.
СЕРЦЕВИЙ ЦИКЛ
У судинах кров рухається завдяки градієнту тиску в напрямі від високого до нижчого. Шлуночки є тим органом, який створює вказаний градієнт.
Зміна станів скорочення (систоли) і розслаблення (діастоли) відділів серця, яка повторюється циклічно, називається серцевим циклом. При частоті скорочень серця (ЧСС) 75 за 1 хв тривалість усього циклу становить 0,8 є (мал. 141). ,
Серцевий цикл зручно розглядати, починаючи із загальної діастоли передсердь і шлуночків (пауза серця). При цьому серце перебуває в такому стані: півмісячні клапани закриті, а атріовентрикулярні відкриті. Кров із вен надходить вільно і повністю заповнює порожнини передсердь і шлуночків. Тиск крові в них, як і у венах, що лежать поруч, становить близько 0 мм рт. ст. У правій і лівій половинах серця дорослої людини в кінці загальної діастоли вміщується приблизно по 180—200 мл крові.
Систола передсердь. Збудження, що зародилось у синусному вузлі, насамперед надходить до міокарда передсердь — відбувається систола передсердь (0,1 с). При цьому за рахунок скорочення м’язових волокон, розташованих навколо отворів вен, перекривається їх просвіт. Утворюється своєрідна замкнута атріовентрику-лярна порожнина. При скороченні міокарда передсердь тиск у них підвищується до 3—8 мм рт. ст. (0,4—1,1 кПа). Унаслідок цього частина крові з передсердь через відкриті атріовентрикулярні отвори переходить у шлуночки, доводячи об’єм крові в них до 130—140 мл (кінцево-діастолічний об’єм шлуночків — КДО). Після цього починається діастола передсердь (0,7 с).
Систола шлуночків. На цей час провідною системою збудження поширюється на кардіоміоцити шлуночків і починається систола шлуночків, що триває близько 0,33 с. її ділять на два періоди. Кожнийгзтіеріодів відповідно складається із фаз.
Перший період напруження триває доти, поки не відкриються півмісячні клапани. Для їх відкриття тиск у шлуночках має піднятися до вищого рівня, ніж у відповідних артеріальних стовбурах. Діастолічний тиск в аорті становить близько 70—80 мм рт. ст. (9,3—10,6 кПа), а в легеневій артерії — 10—15 мм рт. ст. (1,3—2,0 кПа). Період напруження триває близько 0,08 с.
Починається він із фази асинхронного скорочення (0,05 с), про що свідчить неодночасне скорочення всіх волокон шлуночків. Першими скорочуються кардіоміоцити, які розташовані поблизу волокон провідної системи.
Мал. 141. Зміна деяких показників під час серцевого циклу:
/ — закриття атріовентрикулярного клапана; 2 — відкриття аортального клапана; 3 —закриття аортального клапана; 4 —відкриття атріовентрикулярного клапана; 5 — систола передсердя; 6 — фаза ізометричного скорочення; 7 — період вигнання; 8 — фаза ізометричного розслаблення; 9 — фаза швидкого наповнення; 10— фаза повільного наповнення
Наступна ф а з а ізометричного скорочення (0,03 с) характеризується залученням до процесу скорочення всіх волокон шлуночків. Початок скорочення шлуночків призводить до того, що при закритих ще півмісячних клапанах кров спрямовується до ділянки найменшого тиску — в бік передсердь. Атріовентрикулярні клапани, що лежать на її шляху, током крові закриваються. Вивертанню їх у передсердя запобігають сухожильні нитки, а папілярні м’язи, скорочуючись, роблять їх ще стійкішими. Внаслідок цього на певний Час створюються замкнуті порожнини шлуночків. І доки за рахунок скорочення у шлуночках не підніметься тиск крові вище від рівня, потрібного для відкриття півмісячних клапанів, істотного скорочення волокон не відбувається. Підвищується лише їх внутрішня напруга. Таким чином, у фазу ізометричного скорочення всі клапани серця закриті.
Період вигнання крові починається з відкриття клапанів аорти і легеневої артерії. Він триває 0,25 с і складається з фаз швидкого (0,12 с) і повільного (0,13 с) вигнання крові. Аортальні клапани відкриваються при тиску крові близько 80 мм рт. ст. (10,6кПа), а легеневі — 15 мм рт. ст (2,0 кПа). Відносно вузькі отвори артерій неспроможні відразу пропустити весь об’єм виштовхуваної кро
ві (70 мл), тому скорочення міокарда призводить до подальшого збільшення тиску крові в шлуночках. У лівому воно підвищується до 120—130 мм рт. ст. (16,0—17,3 кПа), а в правому — до 20— 25 мм рт. ст. (2,6—3,3 кПа). Створюваний високий градієнт тиску між шлуночком і аортою (легеневою артерією) сприяє швидкому викиданню частини крові в судину.
Однак через порівняно невелику пропускну здатність судини, в яких досі була кров, переповнюються. Тепер тиск зростає вже в судинах. Градієнт тиску між шлуночками і судинами поступово зменшується, і швидкість течії крові сповільнюється.
У зв’язку з тим що діастолічний тиск у легеневій артерії нижчий, відкриття клапанів вигнання крові з правого шлуночка починаються дещо раніше, ніж з лівого. А через нижчий градієнт вигнання крові закінчується дещо пізніше. Тому діастола правого шлуночка триває на 10—ЗО мс довше, ніж лівого.
Діастола. Наприкінці, коли тиск у судинах підвищується до рівня тиску в порожнинах шлуночків, вигнання крові припиняється. Розпочинається їх діастола, що триває близько 0,47 с. Час закінчення систолічного вигнання крові збігається з часом припинення скорочення шлуночків. Звичайно в шлуночках залишається 60—70 мл крові (кінцево-систолічний об’єм — КСО). Припинення вигнання призводить до того, що кров, яка міститься в судинах, зворотним током закриває півмісячні клапани. Цей період називається протодіастолічним (0,04 с). Після цього напруга спадає, і настає ізометричний період розслаблення (0,08 с), після якого шлуночки під впливом крові, що надходить, починають розправлятися.
На цей час передсердя після систоли вже повністю заповнені кров’ю. Діастола передсердь триває близько 0,7 с. Наповнюються передсердя головним чином кров’ю, що пасивно витікає з вен. Але можна виділити й «активний» компонент, який проявляється у зв’язку з частковим збігом його діастоли з систолою шлуночків. При скороченні останніх площина атріовентрикулярної перегородки зміщується в напрямку до верхівки серця; внаслідок цього утворюється при-смоктувальний ефект (мал. 142).
Коли спадає напруження стінки шлуночків, атріовентрикулярні клапани током крові відкриваються. Кров, що заповнює шлуночки, поступово розправляє їх.
Мал. 142. Механізм присмоктування при вміщенні атріовентрикулярної перегородки (за даними Р. Ф. Шмідта, Г. Тевса, 1985):
Л _ діастола передсердь 1 систола шлуночків (тристулковий клапан закритий, легеневий — відкритий); Б — систола передсердь, діастола шлуночків (тристулковий клапан відкритий, легеневий — закритий)
Період наповнення шлуночків кров’ю ділиться на фази швидкого {при діастолі передсердь) і повільного (при систолі передсердь) наповнення. Перед початком нового циклу (систоли передсердь) шлуночки, як і передсердя, встигають повністю заповнитися кров’ю. Тому за рахунок надходження крові при систолі передсердь внутрішньошлунковий об’єм збільшується приблизно лише на 20—ЗО %. Але цей показник істотно зростає при інтенсифікації роботи серця, коли скорочується загальна діастола і кров не встигає заповнити шлуночки.
СИСТОЛІЧНИЙ І ХВИЛИННИЙ
ОБ'ЄМИ КРОВОТОКУ
Кількість крові, що викидається шлуночками при кожному скороченні, називається систолічним, або ударним, об’ємом (УО). Величина УО залежить від статі, віку людини, функціонального стану організму. В спокійному стані у дорослого чоловіка УО дорівнює 65—70 мл, у жінки — 50—60 мл. За рахунок підключення резервних можливостей серця УО може бути збільшений приблизно у 2 рази (мал. 143).
Перед систолою в шлуночку міститься близько 130—140- мл крові — к і н ц е в о - д і а ст о л і ч н а ємкість (КДЄ). А після систоли в шлуночках залишається кінцево-систолічний о б’ є м, що дорівнює 60—70 мл. При потужнішому скороченні УО може збільшуватися до 100 мл за рахунок ЗО—40 мл систолічного резервного об’єму (СРО). В кінці діастоли в шлуночках може бути на ЗО—40 мл більше крові. Це резервний діастолічний об’єм (РДО). Таким чином, загальна ємкість шлуночка може бути збільшена до 170—180 мл. Використовуючи обидва резервні об’єми, шлуночок може довести систолічний викид до 130—140 мл. Після найсильнішого скорочення в шлуночках залишається близько 40 мл залишкового об’єму (ЗО) крові.
УО обох шлуночків приблизно однаковий. Однаковим повинен бути і х в и л и н н и й об’єм кровотоку (ХОК), що називає-хвилинним об’ємом серця.
Його легко визначити, знаючи УО та ЧСС : ХОК=УОхЧСС^
У стані спокою у дорослого чоловіка ХОК дорівнює близько 5 л. За певних умов, наприклад, при виконанні фізичної праці, ХОК за рахунок збільшення УО і ЧСС може підвищуватись до 20—ЗО л. Максимальний приріст ЧСС залежить від віку людини.
ться серцевим викидом,
Таблиця 12. Тривалість систоли та діастоли шлуночків при різній ЧСС
ЧСС за 1 хв Систола, с Діастола, с
70 0,28 0,58
150 0,25 0,15
200 0,21 0,11
Мал. 143. Фракції діастолічної ємкості лівого шлуночка (за даними В. Л. Карпмана, 1978): ДРО — додатковий резервний об’єм; УО — ударний об’єм; БРО — базальний резервний об’єм; ЗО — залишковий об’єм
Його приблизну величину можна визначити за формулою:
ЧССмакс=220 —В, де В — вік (роки).
ЧСС збільшується за рахунок незначного скорочення тривалості систоли та істотного зменшення тривалості діастоли (табл. 12).
Надмірне скорочення тривалості діастоли супроводжуєтья зниженням КДЄ. Це в свою чергу призводить до зменшення УО. Найвища продуктивність діяльності серця молодої людини звичайно буває при ЧСС 150—170 за 1 хв.
На сьогодні розроблено чимало методів, що дозволяють прямо або посередньо судити про величину серцевого викиду. Запропонований А. Еіск (1870) метод грунтується на визначенні різниці вмісту О2 в артеріальній і змішаній венозній крові, що надходить
у легені, а також встановленні об’єму О2, що споживається людиною за 1 хв. Простий розрахунок дозволяє встановити об’єм крові, що пройшла через легені за 1 хв (ХОК). Стільки ж крові викидає за 1 хв і лівий шлуночок. Тому, знаючи ЧСС, легко визначити і середню величину УО (ХОК : ЧСС).
Широкого застосування набув метод розведення. Суть його полягає у визначенні ступеня розведення і швидкості циркуляції в крові в різні проміжки часу речовин (деякі фарби, радіонукліди, охолоджений ізотонічний розчин натрію хлориду), введених у вену.
Використовують метод і прямого вимірювання ХОК за допомо-
гою накладання ультразвукових чи електромагнітних датчиків на аорту з реєстрацією показників на моніторі та папері.
Останнім часом широко використовують неінвазивні методи (інтегральна реографія, ехокардіографія), які дозволяють досить точно визначити ці показники як у стані спокою, так і при різноманітних навантаженнях.
МЕХАНІЧНА РОБОТА СЕРЦЯ
Під час викиду шлуночки здійснюють роботу по переміщенню об’єму крові в судини. Кров, що міститься в судинах, та власне судини при цьому чинять опір. Робота (XV) складається із зусиль,
спрямованих на переміщення об’єму (V) крові проти тиску (Р), та надання маїсі крові (т) прискорення: XV = Р XV+ту2/2.
Про середній артеріальний тиск (Рсер), середню лінійну швидкість (Усер) розповідається в наступному розділі. Тут наведено лише формули розрахунку роботи обох шлуночків.
Робота лівого шлуночка: РхУ=0,931 Нм*; ту2/2=0,009 Нм; XV = 0,94 Нм.
Робота правого шлуночка: РхУ=0,14 Нм; ту2/2=0,09 Нм; ХУ = 0,15 Нм.
Потужність (робота, що виконується за певну одиницю часу) серця залежить від ЧСС та УО. У стані спокою вона приблизно становить 0,1 кГм/с (1 Вт). При виконанні м’язової роботи потужність серця значно зростає, тому збільшується ХОК.
ВЗАЄМОВІДНОСИНИ МІЖ СЕРЦЕВИМ ТИСКОМ
І НАПРУЖЕННЯМ СТІНКИ
Згідно із законом Лапласа, підвищення тиску в середині шлуночків при скороченні пов’язане зі зменшенням їх розмірів. Але зростання тиску міокарда на кров супроводжується розвитком напруження у власній стінці. Напруження — сила, що припадає на одиницю поперечного перетину стінки:
Р,=р.2с1/г,
де Рі — тиск, Р — напруження стінки серця, г — радіус, <1 — товщина стінки.
Якщо умовно прийняти шлуночок за сферу, радіус якої в період вигнання зменшується, а товщина стінки збільшується, то вищенаведена формула свідчитиме про те, що зі зростанням тиску напруження стінки підвищується. Виходячи з формули, напруження зростає прямо пропорційно радіусові і зворотно пропорційно товщині стінки:
Р = Р4 • г/26.
З виникненням напруження у серцевому м’язі доводиться рахуватися у разі патологічних станів. Так, при інфаркті, коли руйнуються міокардіальнІ клітини і розвивається сполучна тканина, серце може розірватися.
ПОКАЗНИКИ ФУНКЦІЇ СЕРЦЯ
Усі функціональні властивості серця можна проконтролювати. На сьогодні розроблено велику кількість методів, які дозволяють одержати об’єктивну характеристику стану серця, визначити його
* Нм — ньютонометр.
активність і функціональні резерви. Вони детально описані в посібниках з кардіології. Тут ознайомимося лише з основами деяких із них.
ЕЛЕКТРОКАРДІОГРАФІЯ
Електрокардіографія — графічний запис змін різниці електричних потенціалів, що виникають на поверхні тіла внаслідок діяльності серця.
Процес поширення потенціалу (хвилі деполяризації і реполяри-зації) можна умовно уявити як переміщення подвійного шару зарядів, розташованих на кордоні збудженої і незбудженої ділянок міокарда. Ці заряди однакові за величиною і протилежні за знаком. Вони перебувають на безкінечно малій відстані один від одного і позначаються диполем. Позитивний полюс диполя ( + ) завжди повернений у бік незбудженої, а негативний (—) — у бік збудженої ділянки міокардіального волокна. Диполь складає елементарну ЕРС. ЕРС диполя — векторна величина. Прийнято вважати, що напрямок вектора будь-якого диполя йде від його негативного полюса до позитивного.
При збудженні в/серці одночасно виникає багато векторів, які мають різні величину й напрямок. На ЕКГ реєструється сумарний (моментний) вектор, який визначається як алгебраїчна сума всіх векторів, що його складають. Таким чином, при записуванні ЕКГ напруга, яка реєструється між двома електродами на поверхні тіла, залежить від величини сумарного моментного вектора (ЕРС), питомого опору тканини тіла і орієнтації вектора стосовно відвідних електродів. Напруга пропорційна косинусу кута, який міститься між віссю диполя і віссю відведення. Вона буде найвищою в тих випадках, коли ці всі вісі паралельні одна до одної, і дорівнює 0, якщо вони перпендикулярні.
Величина зубців ЕКГ зворотно пропорційна квадрату відстані від електрода до серця як джерела ЕРС. Це означає, що чим далі розташований електрод від джерела струму, тим менша амплітуда зубців ЕКГ. Однак при віддаленні електродів більше ніж на 12 см від серця подальші зміни амплітуди зубців будуть незначними.
Реєстрація ЕКГ проводиться за допомогою електрокардіографів. При реєстрації ЕКГ використовують не менше як 12 відведень. Стандартні відведення від кінцівок запропонував у 1913 р. XV. ЕіпіЬоуєп (мал. 144). Це 3 двополюсні відведення: І —1 права рука (—)—ліва ( + ); II — права рука (—)—ліва нога ( + ); III — ліва нога ( + ) — ліва рука (—). Знаком (—) і ( + ) позначені позитивний і негативний полюси відведення. Лінія, що з’єднує 2 точки відведення, називається лінією відведення. Три стандартних відведення утворюють рівнобедрений трикутник — трикут-
Мал. 144. Стандартні двополюсні відведення від кінцівок (за даними А. Везро-роиіоз, 81. 8і1Ьегпа£І, 1986):
І, II, III — біполярні відведення у трикутнику Ейнтховена
ник Ейнтховена, в центрі якого міститься серцевий єдиний диполь. Перпендикуляри, опущені із центра трикутника, ділять кожну лінію відведення на 2 частини — позитивну й негативну. Якщо мо-ментний вектор серця проектується на позитивну частину лінії відведення, реєструється позитивний зубець, спрямований вгору, якщо на негативну — негативний, спрямований вниз (мал. 145).
При реєстрації підсилених однополюсних відведень від кінцівок (за методом Е. СоІдЬег^ег, 1942) записується різниця потенціалів між однією із кінцівок, електрод від якої приєднаний до позитивного полюса електрокардіографа, і об’єднаним електродом Гольдбергера. Об’єднаний електрод утворюється при з’єднуванні двох інших відведень від кінцівок через опір.
Стандартні й підсилені відведення від кінцівок дозволяють зареєструвати поширення деполяризації і реполяризації у фронталщ ній площині.
Грудні однополюсні відведення, запропоновані Р. \Уі1зоп (1934), характеризуються накладанням одного із електродів (активного) на поверхню грудної клітки в спеціальних точках. Другий (об’єд-
Мал. 145. Векторний аналіз (а), векторна нетля у просторі (б)
наний) електрод Вільсона, що утворюється при з’єднанні через додаткові опори електродів З кінцівок, об’єднаний потенціал яких становить близько 0,2 мВ, приєднують до негативного полюса електрокардіографа. Грудні відведення позначають латинською літерою V (V]— Уб). Вони дозволяють реєструвати зміни ЕРС у горизонтальній площині. Лінія (вісь) відведень — лінія, що з’єднує центр диполя серця з місцем розташування відвідного (активного) електрода на грудній клітці. >
Двополюсні грудні відведення (за методом XV. МеііЬ, 1938) характеризуються тим, що електроди, які застосовують при стандартних відведеннях від кінцівок, розташовують на грудній клітці. Ці відведення дозволяють точніше оцінити зміни ЕРС міокарда задньої, перед-ньобокової і верхніх відділів передньої стінки.
Форма ЕКГ залежить як від місцеперебування електродів на тілі, так і від розташування серця у грудній клітці (електричної осі). Простежується чітка залежність між формами ЕКГ та її зубців і функціональним станом міокарда.
При патології форма електрокардіограми змінюється. Це є критерієм для встановлення діагнозу.
На прикладі «класичного» другого відведення (мал. 146) розглянемо походження кожного із елементів ЕКГ. При аналізі ЕКГ звичайно звертають увагу на характер кожного з елементів, їх розташування на кривій, відхилення від ізоелектричної лінії (зубці), вираженість (амплітуду) відхилень та їх тривалість. Амплітуду ЕКГ-зубців визначають за величиною середніх серцевих векторів, а їх полярність — за орієнтацією середніх серцевих векторів. Інтервали ЕКГ характеризують швидкість деполяризації і реполяризації.
При загальній діастолі серця реєструється ізоелектрична лінія, яка свідчить про відсутність різниці потенціалів між окремими структурами серця. Зубець Р відповідає періоду збудження
Мал. 146. Зубці, інтервали та сегменти електрокардіограми (інтервали Р<2, <2Т, сегменти Р<2, 8Т)
передсердя. Амплітуда його менша чи дорівнює 0,2 мВ, тривалість— 0,11 с. Хвиля реполяриза-ції передсердь не помітна на ЕКГ через те, що вона маскується наступними хвилями. Середній вектор орієнтований униз, ліворуч, дещо вперед чи назад. У нормі у відведеннях І, II, аУЕ, Уг—Ує зубець Р завжди позитивний.
Інтервал Р(2 вимірюється від початку зубця Р до початку комплексу (2Р8, тобто зубців $ чи Р (якщо <2 дорівнює 0). Він відображає час від початку де
поляризації передсердь до початку деполяризації шлуночків і характеризує швидкість проведення збудження передсердями, АВ-вузлом, пучком Гіса і його розгалуженнями. Його тривалість — 0,1—0,21 с. У нормі що більша час-
тота скорочень серця, то коротший цей інтервал.
Процес деполяризації шлуночків характеризується трьома векторами шлуночкового комплексу — початковим, головним і кінцевим. Той вектор, що відповідає періоду формування зубця <2, орієнтований вперед праворуч угору чи вниз —
залежно від положення серця. Він утворений початковим момент-ним вектором деполяризації міжшлуночкової перегородки. Зубець 0, формується за рахунок збудження провідної системи шлуночків, близько розташованих кардіоміоцитів внутрішньої поверхні шлуночків, правого сосочкового м’яза та верхівки серця. Він має амплітуду меншу ніж */4 зубця Р, тривалість — 0,04 с. У нормі реєструється в усіх стандартних і посилених однополюсних відведеннях від кінцівок і в грудних відведеннях. У відведеннях аУК може бути зареєстрований глибокий і широкий зубець (2.
Зубець Р — головний вектор комплексу 0Р8. Він відображає процес подальшого поширення збудження міжшлуночковою перегородкою, міокардом правого і лівого шлуночків. Цей момент-ний вектор називають головним вектором серця, а лінію, яка проходить через нього до перетину з лінією І відведення,— електричною віссю серця. В нормі зубець Р може реєструватись у всіх стандартних і посилених відведеннях. Головний вектор серця орієнтований ліворуч, назад і вниз або вгору — залежно від положення серця. У відведенні аУЬ зубець Р іноді погано виражений або відсутній. У грудних відведеннях амплітуда зубця завжди збільшується, наростаючи від відведення Уі до відведення У4, а потім дещо зменшується у відведенні У5 і У6; іноді у відведенні Уі він
може бути відсутнім. Тривалість зубця /? становить 0,04 с. Під кінець зубця /? збудженням охоплюються обидва шлуночки, за винятком невеликої частини основи лівого шлуночка.
Зубець 5 — кінцевий вектор деполяризації обох шлуночків. Він відображає деполяризацію в базальних відділах міжшлуноч-кової перегородки правого і лівого шлуночків. Вектор орієнтований назад, вгору і дещо праворуч. Амплітуда зубця 5 коливається у великих межах (залежно від відведення). Проекція вектора записується як негативний зубець 5 у більшості відведень, за винятком аУЬ і лівого грудного Уб. У грудних відведеннях Уг, Уз або Уз і У 4 може дорівнювати зубцю /?. Тривалість його — 0,06 с. Максимальна Тривалість шлуночкового комплексу <2Р8— 0,07— 0,09. Інтервал вимірюється від початку комплексу С}Р8 до кінця зубця Т. Цей інтервал відображає швидкість деполяризації ((2Р8) і реполяризації (8Т) щлуночків. Його називають електричною систолою шлуночків. Тривалість його становить 0,35—0,40 с при частоті 75 скорочень за 1 хв.
Зубець Т відображає реполяризацію шлуночків. Середній моментний вектор орієнтований у тому самому напрямку, що й головний вектор серця — зубець /?, Отже, полярність зубця Т збігається з напрямом зубця /?, тобто він позитивний у відведеннях І, II, аУЕ, У«—Уб, негативний — в аУК і негативний, двофазний або позитивний — у відведеннях III, аУЬ, Уі—Уз. Амплітуда зубця Т у відведеннях від кінцівок не перевищує 0,5— 0,6 мВ, у грудних відведеннях—1,5—1,7 мВ, тривалість — 0,16— 1,24 с.
Інтервал між зубцями Т і новим зубцем Р відповідає періоду електричної діастоли серця.
Окрім інтервалів, протягом серцевого циклу на ЕКГ відображаються сегменти, для яких не характерна різниця потенціалів — Ці ділянки ЕКГ розташовані на ізолінії. Сегмент РС} відображає період, коЛи передсердя повністю деполяризовані. Вимірюється він від кінця зубця Р до початку зубця Р. Сегмент 8Т — відрізок ізолінії від кінця комплексу &Р8 до початку зубця Т. Він відповідає періоду повної деполяризації обох шлуночків. У нормі сегмент 8Т у відведеннях від кінцівок лежйть на ізолінії (±0,5 мВ). У грудних відведеннях Уі—У3 відхилення сегмента вгору не повинно перевищувати 2 мм, а у відведеннях У4—Ує — вниз не більше 0,5 мм. ,
Електрична вісь серця. Проекцію середнього результативного вектора на фронтальну площину називають середньою електричною віссю серця (А (}8Р). Положення електричної осі серця в шестивісьовій систолі Бейлі виражається величиною кута альфа (а); утвореного електричною віссю серця і ПОЗИТИВНОЮ половиною осі І відведення (мал. 147). У нормі положення електричної осі
серця приблизно відповідає положенню його анатомічної осі. Залежно від конституції (нормостенічна, астенічна, гіперстеніч-на)', а також положення анатомічної осі серця в грудній клітці розрізняютьДакі варіанти положення електричної осі серця: а) нормальне, коли кут а складає ( + )30 — (4-)69°; б) вертикальне, коли кут а дорівнює (+)70— ( + )90°; в) горизонтальне, коли величина кута а варіює від 0 до ( + )29°.
Значні повороти електричної осі серця
Мал. 147. Визначення навколо передньо-задньої осі, як прави-кута а ло, зумовлені змінами в міокарді (гіпер-
трофія міокарда шлуночків або порушення внутрішньошлуночкової провідності, зміни під час вагітності).
ВЕРХІВКОВИЙ ПОШТОВХ
Методом простої пальпації або за допомогою приладів можна встановити, що при кожній систолі в лівому п’ятому міжребер’ї по серединноключичній лінії протягом короткого часу з’являється випинання грудної стінки. Воно є наслідком переміщення верхівки серця в бік передньої стінки грудної клітки при зміні форми і об’єму серця в момент систоли.
ТОНИ СЕРЦЯ
Якщо над проекцією клапанних стулок або в найближчій до аорти і легеневої артерії ділянці до грудей прикласти стетоскоп чи мікрофон фонокардіографа, то можна почути звуки, що супроводжують кожне скорочення серця (мал. 148). Вухом можна розрізнити 2 звуки (тони). Чутливіший прилад дозволяє зафіксувати появу 4 тонів.
Перший (систолічний) тон збігається за часом із початком систоли шлуночків. У його формуванні беруть участь З компоненти — клапанний, м’язовий та судинний. Клапанний компонент зумовлений закриттям стулок передсердно-шлуйочкових клапанів, вібрацією цих стулок та сухожильних ниток, які утримують ці стулки, турбулентним рухом крові, вібрацією стінки шлуночків у фазу ізометричного скорочення, а також коливанням початкових відділів аорти та легеневого стовбура у фазу швидкого викидання крові.
Основним компонентом названого тону є клапанний. Він головним чином впливає на силу систолічного тону. Так, при підвищенні інтенсивності скорочення шлуночків у зв’язку з швидким на-
0,1с
Мал. 148. Фонокардіограма
ростанням тиску тон стає голоснішим. Це ж саме спостерігається і в тому випадку, коли стулки клапанів розкриті ширше при збільшенні кровонаповнення шлуночків. Тривалість систолічного тону становить близько 0,14 с.
Другий (діастоЛічний) тон зумовлений ударом стулок півмісячних клапанів одна об одну при їх закритті на початку діастоли, їх вібрацією, турбулентним рухом крові, яка б’ється об закриті стулки клапанів, вібрацією великих артерій (аорти та легеневого стовбура). Його тривалість — від 0,08 до 0,11 с.
Третій тон виникає внаслідок вібрації стінок шлуночків у фазу швидкого заповнення їх кров’ю, четвертий — при систолі передсердь і поверненні частини крові в передсердя, коли на початку систоли шлуночків атріовентрикулярні клапани ще відкриті.
Тони серця добре чути над клапанами: перший — над атріо-вентрикулярними, другий — над півмісячними. Звук краще проводиться з током крові, і тому окремо клапани краще вислуховувати за ходом відповідної судини (аорти чи легеневої артерії).
При вадах клапанів, порушенні стану скоротливого міокарда тони змінюються: підвищується чи знижується інтенсивність звучання їх, з’являються шуми. Реєстрація дефекту тону над проекцією певного клапану допомагає встановити природу порушення.
ВІКОВІ ОСОБЛИВОСТІ
ФУНКЦІЇ СЕРЦЯ
✓
У ембріональний період основні структури серця формуються рано, тому ца 3-му тижні воно вже функціонує під впливом власного ритМу синусного вузла. (Центральна артерія синусного вузла, що. сприяє ритмом свого пульсу функціональному об’єднанню, синхронізації окремих пейсмекерних клітин його, також формується на ранніх етапах розвитку).
Іннервація синусного вузла спостерігається ще у внутрішньо-утробний період і здійснюється спочатку адренергічними структурами. Холінергічна іннервація розвивається значно пізніше і завершується через кілька місяців після народження. Однак оста-
Таблиця 13. Функціональні показники серця у людей різного віку
Вік ЧСС за 1 хв УО хок
Абсолютна величина, мл Відносна величина, мл/кг Абсолютна величина, мл Відносна величина, мл/кг
Внутрішньоутробний період 6 міс 140 1,0 1»о 140 140
8 » 130 3,1 1,5 400 195
Новонароджений 140 3,5 1,0 490 140
1 рік 120 10,5 1,0 1250 126
4 роки 105 19,0 1,2 1995 124
6 років 90 25,0 1,1 2500 114
10 » 78 44,0 1,1 3200 80
14 » 74 59,0 1.1 4300 78
Доросла людина Людина похилого 72 70,0 1,0 5000 70
віку 68 60,9 0,87 . 4040 58
точне формування механізмів регуляції функції серця відбувається тільки через 2 роки.
Загалом у період внутрішньоутробного розвитку нервова регуляція діяльності серця не має великого значення. ЧСС плода залежить головним чином від автоматизму водія ритму.
За допомогою овального міжпередсердного отвору і артеріальної протоки обидва шлуночки серця з’єднуються у функціональний орган, що виганяє кров у загальну систему кровообігу. Тому у плода і Немовляти стінки обох шлуночків мають майже однакову товщину. На момент народження маса правого і лівого шлуночків складає відповідно 38,6 і 29,9 % від загальної маси серця. Правий шлуночок серця має більшу масу, оскільки на нього припадає більше навантаження у зв’язку з переборюванням опору, який чинить вузька артеріальна протока. У внутрішньоутробний період у правому шлуночку тиск підвищується до 60—70 мм рт. ст. (8— 9,3 кПа), а в лівому — до 50—60 мм рт. ст. (6,7—8 кПа).
Після народження у зв’язку із включенням малого кола кровообігу та розподілом обох кіл опір у великому колі різко підвищується і стінка лівого шлуночка поступово гіпертрофується. За весь період дитинства маса лівого шлуночка збільшується в 2,5 разу, а правого — лише в 0,5 разу. ЧСС до моменту народження становить близько 130 за 1 хв. Тривалість систоли складає 0,17— 0,25 с, а діастоли — 0,15—0,24 с. СО доходить до 3—3,5 мл, а ХОК складає близько 450 мл/хв. Маленьке серце плода постачає тканинам в 2—3 рази більший об’єм крові, ніж серце дорослої людини. Інтенсивніший кровотік у плода зумовлюється не тільки високою активністю процесів обміну в їх тканинах, але й тим, що з кожним мілілітром крові плода надходить до тканин менша кількість кисню.
Після народження функціональні показники серця поступово змінюються (табл. 13).
У похилому віці УО і ХОК зменшуються відповідно на 26 і ЗО %. Падають серцевий (до 26 %) і робочий (на 10 %) індекси лівого шлуночка, зменшуються тиск крові в лівому шлуночку (на 11 %) і максимальна швидкість наростання внутрішньошлуночко-вого тиску (на 19 %). Знижуються максимальна швидкість скорочення волокон міокарда (на 15 °/о) і індекс його скоротливості (на 30%). У старечому віці збільшується тривалість систоли, її періодів та фаз, зменшується тривалість діастоли. Вплив вегетативної нервової системи на серце зменшується, а чутливість міокарда до гуморальних чинників підвищується.
Таким чином, протягом життя функція серця змінюється нерівномірно. На ранніх етапах онтогенезу вона поступово наростає, в молодому віці тримається на оптимальному рівні, а в похилому — вірогідно знижується.
РЕГУЛЯЦІЯ ДІЯЛЬНОСТІ СЕРЦЯ
Функція серця, тобто сила і частота його скорочень, змінюється залежно від стану організму і умов, у яких організм перебуває. Забезпечуються ці зміни регуляторними механізмами, які можна поділити на міогенні (пов’язані з фізіологічними властивостями власне структур серйя), гуморальні (вплив різних фізіологічно активних речовин, що виробляються безпосередньо в серці і організмі) та нервові (здійснюються за допомогою інтра- і екст-ракардіальної системи).
Міогенні механізми. Закон Франка—Старлінга. Завдяки властивостям скоротливих міофіламентів міокард може змінювати силу скорочення залежно від ступеня наповнення порожнин серця. При постійній ЧСС сила серцевих скорочень збільшується з ростом венозного припливу крові. Це спостерігається, наприклад, при зростанні кінцево-діастолічного об’єму із 130 до 180 мл.
Припускають, що в основі механізму Франка—Старлінга лежить початкове розташування актинових і міозинових філаментів у саркомірі. Ковзання ниток одна відносно іншої здійснюється при взаємному перекритті завдяки утворюваним поперечним місткам. Якщо ці нитки розтягнуті, то кількість можливих «кроків» зросте, отже, збільшиться й сила наступного скорочення (позитивний інотропний ефект). Але подальше розтягування може призвести до того, що актинові і міозинові нитки вже не будуть перекриватися і не зможуть утворити містки для скорочення. Тому надмірне розтягнення м’язових волокон спричинить зменшення сили скорочення, тобто негативний інотропний ефект. Це спостерігається при збільшенні кінцево-діастоличного об’єму вище від 180 мл (мал. 149).
<- 1. > - -І_І—
75 100 125 150 175 мм репет.
Тиску аорті
О Ю 20 ЗО 40
Приплив, мл
Мал. 149. Співвідношення припливу, хвилинного об’єму (1) і частоти скорочень серця (2)
Мал. 150. Залежність ударної роботи серця від тиску крові в аорті
Механізм Франка—Стерлінга забезпечує збільшення УО при підвищенні венозного припливу крові у відповідний відділ (правий чи лівий) серця. Він же сприяє посиленню серцевих скорочень при зростанні опору викиданню крові в судини. Остання обставина може бути наслідком підвищення діастолічного тиску в аорті (легеневій артерії) або звуження цих судин (коарктації). В даному випадку можна уявити таку послідовність розвитку змін. Підвищення тиску в аорті призводить до різкого збільшення коронарного кровотоку, при якому механічно розтягуються кардіоміоцити і, згідно з механізмом Франка—Старлінга, до їх посиленого скорочення, підвищення УО крові. Це явище носить назву ефекту Анре-па (мал. 150).
Механізм Франка—Старлінга і ефект Анрепа забезпечує авторегуляцію функції серця при багатьох фізіологічних станах (наприклад, при фізичному навантаженні). У такому разі ХОК може бути збільшеним на 13—15 л/хв.
Хроноінотропія. Залежність сили скорочення серця від частоти його діяльності (драбина Боудіча) є фундаментальною властивістю міокарда. Серце людини та більшості тварин, за винятком щурів, у відповідь на підвищення ритму реагує збільшенням сили скорочень і, навпаки, зі зменшенням ритму сила скорочень падає. Механізм цього феномена зв’язаний з накопиченням чи падінням в міоплазмі концентрації Са2+, а також збільшенням чи зменшенням кількості поперечних містків, що зумовлює позитивні або негативні ефекти серця.
Гуморальні механізми. Вплив інкреторної функції серця. У серці, особливо в його передсердях, утворюються біологічно активні сполуки (дигіталісоподібні чинники, катехоламіни, продукти арахідонової кислоти) і гормони, зокрема, передсердний
натрійуретичний та ренін-ангіотензиновї сполуки. Обидва гормони беруть участь у регуляції скоротливої активності міокарда, ХОК. Останній із них має специфічні рецептори, при дії на які розвивається гіпертрофія міокарда.
Вплив іонів на функцію серця. Переважна більшість регуляторних впливів на функціональний стан серця пов’язана з мембранними механізмами провідної системи та кардіоміоцитів. Мембрани передусім відповідають за проникнення іонів. Стан мембранних каналів, переносників, а також насосів, що використовують енергію АТФ, впливає на концентрацію іонів у міоплазмі. Істотна роль у трансмембранному обміні іонами належить концентраційному градієнту, який визначається насамперед концентрацією їх у крові, а отже, і в міжклітинній рідині. Збільшення зовнішньо-клітинної концентрації іонів призводить до зростання пасивного надходження їх у кардіоцити, зниження — до «вимивання». Цілком ймовірно, що кардіогенний ефект іонів послужив однією із підстав для формування в процесі еволюції складних систем регуляції, що забезпечує їх гомеостаз у крові.
Вплив Са2+. Якщо вміст Са2+ у крові знижується, то збудливість і скоротливість серця зменшується, а при збільшенні, навпаки, підвищується. Механізм цього явища зв’язаний із рівнем Са2+ у клітинах провідної системи та робочого міокарда, залежно від якого розвиваються позитивні чи негативні ефекти діяльності серця.
Вплив к+. При зменшенні концентрації К+ (менше ніж 4 ммоль/л) у крові зростають пейсмекерна активність та ЧСС. При збільшенні його концентрації ці показники зменшуються. Дворазове підвищення вмісту К+ в крові може призвести до зупинки серця. Цей ефект використовують у клінічній практиці для зупинки серця під час проведення на ньфму хірургічних операцій. Механізм цих змін пов’язаний зі зменшенням співвідношення між зовнішнім і внутрішньоклітинним к+, підвищенням проникності мембран до К+, зниженням потенціалу спокою.
Вплив Ца+. Зниження вмісту Ца+ в крові може призвести до зупинки серця. В основі цього впливу лежить порушення градієнтного трансмембранного транспорту №+, Са2+ і поєднання збудливості із скоротливістю. Незначне підвищення рівня Ца+ завдяки Ца+-, Са2+-обміннику призведе до збільшення скоротливості міокарда.
Вплив гормонів. Ряд справжніх (адреналін, норадреналін, глюкагон, інсулін та ін.) і тканинних (ангіотензин II, гістамін, серотонін та ін.) гормонів стимулюють функцію серця. Механізм дії, наприклад, норадреналіну, серотоніну і гістаміну пов’язаний із відповідними рецепторами: 0-адренорецепторами, На-гістаміновими і серотоніновими. Внаслідок їх взаємодії збільшуються концентрації аденілатциклази, цАМФ, активізуються кальцієві канали, на-
копичується внутрішньоклітинний Са2+, що і зумовлює зрештою підвищення діяльності серця.
Крім цього, гормони, які активізують аденілатциклазу, утворення цАМФ, можуть діяти на міокард опосередковано, через посилення розщеплення глікогену та окислення глюкози. Інтенсифікуючи утворення АТФ, такі гормони, як адреналін і глюкагон, також стають причиною позитивної ігіотропної реакції.
Навпаки, стимуляція утворення цГМФ інактивує Са2+-канали, що обумовлює негативний вплив на функції серця. Таким чином діють на кардіоміоцити медіатор парасимпатичної нервової системи ацетилхолін, а також брадикінін. Але, крім цього, ацетилхолін &К+-проникність і тим самим зумовлює гіперполяризацію. Наслідком цих впливів є зниження швидкості деполяризації, скорочення тривалості ПД, зниження сили скорочення.
Вплив метаболітів. Для нормального функціонування серця потрібна енергія. Тому всі зміни вінцевого кровотоку, трофічної функції крові позначаються на роботі міокарда.
При гіпоксії, внутрішньоклітинному ацидозі блокуються на мембрані кардіоміоцитів повільні Са2+-канали, пригнічуючи тим самим скоротливу активність. У цьому ефекті є елементи самозахисту серця, оскільки не витрачена на скорочення АТФ забезпечує життєздатність кардіоміоцитів. І якщо гіпоксія буде ліквідована, то збережений кардіоміоцит почне знову виконувати нагнітальну функцію.
Збідьшення в серці концентрацій креатинфосфату, вільних жирних кислот, молочної кислоти як джерела енергії супроводжується підвищенням діяльності міокарда. Розкладаючи молочну кислоту, серце не тільки отримує додаткову енергію, а й сприяє підтримці постійної рН крові.
Механізми нервової регуляції серця
Вплив інтракардіальної нервової системи. В серці містяться всі структури, що забезпечують місцеві кардіо-кардіальні рефлекси, дуга яких замикається на рівні інтрамуральних гангліїв (мал. 151). У передсердях та лівому шлуночку виявлено два типи рецепторів, що відповідають за сприймання активної напруги і пасивного розтягу їх стінок. Аферентні волокна від них закінчують-: ся на нейронах, розташованих між міокардіальними волокнами. Еференти забезпечують передачу збудження до міокарда як у місці їх знаходження, так і в інші відділи серця.
Внутрішньосерцеві рефлекси здатні змінити скоротливу активність різних відділів серця. Прикладом такого рефлексу може бути те, що при збільшенні припливу крові до правого передсердя посилюється скорочення лівого шлуночка. Адаптивний сенс цього рефлексу полягає в тому, що серце ніби заздалегідь «звіль-
Це призведе до знижен-
Мал. 151. Схема інтракардіальних рефлекторних дуг та екстракардіальної нервової системи (за даними Г. І. Коснцького, 1975): /—міокард; 2 — рецептори розтягування міокарда; 3 — аферентні нейрони внутрішньосерцевої нервової системи; 4 — холінергічний еферентний нейрон внутрішньосерцевої нервової системи; 5 — адренергічний еферентний нейрон внутрішньосерцевої системи; 6 — вставний гальмівний нейрон внутрішньосерцевої системи; 7 — прегангліонарні волокна екстракардіальних нервових центрів яяє місце» для крові, що незабаром почне надходити в більшому об’ємі в ліву половину, пройшовши мале коло кровообігу. Але така відповідь спостерігається лише на фоні низького вихідного наповнення серця та відносно невеликого тиску в отворі аорти і коронарних судинах. Якщо ж камери серця, аорта та коронарні артерії переповнені кров’ю, то через розтягування передсердь буде пригнічуватися скоротливість шлуночків,
ня серцевого викиду і зменшення тиску в аорті та коронарних судинах. Тим самим ніби «відміняється» закон Франка—Старлінга, і при більшому Наповненні серця зменшується викид крові.
Цілком адекватна регуляція роботи пересадженого серця при перерізці екстракардіальних нервових волокон якраз і забезпечується місцевими інтракардіальними рефлексами.
Вказані вище елементи інтракардіальних рефлекторних дуг належать переважно до утворень парасимпатичної нервової системи. Крім них у серці виявлено адренергічні клітини, так звані ЗІР (слабка інтенсивність флюоресценції). Ці клітини не мають безпосереднього зв’язку з симпатичними нервами, що надходять від гангліїв. Вони залишаються й після денервації і разом з парасимпатичними клітинамй беруть участь у виконанні 'кардіо-кардіаль-них рефлексів.
В умовах цілісного організму вказані вище інтракардіальні рефлекси тісно взаємодіють з рефлексами, що замикаються на рівні інших ділянок вегетативної нервової системи, розташованих у симпатичних гангліях, спинному та головному мозку.
Аференти, що містяться в серці, посилають імпульси не тільки до власних нейронів серця, а й до вищерозташованих відділів вегетативної нервової системи. Вони проходять у складі змішаних парасимпатичних та симпатичних нервів. Причому аференти симпатичних нервів, крім регуляції функції серця, беруть участь у сприйнятті больової чутливості. В них зароджується сегментарна
іррадіація, що спостерігається, наприклад, при ішемічній хворобі серця.
З рецепторів серця починаються також рефлекси, аферентною ланкою яких є судини (кардіовазальні). У той же час серце може бути аферентною ланкою рефлексів, що зароджуються в судинах, внутрішніх органах, скелетних м’язах, шкірі. Всі ці рефлекси виконуються різними відділами вегетативної нервової системи. Рефлекторна дуга їх може замикатися на будь-якому рівні, починаючи з гангліїв і кінчаючи гіпоталамусом — вищим відділом вегетативної нервової системи.
Вплив екстракардіальної нервової системи. Симпатичні і парасимпатичні екстракардіальні нерви разом із інтракардіальними нервовими волокнами беруть участь у рефлекторній регуляції роботи серця.
Волокна правого блукаючого нерва іннервують переважно праве передсердя і особливо щедро — синоатріальний вузол. Лівий блукаючий нерв доходить до атріовентрикулярного вузла і робочого міокарда. Симпатичні постгангліонарні волокна іннервують як провідну систему, так і робочий міокард усіх відділів.
Нервові закінчення особливо густо оплітають клітини провідної системи серця. Крім справжніх нервово-м’язових синапсів, у міокарді є найтонші терміналі з численними варикозними потовщеннями. Терміналі стеляться вздовж м’язових волокощ обплутують їх і прилягають з різною щільністю до поверхні клітини, утворюючи тим самим велику площу контакту. Причому закінчення симпатичних і парасимпатичних нервів тісно переплетені, і їх медіатори можуть здійснювати модулюючий ефект на виділення один одного.
Завдяки особливості іннервації симпатичні нерви діють на функції провідної системи (хронотропно, батмотропно і дромо-тропно) і скоротливість кардіоміоцитів (інотропний вплив). Сим-патичні'нерви справляють на серце і трофічний вплив.
Вплив правого блукаючого нерва позначається переважно на хронотропній функції серця (ЧСС), а лівого — на атріовентрику-ляторному проведенні (дромотропна дія) і на інотропному ефекті кардіоміоцитів.
Вплив нервових імпульсів на міокард визначається характером медіатора. Медіатором парасимпатичних нервів є ацетилхолін, симпатичних — норадреналін. Механізм дії їх розглянуто вище. Імпульси парасимпатичних нервів чинять негативні батмотропний (зниження збудливості), хронотропний (сповільнення ритму серцевих скорочень), дромотропний (погіршення провідності збудження серцем) і інотропний (зменшення амплітуди скорочення) ефекти (мал. 152). При сильному подразненні парасимпатичного нерва (блукаючого) не тільки гальмується робота серця, але й може настати його зупинка в діастолі. Механізм її зв’язаний з гіпер-
« ‘ 1 І І 1 1..... І 1.1 1 І 1.1. 1 1 І 1 І І І І І І І І 1 1 І І 1 І 1 І І І І І І І 1 І І І І І І І 1 е
Чаг с
Мал. 152. Вплив подразнення блукаючого нерва на серце жаби. Тривалість подразнення позначено на середній лінії
---------------------------------------------------------------_
-I । ‘І । «'» । । । । । । । ' । । । । । । ' 1- 1 । । । । । । । । । І І І І І । 1 । 1 । । *
Час, с
Мал. 153. Вплив подразнення симпатичного нерва на серце жаби. Тривалість подразнення позначено на середній лінії
поляризацією мембран міокарда. Тривале подразнення блукаючого* нерва призводить до припинення впливу його на серце, внаслідок чого скорочення відновлюються. Це явище називають вислизанням серця з-під впливу блукаючого нерва.
Симпатична нервова система, навпаки, посилює усі вказані функції серця: розвиваються позитивні батмо-, хроно-, дромо- і інотропний ефекти (мал. 153). При подразненні симпатичних нервових волокон прискорюється спонтанна деполяризація клітин — водіїв ритму в діастолу, що веде до прискорення серцевих скорочень. Збільшується амплітуда потенціалу дії.
І. П. Павловим доведено, що існують симпатичні нервові волоконця, які посилюють серцеві скорочення без зміни ритму. Вчений їх назвав підсилювачами серцевої діяльності. Призначення їх, на думку І. П. Павлова, полягає у виконанні трофічної функції в серці шляхом стимуляції процесів обміну речовин.
Центральні механізми регуляції роботи серця. Основні центри, які регулюють функцію серця (і судин), містяться головним чином у довгастому мозку: в дорсолатеральному (пресорному) і вентро-
медіальному (депресорному) відділах дна четвертого шлуночка. Крім них, можна виділити сенсорну ділянку, яка локалізована в задньобокових відділах довгастого мозку. Сюди надходять сенсорні імпульси, які потім передаються до відповідного дорсолате-рального чи вентромедіального скупчення нейронів. Збудження дорсолатерального центру через симпатичні нерви супроводжується посиленням діяльності серця і розширенням коронарних судин. Ефект збудження вентромедіального центру має протилежний характер. З одного боку, він зумовлений реципрокним гальмуванням активності нейронів дорсолатерального центру, а з другого — прямим впливом блукаючого нерва на серце.
Однак досі точно локалізувати в мозку особливий центр, що регулює функцію серця, не вдалось. На рівні довгастого мозку основна роль у регуляції діяльності серця належить парасимпатичному «центру», до складу якого входять ядро одиночного шляху (аферентна частина), двояке та дорсальне ядра. Ці ядра взаємодіють з торакальним відділом симпатичної нервової системи та вищележачими відділами вегетативної нервової системи і забезпечують рефлекторну регуляцію функції серця. Але при збережених природних зв’язках і в інших відділах ЦНС знайдено скупчення нейронів, що впливають на роботу серця. Так, у гіпоталамусі є ділянки, подразнення яких супроводжується певним впливом на діяльність серця. При точковому подразненні деяких структур гіпоталамуса можна спостерігати ізольовані зміни тільки ритму, сили скорочення або ступеня розслаблення окремого шлуночка. Такі ж ефекти можна отримати і при подразненні інших структур лімбічної системи, кори великого мозку. Усі ці факти раніше пояснювалися опосередкованим впливом на серце через «центр» довгастого мозку. Але є також прямі шляхи від гіпоталамуса до симпатичних нейронів спинного мозку. На рівні спинного мозку можуть замикатися рефлекси, наприклад, при скороченні скелетних м’язів.
Роль рефлексогенних зон у регуляції діяльності серця. У стінках багатьох відділів судинної системи серця містяться рецептори, які подразнюються під впливом тиску крові (барорецептори) або під дією хімічних агентів (хеморецептори). Найбільше значення для серцевої діяльності мають рефлексогенні зони дуги аорти, розгалужень сонних і легеневої артерій, порожнисті вени і епікард.
Подразнення барорецепторів цих зон спостерігається при підвищенні або зниженні їх кровонаповнення. При збільшенні об’єму крові в дузі аорти вона розтягується. Це призводить до збудження механорецепторів, імпульсація від яких надходить депресорним нервом у ядра, що зумовлює підвищення їх тонусу. Інформація із них передається блукаючим нервом до серця, знижуючи його функцію. Подібна закономірність спостерігається і при підвищенні
тиску в синокаротидній зоні, інформація від рецепторів якої надходить у центр нервом Герінга.
При зменшенні об’єму крові (тиску) в рефлексогенних зонах послаблюється тонус ядер блукаючого нерва, завдяки чому підвищується активність симпатичної нервової системи, яка супроводжується посиленням функції серця. Такий же механізм підвищення роботи серця спостерігається і при розтягненні великими порціями крові порожнистих вен у місці їх впадіння в праве пе-редсердця (рефлекс Бейнбріджа).
Рефлексогенні зони відповідають не тільки на механічні подразнення, а й на хімічні речовини, які заносяться до них кров’ю. Так, при подразненні хеморецепторів ізольованого каротидного синусу адреналіном, нікотином, вуглекислотою інформація надходить у ядра блукаючого нерва, підвищуючи його тонус. Це супроводжується зниженням функції серця.
Виявлено також рецептори в серці — епікарді, міокарді та ендокарді. їх подразнення рефлекторно змінює серцеву діяльність. Нервові волокна від їх рецепторів у основному проходять у складі блукаючого нерва.
За допомогою блукаючого нерва виникає і рефлекс Гольца — зупинка серця при нанесенні удару в живіт, його розвиток зв’язаний із збудженням черевного нерва кишок, інформація по якому передається в центр блукаючого нерва, а від нього до серця.
До рефлексів, зв’язаних із блукаючим нервом, належить і очно-серцевий рефлекс Ашнера — при натисканні на очні яблука істотно* зменшується ЧСС.
Багато рівнів систем нервової регуляції серця спрямовані головним чином на узгодження функції серця зі станом решти відділів серцево-судинної системи, функціональну активність інших органів і організму в цілому. Причому що вище розташований відділ ЦНС, то більше інформації він отримує і точніше регулює діяльність серця. Взаємодія різних рівнів регуляторних систем утворює цілісну ієрархічну систему механізмів регуляції, що дозволяє серцю функціонувати у точній відповідності з конкретними потребами організму в кровопостачанні.
ФІЗІОЛОГІЯ КРОВОНОСНИХ СУДИН
Судинне русло розподіляє викинуту кров між окремими органами. До кожного органа повинно надходити стільки крові, щоб забезпечити його трофіку і специфічну функцію. Своєрідним показником особливості кровообігу органа може бути вміст кисню у крові, яка відтікає від нього: що більшою мірою кровотік органу перевищує рівень, потрібний для забезпечення трофіки, то більше кисню залишиться у венозній крові.
Судинами кров рухається завдя-ки градієнту тиску, тобто від
Мал. 154. Функціональна схема системи кровообігу
вищого до нижчого. Початковий тиск створюється завдяки діяльності серця. Тому найвищий кров’яний тиск у артеріях, які відходять від серця, а найнижчий — у венах, тобто у напрямку до серця (мал. 154).
Серце не тільки перекачує кров з ділянки низького тиску до ділянки високого, але й з’єднує два відділення судинного русла (мале й велике кола кровообігу) в єдину серцево-судинну систему. Насосом для малого кола кровообігу є правий шлуночок, для великого — лівий. Мале коло кровообігу служить для збагачення крові киснем та виділення вуг-
лекислого газу. В судинах великого кола кровообігу кров
виконує всі інші функції. Для безперервної циркуляції крові через з’єднані послідовно кола кровообігу ХОК обох шлуночків повинен бути однаковим.
ОСНОВНІ ПРИНЦИПИ ГЕМОДИНАМІКИ
Вчення про рух крові в судиндх грунтується на законах гідродинаміки — вчення про рух рідин. Рух рідини трубами залежить: а) від тиску на початку та в кінці труби; б) від опору в цій трубі. Перший з цих чинників сприяє, а другий — перешкоджає руху рідини. Кількість рідини, що тече трубою, прямо пропорційна різниці тиску на початку і в кінці її і зворотно пропорційна опору.
У системі кровообігу об’єм крові, що тече судинами, теж залежить від величини тиску на початку системи судин (в аорті — Рі) і в кінці (у венах, що впадають у серце,— Рг), а також від опору судин (мал. 155). Ця залежність виражається рівнянням:
о = Рі —~ Р2 = АР
4 К К ’
де 0 — об’єм рідини; АР — різниця тиску; П — опір току крові.
Об’єм крові, що тече через кожний відділ судинного русла за одиницю часу, однаковий. Це означає, що за 1 хв через аорту, або легеневі артерії, або сумарний поперечний переріз, проведений на будь-якому рівні усіх артерій, капілярів, вен, протікає однакова
кількість крові. Це і є ХОК. Об’єм крові, що тече через судини, виражають у мілілітрах за 1 хв.
Опір у судинах залежить, відповідно до формули Пуазей-ля, від довжини судини (1), в’язкості крові (т]) і радіуса судини (г):
Мал. 155. Показники гемодинаміки у різних відділах судинного русла (за даними А. В. Коробкова, С. А. Чеснокової, 1986):
Р — тиск (мм рт. ст.): V — лінійна швидкість кровотоку (см/с), 5 — загальна площа поперечного перерізу суднн (см2); світлі кружальця — артеріальна кров, темні — венозна
яг
Згідно з рівнянням, максимальний опір руху крові повинен бути в найтонших кровоносних судинах — артеріолах і
капілярах, а саме: близько 50 % загального периферичного опору припадає на артеріоли і 25% на капіляри. Менший опір у капілярах пояснюється тим, що вони набагато коротші від артеріол.
На опір впливає також в’язкість крові, яка визначається насамперед форменими елементами і меншою мірою білками крові. У людини вона складає '3—5. Формені елементи, що локалізуються біля стінок судин, переміщуються внаслідок тертя між собою і стінкою з меншою швидкістю, ніж ті, що концентруються в центрі. Вони і відіграють певну роль у розвитку опору і тиску крові.
Гідродинамічний опір всієї судинної системи безпосередньо виміряти неможливо. Однак його легко можна вирахувати за формулою, пам’ятаючи, що Рі в аорті становить 100 мм рт. ст. (13,3 кПа), а Рг в порожнистих венах — близько 0. Якщо Р подається в міліметрах ртутного стовпа, то опір (в одиницях СІ) розраховується за формулою:
ЛР —1
К = • 13,3 (кПа • мл • с) ,
де 13,3 кПа відповідає 100 мм рт. ст.
Загальний периферичний опір судин виражають у абсолютних фізичних величинах. У дорослої людини він складає 1400— 2500 дин (с/см5).
Наступним показником гемодинаміки є лінійна швидкість кровотоку. Вона залежить від сумарної площі перерізу судин:
V = яг2 *
де V — лінійна швидкість; (2 — об’єм крові; яг2 — поперечна площа. Як випливає із рівняння, котре виражає співвідношення лі-
Таблиця 14. Лінійній кровотік та тиск у різних відділах судинного русла
Назва судини Сумарна площа поперечного перерізу суднн, см2 Середня лінійна швидкість, см/с Середній тиск, мм рт. ст
Аорта 2,5 20 100 (13,3)
Дрібні артерії 20 10—15 95 (12,7)
Артеріоли 40 0,2—0,3 70—35 (9,3—4,7)
Капіляри 2500 0,03 35—15 (4,7—2)
Венули 250 0,5—1,0 10—15 (1,3—2)
Дрібні і середні вени 80 1—5 < 15 « 2)
Порожнисті вени 8 10—15 < 5 « 0,7)
Примітка: в дужках вказано тиск крові в кілопаскалях.
нійної та об’ємної швидкостей, що більша загальна площа перерізу судин, то менша лінійна швидкість току крові. Тому в аорті,, площа поперечного перерізу судин якої складає лише 2,5 см2, лінійна швидкість найбільша, а в капілярах, сумарний показник яких найбільший, лінійна швидкість дуже мала — 0,03—0,05 см/с. Через високий опір дрібних артерій знижується лінійна швидкість руху частинок крові (табл. 14). Найменша швидкість кровотоку в капілярах. У венулах у міру збільшення їх діаметру лінійна швидкість течії крові зростає.
ВЛАСТИВОСТІ СТІНОК КРОВОНОСНИХ
СУДИН 1 ГЕМОДИНАМІКА
На підставі описаних вище законів гідродинаміки можна скласти уявлення про рух рідини в твердих трубках. Проте на деякі параметри кровотоку впливає будова стінки судин. Вона вносить певну корекцію у створення судинного тонусу і величину просвіту судин згідно з фізіологічними потребами.-
Трансмуральний тиск — різниця між внутрішнім тиском крові на стінку судини і зовнішнім тиском тканин, що її оточують. У деяких випадках зовнішній тиск на судини може змінюватися. Ще більшою мірою трансмуральний тиск змінюється при зміні положення тіла. У цьому разі проявляється гідростатичний Тиск — тиск стовпа рідини.
Рівень серця (джерела гідродинамічного тиску) є нульовим. У судинах, розташованих вище від серця, внутрішній тиск крові на стінку за рахунок гідростатичного тиску зменшує гідродинамічний тиск. У судинах, локалізованих нижче від рівня серця, обидва тиски, навпаки, підсумовуються.
У людини, що лежить, трансмуральний тиск практично залежить від гідростатичного, оскільки при цьому судини розташо-
Мал. 156. Вплив гідростатичного тиску на венозний та артеріальний тиск в положенні стоячи (за даними Р. Шмідта, Г. Тевса, 1985)
вуються на одній площині з серцем. У людини, яка стоїть вертикально, гідростатичний тиск істотно впливає на рівень трансму-рального. Внаслідок цього транс-муральний тиск у судинах голови, розташованих на 40 см вище від серця, знижується приблизно на ЗО мм рт. ст. (4 кПа). У той же час, що нижче від серця лежить судина, то більшим стає трансму-ральний тиск. На рівні 120 см нижче від серця трансмуральний тиск перевищує гідродинамічний на 90 мм рт. ст., або 12 кПа (мал. 156).
Трансмуральний тиск сприяє виникненню в стінці судини напруги. Взаємозв’язок напруги і трансмурального тиску виражається за законом Лапласа (у формулі не враховується товщина стінки):
Рі = Е : г,
де Рі — трансмуральний тиск; Р — напруга; г — радіус судини. З рівняння випливає: що менший радіус судини, то менша напру
га в її стінці при однаковому трансмуральному тиску. Завдяки цьому найменші судини, тобто капіляри, стінка яких складається з одного шару клітин, не розриваються, не зважаючи на відносно високий тиск. Через наявність гладких м’язів у малих артеріях та венах напруга в стінці може знизитися за рахунок активного звуження судини (зменшиться радіус).
Стінка судини складається з еластичних, колагенових волокон та гладком’язових клітин. Еластичних волокон особливо багато в інтимі судин, де вони утворюють густу сітку, що легко розтягується.
Колагенові волокна середньої та зовнішньої оболонок судин також утворюють сітку. Але вони чинять більший опір розтягуванню, ніж еластичні. Однак колагенові волокна в стінці багатьох судин розташовуються вільніше, а тому починають протидіяти тільки тоді, коли судина розтягнута до певної межі.
Гладком’язові клітини аналогічно зв’язані з колагеновими та еластичними волокнами. Скорочуючись і натягуючи вказані волок
на, гладкі м’язи утворюють активну напругу в стінці судини (судинний тонус). У той же час, змінюючи просвіт судини, вони регулюють напругу стінки.
Можна виділити два принципово однакові шляхи модуляції напруги гладкими м’язами. Якщо тиск зростає швидко, то м’язові клітини, скорочуючись, зменшують просвіт судини і знижують напругу. При повільному зростанні тиску напруга знижується шляхом поступової релаксації м’язів та збільшення просвіту судини. У першому випадку зниження напруги відбувається не тільки у зв’язку зі зменшенням діаметру судини, але й внаслідок зменшення об’ємного кровотоку. У другому випадку ефект зниження напруги зумовлений зменшенням тиску крові на стінки розтягнутої судини. Як пряма, так і зворотна релаксація напруги виражені більшою мірою у венах, ніж в артеріях. Завдяки цьому у венах підтримується тиск наповнення, не зважаючи на низький гідродинамічний тиск. Це забезпечує досить високу швидкість кровотоку у венах.
Вказані структури судинної стінки, утворюючи напругу, протидіють судинорозширювальній дії трансмурального тиску. Але, якщо зробити поздовжній розріз судинної стінки, то внаслідок дії сил напруги місце розрізу буде зяяти.
Величина напруги залежить від співвідношення структурних елементів у судинній стінці. Межа розтяжності судини залежить від співвідношення колагенових та еластичних елементів. Так, артерії великого кола кровообігу в 6—10 разів менше розтяжні, ніж вени цього ж відділу. Вени малого кола кровообігу мають таку ж розтяжність, як і великого, а легеневі артерії більш розтяжні, ніж артерії великого кола. Найвища напруга в стінці аорти: вона в 1000 разів більша, ніж у капілярі, тоді як у подібній за діаметром порожнистій вені — лише в 130 разів.
ЗАЛЕЖНІСТЬ КРОВОТОКУ
ВІД СТАНУ СУДИН
Кровотік багато в чому залежить від еластичності, розтяжності та скоротливості судин. Певним чином впливає також і циркулююча в судинах реальна кров.
У судинах з еластичною стінкою об’ємна швидкість кровотоку більшою мірою залежить від тиску, ніж у жорстких трубках. Під впливом тиску судина розтягується, внаслідок чого, з одного боку, зменшується тиск, а з другого — збільшується об’ємний кровотік. Судини м’язового типу можуть активно перешкоджати зміні кровотоку при зростанні тиску. Регуляція здійснюється шляхом використання реакцій власне гладких м’язів і рефлекторними механізмами. При швидкому зростанні тиску гладкі м’язи скорочуються, внаслідок чого зменшується просвіт судини і кровотік. При
кип І 'іНриІд
Мал. 157. Параболічний розподіл швидкості руху рідини судинами при течії Пуазейля
Потік вф
Зменшення діаметра
^77^7777^7^7^^77^77777777777777^77777,
Застійна зона
Мал. 158. Механізм виникнення турбулентності при дефекті інтими судини
повільному зростанні тиску проявляється ефект пластичності глад-ком’язових клітин і судина поступово розширюється.
У малих артеріях можна виявити ще один ефект — критичний тиск закриття. При зниженні тиску нижче як 20 мм рт. ст. (2,7 кПа) артеріоли спадаються і кров у подальші відділи судинного русла надходити не буде.
У судинах з великим діаметром кров тече ламінарно. При цьому спостерігається циліндричний осьовий потік, коли частки крові переміщуються паралельно одна до одної, шарами (мал. 157). Прилеглий до стінки судини шар майже не рухається. З ним з дещо більшою швидкістю ковзає наступний шар,— так до центрального циліндра, що тече найшвидше. Тут же рухається, як правило, більшість формених елементів. Збільшення швидкості кровотоку, поява перешкод у місці розгалуження судин призводить до виникнення турбулентності, яка різко затрудняє кровотік (мал. 158). Так, при турбулентності для збільшення об’ємного кровотоку в 2 рази тиск треба підвищити майже в 4 рази.
ФУНКЦІОНАЛЬНА ХАРАКТЕРИСТИКА СУДИН
Залежно від виконуваної функції судини можна поділити на амортизуючі, резистивні, обмінні, шунтуючі та ємкісні. Резистив-ні, обмінні та шунтуючі судини утворюють мікроциркуляторне русло. Функціональна характеристика судин подана на прикладі великого кола кровообігу.
Амортизуючі судини
Амортизація пульсових коливань. До амортизуючих судин належать еластичні та великі м’язові артерії. Ефект амортизації полягає у згладжуванні систолічних коливань кровотоку, що виникають періодично.
УО крові, що виганяється з великою швидкістю із шлуночка,
надає прискорення рухові тієї частини крові, що була перед цим у судинах. Діаметр аорти відносно порожнин шлуночка невеликий і весь УО (70 мл) через неї за час викиду пройти не може. Під впливом крові, що надходить, аорта розтягується і в кінці систоли приймає додатково приблизно ЗО мл крові. За рахунок цього кінетична енергія скорочуваного серця ділиться на дві частини. Частина енергії використовується одразу на прискорення руху крові, а частина переходить у енергію розтягування стінки судини. Ця потенціальна енергія деформації аорти переходить у кінетичну енергію руху крові в період діастоли серця. Розтягнуті еластичні волокна, скорочуючись, підтримують високий тиск в аорті в міру відтоку із неї крові і тим самим утворюють потрібний для постійного кровотоку градієнт тиску з розташованими нижче артеріями. Таким чином, за рахунок еластичності аорти утворюється сила, яка сприяє підтриманню кровотоку на постійному рівні при пульсації серця. Крім цього, еластичність судин, що прилягають до серця, їх легке розтягування зменшують перешкоду серцевому викиду крові. Внаслідок склеротичних процесів, що розвиваються з віком, зменшується еластичність аорти, а це утруднює нагнітальну функцію серця.
Артеріальний тиск і об'єм крові
Не зважаючи на розтяжність еластичної аорти, при надходженні «зайвого» об’єму крові тиск зростає. Тиск, створюваний під час систоли, називається систолічним (Рс). У молодому віці він становить ПО—‘120 мм рт. ст. (14,6—16,0 кПа). Тиск, що реєструється під час діастоли, називається діастолічним (Рд). Він дорівнює близько 70 мм рт. ст. (9,3 кПа). Якщо систолічний тиск залежить від серцевого викиду, то діастолічний — від периферичного опору судин, кількості крові, що міститься в резистив-них судинах, її в’язкості (мал. 159).
Звертає на себе увагу зміна тиску на початку і в кінці систоли. Перші порції крові розтягують податливіші еластичні волокна, наступні — менш податливі колагенові. Це призводить до того, що на початку виштовхування крові тиск у аорті буде менший, ніж наприкінці. Внаслідок цього під час значного збільшення УО Рс починає різко зростати. Зниження еластичності аорти при склерозі зумовлює зростання тиску при відповідному своїй нормі або дещо зниженому У О.
У артеріях, що відходять від аорти, під час систоли збирається до 10 мл додаткового об’єму крові. Незважаючи на те що цей об’єм розподіляється по багатьох артеріальних судинах, тиск у них під час систоли зростає. Стінки менш еластичних артерій м’язового типу під впливом надходження навіть невеликого об’єму кро-
Мал. 159. Реєстрація артеріального тиску за допомогою прямого (кривавого) методу:
/ —канюля в сонній артерії; 2 — ртутний манометр; 3 — записування артеріального тиску; 4— пульсові хвилі; 5 — дихальні хвилі
ві чинять більший опір, ніж еластичні артерії. Внаслідок цього вздовж артеріального русла Рс поступово збільшується: у стегновій артерії — на 20 мм рт. ст. (2,7 кПа), а в тильній артерії стопи— на 40 мм рт. ст. (5,3 кПа). У той же час Рд дещо знижується.
У період викидання крові із серця змінюється її об’єм у судинах, що призводить до виникнення пульсової хвилі. Дійшовши до артеріол, ця хвиля відбивається і рухається назустріч попередній. Припускають, що при сумації прямої і відбитої хвиль створюється великий приріст рівня Рс в артеріях, розташованих ближче до місця відбивання. Сумація їх залежить від швидкості поширення хвилі: відбита хвиля досягає еластичніших початкових відділів артеріального русла в той момент, коли пік прямої хвилі в них уже минув.
Швидкість поширення пульсової хвилі «об’єму — тиску» значно вища, ніж лінійна швидкість'кровотоку. Пульсова хвиля до артерії стопи дійде за 0,2 с, тоді як частина крові досягне цієї ж ділянки не раніше як через 7—10 с після викиду з серця. Швидкість поширення пульсової хвилі залежить, з одного боку, від співвідношення товщини стінки і її радіуса, а з другого — від еластичності
судини; що еластичніша і ширша судина, то менша швидкість поширення пульсової хвилі. Так, у аорті вона складає 4—6 м/с, а в менш еластичних артеріях м’язового типу — 8—12 м/с.
Пульсові коливання тиску
Пульсові коливання між Рс і Рд в артеріальній частині судинного русла називаються пульсовим тиском (Рп). В аорті він відносно невеликий: Рп = 120 — 80=40 мм рт. ст. (5,3 кПа). У міру віддалення від серця поряд зі збільшенням Рс відзначається зниження Рд, тому Рп зростає.
Запис артеріального пульсу (сфігмограма) свідчить (мал. 160), що у різних відділах судинного русла змінюється не тільки Рп, але й власне сфігмограма. Підйом кривої, що називається анакротою, зумовлюється різким підвищенням тиску на початку фази вигнання, коли в артерії швидко надходить додатковий об’єм крові. З кінця фази повільного вигнання тиск поступово починає знижуватися — катакрота. На початку катакроти спостерігається інцизура — швидке падіння тиску, зумовлене ретроградним відтоком крові. Закриття аортальних клапанів перешкоджає відтоку крові в лівий шлуночок, зумовлює нове, хоч і незначне, підвищення тиску, яке називається дикротичним. Після надходження крові до наступних відділів судинного русла тиск поступово знижується.
У периферичних судинах тривалість Рс менша, а швидкість зниження тиску вища. У зв’язку з цим середній тиск (Рср) у цих судинах ближчий до діастолічного, ніж у вищерозташованій аорті. Рср можна приблизно підрахувати, скориставшись такими формулами: для аорти Рср = Рд+(Рс — Рд) : 2; для артерій Рср = = Рд+(Рс-Рд) : 3.
Різниця рівнів Рср вздовж судинного русла і визначає напрям руху крові. У капіляри більшості органів кров надходить уже під постійним тиском.
Пульс
При викиданні з серця нової порції крові виникає ударна хвиля, яка поширюється через кров і стінку артерій на периферію. Цей удар називається пульсом. За його станом лікар певною мірою може визначати стан серцево-судинної системи. Пульс виникає при кожному серцевому скороченні, що дає можливість визначити ЧСС. Другим показником пульсу є його ритмічність. Крім цих відносно простих характеристик, завдяки пульсу можна отримати й такі, які дають можливість глибше оцінити функції серця і стан судин. Так, за висотою пульсової хвилі можна судити про величину УО та еластичність судин: при однаковому об’ємі крові
амплітуда пульсу тим менша, чим більша еластичність судин. За швидкістю зростання ана-кроти пульсової хвилі можна судити як про стан судини, так і про активність скорочення серця. А за напругою пульсу (зусилля, з яким треба перетискати артерію, щоб припи-
Мал. 160. Сфігмограма:
а — анакрота; б —катакрота; в — дикроіич-ний підйом
нити пульсові коливання) можна зробити висновок про системний тиск. На підставі аналізу пульсу можна встановити орієнтовний діагноз багатьох захворювань не лише серцево-судинної системи, але й інших органів та систем. Особливо добре розвинута ця діагностика в медицині Сходу.
Пульсові коливання швидкості кровотоку
У початковій частині судинної системи лінійний кровотік залежить від фази серцевого циклу. На висоті систолічного вигнання швидкість крові в аорті може досягти 100 см/с. Одразу після викиду у висхідному відділенні аорти кров тече ретроградно, а після цього на короткий час кровотік тут взагалі припиняється. Що далі від серця, то менше проявляється пульсове зниження швидкості кровотоку, оскільки переміщенню крові в діастолі сприяють скоротливі амортизуючі судини.
Незважаючи на таку різку пульсацію, в переважній частині аорти кровотік найінтенсивніший, і середня швидкість переміщення частини крові складає близько 20 см/с (мал. 161). У наступних відділах, аж до венозної частини капіляра, швидкість руху крові поступово знижується. Починаючи з венул, лінійний кровотік знову зростає. Пульсові коливання швидкості, як правило, закінчуються в капілярах. Проте вони знову з’являються у венах, що прилягають до серця.
МІКРОЦИРКУЛЯТОРНЕ РУСЛО
Важливим відділом судинного русла, де кров виконує практично всі свої функції, є мікроциркуляторне русло. В ньому можна виділити такі функціональні групи судин: артеріоли, прекапіляри (резистивні судини), капіляри, судини-шунти, резистивні постка-піляри (мал. 162).
Більшість авторів вважає, що до мікроциркуляторного русла належать судини, що мають діаметр, менший від 100 мкм. Якщо одна частина цих судин належить до справжніх обмінних, то інша — створює умови для здійснення цього обміну. Умови ці такі:
ПраВа піВклннична артерія
Тискам рт. ст.
ПмтгтВна артерія Тискамрт.ст.
Мал. 161. Порівняння артеріального тиску та швидкості кровотоку в різних судинах собаки (за даними Б. А. Мсбопаїб, 1977) — А та людини (за даними Е. Міііз, 1978) — Б
Мал. 162. Схема мікроциркуля-торного русла:
а — артеріола; е — венула; ПС — сфінктери; ІК>— капіляри, що перфузуються
якнайтісніший контакт кожної часточки крові з обмінною поверхнею; у міру можливості найдовше перебування частиночки крові в обмінній судині; достатня щільність власне судин у тканинах, щоб забезпечити можливість обміну між найвіддаленішими клітинами та кровоносними судинами. Усім цим умовам відповідає кровотік у капілярах і посткапілярних венах. Інші частини мікроциркуляторного русла підтримують кровотік в обмінних судинах на рівні, що відповідає конкретним потребам органа. Попередні амортизуючі судини забезпечують постійність кровотоку в мікроциркуляторних судинах.
Капіляри
Середній капіляр має радіус від 6 до 2—3 мкм, довжину — 750 мкм. При площі поперечного перерізу до ЗО мкм2 обмінна площа капіляра складає близько 14 000 мкм2. Швидкість кровотоку в капілярі порівняно невелика — 0,3 мм/с, що дозволяє еритроцитові перебувати в капілярі близько 2—3 с. Залежно від будови стінки розрізняють капіляри соматичного, вісцерального та синусоїдного типу.
Стінка капіляра складається з одного шару ендотеліальних клітин. Ендотеліоцити в капілярах, як і в інших відділах судинного русла, є активними елементами судинної стінки. В них синтезуються різні ферменти і біологічно активні сполуки, наприклад, антитромбін III, ендотеліальний фактор розслаблення (ЕФР) і скорочення (ЕФС), які активізують або гальмують дію гормонів, медіаторів на судинну стінку, факторів тромбоутворення або ж самі спричиняють фізіологічні ефекти.
Доведено, що за деяких умов ендотеліоцити можуть скорочуватися і з плоских ставати об’ємнішими. В них містяться мікро-фібрили, що складаються з актинових, міозинових та інших скоротливих елементів. Ці утворення розташовані переважно вздовж основи клітин і прикріплюються до цитолеми в місцях міжклітинних контактів (мал. 163). Скорочення мікрофібрил може спричинити два ефекти: розходження клітин і збільшення міжклітинної щілини або ж зміни форми клітини і випинання її в просвіт судини. Конкретний наслідок визначається тиском крові на стінку капіляра: якщо він досить великий, то закривається просвіт капіляра.
Регуляція кровотоку в мікроциркуляторному руслі
У зв’язку з відсутністю в стінках капілярів гладком’язових во-
локон, які могли б активно змінити їх просвіт, функція регуляції кровотоку через них належить артеріолам, метартеріолам, прекапі-лярним сфінктерам, посткапілярним венулам та артеріовенулярним шунтам. Кінцеві артерії та артеріоли містять у стінці відносно ве
лику кількість гладком’язових волокон. У міру зменшення діаметру артерій товщина м’язового шару поступово зменшується, і в артеріолах м’язові клітини розташовані вже в один шар. У місцях переходу артеріол у капіляри м’язові клітини зустрічаються все рід-
Мал. 163. Зміни стану капіляра
ше і врешті у капілярах губляться зовсім. Окрім м’язових клітин, для артеріальної стінки характерною є наявність рухливих і чутливих нервових закінчень. За рахунок їх здійснюється нервова рефлекторна регуляція просвіту вказаних судин. М’язовий шар і нервові закінчення з’являються у венулах. Стінка артеріоловену-лярних анастомозів товста — у 2—3 рази товща від стінки артерій, від яких відгалужується. Основу її становлять видозмінені м’язові клітини. Тут також містяться закінчення чутливих та рухових нервових волокон.
Об’єм крові, що надходить до капілярів, залежить від просвіту попередніх артеріол та метартеріол. Крім того, в деяких тканинах біля отворів деяких капілярів є потовщення гладком’язового шару, це сфінктери. У ділянках розширення всіх цих відділів інтенсифікується кровотік, підвищується тиск у отворах капілярів. Унаслідок цього капіляри пасивно відкриваються. Навпаки, у ділянках звуження вказаних утворень зменшується кровотік і капіляри закриваються. На кровотік через метартеріоли і на капіляри опосередковано впливають також артеріоловенулярні шунти. Вони є не у всіх органах, але в підшкірній основі їх дуже багато. Завдяки скороченню гладком’язових клітин стінки шунта майже вся кров проходить через основні ділянки мікроциркуляторного русла. І навпаки, розширення шунтів дозволяє скерувати частину крові повз капіляри безпосередньо у вени. Завдяки цьому частина крові звільняється від виконання обмінних функцій. Наприклад, у шкірі за рахунок різкого розширення шунтів збільшується тепловіддача.
Кровотік у капілярах
Якщо капіляри відкриваються пасивно прибулою кров’ю, то механізм закриття їх дещо складніший. При спостереженні за рухом крові в мікроциркуляторному руслі було виявлено кілька його особливостей. По-перше, в міру зменшення діаметру судини співвідношення між форменими елементами крові і плазмою поступово зменшується. По-друге, при зменшенні діаметру судини рух крові (зворотний в’язкості показник) зростає. Цей феномен, названий феноменом Фореуса — Ліндквіста, спостерігається у тих судинах, у яких діаметр менший за 300 мкм. У крові, що належить до неньютонівських рідин (ньютонівська рідина — справжній розчин), ефект зниження в’язкості утворюється за рахунок наявності в ній формених елементів. Вважають, що в основі цього ефекту лежить особливість руху власне еритроцитів. Еритроцити в судинах з невеликим діаметром під час руху шикуються один за одним, об’єднуючись у окремі групи, в яких клітини відокремлені одна від одної порціями плазми. Ця частина плазми перебуває у нерухомому стані, а отже, зменшується тертя між її шарами. В той
же час плазма, що міститься біля стінок судини, є своєрідним мастилом для еритроцитів, які рухаються у ній. Причому завдяки еластичності мембрани еритроцит може проходити через капіляри, які за діаметром менші від власне клітини, змінюючи свою форму. Природно, зниження еластичності мембрани еритроцитів утруднює його проходження через такі капіляри. Утруднюють кровотік і лейкоцити — клітини, що мають не тільки більші розміри, але й більше ядро.
Під час руху еритроцитів через капіляр спостерігається ще один ефект: через те, що вміст еритроцитів не здатний стискуватись, створюється зона підвищеного тиску в тій частині плазми, яка міститься між його мембраною і стінкою капіляра. Ця сила допомагає утримувати капіляр у розправленому стані. У міру зменшення концентрації еритроцитів вказаний вплив знижується. Зустрічаються капіляри, що містять лише одну плазму. Такі плазматичні капіляри є перехідними від функціонуючих до нефункціо-нуючих.
Зменшення діаметра плазматичного капіляра зумовлює зсув формули крові вліво. За цією формулою визначається напруга у стінці: Р=Ріг. І як тільки внутрішньостінкова напруга почне переважати над трансмуральним тиском, виникнуть умови для закриття капілярів. Напруга в них створюється за рахунок не лише еластичності, але й активного скорочення ендотеліоцитів. Звичайно, скорочуються вони повільно, з незначною силою. Але під впливом катехоламінів, ацетилхоліну, гістаміну, простагландинів та інших фізіологічно активних речовин, які утворюються в тканинах або надходять із кров’ю, скорочення посилюється і капіляр легко виключається з кровотоку. Всі вищевказані механізми забезпечують належне співвідношення перфузованих і неперфузо-ваних капілярів у органах та тканинах. Наприклад, у стані фізіологічного спокою найбільша кількість нефункціонуючих капілярів міститься в скелетних м’язах. Що інтенсивніша м’язова робота, то більша кількість капілярів, які перфузуються. Внаслідок зростання щільності капілярного русла зменшується відстань між капілярами і клітинами органа, що значно поліпшує умови для процесів обміну.
Процеси обміну
в мікроциркуляторному руслі
Стінка капіляра щонайкраще пристосована для виконання обмінних функцій. У переважній кількості органів стінка капіляра складається лише з одного шару ендотеліальних клітин, між якими існують вузькі щілини. В мембрані ендотеліоцитів є велика кількість найдрібніших пор. У той же час стінка капілярів окремих органів має своєрідну будову. Так, клубочки нирок, слизової обо-
Мал. 164. Схема будови стінки капіляра у різних органах
Мал. 165. Схема процесів фільтрації та реабсорбції у капілярі
лонки кишок мають вікончасті капіляри. їх віконця (фенестри) діаметром 0,1 мкм забезпечують інтенсивне проходження не тільки води, але й досить великих молекул. У кістковому мозку, печінці, селезінці частина капілярів має переривчасту стінку, через яку легко проходить не тільки плазма, а й неушкоджені формені елементи (мал. 164).
Розрізняють два основних механізми (дифузія та фільтрація), які забезпечують процеси обміну в капілярах. Дифузія води та іонів відбувається через пори мембран і міжклітинні сполучення. Рушійна сила дифузії — градієнт концентрації іонів і рух розчинника слідом за іонами. Процес дифузії в кровоносних капілярах настільки активний, що під час проходження крові капіляром вода плазми встигає до 40 разів обмінятися з рідиною міжклітинного простору. У стані фізіологічного спокою через стінки всіх капілярів за 1 хв проходить до 60 л води. Звичайно, скільки води виходить з крові, стільки ж її повертається назад. Шляхом дифузії через мембрани обмінюються також гази.
Вода та розчинені в ній сполуки обмінюються теж шляхом фільтрації з наступною реабсорбцією. Згідно з теорією 'Старлінга, ці процеси здійснюються пасивно (без використання енергії) за рахунок взаємодії кількох рушійних сил (мал. 165): гідростатичного тиску в капілярах (Ргк), гідростатичного тиску в тканинній рідині (Ргт), онкотичного тиску плазми в капілярах (Рок) та онкотичного тиску тканинної рідини (Рот). Під впливом Ргк і Рот рідина виходить із капіляра в тканини, під дією Ргт і Рок — входить у капіляр. Таким чином, об’єм рідини (V), що фільтрується, можна вирахувати за формулою:
V = (Ргк + Рот — Ргт — Рок) • К,
де К — коефіцієнт фільтрації.
Якщо V позитивна величина, то виникає фільтрація, якщо негативна — реабсорбція.
Прямими вимірами і за допомогою розрахунків було встановлено, що величина тиску в кінці капіляра дорівнює 32,5 мм рт. ст. (5 кПа), в тканинній рідині — 3 мм рт. ст. (0,4 кПа). Онкотичний тиск плазми становить 25 мм рт. ст. (3,3 кПа), в тканинній рідині — 4,5 мм рт. ст. (0,55 кПа). Виходячи із цих показників, можна визначити фільтраційний і ефективний реабсорбційний тиск. Якщо в кінці артеріального капіляра спрямований зовні тиск дорівнює 37 мм рт. ст., або 4,9 кПа (Ргк=32,5+Рот=4,5), а йому протидіє тиск 28 мм рт. ст., або 3,7 кПа (Рок=25+Ргт = 3), спрямований в середину капіляра, то ефективний фільтраційний тиск буде складати 37 — 28=9 мм рт. ст. (1,2 кПа).
Унаслідок цього в артеріальній частині капіляра вода разом з іонами покидає судинне русло. Під час руху крові через капіляр основна виштовхувальна сила (гідродинамічний тиск) поступово зменшується. Через це знижується також і фільтраційний тиск. Це зумовлено тим, що тиск у кінці венозного капіляра, спрямований зовні, дорівнює 22 мм рт. ст., або 2,2 кПа (Ргк=17,5+Рот= = 4,5), а тиск, спрямований всередину,— 28 мм рт. ст. (3,7 кПа). Виходячи із цього, ефективний реабсорбційний тиск дорівнює 22 — 28=—6 мм рт. ст. (—0,8 кПа).
У початковій частині капіляра під дією фільтраційного тиску приблизно 0,5 % плазми переходить у тканини. Оскільки сумарний фільтраційний тиск в артеріальній половині капіляра вищий, ніж сумарний реабсорбційний тиск у венозній, у кровотік повертаються не 100% рідини, що вийшла, а лише близько 90%. Рідина, що залишилася (10 %), виділяється через лімфатичні судини. В середньому за добу фільтрується близько 20 л, реабсорбуєть-ся 18 л, а 2 л є основою для утворення лімфи.
При зміні будь-якого із вказаних параметрів може порушитись співвідношення фільтрації і реабсорбції. Особливу роль відіграє внутрішньокапілярний тиск. Збільшення його, а це може бути наслідком посилення припливу або утруднення відпливу крові, призводить до ще більшого переважання фільтрації над реабсорбцією. Природно, що при падінні тиску умови для фільтраційного обміну води погіршуються. Тому в нормі кровотік у капілярі підтримується на постійному рівні відповідними структурами, які входять у систему мікроциркуляційного русла.
У наведену класичну схему Старлінга, згідно із сучасними уявленнями, треба внести ряд коректив. По-перше, слід врахувати, що ендотелій судин є не пасивною структурою, а активним утворенням і власні процеси обміну в ньому впливатимуть на обмін води. По-друге, в реальних умовах кровотік у капілярах не постійний, тому швидкість руху крові, об’єм і тиск можуть коливатись. По-третє, скорочення ендотеліоцитів може призвести до збільшення міжклітинних просторів, і тоді капіляр по всій своїй довжині пропускатиме не тільки воду та іони, а й дрібні білки.
Причому посткапілярні венули у багатьох органах можуть пропускати навіть великі молекули білка. І все ж потрібно враховувати, що для утримання рідини в судинному руслі основне значення належить онкотичному тиску. При його зниженні (хвороби нирок, голодування тощо) реабсорбція знижується і розвиваються набряки тканин. Умови фільтрації та реабсорбції можуть змінюватися також залежно й від напруження роботи органа, стану центральної гемодинаміки.
У відтоці рідини важливу роль відіграє й лімфатична система. При порушенні цього механізму розвиваються набряки. Якщо ж лімфатична система функціонує нормально, то й при зміні умов фільтрації та реабсорбції в капілярах набряк може не з’явитися, оскільки лімфатична система компенсує порушення, які виникають.
Названі вище величини тиску в капілярах різних органів можуть відрізнятися, що зумовлено особливостями кровообігу в кожному конкретному органі. Так, у капілярах ниркових клубочків тиск дорівнює 65—70 мм рт. ст. (8,7—9,3 кПа), а в капілярах, які обплітають ниркові канальці,— лише 14—18 мм рт. ст. (1,9—• 2,4 кПа). Тому в клубочках відбувається лише фільтрація, а капіляри канальців служать для реабсорбції. Низький рівень тиску в малому колі кровообігу також перешкоджає фільтрації.
ЄМНІСНІ СУДИНИ
У венозному відділі судинного русла сумарна площа поперечного перерізу поступово зменшується. Проте вона залишається вищою, ніж у відповідних ділянках артеріального відділу. В той же час сумарний об’ємний кровотік повинен залишатися попереднім.
Починаючи з посткапілярів, кожна наступна судина має більший діаметр, ніж попередня. Тому по шляху судинного русла в кожній наступній судині опір кровотоку поступово зменшується. Крім того, стінка вени має високу розтяжність. Завдяки вищевказаним обставинам, у венах тиск падає меншою мірою, ніж у попередніх відділах. Якщо в посткапіляри кров надходить під тиском 12—20 мм рт. ст. (1,6—2,7 кПа), то у великих венах, що лежать за грудною кліткою, він складає ще 5—6 мм рт. ст. (0,7— 0,8 кПа). У венах грудної порожнини тиск коливається в досить широких межах у ритмі дихальних рухів. Під час вдиху тиск зменшується, а при видиху — збільшується.
Трансмуральний тиск у венах
Коливання тиску у венах що містяться в грудній порожнині, обумовлено зміною трансмурального тиску. Розширення грудної порожнини під час вдиху, підвищуючи негативність внутрішньо-
плеврального тиску, сприяє збільшенню у венах трансмурального тиску. З цієї причини між венами, що лежать зовні грудної порожнини і в середині її, зростає градієнт гідродинамічного тиску. Це забезпечує приріст об’ємного кровотоку у венах, що прилягають до серця, під час вдиху.
У інших відділах венозної системи трансмуральний тиск також змінюється, але залежно від положення тіла. У людини, яка стоїть, у судинах голови він знижується на величину гідростатичного тиску, а нижче від діафрагми, навпаки, збільшується. Зміна гідростатичного тиску в артеріальній частині судинного русла, де високий рівень гідродинамічного тиску, при зміні положення тіла на кровотоку істотно не позначається. На відміну від цього у венах кровотік може порушуватися.
Для запобігання утрудненню кровотоку в процесі еволюції стінки вен набули відповідних пристосувальних механізмів. Так, вени головного мозку стали цупкими, що запобігає їх спаданню. А ось у венах нижньої половини тулуба і ніг за рахунок впливу гідростатичного тиску у положенні стоячи об’єм крові може зростати на 500—600 мл порівняно з тим, який спостерігається в положенні лежачи. Підвищення об’єму та трансмурального тиску у венах нижніх кінцівок може призвести до варикозного розширення вен. Цьому сприяють вікові зміни еластичності стінки, утруднення відтоку крові, наприклад, при вагітності, малорухомий спосіб життя. Клапани, розташовані в середині вен, зменшують негативний вплив гідростатичного тиску на кровотік. Вони ніби розбивають стовп крові на окремі частини. В той же час через скупчення тут крові якраз біля клапанів розширення вен виражене найбільшою мірою.
Гідростатичний тиск позначається на лінійному кровотоку у венозному відділі судинного русла лише безпосередньо після зміни положення тіла. Системи регуляції кровообігу (див. с. 350) компенсують ефект, що виникає, і через кілька секунд лінійний кровотік і у венах повністю визначатиметься градієнтом гідродинамічного тиску між окремими частинами венозного русла.
Рівень трансмурального тиску істотно впливає на об’єм крові, що міститься в судині, і поперечний переріз вен. При нульовому трансмуральному тиску вени спадаються. Зміна тиску в межах від 0 до 6—9 мм рт. ст. (0,8—1,2 кПа) відбувається при еліпсоїдному просвіті вен. Починаючи з тиску 6—9 мм рт. ст. (0,8— 1,2 кПа), вени набувають округлого поперечного перерізу, тобто повністю розправляються. При вищому тиску вени розтягуються. Зміна просвіту вен залежно від тиску крові зумовлена будовою їх стінки. В інтимі вен (порівняно з артеріями) значно менше еластичних волокон, а в середньому шарі менше циркуляторних гладком’язових клітин.
Спостерігаються ВІДМІНИ і ЩОДО будови СТІНКИ різних ВІДДІЛІВ’
артерії то артеріоли
Мал. 166. Об’єм крові в різних судинах системи кровообігу
венозного русла. Так, стегнова вена краще розтягується, ніж нижня порожнинна. Розтяжність стінки грудного відділу нижньої порожнинної вени вища, ніж черевного.
Ємкісна функція вен (депо крові]
У венозному відділі судинного русла міститься 75—80 % крові, що циркулює в судинній системі (мал. 166). Тому ці вени називаються ємкісними судинами. Ємкісна функція обумовлена сумарно більшим просвітом даного відділу судинного русла та високою розтяжністю вен. Завдя
ки наявності у стінках вен гладко м’язових клітин при низькому рівні гідродинамічного тиску при скороченні названі судини здатні зменшувати свій просвіт. Це дозволяє перерозподіляти об’єм крові
між венами й іншими відділами судинного русла. У замкнутій судинній системі зміна ємкості якого-небудь одного відділу обов’язково повинна супроводжуватися перерозподілом об’єму крові в другому відділі. В той же час за рахунок скорочення гладких м’язів венозної стінки легко змінюється просвіт судини, оскільки сила, що протидіє тиску крові, невелика. Якщо, наприклад, ємкість вен зменшиться на 2—3 %, то приплив венозної крові до серця зросте практично в 2 рази. Ця кров у свою чергу, пройшовши через мале коло кровообігу, надійде в артерії і може бути спрямована на підвищення тиску в них або бути перерозподіленою на користь інтенсивно функціонуючих органів.
У той же час, завдяки добрій розтяжності підшкірних вен та вен черевної порожнини, зростає їх ємкість і збільшується крово-нацовнення венозного русла, створюється можливість для депонування в цих відділах великих об’ємів крові.
Через вказані особливості ємкісні судини виконують функцію депо крові. Проте не слід вважати, що у венозному депо кров повністю виключена із кровообігу та не виконує властивих їй функцій. Йдеться лише про відносне депо, оскільки кров у названих відділах венозного русла тече. Природно, що швидкість току крові в венах тим менша, чим більше крові міститься в них.
Особливо ємкі деякі відділи венозного русла (що пояснюється їх анатомічною будовою). До них, крім великих вен черевної ділянки і підшкірної основи, належать вени печінки. В цих судинах
об’єм крові порівняно з мінімальним може збільшуватися на 1 л. Вени малого кола кровообігу також можуть викидати в загальний кровотік до 300 мл крові.
Показники кровотоку в ємнісних судинах
У міру наближення до серця гідродинамічний тиск у венах поступово знижується. Якщо після виходу з капілярів він залишається на рівні 12—20 мм рт. ст. (1,6—2,7 кПа), то біля передсердь (у порожнистих венах) становить близько 0. Однак, незважаючи на відносно невеликий градієнт тиску, швидкість руху крові у венах поступово зростає. Як уже вказувалось, ця обставина зумовлена поступовим звуженням загального судинного русла, через яке повинен проходити той же об’єм крові, що й через інші відділи. В порожнистих венах, сумарний просвіт яких майже у 2 рази більший, ніж у аорти, лінійний кровотік зростає до 10—15 см/с. У міру наближення до серця кровотік у венах стає менш рівномірним.
Коливання швидкості тут зумовлене, роботою серця, в яке під час систоли передсердь кров надходити не може. Крім того, на кровотік у венах, локалізованих у грудній порожнині, впливає й періодичність зміни тиску під час дихальних рухів.
Механізм припливу крові до серця
Основним механізмом, що забезпечує приплив крові до серця, по-перше, є градієнт тиску між початковим відділом венозної частини судинної системи і тиску в передсердях під час діастоли. Тиск зумовлюється залишковою енергією систоли шлуночка. Замкнутість системи кровообігу забезпечує безперервність кровотоку в венах (за рахунок підкачування крові з боку капілярів). По-друге, при зміщенні атріовентрикулярної перегородки створюється присмоктувальний ефект. Третій механізм забезпечується диханням. Падіння тиску в грудній порожнині під час вдиху сприяє збільшенню трансмурального тиску у венах, оскільки зовнішній тиск на судини стає ще більш негативним. Унаслідок цього кров; інтенсивніше засмоктується із грудних вен. Цьому сприяє сплощення діафрагми, що знижує трансмуральний тиск у венах черевної порожнини. Зменшення просвіту з наступним зменшенням ємкості вен черевної порожнини сприяє виштовхуванню крові із них. Завдяки клапанам кров спрямовується в бік грудного відділу. Згідно із законом Франка—Старлінга, збільшення припливу крові до правого передсердя під час вдиху посилює викид крові з нього, а згодом і з правого шлуночка. Тому під час вдиху в легеневий
стовбур надходить більше крові. Розправлення легень під час фази вдиху в свою чергу також супроводжується збільшенням надходження крові в мале коло кровообігу. Проте цей же механізм ослаблює повернення крові до лівого передсердя з легеневих вен, які розширюються. Викид крові у велике коло кровообігу дещо знижується, і системний тиск падає.
Мал. 167. Електрокардіограма (А) та флебограма (Б): а, с, х, V, у — хвилі
Під час видиху всі процеси відбуваються у зворотному напрямі: приплив крові до правого відділу знижується, а до лівого підвищується. Це зумовлює збільшення УО і зростання тиску у великому колі. Таким чином, паралельно зі зміною вдиху і видиху змінюється величина викиду то з лівого, то з правого шлуночків. Але загалом хвилинний кровотік обох відділів серця залишається однаковим. Вплив дихальних рухів може бути зареєстрований на кривій безперервного запису артеріального тиску у вигляді дихальних хвиль.
Ще один механізм венозного припливу крові до серця пов’язується із скелетними м’язами. Скорочення їх супроводжується витисканням крові в напрямку до серця. Розслаблення ж, навпаки, забезпечує більший приплив крові до м’язів.
Через нерівномірність надходження крові до серця у венах, розташованих недалеко від нього, можна зареєструвати венний пульс. Зареєстрований на яремних венах пульс зумовлюється зміною об’єму крові в них та пульсацією близько розташованої до них сонної артерії (мал. 167). Перша хвиля (а) пов’язана з припиненням надходження крові до передсердя під час його систоли, друга (позитивна) хвиля (с) зумовлена початковим випинанням атріовентрикулярного клапана в праве передсердя під час систоли шлуночка. Можливо, в походженні цієї хвилі певну роль відіграє також пульсація сонної артерії. Швидке падіння хвилі (х) є наслідком зміщення атріовентрикулярної перегородки вниз у період вигнання крові зі шлуночка та швидкого заповнення передсердя. Хвиля «ц» зумовлена затримкою кровотоку систолою шлуночка, яка триває, а нове западання (у) свідчить про швидке заповнення шлуночка кров’ю.
Таким чином, венозний відділ судинного русла виконує такі найважливіші функції: а) відводить кров від капілярів; б) депонує кров з метою можливого її перерозподілу; в) повертає кров
до серця.
РЕГУЛЯЦІЯ КРОВООБІГУ В СУДИНАХ
Кровотік у судинах залежить від продуктивності серця, просвіту судин і стану крові. Активна (регульована) зміна просвіту судин визначається гладкими м’язами. На стан гладких м’язів-судинної стінки впливає багато факторів, а саме: а) об’єм крові в них і його зміни за часом; б) метаболізм гладком’язових клітин і навколишніх тканин; в) вплив нервів; г) гуморальні дії.
Електрофізіологічні дослідження засвідчили, що гладком’язові клітини стінок судин не однакові. В одних м’язах електричні і скоротливі реакції синхронізовані, в інших же скорочення розвивається після невеликого латентного проміжку вслід за деполяризацією, а ще в інших м’язових клітинах спостерігається повільний розвиток скорочення на тлі повільної деполяризації. Скорочення деяких волокон відбувається взагалі, без зміни мембранного потенціалу. Компонування цих волокон у різних судинах відчутно позначається на сумарних фізіологічних властивостях, реакції цих судин на різні подразники.
Судинний тонус
Судинна стінка перебуває в постійному напруженні, або тонусі. Під судинним тонусом розуміють стан тривалого збудження гладких м’язів судин, що проявляється відповідною інтенсивністю їх скоротливої активності і не супроводжується розвитком втоми. Вираженість тонусу в кожному відділі судинної системи різна. Наприклад, тонус судин шкіри менший, ніж тонус скелетних м’язів.
Основою тонічного напруження є фізіологічні властивості власне гладком’язових клітин і їх реакції на зовнішні впливи. Частина гладком’язових клітин володіє пейсмекерною активністю. Вона найбільше виражена в артеріальних судинах, особливо в їх ре-зистивному відділі. Спонтанна деполяризація цих клітин, поширюючись на сусідні клітини, створює так званий базальний тонус.
В умовах цілого організму тонус судин підтримується: а) реакцією гладких м’язів на розтягування тиском крові; б) постійно утворюваними в тканинах вазоактивними метаболітами; в) циркулюючими в крові гуморальними факторами; г) тонічними імпульсами, що'надходять нервами. У стані фізіологічного спокою постійно судиноруховими нервами до судин надходять імпульси з частотою 1—3 за 1 с.
Чутливість до зовнішніх впливів у різних м’язів не однакова. За реакцією судинної стінки можна виділити щонайменше два типи м’язових клітин — тонічні й фазні. Чутливішими до зовнішніх подразників є фазні м’язи. В цілому ж тонус судин зумовлюється інтеграцією базального тонусу і фазних скорочень.
МЕХАНІЗМИ ВПЛИВУ НА ГЛАДКІ М'ЯЗИ СУДИН
Механічні стимули
Гладкі м’язи стінки судин реагують на механічні стимули, пов’язані зі зміною тиску крові. Причому реакція їх залежить від швидкості впливу. При повільному розтягуванні збільшеним об’ємом крові пластичність гладких м’язів забезпечує поступове розширення судини, тому тиск у ній може і не збільшуватися. Навпаки, різке розширення призводить до скорочення м’язів. Скорочення при цьому відбувається внаслідок підвищення проникності мембрани гладком’язових клітин для Са2+ та збільшення концентрації його в саркоплазмі. Можливий і прямий вплив розтягування на систему актину — міозину. Найчіткіша реакція на розтягування спостерігається у фазних м’язах.
Гуморальна стимуляція
Гуморальна стимуляція найчастіше зумовлена взаємодією ва-зоактивних речовин з рецепторами мембран. Так, у більшості судин гладком’язові клітини мають а- І р-адренорецептори. Взаємодія адреналіну (норадреналіну) з цими рецепторами може зумовити різні ефекти. Активізація а-рецепторів призводить до зниження рівня цАМФ у середині клітини, збільшення концентрації Са2+, скорочення м’язів і звуження судини. Взаємодія з р-рецеп-торами супроводжується збільшенням рівня цАМФ, зменшенням концентрації вільного Са2+ і розслабленням гладком’язової клітини. Реакція судини на адреналін і норадреналін залежить від співвідношення в судинах а- і р-рецепторів та від їхньої чутливості до відповідних речовин. У фізіологічній концентрації адреналін взаємодіє з чутливішими до нього р-рецепторами і судини розширюються. При високій концентрації гормон взаємодіє з «-рецепторами і звужує судини. Норадреналін більшою мірою впливає на а-рецептори і в малій концентрації звужує судини.
Кількість рецепторів на мембрані, їх співвідношення не є постійними і протягом життя можуть змінюватися. Так, у коронарних судинах з розвитком вікових змін збільшується чутливість а-рецепторів. Тому в старечому віці при емоціях і інших станах збільшення в крові рівня адреналіну чи норадреналіну може зумовити спазм коронарних судин.
У судинах різних органів щільність рецепторів не однакова. Так, у судинах нирок немає а-рецепторів. У гладких м’язах судин кишок а-рецепторів більше, ніж у скелетних м’язах. У судинах мозку менше а- і р-рецепторів, ніж у судинах кишок, скелетних м’язах і внутрішніх органах. Пам’ятаючи про це, можна дійти ви
сновку, що реакція різних судинних зон на катехоламіни дуже варіабельна.
Ацетилхолін через М-холінорецептори призводить до збільшення рівня цГМФ. Унаслідок цього знижується рівень вільного внутрішньоклітинного Са2+ і клітина розслаблюється.
Щодо гістаміну є два типи рецепторів — Ні і Н2. Активізація Нгрецепторів супроводжується деполяризацією мембрани, збільшуючи вихід К+ з клітини. При цьому знижується сила скорочення м’яза, але скорочення зберігається, тому що при активізації Нгрецепторів зменшується вихід К+ з клітини і Са2+ з депо в цитоплазму, що призводить до розслаблення гладкого м’яза.
Потужним судинозвужувальним фактором є ангіотензин II,. який стимулює надходження Са2+ через саркоплазму в середину клітини. Він діє переважно на дрібні артерії і артеріоли шкіри, органів черевної порожнини. На вени та судини малого кола кровообігу вплив ангіотензину II незначний. Помітний констриктор-ний ефект викликає вазопресин. Механізм його пов’язаний із скороченням гладких м’язів артеріол.
Усі простагландини (Еь Е2, Ві, Аь А2, Е2), як правило, зумовлюють розширення судин. Можливо, це відбувається шляхом підвищення проникності мембран для к+.
Безумовно, істотна зміна в крові або тканинах концентрації К+, Иа+, Са2+ також може позначитись на стані судинної стінки.
У тканинах утворюються метаболіти, які впливають на стан розташованих поруч судин. До вазоактивних метаболітів, які розширюють судини, належать молочна і піровиноградна кислоти,. АТФ, АДФ, аденозин, СО2, такі біологічно активні сполуки, як кініни, нейропептиди. Судини розширюються під впливом рН, К4' та ін.
Модулювальна функція
судинної стінки
Судинна стінка не є’ пасивним об’єктом впливу регуляторі в. її власний метаболізм істотно відбивається на характері реакції при дії різних регуляторних факторів. Модулювальною функцією^ володіють як гладком’язові клітини, так і ендотелій стінки судини.
Реакція стінки судини на регуляторний стимул залежить від рівня Ро2 у крові. При дефіциті кисню в стінці артерії зменшується реакція на норадреналін і ацетилхолін. Обмеження збудливості м’язових клітин при цьому зумовлено зниженням активності іонних насосів їх мембран. При гіпоксії реакція стінки судин на механічне й нейрогенне подразнення також виражена меншою мірою.
З другого боку, при підвищеному рівні Ро2 також змінюється
стан стінки судин. Під час дихання чистим киснем або перебування в барокамері при кисневому тиску понад 1 атм підвищення рівня Рао2 стимулює утворення в тканинах пероксиду водню і продуктів перекисного окислення ліпідів (ПОЛ) мембран. Унаслідок цього в стінці судини можуть значною мірою порушуватися обмінні процеси (аж до руйнування гіалуронової кислоти і колагену). Комплекс метаболічних порушень, що розвиваються, призводить до спазму судин. Навіть помірне підвищення рівня ПОЛ зумовлює збільшення проникності мембран для Са2+ та порушення виведення його з клітини. Це супроводжується тривалим скороченням гладком’язових клітин. Ефект гідропероксидів може бути як прямим, так і непрямим, наприклад, через підвищення утворення простагландинів. Тому тривале дихання киснем може спричинити спазм судин, підвищену проникність їх мембран і набряк тканин (особливо небезпечний набряк мозку).
В останні роки було виявлено модулювальний вплив ендотелію судин на гуморальні механізми регуляції. Ендотеліальні клітини продукують кілька факторів: метаболіти арахідонової кислоти (найпотужнішим із них є простациклін РОІ2); фактор розслаблення судин (ФРС-оксид азоту); фактор скорочення судин (ФСС-ен-дотеліїн); вільні радикали. їх можна зарахувати до паракринних клітин (система АРИД). Вказані субстанції утворюються при механічному впливі на судини кров’яного тиску або зміні рівня Р02 у крові.
Більшість цих субстанцій (простациклін, ФСС) дає судинозвужувальний ефект. ФРС, який є оксидом азоту (N0), розширює судини. Під його впливом у гладком’язових клітинах активізується процес утворення цГМФ, внаслідок чого зменшується концентрація кальцію. Деякі вазоактивні сполуки впливають на судини опосередковано, через утворення ФРС. До таких речовин належать субстанція Р, АТФ, АДФ, аденозин, серотонін, ацетилхолін. ФРС є місцевим модулятором, оскільки руйнується через кілька секунд після утворення.
Іннервація судин
Нервова регуляція судинного тонусу досягається за допомогою вегетативної нервової системи. До всіх судин, що мають гладкі м’язи, підходять симпатичні нервові волоконця, подразнення яких зумовлює скорочення судинних м’язів, звуження діаметру судин. Ця закономірність добре простежується в досліді К. Бернара з перерізкою симпатичних нервів, які контролюють тонус судин вуха кроля. Якщо перерізати нерви і таким чином зняти тонічну симпатичну імпульсацію частотою 1—3 за 1 с, то спостерігаються вазодилатація, почервоніння вуха, підвищення його температури. При подразненні цих нервів судини знову звужуються. Таким чи-
Мал. 168. Вплив симпатичної нервової системи на тонус кровоносних судин:
1 — кіркова речовина великого мозку; 2 — гіпоталамус; 3 — бульбарннй центр
ном, залежно від частоти імпульсів, що йдуть симпатичними нервами, судини можуть звужуватись (вазоконстрикторний вплив) або розширюватись (вазодилататорна реакція). Це дуже помітно на мал. 168.
У той же час не всі симпатичні нерви зумовлюють констрик-цію судин. Так, у складі симпатичної системи є волокна, які йдуть від кори великого мозку до скелетних м’язів і спричиняють, особливо при навантаженні, дилатацію судин. Симпатичні нерви, післягангліонарні волокна яких виділяють медіатор ацетилхолін, також розширюють судини. Окрім симпатичних нервових волокон, до судин органів малого тазу, м’якої оболонки великого мозку, секреторних залоз системи травлення підходять парасимпатичні нерви, під впливом яких розвивається вазодилатація судин.
Деяким органам, наприклад
шкірі, притаманний судинорозширювальний аксон-рефлекс. У відповідь на механічне, температурне або хімічне подразнення шкіри він зумовлює розширення судин тієї ділянки, яка зазнала подразнення.
На рівні гладком’йзових клітин також взаємодіють нейрогенні медіатори й інші вазоактивні сполуки. Нервові закінчення не утворюють типових синапсів у судинах, а виділяють медіатор відносно далеко від мембрани клітини (понад 80 нм). У цей самий простір надходять тканинні метаболіти, вазоактивні речовини крові і медіатори інших нервів, які іннервують судини. Вплив на клітини стінок судин може бути синергічним (НА і нейропептид V) або антагоністичним (речовина Р і серотонін). До того ж ряд речовин може впливати і на мембрану сусіднього нервового закінчення, змінюючи вихід медіатора. Так, ацетилхолін, гістамін, АТФ затримують вихід НА. Багато таких сполук мають як прямий вплив на м’язові клітини, так і опосередкований — через вихід медіатора з нервового закінчення чи ЕФР у ендотеліальних клітинах.
Реакція клітин на медіатор норадреналін, як і на циркулюючий у крові гормон адреналін, залежить від наявності а- або р-рецепто-рів. У більшості судинних зон імпульсація симпатичних нервів при
зводить до звуження судин. Цей ефект зумовлений взаємодією НА з а-рецепторами. НА, що виділяється закінченнями симпатичних нервів або наднирковими залозами, має більшу спорідненість з а-, ніж з р-рецепторами.
МЕХАНІЗМИ РЕГУЛЯЦІЇ
ГЕМОДИНАМЕКИ
Підтримання кровообігу на постійному рівні у стані фізіологічного спокою, а також адаптація його до конкретних умов у період функціонування організму відбуваються завдяки нейрогуморальним механізмам регуляції.
Однією із центральних ланок регуляції кровообігу є нейрони дорсолатеральної і вентромедіальної ділянок довгастого мозку, які отримали назву с у д и н о р у хо в о г о центра. При збудженні дорсолатеральної зони спостерігається пресорний ефект — підвищення кров’яного тиску. Він пов’язаний із збільшенням тонусу резистивних і ємкісних судин. Паралельно зростають частота й сила серцевих скорочень, ХОК- При збудженні вентромедіальної зони розвивається депресорна реакція — знижується тиск, зменшується діяльність серця.
Регуляторний вплив нейронів дорсолатеральної зони здійснюється шляхом підвищення тонусу симпатичних судинозвужуючих нервів, які беруть початок у цій зоні й іннервують кровоносні судини та серце. Дещо складніший механізм дії вентромедіальних нейронів. При їх збудженні інформація передається в дорсолате-ральну зону, в якій пригнічується тонус симпатичних нервів і таким чином судини звільняються від тонічних впливів симпатичної системи. Паралельно інформація із цієї зони парасимпатичними нервами надходить до серця, що супроводжується зменшенням його діяльності та зниженням серцевого викиду крові.
На тонус судинорухового центра постійно впливає аферентна імпульсація від рецепторів судин і серця, яка повідомляє його про функціональний стан цих органів, змушує проводити корекцію їх діяльності.
З бульварними відділами безпосередньо зв’язані вищерозта-шовані центри гіпоталамуса. Подразнення окремих його ділянок може призвести до звуження або розширення локальних судинних зон (нирок, скелетних м’язів, черевної ділянки), а також до змін функції серця. Задній (ерготропний) гіпоталамус залучає систему кровообігу до організації адаптивних відповідей при таких станах, як емоційний спалах, м’язова діяльність. Передній (трофотропний) гіпоталамус, навпаки, сприяє відновленню кровообігу після інтенсивної діяльності організму.
Певний внесок у регуляцію кровообігу належить корі великого мозку. При стимуляції неокортексу в моторній та примоторній
ділянках переважно підвищується кров’яний тиск і прискорюється ЧСС. При подразненні палеокортексу в ділянці передньої поясної звивини розвивається депресорна реакція. Відділи кори великого мозку впливають на судини найчастіше опосередковано, через вказані центри гіпоталамуса і стовбура мозку. Не виключається й прямий вплив їх на нейрони відповідних відділів вегетативної нервової системи, розташованих у спинному мозку та іннервованих судинах. Враховуючи те, що багато структур великого мозку беруть активну участь у регуляції функції судин і серця, було висловлено припущення про є д и н и й гемодинамічний центр регуляції системи кровообігу (В. В. Фролькіс, 1959).
На рівні спинного мозку (в симпатичних нейронах бокових рогів) також розташовані центри регуляції тиску, які проявляють свою активність у разі відсутності впливу вищих відділів ЦНС.
Як правило, при здійсненні більшості рефлексів стан судин змінюється разом із функцією серця і дихання. Нейрони бульварного відділу серцево-судинного центра містяться поруч із дихальними, тому аферентні імпульси, які надійшли до одного з них, можуть спричинити збудження сусідніх нейронів. Гіпоталамус, беручи участь у мобілізації систем організму при адаптивних поведін-кових реакціях, підключає до них системи кровообігу й дихання.
Судинорухові центри впливають на кровообіг таким чином: 1) регулюючи загальний периферичний опір через зміну тонусу резистивних судин; 2) регулюючи ємкість судинної системи через тонус венозного відділу; 3) регулюючи об’єм циркулюючої крові.
В основі рефлекторної регуляції судинного тонусу лежить принцип негативного зворотного зв’язку. Реакції, як правило, спрямовані на усунення подразника. До типових реакцій належать рефлекторні впливи з хемо- і барорецепторів. У даному разі можна виявити два принципи вмикання: на виході (за розходженням) і на вході (за збуренням). Рецептори дуги аорти й каротидного синуса містяться на виході, сприймаючи зміни, які вже виникли. Тому рефлекси, які починаються з подразнення цих утворень, спрямовані на усунення подразника. Більшість відповідних реакцій при розтягуванні венозних судин і передсердь, коли йдеться про стан саме цих відділів, спрацьовує за цим же принципом. Друга частина реакції, коли, наприклад, треба запобігти збільшенню об’єму крові, яка надходить до серця, спрацьовує ще до того, як кров надійде в артеріальний відділ судинного русла.
Рефлекси з барорецепторів артерій
У стінці артерій можна виявити рецептори, які реагують на тиск. У ряді ділянок вони містяться у великій кількості. Ці ділянки називають рефлексогенними зонами. Виділяють три найважливіші для регуляції системи кровообігу зони. Вони розта
шовані в ділянці дуги аорти, в каротидному синусі і легеневій артерії. Рецептори інших артерій, у тому числі й мікроциркулятор-ного русла, беруть участь головним чином у місцевих перерозпо-дільних реакціях кровообігу.
Барорецептори подразнюються під час розтягування стінки судини. Імпульсація з барорецепторів дуги аорти й каротидного синуса посилюється майже лінійно при зростанні тиску від 80 мм рт. ст. (10,7 кПа) до 170 мм рт. ст. (22,7 кПа). Причому має значення не тільки амплітуда розтягування судин, але й швидкість зростання тиску. При постійно високому тискові рецептори поступово адаптуються і інтенсивність імпульсації слабшає.
Аферентні імпульси від барорецепторів надходять до бульварних судинорухових нейронів, де через збудження депресорного відділу гальмується пресорний. Унаслідок цього імпульсація симпатичних нервів слабшає і тонус артерій, особливо резистивних, знижується. При цьому опір кровотоку зменшується, а відплив крові в розташовані далі судини збільшується. Тиск у вищерозта-шованих артеріальних судинах знижується. Одночасно зменшується симпатичний тонічний вплив і на венозний відділ, що призводить до збільшення його ємкості. Внаслідок цього знижуються приплив крові з вен до серця і його ударний об’єм, чому сприяє також прямий вплив на серце бульварного відділу (імпульси надходять блукаючими нервами). Цей рефлекс, певно, спрацьовує при кожному систолічному викиді і сприяє виникненню регуляторних впливів на периферичні судини.
Протилежна спрямованість відповіді спостерігається у разі зниження тиску. Зниження імпульсації від барорецепторів супроводжується ефекторним впливом на судини через симпатичні нерви. При цьому може приєднуватися і гормональний шлях впливу на судини: внаслідок інтенсивної імпульсації симпатичними нервами посилюється виділення катехоламінов із надниркових залоз.
У судинах малого кола кровообігу також є барорецептори. Виділяють три основні рецепторні зони: стовбур легеневої артерії і її біфуркація, позачасточкові ділянки легеневих вен, найдріб-ніші судини. Особливо важлива зона стовбура легеневої артерії, в період розтягування якої розпочинається рефлекс розширення судин великого кола кровообігу. При цьому одночасно знижується ЧСС. Вказаний рефлекс реалізується також через вищеназвані бульбарні структури.
Модуляція чутливості барорецепторів. Чутливість барорецепторів до тиску крові змінюється залежно від багатьох чинників. Так, у рецепторах каротидного синуса чутливість підвищується при зміні в крові концентрації Ца+, К+, Са2+ і активності Ца-, К-насосу. На їх чутливість впливають імпульсація симпатичного нерва, який підходить сюди, і зміни рівня адреналіну в крові.
Особливо велику роль відіграють сполуки, вироблені ендоте
лієм стінки судйн. Так, простациклін (Р6І2) збільшує чутливість барорецепторів каротидного синуса, а фактор розслаблення (ФРС), навпаки, пригнічує її. Модулювальна роль ендотеліальних факторів, очевидно, має більше значення для спотворення чутливості барорецепторів при патології, зокрема при розвитку атеросклерозу і хронічній гіпертензії. Цілком зрозуміло, що в нормі співвідношення факторів, які підвищують і знижують чутливість рецепторів, урівноважене. При розвитку склерозу переважають фактори, які знижують чутливість барорецепторних зон. Унаслідок цього порушується рефлекторна регуляція, завдяки якій підтримується нормальний рівень тиску крові, і розвивається гіпертензія.
Рефлекси з барорецепторів передсердь та великих вен
У обох передсердях також є рецептори, які реагують на розтягування. У відповідь на активне розтягування передсердь під час їх систоли збуджуються рецептори Типу Аз. При пасивному розтягуванні передсердь збуджуються рецептори типу В. Від цих рецепторів імпульси волокнами блукаючого нерва досягають довгастого мозку. Імпульси з барорецепторів передсердь особливо істотно впливають на судини нирок, що призводить до інтенсифікації процесів фільтрації плазми крові. Таким чином вказані рецептори беруть участь і в регуляції ОЦК-
При розтягуванні передсердь спрацьовує й гормональний механізм, який бере участь у підтримці ОЦК. У міокарді передсердь виробляється атріонатрійуретичний фактор. Цей пептид сприяє виведенню Ца+ (а разом з ним і води) з організму, розширенню судин. За його допомогою не допускається перенавантаження серця підвищеним припливом крові. Атріонатрійуретичний фактор утворюється в спеціалізованих клітинах серця, найбільше яких міститься у вушках передсердь. Ці клітини вирізняються серед інших відсутністю скоротливих елементів і потужного секреторного апарата.
Рецептори розтягування є і у венозних відділах, особливо в порожнистих венах. їх розтягування призводить до таких змін, які спостерігаються й при подразненні передсердних рецепторів.
Рефлекси з хеморецепторів
Адекватним подразником для хеморецепторів судин є зниження напруги О2 і підвищення напруги СО2, або збільшення концентрації Н+ у крові. Імпульси від збуджених рецепторів, розташованих у каротидному синусі, дузі аорти, інших судинах, спрямовуються в довгастий мозок. Тут вони перемикаються на
симпатичні й парасимпатичні структури. Стимуляція симпатичних нейронів призводить до звуження судин, парасимпатичних — до зниження ЧСС, зменшення серцевого викиду крові. Вираженість реакції судин не узгоджується зі зміною серцевого викиду, що проявляється сумарним зростанням тиску крові. Внаслідок цього прискорюється кровотік, який певною мірою поліпшує доставку Ог до тканин. Задишка, що виникає при цьому, сприяє насиченню крові О2, виведенню основного подразника — хеморецепторів СОг. Хеморецептори каротидного синуса збуджуються також під впливом ціанідів, нікотину та інших сполук, які надходять до них із кров’ю.
МЕХАНІЗМИ РЕГУЛЯЦІЇ МІКРОЦИРКУЛЯЦЦ
І ЛОКАЛЬНОГО КРОВОТОКУ
Кровообіг у кожному органі залежить від анатомічних особливостей його судинного русла. Проте в реальних умовах життя нерідко виникає потреба у зміні кровопостачання органа. Це завдання виконують відповідні системи регуляції. Регуляцією системи мікроциркуляції передбачається підтримання належних параметрів кровообігу в капілярах, які б у міру можливості не залежали від коливання показників центральної гемодинаміки. У той же час мікроциркуляторне русло повинно активно змінюватися, щоб відповідати інтенсивності обміну речовин у певному органі.
Особливості місцевої гемодинаміки в кожному органі обумовлені значенням кровообігу для забезпечення його функції. Можна виділити три основних типи організації судинного русла органів.
1. Кровотік точно відповідає потребам органа в надходженні з кров’ю поживних речовин та кисню. Кровотік у таких органах практично виконує лише трофічну функцію. До них належать серце й головний мозок. Тканини їх найбільше страждають при недостатньому кровотоці, тому постачання кров’ю повинно відповідати зміні їх продуктивності. Кровотік у цих органах регулюється складними багатоповерховими системами.
2. Кровотік відбувається з надлишком. Кров у таких органах не тільки виконує трофічну функцію, але й бере участь у реалізації цієї специфічної функції. До таких органів належать нирки, ендокринні залози, легені. В основі регуляції кровотоку в названих органах лежить принцип максимально можливої автономності. Кровообіг у них відносно мало змінюється при коливанні центральної гемодинаміки, хоча значні її відхилення можуть позначатися на кровотоку і цих органів.
3. За деяких обставин орган може виконувати функцію й при недостатньому кровотоці. До таких органів належать травний канал та скелетні м’язи. Наприклад, при інтенсивному скороченні
скелетних м’язів робота протягом якогось часу може продовжуватись і при відносній невідповідності їх оксигенації («у борг»).
Регуляція локального кровотоку здійснюється місцевими й загальними механізмами. Система регуляції мікроциркуляторного русла повинна одержувати інформацію про стан судин, кровотік у них і трофіку тканин. Ці сигнали надходять: а) від власне гладких м’язів судин при їх розтягуванні; б) від рецепторів розтягування, які містяться в стінках судин; в) під час надходження до судинної стінки вазоактивних речовин, які утворюються в тканинах.
Можна чітко виділити кілька рівнів вмикання механізмів регуляції. Перший рівень регулювання — міогенний, який грунтується на властивостях гладком’язових клітин стінок судин. Другий — гуморальний, обумовлений впливом на гладком’язові клітини вазоактивних метаболітів, які утворюються в тканинах або ж безпосередньо в судинній стінці, коли їх кровопостачання стає неадекватним. Для більшості органів характерна також нейрогенна регуляція мікроциркуляторного русла, здійснювана місцевими рефлексами. В реальних умовах названі впливи реалізуються одночасно в різних поєднаннях. Так, при підвищенні тиску в центральних судинах і неадекватному зростанні кровотоку можуть від-реагувати власне гладкі м’язи, які сприймають розтягування. У відповідь на нього вони можуть скоротитися і зменшити кровотік у розташованих за ними утвореннях мікроциркуляторного русла. Тут же підключається рефлекторний механізм, який запускається подразненням механорецепторів.
При зниженні кровотоку регуляція здійснюється в основному за рахунок впливу метаболітів та інших біологічно активних сполук, які розширюють периферичні судини. Судинорозширювальний ефект мають Н+, К+, аденозин, кініни, які утворюються в цих умовах у великій кількості. Вони діють безпосередньо на гладкі м’язи. Частина з них впливає також і через хеморецептори, які є в мікроциркуляторному руслі деяких органів і тканин. Цікаво,-що окремі механізми регуляції можуть модулювати дію інших. Наприклад, при зміні напруги Ог і СО2 в крові прямий міогенний вплив на розтягування виключається. В цьому випадку в регуляції мікроциркуляторного русла беруть участь накопичені в тканинах вазоактивні речовини, які діють на гладкі м’язи безпосередньо або через хеморецептори. Внаслідок цього артеріоли розширюються і кровотік поліпшується.
Для підтримання сталості мікроциркуляції при зміні артеріального тиску також використовуються як прямі міогенні механізми (через гладкі м’язи), так і опосередковані (через нейрогенні вазомоторні сигнали). У підтриманні сталості об’єму крові в мік-роциркуляторних судинах першочергову роль відіграють дрібні вени, які розширюються. Рефлекторний зв’язок досягає приносних
артеріол, при звуженні яких зменшується надходження крові в мікроциркуляторне русло.
Вказані механізми місцевої регуляції кровотоку можуть чинити вплив на судини, який часом не узгоджується з центральними рефлекторними імпульсами, що надходять до них. Так, при появі ва-зоактивних дилататорів розширюються судини функціонуючих м’язів всупереч судинозвужувальним впливам симпатичних нервів. Ці ж місцеві механізми, незважаючи на зміни в системі кровообігу (наприклад, при крововтраті), дозволяють підтримувати гемо-динаміку в життєво важливих органах на стабільному рівні. Особливо добре функціонує система місцевого регулювання серця і головного мозку, тобто тих органів, кровотік яких повинен точно відповідати їх функціональному стану.
РЕГУЛЯЦІЯ СИСТЕМНОГО КРОВООБІГУ
В СТАНІ ФІЗІОЛОГІЧНОГО спокою
В умовах фізіологічного спокою кровообіг здійснюється з мінімальною активністю систем регуляції. Для забезпечення кровотоку в кожному органі і в усій серцево-судинній системі використовують головним чином фізіологічні властивості власне структур; у серці — властивості скоротливого міокарда і провідної системи (автоматизм); у судинах — специфіку розподілу ХОК між органами (він здійснюється залежно від анатомічних особливостей судин — діаметра, елементів стінки, їх тонусу). Тонус кожного відділу судинного русла залежить від властивостей скоротливих елементів і об’єму крові, яка надходить. Крім того, мають значення вміст у крові вазоактивних сполук (гормонів, метаболітів), базальний рівень нейрогенних тонічних впливів, вплив гормонів крові й метаболітів інших органів. Завдяки комплексу вказаних механізмів підтримуються відповідні параметри функції серця (УО, ЧСС), рівень артеріального тиску у великих артеріях та венах, а також постійна кількість і склад циркулюючої крові.
Основним контрольним механізмом, що підключає рефлекторні механізми регуляції, є барорецептори великих судин. А головним регульованим параметром справедливо вважається рівень артеріального тиску (АТ). Рівень Рс залежить головним чином від УО серця, в той час як Рд — від опору резистивних судин. Ці параметри контролюють барорецептори, які у випадку відхилення вмикають відповідні рефлекси стосовно серця і кровоносних судин.
У стані спокою на кривій запису АТ виявляються хвилі трьох порядків. Хвилі першого порядку зумовлені коливанням систолічного і діастолічного тиску. Хвилі другого порядку зумовлені впливом вдиху і видиху на приплив крові до відділів серця і взаємодією дихального та судинорухового центрів стовбура головного мозку: під час вдиху в артеріях великого кола кровообігу тиск зменшує
ться, а при видиху збільшується. Хвилі третього порядку є наслідком повільного коливання тонусу периферичних судин з періодичністю 6—20 с. Мабуть, вони залежать від ритму центральних рефлекторних механізмів, тобто коливання тонусу центрів.
Крім того, можна виявити добові коливання артеріального тиску, спричинені так званими циркадними ритмами: максимальний тиск спостерігається в період близько 15-ї години, а мінімальний — о 3-й годині.
РЕГУЛЯЦІЯ КРОВООБІГУ В МІНЛИВИХ
УМОВАХ ІСНУВАННЯ
Людина протягом життя більшу частину часу проводить в мінливих умовах. При цьому зміна функціонального стану організму неможлива без зміни кровообігу. Крім того, нерідко можуть виникати різноманітні відхилення в діяльності власне серцево-судинної системи. Для забезпечення кровотоку в цих умовах вмикається адаптивний контур регуляції.
Відновлення кровотоку при підвищенні тиску
При короткочасних відхиленнях параметрів системного АТ і об’єму крові вмикаються переважно судинні рефлекторні реакції, спрямовані на стабілізацію цих показників. У разі підвищення тиску в артеріях подразнюються барорецептори рефлексогенних зон аорти та каротидного синуса. Аферентні імпульси через бульварний відділ судинорухового центра гальмують пресорний його відділ і збуджують депресорний. При цьому тонічний вплив на резистивні судини знижується і вони розширюються, що сприяє збільшенню їх ємкості та зниженню повернення крові до серця. Одночасно зменшуються сила та частота серцевих скорочень. Унаслідок комплексу вказаних змін тиск знижується. Така реакція серцево-судинної системи на підвищення тиску називається депресорним аортальним і синокарбтидним рефлексом.
Відновлення кровотоку при зниженні тиску
При зниженні тиску зменшується частота імпульсації від барорецепторів у судиноруховий центр, що призводить до протилежної реакції судин та серця і зрештою до підвищення тиску. Це відбувається за рахунок рефлекторного спазму судин, прискорення скорочення серця, підвищення ХОК. Подібні зміни кровообігу у відповідь на зниження тиску крові мають назву пресорного, аортального і синокаротидного рефлексу (мал. 169), Разом із тим при спазмі
Мал. 169. Схема рефлекторних дуг при пресорному та депресорному баро- і хе-морефлексах із каротидного синусу та дуги аорти:
ТІ Р — підвищення чи зниження Кров’яного тиску; 1 СО2 — підвищення вмісту вуглекислоти в крові; 1 О2— зниження вмісту кисню в крові; ТІ Н"Ь — ацидоз чи алкалоз периферичних судин знижується ефективний фільтраційний тиск та підвищується реабсорбція води з міжклітинної рідини. Це зумовлює збільшення ОЦК, унаслідок чого підвищується АТ. Крім того, лише збільшення ОЦК саме по собі сприяє підвищенню венозного повернення до серця, включенню механізму Франка—Старлінга і зростанню АТ.
Коли цих механізмів не до
сить, то для нормалізації параметрів підключається новий рівень регуляторних дій, в основі яких лежать гормональні впливи. Збудження симпатичних нервів супроводжується посиленням виділення катехоламінів мозковою речовиною надниркових залоз. При деяких екстремальних обставинах рівень їх у крові може збільшуватися в 10—20 разів. Ці гормони стимулюють діяльність серця і звужують судини більшості органів. За допомогою вказаних гормонів збільшується тривалість адаптивної дії Симпатичних нервів на серцево-судинну систему.
Гормони, зокрема натрійуретичний гормон передсердь, вазопресин та ренін-ангіотензин-альдостеронова система впливають також і на об’єм циркулюючої плазми.
Ренін-ангіотензин-альдостеронова система активізується при порушенні системного і регіонарного (ниркового) кровотоку. Зниження кровопостачання нирок спостерігається при падінні системного тиску чи спазмі судин нирок. Утворений ангіотензин II діє двояко. З одного боку, він звужує артеріальні судини і підвищує системний тиск, а з другого — стимулює виділення в надниркових залозах альдостерону, котрий за допомогою нирок утримує в крові Ца+ і воду. Ренін-ангіотензин-альдостеронова система відіграє важливу роль у нормалізації кровотоку при зниженні тиску та зменшенні об’єму крові. Зміни цієї системи при ураженні нцрок можуть бути і причиною розвитку деяких видів ниркової гіпертензії.
АТ підтримується на нормальному рівні елементами функціональної системи, яка працює за принципом саморегуляції. Зміна його під впливом різних чинників зовнішнього середовища відповід
но до вимог організму є конче потрібкою умовою для пристосування. Функціональна система, яка забезпечує оптимальний рівень АТ, визначає межі його коливання. Верхня межа регулюється шляхом зворотної аферентації від барорецепторів ділянок високого тиску (дуги аорти, синокаротидної зони). Нижня межа встановлюється відповідно до потреб організму в кровопостачанні. В його забезпеченні беруть участь периферичні хемо-, баро- і во-люморецептори ділянок низького тиску.
Система підтримки АТ ділиться умовно на систему швидкого (негайного) і тривалого (відсунутого) реагування. Система швидкого реагування складається із контура зворотного зв’язку (баро-і хеморецепторів великих артерій, які є початковою ланкою цього ланцюга) і резистивних ємкісних судин і серця (її кінцевої ланки). її функція спрямована на буферування коливань АТ, особливо його верхніх рівнів. При зміні положення тіла, психоемоційному стресі, фізичному навантаженні ця система служить противагою щодо чинників зовнішнього середовища, здатних підвищувати АТ. Дія цієї системи, котра реалізується через рецептори зон високого тиску, розпочинається через кілька секунд і досягає максимуму через 10—ЗО с. Інформація від барорецепторів надходить у довгастий мозок. Збудження альфа-адренорецепторів (аналогічні зміни спостерігаються при дії центральних альфа-адреноміметич-них засобів), які виникають у ділянці ядер солітарного шляху, призводять до зниження периферичного тонусу (відповідно до змін функції серця і судин), а зрештою, і до зниження АТ.
На противагу гіпотензії, що розвивається, викликається інша система — ниркові механізми, які спрямовані на підвищення АТ. У відповідь на зниження тиску, подразнення волюмо- і хеморецепторів нирки виділяють ренін, який через певний каскад реакцій перетворюється на ангіотензин II — сильний вазоконстрикторний фактор. Поруч із вазоконстрикторною дією ангіотензин II збільшує канальцеву реабсорбцію №+ і підвищує секрецію альдостерони наднирковими залозами, який збільшує реабсорбцію №+ у дистальних відділах збиральних канальців, сприяє затримці води в організмі, зростанню об’єму циркулюючої крові. Накопичення №+ у м’язовій стінці артерій призводить до їх спазму, підвищення АТ. За принципом зворотного зв’язку секреція реніну гальмується ан-гіотензином II. На секрецію реніну, окрім вище згаданого механізму, впливають симпатична нервова система, ниркові простагландини (особливо ПГІ2) і калікреїн-кінінова система, катехоламіни, глюкагон, вазопресин, які циркулюють у крові.
За останні роки спектр гуморальних речовин, що беруть участь у регуляції водно-електролітного обміну, а отже й АТ, розширився за рахунок виявлення натрійуретичних гормонів ниркового, гіпо-фізарного і передсердного походження. їх дія скерована на підвищення виділення із організму N3+ і води, зниження АТ. Між
рівнем АТ і виділенням N3+ і води існує 8-подібна залежність: при підвищенні АТ значно зростають натрійурез і діурез, при знижен-ні — навпаки. У здоровому організмі ці системи дуже тісно пов’язані, а остаточний рівень АТ залежить від інтеграції механізмів (швидкого чи тривалого) його регулювання.
Відновлення кровотоку при зміні об'єму крові
Подібне підключення механізмів регуляції спостерігається при зміні об’єму крові. Запускаються вони з венозного відділу серцево-судинної системи. Подразнення волюморецепторів, розташованих у порожнистих венах і передсердях, передається у два відділи ЦНС: довгастий мозок та у центр осморегуляції гіпоталамуса. Внаслідок цього збуджується парасимпатичний і гальмується симпатичний відділ гемодинамічного центра. Внаслідок цієї перебудови, з одного боку, розширюються судини, а з другого — гальмується серцева діяльність. Із гіпоталамуса виходить гормон вазопресин, який звужує судини і посилює реабсорбцію води. Кількість виділеного вазопресину залежить від імпульсації з рецепторів передсердь. Тривале надходження великих об’ємів крові в передсердя або вплив на осморегулюючий центр гіпоталамуса гальмує виділення вазопресину. Цей рефлекторний ефект проявляється через 10—20 хв і може тривати, поступово зростаючи, протягом кількох діб. Унаслідок цього виділення води нирками збільшується. Навпаки, при зниженні венозного повернення, ОЦК утворення вазопресину збільшується. Затримка рідини вазопресином полегшує іншим механізмам підтримку гемодинаміки при раптових порушеннях співвідношення об’єму крові і ємнісного русла. Крім того, при тривалому подразненні барорецепторів із передсердь виділяється натрійуретичний гормон. Він надходить до нирок, де знижує реабсорбцію N3+ і таким чином сприяє виділенню води і зменшенню ОЦК.
Взаємодія різних механізмів регуляції кровотоку
Усі вказані механізми регуляції кровотоку дуже тісно пов’язані між собою. Інколи вони не тільки паралельно виконують ту ж саму функцію, але й посилюють вплив один одного. Так, ангіотен-зин II посилює збудження центральних і периферичних симпатичних структур, вазопресин збільшує чутливість ниркових регуляційних систем тощо.
Окремі утворення серцево-судинної системи включаються в організацію адаптивних реакцій також поетапно. У першу чергу зміни охоплюють систему локального (місцевого) кровотоку мікро-
циркуляторного русла. І якщо орган відносно невеликий або функціональна активність змінюється лише в частині його, то інтенсифікація кровообігу в ньому може не позначитись на загальній гемодинаміці. Так, крізь порожній шлунок проходить тільки 20— 40 мл(хв-100 г тканини) крові, близько 70 % її припадає на слизову оболонку. Активізація процесу сокотворення і особливо секреції хлористоводневої кислоти супроводжується посиленням кровотоку. При розширенні судин кровотік збільшується до 80—• 100 мл(хв-100 г тканини), що мало впливає на кровопостачання інших органів. Судини в цій ситуації розширюються під впливом комплексу біологічно активних сполук, утворених у травному каналі.
Практично без підключення системних механізмів регуляції змінюється кровообіг і в головному мозку при інтенсифікації його функції. В такому разі система ауторегуляції забезпечує перерозподіл об’єму крові, яка надходить до мозку, між активно функціонуючими центрами і тими, що перебувають у стані відносного спокою.
Але якщо орган досить великий, то для поліпшення його кровопостачання одних лише місцевих реакцій не вистачає. При цьому перерозподіл неминуче призведе до зміни гемодинаміки в інших органах і порушить системний кровотік. Тому до місцевих регуляторних механізмів паралельно підключаються системи регуляції різних рівнів. Послідовність і характер їх підключення приблизно такі ж, як і при змінах кровотоку в судинній системі.
ЗМІНИ ГЕМОДИНАМІКИ ПРИ ДЕЯКИХ
СТАНАХ ОРГАНІЗМУ
.Кровообіг при зміні положення тіла
Зміна положення тіла з горизонтального на вертикальне (активна чи пасивна) супроводжується перерозподілом крові. Під’ впливом сили тяжіння за рахунок збільшення гідростатичного тиску вени нижньої частини тулуба розширюються і можуть затримувати додатково до 500 мл крові. Внаслідок цього венозне повернення крові до серця знижується, зумовлюючи падіння УО і Рс.
Вказані зміни в системі кровотоку запускають механізми, спрямовані на активну компенсацію їх. За сигналом з барорецепторів аортальної, синокаротидної зон і венозної частини судинного русла звужуються резистивні судини. Особливо помітно звужуються судини в таких органах, як скелетні м'язи, шкіра, черевна ділянка. Паралельно до цього підвищується ЧСС. За рахунок цього компенсується знижений У О; при збільшенні ЧСС ХОК може підтримуватися на близькому до норми рівні. Звуження резистивних і
ємкісних судин супроводжується збільшенням венозного повернення (воно поступово повертається до висхідного рівня), нормалізацією АТ. При цьому інколи може підвищуватися навіть секреція катехоламінів, вазопресину та активізуватися ренін-ангіотензин-альдостеронова система.
Якщо вказаним механізмам вдається компенсувати тимчасові зміни гемодинаміки, то настає стабілізація процесу. Але при недостатній активності систем регуляції може бути ортостатична непритомність. Вона є наслідком недостатнього кровопостачання головного мозку. Суб’єктивно це проявляється «потемнінням» у очах або навіть втратою свідомості. Проте частіше цього не спостерігається, оскільки механізми регуляції швидко компенсують тимчасове зниження венозного повернення. З іншого боку, мозковий кровообіг має свою досить ефективну систему регуляції, завдяки якій він певною мірою не залежить від центральної гемодинаміки (див. с. 373).
У медицині для тестування надійності системи регуляції кровообігу широко використовують так звану кліно-ортостатичну пробу. В її основі лежить зміна ЧСС через 10 с після переходу із положення лежачи (кліно) у положення стоячи (ортостаз) і навпаки. Кліностатичний рефлекс у нормі — зменшення ЧСС на 4— 6 за 1 хв при переході із вертикального в горизонтальне положення; ортостатичний рефлекс — збільшення ЧСС на 6—24 за 1 хв при переході із горизонтального у вертикальне положення. Вира-женість змін порівняно з початковим рівнем і служить підставою для судження про активність системи регуляції кровообігу.
Кровообіг при фізичному навантаженні
Фізичне навантаження супроводжується однією із найприродні-ших для організму адаптивних реакцій, для якої потрібна добра взаємодія всіх ланцюгів системи кровообігу. Той факт, що скелетні м’язи складають до 40 % маси тіла, а інтенсивність їх діяльності може коливатися в дуже широких межах, ставить їх у особливе становище порівняно з іншими органами. До того ж треба враховувати, що у природі від функціональних можливостей скелетних м’язів залежать як пошуки їжі, так, часом, і саме життя. Тому в процесі еволюції виробилися тісні взаємозв’язки м’язових скорочень і серцево-судинної системи. Вони спрямовані на створення, у міру можливості, максимальних умов для кровопостачання м’язів, навіть за рахунок зниження кровотоку в інших органах і системах. Зважаючи на важливість забезпечення кров’ю скоротливих м’язів, у процесі еволюції сформувався новий рівень регуляції гемодинаміки з боку моторних відділів ЦНС. За рахунок їх формуються умовнорефлекторні механізми регуляції кровообігу, тобто
передстартові реакції. Значення їх полягає в мобілізації серцево-судинної системи, завдяки чому ще перед початком м’язової діяльності серцеві скорочення частішають, а тиск підвищується.
Послідовність включення серцево-судинної системи під час фізичної праці можна простежити при інтенсивному навантаженні. М’язи скорочуються під впливом імпульсів, що йдуть пірамідними шляхами, які починаються в прецентральній закрутці. Спускаючись до м’язів, вони поряд з моторними відділами ЦНС збуджують також дихальні та вазомоторні центри довгастого мозку. Звідси через симпатичну нервову систему посилюється діяльність серця та звужуються судини. Одночасно із надниркових залоз у кровотік викидаються катехоламіни, які звужують судини. У функціонуючих м’язах судини, навпаки, різко розширюються. Це відбувається головним чином за рахунок накопичення метаболітів, таких, як Н+, СОг, К+, аденозин тощо. Внаслідок цього виникає перерозподільча реакція кровотоку: що більша кількість м’язів скорочується, то більше крові, викинутої серцем, надходить до них. У зв’язку з тим що для забезпечення підвищеної потреби в крові функціонуючих м’язів попереднього ХОК вже не досить, швидко підвищується діяльність серця. При цьому ХОК може збільшуватися в 5—6 разів і досягати 20—ЗО л/хв. З цього об’єму до 80—85 % надходить до функціонуючих скелетних м’язів. Якщо в стані спокою через м’язи проходить 0,9—1,0 л/хв (15—20 % від ХОК у 5 л/хв) крові, то під час скорочення м’язи можуть одержувати до 20 л/хв і більше.
При цьому саме скорочення м’язів також впливає на кровотік. При інтенсивному скороченні внаслідок стискання судин доступ крові до м’язів зменшується але при розслабленні швидко збільшується. При меншій силі скорочення доступ крові збільшується під час фази як скорочення, так і розслаблення. Крім того, скорочені м’язи вичавлюють кров із венозного відділу, що, з одного боку, супроводжується збільшенням венозного повернення до серця, а з другого — створюються передумови для збільшення доступу крові до м’язів під час фази розслаблення.
Інтенсифікація діяльності серця при м’язовому скороченні відбувається на тлі пропорційного посилення кровотоку через коронарні судини. Автономна регуляція забезпечує збереження мозкового кровотоку на попередньому рівні. Кровозабезпечення інших органів залежить від навантаження. Якщо м’язове навантаження інтенсивне, то, незважаючи на ріст ХОК, доступ крові до багатьох внутрішніх органів може погіршуватися. Це відбувається внаслідок різкого скорочення приносних артерій під впливом симпатичних судинозвужувальних імпульсів. Розвинута перерозподільча реакція може бути виражена такою мірою, що, наприклад, внаслідок зниження ниркового кровотоку майже зовсім припиняється сечотворення.
Зростання ХОК призводить до збільшення Рс. Рд за рахунок
розширення судин м’язів може залишатися попереднім чи навіть знижуватися. Якщо зменшення Опору судинного відділу скелетних м’язів не компенсує звуження інших судинних зон, то зростає Рд.
Під час фізичного навантаження збудженню судинорухових нейронів сприяють також імпульси з пропріорецепторів м’язів, хеморецепторів судин. Поряд із цим при м’язовій роботі в регуляції кровотоку бере участь адреналова система надниркових залоз. Під час тривалої роботи вмикаються й інші гормональні механізми регуляції кровотоку (вазопресин, тироксин, ренін, передсердний .натрійуретичний гормон).
Під час м’язової роботи «відміняються» рефлекси, які контролюють АТ у стані спокою. Незважаючи на збільшення АТ, рефлекси з барорецепторів не гальмують діяльність серця. В такому випадку переважає вплив інших регулюючих механізмів.
У функціонуючих м’язах збільшення АТ при розширенні судин призводить і до змін умов водного обміну. Збільшення фільтраційного тиску сприяє затримці в тканинах частини рідини. Це зумовлює ріст гематокриту. Збільшення концентрації еритроцитів (інколи на 0Л-10,2/л) є однією з доцільних реакцій організму, оскільки при цьому збільшується киснева ємкість крові.
Відновлення кровотоку
при крововтраті
Під час крововтрати порушується кровообіг, позаяк при цьому змінюється співвідношення ємкості судинного русла і ОЦК. Зменшення ОЦК супроводжується зниженням тиску наповнення в усій судинній системі. При цьому в першу чергу починають діяти системи рефлекторної компенсації зниження тиску і венозного повернення крові до серця. Вони спрямовані на зменшення ємкості судинного русла. Пізніше мобілізуються резерви збільшення ОЦК. Зниження венозного повернення й УО здійснюється практично тими ж механізмами, що й при ортостазі. Якщо об’єм втраченої крові не перевищує 15 мл/кг, то системи регуляції можуть компенсувати його і середній АТ швидко відновлюється. При більшій втраті крові можливості рефлекторної компенсації шляхом зменшення судинного русла недостатні і тиск у великих артеріях знижується.
Зменшення подразнення артеріальних і венозних барорецепторів призводить до активізації пресорного впливу, звуження судин і прискорення серцевого ритму. В першу чергу звужуються рези-стивні судини шкіри, м’язів, внутрішніх органів. Виняток складають судини серця й мозку, які повинні добре постачатись кров’ю. Звуження вен підшкірної основи, скелетних м’язів, черевної ділянки, а також легенів призводить до зменшення об’єму ємнісних судин. Унаслідок цього розвивається стан, який має назву
централізації кровотоку: менший об’єм крові, що залишився, перерозподіляється до найбільш життєво важливих органів.
Одночасно спостерігається гормонально регульоване збільшення об’єму плазми. Зниження тиску в капілярах призводить до переважання реабсорбції над фільтрацією і відкривається доступ рідини з міжклітинного простору в кров. Внаслідок гормональної перебудови (збільшення секреції вазопресину і активізація ренін-ангіотензин-альдостеронової системи) та звуження судин нирок зменшується виділення води й солей із сечею, і за сприятливих умов вже через 10—ЗО хв після втрати 500 мл крові 80—100 % об’єму поповнюється за рахунок рідини. При більшій крововтраті об’єм плазми поповнюється протягом 10—70 год. Але разом із затримкою води для її збереження в плазмі повинна відновитися концентрація іонів і білків. Особливо важливо нормалізувати онкотичний тиск. Це дає змогу зберегти відповідний об’єм плазми в крові, що проходить через нирки, а також створити умови для обміну рідини в мікроциркуляторному русі. Тільки після відновлення ОЦК зменшується напруга регуляторних механізмів, спрямованих на звуження судин, і нормалізується їх тонус.
Рівень формених елементів крові відновлюється в різний час. Концентрація тромбоцитів і лейкоцитів нормалізується швидко за рахунок виходу їх із депо. Відсутність у організмі справжнього депо еритроцитів призводить до зниження гематокриту, оскільки ті еритроцити, які залишились у крові, розбавляються у плазмі, об’єм котрої поступово зростає. Для ліквідації анемії активізуються органи кровотворення, але це повільний процес. Він може тривати кілька тижнів.
Якщо системи регуляції не компенсують виниклих змін, то різке зниження тиску після великої крововтрати істотно порушує діяльність серцево-судинної системи. Це може спричинити шок.
РЕГІОНАРНИЙ КРОВОТІК
ГЕМОДИНАМІКА МАЛОГО КОЛА КРОВООБІГУ
Легені належать до органів, кровообіг яких поряд із трофічною виконує й специфічну (газообмінну) функцію. Трофіку легеневої тканини забезпечують судини великого кола кровообігу, мале ж коло служить для газообміну.
Мале коло кровообігу починається легеневою артерією з правого шлуночка серця. Легенева артерія розгалужується паралельно до бронхіального дерева аж до респіраторних бронхіол і дає 17 генерацій. Легенева артерія і її гілки діаметром не менше як 1 мм належать до артерій еластичного типу. В стінці артеріол гладкі м’язи такі рідкі, що не утворюють суцільного шару, а у артеріол діаметром менше за 45 мкм їх взагалі немає. У зв’язку з цим у
10.7 кЛа
час
120 ет'
Вдих Видих
IV -0.8
-2
0
&-
вії ммрт. ст.
25
" 1.3І- 10
кЛа мм.
іц *0,5 *0
VII
на крово-і малого
80 60
Мал. 170. Вплив дихання обіг у судинах великого кола:
І — тиск у артеріальній системі; II—тиск у легеневих артеріях; III—тиск у верхній порожнистій вені; IV — виутрішиьогрудний тиск; V — трансмуральний тиск; VI • кровотік у легеневих артеріях (мл/с); УП —* ударний об’єм правого шлуночка (мл)
мл/с 500г
малому колі кровообігу артеріоли не можуть ефективно виконувати резистивну функцію. її здійснюють відносно великі артерії м’язового типу.
Артеріоли, прекапіляри і капіляри тісно пов’язані з альвеолярною паренхімою. Відносно короткі (до 350 мкм) і широкі (понад 8 мкм) капіляри створюють настільки густу мережу, що в умовах прижиттєвої мікроскопії важко виявити межі кровотоку між окремими капілярами. Таким чином, у легенях кров омиває альвеоли майже суцільним безперервним потоком. Капіляри переходять у тонкі безм’язові постка-піляри, які зливаються у венули, у стінці яких з’являються окремі гладком’язові клітини. Через 15 генерацій утворюються вени, що впадають у ліве передсердя. У венах легенів немає клапанів. Але в ділянці з’єднання вен з передсердям є м’язові потовщення,
які можуть грати роль жомів, котрі не допускають ретроградного потоку крові при значному підвищенні внутрішньопередсердного тиску в період його систоли. Завдяки особливостям будови резе-стивного відділу і мікроциркуляторного русла легень створюється низький опір кровотоку. Тому для забезпечення кровообігу в нормі цілком досить відносно невисокого діастолічного і систолічного тиску в правому шлуночку і легеневій артерії (м.ал. 170). Відповідно вони дорівнюють 20—24 мм рт. ст. (2,7—3,2 кПа) та 6— 12 мм рт. ст. (0,8—1,6 кПа). Малий опір резистивного відділу і мікроциркуляторного русла забезпечує потрібний тиск у капілярах— близько 6,5 мм рт. ст. 40,9 кПа). Такий рівень тиску може забезпечити градієнт тиску для руху крові в подальших судинах. У той же час він малий, щоб фільтрувати воду в міжклітинний простір.
Загальний опір судин малого кола кровообігу в 6—8 разів менший, ніж судин великого кола. Тому навіть помітне збільшення ХОК майже ніколи не супроводиться збільшенням АТ. Так, при збільшенні ХОК у 4 рази Рс зростає лише до 36 мм рт. стл (4,8 кПа), а Рд —до 15 мм рт. ст. (2,0 кПа).
Дихання та гідростатичний тиск помітно впливають на вели
чину трансмурального тиску на стінках екстрапаренхіматозних артерій та вен: під час вдиху він зменшується, під час видиху — збільшується. При спокійному диханні найпомітніші коливання «негативності» відбуваються в нижній, яка функціонує найактивніше, частині легенів, поблизу діафрагми. Зміна тиску на відстані від верхівки до основи легенів може досягати 5,5—6 мм рт. ст. (0,75—0,8 кПа). Внаслідок цього в основі легень трансмуральний тиск підвищується. Під час задишки легені розправляються рівномірніше, а «негативність» у плевральній порожнині на висоті вдиху зростає. Тому при вдихові в усіх судинах трансмуральний тиск збільшується. Під час видиху, особливо глибокого, він знижується.
Ще істотніше впливає на рівень трансмурального тиску гідростатичний. У положенні стоячи в судинах верхівки легенів тиск на 11 мм рт. ст. (1,5 кПа) нижчий, а біля їх основи приблизно на стільки ж вищий, ніж середній тиск у великих судинах, розташованих приблизно посередині легень.
Легеневі судини дуже еластичні. Тому швидкість поширення пульсової хвилі відносно невелика — приблизно 1,5—2 м/с. Завдяки високій еластичності судин при відносно малому трансмураль-ному тиску в судинах легень міститься 400—600 мл крові. Зміна положення тіла з вертикального на горизонтальне призводить до підвищення кровонаповнення легень на 20—25 %. Під час виконання фізичних вправ об’єм крові в легенях може збільшуватися, оскільки при цьому розправляються всі відділи легень. При задишці у зв’язку з різким коливанням трансмурального тиску швидкість кровотоку під час вдиху та видиху стає нерівномірною.
Сумарний кровотік через судини малого кола кровообігу дорівнює ХОК. Середня лінійна швидкість у легеневій артерії становить близько 20 см/с, тобто вона приблизно така ж, як і в аорті. Хоча максимальна швидкість кровотоку досягає лише 0,7 м/с, висока еластичність та низький периферичний опір забезпечують відносно велику швидкість його в легеневій артерії й під час діастоли. Через капіляр кров тече зі швидкістю близько 0,3—0,4 мм/с. Отже, еритроцит перебуває в ньому близько 1 с. При задишці, різкому підвищенні ХОК відповідно збільшується й лінійний кровотік.
Кровотік у всіх судинах легень багато в чому залежить від рівня гідростатичного тиску. В положенні стоячи в мікроцйркулятор-ному руслі верхівок легень трансмуральний тиск настільки малий, що перфузується лише незначна частина капілярів. Навпаки, біля їх основи гідростатичний тиск додається до гідродинамічного, а тому капіляри та інші відділи судинного русла розтягнуті. В стані спокою перфузуються та аеруються переважно нижні відділи легень, тому газообмін відбувається добре. Але у верхніх частках легень (в частині альвеол) нерідко спостерігається невідповідність аерації кровотоку. Тут насичується киснем не вся кров, тому в змі
шаній крові вен малого кола кровообігу міститься менше 100 %' НЬОг. До того ж частина венозної крові, що надходить у легеневу тканину, по анастомозах впадає у вени малого кола кровообігу, і насичення крові, що надходить у ліве передсердя, киснем становить 96—98 %. При форсованому диханні збільшується кількість аерованих та перфузованих альвеол, завдяки чому поліпшуються умови газообміну. Судини малого кола кровообігу перебувають під впливом дихальних рухів. Унаслідок цього змінюються об’єм крові, яка надходить у легені, та її венозне повернення до серця. Тому механізми регуляції тонусу судин малого кола кровообігу простіші. З одного боку, вони не такі чутливі до зміни кровотоку в них, а з другого — не так активно реагують на вазоактивні речовини та нервову імпульсацію. З судин малого кола кровообігу починаються рефлекси, еферентною ланкою яких є судини як малого, так і великого кола кровообігу.
Менша реакція резистивних судин легень закріплена й морфологічно. У них рідше розташовані гладком’язові клітини й менша густина нервових терміналей. Серед еферентів легеневих судин виявлено не тільки симпатичні, а й парасимпатичні волокна. Однак досі не з’ясоване призначення усіх цих волокон в умовах фізіологічної норми. Встановлено лише констрикторний ефект прц подразненні симпатичних нервів. До того ж він виражений меншою мірою, ніж у судинах великого кола кровообігу. Безпосередній судинорозширювальний ефект парасимпатичної нервової системи проявляється не так чітко.
Тонічний вплив симпатичних нервів на судини великого та малого калібру опосередкований через ’а-адренергічний механізм. Рефлекси з рецепторів великого й малого кіл кровообігу посилюють або послаблюють тонус як артеріальних, так і венозних судин. Звуження артерій, зумовлене симпатичною нервовою системою, ненабагато збільшує опір, позаяк реагують звуженням відносно великі судини. В той же час звуження вен супроводжується зменшенням їх ємкості й збільшенням повернення крові до лівого передсердя. Тим самим легені беруть участь у перерозподілі крові із малого кола кровообігу у велике.
Легеневі судини реагують на гуморальні вазоактивні сполуки. Проте ці реакції також виражені меншою мірою, ніж у інших ділянках судинного русла. Констрикцію судин артеріального та венозного відділів спричинюють адреналін та норадреналін. Тучні клітини, яких у легеневій тканині велика кількість, є місцевим джерелом гістаміну. Гістамін може надходити і з кров’ю. Залежно від цього може бути загальне або локальне звуження легеневих судин. Досить сильними констрикторами легенених судин є серотонін та ангіотензин II. Простагландини групи Е є вазодилатато-рами, а групи Р — вазоконстрикторами.
Крім вказаних сполук, що утворюються в легеневій тканині,
у місцевій регуляції тонусу судин беруть участь гази крові. При зниженні рівня Рао, або при підвищенні вмісту Расо, судини відповідних ділянок легень звужуються.
КРОВОТІК У ОРГАНАХ
ЧЕРЕВНО! ДІЛЯНКИ
У черевній порожнині розташовані органи, які беруть участь у процесі травлення та виконанні інших функцій. Залежно від функцій органів кровотік у них має свою специфіку.
Кишки постачаються кров’ю із брижових артерій, що відходять від аорти. Венозна кров від них, перш ніж повернутись до серця, проходить через печінку. Вікончастого типу капіляри слизової оболонки тонких кишок мають діаметр ЗО—60 мм, тому вони здатні пропускати досить великі молекули. Коефіцієнт капілярної фільтрації в кишках у 8—10 разів більший, ніж у скелетних м’язах. У стані спокою для перфузії відкрито лише ЗО—40 % капілярів кишок. Через судини кишок проходить 7—10 мл(хв-100 г) крові. Кровотік тонкої кишки інтенсивніший, ніж товстої. Сумарний кровотік слизово-підслизорого шару становить близько 8 %; 20 % крові припадає на м’язову оболонку. В період травлення кровотік збільшується, але інтенсифікація його відбувається головним чином, у слизовому прошарку. Кровотік має збільшуватись у 3 рази. Це зумовлюється впливом вазоактивних метаболітів, гормонів травлення — секретину та холецистокініну, а також таких біологічно активних сполук, як серотонін, кінін тощо.
Кровотік у органах травлення істотно залежить від активності його структур. Підвищення секреторної, моторної та всмоктувальної функцій супроводжується інтенсифікацією кровотоку протягом З—6 год. Регулюється кровотік гуморальними та нервовими механізмами.
До гуморальних механізмів належать: 1) вазодилататорний вплив пептидів (ВІП, гастрин, секретин, холецистокінін-панкрео-зимін); 2) вазодилататорний вплив кінінів (брадикінін, калідин); цей вплив особливо помітний у слизових оболонках під час секреції; 3) розширення судин при зниженні рівня Ог у тканинах, внаслідок чого кровотік збільшується приблизно на 50 °/о (можливу роль у цьому процесі грає аденозин, концентрація якого збільшується при гіпоксії^.
Нервові механізми проявляються таким чином. Подразнення парасимпатичних нервів зумовлює вазодилататорний вплив на шлунок та нижні відділи товстої кишки, але це, можливо, не пряма реакція нервів на судини, а наслідок підвищення функції їхніх структур. Симпатична нервова система звужує артеріоли органів травлення. Цей вплив спостерігається при інтенсивній фізичній праці, емоціях, втраті крові.
Крім того, в ауторегуляції кишкового кровотоку беруть участь місцеві рефлекторні дуги та міогенні механізми. Нейрогенна регуляція здійснюється симпатичними волокнами. Артерії кишок пронизані нервовими волокнами набагато більше, ніж вени. Тому при збудженні симпатичного відділу вегетативної нервової системи кровообіг у кишках може різко зменшуватись. Однак судинозвужувальна реакція проявляється не завжди. Вона залежить, з одного боку, від наповнення кишок, а з другого — від характеру адаптивної відповіді. Високий кровотік у кишках краще підтримується за наявності хімусу. При м’язовому навантаженні кровотік у кишках істотно зменшується лише у разі відсутності їжі в органах травлення. В той же час емоційний стрес може запобігти дилатації і за наявності хімусу в кишках. Таким чином порушується відповідна залежність між кровотоком і функціональною активністю органа.
Споживання їжі супроводжується незначним збільшенням Рс і зниженням Рд в центральних судинах. Це зумовлено механізмами системної регуляції, які спрацьовують у відповідь на розширення судин органів травлення.
Забезпечення кров’ю печінки вирізняється тим, що кров до неї надходить артеріями та ворітною веною. Ворітною веною кров надходить, пройшовши перед цим через кишки, підшлункову залозу, селезінку. В печінці кров поряд із трофічною дією забезпечує здійснення секреторної та екскреторної функцій. Тому кровотік у ній відбувається з надлишком. Але за деяких умов кровозабезпе-чення печінки частково може знижуватися. У такому разі печінка змушена брати участь у перерозподілі крові, тобто виконувати де-понуючу функцію. У стані спокою через печінку проходить близько 25 % ХОК (до 1400 мл/хв), із яких печінковою артерією надходить лише 350 мл/хв. із артеріальною кров’ю печінка отримує 40 % кисню, із венозною портальною — 60 %.
Основний механізм регуляції печінкового кровотоку нейроген-ний. Симпатичні нерви, звужуючи судини, виконують перерозпо-дільчу функцію. Рефлекси системного кровотоку з рецепторів сино-каротидної зони, легеневих судин та місця впадіння порожнистих вен знижують печінковий кровотік.
Кровозабезпечення селезінки. Селезінка є одним із ланцюгів макрофагальної та лімфоїдної систем організму. В системі кровообігу вона виконує приблизно ті самі функції, що й лімфатичні залози в системі лімфотоку. Кров, яка проходить через її синуси, фільтрується, з йеї вилучаються застарілі і ушкоджені еритроцити, сторонні антигени та інші шкідливі речовини. Еритроцити захоплюються макрофагальними елементами і розпадаються. Продукти їх розпаду надходять у печінку. Окрім функції обміну, цей орган бере участь у забезпеченні імунних механізмів.
Селезінка людини, на відміну від селезінки собаки, коня та де
яких інших тварин, не депонує кров. У нормі в ній міститься ие більше 60—100 мл крові, що складає 1,5—2 % ОЦК. Основною структурною відмінністю селезінки є мала кількість гладком’язових клітин як у пульпі, так і в капсулі. Нерви входять у селезінку переважно в судинному сплетінні, створюючи сітку, яка іниервує венозні синуси, капіляри та ретикулярний синцитій. При підвищенні симпатичної імпульсації судини селезінки звужуються і кровотік через неї знижується. Судини селезінки скорочуються також під впливом таких вазоактивних сполук, як ангіотензин II, вазопресин, адреналін, серотонін, простагландини, брадикінін. Такі ж речовини, як гістамін, аденозин, розширюють судини. Отже, не зважаючи на значно меншу депонуючу спроможність, селезінка людини також бере участь у перерозподільчих реакціях крові (адже кровотік у ній становить 750—800 мл/хв). При деяких захворюваннях розміри цього органа збільшуються (спленомегалія) г зростають її депонуючі можливості.
КОРОНАРНИЙ КРОВОТІК
Ритмічність діяльності серця позначається на кровозабезпечен-ні власне міокарда: кровотік буває максимальним під час діастоли, мінімальним — під час систоли (мал. 171). У той же час висока метаболічна активність міокарда супроводжується надзвичайно високою утилізацію Ог з крові, що протікає (близько 2/з кисню). У венозній крові лишається мінімальна кількість оксигемоглобіну, і тому резерву для утилізації кисню із крові міокард практично не має. Тому при збільшенні функціональної активності серця потрібне пропорційне зростання кровотоку через коронарні судини.
Коронарні артерії є першими гілками аорти. Проходячи зовні серцевих м’язів, артерії при досягненні діаметра 1—2 мм віддають гілки, які йдуть у глиб серцевої стінки майже під прямим кутом. Інтенсивність васкуляризації зростає у напрямку від епікарда до ендокарда. Але тонкий прошарок міокарда, який безпосередньо прилягає до ендокарда, майже не має судин і кисень одержує переважно із порожнин шлуночків за допомогою судин В’єссена— Тебезія. Недостатньо васкуляризована й провідна система серця Відтік крові здійснюється переважно в коронарний синус, що відкривається у праве передсердя. Кров передніх відділів правого шлуночка відтікає в порожнину правої половини серця.
У коронарні артерії надходить близько 5 % ХОК, що в стані спокою складає близько 250 мл/хв. У лівій коронарній артерії на початку систоли кровотік майже припиняється, а під час діастоли після зниження напруги міокарда різко зростає. У басейні правої коронарної артерії під час систоли менша напруга, тому тут кровотік лише частково знижується. Відтік крові із коронарного синуса під час систоли шлуночків, навпаки, різко збільшується. Епікар-
Мал. 171. Зв’язок коронарного кровотоку з систолою, діастолою серця і тиском крові в аорті:
1 — тиск крові в аорті; 2 — кровотік у лівій коронарній артерії; 3 — кровотік у правій коронарній артерії; 4 — відтік крові у венозний синус (за даними Р. Шмідта, Г. Тевса, 1985)
діяльні та інтрамуральні коронарні артерії мають досить розвинені м’язи, які іннервуються симпатичними й парасимпатичними нервовими волокнами. Стимуляція їх зумовлює виражене розширення коронарних артерій.
Коронарні судини мають велику кількість адрено- і холінорецепто-рів. У проксимальних відділах судин в основному містяться а-адре-норецептори, в дистальних — р-ад-ренорецептори. У нормі кількість р-адренорецепторів значно перевищує кількість а-адренорецепторів. М-холінорецептори' рівномірно розташовані протягом усієї судини.
Стимуляція р-адренорецепторів катехоламінами призводить до значної дилатації коронарних судин, стимуляція а-адренорецепторів — до констрикції. У старечому віці, при атеросклеротичному ураженні коронарних судин кількість Р-адренорецепторів зменшується. Катехоламі
ни внаслідок взаємодії з а-адрено-рецепторами часто спричинюють спазм коронарних судин. Стимуляція М-холінорецепторів ацетилхоліном супроводжується дилата-
цією коронарних судин.
Велику роль у регуляції коронарного кровообігу грають метаболіти, які утворюються під час скорочення міокарда або заносяться кровотоком. Так, під впливом аденозину, простагландинів, К+ розвивається коронародилататорний ефект, механізм якого пов’язаний як із прямою дією метаболітів на гладкі м’язи судини, так і зі зниженням продуктами метаболізму чутливості а-адренорецепторів до катехоламінів.
Значну роль у регуляції коронарного кровотоку грають гіпоксія, підвищення рівня Рсо,, зниження рН крові. Під їх впливом розширюються коронарні судини, збільшується коронарний кровообіг. Таким чином, унаслідок цілого комплексу впливів при підвищенні продуктивності серця відбуваються пропорційне зростання ХОК, приріст коронарного кровотоку і до серця надходять все ті ж 4-5 % ХОК.
КРОВООБІГ ГОЛОВНОГО МОЗКУ
Через судини мозку за 1 хв проходить 750 мл крові. Це становить близько 13 % ХОК (якщо маса мозку складає близько 2— 2,5 % маси тіла). У дорослої людини кровообіг у мозку в середньому досягає 50 мл(хв-100 г). У дітей інтенсивність кровопостачання мозку на 50—60 % вища, а у престарілих — на 20 % нижча.
До головного мозку кров притікає по чотирьох магістральних судинах (двох внутрішніх сонних і двох хребетних), а відтікає по двох яремних венах. Спочатку артерії основи мозку розгалужуються, утворюють мережу піальних судин, котрі лежать на поверхні мозку. Окремі їх гілки, проходячи у глиб мозку, утворюють судинні сплетіння шлуночків.
Мікроциркуляторне русло власне мозку утворюється із радіальних судин, які відходять від піальних артерій. Різні структури мозку мають неоднакову щільність капілярів: у сірій речовині їх більше, ніж у білій; у корі великого мозку, мозочку і паравентрику-лярних ядрах гіпоталамуса цих судин більше, ніж у інших відділах мозку. Характерною особливістю мікроциркуляторного русла мозКу є наявність двох типів капілярів. Центральні, короткі, капіляри забезпечують відносно постійний кровотік. Кровотік у бокових, довших, капілярах мінливий. У. цих капілярах дещо вищий опір, їх близько 75 Со-
ціальні вени впадають у синуси. Це, з одного боку, запобігає їх стисканню при набряку мозку, а з другого — спазму при зміні положення тіла за рахунок зменшення трансмурального тиску гідростатичної природи.
Між капілярами й нейронами містяться астроцити, які беруть участь у створенні гематоенцефалічного бар’єру між кров’ю й нейронами. Через низьку проникність бар’єру зменшується можливість проникнення речовин з крові в тканину мозку.
Однією з найхарактерніших особливостей мозкового кровотоку є його відносна автономність. Сумарний об’ємний кровотік мало залежить від змін центральної гемодинаміки, тому він майже завжди постійний. Кровотік у судинах мозку може порушуватися лише при різко вираженій зміні центральної гемодинаміки. З другого боку, збільшення функціональної активності мозКу, як правило, не позначається на центральній гемодинаміці й об’ємі крові, що надходить до мозку: лише при судомному збудженні нейронів сумарний кровотік може підвищуватися у 1,5—2 рази. Відносна постійність кровотоку мозку визначається потребою у створенні гемостатичних умов для функціонування нейронів. У мозку немає запасів кисню й майже немає запасів основного метаболіту окислення — глюкози. Тому вкрай потрібно, щоб вони постійно надходили разом із кров’ю. Крім того, постійність мікроциркуляторного русла забезпечує сталість водного обміну між тка
ниною мозку й кров’ю, кров’ю та спинномозковою рідиною. Збільшення кількості спинномозкової рідини і міжклітинної води може призвести до стискування мозку, який лежить у замкнутій черепній коробці.
Автономність мозкового кровотоку забезпечується завдяки структурно-функціональним особливостям мозкових судин і складній багаторівневій системі регуляції. У свою чергу система регуляції має не менше трьох контурів механізмів регуляції, кожен із яких у свою чергу містить нейрогенний, міогенний і метаболічний компоненти. Можна сказати, що існує кілька чітко виражених «рубежів оборони», котрі грунтуються як на відповідних структурах судин, так і на механізмах регуляції їх просвіту.
Найбільше значення для здійснення автономності мозкового кровотоку мають нейрогенні механізми регуляції. Практично всі артерії й вени іннервуються симпатичними нервами. Є відомості й про те, що деякі мозкові судини містять пептидергічні, серотонін-ергічні, гістамінергічні та пуринергічні нервові закінчення.
Внутрішньомозкові судини меншою мірою чутливі до системних нейрогенних впливів, ніж судини інших ділянок. Тому мозкові судини майже не включаються в загальну перебудову кровотоку при різних адаптивних реакціях.
У той же час нейрогенні механізми власне мозкових судин досить активні. Чутливі до розтягування та хімічних подразників рецептори містяться в багатьох мозкових судинах. Багаті на них судини артеріального кола великого мозку, або віллізієвого кола, твердої мозкової оболонки, венозної пазухи. Хеморецептори є також на поверхні шлуночків та у власній тканині мозку. Перший «рубіж оборони» розпочинається ще в каротидному синусі. Рефлекси, які зароджуються на вході крові в мозок, мають найважливіше значення не тільки для підтримання загальної гемодинамі-ки, але й для забезпечення автономності кровотоку всього мозку. Завдяки відповідній реакції приносних судин зберігається мозковий кровотік на постійному рівні при зміні системного тиску від 70 мм рт. ст. (9,3 кПа) до 160 мм рт. ст. (21,3 кПа). Період компенсації тиску в судинах власне мозку становить від 10 до ЗО с.
Два інших «рубежі оборони» містяться в судинах власне мозку. Другий «рубіж» включає судини віллізієвого кола і піальної оболонки. В його регуляції беруть участь міогенні механізми і місцеві рефлекси. Міогенний контур включається в прямі реакції гладких м’язів судин у відповідь на зміну внутрішньосудинного тиску. Так, при різкому підвищенні тиску м’язи скорочуються, внаслідок чого знижується інтенсивність кровотоку. Метаболічний контур регуляції грунтується на прямій дії на гладкі м’язи судин вазоактивних метаболітів і гормонів, які приносяться кров’ю або дифундують з тканин у судини. Чутливість рецепторів мозкових судин до відносних подразнень дещо нижча, ніж у інших відділах
судинного русла. Зміна параметрів газів у крові мозку мало впливає на кровотік. Судини розширюються лише при зниженні рівня Ра , понад ЗО мм рт. ст. (4 кПа), а починають звужуватися при рівні Рао± понад 300 мм рт. ст. (40 кПа), як це буває при диханні чистим киснем або при гіпербаричній оксигенації. На відміну від О2, СО2 впливає на мозкові судини при близьких до фізіологічних параметрах: судини розширюються при рівні Расо, понад 40 мм рт. ст. (5,3 кПа), а звужуються при рівні Расо,, нижчому від 26 мм рт. ст. (3,5 кПа).
Третій «рубіж оборони» розташований на рівні мікроциркуля-торного русла. Головним його завданням є адекватне функціональній активності нейронів постачання крові. Воно розв’язується внутрішньомозковим перерозподілом крові під впливом метаболічних і місцевих нейрогенних механізмів. Більшість метаболітів, таких, як Н+, зовнішньоклітинний к+, аденозин, простагландини, ГАМК, гістамін, серотонін, надходячи з тканин мозку до судинної стінки, сприяють місцевому розширенню судин. Крім того, метаболіти через хеморецептори запускають місцеві судинорозширювальні рефлекси. Вони сприяють розширенню також артеріальних судин, які лежать вище. Вихідні рефлекси забезпечують розширення не тільки приносних судин тканини мозку, але й піальних судин, які розташовані поруч. Природно, що чим більшою мірою функціонують відділи мозку, тим більш виражена перерозподільна реакція крові. Внаслідок цього менш активно функціонуючі зони мозку отримують менше крові. Перерозподільча реакція здійснюється за допомогою двох головних механізмів — швидкого й повільного. Швидкий механізм забезпечується місцевими рефлексами й такими метаболітами, як аденозин, зовнішньоклітинні К+ та Са2+, простагландини. Судинорозширювальна реакція, що повільно розвивається, зумовлена підвищенням [Н+], Рсо, в навколишньому середовищі.
КРОВОПОСТАЧАННЯ ПЛОДА
Кровотік у невагітній матці коливається відповідно до процесів метаболізму, які відбуваються в ній. Під час вагітності його інтенсивність у матці підвищується у 20—40 разів.
Імплантація заплідненої яйцеклітини супроводжується розширенням маткових судин та утворенням лакун, у яких міститься материнська кров. Тут відбувається обмін крові матері з кров’ю плода, що надходить капілярами ворсинок хоріона. Між кров’ю матері та плода існує плацентарний бар’єр, який складається з ендотелію капілярів пупкових судин і двох шарів клітин, що утворюють стінки хоріальних ворсинок. Товщина його дорівнює 2— 6 мкм, тобто дещо більша, ніж товщина легеневої мембрани. Перехід сполук через плацентарний бар’єр відбувається шляхом дифу
зії й активного транспорту. За градієнтом концентрації дифунду* ють гази, глюкоза, амінокислоти. Однак у крові плода багато які речовини містяться в більшій концентрації, ніж у материнській крові. До них належать №+, К+, Са2+, вітаміни Ві, Ве, В^, С. Це свідчить про активний транспорт. Як правило, плацентарний бар’єр непроникний для сполук з молекулярною масою понад 1000. Але з цього правила є й винятки. Наприклад, через плаценту проходять тироксин, вазопресин та деякі інші речовини, що мають велику молекулярну масу.
На кінець вагітності судинами матки проходить до 700—800 мл крові за 1 хв, що майже у 2 рази більше, ніж через плаценту з боку плода. Проникність плацентарної мембрани для Ог нижча, ніж легеневої. Це частково компенсується вищою спорідненістю гемоглобіну плода (НЬР) до Ог.
Від плаценти артеріальна кров надходить до організму плода непарною веною пуповини (мал. 172). Частина її одразу потрапляє до печінки, що забезпечує інтенсивний розвиток цього органа. Пройшовши печінку, кров вливається в нижню порожнисту вену, де разом із іншою частиною артеріальної крові змішується з венозною, рухаючись у напрямку від нижньої половини тіла до верхньої у праве передсердя, разом із змішаною кров’ю з нижньої порожнистої вени надходить венозна кров з верхньої порожнистої вени. З правого передсердя вона спрямовується в ліве передсердя через овальний отвір і далі — в лівий шлуночок і аорту. Друга частина крові надходить у правий шлуночок і легеневий стовбур, а оскільки судини легень плода звужені, то майже вся кров з правого шлуночка через артеріальну протоку також спрямовується в аорту.
Проте в правому передсерді не відбувається повного змішування крові, шо надходить з нижньої та верхньої порожнистих вен. Більше насичена киснем кров нижньої порожнистої вени завдяки виступу на стінці правого передсердя надходить переважно в ліву половину серця. Ця кров з дуги аорти насамперед потрапляє в Коронарні судини, мозок і верхні кінцівки. Це забезпечує розвиток вказаних частин тіла у внутрішньоутробний період. Кров, що залишилася, змішуючись з менш оксигенованою кров’ю артеріальної протоки, через низхідну аорту надходить до органів нижньої половини тулуба і плаценти.
Під кінець вагітності обидва шлуночки функціонують паралельно і перекачують за 1 хв до 750 мл крові, Близько 60 % цієї кількості крові надходить до плаценти, а 40 % —До тканин плода.
Припинення плацентарного кровообігу після народження значно змінює умови кровотоку дитини. По-перше, при вилученні з системи кровообігу пупкових артерій різко збільшується периферичний опір судин великого кола кровообігу. Це призводить до зростання артеріального тиску з 60—70 мм рт. ст. (8—9,3 кПа) в
НЕ ФУНКЦІО- ' ‘ НУЮТЬ/
ЛЕГЕНІ
(МЛ/ХВ)
35Д
МАТКА
ПРИБЛИЗНИЙ КРОВОТІК НА 1 КГ МАСИ ТІЛА
00СТ08 АРТЕРЮ808
0.25
ПЕЧ НКА
ЛЕГЕНЕВА ВЕНА
Ог ХАРЧОВІ РЕЧОВИНИ
МАТКОВА МАТКОВА
ВЕНА АРТЕРІЯ МАТЕРИНСЬКА КРОВ СУДИНИ ПЛОДА ХОРІОН
□ОСТОВ
УЕМ0808<
ПУПКОВА
АРТЕР Я
ПУПКОВА
НАСИЧЕННЯ 02 = 1.0
ВЕРХ
ТУЛУБА
ЛЕГЕНЕВА АРТЕРІЯ
РОРАМЕИ
ОУАІ_Е
170
Гчо
ВЕНА
130
ПОРТАЛЬНА ВЕНА
НИЗ
ТУЛУБА
МАТЕРИНСЬКА СОг ^КРОВ РЕЧОВИНИ РОЗПАДУ \
Мал 172. Кровопостачання плода (за даними А. Безроропіоа, 81. ЗіІЬегпадІ,
кінці вагітності до 85—90 мм рт. ст. (11,3—12 кПа) після народження. По-друге, з початком легеневого дихання майже у 5 разів знижується гідростатичний опір судин малого кола кровообігу й різко збільшується кровотік через них. По-третє, припинення надходження крові з плаценти зумовлює зменшення об’єму та тиску крові в правому передсерді, в той час як різко збільшений приплив крові по легеневих венах призводить до збільшення тиску в лівому передсерді. Внаслідок градієнту тиску, що виникає між передсердями, закривається клапан овального отвору. На кінець другого місяця після народження цей отвір зростає.
Одразу після народження внаслідок підвищення тиску в аорті й зниження в легеневій артерії частина крові через артеріальну протоку тече назустріч потоку, що йшов у внутрішньоутробний період (з аорти в легеневу артерію). Але незабаром унаслідок скорочення гладких м’язів протоки кровотік по ньому знижується, а через 1—8 діб майже зовсім припиняється. Головною причиною скорочення гладких м’язів є збільшення напруги кисню в аортальній крові, яка надходить тепер із легень. Але якщо рівень Рао, знизиться, то артеріальна протока може знову відкритися. Спазм протоки супроводжується ішемією власне стінки, що призводить до розвитку в ній сполучної тканини і анатомічного закриття протоку. Звичайно це відбувається у 2—5 міс.
Регуляція кровотоку у внутрішньоутробний період ще недосконала. Хоча судини іннервовані добре вже з 4-го місяця і рефлексогенні зони з’являються рано, рефлекси в них ще слабкі. У плода -більшою мірою виражені міогенні і гуморальні механізми регуляції. Тонус судин залежить головним чином від автоматизму м’язових клітин, реакції їх на тиск та гормонально-метаболічні фактори. На тонус судин впливає також напруга Ог в крові: при зменшенні рівня Рао, тонус судин деяких органів слабшає, при підвищенні, навпаки, збільшується. При- гіпоксії зростає ЧСС, звужуються судини скелетних м’язів, шкіри, збільшується кровотік по пупкових судинах. Норадреналін та вазопресин збільшують рух крові через плаценту, а ангіотензин II зменшує його.
Після народження поступово вдосконалюється система регуляції кровообігу. Цей процес завершується Лише під кінець періоду статевого дозрівання. У малюків віком до 7—8 міс ще не виражений депресорний рефлекс з барорецепторів синокаротидної та аортальної зон. Найактивніше формуються рефлекторні механізми регуляції кровотоку в період становлення рухової системи дитини. Спочатку, приблизно наприкінці першого року життя, формуються рефлекси з хеморецепторів, а згодом, поступово,— із барорецепторів. Ренін-ангіотензин-альдостеронова система включається в процес регуляції кровообігу вже у новонароджених.
ЛІМФАТИЧНА СИСТЕМА
Лімфатична система транспортує рідину і включені в неї речовини. Завдяки їй забезпечується гомеостаз внутрішнього середовища організму (рідини, білків, ліпідів, електролітів, гормонів, ферментів та інших компонентів). Вона є в усіх органах, за винятком мозку, кришталика, рогівки, скловидного тіла й плаценти. Лімфатична система як система транспорту рідини в організмі може бути представлена у вигляді такої схеми: кров -> інтерстицій -> лімфа -> кров.
У дорослої людини за 1 добу із кровоносної системи виділяється до 20 л рідини; 2—4 л її у вигляді лімфи повертаються лімфатичними судинами в кровоносну систему. Разом із рідиною з крові в інтерстицій потрапляє 50—100 % циркулюючих у плазмі білків. Частина із них розщеплюється клітинами тканин для власних потреб,- а частина (особливо альбуміни) навантажується адсорбованими на їх поверхні продуктами клітинного метаболізму, фізіологічно активними речовинами для подальшого їх переносу.
Завдяки лімфатичній системі нормалізується кількість інтер-стиціальної рідини і плазми крові. Таким чином забезпечується циркуляторний і тканинний гомеостаз у організмі. Перекриття лімфатичних судин призводить до появи лімфостатичного набряку, зменшення кількості лімфи (гіповолемічного колапсу).
Лімфотворення. Безпосереднім оточенням кровоносної судини і прилеглих до неї клітин є інтерстиціальний простір. Це мережа колагенових і еластичних волокон, які утворюють комірки різної величини і форми, заповнені гелеподібною речовиною, що складається із білків, полісахаридів, неорганічних солей і води.
Інтерстиціальний простір має фільтраційну (комплекс кровоносних капілярів) і реабсорбційну (лімфатичні капіляри і вену-лярні мікросудини) системи. Завдяки конвекційному переносу (за допомогою циркуляції водних розчинів) і дифузії молекул у середовищі інтерстиціальна рідина рухається від кровоносних до лімфатичних капілярів.
Лімфатичні капіляри мають вигляд або трубочки діаметром 20—200 мкм із сліпим кінцем, або петлі чи сіточки, або синусоїди. Стінки капілярів складаються із ущільнених ендогеліальних клітин, які містять органели, мікропіноцитозні везикули і лізосоми. Стінки лімфатичних судин мають багато отворів, через які проникають елементи інтерстиціальної рідини. Низько- і високодисперсні речовини та вода проникають у просвіт лімфатичних капілярів завдяки гідростатичному і осмотичному тиску в інтерстиції. Макромолекули й інші частинки діаметром 3—5 мкм проникають за допомогою піноцитозних міхурців.
Склад лімфи. У лімфі міститься 60—70 % білків (100 г, а у плазмі— 220 г). За концентрацією альбуміни значно перевищують
глобуліни (у грудній протоці це співвідношення становить 2:1)'. Рівень ферментів (лактатдегідрогеназа, лужна фосфатаза) нижчий, ніж у крові. У лімфі міститься велика кількість ліпідів — три-гліцеридів, ліпопротеїдів з дуже низькою і високою щільністю, жирні кислоти і хіломікрони, холестерин і фосфоліпіди, а також лімфоцити (7800 в 1 мм3; у крові — 280 в 1 мм3). Зустрічаються окремі еритроцити, але ніколи не буває тромбоцитів.
Лімфатичні капіляри переходять у лімфатичні судини, які транспортують лімфу від капілярів до вен шиї і депонують рідину. В середині лімфатичної судини є клапани, які запобігають зворотному руху лімфи.
Частина лімфатичної судини, яка міститься між двома клапанами, називається лімфангіоном. У лімфангіоні є м’язові волокна (манжетки), які можуть спонтанно скорочуватись і розслаблюватись. Розрізняють два типи скорочень: 1) швидкі ритмічні, з частотою 15—20 за 1 хв; 2) повільні — 2—5 за 1 хв. Тонус лімфатичних судин залежить від кількості в них м’язових клітин. Він є висхідним для наступного скорочення.
Електричні явища в лімфатичних судинах. Мембранний потенціал міоцитів лімфатичних судин становить 24—36 мВ, тобто майже такий, який характерний для деполяризації гладком’язових клітин кровоносних судин. ПД виникає спонтанно. Він розпочинається із швидкої деполяризації, має фазу швидкої і повільної репо-ляризації і розглядається як пусковий механізм ритмічної активності лімфатичних міоцитів. Природа пейсмекерної активності пов’язана з кальцієвим механізмом. Блокада Са2+ каналів гальмує розвиток потенціалу дії.
Фазні зміни ПД зумовлюють фазні скорочення міоцитів, які збігаються з розвитком фаз ПД. Механізм м’язового скорочення пов’язаний із процесом входження Са2+ у міоплазму, зняттям тро-понінової і тропоміозинової депресії, утворенням актоміозинових містків і гребних рухів, які супроводжуються скороченням міо-дита.
Насосна функція лімфангіона. Лімфатичні судини, ритмічно скорочуючись, спричинюють підвищення внутрішньосудинного тиску на 0,5—12 см вод. ст. Під дією цього тиску відкривається проксимальний клапан і лімфа переміщується у той відрізок лімфатичної •судини, який лежить вище. Наприкінці фазного скорочення і відкриття дистального клапана тиск швидко падає. На тиск лімфи в судині впливає рух сусідніх тканин (дихальні рухи, перистальтика кишок, скорочення м’язів тощо).
Координація роботи лімфангіонів. Типовою формою моторики ланцюжка лімфангіонів є послідовне (від дистального до проксимального відділу) їх скорочення. Окремі лімфангіони впливають один на одного. Це здійснюється трьома шляхами: 1) скорочуючись, лімангіон розтягує ангіон, що лежить проксимально; 2) ско
рочення лімфангіона супроводжується засмоктуванням лімфи дистальною ділянкою судини; 3) розтягнуті лімфангіони набувають попереднього стану за рахунок з’єднання з сусідніми лімфангіо-нами.
Регуляція лімфообігу. При нервовій регуляції великі лімфатичні судини загалом іннервуються симпатичним відділом нервової системи, волокна якої відходять від нервових сплетінь адвентицію кровоносних судин і черевних (для кишок) симпатичних нервів. Збудження симпатичних волокон супроводжується звуженням лімфатичних судин, підвищенням їх тонусу, збільшенням лімфотоку. Стимуляція парасимпатичної нервової системи (закінчень блукаючого нерва) зумовлює як розслаблення, так і скорочення лімфатичних судин, тобто збільшення або зменшення лімфотоку.
Механізм гуморальної регуляції такий. Під впливом катехола-мінів, серотоніну, вазопресину скорочується лімфангіон, підвищується внутрішньосудинний тиск, збільшується лімфотік. Під впливом ацетилхоліну, окситоцину зменшуються частота і амплітуда скорочень міоцитів, знижуються тиск лімфи і швидкість лімфотоку.
Виражений вплив на величину лімфотоку справляють №+, К+, Са2+. Так, Са2+ у малих концентраціях знижує швидкість лімфотоку, у великих — збільшує. К+ у малих концентраціях підвищує частоту фазних скорочень і швидкість лімфотоку, у великих — зумовлює тривале тонічне скорочення, зменшення швидкості лімфотоку. При зміні концентрації Ка+ лімфотік дещо зменшується у зв’язку з порушенням співвідношення Ь4а+/Са2+. Гіпоксія супроводжується спочатку зменшенням ритму і амплітуди скорочень, зниженням швидкості лімфотоку, а через ЗО хв зовсім припиняється скорочення і розвивається лімфостаз.
ФУНКЦІЯ ЛІМФИ
Резорбція полягає у всмоктуванні із тканин і органів білків та їх метаболітів, ліпідів, клітин та їх фрагментів, сторонніх часток тощо. Висока проникність лімфатичних капілярів (щілини пропускають частки розміром до 100 нм, а іноді й більші) забезпечує звільнення тканин від великих метаболітів, мікроорганізмів, чужорідних часток. Так, пилоподібні частки, що потрапляють у дихальні шляхи, резорбуючись лімфатичними капілярами, надходять у регіонарні лімфатичні вузли легенів.
Тісно взаємозв’язана із вказаною функцією б а р’ є р н а функція лімфатичних вузлів, а також лімфоїдних елементів, розташованих у великій кількості в слизовій оболонці кишок. У них затримуються колоїдні і корпускулярні речовини, перероджені клітини, мікроорганізми. Розташовані тут ретикулярні та ендотеліальні клітини володіють фагоцитарною властивістю.
Адсорбційна функція пов’язана із надходженням води до лімфатичних судин унаслідок різниці онкотичного тиску. Це особливо проявляється під час «відкачування» рідини із серозних та синовіальних порожнин.
Частина жирів, а також інших перетравлених речовин через ворсинки кишок надходить до лімфатичних капілярів. У такий спосіб лімфатична система бере участь у процесі всмоктування. Після прийняття їжі, особливо жирної, лімфа, що відтікає, набуває молочного кольору.
Система дихання
Біологічні процеси на рівні окремої клітини або цілого організму здійснюються з використанням енергії. Для утворення її потрібно забезпечити постійне надходження кисню до мітохондрій клітин. Шляхи надходження кисню, використання його в окислю
вальних процесах і механізм зворотного транспорту вуглекислого газу складають єдину систему дихання (транспорту газів). Традиційно вважають, що клітинне (внутрішнє) дихання вивчає
біохімія, а інші процеси — фізіологія.
Під системою дихання розуміють комплекс структур, які беруть участь у газообміні, і механізми їх регуляції.
Споживання кисню. Завдання системи транспорту газів полягає у забезпеченні організму такою кількістю кисню, яка адекватна його енергетичним потребам. Сумарним показником активності дихальної системи є споживання кисню (СК) за 1 хв. У дорослої людини у стані спокою СК становить близько 3,5 мл (хв-кг). Під
Мал. 173. Етапи дихання:
1 — зовнішнє; З — дифузія і азів у легенях; 3 — транспорт газів кров’ю; 4 — дифузія газів у тканинах; 5 — внутрішнє (тканинне) дихання
вищення функціонального стану будь-якого органа супроводжується зростанням СК. Особливо значно збільшується СК під час роботи м’язів. Виконання фізичної роботи потребує посилення функції всіх органів системи транспорту газів. З’являється задишка. Вона виникає і при багатьох захворюваннях, які порушують функцію системи дихання.
Механізм транспорту газів. На окремих етапах процесу дихання перенесення газів забезпечують два основних механізми: дифузія і конвекція. Рушійною силою дифузії є градієнт концентрації газу (Рі—Р2): що він вищий, то ін-тенсивніший газообмін. Фізико-
хімічні закономірності, що визначають цей вид транспорту, забезпечують газообмін без використання енергії. Проте при дифузії швидкість руху газів порівняно низька, внаслідок чого вони переміщуються на невеликі відстані. Таким чином відбувається газо-перенос між повітрям, що надійшло у повітроносні шляхи, і альвеолами, альвеолярним повітрям і кров’ю, кров’ю і тканинами.
Інший шлях газопереносу — конвекція — оснований на градієнті тиску. Для створення градієнта тиску потрібно затратити енергію. Струмінь повітря переміщується із зовнішнього середовища у дихальні шляхи, Ог з кров’ю — від легенів до тканини, а СОг — із тканин до легенів.
Можна виділити п’ять основних етапів газопереносу в системі дихання:
1) конвекційне надходження повітря в повітроносні шляхи і дифузія газів між повітроносними шляхами та альвеолами (зовнішнє дихання);
2) дифузія газів між альвеолами і кров’ю;
3) перенос газів кров’ю;
4) дифузія газів між капілярною кров’ю і тканинами;
5) внутрішнє, або тканинне, дихання (мал. 173).
ЗОВНІШНЄ ДИХАННЯ
Під зовнішнім диханням розуміють обмін газів між зовнішнім середовищем і альвеолами.
ДИХАЛЬНІ РУХИ
Перший етап дихання відбувається шляхом чергування вдихів (інспірацій) і видихів (експірацій). Під час вдиху порція повітря надходить у легені, а під час видиху виводиться з них. Повітря переміщується завдяки черговому збільшенню та зменшенню розмірів грудної порожнини.
Розміри грудної порожнини змінюються під час руху ребер і сплощення діафрагми. Ребра, утворюючи рухомі сполучення з тілами і поперечними відростками хребців, під час руху обертаються навколо осей, які проходять через місце фіксації. Причому верхні ребра обертаються майже впоперек, і під час їх руху збільшуються головним чином передньозадні розміри грудної порожнини. Вісь обертання нижніх ребер більш сагітальна, і від їх рухів залежать переважно бічні розміри грудної порожнини. Амплітуда рухів залежить від сили скорочення м’язів. Але тут визначну роль відіграють рухомість сполучень передніх кінців ребер з грудиною, еластичність реберних хрящів. Вікове зменшення еластичності хрящів утруднює дихальні екскурсії грудної клітки.
ДИХАЛЬНІ М’ЯЗИ
Спокійне дихання від форсованого відрізняється багатьма параметрами. У першу чергу, у здійсненні дихальних рухів бере участь різна кількість м’язів. Усі м’язи, що виконують дихальні рухи, скелетні. У стані спокою на 4/б інспірацію здійснює діафрагма. Скорочення м’язів діафрагми, передаючись на сухожильний центр, призводить до сплощення її купола і збільшення вертикальних розмірів грудної порожнини. Прц цьому органи черевної порожнини відтісняються вниз, і при розслабленні м’язи черевної стінки розтягують її вперед і вбік. Такий тип дихання називають черевним.
Рух ребер можуть здійснювати практично всі м’язи, що до них прикріплюються. Основні м’язи виконують спокійне дихання, а допоміжні приєднуються до них при глибшому форсованому диханні. Крім діафрагми основними дихальними м’язами є зовнішні і внутрішні міжреберні. При скороченні вони тягнуть обидва ребра одне до одного. Напрямок руху залежить від відношення важелів, місця прикладання зовнішніх сил і точки фіксації ребер (мал. 174). Точка прикріплення міжреберних м’язів до нижче розташованого
Мал. 174. Дихальні м’язи і схема дихальних рухів (за даними А. Оезророиіоз, 81. 8і1Ьегпа£І, 1986):
В, В; С, С — місця фіксації міжреберних м’язів до ребер; А. А — місця приєднання ребер до хребців. Якщо важіль А — В менший, ніж А — С,— ребра піднімаються, якщо ж вія більший, ніж А — С,— ребра опускаються
ребра розміщена далі від центра обертання, ніж точка прикріплення до вище розташованого ребра (для міжреберних м’язів — це хребет, а для міжхрящових — грудина). Тому сумарна дія їх обумовлює загальне піднімання ребер і збільшення сагітального розміру та об’єму грудної клітки. Результат дії сил при скороченні внутрішніх міжреберних м’язів протилежний, тому ребра опускаються. Це призводить до зменшення сагітального розміру та об’єму грудної клітки. Тому внутрішні міжреберні м’язи є м’язами видиху.
Дихальні м’язи також дещо повертають ребра навколо їх поздовжньої осі, що призводить до збільшення поперечного розміру грудної клітки при вдиху і зменшення при видиху.
До допоміжних інспіраторних м’язів належать усі м’язи, що прикріплюються одним кінцем до ребер грудини, а іншим — до черепа, плечового пояса або до вищележачого хребця. Це — великі і малі грудні, драбинчасті, грудиноключичнососкові, трапецієвидні, м’язи, що піднімають лопатку. Найважливішими допоміжними експіраторними м’язами є м’язи живота, що стискають органи черевної порожнини, а отже, посилюють піднімання діафрагми. Крім цього, м’язи живота, як і м’язи, іщ> згинають хребет, сприяють опусканню ребер.
ФУНКЦІЇ ПОВІТРОНОСНИХ ШЛЯХІВ
В альвеоли повітря надходить через повітроносні шляхи. Дихальні шляхи починаються верхнім відділом: носовими ходами,, ротовою порожниною і гортанню. Розміщена за гортанню трахея ділиться на два бронхи, кожний з яких послідовно і багаторазова розподіляється дихотомічно. Всього нараховується близько 20— 25 генерацій бронхів (мал. 175). Довжина і діаметр кожного наступного бронха зменшуються. Однак, починаючи з 4-ї генерації, через різке збільшення їх кількості, сумарний поперечний діаметр прогресивно зростає. Так, коли просвіт дихальних шляхів до 4-ї генерації складає 2,0—2,5 см2, то до 16-ї він вже становить 180 см2, до 19-ї — 940 см2, а на рівні 23-ї генерації сумарний просвіт бронхіол складає 11 400 см2.
Сумарний просвіт дихальних шляхів може змінюватись при підвищенні тонусу гладких м’язів дихальних шляхів.
Дихальні шляхи ділять на кондуктивну (провідну), транзиторну (перехідну) і дихальну зони. До першої зони належать від 1-ї до 16-ї генерації бронхів, до другої — наступні. Із загального об’єму легень провідна зона займає 3 % (близько 150 мл), транзиторна — близько ЗО % (1500 мл).
Починаючи з 17-го поділу, на стінках бронхів з’являються поодинокі альвеоли. Далі, аж до 23-ї генерації, кількість альвеол збільшується. В зв’язку з цим 17—23-тя генерації називаються дихальними бронхіолами; 23-тя генерація бронхіол переходить у
Мал. 175. Схема повітроносних шляхів людини (за даними Е. ШеЬеІ, 1987):
П — порядок генерації бронха; БР — бронхи; БЛ — бронхіоли; КБ Я — кінцеві бронхіоли; ДБЛ — дихальні бронхіоли; АХ — альвеолярні ходи; А — альвеоли
Мал. 176. Схема об’єму повітроносних шляхів і альвеол:
Т — трахея; Б — бронхи; ДБЛ — дихальні бронхіоли; А2 — альвеолярні ходи; АМ—альвеолярні мішечки; А — альвеоли
альвеолярні мішечки, що розділені перегородками приблизно на 20 порожнин — альвеол (мал. 176).
Власне дихальна зона складається приблизно із 300 млн альвеол, які мають форму зрізаної сфери діаметром 0,15—0,3 мм.
У немовлят діаметр альвеол приблизно такий же, як і у дорослих. У їх легенях нараховується близько ЗО млн альвеол, легені виповнюють усю грудну порожнину. З віком грудна стінка росте швидше, ніж легені. Тому легені постійно перебувають у розтягнутому стані.
Гілки легеневої артерії майже повністю повторюють поділ бронхів. Легеневі артерії, капіляри і посткапілярні вени, які тісно сполучені з альвеолами, густо обплітають їх. Тому форма альвеол безпосередньо залежить від стану кровонаповнення легень. Альвеолярне повітря від крові відділяється лише двома шарами клітин, між якими міститься тонкий шар сполучної тканини. Товщина легеневої мембрани складає 0,4—1,5 мкм (мал. 177).
Повітроносні шляхи майже не беруть участі в газообміні. Але ці шляхи виконують ряд інших важливих функцій, спрямованих на «кондиціонування» повітря. Можна виділити три основних механізми забезпечення кондиціонування.
1. Зігрівання. Під час проходження через повітроносні шляхи
Епітелій днтерспиіцій Ендотелій
Мал. 177. Альвеолярно-капілярна мембрана: ОК — оболонка клітини; БМ — базальна мембрана
повітря зігрівається завдяки тісному контакту з широкою мережею кровоносних капілярів підслизового шару.
2. Зволоження. Незалежно від вологості атмосфери повітря легенів насичене до 100 °/о парою води.
Повітря, проходячи через повітроносні шляхи, під час видиху встигає частково повернути слизовим оболонкам як тепло, так і воду. У такий спосіб у повітроносних шляхах здійснюється регенерація повітря. Вираженість цих процесів багато в чому залежить від стану навколишнього середовища й глибини дихання. При форсованому диханні організм людини може втрачати до 10 % тепла і до 200 мл/год води.
3. Очищення повітря. Часточки, шо за розміром більші від 10 мкм, затримуються на волосинках та вологих слизових оболонках носових ходів. Ті ж часточки, які минули ці перешкоди, осідають на стінках трахеї, бронхів, укритих війчастим епітелієм. Вії здійснюють коливальні рухи: вони повільно рухаються відповідно до напрямку видиху й швидко повертаються в попереднє положення. Завдяки цьому слиз разом із часточками поступово рухається у напрямку гортані, де відхаркується або проковтується. Середня швидкість руху слизу — близько 1 см/хв. Дрібні часточки, які потрапили до альвеол, можуть бути поглинуті макрофагами сполучної тканини. Після цього вони залишаються на місці (вугільний пил зберігається в тканинах легенів протягом кількох років) або через лімфу та кров відносяться від легенів. Аналогічна ситуація спостерігається і з мікроорганізмами.
Повітроносні шляхи виконують захисну функцію й рефлекторним шляхом: при чханні та кашлі разом із струменем повітря виводиться подразник. Чхальний рефлекс зароджується в рецепторах слизової оболонки носа, а кашльовий — у слизовій оболонці глотки, трахеї, бронхів.
ОПІР ДИХАННЮ
По більшості дихальних шляхів повітря рухається ламінарно. Однак у місцях розгалуження може виникати завихрення і течія стає турбулентною. При цьому завдяки тертю шарів повітря між собою та об стінки дихальних шляхів виникає аеродинамічний опір.
Робота м’язів, що скорочуються при здійсненні дихальних рухів, спрямована на подолання аеродинамічного опору, а також опору стінок і органів грудної та черевної порожнин під час їх деформації. Розрізняють в’язкий та еластичний опір. В’язкий опір виникає завдяки внутрішньому тертю та непружній деформації тканин, а також тертю поверхонь, які прилягають одна до одної.
Еластичість і поверхневий натяг легенів
Колагенові й еластичні волокна стінок альвеол здійснюють еластичний опір, який спрямований на зменшення об’єму альвеол. Крім того, у ділянці розділу повітря з рідиною виникають сили, які також спрямовані на зменшення поверхні — це сили поверхневого натягу. До того ж, що менший діаметр альвеол, то більший поверхневий натяг. Якби ці сили діяли без перешкод, то завдяки сполученню між окремими альвеолами повітря з малих альвеол переходило б у більші, а найменші альвеоли повинні були б зникнути.
Проте у організмі існує біологічне пристосування, що протидіє цим силам. Цесурфактанти (поверхнево-активні речовини — ПАР), які містяться у поверхневому шарі рідини. Вони виробляються пневмоцитами II типу. Що менший діаметр альвеол і більша сила поверхневого натягу, то активніші сурфактанти. У присутності ПАР поверхневий натяг знижується майже в 10 разів. Якщо змити водою рідину, котра містить сурфактанти й покриває тонким шаром епітелій альвеол, то альвеоли спадуться.
Функції сурфактантів. 1. Збереження розмірів і форми альвеол. Головним елементом ПАР є дипальмітилфосфатидилхолін(ДПФХ), який синтезується із жирних кислот. Ці кислоти приносить до легень кров. Вважають, що поверхневий натяг знижується завдяки особливостям молекули ДПФХ. Вона з одного краю гідрофобна, а з другого — гідрофільна, завдяки цьому молекула розтікається по поверхні води тонким шаром. За рахунок здатності відштовхування сурфактанти протидіють притягуванню молекул води, які забезпечують поверхневий натяг. Зростання активності ПАР при зменшенні площі поверхні альвеол забезпечується тісним приляганням
молекул ДПФХ одна до одної, що й збільшує силу взаємного відштовхування.
2. Гістерезис легень. ПАР синтезуються пневмоцитами постійно і спочатку надходять у так звану гі-пофазу. Це своєрідне депо сурфак-тантів розташоване під поверхневим моношаром. Руйнування ділянок верхнього активного шару, які зістарилися, супроводжується надходженням готових молекул сурфак-тантів із гіпофази. ПАР надходять до моношару також при розтягненні легенів у фазу вдиху. Зростаюча під час видиху концентрація їх сприяє
Мал. 178. Динаміка кривої «тиск — об’єм» легень щура. Петля гістерезиса (за даними В. Я. Бе-резовського)
початковій затримці спадіння аль-
веол. У цю мить, незважаючи на зменшення сили внутрішнього
розтягування альвеол, діаметр їх залишається порівняно більшим, ніж при вдиху. Тобто спостерігається невідповідність об’єму зовнішнього тиску. Ця невідповідність зображена на графіку у вигляді петлі гістерезису (від грец. Ьузіегезіз — відставання, запізнення; мал. 178). При нормальній глибині дихання об’єм альвеол змінюється мало (до 3—5 %). Завдяки цьому гістерезис не має істотного значення. На відміну від цього при глибокому диханні гістерезис починає відігравати важливу роль у полегшенні дихальних рухів. Крім того, затримка спадіння альвеол у свою чергу сприяє тривалішому зберіганню повітря в альвеолах, що поліпшує умови газообміну.
3. ПАР беруть участь у періодичному виключенні частини альвеол із процесу дихання. Хоча синтез сурфактантів у пневмоцитах відбувається постійно, «вистрілюються» вони в навколишню гіпо-фазу періодично. Завдяки цьому ті ПАР, які зістарилися, зникаючи з поверхні деяких альвеол або і окремих ділянок, можуть на деякий час оголити поверхню. Збільшення поверхневого натягу
зумовлює зменшення входу до альвеол.
4. Очищення альвеол. На поверхні альвеол ПАР поступово переміщуються в напрямку градієнта поверхневого напруження. На місці секреції сурфактантів поверхневий натяг найменший, а в частині, що прилягає до бронхіол, де немає секреторних клітин, поверхневий натяг вищий. Тому сюди, до виходу з альвеол, і рухаються сурфактанти. З поверхні альвеол разом з ПАР можуть виводитися пилові частинки, зруйнований епітелій. У запиленій атмосфері ці процеси посилюються, отже активізується й синтез сурфактантів. Через високу активність цих процесів може поступо-
во виснажуватись біосинтез ПАР. Це є однією з причин розвитку ателектазу — зникнення частини дрібних альвеол.
5. Побутує думка, що ПАР сприяють збереженню сухості поверхні альвеол і приблизно на 50 % знижують випаровування води через легені. Не виключена й участь їх у перенесенні газів через легеневу мембрану. Але, безумовно, найважливішою функцією ПАР є збереження стабільності альвеол.
Крім сурфактантів, у підтримці структури легень важливу роль відіграє структурна взаємозалежність альвеол. Зрощення їх одна з одною сприяє взаємному розтягуванню сусідніх альвеол.
Сурфактанти починають синтезуватися в кінці внутрішньоут-робного періоду. їх присутність полегшує здійснення першого вдиху. Під час передчасних пологів легені дитини можуть бути не підготовленими для дихання, що може спричинити виникнення ділянок ателектазу.
Робота дихальних м’язів, що виконують вдих, спрямована, в першу чергу, на подолання усіх видів опору. Крім цього, дихальні м’язи долають гравітацію, яка перешкоджає підніманню грудної клітки і плечового пояса при вдиху. Особливо слід підкреслити важливість подолання аеродинамічного опору. Цей опір зростає при звуженні повітроносних шляхів, а також при збільшенні швидкості вентиляції легень. Так, набряк слизової оболонки, що виникає навіть при короткочасному вдиху диму сигарет, на 20—ЗО хв збільшує опір рухові повітря у 2—3 рази. Ще більшою мірою зростає опір рухові повітря при звуженні бронхів при бронхіальній астмі. Внаслідок цього у хворого для виконання навіть спокійного дихання повинні підключатися допоміжні м’язи. Збільшення швидкості руху повітря при форсованому диханні призводить до значного зростання турбулентних завихрень і підвищення опору без зміни просвіту дихальних шляхів. Це настільки утруднює роботу дихальних м’язів, що для зниження аеродинамічного опору при форсованому диханні людина мимоволі переходить на дихання через рот. Встановлено, що дихання через рот на ЗО—40 % знижує аеродинамічний опір.
ВПЛИВ ЗМІНИ ОБ'ЄМУ
ГРУДНОЇ КЛІТКИ НА ЛЕГЕНІ
Грудна клітка зсередини покрита парієтальним листком плеври. Вісцеральний листок плеври укриває легені з зовнішнього боку. Між ними міститься плевральна щілина, заповнена рідиною, яка виконує роль «мастила». Завдяки цьому легені і грудна стінка ковзають одне повз одне. Цим забезпечується зчеплення легень із стінками грудної клітки, завдяки чому при збільшенні грудної порожнини легені йдуть услід за грудною кліткою, не деформуючись
при цьому. Зрощення обох листків плеври (після плевриту) різко погіршує умови вентиляції відповідних ділянок легенів.
Еластичні елементи легень і сили поверхневого натягу зумовлюють виникнення міжплевральної напруги. Сумарна величина цих сил може бути визначена шляхом уведення канюлі манометра між листками плеври. Цей показник має назву внутрішньоплев-рального тиску. Величина його на 5 см вод. ст. (0,3— 0,5 кПа) нижча від показника атмосферного тиску. Під час вдиху тиск між листками плеври стає ще нижчим (—7,5 см вод. ст., 0,6— 0,8 кПа), а під час глибокого вдиху може знизитись ще більшою мірою.
Якщо повітря проникає у плевральну порожнину, розвивається пневмоторакс (коли порушена цілість грудної клітки або легенів) і через еластичне напруження легені спадаються. Тоді легені вже неспроможні рухатись разом із грудною кліткою, і дихання стає неможливим.
МЕХАНІЗМИ ВДИХУ І ВИДИХУ
Перед черговим вдиханням повітря в легенях перебуває під тиском, який дорівнює атмосферному, а міжплевральний тиск нижчий від атмосферного на 5 см вод. ст. Під час вдиху послідовність процесів така: по нервах імпульси надходять до інспіратор-них м’язів, вони скорочуються, і внаслідок цього збільшуються розміри грудної клітини у всіх площинах. Це супроводжується
зниженням внутрішньоплеврального тиску. Паралельно до’ збільшення розмірів грудної клітки зростає об’єм легень. При розтяганні легенів повітря, що в них є, розподіляється у більшому об’ємі. Це призводить до зменшення тиску в легенях. Через градієнт тиску, який виник при відкритих дихальних шляхах, повітря надходить у легені і тиск у них знову вирівнюється з атмосферним. У міру поглиблення вдиху в розтягнутих легенях зростає еластичний опір і для розтягування легенів потрібна більша сила (щоб подолати внутрішньоплевральний тиск).
Механізм вдиху зручно розглядати на моделі Дондерса (мал. 179).
Мал. 179. Схема Дондерса (пояснення у тексті)
У скляну посудину без дна поміщають легені. Посудина імітує грудну клітку. Знизу вона закрита гумовою плівкою, яка імітує діафрагму. Коли відтягнути «діафрагму» вниз, знизиться «внутрішньоплевральний» тиск, легені розширяться, і в них надійде повітря.
Енергія інспіраторних м’язів витрачається не тільки на подолання аеродинамічного опору повітря. Частина її йде на подолання еластичного і нееластичного опору тканин внутрішніх органів, черевної і грудної стінок, а частина — на подолання гравітаційних сил, які протидіють підніманню плечового пояса і грудної клітки. Тобто частина енергії переходить употенціальну енергію. Після скорочення інспіраторних м’язів ця потенціальна енергія забезпечує пасивний видих. При цьому ребра і плечовий пояс опускаються, а діафрагма піднімається. Внаслідок цього внутрішньоплевральний тиск збільшується від —7 до —5 см вод. ст. Еластичний і поверхневий натяги розтягнутих перед цим легень вже не урівноважуються внутрішньоплевральним тиском, і легені починають спадатися. Тиск у легенях стає вищим від атмосферного, і повітря виходить через повітроносні шляхи. Якщо запасної потенціальної енергії недостатньо для видиху, то підключаються експіраторні м’язи.
Для виконання глибокого вдиху потрібне інтенсивніше розширення грудної клітки. Природно, що чим глибший вдих, тим більше м’язів повинно скорочуватися: підключаються м’язи, які піднімають ребра, грудну клітку. Легені розтягуються з більшими швидкістю і силою, що призводить до збільшення об’єму і швидкості надходження повітря в дихальні шляхи.
У кінці глибокого видиху нагромаджується більше потенціальної енергії. Але, незважаючи на це, для виконання форсованого видиху обов’язково повинні підключатися експіраторні м’язи, які прискорюють і посилюють зворотні рухи діафрагми, грудної клітки, легенів.
Взаємовідношення між об’ємом легень, величиною тиску в них і між листками плеври під час дихального циклу показані на мал. 180.
ЛЕГЕНЕВИЙ ОБ’ЄМ І ЄМКІСТЬ
Газообмін у легенях відбувається між повітрям альвеол і кров’ю, яка їх омиває. У свою чергу при диханні повітря альвеол повинне обмінюватися із зовнішнім повітрям. Але якими б глибокими не були дихальні рухи, повного обміну альвеолярного повітря на атмосферне ніколи не буває. Альвеолярна вентиляція визначається глибиною і частотою дихальних рухів, а також відношенням об’єму провідних шляхів і альвеол. Прийнято визначати показники, що характеризують зовнішнє дихання,— статичні і динамічні (мал. 181). Більшість із них багато в чому залежить від об’єму
РОмЮООмл
Мал. 180. Зміни об’єму легень, тиску в легенях, внутрішньоплеврального та транслегеневого тиску при нормальному диханні (за даними А. С. Оиуіоп, 1991)
РО.. 2500м/і
ДО500 м/
ЗО 1000мл
•ЖЄЛЬОООмл
ш
•ЗЄЛ5000мл
Мал. 181. Статичні показники зовнішнього дихання:
ДО — дихальний об’єм; >КЄЛ — життєва ємкість легень; РОвд—резервний об’єм вдиху; РО Вид— резервний об’єм видиху; ЗЄЛ — загальна ємкість легень; ЗО — залишковий об’єм
грудної порожнини і рухомості грудної клітки. До статичних належать такі показники.
1. Дихальний об’єм (ДО) — кількість повітря, що надходить у легені за один спокійний вдих (500 мл).
2. Резервний об’єм вдиху (РОвд) — максимальна кількість повітря, яку людина може вдихнути після нормального видиху (2500 мл).
3. Резервний об’єм видиху (РОвид) — максимальна кількість повітря, яку людина може видихнути після спокійного вдиху (1000 мл).
4. Життєва ємкість легенів (ЖЄЛ) — найбільша кількість повітря, яке людина може видихнути після максимально глибокого вдиху. Цей сумарний показник легко визначити, знаючи попередні величини: ЖЄЛ=ДО+РОвд+РОвид.
ЖЄЛ залежить від віку, статі, росту, маси тіла і фізичного розвитку людини. Заняття деякими видами спорту, зокрема греблею, плаванням тощо, підвищують ЖЄЛ.
5. Після максимально глибокого видиху в легенях залишається повітря, яке називається залишковим об’ємом (ЗО; 1000 мл).
6. Загальна ємкість легенів (ЗЄЛ) — кількість повітря, яке міститься в легенях на висоті максимуму вдиху: ЗЄЛ=ЖЄЛ+30.
7. Об’єм дихальних шляхів («мертвий простір», МП) дорівнює в середньому 150 мл.
8. Функціональна залишкова ємкість (ФЗЄ) — кількість повітря, яка залишається в легенях у кінці видиху: ФЗЄ=РОвид+ЗО.
ВЕНТИЛЯЦІЯ ЛЕГЕНЬ
Вентиляція легень залежить від співвідношення обновлюваного за кожний дихальний цикл об’єму повітря і об’єму повітря, що міститься в легенях. Так, якщо при спокійному диханні в легені надходить близько 500 мл повітря, то цей об’єм додається до ЗО і РОвид, який дорівнює приблизно 2000 мл. Але частина повітря, що вдихається, не доходить до альвеол і залишається в дихальних шляхах.
У зв’язку з наявністю МП альвеолярна вентиляція відрізняється від легеневої: із 500 мл повітря до альвеол не доходить 150 мл. Тобто за кожний дихальний цикл до альвеол надходить близько 350 мл повітря, що складає приблизно '/? всього повітря, що міститься в альвеолах. Природно, що чим глибше дихання, тим інтенсивніше альвеолярна вентиляція, оскільки з одного боку, при глибшому видиху в легенях залишається менше повітря, а з другого — при форсованому диханні істотно збільшується ДО.
Для характеристики дихання людини визначають ще ряд динамічних показників, що дають уявлення про дихання за певний час (частіше за 1 хв). До них належать такі.
1. Частота дихальних рухів (ЧДР).
2. Хвилинний об’єм дихання (ХОД) — кількість повітря, що надходить у легені за 1 хв: ХОД=ДО-ЧДР.
3. Альвеолярна вентиляція (АВ) характеризує вентиляцію альвеол: АВ= (ДО—МП)-ЧДР.
4. Максимальна вентиляція легень (МВЛ) — кількість повітря, яке людина вдихає і видихає при максимальній глибині і частоті дихання.
5. Резерв дихання — різниця між МВЛ і ХОД.
6. Коефіцієнт легеневої вентиляції (КЛВ) — та частина повітря, яка обмінюється в легенях під час кожного вдиху: КЛВ = = (ДО—МП) : ФЗЄ.
7. Коефіцієнт альвеолярна вентиляція!легеневий кровотік : АВ з ЛК=4 л : 5 л=0,8.
ГАЗООБМІН У ЛЕГЕНЯХ
Газообмін між вдихуваним повітрям і альвеолярним, між альвеолярним повітрям і кров’ю залежить від складу газів у вказаних середовищах (табл. 15).
Парціальний тиск газів
Згідно із законом Дальтона, парціальний тиск кожного газу в суміші пропорційний його об’єму. Позаяк у легенях поряд із киснем, вуглекислим газом і азотом міститься ще й пара води, то для
Таблиця 15. Процентний склад газових сумішей
Повітря о, СО, К2 та інертні гази
Атмосферне 20,93 0,03 79,04
Видихуване Альвеолярна газова 16,0 4,5 79,5
суміш 14,0 5,5 80,5
визначення парціального тиску кожного газу потрібно визначити тиск «сухої» газової суміші. Якщо людина перебуває в «сухому» повітрі, то парціальний тиск кожного газу слід розраховувати, виходячи із загального тиску. Для урахування вологості треба внести відповідні поправки на пару НгО. У табл. 16 наведено величини тиску газів для «сухого» атмосферного повітря.
Аналіз видихуваного повітря свідчить, що різні порції його істотно відрізняються щодо процентного співвідношення Ог І СОг. За складом перші порції повітря ближчі до атмосферного, оскільки це повітря МП. Останні порції повітря наближаються за своїм складом до альвеолярного. Тому його доцільно називати альвеолярною сумішшю газів, розуміючи під поняттям «повітря» атмосферне повітря.
Для визначення Рао, і Расо, в альвеолярній суміші треба «звільнитися» від частки, що припадає на N2 і НгО. Враховуючи це, дійдемо висновку, що рівень Рао, дорівнює 102 мм рт. ст. (13,6 кПа), Расо,— 40 мм рт. ст. (5,3 кПа).
Для визначення інтенсивності газообміну в організмі, крім парціального тиску газів треба знати кількість Ог, що поглинається, і кількість СОг, що виділяється. При проведенні дослідів потрібно дотримувати стандартних умов визначення газового складу атмосферного повітря і альвеолярної суміші.
1. Умови 8ТРП: стандартні температура (Т=273°К), тиск (Р=760 мм рт. ст., 101 кПа) і сухе повітря (РН2О=0).
2. Умови ВТР8 (реальні температура і тиск у легенях і 100 % • насичення парою води). У легенях: Т=273 + 37=310°К; Р — відповідає конкретному барометричному тиску. РН2О дорівнює тиску
Таблиця 16. Парціальний тиск і напруга кисню та вуглекислого газу в легенях, мм рт. ст.
Гази Венозна кров Альвеолярне повітря Артеріальна кров
о2 40 (5,3) 102 (13.6) 96 (13,3)
со2 46 (6,1) 40 (5,3) 39 (5,3)
Примітка: в дужках показники наведено у кілопаскалях.
насичення повітря парою води при температурі 37 °С — 47 мм рт. ст. (6,3 кПа).
Якщо конкретні умови обстеження людини відрізняються від стандартних, то потрібно внести поправки, привівши ці об’єми у відповідність із рівнянням стану ідеального газу:
V • Р = М • К • Т,
де М — кількість газу, К — універсальна газова постійна, Т — абсолютна температура.
Для вищеприведених умов це рівняння має такий вигляд:
У5Тро 760 = М • К • 273; УВТР5 (Р —47) М • В • 310.
Після цього можна визначити співвідношення об’ємів газів, виміряних у різних умовах — в умовах атмосфери і альвеол:
У5ТРГ) : УВТР$ = 273 : 310 • (Р — 47) : 760 = (Р — 47) : 863.
У стані спокою організм дорослої людини поглинає за 1 хв 250—300 мл О2, виділяє 200—250 мл СО2.
Газообмін між вдихуваним і альвеолярним повітрям
Яким же чином відбувається обмін киснем і вуглекислим газом між повітрям ФЗЄ і зовнішнім повітрям? Питання це має не тільки теоретичне, а й практичне значення, оскільки нерідко умови дихання змінюються (набряк слизової оболонки, спазм бронхів при астмі тощо). Це призводить до зміни глибини дихання і швидкості дихальних рухів.
Зовнішнє повітря надходить до альвеол під час активного вдиху. Але при цьому не враховують різкого розширення сумарної площі поперечного перерізу дихальних шляхів при розгалуженні бронхів, що призводить до збільшення сумарного об’єму дихальних шляхів. Швидкість струменю повітря на вдиху з розширенням русла повинна неминуче знижуватися. Згідно з розрахунками, під час спокійного дихання перші порції повітря досягають 17-ї генерації бронхів за 0,87 с, 20-ї — за 2,04 с, а рівня 23-ї генерації — лише за 6,7 с. Але звичайно вдих відбувається протягом 1,5—2 с, вслід за чим одразу настає видих. Тобто, якщо б повітря надходило до альвеол шляхом конвекційного току, то воно ніколи не до-сягло б альвеол.
Вважають, що, починаючи із 17-ї генерації бронхіол, до процесу надходження повітря приєднується дифузійний обмін О2 і СО2. При дифузії рушійною силою газообміну є різниця парціального тиску в дихальних шляхах і альвеолах. За рахунок цього О2 дифундує до альвеол, а у протилежному напрямку рухається СО2. Форсування дихання супроводжується підвищенням початкової
швидкості руху струменя повітря і подовженням конвекційного потоку до 19-ї генерації. У зв’язку з цим 17—19-та генерації бронхіол називаються перехідною зоною. Але звичайно форсування дихання супроводжується збільшенням його частоти. Це, ясна річ, залишає менше часу для конвекції. Значно змінюються умови газообміну між атмосферним повітрям та альвеолярною сумішшю і тоді, коли знижується амплітуда дихання. Дихальні шляхи об’ємом до 1500 мл є своєрідною буферною зоною між повітрям, що видихається, і альвеолярним. Верхні її ділянки обмінюються повітрям, яке надходить, а прилеглі до альвеол — з ними.
Швидкість дифузії газів значна і достатня для газообміну. Це є однією з умов підтримання постійного газового складу альвеолярної суміші незалежно від фаз дихання («вдих» — «видих»), У нормі цей рівень підтримується за рахунок відповідної глибини і частоти дихальних рухів. Форсування, як і припинення дихання, порушує цю сталість. Це впливає на газообмін між альвеолами і кров’ю, внаслідок чого змінюється газовий склад крові, що тече від легенів. У свою чергу градієнт парціальних тисків між повітрям бронхів і альвеол забезпечує постійний рівень газообміну незалежно від фаз дихання.
ГАЗООБМІН МІЖ АЛЬВЕОЛАМИ
І КРОВ'Ю
ГЕМОДИНАМІКА ЛЕГЕНЬ
Легені оснащені подвійною мережею капілярів. Живлення власне тканини легенів відбувається за рахунок судин великого кола кровообігу. Ця частина складає незначний процент (1—2 °/о) усієї крові легень.
У судинах малого кола кровообігу міститься 10—12 % крові, що циркулює в організмі. Ці судини належать до системи з низьким АТ (25—10 мм рт. ст., або 3,3—1,3 кПа). Капіляри малого кола кровообігу мають більшу площу у поперечному розрізі (приблизно на 80 %), ніж капіляри великого кола. Цих капілярів надзвичайно багато, але дещо менше, ніж капілярів великого кола (8—10 млрд відповідно). Через малий тиск крові спостерігається нерівномірність перфузії у різних відділах легень. У людини, що перебуває під дією сил гравітації, до верхніх відділів легень надходить менше крові.
Для нормального газообміну повинно бути адекватне співвідношення вентиляції альвеол і кровообігу у капілярах, котрі обплітають альвеоли. Але ці умови не завжди виконуються. Окремі ділянки легень вентилюються і перфузуються не завжди однаково. Одні альвеоли погано або зовсім не вентилюються при збереженні кровообігу, інші ж, навпаки, добре вентилюються, але не перфу-
Мал. 182. Співвідношення кровотоку та вентиляції у легенях (за даними А. Беаророиіоз, 81. ЗіІЬегпа^І, 1986):
1 — нормальна вентиляція та перфузія; 2 — зменшена перфузія; 3 — порушена дифузія газів; 4 — зменшена вентиляція
зуються (мал. 182). За рахунок цього об’єм ділянок легенів, у яких не відбуваються газообмінні процеси, збільшується. Тому, крім анатомічного, вводиться термін «фізіологічний мертвий простір» (ФМП). Під ним розуміється сума анатомічного і альвеолярного МП (об’єм альвеол, що не вентилюються). Якщо у нормі ФМП мало відрізняється від АМП, то при патології він значно впливає на газообмін.
Ще одна особливість мікроциркуляторного русла легень полягає у наявності артеріовенозних шунтів. Завдяки прямому сполученню артерій і вен частина венозної крові надходить із артерій у вени. Наявність артеріовенозних шунтів і нерівномірна венггиляція та перфузія призводять до того, що кров, яка відтікає від легень, несе трохи менше О2, ніж при ідеальних умовах. Окрім того, до крові малого кола кровообігу домішується незначна кількість крові великого кола, що відтікає від тканини легенів. Ця порція крові також «розчиняє» артеріальну кров малого кола, що надходить по венах від легень до лівого передсердя.
ГАЗООБМІН ЧЕРЕЗ ЛЕГЕНЕВУ МЕМБРАНУ
Газообмін у легенях лю)ціни відбувається на площі 50—90 м2. Товщина легеневої мембрани становить 0,4—1,5 мкм. Газообмін через цю мембрану залежить від: 1) поверхні, через яку відбувається дифузія (8); 2) товщини мембрани (Ь); 3) градієнту тиску газів у альвеолах та крові (Ар); 4) коефіцієнту дифузії (К); 5) стану мембрани. Гази через мембрану проникають шляхом дифузії завдяки градієнтам парціального тиску. Вони проходять через 2 шари клітини (епітелій альвеол і ендотелій капілярів), а також інтерстиціальний простір між ними. Найбільш «важкопрохідними» ділянками є мембрани клітин. На шляху кожного газу містяться 5 клітинних і основна мембрани, а також 5 водяних розчинів. У цей перелік входять також плазма крові та еритроцити. Швидкість проходження через усі середовища кожного газу визначається, з одного боку, градієнтом парціальних тисків, а з другого — розчинністю газів у ліпідах, які складають основу мембран, і воді. Вуглекислий газ у 20 разів активніше розчиняється у ліпідах і воді, ніж кисень. Тому, незважаючи на менший градієнт тисків (для СОг — 6 мм рт. ст., а для О2 — 60 мм рт. ст.), СО2 проходить через легеневу мембрану швидше, ніж О2 (мал. 183). Коли кров проходить по капіляру, РАог в альвеолах і крові вирівнюється через 0,2—0,25 с, а вміст СО2 — через 0,1 с (символом РАо, позначається парціальний тиск кисню у альвеолах, Рао, — у артеріальній крові, Ру о, —у венозній крові).
Сумарну швидкість проникання газу через легеневу мембрану характеризує показник, який називається дифузійною здатністю легень (ДЛ). Цим терміном позначається кількість газу, яка проходить через легеневу мембрану за 1 хв при градієнті тиску 1 мм рт. ст. Для кисню ДЛ складає 25—ЗО мл(хв-мм рт. ст.). З віком, як і при ряді патологічних станів, цей показник знижується. Це відбувається через зменшення обмінної площі альвеол, збільшення відстані при дифузії у разі набряку чи склеротичних змін.
Ефективність газообміну у легенях залежить від швидкості кровотоку. Еритроцит проходить по капіляру за 0,6—1 с. За цей час РАо2 і Рао2 встигають вирівнятися. Але
Легені
Артерія Капіляр Вена нмрт.ст. і во -80-40
20 -ммрт.ст. 48-46— 44 -42 -40^-
-Ро, крові І
Транзитний час\ у капілярі, с । \—Рсог крові [
-/05
4Д
Вена
Артерія
Мал. 183. Обмін газів у
легенях
Ро.^/0/ Рсо.
Альвеол
Ро.-ЮЗ
Рсо,-40
при надмірному підвищенні швидкості кровотоку, наприклад при інтенсивному фізичному навантаженні, еритроцит через легеневий капіляр може «проскакувати» швидше, ніж за критичні 0,2— 0,25 с, і тоді насичення крові киснем знижується.
ТРАНСПОРТ ГАЗІВ КРОВ'Ю
ТРАНСПОРТ КИСНЮ
Кисень, що надходить у кров, спочатку розчиняється у плазмі крові. При РАо, 100 мм рт. ст. у 100 мл плазми розчиняється 0,3 мл Ог.
Кисень, що розчинився у плазмі крові, за градієнтом концентрації проходить через мембрану еритроцита і утворює оксигемоглобін (НЬОг). При цьому валентність заліза не змінюється. Оксигемоглобін — нестійка сполука і легко розкладається. Пряма реакція називається оксигенацією, а зворотний процес — дезоксигенацією гемоглобіну. При сполученні Ог із гемоглобіном Ре2+ залишається двовалентним.
Кожна молекула НЬ може приєднати 4 молекули Ог, що у перерахунку на 1 г НЬ означає 1,34 мл Ог- Знаючи кількість гемоглобіну в крові, можна визначити кисневу ємкість крові (КЄК): КЄК=НЬ-1,34. Якщо в 100 мл крові міститься 15 г НЬ, то 15-1,34 = 20 мл О2 у 100 мл крові.
Враховуючи те, що 100 мл крові містять лише 0,3 мл розчиненого Ог, можна уявити, що основний об’єм кисню транспортується у стані хімічного зв’язку з гемоглобіном. Але, незважаючи на відносно низьку розчинність, кількість розчиненого в крові Ог можна збільшити штучно. Розчинність газу в рідині залежить від температури, складу рідини, тиску газу і його природи. Позаяк склад крові, її температура у організмі майже завжди постійні, кількість розчиненого газу можна вирахувати за формулою:
0 = 2 . V • РАо,: Ратм,
де <2— кількість розчиненого в рідині газу; % — його адсорбційний коефіцієнт при 1=37 °С (для Ог він становить 0,023); V — об’єм крові; Ратм — атмосферний тиск.
Коли збільшується тиск газу над рідиною, кількість розчиненого газу збільшується. Так, при диханні чистим Ог, коли його парціальний тиск у альвеолах може перевищувати 600 мм рт. ст., у 100 мл крові розчиняється вже близько 2 мл кисню. Але якщо людина перебуває в умовах з підвищеним тиском кисню (у барокамері), то кількість розчиненого у крові кисню буде зростати пропорційно до тиску (гіпербарична оксигенація). Наприклад, при парціальному тиску 3 атм, коли РАо, збільшується до 2280 мм рт. ст. (304 кПа), в 100 мл крові може розчинитись близь
ко 5—6 мл О2. Цієї кількості кисню досить для того, щоб тканини не відчували кисневої недостатності навіть за відсутності зв’язаного з гемоглобіном О2. Вказаний ефект можна використовувати при наданні допомоги тим хворим, у яких гемоглобін не може транспортувати кисень. Наприклад, дихання чистим киснем рекомендовано при отруєнні чадним газом, коли утворюється стійка сполука карбоксигемоглобін (дисоціює у 1000 разів повільніше, ніж оксигемоглобін).
Розчинність газів зменшується при підвищенні температури, але в умовах організму це великої ролі не відіграє. Про значення природи газу свідчить той факт, що розчинність кисню у 20—25 разів нижча, ніж вуглекислого газу.
Асоціація і дисоціація оксигемоглобіну
Між кількістю оксигемоглобіну в крові і напругою в ній кисню є залежність. Встановлено, що коли в крові немає кисню (Ро2 =0), то нема і оксигемоглобіну, він міститься у формі відновленого гемоглобіну. Якщо Ро2 = 10 мм рт. ст., 5,5 % гемоглобіну перейде у форму НЬО2, коли ж вміст Ро2 досягне 20 мм рт. ст., то оксигемоглобіну буде вже 25 %, при рівні 40 мм рт. ст. буде 74 %, а при рівні 100 мм рт. ст. у формі НЬО2 буде близько 92 % О2. Таким чином, що більша напруга кисню в крові, то більше буде оксигемоглобіну.
Але ця залежність не лінійна, вона виражається 8-подібною кривою. На мал. 184 показана залежність між Ро2 крові і процентом НЬО2 в ній.
Крива дисоціації оксигемоглобіну. Треба звернути увагу на дві частини цієї кривої. Верхня частина кривої, яка за формою наближається до горизонтальної, має значення для утворення оксигемоглобіну в капілярах легень. Сюда надходить венозна кров, у якій Ро2=40 мм рт. ст. (в альвеолярному повітрі Ро2 =100 мм рт. ст.), тому кисень дуже швидко переходить у кров і рівень НЬО2 зростає до 92 %.
Але не завжди Ро2 в альвеолярному повітрі буде становити 100 мм рт. ст. При підніманні на висоту, зниженні альвеолярної вентиляції він зменшиться. Проте, незважаючи на це, кількість гемоглобіну у формі НЬО2 ще довго (до певної межі) буде досить високою і гемоглобін виконуватиме функцію транспорту кисню (цю частину кривої порівнюють із графічним зображенням процесу зарядження акумулятора).
Середня частина кривої, яка за формою наближається до вертикальної, має значення для процесів, що відбуваються в капілярах тканин. При Ро. 40 мм рт. ст. (5,3 кПа) лише 72 % припадає на НЬО2, але що інтенсивніше працюватиме орган, то менше буде
_ ммргпст.
« О 20 40 60 80 100 120
* 100
^90
Є П
І- 60
.При підвищену ні рН чи змен-\ шенні 1°або І зменшенні / г.ЗДФГ //
Р^Ог
20
Насичення у легенях
Нормальна кри ва при рН 7,4та37°С
При зменшенні рН чи підвищенні Iа або 2,3 ДФГ
Тканини Легені
Десатуроійя • тканинних капілярах
10 0_____________
1 2 3 4 5 6 7 8 9 Ю 11 12 13
Напруго кисню артеріальної мові. кПа
Мал. 184. Криві дисоціації оксигемоглобіну
&
§
в крові Ро, і більша буде дисоціація НЬО2 на НЬ і кисень. Отже, оксигенація клітин, що інтенсивно працюють, буде зростати. Цю частину кривої можна порівняти із графічним зображенням процесу розрядження акумулятора.
Показником, що характеризує інтенсивність використання Ог тканинами, є різниця кількості НЬОг в крові, яка притікає і відтікає,— артеріовенозна різниця (АВРог).
Нахил кривої дисоціації оксигемоглобіну в крові людини не постійний і за деяких
умов може змінюватися. Характер кривої дисоціації відображає показник, який має назву «напруга напівнасичення» (Рво). Рбо— така напруга Ог, при котрій насичення гемоглобіну киснем складає 50 %. У нормі Рво артеріальної крові становить близько 26 мм рт. ст. (3,5 кПа).
Конфігурація кривої дисоціації НЬОг. обумовлена хімічною спорідненістю гемоглобіну до Ог й іншими зовнішніми факторами, що змінюють характер кривої. До таких факторів належать температура, рН, Рсо2, концентрація в еритроциті 2,3-ДФГ.
Форма кривої дисоціації оксигемоглобіну значною мірою залежить від концентрації в крові Н+. При зниженні рН крива зміщується вправо, що свідчить про зменшення спорідненості НЬ до О2. При підвищенні рН збільшується спорідненість НЬ до О2 і крива зміщується вліво. Вплив рН на спорідненість НЬ до О2 називається ефектом Бора. Ефект Бора відіграє певну роль у газотранспортній функції крові: утворення великої кількості СО2 в тканинах сприяє збільшенню віддачі кисню за рахунок зниження спорідненості НЬ до нього. При виділенні СО2 у легенях зменшується рН крові і поліпшується оксигенація. СО2 також впливає на дисоціацію НЬО2. Причому згаданий ефект обумовлений не тільки Н2СОз, але й прямим впливом рівня Рсо, на гемоглобін.
При зниженні температури віддача О2 оксигемоглобіном сповільнюється, а при її збільшенні прискорюється цей процес. Зміщенню кривої вправо сприяє також збільшення вмісту в еритроцитах 2,3-ДФГ. Вміст цієї речовини в еритроциті збільшується при анемії, що сприяє надходженню О2 до тканин і частково компенсує
зниження рівня КЄК. Таким чином, відсутність у організмі запасів Ог компенсується за рахунок різкого збільшення використання його з крові, підвищення АВРо,. При інтенсивній роботі тканин, коли утворюється більше СОг, Н+ і підвищується температура, створюються умови для поліпшення доставки кисню клітинам.
ТРАНСПОРТ ВУГЛЕКИСЛОГО
ГАЗУ КРОВ'Ю
У венозній крові міститься близько 580 мл/л СОг. У крові він міститься в трьох формах: зв’язаний у вигляді вугільної кислоти і її солей, зв’язаний з гемоглобіном і у розчиненому вигляді.
СОг утворюється в тканинах при окислювальних процесах. У більшості тканин Рсо2 складає 50—60 мм рт. ст. (6,7—8 кПа). У крові, що надходить у артеріальний кінець капілярів, Расо, становить близько 40 мм рт. ст. (5,3 кПа). Наявність градієнту змушує СОг дифундувати із тканинної рідини до капілярів. Що активніше в тканинах здійснюються процеси окислення, то більше створюється СОг і то більший РТк.со2. Інтенсивність окислення у різних тканинах різна. У венозній крові, що відтікає від тканини, Русо наближається до 50 мм рт. ст. (6,7 кПа). А в крові, що відтікає від нирок, Русо2 становить близько 43 мм рт. ст. Тому у змішаній венозній крові, що надходить до правого передсердя, у стані спокою Русо2 дорівнює 46 мм рт. ст. (6,1 кПа).
СО2 розчиняється в рідинах активніше, ніж О2. При Рсо2, який дорівнює 40 мм рт. ст. (5,3 кПа), у 100 мл крові розчинено 2,4— 2,5 мл СОг, Що складає приблизно 5 % від загальної кількості газу, який транспортується кров’ю. Кров, що проходить через легені, віддає далеко не весь СО2. Велика частина його залишається в артеріальній крові, оскільки сполуки, які утворюються на основі СО2, беруть участь у підтриманні кислотно-основної рівноваги крові — одного із параметрів гомеостазу.
Хімічно зв’язаний СО2 перебуває в крові в одній із трьох форм: 1) вугільна кислота (Н2СО3): 2) бікарбонатний іон (НСОз); 3) карбогемоглобін (ННЬСО2). У формі вугільної кислоти переноситься лише 7 °/о СО2, бікарбонатних іонів — 70 %, карбогемоглобіну — 23 %.
СО2, який проникає у кров, спочатку піддається гідратації з утворенням вугільної кислоти: СО2+Н2ОН2СО3.
Ця реакція в плазмі крові відбувається повільно. В еритроциті, куди СО2 проникає за градієнтом концентрації, завдяки спеціальному ферменту — карбоангідразі — цей процес прискорюється приблизно в 10 000 разів. Тому ця реакція відбувається в основному в еритроцитах (мал. 185). Утворювана тут вугільна кислота швидко дисоціює на Н+ і НСОз-, чому сприяє постійне утворення вугільної кислоти: Н2СО3 Н++НСОГ.
.Артеріальна кров РСОг -40 нм
Венозна крої РСОр.^Вмм
Мал. 185. Транспорт С02 кров’ю
У еритроциті при дисоціації вугільної кислоти Н+ утворює комплекс з відновленим гемоглобіном:
НЬ О2 О2 4- НЬ,
НЬ -ь н+ <2 ннь.
При накопиченні НСОГ в еритроцитах створюється його градієнт з плазмою. Можливість виходу НСОГ у плазму визначається такими умовами: вихід НСОГ повинен супроводжуватися одночасним виходом катіону або ж надходженням іншого аніону. Мембрана еритроциту добре пропускає негативні, але погано — позитивні іони. Найчастіше утворення і вихід НСОГ із еритроцитів супроводжується надходженням у клітину СІ-. Це переміщення називають хлоридним зрушенням.
У плазмі крові НСОГ» взаємодіючи з катіонами, створює солі вугільної кислоти. У вигляді солей вугільної кислоти транспортується близько 510 мл/л СОг.
Крім того, СОг може зв’язуватися з білками крові: частково — з білками плазми, але головним чином — з гемоглобіном еритроцитів. При цьому СОг взаємодіє з білковою частиною гемоглобіну — глобіном. Гем же залишається вільним і зберігає здатність гемоглобіну перебувати одночасно у зв’язку як з СОг, так і з Ог. Таким чином, одна молекула НЬ може транспортувати обидва гази.
У крові альвеолярних капілярів усі процеси здійснюються в протилежному напрямі. Головна із хімічних реакцій — дегідратація — відбувається в еритроцитах за участю тієї ж _карбоангід-рази: Н++НСОз ^±Н2СО3ч*
Н2О + СО2.
Спрямування реакції визначається безперервним виходом СО2 з еритроциту у плазму, а із плазми в альвеоли. У легенях у зв’язку з постійним його виділенням відбувається реакція дисоціації карбогемоглобіну: ННЬСО2+О2 -> ННЬО2 + СО2 -> ->НЬО2+Н++СО2.
Взаємозв’язок транспорту кис-
Папруга С0г, КПа
Мал. 186. Криві вмісту СО2 в окси-генованій (/) та дезоксигенованій (2) крові (за даними Р. Шмідта та Г. Тевса, 1986). Лінія «а — в» характеризує фактичний газообмін
ню та двооксиду вуглецю. Вище вказувалося, що форма кривої дисоціації оксигемоглобіну впливає на вміст СО2 у крові. Ця залежність пов’язана з тим, що дезоксигемоглобін є слабшою кислотою, ніж оксигемоглобін, і може приєднувати більше Н+. Унаслідок цього при зменшенні вмісту оксигемоглобіну підвищується ступінь дисоціації Н2СОз, а отже, збільшується транспорт СО2 кров’ю. Ця залежність називається ефектом Холдейна (мал. 186).
Взаємозв’язок обмінів двооксиду вуглецю і кисню яскраво ви
являється в тканинах і легенях. До тканин надходить оксигенова-
на кров. Тут під впливом СО2 посилюється дисоціація гемоглобіну. Тому надходження кисню в тканини сприяє прискоренню поглинання СО2 кров’ю.
У легенях відбуваються зворотні процеси. Надходження О2 знижує спорідненість крові до СО2 і полегшує дифузію СО2 в альвеоли. Це, в свою чергу, активізує асоціацію гемоглобіну з киснем.
ОБМІН ГАЗІВ У ТКАНИНАХ
На газообмін у тканинах впливають ті ж самі 5 факторів, що і на газообмін у легенях,— площа дифузії, градієнт напруги газів у крові і клітинах; відстань, яку проходить газ; коефіцієнт дифузії; стан мембран, через які проходять тази. Кількість О2, що надійшла до органа, може бути визначена на підставі об’єму кровообігу і вмісту О2 в приносній артерії і вені. АВРо2 і кровотік залежать від рівня метаболізму органа: що інтенсивніший обмін речовин, то більше використовується О2.
О2 використовується в мітохондріях клітин для реалізації процесу окислення. Тому найменше вільного О2 концентрується поряд
рО2
мирт ст.
Атмосферне поі/тря
ІчО-Ів.7
120
16.0
100 -~—
Альвеолярне поВітря і артеріально кров
Не/рункціонуючі з капіляри
У стані спокою
80 -10.7
60 8,0
40 -5.3-
20 2,7
О.
Венозно кров
~~| Міжклітинна
\рідина
_ Клітини
Ро9 = 100нн п„ _
Мал. 187. Зміни Ро2 на етапах дихання
Мал. 188. Дифузія 02 в тканинах
з мітохондріями. У нормі при найвищій активності окислювального процесу мінімальний Ро2 біля мітохондрій не повинен бути меншим від 1 мм рт. ст. Це критична напруга Ог в мітохондріях. При нижчому її показнику процес окислення стає неможливим. Р° біля мітохондрії становить 5—10 мм рт. ст. (0,7—1,3 кПа). У тканинній рідині біля капіляра Ро2 досягає ЗО—40 мм рт. ст. (4— 5,3 кПа), а у крові, яка надходить,— 100 мм рт. ст. Перепад Р ° від крові капіляра до мітохондрій забезпечує процес дифузії Ог за градієнтом концентрації. Природно, шо клітини, які прилягають до капіляра, забезпечуються киснем краще. Тому в клітині мітохондрії, які розташовані ближче' до мембрани, також отримують більше кисню. Весь шлях, що проходить кисень від атмосферного повітря до мітохондрій клітин, нагадує ряд каскадів (мал. 187).
При інтенсифікації споживання Ог рівень Ро2 біля мітохондрій стає набагато нижчим від 10 мм рт. ст., що й сприяє прискоренню дифузії. У свою чергу зниження РОг біля капіляра до рівня, що нижчий від 40 мм рт. ст. (5,3 кПа), різко стимулює дисоціацію «оксигемоглобіну. Та частина кисню артеріальної крові, що застосовується тканинами, називається коефіцієнтом утилізації кисню. У стані спокою він дорівнює близько 30%, а при інтенсивній праці підвищується до 60—70 % (мал. 188).
У протилежному напрямі від мітохондрій надходить утворений при окисленні СОг. Звичайно Рсо2 у тканинах перебуває на рівні близько 60 мм рт. ст. (8,0 кПа), а біля капіляра — близько 50 мм рт. ст. (6,7 кПа). Тому СОг надходить від мітохондрій до міжклітинної рідини, а звідти — до кровоносних капілярів і у кров.
РЕГУЛЯЦІЯ ДИХАННЯ
Зовнішнє дихання — одна із найважливіших функцій організму. Зупинка дихання зумовлює неминучу смерть вже через 3—5 хв. Кількість кисню в організмі незначна, тому важливо, щоб він постійно надходив через систему зовнішнього дихання. Цим пояснюється формування в процесі еволюції такого механізму регуляції, який би забезпечив високу надійність дихання. В основі регуляції дихання лежить підтримка константного рівня- таких показників організму, як Рсо„ Ро, і рН. Основним принципом регуляції є саморегуляція, при якій відхилення цих параметрів від нормального рівня негайно викликає ряд процесів, спрямованих на їх відновлення.
У системі регуляції дихання можна виділити внутрішні та зовнішні ланки саморегуляції. Внутрішні ланки зв’язані зі станом крові (буферні властивості, вміст гемоглобіну) та серцево-судинної системи, зовнішні — з механізмами зовнішнього дихання. Змінюваними параметрами системи регуляції зовнішнього дихання є глибина та частота дихальних рухів.
Основним регульованим об’єктом є дихальні м’язи, які належать до скелетних м’язів. Крім них, до об’єкту регуляції дихання повинні бути зараховані гладкі м’язи глотки, трахеї та бронхів, які впливають на стан дихальних шляхів. Транспорт газів кров’ю та газообмін у тканинах здійснює серцево-судинна система, про регуляцію функцій якої мова піде у відповідних розділах.
Дихання регулюється головним чином рефлекторним шляхом, який включає в себе 3 елементи: і) рецептори, що сприймають інформацію, та аферентні шляхи, які передають її нервовим центрам; 2) нервові центри; 3) ефектори — шляхи передачі команд від центрів та власне виконавчі елементи.
ДИХАЛЬНИЙ ЦЕНТР
У експериментах на тваринах за допомогою перерізування мозку на різних рівнях встановлено, що дихальний центр розташований у стовбурі головного мозку. Реєстрація електричної активності, подразнення відділів довгастого мозку засвідчили, що він складається з дорсального та вентрального ядер (мал. 189). Нейрони цих ядер контактують з ретикулярною формацією.
У дорсальному ядрі постійно виникають імпульси (інспіраторні розряди), які зумовлюють вдих. Отже, тут містяться інспіраторні нейрони. Ці імпульси виникають навіть після перерізування всіх аферентних нервів і мозку вище та нижче розташування дорсального ядра. Це свідчить про автоматизм інспіраторних нейронів.
У дорсальному ядрі розрізняють 2 основних типи і н с п і р а -
✓ X Мал. 189. Схема центру дихання у стовбурі мозку (за
І ¥ даними А. С. Сиуіоп, 1991):
’ т д 1 — дорсальне ядро; 2 — вентральне ядро; 3 — пневмотаксичний
і І центр; 4 — апнейстичний центр; 5 — IV шлуночок; 6 — язикоглот-
/ і / ковнй та блукаючий нерви; 7 — нервові волокна до спинного мозку
V М Ч
\ її ( торних нейронів: нейрони Іа збуджують-
ЛІД-'2 ся лише при вдиху, нейрони ір одержують ім-
ЛИ Г/ пульси від нейронів Іа та від рецепторів легень.
//ІІуТ/ Припускають існування нейронів, які гальмують
6 Ьсч збудження в Іа-нейронах. У дорсальному ядрі є
й інші нейрони, які послідовно збуджуються у відповідну фазу дихання, передаючи збудження один одному. Наприклад, одні інспіраторні нейрони збуджуються лише на початку вдиху, інші — наприкінці тощо. В умовах спокійного дихання залп імпульсів посилюється протягом 2 с і закінчується протягом наступних 3 с. Імпульси йдуть до центру діафрагмального нерва та центрів, що іннервують зовнішні міжреберні м’язи. Внаслідок цього об’єм легень збільшується.
Вентральне ядро малоактивне під час спокійного дихання. Воно починає функціонувати тоді, коли треба посилити вентиляцію легень (фізична робота, хвилювання тощо). У вентральному ядрі містяться як інспіраторні, так і експіраторні нейро-н и. Останні зумовлюють скорочення м’язів під час видиху, зокрема м’язів черевного преса.
У верхній частині варолієвого моста міститься пневмотаксичний центр, який лімітує тривалість вдиху, впливаючи таким чином на частоту дихання. Імпульси йдуть від нього до дорсального ядра і змінюють тривалість вдиху від 0,5 до 5 с. Змінюється звичайно й тривалість видиху. Частота дихання змінюється в діапазоні від кількох дихальних циклів протягом 1 хв до 40 і більше.
Деякі автори вважають, що в нижньому відділі варолієвого моста розташований ще один центр — апнейстичний. Досі не з’ясована його фізіологічна роль, але при деяких захворюваннях може виникнути апнейстичне дихання — сповільнений вдих, затримка дихання на висоті вдиху і посилений видих.
РЕЦЕПТОРИ
Рецептори, які беруть участь у рефлекторній регуляції дихання, є в легенях, судинах, головному мозку. За механізмом збудження вони є хеморецепторами і механорецепторами.
На вентральній поверхні довгастого мозку біля виходу IX та X пар черепних нервів на глибині 200—400 мкм розташовані центральні хеморецептори. Присутність їх можна пояснити необхідністю контролю за постачанням О2 мозку, оскільки
при недостачі кисню найшвидше гинуть клітини ЦНС. Провідним фактором подразнення цих рецепторів є концентрація Н+. Центральні хеморецептори омиваються міжклітинною рідиною, склад якої залежить від метаболізму нейронів і місцевого кровотоку. Крім цього, склад міжклітинної рідини багато в чому залежить від складу спинномозкової рідини.
Спинномозкова рідина (СМР) відокремлена від крові гемато-енцефалічним бар’єром. Структури, що його утворюють, слабопро-никні для Н+ та НСОГ. але добре пропускають нейтральний СО2. Внаслідок цього при підвищенні в крові вмісту СО2 він дифундує у СМР. Це призводить до утворення в ній нестійкої вугільної кислоти, продукти якої стимулюють хеморецептори. Потрібно враховувати, що у нормі рН СМР нижча, ніж рН крові,— 7,32. Крім цього, у зв’язку із зменшенням вмісту білків буферна ємкість СМР також нижча, ніж крові. Тому при підвищенні рівня Рсо2 в СМР рН змінюється швидше.
Центральні хеморецептори справляють великий вплив на дихальний центр. Вони стимулюють інспіраторні та експіраторні нейрони, посилюючи як вдих, так і видих. Тому, наприклад, при зниженні рН СМР лише на 0,01 вентиляція легень збільшується на 4 л/хв.
Периферичні хеморецептори містяться в каротид-них тільцях, які розташовані в ділянці біфуркації загальних сонних артерій, і в аортальних тільцях, які є на верхній та нижній поверхнях дуги аорти. Найбільше значення для регуляції дихання мають каротидні тільця, котрі контролюють газовий склад крові, яка надходить до мозку.
Унікальною особливістю рецепторних клітин каротидного синусу є висока чутливість до змін Ра °8. При цьому рецептори реагують на відхилення параметрів Рао, в дуже широких межах: від 100 до 20 мм рт. ст., і менше. Що нижчий Рао, в крові, яка омиває рецептори, то більша частота імпульсів, які йдуть від них по нервах Герінга. В основі рецепції лежить власне інтенсивне кровопостачання тільця — до 20 мл(хв-г). У зв’язку з тим що О2 в них використовується мало, градієнт АВРо, невеликий. Тому рецептори реагують на рівень Ро, артеріальної, а не венозної крові. Вважають, що механізм подразнення рецепторних клітин при недостачі О? пов’язаний з їх власним метаболізмом, де при найменшому зниженні рівня Ро2 з’являються недоокислені продукти обміну.
Імпульсація від каротидних рецепторів досягає нейронів довгастого мозку і затримує вдих, унаслідок чого поглиблюється дихання. Рефлекси, які призводять до зміни активності дихання, виникають при падінні Рао2 нижче 100 мм рт. ст. При цьому зміни дихання при подразненні каротидних хеморецепторів настають надзвичайно швидко. їх можна виявити навіть протягом одного дихального циклу при відносно незначних коливаннях концентра-
Мал. 190. Хвилинний об’єм дихання при диханні різними газовими сумішами: І—вплив СО2; II — вплив рН крові; III — вплив Од; 1 — у природних умовах; 2— при «постійному Ра£0е
III
РаС02=Р0мм рт.ст. (5,ЗкПоІ '/
90 10 50 ЗОммрт.ст.
дії газів у крові. Подразнюються ці рецептори також при зниженні рН або підвищенні Расо2. Гіпоксія і гіперкапнія взаємно підсилюють імпульсацію від цих рецепторів (мал. 190).
Менше значення для регуляції дихання мають аортальні хеморецептори, які відіграють помітнішу роль у регулюванні кровообігу.
Рецептори легень і повітроносних шляхів. Ці рецептори належать до механо- і хеморецепторів. У гладких м’язах повітроносних шляхів, починаючи від трахеї і закінчуючи бронхами, містяться рецептори розтягання легень. У кожній із легень є до 1000 рецепторів.
Виділяють кілька типів рецепторів, які реагують на розтягування легень. Близько половини рецепторів подразнюються тільки при глибокому вдисі. Це порогові рецептори. Низькопорогові рецептори подразнюються і при малому об’ємі легень, тобто під час як вдиху, так і видиху. Під час видиху частота імпульсації від цих рецепторів зростає.
Механізм подразнення рецепторів легень полягає в тому, що дрібні бронхи розтягуються за рахунок їх еластичності, яка залежить від ступеня розширення альвеол; що воно більше, то сильніше розтягнення структурно пов’язаних з ними повітроносних шляхів. Великі повітроносні шляхи структурно не зв’язані з легеневою тканиною і подразнюються внаслідок «негативності тиску» в плевральній щілині.
Рецептори розтягування належать до таких, які мало здатні до адаптації, і при тривалій затримці вдиху частота імпульсів від легенів зменшується повільно. Чутливість цих рецепторів не постійна. Наприклад, при бронхіальній астмі за рахунок спазму бронхіол збудливість рецепторів зростає. Тому рефлекс з’являється при меншому розтягненні легень. Склад повітря, яке міститься в леге
нях, також впливає на чутливість рецепторів. При збільшенні рівня СО2 в повітроносних шляхах імпульсація з рецепторів розтягнення зменшується.
Більшість аферентних імпульсів від рецепторів розтягнення легень спрямовується до дорсального ядра бульварного відділу дихального центру і активізує 10-нейрони. У свою чергу ці нейрони, гальмуючи активність Іа-нейронів, зупиняють вдих. Але такі реакції спостерігаються тільки при високій частоті імпульсів, яка досягається на висоті вдиху. При низькій частоті рецептори розтягнення, навпаки, продовжують вдих і скорочують видих. Гадають, що відносно рідкі розряди, які надходять під час видиху від рецепторів розтягнення, сприяють настанню вдиху.
У людини рефлекси, пов’язані з подразненням механорецепто-рів легень (рефлекси Герінга—Брейєра), великого значення не мають; вони лише запобігають надмірному розтягуванню легень при вдиханні понад 1,5 л повітря.
Іритантні рецептори розташовані в епітеліальному і субепітелі-альному шарах повітроносних шляхів. Особливо багато їх у ділянці коренів легень. Імпульси від цих рецепторів ідуть по мієлінових волокнах блукаючих нервів. Іритантні рецептори мають одночасно властивості механо- і хеморецепторів. Вони швидко адаптуються. Подразниками цих рецепторів є також їдкі гази, холодне повітря, пил, тютюновий дим, біологічно активні речовини, які утворюються в легенях (наприклад, гістамін).
Подразнення іритантних рецепторів супроводжується неприємним відчуттям — печінням, кашлем та ін. Імпульси з цих рецепторів, які надходять за рахунок більш раннього вдиху, скорочують видих. Певно, «зітхання» (в середньому 3 рази за 1 год), які виникають при спокійному диханні, також обумовлені рефлексами з іритантних рецепторів. До того як виникають «зітхання», порушується рівномірність вентиляції легенів. Це призводить до подразнення іритантних рецепторів і поглиблюється один із вдихів, унаслідок чого розширюються відділи легенів, які до цього спалися. Подразнення іритантних рецепторів через блукаючий нерв може призвести до скорочення гладких м’язів бронхів. Цей рефлекс лежить в> основі бронхоспазму при збудженні рецепторів гістаміном, який утворюється при бронхіальній астмі. Фізіологічне значення вказаного рефлексу полягає в тому, що при вдиханні токсичних речовин змінюється просвіт бронхів, знижуються вентиляція альвеол і газообмін між дихальними шляхами і альвеолами. Завдяки цьому в альвеоли і кров потрапляє менше токсичних речовин.
.І-рецептори, або юкстамедулярні рецептори, називаються так тому, що розташовані у стінках альвеол біля капілярів. Подразнюються вони при надходженні біологічно активних речовин у мале коло кровообігу, а також при збільшенні об’єму інтерстиці-альної рідини легеневої тканини. Імпульси від них ідуть у довгас
тий мозок по немієлінізованих волокнах блукаючого нерва. У нормі .І-рецептори перебувають у стані слабкого тонічного збудження. Посилення імпульсації призводить до частого поверхневого дихання. Роль цих рецепторів у регулюванні дихання невідома. Можливо, вони разом з іритантними рецепторами спричинюють задишку при набряканні легенів.
На регулювання дихання впливають імпульси ще від кількох типів рецепторів.
Рецептори плеври належать до механорецепторів. Вони відіграють певну роль у зміні характеру дихання при порушенні властивостей плеври. При цьому виникає відчуття болю, головним чином пов’язане з подразненням парієтального листка плеври.
Рецептори верхніх дихальних шляхів реагують на механічні і хімічні подразники. Вони подібні до іритантних рецепторів. їх подразнення зумовлює чхання, кашель та звуження бронхів.
Рецептори дихальних м’язів. М’язові веретена дихальних м’язів (міжреберних м’язів та м’язів стінки живота) збуджуються як при розтягуванні м’яза, так і за принципом гема-петлі. Рефлекторні дуги з цих рецепторів замикаються на рівні відповідних сегментів «спинного мозку. Фізіологічне значення цих рефлексів полягає в тому, що при утрудненні дихальних рухів автоматично посилюється сила скорочення м’язів. Опір диханню збільшується, наприклад, при зменшенні еластичності легенів, бронхоспазмі, набряку слизової оболонки, зовнішньому опору розширенню грудної клітки. У звичайних умовах пропріорецептори дихальних м’язів значної ролі не відіграють. Але їх вплив легко виявити при інтенсивному «стисканні грудної клітки, при якому вони включають вдих. У діафрагмі міститься дуже мало рецепторів (10—ЗО), і вони не відіграють істотної ролі в регулюванні дихання.
Рецептори суглобів та «недихальних» скелетних м’язів грають •певну роль у підтримці рефлекторної задишки при виконанні фізичної праці. Імпульси від них досягають бульварного центра дихання.
Подразнення больових і температурних рецепторів може рефлекторно впливати на характер дихання. Частіше спостерігається початкова затримка дихання з наступною задишкою. Гіпервенти-ляція може виникнути і при подразненні температурних рецепторів шкіри. Внаслідок цього зростає частота дихання при зменшенні його глибини. Це сприяє збільшенню вентиляції легеневого простору та виділенню надлишку тепла.
МЕХАНІЗМ ПЕРІОДИЧНОЇ АКТИВНОСТІ
ДИХАЛЬНОГО ЦЕНТРА
Головною особливістю дихального центра є періодичність, при якій збудження нейронів змінюється їх гальмуванням. В основі періодичності лежить функція бульбарного відділу. При цьому вирішальна роль належить нейронам дорсального ядра. Вважають, що вони є своєрідним «водієм ритму».
До бульбарного центра надходить збудження від багатьох утворень ЦНС, у тому числі від пневмотаксичного центру. Так, якщо перерізати стовбур мозку, відділивши варолієв міст від довгастого мозку, то у тварин знижується частота дихальних рухів. При цьому обидві складові — і вдих і видих — стають тривалішими. Пневмотаксичний та бульбарний центри мають двобічні зв’язки, за допомогою яких пневмотаксичний центр прискорює виникнення наступних інспірацій та експірацій.
На активність нейронів дихального центра впливають інші відділи ЦНС, такі, як ретикулярна формація, гіпоталамус, кора великих півкуль. Наприклад, характер дихання змінюється при емоціях. Скелетні м’язи, які беруть участь у диханні, часто виконують й інші рухи. Та й власне дихання, його глибину і частоту людина може, змінювати свідомо, що свідчить про вплив на дихальний центр кори великих півкуль. Завдяки цим зв’язкам дихання узгоджується з виконанням робочих рухів, мовною функцією людини.
У такий спосіб інспіраторні нейрони, як «водії ритму», істотно відрізняються від справжніх пейсмекерних клітин. При виникненні ритміки основних дихальних нейронів дорсального ядра треба враховувати дві умови: а) «послідовність вступу» кожної групи нейронів саме цього відділу; б) обов’язкову імпульсацію від інших відділів ЦНС та імпульсацію від різноманітних рецепторів. Тому при повному відокремленні бульбарного відділу дихального центра в ньому можна зареєструвати лише спалахи активності з частотою, яка значно менша, ніж у звичайних умовах цілого організму.
Дихання є вегетативною функцією, а виконується скелетними м’язами. Тому механізми його регуляції мають спільні риси з механізмами регулювання діяльності як вегетативних органів, так і скелетних м’язів. Потреба в постійному диханні забезпечується автоматично за рахунок активності дихального центра. Проте внаслідок того, що дихання здійснюють скелетні м’язи, можливі й довільні зміни характеру дихання, зумовлені впливом кори великих півкуль на дихальний центр (мал. 191).
Якщо у внутрішніх органах (серце, кишки) автоматизм обумовлений лише властивостями водіїв ритму, то в дихальному центрі періодична діяльність керується дещо складнішими механізмами. Періодичність обумовлена: 1) узгодженою активністю різних
С02 (рН) НОРМАЛІЗАЦІЯ
НОРМАЛІЗАЦІЯ ДИХАННЯ
НОРМАЛІЗАЦІЯ ДИХАННЯ
ВИДИХ
Сб-8
РЕГУЛЯТОРНИЙ ЦИКЛ СО2І(рН)|
ДИХАННЯ I
РЕГУЛЯТОРНИЙ цикл 02 | дихання!
♦
Ог НОРМАЛІЗАЦІЯ
РН+С02
ВСМР
рн + сог
В КРОВ
02 + С02
В КРОВІ
АОРТА.
ХЕМОРЕ-
ЦЕП-
ТОРИ
ШК РИ
РОЗТЯГУ-
ВАННЯ
ЛЕГЕНЬ
КОВТАННЯ ЧХАННЯ
КАШЕЛЬ
КОРА ВЕЛИКОГО МОЗКУ
ТЕМПЕРА-
ТУРА КРОВІ
М’ЯЗОВІ РЕЦЕПТОРИ
ПРЕСО-РЕЦЕПТОРИ
СТЕРОЇДИ АДРЕНАЛІН
ХОЛОДОВІ
РЕЦЕПТОРИ
вдих
РЕЦЕПТОРИ
Мал. 191. Механізми регуляції дихання (за даними А. Оезророиіоз. 81. БіІЬег-па£І, 1986). Пояснення у тексті
відділів дихального центра; 2) надходженням сюди імпульсів від рецепторів; 3) надходженням сигналів від інших відділів ЦНС, у тому числі і від кори головного мозку. Крім того, при аналізі механізму періодичності дихання потрібно врахувати, що спокійне і форсоване дихання суттєво відрізняються за кількістю м’язів, які беруть участь у цьому акті. Багато в чому ця різниця визначається рівнем залучення вентрального відділу бульбарного дихального центра, в якому є як інспіраторні, так і експіраторні нейрони. При спокійному диханні ці нейрони відносно малоактивні, а при глибокому диханні їх роль різко зростає.
ОСОБЛИВОСТІ РЕГУЛЯЦІЇ ДИХАННЯ В СТАНІ СПОКОЮ І В УМОВАХ
ФОРСОВАНОГО ДИХАННЯ
Регулювання дихання в стані спокою. В спокійному стані активність дихального центра спрямована на збудження мотонейро-нів інспіраторних м’язів (діафрагми і меншою мірою міжреберних), які виконують спокійний вдих. Припинення їх збудження призводить до пасивного видиху. Це завдання виконують нейрони дорсального ядра. Збудження в ньому розпочинається із активізації Іа-нейронів. Механізм активізації не з’ясований. У міру поглиблення вдиху зростає частота імпульсації і збільшується кількість активних нейронів. Вони збуджують мотонейрони діафрагми прямим шляхом і опосередковано, через інспіраторні нейрони вентрального ядра, мотонейрони міжреберних м’язів. Одночасно імпульси надходять також і до 10-нейронів цього ж ядра. У процесі розвитку інспірації все більша кількість 10-нейронів втягується в процес збудження. Зрештою досягається пороговий рівень і гальмування Іа-нейронів. Унаслідок цього вдих обривається, а після нього настає наступний видих.
Особливості регуляції глибокого дихання. При форсованому диханні вдих і видих чергуються при більш активній участі пнев-мотаксичного центру і інших відділів ЦНС. Зростає також значення аферентних імпульсів, які надходять від різних механо- і хеморецепторів. Результатом посиленої аферентації є активне підключення впливів вентрального ядра з його інспіраторними та експіраторними нейронами. При цьому під час вдиху інтенсивніше збуджуються інспіраторні нейрони вентрального ядра, що забезпечує підключення допоміжних м’язів для посилення вдиху.
При форсованому диханні видих також розпочинається з виключення Іа-нейронів. їх гальмування призводить до припинення збуджувального впливу на інспіраторні нейрони вентрального ядра. Одночасно закінчується гальмування інспіраторними нейронами вентрального ядра розташованих тут експіраторних нейронів. Останні безперешкодно збуджуються і посилають імпульси в спин
ний мозок до мотонейронів м’язів, які беруть участь у видиху. Такий видих є активним.
В умовах форсованого дихання, крім забезпечення організму О2, виникає потреба в підтримці гомеостатичних параметрів та КОС крові, тому що при задишці активно виводиться СО2. Більшого значення набувають імпульси від різних хеморецепторів. Вони стають головними регуляторами активності дихальних нейронів, точно дозуючи інтенсивність дихання відповідно до конкретних потреб організму.
Крім того, при форсованому диханні, як правило, виникає усвідомлення задишки. Головним джерелом імпульсів, які зумовлюють відчуття задишки, є вплив пропріорецепторів міжреберних м’язів. Імпульси від них надходять у дихальний центр з лімбічної системи, що і є основою зародження негативних емоцій, які супроводжують відчуття задишки.
Безпосереднє усвідомлення задишки зумовлене надходженням аферентації до великих півкуль.
Глибоке дихання обов’язково спричинює зміни й інших етапів процесу дихання. Зростають дифузія газів у легенях за рахунок збільшення активної дихальної поверхні і градієнт тиску газів.
З цим пов’язані розкриття резервних капілярів, зменшення руху крові по артеріовенозних шунтах легень, прискорення швидкості кровотоку. Зростає також транспорт газів кров’ю, підвищується дифузія газів у органах, які активно функціонують.
Дуже важливий взаємозв’язок між регуляцією функцій систем дихання та кровообігу, центри яких розташовані поруч — у довгастому мозку.
Регуляція гладких м’язів бронхіол. Для ефективної альвеолярної вентиляції важливо, щоб повітря вільно проходило дихальними шляхами. Гладкі м’язи бронхіол іннервуються волокнами вегетативної нервової системи. Прямий вплив симпатичної системи незначний, зате катехоламіни, що містяться в крові, особливо адреналін, діючи на р-адренорецептори, зумовлюють розслаблення цих м’язів.
Ацетилхолін, що виділяється волокнами блукаючого нерва, звужує бронхіоли. Тому введення атропіну сульфату може спричинити розширення бронхіол. За участю парасимпатичних нервів реалізується ряд рефлексів, які починаються у дихальних шляхах у разі подразнення їх рецепторів димом, отруйними газами, інфекцією тощо. Деякі речовини, що зумовлюють алергічні реакції, також можуть звужувати бронхіоли.
ОСОБЛИВОСТІ РЕГУЛЯЦІЇ ДИХАННЯ
У ЗМІНЕНИХ УМОВАХ
Найважливішим регулятором вдихів і видихів при форсованому диханні є рефлекси з центральних і каротидних хеморецепторів. У цьому можна переконатися, затримавши дихання, або, навпаки, проводячи гіпервентиляцію легень. Так, після довільної гіпервен-тиляції, що призводить до прискорення виведення СОг і зменшення Расо,, збудливість дихального центру на деякий час слабшає і дихати «не хочеться». Затримка виведення СОг із крові, навпаки, зумовлює гіпервентиляцію.
Кількісну залежність легеневої вентиляції від рівня Расо, можна виявити у дослідах із застосуванням дихання спеціальними газовими сумішами. Наприклад, якщо дихати газовою сумішшю, що містить 7 % СО2 і 93 % Ог, підтримуючи високий Расо,, можна порушити умови виведення СО2. (Нагадаємо, що у нормі у альвеолярному повітрі концентрація СО2 становить 5,3%). При підвищенні Расо, на кожні 1 мм рт. ст. вентиляція збільшується на 2—3 л/хв. Але збільшення парціального тиску СО2 стимулює дихання лише до певної міри. Коли СО2 в атмосферному повітрі стає більше 7 %, функція дихального центру порушується.
Чутливість дихального центру до СО2 не постійна. Вентиляторна реакція на збільшення Расо, ослаблюється під час сну, а також у людей похилого віку. Після тривалих тренувань у спортсменів, які пірнають у воду, чутливість до СО2 знижується, внаслідок чого вони можуть тривалий час перебувати під водою. Знижують чутливість дихального центру і багато лікарських препаратів, наприклад, морфій, барбітурати.
Вплив зменшення Рао, на дихання можна досліджувати під час дихання газовими сумішами із зниженим вмістом О2. При диханні сумішшю, що містить меншу концентрацію О2 при нормальному рівні СО2 (близько 36 мм рт. ст., або 4,8 кПа), можна визначити реакцію дихання на гіпоксію. Чутливість до зниженого Рао, нижча, ніж до збільшення Расо,: істотне зростання вентиляції розпочинається тоді, коли Рао, стає нижчим від 50 мм рт. ст. (6,65 кПа).
Якщо на фоні низького вмісту кисню у газову суміш додати СО2 в концентрації, що забезпечує затримку його в організмі, то гіпервентиляція різко збільшується. У цій ситуації спостерігається ефект нелінійного синергізму дії двох стимуляторів, коли сумарний ефект більший, ніж при простому додаванні впливу кожного із них. З таким поєднаним впливом доводиться зустрічатися у тих випадках, коли у хворого утруднені надходження О2 і виділення СО2 (наприклад, при тяжкій пневмонії).
При підйомі в гори у зв’язку з падінням барометричного тиску гіпоксія розвивається на тлі відсутності затримки у організмі СО2.
Так, на висоті 5000 м Ро, складає лише 70 мм рт. ст., а на вершині Джомолунгми (близько 9000 м) — 47 мм рт. ст. Зниження парціального тиску кисню у видихуваному повітрі спричиняє ще більше падіння його в альвеолярній крові. Найважливішою компенсаторною реакцією на гіпоксію є гіпервентиляція. В основі її виникнення на початку дії гіпоксії лежить сумарне подразнення каротидних хеморецепторів низьким рівнем Ро. і продуктами, що надходять із тканин. Недостатня оксигенація тканин розвивається в основному при падінні Рао. нижче від 60 мм рт. ст. (8,0 кПа), коли різко зменшується кількість оксигемоглобіну в артеріальній крові. Але при форсованому диханні поряд зі збільшенням надходження кисню в альвеоли інтенсифікується виведення вуглекислого газу. Падіння Расо, призводить до зменшення в крові рівня одного із основних подразників центральних хеморецепторів. Тому після початкової значної гіпервентиляції згодом задишка тримається на рівні, який оптимальний для надходження максимально можливої кількості О2 і збереження СОг в крові.
При тривалому перебуванні в горах у організмі розвиваються адаптивні процеси у всіх ланках системи транспорту газів, завдяки чому зменшується напруженість функціонування системи дихання. Так, за рахунок підвищення концентрації еритроцитів і спорідненості гемоглобіну до О2 (в еритроцитах зростає рівень 2,3-ДФГ) збільшується КЄК. Відповідним чином перебудовується і функція серцево-судинної системи в плані збільшення функціональних резервів і цієї ланки системи транспорту газів. Звичайно, в природних умовах існування людини спостерігається лише недостатнє надходження кисню, що зумовлює гіпоксію. Однак штучно можна створити умови для його підвищеного надходження і гіпероксії. Такою умовою є дихання чистим киснем під звичайним або підвищеним тиском.
Дихання чистим киснем різко збільшує напругу кисню у альвеолярному повітрі, а отже, і в артеріальній крові. Оскільки у звичайних умовах практично весь гемоглобін еритроцитів уже насичений киснем, то зростання Рао. призведе лише до збільшення кількості розчиненого в плазмі кисню. Якщо в нормі у розчиненому стані міститься 0,3 мл О2 у 100 мл крові, то в умовах тиску 1 атм розчиняється вже 2,04 мл, 2 атм — 4,34 мл, 3 атм — 6,65 мл О2. Гіпербарія, крім збільшення КЄК, створює можливість для підвищення постачання тканин киснем за рахунок росту градієнта Ро, між кров’ю і тканинами. Особливо важливо скористатися підвищенням вмісту розчиненого в плазмі О2, коли у хворого порушений основний механізм транспорту його — гемоглобіновий. При підвищенні тиску до 2—3 атм одного лише розчиненого кисню цілком досить, щоб забезпечити тканини людини, котра перебуває в стані спокою.
Збільшення Ро, може призвести до зниження вентиляції ле
гень. Але це спостерігається лише при короткочасному перебуванні в умовах гіпербарії. При тривалому впливі реакція системи дихання може бути і протилежною. Річ у тім, що зростання Ро\ для мешканців Землі є неприродним. З таким рівнем Ро, живі істоти в процесі еволюції не стикались. І незабаром почне проявлятися токсична дія кисню на тканини. Одним з цих проявів буде утворення в клітинах великої кількості активних сполук кисню (синглетного кисню, гідропероксиду). При цьому спостерігатиметься стимулювання перекисного окислення ліпідів, що передусім призведе до порушення функцій клітинних мембран або викличе набряк тканин і інші зміни. При диханні в умовах гіпербарії в першу чергу страждають ЦНС, легені, система кровообігу. В різних людей вказані зміни розвиваються в різний час і вираженість їх неоднакова. Приблизно через добу в переважної більшості здорових людей при диханні чистим киснем виникають неприємні відчуття за грудиною. Може розвиватися ателектаз (спадіння частини альвеол) або набряк легенів, мозку. Ще помітніші зміни можуть відбутися при диханні чистим киснем під тиском, який перевищує атмосферний. Набряк мозку, легенів, судоми — ось перші наслідки тривалої гіпербарії у 2—3 атм або навіть короткочасної дії надто високого (понад 4 атм) тиску. Тому при дії отрут, що спричиняють блокування гемоглобіну, з терапевтичними цілями можна застосовувати барокамеру лише протягом лічених годин і при тиску, що не перевищує 3 атм.
Під високим тиском повітря працюють і водолази. При зануренні у воду тиск збільшується на 1 атм, на кожні 10 м глибини. Водолаз змушений більше енергії витрачати на виконання власне дихальних рухів, оскільки повітря стає густішим. Навпаки, при розрідженні повітря, як це буває під час спливання, особливо швидкого, може відбутися розрив легень. Крім того, під час швидкого підйому розвивається декомпресійна хвороба.' Механізм її обумовлений наявністю в тканинах і крові інертного газу азоту. N2 розчиняється у рідинах погано і повільно, однак під час перебування під водою (для дихання повітря подається під тиском) у жировій тканині його може накопичуватися багато. Вихід N2 з тканин під час спливання відбувається повільно і потрібен час, щоб його надлишок був виведений з крові через легені. Тому при надто швидкому підйомі в крові утворюються бульбашки азоту, які закупорюють дрібні судини і порушують циркуляцію крові. У тяжких випадках це може призвести навіть до смерті.
М’язова праця є найчастішим природним навантаженням, що пред’являє підвищені вимоги до системи дихання. Різке збільшення використання Ог для забезпечення енергією м’язів призводить до активізації всіх ланок ланцюга транспорту О2. Природність і повторюваність м’язової праці в процесі філо- і онтогенезу призвели до формування рефлекторних взаємозв’язків між м’язами,
що скорочуються, і дихальним центром. Тому задишка може розвиватися заздалегідь, ще перед виконанням праці, тобто умовнорефлекторно. Інтенсифікація дихання відбувається у зв’язку з включенням кількох механізмів регулювання. Збудження, що зародилося у моторних центрах ЦНС, спускаючись по пірамідному тракту, по колатералях, активізує нейрони дихального центру стовбура головного мозку. Це збудження підтримується також аферентними імпульсами, що йдуть від рецепторів м’язів, які скорочуються, та суглобів. Однак при виконанні м’язової праці точність гіпервентиляції, відповідність її конкретним умовам адекватного постачання газами крові забезпечуються хеморецепторами, що контролюють Рао,, Расо, і рН крові.
ВІКОВІ ОСОБЛИВОСТІ ГАЗООБМІНУ
Газообмін плода відбувається через плаценту. Материнська кров з маткових артерій надходить у міжворсинчасті лакуни. У свою чергу, кров плода, що підходить до плаценти пупковими артеріями, досягає міжворсинчастого простору, де широко розгалужуються капілярні петлі. Товщина бар’єра, що відокремлює кров матері від крові плода, становить близько 3,5 мкм. Він складається із 3 шарів клітин. У материнській крові Ро, відносно невисокий (це змішана кров), і тому у крові, що надходить до плода по пупковій вені, Ро, складає близько 60 мм рт. ст. (8 кПа). Однак низький Ро, в крові плода компенсується за рахунок підвищеної спорідненості фетального гемоглобіну (НЬР) до кисню
м/іОгім пробі
Р^, ммрт.ст.
Мал. 192. Вміст НЬО2 у крові матері та плода під час народження. Під час плацентарного газообміну вміст О2 знижується від а до Ь, а у плода зростає від с до 4.
(мал. 192). Це, поряд з високим рівнем еритроцитів, забезпечує досить високу кисневу ємкість крові (до 16—17 мл/л). Крім того, завдяки особливостям кровообігу плода, до таких найважливіших органів, як головний мозок і серце, надходить відносно високо оксигенована кров. У інших органах плода у зв’язку з низьким рівнем оксигенації АТФ утворюється не тільки за рахунок окислення, але й анаеробним шляхом. Тому тканини плода стійкіші до гіпоксії.
Пертий вдих. Дихальні рухи незначної амплітуди спостерігаються ще у внутрішньоутробно-му періоді. Під час пологів пла-
центарний газообмін порушується, що призводить до виникнення гіпоксії і гіперкапнії. Одночасно різко підвищується чутливість хеморецепторів, що шляхом сумарного впливу гіпоксії і гіперкапнії забезпечує посилення дихальних рухів. Легені плода заповнені приблизно на 40 % ЗЄЛ рідиною, яка секретується альвеолярними клітинами. Під час проходження через родові шляхи частина рідини вичавлюється. Рідина, що лишилася в дихальних шляхах, утруднює здійснення перших вдихів, оскільки при цьому треба перебороти значної сили поверхневий натяг. Вирішальним моментом є перев’язування пуповини в той час, коли починає підвищуватись напруга СО2 в крові новонародженого. Коли РСО2 досягає критичної величини, через центральні хеморецептори збуджуються інспіраторні нейрони і відбувається перший вдих. Під час вдиху внутрішньоплевральний тиск новонародженого може знижуватись на ЗО мм рт. ст. Спочатку легені новонародженого розправлені нерівномірно. Проте поступове всмоктування рідини, що залишилася, і біосинтез сурфактанту сприяють стабілізації альвеол. Вентиляція легенів стає рівномірною лише через кілька діб.
Дихальні м’язи у немовляти функціонують дещо інакше, ніж у дорослих. Так, через піддатливість грудної стінки скорочення діафрагми може спричинити парадоксальне втягнення міжреберних проміжків; у дітей, особливо недоношених, під час сну, коли тонус міжреберних м’язів знижується, можуть порушуватися дихання і навіть виникати параліч його.
Помітні зміни відбуваються в системі дихання в період старіння: знижується життєва ємкість легень, особливо у чоловіків, збільшується анатомічний та фізіологічний' мертві простори, частішає дихання, зменшуються еластичність легень, кількість капілярів у стінках альвеол. Унаслідок цього значно знижується дифузія газів у легенях, особливо під час фізичної праці. Зменшується максимальне поглинання кисню. Альвеолоартеріальна різниця за О2 збільшується, знижується напруга кисню в артеріальній крові, але Рсо, істотно не змінюється.
У віці понад 65 років значно зменшується здатність реагувати гіпервентиляцією на гіпоксію, меншою мірою зменшується реакція на гіперкапнію.
Гірська хвороба розвивається у літніх та старих людей вже на висоті І км над рівнем моря, у молодих — 2 км, а інколи — навіть 4 км.
Обмін енергії і терморегуляція
ОБМІН ЕНЕРГІЇ
Усі процеси життєдіяльності клітин здійснюються з використанням енергії. Вона витрачається на створення цілісності клітинних структур, підтримку іонних градієнтів, біосинтетичних процесів, забезпечення специфічних форм клітинної активності (скорочення, проведення нервового імпульсу, секрецію) тощо. У процесі творення енергоємких макроергів частина енергії відразу виділяється у вигляді тепла — це первинне тепло. Після використання АТФ частина енергії трансформується у тепло, що зветься вторинним. Уся енергія, яку виробляє організм за одиницю часу, є сумою енергії, потрібної для виконання праці, енергії, витраченої на теплотворення, -і запасів енергії. Виходячи з цього, можна визначити ККД клітин:
Ккд___ зовнішня робота _ ЮО %
вироблена енергія
Наприклад, ККД ізольованого м’яза може досягти 35 %, хоча в природних умовах при м’язовій праці ця величина рідко перевищує 25 %.
Теоретично для будь-якої клітини можна виділити три метаболічні рівні — активності, готовності та підтримання цілості. Р і -вень активності — інтенсивність процесів обміну при виконанні специфічної функції клітини (секреція клітин, скорочення м’яза тощо). Рівень готовності — метаболічний рівень, який неактивна у даний момент клітина повинна підтримувати, щоб у будь-який момент бути готового почати функціонувати. Рівень підтримання цілості — це мінімум, якого досить для збереження клітинної структури. Для цього треба зберегти в клітині не менше як 15 % енергії рівня активності. При меншому рівні енергії вона загине. Так, якщо при інтенсивній фізичній праці макроергів буде витрачу-о більше, ніж цей критичний рівень, то організм може не віднови.ися і загинути (один із наслідків використання допінгу, що затримує появу втоми).
Витрачені енергетичні ресурси організм має постійно відновлювати за рахунок їжі,-Білки, жири, вуглеводи та інші сполуки, які надходять з їжою, використовуються для відновлення структур організму, поповнення енергетичних витрат. Зниження інтенсивності цих процесів або їх припинення призводить до загибелі цих структур. Передусім організм страждає від порушення енергетичного обміну. Це треба враховувати при порушенні процесів обміну, отруєннях, утрудненні доставки кисню. Тривалість зберігання життєдіяльності при порушенні доставки енергії в різних органах залежить від особливостей утворення в них енергії, відносного рівня
метаболізму та філогенетичної зрілості структур. Так, при повній ішемії головного мозку, в якому енергія утворюється переважно за рахунок аеробних процесів, приблизно через 10 с настає непритомність, а через 3—8 хв у клітинах кори виникають необоротні зміни. В інших органах ці зміни виникають пізніше: у серці, нирках — через ЗО—40 хв, у скелетних м’язах — через 1—2 год.
Енергетична цінність вуглеводів, білків та жирів різна. При окисленні вуглеводів виділяється 17,16 кДж/г (4,1 ккал/г), при окисленні білків —17,17 кДж/г (4,1 ккал/г) енергії. Але при згоранні білків до кінцевих продуктів ця величина перевищує 22,61 кДж/г (5,6 ккал/г). Максимальну енергетичну цінність мають жири — 38,94 кДж/г (9,3 ккал/г).
ОСНОВНИЙ ОБМІН
У організмі інтенсивність процесів обміну в різних умовах існування в багатьох органах перебуває на рівні, який відрізняється від стану готовності. Так, у дихальних м’язах, серці, печінці, нирках, ЦНС, ендокринних залозах процеси обміну завжди повинні перевищувати рівень, який потрібний для самопідтримання їх структур. Ці органи виконують роботу навіть в умовах абсолютного спокою, оскільки від їх функцій залежить життєздатність організму. Тому вказані органи постійно перебувають у активному стані. Інші органи (скелетні м’язи, органи травлення) протягом більш чи менш тривалого часу можуть бути у стані готовності без особливої шкоди для організму. Сумарна інтенсивність процесів обміну, визначена в умовах спокою, характеризує так званий основний обмін.
Для визначення рівня основного обміну треба дотримувати таких умов: дослідження проводити вранці натщесерце у стані фізичного та психічного спокою, в положенні лежачи, в умовах температурного комфорту (25—26°С). При цьому враховуються ті основні фактори, які можуть впливати на інтенсивність процесів обміну.
Навіть при суворому дотриманні умов визначення основного обміну показники його відрізняються у різних людей. Насамперед це зумовлено різницею щодо віку, зросту, маси тіла, статі, а також активності механізмів регулювання обміну речовин. За основу може бути взята величина, що дорівнює 1 ккал/(кг-год), або 42 кДж/(кг-год).
Близько 50 % основного обміну припадає на енергоспоживання печінкою та скелетними м’язами. Під час сну при мінімальному тонусі скелетних м’язів обмін речовин стає нижчим від рівня основного обміну. При голодуванні, коли функціональна активність печінки знижена, основний обмін також зменшується.
Інтенсивність основного обміну протягом доби коливається? уранці він поступово підвищується, а у нічний час знижується.
У зв’язку з різною масою тіла краще визначити питому величину основного обміну на І кг маси тіла. Було зазначено, що не тільки люди, але й тварини перебувають значно ближче один до одного за енерготворенням у перерахунку не на одиницю маси тіла, а на одиницю його поверхні. Запропоновано правило, згідно з яким рівень процесів обміну пропорційний поверхні тіла, тобто тій його частині, на якій відбувається тепловіддача.
При деяких захворюваннях, особливо зумовлених порушенням функції щитовидної залози, рівень основного обміну змінюється. При гіперфункції він підвищується, а при гіпофункції — знижується.
ЗАГАЛЬНИЙ ОБМІН
При фізичній і розумовій праці, після їди, при зміні пози тіла, емоціях процеси обміну стають інтенсивнішими. Рівень обміну в звичайних умовах називається загальним обміном. Його приріст залежить від інтенсивності скорочення м’язів. Має значення і розумова активність; якщо вона супроводжується емоціями, то обмін активізується значною мірою. Це пояснюється активізацією процесів творення ряду гормонів, які посилюють процеси обміну.
Специфічно-динамічний вплив їжі. Підвищення обміну спостерігається протягом багатьох годин після їди (до 10—12 год). У даному випадку енергія витрачається не тільки на сам процес травлення (секреція, моторика, всмоктування). Проявляється так звана специфічно-динамічна дія їжі. Вона значною мірою обумовлюється активізацією процесів обміну продуктами травлення. Особливо цей вплив виражений при надходженні білків. Вже через 1 год і протягом наступних 3—12 год (тривалість залежить від кількості прийнятої їжі) при надходженні білків активність процесів енерготворення зростає до ЗО % від рівня загального обміну. При надходженні вуглеводів та жирів цей приріст становить не більше 15 %.
Вплив температури. Інтенсивність процесів обміну збільшується при відхиленнях температури навколишнього середовища від комфортного рівня. Найбільше це проявляється при зниженні температури, оскільки для збереження постійної температури тіла енергія інших видів переходить у теплову.
Обмін енергії при трудовій діяльності. Найбільший приріст енерговитрат обумовлюється скороченням скелетних м’язів. Тому рівень процесів обміну в першу чергу залежить від фізичної активності людини. Доросле населення за рівнем загального обміну може бути поділено на п’ять груп:
1-ша — ті, що зайняті переважно розумовою працею;
Таблиця 17. Потреби в енергії дорослого працездатного населення в різною інтенсивністю праці залежно від віку та статі
Група Вік, роки Потреби в енергії
Чоловіки ЖІНКИ
кДж ккал кДж | ккал
1 18—29 11 715 2800 11 142 2400
30—39 11 297 2700 9623 2300
40—59 10 669 2500 9205 2200
2 18—29 12 552 3000 16 669 2550
30—39 12133 2900 10 950 2450
40—59 11506 2750 9832 2350
3 18—29 13 388 3200 11 296 2700
30—39 12 970 3100 10 878 2600
40—59 12 342 2950 10 460 2500
4 18—29 15 480 3700 13 179 4150
30—39 15 962 3600 12 761 3050
40—59 14 434 3450 12133 2900
5 18—29 17 991 4300 —- —
30—39 16154 4100 —— —.
40—59 16 317 3900 — —
Примітка: 1) потреба жінки при вагітності строком 5—6 міс в середньому становить 12 133 кДж (2900 ккал); 2) потреба матерів, що годують дітей груддю, в середньому складає 13388 кДж (3200 ккал).
2-га — зайняті легкою фізичною працею;
3-тя — ті, хто виконує середньої важкості фізичну роботу;
4-та — зайняті важкою фізичною працею;
5-та — зайняті дуже важкою фізичною працею.
В основу класифікації покладено інтенсивність фізичної праці, ступінь нервового напруження, що виникає при виконанні трудових процесів, окремих його операцій, та ін. У міру запровадження та поширення нових видів і форм трудової діяльності, пов’язаних з технічним прогресом, класифікація повинна переглядатись, уточнюватись і доповнюватись.
У зв’язку з менш інтенсивною динамікою процесів обміну, меншою м’язовою масою потреба організму жінок у енергії приблизно на 15 % нижча, ніж у чоловіків. Потреба в енергії підвищується у людей, праця яких супроводжується не тільки фізичним, але й нервово-психічним навантаженням. Причому у сучасних умовах значення останнього фактору підвищується. При встановленні потреби в енергії дорослого працездатного населення визнано доцільним усі розрахунки проводити для трьох вікових категорій: 18—29 років, ЗО—39 років, 40—59 років. Підставою для цього є деякі вікові особливості обміну речовин. Так, у віці 18—19 років ще продовжуються процеси росту і фізичного розвитку. Починаючи з 40 років, а особливо після 50, процеси катаболізму починають домінувати над процесами анаболізму. При розробці критеріїв по
треби в енергії для населення віком від 18 до 60 років враховується умовно прийнята ідеальна маса тіла: у чоловіків вона становить 70 кг, у жінок —60 кг. Потреба в енергії може розраховуватись на 1 кг ідеальної маси тіла у чоловіків і жінок практично однаково і складає для першої групи 167,4 кДж (40 ккал), для другої— 179,9 кДж (43 ккал), для.третьої — 192,5 кДж (46 ккал), для четвертої — 221,7 кДж (53 ккал), для п’ятої — 255,2 кДж (61 ккал). У табл. 17 наведено основні величини добової потреби в енергії для дорослого працездатного населення залежно від віку, статі й інтенсивності праці.
РЕГУЛЯЦІЯ ОБМІНУ ЕНЕРГІЇ
На рівні окремих клітин і цілих органів діють місцеві механізми регулювання процесу енерготворення. Так, при виконанні м’язової роботи на початку скорочення м’яза запускаються процеси ресинтезу використаної АТФ (див. розділ «Фізіологія скелетних м’язів»).
Регуляція процесів енерготворення загалом у організмі здійснюється головним чином за рахунок ендокринної та вегетативної нервової системи. Основними регуляторами є гормони щитовидної залози — тироксин і трийодтиронін, а також адреналін, які стимулюють ці процеси. Причому ці гормони впливають і на перерозподіл речовин, що використовуються для утворення енергії. Так, при фізичному навантаженні з печінки, жирових депо в кров надходять глюкоза, жирні кислоти, які використовуються м’язами.
Особлива роль у регуляції належить гіпоталамусу, через який реалізуються нервово-рефлекторні і ендокринні механізми. Можна виявити також умовнорефлекторне збільшення рівня енерготворення. Так, у спортсмена перед стартом, у робітника перед виконанням завдання активізуються процеси обміну. Під дією гіпнозу, навіювання, при виконанні важкої м’язової праці підвищується інтенсивність обміну речовин.
МЕТОДИ ДОСЛІДЖЕННЯ
Методи оцінки енергетичної рівноваги в організмі грунтуються на двох головних принципах: прямому вимірюванні кількості тепла, яке виділилося (пряма калориметрія), та непрямому’— шляхом визначення кількості вжитого кисню та виділеного вуглекислого газу (непряма калориметрія).
Метод прямої калориметрії грунтується на положенні, що усі види енергії зрештою перетворюються на тепло. Помістивши людину в спеціальну термоізольовану камеру, можна визначити кількість тепла, яке виділилось. Для цього потрібно знати кількість води в камері (т), початкову її температуру (її) і кінцеву (і2).
Тоді кількість тепла ((З) дорівнює (3=с*т(І:2—іі), де с (питома теплоємність води) дорівнює І. Цей спосіб дуже громіздкий і у наш час використовується лише для проведення точних наукових досліджень.
Найчастіше використовуються способи непрямої калориметрії — визначення теплопродукції за показниками газообміну. Вра'г ховується те, що при теплопродукції використовується кисень і утворюється СО2. Що більша теплопродукція, то більше викориі стовується О2 і утворюється СО2. Знаючи об’єм використаного О2 і утвореного СО2, можна визначити дихальний коефіцієнт (ДК) — відношення об’єму виділеного СО2 до об’єму вжитого О2:
ДК=УСО2: УО2.
Величина ДК різна при окисленні білків, вуглеводів чи жирів. Позаяк при окисленні глюкози для утворення кожної молекули СО2 споживається стільки ж молекул О2, то ДК дорівнює 1. Оскільки у структурі жирних кислот на 1 атом С припадає менше атомів О2, ніж у структурі вуглеводів, при їх окисленні ДК=0,7. При споживанні білкової їжі ДК=0,8. При змішаному харчуванні цей коефіцієнт коливається в межах 0,85—0,90. Знаючи ДК, можна за таблицею знайти величину калоричного коефіцієнту кисню. Цей коефіцієнт показує кількість енергії, яка виділяється при використанні 1 л кисню. Нарешті, знаючи кількість використаного кисню (за 1 хв, 1 год чи за 1 добу) і калоричний коефіцієнт, можна визначити теплопродукцію організму.
Є й інший, простіший метод непрямої калориметрії. Треба знати лише об’єм використаного кисню і величину ДК (звичайно береться величина 0,82).
Якщо дослідження проводять в умовах основного обміну, то одержимо показник рівня цього обміну. Але отриману в умовах лабораторії величину треба порівнятиз величиною, яка повинна бути у даної людини. Для цього треба знати її вік, зріст, стать та масу тіла. За таблицями, номограмами чи формулами можна вирахувати цю величину — стандартний обмін.
При фізичній праці обмін вищий на так звану робочу надбавку, це робочий обмін. У цих умовах на величину ДК можуть впливати й інші фактори. Так, гіпервентиляція супроводжується виділенням із основних резервів крові «запасних» кількостей СО2. Природно, що при цьому ДК може бути навіть вищим за 1. Це спостерігається, наприклад, на початку виконання м’язової праці в перехідний період перед встановленням нового стаціонарного робочого рівня процесів обміну.
ДК може змінюватись і при одноманітному харчуванні, коли спостерігається перехід одного виду процесів обміну в інший. Так, при харчуванні переважно продуктами, які містять вуглеводи, час
тина їх може перетворюватися на жири. У зв’язку з меншим вмістом О2 у складі жирів такий процес супроводжується виділенням О2, що призведе до росту ДК і зміни справжнього рівня процесів обміну.
При голодуванні або цукровому діабеті у зв’язку із зменшенням використання вуглеводів ДК знижується. Різко, інколи до 0,5, падає ДК і після інтенсивного фізичного навантаження. Це зумовлено поступовим виведенням молочної кислоти з крові. Зменшення кількості лактату супроводжується вивільненням буферних основ крові, які зв’язують частинку утворюваного при окисленні СО2 і затримують його в організмі.
ВІКОВІ ЗМІНИ
ЕНЕРГЕТИЧНОГО ОБМІНУ
У період онтогенетичного завершення розвитку процеси обміну зазнають значних змін. До періоду статевого дозрівання (табл. 18) переважають процеси анаболізму. Оскільки для забезпечення розвитку організму витрачається велика кількість енергії, рівень основного обміну в перерахунку на одиницю як маси, так і поверхні тіла різко збільшений. Особливо високі показники протягом перших років життя дитини, коли основний обмін збільшений порівняно з таким у дорослого у 2—2,5 разу. При старінні організму переважають катаболічні процеси, що супроводжуються поступовим зниженням основного обміну (мал. 193).
ТЕМПЕРАТУРА ТІЛА ТА її РЕГУЛЯЦІЯ
ПОНЯТТЯ ПРО ПОЙКІЛОТЕРМІЮ І ГОМОЙОТЕРМНО
Процеси, що відбуваються в організмі з використанням енергії, закінчуються виділенням тепла. В одних випадках тепло є побічним продуктом життєдіяльності, в інших його виділення є голов-
Таблиця 18. Вікові зміни загального і основного обміну
Вік Загальний обмін Основний обмін
ккал/добу кка л /добу | ккал/(м*-добу) ккал /(кг • г од)
1 доба 160 122 580 1,5
1 міс 293 205 860 2,0
1 рік 853 580 1318 2,4
3 роки 1202 750 1240 2,1
5 років 1420 840 1164 2,0
10 » 1854 1120 1096 1,6
14 » 2550 1360 1028 1,4
Дорослі 3000 1700 1000 1,0
ним шляхом перетворення енергії. В той же час існує зворотний зв’язок між температурою і біологічними процесами. Так, швидкість хімічної реакції залежить від температури середовища згідно з правилом Ванг-Гоффа: при зміні температури на 10 °С інтенсивність обміну змінюється у 2—4 рази.
Вказана закономірність пояснює високу термозалежність усіх життєвих процесів, які впливають навіть на еволюційний розвиток. Низька температура взимку, як і зниження температури вночі, сповільнювали або зупиняли всі процеси життєдіяльності. Це стосується так званих п о й к і л о -
Інтенсивність основного обміну кЛнм'гі'’
Мал. 193. Вікова динаміка рівнів основного обміну у чоловіків та жінок
те р м н и х тварин. У них темпе-
ратура тіла змінюється відповідно до температури зовнішнього середовища. Але на певному етапі еволюції деякі тварини набули здатності зберігати температуру постійною. Це гомойотермні істоти. Вони можуть зберігати температуру постійною, тобто у них сформувалися механізми терморегуляції, внаслідок чого різко зріс еволюційний потенціал. Гомойотермні організми стали незалежни-
ми від зміни температури навколишнього середовища. Значно розширився ареал їх розселення. Ці види живуть в умовах як досить низької, так і досить високої температури.
Основне значення постійного рівня температури організму полягає у можливості реалізувати функції в умовах температурного оптимуму дії ферментів.
При значній зміні температури організму можуть змінюватись структура й функції білків, нуклеїнових кислот, фізико-хімічний стан і функція ліпідів (основа мембрани клітин), швидкість ферментативних реакцій. Вказані зміни призводять до порушення функцій і структур різноманітних^рганів і систем. Для всіх гомойотермних тварин поріг верхньої, вже смертельної, температури перебуває у межах 43 °С. При цьому змінюються фізико-хімічні властивості мембран. Нижньою межею є температура 26 °С, при якій зупиняється серце. Для клітин нижньою межею є температура —2 °С, при якій замерзає внутрішньоклітинна вода.
ТЕМПЕРАТУРА ОБОЛОНКИ І ЯДРА
У гомойотермних організмів температура різних частин тіла не однакова. Розрізняють температуру оболонки і температуру ядра. Температура оболонки — це температура шкіри, яка залежить від температури навколишнього середовища. Температура ядра (температура внутрішніх органів, м’язів), навпаки, характеризується постійністю.
Різні ділянки поверхні шкіри мають різну температуру. Температура шкіри тулуба і голови становить 33—34 °С, кінцівок, особливо в дистальних відділах,— 28 °С.
Температура ядра теж не скрізь однакова — вона вища в печінці, у прямій кишці, у м’язах, які працюють. Робота скелетних м’язів може значно вплинути на температуру всього організму.
Для встановлення температури ядра на практиці визначають температуру в прямій кишці (37,3—37,6°С), в порожнині рота (36,7—37 °С), під пахвою (36,6 °С). Протягом доби температура тіла може коливатись: до 4-ї години вона знижується, а до 17-ї — підвищується. Амплітуда коливання може досягти 1 °С. Температура тіла може змінюватися і залежно від прийняття їжі, інтенсивності виконуваної м’язової праці та емоційного стану. Так, у спортсмена після двогодинного інтенсивного бігу (марафонська відстань) температура ядра може наближатися до 40—41 °С (мал. 194).
Температура тіла жінки залежить від ритму гормональної активності, менструального циклу (мал. 195). У першу половину циклу температура приблизно на 0,5 °С нижча, ніж у другій (піс-ляовуляційний період).
МЕХАНІЗМИ ТЕРМОРЕГУЛЯЦІЇ
Регуляція температури полягає в узгодженні процесів теплопродукції (хімічна терморегуляція) та тепловіддачі (фізична терморегуляція) .
Процеси теплопродукції. В усіх органах унаслідок процесів обміну речовин відбувається теплопродукція. Тому кров, яка відтікає від органів, як правило, має вищу температуру, ніж та, що притікає. Але роль різних органів у теплопродукції різна. У стані спокою на печінку припадає близько 20 % загальної теплопродукції, на інші внутрішні органи — 56%, на скелетні м’язи — 20%; при фізичному навантаженні на скелетні м’язи — до 90 %, на внутрішні органи — лише 8 %.
Таким чином, найпотужнішим резервним джерелом теплопродукції є м’язи при їх скороченні. Зміна активності їх метаболізму при локомоціях — основний механізм теплопродукції. Серед різно-
і,°С
39-
важка фізична праця
38-
Помірна фізична праця, емоції
Звичайні коливання температури
Мал. 195. Добове коливання температури тіла жінки у перед- (/) та постовулятор-ний (2) періоди менструального циклу (за даними Р. Шмідта, Г. Тевса, 1986)
► Ранній ранок
Мал. 194. Зміни ректальної температури у нормі
манітних локомоцій можна виділити кілька етапів участі м’язів у теплопродукції.
1. Терморегуляційний тонус. При цьому м’язи не Скорочуються. Підвищуються лише їх тонус та метаболізм. Цей тонус виникає загалом у м’язах шиї, тулуба та кінцівок. Унаслідок цього теплопродукція підвищується на 50—100 %.
2. Тремтіння виникає несвідомо і полягає в періодичній активності високопорогових рухових одиниць на тлі терморегуляційного тонусу. При тремтінні вся енергія спрямована лише на збільшення теплотворення, у той час як при звичайних локомоціях частина енергії витрачається на переміщення відповідної кінцівки, а частина — на термогенез. При тремтінні теплопродукція підвищується у 2—3 рази. Тремтіння починається часто з м’язів шиї, обличчя. Це пояснюється тим, що передусім має підвищитись температура крові, яка тече до головного мозку.
3. Довільні скорочення полягають у свідомому підвищенні скорочення м’язів. Це спостерігається в умовах низької зовнішньої температури, коли перших двох етапів не досить. При довільних скороченнях теплопродукція може збільшитись у 10—20 разів.
Регуляція теплопродукції в м’язах гіов’язана з впливом а-мото-нейронів на функцію та метаболізм/м’язів, у інших тканинах — симпатичної нервової системи і кат^холамінів (підвищують інтенсивність метаболізму на 50 %) та дією гормонів, особливо тироксину, який підвищує теплопродукції^/ майже вдвічі.
Значна роль у термогенезі ліпідів, які виділяють при гідролізі значно більше енергії (9,3 ккал/г), ніж вуглеводи (4,1 ккал/г). Особливе значення, зокрема у дітей, має бурий жир.
Процеси тепловіддачі відбуваються такими шляхами — радіація, конвекція, випаровування та теплопровідність.
Радіація відбувається за допомогою інфрачервоного довгохвильового випромінювання. Для цього потрібен градієнт температур між теплою шкірою і холодними стінами та іншими предметами навколишнього середовища. Таким чином, величина радіації залежить від температури і поверхні шкіри.
Теплопровідність здійснюється при безпосередньому контакті тіла з предметами (стілець, ліжко тощо). При цьому швидкість перенесення тепла від більш нагрітого тіла до менш нагрітого предмета визначається температурним градієнтом і їх термопро-відністю. Віддача тепла цим шляхом значно (у 14 разів) збільшується при перебуванні людини у воді. Частково шляхом проведення тепло передається від внутрішніх органів до поверхні тіла. Але цей процес гальмується внаслідок низької теплопровідності жиру.
Конвекційний шлях. Повітря, що контактує з поверхнею тіла, за наявності градієнту температур нагрівається. При цьому воно стає легшим і, піднімаючись від тіла, звільняє місце для нових порцій повітря. Таким чином воно забирає частину тепла. Інтенсивність природної конвекції може бути збільшена за рахунок додаткового руху повітря, зменшення перепон при надходженні його до тіла (відповідним одягом).
Випаровування поту. При кімнатній температурі у роздягненої людини близько 20 % тепла віддається за допомогою випаровування.
Теплопровідність, конвекція і випромінювання є пасивними шляхами тепловіддачі, які грунтуються на законах фізики. Вони ефективні лише при збереженні позитивного температурного градієнта. Що менша різниця температури між тілом і навколишнім середовищем, то менше тепла віддається. При однакових показниках або при вищій температурі навколишнього середовища згадані шляхи не тільки не ефективні, але при цьому відбувається нагрівання тіла. У цих умовах в організмі спрацьовує лише один механізм віддачі тепла, пов’язаний із процесами потовиділення і потовипаровування. Тут використовуються як фізичні закономірності (витрати енергії на процес випаровування), так і біологічні (потовиділення). Охолодженню шкіри сприяє те, що для випаровування 1 мл поту витрачається 0,58 ккал. Якщо не відбувається
випаровування поту, то ефективність тепловіддачі різко знижується. \
Швидкість випаровування доту залежить від градієнта температури і насичення водяною парою навколишнього повітря. Що вища вологість, то менш ефективним стає цей шлях тепловіддачі. Різко зменшується результативність тепловіддачі при перебуванні у воді або в щільному одязі. При цьому організм змушений компенсувати відсутність потовипаровування за рахунок збільшення потовиділення.
Випаровування має два механізми: а) перспірація — без участі потових залоз; б) випаровування — при активній участі потових залоз.
Перспірація — випаровування води з поверхні легень, слизових оболонок, шкіри, яка завжди волога. Це випаровування не регулюється, воно залежить від градієнта температур і вологості навколишнього повітря, його величина становить близько 600 мл/до-бу. Що вища вологість, то менш ефективний цей вид тепловіддачі.
Механізм секреції поту. Потова залоза складається з двох частин: власне залози, яка розташована в субдермальному шарі, і вивідних протоків, що відкриваються на поверхні шкіри. В залозі утворюється первинний секрет, а в протоках завдяки реабсорбції формується вторинний секрет — піт.
Первинний секрет подібний до плазми крові. Різниця полягає в тому, що в цьому секреті немає білків та глюкози, менше Ца+. Так, у первинному поті концентрація натрію становить близько 144 нмоль/л, хлору — 104 нмоль/л. Ці іони активно абсорбуються при проходженні поту по вивідних протоках, що забезпечує абсорбцію води. Процес абсорбції багато в чому залежить від швидкості утворення і просування поту: що ці процеси активніші, то більше №+ і СІ- залишається. При сильному потовиділенні в поту може залишатися до половини концентрації цих іонів. Сильне потоутворення супроводжується збільшенням концентрації сечовини (до 4 разів вище, ніж у плазмі) і калію (до 1,2 разу більше, ніж у плазмі). Сумарна висока концентрація іонів, утворюючи високий рівень осмотичного тиску, забезпечує зниження реабсорбції і виділення з потом великої кількості води.
При сильному потовиділенні може витрачатись багато ЦаСІ (до 15—ЗО г/добу). Однак у організмі діють механізми, що забезпечують збереження цих важливих іонів при великому потовиділенні. Вони беруть участь у процесах адаптації, зокрема, альдостерон посилює реабсорбцію №+.
Функції потових залоз регулюються особливими механізмами. На їх активність впливає симпатична нервова система, проте медіатором тут є ацетилхолін. Секреторні клітини, крім М-холіноре-цепторів, мають також адренорецептори, які реагують на катехо-
секрет
Перспірація
Мал. 196. Схема регуляції секреції потової залози
Мал. 197. Взаємозв’язок між температурою ядра і оболонки, теп-лопродукпією та випаровуванням при підвищенні температури навколишнього середовища (за даними А. С. биуіоп, 1991):
1 — ректальна температура; 2 — температура шкіри; З — теплопродукція; 4 — ' випаровування
базальний термоеенез
Радіація !65°М
Кескоротливий термоеенез м’язів (підвищення тепло-продукци у 2рази)
Скоротливий термоеенез (тремтіння) -підвищення в 2-4 рази
Довільні скорочення (підвищення в 101 більше разів)
І =
Випаровування <20
Конвекція (12’4) І
Проведення (З’М |
Теплопродукція
Витчи
Тепловіддачо
Вища
Мал. 198. Вплив теплопродукції та тепловіддачі на температуру організму
ламіни крові1. Активізація функції потових залоз супроводжується збільшенням їх кровопостачання (мал. 196).
Кількість виділеного поту Чіоже досягати 1,5 л/год, а у адаптованих людей — до 3 л/год.
При кімнатній температурі у роздягненої людини близько 60 % тепла віддається за рахунок радіації, близько 12—15%—конвекції повітря, близько 20 % — випаровування, 2—5 % — теплопровідності. Але це співвідношення залежить від ряду умов, зокрема від температури зовнішнього середовища (мал. 197).
Головну роль у регуляції процесів тепловіддачі відіграють зміни кровопостачання шкіри. Звуження судин шкіри, відкриття артеріовенозних анастомозів сприяє меншому припливу тепла від ядра до оболонки і збереженню його в організмі. Навпаки, при розширенні судин шкіри її температура може збільшуватись на 7—8 °С. При цьому збільшується і тепловіддача.
Умовно шкіру можна назвати радіаторною системою організму. Кровотік у шкірі може змінюватись від 0 до ЗО % ХОК. Тонус судин шкіри контролюється симпатичною нервовою системою.
Таким чином, температура тіла — баланс між процесами теплопродукції та тепловіддачі. Коли теплопродукція переважає над тепловіддачею, температура тіла підвищується і, навпаки, якщо тепловіддача вища, ніж теплопродукція, температура організму знижується (мал. 198).
СИСТЕМА ТЕРМОРЕГУЛЯЦІЇ
Система терморегуляції сформована у гомойотермних організмів. Вона регулює і підтримує на постійному рівні оптимальну температуру тіла.
ТЕРМОРЕЦЕПТОРИ
Температура тіла контролюється специфічними терморецепто-рами. Вони діляться на периферичні і центральні.
Розташовані в шкірі, підшкірній основі та кровоносних судинах цих ділянок, периферичні рецептори бувають двох типів — теплові та холодові (переважно холодові). Крім того, в шкірі є терморецептори, які збуджуються при температурі понад 45 °С. Але вони належать до проміжного типу між термо- та ноци-рецепторами.
Центральні рецептори містяться в гіпоталамусі (загалом у передоптичній зоні). Деяка їх кількість розташована в шийно-грудному відділі спинного мозку, у м’язах абдомінальної зони. Тут також містяться обидва типи рецепторів (переважно теплові). Ці рецептори відіграють основну роль у регулюванні теплообміну, тому що вони контролюють температуру ядра.
Між центральними і периферичними терморецепторними імпульсами може бути реципрокна взаємодія. Так, в умовах активізації шкірних холодових рецепторів звужуються судини, а утворення тепла посилюється. Але процес підвищений теплопродукції при цьому не відбувається так інтенсивно, щоб зумовити підвищення температури ядра. Цьому перешкоджають внутрішні теплові рецептори. Навпаки, при підвищенні температури тіла при фізичній праці збуджуються внутрішні теплові рецептори, запускаються процеси видалення надлишку тепла шляхом розширення судин, потіння. Розвиток цих реакцій можуть гальмувати холодові рецептори шкіри, особливо тоді, коли приєднується вплив низької температури навколишнього середовища.
Частота виникнення нервових імпульсів у рецепторах залежить від температури. Холодові і теплові рецептори генерують спонтанну активність. На цю активність накладається відповідне температурне подразнення. Так, у волокнах, що надходять від теплових рецепторів, імпульсація спостерігається в діапазоні від 20 до 40 °С, а максимальна активність — у межах 38 °С і більше. Волокна холодових рецепторів активні в діапазоні 10—40 °С, але найбільша частота імпульсації в них при температурі 20—34 °С. Раптове підвищення або зниження температури призводить до короткочасного різкого збільшення частоти розрядів у відповідних рецепторах із наступним поступовим зниженням до рівня, характерного для даної температури.
При температурі шкіри 34—38 °С імпульсація в обох типах ре-1 цепторів мінімальна. Це створює уяву про температурний комфорт. Приблизно за такою схемою функціонують і центральні терморе-цептори, але для них «температурне вікно» вужче — в межах 37— 37,5 СС.
Імпульси від периферичних рецепторів переключаються в структурах задніх рогів спинного мозку. В головний мозок вони надходять по спіноталамічному та спіноретикулярному шляхах. Після проходження через ретикулярну формацію і неспецифічні ядра таламуса імпульсація надходить у гіпоталамус і асоціативні зони кори головного мозку.
ЦЕНТР ТЕРМОРЕГУЛЯЦІЇ
Центр терморегуляції міститься в гіпоталамусі. Передній відділ гіпоталамуса сприймає інформацію від периферичних та центральних терморецепторів. Центр теплопродукції розташований у ядрах заднього відділу гіпоталамуса. Звідси через симпатичну нервову систему ідуть імпульси, що підвищують метаболізм, звужують судини шкіри, активізують терморегуляцію скелетних м’язів. У цих реакціях беруть участь і гормони — адреналін, норадреналін, тироксин та ін. Це проявляється в ефектах теплокон-
сервації і спостерігається при надходженні імпульсів від холодових рецепторів.
Центр тепловіддачі міститься в ядрах переднього відділу гіпоталамуса. Звідси йдуть імпульси, які розширюють судини шкіри, підвищують виділення поту, знижують теплопродукцію. При руйнуванні центру терморегуляції в гіпоталамусі гомойотермна тварина перетворюється на пойкілотермну (мал. 199).
Певну роль у регуляції температури тіла грають і інші відділи ЦНС (ретикулярна формація, лімбічна систе-
Мал. 199. Вплив гіпоталамуса на тепловіддачу та теплопродукцію
ма, кора головного мозку).
Вмикання різноманітних механізмів теплообміну відбувається постійно, залежно від конкретних умов. Так, такі механізми, як потовиділення або м’язове тремтіння, вмикаються тоді, коли інші
шляхи підтримання постійної температури ядра виявляються не досить ефективними. Потовиділення і м’язове тремтіння супроводжуються відчуттям температурного дискомфорту.
Центри гіпоталамуса ніби налагоджені на «задане значення» температури тіла. Цей показник визначається такою сумарною температурою тіла, яка виникає тоді, коли механізми тепловіддачі і теплотворення перебувають на рівні мінімальної активності. В цьому не беруть участі додаткові механізми, що забезпечують одержання або виділення надлишку тепла. Теплові і холодові рецептори перебувають у найменш збудженому стані. Це умова температурного комфорту. Для створення відчуття температурного комфорту у легко одягненої дорослої людини, яка спокійно сидить, треба, щоб температура стін і повітря була на рівні 25—26 °С, відносна вологість — 50%. Будь-яка зміна цих умов призведе до подразнення відповідних рецепторів і вмикання механізмів терморегуляції.
Етапність вмикання механізмів регуляції полягає у тому, що спочатку вмикаються енергоекономні механізми, наприклад, пове-дінкові. Якщо їх не досить, то вмикаються судинорухові. А такі механізми, як тремтіння, локомоції або потовиділення, приєднуються насамперед. Що далі умови від комфортних, то більше відчуття дискомфорту.
Стан терморегулюючих зон гіпоталамуса може змінюватися під впливом ряду факторів крові. Такими факторами є вміст Са2+ і N3+, глюкози, осмотичний тиск. Підвищення рівня одного із найбільш біологічно активних іонів (Са2+) модифікує чутливість центральних механізмів до температури, нейромедіаторів, що призводить до активізації механізмів тепловіддачі. Це особливо помітно при фізичному навантаженні. Ріст осмолярності крові зумовлює підвищення межі температурної чутливості і зниження інтенсивності потовиділення.
ППО- І ГІПЕРТЕРМІЯ
У реальному житті процеси теплопродукції не завжди відповідають процесам тепловіддачі. Так, у випадку переваги одного із процесів над іншим температура ядра змінюється. Температура може змінюватись під впливом ендогенних або екзогенних чинників. Наприклад, при дії низької температури паралельно з інтенсифікацією процесів теплопродукції для зменшення тепловіддачі звужуються судини шкіри. Але при дуже низькій температурі це може спричинити відмороження. Тому звичайно після звуження кровоносні судини можуть розширюватися і кров знову рухається до шкіри. Ця місцева реакція обумовлена локальною термочутли-вістю м’язів судин і добре виражена в адаптованих до холоду людей.
В умовах дуже низької навколишньої температури розширення судин шкіри може призвести до збільшення тепловитрат, зниження температури ядра, і людина може замерзнути. Зниження температури ядра, згідно з правилом Вант-Гоффа, супроводжується зниженням активності обмінних процесів. Смерть при охолодженні настає при температурі ядра 26—28 °С. Але ще перед цим низька температура призведе до різкого пригнічення активності нейронів ЦНС, до «засинання» і непритомності.
Вказану залежність сьогодні використовують з лікувальною метою, коли потрібно на деякий час відключити кровообіг, щоб зробити операцію на серці. Такий метод називається керованою гіпотермією. Для його здійснення використовують принцип поступового екстракорпорального охолодження крові. Попередньо під відповідним наркозом потрібно вимкнути центр терморегуляції. Звичайно, температуру тіла поступово знижують до 23—25 °С, що дозволяє на 20—ЗО хв зупинити кровообіг. Потім, також поступово, температуру підвищують. Ясна річ, охолоджене серце самостійно не зможе «запуститися». Його скорочення стимулюють за допомогою дефібрилятора.
Протилежний гіпотермії стан називають гіпертермією. Гіпертермія спостерігається і у здорових людей. Це відбувається, наприклад, при інтенсивній фізичній праці, коли тепловіддача від
стає від теплотворення. Висока навколишня температура, особливо при високій вологості, інтенсивний вплив сонця також можуть спричинити гіпертермію. При підвищенні температури тіла понад 41 °С розвивається набряк мозку, порушується процес терморегуляції і без медичної допомоги може настати смерть.
Гіпертермія супроводжує багато хвороб. Вважають, що механізм появи пропасниці обумовлений зміщенням «заданого значення» температури в гіпоталамічному центрі. Зміна функції центру є наслідком дії на нього пірогенів — полісахаридів бактеріальних мембран, які надходять у кров і зумовлюють синтез лейкоцитарних пірогенів. Унаслідок зміни «заданого рівня» центр терморегуляції за «норму» вважає іншу температуру і налагоджує усі механізми терморегулювання на новому рівні. Підвищення температури відбувається внаслідок тремтіння, зменшення потовиділення і звуження судин шкіри. Виведення пірогенів сприяє підвищенню активності механізмів тепловіддачі: посилюється потовиділення, розширюються судини шкіри, і температура тіла знижується.
ТЕМПЕРАТУРНА АДАПТАЦІЯ
Тривала адаптація, акліматизація до поступово змінюваного температурного режиму сприяють суттєвому розширенню ареалу існування людини. Найважливіше значення при цьому має зміна активності обмінних процесів. Так, у мешканців високих широт підвищений основний обмін, а у мешканців пустель, навпаки, знижений. Це зумовлено зміною рівня гормонів, насамперед тироксину — одного з основних стимуляторів термогенезу.
Як зазначалось, при підвищенні зовнішньої температури для виділення тепла використовується механізм потовиділення. При цьому з потом може втрачатися велика кількість ПаСІ. Але у процесі адаптації поступово протягом кількох тижнів відбуваються два взаємозв’язаних процеси: інтенсифікується виділення . поту (до 1,5—2,0 л/г) при одночасному зниженні виведення ПаСІ. Якщо у неакліматизованої людини з потом виводиться 15—ЗО г/л ЦаСІ, то в акліматизованої лише 3—5 г/л. Механізм затримки натрію обумовлений активізацією утворення альдостерону.
Крім цього, у людей, які живуть у названих зонах, дещо змінені і нервово-рефлекторні механізми терморегуляції. Температура ядра у людей, які мешкають у широтах з гарячим кліматом, на 0,5—1 °С вища, а у мешканців регіонів з холодним кліматом знижена. Інші також межі початку реагування периферичних рецепторів і вимкнення механізмів терморегуляції. У мешканців тропіків судини і потові залози починають реагувати при високій температурі тіла, а у мешканців високогірних районів — при нижчій, ніж у тих, хто живе у регіонах з помірним кліматом (на 0,5—1 °С).
У процесі адаптації до багатовікового перебування в умовах відповідних температур, крім суто функціональних особливостей, виробились і морфологічні відмінності. Так, у мешканців тропіків у шкірі порівняно більше потових залоз.
ВІКОВІ ЗМІНИ
СИСТЕМИ ТЕРМОРЕГУЛЯЦІЇ
Немовля, навіть якщо воно народилося дещо недоношеним, має добре розвинену систему терморегуляції. Але у малюка істотно відрізняються умови теплообміну і спостерігаються деякі особливості терморегуляції. Передусім у дітей інше порівняно з дорослими співвідношення площі поверхні тіла (де відбувається тепловіддача) і її маси (де створюється тепло). За рахунок значної переваги поверхні зміщується співвідношення «тепловіддача — теплотворення» у бік підвищення тепловіддачі. Завдяки цьому змінюється й режим температурного комфорту в бік підвищення зовнішньої температури до 32—34 °С. Велика площа поверхні створює умови для інтенсивнішого охолодження і підігрівання. Крім того, у дітей значно тонший теплоізолюючий шар підшкірної основи.
У малюків, особливо у перші місяці життя, велику роль у терморегуляції відіграє бурий жир. Він розташований під шкірою шиї, між лопатками. Це створює умови для постачання кров’ю саме головного мозку, клітини якого особливо чутливі до порушення температурного гомеостазу. Бурий жир добре іннервований симпатичними нервами і добре забезпечується кров’ю. У клітинах бурого жиру є дрібні краплі жиру, а не одна велика, як у білому. Тут більше мітохондрій, цитохромів (які і надають йому своєрідного забарвлення). Унаслідок цього швидкість окислення жирних кислот у 20 разів вища, але при цьому відсутні синтез та гідроліз АТФ, завдяки чому одразу утворюється тепло. Це зумовлене присутністю спеціального мембранного поліпептиду — термогеніну. У разі потреби за рахунок інтенсивного окислення бурого жиру процес створення тепла може підвищуватися у 2—3 рази. Лише при недостатності цього механізму приєднуються тремтіння та інші механізми, спрямовані на збереження тепла.
Діти, особливо першого року життя, для підтримання температурного режиму організму потребують відповідного догляду. До того ж вони не так чутливо, як дорослі, реагують на порушення температурного гомеостазу і при переохолодженні можуть не плакати.
Система травлення
Під травленням розуміють фізичну та хімічну обробку їжі, яка надійшла в організм, і всмоктування одержаних продуктів у внутрішньому середовищі. В процесі травлення беруть участь органи травлення та нервово-гуморальні механізми регуляції їх функцій. Завдяки травленню відбувається зв’язок організму із зовнішнім середовищем, надходять речовини, потрібні для пластичного та енергетичного обміну (білки, жири, вуглеводи, мінеральні солі, вітаміни, мікроелементи та вода).
У внутрішнє середовище (кров та лімфу) можуть надходити через мембрани клітин лише відносно прості невеликі за розміром молекули в розчиненому стані. Тому в травному каналі завдяки дії багатьох ферментів відбувається гідроліз білків до амінокислот або пептидів, жирів — до жирних кислот та моногліцеридів, вуглеводів — до моносахаридів.
У процесі гідролізу білки втрачають свою видову специфіку і не розвиваються реакції, пов’язані з їх несумісністю.
У зв’язку з цим парентерально вводять лише прості сполуки.
Система травлення виконує три основні взаємозв’язані функції — секреторну (утворення секретів, які забезпечують гідроліз), моторну (перемішування та поступове пересування вмісту в травному каналі), всмоктування (перехід продуктів гідролізу в кров та лімфу).
Розрізняють такі види травлення: внутрішньоклітинне
(спостерігається у одноклітинних організмів, а у людини збереглося у вигляді фагоцитозу), порожнинне (відбувається в травному каналі), мембранне, або контактне (відбувається на мембранах клітин).
Процес травлення відбувається послідовно в таких відділах: у порожнині рота, в шлунку, в тонкій та товстій кишках. Час перебування їжі
Мал. 200. Схема відділів органів травлення та час перебування вмісту в кожному з них:
1 — рот (15—20 с); 2 — глотка; 5 — стравохід (10 с); 4 —шлунок (1—3 год); 5 — сфінктер воротаря; 6 — підшлункова залоза; 7 — тонка кишка (7—9 год); 8 — ілеоцекальннй сфінктер;
9— товста кншка (24—30 год); 10— внутрішній та зовнішній сфінктери заднього проходу; 11 — печінка; 12 — кардіальний сфінктер; 13 — слинні залози
(хімуса, або калу) залежить від ‘ консистенції, кількості та якісного її складу (мал. 200).
Розпочинається травлення в порожнині рота. Тут відбуваються такі основні процеси: 1) первинний аналіз речовин, що надходять у організм (функція смакового аналізатора); 2) рефлекторна сигналізація з рецепторів, які локалізуються в даній ділянці, іншим •органам системи травлення; 3) хімічна обробка їжі; 4) механічна її обробка; 5) всмоктування деяких речовин.
СМАКОВИЙ АНАЛІЗАТОР
До складу смакового аналізатора входять рецептори, що сприймають смакові подразнення, нервові волокна, які передають інформацію від цих рецепторів у ЦНС, та кірковий відділ, де аналізується інформація (мал. 204).
Смакові рецептори містяться в слизовій оболонці язика. Це «літини смакових цибулин. Вони реагують на всі види смакових відчуттів — солоне, гірке, кисле та солодке. Поява рецепторних потенціалів залежить від дії катіонів солей, Н+ та інших подразників.
Гірке сприймається переважно рецепторами кореня язика, солодке — його кінчиком, кисле — боковими поверхнями. Міра чутливості для різних речовин не однакова: для ІЧаСІ та цукру — 0,01 М розчин, для НС1 — 0,007 М
Мал. 201. Схема смакового аналізатора:
/ — рецептори язика; 2 — аферентні •нерви; 3 — довгастий мозок; 4 — таламус; 5 — кіркова речовина великого мозку
розчин, а для хініну — лише 0,000008 М розчин. Це зв’язано з однієї із основних функцій смакового аналізатора — диференціацією харчових та нехарчових подразників. Останні часто бувають гіркі на смак.
Смакова чутливість залежить від віку (вона підвищується до 20— 25 років, а потім знижується). Істотна роль належить прийому їжі, після чого смакова чутливість значно знижується. При тривалому подразненні смакові рецептори адаптуються і їх чутливість знижується. Смакова чутливість залежить також від температури страви. Оптимальною є температура 35 °С. На смакову чутливість впливають також емоційний стан людини, індивідуальні її особливості (далеко не кожний
може працювати дегустатором). Смакова чутливість змінюється також під час вагітності, при різних захворюваннях.
Смакові клітини існують близько 10 діб. Потім вони замінюються новими, молодими клітинами.
Збудження смакових клітин через синапси передається аферентним волокнам, волокнами барабанної струни (гілка лицьового нерва) — від передньої та бокових частин язика, волокнами язикоглоткового та блукаючого нервів — від задньої його частини. Ці нерви проводять імпульси в довгастий мозок, а потім, через медіальну петлю,— в ядра таламуса. Звідси аксони через внутрішню капсулу спрямовуються в нижню частину постцентральної звивини кори великою мозку.
Крім смакових рецепторів, на сприйняття різних речовин, що потрапляють до рота, впливають також тактильні, температурні, больові рецептори слизової оболонки рота, а також пропріорецептори м’язів цієї ділянки. Значну роль відіграє і нюховий аналі-лізатор. Таким чином, для аналізу речовин, які надходять у ротову порожнину, має значення подразнення різних рецепторів. При цьому формується комплексний характер якості та кількості їжі або інших речовин.
СЕКРЕТОРНІ ПРОЦЕСИ
В ОРГАНАХ ТРАВЛЕННЯ
МЕХАНІЗМИ УТВОРЕННЯ
І ВИДІЛЕННЯ СЕКРЕТІВ
Секреторні "КЛІТИНИ істотно відрізняються від нервових та м’язових. їх відмінність полягає ось у чому. По-перше, секреторні клітини характеризуються полярністю (їхні мембрани — базальні, апікальні та латеральні — мають різні структуру та функції). По-друге, ці клітини пристосовані для синтезу та виведення секретів. У них добре розвинені ендоплазматична сітка, комплекс Гольджі, є багато рибосом. Для синтетичних процесів потрібна енергія. Клітини містять чимало мітохондрій. Структурні елементи клітин мають характерні топографічні особливості, завдяки яким полегшуються синтез і транспорт секретів (мал. 202). По-третє, для утворення секретів потрібно, щоб секреторні клітини під час їх активності добре постачались к р о в’ ю.
У людини хімічна обробка їжі відбувається головним чином у травному каналі. Лише деякі інгредієнти (ліпіди, олігопептиди) змінюються в клітинах слизової оболонки кишок. Під впливом травних соків, які виділяються секреторними клітинами, відбувається внутрішньо порожнинне травлення. Одні секреторні клітини утворюють компактні органи, зокрема слинні залози, підшлункову залозу, печінку, а інші входять до складу слизової оболонки
Мал. 202. Схема будови секреторної клітини:
7— капіляр; 2— базальна мембрана; З — ендоплазматична сітка; 4 — мітохондрії; 5 — ядро; б — комплекс пластинчастий (Гольджі); 7 — гранули секрету; 8 — латеральна мембрана; 9— «апікальна мембрана
шлунка, тонкої та товстої кишок. Схематично процес утворення окремих компонентів соків травних залоз можна зобразити так:
• 1) матеріал для утворення компонентів секрету надходить через базальну мембрану шляхом пасивного або активного транспорту з кровоносних капілярів;
2) переважна більшість міто-хондрій розташована біля базальної мембрани, що свідчить про високу енергетичну залежність процесів, які відбуваються в цих ділянках клітини. Енергія АТФ, що вивільнюється, використовується для процесів синтезу;
3) через цю ж мембрану клітина одержує сигнали від біологічно активних речовин, що виділяються нервовими волокнами або приносяться кров’ю;
4) за участю вказаних вище структур клітини формуються гранули секрету;
5) гранули секрету виділяються через апікальну мембрану під .впливом нервової або гуморальної стимуляції. Контрольні сигнали реалізуються за участю іонів вільного Са2+, концентрація яких у секреторній клітині значно зростає під час секреції.
Умовно можна виділити кілька фаз секреторного циклу: спокою, екструзії (виведення секрету з клітини) і відновлення (в цей час посилюється здатність клітини до синтезу) .
Основою секрету є вода й електроліти. У багатьох секреторних клітинах специфічні стимули, які діють на базальну мембрану, впливають на активний вхід СІ- та катіонів у клітину, внаслідок чого в ній підвищується осмотичний тиск і в клітину входить вода. Це супроводжується зростанням у клітині гідростатичного тиску і створюються умови для виходу секрету в просвіт .залози.
ОСНОВНІ ПРИНЦИПИ РЕГУЛЯЦІЇ СЕКРЕТОРНИХ ПРОЦЕСІВ
Натщесерце секреторні клітини перебувають у стані відносного спокою, періодично активізуючись. Після їди значно посилюється секреторний процес, перебіг якого залежить від кількості та якіс
ного складу їжі. Розрізняють пускові, коригуючі (зміни інтенсивності та характеру секреції під час її розвитку) та гальмівні впливи.
Регуляторні впливи можуть бути двох видів.
1. Нервова регуляція через рефлекторні дуги, що замикаються в ЦНС (мал. 203) або в гангліях, розташованих у стінці органа чи поблизу нього (місцеві, периферичні рефлекси). У регуляції бере участь вегетативна нервова система. Рефлекторна регуляція за участю ЦНС реалізується завдяки безумовним та умовним рефлексам. Початком цих рефлек-
£кстеро- ейо
штерорецептор
Секреторна клітина
ЦНС І
Екстерн- одо інтсрорщептор
Секреторна
клітина
'Енйркршша клітина
-І ЦНС ]>
Хіндс
।—р Інтерорецептор
О Ганглій .Вегетативної і і~* нервової системи Секреторна клітина
Ендокринна клітина
Секреторна клітина
торних дуг є рецептори, розташовані в слизовій оболонці рота, рецептори різних аналізаторів (зорового, нюхового,
Мал. 203. Види регуляторних механізмів секреторних клітин (пояснення у тексті)
слухового та інших), а також рецептори (механо-, хемо-, терморе-цептори) слизової оболонки різних відділів травного каналу. Ці рецептори реагують на кількість та якість їжі( хімусу). Аналізуються об’єм, консистенція, гідростатичний та осмотичний тиск, рН,
температура, ступінь гідролізу поживних речовин тощо.
Нервові впливи можуть стимулювати виділення інтестинальних гормонів, які в свою чергу впливають на секреторні клітини.
2. Гуморальна регуляція за допомогою гормонів та інших біологічно активних сполук, які утворюються в численних ендокринних клітинах слизової оболонки органів травлення. Більшість гастроінтестинальних гормонів (ГІГ) — пептиди — мають короткий напівперіод існування (секунди, хвилина). Тому їх дія зменшується у разі збільшення відстані. Виявлено понад Десять різновидів клітин, які виробляють ГІГ. Ці клітини розташовані дифузно у слизовій оболонці шлунка, кишок, підшлунковій залозі.
Існують також гуморальні паракринні механізми, які забезпечують дію фізіологічно активних речовин ендокринних клітин на сусідні гландулоцити через міжклітинну рідину. Істотне значення має наявність чи відсутність на мембранах секреторних клітин циторецепторів, що сприймають вплив нейромедіаторів, пептидів або інших сполук. Останнім часом відкрито внутрішньоклітинні механізми, які реагують на стимуляцію цих циторецепторів.
У різних відділах системи травлення переважають ті чи ті механізми регуляції.
СЕКРЕТОРНА ФУНКЦІЯ СЛИННИХ ЗАЛОЗ
У ротову порожнину відкриваються вивідні протоки трьох пар великих слинних залоз: привушних, підщелепних, під’язикових. Крім того, в слизовій оболонці є багато дрібних залоз, які виділяють водянисту слину. Загальна маса всіх цих залоз становить близько 70 г. Привушні залози складаються з клітин серозного типу, дрібні залози слизової оболонки — зі слизових клітин, що виробляють слину, багату на муцин. У підщелепній та під’язиковій залозах є клітини обох типів, тому ці залози вважаються змішаними.
Для дослідження секреторної функції слинних залоз застосовують гострі та хронічні методи. Гострі методи полягають у тому, що тварині під наркозом вводять канюлю в протоку слинної залози і вивчають секрецію під час подразнення нервів чи введення гуморальних стимуляторів секреції.
Хронічні методи було розроблено в лабораторії І. П. Павлова. У тварин (переважно у собак) під час операції виводять на щоку протоку однієї із слинних залоз (роблять фістулу залози). Після одужання тварини на її щоці фіксують лійку і у підвішену пробірку збирають слину. Ця методика дає змогу одержати чисту слину, яку потім досліджують (мал. 204).
У людини при вивченні функції слинних залоз використовують капсулу Лешлі—Красногорського, яку фіксують на слизовій оболонці проти протоки слинної залози.
Кількість слини залежить від ступеня сухості їжі, її подрібнен-потрапляють у рот, тощо. Під час сну виділяється близько 0,05 мл/хв слини, у стані спокою — 0,5 мл/хв, при максимальній секреції — близько 5 .мл/хв. Протягом доби у людини виділяється 0,8—1,5 л слини.
Склад слини різних залоз неоднаковий. Привушні залози виділяють найрідшу слину, а під’язикові — найбільш тягучу. Змішана слина містить 99,4—99,5 % води, решту складають органічні та неорганічні речовини. До органічних речовин належать а-амі-
ня, хімічного складу речовин, що
Мал. 204. Собака з фістулою привушної слинної залози
Мал. 205. Схема утворення первинної та вторинної слини (за даними Н. XV. Вауеп-рогі, 1978)
л/ґза, ліпаза слизової оболонки язика, кисла та лужна фосфатази, РДК-ази, ДНК-ази, муцин (глікопро-теїн), захисні речовини (лізоцим, тіоціанати, білкові антитіла). Але найбільше значення має а-амілаза, яка в слабколужному середовищі розщеплює вуглеводи.
Серед неорганічних речовин переважають N3+, К+, Са2+, С1~, НСОз та ін. Іонний склад залежить від швидкості секреції. рН змішаної слини коливається у межах 5,8—7,4. При різкому збільшенні швидкості секреції рН слини може підвищуватися до 7,8.
Механізм утворення слини. Концентрація електролітів у слині відрізняється від такої у плазмі крові. Це свідчить про активний характер процесів секреції у слинних залозах. Іони (Па+,'
К+ та ряд інших) рухаються проти електрохімічного градієнта за допомогою активного транспорту. Про активність процесів слиноутворення свідчать поліпшення засвоєння кисню, підвищення температури залоз під час секреції. В ацинарних клітинах .утворюється первинна слина, для синтезу якої потрібні амінокислоти, глюкоза, мінеральні речовини (особливо Са2+). У клітинах слинних залоз відбуваються і пасивні процеси, які забезпечують рух води і електролітів із крові у вивідні протоки залоз. При проходженні слини протоками склад її змінюється, бо тут відбуваються реабсорбція Ца+, С1~, секреція К+ та НСОГ, тобто утворюється вторинна слина (мал. 205). На ці процеси впливає швидкість секреції — при високій її швидкості реабсорбція та секреція зменшуються. Під впливом альдостерону збільшується реабсорбція ІЧа+, а також секреція К+.
Значення слини для процесів травлення. Слина служить для змочування твердої їжі, розчинення речовин, що діють на смакові рецептори. Слина зволожує оболонку рота, формує та покриває слизом харчову грудку, сприяє ковтанню, розпочинає гідроліз вуглеводів (який продовжується у шлунку). Захисна функція слини
полягає в тому, що вона містить бактерицидні речовини, здійснює санацію рота, частково нейтралізує шлункову кислотність, нейтралізує шлунковий сік, коли він потрапляє у стравохід. При годуванні немовляти слина забезпечує герметичність між губами і соском, без чого смоктання неможливе.
Регуляція секреторної функції слинних залоз
Регуляція секреторної функції слинних залоз відбувається реф-лекторно. Розрізняють умовнорефлекторні та безумовнорефлек-торні впливи. Умовнорефлекторні реакції зумовлюються виглядом, запахом страви та іншими подразниками, пов’язаними з їжею. Безумовнорефлекторні впливи розпочинаються з рецепторів язика та інших органів порожнини рота. Від них імпульси передаються через волокна трійчастого, лицьового, язикоглоткового і блукаючого нервів у центр слиновиділення в довгастому мозку, а звідти — волокнами VII та IX черепних нервів повертаються до слинних залоз. Це парасимпатична іннервація залоз (мал. 206). Слинні залози іннервуються також симпатичними нервами. Вони починаються з бокових рогів верхніх (II—IV) грудних сегментів спинного мозку, а потім через верхній шийний симпатичний ганглій спрямовуються до слинних залоз. Кора великого мозку, гіпоталамус, лімбічна система регулюють слиновиділення через названі нерви. Відповідні умовні сигнали, емоції можуть загальмувати процес виділення слини.
Обидва типи нервів є секреторними. Але, коли під впливом парасимпатичних нервів виділяється велика кількість слини, яка містить значну кількість солей, то симпатичний нерв зумовлює виділення незначної кількості слини, багатої на органічні речови-
ни. На рівні секреторної клітини регуляція відбувається так: медіатор парасимпатичної нервової системи ацетилхолін діє на М-холінорецептори базолатеральних мембран і активізує вхід Са2+ по хемочутливих каналах
(мал. 207). За участю кальмодулі-ну відбувається ряд реакцій, які супроводжуються виділенням великої кількості слини з низьким вмістом органічних речовин. Медіатор
Мал. 206. Регуляція секреції слинних залоз:
1 — язик; 2 — аферентні нерви (V, VII, IX, X): З — довгастий мозок; 4 — еферентні нерви (VII, IX); 5 — ганглій парасимпатичного нерва; 6 — слинна залоза; 7 — спинний мозок; 8— ганглій симпатичного нерва; 9 — постгангліонарні волокна симпатичного нерва; 10 — таламус; //—кіркова речовина мозку; 12 — гіпоталамус
Мал. 207. Схема регуляції утворення первинної слнни (за даними О. N. Реіегзеп, 1988)
Мал. 208. Схема будови шлунка:
1 — стравохід; 2 — дно; 3 — тіло; 4 — антральннй відділ;
5 — дванадцятипала кншка;
6— сфінктер воротаря; 7.— кардіальний сфінктер
симпатичної нервової системи норадреналін діє на адренорецепто-ри базолатеральних мембран, активізує аденілатциклазу, внаслідок чого утворюється цАМФ. Через посередництво ряду реакцій здійснюється секреція невеликої кількості слини, багатої на органічні речовини.
Кровотік у слинних залозах під час секреції різко (інколи у 5 разів) збільшується, що зумовлено прямим впливом парасимпатичних судинорозширювальних нервів, а також тим, що функціонуюча клітина поряд із секретом виділяє фермент калікреїн. Цей фермент активізує кініноген плазми крові, внаслідок чого утворюється сильний вазодилататор з місцевою дією брадикінін.
СЕКРЕТОРНА ФУНКЦІЯ ШЛУНКА
Шлунок має кілька відділів (мал. 208). Слизова оболонка його продукує сік. Приблизно 80 % цієї оболонки припадає на тіло та дно. Шлункові залози цих відділів складаються з головних, парієтальних та слизових клітин. У кардіальному та пілорич-ному відділах є залози, які майже не мають парієтальних клітин.
Методи дослідження секреторної функції шлунка в експерименті. Поширеним є метод, запропонований В. О. Басовим (1842).
Під час операції тварині вводять у шлунок фістулу, яка з’єднує його порожнину із зовнішнім середовищем. Коли досліди не проводяться, ця фістула закрита, а під час дослідів через неї одержують шлунковий сік. Проте цей сік містить їжу та слину.
І. П. Павлов запропонував метод «уявного годування». Операція введення фістули шлунка поєднувалась з езофаготомією (перерізування стравоходу). Коли тварина їсть (мал. 209), їжа
Мал. 209. Уявне годування Мал. 210. Малий шлуночок, за
даними Р. Гейденгайна (1878) /// та І. П. Павлова (1910) 121
випадає з отворе стравохода і в шлунок не потрапляє. Таке «годування» може тривати довго, а тварина залишається голодною.
В цих умовах можна одержати багато шлункового соку, який після фільтрування та очищення можна використовувати як натуральний шлунковий сік. Цей метод дозволяє простежити за процесом виділення шлункового соку під час першої фази секреції.
Р. Гейденгайном (1878) розроблена методика операції «малого шлуночк а»: з шлунка вирізають частину, яку з’єднують із зовнішнім середовищем. Але при цьому перерізують гілки блукаючого нерва і шлуночок стає денервованим. У цих умовах можна вивчати вплив на секрецію соку лише гуморальних стимуляторів.
І. П. Павлов (1910) удосконалив цей метод. Нерви при цьому не перерізували, «малий шлуночок» відокремлювали від великого двома шарами слизової оболонки (мал. 210). При цьому «шлуночок» реагував як на гуморальні, так і на нервові впливи. Хоча соку було мало, це була повна копія тих процесів, які відбувалися у шлунку.
Кількість соку. Протягом доби у людини утворюється близько 2,5 л соку, його основні складові частини — ферменти, ВСІ та слиз. Натщесерце рН соку близька до нейтральної або слабколужна, а після їди — кисла (0,8—1,5).
Ферменти соку. Головні клітини залоз виробляють неактивні ферменти — пепсиногени. їх виявлено 7; 5 пепсиногенів утворюється в тілі та дні шлунка, а 2 — в антральному та піло-ричному відділах. Пепсиногени. синтезуються клітинами постійно і депонуються у вигляді гранул діаметром 0,5—2,0 мкм. У процесі травлення посилюється не тільки виділення, а й синтез пепсино-
генів. Молекулярна маса пепсиногенів становить близько 42 500. Під впливом НС1 ця молекула ділиться на активний пепсин (молекулярна маса 35 000) та поліпептид. Пепсинактивні протеолітичні ферменти гід-ролізують білки до поліпептидів. Оптимум їх дії спостерігається при рН 1,5— 2,0. У нейтральному та лужному середовищі вони не активні. Пепсиноген, який досягає найвищої активності при рН 3,2—3,5, називається гастриксином. У шлунковому соку є незначна кількість інших ферментів — лі-
пази, желатинази.
Хлористоводнева кислота утворюється в парієталь-них клітинах. У них є канальці, які відкриваються в просвіт залози. Секрет цих клітин містить близько 160 ммоль/л кислоти, рН становить близько 0,8. Концентрація Н+ у цьому секреті у 3 млн раз вища, ніж у крові. Для здійснення функції парієтальні клітини потребують значних енергетичних витрат (1500 ккал на 1 л соку), для чого використовуються в основному ліпіди.
Механізм утворення НС1 такий (мал. 211): СІ- активно транспортується в просвіт канальця, а №+ — з канальця в цитоплазму. Вода в цитоплазмі дисоціює на Н+ та ОН-. Н+ активно виділяється в канадець у обмін на К+. У цьому процесі бере участь №+-, К+-АТФ-аза. Таким чином, К+ та №+ активно реабсорбуються з канальця в цитоплазму.
Вода пасивно проходить через клітину завдяки осмосу. СО2, що утворився в клітині чи увійшов з крові під впливом карбоангідра-зи, реагує з Н+, утворюючи НСОГ Цей аніон дифундує з клітини в кров у обмін на СІ-. Інгібітори карбоангідрази гальмують утворення НС1.
Цікаво, що Рсо, в артеріальній крові вищий, ніж у венозній, яка відтікає від шлунка. Венозна кров має високу концентрацію НСОз-. Знання механізмів утворення НС1 важливе тому, що ведуться пошуки препаратів, які можуть регулювати цей процес на клітинному рівні.
Хлористоводнева кислота істотно впливає на процеси травлення, а саме: 1) сприяє набряканню білків, полегшуючи їх гідроліз; 2) сприяє перетворенню пепсиногенів на пепсини; 3) створює оп
тимальні умови для дії пепсинів (у примукозному шарі рН дорівнює 1—1,5, у порожнині шлунка — 3—5); 4) виконує захисну функцію, бо має бактерицидні властивості і запобігає попаданню бактерій у тонку кишку; 5) сприяє моторній та евакуаторній функціям шлунка; 6) стимулює виділення 5-клітинами слизової оболонки дванадцятипалої кишки гормона секретину.
Слиз утворюється в клітинах покривного епітелію, слизових клітинах шийки залоз (мукоцитах), у кардіальних та пілоричних залозах. Слиз складається з глікопротеїдів, має лужну реакцію і частково нейтралізує хлористоводневу кислоту. Основна функція слизу захисна. Він вкриває тонким шаром гелю (завтовшки 1 мм) слизову оболонку, запобігаючи її механічним чи хімічним ушкодженням.
В’язкість слизу залежить від рН, вона максимальна при рН 5. При зниженні або підвищенні рН в’язкість зменшується. Менш в’язкий слиз легше видаляється з поверхні оболонки. Тому при підвищенні секреції НС1 епітелій слизової оболонки стає вразливішим.
У нормі існує дві лінії захисту проти самоперетравлення слизової оболонки — слиз та клітини покривного епітелію. Вони запобігають зворотній дифузії Н+ з порожнини шлунка в глиб слизової оболонки. Деякі речовини (алкоголь, оцет, ацетилсаліцилова кислота, солі жовчних кислот) порушують цей бар’єр, що може призвести до розвитку виразкової хвороби шлунка.
Вважають, що шлунковий сік складається з двох компонентів — кислотного (утворюється в парієтальних клітинах) та лужного (слиз). В утворенні лужного компоненту беруть участь мукоцити залоз тіла та дна шлунка, кардіальні та пілоричні залози, клітини покривного епітелію. рН соку залежить від співвідношення цих компонентів. Натщесерце та після їди це співвідношення значно змінюється.
Регуляція секреторної функції шлунка
Натщесерце утворюється мало соку (кілька мілілітрів за 1 год). В ньому містяться велика кількість слизу, мало ферментів, майже немає хлористоводневої кислоти. Реакція соку слабколужна. Різке посилення секреції шлункового соку в процесі травлення зумовлено комплексом нейрогуморальних регуляторних механізмів. Розрізняють три фази секреції. Для кожної з них характерні свої механізми регуляції: головний, шлунковий і кишковий.
Під час першої фази секреція стимулюється переважно нервовою системою. Компонентами її є умовні та безумовні рефлекси. Запускається процес соковиділення умовними рефлексами, викликаними виглядом, запахом їжі або навіть уявленням про неї.
Мал. 212. Регуляція секреції шлунка під час першої, «головної», фази: 1 — язик; 2 — аферентні нерви; 3 — довгастий мозок; 4 — волокна блукаючого нерва, що іннервують залози; 5, 8 — ганглії блукаючого нерва; 6— шлунок, 7 — волокна блукаючого нерва, що іннервують гастрин-продукуючі клітини в слизовій оболонці воротаря; 9 — С-клітини; 10 — кровоносний капіляр; 11 — таламус; 12 — кіркова речовина великогд мозку: 13 — гіпоталамус
Безумовнорефлекторні реакції пов’язані з подразненням рецепторів слизової оболонки язика та інших органів порожнини рота. Чутливими нервами (V, VII, IX, X пара) імпульси досягають довгастого мозку, а звідти волокнами блукаючого нерва йдуть до шлунка (мал. 212). Цей нерв впливає на залози шлунка через М-хо-лінорецептори мембран. Крім нервових, під час цієї фази спостерігаються й гуморальні впливи: гілочка блукаючого
нерва, що іннервує пілоричний відділ шлунка, виділяє гормон гастрин. Цей гормон впливає на С-клітини, які вже через кілька хвилин після початку приймання їжі виділяють у відповідь на це так званий вагусний гастрин. Головна фаза секреції має короткий латентний період. Це недовготривала фаза. Сік, виділюваний у цей період, має значну кислотність та високу травну силу. Головну фазу в «чистому» вигляді можна продемонструвати в досліді з умовним годуванням тварин.
На першу фазу секреції накладається друга — шлункова. Ця фаза залежно від наявності їжі в шлунку (розтягування їжою, тактильними та хімічними подразниками) триває кілька годин. У реалізації шлункової фази беруть участь ваго-вагальні рефлекси (за участю ЦНС) та місцеві, периферичні рефлекси, які замикаються в гангліях стінки шлунка (мал. 213). Секреторна активність шлункових залоз, стимульована однією лише наявністю їжі в шлунку, наприклад, як у досліді після прямого вкладання їжі в шлунок через фістулу, характеризується довротривалістю. При цьому виділяється значна кількість соку. Ця фаза важлива для корекції соковиділення. Тривалість виділення соку під час вживання їжі тієї або тієї консистенції переважно визначається відповідними імпульсами з рецепторів шлунка. Еферентами цих рефлексів також є волокна блукаючого нерва.
Під час шлункової фази до нервових приєднуються ендокринні
Мал. 213. Регуляція секреції шлунка під час другої, або шлункової, фази. Нервові механізми;
/ — їжа у порожнині шлунка; 2 —рецептори; З — аферентні волокна блукаючого нерва; 4 — довгастий мозок; 5 — еферентні волокна блукаючого нерва; 6 — ганглій блукаючого нерва; 7 — закінчення цього нерва в слизовій оболонці; 8 — місцевий (периферичний) рефлекс
Мал. 214. Регуляція секреції шлунка під час другої, або «шлункової», фази. Гуморальні механізми:
/ — вплив блукаючого нерва; 2 — розтягання шлунка; 3 — вплив продуктів гідролізу білків; 4 — вплив екстрактивних речовин; 5 — вплив розчину алкоголю; 6 — С-клітинн; 7 — парієтальиі клітини; 8— тучні клітини, їх паракрииннй вплйв на сусідні парієтальні
та паракринні механізми (діють гастрин та гістамін). Гастрин утворюється в С-клітинах слизової оболонки пілоричного відділу і має три різновиди залежно від кількості амінокислот у молекулі (С=34, С=17, С=14). Ці гормони виділяються в кров і впливають переважно на парієтальиі клітини, меншою мірою — на головні. Гастрини стимулюють також ріст слизової оболонки шлунка. На виділення гастрину впливають в основному хімічні подразники, зокрема продукти гідролізу білка, екстрактивні речовини, алкоголь тощо (мал. 214).
Гістамін належить до біогенних амінів. Він утворюється в тучних клітинах і є сильним стимулятором секреції НС1. Невелика кількість гістаміну утворюється постійно. У присутності ацетилхоліну та гастрину його секреція значно посилюється. Гістамін — кофактор, конче потрібний для стимуляції секреції НС1.
Стимулятори секреції, тобто ацетилхолін, гастрин та гістамін, взаємопосилюють дію один одного. Це вмикається потенціюючий механізм. Він пов’язаний з процесами, що відбуваються в паріє-тальних клітинах унаслідок дії цих стимуляторів на відповідні клітинні мембрани (мал. 215). У клініці застосовують препарати, які блокують впливи на секрецію хлористоводневої кислоти на різних рівнях. Це гангліоблокатори (бензогексоній), блокатори М-холінорецепторів (атропін), блокатори Н2-гістамінових рецепторів (циметидин).
Кишкова фаза шлункової секреції залежить та-
кож від нервових та гуморальних впливів, але переважають останні. Нервові впливи з механо- і хеморецепторів кишок через дуоде-ногастральний рефлекс посилюють секреторні процеси в шлунку, якщо сюди надходить ще не досить перетравлений хімус. Однак найбільше значення, особливо щодо корекції шлункової секреції, мають не нервово-рефлекторні механізми, а гастроін-тестинальні гормони і про-
.Н*
Н/К АТФ-оза ЬЦ(.
Протеїнкіназа
Со“
Звільнення Сог*з клітинних запосіб
Гсстриновий рецептор
Насос к* ''Ч Протеїнкіназа
Саи
Протеїнкіназа | (Звільнення Саг* з клітинних запосіб
цАМФ
М-Холіно-
Нг-Рецептор рецептор
Саг^
0
Гастрин Гістамін
□
Ацетилхолін
дукти гідролізу харчових Мал _Механізми регуляції секреції
білків. паріетальної клітини
Секреція шлункової НС1 знижується, коли рН у дванадцятипалій кишці стає нижчою за 4,0. У цих умовах слизова
оболонка дванадцятипалої кишки виділяє секретин, який гальмує утворення НС1. Пригнічує секрецію шлункового соку і жирний хімус, що надійшов у кишки. Цей вплив пов’язують із виділенням шлунковогальмівного пептиду і ХЦК-ПЗ. Названі гормони, утворюючись у дванадцятипалій кишці, надходять до залоз шлунка разом із кров’ю. Секретин і ХЦК-ПЗ, гальмуючи секрецію НС1, навпаки, стимулюють виділення пепсиногенів. Продукти розпаду їжі (особливо білків) після всмоктування в кров також стимулюють залози шлунка. Вони впливають на секреторні клітини також шляхом утворення гастрину і гістаміну. Гальмівний вплив на секрецію шлункового соку здійснюють соматостатин, ентерогастрин, бульбо-гастрон, серотонін. Крім того, секрецію пепсиногенів зменшують місцеві тканинні фактори — кінінн і простагландини. їх вміст у зоні секреторних клітин збільшується в період активного секреторного процесу, що дещо активізує дію стимуляторів і сприяє функціональній відповіді.
Секреція шлункового соку гальмується як шляхом зменшення утворення гормональних стимуляторів, так і безпосередньо впливом на секреторні клітини. В обох випадках більшість інгібіторів гальмує внутрішньоклітинні процеси утворення цАМФ і надходження Са2+.
Гальмування секреторної функції шлунка спостерігається також під час фізичної праці, при негативних емоціях, дії больових подразників. Механізм цих впливів реалізується через симпатичну
нервову систему.
Завдяки комплексному впливу нервово-рефлекторних, гормо
нальних подразників і екстрактивних речовин, які містяться в ї$кі, час секреції і склад соку, що виділяється, відповідають прийнятій їжі. Тому, якщо людина протягом тривалого часу харчується одноманітно, характер виділюваного соку може істотно змінитися. При вживанні рослинної їжі зменшується секреторна активність у другу і третю фази, але дещо збільшується в першу. Білкова їжа, навпаки, стимулює виділення соку, особливо в другу і третю фази. Може трансформуватися і склад соку.
СЕКРЕТОРНА ФУНКЦІЯ
ПІДШЛУНКОВОЇ ЗАЛОЗИ
Підшлункова залоза виконує дві функції — зовнішньосекретор-ну (екзогенні панкреоцити та клітини протоків виробляють панкреатичний сік) та внутрішньосекреторну (інсулоцити продукують інсулін, глюкагон, гастрин, які надходять у кров і впливають на ряд функцій).
Методи дослідження можна розділити на гострі та хронічні. Гострі методи полягають у тому, що під наркозом уводять канюлю в протоку залози і одержують сік під впливом нервових чи гуморальних подразників.
Хронічні методи дослідження розробив ще І. П. Павлов. На підготовчому етапі під час операції виводять протоку підшлункової залози на поверхню шкіри живота. Після одужання тварини збирають сік, що виділяється під впливом різних подразників, визначають його кількість і склад. Певне значення має дослідження активності амілази та ліпази, які містяться в крові та сечі.
Кількість соку підшлункової залози у людини становить 1,5— 2 л за добу. Реакція його лужна (рН 8,0—8,5), оскільки він містить велику кількість гідрокарбонатів. 1
Сік підшлункової залози багатий на білки (до 10 %). Це в основйому ферменти, що діють на білки, жири та вуглеводи. Протеолітичні ферменти, зокрема трипсиноген, хемотрипси-ноген, прокарбоксиполіпептидаза тощо, утворюються в ацинарних клітинах залози в неактивній формі. Активується трипсиноген ферментом ентерокіназою, яка продукується клітинами слизової оболонки дванадцятипалої кишки. Таким чином, до виходу в дванадцятипалу кишку цей фермент неактивний. Запобігає його активізації також інгібітор, що виробляється в ацинарних клітинах і оточує шаром молекули проферменту.
Активний трипсин активує хемотрипсиноген, переводячи його в хемотрипсин, а прокарбоксиполіпептидазу — в карбоксиполіпеп-тидазу. В соку підшлункової залози є й інші протеолітичні ферменти — еластази, нуклеази та ін. Протеолітичні ферменти гідро-лізують білки до пептидів та амінокислот.
Ліполітичні ферменти — ліпаза, фосфоліпаза — гідролі-зують жири та фосфоліпіди до жирних кислот і гліцерину.
Амілолітичний фермент а-амілаза гідролізує крохмаль та глікоген до оліго-, ди- та моносахаридів. Гідроліз жирів посилюється в присутності солей жовчних кислот та Са2+.
Певні процеси відбуваються і в протоках підшлункової залози. Тут з первинного формується кінцевий сік. Це відбувається завдяки активному транспорту в крові №+ та НСОГ, за якими згідно з осмотичним градієнтом іде вода. В кров же в протилежному напрямку надходить Н+. Концентрація НСОГ в кінцевому секреті може бути значно вищою (у 5 разів), ніж у плазмі крові.
Значення соку підшлункової залози полягає в основному в тому, що під його впливом гідролізуються білки та жири. Якщо перев’язати протоку залози, то буде засвоюватись лише 40 °/о жирів та 50 % білків (до перев’язки засвоювалось відповідно 94 та 92 %). Гідрокарбонати, що входять до складу соку, нейтралізують кислий хімус, який надходить із шлунка. Створюються оптимальні умови для дії ферментів підшлункової залози та кишкового соку.
Регуляція секреції підшлункової залози
Регуляція секреції підшлункової залози здійснюється комплексом нейрогуморальних механізмів.
Розрізняють три фази секреції: головну, шлункову та кишкову. Під час головної фази секреції основна роль належить нервовим впливам, що реалізуються через блукаючий нерв під час умовно-та безумовнорефлекторних реакцій. Під впливом вигляду, запаху їжі, її надходження у ротову порожнину рефлекторно виділяється сік підшлункової залози. Секреція розпочинається вже через 1— 2 хв після початку приймання їжі. В цей час виділяється помірна кількість ферментів. Сік містить незначну кількість води та електролітів. Симпатичні нерви здійснюють трофічний вплив на підшлункову залозу. їх імпульси посилюють синтез органічних речовин, у той же час пригнічуючи їх виділення. Тому емоції та інші стани, внаслідок яких збуджується симпатичний відділ вегетативної нервової системи, гальмують виділення соку.
Під час шлункової фази нервові впливи зберігаються, але починають діяти гуморальні фактори, зокрема шлунковий гастрин.
Кишкова фаза характеризується чіткою залежністю кількості соку та його складу від складу хімусу. В цей час вирішальне значення мають гуморальні фактори. Під впливом хімусу, що надійшов у дванадцятипалу кишку, утворюються два гормони — секретин і ХЦК-ПЗ. Тобто секретин утворюється у 8-клітинах слизової
Мал. 216. Вплив секретину та ХЦК-ПЗ на секреторну функцію підшлункової залози:
1 — І-клітини, 2 — 8-клітнни
Мал. 217. Схема регуляції секреторної клітини підшлункової залози
оболонки дванадцятипалої кишки під впливом НС1, ХЦК-ПЗ, у І-клітинах цієї оболонки — під впливом продуктів гідролізу білків та жирів (мал. 216).
Секретин діє на клітини проток підшлункової залози. Під його впливом виділяється багато соку з високою концентрацією гідрокарбонатів та малою кількістю ферментів.
ХЦК-ПЗ впливає на синтез та виділення ферментів ацинарни-ми клітинами залози. У цей час виділяється мало соку, але він містить значну кількість ферментів. На функцію ацинарних клітин впливають також гормони власне підшлункової залози (є дані, які свідчать про те, що кров спочатку протікає через панкреатичні острівці (острівці Лангерганса) і лише потім досягає ацинарних клітин.
Під дією секретину відбувається лужна реакція в тонкій кишці. Секретин починає виділятись у кров, коли рН у дванадцятипалій кишці зменшується до 4,5. При рН менше від 3,0 виділення секретину значно зростає. Тоді виділяється сік з високою концентрацією гідрокарбонатів. Він нейтралізує кислу реакцію хімусу, що надходить із шлунка. Таким чином, що кислішою буде реакція хімусу, то активніше вона нейтралізуватиметься.
Якщо в хімусі багато білків або жирів, то утворюється значна кількість ХЦК-ПЗ. Сік підшлункової залози за цих умов міститиме високоактивні ферменти, що забезпечить повноцінний гідроліз названих речовин.
Вплив на ацинарні клітини реалізується через фосфоліпазу С, а на клітини проток — через цАМФ.
Основні стимулятори секреції залози ацетилхолін, гастрин, секретин та ХЦК-ПЗ взаємодіють між собою і посилюють кінцевий результат — вони мають потенціюючий вплив (мал. 217).
При прийомі їжі з різним вмістом білків, жирів та вуглеводів
змінюються кількість та -склад соку. Таким чином підшлункова залоза пристосовується до різних умов, тобто відбувається її адаптація.
СЕКРЕТОРНА ФУНКЦІЯ ПЕЧІНКИ
Жовч утворюється в гепатоцитах печінки, потім системою жовчних протоків потрапляє в жовчний міхур і через відкритий сфінктер загальної жовчної протоки — у дванадцятипалу кишку. Жовч утворюється в печінці постійно, а надходить у кишку періодично. Тому розрізняють два процеси — секреції жовчі та її виділення в кишку у зв’язку з прийомом їжі.
Методи дослідження секреції жовчі полягають у спостереженні за тваринами після операції накладання фістули жовчного міхура і перев’язування загальної жовчної протоки. Для вивчення процесу виділення жовчі накладають фістулу протоки (виводять її на поверхню шкіри живота).
Кількість жовчі коливається в межах 0,6—1,2 л за 1 добу — залежно від кількості та якості їжі.
Склад жовчі залежить від того, звідки її одержано. Свіжа, новоутворена жовч змінює свій склад у міру проходження протоками, а також перебування в жовчному міхурі (табл. 19).
До складу жовчі входять солі жовчних кислот (утворені з холестерину холеві кислоти сполучаються з таурином або з глікоколом), жовчні пігменти — білірубін та білівердин (продукти перетворення гемоглобіну), холестерин, лецитин та інші органічні речовини. У міру протікання протоками склад жовчі змінюється: в неї переходять вода, гідрокарбонати, N3+. При цьому
Таблиця 19. ВмІ£Т основних компонентів у печінковій жовчі та жовчі міхура
Компоненти жовчі Печінкова жовч Жовч міхура
Вода, % 95—98 86—92
Сухий залишок, г/л: 26 133,5
солі жовчних кислот 10—11 30—100
жирні кислоти і ліпіди 1,4 3—12
пігменти і муцин 5,3 9—20
холестерин 0,6 2,6—9
неорганічні солі 8,4 6,5
Іони, ммоль/л: 145 130
к+ 5 9
Са2+ 2,5 6
сі- 100 75
нсо^- 28 ’ 10
рн 7,3—8,0 6,0—7,0
кількість жовчі збільшується майже вдвічі. В жовчному міхурі (його об’єм досягає 20—60 мл) жовч концентрується за рахунок всмоктування води. При цьому концентрація солей жовчних кислот, пігментів, холестерину збільшується приблизно в 5 разів. У жовчному міхурі та жовчних протоках до жовчі додається слиз. рН жовчі становить 7,3—8,0.
Значення жовчі полягає в її впливі на гідроліз та всмоктування жирів. Без жовчі через органи травлення виводиться близько 40 % жиру. Цю функцію виконують солі жовчних кислот — вони зменшують поверхневий тиск хімусу. При цьому створюється жирова емульсія та відбувається її стабілізація. Дрібні крапельки жиру краще гідролізуються ліпазою соку підшлункової залози. Жовчні кислоти утворюють також комплексні сполуки з жирними кислотами — міцели, що сприяє їх усмоктуванню. Солі жовчних кислот стимулюють моторну функцію кишок. Жовч разом із соком підшлункової залози нейтралізує кислу реакцію хімусу, що надходить із шлунка.
У складі жовчі виводиться з організму ряд екскретів (жовчні пігменти, холестерин та ін.).
Регуляція секреції та виділення жовчі
Регуляція секреції жовчі. Секреція жовчі відбувається постійно, але вона посилюється під впливом жовчних кислот, ХЦК-ПЗ, секретину та інших гормонів. Близько 94 % жовчних кислот всмоктується в кров у верхніх відділах тонкої кишки. Перш ніж видалитись із організму, молекула жовчної кислоти може циркулювати 18—20 разів (ентерогепатична циркуляція жовчних кислот). Таким чином, що більше жовчі виділяється в дванадцятипалу кишку, то більше всмоктується жовчних кислот, які з кров’ю надходять знову в печінку і стимулюють утворення нових порцій жовчі.
Регуляція виділення жовчі. Виділення жовчі в дванадцятипалу кишку відбувається періодично, відповідно до прийому їжі. Рух жовчі жовчовивідними протоками залежить від швидкості її утворення, стану цих проток і сфінктерів. Ступінь наповнення жовчних проток, скорочення гладких м’язів жовчного міхура і проток впливають на тиск. У загальній жовчній протоці тиск коливається від 4 до 300 мм вод. ст. Натщесерце тиск у жовчному міхурі перебуває на рівні 60—180 мм вод. ст. За рахунок скорочення м’язів жовчного міхура тиск у ньому підвищується до 150—260 мм вод. ст. і при відкритому сфінктері загальної жовчної протоки жовч з міхура виходить у дванадцятипалу кишку.
Умовні й безумовні рефлекси, пов’язані з прийняттям їжі, супроводжуються виділенням незначної кількості жовчі. Імпульси
Мал. 218. Нервові та гуморальні механізми виділення жовчі:
1 — рецептори; 2— аферентні нерви; 3 — довгастий мозок; 4 — блукаючий нерв; 5 — сфінктер Одді; 6 — жовчний міхур: 7 — дванадцятипала кишка; 8 — продукти гідролізу жирів та білків; 9 — І-клітини у слизовій оболонці дванадцятипалої кишки; 10 — кровоносні судннн
йдуть у центр блукаючого нерва, а звідти еферентними його волокнами — до гладких м’язів жовчного міхура та сфінктера загальної жовчної протоки (м’язи жовчного міхура скорочуються, а сфінктера — розслаблюються). При відкритому сфінктері загальної жовчної протоки жовч виділяється у кишки. Після того як спорожніє міхур, у кишки жовч надходить просто з печінки. Під
час травлення інтенсивність виділення жовчі значно збільшується. Основний механізм регуляції виділення жовчі — гуморальний. Скорочення м’язів жовчного міхура і жовчних проток при одночасному розслабленні сфінктерів супроводжується виділенням жовчі. Головна роль при цьому належить ХЦК-ПЗ, який утворюється в І-клітинах слизової оболонки дванадцятипалої кишки під впливом продуктів гідролізу жирів та білків (мал. 218). Таким чином, що більше жирів буде в дванадцятипалій кишці, то більше виділятиметься жовчі, гідролізуватиметься та всмоктуватиметься жирів. Секреція багатої на гідрокарбонати жовчі стимулюється секретином. Посилюють жовчовиділення жири, жовток і магнію сульфат, які надходять у дванадцятипалу кишку, а також жовч.
СЕКРЕТОРНА ФУНКЦІЯ
ТОНКОЇ КИШКИ
Тонка кишка складається з трьох відділів — дванадцятипалої, порожньої та клубової. В них відбуваються .взаємозв’язані процеси — остаточний гідроліз поживних речовин, які всмоктуються в кров та лімфу, та моторна функція.
Залози, що містяться в слизовій оболонці тонкої кишки, мають різну будову та функції. У початковому відділі дванадцятипалої кишки переважають дуоденальні залози (Бруннера), які виділяють багато слизу. Цей слиз захищає слизову оболонку від кислого хімусу.
Мал. 219. Накладання фістули тонкої кишки за методом Тірі—Велла
У інших відділах тонкої кишки розташовані крипти. В них містяться епітеліальні клітини кількох видів — епіте-ліоцити, бокалоподібнї клітини, ендокриноцити, ендокрино-цити з ацидофільною зернистістю, що утворюють ферменти та імуноглобуліни, а також не-диференційовані клітини.
Методи дослідження. Чистий кишковий сік можна одержати з ізольованих петель тонкої кишки. Існує кілька модифікацій цих операцій — за ме
тодом Тірі, Тірі—Велла, Бабкіна. Найпоширеніша з них — накладання фістули тонкої кишки за методом Тірі—Велла (мал. 219). Кількість та склад соку. Протягом доби утворюється близько 1,8 л соку. При центрифугуванні сік ділиться на дві частини: надосадова рідина майже не містить ферментів, а в осад випадають велика кількість злущених з поверхні кишки епітеліоцитів (за добу злущується близько 200 г), слиз, лейкоцити і значна кількість різних ферментів (близько 20), які беруть участь у завершальних стадіях гідролізу білків, жирів та вуглеводів. Найважливіші з них — пептидази, сахараза, мальтаза, лактаза та ліпаза. Сік також містить ряд неорганічних сполук. рН соку досягає 7,5—8,0. Епіте-ліоцити слизової оболонки тонкої кишки інтенсивно відновлюються, їх життєвий цикл становить близько 5 діб.
Функції кишкового соку різноманітні. За його участю відбуваються остаточний гідроліз поживних речовин, захист слизової оболонки, підтримання хімусу в рідкому стані, формування лужної реакції кишкового вмісту.
Мембранне травлення
Процеси остаточного гідролізу і всмоктування поживних речовин відбуваються на мембрані епітеліальних клітин тонкої кишки. Сюди надходять частково перетравлені інгредієнти після попереднього розщеплення під впливом ферментів травних соків у кишках. Внутрішня поверхня кишок має вирости — мікроворсинки. У свою чергу їхня поверхня вкрита шаром глікокаліксу (мукопо-лісахариди). На глікокаліксі містяться адсорбовані ферменти, що утворюють своєрідний «малий конвейєр». Ферменти, які лежать ближче до порожнин кишки, перетравлюють відносно великі молекули харчових речовин («провалюючись» між «волосинками» глікокаліксу, вони зазнають дії гідролаз). Біля основи глікока-
ліксу містяться ферменти, фіксовані на клітинній мембрані, які остаточно гідролізують речовини. Тут, на мембранах ентероцитів, розташовані й системи транспорту, котрі забезпечують їх всмоктування.
Ферменти, які здійснюють мембранне травлення, утворюються власне епітеліоцитами, а також надходять сюди з соком підшлункової залози. Серед них є ферменти, що остаточно гідролізують вуглеводи, білки та жири.
За рахунок складок слизової оболонки кишок, ворсинок і мік-роворсинок різко збільшується загальна площа тонкої кишки. У дорослої людини вона становить близько 200 м2.
Мембранне травлення відбувається завдяки ферментам, фіксованим на мембранах. їхні активні центри орієнтовані на субстрат. Ці ферменти часто об’єднані в своєрідні «ансамблі»:, одні ферменти розпочинають гідроліз речовин, інші продовжують його, ще інші завершують цей процес. Мембранне травлення відбувається в глибині складок мікроворсинок у стерильних умовах і тісно зв’язане з процесами всмоктування (травно-транспортний конвейєр) .
ПРОЦЕСИ ТРАВЛЕННЯ
В ТОВСТІЙ КИШЦІ
Сік товстої кишки у разі відсутності дії механічного подразника виділяється в незначній кількості. При подразненні сокотво-рення збільшується у 8—10 разів. Сік містить слиз та епітеліальні клітини. Травна функція соку полягає в захисті слизової оболонки від механічних, хімічних подразнень та забезпеченні лужної реакції.
Мікрофлора. Істотну роль у процесах травлення у товстій кишці відіграє мікрофлора. Якщо у тонкій кишці міститься відносно незначна кількість мікробів, то у товстій їх наявність конче потрібна для нормального існування організму. До 90 % мікрофлори припадає на безспорові анаероби, 10%—на молочнокислі бактерії, кишкову паличку, стрептококи та спороносні анаероби.
Під дією мікроорганізмів відбувається остаточний розклад залишків неперетравлених речовин і компонентів травних секретів, створюється імунний бар’єр шляхом гальмування патогенних мікроорганізмів, синтезуються деякі вітаміни (групи В, К) та інші біологічно активні речовини. Мікрофлора також бере участь у обміні речовин.
У немовлят порожнина товстої кишки стерильна. Вона заселяється мікроорганізмами протягом перших місяців життя.
Під дією мікробів неперетравлені вуглеводи розпадаються на молочну і оцтову кислоти, алкоголь, СО2 і Н2О. Білки, що збереглися, підлягають гнильному розкладу з утворенням токсичних ре
човин (індолу, скатолу/фенолу тощо) і таких біологічно активних сполук, як гістамін, тирамін. При збалансованому харчуванні процеси гниття й бродіння зрівноважуються. Так, утворювані під час бродіння кислі продукти перешкоджають гниттю. Одноманітне харчування призводить до розладу вказаних процесів. У такому разі один процес переважає над іншим.
Регуляція секреції тонкої та товстої кишок
Приймання їжі практично не впливає на секрецію соку. Домінуючу роль у регуляції секреторної функції тонкої кишки відіграють місцеві рефлекси (мал. 220). Це реакція на тактильні чи хімічні подразники. Хімічними стимуляторами є продукти травлення білків або жирів, панкреатичний сік, кислоти. Наявність у хімусі продуктів гідролізу білків та жирів стимулює секрецію багатого на ферменти соку. Таким чином, секреція стимулюється тоді, коли є хімус.
Секрецію соку тонкої кишки посилює ряд гормонів, зокрема, секретин, ВІП, ХЦК-ПЗ, мотилін. Соматостатин секрецію гальмує.
У товстій кишці стимуляція секреції теж відбувається за рахунок місцевих рефлексів. Під впливом механічного подразнення секреція посилюється у 8—10 разів. Певне значення мають впливи парасимпатичних нервів, які іннервують */2—2/з нижніх частин товстої кишки. При цьому посилюється секреція соку, який багатий на слиз.
РУХОВА ФУНКЦІЯ
СИСТЕМИ ТРАВЛЕННЯ
У початковому (ротова порожнина, глотка, початкова частина стравоходу) і кінцевому (зовнішній сфінктер) відділах органів травлення їжа і кал пересуваються поперечносмугастими м’язами, в інших частинах—гладкими. Стінка травного каналу в усіх відділах має приблизно однакову будову. М’язи її розташовані в три шари: зовнішні і внутрішні — поздовжні, а середній — циркулярний. Всередині травний канал вкритий слизовою оболонкою, зовні — серозною.
Між м’язовими шарами лежить міжм’язове нервове сплетіння, яке регулює моторну функцію. Підслизове нервове сплетіння регулює як моторну, так і секреторну функції. У названих нервових сплетіннях є всі структурні елементи, потрібні для місцевої рефлекторної регуляції. Органи системи травлення іннервує і ВНС (симпатичні та парасимпатичні нерви). А там, де є скелетні м’язи, іннервація здійснюється соматичними нервами.
Нервові сплетіння, які локалізуються в стінці кишки, мають
численні ганглії й нервові зв’язки, котрі з’єД* нують сплетіння один з одним, а також з нервовими елементами вищерозташованих відділів ЦНС. Ці сплетіння забезпечують електрофізіологічні контакти гладком’язо-. вих волокон. Це дозволяє хвилі деполяризації, проходячи через усю масу волокон, узгоджувати їхні скорочення. Для перемішування і просування хімусу травним каналом зовсім не обов’язковим є втручання вищих центрів симпатичного і парасимпатичного відділів ЦНС. Тут ведуча роль належить місцевим рефлекторним дугам.
Механізми ритмічної активності
Однією з характерних особливостей гладких м’язів, яка найбільшою мірою виражена у тонкій кишці, є здатність до спонтанної ритмічної деполяризації і утворення спайок (мал. 221). Спонтанна деполяризація, можливо, зумовлена ритмічною зміною активності Иа+/К+-насосу. Виникаючи в окремих клітинах, деполяризація (5—15 мв) може поширюватися на інші. Але у даному випадку не кожен цикл деполяризації зумовлює м’язове скорочення. Для ініціації скорочення потрібне накладання на спонтанну деполяризацію спайкового ПД. Таким чином, спонтанна деполяризація виражає стан готовності до наступного скоро-
Мал. 220. Регуляція секреції кишкового соку: / — порожнина кишки; 2 — хімус; 3 — ганглій у стінці кишки: 4 — секреторна клітина
чення.
Спайковий потенціал є справжнім ПД. ПД
ляризації мембран до порогового спокою становить близько 50—60
Мал. 221. Спонтанна ритмічна деполяризація та спайки у гладких м’язах кишки
виникає при депо-рівня — 40 мВ (рівень потенціалу мВ). Він обумовлений надходженням Са2+ через Са2+/Ца+-канали.
Спонтанний ритм деполяризації знижується за ходом травного каналу. Електричні контакти дають можливість клітинам із швидким ритмом керувати більш «повільнішими» клітинами. Деякі автори виділяють у кишках тонку мережу провідної системи, певні клітини якої діють як типові пейсмекери. Так звані пейсме-керні клітини розташовані у кардіальній частині шлунка і тонкій кишці відразу за воро
тарем (пілорусом). У/людини ритміка спонтанної деполяризації становить близько 10/імп/хв.
Вважають, що ЙД, які зумовлюють скорочення м’язів, зароджуються у .нервових структурах, розташованих у стінці кишки. Нервові сплетіння власне кишок мають як аферентні, так і еферентні механізми, що забезпечують виникнення місцевих рефлексів. Роль вищерозташованих відділів ВНС зводиться до корекції місцевих рефлексів залежно від стану інших відділів органів травлення та всього організму.
Аферентні волокна блукаючого нерва входять у довгастий мозок до ядра одинокого шляху (іг. зоїііагіиз). Із сусіднього дорсального ядра починається еферентний шлях блукаючого нерва. Імпульси блукаючого нерва посилюють, а симпатичного — послаблюють перистальтику. В нормальному стані зберігається збалансованість між холінергічними і адренергічними впливами.
Крім того, у регуляції моторики беруть участь гормони, які утворюються в ендокринних залозах або безпосередньо в органах травлення. Так, мотилін стимулює виникнення спайок у гастродуо-денальних пейсмекерних вузлах.
Роль внутрішніх нервових сплетінь не обмежується виникненням ПД. Ці імпульси поширюються головним чином за допомогою вказаних нервових волокон. Так, після перерізування і наступного відновлення цілості кишки спочатку переривається передавання збудження. Сполучна тканина, що розвивається, блокує передавання збудження через м’язові волокна. Але після проростання нервових волокон електричні контакти відновлюються.
РОТОВА ПОРОЖНИНА
Ротова порожнина виконує кілька функцій, пов’язаних із травленням. Вона служить для захоплення їжі, пережовування її та аналізу. Велика кількість рецепторів, розташованих тут, започатковує багато рефлекторних реакцій усієї системи травлення.
У ротовій порожнині здійснюється первинна обробка їжі, тобто механічне подріблення й змочування її слиною. Рідка їжа проковтується одразу, а тверді частки жуються. Жування здійснюється за допомогою рухів нижньої щелепи, узгоджених з переміщенням їжі у ротовій порожнині язиком і м’язами щік. Усі ці рухи виконують поперечносмугасті м’язи. Процес жування має кілька фаз (мал. 222).
Жування — рефлекторний акт, який починається з рецепторів слизової оболонки. Імпульси від них передаються чутливими волокнами трійчастого нерва у довгастий мозок, до центру жування. Еферентними є рухові гілки трійчастого нерва. До жувального центру надходять імпульси від моторної зони кори великого мозку, завдяки чому процес жування можна свідомо коригувати.
Мал. 222. Запис періодів жування (мастикаціограма):
І—фаза спокою; II — фаза введення'ї?кі в рот; ПІ — орієнтовна фаза; IV — основна фаза; V — фаза формування харчової грудки і ковтання
Під час жування їжа переміщується, просочується слиною до такої консистенції, яка забезпечує можливість ковтання. Сформована грудка їжі проштовхується в початковий відділ глотки.
Ковтання — рефлекторний акт. Ковтальний рефлекс починається з подразнення рецепторів кореня язика, піднебіння, задньої стінки глотки. До центру ковтального рефлексу в довгастий мозок збудження надходить язикоглотковим нервом. Еферентними шляхами є під’язиковий, язикоглотковий, трійчастий та блукаючий нерви, що йдуть до м’язів ротової порожнини, язика, глотки та стравоходу.
Розпочинається процес ковтання за допомогою скорочення поперечносмугастих м’язів. Тому це керований процес. Глоткова і
стравохідна фази ковтання мимовільні. Глоткова фаза відбувається швидко, а стравохідна — повільно (мал. 223).
Завдяки координованому скороченню багатьох м’язів грудка їжі проштовхується у нижні відділи глотки, а потім у стравохід. На своєму шляху грудка їжі перетинає дихальні шляхи, але не потрапляє до них, оскільки при цьому рефлекторно піднімається м’яке піднебіння, закриваючи носову частину глотки, а надгортанник, опускаючись, перекриває вхід до гортані. Поза ковтальними рухами вхід у шлунок закритий завдяки сфінктеру, м’язи якого перебувають у спастичному стані. Коли перистальтична хвиля доходить до сфінктера, тонус м’язів кардіальної частини шлунка знижується і їжа потрапляє в порожнину шлунка.
Мал. 223. Зміна тиску за ходом травного каналу при ковтанні їжі
МОТОРНА ФУНКЦІЯ ШЛУНКА
Шлунок людини вміщує до 3 л їжі або рідини, тому він виконує функцію депо. 1<рім того, у шлунку продовжується механічна та хімічна обробка їжі. Перебуваючи у шлунку протягом кількох годин, їжа перемішується, набухає, розріджується. Деякі її компоненти розчиняються і піддаються гідролізу ферментами шлункового соку та слини.
Для повноцінного виконання функцій наступними відділами травного каналу потрібно, щоб хімус надходив туди порціями. Шлунок, входячи до складу органів травлення, виконує це завдання. Відповідно до функціонального призначення гладкі м’язи шлунка забезпечують депонування, перемішування й евакуацію хімусу.
М’язова оболонка шлунка складається з трьох шарів гладких м’язів. Зовнішній поздовжній шар розвинутий найбільшою мірою вздовж малої і великої кривизн. Середній коловий шар однаково добре представлений в усіх відділах. У ділянці воротаря шлунка волокна колового і поздовжнього шарів утворюють сфінктер.
Деякі м’язові клітини внутрішнього шару мають пейсмекерну активність. Локалізуються вони на великій кривизні у проксимальній частині тіла шлунка. У них мимовільно генерується ПД з частотою близько 3,2 за 1 хв, який поширюється по «провідній системі» — міоцитах внутрішнього шару. Міжм’язові контакти — нексуси — служать для об’єднання міоцитів у єдиний функціональний синцитій.
Виникнення ПД у пейсмекерних клітинах зумовлене підвищенням концентрацій Са2+. Унаслідок цього активізуються кальмоду-лін і аденілатциклаза. Збільшення внутрішньоклітинної концентрації цАМФ супроводжується активізацією процесу видалення Са2+ із цитозолю. Після цього цикл повторюється. Оскільки іонний транспорт і утворення цАМФ енергомісткі процеси, то спонтанна електрична активність пейсмекерних клітин залежить від рівня АТФ у них.
Порожній шлунок має певний тонус, завдяки якому підтримується постійний внутрішньопорожнинний тиск. Під час їди відбувається релаксація гладких м’язів стінки. Тому надходження навіть великих порцій їжі мало впливає на внутрішньопорожнинний тиск. Релаксація забезпечується пластичністю волокон гладких м’язів, а також зниженням впливу блукаючого нерва.
Через деякий час після їди шлунок починає скорочуватись. Хвиля скорочення зароджується в ділянці розташування карді-ального водія ритму. Звідси скорочення поширюється зі швидкістю 10—40 см/с, поступово посилюючись, у напрямку до воротаря. У процесі таких скорочень, які повторюються з інтервалом близько 20 с, їжа, яка міститься біля стінки шлунка, просувається до
антрального відділу. Скорочення, як правило, мають неоднакові силу й тривалість. Можна виділити хвилі трьох типів. Перший тип — хвилі з низькою амплітудою тривалістю 5—20 с, другий — з дещо вищою амплітудою тривалістю 12—60 с. Ці хвилі утримують тонус шлунка на певному рівні і сприяють повільному перемішуванню їжі, що міститься біля його стінки, з шлунковим соком. Вони звичайно затухають у відділі воротаря. Хвилі третього типу характерні в основному для цього відділу. Вони мають високу амплітуду, носять пропульсивний характер і сприяють евакуації хімусу у дванадцятипалу кишку.
Протягом першої години після їди перистальтичні хвилі слабкі. Потім вони посилюються. При цьому передусім до воротаря надходить та частина їжі, яка містилась біля стінки шлунка, отже насичена шлунковим соком значно краще, ніж решта вмісту. Якщо у шлунок надійшло досить багато їжі, то внутрішні шари її протягом 4—6 год можуть лишатися не обробленими шлунковим соком. Вони евакуюються в останню чергу. Рідка їжа видаляється із шлунка значно швидше.
Позаяк основним іоном, що стимулює процеси збудження і скорочення гладких м’язів шлунка, є Са2+, швидкість зростання концентрації його у міоплазмі впливає на силу і частоту хвиль перистальтики. Тому, як правило, всі чинники, які збільшують пропускну здатність Са2+-каналів, посилюють скорочення шлунка. Регулятори, котрі зумовлюють зниження швидкості трансмембранного обміну Са2+, гальмують моторну функцію.
Ритм активності місцевого пейсмекерного водія модулюється під впливом механізмів нейрогормональної регуляції. Подразнення рецепторів ротової порожнини, стравоходу, шлунка, кишок та ряду інших органів супроводжується відповідними рефлексами. Через посередництво периферичних і центральних утворень ВНС імпульси парасимпатичними і симпатичними нервами досягають гладких м’язів шлунка. Рухи шлунка стимулює парасимпатичний нерв. Завдяки взаємодії ацетилхоліну і м-холінорецепторів збільшується потік Са2+.
У складі постгангліонарних волокон блукаючого нерва виявлено закінчення, що виділяють аденозин. На відміну від ацетилхоліну аденозин, взаємодіючи зі специфічними рецепторами, прискорює вихід Са2+ із міоцитів і забезпечує розслаблення шлунка, підтримуючи оптимальну базальну релаксацію його.
Симпатичний нерв, навпаки, гальмує перистальтику. Постганг-ліонарні симпатичні волокна закінчуються як на інтрамуральних гангліях, так і на міоцитах. Це визначає механізм гальмування. Так, вплив на нейронні структури супроводжується гальмуванням норадреналіном дії ацетилхоліну на них. У міоцитах норадреналін гальмує процес розщеплення глікогену. Це супроводжується зниженням рівнів АТФ і Са2+.
У регуляції моторної функції шлунка беруть участь гастроін-тестинальні гормони, інші біологічно активні речовини і продукти гідролізу їжі. Моторну функцію стимулює гастрин, хОлецисто-кінін — панкреозимін, мотилін, серотонін, інсулін. Гастрин, ХЦК-ПЗ впливають переважно на шлунковий пейсмекер, а мотилін — на відділ воротаря. Ацетилхолін підвищує чутливість міоци-тів шлунка до мотиліну. Моторна функція шлунка гальмується секретином, ШШ, ВІП. Продукти гідролізу жиру при надходженні у кров також гальмують моторну функцію.
Таким чином, регуляція моторної функції шлунка забезпечується комплексом нейрогуморальних чинників, які взаємодіють у природних умовах.
Посилення моторної функції після прийняття їжі розпочинається за участю п. уарщз, потім приєднуються гормональні регулятори. З виходом їжі з шлунка припиняється подразнення нервових закінчень і поступово знижуються гуморальні впливи. Внаслідок цього відновлюється рівень базальної активності м’язового апарата шлунка.
Перехід хімусу
в дванадцятипалу кишку
Зі шлунка хімус окремими порціями евакуюється в дванадцятипалу кишку. Хімус, багатий на вуглеводи, евакуюється швидше, а багатий на жири — найповільніше.
У дітей перших місяців життя евакуація вмісту шлунка сповільнена. У разі штучного годування ще більше затримується надходження їжі у дванадцятипалу кишку.
У переході порцій харчового хімусу в кишки важливу роль грає сфінктер воротаря. Але й при його видаленні швидкість евакуації їжі мало чим відрізняється від нормальної.
Процес переходу хімусу регулюється комплексом механізмів. Передусім має значення пропульсивна перистальтика шлунка, завдяки якій створюється високий тиск у відділі воротаря. Що більший градієнт тиску між шлунком і кишкою, то швидше евакуюється вміст воротаря. Порожня дванадцятипала кишка прискорює евакуацію. Прояв названих механізмів зумовлений узгодженим впливом механорецепторів шлунка (прискорення) і дванадцятипалої кишки (сповільнення).
Важлива роль у регуляції евакуації належить також узгодженій дії хімічних агентів їжі та гастроінтестинальних гормонів. У разі наявності в дванадцятипалій кишці хлористоводневої кислоти та жирів гальмується евакуація зі шлунка. Надходження жирів і кислого шлункового хімусу зумовлює вивільнення секретину, холецистокінінупанкреозиміну і шлункогальмівного пептиду. Усі ці чинники сповільнюють евакуацію шлункового вмісту. Просу
вання жирного або кислого хімусу з дванадцятипалої кишки, нейтралізація його кишковим соком полегшують відкриття сфінктера і надходження нової порції шлункового вмісту. Прискорюють евакуацію хімусу також мотилін і соматостатин.
Блювання
Блювання — складний рефлекторний акт, спрямований на видалення шлункового вмісту через стравохід і ротову порожнину. Захисний блювотний рефлекс виникає внаслідок подразнення рецепторів кореня язика, глотки, слизової оболонки шлунка, кишок. Від цих органів через різні аференти надходять сигнали до центру блювання, розташованого у ретикулярній формації довгастого мозку. Еферентні імпульси йдуть волокнами блукаючого і черевного нервів до м’язів стравоходу, шлунка, кишок, а через рухові нерви — до м’язів живота й діафрагми. Спричинюють блювання й деякі речовини (наприклад, апоморфін), що з кров’ю досягають відповідного центру. Блювання можуть зумовити імпульси від вестибулярного аналізатора і навіть умовнорефлекторні механізми.
Акту блювання передують нудота, слиновиділення, повільне й глибоке дихання, потовиділення і звужування судин. Він розпочинається з антиперистальтичних рухів кишок, шлунка. Внаслідок скорочення діафрагми і м’язів черевного пресу при закритих дихальних шляхах і розслабленому стравоході вміст шлунка викидається назовні.
МОТОРНА ФУНКЦІЯ ТОНКОЇ кишки
Завдяки рухам тонкої кишки порції хімусу перемішуються із соком підшлункової залози, жовчю і секретами кишкових залоз. Переміщування здійснюється за рахунок перистальтики, ритмічної сегментації та маятникоподібних рухів. Скорочення кишок відбувається на тлі певного тонусу стінок (мал. 224).
Ритмічна сегментація полягає в скороченні циркулярного шару м’язів на ділянках завширшки 1—1,5 см, віддалених одна від одної на 15—20 см. Для маятникоподібних рухів характерне, навпаки, скорочення невеликої ділянки поздовжніх м’язів, завдяки чому стінка кишки зміщується стосовно хімусу. При поперемінному повторенні вказаних скорочень хімус переміщується вперед-назад, ретельно перемішуючись.
Просувається хімус завдяки перистальтичним рухам, які виникають при узгодженому скороченні циркуляторних і поздовжніх м’язових шарів. При цьому вище від хімусу утворюється своєрідне звуження, а нижче — розширення порожнини кишки. Такі хвилеподібні рухи можуть поширюватися на відносно невеликий відрізок кишки, просуваючи в напрямку до ануса поверхневі шари хі-
Мал. 224. Види скорочень тонкої кишки:
1 — перистальтика; 2 — ритмічна сегментація: 3 — З — маятникоподібні рухи
Мал. 225. Місцевий рефлекс регуляції скорочень тонкої кишки:
/ — слизова оболонка; 2— підслизова оболонка; 3—м’язова оболонка; 4 — хімус; 5 — рецептор; 6 — аферентний нейрон; 7 — ганглій;
8 — еферентні нейрони; 9 — аксон нейрона з ЦНС; 10 — ділянка розслаблення м’язів; 11 — ділянка скорочення м’язів
мусу. Оскільки майже всі харчові речовини всмоктуються у тонкій кишці, у товсту кишку надходять лише залишки харчового хімусу. Це відбувається за допомогою хвиль перистальтики. Вони з’являються наприкінці травлення, поширюючись уздовж усієї тонкої кишки. Внаслідок цього перші порції хімусу надходять у товсту кишку через 3,5—4 год, а через 8—10 год після їди перехід хімусу в товсту кишку завершується.
Крім того, протягом усього процесу травлення спостерігаються скорочення і розслаблення ворсинок кишок. Це забезпечує контакт їх із новими порціями хімусу, поліпшує всмоктування і відтік лімфи.
Моторна функція кишок здійснюється під впливом комплексу регуляторних механізмів. По-перше, гладким м’язам стінки кишок властивий автоматизм, обумовлений спонтанною деполяризацією пейсмекерних клітин. Ритміка скорочень створюється двома «вузлами», один з яких локалізується в ділянці впадіння жовчної протоки у дванадцятипалу кишку, другий — у клубовій кишці.
Рефлекторну регуляцію моторної функції здійснює головним чином міжм’язове сплетіння у відповідь на розтягування стінки
кишки хімусом. Місцеві рефлекторні дуги забезпечують координоване скорочення поздовжніх і циркулярних шарів м’язів (мал. 225). Цікаво, що коли вирізану ділянку кишки вшити знову, помінявши при цьому оральний і анальний краї, то попередній напрям перистальтики вшитого відрізка збережеться, і харчова грудка затримуватиметься вище від нього.
Автоматизм і місцеві рефлекси коригуються вищерозташованими центрами вегетативної нервової системи і гормональними чинниками. Парасимпатичні нерви переважно збуджують скорочення тонкої кишки, а симпатичні — гальмують. Посилюють моторну функцію вазопресин, окситоцин, брадикінін, серотонін, гістамін, гастрин, мотилін, ХЦК-ПЗ, речовина Р, а також кислоти, основи, продукти травлення.
Рух ворсинок регулюється підслизовим нервовим сплетінням. Під впливом кислого хімусу в слизовій оболонці кишки утворюється гормон вілікінін, що посилює рух ворсинок.
МОТОРНА ФУНКЦІЯ ТОВСТОЇ КИШКИ
Неперетравлені у тонкій кишці рештки хімусу (за добу їх збирається 300—500 мл) надходять через ілеоцекальну заслінку в сліпу кишку. В товстій кишці хімус концентрується шляхом всмоктування води. Тут продовжується також всмоктування електролітів, водорозчинних вітамінів тощо. Формуючись, калові маси поступово рухаються до прямої кишки.
Моторна функція товстої кишки забезпечує депонування калу. Харчовий хімус проходить увесь травний канал за 2—3 доби. Більшу частину часу він перебуває в товстій кишці. Зовнішній поздовжній шар м’язів має вигляд смуг і перебуває у постійному тонусі. Завдяки скороченню окремих частин циркуляторного м’язового шару створюються складки (гаустри). Звичайно хвилі повільно проходять товстою кишкою: 3—4 рази за добу виникає сильна пропульсивна перистальтична хвиля, яка проштовхує вміст у каудальному напрямі. Ці рухи зв’язують зі шлунково-ободовим рефлексом (вони часто спостерігаються після їди).
Місцеве розтягування товстої кишки також супроводжується перистальтичними скороченнями. Механічні та хімічні подразники підвищують рухову активність і прискорюють проходження хімусу кишкою. Тому рослинна клітковина, яка погано перетравлюється, стимулює перистальтику.
Регуляція руху товстої кишки відбувається головним чином інтрамуральними нервовими сплетіннями. Корекція місцевих рефлексів відбувається вищерозташованими центрами ВНС. Парасимпатичні нерви стимулюють, а симпатичні гальмують моторну функцію товстої кишки.
ДЕФЕКАЦІЯ
За добу утворюється 100—200 г калу, до складу якого входить 75—80 % води. Сухий залишок містить целюлозу та інші непере-травлені речовини, 10—ЗО % бактерій, 10—15 % неорганічних речовин, близько 5 % жиру, слизу, злущеного епітелію. Колір калових мас зумовлений продуктами розкладу жовчних пігментів, а запах — сірководними органічними кислотами.
Дефекація — рефлекторний наслідок подразнення рецепторів прямої кишки калом, якщо тиск досягає ЗО—40 мм рт. ст. (3,9— 4,9 кПа). Сфінктери (внутрішній складається з гладких м’язів, зовнішній — із поперечносмугастих) закривають вихід із кишки. При скороченні м’язів кишок та розслабленні м’язів сфінктерів кал виходить назовні. Цей процес посилюється завдяки скороченню м’язів черевного преса та діафрагми, внаслідок чого тиск у черевній порожнині значно підвищується.
Дуга рефлексу дефекації замикається в попереково-крижовому відділі спинного мозку. Через парасимпатичні впливи тонус сфінктера гальмується і стимулюється моторика кишок, симпатичні впливи дають протилежний ефект. Цей рефлекс мимовільний, але на нього впливають вище розташовані центри — довгастий мозок, гіпоталамус, кора великого мозку. Таким чином рефлекс затримується.
ВСМОКТУВАННЯ
Під всмоктуванням у травному каналі розуміють перехід речовин із порожнин цього каналу у внутрішнє середовище організму, тобто в кров або лімфу. Роль відділів травного каналу в процесі всмоктування різна. Слизовою оболонкою рота всмоктуються переважно деякі лікарські препарати (валідол, нітрогліцерин тощо) і вже через кілька хвилин викликають ефект. Дуже швидко (протягом секунд) тут всмоктуються деякі високотоксичні речовини, наприклад синильна кислота та її солі.
У шлунку всмоктуються алкоголь і невелика кількість інших речовин. У товстій кишці всмоктується вода і завершується всмоктування невеликої кількості продуктів гідролізу вуглеводів, білків та жирів. Завдяки цьому можуть всмоктуватись компоненти, які входять до складу живильних клізм (глюкоза, вітаміни, вода та ін.).
Всмоктування відбувається в основному в тонкій кишці, яка має довжину близько 3 м (дванадцятипала — приблизно ЗО см, порожня — 120 см, клубова — 130 см). Переважно речовини всмоктуються в порожній кишці,- а клубова кишка є резервною зоною. Завдяки складкам, ворсинкам і мікроворсинкам загальна поверх
ня, на якій відбувається всмоктування, значно більша (в 600 разів) від поверхні тонкої кишки і становить близько 200 м2.
Структурною основою всмоктування є ворсинка, вкрита ентеро-цитами, мембрана яких забезпечує заключний мембранний гідроліз поживних речовин та початкові етапи всмоктування. Кожна ворсинка має артеріолу, яка розгалужується на капіляри, вену, лімфатичну судину та гладком’язові клітини (завдяки ним ворсинки періодично скорочуються).
Протягом доби всмоктується кілька сотень грамів вуглеводів, близько 100 г жиру, 50—100 г білків, 7—8 л води, до 100 г різних електролітів. Але потенційні можливості всмоктування значно більші: може всмоктуватись кілька кілограмів вуглеводів, до 1 кг жиру, 0,7 кг білків, близько 20 л води.
Механізми всмоктування. Всмоктування відбувається завдяки пасивному транспорту речовин без затрат енергії (дифузія, осмос, фільтрація) і активному — з її витратами. Звичайно домінує один або кілька механізмів всмоктування.
Велика роль у процесах всмоктування належить інтенсивності кровотоку. Якщо до їди через слизову оболонку тонкої кишки протікало близько 200 мл крові за 1 хв, то в процесі травлення кровотік зростає до 500—600 мл за 1 хв. Завдяки цьому ентероцити забезпечуються енергією для активних процесів всмоктування, постійно підтримується градієнт кожної речовини між вмістом ворсинок і кров’ю. Одні речовини всмоктуються активно в ентероцит, а потім пасивно — в міжклітинну рідину і кров, інші проходять по проміжках між ентероцитами. Певне значення для переходу речовин через ентероцит має їх розчинність у ліпідах мембран.
Сполуки, які всмоктались у шлунку та тонкій кишці, відтікають через портальну вену в печінку і лише потім потрапляють у загальний кровообіг. Лише від слизової оболонки рота та від прямої кишки речовини відразу надходять у загальне русло, обминаючи печінку. Сюди ж вливається й лімфа, теж минаючи печінку.
ВСМОКТУВАННЯ води
Й МІНЕРАЛЬНИХ СОЛЕЙ
До органів травлення щодоби надходить близько 10 л води: 2— З л з їжою, від 6 до 7 л — з травними соками. З калом же виділяється лише 100—150 мл її. Основна маса води всмоктується у тонкій кишці. Незначна кількість води всмоктується у шлунку та товстій кишці.
Вода всмоктується переважно у верхніх відділах тонкої кишки завдяки осмосу, якщо осмотичний тиск хімусу нижчий, ніж плазми крові. Вода легко проникає через бар’єр за осмотичним градієнтом. А якщо у дванадцятипалій кишці міститься гіперосмотичний хімус, то вода з ^деові надходить сюди. Всмоктування вуглеводів,
Мал. 226. Схема всмоктування №+
амінокислот, а особливо мінеральних солей сприяє одночасному всмоктуванню води. Разом із водою всмоктуються й водорозчинні вітаміни. Тому всі чинники, які порушують процес всмоктування харчових речовин, утруднюють і водний обмін організму.
Вирішальна роль у перенесенні води через мембрани і міжклітинні проміжки належить іонам №+ і С1~.
Можна виділити два етапи транспорту N3+ (мал. 226). На ба-золатеральних мембранах ентероциту активно функціонує енерго-залежний №+-/К+-насос. Цій мембрані властива висока активність Ца+-, К+-АТФ-ази. Завдяки такому насосу в клітині підтримується досить низька концентрація Ца+. Біля апікальної мембрани створюється значний концентраційний градієнт №+, завдяки якому цей іон через апікальну мембрану пасивно переходить із хімусу в ентероцит. Крім концентраційного має значення й електричний градієнт — різниця електричних потенціалів в середині клітини і зовні її. За №+ за електрохімічним градієнтом надходять іони
СІ- і НСОз • У кишках відбувається також і обмінна дифузія Ца+ на К+, С1~ на НСОГ.
Мінералокортикоїд альдостерон поліпшує всмоктування N3+ і Н2О. Абсорбція Ца+ посилюється і під впливом кортикостероїдів.
Двовалентні іони всмоктуються повільніше від одновалентних, а Са2+ — швидше, ніж М^2+. Багато двовалентних іонів всмоктуються активно за допомогою транспортних систем. Функціональна активність цих систем контролюється відповідними механізмами регуляції. Так, Са2+ всмоктується загалом активно — залежно від потреб організму. Для переносу його потрібні вітамін Ц, білок, який зв’язує Са2+. При цьому процес всмоктування Са2+ залежить від співвідношення гормонів гіпофіза, надниркових залоз і (особливо) щитовидної (кальцитонін) та прищитовидної (паратгормон)
залоз.
М§2+ всмоктується тими ж системами, що й Са2+, і вони взаємно конкурентні. Залізо, всмоктуючись активно, в ентероцитах з’єднується з транспортним білком — апоферитином. Звичайно всмоктується невеликий процент заліза, яке міститься в їжі, але при інтенсивному кровотворенні у зв’язку з ростом потреб організму в цьому мікроелементі процес всмоктування посилюється.
ВСМОКТУВАННЯ ВУГЛЕВОДІВ
Вуглеводи всмоктуються у вигляді моносахаридів. Найактивніше всмоктуються глюкоза і галактоза. їх всмоктування забезпечується тісно пов’язаним із №+ трансмембранним транспортом. У апікальній мембрані міститься особливий білок — переносник Ца+ та глюкози. Він має два місця — на одне «сідає» Ца+, на друге — глюкоза. На внутрішній поверхні мембрани переносник звільняється від №+ і глюкози і повертається назад. Це вторинний активний транспорт глюкози.
№+ спочатку за градієнтом концентрації досягає базолате-ральної мембрани, а потім відкачується насосом. Глюкоза переходить через безолатеральні мембрани за концентраційним градієнтом.
У разі відсутності №+ або при блокаді насоса глюкоза всмоктується у 100 разів повільніше. При цьому, певно, «працює» механізм простої дифузії. Шляхом простої дифузії у клітини надходить манноза, а шляхом полегшеної — фруктоза.
У різних відділах тонкої кишки швидкість всмоктування глюкози неоднакова. У порожній кишці вона у 3 рази вища, ніж у клубовій. На швидкість всмоктування вуглеводів впливає дієта. Деякі амінокислоти гальмують всмоктування глюкози, а глюкокортикоїди, тироксин, інсулін, серотонін посилюють його. Гістамін і со-матостатин гальмують всмоктування. Парасимпатичні нерви стимулюють, а симпатичні гальмують цей процес.
ВСМОКТУВАННЯ БІЛКІВ
Продукти гідролізу білків всмоктуються у вигляді вільних амінокислот, дипептидів та трипептидів.
Амінокислоти й олігопептиди всмоктуються головним чином шляхом зв’язаного з №+ вторинного активного транспорту. Кількість амінокислот, що всмоктується шляхом простої дифузії, незначна.
Швидкість всмоктування різних амінокислот різна. Так, найшвидше всмоктуються аргінін, метіонін, лейцин, а дещо повільніше — аланін, серин, глутамінова кислота. Ь-Форми амінокислот всмоктуються активніше, ніж Ц-форми.
Розрізняють п’ять білків-переносників у апікальній мембрані ентероциту: для основних, кислих, нейтральних, 0- та у-амінокис-лот і для проліну. Кожен із них переносить лише один тип амінокислот.
Шляхом вторинного активного транспорту в середину ентеро-цитів може також надходити деяка кількість олігопептидів. Тут вони під впливом пептидаз цитозолю розщеплюються до амінокислот.
Через базальну та латеральну мембрани амінокислоти за градієнтом концентрації переходять у міжклітинну рідину, а потім у кров. Через слизову оболонку тонкої кишки всмоктується незначна кількість деяких невеликих пептидів. Це особливо виражено у новонароджених, коли ще не досить активні протеолітичні ферменти шлунка та підшлункової залози. Всмоктування відбувається шляхом піноцитозу. Таким чином у організм дитини з молоком матері надходять антитіла, що забезпечують імунні реакції.
Продукти гідролізу білка, всмоктавшись у кров, потрапляють у ворітну вену, що впадає в печінку. Цей орган відіграє істотну роль у процесах, пов’язаних із всмоктуванням продуктів гідролізу білка. Якщо в експерименті виконати операцію накладання порто-кавального анастомозу (ворітну вену з’єднують із нижньою порожнистою, внаслідок чого кров із ворітної вени надходить в організм, минаючи печінку), то це призведе до швидкої загибелі тварини. Причиною її смерті є надходження в організм токсичних продуктів гідролізу білка (індол, скатол та ін.). Звичайно в печінці ці токсичні речовини знешкоджуються, тобто печінка таким чином відіграє захисну роль.
ВСМОКТУВАННЯ ЖИРІВ
Жири всмоктуються в проксимальних відділах тонкої кишки. Продукти гідролізу жиру — жирні кислоти, моногліцериди, фосфо-ліпіди, холестерин — утворюють разом із солями жовчних кислот у порожнині кишки міцели діаметром близько 3 нм (мал. 227). Гідрофобне ядро міцели оточене зовні гідрофільною оболонкою із солей жовчних кислот. Коли міцела контактує з апікальною мембраною ентероцита, солі жовчних кислот залишають міцелу, виконавши транспортну роль. Без жовчних кислот всмоктується лише 50—60 % жирів.
Інші складові частини міцели шляхом дифузії проникають у ентероцит, і в його ендоплазматичній сітці та пластинчастому комплексі (апараті Гольджі) відбувається синтез нових триглі-церидів, притаманних даному організму. Тут утворюються хіло-мікрони — дуже дрібні структури, до складу яких, крім триглі-церидів, входять фосфоліпіди, холестерин та інші ліпіди. Хіло-мікрони вкриті ззовні ліпопротеїновою оболонкою. З ентероцитів хіломікрони проникають у лімфатичні судини шляхом піноцитозу. Вони проходять між клітинами. Таким чином, у лімфу потрапляє 80—90 % жиру, що всмоктався. В хіломікронах виявляють довго-ланцюгові жирні кислоти. Через 3—4 год після вживання жирної їжі, коли лімфа починає надходити в кров, плазма крові завдяки присутності хіломікронів стає подібною до молока.
Коротколанцюгові жирні кислоти краще розчиняються у воді і
Мал. 227. Схема всмоктування жиру: е. р.— ендоплазматична сітка; а. Г.— апарат Гольджі
всмоктуються в кров. На них припадає 10—20 % жиру, що всмоктався.
Секретин, ХТЦ-ПЗ, гормони кори надниркових, щитовидної залоз, гіпофіза посилюють всмоктування жиру. Парасимпатичні нерви стимулюють, а симпатичні гальмують цей процес.
Всмоктування жиророзчинних вітамінів (А, П, Е, К) зв’язане із всмоктуванням жирів.
РЕГУЛЯЦІЯ СИСТЕМИ ТРАВЛЕННЯ
У системі травлення відбуваються три взаємозв’язаних процеси — секреція, моторна функція та всмоктування. Кінцевим результатом діяльності системи травлення є надходження у внутрішнє середовище організму поживних речовин, води, вітамінів, електролітів та мікроелементів.
Натщесерце у стані спокою органів травлення виникає періодична їх діяльність, що проявляється скороченням шлунка та кишок, виділенням невеликої кількості шлункового соку, жовчі, со
ку підшлункової залози і кишок. У людини стан спокою триває близько 45—90 хв, а стан активності — 20—50 хв. Періодичну діяльність називають ще голодною періодикою, бо вона пов’язана з відчуттям голоду і стимулює пошук їжі.
їда впливає рефлекторно на проксимальні відділи органів травлення: розпочинається механічна обробка їжі в роті; посилюється секреція слинних залоз, залоз шлунка, підшлункової залози; виділяється в кишку жовч. Шлунок у цей час розслаблюється (харчова релаксація). Далі секреція, моторна функція та процес всмоктування регулюються нервовими та гуморальними впливами за участю зворотних зв’язків, які залежать від рецепції вмісту травного каналу, тобто його об’єму, консистенції, величини рН, гідростатичного та осмотичного тиску, температури, концентрації продуктів гідролізу різних речовин тощо. Це відбувається завдяки участі парасимпатичної, симпатичної нервової системи, а також численних гастроінтестинальних гормонів.
У ротовій порожнині вирішальне значення мають нервові рефлекторні механізми за участю ЦНС, а гуморальні та місцеві периферичні механізми майже не грають ролі. У шлунку, підшлунковій залозі поряд з рефлекторними механізмами значна роль належить гормональним впливам.
У тонкій та товстій кишках (за винятком кінцевого відділу) вплив центральних рефлекторних механізмів значно зменшується; зате збільшується роль місцевих рефлексів (метасимпатична система). В кінцевому відділі прямої кишки вирішальний вплив мають центральні рефлекторні механізми регуляції акта дефекації.
Для повноцінного травлення велике значення має своєчасний послідовний перехід вмісту травного каналу в наступний відділ. Це здійснюється за допомогою сфінктерів.
Гастроінтестинальні гормони беруть участь у регуляції всіх процесів, що відбуваються в травному каналі, але різною мірою. На табл. 20 показано характеристики деяких із них.
Названі гормони, всмоктуючись у кров, протягом кількох хвилин (це короткоживучі сполуки) впливають не тільки на органи травлення. Вони беруть участь у регуляції функцій ЦНС, ендокринних залоз, впливають на обмін речовин. Тому гормони органів травлення є повноправними регуляторами функцій всього організму.
Крім гастроінтестинальних гормонів, у травному каналі утворюються інші біологічно активні сполуки (кініни, простагландини), які беруть участь у регуляції процесів травлення. Вони впливають на кровотік, моторну функцію та секреторні процеси.
Деякі гормони травного каналу (гастрин, ХЦК-ПЗ, ВІП, субстанція Р, енкефалін, нейротензин) виявлені і в клітинах ЦНС. Тут, а також у структурах серцево-судинної системи, містяться
рецептори до гастроінтестинальних гормонів. У нейронних ланцюгах вони виконують функцію допоміжних медіаторів, модулюючи їх дію. Рецептори до вказаних пептидів виявлено на нейронних структурах органів травлення.
Отже, у травному каналі регуляторну функцію виконує складний комплекс біологічно активних сполук, власне гормонів, місцевих рефлекторних дуг та різні типи еферентних нервів (холінер-гічні, адренергічні, пуринергічні та ін.).
Органи травлення правильно функціонують завдяки складній системі регуляторних механізмів, що складаються із нервово-рефлекторних і гуморальних ланок. Ці механізми забезпечують процеси поєднання моторної функції, соковиділення, контролю за перетравлюванням і всмоктуванням речовин. Ще І. П. Павлов вказав на три типи ефекторних впливів регуляторних механізмів: функ-ціона.льний, судиноруховий й трофічний. Функціональний механізм полягає у. запуску або корекції тієї чи тієї основної активності органу, судиноруховий — у зміні рівня кровопостачання, приведенні його у відповідність із рівнем функціональної активності органа. Трофічним механізмом передбачені зміна трофічних процесів, приведення їх у відповідність до рівня функціонального стану органа.
Загальну закономірність впливу механізмів регуляції на функції травної системи можна сформулювати так: подразник (їжа, хімус) безпосередньо у місці дії і у каудальному напрямі посилює активність моторного і секреторного апаратів, сприяє процесу травлення і появі стану готовності (превентивний впливу. У краніальному напрямку, звідки їжа вже вийшла, навпаки, гальмуються всі процеси травлення. Але якщо їжа у будь-який відділ органів травлення надходить у малій кількості, не досить добре переробленою на попередньому етапі, то евакуація харчового хімусу затримується. При цьому зростає секреція соків тут і у вищероз-тащованих відділах, завдяки чому в міру можливості компенсується недостатність попереднього перетравлювання їжі.
Крім місцевих нервових сплетінь, рефлекторна регуляція травної функції здійснюється за дошжогою «мозкового» травного центру. Точно окреслити центр травлення важко. Для кожного відділу травного каналу він різний і може локалізуватися в різних відділах ЦНС, починаючи від кори великого мозку до сакрального відділу спинного мозку, де розташовані нейрони, що координують акт дефекації. Структури, пов’язані з відчуттям голоду і насичення, розташовані в гіпоталамусі, лімбічній системі, в ретикулярній формації і корі великого мозку. Ведуча роль в активізації функцій травного центру належить ядрам гіпоталамуса.
Еферентними нервами є симпатичні та парасимпатичні. Крім адренергічних і холінергічних рецепторів на мембранах нейронів і ефекторних клітинах Виявлено й пуринергічні рецептори (до аде-
оо ю
Таблиця 20. Основні властивості гастроінтестинальних гормонів
Гормон Локалізація, місце утворення Спосіб де ставлення гормона Характер впливу Примітка
Гастрин Воротар (О-клітини) Циркулюючий гормон Секреція НС1 шлунком; посилення моторної функції; трофічний вплив на слизову оболонку шлунка, тонкої кишки, підшлункову залозу Існує кілька форм пептидів. Один із них схожий на ХЦК-ПЗ
Секретин Дванадцятипала кишка, проксимальна частина порожньої киш* кн (8-клітИни) Те саме Секреція бікарбонатів у підшлунковій залозі; пригнічення секреції НС1 у шлунку; стимулювання секреції жовчі, кишкового соку Біологічно активний гормон
хцк-пз Дванадцятипала кишка, проксимальна частина порожньої (І-клітини) Моторна функція жовчного міхура, стимуляція жовчотво-рення, секреція ферментів підшлункової залози; трофіка підшлункової залози Біологічно активний С-кінцевий октапеп-тид
Панкреатичний поліпептид (ПП) Підшлункова залоза Бере участь у регуляції секреції НС1 у шлунку, виділенні соку підшлункової залози, у виділенні жовчі Біологічно активний С-кінцевий гектапеп-тид
Бомбезин Шлунок і тонка кишка Нейротрансмітер Стимулює секрецію НС1 і гастрину, соку підшлункової залози, виділення гастрину і хцк-пз
Соматостатин Підшлункова залоза (П-клітинн) Циркулюючий гормон, місцевий паракрин-ний ефект Гальмує шлункову і панкреатичну секрецію. Гальмує утворення гастрину, інсуліну і Виявлено також і гіпоталамусі
глюкагону
о • Енкефалін Воротар, дванадцяти- Нейротрансмітер пала кишка, підшлункова залоза Зниження секреції соків. Галь- Виконує функції ак-мування моторної функції тиноцицептора
ПІлуиково-таль-мівиий пептид (ШГП) Тонка кишка (К-клі- Циркулюючий гормон тини) Гальмування секреції НС1, стимуляція секреції соків тонкої кишки, творення інсуліну
Мотилін Дванадцятипала киш- Те саме ка, порожня кишка (Ес-клітини) Стимуляція евакуаторноі функції шлунка, перистальтики кишок
Нейротеизин Тонка кишка (ЬІ-клі- » тини) Гальмування • секреції НС1, У великій коицент-моторної функції шлунка, сти- рації спричинює ва» муляція панкреатичної секре* зодилатацію ції
Ентероглюкагон Тонка і товста кишки » (ЕО-клітини) Гальмування перистальтики, вплив на трофіку слизової оболонки тонкої кишки, посилення глікогенолізу
Вазоактивний ін-тестинальний пептид (В1П) Залози воротаря, тон- Нейротрансмітер кої кишки, підшлункової залози (Оі-клі-тини) Гальмування секреції НС1, стимуляція інтестинальної і панкреатичної секреції; вивільнення інсуліну: розширення судин
& 00 03 Субстанція Р Нейрони ЦНС і трав- Те саме ного каналу (Ес-клі-тиии) Стимуляція секреції соку під- Дуже поширений у шлункової залози, виділення ноцицептивних струк-слиии; посилення перисталь- турах ЦНС тики кишок, розширення судин
нозину і АТФ). Це свідчить про участь відповідних нервів у регуляції процесу травлення.
Процес травлення регулюється комплексом умовних і безумовних рефлексів. Безумовні рефлекси починають діяти у відповідь на подразнення різних рецепторів ротової порожнини та інших відділів травної системи. Ці рефлекси запускають не тільки рефлекси подразнюваного відділу травного каналу, але й інших відділів. Крім того, є ще одна закономірність, пов’язана з поширенням рефлекторної відповіді при подразненні рецепторів: а) що оральніше розташований рецептор, то більший відділ травного каналу залучається у відповідну реакцію; б) що далі розташований подразнюваний відділ, то його рефлекторний Вплив стає локальнішим. Наприклад, у кишках проявляються здебільшого місцеві рефлекси.
Умовні рефлекси формуються в процесі розвитку організму на вигляд, запах їжі, обстановку, час її прийняття. Ці рефлекси більше виражені у Верхній частині травного каналу. В міру віддалення від ротової порожнини значення їх поступово знижується. Так, найбільшою мірою регулюється виділення слини, дещо меншою — соку шлункових залоз, підшлункової залози. Практично від умовного рефлексу не залежить виділення соку кишковими залозами.
ВІДЧУТТЯ ГОЛОДУ ТА НАСИЧЕННЯ
Поява відчуття голоду зв’язана з формуванням збудження у нервових центрах. У гіпоталамусі експериментально виявлено структури, що належать до центрів голоду та насичення. Так, коли тварині ввести електроди в латеральні ядра гіпоталамуса і подразнювати їх, то розів’ється поліфагія (прийом надмірної кількості їжі): у зв’язку з появою голоду не тільки натщесерце, але й при повному шлунку тварина продовжуватиме їсти. Місце розташування електродів назвали центром голоду.
Подразнення вентромедіальної зони гіпоталамуса призводить до відмови від прийняття їжі (гіпофагія). Ці ядра називаються центром насичення. З гіпоталамічним харчовим центром тісно зв’язані нейрони мигдаликів і кіркові відділи лімбічної системи. Збудження цих ділянок супроводжується формуванням відповідних емоцій, які бувають при відчутті голоду та насичення. Завдяки активності вказаних відділів забезпечується й початок поведінко-вої реакції, спрямованої на пошуки їжі.
Харчовий центр збуджується під впливом комплексу різноманітних чинників. їх можна розподілити на дві групи: метаболіти крові і стан травного каналу.
Одним із механізмів, що викликають відчуття голоду, є скорочення порожнього шлунка, яке сприймається механорецепторами Стінки шлунка (мал. 228). Це важливий, але далеко не єдиний
Мал. 228. Схема виникнення відчуття голоду та насичення
чинник, оскільки після денервації шлунка або ж видалення його відчуття голоду зберігається. Відчуття голоду також залежить від концентрації в крові деяких речовин. Згідно з так званою глюко-статичною теорією, відчуття голоду настає внаслідок зниження в крові вмісту глюкози. Зниження його позначається на глюкоре-цепторах гіпоталамуса, с’инокаротидної зони та ін. Відповідно до іншої теорії, відчуття голоду зумовлюється зниженням у крові концентрації амінокислот, продуктів обміну ліпідів та інших речовин.
Відчуття насичення пов’язане з подразненням рецепторів органів травлення, зокрема шлунка та дванадцятипалої кишки. Особливо помітну роль відіграє їх наповнення, при якому пригнічується центр голоду. Нервові впливи передаються за допомогою аферентів блукаючого та симпатичного нервів. Гормон холецистокінін також зменшує відчуття голоду.
Розрізняють два види насичення — сенсорне (первинне) і обмінне (вторинне). Первинне насичення виникає внаслідок подразнення смакових, нюхових рецепторів, механорецепторів рота і шлунка. Воно виникає ще під час їжі. В цей час підвищується концентрація в крові глюкози, вільних жирних кислот, що надходять із депо.
Вторинне насичення виникає дещо пізніше, лише тоді, коли продукти гідролізу поживних речовин всмоктуються В кров та лімфу. В цей час деякі гормони (ХЦК-ПЗ, соматостатин, бомбезин, субстанція Р) посилюють насичення і знижують відчуття голоду. Навпаки, пентагастрин, інсулін, окситоцин активізують споживанг ня їжі.
▲ПЕТИТ
Під апетитом розуміють емоційний стан, що характеризується підвищеним прагненням до їжі. Апетит формується па підставі потреби організму в поживних речовинах і посилюється при дії пускових та обстановочних подразників (вигляд та запах їжі, сервірування столу, музика, квіти, відповідне оточення тощо). Він залежить від національних та індивідуальних особливостей харчування й істотно впливає на травлення (наприклад, на виділення апетитного, або «запального», шлункового соку). Апетит посилюється в перші хвилини прийому смачної їжі. Існує вибірковий апетит до певних харчових чи нехарчових речовин. Особливо він проявляється під час вагітності, коли підвищується потреба в солях кальцію.
Апетит може порушуватись у несприятливій для прийому їжі обстановці (брудний посуд, неприємний запах їжі, небажані «додатки» в їжі, негативні емоції тощо). Читання під час їжі, інші моменти, які відволікають увагу, також порушують апетит, особливо у дітей.
ВІКОВІ ОСОБЛИВОСТІ
СИСТЕМИ ТРАВЛЕННЯ
Особливості системи травлення в період онтогенезу
У внутрішньоутробний період розвитку основний тип живлення гематотрофний, при якому поживні речовини надходять до організму плода через плаценту. Плацентарна мембрана добре пропускає воду, глюкозу, амінокислоти, дипептиди та інші сполуки, потрібні для здійснення обмінних процесів у організмі плода. Більшість білків, ліпідів і полісахаридів у плаценті спочатку піддаються ферментативному гідролізу. У кров плода вони надходять у вигляді мономерів.
З 4—5 міс внутрішньоутробного розвитку починають діяти органи травлення. До гематотрофного живлення приєднується амніо-трофне — надходження навколоплідних вод. Амніотрофна рідина у органи травлення плода надходить при смоктальних, ковтальних і дихальних рухах. Протягом останнього місяця вагітності за добу плід поглинає близько 1 л рідини.
Ферментативна активність тонкої кишки формується раніше, ніж інших відділів. У період внутрішньоутробного розвитку поступово формується й ендокринний апарат системи травлення: збільшується кількість ендокринних клітин, у них підвищується вміст гастроінтестинальних гормонів.
Після народження дитини тип живлення стає лактотрофним.
Материнське молоко забезпечує організм, який посилено росте, пластичним і енергетичним матеріалом. З молоком надходять вітаміни, ферменти, мінеральні речовини, вода, біологічно активні сполуки тощо. Починаючи з 5—6 міс, у раціон немовляти вводять прикорм, а згодом дитину поступово переводять на дефінітивне харчування. Процеси поступового переходу від одного типу харчування до іншого визначаються етапами формування системи травлення і механізмів регуляції. У разі раннього застосування змішаного харчування прискорюється розвиток травної системи.
У гідролізі поживних речовин, що містяться в грудному молоці, беруть участь ферменти молока і залоз органів травлення дитини. Слина новонародженого служить головним чином для створення герметичності між соском і губами під час смоктання. Ферментативна активність слини незначна, але достатня для зсідання молока у шлунку. Амілаза, яка міститься в слині новонародженого, складає приблизно */з її активності у дорослих. Протягом перших 1—2 років ферментативна активність слини підвищується. Провідне значення для регуляції слиновиділення мають рефлекси з рецепторів язика і слизової оболонки рота. Умовний слиновидільний рефлекс формується на першому році життя.
Шлунок новонародженого має місткість 5—10 мл. До кінця року він поступово збільшується до 250—300 мл. Диференціація головних і парієтальних гландулоцитів відбувається ще у період-внутрішньоутробного розвитку. До того ж головні клітини починають функціонувати раніше від парієтальних: пепсиногени з’являються раніше, ніж хлористоводнева кислота. Секреція хлористоводневої кислоти залежить від типу харчування. У разі переведення на штучне вигодовування збільшується кислотність соку у 2—4 рази. З віком збільшується також і щільність залоз на поверхні слизової оболонки. Ферментативна активність соку залежить від типу харчування: у перші місяці практично не розщеплюються білки, які містяться в продуктах рослинного походження і м’ясі.
Довжина кишок у дітей стосовно довжини тіла більша, ніж у дорослих (у новороджених — у 8,3 разу, а у дорослих — у 5,4 разу). Секреторна активність підшлункової залози й печінки нижча, ніж у дорослих. Унаслідок цього на першому році життя переважає мембранне травлення. У ранньому віці проникність мембран тонкої кишки ще досить висока, тому деяка кількість високомоле-кулярних речовин їжі продовжує всмоктуватися і надходити у кровотік.
Заселення товстої кишки мікрофлорою відбувається вже протягом перших 2—4 діб життя. Нормальна мікрофлора бере участь у травленні, формуванні імунологічної реактивності, пригніченні розвитку патогенної мікрофлори, синтезує ряд вітамінів, інакти-вує ряд фізіологічно активних сполук.
На ранніх етапах розвитку формуються гормональні й місцеві системи регуляції секреторної активності і моторна функція органів травлення. Центральні нервово-рефлекторні механізми підключаються пізніше. Формування системи травлення завершується на час статевого дозрівання.
Особливості травлення при старінні
У похилому та старечому віці сповільнюються проліферація та визрівання епітелію системи травлення, знижується синтез ферментів, унаслідок чого погіршується гідроліз поживних речовин. Зменшуються проникність і транспортна активність мембран, порушуються також нервові та гуморальні механізми регуляції діяльності органів травлення.
Зміни в порожнині рота зв’язані з патологією зубів, унаслідок чого знижується ефективність жування, зменшується кількість смакових цибулин, отже, смакова чутливість, особливо на солодке. Зменшується секреція слини, тому частіше спостерігається сухість слизової оболонки рота. Порушується ковтання, бо сила м’язів глотки зменшується.
Стає меншою кількість шлункового соку, падає концентрація в ньому пепсиногенів і особливо хлористоводневої кислоти. Це пояснюється зниженням кількості парієтальних та головних клітин унаслідок атрофії слизової оболонки. Зміни моторної активності шлунка зумовлюють зниження тонусу та трофіки м’язів, а також перистальтики.
Відбуваються атрофічні зміни і в підшлунковій залозі: знижується її секреторна функція, спочатку стає менше ферментів, особливо протеаз і ліпаз, а потім — бікарбонатів. Знижується маса печінки, а отже й продукція жовчі. У жовчі стає менше жовчних кислої, фосфоліпідів, але більше холестерину. Гірше скорочується жовчний міхур, стає асинхронною діяльність сфінктерів жовчовивідних шляхів.
Зменшуються товщина слизової оболонки тонкої кишки, кількість ентероцитів, ворсинок, погіршуються проліферативні процеси в цій оболонці. Порушується виділення ферментів, особливо ліпаз. Тому в похилому і старечому віці гірше засвоюються молоко, жири. Пацієнти такого віку надають перевагу солодощам. З віком порушується процес всмоктування білків, жирів, меншою мірою — вуглеводів. Знижується тонус тонкої кишки, сповільнюються перистальтика і евакуація кишкового вмісту, частіше буває запор. У товстій кишці збільшується кількість мікроорганізмів, змінюється їх склад — підвищується кількість гнильних форм і зменшується число молочнокислих.
Істотну роль у порушенні функції системи травлення має по
гіршення кровопостачання її органів, яке спостерігається у літніх людей. Вказані зміни треба враховувати при складанні раціону харчування для людей похилого та старечого віку.
Система виділення
У процесі метаболізму утворюються речовини, які потрібно виводити із організму. Виділенню підлягають також деякі речовини, які .надходять з їжою або вводяться під час проведення лікувальних процедур. Серед вказаних метаболітів є газоподібні, рідкі і тверді речовини. У виведенні їх беруть участь багато органів: легені, шкіра, органи травлення, нирки. Таким чином ці органи беруть участь у підтримці гомеостазу.
НИРКИ
Найважливіша роль у видаленні продуктів життєдіяльності належить ниркам. Крім видалення шлаків, нирки виконують також функції щодо підтримки параметрів гомеостазу крові, регулювання кровообігу.
Функції нирок: 1) екскреція кінцевих метаболітів азотного обміну; 2) екскреція чужорідних речовин; 3) екскреція надлишку органічних та неорганічних речовин, які потрапляють з їжею або утворюються в процесі метаболізму; 4) підтримка осмотичного тиску крові на постійному рівні; 5) підтримка іонного балансу організму; 6) підтримка кислотно-основного стану організму; 7) участь у регулюванні кровообігу; 8) утворення біологічно активних речовин та ферментів (брадикінін, простагландини, урокі-нази, вітамін Бз, еритропоетини, ренін та ін.); 9) участь у регулюванні об’єму циркулюючої крові.
МОРФОФУНКЦІОНАЛЬНА
ХАРАКТЕРИСТИКА НИРОК
Структурно-функціональною одиницею нирки є н е ф р о н. У кожній нирці їх нараховується понад 1 млн. Залежно від місця розташування в нирці виділяють суперфіціальні (поверхневі), ін-тракортикальні і коломозкові нефрони (мал. 229). Незважаючи на деяку різницю, схема будови та функції нефронів однакові.
Нефрон складається з судинного клубочка, капсули ниркового клубочка (капсули Шумлянського—Боумена) та ниркових канальців. Судинний клубочок включає в себе від 50 до 160 капілярів, на які розпадається приносна артеріола — уаз аїїегепз. Капіляри клубочка збираються у виносну артеріолу — уаз еПегепз. До капілярів прилягає внутрішня стінка двошарової капсули ниркового
Мал. 229. Схема нефронів різного типу (а) та особливості будови епітелію ниркових канальців (б):
а: 1 — кірковий нефрон; 2 — ниркова вена; 3 — збиральна трубочка; 4— пряма судина; 5 — петля Генле; 6 — юкстамедулярний нефрон; 7 — міжчасточкова артерія; б: / — проксимальний авитнй канадець; 2 — дистальний ваитий канадець; 3 — висхідне коліно петлі Генле; 4 — низхідне коліно петлі Генле; 5 — збиральна трубочка
клубочка. Простір між двома шарами капсули сполучається з просвітом канальця.
Канальці починаються проксимальною звивистою частиною, яка переходить у низхідний відділ петлі нефрона (петлі Генле). Висхідний відділ петлі чнефрона піднімається до рівня капілярів свого ж нефрона, де переходить у дистальний звивистий канадець. Початкова частина цього відділу доторкується до клубочка між приносною і виносною артеріолами. Дистальний звивистий канадець переходить у збиральну трубку, яка починається в кірковій речовині нирки, спускається в мозкову речовину, де і зливається з іншими канальцями. Діаметр капсули ниркового клубочка становить близько 0,2 мм, а довжина канальців одного нефрона — близько 35—50 мм.
Нефрони відрізняються між собою не лише розташуванням, а й деякими особливостями канальців. Так, розташовані ближче до
капсули, суперфіціальні нефрони мають більших розмірів клубочки та коротку петлю нефрона з поворотом на межі кіркової та мозкової речовин. Розташовані на межі цих шарів нирки білямоз-кові клубочки мають довгу петлю нефрона, яка досягає майже кінця сосочка нирки.
Від розташування кожної із частин нефрона залежить їх функція.
Кровопостачання нирки характеризується тим, що кров, яка тече через них, використовується не тільки для підтримання трофіки органа, але й для сечотворення. Тому кровоносні судини, забезпечуючи процес творення сечі, при виконанні функції відповідними відділами нефрона тісно взаємодіють з кожним відділом нефрона в кожній частині. Капіляри клубочків не виконують трофічної функції. Кров, яка виходить з капсули, залишається артеріальною, тобто містить практично стільки ж газів, скільки й та, що надходить. Виносна артеріола в кірковій речовині нирки знову розпадається на капіляри. Навколо звивистих частин канальців, розташованих у кірковому відділі, утворюється густа мережа капілярів. На відміну від цього капіляри, які супроводжують ка-нальці мозкового шару нирки, утворюють прямі судини, котрі рідко розгалужуються. Ці капіляри беруть участь у процесі сечотворення і виконують трофічну функцію.
Кровопостачання нирки за інтенсивністю нагадує кровопостачання ендокринних залоз. У нормі у дорослої людини через нирки проходить до 25 °/о крові, яка викидається серцем (1000— 1200 мл/хв). При йасі обох нирок 300 г питомий кровообіг через них складає 4 мл/(хв-г). Таке багате кровопостачання забезпечується завдяки анатомічним особливостям ниркових артерій, які відходять від черевного відділу аорти у вигляді короткого товстого стовбура. За рахунок невеликої довжини розгалужень ниркових артерій забезпечується високий тиск у капілярах клубочків (65— 70 мм рт. ст.). Підтримці високого тиску сприяє і менший діаметр виносної судини, яка забезпечує підвищений опір кровообігу. Такий рівень тиску потрібен для здійснення першої фази процесу сечотворення — фільтрації.
СЕЧОТВОРЕННЯ
Процес сечотворення відбувається при взаємодії усіх структур нефрона і капілярів. Можна виділити 3 основні фізіологічні процеси, які відбуваються в комплексі і забезпечують утворення кінцевої сечі: клубочкова фільтрація, канальцева реабсорбція та секреція.
Клубочкова фільтрація
Кров, яка тече по капілярах клубочка, від фільтрата, який міститься в порожнині між двома листками капсули ниркового клубочка, відокремлює ниркова мембрана, що складається з 3 шарів: ендотелію, базальної мембрани і епітеліальних клітин — подоци-тів (мал. 230). За допомогою електронної мікроскопії виявлено, що всі ці утворення мають «вікна», через які можуть легко проходити вода і більшість розчинених у плазмі речовин.
Круглі або овальні отвори ендотелію капілярів займають до ЗО % площі мембрани. Подоцити епітелію внутрішнього шару капсули переплітаються відростками, між якими також утворюються широкі щілини. Отвори ендотеліальних клітин та простори між відростками подоцитів закриті тонкими діафрагмами, які обмежують проходження білків. Найменш проникною є базальна мембрана. Вона утворюється мережею колагенових волокон. Проміжки між ними становлять приблизно 3—7,5 нм.
Сумарне «сито» мембрани капсули добре проникне для речовин, які мають молекулярну масу менше за 5500. Проходження молекул утруднене не тільки через їх розміри, але й через негативний заряд стінки пор і одноіменний заряд молекули. У нормі молекулярна маса становить 80 000. Це абсолютна межа для проходження частин через пори. В цьому проміжку молекули філь
Мал. 230. Схема будови ниркового клубочка та фільтруючої мембрани: у —приносна артеріола; І—виносна артеріо-ла- з — просвіт капсули; 4 — початок прокси-ма'льного канальця; 5 — капсула Боумена
труються тим меншою мірою, чим більший їх розмір. Так, фільтраційна спроможність гемоглобіну (молекулярна тиаса 64 500) складає близько 3 %, а альбуміну (молекулярна маса 69 000) — менше за 1 % • Природно, що при ураженні гломерулярних відділів нирки проникність їхнього фільтру змінюється і у сечу можуть потрапити білки і навіть клітини крові.
Таким чином, в умовах фізіологічної норми розміри пор визначають склад клубочково-го фільтру. В нормі у фільтраті можна виявити майже всі речовини, які містяться в плазмі крові, за винятком білків великих розмірів. КІЛЬКІСТЬ фільтрату, швидкість його утворення залежать від ефек
тивного фільтраційного тиску та коефіцієнту фільтрації. Фільтрація відбувається без витрати енергії. Це пасивний вид транспорту речовини.
• Ефективний фільтраційний тиск ( ЕФТ) є сумою сил, які впливають на фільтрацію. Збільшує фільтрацію гідростатичний тиск (Рк) крові клубочка, протидіють цьому — онкотичний тиск крові (Ро) та гідростатичний тиск рідини, яка міститься в проміжку капсули (Рк):
ЕФТ = Рк — (Ро + Рк).
У звичайних умовах ЕФТ дорівнює: 65—(25 + 15) =25 мм рт. ст. (33 кПа).
Коефіцієнт фільтрації (КФ) залежать від проникності мембрани. При патології, коли збільшуються пори ниркового «сита», значно змінюється швидкість фільтрації:
ШФ = ЕФТ • КФ (мл/хв).
У чоловіків ШФ становить близько 125 мл/хв, а у жінок — 110 мл/хв з розрахунку на 1,73 м2 площі поверхні тіла. У фільтрат надходить приблизно '/б плазми, яка проходить через нирку. Внаслідок цього за добу утворюється 150—180 л фільтрату (первинної сечі). Тобто вся плазма крові очищається нирками 60 разів на добу.
На відміну від плазми фільтрат майже не містить білків. Крім того, в ньому трохи менше катіонів, які затримуються в плазмі у зв’язаному з білками стані. Виділення одновалентних іонів незначне, а двовалентних — істотне. Так, у плазмі зв’язані з білками до 40 % Са2+ та 25 % М^2+. Через це в плазмі кальцію міститься 2,5 ммоль/л, а у фільтраті —1,5 ммоль/л вільних іонів та 0,2 ммоль/л низькомолекулярних комплексів. _
У зв’язку із тим що КФ крові має велике значення для клубоч-кової фільтрації, стає зрозумілим, чому він повинен підтримуватися на постійному рівні. Але в житті навіть, у здорової людини процес фільтрації не завжди постійний. Він може змінюватись залежно від стану організму.
Канальцева реабсорбція
Первинна сеча, проходячи по канальцях та збиральних трубочках, перед тим як перетворитися на кінцеву сечу, зазнає значних змін. Різниця полягає не тільки в її кількості (із 180 л залишається 1—1,5 л), але й якості (табл. 21). Деякі речовини, потрібні організму, цілком зникають із сечі або їх стає набагато менше. Відбувається процес реабсорбції. Концентрація інших речовин у багато разів збільшується: вони концентруються при реабсорбції води. Ще інші речовини, яких взагалі не було в первинній сечі,
Мал. 231. Схема реабсорбції та секреції різних речовин у нефроні (за даними А. Везророиіоз, 81. ЗіІЬегпа-£е, 1986)
з’являються в кінцевій. Це відбувається в результаті їх секреції.
Процеси реабсорбції можуть бути активними або пасивними. Для здійснення активного процесу потрібно, щоб були специфічні транспортні системи та енергія. Пасивні процеси відбуваються, як правило, без витрати енергії за законами фізики і хімії.
Канальцева реабсорбція відбувається у всіх відділах, але її механізм у різних частинах неоднаковий. Умовно можна виділити З відділи: проксимальний звиви-
стий канадець, петля нефрона та дистальний звивистий канадець із збиральною трубочкою (мал. 231).
У проксимальних звивистих канальцях повністю реабсорбують-ся амінокислоти, глюкоза, вітаміни, білки, мікроелементи. В цьому ж відділі реабсорбується близько % води та неорганічних солей Па+, К+, Са2+, М^2+ , СІ-, НСОГ, тобто ті речовини, які потрібні організму для його діяльності. Механізм реабсорбції головним чином прямо чи посередньо пов’язаний з реабсорбцією №+.
Реабсорбція натрію. Більша частина Иа+ реабсорбується проти градієнту концентрації за рахунок енергії АТФ. Реабсорбція №+ здійснюється в 3 етапи: перенесення іона через апікальну мембрану епітеліальних клітин канальців, транспортування до базальної або латеральної мембрани та перенесення через зазначені мембрани в міжклітинну рідину і в кров. Основною рушійною силою реабсорбції є перенесення Иа+ за допомогою Г4а+, К+-АТФ-ази
Таблиця 21. Концентрація деяких речовин у плазмі крові та кінцевій сечі
Речовина Плазма Сеча Плазматичний кліренс за 1 хв
[\іа+, мекв/л 142 128 0,9
к+, мекв/л 5 60 1,2
СГ, мекв/л 103 134 1,3
Глюкоза, мг/мл 100 0 0
Сечовина 26 1820 70
Сечова кислота 3, 42 14
Креатинів 1,1 196 140
Білок, г/л 70—80 0 0
Мал. 232. Схема реабсорбції води та КаСІ (за даними К. Ріїїз).
Зліва: Ка пасивно проходить крізь апікальну мембрану (пунктирна стрілка) і активно— крізь латеральну мембрану в міжклітинний проміжок (темна стрілка). В проміжку підвищується осмотичний тиск і вода пасивно проходить слідом за N3^ та СІ
Справа: коли підвищується гідростатичний тиск в капілярі або знижується онкотичний тиск крові, перехід КаСІ і води в капіляр сповільнюються, латеральні проміжки розширюються і більше МаСІ та води повертається через міжклітинний проміжок в канадець: 1 — базальна мембрана, 2 — капіляр
через базолатеральну мембрану. Це забезпечує постійне відтікай-’ ня іонів з клітин. Унаслідок цього Иа+ за градієнтом концентрації за допомогою спеціальних утворень ендоплазматичного ретикулу-му надходить до мембран, повернутих до міжклітинного середовища (мал. 232).
Внаслідок цього постійно діючого конвейєра концентрація іонів в середині клітини і особливо поблизу апікальної мембрани стає значно нижчою, ніж з другого її боку. Це сприяє пасивному надходженню Иа+ в клітину по іонному градієнту. Таким чином, 2 етапи натрієвої реабсорбції клітинами канальців є пасивними і лише один, кінцевий, потребує витрат енергії. Крім того, частина Ма+ реабсорбується пасивно по міжклітинних проміжках разом із водою.
Глюкоза. Глюкоза реабсорбується разом із транспортом №+. В апікальній мембрані клітин є спеціальні трайспортери. Це білки з молекулярною масою 320 000, які в початкових відділах проксимального канальця переносять один На+ та одну молекулу глюкози (поступове зменшення концентрації глюкози в сечі призводить до того, що в наступній ділянці канальця для перенесення однієї молекули глюкози використовується вже два N3+). Рушійною силою цього процесу є також електрохімічний градієнт N3+. На протилежному боці клітини комплекс На — глюкоза — переносник розпадається на три елементи. Внаслідок цього звільнений переносник повертається на своє колишнє місце і знову набуває здатності переносити нові комплекси Иа+ та глюкози. В клі-
5 600
5 600 яз
І .
Фільтрація /Екскреція
0
Ш00-. Є І200-6
/ Реабсорбція
^НОКС
375 мг/хі
СКФ 125 млу>й
2 4...' 7 і
Глюкоза плазми, ме/мл
Мал. 233. Залежність реабсорбції та екскреції глюкози від її концентрації у крові (за даними XV. Р. Оа-поп£, 1979)
тині концентрація глюкози збільшується, завдяки чому утворюється градієнт концентрації, який спрямовує її до базально-латеральних мембран клітини та забезпечує вихід у міжклітинну рідину. Звідси глюкоза надходить у кровоносні капіляри і повертається в загальний кровообіг. Апікальна мембрана не пропускає глюкозу назад у просвіт канальця. Транспортні переносники глюкози містяться лише в проксимальному відділі канальців, тому глюкоза реабсорбується тільки тут.
У нормі при звичайному рівні глюкози в крові, а отже й концентрації ЇЇ в первинній сечі, реабсорбується вся глюкоза. Однак при підвищенні рівня глюкози в крові понад 10 ммол/л (близько 1,8 г/л) потужність транспортних систем стає недостатньою для реабсорбції.
Перші сліди нереабсорбованої глюкози в кінцевій сечі виявляються при перевищенні її концентрації в крові. Що вища концентрація глюкози в крові, то більша кількість нереабсорбованої глюкози.
До концентрації її 3,5 г/л це збільшення ще не є прямо пропор-ціональним, оскільки в процес ще не включається частина транспортерів. Але, починаючи з рівня 3,5 г/л, виведення глюкози із сечею стає прямо пропорціональним концентрації її в крові (мал. 233). У чоловіків повне навантаження системи реабсорбції спостерігається при надходженні 2,08 ммоль/хв (375 мг/хв) глюкози, а у жінок—1,68 ммоль/хв (303 мг/хв) з розрахунку на 1,73 м2 площі поверхні тіла.
При неушкоджених нирках поява глюкози в сечі, наприклад при цукровому діабеті, є наслідком перевищення порогової концентрації (10 ммоль/л) глюкози в крові.
Амінокислоти. Реабсорбція амінокислот відбувається за таким же механізмом, як і реабсорбція глюкози. Повна реабсорбція амінокислот відбувається вже в початкових відділах проксимальних канальців. Цей процес такб'ж пов’язаний з активною реабсорбцією N3+ через апікальну мембрану клітин. Виявлено 4 типи транспортних систем: а) для основних; б) для кислих; в) для гідрофільних; г) для гідрофобних амінокислот. Із клітини амінокислоти пасивно по градієнту концентрації проходять через базальну мембрану в міжклітинну рідину, а звідти — в кров. Поява амінокислот у сечі може бути наслідком порушення транспортних систем або дуже високої концентрації їх у крові. В останньому випадку може про
являтися ефект, який за механізмом нагадує глюкозурію — перевантаження транспортних систем. Інколи спостерігається конкуренція "Кислот одного типу за загальний переносник.
Білки. Механізм реабсорбції білків значно відрізняється від механізму реабсорбції описаних сполук. Потрапляючи в первинну <*ечу, невелика кількість білків у нормі майже повністю реабсорбується шляхом піноцитозу. В цитоплазмі клітин проксимальних канальців (білки розпадаються за участю лізосомальних ферментів. Амінокислоти, які утворюються, за градієнтом концентрації з клітини надходять у міжклітинну рідину, а звідти — в кровоносні капіляри. Таким шляхом може реабсорбуватися до ЗО мг білка за 1 хв. При ушкодженні клубочків у фільтрат потрапляє більше білків і частина їх може надходити в сечу (протеїнурія).
Реабсорбція води. Процеси реабсорбції води відбуваються в усіх відділах нефрона. Але механізми реабсорбції в різних відділах різні. У проксимальних звивистих канальцях реабсорбується близько 2/з води. Близько 15 % первинної сечі реабсорбується в петлі нефрона і 15 % — в дистальних звивистих канальцях та збиральних трубочках. У кінцевій сечі, як правило, залишається лише 1 % води первинного фільтрату. Причому в перших двох відділах кількість реабсорбованої води мало залежить від водного навантаження організму і майже не регулюється. В дистальних відділах реабсорбція регулюється залежно від потреби організму: вода, яка потрапила сюди, може затримуватися в організмі чи виводитися з сечею.
В основі реабсорбції води в проксимальних канальцях лежать процеси осмосу. Вода реабсорбується вслід за іонами. Основним іоном, який забезпечує пасивне всмоктування води, є N3+. Реабсорбція інших речовин (вуглеводів, амінокислот та ін.), яка здійснюється в цих відділах нефрона, також сприяє всмоктуванню води.
Реабсорбція води та електролітів у петлі нефрона (поворотно-протипоточний механізм). Унаслідок вказаних змін у петлю нефрона надходить сеча, яка є ізотонічною щодо навколишньої міжклітинної рідини. Механізм реабсорбції води та Па+ і СІ- у даній ділянці нефрона істотно відрізняється від такого у інших відділах. Тут вода реабсорбується згідно з механізмом поворотно-протипо-точної системи. В її основі лежать особливості розташування висхідних та низхідних частин у безпосередній близькості одна від одної. Паралельно до цього вглиб мозкової речовини йдуть збиральні трубочки та кровоносні капіляри.
Поворотно-протипоточний механізм визначається такими функціональними характеристиками нирок: а) що глибше в мозкову речоцину опускається петля нефрона, то вищим стає осмотичний тиск навколишньої міжклітинної рідини (з 300 мосм/л у кірковій речовині нирки до 1200—1450 мосм/л на верхівці сосочка); б) висхідний відділ не досить проникний для води; в) епітелій висхід-
ф Активний транспорт Пасивний транспмт М ОІИІН ЯГмК* сіп Н' "ф
Мал. 234. Поворотно-протипотоковий механізм
ного відділу активно, за допомогою транспортних систем, викачує N8+ та Сі- (мал. 234)>
Активне викачування №С1 з епітелію висхідного відділу зумовлює підвищення осмотичного тиску міжклітинної рідини. Завдяки цьому вода дифундує сюди з низхідного відділу петлі нефро--на. У початковий відділ низхідної частини надходить фільтрат, який має нижчий осмотичний тиск порівняно з навколишньою речовиною. Сеча у міру спускання по низхідному відділу, віддаючи воду, має постійний осмотичний градієнт між фільтратом і міжклітинною рідиною. Тому вода 'залишає фільтрат у ділянці низхідного коліна, чим забезпечується тут реабсорбція близько 15 % об’єму первинної сечі. Крім того, у формуванні осмолярності фільтрату в петлі нефрона певне
значення належить сечовині, яка може сюди потрапити при підвищенні її концентрації в паренхімі нирки.
У зв’язку з виходом води осмотичний тиск сечі поступово зростає і досягає свого максимуму в ділянці повороту петлі нефрона. Гіперосмотична сеча піднімається по висхідному відділу, де, як вказувалось вище, втрачає N3+ та Сі-, котрі виводяться завдяки активному функціонуванню транспортних систем. Тому в дистальні звивисті канальці фільтрат надходить навіть гіпоосмотичним (близько 100—200 мосм/л). Таким чином, у низхідному коліні відбувається процес концентрування сечі, а у висхідному — її розведення.
Особливості функціонування окремих нефронів багато в чому залежать від довжини петлі нефрона та вираженості низхідного та висхідного відділів. Що довше петля (юкстамедулярні нефро-ни), то більш виражені процеси концентрації сечі.
У дистальні звивисті канальці та збиральні трубочки найчастіше надходить близько 15 % об’єму первинного фільтрату. Але в кінцевій сечі, як правило, залишається лише 1 % первинного фільтрату. В перших двох відділах кількість реабсорбованої води мало залежить від водного навантаження організму і майже не регулюється (облігатна реабсорбція). У дистальних відділах реабсорбція регулюється з урахуванням потреб організ
му: вода, яка надійшла сюди, може затримуватися в організмі чи виводитися з сечею (факультативна реабсорбція). Регулюєтеся вона гормонами, утворення яких залежить від водного та іонного стану організму.
Канальцева реабсорбція та секреція
Ряд сполук, які мають бути виведені з сечею, можуть зазнавати як реабсорбції, так і секреції. Секреція— це процес, спрямований на активний перехід речовини з крові через клітини канальців у сечу. Вона може бути активною, тобто використовувати транспортні системи та енергію АТФ, і пасивною.
Сечовина — речовина, яка завдяки неполярності може проникати через клітинні мембрани. Вона вільно фільтрується в клубочках. Але коли створюється градієнт концентрації її між фільтратом і міжклітинною рідиною, яка оточує канальці, сечовина може пасивно реабсорбуватися. Інтенсивність цього процесу залежить .від градієнту концентрації та швидкості просування фільтрату по канальцях. Якщо внаслідок малої кількості фільтрату швидкість руху знижується, то реабсорбція сечовини збільшується. Навпаки, активізація процесу сечотворення сприяє виведенню сечовини з організму: рухаючись по сечобих шляхах, вона не встигає реабсорбуватися.
Сечовина може не тільки реабсорбуватися, але й секретуватися. Справжня реабсорбція сечовини відбувається головним чином у збиральних трубочках. Це збільшує концентрацію її в міжклітинній речовині, за рахунок чого вона по градієнту концентрації може секретуватися в попередній відділ нефрона — його петлю.
Слабкі органічні кислоти та основи підлягають, як і сечовина, реабсорбції та секреції. Основою взаємодії цих процесів є неіонна дифузія. Такі речовини в недисоційованому вигляді добре розчиняються в жирах і тому можуть дифундувати по градієнту концентрації. В іонізованому стані вони гірше проникають через мембрани і затримуються у фільтраті. Виходячи з цього, реабсорбція зазначених сполук визначається співвідношенням їх дисоці-йованого та недисоційованого стану в сечі. В свою чергу, ступінь дисоціації слабких кислот та основ значною мірою залежить від рН розчину. При відносно низьких значеннях рН слабкі кислоти містяться в сечі переважно в недисоційованому стані, а основи — в дисоційованому. У зв’язку з цим у кислій сечі швидкість реабсорбції слабких кислот збільшується, отже знижується швидкість їх виділення. У цих умовах швидкість реабсорбції слабких основ, навпаки, зменшується, а виділення — збільшується. В лужному середовищі спостерігається зворотна картина. Наприклад, слабка основа (нікотин) у 3—4 рази швидше виводиться з кислою сечею (рН близько 5).
Секреція аміаку. Принцип неіонної дифузії лежить у основі виведення аміаку. ЬІНз надходить у епітелій при обміні амінокислот, головним чином глутаміну. Аміак добре розчинний у жирах і легко проникає через мембрану в сечу. Але, якщо його не зв’язати в сечі, то він може повернутися в клітину або міжклітинну рідину. В сечі завдяки присутності Н+ аміак перебуває у стані рівноваги з амонієм:
МН8 + Н+ ин+.
Іон амонію погано проникає через мембрану і, зв’язуючись з катіонами, виділяється з сечею. Таким чином, кисла сеча, яка містить велику кількість Н+, сприяє екскреції аміаку.
Закономірності неіонної дифузії можна використовувати в клініці при отруєнні. Слід створити таку реакцію сечі, яка б прискорювала виділення токсичної речовини. При отруєнні кислими речовинами сечу роблять лужною і, навпаки, при отруєнні лужними її закисляють.
Активна секреція органічних кислот та основ. У проксимальних канальцях діють три типи транспортних систем, які активно (з використанням АТФ) секретують різні речовини. Одна з них секре-тує органічні кислоти (парааміногіпурову, сечову кислоти, пеніцилін тощо), друга — відносно сильні органічні основи (гуанідин, холін), третя — етилендіамінтетраацетат. Вони функціонують незалежно одна від одної. Завдяки активній секреції ці речовини надходять у сечу за допомогою клубочкової фільтрації і каналь-цевої секреції, декретуються речовини проти градієнту концентрації за допомогою спеціальних переносників та з використанням АТФ. Тому в кінцевій сечі концентрація їх може у 500—1000 разів перевищувати концентрацію в крові. Деякі речовини секре-туються так активно, що плазма, проходячи через подвійну мережу капілярів, майже звільняється від цих сполук. Транспортні секретуючі механізми мають здатність до адаптації — при тривалому надходженні цих речовин у кров кількість транспортних систем поступово збільшується за рахунок білкового синтезу. Це треба мати на увазі, наприклад, при лікуванні хворих препаратами групи пеніциліну: з часом кров очищається від них більшою мірою, а це означає, що для підтримання потрібної терапевтичної концентрації їх у крові слід збільшувати дозу.
Фільтрація та секреція водню і участь нирок у підтримці КОС. Участь нирод у підтримці КОС обумовлена потребою в очищенні крові від нелетких кислот та основ, утворених у процесі метаболізму, та тих, що надійшли в організм із продуктами харчування у надмірній кількості. При розщепленні білків та нуклеїнових кислот утворюються аніони — фосфати і сульфати. Компенсація зрушення рН при цьому відбувається у два етапи. Спочатку вони нейтралізуються за рахунок перетворення буферного аніону крові
НСО на С02, котрий виділяється через легені. Потім аніони сильних кислот виводяться нирковими канальними, а НСОГ реабсорбується. Ці процеси поєднані з іншими процесами творення сечі і характеризуються надзвичайною економічністю. Одні іони виводяться, а інші можуть затримуватися або обмінюватися на менш важливі для організму. Так, конче потрібний для забезпечення багатьох функцій організму Иа+ може обмінюватися на Н+ і К+
При виведенні іонів із сечею змінюється її рН у досить широких межах — від 4,5 до 8,6. При максимальному закисленні сечі Н+ виводиться як у вільному стані (за добу до 50 мкмоль Н+), так і у зв’язаному з буферними сполуками. Н+ потрапляє у сечу не тільки з фільтратом. Він може секретуватися в дистальних і проксимальних ділянках нефрона. У проксимальних відділах Н+ обмінюється з Иа+ при реабсорбції останнього в ділянці апікальної поверхні ендотеліальних клітин
НаНС03
№НСО3
Щ.
НоНСО3
сог
^нсо3
N0
Н2С0з
Н20 +со2
СО2+Н2О
НСО,
N0*
Ма'
НаСІ.НаНСОз, СЩіРО*
N0* г і н*‘+нсо;
Н2С03
- Н20+С02
Н2С0, И Н20 *со2
Глутанін
Гпутаніпаза
Глутаміноба *МН3~ кислота
’ІУа
Н+
СГ
СГ
Н
СГ.
~Мз+ А*
Л7Г сг НаНгРО^НН^СІ
Мал. 235. Схема процесів, які відображають участь ннркн в підтриманні постійного рівня кислотно-основного стану організму
(Р. Шмідт, Г. Тевс, 1985)
(мал. 235).
Обмінна для Иа+ секреція відбувається і в дистальних відділах, тобто там, де відбувається регульована альдостероном його реабсорбція. За участю карбоангідрази в клітинах утворюється Н+:
Н,0 + СО, Н,СО, Н+ + НСОГ.
2 ’ Її / £ » о
У середині клітини НСОГ взаємодіє з реабсорбованим із фільтрату На+, а Н+ сечі сполучається тут за зворотною реакцією і утворюються НгО і СОг. СОг, який легко дифундує через мембрану, за градієнтом концентрації надходить у клітину і вступає в
реакцію творення вугільної кислоти. Таким шляхом у крові утримуються бікарбонати і На+.
Основна кількість водню в сечі залежить від вмісту в ній аміаку. При алкалозі РН крові і концентрація в ній НСОз- зростають і нирки починають виділяти лужну сечу. Завдяки великій кількості НСОз у сечі канальцевого відділу відбувається зв’язування Н+ і №+. У відповідь на це активізується механізм затримки На+. Регульована альдостероном абсорбція На+ супроводжується зниженням абсорбції К+. І якщо цей процес здійснюється тривалий час, то без поповнення К+ може виникнути його дефіцит.
РЕГУЛЯЦІЯ ФУНКЦІЇ НИРОК
Регуляція ниркового кровообігу. Процес сечотворення потребує забезпечення постійних параметрів кровообігу. Тому кровообіг у нирках є відносно автономним. Тиск у капілярах залишається постійним, незважаючи на коливання артеріального тиску в межах 90—190 мм рт. ст. (12,3—25 кПа). Це забезпечується механізмами ауторегуляції кровообігу. У зв’язку з відносно невеликою кількістю адренорецепторів симпатичні нерви слабо впливають на ниркові судини. Стабільний тиск у капілярах клубочка значною мірою підтримується за рахунок раціонального співвідношення діаметрів приносної та виносної судин. Є два основних механізми їх регуляції: міогенна ауторегуляція та гуморальна.
Міогенна ауторегуляція полягає в тому, що гладкі м’язи приносної артеріоли скорочуються при підвищенні в них артеріального тиску. При цьому кількість крові, яка надходить у капіляри, зменшується і тиск у них знижується.
Тонус артеріол регулюють гормони і вазоактивні субстанції, більшість із яких утворюється в нирці. Одні з них діють на обидві судини (V. аНегепз і V. еіїегепз), інші — переважно на одну. Найважливіша речовина — ангіотензин II — звужує обидві судини, але активніше — V. еїїегепз. Подібним чином впливають тромбок-сан і лейкотрієн. Аденозин звужує приносну артеріолу. Передсерд-ний натрійуретичний пептид розширює V. аіїегепз. Вазодилатато-рами обох судин є ацетилхолін, дофамін, гістамін, простациклін. Ендотеліальний фактор розслаблення, який утворюється в ендотелії артеріол, посилює здатність багатьох із названих . сполук до розширення судин. Комплекс вказаних механізмів забезпечує підтримку кровообігу і тиску в капілярах клубочка на постійному рівні.
Незважаючи на відносну постійність ниркового кровообігу, при ряді стресових ситуацій (крововтрата, інтенсивне фізичне навантаження, емоційний стрес тощо) кровообіг у нирках може змінюватись. Приносні артеріоли звужуються, інколи настільки сильно,
що кровообіг майже цілком припиняється; отже, порушується і процес сечотворення. Це відбувається під впливом інтенсивної симпатичної імпульсації та дії судинозвужувальних гормонів і місцевих вазоактивних субстанцій.
Регуляція реабсорбції води і солей у дистальному відділі нефрона. Умовно реабсорбцію води можна поділити на два етапи: відносно облігатна реабсорбція у проксимальних канальцях і петлі нефрона (мало залежить від водного навантаження і механізмів регуляції) та факультативна (залежна) — у інших відділах. Реабсорбція води й іонів у дистальних звивистих канальцях і збиральних трубочках перебуває під постійним контролем. Регуляцію здійснюють гормони залежно від балансу води і концентрації солей у організмі.
Основний гормон, який контролює інтенсивність факультативної реабсорбції води,— АДГ (вазопресин) гіпофіза. АДГ належить до гормонів, які зберігають воду. Під його впливом у дистальних відділах нефрона створюються умови для утримання води в організмі. На базолатеральній''мембрані клітин розташовані рецептори до АДГ — Уі і У2. Взаємодія з рецептором У2 зумовлює активацію аденілатциклази і збільшення утворення цАМФ. При дифузії цАМФ на протилежний кінець клітини до апікальної мембрани разом з кальцієм активується якийсь білок, що сприяє підвищенню проникності мембрани для води. Вода може надходити до клітин із фільтрату. Взаємодія ж із рецептором Уі супроводжується утворенням інших вторинних месенджерів — інозитолтри-фосфату і діацилгліцерину. Ці посередники регулюють рівень цАМФ у клітині, знижуючи його. Таким чином, вазопресин може не тільки підвищувати проникність мембрани для води, але й регулювати її залежно від стану організму. Недостатнє утворення АДГ призводить до розвитку нецукрового діабету — виділення великої кількості сечі, яка надійшла сюди з фільтратом (близько 15 % об’єму первинної сечі). Утворення АДГ, у свою чергу, залежить від осмотичного тиску крові. •
Завдяки цьому створюються умови для реабсорбції води. Рух води визначається співвідношенням вмісту іонів у сечі і міжклітинній рідині. Оскільки у паренхімі нирок, яка оточує дистальні канальці та (особливо) збиральні трубочки, осмотичний тиск високий, то вода виходить із фільтрату і затримується в організмі. Проте якщо з будь-якої причини на попередніх етапах не відбудеться реабсорбція іонів і концентрація їх у сечі залишиться високою, то, незважаючи на присутність АДГ, діурез буде підвищеним. Через гіперосмію вода не вийде із канальця.
На процес всмоктування води в цьому відділі нефрона впливає головним чином реабсорбція Ца+ та СІ-. Якщо Ца+ не буде реаб-сорбуватися, то буде утруднена реабсорбція води. В свою чергу реабсорбцію натрію регулюють альдостерон — гормон кірко-
Мембрана ядра —^—^^^-гРец.ептор : Акцептор \1-РНК Амінокислоти
Мембранні фосфоліпіди |
Індукобані білки
Транспорт електронів
Субстрат Ої~~СОі +Нг0 Мітохондрія Ч
'Альдостерон
N0*^
Пермеаза
-АТФ
"АА<Р
вої речовини надниркової залози і натрійуретичний гормон передсердь.
Зниження в крові концентрації Ца+ стимулює утворення альдостерону, який впливає на активну реабсорбцію Ка+ епітеліальними клітинами дистальних відділів нефрона. В основі впливу альдостерону лежить
Мал. 236. Механізм дії альдостерону регулювання біосинтезу N3-, К-АТФ-ази у цих клітинах. Активне відкачування Иа+ з клітин забезпечує процес надходження іону в клітини з фільтрату. Інтенсивність утворення альдосте-
рону залежить також від рівня в крові ангіотензину II (мал, 236).
Ще одним регулятором реабсорбції N3+ є натрійуретичний гормон. Це пептид. Він утворюється в передсердях при перерозтяганні їх кров’ю. В нирках він сприяє зменшенню реабсорбції №+, а отже, й води. Біологічна роль утворення цього гормона в передсердях полягає в тому, що він може змінювати об’єм крові, впливаючи на реабсорбцію води в нирках. При появі цього гормона в крові знижується реабсорбція води, внаслідок чого зменшуються ОЦК і ступінь розтягання' передсердь кров’ю, яка
надходить.
У організмі є й інші гормони, які впливають на всмоктування іонів. Так, реабсорбція Са2+ регулюється за допомогою паратгор-мону, тиреокальцитоніну та вітаміну Вз. Паратгормон впливає не тільки на клітини дистальних відділів, але й на проксимальний звивистий канадець та висхідний відділ петлі нефрона. Стимулюючи реабсорбцію Са2+, паратгормон сприяє виділенню фосфату. Кальцитонін впливає на висхідний відділ петлі нефрона та початкову частину дистальних відділів. Він підвищує екскрецію Са2+ і Р2+. Вітамін Ь3 (холекальциферол) теж сприяє реабсорбції Са2+ у нирках і кишках. Реабсорбцію Са2+ і М§2+ стимулює й вазо-
пресин.
Ефект практично всіх гормонів, які регулюють реабсорбцію солей, інтегрований з місцевими регуляторами — простагландинами та кінінами. Так, брадикініни є сильними вазодилятаторами судин, а простагландин Е2 сприяє виділенню Ца~, зменшує реакцію клітин на АДГ.
Таким чином, процес утворення гормонів, які регулюють реабсорбцію води й іонів, залежить від об’єму циркулюючої крові, концентрації в крові Ца+ та її осмотичного тиску. Окрім цього, при стимулюванні волюморецепторів рефлекторно через симпатичний
| Двріит смі |
| Наілшіш смі |
Малх237. Схема регуляції функцій нирки при надлишку та дефіциті води і солі в організмі. ПНУГ — передсердний натрійуретичний гормон (за даними А. Безророиіоз, 81. 8і1Ьегпа£І, 1986)
Мал. 238. Схема будови юкстагломе-рулярного комплексу нирки (за даними Р. ІПмідта, Г. Тевса, 1986):
І — прииосна артеріола; 2 — кжстагломеру-лярні клітини; 3 — клітини дистального канальця; 4 — щільна пляма, 5 — виносна артеріола; 6 — клубочок; 7 — нервове волокно
нерв знижується реабсорбція №+ і води в канальцях. При цьому також зменшується секреція реніну юкстагломерулярними клітинами, внаслідок чого знижується інтенсивність процесу творення альдостерону (мал. 237).
Інкреторна функція нирок. Ренін-ангіотензивна система організму. Підтримка іонного балансу організму тісно пов’язана з підтримкою КОС, водним обміном і центральною гемодинамікою. Вище розглядався механізм регулювання альдостероном реабсорбції N3+ і К+ Однак існує ще один шлях регулювання реабсорбіції №+ і К+ за допомогою альдостерону — через утворення в нирках реніну.
У зв’язку з тим що кровообіг у нирках значно впливає на процес творення сечі, нирки беруть участь у регулюванні як свого власного внутрішньоорганного кровообігу, так і системного ОЦК
Мал. 239. Схема ренін-ангіотензин-альдо-стеронової системи (за даними А. Безро-роиіоз, 8і. ЗіІЬегпа^І, 1986)
шляхом затримки або виділення води. Чималу роль щодо цього відіграє й специфічний фактор — ренін, який контролює судинний тонус. При зниженні артеріального тиску в приносних судинах нирок включаються місцеві барорецепторні механізми. Крім того, одночасно в клітинах юкстагломе-рулярного апарату (мал. 238) утворюється ренін. Це протеаза, під впливом якої в плазмі крові аг-глобулін (ангіотензиноген печінкового походження) перетворюється на декапептид — ангіотензин І. У свою чергу під впливом специфічного ферменту (активність його найвища в легенях) ангіотензин І трансформується в ангіотензин II. Ан-
гіотензин II — одна з найсильніших судинозвужувальних речовин. Під його впливом підвищується артеріальний тиск. Крім того, ангіотензин II впливає на надниркові залози, стимулюючи утворення альдостерону (мал. 239). Альдостерон забезпечує реабсорбцію Ца+ в нирках, тим самим утримуючи в організмі воду. Ці механізми (звуження судин і затримка води) забезпечують оптимальний рівень артеріального тиску і нормалізують кровотік у нирках у випадку його зниження.
Виділення реніну збільшується і при зменшенні об’єму плазми. Швидкість його утворення залежить ще й від кількості ЦаСІ, який надходить у дистальні канальці. Вказаний механізм забезпечує місцевий зворотний зв’язок між вмістом Ца+ в канальцях та регуляцією його реабсорбції ренін-ангіотензин-альдостероновою системою. Процес творення реніну інтенсифікується також при збудженні симпатичної нервової системи (через посередництво а-адре-норецепторів). У нирках існує механізм зворотного зв’язку, який гальмує утворення реніну за допомогою ангіотензину II та АДГ.
Завданням ренін-ангіотензин-альдостеронової системи є підвищення системного артеріального тиску та кровообігу через нирки і утримання води та №С1 в організмі.
Інші інкреторні функції нирок. Інкреторна функція нирок полягає не тільки в утворенні реніну. В них утворюються проста
гландини, які можуть надходити в загальний кровообіг і виявляти свою дистантну дію. Клітини нирки беруть із плазми крові прогормон — вітамін П3, який утворюється в печінці, і перетворюють його на біологічно активний гормон. Цей гормон регулює реабсорбцію Са2+ у нирках, сприяє виведенню його з кісток, всмоктуванню в кишках.
Нирки можуть екскретувати ряд речовин, які утворюються без- . посередньо в них. До них належать такі продукти азотного обміну, як аміак, сечовина, сечова кислота, креатинін. Вони можуть надходити з кров’ю і потрапляють у фільтрат, після чого частково або повністю реабсорбуються та секретуються. Можуть утворюватись у процесі метаболізму в нирці. З сечею виводяться багато які гормони або їх метаболіти. Колір сечі залежить як від величини діурезу (при виділенні великої кількості сечі вона стає світлішою у зв’язку зі зменшенням концентрації пігментів), так і від стійкості пігментів, які утворюються при розпаді гемоглобіну (вони потрапляють у сечу безпосередньо з крові або після всмоктування в кишечнику).
Якщо ряд функцій, які виконують нирки, можна компенсувати за рахунок діяльності інших органів, то екскреторну функцію замінити практично неможливо. Незважаючи на деякий «запас надійності» (людина може жити і з однією ниркою), при ураженні нирок розвивається уремія. При цьому безпосередньою причиною смерті хворого може бути затримка в організмі продуктів обміну азоту.
СЕЧОВИДІЛЕННЯ ТА СЕЧОВИПУСКАННЯ
Сеча, яка надходить із збиральних трубочок у ниркову миску, по сечоводові потрапляє у сечовий міхур. Для цього миска повинна заповнитися до певного рівня, який контролюється барорецепторами. Подразнення цих рецепторів сприяє розкриттю сечовода і скороченню м’язів ниркової миски.
На початковому етапі заповнення сечового міхура відбувається релаксація м’язів його стінок, тиск в ньому не змінюється. Розтягання стінок до певної межі призводить до подразнення барорецепторів і появи перших позивів до сечовипускання. Провідним механізмом подразнення рецепторів сечового міхура є його розтягання, а не зростання тиску сечі. Певне значення має й швидкість розтягання міхура — при швидкому його наповненні імпульсація різко збільшується. У дорослої людини перші позиви до сечовипускання починають з’являтися за наявності в міхурі 150 мл сечі, а при 200—300 мл потік імпульсів різко збільшується.
Подразнення механорецепторів міхура центрострімкими нервами передається до крижового відділу спинного мозку, де розташований центр сечовипускання. Спінальний центр регулюється
вищерозташованими відділами: кора великих півкуль і Середній мозок гальмують, а задній відділ гіпоталамуса і передня частина моста стимулюють його активність. Стійкий кортикальний контроль сечовиведення формується на кінець другого року життя, хоча умовні рефлекси починають з’являтися на кінець першого року.
Сеча, яка міститься в сечовому міхурі, може зазнавати подальшої трансформації і певною мірою впливати на процес творення сечі в Нирках. Так, наповнення сечового міхура до 100 мл призводить до зниження швидкості творення кінцевої сечі, оскільки збільшується реабсорбція води. В сечовому міхурі із сечі всмоктується ряд речовин, N3+ сечовина. В нормі ці процеси не мають суттєвого значення для організму, але при утрудненні відтоку (наприклад, при аденомі передміхурової залози) може розвиватися азотемія.
ФІЗІОЛОГІЧНІ ПРИНЦИПИ МЕТОДІВ
ДОСЛІДЖЕННЯ ФУНКЦІЇ НИРОК
Найпростішим методом дослідження функції нирок є визначення хімічного складу сечі. При катетеризації сечоводів можна одержати сечу з будь-якої нирки.
Позаяк усі процеси творення сечі прямо пов’язані з кровообігом, його інтенсивність, а також склад крові позначаються на складі сечі. При порівнянні складу крові зі складом сечі можна зробити висновок про активність патологічного процесу, який відбувається в нирках. Оскільки різні речовини виводяться різними шляхами, ефективність очищення крові від них дозволяє оцінити ці механізми. Для дослідження можна застосовувати сполуки, які утворюються природним шляхом в організмові або вводяться із зовні. Для визначення швидкості виведення запроваджено поняття про нирковий кліренс, який відображає швидкість очищення плазми:
Кр = Мр • У/Пр,
де: Кр — кліренс речовини; Мр — концентрація її в сечі; V — кількість сечі, яка утворюється за 1 хв; Пр — концентрація у крові.
Виходячи з уявлення про те, що одні речовини тільки фільтруються і не реабсорбуються, інші — фільтруються І ПОТІМ ПОВНІСТЮ реабсорбуються, а ще інші — і фільтруються, і секретуються, за їх кліренсом можна зробити висновок про активність усіх механізмів процесу сечотворення.
Інтенсивність ниркового кровообігу можна визначити за швидкістю виведення такої речовини, від якої кров шляхом фільтрації та секреції цілком звільнюється при одноразовому проходженні через нирки. Такою речовиною є парааміногіпурова кислота
(ПАГ). Знаючи кількість ПАГ, виведеної за 1 хв, і концентрацію її в плазмі, можна вирахувати нирковий плазмотік: <2 = Кпаг-У/Пр.
Враховуючи гематокрит, можна легко визначити кровообіг. (Кров, проходячи через нирки, звільняється від ПАГ лише на 90— 95 %. При визначенні кровотоку враховують цю обставину).
У зв’язку з тим що ПАГ фільтрується і секретується, для визначення активності кожного з цих механізмів виділення її порівнюють з кліренсом інуліну, який тільки фільтрується. Кліренс інуліну дає уявлення про фільтраційну здатність нирок.
Активність процесу реабсорбції нирки можна-визначити за допомогою навантажувальної проби з глюкозою: визначають той рівень глюкози в крові, коли концентрація її в сечі стає прямо пропорційною кількості цієї речовини в крові. Це відбудеться при максимальному навантаженні системи реабсорбції глюкози.
ОНТОГЕНЕЗ ФУНКЦІЇ НИРОК
Починаючи з 5-го тижня, у ембріона формується кінцева нирка. Незважаючи на те що під час внутрішньоутробного періоду розвитку основним органом виділення є плацента, вже з 9-го тижня починають функціонувати нирки. Сеча, яка утворюється, виводиться в навколоплідну рідину. З 5-го по 9-й місяць внутрішньо-утробного розвитку утворення сечі збільшується з 2 до 26,7 мл/год. Але до моменту народження розвиток нирок ще не завершується. У новонародженого ще багато недиференційованих нефронів і співвідношення кіркової та мозкової речовин становить 1 :4 (у дорослого— 1:2). Найбільш активно розвиваються нирки протягом першого року життя та в період статевого дозрівання.
У новонароджених клубочковий апарат ще не сформований і відносний нирковий кровотік та фільтрація складають лише ’Д— */5 таких у дорослих. До моменту народження канальцевий апарат нирки ще не сформований. Проте реабсорбція білків та вуглеводів відбувається досить інтенсивно, а амінокислоти можуть з’являтися і у вторинній сечі. Також знижена реабсорбція Ца+ і води. Процеси секреції в нирках новонароджених теж ще не досконалі.
У новонароджених вода активно виводиться також через легені та шкіру. Тому добова потреба у воді у дітей вища, ніж у дорослих. У немовлят, яких годують материнським молоком, нирки цілком справляються з підтримкою водно-сольового обміну та КОС. Але резерви пристосування нирок до змін умов значно обмежені. Структури нефрона нирки у перший рік слабко реагують на гормональні регулятори процесів реабсорбції.
З віком (після 40—50 років) функція сечотворення нирок поступово знижується. Зменшується інтенсивність кровопостачання і фільтрації, а також реабсорбції і секреції. Цілком імовірно, що основною причиною таких змін є розвиток склерозу.
ВИДІЛЬНА ФУНКЦІЯ ШКІРИ,
ОРГАНІВ ТРАВЛЕННЯ ТА ЛЕГЕНЬ
Одна з функцій шкіри — видільна — забезпечується потовими та сальними залозами. З потом виділяються не тільки вода та сіль (див. розділ «Терморегуляція»), але й сечовина, азот та інші речовини, які надходять у організм ззовні або утворюються в ньому.
Концентрація сечовини в поті може бути в 2 рази виша, ніж у плазмі, К+ — у 1,2 разу. З потом виводиться також значна кількість №+, СІ- тощо.
Органи системи травлення відіграють істотну роль у виведенні з організму різних речовин екстраренальним шляхом. Ці органи здатні виводити як ендогенні метаболіти, так і екзогенні речовини. Слигіні залози можуть виводити сечовину, сполуки ртуті, вісмуту, брому, йоду.
Слизова оболонка шлунка виводить сечовину, сполуки ртуті, миш’яка, хлороформу, брому, саліцилати тощо. Підшлункова залоза виводить сечовину, сечову кислоту, солі кальцію, цинку, сполуки заліза, ртуті, срібла, брому, хінін, сульфаніламіди.
У процесах екскреції важлива роль належить печінці: вона виводить сечовину, глутамін, креатинін, холестерин, жовчні пігменти та багато інших речовин. Різні відділи тонкої кишки виділяють сечовину, сечову кислоту, К+, Са2+, Р2+, С1~, сполуки ртуті, нікелю тощо.
Через легені виводяться леткі сполуки — СОг, ефір, хлороформ, ацетон та ін.
Через шкіру, органи системи травлення, легені виводиться також значна кількість води. Ця кількість змінюється залежно від умов.
Екстраренальні шляхи виведення шкідливих речовин з організму починають відігравати значну роль при порушенні діяльності нирок,' але повністю замінити їх функцію вони не можуть.
РОЗДІЛ 4
Фізіологічні основи поведінки
ПОНЯТТЯ ПРО НИЖЧУ І ВИЩУ
НЕРВОВУ ДІЯЛЬНІСТЬ
Діяльність нервової системи умовно можна поділити на нижчу й вищу. Функції нервової системи, спрямовані на регуляцію життєдіяльності органів і систем, об’єднання їх у єдиний організм, належать до нижчої нервової діяльності. Функції ж, які обумовлюють поведінку індивіда в навколишньому середовищі і пристосування його до змінних умов зовнішнього середовища, належать до вищої нервової діяльності.
Структурною основою вищої нервової діяльності є кора великого мозку й прилеглі до неї підкіркові утворення. При формуванні поведінки в нервовій системі формуються різної складності ней-ронні ланцюги, які є основою розвитку різних рефлексів, мотивацій, емоцій і мислення.
Розрізняють природжені й набуті в процесі індивідуального розвитку форми поведінки. Вони спрямовані на збереження індивідуума та виду.
ПРИРОДЖЕНІ ФОРМИ ПОВЕДІНКИ
До природжених форм поведінки тварин і людини належать безумовні рефлекси, інстинкти, біологічні мотивації та емоції.
Фізіологічні властивості безумовних рефлексів. Безумовні рефлекси виникають у відповідь на безпосереднє подразнення певного рецептивного поля і не потребують спеціальних умов. Стимули, які зумовлюють специфічну рефлекторну реакцію, називають безумовними подразниками. Вони можуть бути різноманітними і походять іззовні або з внутрішнього середовища організму. Безумовні рефлекси здійснюються за принципом стимул — відповідна реакція — зворотна аферентація (про результат дії).
Безумовні рефлекси формуються й реалізуються за жорсткою генетичною програмою. Більшість із них проявляється відразу після появи істоти на світ (наприклад, клювальний рефлекс у птахів, смоктальний — у ссавців та ін.). Деякі ж безумовні рефлекси (наприклад, статеві) формуються після народження у міру морфофункціонального дозрівання нервової, ендокринної та інших систем.
Дуги безумовних рефлексів замикаються на різних рівнях
ЦНС. Центральна частина дуги безумовного рефлексу має багаторівневу структуру, тобто складається з кількох гілок, які проходять через різні рівні ЦНС — спинний мозок, довгастий мозок, стовбурові центри тощо. Найвища частина дуги проходить через кору великого мозку і є кірковим представництвом певного безумовного рефлексу.
Безумовні рефлекси носять видовий характер, тобто вони специфічні для представників того чи того виду. Внаслідок цього їх ще називають видовими рефлексами. Безумовні рефлекси дуже стійкі; вони зберігаються не тільки протягом життя даної тварини, але й протягом існування виду, до якого належить ця тварина. За допомогою безумовних рефлексів здійснюється відносно постійний зв’язок організму з середовищем. Часто сила відповідної реакції на визначений подразник буває однаковою. Безумовні рефлекси мають специфічні рецептивні поля і можуть викликатися в разі дії на них адекватних подразників (наприклад, безумовно-рефлекторне слиновиділення в природних умовах спостерігається тільки при дії подразників на слизову оболонку порожнини рота і язика, які є специфічним рецептивним полем для слиновидільного рефлексу).
Класифікація безумовних рефлексів. Запропоновано кілька класифікацій безумовних рефлексів залежно від характеру подразнень, які їх зумовлюють, та біологічної ролі, рівня керування ЦНС тощо. Так, безумовні рефлекси ділять на рухові (локомоторні, статичні, статокінетичні тощо), вегетативні, або вісцеральні (харчові, статеві, дихальні, судинні тощо), орієнтовні (рефлекси за типом «що таке?»), захисні та ін.
ІНСТИНКТИ
У формуванні цілісної поведінки тварин велику роль відіграють інстинкти. Частково роль їх зберігається і при формуванні поведінки людини, але, як правило, в прояві їх домінує розумова діяльність. Людина свідомо може пригнічувати або різко згладжувати прояви інстинктів.
Інстинкт — це складна система безумовних рефлексів, які носять ланцюговий характер, де кінець однієї рефлекторної ланки є початком другої. За суттю інстинкти є комплексом простих безумовних рефлексів. Вони проявляються цілеспрямованою пристосувальною діяльністю, зумовленою природженими механізмами.
Інстинкти діляться таким чином: вітальні, або ті, що забезпечують фізичне виживання особи (питний, харчовий, оборонний); рольові, у тому числі статевий, батьківський, територіальний, ієрархічний; саморозвитку (дослідницький, імітаційний, ігровий). Хоча інстинкти є видовими, в них можна виявити елементи індивідуальності, зумовлені природженими особливостями нервової
системи, а також навчанням, набутим у період попереднього життя.
Вираженість інстинкту залежить від багатьох чинників зовнішнього і внутрішнього середовища (від конкретної ситуації, метаболізму, гормональних впливів, процесів мислення).
Фази прояву інстинктивної діяльності. Будова ланцюжка рефлекторних актів у процесі розвитку інстинкту відбувається у дві фази: перша—пошукова, друга — завершальна. В першу фазу прояви інстинктивної поведінки досить пластичні, залежать від конкретних, реальних умов. Завершальна ж фаза, навпаки, відзначається жорстким стереотипом, який залежить від анатомо-фі-зіологічних особливостей нервової системи. На відміну від першої фази у другу фазу набуті компоненти відіграють незначну роль, а нерідко відсутні зовсім. Жорстка видова одноманітність інстинктів забезпечує зберігання життєво важливих функцій, спрямованих на виживання особи і виду незалежно від випадкових умов середовища. Біологічне значення інстинктів не обмежується лише організацією поведінки тварин. Вони є еволюційною основою формування складніших форм поведінки.
БІОЛОГІЧНІ МОТИВАЦІЇ
До природжених форм поведінки належать біологічні мотивації (лат. тоііуасіо — спонукання), «основні прагнення», або «драйв», драйв-рефлекси, які відображають зміни у внутрішньому середовищі організму (яких-небудь його фізіологічних констант) і зв’язані з біологічними потребами — голодом, спрагою, статевим відчуттям тощо. Біологічні мотивації — поведінкові акти, спрямовані на пошуки спеціальних подразників у зовнішньому середовищі. Вони забезпечують задоволення виниклих певних внутрішніх потреб. Біологічні мотивації належать до нижчих, простих або первинних. У людини на грунті нижчих мотивацій, пізнання, а також навчання протягом життя формуються складні системи вищих, соціальних мотивацій, які відрізняються від біологічних за змістом, метою, стійкістю. До соціальних мотивацій людини належать прагнення до освіти, мистецтва, набуття певного фаху тощо.
Нервовим субстратом біологічних мотивацій є в основному гі-поталамічна ділянка мозку, де розташовані «центри» голоду, статевої й захисної поведінки. Мотиваційні збудження, які виникають тут, потім іррадіюють у висхідному напрямі в лімбічні структури і кору великого мозку, переважно в її передні відділи, де формуються програми цілеспрямованої дії, яка веде до задоволення вихідної біологічної потреби (мал. 240).
Важливу роль у дослідженні природжених форм поведінки тварин відіграли дані етології, тобто вивчення всіх складнощів їх
Мал. 240. Схема формування мотиваційного збудження, яке зумовлює цілеспрямовану поведінку і задоволення потреби (за даними К. В. Судакова):
К—‘Константа крові; Кі у Кг — відхилення константи від оптимального рівня; 1 — цілеспрямована поведінка; 2 — результат поведінки; 3—внутрішні резерви; 4 — гуморальна сигналізація, яка викликає мотиваційне збудження; 5 — нервова сигналізація; 6 — рецептор результату
поведінки в природних умовах існування. Основні положення етології полягають у тому, що інстинктивна поведінка складається з комплексів природжених стереотипних рухових актів («фіксованих патернів»). Під дією внутрішніх і зовнішніх подразників (гор
монального фону, температури зовнішнього середовища тощо) в нервових центрах нагромаджується «специфічна енергія дії», яка
спричинює пошукову поведінку, спрямовану на задоволення певної потреби (голоду, спраги, статевої потреби та ін.). Згідно з концепцією етологів, ЦНС блокує комплекси фіксованих дій. Блок знімається «ключовими подразниками» (стимул-об’єкти, релізери), які вивільняють «природжений реалізуючий механізм». Багато з положень етологів, наприклад, уявлення про «специфічну енергію дії», «природжений реалізуючий механізм», несумісні з фізіологічним підходом до вивчення природженої і набутої поведінки.
У дорослої особи природжена діяльність звичайно не проявляється в «чистому» вигляді, вона видозмінюється за рахунок набутих умовних рефлексів, які формуються в процесі онтогенезу. Деякі природжені рефлекси, наприклад, комплекс рухів, пов’язаних із смоктанням, хапальний рефлекс, міміка дитини тощо, надзвичайно стійкі. Інші ж природжені рефлекси вирізняються великою пластичністю або проявляються на відносно пізніх етапах розвитку, наприклад, статеві рефлекси. Діапазон природжених форм поведінки (так звані норми реакції) визначений генетичною програмою.
ФІЗІОЛОГІЯ ЕМОЦІЙ
Мотивації нерідко мають емоційне забарвлення. Однак незважаючи на тісний зв’язок, мотивації і емоції належать до різних станів організму, оскільки виникнення їх визначається різними нейронними утвореннями мозку.
Під емоцією розуміється своєрідний фізіологічний стан. Це один з найважливіших аспектів діяльності ЦНС, що характеризує особисте ставлення людини до навколишнього середовища, є однією з форм відображення дійсності. В емоціях відображаються певні потреби людини і реалізуються їх задоволення, досягнення мети.
Класифікація емоцій. Емоції прийнято ділити на негативні та позитивні. Розрізняють стенічні негативні емоції, які зумовлюють активну діяльність (гнів, лють, стан афекту, агресія тощо), і астенічні, що знижують активність (страх, горе, смуток, депресія). До позитивних емоцій належать радість, задоволення, насолода, стан комфорту, відчуття любові та щастя. Розрізняють нижчі та вищі емоції. Нижчі емоції елементарні, пов’язані з органічними потребами людини й тварини (голод, спрага, статевий інстинкт, самозбереження тощо). У людини навіть елементарні емоції — продукт соціально-історичного розвитку, в процесі якого формується культура емоцій. Вищі емоції виникають тільки у людини у зв’язку із задоволенням соціальних потреб (інтелектуальних, моральних,, естетичних тощо). Ці складні емоції розвивались на основі свідомості; вони контролюють і гальмують нижчі емоції.
Поява емоцій в онтогенезі, У новонародженої дитини чітко-проявляються емоції страху, гніву, задоволення. Голод, біль, охолодження, мокра постіль викликають у немовляти незадоволення з характерними зовнішніми ознаками: гримасою страждань і плачем. Несподівано сильний звук або втрата рівноваги зумовлюють стан страху, а насильне обмеження рухової активності (сповивання) — гнів. Типові ознаки задоволення з’являються у дитини під час її колисання і при тактильному подразненні тих рецепторних зон, які згодом набудуть значення ерогенних. Є також відомості,, що емоції (як позитивні, так і негативні) виявляються навіть у плода на 5—6-му місяці ембріонального розвитку. Однак остаточно емоційна сфера формується поступово, на грунті поєднання набутих стереотипів з природженими механізмами. Таким чином, нижчі емоції, як і безумовні рефлекси та інстинкти, є природженими формами відображення дійсності.
Біологічне значення емоцій. Появу емоцій слід розглядати як важливе емоційне надбання, яке полегшує формування комплексу нейронних взаємодій для вироблення складних форм поведінки. Вони мають важливе значення не тільки для організації інстинктивної поведінки, а й для виникнення умовних рефлексів, форму
вання процесу мислення. Роль негативних емоцій в організації поведінки полягає в тому, що вони дозволяють швидко оцінити ситуацію, яка виникла (корисна чи шкідлива). Вони мобілізують зусилля людини або тварини, спрямовані на задоволення певної потреби, компенсують, доповнюють знання, де їх не вистачає, для досягнення мети (компенсуюча, захисна функція емоцій).
Пристосувальне значення позитивних емоцій полягає в їх тонізуючому впливі. Успіх окрилює, породжує відчуття впевненості в своїх силах, санкціонує подальші пошуки. Емоційне збудження сприяє мобілізації життєвого досвіду, що зберігається в пам’яті тривалий час.
Зовнішній прояв емоцій. Емоції проявляються в поведінці й різноманітних реакціях з боку рухової, вегетативної і ендокринної систем. До них належать жвава міміка та жестикуляція, зміна голосу й мови, пози та ходи, різноманітні вегетативні реакції (порушення діяльності серцево-судинної, дихальної, травної систем; внутрішньої секреції, потовиділення, поява сліз, сухості в роті тощо). Вегетативні зміни, що виникають при негативних емоціях, реалізуються за участю переважно симпатико-адреналової системи (розширення зіниць, прискорення серцебиття, дихання, підвищення артеріального тиску, рівнів катехоламінів, 17-кортикосте-роїдів у крові та ін.). Позитивні емоції іноді супроводжуються активізацією діяльності парасимпатичного відділу вегетативної нервової системи. Проте співвідношення між симпатичною і парасимпатичною активністю при емоціях не зводяться до прямої ре-ципрокності. Збудження симпатичного відділу завжди супроводжується збудженням парасимпатичного, проте участь кожного з них різна у виникненні тієї чи тієї групи емоцій. Свідоме пригнічення емоцій при різкому збудженні вегетативної нервової системи, підвищенні вмісту фізіологічно активних речовин у крові може призвести до патологічних змін в організмі. Це зв’язано з тим, що активізація нервово-гуморальної системи не впливає на зовнішні прояви емоцій, а позначається на різних органах і системах, зумовлюючи парадоксальні реакції. Такі наслідки активізації нервового апарата емоцій. Що ж становить собою цей апарат?
Нервовий апарат емоцій. Центральний нервовий апарат емоцій представлений сукупністю мозкових утворень, які прийнято називати вісцеральним мозком, або лімбічною системою. До нього належать гіпокамп, мигдалевидне тіло, поясна закрутка та ін. (див. с. 181). Вказані структури мозку морфофункціонально тісно зв’язані між собою і утворюють «емоційне коло» («коло Пейпеца»), в якому може тривалий час циркулювати емоційне збудження. Можливо, цей замкнений шлях служить важливим нервовим апаратом, який відповідає за формування емоцій. Лімбічна система тісно зв’язана з новою корою великого мозку, особливо з її лобними, скроневими й тім’яними частками, а також з
ретикулярною формацією мозкового стовбура. Скронева ділянка відповідає за передачу інформації із зорової, слухової та соматосенсорної кори до мигдалевидного тіла й гіпо-кампа. Лобна ділянка регулює діяльність лімбічної кори. Ретикулярна формація підвищує активність висхідних впливів на лімбічну систему. Саме че-
Мал. 241. Структури головного мозку людини, які беруть участь у формуванні емоцій. Чорними квадратами позначено зони, подразнення яких зумовлює появу емоційних реакцій. Розміри квадратів відповідають інтенсивності і постійності цих реакцій
рез ці зв’язки можна свідомо керувати появою і проявом емоцій (мал. 241).
Особливо багато інформації про ці структури дали досліди з самоподразненням мозку тварин. Щурам було
вживлено в різні ділянки мозку електроди. Причому тварини мали
можливість самостійно вмикати подразний струм за допомогою спеціального важеля. Виявилося, що при певній локалізації країв електродів щур натискає на важіль до 8 тис. разів протягом 1 год, аж до цілковитого виснаження. В інших випадках щур, натиснувши рілька разів на важіль, більше до нього не доторку
ється.
Ділянки, подразнення яких зумовлює підкріплення або уникання подразника, було названо «центрами задоволення» («нагороди») і незадоволення («покарання»). Особливо багато їх у гіпота-ламічній ділянці, мигдалевидному тілі. Часто ці центри локалізуються у структурах, пов’язаних із статевою та харчовою активністю, але є чимало ділянок, які важко пов’язати з певною йо-требою.
Досліди щодо самоподразнення було проведено й на інших тваринах, у тому числі й на мавпах. Результати цих дослідів можна екстраполювати й на людину. Останнім часом для діагностики й лікування деяких захворювань було розроблено техніку введення електродів у глибинні структури мозку людини. Коли хворому під час нейрохірургічної операції дають можливість подразнювати власний мозок (тобто проводити самоподразнення), то при стимуляції певних ділянок мозку люди нерідко повідомляють про виникнення у них приємних або неприємних відчуттів. Приємні відчуття часто мають сексуальне забарвлення, супроводжуються бадьорістю і підйомом настрою, немотивованою радістю (ейфорія). Під час стимуляції негативних точок (так званих центрів незадоволення) у людини виникає відчуття неспокою, тривоги, страху і жаху.
За даними літератури, ведучу роль у формуванні емоцій відіграє права півкуля мозку, де зароджуються негативні афекти. Ліва півкуля відповідає за позитивне забарвлення емоцій.
Теорії емоцій. Найбільших успіхів у теоретичній розробці проблеми емоцій досягнуто в рамках теорії функціональних систем і з позицій інформаційного підходу.
Біологічна теорія емоцій (П. К. Анохін, 1949) має два аспекти — еволюційний та нейрофізіологічний. Суть еволюційного підходу полягає в тому, що життєвий процес є сукупністю двох станів організму: стадії формування потреб і основних потягів (мотивацій) та стадії їх задоволення. Перша стадія супроводжується негативними емоціями, друга — позитивними, які закріплюють (санкціонують) поведінковий акт. Згідно з позиціями теорії функціональних систем, негативні емоції виникають також при неузгодженні в акцепторі результату дії реальних наслідків із очікуваними (їх аферентною моделлю), а позитивні емоції — при повному збігові результатів.
Відповідно до інформаційної теорії (П. В. Симонов, 1966, та ін.), емоції є відображенням сили потреби і можливості (ймовірності) її задоволення в даний момент. Якщо потреби немає, то емоції не виникають. їх не буває й тоді, коли людина володіє інформацією, якої досить для організації дій щодо досягнення мети. У разі дефіциту інформації створюються умови для формування негативних емоцій. Якщо ж з’являється надлишок інформації про досягнення мети, то виникає позитивна емоція. Крім того, мають значення й інші чинники, зокрема час, потрібний для задоволення потреб (у разі його дефіциту часто виникають негативні емоції), енергетичні можливості людини тощо.
Розрізняють чотири ступені стану емоційного напруження. Перший ступінь — стан уваги, мобілізації — характеризується посиленням діяльності органів і систем, інтелектуальних і фізичних ресурсів, підвищенням працездатності. Другий ступінь буває тоді, коли мобілізація сил організму виявляється недостатньою. Він супроводжується виникненням негативної стенічної реакції (гнів, лють тощо). Третій ступінь характеризується появою астенічної негативної емоції (страх, жах, депресія). Він виникає навіть при максимальній мобілізації життєвих сил. Це стадія напруження, або емоційного стресу. При тривалому впливі вона дуже шкідливо позначається на організмі людини. Четвертий ступінь проявляється розвитком невротичного стану, що свідчить про захворювання людини.
Нейрохімія емоцій. У здійсненні будь-якої емоції беруть участь усі нейромедіаторні системи (норадрен-, холін-, серотонін-, до-фамінергічна), а також цілий ряд нейропептидів, в тому числі й ендогенні опіати. Разом з тим, питома вага кожної з них в емоційній реакції різного знаку неоднакова. Наприклад, доведено, що
позитивні емоції («нагороди») збуджують катехоламіни, а негативні («покарання») — ацетилхолін. Роль холінергічної системи виразно проявляється в агресивній поведінці тварин. Серотонін відіграє роль гальмівного медіатора стосовно обох систем. Послабленням гальмівного впливу серотоніну схильні пояснювати підвищену агресивність. Пригнічення серотонінергічної системи стимулює статеву поведінку, в той час як пригнічення норадрен-та дофамінергічної систем дає зворотний ефект.
Дані, отримані в експерименті на тваринах, збігаються з результатами біохімічних досліджень у людини. Так, зменшення рівня серотоніну у крові людини супроводжується немотивованою тривогою, а дефіцит норадреналіну — депресією, тугою.
НАБУТІ ФОРМИ ПОВЕДІНКИ
В основі набуття індивідуального досвіду лежить здатність до навчання. Під навчанням розуміють процес, що полягає в появі адаптивних змін індивідуальної поведінки внаслідок набутого досвіду. Це можливо завдяки властивості організму зберігати певний строк елементи навчання, тобто властивості пам’яті.
Стимулзалежне навчання. На ранніх етапах філо- та онтогенезу живих істот набуття індивідуального досвіду (навчання) має неасоційований, стимулзалежний характер. Воно обумовлено набором різних чинників і не потребує їх обов’язкового зв’язку з цілісною діяльністю організму. До цієї форми навчання належать сумаційний рефлекс, звикання, закарбування (імпринтинг), наслідування (імітація).
Основою сумаційного рефлексу є явища сенсибілізації (підвищення чутливості до існуючих подразників) і фасилітації (полегшення запуску відповідної реакції). До таких рефлексів належать, наприклад, освоєння певного маршруту пересування, розрізнення їстівних та неїстівних продуктів тощо. Сумаційні рефлекси не можуть зберігатися тривалий час і після зникнення самостійно не відновлюються. Подразники, які їх зумовлюють, не мають спеціалізованого сигнального значення.
Звикання становить собою таку форму навчання, яка характеризується стійким ослабленням реакції внаслідок багаторазового повторення подразника, що не супроводжується яким-небудь біологічно важливим агентом (харчовим, захисним тощо). Найпоширенішою формою звикання є орієнтовний рефлекс, («що таке»?»), який проявляється повертанням голови, очей у напрямку джерела подразнення, висловленням здивування та ін. Основними чинниками розвитку цього рефлексу є новина і несподіваність та значущість подразника для організму. При повторному подразненні реакція послаблюється і зникає (згасає).
Особливою формою «одномоментного» навчання є імпринтинг (закарбовування), встановлений етологами стосовно ново
народжених тварин. Імпринтинг спостерігається в постнатальний період (критичний або чутливий), що триває від 6—8 год до 4— 5 діб. Наприклад, у птахів реакція пересування виникає зразу після народження у відповідь на перший рухомий об’єкт, з яким пташеня контактує. Це можуть бути мати, інші види птахів, людина або будь-які рухомі об’єкти. Явище імпринтингу є наслідком взаємодії індивідуального досвіду і природжених властивостей молодого організму. Отримана інформація швидко фіксується в механізмах пам’яті.
Наслідування (імітація) полягає в тому, що тварини і людина в своєму поводженні орієнтуються безпосередньо на дії інших тварин або людей, які їх оточують. Особливо це характерно для молодих організмів.
На подальших етапах філо- та онтогенезу поведінка набуває все активнішого асоціативного ефектзалежного характеру, тобто визначається результатами контакту організму з навколишнім середовищем. До цієї форми навчання належать асоціації — умовні рефлекси.
КЛАСИФІКАЦІЯ УМОВНИХ РЕФЛЕКСІВ
Найбільш загальним є поділ рефлексів за їх біологічним значенням (харчові, захисні, статеві, вісцеральні, рухові). Умовні рефлекси діляться також по відношенню умовних подразників до діючих безумовних (щтучні і натуральні). Штучні рефлекси — це умовні рефлекси на подразники, якЬибЧтосуються безумовного подразника (наприклад, звук Дзвінка, метронома тощо не мають ніякого відношення до їжі), але при збігові з годуванням набувають умовнорефлекторної дії. Натуральні умовні рефлекси на подразники є невід’ємною властивістю безумовного подразника, тісно з ним пов’язані (наприклад, вигляд, смак і запах їжі). Натуральні рефлекси формуються з першого моменту знайомства людини або тварини з навколишнім світом, постійно підкріплюються і внаслідок цього стають стійкішими, міцнішими від штучних умовних рефлексів.
Стосовно часу дії умовного і безумовного подразників умовні рефлекси діляться на одночасні (які збігаються), відсунуті (при великому відставанні умовного подразника від безумовного) або запізнілі й слідові. Залежно від того, з якого рецептивного поля виробляються умовні рефлекси, вони можуть бути класифіковані на екстеро-, вісцеро- і пропріоцептив-ні. Вісцероцептивні, або інтероцептивні, умовні рефлекси, будучи рефлексами, які формуються у органах, мають особливе значення.
Умовні рефлекси бувають першого, другого, третього і вищого порядку. Умовні рефлекси першого порядку виробляються на грунті якого-небудь безумовного реф-
Мал. 242. Схема установки для вивчення інструментальних умовних рефлексів' добування їжі у мавп
лексу. Умовні рефлекси другого і вищих порядків можуть бути вироблені при підкріпленні не безумовними, а умовними подразниками зміцнілого умовного рефлексутобто на тлі умовних рефлексів, що утворились раніше. Рефлекси- вищого порядку-утворю-ються лише при високій організації нервової системи. Так, у собак можна виробити умовні рефлекси II—IV порядку, у мавп — Дещо більше, а у людини умовні рефлекси вищих (II—XX) порядків переважно представляють його вищу нервову діяльність.
Умовні ланцюгові рефлекси — спеціальний вид об’єднання двох або більше умовних рефлексів (синтез рефлексів). Якщо, наприклад, кілька рухових рефлексів, вироблених у відповідь на різні умовні сигнали, багаторазово здійснюються в певній послідовності, то сигнальний подразник першого в цьому ряду рефлексу набуває властивості запускати весь ланцюг послідовних рухових рефлексів. Такий складний ланцюг (система) умовних рефлексів отримав назву динамічного стереотипу. Явища стереотипу є основою різних форм поведінкової діяльності тварин, а також мовних, трудових, спортивних, музичних та інших навиків людини. До них належать і суворо регламентований режим дня (у лікарні, санаторії та ін.), розклад навчальних занять.
Виділяють також інструментальні, або оперантні, умовні рефлекси. Найхарактернішою особливістю цих рефлексів вважається те, що їх здійснення у вигляді тих чи тих рухових реакцій є обов’язковою умовою як для одержання ефекту «нагороди», так і для уникнення дії больового подразника тощо, тобто підкріплення залежить від дії власне суб’єкта (мал. 242). Метод оперантних умовних рефлексів останнім часом застосовується в клініці.
У природних умовах перелічені вище типи рефлекторних реакцій порівняно рідко зустрічаються в ізольованому вигляді. Набагато частіше вони утворюють складні динамічні системи, комплекси, які й складають фізіологічну основу цілісних поведінкових актів і пристосувальних навичок.
ЗАКОНОМІРНОСТІ
УМОВНОРЕФЛЕКТОРНОЇ ДІЯЛЬНОСТІ
Умовні рефлекси — це індивідуально набуті системні пристосувальні реакції тварин і людини, які виникають на підставі утворення в ЦНС тимчасового зв’язку між умовним (сигнальним) подразником і будь-яким безумовнорефлекторним актом. Біологічне значення такого рефлексу полягає в його сигнальності, тобто в набутті яким-небудь індиферентним подразником ролі запобіжного чинника, який сигналізує про настання подальших подій і готує організм до взаємодії з ними. За допомогою умовних рефлексів тварина або людина може уникнути небезпеки або підготуватися до прийому їжі, зустрічі із статевим партнером тощо.
Фізіологічні властивості умовних рефлексів. Умовні рефлекси багато в чому відрізняються від безумовних. Передусім вони є індивідуальними рефлексами, набутими протягом життя даного організму. Умовні рефлекси виникають завдяки утворенню функціональних тимчасових зв’язків, прокладанню нових нервових шляхів у вищих відділах ЦНС внаслідок специфічної замкненої функції, яка є важливою фізіологічною властивістю цих відділів мозку. Умовні рефлекси лабільні за інтенсивністю і тривалістю. Це тимчасові рефлекси.
Рефлекторна дуга умовного рефлексу проходить в основному через кіркові структури, але елементи замикання її (особливо простих, елементарних умовних рефлексів) є й у підкіркових структурах. Завдяки складності рефлекторної дуги умовні рефлекси мають триваліший латентний період, ніж безумовні.
Умовні рефлекси не мають специфічного рецептивного поля і можуть викликатися зі всіх екстеро- і інтеро-цептивних полів (наприклад, умовне слиновиділення можна викликати, впливаючи на рецептори ока, вуха, носа й інші рецепторні поверхні). Умовні рефлекси можуть викликати і неадекватні подразники (наприклад, звук метронома може стати умовним секреторним або руховим подразником, хоч не мдє ніякого відношення ні до секреторної, ні до рухової діяльності).
Умови, потрібні для вироблення умовних рефлексів. Першою умовою утворення умовного рефлексу є збіг у часі або деяке передування індиферентного (умовного) подразника безумовному, так зване підкріплення (мал. 243). Наприклад, дія умовного подразника (світло електричної лампочки) і підкріплення (їжа). Тільки за
Мал. 243. Схема утворення рефлекторної дуги умовного слиновидільного рефлекса:
<1 — подразнення світлом (умовний сигнал) супроводжується збудженням кіркового центру зору; б подразнення світлом, яке супроводжується годуванням, зумовлює збудження в кірковому центрі зору і пункті кіркового представництва центру слиновиділення; в — після багаторазового поєднання цих подразників світло лампочки спричинює виділення слинн
такої умови виникає тимчасовий зв’язок у корі великого мозку. Як бачимо, на відміну від безумовних рефлексів, тут якісно новою ланкою є підкріплення, тобто збіг у часі дії умовного й безумовного подразників. Обов’язковою умовою тимчасового зв’язку є також дійовий стан кори великого мозку. Під час глибокого сну або в стані наркозу умовні рефлекси не виробляються. Очевидно, замикальна функція кори великого мозку здійснюється лише в стані неспання, який підтримується переважно ретикулярною активізуючою
системою (РАС) мозку (див. с. 69). Дуже важко виробляються умовні рефлекси при глибокій втомі. Важливою умовою утворення тимчасових зв’язків є вільний від інших видів діяльності стан кори великого мозку під час вироблення умовного рефлексу. Тому всі подразнення, які зумовлюють енергічну діяльність кіркової речовини, заважають утворенню умовного рефлексу. Було створено спеціальні камери для вироблення умовних рефлексів — піддослідна тварина і експериментатор перебувають у різних приміщеннях (мал. 244).
Подразнення можуть надходити як із навколишнього середовища, так і з внутрішніх органів (переповненого сечового міхура, прямої кишки, шлунка, матки тощо).
Істотною умовою утворення тимчасових зв’язків є наявність сили індиферентного агента, який повинен стати умовним подразником. У відповідь на слабші (фізично чи біологічно) умовні подразники і рефлекси утворюються повільніше; вони менш стійкі й, будучи непідкріпленими, швидко згасають. Це і зрозуміло, адже умовний подразник за фізичною характеристикою і біологічним значенням повинен бути слабший, ніж безумовний.
Мал. 244. Камера для вивчення умовних рефлексів
Умовні рефлекси формуються поступово, при багаторазовому повторенні всіх вказаних вище умов, причому це відбувається хвилеподібно — вони то з’являються, то зникають, доки не настане їх стабілізація за інтенсивністю й регулярністю, яка свідчить про зміцнення умовних рефлексів.
Агенти, які можуть викликати умовні рефлекси. Умовним подразником може стати будь-який агент навколишнього зовнішнього або внутрішнього середовища, для якого організм має рецейтор-ний апарат. Одні з них діють через екстеро- й інтероцептори, інші — впливають безпосередньо на рефлекторні центри внаслідок зміни складу крові або коливання обмінних процесів у тканинах (так звані автоматичні умовні подразники, які впливають на центральні відділи рефлекторної дуги). До умовних подразників належить також час дії. Умовний подразник, який впливає через рецептори, може бути ізольованим або частиною комплексного. Наприклад, приміщення, в якому виробляється умовний рефлекс, своїм виглядом, звуками, запахами, іншими подразниками входить як єдине ціле до складу комплексного умовного подразника. Комплексні подразники бувають одночасні (коли різні агенти діють одночасно), послідовні (окремі агенти розташовуються у визначеній послідовності) та ланцюгові (на ланцюгу подразників кожна
ланка діє ізольовано одразу після попередньої). Агенти, які входять до складу комплексних подразників, можуть діяти на одну й ту ж сенсорну систему або на різні.
Стадії утворення умовних рефлексів. У початкових стадіях утворення умовних рефлексів відповідна реакція виникає не тільки на підкріплюваний умовний подразник, але й на інші подразники тієї чи тієї модальності. Це явище дістало назву узагальнення, або генералізації умовних рефлексів. У його основі лежить процес іррадіації збудження, в якому важливу роль відіграє РАС. Одразу за генералізацією умовного рефлексу, після поєднання умовного подразника з безумовним, настає стадія спеціалізації умовних рефлексів (умовна реакція приурочується до конкретного подразника і починає носити локальний характер). Важливу роль при цьому відіграє процес гальмування в корі великого мозку.
Гальмування умовних рефлексів. Гальмування умовнорефлекторної діяльності, як і діяльності ЦНС в цілому, відіграє виняткову роль. Завдяки йому уточнюються умовні рефлекси відповідно до змінних умов або відбувається їх тимчасова відміна, якщо умовний подразник втратив своє сигнальне значення. Гальмування лежить також в основі уміння чекати, зберігати самовладання, розрізняти (диференціювати) схожі між собою умовні сигнали тощо. Крім того, гальмування виконує й захисні функції стосовно нервових клітин у випадку впливу занадто сильних умовних подразників. Гальмівні процеси, які відбуваються в корі великого мозку, були розділені І. П. Павловим на дві групи: зовнішні, або безумовні, та внутрішні, або умовні.
Зовнішнє (безумовне) гальмування виникає одразу, не потребує спеціального вироблення, є природженим, як і безумовні рефлекси. Воно виникає тоді, коли при роботі одного із центрів кори великого мозку внаслідок подразнення аферентних нервів приходить у дію інший центр. Відбувається своєрідний конфлікт, або конкуренція між цими нервовими осередками. Умовнорефлекторна діяльність у кожному окремому випадку може бути затримана під впливом сторонніх зовнішніх подразників (поява нових предметів, звуків, запахів, зміна освітлення тощо), які зумовлюють орієнтовний рефлекс. Орієнтовний рефлекс — це чинник безумовного гальмування, який зустрічається найчастіше. При багаторазовій дії гальмівна дія подразника слабшає, він втрачає свій гальмівний вплив на умовні рефлекси. Такі поступові подразники, які при повторенні втрачають гальмівну дію, називаються тимчасовими, або гаснучими, гальмами. На відміну від них існують і постійні гальма, які зберігають свою гальмівну дію тривалий час. Ними часто стають патологічні процеси (наприклад, запальні), які відбуваються в організмі, сильні інтероцептивні подразнення (розтягнуті сечовий міхур, пряма кишка).
Позамежне (охоронне) гальмування виникає переважно у разі дії сильних подразників або тривалого впливу помірної інтенсивності подразників. З розвитком у вищих відділах ЦНС позамежного гальмування зв’язаний, зокрема, стан ступору (цілковитої нерухомості, заціпеніння).
У чому полягає біологічне значення позамежного гальмування? За даними І. П. Павлова, цей вид гальмування відіграє захисну роль. Своєчасний розвиток гальмування запобігає небезпеці глибокого функціонального виснаження клітин кори великого мозку, яку може спричинити дія сильного умовного подразника. Гальмування також сприяє відновленню метаболізму і працездатності нервових клітин, якщо вони під впливом позамежних подразників були виснажені.
Внутрішнє (умовне) гальмування є специфічним для кори великого мозку, потребує вироблення, тренування певних умов. Первинно воно виникає в середині центральних нервових структур власне умових рефлексів під впливом власних умовних подразників, які діють у особливих умовах. Звідси й походить його назва — внутрішнє, або умовне. Основною умовою для виникнення внутрішнього гальмування є те, що за дією умовного подразника припиняється дія безумовного рефлексу, тобто відміняється підкріплення. Як бачимо, ця умова прямо протилежна тій, при якій виробляється умовний рефлекс. Систематичний вплив умовного подразника без поєднання його з безумовним призводить до поступового ослаблення умовного рефлексу, а згодом і до його зникнення. Послаблення і зникнення умовного рефлексу свідчить не про руйнування, а лише про розрив тимчасового зв’язку, тобто про його гальмування. По-перше, зниклий рефлекс через деякий час відновлюється сам. По-друге, він відновлюється у разі дії сторонніх подразників (так зване розгальмування). Нарешті, рефлекс відновлюється навіть при одноразовому підкріпленні.
Внутрішнє гальмування можна поділити на: згасаюче, дифе-ренціювальне, запізніле й умовне.
Згасаюче гальмування розвивається тоді, коли вироблений умовний рефлекс не підкріплюється безумовним подразником. Воно має важливе біологічне значення: завдяки згасаючому гальмуванню великий мозок звільняється від інформації, яка за даних умов втратила своє-значення.
Диференціювальне гальмування розвивається тоді, коли із двох умовних подразників один систематично підкріплюється безумовним подразником, а дія другого не підкріплюється. Внаслідок цього умовний рефлекс на перший подразник майже не змінюється, а умовний рефлекс на другий (диференціюваль-ний) подразник поступово, хвилеподібно зменшується доти, доки не зникає зовсім. Диференціювальне гальмування є фізіологічною основою тонкого й досконалого умовнорефлекторного аналі
зу предметів і явищ навколишнього світу, а також подразників внутрішнього середовища організму.
Умовне гальмування є різновидом диференціювально-го за таких обставин: якщо до умовного подразника додається новий агент і ця комбінація повторюється багато разів без підкріплення. У такому випадку умовний подразник у вказаній комбінації втрачає свою сигнальну позитивну дію, а комбінація набуває гальмівного впливу. Завдяки умовному гальмуванню постійно коригується і уточнюється характер умовнорефлекторних реакцій на конкретні умови середовища.
Запізніле гальмування. Збільшуючи проміжок часу між дією умовного і безумовного подразників, тобто затримуючи підкріплення, можна спостерігати відповідне запізнення початку умовнорефлекторної реакції. Це гальмування отримало назву за-пізнілого. У дії запізнілого рефлексу розрізняють дві фази — початкову (недіяльну) і другу (діяльну). Початкова фаза характеризується відсутністю видимої дії умовного рефлексу і є проявом запізнілого гальмування, друга — проявом умовного рефлексу. Запізніле гальмування має велике біологічне значення. Завдяки йому регулюється діяльність органів (наприклад, початок шлункової секреції після їди), виробляється вміння чекати, зберігається енергія у випадку великого напруження тощо. Таким чином, за допомогою внутрішнього гальмування безперервно уточнюється й коригується характер умовнорефлекторних реакцій.
Механізми виникнення внутрішнього і зовнішнього гальмування ідентичні. Гальмування в корі великого мозку здійснюється гальмівними інтернейронами, які закінчуються на сомі й дендритах. Найімовірнішими кандидатами в гальмівні інтернейрони є зірчасті клітини. Встановлено, що кіркове гальмування є пост-синаптичним гіперполяризаційним, зумовленим головним чином зміною проникності С1_-каналів постсинаптичної мембрани. Основним медіатором кіркового гальмування є ГАМК.
МЕХАНІЗМ ТВОРЕННЯ
УМОВНИХ РЕФЛЕКСІВ
Будь-який умовний рефлекс починається з конвергенції гете-росенсорних стимулів (умовних і безумовних), а також з полегшення (потенціації) та реверберації збудження в нервових сітках (див. с. 59).
У процесі формування умовного рефлексу напрям руху нервових процесів у корі великого мозку визначається механізмом і властивостями домінанти (див. 65). Осередок збудження, що виникає в корі великого мозку від умовного стимулу, може іррадіювати в усі боки. Проте у разі наявності домінантного осередку збудження, зумовленого підкріпленням, іррадіація буде спрямову
ватися в його бік. Таким чином, домінанта забезпечує генералізацію умовного рефлексу, пошукову фазу поведінки. Наявність домінанти є умовою швидкого вироблення умовного рефлексу.
Клітинні механізми утворення умовного рефлексу. Існують дві гіпотези вироблення умовного рефлексу: синаптична і мембранна. Згідно з першою гіпотезою, механізмом формування умовного рефлексу є зміна ефективності синапсів. Прихильники другої гіпотези вважають, що основним механізмом умовного рефлексу є зміна властивостей збудливої постсинаптичної мембрани. Використання внутрішньоклітинної реєстрації постсинаптичних потенціалів дозволило зробити висновок про визначальну роль синаптичних змін в утворенні тимчасового зв’язку. Дослідження реакції нейронів головного мозку при формуванні умовного рефлексу показали, що найістотніші зміни характерні для кіркових полісенсорних нейронів. Якщо до першого поєднання стимула з підкріплюючим рефлексом нейрони були переважно моносенсорними, то у міру подальшого поєднання вони набувають здатності відповідати на стимули різних сенсорних модальностей і параметрів, тобто стають полісенсорними. При досить стійкому умовному рефлексі відповіді нейронів знову набувають моносенсорного характеру, але тепер це вибіркова реакція — тільки на той стимул, який набув сигнального значення для поведінкового акта. У формуванні умовних рефлексів бере участь два класи інтернейронів: командні нейрони, які реалізують специфічні поведінкові акти, і модулюючі, що регулюють стан командних нейронів.
Останнім часом висловлюють припущення про механізми замикання тимчасового зв’язку на молекулярному рівні, а також про появу нових синапсів або їх ріст у процесі вироблення умовних рефлексів (навчання). Вважають, що під впливом зовнішнього сигналу в РНК створюється певний код, і до цього індиферентний (умовний) подразник набуває сигнального значення. У разі тривалого, часто повторюваного впливу зовнішнього подразника під дією активізації апарата синтезу нуклеїнових кислот і білків у нейронах виникають нові синаптичні зв’язки і навіть відбувається ріст нейрона та його відростків. Перебігу цього процесу в порівняно короткі інтервали часу може сприяти транспорт готових ну-клеотидів і потрібних ферментів з нейроглії в нейрон, який функціонує.
Процес утворення тимчасових зв’язків залежить також від активності катехоламінергічних та серотонінергічних систем мозку. Вважають, що норадренергічні системи більшою мірою причетні до формування тимчасових зв’язків, а серотонінергічні — до їх фіксації.
Найбільше значення для навчання мають фронтальна і сенсорна кора та гіпокамп. У цих відділах мозку змінюється імпульсна активність нейронів вже при перших поєднаннях умовного подраз
ника і поведінкової рухової реакції. Так, реакції нейронів сенсо-моторної кори (зниження опору мембрани і збільшення збудності клітини) передували появі перших умовнорефлекторних рухів і зникали у разі їх відсутності. Таким чином, першочергово виниклі функціональні зміни, які виражаються переважно в активізації нейромедіаторних систем і апарата синтезу білка, потім набувають структурних змін і стають основою тривалих зв’язків, характерних для умовного рефлексу. Проблема замикання умовнорефлекторного тимчасового зв’язку є частково загальною проблемою формування пам’яті.
ПАМ'ЯТЬ
Пам’яттю називається збереження інформації про подразник після припинення його дії. Механізми пам’яті забезпечують: фіксацію поточної інформації, її збереження у вигляді слідів (ен-грам), відтворення (згадування) у міру потреби. Розрізняють пам’ять як біологічну функцію і пам’ять як функцію психічну (або нервово-психічну). Пам’ять як біологічна функція — це насамперед пам’ять філогенетична, або генетична, яка визначає будову і форми поведінки кожного організму відповідно до історії розвитку його виду. Біологічна пам’ять існує не тільки у філогенетичній, але й у онтогенетичній формі. До онтогенетичної пам’яті належить, наприклад, явище імунітету (імунологічна пам’ять), набутого в процесі онтогенезу. Пам’ять як психічна функція також є онтогенетичною.
Загальними характеристиками пам’яті є тривалість і міцність збереження інформації, об’єм закарбованої інформації, точність зчитування і особливості її відтворення. У людини механізми зчитування і відтворення розвинуті, порівняно з іншими біологічними системами, максимально. Проте саме ці механізми є й найуразли-вішими у разі патології мозку.
Види пам’яті. За тривалістю процеси пам’яті ділять на такі категорії: сенсорна - пам’ять (характерне короткочасне відображення— «фотографування» — слідів; триває 0,1—0,5 с); короткочасна пам’ять (процеси відображення, які тривають кілька секунд або хвилин, наприклад, запам’ятовування номера телефону, який людина тільки-но прочитала) і довготривала пам’ять (тривале, можливо, протягом усього життя, зберігання слідів пам’яті). Крім того, виділяють проміжну, або лабільну, пам’ять (перехід енграми з короткотривалої в довготривалу пам’ять, що триває певний період без повторення, тобто зберігає інформацію на час, потрібний для поточної діяльності).
Вважають, що із загального потоку свідомо сприйнятої інформації довготривала пам’ять повинна відбирати приблизно 1 %. Ясна річ, при цьому відбирається найважливіша інформація (на
приклад, така, яка потрібна для виживання організму). Якщо інформація, що зберігається в короткочасній пам’яті, не трансформується в довготривалу, вона швидко «витирається». У довготривалій пам’яті інформація зберігається в доступному для зчитування і відтворення вигляді. Існує припущення, що обробка й переведення інформації із проміжної в довготривалу пам’ять відбувається під час сну.
Пам’ять як нервово-психічна функція характеризується, крім перерахованих видів, ще рядом інших. Розрізняють пам’ять механічну, логічну, образну. В однієї людини може бути краще розвинута логічна пам’ять, наприклад, на міркування й думки, у іншої — образна. Така людина добре пам’ятає картини природи, почуту колись музику, побачені художні полотнища тощо. З точки зору модальності (якості подразника) процесів пам’яті відповідно виділяють зорову, тактильну, рухову (моторну), нюхову пам’ять та ін. Відомо, що різні за модальністю подразники закарбовуються людьми по-різному. В цьому не малу роль відіграють природжені здібності людини. Одна людина краще запам’ятовує зорову інформацію, інша — шкірно-кінестичну або звукову (мовну або не-мовну).
Механізми пам’яті. Припускається, що в основі різних видів пам’яті лежать різні, хоча й взаємозв’язані, механізми (фізіологічні, біохімічні, структурні та ін.). Судячи за морфологічними та електрофізіологічними даними, механізми короткочасної пам’яті полягають, можливо, в реверберації збудження в замкнених ланцюгах нейронів, нейрональних комплексах. Висловлюється також думка про значення в механізмах короткочасної пам’яті посттета-нічної потенціації (див. с. 52), яка супроводжується підвищенням ефективності синаптичного проведення збудження. Аргументом на користь такої точки зору служать дані про тривалість посттетанічної потенціації, яка в деяких збуджувальних синапсах (наприклад, пірамідних нейронах гіпокампа) може тривати кілька годин.
Дещо складніші і менше вивчені механізми довготривалої пам’яті. Результати експериментальних досліджень засвідчили, що серед великої кількості біохімічних компонентів нервової тканини тільки нуклеїнові кислоти (ДНК і РНК), білки і їх комплекси з цукрами та ліпідами можна розглядати як кандидатури на «молекули пам’яті», оскільки вони більшою мірою задовольняють вимоги: беруть участь у кодуванні великого об’єму інформації (приблизно 3-Ю8 бит), лабільні (їх молекули здатні змінювати властивості під впливом інформації, яка підлягає запам’ятовуванню), стабільні (молекули можуть зберігати інформацію або її відтворювати протягом усього життя). Доведено, що РНК-залежний синтез білків є умовою (хоча, можливо, й не єдиною) консоліда-
ції і формування тривалої пам’яті. Було виділено (переважно з нервової тканини) специфічні білки та поліпептиди, вміст яких у нейронах та гліальних клітинах при виробленні нових поведінко-вих навичок відчутно збільшується. До них належать поліпептид скотофобін та ін. Вплив інгібіторів на синтез специфічного білка веде до порушення пам’яті. Все це вказує на важливу роль системи РНК — білок у забезпеченні пам’яті у людини і тварин. Трива
ла пам’ять припускає також стійкі структурні зміни на клітинному
рівні — у відповідних синапсах.
Таким чином, у основі цих двох видів пам’яті лежать різні, хоча й взаємозв’язані механізми. Короткочасна пам’ять забезпе
чується нейродинамічними, біоелектричними процесами, довготри-вала — допускає стійкі зміни на клітинному (в ділянці синапсів
тощо), САПИЛНинному 1 молекулярному"^ молекулах РНК, глюкопротеїдах тощо) рівнях. Незважаючи на такі відмінності між ко-
роткочасною і довготривалою пам’яттю, їх передусім треба розглядати як послідовні етапи єдиного процесу.
Мозковий апарат пам’яті. Основним місцем тривалого зберігання слідів минулого досвіду є кора великого мозку, причому особливе значення мають асоціативна зона скроневої кори, скроне-тім’яна, лобні ділянки мозку. Разом із тим для передавання слідів збудження з проміжної пам’яті в довготривалу істотну роль відіграє гіпокамп. Отримано також дані про участь у процесах пам’яті деяких таламічних ядер і ретикулярної формації мозкового
стовбура. Значення ретикулярної формації визначається важливою роллю цієї структури в підтриманні рівня неспання і спрямо-
ваної уваги.
Порушення пам’яті бувають надзвичайно різноманітними. У клі
нічній літературі описано випадки не тільки послаблення чи повного випадання пам’яті, але й її посилення. Ослаблення пам’яті
(гіпоамнезія) може бути зв’язане з віковими змінами або бути "природженим чи розвиватися внаслідок якого-небудь захворювання мозку (склерозу мозкових судин тощо). До особливого типу порушення пам’яті належать амнезія (значне зниження або відсутність пам’яті, які виникають При ушкодженні мозку), струс мозку, інсульт та ін. При ретроградній амнезії спостерігається втрата здатності до видобування інформації, накопиченої в пам’яті до моменту ушкодження мозку, тобто відбувається «спустошення» проміжної пам’яті. У випАдку антеградної амнезії хворі втрачають пам’ять на поточні події при'збереженні її на окремі моменти. Така амнезія є наслідком втрати здатності до передавання інформації від проміжної пам’яті в довготривалу, і виникає, зокрема, при ушкодженні гіпокампальної ділянки лімбічної системи. Однією з аномалій пам’яті є гіперамнезія^ різке збільшення об’єму й міцності запам’ятовування матеріалу в порівнянні з нор
мою. Відомі випадки й природженої гіперамнезії. Ці порушення виникають також при локальних ушкодженнях мозку (наприклад, при гіпофізарній патології).
ФУНКЦІОНАЛЬНА СТРУКТУРА
ПОВЕДІНКИ
Здатність до формування програм поведінки, планів є найважливішою ланкою в системі адаптивних властивостей організму. Однак процеси й механізми формування поведінкових програм ще не досить вивчені.
Функціональна структура поведінкового акту грунтується на минулому життєвому досвіді (довготривала пам’ять), домінуючій у даний момент мотивації і оцінці наявної ситуації.
Стадії поведінкового акту. Згідно з теорією функціональних систем (П. К. Анохін, 1935), фізіологічна архітектура поведінкового акту складається з таких послідовно змінних стадій: аферентного синтезу, прийняття рішення, акцептора результату дії, еферентного синтезу (або програми дії), формування власне дії (виконання програми поведінки), оцінки досягнутого результату (мал. 245).
Поведінковий акт будь-якої складності починається із стадії аферентного синтезу. Під час цієї стадії в ЦНС взаємодіють кілька чинників, зокрема, домінуючої мотивації, пам’яті, обстановочної аферентації і пускової аферентації. Однією із умов аферентного синтезу є одночасне поєднання усіх цих чинників. Цей синтетичний процес здійснюється на підставі конвергенції, яка відбувається на одному й тому ж нейроні. У процесі аферентного синтезу одночасно вирішуються такі питання: що робити? (домінуюча мотивація і обстановочна аферентація), як робити? (пам’ять) і коли робити? (пускова аферентація — умовний сигнал). Наприклад, при переході через вулицю людина, перше ніж прийняти цц рішення, повинна ретельно оцінити досить велику кількість компонентів аферентного синтезу — кількість машин, швидкість руху, ширину вулиці, свої сили, видобутий з пам’яті минулого життєвий досвід тощо (звичайно, все це триває мить).
Прийняття рішення грунтується на аферентному синтезі і є вибором найоптимальнішого варіанту подальших дій. Тобто відбуваються вибір потрібних у даний момент потенційних ступенів свободи і гальмування непотрібних ступенів свободи. Вважають, що механізм «прийняття рішення» зосереджений у лобних частках— найбільш інтегруючих і компактних структурах головного мозку. При їх ушкодженні, поряд з іншими симптомами так званого лобного синдрому, істотно порушується процес прийняття рішення.
Формування акцептора наслідку дії. Акцептор наслідків дії
Поведінковий акт
Зворотно аферентація
ОбстаноВочна аферентація (Що?} ----
Пусковий ----
стимул (Коли?)
Мал. 245. Схема структури цілеспрямованого акту поведінки (за даними П. К. Анохіна, 1970)
становить собою дуже складний нервовий апарат, який формується безпосередньо після прийняття рішення і початку виходу еферентних збуджень із мозку. Це аферентна модель майбутнього наслідку й оцінки реального наслідку. Вона дозволяє прогнозувати, передбачати ознаки потрібного в даний момент майбутнього наслідку дії і порівнювати їх із параметрами реального наслідку. Інформація надходить до акцептора завдяки зворотній аферентації. Саме цей апарат дозволяє організму виправити помилку поведінки буквально за частки секунди і довести поведінкові акти до запрограмованих. Вважають, що в акцептор входять кіркові нейрони, на яких конвертують не тільки різноманітні аферентні, але й еферентні збудження, які надходять до цих нейронів аксонними колатералями від пірамідних клітин кори великого мозку. Всі ці збудження циркулюють у створених за рахунок багатьох колате-ралей замкнутих нейронних ланцюгах (своєрідні кола чекання). В них і порівнюється та оцінюється реальний результат з очікуваним (його аферентною моделлю). Якщо при такому порівнянні з’ясувалося, що параметри реального результати (закодованого в зворотній аферентації) відповідають параметрам його моделі^ то-
даний поведінковий акт завершується і настає наступний етап по-ведінкової діяльності. . Якщо ж указані параметри не збігаються ® акцепторі, то виникає так зване неузгодження (розлад), яке -стає стимулом для прийняття нового рішення. В цьому випадку виникає орієнтувальний рефлекс, який супроводжується підвищеною активізацією нервової діяльності й сприяє активному підбору додаткової інформації для досягнення кращого результату.
У процесі організації поведінкового акту беруть участь різні мозкові структури. До них належать насамперед передні відділи нової кори, гіпокамп, мигдалевидне тіло, гіпоталамус, ретикулярна формація, які взаємодіють між собою і відіграють вирішальну роль в оцінці сигналів, що надходять із зовнішнього та внутрішнього середовища, а також у виборі відповідних поведінкових реакцій (прийняття рішення). Важливе значення для реалізації поведінкового акту мають асоціативні таламокортикальні системи (див. с. 89). Ці утвори мозку беруть участь у виконанні багатьох психічних функцій: програмуванні цілеспрямованих рухів і дій, пізнавальних процесів, мовної функції та ін.
Нейронні механізми поведінки. На підставі матеріалів вивчення активності окремих нейронів під час виконання складних по-ведінкових актів було виділено велику кількість груп нейронів, які відрізняються між собою функціями. До них належить велика група сенсорних нейронів, зокрема нейрони-детектори. Вони вибірково реагують на певну досить просту якість або властивість зовнішнього світу (елементи форми, кольору тощо). Серед сенсорних нейронів у верхній скроневій ділянці кори великого мозку і мигда-левидному тілі мавп виявлено групу спеціальних нейронів — гностичних одиниць, які вибірково реагують вже не на прості, а на складні інтегративні ознаки (обличчя конкретних людей або мавп, на їх фотографії тощо). Крім того, відкрито нейрони, які вибірково реагують на емоційні стимули (наприклад, вираз загрози на «обличчі). Виділено також особливий клас нейронів, активність яких посилюється під впливом нових стимулів і знижується у міру звикання до них. Це так звані нейрони новини, які описані для тіпокампа, неспецифічного таламуса, ретикулярної формації та інших структур.
Особливу групу нейронів складають нейрони середовища, або місця, які вибірково збуджуються у відповідь на певну обстановку або певне місце в просторі. Наприклад, у досліді ці нейрони реагували на умовний сигнал, поданий зліва або справа чи у момент перебування тварини в певній ділянці клітки. Такі нейрони виявлено в моторній, сенсомоторній, зоровій корі великого мозку та гіпокампі.
У багатьох структурах мозку містяться нейрони очікування, •які активізуються під впливом мети поведінкового акту, наприклад, реакції на вигляд їжі. Вони були зареєстровані в гіпотала
Мусі, лобній, скроневій та тім’яній ділянках кори великого мозку мавп. Реакції цих нейронів залежали від мотиваційного збудження (рівня мотивації).
Виділено також нейрони, які активізуються при виконанні цілеспрямованих рухів. Це нейрони мети. їх зареєстровано в мотор-лій, сенсомоторній, зоровій корі великого мозку та гіпокампі. Нарешті, описані також нейрони, активізація яких тісно пов’язана із; запуском рухів, із здійсненням певних рухів, незалежно від їх; ролі й місця у структурі поведінкового акту. Серед них розрізняють командні нейрони, збудження яких пов’язане із скороченням або розслабленням окремого м’яза, і мотонейрони.
Таким чином, дослідження, виконані на нейронному рівні, дозволяють зробити висновок про те, що активність нейронів пов’язана з поведінковим актом і що окремі його стадії, етапи представлені різними групами нейронів. При цьому нейрони зі схожими функціями можна виявити в різних структурах мозку, що не заперечує їх спеціалізації. Так, для гіпокампа характерні нейрони місця, хоча їх виявлено також у неокортексі й гіпоталамусі. Але в цих структурах їх міститься незначна кількість, тоді як у полях, гіпокампа вони складають більшість.
ОСОБЛИВОСТІ ПСИХІЧНОЇ ДІЯЛЬНОСТІ людини
Основні закономірності умовнорефлекторної діяльності вищих тварин і людини є спільними. Але мозок людини від мозку тварин принципово відрізняється у функціональному відношенні. І. П. Пав-ловим було висловлено ідею про специфіку мозку людини. Учений запропонував при оцінці функціональних особливостей мозку людини виходити з характеру тих сигналів, які специфічні тільки-для людини. Для тварин умовними сигналами, які ведуть до утворення умовних рефлексів, є безпосередні подразнення та їх сліди, тобто всі екстеро- та інтероцептивні подразнення, які надходять у кору великого мозку. Це те, що і ми вважаємо відчуттями, враженнями, уявленнями про навколишній світ. За І. П. Павловим, це перша сигнальна система дійсності, яка є спільною для людини і тварин. Але завдяки слову (мові) сформувалась друга, спеціально людська, сигнальна система дійсності. Вона розвинулась завдяки праці, суспільно-трудовій діяльності, яка сприяла все тіснішому спілкуванню первісних людей між собою і утворенню суспільства. При цьому з’явилась потреба в звуковій сигналізації — членороздільній мові, завдяки якій стали можливими узгодження трудових рухів і взаємної підтримки. «Слово зробило нас людьми»,— писав* І. П. Павлов.
СЛОВО ЯК УМОВНИЙ ПОДРАЗНИК
Слово, будучи умовним подразником, характеризується такими властивостями: а) воно є сигналом конкретних сигналів (сигнал сигналів); б) здатне до узагальнення різних конкретних, чутливих сигналів першої сигнальної системи (наприклад, у слові «дерево» узагальнено ознаки всіх дерев, незалежно від їх конкретної різниці); в) слово може відволікати (абстрагувати) від конкретної. дійсності, на цьому грунті формується абстрактне, логічне мислення людини.
До умовних сигналів другої сигнальної системи слід зарахувати не тільки ті слова, які чуємо, бачимо написаними, але й нотні знаки, міміку та жести глухонімих, які теж виконують функції позначення перших конкретних сигналів дійсності. Потужним подразником людського мозку є так звана внутрішня мова (сам до себе). Слово як умовний подразник другої сигнальної системи діє на людину своїм змістом (семантикою), а не звуковою характеристикою (акустичною оболонкою). Про це свідчить ряд експериментів (наприклад, вироблений умовний рефлекс на слово «доріжка» може бути викликаний його синонімом «стежка»; умовний подразник — цифра 5 — може бути замінений цифрами 2 + 3 (або 10:2 тощо). У тварин слово теж може служити умовним сигналом, але діє воно своєю акустичною характеристикою, а не змістом.
Таким чином, людина сприймає безпосередньо навколишній світ на основі першої сигнальної системи, а абстрактне, понятійне мислення зв’язане з другою сигнальною системою. Друга сигнальна система є вищою формою нервової діяльності людини, вищим регулятором людської поведінки.
Дуже важливо, що слово є не тільки фізіологічним, але й сильним лікувальним чинником. Тому лікарі та інші медичні працівники повинні бути дуже обережними в словах, щоб не спричинити у хворого так звану ятрогенію, тобто захворювання (переважно психоневроз), які виникають при недоречних висловлюваннях лікаря, іноді навіть відповідній міміці.
Фізіологічні основи мови. Мова є дуже складною психічною діяльністю, специфічно людською формою відображення дійсності.
Функції мови. Мова виконує важливі функції, а саме: комунікативну, понятійну, регуляторну й програмуючу. Комунікативну функцію можна визначити як процес спілкування за допомогою мови (в елементарній формі ця функція притаманна й тваринам у вигляді відтворення звукових або зорових подразників, які є сигналами для інших тварин). Понятійна функція полягає в тому, що мова є основою і засобом понятійного, абстрактного, логічного мислення, механізмом інтелектуальної діяльності людини. Регуляторна функція мови полягає в тому, що за допомогою словесних
інструкцій або внутрішньої мови здійснюється керування найрізноманітнішими власними мимовільними діями і рухами, а також поведінкою інших людей. Слова впливають також на діяльність різних органів і систем організму людини. Програмуюча функція мови виражається в побудові (за допомогою внутрішньої мови) змістовних схем висловлювання, граматичної структури речення, різних рухів і дій.
Види мови. Виділяють експресивну і імпресивну мову. Експресивна мова — це процес мовного висловлювання (у вигляді усної мови чи письма), який починається із задуму (програми висловлювання), потім проходить стадію внутрішньої мови і завершується висловлюванням за допомогою слів. Імпресивна мова — процес розуміння мовного висловлювання (усного чи письмового), який розпочинається із сенсорного його сприйняття (через слух або зір), потім відбувається декодування словесної інформації і завершується формуванням змістової її схеми. Для декодування словесної інформації потрібні активний аналіз найістотніших елементів її змісту, вилучення їх із пам’яті. Ці процеси здійснюються переважно скроне-тім’яно-потиличними відділами лівої півкулі великого мозку. Ушкодження цих відділів спричинюють розлади розуміння загального змісту мови, складних логіко-граматичних форм мови і лічильних операцій.
Усі ці форми мови складають єдину функціональну систему. Про це свідчать як дані нейропсихології, так і клінічні спостереження: при локальних ушкодженнях великого мозку (переважно лівої півкулі) розлади поширюються на всі форми мовної діяльності з переважанням того чи того дефекту мови. Такі мовні розлади називають афазіями.
Центри мови займають кілька ділянок кори великого мозку. Понад 100 років тому П. Брока (1861) вперше виявив, що при ураженні нижніх відділів третьої лобної лівої півкулі втрачається мова. Цей центр локалізується поруч із рухливою ділянкою, котра контролює функцію м’язів язика і глотки, обличчя, тобто тих м’язів, які беруть участь у артикуляції. Він називається моторним центром мови. Екстирпація або інші ушкодження зони Брока призводять до афазії. Такі хворі розуміють мову, але говорити не можуть.
Другим центром мови є ділянка задніх відділів першої скроневої борозни (сенсорний центр мови Верніке). Він розташований поруч із слуховою зоною (мал. 246). Ураження його супроводжується. порушенням розуміння мови при збереженні здатності до перекрученої спонтанної мови. Цей тип патології називається сенсорною афазією.
Пізніше виникли центри мови, які забезпечують процеси читання й письма. Центр письмової мови розташований у ділянці потилиці — перед кірковим відділом зорового аналізатора. Однією із
Мал. 246. Ділянки кіркової речовини великих півкуль, пов'язані з мовними функціями. Мовні функції лівої півкулі: а — зона Брока; б — зона Верніке; в — центр зорових представництв
форм афазії е амнезія (потилична афазія), яка характеризується забуванням окремих слів (мовна пам’ять).
Перераховані центри мови в більшості людей містяться в лівій півкулі великого мозку. Локалізація центра мови в лівій півкулі великого мозку свідчить про те, що виникнення мови зв’язане з трудовою діяльністю людини: її досконаліша (вміла) права рука іннервується саме із лівої половини великого мозку.
УТВОРЕННЯ ГОЛОСУ (ВОКАЛІЗАЦІЯ)
Будова верхніх дихальних шляхів забезпечує не тільки проведення повітря в легені і назад, але й виконання однієї із найважливіших для людини функцій — утворення голосу. Це забезпечується: а) особливостями будови гортані; б) наявністю резонаторів; в) здатністю керувати швидкістю руху повітря; г) здатністю контролювати положення і натяг голосових зв’язок положенням губ, м’якого піднебіння.
Вокалізація включає два взаємопов’язаних процеси: фонацію і артикуляцію.
Фонація. Звук утворюється при вібрації голосових зв’язок тоді, коли повітря під час видиху проходить між ними. Голосові зв’язки розташовані вздовж латеральних стінок гортані. їх положення і натяг забезпечуються групою відповідних м’язів (мал. 247). Так, при скороченні заднього персневидно-черпакуватого м’яза, що ру-
хае назад черпакуваті хрящі, голосові зв’язки натягуються. Поперечний черпакуватий м’яз при скороченні зближує голосові зв’язки. Латеральні персневидно-черпакуваті м’язи, зближуючи черпакуваті хрящі, розширюють голосові зв’язки.
Особлива роль належить щитовидно-черпакуватим м’язам, які містяться в складках разом із голосовими зв’язками. Ці м’язи складаються з ізольованих волокон, кожне з яких іннервує-
Мал. 247. Схема звукового апарата гортані (за даними А. Сиуіоп, 1991):
1 — с. іЬугеоісІез; 2 — голосова зв’язка; Я— т. іЬугеоагуіаепоМеиз;
4 — рг. УосаІІз; 5-е. агуїаепоідеиз* 6 — іп. сгісоагуіепоідеиз Іаґ; 7 — т. ігапзуегзиз агуіепоідеиз; б — т. сгісоагуІепоИеиз розі
ться окремою гілочкою відповідного нерва. Завдяки цьому вони можуть скорочуватися окремими частинами і регулювати тонші голосові зв’язки й щілину, яка створюється між ними.
Вібрація голосових зв’язок відбувається при відносно швидкому про-
ходженні повітря ПІД час видиху через
звужену голосову щілину. Вважають, що вібрація відбувається за
вдяки такому механізму. При звужених голосових зв’язках повітря, яке проходить, їх роздимає. При цьому відносна вузькість щілини
сприяє току повітря.в цьому відділі, що в свою чергу створює часткове розрідження в просторі між голосовими зв’язками. Завдяки
цьому, згідно з законом Бернуллі, голосові зв’язки перекривають одна одну. Внаслідок цього потік повітря на деякий час припиняється, але ПІД ЙОГО ТИСКОМ, ЯКИЙ при цьому підвищується, вони знову розсуваються. Зазначений ефект повторюється, що і зумовлює вібрацію голосових зв’язок та виникнення звука.
Частота вібрації змінюється за рахунок послаблення або збіль-
шення напруги голосових зв’язок та зміни конфігурації голосової щілини. Перший механізм забезпечується скороченням власне м’язів гортані. М’язи, які оточують гортань, теж можуть брати участь у зміні положення хрящів. При збільшенні напруги голосових зв’язок формується високий звук високого тону, а при їх зниженні створюються умови для формування низького тону. Висота звука залежить також від кута між зв’язками (мал. 248). Гострий кут забезпечує високочастотний звук, а при його збільшенні тон
знижується.
Артикуляція. Основними органами артикуляції є губи, язик і м’яке піднебіння. їх положення під час проходження повітря дозволяє відтворювати окремі звуки. Стан кожного із них, конфігурація контролюються свідомо корою великих півкуль.
Індивідуальні особливості губ, язика, м’якого піднебіння на-
Мал. 248. Положення голосових зв’язок при фонації (за даними А. С. Сиуіоп, 1991)
дають звукам індивідуального забарвлення. Велике значення при цьому мають резонатори — порожнини рота, носа, пазухи лицьового черепа, глотки та грудної клітки.
Міжцентральні зв’язки в забезпеченні формування мови. У процесі формування мови виникає взаємодія між окремими її центрами. Вона здійснюється за двома зв’язками: прямим кортико-кортикальним і опосередкованим через таламус. Різні структури кооперуються за такою схемою. Спочатку акустична інформація, котра міститься в слові, обробляється в слуховій сенсорній системі мозку. Потім вона передається у розташований поруч із кірковим краєм слухового аналізатора центр Верніке, де розшифровується зміст слова. При прочитанні слова імпульси, які надходять у зорову сенсорну систему, заносяться в кутову борозну, через яку зорове нейронне збудження сполучається з його акустичним аналогом, розташованим у зоні Верніке. Для вимовлення слова треба, щоб уявлення про його зображення надійшло в зону Брока. Зв’язуються названі центри за допомогою дугоподібного жмута волокон. У ділянці Брока імпульси, які надходять, сприяють формуванню програми артикуляції. Ця програма реалізується завдяки передачі імпульсів у обидві половини моторної зони мозку (пре-центральну борозну). Але для вимовлення звуків потрібне узгодження рухів відповідних органів з проходженням повітря.
Окрім цього, мовна функція має ще одну особливість — її емоційне забарвлення. Афективність мови забезпечують зв’язки лобатої і тім’яно-скроневої часток із структурами лімбічної системи,
а саме передньою лімбічною корою, покришкою і центральною сірою речовиною середнього мозку. Процеси, які забезпечують емоційне забарвлення і розуміння слова, є природженими.
РОЗВИТОК МОВНОЇ ФУНКЦІЇ У дитини
Основні закономірності розуміння усної мови формуються ще на початкових етапах онтогенезу — коли дитина починає вимовляти перші слова («дай», «мама» тощо). У неї на слова виробляються умовні рефлекси. Протягом другого року дитина привчається завдяки звуконаслідуванню з’єднувати слова в прості словесні системи з двох-трьох слів. На третьому році життя дитина дуже любить наслідувати когось, повторює окремі слова й словосполучення, які фіксуються в пам’яті й стають словесними стереотипами. За допомогою цих стереотипів дитина сама виражає системні процеси, які відбуваються в її мозку у відповідь на зовнішні подразнення. Наприкінці третього року словниковий запас дитини становить близько 500—700 слів. На четвертому, п’ятому і шостому роках життя відбуваються подальше вдосконалення і закріплення мовних функцій. До 5—7 років діти вже вільно говорять рідною мовою. В їх лексиконі з’являються абстрактні, понятійні позначення. Створюються можливості для навчання читати й писати. Мовна система продовжує вдосконалюватись і в наступні роки, збагачується словниковий фонд, висловлювання стають все точнішими тощо.
ФУНКЦІОНАЛЬНА АСИМЕТРІЯ КОРИ
ПІВКУЛЬ ВЕЛИКОГО МОЗКУ
Відомості про локалізацію й функцію окремих відділів головного мозку людини було отримано відносно недавно. Основою цих досліджень є анатомо-фізіологічні особливості: висхідні й низхідні провідні системи мозку переходять на протилежну половину тіла, а тому ліва півкуля великого мозку відповідає за соматосенсорну чутливість і рух правої половини тіла, а права навпаки.
Найвірогідніші дані про латералізацію функцій м о з -к у вчені отримали при обстеженні хворих на епілепсію, в яких з лікувальною метою повністю перерізували мозолисте тіло, яке складається з мільйонів волоконець, котрі сполучають обидві півкулі великого мозку. Дослідження свідчать про те, що аналітико-синтетичні процеси, які відбуваються в асоціативних зонах кори лівої і правої півкуль великого мозку, здійснюються по-різному. Особливо наочно це проявляється стосовно функцій, пов’язаних із мовою. У правші ізольована ліва півкуля великого мозку функціонує майже так само ефективно, як і весь мозок, здатна забез
печити всі види мови, а права півкуля не може забезпечити ні усну, ні письмову мову. Однак ці уявлення не є абсолютними. Доведено, що центральні механізми, котрі відповідають за письмо' й читання, у правші дещо залежать від способу написання. При позначенні слова літерами цей центр локалізований у лівій півкулі великого мозку; при написанні ієрогліфів, коли використовується спосіб креслення складів, слів або фраз, центр письмової мови локалізується в правій півкулі.
Описані міжпівкульні функціональні відмінності проявляються і при опрацюванні інформації, яка надходить структурами першої сигнальної системи. Правша краще сприймає інформацію правим вухом, а у лівші така закономірність не простежується. У більшості людей бінокулярний зір здійснюється переважно правим оком (60—70 %). Таким чином, у багатьох людей асиметрія мозку проявляється в двох формах: право- і лівостороння. Приналежність до правші чи лівші спадково запрограмована. Переучування в дитинстві лівши, у якого природжено центр мови розташований праворуч, призводить до одночасного перенесення центра мови (в цілому або частково) в ліву півкулю великого мозку, а це може істотно вплинути на мовну функцію мозку, зокрема, зумовити заїкання.
Висловлюють припущення, що ліва півкуля обробляє інформацію послідовно, у міру її надходження, права ж працює одразу з кількома входами, одномоментно й паралельно. Певно, інтуїція і прозріння є функціями правої півкулі великого мозку. Сьогодні наші уявлення про функції головного мозку, його лівої та правої половини збігаються з уявленнями про можливість виділення мислячого і художнього типу людей. Основою логічного способу мислення є ліва півкуля великого мозку, а образного, інтуїтивного — права.
УВАГА
Увагу не можна розглядати як самостійний психічний процес, оскільки вона не має свого змісту. Увага характеризує динаміку будь-якого психічного процесу, забезпечує вибірковість (селективність) перебігу будь-якої психічної діяльності, сприяє вибірковому прийому та переробці різної інформації. Вивчення уваги має велике значення для розв’язання ряду практичних завдань (праця диспетчера, служба спостереження тощо).
Розрізняють кілька форм уваги: сенсорна (зорова, слухова тощо); рухова (проявляється в регуляції рухів, дій, навиків, їх усвідомленні); інтелектуальна (увага до предмету, пізнавальної, інтелектуальної діяльності та ін.); емоційна (до стимулів, які мають емоційне значення). Виділяють також два рівні уваги — довільний і мимовільний. Мимовільна увага є природженою, довіль-
на ж — формується у міру розвитку інших психічних функцій і є соціально опосередкованим типом уваги. У дорослої людини вона тісно пов’язана з мовою. Мимовільна увага залежить переважно від функцій нижніх відділів мозкового стовбура і середнього мозку, у той же час як довільна — від діяльності кори великого мозку, передусім медіобазальних відділів лобної й скроневої часток. До формування сенсорної уваги мають відношення кіркова зона і таламокортикальні ланки відповідних (зорової, слухової та ін.) сенсорних систем. У разі їх ушкодження порушується усвідомлення стимулів відповідної модальності (зорових, слухових, тактильних) і спостерігаються так звані явища незвертання уваги, або ігнорування тих чи тих стимулів. Ці порушення не мають нічого спільного з порушеннями сприйняття. Рухова увага контролюється передніми відділами великого мозку (особливо правої півкулі) — премоторними, префрональними, базальними ядрами та ін. За інтелектуальну увагу відповідальна насамперед кора лобних часток мозку, а за емоційну — лімбічна система. Таким чином, у механізмах формування різних форм уваги беруть участь різні структури мозку.
МИСЛЕННЯ
Мислення є вищою формою відображення світу. Це процес опосередкованого, узагальненого відображення дійсності; активна психічна діяльність, спрямована на розв’язання певної задачі (досягнення мети). Мислення виникає за наявності відповідного мотиву. Як зазначалось вище, розумова діяльність значною мірою опосередковується мовною функцією (внутрішня мова). Згідно із даними нейрофізіологічних та нейропсихологічних досліджень, наочно-образне або предметно-просторове мислення обумовлюється переважно структурами правої півкулі великого мозку, а абстрактне, словесно-логічне — лівої. Порушення мислення, інтелектуальної діяльності спостерігається загалом при ушкодженні тім’яно-потиличних та скроневих відділів лівої півкулі великого мозку лобних часток.
Свідомість — специфічна форма відображення діяльності й цілеспрямованого регулювання взаємовідносин особи з навколишнім світом. Вона формується тільки за умов суспільного життя. Свідомість визначається також як знання, яке за допомогою слів, математичних символів і узагальнюючих образів художніх творів може бути передане іншим людям, стати надбанням інших членів суспільства. Вона об’єднує все те, що може бути повідомлено або повідомляється, передається іншим людям. У формуванні свідомості вирішальну роль відіграє діяльність мовних структур мозку. Як зазначалося вище, для усвідомлення потрібен деякий рівень активності вищих відділів ЦНС, який головним чином підтримує
ться висхідною активізуючою системою головного мозку (ретикулярна формація мозкового стовбура, неспецифічні ядра таламуса, гіпоталамо-лімбічні структури).
Поряд із свідомістю психічна діяльність людини включає в себе підсвідомість. Термін «підсвідомість» (замість «несвідоме») використовується для позначення неусвідомлюваного психічного, нерозривно пов’язаного із свідомістю. До цієї групи психічних явищ належить усе те, що було усвідомленим або може стати усвідомленим за певних умов, наприклад, глибоко й міцно засвоєні людиною соціальні норми («голос совісті», «почуття обов’язку», «поклик серця» тощо), міцно автоматизовані навики (наприклад, рухові навики шофера, спортсмена, піаніста та ін.), поява інтуїції, яка грунтується лише на раніше набутому життєвому або професійному досвіді. Так, досвідчений лікар інтуїтивно (підсвідомо) ставить правильний діагноз, тому що його мозок зберігає сліди (е н г р а м и) ряду симптомів, типових для даного захворювання (характерна поза, міміка, колір шкіри, забарвлення склер тощо). Специфічними проявами діяльності підсвідомості є активізація творчих можливостей людини у стані глибокого гіпнозу, гіпнопедія (навчання під час сну, тобто без участі свідомості), а також, очевидно, і механізм сновидінь як різновидності пошукової активності. Про підсвідомі прояви психічної діяльності людини свідчить також можливість вироблення умовних рефлексів у відповідь на невідчутні (підпорогові) звукові подразнення.
Різновидом несвідомого психічного є також надсвідомість (су-персвідомість). До сфери надсвідомого належать первинні етапи будь-якої творчості (виникнення нових ідей, сміливих гіпотез, оригінального задуму, творчих задумів), які виникають на грунті слідів, отриманих іззовні вражень (без свідомого вольового зусилля, передчасного втручання свідомості тощо). Надсвідомість відіграє важливу роль і у походженні різноманітних забобонів, міфів та ін.
Патологічно змінена взаємодія свідомості з під- і надсвідо-містю може проявитися у вигляді марення, галюцинацій, які виникають під впливом деяких психотропних речовин (ЛСД, гало-перидол та ін.).
Таким чином, психічна діяльність людини має трьохрівневу структуру, включаючи в себе свідомість, підсвідомість і надсвідомість.
ІНДИВІДУАЛЬНІ [ТИПОЛОГІЧНІ)
ОСОБЛИВОСТІ людини
При аналізі індивідуальних особливостей людини, які проявляються в її соціальній поведінці, звичайно користуються такими термінами, як «темперамент», «характер» та «особистість».
Темперамент (у пер. з грецьк.— пропорція), або тип нервової
системи, характеризує природжені властивості і особливості психічної діяльності індивіда (генотип). У структурі темпераменту можна виділити три головних компоненти — загальну активність індивіда, його рухові прояви й емоційність. Характер — індивідуальний склад психічного життя, форма його поведінки, «норов» людини, який проявляється в її манерах, звичках, емоційній сфері. Характер є основою поведінки людини. Формується він під впливом конкретного соціального середовища, умов виховання. Особистість може бути визначена як окремо взята конкретна людина. Особистість включає в себе і темперамент, і характер, і інтелект людини, а також соціально значущі риси, які характеризують індивіда як члена того чи того суспільства або спільності людей. Особистість інтегрує різні психічні процеси і формується (як і характер) під впливом конкретного соціального середовища. Поняття «характер» і «темперамент» часто ототожнюються, хоча характер є не стільки вираженням біологічних, природних властивостей нервової системи, скільки наслідком впливу на людину навколишнього середовища, насамперед суспільних, соціальних умов.
Класифікація темпераментів. Ще Гіппократом була створена класифікація темпераментів, у основу якої було покладено сукупність постійних ознак у поведінці людини, його життєву активність, ініціативу й здатність до більш-менш енергійної діяльності. Великий вчений вважав, що надлишкове виділення крові зумовлює темперамент сангвінічний, надмірна продукція жовтої жовчі — холеричний, чорної жовчі — меланхолічний, слизу — флегматичний. Це уявлення про механізм виникнення темпераментів у світлі сучасних знань є наївними, але вчення про темпераменти і їх систематизація не втратили свого значення й досі.
Вивчаючи закономірності діяльності великого мозку, І. П. Пав-лов переконався у можливості оцінювати індивідуальні особливості його функцій на підставі вчення про типи нервової системи. В основу своєї класифікації типів нервової системи, або темпераментів, і. 11. Ііавлов поклав такі головні принципи: силу, врівноваженість і рухомість нервових процесів (збудження і гальмування) у корі великого мозку. Під силою збуджувального процесу розуміють здатність переносити досить сильні дії без вмикання позамежного гальмування. Сила гальмівного процесу характеризується швидкістю і міцністю внутрішнього (дифе-ренціювальне, запізніле тощо) гальмування. Сила нервових процесів у одного й того ж індивіда не є постійною, вона залежить від віку, харчування, ендокринних впливів, тренування нервової системи тощо. Другим принципом, покладеним в основу класифікації типів нервової системи, є ступінь урівноваження процесів збудження та гальмування. Якщо вони врівноважують один одного і навіть при сильному нервовому напруженні цей баланс нервових процесів зберігається, то такий тип нервової системи
називається врівноваженим. Якщо ж один із процесів домінує (частіше переважає процес збудження над процесом гальмування), то такий тип називається неврівноваженим. Третім принципом є рухливість нервових процесів, тобто здатність швидко або повіль-
но, легко або важко збуджуватись чи гальмуватись.
Таким ..чином, оцінюючи вказані вище фізіологічні властивості нервової системи, 1. 11. 1ІШЯЮВ ВИДІЛИВ чогири основні тиші ІІРр-
вової системи вищих тварин і людини; 1) сильний, урівноважений, рухомий («жвавий»); 2) сильний, урівноважений, інертний («спокійний», «солідний»); 3) сильний, неурівноважений з переважанням процесів збудження над процесами гальмування і з рухомою
нервовою системою (нестримний); 4) слабкий (вирізняється слабкістю як збудливого, так і гальмівного процесів і схильністю до розвитку позамежного гальмування). Класифікація темпераментів, запропонована Гіппократом, найближча до класифікації І. П. Павлова. При оцінці варіантів сильного типу треба враховувати, що сильний урівноважений тип з рухомою нервовою системою відповідає сангвінічному темпераменту, сильний урівноважений тип з інертною нервовою системою — флегматичному, сильний неврівноважений, нестримний тип — холеричному, слабкий тип —
Меланхолічному темпераменту.
Сангвінік вирізняється жвавістю, енергійністю, працездатністю, життєрадісністю, швидкою зміною станів, на зовнішні впливи реагує хоч і швидко, але неглибоко, добре пристосовується до життєвих умов (стереотипів). Холерик ще рухливіший від сангвініка, дуже енергійний (не знає міри!), але його життєва енергія швидко вичерпується і почата справа рідко доводиться до кінця. Він легко переходить від стану сильного збудження до млявості, часто вступає в конфлікти з людьми. Флегматики працездатні, повільні, холоднокровні. У них настільки слабка активність, що іноді межує з байдужістю. Для меланхоліка характерні загальна слабкість життєдіяльності, невпевненість у собі, нерішучість, відсутність ініціативи й активності, постійне незадоволення. Працездатність залежить від конкретних умов.
Характеризуючи форму поведінки людини, індивідуальний
склад його духовного життя, ми часто говоримо про характер людини: сильний, слабкий, твердий, м’який, тяжкий, наполегливий тощо. Характер проявляється в діяльності людини (активний, цілеспрямований, нерішучий та ін.).
При формуванні типів нервової системи виняткового значення набувають взаємодія між першою і другою сигнальними системами та рівновага між ними. Цей принцип був покладений І. П. Пав-ловим в основу класифікації спеціальних типів людини. Було виділено три основних типи — художній, мислячий і середній. Людина, що належить до художнього типу, добре сприймає навколишню дійсність (барви, звуки, запахи тощо, тобто конкретні ситна-
ли). Такі люди охоплюють дійсність у цілому, повністю. Людина мислячого типу, навпаки, кожне явище аналізує, розбирає до найменших деталей, створює абстрактні уявлення про явища й події, які відбуваються. У людини, яка належить до художнього типу, особливо яскраво виявлена діяльність першої сигнальної системи (хоча у неї домінує вплив другої сигнальної системи). Для людини, яка належить до мислячого типу, характерні чітко виражені впливи другої сигнальної системи. У середнього типу певною мірою діють обидві сигнальні системи. Спеціально людські типи можна розглядати як наслідок індивідуальних варіацій функціональної асиметрії великого мозку. Художньому типові відповідає відносне домінування правої (немовної, конкретнообразної) півкулі, а мислячому — лівої.
У міру подальших досліджень типології людини ставало все очевиднішим, що перелік властивостей нервової системи, комбінація яких характеризує ту чи ту індивідуальність, слід істотно розширити. За допомогою спеціально розроблених психологічних тестів Г. Айзенк виділив три основні параметри: 1) екстра- та ін-троверсивність; 2) емоційна стійкість і невротизм; 3) психотизм, протилежним полюсом якого є стійке дотримування соціальних норм. Екстраверт характеризується як відкритий, балакучий, соціальний, активний суб’єкт, а інтроверт — як замкнутий, пасивний, мовчазний. Невроїдний суб’єкт тривожний, схильний до гніву, емоційно нестійкий, йому протистоїть емоційно стійка особистість. Високопсихоїдний тип — егоцентричний, холодний, байдужий до всіх і агресивний суб’єкт. Ступінь екстра- та інтроверсивності визначається головним чином за допомогою спеціально розроблених анкет.
Вважають, що в основі екстраверсії лежать індивідуальні особливості взаємодії активізуючої ретикулярної формації, передніх відділів нової кори. У інтроверта більш розвинена септогіпокам-пальна, гальмівна система. Ступінь невротизму залежить від індивідуальних особливостей взаємодії лімбічних структур і нової кори.
У дитинстві, юності оптимальною формою взаємодії людини з навколишнім середовищем є амбіверсія (середня між екстра- та інтроверсією). Соціальне середовище формує психологічні риси особливості в бік екстра- й інтроверсії. З віком ці особливості стають виразнішими, яскравіше проявляються дратливість, збудливість, емоційна нестійкість, невпевненість, тривога.
Було запропоновано також ділити людей на типи А і Б. Зокрема особи, які належать до типу А, характеризуються постійним внутрішнім напруженням, гонором, прагнуть до швидкої реалізації все нових планів, до лідерства. Вони часто незадоволені собою, недовірливі.
ВІКОВІ ОСОБЛИВОСТІ УМОВНОРЕФЛЕКТОРНОЇ
ДІЯЛЬНОСТІ Й ВИЩИХ ПСИХІЧНИХ
ФУНКЦІЙ людини
У процесі онтогенетичного розвитку у формуванні умовних рефлексів важливу роль відіграє орієнтувальна реакція, яка передує появі умовного рефлексу. Спочатку з’являється загальнорухо-ва форма умовного рефлексу, а потім — спеціалізована. Харчово-рухові умовні рефлекси спочатку утворюються з філогенетично старіших аналізаторних систем, а потім — із філогенетично молодших. Загальнорухові й спеціалізовані захисні рефлекси утворюються приблизно в одні й ті самі строки як із молодих, так і з філогенетично старіших сенсорних систем. Швидкість утворення перших позитивних умовних рефлексів залежить від віку: що молодша людина або тварина, то повільніше закріплюється і спеціалізується рефлекс. Швидкість утворення тривалих, стійких умовних рефлексів також залежить від аналізатора, з якого вони виробляються. Швидше закріплюються шкірно-тактильні й слухові умовні рефлекси, повільніше — зорові, що пояснюється неодночасним дозріванням кіркових і підкіркових ланцюгів відповідних аналізаторів. Ці ж закономірності виявляються й стосовно утворення гальмівних умовних рефлексів, різних форм внутрішнього гальмування — згасаючого, диференційованого, запізнілого, а також удосконалення рухливості й урівноваження нервових процесів та здатності їх до тренування з віком. У експериментах на тваринах, під час обстеження людей було помічено, що з літами повільніше виробляються й згасають умовні рефлекси, тяжче здійснюється диференціювання, ослаблена інтенсивність відновних процесів тощо. Виявилось, що в процесі старіння передусім порушується внутрішнє гальмування, а вже потім — сила збудливого процесу, рухливість і врівноваженість основних нервових процесів.
Розвиток вищих психічних функцій зумовлений не тільки мор-фофункціональними особливостями головного мозку, а й соціальними умовами. Формування фізіологічних механізмів, які лежать у їх основі, пов’язане з дозріванням різних відділів кори великого мозку. Як зазначалось вище, на першому році життя у дитини з’являються умовні рефлекси (вегетативні, рухові, мовно-рухові) і потім, до чотирьох років, швидко розвиваються мовні функції, що вказує на формування вищих психічних функцій (узагальнення, абстракції). Вік 4—6 років є періодом бурхливого розвитку аналітико-синтетичної діяльності мозку. У 7—9 років спостерігається значний розвиток функцій узагальнення й абстрагування, в 10—17 років вищі психічні функції досягають такого рівня розвитку, який властивий дорослій людині, хоча в період статевого дозрівання (13—15 років) дещо сповільнюється їх формування.
Вікові особливості пам’яті характеризуються тим, що у дітей
яскравіша образна пам’ять порівняно з дорослими, а у людей зрілого віку — порівняно із літніми людьми. Проте при цьому не можна не враховувати й ролі звичайної професійної діяльності: у художників, наприклад, з роками не слабне пам’ять на зорові образи, колір, форму предмета, з віком пам’ять на поточні події знижується, але зберігається на події далекого минулого. Разом із тим, якщо компонент механічного запам’ятовування різко зменшується в старості, то логічно-змістовний компонент зберігається і набуває особливого значення для пам’яті людини. Старші люди зберігають здатність до системної пам’яті, що дозволяє відтворювати події завдяки досвіду, знанням. Літня людина правильно оцінює ситуацію, робить правильні висновки там, де молодому потрібно було зробити чимало перевірок.
У похилому віці порушується внутрішнє гальмування, що негативно позначається на емоційній стабільності, працездатності тощо. У старечому віці підвищується здатність до розвитку позамежного гальмування, порушується співвідношення між збудливим і гальмівним процесами. Різко знижується концентрування уваги.
ФІЗІОЛОГІЧНІ ОСНОВИ СНУ
Цикл сон—неспання є одним із найяскравіших проявів внутрішніх циркадних (добових) ритмів організму, що відображають часове співвідношення навколишнього середовища. Сон, що періодично настає, тобто добовий сон, є життєвою потребою організму. Експерименти, в яких на тривалий час собак позбавляли сну, свідчать, що при цьому дорослі тварини гинуть на 10—12-ту добу, цуценята — на 5—10-ту. У людини при позбавленні сну (деприва-вації) на 3-тю добу розвиваються емоційна нестійкість, стан депресії, різко знижуються увага, пам’ять, розумова працездатність. На кінець 7-ї доби спостерігаються розлад свідомості, психомоторне збудження, емоційна байдужість, зникає реальне уявлення про навколишнє оточення тощо.
Основна функція сну — це відновлення фізичних та психічних сил, яке дозволяє максимально адаптуватися до зміни умов зовнішнього і внутрішнього середовищ. Сон становить собою чергування різних функціональних станів головного мозку, а не є «відпочинком» для головного мозку, як вважали раніше. Під час сну перебудовується мозкова діяльність, яка потрібна для переробки і консолідації інформації, що потрапила в період неспання, переведення її із проміжної в довготривалу пам’ять.
Активність нейронів у різних відділах кори великого мозку і глибинних структурах мозку під час сну лишається практично такою ж, як і при неспанні.
Структура (види) добового сну. За сучасними уявленнями, сон
1
50мнВ
50 мкВ
Мал. 249. ЕЕГ людини при різних рівнях активності:
І — у стані збудження; 2 — у стані спокою; 3 — під час дріїіання; 4 — під час засинання; 5 — у стані глибокого сну
не єдиний стан мозку і організму, а сукупність двох якісно різних станів — так званого повільного і швидкого сну.
Повільний сон (синоніми: синхронізований, ортодоксальний} у свою чергу ділиться иа кілька стадій, виділених на підставі змін ЕЕГ (мал. 249). Перша стадія (дрімоти) характеризується пригніченням основного ритму (альфа-хвиль), який поступово змінюється низькоамплітудними коливаннями різної частоти. Друга стадія характеризується періодичним виникненням «сонних веретен» (пачок хвиль із частотою 12—18 Гц). Третя й четверта стадії характеризуються поступовим збільшенням на ЕЕГ високоамплі-тудних повільних дельта-хвиль. Ці стадії відповідають глвбокому сну (так званий дельта-сон). Як правило, максимальна глибина сну при кожному циклі під ранок зменшується. І в ранкові години четверта фаза вже не досягається. При наркотичному сні остання стадія називається хірургічною, коли починається оперативне втручання. В цілому у міру поглиблення сну ритм ЕЕГ стає все повільнішим (синхронізованим).
Крім електрофізіологічних, для повільного сну характерні певні метаболічні, вегетативні й гормональні зміни. Так, в організмі, під час сну відбуваються інтенсивні анаболічні процеси, спрямовані на компенсацію підвищеного катаболізму, який спостерігається в період неспання. Важливим компонентом цієї компенсаторної функції є синтез білкових макромолекул, у тому числі в головному
мозку. Під час сну збільшується екскреція анаболіч-них гормонів (гормону росту, пролактину), підвищується тонус парасимпатичної нервової системи тощо. Під час повільного сну знижується також м’язовий тонус, стають різними частота дихання і пульс. Межа пробудження збільшується від першої стадії до четвертої. Тому сновидіння під час по-
Мал. 250. Фази нічного сну. Початок сну — о 23 год 10 хв, закінчення —о 6 год ЗО хв: 1—4— сходинки сну
вільного сну у більшості людей не буває.
Швидкий сон (синоніми: десинхронізований, парадоксальний). Протягом нічного сну швидкий сон буває 4—5 разів (приблизно через 1,5 год) і триває 6,8 або 20 хв (мал. 250). У дорослих на швидкий сон припадає приблизно 20 %, у дітей — ЗО %, у новонароджених— 50% загальної тривалості Сну (мал. 251). Швидкий сон характеризується появою на ЕЕГ швидких низькоамплітудних ритмів. Під час швидкого сну різко пригнічуються спинномозкові рефлекси. Проте на тлі загального зниження тонусу з’являються короткі посіпування окремих м’язів тулуба і особливо обличчя. В той же час мозковий кровотік посилюється. Характерними проявами швидкого сну є швидкі рухи очей (60—70 за 1 хв) при закритих повіках, зміни ЕЕГ, нерегулярне збільшення частоти серцевих скорочень, артеріального тиску, посилення гормональної активності («вегетативна буря»). При пробудженні зі швидкого сну 80— 90 % пацієнтів розповідають про сновидіння (мал. 252).
Таким чином, весь нічний сон складається із 4—5 циклів. Ко-
жен із них розпочинається з перших стадій повільного сну і закінчується швидким сном. Тривалість циклу становить 80—100 хв. У перших циклах переважає дельта-сон, в останніх циклах —
швидкий сощ
Механізми сну. Мозкові структури, які беруть участь в організації сну, досить чисельні й локалізуються на різних рівнях мозкового стовбура — так звана сомногенна (гіпногенна) система (мал. 253). Основними структурами, що забезпечують повільний сон, є серотонінергічні нейронні утворення ядер шва у стовбурі головного мозку і таламічна синхронізуюча система, а також деякі гіпотала-мічні структури (ядра перегородки). Система, за участю якої формується швидкий сон, включає ретикулярні ядра моста головного мозку (варолієвого моста) і лімбічні структури мозку.
Як свідчать дані електрофізіологічного дослідження, в повільному сні відбувається незначне зменшення частоти розрядів нейронів, у швидкому, навпаки,— їх збільшення. Тому активність ней-
' ТИЖНІ
МІСЯЦІ
РОКИ
Мал. 251. Вікові зміни тривалості і структури сну
років у різних відділах кори і підкіркових структур великого мозку під час сну лишається практично такою ж, як і при неспанні. Енергетичний метаболізм мозку в швидкому сні значно вищий, ніж у стані спокійного неспання.
Церебральні біохімічні механізми, що лежать в основі виникнення сну, складні й включають багато ланок. У них беруть участь серотонін-, адрен-, холінергічні системи, деякі поліпептиди (дель-та-пептид), аргінін-вазотонін, бета-ендорфін, субстанції «Р> та ін.
Так, із мозку і сечі тварин виділено низькомолекулярний пептид-ний фактор 8, при введенні якого розвивається повільний сон. Подібний ефект настає і при введенні поліпептида Ц8ІР (деііа-зіеер іпдпсіпд реріісіе), який не тільки зумовлює сон, але й значно збільшує його тривалість. У літературі наводяться дані про взаємозв’язок різних гормонів і циклу сон — неспання. Найбільша залежність виявлена для соматотропіну (гормон росту), який секретує-ться в основному у фазі дельта-сну. Тісно пов’язаний із нічним сном і гормон пролактин, секреція якого різко підвищується (особливо в другу половину ночі). Секреція ряду гормонів під час ніч
ного сну різко знижується. До них належать тиреотропін, адре-нокортикотропін і кортизол. Як бачимо, під час сну збільшується секреція анаболічних гормонів і зменшується секреція катабо-лічних.
Чинники, що зумовлюють сон. Можна виділити чотири групи чинників’ які зумовлюють періодичний добовий сон: 1) ендогенні чинники, пов’язані зі стомленням і гіпногенними речовинами (серотонін, норадреналін, гамма-окси-бутират, дельта-пептид та ін.); 2) які діють ендогенно, ритмічно («внутрішній годинник»); 3) безумовні (темрява, спокій, положення тіла, сенсорна монотонність, вплив температури, атмосферного тиску); 4) умовнорефлекторні (звикання до певного часу сну, його тривалості та ін.).
Пробудження настає внаслідок зняття гальмування в ретикулярній формації з боку серото-нінергічних нейронів голубої плями. Внаслідок розгальмовування збільшується збудність ретику-
мозок Схо М’язи
аг "сог ємг
Неспання
‘Подільний сон Стадія 1
Стадія2
СтаіІЇяЗ
Стадія 4 Д-ЛЛ
ШВидкий сон л/Л-Л
о.......’7 0 7 0 7с
Мал. 252. Зміни електроенцефалограми (ЕЕГ), рухів ока (ЕОГ) і активності м’язів шиї (ЕМГ) у різні фази сну
лярної системи до аферентних імпульсів, що надходять сюди, підвищується активність кори великого мозку, завдяки чому відновлюється стан ЦНС, характерний для періоду неспання.
Фізіологічна сутність сновидінь. За сучасними даними, снови-
діння є наслідком невпорядкованої активності нейронів великого мозку при дефіциті внутрішнього диференційованого гальмування. Пристосувальне (адаптивне) значення сновидінь поки що не доведене. Вважають, що сновидіння виконують захисну функцію, відволікаючи частково несплячу свідомість від різних зовнішніх та внутрішніх подразнень, які могли б збудити. До зовнішніх подразників, які збуджують окремі групи клітин кори великого мозку і породжують сновидіння (найчастіше у фазу швидкого сну), належать різноманітні впливи на сенсорні системи сплячої людини. Це шум, яскраве освітлення кімнати, гострі запахи, температурні подразнення шкіри тощо, а також різні інтероцептивні імпульси, спричинені переповненим шлунком, сечовим міхуром, затрудненим диханням та ін. Сновидіння можуть зумовлюватись мотиваційною
Мал. 253. Схема відділів мозку, які регулюють стани бадьорості і сну:
І —переріз між передніми і задніми горбками чотиригорбкового тіла; II, III, IV — переріз у передньому, середньому І задньому відділах вароліевого моста; V — переріз між довгастим і спинним мозком (/ — активуюча ретикулярна формація; 2, 3 — довгастий мозок; 4, 5—проміжний мозок; 6 — варолієв міст; 7, 8— гіпоталамічна ділянка; 9— лімбічна система; 10 — неокортекс). Знак (+) — активація, знак (—) — пригнічення. Стрілками вказано взаємні впливи структур мозку
домінантою. Наприклад, у голодної людини часто бувають сновидіння, лейтмотивом яких є пошуки і прийом їжі; на тлі статевої домінанти виникають сексуально забарвлені сновидіння. Після реалізації домінанти ці сновидіння зникають. У зв’язку з цим у сновидіннях можуть «здійснюватись» різноманітні бажання, мрії, які недосягиенні в реальному житті. Сновидіння можуть породжувати сліди сильних вражень, хвилюючих бурхливих суперечок тощо. Згідно із психоаналітичною концепцією, в сновидіннях відбувається своєрідна розрядка пригнічених біологічних мотивів, притаманних усім людям (ворожість, сексуальність та ін.). Це своєрідний «дренаж» мозку, що знімає надлишкове збудження. Проте така концепція вважається сумнівною. На даний час висувається гіпотеза про імпульси сновидінь, потоки яких посилюються у зв’язку із утрудненням дихання (гіпоксія), порушенням серцевої діяльності, підвищенням температури тіла тощо.
Інколи один і той же сон повторюється протягом кількох діб і навіть місяців. У таких випадках можна говорити про діагностичне значення сновидіння, йдеться про сни, причиною яких слу
жать подразнення, що йдуть від внутріїййіх органів. Тому одноманітні сновидіння, які тривалий час повторюються, повинні бути проаналізовані лікарем.
Розмноження
Розмноження — процес, який забезпечує продовження живих організмів створенням нових індивідів, що зберігають основні риси того виду, до якого належать. Існує певна рівновага між двома суперечливими тенденціями — стійкістю ознак, які зберігають єдність виду протягом багатьох поколінь, і еволюцією під впливом умов зовнішнього середовища, що забезпечує пристосування з метою виживання.
Розмноження взаємозв’язане і взаємообумовлене статевою функцією, яка становить собою сукупність морфологічних, фізіологічних і поведінкових пристосувань, що роблять можливим статеве відтворення в період зрілості. В основі статевої функції лежить статева диференціація, яка генетично визначається геносома-ми диплоїдного хромосомного набору яйцеклітини. Статева функція — наслідок активності статевих залоз. Слід зазначити, що у людини розмежування статевої і відтворювальної функцій виражене більшою мірою, ніж у будь-якого виду живих організмів, що пояснюється розвитком активності. У самок у період статевої зрілості можливі лише два стани — вагітності і лактації. У жінок же психічний контроль сексуальності і усвідомлення розмноження (вагітність) робить можливим і третій, проміжний, стан, при якому виражена тільки статева функція. Розмножувальна функція носить лише потенціальний характер.
СТАДІЇ РОЗМНОЖЕННЯ
Розрізняють такі стадії розмноження: формування статевого дозрівання; формування і реалізація статевої мотивації; запліднення; вагітність, пологи, вигодовування немовляти молоком і його виховання.
Статеве дозрівання. Статеве дозрівання розпочинається із збільшення секреції гонадотропінів гіпофізом, який виконує «команду» гіпоталамуса. У період статевого дозрівання відбувається, з одного боку, виділення різних гамет у індивідів чоловічої й жіночої статі, а з другого — вироблення гормонів, під впливом яких створюються прямо або опосередковано оптимальні морфологічні, ендокринно-метаболічні і поведінкові умови, які дають можливість зливатись гаметам у процесі запліднення й утворювати яйцеклітину. Вже на дуже ранніх стадіях розвитку статеві гормони проявляють свою активність, яка триває протягом усього життя.
Утворення андрогенів припиняється після завершення ембріо
нального розвитку плода чоловічої статі. У період статевого дозрівання ендокринна активність статевих залоз хлопчиків відновлюється, а у дівчаток — виникає вперше. Під впливом естрогенів і гестагенів у дівчаток і андрогенів у хлопчиків статеві органи ростуть і дозрівають. Чоловічому організмові тестостерон потрібний також для сперматогенезу. Естрогени стимулюють проліферацію гермінтативного епітелію яєчників. Статеві гормони зумовлюють також розвиток вторинних статевих ознак — молочних залоз, характерної будови тіла. Оволосіння в ділянці лобкового симфізу розвивається під впливом андрогенів навіть у дівчат (ці гормони виробляються в корі надниркових залоз і меншою мірою — в яєчниках).
У період статевої зрілості статева функція повноцінно розвинута і робить можливим розмноження. В цей час статеві гормони впливають не тільки безпосередньо на статеві органи-мішені, але й на оргайізм у цілому. Внаслідок цього стає можливим запліднення яйцеклітини і створюються оптимальні умови для розвитку та подальшого росту плода. У чоловіків у цей час сперматогенез досягає оптимального рівня (як у кількісному, так і в якісному відношенні), а у жінок спостерігаються регулярні овуляторні цикли (див. с. 561), відзначається максимальна пристосувальна здатність усіх органів і систем, яка забезпечує адаптацію до зумовленого вагітністю фізіологічного навантаження. У період статевої зрілості забезпечуються найкращі психофізіологічні умови для розмноження.
Формування і механізми статевої мотивації. Статева поведінка формується на підставі статевої мотивації. Як зазначалось (див. с. 556), під мотивацією слід розуміти зумовлене тією чи тією потребою організму емоційно забарвлене збудження, котре вибірково об’єднує нервові елементи різних рівнів мозку, спрямоване на задоволення вихідної потреби (К. В. Судаков, 1971). Кожна мотивація має спеціальні внутрішні подразники і чітко окреслене біологічне значення. Виходячи з цього критерію, можна вважати, що при формуванні статевої мотивації таким домінуючим внутрішнім подразником є відхилення рівня гіпофізотропних гормонів гіпоталамуса, гонадотропних гормонів аденогіпофіза і статевих гормонів.
Статева мотивація включає природжений і цілеспрямований компоненти. Останній формується протягом усього життя залежно від індивідуального досвіду. У людини внаслідок розвитку другої сигнальної системи і соціального життя на біологічну статеву мотивацію нашаровується психологічна мотивація, яка забезпечує задоволення вихідної потреби в соціальних рамках.
У формуванні та реалізації статевої мотивації беруть участь практично майже всі рівні ЦНС. Так, за рахунок спеціальних механізмів у самців забезпечуються ерекція статевого члена і еякуля
ція, самка набуває відповідної пози тощо. Разом із тим статевий потяг і відповідна поведінка формуються іншими, дещо складнішими механізмами. Безпосереднє відношення до формування статевої мотивації має гіпоталамічна ділянка. В дослідах на тваринах доведено, що руйнування переднього і заднього відділів гіпоталамуса (особливо мамілярних тіл) веде до зникнення статевої поведінки і зміни статевих залоз та статевого апарата. Подразнення гіпоталамічної ділянки стимулює у самок секрецію естрогенів і овуляцію, зумовлює у самців ерекцію статевого члена та еякуляцію. Ці експерименти свідчать про наявність у гіпоталаміч-ній ділянці спеціальних хеморецепторів, які вибірково чутливі до рівня статевих гормонів, що циркулюють у крові і беруть участь у формуванні статевої поведінки.
У формуванні статевих мотивацій беруть участь також лімбіч-ні структури мозку, особливо амігдала й септум, а також кора великого мозку, насамперед її передні відділи. Наприклад, руйнування амігдали супроводжується підвищенням статевої активності (гіперсексуальність) тварин. Разом із тим різні відділи кори великого мозку та інші структури мозку в свою чергу здійснюють регуляторні висхідні впливи на центри гіпоталамуса. Таким чином, статеві мотивації і їх задоволення є складними інтегративними актами, в яких беруть участь різні відділи нервової системи, розміщені на різних її рівнях.
Статеві реакції у чоловіків. До статевих реакцій у чоловіків належать ерекція статевого члена, емісія сім’яної рідини (сперми і секретів додаткових статевих залоз) у задні відділи сечівника і еякуляція цієї рідини з передніх відділів сечівника.
Ерекція статевого члена зв’язана з розширенням артерій печеристих тіл статевого члена і губчастого тіла сечівника. Венозні синуси, з яких складається печериста тканина, наповнюються кров’ю, тиск у них підвищується і вони максимально розширюються. При цьому венозний відтік з печеристої тканини припиняється (внаслідок стиснення вен статевого члена в ділянці його білочної оболонки). Розширення артерій зумовлюється збудженням парасимпатичних волокон тазових нервів, клітинні тіла яких містяться в крижових сегментах (82—84) спинного мозку. Ці нейрони збуджуються рефлекторним шляхом унаслідок припливу аферентних сигналів від зовнішніх статевих органів і сусідніх тканин, а також унаслідок психічних впливів, опосередкованих головним чином корою і лімбічними структурами головного мозку. Найбільша кількість механорецепторів локалізується в ділянці головки статевого члена. Адекватне їх подразнення виникає при ковзких рухах (фрикціях) статевого члена під час статевого акту. Важливу роль у збудженні рецепторів головки відіграє зволоження поверхні піхви і статевого члена, яке відбувається за рахунок рефлекторної
транссудації зі стінок піхви і секреції бульбоуретральних залоз (у чоловіків).
Ерекція я еякуляція є кульмінаціє^ статевого акту у чоловіків. Збудження, яке все зростає (внаслідок сумації), під час статевого акту передається аферентними волокнами статевого і тазового нервів до сакральних відділів спинного мозку та в складі симпатичних нервів — до тораколюмбальних його відділів. Завдяки рефлекторному збудженню симпатичних волокон скорочуються придаток яєчка, сім’явиносна протока, сім’яні міхурці та передміхурова залоза. Внаслідок цього сім’яна рідина викидається в задні відділи сечівника, а скорочення внутрішнього сфінктера сечового міхура, яке одночасно виникає, запобігає попаданню сім’яної рідини в сечовий міхур. Збудження парасимпатичних і симпатичних волокон, котрі іннервують статеві органи, під час емісії досягає максимуму. Це супроводжується ритмічними скороченнями м’язів, які межують із печеристими та губчастими тілами, а також м’язів тазового дна. Завдяки цим скороченням сім’яна рідина викидається із задніх відділів сечівника в передній і далі. Одночасно із цим ритмічно скорочуються м’язи уулуба і таза, що сприяє попаданню сім’яної рідини в проксимальні відділи піхви та шийку матки. Аферентна імпульсація, яка виникає при проходженні сім’я через отвір сім’явикидних проток, замикається в ядрах таламуса. На думку багатьох учених, тут міститься вищий чутливий центр оргазму (любострасних відчуттів), якими супроводжується еякуляція.
Статеві реакції у жінок. Статеве збудження у жінок супроводжується змінами в зовнішніх статевих органах: великі статеві губи розходяться, переповнюються венозною кров’ю, набрякають також малі статеві губи й клітор, який підтягується до лобкового симфізу. Ерекція клітора, як і статевого члена, зумовлена переповненням кров’ю кавернозної тканини. Ці зміни відбуваються рефлекторним шляхом унаслідок подразнення рецепторів статевих органів і суміжних тканин, а також збудження сакральних сегментів (82—84) спинного мозку, психічних впливів з боку кірково-підкіркових структур головного мозку. Важливу роль у статевому збудженні відіграє клітор, який має велику кількість механорецеп-торів. Під час статевого збудження відбувається транссудація слизової рідини через епітелій піхви, що пояснюється загальним переповненням венозною кров’ю її стінки. У міру наростання статевого збудження спостерігаються видовження і розширення піхви і внаслідок місцевого застою крові в нижній третині піхви створюється так звана оргастична манжетка. Положення матки в тазу змінюється: вона піднімається, збільшується; шийка відхиляється від задньої стінки піхви, внаслідок чого утворюється порожнина для прийому сперми. Під час оргазму завдяки нервовим впливам з боку симпатичної системи оргастична манжетка і матка скорочуються.
Після оргазму протягом 20—ЗО хв зовнішні і внутрішні статеві органи набувають вихідного стану. Якщо оргазм не настав, стадій збудження триває.
У розмноженні важливу роль відіграє піхвове середовище. Встановлено, що протягом 8 с після проникнення сперми в піхву рН збільшується з 4,3 до 7,2. Цей процес розглядається як захисний механізм стосовно сперматозоонів, які втрачають рухомість (іммобілізуються) при рН менше за 5.
Капацитація — процеси, які відбуваються в період запліднення і перебування сперматозоонів у жіночих статевих органах і спрямовані на перетворення сперматозоонів на цілком «дієздатні» клітини. Капацитація складається з двох етапів: 1) підготовка спер-матозоона до акросомальної реакції (звільнення вмісту акросоми); 2) збільшення активності джгутика (гіперактивність). Важливу роль у цих процесах відіграє внутрішньоклітинна концентрація Са2+. її підвищення конче потрібне для виходу акросомальних ферментів і прискорення обертання джгутика. В акросомальній реакції бере участь і цАМФ.
Фізіологія статевого акта. Статевому акту властиві різноманітні фізіологічні й психологічні моменти. В ньому виділяють такі послідовні фази: збудження, найбільшого статевого напруження (плато), оргазм і завершувальна, або розслаблююча, фаза (спад). Найтриваліші фази збудження та спаду.
Фаза збудження обумовлена різними фізіологічними (подразнення ерогенних зон та ін.) і психологічними стимулами, які відіграють ведучу роль у підвищенні статевого напруження. Залежно від їх інтенсивності фазу збудження можна скоротити або подовжити. Коли вплив статевих стимулів триває, тоді здійснюється перехід до фази найбільшого статевого напруження, при якій статеве збудження досягає найвищого ступеня. В цих умовах індивід, незалежно від статі, досягає оргазму.
Фаза оргазму триває кілька секунд. Любострасні відчуття при цьому виникають у жінок на рівні клітора, піхви і матки, у чоловіків — статевого члена, передміхурової залози, сім’яних міхурців. У жінок для появи оргазму потрібне подразнення набагато більшої кількості ерогенних зон, ніж у чоловіків. Чоловікам для цього досить збудності центрів ерекції і еякуляції, тобто досить еротичної готовності. Наростання оргазму в чоловіків відбувається набагато швидше, ніж у жінок, але тривалість періоду «вершини» його однакова.
Під час фази спаду у жінок може настати повторний оргазм за умови адекватного стимулювання, в той час як у чоловіків у цю фазу досягти статевого збудження неможливо (рефрактер-ність). Фаза спаду у жінок триває довше, ніж у чоловіків. Це диктує необхідність у відповідній поведінці чоловіків як перед оргазмом, так і після нього (продовження ласк тощо).
Дозрівання фолікула
Ріст жовтого тіла
Овуляція
Жовте тіло
Фолікул
Фаза секреції
Менструація
Фазо промрера-
го 24 ге
Унг менструального циклу
Мал. 254. Фази менструального циклу
Менструація
І
Тривалість статевого акту становить від 1,5 до 4 хв, рідко — до 6 хв. На нього впливає частота статевих стосунків, а також інтервали між статевими актами (якщо вони коротші, то статевий акт триває довше). Після тривалого статевого збудження час статевої близькості значно зменшується, інколи проведення його для чоловіків тимчасово стає неможливим.
Слід зазначити, що жоден фізіологічний акт не викликає такої сильної і різноманітної реак-
ції в організмі, як статевий. При цьому виникає бурхлива вегетативна реакція: розширюються зіниці, прискорюються серцеві скорочення (до 100—180 за 1 хв), підвищується артеріальний (особливо діастолічний) тиск, прискорюється і стає переривчастим дихання, спостерігаються довільні і мимовільні скорочення м’язів, ритмічні скорочення анального сфінктера, збільшення молочних залоз, почервоніння шкіри та ін.
Нормальний інтервал між статевими актами становить 3— 4 доби, хоча можлива й інша періодичність (навіть 1 раз на 1 тиж). Протягом доби (ночі) деякі чоловіки можуть мати 2— З і більше статевих актів, але не завжди, а лиш при особливих станах і за певних обставин. Готовність до повторної статевої близькості у чоловіків з’являється через 15—20 хв.
Статевий цикл у жінок (циклічні зміни в матці і яєчниках). У період статевої зрілості у жінок відбуваються періодичні зміни функціональної активності яєчників, пов’язані з дозріванням фолікула, його розривом, виходом яйцеклітини, утворенням жовтого тіла, зворотним його розвитком і розсмоктуванням. Зміни в яєчнику супроводжуються циклічними змінами в матці.
Статевий цикл включає чотири періоди: передовуляційний, ову-ляційний, післяовуляційний і спокою (мал. 254).
Передовуляційний період. Під впливом фолікулостимулюваль-ного гормону фолітропіну — гормону аденогіпофіза — в яєчниках посилено утворюються естрогени. Вони стимулюють ріст матки. Розростається також слизова оболонка яєчника. Маткові труби і м’язовий шар матки починають сильно і часто скорочуватись. Збільшується слизова оболонка піхви. Одночасно з цим фолітропін прискорює дозрівання найбільш зрілого фолікула в яєчнику — гра-афового міхурця. Поверхня його розривається, і з нього виходить яйцеклітина, тобто відбувається овуляція. Передовуляційний період триває з 5-ї по 14-ту добу від початку менструації.
Овуляційний період починається з моменту розривання граафо-вого міхурця і виходу з нього яйцеклітини, яка спрямовується в маткову трубу рухами її миготливого епітелію. Руху яйцеклітини в напрямі до матки сприяє скорочення гладких м’язів маткової труби. Запліднена яйцеклітина потрапляє в матку і прикріплюється до її слизової оболонки. Статевий цикл на цьому переривається, оскільки настає вагітність. На місці фолікула, що лопнув, розвивається жовте тіло, клітини якого починають виробляти гормон прогестерон. Овуляційний період триває з 15-ї по 28-му добу статевого циклу. Якщо запліднення яйцеклітини не відбулося, то настає післяовуляційний період.
Потрібно зазначити, що введення естрогену і гестагену на початку циклу гальмує секрецію рилізинг-гормона (люгормона) шляхом негативного зворотного зв’язку. При цьому овуляції не відбувається, оскільки не виникає пікового рівня люгормону. Власне, за таким принципом діють контрацептивні (запобіжні) засоби. Замість природних естрогенів і гестагенів застосовують їх похідні, які не руйнуються в печінці і ефективні при пероральному введенні.
Післяовуляційний період починається з появою менструації. Незапліднена яйцеклітина, що потрапила в матку, залишається там кілька діб живою, а потім гине. В цей період під впливом прогестерону жовтого тіла зменшується продукція фолітропіну в аденогіпофізі, що веде до зниження продукції естрогенів у яєчниках. Унаслідок цього зміни матки, труб, піхви, які відбулися в передовуляційний період, зникають. Одночасно в аденогіпофізі посилюється утворення лютропіну, що зумовлює атрофію жовтого тіла. В цей період за рахунок зменшення в крові вмісту естрогенів починає скорочуватись матка. Це спричинює десквамацію (відшарування) частини слизової оболонки поверхневого функціонального шару. Клаптики слизової оболонки виходять разом із кров’ю (менструація). Після закінчення менструації відбувається регенерація (відновлення) слизової оболонки матки.
Період спокою настає після закінчення післяовуляційного періоду. Він триває з 1-ї по 5-ту добу статевого циклу.
Вагітність. Запліднення, тобто злиття двох гамет різної статі — сперматозоона і яйцеклітини, є основним процесом статевого розмноження. Власне вагітність починається з імплантації яйцеклітини в слизову оболонку матки, яка здійснюється у жінки на .стадії бластоциту на 6-ту добу після запліднення.
Імплантація заплідненої яйцеклітини в слизову оболонку матки обумовлюється гормонами, які виділяються імплантованим трофо-бластом, а саме хоріонічним гонадотропіном і плацентарним лак-тогеном. Під впливом цих плацентарних гормонів збільшується секреція прогестерону жовтим тілом, що перешкоджає руйнуванню і виділенню слизової оболонки матки. До кінця першого місяця
вагітності жовте тіло підлягає зворотному розвитку. З цього часу плацента бере на себе вироблення прогестерону і естрогену, конче потрібних для нормального перебігу вагітності.
Слід відзначити, що хоріонічний гонадотропін, який починає виділятися з сечею відразу після настання вагітності, викликає овуляцію у гризунів і виділення Сперматозоїдів у жаб. Ця властивість використовується як тести (проби Ашгейма—Цондека і Галлі—Маніні) для ранньої діагностики вагітності.
При вагітності виникає ряд пристосувальних функціональних і морфологічних змін у всіх тканинах, органах і системах материнського організму з метою забезпечення оптимальних умов для захисту, росту і розвитку плода, а також малюка в перші місяці життя після народження. Під час вагітності співвідношення гормонів у організмі майбутньої матері безперервно змінюється залежно від потреб плода. Продукція прогестерона і його концентрація в крові жінки прогресивно збільшуються до строку розродження. Оскільки в основному гормон виділяється плацентою (в усякому разі протягом першого-другого місяців вагітності), вважають, що його більша частина потрапляє до матки, безпосередньо впливаючи на неї. Прогестерон знижує збудність м’язів стінок матки і їх чутливість до окситоцину.
У перші тижні вагітності естрогени (естрол, естрадіол, естрі-ол) синтезуються переважно жовтим тілом. Потім їх починає синтезувати плацента, яка вже на 7-му тижні виробляє понад 50 % естрогенів, які надходять у кровотік вагітної. З часом плацента стає ведучим джерелом естрогенів. Під впливом естрогенів розвивається децидуальна оболонка, гіпертрофуються м’язи стінки матки, інтенсифікується кровопостачання. До строку пологів усувається вплив прогестерону на м’язи стінки матки, збільшується чутливість матки до окситоцину.
Ріст молочних залоз зумовлений спільною дією прогестерону і естрогенів. Проте у цьому процесі роль статевих стероїдів вторинна, позаяк у разі відсутності пролактину вони стають неефективними.
Естрогени відіграють важливу роль у регуляції водно-електролітного балансу у вагітних, стимулюють затримку натрію, набрякання тканин, розслабляють шийку матки, тазові зчленування тощо. Під час вагітності підвищується адренокортикальна функція надниркових і щитовидної залоз, гіпофіза. Наприкінці вагітності посилюється секреція глюкокортикоїдів корою надниркових залоз плода. Вагітність супроводжується збільшенням частоти серцевих скорочень, систолічного викиду і деяким зниженням артеріального (головним чином діастолічного) тиску, що пояснюється зменшенням опору периферичних судин. Поряд із цим збільшується кровопостачання матки, нирок, кишок, шкіри.
Під час вагітності підвищується концентрація фібриногену і
більшості плазмових факторів зсідання крові (VII, VIII, IX, X), але час зсідання крові не виходить за межі норми. Фібринолітич-на активність під час вагітності знижується, причому найінтен-сивніше в останні дні перед пологами.
Вагітність супроводжується посиленням дихального обміну для задоволення інтенсивності метаболічних процесів, яка безперервно збільшується у міру росту плода. Так, починаючи з 8—9-го тижня вагітності дихальна система зазнає ряду морфофункціональних змін, за рахунок яких (а також змін у системах крові і кровообігу) створюються умови для легеневої гіпервентиляції, посилення дихального газообміну відповідно до потреб організму.
Під час вагітності витрачається велика кількість енергії і пластичних матеріалів (для будови організму плода і гіпертрофії статевих органів матері). Надлишок енергетичних і пластичних матеріалів, які надходять із їжою, забезпечується посиленою активністю органів травлення. У більшості вагітних відзначаються чітко виражене підвищення апетиту, зміна смаків. Часто вагітні перевагу надають фруктам, солоним і гострим стравам. Очевидно, це можна пояснити зниженням гостроти смакового відчуття і забезпечення організму вітамінами, мікроелементами.
Інтенсивний обмін речовин у організмі матері, який супроводжується неухильним зростанням метаболічних процесів у плода, зумовлює велике навантаження на нирки. їх функція активізується за рахунок підвищення плазмовідтоку нирок (225 мл/хв), росту клубочкової фільтрації (150—200 мл/хв), канальцевої реабсорбції і секреції води та електролітів, збільшення виділення із сечею продуктів метаболізму та травлення (глюкоза, водорозчинні вітаміни та ін.). Поряд із цим спостерігається підвищення інкреторної функції нирок, зокрема, продукції реніну, який запускає ренін-ангіотензин-альдостеронову систему. Однак при нормальному перебігу вагітність не супроводжується гіпертензією, що пояснюється зменшенням реактивності судин на ангіотензин II.
Під час вагітності встановлюється імунологічний взаємозв’язок між організмом матері й плода, який забезпечує існування плідно-плацентарного алотрансплантата (плода). Це досягається головним чином зниженням материнської імунологічної реактивності і матково-плацентарним бар’єром. Вважають, що прогестерон — гормон вагітності — здатний пригнічувати опосередковану Т-лімфоци-тами реакцію відшарування.
Пологи. Виникнення пологового акту пов’язано з цілим рядом змін, які настають у організмі наприкінці вагітності. Це подразнення баро- і механорецепторів матки плодом, який стає все більшим. Протягом майже всього періоду вагітності м’язи матки здійснюють лише незначні ритмічні скорочення, які посилюють кровообіг у власне матці. В міру розтягання м’язових волокон матки (під час росту плода) їх збудність збільшується, В останні дні
вагітності скорочення матки посилюється. При цьому змінюється положення плода, а також -розширюються кільцеві м’язи шийки матки. Безумовні рефлекси, які безпосередньо пов’язані з пологовим актом, здійснюються через поперековий відділ спинного мозку. Спинномозкова координація пологового акту в свою чергу перебуває під впливом вищих центрів ЦНС, передусім кори великого мозку. Відомо, що деякі подразнення (наприклад, емоції) можуть впливати на перебіг пологів.
Вони настають, як правило, через 270 діб після зачаття. Вирішальним чинником, який зумовлює початок пологів, є посилення секреції глюкокортикоїдів корою надниркових залоз плода в кінці вагітності. Ці речовини стимулюють утворення естрогену з прогестерону в плаценті, внаслідок чого концентрація прогестерону падає, а естрогену підвищується. Починає виділятись простагландин Е, що в свою чергу підвищує чутливість матки до окситоцину і стимулює її скорочення.
Власне пологовий акт складається з ряду послідовних скорочень м’язів матки, які насамперед спрямовані на розширення шийки матки (перша стадія пологового акту — періоду розкриття). У цей період скорочення поздовжніх м’язів волокон матки зумовлюють розширення кільця шийки матки. Цьому ж сприяє і втиснення в канал шийки матки наповненого навколоплідною рідиною плодового міхура. Цей період закінчується розкриттям шийки матки і при нормальних пологах — входженням голівки плода в таз.
Другий період пологів — період вигнання —г супроводжується частими тривалими скороченнями м’язів матки, живота і діафрагми, що призводить до збільшення загального тиску в черевній порожнині. За рахунок підвищення тиску і скорочення матки плід проштовхується через тазовий отвір і піхву назовні.
Третій період — післяпологовий — настає звичайно через 20— ЗО хв після народження дитини, завдяки скороченню м’язів матки видаляються плацента і децидуальні оболонки.
Лактація. З настанням вагітності підвищення рівнів естрогенів і гестагену зумолює формування дистальних альвеол і часточок молочної залози. В цьому процесі беруть участь плацентарний лактоген, інсулін, тироксин, кортизол. Секреція молока починається тільки після пологів і лише за наявності пролактину. Молоко виділяється у відповідь на рефлекторну стимуляцію, яка виникає під час смоктання. Смоктання зумовлює виділення окситоцину, який сприяє скороченню міоепітеліальних клітин стінок альвеол молочної залози (рефлекс виділення молока).
Треба зазначити, що в організм немовляти разом із молоком матері надходять не лише поживні речовини, а й імуноглобуліни та інші високомолекулярні компоненти без будь-якого попереднього їх розщеплення. Тому ранній перехід від грудного вигодовування до штучного (коров’ячим молоком або сумішами) може
зумовити ускладнення через недосконалість імунологічного бар’єру. У зв’язку з цим у тих випадках, коли у матері-годувальниці немає молока або його не вистачає для дитини (гіполактія), рекомендується використовувати донорське молоко, а не його замінники.
ВІКОВІ ЗМІНИ СИСТЕМИ РОЗМНОЖЕННЯ
Період спаду статевої функції називається клімаксом. Він триває 10—20 років і знаменує собою перехід від періоду статевої зрілості до старості. У жінок і чоловіків клімакс проявляється по-різному. Так, у жінок він об’єктивно виражається припиненням менструації (настає менопауза), в той час як у чоловіків перехід відбувається дуже повільно, в окремих випадках зі збереженням статевої, а інколи й репродуктивної функції до похилого віку.
Гонадна інволюція у жінок. Вік настання менопаузи перебуває в межах 48—52 років. Маса яєчників прогресивно зменшується з 10—12 г (у 25—ЗО років) до 3—5 г (у 60 років). Одночасно зі зменшенням маси яєчників відзначаються розростання сполучної тканини, зменшення числа овоцитів, ослаблення чутливості фолікулів яєчників до гонадотропінів, різке зниження виділення естрогенів яєчниками та ін. Усе це зумовлює настання аменореї, тобто власне менопаузи, яка свідчить про те, що фолікулярний запас яєчників повністю вичерпаний. Зниження рівня естрогенів у крові за механізмом негативного зворотного зв’язку супроводжується підвищенням секреції гонадотропінів (особливо Р8Н). Унаслідок цього з’являються відчуття хвилеподібного припливу крові до голови з надмірним потовиділенням. Частота цих припливів коливається від 1—2 на добу до 15—ЗО за 1 хв, а тривалість — від кількох секунд до 1 год. Названі явища, певно, спричинюються дією великої кількості гонадотропінів, які виділяються за дуже короткий час, на вазомоторні центри проміжного мозку. Матка і зовнішні статеві органи повільно, але неухильно атрофуються.
Жінки під час клімаксу іноді скаржаться на загальну слабкість, поганий сон, швидке настання втоми, неприємні відчуття в ділянці серця, шлунка, коливання артеріального тиску та ін. Статеве відчуття поступово втрачається, але приблизно у 20 % жінок статевий потяг зберігається ще тривалий час після менопаузи.
Гонадна інволюція у чоловіків. Функція яєчок — сперматогенез^ синтез і секреція тестостерону — зберігається • до похилого віку (звичайно на низькому рівні). Так звана лейдигова недостатність зумовлює клімакс, або андропаузу, в чоловіків. При цьому спостерігаються характерні нейровегетативні розлади — приплив крові до голови, підвищена дратливість, виражена психічна нестійкість,
коливання артеріального тиску тощо. До них долучаються втрата лібідо й статевої здатності. У чоловіка навіть у період старіння утворення сперматозоонів не припиняється, але спостерігається прогресивне зниження їх густини в сім’яній рідині. Прийнято вважати, що у чоловіка віком понад 60 років цей показник зменшується на 30% порівняно з молодими, а після 80 років — на 50%. Рухомість і життєздатність сперматозоонів знижуються.
Статевий потяг і потенція також з віком знижуються, проте щодо цього відзначаються значні індивідуальні коливання. Так, у 60 років потенцію зберігають 80 % чоловіків, у 70 років — 73 %, у 75—45 %, у 80 років — 25% чоловіків. Після 60 років ерекція статевого члена настає повільніше, нерідко буває неповною, сім’я викидається швидко або зовсім не виділяється, знижується інтенсивність оргазму.
Зниження концентрації тестостерону в плазмі збігається з ростом рівня естрогенів, що свідчить про наявність певного ритму концентрації андрогенів. У процесі старіння відбуваються також зміни з боку передміхурової залози, в тому числі її гіпертрофія (гіперплазія). Вона спостерігається у ЗО—60 % чоловіків віком за 60 років.
Фізіологія процесів адаптації
ПОНЯТТЯ ПРО АДАПТАЦІЮ
Протягом свого існування людина змінюється. В її організмі відбувається істотна перебудова, яка охоплює багато органів та систем.
Адаптація — це процес пристосування, що формується протягом життя людини. Завдяки адаптаційним процесам людина пристосовується до незвичних умов чи нового рівня активності, тобто підвищується стійкість її організму проти дії різних чинників. Організм людини може адаптуватися до високої та низької температури, до дії.незвичних емоційних подразнень (страх, біль тощо), до низького атмосферного тиску або навіть деяких патогенних чинників. Наприклад, адаптований до нестачі кисню альпініст може піднятися на гірську вершину заввишки 8000 м і більше, де парціальний тиск кисню наближається до 50 мм рт. ст. (6,7 кПа). Атмосфера на такій висоті настільки розріджена, що нетренована людина гине за кілька хвилин (через нестачу кисню) навіть у стані спокою.
Люди, що живуть у північних чи південних широтах, у горах чи на рівнині, у вологих тропіках чи в пустелі за багатьма показниками гомеостазу відрізняються один від одного. Тому ряд показників норми для окремих регіонів земної кулі може відрізнятись.
Можна сказати, що життя людини в реальних умовах є постійним адаптаційним процесом. Організм її адаптується до дії різних кліматогеографічних, природних (атмосферний тиск і газовий склад повітря, тривалість та інтенсивність інсоляції, температура та вологість повітря, сезонні та добові ритми, географічна довгота й широта, гори та рівнина тощо) та соціальних чинників, умов цивілізації. Як правило, організм адаптується до дії комплексу різних чинників.
Потреба в стимулюванні механізмів, що приводять у дію процес адаптації, виникає у міру наростання сили або тривалості впливу ряду зовнішніх чинників. Наприклад, у природних умовах життя такі процеси розвиваються восени та навесні, коли організм поступово перебудовується, адаптуючись до похолодання, чи при потеплінні.
Адаптація розвивається й тоді, коли людина змінює рівень активності і починає займатися фізкультурою або якимось нехарактерним видом трудової діяльності, тобто наростає активність рухового апарата. У сучасних умовах у зв’язку з розвитком швидкісного транспорту людина часто змінює не лише кліматогеогра-фічні умови, але й годинні пояси. Це накладає свій відбиток на біоритми, що також супроводжується розвитком адаптаційних процесів.
Поняття адаптації близьке до поняття стресу. Але їх доцільно розрізняти, незважаючи на деяку спільність механізмів розвитку. Реакція організму, характер змін, які виникають у ньому, залежать як від стану та можливостей організму, так і від виду, сили й тривалості чинника, що діє на цей організм.
Стрес — спосіб досягнення резистентності організму при дії на нього травмівного чинника. Природно, що будь-який чинник зовнішнього середовища (наприклад, дуже низька чи дуже висока температура}, до якого адаптується організм, якщо діє тривалий час або занадто інтенсивно, може перейти в розряд стресор-них. Стресорними ці чинники можуть стати у разі ослаблення організму.
СТАДІЇ РОЗВИТКУ
ПРОЦЕСУ АДАПТАЦІЇ
Процес адаптації має кілька стадій розвитку. При дії незвичної сили подразника в організмі можуть змінюватись деякі параметри. Ці зміни торкаються одного органа або охоплюють багато систем чи весь організм. У відповідь на це активізуються механізми гомеостатичної регуляції, під дією яких система намагається набути початкового стану. Спочатку активізуються енергетичні, а потім і пластичні ресурси клітин. Якщо цих ресурсів досить (це буває у разі дії не дуже сильного подразника), стан організму
нормалізується, якщо ж їх бракує, то виникає потреба в мобілізації ресурсів усього організму і тоді починають розгортатись усі стадії адаптації.
Фізіологічна (термінова) стадія. У разі дії на організм незвичного за якістю або силою подразника для відповіді використовуються резервні можливості організму, що обумовлені надмірною організацією його структур. Надмірна організація — це дублювання органів, клітин в органі, окремих елементів у клітині. У стані відносного спокою кожний орган, система органів і організм у цілому ніколи не функціонують на повну силу з використанням усіх структурних можливостей. Звичайно структури органів функціонують на Уб—*/ю потенційних можливостей. Наприклад, для забезпечення організму киснем цілком досить однієї легені, для виведення метаболітів — однієї нирки. В умовах відносного спокою м’язів поглинається близько 250 мл кисню за 1 хв, а при інтенсивній праці його може поглинатись до 2—3 л. Хвилинний об’єм дихання у стані спокою становить близько 6 л, а при роботі навіть у нетренованих людей він може досягати 120—150 л, хвилинний об’єм крові може збільшитись до 20—24 л (у стані спокою 5— 6 л).
Коли до органа пред’явлено підвищені вимоги і він починає функціонувати активніше, то спочатку використовується запас функціональних резервів (наприклад, у разі підвищення температури тіла секретується більше поту, а під час виконання м’язової роботи інтенсивно скорочуються рухові структури м’язів). Активніше функціонування неможливе без збільшення використання енергії. Запас же енергетичних речовин (АТФ) у клітинах, як правило, незначний, тому передусім виникає потреба в компенсації енергетичних витрат органа, який посилено функціонує. Для цього доставка кисню і субстратне окислення вуглеводів, жирів тощо інтенсифікуються. Використання фізіологічних резервів організму для відповіді на дію певного подразника й обумовлює назву періоду адаптації («фізіологічна фаза»),
Позаяк фізіологічна фаза розвивається за активної участі симпатико-адреналової системи, механізмів, що відповідають за емоційну сферу, ця фаза називається реакцією тривоги.
Морфологічна (тривала) стадія. У разі повторної дії подразників, наприклад фізичних тренувань, або дуже тривалої їх дії (перебування в горах в умовах розрідженої атмосфери, в нових клі-матогеографічних умовах) перша стадія поступово переходить у наступну, що має назву морфологічної. Вона розвивається лише внаслідок багаторазового повторення негайних адаптаційних реакцій. Під час цієї стадії поступово відбувається структурна перебудова органів. Морфологічна основа того чи того органа (органів) поступово збільшується — наростають функціональні резерви. То-Му подразник, що раніше був незвичним для організму, стає звич
ним, і завдяки зміні структури організм легко справляється з ним. Ця фаза називається стадією резистентності. Тут поряд із розвитком неспецифічних змін у організмі, що характерно для дії будь-якого чинника, проявляються й специфічні механізми, які підвищують стійкість головним чином до конкретного подразника.
РЕГУЛЯЦІЯ РОЗВИТКУ
АДАПТАЦІЙНОГО ПРОЦЕСУ
Адаптивні реакції, як правило, охоплюють весь організм, починаючи з мозку, що організовує поведінку в нових умовах, і кінчаючи конкретним органом, з функцією якого в основному пов’язана відповідь на подразник. Ведучою еферентною ланкою, що запускає першу стадію адаптації, є симпатико-адреналова система. Вона мобілізується під впливом центральних механізмів емоційної сфери, пам’яті, а нерідко й вищих відділів кори великого мозку, де формуються механізми організації складного акта поведінки — асоціативні зони. З центральних структур найважливіша роль-належить гіпоталамусу, ретикулярній формації, мигдалевидним ядрам, гіпокампу. У разі дії незвичного подразника підвищується тонус симпатичного відділу вегетативної нервової системи, активізуються продукція, вихід у кров так званих стресових гормонів — кіркової (глюкокортикоїди) та мозкової (катехоламіни) речовини надниркових залоз. Крім того, для збалансованого обміну вуглеводів велике значення має інсулін, що забезпечує засвоєння клітинами глюкози. У початковій стадії виділення інсуліну збільшується.
Адаптаційні механізми можуть реалізуватись винятково на рівні вегетативної регуляції без участі кори великого мозку, але в природних умовах життєдіяльності людини в їх розвитку, як правило, беруть участь певні її відділи. Про це свідчить реакція десинхронізації ЕЕГ під впливом активізуючого впливу ретикулярної формації. Імпульси від рецепторів після обробки на різних рівнях ЦНС надходять у лімбічну систему, де ця інформація набуває відповідного емоційного забарвлення і виходить на вегетативні центри гіпоталамуса та довгастого мозку, коригуючи при цьому первинну реакцію. Обробка інформації, що надійшла (особливо від екстерорецепторів), і прийняття рішення відбуваються в лобних відділах півкуль великого мозку.
Разом із гіпокампом, гіпоталамусом вони беруть участь у реалізації реакції, особливо на маломожливі події. Якщо вилучити1 передні відділи нової кори, то у експериментальних тварин не спостерігатимуться емоційні та вегетосудинні реакції, характерні для складних форм поведінки. При цьому вони допускають велику кількість помилок. Руйнування гіпокампа не дає можливості тваринам прогнозувати маломожливі події: виключається емоційна
сфера, зникають сумніви, але внаслідок цього утруднюється утворення рефлексів, погіршується поведінкова адаптація.
У разі дії на організм особливо несприятливих чинників зовнішнього середовища активність симпатико-адреналової та гіпота-ламо-гіпофізарно-надниркової систем (особливо у людей з високим рівнем тривожності) підвищена настільки різко, що може розвинутись психосоматична патологія, зокрема вегетосудинна дистонія, неврози та ін.
Внаслідок комплексного впливу загальних та місцевих чинників використовуються власні енергетичні резерви органа (гліколіз) і пластичні (біосинтез ферментів за рахунок вільного пула амінокислот). Поступово, у міру виснаження власних резервів, організм починає використовувати свої ресурси, наприклад, глікоген печінки (розщеплення його активізують катехоламіни), жирові депо (під впливом комплексу гормонів активізується ліполіз). До ефектів збільшення рівня глюкокортикоїдів у крові належать мобілізація фонду амінокислот, транспорт їх до органів і синтез ферментів та структурних білків.
Крім того, підвищується функція органів системи транспорту кисню (дихальна, серцево-судинна системи). Схематично механізм, що забезпечує розвиток другої стадії адаптації, можна уявити так: інтенсивне функціонування органа призводить до виснаження його резервів. Передусім виснажуються джерела утворення енергії, починають накопичуватись продукти обміну, в тому числі недоокислені субстрати (наприклад, молочна кислота), зменшується запас глікогену тощо. Внаслідок цього гомеостатичні умови динаміки процесів обміну порушуються, що позначається на процесах відновлення клітинних структур, тобто на фізіологічній регенерації. Фізіологічна регенерація — процес відновлення структур на рівні молекул, субклітинних утворень або цілих клітин. Цей процес збалансований так, що активність його Залежить від функціональних потреб клітин, органів і організму в цілому. В умовах звичайного функціонування руйнується стільки «відпрацьованих» структур, скільки й відновлюється. Коли починає руйнуватись їх -більше, як це буває при підвищенні функціональної активності, то й процес відновлення пожвавлюється. Як правило, відновлення в умовах підвищеної функціональної активності відбувається навіть з перевищенням, отже синтезується речовин більше, ніж руйнується. Насамперед ці зміни торкаються молекулярного та субклітинного рівнів. Так, у разі підвищення фізичної активності у м’язах спочатку спостерігаються зміни на рівні ферментів, субстратів, органоїдів. Дещо помітніші зміни структури, які можна зауважити простим оком чи під мікроскопом, з’являються не зразу і не завжди і є власне сумою перетворень на біохімічному рівні. Внаслідок цього з’являються нові функціональні можливості зміненої структури. Таким чином, різні функціональні стани не мо
жуть бути пов’язані з однією якістю структури, бо будь-яка спеціальна функція формується на основі всієї конструкції. Наприклад, структурною основою м’язів спортсмена-спринтера є генетично обумовлений вміст у них 50—80 % швидких і лише 20—25 % повільних м’язових волокон, а у спортсмена-стайєра, навпаки,— 70— 90 % повільних волокон. Тому у спортсменів-початківців при визначенні спеціалізації — спринтери чи стайєри — доцільно вивчати вміст у м’язах швидких та повільних волокон.
Треба мати на думці, що пристосувальний процес характеризується розвитком як негайної, так і тривалої адаптації.
АДАПТАЦІЯ — ПРОЦЕС ПІДВИЩЕННЯ ФУНКЦІОНАЛЬНИХ РЕЗЕРВІВ
У перебігу стадій адаптації є багато спільних рис, що свідчить про реакцію організму на дію різних агентів-стресорів. До них, зокрема, можна зарахувати підвищення захисних можливостей організму на різні патогенні чинники. Але у процесі розвитку .адаптації починають проявлятися й специфічні риси, що виражаються в морфофункціональній перебудові, яка торкається переважно тих систем, які безпосередньо реагують на подразник (наприклад, у м’язах відбувається перебудова структури при тренуванні, в системі терморегуляції — у разі дії низької та високої температур).
Внаслідок перебудови підвищуються резервні можливості, ї адаптований організм відрізняється від неадаптованого тим, що-для нього подразник, який раніше був незвичним, стає звичним. Тому тренована (адаптована) людина може пробігти марафонську дистанцію, піднятися на гірську вершину тощо.
ПЕРЕХРЕСНА АДАПТАЦІЯ
Коли адаптаційні процеси виражені помірно, то в процесі їх розвитку стосовно будь-якого конкретного подразника можна виявити підвищення стійкості й до дії інших чинників. Такий стан називається перехресною адаптацією. Вона обумовлена передусім тим, що має не лише специфічні, але й неспецифічні риси. Неспецифічний характер реакції організму на дію найрізноманітніших чинників, до яких організм адаптується, особливо виражений у період термінової стадії. Неспецифічність зумовлена тим, що для забезпечення інтенсивнішої реакції будь-якого органа треба використати енергетичні резерви організму. А ці резерви залежать від стану систем дихання й кровообігу, від мобілізації енерготворчих субстратів, що надходять у орган із депо.
Для розвитку перехресної адаптації також потрібна патогенетична спорідненість змін, які виникають в організмі під час дії подразника. Наприклад, гіпоксія проявляється при фізичному тре
нуванні й диханні високогірним повітрям. Тому спортсмени нормально почувають себе в горах. Дані про перехресну адаптацію покладено в основу застосування засобів фізичної культури для підвищення стійкості організму проти холоду, інших несприятливих умов зовнішнього середовища.
ІНДИВІДУАЛЬНІСТЬ ПРОЦЕСІВ
АДАПТАЦІЇ
Хоча процеси адаптації розвиваються за єдиним принципом, вираженість їх у різних людей різна. Це залежить як від природжених, так і набутих протягом життя індивідуальних особливостей організму, які визначають рівень функціональних його резервів. Величина цих резервів значною мірою залежить від генетичних чинників. Так, люди, у яких переважає тонус парасимпатичної частини нервової системи над тонусом її симпатичної частини, порівняно з людьми, у яких домінує тонус симпатичної частини над тонусом парасимпатичної, стійкіші до дії екстремальних чинників. Правильно встановлений рівень резервів може допомогти в профорієнтації, визначенні оптимальної зони існування, «чутливості» до хвороби і лікувальних процедур. При адаптації ці резерви підвищуються. Треба підкреслити участь у цьому процесі, кори великого мозку, бо вольовим зусиллям можна підвищити рівень фізіологічних резервів.
Здатність організму до адаптації можна розглядати як міру його індивідуального здоров’я. Стан здоров’я людини залежить від кількості та сили його адаптаційних резервів. Що вищі функціональні резерви, то нижча «ціна» адаптації. Одним з важливих розділів вчення про здоров’я людини є розробка заходів щодо розширення функціональних резервів. З цією метою застосовують чинники фізичної культури, загартовування, тренування до специфічних умов, а також медикаментозні засоби (адаптогени).
У сьогоднішніх умовах особливого значення набуває вчення про адаптацію. Нині людина все частіше зазнає впливу різних стресових, субстресових та екстремальних чинників, які потрібно вивчати, а знання використати для профілактики можливих захворювань.
«ПЛАТА» ЗА АДАПТАЦІЮ
Вже на першій стадії розвитку адаптації в організмі, який посилено функціонує, різко посилюється біосинтез білків і починають використовуватись пластичні резерви як того органа, що посилено функціонує, так і всього організму. Але одночасно пластичне забезпечення всіх тканин посилитись не може, тому в кожному конкретному випадку відбувається певний відбір на користь того
органа і того процесу в ньому, який максимально потребує пластичного забезпечення, іноді за рахунок інших органів. Наслідком цього може бути зниження функціональних можливостей перевантажених органів. Наприклад, іноді у спортсменів на вершині їх фізичних досягнень спостерігається зниження опору організму простудним, інфекційним захворюванням. Це своєрідна «плата» за виражену спеціалізовану адаптацію.
Якщо чинник, який впливає на організм, надто сильний або організм перебуває в такому стані, що реакція адаптації не може розвинутись, відбувається зрив адаптації, і настає стадія виснаження. Адаптація переходить у стрес. Стадія виснаження становить собою сукупність реакцій організму, що розвиваються внаслідок надто тривалої або багаторазової дії подразника — стресора, якому організм не може протистояти. Нерідко ця стадія закінчується смертю.
ВТРАТА АДАПТАЦІЇ
ТА РЕАДАПТАЦІЯ
При зміні умов існування (поверненні в колишні умови) набуті адаптаційні зрушення поступово втрачаються. У різних органах та системах адаптаційні зміни виникають і втрачаються неодночасно. У разі повторного впливу чинника, який зумовлює адаптацію, розвивається реадаптація. Адаптаційні зміни при цьому розвиваються швидше. Але надто часта зміна процесів адаптації і втрата її можуть призвести до порушень систем адаптації і спричинити захворювання або навіть смерть.
ВІКОВІ ЗМІНИ АДАПТАЦІЇ
У дитячому віці адаптаційні процеси відбуваються швидше. Але через залежність від віку і ще не завжди досконалі системи організму і механізми регуляції процеси адаптації у відповідь на дію деяких чинників утруднені. Наприклад, новонароджені, діти перших років життя гірше переносять екстремальні температури. У людей похилого віку функціональні резерви найважливіших систем (кровообігу, дихання) знижені. Менші також і можливості систем регуляції, особливо гормональних. Це, звичайно, погіршує розвиток як фізіологічної, так і морфологічної фази адаптації.
ОСНОВИ ФІЗІОЛОГІЇ СПОРТУ
Окремим видом адаптації, що розвивається при зміні рівня функціональної активності, є адаптація при спортивному тренуванні. Адаптаційний процес розвивається при багаторазовому повто
рюванні фізичних вправ. Фізичні вправи — це певним чином скомпоновані м’язові рухи, основною метою яких є підвищення функціональних можливостей тих органів та систем, які забезпечують оптимальне виконання відповідної м’язової роботи або збереження й відновлення здоров’я.
ІНТЕНСИВНІСТЬ М'ЯЗОВИХ РУХІВ
Реакція і характер змін, що виникають в організмі у відповідь на фізичні вправи, залежать від інтенсивності м’язових рухів. З урахуванням інтенсивності навантаження їх можна розділити таким чином: а) надто великі; б) тренувальні (близькі до межових); в) підтримувальні (недостатні для наростання адаптаційних змін, але достатні для того, щоб запобігтй зворотному розвитку тренованості); г) відновні (недостатні для підтримання досягнутого рівня, але такі, які прискорюють процеси відновлення після тренувального навантаження); д) малі (не впливають істотно на фізіологічний ефект). Але одна і та сама інтенсивність вправ може зумовити різний ефект залежно від функціонального стану організму. А цей стан може змінюватись протягом однієї доби залежно від біоритмів, активності процесів обміну, систем регуляції, від попереднього навантаження та емоційного стану.
ПЕРІОДИЗАЦІЯ ПРОЦЕСІВ,
ЩО ВІДБУВАЮТЬСЯ В ОРГАНІЗМІ ПРИ ВИКОНАННІ ФІЗИЧНО! ПРАЦІ
Під час фізичної праці спостерігаються такі стадії: передстар-тового стану, впрацьовування, стійкої працездатності, стомлення, відновлення. Тривалість їх залежить від систем регуляції, енерго-творчих процесів у м’язах і в усьому організмі. Енергетичні потреби розслабленого м’яза-незначні, тому порівняно невелика кількість АТФ використовується для відновлення структур і функціонування іонних насосів. При скороченні м’яза витрати АТФ різко збільшуються і працездатність м’яза (інтенсивність і тривалість скорочень) знижується. Для ресинтезу АТФ спочатку використовується креатинфосфатний шлях ресинтезу. За його рахунок утворюється досить багато АТФ (близько 3,6 моль/хв), але запасу креатинфосфату у м’язі досить лише на 1—2 с роботи.
Гліколітичний шлях не такий енергоємкий (1,2 ммоль/хв). При ньому утворюються недоокислені продукти, що перешкоджає роботі м’яза. Найекономнішим шляхом ресинтезу є аеробне окислення. Але цей шлях найбільш інерційний — активність ферментів у м’язі підвищується через 2—4 хв після початку скорочення м’яза. Для нього потрібний кисень, доставка якого до м’язів залежить від систем дихання і кровообігу. А ці системи впрацьовуються поступово.
Впрацьовування — процес поступового виходу на потрібний рівень функцій м’язового апарата і вегетативних функцій, що забезпечують м’язову діяльність. Час, потрібний для переходу на новий функціональний рівень, тим довший, чим складніша система. У забезпеченні м’язової роботи беруть участь багато органів та систем, що мають різні структури й регуляцію, тому впрацьовування їх після початку м’язової діяльності відбувається не одночасно — гетерохронно.
Власне м’язи, що іннервуються соматичною нервовою системою, виходять на належний функціональний рівень досить швидко (через 4—5 с). Цей час потрібний для збудження ЦНС, залучення необхідної кількості м’язів і рухових одиниць. Значно інертніші системи дихання та кровообігу. Зовнішнє дихання за рахунок участі скелетних м’язів регулюється швидше. Вже при перших скороченнях скелетних м’язів дихальні рухи частішають, а через 20— ЗО с поглиблюються. Але точна відповідність хвилинного об’єму дихання потребі в газообміні встановлюється через кілька хвилин після початку м’язової роботи.
Серцево-судинна система пристосовується до рівня кровопостачання м’язів, які функціонують, через 3—5 хв після початку роботи. ХОК росте поступово за рахунок збільшення частоти та сили скорочень серця. Встановлюється нове співвідношення стану судин — розширюються судини м’язів, які працюють, і відбувається перерозподіл кровотоку (табл. 22).
Час впрацьовування органів та систем після початку роботи залежить від важкості праці, стану організму, його тренованості. Що інтенсивніша м’язова робота, то коротший час впрацьовування системи транспорту кисню. Так, при інтенсивному навантаженні (на рівні максимального поглинання кисню) потрібний рівень вегетативного забезпечення встановлюється вже до кінця 1-ї хвилини, а при виконанні вдвічі легшої роботи впрацьовування закінчується лише через 3—5 хв.
Період впрацьовування закінчується тоді, коли системи організму виходять на новий стійкий рівень функціональної активності, який забезпечує задану інтенсивність м’язової роботи. Цей етап
Таблиця 22. Кровотік у деяких органах людини у стані спокою і під час виконання фізичної праці (Б. Фолков, Е. Ніл, 1976)
Стан ХОК, л/хв М’язи, л/хв Серце, л/хв Головний мозок. л/хв Нирки, л/хв
Спокою 5,5 0,8—1,0 (17) 0,25 (4—5) 0,75 (15) 1,2 (20)
При важкій праці 25 20,0 (80) 1—1,2 (4—5) 0,75 (3-4) 0,5 (2—4)
Примітка: в дужках наведено показники у відсотках.
характеризується підтриманням на стаціонарному рівні систем транспорту газів. Час роботи в стійкому стані залежить від величини навантаження і стану організму. Що інтенсивніша робота, то коротший цей стійкий стан. Це залежить від можливих шляхів ресинтезу АТФ у м’язах. При інтенсивному навантаженні посилюється гліколіз. При цьому утворюються недоокислені продукти обміну, що обмежує працездатність. Що тренованіша людина до даного навантаження, то довше її організм може підтримувати стійкий стан.
За рахунок перерозподілу крові м’язи, що інтенсивно скорочуються, можуть одержувати у 20 разів більше крові, а інтенсивність поглинання кисню може збільшитись у 50—60 разів. Інтенсивність поглинання кисню м’язами, які працюють, залежить від таких чинників: а) зниження рівня Роа у м’язах і збільшення градієнта напруги Ог між ними і кров’ю, яка притікає; б) підвищення температури тіла; в) зменшення рівня рН; г) збільшення концентрації в еритроцитах 2,3-ДФГ. Усі ці чинники прискорюють дисоціацію оксигемоглобіну. Внаслідок зростання в крові напруги Рсо„ і недоокислених продуктів обміну, активності симпатичної нервової системи підтримуються на високому рівні інтенсивність дихання і функція серця.
Стійкий робочий стан раніше чи пізніше завершується втомою. Втомою називають зниження функції внаслідок тривалої чи напруженої роботи. Погіршуються стан опорно-рухової системи, вегетативних функцій, їх координація. При спортивному тренуванні стомлення є компонентом, без якого не розвинеться адаптаційна перебудова. Втома — закономірний результат попередньої роботи, вонахзапобігає надмірному виснаженню. Вважають, що для відновлення потрібна певна кількість енергетичних речовин. А коли за допомогою допінгу загальмувати початок втоми, то наступне відновлення буде дуже важке, іноді навіть неможливе, і людина може загинути.
Втома розвивається тим швидше, чим інтенсивніша робота і менше тренована людина. Основною ознакою втоми є зниження працездатності. При цьому порушується координація функцій у власне опорно-руховій системі і між нею і вегетативними реакціями, знижується їх економічність.
Ведуча роль у відмові від м’язової роботи при розвитку втоми належить механізмам регуляції і насамперед нервовій системі. Втома — це реакція всього організму на фізичну роботу, розвивається вона внаслідок комплексу змін. Дуже інтенсивна робота призводить до швидкого виснаження запасів АТФ та КФ у м’язах, і людина не може витримувати навантаження на вказаному рівні. Крім «м’язового» компоненту відмови від виконання роботи існує й нейрогенний механізм: висока частота аферентної та еферентної імпульсації в моторних центрах знижує їх збудливість. При цьому
знижується провідність у нейром’язових синапсах (не встигає ре-синтезуватись медіатор). При субмаксимальному навантаженн на перший план висувається зміна рН саркоплазми за рахунок продуктів гліколізу. Якщо рН у м’язових волокнах знижується до 6,3—6,5, то активність ферментів гліколізу різко знижується. Падає АТФ-азна активність міозину і зменшується можливість виходу Са2+ з саркоплазматичної сітки. Все це призводить до зниження працездатності.
При менш інтенсивній, але тривалішій роботі домінують процеси, що розвиваються в ЦНС. Вони пов’язані з погіршенням кровопостачання і розвитком метаболічних змін у ЦНС та всьому організмі. Наприклад, після подолання марафонської дистанції у спортсменів різко зменшуються запаси глікогену в м’язах і печінці, що супроводжується зниженням рівня глюкози в крові. А це — основний із продуктів окислення в нервових клітинах. Унаслідок цього знижується збудливість нервових клітин з одночасним ростом у них гальмівних медіаторів (зокрема, ГАМК). Вказані зміни в нервових центрах призводять до порушень регуляції функції скелетних м’язів, вегетативних функцій. У м’язах починають функціонувати більші рухомі одиниці (а вони для ресинтезу АТФ використовують головним чином вуглеводи), підключаються інші м’язи. Це зумовлює зміни характеру рухів. Одночасно розвивається дискоординація функцій серцево-судинної системи, системи дихання, що ще більше утруднює виконання роботи. Процеси, які розвиваються при цьому в ЦНС, спричиняють відчуття втоми. Стомлення — суб’єктивний показник втоми організму.
Процес стомлення вивчали переважно на скелетних м’язах — ізольованих або в умовах цілого організму. За ергограмою (запис скорочень м’яза при його тривалій роботі) можна виділити три основних періоди: впрацьовування, стійкої працездатності та втоми. Під час періоду впрацьовування працездатність підвищується, під час стійкої працездатності вона тривалий час підтримується на певному рівні, а під час періоду втоми працездатність знижується і нарешті зовсім втрачається.
Тривалість роботи залежить від величини навантаження (що воно більше, то раніше настає втома), інтенсивності праці (що частіше скорочується м’яз, то швидше настає втома) та наявності чи відсутності перерв у роботі (перерви віддаляють розвиток втоми; мають значення час настання перерви — на початку, в середині чи в кінці роботи, а також тривалість перерви).
Чому розвивається втома? Щодо цього існує кілька теорій. Одна з них (теорія виснаження) пояснює втому зменшенням в органі поживних речовин, які потрібні для його функціонування. До них належать АТФ, креатинфосфат, глікоген, ліпіди та ін. Згідно з іншою точкою зору (теорія засмічення), втома настає внаслідок накопичення в органі метаболітів (молочна кислота, СОг, продук
ти азотистого обміну та ін,). Ще одна теорія (теорія задушення) пояснює втому зниженням напруги кисню в органі — гіпоксією, що гальмує ресинтез АТФ та креатинфосфату. Очевидно, у розвитку втоми беруть участь одночасно всі ці явища, але за різних умов праці може переважати одне з них.
М’язові волокна втомлюються не одночасно: спочатку припиняють скорочуватись швидкі (білі) волокна, потім повільні (червоні) і нарешті волокна тонічні. Ізольовані м’язи втомлюються досить повільно. Вони здатні скорочуватись у певних умовах при тривалому подразненні протягом тривалого часу. Однак при подразненні м’яза через нерв (непряме подразнення) втома настає швидше, найраніше воно розвивається в нервово-м’язовому синап-сі. Причинами цього є порушення синтезу, виділення та вплив медіаторів на рецептори плазматичної мембрани.
В умовах цілого організму втома розвивається раніше в центральних синапсах. У нервових клітинах при тривалій їх роботі розвивається процес гальмування, який припиняє діяльність раніше, ніж розів’ється глибоке виснаження цих клітин. Цікаво, що у нижчих організмів можна досягти при тривалій роботі глибокого виснаження, оскільки у них процес гальмування не запобігає розвитку крайніх форм втоми. Таким чином, гальмування в Центральній нервовій системі має захисний характер.
При тривалій роботі опорно-рухового апарата (наприклад, марафонський біг на 42 км 195 м) метаболізм може зрости на 2000 %. За дахунок АТФ та креатинфосфату енергія звільняється лише протягом перших 8—10 с, за рахунок глікогену, депонованого в м’язах (анаеробний гліколіз),— протягом 90—100 с. Потім потрібне окислення депонованих, в організмі глікогену та ліпідів (у формі вільних жирних кислот та ацетооцтової кислоти), і що довше людина працює фізично, то більша частина енергії звільнюється за рахунок окислення ліпідів (до 85 %). Після важкої праці запаси глікогену відновлюються лише через 2—5 діб. Запаси кисню в організмі (близько 2 л у легенях, 1,5 л — у формі оксигемоглобіну, 0,4 л — міоглобіну) швидко вичерпуються, їх поновлення відбувається після закінчення роботи (кисневий «борг»).
Основні закономірності процесів стомлення та відновлення. (за Г. В. Фольбортом, 1981) такі:
1. Рівень працездатності залежить від співвідношення процесів виснаження та відновлення. Під виснаженням розуміють комплекс біохімічних змін, що супроводжуються зменшенням енергетичного потенціалу (зменшення рівнів АТФ, креатинфосфату, глікогену, ліпідів, напруги Ог тощо). Виснаження розвивається в процесі втоми. При відновленні, навпаки, енергетичний потенціал збільшується. Ці процеси розвиваються одночасно, але переважає один із них: якщо домінує виснаження, працездатність знижується, якщо відновлення, працездатність збільшується.
2. Між виснаженням та відновленням існує тісний взаємозв’язок. Відновлення стимулюється тими змінами, які відбуваються в процесі виснаження. Таким чином, не може бути відновлення без попереднього розвитку втоми. Втома — передумова підвищення працездатності. Під час праці і після неї співвідношення між процесами виснаження і відновлення змінюється: під час роботи переважають процеси виснаження, але виражені вже й процеси відновлення. Після праці домінують процеси відновлення.
3. На інтенсивність відновних процесів впливає швидкість розвитку виснаження. Що швидше розвивається виснаження (при ін-тенсивнішій роботі), то швидше відбувається відновлення після завершення роботи.
4. Відновні процеси розвиваються не прямолінійно, а хвилеподібно. Загальна тенденція до підвищення працездатності зберігається. У процесі відновлення розрізняють дві фази — досягнення початкової працездатності і стійкої, постійної працездатності.
5. Змінюючи тривалість праці і відпочинку після неї, можна досягти двох станів — хронічного виснаження (перевтоми) і поступового підвищення працездатності (тренування). Якщо людина починає повторно працювати до досягнення нею стану стійкої працездатності, то процеси виснаження поглиблюються і розвивається хронічне виснаження. Після цього стану відновлення відбувається повільно, протягом кількох тижнів або навіть місяців. Якщо ж вона стає до роботи тоді, коли вже розвинувся стан стійкого відновлення, то працездатність підвищується, розвивається тренування.
Встановлено, що в процесі тренування м’язи гіпертрофуються, тобто їх маса збільшується на ЗО—60 %. Загалом це наслідок збільшення діаметра м’язових волокон, але зростає й кількість міофібрил, АТФ та креатинфосфату, підвищується активність ферментів, збільшуються запаси у м’язах глікогену та тригліцеридів. Таким чином, активізується аеробний та анаеробний метаболізм.
Зміни торкаються й швидких та повільних волокон, тому тренування спортсменів, здатних витримувати швидкі та короткочасні або повільні та тривалі навантаження, істотно відрізняється. У процесі тренування вдосконалюються нервова та гуморальна регуляція систем кровообігу, дихання, виділення, терморегуляція, підвищуються їх резервні можливості тощо.
6. На розвиток втоми впливає гальмування в нервових центрах: гальмування припиняє роботу, перешкоджаючи розвитку хронічного виснаження і стимулюючи розвиток відновних процесів.
Для розвитку відновних процесів при фізичній праці має значення активний відпочинок (І. М. Сєченов), який полягає в тому, що під час перерви працюють інші групи м’язів, а не ті, що працювали досі. Наприклад, якщо людина працювала правою рукою, то під час активного відпочинку працює ліва рука. Встановлено, що після активного відпочинку працездатність зростає більшою мі
рою, ніж після пасивного. Пояснюється цей вплив активного відпочинку взаємовідносинами, що спостерігаються в центрах регуляції цих м’язів.
Втома, відновлення і вік. При старінні знижується як фізична, так і розумова працездатність. Це пояснюється зменшенням інтенсивності відновних процесів, і вирішальна роль в цьому належить нервовим центрам. Порушуються синтез медіаторів і здатність рецепторів клітинних мембран реагувати на ці медіатори. В центрах розвиваються гальмівні процеси, які охороняють нервові клітини від глибокого стомлення. Системи кровообігу та дихання у старих людей не можуть забезпечити клітини, які працюють, достатньою кількістю кисню та поживних речовин. Нервові центри не здатні генерувати високі частоти імпульсів. Перемикатись з одного ритму роботи на інший літнім людям важко, адже у них вже сформувався стереотип і перехід на інший дається нелегко.
Враховуючи ці особливості, літнім людям доцільно розподілити час між працею та відпочинком так, щоб відпочинок був тривалішим, щоб робота виконувалась не так інтенсивно.
Але фізичні навантаження потрібні й у похилому віці, бо тривала гіподинамія супроводжується детренуванням опорно-рухового апарата, системи кровообігу та дихання, сприяє розвитку передчасного старіння.
Відновлення. Уже під час виконання роботи в організмі відбуваються процеси, спрямовані на відновлення енергетичних ресурсів та оновлення структур, тобто розвивається тривала стадія адаптації. Але найактивніше відновлення спостерігається після закінчення праці. При правильному чергуванні тренування й відпочинку може не тільки відновитись попередній рівень усіх ресурсів організму, але можна й перевищити його. В цей період проявляється специфіка фізичної вправи: характер адаптаційних змін залежить від виду навантаження, рівня тренованості, природних особливостей. Це впливає і на гетерохронність розвитку відновлення в різних органах і системах. Так, після максимального навантаження відновлення розвивається швидко і може закінчитись через кілька годин, а після подолання марафонської дистанції навіть у тренованого спортсмена цей процес затягується на кілька діб (основний обмін нормалізується через 3 доби). Регуляція процесів відновлення залежить від впливу місцевих метаболітів, гормонів, вегетативної нервової системи.
Процес відновлення потребує відповідних харчування, режиму життя. Відновлення прискорюється при зміні виду діяльності, так званому активному відпочинку. Одним з його видів є робота в період відпочинку тих м’язів, які не брали участі у виконанні основної роботи. Іншим видом активного відпочинку є зміна режиму фізичної праці. Так, якщо фізичні вправи супроводжувались нака4
пнченням великої кількості недоокисленнх продуктів обміну, то після закінчення їх виконання корисно взятись за роботу невеликої інтенсивності. Нове навантаження сприятиме поліпшенню кровообігу, посиленню дихання і виведенню продуктів обміну з м’язів, які працюють, посиленню процесів окислення. Молочна кислота активно окислятиметься, а одним із органів, де вона поглинається, є серце.
Передстартовий стан. Як правило, ще перед початком виконання фізичних вправ відбуваються помітні зміни функцій ряду органів та систем. Вони спрямовані на підготовку організму до наступної діяльності і сприяють прискоренню впрацьовування. У спортсмена заздалегідь підвищується частота скорочень серця, посилюється дихання, активізується транспорт газів. Можна виявити зміни і в показниках крові (гіперглікемія; може підвищитись концентрація лактату). Усі ці зміни — наслідок збудження снмпатико-адреналової системи, активність якої зумовлена умовнорефлекторними механізмами. Проявляється рефлекс на час, місце тощо. Передстартовий стан найбільше виражений перед спортивними змаганнями. Він може проявитись за кілька годин ї навіть діб до старту.
ОСНОВИ ФІЗІОЛОГІЇ ПРАЦІ
У процесі трудової діяльності також розвиваються процеси адаптації. Фізіологія праці — прикладний розділ фізіології, який вивчає механізми адаптації до праці з метою розробки заходів, спрямованих на збереження здоров’я, підвищення продуктивності праці при мінімальній шкоді для здоров’я. Вивчають не тільки організм людини, його адаптацію, але й умови праці, шкідливі чинники. Крім того, фізіологія праці дозволяє розробити показники для професійного відбору.
Цілеспрямована трудова діяльність людини відрізняється від діяльності тварин тим, що його взаємодія з природою відбувається шляхом активного її перетворення (не завжди корисного). Соціальне й біологічне в природі людини — два якісно різні ступені розвитку. Трудовий процес має соціальний характер, тому біологічне начало повинно підкорятись соціальному і включатися в нього. Але біологічна суть зберігає свою самостійність (добовий біологічний ритм, швидкість реакцій, м’язова сила тощо), як і свої характерні константи життєдіяльності (гомеостаз).
Діяльність людини в складній виробничій системі реалізується з урахуванням процесів перебудови багатьох функцій під впливом різноманітних чинників, які діють на організм у процесі трудової діяльності. Одним із основних механізмів, що формуються в процесі оволодіння трудовими навиками, є динамічний стереотип. Утворення робочого динамічного стереотипу в людини відбувається під впливом чинників спадкового розвитку морфофункціональних ме
ханізмів нервових центрів, чинників зовнішнього середовища та цілеспрямованих педагогічних впливів.
ОСНОВНІ ФОРМИ
ТРУДОВОЇ ДІЯЛЬНОСТІ
Усі види праці можна розділити на дві групи: фізична, де переважає м’язова діяльність, і розумова, де домінує розумова діяльність. Такий поділ досить умовний, бо жоден із видів праці не може відбуватись без діяльності ЦНС. Але такий поділ конче потрібен, бо ці два види праці мають свої особливості. Існує така класифікація трудової діяльності:
І. Форми праці, що потребують значної м’язової активності. Цих форм стає все менше, бо вони пов’язані з важкою фізичною працею (землекопи, лісоруби, косарі тощо). У представників цих професій повністю або частково відсутня механізація виробничого процесу. Названі професії потребують значних енергетичних затрат. Хоча така фізична праця й розвиває м’язову систему людини, вона зумовлює ряд негативних наслідків. Основний із них — соціальна неефективність фізичної праці. Для досягнення певної продуктивності потрібне значне напруження фізичних сил людини.
2. Механізовані форми праці — це численні професії в усіх галузях виробництва. Характерні риси механізованих форм праці пов’язані зі зниженням м’язового компоненту в роботі і ускладненням програми дій. Механізація переводить м’язову активність з проксимальних ланок на дистальні, зменшуючи роль великих м’язів на користь дрібних, завдання яких полягає переважно в розвитку точних і швидких рухів.
Ускладнення програми дій при механізованих формах праці пов’язано із набуттям спеціальних знань і рухових навиків.
3. Групові форми праці (конвейєр). Основою високої продуктивності праці на конвейєрі є автоматизація рухових навиків, звільнення робітника від допоміжних операцій, синхронізація праці всіх її учасників. Ця форма праці вирізняється монотонністю одноманітних трудових процесів. Величину такту — інтервал часу між операціями — можна прийняти за міру монотонності. У зв’язку з цим високе навантаження припадає на нервову систему, емоціональну сферу. Оскільки на конвейєрі працюють люди з різними властивостями нервової системи, то створюються додаткові навантаження на неї.
4. Форми праці, пов’язані з напівавтоматичним або автоматичним виробництвом. У цих формах праці механізація виробничого процесе виражена більшою мірою. Людина не доповнює механізм, а керує ним, забезпечує його безперебійну роботу. Основною рисою діяльності робітника є готовність до дії і пов’язана З нею терміновість реакції. Такий функціональний стан назвали «оперативним спокоєм» (О. О. Ухтомськнй, 1927). Ця трудова до
мінанта спрямована на подальшу діяльність. Рівень «оперативного спокою» буває різним залежно від відповідальності майбутньої роботи, ставлення до неї, терміновості дій, індивідуальних властивостей робітника. Збереження стану «оперативного спокою» — велика нервова праця.
5, Форми праці, пов’язані з дистанційним керуванням. Розріз-,няють два основних робочих ритми. В одних випадках пульти управління потребують частих активних дій людини, в інших — рідких. У першому випадку безперервна увага робітника одержує розрядку в численних рухах або мовно-рухових актах, в другому — робітник перебуває головним чином у стані готовності до дії. Найскладніші форми — діяльність диспетчерів на виробництві чи транспорті.
6. Форми інтелектуальної праці. З фізіологічної точки зору інтелектуальна діяльність грунтується на складній роботі ЦНС, в якій формується відповідна програма дій. Інтелектуальна праця дуже різноманітна, і програми можуть бути різні за якістю і складністю. З одного боку, це постійна, проста програма дій, що створює монотонний стереотип (телеграфісти, рахівники та ін.), а з іншого — мінлива, складна програма дій, якої дотримується талановитий вчений, видатний конструктор (творча праця).
Особливості розумової праці. Розумовою вважається праця, пов’язана з прийомом та переробкою інформації. Вона потребує участі сенсорних систем, уваги, пам’яті, активізації мислення, емоційної сфери. Розумова праця характеризується великим напруженням діяльності ЦНС, особливо другої сигнальної системи, але справді розумова (творча) діяльність зовсім не виключає можливості фізичних напружень, навіть значних.
Основні види розумової праці:
1. Праця оператора — група професій, пов’язана з керуванням машинами, устаткуванням, технологічними процесами (операторн-спостерігачі, оператори-виконавці, оператори-технологи і ін.). Для дослідження цих професій, що дуже поширені в сучасному виробництві, виник навіть новий розділ науки — інженерна психологія, яка вивчає функції людини в автоматизованих системах.
2. Управлінська праця — керівники підприємств, установ, викладачі. В цій групі домінують чинники, обумовлені зростанням об’єму інформації, зокрема, дефіцитом часу для її переробки, підвищенням соціального значення і особистою відповідальністю за прийняття рішень. Сучасному керівнику потрібні велика кількість різних якостей (політичних, організаторських, ділових, професійних, особистих), широке коло знань (економіки, управління, техніки, технології, психології), наявність певних навиків (педагога, вихователя). Для даної форми праці характерні нестандартність рішень, нерегулярність навантаження, можливість конфліктних ситуацій.
3. Творча праця — одна з найскладніших форм діяльності лю
дини, бо вона потребує багаторічної підготовки, високої кваліфікації. Це наукові працівники, письменники, композитори, артисти, художники, конструктори. Для їх роботи характерні створення нових алгоритмів діяльності (частіше, ніж у представників інших професій), значний об’єм пам’яті, пильна увага, що підвищує рівень нервово-емоційного напруження. Крім того, нерегламентова* ний графік діяльності.
4. Праця медичних робітників. При всій різноманітності спеціальностей лікаря і середнього медичного працівника у них є загальні риси, пов’язані із постійними контактами з людьми, переважно хворими, підвищеною відповідальністю, часто — дефіцитом інформації для прийняття правильного рішення.
5. Праця учнів та студентів. Навчальний процес потребує напруження основних психічних функцій — пам’яті, уваги (особливо її концентрації і стійкості), сприйняття. Навчання часто супроводжується стресовими ситуаціями (екзамени, заліки).
ФІЗІОЛОГІЧНА ХАРАКТЕРИСТИКА
РОЗУМОВОЇ ПРАЦІ
Основною умовою трудового процесу є створення і підтримка стійкої домінанти. Психічна діяльність реалізується всім мозком в цілому. При цьому різні відділи ЦНС функціонують досить диференційовано, але включаються в єдине ціле для забезпечення форм психічної діяльності. Залучаються як специфічні (аналізаторні), так і неспецифічні структури мозку. Під час розумової діяльності процеси охоплюють різні кірково-підкіркові взаємовідношення в обох півкулях великого мозку.
Якщо генералізовані (загальні) зміни активності мозку супроводжують будь-який вид розумової діяльності, то локальні процеси активізації спостерігаються при різних видах діяльності і в різних ділянках кори. Що складніша робота мозку, то більше його структур функціонує синхронно. Наприклад, якщо робота пов’язана з мовною функцією, то велику роль відіграють відділи лівої півкулі великого мозку (центри мови). Значну роль відіграють лобні відділи мозку, які об’єднують неспецифічні форми активності з аферентною інформацією, що надходить.
Будь-яка розумова праця супроводжується певним нервово-емоційним напруженням. При цьому загострюються сприймання, увага, пам’ять, проявляються вегетативні зміни. Для кожного виду діяльності потрібен певний оптимум емоційного напруження, при якому реакція організму стає ефективною і досконалою. Емоційне напруження значною мірою залежить від складних соціально-психологічних мотивів.
Під час виконання розумової праці психічні процеси істотно змінюються. На початку увага, здатність запам’ятовувати, швидкість розв’язання «тестових» задач поступово поліпшуються (впра-
цьовування). Але надмірна розумова праця може пригнічувати психічну діяльність.
Для збереження розумової працездатності велике значення мають вегетативні функції, що забезпечують енергетичні потреби. Підвищення активності симпатико-адреналової, гіпоталамо-гіпофізар-но-надниркової системи мобілізує енергозабезпечення. Але позитивне їх значення реалізується при нетривалому емоційному збудженні. Тривале емоційне напруження може мати негативний ефект.
У процесі емоційного збудження посилюються обмін катехола-мінів (синтез і вихід), що стимулюють енергетичні процеси, мінеральний обмін (підвищується збудність нейронів). Поряд із підвищенням рівня глюкози в крові (гіперглікемія) підвищується і концентрація вільних жирних кислот. Скорочення серця стають частішими, підвищується артеріальний тиск. Тривале емоційне напруження може призвести до розвитку порушень у серці, про що свідчать зміни на ЕКГ.
Важливим механізмом забезпечення ефективності розумової праці є збільшення кровотоку в нервових центрах, які активно працюють. Це відбувається в основному за рахунок перерозподілу кровотоку в судинах мозку.
Всі вказані зміни при частому (щоденному) повторенні можуть призвести до патологічних змін у організмі. Зміни тоді розвиваються не лише у вегетативній, але і в психічній сфері. Особливо часто це буває тоді, коли повного відновлення після роботи, не відбувається і стомлення переходить у хронічне (перевтома).
Проблема втоми і працездатності при розумовій праці тісно пов’язана з віковими особливостями людини і з її біоритмами. Важливо, що при розумовій втомі знижується також і фізична працездатність.
Ознаки втоми при розумовій праці: відчуття слабкості, зниження уваги, погіршення пам’яті і мислення, ослаблення волі, моторні порушення (порушується координація рухів, знижується сила), сонливість. Розвиток втоми залежить від стану організму, зовнішніх чинників. При розумовій перевтомі праця продовжується за рахунок підвищення емоційної напруженості.
На Швидкість розвитку втоми впливає вік. У дітей у зв’язку зі слабкими процесами гальмування втома розвивається швидше. У літніх людей при розумовій праці більшою мірою виражена активізація вегетативної нервової системи і спостерігається погіршення психічних функцій (особливо при напруженій праці).
Сама по собі розумова праця, не ускладнена негативними емо- . ціями, не впливає істотно на організм. Але серед тих, хто займається розумовою працею, досить високий процент людей з захворюваннями серцево-гудинної та нервової систем.
Важливим методом підтримання високої працездатності є чергування розумової і фізичної праці.
Додаток
Основні фізіологічні константи
Система крові
ОЦК Близько 7 % (7із маси
Об’єм плазми Вміст білків у плазмі, г/л альбумінів глобулінів Альбуміно-глобуліновий коефіцієнт фібриноген Концентрація мінеральних солей у крові Концентрація глюкози у крові Осмотичний тиск плазми крові Онкотичний тиск плазми крові тіла) 55—60 % 65—85 40 28 1,2—2,0 3 г/л 0,9—0,95 % 4,4—6,6 ммоль/л 7,5 атм (300 мосм/л) 25—ЗО мм рт. ст.
Температура замерзання крові рН артеріальної крові венозної крові Кількість еритроцитів у крові чоловіка жінки ~ ШОЕ, мм/год у чоловіка у жінки Кількість гемоглобіну віл крові чоловіка жінки Загальна кількість гемоглобіну в крові дорослої людини 1 г гемоглобіну приєднує Киснева ємкість крові Середня концентрація гемоглобіну в еритроциті Резистентність еритроцитів, % мінімальна максимальна Кількість тромбоцитів у 1 л крові Тривалість кровотечі Час зсідання крові Ретракція кров’яного згустка Кількісіь лейкоцитів у крові зернисті, % еозинофіли базофіли нейтрофіли паличкоядерні сегментоядерні незернисті, % лімфоцити моноцити (1,3 мосм/л) —0,56 °С 7,4 7,35 4,0—5,1- 10і 2/л 3,7—4,7-1012/л 1—10 2—15 132—164 г 115—145 г Близько 700 г 1,34 мл О2 Близько 20,0 об. % 30-38 % 0,5—0,4 0,36—0,39 188—320- Ю’/л 2—5 хв 5—8 хв 40—50 % 4,0—9,0-Ю’/л 0,5-4 0—1 1-5 50-70 19-37 3-11
Система кровообігу
ЧСС у стані спокою, за 1 хв
у тренованих +60—65
у нетренованих +70-75
Тривалість серцевого циклу, окремих періодів і фаз
(ЧСС 70—75 за 1 хв):
систола шлуночків
+0,33—0,34 с для чоловіка і
0,35—0,36 с для жінки
період напруження міокарда шлуночків +0,08 с
фаза асинхронного скорочення +0,05 с
фаза ізометричного скорочення —0,03 с
період вигнання +0,25 с
фаза швидкого вигнання +0,12 с
фаза повільного вигнання +0,13 с
діастола шлуночків +0,47 с
період розслаблення +0,12 с
протодіастолічний інтервал +0,04 с
ізометричне розслаблення +0,08 с
період наповнення —0,35 с
фаза швидкого наповнення —0,09 с
фаза повільного наповнення +0,26 с
систола передсердь +0,1 с
діастола передсердь —0,7 с
загальний цикл 0,8 с
Швидкість поширення збудження в серці
міокардом передсердь +0,8—1,0 м/с
атріовентрикулярним вузлом 0,02—0,05 м/с
у провідній системі шлуночків 1,5—4,0 м/с
міокардом шлуночків +0,3—0,9 м/с
Тривалість періоду рефрактерності серцевого м’я-
за, с
абсолютної —0,25 с
відносної —0,03 с
Тривалість і висота зубців та інтервалів електро-
кардіограми:
а) тривалість зубців і інтервалів ЕКП
зубець, відрізок, інтервал, с
зубець Р 0,11
інтервал Р — (} 0,1—0,21
зубець 0,04, менше 1/4 Р за ам-
плітудою
комплекс (}Р8 0,04
інтервал 5 — Т Залежить від ЧС0
зубець Т 0,16—1,24
інтервал 0 — Т 0,34—0,36
інтервал /? — Р Залежить від ЧСС
б) величина зубців при калібровочній напрузі
1 мВ-10 мм:
зубець величина, мВ висота, мм
Р 0,2 0,5—2,5
0 0—0,3 (1/4 Р) 0,3
Р 0,6—2,2 6—22
5 0—0,6—2,0 (у грудному відве- 0,6
денні)
Т 0,5—0,6 2,5-6
Інтервали:
Р — (2 ізоелектричний
(} — Т ізоелектричний
5 — Т ізоелектричний
Електрична вісь серця:
нормальне положення електричної осі серця + кут а становить від+ 30 до + 69 відхилення електричної осі серця вправо (вертикальне положення) + кут а становить від + 70 до 90 °;
відхилення електричної осі серця вліво (горизонтальне положення) + кут а становить від + ЗО до 0 °.
Тиск крові у різних відділах серця, аорті та легеневій артерії, гПа (тут і далі у дужках тиск крові наведено у міліметрах ртутного стовпа):
праве предсердя правий шлуночок легенева артерія ліве предсердя лівий шлуночок аорта
систолічний
6,65—10,64 (5—8)
26—33 (20—25)
26—33 (20—25)
6,65—10,64 (5—8) 160—173 (120—130) 146,3—166,25 (110—125)
діастолічннй
до 0
2,66—5,32 (2—4) 13—20 (10—15) до 0
2,66—5,32 (2—4) 93—106 (70—80)
Тиск у плечовій артерії залежно від віку, гПа:
систолічний
діастолічннй
53,2 (40)
106,4 (80)
133—146,3 (100—110)
133—159,6 (110—120)
172,9—192,85 (130—145)
новонароджений вік 1 міс 10—15 років 20—ЗО років 50—69 років Кров’яний тиск, гПа:
у венах, що лежать за межами грудної порожнини у венах, що лежать у грудній порожнині або близько від неї, на вдиху на видиху
106,4 (80)
93,2 (70)
106,4—119,7 (80—90)
7—8 (5—6)
Систолічний об’єм серця в стані спокою
Хвилинний об’єм серця в стані спокою
2,66—4 (від — 2 до — 3) 2,66+6,65 (від + 2 до + +5)
—70—80 мл (О,О7Х
Х10-3 м3);
—4—5 л (4Х1О~3— 5х10~3 м3).
Лінійна швидкість кровотоку у різних відділах судинної системи, м/с:
аорта
артерії великого калібру
артерії середнього калібру
артеріоли
капіляри
середні вени
порожнисті вени
0,20
0,1—0,2
0,1—0,15 0.002—0,003 6,0003
0,001—0,05 0,10—0,15
Час обігу крові
у дорослої людини при ЧСС 70—80 за 1 хв 20—23 с на велике коло кровообігу припадає 4/5 часу повного кругообігу, на малий—1/5
Загальний поперечний переріз капілярів великого кола кровообігу
Поперечний переріз аорти
Діаметр капіляра
Довжина капіляра
Число функціонуючих капілярів на 1 мм2 поперечного перерізу скелетного м’яза у стані спокою під час роботи
Тиск у капілярах на артеріальному кінці на венозному кінці
Кровопостачання окремих органів, мл/хв коронарний кровотік у стані спокою під час фізичної праці кровотік головного мозку
Система дихання
Число дихань за 1 хв у стані спокою Дихальний об’єм
Резервний об’єм вдиху видиху
Життєва ємкість легень чоловіка жінки Залишковий об’єм
«Мертвий простір»
Загальна ємкість легень
Легенева вентиляція, л/хв
у стані спокою під час роботи Альвеолярна вентиляція в середньому Максимальна вентиляція легень, л/хв чоловіка жінки
Коефіцієнт альвеолярної вентиляції
Співвідношення між альвеолярною вентиляцією та легеневим кровотоком
Внутрішньоплевральний тиск
під час вдиху
Склад газів повітря, %
атмосферне видихуване альвеолярне
Парціальний тиск газів у альвеолярному повітрі:
Напруга газів у артеріальній крові!
2500 см2
2,5 см2 8—12 мкм 0,4—0,6 мм
32—270
2500
33,2—40 гПа (25—30) 10—16 гПа (8—12)
200—250 (4—6 % ХОК)
До 5000
(15 % ХОК)
16—20
500 мл (300—900 мл) 1500 мл (1000—2000 мл) 1200 мл (1000—1500 мл) 3500—5000 мл 3000—3500 мл
1000 мл
150 мл
4—6 л
6—10 л/хв
50—100 л/хв
4200 мл/хв
До 150
До 100
1/7
0,8
5 см Н2О (0,75 кПа)
8 см НаО (1,2 кПа)
Оа—20,93; СОа—0,03
Оа—16; СОа—4,4
Оа—14; СОа—5,5
Оа—14,7 кПа
(102 мм рт. ст.)
СОа—5,3 кПа (40 мм рт. ст.)
РОі 13,3 кПа
(96 мм рт. ст.)
РСО1 5,3 кПа
(40 мм рт. ст.)
у венозній крові
у міжклітинній рідині
у клітинах
Споживання кисню, мл/хв
у стані спокою
під час роботи
Виділення СО2
Киснева ємкість крові
Коефіцієнт утилізації кисню, %
у стані спокою
при інтенсивній діяльності
Тривалість затримки дихання, с
після глибокого вдиху (проба Штанге) після глибокого видиху (проба Генча) після гіпервентиляції
РОі 5,3 кПа (40 мм рт, ст.) РСОї 6,3 кПа (46. мм рт. ст.) РОі 2.6—5,3 кПа (20—40 мм рт. ст.) рсо„ 6,1 кПа (46 мм рт. ст.) Ро 0,6 кПа (5ммрт. ст.) Рсо± 8 кПа (60 мм рт. ст.)
250—300 1300—2400 200—250 мл/хв 20 мл у 100 мл крові
ЗО 60—70
40—60 30—40 90—100
1.0
0,7
0,8
Енергетичний обмін та терморегуляція
Дихальний коефіцієнт при окисленні вуглеводів жирів білків
Енергетична цінність вуглеводів жирів білків
Основний обмін протягом доби
Тепловіддача у стані спокою, % шляхом радіації випаровування конаекції та проведення
Шляхом перспірації за добу виділяється 600 млводи Виділення поту за добу, л середній показник максимальний показник
На випаровування 1 мл води витрачаєтьси
Система травлення
17,16 кДж/г (4,1 ккал/г)
38,94 кДж/г (9,3 ккал/г)
17,16 кДж/г (4,1 ккал/г) 7118 кДж/г (1700 ккал)
Близько 60
20 14—20
1,5 10—12
2,42 кДж (0,58 ккал)
Травні соки
Слина
Кількість
Швидкість виділення
500—2000 мл за 1 добу 0,1—1,8 мл/хв
99,14—99,42 % 0,5—0,6 %
Вміст води
Сухий залишок
Органічні речовини: білки, амінокислоти, муцин, калікреїн тощо
Неорганічні речовини: хлориди, карбонати, фосфати, солі натрію, калію тощо
Ферменти — головним чином а-амілаза, мальтаза, у слині міститься муцин, лізоцим (мурамідаза)
Шлунковий сік
Кількість
Швидкість секреції Відносна густина Вміст води рИ
Концентрація НС1
2—3 л за 1 добу 2—9 мл/хв 1,004—1,01
99,4 %
0,9—1,8
0,4—0,5 %
Показники секреторної функції шлунка
Показник Базальний Після введення гістаміну
Субмаксимальний, 0,008 мг/кг Максимальний 0,024 мг/кг
Об’єм шлункового соку, мл 50—100 100—140 180—200 рН 1,4—1,8 1,25—1,3 1,14—1,1 Кислотність, ммоль/л вільна 20—40 70—90 90—100 загальна 28—48 78—98 98—108 Дебіт вільної НС1, ммоль/год 1—4 6,5—12 16—24 Кислотна продукція, ммоль 1,5—5,5 8—14 18—25 Концентрація пепсину, ммоль/л 0,6—1,1 1,4—1,9 1,4—2,1 Дебіт пепсину, ммоль/год 0,03—0,11 0,14—0,26 0,26—0,46 Ферменти пепсин (оптимум дії при рН 1,5—2,4) гастриксин (оптимум дії при рН близько 3,0) желатиназа, ліпаза, лізоцим Сік підшлункової залови Кількість 1200—2000 мл/добу Швидкість секреції 1—5 мл/хв Відносна густина 1,005—1,014 рН 7,8—8,4 Вміст води 98,2—98,5 % Сухий залишок 1,8—1,5 % Органічні речовини: білки, вуглеводи тощо Неорганічні речовини: бікарбонати, натрій, калій, хлориди 66—127 ммоль/л Ферменти: трипсин, хімотрипсин, карбоксипептидази, еластаза, ліпази, фосфо, ліпаза, амілаза, мальтаза, лактаза, нуклеаза, фосфатаза, естераза
Жовч
Добова кількість Відносна густина міхурова жовч печінкова жовч
рН (відповідно) Вміст води Сухий залишок
500—1500 мл
1,011—1,032
1,008—1,015
5,6—8,0 і 6,2—8,5
85,9 і 97,4 %
26 і 133,5 г/л
Сік тонкої кишки
Кількість до 2500 мл за 1 добу
рН 7,2—8,6
Вміст води 97,5 %
Ферменти: сахараза, лактаза, ентерокіназа, ліпаза, фосфоліпаза, пептидазн, нуклеази тощо Сік товстої кишки
Кількість
вн.
Вміст води
Ферменти: пептидази, ліпаза, амілаза,
Система
Кровопостачання нирки
Тиск у капілярах клубочків Ефективний фільтраційний тиск
Плазмотік
Кількість первинної сечі
Реабсорбція, %
Проксимальна
Дистальна
Кількість кінцевої сечі
Р.Н
Відносна густина
Виділення сечовини
Виділення сечової кислоти
Виділення загального азоту
Тиск у сечовому міхурі, що викликає човипускання
Кількість сечі у сечовому міхурі
270—1550 мл за 1 добу 8,5—9,0 86,4—93,9 %
нуклеази (у невеликій кількості)
виділення
1000—1200 мл/хв 65—70 мм рт. ст, 33 кПа (близько 25 мм рт. ст.) 600—650 мл/хв 150—180 мл за 1 добу (близько 125 мл за 1 хв)
80
Приблизно 20
1,0—1,5 л за 1 добу
4,5-8,6
1,010—1,025
333—583 ммоль за 1 добу (20—30 г)
3,0—5,9 ммоль за 1 добу (0,5—1,0 г)
428—1213 ммоль за 1 добу позив до се- 12—16 см Н2О (1,17—
1,56 гПа) 200—250 мл
Предметний покажчик
А
Аберація 111
Абсолютна рефрактерність 17
Автоматизм 295, 473
Аглютинація 268
Адаптаційно-трофічний вплив 174
Адаптація 124, 439, 566
Адіадохокінез 163
Адреналін 209, 317
Адренергічні нейрони 178
Адренокортикотропний гормон (АКТГ) 203
Адренорецептори 177
Аерогематичний бар’єр 399
Акомодація ПО
Аксонний транспорт 24, 55
Аксон-рефлекс 185
Актин 27
Алкалоз 252
Альбуміни 246
Альвеолярне повітря 395
Альдостерон 503
Альфа-мотонейрони 143
Амілаза 446, 457
Аналізатор 80, 97, 100, 127, 130, 442
Андрогени 223, 555
Аномалії рефракції 112
Антигени 259, 267
Антидіуретичний гормон (АДГ) 503,
504
Антикоагулянти 281
Антиноциптивна система 138
Антитіла 259, 268
Апетит 486
Артерії 326
Артеріоли 326
Астигматизм 112
Астенія 163
Атаксія 163
Аферентний синтез 532
Аферентний нейрон 39
Ацетилхолін 43, 176
Ацидоз 252
Б
Базальні ганглії 157
Бізофілн 263, 265
Барабанна перетинка 102
Батмотропна дія 320
Барорецептори 352
Блювання 471
Боуменова капсула 492
Безумовний рефлекс 512
Білівердин 459
Білірубін 459
Біль 133
Бінокулярний зір 127
Бліда куля 157
Блукаючий нерв 168, 180, 320, 453, 457
Бронхи 385 '
Бронхіоли 386, 416
Буферні системи крові 250
В
Вагітність 561
Вазодилататорн 347, 349
Вазоконстриктори 347, 348, 349
Вазопресин (АДГ) 503, 504
Вароліїв міст 23, 152, 408
Вдих 391, 393, 407
Вегетативна нервова система 167
Вегетативні, центри 180
Великий мозок 90
Вени 326, 340, 342
Венозний пульс 344
Вентиляція альвеол 394
Веретено м’язове 144
Вестибулярний апарат 97
Видих 391, 393
Видільна система 489
Випаровування 432
Вища нервова діяльність 511
Відновний період м’яза 578
Відносна рефрактерність 17
Вікові зміни 20, 37, 186, 235, 253, 267, 284, 313, 420, 428, 440, 486, 565, 573
Вінцева артерія 371
Вісцерорецеитори 130
Внутрішнє вухо 104
Внутрішнє середовище 233, 236
Впрацьовування 575
<Все або нічого» закон 17
Всмоктування 474
Втома клітин 577
Вухо зовнішнє 100
В’язкість крові 249
Г
Гази крові 400
Газообмін в альвеолах 397
Газообмін у клітинах 405, 575
Гальмування 42, 48, 50, 64, 151, 175, 320, 411, 455, 525
Ганглії базальні 157, 169, 175
Гастрин 452
Гем 257
Гемодинаміка 324, 397
Гематоенцефалічний бар’єр 239
Гемоглобін 257
Гемоліз 255
Гемостаз 272
Гемофілія 275
Гепарин 282
Гідростатичний тиск 327, 338
Гіпербарична оксигенація 400
Гіперглікемія 220
Гіпертермія 438
Гіпоглікемія 219
Гіпоталамус 156
Гіпоталамо-гіпофізариа система 197
Гіпотермія 438
Гіпофіз 202
Гірська хвороба 417
Гіса пучок 289
Гістамін 229, 454
Гістерезис легень 389
Глобін 257
Глобуліни 246
Глюкагон 219
Голод 484
Голосовий апарат 538
Гомеостаз 230
Гомеокінез 231
Гомойотермні організми 429
Гонадна інволюція 565
Гонадотропні гормони 223
Гормони 188, 191, 194, 203, 204, 205, 206, 212, 222, 228, 293, 358, 482, 504 Гормональна регуляція 188
Гортань 385
Гострота зору 127
Групи крові 267
Гуморальна регуляція 188
Гуморальні фактори 189
Д
Далекозорість 112 Дальтонізм 123 Дванадцятипала кишка 456 Дегідратація 516 Деполяризація 13 Дерматоми 94 Децеребрація 152 Дефекація 474 Дивергенція 60 Дифузія 8, 397 Дихальний акт 383 Дихальні м’язи 385 Діастола 288, 303 Діафрагма 384 Діацилгліцерол 20 Діурез 507 Довгастий мозок 88, 149 Домінанта 65 Дотик 92
Е
ЕЕГ
Езофаготомія 449 Екскреція 489 Екстензорний тонус 152 Екстероцептори 84 Екстрапірамідна система 160 Екстрогени 556 Електроенцефалографія 73 Електрокардіографія 307 Електроретинограма 116 Емоція 515
Емульгування жирів 460 Ендокринні залози 190 Ендорфіни 138 Енкефаліни 138 Енергетичний обмін 422 Ентерокіназа 456 Еозинофіли 265 Епіфіз 200 Ерготропна реакція 173 Ерекція 557 Еритроцити 253 Естрадіол 223 Еритропоез 286 Естрогени 223, 562 Еферентні нейрони 39 Еякуляція 557
Ж
Жирні кислоти 478
Життєва ємкість легень 393 Жіночі статеві реакції 558 Жовч 459
Жовчна протока 460 Жовчні кислоти 459
Жовчні пігменти 459
Жовчний міхур 459
Жовчовиділення 460
Жовчотворення 460
З
Загальна ємкість легень'393
Загальний обмін 424
Залишковий об’єм 393
Залоза підшлункова 456
Залоза слинна 446
Залоза щитовидна 212
Залози внутрішньої секреції 188
Запахи 127
Захисна роль лейкоцитів 258
Збудливість 17
Зіничний рефлекс 112
Зсідання крові 283
І
Ізометричне скорочення 29
Ізотонічне скорочення 29
Ізотропні диски 28
Імпринтинг 519
Імунітет 258, 265
Індиферентний умовний подразник
523
Інозитолтрифосфат 20
Інстинкти 512
Інсулін 219
Інтернейрони 39
Іитероцептори 130
Інтрафузальні волокна 144
Іритантні рецептори 411
Й
Иодопсин 114
К
Калориметрія 426
Капіляри 335
Капсула Боуменва 492
Карбоангідраза 403
Карбогемоглобіи 258, 403
Карбооксигемоглобін 258, 400
Курареподібні речовини 26
Кислота хлористоводнева 451
Кислотність шлункового соку 451
Киснева ємкість крові 400
Кишкова фістула 462
Кишковий сік 462
Кістковий мозок 284
Клапани лімфатичних судии 380
серця 300
Клубочкова фільтрація 492
Коагуляція 278
Ковтання 467
Коефіцієнт легеневої вентиляції 394
утилізації кисню 406
дихальний 427
корисної дії м’язової роботи 33
Колінний рефлекс 147
Кольорова чутливість 112
Конвекція 432
Конвергенція 112
Координація рефлексів 63
Кора великого мозку 159
Коронарна система серця 371
Кортіїв орган 101
Криві дисоціації оксигемоглобіну 401
Критичний рівень деполяризації 16
Кришталик 109
Кров 244
Кровотворення 284
Кровоносна система (система кровообігу) 287
Кровопостачання плода 375
Кровотік головного мозку 371
після крововтрати 364
при фізичній роботі 362
при зміні положення тіла 361
капілярах- 336
легенях 365
органах травлення 369
серці 371
Кураре 26
Л
Лабіринт внутрішнього вуха 99
Лактація 564
Латентний період рефлексу ЗО
Легені 388
Лейкоцити 263
Ліберини 199
Ліквор 238
Лімфа 279
Лімфатична система 379
Лімфангіон 380
Лімфатичні вузли 381
капіляри 380
судини 380
Лімфоцити 263
Ліпаза 447, 457, 462
Локальна відповідь 16
Локомоція 141, 166
М
Максимальна вентиляція легень 394
Мале коло кровообігу 365
Маленький шлуночок 450
Матка 560
Маятникоподібні рухи кишки 472
Медіатори ЦНС 43
Меланотонін 201
Меланхолік 546
Мембранна клітина 6
Мембранний потенціал спокою 12
Менструальний цикл 560
Метасимпатична нервова система 174
Метгемоглобін 258
«Мертвий простір» 385, 393
Мікроциркуляція 333
Методика хронічного досліду 5
Механізм дихального газообміну 397 дії вуглекислоти на дихальний центр 408 м’язового скорочення 31 подразнення 16 регуляції діяльності органів травлення 479 рухової іннервації м’язів 25 серцевої автоматі! 292 утворення лімфи 379
Механорецептори 84
Мислення 543
Мієлінове волокно 21 Г
Міжклітинна (позаклітинна) рідина 7
Мікроциркуляція 333
Мінеральний склад крові 247
Міозин 31
Міокард 288
Міхурна жовч 459
Мова 536
Мозок довгастий 149
Мозочкова атаксія 163
Мозочок 162 •
Молочні залози 564
Моноамінергічні системи мозку 72
Моноцити 263
Мотивації 556
Мотонейрони 143
Моторика кишок 471, 473 шлунка 468
Моторна зона кори великого мозку 159
Моторна (рухова) функція органів травлення 464
Муцин 447
М’язи 27, 33
М’язове волокно 27
Н
Надгортанник 467
Надниркові залози 206
Напруга газів 395
Натрійуретичний гормон 504
Насичення 484
Напівкружні канали 99
Нейрон 38
Нейтрофіли 263
Нервові волокна 21
Нервові центри 59
Нервові імпульси 17
Нервово-м’язова передача 25
Нефрон 489
Нирки 489
Нікотин 179
Ністагм 100, 155
Норадреналін 209
Ноцицептнвні подразнення 133
Нюховий аналізатор 127
О
Об’єм кровотоку 304
Обмін вуглекислоти 403, 406, 424
газів у капілярах легень 399
газів у капілярах тканин 406
кисню 400, 406
основний 423
під час роботи 425
стандартний 427
Овуляція 561
Окиснення білків 427
вуглеводів 427
жирів 427
Оклюзія 67
Око 107
Оксигемоглобін 257, 400
Окситоцин 20
Онкотичний тиск 237, 247, 338
Оргазм 559
Орієнтовні рефлекси 155
Основний обмін 423
Охоронне гальмування 526
П
Палички сітківки 113
Пам’ять 529
Панкреатичний сік 456
Панкреозимін-холецистокінін (ХЦК-ПЗ) 458
Парасимпатична іннервація 171
Прищитовидні залози 216
Паратгормон 216
Парціальний тиск газів 395
Пепсин 451
Передній мозок 158
Предсердно-шлуночковий вузол 290
Переливання крові 271
Перистальтика 472
Перспірація 432
Перший тон серця 312
Петля Генле 498
Печінка 459
Підпорогове подразнення 16'
Підшлункова залоза 456
Під’язикова залоза 446
Піноцитоз 11
Пірамідний тракт 160
Піт 433
Плазма крові 245
Плацента 227
Пневмотаксичний центр 408
Пневмоторакс 391
Плевральна рідина 241
Повітроносні шляхи 385
Поворотно-протипоточний механізм 497
Пойкілотермні тварини 429
Поле зору ока 113
Пологи 563
Поляризована мембрана 12
Пороговий струм 16
Постгангліонарні волокна 169
Потенціал спокою мембранний 12
Потенціал дії 13
кінцевої пластинки 26
рецепторний 93
Потові залози 433
Поширення нервового імпульсу 21
Прегангліонарні волокна 169
Премоторна зона 159
Привушні залози 446
Пристосування 566
Проведення збудження нервовими волокнами 21
Провідникова система серця 289
Прогестерон 223
Прокарбоксиполіпептидаза 456
Пролактин 203
Проміжний мозок 156
Пропріоцептори 96, 142
Простагландини 229
Проста рефлекторна дуга 57
Просторова сумація 47
Протромбін 278
Пульс 332, 344
Р
Рйдужна оболонка ока 111
Реабсорбція в капілярах 493
Регуляція вегетативних функцій 167
гемодинаміки 350
дихальних рухів 415
діяльності серця 315
кровообігу в мікроциркуляторному
руслі 335
рухових функцій 142
системи травлення 479
системного кровообігу 356
секреції слинних залоз 448
секреції шлунка 452
секреції підшлункової залози 457
секреції тонкої кишки 461
тепловіддачі 437
теплопродукції 436
Резерв дихання 394
Резервний об’єм вдиху, видиху 393
Резистентність еритроцитів 257
Реабсорбція в канальцях нирки 493
Резус-фактор 269
Ренін-ангіотензин-альдостеронова си-
стема 358, 506
Реполяризація 13
Ретикулярна формація 69
Ретракція згустка 280
Рефлекс 56
ахілів 147
безумовний 511
вестибулярний 150
вегетативні 183
випрямлення 153
дуга 58
екстероцептивний 58
зіничний 112
інтероцептивний 58
координація 63
міотатичний 144
орієнтовні 155
пропріоцептивні 58
ритмічні 148
рухові 58
спинномозкові 146
статичні 150
статокінетичні 153
сухожильні 147
тонічні 144
фазні 144
шкірні 147
Рефлекси умовні 520
Рефлекторна дуга 57
Рефлексогенні зони 351
Рефрактерність 17
Рефракція 108
Рецептори 84
загальні властивості 85
класифікація 84, 130
артеріальної системи 351
больової чутливості 133
вестибулярного апарату 97
вісцеральні 130
дистантні 85
дихального апарату 408
дотику 92
звуку 100
іритантні 411
кольору 122
контактні 85
лабіринту 97
легеневі 410
м’язів 144
нюхові 127
мембрани 19
периферичні 409
півколових каналів 99
сітківки 113
центральні 408
юкстамедулярні 411
Рефлексогенна зона 94
Ригідність децеребраційна 152
Рилізинг-гормони 199
Ритм дихальних рухів 413
моторної функції тонкої кишки
472
серцевих скорочень 296
Рогівка 109
Родопсин 115
Розмноження 555
Розчинність газів у крові 395
Розширення судин 348
С
Сангвінік 546
Світлова адаптація 124
Сегменти спинного мозку 95
Секретин 457
Секреторна функція в канальцях нирки 499
травного апарату 443
слинних залоз 446
шлунка 449
Сенсорні системи 80
вестибулярна 97
вісцеральна 130
зорова 107
нюхова 127
слухова 100
смакова 442
шкірна 92
Середнє вухо 102
Середній мозок 152
Серце
автоматизм 295
збудливість 292
провідність 297
провідникова система 289
регуляція 315
рефрактерність 297
робота 305
тони 312
цикл ЗОЇ
Сечовиділення 507
Сечовий міхур 507
Сечові канальці 493
Сечоводи 507
Симпатична нервова система 171
Синапси вегетативної нервової системи 176
Синусовий вузол серця 290
Синцитій 289
Система ренін-ангіотензин-альдостеро' нова 358
Систола передсердь ЗОЇ
шлуночків 288, ЗОЇ
Систолічний об’єм серця 304
Сім’яна рідина 557
Сітківка ока 113
Скелетні м’язи 27
Слинні залози 446
Слідові потенціали 13
Слізні залози 108
Слуховий аналізатор 100
Смаковий аналізатор 442
Смугасте тіло 157
Соматостатии 219
Соматотропін (гормон росту) 203
Сон 549
Спинальний шок 148
Спинний мозок 142
сенсорні функції 87.
Споживання кисню 382
Стандартний обмін 427
Статеве дозрівання 555
Статева мотивація 556
Статевий акт 559
Статевий цикл 560
Статеві гормони 222, 555
Статннн 199
Статоліти 98
Стато-кінетичні рефлекси 153
Стовбур головного мозоку 88, 149,
350, 407, 479
Стравохід 467
Судини крвоносні 323, 329, 333, 340
Судиннозвужувальні волокна 349
Сурфактант 388
Т
Тактильні рецептори 92
Таламус 89
Темнова адаптація 124
Темперамент 544
Температурні рецептори 96, 435
Терморегуляційний центр 436
Тепловипромінювання (радіація) 432
Терморецептори 96
Тестостерон 222
Тетанічне скорочення ЗО
Типологічні особливості людини 544
Тиреотропний гормон 204
Тироксин 212
Тиск крові 326
внутрішньоплевральний 391
гідростатичний 338
діастолічний 330
Товста кишка 461
Тонічні м’язи 143
Травлення 441, 464, 474
Транспорт активний 10
вуглекислого газу 403
кисню 400
пасивний 8
Трийодтиронін 212
Трипсин 456
Тромбін 278
Тромбоцити 273
Трофотропна реакція 173
У
Увага 542
«Уявне годування» 449
Ф
Фагоцитоз 259
Ферменти кишкового соку 461
лейкоцитів 264
панкреатичного соку 456
слини 446
шлункового соку 449
Фібрин 279
Фібриноген 279
Фібриноліз 280
Флегматик 546
Функціональна залишкова ємкість легень 393
X <
Хвилинний об’єм кровотоку 304
Хвилинний об’єм дихання 394
Хеморецептори нюхові 128
передсердь 352
периферичні 409
судин 353
центральні 408
Хемотриопсин 456
Хлористоводнева кислота 451
Холерики 456
Холестерин 459
Холецистокінін-панкреозимін 457
Холінестераза 177
Холінорецептори 177
Холодові рецептори 435
Ц
Центри автоматизму серця 295
блювання 471
Брока 537
вегетативних функцій 180
Верніке 537
гіпоталамуса 180
емоцій 517
дефекації 474
дихання 407
довгастого мозку 149, 180
жування 446
зіничного рефлексу 112
ковтання 467
локомоції 161
пнеймотаксичний 408
секреції шлункового та панкреатичного соку 453, 457 сечовипускання 507 слиновиділення 448
смакового аналізатора 443'
сну 551
спинного мозку 87, 146
спраги 505
теплорегуляції 436
харчовий 484
Центральна нервова система 38
Циклічна АМФ 1£>~
Ч
Червоне ядро 155
Червоні м’язові волокна 27
Чорна речовина 156
Чутливість больова 133
зорова 107
інтероцептивна 130
нюхового аналізатора 127
слухова 100
смакова 442
тактильна 92
температурна 435 шкірна 92
Ш
Швидкість осідання еритроцитів 252 проведення нервових імпульсів 23 руху крові 325
Шийний тонічний рефлекс 150
Шкірний аналізатор 92
Шлунковий сік 450
Шлунок 449
Шок больовий 134
щ
Щитовидна залоза 212
Я
Яєчники 560
Язик 442
Список літератури
Загальні питання фізіології
Коробков А. В., Чеснокова С. А. Атлас по нормальной фнзнологни / Под ред. Н. А. Агаджаняна.— М.: Вьісш. шк., 1986.— 398 с.
Куффлер С., Николс Док. От нейрона к мозгу: Пер. с англ.—М.: Мнр, 1979.— 436 с.
Кандел 9. Клеточнне основні поведений: Пер. с англ.— М.: Мнр, 1980.— 560 с.
Нормальная фнзнологни / Под ред. Г. И. Косицкого.— М.: Медицина, 1985.— 535 с.
Общий курс фнзиологии человека и животннх / Под ред. А. Д. Ноздрачева: В 2 т.— М. : Внсш. шк., 1991.— Т. 1.— 509 с.; Т. 2.— 522 с.
Словарь физиологических терминов/Под ред. О. Г. Газенко.— М.: Наука, 1987,—446 с.
•Сравнительнаи физиологии животннх: Пер. с англ.— М.: Мир, 1967.— 766 с.
Физнологии плода и детей / Под ред. В. Д. Глебовского.— М.: Медицина, 1988 — 219 с.
Физиология человека / Под ред. Р. Шмидта, Г. Тевса: Пер. с англ.: В 4 т.— М.: Мир, 1985—1986.—Т. 1,—266 с.; Т. 2 — 237 с.; Т. З,—287 с.; Т. 4,— 311 с.
Виїїоск Воиіе І., ХСапу М. Рйузіиіо^у. 2 — псі. ед. Нагсіаі РиЬІізйіп^ Сотрапу. Медіа Реппзуїуапіа.— 1991 р.
Шеперд Г. Нейробиологии: Пер. с англ.: В 2 т.— М.: Мир, 1987.— Т. 1.— 451 с.; Т. 2.— 366 с.
Шмидт-Ниельсен К- Физиология животннх. Приспособленне и среда: Пер. с англ.— М.: Мир, 1982.— 798 с.
Харди Р. Гомеостаз: Пер. с англ.— М.: Мир, 1986.— 80 с.
Зккерт Р., Рзнделл Д., Огастин Док. Физиология животннх. Мехаиизмн и адап-тация: В 2 т.— М.: Мир, 1992.— Т. 1.— 433 с.; Т. 2.— 343 с.
Деарароиіоа А., ЗіІЬегпадІ 8і. Соїог аііаз о! рйузіоіо^у. 4 — ІЬ. ед. 1991. Зіиіі^агі, Иете Уогк. 1986. Сеогд Тіііете Уег1а£.— 369 р.
Остапу V. Р. Реуіете оі Медісаі РЬузіоІо^у. 15 —Ні. ей. Ьоз АНоз, СаІИогпіа 1979. Ьап£е Мед. РиЬІісаНопз— 754 р.
Оиепагд. Н. Рііузіоіо^іе Ьитаіпе — Рагіз. 1991. Едіііопз ргадеї— 420 р.
Оиуіоп А. С. ТехіЬоок о! Медісаі Ркузіоіо^у 8-Ні. ед. Ркуіадеіркіа. Ьоп-доп. Тогопіо. Мопігеаі. 8удпеу. Токуо. 1991. XV. В. Баипдегз Сотрапу — 1014 р.
Моипісааііе V. В. Медісаі РЬузіоІо^у 14-Ні. ед. V. 1—2. 81. Ьоиіз, 1980 Мозіу — 1807 р.
ХРеаі І. В. Везі апд Тауіог’з Рііузіоіо^ісаі Вазіз оі Медісаі РгасНсе. 11-Ні. ед. ВаІНтоге. 1985 "МПіатз а. ХУіІкіпз.—1062 р.
Загальна фізіологія
Бреоке М. Злектрическая активность иервной системи: Пер. с англ.— ЛІ.: Мир, 1979,—263 е.
Катц Б. Нерв, мншца, сииапс: Пер. с англ.— М.— Л.: Мир, 1969.— 220 с.
Лишко В. К., Шевченко М. И. Мембрани н жизнь клетки.— К.: Наук, думка, 1987 — 103 є.
Обіцая физнология возбудимнх мембран: Руководство по физиологии.— М.: Наука, 1975.— 408 с.
Скок. В. И., Шуба М. Ф. Нервнс-мьшіечнаи физиологня.— К.: Вища шк., 1986.— 224 с.
Ходжкин А. Нервннй импульс: Пер с англ.— М.: Мир, 1965.— 125 с.
Хухо Ф. Нейрохнмия. Основи и принципи: Пер. с англ.— М.: Мир, 1990 — 384 с.
Механізми регуляції фізіологічних процесів
Бак 3. Химнческая передача нервного импульса: Пер. с франц.— М.: Мир, 1977,— 118 с.
Костюк. Л. Г. Физнология центральной нервной системи.— К.: Вища шк., 1977,—319 с.
Мозг/Хьюбел Д. и др.: Пер. с англ.— М.: Мир, 1982.— 280 с.
Нейро-трансмиттерине системи/Под ред. Н. Дж. Легга: Пер. с англ.— М.: Медицина, 1982.— 224 с.
Обіцая физнология нервной системи/Под ред. П. Г. Костюка.— М.: Наука, 1979.— 716 с.
Шеррингтон. Ч. Интегративная деятельность нервной системи: Пер. с англ.— Л.: Наука, 1969.— 391 с.
Фізіологія сенсорних систем
Батуев А. С., Куликов Г. А. Введение в физиологию сенсорних систем.— Л.: Висш. шк., 1984.— 247 С.
Кейдель В. Физнология органов чувств: Пер. с нем.— М.: Медицина, 1975.— 216 с.
Основи сенсорной физиологии / Под ред. Р. Шмидта: Пер. с англ.— М.: Мир, 1984,—287 с. •
Тамар Г. Основи сенсорной физиологии: Пер. с англ.— М.: Мир, 1976.— 520 с.
Физиологии сенсорних систем:/Под ред. В. Г. Самсоновой.— Л.: Наука, 1971.— Ч. 1.—416 с.
Физнология сенсорних систем/Под ред Г. В. -Гершуни.— Л.: Наука, 1972.— Ч. 2,—702 с.
Роль ЦНС у регуляції рухових функцій
Александер Р. Биомехаиика: Пер. с англ.— М.: Мир, 1970.— 339 с.
Бендел Дж. Мншца, молекула и движеиие: Пер. с англ.— М.: Мир, 1970.— 256 с.
Бзгиюу К. Мншечное сокращение: Пер. с аигл — М.: Мир, 1985.— 128 с.
Бернштейн Н. А. Очерки по физиологии движений и физиологической актив-ности.— М.: Медицина, 1960.— 346 с.
Гранит Р. Основи регуляции движеиий: Пер. с англ.— М.: Мир, 1973.— 386 с.
Магнус Р. Установка тела: Пер. с ием.— М.— Л.: Изд. АН СССР, 1962.— 624 с.
Общая и частная физиологии нервной системи: Руководство по физиологии/ Под ред. А. Г. Костюка.— Л.: Наука, 1969.— 355 с.
Физнология мншечной деятельности труда и спорта.— Л.: Наука, 1969.— 565 с.
Хилл А. Механика мншечиого сокращения.— М. : Мир, 1972.— 183 с.
Нервова регуляція вегетативних функцій
Достюк П. Г., Преображенскіш Н. М. Механизми интеграции висцеральннх и соматнческих афферентннх сигналов.— Л.: Наука, 1975.— 222 с,
Ноздрачев- А. Д. Физиология вегетативной нервной системи.— Л.: Наука, 1983.— 750 с.
Ноздрачев А. Д., Черньїшева М. П. Висцеральньїе рефлекси.— Л.: Изд-во Леї нингр. ун-та, 1989.— 189 с.
Скок В. И. Физиология вегетативних ганглиев.— Л.: Наука, 1970.— 235 с.
Гуморальна регуляція функцій
Бакл Дж. Гормони животиих: Пер. с англ.— М.: Мир, 1986.— 126 с.
Взаимодействие гормонов с рецепторами / Под ред. Дж. Леви: Пер. с англ.— М.:Мир, 1979.—432 с.
Потемкин В. В. Зндокринологии.— М.: Медицина, 1984.— 432 с.
Розен В. Б. Основи зидокринологии.— М.: Внсш. шк., 1984.— 344 с.
Теппермен Дж., Теппермен X. Физиология обмена веществ и зидокриниой системи. Вводний курс: Пер. с англ.— М. :Мир, 1989.— 656 с.
Физиология зндокринной системи. Руководство по физиологии / Под ред.
В. Г. Бараиова.— Л.: Наука, 1979.— 680 с.
Зидокринологии / Ефимов А. С. и др.— К.: Вища шк., 1983.— 327 с.
Система крові
Баркаган 3. С. Геморрагические заболевании и синдроми.— М.: Медицина, 1988.—528 с.
Иммуногенез, гемостаз и неспецифическаи резистентность оргаиизма / Куз-ник Б. И. и др.— М.: Медицина, 1989.— 319 с.
Кассиль Г. И. Внутренняи среда организма.— М. : Наука, 1983.— 264 с.
Лабораторние методи исследовании в клинике/Под ред. В. В. Меньшикова.—
М.: Медицина, 1987.— 368 с. і
Петров Р. В. Иммунология.— М.: Медицина, 1983.— 368 с.
Прокоп О., Геллер В. Группн крови человека: Пер. с нем.— М.: Медицина, 1991,— 510 с.
Рябов С. И., Шостка Г. Д. Зритрон и почка.— Л.: Наука, 1985.— 222 с.
Фермилен Ж., Ферстрате М. Гемостаз: Пер. с франц,— М.: Медицина, 1984.— 192 с.
Физиология системи кровн/Под ред. В. Н. Черниговского.— Л.: Наука, 1979.— 280 с.
Система кровообігу
Гайтон А. Физиология кровообращения. Минутньїй обьем сердца и его регуля-ция: Пер. с англ.— М.: Медицина, 1969.— 472 с.
Джонсон П. Периферическое кровообращение: Пер. с англ.— М: Медицина, 1982,—440 с.
Мурашко В. В., Струтьінский А. В. Злектрокардиографии.— М.: Медицина, 1991.—285 с.
Панченков Р. Т., Ярема И. В., Сильманович Н. Н. Лимфостимуляции.— М. 5 Медицина, 1986.— 240 с.
Раїимер Р. Ф. Динамика сердечно-сосудистой системи: Пер. с англ.— М.: Медицина, 1981.— 600 с.
Руководство по кардиологии І Под ред. Е. И. Чазова.— М.: Медицина, 1982.— 468 с.
Физиология кровообращеиии: Руководство по физиологии / Под ред. Б. И. Тка-ченко.— Л.: Наука, 1986.— 640 с.
Физиология кровообращения. Физиологии сердца/Под ред. Е. Б. Бабского.— Л.: Наука, 1980.— 598 с.
Физиология кровообращения. Физиология сосудистой системи / Под ред. Б. И. Ткаченко.— Л.: Наука, 1984.— 652 с.
Фолков Б., Нил 3. Кровообращение: Пер. с англ.— М.: Медицина, 1976.— 440 с.
Чернух А. М., Александров П. Я., Алексеее О. В« МикрбЦиркуляция.— М.: Медицина, 1975.-— 456 с.
Шуба М. Ф., Кочемасова Я. Г. Физиология сосудистьіх гладких мьшш.— К.: Наук, думка, 1988,— 250 с.
Система дихання
Бреслав Я. С., Глебовский В. Д. Регуляция дьіхания.— Л.: Наука, 1981.— 280 с.
Легкие. Клиническаи физиология и функциональньїе проби /Комро Дж. Г. и др.: Пер. с англ.— М.: Биомедгиз, 1961.— 386 с.
Панасюк Е. М., Корзюк Л. С., Федорів Я. М. Фізіологія і патологія дихальної системи.— Львів : Світ, 1992.— 216 с.
Сафонов В. А., Ефимов В. А., Чумаченко А. А. Нейрофизиология дихання.— М.: Медицина, 1980.— 224 с.
У зет Дж. Физиология днхании. Основи: Пер. с англ.— М. :Мир, 1988.— 200 с. Физиологии дихання: Руководство по физиологии / Под ред. Л. Л. Пінка.— Л.: Наука, 1973,—351 с.
Обмін енергії.
Температура тіла та її регуляція
Мак-Мюррей В. Обмен веществ у человека: Пер. с англ.— М.: Мир, 1980.— 388 с.
Физиология терморегуляции: Руководство по физиологии / Под ред. К. П. Ива-нова.— Л.: Наука, 1984.— 470 с.
Система травлення
Гастроентерология/Под ред. Дж. X. Барона, Ф. Г. Муди: В 3 т.— М.: Медицина, 1985.—Т. 1,—304 с.; Т. 2,—384 с.; Т. З,—320 с.
Желудочно-кишечнне гормони и патология лищеварительной системи / Грос-сман А. и др.: Пер. с англ.— М.: Медицина, 1981.— 272 с.
Климов П. К. Пептиди и пищеварительная система.— Л.: Наука, 1983.— 272 с.
Коротько Г. Ф. Введение в физиологию желудочно-кишечного тракта.— Таш-кент: Медицина УзССР, 1987.— 221 с.
Дуиіак Р. Я. Пищеварительно-транспортная система знтероцитов.— Рига : Зи-натне, 1983.— 304 с.
Павлоцкая Л. Ф„ Дуденко Н. В., дйдельман М. М. Физиологии питаним.— М.: Висш. шк., 1989.— 368 с.
Уголев А. М. Знтериновая (кишечная гормональная) система.— Л.: Наука. 1978,—316 с.
Физиология и патология желудочно-кишечного тракта / Под ред. Дж. М. Полак и др.: Пер. с англ.— М.: Медицина, 1989.— 496 с.
Физиология пищевареиия: Руководство по физиологии.— Л.: Наука, 1974.— 762 с.
Физиология всаснвания: Руководство по физиологии.— Л.: Наука, 1977.— 668 с.
Шубникова Е. А., Коротько Г. Ф. Секреция желез.— М.: Изд-во МГУ. 1986.— 130 о.
Система виділення
Наточин Ю. В. Основи физиологии почки.— Л.: Медицина, Ленингр. отд-иие, 1982,—208 с.
Почечная зидокринологии І Под ред. М. Дж. Данн: Пер. с англ.— М.: Медицина, 1987.— 666 с.
Робинсон Дж. Р. Основи регуляции кислотно-щелочного равновесии: Пер. с англ.— М.: Медицина, 1969.— 72 с.
Роле Б., Роле 9. Т. Жажда: Пер. с англ.— М.: Медицина, 1984.— 192 с.
Физиология почки / Под ред. Ю. В. Наточина.— Л.: Наука, 1972,— 398 с.
Фізіологічні основи поведінки
Анохин П. К. Узловне вопросн теории функциональних систем.— М.: Наука, 1980.— 197 с.
Батуев А. С. Вьісшаи нервиая деительность.— М.: Виєш. шк., 1991.— 256 с.
Блум Ф., Лайзерсон А., Хорстедтер Л. Мозг, разум и поведение: Пер. с англ.— М.: Мир, 1988 — 246 с.
Каган А. Б. Основи физиологии внсшей нервной деятельности.— М.; Внсш. шк., 1988.—543 с.
Кокс Т. Стресе: Пер. с англ.— М.: Медицина, 1981.— 213 С.
Милнер П. Физиологическая психология: Пер. с англ.— Л.: Мир, 1973.— 647 с.
Спрингер С., Дейч Г. Левнй мозг, правий мозг: Пер. с англ.— М.: Мир, 1983.— 256 с.
Хзссет Дж. Введение в психофизиологию: Пер. с англ.— М. :Мир, 1981.— 248 с. Чайченко Г. М. Основи физиологии внсшей нервной деятельности.— К.: Вища шк., 1987,— 176 с.
Система розмноження
Вундер П. А. Зндокрииология пола.— М.: Наука, 1980.— 253 с.
Доноеал Б. Т. Физнология полового развития.— М.: Педагогика, 1974.— 189 С.
Смит Дж. М. Зволюции полового размножения: Пер. с англ.— М.: Мнр, 1981.— 271 с.
Колесов Д. В., Сильверова Н. Б. Физиолого-педагогические аспекти полового созревания.— М.: Педагогика, 1978.— 224 с.
Мейнуоринг У. Механизм действия андрогенов: Пер. с англ.— М.: Мир, 1979.— 224 с.
Фізіологія процесів адаптації
Агаджанян Н. А. Адаптапия и резерви организма.— М.: ФиС, 1983.— 176 с.
Виру А. А. Гормоиальнне механизмн адаптации и тренировки.— Л.: Наука, 1981.— 155 с.
Меерсон Ф. 3., Пиіенникова М. Г. Адаптапия к стрессовнм ситуациям и физи-ческим нагрузкам.— М.: Медицина, 1988.— 256 с.
Зкологическая физнология человека. Адаптацня человека к зкетремальинм усло-виям ередн.— М.: Наука, 1979.— 70 с.
Зміст
ї
Передмова
РОЗДІЛ 1 ____________
Загальна фізіологія (Наливайко Д. Г., / Райцес В. С.|)........
Основні поняття фізіології . . . •................................
Фізіологія мембран................................•...............
Транспорт іонів та молекул через мемрану.....................
Мембранний потенціал спокою та потенціал дії......................
Рецепторна функція клітинної мембрани.............................
Проведення імпульсів нервовими волокнами ................. . . .
Нервово-м’изова передача.............................• . . . .
Фізіологіи скелетних м’язів.............•.........................
Фізіологія гладких м’язів............................- . . . .
РОЗДІЛ 2 ____________
Механізми регуляції фізіологічних процесів (| Райцес В. С. |, Шевчук В. Г.)
Загальні закономірності діяльності ЦНС............................
Структура і функції центральних синапсів..........................
Збудження в ЦНС.......................................
Гальмування в ЦНС............................................. .
Інтегративна функція центрального нейрона...........................
Загальні принципи рефлеторної діильності............................
Властивості нервових центрів......................................
Принципи координації рефлексів...................................
Функції ретикулярної формації.....................................
Моноамінергічні системи мозку.......................................
Електроенцефалографія ............................................
Вікові зміни функцій ЦНС...................................... .
Фізіологія сенсорних систем (Філімонов В. 1., | Райцес В. С. |).......
Фізіологія рецепторів............................................
Сенсорні функції спинного мозку .................................
Сенсорні функції стовбура мозку . ................................
Сенсорні функції таламуса.........................................
Сенсорні фукції кори великого мозку............................•
Шкірна чутливість . . •.........................................
Відчуття рівноваги (фізіологія вестибулярного аналізатора) . . . . Фізіологія слухової сенсорної системи............................
Фізіологія зорової сенсорної системи •...........................
Нюхова сенсорна система..........................................
Інтероцептивний (вісцеральний) аналізатор . . ..................
Фізіологічні основи болю та знеболювання . . .....................
Роль ЦНС у регуляції рухових функцій (\ Райцес В. С.|, Наливайко Д. Г.) Роль спинного мозку в регуляції рухових функцій . . •.................
Роль заднього мозку в регуляції рухових функцій...................
Роль середнього мозку в регуляції рухових функцій................
Участь проміжного мозку в регуляції рухових функцій..............
Роль переднього мозку в регуляції рухових функцій................
Роль кори великого мозку в регуляції рухових функцій..............
Роль мозочка в регуляції рухових функцій . . .....................
Інтеграція рівнів регуляції рухових функцій............... , , .
з
5
5
6
8
12
19
21
25
27
33
38
38
41
44
48
52
56
59
63
69
72
73
77
80
84
87
88
89
90
92
97
100
107
127
130
133
141
142
149
152
156
157
159
162
164
Нервова регуляція вегетативних функцій б/ Райцес В. С. |, Шевчук В. Г.) Функції вегетативної нервової системи . . . -.......................
Особливості будови вегетативної нервової системи................
Відділи вегетативної нервової системи...........................
Вплив вегетативної нервової системи на ефекторні органи.........
Функції гангліїв вегетативної нервової системи •................
Передача збудження в синапсах вегетативної нервової системи Тонус вегетативних «центрів» ...................................
Роль різних відділів ЦНС у регуляції вегетативних функцій організму Вегетативні рефлекси.....................................• . . .
Вікові зміни вегетативної нервової системи.........• . . . .
Клініко-фізіологічний аспект..................................•
Гуморальна регуляція функцій організму | (Райцес В. С. Шевчук В. Г.) Загальна ендокринологія . •........................................
Регуляція утворення гормонів....................................
Гіпоталамо-гіпофізарна система . . . •..........................
Принципи регуляції ендокринних залоз............................
Епіфіз............•.............................................
Гіпофіз...........................................•.............
Надниркові залози ..........................
Щитовидна залоза . ...............................................
Прищитовидні залози.............•...............................
Підгрудинна залоза............................................•
Ендокринна функція підшлункової залози .........................
Статеві залози .................................................
Поняття про тканинні гормони . . •..............................
РОЗДІЛ З
Фізіологія вісцеральних систем (Філімонов В. І.)....................
Гомеостаз і гомеокіиез ......................... . ............
Механізми гомеокінезу і їх регуляція............................
Значення рідких середовищ організму для гомеостазу •............
Рідкі середовища організму......................................
Інтерстиціальна рідина ...........................
Ліквор...................................................- ..
Рідини закритих порожнин тіла...................................
Система крові (Філімонов В. І.).....................................
Функції крові ...........................................• . . .
Плазма крові . . . ............................................
Фізико-хімічні властивості крові................................
Транспорт газів кров’ю .........................................
Захисні функції крові , . . . .............. • Групи крові . ..................................................
Гемостаз..........................................-.............
Кровотворення та його регуляція.............•...................
Система кровообігу (Філімонов В. І., Шевчук В. Г.) ................
Фізіологія серця...............................................
Нагнітальна функція серця.......................................
Серцевий цикл . -....................... . . «...............
, Систолічний і хвилинний об’єми кровотоку ......................
Механічна робота серця............................•.............
Показники функції серця...........................•.............
Регуляція діяльності серця................ .....................
Фізіологія кровоносних судин........................
Механізми регуляції гемодинаміки.........................• . . .
Регіонарний кровотік ........................... . •...........
Лімфатична система .........................•...................
Система дихання (Філімонов В. І., Наливайко Д. Г.) ........
167
168 169
171
172
175
176 179
180
183
186
187
188
189 196
197
200 200
202 206
212
216 217
219
222 228
230 230
232 233
236 238
238
241
244 244
245
247
253 258
267 272
284
287 288
300 ЗОЇ
304 305 306
315
323 350 365
379
382
Зовнішнє дихання і»:/; '. і..............
Газообмін між альвеолами і кров’ю................................
Транспорт газів кров’ю..........................................
Обмін газів у тканинах....................................... . .
Регуляція дихання....................* ..........................
Обмін енергії і терморегуляція (Філімонов В. І., Наливайко Д. Г.) Обмін енергії.......................................................
Температура тіла та її регуляція ..."....................... .
Система травлення (Наливайко Д. Г„ Філімонов В. І.)...............•
Смаковий аналізатор.............................................
Секреторні процеси в органах травлення ...................... •
Секреторна функція слинних залоз . . ........... Секреторна функція шлунка........................................
Секреторна функція підшлункової залози...........................
Секреторна функція печінки.......................................
Секреторна функція тонкої кишки..................................
Рухова функцій системи травлення.................................
Всмоктування . . ......................•.........................
Регуляція системи травлення ...............................• .
Система виділення (Філімонов В. І.)................•.................
Нирки . . . .........................•...........................
Сечотворення.....................................................
Регуляція функції нирок........................................
Сечовиділення та сечовипускання................................. ,
Фізіологічні принципи методів дослідження функції нирок . , . , Видільна функція шкіри, органів травлення та легень •................
РОЗДІЛ 4 ____________
Фізіологічні основи поведінки (| Райцес В. С. |, Філімонов В. І., Шевчук В. Г.)
Поняття про нижчу і вищу нервову діяльність......................
Біологічні мотивації...............................................
Фізіологія емоцій................................................
Набуті форми поведінки...........................................
Закономірності умовнорефлекторної діяльності.....................
Механізм творення умовних рефлексів................................
Пам’ять.....................-....................................
Функціональна структура поведінки................................
Особливості психічної діяльності людини..........................
Вікові особливості умовнорефлекторної діяльності й вищих психічних функцій людини...................................................
фізіологічні основи сну .........................................
Розмноження ([ 'Райцес В. С.) |) ...............................•
Стадії розмноження . . . • ..................................
Вікові зміни системи розмноження.................................
Фізіологія процесів адаптації (Філімонов В. І.) ..........
Поняття про адаптацію.........................................<
Стадії розвитку процесу адаптації . -.......................
Регуляція розвитку адаптаційного процесу.........................
Адаптація — процес підвищення функціональних резервів ..... Вікові зміни адаптації . . ............... ...................
Основи фізіології спорту.........................................
Основи фізіології праці..........................................
Додаток..............................................................
Основні фізіологічні константи.............................«...
Предметний покажчик..................................................
Список літератури » . . •............................................
383
397
400
405
407
422
422
428
441
442
443
446
449
456
459
461
464
474
479
489
489
491
502
507
508
510
511
511
513
515
519
522
527
529
532
535
548
549
555
555
565 56,6 566
567
569
571
573
573
581
586
586
593
600
Навчальне видання
Філімонов Володимир Іванович Наливайко Дмитро Георгійович | Райцес Володимир Семеновичі
Шевчук Віктор Григорович
НОРМАЛЬНА ФІЗІОЛОГІЯ
За редакцією професора В. І. Філімонова
Затверджено Головним управлінням навчальних закладів, кадрів і науки Міністерства охорони здоров’я України як підручник для студентів медичних вузів Київ «Здоров’я»
Редактор
В. К. Кульова
Художник-оформлювач
В. С. Жиборовський
Художній редактор
М. П. Черненко
Технічний редактор Л. О. Запольська
Коректори
А. В. Башкатова,
О. М. Л е в і и а,
В. І. Коваль
Здано до складання 26.01.94. ПіДп. до друку 17.06.94. Формат 60Х841Ав. Папір друк. № 2. Гарн. літ. Друк вис. Ум. друк. арк. 35,34. Ум. фарб.-відб. 35,34. Обл.-вид. арк. 42,5. Зам. 4—221.
Видавництво «Здоров’я», 252601, МСП, м. Київ-1, вул. Чкалова, 65.
Головне підпрнємство_республіканського виробничого об’єднання «Поліграфкнига», 252057, м. Київ-57, вул. Довженка, З#
Нормальна фізіологія / Кол. авторів; За ред. В. І. Філімоно-Н83 ва.— К. : Здоров’я, 1994.— 608 с., іл.: 3,71 арк. іл.
І8ВИ 5-311-00736-2
Підручник підготовлено відповідно до діючої програми з курсу нормальної фізіології, написаний він за системним принципом.
З метою підготовки лікаря широкого профілю особливу увагу приділено фізіології вісцеральних систем. Введено деякі нові розділи, а саме: «Фізіологія мембран», «Гомеостаз і гомеокіиез», «Фізіологічні аспекти адаптації» тощо.
В «Додатку» наведено головні фізіологічні показники.
Для студентів медичних вузів і медичних факультетів університетів.
1910000000-036 И6.83
н 209-94
ББК 28.903я7»