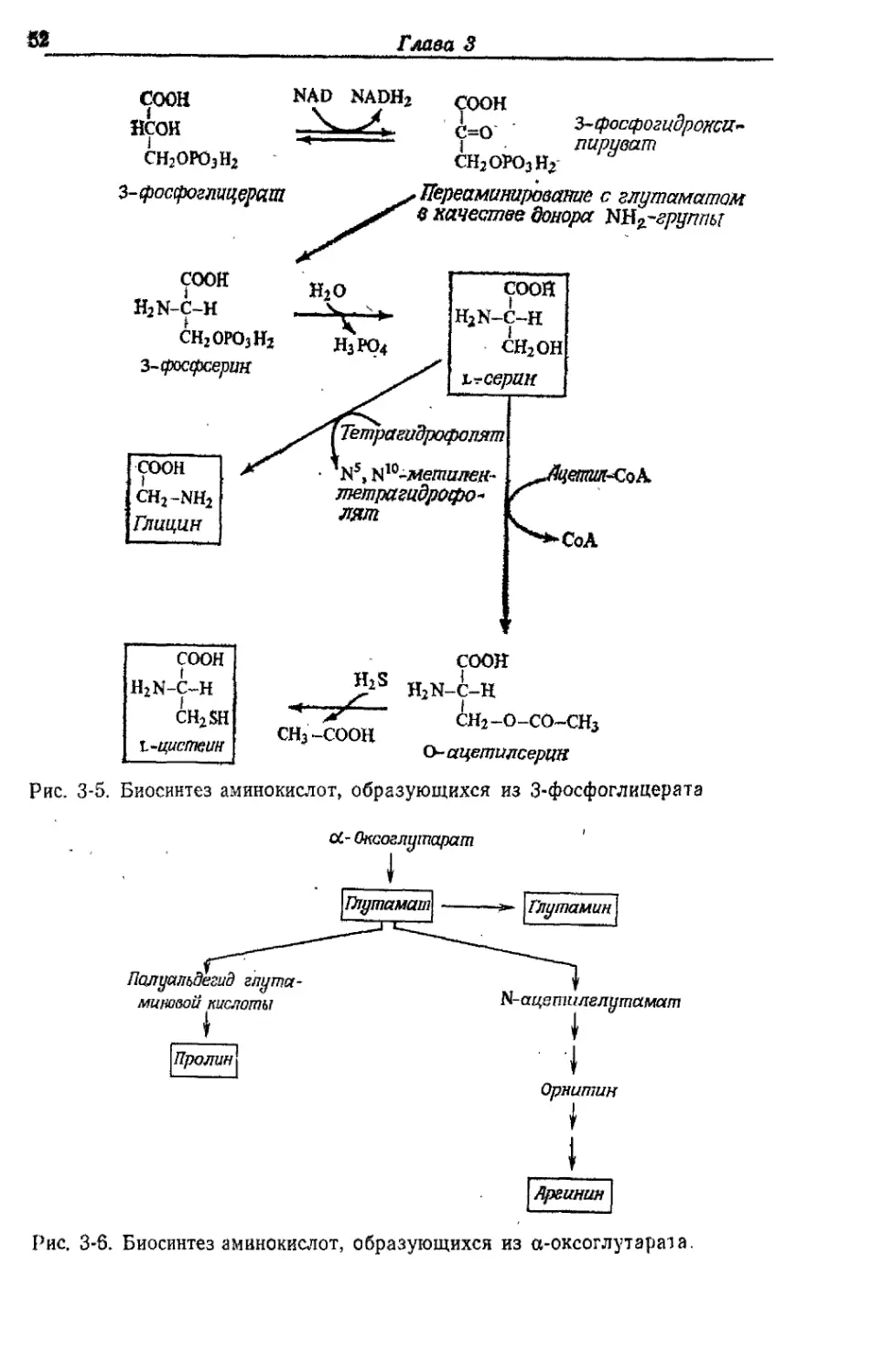
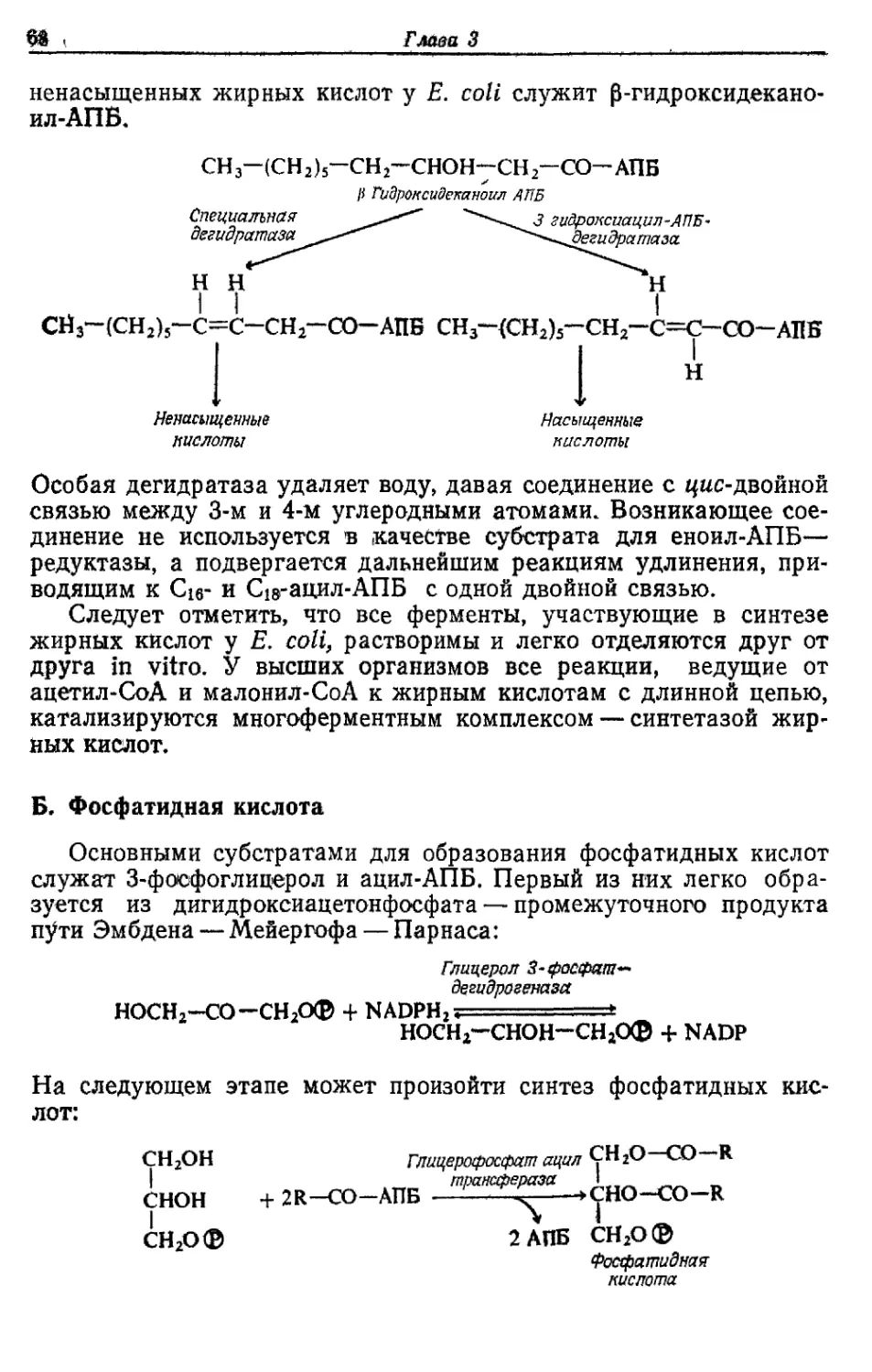
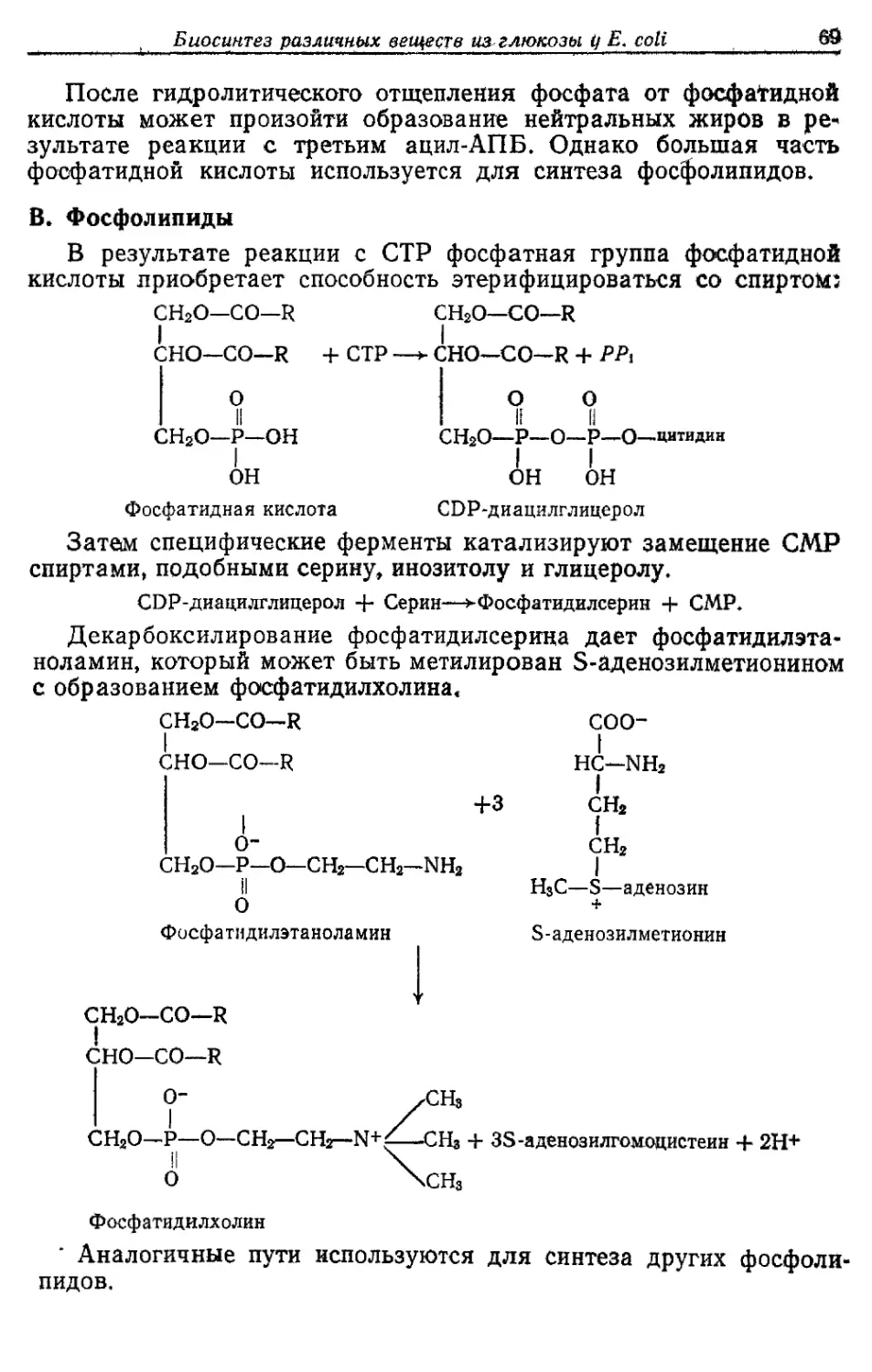
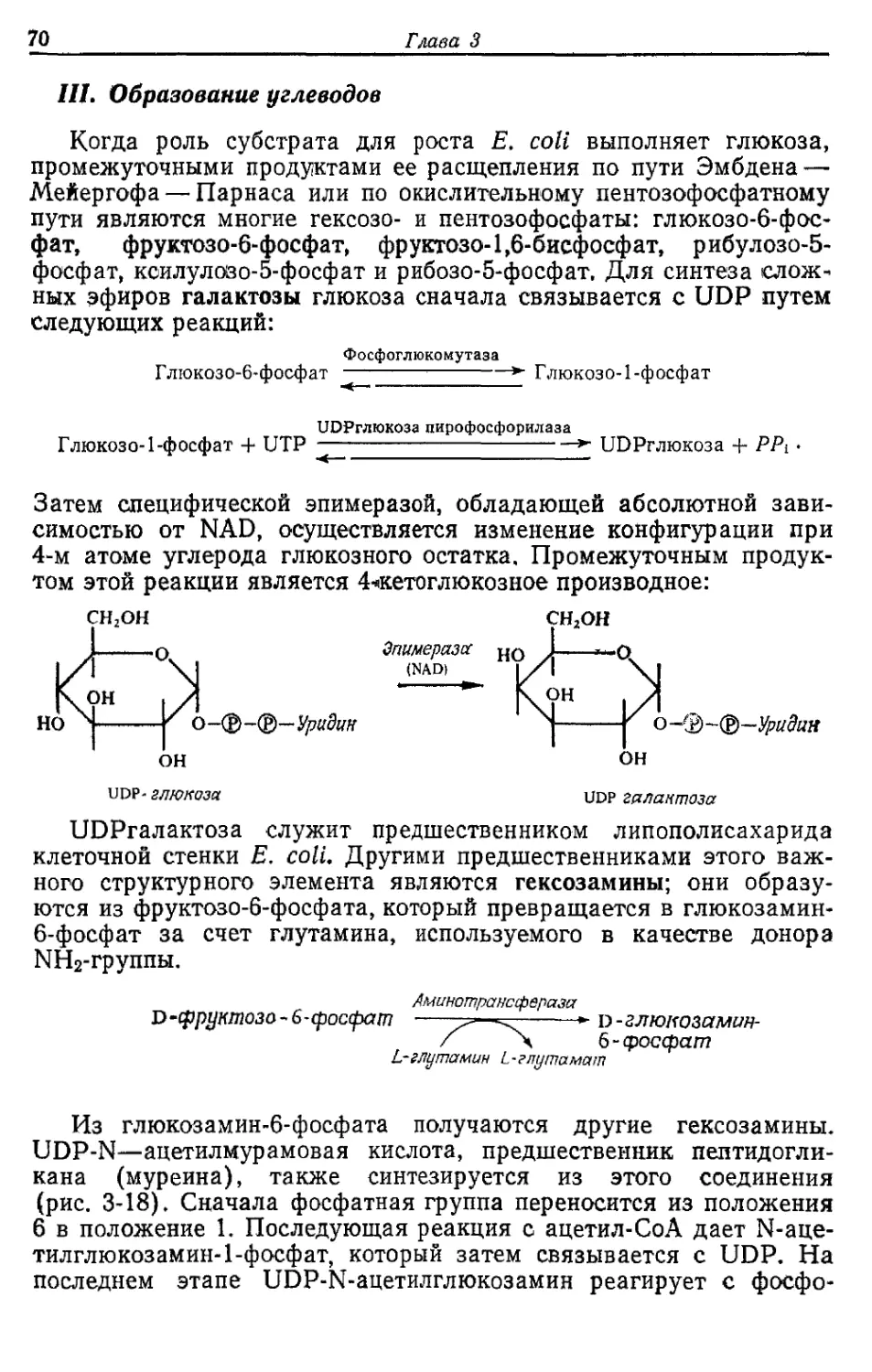
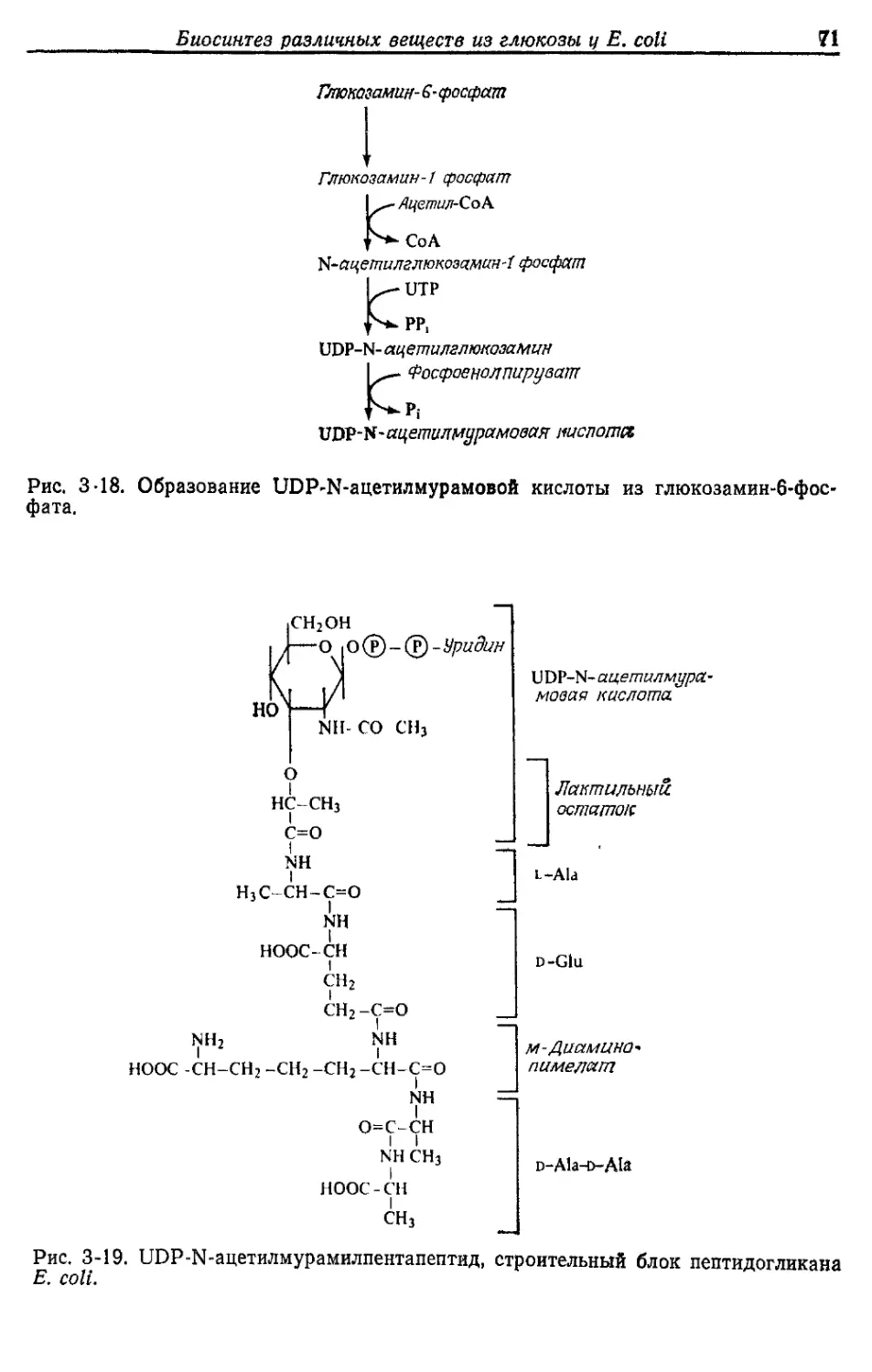
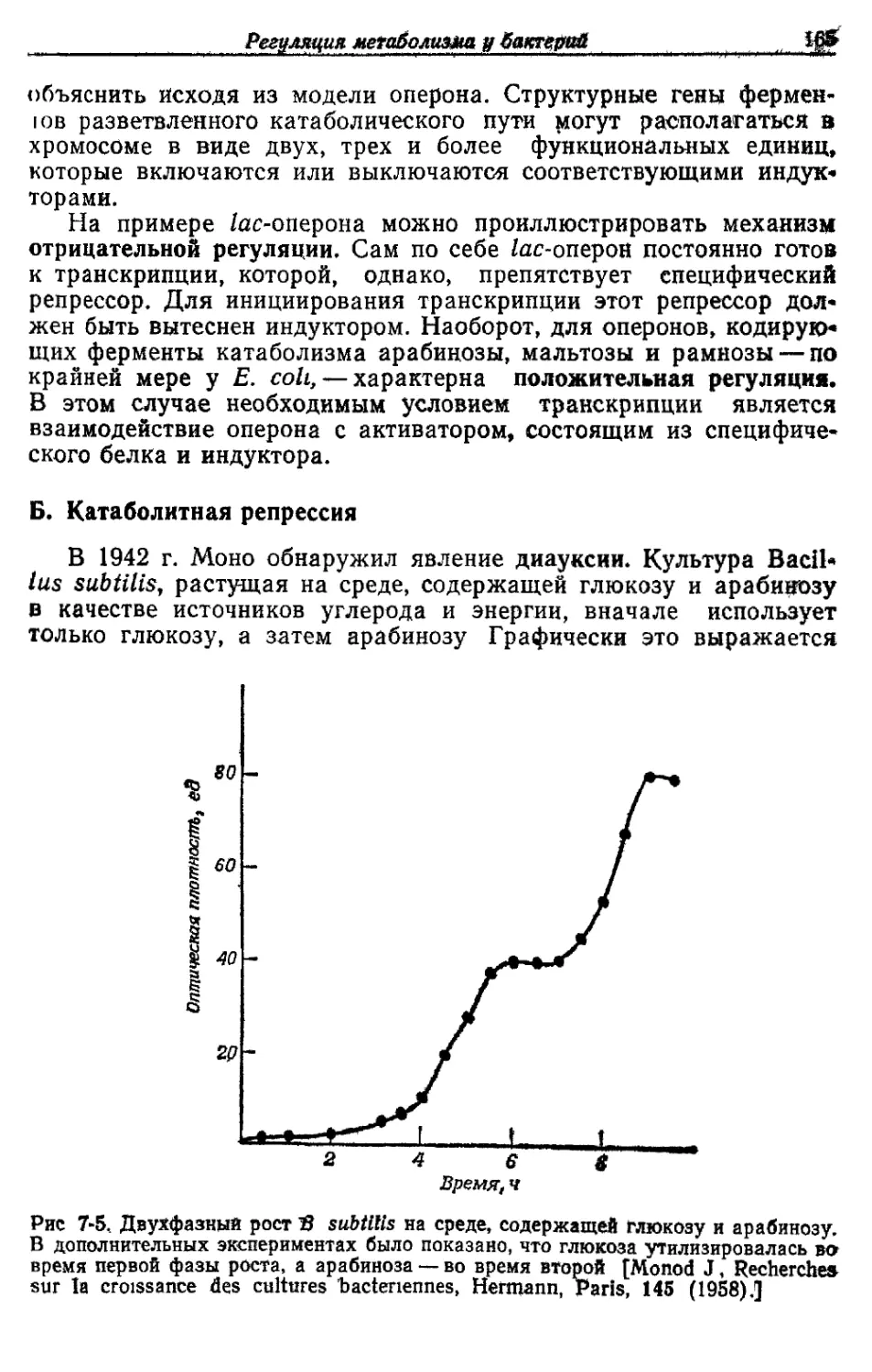
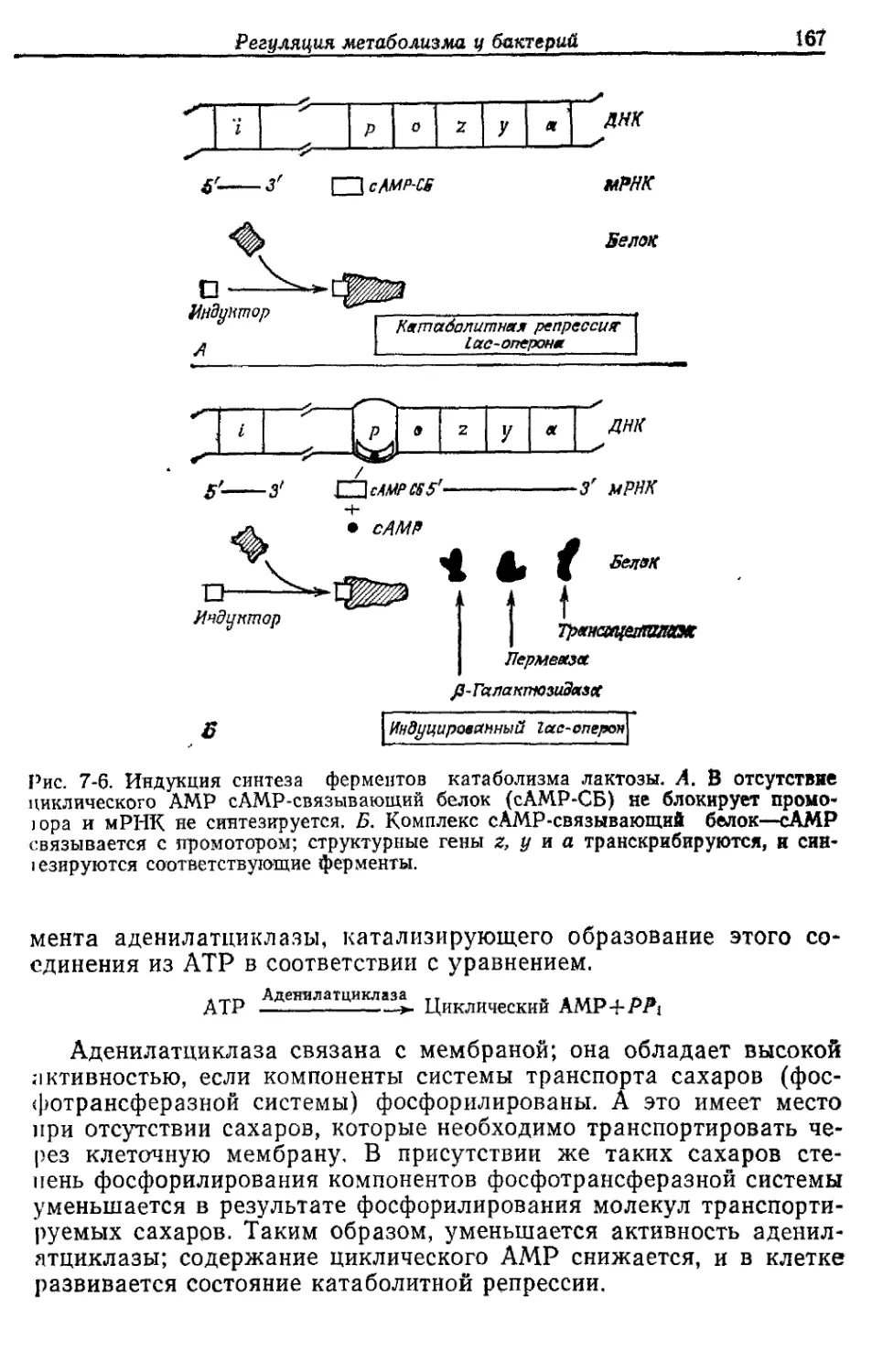
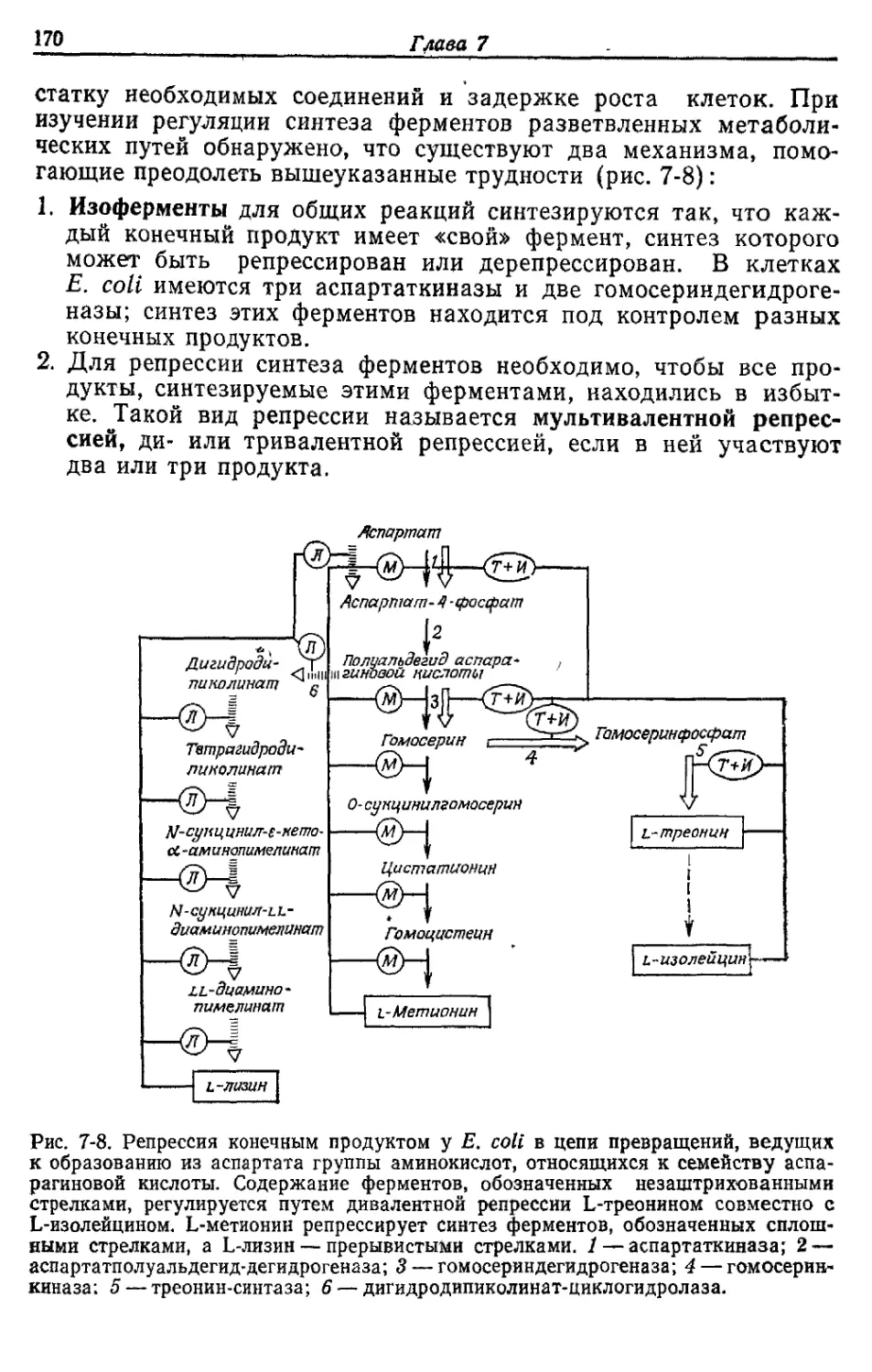
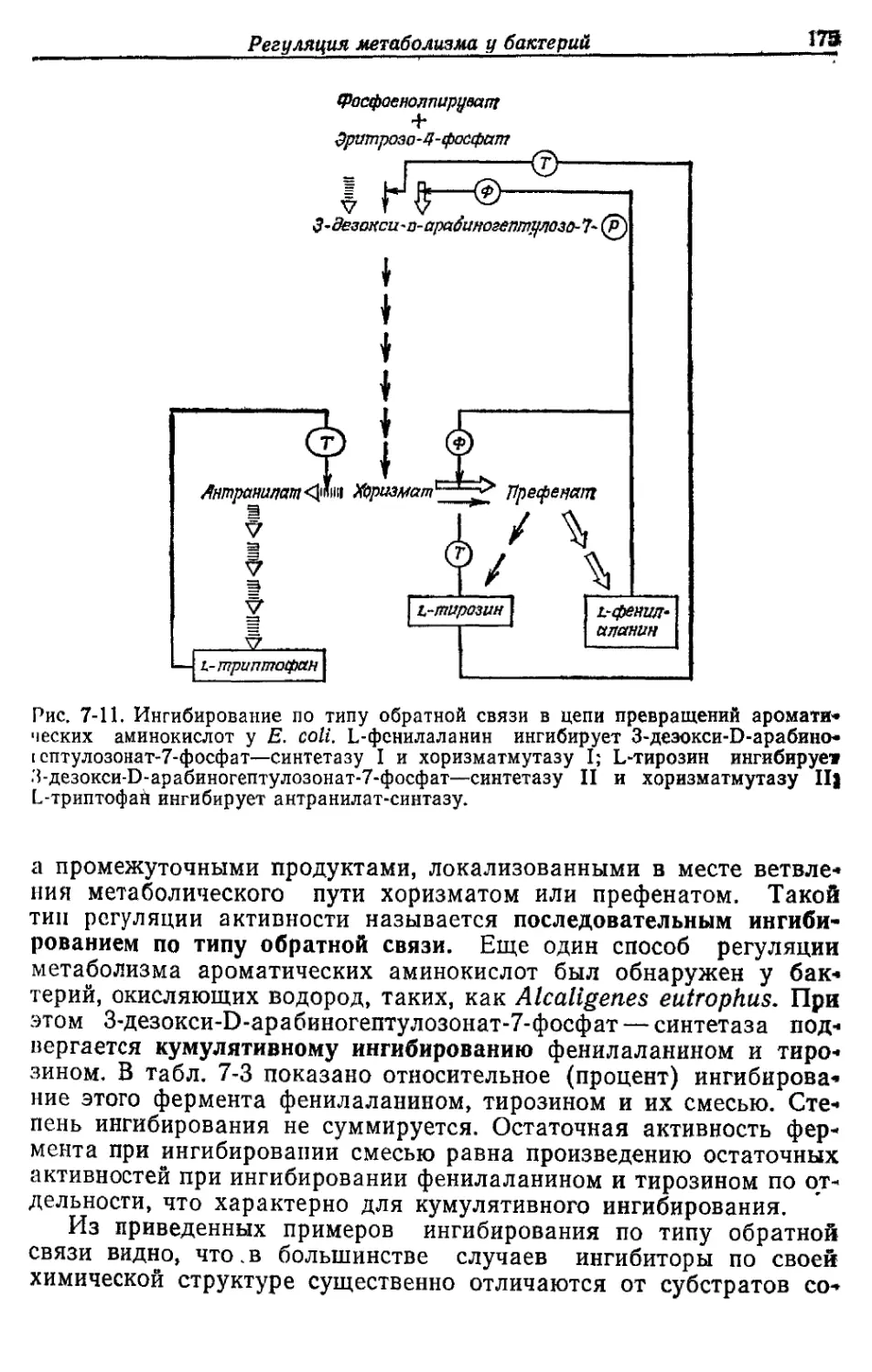
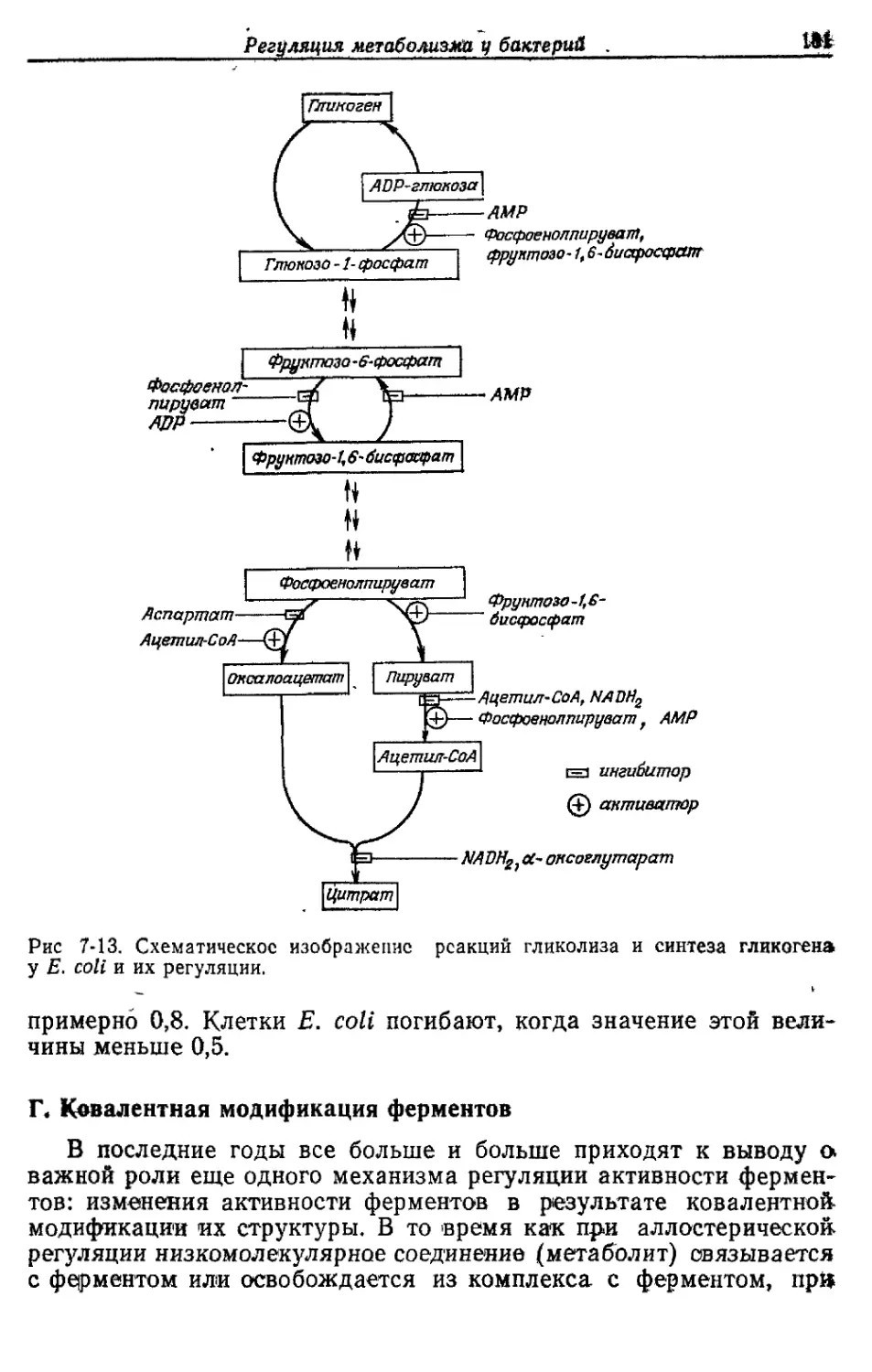
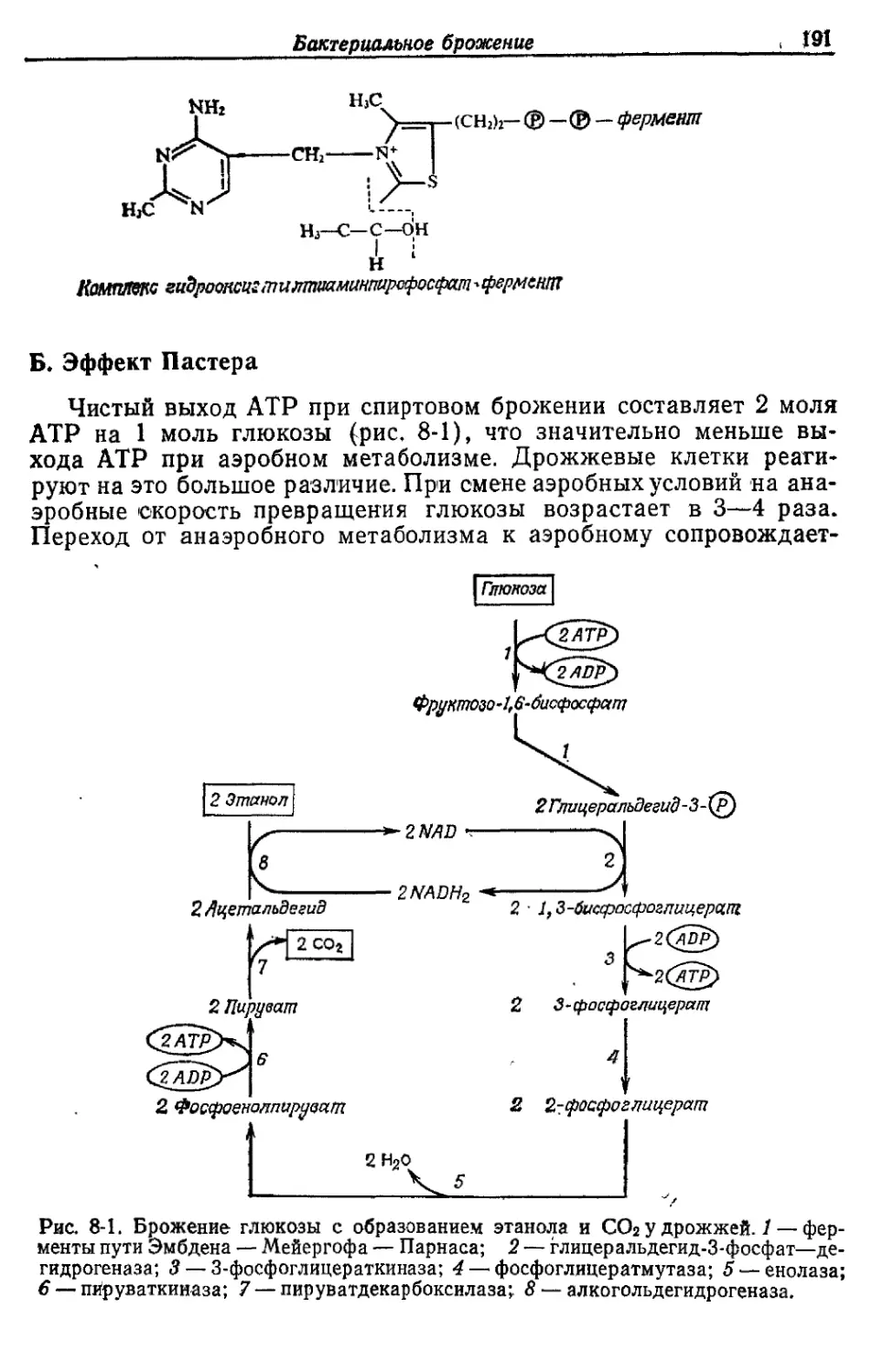
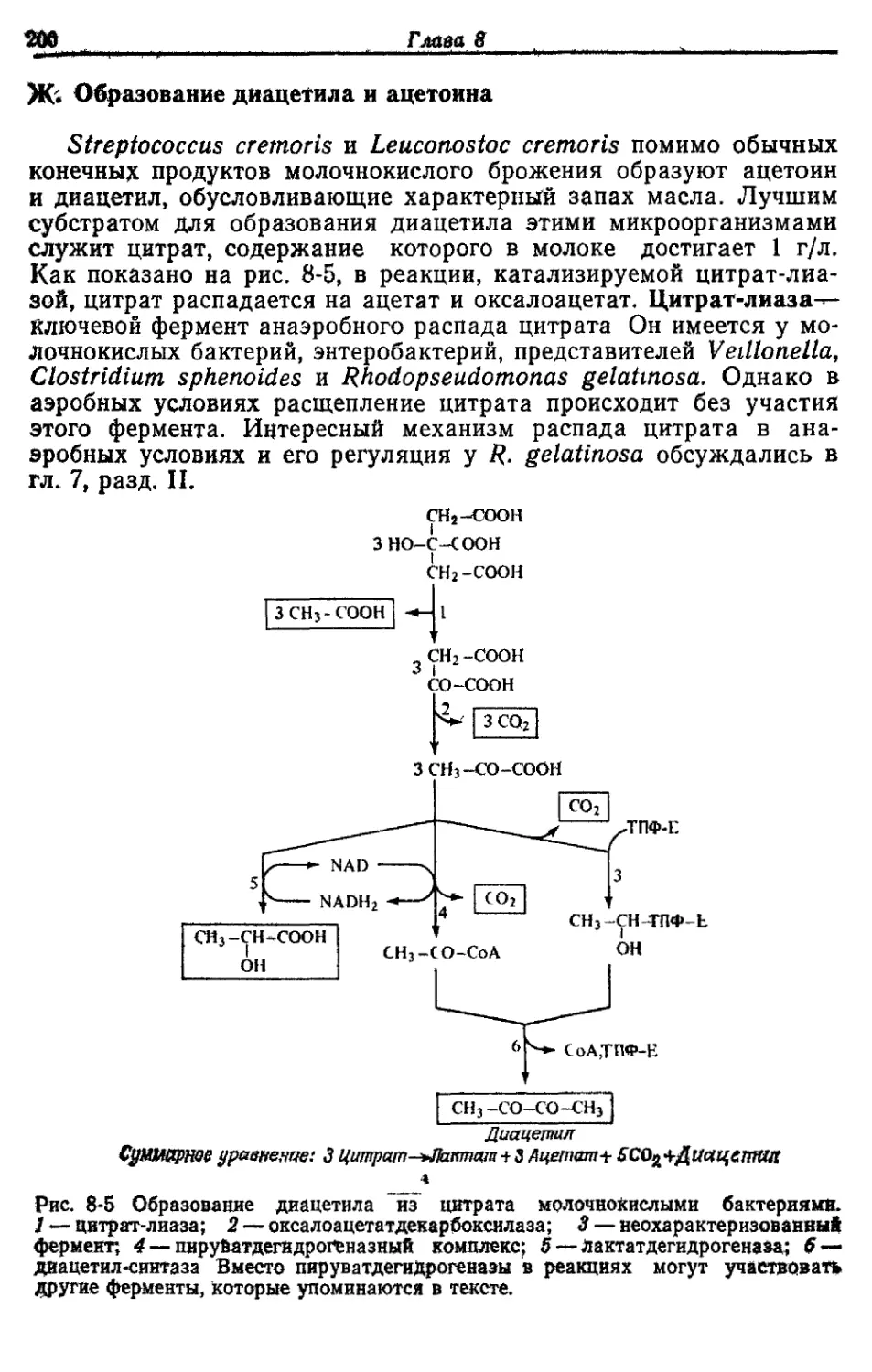
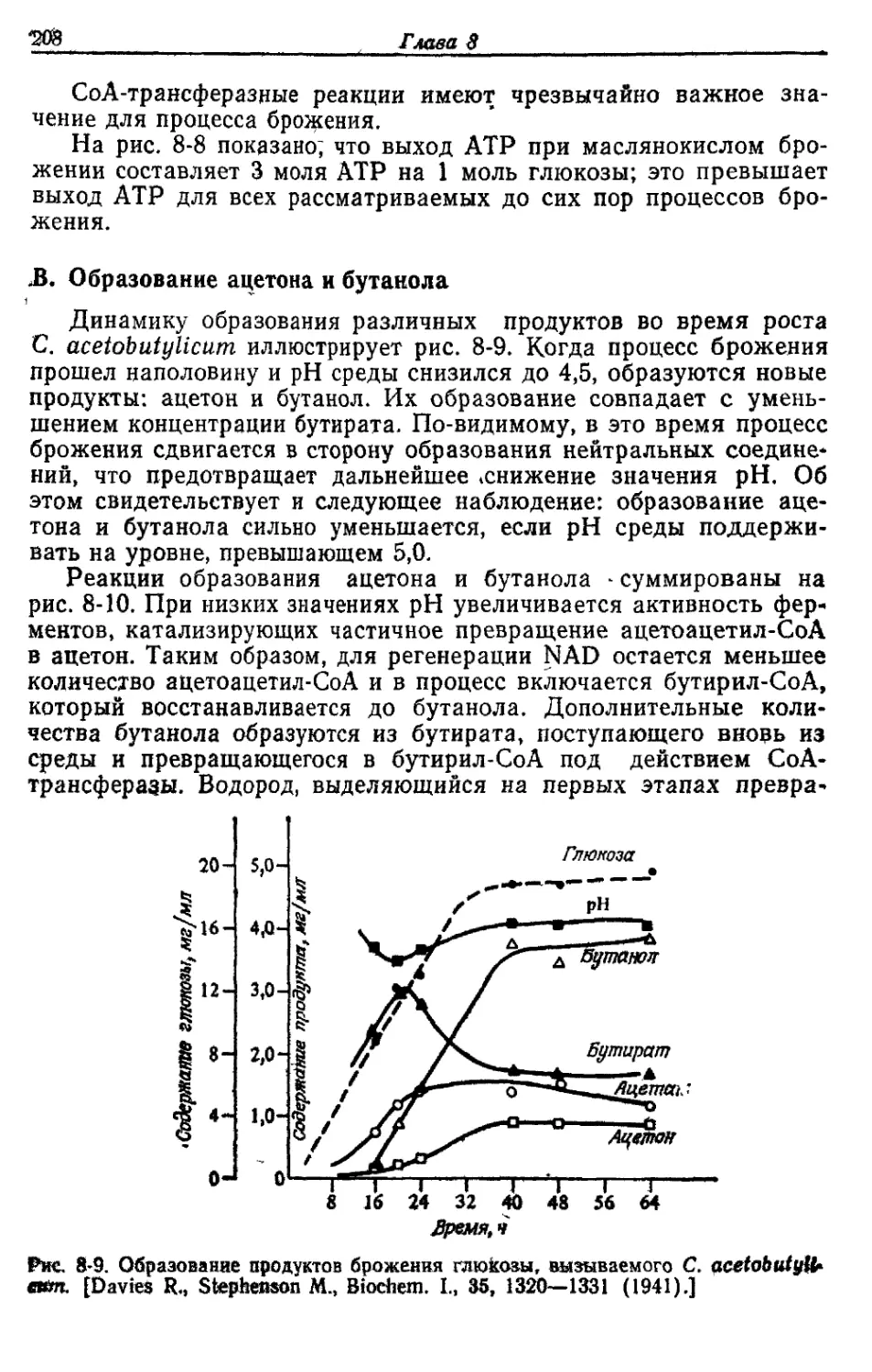
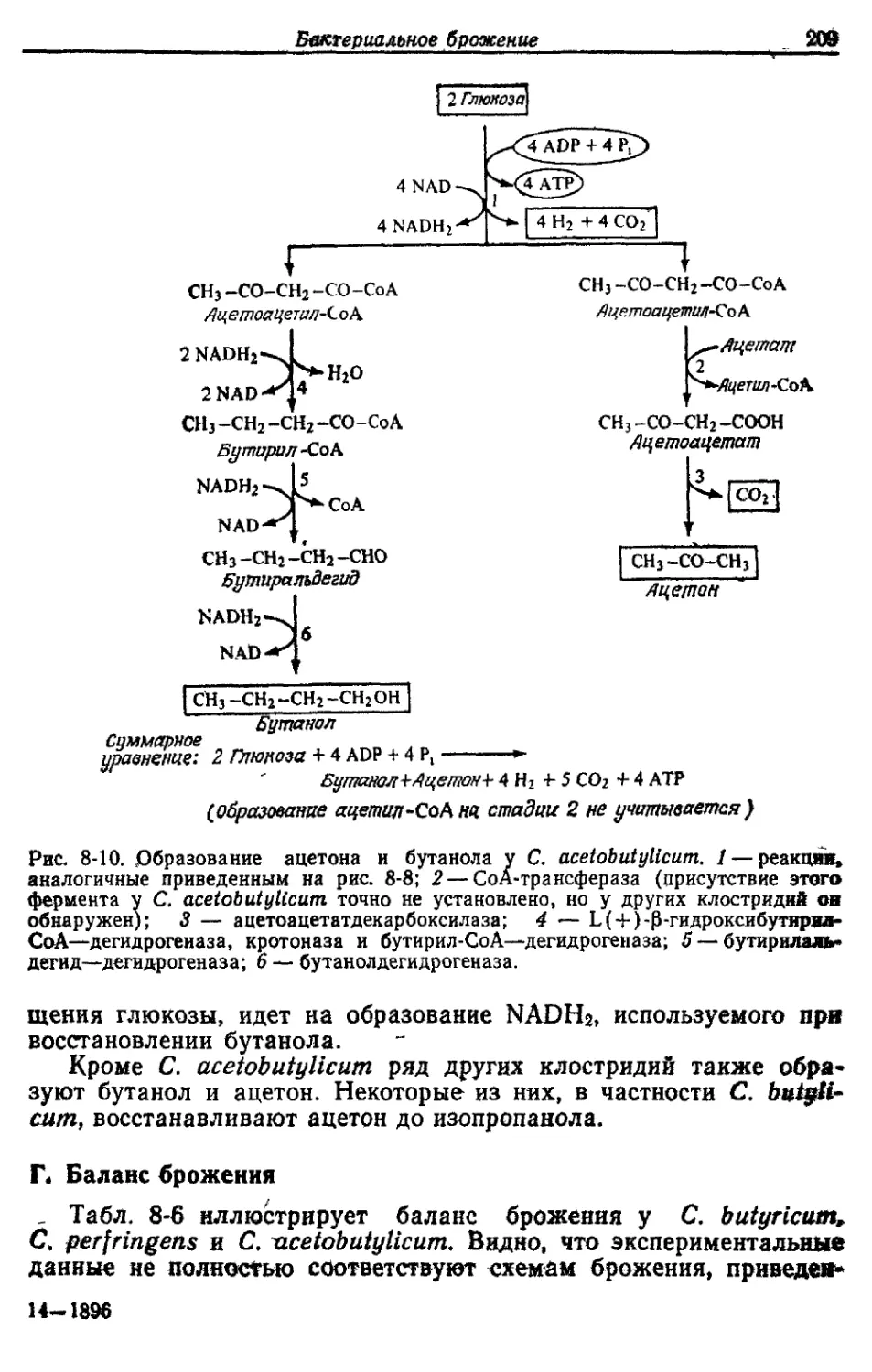
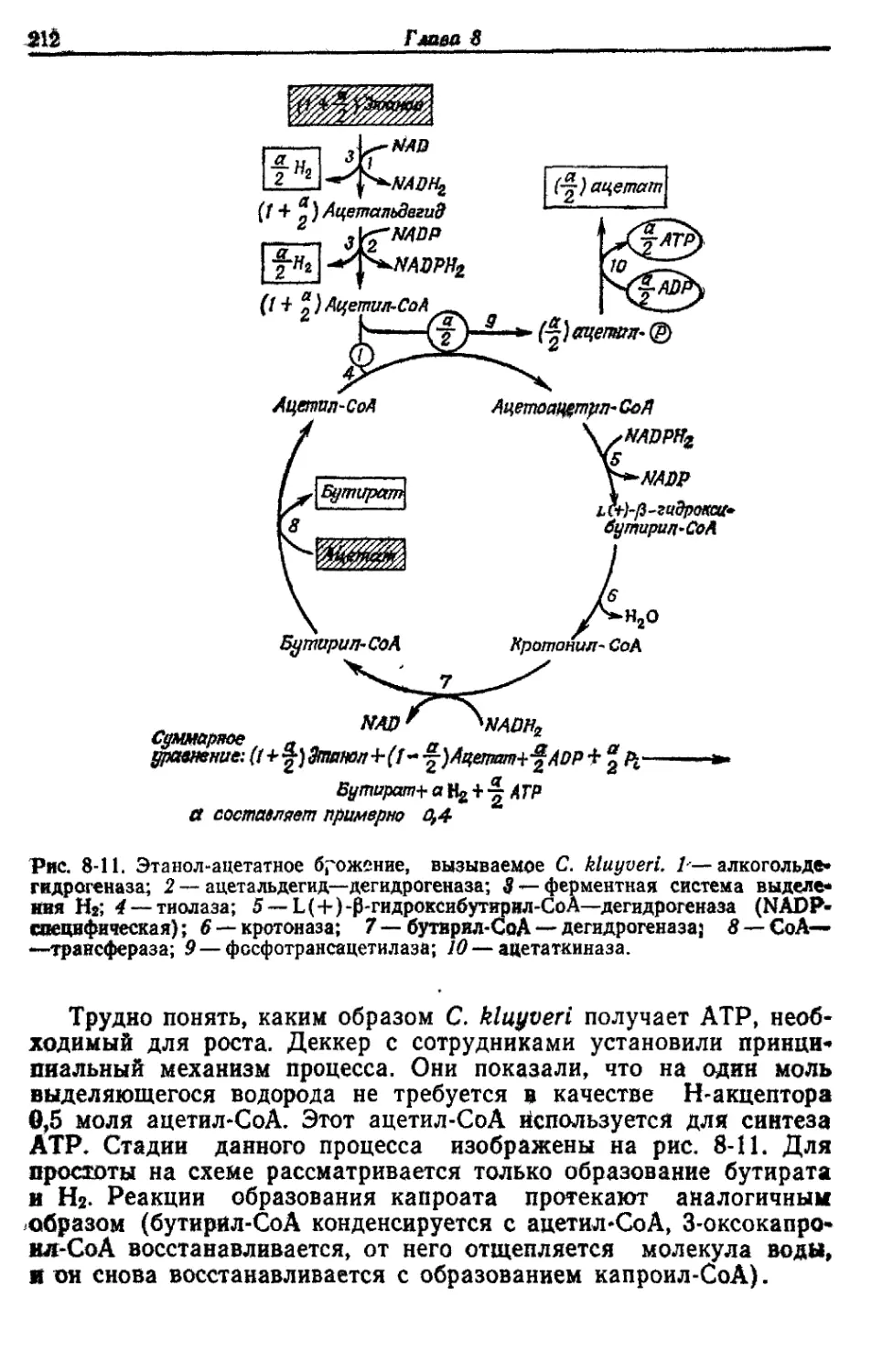
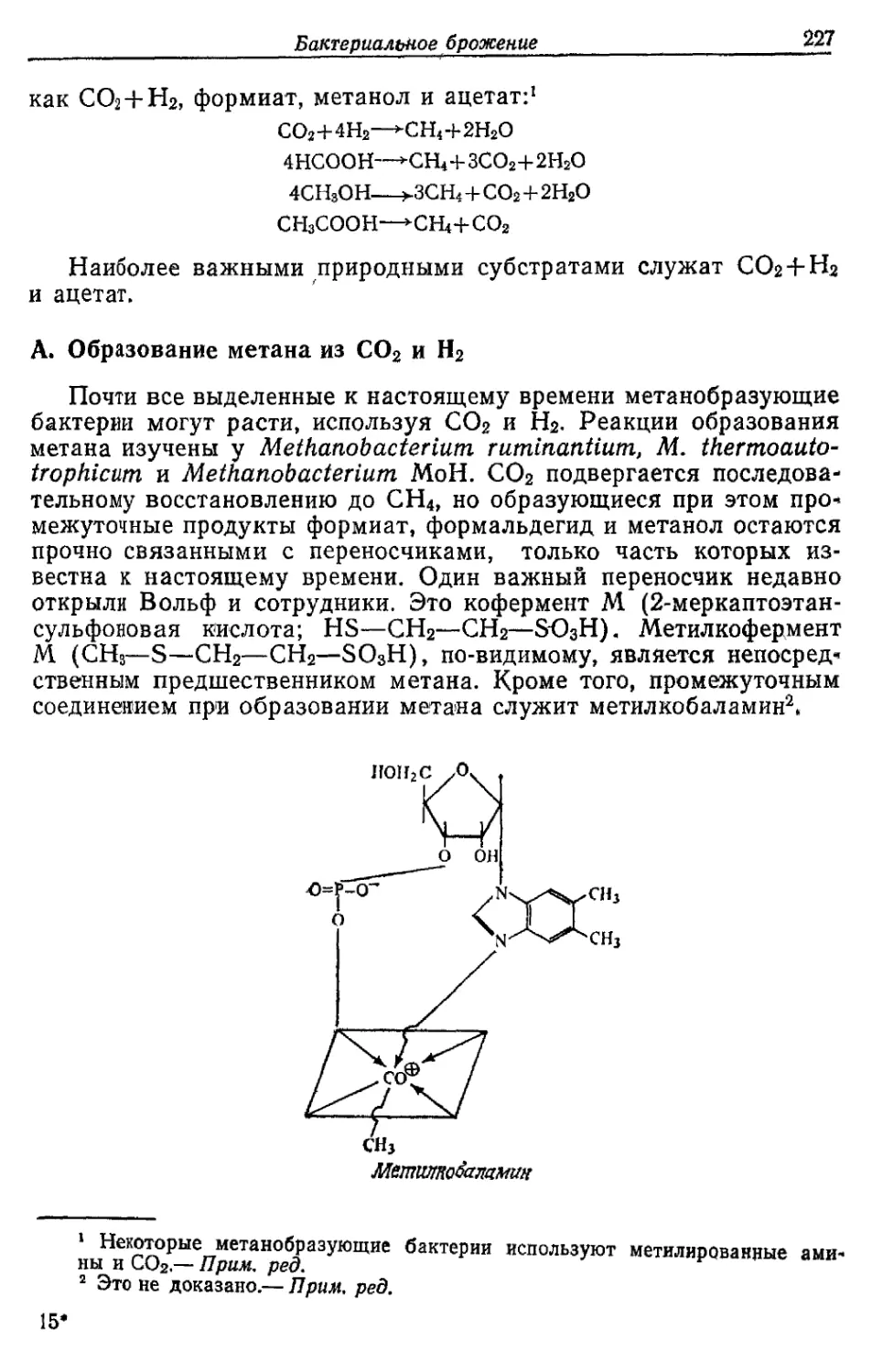
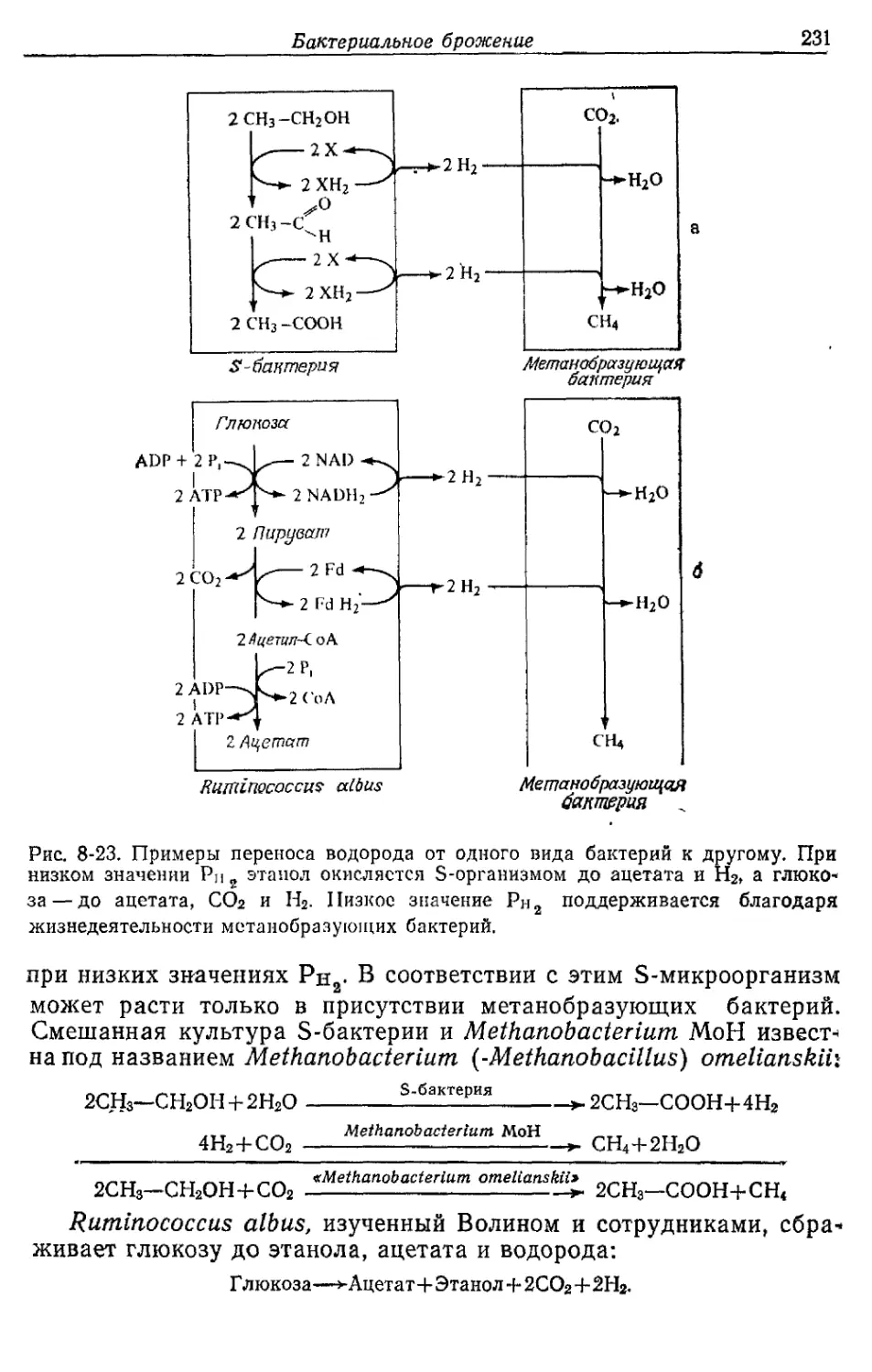
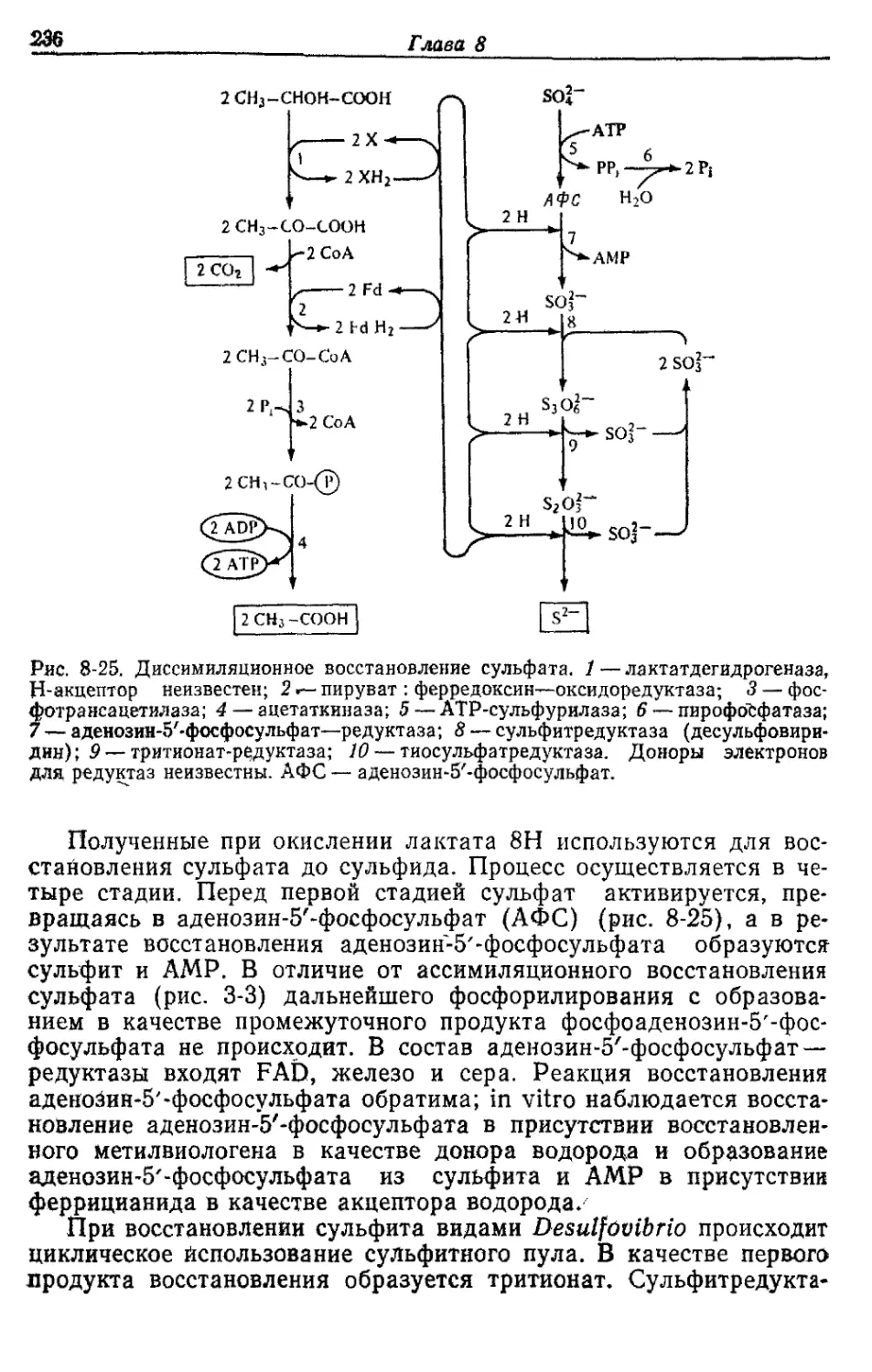
Автор: Готшак Г.
Теги: биология клетки и субклеточных частиц цитология биология микробиология
Год: 1982
Текст
V'^yproTTUJ а л к
Метаболизм
бактерий
Gcrli.ii (1 Gol I •a'Ii.'i I к
Bacterial
Metabolism
Springer-Verlag
New York Heidelberg Berlin
Г. Готтшалк
Метаболизм
бактерий
Перевод с английского
канд. биол. наук Г. П. МИРОШНИЧЕНКО
и Т. Ю. ПЕРЕСЛЕНИ
под редакцией
проф. Е. Н. КОНДРАТЬЕВОЙ
Москва «Мир» 1982
УДК 576.8 Ь 577.1
В книге известного ученого из ФРГ Г. Готтшалка рассмотрены
типы питания микроорганизмов, пути превращения углеводов, угле-
водородов, аминокислот, органических кислот и других соединений,
ассимиляция молекулярного азота, особенности обмена веществ у
гетеротрофных и хемолитоавтотрофных и фототрофных бактерий.
Эти данные имеют большое значение для практического использова-
ния бактерий в сельском хозяйстве и промышленности.
Предназначена для микробиологов, биохимиков, работников мик-
робиологической промышленности, преподавателей, аспирантов и
студентов университетов, медицинских и сельскохозяйственных
вузов.
Редакция литературы по биологии
2003000000
21007—116 ,
Г 041(01)—82 ,,6—82’ ч- 1
© by Springer-Verlag Berlin — Heidelberg 1979.
All Rights Reserved. Authorized translation from
English language edition published by Springer —
Verlag Berlin — Heidelberg — New York.
© Перевод на русский язык, «Мир», 1982.
ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДА
Книга «Метаболизм бактерий», написанная профессором Гёт-
тингенского университета (ФРГ) Г. Готтшалком, широко извест-
ного как специалиста в области биохимии микроорганизмов, осо-
бенно анаэробов, охватывает важнейшие сведения об энергетиче-
ских и биосинтетических процессах у разных бактерий, характери-
зующихся в этом плане поразительным разнообразием.
Наиболее подробно освещаются особенности метаболизма
Escherichia coli — излюбленного объекта многих микробиологиче-
ских, биохимических и генетических исследований. На примере
этой бактерии наглядно показано, какими широкими возможностя-
ми в отношении путей превращения органических соединений мо-
жет обладать даже один вид микроорганизма. Разбираются также
особенности метаболизма других гетеротрофных бактерий, способ-
ных использовать для роста разные органические соединения, на-
чиная от полимерных и кончая одноуглеродными.
Интересен раздел, посвященный анаэробным бактериям, осу-
ществляющим разные типы брожения и способным к так назы-
ваемому анаэробному дыханию, ведущему к образованию метана,
сероводорода и других продуктов обмена, накапливающихся в
среде. Такие микроорганизмы в настоящее время привлекают к
себе большое внимание в связи с рядом проблем фундаменталь-
ного и прикладного значения. В книге приводятся важнейшие дан-
ные о метаболизме хемолитоавтотрофных и фототрофных бакте-
рий, а также о механизме азотфиксации. Кроме того, рассматри-
ваются существующие у бактерий принципы регуляции биохими-
ческих процессов на разных уровнях.
Таким образом, несмотря на небольшой объем, ,книга дает
представление о метаболизме разных групп бактерий, знакомя
читателя с новейшими литературными сведениями и данными, по-
лученными самим автором. Материал изложен просто и в то же
время, на высоком научном уровне. Его восприятие значительно
облегчается большим количеством иллюстраций, представленных
главным образом в виде схем.
Книга полезна не только для микробиологов, но для специа-
листов других областей науки, а также практических работников,
чьи интересы связаны с исследованием микроорганизмов.
Е. Н. Кондратьева
Посвящается Элен
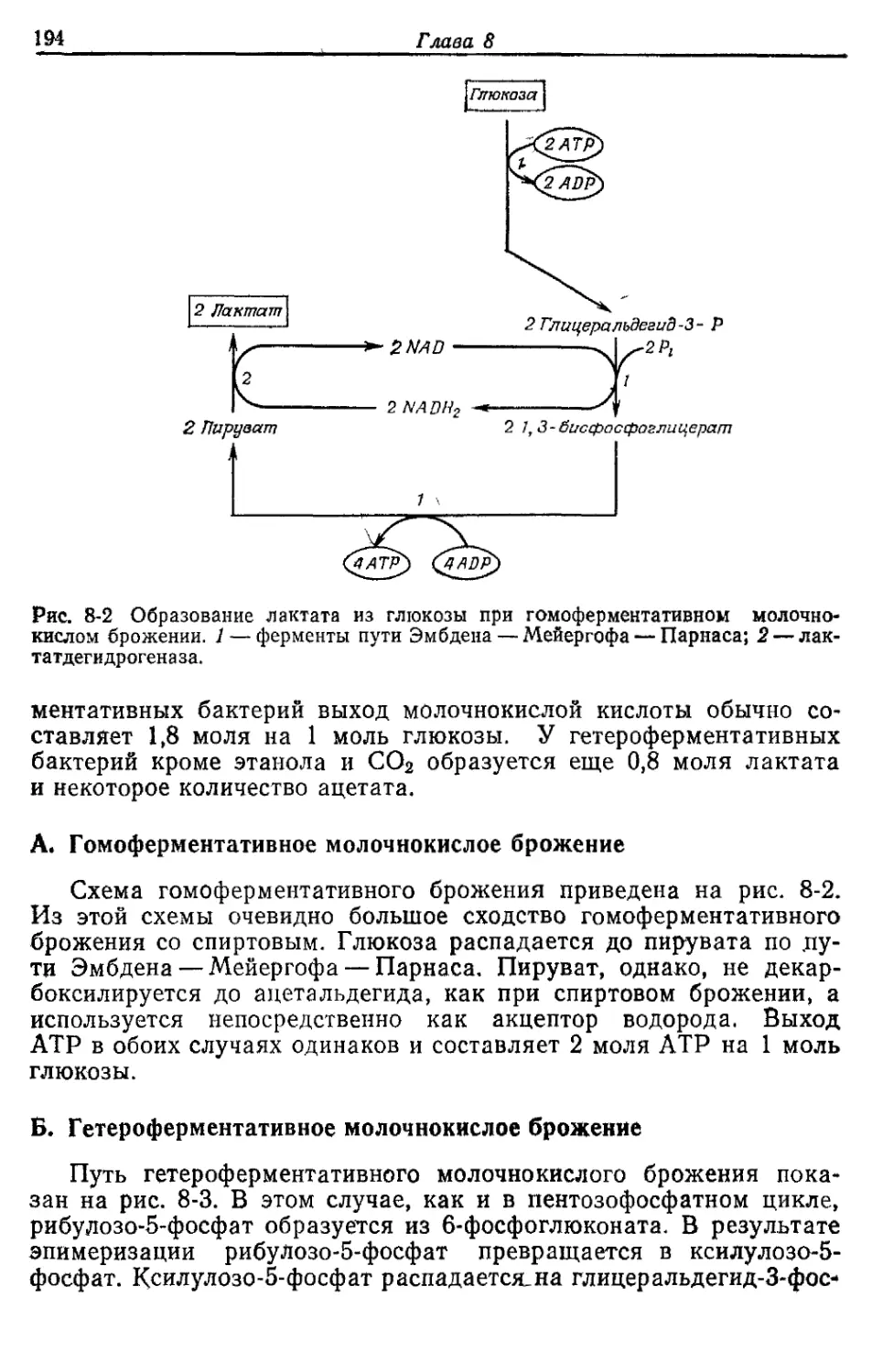
ПРЕДИСЛОВИЕ
Эта книга написана для студентов, слушающих курс лекций
по метаболизму бактерий. Однако я надеюсь, что она сможет быть
использована также в качестве пособия при преподавании или в
качестве своего рода обзора по специальным вопросам обмена ве-
ществ у бактерий.
Содержание книги, ее концепцию определил мой опыт препо-
давания метаболизма бактерий. В первых главах на примере
Е. coli обсуждаются основные реакции энергетического обмена и
биосинтеза. Далее в общих чертах рассматриваются различные
пути обмена веществ у аэробных бактерий. После краткого опи-
сания механизмов регуляции количества ферментов и их активно-
сти в бактериальной клетке обсуждаются особенности фермента-
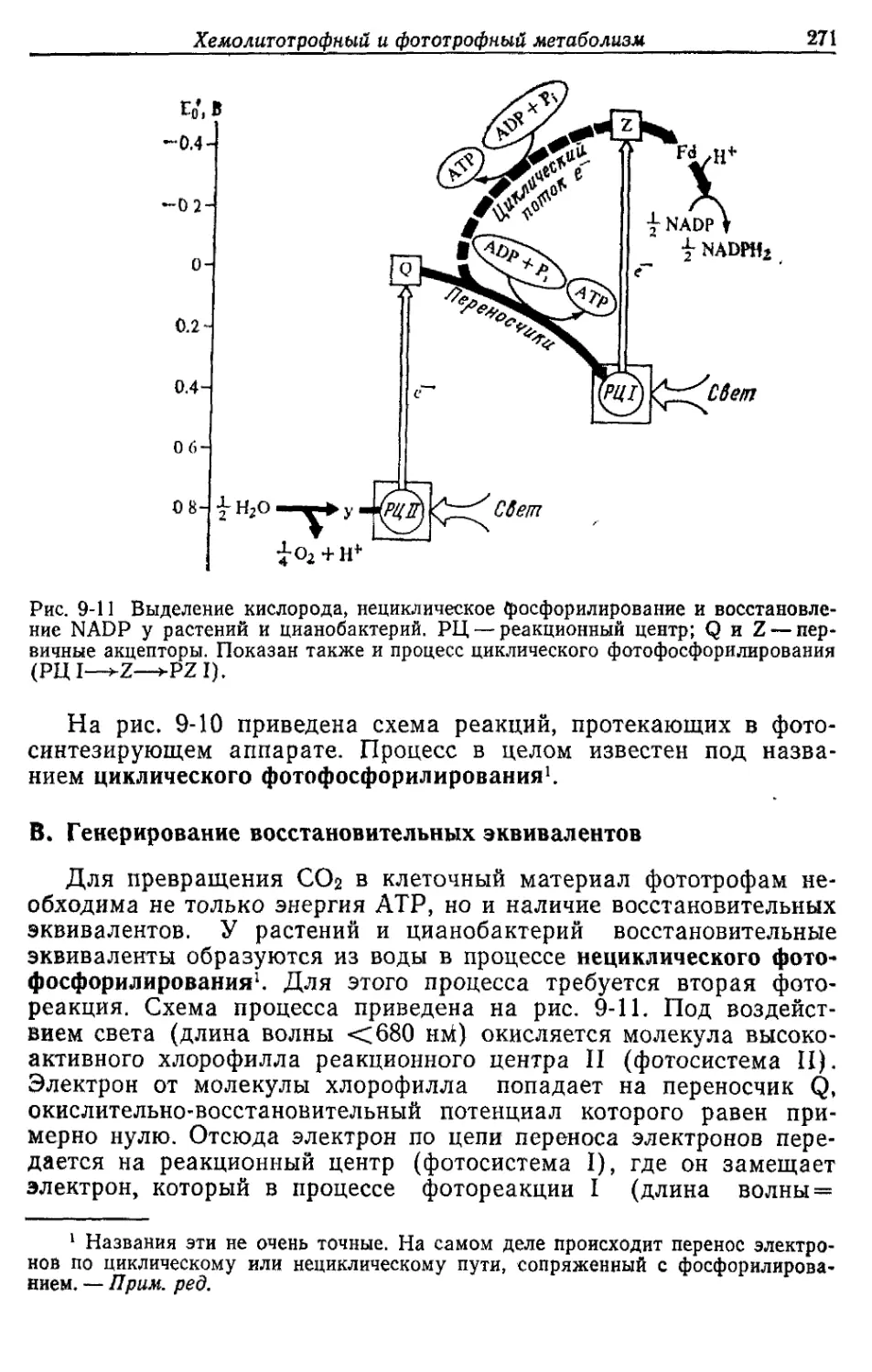
тивного, хемолитотрофного и фототрофного типов метаболизма.
И, наконец, последняя глава посвящена фиксации азота. Всюду
при изложении материала я старался не только описать метабо-
лические пути и ферментативные реакции, но также дать пред-
ставление о физиологии микроорганизмов, для которых характер-
ны эти реакции.
Необходимо сделать два замечания по поводу формул, исполь-
зуемых в этой книге. Вместо названий органических кислот обыч-
но употребляются более короткие названия соответствующих со-
лей (формиат для муравьиной кислоты, пируват для пировино-
градной кислоты и т. п.). Однако на схемах и рисунках приводятся
формулы свободных кислот. Кроме того, следует отметить, что,
вопреки принятой номенклатуре, для восстановленных никотина-
мидадениндинуклеотида и никотинамидадениндинуклеотидфосфата
используются соответственно сокращенные обозначения NADH2 и
NADPH2, а не NAD и NADH. Эти два соединения являются пере-
носчиками электронов, и такое обозначение упрощает запись окис-
лительно-восстановительных реакций, протекающих с их участием.
Я весьма признателен Джоан Мэйси, Линии Квонт, Яну Ан-
дрисену и Питеру Хиллмеру за чтение рукописи, критические за-
мечания и советы и благодарен Юте Квонт за перепечатку руко-
писи и за неоценимую помощь при составлении предметного ука-
зателя и подготовке рисунков. Наконец, я приношу благодарность
издателям за их терпение, охотно предоставляющуюся помощь и
сотрудничество.
Герхард Готтшалк.
Гёттинген, 1978
1 лава 1
ПИТАНИЕ БАКТЕРИЙ
Бактерии, как и другие организмы, нуждаются для своего рос-
та в определенных питательных веществах. В состав таких пита-
тельных веществ должны входить все те химические элементы,
которые необходимы для построения клеточного материала, для
активности ферментов и для работы транспортных систем. Кроме
того, питательные вещества должны поставлять организму мате-
риал, используемый для генерирования биологически полезной
энергии.
I. Главные и минорные биоэлементы
Только небольшое число элементов периодической системы тре-
буется организмам в относительно высоких концентрациях
(>10~4 М). Это десять главных биологических элементов, кото-
рые наряду с некоторыми из выполняемых ими функций приведе-
ны в табл. 1-1. Углерод, кислород, водород и азот — основные ком-
поненты органических соединений, содержащихся в тканях раз-
личных организмов. Сера требуется для синтеза аминокислот
цистеина и метионина и некоторых коферментов. Фосфор входит
в состав нуклеиновых кислот, фосфолипидов, тейхоевых кислот и
таких нуклеотидов, как ATP, GTP, NAD и FAD. Остальные четы-
ре главных биоэлемента — это ионы металлов, используемые в ка-
честве кофакторов ферментов, а также в качестве компонентов
металлокомплексов. Так, например, большинство биоактивных
фосфорных эфиров находится в клетках в виде комплексов с маг-
нием. Фосфолипопротеиды клеточной стенки бактерий также об-
разуют хелатные комплексы с ионами магния.
Экзоферменты, такие, как амилазы и протеазы, представляют
собой кальцийсодержащие белки, а дипиколинат кальция служит
важным компонентом эндоспор. Ионы двух- и трехвалентного же-
леза входят в состав компонентов электронпереносящей цепи, та-
ких, как цитохромы и железосеропротеиды.
Помимо этих десяти главных биоэлементов микроорганизмам
требуется еще и ряд других элементов, но в малых количествах
(табл. 1-2). Ионы цинка и марганца необходимы всем микроорга-
низмам. Цинк имеет особенно важное значение, поскольку РНК-
и ДНК-полимеразы относятся к цинкпротеидам. Галлофильным
микроорганизмам требуются высокие концентрации хлористого нат-
8
Глава 1
Таблица 1-1
Десять главных биоэлементов, их источники
и некоторые из выполняемых ими функций у микроорганизмов
Эле-
мент
Источник
Функция в метаболизме
С Органические соединения, СО2 1
® Ог, НгО, органические соедине-
ния, СО2
Н Нг, НгО, органические соеди- '
нения
N NHi+, NO3~, N2, органические
соединения
S SO42-, HS_, S°, S2O32-, органи-
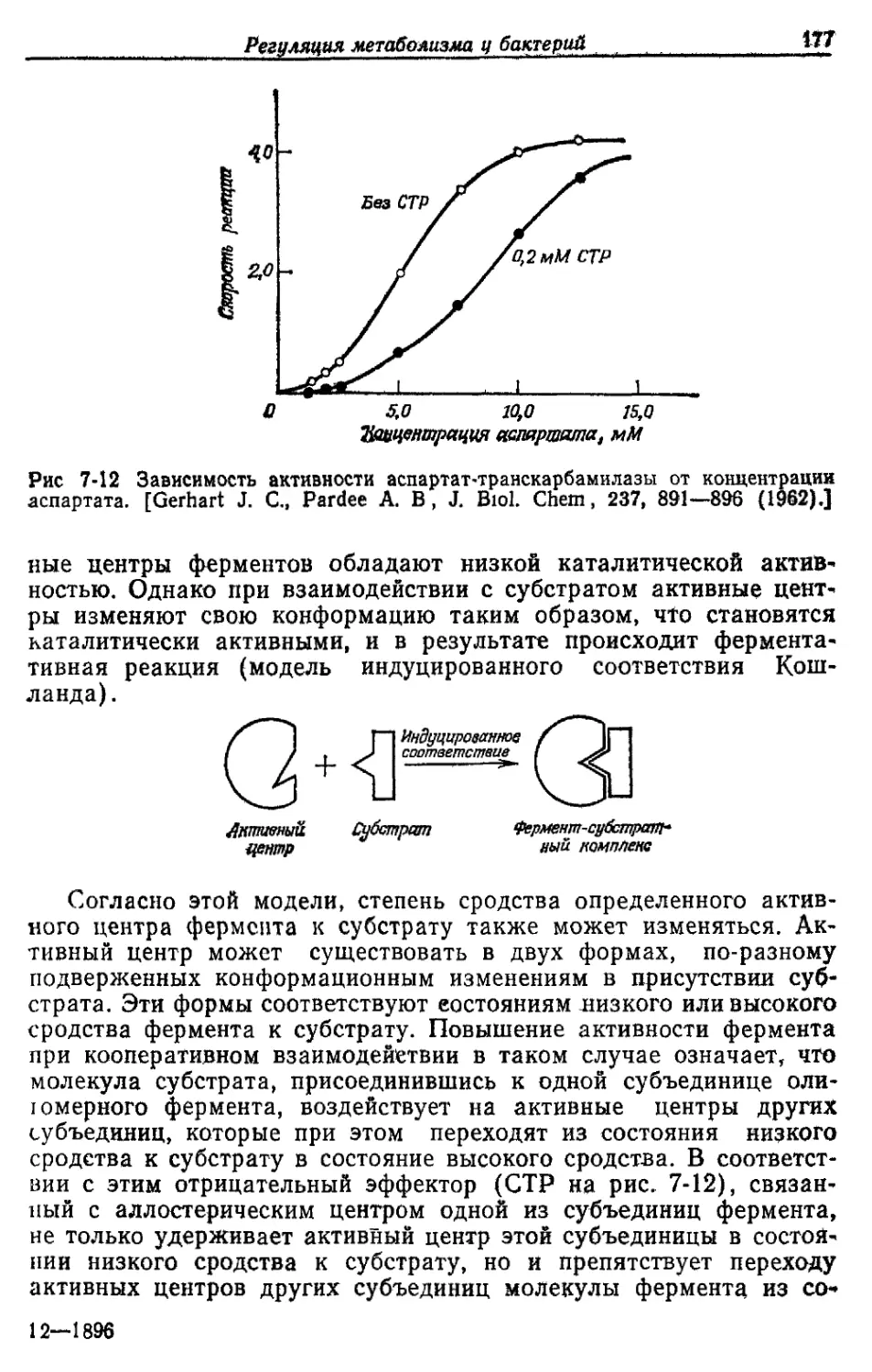
ческие соединения серы
Р НРО42-
к К+
Mg Mg2+
Са Са2+
Fe Fe2+, Fe3*'
Основные компоненты клеточного ма-
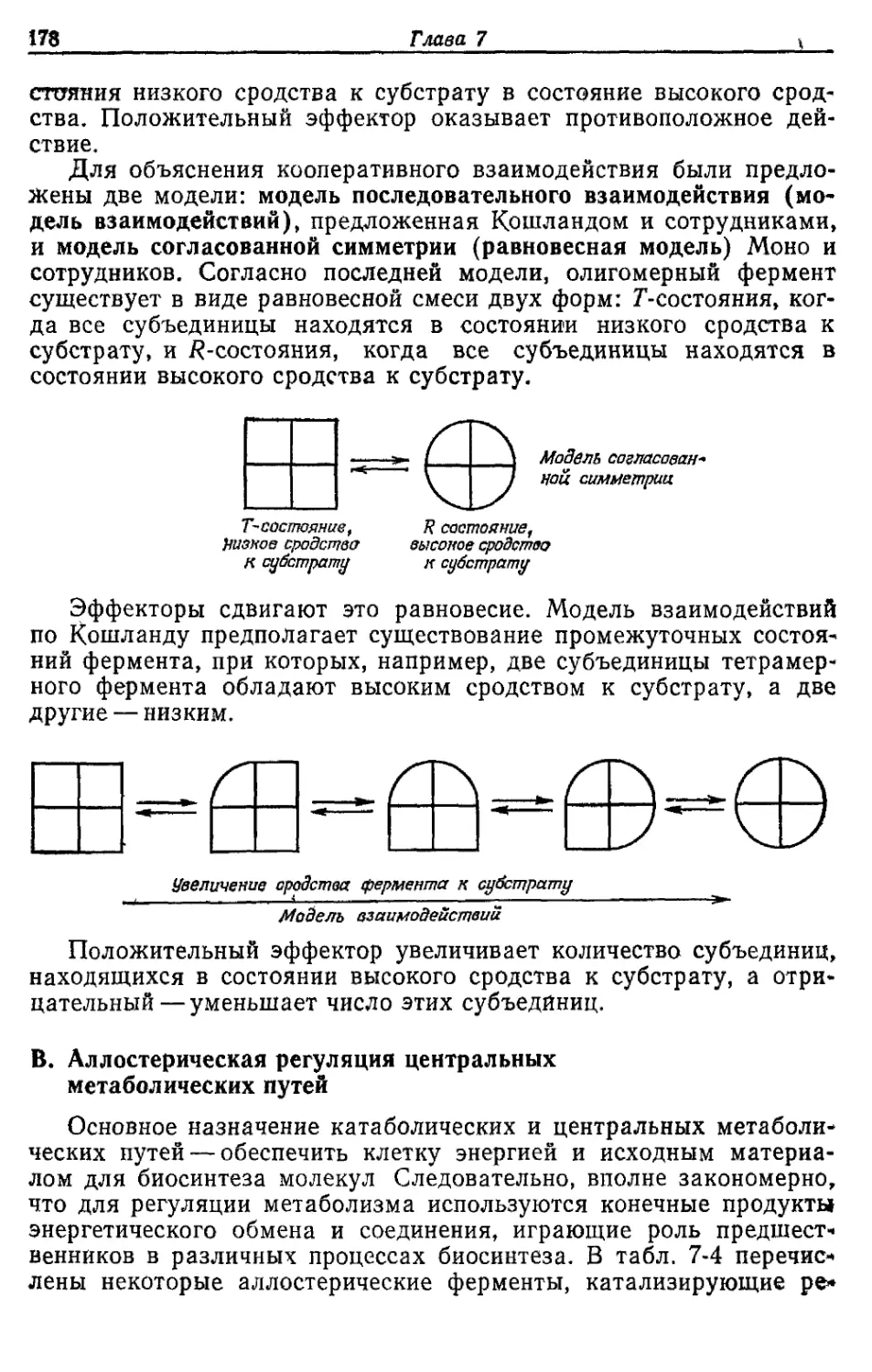
териала клетки
Компонент цистеина, метионина, ти-
аминпирофосфата, кофермента А,
биотина и сс-липоевой кислоты
Компонент нуклеиновых кислот, фос-
фолипидов и нукл'еотидов
Основной неорганический катион в
клетке, кофактор некоторых фер-
ментов
Кофактор многих ферментов (напри-
мер, киназ); присутствует в кле-
точных стенках, мембранах и эфи-
рах фосфорной кислоты
Кофактор ферментов, присутствует
в экзоферментах (в амилазе, про-
теазе) ; Са-дипиколинат является
важным компонентом эндоспор
Содержится в цитохромах, фер-
редоксинах и других железосеро-
протеидах, кофактор ферментов
(некоторые дегидратазы)
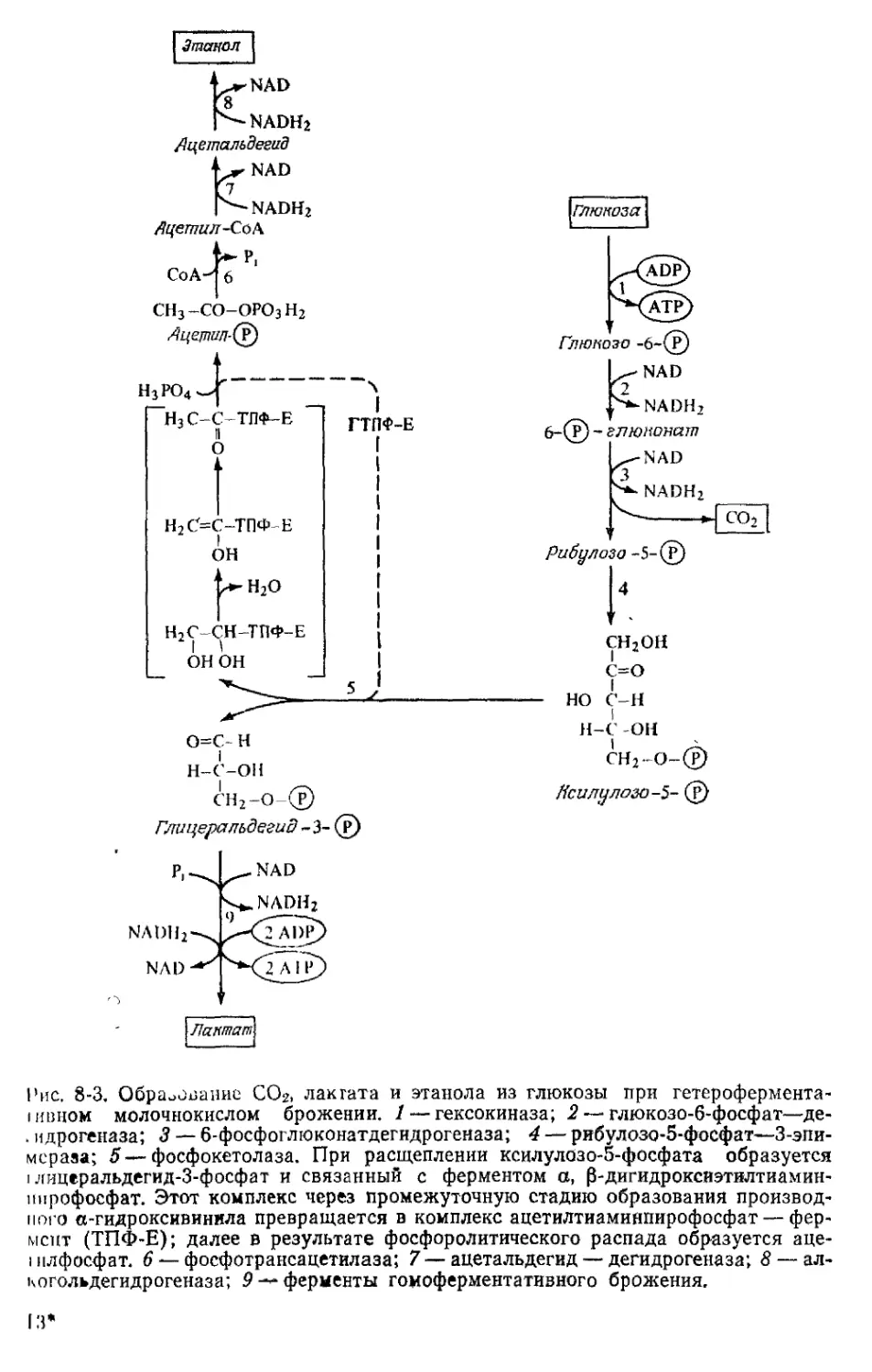
рия. Однако эти организмы составляют исключение. У большин-
ства микроорганизмов потребность в ионах натрия и хлора неве-
лика. Специфические функции могут выполнять и другие металлы,
приведенные в табл. 1-2. Молибденпротеиды играют важную роль
в азотном обмене и в окислении формиата. Ксантиндегидрогеназа
также содержит молибден. Из селенпротеидов, приведенных в
табл. 1-2, глицинредуктаза содержит селен в форме селенцистеина.
Кобальт требуется всем тем микроорганизмам, у которых проте-
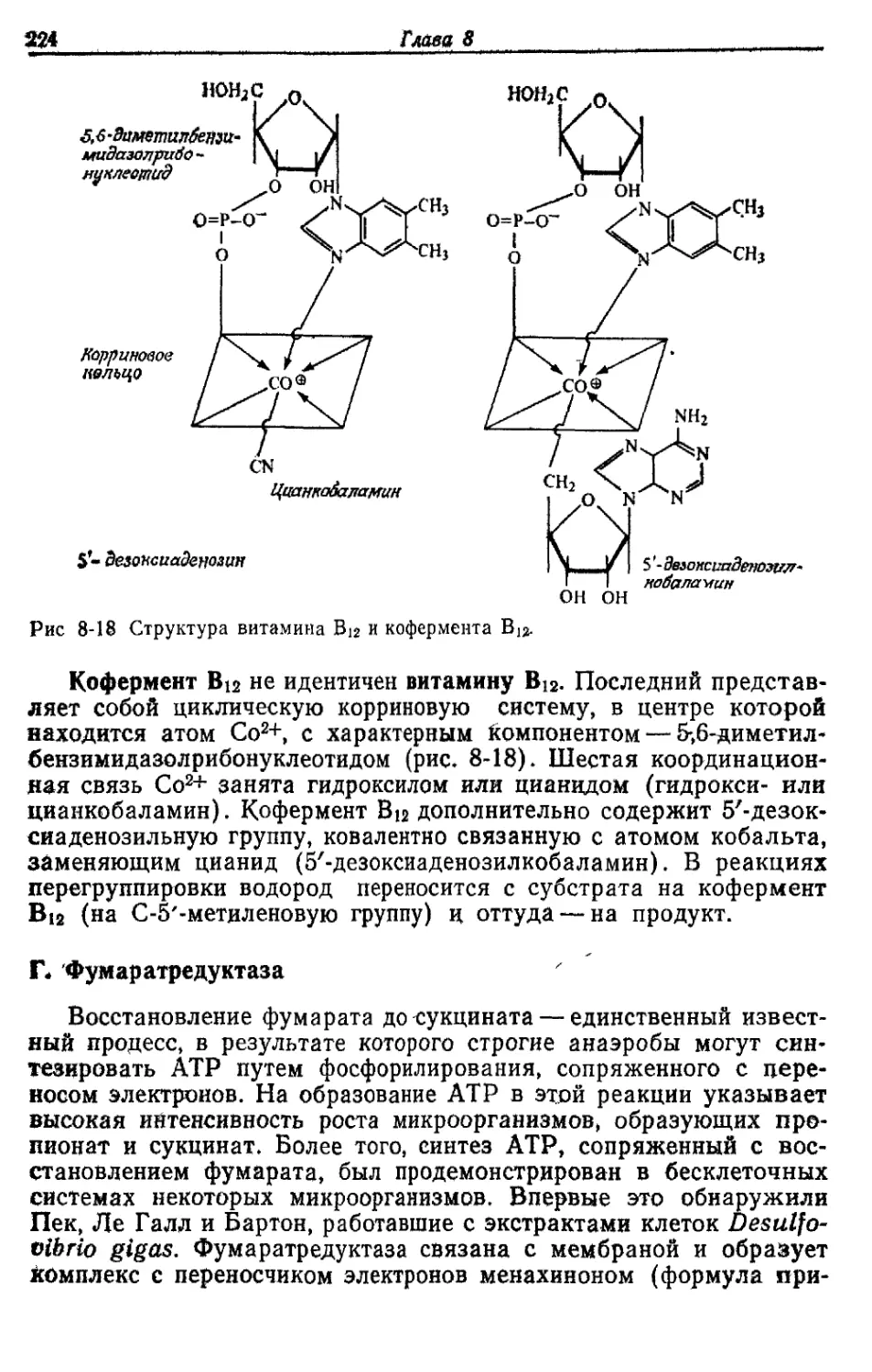
кают реакции, зависимые от витамина В12. Медь присутствует в
ряде ферментов, переносящих электроны от субстратов к кисло-
роду. И наконец, в некоторых редких случаях микроорганизмам
требуются вольфрам и никель.
Питание бактерий
9
Таблица 1-2
Минорные биоэлементы, их источники и некоторые
из выполняемых ими функций у микроорганизмов
Элемент Источник Функция в обмене веществ
Zn Zn2+ Содержится в алкогольдегидрогеназе, ще- лочной фосфатазе, альдолазе, РНК- и ДНК-пол имеразе
Мп Мп2+ Содержится в бактериальной пероксиддис- мутазе; кофактор некоторых ферментов (фосфоенолпируват-карбоксикиназы, цит- рат (те) -синтазы).
Na Na+ I
Cl ( Cl- / Необходимы галофильным бактериям
м® Моо42- Содержится в нитратредуктазе, нитрогена- зе и формиатдегидрогеназе
Se SeO32~ Содержится в глицинредуктазе и формиат- дегидрогеназе
Со Со2+ Содержится в коферменте витамин-В12-фер- ментов (глутаматмутазе, метилмалонил- СоА—мутазе)
Си Cu2+ Содержится в цитохромоксидазе и оксиге- назах
W WO42- Содержится в некоторых формиатдегидро- геназах
Ni Ni2F Содержится в уреазе; требуется для авто- трофного роста водородных бактерий
В природе большинство биологических элементов находится в
виде солей; микроорганизмы их поглощают соответственно в виде
катионов и анионов. Большее разнообразие соединений, исполь-
зуемых микроорганизмами, наблюдается только в отношении пер-
вых пяти элементов, приведенных в табл. 1-1: серы, азота, кис-
лорода, водорода и углерода.
Сера обычно потребляется в виде сульфата, восстанавливается
до уровня сульфида и затем используется для биосинтетических
.Процессов. Однако определенные группы бактерий нуждаются в
восстановленных соединениях серы. Некоторые метанобразующие
бактерии растут только в присутствии сероводорода, используе-
мого в качестве источника серы. Тиобациллы и ряд фототрофных
бактерий нуждаются в сульфиде, элементарной сере или тиосуль-
фате в качестве донора электронов.
Азот требуется в больших количествах, поскольку его содержа-
ние у бактерий составляет примерно 10% (в расчете на сухую
10
Глава 1
биомассу). В природе он встречается в форме аммиака, нитрата,
нитрита, азотсодержащих органических соединений и молекуляр-
ного азота. Предпочтительным источником азота у микроорганиз-
мов служит аммиак, который может использоваться практически
всеми микроорганизмами. Нитрат также используется многими
микроорганизмами, но не всеми Прежде чем включиться в орга-
нические соединения, нитрат должен быть восстановлен до аммиа-
ка Нитрит является продуктом нитрат-нитритного дыхания и ме-
таболической активности Nitrosomonas, а также близких видов.
Ряд микроорганизмов восстанавливает его до аммиака или до N2.
Нитрит, кроме того, может окисляться до нитрата клетками Nitro-
bacter Ряд бактерий способен фиксировать молекулярный азот
и восстанавливать его до аммиака Эта способность обнаружена
только у некоторых прокариот, но не у эукариот. Наконец, мно-
гие микроорганизмы в качестве источника азота используют ор-
ганические соединения Обычно эти соединения разрушаются та-
ким образом, что аммиак освобождается, становясь доступным для
процессов биосинтеза.
Углерод, водород и кислород могут использоваться бактерия-
ми в форме органических и неорганических соединений. К исполь-
зуемым неорганическим соединениям этих элементов относятся
COs, Н2, H2S, NH3, Н2О, О2, NOjjH SO4”. Ни одно из органических
соединений, образующихся в результате жизнедеятельности раз-
личных организмов, на Земле не накапливается. Следовательно,
Можно думать: что все они подвергаются процессам разложения.
Важную роль в разложении этих соединений играют микроорга-
низмы. Многообразие процессов жизнедеятельности у микроор-
ганизмов привело к формулированию «доктрины катаболической
безотказности микробов», согласно которой любое имеющееся в
природе соединение углерода используется каким-либо микробом.
Метаболизм соединений, содержащих углерод, водород или кис-
лород, имеет важное значение не только потому, что эти элементы
являются основными компонентами клетки, но и потому, что эти
соединения служат важными субстратами для получения микро-
организмами энергии.
И. Два основных механизма синтеза АТР
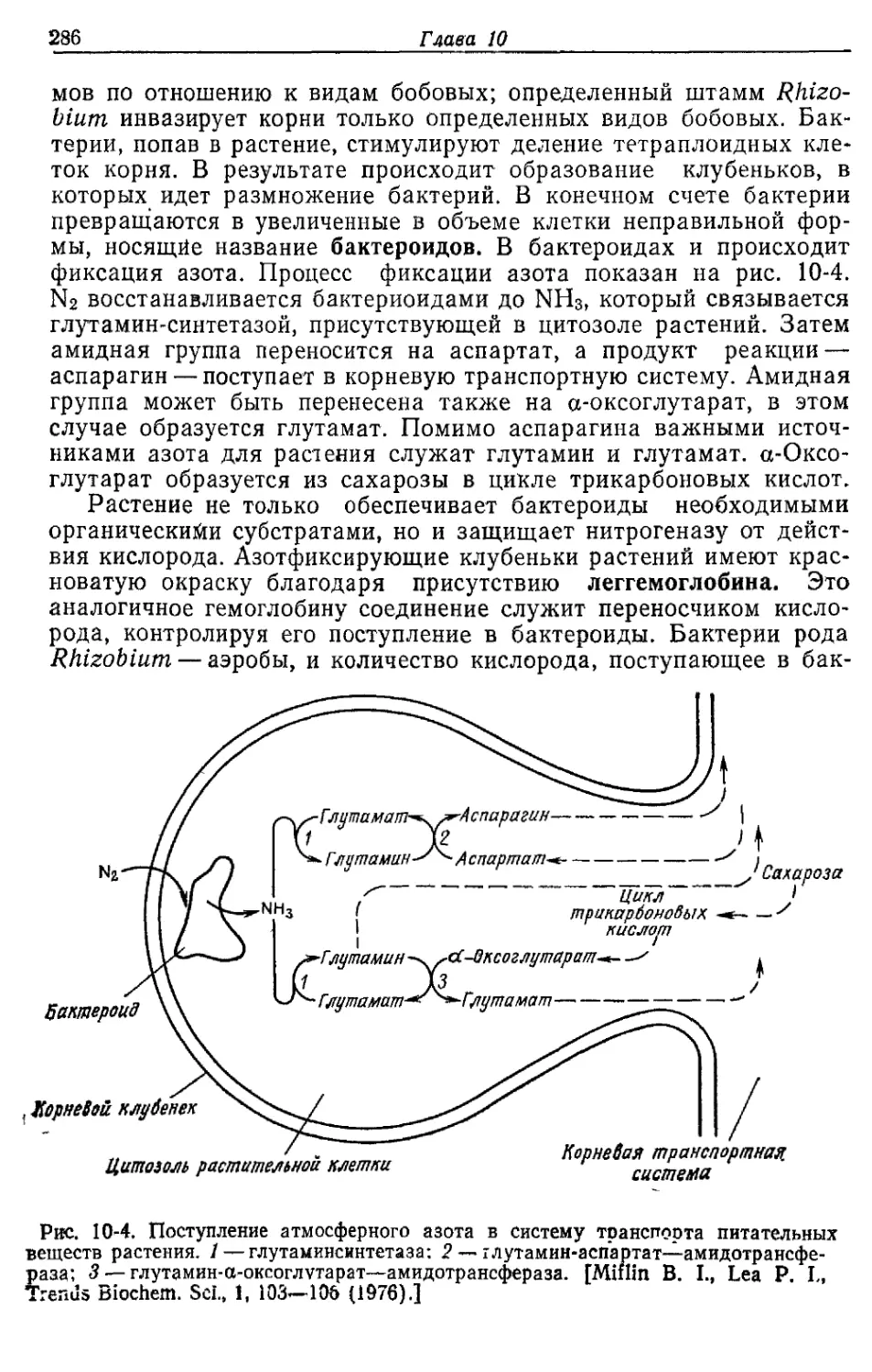
Основным носителем биологически используемой энергии слу-
жит аденозин-5'-трифосфат (АТР), и все энергозависимые про-
цессы в живых клетках прямо или косвенно сопряжены с превра-
Клегпочные процессы
АТР + Н2О —АВР + Р/
щением АТР в аденозин-5'-дифосфат (ADP) и неорганический
фосфат (Pi). АТР содержит две фосфатные связи с высокой сво-
Питание бактерий
У
бодной энергией гидролиза. Эти связи часто обозначаются знаком
В связи с наличием богатых энергией фосфорильных связей
АТР является прекрасным фосфорилирующим агентом и исполь-
зуется в качестве такого агента в многочисленных реакциях у
всех организмов. За счет АТР промежуточные продукты клеточ-
ного метаболизма активируются для дальнейших реакций, к ко-
торым относятся реакции конденсации, восстановления и расщеп-
ления. Например, глутамин может синтезироваться из глутамата
и аммиака, только если образуется фосфорилированный проме-
жуточный продукт. Следовательно, эта реакция связана с обра-
зованием ADP и Ру из АТР:
Глутамат+NH3+АТР—>Глутамин+АПР+Р.
Присущий молекулам АМР и ADP высокий потенциал перено-
са групп также используется во многих реакциях. Аминокислоты
активируются путем их превращения в соответствующие АМР-про-
изводные за счет АТР, а при образовании аминоацил-тРНК АМР
освобождается:
Аминокислота+АТР—Аминоацил-АМР + Пирофосфат,
Аминоацил-АМРн-Траиспортная РНК—>-Аминоацил]-тРНК+АМР
Фермент аденилаткиназа катализирует фосфорилирование АМР
в ADP за счет АТР, пирофосфат (PPi) гидролизуется до неорга-
нического фосфата пирофосфатазой, так что конечными продук-
тами этой серии реакций также являются ADP и Л:
Аденилаткиназа
АМР+АТР—----------->2ADP
Пирофосфатаза
РР1+Н2О------------► 2Pi
Таким образом, ADP и Pi представляют собой основные продукты,
образующиеся при затрате энергии в обмене веществ, а синтез
АТР из ADP и Pi — процесс, жизненно важный для всех живых
организмов. Существует два основных механизма образования
АТР: фосфорилирование при переносе электронов и фосфорили-
рование на уровне субстрата.
Глава 1
Фосфорилирование при переносе электронов представляет ме-
ханизм, в котором поток электронов от доноров с отрицательным
окислительно-восстановительным потенциалом к акцепторам с бо-
лее положительным потенциалом сопряжен с синтезом АТР из
ADP и Pi. Системами, в которых происходит фосфорилирование
при переносе электронов, являются дыхательные цепи и фотосин-
тетический аппарат.
Фосфорилирование на уровне субстрата — это второй механизм
образования АТР. При расщеплении органических субстратов об-
разуется небольшое количество промежуточных продуктов, содер-
жащих богатые энергией фосфорильные связи. Промежуточными
продуктами такого рода являются:
О
С—О~РОаН3
Н^—ОН 1,3-бисфосфоглицерат
(1н3-О-РО3Н3
СН2
II
С—О~РО3Н3 Фосфоенолпируват
соон
о
II
С—О~РО3Н2 Ацилфосфат
Ан3
Дальнейший обмен таких органических ~Р-соединений сопряжен
с переносом фосфатной группы на ADP. Этот способ синтеза АТР
называется фосфорилированием на уровне субстрата (или суб-
стратным фосфорилированием):
Н2С=С—СООН
I +ADP—>СН3-СО—СООН+АТР
О~РО3Н2
III. Питательные вещества как источники энергии
Как уже упоминалось, роль питательных веществ состоит не
только в том, что они обеспечивают организмы необходимыми для
жизнедеятельности элементами. Питательные вещества требуют-
ся также в качестве источников энергии, т. е. как топливо для
получения АТР. Существующие в природе источники энергии весь-
ма разнообразны, однако каждый данный микроорганизм может
использовать лишь какие-то определенные из этих соединений.
Бактерии можно сгруппировать на основе характерных для них
источников энергии. Организмы, использующие в качестве источ-
ника энергии свет, называются фототрофами (от греч. phos — свет*
Питание бактерий
IS
trophe — питание). Организмы же с таким типом энергетического
обмена, при котором АТР образуется в результате химических
реакций, называются хемотрофами.
А. Фототрофия
У фототрофов имеется фотосинтезирующий аппарат, который
дает им возможность превращать энергию солнечного света в бо-
гатые энергией фосфатные связи АТР:
Свет
ADP4-P,--->АТР+Н2О.
В качестве источников углерода фототрофы обычно используют
углекислоту (СО2). Такие организмы, которые получают большую
часть углерода своей клетки из СО2, называются С-автотрофамн1
(от греч. autos — сам и trophe — питание; автотроф — самопитаю-
щийся). Следовательно, фототрофные бактерии относятся к С-аВ-
тотрофным организмам. При росте в присутствии СО2 им требуется
какой-либо донор электронов для восстановления СО2 до уровня
клеточного материала. Как видно из табл. 1-3, и растения, и циа-
нобактерии2 часто используют в качестве доноров электронов не-
органические соединения. У некоторых фототрофных бактерий роль
доноров электронов выполняют молекулярный водород или вос-
становленные соединения серы. В таком случае их называют фо-
толитотрофами (от греч. lithos — камень). Но ряд фототрофных
бактерий может также расти при освещении, используя органи-
ческие субстраты, например сукцинат или ацетат. В этих условиях
источником всех электронов, используемых в восстановительных
реакциях, служит органический субстрат, а бактерии при этом
ведут себя как фотоорганотрофы. Ясно, что в таком случае основ-
ным источником углерода клетки служит органический субстрат,
Таблица 1*3
Два типа фототрофного метаболизма
Тип Донор электронов Источник углерода Примеры
Фотолитотрофный н2о СО2 Растения, цианобактерии
H2S, S°, Н2 со2 Chromatiaceae, Chlorobtaceae
Фотоорганотроф- ный Органические субстраты Органические субстраты Rhodespirillapeae
1 Правильнее называть автотрофами организмы, способные синтезировать
из СО2 все компоненты клеток. — Прим. ред.
2 Раньше Цйанобактерии называли сине-зелеными водорослями. — Прим,
ред
14 Глава 1
а не С02, и микроорганизмы являются С-гетеротрофами (от греч.
heteros— другой и trophe — питание; гетеротроф — питающийся на
других). Отсюда следует, что термины С-автотроф и С-гетеротроф
отражают природу источника углерода, тогда как термины лито-
троф и органотроф — природу используемого донора электронов.
Б. Хемотрофия
У большинства бактерий АТР образуется в результате хими-
ческих реакций. Обычно это окислительно-восстановительные ре-
акции, т. е. реакции, в которых один субстрат восстанавливается
за счет другого:
X । а _______> X I а
ееит • ^восст
ADP + Р, АТР + Н2О
Высшие организмы в качестве доноров электронов (ХвоССТ) могут
использовать только органические субстраты, а в качестве акцеп-
тора электронов (Аокисл) — только кислород. Способность же ис-
пользовать другие доноры и акцепторы электронов — особенность
энергетического метаболизма некоторых бактерий. В этом случае
АОКисл может обозначать кислород, нитрат, сульфат, СО2 или ор-
ганическое соединение, а Хвосст — неорганическое или органическое
соединение. По аналогии с классификацией фототрофов по спосо-
бу питания бактерии, использующие какое-либо органическое сое-
динение в качестве донора электронов, называются хемооргано-
трофами. Эта группа влючает аэробов и анаэробов. Как видно из
таблицы 1-4, анаэробные хемоорганотрофы используют в качестве
акцепторов электронов нитрат, сульфат или органические субстра-
ты. Следовательно, организмы, осуществляющие брожение, — та-
кие, как клостридии или молочнокислые бактерии, — принадлежат
к этой группе.
Хемолитотрофы используют неорганические доноры электронов,
такие, как водород, сероводород, ионы двухвалентного железа,
нитриты или аммиак. Эти соединения окисляются кислородом со-
ответственно до воды, сульфата, ионов трехвалентного железа и
нитрата. Такие реакции, идущие с выделением энергии, сопряжены
с образованием АТР из ADP и Рр.
н2 + 1о2~^-*н2о
ADP + Р, АТР + Н2О
Некоторые микроорганизмы, например Thiobacillus denitrificans»
могут вместо кислорода использовать нитрат в качестве акцептора
электронов.
Питание бактерий
15
Таблица 1-4
Два типа хемолитотрофного метаболизма
Тип _ Акцептор Донор электронов электронов Источник углерода Примеры
Хемооргано- трофный Органический субстрат о2 Органический субстрат Псевдомонады, ба- циллы
То же NO3- То же Bacillus lichentfor- tnts
SO42- » Сульфатредуци- рующие бактерии
Органический субстрат » Клостридии, молоч- нокислые бакте- рии
Хемолито- трофный н2 О2 СО2 Водородокисляю- щие бактерии
H2S о2 со2 Тиобациллы
H2S NO3" со2 Th. denitrificans
ре2+ 02 со2 Th. ferrooxidans
NH3 02 со2 Nitrosomonas
КО2- 02 со2 Nitrobacter
Н3 со2 со2 Метанообразую- щие бактерии
На со2 со2 Acetobacterium
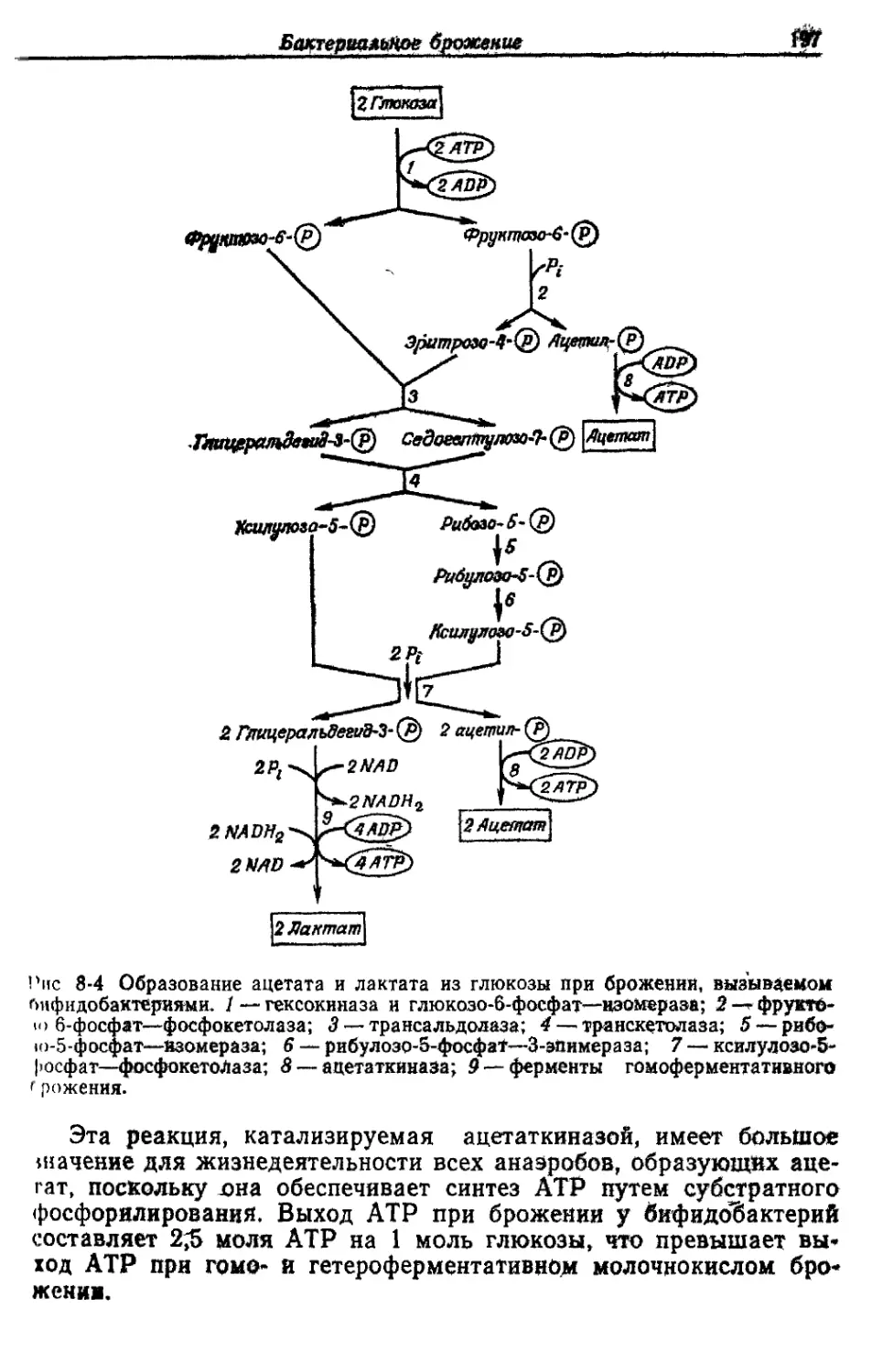
Хотя метанобразующие и ацет атобр азу ющие (ацетатные) бак-
терии резко отличаются от всех других хемолитотрофов тем, что
являются строго анаэробными организмами, по способу питания
они принадлежат к той же группе. Синтез АТР у них происходит
в результате восстановления СО2 до метана или ацетата за счет
молекулярного водорода. Следовательно, для получения энергии
они используют неорганические субстраты.
Очевидно, что у хемолитотрофов образование АТР не требует
использования органических соединений. Источником углерода у
них служит обычно СО2. Следовательно, они являются С-автотро-
фами. Однако у многих хемолитотрофов существует и другой тип
энергетического обмена. Например, водородокисляющие (водород-
ные) бактерии в соответствующих условиях способны расти как
хемоорганотрофы (при наличии О2, на средах с углеводами или
органическими кислотами). Поэтому их называют факультативны-
ми хемолитотрофами (к ним относятся все водородокисляющие
бактерии и некоторые серобактерии. Виды, не способные расти в
отсутствие специфических неорганических доноров электронов
(Nitrosomonas, Thiobacillus thiooxidans), называются облигатными
хемолитотрофами.
16 Глава 1
IV. Потребности бактерий в факторах роста
До сих пор предполагалось, что микроорганизмы способны са-
ми синтезировать все необходимые для роста органические соеди-
нения. На самом же деле существуют С-автотрофные бактерии,
получающие углерод для синтеза клеточных компонентов клеток
исключительно из СО2 (например, Alcaligenes eutrophus и Nitro-
'bacter Winogradskyi), и С-гетеротрофы, растущие на средах с та-
кими простыми источниками углерода, как глюкоза (например,
Escherichia coli, Bacillus megaterium и Clostridium pasteurianum).
Однако многие бактерии лишены способности синтезировать все
Таблица 1-5
Витамины, близкие к ним соединения
и соответствующие функции в метаболизме
Соединение Функция метаболизма
n-Аминобензойная кислота Предшественник тетрагидрофолиевой кислоты, ко- фермент, участвующий в переносе одноуглерод- ных единиц
Биотин Простетическая группа ферментов, катализирую- щих реакции карбоксилирования
Кофермент М Фолиевая кислота Кофермент, участвующий в образовании метана Тетрагидрофолиевая кислота является кофермен- том, участвующим в переносе одноуглеродных единиц
Гемин Липоевая кислота (дитио- октановая кислота) Никотиновая кислота Предшественник цитохромов Простетическая группа пируватдегидрогеназно го комплекса Предшественник NAD и NADP, являющихся ко- ферментами многих дегидрогеназ
Пантотеновая кислота Предшественник кофермента А и простетическая группа ацилпереносящих белков
Пиридоксин (витамин Be) Пиридоксальфосфат служит коферментом транс- аминаз и декарбоксилаз аминокислот
Рибофлавин (витамин Вэ) Предшественник флавинмононуклеотида (FMN) и флавинадениндинуклеотида (FAD), являющихся простетическими группами флавопротеидов
Тиамин (витамин Bi) Тиаминпирофосфат служит простетической груп- пой декарбоксилаз, трансальдолаз и транскето- лаз
Витамин В12 (цианкобал- амин) Витамин К Кофермент В12 участвует в реакциях перегруппи- ровок (например, глутаматмутаза) Предшественник менахинона, функционирующего как переносчик электронов (например, в фу- маратредуктазе)
_______________________Питание бактерий________ 17
органические соединения, необходимые для роста, и зависят от
наличия в среде определенных факторов роста. Эти факторы мож-
но объединить в три группы:
1) витамины и родственные соединения, требующиеся в малых
количествах;
2) аминокислоты;
3) пурины и пиримидины.
Количество и природа факторов роста, которые должны при-
сутствовать в инкубационной среде, различны для разных бакте-
рий. Для роста молочнокислых бактерий требуются практически
все аминокислоты, пурины, пиримидины и витамины. Способность
к процессам биосинтеза у этих организмов довольно ограничена.
Общим свойством всех микроорганизмов является потребность в
витаминах и родственных соединениях. Некоторые из этих соеди-
нений, а также их функции в обмене веществ приведены в
табл. 1-5.
Потребность в факторах роста точно установлена не для всех
микроорганизмов. Поэтому микробиологи часто добавляют в среду
дрожжевой экстракт и пептон в качестве полноценных и дешевых
источников таких факторов. При использовании в специальных
целях синтетических сред (т. е. сред известного состава) удалось
установить потребность в факторах роста у ряда микроорганиз-
мов. Так, Clostridium kluyveri растет на среде, содержащей био-
тин и n-аминобензойную кислоту. В среды для многих фототроф-
ных бактерий добавляют раствор витаминов, содержащий нико-
тиновую кислоту, тиамин, n-аминобензойную кислоту, биотин и
витамин В12. Некоторые микроорганизмы характеризуются особы-
ми потребностями. Так, у видов Haemophilus среда должна содер-
жать гемин для биосинтеза цитохромов, а также NAD. Гемин
требуется представителям рода Bacteriodes. Methanobacterium ru-
minantium растет только в присутствии кофермента М (2-меркап-
тоэтансульфоновой кислоты) и 2-метил-н-масляной кислоты. Эти
несколько примеров свидетельствуют о том, что у микроорганизмов
могут быть нарушены процессы биосинтеза различных соединений
и что многие из них нуждаются в определенных факторах роста.
V. Выводы
1. Десять химических элементов требуются организмам в от-
носительно высоких концентрациях: С, О, Н, N, S, Р, К, Mg,
Са, Fe.
2. К числу минорных биологических элементов относятся неко-
торые элементы, незаменимые для всех микроорганизмов (Zn,
Мп), а также ряд других элементов, требующихся только микро-
организмам с особым типом метаболической активности (напри-
мер, Se, Mo, Со, Си, W).
3. АТР синтезируется из ADP и Pi путем фосфорилирования
при переносе электронов или путем фосфорилирования на уровне
2—18|б
18
Глава 1
субстрата. Для синтеза АТР микроорганизмы используют либо
физическую энергию (энергию солнечного света), либо химиче-
скую энергию.
4. Фототрофные бактерии, использующие неорганические до-
норы электронов, подобные Н2 или H2S, для восстановления СО2
до уровня углерода клеток, называют фотолитотрофами. Организ-
мы, растущие при освещении на органических субстратах, назы-
вают фотоорганотрофами.
5. Хемотрофные организмы используют энергию химических
реакций, в большинстве случаев реакций окисления. Хемооргано-
трофы метаболизируют органические субстраты. Микроорганизмы,
использующие для получения энергии только неорганические сое-
динения, называются хемолитотрофами.
6. На основе природы используемых источников углерода мик-
роорганизмы подразделяют на С-гетеротрофы и С-автотрофы;
в качестве основного источника углерода первые используют орга-
нические соединения, а вторые — СО2.
7. Помимо простых источников углерода многим микроорганиз-
мам требуются еще один или несколько факторов роста. К этим
факторам относятся витамины и их производные, аминокислоты,
пурины и пиримидины. Чаще всего наблюдается потребность в
таких витаминах, как биотин, п-аминобензойная кислота, тиазин,
никотиновая кислота и витамин Bi2.
Глава 2
КАК ESCHERICHIA COLI
СИНТЕЗИРУЕТ АТР ПРИ АЭРОБНОМ РОСТЕ
НА СРЕДАХ С ГЛЮКОЗОЙ
Escherichia coli принадлежит к группе факультативно анаэроб-
ных бактерий. Она способна расти на многих субстратах в при-
сутствии кислорода или в его отсутствие. В аэробных условиях
часть субстрата окисляется до СО2 за счет кислорода, исполь-
зуемого в качестве конечного акцептора электронов. Этот процесс
идет с выделением энергии и сопровождается образованием АТР,
который требуется для процессов биосинтеза клеточных компонен-
тов. Если субстратом служит глюкоза, то около 50% ее окисляет-
ся до СО2; это дает достаточно АТР для превращения остальных
50% глюкозы в клеточный материал:
Чтобы энергия, высвобождающаяся при окислении глюкозы,
эффективно использовалась для образования АТР из ADP и неор-
ганического фосфата, молекула глюкозы должна претерпеть ряд
превращений, которые с первого взгляда кажутся довольно слож-
ными, но тем не менее являются очень экономичными. Все реак-
ции, участвующие в окислении глюкозы до СО2, можно разделить
на несколько функциональных блоков; у Е. coli эти блоки приве-
дены на схеме (2-1).
В совокупности эти реакции обеспечивают окисление глюкозы
до СО2 и воды с сохранением части высвобождающейся энергии
в виде энергии фосфатных связей АТР. 1
I. Транспорт глюкозы в клетки £. coli
Плазматическая мембрана Е. coli не просто проницаема для
глюкозы. Свободной диффузии глюкозы в бактериальную клетку
и из нее, которая приводила бы к уравниванию концентрации са-
хара внутри и снаружи, не происходит. Но в клетках Е. coli име-
ется система транспорта, специфически узнающая глюкозу. Эта
система поглощает глюкозу на той стороне плазматической мемб-
о*
20
Глава 2
Транспорт глюкозы а клетки Г.соИ.
Глюкоза
(снаружи)
Фосфоенол -
/"пируват
, Пируват
Глюкозо-6-фосфат
(внутри'
А Транспорт глюкозы в клетки
с помощью фосфоеналпируват-
глюкоз а - фосфощрансферазной
системы
2 Пируват
Б. Расщепление глюкоза-6-фосфата
до пирувата по пути Эмбдена -
Мейергофа - Парнаса
В. Окислительное декарбоксилирование
пирувата до ацетил-кофермента fl
пируватдегидрогеназой
Г. Окисление ацетильной части ацетил -
кофермента fl до СО2 в цикле три-
карбоновых кислот
Д. Окисление восстановленных коферментовt
образовавшихся на стадиях Б- Г дыха -
тельной цепи
(2-1)
раны, которая обращена к среде, и освобождает ее с той стороны
мембраны, на которой находится цитоплазма. Такой процесс транс-
порта сопряжен с химическим превращением субстрата, а именно
с фосфорилированием глюкозы в глюкозо-6-фосфат.
Донором фосфатной группы в этой реакции служит фосфоенол-
пируват, а ферментный комплекс, катализирующий этот процесс
транспорта, называется фосфоенолпируват: глюкоза — фосфотранс-
феразной системой. Процесс состоит из двух реакций:
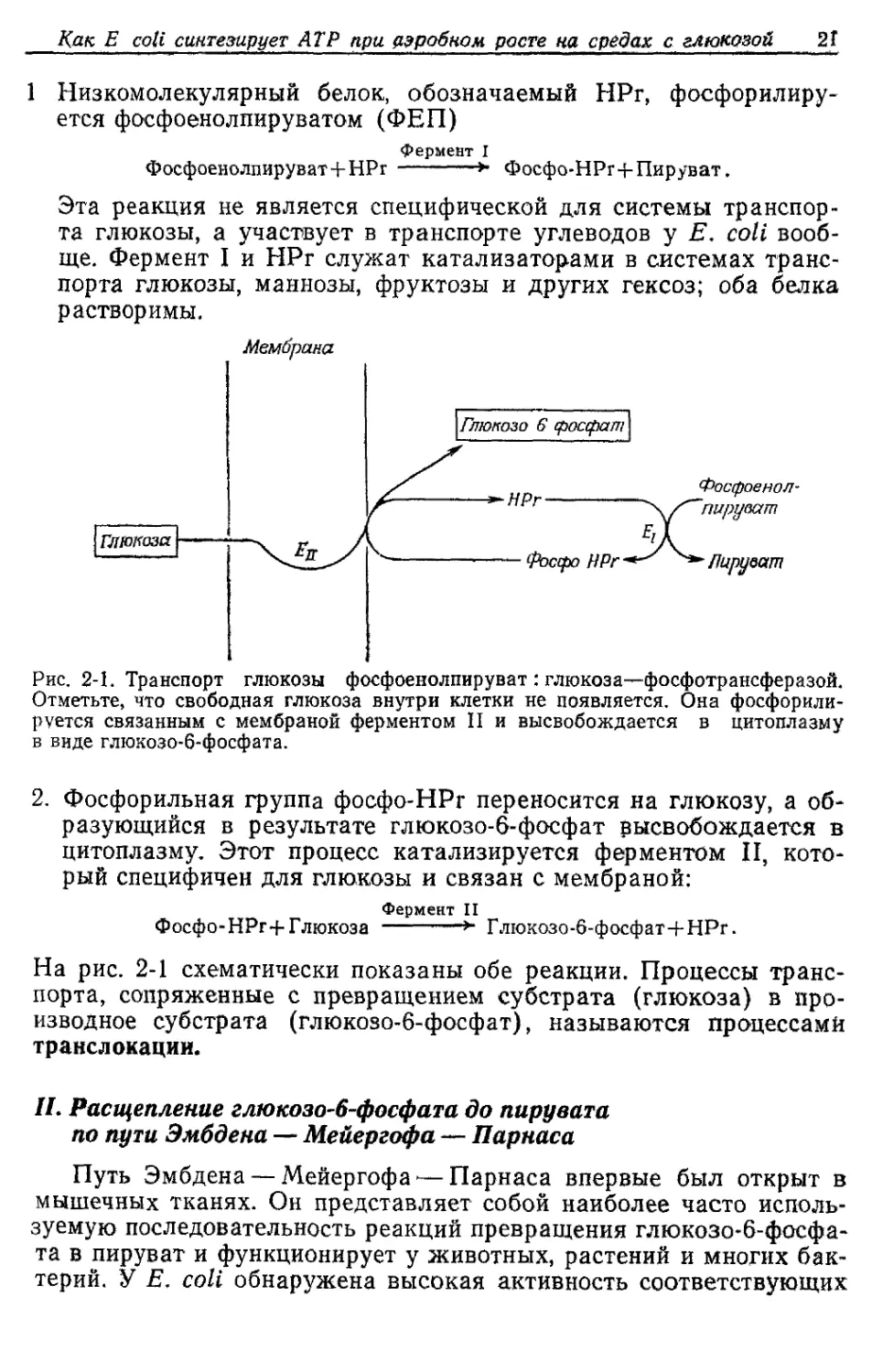
Как E coli синтезирует АТР при аэробном росте на средах с глюкозой 2 Г
1 Низкомолекулярный белок, обозначаемый НРг, фосфорилиру-
ется фосфоенолпируватом (ФЕП)
Фермент I
Фосфоенолпируват+НРг -----> Фосфо-НРг+Пируват.
Эта реакция не является специфической для системы транспор-
та глюкозы, а участвует в транспорте углеводов у Е. coll вооб-
ще. Фермент I и НРг служат катализаторами в системах транс-
порта глюкозы, маннозы, фруктозы и других гексоз; оба белка
растворимы.
Мембрана
Рис. 2-1. Транспорт глюкозы фосфоенолпируват : глюкоза—фосфотрансферазой.
Отметьте, что свободная глюкоза внутри клетки не появляется. Она фосфорили-
руется связанным с мембраной ферментом II и высвобождается в цитоплазму
в виде глюкозо-6-фосфата.
2. Фосфорильная группа фосфо-HPr переносится на глюкозу, а об-
разующийся в результате глюкозо-6-фосфат высвобождается в
цитоплазму. Этот процесс катализируется ферментом П, кото-
рый специфичен для глюкозы и связан с мембраной:
Фермент II
Фосфо-НРг+Глюкоза ------*" Глюкозо-6-фосфат+НРг.
На рис. 2-1 схематически показаны обе реакции. Процессы транс-
порта, сопряженные с превращением субстрата (глюкоза) в про-
изводное субстрата (глюкозо-6-фосфат), называются процессами
транслокации.
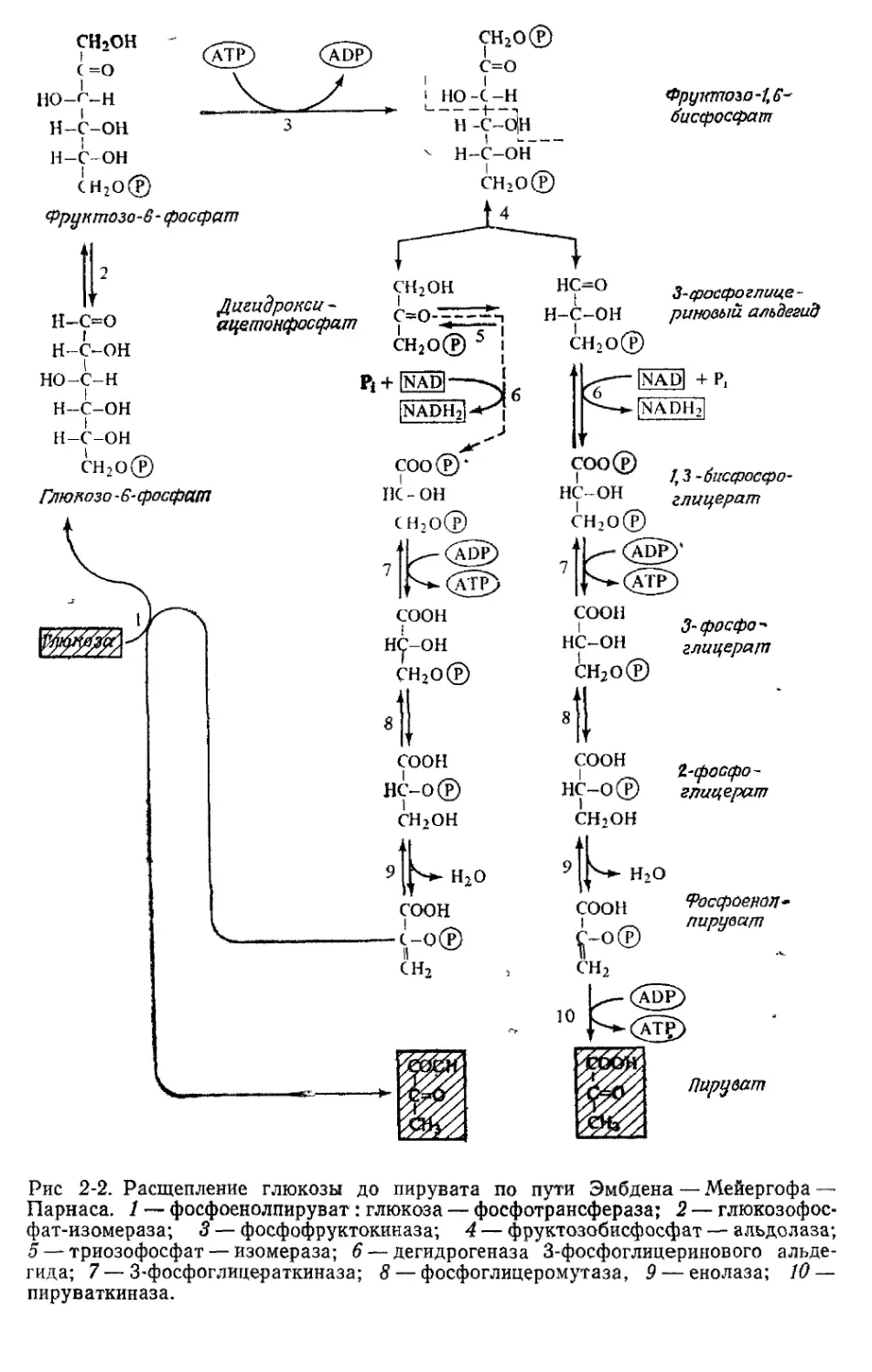
Расщепление глюкозо-6-фосфата до пирувата
по пути Эмбдена — Мейергофа — Парнаса
Путь Эмбдена — Мейергофа’—Парнаса впервые был открыт в
мышечных тканях. Он представляет собой наиболее часто исполь-
зуемую последовательность реакций превращения глюкозо-6-фосфа-
та в пируват и функционирует у животных, растений и многих бак-
терий. У Е. coli обнаружена высокая активность соответствующих
22
/ taaa 2
ферментов В первых двух реакциях, катализируемых ферментами
глюкозофосфат-изомеразой и фосфофруктокиназой, глюкозо-6-фос-
фат превращается во фруктозо-1,6-бисфосфат, характерный для это-
го пути промежуточный продукт Фруктозобисфосфат-альдолаза
расщепляет фруктозе-1,6-бисфосфат на два С3-фрагмента дигидр-
оксиацетонфосфат и 3-фосфоглицериновый альдегид. Благодаря на-
личию фермента триозофосфат-изомеразы между двумя триозами
устанавливается равновесие. Константа равновесия изомеразной
реакции обеспечивает преимущественное образование дигидрокси-
ацетонфосфата, однако фермент триозофосфат-изомераза настоль-
ко активен (по сравнению с другими ферментами данного пути),
что образующееся кетопроизводное немедленно превращается в
алъдозный изомер. Следовательно, если дигидроксиацетонфосфат
и требуется клеткам, то только в малых количествах Большая
же часть Сз-фрагментов, возникающих из фруктозо-1,6-бисфосфа-
та, может подвергаться дальнейшим превращениям через 3-фос-
фоглицериновый альдегид Так обычно и происходит (рис. 2-2)
Окисление 3-фосфоглицеринового альдегида обеспечивается
двумя ферментами, которые вместе осуществляют окисление аль-
дегидной группы в карбоксильную. Первый из них — глицеральде-
гид-3-фосфат — дегидрогеназа. Она содержит связанный NAD,
и реакция протекает, как показано на рис. 2-3.
Образовавшийся 1,3-бисфосфоглицерат является смешанным
ангидридом 3-фосфоглицерата и фосфата, и свободная энергия
гидролиза этого ангидрида выше, чем соответствующая величина
для реакции АТР Н2У° ADP + А. Следовательно, превращение 1,3-
бисфосфоглицерата в 3-фосфоглицерат может быть сопряжено с
фосфорилированием ADP в АТР. Реакцию эту катализирует фер-
мент 3-фосфоглицераткиназа Это один из двух пунктов пути Эмб-
дена— Мейергофа — Парнаса, в которых АТР образуется в ре-
зультате фосфорилирования на уровне субстрата:
3 фосфоглицераткиназа
1,3 бисфосфоглицерат-4-ADP -----------—3-фосфоглицерат+АТР»
На следующих двух стадиях 3-фосфоглицерат превращается в
фосфоенолпируват. Сначала фосфоглицератмутаза переносит фос-
форильную группу из положения 3 в положение 2 молекулы гли-
церата Этому ферменту в качестве кофактора требуется 2,3-бис-
фосфоглицерат Енолаза (фосфопируват-гидратаза) отщепляет во-
ду с образованием фосфоенолпирувата Это второе соединение,
содержащее фосфорильную связь с высокой энергией гидролиза;
в ходе образования пирувата из фосфоенолпирувата фосфорильная
связь переносится на ADP с образованием АТР. Эту реакцию
катализирует пируваткиназа (второй пункт образования АТР в
пути Эмбдена — Мейергофа — Парнаса):
Пируваткиназа
Фосфоенолпируват+ADP -------->- Пируват+АТР.
ClbOH
1
С =0
НО-г-н
I
Н-С-ОН
Н-С-ОН
СН2О®
СН2О®
с=о
I I
но-с-н
н -сон
V н-с-он"" ‘
сн2о®
Фрукгпозо-1,6-^
бисфоссраш
Фруктозо-6-фосфат
Н—с=о
н-с-он
I
но-с-н
I
н-с-он
I
Н-С-ОН
СН2О®
Глюкоза-6-фосфат
Дигидрокси -
ацетонфосфат
СН20Н
C=O---"-^i
сн2о® 5 ;
р« + InadI—
г---------> Л °
[NADH2|-*-|
нс=о
Н-С-ОН
сн2о®
З-фосфоглице -
риновый альдегид
|NAP| + Pi
[NADH'zl
COO® , , ,
I 7,3 -бисфосфо-
НС-ОН глицерат
СН2О®
COO® ‘
ПС-ОН
сн2о®
СООН
Н^?-ОН
СН2О®
8
СООН
НС-ОН
СН2О®
8
3-фосфо -
глицерат
СООН
нс-о®
СН2ОН
9^"*- Н20
СООН
-1-0®
сн2
СООН „
I 2-фосфо-
НС-0® глицерат
СН2ОН
9^*- Н2О
СООН Фосфоенол-
I _ пируват
сн2
Пируват
Рис 2-2. Расщепление глюкозы до пирувата по пути Эмбдена — Мейергофа —
Парнаса. 1 — фосфоенолпируват : глюкоза — фосфотрансфераза; 2 — глюкозофос-
фат-изомераза; 3 — фосфофруктокиназа; 4 — фруктоз°бисфосфат — альдолаза;
5 — триозофосфат — изомераза; 6 — дегидрогеназа 3-фосфоглицеринового альде-
гида; 7 — 3-фосфоглицераткиназа; 8 — фосфоглицеромутаза, 9 — енолаза; 10 —
пируваткиназа.
24
Г тина 2
NAD
_L_.
Е -SH +
Н-С=О
(
Н-С-ОН
СН2О®
nadh2
—н
Е -S-C=O
Н-С-ОН
<н2о®
NADHi
+ NAD
н-с-он
сн2о(р)
NAD
Ь -S-OO
Н-С-ОН + NADHi
CH2O®
NAD
I—
E -S-C-0
H-C-OH
CH2O®
NAD
_L_,
+ P1
O=C-O-®
E |-*SH + H-C-OH
CH2O®
Рис 2-3 Превращение 3-фосфоглицеринового альдегида в 1,3-бисфосфоглицерат.
В начальной реакции альдегид окисляется до тиоэфира, а восстановительная спо-
собность передается на связанный с ферментом NAD Затем происходит реакция
обмена с растворимым NAD И наконец, ацильная группа на ферменте передает-
ся на неорганический фосфат
Поскольку фосфоенолпируват требуется и для системы транспорта
глюкозы, то в пируваткиназной реакции расходуется только поло-
вина его количества.
В общем виде рассмотренные реакции можно выразить с по-
мощью следующих уравнений
Глюкоза + Фосфоенолпируват—> Глюкозо-6-фосфат+Пируват
Глюкозо-6 фосфат+ADP+2NAD+2Pt—>-Фосфоенолпируват+АТР+2NADH2
________Фосфоенолпируват+АРР—>-Пируват+АТР______
Глюкоза+2ADP+2NAD + 2РХ—>-2 Пируват+2АТР+NADH2
NADH2 образуется в реакции, катализируемой глицеральдегид-3-
фосфат—дегидрогеназой, а АТР — в реакциях, катализируемых
3-фосфоглицераткиназой и пируваткиназой Одна молекула АТР
расходуется в фосфофруктокиназной' реакции (на фосфорилирова-
ние фруктозо-6-фосфата)
111, Окислительное декарбоксилирование пирувата
до ацетилкофермента А
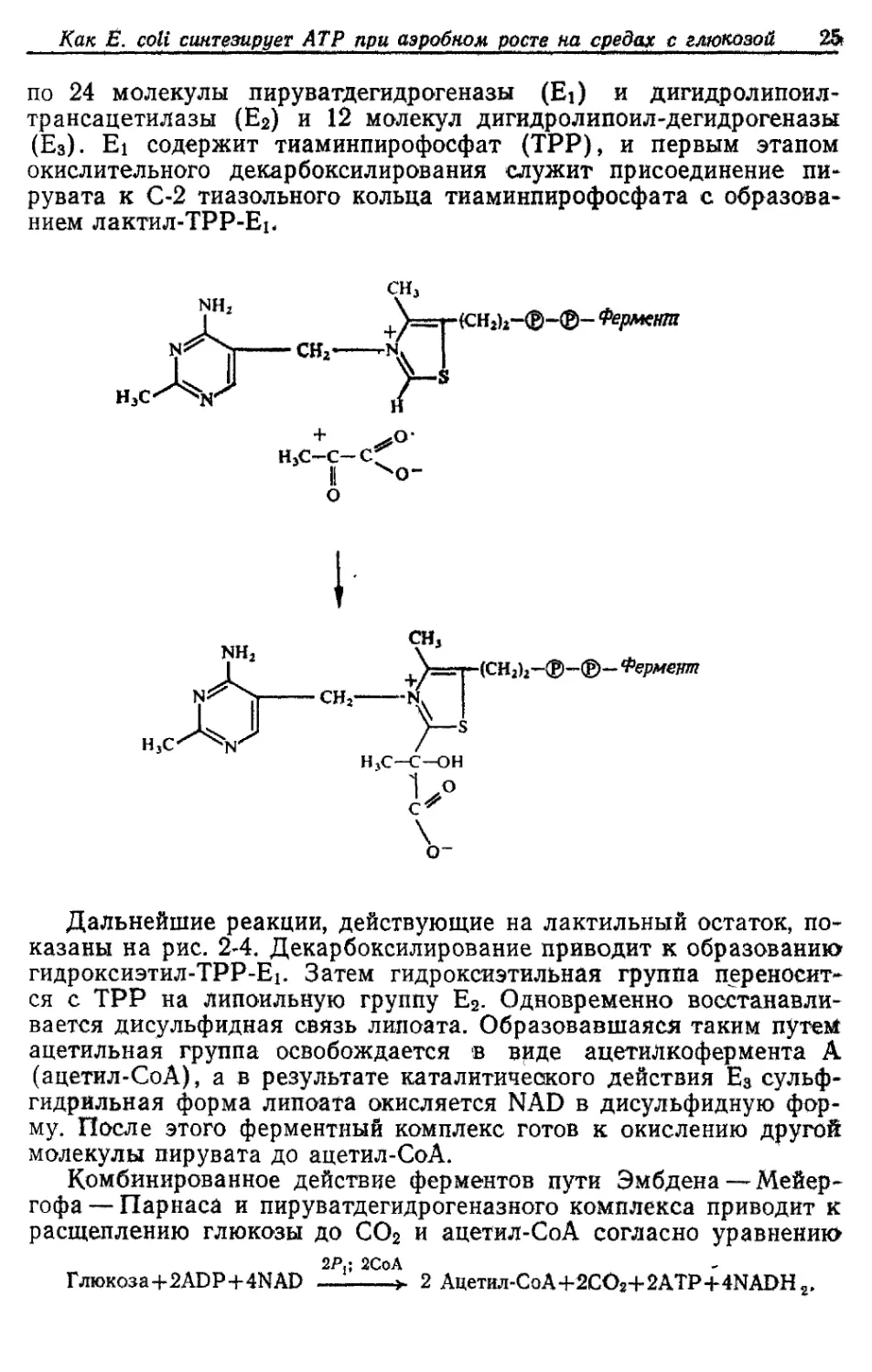
Как у большинства аэробных микроорганизмов, образование
ацетил-СоА из пирувата у Е coli катализируется пируватдегидро-
геназным комплексом. Этот комплекс состоит из трех ферментов:
Как Ё coli синтезирует АТР при аэробном росте на средах с глюкозой 2S
по 24 молекулы пируватдегидрогеназы (Ei) и дигидролипоил-
трансацетилазы (Е2) и 12 молекул дигидролипоил-дегидрогеназы
(Е3). Ei содержит тиаминпирофосфат (ТРР), и первым этапом
окислительного декарбоксилирования служит присоединение пи-
рувата к С-2 тиазольного кольца тиаминпирофосфата с образова-
нием лактил-ТРР-Ер
СН2
(сн2)2-©~®- Фермент
+
НэС-С-С^
II чо-
о
Дальнейшие реакции, действующие на лактильный остаток, по-
казаны на рис. 2-4. Декарбоксилирование приводит к образованию
гидроксиэтил-ТРР-Еь Затем гидроксиэтильная группа переносит-
ся с ТРР на липоильную группу Е2. Одновременно восстанавли-
вается дисульфидная связь липоата. Образовавшаяся таким путем
ацетильная группа освобождается в виде ацетил кофер мента А
(ацетил-СоА), а в результате каталитического действия Е3 сульф-
гидрильная форма липоата окисляется NAD в дисульфидную фор-
му. После этого ферментный комплекс готов к окислению другой
молекулы пирувата до ацетил-СоА.
Комбинированное действие ферментов пути Эмбдена — Мейер-
гофа— Парнаса и пируватдегидрогеназного комплекса приводит к
расщеплению глюкозы до СО2 и ацетил-СоА согласно уравнению
Глюкоза+2ADP+4NAD 2 Ацетил-СоА+2CO2+2ATP+4NADH2.
26
Глава 2
Ез
ТПФ-СН-СН3 + со2
- S он
-S
FAD
+ CH3-CO-SCOA
ТПФ
- S
- S
FAD + NADH2
Суммарное
уравнение: СН3-СО-СООН + СоА 4- NAD - СН3 -СО-СоА + СО2 + NADH2
Рис 2-4 Реакции, катализируемые пируватдегидрогеназным комплексом Ei — пи-
руватдегидрогеназа, Е2 — дигидролипоил-трансацетилаза; Е3 — дигидролипоилде-
гидрогеназа; ТПФ — тиаминпирофосфат; дисульфидное соединение, связанное
с Е2, представляет собой окисленную форму липоата.
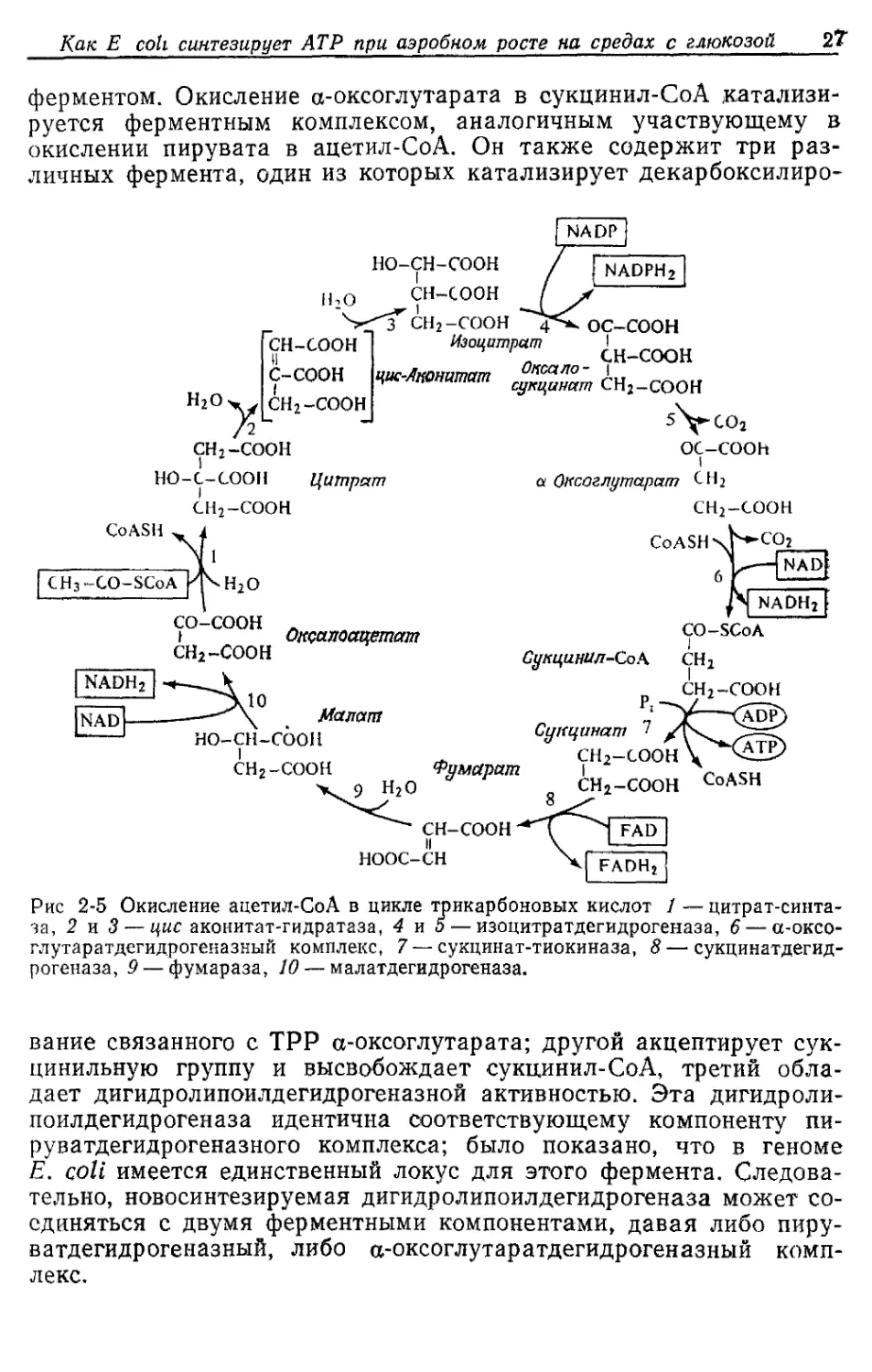
JV. Окисление ацетил-СоА в цикле трикарбоновых кислот
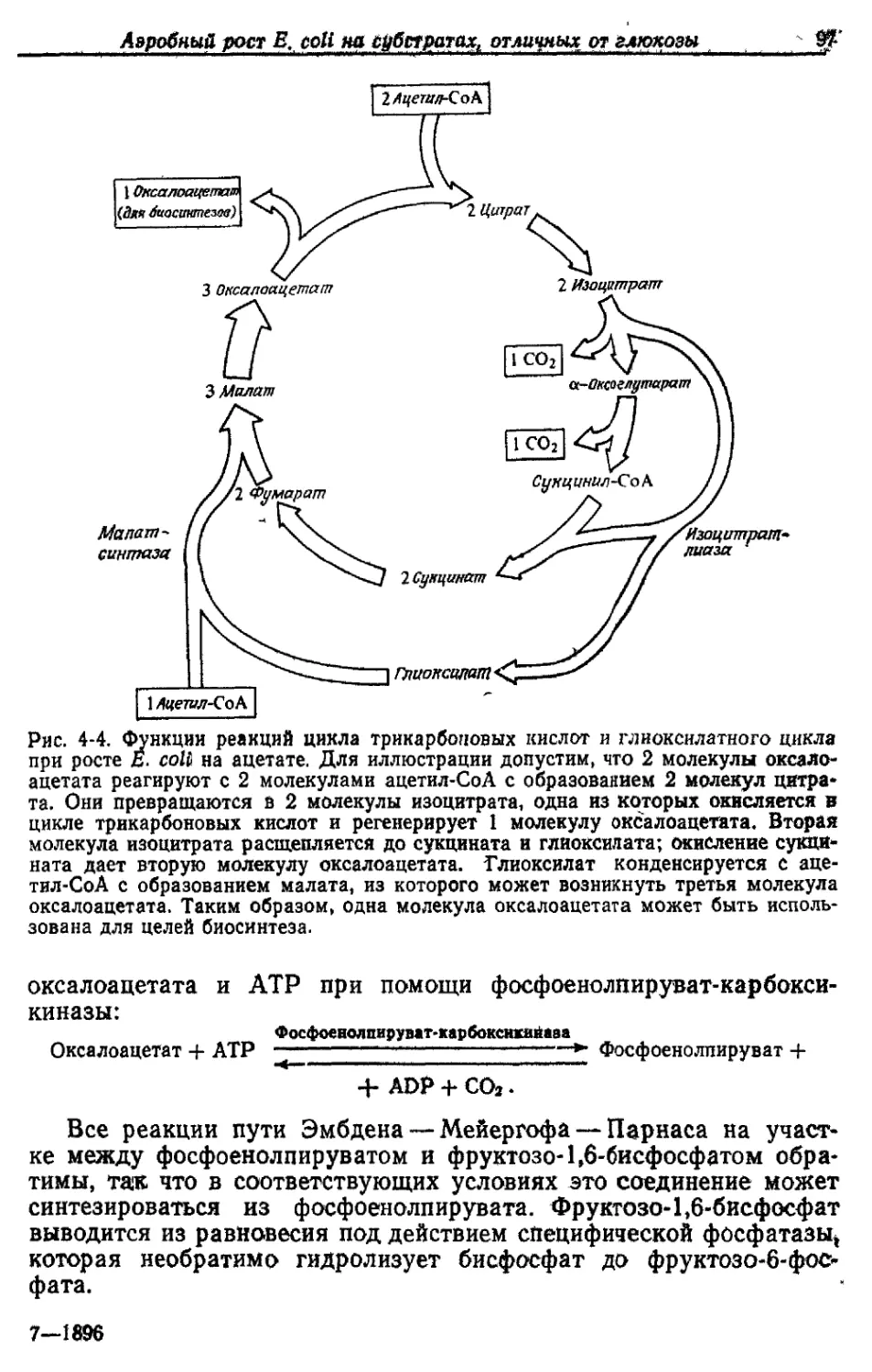
Этот цикл был открыт Эглестоном и Кребсом в тканях живот-
ных. Его часто называют циклом Кребса, или циклом лимонной
кислоты. Наличие цикла трикарбоновых кислот у Е. coli было по-
казано ферментативными методами и в экспериментах с исполь-
зованием радиоактивных субстратов. В этом цикле происходит
окисление ацетильной части ацетил-СоА до СО2 с переносом вос-
становительных эквивалентов на NAD, NADP и FAD. Ацетил-СоА
вводится в цикл в результате цитрат-синтазной реакции, в которой
оксалоацетат и ацетил-СоА конденсируются с образованием цит-
рата. В последующих реакциях цикла происходит регенерация че-
тырехуглеродного акцептора следующей молекулы ацетил-СоА,
т. е. аксалоацетата.
Как показано на рис. 2-5, цитрат вначале изомеризуется в
изоцитрат. Это происходит путем отщепления воды с образовани-
ем связанного с ферментом tjuc-аконитата, который затем при-
соединяет воду, давая изоцитрат. Далее изоцитрат окисляется в
оксалосукцинат, который декарбоксилируется тем же ферментом —
изоцитратдегидрогеназой — с образованием а-оксоглутарата. По-
добно соответствующему ферменту у большинства других бакте-
рий, изоцитратдегидрогеназа Е. coli является NADP-зависимым
Как Е coll синтезирует АТР при аэробном росте на средах с глюкозой 2Т
ферментом. Окисление а-оксоглутарата в сукцинил-СоА катализи-
руется ферментным комплексом, аналогичным участвующему в
окислении пирувата в ацетил-СоА. Он также содержит три раз-
личных фермента, один из которых катализирует декарбоксилиро-
н2о
[NADP|
< [nadph2 |
СН-СООН
м
с-соон
сн2-соон
'2 "
сн2-соон
НО-С-СООН Цитрат
СН2-СООН
н2о
но-сн-соон
сн-соон
СН2 -СООН ОС-СООН
сн-соон
сн,-соон
ос-соон
а Оксоглутарат СН2
сн2-соон
CoASH х 4
CoASH
|СНз-CO-SCoA
со-соон л
I Оксапоацетат
СН2-СООН
Н2О
nadh2|
NAD
Сукцинил-Со Ь.
10
Малат
НО-СН-СООН
СНг-СООН Фумарат.
х. 9 Н2О
PI
Сукцинат 1
СН2-СООН
СН2-СООН C°ASH
8
CO-SCoA
I
сн2
сн2-соон
ADP
СН-СООН
II
НООС-СН
FAD |
[ fadh2 |
Рис 2-5 Окисление ацетил-СоА в цикле трикарбоновых кислот 1 — цитрат-синта-
за, 2 и 3— цис аконитат-гидратаза, 4 и 5 — изоцитратдегидрогеназа, 6 — сс-оксо-
глутаратдегидрогеназный комплекс, 7 — сукцинат-тиокиназа, 8 — сукцинатдегид-
рогеназа, 9— фумараза, 10 — малатдегидрогеназа.
вание связанного с ТРР а-оксоглутарата; другой акцептирует сук-
цинильную группу и высвобождает сукцинил-СоА, третий обла-
дает дигидролипоилдегидрогеназной активностью. Эта дигидроли-
поилдегидрогеназа идентична соответствующему компоненту пи-
руватдегидрогеназного комплекса; было показано, что в геноме
Е. coli имеется единственный локус для этого фермента. Следова-
тельно, новосинтезируемая дигидролипоилдегидрогеназа может со-
единяться с двумя ферментными компонентами, давая либо пиру-
ватдегидрогеназный, либо а-оксоглутаратдегидрогеназный комп-
лекс.
28
Глава 2
На следующем этапе энергия тиоэфирной связи сукцинил-СоА
используется для синтеза АТР из ADP и неорганического фосфата.
Это еще одна реакция, в которой АТР образуется в результате
фосфорилирования на уровне субстрата.
Сукцинаттиокиназа
Сукцинил-СоА+Л+ADP---------------► Сукцинат+АТР-Ь СоА.
Соответствующий фермент млекопитающих фосфорилирует
GDP и IDP, но не ADP. Сукцинад окисляется сукцинатдегидроге-
назой до фумарата. Сукцинатдегидрогеназа локализована в части-
цах, связанных с цитоплазматической мембраной, и переносит
электроны от сукцината к связанному FAD. Как будет обсуждать-
ся ниже, электроны затем направляются от FAD в дыхательную
цепь. NAD не используется как акцептор электронов в этой реак-
ции окисления, поскольку система фумарат/сукцинат имеет более
высокий окислительно-восстановительный потенциал (Eq =
= +0,03 В), чем система NAD/NADH2 (£6 =—0,32 В). Следователь-
но, сукцинат является слишком слабым восстановителем для NAD.
Более пригоден для этой цели связанный с белком FAD с Eq око-
ло —0,06 В.
Для образования оксалоацетата необходимы еще два фермен-
та. Сначала фумараза присоединяет воду к фумарату с образова-
нием L-малата, затем L-малатдегидрогеназа окисляет L-малат до
оксалоацетата, используя NAD в качестве акцептора Н.
При -^окислении двух молекул ацетил-СоА в цикле трикарбо-
новых кислот глюкоза полностью окисляется до СО2 Водород,
который теоретически выделяется при этом окислении, сохраняет-
ся в форме восстановленных коферментов. Число участвующих в
реакции атомов водорода обычно рассчитывают по окислению суб-
страта (на бумаге) до СО2 с участием воды; для глюкозы оно со-
ставляет 24 (Н):
С6Н12О6+6Н2О—>-24 (Н) +6СО2
Глюкоза Участвующий
в реакции водород
Глюкоза+8 NAD + 2 NADP+2 FAD + 4 ADP+4 Pj—>-
—>8 NADH2+2 NADPH2+2 FADH2+4 ATP+6 CO2.
24(H)
Очевидно, что процесс окисления глюкозы быстро прекратился
бы, если бы не было реакций, в которых регенерируются окислен-
ные формы коферментов Как и у других аэробных организмов,
основным акцептором водорода при аэробном росте Е coli служит
кислород, а механизмом, использующимся для взаимодействия
восстановленных форм коферментов с кислородом, является ды-
хательная цепь. Однако следует отметить, что Е. coli — факульта-
тивный анаэроб, который даже в аэробных условиях разлагает
Как Е, coli синтезирует АТР при аэробном росте на средах с глюкозой 29
часть глюкозы путем брожения, т. е. без участия кислорода. Для
упрощения здесь мы опустим одновременно происходящие у Е. coli
процессы брожения и рассмотрим их в нижеследующих главах.
V. Образование АТР в дыхательной цепи
А. Окислительно-восстановительный потенциал
Любая окислительно-восстановительная реакция может быть
записана следующим образом:
Авосст^ Аокисл -J- п электронов,
Вокисл-М электронов^В восст-
Если эквимолярный раствор АВосст/АОкисл добавлен к эквимо-
лярному раствору Ввосст/Вокисл, то направление реакции зависит
от стремления системы АВОсст/Аокисл отдавать электроны системе
Ввосст/Вокисл» и наоборот. Количественной мерой этого «стремле-
ния» в окислительно-восстановительных системах служит их окис-
лительно-восстановительный потенциал.
Для измерения окислительно-восстановительных потенциалов в
качестве стандартного электрода обычно используют водородный
электрод — раствор, содержащий Н+ с активностью, равной 1
(рН=0), и электрод из инертного металла в равновесии с Н2 при
1 атм. Его окислительно-восстановительный потенциал условно
принят за 0 (Ео—0 В). Спонтанно или в присутствии соответст-
вующих катализаторов окислительно-восстановительные системы с
отрицательными окислительно-восстановительными потенциалами
восстанавливают Н+ до водорода. Окислительно-восстановительные
системы с положительными Ео восстанавливаются Н2. Зависимость
окислительно-восстановительного потенциала от концентрации
компонентов системы выражается уравнением Нернста:
F р , т 1п [°кисл1
п - F [восст]
(К — газовая постоянная, Т — абсолютная температура, п — число
электронов, F — константа Фарадея).
Во всех реакциях, протекающих с участием протонов, стандарт-
ный окислительно-восстановительный потенциал относят к рН = 0.
В случае реакций, более характерных для биологических процес-
сов и происходящих при значениях pH, близких к 7,0, практически
удобнее рассчитывать стандартный окислительно-восстановитель-
ный потенциал биологических систем, когда рН=--7.
При рН7 и 30 С° потенциал водородного электрона становится
равным —0,42 В:
R т
---- • In 10-7,
<РН=7) (рН=0) п • F
„ п , 8,314 • 303
£»=0+ТГ9649Г'2'3<В’~7= -°'42В-
R Т
30
Глава 2
Величины Eq NAD и О2 соответственно равны —0,32 и +0,81 В,
а разница между ними представляет собой область потенциалов
дыхательной цепи.
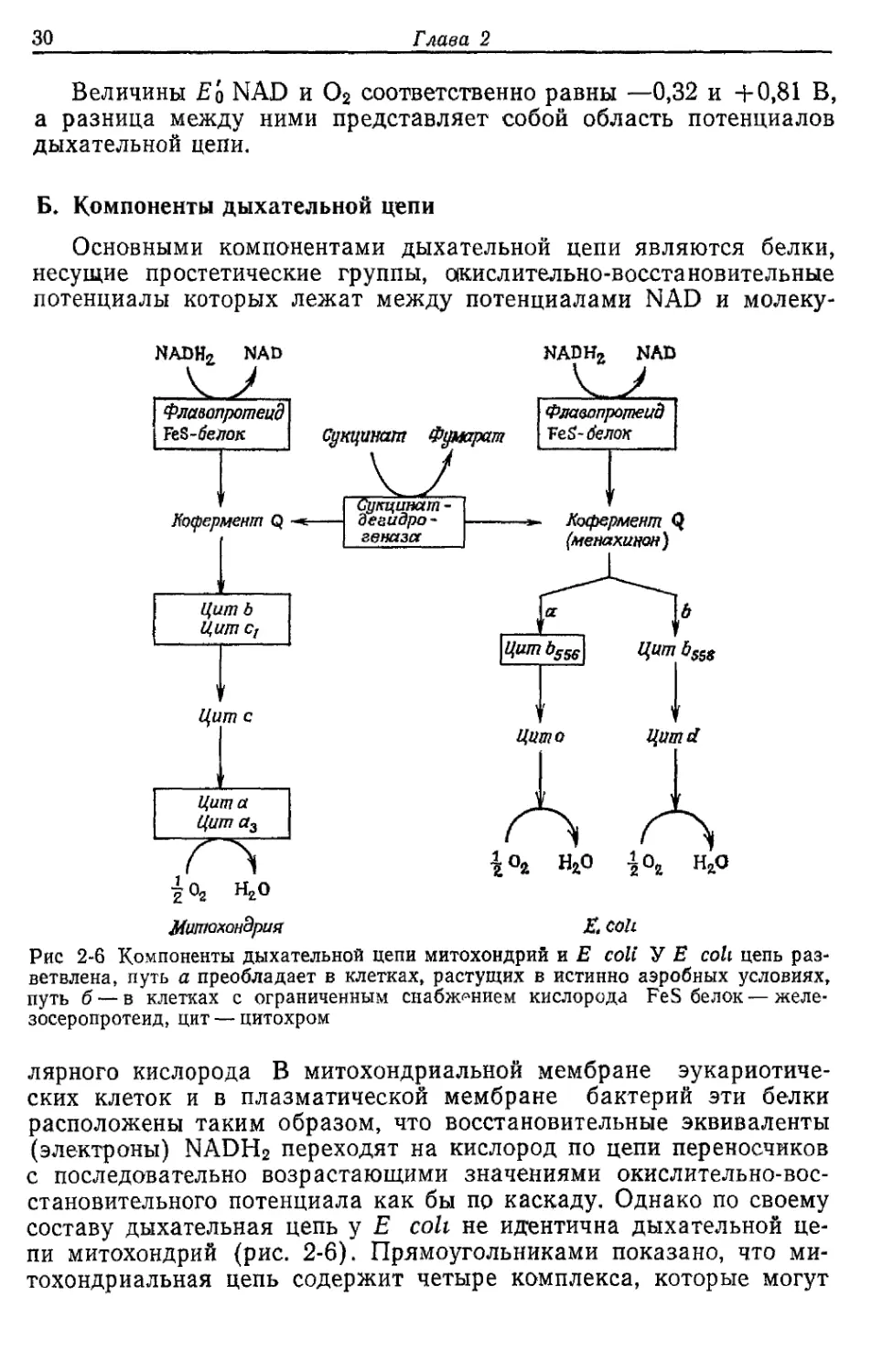
Б. Компоненты дыхательной цепи
Основными компонентами дыхательной цепи являются белки,
несущие простетические группы, окислительно-восстановительные
потенциалы которых лежат между потенциалами NAD и молеку-
NADHZ NAD
NADHZ NAD
Флаболротеид
FeS-беЛок
Сукцинат Фумарат
Флавопротеид
FeS-белок
Кофермент Q
Сукцинат -
Ьеаидро~
геназа
Цит b
Цит С/
Цит с
Цит а
Цит а3
2 ^0
Кофермент Q
(менакинон)
Митохондрия £, coh
Рис 2-6 Компоненты дыхательной цепи митохондрий и Е coll У Е coll цепь раз-
ветвлена, путь а преобладает в клетках, растущих в истинно аэробных условиях,
путь б — в клетках с ограниченным снабжением кислорода FeS белок—желе-
зосеропротеид, цит — цитохром
лярного кислорода В митохондриальной мембране эукариотиче-
ских клеток и в плазматической мембране бактерий эти белки
расположены таким образом, что восстановительные эквиваленты
(электроны) NADH2 переходят на кислород по цепи переносчиков
с последовательно возрастающими значениями окислительно-вос-
становительного потенциала как бы по каскаду. Однако по своему
составу дыхательная цепь у Е colt не идентична дыхательной це-
пи митохондрий (рис. 2-6). Прямоугольниками показано, что ми-
тохондриальная цепь содержит четыре комплекса, которые могут
Как Е. coli синтезирует АТР при аэробном росте на средах с глюкозой 31
СНОН
СНОП
CHxOPOjHj
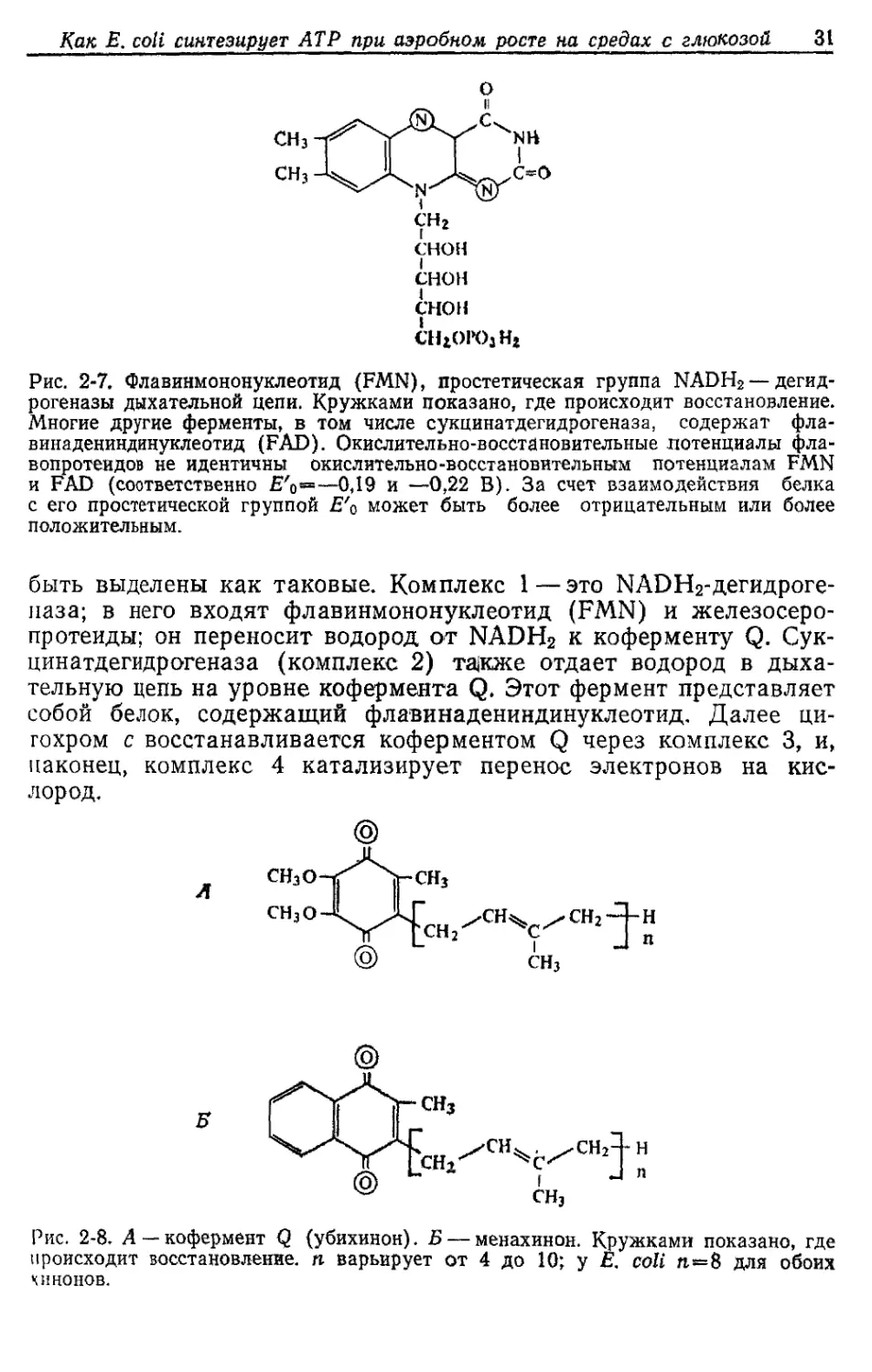
Рис. 2-7. Флавинмононуклеотид (FMN), простетическая группа NADH2 —дегид-
рогеназы дыхательной цепи. Кружками показано, где происходит восстановление.
Многие другие ферменты, в том числе сукцинатдегидрогеназа, содержат фла-
винадениндинуклеотид (FAD). Окислительно-восстановительные потенциалы фла-
вопротеидов не идентичны окислительно-восстановительным потенциалам FMN
и FAD (соответственно Е'й=—0,19 и —0,22 В). За счет взаимодействия белка
с его простетической группой Е'о может быть более отрицательным или более
положительным.
быть выделены как таковые. Комплекс 1—это NADH2-дегидроге-
наза; в него входят флавинмононуклеотид (FMN) и железосеро-
протеиды; он переносит водород от NADH2 к коферменту Q. Сук-
цинатдегидрогеназа (комплекс 2) также отдает водород в дыха-
тельную цепь на уровне кофермента Q. Этот фермент представляет
собой белок, содержащий флавинадениндинуклеотид. Далее ци-
гохром с восстанавливается коферментом Q через комплекс 3, и,
наконец, комплекс 4 катализирует перенос электронов на кис-
лород.
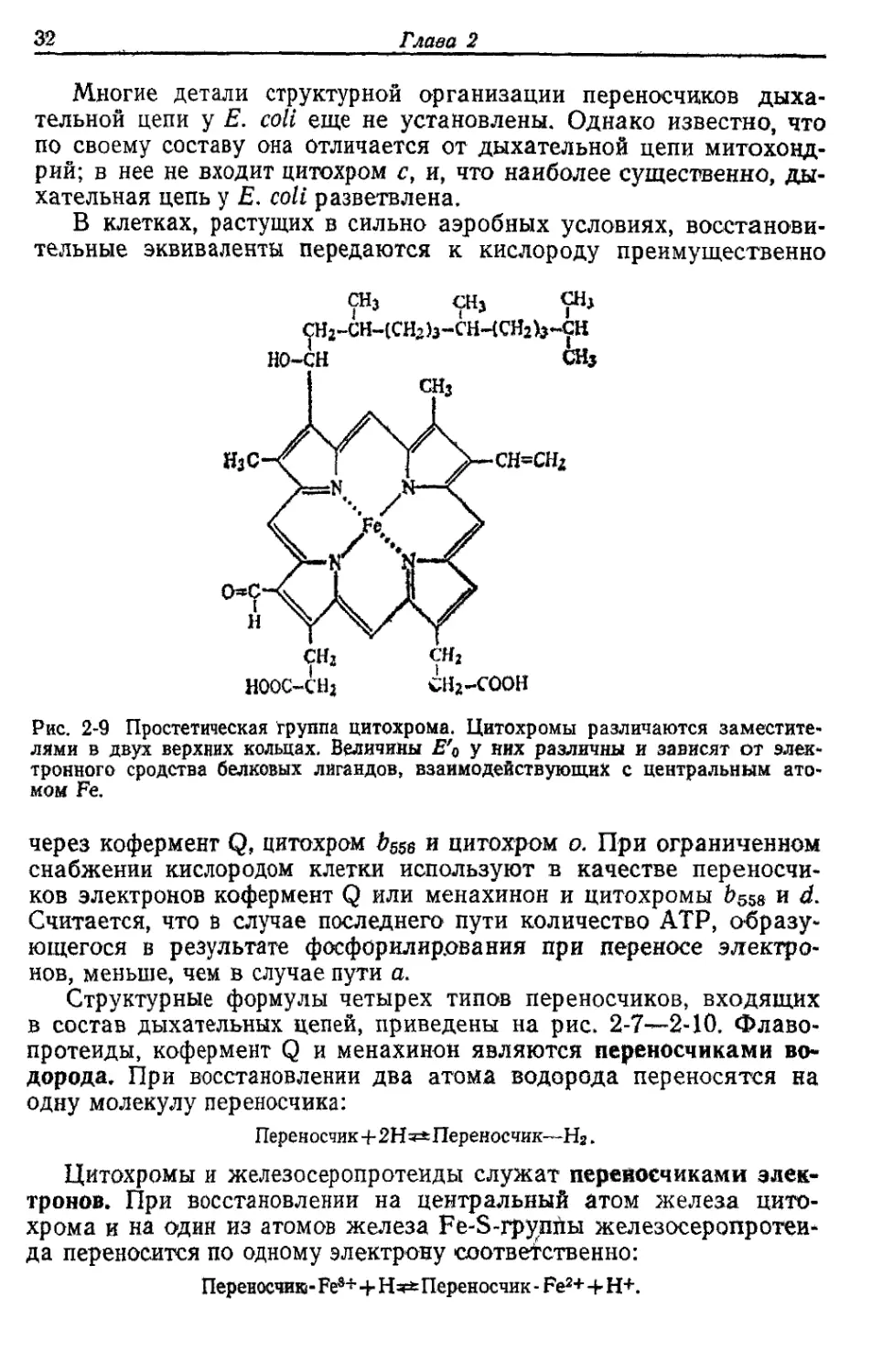
Рис. 2-8. А — кофермент Q (убихинон). Б — менахинон. Кружками показано, где
происходит восстановление, п варьирует от 4 до 10; у Е. coli п=8 для обоих
хинонов.
32
Глава 2
Многие детали структурной организации переносчиков дыха-
тельной цепи у Е. coli еще не установлены. Однако известно, что
по своему составу она отличается от дыхательной цепи митохонд-
рий; в нее не входит цитохром с, и, что наиболее существенно, ды-
хательная цепь у Е. coli разветвлена.
В клетках, растущих в сильно аэробных условиях, восстанови-
тельные эквиваленты передаются к кислороду преимущественно
сн3 сн3 снд
сн2-снчсн3)з-снчсн2ъ-ак
НО-СН CHj
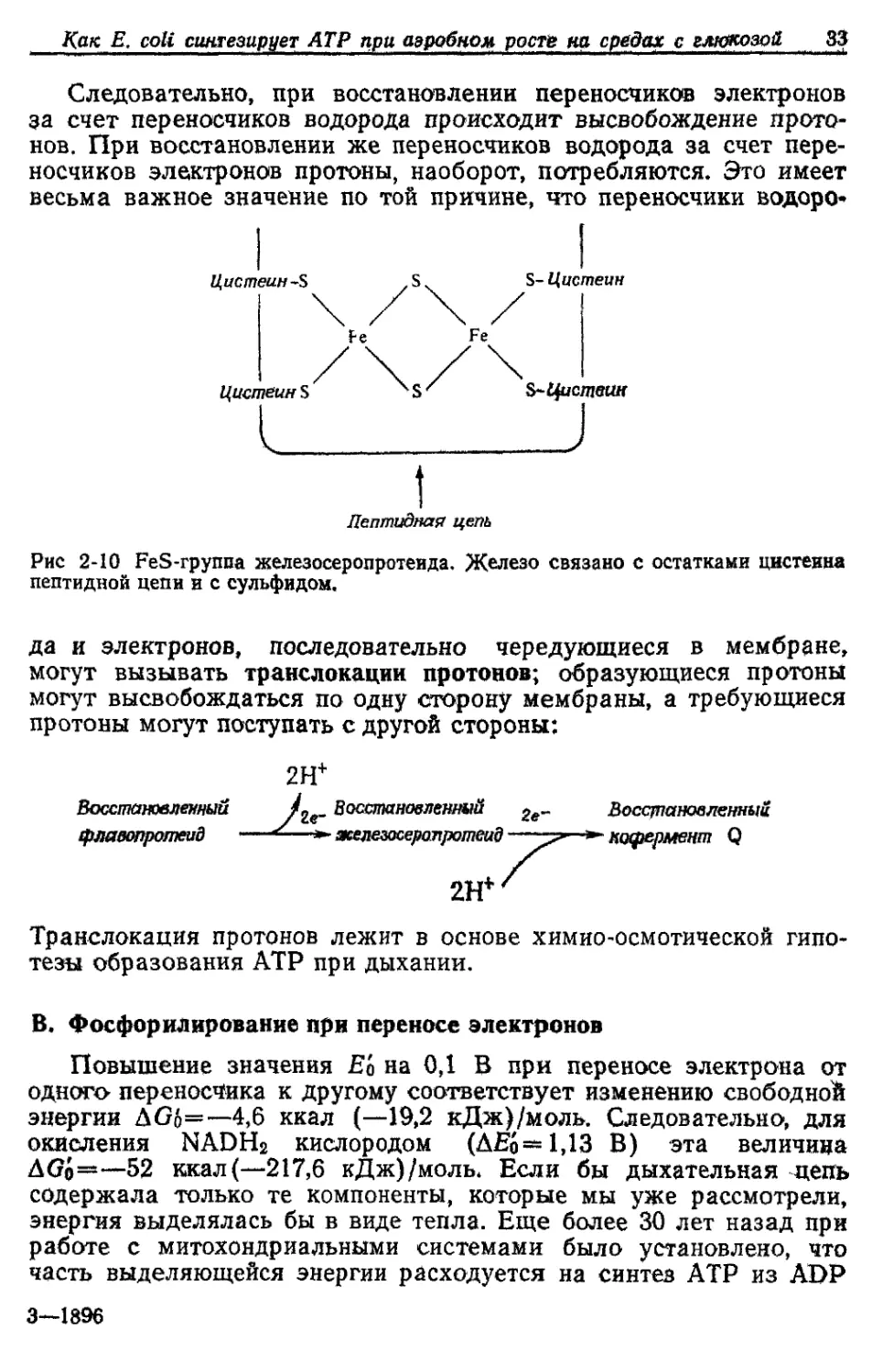
Рис. 2-9 Простетическая Группа цитохрома. Цитохромы различаются заместите-
лями в двух верхних кольцах. Величины Е'о у них различны и зависят от элек-
тронного сродства белковых лигандов, взаимодействующих с центральным ато-
мом Fe.
через кофермент Q, цитохром ^5б и цитохром о. При ограниченном
снабжении кислородом клетки используют в качестве переносчи-
ков электронов кофермент Q или менахинон и цитохромы Ь558 и d.
Считается, что в случае последнего пути количество АТР, образу-
ющегося в результате фосфорилирования при переносе электро-
нов, меньше, чем в случае пути а.
Структурные формулы четырех типов переносчиков, входящих
в состав дыхательных цепей, приведены на рис. 2-7—2-10. Флаво-
протеиды, кофермент Q и менахинон являются переносчиками во-
дорода, При восстановлении два атома водорода переносятся на
одну молекулу переносчика:
Переносчик+2Н** Переносчик—Н2.
Цитохромы и железосер опротеиды служат переносчиками элек-
тронов. При восстановлении на центральный атом железа цито-
хрома и на один из атомов железа Fe-S-групйы железосеропротеи*
да переносится по одному электрону соответственно:
Переносчик- Fes++Переносчик - Fe2+ 4- Н+.
Как Е. coli синтезирует АТР при аэробном росте на средах с глюкозой 33
Следовательно, при восстановлении переносчиков электронов
за счет переносчиков водорода происходит высвобождение прото-
нов. При восстановлении же переносчиков водорода за счет пере-
носчиков электронов протоны, наоборот, потребляются. Это имеет
весьма важное значение по той причине, что переносчики водоро-
Пептидная цепь
Рис 2-10 FeS-группа железосеропротеида. Железо связано с остатками цистеина
пептидной цепи и с сульфидом.
да и электронов, последовательно чередующиеся в мембране,
могут вызывать транслокации протонов; образующиеся протоны
могут высвобождаться по одну сторону мембраны, а требующиеся
протоны могут поступать с другой стороны:
2Н+
Восстановленный Восстановленный 2е- Восстановленный
флавопротеид - S яселееосеронротеид—» кофермент Q
2Н*'
Транслокация протонов лежит в основе химио-осмотической гипо-
тезы образования АТР при дыхании.
В. Фосфорилирование при переносе электронов
Повышение значения Ео на 0,1 В при переносе электрона от
одного- переносчика к другому соответствует изменению свободной
энергии Д66=—4,6 ккал (—19,2 кДж)/моль. Следовательно, для
окисления NADH2 кислородом (Af6—1,13 В) эта величина
Д(?о——52 ккал(—217,6 кДж)/моль. Если бы дыхательная цепь
содержала только те компоненты, которые мы уже рассмотрели,
энергия выделялась бы в виде тепла. Еще более 30 лет назад при
работе с митохондриальными системами было установлено, что
часть выделяющейся энергии расходуется на синтез АТР из ADP
3—1896
34
Глава 2
и неорганического фосфата. Этот процесс называется окислитель-
ным фосфорилированием, или фосфорилированием при переносе
электронов. Впервые его продемонстрировали Калькар и Белицер,
работая со срезами печени и мышечной ткани. Фосфорилирование
при переносе электронов in vitro исследовать очень трудно, так
как при получении субклеточных фракций растворимые компонен-
ты легко отделяются от связанной с матриксом дыхательной цепи.
Следовательно, для реконструкции цепи, способной одновременно
катализировать окисление NADH2 и эффективное фосфорилирова-
ние при переносе электронов, необходимы самые тонкие методы.
Работы Грина, Рэкера, Ленинджера, Чанса и некоторых других
исследователей показали, что в дыхательной цепи митохондрий
существует три пункта фосфорилирования. Следовательно, на каж-
дые два электрона, перенесенных с NADH2 на кислород, могут
фосфорилироваться три молекулы ADP. Число молекул ADP, фос-
форилированных в расчете на один атом кислорода, часто выра-
жают как отношение P/О; в митохондриальной дыхательной цепи
оно равно трем, если донором электронов служит NADH2, и двум,
если роль донора электронов выполняет FADH2. Известны даже
пункты образования АТР: дегидрирование NADH2, окисление ци-
тохрома b и окисление цитохрома а (рис. 2-6).
Дыхательная цепь бактерий, по-видимому, еще более чувстви-
тельна к тем воздействиям, с которыми неизбежно сопряжены
процессы ее выделения. В результате, будучи выделенными, суб-
клеточные фракции часто почти полностью утрачивают способ-
ность к сопряжению переноса электронов с фосфорилированием
ADP, Первые значения отношения P/О, устанавливаемые при изу-
чении бактериальных систем, были, как правило, меньше 1. По-
этому считалось, что фосфорилирование при переносе электронов
у бактерий менее эффективно, чем в митохондриях. С развитием
улучшенных методов, значительно предотвращающих повреждения
структуры частиц и предусматривающих дополнительное внесение
утрачиваемых растворимых факторов, для многих бажтерий уда-
лось получить отношение Р/О>2. Следовательно, есть основания
думать, что по крайней мере некоторые аэробные бактерии спо-
собны окислять NADH2 через дыхательную цепь с отношением
P/О, равным 3. Для Е. coli эта величина, по-видимому, составля-
ет 2, а пунктами фосфорилирования (образования АТР) являют-
ся дегидрирование NADH2 и окисление одного из цитохромов.
Как же тогда синтезируется АТР? Несмотря на большие уси-
лия, сделанные за многие годы во многих лабораториях, точный
механизм фосфорилирования при переносе электронов изучен еще
далеко не полностью. Поток водорода и электронов по дыхатель-
ной цепи способен создавать обогащенное энергией состояние
(«~») двух или трех компонентов цепи, которые при возвращении
в нормальное состояние могут поставлять энергию для синтеза
АТР (рис. 2-11).
Как E. coli синтезирует АТР при аэробном росте на средах с глюкозой 35
NADHa
Дыхательная цепь
ЗАТР
или
NADHa
Дыхательная цепь
2 ADP+ 2Р,
2 АТР
3 ADP + ЗР[
Рис. 2-11 Поток электронов от NADH2 к кислороду создает энергизованное со-
стояние компонентов дыхательной цепи.
Следовательно, возникает вопрос: что же такое «~»? В от-
ношении дыхательной цепи митохондрий было высказано три ги-
потезы.
1. Гипотеза химического сопряжения. Эта гипотеза, предложенная
Ленинджером, использует в качестве моделей хорошо известные
ферментативные реакции. Как показано на рис. 2-12, окисление
переносчика (А) в дыхательной цепи сопряжено с образованием
связи (A~J) с высокой энергией гидролиза. Реакции такого типа
известны на примерах реакций, катализируемых 3-фосфоглицераль-
дегид—дегидрогеназой и пируватдегидрогеназой. При последую-
щих трансферазных реакциях переносчик А регенерируется и об-
разуется фосфорилированный фермент (Е~Р), который в конце
концов и фосфорилирует ADP в АТР.
2. Механо-химическая, или конформационная, гипотеза сопряже-
ния. Превращение химической работы (гидролиз АТР) в механи-
ческую хорошо известно из исследований мышечного сокращения,
а в фосфорилировании при переносе электронов, вероятно, может
иметь место обратный процесс: перетекание электронов по дыха-
тельной цепи способно привести к конформационным изменениям
некоторых компонентов цепи, а результатом их возвращения из
напряженного, энергизованного, состояния к нормальному может
быть одновременное образование АТР из ADP и Pi. И действи-
тельно, можно наблюдать изменения митохондриального объема.
з*
Глава 2
ADP АТР
Рис. 2-12. Гипотеза химического сопряжения. При переносе электронов от пере-
носчика А к переносчику В соединение J реагирует с А с образованием высоко-
энергетического соединения A~J В результате трансферазной реакции между Е
и A~J образуются А и E~J. Затем J замещается неор!аническим фосфатом
И наконец, Е~Р фосфорилирует ADP с образованием АТР.
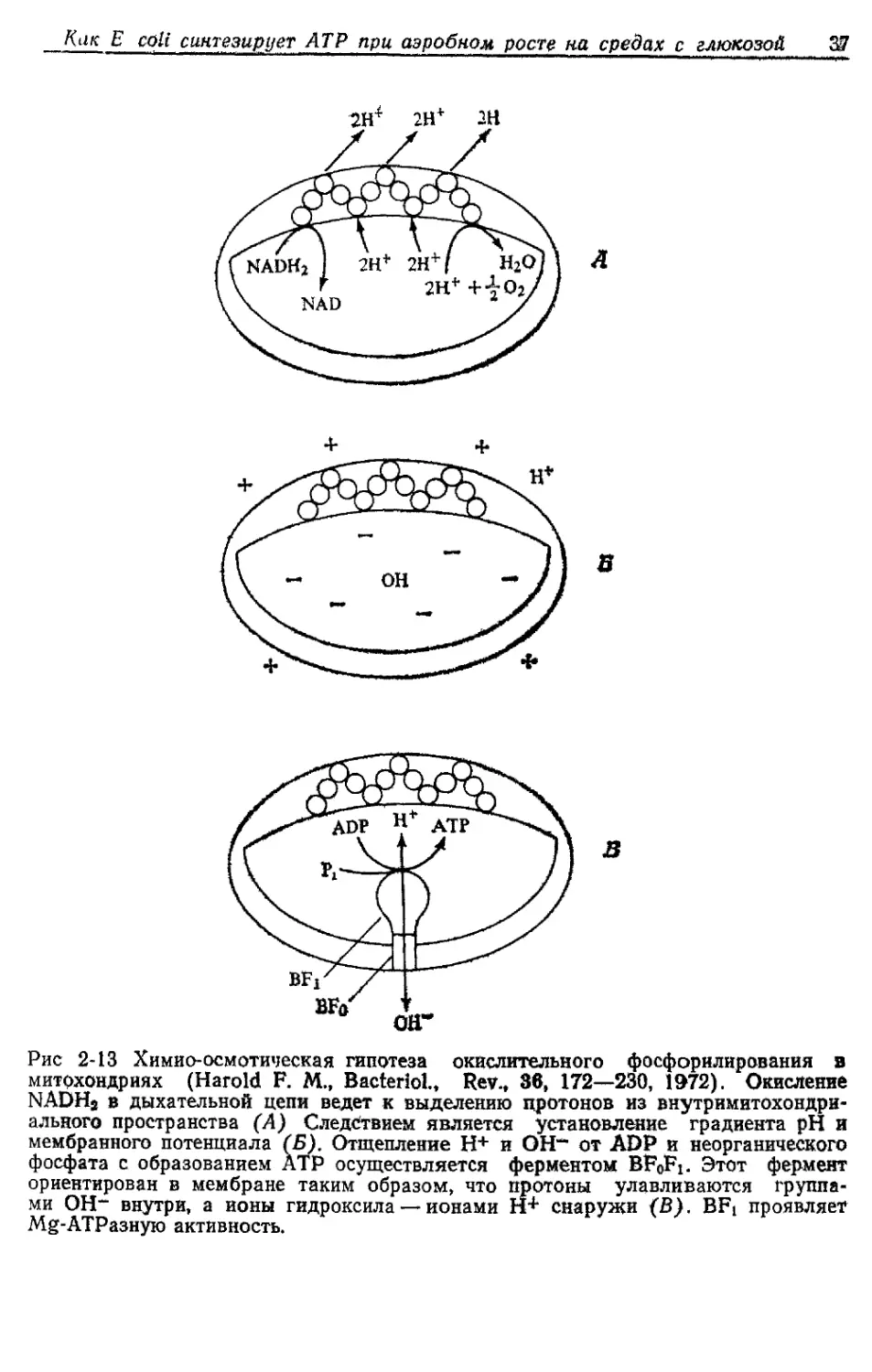
3. Химио-осмотическая гипотеза. В 1961 г. Митчелл предложил
свою весьма привлекательную гипотезу. Предполагается, что
1) мембрана, в которой локализована дыхательная цепь, непро-
ницаема для ОН- и Н+; 2) дыхательная цепь локализована в
мембране таким образом, что в результате направленных опреде-
ленным образом актов извлечения протонов и их выброса в среду
при переносе электронов создаются градиент pH и мембранный
потенциал, и 3) АТРаза так удачно устроена, что может способ-
ствовать возникновению протонодвижущей силы (сумма химиче-
ского градиента протонов и мембранного потенциала). Гипотеза
Митчелла проиллюстрирована на рис. 2-13. Уже упоминалось, что
чередующиеся последовательности переносчиков водорода и элек-
тронов способны вызывать транслокации протонов. Предполага-
ется, что переносчики так организованы в мембране, что образуют
петли, в которых переносчики электронов обращены К наружной,
а переносчики водорода — к внутренней стороне мембраны
(рис. 2-13,А). При окислении NADH2 возникают градиент pH и
мембранный потенциал (рис 2-13,Б). Это делает возможным син-
тез АТР из ADP и неорганического фосфата на ферменте (BFqFi),
ориентированном в мембране таким образом, что образующиеся
Как Е coli синтезирует АТР при аэробном, росте на средах с глюкозой 37
Рис 2-13 Химио-осмотическая гипотеза окислительного фосфорилирования в
митохондриях (Harold F. М., Bacterlol., Rev., 36, 172—230, 1R72). Окисление
NADHj в дыхательной цепи ведет к выделению протонов из внутримитохондри-
ального пространства (А) Следствием является установление градиента pH и
мембранного потенциала (Б). Отщепление Н+ и ОН“" от ADP и неорганического
фосфата с образованием АТР осуществляется ферментом BF0Fi. Этот фермент
ориентирован в мембране таким образом, что протоны улавливаются группа-
ми ОН~ внутри, а ионы гидроксила — ионами Н+ снаружи (В). BFt проявляет
Mg-АТРазную активность.
за
Гелла 2
Рис. 2-14. Функциональная организация компонентов дыхательной цепи Ef coll
(Haddock В. A., Jones С. W., Bacteriol. Rev., 41, 47—99, 1977). На этой схеме не
показана ветвь с цитохромами &55в и d, обусловливающая меньший выход АТР
(см. рис. 2-6).
протоны улавливаются ОН_-группами внутри, а образовавшиеся
гидроксильные ионы «выбрасываются» наружу (рис. 2-13, В)
BFoFi
ADP+Pi------->АТР + Н+| + ОН-|.
Фермент BF0Fi состоит из двух компонентов: BFo, который
встроен в мембрану, и BFb /который связан с BF0. Компонент BFi
называют также сопрягающим фактором. Он может быть выделен
из мембраны и проявляет АТРазную активность, зависимую от
ионов магния.
Функциональная организация окислительно-восстановительных
переносчиков в дыхательной цепи Е. coli, предложенная Хэддоком
и Джонсом, схематически показана на рис. 2-14. Как видно из
рисунка, в этой цепи имеется только два пункта, в которых про-
исходит «выброс» протонов, а не три, как в случае митохондри-
альной цепи. Следовательно, соотношение P/О для дыхательной
цепи Е. coli может составлять только 2.
В свете наших знаний относительно механизмов реакций, ка-
тализируемых ферментами, гипотеза химического сопряжения ка-
Как Е colt синтезирует АТР при аэробном росте на средах с глюкозой 89
жется вполне правомочной. Однако в этой гипотезе не отводится
никакого места функциональному значению мембраны. Кроме то-
го, постулируемые богатые энергией промежуточные соединения
(А~J; E~J) никогда не были обнаружены. Конформационное
сопряжение отчасти связано с химическим сопряжением, но оно
заменяет определенное промежуточное соединение (A~J) богатым
энергией конформационным состоянием. Химио-осмотическая ги-
потеза приписывает важную роль мембране (градиент pH, мемб-
ранный потенциал) и предполагает наличие связанной с мембра-
ной АТРазы, которая действительно присутствует в митохондриях
и бактериях.
Следует отметить, что большинство экспериментов, касающих-
ся механизма фосфорилирования при переносе электронов, было
проведено с митохондриальными системами. Однако в связи с
большим сходством между дыхательной цепью митохондрий и бак-
териальной клетки представляется вероятным, что механизм фос-
форилирования при переносе электронов в бактериях и в мито-
хондриях в основном одинаков. Кроме того, высказывались пред-
положения, что митохондрии эукариотических клеток произошли
в процессе эволюции из микробов-симбионтов. Если это верно,
то это лишь подтверждает предположение о сходстве между ме-
ханизмами фосфорилирования при переносе электронов в мито-
хондриях и бактериях.
Г. Разобщители и ингибиторы
В растущих клетках Е. coli окисление NADH2 и фосфорилиро-
вание ADP — процессы сопряженные. При получении субклеточ-
ных фракций способность к такому сопряжению в значительной
степени утрачивается. В результате отношение P/О оказывается
низким и количество АТР, образующегося при окислении NADH2,
уменьшается. In vivo это разобщение также может быть достиг-
нуто добавлением некоторых соединений к клеточным суспензиям.
Классическим разобщающим агентом, предложенным Лумисом и
Липманом, служит 2,4-динитрофенол. В присутствии 2,4-динитро-
фенола глюкоза окисляется почти полностью, но образования АТР
при этом не происходит, а следовательно, не может происходить
и синтеза клеточного материала. В отсутствие 2,4-динитрофенола
около 50% углерода глюкозы освобождается в виде СО2, а остав-
шиеся 50% расходуются на построение клеточного материала:
Рост
С6Н12О6+ЗО2 -------> Клеточный материал + ЗСО2+ЗН2О,
Динитрофенол
С6н12о6+6О2-------->- 6СО2 + 6Н2О.
Некоторые ^красители, например метиленовая синь, могут за-
менять кислород в качестве акцепторов электронов, что делает
40
Глава 2
возможным окисление органических соединений в СО2 в отсутст-
вие кислорода. Метиленовая синь акцептирует водород от флаво-
протеидов, восстанавливаясь при этом в лейкоформу:
Метиленовая синь
(СНЭ)2Ы
+ н+
N(CH3)2
Лейкоформа
Время, необходимое для восстановления определенного коли-
чества метиленовой сини, использовалось как мера способности
отмытых клеточных суспензий Е. coli окислять глюкозу и другие
органические субстраты (метод Тунберга).
Антибиотик олигомицин ингибирует окислительное фосфорили-
рование и, следовательно, блокирует дыхание, когда оно сопряже-
но с фосфорилированием ADP (в присутствии разобщителя оли-
гомицин не ингибирует дыхания).
Соединения, подобные азиду, цианиду, СО и некоторым бар-
битуратам, ингибируют перенос водорода или электронов в одной
или более точках дыхательной цепи. Все эти агенты послужили
ценными инструментами для изучения дыхания и фосфорилирова-
ния при переносе электронов.
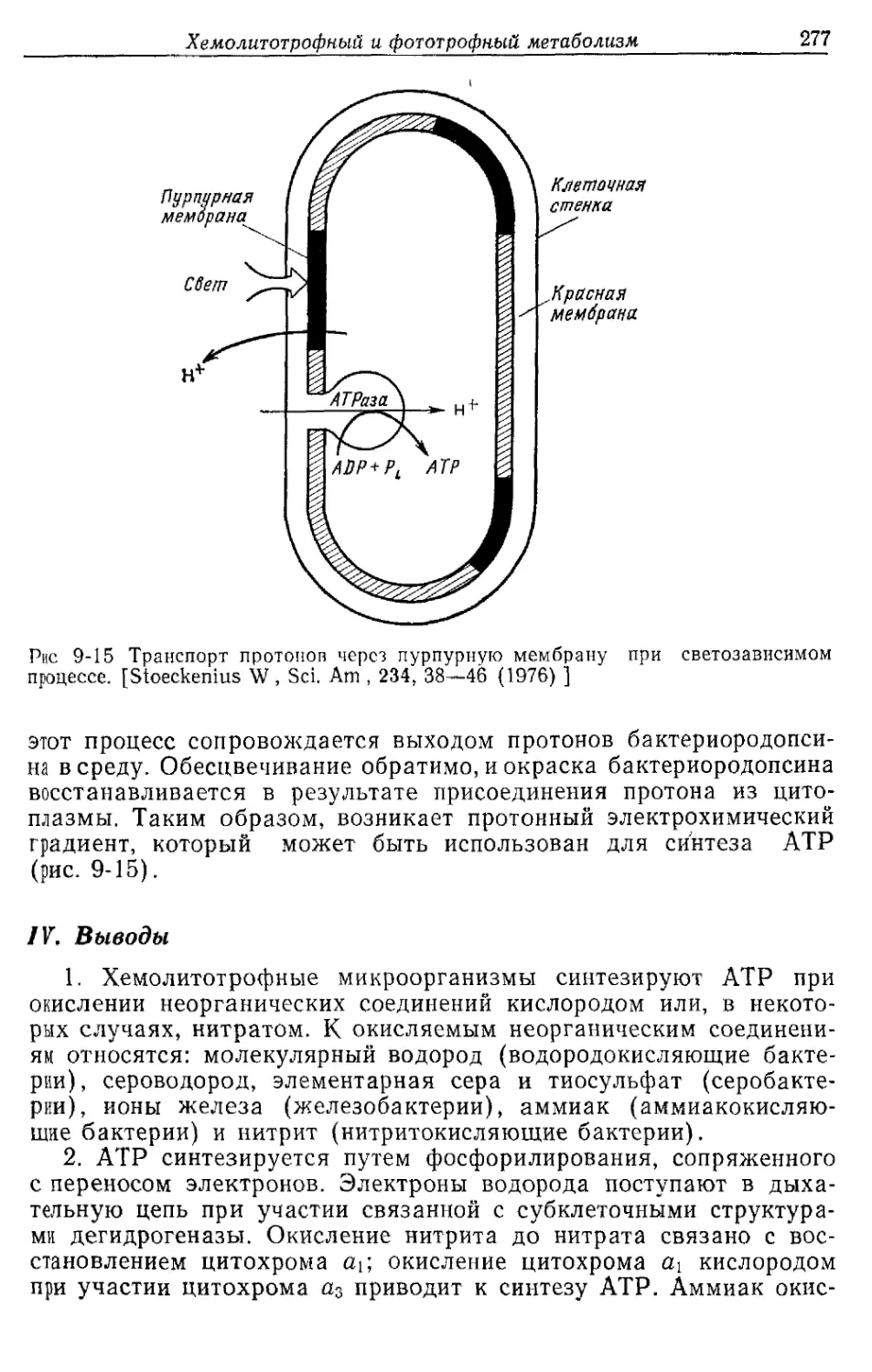
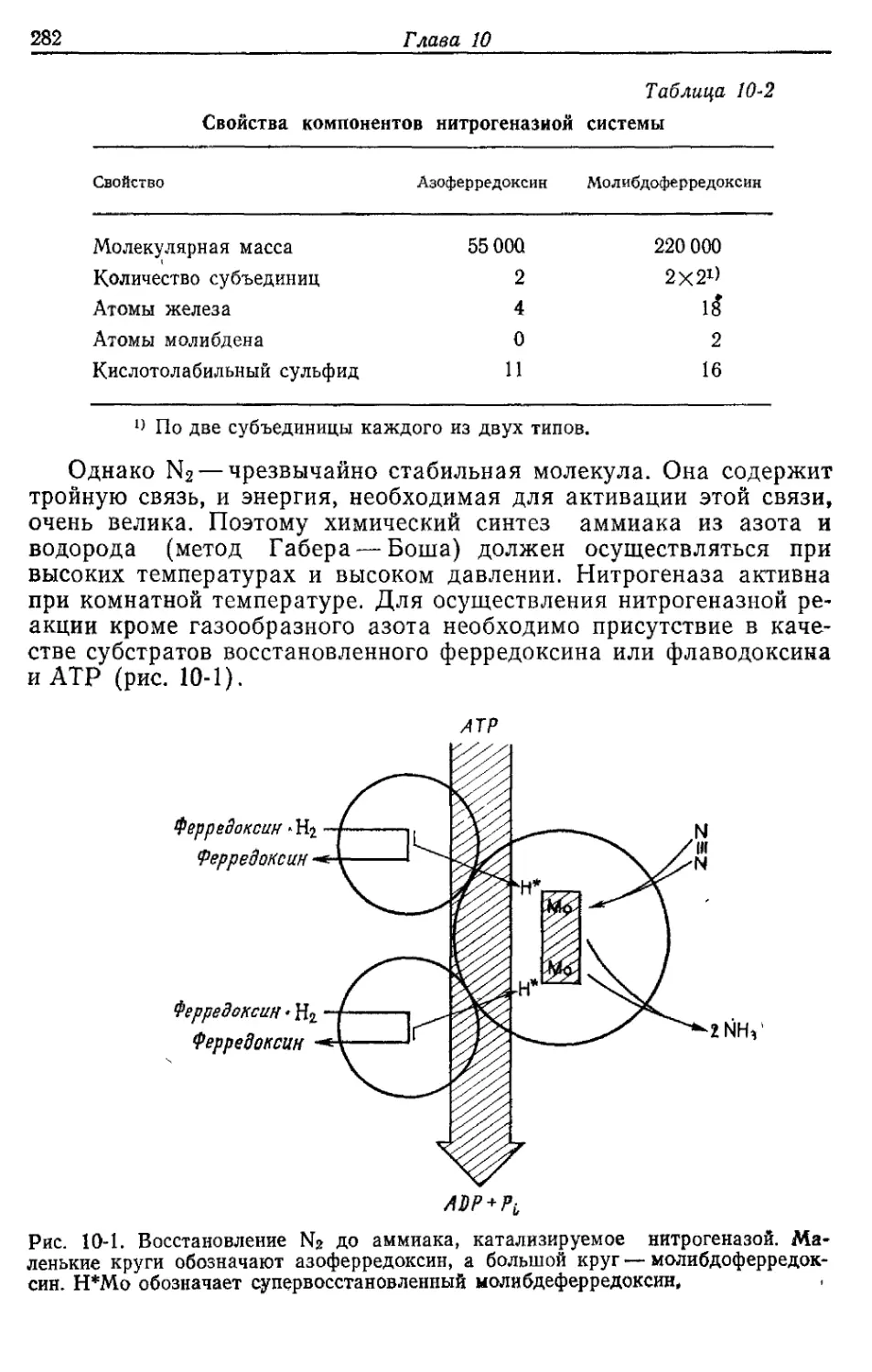
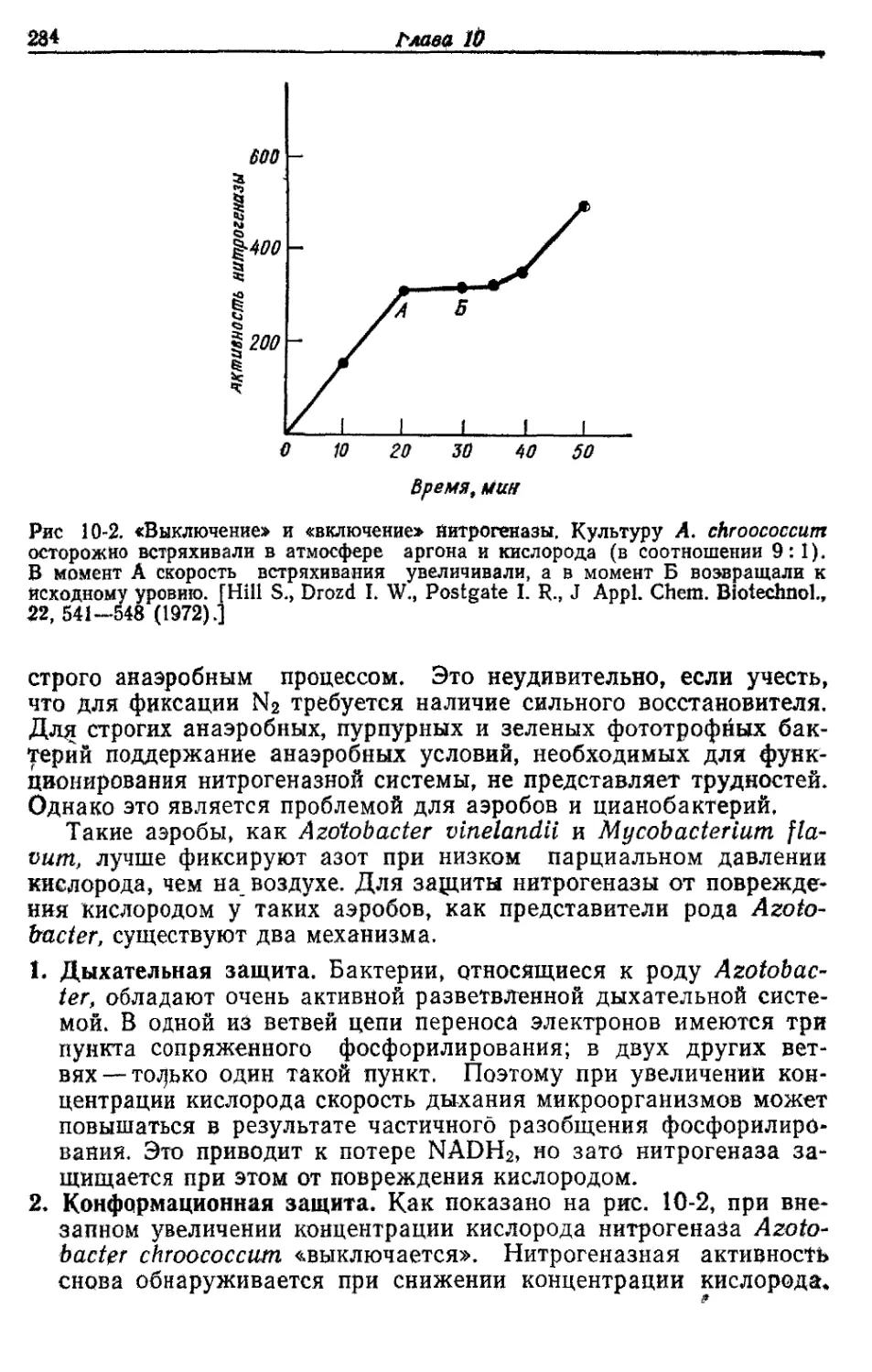
Д. Значение пероксид-дисмутазы
Кислород в концентрации, превышающей его концентрацию в
воздухе, токсичен для многих аэробных микроорганизмов. Обли-
гатные анаэробы, такие, как клостридии и метанобразующие бак-
терии, погибают при контакте с воздухом. В течение некоторого
времени такое повреждающее действие кислорода связывали ис-
ключительно с накоплением продукта его восстановления — пере-
киси водорода (Н2О2), образующейся всякий раз, когда активи-
рованный водород восстановленных флавопротеидов или восста-
новленных железосеропротеидов соединяется с кислородом и ок-
сидазами, которые имеются во всех организмах.
Оксидаза
FADH2+O2---------► FAD+H2O2. '
Поэтому у аэробов имеется каталаза, превращающая Н2О2 в
кислород и воду:
Каталаза
2Н2О2 --------»- 2Н2О+О2.
Как Ё. coli синтезирует АТР при аэробном росте на средах с глюкозой 41
Каталаза действительно играет очень важную роль. -Однако в на-
стоящее время установлено, что в биологических системах из кис-
лорода возникает еще более токсичное соединение, чем Н2О2. Это
соединение — перекисный радикал (О2), образующийся при одно-
валентном восстановлении кислорода восстановленными флавина-
ми, хинонами или другими переносчиками электронов. Е. coli и
все аэробные, а также аэротолерантные микроорганизмы содер-
жат фермент — пероксид-дисмутазу, которая превращает этот ра-
дикал в Н2О2 и О2<
Пероксид-дисмутаза
О, Оа 2Н+ * Н2О2+О2
Пер оксид-дисмутаза у Е. coli— красйый, содержащий марганец
белок, тогда как у млекопитающих этот фермент содержит медь
или цинк.
VI. Выводы
1. Escherichia coli содержит фосфоенолпируват-фосфотрансфер-
азную систему, обеспечивающую поступление в клетки глюкозы.
Транспорт этого сахара в клетку сопряжен с его фосфорилирова-
нием в глюкозо-6-фосфат.
2. Глюкозо-6-фосфат расщепляется до пирувата по пути Эмб-
дена— Мейергофа — Парнаса. Ключевым промежуточным продук-
том этого пути является фруктозо-1,6-бисфосфат. При превраще-
нии глюкозо-6-фосфата в пируват для фосфофруктокиназной ре-
акции требуется АТР; образование АТР происходит в реакциях,
катализируемых 3-фосфоглицераткиназой и пируваткиназой.
3. Окислительное декарбоксилирование пирувата в ацетил-СоА
осуществляется пируватдегидрогеназным комплексом. Этот комп-
лекс состоит из трех ферментов: пируватдегидрогеназы, дигидро-
липоил-трансацетилазы, которая переносит ацетильный остаток на
кофермент А, и дигидролипоил-дегидрогеназы, которая переносит
водород от фермента 2 на NAD,
4. Ацетил-СоА окисляется в цикле трикарбоновых кислот. При
этом происходит образование NADPH2 в изоцитратдегидрогеназ-
ной реакции, NADH2 в а-оксоглутаратдегидрогеназной и малатде-
гидрогеназной реакциях и FADH2 — в сукцинатдегидрогеназной ре-
акции. АТР образуется при превращении сукцинил-СоА в сукци-
нат.
5. Дыхательные цепи Е. coli и митохондрий различны. Дыха-
тельная ' цепь Е. coli не содержит цитохрома с-типа; кроме того,
она разветвлена. Перенос двух электронов от NADH2 на кислород
сопряжен с фосфорилированием, вероятно, двух молекул ADP.
В случае дыхательной цепи митохондрий и некоторых других бак-
терий происходит образование трех молекул ADP.
42
Глава 2
6. Механизм, лежащий в основе образования АТР путем фос-
форилирования при переносе электронов, полностью не установ-
лен. Многие экспериментальные результаты свидетельствуют в
пользу химио-осмотической гипотезы Митчелла. Транспорт элек-
тронов создает в мембране протонодвижущую силу, поставляя тем
самым энергию для синтеза АТР на ферменте BF0Fi.
7. Биологическое окисление сопровождается образованием не-
больших количеств токсичного перекисного радикала О2. Под дей-
ствием пероксид-дисмутазы это соединение превращается в Н2О2
и О2.
8. Суммарное уравнение окисления глюкозы у Е. coli выглядит
следующим образом:
Глюкоза 4-8 NAD 4-2 NADP+2 FAD4-4 ADP4-4 Pi—>-
—*8 NADH24-2 NADPH2+2 FADH2+4 ATP+6 CO2.
При окислении 10 молекул NAD(P)H2 в дыхательной цепи об-
разуется максимально 20 молекул АТР, а при окислении 2 моле-
кул FADH2 — максимально 2 молекулы АТР.
Глава 3
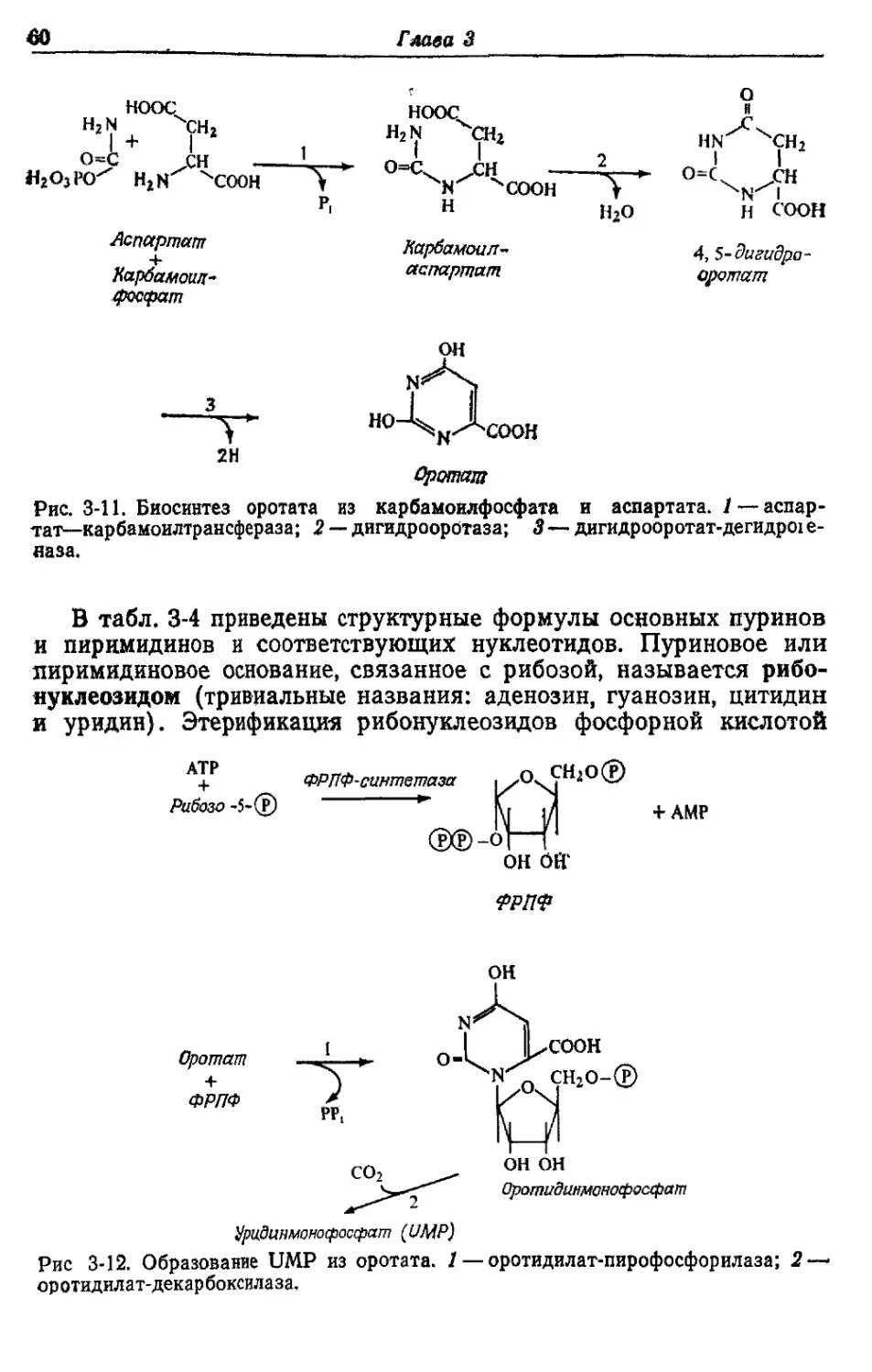
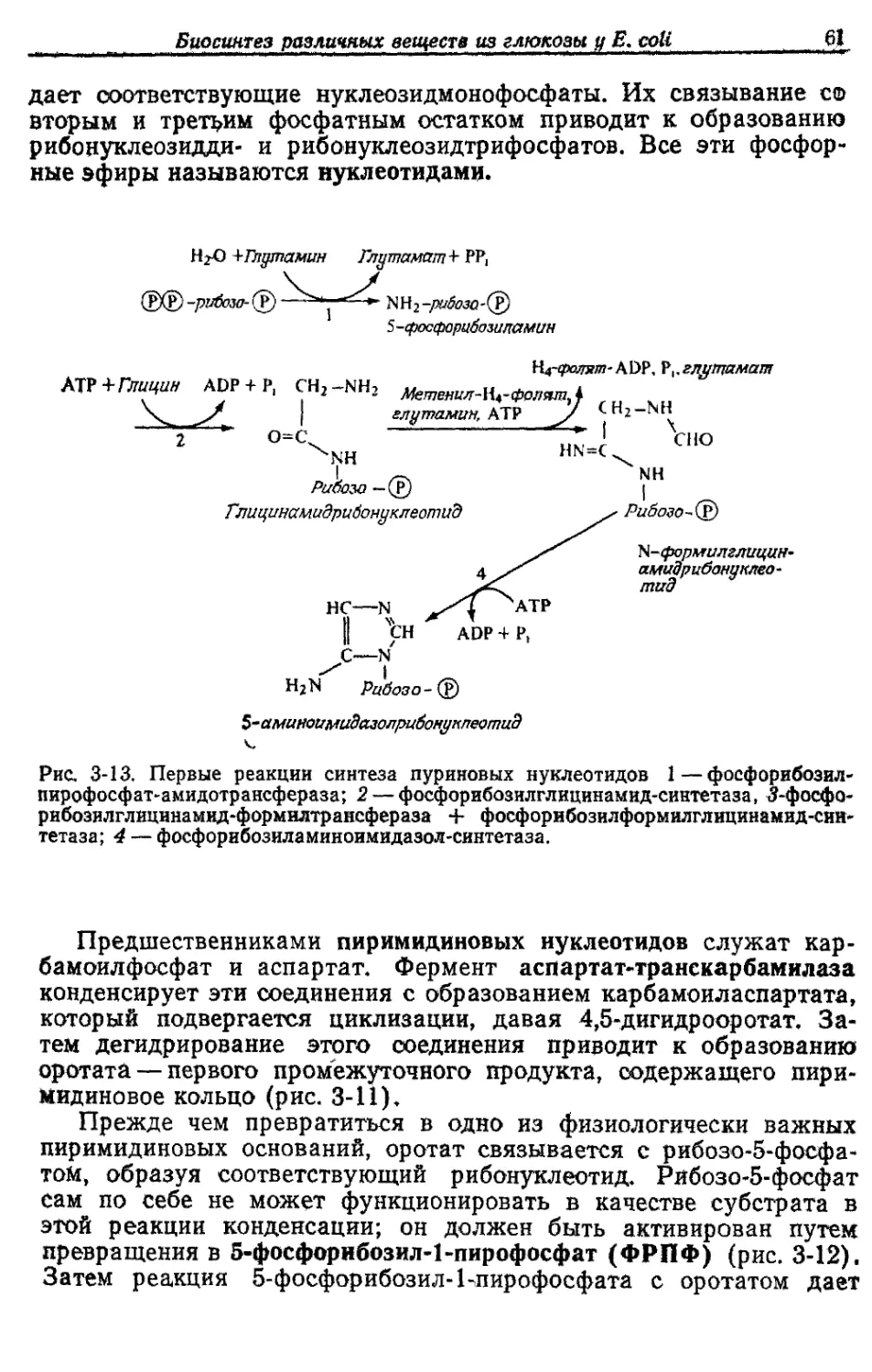
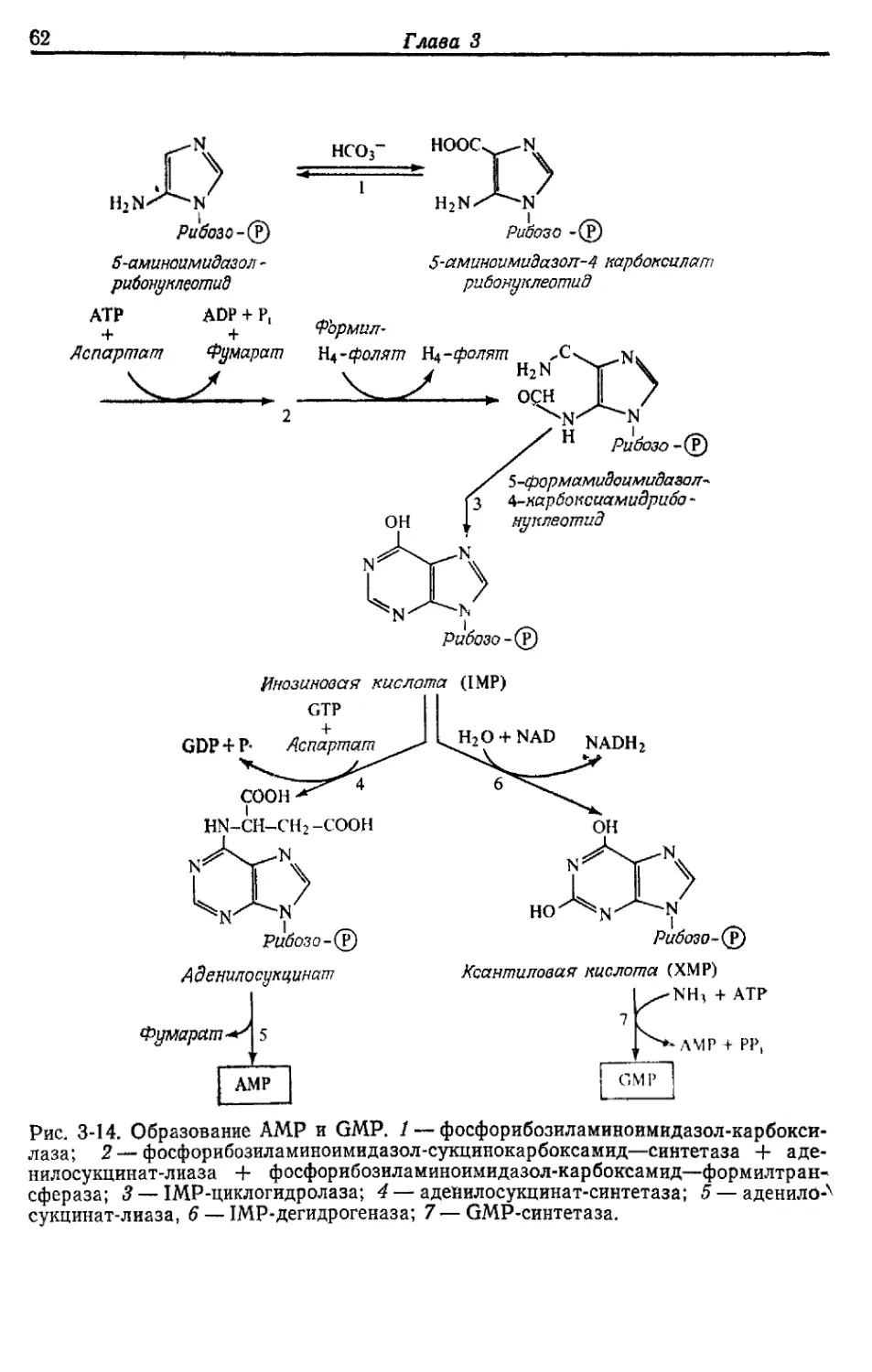
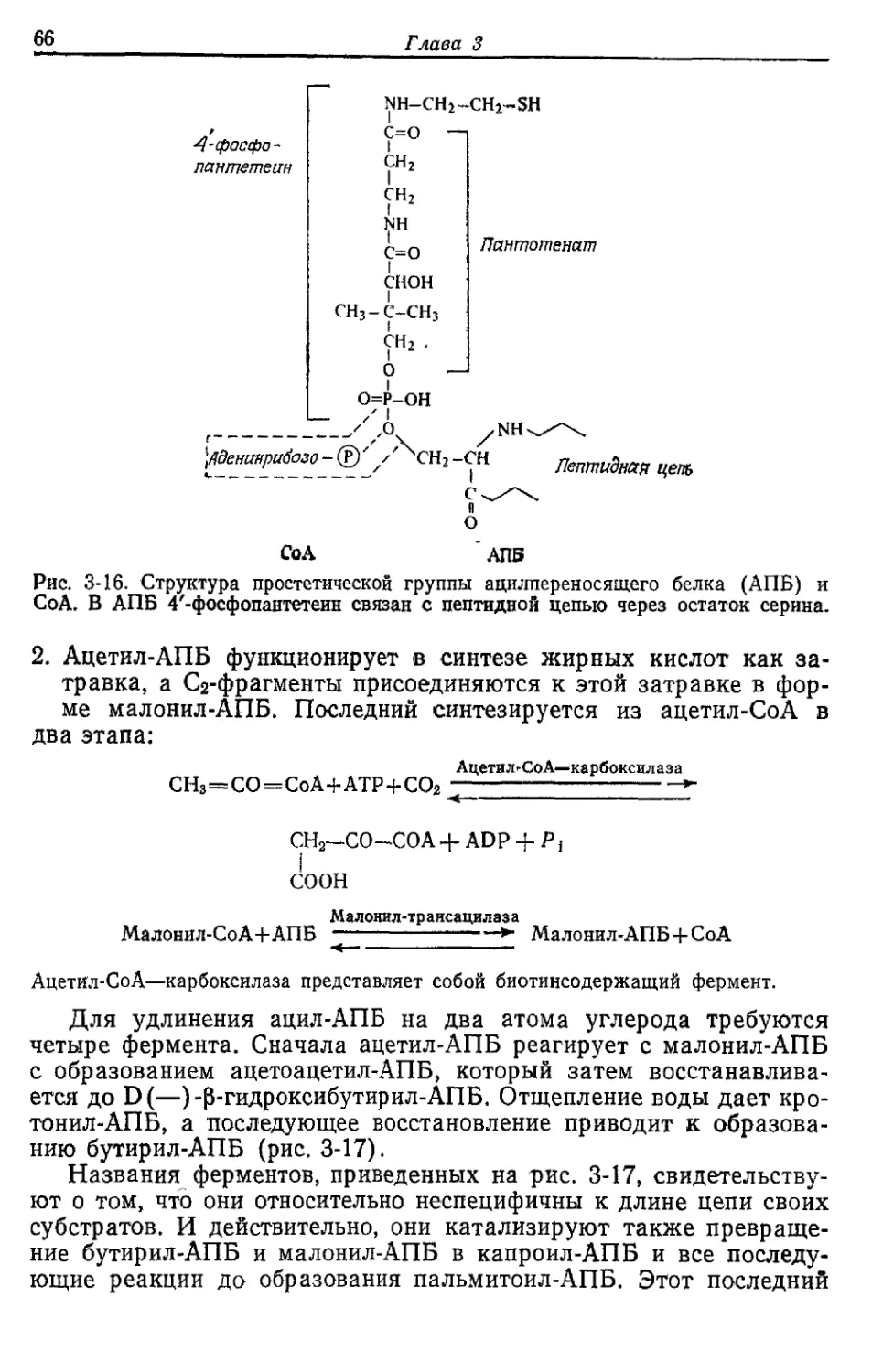
БИОСИНТЕЗ РАЗЛИЧНЫХ ВЕЩЕСТВ
ИЗ ГЛЮКОЗЫ У ESCHERICHIA COLI
Как уже отмечалось, у Е. coli, растущей в аэробных условиях
на среде с глюкозой, около 50% глюкозы окисляется до СО2, рас-
ходуясь на получение АТР. Остальные 50% превращаются в кле-
точный материал. Именно на эти превращения и уходит большая
часть АТР, образовавшегося при окислении. В этой главе мы
рассмотрим кратко основные биосинтетические реакции, участву-
ющие в синтезе клеточного материала, а также основные реакции,
идущие с затратой АТР.
/. Состав клеток Е. coli
Более 95% клеточного материала Е. coli и других микроорга-
низмов состоит из макромолекул. Типичные результаты анализа
микробных клеток приведены в табл. 3-1. На долю белков прихо-
дится примерно 52%, а на долю нуклеиновых кислот—19% мас-
сы сухого вещества. Около 3% сухого вещества клеток составляют
низкомолекулярные органические соединения и соли.
Таблица 3-1
Содержание макромолекул
в бактериальных клетках1)
Макромолекулы
Количество, г/100 г
сухих клеток
Белки 52,4
Полисахариды 16,6
Липиды 9,4
РНК 15,7
ДНК 3,2
Сумма 97,3
° Stouthamer А. Н., Anfonie van Leeuwenhoek; 39, 545—565 (1973).
Примечание: Приведены типичные данные. В действительности состав клеток
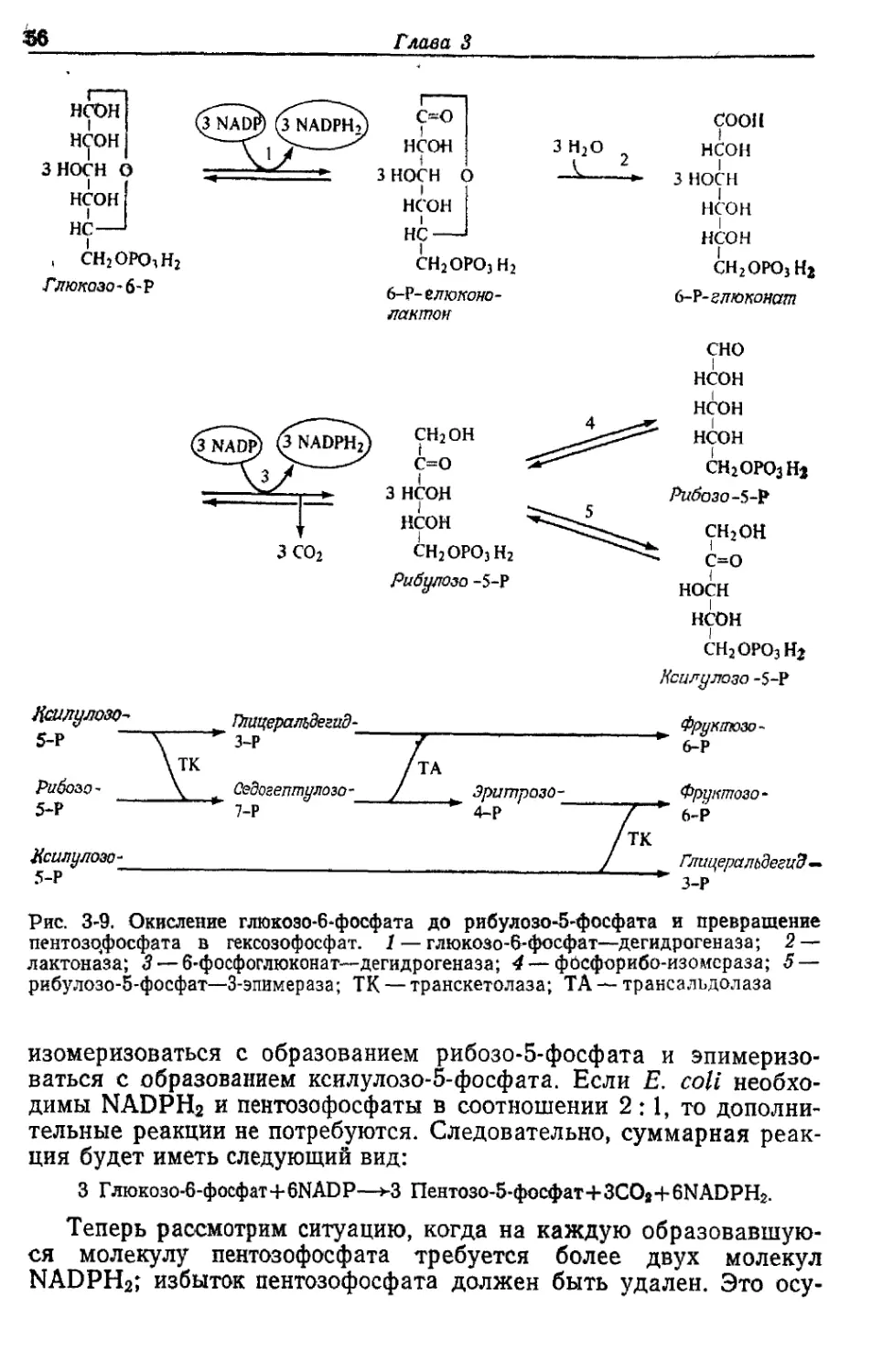
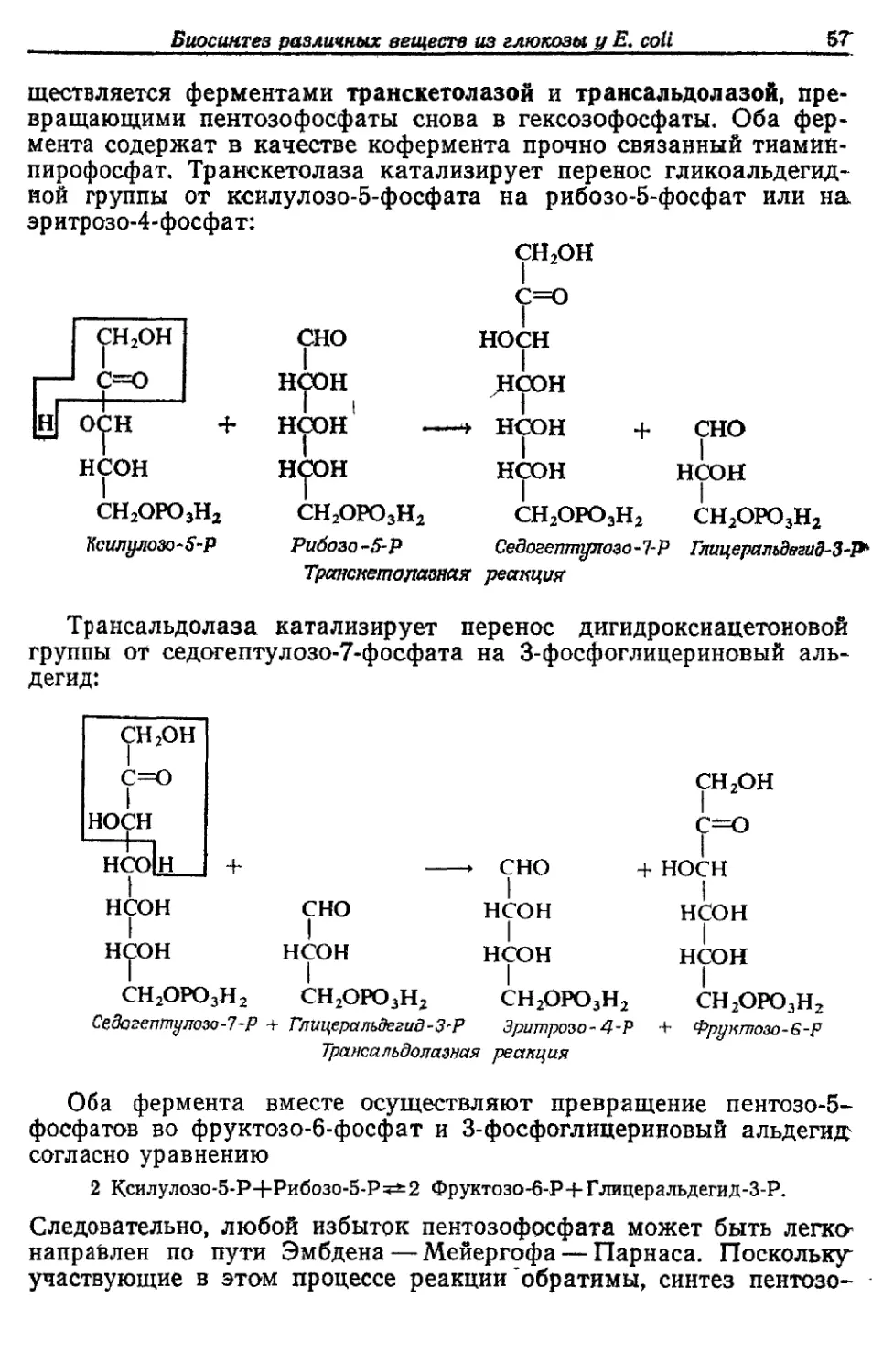
различен у разных бактерий (например, у грамположительных по сравнению
с грамотрицательными) и варьирует при различных условиях роста (например,
(одержание РНК).
44
Глава 3
Мономеры Макромолекул^.
Аминокислоты-------Белки
Витамины
Сахарофосфаты----* Полисахариды
Жирные кислоты---* Липиды
Рибонуклеотиды----* РНК
Дезоксарибонуклеотиды-^- ДНИ
Рис. 3-1. Общая схема путей биосинтеза клеточного материала из глюкозы.
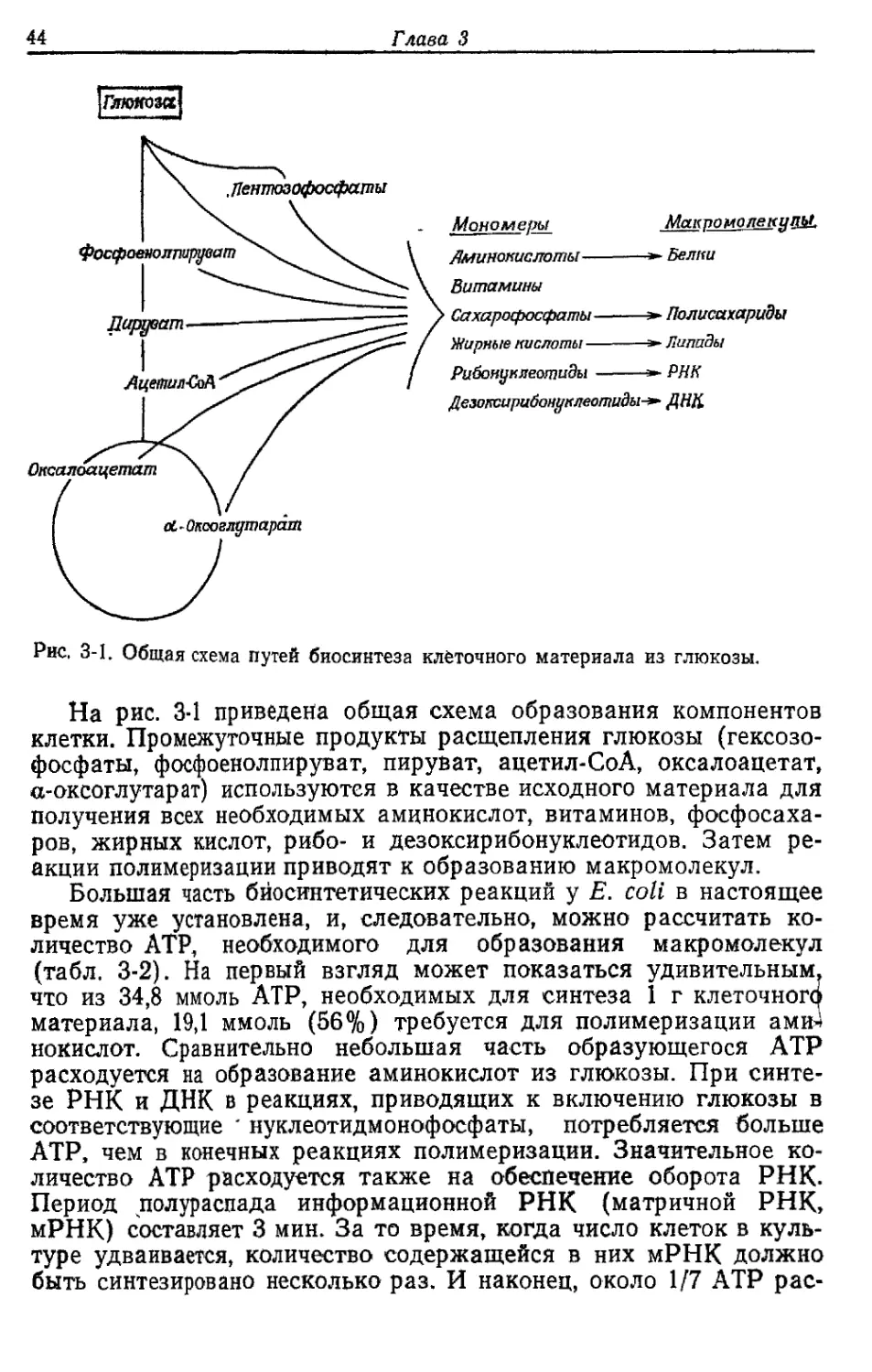
На рис. 3-1 приведена общая схема образования компонентов
клетки. Промежуточные продукты расщепления глюкозы (гексозо-
фосфаты, фосфоенолпируват, пируват, ацетил-СоА, оксалоацетат,
а-оксоглутарат) используются в качестве исходного материала для
получения всех необходимых аминокислот, витаминов, фосфосаха-
ров, жирных кислот, рибо- и дезоксирибонуклеотидов. Затем ре-
акции полимеризации приводят к образованию макромолекул.
Большая часть биосинтетических реакций у Е. coli в настоящее
время уже установлена, и, следовательно, можно рассчитать ко-
личество АТР, необходимого для образования макромолекул
(табл. 3-2). На первый взгляд может показаться удивительным,
что из 34,8 ммоль АТР, необходимых для синтеза 1 г клеточного
материала, 19,1 ммоль (56%) требуется для полимеризации ами4
нокислот. Сравнительно небольшая часть образующегося АТР
расходуется на образование аминокислот из глюкозы. При синте-
зе РНК и ДНК в реакциях, приводящих к включению глюкозы в
соответствующие ' нуклеотидмонофосфаты, потребляется больше
АТР, чем в конечных реакциях полимеризации. Значительное ко-
личество АТР расходуется также на обеспечение оборота РНК.
Период полураспада информационной РНК (матричной РНК,
мРНК) составляет 3 мин. За то время, когда число клеток в куль-
туре удваивается, количество содержащейся в них мРНК должно
быть синтезировано несколько раз. И наконец, около 1/7 АТР рас-
Биосинтез различных веществ из глюкозы у Е. coli
Таблица 3-2
Потребность в АТР для образования бактериальных клеток из глюкозы
и неорганических солей1)
Молекулы Количество (ммоль) АТР, тре- бующегося для синтеза макро- молекул, содержащихся в 1 г сухих клеток
Полисахариды Белки Глюкоза—>-Аминоки слоты Полимеризация Липиды РНК Глюкоза—»-Нуклеози д моноф осф аты Полимеризация ДНК Глюкоза—► Дезоксинуклеозидмонофосфаты Полимеризация АТР, требующийся для процессов транспорта (солей) АТР, требующийся для оборота РНК 2,1 1.4 19,1 0,1 3,5 0,9 0,9 0,2 5,2 1,4
Общая потребность в АТР 34,8
Stouthamer А. Н, Antonie van Leeuwenhoek, 39, 545—565 (1973).
ходуется на процессы транспорта, наибольшая часть этого коли-
чества необходима для поступления ионов аммония.
Таким образом, культура Е. coli, растущая в аэробных услови-
ях на среде с глюкозой, должна вкладывать основное количество
АТР, полученного при дыхании, в полимеризацию аминокислот.
Меньшее количество АТР расходуется на синтез мономеров, на
другие реакции полимеризации и на процессы транспорта. Мы не
рассматривали здесь энергию поддержания, которая в значитель-
ной степени зависит от условий роста и может составлять 10—20%
энергии, расходуемой в ATP-зависимых реакциях, а также энер-
гию движения жгутиков, которая сравнительно невелика.
В следующих разделах мы рассмотрим некоторые биосинтети-
ческие реакции у Е. coli.
II. Ассимиляция аммиака
Если Е. coli культивируют в среде с высокой концентрацией
аммиака, то он ассимилируется путем восстановительного амини-
рования промежуточного продукта цикла трикарбоновых кислот —
а-оксоглутарата. Фермент, катализирующий эту реакцию, NADP-
•46
Глава 3
зависимая L-глутаматдегидрогенаЗа. С образовавшегося таким пу-
тем L-глутамата аминогруппа далее может быть перенесена на
а-окоокислоты. Е. coli содержит два фермента, трансаминазы А и
В, ответственные за катализ такого переноса аминогрупп; их низ-
кая специфичность делает возможным образование более чем
10 аминокислот из соответствующих а-оксокислот. На рис. 3-2, А
показаны глутаматдегидрогеназная реакция и образование валина
цз а-оксоизовалерианата в качестве примера трансаминазной ре-
акции.
Второй реакцией, имеющей важное значение для ассимиляции
аммиака, является реакция, катализируемая L-глутамин-синте-
тазой:
СООН СООН
h2n-ch h2n-ch
I _____ I
CH J + ATP + NH3 —---------»CH2 + ADP + Pt
। д I---* г.-гпутамин синте-
CH2 ™aaa CH2
соон со-{Ж1
Глутамин служит донором NH2 группы при биосинтезе многих
соединений, таких, как пурины, триптофан, гистидин, глюкозамин-
6-фосфат, а также при образовании карбамоилфосфата, являюще-
гося одним из предшественников производных пиримидина:
СООН соон
h2n—ch нсо? h2n—ch |h2N|~CO—ОРО3Н2
СН2 Карбамоилсроарат -* £^2 +
сн2 синтетаза | 2АТР СН2
1 СО-р1Н 1 + 2ADP + Р, J СООН
В последние годы было установлено, что при низких концент-
рациях аммиака (<1 мМ) глутаматдегидрогеназа не участвует
в его первичной ассимиляции. Значение /См этого фермента для
аммиака — величина очень высокая, и при низкой концентрации
аммиака он неактивен. Впервые Темпест, а позднее — другие ис-
следователи показали, что при низких концентрациях NH3 обра-
зование глутамата из а-оксоглутарата и аммиака обеспечивается
согласованным действием двух ферментов — глутамин-синтетазы и
глутамат-синтазы. Последний фермент, часто называемый глут-
амин: а-оксоглутарат—аминотрансфераза, катализирует восстано-
Биосинтез различных веществ us глюкозы у Е. coli
47
а-Оксоглутпарат
/?
Глутамат
Рис. 3-2. Ассимиляция аммония. А. Глутаматдегидрогеназой (1) с последующим
переносом аминогруппы трансаминазой (2). Б. Глутамин-синтетазой/глутамат-син-
тазой.
вительный перенос амидогруппы глутамина на а-оксоглутарат.
Этот путь, который широко распространен среди бактерий, пока-
зан на рис. 3-2, Б.
III. Ассимиляционное восстановление сульфата
Подобно большинству бактерий, в качестве основного источ-
ника серы Е. coli использует сульфат. Однако этот сульфат дол-
жен быть восстановлен, поскольку в большинстве серусодержащих
компонентов клетки сера находится на окислительном уровне H2S.
Путь восстановления сульфата показан на .рис. 3-3. Сначала с
помощью механизма активного транспорта сульфат проникает в
клетку, а затем активируется под действием АТР-сульфурилазы с
образованным аденозин-5'-фосфосульфата (АФС) и пирофосфата.
Последний может гидролизоваться пирофосфатазой, способствуя
тем самым синтезу АФС. Последующее фосфорилирование АФС по
З'-положению дает аденозин-3'-фосфат-5'-фосфосульфат (ФАФС).
48
Глава 3
Аденин п СН2—О—Р—О—S—О’*
L^°^J I II
КГ р °' °
ОН OR
R«H, (tdeHOMtH-S-фосфссухьфст (А<РС)
R » РО,Н„ аВею»1щ-3'-(росфат-^-фскфоо^я1>фагп (ФАФС)
Восстановление ФАФС протекает с участием тиолового соеди-
нения (тиоредоксина) и приводит к образованию сульфита. Затем
фермент сульфитредуктаза катализирует перенос шести электро-
нов от 3NADPH2 на сульфит с образованием H2S. Будучи очень
токсичным для многих микроорганизмов, H2S немедленно вклю-
чается в О-ацетилсерин. Образующийся продукт, L-цистеин, слу-
жит са!мым важным предшественником серусодержащих соедине-
ний клетки:
СООН
H3N----<Lh L-цястеин
I
CH2SH
Рассмотренный путь называют ассимиляционным восстановле-
нием сульфата. У некоторых анаэробных бактерий обнаружен дру-
гой механизм восстановления сульфата — диссимиляционного типа
(гл. 8).
Активный транспорт
Сульфат (снаружи)------------------► Сульфат (внутри)
, АТР-сульфурилаза
АТР+Сульфат-----------------► Аденозин-б'-фосфосульфат+РРь
(АФС)
АФС-фосфокиназа
АТР+АФС---------------►Аденозин-3'-фосфат-5'-фосфосульфат+ ADP
(ФАФС)
ФАФС редуктаза
2R—SH+ФАФС-------------------* Сульфит-f-АМР-З'-фосфат+R—SS—R
Сульфитредуктаза
Сульфит+3NADPH2 ------------—► H2S + 3NADP
О-ацетил серин-ацетат-лиаза
О-ацетил-Ь-серин+Н25----------------------* L-цистеин+Ацетат+Н2О
Рис 3-3. Ассимиляционное восстановление сульфата и образование цистеина.
R-SH — тиоредоксин; его восстановленная форма регенерируется из окисленной
формы за счет NADPH2.
Биосинтез различныхвеществ из глюкозы у В. coli 4$
IV, Биосинтез аминокислот
Для биосинтеза белков необходимы 20 аминокислот. Они об-
разуются из метаболических предшественников, перечисленных в
табл. 3-3. Как видно из этой таблицы, субстратами при синтезе
аминокислот служат всего несколько соединений. Например, ок-
салоацетат представляет собой отправную точку для синтеза ше-
сти аминокислот, а-оксоглутарат является предшественником че-
тырех, а пируват — трех аминокислот.
Таблица 3-3
Предшественники для биосинтеза аминокислот
Предшественник
Пируват
Оксалоацетат
а-оксоглутарат
3-фосфоглицерат
Фосфоенолпируват
Эритрозо-4-фосфат
5-фосфорибозил-1-пирофосфат+
+АТР
Аминокислота
Аланин
Валин
Лейцин
Аспартат
Аспарагин
Метионин
Лизин
Треонин
Изолейцин
Глутамат
Глутамин
Аргинин
Пролин
Серин
Глицин
Цистеин
Фенилаланин
Тирозин
Триптофан
Г истидин
Проанализировав метаболические пути синтеза тех или иных
аминокислот, можно увидеть, что для образования различных амИ’
нокислот часто используются общие пути. На рис. 3-4 показаны
все реакции, приводящие к образованию аминокислот семейства
оксалоацетата и пирувата. В результате простых реакций переами*
нирования из оксалоацетата образуется аспартат, а из пирувата —
аланин. Аспартат превращается в аспарагин под действием аспара-
гин-синтетазы. Центральным промежуточным’ продуктом синтеза
лизина, треонина и метионина является полуальдегид аспарагино-
вой кислоты; он образуется из аспартата через стадию аспартат-
4-фосфата. Его конденсация с пируватом дает дигидродипиколи-
4—1896
50
Глава 3
ct-ацето -
сс-гидроксибцтират
ос-ацето-
лактат
2 оксо-З-метил-
валерианам
I
Изолейцин\
1' Ацетил-GoA
ot Оксо- Ч. oL-изопропил-
изовпле- малат
рианат ।
Валин \лейцин
Рис. 3-4. Биосинтез аминокислот, образующихся из оксалоацетата и пирувата.
нат, который служит предшественником диаминопимелината и ли-
зина. При восстановлении полуальдегида аспарагиновой кислоты
получается гомосерин, который может далее метаболизироваться
в метионин и треонин. Последняя аминокислота используется не
только для синтеза белков; часть ее под действием фермента трео-
ниндезаминазы превращается в а-оксобутират, который в резуль-
тате определенной последовательности реакций переводится в изо-
лейцин. Примечательно, что тот же самый набор ферментов, 'ко-
торый катализирует реакции от а-оксобутирата до изолейцина,
превращает и пируват в валин.
Биосинтез различных веществ Из глюкозы у Е. coli
&
Биосинтез лейцина ответвляется от пути синтеза валина на
уровне а-оксоизовалерианатаФ Следовательно, один и тот же на-
бор ферментов участвует в биосинтезе трех аминокислот — изолей-
цина, валина и лейцина.
сн3—сн2—со—соон----------->
ct-Оксобутират
4-фермент
_ и
сн3—со—соон---------------►
Пируват
Н3С-СН2
\н-сн-соон
Н3С nh2
Изолейаин
сн3
\:н—сн—соон
сн3 nh2
Валин
На рис. 3-5 суммированы реакции, ведущие от 3-фосфоглице-
рата к серину, глицину и цистеину. Дегидрирование 3-фосфогли-
церата и последующее действие трансаминазы и фосфатазы дают
L-серин. Эта аминокислота может быть превращена в цистеин, как
упоминалось в связи с ассимиляцией сульфата, или в глицин под
действием фермента серин-гидроксиметилтрансферазы.
Метилентетрагидрофолиевая кислота может быть восстановле-
на в Ы5-метилтетрагидрофолиевую кислоту, функционирующую в
качестве донора метильных групп во многих биосинтетических ре-
акциях, например в синтезе метионина из гомосерина.
Тетрагидрофолиевая
кислота
сн2
I
__Серин СООН
С Серин- гидроксиметалтратфераз№
Глицин
Ns, ^™~метилентетрагидрофолиевая
кислота
а-Оксоглутарат является предшественником глутамата и глут-
амина— соединений, которые служат не только строительными
4'
52 Глава 3
соон
неон
I
CH2OPO3H2
З-фосфогтщераО!
NAD NADH2
HjO
COOH
A=o 3~фосфогцдрохса~
1 . пирцват
CH2OPO3H2
Переаминирсванио с глутаматом
6 качестве донора ЗЯН^-группы
COOK
H2N-C-H
ch2opo3h2
З-фосфсерин
COOH
ch2-nh2
ЛШ£ЩН
H3PO4
COOH
h2n-c~h
CH2OH
t-rcepait
Тетрагидрофолят
№, З^метапен-
тетрагидрофо-
лит.
Aom-OoA
CoA
соон
h2n-c-h
ch2sh
t-цистеии
H2S
CH3-COOH
СООН
H2N-C-H
CH2-O-CO~CH3
О- ацетилсерцц
Рис. 3-5. Биосинтез аминокислот, образующихся из 3-фосфоглицерата
о<- Оксоглутарат
I
Орнитин
1
Аргинин
Рис. 3-6. Биосинтез аминокислот, образующихся из а-оксоглутарата.
Биосинтез различных веществ из глюкозы д Е. coll
сно соон
I I
СИОН + С-ОРО3Н2
I Н -
СНОН 1 сн,
I
Н2О3Р-ОСН2 ЧСНг
НО-CH н й-с-он
5-Дегидрохинат
Шикимат
Харизмам
НООС^СНг-СО-СООН
ОН
Префенат
Рис. 3-7. Биосинтез ароматических аминокислот.
S4
Глава 3
СН2ОРО3Нг
CH2OPO3H2
ФРПФ
C0-NH2
с=о
I
Н-С-ОН
Н-С-ОН
I
СН2ОРО3Н2 I
I +гпутпамин
I
НС—NH\
II ^СН
C-N^
I
сн2
hc-nh2
СООН
\.~гистидин
Рис. 3-8. Происхождение гистидинового скелета и 5-фосфорибозилпирофосфата,
АТР и глутамина.
блоками при синтезе белка, но и важными промежуточными про-
дуктами в азотном обмене, как это уже отмечалось. Кроме того,
глутамат является предшественником пролина и аргинина
(рис. 3-6).
Путь биосинтеза ароматических аминокислот весьма сложен;
однако он представляет особый интерес для исследователей, по-
скольку включает в себя биосинтез ароматического ядра из али-
фатических предшественников. Как показано на рис. 3-7, эритро-
зо-4-фосфат и фосфоенолпируват конденсируются с образованием
С7-соединения, которое подвергается циклизации (катализируемой
ферментом) в 5-дегидрохинат. Последний превращается в хориз-
мат — соединение, идентифицированное в 1964 г. как общий про-
межуточный продукт биосинтеза ароматических аминокислот.
В этой точке биосинтетический путь разветвляется на два, один
из которых ведет к триптофану через антранилат, а другой дает
префенат, являющийся предшественником как тирозина, так и
фенилаланина. Рассматривая схему синтеза ароматических ами-
нокислот, можно понять, во-первых, как Дэвису удалось выделить
мутант Е. coli, которому требуются фенилаланин, тирозин и трип-
тофан (а также n-аминобензоат), и во-вторых, почему такой му-
Биосинтез различных веществ из глюкозы у Е. coli 55»
тант может расти в присутствии шикимата. Это соединение об-
разуется в качестве промежуточного продукта при синтезе всех
трех аминокислот. Следовательно, данный мутант, вероятно, явля-
ется дефектным по способности к синтезу одного из ферментов,
участвующих в образовании шикимата из эритрозо-4-фосфата и
фосфоенолпирувата.
Для биосинтеза гистидина используется путь, совершенно не-
зависимый от реакций, обсуждавшихся до сих пор. Он включает
в себя девять ферментов, которые участвуют в синтезе гистидина
из 5-фосфорибозил-(-пирофосфата (ФРПФ), АТР и глутамина.
Образующийся в результате аминокислотный скелет содержит пять
углеродных атомов от 5-фосфорибозил-1 -пирофосфата, один атом
углерода и один — азота от пиримидинового кольца АТР и один
атом амидного азота от глутамина (рис. 3-8).
V. Как образуются пентозофосфаты и NADPH%
Для многих реакций гидрирования на путях биосинтеза в ка-
честве восстанавливающего агента требуется NADPH2, а не
NADH2, однако именно последний образуется в большинстве окис-
лительно-восстановительных реакций, участвующих в окислении
глюкозы до СО2. Только реакция, катализируемая изоцитратде-
гидрогеназой, дает NADPH2. Подобно тому, что наблюдается у
животных и многих других микроорганизмов, у Е. coli регенери-
руется дополнительный NADPH2 в окислительном пентозофосфат-
ном цикле. Этот же самый путь служит для клетки также и источ-
ником пентозофосфатов, один из которых (5-фосфорибозил-1-пи-
рофосфат) требуется для биосинтеза нуклеотидов.
В окислительном пентозофосфатном цикле можно выделить три
серии реакций:
1. Окисление глюкозо-6-фосфата до рибулозо-5-фосфата с обра-
зованием NADPH2 и СО2. Эта реакция катализируется фермен-
тами глюкозо-6-фосфат—дегидрогеназой, лактоназой и 6-фосфо-
глюконат—дегидрогеназой.
2. Образование рибозо-5-фосфата и ксилулозо-5-фосфата из рибу-
лозо-5-фосфата под действием ферментов фосфорибозо-изоме-
разы и рибулозо-5-фосфат — 3-эпимеразы.
3. Образование гексозо-6-фосфатов из пентозо-5-фосфатов в реак-
циях, катализируемых трансальдолазой и транскетолазой.
На рис. 3-9 суммированы все реакции окислительного пентозо-
фосфатного цикла. Сначала глюкозо-6-фосфат окисляется в 6-фос-
фоглюконат NADP-зависимой глюкозо-6-фосфат—дегидрогеназой.
Затем под действием 6-фосфоглюконат—дегидрогеназы происходит
восстановление другой молекулы NADP и образование рибулозо-
5-фосфата и СО2; в качестве промежуточного продукта реакции
образуется З-кето-6-фосфоглюконат. Рибулозо-5-фосфат может
56
Глава 3
неон
неон
I
зноен о
неон!
нс—'
I СН2ОРО1Н2
Глюказо-6-Р
с-о
I
неон
1
3 носн о
неон
НС----’
I
СН2ОРО3Н2
ЗН2О
I I
6-Р-елютоно-
лактон
соон
I
неон
I
3 НОСН
I
неон
I
неон
CH2OPOj н2
б-Р-гдлэлошот
ЗСО2
сн2он
с=о
I
з неон
неон
СН20Р03 н2
Рибулоза -5-Р
ено
неон
неон
неон
СН20Р03Н1
Рибоза-5-Р
СН2ОН
С=О
НОСН
неон
I
СН20РО3Н2
Реалу лоза -5-Р
Дсилулозо- Глицеральдегид-_______________________________ Фруктоза -
5-Р V з-Р у ► б-р
\тк /та
Рибоза- ______\ Седогептулоза- J Эритроза- Фруктоза-
5-Р 7-Р * 4-Р "Г* 6-Р
/тк
Цсилулозо-_______________________________________ / Глицеральдегид—
5-Р 3-Р
Рис. 3-9. Окисление глюкозо-6-фосфата до рибулозо-5-фосфата и превращение
пентозофосфата в гексозофосфат. 1 — глюкозо-6-фосфат—дегидрогеназа; 2 —
лактоназа; 3 — 6-фосфоглюконат— дегидрогеназа; 4—фОсфорибо-изомсраза; 5 —
рибулозо-5-фосфат—3-эпимераза; ТК — транскетолаза; ТА — трансалъдолаза
изомеризоваться с образованием рибозо-5-фосфата и эпимеризо-
ваться с образованием ксилулозо-5-фосфата. Если Е. coli необхо-
димы NADPH2 и пентозофосфаты в соотношении 2:1, то дополни-
тельные реакции не потребуются. Следовательно, суммарная реак-
ция будет иметь следующий вид:
3 Глюкозо-б-фосфат+бЫАСР—>-3 Пентозо-б-фосфат+ЗСОг+бМАЭРНг.
Теперь рассмотрим ситуацию, когда на каждую образовавшую-
ся молекулу пентозофосфата требуется более двух молекул
NADPH2; избыток пентозофосфата должен быть удален. Это осу-
Биосинтез различных веществ из глюкозы у Е. coll
57"
щестзляется ферментами транскетолазой и трансальдолазой, пре-
вращающими пентозофосфаты снова в гексозофосфаты. Оба фер-
мента содержат в качестве кофермента прочно связанный тиамин-
пирофосфат. Транскетолаза катализирует перенос гликоальдегид-
ной группы от ксилулозо-5-фосфата на рибозо-5-фосфат или на.
эритроз о-4-фосфат:
СН2ОН с=о
сно НОСН
неон 1 1 НСОН
неон — НСОН + сно
н^он неон неон 1
СН2ОРО3Н2 СН2ОРО3Н2 СН2ОРО3Н;
Рибозо-5-Р Седогептулоза-ТР Глицеральдегид-ЗГР
Транскетолазная реакция
неон
СН2ОРО3Н2
Ксилулозо-S-P
Трансальдолаза катализирует перенос дигидроксиацетоновой
группы от седогептулозо-7-фосфата на 3-фосфоглицериновый аль-
дегид:
СН2ОН
носн
нсо|н
сно
неон
сно
неон
неон
неон
неон
СН2ОРО3Н2
Седогепгпулозо-7-Р + Глицеральдегид-3-Р
Трансальдолазная
СН2ОРО3Н2
СН2ОР03Н2
Эритпрозо-4-Р
реакция
+ Фруктозе-G-P
Оба фермента вместе осуществляют превращение пентозо-5-
фосфатов во фруктозо-6-фосфат и 3-фосфоглицериновый альдегид
согласно уравнению
2 Ксилулозо-5-Р-|-Рибозо-5-Р 5=^2 Фруктозо-6-Р+ГлицеральдегиД-З-Р.
Следовательно, любой избыток пентозофосфата может быть легко
направлен по пути Эмбдена — Мейергофа — Парнаса. Поскольку
участвующие в этом процессе реакции обратимы, синтез пентозо-
58
Глава 3
Рис. 3-10 Образование радиоактивного СО2 клетками Е coll из глюкозы, мечен-
ной 14С в различных положениях. Количество образовавшегося за 1 ч радио-
активного СО2 отложено против времени (Wang С. Н., Stern I., Gilmour С М.
et al, Y. Bactenol 76, 207—216, 1958).
фосфатов из гексозофосфатов возможен также в условиях, когда
образование NADPH2 в окислительной части цикла нежелательно.
Кроме того, реакции пентозофосфатного пути снабжают клетки
эритрозо-4-фосфатом, требующимся, например, для биосинтеза
ароматических аминокислот.
Около 28% всей расходуемой Е. coli глюкозы расщепляется по
окислительному пентозофосфатному пути и 72% —по пути Эмбде-
на— Мейергофа — Парнаса. Это можно рассчитать из радиоизо-
топных экспериментов, подобных тому, который отображен на
рис. 3-10, где показана скорость выделения радиоактивной СО2
культурами Е. coli, растущими на радиоактивной глюкозе, мечен-
ной в различных положениях. Как видно, преимущественными ис-
точниками СО2 служат углеродные атомы 3 и 4; при расщеплении
глюкозы по пути Эмбдена — Мейергофа — Парнаса С-3 и С-4 глю-
козы превращаются в карбоксильные группы пирувата и освобож-
даются в виде СО2 при образовании ацетил-СоА. Радиоактивность
из 1-14С-глюкозы появляется в СО2 при окислении б-фосфоглкщо-
ната в рибулозо-5-фосфат (первый пик) и при окислении ацетил-
СоА в цикле трикарбоновых кислот (второй пик). Последний про-
цесс приводит также к образованию 14СО2 из 2-14С-глюкозы.
VI, Рибонуклеотиды и дезоксирибонуклеотиды
Рибонуклеотиды состоят из пуринового или пиримидинового
основания, рибозы и фосфатной, пирофосфатной или трифосфат-
ной группы:
Пурин
Пиримидин
____ ________®
Рибоза -_____®~®
----®-®-®
Таблица 3-4
Основные пиримидины, пурины и соответствующие нуклеотиды
Основание
Нуклеотид
О—РОЛН2
Урацилрибозо-(Р)
УриЗинмонофосфат (UMP)
NHi
•О—POjHi
Цитозинрибозо -(Р)
Цитидинмонофосфагп (СМР)
„ СН2—О—РО,Н2
г" °»
______I/1 Тиминрибозо- (£)
| Г Тимидинмонафпсфат (ТМРр
ОН ОН
Л СН2ОРО,Нг
I [ Аденинрибозо-(Р)
ОН ОН Аденозинмонофосфат (ЛМР)
О
Гуанин
60
Глава 3
ноос
H2N Чн2
I + I
О-С СН
И2ОзРС< h2n '"•соон
НООС
h2n снг
О=С /СН
N "-СООН
н
О
н
HN'^CH,
I । '
О=с сн
н соон
Аспартат
+
Карбамоил*
фосфат
Карбамоил*-
аспартат.
4, 5- ди гидра-
оротпат
он
Оротат
Рис. 3-11. Биосинтез оротата из карбамоилфосфата и аспартата./ — аспар-
тат—карбамоилтрансфераза; 2 — дигидроорбтаза; 3 — дигидрооротат-дегидро! е-
ааза.
В табл. 3-4 приведены структурные формулы основных пуринов
и пиримидинов и соответствующих нуклеотидов. Пуриновое или
пиримидиновое основание, связанное с рибозой, называется рибо-
нуклеозидом (тривиальные названия: аденозин, гуанозин, цитидин
и уридин). Этерификация рибонуклеозидов фосфорной кислотой
АТР
+
Рибозо -5-(Р)
ФРПФ-синтетаза
,О СН,О©
+ АМР
®®-о
ОН Ой'
ФРПФ
Оротат
+
ФРПФ
Уридинманофоссрат (UMP)
Рис 3-12. Образование UMP из оротата. 1 — оротидилат-пирофосфорилаза; 2 —
оротидилат-декарбоксилаза.
Биосинтез различных веществ из глюкозы у Е. coli
61
дает соответствующие нуклеозидмонофосфаты. Их связывание с©
вторым и третьим фосфатным остатком приводит к образованию
рибонуклеозидди- и рибонуклеозидтрифосфатов. Все эти фосфор-
ные эфиры называются нуклеотидами.
НгО +Глутамин Глутамат + РР|
^$)-рибозо-(?)
NH2-/w<foJO-(P)
5-фосфарибозиламин
АТР + Глицин ADP + P| CH2-NH2
о=с.
NH
I /-Х
Рибоза — (Р)
ГлицинамидрибонуклеотиЪ
Н4-<родял7-ADP, V ^глутамат
Метенилфолят А
глутамин, АТР Н2 -N Н
СНО
HN=C
НС—N
АТР
ADP + Р,
N-формилглицин-
амид рибо нуклео-
тид
NH
I
Рибозо-(р)
—N
Рибозо-(§)
аминоимид азол рибо нуклеотид
2
Рис. 3-13. Первые реакции синтеза пуриновых нуклеотидов 1—фосфорибозил-
пирофосфат-амидотрансфераза; 2 — фосфорибозилглицинамид-синтетаза, 3-фосфо-
рибозилглицинамид-формилтрансфераза + фосфорибозилформилглицинамид-син-
тетаза; 4 — фосфорибозила миноимидазол-синтетаза.
Предшественниками пиримидиновых нуклеотидов служат кар-
бамоилфосфат и аспартат. Фермент аспартат-транскарбамилаза
конденсирует эти соединения с образованием карбамоил аспартата,
который подвергается циклизации, давая 4,5-дигидрооротат. За-
тем дегидрирование этого соединения приводит к образованию
оротата — первого промежуточного продукта, содержащего пири-
мидиновое кольцо (рис. 3-11).
Прежде чем превратиться в одно из физиологически важных
пиримидиновых оснований, оротат связывается с рибозо-5-фосфа-
том, образуя соответствующий рибонуклеотид. Рибозо-5-фосфат
сам по себе не может функционировать в качестве субстрата в
этой реакции конденсации; он должен быть активирован путем
превращения в 5-фосфорибозил-1-пирофосфат (ФРПФ) (рис. 3-12).
Затем реакция 5-фосфорибозил- 1-пирофосфата с оротатом дает
62
Глава 3
Рибоз О -(Р)
5-аминоимидазол -
рибонуклеотид
НСО3" HOOC^-N
АТР ADP + Р,
+ +
Аспартам Фумарат
H,N/^N
Ридозо -(р)
5-аминоимидазол-4 карбоксилат
рибонуклеотид
А делило сукцинат
Фумарат-^ 5
Ксантиновая кислота (ХМР)
АМР
Рис. 3-14. Образование АМР и GMP. 1 — фосфорибозиламиноимидазол-карбокси-
лаза; 2—фосфорибозиламиноимидазол-сукцинокарбоксамид—синтетаза + аде-
нилосукцинат-лиаза + фосфорибозиламиноимидазол-карбоксамид—формилтран-
сфераза; 3 — 1МР-циклогидролаза; 4 — адейилосукцинат-синтетаза; 5 — аденило-4
сукцинат-лиаза, 6 — IMP-дегидрогеназа; 7 — GMP-синтетаза.
Биосинтез различных веществ из глюкозы у Е. coli
63
оротидинмонофосфат, который дальше декарбоксилируется в ури-
динмонофосфат (UMP).
UMP может быть превращен в UTP в результате киназных
реакций; последующая реакция аминирования дает цитидинтри-
фосфат (СТР):
UMP UDP АТР
ADP
UTP
АТР
ADP
Глутамин
(2тр Глутамат + Р{
Синтез пуриновых нуклеотидов протекает более сложным пу-
тем. В результате метаболического пути, начинающегося с ФРПФ,
образуется имидазольный нуклеотид (рис. 3-13).
Три атома пиримидинового кольца, дополнительно требующие-
ся для образования пуринового кольца из 5-аминоимидазола, по-
ступают из бикарбоната, аспартата и формилтетрагидрофолиевой
кислоты. Замыкание кольца дает инозиновую кислоту (рис. 3-14).
Несколько дополнительных реакций приводят от IMP к АМР или
к GMP, а затем под действием фермента аденилаткиназы (в тка-
нях животных миокиназы) АМР превращается в ADP:
Аденилаткиназа
АМР + АТР -— 2ADP .
И наконец, АТР может быть образован путем фосфорилирова-
ния при переносе электронов или на уровне субстрата. У Е. coli
имеются дополнительные нуклеозидмонофосфаткиназы, фосфори-
лирующие GMP за счет АТР, основного источника высокоэнерге-
тического фосфата.
Пуриновые и пиримидиновые нуклеотиды играют в клеточном
метаболизме весьма разнообразную роль. Так, многие фермента-
тивные реакции зависят от АТР, GTP, UTP или СТР, используе-
мых в качестве источников высокоэнергетического фосфата или
группировок с высоким потенциалом переноса группы (например,
ADP в ADP-глюкозе). Рибонуклеотиды являются предшественни-
ками дезоксинуклеотидов и, следовательно, служат субстратами в
синтезе как РНК, так и ДНК.
А. Синтез дезоксирибонуклеотидов
Восстановление рибонуклеотидов до дезоксирибонуклеотидов
происходит у Е. coli на уровне дифосфатов:
64
Глава 3
Основание q ц;— ф—ф Основание СН2—©— ф
NADP
восстание- окисленный
ленный
NADPHz
Восстанавливающим агентом в этой реакции служит флаво-
протеидтиоредоксин; его восстановленная форма регенерируется
за счет NADPH2.
Четыре нуклеозиддифосфата восстанавливаются согласно сле-
дующей схеме:
UDP CDP ADP GDP
dUDP
dCDP dADP
dGDP
Дезоксиуридинфосфат встречается в ДНК лишь как минорный
компонент. Однако он служит предшественником тиминсодержа*
щих дезоксинуклеотидов, он гидролизуется до dUMP и затем ме-
тилируется:
dUDP --------dUMP + Р,
Меттшлен-Щ-фонят
Н^фолят
Тимидилат-синтетаза
-----> dTMP
При метилировании dUMP в dTMP метилентетрагидрофолиевая
кислота играет особую роль; она является не только донором
Ci-фрагмента, но служит также восстанавливающим агентом.
У £. coli имеются киназы, которые катализируют образование со-
ответствующего дезоксинуклеозидтрифосфата, используя АТР в
качестве донора высокоэнергетического фосфата.
VII. Биосинтез липидов
Бактерии не накапливают липидов в качестве резервного ма-
териала, но у них содержатся значительные количества липидов —
особенно фосфолипидов и гликолипидов, являющихся компонента-
ми мембранных систем. Общая структура этих липидов показана
на рис. 3-15.
Ниже описан в общих чертах синтез основных компонентов ли-
пидов: жирных кислот, глицерола и холина.
Биосинтез различных веществ из глюкозы у Е. coli
&
СН2—O-C0-R
СН-О COR
СНз-O-CO-R
Липид
(нейтраль-
ные жиры)
I Фосфолипид
CH-O-C0-R
I °,
СН2 -ОРО- СН2 -СН2 СН3
6- ^СН3
ch2-o-co-r
CH-O-CO-R Нпмояипид
о СНг0Н
сн2~о---(оной
>|—^он
Рис. 3-15. Общая структура липидов, фосфолипидов и гликолипидов. R — угле-
родные цепи жирных кислот, образующих сложные эфиры с глицеролом. Холин
(показанный здесь) — один из спиртов, которые могут присутствовать в фосфо-
липидах; другие такие спирты — это этаноламин, серин и инозитол. В изобра-
женном гликолипиде углеводный компонент представлен D-маннозой. Другие
гликолипиды содержат галактозу, глюкозу или олигосахариды.
А. Жирные кислоты
Большинство жирных кислот, встречающихся в липидах, содержит
16 или 18 атомов углерода; эти кислоты либо насыщены, либо
имеют одну или более двойных связей. Предшественником жирных
кислот служит ацетил-СоА. Однако удлинение цепи достигается
не конденсацией двух молекул ацетил-СоА с последующей даль-
нейшей конденсацией образующегося Отсоединения с ацетил-СоА,
как в последовательности реакций, осуществляемых клостридиями
при образовании бутирата и капроата. Следует отметить два важ-
ных отличия.
1. СоА-производные не являются субстратами ферментов, участ-
вующих в синтезе жирных кислот. Вместо них Е. coli использует
ацилпереносящий белок (АПБ) с мол. массой 10 000; его про-
статической группой служит 4'-фосфопантетеиы, и, следователь-
но, он сходен с коферментом А (рис. 3-16). Первая реакция в
синтезе жирных кислот — это образование ацетил-АПБ:
Ацетил-трансаденилаза
Ацетил-СоА+АПБ------- --- ,......Ацетил-АПБ+СоА.
5—1896
66
Глава 3
NH-CH2-CH2~SH
4 - фосфо-
пантетеин
с=о —I
I
сн2
Ь
NH
I
с=о
I
снон
I
СН3-С-СН3
К
о —
Пантотенат
0=Р-ОН
L— /1
г____________/ у0
СН2_ен Пептидная ц&ь
О
СоА ' АПБ
Рис. 3-16. Структура простетической группы ацилпереносящего белка (АПБ) и
СоА. В АПБ 4'-фосфопантетеин связан с пептидной цепью через остаток серина.
2. Ацетил-АПБ функционирует в синтезе жирных кислот как за-
травка, а Сг-фрагменты присоединяются к этой затравке в фор-
ме малонил-АПБ. Последний синтезируется из ацетил-СоА в
два этапа:
Ацетил-СоА—карбоксилаза
СНз=СО=СоА+АТР+СО2 — ---------- —
СН2—СО—СОА 4- ADP + Р j
СООН
Малонил-тр ансацил аз а
Малонил-СоА+АПБ —- ............» Малонил-АПБ+СоА
Ацетил-СоА—карбоксилаза представляет собой биотинсодержащий фермент.
Для удлинения ацил-АПБ на два атома углерода требуются
четыре фермента. Сначала ацетил-АПБ реагирует с малонил-АПБ
с образованием ацетоацетил-АПБ, который затем восстанавлива-
ется до D(—)-р-гидроксибутирил-АПБ. Отщепление воды дает кро-
тонил-АПБ, а последующее восстановление приводит к образова-
нию бутирил-АПБ (рис. 3-17).
Названия ферментов, приведенных на рис. 3-17, свидетельству-
ют о том, что они относительно неспецифичны к длине цепи своих
субстратов. И действительно, они катализируют также превраще-
ние бутирил-АПБ и малонил-АПБ в капроил-АПБ и все последу-
ющие реакции до образования пальмитоил-АПБ. Этот последний
Биосинтез различных веществ из глюкозы у Е. coli
67
З-кетоацил-АПБ — синтетаза
Ацетил -АПБ+Малонил-АПБ — Ацетоацетил-АПБ + СОа+АПБ
З-кетоацил-АПБ — редуктаза
Ацетоацетил-АПБ + NADPH2 — —>|3-Гидроксибутирил-АПБ+
+ NADP
f$ Гидрокси ацил-АПБ — дегидратаза
0-Гидроксибутирил-АПБ — ----*" Кротонил-АПБ + НгО
Еноил-АПБ — редуктаза
Кротонил-АПБ + NADPH — ............... Бутирил-АПБ + NADP
Рис. 3-17. Реакции, участвующие в образовании бутирил-АПБ из ацетил-АПБ и
малонил-АПБ.
является основным насыщенным ацил-АПБ, образуемым Е. coli.
Обусловлено это тем обстоятельством, что З-кетоацил-АПБ—син-
тетаза активна в отношении субстратов, длина цепи которых не
превышает Си (табл. 3-5). Следовательно, в ряду насыщенных
ацильных производных пальмитоил-АПБ — конечный продукт.
Некоторые ненасыщенные жирные кислоты являются также
важными компонентами фосфолипидов. Из ненасыщенных жирных
кислот у Е. coli преобладают пальмитолеат (ццс-9-гексадекеноат)
и ijuc-вакценат (цис-11-октадекеноат). В их синтезе участвуют
ферментные системы, обсуждавшиеся выше. Как видно из табл. 3-5,
З-кетоацил-АПБ—синтетаза все еще активна в отношении нена-
сыщенных Си-АПБ, так что цис-вакценил-АПБ может при этом
образоваться. Точкой разветвления путей синтеза насыщенных и
Таблица 3~5
Активность З-кетоацил-АПБ—синтетазы с различными
ацил -А П Б-соединениям и1 >
Субстрат Скорость реакции Умакс, ц моль продукта/(мин-мг)
Ацетил-АПБ 2,8
Деканоил-АПБ 2,8
Додеканоил-АПБ 0,97
Т етр а декано ил-АПБ 0,31
Гексадеканоил-АПБ 0
tjUc-5-Додексноил-АПБ 1,7
tjwc-9-Гексадекеноил-АПБ 0,37
цисЛ1-Октадекеноил-АПБ 0
о Prescott D J„ Vagelos Р. R., Adv. Enzymol., 36, 269—311 (1972).
5*
Глава 3
ненасыщенных жирных кислот у Е. coli служит р-гидроксидекано-
ил-АПБ.
СН3—(СН2)5-СН2~СНОН-уСН2-СО~АПБ
/J Гидроксидеканоил АПБ
Специальная
дегидратаза
3 гидроксиацил-АПБ~
дегидратаза
н н
н
СЙ3-(СН2)-С=С-СН2-СО-АПБ СН3-~(СН2)5—СН2—С=С~СО—АТШ
н
Ненасыщенные
кислоты
Насыщенные
кислоты
Особая дегидратаза удаляет воду, давая соединение с tfwc-двойной
связью между 3-м и 4-м углеродными атомами. Возникающее сое-
динение не используется в качестве субстрата для еноил-АПБ—
редуктазы, а подвергается дальнейшим реакциям удлинения, при-
водящим к С16- и С18-ацил-АПБ с одной двойной связью.
Следует отметить, что все ферменты, участвующие в синтезе
жирных кислот у Е. coli, растворимы и легко отделяются друг от
друга in vitro. У высших организмов все реакции, ведущие от
ацетил-СоА и малонил-СоА к жирным кислотам с длинной цепью,
катализируются многоферментным комплексом — синтетазой жир-
ных кислот.
Б. Фосфатидная кислота
Основными субстратами для образования фосфатидных кислот
служат 3-фосфоглицерол и ацил-АПБ. Первый из них легко обра-
зуется из дигидроксиацетонфосфата — промежуточного продукта
пути Эмбдена — Мейергофа — Парнаса:
Глицерол 3-фосфат—
дегидрогеназа.
НОСН2-СО-СН2О® + NADPH2^= -----------►
НОСН2-СНОН-СН2О® + NADP
На следующем этапе может произойти синтез фосфатидных кис-
лот:
СН2ОН Глицерофосфат ацил СН2О CD R
снон трансфераза I _ _ + 2R—СО—АПБ — >СНО-СО- R
СН2О® 2АПБ СН2О® фосфатидная
кислота
Биосинтез различных веществ и& глюкозы if Е. coli 69
После гидролитического отщепления фосфата от фосфатидной
кислоты может произойти образование нейтральных жиров в ре-
зультате реакции с третьим ацил-АПБ. Однако большая часть
фосфатидной кислоты используется для синтеза фосфолипидов.
В. Фосфолипиды
В результате реакции с СТР фосфатная группа фосфатидной
кислоты приобретает способность этерифицироваться со спиртом:
СН2О—СО—R СН2О—СО—R
СНО—СО—R + СТР —> СНО—СО—R + PPi
О
II
СН2О—Р—ОН
I
он
СН2О—Р—О—Р—О—ЦИТИДИН
I I
ОН ОН
Фосфатидная кислота
CDP-диацилглицерол
Затем специфические ферменты катализируют замещение СМР
спиртами, подобными серину, инозитолу и глицеролу.
CDP-диацилглицерол 4- Серин—>Фосфатидилсерин н- СМР.
Декарбоксилирование фосфатидилсерина дает фосфатидилэта-
ноламин, который может быть метилирован S-аденозилметионином
с образованием фосфатидилхолина.
сн2О—СО—R
I
CHO-CO—R
+3
I
о-
СН2О—Р—о—сн2—CH2-NH2
Фосфатидилэтаноламин
соо-
I
нс—nh2
I
сн2
f
сн2
I
НзС—S—аденозин
+
S-аденозилметионин
СН20—CO—R
СНО—СО—R
-аденозилгомоцистеин + 2Н+
Фосфатидилхолин
' Аналогичные пути используются для синтеза других фосфоли-
пидов.
70
Глава 3
III. Образование углеводов
Когда роль субстрата для роста Е. coli выполняет глюкоза,
промежуточными продуктами ее расщепления по пути Эмбдена —
Мейергофа — Парнаса или по окислительному пентозофосфатному
пути являются многие гексозо- и пентозофосфаты: глюкозо-6-фос-
фат, фруктозо-6-фосфат, фруктозо-1,6-бисфосфат, рибулозо-5-
фосфат, ксилулозо-5-фосфат и рибозо-5-фосфат, Для синтеза слож-
ных эфиров галактозы глюкоза сначала связывается с UDP путем
следующих реакций:
Фосфоглюкомутаза
Глюкозо-6-фосфат --- -----------> Глюкозо-1-фосфат
иЭРглюкоза пирофосфорилаза
Глюкозо-1-фосфат + UTP ---- ------------------->• иЭРглюкоза + PPi •
Затем специфической эпимеразой, обладающей абсолютной зави-
симостью от NAD, осуществляется изменение конфигурации при
4-м атоме углерода глюкозного остатка. Промежуточным продук-
том этой реакции является 4«кетоглюкозное производное:
он он
UDP- глюкоза
UDP галактоза
ГЮРгалактоза служит предшественником липополисахарида
клеточной стенки Е. coli. Другими предшественниками этого важ-
ного структурного элемента являются гексозамины; они образу-
ются из фруктозо-6-фосфата, который превращается в глюкозамин-
6-фосфат за счет глутамина, используемого в качестве донора
МН2-группы.
Аминотрансфераза
г>-(рруюпозо-б-(рос(рат —-------------► ъ-глюкозамин-
/ ч б - tpoctpam
L-глутамин L-глутамат
Из глюкозамин-6-фосфата получаются другие гексозамины.
UDP-N—ацетилмурамовая кислота, предшественник пептидогли-
кана (муреина), также синтезируется из этого соединения
(рис. 3-18). Сначала фосфатная группа переносится из положения
6 в положение 1. Последующая реакция с ацетил-СоА дает N-аце-
тилглюкозамин-1-фосфат, который затем связывается с UDP. На
последнем этапе UDP-N-ацетилглюкозамин реагирует с фосфо-
Биосинтез различных веществ из глюкозы у Е. coli
71
Глюказамин- G- фосфат
Глюкозамин-I фосфат
Ацетил-СоК
f4* СоА
^-ацетилглюкозаманФ фосфат
^-UTP
iS^pp,
UDP-N- ацетилглюкозамин
К— Фосфоенолпируват
Г^Р;
ХБУР-Л-ацетилмурамовая кислота
Рис. 3-18. Образование UDP-N-ацетилмурамовой кислоты из глюкозамин-6-фос-
фата.
|СН2ОН
—О -Уридин
НО
NH- СО СНз
UDP-N- ацетилмура-
мовая кислота
О
I
НССН3
с=о
I
NH
I
Н3С-СН~С=О
NH
I
НООС- СН
I
сн2
СН2-С=О
NH2 NH
НООС-СН-СН2-СН2-СН2-СН-С=О
NH
I
о=с-сн
I I
NH СНз
I
ноос-сн
I
СНз
Лактильныи.
остаток
L-Ala
D-Glu
м-Диамино*
пимелат
D-Ala-o-AIa
Рис. 3-19. UDP-N-ацетилмурамилпентапептид, строительный блок пептидогликана
Е. coli.
72 Глава 3
енолпируватом, давая 3-лактильное производное, называемое
UDP-N-ацетилмурамовой кислотой.
Лактильный остаток UDP-N-ацетилмурамовой кислоты имеет
очень важное значение, поскольку строительным блоком пептидо-
гликана (муреина) клеточной стенки бактерий является мурамил-
пентапептид, и пептидная цепь связана с карбоксильной группой
этого лактильного остатка (рис. 3-19). Пентапептид Е. coli синте-
зируется из UDP-N-ацетилмурамовой кислоты при последователь-
ных реакциях с L-аланином+АТР, D-глутаматом 4-АТР, мезо-ди-
аминопимелатом 4-АТР и О-аланил-О-аланином4-АТР. Образова-
ние О-аланил-О-аланина из D-аланина специфически ингибируется
антибиотиком циклосерином.
„ „„„ Циклосерин
2-Л-аланин+ДТР ----fl-—^п-аланал-о аланин+ADP+Pf
IX, Синтез полимеров
Уже упоминалось, что около 97% клеточного материала состав-
ляют макромолекулы. Их можно разделить на три группы: липи-
ды, периодические макромолекулы типа пептидогликана и полиса-
харидов и информационные макромолекулы, такие, как нуклеино-
вые кислоты и белки.
А. Липиды
Липиды не являются истинными макромолекулами, поскольку
мономеры, из которых они состоят, не образуют между собой ко-
валентных связей. Однако в водной среде молекулы фосфолипи-
дов, подобных фосфатидилхолину, ассоциируют таким образом,
что образуется двуслойная структура (рис 3-20,А) Такая струк-
тура стабилизируется в результате взаимодействия гидрофобных
«хвостов» и образования водородных связей между гидрофильны-
ми «головками» фосфолипида. Липиды вместе с белками связаны
ишт
шшн
д
Рис 3 20 Расположение молекул фосфолипидов в мембранах А Двойной слой
молекул фосфолипидов (черные кружки — гидрофильные «головки», волнистые ли-
нии— гидрофобные «хвосты») Б Модель мембраны, содержащей фосфолипиды
и белки
Биосинтез различных веществ аз глюкозы у Ё. coli 73
с мембранами; их общая структура показана на рис. 3-20, Б. Мем-
браны содержат до 60% белков, некоторые из этих белков погру-
жены в липидные слои и выполняют специфические функций в
различных процессах транспорта. Мембрана с такой общей струк-
турой окружает цитоплазму бактериальной клетки и называется
клеточной, или плазматической, мембраной.
Б. Периодические макромолекулы
В отличие от информационных макромолекул периодический
молекулы синтезируются не на матрице. Они образуются специ-
фическими ферментами из одного (гликоген), двух (пептидогли-
кан) или нескольких (липополисахариды) типов строительных
блоков.
1. Гликоген. При росте на среде с глюкозой Е. coli запасает не-
которую часть глюкозы, поступившей в клетку, в виде гликогена.
Синтез гликогена включает два этапа: активацию глюкозы и пе-
ренос глюкозного остатка к молекуле-затравке. Активированным
производным глюкбзы является АОРглюкоза; она образуется из
глюкозо-1-фосфата АОРглюкозо-пирофосфорилазой:
Глюкозо-1-Р + АТР —► АВРглюкоза + PPi
Затем происходит перенос глюкозного остатка к невосстанав-
ливающему концу олигосахарида (затравки), который должен со-
держать более четырех глюкозных остатков (рис. 3-21).
Гликоген Е. coll представляет собой сильно разветвленный по-
лисахарид и помимо а-(1->4)-связей между молекулами глюкозы
содержит большое количество а- (1->6) -связей, образующихся пу-
тем трансглюкозилирования; олигосахарид переносится от невос-
станавливающего конца на ОН-группу при С-6 глюкозного остатка
в цепи (рис. 3-22).
Следует отметить, что у животных субстратом для синтеза гли-
когена служит ГЮРглюкоза.
2. Клеточная стенка. На рис. 3-23 схематически изображены мак-
ромолекулярные структуры, окружающие цитоплазму Е. coll. Мож-
но видеть, что клеточная мембрана покрыта довольно тонким сло-
ем пептидогликана, что характерно для грамотрицательных бак-
терий. Последний слой представляет собой наружную мембрану
и состоит из липополисахаридов, липидов и белков.
Пептидогликан (муреин) синтезируется из двух строительных
блоков: UDP-N-ацетилмурамилпентапептида и UDP-N-ацетилглю-
козамина. Образование этих компонентов в цитоплазме было уже
описано Как показано на рис. 3-24, N-ацетилмурамилпентапептид
74
Глава 3
Рис. 3-21. Удлинение полисахаридной цепи гликогена. Фермент называется гли-
коген-синтазой.
Рис. 3-22. Разветвление в результате трансглюкозилирования
1 1
mmiiimniiiiiiiiiiiwiii! ншн / и ч шч iiiiiiiiiiiiiiiinmimiitiiiiiiii пг
шшшшшшлшшшшдш ™
Рис. 3-23. Срез поверхностных слоев Е. coli. КМ — клеточная мембрана; НМ — на-
ружная мембрана; ПГ — пептидогликан.
Биосинтез различных веществ из глюкозы у Е. coll
75
M-G-M-G-M-G-M-G-M-G
M—G-M-G-M-G-M-G-M-G
Пептидогликан 4
MGM-G-NUGM-G-M-G-M-G
M—G-M-G-M--G-M-GM-G -
Плазматическая
мембрана
Цитоппазма
MurNAe-GlcNAc
Пентапептид
MurN Ae-GlcN Ac
1
Пентапептид
Ундекапренил -PP
UDP- | GlcNAc |
UDP-
ндекапренил-PP-
Ундекапренил -P
MurN Ac
Пентапептид
MurN Ac
Пентапептид
К 2
UMP
UMP
Рис. 3-24. Реакции, участвующие в удлинении цепи пептидогликана с помощью
дисахаридпептида. GlcNAc (G) — N-ацетилглюкозамин; MurNAc(M) — N-ацетил-
мурамовая кислота; 1 — перенос MurNAc-пентапептида на ундекапренил-Р; 2 —
образование дисахаридпентапептида; 3 — перенос на цепь пептидогликана.
сначала переносится на мембранный липидный переносчик — ун-
декапренилфосфат (бактопренол):
СН3 сн3 сн3
\:=СН-СН2-(СН-С=СН-СН2)-СН2-С=СН-СН2О®
Z Бактопренол
СИ з
Затем он связывается с N-ацетилглюкозамином, Далее этот ди-
сахаридпентапептид транспортируется липидным переносчиком на
внеклеточную зону плазматической мембраны и используется как
строительный блок при удлинении цепи пептидогликана. По всей
вероятности, пептидогликан Е. coli состоит из мономолекулярного
слоя, в котором полисахаридный каркас обращен наружу, а пеп-
тидные остатки — к плазматической мембране. Образование поре-
76
Глава 3
Плазма ти чесная
мембрана
Рис. 3-25. Образование поперечных связей в результате транспептидации. Из
одного пептидного звена освобождается D-аланин; пептидная связь образуется
между оставшимся D-аланиновым остатком и свободной аминогруппой остатка
диаминопимелиновой кислоты (ДАП) в соседнем пептидном звене. Концевые
остатки D-аланина, не участвующие в реакциях транспептидации удаляются
D-аланин—карбоксипептидазой.
речных связей между соседними цепями происходит путем замы-
кания мостиков между некоторыми пептидными звеньями. Это
осуществляется в транспептидазной реакции. Как показано на
рис. 3-25, пептидная связь между двумя остатками D-аланина за-
меняется пептидной связью между D-аланином и остатком мезо-
диаминопимелата в соседней цепи. Освободившийся D-аланин пе-
реносится обратно в цитоплазму.
Образование поперечных связей посредством транспептидации
вне цитоплазмы, очевидно, выгодно1, поскольку при этом использу-
ется энергия пептидной связи и, следовательно, не требуется АТР.
Очевидно также, что для образования поперечной связи в поло-
жении 3 пептидного звена должна присутствовать аминокислота
со свободной функциональной группой. В пептидогликане Е. coli
это положение занято диаминопимелатом, тогда как пептидогли-
каны других микроорганизмов содержат лизин или орнитин (гл. 5,
разд. VIII).
Некоторые антибиотики препятствуют синтезу пептидогликана.
Пенициллин и цефалоспорин ингибируют реакцию транспептида-
ции. Поскольку эти реакции образования поперечных связей про-
исходят в растущих, а не в покоящихся клетках, то понятно, что
пенициллин и цефалоспорин убивают преимущественно растущие
клетки. На грамотрицательные бактерии, такие, как Е. coli, пени-
циллин не оказывает очень сильного действия, поскольку, чтобы
достигнуть слоя пептидогликана, он должен проникнуть сквозь до-
вольно толстый слой липополисахаридов и других компонентов
Ьиосинтез различных веществ из глюкозы у Е coli ТТ
* 11 - ................. ................. ,,,« Г,«И -I . ...
наружной мембраны. На грамположительные бактерии пенициллин
оказывает более сильное действие, чем на грамотрицательные.
3. Наружный слой мембраны. Этот слой содержит около 50% ли-
пополисахаридов, 35% фосфолипидов и 15% белков. Расположе-
ние данных компонентов схематически показано на рис. 3-26.
В состав липида А входят жирные кислоты, отличные от тех,
которые содержатся в фосфолипидах; особенно много в липиде А
3-гидрокситетрадекановой кислоты. Шесть молекул этой кислоты
связаны с глюкозаминовым дисахаридом липида А сложноэфир-
ными и амидными связями. Кроме того, этот дисахарид несет на
себе фосфатную группу и пирофосфорилэтаноламин (рис. 3-27).
Липид А распределен между молекулами фосфолипидов и соеди-
нен с олигосахаридным ядром (кором). Олигосахаридный кор со-
держит два необычных компонента: гептозу и 3-дезокси-Э-л*ая-
но-октулозоновую кислоту (прежде называвшуюся 2-кето-З-дезокси-
октоновой кислотой, КДО) В олигосахаридном коре присутствуют
также глюкоза, галактоза и N-ацетилглюкозамин.
СН2ОН СН2ОН
носн носн
Гептоза 3 дезокси-в манно октуло*
зоноеая кислота
Синтез олигосахаридного кора происходит ступенчато. Сначала
UDP-производные соответствующих сахаров с помощью пока еще
не установленных механизмов переносятся в зону липополисаха-
ридов и присоединяются к растущей цепи специфическими транс-
феразами. Состав олигосахаридного кора почти идентичен у всех
энтеробактерий. Однако в составе повторяющихся олигосахарид-
ных цепей существуют большие различия. Обычно 4 или 6 сахаров
образуют повторяющееся звено; в пределах одного вида, такого,
как Е. coli или, в особенности, Salmonella typhimurium, наблюда-
ется большое разнообразие в природе этих сахаров и последова-
тельности их расположения. Один щ^мер повторяющегося звена,
обнаруженного у Е. coli, приведен на рис. 3-28. Повторяющиеся
олигосахаридные цепи в основном ответственны за соматическую
(О) антигенную специфичность грамотрицательных бактерий
Биосинтез повторяющихся олигосахаридных цепей происходит
в результате реакций, аналогичных реакциям образования пепти-
догликана. Участвующие в этом процессе ферменты связаны С
мембранамй, а роль липидного переносчика играет ундекапренил-
фосфат. Активированные нуклеозиддифосфатом сахара переносят-
78
Глава 3
Првтд^ющиесй олиго-
сахариЬные цепи
Полисахаридный лор
Липид Л
Фосфолипид
Белок
Рис, 3-26. Расположение компонентов наружного слоя мембраны.
| Повторяющийся олигосахарид |
Глюкозой-ацетилглюкозамин
Глюкоза.
Глюкоза «--Галактоза
Гептоза--^Гептою-©
Гептозе -©-©-зтаноламин
дм ОК
[Зтаноламин
I
ЯИЯГ'-ЙИ^-©.®
©------
I
©
I
Зтаноламин
Флю1юзамин-^^Т'лю1Ю9амин- ©
Липид А
6 молекул жирной кислоты
Рис. 3-27. Строение липида А и олигосахаридного кора Е. coli. дмОК — 3-дезо]
сиО-лшн«о-октулозоновая кислота (ранее сокращавшаяся как КДО).
Биосинтез различных веществ из глюкозы у Е. coli
79
Рамноза
Галактоза-*----Матоза
ЪРацетилглюкозамин
Олигосаха-
рид ный.
кор
[ Липид А |
Рис. 3-28. Строение повторяющейся олигосахаридной цепи Е. coli.
ся на ундекапренилфосфат в нужном порядке для образования
ундекапренилпирофосфатолигосахарида. На наружной поверхно-
сти цитоплазматической мембраны эти звенья полимеризуются,
а затем переносятся к олигосахаридному кору.
В. Синтез информационных макромолекул
Макромолекулы, о которых мы говорили до сих пор, составле-
ны из повторяющихся последовательностей строительных блоков.
Например, гликоген состоит из молекул глюкозы, соединенных
друг с другом связями а-(1->4) или а(1->6). Пептидогликан пред-
ставляет собой полимер с чередующейся последовательностью
N-ацетилглюкозамина и N-ацетилмурамовой кислоты. Последняя
несет на себе тетрапептидную цепь, которая для данного микро-
организма всегда состоит из одних и тех же четырех аминокислот.
Понятно, что такие макромолекулы могут быть синтезированы
при участии небольшого числа специфических ферментов и что
для объединения строительных блоков в соответствующую
последовательность нет йеобходимости в матрице. Дело обстоит
иначе, когда мы обращаемся к синтезу нуклеиновых кислот и
белков. В этом случае отсутствуют регулярно повторяющиеся еди-
ницы, и синтез таких макромолекул должен происходить на мат-
рице, содержащей необходимую информацию. За исключением не*
которых вирусов, одна и та же иерархия установилась в матрич-
ной функции у всех организмов: ДНК служит матрицей для
синтеза ДНК и РНК; РНК служит матрицей для синтеза белков.
Происходящие при этом процессы мы рассмотрим здесь лишь
вкратце.
ео
Глава 3
Н--------20А-
Рис 3-29. Двуспиральная структура ДНК. Dдезоксирибоза; Р — фосфоэфирная
связь; А ~ аденин; С — цитозин; G — гуанин; Т — тимин.
1. Синтез ДНК и РНК. ДНК представляет собой двойную спираль
(модель Уотсона — Крика). Две полинуклеотидные цепи удержи-
ваются вместе водородными связями, которые наиболее эффектив-
но могут быть образованы только между двумя парами из че-
тырех оснований, присутствующих в ДНК: между аденином и
тимином и между гуанином и цитозином. На рис. 3-29 показан
короткий участок двойной спирали ДНК, а на рис. 3-30 — двойная
структура из двух пентануклеотидов. Можно видеть, что внутри
одной цепи нуклеозиды соединены друг с другом фосфатными
мостиками между 3'- и 5'-углеродными атомами дезоксирибозы.
Обе цепи закручены антипараллельно, т. е. левая цепь ориентиро-
= дезоксирибоза
Рис. 3-30. Двойная структура из двух пентануклеотидов.
Рис. 3-31 s АТ- и GC-пары оснований удерживаются вместе водородными ci
зями.
6*—1896
82
Глава 3
Рис. 3-32. Репликация ДНК. Полимераза присоединяет поступающий нуклеотид
к З'-гидроксильной группе, так что цепь растет в направлении 5'—>-3'. Полиме-
ризация сопровождается освобождением пирофосфата.
вана в направлении от концевой 5'-фосфатной группы к З'-гидро-
ксильной группе, а правая — в противоположном направлении.
На рис. 3-31 более детально показаны первые две пары осно-
ваний. Водородные связи обеспечивают настолько прочное спа-
ривание между А и Т и между G и С, что другие комбинации
оснований невозможны. Поскольку генетическая информация хра-
нится в ДНК в форме определенных последовательностей основа-
ний, удвоение этой информации осуществляется с помощью сле-
дующего механизма. Две цепи разъединяются; вдоль родитель-
ских цепей образуются две новые цепи, а природа каждого нук-
леотида; присоединяющегося к растущей цепи, определяется при-
родой основания в соответствующем положении родительской це-
пи. Процесс этот называется репликацией; катализируется он ДНК-
полимеразой (рис. 3-32).
ДНК-полимеразу обнаружили у Е. coli А. Корнберг и его со-
трудники в 1955 г. Этот фермент катализирует образование ДНК
из четырех дезоксирибонуклеозидтрифосфатов только в при-
сутствии матрицы. Как показано на рис. 3-32, мономеры присое-
диняются к З'-гидроксильной группе растущей цепи. В связи с
такой субстратной специфичностью возникает вопрос: каким об-
разом одновременно может реплицироваться другая родительская
цепь? Имеются данные о том, что после нескольких этапов поли-
меризации на родительской цепи А ДНК-полимераза перескаки-
вает на другую родительскую цепь (Б) и реплицирует ее в обрат-
ном направлении. Затем на родительской цепи А должен снова
Биосинтез различных веществ из глюкозы у Е. coli 83
начаться второй цикл репликации. Конечным результатом репли-
кации является образование из одной молекулы двух двухцепо-
чечных молекул ДНК, причем каждая из них содержит одну ро-
дительскую и одну новосинтезированную цепь.
У Е. coli имеется три ДНК-полимер азы. Фермент, впервые от-
крытый Корнбергом, вероятно, является в основном репарирую-
щим ферментом, а два других фермента участвуют главным об-
разом в репликации ДНК. Все они катализируют одну и ту же
общую реакцию:
Матрица
пДезоксинуклеозидтрифосфат----ДНКя 4- РР\.
Пирофосфат гидролизуется до фосфата пирофосфатазой. Сле-
довательно, образование ДНК обходится клетке в две молекулы
АТР в расчете на один мономер. В связи с тем, что содержание
ДНК в клетках составляет около 3%, только незначительная доля
необходимого для роста АТР тратится на синтез ДНК (табл. 3-2).
Синтез РНК осуществляется в основном при помощи анало-
гичного механизма. Клетки содержат ДНК-зависимую РНК-поли-
меразу, которая нуждается в GTP, СТР, АТР и UTP в качестве
субстратов. Таким образом, в отличие от ДНК, содержащего ти-
мин, РНК содержит урацил. Это не влияет на спаривание с аде-
нином, так как структуры урацила и тимина различаются только
одной метильной группой (табл. 3-4). РНК-полимераза транскри-
бирует только одну из цепей ДНК, и удлинение цепи происходит
в направлении Более того, в РНК-последовательности
транскрибируется не вся ДНК генома. Гены, в фенотипическом
выражении которых нет необходимости при существующих в клет-
ке физиологических условиях, остаются «молчащими». Гены же,
детерминирующие белок, требующийся в больших количествах,
транскрибируются чаще других. Следовательно, РНК-полимераза
должна получать сигналы, «сообщающие» ей, какую цепь ДНК
транскрибировать и в какой точке транскрипция должна начи-
наться и заканчиваться. Следовательно, транскрипция — процесс
более сложный, чем репликация.
РНК-полимераза также имеет очень сложную структуру; она
состоит из шести субъединиц: двух а-субъединиц и по одной субъ-
единице р, р', со и o'. Следовательно; в молекуле фермента присут-
ствует шесть различных полипептидных цепей. Так называемый
минимальный фермент (соге-фермент) агРР'со (без о) проявляет
каталитическую активность, но не способен узнавать стартовые
сигналы в ДНК. Однако агрегация o'-фактора с минимальным
ферментом приводит к образованию физиологически компетентной
РНК-полимеразы. Следовательно, a-фактор способствует узнава-
нию тех участков в ДНК, в которых должна произойти инициация
синтеза РНК. Для узнавания стоп-сигнала при синтезе РНК, по
6*
84
Глава 3
Рис 3 33 Синтез РНК Соге-фермент РНК-полимеразы соединяется с а факто-
ром Последний узнает стартовый сигнал на ДНК. При синтезе РНК о-фактор
освобождается Синтез РНК прекращается р-фактором.
крайней мере в некоторых случаях, требуется дополнительный
белковый фактор, обеспечивающий остановку РНК-полимеразы &
определенных точках. На рис. 3-33 показан ДНК-зависимый син-
тез РНК.
При синтезе РНК расходуется такое количество АТР на мо-
номер, как и при синтезе ДНК. Из трех классов образовавшейся
РНК — транспортной РНК (тРНК), рибосомной РНК (рРНК) и
информационной РНК (мРНК, матричная РНК) —последняя име-
ет очень короткую продолжительность жизни (период ее полужиз-
ни у £ coli — 3 мин) и быстро распадается до нуклеозидмонофос-
фатов, которые после фосфорилирования до соответствующих три-
фосфатов снова могут быть использованы для синтеза РНК. Если
культура £ colt за 30 мин увеличивает вдвое свою клеточную
массу, она успевает при этом синтезировать исходное количество
содержавшейся в ней информационной РНК примерно 10 раз!
С точки зрения потребности в АТР синтез РНК приблизительно
в 12 раз дороже для клеток, чем синтез ДНК (табл. 3-2).
2. Синтез белка. При репликации и транскрипции определенная
последовательность оснований в ДНК функционирует в качестве
матрицы для синтеза молекул ДНК и РНК, которые также имеют
строго определенную последовательность оснований. Оба процесса
можно легко объяснить, исходя из специфического спаривания
оснований. Очевидно, что синтез белков, состоящих из определен-
ной последовательности аминокислот, понять труднее, так как
Биосинтез различных веществ из глюкозы у Е. coli
85
Рис 3-34. Скрученная полипептидная цепь ферментного белка. || •— дисульфидные
мостики; активный центр.
аминокислота сама по себе не может узнать определенную после-
довательность оснований в РНК. Таким образом, называемый
трансляцией процесс перевода последовательности оснований в
последовательность аминокислот, составляющую данную полипеп-
тидную цепь, очень сложен.
Все функции белков определяются их аминокислотной после-
довательностью. На рис. 3-34 приведена модель ферментного бел-
ка. Соответствующее положение определенных аминокислот обус-
ловливает правильное свертывание полипептидной цепи, образо-
вание ковалентных связей (например, —S—S-мостиков) между
цепями и функционирование определенного участка молекулы
фермента в качестве активного центра. Ясно, что синтез биологи-
чески активных белков должен осуществляться, с большей точ-
ностью. Включение глутамата вместо лизина в определенное по-
ложение полипептидной цепи вполне может привести к потере
белком ферментативной активности.
В 1961 г. Маттеи и Ниренберг показали, что образование по-
лифенилаланина в бесклеточной системе можно катализировать
добавлением полиуридиловой кислоты в качестве матрицы; дру-
гие аминокислоты при этом не полимеризовались. Поскольку к
этому времени уже было известно, что звено из трех нуклеотидов
РНК (триплет) кодирует одну аминокислоту, было сделано за-
ключение, что триплет UUU является кодовым словом (кодоном)
для фенилаланина. С помощью синтетически полученных рибо-
цуклеотидов с известной последовательностью оснований оказа-
лось возможным разгадать значение всех 64 (43) возможных ком-
бинаций триплетов. Некоторые кодоны, легко запоминаемые, при-
ведены в табл. 3-6.
Каким же образом триплет оснований обеспечивает включение
определенной аминокислоты в растущую полипептидную цепь?
Принцип этого процесса схематически показан на рис. 3-35. Как
85
Глава 3
Таблица 3-6
Значение некоторых триплетов оснований
ДНК Информационная РНК Аминокислота
ААА UUU Фенилаланин
ттт ААА Лизин
GGG ссс Пролин
ТАС AUG Метионин
видно из приведенного рисунка, в синтезе полипептидной цепи
участвует несколько компонентов: информационная РНК, функ-
ционирующая в качестве матрицы; связанные с ней 708-рибосомы,
которые катализируют образование пептидных связей и состоят
из 30S- и 508-субчастиц; транспортные РНК, к которым при по-
мощи специфических ферментов — аминоацил-тРНК—синтетаз —
присоединяются соответствующие аминокислоты. В примере, по-
казанном на рис. 3-35, специфическая для фенилаланина синтетаза
связывает данную аминокислоту со специфической для фенилала-
нина тРНК. Эта тРНК благодаря механизму спаривания основа-
ний узнает своим антикодоновым участком (ААА) кодон фенил-
аланина (UUU) в молекуле информационной РНК- Пептидная
связь образуется путем переноса полипептидной цепи от соседней
Рис, 3-35. Принцип трансляции.
Биосинтез различных веществ из глюкозы у Е. Coll 87
тРНК (на рис. 3-35 — пролиновая тРНК) на аминогруппу фенил-
аланина.
Образование аминоацил-тРНК катализируется аминоацил-
тРНК—синтетазами согласно следующим уравнениям:
R—СН-СООН + АТР + Фермент—>• (R—СН—СО-АМР)-фермент + РА
NH2 nh2
(R—СН-СО—АМР)-фермент+тРНК—*R—СН—СО-тРНК+Фермент+АМР
NH, NH2
Аминоацильная группа связана с З'-ОН-группой концевого
аденозина тРНК. У Е. coli содержится более 50 различных тРНК,
так что для каждой аминокислоты существует от одной до трех
специфических тРНК. В наличии имеется также по крайней мере
20 различных аминоацил-тРНК—синтетаз, которые высоко специ-
фичны. Каждая из них способна выбрать «свою» аминокислоту из
20 имеющихся в цитоплазме, образовать соответствующий адени-
лат и перенести аминоацильный остаток к «правильной» тРНК.
Каталитическая машина для синтеза полипептидов спрятана в
рибосомах, которые состоят из тяжелой (50S) и легкой (30S)
субчастиц и содержат белки и рибосомную РНК. Образование
пептидной связи осуществляется поочередно двумя центрами ри-
босомы, аминоацильным центром (А) и пептидильным центром
(Р). Один полный цикл изображен на рис. 3-36. Из способа осу-
ществления трансферазной реакции (стадия 2) следует, что поли-
пептидная цепь растет в направлении от N-концевой аминокисло-
ты к C-концевой аминокислоте.
У Е. coli и других бактерий синтез всех белков начинается со
связывания N-формилметионил-тРНК с пептидильным центром
ЗОБ-субчастицы, которая присоединена к инициирующему три-
плету мРНК (AUG или GUG). Затем, после присоединения 50S-
субчастицы, нужная аминоацил-тРНК приближается к А-центру
рибосомы и образуется первая пептидная связь. Сигналом терми-
нации полипептидной цепи служат специальные кодоны мРНК
(UAG или UAA). Большинство белков не содержит в качестве
N-концевой аминокислоты N-формилметионин. Формильная груп-
па и ©о многих случаях остаток метионина удаляются из готовых
белков специфическими ферментами.
Для синтеза белков требуется много энергии. Активация ами-
нокислоты обеспечивается превращением одной молекулы АТР в
АМР и РРс, в одном цикле элонгации 2 молекулы GTP гидроли-
зуются до 2GTP+2P1. Таким образом для образования одной пеп-
тидной связи необходим эквивалент 4АТР. Это делает биосинтез
белка наиболее дорогостоящим процессом. Е. coli, растущая на
среде с глюкозой, должна вкладывать в синтез белка около 50%
энергии, полученной в процессе метаболизма.
Рис. 3-36. Стадии удлинения пептида на одну аминокислоту. А. Фенилаланин-
-тРНК связывается с центром А. На этой стадии требуется GTP; он гидроли-
зуется до GDP и Pj. Б. Пептидная связь образуется путем переноса пептида на
фенилаланин-тРНК. Пролиновая тРНК освобождается, В. Реакция транслока-
ции. Рибосома передвигается на один шаг, так что пептидил-тРНК связывается
с P-центром. Эта реакция также сопровождается гидролизом GTP. Г К А-центру
приближается лизин-тРНК.
Биосинтез различных веществ из глюкозы у Е. coli
X. Потребность в анаплеротической
последовательности
Как было отмечено,' промежуточные продукты цикла трикар-
боновых кислот, подобные а-оксоглутарату, служат предшествен-
никами в биосинтезе некоторых компонентов клетки. Следователь-
но, цикл трикарбоновых кислот имеет двойную функцию: он реге-
нерирует восстановленные пиридиновые и флавиновые нуклеотиды
для дыхательной цепи и поставляет исходный материал для био-
синтетических последовательностей. Последняя функция создает
определенную проблему, так как принцип цикла состоит в том,
что С4-дикар боновая кислота конденсируется с Са-соединением,
образуя С6-соединение. Образовавшееся С6-соединение окисляет-
ся таким образом, что С4-дикарбоновая кислота регенерируется.
Если промежуточный продукт типа а-оксоглутарата расходуется
на биосинтетические цели, то общий запас С4-дикарбоновых кис-
лот должен резко сократиться. Ясно, что должны существовать
дополнительные реакции, в которых С4-дикар боновые кислоты об-
разуются непосредственно из промежуточных продуктов распада
глюкозы. Согласно Корнбергу, реакции такого типа называются
анаплеротическими последовательностями (восполняющими реак-
циями). Ситуация у Е. coli, растущей на глюкозе, показана на
рис. 3-37. Промежуточные продукты цикла используются для син-
теза глутамата, порфиринов и аспартата; необходимый оксалоаце-
тат поставляется реакцией, катализируемой фосфоенолпируват-
Рис. 3-37. Функция фосфоенолпируват-карбоксилазы в качестве анаплеротеческо-
го фермента при росте Б. coli на среде с глюкозой.
so
Глава 3
карбоксилазой:
Фосфоенолпируват-карбоксилаза
Фосфоенолпируват + СО2---------------------*“ Оксалоацетат + Pi.
Мутанты Е, coli, лишенные этого фермента, могут расти на
глюкозе только при добавлении в среду пригодных к использова-
нию промежуточных продуктов цикла трикарбоновых кислот или
их предшественников. Как будет обсуждаться ниже, другие орга-
низмы используют пируваткарбоксилазу в качестве анаплероти-
ческого фермента при росте на углеводах; при росте на субстра-
тах, подобных ацетату и пирувату, действуют другие анаплероти-
ческие последовательности.
XI, Выводы
1. Escherichia coli способна синтезировать все компоненты кле-
ток из глюкозы и минеральных веществ. Стратегия биосинтеза со-
стоит в том, что относительно немногие промежуточные продукты
энергетического обмена (глюкозо-6-фосфат, фосфоенолпируват,
а-оксоглутарат и т. д.) используются для синтеза мономеров, ко-
торые затем полимеризуются, образуя макромолекулы. На долю
последних приходится приблизительно 97% от сухой биомассы.
2. При низких концентрациях аммиака он ассимилируется при
помощи глутаминсинтетазы. В результате переноса амидной груп-
пы на а-оксоглутарат (глутаматсинтазная реакция) образуется
глутамат. При высоких концентрациях аммиака глутамат образу-
ется из а-оксоглутарата также и в реакции, катализируемой глу-
таматдегидрогеназой.
3. Основным источником серы служит сульфат. Он восстанав-
ливается до H2S через АФС и ФАФС. H2S реагирует с О-ацетил-
серином с образованием цистеина.
4. Для белкового синтеза требуется 20 аминокислот. Аланин
и аспартат синтезируются из пирувата и оксалоацетата путем
переаминирования с использованием глутамата в качестве донора
NHa-rpynnbi. Аспарагин образуется в реакции, аналогичной реак-
ции, катализируемой глутамин-сиптетазой. Восстановление аспар-
тата дает полуальдегид аспарагиновой кислоты — предшественник
лизина, треонина и метионина. Дезаминирование треонина приво-
дит к образованию а-оксобутирата, который в результате после-
довательного действия четырех ферментов превращается в изолей-
цин. Те же четыре фермента превращают пируват в валин; про-
межуточный продукт синтеза валина служит также предшествен-
ником в образовании лейцина. Серин, глицин и цистеин образуются
из 3-фосфоглицерата, а пролин и аргинин — из глутамата. Три
ароматические аминокислоты (тирозин, фенилаланин и триптофан)
синтезируются из эритрозо-4-фосфата и фосфоенолпирувата; ши-
кимат и хоризмат являются общими промежуточными продукта-
Биосинтез различных веществ из глюкозы у Е. coli^91
ми для всех этих трех аминокислот. Гистидин образуется из 5-фос-
форибозил-1-пирофосфата и АТР в сложных сериях реакций под
действием девяти ферментов.
5. Пентозофосфаты и NADPH2 синтезируются в окислитель-
ном пентозофосфатном цикле. К образованию NADPH2 ведут ре-
акции, катализируемые глюкозо-6-фосфат- и 6-фосфоглюконат-де-
гидрогеназами. Первым образовавшимся пентозофосфатом явля-
ется рибулозо-5-фосфат; он может изомеризоваться с образованием
рибозо-5-фосфата. Пентозофосфаты могут снова превращаться в
гексозофосфаты в результате реакций, катализируемых транске-
толазой и трансальдолазой.
6. Аспартат, карбамоилфосфат и 5-фосфорибозил-1-пирофосфат
служат предшественниками пиримидиновых нуклеотидов. Сначала
образуется оротовая кислота; она превращается в оротидинмоно-
фосфат и, наконец, в UTP и СТР. Имидазолрибонуклеотид явля-
ется промежуточным продуктом в синтезе пуриновых нуклеоти-
дов. Последующие реакции карбоксилирования, формилирования
и аминирования дают инозиновую кислоту (IMP), которая служит
конечным предшественником АТР и GTP. Восстановление рибо-
нуклеотидов в дезоксирибонуклеотиды происходит на уровне ди-
фосфатов.
7. Escherichia coli содержит фосфолипиды и гликолипиды в ка-
честве компонентов мембранных систем. Запасания нейтральных
жиров у Е. coli не происходит. Жирные кислоты с длинной цепью-
синтезируются растворимыми ферментными системами из ацетил-
АПБ (АПБ — ацилпереносящий белок) и малонил-АПБ. От обра-
зовавшегося в результате ацил-АПБ ацильный остаток переносит-
ся на глицерофосфат с образованием фосфатидных кислот. Обра-
зование сложных эфиров последних со спиртами дает различные
фосфолипиды.
8. UDP-N-ацетилглюкозамин и его 3-лактильное производное,
UDP-N-ацетилмурамовая кислота, служат предшественниками
пептидогликана. Они синтезируются из фруктозо-6-фосфата. UDP-
N-ацетилмурамовая кислота далее превращается в UDP-N-аце-
тилмурамилпентапептид. Пентапептидная цепь у Е. coli состоит из
L-аланина, D-глутамата, л^зо-диаминопимелиновой кислоты и
D-аланина.
9. Мембраны, такие, как плазматическая мембрана, состоят из
двойного слоя фосфолипидных молекул; они содержат до 60%
белка. Мембраны выполняют специфические функции в процессах
транспорта.
10. Периодические макромолекулы типа гликогена, пептидо-
гликана и компонентов наружного слоя мембраны синтезируются
из своих строительных блоков под действием специфических фер-
ментов. Гликоген образуется путем переноса глюкозы от АОРглю-
козы на олигосахаридную затравку. Два строительных блока пеп-
тидогликана сначала переносятся на мембранный липидный пере-
92
Глава 3
носчик ундекапренилфосфат (бактопренол), а затем транспорти-
руются к месту удлинения пептидогликана. Образуются полиса-
харидные связи, а поперечные сшивки между полисахаридными
цепями осуществляются с помощью пептидных связей между ос-
татком л<езо-диаминопимелата одной цепи и остатком D-аланина
другой. Наружный слой мембраны состоит из липида А, олигоса-
харидного остова и повторяющихся олигосахаридных цепей.
11. Синтез информационных макромолекул происходит на мат-
рицах. ДНК служит матрицей для синтеза ДНК и РНК, а инфор-
мационная РНК — матрицей для синтеза белка. Информация хра-
нится в ДНК в форме определенных последовательностей основа-
ний; эти последовательности узнаются путем спаривания основа-
ний между аденином и тимином (урацилом в случае РНК) и меж-
ду гуанином и цитозином. Субстратами при синтезе ДНК и РНК
служат дезоксирибонуклеозид- и рибонуклеозидтрифосфаты соот-
ветственно; в ^результате реакций полимеризации происходит
образование пирофосфата.
При трансляции последовательностей оснований в соответству-
ющие последовательности аминокислот триплеты оснований ин-
формационной РНК служат кодонами аминокислот. Триплет ос-
нований опознается антикодоновым участком транспортной РНК
благодаря механизму спаривания оснований. Например, триплёт
UUU опознается антикодоном ААА транспортной РНК, специфи-
ческой для фенилаланина. Таким образом, фенилаланин включа-
ется в растущую пептидную цепь, когда на информационной РНК
появляется UUU. Синтез белка происходит на рибосомах, состоя-
щих из 50S- и 30S-субчастиц. Синтез белка инициируется связы-
ванием N-формилметионил-тРНК с 30S-субчастицей рибосомы, ко-
торая присоединена к инициирующему триплету информационной
РНК. Затем происходит присоединение 503-субчастицы и начина-
ется образование пептидных связей. Для образования одной пеп-
тидной связи требуется эквивалент 4 молекул АТР.
12. При росте Е. coll на среде с глюкозой реакция, катализи-
руемая фосфоенолпируват-карбоксилазой, служит анаплеротиче-
ской реакцией.
Глава 4
АЭРОБНЫЙ РОСТ ESCHERICHIA COLI
НА СУБСТРАТАХ, ОТЛИЧНЫХ ОТ ГЛЮКОЗЫ
Escherichia coli способна расти на средах, содержащих вместо
глюкозы другие углеводы, а также на средах со многими органи-
ческими кислотами и аминокислотами. В этой главе мы рассмот-
рим дополнительные ферментные системы, требующиеся для ис-
пользования некоторых из этих субстратов.
I. Фруктоза и лактоза в качестве субстратов
Фруктоза служит прекрасным субстратом для многих бакте-
рий. Как и в случае глюкозы, поступление фруктозы в клетки
Е, coli обеспечивается фосфоенолпируват-фосфотрансферазной сис-
темой. Однако в этом случае в клетке образуется фруктозо-1-фос-
фат, а не фруктозо-6-фосфат.
Фермент I
Фосфоенолпируват + Нрг —Фосфо-Нрг + Пируват,
Фермент II
Фосфо-Нрг + Фруктоза----------► Фруктозо-1-фосфат + НРг.
Следовательно, помимо специфического в отношении фрукто-
зы фермента II в системе транспорта, для использования фрукто-
зы требуется второй фермент: 1-фосфофруктокиназа. Синтез этого
фермента специфически индуцируется фруктозой. На рис. 4-1 про-
иллюстрированы различия в первых этапах обмена глюкозы и
фруктозы. Отсюда становится ясным, почему Корнбергу и его со-
трудникам удалось выделить мутанты, которые росли на среде с
глюкозой, но не на среде с фруктозой. Эти мутанты лишены 1-фос-
фофруктокиназы.
Клетки Е. coli, выращенные на глюкозе, не способны сразу ис-
пользовать лактозу. Для этого им требуются дополнительные фер-
менты, образование которых индуцируется только при наличии в
среде лактозы.
После добавления к среде лактозы в клетках начинают синте-
зироваться три фермента: лактозопермеаза, р-галактозидаза и
^-галактозид—ацетилтрансфераза. Эти ферменты имеют очень
94
Глава 4
Фруктоза
Глюкоза
Фосфоенолпируват- фосфотрансферазные системы
Фруктоза-}-® Глюкоз о -6-(Р)
Фосфоглюназо -
изомераза
дур Фруктозо-Ь-®
ADP 6-фоефофрукти-
s' киназа
Фруктоза-}, 6-бисфосфат
Рис. 4-1. Первые этапы метаболизма глюкозы и фруктозы у Е. coll.
важное значение не только потому, что благодаря им Е. coli при-
обретает способность расти на средах с лактозой, но еще и пото-
му, что изучение их координированного образования привело к
созданию модели оперона Жакоба и Моно и к выяснению меха-
низма регуляции синтеза ферментов. Это мы рассмотрим в гл. 7.
Лактозопермеаза катализирует энергозависимый транспорт
лактозы в клетку, а р-галактозидаза гидролизует лактозу с обра-
зованием глюкозы и галактозы (рис. 4-2). Биологическая функция
Р-галактозид—ацетилтрансферазы, которая ацетилирует лактозу и
Лактоза
________________I___________
Пермеаза (нул< бающаяся в энергии) МсмЬра,
Лактоза
0~ Гялактозидаза
Галактоза Глюкоза
Рис 4-2. Превращение лактозы в галактозу и глюкозу
Адробный рост Е, coli на субстратах, отличных от глюкозы
95
Рис. 4-3, Превращение галактозы в глюкозо-1-фосфат. 1 — галактокиназа; 2 —
глюкоза: галактозо-1-фосфат—уридилилтрансфераза; 3 — уридиндифосфат—глю-
козоэпимераза.
другие р-галактозиды, используя ацетил-СоА, вероятно, состоит в
его обезвреживающем действии: с его помощью неметаболизируе-
мые структурные аналоги лактозы ацетилируются и удаляются.
Глюкоза, образовавшаяся из лактозы, фосфорилируется под
действием гексокиназы до глюкозо-6-фосфата. Следует напомнить,
что гексокиназа не требуется для роста Ё. coli на средах с глюко-
зой или фруктозой: фосфоенолпируват-фосфотрансферазные сис-
темы образуют гексозомонофосфат непосредственно. Однако гексо-
киназа используется для фосфорилирования глюкозы или фрукто-
зы, образующихся в самой клетке при гидролизе олигосахаридов.
Галактоза, возникшая из лактозы, индуцирует синтез трех фер-
ментов, участвующих в ее дальнейшем метаболизме: галактокин-
азы (1), глюкоза: галактозо-1-фосфат—уридилилтрансферазы (2)
и СЮРглюкоза — 4-эпимеразы (3). В совокупности они катализи-
руют следующие реакции: галактоза фосфорилируется при 1-м уг-
леродном атоме; ГЮРглюкоза реагирует с галактозо-1-фосфатом
с образованием глюкозо-1-фосфата и UDPra лактозы; последняя
эпимеризуется до ГЮРглюкозы (рис. 4-3).
Индукция этих ферментов обусловливает поступление лактозы
в путь Эмбдена—Мейергофа — Парнаса и в реакции последую-
щих превращений.
' И. Ацетат, пируват и малат в качестве субстратов
При переносе Е. coll со среды, содержащей глюкозу или фрук-
тозу, на среду, содержащую ацетат в качестве источника углеро-
да и энергии, изменение оказывается довольно резким, поскольку
синтез всех клеточных компонентов должен теперь начинаться с
С2-единиц. Очевидно, что при этом возникает потребность в но-
вых ферментных системах, описание которых будет приведено ни-
же. Образование NADH2, необходимого для синтеза АТР в дыха-
$6
Глава 4
тельной цепи, происходит очень просто. Ацетат активно транспор-
тируется в клетку, а затем превращается в ацетил-СоА:
Ацетаткинааа
Ацетат 4- АТР---------► Ацетилфосфат 4- ADP,
Фос фотрансацетил аз а
Ацетилфосфат 4- СоА---------------► Ацетил СоА 4- Pt.
Ацетил-СоА затем вводится в цикл трикарбоновых кислот, да-
вая таким образом NADH2.
Однако возникает вопрос: каким образом осуществляется ре-
генерация промежуточных продуктов цикла, служащих исходным
материалом для процессов биосинтеза? Очевидно, что анаплеро-
тическая последовательность, приводящая к образованию оксало-
ацетата из фосфоенолпирувата, которая имеет значение при росте
на средах с углеводами, в данном случае не может функциониро-
вать; прямого образования фосфоенолпирувата из ацетата не про-
исходит. Вместо этого используются два других анаплеротических
фермента, изоцитрат-лиаза и малат-синтаза. Первый из них ка-
тализирует расщепление изоцитрата до сукцината и глиоксилата:
сн2-соон 1 Изоцитрат-лиаза сн2-соон
НС—соон ..... ...... — . .. Чн .... сн2-соон
но—сн—соон О сн—соон
Малат-синтаза катализирует конденсацию ацетил-СоА с глио-
ксилатом с образованием малата — реакция, аналогичная цитрат-
синтазной реакции.
СНз—СО—СоА +н,0 _ СНа—СООН
' * | _l
о сн—соон Малат синтаза он—сн—соон
Вместе с ферментами цикла трикарбоновых кислот эти реак-
ции образуют так называемый глиоксилатный цикл. Значение это-
го цикла проиллюстрировано на рис. 4-4. Реакции цикла трикар-
боновых кислот в сочетании с изоцитрат-лиазной реакцией ката-
лизируют окисление ацетил-СоА до глиоксилата Последний может
затем конденсироваться с другой молекулой ацетил-СоА с обра-
зованием малата. Таким образом, синтезируется дополнительный
оксалоацетат (в действительности образованный из двух молейсул
ацетил-СоА), который может использоваться для образования глу-
тамата (через цитрат и а-оксоглутурат) и других соединений, об-
разующихся из промежуточных продуктов цикла. Кроме того, ок-
салоацетат служит исходным материалом для всех углеводов, тре-
бующихся для синтеза полимеров. Основным предшественником в
глюконеогенезе является фосфоенолпируват, а он образуется из
Аэробный рост Е. coli на субстратах, отличных от глюкозы
Рис. 4-4. Функции реакций цикла трикарбоповых кислот и глиоксилатного цикла
при росте Е. coll на ацетате. Для иллюстрации допустим, что 2 молекулы оксало-
ацетата реагируют с 2 молекулами ацетил-СоА с образованием 2 молекул цитра*
та. Они превращаются в 2 молекулы изоцитрата, одна из которых окисляется в
цикле трнкарбоновых кислот н регенерирует 1 молекулу оксалоацетата. Вторая
молекула изоцитрата расщепляется до сукцината и глиоксил ата; окисление сукци-
ната дает вторую молекулу оксалоацетата. Глиоксилат конденсируется с аце-
тил-СоА с образованием малата, из которого может возникнуть третья молекула
оксалоацетата. Таким образом, одна молекула оксалоацетата может быть исполь-
зована для целей биосинтеза.
оксалоацетата и АТР при помощи фосфоенолпируват-карбокси-
киназы:
Фосфоенолпируват-карбокснкиназа
Оксалоацетат + АТР —..................- ..—> Фосфоенолпируват +
4- ADP + СО2.
Все реакции пути Эмбдена — Мейергофа — Парнаса на участ-
ке между фосфоенолпируватом и фруктозе-1,6-бисфосфатом обра-
тимы, так что в соответствующих условиях это соединение может
синтезироваться из фосфоенолпирувата. Фруктозо-1,6-бисфосфат
выводится из равновесия под действием специфической фосфатазы*
которая необратимо гидролизует бисфосфат до фруктозо-6-фос-
фата.
7—1896
©8
Глава 4
Реакции глиоксилатного цикла служат анаплеротической по-
следовательностью у Е. coli, использующей в качестве субстрата
ацетат или соединения, расщепление которых сопровождается об-
разованием ацетил-СоА,
Ацпл. Эм^еияг* ...
<рруктозо-6-фоссрат
Удивительно, что при росте на среде с пируватом Е. coli ис-
пользует другую анаплеротическую последовательность. Под дей-
ствием пируватдегидрогеназного комплекса пируват окисляется до
ацетил-СоА, который затем поступает в цикл трикарбоновых кис-
лот. В синтезе фосфоенолпирувата участвует новый фермент —
фосфоенолпируват-синтетаза, В связи с этим следует напомнить,
что в пути Эмбдена — Мейергофа — Парнаса пируваткиназа ката-
лизирует превращение фосфоенолпирувата в пируват, причем ре-
акция сопровождается увеличением стандартной свободной энер-
гии при pH 7,0 на 5,7 ккал/моль (23,8 кДж/моль):
Пируваткиназа
Фосфоенолпируват + ADP-----------> Пируват + АТР Дб'о=—5,7 ккал/моль
(—23,8 кДж/моль)
Следовательно, эта реакция необратима и не может постав-
лять фосфоенолпируват для глюконеогенеза. В фосфоенолпируват-
синтетазной реакции отрицательное изменение свободной энергии
достигается гидролизом одной из высокоэнергетических пирофос-
фатных связей АТР:
Фосфоенолпируват-синтетаза
Пируват + АТР----------------------► Фосфоенолпирурат + АМР + Pi -
AG0 = —2 ккал/моль (—8,4 кДж/моль)
Промежуточным продуктом этой реакции является пирофосфо-
рилированный фермент:
Фермент + АТР 4--"-te Фермент-РР + АМР
Фермент-РР 4- Н^О ч---* Фермент-Р + Р>
Фермент-Р + Пируват <- >• Фосфоенолпируват + Фермент
Оксалоацетат, требующийся для восполнения запаса промежу-
точных продуктов цикла трикарбоновых кислот, образуется из
фосфоенолпирувата с помощью карбоксилазы, как и при росте на
средах с глюкозой и другими углеводами. Важное значение фос-
фоенолпируват-синтетазы при росте Ё. coli на средах с пируватом
Аэробный рост В. coli на субстратах, отличных от глюкозы 9£Г
или лактатом четко установлено. Получены мутанты, способные
использовать в качестве субстрата глюкозу и ацетат, но не пиру-
ват и лактат; фосфоенолпируват-синтетаза у таких мутантов не’
образуется.
С4-дикар боновые кислоты являются хорошими субстратами для
аэробного роста Е. coli. Например, L-малат поглощается и окис-
ляется до оксалоацетата малатдегидрогеназой. Образовавшийся
таким путем оксалоацетат может служить субстратом в анаболи-
ческих реакциях и в цикле трикарбоновых кислот. Однако доволь-
но очевидно, что для превращения малата в пируват требуется
определенная ферментная система; инаце не происходило бы об-
разование ацетил-СоА и различных метаболитов, образующихся
из пирувата. Синтез пирувата осуществляется малатдегидрогена-
зой декарбоксилирующей (так называемым «яблочным» фермен-
том):
Малатдегидрогеназа (декарбоксилирующая)
L-малат + NAD <— . -. — Пируват + NADH2 + СОд
Помимо NAD-специфического фермента в клетках Е. coli, расту-
щих на среде с малатом, присутствует NADP-специфическая ма-
латдегидрогеназа. Она поставляет NADPH2 для процессов био-
синтеза. Фосфоенолпируват образуется из оксалоацетата с по-
мощью фосфоенолпируват-карбоксикиназы и из пирувата — под
действием фосфоенолпируват-синтетазы.
Доля АТР, которая должна быть израсходована на биосинтез
мономеров в процессе роста, в большой степени зависит от при-
роды субстрата. Эта доля невелика, когда в качестве субстрата
используется глюкоза, поскольку образование предшественников
в синтезе мономеров (фосфоенолпируват, пируват, ацетил-СоА)
связано с накоплением АТР. При образовании жё тех же самых
соединений из ацетата АТР расходуется. Стаутхамер подсчитал,
что для образования 1 г клеток из глюкозы требуется 34,8 ммоль
АТР, а для образования 1 г клеток из ацетата — 99,5 ммоль АТР.
III. Выводы
1. Изменение субстрата делает необходимыми изменения в
ферментном аппарате клетки: 1) синтез соответствующих фермен-
тов катаболизма и систем транспорта, специфичных для данного
субстрата; 2) функционирование соответствующих анаплеротиче-
ских последовательностей.
2. При транспорте фруктозы фосфоенолпируват-фосфотранс-
феразной системой образуется фруктозо-1-фосфат, который фос-
форилируется 1-фосфофруктокиназой во фруктозо-1,6-бисфосфат.
Лактоза транспортируется лактозопермеазой в клетки и затем
расщепляется fJ-глактозидазой до глюкозы и галактозы.
3. При росте на среде с ацетатом в качестве анаплеротической
последовательности Е. coli требуется глиоксилатный цикл, для
7*
100 Глава 4
функционирования которого необходимы ферменты цикла трикар-
боновых кислот плюс изоцитр ат-ли аз а и малат-синтаза. Глиокси-
латный цикл осуществляет синтез С4-дикарбоновых кислот из аце-
тата. Кроме того, для образования фосфоенолпирувата при глю-
конеогенезе требуется фосфоенолпируватчкарбоксикиназа.
4. При росте Е. coli на среде с пируватом фосфоенолпируват-
синтетаза и фосфоенолпируват-карбоксилаза служат анаплероти-
ческими ферментами; при росте на L-малате для образования
пирувата требуется малатдегидрогеназа декарбоксилирующая.
5. Доля АТР, которая должна быть вложена в биосинтез мо-
номеров в процессе роста, зависит от природы использованного
субстрата.
Глава 5
МЕТАБОЛИЧЕСКОЕ РАЗНООБРАЗИЕ
АЭРОБНЫХ ГЕТЕРОТРОФОВ
В предыдущих главах мы рассматривали Е. coli в качестве мо-
дельного организма, чтобы познакомиться с основными реакция-
ми, участвующими в образовании АТР при аэробном росте и в
биосинтезе различных компонентов клетки. Кроме того, мы обсуж-
дали те изменения в ферментном аппарате клетки, которые, оче-
видно, происходят при замене глюкозы другими субстратами.
Эта относительно простая картина окажется значительно слож-
нее, если мы обратимся к другим бактериям. Многие из них сход-
ны с Е. coli по своим пищевым потребностям, но используют из-
мененные катаболические пути и иные анаплеротические после-
довательности или образуют другие запасные вещества и другие
компоненты клеточной стенки. Некоторые аспекты этого метабо-
лического разнообразия среди аэробных гетеротрофов мы обсу-
дим в данной главе.
I. Различные механизмы поглощения субстратов
Клетки Е. coli поглощают глюкозу и фруктозу при помощи
фосфотрансферазных систем, а лактозу, напротив, путем активно-
го транспорта. При сравнении способов, с помощью которых ве-
щества из окружающей среды проходят через клеточную мембра-
ну в цитоплазму, можно выделить четыре различных механизма:
пассивную диффузию, облегченную диффузию, активный транс-
порт и перенос групп.
А. Пассивная диффузия
Переносимое вещество не взаимодействует специфически с
компонентами клеточной мембраны. Оно проходит сквозь мембра-
ну до тех пор, пока не установится равновесие между концентра-
циями внутри и снаружи. Из того факта, что в 'природе концен-
трация большинства метаболитов в клетке выше, чем снаружи,
очевидно, что транспорт путем пассивной диффузии должен быть
ограничен небольшой группой веществ, а именно газами, такими,
102
Глава 5
как кислород, водой и некоторыми ионами. У Е. coli ионы натрия
постулают путем пассивной диффузии, тогда как ионы калия и
магния транспортируются в клетку активно. Однако следует так-
же отметить, что многие другие бактерии используют системы
активного транспорта и для ионов натрия.
Б. Облегченная диффузия
Облегченная диффузия — это процесс, сходный с пассивной
диффузией в том отношении, что ни один из этих процессов не
требует метаболической энергии, и оба они легко обратимы, так
что концентрация вещества в клетке и в среде оказывается оди-
наковой. Однако в отличие от пассивной диффузии облегченная
диффузия включает в себя транспорт соответствующего вещества
с помощью специфического мембранного переносчика; переносимое
вещество связывается с переносчиком снаружи и освобождается
внутри клетки. Следовательно, транспорт специфичен по отноше-
нию к субстрату. Если, например, мембрана содержит только
глюкозоспецифический переносчик, то другие углеводы не смогут
транспортироваться в клетку. Эритроциты и дрожжевые клетки
поглощают сахара путем облегченной диффузии, тогда как у
аэробных бактерий такой механизм транспорта представляется не
очень существенным. Однако у анаэробов этот процесс, по всей
видимости, участвует в поглощении некоторых соединений и в вы-
делении продуктов брожений.
В. Активный транспорт
Более высокая эффективность активного транспорта по срав-
нению с процессами диффузии проиллюстрирована на рис. 5-1.
Очевидно, что активный транспорт приводит к насыщению фер-
ментного аппарата клетки субстратом при значительно более низ-
кой концентрации субстрата в среде, чем это имеет место при
диффузионных процессах. Наблюдалось концентрирование веществ
в несколько сотен раз; следовательно, активный транспорт дает
клеткам возможность расти на средах, содержащих субстраты в
низких концентрациях, — ситуация, обычная в природе. Процесс
поглощения определяется как активный транспорт в соответствии
со следующими параметрами.
1. Специфичность по отношению к субстрату; на наружной по-
верхности мембраны образуется комплекс переносчик — суб-
страт.
2. Потребность в метаболической энергии; переносчик обладает
высоким сродством к субстрату, когда он обращен к внешней
поверхности мембраны, и низким сродством к нему, когда об-
ращен к ее внутренней поверхности. На эти изменения перенос-
чика и расходуется энергия.
Метаболическое разнообразие аэробных гетеротрофов
103
Рис. 5-1. Внутренняя концентрация лактозы у Е. coll в зависимости от концен-
трации лактозы в среде и от используемого процесса транспорта. Концентрация
лактозы приведена в произвольных единицах.
3. Транспорт соответствующего субстрата против градиента кон-
центрации; это происходит за счет изменения сродства пере-
носчика к субстрату при переходе снаружи внутрь.
4. Освобождение в цитоплазму немодифицированного субстрата
(в отличие от переноса групп).
Активный транспорт схематически показан на рис. 5-2.
Что же служит источником энергии для активного транспорта?
Рис. 5-2 Поглощение молекулы субстрата за счет активного транспорта. Д. Пе-
реносчик обращен к наружной поверхности мембраны и обладает высоким
сродством к связыванию субстрата. Б. За счет метаболической энергии комплекс
переносчик — субстрат модифицируется таким образом, что обращен к внутрен-
ней поверхности мембраны. На внутренней стороне мембраны сродство перенос-
чика к субстрату значительно снижается, так что комплекс диссоциирует даже
при высоких концентрациях субстрата.
104
Глава 5
Рис 5-3. Протонодвижущая сила как источник энергии для активного транспор-
та. А. Возникновение протонодвижущей силы при дыхании. Б. Возникновение
протонодвижущей силы при гидролизе АТР. В. Активный транспорт при помощи
переносчика с местами связывания для определенного субстрата и протонов
В большинстве систем это, вероятно, протонодвижущая сила, ко-
торая может возникать за счет переноса электронов или гидроли-
за АТР, катализируемого связанной с мембраной АТРазой BFi
(рис. 5-3,А и Б). Переносчики, имеющие места связывания про-
тонов и определенного субстрата, используют протонодвижущую
силу для транспорта в клетку протонов и молекул субстрата
(рис. 5-3,В). Протонированная форма переносчика должна иметь
высокое сродство к субстрату, а лишенная протона форма —
низкое.
Тот факт, что перенос электронов или АТР может обеспечивать
энергией активный транспорт, имеет важное значение, поскольку
такие системы транспорта требуются не только аэробам и фото-
трофам, но и анаэробам. У многих из этих организмов АТР обра-
зуется только путем субстратного фосфорилирования — дыхатель-
ных цепей у них нет. На рис. 5-4 приведены источники энергии для.
активного транспорта через энергизованную мембрану.
Существует и другая система активного транспорта, имеющая-
ся у Е. coli и других микроорганизмов (в частности, у грамотрица-
Метаболическое разнообразие аэробных гетеротрофов
105
Перенос
электронов Фосфорилирование
на уровне субстрата
Энергизованная
мембрана
(протонодвижущая
сила)
^A^TPasct^ АТР
Активный
транспорт
Рес. 5-4. АТР и перенос электронов как источники энергии для активного транс-
порта.
тельных бактерий). Эта система участвует в транспорте амино-
кислот, пептидов, некоторых сахаров и органических кислот и
состоит из субстратспецифического связывающего белка и нуж-
дающейся в АТР транспортной единицы. Связывающие белки от-
личаются от переносчиков системы сопряженного транспорта элек-
тронов тем, что они легко освобождаются из периплазматического
пространства методом осмотического шока, предложенным Хеп-
пелем. По этому методу бактерии, суспендированные в гипертони-
ческом растворе (20%-ный раствор глюкозы с буфером и ЭДТА),
быстро переносят в холодный раствор с низкой ионной силой (во-
да или 5 мМ раствор MgCl2); после этого связывающие белки
появляются в растворе. Такие соединения, как глутамин, пролин,
галактоза и мальтоза, активно переносятся в клетки Е. coli при
помощи связывающих белков.
Г. Перенос групп
Этот процесс отличается от активного транспорта тем, что суб-
страт появляется внутри клетки в химически модифицированной
форме — обычно в виде фосфатного эфира. У многих микроорга-
низмов сахара транспортируются в клетки путем переноса групп.
Движущей силой транспорта в этом случае является то, что внут-
ри мембраны сахар улавливается реакцией с фосфорилированным
ферментом и образующийся в результате фосфатный эфир осво-
бождается в цитоплазму. Фосфорилированный фермент возникает
с использованием фосфоенолпирувата в качестве основного источ-
ника энергии фосфатной связи. Механизм действия фосфоенолпи-
руват-фосфотрансферазных систем вкратце рассматривался в гл. 2,
разд. I (глюкоза), и в гл. 4, раздел I (фруктоза). У Е. coli с по-
мощью механизма переноса групп транспортируются глюкоза,
фруктоза, манноза и маннит, а у Staphylococcus aureus таким же
способом транспортируются лактоза и другие дисахариды.
Однако, ка»к можно видеть из табл. 5-1, не у всех бактерий,
способных расти на глюкозе, имеется фосфотрансферазная систе-
106
Глава S
Фосфоенолпируват-фосфотрансфераза и системы Таблица 5-1 активного
транспорта глюкозы у бактерии1)
Микроорганизм Фосфотрансфераза Активный транспорт
Виды Arthrobacter +
Azotobacter vinelandii +
Bacillus megaterium + —
В. subtilis + —
Brucella abortus + —
Clostridium butyricum —
C. pasteurianum —
Энтеробактерии + —
Micrococcus lute us — +
Mycobacterium smegmatis — +
Pseudomonas aeruginosa — +
Staphylococcus aureus +
Большинство данных из работы Romano А. Н., Eberhard S. J., Dingle S. L.,
McDowell T D., J. Bacteriol, 104, 808—813 (1970).
ма. По-видимому, эта система свойственна преимущественно фа-
культативным и строго анаэробным бактериям. Такие аэробы,
как Azotobacter vinelandii и Pseudomonas aeruginosa, используют
для поглощения глюкозы систему активного транспорта. Есть, ко-
нечно, и исключения: виды Arthrobacter, Bacillus megaterium
и В. subtilis, относящиеся к аэробам, транспортируют в клетки
глюкозу с помощью фосфотрансфер азной системы. Для анаэробов
фосфот^ансферазная система имеет большое значение, поскольку
она помогает сохранить АТР.
Имеются указания, что пуриновые и пиримидиновые основа-
ния также транспортируются путем переноса групп. В поглощении
аденина Е. coli и Salmonella typhimurium участвует ферментная
система, нуждающаяся в фосфорибозил-1-пирофосфате; в клетке
при этом появляется АМР:
0 /ягЛис-00
Аденин------> ДМР
II, Путь Энтнера — Дудорова
Помимо пути Эмбдена — Мейергофа — Парнаса существует
второй важный путь, используемый для расщепления углеводов,
который широко распространен у бактерий. Впервые его обнару-
Метаболическое разнообразие аэробных гетеротрофов
107
н^=о
нс-он
но-сн
нс-он
нс-он
СН2О-(р)
Глюкозо-4-®
nadph2
соон
I
нс-он
но-сн __
нс-он
I
нс-он
сн2о-0
6-®-глюконат
н2о
2
(ООН
С=О
I
СН2
нс-он
нс-он
сн2о-0
КДФГ
соон
с=о
I
сн3
нс=о
нс-он
сн2о-(?)
3-(p)-277tfqep-
альдееид
Рис 5-5 Реакции пути Энтнера — Дудорова. 1 — глюкозо-6-фосфат — дегидроге-
наза; 2 •— 6-фосфоглюконат—дегидратаза; 3 — 2-кето-3-дезокси-6-фосфоглюко-
нат — альдолаза. КДФГ — 2-кето-3-дезокси-6-фосфоглюконат.
жили Энтнер и Дудоров у Pseudomonas saccharophila. Как и в
пентозофосфатном цикле, глюкозофосфат сначала дегидрируется
с образованием 6-фосфоглюконата (рис. 5-5). Под действием де-
гидратазы и альдолазы из одной молекулы 6-фосфоглюконата об-
разуются 1 молекула 3-фосфоглицеринового альдегида и 1 моле-
кула пирувата. Далее 3-фосфоглицериновый альдегид может быть
окислен до пирувата ферментами пути Эмбдена — Мейергофа —
Парнаса.
В чем же состоит различие между путями Эмбдена — Мейерго-
фа— Парнаса и Энтнера — Дудорова и как их можно дифферен-
цировать? Ключевыми ферментами пути Эмбдена — Мейергофа —
Парнаса, т. е. ферментами, присущими только этому пути, явля-
ются 1- и 6-фосфофруктокиназы. Все другие ферменты данного
пути могут с таким же успехом участвовать в других метаболиче-
1 нс=о ICHj 1СНз
2 НС-ОН зно-сн эмп
3 соон 1 3 со2 1
4 НС-ОН ** 4 СООН | 4 С02 j
5 НС-ОН 6 СН2ОН 5С=0 6 СНз 5 COSCoA 6CH3
1 нс=о 1С00Н 1 1C°2 |
2 НС-ОН з но-сн зд 2С=0 «— Г 3 СНз 2 COSCoA 3CH3
4 НС- ОН * 4 СООН |4CO2 j
5 НС-ОН 5С=0 — 5 COSCoA
б СН20Н б СНз 6CH2
Рис 5-6. Происхождение углерода С02, образовавшегося в пируватдегидрогеназ-
ной реакции после расщепления глюкозы по пути Эмбдена — Мейергофа — Пар-
наса (ЭМП) или Энтнера — Дудорова (ЭД).
108
Глава 5
ских последовательностях (например, фруктозобисфосфат-альдо-
лаза —в глюконеогенезе или в пентозофосфатном цикле). Ключе-
выми ферментами пути Энтнера— Дудорова служат 6-фосфоглю-
конат — дегидратаза и 2-кето-3-дезокси-6-фосфоглюконат — аль-
долаза. Следовательно, эти пути можно различить таким способом:
клетки данной бактерии выращивают на глюкозе, получают кле-
точные экстракты и определяют ключевые ферменты обоих путей.
Если активность дегидратазы и 2-кето-3-дезокси-6-фосфоглю-
конат—-альдолазы оказывается высокой, а фосфофруктокиназа при
этом не обнаруживается, то делают вывод, что расщепление глю-
козы осуществляется, очевидно, по пути Энтнера — Дудорова. Оп-
ределить, действует ли у данного микроорганизма путь Эмбдена —
Мейергофа — Парнаса или путь Энтнера — Дудорова, можно так-
же с помощью другого метода — радиореспирометрии. Основа это-
го метода проиллюстрирована на рис. 5-6. Очевидно, что пируват,
образующийся из первых трех атомов углерода глюкозы, при ис-
пользовании двух этих путей различен. В одном случае (путь Эмб-
дена— Мейергофа — Парнаса) карбоксильная группа происходит
из 3-го углеродного атома глюкозы, в другом (путь Энтнера —
Дудорова)—из 1-го углеродного атома глюкозы. При аэробном
окислении глюкозы первая молекула С02 возникает в результате
окислительного декарбоксилирования пирувата; следовательно,
она происходит из 3-го и 4-го (путь Эмбдена — Мейергофа — Пар-
наса) или из 1-го и 4-го (путь Энтнера — Дудорова) углеродных
атомов глюкозы. Эта разница обнаруживается радиореспиромет-
рическими методами. Например, к суспензиям клеток Bacillus
subtilis или Xanthomonas phaseoli добавляют глюкозу, меченную
14С по С-1, С-3 или С-4. Выделяющуюся С02 собирают каждый
час и определяют ее радиоактивность. Из рис. 5-7 видно, что у
Метаболическое разнообразие аэробпых гетеротрофов tOf
Таблица 5-3
Пути, используемые в расщеплении сахаров у бактерий
Микроорганизм Путь Эмбдена- Мейергофа— Парнаса Путь Энтнера— Дудорова
Виды Arthrobacter +
Azotobacter chroococcum + —
Alcallgenes eutrophus —• 4-
'Bacillus subtilis, B. cereus + другие виды 4- —
Escherichia coli 4- другие энтеробактерии 4-
Pseudomonas saccharophila, P. Jluorescens + дру- — +
гие виды
Rhizoblum japonlcum + другие виды — 4-
Thiobacillus intermedlus, Th. ferrooxldans — 4-
Xanihotnonas phaseoli + другие виды — 4-
В. subtilis радиоактивность ь, СОз быстоее появляется из С-4 и
С-3 глюкозы, а у X phaseoli — из С-1 и С-4; следовательно, у пер-
вой бактерии расщепление глюкозы идет по пути Эмбдена — Мей-
ергофа— Парнаса, а у второй —по пути Энтнера— Дудорова.
В табл. 5-2 показано, какой из этих двух путей преимуществен-
но участвует в расщеплении гексоз различными бактериями. Как
можно видеть, путь Энтнера — Дурова распространен довольно
широко, особенно среди грамотрицательных бактерий, тогда как
у анаэробов он встречается не очень часто. В связи с тем, что у
анаэробов нет дыхательной цепи и АТР у них образуется в ре-
зультате фосфорилирования на уровне субстрата, путь Эмбдена —
Мейергофа — Парнаса для них более экономичен: этот путь дает
2 молекулы АТР при превращении 1 молекулы глюкозы в 2 моле-
кулы пирувата; при использовании пути Энтнера — Дудорова на
2 молекулы пирувата образуется только одна молекула АТР.
Путь Энтнера — Дудорова имеет важное значение, когда суб-
стратами служат такие соединения, как глюконат, маннонат или
гексуронаты. Если Е. coli перенести со среды с глюкозой на среду
с глюконатом, то образуются следующие ферменты: глюконоки-
наза, которая фосфорилирует глюконат в 6-м положении, и два
ключевых фермента пути Энтнера — Дудорова. Следовательно, у
Е. coli глюкоза и другие гексозы распадаются по пути Эмбдена —
Мейергофа — Парнаса, а глюконат и его производные — по пути
Энтнера — Дудорова (рис. 5-8).
Очевидно, что путь Эмбдена—Мейергофа — Парнаса не очень
пригоден для расщепления глюконата. Неизвестно ни одной по-
следовательности реакций, которая вела бы непосредственно от
по
Глава 5
Глюкоза
Глюквнат
Пируват
Глюкозо-6-(р)
Глюююкит
б-фФСфоелюконат
Путь Ж
Путь ЭД
Рис 5-8. Расщепление глюкозы и глюконата Е, coll.
6-фосфоглюконата к глюкозо-6-фосфату. У многих бактерий мета-
болизм глюконовой, манноновой, глюкуроновой кислот и родст-
венных им соединений идет по пути Энтнера — Дудорова.
В связи с этим следует упомянуть, что многие псевдомонады
также расщепляют глюкозу через глюконат. Р. aeruginosa, Р. fluo-
rescens и Р. putida содержат глюкозодегидрогеназу, превращаю-
щую глюкозу в глюконат. Этот последний может либо фосфори-
лироваться до 6-фосфоглюконата, либо окисляться далее до 2-ке-
тоглюконата, который затем фосфорилируется и восстанавливает-
ся, также давая 6-фосфоглюконат (рис. 5-9). Глюкозо- и глюко-
натдегидрогеназы связаны с мембраной. Эти ферменты осуществ-
ляют внеклеточное превращение глюкозы в соединения, которые
используются меньшим числом других микроорганизмов, чем глю-
коза. Следовательно, эти ферменты имеют преимущество для
псевдомонад, которые могут транспортировать и расщеплять глю-
Мембрана
Глюкоза
Глюкоза
Глюкозо
дегидро-
геназа
Глюконат О2
Глюконат-
дегидро -
геназа
2 - кетоглюконат
Цитоплазма
2-кетоглюконат
Глюкозо-Ь-
NAD NADH2
Глюконат
| Путь ЭД
2-кето-б
Рис. 5-9 Внеклеточное окисление глюкозы псевдомонадами и внутриклеточное
превращение глюкозы, глюконата и 2-кетоглюконата в 6-фосфоглюконат. 1 —
гексокиназа; 2 — глюконокиназа; 3 — 2-кетоглюконокиназа; 4— глюкозо-6-фос-
фатдегидрогеназа; 2 — 2-кето-6-фосф оглКжонат — редуктаза.
Метаболическое разнообразие аэробных гетеротрофов
ш
козу, глюконат и 2-кетоглюконат. Метаболизм фруктозы у этих
организмов осуществляется по обычному пути Энтнера — Дудо-
рова.
III. Расщепление сахаров в пентозофосфатном цикле
Как уже отмечалось в гл. 3, у Е. coli часть глюкозы окисляется
через 6-фосфоглюконат до пентозофосфатов, что необходимо для
удовлетворения потребностей растущей клетки в NADPH2 и в
предшественниках для биосинтеза нуклеотидов. У большинства
аэробных микроорганизмов происходит то же самое, так как мож-
но подсчитать, что около 20% глюкозы расщепляется по этому
пути. Уже указывалось также, что в результате ряда обратимых
трансальдолазных и транскетолазных реакций пентозофосфаты мо-
гут быть превращены во фруктозо-6-фосфат и 3-фосфоглицерино-
вый альдегид. Комбинация этих реакций образует цикл, осущест-
вляющий расщепление сахаров (рис. 5-10). Глюкоза может окис-
ляться до 3 молекул СО2 и глицеральдегид-3-фосфата, который
через пируват может влиться в цикл трикарбоновых кислот. Таким
образом, глюкоза может быть окислена и без участия нути Эмбде-
на— Мейергофа — Парнаса или пути Энтнера — Дудорова. Окис-
лительный и пентозофосфатный цикл был обнаружен у Thiobacillus
novellas и Brucella abortus, которые, будучи лишены ключевых
Рис. 5-10. Окислительный пентозофосфатный цикл. Глюкоза окисляется до 3 СО2
и глицеральдегид-3-фосфата. 1 — глюкозо-6-фосфат — дегидрогеназа; 2 — глюко-
нат-6-фосфат —дегидрогеназа; 3 — трансальдолаза и транскетолаза; 4 — фосфо-
глюкозо-изомераза; NAD(P) означает, что дегидрогеназа использует в качестве
коферментов NAD или NADP.
И2
Глава 5
ферментов путей Эмбдена — Мейергофа — Парнаса и Энтнера —
Дудорова, растут тем не менее на среде с глюкозой. <
Окислительный пентозофосфатный цикл может также обеспе-
чивать аэробный рост бактерий на углеводах без участия цикла
трикарбоновых кислот. Если глицеральдегид-3-фосфат возвраща-
ется в пул гексозомонофосфатов (через фруктозо-1,6-бисфосфат),
то возможно полное окисление глюкозы в этом цикле. Однако
глицеральдегид-3-фосфат может также быть окислен до ацетата,
который затем выделяется в среду. Это наблюдается у некоторых
уксуснокислых бактерий, у которых нет полного цикла трикарбо-
новых кислот.
Наконец, следует упомянуть, что неокислительные реакции пен-
тозофосфатного цикла участвуют в расщеплении пентоз у многих
бактерий. Широко распространен следующий путь: фосфорилиро-
вание пентозы в положении 5, изомеризация и эпимеризация до
промежуточных продуктов цикла, превращение во фруктозо-6-фос-
фат и глицеральдегид-3-фосфат, расщепление по пути Эмбдена —
Мейергофа — Парнаса.
IV. Метилглиоксалевый шунт
В 1923 г. Гарден высказал предположение, что метилглиоксаль
служит промежуточным продуктом катаболизма глюкозы. После
идентификации фосфорилированных соединений в качестве про-
межуточных продуктов расщепления глюкозы накопление метил-
глиоксаля, наблюдавшееся в некоторых условиях, стали рассмат-
Фруктозо * 1,-ё-бисфосфат
НОН2С-СО-СН2О-@ z
Дигидроксиацетокфосфатп
' Глицеральдегид'
3‘фосфатп
Н3С-СО сно
Метилглиоксаль
HjC-CHOH-COOH
D- лактат
Пируват
Рис 5-11. Метилглиоксалевый шунт. 1 — метилглиоксаль-синтаза; 2 — глиоксала-
за I и III; 3—D-лактатоксидаза (связанная с флавином).
Метаболическое разнообразие аэробных гетеротрофов
113
ривать как результат неферментативных реакций. Однако в по-
следние годы Кунер и его сотрудники открыли метилглиоксалевый
шунт, обусловливающий превращение дигидроксиацетонфосфата в
пируват.
Этот шунт (рис. 5-11) имеется у Е. coli, Pseudomonas saccha-
rophila и, вероятно, у ряда других аэробных бактерий. Его физио-
логическое значение состоит в том, что он делает возможным об-
разование ацетил-СоА из дигидроксиацетонфосфата в условиях,
когда низкие концентрации фосфата лимитируют активность гли-
церальдегид-3-фосфат — дегидрогеназы. В соответствии с этой
ролью метилглиоксаль-синтаза ингибируется неорганическим фос-
фатом.
V. Разнообразие энер гетического метаболизма
Теперь, когда мы рассмотрели различные пути распада саха-
ров, имеющиеся у некоторых бактерий помимо пути Эмбдена —
Мейергофа — Парнаса, можно задать вопрос, все ли аэробные
гетеротрофы используют один и тот же тип ферментных систем
для синтеза АТР. Как будет показано, и в этом случае имеются
различия.
А. Пируватдегидрогеназа
Обычно у анаэробов нет пируватдегидрогеназы. Это фермент,
характерный для аэробных гетеротрофов. Он имеется практиче-
ски у всех бактерий, осуществляющих катаболизм субстратов
через пируват. Однако некоторые аэробы очень ограничены в отно-
шении субстратов, которые они способны использовать. Например,
виды Hyphomicrobium используют только Сг и Сг-соединения
(метанол, метиламин, ацетат); они лишены пируватдегидрогеназы.
Это, вероятно, относится и к другим микроорганизмам, способным
использовать в качестве субстрата лишь Ci-соединения.
Б. Цикл трикарбоновых кислот (ЦТК)
Несомненно, что подавляющее большинство аэробных гетеро-
трофов использует ЦТК для получения NADH2, поступающего в
дыхательную цепь, и соединений, используемых в качестве пред-
шественников в биосинтезе различных компонентов клетки. У не-
которых аэробов нет полного цикла трикарбоновых кислот. К ним
относятся: ряд уксуснокислых бактерий и бактерий, способных ис-
пользовать в качестве субстрата только Срсоединения (гл. 6).
У этих организмов нет а-оксоглутар ат дегидрогеназы. Следователь-
но, цикл у них прерывается, но глутамат все же может синтези-
роваться через цитрат, изоцитрат и а-оксоглутарат. Сукцинил-СоА
и его производные образуются у таких организмов из оксалоаце-
8—1896
114
Глава 5
тата через L-малат, фумарат и сукцинат. В то время как восста-
новление оксалоацетата до L-малата и дегидратация последнего
в фумарат катализируются соответствующими ферментами ЦТК,
малатдегидрогеназой и фумаразой, для образования сукцината
используется специальный фермент — фумаратредуктаза. В качест-
ве донора водорода при этом используется NADH2. Следовательно,
этот фермент отличается от сукцинатдегидрогеназы. И наконец,
цукцинил-СоА образуется под действием сукцинат-тиокиназы.
В. Дыхательная цепь
Хотя наличие дыхательной цепи — характерная особенность
всех аэробов, при анализе компонентов дыхательной цепи у мно-
гих бактерий были обнаружены различия — в отличие от дыха-
тельной цепи митохондрий, которая по своему общему составу не
проявляет видоспецифических вариаций. Несколько примеров при-
ведено на рис. 5.12. Можно видеть, что дыхательная цепь Е. coli,
лишенная цитохрома с-типа, характерна не для всех бактерий.
У Paracoccus denitrifleans и Micrococcus lysodeikticus в состав ды-
Субстрат
ч
nadh2
Субстрат
v
nadh2
Субстрат
nadh2
Флавопротеид
Кофермент Q
Цат Цчт ^а
Цата
О2
Цит о
О2
ФлавопратеиВ
Кофермент Q
ЦитЬ
v
Цито
Цит
флавопротеид
Менахщюн
ЦитЬ
\<
Цит с
Цитаа3 Цито
о2
Б
Рис. 5-12. Компоненты дыхательной цепи трех бактерий. А — Escherichia coli.
Б — Paracoccus denitrificans. В — Micrococcus lysodecticus.
Метаболическое разнообразие аэробных гетеротрофов
115
хательной цепи входят цитохромы типа Ь, с и а. Еще нет уверен-
ности в том, что отношение P/О одинаково у всех бактерий.
Экспериментальные данные указывают, что у Е. coli в дыхательной
цепи имеется два пункта фосфорилирования, а у Р. denitrificans и
М. lysodeikticus — три таких пункта.
Замечательное свойство системы переноса электронов у мно-
гих бактерий состоит в том, что в некоторых условиях в качестве
акцептора Н вместо кислорода может использоваться нитрат. Это
мы рассмотрим в следующем разделе.
VI. Диссимиляционное восстановление нитрата
Глюкоза + 6О2 —► 6СОя + 6Н2О Д<?£ = —686 ккал (—2870 кДж) (5-1)
Глюкоза+4,8Ь1Од + 4,8Н+—*-
—► 6COs+2,4N»+8,4HeO =—638 ккал (—2669 кДж) (5-2)
Глюкоза-1- 12NO;—*-6СО2+6Н2О4- 12NO2
ДОо=—422 ккал (—1766 кДж) (5-3)
Из приведенных выше уравнений видно, что изменения свобод-
ной энергии при окислении глюкозы нитратом или кислородом
сравнимы друг с другом. Следовательно, вполне логично, что не-
которые бактерии способны «дышать», используя в качестве акцеп-
тора водорода вместо кислорода нитрат. В результате такого ды-
хания нитрат восстанавливается до N2 (и до N2O в некоторых
случаях). Эти так называемые денитрифицирующие бактерии со-
ставляют очень широкую группу микроорганизмов, принадлежа-
щих к самым различным родам. Некоторые представители этой
группы перечислены в табл. 5-3. Особенно часто денитрификацию
способны осуществлять многие бациллы и псевдомонады.
Таблица 5-3
Денитрифицирующие бактерии
Alcallgenes faecalis
Bacillus licheniformis
Hyphotnlcrobium vulgare
Paracoccus denitrificans
Pseudomonas stutzerl
Spirillum iiersonli
Thiobacillus denitrificans
Некоторые бактерии, например большинство энтеробактерий,
способны к нитрат-нитритному дыханию, при котором нитрат вос-
станавливается до нитрита (уравнение 5-3). Образующийся нитрит
выделяется или восстанавливается до аммиака в реакциях, не
сопряженных с образованием АТР (рис. 5-13).
116
Глава 5
Денитрификация
NOj----------- N02-----*- NO-------*- N2O----*-N2
Натрет/нитритное дыхание j
a V *
Выделяется ила
восстанавливается до NH3
Рис. 5-13 Денитрификация и нитрат/нитритное дыхание.
Ферментный аппарат обоих процессов — нитрат-нитритного ды-
хания и денитрификации — образуется только в анаэробных ус-
ловиях или в условиях низкого напряжения кислорода. В боль-
шинстве случаев для этого требуется нитрат в качестве индуктора.
Кислород сильно ингибирует активность ферментов, участвующих
в диссимиляционном восстановлении нитрата. Следовательно, де-
нитрификация и нитрат-нитритное дыхание могут происходить
лишь в том случае, если кислорода нет совсем или если его кон-
центрация незначительна. В аэробных же условиях все бактерии,
способные осуществлять эти типы дыхания, предпочитают кисло-
родное дыхание.
Подобно дыханию в присутствии кислорода, денитрификация
приводит к полному окислению органического субстрата до СО2.
Например, при росте Bacillus licheniformis на среде с глюкозой и
нитратом в анаэробных условиях субстрат распадается по пути
Эмбдена — Мейергофа — Парнаса. Образующийся при этом из пи-
рувата ацетил-СоА окисляется в цикле трикарбоновых кислот, да-
вая NADH2 и FADH2, поступающие в дыхательную цепь в каче-
стве доноров электронов. Однако нитрат не просто заменяет кис-
лород. При денитрификации происходит образование специальных
типов цитохромов и связанных с мембранами ферментных систем,
которые восстанавливают нитрат до нитрита и далее до молеку-
лярного азота. Поток электронов при этом типе дыхания схема-
тически показан на рис 5-14. Как видно из приведенной схемы,
при денитрификации можно различить четыре стадии восстанов-
ления.
ХЮз NOj -* NO -*N20-*N2
Рис. 5-14. Поток электронов при денитрификации, fp — флавопротеид.
Метаболическое разнообразие аэробных гетеротрофов
117
Нитратредуктаза является молибденсодерд<ащим, связанным с
мембраной ферментом, Который восстанавливает нитрат до нит-
рита:
NOa+2e- + 2H+ —> NO; +Н2О.
Нитритредуктаза и редуктаза окиси азота при фракционирова-
нии клеток денитрифицирующих бактерий обнаруживаются как
растворимые ферменты:
NO7+е- + Н+ —► NO+ОН- ,
2NO+2e-+2H+ —> N2O+H2O .
Редуктаза закиси азота связана с мембраной
N2O+2e-+2H+ —> N2+H2O.
Денитрифицирующие бактерии могут использовать в качестве
акцепторов электронов нитрат, а многие из них — также нитрит,
NO и N2O Это означает, что по крайней мере две из четырех ста-
дий восстановления сопряжены с фосфорилированием при переносе
электронов в дыхательной цепи (восстановление NO<" и N2O).
Имеются данные о том, что восстановление NO2“ в N2O также
сопряжено с образованием АТР.
У бактерий, осуществляющих нитрат-нитритное дыхание, толь-
ко восстановление нитрата до нитрита происходит с участием ды-
хательной цепи. Нитрит выделяется или восстанавливается до
аммиака ферментными системами, не связанными с дыхательной
цепью Следовательно, у этих бактерий АТР образуется только
при восстановлении нитрата в нитрит
В связи с этим следует отметить, что большинство неденитри-
фицирующих бактерий также способно восстанавливать нитрит и
нитрат в аммиак при помощи растворимых ферментных систем,
которые не чувствительны к кислороду и не сопряжены с реакция-
ми, генерирующими АТР Этот процесс, называемый ассимиляци-
онным восстановлением нитрата, поставляет клеткам аммиак для
биосинтеза клеточного материала Он действует у всех бактерий,
которые растут на средах с нитратом в качестве источника азота.
В соответствии с этим аммиак репрессирует синтез ферментов ас-
симиляционного восстановления нитрата.
VII. Другие анаплеротические последовательности
Мы видели, что тип анаплеротических последовательностей,
используемых Е coli, зависит от природы используемого для роста
субстрата: на средах с глюкозой оксалоацетат синтезируется из
фосфоенолпирувата с помощью фосфоенолпируват-карбоксилазы;
на средах с ацетатом индуцируется глиоксилатный цикл и фос-
фоенолпируват образуется при участии фосфоенолпируват-карбо-
ксикиназы, на средах с пируватом образование фосфоенолпиру-
118
Глава 5
вата для глюконеогенеза обеспечивается фосфоенолпируват-синте-
тазойь Хотя немногие бактерии были изучены столь детально, как
Е. coli, имеющиеся экспериментальные данные показывают, что
другие анаплеротические последовательности имеются и у них.
Для субстратов, катаболизм которых осуществляется через
стадию фосфоенолпирувата (глюкоза и другие углеводы), у бак-
терий широко распространены следующие две анаплеротические
последовательности.
А. Фосфоенолпируват-карбоксилаза
Фосфоенолпируват 4-HCOj—> Оксалоацетат+Рь
Этот фермент обеспечивает восполнение запаса оксалоацетата у
энтеробактерий, Bacillus anthracis, Acetobacter xylinum, Thiobacil-
lus novellis и Azotobacter vinelandii.
Б. Пируваткарбоксилаза
Пируват+HCOg + АТРч± Оксал оацетат 4- ADP 4- Л.
Подобно млекопитающим, ряд бактерий использует пируват-
карбоксилазу для синтеза оксалоацетата. Этот фермент содержит
биотин, который непосредственно участвует в реакции карбокси-
лирования:
Ацетил-СоА, Mg2+
Фермент—биотин4-АТР4-НСОд • • •• Фермент—биотин ~ СО24-
4-ADP+Pj
Фермент—биотин ~ СО24-Пируват Фермент—биотин4-Оксалоацетат.
too/r-NH-CHCH2)4"X,^'S '
<Рврмент-биотин~ COi
Для максимальной активности пируваткарбоксилазы, выделяе-
мой из тканей млекопитающих, требуется ацетил-СоА. Это спра-
ведливо также для фермента из многих бактерий, в том числе
Arthrobacter globiformis, Bacillus coagulans, Acinetobacter calcoace-
ticus и Rhodopseudomonas sphaeroides; исключение составляют
Pseudomonas citronellolis и P. aeruginosa.
Бактерии, которые растут на средах с ацетатом или с соеди-
нениями, вступающими в промежуточный обмен через ацетил-СоА
Метаболическое разнообразие аэробных гетеротрофов
(бутират, алифатические углеводороды), обычно используют гли-
оксилатный цикл для образования Сгдикарбоновых кислот и фос-
фоенолпируват-карбоксикиназу, чтобы синтезировать фосфоенол-
пируват для глюконеогенеза. Однако у некоторых фототрофных
бактерий (Rhodospirilium rubrum, Rhodopseudomonas sphaeroides)
при аэробном росте на ацетате имеется малат-синтаза, но отсут-
ствует изоцитрат-лиаза. До сих пор неизвестно, каким образом у
этих микроорганизмов происходит образование глиоксилата.
Многие бактерии способны расти на средах с пируватом и лак-
татом. Для тех из них, которые содержат пируваткарбоксилазу,
проблемы синтеза оксалоацетата не существует. Другие — как мы
уже видели в случае Е. coli — могут использовать фосфоенолпиру-
ват-синтетазу для образования фосфоенолпирувата из пирувата и
фосфоенолпируват-карбоксилазу для восполнения пула оксалоаце-
тата. О распространении фосфоенолпируват-синтетазы известно
немногое. Она обнаружена у Е, coll и Salmonella typhimurium и,
вероятно, у других энтеробактерий. Acetobacter xylinum и анаэроб
Propionibacterium shermanii содержат другой фермент, который
также обеспечивает прямой синтез фосфоенолпирувата из пирува-
та,— пируват, фосфат—дикиназу. Реакции, катализируемые фос-
Таблица 5-4
Тип ферментных систем, участвующих в синтезе оксалоацетата
и фосфоенолпирувата в зависимости от природы субстрата,
используемого микроорганизмами для роста
Катаболическая ______________________________________________________
последовательность
оксалоацетат фосфоенолпируват
Субстрат Фосфоенолпируват-карбокси-
| лаза или пирув ат-кар бокси-
Фосфоенолпируват лаза
Пируват
I
Ацетил-СоА
Субстрат
I
Пируват
Ацетил-СоА
Субстрат
I
Ацетил-СоА
Пируват-карбоксилаза Фосфоенолпируват-
карбоксикиназа
Фосфоенолпируват- или кар- Фосфоенолпируват-
боксилаза синтетаза или пиру-
ват-фосфат — дики-
наза
Глиоксилатный цикл
Фосфоенолпируват-
карбоксикиназа
120
Глава 5
фоенолпируват-синтетазой и этой дикиназой, записываются в виде
следующих уравнений:
Фосфоенолпируват-синтетаза
Пируват-ЬАТР <-— Фосфоенолпируват-]-АМР+Pi
Пируйат-фосфат — дикиназа
Пируват+АТР 4-Pi - ~Фосфоенолпируват+АМ.Р+РР1
- , Различия между действием этих ферментов очевидны. Если
промежуточными продуктами являются фосфорилированные фер-
менты, то фосфоенолпируват-синтетаза освобождает одну из этих
фосфатных групп в виде фосфата, а другую переносит на пируват;
в реакции, катализируемой дикиназой, одна из фосфатных групп
переносится на фосфат с образованием пирофосфата, а другая —
на пируват. В табл. 5-4 приведены функции ферментных систем,
обсуждавшихся в этом разделе.
VIII, Биосинтез мономеров и полимеров
Пути, используемые разными микроорганизмами для синтеза
аминокислот, пуриновых и пиримидиновых оснований, различных
липидов и углеводов, обычно те же, что были описаны в случае
Escherichia coli. Не наблюдается большого разнообразия и в при-
роде промежуточных продуктов, участвующих в синтезе этих со-
единений. Однако это отнюдь не означает, что ферменты, катали-
зирующие один и тот же тип реакций, у разных бактерий идентич-
ны. Например, хоризматмутаза и аспартаткиназа Е. coli отлича-
ются от соответствующих ферментов Bacillus subtilis. Их молеку-
лярная масса, а также химические и физические свойства различ-
ны, но в обоих случаях ферменты действительно являются хориз-
матмутазой или аспартаткиназой. То же самое справедливо для
многих ферментов различных бактерий. Примечательно, что фер-
менты, специфичные для одной и той же реакции, очень часто
по своим регуляторным свойствам различаются у разных видов
бактерий. Это мы рассмотрим в гл. 7.
Следовательно, мы можем сделать вывод, что, с одной сторо-
ны, у бактерий имеется относительно постоянный набор анаболи-
ческих реакций, а с другой — большие различия в структуре и
свойствах участвующих ферментных систем.
Однако многие бактерии лишены ферментных систем, требую-
щихся для синтеза одного или более предшественников полимеров
Е. coli; некоторые другие энтеробактерии, Bacillus megaterium и
Azobacter vinelandii, — если ограничиться только этими приме-
рами— способны расти на средах с глюкозой и минеральными
солями, т. е. они содержат полный набор ферментов, необходи-
мых для образования всех соединений, требующихся для роста.
Рост ряда бацилл и псевдомонад зависит от присутствия в окру-
жающей среде яекоторых витаминов и аминокислот. В лаборато-
Метаболическое разнообразие аэробных гетеротрофов
I»
рии их выращивают на среде, в которую в качестве источников
этих соединений добавляют пептон и дрожжевой или мясной экс-
тракт. Особенно нуждаются в готовых мономерах бактерии, кото-
рые в нормальных условиях растут на сложных органических суб-
стратах (сок, молоко, гниющие растения и т. д.). Например, ана-
эробные молочнокислые бактерии настолько плохо снабжены ана-
болическими ферментными системами, что им для роста требуются
практически все мономеры.
Насколько известно, синтез информационных макромолекул
(ДНК, РНК и белков) осуществляется у всех бактерий одинако-
вым путем. Это относится и к периодическим макромолекулам,
хотя здесь следует иметь в виду, что не все бактерии образуют
периодические макромолекулы одинакового состава и структуры.
Бактерии различаются по типу запасных веществ, которые они
накапливают в некоторых условиях. В табл. 5-5 приведены неко-
торые из бактерий, которые накапливают одно или более типичных
запасных веществ микроорганизмов: гликоген, поли-р-гидроксибу-
тират или полифосфат. Видимо, существуют некоторые микроор-
ганизмы, которые не образуют никакого резервного материала;
одним из таких микроорганизмов является Pseudomonas aerugi-
nosa.
Таблица 5-5
Наличие гликогена, поли-р-гидроксибутирата (ПОБ)
и полифосфатов у бактерий
Микроорганизм Гликоген ПОБ Полифосфат
Enterobacter aerogenes + — +
Alcaligenes eutrophus — +
Azotobacter vinelandii — +
Bacillus megaterium + + —
Escherichia coll + — +
Mycobacterium phlei + — +
Pseudomonas aeruginosa — —
Pseudomonas multivorans — + ?
Rhodospirillum rubrum 4- + ?
Sphaerotilus natans — + ?
Накопление полифосфатов широко распространено среди бак-
терий. Они играют роль запасного фосфора и используются для
синтеза нуклеиновых кислот и фосфолипидов в условиях недостат-
ка фосфора.
Гликоген и поли-р-гидроксибутират служат формами хранения
энергии. В отсутствие экзогенного источника энергии они медленно
122
Глава 5
СоА
2 CHj-CO-SCoA s,. CHa-CO-Ctb -CO-SCoA
1 1
^NADPH2
^NADP
СоА
ДГД « К----CHj -CHOH-CIh-CO-SCoA
Рис. 5-15. Синтез поли-Р-гидроксибутирата (ПГБ1 у Azotobacter beijerinckii.
1 — р-кетотиолаза; 2 — D (—) -р-гидроксибутирил-СоА — дегидрогеназа; 3—D (—) -
|}-гидроксибутирил-СоА — полимераза.
распадаются и снабжают клетку АТР для поддержания метабо-
лизма. Ферменты, участвующие в синтезе и распаде гликогена,
рассматривались в гл. 3.
Поли-р-гидроксибутират— типичный запасной материал прока-
риот. Он широко* распространен у бацилл, хемолитотрофных и фото-
трофных бактерий и псевдомонад (но не встречается в группе
флуоресцирующих бактерий). Поли-р-гидроксибутират представля-
ет собой полимер D (—)-p-гидроксибутирата с молекулярной мас-
сой между 60 000 и 250 000.
но-сн-Н2С—С Г-О-СН-СН2-С—’| -о-сн-сн2-соон
I II I II I I
сн3 о[ сн3 О J„ сн3
Поли-р-гидроксибутират
Он накапливается в клетках в виде гранул, окруженных мембра-
нами. В соответствующих условиях (отсутствие источника азота,
но достаточно энергии и органических субстратов) бактериальные
клетки могут накапливать так много поли-р-гидроксибутирата, что
на его долю приходится примерно 60% сухой биомассы клеток.
Синтез поли-р-гидроксибутирата Azotobacter beijerinckii проис-
ходит, как показано на рис. 5-15. Полимераза, по-видимому, свя-
зана с гранулами. Rhodospirillum rubrum использует для синтеза
D(—)-мономера другой путь. Этот микроорганизм содержит
L( + )-р-гидроксибутирил-СоА — дегидрогеназу, а кроме нее — две
кротоназы, которые вызывают превращение L( + )-формы в D(—)-
форму:
L(A-fl-8udpoKcu6ymupuJt-Cof\.
^Нго Нротаназа I
Кротомил-СоА
^-н2о кротоноаа К
р-гидроксибутирил-СоА
Метаболическое разнообразие аэробных гетеротрофов
I
^-NAD
2 <
^NADHj
Ацетоацетат-
Сдицщшл -СоА
^ацетоацетпл-СоЬ.
Сукцинат
Рис 516. Расщепление полиф-гидроксибутирата. 1 — деполимераза; 2 — D(—)-₽-
гидроксибутират — дегидрогеназа; 3 — СоА-трансфераза.
Использование поли-р-гидроксибутирата начинается тогда, когч
да клетки больше не получают экзогенного источника энер!ии.
Тогда под действием деполимеразы из гранул освобождается
D(—)-ф-гидроксибутират, который затем окисляется до ацетоаце-^
тата NAD-специфической D(—)-р-гидроксибутират— дегидроге-.
назой. Включившись в реакцию, катализируемую СоА-трансфера-
зой, образовавшийся ацетоацетат направляется в промежуточный
метаболизм (рис. 5-16). Таким образом, эфиры СоА служат суб-
стратами для синтеза поли-р-гидроксибутирата, а кислоты обра-
зуются как продукты распада этого соединения. Такое разграниче-
ние функций облегчает регуляцию обоих процессов.
При обсуждении разнообразия путей, обеспечивающих биосин-
тез периодических макромолекул, необходимо также иметь в виду,
что бактерии различаются и по составу своих клеточных стенок.
Это, конечно, свидетельствует о том, что в образовании таких
структур у различных бактерий участвуют разные ферментные
системы.
Синтез слоев клеточной стенки Е. coll в общих чертах рассмат-
ривался в гл. 3. Примерно 10% клеточной стенки Е. coli и других
грамотрицательных бактерий состоит из пептидогликана. Изучение
стенок довольно большого числа грамотрицательных бактерий
показало, что состав их пептидогликановых (муреиновых) слоев
очень сходен (в число изученных грамотрицательных бактерий
входят, например, Acetobacter xylinum, Aerobacter aerogenes, Azo-,
tobacter chroococcutn, Cautobacter, E. coli, Proteus mirabilis, Pseu-
domonas aeruginosa и Spirillum serpens). Все они содержат N-аце-
тилмурамовую кислоту, N-ацетилглюкозамин, 2,6-диаминопимели-
новую кислоту, аланин и глутамат в молярном соотношении
1 :1:1: 2 :1. В образовании поперечных связей между пептидными
цепями всегда участвуют аминогруппа диаминопимелиновой кис-^
лоты и D-аланин (рис. 3-25).
Наружная мембрана грамотрицательных бактерий сильно варь-.
ирует по составу. В ней было обнаружено множество различных
фосфолипидов, а углеводные компоненты липополисахаридов раз-.
124
Глава 5
личны даже в пределах одного вида (различные серотипы Salmo-
nella в соответствии со схемой Кауфмана — Уайта). Очевидно, что
грамотрицательные бактерии должны содержать видоспецифиче-
ские ферментные системы, которые обусловливают такие разли-
чия в составе их клеточных стенок.
Грамположительные бактерии — роль основного компонента
клеточной стенки выполняет очень сложный пептидогликан. У мно-
гих из этих микроорганизмов на долю этого пептидогликана при-
ходится до 80—90% компонентов клеточной стенки. Как и в пеп-
тидогликане грамотрицательных бактерий, его кор состоит из
чередующихся последовательностей N-ацетилмурамовой кислоты и
N-ацетилглюкозамина1. Однако из работы Кандлера, Шлейфера и
других следует, что пептидогликан грамположительных бактерий
отличается от грамотрицательных бактерий в двух отношениях.
1. Состав тетрапептида, соединенного с ядром (кором) различа-
ется до некоторой степени. В табл. 5*6 приведено несколько
примеров. Наибольшие различия мы обнаруживаем в положе-
нии 3. В то время как у грамотрицательных бактерий в этом
положении всегда находится лгезо-диаминопимелиновая кислота
(м-ДАП), у многих грамположительных бактерий она заменена
L-лизином, L-орнитином или гомосерином. Кроме того, в неко-
Таблица 5-6
Состав тетрапептидов пептидогликанов
грамположительных бактерий1)
Тетрапептид Организмы
L-Ala-D-Gln-L-Lys-D-Ala Молочнокислые бактерии, стрептококки
L-Ala-D-Glu-M-AAILD-Ala L-Ala-D-G!n-L-Orn-D-Ala Бациллы Некоторые микрококки
L-Ala-D-Glu-Homoser-D-Ala L-Ser-D-Glu-L-Orn-D-Ala Некоторые коринебактерии Eubacterium limosum
Reaveley D. A., Burge R. Е., Adv. Microbiol. Physiol., 7, 2—71
(1972).
1 Пептидогликан, содержащий N-ацетилмурамовую кислоту, имеется в кле-
точных стенках не всех бактерий. У представителей так называемых архебакте-
риб, к которым относят метанобразующие виды, галобактерии и некоторые дру-
гие микроорганизмы, клеточные стенки состоят в основном из белковых субъеди-
ниц, полисахаридов или содержат особый пептидогликан (псевдомуреин). В за-
висимости от состава клеточных стенок отдельные представители таких бактерий
различаются окраской по Граму и устойчивостью к некоторым антибиотикам. -*
Прим. ред.
Метаболическое разнообразие аэробных гетеротрофов
125
торых тетрапептидах а-карбоксильная группа D-глутамата
амидироваяа (у-карбоксйЛьная группа всегда образует пептид-
ную связь со следующей аминокислотой). И наконец, пептидо-
гликан Eubacterium limosum вместо L-аланина в качестве пер-
вой аминокислоты тетрапептида содержит L-серин.
2. В отличие от грамотрицательных бактерий, у которых пептид-
ные цепи всегда соединены пептидной связью между е-амино-
группой 2,6-диаминопимелиновой кислоты и карбоксильной
группой D-аланина, образование поперечных связей у грампо-
ложительных бактерий осуществляется по-разному:
а. Непосредственное образование
поперечных связей между по-
ложениями 3 и 4 двух тетра-
пептидов (большинство ба-
цилл, подобно грамотрицатель-
ным бактериям)
б. Образование поперечных свя-
зей между положениями 3 и
4 за счет межпептидных мости-
ков, подобных пентаглициль-
ным цепям (стафилококки)
или цепям (из 2—5 аминокис-
лот) , содержащим L-аланин,
L-треонин, L-серин и (или) гли-
цин (Arthrobacter, микрококки,
стрептококки). У видов Cellu-
lomonas имеется мостик из
аспарата или глутамата.
-G-M-G-
I
L-Ala
X
d-G1u
i
m-DAP *—/р-’АШ
X i
D-Ala
-G-M-G-
I
L-Ala
X
d-G1u
|y
L-Lys <---(Gly)5«~D-Ala
I I
D-Ala
в. Образование поперечных свя-
зей между а-карбоксильной
группой D-глутамата в поло-
жении 2 одного пептида и кар-
боксильной группой D-алани-
на второго пептида через ди-
аминокислоту (лизин, орни-
тин). Этот тип связывания об-
наружен у Eubacterium limo-
sum и у некоторых коринебак-
терий.
-G-M-G-
4
L-Ser
X
d-G1u----►
L-ОГП
X
D-Ala
ь-Lys <—D-Ala
126
Глава 5
Очевидно, что грамположительные бактерии очень различаются
по составу своих пептидогликанов.
Грамотрицательные бактерии содержат очень тонкий слой пеп-
тидогликана (моно- или бимолекулярный слой). У грамположи-
тельных бактерий этот слой очень толстый и поперечные связи
образуются не только между соседними цепями, но и между слоя-
ми, лежащими друг под другом.
f Клеточная стенка грамположительных бактерий не содержит
компонентов, сравнимых с наружной частью мембраны грамотри-
цательных бактерий. Однако, помимо пептидогликанового слоя,
эта стенка содержит различные белки и так называемые тейхое-
вые кислоты, содержание которых составляет до 10—20% от мас-
сы стенки (в расчете на сухое вещество). Тейхоевые кислоты
представляют собой полимеры глицерол- или рибитолфосфата, за-
мещенные различными сахарами и D-аланином.
но-сн2 о-сн2
Н-С-0 Ala О /н-с-О Ala О / H-C-OAla
н-с-он V н-^-он р н-с-он
Н—С—О Сахар ОН Н—С—О Сахар' ОН Н~С—О Сахар,
сн2о / сщо/ CH2O"Z
1,5- Поли (рибигполфосфатп) met/хоевая кислота
Они ковалентно связаны с пептидогликановым слоем фосфо-
эфирными мостиками. Одна из функций тейхоевых кислот состоит
в поддержании высокой концентрации двухвалентных катионов
вблизи клеток. Кроме того, они способствуют стабильности стенок
грамположительных бактерий.
IX. Выводы
1. При сравнении способов, благодаря которым вещества из
окружающей среды проникают через клеточную мембрану в ци-
топлазму, можно различить четыре различных механизма: пассив-
ную диффузию, облегченную диффузию, активный транспорт и
перенос групп. Два последних процесса имеют важное значение
для поглощения субстратов бактериями.
Активный транспорт обеспечивает транспорт против градиента
концентрации. Необходимая для этого энергия обычно поставля-
ется энергизованной мембраной, в некоторых системах — непо-
средственно АТР. Провесе переноса групп очень эффективен, по-
скольку в этом случае субстрат связывается в результате химиче-
ской модификации в мембране. Глюкоза превращается в глюкозо-
6-фосфат, а фруктоза — во фруктозо-1-фосфат. Соответствующие
Метаболическое разнообразие аэробных гетеротрофов 127
фосфотрансферазные системы используются преимущественно фа-
культативными и строго анаэробными бактериями. Многие аэробы
используют системы активного транспорта для сахаров.
2. Псевдомонады и многие другие грамотрицательные бактерии
для расщепления гексоз используют путь Энтнера— Дудорова.
Ключевыми ферментами этого пути являются 6-фосфоглюконат —
дегидратаза и 2-кето-3-дегидрокси-6-фосфоглюконат— альдолаза.
Превращение глюкозы в 2 молекулы пирувата дает 1 молекулу
АТР, тогда как в случае пути Эмбдена — Мейергофа — Парнаса
образуются 2 молекуДы АТР. Путь Энтнера — Дудорова играет
важную роль также у бактерий, растущих на средах с глюконовой,
манноновой и гексуроновой кислотами.
3. В окислительном пентозофосфатном цикле глюкоза окисля-
ется до 3 молекул СОг и 3-фосфоглицеринового альдегида. После-
дующее окисление 3-фосфоглицеринового альдегида в цикле три-
карбоновых кислот приводит к тому, что катаболизм глюкозы
минует пути Энтнера — Дудорова и Эмбдена — Мейергофа — Пар-
наса.
4. При низких концентрациях фосфата ряд бактерий использу-
ет метилглиоксалевый шунт с образованием ацетил-СоА из диокси-
ацетонфосфата.
5 Большинство аэробных гетеротрофов использует цикл три-
карбоновых кислот для образования восстановительных эквива-
лентов. У микроорганизмов, использующих только (^-соединения,
и некоторых уксуснокислых бактерий нет полного цикла трикар-
боновых кислот. Такие микроорганизмы лишены а-оксоглутарат —
дегидрогеназы. Эти бактерии могут синтезировать L-глутамат че-
рез цитрат, а сукцинил-СоА — через фумарат и сукцинат.
Состав дыхательной цепи у разных бактерий неодинаков. Раз-
личия обнаружены в числе и в типе участвующих цитохромов.
6. Ряд бактерий способен использовать для дыхания вместо
кислорода нитрат в качестве акцептора водорода. Нитратное
дыхание происходит только в анаэробных условиях. В этом типе
дыхания различают два процесса: денитрификацию, при которой
нитрат восстанавливается до Na или NgO, и нитрат/нитритное ды-
хание, при котором нитрат восстанавливается до нитрита. Послед-
ний либо выделяется, либо восстанавливается до аммиака.
7. Бактерии, которые метаболизируют субстраты через стадию
фосфоенолпирувата, для синтеза оксалоацетата используют фос-
фоенолпируват-карбоксилазу или пируват-карбоксилазу. При ро-
сте аэробов на средах с ацетатом оксалоацетат обычно синтези-
руется в глиоксилатном цикле. У некоторых микроорганизмов син-
тез фосфоенолпирувата из пирувата осуществляется под действием
фосфоенолпируват-синтетазы и пируват-фосфат — дикиназы.
8. Запасными веществами, накапливаемыми бактериями в не-
которых условиях, являются полифосфат и такие запасающие
энергию соединения, как гликоген и поли-р-гидроксибутират.
128
Глава 5
9. Бактерии очень различаются по составу клеточных стенок.
У грамотрицательных бактерий состав пептидогликанового слоя
очень сходен, но в наружном слое мембраны обнаружены значи-
тельные различия в природе имеющихся там фосфолипидов и са-
харов.
У Грамположительных бактерий на долю пептидогликанового
слоя приходится 80—90% компонентов клеточной стенки. У грам-
положительных бактерий состав тетрапептидных цепей и тип по-
перечных связей варьируют. В положении 3 пептидных цепей
вместо лезо-диаминопимелиновой кислоты обнаружены L-лизин и
L-орнитин; наряду с непосредственным образованием поперечных
связей между 3-м и 4-м положениями двух соседних пептидов об-
наруживаются межпептидные мостики, подобные пентаглицильным
мостикам. Клеточные стенки грамположительных бактерий содер-
жат также белки и тейхоевые кислоты.
Глава &
КАТАБОЛИЧЕСКАЯ АКТИВНОСТЬ
АЭРОБНЫХ ГЕТЕРОТРОФОВ
До сих пор мы рассматривали аэробный рост бактерий на сре-
дах с очень обычными субстратами, такими, как глюкоза, лактоза
и некоторые органические кислоты. Ясно, что минерализация ор-
ганических веществ требует, чтобы микроорганизмы обладали
способностью разлагать огромное количество органических соеди-
нений. После смерти животных и растений многие низкомолеку-
лярные соединения начинают подвергаться действию микроорга-
низмов; то же'Можно сказать и о полимерах, таких, как крахмал,
целлюлоза, другие полисахариды, нуклеиновые кислоты й белки.
Кроме того, в аэробные зоны диффундируют конечные продукты
различных бактериальных процессов (метан, пропионат, бутират
и т. д.), которые могут использоваться в качестве субстратов
роста.
Многие бактерии проявляют огромную гибкость в отношении
природы и числа субстратов, которые они могут использовать. Ден
Дурен де Йонг обнаружил, что у Pseudomonas putida единствен-
ным источником углерода и энергии может служить любое из
200 различных органических соединений. Другие псевдомонады,
виды Bacillus, Azotobacter и Acinetobacter, также замечательны в
том отношении, что могут расти на многих субстратах. С другой
стороны, существуют организмы, которые более «специализирова-
ны», например, Bacillus [astidiosus может использовать только
мочевую кислоту и близкие пуриновые соединения. Многие бакте*
рии, растущие на метане, способны использовать в качестве суб-
стратов роста толькр Ci-соединения. Мы рассмотрим некоторые
катаболические процессы у аэробных микроорганизмов.
I, Расщепление полимеров экзоферментами
Полимеры как таковые не могут проникать через клеточную
Мембрану, Поэтому бактерии выделяют ферменты (в большинстве
случаев гидролазы), которые разлагают полимеры до небольших,
легко транспортируемых молекул.
Крахмал и гликоген (гликозидные связи а (1—^4); связи
а(1—>-6) в точках ветвления) расщепляются амилазами. а-Амил-
9—1896
130
Глава 6
Рис. 6-1 Действие а-амилазы Образование мальтозы (оо), глюкозы (О) и оли-
госахарида со связью (1—>-6).
азы, продуцируемые бациллами и псевдомонадами, расщепляют
крахмал сначала на декстрины, а затем до мальтозы, глюкозы и
олигосахаридов. При этом связи (1—*6) остаются незатронутыми
(рис. 6-1).
0-Амилаза действует по-другому; она интенсивно отделяет ос-
татки мальтозы от невосстанавливающего конца крахмала или
гликогена. Такой тип фермента обычен для растений, но не для
бактерий.
Гликозидные связи 0 (1->4) целлюлозы гидролизуются целлю-
лазой. Этот фермент выделяется рядом бактерий (Cytophaga, Cel-
lulomonas, бактериями рубца, такими, как виды Bacteroldes и
Ruminococcus, некоторыми бациллами и клостридиями) и многими
грибами (например, Trichoderma viride, Aspergillus niger). Неко-
торые из продуцируемых целлюлаз не относятся к истинным экзо-
ферментам. Например, целлюлитическая активность Cytophaga
остается связанной с поверхностью клетки. Продуктами фермента-
тивного гидролиза целлюлозы являются глюкоза и целлобиоза,
представляющая собой дисахарид с гликозидной связью 0(1—М).
Целлобиоза — мощный ингибитор целлюлазы. Однако она быстро
поглощается клеткой и разрушается.
Внутриклеточное разрушение дисахаридов бактериями часто
начинается с пирофосфоролитического расщепления:
Целлобиозофосфорилаза
Целлобиоза+Pi ---------------—>- Глюкозо-1-Р+Глюкоза,
_ Мальтозофосфорилаза „ . _ „
Мальтоза 4-Р|----------------► Глюкозо-1 -Р + Глюкоза,
_ _ Сахарозофосфорилаза _ , .
Сахароза + Р|----------------► Глюкою-1-Р 1-Фрукгоза
Конечно, фосфорилазы более экономичны, чем гидролазы типа
0-галактозидазы и инвертазы (гидролизует сахарозу до фрукто-
зы + глюцрза): энергия гликозидной связи сохраняется, и для об-
разования углевод-1-фосфата не требуется АТР.
Впервые сахарозофосфорилаза была обнаружена у Pseudomo-
nas saccharophila. Мальтозо- и целлобиозофосфорилазы имеются
у бактерий, разлагающих крахмал и целлюлозу.
Другие полисахариды и их производные также гидролизуются
специфическими экзоферментами. Многие бактерии способны об-
Катаболическая активность аэробных гетеротрофов
iai
разовывать пектиназу и разрушать пектин (например, Bacillus
polymyxa, Erwinia carotovora, Clostridium felsineum). Коринебакте-
рии, Chromobacterium violaceum, Pseudomonas chitinovorans и дру-
гие почвенные бактерии выделяют хитиназу. К ферментам бакте-
риального происхождения относятся также гиалуронидаза, нейра-
минидаза, ксиланаза и агараза.
Многие бактерии экскретируют протеазы, позволяющие исполь-1
зовать белки умерших организмов. К таким бактериям относятся
бациллы, псевдомонады, Proteus vulgaris, а также многие анаэро-
бы. Хорошо охарактеризованной протеазой является субтилизин,
продуцируемый bacillus subtilis. Он не специфичен по отношению
к пептидным связям между определенными аминокислотами и гид-
ролизует как внутренние, так и концевые пептидные связи.
Нуклеиновые кислоты гидролизуются рибонуклеазами (РНК-
азами), и дезоксирибонуклеазами (ДНКазами). Экскретирование
последнего типа ферментов обнаружено у гемолитических стреп-
тококков, Staphylococcus aureus и некоторых видов клостридиев.
Активная рибонуклеаза выделяется Bacillus subtilis в позднюю
экспоненциальную и стационарную фазы. Внеклеточная РНКаза
имеет меньшую молекулярную массу, чем внутриклеточный фер-
мент В. subtilis. Они различаются также по специфичности: тогда
как внутриклеточная РНКаза неспецифична, экзофермент рас-
щепляет преимущественно фосфодиэфирные связи З'-гуаниновых
ннкам
В subtilis?
Нго
Рис. 6-2. Действие внеклеточной РНКазы, специфичной к фосфодиэфирным свя-
зям З'-гуаниновых нуклеотидов [Egami F„ Nakamura К, Microbiol. Ribonucleases.
Springer-Verlag. Berlin — Heidelberg — New York, p. 29 (1969).]
9*
132
Глава 6
нуклеотидов, так что в качестве промежуточных продуктов обра-
зуются 2,3-ццклонуклеотиды, а в качестве конечных — 3'-фосфаты
(рис. 6-2), Другие внеклеточные РНКазы специфичны по отноше-
нию к пуринам (гидролизуют связи З'-адениновых и гуаниновых
нуклеотидов).
И. Рост на аминокислотах
, Аминокислоты и низкомолекулярные пептиды, образуемые
протеазами, активно поглощаются и используются для роста мно-
гими микроорганизмами. Некоторые из аминокислот настолько
структурно связаны с центральными промежуточными продуктами
клеточного метаболизма, что их расщепление осуществляется
очень легко. В большинстве случаев аминокислота сначала пре-
вращается в соответствующую оксокислоту.
Глутамат ----► 2-оксоглутарат
Аспартат ----► Оксалоацетат
Аланин ------► Пируват
Валин ------> 2-оксоизовалерианат
Лейцин ------► 2-оксоизокапроат
Изолейцин ---► 2-оксо-З-метилвалерианат
Такое окислительное дезаминирование может осуществляться
следующими путями.
а. Окисление связанными с цитохромом оксидазами.
R—СН—СООН+ V2O2 —* R—COOH+NH3
i!ih2
Некоторые бактерии содержат оксидазы L-амино- и D-амино-
кислот. Последние имеют важное значение в связи с наличием
D-аминокислот в некоторых полимерах (например, в пептидо-
глюкане) и в связи с тем, что они функционируют вместе с ра-
цемазами, катализирующими превращение L-аминокислот в
D-аминокислоты. Оксидазы являются флавопротеидами и по-
ставляют электроны в дыхательную цепь. Они относительно
малоспецифичны, и каждая данная оксидаза может атаковать
10 различных аминокислот.
б- Окисление NAD (Р)-зависимыми дегидрогеназами.
Аланиндегидрогеназа
СНз—СН—СООН+NAD+ Н2О ^1""' СН3—СО—СООН +
NH2
+nadh2+nh3
Аланиндегидрогеназа имеется у многих бацилл и клостридиев.
Глутаматдегидрогеназа очень широко распространена и катали-
зирует аналогичную реакцию 'с глутаматом в качестве суб-
страта.
Катаболическая активность аэробных гетеротрофов 133,
в. Переаминирование с пируватом или 2-оксоглутаратом в качест-
ве акцептора аминогруппы и последующей регенерацией акцеп-
тора в результате реакции дегидрирования (как в случае б).
Я СНз К СН3
гтЛ^гтг 1 Трансаминаза. I I
нсын2 + со »с=о + hcnh2
соон соон соон соон
- Л^лед/^егцЗрогеНЯ?^^
В то время как с 2-оксоглутаратом, оксалоацетатом и пиру-
ватом бактериальные клетки справляются без труда, для того
чтобы направить в промежуточный обмен 2-оксоизовалерианат
или 2-оксоизокапроат, требуются специальные катаболические пу-
ти. Соответствующие последовательности реакций, обнаруженные
у бактерий, — это те же катаболические пути, которые имеются у
животных и которые приводят к образованию ацетил-СоА и про-
пионил-СоА.
Другой реакцией, используемой для запуска разрушения ами-
нокислот, является дезаминирование. Эта реакция с серином и
треонином дает соответственно пируват и 2-оксобутират. 2-оксобу-
тират может быть окислен мультиферментным комплексом, сход-
ным с пируватдегидрогеназным комплексом, с образованием про-
пионил-СоА; судьбу последнего в метаболизме мы рассмотрим
ниже.
Сериндегидратаза
СН2—СН-СООН 4-..............СНз—СО—COOH+NHs
I I , Пируват
ОН NH2
Серин
Н3—СН—СН—СООН Треоии11дсгидрата^ CH3-CH2-CO-COOH4-NH3
| | 2-оксобутират
ОН NH2
Эти реакции начинаются с удаления воды:
СН2ОН
hc-nh2
соон
C-NH,
СООН
СООН
нр
Катаболическая треониндегидратаза Е. coli отличается своими
свойствами — в частности, регуляторными — от анаболической
треониндегидратазы, присутствующей в том же самом организме;
последняя катализирует первый этап в последовательности реак-
ций, ведущих от 2-оксобутирата к изолейцину.
134
Глава 6
СООН
h2nch
сн2
Гистидаза
NH3
соон
I
сн
II
сн
Уроканаза
Н2О
СООН
I
сн2
сн2
Уроканат •Ь-имидазопаа-
5-пропионат
соон
1
сн2
Имидазолом- I
пропионаза । 2
-----2=^ HC -NH-CH=NH
Н2О соон
Формимина-
глутамаза
соон
+ HC*-NH2 + HCONH2
соон
N'tpOpMUMUHQ-L*
глутамат
ъ-глутамат »- срормцмиЭ
Рис. 6-3. Расщепление гистидина.
Многие аэробы при росте на аспартате синтезируют аспартазу!
Аспартаза
Аспартат < . —. Фумарат+NH3
С аналогичной реакции начинается разрушение гистидина
(рис. 6-3). Аэробное расщепление ароматических аминокислот
также осуществимо многими микроорганизмами. Таким образом,
очевидно, что аэробы хорошо растут на питательном бульоне и
других средах, содержащих главным образом аминокислоты и пеп-
тиды.
III. Рост на органических кислотах
В связи с общим метаболизмом Е. coli мы уже обсуждали ос-
новы роста микроорганизмов на кислотах, таких, как пируват и
ацетат, в частности необходимость специальных анаплсротических
последовательностей для использования этих соединений.
Следует сделать некоторые дополнительные замечания относитель-
но роста на органических кислотах. Ряд аэробов может расти на
жирных кислотах с длинной цепью (псевдомонады, Acinetobacter,
бациллы, Е. coli); они обычно разлагаются путем р-окисления.
Сначала жирная кислота, например пальмитиновая, превращается
с помощью ацил-СоА — синтетазы в соответствующий сложный
эфир кофермента А. Такие синтетазы обладают низкой специфич-
ностью. Например, фермент из Bacillus megaterium реагирует с
кислотами от Сб до С20. Далее СоА-эфир окисляется по р-положе-
Катаболцческая активность аэробных гетеротрофов
135
СЩ-‘СН1-СН:-.СН2~СН2~СН|-СНд-СН2-Сй3-СН1*<Й2-СН2-СН2-СН2-СН2-СООН
Со А, АТР
.S-АМР, РР,
/Щш1-Со\~сиыпетазС1
СНз-СНг-сн2-сн2-сн2-сн2-сн2-сн2-сн2-сн2-сн2-сн2-сн2-сн2-сн2-со-СоА
L— FAD , А „
Г ЛЦ«Л-СоА-оег«ЭйогеЯЙ5ос
f"**FADH2
СН3-СНг-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СНг-СН2-СН2-СН=СН-СО-СоА
О з-гидро^сиаци^-СоА-зидро^а^
СМ3 ~СН2 - с Н2- СН2 -сн 2- СНд-СНг ~СЯ2-СНА-СН2 -СН2 -СН2 -СН2 -СН-СН2 -СО—Со а
L-NAP он
. ъ-З-гидроксиацая-СоА-дегцдрс;-?
i^-NADHi геназа
СН3-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-С-СН2-СО-СоА
<—CoA о
р-хетотиалаза.
Н2О, Со А'
СНз-СН2-СН2-сн2-сн2-си2-сн2-сн2-сн2-сн2 -СН2-СН2 -СН2 -СО-СоА +|сн3-со-соа|
Н2О, CoA'^J^FAD, NAD
->*fadh2,nadh2
CHj -CH2-CH2 -CH2-CH2-CH2-CH2-CH2-CH2 -CH2 -СЩ-СО-СоА +[сНз-СО-Соа|
C|ft-( H2-ai2-CH2-CH2-CH2-CH2-CH2-CH2-CO-CoA +|(Нз-СО-Соа]
СНз -CH2-CH2 -CH2-CH2 -CH2-CH2 - CO-Co A +^CH3—CO-CoA j
СН,-СНг-СН2-СН2-СН2-СО-СоА +]ch3-( O-~C~qa]
CH2-CH2-CH2-CO-CoA+ I СНз-CO-Co a|
[сн3-СО-СоА| + |cH3-CO-CoA , (
Рис. 6-4. р-Окисление пальмитиновой кислоты.
нию, а затем расщепляется с образованием ацетил-СоА и СоА-
эфира с жирной кислотой, укороченной на два углеродных атома.
Один цикл р-окисления требует действия четырех ферментов, как
показано на рис. 6-4. Жирные кислоты с четным числом атомов
136
Глава 6
СНз
СН2
Со—SCoA
СО 2 Р,
АТР ADP
Биотин
Пропионил- СоА
СООН
I 2
НССНз .....»•
СО—SCoA
L -метилмалонил- СоА
соон 3
НзС-С-Н Л в1г
"--CO-SCoA
СООН
I
Н2С- сн2
CO-SCoA
Сукцимил-СъА,
О метилмалонил СоА
Рис. 6-5. Образование сукцинил-СоА из пропионил-СоА. 1 — пропионил-СоА —
Карбоксилаза; 2 — метилмалонил-КоА рацемаза; <? — метилмалонил-СоА — му-
таза.
дают только ацетил-СоА, и, следовательно, микроорганизмам, ра-
стущим на таких субстратах, требуется глиоксилатнЫй .цикл в
качестве анаплеротической последовательности и фосфоенолпиру-
ват-карбоксикиназа для образования фосфоенолпирувата, необхо-
димого при глюконеогенезе.
В случае жирных кислот с нечётным числом атомов конечный
цикл ^-окисления дает ацетил-СоА и пропионил-СоА. Последний
образуется также при катаболизме валина и изолейцина, и мно-
гие бактерии способны использовать в качестве источника анергии
и углерода пропионат.
Метаболизм пропионата начинается с его активации с обра-
зованием пропионил-СоА. Были обнаружены различные пути, кото-
рые могут участвовать в дальнейшем обмене пропионил-СоА.
Широко распространено превращение пропионил-СоА в сукцинил-
СоА; оно встречается в различных тканях животных, у Paracoccus
denitrificans и ризобий. Первый фермент карбоксилирует пропио-
нил-СоА с образованием метилмалонил-СоА, который подвергается
реакциям перегруппировок, приводящим к сукцинил-СоА. Мутаза,
катализирующая последнюю реакцию, содержит в качестве кофер-
мента производное витамина В12- Образование сукцинил-СоА
показано на рис. 6-5. В связи с очень важной ролью этих реакций
в пропионовокислом брожении в гл. 8 мы рассмотрим их более
детально.
У Е. coli пропионил-СоА превращается в пируват в результате
следующей последовательности реакций:
сн3
I 2Н
сн, .
СО—SCoA
Пропионил-СоА
СН2
II
СН
СО—SCoA
Акрилил-СоА
Лаютил-СоА
г°
соон
Пируват
Катаболическая активность аэробных гетеротрофов
Ж
Урат Аллантоин
NHj' СООН NHz
Н2О NH3 СОг
] Р acidovorans [
О >Г \ Ч)
Н И
Аллантоат
NHj СООН
.СН NHz
’ NH
Уреидоглицин
I’ arr itpnosa
<H.O
NHj
I
COOH c=o
। 1
Мочевинам HO-CH NH
NHz
C~O COOH
I I
NH----CH-OH
(—) Уреидогли колат
(+) Уреидогликолат
(ООН
I + Мочевина
нс-o
Глиоксилам
Рис 6-6 Распад мочевой кислоты До глиоксилата у Р. aeruginosa и Р. ocido*
vorans 7—уриказа; 2— аллантоиназа, 3 — аллантоиназа, 4 — аллантоат-амидо-
гидролаза, 5 — уреидоглицин-аминогидролаза; 6 — уреидогликолаза
Те же промежуточные продукты образуются у Moraxella Iwofft,
но, будучи связаны с ферментом, они не обнаруживаются в виде
СоА-эфиров.
Глиоксилат появляется в природе как продукт расщепления пу-
риновых оснований, В аэробных условиях эти основания окисля-
ются ксантиноксидазой до мочевой кислоты. Последняя далее
окисляется до аллантоина ферментом уриказой. Гидролиз аллан-
тоина дает аллантоинат, который у различных микроорганизмов
подвергается дальнейшим превращениям в одной из двух после-
довательностей реакций, изображенных на рис. 6-6. У Pseudomonas
aeruginosa; Р. fluorescens и видов Penicillium сначала образуются
2 молекулы мочевины и 1 молекула глиоксилата. С другой сторо-
ны, у Р. acidovorans, Streptococcus allantoic us, Arthrobacter allan-
toicus и E, coli вначале отщепляются аммиак и COs, так что в ко-
138
Глава 6
Рис. 6-7. Окисление глиоксилата в цикле дпкарбононых кислот. 1 — малат-синта*
за; 2 — малатдегидрогеназа; 3 — фосфоенолпируват — карбоксикиназа; 4 — пиру-
ваткиназа; 5 — пируватдегидрогеназный комплекс.
нечном счете образуется 1 молекула мочевины на каждую моле-
кулу образовавшегося глиоксилата. Эти различия, вероятно, не-
существенны для микроорганизмов, так как в условиях, когда ам-
миак становится лимитирующим фактором, они синтезируют фер-
мент уреазу. Уреаза расщепляет мочевину на аммиак и двуокись
углерода:
NH2-C—NH2 + H2O 2N113 + CO2
Для роста Е. coli и псевдомонад за счет глиоксилата требуются
некоторые ферменты, о которых еще не было речи. При росте на
этом субстрате обеспечение дыхательной цепи восстановительны-
ми эквивалентами осуществляется очень легко. Глиоксилат вво-
дится в циклический процесс в результате реакции, катализируе-
мой малат-синтазой. Акцептор ацетил-СоА регенерируется в серии
реакций, называемых циклом дикарбоновых кислот (рис. 6-7).
В ходе окисления 1 молекулы глиоксилата восстанавливаются
2 молекулы NAD. Для восполнения запаса фосфоенолпирувата и
Зцетил-СоА, которые являются промежуточными продуктами этого
цикла, требуется анаплеротическая последовательность реакций.
Она включает в себя три фермента и известна как глицератный
путь (рис. 6-8). Первый фермент, глиоксилат-карболигаза, ката-
лизирует конденсацию двух молекул глиоксилата с образованием
Катаболическая активность аэробных гетеротрофов
139
со4
2О=СН-С00Н
Глиотат
о=сн~снон-соон
Ла/шатЭегад тартпрно*
• вой кислт
NADНа
^NAD
НОСН2-СНОН-СООН
ГШЦерат
-АТР
SC
^-ADP
(р)0СН2,-СН0Н-С0С>Н
й-фасфошцерат
Рис. 6-8 Глицератный лун, 1 — iлиоксилат-карболигаза, 2 — редуктаза полуаль-
дегида тартроновой кислоты; 3 — 1 лицераткиназа.
СОг и полуальдегида тартроновой кислоты. Последний восстанав-
ливается до глицерата, который фосфорилируется с образованием
3-фосфоглицерата— промежуточного продукта пути Эмбдена —
Мейергофа — Парнаса.
Метаболизм глиоксилата у Paracoccus denitrificans осуществля-
ется иным путем. Из глиоксилата в результате переаминирования
возникает глицин. Он затем конденсируется с другой молекулой
глиоксилата, образуя зр/путо-р-гидроксиаспартат, который превра-
щается в оксалоацетат и аммиак (рис. 6-9). Обмен гликолата у
Р. denitrificans протекает сходным путем.
Наиболее окисленным Сг-соединением является оксалат, и при-
ходится лишь удивляться, что некоторые микроорганизмы способ-
ны использовать его в качестве источника углерода и энергии.
Один из пих — Pseudomonas oxalaticus, детально изученный Кве-
лом. У Р. oxalaticus восстановительные эквиваленты образуются в
результате окисления оксалата до СОг через оксалил-СоА и фор-
миат (рис. 6-10).
Лереаминц-
рование
О=СН-СООН---------МН2 -CH2-COOH
I NH2-CH-COOH
X. 1
О=СН-СООН-----> НО-СН-СООН
эритро-fl - Гидроксиаспартат
Окса ксацетатЬ Аммиак
Рис. 6-9. p-гидроксиаспартатный путь. 1—эритро-р-гидроксиаспартат—альдолаза;
2 — эритро-р-гидроксиаспартат—дегидратаза.
UO
Глава 6
ФормылСоК
ноос-соон
Оксалат
HCO-SCoA НСООН
HOOC-CO-SCoA
Оксддаг-Со А
Формиат
3
С NAD
NADH2
СО2
Рис. 6-10. Окисление оксалата у Р. oxalaticus. 1 — оксалат превращается в окса-
лил-СоА в результате реакции, катализируемой СоА-трансферазой, использующей
формил-СоА в качестве донора; — оксалил-СоА декарбоксилируется р образова-
нием формил-СоА, который превращается в формиат под действием трансферазы;
3— формиат окисляется формиатдегидрогеназой.
Синтез компонентов клетки начинается с восстановления окса-
лил-СоА до глиоксилата:
Оксалил-СоА+ NADPH2 —>- Глиоксилат+NADP+CoA.
Глиоксилат затем вступает в дальнейший обмен через глице-
ратный путь.
IV. Рост на алифатических углеводородах
В связи с инертностью углеводородов очень интересно, что
многие микроорганизмы способны использовать эти соединения
для роста. Для первичной атаки углеводородов требуется кисло-
род, так что рост на этих субстратах — процесс, строго аэробный.
Исходя из природы используемых субстратов, можно рассматри-
вать две группы организмов.
а. Бактерии, растущие на метане. Поскольку для роста на
Срсоединениях требуются специальные пути, эти бактерии заслу-
живают особого внимания и будут рассматриваться в последнем
разделе этой главы. Бактерии, окисляющие метан, обычно не рас-
тут на других углеводородах.
б. Организмы, растущие на углеводородах, отличных от мета-
на. Это довольно гетерогенная группа. Относительно немного ви-
дов бактерий (микобактерии, флавобактерии, Nocardia} способны
расти на этане, пропане, бутане и углеводородах, содержащих до
восьми атомов углерода. Использование же углеводородов с длин-
ной цепью распространено у микроорганизмов широко, и н-алканы
с 10—18 атомами углерода используется очень часто и с огромной
скоростью. В табл. 6-1 приведены некоторые микроорганизмы,
способные расЫ на углеводородах с длинной цепью. Примеча-
тельно, что дрожжи и другие грибы тоже используют такие суб-
Катаболическая активность аэробных гетеротрофов. ..... HI
страты. Е. coll, Enterobacter aerogenes и Bacillus subtilis неспособ*
ны расти на углеводородах.
Таблица 6-1
Организмы, способные расти на
углеводородах с длинной цепью
Pseudomonas fluorescens
Р. aeruginosa
Acinetobacter calcoaceticus
Mycobacterium smegmatis
Nocardia petroleophila
Candida lipolytica
Torulopsis colllculosa
Cephalosporium roseum
Arthrobacter paraffineus
Arthrobacter simplex
Corynebacterium glutamicum
Углеводороды — соединения водонерастворимые, и, следова-
тельно, их поглощение является, вероятно, сложным процессом.
Электронно-микроскопические исследования показали, что у расту-
щих на углеводородах микроорганизмов эти соединения накапли-
ваются в значительных количествах в виде внутрицитоплазматиче-
ских включений. Следовательно, бактерии, дрожжи и другие гри-
бы должны, очевидно, иметь очень эффективную систему транс-
порта углеводородов. Часть этой системы транспорта составляют
гликолипиды, которые локализованы во внешней частц клеточной
стенки и вызывают образование микроэмульсий углеводородов^
так что они могут проходить через клеточную мембрану.
В большинстве случаев разложение углеводорода начинается
с окисления концевой метильной группы в первичную спиртовую
группу. У Pseudomonas oleovorans для этой реакции требуются три
белка, рубредоксин (который представляет собой железосеропро-
теид), NADH2: рубредоксин— оксидоредуктаза и алкан-1-гидро-
ксилаза. Как показано на рис. 6-11,*рубредоксин вначале восста-
навливается за счет NADH2. Затем окисление углеводорода ката-
лизирует монооксигеназа (гидроксилаза), которая, помимо суб-
страта, нуждается в доноре электронов (восстановленном рубре-
доксине). У других организмов, окисляющих алканы, вместо руб-
редоксина в качестве косубстрата могут функционировать другие
доноры электронов. Общее уравнение для реакций этого типа име-
ет следующий вид:
Монооксигеназа
Субстрат—Н+Ог+АНд——к<:и.^32^. Субстрат—ОН+Н2О+А.
142
Глава 6
NADHj NAD
Гидроксилаза
Рис 6-11. Терминальное окисление я-алкана у Pseudomonas oleovorans.
Первичный спирт, образовавшийся из углеводорода, окисляет-
ся сначала до альдегида, а затем под действием NAD-зависимых
дегидрогеназ до соответствующей жирной кислоты. Жирные кисло-
ты распадаются путем |3-окисления, как уже было описано.
Следует отметить, что имеются также данные о субтерминаль-
ном окислении углеводородов с участием кислорода. Кроме того,
может происходить дитерминальное окисление с двух концов;
образующаяся в первом цикле реакций жирная кислота снова
гидроксилируется по концевой метильной группе, давая дикарбо-
новую кислоту, которая затем подвергается р-окислению.
V. Рост на ароматических соединениях
Растения образуют большое количество соединений, содержа-
щих ароматические кольца. Преобладающее среди них — это лиг-
нин. Ароматические аминокислоты и витамины встречаются во
всех организмах. Все эти соединения высвобождаются, когда орга-
низмы умирают и органическая материя распадается. Они разру-
шаются бактериями и грибами. Млекопитающие могут разрушать
только фенилаланин и тирозин, но не триптофан и другие арома-
тические соединения.
Пути, используемые животными и бактериями для разрушения
фенилаланина и тирозина, показаны на рис. 6-12. Ключевым про-
межуточным продуктом здесь является гомогентизиновая кислота,
Катаболическая активность аэробных гетеротрофов
из
Фенилаланин Тирозин
ОН
сн2
с=о
I
соон
п-Гидронсифвнил»
пируват
сн2-соон
Гомогенгпизиат 4-малеилацетоацетат
4-фумарилацетбацетап1
СООН
— J + ?’
/ О=С-СН2-СООН
НООС
Фумарат тацетоацетпат
Рис. 6-12 Распад фенилаланина и тирозина на пути гомогентизиновой кислоты.
1 — фенилаланин-гидроксилаза; 2—реакция переаминирования; 3—и-гидрокси-
фенилпируват—оксидаза, катализирующая декарбоксилирование, миграцию бо-
ковой цепи и гидроксилирование кольца; 4 — гомогентизат-оксидаза; 5 — ма-
леилацетоацетат-изомераза (нуждается в глутатионе); 6 — фумарилацетоацетат-
гидролаза
которая окисляется в малеилацетоацетат и метаболизируется даль-
ше до фумарата и ацетоацетата. Ряд бактерий способны сходным
образом расщеплять гентизиновую кислоту, образуя в результате
фумарат и пируват. Гентизиновая кислота может быть образована
Pseudontonas acidovorans, например, путем гидроксилирования
.м-гидроксибензойной кислоты.
ОН
j^cooh
он
Гентизиновая кислота
144
Глава 6
Следует, однако, иметь в виду, что гентйзиновая и гомогенти-
зиновая кислоты не единственные соединения, способные подвер-
гаться окислительному расщеплению до /еароматических продук-
тов. Действительно', большинство ароматических соединений пре-
вращается под действием бактерий в /катехол и протокатеховую
кислоту, которые — как было открыта Станиером и его сотрудни-
ками— служат «исходными субстратами» для последующих реак-
ций окислительного расщепления. На рис. 6-13 и 6-14 показаны
катаболические пути, ведущие к образованию катехола и протока-
тСховой кислоты Очевидно, что должны существовать пути, по
которым соединения, подобные антрацену, манделату, триптофану
или хинной кислоте, могут метаболизироваться до упомянутых
со-соон
сноп
он
СООН
П-Гидрокси
манделат
СНз
соон
п-Тояусцп
он
п-Ги дроксибенз аилформиат
сно
ОН
п-Гидракси-
бензатдезцд
соон
Зензоат
соон
№ соон
ОН
он
'Канаш
соон
(ООП
ОН
5-дегидроашнимат
ОН
/?- Гидрокси бензоат
ОН
м-Гидрокоибенза
ат
соон
он
ОН
Протокатехат
соон
OCHj
он
Вани/tam
Рис 6-13 Ароматические и гидроароматические соединения, которые могут быть
превращены в протокатеховую кислоту [Stanier R Y, Ornston L N, Adv Micro-
bial Physiol, 9, 89—151 (1973) ]
Катаболическая активность азробныхгетеротрофов
СНОН-СООН
I.-манделат
со-соон
сн2он н
{.-триптофан
Бензиловый спирт
Бензоилфирмиат
CO-CH2*-CHNH2 -СООН
NHCHO
Фррмилкинуренж
СО-СН2-СНЫН2-СООН
L-Кинуренин
СООН
бензол
Катехол
Фенол
Рис. 644 Ароматические соединения, которые могут быть превращены в кате-
хол. [Stanjer R. Y, Ornston L. N., Adv. Microbial Physiol., 9, 89—151 (1973).]
«исходных субстратов». В действительности на рис. 6-13 и 6-14
показана только незначительная часть этих соединений.
Для катехола и протокатеховой кислоты известно два типа
реакций расщепления: орто-расщепление и лсетн-расщепление.
А. Орто -расщепление, или 3-оксоадипатный путь
Как показано на рис. 6-15, ароматические кольца катехола и
протокатеховой кисЛоты разрываются в результате оксигеназных
10—1896
146
Глава 6
СООН
СООН
С соон
соон
"Цис, цис -Мцконат
fl-Карбокси цис,цис г"щонсип
Л-оксоадипагп-
енол- лактон
Рис. 6-15 Реакции 3-оксоадипатного пути. 1—катехол-1,2-оксигеназа; 2 — муко-
нат-лактонизирующий фермент; 3 — муконолактон-изомераза; 4 — протокатехат-
3,4-оксигеназа; 5— Р-карбоксимуконат-лактонизирующий фермст; 6 — у-карбок-
симуконолактон — декарбоксилаза; 7 — 4-оксоадипат-снол — лактон-гидрола^а;
8 — 3-оксоадипат-сукцинил — СоА-трапсфераза; 9 — З-оксоадииил — СоА-тиолаза.
реакций между двумя гидроксильными группами. Образующиеся
при этом продукты — цис, tfuc-муконат и З-карбокси-^цс, цкс-му-
конат — дают затем в результате двух реакций первое общее про-
межуточное соединение этих путей — 4-оксоадипатеноллактон. Это
соединение распадается далее с образованием сукцината и аце-
тил-СоА. Реакции катехоловой ветви и ветви протокатеховой кис-
лоты катализируются разными наборами ферментов; существует,
___________Катаболическая активность аэробных гетеротрофов__147
например, катехол—1 ^-диоксигеназа и протокатехат—4,5-диокси-
геназа. Такой тип реакции можно изобразить следующим образом:
Реакция, катализируемая
кащекол- 7,2- оксигеназой
В отличие от реакций, катализируемых гидроксилазой или мо-
нооксигеназой (см. окисление углеводородов), в диоксигеназной
реакции не требуется дополнительный донор водорода, такой, как
NADPH; оба атома кислорода появляются в конечном продукте.
Б. Мета-расщепление
В 1959 г. Дэгли и Стофер обнаружили, что почвенная псевдо-
монада содержит ферментные системы, катализирующие расщеп-
ление катехола и протокатеховой кислоты по иному пути. В этом
случае кольцо раскрывается по соседству с гидроксильной груп-
пой, так что образуется полуальдегид 2-гидроксимуконовой кислоты
или полуальдегид 2-гидрокси-4-карбоксимуконовой кислоты. Даль-
нейший метаболизм этих продуктов приводит к образованию' пи-
рувата, формиата и ацетальдегида (рис. 6-16).
Распределение различных метаболических путей у бактерий
очень сложно. У Pseudomonas acidovorans и Р. testosteroni мета-
болизм субстратов, из которых образуется и пирокатеховая кисло-
та, идет по пути .чета-расщепления, а метаболизм субстратов, даю-
щих начало катехолу, — по пути орго-расщепления. У других псев-
доманад преобладает путь орто-расщепления; это может относить-
ся ко многим бактериям, которые растут на ароматических суб-
стратах.
VI. Рост на С ^соединениях
В связи с энергетическим обменом у аэробов упоминалось, что
несколько групп бактерий не могут использовать цикл трикарбо-
новых кислот для образования восстановительных) эквивалентов.
Одна из этих групп включает микроорганизмы, растущие на Ci-co-
единениях. Микроорганизмы этой группы можно подразделить на
две подгруппы:
1. Облигатные метилотрофы, которые растут только за счет соеди-
нений, содержащих не углерод-углеродные связи (метан, мета-
нол и т. п.).
2. Факультативные метилотрофы, которые растут на различных
углеродных субстратах, включая Ci-соединения. Большинство
из этих микроорганизмов использует метанол и метиламин, но
не метан.
10'
148
Глава 6
Лротакатехат
5 <Ог
Нолцадъдегид 2,-гидрОКсиму-
коновой кислоты
HOOC^^^oH
L СООН
„ СНО, ,
Полцапъдегио
2-гидрокси-4 карбоксину*
навой кислоты
<ЛН2
НС с=о
I I
снг соон
-Ячмюмент 4 еноат
,]гН2О
НООС СнЧ
с=о
сн2 соон
2 OKCQ 4 карбоксипент
4 еноат
7<Н2О
>'lb.
неон с=о
I I
СНз соон
4-гидр<жаи*2~бХса*
валерианам
4
ITuptflWn+Ацетальдегид
НООСх. _Л'И2
сон с=о
сн3 соон
4 гидрокси * 4 карбоми 2 сксб-
валерианам
2 пару earn
Рис 6 16 Диссимиляция катехола и протокатеховой кислоты в метаболических
путях, включающих лета-расщепление 1 — катехол — 2,3-оксигеназа, 2 — гидро-
лаза полуальдегида 2-гидроксимуконовой кислоты, 3 — гидролаза 2-оксопент-4-
еноевой кислоты, 4 — 4-гидрокси 2-оксовалерианат— альдолаза, 5 — протокате-
хат -— 4,5 оксигеназа, 6 — гидролаза полуальдегида, 2 — гидрокси-4-карбоксиму-
коновой кислоты, 7 — гидролаза 2 оксо 4 карбоксипент 4 еновой кислоты, 8 — 4-
гидрокси-4 карбокси-2-оксовалерианат — альдолаза
А. Облигатные метилотрофы
Первым выделенным метилотрофом была бактерия, назван-
ная Bacillus methanicus (Sohngen, 1906). Пятьдесят лет назад ее
снова выделили и на этот раз назвали Pseudomonas methanica
(Methylomonas methanica) За последние десять лет в результате
работ Виттенбери и Уилкинсона стало известно большое количест-
Катаболическая активность аэробных гетеротрофов 1W
1
CH4+Oa+NADH2 —>- CH3OH+H2O+NAD
2
СНзОН+Х-^ СН2О+ХН2
3
СН2О+Х+Н2О НСООН+ХНг
4
HCOOH4-NAD —► CO2+NADH2
Рис. 6-17 Окисление метана до СО2 [Ferenci Т., Strom Т., Quale J. R., J. Gen.
Microbiol, 91, 79—91 (1975).] / — монооксигеназа; 2 — метанолдегидрогеназа;
3 — формальдегиддегидрогеназа; 4 — формиатдегидрогеназа; X —-неизвестный пе-
реносчик электронов.
во метилотрофных бактерий, использующих метан. По форме»
структуре внутренних мембран и способности к образованию цист
среди таких метилотрофов различают Methylosinus, Methylocystis*
Methylomonas, Methylobacter и Methylococcus.
Ясно, что при использовании для роста метана восстановитель-
ные эквиваленты для дыхательной цепи могут быть получены
только путем окисления метана (СН4) до СО2, поскольку в этих
условиях не образуется ацетил-СоА, необходимый для окисления
в цикле трикарбоновых кислот. Окисление метана происходит, как
показано на рис. 6-17. Вначале метан окисляется оксидазой со
смешанными функциями (монооксигеназой) до метанола. Окисле-
ние метанола до формальдегида и формальдегида до формиата
сопряжено с восстановлением переносчика X до ХН2; природа
этого переносчика электронов неизвестна1. И наконец, в результате
формиатдегидрогеназной реакции образуется NADH2, необходи-
мый для первой стадии окисления метана.
Следует заметить, что одно из экспериментальных наблюдений
нельзя объяснить, исходя из вышеприведенной схемы, а именно:
количество клеток, полученных при использовании 1 моля метана,
больше того количества, которое получается при использовании
1 моля метанола Если субстратом служит метанол, то на каждую
молекулу субстрата в качестве донора водорода образуются 2 мо-
лекулы ХН2 и, кроме того, 1 молекула NADHs. Это должно было
бы привести к образованию большего количества АТР и, следо-
вательно, большего количества клеток по сравнению с тем случа-
ем, когда в качестве субстрата используется метан В настоящее
время нельзя дать приемлемого объяснения этому противоречию.
Однако возможно, что клетки, растущие на метаноле, должны рас-
ходовать больше АТР на транспорт субстрата.
1 Видимо, таким переносчиком при окислении метанола служит цитохром
типа с. — Прим. ред.
Рис. 6-18. Образование ацетил-СоА из формальдегида и СОг в сериновом пути.
1 — серингидроксиметилаза; 2 — трансаминаза, которая превращает серин в
гидроксипируват и глиоксилат в глицин; 3 — гидроксипируватредуктаза; 4 — гли-
цераткиназа; 5 — фосфоглицсромутаза и енолаза; 6 — фосфоенолпируват —
карбоксилаза; 7 — малатдсгидрогсиаза; 8— малил-СоЛ — синтетаза; 9 — малил-
СоА— лиаза.
Анаболический метаболизм метилотрофов расходится с энер-
гетическим метаболизмом на уровне формальдегида. В значитель-
ной степени благодаря работам, выполненным в лабораториях
Квела и Хёрша, были установлены два цикла фиксации формаль-
дегида.
1. Серин-изоцитрат—лиазный путь. Образование ацетил-СоА из
формальдегида и СО^ в сериновом пути показано на рис. 6-18.
Акцептором формальдегида служит глицин, а серин, образовав-
шийся под действием гидроксиметил азы, превращается в соответ-
ствующую а-оксокислоту в результате трансаминазной реакции.
Далее гидроксипируват превращается в фосфенолпируват под дей-
ствием нескольких ферментов. В результате реакции, катализи-
руемой фосфоенолпируват-карбоксилазой, возникает оксалоацетат.
Ключевой фермент образования глиоксилата — малил-СоА-лиа-
за — начали изучать только в последнее время, хотя эта реакция
Катаболическая активность аэробных гетеротрофов
151
расщепления была открыта 15 лет назад у Rhodopseudomonas
sphaeroides.
СООН .соон
1 , Мали л- СоА - НСОН лиаза у / нс=о
сн2 ч сн3
со—SCO А CO~SCoA
Конечно, ферментная система (малил-СоА—синтетаза), ответ-
ственная за образование малил-СоА из малата, нуждается в АТР.
До сих пор ее не удалось обнаружить у всех микроорганизмов,
которые содержат малил-СоА—лиазу. Кромр малил-СоА—синтета-
зы и малил-СоА—-лиазы, роль ключевых ферментов в этом цикле
играют еще два фермента: серин-глиоксилат—трансаминаза и
гидроксипируватредуктаза.
В результате серинового пути происходит образование ацетил-
СоА из СН2О и СО2. Такого цикла недостаточно, чтобы обеспечить
клетки фосфоенолпируватом и оксалоацетатом для нужд биосин-
тезов. Однако это достигается при его сочетании с цитрат-синтазой,
цис-аконитазой и изоцитрат-лиазой (фиг. 6-19). В сущности, при
этом происходит прямое образование сукцината из двух молекул
СО2 и двух молекул формальдегида. Серин-изоцитрат—лиазный
путь имеется у Methylosinus и Methylocystis и у ряда факульта-
тивных метилотрофов1.
2. Рибулозомонофосфатный цикл. Ключевыми реакциями этого
цикла являются конденсация рибулозо-5-фосфата и формальдегида
под действием гексулозо-6-фосфат—синтазы и изомеризация про-
дукта во фруктозо-6-фосфат.
сн2он <рН2ОН сн2он 1 £
1 f=° НОСН 1 С О
НСОН + сн2о 1 > со 1 носн
НСОН НСОН 1 неон
СН2О® НСОН НСОН
Рибулоза - сн2о® СН2О®
й-зритро L глицерол 3. гексулозо-(>-(^)‘ Фруктоза 6{р)
Акцептор (рибулозо-5-фосфат) регенерируется под действием
транскетолазы и трансальдолазы, как показано на рис. 6-20. В кон-
1 У некоторых метилотрофов, ассимилирующих формальдегид черев серино-
вый пикл, изоцитрат-лиаза не обнаружена. — Прим. ред.
452
Глава 6
Рис. 6-19. Прямое образование сукцината из формальдегида и СОг в ссрин-изо-
дитрат-лиазном пути.
'З-Гексулозо -6- (Р)
3 Рибулоза'-5-'(Р)
Фруктоза *
^Транскетолаза |
1_ + я -I
\Граксст,долазаь - ~
I_____________I Глицеральдегид-3-(Р)
Фруктоза-6- (?)
^—АТР
| Дигидроксиацетон-®
Фруктоза -1,6- (fj)
Рис. 6-20. Рйбулозомонофосфатпый цикл.
це концов три молекулы формальдегида оказываются в одной
молекуле дигидроксиацетонфосфата, который может использовать-
ся для целей биосинтеза. Рйбулозомонофосфатпый цикл осуществ-
ляется у представителей Methylococcus и Methylomonas.
Катаболическая активность аэробныхгётеротрофрв>
1М
Б. Факультативные метилотрофы
Помимо облигатных метилотрофов существует ряд других мик-
роорганизмов, способных использовать для роста Q-соединения и
более сложные органические вещества. К ним относятся дрожжи,
представители Hiphomlcrobtum, псевдомонады, такие, как Р. оха-
laticus и Pseudomonas AMI, а также Ргotaminobacter. Эти микро-
организмы используют метанол, формиат или метиламин, но не-
способны расти на метане. Однако недавно была выделена бак-
терия (Methylobacterium organophilum), которая является факуль-
тативным метилотрофом, но способна при этом использовать так-
же метан1.
При росте на метаноле факультативные метилотрофы исполь-
зуют серин-изоцитрат—лиазный путь или рибулозомонофосфатный
цикл. Формиат ассимилируется Р. oxalaticus через СО2 и рибуло-
зе-1,5-бисфосфатный цикл (гл. 9)2.
VII. Неполные окисления
При росте аэробных гетеротрофов часть субстрата в норме
окисляется до СО2, а остальная часть используется для синтеза
клеточного материала. У некоторых организмов полное окисление
органического субстрата невозможно, в результате у них образу-
ются и выделяются частично окисленные продукты — обычно орга-
нические кислоты. Например, группа уксуснокислых бактерий
неспособна окислять ацетат Эти бактерии растут на средах с эта-
нолом, и их метаболизм можно описать следующим образом.
Этанол окисляется алкоголь- и ацетальдегиддегидрогеназами
с образованием ацетата и 2 молекул NADH2
О йГ о
- Алкогольдегидрогеназа
|СН3С1 ЬОН+NAD...........СНэ-С +NADH2
BSP,».'
О
Альдегиддегидрогеназа
снз- о +nad+h2o ch3- cooh+nadh2
Образующийся таким образом NADH2 используется для полу-
чения АТР в дыхательной цепи; ацетил-СоА не может быть окис-
лен в цикле трикарбоновых кислот, и, следовательно, больщая
часть образовавшегося ацетата выделяется.
1 Обнаружены также дрожжи, использующие для роста метан. — Прим. ped.
2 Такой же цикл функционирует у некоторых других бактерий, растущих в
метилотрофных условиях, например у Paracoccus denitrificans. — Прим. ред.
154
Глава 6
Рис. 6-21. Схематическое изображение метаболизма у Gluconobacter suboxydans.
Некоторые реакции ЦТК служат анаболической последовательностью; цикл в
целом не разрывается Реакции, ведущие к образованию оксалоацетата, неиз-
вестны.
На рис. 6-21 показана метаболическая ситуация у Gluconobac-
ter suboxydans. Видимо, отсутствие у этой бактерии способности
к окислению ацетил-СоА обусловлено не утратой цикла трикарбо-
новых кислот как такового. В самом деле, у них имеются цитрат-
синтаза, tfuc-аконитаза и изоцитратдегидрогеназа, которые ис-
пользуются для синтеза глутамата; однако а-оксоглутаратдегид-
рогеназы у них нет. Группа suboxydans лишена также изоцитрат-
лиазы и малат-синтазы, и природа анаплеротической последова-
тельности, требующейся для образования фосфоенолпирувата и
оксалоацетата у этих бактерий, до сих пор не установлена.
Другие уксуснокислые бактерии (Acetobacter aceti, A. xylinum,
A. peroxydans) отличаются от G. suboxydans тем, что в условиях,
когда весь этанол уже израсходован, они используют выделивший-
ся ацетат и окисляют его до СОг. Скорость этого окисления аце-
тата низкая у A. aceti и A. xylinum и умеренная у A. peroxydans.
У этих видов функционирует цикл трикарбоновых кислот.
Катаболическая активность аэробных гетеротрофов
155
Кроме этанола, уксуснокислые бактерии окисляют большое ко-
личество других спиртов до соответствующих кислот и кетонов.
В качестве примеров приведем следующие реакции:
Пропанол --------► Пропионат
Изопропанол -----► Ацетон
Глицерол --------> Дигидроксиацетон
Глюкоза ---------► Глюконат
Глюконат --------► 5-кетоглюконат
Эти организмы также не способны к синтезу катаболических
ферментов, необходимых для высокоактивного расщепления этих
субстратов. В результате они выделяют в среду кислоты и кетоны.
Особый интерес представляет окисление уксусными бактериями
D-сорбитола до L-сорбозы. Последняя требуется в больших количе-
ствах для синтеза витамина С (рис. 6-22).
Многие микроорганизмы переходят от полного окисления к не-
полному окислению при аномальных физиологических условиях
(высокие концентрации субстрата или крайние значения pH).
Дрожжи и другие грибы выделяют в определенных условиях цит-
рат, фумарат и глюконат. Их используют для получения этих
кислот в промышленном масштабе. Corynebacterium glutamicum
может выделять большие количества L-глутамата. Этот микроор-
ганизм и другие бактерии (а также мутанты) используются влна-
стоящее время для получения аминокислот и других метаболитов.
Большинство бацилл осуществляет неполные окисления при
росте на углеводах. Как показано на рис. 6-23, при аэробном росте
В. megaterium глюкоза частично превращается в ацетат, пируват,
VH0 VHl0H
Н-С-ОН ческое вое- H-C-OH
Ю-С-Н становление но4_н
H-C-OH Н-С-ОН
и с он н с он
CHjOH СН20Н
в - глюкоза d - сорбитол
сн2он
с=о
носн
н-с-он
HOC-H
СН2ОН
1- сорбоза
Химическое окисление
диацетоновых производных
<7. зиЪоху*
dans
сн2он
н-с-он
носн
I
н-с-он
I
о=с
I
сн2он
л.-сорбоза
С-----
но-с
II
но-с
1
с-----
но-с-н
CHjOH
Рис. 6-22. Синтез витамина С. Электролитическое восстановление D-глюкозы дает
D-сорбитол, который окисляется G. suboxydans до L-сорбозы. Химическое окисле-
ние приводит к образованию витамина.
156
Глава 6
tfpopacrmze и „ . .
деление клеток споруляция
Cnamt-----------*•&? гетжные клетки <—‘--*- Сперм
,-------—-------------------?'
а о
Рис 6-23 Неполное окисление глюкозы при аэробном росте В megaterium.
а — около 30% использованной глюкозы превращается в ацетат, пируват и
2,3-бутандиол, б — после истощения глюкозы продукты неполного окисления окис-
ляются, чтобы дйть энергию, необходимую для споруляции
ацетоин и 2,3-бутандиол Когда глюкоза истощается, эти соедине-
ния снова поглощаются. Они окисляются до СО2 и таким образом
служат источником АТР для процесса споруляции Ацетоин и
2,3-бутандиол синтезируются из пирувата через а-ацетолактат При
споруляции ацетат образуется из этих Отсоединений в 2,3-бутан-
диоловом цикле (рис. 6-24) В этом цикле диацетил расщепляется
на ацетат и связанный с ферментом гцдроксиэтилтиаминпирофос-
фат. Гидроксиэтильный остаток переносится на другую молекулу
днацетила с образованием диацетилметилкарбинола. Последний
восстанавливается и расщепляется с образованием ацетата и бу-
тандиола, который затем окисляется в диацетил Полученный та-
ким образом ацетат поступает в цикл трикарбоновых кислот
Имеются также данные относительно прямого расщепления
ацетоина на ацетат и ацетальдегид:
нго
СН3-С-СН-СН3 СНз-СООН + СНз-СНО
О ОН х хщ
Природный акцептор электронов (X) неизвестен; in vitro может
использоваться дихлорфенолиндофенол Расщепляющий фермент
идентичен диацетилметилкарбинол-синтазе Вполне возможно, что
расщепление ацетоина играет более важную роль при образовании
ацетата из этих С4-соединений чем 2,3-бутандиоловый цикл.
VIII. Выводы
1 Полимеры органического материала мертвых тканей (или
клеток) гидролизуются экзоферментами, которые выделяются1 бак-
териями и грибами а-Амилаза расщепляет крахмал до декстринов,
а затем до мальтозы, глюкозы и олигосахаридов Целлюлаза гид-
ролизует целлюлозу до целлобиозы. Дисахариды поглощаются
бактериями и расщепляются специфическими фосфорилазами до
гексозо-1-фосфата и гексозы
2 Протеазы образуются бациллами, псевдомонадами и многи-
ми анаэробами; ДНКазы выделяются гемолитическими стрепто-
кокками, Staphylococcus aureus и клостридиями Bacillus subtilis
выделяет активную РНКазу.
2СНз-СО-СООН
ТТируват
СОг^1
СНз-С(ОН)-СООН
со-сн3 1
и-ацетолактш
СО2
CHj-CO-CHOH-СНз
Ацетоин
NADH2^
NAD
СЯэ-СНОН-СНОН-СНз
2,3- бутандиол
А
NADHz
Ctfj-CO-CO-CHj
Диацетип
^Ацетат |
СК3-СО-СНОН-СН3
Ацетоцн
Гидроксиэтил -т п ф
иацётш\
NADth^J L
NAD'
СНз-СИОН СПОН-(И,
2, 3-6утандиол
СНт-СО-С(ОН)-СН3
СО-СНз
ДиацетипметилкарбинМ
(y^-NADHj
^•NAU
|/?zjCT7a/7?[^-
СН;-СНОН~С(ОН)-СНз
co-cHj
Ацетилбутандиол
5
Рис. 6-24. Образование ацетоина и 2,3-бутандиола при росте бацилл на глюко-
зе (Л) и образование ацетата в 2,3-бутандиоловом цикле при споруляций (Б),
1 — а-ацетолактат-синтаза — фермент, содержащий тиаминпирофосфат; 2 — а-аце-
толактат — декарбоксилаза; 3 — 2,3-бутандиолдегидрогеназа; 4—ацето индегидро-
геназа; 5 — диацетилметилкарбинол-синтаза; 6 — диацетилметилкарбинол-редукта-
за; 7 — ацетилбутиленгликоль-гидролаза.
158
Глава 6
3. Распад многих аминокислот начинается с их превращения в
соответствующие а-оксокислоты. Это осуществляется цитохромза-
висимыми оксидазами или NAD(Р)-зависимыми дегидрогеназами
и трансаминазами. Серин и треонин превращаются в а-оксокисло-
ты под действием дегидратаз. Многие бактерии образуют аспарта-
зу, которая отщепляет аммиак от аспартата с образованием фума-
рата.
4. Жирные кислоты распадаются путем р-окисления. Бактерии,
растущие на этих соединениях, используют глиоксилатный цикл
для образования Сгдикарбоновых кислот.
Пропионат используется в метилмалонил-СоА-пути или в акри-
лил-СоА-пути. Глиоксилат образуется как продукт разрушения
пуриновых оснований; он окисляется в цикле дикарбоновых кис-
лот, в котором малат, образовавшийся из глиоксилата и ацетил-
СоА, окисляется до ацетил-СоА. Фосфоенолпируват, необходимый
для процессов биосинтеза, образуется в глицератном пути через
стадию полуальдегида тартроновой кислоты. Pseudomonas oxala-
ticus растет на оксалате, который окисляется до COs через фор-
миат с образованием АТР и восстанавливается до глиоксилата,
необходимого для синтеза компонентов клетки
5. Алифатические углеводороды окисляются монооксигеназами
по концевой метильной группе до соответствующих спиртов. Спир-
ты далее окисляются до жирных кислот NAD-зависимыми дегид-
рогеназами. Имеются также сообщения о субтерминальном и ди-
терминальном окислении углеводородов кислородом.
6. Большинство ароматических соединений, используемых бак-
териями, вначале превращается в катехол и протокатеховую кис-
лоту. У бактерий встречается два типа реакций расщепления этих
соединений: 1) орто-р^сщеплсние, при котором катехол окисляется
в цис, rpc-муконовую кислоту; 2) лн?та-расщеплснис, при котором
катехол окисляется до полуальдегида 2-гидроксимуконовой кис-
лоты.
7. Метилотрофы используют для роста метан и другие Сi-со-
единения. Восстановительные эквиваленты для дыхательной цепи
образуются этими организмами за счет окисления Ci-соединений до
COs- Формальдегид часто является исходным материалом для про-
цессов биосинтеза. Ой ассимилируется в рибулозомонофосфатном
цикле или за счет серин-изоцитрат—лиазного пути.
8. У уксуснокислых бактерий необходимый для дыхательной
цепи NADHs образуется при окислении этанола в ацетат. Послед-
ний выделяется в среду из-за отсутствия полного цикла трикарбо-
новых кислот или из-за его низкой активности. При своем росте
бациллы окисляют сахара до ацетата, пирувата и 2,3-бутандиола.
При споруляции эти соединения служат источником энергии и
окисляются до СО2.
Глава 7
РЕГУЛЯЦИЯ МЕТАБОЛИЗМА У БАКТЕРИЙ
При обсуждении метаболизма аэробных гетеротрофов мы от-
метили, что ряд катаболических и анаплеротических ферментов
необходим микроорганизмам только при определенных условиях
роста. Так, 0-галактозидаза требуется Е. colt при росте на среде,
содержащей лактозу, но не требуется, если источником питания
служит глюкоза Псевдомонадам для использования содержащего-
ся в окружающей среде фенола необходимо наличие нескольких
специфических ферментов. Эти ферменты бывают не нужны, если
псевдомонады в качестве субстратов используют органические
кислоты, такие, например, как яблочную и янтарную. Поэтому
целесообразным и экономичным оказывается тот факт, что у мик-
роорганизмов не происходит постоянного синтеза всех ферментов,
которые они способны синтезировать, а синтезируются только те
ферменты, которые необходимы для метаболизма в данных фи-
зиологических условиях Регуляция синтеза ферментов осуществ-
ляется путем индукции и репрессии
Помимо регуляции синтеза ферментов должна регулироваться
также и активность ферментов, присутствующих в клетке. Необ-
ходимо, чтобы реакции, катализируемые ферментами, протекали в
соответствии с потребностями клетки в энергий и в определенных
химических соединениях, входящих в состав клеточных структур.
Следовательно, клетка должна обладать механизмами, снижаю-
щими или увеличивающими скорость синтеза определенных амино-
кислот или скорость образования АТР. Такого рода контроль
обеспечивается способностью клетки увеличивать или уменьшать
активность определенных ключевых ферментов метаболических
путей.
I. Регуляция синтеза ферментов путем индукции
и репрессии
А. Индукция ферментов
Известно, что при добавлении в культуральную среду лактозы
активность р-галактозидазы в клетках Е. coli повышается
(рис. 7-1). В отсутствие лактозы содержание этого фермента в
160
Глаеа 7
Рис. 7-1 Повышение удельной активности р-галактозидазы у Е coll при добав-
лении лактозы в суспензию клеток
клетках Е. coli так мало, что обнаружить его можно только при
помощи специального метода. При добавлении лактозы количество
фермента увеличивается примерно в 1000 раз. Уже через 1,4 мин
после добавления в среду лактозы можно зафиксировать повыше-
ние активности фермента Кривая активности фермента выходит
на плато через 15—180 мин в зависимости от условий роста бак-
терий. Этот процесс стимуляции синтеза фермента субстратом
носит название индукции фермента. Фактическим индуктором
^-галактозидазы служит аллолактоза (а-П-галактозил-р-1,6-П-
глюкоза), образующаяся из лактозы (а-Е>-галактозил-р-1,4-П-глю-
козы).
Мы уже знаем, что для полного метаболизма субстрата обыч-
но требуется более чем один фермент. Для расщепления лактозы
необходимы пермеаза, р-галактозидаза и ферменты, превращаю-
щие галактозу в глюкозо-1-фосфат (гл. 4). При росте на среде,
содержащей ароматическйе соединения, клетки Pseudomonas ри-
tida должны синтезировать примерно десять ферментоц, которые
при росте на других субстратах не образуются. Каким же обра-
зом осуществляется индукция синтеза этих ферментов? Различают
два механизма индукции — координированную индукцию и после-
довательную. В первом случае субстрат, содержащийся в пита-
тельной среде, включает синтез всех ферментов, необходимых для
его распада. Такой механизм обнаружен для коротких последова-
тельностей катаболических реакций: Синтез ферментов пути Энт-
нера— Дудорова стимулируется при помощи координированной
индукции, так же как и синтез ферментов метаболизма арабинозы.
В случае координированной индукции лактоза индуцирует синтез
специфической пермеазы р-галактозидазы и трансацетилазы. Га-
лактоза, образовавшаяся в р-галактозидазной реакции, индуциру-
Рис 7-2. Координированная (А) и последовательная (Б) индукция ферментов а,
б и в
ет синтез ферментов, необходимых для ее превращения в глюкозо*
1-фосфат. При координированной индукции добавление субстрата
приводит почти к одновременной индукции всех ферментов, как
показано на рис. 7-2.
Последовательная индукция обнаруживается в случае длинных
катаболических путей',, приводящих к распаду нескольких субстра-
тов. Если субстраты А, Б, В и Г распадаются, как показано на
приведенной схеме, то для превращения всех четырех субстратов
необходимо несколько ферментов; некоторые из них участвуют в
расщеплении двух субстратов, а некоторые—только одного: А, Б
или В. Здесь проявляется экономичность механизма прследова*
тельной индукции. Одним из наиболее изученных примеров ио
следовательной индукции служит синтез ферментов, катализирую-
щих распад ароматических соединений. Индукторы синтеза фер*
ментов 3-оксоадипинатного пути у Pseudomonas putida приведены
на рис. 7-3. Легко заметить, что две ветви этого метаболического
пути регулируются по-разному. Протокатехат служит индуктором
протйкатехатоксигеназы. Четыре последующих фермента совмест-
11—1896
162
Глава 7
М$уктор Фермент
Метаболиты Фермент Ннбуктор
фи»» пР°™«агг,етт-
‘ оксигеназа
Катехол-
оксигеназа
цис, -цие-
Ыу канат
сог
С02~
Р-Кар6оксимуконат~
лактонизирукпций
фермент
f-Нарбохсимуноналак-
нюн-декарбоксилаза
СО£“
сог
Муканат-
лактоназа-
рующий
фермент
сог-
С=0
Муконо-
лаитОн-
азомераза
цис, цив'
Муконит
&охсоади- „
пинит
4-охсоаЭипинат-енол-
лактоназа
З-онсоадипинат-СоА -
трансфераза
Индуктор З-о'ксоадипинил-
неизучен СМ-тиолаза
v
Сукцинат и ацетил-СоА
Рис. 7-3. Индукторы ферментов 3-оксоадипинатного пути у Pseudomonas putida.
(Starrier R. Y., Ornston L. N., Adv. Microbial Physiol., 9, 89—151 (1973).]
но индуцируются одним из конечных промежуточных продуктов,
3-оксоадипинатом. При метаболизме катехола цис,цис-муконат
выступает как продукт — индуктор катехол — 1,2-оксигеназы и как
субстрат — индуктор фермента, катализирующего превращение му’
коната в лактон, и муконолактон-изомеразы. Поскольку катехол —
1,2-оксигеназа и ферменты, катализирующие конечные реакции
Регуляция метаболизма у бактерий
163
этого метаболического пути, индуцируются продуктами соответст*
вующих реакций, для индукции этих ферментов необходимо пре-
вращение катехола в цнс,ццс-муконат и муконолактона — в 3-оксо-
адипинат. И- действительно, в неиндуцированных клетках содер-
жание соответствующих ферментов оказывается низким (табл. 7-1),
Таблица 7~1
Уровень активности некоторых ферментов 3-оксоадипинатного пути
в индуцированных и неиндуцированных клетках Pceudomonas putida1'!
Фермент Удельная активность, ед/мг белка
неиндуциро- ванные (сукцинат) индуцирован- ные (бензоат)
Катехол—1,2-диоксигеназа <0,2 1090
цнс,Ч«с-Муконатлактонизирующий фермент <0,2 390
Муконолактон-изомераза <20,0 2200
4- Оксоадипинат- енол—лактонгидро л аза 30,0 1490
» R. Y. Stanier and L. N. Ornston, Adv. Microbial Physiol., 9, 89—151
(1973).
Следует отметить, что способ регуляции 3-оксоадипинатнопэ
пути, обнаруженный у Р. putida, отнюдь не является общим для
всех бактерий. Стейниер и сотрудники обнаружили весьма значи-
тельные видоспецифические различия. В клетках Acinetobacter
calcoaceticus все ферменты, катализирующие распад протокатеха*
та, индуцируются им самим; цнс^цс-муконат индуцирует все
необходимые ферменты, если субстратом является катехол. Еще
один способ регуляции 3-оксоадипинатного пути обнаружен у
Alcaligenes eutrophus.
Каким образом индуктор дает клетке команду синтезировать
ферменты катаболического пути? В гл. 3 мы обсудили механизм
синтеза белка. Клетки Е. coli, растущие на среде с глюкозой, не
содержат ферментов метаболизма лактозы и многих других суб-
стратов. Следовательно, транскрипция бактериального генома а
образованием соответствующих последовательностей РНК и их
трансляцией происходит не полностью и избирательно. Фенотипи-
ческое выражение генов регулируется при помощи сложных меха-
низмов. Некоторые гены выражаются в растущих клетках посто-
янно, так как бактериальные клетки независимо от состава среды
должны содержать определенный набор ферментов (конститутив-
ные ферменты). Другие гены включаются или выключаются по
мере необходимости в зависимости от конкретных физиологиче-
ских условий. Для ряда индуцибельных ферментов теперь уже
известно, как это происходит. Наиболее обстоятельно изучен син-
тез ферментов катаболизма лактозы у Е. coli,
11*
Ж
Глава 7
S'-----3' 5'
3 мРНК
□
Мндуктор
Белок
Трансацетилаза
Пермеаза
/7- Галактозидаза
Индуцированный
lac- опорой
S
Рис. 7-4. Индукция синтеза ферментов катаболизма лактозы. А. Продукт гена I
является репрессорным белком, который связывается с операторным участком
о Zac-оперона и препятствует таким образом транскрипции этого оперена. Б. Ин-
дуктор (аллолактоза) взаимодействует с репрессором, который при Этом теряет
способность связываться с участком о. В результате образуется мРНК и синтези-
руются три белка, р— промотор; о —оператор; г, у и а —гены, кодирующие
р-галактозидазу, пермеазу и трансацетилазу. Следует заметить, что длины участ-
ков нуклеотидной цепи, соответствующих структурным генам и участкам д и о,
сильно различаются, а не идентичны, как это можно было бы заключить на осно-
еании изображения ДНК на этом рисунке.
Три гена, которые кодируют лактопермеазу, р-галактозидазу
и трансацетилазу, локализованы в хромосоме Е. coli рядом
друг с другом. Вместе с промотором и оператором они образуют
одну функциональную единицу, /ас-оперон. /ac-Оперон не транс-
крибируется в отсутствие лактозы, поскольку в этих условиях
операторная область блокируется репрессором [рис. 7-4, Л]. Когда
в клетку Е. coli попадает лактоза, из нее при участии Д-галакто*
Зидазы образуется некоторое количество аллолактозы, содержа-
ние которой в неиндуцированных клетках очень невелико. Алло-
лактоза связывается белком-репрессором, конформация которого
при этом меняется так, что разрываете^ его связь с операторным
участкам; транскрипция теперь становится возможной (рис. 7-4,5).
По-Видимому, аналогичным путем регулируется синтез ряда
индуцибельных ферментов. Последовательную индукцию можно
Регуляция метаболизма у бактерий,. ......., ..,. Ду
объяснить исходя из модели оперона. Структурные гены фермен-
те разветвленного катаболического пути могут располагаться в
хромосоме в виде двух, трех и более функциональных единиц,
которые включаются или выключаются соответствующими индук*
торами.
На примере Zac-оперона можно проиллюстрировать механизм
отрицательной регуляции. Сам по себе Zac-оперон постоянно готов
к транскрипции, которой, однако, препятствует специфический
репрессор. Для инициирования транскрипции этот репрессор дол-
жен быть вытеснен индуктором. Наоборот, для оперонов, кодирую-
щих ферменты катаболизма арабинозы, мальтозы и рамнозы — по
крайней мере у Е. colt, — характерна положительная регуляция.
В этом случае необходимым условием транскрипции является
взаимодействие оперона с активатором, состоящим из специфиче-
ского белка и индуктора.
Б. Катаболитная репрессия
В 1942 г. Моно обнаружил явление диауксии. Культура ВасП-
lus subtilis, растущая на среде, содержащей глюкозу и арабинозу
в качестве источников углерода и энергии, вначале использует
только глюкозу, а затем арабинозу Графически это выражается
Рис 7-5, Двухфазный рост Я subtilis на среде, содержащей глюкозу и арабинозу.
В дополнительных экспериментах было показано, что глюкоза утилизировалась во
время первой фазы роста, а арабиноза — во время второй [Monod J, Recherche»
sur la croissance des cultures bactenennes, Hermann, Paris, 145 (1958).]
166
Глава 7
двухфазной кривой роста (рис. 7-5). Такой же характер роста
наблюдается и при использовании множества других комбинаций
субстратов В. sub Ulis, Е. coli и многими другими микроорганизма-
ми. Во всех случаях один более активно усваиваемый субстрат
подавляет усвоение других субстратов. Магасаник назвал это яв-
ление «катаболитной репрессией».
На среде, содержащей смесь глюкозы и лактозы, клетки
Е. coli сначала растут за счет глюкозы. Три структурных гена
'/аг-оперона в это время не функционируют. Гены начинают вы-
ражаться в фенотипе, когда концентрация глюкозы становится
низкой. Каким же образом глюкоза мешает лактозе инициировать
синтез ферментов /czc-оперона? Этот вопрос интенсивно исследо-
вался во многих лабораториях. В результате было обнаружено,
что катаболитная репрессия связана с содержанием в клетках
циклического АМР.
кн2
>н
Использование клетками Е. coli глюкозы приводит к очень
сильному уменьшению внутриклеточной концентрации циклическо-
го АМР. После потребления клетками большей части глюкозы
содержание циклического АМР снова возрастает. Удалось пока-
зать, что циклический АМР необходим для транскрипции 1ас-
оперона. Циклический АМР образует комплекс с сАМР-связываю-
щим белком (CRP — сАМР receptor protein). Образующийся
комплекс связывается с промоторной областью (областью р) 1ас-
оперона. Инициация транскрипции /ас-оперона возможна только в
присутствии этого комплекса. Таким образом, на рис. 7-4,5 изо-
бражен неполный механизм индукции фермента; результаты более
поздних данных о роли циклического АМР в механизме индукции
ферментов показаны на рцс. 7-6, Б. В соответствии с этим меха-
низмом катаболитная репрессия синтеза ферментов /ас-оперона
глюкозой в присутствии лактозы может быть снята при добавле-
нии в ростовую среду циклического АМР в высоких концентрациях.
Почему же при наличии в клетке метаболизируемой глюкозы
содержание циклического АМР понижается? Как известно, содер-
жание циклического АМР в клетках зависит от активности фер-
Регуляция метаболизма у бактерий
167
ДНК
мРНК
3 мРНК
Беляк
д'----3' CJ
• сАМР
П
Мндуктар
I ТркнсМфПШМЗК
Пермеаза
J3- Галактозидаза
£ Индуцированный 1ас~ опером
Рис. 7-6. Индукция синтеза ферментов катаболизма лактозы. Л. В отсутствие
циклического АМР сАМР-связывающий белок (сАМР-СБ) не блокирует промо-
юра и мРНК не синтезируется. Б. Комплекс сАМР-связывающий белок—сАМР
связывается с промотором; структурные гены z, у и а транскрибируются, и снн-
юзируются соответствующие ферменты.
мента аденилатциклазы, катализирующего образование этого со-
единения из АТР в соответствии с уравнением.
АТР
Аденилатциклаза
Циклический АМР+РА
Аденилатциклаза связана с мембраной; она обладает высокой
активностью, если компоненты системы транспорта сахаров (фос-
фотрансферазной системы) фосфорилированы. А это имеет место
при отсутствии сахаров, которые необходимо транспортировать че-
рез клеточную мембрану. В присутствии же таких сахаров сте-
пень фосфорилирования компонентов фосфотрансферазной системы
уменьшается в результате фосфорилирования молекул транспорти-
руемых сахаров. Таким образом, уменьшается активность аденил-
атциклазы; содержание циклического АМР снижается, и в клетке
развивается состояние катаболитной репрессии.
168
Глава 7
Глюкоза сама ио себе вызывает не катаболитную репрессию,
а изменение концентрации общего метаболита, циклического АМР.
В этом свете становится понятным тот факт, что такого рода ре-
прессия обнаруживается для различных комбинаций субстратов.
В клетках Е. coli Глюкоза подавляет, включение нескольких ката-
болических путей (утилизацию лактозы, сорбитола, ксилитола,
арабинозы, глицерола и т. д.). Фруктоза и глюкозо-6-фосфат об-
ладают аналогичным действием. Можно сделать заключение, что,
как правило, субстраты, используемые конститутивными фермент-
ными системами, вызывают катаболитную репрессию индуцнбель-
ных метаболических путей. Глюкоза и фруктоза не у всех микро-
организмов являются доминирующими соединениями в этом про-
цессе. У Clostridium tetanomorphum L-глутамат репрессирует син-
тез ферментов метаболизма глюкозы; у Alcaligenes eutrophus, хе-
молитотрофа, окисляющего водород, Н2 препятствует запуску
фруктозой метаболического пути Энтнера — Дудорова.
В. Репрессия конечным продуктом
При росте клеток Е. coli на -минимальной среде с глюкозой в
качестве источника углерода и энергии все мономеры, необходи-
мые для образования макромолекул, синтезируются в соответст-
вии с метаболическими путями, описанными в гл. 3. Для синтеза
йолимеров требуются строго определенные количества аминокис-
лот, нуклеотидов и т. д., и избыточного образования мономеров
происходить не должно. Иногда некоторые мономеры поступают
в бактериальные клетки из окружающей среды. Если, например,
гистидин или триптофан присутствуют в среде, то нет необходимо-
сти в биосинтезе этих соединений. Поэтому для экономии энергии
у бактерий должны существовать механизмы, регулирующие со-
держание анаболйческих ферментов. Такое регулирование осуще-
ствляется путем репрессии синтеза анаболического фермента соот-
ветствующим конечным продуктом. Если в растущую культуру
Е. coli добавить триптофан или гистидин, то клетки перестают
синтезировать ферменты, катализирующие образование гистидина
из фосфорибозилпирофосфата и триптофана из хоризмата.
В изучении механизма репрессии конечным продуктом сущест-
венную роль сыграл тот факт, что структурные гены нескольких
анаболитических ферментов в хромосоме также организованы в
виде оперонов. Девять генов, ответственных за синтез ферментов
биосинтеза гистидина у Salmonella typhimurium, организованы в
единый оперон. Пять генов, кодирующих образование ферментов,
катализирующих синтез триптофана из хоризмата, также образуют
один оперон (рис. 7-7, Л). Учитывая это, репрессию синтеза фер-
ментов можнр представить таким образом: когда продукт мета-
болического пути накапливается в клетках, он взаимодействует
с белком-репрессором с образованием активного репрессора. По-
Регуляция метаболизма у 'бактерия
Репрессор
(неактивный)
ДНК
з' МРНК
5'
Л
I I
Триптофан синтаза (Д+В)
Индолглицерофосфат-синтетаза
Днтранилатсинтазный комплекс
Выражение tгр - олерона
ДНК
мРНК
Белок
Триятофак'
Репрессия trp-аперона конечным
I продуктом
Рис 7-7. Триптофановый оперон и механизм репрессии конечным продуктом. А.
В отсутствие триптофана репрессор неактивен; структурные гены транскриби-
руются, и синтезируются белки. Продукты генов е и d образуют антранилат-син-
|.1зный комплекс, продуктом гена с является индолглицерофосфат-синтетаза,
продуктами генов а и Ъ — два компонента триптофан-синтазы. Б. При накопле-
нии триптофана образуется активный репрессор и транскрипция подавляется.
следний присоединяется к операторному участку и подавляет
транскрипцию оперона (рис. 7-7, Б).
Время полужизни мРНК непродолжительно, поэтому конечный
продукт останавливает синтез фермента лишь на короткое время.
Сам по себе конечный продукт является корепрессором не при
всех анаболических превращениях. При биосинтезе некоторых ами-
нокислот, например гистидина или валина, корепрессором служит
производное тРНК. Следует также отметить, что объединение ге-
нов, ответственных за синтез ферментов анаболизма, в кластеры
не является непременным условием для регуляции конечным про-
дуктом. В клетках Е. coli гены, кодирующие ферменты биосинтеза
аргинина, занимают различные участки в хромосоме; все они вы-
ключаются одним и тем же комплексом репрессор—аргинин.
Регуляция синтеза ферментов путем репрессии конечным про-
дуктом оказывается более сложной в случае разветвленных путей
анаболизма. В таком случае, если бы один из конечных продуктов
полностью подавлял образование ферментов, участвующих также-
и в синтезе других мономеров, то это могло бы привести к не до-
170
Гддва 7
статку необходимых соединений и задержке роста клеток. При
изучении регуляции синтеза ферментов разветвленных метаболи-
ческих путей обнаружено, что существуют два механизма, помо-
гающие преодолеть вышеуказанные трудности (рис. 7-8):
1. Изоферменты для общих реакций синтезируются так, что каж-
дый конечный продукт имеет «свой» фермент, синтез которого
может быть репрессирован или дерепрессирован. В клетках
Е. colt имеются три аспартаткиназы и две гомосериндегидроге-
назы; синтез этих ферментов находится под контролем разных
конечных продуктов.
2. Для репрессии синтеза ферментов необходимо, чтобы все про-
дукты, синтезируемые этими ферментами, находились в избыт-
ке. Такой вид репрессии называется мультивалентной репрес-
сией, ди- или тривалентной репрессией, если в ней участвуют
два или три продукта.
Рис. 7-8. Репрессия конечным продуктом у Е. coll в цепи превращений, ведущих
к образованию из аспартата группы аминокислот, относящихся к семейству аспа-
рагиновой кислоты. Содержание ферментов, обозначенных незащтрихюванными
стрелками, регулируется путем дивалентной репрессии L-треонином совместно с
L-изолейцином. L-метионин репрессирует синтез ферментов, обозначенных сплош-
ными стрелками, а L-лизин — прерывистыми стрелками. 1 — аспартаткиназа; 2—
аспартатполуальдегид-дегидрогеназа; 3 — гомосериндегидрогеназа; 4 — гомосерин-
киназа; 5 — треонин-синтаза; 6 — дигидродипиколинат-циклогидролаза.
Регуляция метаболизма у бактерий
171
Оксобутират
И+ в +л
Пируват
&-Ацетолактат
а.-Ацето-ос-гидро -
ксибутцрат
И+В+Л
о1, Д>-Дигидрокси-
fi-метилвалериансгт
Л,Р-ДигиЗрокса~ 'i
U-метилбутират
а-Оксо-Д - метил-
валерианат
обОксо-Д-метил-
бутират
а-Изопропил-
малат
6
\/.-изолеициг/\
|T"gg7№w|
р-Пзапропил-
малат
7
а-Оксоизонапроат
jz-лейцил
Рис. 7-9. Регуляция синтеза ферментов, участвующих в образовании L-изолейци-
па, L-валина и L-лейцина у Salmonella typhimurium. И + В + Л—тривалентная
репрессия L-изолейцином, L-валином и L-лейцином; 1 — синтаза ацетогидрокси-
кислоты; 2 — изомероредуктаза ацетогидроксикислоты; 3 — дегидратаза ди-
гидроксикислоты, 4 — трансаминаза; 5 — а-изопропилмалат-синтаза; 6 — изопро-
пилмалат-изомераза; 7 — р-изопропилмалат-дегидрогеназа.
На рис. 7-8 показано, что синтез аспартаткиназы I и гомосе-
риндегидрогеназы I (незаштрихованные стрелки) регулируется
путем дивалентной репрессии L-треонином и L-изолейцином. Это
и неудивительно. Поскольку L-треонин является предшественни-
ком L-изолейцина, репрессия синтеза фермента только L-треони-
пом в качестве конечного продукта создала бы трудности для
клетки. Содержание аспартаткиназы II и гомосериндегидрогена-
зы II находится под контролем L-метионина, а содержание аспар-
таткиназы III — под контролем L-лизина.
Интересен также механизм регуляции другого разветвленного
метаболического пути — пути биосинтеза L-изолейцина, L-валина
и L-лейцина. Здесь необходимо вспомнить, что каждая из четырех
стадий синтеза L-валина и L-изолейцина катализируется одним
и тем же ферментом и что «-оксо-р-метилбутират является не
только предшественником L-валина, но и исходным материалом
для синтеза L-лейцина (рис. 7-9). В этом случае для предотвра-
щения недостатка одной из трех аминокислот используется меха-
низм тривалентной репрессии. Синтез ферментов, катализирующих
превращение а-оксо-р-метилбутирата в L-лейцин, подавляется
только L-лейцином.
172 Глйво 7
Синтез ферментов, участвующих в образовании ароматических
аминокислот, также находится под контролем. Клетка Е. coli со-
держит три 7-фосфо-3-дезокси-В-арабиногептулозонат—синтетазы
и две хоризматмутазы. Механизм регуляции синтеза этих фермен-
тов конечным "Продуктом — фенилаланином, тирозином и трипто-
фаном— совершенно не отличается от регуляции метаболизма
производных аспартата.
Обсуждаемые здесь схемы регуляции детально изучены
для клеток Е. coli и Salmonella typhimurium, но их нельзя распро-
странять на все виды микроорганизмов. Действительно, сравни-
тельные исследования показали, что в бактериальных клетках вы-
работались и используются другие механизмы регуляции развет-
вленных метаболических путей. Так, в клетках Bacillus polymyxa
и Rhodospirillum rubrum имеются только одна аспартаткиназа и
одна гомосериндегидрогеназа; синтез этих ферментов регулируется
путем мультивалентной репрессии. Bacillus subtilis содержит одну
7-фосфо-3-дезокси-Э-арабиногептулозонат—синтетазу, но две хо-
ризматмутазы. Можно заключить, что в процессе эволюции раз-
личных микроорганизмов анаболические пути не изменились, но
значительно изменился способ их регуляции.
Г» Синтез ферментов центральных
метаболических путей
Термин индукция тесно связан с представлением о катаболиче-
ских ферментах, а термин репрессия — с представлением об ана-
болических ферментах. В связи с этим необходимо помнить, что
содержание ферментов центральных метаболических путей также
должно регулироваться. Потребность клетки в тех или иных ана-
плеротических последовательностях меняется в зависимости от
Таблица 7-2
Содержание ферментов цикла трикарбоновых кислот
в клетках Е. coll, растущих в аэробных
и анаэробных условиях на среде, содержащей глюкозу1 )
Фермент Удельная активность, ед/мг белка
аэробный рост анаэробный рост
Цитрат-синтаэа 51,1 10,5
цмс-Аконитаза 317 16,1
Изоцитратдегидрогеназа 1416 138
а-Оксоглутаратдегидрогеназа 17,4 0
Gray С. Т., Wimpenny I. W., Mossman М. R., Biochim. Bio-
phys. Acta, 117, 33—41 Q966).
Регуляция метаболизма I/ бактерий
с
характера используемого субстрата. Когда Е coli переносят со
среды, содержащей глюкозу, на среду, содержащую ацетат, син-
тезируются изоцитрат-лиаза и малат-синтаза. У факультативных
анаэробов при изменении аэробных условий на анаэробные изме-
няется содержание ферментов центральных метаболических путей.
В анаэробных условиях нет необходимости в полном цикле три-
карбоновых кислот, и бактерии прекращают синтезировать а-оксо-
глутаратдегидрогеназу. Цитрат-синтаза, /pc-аконитаза и изоцит-
ратдегидрогеназа в этом случае нужны только для синтеза глута-
мата, поэтому в анаэробных условиях их содержание в бактери-
альных клетках ниже, чем в аэробных условиях (табл. 7-2).
Механизмы и метаболиты, определяющие содержание ферментов
центральных метаболических путей, выяснены пока не полностью.
II. Регуляция активности ферментов
А. Ингибирование по типу обратной связи
Кроме механизмов, регулирующих содержание ферментов, клет*
ка должна иметь механизмы, изменяющие активность фермейтов
в зависимости от ее метаболических потребностей. Если какой-
либо мономер синтезируется в количествах, больших, чем это не*
обходимо для синтеза полимера, недостаточно просто остановить,
синтез ферментов, участвующих в этом процессе, — надо такжа
немедленно уменьшить синтез самого мономера. Это достигаете®
путем ингибирования по типу обратной связи; конечный продукт
реакции при накоплении в клетке ингибирует активность фермент
та, катализирующего первую стадию его образования. Если изот
лейцин синтезируется в избытке, он ингибирует активность фер-ч
мента первой стадии своего биосинтеза, треониндезаминизыз
Треонин —► а-Оксобутират —► —► —► —► Изолейцин
Если пиримидиновые нуклеотиды накапливаются в клетке,
СТР подавляет активность аспартат-транскарбамилазы аспартат-
карбамоилтрансферазы), фермента, катализирующего первую ста-
дию их биосинтеза:
Аспартат
+ —Карбамоиласпартат —► —► —*- —* —*- —► СТР
Карбамоилфосфат I 1
Как только ингибируется активность треониндезаминазы и ас-
партат-транскарбамилазы, ферменты последующих этапов мета-
болического пути лишаются субстратов и синтез мономера пре-
кращается. Сейчас установлено, что поток субстрата для большин-
ства биосинтетических путей регулируется путем ингибирования
f71
Глава 7
Аспартат
Л)—*t 1
Дигадро-
тпико-
линат
f'
— L-лизин!
Аспартат-Ффасфат
Полу альдегид аспарагиновой кислоты
Гомосерин <=>
н—
О- сукцинилгомосерин
Гомосеринфосфат
| ь-треонйн\—
!*(#)—i
Л-Оксобутират
j L-метионин |-
| z.-wo/re&ftw]—
Ряс. 7-10. Ингибирование по типу обратной связи в цепи превращений, ведущих
к образованию из аспартата группы аминокислот, относящихся к семейству аспа-
рагиновой кислоты, у Е. coli. L-изолейцин ингибирует треониндезаминазу; L-трео-
нин ингибирует аспартаткиназу I и гомосериндегидрогеназу I; L-метионин инги-
бирует О-сукцинилгомосерин-синтетазу; L-лизин ингибирует аспартаткиназу III и
дигидродипиколинат-синтетазу.
too типу обратной связи. Аналогично регуляции содержания в клет-
ке ферментов регуляция активности ферментов для разветвленных
^метаболических путей осуществляется более сложным путем, чем
для неразветвленных. На рис. 7-10 суммированы ингибиторные
эффекты аминокислот — производных аспартата. Активность аспар-
таткиназы I и гомосериндегидрогеназы I контролируется L-треони-
ном. Активность аспартаткиназы III регулируется L-лизином.
Интересно, что изофермент II не ингибируется L-метионином по
типу обратной связи; L-метионин ингибирует фермент, катализи-
рующий первую стадию биосинтеза собственно метионина (О-сук-
цинилгомосерин — синтетазу).
На рис. 7-11 приведена схема контроля активности ферментов
биосинтеза ароматических аминокислот у Е. coli. Одна 3-дезокси-
Б-арабиногептулозанат-7-фосфат—синтетаза ингибируется L-фе,-
нилаланином, вторая — L-тирозином. Третий фермент — с самой
Низкой активностью — не ингибируется триптофаном. Однако
(триптофан ингибирует антранилат-синтазу. Обе хоризматмутазы
также находятся под контролем соответствующих конечных про-
дуктов. Большинство энтеробактерий содержат три З-дезокси-D-
арабиногецтулозонат-7-фосфат — синтетазы, активность которых
регулируется сходным образом. У представителей Bacillus имеется
(только одна сицтетаза; она ингибируется не конечным продуктом,
Регуляция метаболизма у бактерий
173
фосфаенолтшрувап!
4*
Рритгтоэо-4-фосфап?
-------------
3-дезонси~п-ара6ипогептулозо-7- (р)
I
—| t-триптофан
Рис. 7-11. Ингибирование по типу обратной связи в цепи превращений аромати*
ческих аминокислот у Е. coli. L-фенилаланин ингибирует З-дезокси-В-арабино-
[ сптулозонат-7-фосфат—синтетазу I и хоризматмутазу I; L-тирозин ингибируе»
3-дезокси-Б-арабиногептулозонат-7-фосфат—синтетазу II и хоризматмутазу Ilj
L-триптофай ингибирует антранилат-синтазу.
Ррефенащ
t-фенил-
аланин
а промежуточными продуктами, локализованными в месте ветвле-
ния метаболического пути хоризматом или префенатом. Такой
тип регуляции активности называется последовательным ингиби-
рованием по типу обратной связи. Еще один способ регуляции
метаболизма ароматических аминокислот был обнаружен у бак-
терий, окисляющих водород, таких, как Alcaligenes eutrophus. При
этом 3-дезокси-П-арабиногептулозонат-7-фосфат— синтетаза под-
вергается кумулятивному ингибированию фенилаланином и тиро-
зином. В табл. 7-3 показано относительное (процент) ингибирова-
ние этого фермента фенилаланином, тирозином и их смесью. Сте-
пень ингибирования не суммируется. Остаточная активность фер-
мента при ингибировании смесью равна произведению остаточных
активностей при ингибировании фенилаланином и тирозином по от-
дельности, что характерно для кумулятивного ингибирования.
Из приведенных примеров ингибирования по типу обратной
связи видно, что.в большинстве случаев ингибиторы по своей
химической структуре существенно отличаются от субстратов со-
m, Глава?
Таблица 7-~3
Регуляция активности З-дезокси-О-арабиногептулозонат-7-фосфат —
синтетазы путем кумулятивного ингибирования1)
Аминокислота, присутствую- щая в реакционной смеси Ингибирова- ние, % Остаточная активность (100%=1)
наблюдаемая рассчитанная
Фенилаланин 25 0,75 0,75 X
Тирозин 47,5 0,525 0,525
Смесь 58,2 0,418 0,394
l> Jensen R. A., Nasser D. S., Nester Е. W., J. Bacteriol., 94,
1582—1593 (1967),
ответствующих ферментов. Карбамоилфосфат и аспартат, субстра-
ты аспартат-транскарбамилазы, сильно отличаются от ингибитора
этого фермента, СТР. Поэтому маловероятно, что СТР конкуриру-
ет с субстратами аспартат-транскарбамилазы за активный центр
фермента, как малонат с сукцинатом в случае сукцинатдегидро-
геназы. Поскольку ингибиторы не являются стерическими аналога-
ми субстратов, ферменты должны содержать специальные участки
связывания ингибиторов Моно, Шанжё и Жакоб ввели термин
«аллостерические центры» для обозначения таких участков фер-
ментов. Соединения, которые связываются с этими центрами и
изменяют активность ферментов, называются аллостерическими
эффекторами, а ферменты, активность которых эти эффекторы
контролируют, — аллостерическими ферментами.
Б. Свойства аллостерических ферментов
Аллостерические ферменты представляют собой олигомеры;
они состоят из двух, четырех, шести или более идентичных или
различных субъединиц. Одна из наиболее характерных особен-
ностей аллостерических ферментов — их необычные кинетические
характеристики. Для аллостерических ферментов график зависи-
мости скорости реакции от концентрации субстрата представляет
собой сигмоидную кривую, а не гиперболу, как для ферментов,
кинетика которых подчиняется уравнению Михаэлиса — Ментен.
Кинетика реакции, катализируемой аспартат-транскарбамилазой,
представдена на рис. 7-12. СТР является отрицательным эффек-
тором этого фермента, и при средних концентрациях аспартата
наблюдается значительное уменьшение скорости реакции, вызван-
ное добавлением 0,2 мМ СТР
Сигмоидная форма кривой зависимости скорости реакции от
концентрации субстрата объясняется явлением кооперативного
взаимодействия. Предполагают, что в отсутствие субстрата актив-
Регуляция метаболизма у бактерий
m
Рис 7-12 Зависимость активности аспартат-транскарбамилазы от концентрации
аспартата. [Gerhart J. С., Pardee А. В, J. Biol. Chem, 237, 891—896 (1962).]
ные центры ферментов обладают низкой каталитической актив-
ностью. Однако при взаимодействии с субстратом активные цент-
ры изменяют свою конформацию таким образом, что становятся
каталитически активными, и в результате происходит фермента-
тивная реакция (модель индуцированного соответствия Кош-
ланда).
Дншивный, Субстрат ‘Рермент-субстпратп^
центр ный комплекс
Согласно этой модели, степень сродства определенного актив-
ного центра фермента к субстрату также может изменяться. Ак-
тивный центр может существовать в двух формах, по-разному
подверженных конформационным изменениям в присутствии суб-
страта. Эти формы соответствуют состояниям низкого или высокого
сродства фермента к субстрату. Повышение активности фермента
при кооперативном взаимодействии в таком случае означает, что
молекула субстрата, присоединившись к одной субъединице оли-
юмерного фермента, воздействует на активные центры других
субъединиц, которые при этом переходят из состояния низкого
сродства к субстрату в состояние высокого сродства. В соответст-
вии с этим отрицательный эффектор (СТР на рис. 7-12), связан-
ный с аллостерическим центром одной из субъединиц фермента,
не только удерживает активный центр этой субъединицы в состоя-
нии низкого сродства к субстрату, но и препятствует переходу
активных центров других субъединиц молекулы фермента из со*
12—1896
178
Глава 7
стояния низкого сродства к субстрату в состояние высокого срод-
ства. Положительный эффектор оказывает противоположное дей-
ствие.
Для объяснения кооперативного взаимодействия были предло-
жены две модели: модель последовательного взаимодействия (мо-
дель взаимодействий), предложенная Кошландом и сотрудниками,
и модель согласованной симметрии (равновесная модель) Моно и
сотрудников. Согласно последней модели, олигомерный фермент
существует в виде равновесной смеси двух форм: Г-состояния, ког-
да все субъединицы находятся в состоянии низкого сродства к
субстрату, и /^-состояния, когда все субъединицы находятся в
состоянии высокого сродства к субстрату.
Модель согласован-
ной симметрии
Т-состояние,
ризное сродство
к субстрату
/? состояние,
высоте сродство
к субстрату
Эффекторы сдвигают это равновесие. Модель взаимодействий
по Кошланду предполагает существование промежуточных состоя-
ний фермента, при которых, например, две субъединицы тетрамер-
ного фермента обладают высоким сродством к субстрату, а две
другие — низким.
Положительный эффектор увеличивает количество субъединиц,
находящихся в состоянии высокого сродства к субстрату, а отри-
цательный— уменьшает число этих субъединиц.
В. Аллостерическая регуляция центральных
метаболических путей
Основное назначение катаболических и центральных метаболи-
ческих путей — обеспечить клетку энергией и исходным материа-
лом для биосинтеза молекул Следовательно, вполне закономерно,
что для регуляции метаболизма используются конечные продукты
энергетического обмена и соединения, играющие роль предшест-
венников в различных процессах биосинтеза. В табл. 7-4 перечне**
лены некоторые аллостерические ферменты, катализирующие ре-
Регуляция метаболизма у бактерий
ХТ9
Таблица 7-4
Аллостерические ферменты центральных у Е. coli^ метаболических путей
Фермент Ингибитор Активатор
АПРглюкозо-пирофос- формлаза АМР Г лицеральдегид-З-Р, фруктозо-1,6-бисфос- фат, фосфоенолпируват
Фруктозо-бифосфатаза АМР —
Фосфофруктокиназа Фосфоенолпируват ADP, • GDP
Пируваткиназа Фруктозо-1,6-бисфосфат
Пируватдегидрогеназа NaDH2, ацетил-СоА Фосфоенолпируват, GDP, АМР
Фосфоенолпируват-кар- боксилаза Аспартат, малат Ацетил-СоА, СТР, фрук- тозо-1,6-бисфосфат, GTP
Цитат-синтаза NADH2, а-оксоглутарат
Малатдегидрогеназа nadh2
15 Sanwal В. D., Bacteriol. Rev., 34, 20—39 (1970).
акции центральных метаболических путей в Е. coli, а также их
ингибиторы и активаторы. Увеличение концентрации HADH2 в
клетке сигнализирует о насыщении дыхательной цепи HADH2 и
возможности уменьшения скорости реакций цикла трикарбоновых
кислот. Поэтому цитрат-синтаза, а также малатдегидрогеназа и
пируватдегидрогеназный комплекс ингибируются HADH2. Кроме
того, цитрат-синтаза ингибируется а-оксоглутаратом, а пируват-
дегидрогеназный комплекс — ацетил-СоА.
HADH2 ингибирует не все бактериальные цитрат-синтазы. Фер-
менты, которые ингибируются HADH2, встречаются в основном
у грамотрицательных бактерий. В клетках грамположительных
бактерий цитрат-синтаза ингибируется АТР, так же как и в клет-
ках эудариот. а-Оксоглутарат ингибирует этот фермент только у
энтеробактерий.
Фосфоенолпируват-карбоксилаза ингибируется аспартатом и
малатом. Высокое содержание этих соединений служит сигналом,
что нет необходимости в синтезе С4-дикарбоновых кислот. С дру-
гой стороны, повышение концентрации ацетил-СоА указывает на
недостаток С4-дикарбоновых кислот. Таким образом, ацетил-СоА
служит активатором фосфоенолпируват-карбоксилазы. Многие
микроорганизмы в качестве анаплеротического фермента вместо
фосфоенолпируват-карбоксилазы содержат пируват-карбоксилазу.
В большинстве случаев пируваткарбоксилаза также активируется
ацетил-СоА.
12*
ISO Глава 7
Фруктозе-1,6-бисфосфат — стратегически важный промежуточ-
ный продукт, на уровне которого пересекаются пути гликолиза в
образования гликогена При повышении содержания АМР проис-
ходит ингибирование ADP глюкозо-пирофосфорилазы и фруктозо-
бисфосфатазы — двух ферментов, участвующих в синтезе гликоге-
на. Повышение концентрации фруктозо-1,6-бисфосфата положи-
тельно сказывается на протекании гликолиза, поскольку и пиру-
ваткиназа, и фосфоенолпируват-карбоксилаза активируются
4руктозо- 1,6-бисфосфатом. Синтез гликогена стимулируется также
при активации ADP глюкозо-пирофосфорилазы. Если нет необхо-
димости в дальнейшем увеличении гликолитической активности
клетки, фосфоенолпируват ингибирует фосфофруктокиназу, что
способствует образованию гликогена.
На рис 7-13 суммированы механизмы регуляции гликолиза и
синтеза гликогена у Е coli Видно, что ферменты-мишени, контро-
лирующие определенные последовательности реакций, обычно ка-
тализируют реакции, необратимые при физиологических условиях.
Эти ферменты (фосфофруктокиназа, пируваткиназа и т. д) опре-
деляют скорость всей цепи реакций; поэтому регуляция их актив-
ности оказывается очень эффективной. Кроме того, как видно из
рис. 7-13, антагонистические ферменты, например фосфофруктоки-
наза и фруктозе-1,6-бисфосфатаза, функционируют в клетке одно-
временно Эти ферменты особенно должны находиться под строгим
контролем, иначе будут происходить так называемые пустые циклы
(бесполезные циклические превращения), сопровождающиеся гид-
ролизом АТР: фруктозо-6-фосфат будет фосфорилироваться фос-
фофруктокиназой, а образующийся фруктозобисфосфат — снова
гидролизоваться фосфатазой Пустые циклы могут происходить
и при участии в качестве компонентов глюкозо-1-фосфата, ADP-
глюкозы и гликогена
На рис. 7-13 показано, что адениннуклеотиды относятся к числу
важных эффекторов. АМР, так же как и ADP, образуется из АТР
во многих биосинтетических реакциях Любое увеличение концент-
рации этих нуклеотидов приводит к стимуляции синтеза АТР.
В результате регуляции процессов синтеза и распада АТР в клет-
ках живых организмов поддерживается стационарное энергетиче-
ское состояние. Согласно Аткинсону, этот энергетический статус
14оЖет быть охарактеризован при помощи энергетического заряда
(ЭЗ), который определяется следующим образом:
[АТРЦ- — [ADP]
эз в ----------------
[ATP]+[ADP]+[AMP]
Для систем, содержащих только АТР, энергетический заряд
равен 1, а для систем, содержащих только АМР, — 0. Измерения
показали, что энергетический заряд растущих клеток равняется
Регуляция метаболизма у бактерий .
l/jTMVQggffJ
I j АОР-ётахоза\
\ ----АМР
----- Фосфоенолпируват,
[ Глюкоза-1-фосфа.т | ФрУ^^-бисфосфОЛГ
| Фруктоза-S-фосфат |
Фосфоенол- Z2 V, ............ ..„ Аjap
пируват .Я" Т1 ЛМР
| фруктоза f,S-(fucipaapam\
fl
II
_________н___________
I Фосфоенолпируват
’---~7---- —SJjS----- Фрунтоза-1,£~
мспартат биссросфат
Ацетил-СоА—\
IОксалоацетат\ I Пируват
'----—------ Ааетил-СоА. NADU,
— Фосфоенолпируват f АМР
^Ацетил-СоА |
г=] ингибитор
(+) активатор
NADH2j сс~ оксоглутарат
| Ци/прдгт |
Рис 7-13. Схематическое изображение реакций гликолиза и синтеза гликогена
у Е. coli и их регуляции.
примерно 0,8. Клетки Е. coli погибают, когда значение этой вели-
чины меньше 0,5.
Г. Ковалентная модификация ферментов
В последние годы все больше и больше приходят к выводу а
важной роли еще одного механизма регуляции активности фермен-
тов: изменения активности ферментов в результате ковалентной
модификации их структуры. В то время как при аллостерической,
регуляции низкомолекулярное соединение (метаболит) связывается
с ферментом или освобождается из комплекса с ферментом, при
182
Глава 7
обсуждаемом здесь типе регуляции фермент подвергается ковалент-
ному изменению в реакции, катализируемой специальным фермен-
том. Принцип такого регуляторного механизма ясен из следующих
уравнений:
Фермент—X —-----------——-----Фермент+Х
Модифицирующий фермент(ы)
(активный) -<--------------------(неактивный)
ИЛИ
Фермент+Х -----------------—► Фермент—X
Модифицирующий фермент(ы)
(активный) -<-------------------(неактивный)
Как видно, рассматриваемые здесь ферменты существуют в
двух формах, активной и неактивной, и эти формы способны пе-
реходить одна в другую.
Эти две формы фермента различаются тем, что в одном случае
фермент несет ковалентно-связанную с ним группировку, а в дру-
гом— нет. Первый фермент, существующий в двух формах, обна-
ружили Кори и сотрудники. Это была мышечная гликоген-фосфо-
р ил аз а. Форма b этого фермента фактически неактивна; она при-
сутствует в «аэробной» мышце. В работающей мышце, когда воз-
никает потребность в процессе гликогенолиза, форма b фосфори-
лазы фосфорилируется и превращается в высокоактивную фор-
му а. При расщеплении АТР ее фосфорильные группы присоеди-
няются к сериновому остатку фермента, по одной на каждую
субъединицу. Превращение формы а в форму b достигается путем
гидролитического отщепления фосфатных групп. Таким образом,
для модификации фосфорилазы требуются два фермента: киназа
фосфорилазы и фосфатаза фосфорилазы. Эти регуляторные фер-
менты, конечно, также должны находиться под контролем; поэтому
регуляция мышечной фосфорилазы осуществляется путем высоко-
чувствительного каскадного механизма.
Необходимо отметить, что активность гликоген-фосфорилазы
прокариот не регулируется путем ковалентной модификации и что
модификация ферментных систем путем фосфорилирования-де-
фосфорилирования, как правило, более распространена у эукариот.
У бактерий обнаружены две интересные системы ковалентной мо-
дификации ферментов: активность глутаминсинтетазы Е. coli ре-
гулируется путем аденилирования-деаденилирования и активность
цитрат-лиазы Rhodopseudomonas gelatinosa — путем ацетилирова-
ния-деацетилирования. На рис. 7-14 приведена схема регуляции
активности глутаминсинтетазы, предложенная Стэдманом и Холь-
цером и их сотрудниками. Этот фермент состоит из двенадцати
субъединиц. Его деаденилированная форма очень активна. При
высоком содержании глутамина и низком — а-оксоглутарата в
каждой субъединице фермента аденилируется один остаток тиро-
зина. В таком состоянии фермент обладает низкой активностью
и к тому же подвергается кумулятивному ингибированию по типу
Регуляция метаболизма у бактерий
183
Рис. 7-14. Регуляция активности глутамин-синтетазы Е. coll путем ковалентной
модификации. Взаимопревращение двух форм фермента катализируется адени-
лилтрансферазой вместе с регуляторным белком Рц. Для деаденилирования не-
обходим UTP (для присоединения уридилового остатка к Рп с образованием
Рп — UMP), а-оксоглутарат и отсутствие глутамина; для аденилирования необ-
ходимы глутамин, низкое содержание а-оксоглутарата и наличие Рц.
обратной связи такими соединениями, как АМР, СМР, триптофан,
гистидин, глюкозамин-6-фосфат и карбамоилфосфат. В случае
уменьшения содержания глутамина остатки АМР переносятся на
неорганический фосфат и активность фермента снова восстанав-
ливается. Взаимопревращение двух форм глутаминсинтетазы ка-
тализируется аденилилтрансферазой и регуляторным белком (Рц),
который может уридилироваться за счет UTP. В присутствии ури-
дилированного белка (Рц — UMP) трансфераза катализирует де-
аденилирование синтетазы; в противном случае происходит адени-
лирование.
Активность глутамин-синтетазы многих других видов бактерий
не регулируется путем ковалентной модификации. Обнаружено
также, что активность цитрат-лиазы регулируется путем ацетили-
рования-деацетилирования только у фототрофа Rhodopseudomotias
gelatinosa (рис. 7-15). Цитрат-лиаза расщепляет цитрат на оксало-
ацетат и ацетат. Фермент активен, если клетки могут использовать
цитрат в качестве субстрата. В этих условиях деацетилирующий
фермент ингибируется L-глутаматом, для которого цитрат служит
предшественником. В отсутствие цитрата концентрация глутамата
в клетках уменьшается и цитрат-лиаза инактивируется специфи-
184
Глава 7
Рйс. 7-15. Регуляция активности цитрат-лиазы у Rhodopseudomonas gelaiinosa
путем ацетилирования и деацетилирования. L-глутамат ингибирует реакцию
деацетилирования; ацетилирование происходит в присутствии цитрата.
ческой деацетилазой. Если цитрат снова становится доступным
для клеток, путем ацетилирования образуется активная форма
фермента. Система регуляции цитрат-лиазы отличается от других
рассмотренных нами систем тем, что модификатор структуры фер-
мента (ацетильная группа) участвует в ферментативной реакции.
Согласно Эгереру и др., механизм реакции, катализируемый лиа-
зой, можно представить следующим образом:
Ацетил-Б-фермент+Цитрат ч Цитрил-Б-фермент+Ацетат,
Цитрил-Б-фермент ц.. -fc Ацетил-Б-ферментЧ-Оксалоацетат
Ацетильная группа участвует в йервой стадии трансферазной
реакции, поэтому очевидно, что HS-фермент должен быть неак-
тивным.
til, Выводы
1. Процесс субстрат-зависимого синтеза ферментов называется
индукцией ферментов. При координированной индукции синтез
всех ферментов метаболического пути находится под контролем
одного индуктора. В последовательной индукции участвует не-
сколько индукторов.
2. Гены индуцибельных ферментов, которые синтезируются ко-
ординированно, расположены в бактериальной хромосоме рядом.
Вместе с оператором и промотором они образуют регуляторную
единицу, оперон. В отсутствие индуктора выражению гена пре-
пятствует репрессор, который блокирует оператор, связываясь с
«им. Индуктор препятствует этому связыванию, обусловливав тем
самым транскрипцию.
3, Субстраты, которые легко могут быть использованы клеткой,
способны подавлять индукцию ферментов других путей катабо-,
лизма— явление, называемое «катаболитной репрессией». Транс-
порт этих субстратов в клетку вызывает значительное снижение
внутриклеточного содержания циклического АМР. Циклический
АМР, однако, необходим для инициации синтеза РНК на оперб-
нах, кодирующих индуцибельные ферменты. 1
4. Содержание в клетке ферментов анаболических путей регу-
лируется путем репрессии конечным продуктом. Конечный продукт
реакции, который накапливается в клетке, взаимодействует со
специфическим апорепрессором с образованием активного репрес-
сора. Активный репрессор препятствует транскрипции генов, от-
ветственных за синтез ферментов данного метаболического пути.
Регуляция активности ферментов разветвленных метаболических,
путей носит более сложный характер; существование изоферментов,
и мультивалентной репрессии не позволяет одному конечному про-
дукту препятствовать синтезу другого конечного продукта того,
же метаболического пути.
5. При ингибировании по типу обратной связи конечный про1
дукт анаболического пути уменьшает активность фермента, ката-
лизирующего первую стадию его образования. Этот механизм по-
зволяет быстро привести в соответствие скорость синтеза продуктам
реакции с Потребностями клетки. Ферменты-мишени, т. е. фер-
менты, активность которых регулируется по типу обратной связи,,
являются аллостерическими. Кроме активных центров аллостери-
ческие ферменты содержат специальные участки связывания соот-
ветствующих эффекторов (ингибиторов или актиПаторов). Для боль-
шинства аллостерических ферментов характерна сигмоидная зави-
симость скорости ферментативной реакции от возрастающей кон-
центрации субстрата. Это объясняется кооперативным взаимодей-
ствием субстрата и (или) эффекторов с ферментом.
6. При регуляции активности ферментов центральных метабо-
лических путей роль сигналов играют продукты энергетического
обмена (AMP, ADP, АТР, HADH2) и важные предшественники
ряда продуктов биосинтетических реакций (фосфоенолпируват,
ацетил-СоА, аспартат). Скорость протекания реакций центральных
метаболических путей обычно определяют аллостерические фер-
менты (пейсмейкеры).
7. Энергетическое состояние клеток характеризуется энергети-
ческим зарядом: Э3= [АТР] [ADP]/[ATP] +{ADP] +,[AMPJ.
8. Активность ряда ключевых ферментов регулируется путем
ковалентной модификации. Эти ферменты могут существовать в
активной, неактивной или менее активной формах. Взаимный пе-
реход фермента из одной формы в другую достигается путем фос-
форилирования-дефосфорилирования (для участвующих в мета-
болизме гликогена ферментов эукариотических клеток), аденили-
рования-деаденилирования (синтез глутамина у Е. coli) и ацети-
лирования-деацетилирования (для цитрат-лиазы у Rhodopseudo- -
monos).
Глава 8
БАКТЕРИАЛЬНЫЕ БРОЖЕНИЯ
Большие пространства на суше, в реках, озерах и океанах ли-
шены кислорода. Тем не менее многочисленные микроорганизмы
существуют в этой анаэробной среде. Мы уже рассматривали про-
цесс диссимиляционного восстановления нитратов в анаэробных
условиях. Кроме него два других процесса играют важную роль
в жизнедеятельности бактерий в анаэробной среде: брожение и
фотосинтез. Термин «брожение» впервые был введен Пастером,
которому мы обязаны первыми исследованиями в этой области.
Он характеризовал брожение как жизнь без кислорода. В настоя-
щее время под брожением понимают биологические процессы, ко-
торые протекают в темноте без участия дыхательных цепей с кис-
лородом или нитратом в качестве акцепторов электронов1. Во мно-
гих случаях при брожении АТР образуется только путем субстрат-
ного фосфорилирования. Однако в ряде случаев АТР синтезирует-
ся также путем фосфорилирования, сопряженного с переносом
электронов в дыхательной цепи.
Бактерии, вызывающие брожение, относятся к факультативным
или облигатным анаэробам -Факультативные, анаэробы, такие,
например, как энтеробактерии, в присутствии кислорода растут
как аэробные гетеротрофы; в анаэробных же условиях их обмен
переключается на брожение В отличие от таких микроорганизмов
облигатные анаэробы не могут синтезировать компоненты связан-
ной с кислородом дыхательной цепи. Следовательно, они не могут
расти как аэробы. Более того, многие облигатные анаэробы вооб-
ще не выносят присутствия кислорода в среде и погибают на
воздухе. Эти микроорганизмы относятся к строгим анаэробам.
Когда восстановленные флавопротеиды или восстановленные
железосеропротеиды взаимодействуют с кислородом, то образу-
1 Имеется несколько Другое определение брожения. Так называют анаэроб-
ные процессы, при которых синтез АТР осуществляется только на субстратном
уровне Если АТР образуется в результате функционирования электроперенося-
щей цепи в отсутствие Q2, процесс называют анаэробным дыханием независимо
от того, является ли акцептором электронов NO3 или друхие соединения Воз-
можно, сочетание брожения и аэробного или анаэробного дыхания (см. Стей-
ниер Р, Эдельберг Э., Ингрэм Дж, Мир микробов, М., <Мир», 1979).—Прим,
ред
Бактериальное брожение
187
Таблица 8-1
Активность пероксид-дисмутазы и каталазы в клетках
различных микроорганизмов1)
Удельная активность, ед./нг белка
Микроорганизм пероксид- _ дисмутаза каталаза
Аэробы Escherichia coli Salmonella typhimurium Rhizobium japonicum Micrococcus radiodurans Виды Pseudomonas 1.8 1,4 2,6 7,0 2,0 6,1 2,4 0,7 289 22,5
Аэротолерантные анаэробы Eubacterlum limosum 1.6 0
Streptococcus faecalis 0,8 0
Streptococcus lactis 1,4 0
Clostridium oroticum 0,6 0
Lactobacillus plantarum 0 0
Строгие анаэробы Veilonella alcalescens 0 a
Clostridium pasteurianum 0 0
Clostridium barkeri 0 0
Clostridium sticklandii 0 0
Butyrivibrio fibrisolvens 0 0,1
McCord J. M., Keele В. B., Fridovich I., Proc. Natl. Acad. Sci.f
68, 1024-1027 (1971).
ются два токсичных соединения: пероксид водорода и пероксидныЙ
радикал (см. гл. 2, разд. V). Для разрушения этих соединений в
клетках аэробных бактерий имеются ферменты каталаза и пе-
роксид-дисмутаза. В табл. 8-1 приведены активности этих фермен-
тов у аэробов, аэротолерантных анаэробов и строгих анаэробов.
Видно, что клетки аэробов характеризуются высокой активностью
каталазы и пероксид-дисмутазы. Клетки большинства аэротоле-
рантных анаэробов лишены каталазы, но у них имеется пероксид-
дисмутаза. В клетках же строгих анаэробов отсутствуют оба
фермента.-Отсюда можно сделать вывод, что аэроинтолерантные
виды бактерий (облигатные виды) погибают в присутствии кисло-
рода вследствие токсического действия пероксидного радикала,
хотя не исключено, что существуют и другие причины их гибели.
Отсутствие молекулярного кислорода в среде — недостаточное
условие для роста большинства строгих анаэробов. Необходимо
также, чтобы был низкий окислительно-восстановительный потен-
циал, а ростовая среда содержала —SH-соединения, такие, как
тиогликолат, цистеин или сульфид натрия. Эти соединения созда-
ют условия, необходимые для протекания восстановительных ре-
акций. МеТанобраЗующие бактерии растут только в таких средах,
окислительно-восстановительный потенциал которых меньше, чем
Е'о=— 0,3 В.
При сравнении аэробного гетеротрофного метаболизма с бро-
жением обнаруживается одно главное различие: у аэробных гете-
ротрофов окисление органических субстратов сопряжено с восста-
новлением кислорода или нитрата. В этом процессе участвует
дыхательная цепь и образуется много АТР. Субстраты, за исклю-
чением некоторых соединений, окисляющихся не полностью, пре-
вращаются в клеточные вещества, углекислоту (двуокись угле-
рода) и воду.
При брожении в клетках анаэробов протекает множество окис-
лительно-восстановительных реакций с участием органических ве-
ществ, двуокиси углерода, молекулярного водорода и соединений
серы. Все эти реакции характеризуются образованием лишь не-
большого количества АТР. Поэтому число образующихся бакте-
риальных клеток, приходящихся на один моль использованного
субстрата, значительно меньше, чем у аэробов. Кроме того, обра-
зуется большое количество «конечных продуктов брожения».
Существуют два процесса брожения, которые на первый взгляд
тождественны дыханию клеток с использованием кислорода или
нитратов: восстановление СОз до метана и восстановление суль-
фатов до сульфидов. Как и процесс дыхания, зависящий от нит-
ратов, эти процессы часто называют анаэробным дыханием. Одна-
ко они мало походят на процесс денитрификации Восстановление
СО2 и сульфатов протекает в клетках строгих анаэробов, в то
время как восстановление нитратов характерно для некоторых
факультативных аэробов при отсутствии в среде кислорода. Бак-
терии, у которых дыхание осуществляется за счет нитратов, со-
держат истинную дыхательную цепь; у бактерий, восстанавливаю-
щих сульфат и СО2, нет дыхательной цепи Кроме того, эти про-
цессы различаются энергетически. В табл. 8-2 показано, что изме-
нение свободной энергии при восстановлении О2 и нитрата в пере-
счете на пару электронов примерно одинаково. Эти величины
значительно ниже при восстановлении СО2 и сульфата. Действи-
тельно, изменение свободной энергии при восстановлении СО2 и
сульфата настолько мало, что при окислении Н2 или HADH2 не
может синтезироваться даже одна молекула АТР (для синтеза
АТР из ADP и неорганического фосфата требуется более 8,5 ккал
(или 35,6 кДж) на 1 моль). Следовательно, не все реакции вос-
становления при образовании метана и сульфидов приводят к
синтезу АТР. Восстановление только одного или двух промежуточ-
ных продуктов в этих процессах сопровождается образованием
АТР в результате фосфорилирования, сопряженного с переносом
электронов, и выход АТР поэтому оказывается небольшим В за-
ключение следует отметить, что термин «анаэробное дыхание»
целесообразно сохранить для обозначения процессов денитрифика*
Таблица 8-2
Изменение свободной энергии при аэробном и анаэробном дыхании и при сульфидном
и метановом брожении1*
Окислительно-восстановительная реакция ЛО'о» (ккал/моль акцептора) AG'o, (ккал/2 е~) На NADHa
2Н2+Оа-*2Н2О —113,38(—474,38) 5 1 у Ha+NO;+H+-* —N2+3H2O —133,99(—560,61) 3 1 1 4H2+SO?"+— — H2S + — HS-4-4H2O —36,68(—153,46) 2 Н+—* 2 2 4Н2+СО2—СН4+2Н2О -31,26(—130,79) —56,69(—237,19) —52,36(—219,07) —53,60(—224,24) —49,27 (—206,12) —9,17(—38,36) —4,84(—20,24) —7,81 (-32,70) —3,48(—14,58)
** В скобках приведены соответствующие значения в килоджоулях
190
Глава 8
ции и нитрат-нитритного дыхания; восстановление же СО2 и суль-
фатов следует относить к брожению.
Процесс брожения обычно классифицируют в соответствии с
главными конечными продуктами. Различают спиртовое, молочно-
кислое, пропионовокислое, маслянокислое, смешанное, уксуснокис-
лое, метановое и сульфидное брожения.
I. Спиртовое брожение
А. Образование этанола дрожжами
Спиртовое брожение характерно в основном для дрожжей, осо-
бенно для видов Saccharomyces, и соответственно большая часть
этилового спирта, как природного, так и получаемого промышлен-
ным путем, образуется в результате анаэробного разложения глю-
козы И других гексоз этими организмами. Уже в 1815 г. Гей-
Люссак установил, что гексозы превращаются в этанол и СО2 в
соответствии со следующим уравнением:
CeHi2O6 —> 2С2НБОН+2СОа
На рис. 8-1 показан процесс спиртового брожения дрожжей.
Видно, что распад глюкозы идет по пути Эмбдена — Мейергофа —
Парнаса. Так, из 1 моля глюкозы образуются 2 моля пирувата.
Пируват, однако, не превращается в ацетил-СоА, как при аэроб-
ном метаболизме, а декарбоксилируется до ацетальдегида. Эту
реакцию катализирует фермент пируватдекарбоксилаза, который
можно считать ключевым ферментом спиртового брожения. Пиру-
ватдекарбоксилаза в качестве кофермента содержит тиаминпиро-
фосфат; функция тиаминпирофосфата была впервые исследована
в связи с изучением этого фермента. Как и в реакции, катализи-
руемой пируватдегидрогеназой, в качестве промежуточного про-
дукта в этом случае также образуется комплекс гидроксиэтил—
тиаминпирофосфат—пируватдекарбоксилаза. Однако гидрокси-
этильная группа не окисляется, а освобождается в виде свободного
ацетальдегида. Последний затем восстанавливается до этанола в
реакции, катализируемой алкогольдегидрогеназой.
Как показано на рис. 8-1, при спиртовом брожении баланс во-
дорода остается постоянным, что является важной характеристи-
кой этого процесса. Поскольку в данном случае отсутствует такой
внешний акцептор водорода, как кислород, реакции синтеза и по-
требления HADH2 должны быть сбалансированы. Это означает
также, что у анаэробов образование HADH2 сведено к минимуму.
У них не происходит окисления ацетил-СоА в цикле трикарбоновых
кислот. Цикл обычно прерывается между а-оксоглутаратом и сук-
цинил-СоА, так что глутамат еще может синтезироваться из окса-
лоацетата и ацетил-СоА через стадию образования цитрата.
Бактериальное брожение
191
(сн2)2— ®—® — фермент
Комплекс гиЗрооксигтилтиаминпирсфосфат-фермснт
Б. Эффект Пастера
Чистый выход АТР при спиртовом брожении составляет 2 моля
АТР на 1 моль глюкозы (рис. 8-1), что значительно меньше вы-
хода АТР при аэробном метаболизме. Дрожжевые клетки реаги-
руют на это большое различие. При смене аэробных условий на ана-
эробные скорость превращения глюкозы возрастает в 3—4 раза.
Переход от анаэробного метаболизма к аэробному сопровождает-
Глюкоза |
2 Фосфоенолпируват 2 2-фосфоглицерат
Рис. 8-1. Брожение глюкозы с образованием этанола и COj у дрожжей. 1 — фер-
менты пути Эмбдена — Мейергофа — Парнаса; 2 — глицеральдегид-3-фосфат—де-
гидрогеназа; 3 — 3-фосфоглицераткиназа; 4 — фосфоглицератмутаза; 5 — енолаза;
€ — пируваткиназа; 7 — пируватдекарбоксилаза; 8 — алкогольдегидрогеназа.
W Глада g
ся снижением скорости этого процесса» и образование спирта пре*
кращается. Это явление носит название эффекта Пастера. По-ви-
дийому, эффект Пастера обусловлен различием энергетического
заряда клеток в аэробных и анаэробных условиях. В присутствии
кислорода дыхательная цепь и субстратное фосфорилирование на
уровне гликолиза конкурируют за ADP. Кроме того, активность
фосфофруктокиназы зависит от содержания АТР и цитрата. В ана-
эробных условиях активность фосфофруктокиназы возрастает, по-
скольку она активируется ADP и АМР; таким образом, для фер-
ментов, катализирующих реакции субстратного фосфорилирования,
становится доступным большее количество ADP. Все это способст-
вует большему оттоку субстратов на гликолитический путь.
В. Спиртовое брожение, вызываемое бактериями
Следует отметить, что'дрожжи не относятся к истинным фа-
культативным анаэробам. В анаэробных условиях они дают толь-
ко несколько генераций. Существуют, однако, некоторые виды
бактерий, у которых происходит спиртовое брожение и которые
хорошо растут в анаэробных условиях. Вид Zymomonas mobilis,
выделенный из мексиканской пульки1, и близкий к нему вид Zy-
momonas anaerobica могут превращать глюкозу в пируват по пути
Энтнера — Дудорова. В клетках этих бактерий содержится пиру-
ватдекарбоксилаза, и из 1 моля глюкозы у них образуется при-
мерно по 2 моля этанола и двуокиси углерода. Sarcina ventriculi,
строгий анаэроб, способный расти в чрезвычайно кислой среде, и
Erwinia amylovora, факультативная анаэробная энтеробактерия^
сбраживают глюкозу до этанола и СОг по пути Эмбдена — Мейер-
гофа— Парнаса с участием пируватдекарбоксилазы и алкогольде-
гидрогеназы. У этих микроорганизмов, однако, в неболь-
ших количествах образуются и побочные продукты: ацетат и мо-
лекулярный -водород (S. ventriculi) и лактат (Е. amylovora). Во-
обще же 'пируватдекарбоксилаза редко встречается у бактерий.
Многие молочнокислые бактерии, энтеробактерии и клостридии
образуют значительные количества этанола, но у них отсутствует
пируватдекарбоксилаза для синтеза ацетальдегида. У этих микро-
организмов ацетил-СоА функционирует в качестве непосредствен-
ного предшественника ацетальдегида; он восстанавливается в ре-
акции, катализируемой ацетальдегиддегидрогеназой:
ч О
СН8—СО—CoA+NADH2 ХХгенТзТ CH3-CZz <CoA+NAD
гЦС1 СПаоа
н
Изучение спиртового брожения имело неоценимое значение для
развития биологии. В 1892 г. братья Бухнер обнаружили, что
1 Алкогольный напиток из сока агавы.— Прим, перев.
Бактер^иальное брожение ШЗ
экстракт мацерированных дрожжей обладав! способностью сбра-
живать глюкозу до этанола. Так, было показано, что сложный
биологический процесс брожения может происходить-и вне клетки.
В 1905 г. Гарден и Йонг обнаружили важную роль фосфорных
эфиров в метаболизме; они доказали, что гексозобисфосфат
(фруктозо-1,6-бисфосфат) является промежуточным продуктом
брожения сахара. Позже Нойберг, Эмбден, Мейергоф, Парнас и
Варбург исследовали метаболический путь распада глюкозы и
функции коферментов в этом процессе.
II. Молочнокислое брожение
Лактат — широко распространенный конечный продукт бакте-
риальных брожений. У некоторых родов бактерий — обычно их
называют молочнокислыми бактериями — он образуется в больших
количествах. Общей чертой таких микроорганизмов являются вы-
сокая сахаролитическая способность и отсутствие большинства
анаболических путей. Это обусловливает высокую требователь-
ность молочнокислых бактерий к источникам питания, которая
удовлетворяется такими средами обитания, как ткани растений,
молоко и кишечник животных. Большинство молочнокислых бак-
терий способно существовать только за счет брожения, но при этом
они аэротолерантны. Однако некоторые стрептококки могут ис-
пользовать кислород в качестве акцептора водорода и в опреде-
ленных условиях способны даже синтезировать цитохромы.
В табл. 8-3 приведены данные о молочнокислом брожении бак-
терий, относящихся к родам Lactobacillus, Sporolactobacillus, Strep-
tococcus, Leuconostoc, Pedicoccus и Bifidobacterium. Каждый из
трех приведенных ниже метаболических путей используется этими
микроорганизмами для сбраживания углеводов до лактата.
При гомоферментативном брожении образуются 2 моля лактата
на 1 моль глюкозы:
Гомоферментативное
Глюкоза-----;---------► 2 Лактат-
брожение
При гетероферментативном брожении образуется по 1 молю
лактата, этанола и СО2 на 1 моль глюкозы:
Г етероферментативное
Глюкоза --------------► Лактат+Этанол+СО2.
брожение *
При брожении, вызываемом бифидобактериями (бифидоброжениц),
образуются ацетат и лактат в соотношений 3:2
Брожение вызываемое
2 Глюкоза ———— -----------► 3 Ацетат+2 Лактат.
бифидобактериями
Молочнокислое брожение, конечно, протекает не в точном
соответствии с приведенными уравнениями реакций — у гомофер-
13-1806
194
Глава 8
2 Лактпатп
2 NAD —
2 NADH2 -
Рис. 8-2 Образование лактата из глюкозы при гомоферментативном молочно-
кислом брожении. 1 — ферменты пути Эмбдена — Мейергофа — Парнаса; 2 — лак-
татдегидрогеназа.
ментативных бактерий выход молочнокислой кислоты обычно со-
ставляет 1,8 моля на 1 моль глюкозы. У гетероферментативных
бактерий кроме этанола и СОз образуется еще 0,8 моля лактата
и некоторое количество ацетата.
А. Гомоферментативное молочнокислое брожение
Схема гомоферментативного брожения приведена на рис. 8-2.
Из этой схемы очевидно большое сходство гомоферментативного
брожения со спиртовым. Глюкоза распадается до пирувата по .пу-
ти Эмбдена — Мейергофа — Парнаса. Пируват, однако, не декар-
боксилируется до ацетальдегида, как при спиртовом брожении, а
используется непосредственно как акцептор водорода. Выход
АТР в обоих случаях одинаков и составляет 2 моля АТР на 1 моль
глюкозы.
Б. Гетероферментативное молочнокислое брожение
Путь гетероферментативного молочнокислого брожения пока-
зан на рис. 8-3. В этом случае, как и в пентозофосфатном цикле,
рибулозо-5-фосфат образуется из 6-фосфоглюконата. В результате
эпимеризации рибулозо-5-фосфат превращается в ксилулозо-5-
фосфат. Ксилулозо-5-фосфат распадается,на глицеральдегид-З-фос-»
Зтанол
^NAD
*8
nadh2
Ацетальдегид
NAD
I^NADHj
Ацетил-Cx>\
СоА
CH3-CO-OPO3H2
Ацетил-®
\Глюкоза
Н3РО4ч_Г
~Н3 С-СТПФ-Е
II
О
I
ГТПФ-Е
L--NAD
P*-NADH2
6-(р) - глюнонагп
Рибулоза -5-(р)
н2с=с--тпфе
он
>н2о
Н2С СН-ТПФ-Е
I I
он он
о=с н
I
н-с-он
СН2-О-(р)
Глицеральдегид - 3- (?)
СН2ОН
С=О
I
НО С-Н
I
Н-С-ОН
сн2-о-0
Нсилулозо-5- (?)
1’ис. 8-3. Образование СО2, лакгата и этанола из глюкозы при гетерофермента-
1ивном молочнокислом брожении. 1 — гексокиназа; 2 — глюкозо-6-фосфат—де-
. идрогеназа; 3 — 6-фосфоглюконатдегидрогеназа; 4 — рибулозо-5-фосфат—3-эпи-
мсрааа; 5—фосфокетолаза. При расщеплении ксилулйзо-5-фосфата образуется
। лицеральдегид-3-фосфат и связанный с ферментом а, р-дигидроксиэтилтиамин-
ппрофосфат. Этот комплекс через промежуточную стадию образования производ-
ного а-гидроксивинила превращается в комплекс ацетилтиамияпирофосфат — фер-
мент (ТПФ-Е); далее в результате фосфоролитического распада образуется аце-
। плфосфат. 6 — фосфотрансацетилаза; 7 — ацетальдегид — дегидрогеназа; 8 — ал-
когольдегидрогеназа; 9 -—ферменты гомоферментативного брожения,
13*
196........................... Глаза 3 ,
фа! и а дети л фосф ат при участии фосфокетолазы, о которой до сих
пор не упоминалось. Коферментом фосфокетолазы служит тиамин-
пирофосфат, И образование ацетилфосфата легко представить, если
предположить, что в качестве промежуточного продукта образу-
ется комплекс фермента с а-гидроксивинилтиаминпирофосфатом.
Ацетилфосфат превращается в ацетил-СоА в реакции, катали-
зируемой фосфотрансацетилазой. В результате последующего вос-
становления ацетил-СоА ацетальдегид- и алкогольдегидрогеназа-
ми образуется этанол. Глицеральдегид-З-фосфат, образовавшийся
в фосфокетолазной реакции, превращается в лактат, как и при
гомоферментативном брожении.
При гетероферментативном брожении образуются и расходуют-
ся 2NADH2; выход АТР составляет один моль на один моль глю-
козы, т. е. в два раза меньше, чем при гомоферментативном мо-
лочнокислом брожении.
В« Брожение, вызываемое бифидобактериями
В расщеплении глюкозы под действием Bifidobacterium bifidum
участвуют две фосфокетолазы; для одной из них специфичным
субстратом служит фруктозо-6-фосфат, а для другой — ксилулозо-
5-фОсфат. Механизмы этих реакций сходны, фруктозо-6-фосфат—
фосфокетолаза расщепляет фруктозо-6-фосфат на ацетилфосфат и
эрйтрозо-4-фосфат.
н-с-он
сн2-о-р
СН3-СО-ОРО3Н2
+
' н-^=о
н-|-он
н-с-он
СН2-Ю-Р
' Метаболический путь, вызываемый бифидобактериями, показан
на рис. 8-4. Он представляет собой очень интересную последова-
тельность реакций. 2 моля глюкозы превращаются в 3 моля аце-
тата и 2 моля глицеральдегид-3-фосфата без участия реакций
гидрирования' и дегидрирования. Превращение глицеральде-
гйд^З-фосфата в лактат катализируют г лидер альдегид-3-фрсфат—
дегидрогеназа и лактатдегидрогеназа. Образование ацетата из
ацетилфосфата сопряжено с образованием АТР из ADP:
Ацетаткняаза
СНЕ»—С—О—PO3H2+ADP ---------т-*- СНз—СООН+АТР
— .. 1 " *" ""
Бактериальное брожение
2 Лактат
Рис 8-4 Образование ацетата и лактата из глюкозы при брожении, вызываемом
бифидобактериями. 1 — гексокиназа и глюкозо-б-фосфат—изомераза; 2 —г фрукто-
ю 6-фосфат— фосфокетолаза; 3 — трансальдолаза; 4— транскетолаза; 5 — рибо-
ю-5-фосфат—изомераза; 6 — рибулозо-5-фосфат—3-эпнмераза; 7 — ксилулозо-5-
|>осфат—фосфокетолаза; 8 — ацетаткиназа; Р —ферменты гомоферментативного
г рожения.
Эта реакция, катализируемая ацетаткиназой, имеет большое
iкачение для жизнедеятельности всех анаэробов, образующих аце-
тат, поскольку х>на обеспечивает синтез АТР путем субстратного
фосфорилирования. Выход АТР при брожении у бифидобактерий
составляет 2;5 моля АТР на 1 моль глюкозы, что превышает вы*
ход АТР при гомо- и гетероферментативном молочнокислом бро-
жении.
198
Глава 8
Г« Стереоспецифичность лактатдегидрогеназ
В табл. 8-3 показано, что молочнокислые бактерии образуют
D(—)-, L( + )- или DL-формы молочной кислоты. Продуценты
D(—)-формы молочной кислоты могут образовывать только дан*
ный оптический изомер, в то время как продуценты Ь( + )-формы
всегда производят и некоторое количество D(—)-изомера. Боль-
шинство микроорганизмов, образующих смесь D- и L-формы лак-
тата, содержат две лактатдегидрогеназы, которые различаются по
присущей им стереоспецифичности. Однако некоторые бактерии
рода Lactobacillus сначала образуют L( + )-форму молочной кис-
лоты, которая по мере накопления в клетке индуцирует синтез
рацемазы. При участии рацемазы L( + )-форма лактата превраща-
ется в D(—)-форму, пока не наступит равновесие. К небольшой
группе таких молочнокислых бактерий относится L. curvatus.
Таблица 8-3
Гомо- и гетероф ер ментативные молочнокислые бактерии
и конфигурация образующейся молочной кислоты
Гомофермен- Гетерофер- Конфигур ация
Род и вид бактерий тативиое брожение ментативное брожение молочной кислоты
Lactobacillus
L. delbrueckii + — D(-)
L. lactis + — D (—)
L. bulgarlcus + — D(-)
L. easel 4 — L( + )
L. plantarum 4' + DL
L. curvatus h — DL
L. brevis —- + DL
L. fermentum + DL
S porolactobacill us S. inulinus + — D(~)
Streptococcus S. faecalis -L — D (-)
S. cremoris + D(-)
S. lactis -h — D (—)
Leuconostoc L. mesenteroides + D (-)
L. dextranum — D(-)
Pediococcus P. cerevisiae + —
Bifidobacterium B. bifidum —- — (+)
Бактериальное брожение
Для лактатдегидрогеназ стрептококков, Bifidobacterium bifidum
и Л casei, характерна абсолютная и специфическая потребность
н присутствии фруктозо-1,6-бисфосфата и ионов магния. Фруктозо-
1,(>-бисфосфаг выполняет функцию положительного аллостериче-
(кого эффектора. Для лактатдегидрогеназ других Молочнокислых
бактерий эти вещества не нужны.
Д. Брожение других сахаров
Кроме глюкозы молочнокислые бактерии сбраживают большое
количество других сахаров: фруктозу, галактозу, маннозу, саха-
розу, лактозу, мальтозу и пентозы. При сбраживании этих субстра-
юв наблюдаются некоторые отклонения от обычных схем броже-
ния. Например, некоторые гомоферментативные молочнокислые
бактерии (в частности, L. casei) сбраживают пентозы при участии
фосфокетолазы, ключевого фермента гетероферментативного бро-
жения. Leuconostoc mesenteroides сбраживают фруктозу, но часть
•образующегося HADH2 не используется для восстановления аце-
। пл-СоА до этанола; вместо этого фруктоза восстанавливается с
образованием маннитола. Таким образом, при брожении фруктозы
образуются лактат, ацетат, С02 и маннитол.
I . Яблочно-молочнокислое брожение
Уменьшение кислотности вина частично связано с превраще-
нием L-малата в L-лактат. Этот процесс, носящий название яблоч-'
ио молочнокислого брожения, протекает при участии некоторых
молочнокислых бактерий, например L. plantarum, L. casei и Lc.
fiie^enteroides. В присутствии L-малата из сбраживаемого сахара
он Микроорганизмы синтезируют специальный фермент, получив-
ший название малатдегидрогеназы (декарбоксилирующей), или
«яблочного» фермента, который катализирует реакцию превраще-
ния L-малата в L-лактат:
Мп2+ NAD
L-малат---------- L-лактат+С02.
Очищенный фермент не обладает лактатдегидрогеназной ак-
iявностью, поэтому свободный пируват не может быть промежу-
(очным продуктом в данной реакции. По-видимому, в качестве
промежуточных продуктов здесь образуются связанные с фермен-
1ом оксалоадетат и пируват. Образования АТР при яблочно-мо-
||очнокислом брожении не происходит. Следовательно, микроорга-
низмы могут расти только в том случае, если в среде кроме
I -малата присутствует и сбраживаемый сахар.
Глава 8
Ж. Образование ди ацетил а и ацетоина
Streptococcus cremoris и Leuconostoc cremoris помимо обычных
конечных продуктов молочнокислого брожения образуют ацетоин
и диацетил, обусловливающие характерный запах масла. Лучшим
субстратом для образования диацетила этими микроорганизмами
служит цитрат, содержание которого в молоке достигает 1 г/л.
Как показано на рис. 8-5, в реакции, катализируемой цитрат-лиа-
эой, цитрат распадается на ацетат и оксалоацетат. Цитрат-лиаза-г-
Ключевой фермент анаэробного распада цитрата Он имеется у мо-
лочнокислых бактерий, энтеробактерий, представителей Veillonella,
Clostridium sphenoides и Rhodopseudomonas gelatmosa. Однако в
аэробных условиях расщепление цитрата происходит без участия
этого фермента. Интересный механизм распада цитрата в ана-
эробных условиях и его регуляция у gelatinosa обсуждались в
гл. 7, разд. II.
сн2-соон
зно-с-соон
сн2-соон
I 3 СН?-СОО~Н~] I
сн2 -соон
со-соон
| зсо2|
ЗСНз-СО-СООН
Диацетпил
Суммарное уравнение: 3 Цитрагп-^Лантатл J Ацетату ССО^+Дисщетид;
а
Рис. 8-5 Образование диацетила из цитрата молочнокислыми бактериями.
1 — цитрат-лиаза; 2 — окса л о ацетатдекарбокси л а за; 3 — ^охарактеризованный
фермент; 4 — пируйатдегидрогеназный комплекс; 5— лактатдегидрогеназа; б—-
диацетил-синтаза Вместо пируватдегидрогеназы в реакциях могут участвовать
другие ферменты, которые упоминаются в тексте.
Бактериальное брожение ......
Ацетат, образующийся под действием цитрат-лиазы, выделяется
бактериальными клетками во внешнюю среду, а оксалоацетат де-
карбоксилируется с образованием пирувата. В отличие от того,
что наблюдается у бацилл (рис. 6-24) или энтеробактерий
(рис 8-13) при синтезе диацетила, у молочнокислых бактерий не
происходит образования ацетоацетата в качестве промежуточного
продукта, а процесс завершается реакцией ацетил-СоА с «актив-
ным ацетальдегидом» (комплекс фермент—гидроксиэтилтиамин-
пирофосфат). При восстановлении диацетила ацетоин дегидрогена-
зой образуется ацетоин:
Ацетоиндегидрогеназа
СНз—СО—СО—CH3+NADH2 7~ .../
СНз—СН—СО—СН3+NAD
Цитрат служит хорошим субстратом для образования диаце-
тила, так как получение пирувата при этом не сопровождается
синтезом NADH2, и пируват далее может быть использован • не
только для образования лактата, но и в других реакциях. Для
синтеза диацетила необходимо превращение пирувата в С2-соеди-
нения. Более того, у всех гомоферментативных молочнокислых
бактерий пируват расходуется на синтез ацетил-СоА, участвующе-
го в различных биосинтетических процессах. В клетках молочно-
кислых бактерий обнаружены три ферментные системы, катали-
зирующие синтез ацетил-СоА или ацетил фосф ата из пирувата.
Стрептококки содержат пируватдегидрогеназный мультифермент-
пый комплекс. Кроме того, у S. faecalis, Bifidobacterium bifidum
и у некоторых молочнокислых палочек (например, L. casei) была
обнаружена пируват—формиат-лиазная система, которая будет
рассматриваться в разд. IV. Наконец, в клетках L. delbruckii и
L. plantarum происходит реакция дисмутации пирувата в лактат
и ацетилфосфат:
Пируаатоксидаза
Пируват+Л+FAD---------------► Ацетилфосфат+СОг+РАЛНа
Лактат-
FADH2 4-Пируват------* Лактат+FAD
ч оксидаза
Пируватоксидаза представляет собой флавопротеид, содержа*
щий тиаминпирофосфат. Ни липоат, ни кофермент А не участвуют
в образовании ацетилфосфата. Лактатоксидаза также является
флавопротеидом, а перенос водорода от одного флавопротеида к
другому осуществляется при помощи рибофлавина.
3. Выход биомассы
В гл. 3 отмечалось (табл. 3-2), что для биосинтеза 1 г бакте-
риальной клеточной массы из глюкозы и неорганических солей
требуется приблизительно 35 ммолей АТР. Таким образом, на
202
Глава 8
один моль АТР образуется около 30 г бактериальных клеток. Эта
величина не включает энергии АТР, необходимой для поддержи*
ния жизнедеятельности и для работы клетки. Однако если коли*
чество АТР, необходимое для этих процессов, постоянно или ме*
няется незначительно, то оно должно обусловливать прирост од*
ного и того же количества бактериальных клеток независимо от
вида бактерий. Так оно на деле и происходит, что доказали Бочоп
и Элсден. Они установили, что при сбраживании одного моля
глюкозы образуется 22 г биомассы S. faecalis (в питательную сре-
ду были добавлены все мономеры, необходимые для синтеза мак-
ромолекул). Поскольку при гомоферментативном молочнокислом
брожении на каждый моль сбраживаемой глюкозы образуется
2 моля АТР, то на 1 моль израсходованного АТР образуется Иг
биомассы:
Выход биомассы S. faecalis: 22 г/моль глюкозы
Уатр= 11 г/моль АТР
Для Zymomonas mobilis, сбруаживаюгцей глюкозу до этанола
и СОг по пути Энтнера — Дудорова (1 моль АТР на 1 моль глю-
козы; см. след. разд, данной главы), выход биомассы составляет
8,3 г клеточной массы на 1 моль глюкозы.
Выход биомассы Z. mobilis : Ум= 8,3 г/моль глюкозы
Уатр = 8,3 г/моль АТР
Таким образом, у бактерий, получающих вдвое меньше АТР
при сбраживании глюкозы (по сравнению с S. faecalis), образуется
примерно в два раза меньше клеток. Для большинства бактерий,
растущих на среде, содержащей все необходимые для биосинтезов
мономеры, Удтр=Ю,5.
И. Рост на воздухе
Ранее уже упоминалось, что многие молочнокислые бактерии
являются аэротолерантными. Эти микроорганизмы имеют перо-
ксид-дисмутазу, но у них отсутствует истинная каталаза. Вместо
каталазы они содержат пероксидазы — ферменты, катализирую-
щие окисление органических соединений (спиртов, альдегидов)
или окисление NADH2 перекисью водорода (Н2О2):
.T.nLr . тт гл NADHa-пероксидаза
NADH2 + Н2О2 --------------► NAD + 2Н2О.
Однако некоторые молочнокислые бактерии, особенно S. faeca-
lis, L. brevis и L. planlarum, при росте в присутствии гемина син-
тезируют каталазу. Таким образом, эти микроорганизмы просто не
могут сами синтезировать гем-простетическую группу каталазы.
Когда аэротолерантные молочнокислые бактерии растут в при*
сутствии воздуха, выход культуры обычно бывает значительно
больше, чем в анаэробных условиях. Для 5. faecalis значение Ум
Бактериальное брожение
203
возрастает от 22 до 52. Это увеличение отчасти происходит из-за
изменения характера брожения: NADH2 окисляется кислородом;
пируват может превращаться в ацетил-СоА, и в результате реак-
ции, катализируемой ацетаткиназой, может синтезироваться допол-
нительное количество АТР. Таким образом, в присутствии кисло-
рода молочнокислое брожение переходит в уксуснокислое. Имеют-
ся также данные о том, что у S. faecalis в ограниченной степени
может происходить и окислительное фосфорилирование. В присут-
ствии гемина и при доступе воздуха S. faecalis и некоторые другие
стрептококки могут синтезировать цитохромы. Следовательно, оче*
видно, что некоторые молочнокислые бактерии не являются истин*
ными облигатными анаэробами.
III. Маслянокислое и ацетон-бутаноловое брожение
Брожение сахаров с образованием масляной кислоты было от*
крыто Пастером в 1861 г. Вскоре после этого были обнаружены
микроорганизмы, образующие масляную кислоту, и было выясне*
но, что этот тип брожения присущ некоторым видам клостридий.
Как правило, только облигатные анаэробы в качестве основного
продукта брожения образуют бутират; к ним относятся представи*
тели четырех родов Clostridium, Butyrivibrio, Eubacterium и Fuso-
bacterium (табл. 8-4).
Таблица 8-4
Некоторые виды бактерий, образующих в качестве
главного конечного продукта брожения бутират
Clostridium butyricum
С. kluyveri
С. pasteurianum
Butyrivibrio fibrisolvens
Eubacterium limosum (старое название Butyrlbacterium
rettgeri)
Fusobacterium nucleatum
Механизм образования бутирата был мало понятен; пока не
появились работы Баркера и сотрудников, впервые исследовавших
этот вопрос на примере С. kluyveri, и пока у С. pasteurianum не
был обнаружен ферредоксин. Для поглощения сахаров клостридии
используют фосфотрансферазную систему, а расщепление гексозо*
фосфатов до пирувата идет по пути Эмбдена — Мейергофа — Пар*
наса. Превращение пирувата в ацетил-СоА происходит при уча*
стин пируват: ферредоксин — оксидоредуктазы, ферментной систе*
мы, еще не обсуждавшейся нами.
Ж
Глава 8
А. Ферредоксин и пируват: ферредоксин — оксидоредуктаза
Если экстракт клеток С. pasieurtanum инкубируют с пируватом
в анаэробных условиях, наблюдается расщепление пирувата в со-»
ответствии со следующим уравнением реакции:
СН3 - СО - СООА 4- Н3РО4 —ь СН3 - СО - рРО3На + СО2 + На.
Образуется ацетилфосфат и выделяется газообразный водород.
Эта реакция называется фосфорокластической. Тщательное изуче-
ние участвующих в ней ферментов показало, что процесс фосфо-
ролитического распада включает несколько реакций; они сумми-
рованы на рис. 8-6. Сначала пируват декарбоксилируется пируват:
ферредоксин—оксидоредуктазой; оставшийся двууглеродный фраг-
мент ковалентно связывается ферментом, содержащим тиаминпи-
рофосфат (ТПФ), — как и в реакциях, катализируемых декарбо-
ксйлазой и пируватдегидрогеназой. На следующем этапе образу-
емся ацеТил-СоА; в отличие от пируватдегидрогеназной реакции
два атома водорода служат для восстановления ферредоксина, а
не переносятся на NAD. Это отличие существенно, поскольку
ферредоксин Имеет очень низкий окислительно-восстановительный
потенциал; при pH=7,0 он равен стандартному окислительно-вос-
становительному потенциалу водородного электрода:
Водородный электрод ££=*—*0,42 В
Ферредоксин £»-—-(),41 В
NADH24=—0,32 В
Следовательно, даже в среде, насыщенной газообразным водо-
родом, восстановленный ферредоксин способен переносить элект-
роны на гидрогеназу, и при этом может выделяться молекулярный
водород. Такой эффект наблюдается при сбраживании клостридия-
ми углеводов. Более того, реакция, катализируемая пируват: фер-
1 + ТЛФ-Е Т' 1 » ГЭТПФ + [с57|
5 ГЭТЛФ-Е+Ферредокам^СоА ц"1 ,.fc ТПФ-Е + Ацетил- СоА+ ФерреЗопсин Нй
Гидрыеназа
3 Ферр&жам < w" ---------Ферредоксин i |на |
, Фосфотранс- .
4* Ацегпш+ -у-I Аилтилфосфат I ♦ СМ
ацетиляза u 1 1 ' 1
Рас. 8-6. Стадии фосфорокластической реакции. Стадии 1 и 2 осуществляются*
соучастием пируват: ферредоксин—оксидоредуктазы и ферредоксина. ТПФ-Е—-
фермент, содержащий тнаминпирофосфат; ГЭТПФ-Е — фермент, содержащий*
гйдроксиэтилтйамийпирофосфат. Стадии 3 и 4 катализируются гидрогеназой »
фосфотрансацетилазой соответственно.
Б&хте/шадьхое броясвнае
Рис. 8-7. Кластер ферредоксина, содержащий железо и серу, ф— атом железа;
О — атомы серы
редоксин—оксидоредуктазой, обратима, и в соответствующих ус-
ловиях из ацетил-СоА, восстановленного ферредоксина и СО2 мо-
жет синтезироваться пируват (см. С. kluyveri).
NADH2 — более слабый восстановитель, чем восстановленный
ферредоксин. По этой причине реакция, катализируемая пируват-
дегидрогеназой, необратима.
Ферредоксин был обнаружен в клетках С. pasteurianum Мор-
тенсоном, Валентайном и Карнаханом в 1962 г. Он относится к
железосеропротеидам, которые до последнего времени называли
белками, содержащими негемовое железо Напомним, что белки
этого класса играют важную роль и в дыхательной цепи (рис 2-6
и 2-10). Ферредоксины клостридий имеют мол. массу 6000; моле-
кула ферредоксина содержит восемь атомов железа, которые при
взаимодействии с серой образуют две кубические структуры —
кластеры. Одна из таких структур показана на рис. 8-7. Атомы
железа связаны с цистеиновыми остатками пептидной цепи и со-
единены между собой сульфидными мостиками. Таким образом,
ферредоксин содержит восемь сульфидных групп; при подкислении
раствора ферредоксина они освобождаются в виде H2S. Поэтому
сера, входящая в состав ферредоксина, называется лабильной
серой. Ферредоксины клостридий — переносчики двух электронов
(каждый кластер служит переносчиком одного электрона). Ферре-
доксины окрашены в коричневатый цвет, поэтому их легко обна?
ружить в клеточных экстрактах и при фракционировании этих
экстрактов.
Следует подчеркнуть, что ферредоксины разных микроорганиз-
мов могут различаться по своему строению. Варианты строения
ферредоксинов различных видов бактерий видны из табл. 8-5.
У большинства клостридий и фототрофных бактерий (Chromatlum)
в состав ферредоксинов входят два железосерных кластера. Мо-
лекула ферредоксина у сульф атр еду пирующих бактерий содержит
206
Глава 8
Таблица 8-5
Свойства различных ферредоксинов
Организм Мол. масса Атомы железа/мо- лекула Атомы лабиль- ной серы/мо- лекула Е'О (В)
Clostridium pasteurianum 6000 8 8 —0,41
Qhromatium штамм D 10 000 8 8 —0,49
Desulfovibrio desulfurl- cans 6000 4 4 —0,33
Шпинат И 000 2 2 —0,42
только один кластер на молекулу, а у растений — один кластер с
двумя атомами железа и двумя сульфидными мостиками. Однако,
независимо от строения, все ферредоксины относятся к перенос-
чикам электронов с низким окислительно-восстановительным по-
тенциалом.
Известен еще один белок, флаводоксин, также имеющий низкий
окислительно-восстановительный потенциал, но отличающийся от
ферредоксина в другом отношении. Он синтезируется некоторыми
облигатными анаэробами при росте на среде с недостатком желе-
за. У флаводоксина отсутствуют железо и лабильная сера, а в
окислительно-восстановительных реакциях участвует флавинмоно-
нуклеотид. Окисительно-восстановительный потенциал флаводок-
сина равен примерно —0,4 В. Наконец, у многих анаэробов встре-
чается рубредоксин. Каждый окислительно-восстановительный
центр этого переносчика электронов содержит один атом железа,
который связан с четырьмя цистеиновыми остатками полипептид-
ной цепи. Таким образом, рубредоксин не содержит лабильного
сульфида. Его окислительно-восстановительный потенциал состав-
ляет примерно —0,06 В. Функция рубредоксина у анаэробов не-
известна; у некоторых аэробов он участвует в окислении алканов
(см. рис. 6-11).
Б. Путь образования бутирата
На рис. 8-8 приведена последовательность реакций образования
бутирата из глюкозы. В результате превращения глюкозы по пути
Эмбдена — Мейергофа — Парнаса и при участии реакции, катали-
зируемой пируват: ферредоксин—оксидоредуктазой, образуются
две молекулы ацетил-СоА, две молекулы COs и две молекулы вос-
становленного ферредоксина, которые под действием гидрогеназы
вновь переводятся в окисленную форму с выделением водорода.
Кроме того, восстанавливаются две молекулы NAD и образуются
две молекулы АТР. Преимущество выделения газообразного водо-
рода при распаде пирувата очевидно, поскольку при расщейлении
Бактериальное брожение
20?
I CHj-CJh-CHz cootf]
р, Бутират
СоА Дцепшл-Сок
Ацетил -Р
Лиетат
(АВР)к
10 (АТР
СН3 -СН2 -СН2 - СО - Со А
Бутирил -СоА
NAD^.1
NADHj-^l
СН3-СН=СН-СО-СоА
Кротонил- СоА
*°Ч
СПз СН СНг-СО-СоА
ОН
L {У)-$~гидроксибутип- СоА
t_____________
^~] 2 СНз -СО-СООН
н 2 Fd I 2 С°2--1
*3 -2
п .— 2 СоА
2 Fd Н2 г
2CHj—СО—СоА
4
ч'А-( оА
СН3-СО-СН2-СО-СоД
Дцетоацетил-Г. о А
8
NAD NADHj
Суммарное уравнение; Глюкоза. + 3 ADP + 3 Pj—^Бутират + 2 СО2 + 2 Н2 + 3 АТР
Рис. 8-8, Образование бутирата из глюкозы. 1 — фосфотрансферазная система и
путь Эмбдена — Мейергофа — Парнаса; 2 — пируват : ферредоксин—оксидоредук-
таза* 3 — гидрогеназа; 4— ацетил-СоА—трансфераза (тиолаза); 5—L(4-)-fJ-
гидроксибутирил-СоА-дегидрогеназа; 6 — L-3-гидроксиацил-СоА—гидролаза (кро-
тоназа); 7 — бутирил-СоА—дегидрогеназа; 8 — СоА-трансфераза; 9 — фосфо-
трансацетилаза; 10 — ацетаткиназа.
глюкозы до ацетил-СоА образуются только две молекулы NADH2.
NADH2, образующийся в реакции, катализируемой глицераль-
дегид-3-фосфат—дегидрогеназой, окисляется при превращении
двух молекул ацетил-СоА в бутират. При этом в качестве проме-
жуточных продуктов образуются ацетоацетил-СоА, Ь( + )-р-гидр-
оксибутирил-СоА и кротонил-СоА. Следует иметь в виду, что
накапливающаяся поли-р-гидроксимасляная кислота представляет
собой полимер D(—)-формы (см. рис. 5-15) и что тиоэфир D(—)-
энантиомера является промежуточным продуктом при синтезе
жирных кислот с длинной углеродной цепью.
Бутират образуется из бутирил-СоА не путем простого гидро-
лиза; это было бы связано с потерей энергии. Вместо этого тио-
эфирная связь разрывается и СоА переносится на ацетат; обра-
зующийся ацетил-СоА может быть использован для синтеза АТР
или анаболических превращений:
СоА-трансфераза
Бутирил-СоА+Ацетат <—— -----Ацетил-СоА+Бутират.
Глава 8
СоА-трансферазные реакции имеют чрезвычайно важное зна-
чение для процесса брожения.
На рис. 8-8 показано; что выход АТР при маслянокислом бро-
жении составляет 3 моля АТР на 1 моль глюкозы; это превышает
выход АТР для всех рассматриваемых до сих пор процессов бро-
жения.
3. Образование ацетона и бутанола
Динамику образования различных продуктов во время роста
С. aceiobutylicum иллюстрирует рис. 8-9. Когда процесс брожения
прошел наполовину и pH среды снизился до 4,5, образуются новые
продукты: ацетон и бутанол. Их образование совпадает с умень-
шением концентрации бутирата. По-видимому, в это время процесс
брожения сдвигается в сторону образования нейтральных соедине-
ний, что предотвращает дальнейшее ^снижение значения pH. Об
этом свидетельствует и следующее наблюдение: образование аце-
тона и бутанола сильно уменьшается, если pH среды поддержи-
вать на уровне, превышающем 5,0.
Реакции образования ацетона и бутанола - суммированы на
рис. 8-10. При низких значениях pH увеличивается активность фер-
ментов, катализирующих частичное превращение ацетоацетил-СоА
в ацетон. Таким образом, для регенерации NAD остается меньшее
количество ацетоацетил-СоА и в процесс включается бутирил-СоА,
который восстанавливается до бутанола. Дополнительные коли-
чества бутанола образуются из бутирата, поступающего вновь из
среды и превращающегося в бутирил-СоА под действием СоА-
трансферазы. Водород, выделяющийся на первых этапах превра-
Рис. 8-9. Образование продуктов брожения глюкозы, вызываемого С. acetob ut у &
cum. [Davies R., Stephenson М., Biochem. I., 35, 1320—1331 (1941).]
Бактериальное брожение
2 Глюкоза]
+4
4 NAD-^ ^(Гатр) 1
4 NADH2"*'/ 1— 1 4 Н2 +4СО2‘] — - т
1 СНз-СО-СН2-СО-СоА АцетоаЦетил-С о А т СН3-СО-СН2-СО-СоА Ацетоацепшл-ОоК
2NAD-< 4
СНз-СН2-СН2-СО-СоА
Бутирил -Со А
СНз-СН2-СН2-СНО
Бутиральдегид
^-Ацетат
^Д/ели-СоА.
СН3СО-СН2-СООН
Ацетоацетат
з .____.
^{со2-|
СН3-СО-СН3
Ацетон
КАВНг-^
NAD-*"7
б
|сн3-сн2-сн2-сн2он |
Бутанол
Суммарное _ Л п
уравнение'- 2 ГЛюноза + 4 ADP + 4 Pj--*
Бутанол+Ацелюн± 4 Н2 + 5 СО2 + 4 АТР
(Образование ацетил-СоА ни стадии 2 не учитывается)
Рис. 8-10. Образование ацетона и бутанола у С. acetobutylicum. 1 — реакции,
аналогичные приведенным на рис. 8-8; 2 — СоА-трансфераза (присутствие этого
фермента у С. acetobutylicum точно не установлено, но у других клостридий он
обнаружен); 3 — ацетоацетатдекарбоксилаза; 4 — L -гид рокси бутирил-
СоА—дегидрогеназа, кротоназа и бутирил-СоА—дегидрогеназа; 5 — бутирилаль-
дегид—дегидрогеназа; 6 — бутанолдегидрогеназа.
щения глюкозы, идет на образование NADHs, используемого при
восстановлении бутанола.
Кроме С. acetobutylicum ряд других клостридий также обра-
зуют бутанол и ацетон. Некоторые из них, в частности С. butyli-
сит, восстанавливают ацетон до изопропанола.
Г* Баланс брожения
_ Табл. 8-6 иллюстрирует баланс брожения у С. butyricum,
С, perfringens и С. acetobutylicum. Видно, что экспериментальные
данные не полностью соответствуют схемам брожения, приведен*
14-1896
210
Глава 8
Таблица 8-6
Баланс брожения у клостридиев’)
С. butyricutn С. perfringens С. acetobutylicum
Продукты брожения -------------------------------------------------------------—
(моль продукта/100 моль сбраживаемой глюкозы)
Бутират 76 34 4
Ацетат 42 60 14
Лактат 33 —
СО3 188 176 221
н2 235 214 135
Этанол — 26 7
Бутанол — 56
Ацетон ж* — 22
’> Wood W. A. In: The Bacteria, I. C. Gunsalus and Stanier R. Y.
(eds). Academic Press, New York and London, 1961, vol. 2, pp. 59—
149.
ным на рис. 8-8 и рис. 8-10. С. butyricum образует ацетат и неко-
торое количество молекулярного водорода; С. per f г ingens обра-
зует лактат и этанол, как и многие сахаролитические клостридии.
При брожении, вызываемом С. acetobutylicum, количество выделяе-
Таблица 8-7
Баланс углерода, О/В баланс и баланс водорода
при ацетонбутаноловом брожении1)
Субстрат и продукты Моль/100 молен субстрата Моль углерода О/В баланс Баланс водорода
О/В О/В (Моль/100 молей) Н Н (моль/100 молей)
Глюкоза 100 600 0 24 2400
Бутират 4 16 —2 —8 20 80
Ацетат 14 28 0 - 8 112
СО2 221 221 ~+2 +442 0
Н2 135 —1 -135 2 270
Этанол 7 14 —2 — 14 12 84
Бутанол 56 224 —4 —224 24 1344
Ацетон 22 66 —2 —44 16 352
Итого 569 —425 +442 2242
о Баланс углерода: (569/600) XI00= 94,8 %; О/В баланс: 442/425=1,04; ба-
ланс участвующих в реакциях атомов Н: 2400/2242=1,07. Две последние вели-
чины различаются, поскольку выход углерода влияет на баланс участвующих
в реакциях атомов Н, но не влияет на О/В баланс (OZB для глюкозы=0).
Бактериальное брожение
211
мого Н2 меньше, так как бутират используется для синтеза бута-
нола.
При сложных процессах, таких, как брожение при участии
С. acetobutylicum, трудно определить, сохраняется ли постоянным
баланс водорода. Поэтому окислительно-восстановительный (О/В)
баланс сложных процессов брожения определяют, как показано в
табл. 8-7. Величина О/В формальдегида и его производных про-
извольно была принята за нуль. Для каждых 2Н в избытке отно-
шение О/В считается равным —1, при недостатке 2Н О/В равня-
ется + 1. Формула этанола — С2Н6О; в результате присоединения
молекулы Н2О образуется соединение с общей формулой С2Н8О2.
По сравнению с С2Н4О2 С2Н8О2 имеется в избытке 4Н (О/В= —2).
Из СО2 вычтем воду; в полученном С(—2Н)О имеется недостаток
четырех атомов водорода по сравнению с СН2О (О/В= +2).
С другой стороны, такие подсчеты можно проводить, исходя
из числа участвующих в реакции атомов водорода субстрата и
продуктов. Это число определяют путем окисления данного соеди-
нения до СО2 при реакции с водой (CGHi2O6+6H2O->24H + 6CO2;
С3Н6О + 5Н2О->16 Н + ЗСО2).
Д. Не все сахаролитические клостридии
образуют бутират
Метаболизм клостридий обычно тесно связывают с масляно-
кислым брожением; поэтому важно подчеркнуть, что некоторые
сахаролитические клостридии вообще не образуют бутирата. На-
пример, С, sphenoides сбраживает глюкозу до этанола, ацетата,
СО2 и водорода. Кроме того, некоторые виды клостридий (С. ther-
moaceticum и С. formicoaceticum) сбраживают гексозу, образуя
примерно до трех молей ацетата на один моль используемого суб-
страта. Особенности этих микроорганизмов будут рассматриваться
вместе с метанобразующими бактериями.
Е. Этанол-ацетатное брожение
у Clostridium kluyveri
Очень интересное брожение вызывает С. kluyveri. Эта бактерия
образует бутират, капроат и водород из этанола и ацетата. Один
этанол не сбраживается, а ацетат может быть заменен пропиона-
том. Соотношение образующихся бутирата и капроата может ме-
няться; увеличение концентрации этанола в среде благоприятствует
образованию капроата. Типичное уравнение такого брожения име-
ет следующий вид:
бЭтанол-рЭАцетат—>ЗБутират+1 Капроат-}-2Н2+4 Н2О+Н+.
При брожении выделяется примерно 0,3 моля молекулярного
водорода на каждый моль использованного этанола.
14*
212
Глава 8
f"‘
NADH^
(t + Ацетальдегид
3^NADP
S^NADPH2
(l + g) Ацетил-СоА
Ацетил-СоА
(~) ацетат
JO
(^ацетил-®
Бутират^
8
Ацетоацетрп- СоА
\/МЮРЪ
иС+)-/3-гидрокса»
бутирил-СоА
Бдтирии-СоА
у^*н2о
Kp отопил- СоА
NAD
NADH2
Суммарное а
уравнение: ({+*•) Этанол )Ацетат*-%АОР *%Pi
Бутират* a Н2 + Л ГР
а составляет примерно 0,4
Рис. 8-11. Этанол-ацетатное брожение, вызываемое С. kluyveri. 1'—алкогольде»
гидрогеназа; 2 — ацетальдегид—дегидрогеназа; 3 — ферментная система выделе»
ния Hr; 4 — тиолаза; 5 — Ь( + )-р-гидроксибутирил-СоА—дегидрогеназа (NADP-
спецнфическая); 6 — кротоназа; 7 — бутирил-СоА — дегидрогеназа} 8 — СоА—
—-трансфераза; 9 — фссфотрансацетилаза; 10 — ацетаткиназа.
Трудно понять, каким образом С. kluyveri получает АТР, необ-
ходимый для роста. Деккер с сотрудниками установили принци*
пиальный механизм процесса. Они показали, что на один моль
выделяющегося водорода не требуется в качестве Н-акцептора
0,5 моля ацетил-СоА. Этот ацетил-СоА Используется для синтеза
АТР. Стадии данного процесса изображены на рис. 8-11. Для
простоты на схеме рассматривается только образование бутирата
и Нг- Реакции образования капроата протекают аналогичным
образом (бутирил-СоА конденсируется с ацетил-СоА, 3-оксокапро»
mi-СоА восстанавливается, от него отщепляется молекула воды,
и он снова восстанавливается с образованием капроил-СоА).
Бактериальное брожение 2t>
Алкоголь- и ацетальдегиддегидрогеназы ассоциированы Друг с
другом и при этом связаны с субклеточными частицами. Первый
фермент является NAD-специфическим, для второго коферментом
служит NAD и (или) NADP. Механизм выделения водорода в
результате реакций, протекающих с участием этих ферментов, до»
конца не установлен. По-видимому, электроны переносятся с
NADH2 на гидрогеназу при помощи ферредоксина. Показано, что»
NADH2: ферредоксин — редуктаза, активная в присутствии ацетил-
СоА, содержится в клеточных экстрактах С, kluyveri. L(H-)-p-
гидроксибутирил-СоА—дегидрогеназа является уникальным фер-
ментом для микроорганизмов, образующих бутират, поскольку ко-
ферментом для него служит NADP. Существование этого фермента
указывает на тесную связь между процессами окисления ацеталь-
дегида и восстановления ацетоацетил-СоА.
Как показано на рис. 8-11, величина «а» составляет примерно*
0,4, что означает выделение приблизительно 0,4 моля Н2 на 1,2 мо-
ля использованного этанола. Из образовавшегося 1,2 моля ацетил-
СоА 1 моль требуется для окисления NADH2 и NADPH2 в бути-
ратном цикле; 0,2 моля идет на синтез АТР. Таким образом, вы-
ход АТР составляет 0,2/1,2 или 1 моль АТР на 6 молей этанола.
Ж. Особенности биосинтетического метаболизма
Clostridium kluyveri
Хотя С. kluyveri растет на средах, содержащих Сг-соединения,
у этого микроорганизма отсутствует глиоксилатный цикл для син-
теза С4-дикарбоновых кислот. Вместо глиоксилатного цикла ис-
пользуется обратимость реакции, катализируемой пируват: ферре-
доксин—оксидоредуктазой. Наличие восстановителя при этанол-
ацетатном брожении делает возможным восстановительное карбо-
ксилирование ацетил-СоА:
СНзСО—SCoA+CO2+Fd-H2^CH3-CO—COOH+HSCoA+Fd.
Пируват идет на образование аланина или карбоксилируется
при участии пируваткарбоксилазы с образованием оксалоацетата.
Реакции карбоксилирования играют важную роль в биосинтетиче-
ских процессах у С. kluyveri, поскольку для роста этого микроор-
ганизма необходима СО2Г Окбло 30% клеточных веществ этого
микроорганизма образуется из СОа. В соответствии с приведенны-
ми выше реакциями карбоксильная группа аланина и обе карбо-
ксильные группы аспартата образуются количественно из СО2. По-
скольку в клетках С. kluyveri содержится также пируват — форми-
ат-лиаза,'карбоксильная группа пирувата служит предшественни-
ком и для образования формиата, который используется в качестве
исходного материала для биосинтеза Срсоедииений.
Интересно, что у С. kluyveri, как и у многих других облигатных,
анаэробов, синтез глутамата происходит при участии ферментов
1214
Глава 8
Ноос-н2с,
Цитрат (si)
bJ_ _ НГ“ * I синтаза
С=0 + СНз СО-СоА ------------1
соон ------------
НООС н
НООС-lbC. ,°1—--------6 ' С.
•с- |сн,-гоон| — с -------
СООН НООС I СН2-СООН
ь L.J—.—?...
Цитрат (ге)*
синтаза s
HOOC-H2CZ/ J снг соон~]
С-ОН
соон
| НООС-Н;С |
1 С СНг-СООН
соон
а
Рис 8-12 Образование цитрата в реакциях, катализируемых цитр ат-(si) -синта-
зой и цитрат-(ге)-синтазой. Следует обратить внимание на то, что карбоксильный
остаток ацетил-СоА занимает различные положения а — молекула повернута на
120°; б — при стереоспецифическом удалении молекулы воды цис-аконитазой
четко видно различие в положении карбоксиметильных групп радиоактивного
цитрата. При использовании 14С-ацетил-СоА образуются соответственно 4,5-14С-
Ч«с-аконитат и 1,2-14С-цис-аконитат.
цикла трикарбоновых кислот, цитрат—синтазы, аконитазы, изо-
цитратдегидрогеназы и глутаматдегидрогеназы. Это обстоятельство
подчеркивает существование двойной функции трикарбоновых
кислот в образовании NADH2 как компонента полного цикла
(у аэробов) и образования а-оксоглутарата (у аэробов и ана-
эробов) .
Цитрат-синтаза С. kluyveri и ряда других анаэробов (С. acidi-
urici, С cylindrosporum, некоторые сульфатредуцирующие бакте-
рии) в двух отношениях отличается от всех других цитрат-синтаз.
Для работы этого фермента необходимы ионы Мп2+, в то время
как для цитрат-синтаз других микроорганизмов вообще не требу-
ется ионов металла. Более того, этот фермент отличается и по
стереоспецифичности (рис 8-12). Таким образом, очень небольшая
группа анаэробных бактерий содержит специальный фермент, цит-
рат (га)-синтазу. Как установлено, все другие микроорганизмы
содержат цитрат-синтазу st-типа.
IV. Смешанное и бутандиоловое брожение
Этот вид брожения характерен для энтеробактерий. Микроор-
ганизмы, принадлежащие к родам Escherichia, Salmonella и Shi-
gella, сбраживают сахара до молочной, уксусной, янтарной и му-
равьиной кислот. Кроме кислот образуются также С02, Н2 и эта-
нол. Бактерии, относящиеся к родам Enterobacter, Serratia и
Erwinia, продуцируют меньше кислот, но больше С02, этанола и,
кроме того, большие количества 2,3-бутандиола. Баланс двух
Типичных процессов брожения приведен в табл. 8-8, а пути обра-
зования продуктов брожения — на рис. 8-13.
У энтеробактерий расщепление гексозы идет по пути Эмбде-
на— Мейергофа — Парнаса. На уровне фосфоенолпирувата про-
исходит ответвление пути образования сукцината; все остальные
Бактериальное брожение
21S
Таблица 8-8
Продукты, образующиеся при смешанном и бутандиоловом
брожении1)
Продукт Количество продукта, моль/100 моль сбраживаемой глюкозы
Escherichia coli Enterobacier aerogenes
Формиат 2,4 17,0
Ацетат 36,5 0,5
Лактат 79,5 2,9
Сукцинат 10,7 —
Этанол 49,8 69,5
2,3-бутандиол 0,3 66,4
СОз 88,0 172,0
Водород (Н2) 75,0 35,4
о Wood W. A. In: The Bacteria. I C. Gunsalus and R. Y. Stanier
(eds ), Academic Press- New York and London, 1961, vol. 2, pp. 59—
149.
конечные продукты образуются из пирувата. Пируват метаболизи-
руется при участии трех ферментных систем, и количество обра-
зующихся продуктов брожения сильно зависит от активности этих
ферментных систем. При смешанном брожении участие лактатде-
гидрогеназы обеспечивает образование большого количества лак-
тата. При бутандиоловом брожении образуется только небольшое
количество лактата. Специального внимания заслуживают две
другие ферментные системы: пируват—формиат-лиазная и а-аце-
толактат—синтазная.
А. Пируват—формиат-лиаза
Энтеробактерии способны синтезировать две ферментные систе-
мы для превращения пирувата в ацетил-СоА. Пируватдегидроге-
назный мультиферментный комплекс' функционирует в аэробных
условиях. В анаэробных условиях он не синтезируется, а остав-
шиеся ферменты ингибируются NADH2. Вместо пируватдегидро-
геназы в анаэробных условиях индуцируется синтез пируват—фор-
миат-лиазы. Реакция, катализируемая этим ферментом, протекает
в два этапа с образованием промежуточного комплекса ацетил-
фермент, а также формиата и ацетил-СоА в качестве продуктов-
реакции:
СН3—СО—СООН+Фермент-^СНз—СО-фермент+НСООН,
СНз—СО-фермент+СоА—5Н^Фермент+СН3— СО—S— СоА.
•216
Глава 8
Пируват—формиат-лиаза на воздухе необратимо и быстро ин-
активируется, поэтому данный фермент участвует только в бро-
дкении энтеробактерий. По-видимому, даже в анаэробных условиях
«активный фермент не очень стабилен; при низких концентрациях
пирувата он превращается в неактивную форму, но активность
которой сноба может быть восстановлена/ Для реактивации фер-
мента необходимо присутствие четырех соединений: восстановлен-
ного флаводоксина, активирующего фермента (фермента II), S-
адейозилметионина и пирувата. Пируват не расходуется при акти-
вации фермента, он действует в качестве положительного эффек-
тора.
Пируват—формиат-лиаза
(неактивная)
Пируват—формиат-лиаза
(активная)
Восстановленный флаводоксин Флаводоксин
(пируват)
4- +
S-аденозилметионин Метионин+5'-дезоксиаденознн
При восстановлении S-аденозилметионина в процессе активации
-пируват—формйат-лиазы он разрушается. Каким образом и где
модифицируется пируват—формиат-лиаза, неизвестно.
Преимущество использования пируват—формиат-лиазы по
сравнению с пируватдегидрогеназным комплексом при брожении
очевидно: в реакции, катализируемой пируват—формиат-лиазой,
образование ацетил-СоА не сопровождается восстановлением
NAD.
Б. а-Ацетолактат-синтаза
Третья ферментная система, участвующая в метаболизме пи-
рувата — ц-ацетолактат-синтаза. Этот ’фермент также участвует
в образований42,3-бутандиола бациллами (рис. 6-24). Коферментом
«-ацетолактат-синтазы служит тиаминпирофосфат. Сначала пиру-
ват образует с ферментом комплекс — фермент—гидроксиэтилтиа-
минпирофосфат, при этом отщепляется молекула СОг- Затем ак-
Рис. 8-13. Смешанное (А) и бутандиоловое (Б) брожение. 1— ферменты путж
ЭмбДена — Мейергофа — Парнаса; 2 — лактатдегидрогеназа; 3 — пируват—фор-
миат-лиаза; 4— формиат—водород-лиаза; 5 — ацетальдегид—дегидрогеназа; б —
алкогольдегидрогеназа; 7 — фосфотрансацетнлаза; 8 — ацетаткиназа; 9— фосфо-
«нолпируват-карбокснлаза; 10— малатдегидрогеназа, фумараза и фумаратредуж-
тгаза; 11 — а-ацетолактат-синтаза; 12 — а-ацетолактат-декарбоксил аза; Z3 — 2,3*
бутандиолдегндрогеназа.
Лтю«оадг|
>(Н)
>-ADP
г——...... «. i л (Н) л СОг ’ '** АТР
I Сугщанату ^^-г—О^салоацегат -о-™./—ФЕП
ДцетпатЗегид
^Ацетал^
\Глюлоза
S^(H)
„z-ADP
I Лактат | .ц / t
(Н)
Ацогнап^ЭегиЭ -ч—А
б/(Н)
(Н)
Пируват
3
Этанол
3
лАцгнктаюпат
218
Глава 8
тивный ацетальдегид переносится на вторую молекулу пирувата:
СНз—СО-СООН+ (Н) ТПФ—Е-^СНз~СН—ТПФ—Е+СО2
ОН
СНз-СН—ТПФ-Е
ОН
+
СНз-СО-СООН
СНз—со
| +(Н)ТПФ—Е
СНз—С—СООН
I
ОН
а-Ацетолактат-синтаза синтезируется и проявляет свою актив-
ность в слабокислой среде, поэтому она относится к рНб-фермен-
там. Таким образом, у Enterobacter aerogenes снижение pH среды
приводит к повышенному образованию 2,3-бутандиола. Соответст-
венно из пирувата образуется меньше кислот.
pH 6-фермент отличается от анаболической а-ацетолактат-син-
тазы, которая участвует в синтезе валина. Этот фермент проявляет
наибольшую активность при pH 8,0 (pH 8-фермент) и ингибиру-
ется по типу обратной связи L-валином.
В. Формиат—водород-лиаза
Виды бактерий, относящиеся к родам Shigella и Erwinia, не
содержат формиат—водород-лиазы (формиат—гидроген-лиазы).
Они образуют значительные количества формиата. Escherichia coli
и Enterobacter aerogenes при росте в анаэробных условиях на сре-
де, включающей сахара, содержат этот ферментный комплекс;
поэтому большая часть формиата расщепляется до СО2 и Н2.
Формиат—водород-лиаза состоит из нескольких компонентов.
Как видно из рис. 8-14, А, формиат окисляется до СО2 под дей-
ствием формиатдегидрогеназы. При участии переносчиков Xi и Х2
электроны передаются на гидрогеназу, катализирующую вы-
деление Н2.
{Формиат-водород лиазный комплекс^
Гидро-
геназа
\Нигпратредунтазный комплекс^
Рис 8-14. Компоненты формиат-водород-лиазного комплекса (Д) и нитратредук-
тазного комплекса (Б) у Е. coll. Xj и Х2— переносчики электронов неизвестной
структуры.
Бактериальное брожение
21W
Природа переносчиков Xi и Хг не известна; ни один из них не
относится к цитохромам. Формиат—водород-лиаза у энтеробакте-
рий представляет собой связанный с мембраной мультифермент-
ный комплекс. Особенно интересно то обстоятельство, что для
образования активной формиатдегидрогеназы требуются селенит и
молибдат. Se и Мо входят в состав фермента.
Формиат—водород-лиазный комплекс индуцируется формиатом;
его синтез подавляется кислородом, а в анаэробных условиях так-
же и нитратами. В анаэробных условиях при диссимиляционном
восстановлении нитратов до нитритов (нитрат/нитритное дыхание,
см. гл. 5, раздел VI) формиат служит донором электронбв. Как
показано на рис. 8-14, Б, за транспорт электронов от формиата к
нитрату отвечает мультиферментный комплекс, отличающийся от
формиат—водород-лиазного. В его состав входит формиатдегидро-
геназа, которая также содержит Se и Мо, но по кинетическим
свойствам отличается от соответствующего фермента водород-ли-
азного комплекса. Кроме того, в состав комплекса входят два
белка-переносчика с 'Цитохромом ^555 в качестве простатической
группы, кофермент Q и нитратредуктаза, которая также является
Мо-белком.
Г. Выход АТР
Выход АТР в смешанном и бутандиоловом брожении составля-
ет 2—2,5 моля АТР на 1 моль глюкозы. Кроме 2 молей АТР, об-
разующихся в метаболическом пути Эмбдена — Мейергофа — Пар-
наса, еще некоторое количество АТР синтезируется при образова-
нии ацетата, катализируемом ацетаткиназой.
V. Пропионовокислое и янтарнокислое брожение
Пропионат является главным продуктом брожения, вызывае-
мого различными анаэробными бактериями. Многие анаэробы
сбраживают глюкозу с образованием пропионата, ацетата и СО2:
1,5 Глюкоза—>2 Пропионат+Ацетат+СО2.
Предпочтительным субстратом для пропионовокислых бакте-
рий служит лактат, так что эти микроорганизмы могут расти, ис-
пользуя главный продукт молочнокислого брожения:
3 Лактат—>2 Пропионат+Ацетат+СО2.
Существуют два метаболических пути образования пропионата;
в акрилатном пути лактат постепенно восстанавливается до про-
пионата, в сукцинат-пропионатном пути лактат превращается в
пропионат через стадии образования пирувата и сукцината.
=220
Глава 8
Рис 8-15. Образование пропионата, ацетата и СО2 из Dfc-лактата при брожении,
вызываемом Megasphaera elsdenii и Clostridium propionicum. 1 — лактатрацема-
за; 2 —СоА-трансфераза; 3 — не изученная реакция; 4 — дегидрогеназа, исполь-
зующая в качестве Н-донора восстановленный электронпереносящий флавопро-
теид (ЭПФ- Hz), 5 — D-лактатдегидрогеназа; 6 -г- пируват : ферредоксин—оксидо-
редуктаза; 7 — трансгидрогеназа; 8 — фосфотрансацетилаза + ацетаткиназа.
А. Акрилатный путь
Этот метаболический путь присущ, по-видимому, только не-
скольким микроорганизмам, например Clostridium propionicum и
Megasphaera (Peptostreptococcus) elsdenii. Как показано на
рис. 8-15, субстратами для данного метаболического пути могут
служить L-, D- или LD-лактат. В клетках указанных бактерий
присутствует рацемаза, катализирующая взаимопревращения сте-
реоизомеров. L-лактат превращается в L-лактил-СоА в реакции,
катализируемой СоА-трансферазой. В результате пока еще не
изученных детально реакций образуется акрилил-СоА Он восста-
навливается до иропионил-СоА, и при участии упоминавшейся
выше СоА-трансферазы образуется пропионат.
Донором протонов при восстановлении акрнлил-СоА служит
восстановленный переносчик электронов — флавопротеид. Он об-
разуется из D-лактата и восстановленного ферредоксина или фла*
Бактериальное брожение
водоксина. Выход АТР при этом виде брожения составляет 1 моль
на 3 моля лактата.
С. propionicum сбраживает также аланин и акрилат до пропио-
ната.
Б. Сукцинат-пропионатный путь
Этот метаболический путь имеется у большинства микроорга-
низмов, образующих пропионат. Сукцинат в данном случае играет
роль промежуточного продукта, но может синтезироваться также
в качестве конечного продукта в малых или больших количествах»
С другой стороны, бактерии, использующие акрилатный путь, не
образуют сколько-нибудь значительных количеств сукцината.
Расшифровка сукцинат-пропионатного метаболического пути
была довольно сложной задачей. Как показано на рис. 8-16, в этом
[сн3-снх-соон| |сн3-снон-соон|
CHj-CHi-CO-CoA
2
CHj —-------— Биатин*+
HOOC-C-CO-CoA(S)
А 1
Н 8
HOOC-C-CO-CoA(R)
СН3|
Ъ\1~фермент
S*-2H
1'
СН3-СО-СООН
НООС-СН; -со-соон
^NADHj
>*-NAD
HpOC-CHz-CHj-CO-CoA НООС-СН2-СНОП-COOH
Суммарное
уравнение: Лают(спп+ NADHj + ADP f Р[
-и----^Лропиананг + NAD + АТР
Рис 8-16 Сбраживание лактата в сукцинат-пропионатном метаболическом пути
пропионовокислыми бактериями 1 — лактатдегидрогеназа (Н-акцептором, по-ви-
димому, является флавопротеид) ; 2—(5)-метилмалонил-СоА: пируват—транс-
карбоксилаза; 3—малатдегидрогеназа; 4 — фумараза; 5—фумаратредуктаза;
б — СоА-траисфераза; 7 — (R) -метилмалонил-СоА—мутаза; 8 — метилмало-
иад-СоА—рацемаза.
222
Глава 8
процессе участвует несколько ферментов. Сначала лактат окисля-
ется до пирувата при участии флавопротеида в качестве акцептора
водорода. Затем в реакции транскарбоксилирования образуется
оксалоацетат. Донором СОг служит (S)-метилмалонил-СоА, а
переносчиком СОз—биотин. Под действием малатдегидрогеназы и
фумаразы образуется фумарат, который восстанавливается до сук-
цината в реакции, катализируемой фумаратредуктазой. Эта реак-
ция сопряжена с синтезом АТР путем фосфорилирования, сопря-
женного с переносом электронов. Далее в СоА-трансферазной реак-
ции образуется сукцинил-СоА. Затем, под действием метилмало-
нил-СоА—мутазы, содержащей кофермент В12, осуществляется
перегруппировка, ведущая к образованию (R)-метилмалонил-СоА,
который, однако, не является субстратом для транскарбоксилазы.
Скорее всего, (S)-стереоизомер образуется при действии специфи-
ческой рацемазы. В этом случае в реакции транскарбоксилирова-
ния синтезируется пропионил-СоА, и в результате последующего
переноса СоА на сукцинат освобождается пропионат.
В процессе сбраживания лактата в пропионат потребляется
одна молекула NADH2. Она образуется при окислении лактата до
ацетата в соответствии с суммарным уравнением реакций броже-'
ния, приведенным выше.
Кроме транскарбоксилазы — биотинсодержащего высокомолеку-
лярного фермента (его мол. масса составляет примерно 800000
дальтон) с очень сложной четвертичной структурой — специального
внимания заслуживают еще два фермента сукцинат-пропионатного
метаболического пути: метилмалонил-СоА—мутаза и фумаратре-
дуктаза.
В. Реакции перегруппировки, катализируемые
метилмалонил-СоА — мутазой
и другими кофермент В12-зависимыми ферментами
Перегруппировки этого типа обнаружили Баркер и сотрудники
при изучении брожения глутамата у Clostridium tetanomorphum.
Как видно из рис. 8-17, глутамат и сукцинил-СоА перегруппиро-
вываются сходным образом с образованием fJ-метиласпартата и
метилмалонил-СоА соответственно. Принципиальный механизм этих
реакций заключается в переносе заместителя от одного атома
углерода к соседнему, а водорода — в обратном направлении.
В кофермент В12-зависимых реакциях перестраиваются не только
углерод-углеродные связи. Ряд дегидратаз, дезаминаз и аминому-
таз также принадлежит к В12-ферментам и катализирует анало-
гичные реакции (рис. 8-17, в — д). Глицеролдегидратаза, встречаю-
щаяся у некоторых лактобацилл, катализирует- превращение гли-
церола в 0-гидроксипропиональдегид. Этаноламиндезамнназа при-
сутствует у клостридий, сбраживающих холин, а р-лизнн-мутаэа
является вторым ферментом сбраживания L-лизина у клостридий
(гл. 8, разд. VIII).
Бактериальное брожение
223
i) Глцтамапуиутаза
Г соон]
I H2N -C- Н I
I—---Ь
I H-C-H-i
1 1 f г*
1—H4-C\HJ
соон
1-глутамат
Н <Hj
НООС-С—С-Н
1 I
nh2 соон
тпрео-fi-Метил ъ-аспартпят
£>) Метилмалонил-Coh-мутаза
Г СО SCoA~!
(---1-------1
! Н-С- Н"
> [ ,-1
UH-CXHJ
СООН
Сукцинил-Со К
сщ
СоAS-ОС-С-Н
СООН
(ЛУметилмаронил- СоА
в) Гтщеролдегийраза
Н
Гн+с-он^
Ь--| ।--4 :
Ч1-с>он !
। >—j
Н2С-ОН
Глицерол
ОН
I
Н-С -ОН
I
н-с-н
I
Н2С-ОНJ
Н20
СНО
сп2
Н2С-ОН
JTrudpoKCurtp опиональдег ид
г) дтиноламиндезаминаза
Н
I--1 I
Н + С-ОН-> т " *-
I--* 1 * * I I-ч
•*HjC4NH2 I
Зтаноламин
Н-С-ОН
NH3
► СНО
I
СН3
Лцетапбдегид
д) р-Цизин-'з: аминомутаза
ооон
।
он2
HjN-C-h'
- Г4’
ГнХс-н*-.
j—> 11---1
l*H2C4Mt1!J
Ливан
СООН
I
сн2
h2n-c-h
|Н;
H2N-C-H
СНз
б - диаминогексанаат
Рис. 8-17. Кофермент Независимые реакции перегруппировки.
Глава 8
HOHjC 01
мидазолрийо -
нуклеотид
ОН
О=Р~О~
I
о
Корриновое
нвльцо
Циатодаламин
$ - ЭезокскаЭедолшг
Рис 8-18 Структура витамина Bj2 и кофермента В]2.
Кофермент В12 не идентичен витамину Bj2. Последний представ-
ляет собой циклическую корриновую систему, в центре которой
находится атом Со2+, с характерным компонентом — 5-,6-диметил-
бензимидазолрибонуклеотидом (рис. 8-18). Шестая координацион-
ная связь Со2+ занята гидроксилом или цианидом (гидрокси- или
цианкобаламин). Кофермент В12 дополнительно содержит б'-дезок-
сиаденозильную группу, ковалентно связанную с атомом кобальта,
заменяющим цианид (б'-дезоксиаденозилкобаламин). В реакциях
перегруппировки водород переносится с субстрата на кофермент
Bia (на С-5'-метиленовую группу) ц оттуда — на продукт.
Г< Фумаратредуктаза
Восстановление фумарата до сукцината — единственный извест-
ный процесс, в результате которого строгие анаэробы могут син-
тезировать АТР путем фосфорилирования, сопряженного с пере-
носом электронов. На образование АТР в этой реакции указывает
высокая интенсивность роста микроорганизмов, образующих про-
пионат и сукцинат. Более того, синтез АТР, сопряженный с вос-
становлением фумарата, был продемонстрирован в бесклеточных
системах некоторых микроорганизмов. Впервые это обнаружили
Пек, Ле Галл и Бартон, работавшие с экстрактами клеток Desulf о-
vibrio gigas. Фумаратредуктаза связана с мембраной и образует
комплекс с переносчиком электронов менахиноном (формула при-
Бактериальное брожение
225
Донор
электронов
(Нг или NADHp)
Л'/м
(Цит Ь)
пл
^•Фумарат
~ Фумарат- (
* редуктаза I
’ Сукцинат
Рис 8-19 Перенос электронов с таких Н-доноров, как Н2 и NADH2, на фумарат.
X — переносчик электронов неизвестной природы, Мх — менахинон.
ведена на рис. 2-8). У многих, но не у всех Микроорганизмов, в
состав фумаратредуктазной системы входит также цитохром Ь.
В отсутствие гемина (предшественника цитохрома) Bacteroides
fragilis растет только медленно и сбраживает глюкозу до лактата,
ацетата и фумарата. Однако в присутствии гемина синтезируется
цитохром Ь, и глюкоза быстро сбраживается до пропионата и сук-
цината. У этого микроорганизма цитохром b является необходи-
мым компонентом фумаратредуктазной системы. В то же время
Bacteroides amylophilus образует сукцинат без участия цитохрома.
Перенос электронов от Нг и NADHs к фумарату показан на
рис. 8-19. Окислительно-восстановительный потенциал системы
фумарат/сукцинат составляет Eq~ -f-0,03 В. Таким образом, раз-
ница окислительно-восстановительных потенциалов систем
NADH2/NAD (Е'о~—0,32 В) и фумарат/сукцинат достаточно ве-
лика для синтеза АТР путем фосфорилирования при переносе
электронов.
Фумаратредуктазная система присутствует не только у таких
классических пропионатсинтезирующих микроорганизмов, какими
являются пропионовокислые бактерии, но и у некоторых энтеробак-
терий и у различных видов бактерий, относящихся к родам Bade-
roides,. Veilonella, Peptostreptococcus, Rumtaococcus Succtnivibrio и
Selenomonas. Даже клостридии (C. formicoaceticum) содержат
фумаратредуктазу. Некоторые из перечисленных бактерий обра-
зуют только сукцинат, но не образуют пропионата. Наконец, сле-
дует упомянуть об очень интересном виде брожения, а именно о
превращении фумарата в сукцинат с использованием Нг или фор-
миата в качестве доноров водорода.
Фумарат+Н2—»-Сукцинат,
Фумарат-Ь Формиат—>Сукцинат+СО2.
Такие микроорганизмы, как Vibrio succinogenes, почти все эн-
теробактерии и Desulfovibrio gigas могут расти, используя этот тип
брожения. Это еще раз подтверждает тот факт, что синтез АТР
сдпряжен с восстановлением фумарата до сукцината.
15—1896
226
Глава 8
Д« Фосфоенолпируват-карбокситрансфосфорилаза
пропионовокислых бактерий
Поскольку пропионовокислые бактерии кроме пропионата обра-
зуют сукцинат, Сгдикарбоновые кислоты не могут синтезироваться
при участии только одной транскарбоксилазы; у этих микроорга-
низмов должна существовать ферментная система, катализирующая
синтез С4-дикарбоновых кислот из С3-соединений и СО2. Такой про-
цесс был открыт Вудом и Беркманом в 1936 г. С тех пор реакции
карбоксилирования, в результате которых образуется оксалоацетат,
называются реакциями Вуда—Беркмана. Мы уже рассматривали
функцию пируваткарбоксилазы и фосфоенолпируват-карбоксилазы
в качестве ферментов, катализирующих карбоксилирование С3-со-
единений. У некоторых видов Bacteroides образование оксалоаце-
тата происходит в реакции, катализируемой запасающей энергию
фосфоенолпируват-карбоксикиназой, которая обычно катализирует
обратную реакцию, т. е. синтез фосфоенолпирувата (табл* 5-4) *
Фосфоенолпируват-карбоксикиназа
Фосфоенолпируват-!-CO2+ADP ....... Оксалоацетат+АТР.
Пропионовые бактерии содержат фермент, катализирующий
аналогичную реакцию:
Фосфоенол пируват-карбо-
кситрансфосфорилаза
Фосфоенолпируват-!-СОг+Л t *" Оксалоацетат+РРь
В этой реакции остаток фосфорной кислоты переносится на
неорганический фосфат и образуется пирофосфат. Таким образом,
у пропионовокислых бактерий имеются две ферментные системы,
катализирующие синтез пирофосфата: фосфоенолпируват-карбок-
ситрансфосфорилаза и пируват, фосфат-дикиназа (табл. 5-4). Об-
разующийся пирофосфат используется для фосфорилирования
фруктозо-6-фосфата до фруктозо- 1,6-бисфосфата и серина — до фос-
фосерина.
VI. Метановое и ацетатное брожение
Метан относится к наиболее восстановленным органическим
соединениям. Его синтез является конечным этапом пищевых це-
пей у микроорганизмов, вызывающих брожение. Метанобразующие
бактерии обитают в анаэробной среде, где происходит разложение
органических веществ. Эти микроорганизмы крайне чувствительны
к присутствию кислорода. До последнего времени их выделение и
выращивание чистой культуры представляло очень сложную за-
дачу. Теперь существуют методы выращивания этих микроорга-
низмов на агаре и в жидкой среде (метод Хангейта).
Метанобразующие бактерии не способны использовать сложные
органические соединения; они растут, используя такие субстраты,
Бактериальное брожение
227
как СО2 + Н2, формиат, метанол и ацетат:1
СО2+4Н2—>СН4+2Н2О
4НСООН-—>СН4+ЗСО2+2Н2О
4СН3ОН—>ЗСН4+СО2+2Н2О
СНзСООН-^СН4 + со2
Наиболее важными природными субстратами служат СО2 + Н2
и ацетат.
А. Образование метана из СО2 и Н2
Почти все выделенные к настоящему времени метанобразующие
бактерии могут расти, используя СО2 и Н2. Реакции образования
метана изучены у Methanobacteriutn ruminantium, М. thermoauto-
trophicum и Methanobacteriutn МоН. СО2 подвергается последова-
тельному восстановлению до СН4, но образующиеся при этом про-
межуточные продукты формиат, формальдегид и метанол остаются
прочно связанными с переносчиками, только часть которых из-
вестна к настоящему времени. Один важный переносчик недавно
открыли Вольф и сотрудники. Это кофермент М (2-меркаптоэтан-
сульфоновая кислота; HS—СН2—СН2—SO3H). Метилкофермент
М (СН3—S—СН2—СН2—SO3H), по-видимому, является непосред-
ственным предшественником метана. Кроме того, промежуточным
соединением при образовании метана служит метилкобаламин2.
Некоторые метанобразующие бактерии используют метилированные ами-
ны и СО2.— Прим. ред.
2 Это не доказано.— Прим. ред.
15’
2Э8
Глава 8
coz + х-н--•- Х-СООН
Х-С'НО
2 Н>
Ряс 8-20 Схема восстановления СО2 до метана. X — переносчик неизвестной при*
роды, В1г — гидридкобаламин, HS-CoM — кофермент М
Переносчик, на котором СО2 восстанавливается до окисли-
тельного уровня формиата и формальдегида, не известен. Тетра-
гидрофолят, по-видимому, не участвует в образовании метана.
На рис 8-20 приведена схема, построенная на основе общей
схемы Баркера для образования метана из СО2. Как видно из
этой схемы, СО2 восстанавливается с образованием соединения
переносчик — метил. Затем метильная группа переносится на кофер-
мент М непосредственно или через Bi2. СН4 образуется на этапе
последней восстановительной реакции.
Метанобразующие бактерии содержат в качестве переносчика
водорода флуоресцирующее соединение F4201- У других микроор-
ганизмов F42o не обнаружен; поэтому вследствие его сильной флуо-
ресценции метанобразующие бактерии могут быть легко выявлены
при помощи флуоресцентной микроскопии.
Из схемы, приведенной на рис. 8-20, следует, что образование
метана из СО2 и Н2 не может быть сопряжено с синтезом АТР
путем субстратного фосфорилирования. Следовательно, можно
постулировать, что у метанобразующих бактерий АТР синтезиру-
ется в результате фосфорилирования при переносе электронов.
1 Установлено, что фактор F420 представляет собой особый флавин.— Прин,
ред
Бактериальное брожение
Изменение свободной энергии реакций восстановления бикарбо-
ната до метана определяется следующим образом:
нсо;+На—>нсоо + Н2О
нсоо-+н++Н2—>сн2о+Н2О
СН2О+Н2—>СН3ОН
СН3ОН+ Н2 —уСН4+Н2О
до;
— 0,3 ккал (—1,3 кДж)
+ 5,5 ккал (+23,0 кДж)
—10,7 ккал (—44,8 кДж)
—26,9 ккал (—112,5 кДж)
НСОГ+Н++4Н2—>СН4+ЗН2О —32,4 ккал (—135,6 кДж)
Изменение свободной энергии всего процесса имеет большое
отрицательное значение, но'сравнение &G'O отдельных его этапов
показывает, что величина изменения свободной энергии определя-
ется главным образом реакцией восстановления метанола до ме-
тана. Окислительно-восстановительный потенциал системы мета-
нол/метан равен +0,170 В, и так же, как при восстановлении
фумарата водородом, перенос электронов с водорода на связанный
с носителем метанол может быть сопряжен с синтезом АТР
(рис. 8-21). Следует подчеркнуть, что существование такого меха-
низма синтеза АТР экспериментально пока не доказано.
Поскольку ряд метанобразующих бактерий растет на мине-
ральной среде в присутствии СО2 и Н2, они относятся к хемолито-
трофам. Однако эти микроорганизмы имеют так много общего с
другими бактериями, вызывающими брожение, что представляется
правильным рассматривать их в этой главе. Более того, у метан-
образующих бактерий, по-видимому, отсутствует восстановитель-
ный пентозофосфатный цикл, обычно имеющийся у хемолитотро-
фов (гл. 9). Механизмы синтеза клеточных веществ из СО2 для
метанобразующих бактерий пока не известны.
Рис, 8-21. Возможный участок синтеза АТР при фосфорилировании, сопряженном
с переносом электронов, у метанобразующих бактерий.
230
Глава 8
Б. Межвидовой деренос водорода
Образование метана из СОз и Н2— очень эффективный меха-
низм использования водорода, выделяющегося при брожении.
В рубце жвачных животных и при анаэробном пищеварении, когда
из СОз + Н2 в изобилии образуется СН4, в результате жизнедея-
тельности метанобразующих бактерий парциальное давление водо-
рода сохраняет низкое значение, соответствующее 10~4 атм. Это.
имеет большое значение. При высоком парциальном давлении во-
дород может образоваться только из пирувата (пируват: ферре-
доксин—оксидоредуктаза+гидрогеназа) и из формиата (форми-
ат—водород-лиаза); при низких парциальных давлениях стано-
вится возможным выделение водорода из NADH2(NADH2: ферре-
доксин—редуктаза+гидрогеназа) и других переносчиков водорода.
На рис. 8-22 показано, что при значениях парциального давления
Н2 ниже 10-3 атм изменение свободной энергии процесса выделе-
ния Н2 из NADH2 — величина отрицательная. Так, в смешанных
бактериальных культурах, где благодаря жизнедеятельности ме-
танобразующих бактерий поддерживается низкое значение Рн2>
другие процессы брожения сдвигаются в сторону образования
большего количества водорода и меньшего количества восстанов-
ленных органических соединений. На рис. 8-23 приведены два
примера. Так называемый S-микроорганизм способен окислять
этанол до ацетата и Нг. Термодинамически это возможно только
Рис. 8-22. Изменение свободной энергии окисления NADH2 до NAD и Н2 в за-
висимости от парциального давления водорода.
Бактериальное брожение
231
Рис. 8-23. Примеры переноса водорода от одного вида бактерий к другому. При
низком значении Рл2 этанол окисляется S-организмом до ацетата и Н2, а глюко*
за — до ацетата, СО2 и Н2. Низкое значение Рн2 поддерживается благодаря
жизнедеятельности мстанобразукяцих бактерий.
при низких значениях Рн2- В соответствии с этим S-микроорганизм
может расти только в присутствии метанобразующих бактерий.
Смешанная культура S-бактерии и Methanobacterium МоН извести
на под названием Methanobacterium (-Methanobacillus) omelianskih
2СН3—СН2ОН+2Н2О---------S-бактерия---- 2СН3—СООН+4Н2
_________4Н2+СО2 М°Н СН.+2Н3О
' 2СНз-СН2ОН+СО2 2СН3—СООН+СН,
Ruminococcus albus, изученный Болином и сотрудниками, сбра*
живает глюкозу до этанола, ацетата и водорода:
Глюкоза—>Ацетат+Этанол+2СО2+2Н2.
232 Глава 8
В присутствии метанобразующих бактерий обнаруживаются
только ацетат и СО2. Это выгодно и тому и другому виду микро-
организмов. В смешанных культурах R. albus образуется 4 моля
АТР на 1 моль глюкозы вместо 3 молей АТР на 1 моль глюкозы
в чистой культуре, а метанобразующие бактерии для получения
энергии и роста используют Н2 и СО2.
Следует подчеркнуть, что описанные здесь пищевые цепи име-
ют огромное значение в природе.
В. Образование метана из формиата, метанола
и ацетата
Формиат — хороший субстрат для многих метанобразующих
бактерий; он сначала превращается в СО2 и водород и, следова-
тельно, не является прямым предшественником метана:
4НСООН 4COj+4H2
СОа+4На----------------» CH,+2HSO
Суммарное уравнение: 4НСООН—>СН4+ЗСО2+2Н8О
Метанол — хороший субстрат для Methanosarcina barkeri. Он
служит прямым предшественником метана. В клетках Methanosar-
cina barkeri имеется ферментная система, катализирующая превра-
щение метанола и гидридкобаламина в метил-В12, из которого об-
разуется метан:
СНзОН+В121 НеСК0ЛЬК0 белков^кофакторов ^b^q
Восстановительные эквиваленты для образования метана из
СН3-В12 через СН3-С0М образуются в результате реакции окисле-
ния метанола до СО2. Стехиометрическое уравнение этого процес-
са имеет следующий вид:
СН3ОН+Н2О—^СО2+6Н
ЗСН3ОН+6Н—>зсн4+зн2о
Суммарное уравнение: 4СН3ОН—>-ЗСН4 + СО2+2Н2О
Окисление метанола до СО2 происходит через стадии образо-
вания метилтетрагидрофолята (метил-Н4-фолята), метилен-Н4-фо-
лята, метенил-Н4-фолята и формил-Н4-фолята. Из последнего со-
единения при участии формил-Н4-фолят—-синтетазы образуется
формиат:
АПР+Л+Формил-Н4-фодятч±Формиат+Н4-фолят+АТР.
Таким образом, при окислении метанола АТР синтезируется
путем субстратного фосфорилирования. Поскольку окисление 1 мо-
ля метанола сопряжено с восстановлением 3 молей метанола до
Бактериальное брожение
233
метана, в результате субстратного фосфорилирования образуется
1 моль АТР на 4 моля метанола.
Конечная стадия окисления катализируется формиатдегидроге*
назой, которая переносит водород на переносчик F420:
НСООН+Р42о^С02+Восстановленный F420.
Ацетат относится к наиболее важным субстратам для образо-
вания метана в озерных осадках. Он превращается Methanosarcina
barkeri, Methanospirillum hungatii и некоторыми другими метан-
образующими бактериями в метан и СОг:
СНз—СООН—>СН4+СО2
Баркер и Стэдтман показали, что углерод метильной группы
ацетата вместе со связанными с ним атомами водорода превра-
щается в метан и что СО2 образуется из карбоксильной группы
ацетата. Механизм этого процесса еще не выяснен.
Г. Ацетатное брожение
В 1936 г. Виринга описал микроорганизм Clostridium aceticum,
сбраживающий водород и двуокись углерода до ацетата:
4Н2+ 2СО2—>СН3—СООН+ 2Н2О.
Очевидно, что это брожение тесно связано с метановым броже-
нием. Изменение свободной энергии при ацетатном брожении со-
ставляет AG'0=—25,6 ккал (107,1 кДж), примерно на 28 кДж
меньше, чем при образовании метана из Н2 и СО2. К сожалению,
культура С. aceticum позднее была утеряна и метаболизм этой
бактерии детально не изучен1. Однако Вольф с сотрудниками вы-
делили микроорганизм, не образующий спор (Acetobacterium woo-
dii), который также вызывает ацетатное брожение2.
При рассмотрении ацетатного брожения заслуживают внимания
два других вида клостридий: С. thermoaceticum и С. formicoaceti-
cum. Эти микроорганизмы почти полностью сбраживают гексозы
до ацетата. Они не обладают способностью к выделению водорода
и образованию восстановленных соединений, таких, как лактат,
этанол или бутират. Метаболизм этих соединений можно охаракте-
ризовать при помощи следующих уравнений:
С6Н12О6+Н2О—>СН3—СО—СООН+СНзСООН+СО2+6Н
СО2+6Н+ НХ—>СНз-Х+2Н2О
С Н3—СО-СООН+СНз-Х+ Н2О—>-2СН3—СООН+Н-Х
СвН120б—^ЗСНз—соон
1 Недавно при участии автора этой книги выращена культура С. aceticum
из сохранившихся спор. — Прим, ред,
2 Обнаружены и другие анаэробные бактерии, синтезирующие ацетат из Hi
и СО2. — Прим. ред.
234
Глава 8
Фруктоза
10-#ю/?МцЛ-Н4чрС«Я77
5,1 Ъ-метенил -И, - фолят
^-nadh2
>*NAD
10
5, 10- метилен -Щ'фолят
Lx-FADH2
f^FAD
5-ЙСТКД -Щ-^Й/ВДГ----
Рис. 8-24. Ацетатное брожение, вызываемое Clostridium formicoaceticum. 1 — рас-
пад фруктозы по метаболическому пути Эмбдена — Мейергофа — Парнаса; 2 —
пируват : ферредоксин — оксидоредуктаза, 3 — фосфотрансацетилаза; 4 — ацетат-
киназа; 5 — формиатдегидрогеназа (акцептор электронов неизвестен, у С. thermo*
aceticum это NADP); 6 — формил-Н4-фолят—синтетаза; 7 — метилен-Н4-фолят—
циклогидролаза; S — метилен-Н4-фолят—дегидрогеназа; 9 — метилен-Н4-фо-
Лят—редуктаза; 10— метилтрансфераза; 11 — пируват-метил-В12—транскарбокси-
лаза.
Сначала гексоза распадается до пирувата по пути Эмбдена —
Мейергофа — Парнаса. Далее одна молекула пирувата распадает-
ся до ацетата. Восстановительные эквиваленты (6Н), аккумулиро-
ванные в форме восстановленных коферментов, используются для
восстановления СО2 до связанной с переносчиком метильной груп-
пы (СН3—X). Пируват и СН3—X вступают в транскарбоксилазную
реакцию с образованием двух молекул ацетата. Метаболический
путь образования ацетата полностью приведен на рис. 8-24.
СО2 восстанавливается до формиата при участии формиатде-
гидрогеназы. Фермент содержит селен и вольфрам, что отличает
Бактериальное брожение
235
его от формиатдегидрогеназы Е. coli, у которой молибдат не мо-
жет быть заменен на вольфрамат.
Затем в реакции, катализируемой соответствующей синтета-
зой, формиат превращается в формил-Н4-фолят. В результате ре-
акций восстановления образуется метил-Н4-фолят. Далее следует
перенос метильной группы на В^-содержащий белок, и в транскар-
боксилазной реакции из пирувата и из метильной группы, связан-
ной с В12, образуются две молекулы ацетата.
С. thermoaceticum и С. formicoaceticum сбраживают 1 моль гек-
созы с образованием примерно 2,8 молей ацетата. Кроме того,
С. formicoaceticum выделяет некоторое количество формиата. Эти
микроорганизмы различаются тем, что первый является термофи-
лом, а второй — мезофилом. С. formicoaceticum не может сбражи-
вать глюкозу, но хорошо растет на среде с фруктозой.
VIL Сульфатредукция (десульфатация)
Большинство микроорганизмов использует сульфаты в качестве
основного источника серы и имеет ферментные системы для вос-
становления сульфатов до сульфидов. Такой процесс ассимиляци-
онного восстановления сульфатов рассматривался в гл. 3 (рис. 3-3).
При сульфидном брожении сульфат служит конечным акцептором
электронов и выделяется образующийся сероводород. Поэтому
такой процесс называют диссимиляционным восстановлением суль-
фата, и осуществляется он только строгими анаэробами, относя-
щимися к родам Desulfovibrio, Desulfomonas и Desulfotomaculum.
Сульфатредуцирующие бактерии используют в качестве Н-до-
норов конечные продукты других видов брожения, такие, как лак-
тат, малат и этанол: эти соединения окисляются до ацетата
(и СО2). Образующиеся при этом восстановительные эквиваленты
используются для восстановления сульфатов до сульфидов. Пред-
почтительным субстратом для многих сульфатредуцирующих бак-
терий является лактат.
А. Сбраживание лактата и сульфата
Этот вид брожения может быть описан следующим образом:
2СН3—СНОН-СООН+2Н2О—>2СНз—СООН+2СО2+8Н,
S О®-+8Н—>S2-+4Н2О.
При окислении лактата до ацетата в качестве промежуточных
продуктов образуются пируват и ацетил-СоА. Флавопротеид на
первой стадии окисления, по-видимому, функционирует как акцеп-
тор водорода, а пируват : ферредоксин—оксидоредуктаза участвует
в синтезе ацетил-СоА. Конечная реакция — образование ацетата—-
сопряжена с синтезом АТР.
236
Глава 8
Ряс. 8-25. Диссимиляционное восстановление сульфата. 1—лактатдегидрогеназа,
Н-акцептор неизвестен; 2 г- пируват : ферредоксин—оксидоредуктаза; 3 — фос-
фотрансацетилаза; 4 — ацетаткиназа; 5 — АТР-сульфурилаза; 6 — пирофосфатаза;
7 — аденозин-б'-фосфосульфат—редуктаза; 8 — сульфитредуктаза (десульфовири-
дин); 9— тритионат-редуктаза; 10— тиосульфатредуктаза. Доноры электронов
для редуктаз неизвестны. АФС — аденозин-5'-фосфосульфат.
Полученные при окислении лактата 8Н используются для вос-
становления сульфата до сульфида. Процесс осуществляется в че-
тыре стадии. Перед первой стадией сульфат активируется, пре-
вращаясь в аденозин-5'-фосфосульфат (АФС) (рис. 8-25), а в ре-
зультате восстановления аденозин-5'-фосфосульфата образуются
сульфит и АМР. В отличие от ассимиляционного восстановления
сульфата (рис. 3-3) дальнейшего фосфорилирования с образова-
нием в качестве промежуточного продукта фосфоаденозин-5'-фос-
фосульфата не происходит. В состав аденозин-5'-фосфосульфат —
редуктазы входят FAD, железо и сера. Реакция восстановления
аденоёин-5'-фосфосульфата обратима; in vitro наблюдается восста-
новление аденозин-5'-фосфосульфата в присутствии восстановлен-
ного метилвиологена в качестве донора водорода и образование
аденозин-5'-фосфосульфата из сульфита и АМР в присутствии
феррицианида в качестве акцептора водорода/
При восстановлении сульфита видами Desulfovibrio происходит
циклическое Использование сульфитного пула. В качестве первого
продукта восстановления образуется тритионат. Сульфитредукта-
Бактериальное брожение
237
за, катализирующая эту реакцию, идентична зеленому порфирин-
содержащему белку, десульфовиридину, открытому Постгейтом у
сульфатредуцирующих бактерий в 1956 г. Десульфовиридин в
больших количествах присутствует у большинства видов Desulfo-
vibrio, но у видов Desulfotomaculum не обнаружен. У последних
имеется сульфитредуктаза, спектр поглощения которой отличается
от спектра десульфовиридина. Она, по-видимому, катализирует
все реакции восстановления сульфита до сульфида. В отличие от
этого две конечные реакции восстановления у Desulfovibrio, пока-
занные на рис. 8-25, катализируются тритионатредуктазой и тио-
сульфатредуктазой.
Таким образом, можно сделать вывод, что у сульфатредуци-
рующих бактерий имеются два метаболических пути восстановле-
ния сульфита. Первый метаболический путь включает циклически
восстанавливающийся сульфитный пул, десульфовиридин, тритио-
нат и тиосульфатредуктазу, в то время как для другого пути тре-
буется только одна ферментная система.
На рис. 8-25 показаны не все переносчики электронов, участ-
вующие в четырех стадиях восстановления сульфата Кроме фер-
редоксина виды Desulfovibrio содержат рубредоксин, менахинон
и цитохромы, среди которых наибольшего внимания заслуживает
цитохром с3. Все перечисленные переносчики электронов исполь-
зуются при метаболизме водорода у Desulfovibrio, но реакции, в
которых они участвуют, точно не известны. У видов Desulfotoma-
culum отсутствует цитохром с3, но имеются цитохромы типа Ь1.
Из рис. 8-25 видно, что при окислении 1 моля лактата до аце-
тата у сульфатредуцирующих бактерий синтезируются 2 моля
АТР. С другой стороны, при восстановлении сульфата до сульфита
расходуется энергия двух высокоэнергетических связей (АТР—>
—*-AMP+2Pi). Таким образом, суммарное количество АТР, обра-
зовавшегося путем субстратного фосфорилирования, равно нулю.
Многие сульфатредуцирующие бактерии могут использовать Н2 и
образовывать сульфиды из сульфатов и Н2. Следовательно, вос-
становление сульфатов у них не сопровождается расходом АТР.
Поэтому можно сделать заключение, что при восстановлении 1 мо-
ля сульфата до сульфида по крайней мере два моля АТР синте-
зируются в результате фосфорилирования при переносе электро-
нов. Выход АТР может быть и выше.
Б. Рост на других субстратах
Практически все сульфатредуцирующие бактерии могут расти
в присутствии этанола и сульфата. Подобно Clostridium kluyveri,
эти микроорганизмы для синтеза пирувата используют пируват:
1 Обнаружены также цитохромы типа с, но не с$.— Прим. ред.
238
Глава 8
ферредоксин—оксидоредуктазу, и для их роста необходимо при-
сутствие в среде бикарбоната. Desulfovibrig desulfuricans, D. sale*
xigens и D. africanus сбраживают смесь малат+сульфат, a De-
sulfotomaculum ruminii — смесь формиат+сульфат. Desulfototna-
culum ruminis и D. desulfuricans в отсутствие сульфата сбражи-
вают пируват до ацетата, Н2 и СО21.
В. Desulfигomanas acetoxidans
Пфенниг и сотрудники недавно выделили бактерии, которые
растут на среде с ацетатом и элементарной серой; ацетат окисля-
ется до СО2, и образующиеся восстановительные эквиваленты
используются для восстановления серы до сульфида:
СНЭ—СООН+2Н2О—>2СО2+8Н ДО£ = +25,5 ккал (+106,7 кДж)
4S°+8H —>4H2S AGq-——31,2 ккал (—130,5 кДж)
СНз—COOH+2H2O+4S° —>-2CO2+4H2S ДО£=—5,7 ккал (—23,8 кДж)
У Desulfuromonas отсутствует ферментативная активность, не-
обходимая для роста на среде с пируватом и сахарами. Механиз-
мы окисления ацетата и образования АТР не известны.
III. Брожение азотсодержащих соединений
Сахара и органические кислоты — не единственные субстраты
для анаэробов. Множество микроорганизмов сбраживают амино-
кислоты, образующиеся из белков под воздействием внеклеточных
протеаз, а также пуриновые и пиримидиновые основания.
А. Отдельные аминокислоты
Ряд аминокислот может служить источником энергии и угле-
рода для анаэробов. Аланин сбраживается Clostridium propionicum
в акрилатном метаболическом пути (рис. 8-15). Peptococcus ande-
robius (Diplococcus glycinophilus) сбраживает глицин в соответст-
вии со следующим уравнением реакции:
4H2N—СН2—СООН+2Н2О—*-4NH3+2СО2+ЗСН3—СООН.
Кроме того, выделяются различные количества водорода. Об-
разование Н2 увеличивает выход СО2 и уменьшает выход ацетата.
Опыты с использованием меченых соединений показали, что при
этом типе брожения СО2 образуется из карбоксильной группы
глицина и что оба атома углерода ацетата частично образуются
1 Сейчас получены чистые культуры представителей сульфатредуцируютих
бактерий, отнесенных к новым родам. — Прим. ред.
Бактериальное брожение
239
Фолят-Щ + NH2-CH2-COOH
NAD
NADHi
|со2| + NHj
5. ХО-мепилен-^-фоляпт
NIf2-CH2-COOH
СН2-СН-СООН
ОН NHi
Рис. 8-26. Брожение глицина, вызываемое Peptococcus anaeroblus. 1 — глицин-син-
тазный ферментный комплекс; 2 — серин-гидроксиметилтрансфераза. Часть вос-
становленного ферредоксина идет на восстановление СОг до ацетата. Некоторое
количество восстановленного ферредоксина используется для образования Hj.
из углерода метиленовой группы глицина, а частично — из СО2.
Метаболический путь, изображенный на рис. 8-26, согласуется с
этими данными. В первой, очень сложной реакции расщепляется
глицин; при этом второй атом углерода переносится на тетрагид-
рофолят; NAD при этом восстанавливается. Ферментный комплекс,
глицин-синтаза, катализирующий эту реакцию, состоит из четырех
белков. В результате переноса Ci-радикала (—СН2—ОН) с5,10-ме-
тиленгидрофолята на другую молекулу глицина серин-гидрокси-
метилтрансферазой образуется серин. Далее в реакции, катали-
зируемой сериндегидратазой, образуется пируват, и в конечном
счете при участии пируват : ферредоксин—оксидоредуктазы, фос-
фотрансацетилазы и ацетаткиназы синтезируется ацетат. NADH2,
образовавшийся на первой стадии и восстановленный ферредоксин
служат для восстановления СО2 до ацетата. Тот же метаболиче-
ский путь функционирует, вероятно, у С. thermoaceticum и С. for-
micoaceticum.
Сбраживание треонина (рис. 8-27) инициируется треониндегид-
ратазой (С. propionicum, Peptococcus aerogenes) или треониналь-
долазой (С. pasteurianum). Образующийся а-оксобутират превра-
щается далее в пропионат в серии реакций при участии фермента,
сходного с пируват : ферредоксин—оксидоредуктазой. С. pasteuria-
num восстанавливает ацетальдегид до этанола; судьба глицина не
известна.
240
Глава 8
СООН
h2n-c-h
Н-С-ОН
СНз
Треонин- СООН
альдолаза |
(С posteuri.anum}/*'' CH2—NHj
X. СНО
СН3
L- треонин
ТреонинЗегидратаза
(Р aerogenes)
-----*- СООН
Л с=о
NH5 । —►-—^Пропионат + Н2 + СО2
сн2
СНз
Рис. 8-27. Начальные реакции брожения треонина
Аспартат сбраживается многими факультативными и некото-
рыми облигатными анаэробами; в результате дезаминирования
аспартата образуется фумарат, который частично восстанавлива-
ется до сукцината, а частично окисляется до ацетата. Эти превра-
щения аспартата аналогичны процессам сбраживания фумарата
и малата. Некоторые виды клостридий, например С. welchii, со-
держат декарбоксилазу, которая катализирует превращение аспар-
тата в аланин:
НООС—СН2—СН (NHj) —COO Н^СО2+СНз—СН (NH2) —соон
Большое внимание исследователей привлек процесс сбражи-
вания глутамата облигатными анаэробами. Clostridium tetano-
morphum, по-видимому, предпочтительно использует эту аминокис-
лоту как субстрат и расщепляет ее довольно необычным способом.
Исследуя превращения глутамата, Баркер и его сотрудники откры-
ли первый В12-зависимый фермент — глутаматмутазу. Реакция пе-
регруппировки, катализируемая этим ферментом, уже обсуждалась
в связи с другими-В12-зависимыми ферментами (разд. V данной
главы). Как показано на рис. 8-28,А, образующийся под действием
глутаматмутазы p-метиласпартат дезаминируется с образованием
мезаконата. Мезаконат присоединяет воду и превращается в цит-
рамалат, который расщепляется на ацетат и пируват. Эта реак-
ция имеет много общего с цитрат-лиазной реакцией, а цитрамалат-
лиаза и цитрат-лиаза — ферменты с близкими свойствами. Далее
пируват распадается с образованием ацетил-СоА, СО2 и восста-
новленного ферредоксина, из которого выделяется небольшое ко-
личество водорода. Ацетил-СоА лишь частично превращается в
ацетат, остальная его часть превращается в бутират.
У Peptococcus aerogenes глутамат сбраживается до тех же
продуктов, что и у С. tetanomorphum, но при этом используется
другой метаболический путь. Как видно из рис. 8-28, Б, глутамат
Бактериальное брожение .. .... t.. ?* *
Л соон
H2N-CH 1
сн2 *“
СН2
соон
L- глутамат
СООН
H2N-CH
нс-соон
I
СНз
C-COOH
I
СНз
1,-тпрео fl Метил
аспаргпап
СНз -СООН
1 Ацетат
СНз -со-СООН
Пирузат
Мезаконат
ф-Н2О
3
соон
I
сн2
но-(ксоон
I
СНз
Цитрамалат
0,2 Ацетат, Бутират,У СО2 0,2 Hi
соон
HjN-CH
сн2
СН2
соон
t-глутамагп
Н2О NH3
+• +
NAD NADH2
COOH Nadh2 NAD
C=O
сиг
CH2
COOH
а- Оксоглутарат
соон
но-с-н
сн2
СИ,
СООН
а-Гидролсиглутарат
CO СоА
I
CH
V
CH
СНз
1 Ацетат
0,5 бутират
Рратонил-Сх>К
Рис 8-28 Пути брожения глутамата, вызываемого Clostridium tetanomorphum (А)
и Peptococcus aerogenes (Б). 1—глутаматмутаза; 2 — 0-метиласпартаза; 3—
цитрамалат-дегидратаза, 4 — цитрамалат-лиаза; 5 — глутаматдегидрогеназа; 6 —
а-гидроксиглутаратдегидрогеназа, 7 — сложная реакция с глутаконил-СоА в ка-
честве возможного промежуточного продукта, 8 — дисмутация кротонил-СоА.
сначала превращается в a-гидроксиглутарат. В реакции, механизм
которой до конца не расшифрован, синтезируется кротонил-СоА.
Освобождающийся в этой реакции СО2 образуется из карбоксиль-
ной группы при С-5 a-гидроксиглутарата. На конечном этапе в
реакции дисмутации кротонил-СоА превращается в ацетат и бути-
рат: одна молекула кротонил-СоА окисляется с образованием двух
16—1896
242
Глава 8
СН2СН2-СН2-СН2 -СН-СООН ♦=.. ь.
nh2 nh2
^з-лизин
6
нн2
сн2 -сн2 -сн2 -сн2 -сн-соон
nh2
1-лизин
1
СН3-СН-СН2-СН2 -СН-СООН.
1 I
nh2 nh2
2, 5-диаминогексаноат
-'L^-NAD + HiO
f^NADH; +NH3
CH3 -C-CH2 -СН2 -СН-СООН
II I
о мн2-
СН2 -СН2 -СНз -СН-СН2 -соон
I I
nh2 nh2
3, б-диаминогвксаноспц (fl-лизин)
2
СНз -СН-СНз -СН-СН2 -соон
I I
NH2 NHj
| сн3-соон~[ |
3, S-диаминогексаноат
' ‘L--NAD + H2O
f**NADH2 +NH3
СНз -CH-CH1 -с-сн2 -соон
' I н
nh2 о
I СНз-сн2-сн2-соон I
З-оксо-5-аминагексатат
I I СНз-COOH
СНз-CH2-CH;-COOH 1
Рис. 8-29. Метаболический путь брожения лизина у клостридий. 1 — пиридоксаль-
фосфат и Ре2+-зависимая L-лизин—2,3-аминомутаза, активируемая S-аденозил-
метионином; 2 — кофермент Независимая fJ-лизин-мутаза; 3 — 3,5-диаминогекса-
ноат-дегидрогеназа; 4— детально не изученные реакции; 5 — лизинрацемаза;
6 — кофермент Независимая D-a-лизинмутаза; 7—2,5-диаминогексаноатдегидро-
геназа; 8 — детально не изученные реакции.
молекул ацетата через ацетоацетил-СоА, а другая восстанавли-
вается с образованием бутирата (через бутирил-СоА).
Лизин сбраживается Clostridium sticklandii и Clostridium SB4
с образованием ацетата и бутирата. Этот интересный метаболиче-
ский путь приведен на рис. 8-29; он включает несколько реакций
перемещения аминогрупп. Две такие реакции, катализируемые
L-0-лизин-мутазой и D-a-лизин-мутазой, требуют наличия кофер-
мента В12. В зависимости от того, происходит ли первое переме-
щение аминогруппы у L- или D-лизина, используются различные
метаболические пути. Сбраживание L-лизина приводит к образо-
Бактериальное брожение
243
nh2
C=NH Н20 NHj
NH \l /
(CH2)3
hc-nh2
соон
nh2
c-o
I
NH
(СН2)з
hc~nh2
COOH
nh2
O-C-O-(p)
nh2
(CH2)3
HC-NH2
COOH
т-аргинин ^.-цитруллин l- орнитин
nh2
1 Z-X 3
O=C-O-(p) + ADP 4—.» ATP + NH3 + CO2
Рис. 8-30. Брожение L-аргинина с образованием L-орнитина. 1 — аргинин-имино-
гидролаза; 2 — орнитин-карбамоилтрансфераза; 3 — АТР : карбамат—фосфотранс-
фераза.
ванию ацетата, в состав которого входят атомы С-1 и С-2 L-лизи-
на, и бутирата, включающего атомы С-3, С-4, С-5 и С-6 лизина.
При метаболизме D-лизина в состав образующегося ацетата вхо-
дят атомы С-5 и С-6. Обычно клостридии сбраживают L-лизин.
Однако в определенных условиях предпочтительнее сбраживается
D-лизин.
Аргинин сбраживается до орнитина, СО2 и NH3 клостридиями,
стрептококками и микоплазмами. Необычным при этом виде бро-
жения является образование АТР из карбамоилфосфата (рис. 8-30).
У С. sticklandii орнитин расщепляется дальше. Как и при сбражи-
вании лизина, расщепление орнитина включает перемещение ами-
ногруппы.
В. Реакция Стикленда
Хотя некоторые виды клостридий растут на среде, содержащей
какую-либо одну аминокислоту, многие клостридии сбраживают
преимущественно смесь аминокислот. У таких клостридий проис-
ходит реакция сопряженного окисления-восстановления пары ами-
нокислот. Одна аминокислота, например аланин, окисляется, а дру-
гая, например глицин, восстанавливается.
СНз—СН (NH2) —СООН+2Н2О—^СН3—СООН + СО2 + NH3+4Н
2NH2—СН2—СООН+4 Н—>-2СН3—СООН+2NH3
Этот тип брожения был обнаружен Стиклендом в 1934 г.; он
присущ практически всем протеолитическим клостридиям, таким,
как С. sporogenes, С. sticklandii, С. histolyticum и С. botulinum. Од-
ни аминокислоты в основном служат донорами водорода, другие —
акцепторами. В табл. 8-9 дан перечень аминокислот, которые
функционируют обычно как доноры и акцепторы водорода.
16*
244
Глава 8
Таблица 8-9
Аминокислоты, выполняющие
функцию доноров и акцепторов
водорода в реакциях Стикленда
Донор водорода Акцептор водорода
Аланин Глицин
Лейцин Пролин
Изолейцин Гидроксипролин
Валин Орнитин
Г ИСТИДИН Аргинин
Триптофан
Окисление аминокислот происходит через стадию образования
соответствующей а-оксокиелоты:
R—СН—СООН -±^NH3+R-CO-COOH R-COOH+CO2
I 2Н 2Н
nh2
Первый этап, окислительное дезаминирование, осуществляется
либо'при участии фермента типй глутаматдегидрогеназы, либо пу-
тем переаминнрования с а-оксоглутаратом в качестве акцептора
ЫНз-группы и последующей регенерации а-оксоглутарата с по-
мощью глутаматдегидрогеназы. Реакция окислительного декарбо-
ксилирования катализируется ферментами, аналогичными пиру-
ват : ферредоксин—оксидоредуктазе. Из СоА-эфиров при воздейст-
вии СоА-трансферазы, фосфотрансацетилазы и ацетаткиназы об-
разуется АТР.
Восстановление аминокислот представляет собой довольно
сложную реакцию. Соответствующие ферментные системы связа-
ны с Мембраной и состоят из нескольких белков. Восстановление
глицина до ацетата требует присутствия низкомолекулярного
селенопротеида, высокомолекулярного белка (белок В) и допол-
нительных факторов (фракция С).
Селенопротеид
NH3-CH2—COOH+NADH2 “б~7в~> CHs-COOH+NHs+NAD
Фракция С
Водород переносится с NADH2 на глицин при участии несколь-
ких переносчиков, причем NADH2~b этой реакции может быть за-
менен димеркаптанами, такими, как 1,4-дитиотреитол. D-пролин-
редуктаза обладает сходными свойствами. Этот фермент специфи-
Бактериальное брожение
245
чен по отношению к D-форме пролина, и клостридии, осуществляю-
щие реакцию Стикленда, содержат рацемазу, превращающую
L-пролин в D-пролин. Продуктом D-пролинредуктазной реакции
является 5-аминовалерианат.
/сх2
г ;сн-соон + nadh2
H2C / H D- пролин CH2~CH2—CH2—CH2—COOH + NAD Ь-амцновалерЦанат
Это соединение образуется также и в реакции, катализируемой
орнитинредуктазой; далее оно сбраживается до валерианата, про-
пионата, ацетата И аммиака.
В. Гетероциклические соединения
Пурины и пиримидины легко сбраживаются в анаэробных
условиях. Clostridium acidi-urici и С. cylindrosporum сбражцвают
гуанин, гипоксантин, урат и ксантин. Эти микроорганизмы настоль-
ко «специализировались» на сбраживании перечисленных веществ,
что не растут ни на каком другом субстрате. Баланс реакций
брожения урата приведен в табл. 8-10. Два вышеупомянутых вида
клостридий различаются тем, что только С. cylindrosporum обра-
зует глицин. <
Сбраживание пуринов начинается с их превращения в ксантин
(рис. 8-31). Фермент ксантиндегидрогеназа, являющийся молибдо-
Таблица 8-10
Брожение урата,
вызываемое Clostridium acidi-urici
и С. cylindrosporum^
Продукт Количество продукта, моль/100 моль урата
С. acidi-urici С. cylindrosporum
CO2 340 275
Формиат 18 48
Ацетат 72 37
Глицин 0 14
Аммиак 397 356
Barker Н. A. In: The Bacteria, I. C. Gunsalus and
R. Y. Stanier (eds.), Academic Press, New York and Lon-
don, 1961, vol. 2, pp. 151—207.
246
Глава 8
о
о
HN'
Н2О TNH3
\ j / HN
° н
Н2О 2Н .4
Ч7/ HNXV4^
H2N-C^ с
N Ч
н
Гуани»
ноос; N
h2n
'СН
'СН
- I II СН
О=С< /
XN XN
н и
Ксантин
Н20
Н2о NHj + С02
... ЧУ..... ,
О-С Х\
^N'
Н‘ Н
брат
НООСЧ,/Ч
о=с\ /
4n xn
Д-уреидо-ъ-имидаз.ол-
Карбоксилат
К
со2
'сн
h,ok6nH; н,с^\с|| н;о
о=ш /
Н
* ^-имидазол
I сн
X. /
h2n^ xn
4-сгмг.шо- Ъ-имидс&оГР
карбоксилат
HN---СН
I II
- Н2С КН
НООС
н
4-аманоимидазап
Фармиминоглицин
с^о
Рис. 8-31. Превращение гуанина, урата и ксантина в формиминоглицин, вызывав*
мое С. acidi-urlci и С. cylindrosporum. 1 — гуаниндезаминаза; 2 — ксантиндегидро-
геназа; 3 — ксантин-амидогидролаза; 4 — 4-уреидо-5-имидазолкарбоксилат—ами-
догидролаза; 5 — 4-амино-5-имидазолкарбоксилат—декарбоксилаза; 6 — 4-амино-
имидазол-дезаминаза, 7 — 4-имидазолоназа.
протеидом, не только восстанавливает урат до ксантина, но и ка-
тализирует превращение гипоксантина в урат через стадию обра-
зования 6,8-дигидроксипурина. Образовавшийся ксантин в ре-
зультате серии реакции дезаминирования и декарбоксилирования
превращается в формиминоглицин. Дальнейшие превращения фор-
миминоглицина могут идти двумя путями (рис. 8-32): он может рас-
щепляться с образованием глицина и формиата (С. cylindrospo-
rum) или, через сериц и пируват, превращаться в ацетат и СОг
(С. acidi-urtci). Метаболический путь, ведущий к образованию гли-
цина и формиата, не включает реакций окисления или восстанов-
ления. АТР образуется из ADP и Pi путем субстратного фосфо-
рилирования в реакции, катализируемой формилтетрагидрофолят-
синтетазой. Когда продуктами превращения пуринов являются
ацетат и СОг, АТР синтезируется при участии ацетаткиназы.
Баланс водорода в этом метаболическом пути также остается
постоянным, поскольку NADPHs, потребляемый в реакции, ката-
лизируемой метилентетрагидрофолят-дегидрогеназой, регенерирует
за счет восстановленного ферредоксина, образующегося под дей-
ствием пируват : ферредоксин—оксидоредуктазы. При сбраживании
урата для его восстановления до ксантина требуются дополнитель-
ные восстановительные эквиваленты. У С. cylindrosporum это усло-
вие выполняется с помощью ферредоксин-зависимой формиатде-
гидрогеназы. У С. acidi-urici, как и у Peptococcus anaerobis, часть
Бактериальное брожение
241
НООС-СН2 —NH-CH=NH
Формиминоглицин
Глицин
З-формшиияо-Щ-фолят
NHj
5-формимляо-^- фолят
2
NH3
5, \О-метенил -Щ-фолят
1О-форлягл-РЦ-фолят
АТР
ADP + Р,
5, ХЪ-метенил -Щ-фолят
5
5, ХЪ-метилен-Щ-фолялг
б] _ -
У^ицин [
Серин
71
P^NH3
Пируват
L- Fd, ADP, Р,
8С
f4** Fd • Н2, АТР
{ицегат+ СО2 [
Рис. 8-32. Превращение формиминоглицина в глицин + формиат и ацетат + СО>
1 — глнцин-формиминотрансфераза, 2 — формимино-Н4-фолят—циклодезаминаза;
3 — метенил-Нгфолятциклогидролаза; 4— формил-Н4-фолят-синтетаза; 5 — мети-
лен-Нгфолят—дегидрогеназа; 6 — серин-гидроксиметилтрансфераза; 7 — серинде*
гидратаза; 8 — пируват 5 ферредоксин—оксидоредуктаза + фосфотрансацетилаза+
4-ацетаткиназа.
глицина превращается в серин при участии глицин-синтазы и се-
рин-гидроксиметилтрансферазы (рис. 8-26). Этот процесс сопряжен
с восстановлением NAD.
Известно, что некоторые бактерии сбраживают пиримидины,
например Clostridium uracilium и С. oroticum. Урацил распадается
до р-аланина, СО2 и NH3, а оротовая кислота — до ацетата, СО2
и NH3. Обычно же пиримидины не сбраживаются так легко, как
пурины.
IX. Выводы
1. Брожение — темновой анаэробный процесс. При брожении
АТР синтезируется путем субстратного фосфорилирования и (или)
фосфорилирования при транспорте электронов.
2. У строго анаэробных бактерий отсутствуют ферменты ката-
лаза и пероксид-дисмутаза; для роста этих бактерий необходим;
низкий окислительно-восстановительный потенциал.
248
Глава 8
3. Дрожжи сбраживают глюкозу до этанола и СОз. Ключевым
ферментом такого типа брожения служит пируватдекарбоксилаза.
На I моль сбраживаемой глюкозы образуются 2 моля АТР; ско-
рость распада глюкозы увеличивается при переносе дрожжей из
аэробных условий в анаэробные (эффект Пастера).
Бактерии Zymomonas, Sarcina ventriculi и Erwinia amylo-
vora вызывают спиртовое брожение. Этанол, синтезируемый в
небольших ' количествах молочнокислыми бактериями, энтеро-
бактериями и клостридиями, образуется путем восстановления аце-
тил-СоА.
4. У молочнокислых бактерий при сбраживании гексоз осуще-
ствляются гомоферментативный, гетероферментативный или би-
фидный типы метаболизма. Прл гомоферментативном молочнокис-
лом брожении из 1 моля глюкозы образуются 2 моля лактата, при
гетероферментативном брожении продуцируются лактат, этанол
и СОз, тогда как при бифидном типе брожения образуются ацетат
и лактат в соотношении 3:2. В двух последних типах брожения
роль ключевого фермента играет фосфокетолаза.
Молочная кислота образуется в разных формах: D(—), L( + )
и DL; молочнокислые бактерии содержат D-лактатдегидрогеназу,
L-лактатдегидрогеназу или смесь этих ферментов. Отдельные про-
дуценты DL-формы молочной кислоты содержат L-лактатдегидро-
геназу плюс рацемазу.
Lactobacillus plantarum и некоторые другие виды бактерий
сбраживают малат до лактата и СОг (яблочно-молочнокислое бро-
жение). Streptococcus cremoris и Leuconostoc cremoris образуют
из цитрата диацетил. Цитрат распадается до ацетата и оксалоаце-
тата при участии цитрат-лиазы, а конечной стадией синтеза диаце-
тила является конденсация ацетил-СоА с гидроксиэтилтиаминпи-
рофосфатом.
При изучении роста молочнокислых бактерий было установле-
но, что на 1 моль продуцируемого АТР может образовываться в
среднем 10,5 г клеток при условйи, что им доступны все мономеры,
необходимые для процессов биосинтеза.
5. Основным продуктом брожения, вызываемого многими клост-*
ридиями, эубактериями, фузобактериями и бутиривибрионами, яв-
ляется бутират. При сбраживании сахаров до бутирата в качестве
промежуточных продуктов образуются пируват, ацетил-СоА, аце-
тоацетил-СоА и бутирил-СоА. Реакция превращения пирувата в
ацетил-СоА катализируется пируват: ферредоксин-оксидоредукта-
зой. Во многих видах брожения при участии гидрогеназы из вос-
становленного ферредоксина образуется Hs.
Некоторые клостридии (например, С. acetobutylicum) при зна-»
ченияХ pH ниже 4,5 образуют ацетон и бутанол. Образование
бутанола обусловлено синтезом ацетона.
Водородный баланс брожения можно определить на основании
величин О/В субстратов и продуктов или на основании количества
Бактериальное брожение
24»
тех атомов водорода в субстратах и продуктах, которые Способны
участвовать в окислительно-восстановительных реакциях.
С. kluyveri сбраживает этанол и ацетат до бутирата, капроата
и молекулярного водорода. Выделение Н2 тесно связано с син-
тезом этим микроорганизмом АТР. На 1 моль выделяющегося Нг
приходится 0,5 моля ацетил-СоА, участвующего в синтезе АТР.
У С kluyveri пируват синтезируется путем восстановительного
карбоксилирования ацетил-СоА, а оксалоацетат — в пируваткар-
боксилазной реакции. Следовательно, около 30% веществ клетки
С. kluyveri образуется из СО2. С. kluyveri содержит цитрат (ге)-
синтазу.
6. Микроорганизмы, относящиеся к родам Escherichia, Salmo-
nella и Shigella, вызывают смешанное брожение и образуют лак-
тат, ацетат, сукцинат, формиат, СО2 и Н2. Ферментами, характер-
ными для этого типа брожения, являются пируват—формиат-лиа-
за, катализирующая распад пирувата до ацетил-СоА и формиата,
и формиат—водород-лиаза, расщепляющая формиат до Н2 и СО2.
Пируват—формиат-лиаза быстро инактивируется кислородом.
7. Микроорганизмы, принадлежащие к родам Enterobacter,
Serratia и Erwinia, продуцируют меньше кислот, чем вышеупомя-
нутые энтеробактерии, но больше СО2, этанола и 2,3-бутандиола.
Первую стадию образования 2,3-бутандиола катализирует а-аце-
толактат-синтаза.
8. Clostridium propionicum и Megasphaera elsdenii образуют
пропионат из лактата акрилатным метаболическим путем. Лактил-
СоА и акрилил-СоА — промежуточные продукты этого пути. В ка-
честве переносчика водорода функционирует электронпереносящий
флавопротеид.
У пропионовых бактерий и других микроорганизмов, образую-
щих пропионат, имеется сукцинат-пропионатный метаболический
путь, в котором сукцинил-СоА и метилмалонил-СоА служат про-
межуточными соединениями. Взаимопревращения этих двух тио-
эфиров катализируются метилмалонил-СоА—мутазой, содержащей
кофермент Bj2.
Восстановление фумарата до сукцината с помощью фумаратре-
дуктазы — единственный.известный процесс, путем которого стро-
гие анаэробы синтезируют АТР в результате фосфорилирования
при переносе электронов. Фумаратредуктаза — фермент, связанный
с мембраной, — ассоциирован с менахиноном, а у многих микро-
организмов — с цитохромом типа b
9. Метанобразующие бактерии используют СО2Ч-Н2, формиат,
метанол и ацетат. Восстановл'ение СО2 до метана происходит через
стадию образования метил-В12 и метилкофермента М (2-метилмер-
каптоэтансульфоновой кислоты). Образование метана из смеси
СО2+Н2 должно приводить к синтезу АТР в результате фосфо-
рилирования при переносе электронов. Механизм этого процесса
не известен.
'250
Глава 8
Парциальное давление молекулярного водорода в иле, при
анаэробном пищеварении в рубце жвачных животных поддержи-
вается низким в результате жизнедеятельности метанобразующих
бактерий. Это создает благоприятные условия для роста микро-
организмов, образующих водород (межвидовой перенос водорода) t
Формиат не восстанавливается непосредственно до метана, снача-
ла он окисляется до СО2. У Methanosarcina barkeri прямым пред-
шественником метана служит метанол. При росте в присутствии
,этого субстрата АТР синтезируется путем субстратного фосфори-
лирования (реакция, катализируемая формилтетрагидрофолят-
синтетазой). Ацетат сбраживается до метана и СО2; при этом угле-
род метильной группы вместе со связанными с ним атомами во-
дорода превращается в метан.
10. С. formicoaceticum и С. thermoaceticum сбраживают 1 моль
гексозы с образованием почти трех молей ацетата. Ацетат образу-
ется в метаболическом пути Эмбдена — Мейергбфа— Парнаса и
путем восстановления СО2 до ацетата. Clostridium aceticum и
Acetobacterium woodii сбраживают смесь Н2 + СО2 до ацетата.
И. При сульфидном брожении окисление органических соеди-
нений сопряжено с восстановлением сульфата до сульфида. Суб-
стратом при восстановлении служит аденозин-б'-фосфосульфат
(АФС); у видов Desulfovibrio этот процесс проходит через стадии
образования сульфита, тритионата и тиосульфата. У видов Desul-
fotomaculum сульфит, по-видимому, прямо восстанавливается до
сульфида. В процессах восстановления сульфата и синтеза АТР
в результате фосфорилирования при переносе электронов участву-
ют такие переносчики электронов, как ферредоксин, цитохром с3,
рубредоксин и менахинон. Desulfuromonas acetoxidans окисляет
ацетат до СО2 и восстанавливает элементарную серу до сульфида.
12. Некоторые анаэробные бактерии вызывают брожение от-
дельных аминокислот: Clostridium propionicum сбраживает аланин,
Peptococcus anaerobius— глицин, С. pasteurianum и другие бакте-
рии— треонин, С. ietanomorphum — глутамат и С. sticklandii — ли-
зин. Сбраживание глутамата и лизина происходит при участии
кофермент В12-содержащих ферментов.
Некоторые протеолитические клостридии вызывают совместное
брожение пары аминокислот (реакция Стикленда). Окисление
одной аминокислоты (например, аланина) сопряжено с восстанов-
лением другой аминокислоты (например, глицина).
Такие микроорганизмы, как С. acidi-urici,. cylindrosporum и
С. uracilium, специализировались на сбраживании пуриновых и
пиримидиновых оснований. С. acidi-urici сбраживает урат с обра-
зованием ацетата, СО2 и аммиака.
Глава 9
ХЕМОЛИТОТРОФНЫЙ И ФОТОТРОФНЫЙ
МЕТАБОЛИЗМ
Хемолитотрофные и фототрофные бактерии обычно способны
расти на минеральной среде, используя в качестве источника уг-
лерода СО2. Восстановительные эквиваленты, необходимые для
ассимиляции СО2, бактерии получают из неорганических соедине-
ний, а энергию — в результате фотохимических реакций или путем
окисления неорганических соединений кислородом или нитратами.
I, Хемолитотрофный метаболизм
А. Физиологические группы хемолитотрофов
Как уже отмечалось, хемолитотрофы получают энергию при
окислении неорганических соединений. В зависимости от природы
окисляемого неорганического соединения различают пять групп
хемолитотрофов (табл. 9-1). В таблице приведены уравнения
протекающих реакций и соответствующие величины изменения
свободной энергии.
Водородокисляющие бактерии имеют ту общую особенность,
что все они используют молекулярный водород в качестве источ-
ника энергии. Однако они сильно различаются по своим физиоло-
гическим и морфологическим свойствам. Поскольку все бактерии,
принадлежащие к этой группе, являются факультативными хемо-
литотрофами, таксономисты обычно рассматривают их вместе с
хемогетеротрофными родственными организмами. К водородокис-
ляющим бактериям относятся Pseudomonas saccharophila, Р. faci-
lis, Alcaligenes eutrophus, Nocardia autotrophica и Paracoccus de-
nitrificans1. Последний в качестве акцептора электронов может
использовать нитрат вместо кислорода.
К бактериям, окисляющим соединения серы, относятся тиоба-
циллы, Thiomicrospira pelophila, морская спиральная форма, и
Sulfolobus, термофильные бактерии с клетками неправильной фор-
мы. Кроме того, нитчатые скользящие бактерии, такие, как Beggia-
1 В последнее время выделен еще ряд бактерий, способных расти в авто-
трофных условиях, окисляя Н2.— Прим. ред.
252
Глава 9
toa и Thiothrix1, способны окислять сульфиды до свободной серы
и далее до сульфатов. Большинство серобактерий — облигатные
хемолитотрофы. Но некоторые из них, например Т. intermedius,
могут расти как аэробные гетеротрофы. Т. denitrificans способны
использовать в качестве акцепторов электронов вместо кислорода
дитраты.
Thiobaeillus ferrooxidans способен использовать в качестве до-
норов электронов либо восстановленные соединения серы, либо
ионы двухвалентного железа. Железобактерии Gallionella, возмож-
но, также получают энергию при окислении Fe2+ до Fe3+. Измене-
ние свободной энергии при окислении Fe2+ при низких значениях
pH достаточно велико для синтеза АТР; в средах с нейтральной
реакцией среды (при значениях pH^7) изменение свободной энер-
гии незначительно, и при рН>4 железобактерии расти не могут.
Окисление аммиака до нитритов осуществляют бактерии родов
Nitrosomonas, Nitrospira, Nitrosovibrio и Nitrococcus. Все они от-
носятся к облигатным хемолитотрофам, так же как и окислители
-нитритов Nitrobacter, Nitrospina, Nitrosovibrio и Nitrococcus, за
исключением некоторых штаммов Nitrobucter. Поскольку нитриты
очень токсичны для большинства организмов, процессы образова-
ния и окисления нитритов имеют очень большое значение.
Б. Получение энергии и генерирование
восстановительных эквивалентов
Растущая культура водородокисляющих бактерий потребляет
Н2, Og и С02 в соотношениях, примерно соответствующих следую-
щим уравнениям реакций:
4Н2+2О2—>4Н2О
2Н2+СО2—НСН2О > +Н20
6Н2+20г+СО2—{ СН2О)~+5НаО.
Таким образом, количества АТР, образующегося при окисле-
нии 4Н2 до воды, вполне достаточно для построения клеточного
материала (< СН2О > ) из С02 и Н2.
АТР синтезируется в результате окислительного фосфорилиро-
вания, как и при аэробном дыхании гетеротрофов. Во фракции
мембран водородокисляющих бактерий обнаружены цитохромы,
убихинон и менахинон. Различия между видами водородокисляю-
щих бактерий касаются переноса электронов от Н2 к компонентам
Дыхательной цепи. Nocardia ораса содержит растворимую гидро-
геназу, которая катализирует восстановление NAD молекулярным
1 Эти бактерии, по имеющимся данным, не получают энергии при окислении
сульфида и являются гетеротрофами, как и ряд микроорганизмов, называемых
железобактериями. — Прим. ред.
Физиологические группы хемолитотрофов I
Таблица 9-1
Группа» Реакцииг-приводящие к синтезу АТР Дб'о
ккал/реакция ккал/2 е—
Водородные бактерии 1 Нг+ "Оа *Н2О —56,7 (—237,2) —56,7(—237,2)
Серобактерии S2-+2Oa—*8ОЛ- —189,9(—794.5) —47,5(—198,6)
S°+l ^Oa+H2O^SO*2"+2H+ —139,8(—584,9) —46,6(—195,0)
Железобактерии 1 1 Fe2+ + “О2+Н+—Fe3++—Н2О 4 2 —10,6i)(-44,4) , —21,2Х>(—88,8)
Бактерии, окисляющие аммиак 1 NH4+ +1 ~О2—NOa-+2Н++Н2О 2 । —64,7(—270,7) —21,6(—90,2)
Бактерии, окисляющие нитриты 1 NOa + "О2" kNOa~ —18,5(—77,4) —18,5(-77,4)
1 Приведены значения Дб0' при рН=0; железобактерии могут расти только при низких значе-
ниях pH. Значение Дб'о при pH=7,0 составило бы —1 ккал/реакция. В скобках даны значения в ки-
лоджоулях.
2 Хемолитотрофы есть и среди строгих анаэробов, в частности метанобразующих бак-
терий,— Прим." ред.
254
Глава 9
Гчдро генеза,
связанная
с субклеточными
Рис. 9-1. Функция двух гидрогеназ у A. eutrophus, Р. saccharophila и Р. г uhlan-
diL [Schlegel Н. G. Antonie van Leuwenhoek, 42, 181—201 (1976),]
водородом. Продукт реакции NADHa служит донором водорода
для компонентов дыхательной цепц. Nocardia ораса представляет
собой исключение. У всех остальных изученных водородокисляю-
щих бактерий имеется связанная субклеточными частицами гидро-
геназа, которая непосредственно передает электроны в дыхатель-
ную цепь. Этот фермент не взаимодействует с NAD.
Некоторые водородокисляющие бактерии (Alcaligenes eutro-
phus, Pseudomonas saccharophila и P. ruhlandii) кроме фермента,
связанного с субклеточными частицами, содержат растворимую
гидрогеназу, которая восстанавливает NAD и обеспечивает обра-
зование в ’первую очередь NADH2 для восстановления СО2. Функ-
ции двух гидрогеназ у этих микроорганизмов показаны на рис. 9-1.
Такие водородокисляющие бактерии, как, например, Pseudomo-
nas facilis, Paracoccus denitrificans, содержат только связанную с
субклеточными частицами гидрогеназу, и не известно, каким обра-
зом они получают NADH2 для восстановления СО2. Скорее всего
у этих микроорганизмов, так же как и других хемолитотрофов,
имеет место обратный перенос электронов.
В табл. 9-2 приведены значения окислительно-восстановитель- '
ных потенциалов для ряда хемолитотрофных реакций. Очевидно,
что молекулярный водород служит хорошим восстановителем
NAD и используется для этих целей некоторыми водородокисляю-
щими бактериями. Из остальных реакций, осуществляемых хемо-
литотрофами, только две могут быть сопряжены с восстановлением
NAD: окисление H2S до серы и окисление сульфита до сульфата.
Однако экспериментального подтверждения существование таких
реакций пока еще не нашло. Соединения, подобные аммиаку или
нитритам, никак не могут служить для восстановления NAD, так
как их окислительно-восстановительный потенциал является слиш-
ком большой положительной величиной. Следовательно, у бакте-
Хемолитотрофный и фототрофиый метаболизм
255
Таблица 9-2
Окислительно-восстановительные
потенциалы основных реакций
хемолитотрофного метаболизма
£'о, В
Н2~*2Н+ + 2е- NADH +H+-^NAD++2e-f2H+ H3S~^S+2H++2e- S+3H2O-*SOs2-+6Н+ +4e- SO32- + H2O -* SOi2-+2H+4- 2e- NH4++2H2O —* NOa-+8H+-F 6e~ NOa- + H2O -* NO-г+2H+ + 2e- O2 4- 4НЧ* + 4e * 2H2O —0,41 —0,32 —0,25 +0,05 —0,28 +0,44 +0,35 +0,86
рий, окисляющих аммиак и нитрит (нитрификаторов), очевидно,
для восстановления NAD должен использоваться обратный перенос
электронов. Обратный перенос электронов означает, что электро-
ны переносятся по дыхательной цепи от компонента с положи-
тельным окислительно-восстановительным потенциалом к компо-
ненту с отрицательным потенциалом за счет энергии гидролиза
АТР. Процесс восстановления NAD у бактерий, окисляющих нит-
риты, представлен на рис. 9-2. Поток электронов от нитрита к
кислороду обеспечивает синтез АТР путем фосфорилирования,
сопряженного с переносом электронов. Поскольку нитрит имеет
положительный окислительно-восстановительный потенциал, пере-
нос пары электронов сопряжен с синтезом только одной молекулы
АТР. Значительная доля синтезируемого в этом процессе АТР
расходуется на образование NADH2 из NAD и нитрита. На пере-
нос пары электронов затрачивается, по-видимому, более трех мо-
лекул АТР. Поэтому неудивительно, что для роста Nitrobacter
необходимо окисление больших количеств нитрита и что растут
эти микроорганизмы очень медленно.
Обратный перенос электронов, по-видимому, используется при
восстановлении NAD также и у бактерий, окисляющих аммиак,
железобактерий и серобактерий. Те водородокисляющие бактерии,
у которых нет растворимой гидрогеназы, также могут использовать
этот механизм для образования NADH2.
По сравнению с окислением нитритов до нитратов, включаю-
щим перенос одной пары электронов, окисление аммиака и вос-
становленных соединений серы представляется процессом более
сложным. Первым и единственным точно известным промежуточ-
ным продуктом при окислении аммиака является гидроксиламин;
256
Глава 9
NADH2 NAD
Флавопротеид
Цитрохром Ь
Обратный
перенос
электронов
^ADP + Pj
АТР
Цитpox ом с
^ADP + P,
^-АТР
NO3 * Цит. а< и.......NOj
Фосфор и- 3
дарование ADP + Р
при переносе ' ‘
электронов ^АТР
V
Ри<?. 9-2, Сопряженное с переносом электронов фосфорилирование и обратный
перенос электронов у окислителей нитритов. Нитрит восстанавливает цитохром at,
Д перенос электронов на кислород сопряжен с синтезом АТР. NAD восстанавли-
вается при переносе электронов с цитохрома ai через цитохромы с, Ъ и флаво-
протеид. Энергию для транспорта электронов обеспечивает АтР.
он образуется в реакции, катализируемой монооксигеназой
(рис. 9-3). Окисление гидроксиламина до нитрита катализируется
ферментным комплексом, связанным с субклеточными структура-
ми, который состоит из гидроксиламин-цитохром-с—редуктазы, и
ферментной системой, окисляющей гипотетический промежуточный
продукт нитроксил (NOH) далее до нитрита. Из рис. 9-3 следует,
что только два электрона, освобождающиеся при изменении ва-
лентности атома азота с —1 до 4-1, поступают в дыхательную
цепь. Неизвестно, сколько молекул АТР образуется при переносе
двух электронов на кислород: одна или две.
Серобактерии могут в качестве восстановителей использовать
сульфиды, элементарную серу или тиосульфаты. Пути окисления
этих соединений до сульфатов показаны на рис. 9-4. Ферментная
система, окисляющая сульфид дд элементарной серы, неизвестна.
Однако легко можно наблюдать быстрое внутриклеточное образо-
вание элементарной серы хемолитотрофами, использующими H2S.
Хемолитотрофный и фототрофный метаболизм
257
Рис. 9-3. Схема окисления аммиака до нитрита. 1 — монооксигеназная реакция
(не сопряженная с синтезом АТР), 2 — гидроксиламин-цитохром-с—редуктаза,
сопряженная с концевой оксидазой; 3 — гипотетический нитроксил окисляется до
нитрита и регенерирует ХН2, косубстрат монооксигеназной реакции.
У нескольких серобактерий было обнаружено наличие раствори-
мого фермента, окисляющего серу. Соответствующие акцепторы
электронов пока не найдены. Обнаружены две ферментные систе-
мы, катализирующие окисление сульфита до сульфата. Сульфит-
оксидаза связана с мембраной; она осуществляет перенос элект-
ронов на цитохром с. Кроме того, у многих серобактерий имеется
аденозин-б^фосфосульфат—редуктаза. В этом случае цитохром с
также используется в качестве акцептора электронов. Образую-
щийся аденозин-5-фосфосульфат (АФС) далее превращается в
сульфат и ADP. Окисление сульфита до сульфата через АФС
сопровождается субстратным фосфорилированием (АМР—>-ADP).
Серобактерии, несомненно, синтезируют АТР путем фосфорилиро-
вания, сопряженного с переносом электронов. Однако неизвестно,
какое количество АТР синтезируется в результате потери восьми
электронов атома серы при окислении сульфида до сульфата.
Тиосульфат включается в цепь окислительных превращений се-
ры путем расщепления до сульфита и элементарной серы.
Рис 9-4 Пути окисления серы у хемолитотрофов 1 — неизвестный фермент;
2—фермент, окисляющий серу, 3 — сульфитоксидаза (сульфит-цитохром-с-окси-
доредуктаза); 4 — аденозин-5-фосфосульфат— редуктаза, АФС-аденозин-5'-фосфо-
сульфат; 5 — ADP-сульфурилаза, 6 — фермент, разрушающий тиосульфат (рода-
неза). [Suzuki I., Ann. Rev Microbiol, 28, 85—101 (1974).]
7—1895
258
Глава 9
В. Факультативные и облигатные хемолитотрофы
Как упоминалось, все до сих пор изученные водородокисляю-
щие бактерии относятся к факультативным хемолитотрофам. Они
растут в аэробных условиях на средах, содержащих сахара, ами-
нокислоты и органические кислоты, а некоторые из них — даже на
средах с пуринами и пиримидинами. Тем не менее у этих микро-
организмов преобладает хемолитотрофный тип метаболизма1. По-
этому в атмосфере Н2/О2 подавляется индукция ферментов, обес-
печивающих катаболизм органических субстратов. Пример такого
подавления приведен на рис. 9-5. Alcaligenes eutrophus в аэробных
условиях растет на средах с фруктозой, используя для расщепле-
ния фруктозы метаболический путь Энтнера — Дудорова. В атмо-
сфере Н2/О2 индукция ферментов пути Энтнера — Дудорова ре-
прессируется, и микроорганизмы в таких условиях не растут.
Механизм этой репрессии не известен. Возможно, он аналогичен
механизму катаболитной репрессии. В атмосфере Н2/О2 АТР обра-
зуется в достаточном количестве, и синтез ферментов катаболизма
может быть репрессирован независимо от наличия или отсутствия
СО2.
Некоторые водородокисляющие бактерии (например, Alcalige-
nes Zi) растут на среде с формиатом. Формиат используется как
квазихемолитотрофный субстрат и окисляется формиатдегидроге-
назой до СО2, которая ассимилируется так же, как и в хемолито-
трофных условиях. АТР образуется при окислении NADH2 в дыха-
тельной цепи.
Рис 9-5 Рост Alcaligenes eutrophus в аэробных условиях иа среде с фруктозой
и подавление роста смесью Н2 + О2 [Gottschalk G., Biochem Z, 341, 260—270
(1965).]
1 Не у всех видов. -- Прим, ред.
Хемолитотрофный и фототрофный метаболизм 259
Среди нитрифицирующих и серных бактерий редко встречаются
факультативные хемолитотрофы Лишь некоторые штаммы Nitro-
bacter очень медленно растут на среде с ацетатом. Thiobacillus
novellas,и Т. intermedins растут на средах с органическими суб-
стратами Другие тиобациллы, такие, как Т. thioparus, Т. neapoli-
tanus и Т. denitrificans, не могут использовать для роста органиче-
ские соединения Возникает вопрос: что лежит в основе облигат-
ного хемолитотрофного метаболизма? Для ответа на этот вопрос
может быть предложено несколько объяснений.
1. Клетки микроорганизмов могут быть непроницаемы для орга-
нических соединений Однако в отношении ряда облигатных
хемолитотрофов показано, что некоторые органические соедине-
ния проникают в клетки и включаются в клеточный материал.
2 Синтез АТР из органических субстратов может быть замедлен
или вообще невозможен Эта гипотеза, предложенная Стейние-
ром и сотрудниками, действительно представляется весьма ве-
роятной Хемолитотрофам не нужен полный цикл трикарбоно-
вых кислот. Показано, что у большинства таких бактерий, как
и у неполных окислителей и некоторых строгих анаэробов, от-
сутствует а-оксоглутаратдегидрогеназа. Таким образом, NADH2
для дыхательной цепи не может быть получен так, как это
обычно происходит у аэробных гетеротрофов. Кроме того, мож-
но допустить, что дыхательная цепь облигатных хемолитотрофов
не способна акцептировать электроны с NADH2, поскольку, как
мы видели, перенос электронов с неорганических субстратов
происходит на уровне цитохромов
3. Бактерии, окисляющие аммиак, и серобактерии в условиях ге-
теротрофного образа жизни могут страдать от недостатка ам-
миака и восстановленных соединений серы. Если, например,
Nitrosomonas инкубировать на воздухе в минеральной среде при
наличии органического субстрата, то аммиак в основном окис-
ляется до нитрита, что истощает источники азота, необходимого
для биосинтетических целей
Причины существования облигатной хемолитотрофии могут
быть различными у разных микроорганизмов. Однако особенности
этого типа метаболизма с большой долей уверенности можно объ-
яснить спецификой энергетического обмена и (или) недостатком
аммиака или восстановленных соединений серы.
Г. Окисление окиси углерода
Показано, что несколько видов микроорганизмов растут в
аэробных условиях в присутствии СО (например, Hydrogenotnonas
carboxydovorans Кистнера и Seliberia carboxyhydrogena Заварзи-
на)1. СО окисляется до СО2, а перенос освобождающихся элект-
1 Обе эти бактерии сейчас относят к роду Pseudomonas. — Прим. ред.
17*
260
Глава 9
ронов на кислород сопровождается синтезом АТР. Микроорганиз-
мы, использующие СО, способны также окислять молекулярный
водород и относятся к физиологической группе водородокисляю-
щих бактерий.
II, Ассимиляция C(h
Хемолитотрофы восстанавливают СО2 и превращают его в кле-
точный материал, используя энергию АТР и восстановительные
эквиваленты, полученные при окислении неорганических субстра-
тов. СО2 служит единственным источником углерода для таких
микроорганизмов, поэтому их часто называют С-автотрофами.
Фиксация СО2 у хемолитотрофов осуществляется в результате
цикла Кальвина — того же механизма, который действует и у зе-
леных растений и который был обнаружен Кальвином, Бенсоном
и Бассамом у зеленых водорослей.
А. Реакции цикла Кальвина
Фиксация СО2 в цикле Кальвина происходит в реакции, ката-
лизируемой рибулозо-1,5-бисфосфат-карбоксилазой, а первичным
стабильным продуктом фиксации СО2 является 3-фосфоглицерат
(рис. 9-6,А). Карбоксильная группа, входящая в состав одной из
двух образующихся молекул 3-фосфоглицерата, содержит углерод
из СО2.
В двух последующих реакциях карбоксильная группа 3-фосфо-
глицерата восстанавливается до альдегидной группы. В этих ре-
ч СН2О® сн2о© сн2о® неон
СО2 V=o С(ОН)-СООН соон.
+ неон с~о
1 1 неон 1 неон i * 1 соон
СН2О® сн2о® неон
А Фиксация со2 сн2о©
СН2О(р) ATP ADP
неон >—bs—
1 2
соон
СН2О©
неон
соо©
сн2о©
неон
сно
NADH2 NAD
P,
5 Ъссстанобление со2
Рис. 9-6. Две первые стадии цикла Кальвина, фиксация СО2(А) и восстановле-
ние СО2 (Б). 1 — рибулозо-1,5-бисфосфат—карбоксилаза. 2 — карбокси-3 кетори-
битол-1, 5-бисфосфат— нестабильный промежуточный продукт, 2—3-фосфоглице-
раткиназа; 3—глицеральдегид-3 фосфат—дегидрогеназа.
Хемолитотрофный и фототрофный метаболизм 261
акциях участвуют ферменты фосфоглицераткиназа и глицеральде-
гид-3-фосфат — дегидрогеназа (рис. 9-6, £>).
В процессе фиксации и восстановления СОг одна молекула
рибулозо-1,5-бисфосфата превращается в две молекулы глице-
ральдегид-3-фосфата. В том случае, если глицеральдегид-3-фосфат
используется только для биосинтетических процессов, фиксация
СО2 вскоре прекращается из-за недостатка рибулозобцсфосфата.
Поэтому у бактерий должен существовать и третий процесс — реге-
нерация акцептора СО2. Этот процес включает целую серию реак-
ций; с большинством из них мы познакомились при обсуждении
гликолитического и пентозофосфатного метаболических путей
(рис. 2-2, 3-9, 5-10). Часть образующегося глицеральдегида-3-фос-
фата при участии триозофосфат-изомеразы, фруктозо-1,6-бисфос-
фат—альдолазы и фосфатазы сначала превращается во фруктозе-
6-фосфат (рис. 9-7). Затем одна молекула фруктозо-6-фосфата,
две молекулы глицеральдегид-3-фосфата и одна молекула дигид-
роксиацетонфосфата взаимодействуют друг с другом с образова-
нием двух молекул ксилулозо-5-фосфат4 и одной молекулы рибо-
зо-5-фосфата.
При сравнении цикла Кальвина с пентозофосфатным циклом
гетеротрофов следует отметить одно важное различие. У гетеро-
трофов в пентозофосфатном цикле участвует фермент альдолаза,
катализирующий обратимую реакцию образования седогептулозо-
7-фосфата и глицеральдегид-3-фосфата из эритрозо-4-фбсфата и
фруктозо-6-фосфата. В цикле Кальвина эту реакцию заменяют об-
ратимая реакция, катализируемая седогептулозо-1,7-бисфосфат —
альдолазой, и необратимая реакция, катализируемая фосфатазой.
Это обеспечивает однонаправленное поступление субстрата к пен-
тозофосфатам, которые после реакций эпимеризации и изомери-
зации в конечном счете фосфорилируются фосфорибулокиназой с
образованием акцептора СО2.
Углеродный баланс всего цикла Кальвина схематически можно
изобразить следующим образом:
ЗС6+ |~ЗС0Г1---► 5Сз +1 ст!
Фиксация и восстановление
5Q ----ЗС5
Регенерация
Количества АТР и NADHs, требующиеся для образования од-
ной молекулы глицеральдегид-3-фосфата (ГАФ) из СОг, видны
из следующего уравнения:
ЗСО2 + 9АТР + 6NABH2 ---► ГАФ + 9ADP + 8Р, 4- 6NAD.
Полностью цикл Кальвина показан на рис. 9-8.
18—1896
262
Глава 9
, ОН
_ 1 I
®O«tC-CO-CHaOH3₽ ОНС-С-СН2О®
х. 2 .Z 1
ОН ОН
ОНС-С~С-СН2О®
н и
Зри/прозо-А-Я
5
н он он он
(р) он2 с- со с - С - С - С~СН2 О ©
онн н и
Седогешпуюзо-\> 7-Р2
Н он он он
1 ! I 1 _
НОН2С-СО-С — С — С — С-СН2О (р)
ОНН н и
j/fcwrjWP3o-5-P [
3 АТР 3ADP
\ g X
3 PvlfyjrojQ-S-? • -г » iPufyiMhli 5-Р2
2Лгг/лулйзр-5-Р ^^7
х Рибоза ’5-Р/Х^
Рис. 9-7. Третья стадия цикла Кальвина, регенерация акцептора. I — триозофос-
фатизомераза; 2 — фруктозо-1,6-бисфосфат—альдолаза; 3 ~ фруктозо-1,6,-бисфос-
фатаза; 4 — транскетолаза; 5—седогептулозо-1,7-бисфосфат—альдолаза; 6 — ре-
акция, катализируемая фруктозо-1,6-бисфосфатазой; 7—фосфопентозоэпимера-
за; 8 — рибозофосфатизомераза; 9 — фосфорибулокиназа.
фруктозо-6-фосфат, Ф-Р2— фруктозо-1,6-бисфосфат; Э-4-Р — эритрозо-4-фосфат;
Су-Р2 — седогептулозо-1,7-бисфосфат; Су-7-Р — седогептулозо-7-фосфат; Ксу-5*
Р — ксилулозо-5-фосфат, Ри-5-Р — рибозо-5-фосфат; Ру-5-Р — рибулозо-5-фосфат.
Б. Фосфорибулокиназа
и рибулозо-1,5-бисфосфат — карбоксилаза
Ключевыми ферментами цикла Кальвина можно считать два
фермента — фосфорибулокиназу и рибулозо-1,5-бисфосфат — кар-*
боксилазу. Эти ферменты встречаются только у организмов, спо-
собных фиксировать СОз в цикле Кальвина. Наличие данных фер-
ментов у хемолитотрофов служит основным доводом в пользу
функционирования такого метаболического цикла у этих орга-
низмов. Кроме того, показано, что у хемолитотрофов, так же как
и у зеленых растений, 3-фосфоглицерат является главным продук-
том фиксации СОз.
Фосфорибулокиназа изучена недостаточно хорошо. Положи-
тельным эффектором этой киназы у Pseudomonas facilis и некото-
рых других хемолитотрофов служит NADH2. АМР ингибирует
этот фермент, что предотвращает непроизводительный расход
18*
264
Глава 9
Таблица 9-3
Структура рибулозо-1,5-бисфосфат—карбоксилазы
у различных организмов
Организм Число субъединиц!)
большие малые
Rhodospirillum rubrum 2 0
Thiobacillus intermedins 8 0
Alcaligenes euirophus 8 8
Pseudomonas facilis 8 8
Водоросли и высшие растения 8 8
’) Примерная мол. масса большой субъединицы равна 54 000, малой субъ-
единицы —13 000.
энергии АТР. Интересно, что фосфоенолпируват, как оказалось,
относится к сильным ингибиторам фосфорибулокиназы Р. facilis;
таким образом, накапливание фосфоенолпирувата препятствует
дальнейшему образованию рибулозо-1,5-бисфосфата, а следова-
тельно, и последующему образованию фосфоглицерата.
СН2О®
С=О
неон
неон
I
СН2О®
о2 сн2о® соон
—соон + неон
сн2оф
- Рибулозо-1,5-бисфосфат—карбоксилаза была выделена из мно-
гих фототрофных и хемолитотрофных микроорганизмов. Структура
этого фермента у разных бактерий различна. Как видно из
табл. 9-3, существуют три типа рибулозо-1,5-бисфосфат — карбокси-
лазы. У большинства микроорганизмов этот фермент состоит из
восьми больших и восьми малых субъединиц. Карбоксилаза Thio-
bacillus intermedius состоит из восьми больших субъединиц. По
сравнению с этими типами больших ферментов карбоксилаза
Rhodospirillum rubrum удивительно мала; она состоит только из
двух больших субъединиц. Эти различия в структуре фермента
указывают на то, что каталитическую функцию выполняет боль-
шая субъединица. Функция малой субъединицы неизвестна.
Активный рибулозо-1,5-бисфосфат—карбоксилазный комплекс
включает фермент Mg2+, рибулозо-1,5-бисфосфат и С02. В отсут-
ствие СО2 и при наличии кислорода рибулозо-1,5-бисфосфат —
карбоксилаза катализирует другую реакцию, оксигенолитический
Хемолитотрофный и фототрофный метаболизм 265
распад рибулозо-1,5-бисфосфата, приводящую к образованию фос-
фогликолата и фосфоглицерата.
Фосфогликолат превращается в гликолат под действием фос-
фатазы, а гликолат участвует в фотодыхании растений. Фото-
трофные и хемолитотрофные бактерии также образуют гликолат,
часть которого выделяется в среду.
Рибулозо-1,5-бисфосфат—карбоксилаза сильно ингибируется
6-фосфоглюконатом1. Для факультативных хемолитотрофов это
представляется рациональным. Образование 6-фосфоглюконата
служит сигналом о том, что функционирует окислительный пен-
тозофосф атный цикл и что в клетке имеется достаточное количе-
ство органических субстратов. Активная рибулозо-1,5-бисфосфат—
карбоксилаза в таких условиях не требуется.
Ш. Фототрофный метаболизм
У зеленых растений^ и цианобактерий (сине-зеленых водоро-
слей) фотосинтез сопровождается выделением кислорода. В отли-
чие от этого у фототрофных (пурпурных и зеленых) бактерий фо-
тосинтез происходит только в анаэробных условиях и без выделе-
ния кислорода. Поскольку фототрофные бактерии не могут исполь-
зовать воду в качестве источника водорода, для их роста требу-
ются другие Н-доноры. Такими донорами служат восстановленные
соединения серы, молекулярный водород и органические соедине-
ния. Однако не каждый Н-донор может быть использован каждым
видом фототрофов. В зависимости от природы соединений, пред-
почтительнее используемых в качестве Н-доноров, и других
свойств различают три семейства фототрофных бактерий: Rho-
dospirillaceae, Chromatiaceae и Chlorobiaceae.
А. Три семейства фототрофных бактерий
Некоторые свойства фототрофных бактерий суммированы в
табл. 9-4. Восстановленные соединения серы в качестве доноров
водорода в основном используются Chromatiaceae и Chlorobiaceae.
Только некоторые виды Rhodospirillaceae (например, Rhodopseu*
domonas palustris) используют в качестве доноров водорода тио-
сульфат и сероводород; ни один из этих видов не способен окис-
лять элементарную серу. Представители всех трех семейств фото-
трофных бактерий способны восстанавливать СОа молекулярным
водородом.
Отношение фототрофов к органическим субстратам различно.
Зеленые серные бактерии могут ассимилировать на свету только
простые органические соединения, такие, как ацетат и бутират;
они не растут в отсутствие СОа и восстановленных соединений се-
ры. Некоторые пурпурные серобактерии используют органические
1 Не у всех организмов. — Прим. ред.
Таблица 9-4
Некоторые Свойства, трех семейств фототрофных бактерий
Rhodospirillaceae (пурпурные несерные бактерии) Chromatiaceae (пурпурные серо- бактерии) Chlorobiасеае (зеленые бактерии)
Вид бактериохлорофилла (Бхл) Бхл а или b Бхл а или Ь Бхл с, d или е1)
Использование H2S в качестве Н-донора — (некоторые +) 4- +
Отложение в клетках S0 и использование S0 в ка- — + 4-2)
честве Н-донора
Использование Нг в качестве Н-донора + + \ +
Использование органических субстратов в качест- + + —
ве Н-донора
Источник углерода СО2 СОз СО2
Органические суб- Органические суб- Органические суб-
страты страты страты
Рост в темноте в аэробных условиях31 + —- ——
п Зеленые бактерии в небольшом количестве содержат также Бхл а.— Прим. ред.
2) Серу в клетках не накапливают, но окисляют. — Прим. ред.
з) Некоторые пурпурные бактерии могут расти в темноте и в анаэробных условиях.—Прим. ред.
Хемолитотрофный и фототрофный метаболизм
267
Рис 9-9 Типичные каротиноиды зеленых серобактерий (4) и пурпурных бакте-
рий (Б). А — изорениератин, Б — спириллоксантин
субстраты даже в отсутствие восстановленных соединений серы и
растут как фотогетеротрофы Наконец, несерные пурпурные бакте-
рии способны расти как фотогетеротрофы или — в присутствии
кислорода — как хемогетеротрофы, ассимилирующие преимущест-
венно органические кислоты. Только один вид серных бактерий,
Thiocapsa roseopersicina, растет в темноте в условиях слабой
аэрации* 1. Следует подчеркнуть, что анаэробные условия необхо-
димы для бактериального фотосинтеза. Поэтому Rhodospirillaceae
растут на воздухе как хемогетеротрофы независимо от наличия или
отсутствия света.
Кроме перечисленных метаболических особенностей представи-
тели разных семейств фототрофных бактерий различаются по
ряду характерных черт. Фотосинтезирующий аппарат зеленых се-
робактерий организован в виде везикул, которые окружены мем-
браной, непроницаемой для электронов. Везикулы располагаются
непосредственно под плазматической мембраной и легко отличимы
от нее2. Фотосинтезирующий аппарат большинства пурпурных бак-
терий, организован в виде внутрицитоплазматической мембранной
системы, образующейся в результате впячиваний плазматической
мембраны.
Различные бактериохлорофиллы (Бхл), встречающиеся у фото-
трофов, перечислены в табл. 9-4, а их строение — в табл. 9-5.
У фототрофных бактерий были обнаружены также типичные кара-
тиноиды. Зеленые серобактерии в основном содержат ароматиче-
ские каратиноиды; в качестве примера на рис. 9-9 приведена
формула изорениератина. Типичным каратиноидом ряда пурпурных
бактерий является спириллоксантин.
1 Ряд пурпурных серобактерий могут расти в темноте —Прим. ред.
1 Везикулы (хлоросомы) зеленых бактерий содержат пигменты антенны
(светособирающей функции) Реакционные центры, видимо, находятся в плазма-
тической мембране —Прим. ред.
Таблица 9-5
СН2
с=*о
о
&
Химическая структура различных видов бактериохлорофиллов.
В бактериохлорофиллах а и b углеродные атомы 3 и 4
связаны одинарной связью1)
Заместитель Бактериохлорофилла) ! ... . .... . ....
a 1 \ b c d ?
Ri —CO—CH8 —CO-CHS —CHOH-CH3 —снон-сн3 снон—сн3
r2 —CH3 -СНз -СНз -СНз —СНО
Rs -ед =сн—сн3 -ед -ед -ед
R4 -<H3 -CH3 -ед -ед -ед
Rs —CO-OCH3 —CO—OCH3 —н —н —Н
R6 Фитил Фитил Фарнезил Фарнезил Фарнезил
r7 —H —H -сн3 —Н -сн9
n Gloe A, Pfennig N., Brockmann Н, Trowitzsch W, Arch, Microbiol,* 102, 103—109
(1975). |
2) Бактериохлорофиллы могут быть этерифицированы и другими спиртами, например ге-
ранидгераниолом ред.
Хемолитотрофный и фототрофный метаболизм 269>
Недавно были опцсаны фототрофные скользящие бактерии.
Бактерии вида Chloroflexus aurantiacus? типичные представители
этой группы, содержат везикулы и обнаруживают сходство с зе-
леными серобактериями, но могут расти как гетеротрофы и в>
аэробных условиях. Возможно, что эти микроорганизмы образуют
четвертое семейство фототрофных бактерий1. К особой группе-
фототрофных прокариот относятся образующие кислород циано-
бактерии2 и Prochlorort.
Б. Реакции фотосинтезирующего аппарата
Фотосинтезирующий аппарат содержит все необходимые ком-
поненты для превращения световой энергии в энергию АТР. О»
организован в виде внутрицитоплазматической мембранной систе-
мы (у пурпурных бактерий) или в виде везикул (у зеленых бак-
терий) . В фотосинтезирующем аппарате осуществляются три слож-
ные реакции.
1. Поглощается свет. Это происходит при участии так называемых
пигментных комплексов антенны, которые включают бактерио-
хлорофилл и каротиноиды. Такие комплексы часто называют
также светособирающими центрами. Спектральные^ свойства
бактериохлорофилла и каротиноидов и их взаимодействие с
.белками определяют область спектра, в которой поглощение-
света происходит у данного организма наиболее эффективно.
Целые клетки фототрофов способны поглощать свет в двух
диапазонах длин волн: между 400 и 500 нм и между 700 и
1000 нм. Изолированные бактериохлорофиллы поглощают свет
более коротких длин волн (соответственно около 400 и 700 нм).
Сдвиг поглощения бактериохлорофиллов в сторону длинновол-
новой области спектра происходит в результате их взаимодей-
ствий с белками пигментных комплексов антенны3. Сдвиг мак-
симума поглощения в ближнюю инфракрасную область позво-
ляет фототрофным бактериям использовать для фотосинтеза ту
часть спектра, в которой отсутствует поглощение у зеленых
растений и цианобактерий.
Каротиноиды обеспечивают максимальное поглощение света
целыми клетками в области 400—500 нм. Они обусловливают
пурпурную и коричневатую окраску фототрофов и защищают
клетки от повреждений при фотоокислении Кроме того, каро-
тиноиды участвуют в передаче энергии света.
2. Под воздействием световой энергии из молекулы бактериохло-
рофилла выбивается электрон. Это происходит в реакционном
1 Таким семейством является Chloroflexaceae.— Прим. ред.
s Некоторые цианобактерий способны осуществлять фотосинтез без выделе-
ния О2 В качестве Н-донора у них используется сероводород — Прим. ред.
• Имеет также значение взаимодействие самих молекул пигментов, их агре-
гация — Прим, ред
270
Глава 9
центре. Энергия возбуждения передается с пигментных комп-
лексов антенны на реакционные центры, в состав которых вхо-
дят бактериохлорофилл, бактериофеофитин (не содержащий
магния бактериохлорофилл), каротиноид, убихинон и белки.
Благодаря сильным взаимодействиям с белками и другими
компонентами бактериохлорофилл реакционного центра особен-
но активен, и при поглощении одного кванта света один элект-
рон переносится с бактериохлорофилла в электронпервносящую
цепь:
Бактериохлорофилл реакционного центра 4-Энергия света—>-
—>-Бактериохлорофилл++е~
Реакционный центр часто называют Р870, где 870 — длина вол-
ны, при которой потеря центром электрона вызывает макси-
мальное выцветание.
3. Бактериохлорофилл реакционного центра восстанавливается в
результате взаимодействия с цитохромом типа с, имеющим вы-
сокое значение окислительно-восстановительного потенциала
(например, с цитохромом с2). По электронпереносящей цепи,
через переносчики X и убихинон электрон переносится от пиг-
мента реакционного центра на цитохром с. Этот процесс со-
пряжен с фосфорилированием ADP при помощи такого же ме-
ханизма, как и в дыхательной цепи.
Рис 9-10 Светозависимый циклический перенос электронов и фосфорилирование
у фототрофных бактерий. Бхл* — бактериохлорофилл реакционного центра; X —
первичный акцептор электронов.
Хемолитот рофный и фототрофный метаболизм
271
Рис. 9-11 Выделение кислорода, нециклическое фосфорилирование и восстановле-
ние NADP у растений и цианобактерий. РЦ — реакционный центр; Q и Z — пер-
вичные акцепторы. Показан также и процесс циклического фотофосфорилирования
(РЦ I—>Z—>PZ I).
На рис. 9-10 приведена схема реакций, протекающих в фото-
синтезирующем аппарате. Процесс в целом известен под назва-
нием циклического фотофосфорилирования1.
В. Генерирование восстановительных эквивалентов
Для превращения СОг в клеточный материал фототрофам не-
обходима не только энергия АТР, но и наличие восстановительных
эквивалентов. У растений и цианобактерий восстановительные
эквиваленты образуются из воды в процессе нециклического фото-
фосфорилирования1. Для этого процесса требуется вторая фото-
реакция. Схема процесса приведена на рис. 9-11. Под воздейст-
вием света (длина волны <680 нМ) окисляется молекула высоко-
активного хлорофилла реакционного центра II (фотосистема II).
Электрон от молекулы хлорофилла попадает на переносчик Q,
окислительно-восстановительный потенциал которого равен при-
мерно нулю. Отсюда электрон по цепи переноса электронов пере-
дается на реакционный центр (фотосистема I), где он замещает
электрон, который в процессе фотореакции I (длина волны =
1 Названия эти не очень точные. На самом деле происходит перенос электро-
нов по циклическому или нециклическому пути, сопряженный с фосфорилирова-
нием. — Прим. ред.
272 Глава 9 -
« ~700 нм) был перенесен на окислительно-восстановительную»
систему Z. Переносчик Z функционирует как восстановитель фер-
редоксина и NADP. Перенос электронов с Q на реакционный
центр I сопряжен с фосфорилированием ADP.
Окислительно-восстановительный потенциал реакционного цент-
ра II настолько положителен, что его окисленная форма может
быть восстановлена водой. По-видимому, вода взаимодействует
с окисленном Mn-белком (Y) с выделением кислорода, а Мп-белок
переносит электроны на хлорофилл реакционного центра II.
У фототрофных бактерий нет всех компонентов, необходимых
для осуществления фотореакции II. Поэтому они не способны ис-
пользовать воду в качестве Н-донора. Окислительно-восстанови-
тельные потенциалы Н-доноров, используемых фототрофными бак-
териями, имеют более отрицательное значение, чем у воды; дей-
ствительно, их значения обычно приближаются к величине
окислительно-восстановительного потенциала NAD. Значения Е'о
реакций окисления сульфида до серы, серы — до сульфита и суль-
фита— до сульфата равны —0,25, 4-0,05, и —0,28 В соответствен-
но (табл. 9*2). Поэтому для сопряжения окисления сульфида с
восстановлением NAD(P) не требуется больших энергетических
затрат. Окисление сульфида осуществляется через стадии образо-
вания элементарной серы, сульфита и аденозин-б'-фосфосульфата,.
как показано на рис. 9-4, а для переноса электронов на NAD(P),
по-видимому, используется тот же’ механизм, что и у хемолито-’
трофов, т. е. АТР-зависнмый обратный перенос электронов. Таким
образом, в отличие от фотосинтеза, протекающего с образованием
кислорода, у фототрофных. бактерий свет, по-видимому, только
косвенно участвует в образовании восстановительных эквивален-
тов; он обеспечивает синтез АТР путем циклического фотофосфо*
рилирования. Не исключено, однако, что у фототрофных бактерий
восстановление NAD(P) может также происходить в результате
сопряженного с фотофосфорилированием нециклического перенос#
электронов. Однако экспериментальных подтверждений существо-
вания такого механизма очень немного.
Окисление сульфида находится в строгой зависимости от фик-
сации СО2. Количественные соотношения потребляемого СО2 Ж
образующегося сульфата были описаны ван Нилом в виде еле*
дующих уравнений:
CO2+2H2S <CH2O>+2S + H2O
3COa+2S+5H2O <CH2O>+2H2SO4
4CO2+2H2S+4H2O 4<CH20> + 2H2SO4
Пока имеется сульфид, он окисляется бактериями преимущест*
венно до элементарной серы, которая накапливается в клеткам
Хемолитотрофный и фототрофный метаболизм 273
(у пурпурных серобактерий) или снаружи (у зеленых бактерий).
При низких концентрациях сульфида накопленная сера окисляется
дальше с образованием сульфата.
Многие фототрофные бактерии могут расти, используя в каче-
стве Н-донора молекулярный водород. Окислительно-восстанови-
тельная пара Н2/Н+ имеет потенциал Е'о=—0,42 В, и поэтому
водород может служить превосходным восстановителем для
NAD(P). Действительно, Н2 выполняет такую функцию у водород-
окисляющих бактерий и метанобразующих бактерий. Однако для
ряда фототрофов {Rhodospirillum rubrutn и Rhodopseudomonas cap-
sulata) показано, что восстановление NAD молекулярным водо-
родом является светозависимым процессом. Это означает, что свет
непосредственно не участвует в процессе восстановления NAD.
Как показано на рис. 9-12, цитохром с, обладающий высоким окис-
лительно-восстановительным потенциалом, восстанавливается мо-
лекулярным водородом, а для перекачивания электронов от цито-
хрома с к NAD требуется энергия АТР. По-видимому, у фототро-
фов отсутствуют ферменты, способные восстанавливать ферре-
доксин или NAD(P) непосредственно молекулярным водородом.
Фототрофная ассимиляция органических субстратов не всегда
связана с восстановлением NAD путем обратного переноса элект-
ронов. При росте бактерий на среде с этанолом, ацетатом и угле-
водами NADH2 образуется в обычных дегидрогеназных реакциях.
Однако окисление сукцината представляет собой АТР-зависимую
реакцию.
АТР
Сукцинат-hNAD --->- Фумарат+NADHa
Рис. 9-12 ATP-зависимое восстановление NAD молекулярным водородом у фо*
тотрофных бактерий.
274
Глава 9
Г. Углеродный метаболизм
При росте пурпурных бактерий на среде с двуокисью углерода
в качестве источника углерода они используют для ее фиксации
цикл Кальвина. Однако у зеленых серобактерий не обнаружены
ключевые ферменты этого цикла, фосфорибулокиназа и рибулозо-
1,5-бисфосфат—карбоксилаза, и механизм фиксации СО2 у этих
микроорганизмов неизвестен1. Рост Chlorobiaceae стимулируется
ацетатом. В этих условиях, как и у Clostridium kluyveri, пируват
синтезируется путем восстановительного карбоксилирования аце-
тил-СоА:
Ацетил-СоА + СО2 -J- FdH2 -► Пируват + Fd 4- СоА.
Эта реакция используется также пурпурными серобактериями
для синтеза пирувата при наличии ацетата и СО2. Rhodospirilla-
сеае растут на среде с ацетатом в анаэробных условиях на свету,
а также и в аэробных условиях. У Rhodospirillum tenue, Rhodop-
seudomonas palustris и Rhodomicrobium vanniellii имеются изоцит-
рат-лиаза и малат-синтаза. В качестве анаплеротической последо-
вательности реакций у них используется глиоксилатный цикл.
У таких видов, как Rhodospirillum rubrum и Rhodopseudomonas
sphaeroides, нет изоцитрат-лиазы, но имеется малат-синтаза. Ка-
ким образом у этих микроорганизмов образуется глиоксилат, не-
известно. Существует, однако, предположение, что пурпурные не-
серные бактерии используют глиоксилатный цикл для синтеза
Сгдикарбоновых кислот из ацетата, в то время как прямые реак-
ции карбоксилирования (Ацетил-СоА—^Пируват—^Оксалоацетат)
используются пурпурными серобактериями и зелеными бактерия-
ми2. Сахара не являются хорошими субстратами для фототрофных
бактерий. Многие виды фототрофов вообще нс используют саха-
ров. Но Thiocapsa roseopersicina так же, как Rhodospirillum rub-
rum, растет на среде с фруктозой. Rhodopseudomonas sphaeroides
и R. capsulata использует фруктозу и глюкозу. Расщепление фрук-
тозы у этих бактерий происходит по пути Эмбдена — Мейергофа —
Парнаса, а глюкозы — по пути Энтнера—Дудорова.
Rhodopseudomonas palustris растет в аэробных условиях на
среде, содержащей n-гидроксибензоат, который окисляется через
стадию образования протокатехата и путем .мета-расщепления.
Ключевых ферментов этого метаболического пути практически нет
в экстрактах клеток R. palustris, выросших в фототрофных ана-
эробных условиях в присутствии а-гидроксибензоата или бензоата»
1 Видимо, у зеленых серобактерий ассимиляция СОз происходит через осо-
бый цикл, называемый восстановительным циклом трикарбоновых кислот.—•
Прим. ред.
2 Показано, что Rhodospirillum rubrum также может образовывать пируват в»,
результате карбоксилирования ацетил-СоА. — Прим. ред.
Хемолитотрофный и фототрофный метаболизм
275
Вензаат
Циклогекс-1-еНч 2-гидроксицик-
^-карбоксилат логексан-
карбоксилат
2Н
2-оксо циклогексан-
карбоксилат
соон
(сна)у
соон
Пимелат
Рис. 9-13. Распад бензоата у Rh. palustris в анаэробных условиях на свету.
Благодаря этим данным был открыт новый путь распада арома-
тических соединений без участия Оз. Как показано на рис. 9-13,
бензоат восстанавливается до циклогекс-1-ен-1-карбоксилата, ко-
торый дальше распадается до пимелата. Насколько широко рас-
пространен данный метаболический путь у фототрофов, неизвестно.
Д. Фотообразование молекулярного водорода
Гест и Камен впервые наблюдали образование молекулярного'
водорода культурами Rhodospirillum rubrum при фототрофном
росте на органических кислотах в присутствии аминокислот (на-
пример, глутамата) в качестве источников азота. У нерастущих
клеток этих культур на свету осуществляется полное окисление
таких субстратов, как ацетат, лактат и малат, с образованием СО2
и Н2:
СН3СООН+2Н2О 2СО2+4Н2,
НООС—СН2—СИОН—СООН+ЗН2О 4СО2+6Н2.
Образование водорода на свету ингибируется NH4+ и N2, что
свидетельствует об участии нитрогеназы в процессе фотовыделе-
ния Н2. Подобно другим представителям Rhodospirillaceae, Rho-
dospirillum rubrum способен фиксировать молекулярный азот. Син-
тез нитрогеназы (гл. 10) дерепрессируется при низких концентра-
циях NH4 (как в случае роста в присутствии глутамата в качестве
источника азота). В отсутствие молекулярного азота под дейст-
вием нитрогеназной системы происходит выделение Н2 из NADH2
в реакции, протекающей с затратой АТР. Таким образом, орга-
нические кислоты окисляются в цикле трикарбоновых кислот, а
образующиеся восстановленные коферменты окисляются нитроге-
27G
Глава 9
назной системой. Если в рассматриваемом процессе отсутствует
такой эффективный акцептор водорода, как Ns, образуется моле-
кулярный водррод.
Е. Фотосинтез у галобактерий
Галобактерии обитают в очень соленых озерах и адаптированы
к высокой концентрации соли в окружающей среде, а также к ин-
тенсивному освещению в таких обычно мелких водоемах. Эти бак-
терии не жизнеспособны при концентрациях NaCl ниже 2,5 М и
лучше всего растут в среде, содержащей 5,0 М. NaCl (концентра-
ция NaCl в морской воде составляет около 0,6 М). Концентрация
соли в бактериальных клетках такая же, как и в окружающей
среде.
Мембрана галобактерий имеет красный цвет и содержит каро-
тиноиды, которые защищают клетки от фотохимических повреж-
дений. Кроме тога, в мембране имеются включения (пятна) пур-
пурного цвета. Эти включения многочисленны в клетках, расту-
щих при низких концентрациях кислорода на свету. Они выполня-
ют очень интересную функцию. Галобактерии — облигатные аэро-
бы1, использующие аминокислоты и органические кислоты. При
низких концентрациях кислорода (растворимость О2 в концентри-.
рованных солевых растворах низка) АТР синтезируется не только
путем окислительного фосфорилирования, но и в результате фото-
синтеза. Стокениус с сотрудниками обнаружили, что окрашенные
в пурпурный цвет участки мембраны содержат бактериородопсин.
Подобно родопсину, 'основному зрительному пигменту палочек
сетчатки человеческого глаза, бактериородопсин состоит из белка
и хромофора ретиналя, который связан с остатком лизина белко*
вой молекулы (рис. 9-14). Пурпурная мембрана играет роль про-
тонного насоса. Она обесцвечивается в процессе фотореакции, и
—n=ch- Депротаниробанная
\ ® форма
/ _ы=сн- Протонироданная
\ н форма
Лизан
Полипептид ретинам
Рис. 9-14. Структура бактериородопсина. Хромофор ретиналь связан с аминогруйй
пой лизина полипептидной цепи. Образовавшееся таким образом шиффово осад
ванне в процессе фотореакции теряет-и вновь присоединяет протон.
1 Показана возможность роста некоторых-' галобактерий и в анаэробный
условиях. — Прим. ред.
Хемолитотрофный и фототрофный метаболизм
277
Рис 9-15 Транспорт протонов через пурпурную мембрану при светозависимом
процессе. [Stoeckenius W , Sci. Am , 234, 38—46 (1976) ]
этот процесс сопровождается выходом протонов бактериородопси-
на вереду. Обесцвечивание обратимо, и окраска бактериородопсина
восстанавливается в результате присоединения протона из цито-
плазмы. Таким образом, возникает протонный электрохимический
градиент, который может быть использован для синтеза АТР
(рис. 9-15).
IV, Выводы
1. Хемолитотрофные микроорганизмы синтезируют АТР при
окислении неорганических соединений кислородом или, в некото-
рых случаях, нитратом. К окисляемым неорганическим соединени-
ям относятся: молекулярный водород (водородокисляющие бакте-
рии), сероводород, элементарная сера и тиосульфат (серобакте-
рии), ионы железа (железобактерии), аммиак (аммиакокисляю-
щие бактерии) и нитрит (нитритокисляющие бактерии).
2. АТР синтезируется путем фосфорилирования, сопряженного
с переносом электронов. Электроны водорода поступают в дыха-
тельную цепь при участии связанной с субклеточными структура-
ми дегидрогеназы. Окисление нитрита до нитрата связано с вос-
становлением цитохрома окисление цитохрома ai кислородом
при участии цитохрома а$ приводит к синтезу АТР. Аммиак окис-
278
Глава 9
ляется до гидроксил амин а монооксигеназой Электроны, освобож-
дающиеся при окислении гидроксиламина, поступают в дыхатель-
ную цепь Сероводород окисляется до сульфата через стадии об-
разования элементарной серы и сульфита. Обнаружены два пути
окисления сульфита до сульфата: при участии сульфитоксидазы и
при участии аденозин-5'-фосфосульфат —редуктазы+АВР-сульфу-
рилазы.
3. Клеточный материал образуется из СОг. Для восстановления
NAD Н-донорами, имеющими высокие значения окислительно-вос-
становительного потенциала (нитрит, гидроксиламин, элементар-
ная сера ит д), у хемолитотрофов, за исключением некоторых
водородных бактерий, используется обратный перенос электронов,
4 Все известные водородокисляющие бактерии, Thiobacillus
novellus, Т intermedius и некоторые штаммы Nitrobacter, являются
факультативными хемолитотрофам Остальные бактерии относятся
к облигатным хемолитотрофам. Облигатная хемолитотрофия, воз-
можно, обусловлена наличием неполного цикла трикарбоновых
кислот, отсутствием у компонентов дыхательной цепи способност»
акцептировать электроны с NADH2, недостатком аммиака иля
восстановленных соединений серы, необходимых для биосинтетиче-
ских процессов
5 Для фиксации СО2 хемолитотрофы используют цикл Каль-
вина Ключевыми ферментами этого цикла являются рибулозо
1,5-бисфосфат—карбоксилаза и фосфорибулокиназа. Для восста-
новления трех молекул COs до глицеральдегид-3-фосфата требует-
ся шесть молекул NADH2 и девять молекул АТР.
6. В отсутствие СОг рибулозо-1,5-бисфосфат — карбоксилаза
катализирует оксигенолитический распад рибулозо-1,5-бис фос-
фата, приводящий к образованию фосфогликолата и фосфоглицй-
рата.
7. Фотосинтез у пурпурных и зеленых бактерий осуществляется
только в анаэробных условиях. Донорами водорода, используемы-
ми этими фототрофными бактериями, служат восстановленный
соединения серы, молекулярный водород и органические субстра-
ты Rhodospinllaceae (пурпурные несерные бактерии) используют
органические субстраты и Н2, Chromatiaceae (пурпурные серобак-
терии) используют органические субстраты Но и восстановленная
соединения серы, a Chlorobiaceae (зеленые серобактерии) —вос-
становленные соединения серы и Н2
8 Фототрофные бактерии содержат различные бактериохлоро-
филлы и каротиноиды Эти соединения организованы в фотосий”
тезирующем аппарате в виде пигментных комплексов Свет погло-
щается пигментным комплексом антенны Бактериохлорофилл
реакционного центра под действием световой энергии теряет элект-
рон Перенос электрона по электронпереносящей цепи обратно на
бактериохлорофилл сопряжен с синтезом АТР (циклическое фото-
фосфорилирование) .
Хемолитотрофный и фототрофный метаболизм 279
9. NAD восстанавливается Н-донорами с высокими значениями
окислительно-восстановительного потенциала (H2S, S°, сукцинат)
в процессе обратного переноса электронов.
10. Пурпурные бактерии для фиксации СО2 используют цикл
Кальвина. Механизм фиксации СО2 у зеленых бактерий не изве-
стен.
11. При росте на среде с аминокислотами в качестве источни-
ков азота некоторые пурпурные несерные бактерии окисляют ор-
ганические субстраты до СО24-Н2. Для этого процесса, включаю-
щего цикл трикарбоновых кислот и реакцию, катализируемую нит-
рогеназой, требуется энергия света (АТР).
12. У галобактерий, растущих в условиях низкого содержания
кислорода, мембрана окрашивается в пурпурный цвет. Такая
мембрана содержит бактериородопсин, который за счет энергии
фотореакции перекачивает протоны в окружающую среду. Возни-
кающий градиент концентрации протонов может использоваться
для синтеза АТР.
Глава 10
ФИКСАЦИЯ МОЛЕКУЛЯРНОГО АЗОТА
Микроорганизмы, обитающие в почве и способные ассимили-
ровать молекулярный азот, были обнаружены много лет назад.
Азотфиксирующую активность принято определять методом Къель-
даля по увеличению количества азота при росте бактерий на сре-
де, не содержащей связанного азота. В 1943 г. Буррис и Уилсон
разработали метод с использованием изотопа 15N, который позво-
лил прямо продемонстрировать фиксацию азота и образование
аммиака из N2. Применение lEN дало возможность обнаружить
также в клеточных экстрактах азотфиксирующую ферментную
систему — нитрогеназу. В последние годы для определения нитро-
геназной активности был предложен очень удобный метод — вос-
становление ацетилена. Нитрогеназа восстанавливает ацетилен до
этилена, количество которого легко определить при помощи газо-
вой хроматографии.
+ 6Н 2Nff3
Нитпрогеиазсс
CH=CH + 2HZ \v=CHa
Использование этого метода во многом способствовало разви-
тию современных представлений о распространенности процесса
фиксации молекулярного азота и его механизме.
I, Азотфиксирующие организмы
Способность к фиксации азота присуща только прокариотам.
Цианобактерии и бактериальные виды, принадлежащие практически
ко всем известным порядкам и семействам, способны фиксировать
молекулярный азот. Обычно различают свободноживущие и сим-
биотические азотфиксирующие бактерии. Последние образуют сим-
биоз с растениями, например все микроорганизмы рода Rhizobi-
шп— с бобовыми, Klebsiella pneumoniae — с определенными тро-
пическими растениями, Spirillum lipoferum — с тропическими тра-
Фиксация молекулярного азота
281
Таблица 10-1
Представители азотфикснруюжмх бактерий
Цианобактерии
Anabaena cylindrica
Виды Gloeocapsa
Фототрофный бактерии
Rhodospirillum rubruin
Rhodopseudotnanas capsalata
Строгие анаэробы
Clostridium pasteurianum
Desulfovibrio vulgaris
Облигатные и факультативные аэробы
Rhizobium japonicum
Frankia alnt
Klebsiella pneumoniae
Azotobacter vinelandii
Bacillus polymyxa
Mycobacterium flavum
Beijerinckia indica
Spirillum lipoferum .
вами, а все представители рода Frankia — с деревьями-пионерами,
такими, как ольха. Некоторые азотфиксирующие микроорганизмы
перечислены в табл. 10-1.
II, Биохимия фиксации азота
В 1960 г. Карнахан с сотрудниками сообщили о первом удач-
ном опыте по восстановлению N2 до аммиака экстрактом клеток
Clostridium pasteurianum. Ферментная система, катализирующая
эту реакцию, называется нитрогеназой. К настоящему времени
изучены нитрогеназы ряда азотфиксирующих микроорганизмов.
А. Строение нитрогеназы
Нитрогеназа состоит из двух белков, содержащихся в соотно-
шении 2:1, азоферредоксина и молибдоферредоксина. Свойства
этих белков указаны в табл. 10-2. Оба белка содержат железо и
серу, а также кислотолабильный сульфид. Кроме того, каждая
молекула молибдоферредоксина содержит два атома молибдена.
Б. Нитрогеназная реакция
Образование аммиака из N2 и Н2— экзотермическая реакция:
N2+3H2—^2NH3, ДЯ=-21,8 ккал (—91,2 кДж).
19-1896
282
Глава 10
Таблица 10-2
Свойства компонентов нитрогеназной системы
Свойство Азоферредоксин Молибдоферредоксин
Молекулярная масса 55 000 220 000
Количество субъединиц 2 2Х21)
Атомы железа 4 1$
Атомы молибдена 0 2
Кислотолабильный сульфид 11 16
° По две субъединицы каждого из двух типов.
Однако N2 — чрезвычайно стабильная молекула. Она содержит
тройную связь, и энергия, необходимая для активации этой связи,
очень велика. Поэтому химический синтез аммиака из азота и
водорода (метод Габера —Боша) должен осуществляться при
высоких температурах и высоком давлении. Нитрогеназа активна
при комнатной температуре. Для осуществления нитрогеназной ре-
акции кроме газообразного азота необходимо присутствие в каче-
стве субстратов восстановленного ферредоксина или флаводоксина
и АТР (рис. 10-1).
АТР
Ферредоксин - Hz
Ферредоксин -
Ферредоксин < Н2
Ферредоксин -
ADP + Pi,
Рис. 10-1. Восстановление Nz до аммиака, катализируемое нитрогеназой. Ма-
ленькие круги обозначают азоферредоксин, а большой круг — молибдоферредок-
син. Н*Мо обозначает супервосстановленный молнбдеферредоксин,
Фиксация молекулярного азота 283
Восстановленный ферредоксин или флаводоксин переносит
электроны на азоферредоксин. При избытке энергии, выделяющей-
ся в результате гидролиза АТР, потенциал окислительно-восста-
новительных групп фермента продолжает понижаться, приводя в
конце концов к образованию супервосстановленного молибдофер-
редоксина, который связывает N2 и постепенно восстанавливает
его до аммиака. Связывание молекулы N2, по-видимому, происхо-
дит путем ее внедрения в две металл—водородные связи, образо-
ванные при участии молибдена
Каждая из входяших в состав нитрогеназы субъединиц имеет
участок связывания АТР, и гидролиз АТР сопровождается как об-
разованием супервосстановителя, так и восстановлением субстра-
та. В опытах с бесклеточными препаратами нитрогеназы было
показано, что в зависимости от экспериментальных условий вос-
становление молекулы N2 сопряжено с гидролизом 6—15 молекул
AJP. In vivo необходимое количество молекул АТР, по-видимому,
ближе к 6, чем к 15:
N2 + 6H-M6—15)АТР ----2NH3+ (6—15)ADP+ (6— 15)Pb
В/ Источники восстановительных эквивалентов
Ранее упоминалось, что в качестве восстановительных эквива-
лентов нитрогеназа использует восстановленные ферредоксин или
флаводоксин. Восстановленный ферредоксин выполняет функцию
восстановителя у строгих анаэробов и фототрофов. Восстановлен-
ная форма ферредоксина образуется в реакции, катализируемой
пируват: ферредоксин—оксидоредуктазой или гидрогеназой (стро-
гие анаэробы) путем нециклического фотофосфорилирования-(циа-
нобактерии) или обратного переноса электронов (другие фототроф-
ные бактерии). Аэробные азотфиксирующие микроорганизмы со-
держат ферредоксин и (или) флаводоксин. Эти переносчики восста-
навливаются такими Н-донорами, как NADH2 или NADPH2.
В отсутствие N2 нитрогеназа катализирует ATP-зависимое вы-
деление молекулярного водорода1:
г. г,Тт, Нитрогеназа ,,
5АТР+2е- + 2Н+ ------->. H2+5ADP+5Pi.
Эта реакция уже рассматривалась в связи с образованием Н2
фототрофными бактериями (гл. 9, разд. III).
Г. Чувствительность к присутствию кислорода
Общее свойство всех препаратов нитрогеназы — их чувстви-
тельность к присутствию кислорода. Фермент необратимо инги-
бируется кислородом. Поэтому фиксацию азота следует считать
1 Некоторое количество Нг может выделяться с участием нитрогеназы и в
присутствии N2 — Прим. ред.
19*
284
Рлава 10
Рис 10-2. «Выключение» и «включение» йитрогеназы. Культуру 4. chroococcum
осторожно встряхивали в атмосфере аргона и кислорода (в соотношении 9:1).
В момент А скорость встряхивания увеличивали, а в момент Б возвращали к
исходному уровню. [Hill S., Drozd I. W., Postgate I. R., J Appl. Chem. Biotechnol.,
22, 541--548 (1972).]
строго анаэробным процессом. Это неудивительно, если учесть,
что для фиксации Na требуется наличие сильного восстановителя.
Для строгих анаэробных, пурпурных и зеленых фототрофных бак-
терий поддержание анаэробных условий, необходимых для функ-
ционирования нитрогеназной системы, не представляет трудностей.
Однако это является проблемой для аэробов и цианобактерий.
Такие аэробы, как Azotobacter vinelandii и Mycobacterium fla-
vum, лучше фиксируют азот при низком парциальном давлении
кислорода, чем на воздухе. Для защиты нитрогеназы от поврежде-
ния кислородом у таких аэробов, как представители рода Azoto-
bacter, существуют два механизма.
1. Дыхательная защита. Бактерии, относящиеся к роду Azotobac-
ier, обладают очень активной разветвленной дыхательной систе-
мой. В одной из ветвей цепи переноса электронов имеются три
пункта сопряженного фосфорилирования; в двух других вет-
вях— только один такой пункт. Поэтому при увеличении кон-
центрации кислорода скорость дыхания микроорганизмов может
повышаться в результате частичного разобщения фосфорилиро-
вания. Это приводит к потере NADH2, но зато нитрогеназа за-
щищается при этом от повреждения кислородом.
2. Конформационная защита. Как показано на рис. 10-2, при вне-
запном увеличении концентрации кислорода нитрогеназа Azoto-
bacter chroococcum «.выключается». Нитрогеназная активность
снова обнаруживается при снижении концентрации кислорода.
Фиксация молекулярного азота
285
7
Рис. 10-3. Фиксация азота в гетероцистах. Метаболиты, необходимые для син-
теза NADPH2, поступают из соседних вегетативных клеток. В гетероцнстак АТР
синтезируется путем фотофосфорилирования. ФС1 — фотосистема I.
По-видимому, защита достигается за счет конформационных
изменений в молекуле фермента и ассоциации с защитными
. белками.
У большинства нитчатых цианобактерий фиксация азота осу-
ществляется в гетероцистах. Эти клетки образуются, когда бакте-
риальное культуры лишаются других источников азота, кроме N2-
Гетероцисты крупнее вегетативных клеток и окружены довольно
плотной клеточной стенкой; они служат центрами фиксации азота?
Гетероцисты лишены фотосистемы II, в связи с чем они не могут
выделять кислород. Следовательно, в гетероцистах фотосинтез с
выделением кислорода не служит препятствием для строго ана-
эробного процесса фиксации азота. Как показано на рис. 10-3, в
гетероцистах АТР синтезируется в результате фотофосфорилиро-
вания. Восстановительные эквиваленты, необходимые для фикса-
ции азота, образуются из метаболитов, поступающих из соседних
вегетативных клеток, которые в свою очередь получают аммиак
из гетероцист.
Этот простой защитный механизм обнаружили, однако, не у
всех нитчатых цианобактерий. Некоторые из них (например, штам-
мы Plectonema) не образуют гетероцист. Эти виды цианобактерий,
а также одноклеточные фиксаторы азота (например, виды Gloeo-
capsa) фиксируют азот только при низких парциальных давлениях
кислорода.
Д. Симбиотическая фиксация азота
Фиксация азота при симбиозе бобовых растений с бактериями
рода Rhizobium имеет важное сельскохозяйственное значение. Она
происходит в корневых клубеньках, которые образуются после ин-
фицирования корневых волосков микроорганизмами, относящими-
ся к видам Rhizobium. Существует специфичность микроорганиз-
286
Глава 10
мов по отношению к видам бобовых; определенный штамм Rhizo-
Ыит инвазирует корни только определенных видов бобовых. Бак-
терии, попав в растение, стимулируют деление тетраплоидных кле-
ток корня. В результате происходит образование клубеньков, в
которых идет размножение бактерий. В конечном счете бактерии
превращаются в увеличенные в объеме клетки неправильной фор-
мы, носящйе название бактероидов. В бактероидах и происходит
фиксация азота. Процесс фиксации азота показан на рис. 10-4.
N2 восстанавливается бактериоидами до NH3, который связывается
глутамин-синтетазой, присутствующей в цитозоле растений. Затем
амидная группа переносится на аспартат, а продукт реакции —
аспарагин — поступает в корневую транспортную систему. Амидная
группа может быть перенесена также на а-оксоглутарат, в этом
случае образуется глутамат. Помимо аспарагина важными источ-
никами азота для растения служат глутамин и глутамат. а-Оксо-
глутарат образуется из сахарозы в цикле трикарбоновых кислот.
Растение не только обеспечивает бактероиды необходимыми
органическийи субстратами, но и защищает нитрогеназу от дейст-
вия кислорода. Азотфиксирующие клубеньки растений имеют крас-
новатую окраску благодаря присутствию леггемоглобина. Это
аналогичное гемоглобину соединение служит переносчиком кисло-
рода, контролируя его поступление в бактероиды. Бактерии рода
Rhizobium— аэробы, и количество кислорода, поступающее в бак-
Рис. 10-4. Поступление атмосферного азота в систему транспорта питательных
веществ растения. 1 — глутаминсинтетаза: 2— глутамин-аспартат—амидотрансфе-
раза; 3 — глутамин-а-оксоглутарат—амидотрансфераза. [Miflin В. I., Lea Р. L,
Trends Biochem. Sol., 1, 103—• 106 (1976).]
Фиксация молекулярного азота
287
териоиды при участии леггемоглобина, вполне достаточно для син-
теза АТР в дыхательной цепи, но не настолько высоко, чтобы
инактивировать нитрогеназу. Некоторые виды Rhtzobium фиксиру-
ют азот в определенной среде при низком рО2 и при росте вне
растения-хозяина.
III. Регуляция активности нитрогеназы
На один моль восстановленного азота расходуется до 15 молей
АТР. Поэтому при недостатке АТР клетка должна прекратить
фиксацию азота. Это достигается образованием ADP — ингибитора
нитрогеназы.
Синтез нитрогеназы также находится под строгим контролем.
Хорошо известно, что при наличии в клетках достаточно высоких
концентраций аммиака этот фермент не синтезируется. Однако
аммиак функционирует не только в качестве прямого репрессора
или корепрессора синтеза нитрогеназы При низких концентрациях
аммиака содержание глутамин-синтетазы в клетках значительно
увеличивается. В этих условиях за включение аммиака в органиче-
ские соединения отвечает система глутамин-синтетаза — гЛутамат-
синтаза (рис. 3-2). У некоторых микроорганизмов глутаМин-синте-
таза играет роль положительного регулятора синтеза ферментов,
катализирующих образование аммиажа. У Enterobacter aerogenes
глутамин-синтетаза активирует транскрипцию генов, кодирующих
гистидазу и пролиноксидазу. Оба фермента катализируют реакции,
приводящие к образованию аммиака.
Гены нитрогеназы (обозначаемые как nif-гены) у Klebsiella
pneumonia находятся под аналогичным контролем. Они транскри-
бируются только при наличии в клетках высоких концентраций
глутамин-синтетазы. По-видимому, подобные механизмы контроля
имеются и у других азотфиксирующих микроорганизмов.
IV. Выводы
1. Фиксация азота обнаружена только у прокариот. Этот про-
цесс встречается у строгих анаэробов, аэробов и фототрофных
микроорганизмов.
2. Восстановление молекулярного азота до аммиака катализи-
рует фермент нитрогеназа. Он состоит из двух белковых субъеди-
ниц, азоферредоксина и молибденоферредоксина. Для восстанов-
ления N2 в качестве источников энергии и водорода необходимо
присутствие АТР и восстановленного ферредоксина.
3. Нитрогеназа катализирует также восстановление ацетилена
до этилена. Эту реакцию удобно использовать для определения
нитрогеназной активности.
4. Нитрогеназа очень чувствительна к присутствию кислорода.
Дыхательная и конформационная защита, а также образование
288 Глава 10
гетероцист служат механизмами, препятствующими инактивации
нитрогеназы кислородом. При симбиотической фиксации азота
перенос кислорода к азотфиксирующим бактериодам контроли-
руется леггемоглобином.
5. Нитрогеназная активность ингибируется ADP. Нитрогеназа
синтезируется только при низкой концентрации аммиака в клет-
ках. В этиз^ условиях в клетках наблюдается высокая активность
фермента глутамин-синтетазы, осуществляющей положительную
регуляцию транскрипции нитрогеназных генов.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Рекомендуется в качестве справочников использовать стандартные учебники
по биохимии и микробиологии. Для более глубокого изучения проблемы можно
использовать небольшой список обзорных статей и книг, приведенный ниже.
Глада 1
Guirard В. М., Snell Е. Е. Nutritional requirements of microorganisms. In: The
Bacteria, vol. 4, I. C Gunsalus and R. Y. Stanier (eds.), Academic Press, New
York, 1962, pp. 33—95.
Hutner S. H. Inorganic nutrition, Ann. Rev. Microbiol., 26, 313—346 (1972).
Глава 2
Fridovich I. Superoxide dismutases, Adv. Enzymol., 41, 35—97 (1974).
Gibson F., Cox G. B. The use of mutants of Escherichia coli К 12 in studying
electron transport and oxidative phosphorylation.' In: Essays in Biochemistry,
vol. 9, P. N. Campbell and F. Dicken (eds.), Academic Press, London and New
York, 1973, pp. 1—29.
Harold F. M. Conservation and transformation of energy by bacterial membranes,
Bacteriol. Rev., 36, 172—230 (1972).
Kornberg H. L. The nature and control of carbohydrate uptake by Escherichia
coli, FEBS Lett., 63, 3-9 (1976).
Krampitz L. 0. Cyclic mechanisms of terminal oxidation. In: The Bacteria, vol. 2,
I. C. Gunsalus and R. Y. Stanier (eds.), Academic Press, New York, 1962,
pp. 209—256.
Papa S. Proton translocation reactions in the respiratory chains, Biochim. Biophys.
Acta, 456, 39—84 (1976).
Глава 3
Cohen S. N. Biosynthesis of- Small Molecules, Harper and Row, New York,
1967.
Costerton I. W., Ingram J. M., Cheng K.-J. Structure and function of the cell enve-
lope of gram-negative bacteria, Bacteriol. Rev., 38, 87—110 (1974).
Dagley S., Nicholson D. E. An Introduction to Metabolic Pathways, Blackwell Scien-
tific Publications, Oxford and Edinburgh, 1970.
Mandelstam Л, McQuillen K. Biochemistry of Bacterial Growth, Blackwell Scien-
tific Publications, Oxford, London, Edinburgh, Melbourne, 1973.
290
Рекомендуемая литература
Nikaido Н. Biosynthesis and assembly of lipopolysaccharide and the outer membra-
ne layer of gram-negative cell wall. In: Bacterial Membranes and Walls, L. Lieve
(ed.), Marcel Dekker, New York, 1973, pp. 131—209.
Zahner H., Mass W. K. Biology of Antibiotics, Springer-Verlag, New York, Heidel-
berg, 1972.
Глава 4 *
Frenkel R. Regulation and physiological functions of malic enzymes, Curr. Top.
Cell. Regul., 9, 157—182 (1975).
Kornberg H. C. Anaplerotic sequences and their role in metabolism. In: Essays in
Biochemistry, vol. 2, P. N. Campbell and G. D. Greville (eds.), Academic Press,
London and New York, 1966, pp. 1—32.
Глава 5
Anderson R. L., Wood W. .A. Carbohydrate metabolism in microorganisms, Ann.
Rev. Microbiol., 23, 539—578 (1969).
Archibald A. R. The structure, biosynthesis and function of teichoic acid, Adv.
Microbial Physiol., 11, 53—90 (1974).
Dawes E. A., Senior P. J. The role and regulation of energy reserve polymers in
microorganisms, Adv. Microbial Physiol., 10, 136—297 (1973).
Delwiche С. C., Bryan B. A. Denitrification, Ann. Rev. Microbiol., 30, 241—262
(1976).
Fraenkel D. G., Vinopal R. T. Carbohydrate metabolism in bacteria, Ann. Rev.
Microbiol., 27, 69—100 (1973).
Hamilton IF. A. Energy coupling in microbial transport, Adv. Microbial Physiol.,
12, 1—48 (1975).
Jones C. W. Aerobic respiratory systems in bacteria. In: Microbial Energetics,
B. A. Haddock and W. A. Hamilton (eds.), Cambridge University Press, 1977,
pp. 23—61.
Kaback H. R. Bacterial transport mechanisms. In: Bacterial Membranes and Walls,
L. Leive (ed.), Marcel Dekker, New York, 1973, pp. 241—293.
Payne W. J. Denitrification, Trends Biochem. Sci., 1, 220—222 (1976).
Postma P. W., Roseman S. The bacterial phosphoenolpyruvate: sugar phospho-
transferase system, Biochim. Biophys. Acta, 457, 213—257 (1976).
Reaveley D. A.} Burge R. E. Walls and membranes in bacteria, Adv. Microbial. Phy-
siol., 7, 2—71 (1972).
Schleifer К. H., Randler O. Peptidoglycan types of bacterial cell walls and their
taxonomic implications, Bacteriol. Rev., 36, 407—477 (1972).
Stouthamer A. H. Biochemistry and genetics of nitrate reductase in bacteria, Adv.
Microbial Physiol., 14, 315—370 (1976).
Utter M. F., Barden R. E., Taylpr B. L. Pyruvate carboxylase, Adv. Enzymol., 42,
1—72 (1975).
Wood H. G., Utter M. F. The role of CO2 fixation in metabolism. In: Essays in Bio-
chemistry, vol. 1, P. N. Campbell and G. D. Greville (eds.), Academic Press, Lon-
don and New York, 1965, pp. 1—28.
Глава 6 ;
Cheldelin V. R. Metabolic Pathways in Microorganisms, John Wiley and Sons,
Inc., New York and London, 1960.
Dagley S. Catabolism of aromatic compounds by microorganisms, Adv. Microbial
Physiol., 6, 1—42 (1971).
Рекомендуемая литература
291
Klug М. J., Markovetz A. J. Utilization of aliphatic hydrocarbons by microorganisms,
Adv. Microbiol Physiol., 5, 1—39 (1971).
Massey L. K-, Sokatch J. R.> Conrad R. S. Branched-chain amino acid catabolism
in bacteria, Bacteriol. Rev., 40, 42—54 (1976).
Quayle J. R. The metabolism of one-carbon compounds by microorganisms, Adv.
Microbial Physiol., 7, 119—197 (1972).
Stanier R. Y., Ornston L. N. The р-ketoadipate pathway, Adv. Microbial Physiol.,
9, 89—149 (1973).
Takagi T., Toda JJ., Isemura T. Bacterial and mold amylases. In: The Enzymes,
vol 5, P. D. Bojer (ed.), Academic Press, New York and London, 1971, pp. 235—
271.
Vogels G. D., van der Drift C. Degradation of puHns and pyrimidines by micro-
organisms, Bacteriol. Rev., 40, 403—468 (1976).
Whitaker D. R. Cellulases. In: The Enzymes, vol. 5, P. D. Boyer (ed.), Academic
Press, New York and London, 1971, pp. 273—289.
Глава 7
Cohen G. The Regulation of Cell Metabolism, Hermann, Paris, 1968.
Koshland D. E, Jr. Conformational aspects of enzyme regulation, Curr. Top. Cell.
Regul., 1, 1—28 (1969).
Ornston L. N. Regulation of catabolic pathways in pseudomonas, Bacteriol. Rev.,
35, 87—116 (1971).
Pastan I., Adhya S. Cyclic adenosine-5'-monophosphate in Escherichia coli, Bacte-
riol. Rev., 40, 527—551 (1976).
Sanwal B. D Allosteric controls of amphibolic pathways in bacteria, Bacteriol. Rev.,
34, 20—39 (1970).
Segal H. L. Enzymatic interconvefsion of active ’and inactive forms of enzymes,
Science, 180, 25—32 (1973).
Stadtman E. R. Mechanisms of enzyme regulation in metabolism. In: The Enzymes,
vol. 1, P. D. Boyer (ed.), Academic Press, New York and London, 1970, pp. 398—
459.
Umbarger H. E. Regulation of the biosynthesis of the branched chain amino acids,
Curr. Top. Cell. Regul., 1, 57—76 (1969).
Wyman J. On allosteric models, Curr. Top. Cell. Regul., 6, 209—226 (1972).
Глава 8
Barker H, A. Bacterial Fermentations, John Wiley and Sons, Inc., New York,
1956.
Barker H. A. Fermentation of nitrogenous organic compounds. In: The Bacterial,
vol. 2, I. C. Gunsalus and R. Y. Stanier (eds.), Academic Press, New York, 1961,
pp. 151—207.
Barker H. A. Coenzyme Bis-dependent mutases causing carbon chain rearrange-
ments. In: The Enzymes, vol, 6, P. D. Boyer (ed.), Academic Press, New York
and London, 1972, pp. 509—537.
Decker K, J ungermann K, Thauer R. K. Energy production in anaerobic organisms,
Angew. Chem. (Engl), 9, 138—158 (1970).
sHungate R. E. The rumen microbial ecosystem, Ann. Rev. Ecol. System., 6, 39—66
(1975).
Krebs H. A. The Pasteur-effect and the relations between respiration and fermenta-
tion. In: Essays in Biochemistry, vol. 8, P. N. Campbell and F. Dickens (eds.),
Academic Press, London and New York, 1972, pp. 1—26.
Kroger A. Phosphorylative electron transport with fumarate and nitrate as terminal
hydrogen acceptors. In: Microbial Energetics, B. A. Haddock and W. A. Hamilton
(eds.), Cambridge University Press, 1973, pp. 61—95.
292 Рекомендуемая литература
Le Gall J., Postgate J. R. The physiology of sulfate-reducing bacteria, Adv. Micro-
bial Physiol, 10, 82—125 (1973).
Ljungdahl L, G., Wood H. G. Total synthe'sis of acetate from CO2 by heterotrophic
bacteria, Ann. Rev. Microbiol., 23, 515—538 (1969).
London 1. The ecology and taxonomic status of the lactobacilli, Ann. Rev. Micro-
biol., 30, 279—301 (1976).
Morris J, G. The physiology of obligate anaerobiosis, Adv. Microbial Physiol., 12,
169—233 (1975).
Palmer G. Iron-'Sulfur proteins. In: The Enzymes, vol. 12, P. D. Boyer (ed.), Aca-
demic Press, New York and London, 1975, pp. 2—55.
Ramaiah A. Pasteur effect and phosphofructokinase, Curr. Top. Cell. Regul., 8,
298—344 (1974).
Srere P. A. The enzymology of the formation and breakdown of citrate, Adv.
Enzymol., 43, 57—102 (1975).
Stadtman T. C. Lysine metabolism by clostridia, Adv. Enzymol., 28, 413—447
(1973).
Wolfe R. S. Microbial formation of methane, Adv. Microbial Physiol, 6, 107—145
(1971).
Wood W. A. Fermentation of carbohydrates and related compounds. In: The Bacte-
ria, vol. 2. I. C. Gunsalus and R. Y. Stanier (eds.), Academic Press, New York,
1961, pp 59—149.
Yoch D. C.,^Valentine R. C. Ferredoxins and flavodoxins in bacteria, Ann Rev.
Microbiol., 26, 139—162 (1972).
Глава 9
Aleem M. I. H. Coupling of energy with electron transfer reactions in chemolitho-
trophic bacteria. Tn- Microbial Energetics, B. A. Haddock and W. A. Hamilton
(eds.), Cambridge University Press, 1977, pp. 351—383.
Baltscheffsky H., Baltscheffsky M., Thore A. Energy conversion reactions in bacte-
rial photosynthesis, Curr. Top. Bioenergetics, 4, 273—325 (1971).
Gest n. Energy conversion and generation of reducing power in bacterial photo-
synthesis, Adv. Microbial Physiol., 7, 243—278 (1972).
McFadden B. A. Autotrophic CO2 assimilation and the evolution of ribulose-di-
phosphate carboxylase, Bacteriol. Rev., 37, 289—319 (1973).
Parson IF. W. Bacterial photosynthesis, Ann. Rev. Microbiol., 28, 41—59 (1974).
Pfennig N. Photosynthetic bacteria, Ann. Rev. Microbiol., 21, 285—324 (1967).
Rittenberg S. C. The roles of exogenous organic matter in the physiology of che-
molithotrophic bacteria, Adv. Microbial. Physiol., 3, 159—193 (1969).
Schlegel H. G., Eberhardt U. Regulatory phenomena in the metabolism of Knall-
gasbacteria, Adv. Microbial. Physiol., 7, 205—240 (1972).
Stoeckenjus IF. The purple membrane of salt-loving bacteria, Sci. Am. 234, 38—58
(1976).
Suzuki I. Mechanisms of inorganic oxidation and energy coupling, Ann. Rev,
Microbiol., 28, 85—102 (1974).
Trtidinger P. A. Assiniilatory and dissimilatory metabolism of inorganic sulfur com-
pounds by microorganisms, Adv. Microbial Physiol., 3, 111—152 (1969).
Глава 10
Benemann J. R., Valentine R. C. The pathways of nitrogen fixation, Adv. Microbial
Physiol, 8, 59—98 (1972).
Dalton H., Mortenson L. E. Dinitrogen (N2) fixation (with a biochemical empha-
sis), Bacteriol. Rev., 36, 231—260. (1972).
Stewart W. D. P. Nitrogen fixation by photosynthetic microorganisms, Ann. Rev.
Microbiol, 27, 283—316 (1973).
Yates M. G.,. Jones C. W7. Respiration and nitrogen fixation in Azotobacter., Adv.
Microbial Physiol., 11, 97—130 (1974).
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Автотрофия, определение 13
Агараза 131
Аденилаткиназа 11, 62
Аденилатциклаза 167
Аденилилтрансфераза 183
Аденилирование 182
Аденилосукцинат лиаза 62
Аденилосукцинат синтетаза 62
Аденин, формула 59
Аденозин-5-дифосфат 179, 180
ADP см Аденозин 5'-дифосфат
АЭРглюкоза 73
АВРглкжозо-пирофосфорилаза 73, 180
S-аденозилметионин 69, 216, 242
Аденозин-3/,5/-монофосфат 166
Аденозин-5'-монофосфат 59, 63, 179,
180
Аденозин-5'-трифосфат 37, 104, 271—
273
— синтез 10— 15, 21—24, 29—39,
186—279
— формула 11
— фосфорилирующий агент 11
Аденозин-3'-фосфат-5'-фосфосуль-
фат 48
Аденозин 5'-фосфосульфат 48, 236,
272
Аденозин-5'-фосфосульфат—редукта-
за 236, 237
Аденозин-5'-фосфосульфат—фосфо-
киназа 46
ADP-сульфурилаза 257
Азид 40
Азот в питании 28
Азота закись 117
Азотистые соединения, сбраживание
238
Азотфнксация 280—288
— симбиотическая 285
Азотфиксирующие организмы 280
Азоферредоксин 281, 282
фщ-Аконитаза 27, 172
цнс-Аконитат 27
Акрилатный путь 220
Акрил-СоА 136
Активный транспорт см. Транспорт
активный
— центр 177
Аланин 50, 72, 132
— сбраживание 238
Аланиндегидрогеназа 132
н-Алкан, окисление 142
Алкан-1-гидроксилаза 141
Алкогольдегидрогеназа 153, 191, 195,
212, 217
Аллантоат 137
Аллантоат амидогидролаза 137
Аллантоиказа 137
Аллантоин 137
Аллантоиназа 137
Аллолактоза 160
Аллостерические ферменты, свойства
176
— эффекторы 176
Альдегиддегидрогеназа 153
Альдолаза 23
Аммиак 116, 138, 238
— ассимиляция 47
— окисление 257
Амилаза 130
Аминоацил тРНК—синтетаза 86
Амипоацильный центр 87
л-Аминобензойная кислота 16
5-Аминовалерианат 245
4-Аминоимидазол 246
4-Амино-5-имидазолкарбоксилат 246
4-Аминоимидазол-4-карбоксилатри-
бонуклеотид 62
5 Аминоимидазолрибонуклеотид 61,
62
Аминокислоты, активация 87
ароматические см Ароматические
аминокислоты
— биосинтез 49—55, 213
— как факторы роста 17
— образование полипептидов 84—89
294
Предметный указатель
Аминокислоты, расщепление 132
— сбраживание 238, 242, 243
2-Амино-5-оксогексаноат 242
Аминотрансфераза см. Трансаминаза
АМР см. Аденозин-5'-монофосфат
Анаплеротические последовательности
89, 117, 122
----- разнообразие 117
Анаэробиоз 186
Анаэробное дыхание 115—117, 188
Анаэробы 186
Антибиотики 72, 86
Антикодон 86
Антранилат 53, 145, 175
Антранилат-синтаза 169, 175
Антрацен 145
Арабиноза 165
Аргинин 43, 243
— сбраживание 243
Аргинин-иминогидролаза 243
Ароматические аминокислоты, регу-
ляция превращений 175
— соединения, расщепление 142—
147, 275
Аскорбат, синтез 155
Аспарагин 50
Аспарагиновой кислоты полуальдегид
50, 174
Аспартаза 134
Аспартат 50, 132
— сбраживание 240
Аспартата семейство, регуляция син-
теза 170
-------- распада 174
Аспартаткиназа 170, 174
Аспартатполуальдегид-дегидрогеназа
170
Аспартат-транскарбамилаза(аспар-
тат-карбамоилтрансфераза) 60,173
178
Ассимиляционное восстановление нит-
рата 117
-----сульфата 47
Ассимиляция аммиака 45
— СО2 260—265
АТР см. Аденозин-5-трифосфат
— образование 33—39, 115, 191, 196,
197, 202, 203, 208, 213, 219, 221,
229, 233, 237
— потребность для синтезов 45
--------фиксации СО2 261
----------№ 283
АТРаза 37, 104, 270, 271
АТР : карбамат—фосфотрансфераза
243
АТР-сульфурилаза 236
АФС см. Аденозив-5'-фосфосульфат
Ацетальдегид 191, 192, 217, 223
Ацетальдегиддегидрогеназа 192, 195,
212, 217
Ацетат 197, 200, 210, 215, 220, 231,
241, 242, 245, 247
— анаэробное окисление 238
— как субстрат 95
— образование 153
— сбраживание 233
Ацетаткиназа 96, 196, 197, 207, 212,
217, 220, 234, 236, 247
Ацетатное брожение 226, 233
Ацетилбутандиол 157
N-ацетилглутамат 52
N-ацетилглюкозамин 78, 124
Ацетилен, восстановление 280
Ацетил-АПБ 65
Ацетил-СоА, образование из пирувата
25, 26, 204, 206, 215, 217
— окисление 26—29
— участие в синтезе жирных кислот
66—68
Ацетил-СоА—карбоксилаза 66
Ацетил-СоА—трансфераза 207
N-ацетилмурамилпептапептид 71, 75
N-ацетилмурамовая кислота 71, 75,
124
О-ацетилсерин 48, 52
О-ацетилсерин—ацетат-лиаза 48
Ацетилфосфат 96, 196—199, 204, 212,
217, 234, 236
Ацетоацетат 143, 209
Ацетоацетатдекарбоксилаза 209
Ацетоацетил-АПБ 67
Ацетоацетил-СоА 208, 209
а-Аието-а-гидроксибутират 50
Ацетогидроксикислоты изомероредук-
таза 17J1
— синтаза 171
Ацетоин 157, 200, 217
— расщепление 156
Ацетоиндегидрогеназа 201
а-Ацетолактат 50, 157, 217
а-Ацетолактат—декарбоксилаза 217
а-Ацетолактат—синтаза 216, 217
Ацетон 155, 208—211
Ацилпереносящий белок (АПБ) 56—
59
--- структура 66
Ацил-СоА—дегидрогеназа 135
Ацил-СоА—синтетаза 135
Аэробные гетеротрофы, катаболичес-
кая активность 129—158
— — метаболическое разнообразие
101—129
Аэробный метаболизм глюкозы 19—
24, 251—258
--- неорганических соединений
. 251—258
Предметный указатель_____________________
Аэробный метаболизм органических
субстратов 129—158
Аэробы, влияние перекиси водорода
40
Бактериальный фотосинтез 265—277
Бактериородопсин 276
Бактериохлорофилл 266—268
Бактероиды 286
Бактопренол 75
Балансы брожений 209, 215, 245
Белки, синтез 84—88
Белок, связывающий, в транспорте
105
Бензальдегид 145
Бензиловый спирт 145
Бензоат 145
— расщепление фототрофами 275
Бензол 145
Биотин 15, 16, 118, 222
Биоэлементы 7—10
1,3-Бисфосфоглицерат 23
Бифидобактерии 193, 196
Брожение 168—250
— ацетатное 233
— ацетон-бутаноловое 203
— бутандиоловое 214, 215
— вызываемое бифидобактериями
193, 196
— маслянокислое 203
— метановое 226
— молочнокислое 193
— пропионовокислое 214
— смешанное 214
— спиртовое 190, 211, 237
— янтарнокислое 219
2,3-Бутандиол 156, 214, 215
2,3 Бутандиолды идрогеназа 216
Бутандиоловое брожение 214—219
2,3 Бутандиоловый цикл 156
Бутанол 208—210
Бутанол-ацетоновое брожение 208—
210
Бутанолдегидрогеназа 209
Бутиральдегид 209
Бутиральдегид-дегидрогеиаза 209
Бутират 208—210, 241—242
— синтез 207
Бутирил-СоА 207, 208, 209
Бутирил-СоА—дегидрогеназа 208,209
212
Чис-Вакценат 67
L-валин 50, 132, 171
Ванилат 144
Витамин Bi см. Тиамин
Витамин В2 см Рибофлавин
Витамин В6 см. Пиридоксин
Витамин Bj2 16, 17, 136, 224, 228,
235
— формула 224
Витамин С см. Аскорбат
Витамин К 16
Водород 14, 207, 209, 212, 215, 217,
225, 227, 230, 231, 239, 241, 273
— в питании 7, 10, 14
— образование 204, 207, 210, 212^
217, 218, 239, 241, 275, 283
— окисление 225, 227, 230, 231, 252,.
254, 266
— фотообразование 275
Галактоза 70, 79, 94, 95
Р-Галактозидаза 94, 159
р-Галактозид—ацилтрансфераза 93
Галактозо-1-фосфат 95
Галактокиназа 95
GDP см. Гуанозин-5'-дифосфат
ifuc-9-Гексадекеноил 67
Гексозамины 60, 70
Гексокиназа 83, 195, 197
Гексулозо-6-фосфат 152
Гемин 16, 225
Генетическая информация 79
Генетический код 85
Гентизат 144
Гены 159—173
Гептоза 77, 78
Гетеротрофия, определение 14
Гетероферментативное молочнокислое
брожение 193, 194
Гетероциклические соединения, сбра-
живание 245
Гетероцисты 285
Гиалуронидаза 131
Гидридкобаламин 232
Гидрогеназа 204, 207, 254
Р-Гидроксиаспартат, эритро 139
p-Гидроксиаспартатный путь 139
Р-Гидроксиацил-АПБ—дегидратаэа
67
L-3-гидроксиацил-СоА—гидролаза
135, 207
L-3-гидроксиацил-СоА—дегидроген-
аза 135
Гидрокси бензальдегид 144
Гидроксибензоат 144
Гидроксибензоилформиат 144
D(—)-р-гидроксибутират 123
D (—) -р-гидроксибутират—дегидро-
геназа 123
296
Предметный указатель
р-Гидроксибутирил-АПБ 67 '
D(—) ф-гидроксибутирил-Со А—де-
гидрогеназа 122
L(+) -р-гидроксибутирил-СоА—де-
гидрогеназа 209, 212
D (—) -р-гидроксибутирил-СоА—по-
лимераза 122
а-Гидроксиглутарат 241
а-Гидроксиглутйрат—Дегидрогеназа
241
^-Гндроксидеканоил-АПБ, в синтезе
жирных кислот 68
4-Гидрокси -4 -карбокси-2 - оксова ле-
рианат—альдолаза 148
4-Гидрокси-2-изовалерианат— альдо-
лаза 148
Гидроксилаза 142
Гидроксиламин 255
Гидроксиламин-цитохром с-редуктаза
256, 257
₽-Гидрокси-Е-манделат 144
идроксипируватредуктаза 150
л-Гидроксилропиональдегид 223
3-Гидрокситетрадекановая кислота 77
л-Гидроксифенилпируват-оксидаза
143
Гидролаза 2-оксо-4-карбоксипент-4-
еноевой кислоты 148
— полуальдегцда 2-гидроксн-4-кар-
боксимуконовой кислоты 148
~---2-гидроксимуконовой кислоты
148
Гистидаза 134
Гистидин 54
— расщепление 134
Гистидиновый оперон 168
Гликоген 122
— расщепление 127
— - синтез 74
----регуляция 180
Гликоген-фосфорилаза 182
Гликолат 139
Гликолиз, регуляция 180
Гликолипид, формула 65
Глиоксилаза 112
Глиоксилат 137, 138
Глиоксилат-карболигаза 139
Глиоксилатный Цикл 96, 97, 119, 136
Глицеральдегид-З-фосфат 197, 260,
263
Гдяцеральдегид-З-фосфат—-дегидро-
геназа 23, 191, 260
— механизм действия 24
Глицерат 138
Глидераткиназа 138, 150
Глицератный путь 138
Глицерол 233
Глицеролдегидраза 223
Глицерофосфат- ацялтраисфераза 68
Глицерол-З-фосфат—дегидрогеназа 68
Глицин 52, 245
— сбраживание 238
Глицинамидрибонуклеотид 61
Глицинредуктаза 244
Глицинсинтаза 239
Глицин-формиминотрансфераза 217
Глутаконил-СоА 241
D-глутамат 71, 124, 125
L-глутамат 46, 52, 90, 132, 134, 213,
241
— сбраживание 240, 241
Глутамата полуальдегид 52
Глутаматдегидрогеназа 46, 47, 241
Глутаматмутаза 233, 240, 241
Глутамат-сийтаза 46, 47
Глутамин 46, 52, 60, 124, 183, 286
— как донор аминогрупп 46
Глутамин-аспартат—амидотрансфе-
раза 286
Глутамин-а-оксоглутар ат—амидо-
трансфераза 286
Глутаминсинтетаза 46, 47, 183, 286
Глюкоза, расщепление 21—24, 93, 94,
107, 111
— сбраживание 191, 193, 197, 207,
214—216, 231
Глюкозамин-6-фосфат 70, 71, 78
Глюкоза : галактозе-1-фосфат—ури-
дилилтрансфераза 95
Глюкоза : фосфоенолпируват—фос-
фотрансфераза 105
Глюкозо-1-фосфат 23, 56, 94, 108, ПО,
111, 193
Глюкозо-6-фосфат—дегидрогеназа 56,
107, НО, 111, 193
Глюкозо-6-фосфат—изомераза 23,197
Глюконат НО, 155
Глюконат-дегидрогеназа 110
Глюконат-6-фосфат(6-фосфогл1рко-
нат) 56, 107, НО, 111, 193
Глюконат-6-фосфат—дегидрогеназа
56, 111, 193
Глюконеогенез 96, 136
Глкжонокиназа ПО
GMP см. Гуанозин-5'-монофосфат
GMP-синтетаза 62
GOGAT см. Глутамат-синтаза
Гомогентизат 143
Гомогентизат-оксидаза 143
Гомосерин 50
Гомосерин-дегидрогеназа 170, 174
Гомоееринкиназа 170
Гомосеринфосфат 50
Гомоферментативное молочнокислое
брожение 193, 194
Гомоцистеин 50
Грамотрицательные бактерии 123, 124
Предметный указатель
297
Грамположительные бактерии * 109,
125
GTP см. Гуанозин-5/-трифосфат
Гуанин 246
— формула 59
Гуанозин-5'-дифосфат 64
Гуанозин-5'-монофосфат 59, 63
Гуанозин-5'-трифосфат 88
Двойная спираль ДНК 80
Двухфазный рост 165
Деаденилирование 183
Деацетилирование 182—184
5-Дегидрохинат 53'
5-Дёгидрошикимат 144
Дезаминирование 133
б'-Дезоксиаденозилкобаламин 224
б'-Дезоксиаденозин 224
З-Дезокси-Ц-арабино-гептулозонат-
7-фосфат 175
З-Дезокси-Ц-арабино-гептулозонат-
7-фосфат—синтетаза 174, 175
З-Дезокси-Ц-м^нно-октулозоновая
кислота 77
Дезоксирибонуклеаза 131
Дезоксирибонуклеотиды 58—64, 82—
84
Декарбоксилирование 24, 27, 199,
200, 204, 209, 217
Денитрификация 115—117
Денитрифицирующие бактерии 115
Десульфатация 235
Десульфови ридин 237
Диаминогексаноат 223, 242
2,5-Диаминогексаноат—дегидроге-
наза 242
3,5-Диаминогексаноат—дегидроге-
наза 242
Диамннопимелат 50, 72
Диауксия 165
Диацетил 200
Диацетилметилкарбинол 157
Днацетил-синтаза 200
Дивалентная репрессия 170
Дигидродипиколинат 50
Йигидродипиколинат-циклогидрола-
за 170
Дигидрокси ацетон 155
Дигидроксиацетонфосфат 23, 112
Дягидроксикислоты дегидратаза- 172
Дигидроксиэтилтиаминпирофосфат
195
Дигидролипоил-дегидрогеназа 25, 26
Дигидролипоил-трансацетилаэа 25, 26
Дигидрооротат 66
Дигидрооротатаза 60
20—1896
ДигидрооротатдеТидрогеназа 60
Дикарбоновые кислоты как субстра-
ты 99
Дикарбоиовых кислот цикл см. Цикл
дикарбоновых кислот
5,6-Диметилбензимидазолрибонукле-
отид 224
2,4-Динитрофенол 39
Диоксигеназа 147
Диссимиляционное восстановление
нитрата 115
-----сульфата 235
Дитиооктановая кислота см. Лнпое-
вая кислота
Диффузця облегченная 102
— пассивная 101
ДНК 80—93
ДНКаза 131
ДНК‘ПОлимераза 82
Дыхание 30—40
— анаэробное 188
— нитратом 115—117
Дыхательная защита нитрогеназы 284
— цепь 30—40
----------компоненты 30
----- различия в составе 114
Ен онл-АПБ—редуктаза 67
Енолаза 23, 150, 191
Железо в ферредоксине 205
—। — питание 8
Железосеропротеиды 30, 38, 186, 205
Жирные кислоты 65—68, 134
-----ненасыщенные 67
----- распад 134
Жирных кислот синтетаза 68
Запасные вещества 73, 121
Зеленые бактерий 266
Изолейцин 50, 132, 170, 171, 174,
244
Изопропанол 155, 209
а-Изопропилмалат 50, 171
р-Изопропилмалат-дегидрогеназа 171
Изопропилмалат-изомераза 171
298
Предметный указатель
а-Изстропилмалат-синтаза 171
Изорениератин 267
Изоферменты 170
Изоцитрат-дегидрогеназа 27
Изоцитрат-лиаза 96, 151, 274
4-Имидазолон 246
Имидазолон-пропионаза 134
4-Имидазолон 5-пропионаг 134
Инвертаза 130
Ингибирование, последовательное по
типу обратной связи 175
Ингибиторы 39
Индолглицерофосфат-синтетаза 169
Индукция координированная и после-
довательная 160
-----ферментов 159—173
Индуцированного соответствия мо-
дель 177
Инозиновая кислота 62
Информационные макромолекулы,
синтез 79—88
IMP см. Инозиновая кислота
ИМР-дегидрогеназа 62
1МР-циклогидролаза 62
Калий в питании 8
Кальвина цикл 260, 263
Кальций в питании 8
Капроат 212
Карбамоиласпартат 60
Карбамоилфосфат 46, 60
Карбамоилфосфатсинтетаза 46
Карбоксилазы 66, 89, 118, 136, 213,
260
3-Карбокси-г{«с, ({ис-муконат 146
Каротиноиды 267
Катаболитная репрессия 165, 258
Каталаза 187
Катехол 145, 146
Катехол-1,2-оксигеназа 146, 147, 162
Катехол-2,3-оксигеназа 148
КДФГ см. 2-кето-3-дезокси-6-фосфо-
глкжонат
КДФГ-альдолаза 107, 108
3-Кетоацил-АПБ—редуктаза 67
3-Кетоацил-АПБ—синтетаза 67
2-Кето-З-дезоксиоктонат 77
2-Кето-3-дезокси-6-фосфоглюконат
107
4-Кетоглюкоз а, производное 70
2 Кетоглюконат 110
5-Кетоглюконат 155
2-Кетоглюконаткиназа 110
а-Кетоглутарат см. а-Оксоглутарат
2-Кето-6-фосфоглюконат ПО
З-Кето-6-фосфоглюконат 55
2-Кето-6-фосфоглюконат—редуктаза
110
р-Кетотиолаза 122, 135
L-Кинуренин 145
Кислород, влияние на строгих ана-
эробов 186
— выделение при фотосинтезе 271
— в питании 2, 15
— действие на нитрогеназу 283
— как акцептор электронов 29—39.
114, 250—257
---продукт каталазной реакции 4G
Клеточная мембрана 73
— стенка 73, 123
Клеточные компоненты 44
Клеточный материал, состав 43
Кобальт 9, 224
Кодон 85
Конфигурация молочной кислоты 198»
Конформационная гипотеза сопряже*
ния 35
— защита нитрогеназы 284
Кооперативное взаимодействие 176
Корневые клубеньки 285
Корриновое кольцо 224
Кофермент А, формула 66
— В12 222, 224, 228
— М 16, 227
— Q 30, 38
---формула 31
Крахмал, расщепление 129
Кребса цикл см. Цикл трикарбоновых
кислот
Кротоназа 122, 207, 209, 212
Кротонил-АПБ 67
Кротонил-СоА 122, 207, 241
Ксантиловая кислота 62
Ксантин 246
Ксантин-амидогидролаза 246
Ксантин-дегидрогеназа 246
Ксантиноксидаза 137
Ксиланаза 131
Ксилулозо-5-фосфат 56, 195, 197, 262
Ксилулозо-5-фосфат—фосфокетола-
за 197
Кумулятивное ингибирование 175
СоА-трансфераза 123, 207, 212, 220,
221
Лактат 99, 195, 197, 200, 210, 214,
217, 220
— сбраживание 221, 222, 235
D-лактат 112
Лактатдегидрогеназа 194, 200, 217,
221, 236
— Стереоспецифичность 198
Предметный указатегь
299
D-лактатдегидрогеназа 220
D-лактатоксидаза 112, 201
Лактатрацемаза 220
Лактил-СоА 136
Лактоза 97—95, 164
— формула 94
Лактоназа 56
Лактопермеаза 93, 164
Леггемоглобин 286
L-лейцин 50, 132, 171, 244
Лизин 124, 223, 242, 243
— сбраживание 242, 243
^-Лизин-5,6-аминомутаза 223
Ь-лизин-2,3-амином)таза 242
Лизин-мутаза 242
Лизинрацемаза 242
Липид А 77, 78
Липиды 44, 64—70,72
Липоевая кислота 16, 25, 26
Липополисахарид 77—79
Lac-оперон 164—168
Магний в питании 8
Макромолекулы, содержание в бакте-
риальной клетке 43
- — информационные 79—88
— периодические 73—79
— расщепление 129
L-Малат 27, 95, 138, 150, 179
— сбраживание 199, 238
L-Малатдегидрогеназа 27, 138, 150,
179, 217, 221
L-Малатдегидрогеназа декарбоксили-
рующая 99, 199
Малат-синтаза 96, 138, 274
4-Малеилацетоацетат 143
Малеилацетоацетат изомераза 143
Малил-СоА 150
Малил-СоА—лиаза 150, 151
Малил-СоА—синтаза 151
Малонил-АПБ 66
Малонил-СоА 66
Малонил-трансацилаза 66
Мальтоза 130
Мальтозофосфорилаза 130
L-Манделат 145 ।
Маннитол 199
D-Манноза 65, 79
Марганец в питании 9
Маслянокислое брожение 203—208
Маслянокислые бактерии 203
Медь в питании 9
Мезаконат 244-
Мембрана цитоплазматическая,струк-
тура 73
20*
— — — наружного слоя *77
---г- ферменты 29—39, 116, 117, 224,
254—257, 269, 277
Мембранный переносчик 102
— потенциал 36
Менахинон 32, 224, 237
— формула 31
2-Меркаптоэтансульфоновая кисло-
та см Кофермент М
Метаболизм хемолитотрофный 251—
260
— хемоорганотрофный 19—41, 93—
100, 129—158
—> фототрофный 265—277
Метаболизм, регуляция 159—185
Метаболическое разнообразие бакте-
рий 101—128
Металлы в питании 7—10
Метан, образование 227—230
--- изменение свободной энергии
229
— окисление 148—153
Метанобразующие бактерии 226,
228—232
Метановое брожение 227
Метанокисляющие бактерии 149, 153
Метанол, окисление 140
— сбраживание 232
Метанолдегидрогеназа 149
Мета-расщепление 147, 148
Метенил-Игфолят 232, 234, 247
Метиламин 153
fJ-Метиласпартаза 241
0-Метиласпартат, L-эритро 241
Метилглиоксалевый шунт 112
Метилглиоксаль-синтаза 112
Метилен-Н4-фолят 62, 232, 234, 247
Метилен-Н4-фолят—дегидрогеназа
234, 247
Метилен-Н4-фолят—редуктаза 234
Метилен-Нгфолят—циклогидролаза
234, 247
Метилкобаламин 227
Метилкофермент М 227
(Ю-метилмалонил-СоА 221, 222
(З)-метилмалонил-СоА 221
(К)-метилмалонил-СоА—мутаза 136,
221—223
(З)-метилмалонил-СоА пируват—
—транскарбоксилаза 221
Метилмалонил-СоА—рацемаза 136,
224
2-Метил-н-масляная кислота 17
/Аетилотрофные бактерии 148, 153
Метил-Н4-фолят 232, 234, 235
Механо-химическая гипотеза 35
Митохондриальная дыхательная цепь
30—34
Модель согласованной симметрии 178
300
Предметный указатель
Модель Уотсона — Крика см Уотсо-
на— Крика модель
Крика модель
Молибден; 9, 117, 219, 281, 282
Молибдоферред оксин 281
Молочная кислота, конфигурация 198
Молочнокислое брожение 193—203
Молочнокислые бактерии 193
Мономеры, биосинтез 41—93
— образование из полимеров 129—
132
Монооксигеназа 142, 149, 257
цис, цис-Муконат 146, 162
цис, г$ис-Муконат-лактонизирующий
фермент 146, 162
Муконолактон-изомераза 146, 162,
163
Мультивалентная репрессия 170
Му рамс® а я кислота 71
Мурамилпентапептид 71
Муреин см. Пептидогликан
Нафталин 145
Нейраминидаза 131
Нейтральные жиры 65
Нернста уравнение 29
Никель в питании 9
Ннкотинамидадениндинуклеотид как
' фактор роста 16
— восстановленный, образование 28
-------при обратном переносе элек-
тронов 254, 272
---окисление кислородом 31, 114
-------при брожениях 191, 194
---судьба На 212, 230
Н икотипами да дениндинуклеотид-
фосфат восстановленный, образо-
вание 55, 271, 272
Никотиновая кислота 16
Нитрат как акцептор электронов 15
— ассимиляционное восстановление
. 117
— диссимиляционное Восстановление
115
— образование 255
Нитрат-нитритное дыхание 116
НиТратредуктаза 117, 219
Нитрит, образование из аммиака
255—256
— -- нитрата 117
— окисление до нитрата 255
Нитритредуктаза 117
Нитрогеназа 275, 280—2Й5
— компоненты 281
— регуляция 284
Нятроксил 256
Нуклеиновые кислоты, синтез 80—84
Нуклеозиды 60
Нуклеотиды, формула 59
— синтез 58—64
NAD см. Никотина мидадениндинук«
леотид
NADHj-AeraflporeHaaa 31
N ADHa-ферредоксин—оксидоредук-
таза 213
МАОН2-пероксидаза 202
NADP см. Никотинамидаденинди-
нуклеотидфосфат
Облигатная хемолитотрофия 258
Облигатные анаэробы 186
Окисление н-алканов 142
— аммиака 227, 257
— водорода 252
— глюкозы 19—29, 106—112
— ионов Fe3+ 253
— метана 149
— метанола 149
— неполное 153
— нитрита 255
— окиси углерода 259
— сульфида 256
— сульфита 257
{1-Окисление 134, 142
Окислительно-восстановительный ба-
ланс 211
— потенциал 29, 204, 255
Окислительное дезаминирование 132
—’декарбоксилирование пирувата 24,
25
--- механизм 25
Оксалат 140
Оксалил-СоА 140
Оксалбацетат 27, 49, 181, 200
— в анаплеротических реакциях 89,
118, 119
---янтарно-пропионовокислом бро-
жении 221, 226
Оксалоацетата семейство 49
Оксалоацетатдекарбоксилаза 200 -
Оксалосукцинат 27
Оксигеназа 141, 147
ОксигенолитйЧеский распад рибуло-
зо-1, 5-бисфосфата 265
Оксидаза аминокислот 132
З-Оксоадипат 146
4-Оксоадипат-енол-лактон 146, 162
4-Оксоадипат-енол—лактон—гидро-
лаза 146, 162
З-Оксоадипатный путь 146
---регуляция 162
З-Оксоаднпат-сукцинил—СоА-транс-
фераза 146, 162
Предметный указатель
301
З-Оксоадипинил—СоА-тиолаза 162
З-Оксо-5-аминогексаноат 243
а-Оксобутират 50, 239
а-Оксоглутарат 27, 52, 97
— в регуляции 179, 182
---сбраживании глутамата 241
а-Оксоглутаратдегидрогеназа 27, 172
а-Оксоизовалерианат 50, 132
а-Оксоизокапроат 132
2-Оксо-З-метилвалерианат 50, 132
2-Оксопент-4-еноевой кислоты гидро-
лаза 148
рис-11 -Октадекеноил-АПБ 67
Олигомицин 40
Олигосахаридный кор 77, 78
Олигосахаридные цепи повторяющие-
ся 79
Оперона модель 164
Органические кислоты, расщепление
95—99, 134—140
L-орнйтин 52, 125, 243
Орнитин-карбамоилтрансфераза 243
Оротат 60, 247
Ороти ди л ат-декарбоксилаза 6Q
Оротидилат-пирофосфорилаза 60
Оротидинмонофосфат 60
Орто-расщепление 145
Пальмитиновая кислота 67
— < — распад 135
Пальмитолеат 67
Пантотенат 16, 66
Пастера эффект 192
Пектиназа 131
Пенициллин 76
Пентозофосфатный цикл 55, 111, 152,
261
Центозофосфаты, синтез 55—58
Пентозы, расщепление 111
— синтез 55—58
Пептидильный центр 87
Пептидная связь, образование 8б
Пептидогликан 71, 73
— синтез 73—76
— состав 124
Пептидогликановый слой 73
Пептон 16
Перекись водорода 40, 187
Переносчик (н) водорода 32
— в облегченной диффузии 102
— — транспорте электронов 32, 204,
270, 271
— углекислого газа 222
Периодические макромолекулы 73—
79, 120—126
Пероксиддисмутаза 40, 187
Пигментные комплексы антенны 269*
Пиридоксин 16
Пиримидиновые нуклеотиды 59
— основания 50
Пиримидины как факторы роста 16>
— сбраживание 245
— синтез 61
— формула 61
Пирофосфат 49, 60, 70, 73, 83, 87,.
226, 236
Пирофосфатаза 11,236
Пируват как субстрат 95
— в синтезе аминокислот 50
— окислительное декарбоксилирова-
ние 24, 25
Пирувата семейство 50
Пируватдегидрогеназный комплекс
24, 25, 138, 200
— — распространение 113
---регуляция 179
Пируватдекарбоксилаза 190
Пируваткарбоксилаза 118, 119, 17t>
Пируваткиназа 22, 23, 138, 179, 191
Пируват-метил-В^—транскарбоксил-
аза 234 >
Пируватоксидаза 201
Пируват : ферредоксин—оксидоре-
дуктаза 204, 207, 213, 220, 234, 236^
246, 247
Пируват—формиат-лиаза 213, 215
Пируват, фосфат-днкиназа 119, 226.
Поли-р-гидроксибутират 122
Полимераза 82, 83, 122
Полимеры см. Макромолекулы
Полипептиды, синтез 84—88
1,5-Поли (рибитолфосфат) тейхоевая
кислота 126
Полисахариды 73, 122
Полиуридиловая кис-лота 85
Полифенилаланин 85
Полифосфаты 121
Последовательное ингибирование по
тийу обратной связи 175
Префенат 53, 175
Пролин 54, 245
Пролинредуктаза 245
Пропанол 155
Пропионат 136, 155, 219, 240
— расщепление 136
Пропионил-СоА—карбоксилаза 136»
Пропионовокислое брожение 219
Протеазы 131
Протокатехат 144, 146, 162
Протокатехат—3,4-оксигена ia 146
Протокатехат—4,5-оксигеназа 147
Протон, транслокация 33, 104, 277
Протонодвижущая сила 36
--- в транспорте 104
Пулька (мексиканский напиток) 192
302
Предметный указатель
Пуриновые основания 50, 59, 63
— нуклеотиды 59, 63
Пурины как факторы роста 16
— сбраживание 245
— синтез 63
— формула 59
Пурпурная мембрана галобактерий
277
Пурпурные бактерии 266 _
Пустые циклы 180
Р870 270
Радиореспирометрия 58, 108
Разобщители фосфорилирования 39
Расщепление (см также Сбражива-
ние) аллантоина 137
— аминокислот 132
— ароматических соединений 143 -
— ацетата 95—97
— галактозы 95
— гистидина 134
— гликогена 129—130
— глиоксилата 138
— глюкозы 21—24, 106, 111
— глюконата 110
— катехола 146, 148
— крахмала 129
— лактозы 92, 93, 164, 165
— малата 99
•— органических кислот 134
— пальмитиновой кислоты 135
— пентоз 111
— пирувата 97, 98
— полимеров 129—131
— поли-fl гидроксибутирата 123
— пропионата 136
- — протокатехата 146, 147
— углеводов 109, 111
— углеводородов 140
— урата 137
— фруктозы 93, 94
— целлюлозы 130
Реакционный центр 269
Регуляция активности нитрогеназы
287
*--рибулозо-1,5-бисфосфат — кар-
боксилазы 265
------ферментов 173—184
отрицательная и положительная
165
— синтеза ферментов 157—173
Редуктаза закиси и окиси азота 117
Репликация ДНК 82
Репрессия 165—173
— ди-, три- и мультивалентная 170
— конечным продуктом 168
Репрессор 168, 169
Ретиналь 276
Рибитолфосфат 126
Рибозо-5-фосфат 56
Рибозо 5-фосфат—изомераза (фос-
форибозоизомераза) 55, 56, 197,
262
Рибонуклеаза 131
Рибонуклеозиды 58
Рибонуклеотиды 58—63
Рибосомы 86
Рибофлавин 16, 201
Рибулозо 1,5-дифосфат—карбокси-
лаза 233, 260—263, 274
— оксигеназная реакция 265
Рнбулозомонофосфатный цикл 151
Рибулозо 5-фоссрат—3-эпимераза 56,
193, 197, 262
РНК 84—87
— информационная (матричная) 84
— — оборот 44
— рибосомная 84
— синтез 80
— содержание в клетке 43
— транспортная 84
РНКаза 131
РНК-полимераза 83
Роданеза 257
Рост, диауксия 165
Роста факторы 16
Рубредоксин 142, 205, 237
Рубца бактерии 130, 230
Салицилат 145
Сахара, расщепление 23, 93, 107, 111,
188
Сахарозофосфорилаза 130
Сбраживание аминокислот 238
— гетероциклических соединений 245
— углеводов 186—219
Светособирающие центры 269
Свободной энергии изменения 33,
189, 253
Связи, богатые энергией 11, 12
— водородные 81
--- в спаривании оснований 81
— пептидные, образование 86
Седогептулозо-1,7-дифосфат 262
Седогептулозе-1,7-дифосфат—альдо-
лаза 262
Седогептулозо-7-фосфат 57, 262
— формула 57
Селен 9, 218, 234
Селенопротеид 244
Сера, восстановление 238
— в питании 8, 9, 13, 14
— элементарная 256
Предметный указатель
зоз
Серы соединения, окисление бактери-
ями 251
L-серин 51, 125, 150
Серингидроксиметилаза 150
Серин-гидроксиметилтрансфераза 51,
239, 247
Сериндегидратаза 133, 242
Серин-изоцитрат—лиазный путь 150
Сероводород 48, 236 z
Синтез аминокислот 50
— ацетона 208
— белков 88
— бутанола 208
— бутирата 206
— витамина С 155
— ДНК 79
— липидов 64, 72
— макромолекул 72
— ненасыщенных жирных кислот 67
— РНК 79
— углеводов 70
— фосфатидной кислоты 68
— фосфолипидов 69
D-сорбитол 155
L-сорбоза 155
Спаривание оснований 81
Спириллоксантин 267
— формула 267
Споруляция 156
С тереоспецифич ность цитр а т-синт азы
214
— лактатдегидрогеназы 198
Стикленда реакция 243
Субтилизин 131
Сукцинат 27, 96, 214, 225
Сукцинатдегидрогеназа 27, 31
Сукцинат-пропионатный путь 221
Сукцинат-тиокиназа 27
О-сукцинилгомосерин- синтетаза 174
Сукцинил-СоА 27, 136, 221, 223
Сульфат как акцептор электронов 14
— ассимиляция 47
“ диссимиляционное восстановление
235
— образование из сульфида 257, 272
— сбраживание 235
Сульфатредуцирующие бактерии 235
Сульфид как донор электронов 15
— окисление 257, 272
Сульфидредукция 235
Сульфит 257
Сульфитоксидаза 257
Сульфитредуктаза 48, 236
Тартроновой кислоты полуальдегид
— — — редуктаза 139
Тейхоевые кислоты 126
Тетрагидрофолиевая кислота 16, 51,
62, 234, 239, 247
— — формула 51
Тетрапептиды пептидогликанов 124
Тиамин 16
Тиаминпирофосфат 26, 201, 204, 216
— формула 26
Тимидинмонофосфат 59, 64
Тимин 59
Тиолаза 207, 212
Тиоредоксин 64
L-тирозин 53, 143, 175
Толуат 144
Толуол 145
ТРР см. Тиаминпирофосфат
Трансальдолаза 56, 111, 152, 197
Трансаминаза 46, 133, 150, 171
Трансгидрогеназа 220
Трансглюкозилирование 74
Транскарбоксилаза 221, 234
Транскетолаза 56, 11, 152, 197, 262
Транскрипция 83
Трансляция 86
Транспептидация в синтезе пептидо*
гликанов 76
Транспорт 101—106
— активный 102, 105
— глюкозы 20, 105
— лактозы 94
— пассивный 101
— фруктозы 93
L-треонин 50, 133, 170
— сбраживание 240
Треонин-альдолаза 240
Треониндегидратаза 133, 240
Треониндезаминаза 173, 174
Трёонин-синтаза 170
Трикарбоновых кислот цикл 26, 97,
154, 214
------- распространение 113
---— регуляция 172, 178
Триозофосфатизомераза 23, 262
L-триптофан 53, 145
— регуляция синтеза 169, 175
Триптофановый оперой 169
Триптофан-синтаза 169
Тритионат-редуктаза 236
Тунберга метод 40
Углеводороды алифатические 140
— расщепление 140
Углеводы, расщепление 21—29, 93—
95, 106—113, 130, 191, 207, 217,
233, 234
— синтез 70 7
364
Предметный указатель
Углекислый газ как источник углеро-
да 15, 203—205, 233, 260-265, 272
—1 — карбоксилирование ацетил-СоА
66, 213
------- пирувата 118
------- пропионата 136
-------фосфоенолпирувата 89
—1---потребность 213, 226
Углерода источники 13, 15
— окись 259
— соединения 8, 15
UDP см Уридин-5 дифосфат
UDP-N-ацетилглюкозамин 71
UDP-N-ацетилмурамилпентапептид
-'71, 75
UDP-N-ацетилмурамовая кислота 71
<Л)Ргалактоза 70, 95
иВРглюкоза 70, 95
иОРглюкоза-пирофосфорилаза 70
Уксуснокислые бактерии 153
Ундекапренилфосфат 75
Уотсона — Крика модель 80
Урат, расщепление 137, 246
Урацил 59, 247
Уреаза 137
Уреидогликолаза 137
Уреидоглицин-аминогидролаза 137
4-Уреидо-5-имидазолкарбоксилат 246
Уридин-5'-дифосфат 70, 95
Уриказа 137
Уроканаза 134
Уроканат 134
Фактор F«o 228
•р-Фактор 84
б-Фактор 83, 84
Фарадея константа 29
ФАФС см. Аденознн-З'-фосфат-б'-фос-
фосульфат
ФАФС-редуктаза 48
L-фенилаланин 53, 143, 175
Фенилаланин-гидроксилаза 143
Фенантрен 145
Фенол 145
фермент, окисляющий серу 257
Ферменты аллостерические 176
-----регуляция 180
Ферредоксин 204—206, 234, 246
FeS-белок ем. Железосеропротеиды
FeS кластер 33, 205
Фиксация молекулярного азота 280—
288
— углекислого таза 260—265
Флавинмононуклеотид, формула 31
Флаводоксин 206, 216
Флавопротеиды 30, 31, 38—40, 114,
116, 201, 220, 256
Фолиевая кислота 16, 51
Формальдегид 150—153, 229
Формальдегиддегидрогеназа 149
Формамид 134
5 Формамидоимидазол-4-карбокси-
амидрнбонуклеотид 62
Формиат 140, 149, 150, 213, 215, 217,
218, 229, 233, 246, 247
— сбраживание 232
Формиат—водород-лиаза 217, 218
Формиат дегидрогеназа 140, 150, 218,
232—234
N формилглицинамидрибонуклеотид
61
Формилкинуренин 145
N-формилметионил-тРНК 87
Формил-СоА 140
Формиминоглицин 246, 247
Формиминоглутамат-гидролаза 134
Ы-формимино-Ь-глутамат 134
Формимино-Н« фолят—циклодез-
аминаза 247
Фосфат в питании 8
Фосфатаза 97, 262
Фосфатидил серин 69
Фосфатидилхолин 69
Фосфатидилэтаноламин 60
Фосфатидная кислота 68
З-Фосфогидроксипируват 52
З-Фосфоглицеральдегид см. Глицер-
альдегид-3-фосфат
2-Фосфоглицерат 23
З-Фосфоглицерат 23, 52, 150, 260
— как продукт фиксации СО2 260
3 Фосфоглицерата семейство 52
З-Фосфоглицераткиназа 16, 22, 191,
260
Фосфоглнцеромутаза 23, 150, 19Д
Фосфоглюкозоизомеразд (Глюкозо-
фосфатизомераза) 23, 94, Ш
Фосфоглюкомутаза 70
6-Фосфоглюконат 56, 107, ПО, 111,
195
Фосфоглюконат-дегидратаза 107, 108
Фосфоглюконат-дегидрогендза 56,
111, 195
Фосфоглюконолактон 56
Фосфоенолпируват 138, 150, 179, 181,
191
— в анаплеротических реакциях 89,
119
-----биосинтезах 44, 61
-----глюконеогенезе 96
-----окислении глюкозы $}3
— формула 12
Фосфоенолпируват глюкоза—фос-
фотрансфераза 20, 23
Предметный указате гь
305
Фосфоенолпируват-карбоксикиназа
97, 119, 138, 226
Фосфоенолпируват-карбоксилаза 89,
118, 119, 150, 179, 217
Фосфоенолпируват-карбокситранс-
фосфорилаза 226
Фосфоенолпируват-синтетаза 98, 119
Фосфоенолпируват-фосфотрансфераз-
ная система 21, 94, 105
Фосфоенолпируват : фруктозо—фос-
фотрансфераза 94
Фосфокетолаза 195—197
Фосфолипиды в мембранах 72, 78
— синтез 68
— формула 65
4-Фосфопантетеин 66
Фосфопентозоэпимераза 56, 262
Фосфорибозиламиноимидазол-карбо-
ксамид—формилтрансфераза 62
Фосфорибозиламиноимидазол-карбо-
ксилаза 62
Фосфорибозиламиноимидазол-синте-
таза 61
Фосфорибозиламиноимидазол-сукци-
нокарбоксиамид—синтетаза 62
Фосфорибозилглицинамид-формил-
трансфераза 61
5-Фосф'орибозил-1-пирофосфат 54, 60
Ф осфори бози л фо р ми л г л ицин а ми д-
синтетаза 61
Фосфорибозоизомераза см. Рйбозо-
фосфатизомераза
Фосфорибулокиназа 262, 263, 274
Фосфорилирование на уровне субст-
рата 12, 22, 24, 28, 195, 236
— ингибиторы и разобщители 39
— при переносе электронов 12, 33—
39, 222, 225, 229, 237, 256
Фосфорокластическая реакция 204
3-Фосфосерин 52
Фосфотрансацетилаза 195, 204, 207,
212, 217, 220, 234, 236, 247
Фосфотрансфераза в транспорте уг-
леводов 20, 93, 105
1-Фосфофруктокиназа 93, 94
6-Фосфофруктокиназа 16, 93
— в эффекте Пастера 191
— регуляция 178, 180
Фосфо-НРг 21, 93
Фотовосстановление NAD 273
Фотолитрофия, определение 13
Фотообразование молекулярного во-
дорода 275
Фотоорганотрофия, определение 13
Фотосинтез 265—277
— у галобактерий 275
Фотосинтетический аппарат 267—271
Фототрофия, определение 12
Фототрофные бактерии 265
Фототрофный метаболизм 265—277
Фотофосфорилирование нецикличе-
ское 271
— циклическое 271
ФРПФ см. 5-фосфорибозил-1-пиро-
фосфат !
Фруктоза как субстрат 93
— сбраживание 192, 234
Фруктозо-1,6-бисфосфат 23, 180, 181>
197
Фруктозо-1,6-бисфосфатаза 180, 261
Фруктозо-1,6-бисфосфат—альдолаза
23, 261
Фруктозо-1-фосфат 94
Фруктозо-6-фосфат 23, 56, 152, 19бг
197
Фруктозо-6-фосфат—фосфокетолаза
197
Фумараза 27, 217, 221
Фумарат 27, 143, 221, 225
Фумаратредуктаза 217, 221—225
4-Фумарилацетоацетат 143
Фумарилацетоаце^атгидролаза 143
Хемолитотрофия 251—260
— облигатная 15, 258
— определение 14—15
—. факультативная 258
Хемоорганотрофия, определение 14
Хемотрофия, определение 14
Химио-осмотическая гипотеза 36, 37
Химические элементы в питании 7—
10_
Химического сопряжения гипотеза 35
Хитиназа 131
Хлористый натрий 9
Холин 69
Хоризмат 53, 175
Хоризматмутаза 175
Целлобиоза 130
Целлобиозофосфорилаза 130
Целлюлаза 130
Целлюлоза, расщепление 130
Цефалоспорин 76
Цианид 40
Цианкобаламид 16, 224
Цикл трикарбоновых кислот см.
Трикарбоновых кислот цикл
Цикло-АМР 166
Цикло-AMP-связывающий белок 166
Циклосерин 72
Циклы пустые см. Пустые циклы
306
Предметный указатель
L-цистсин 33, 37, 52
Цитидин 5-монофосфат, формула 59
Цитидин-5-трифосфат 63, 69, 158
Цитозин, формула 59
Цитохром, формула 32
— а 30, 114
— а3 30
— b 30, 38, 114, 225, 237
— с 30, 114
— сз 237
— d 114
— о 30, 38, 114
Цитрамалат 240, 241
Цитрамалат лиаза 241
Цитрат 27, 200
— сбраживание 200
Цитрат-лиаза 182, 200
— регуляция 182
Цитрат-синтаза 26, 27, 172, 179
— стереоспецифичность 214
L цитруллин 243
CDР-диацетилглицерол 69
Шикимат 53, 143
Электроны, перенос (транспорт) 32,
204, 270, 271
—< — обратный 255, 272
Эффекторы аллостерические 176
Яблочно молочнокислое брожение
199
«Яблочный» фермент 99, 199
Янтарнокислое брожение 219
ОГЛАВЛЕНИЕ
Предисловие редактора перевода................................... 5-
Предисловие........................................................ 6
Глава 1. Питание бактерий , ................................ 7
I. Главные и минорные биоэлементы ... 7
II. Два основных механизма синтеза АТР........................ 10
III. Питательные вещества как источники энергии .... .... 12
А. Фототрофия . . . .'..................................... 13
Б. Хемо^рофия............................................... 14
IV. Потребности бактерий в факторах роста............... .... 16
V. Выводы..................................................... 17
Escherichia coli
Глава 2. Как Escherichia coli синтезирует АТР при аэробном росте на сре-
дах с глюкозой.....................................................19
I. Транспорт глюкозы в клетки Е. coli..........................20
II. Расщепление глюкозо-6-фосфата до пирувата по пути Эмбдена —
Мейергофа — Парнаса............................................ 21
III. Окислительное декарбоксилирование пирувата до ацетилкофермен-
та А............................................................ 24
IV. Окисление ацетил-СоА в цикле трикарбоновых кислот.......... 26
V. Образование АТР в дыхательной цепи . ..................... 29
А. Окислительно-восстановительный потенциал................ 29
Б. Компоненты дыхательной цепи.............................. 30
В. Фосфорилирование при переносе электронов................ 33
Г. Разобщители и ингибиторы................................. 39
Д. Значение пероксид-дисмутазы.............................. 40
VI. Выводы..................................................... 41
Глава 3. Биосинтез различных веществ из глюкозы у Escherichia coli 43
I. Состав клеток Е. coli.................. 43
II. Ассимиляция аммиака.................................... 45
III. Ассимиляционное восстановление сульфата.................. 47
IV. Биосинтез аминокислот.................................... 49
V. Как образуются пентозофосфаты и NADPH2................... 55
VI. Рибонуклеотиды и дезоксирибонуклеотиды................... 58
А. Синтез дезоксирибонуклеотидов.......................... 63
VII, Биосинтез липидов........................................ 64
А. Жирные кислоты......................................... 65
Б. Фосфатидная кислота.................................... 68
В. Фосфолипиды............................................ 69
VIII. Образование углеводов.................................. 70
308
Оглавление
IX‘Синтез полимеров......................’..................... 72
А. Липиды ................................................ 72
Б. Периодические макромолекулы............................ 73
В. Синтез информационных макромолекул . . '............... 79
X Потребность в анаплеротической последовательности......... 89
XI. Выводы .........................,.......................... 90
Глава 4. Аэробный рост Escherichia coli на субстратах, отличных от глю-
козы ...............................-.....................................93
I. Фруктоза и лактоза в качестве субстратов......................... 93
II. Ацетат, пируват и малат в качестве субстратов.................... 95
III. Выводы........................................................... 99
Глава 5. Метаболическое разнообразие аэробных гетеротрофов . . . 101
I. Различные механизмы поглощения субстратов................... 101
А. Пассивная диффузия....................................... 101
Б. Облегченная диффузия .................................... 102
В. Активный транспорт....................................... 102
Г. Перенос групп............................................ 105
П. Путь Энтнера — Дудорова.......................................106
III. Расщепление сахаров в пентозофосфатном цикле................ 111
IV. Метилглиоксалевый шунт.....................„.................112
V. Разнообразие энергетического метаболизма.................... 113
А. Пируватдегидрогеназа..................................... 113
Б. Цикл трикарбоновых кислот (ЦТК)............................ ИЗ
В. Дыхательная цепь......................................... 114
VI. Диссимиляционное восстановление нитрата.....................115
VII. Другие анаплеротические последовательности...................117
А. Фосфоенолпируват-карбоксилаза..............................118
Б. Пируваткарбоксилаза...................................... 118
VIII. Биосинтез мономеров и полимеров............................. 120
IX. Выводы..................................................... 126
Глава 6. Катаболическая активность аэробных гетеротрофов . . 129
I. Расщепление полимеров экзоферментами........................129
II. Рост на аминокислотах.......................................132
III. Рост на органических кислотах...............................134
IV. Рост на алифатических углеводородах..........................140
V. Рост на ароматических соединениях.......................... 142
А. Орто-расщепление, или 3-оксоадипатный путь................ 145
Б. Мета-расщепление ..........................................147
VI. Рост на Ci-соединениях.......................................147
А. Облигатные метилотрофы ....................................148
Б. Факультативные метилотрофы.................................153
VII. Неполные окисления.........................................153
VIII. Выводы......................................................156
Глава 7. Регуляция метаболизма у бактерий.............................159
I. Регуляция синтеза ферментов путем индукции и репрессии . . 159
А. Индукция ферментов......................................... 159
Б. Катаболитная репрессия...................................... 165
В. Репрессия конечным продуктом................................168
Г. Синтез ферментов центральных метаболических путей .... 172
II. Регуляция активности ферментов................................173
А. Ингибирование по типу обратной связи........................ 173
Б. Свойства аллостерических ферментов.................. . . 176
ч В. Аллостерическая регуляция центральных метаболических путей 178
Г. Ковалентная модификация ферментов........................... 183
Ш. Выводы......................................................... 16^
Оглавление 309
Глав# 8. Бактериальное брожение ....................................186
I. Спиртовое брожение...................... *...................190
А. Образование этанола дрожжами.............................. 190
Б. Эффект Пастера........................................... 190
< В. Спиртовое брожение, вызываемое бактериями . . . . т . . . 192
II. Молочнокислое брожение...................................... 193
А. Гомоферментативное молочнокислое брожение................. 194
Б. ГетероферМентативное молочнокислое брожение................194
В. Брожение, вызываемое бифидобактериями......................196
Г. Стереоспецифичность лактатдегидрогеназ ....................198
Д. Брожение других сахаров.................................. 199
Е. Яблочно-молочнокислое брожение............................ 199
Ж. Образование диацетила и ацетоина...........................200
3., Выход биомассы............................................201
И. Рост на воздухе............................................202
III. Маслянокислое и ацетон-бутаноловое брожение..................203
А. Ферредоксин и пируват: ферредоксин-оксидоредуктаза . . . 204
Б. Путь образования бутирата..................................206
В. Образование ацетона и бутанола.............................208
Г. Баланс брожения.......................................... 209
Д. Не все сахаролитические клостридии образуют бутират .... 211
Е. Этанол-ацетатное брожение у Clostridium kluyveri...........211
Ж- Особенности биосинтетического метаболизма Clostridium kluyveri 213
IV. Смешанное и бутандиоловое брожение...........................214
А. Пируват—формиат-лиаза ....................................215
Б. а-Ацетолактат-синтаза.................................... 216
В. Формиат—водород-лиаза...................,.................218
" Г. Выход АТР................................................. 219
V. Пропионовокислое и янтарнокислое брожение....................219
А Акрилатный путь.............................................220
Б. Сукцинат-пропионатный путь.................................221
В. Реакции перегруппировки, катализируемые метилмалрнил-
СоА—мутазой и другими кофермент В!2-зависимыми ферментами 222
Г. Фумаратредуктаза......................................... 224
Д. Фосфоенолпируват-карбокситрансфосфорилаза пропионовых бак-
терий .....................................................226
Vi. Метановое и ацетатное брожение.............................226
А. Образование метана из СО2 и Н2...........................227
Б. Межвидовой перенос водорода...............................230
В. Образование метана из формиата, метанола и ацетата .... 232
Г. Ацетатное брожение...................................... 233
VII. Сульфатредукция '-(десульфатация)'..........................235
А. Сбраживание лактата и сульфата . . . ....................235
Б. Рост на других субстратах.......................... . . 237
В. Desulf urotnanas acetoxidans.............................238
VIII. Брожение азотсодержащих соединений..................- . . 238
А. Отдельные аминокислоты.......................... 238
Б. Реакция Стикленда .' ................. 243
В. Гетероциклические соединения ............................245
IX. Выводы.....................................................247
Глава 9. Хемолитотрофный и фототрофный метаболизм...................251
х I. Хемолитотрофный метаболизм.....................................251
А. Физиологические группы хемолитотрофов.................... 251
Б. Получение энергии и генерирование восстановительных эквива-
лентов ...................................................252
В Факультативные и облигатные хемолитотрофы................258
Г. Окисление окиси углерода............?.....................259
310
Оглавление
II. Ассимиляция СО2.............................................260
А. Реакции цикла Кальвина.....................................260
Б. Фосфорибулокиназа и рибулозо-1,5-бифосфат—карбоксилаза 263
III Фототрофный метаболизм.......................................265
А. Три семейства фототрофных бактерий.........................265
Б. Реакции фотосинтезирующего аппарата........................269
В. Генерирование восстановительных эквивалентов...............271
Г. Углеродный метаболизм......................................274
Д. Фотообразование молекулярного водорода.....................275
Е. Фотосинтез у галобактерий..................................276
IV. Выводы.......................................................277
Глава 10. Фиксация молекулярного азота..............................280
I. Азотфиксирующие организмы....................................280
II. Биохимия фиксации азота.....................................281
А. Строение нитрогеназы......................................281
Б. Нитрогеназная реакция......................................281
В. Источники восстановительных эквивалентов................. 283
Г. Чувствительность к присутствию кислорода...................283
Д. Симбиотическая фиксация азота..............................285
III. Регуляция активности нитрогеназы............................287
IV. Выводы.................>.....................................287
Рекомендуемая литература............................................289
Предметный указатель................................................293