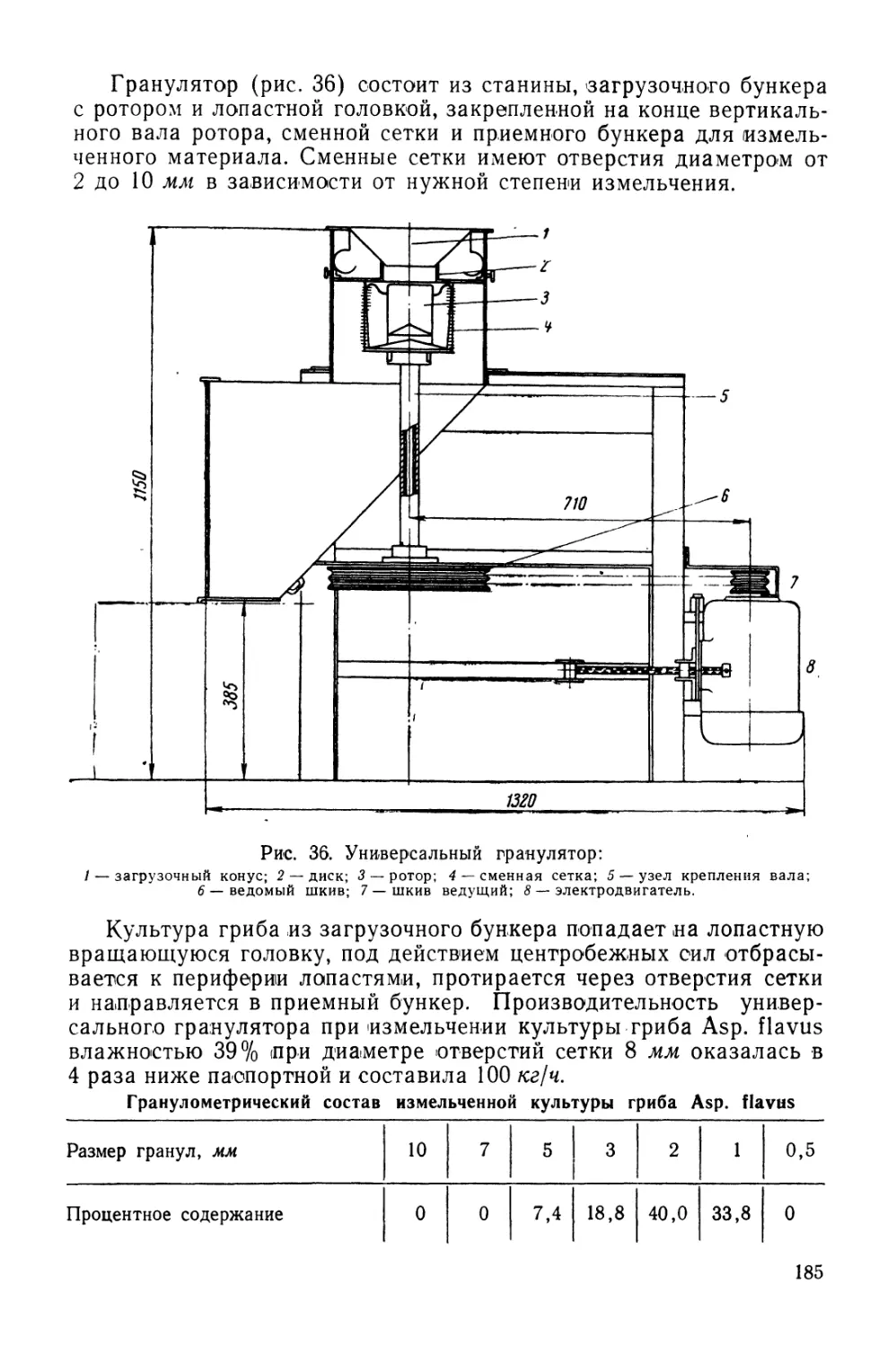
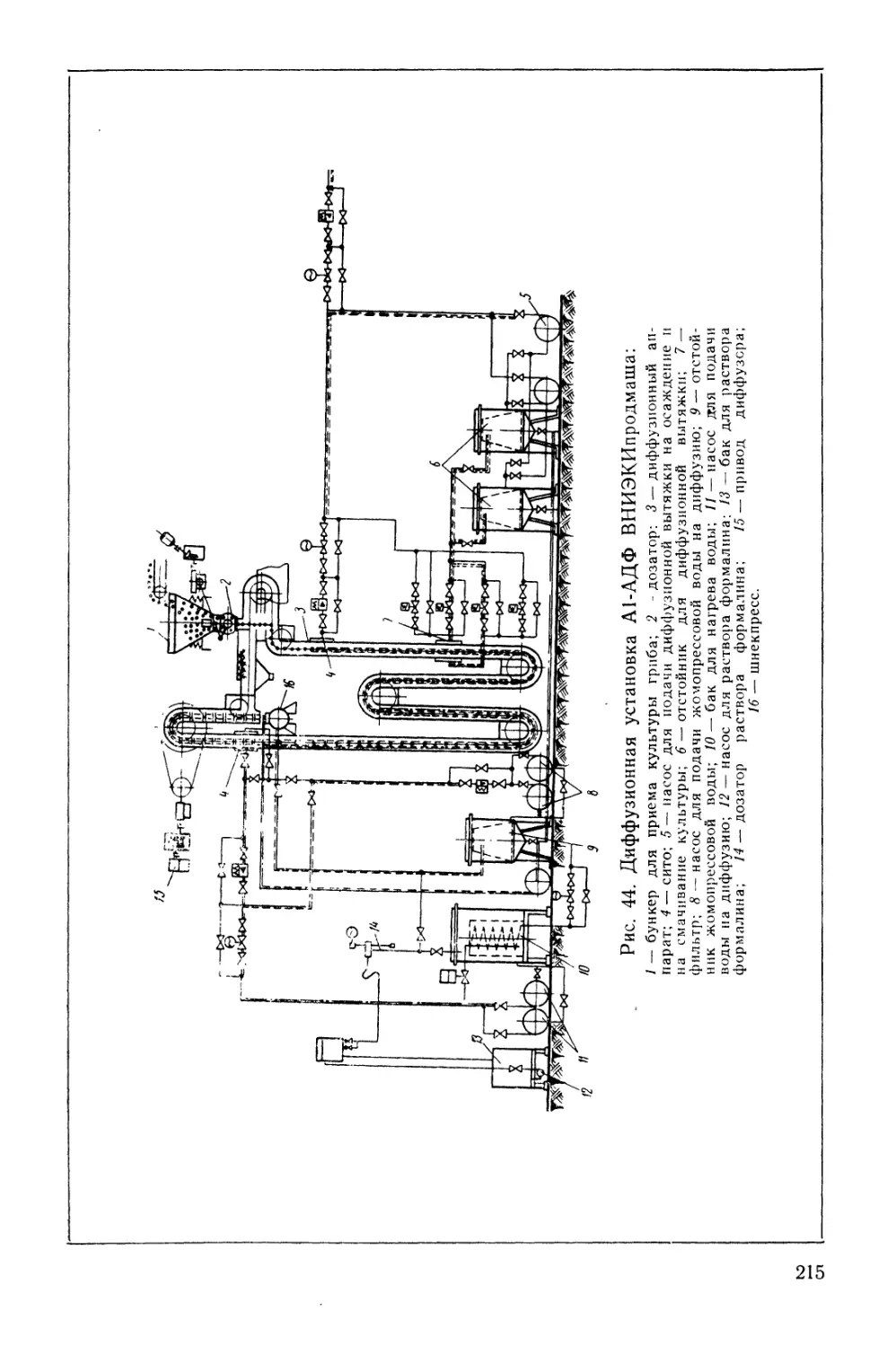
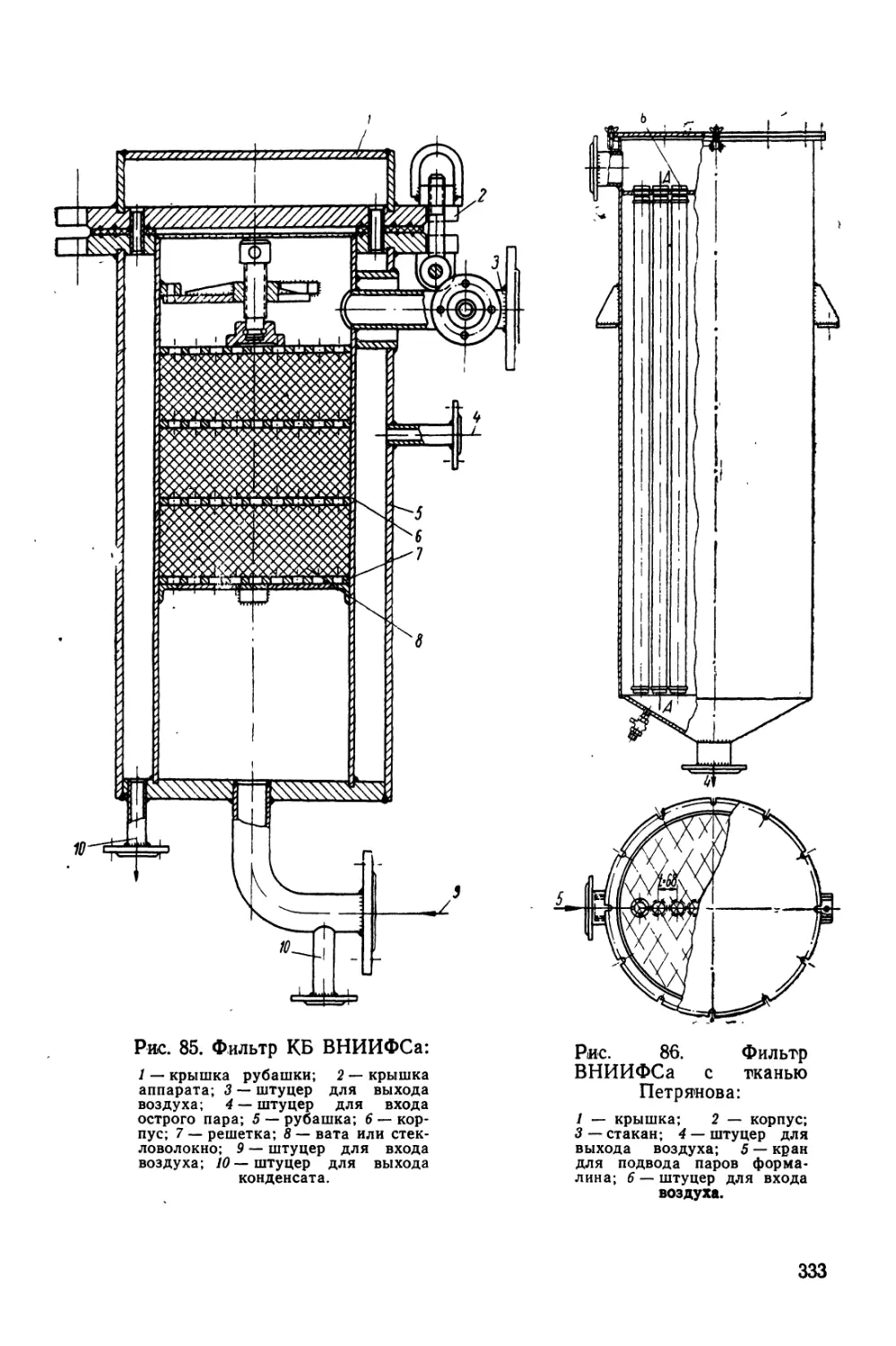
Текст
ЛЛЯРОВЕНКО
К.Л КАЛУНЯНЦ
л иголок
ПРОИЗВОДСТВО
ФЕРМЕНТНЫХ
ПРЕПАРАТОВ
ИЗ ГРИБОВ
И БАКТЕРИЙ
В. Л ЯРОВЕНКО,
К А К АЛ У Н ЯН Ц,
Л И ГОЛГЕР
ПРОИЗВОДСТВО
ФЕРМЕНТНЫХ
ПРЕПАРА ТОВ
ИЗ ГРИБОВ
И БАКТЕРИЙ
ИЗДАТЕЛЬСТВО
„ПИЩЕВАЯ ПРОМЫШЛЕННОСТЬ"
МОСКВА 1910
УДК 577.15:576.8
Яровенко В. Л., Калунянц К. А., Голгер Л. И.
«Производство ферментных препаратов из грибов
и бактерий». 1969. Стр. 444.
Предлагаемая читателю книга является обоб-
щением результатов научно-исследователь-
ских работ, опытного и промышленного производ-
ства ферментных препаратов из грибов и бак-
терий как в нашей стране, так и за рубежом.
Приведено краткое понятие о ферментах и
их свойствах, дана методика определения фер-
ментативной активности. Рассмотрено сырье и
вспомогательные материалы, применяемые для
производства ферментных препаратов. Изложены
методы поверхностного и глубинного культивиро-
вания микроорганизмов — продуцентов фермен-
тов. Описаны технологические схемы целой ли-
нии производства, режимы культивирования и
аппаратурное оформление каждого процесса,
методы выделения ферментов, их очистки, кон-
центрирования, сушки, стандартизации и хра-
нения.
Отдельные главы посвящены применению
ферментных препаратов в народном хозяйстве и
вопросам техники безопасности.
Таблиц 44, иллюстраций 128, библиография
366 названий.
Рецензенты: д-р биол. наук проф. И. Я. ВЕ-
СЕЛОВ, д-р техн, наук проф. В. А. СМИРНОВ
Спецредактор д-р биол. наук,
проф. А. С. ЦЫПЕРОВИЧ
3—17—8
37—69
ПРЕДИСЛОВИЕ
В нашей литературе отсутствуют кни-
ги по технологии ферментных препаратов.
Поэтому нужно приветствовать попытку
подытожить опыт в области технологии и
технологического оборудования промыш-
ленного производства ферментных препа-
ратов плесневого и бактериального про-
исхождения.
Авторы данной книги в течение многих
лет ведут работу в области производства
ферментных препаратов из грибов и бак-
терий. Поэтому обобщение ими отечествен-
ного и зарубежного опыта представляется
своевременным и полезным. Издание этой
книги будет способствовать дальнейшему
развертыванию исследовательской и кон-
структорской работы в данной области.
Член-корр. АН СССР,
профессор В. КРЕТОВИЧ
ОТ АВТОРОВ
Предлагаемая вниманию читателей книга является обобщением
результатов научно-исследовательских работ, опытного и промыш-
ленного производства ферментных препаратов в нашей стране.
В начале книги дается краткое понятие о ферментах и их свой-
ствах, а также излагается методика определения ферментативной
активности различных объектов.
Применение ферментов в промышленности и сельском хозяйстве
(глава II) основано на использовании их каталитических свойств
вызывать резкое ускорение химических превращений при перера-
ботке различного сырья растительного и животного происхождения.
С помощью ферментных препаратов можно не только интенси-
фицировать, но даже преобразовать многие технологические про-
цессы.
Описание используемого в производстве сырья (глава III) имеет
большое значение, поскольку в калькуляции себестоимости сырье
составляет около 70%, а следовательно, подбор его сильно влияет
как на выход ферментов, так и на себестоимость их.
В главе IV и VI рассматриваются способы поверхностного и глу-
бинного культивирования микроорганизмов — продуцентов фер-
ментов. Значение этой проблемы велико. Целый ряд штаммов мик-
роорганизмов обильно продуцирует определенные ферменты только
при поверхностном или глубинном методе выращивания, с чем нель-
зя не считаться. Речь идет о выборе наиболее совершенных техноло-
гических приемов и отработке оптимального режима и соответству-
ющего аппаратурного оформления каждого из указанных методов
культивирования.
Процессы выделения, концентрирования, сушки, стандартизации
и хранения ферментов (главы V и VII) еще.недостаточно изучены
не только у нас в стране, но и за рубежом, а используемая аппара-
тура далеко не совершенна. Поэтому в данной области непочатый
край работы для исследователей и опытных специалистов — проек-
тантов и производственников.
Нестандартность аппаратуры для подготовки и стерилизации
сред, а также для глубинного и поверхностного культивирования
микроорганизмов свидетельствует о сложности технологических ис-
следований и методов их сравнительной оценки.
Разнообразие аппаратуры, используемой в настоящее время для
выделения, концентрирования и стандартизации показывает, с од-
ной стороны, широту проводимых исследований, а с другой — несо-
4
вершенство и неоднозначность критериев оценки. Вместе с тем это
указывает на возможность выбора лучшего из существующего обо-
рудования и, что всего важнее, позволяет более точно определить
задачи при разработке нового оборудования.
Разработке отдельных технологических процессов, производст-
венных линий и аппаратурных форм, приведенных в главах IV—VI I,
в отраслевых институтах (ВНИИ ферментной и -спиртовой промыш-
ленности, УкрНИИ пищевой промышленности, ВНИИ пиво-безал-
когольной промышленности и др.) предшествовала большая и кро-
потливая исследовательская работа. Полученные на этой основе
необходимые сведения и разработки неоднократно проверялись ла-
бораторно и уточнялись, однако, при переходе к большим масшта-
бам они, естественно, вновь рассматриваются, уточняются и совер-
шенствуются в ходе производства.
В заключение хочется отметить, что актуальность издания книги
по технологии ферментных препаратов вызвана отсутствием систе-
матизированного материала по этому вопросу в отечественной и за-
рубежной литературе. Объясняется это тем, что до последнего вре-
мени в нашей стране не было достаточного производственного опы-
та, а технология ферментных препаратов за рубежом засекречена,
в связи с чем в главе VIII дан только краткий обзор ее состояния.
Приступая к работе над книгой, авторы стремились до некоторой
степени восполнить этот пробел. Насколько им это удалось —
судить читателю.
Ознакомление с приводимым ниже фактическим материалом
инженеров и техников ферментных заводов, научных сотрудников
отраслевых научно-исследовательских институтов, студентов и пре-
подавателей техникумов и вузов должно содействовать освоению
и дальнейшему развитию этой отрасли промышленности.
Авторы с большой благодарностью примут все замечания чи-
тателей.
ВВЕДЕНИЕ
Производство ферментных препаратов началось сравнительно
недавно, после того как была доказана решающая роль их в обме-
не веществ живых организмов и установлена возможность примене-
ния для интенсификации различных технологических процессов.
Значение ферментов намного возросло с тех пор, как химикам
и биологам удалось выделить их в чистом виде, что дало возмож-
ность изучить их основные свойства, химическую природу и биоло-
гические функции. Исследования кинетики и механизма действия
ферментов позволяют выяснить и наметить пути применения этих
биологически активных веществ в различных отраслях промышлен-
ности, сельского хозяйства и медицине.
Более сорока лет прошло с момента получения первого кристал-
лического фермента уреазы (Самнер, 1926). За это время открыто
и описано более 800 индивидуальных ферментов, в том числе бо-
лее 20% выделено в высокоочищенном и кристаллическом состоя-
нии.
Отечественная ферментная промышленность начала создавать-
ся после второй мировой войны. Отдельные мелкие цехи для полу-
чения грибной пектиназы (в виде культуры) строились при соко-
экстрактных заводах, в том числе Старо-Русский начал работать
еще в 1935 г., а цехи по выработке грибных культур, содержащих
амилазы в комплексе с протеазами, вводились в эксплуатацию при
пивоваренных и спиртовых заводах. Широкое развитие этой отрас-
ли началось с 1962 г. после выхода в свет соответствующих прави-
тельственных решений о строительстве заводов ферментных пре-
паратов и организации ВНИИ ферментной и спиртовой промышлен-
ности, в котором были проведены научные исследования по разра-
ботке режимов производства и способов применения ферментных
препаратов в пищевой и легкой промышленности.
Научные исследования в области получения грибных культур
и ферментных препаратов были начаты под руководством
Р. В. Фениксовой еще в 1942 г. во ВНИИ спиртовой промышленно-
сти, а в J952 г. на их основе была разработана технологическая до-
кументация и построен цех для производства грибной культуры
Asp. oryzae, предназначенной для полной замены солода в произ-
водстве спирта на Серебряно-Прудском заводе. В дальнейшем на
этом же заводе было освоено и выращивание культуры Asp. awa-
mori для совместного применения с культурой Asp. oryzae в произ-
водстве спирта. Параллельно с этим В. В. Вяткин руководил иссле-
даваниями вопросов глубинного культивирования грибов Asp.
niger S. на Мичуринском и Приволжском заводах.
Производство и применение грибной амилазы Asp. oryzae в тех-
нологии пива было предметом исследований В. Я. Калашникова,
Д. Б. Лифшиц и сотрудников УкрНИИППа, создавших в 1951 г.
цех грибной культуры при Львовском пивоваренном заводе.
С 1950 г. во ВНИИ пиво-безалкогольной промышленности под ру-
ководством И. Я. Веселова и Л. С. Салмановой начались исследо-
вания плесневого гриба Trichothecium roseum, обладающего актив-
ным цитолитическим комплексом ферментов.
Исследования вопросов производства ферментных препаратов
тесно связывались с изысканием способов использования их в хле-
бопечении (В. Л. Кретович, Р. Р. Токарева, Е. И. Ведерникова),
при обезволашивании кожевенного сырья (В. Г. Бабакина), заме-
не сычужного фермента животного происхождения микробным
(И. Я. Веселов, А. И. Чеботарев) и в других отраслях промышлен-
ности.
Большую помощь развитию ферментного производства оказали
и продолжают оказывать специалисты заводов, конструкторских и
проектных организаций, занятые разработкой, монтажом и довод-
кой отдельных видов оборудования и установок, используемых в
качестве экспериментальной базы исследовательских институтов,
такие как А. П. Левчик, И. А. Самохин, А. Г. Козырев, Ю. И. Гон-
чаров, М. В. Бурова, Ю. И. Быков и др.
Исследования в области ферментного производства постоянно
опирались на передовой научно-методический опыт различных ла-
бораторий институтов биохимии и микробиологии АН СССР, а так-
же учитывали достижения иностранных ученых, которые в сжатой
форме публиковались в зарубежной научно-технической литературе.
В настоящее время основной технической базой ферментной про-
мышленности являются действующие цехи поверхностного (кювет-
ного) культивирования плесневых грибов Asp. oryzae, Asp. awamori
при спиртовых и пивоваренных предприятиях. В целях совершенст-
вования этой базы разработана техническая документация, изго-
товляются и испытываются кюветные установки периодического и
непрерывного действия. Базой глубинного культивирования грибов
Asp. batatae, Asp. usamii, Asp. awamori служат цехи, построенные
при Мичуринском ферментно-спиртовом и Приволжском биохими-
ческом заводах. Сюда можно также отнести оборудование заводов
глубинного метода получения лимонной кислоты из пленки гриба
Asp. niger, цеха ферментации глубинного культивирования бакте-
рий Cl. acetobutylicum, бутаноловых и молочнокислотных заводов, а
также заводов, выпускающих медицинские и кормовые антибиотики.
В течение последних лет очищенные ферментные препараты ами-
лазы систематически вырабатываются на Московском опытном фер-
ментном заводе, Вышневолоцком и Рассказовском заводах произ-
водятся очищенные препараты протеазы и пектиназы, технический
препарат протеазы (Оризин ПС), а на Мичуринском заводе — тех-
7
нический препарат Римозин ГР для кожевенной промышленности.
Начато промышленное применение грибных культур, выращенных
поверхностным и глубинным способом, а также ферментных препа-
ратов в виде сиропов и порошков.
Выращиваемые культуры грибов используются на месте или
транспортируются для последующего применения на другие заводы
различных отраслей промышленности, испытываются как добавки
к комбикорму при производстве силоса, используемого в животно-
водстве. Ферментные препараты в виде сиропов и порошков постав-
ляются предприятиям других отраслей, в том числе кожевенной и
меховой.
Таким образом, уже накопился определенный опыт промышлен-
ного производства и применения различных ферментных препара-
тов. По нашим представлениям, пришло время обобщить этот опыт,
чтобы он стал достоянием большого круга обучающихся и специа-
листов-практиков. Очень важно представить себе целесообразную
для настоящего времени технологию и аппаратурное оформление
ферментного производства, а также перспективы его дальнейшего
развития.
Следует отметить все еще невысокий уровень технического осна-
щения ферментных цехов с применением поверхностного выращива-
ния грибов на кюветах, где целый ряд технологических операций
выполняется вручную при контакте рабочих с микробами-продуцен-
тами. Вместе с тем уже изготовлена и доводится некюветная и гер-
метичная аппаратура для поверхностного выращивания в виде вер-
тикальных камер с разъемными кассетами (Мичуринский завод)
и непрерывнодействующих растильных установок. Разрабатывают-
ся, изготовляются и доводятся новые виды аппаратуры, решения
по которым будут приняты после стендовых и заводских испытаний.
Перспективно производство различных ферментов из глубин-
ных культур грибов и бактерий. По этой технологии включаются в
действие Вильнюсский завод и опытные цехи Олайнского, Мичурин-
ского и Приволжского заводов, а также проектируются новые за-
воды большей мощности.
Разрабатываются новые конструкции ферментаторов с повышен-
ным массообменом и увеличенным содержанием растворимого ки-
слорода в среде. Соответственно подбирается, разрабатывается и
частично испытывается аппаратура для отделения биомассы, очи-
стки и концентрирования ферментов с применением специальных
ионообменных смол и других поверхностно-активных веществ, суш-
ки и стандартизации разных ферментов.
Глава I. ФЕРМЕНТЫ, ИХ СВОЙСТВА
И ИСТОЧНИКИ ПОЛУЧЕНИЯ
Ферменты входят в состав клеток всех животных, растений и
микроорганизмов. Академик А. И. Опарин указывал, что ферментам
принадлежит очень важная роль в регуляции обмена в клетках рас-
тений, животных и микроорганизмов. Именно согласованной работе
отдельных ферментов или ферментных комплексов мы обязаны тем,
что химические реакции в клетке протекают не беспорядочно, а
последовательно и взаимосогласованно в пространстве.
В основе жизненного процесса лежит обмен веществ, составны-
ми звеньями которого являются многочисленные биохимические ре-
акции, в подавляющем большинстве случаев катализируемые фер-
ментами. Поэтому ферменты называют биологическими катализа-
торами.
СВОЙСТВА ФЕРМЕНТОВ
Катализаторами обычно называют вещества, способные резко
повышать скорость различных химических реакций. Разнообразные
неорганические катализаторы широко применяются в технике и, в
частности, при производстве серной кислоты, аммиака, азотной ки-
слоты, синтетического спирта и других соединений. В пищевой про-
мышленности при производстве глюкозной патоки и кристалличес-
кой глюкозы из крахмала в качестве катализатора используют кон-
центрированную серную или соляную кислоту.
Однако даже в присутствии неорганических катализаторов эти
процессы протекают медленно, для их проведения требуются боль-
шие давления и высокие температуры, кислая или щелочная среда,
а также специальные установки из устойчивых к коррозии дорогих
материалов.
Совсем по-иному протекает ферментативный катализ. В живом
организме при обмене веществ химические реакции идут с чрезвы-
чайной легкостью. Так, в пищеварительном тракте животного -пре-
вращение белка в аминокислоты, а крахмала в сахара происходит
очень быстро, несмотря на отсутствие «крепкой кислоты или щело-
чи, без давления и при обычной температуре (36—40°С). Это объяс-
няется тем, что в живом организме работают биологические катали-
9
заторы — ферменты, активность которых в сотни и тысячи раз выше
активности небиологических катализаторов.
Если, например, 1 моль ионов железа при 0°С в течение 1 сек
разлагает 10-5 молей перекиси водорода, то соответствующее ко-
личество каталазы при тех же условиях разложит 105 молей.
Другой важной особенностью ферментов является их строгая
специфичность. Многие ферменты катализируют лишь узкую груп-
пу сходных реакций или же одну реакцию с несколькими близкими
по строению соединениями (субстратами), или действуют только
на один субстрат. Это делает ферменты очень ценными катализато-
рами для использования их в промышленности и в аналитической
биохимии для количественного определения тех или иных соедине-
ний, например, глюкозооксидазы из гриба Penicillium vitale — для
количественного определения глюкозы в моче и крови больных диа-
бетом дсахарной болезнью), глютаматдегидрогеназы из сердца
крупного рогатого скота или свиней — для определения L-глютами-
новой кислоты, и др.
Субстратная специфичность ферментов обусловлена наличием
близкого соответствия (комплементарности) между структурой мо-
лекулы субстрата и химической конфигурацией определенного уча-
стка (центра связывания и активного центра) молекулы фермента.
До недавнего времени комплементарность раскрывалась в свете
представлений крупнейшего немецкого химика Э. Фишера, который
сравнивал молекулу субстрата с замком, а молекулу фермента —
с ключом. Такое представление предполагает заранее данные и не-
изменные свойства фермента и субстрата. Но уже в 1958 г. ан-
глийским биохимиком Кошлендом была выдвинута гипотеза прину-
дительной комплементарности, согласно 'которой контакт между
функциональными группами субстрата и активным центром фермен-
та возникает в ходе самого взаимодействия по мере образования
фермент—субстратного комплекса.
Таким образом, комплементарность — не статическое, а динами-
ческое свойство ферментов.
Известно, что химическая реакция между двумя видами моле-
кул может произойти лишь при условии их активации, т. е. когда
они получат определенное количество дополнительной энергии,
достаточное для того, чтобы их столкновения стали эффективными.
Эта энергия называется энергией активации Активация молекул
может быть достигнута путем увеличения их кинетической или вну-
тримолекулярной энергии.
Реакции, катализируемые ферментами, характеризуются более
низким значением энергии активации, чем соответствующие реак-
ции, катализируемые Н+, ОН~ и другими ионами или органически-
ми и неорганическими молекулами. Указанное снижение энергии
активации можно наблюдать на примере гидролиза сахарозы до
смеси глюкозы и фруктозы. Без участия катализатора для осущест-
вления этой реакции требуется энергия 134,1 кдж!моль
(32 ккал!моль). При катализе этой реакции Н+ энергия активации
10
снижается до 107 кдж (25,6 ккал), а при катализе ферментом са-
харазой (инвертазой) она составляет всего 39 кдж (9,4 ккал).
Можно сказать, что в среднем катализаторы небиологической
природы снижают энергию активации на 1'6,8—29,3 кдж!молъ
(4—7 ккал! моль), а ферменты на 67—75 кдж! моль (16—
18 ккал!моль).
Образование промежуточного фермент — субстратного комплек-
са сопровождается предварительной деформацией молекулы суб-
страта и изменением прочности внутримолекулярных связей, т е.
снижением энергетических барьеров, вследствие чего значительно
повышается реакционная способность молекулы субстрата.
Образование промежуточного фермент—субстратного комплек-
са подтверждается изменением спектра поглощения ферментов в
присутствии субстрата по сравнению со спектром поглощения чисто-
го фермента.
Большим достижением ферментологии является выделение и ха-
рактеристика истинных промежуточных фермент—субстратных ком-
плексов. Например, после инкубации трансальдолазы с фруктозо-
6-фосфатом-1—С14 путем осаждения сернокислым аммонием был
выделен довольно устойчивый радиоактивный фермент — субстрат-
ный комплекс.
В образовании и превращениях фермент—субстратных комплек-
сов различают несколько стадий: а) присоединение молекул субст-
рата к ферменту; б) преобразование первичного комплекса в один
или несколько активированных комплексов; в) отделение конечных
продуктов реакции от фермента.
Фермент—субстратный комплекс образуется не только ковален-
тными, координационными и ионными связями, но и за счет менее
прочных водородных связей и ван-дер-ваальсовых сил между не-
полярными участками молекул.
Биологические катализаторы, так же как и химические, ускоря-
ют прямую и обратную реакции (если эти реакции термодинамичес-
ки обратимы).
Впервые А. Я. Данилевский в 1896 г. показал, что протеолити-
ческие ферменты, расщепляющие белки, при определенных услови-
ях обнаруживают синтетическое действие. За .последние годы про-
ведены многочисленные опыты синтеза различных полисахаридов.
Так, с помощью фермента фосфорилазы из глюкозо-1-фосфата син-
тезирован сложный полисахарид амилоза. (Следует напомнить, что
в живом организме синтез амилозы происходит другим путем). С
помощью ферментов, выделенных из различных микроорганизмов,
удалось синтезировать еще более сложные соединения — нуклеино-
вые кислоты, молекулярный вес которых достигает нескольких мил-
лионов/ Следовательно, применение таких мощных катализаторов,
как ферменты, открывает новые пути органического синтеза.
Отличительным свойством ферментов является их большая ла-
бильность (неустойчивость), зависимость от температуры, pH среды,
И
окислительно-восстановительных условий и наличия ничтожных
примесей .некоторых веществ.
Истинная начальная скорость ферментативной реакции с повы-
шением температуры увеличивается, а количество субстрата, пре-
вращающегося за единицу времени, сначала также увеличивается,
но затем, с течением времени, из-за деструкции фермента умень-
шается (рис. 1).
Рис. 1. Типичные кривые хода
ферментативной реакции при
различной температуре, показы-
вающие зависимость кажущего-
ся температурного оптимума от
времени наблюдения:
1 — 40°С, 2 — 50°С, 3 — 60°С, 4 — 70°С
5 - 80° С.
Температура, оптимальная для действия фермента, зависит от
соотношения между влиянием температуры на скорость реакции и
на скорость деструкции фермента. Для ферментов животного про-
исхождения оптимум, как правило, составляет 40—50°С. Продолжи-
тельность реакции также влияет на действие фермента. С увели-
чением продолжительности снижается оптимальная температура
действия фермента, и наоборот.
При нагревании ферменты инактивируются, денатурируются и
необратимо разрушаются, как белки. Большинство ферментов инак-
тивируется в течение нескольких минут при температуре 75°С, но не-
которые из них инактивируются даже при 40—50°С, в то время как
бактериальная а-амилаза Вас. diastaticus не разрушается и при
100сС. Поэтому, изменяя температуру, можно влиять на синтез оп-
ределенного фермента и на скорость его действия в пределах опти-
мальной температуры, времени и других факторов.
Охлаждение значительно снижает ферментативную активность,
и этим приемом пользуются при хранении ферментных растворов и
высушенных препаратов для предотвращения размножения сопут-
ствующей микрофлоры и при хранении тех продуктов растительно-
го и животного происхождения, в которых ферментативные реакции
нежелательны.
12
Ферменты активны только в определенном интервале pH, и в
большинстве случаев для действия каждого фермента наблюдается
определенный оптимум pH (рис. 2).
Стабильность ферментов в значительной степени зависит от pH,
и при крайних значениях pH, как правило, наступает их необрати-
мая денатурация. Действие рассматриваемых факторов может на-
Рис. 2. Влияние pH на активность 1моноаминооксидазы
/ — активность при значениях pH, указанных на оси абсцисс, 2 — ак-
тивность при pH 7,3 после инкубации в течение 5 мин при значениях
pH, указанных на оси абсцисс.
блюдаться в комбинации одного с другим, тогда различить их мож-
но лишь экспериментальным путем. Например, наличие необрати-
мой инактивации устанавливают, инкубируя вначале фермент в ра-
створах с различными значениями pH, а затем определяя его актив-
ность по возвращении pH к исходному стандартному значению; так
как степень инактивации фермента со временем увеличивается, то
положение кажущегося оптимума pH зависит от времени, в течение
которого проводится наблюдение.
Оптимальные значения pH для действия различных ферментов
находятся в узких пределах. Так, например, оптимум pH для ами-
лазы поджелудочной железы 6,7—7,2; а-амилазы Asp. oryzae 4,7—
5,1; Вас. diastaticus 5,8; слюны 6,8; солода 4,2—5,7.
Для протеаз различного происхождения оптимум pH несколько
иной: для пепсина 1,5—2,0; грибной протеазы Asp. awamori 2,5—3,5;
Asp. terricola 7,0—7,3; бактериальной Вас. subtilis 6,3—6,5. Пекти-
наза Asp. niger имеет оптимум действия при pH 3,5.
Таким образом, следует различать влияние pH на скорость ре-
акции фермента и воздействие pH, сопровождающееся разрушени-
ем фермента. Эти понятия в технологии ферментных препаратов
учитывают при очистке и идентификации ферментов, а также при
выработке комплексных ферментных препаратов, когда требуется
усилить действие одного из входящих в комплекс ферментов.
13
Для активности многих ферментов необходимо наличие в них
SH-групп. Поэтому многие ферменты активируются сульфгидриль-
ными соединениями, т. е. веществами, содержащими SH-rpynny.
К ним относятся аминокислоты цистеин и трипептид глютатион
(последний может существовать в двух взаимно превращающихся
формах — восстановленной и окисленной). Соединения, реагирую-
щие с SH-группами (йодацетат, п-хлормеркурибензоат), инактиви-
руют очень многие ферменты.
Действие ферментов ингибируется под влиянием солей тяжелых
металлов (свинца, ртути, вольфрама), трихлоруксусной кислоты;
эти белковые осадители действуют на ферменты неспецифически, и
поэтому любой из них может быть применен для инактивации лю-
бого фермента.
Вместе с тем существуют специфические ингибиторы ферментов,
действие которых основано на специфическом связывании их с от-
дельными химическими группировками в активной группе фермен-
та. Примером может служить синильная кислота, которая, вступая
в химическое соединение с железом или медью, содержащимися в
активной группе ряда окислительных ферментов, блокирует эту ак-
тивную группу, в результате чего фермент теряет каталитическую
активность. Регулирование действия фермента в живой клетке на-
ряду со специфическими активаторами и ингибиторами осущест-
вляется также при помощи связывания этого фермента с белковыми
структурами протоплазмы.
" Установлено, что связывание некоторых ферментов с белками
сопровождается потерей ферментами активности и, наоборот, осво-
бождение фермента из этого соединения восстанавливает его ката-
литическую активность.
На действие фермента немаловажное влияние оказывает концен-
трация субстрата. Скорость образования фермент—субстратного
комплекса определяется скоростью его распада и следует уравне-
нию Михаэлиса — Ментен. Концентрация субстрата, при которой
скорость реакции равна половине максимальной, называется кон-
стантой Михаэлиса (Лм ). Эта константа является одной из важней-
щих характеристик ферментов, поскольку величина, обратная ей
(1/Лм ), определяет сродство ферментов к субстрату.
Для многих ферментов скорость реакции при повышении кон-
центрации субстрата растет, достигая максимума, но при дальней-
шем повышении концентрации снижается настолько, что фермент
можно не обнаружить. Это субстратное ингибирование фермента-
тивной реакции во многих случаях затрудняет определение актив-
ности ферментов: при избытке субстрата активность препарата бу-
дет занижена или вовсе не будет определена (рис. 3).
При оптимальной концентрации субстрата в среде скорость ре-
акции пропорциональна концентрации фермента; в других случаях
эта пропорциональность резко нарушается. Прямая пропорциональ-
ность между концентрацией фермента и скоростью реакции при оп-
тимальном количестве субстрата используется в данное время для
14
разработки методов определения удельной активности промышлен-
ных ферментных препаратов, т. е. активности их в расчете на 1 мг
белка или 1 мг препарата.
Несколько слов о химической природе ферментов. По химиче-
ской структуре они делятся на два больших класса: однокомпонент-
ные, состоящие исключительно из белка, обладающего каталитиче-
скими свойствами, и двухкомпонентные, состоящие из белковой и
небелковой части.
Рис. 3. Изменение скорости реакции в зависимости от
концентрации субстрата.
Исследование химической природы ферментов было начато с по-
мощью разработанного А. Я. Данилевским адсорбционного метода
их очистки, широко использованного позже Вильштеттером, обосно-
вавшим теорию двухкомпонентной природы ферментов. По этой те-
ории многие ферменты представляют собой сочетание активной
простетической группы (агона), вступающей в химическое взаимо-
действие с субстратом, и белкового носителя (ферона).
Примером двухкомпонентного фермента является пируватдекар-
боксилаза, катализирующая расщепление пировиноградной кислоты
на уксусный альдегид и углекислый газ. Простетической группой
пируватдекарбоксилазы является фосфорилированное производное
витамина Bi — тиаминпирофосфат. Простетической группой амино-
трансферазных ферментов, катализирующих важные реакции обра-
тимого переноса аминной группы от аминокислоты на кетокислоту
с образованием соответствующей кетокислоты и новой аминокисло-
ты, является фосфорилированное производное витамина Вб — пи-
ридоксальфосфат. В настоящее время, общепризнано, что биоло-
гическая роль витаминов заключается в том, что они входят (в
фосфорилированной форме) в состав простетических групп.
Двухкомпонентным ферментом является также каталаза, дейст-
вующая на перекись водорода.
15
Прочность связи простатической группы с белковой частью фер-
мента различна. У дегидрогеназ эта связь непрочна, поэтому они
легко диссоциируют, например при диализе на агон и ферон Легко
отделяющуюся от белковой части простетическую группу называют
коферментом. Так, коферментом каталазы служит гематин.
Многие однокомпонентные ферменты получены в очищенном со-
стоянии в виде белковых кристаллов с большой активностью. Так,
например, были получены в кристаллическом виде уреаза, катали-
зирующая гидролиз мочевины до NH3 и СО2, пепсин из желудочно-
го сока, расщепляющий белки до полипептидов.
В каталитическом действии многих однокомпонентных и двух-
компонентных ферментов принимают участие металлы, входящие
в их состав. Железо входит в состав простетической группы катала-
зы и пероксидазы, является составной частью цитохромной системы,
участвующей в процессе дыхания, а также некоторых оксидаз. Медь
входит в состав полифенолоксидазы и аскорбатоксидазы. Молибден
содержится в нитратредуктазе.
По современным представлениям простетическая группа двух-
компонентных ферментов и активная (каталитическая) группа од-
нокомпонентных ферментов определяют сам процесс катализа, а
структура белка (т. е. ферона) определяет субстратную специфич-
ность фермента.
Ингибиторы, стерическая (пространственная) и электронная
конфигурации которых близки конфигурации молекул субстрат#
(т. е. структурные аналоги субстрата), конкурируют с субстратом за
присоединение к активному центру фермента. Такое ингибирова-
ние обратимо, т. е. устраняется при удалении ингибитора (напри-
мер, диализом). Характерной особенностью конкурентного ингиби-
рования является уменьшение степени подавления ферментов при
увеличении концентрации субстрата (при неизменной концентрации
ингибитора). Неконкурентные ингибиторы (например, ионы тяже-
лых металлов) или денатурируют молекулу фермента (ее ферон),
или необратимо блокируют необходимые для него SH-группы (на-
пример, и-хлормеркурибензоат), или, наконец, необратимо реаги-
руют с теми или иными химическими группами активного центра
(например, фосфорорганические соединения, реагирующие с ОН-
группой серина в активном центре эстераз и протеаз).
Молекулярный вес ферментов, как и белков, колеблется в до-
вольно широких пределах, от 10 000 до 1 000 000. Так, молекуляр-
ный вес фосфорилазы картофеля составляет 207 000, амилазы
51 860, протеазы (трипсина) —23 800, химотрипсина 15 000—20 000.
С уменьшением молекулярного веса белков часто возрастает
их термоотабильность. Так, рибонуклеаза с молекулярным весом
12 700 почти не теряет активности при кипячении в кислом рдстворе.
Важнейшей технологической задачей при производстве фермент-
ных препаратов является подбор условий, в том числе и состава
питательной среды, для интенсивного роста микробных тел, позво-
ляющий увеличить образование необходимого фермента Синтез
16
ферментов в клетках микроорганизмов и их активность регулируют-
ся по типу обратной связи. Работы французских исследователей
Ф. Жакоба, Ж. Моно и Ж. П. Шанже позволили в основном рас-
крыть механизм ферментативных регуляций в микроорганизмах.
Сущность механизма обратной связи сводится к следующему.
Зададимся некоторой последовательностью биохимических ре-
акций: А В -> С -> D Е. В этой цепи
вещество А выступает в качестве исходного соединения, а вещество
Е —в качестве конечного продукта реакции. Во многих таких био-
химических цепях (при биосинтезе микроорганизмами лизина из ас-
парагиновой кислоты, изолейцина из треонина, пуринов из аспара-
гиновой кислоты и др.) конечный продукт (Е) подавляет активность
фермента, катализирующего первый этап реакции (А > В). По-
давление активности начального фермента цепи биосинтеза конеч-
ным продуктом этой цепи получило название ретроингибирования.
Механизм ретроингибирования заключается в том, что фермент,
имеющий эту способность (его аллостерический белок), несет не
менее двух центров связывания — активный центр, с которым сое-
диняется молекула субстрата, и центр ретроингибирования, с ко-
торым соединяется молекула конечного продукта. В результате та-
кого соединения изменяется пространственная конфигурация (кон-
формация) белка-фермента (аллостерический переход), после чего
жтивные центры становятся недоступными для воздействия следу-
ющих молекул субстрата. Если разрушить центры ретроингибиро-
вания, например, мягким нагреванием ферментного раствора, то
способность фермента катализировать ферментативную реакцию
сохранится, а способность его обратимо ингибироваться ретроин-
гибитором исчезнет. Ретроингибиторы иначе называют аллостери-
ческими ингибиторами (аллос—иной, т. е. структурно не похожий
на молекулу субстрата).
Подавление конечным продуктом реакции синтеза начального
фермента получило название репрессии.
Механизм этого явления очень сложен, связан с процессом био-
синтеза белка и переносом генетической информации, необходимой
для синтеза данного белка-фермента и записанной в ядерной РНК.
Конечный продукт (Е), выступающий в роли репрессора, «выклю-
чает» работу структурного гена, т. е. того отрезка цепочки ядерной
РНК, в нуклеотидной последовательности которого зашифрована
первичная структура, т. е. последовательность аминокислот белка-
фермента (в данном случае — фермента, катализирующего реак-
цию А -> В).
Репрессия является обратной стороной индукции фермента, т. е.
появления в клетке или же увеличения в ней количества того или
иного фермента в ответ на добавление в среду нового соединения—
индуктора (например, при добавлении в среду соединения А инду-
цируется фермент, превращающий его в соединение В). Индуктором
может служить субстрат, например р-глюкозид для индукции
Р-глюкозидазы у бактерии Escherichia coli, или же соединение,
2—826
17
структурно близкое к нему. Индуктор «включает» работу структур-
ного гена, не работающего в нормальной, неиндуцированной бак-
териальной клетке.
Саморегуляция по типу обратной связи, состоящая, как мы ви-
дим, из ретроингибирования и репрессии, играет огромную роль в
обмене живых клеток. Вследствие ретроингибирования клетка мо-
жет мгновенно реагировать на изменяющиеся условия питания.
Этот механизм позволяет клетке сразу же, в ответ на увеличение
содержания того или иного конечного продукта перестать расходо-
вать промежуточные соединения и энергию на синтез этого ненуж-
ного ей в данный момент вещества. Репрессия приводит к еще боль-
шей экономии — в ответ на длительный, регулярный избыток в ней
конечного продукта клетка перестает тратить аминокислоты и энер-
гию для синтеза ненужного ей в данный момент белка-фермента.
Индукция ферментов также играет важную роль в экономике клет-
ки: она начинает вырабатывать данный фермент лишь в тот момент,
когда он необходим для превращения поступающего в клетку из-
бытка субстрата, хотя потенция, т. е. способность к синтезу этого
фермента, существовала в клетке и до поступления в нее индук-
тора.
С механизмом регуляции, особенно с индукцией ферментов и их
репрессией, необходимо считаться в технологии ферментных препа-
ратов. Общим правилом является выращивание микроорганизмов в
условиях, способствующих индукции интересующего нас фермента
(т. е. в среде с субстратом, вступающим в реакцию с данным фер-
ментом, например, крахмалом при получении амилазного комплек-
са) и уменьшающих репрессию (т. е. в среде с ограниченным коли-
чеством и даже с отсутствием конечного продукта, например, в
среде без изолейцина, валина и лейцина при получении препара-
та треониндезаминазы). Очень перспективно также получение ге-
нетических мутантных штаммов микроорганизмов с нарушенным
механизмом регуляции.
В настоящее время в клетках животных, растений и микроор-
ганизмов открыто более 800 ферментов, осуществляющих самые
разнообразные химические реакции. Их классификация исходит из
природы химического превращения, которое они катализируют.
По рекомендации Комиссии по ферментам Международного
биохимического союза (1957—1961 гг.), все известные ферменты
разделены на 6 главных классов.
1. Оксидоредуктазы, катализирующие окислительно-восстанови-
тельные реакции, происходящие, например, при дыхании и броже-
нии (дегидрогеназы, оксидазы, пероксидазы, каталаза).
2. Трансферазы, катализирующие реакции межмолекулярного
переноса различных химических групп и остатков (фосфотрансфе-
разы, аминотрансферазы, глюкозилтрансферазы).
3. Гидролазы, катализирующие реакции гидролитического рас-
щепления внутримолекулярных связей (эстеразы, карбогидразы,
амидазы, протеазы).
18
4. Лиазы, катализирующие реакции присоединения групп по
двойным связям и обратные реакции отщепления таких групп
(альдолаза, фумаратгидратаза, энолаза, цитратгидролиаза, карбо-
натгидролиаза, пируватдекарбоксилаза, декарбоксилазы амино-
кислот, аспартатаммиаклиаза, изоцитратлиаза).
5. Изомеразы, катализирующие превращения органических сое-
динений в их изомеры (триозофосфатизомераза, рибозофосфати-
зомераза, глюкозофосфатизомераза, гексозо-1-фосфатуридинил-
трансфераза).
6. Лигазы (синтетазы), катализирующие реакции соединения
двух молекул, сопряженные с расщеплением пирофосфатной связи
в молекуле АТФ или аналогичного нуклеотидтрифосфата (глюта-
минсинтетаза).
Каждый класс разделяется на подклассы, а последние — на под-
подклассы, которые детализируют природу ферментативной реак-
ции. В целях идентификации классам, подклассам, подподклассам
и отдельным ферментам присваиваются номера по четырехзначно-
му десятичному коду. По этой системе первая цифра индекса
указывает главный класс, вторая — подкласс, третья — подпод-
класс; эта нумерация определяет характер катализируемого фер-
ментом превращения. Четвертое число означает порядковый но-
мер фермента в данном подподклассе.
Так, фруктокиназа имеет шифр 2.7.1.4, идентифицирующий ее
как трансферазу (класс 2), переносящую фосфатный остаток
(подкласс 7) на спиртовую группу (подподкласс 1), с порядковым
номером 4.
КРАТКАЯ ХАРАКТЕРИСТИКА ФЕРМЕНТОВ
В промышенности больше всего используются ферменты группы
карбогидраз, катализирующие гидролиз и синтез гликозидов, ди-
три- и полисахаридов. Они действуют на связь С—О—С. В состав
олигаз этой группы входят а-глюкозидаза, р-глюкозидаза, а-галак-
тозидаза, р-галактозидаза и p-фруктозидаза, а в состав полиаз —
целлюлаза, а-амилаза, р-амилаза, у-амилаза, инулиназа, пектина-
за.
а-Глюкозидаза (3.2.1.20, a-D-глюкозид — глюкогидролаза).
Фермент расщепляет a-глюкозидную связь в a-D-глюкопиранози-
дах, и, по-видимому, тождествен мальтазе, которая гидролизует
мальтозу. Катализирует также глюкотрансферазные реакции. Со-
держится в тканях растений, в плесневых грибах, дрожжах и бак-
териях.
р-Глюкозидаза (3.2.1.21 p-D-глюкозид — глюкогидролаза).
Отличается широкой специфичностью в отношении p-D-глюкопира-
нозидов.
Наиболее широко распространенными субстратами для этого
фермента являются дисахариды целлобиоза и гептибиоза, а также
гликозиды — амигдалин, арбутин и другие. р-Глюкозидаза содер-
19
жится и может быть получена в очищенном виде из плесневых
грибов, плодов миндаля, некоторых бактерий. Катализирует глю-
котрансферазные реакции.
а-Г а л а кт о з и д а з а (3.2.1.22, a-D-галактозид — галактогидро-
лаза). Фермент типично расщепляет галактозиды — раффинозу и
мелибиозу, действуя на связь между остатком галактопиранозы и
остатком глюкопиранозы с образованием сахарозы и а-галактопи-
ранозы. Катализирует также галактотрансферазные реакции. Со-
держится в пивных дрожжах и плесневом грибе Aspergillus
oryzae.
р-Г алактозидаза (3.2.1.23, p-D-галактозид — галактогидро-
лаза). Катализирует гидролиз лактозы на глюкозу и галактозу, а
также галактотрансферазные реакции, синтезируя лактозу из глю-
козы и галактозы. Содержится в плодах миндаля, лактозных
дрожжах, вызывающих брожение молочных продуктов, бактериях
м плесневых грибах, в молочной железе животных.
Р-Ф руктофуранозидаза (3.2.1.26, p-D-Фруктофуранозид—
фруктогидролаза). Прежние названия: инвертаза, сахараза. Ката-
лизирует расщепление сахарозы, действуя на связь у р-глюкозид-
ного углеродного атома остатка фруктозы, в отличие от а-глюко-
зидазы, разрывающей связь у а-глюкозидного углеродного атома
остатка глюкозы. Поэтому p-фруктофуранозидаза гидролизует
также раффинозу с образованием молекулы фруктозы и молекулы
мелибиозы. Содержится в высших растениях, микроорганизмах и
пищеварительных соках животных. Может быть получена в виде
очищенных препаратов из дрожжей.
Амилазы. Гидролизуют крахмал с образованием декстринов
и мальтозы. Одна из амилаз расщепляет крахмал до глюкозы.
Амилаза была открыта К. С. Кирхгофом в 1814 г. Ферменты это-
го типа содержатся в слюне, соке поджелудочной железы живот-
ных и человека, в проросшем зерне, плесневых грибах и бактери-
ях. До недавнего времени препараты амилазы получали из соло-
да— высушенного проросшего зерна ячменя. Сейчас их получают
преимущественно из бактериальных и грибных культур микроор-
ганизмов. На Востоке, особенно в Японии и Китае, амилазы, со-
держащиеся в плесневых грибах, были известны значительно рань-
ше.
Амилазы гидролизуют как нативные крахмальные зерна, так
и крахмальный клейстер. Скорость расщепления ими крахмала
различного происхождения различна. Эту различную податливость
крахмала действию амилаз А. И. Опарин предложил называть
«атакуемостью». Скорость гидролиза крахмала амилазой зависит
как от количества и активности действующего фермента, так и от
атакуемости субстрата. С увеличением относительной поверхности
крахмальных зерен, т. е. при нарушении их структуры, атакуе-
мость крахмала амилазами увеличивается, что также достигается
при механическом разрушении структуры этого субстрата.
20
Установлено, что наибольшей атакуемостью отличается клейсте-
ризованный крахмал. Поэтому в спиртовой и пивоваренной про-
мышленности зерновое сырье предварительно подвергают тепловой
обработке, а затем воздействию ферментов.
По свойствам и способу действия на крахмал различают а-ами-
лазу и р-амилазу.
а-А м и л а з а (3.2.1.1, а-1,4-глюкан — глюкогидролаза).
Содержится в слюне, пищеварительном соке, выделяемом под-
желудочной железой, в плесневых грибах, бактериях, в проросшем
зерне пшеницы, ржи, ячменя, а также в непроросшем зерне сорго.
Гидролизует а-1,4-глюкановые связи в полисахаридах, содержа-
щих три или более остатков D-глюкозы, соединенных а-1,4-связя-
ми.
Действует на крахмал, гликоген и родственные им поли- и оли-
госахариды; связи разрываются без определенной последователь-
ности.
р-Амилаза (3.2.1.2, а-1,4-глюкан — мальтогидролаза). Гидро-
лизует а-1,4-глюкановые связи в полисахаридах, последовательно
отщепляя остатки мальтозы от нередуцирующих концов цепей;
действует на крахмал, гликоген и родственные поли- и олигосаха-
риды, образуя путем инверсии р-мальтозу. Содержится в зерне
пшеницы, риса, ячменя, в соевых бобах.
По характеру действия на амилозу и амилопектин эти два фер-
мента существенно отличны. Так, р-амилаза расщепляет на 100%
амилозу до мальтозы. Амилопектин она расщепляет на 54%; до
мальтозы и остаточных (или конечных) декстринов, дающих корич-
нево-красное окрашивание с йодом. Декстрины, образовавшиеся
при расщеплении амилопектина р-амилазой, гидролизуются а-ами-
лазой с образованием декстринов меньшего молекулярного веса, не
дающих окрашивания с йодом. При дополнительном очень длитель-
ном воздействии а-амилазы на крахмал 85% его превращается в
мальтозу. При одновременном действии обеих амилаз крахмал
гидролизуется на 95%, между тем как порознь ни одна из них
полностью не превращает его в мальтозу.
Оптимум действия а-амилазы проявляется при pH около 5,7;
она гораздо более чувствительна к подкислению среды, чем р-ами-
лаза с оптимумом действия при pH около 4,2.
Эти два фермента различаются также по устойчивости к воз-
действию температуры. Для действия а-амилазы оптимум темпера-
туры лежит около 66°С, между тем как для р-амилазы он гораздо
ниже — около 50°С.
Глюкоамилаза (3.2.1.3, а-1,4-глюкан — глюкогидролаза).
Гидролизует а-1,4- и а-1,6-глюкановые связи в полисахаридах,
последовательно отщепляя остатки глюкозы от нередуцирующих
концов цепей; действует на крахмал, гликоген и родственные им
поли- и олигосахариды.
Обнаружена в животных тканях, плесневых грибах и дрожжах.
21
Олиг o-l, 6-г люкозидаза (конечная декстриназа, 3.2.1.10,
декстрин-6-глюканогидролаза). Расщепляет а-1,6-глюкановые свя-
зи в изомальтозе, панозе, конечных декстринах. -Содержится в
плесневых грибах и проросшем зерне проса.
Оптимальные для действия амилаз pH и температура зависят
от источников получения ферментов. Так, амилазы бактерий отли-
чаются термоустойчивостью. Они остаются активными и действу-
ют при более высокой температуре, чем амилазы, полученные из
плесневых грибов.
Амилолитические ферменты, гидролизующие крахмал, широко
применяются в спиртовой, пивоваренной, хлебопекарной и тек-
стильной отраслях промышленности.
Целлюлаза (3.2.1.4, р-1,4-глюкан — глюкогидролаза).
Гидролизует клетчатку с образованием целлобиозы. По-видимому,
этот фермент представляет собой комплекс катализаторов, один из
которых гидролизует целлюлозу до целлодекстринов, а другой
расщепляет их с образованием целлобиозы. Содержится в плесне-
вых грибах и некоторых бактериях, в проросшем зерне и в микро-
флоре рубца жвачных животных.
В очищенном виде целлюлаза была получена из фильтратов
культуры гриба Myrothecium verrucaria и кристаллизована из
Irpex lacteus. Молекулярный вес ферментного белка 63 000. Разме-
ры молекулы 200ХЗЗА. Оптимум pH 5,5—6,0.
Гемицеллюлаза. Это название объединяет ферменты, ка-
тализирующие расщепление различных гемицеллюлоз, в том числе
и цитолитические ферменты, получаемые из гриба Trichothecium
roseum Гемицеллюлазы найдены в проросших семенах и плесневых
грибах. Под действием гемицеллюлазы из субстрата — гемицеллю-
лозы— образуется смесь различных моносахаридов и уроновые
кислоты.
Пектиназы. Эта группа ферментов катализирует процессы рас-
щепления сложных пектиновых веществ, состоящих из двух компо-
нентов: полисахаридов (например, галактоарабана, расщепляюще-
гося при гидролизе на галактозу и арабинозу) (и пектиновой кис-
лоты В основе структуры пектиновой кислоты лежит цепь из ос-
татков D-галактуроновой кислоты, соединенных а-1,4-глюкозидны-
ми связями. Карбоксильные группы остатков галактуроновой кис-
лоты частично этерифицированы метиловым спиртом. Кальциевые
соли пектиновой кислоты дают характерные студни. Будучи колло-
идальными по своей природе, пектины образуют растворы весьма
высокой вязкости и стойко удерживают многие материалы в сос-
тоянии суспензии.
Наиболее изучены и известны два вида пектолитических фер-
ментов: пектинэстераза и полигалактуроназа.
Пектинэстераза (3.1.1.11, пектин — пектилгидролаза) гид-
ролизует метоксильные группы СНзО молекулы растворимого пек-
тина.
22
В результате расщепления сложноэфирной связи образуется по-
лигалактуроновая кислота и метиловый спирт. Действует также на
нативный пектин. Содержится преимущественно в высших расте-
ниях и в микроорганизмах. Практически фермент получают из
культур плесневых грибов.
Полигалактуроназа (3.2.1.15, поли-а-1,4-галактуронид —
гликаногидролаза). Гидролизует а-1,4-В-галактуронидные связи в
пектатах и других полигалактуронидах с образованием свободных
а-галактуроновых кислот. Содержится главным образом в различ-
ных видах бактерий и грибов; в высших растениях встречается
редко.
Полнота ферментативного расщепления пектина зависит от
действия каждого из пектинрасщепляющих ферментов. В состав
пектолитического комплекса входят другие ферменты, подробно не
изученные.
Установлено, например, что при низкой температуре или в от-
сутствии пектинэстеразы пектиновая кислота более устойчива к
действию полигалактуроназы, чем метилированный пектин. Пекто-
литические ферменты различных грибов в зависимости от условий
культивирования, длительности воздействия и других условий гид-
ролизуют молекулы пектина в различной степени с образованием
производных пектиновой кислоты различного молекулярного веса
Протеазы (3.4, пептидгидролазы). Катализируют расщепле-
ние пептидной связи — СО — NH — в молекулах белков и полипеп-
тидов. Лишь для немногих ферментов этого подкласса возможны
систематические названия. Различают экзопептидазы, или пепти-
дазы, катализирующие расщепление тех пептидных связей, кото-
рые соединяют концевые остатки аминокислот с главной полипеп-
тидной цепью, и эндопептидазы, или протеиназы, катализирующие
расщепление пептидных связей, удаленных от концевых остатков
аминокислот в пептидной цепи.
Пептидазы (3.4.1 а-аминоацил — пептидгидролазы). Обла-
дают большой специфичностью действия, связанной с наличием .и
расположением определенных химических группировок (атома Н,
NH2, СООН и т.п.) в пептидных связях. Так, аминопептидазы рас-
щепляют пептидную связь в олигопептидах при наличии вблизи
нее аминной группы; карбоксипептидазы — вблизи карбоксильной.
Дипептидазы (3.4.3, дипептидгидролазы). Расщепляют ди-
пептиды до аминокислот, действуя на пептидные связи, по сосед-
ству с которыми находятся одновременно как свободная аминная,
так и свободная карбоксильная группы. Существенно при этом
наличие а-водородных атомов, находящихся у атомов углерода,
связанных со свободной карбоксильной и аминной группами. Так,
пролиназа — иминодипептидаза — расщепляет пептидную связь при
наличии свободной карбоксильной группы пролина. Дипептидазы
имеют оптимум действия при pH 7,6. Содержатся в поджелудоч-
ной железе, почках, и кишечнике животных, дрожжах, проросших
семенах.
23
Протеиназы (3.4.4, пептидилпептидгидролазы). К ним относятся
хорошо изученные и выделенные в кристаллическом виде пепсин,
трипсин, химотрипсин, реннин, а также многие ферменты расти-
тельного происхождения — папаин, фицин и другие. При гидролизе
протеиназами из белка образуются пептоны, полипептиды и сво-
бодные аминокислоты.
В зависимости от pH, при котором действуют грибные про-
тетиназы, различают нейтральные (pH 6,0—7,5), щелочные (pH
8,0—11,0) и кислые (pH 2,5—3,0) протеиназы.
Пепсин (3.4.4.1.). Гидролизует пептиды, особенно по связям,
прилегающим к остаткам ароматических или дикарбоновых
аминокислот.
Образуется из пепсиногена слизистой оболочки желудка. Полу-
чен в кристаллическом виде. Проявляет оптимум действия при
pH 1,5—2,2.
Трипсин (3.4.4.4.)—протеиназа. Гидролизует пептиды, ами-
ды, сложные эфиры по месту связей с карбоксильными группами
аргинина и лизина. Содержится в соке поджелудочной железы и
получен в кристаллическом виде. Образуется из трипсиногена под-
желудочной железы.
Химотрипсин (3.4.4.5). Гидролизует пептиды, амиды, слож-
ные эфиры, особенно по месту связей с карбоксильными группа-
ми ароматических аминокислот. Содержится в соке поджелудоч-
ной железы.
Сычужный фермент, или реннин (3.4.4.3). Вызывает свер-
тывание молока, превращая казеиноген в сгусток казеината каль-
ция. Образуется в сычуге — четвертом отделе желудка теленка из
прореннина.
Папаин (3.4.4.10) — растительная протеиназа. Гидролизует
пептиды, амиды, и сложные эфиры, особенно по связям с диамино-
кислотами, лейцином или глицином. Оптимум действия зависит от
природы гидролизуемого белка и для желатина находится в пре-
делах pH 7,5 — 5,0. Активируется веществами, содержащими SH-
группы, а инактивируется окислителями.
Получается в виде сухого порошка из сока плодов дынного де-
рева.
Грибная протеиназа — ферментный препарат, получен-
ный из культуры плесневого гриба Asp. terricola, выращенной по-
верхностным или глубинным способом. Гидролизует белки, пеп-
тиды и амиды. Оптимум действия в нейтральной и щелочной зо-
нах pH.
Получается в виде сухого порошка из экстракта поверхностной
культуры или фильтрата глубинной культуры путем осаждения
ферментов органическими растворителями, последующего отделе-
ния осадка и его сушки.
24
ИСТОЧНИКИ ПОЛУЧЕНИЯ ФЕРМЕНТОВ
В отличие от большинства химических реактивов, используе-
мых в качестве катализаторов процессов гидролиза и синтеза,
очищенные ферментные препараты применяются в очень неболь-
ших дозах и отличаются нетоксичностью. Это делает возможным
использование их в отраслях пищевой и легкой промышленности,
в животноводстве и здравоохранении.
Ферменты находятся, как было указано раньше, в животных
организмах, высших растениях и в микроорганизмах. В послед-
нее время стремительно увеличивается ассортимент ферментных
препаратов, производимых из микроорганизмов, которые посте-
пенно вытесняют в ряде производств препараты животного и
растительного происхождения.
Получение большого количества биомассы, являющейся источ-
ником для выделения данного фермента, значительно проще и
экономичнее при использовании микроорганизмов, чем при про-
изводстве ферментов на основе животного или растительного
сырья. Действительно, для того чтобы получить одно поколение
микробных клеток, в благоприятных условиях роста требуется
20—30 мин, а урожай растений можно собрать лишь 1—2 раза в
год; для получения потомства животных требуется 2—3 года.
Ассортимент ферментов, вырабатываемых микробной клеткой,
необычайно широк. Она использует для питания разнообразные
отходы пищевых и химических производств, в том числе белковые,
углеводные, углеводородные, а также спирты, кислоты, азотные со-
единения.
Пути превращения питательных веществ в микробной клетке
весьма разнообразны, что привело в процессе эволюции к выра-
ботке ею очень широкого набора ферментов. Именно это обстоя-
тельство используется ферментной промышленностью при выборе
продуцентов. Следует отметить, что содержание ферментов (в-
расчете на 1 мг белка биомассы) в микробных клетках, как пра-
вило, больше, чем в растительных или животных объектах.
Исключительная приспособляемость микроорганизмов к изме-
нению условий культивирования, особенно состава питательных
сред и к воздействию мутагенов, вызывает у них быструю реак-
цию на происходящие изменения, что проявляется в перестройке
аппарата биосинтеза ферментов. Это свойство используется для
направленной селекции микроорганизмов.
На этой основе уже достигнуто повышение ферментативной
активности и удельной продуктивности многих штаммов плесневых
грибов и актиномицетов. В дальнейшем могут быть выведены но-
вые штаммы микроорганизмов, способные продуцировать фермен-
ты, обладающие специальными и даже заранее заданными свой-
ствами. Многообразие путей возможного воздействия на микроор-
25>
ганизмы и их свойство «отзывчивости» на изменения условий об-
мена веществ создает предпосылки для управления процессом
культивирования в условиях промышленного производства фер-
ментных препаратов.
ОПРЕДЕЛЕНИЕ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ
Ферментативная активность препаратов обычно выражается в
произвольно выбранных единицах, определяемых количеством пре-
вращенного субстрата за единицу времени при стандартных усло-
виях. Во многих случаях ферментативную активность определяют
по скорости образования продукта реакции (например, амино-
трансфераз, дегидрогеназ, оксидаз).
Для обеспечения точного определения ферментативной актив-
ности во всех методиках должны быть предусмотрены строго оп-
ределенные стандартные условия проведения реакции, катализи-
руемой ферментами (температура, pH среды, продолжительность
гидролиза, концентрация субстрата и способы его приготовления,
способы приготовления ферментного раствора). Как было показа-
но раньше, на скорость реакции, катализируемой ферментами,
большое влияние оказывает также концентрация фермента в ре-
акционной среде.
Исходя из этого на анализ всегда рекомедуется брать одина-
ковое количество субстрата и ферментного раствора. Но в этом
случае часто не удается сохранить оптимальное соотношение фер-
мент — субстрат из-за различной активности ферментов в определя-
емых препаратах. Во избежание ошибки, зависящей от выбранно-
го соотношения фермент — субстрат, в некоторых методиках реко-
мендуется брать для анализа ограниченное количество фермента.
В большинстве же методик по определению ферментативной ак-
тивности такие ограничения отсутствуют, что приводит к увеличе-
нию ошибки.
В настоящей книге приведены данные о ферментативной ак-
тивности полупродуктов и продуктов ферментного производства,
полученные различными исследователями. Определения проводи-
лись по следующим методикам.
Амилолитическая активность (АС) —характеризует способ-
ность ферментов катализировать ресщепление крахмала. Полупро-
дукты и продукты ферментного производства характеризуются ко-
личеством единиц АС, содержащихся в 1 г или 1 мл исследуемого
продукта.
Одна единица АС выражена таким количеством фермента, ко-
торое способно катализировать гидролиз 1 г растворимого крахма-
ла до продуктов, не дающих окраски с иодом, за 1 ч при темпе-
ратуре 30°С.
Методика определения амилолитической активности основана
на гидролизе крахмала исследуемым ферментным раствором. В
26
качестве субстрата берется 1%-ный раствор растворимого крах-
мала. Полнота гидролиза определяется по иодной пробе.
Навеску ферментного материала обычно берут в следующих ко-
личествах: очищенного ферментного препарата 0,1 г, технического
ферментного препарата ( в виде сиропа или порошка, полученно-
го высушиванием на распылительной сушилке) 2 г, сухой куль-
туры 3 г, сырой культуры 6 г.
Величина амилолитической активности определяется по следую-
щей формуле
0,25-60
АС =------—ед.,
ab
где 0,25 — количество крахмала, которое находится в
25 мл его 1 %-ного раствора, г;
а — навеска ферментного препарата, взятого на анализ, г;
b — время, за которое произошло расщепление крахмала
до продуктов, не дающих окраски с иодом, мин;
60 — пересчет на единицу времени— 1 ч.
Осахаривающая активность (ОС)—характеризует способность
амилолитических ферментов катализировать осахаривание крах-
мала до мальтозы.
За единицу ОС принято такое количество фермента, которое
за 1 ч при температуре 30°С в строго определенных условиях ка-
тализирует расщепление до мальтозы 1 г растворимого крахмала.
ОС продуктов и полупродуктов ферментного производства выра-
жают числом указанных единиц в 1 г или в 1 мл.
Для определения ОС проводят гидролиз 0,25 г растворимого
крахмала 37 мл исследуемого ферментного раствора при pH 4,7 и
температуре 30°С в течение 10 мин, после чего действие фермен-
тов приостанавливают добавлением соляной кислоты и иодометри-
чески определяют количество образовавшейся мальтозы.
Декстринолитическая активность (ДС) —характеризует спо-
собность ферментов катализировать расщепление конечных декст-
ринов до мальтозы.
Для получения конечных декстринов крахмал осахаривают
смесью а- и 0-амилаз при непрерывном удалении образующегося
сахара. В этом случае степень гидролиза крахмала доходит до
92—95%. Оставшиеся неосахаренными частицы крахмала, выде-
ленные из раствора осаждением этиловым спиртом, и есть конеч-
ные декстрины.
Полупродукты и продукты ферментного производства характе-
ризуются количеством единиц ДС, содержащихся в 1 г или 1 мл
исследуемого материала.
За единицу ДС принимается количество фермента, которое в
течение 1 ч катализирует отщепление от конечных декстринов 1 мг
мальтозы при 50°С и pH 4,5—5,0.
Мальтазная активность (МС) —характеризует способность
ферментов катализировать расщепление мальтозы до глюкозы.
27
Полупродукты и продукты ферментного производства характе-
ризуются количеством единиц МС, содержащихся в 1 г или 1 мл
исследуемого материала.
Единица МС выражается таким количеством фермента, кото-
рое способно катализировать расщепление мальтозы с образова-
нием 1 мг глюкозы за 1 ч при температуре 30°С.
В качестве субстрата используется 1%-ный раствор мальтозы.
Навеску ферментного материала обычно берут в следующих ко-
личествах: очищенного ферментного препарата 0,1 г на 100 мл
дистиллированной воды, технического ферментного препарата 2 г,
сухой культуры 3 г, сырой культуры 6 г. Расчет редуцирующих
веществ проводится по таблицам соотношения меди и глюкозы.
Величина мальтазной активности определяется по формуле
Б-25
МС ------ед.,
5С
где Б — количество глюкозы, образовавшееся при действии фер-
мента и найденное в таблице по D, где D=(A—а) 6,3;
(Л—а) — разница в количестве перманганата, израсходованном
на титрование опытной и контрольной проб, мл;
25 — общий объем смеси, мл;
С — количество ферментного препарата, взятое для опреде-
ления, г;
5 — количество реакционной смеси, отбираемое для опре-
деления редуцирующих веществ, мл.
Протеолитическая активность (ПС) —характеризует способ-
ность ферментов катализировать реакцию гидролиза белка до пеп-
тидов и аминокислот.
Полупродукты и продукты ферментного производства харак-
теризуются количеством единиц ПС, содержащихся в 1 г или 1 мл
ферментного материала.
За единицу ПС принимается такое количество фермента, ко-
торое образует 1 мг аминного азота за 1 ч при температуре 40°С
и pH 7,0—7,3.
Метод основан на определении свободных карбоксильных групп
в спиртовых растворах аминокислот и полипептидов, образую-
щихся при гидролизе белка. В качестве субстрата используется
5%-ный раствор желатина.
Протеолитическая активность определяется по формуле
ПС =- 1,4 /О? ед.,
Тп
где а — количество 0,1 н. раствора едкого натра, пошедшее на тит-
рование 1 мл опытной пробы, мл;
ак— то же, для контрольной пробы;
В — общий объем реакционной смеси, мл;
Т — длительность протеолиза, ч;
28
п— количество ферментного раствора в реакционной смеси,
мл;
К — поправка к щелочи;
1,4 — количество азота аминокислот и полипептидов, эквива-
лентное 1 мл 0,1 н. раствора щелочи, мг;
е — коэффициент разведения; для растворов ферментных пре-
паратов е= 1000, для вытяжек из культур е= 10.
Пектолитическая активность (ПкС) —характеризует способ-
ность ферментов катализировать расщепление пектина.
Полупродукты и продукты ферментного производства характе-
ризуются количеством единиц ПкС, содержащихся в 1 г или 1 мл
ферментного материала.
Одна единица ПкС выражается таким количеством фермента,
которое способно катализировать расщепление 1 мг пектина за
1 ч при температуре 37—38°С.
Методика определения пектолитической способности основана
на гидролизе пектина исследуемым раствором ферментного ма-
териала. В качестве субстрата берется 1%-ный раствор свекло-
вичного пектина.
Количественное определение пектинов проводится до и после
гидролиза 1%-ного раствора пектина объемным йодометрическим
методом, который сводится к получению медной соли пектиновой
кислоты в виде осадка и последующему определению связанной
меди йодометрическим методом.
Величина пектолитической активности (ПкС) очищенных фер-
ментных препаратов определяется по формуле
т-т С (а — Ь) В
ПкС = —------— ед.,
а ПТ т
где а — количество 0,01 н. раствора гипосульфита, пошедшее на
титрование 5 мл контрольного раствора пектина, мл;
b — количество 0,01 н. раствора гипосульфита, пошедшее на
титрование 5 мл цаствоца пектина после обработки феп-
ментным препаратом, мл\
С — количество пектина, определяемое для каждой партии пек-
тина кальций-пектатным методом, содержащееся в 5 мл
раствора, взятого на омыление, мг;
Т — длительность гидролиза пектина, ч;
П — количество препарата, содержащееся в объеме фермент-
ного раствора, взятом на определение, г;
В — общий объем реакционной смеси, мл;
т — количество, взятое на омыление (величины а и b берут-
ся с учетом поправки 0,01 н. раствора гипосульфита), мл.
29
Величина пектолитической активности (ПкС) культуры гриба
определяется по формуле
ПкС = С (.-я .РОД
а ПТ т
где П — количество вытяжки из культуры гриба, мл. Все осталь-
ные обозначения аналогичны приведеннььм в формуле для
определения активности очищенных препаратов.
Инвертазная активность (ИС) —характеризует способность
фермента катализировать расщепление сахарозы.
Полупродукты и продукты ферментного производства харак-
теризуются количеством единиц ИС, содержащихся в 1 г или 1 мл
ферментного материала.
Одной единице ИС соответствует такое количество фермента
инвертазы, которое вызывает 50 %-ное расщепление сахарозы за
1 мин, причем концентрация раствора сахарозы должна быть
2,375 г в объеме 50 мл; pH раствора 4,62, температура при инвер-
сии 30°С.
Активность биопрепаратов определяется следующими методами;
1) по показателю общей протеолитической активности, в ос-
нову которого положен метод формольного титрования. Этот по-
казатель характеризуется приростом количества свободных ами-
ногрупп в процессе протеолиза казеина в результате действия био-
препарата; среднее его значение для автолиза составляет
3—2 мл!г;
2) модифицированным методом определения протеиназной ак-
тивности, разработанным ВНИИМСом; среднее ее значение, вы-
раженное в миллиграммах азота, составляет 3,4 мг)г> или
2,2 г! 100 г;
3) колориметрическим методом определения пептидазной ак-
тивности, основанным на цветной реакции азота с реактивом Несс-
лера; прирост аминоазота в результате действия биопрепарата на
казеин составляет в среднем 3,5 мг/г, или 350 мг) 100 г;
4) методом определения активности кислотообразования, сви-
детельствующей о присутствии в препарате живой активной мик-
рофлоры.
Глюкозооксидазная активность — характеризует способность
ферментов катализировать реакцию окисления глюкозы при учас-
тии молекулярного кислорода с образованием в качестве продук-
тов реакции глюконовой кислоты и перекиси водорода.
Принцип метода определения активности основан на установ-
лении количества кислорода, потребляемого для окисления глю-
козы.
Активность препаратов и полупродуктов производства харак-
теризуют величиной QO2 — количеством мкл кислорода, потребля-
емого на один мг фермента за 1 ч или количеством единиц в 1 г
препарата или полупродукта.
30
Единицей активности глюкозооксидазы считается количество
фермента, обеспечивающее потребление 22,4 мкл кислорода за
1 мин при температуре 30°С и pH 5,8 в атмосфере избытка кисло-
рода и присутствии избытка глюкозы.
Цитолитическая активность (ЦС)—характеризует способность
комплекса ферментов катализировать расщепление целлюлозы,
гуминовых веществ и целлобиозы.
Продукты ферментного производства характеризуются как па
общей цитолитической активности (количеством единиц ЦС), так
и по активности отдельных ферментов, входящих в данный комп-
лекс.
Для определения общей цитолитической способности в качестве
субстрата применяется ячмень, освобожденный от крахмала и ре-
дуцирующих веществ; гемицеллюлазную активность определяют
на гемицеллюлозном субстрате, полученном из ячменя; целлюлаз-
ную — на рисовой шелухе, освобожденной от крахмала и реду-
цирующих веществ; целлобиазную — на целлобиозе, а активность,
фермента, расщепляющего гуминовые вещества— на гуммиара-
бике.
Определение общей цитолитической активности и отдельных
ферментов, за исключением фермента, расщепляющего гуминовые
вещества, проводят в течение 2 ч при 40°С и pH 4,6; активность
фермента, расщепляющего гуминовые вещества, определяют при
тех же условиях, но в течение 5 ч.
За единицу активности принимают такое количество фермента,
при действии которого на определенный субстрат в определенных
условиях образуется 10 мг редуцирующих веществ.
Сычужная активность (СС) — характеризует способность фер-
ментов катализировать реакцию свертывания молока. Для опре-
деления СС в качестве субстрата применяется молоко. Сычужную
активность препаратов определяют по времени, протекающему от
момента внесения ферментного препарата в молоко до появления
творожистого осадка при температуре 40°С.
Приведенные выше 'методы определения ферментативной ак-
тивности далеко не совершенны. За последние два года боль-
шинство из них заменено новыми или усовершенствовано.
Исследования ВНИИФСа и УкрНИИППа показали, что вели-
чина активности одного и того же ферментного препарата в боль-
шой степени зависит от количества его, внесенного в реакционную
среду.
При разработке новых методов определения активности были
применены единые физико-химические параметры определения ко-
личества превращенного субстрата и проведения ферментативной
реакции: температура 30°С, pH — оптимальные для действия фер-
ментов, концентрация субстрата 1% (по весу) из расчета дейст-
вующего вещества. Количество субстрата в реакционной среде 2
части, а исследуемого ферментного раствора — 1 часть.
31
Таким образом, за единицу активности в новых методах оп-
ределения принимается такое количество фермента, которое ката-
лизирует расщепление 1 г субстрата за 1 ч в приведенных выше
условиях и при таком соотношении фермента и субстрата в раст-
воре, которое обеспечивает принятую степень гидролиза субстрата.
Определение активности проводится с помощью графика, вы-
ражающего зависимость степени гидролиза субстрата от числа
единиц активности фермента, взятого на анализ. Количество суб-
страта, превращенного в процессе ферментативной реакции, опре-
деляют специально разработанными методами. По найденному
количеству превращенного субстрата с помощью графиков нахо-
дят активность препарата или культуры.
Рабочий график, составляемый при разработке метода для
каждого вида препарата (грибного, бактериального или др.), яв-
ляется неотъемлемой частью инструкции. При составлении графи-
ка используется базовый препарат. Изучая зависимость между
количеством превращенного субстрата в процессе ферментативной
реакции и количеством препарата, взятого на анализ, выбирают
такие дозировки, чтобы гидролиз субстрата проходил в преде-
лах 10—80%. По полученным данным строят график, откладывая
по оси абсцисс количество препарата, взятого на анализ, а по оси
ординат — степень гидролиза субстрата. В большинстве случаев эта
зависимость выражается прямой линией в пределах гидролиза
субстрата 15—75%. Прямолинейный участок графика дает воз-
можность найти зависимость между степенью гидролиза субстра-
та и числом единиц активности в препарате, взятом
на анализ.
Далее определяется активность базового препарата в выбран-
ных единицах.
По графику устанавливают, какое количество препарата (т)
необходимо взять, чтобы прогидролизовалось количество субстрата
(с), соответствующее выбранной степени гидролиза этого субст-
рата, и подсчитывают активность по формуле
Ак = — ед.
пг
Определив активность препарата, на оси абсцисс графика от-
кладывают количество единиц фермента, содержащегося в препа-
рате, а на ординате — степень гидролиза субстрата. Получают ис-
комый рабочий график, позволяющий по количеству превращенного
субстрата определить число единиц активности ферментного препа-
рата. Такой рабочий график строится для каждого вида препарата.
Данный способ составления расчетных уравнений и графиков
был применен при разработке методов определения ферментатив-
ной активности амилолитических, протеолитических и пектолити-
ческих препаратов.
В ферментологии оценка фермента Во1ражается в удельной ак-
тивности, т. е. в миллиграммах или молях потребленного субстра-
32
та или образованного продукта реакции на 1 мг белка фермента
в строго определенных стандартных условиях. Эта удельная ак-
тивность более точно характеризует способность фермента и долж-
на более широко использоваться в экспериментальных исследо-
ваниях с применением очищенных ферментных препаратов.
Как следует из изложенного, в данном разделе приведены
краткие характеристики методов определения ферментативной ак-
тивности, некоторые из которых (определение амилолитической и
протеолитической активности) в настоящее время заменены более
совершенными. Однако авторы были вынуждены привести их, так
как в большинстве исследований, комментируемых в книге, фермен-
тативная активность полупродуктов и продуктов ферментного про-
изводства определялась именно этими методами.
ЛИТЕРАТУРА
1. Генетика и селекция микроорганизмов. Основы молекулярной биологии. Под
ред. Алиханяна С. И. Изд-во «Наука». М., 1964.
2. Афанасьев П. В. Определение активности ферментов. В кн. «Внедрение
ферментов в народное хозяйство». Ч. I. ЦИНТИпищепром. М., 1961.
3. Б и л а й В. И. Биологически активные вещества микроскопических грибов.
Изд-во «Наукова думка». Киев, 1965.
4. Ферменты. Основы молекулярной биологии. Под ред. Браунштейна А. Е. Изд-
во «Наука». М., 1966.
5. Механизм и кинетика ферментативного катализа. Под ред. Браунштейна А. Е.
и Яковлева В. А. Изд-во «Наука». М., 1964.
6. Bergmeyer Н. U. Methoden der enzymatischen Analyse, Enzymologia,
1963, N 3, 208—209.
7. Deshpande К. B. Studies of the pectolytic enzyme system of Rhizootonia
Solani. Kunn. v. Viscosity Reducing enzymes. Enzymologia, 1960, № 5, 295.
8. Диксон M., Уэбб Э. Ферменты. ИЛ. M., 1966.
9. Иванов И. Д. Определение протеолитической активности методом адсорб-
ционной полярографии. В кн. «Внедрение ферментов в народное хозяйство».
Ч. I. ЦИНТИпищепром, 1961.
10. Кафиани К. А. Пути саморегуляции ферментных систем анабиолизма
«Успехи биологической химии», Т. 5. Изд. АН СССР, 1963.
11. Классификация и номенклатура ферментов. Отчет Комиссии по ферментам
Международного биохимического союза. ИЛ. М., 1962.
12. Климовский Д. Н., Родзевич В. И. Метод оценки качества солода.
Труды ВНИИСПа, Вып. IV, 1952.
13. Кретович В. Л. Основы биохимии растений. Изд-во «Советская наука»,
1964.
14. Кретович В. Л. Современные представления о природе и механизме дей-
ствия ферментов. «Известия АН СССР, серия биологическая», № 3, май—
июнь, Изд. АН СССР. М., 1961.
15. Кретович В. Л. Введение в Энзимологию. Изд-во «Наука», 1967.
16. Л ивщиц Д. Б. Методы определения активности ферментов. В кн. «Внедре-
ние ферментных препаратов в народное хозяйство». Ч. 1. ЦИНТИпищепром,
1961.
1/. Мильский А. В. Применение инвертина в кондитерской промышленности.
В кн. «Внедрение ферментных препаратов в народное хозяйство». Ч. I.
ЦИНТИпищепром, 1961.
18. Мосолов В. В. О специфичности действия протеиназ. «Успехи совре-
менной биохимии». Т. 44, 1957.
19. Nakamura S h. Eine allgemeine Teorie fiber den Mechanismus der Enzym-
wirkung., Enzymologia, 1962, № 1, 1—3
3-826
33
20. Нейла ндс Дж., Штумпф П. Очерки по химии ферментов. ИЛ. М..
1958.
21. Нортроп Д., Кунитц М., Херриотт Р. Кристаллические ферменты.
ИЛ, 1950.
22. О п а р и н А. И., К р е т о в и ч В. Л. Ферменты. БСЭ. Т. 44, 1956.
23. Остерман Л. А. Матричный синтез РНК. «Успехи биологической химии».
Т. VII., 1965.
24. Писаренко Н. Ф. и Петрова А. Н. Трансферазы, катализирующие пе-
ренос гликозильных групп. «Успехи биологической химии». Т. V, 1963.
25. П о п о в а Н. В. Определение и расчет протеолитической активности в куль-
турах плесневых грибов и выделенных из них ферментных препаратах. Тру-
ды ВНИИСПа. Вып. IX, 1960.
26. Pfleiderer G. Untersuchungen zum Wirkungsmechanismus von Enzymen.
Angewandte Chemie, 1960, 79, 160.
27. Родзевич В. И., Каллер И. Б., Добролинская Г. М. Амилоли-
тический комплекс ферментов плесневых грибов. В кн. «Внедрение ферментов
в народное хозяйство». Ч. I. ЦИНТИпищепром, 1961.
28. Розенфельд Е. Л., Попова И. А. Глюкомилазы (у-амилазы) животных
и микроорганизов. «Успехи биологической химии». Т. VII, 1965.
29. Салманова Л. С., Горбачкова Е. А., Нуждина Т. Н. Методика
определения активности цитолитических ферментов. Труды ЦНИИПБиВП.
Вып. IX, 1962.
30. С а л м а н о в а Л. С. Способ определения активности цитолитических фермен-
тов. Авт. свид. 150808. «Бюллетень изобретений», № 20, 1962.
31. Самнер Л. Б., Сомерс Г. Ф. Химия ферментов и методы их исследова-
ния. ИЛ., 1948.
32. Сисакян Н. М., Гладилин К. Л. Биохимические аспекты синтеза бел-
ка. «Успехи биологической химии». Т. VII, 1965.
33. Спирин А. С., Дворкина Г. А., Киселев Л. Л. и Смирнов В. Н.
Некторые проблемы биосинтеза белков. «Успехи биологической химии». Т. V,
1963.
34. Ставрова Э. Р., Конева О. И., Могалова К. В., Куприяненко
Л. П., Большакова М. Д. Приготовление и контроль нового биопре-
парата, ускоряющего созревание сыров. Труды ВНИИПК. Вып. VIII, 1964.
35. С т е п а н е и к о Б. Н. Современные представления о строении полисахари-
дов крахмала. «Успехи биологической химии». Т. VII, 1965.
36. Ф е н и к с о в а Р. В. Препараты ферментов, применяемые в пищевой про
мышленности. ВИНИТИ. М., 1958.
37. Ф е н и к с о в а Р. В. Получение концентрированных ферментных препаратов.
ЦИНТИПищепром, 1960.
38. Фен иксов а Р. В. Применение поверхностной культуры гриба взамен со-
лода при производстве спирта. Сборник докладов на Всесоюзной конферен-
ции ЦИНТИПищепром, 1961.
39. Производство и применение ферментных препаратов в пищевой промышлен-
ности. Перевод и редакция Р. В. Фепиксовой. Пищепромиздат, 1963.
40. Цы пер о вич А. С. Ферменты в народном хозяйстве. Гостехиздат Украи-
ны. Киев, 1965.
41. Яковлев В. А. Кинетика ферментативных реакций. Изд-во «Наука», 1965.
34
Глава II. ПРИМЕНЕНИЕ ФЕРМЕНТНЫХ ПРЕПАРАТОВ
В НАРОДНОМ ХОЗЯЙСТВЕ
Применение ферментных препаратов в народном хозяйстве
дает большой экономический эффект./Специальные постановления
правительства предусматривают организацию промышленного про-
изводства ферментных препаратов и внедрение их в народное хо-
зяйство. В данное время намечено широкое практическое исполь-
зование в нашей стране следующих комплексов препаратов фер-
ментов: амилолитического, протеолитического, пектинолитическо-
го и цитолитического. f
Применение ферментных препаратов в ряде отраслей промыш-
ленности обеспечивает значительное ускорение технологических
процессов, улучшает качество и повышает сортность продуктов,
снижает расход сырья, увеличивает выход готовой продукции,
улучшает условия труда, повышает его производительность и в ря-
де производств позволяет перевести технологические процессы на
непрерывный поток.
Путем искусственного повышения содержания ферментов в том
или ином продукте можно создать желательные изменения качест-
ва этого продукта или специфически ускорять процессы. Имеется
также возможность принимать меры, подавляющие действие фер-
ментов, которые вызывают нежелательные изменения в процессе
приготовления того или иного дродукта.
Научными изысканиями различных отраслевых научно-иссле-
довательских институтов Советского Союза выявлена высокая эф-
фективность применения ферментных препаратов в следующих от-
раслях промышленности: спиртовой, пивоваренной, соковой, вино-
дельческой, мясной, рыбной, сыродельной хлебопекарной, крахмало-
паточной, кожевенной, текстильной.
В сельском хозяйстве обогащение комбикорма ферментными
препаратами позволяет значительно увеличить усвояемость кормов
животными, что приводит к увеличению привеса.
В коммунальном хозяйстве и, в частности, в прачечном деле
применение протеолитических и липолитических препаратов не-
сравненно улучшает качество стирки белья.
В здравоохранении ферментные препараты применяются в об-
щей хирургии, терапии, дерматологии, гинекологии, в частности,
35,
для лечения таких тяжелых заболеваний, как инфаркт, инсульт и
АР-
Ниже дается краткое описание способов применения фермент-
ных препаратов и технико-экономическая эффективность их приме-
нения.
СПИРТОВАЯ ПРОМЫШЛЕННОСТЬ
Опыт работы спиртовых заводов, использующих ферменты плес-
невых грибов для полной или частичной замены зернового солода,
подтверждает технико-экономическую эффективность такой замены.
Применение плесневых грибов позволяет сократить расходы высо-
кокачественного солодового зерна и тем самым снизить потери
крахмала в процессе солодоращения.
Вследствие высокой активности амилолитических ферментов
плесневых грибов гидролиз крахмала до сбраживаемых сахаров
проходит глубже, чем при осахаривании солодом, в результате че-
го повышается выход спирта из единицы перерабатываемого сырья.
Амилолитические ферменты некоторых видов плесневых гри-
бов, выращенных на пшеничных отрубях, обладают более высокой
ферментативной активностью, чем солодовые амилазы, так как в
них присутствуют декстриназа и мальтаза, дополняющие действие
амилазы. По данным ВНИИСПа, более быстрое и полное осаха-
ривание крахмала достигается при использовании культуры грибов,
обладающих высокой декстриназной и мальтазной активностью.
Работами, проведенными во ВНИИСПе под руководством
Р. В . Фениксовой, установлена эффективность применения
культур плесневых грибов Asp. oryzae и Asp. awamori для осаха-
ривания крахмала.
Asp. oryzae, выращенный на пшеничных отрубях, образует боль-
шое количество а-амилазы и активный комплекс протеолитических
ферментов, которые расщепляют белковые вещества заторов и тем
самым обеспечивают нормальное развитие дрожжей. Asp. awamori,
выщенный на той же среде, образует меньше а-амилазы, но
больше декстриназы и мальтазы.
При трехсуточном брожении расход смеси указанных грибов
на осахаривание составляет 2,5% к весу перерабатываемого сырья
(5% к весу крахмала). При такой дозировке ферментов удается
получить нормальные отброды и увеличить выход спирта не менее
чем на 0,5%.
На некоторых спиртовых заводах Украины для осахаривания
крахмала сырья применяют только плесневый гриб Asp. oryzae.
Предложен (Даниляк и др.) оригинальный способ использования
плесневого гриба Asp. oryzae для осахаривания крахмалистого
сырья в две ступени. При этом 30% от всего количества гриба
вводится в осахариватель первой ступени при 57—59°С, а 70% —в
бродильный чан при 25°С.
36
Сравнительные испытания осахаривания крахмала сырья фер-
ментами солода и ферментами Asp. oryzae по предложенному спо-
собу (Велико-Любенский спиртовой завод) показали, что при до-
зировке гриба 4,5% к количеству условного крахмала процессы
осахаривания и брожения протекают нормально, а выход спирта из
I т крахмала увеличивается на 0,43 дал, или на 0,6%.
Такой метод добавления плесневых грибов к затору и суслу
имеет некоторые недостатки. При осахаривании необходимо
вносить в сусло для питания дрожжей также и солод, что, конечно,
увеличивает расходы на осахаривание. Кроме того, внесение боль-
шей части амилолитических ферментов с плесневым грибом в
бродильный чан (температура 25° С) приводит к сокращению ско-
рости осахаривания крахмала до сбраживаемых сахаров.
Работами Центрального научно-исследовательского института
спиртовой промышленности (ЦНИИСП) показано, что при совмест-
ном применении солода и плесневого гриба Asp. awamori потреб-
ность в осахаривающих компонентах составляет 4% зернового со-
лода и 2% гриба Asp. awamori, т. е. всего 6% к весу крахмала
перерабатываемого сырья, или 2 и 1%, всего 3% к весу перераба-
тываемого зерна, т. е. в 3,7 раза меньше нормативного расхода со-
лода. При такой частичной замене солода сокращается на 75%
расход зерна для его приготовления и соответственно сокращают-
ся потери крахмала при солодоращении и потери с нерастворен-
ным крахмалом в зрелой бражке, основным источником которых
является крахмал солода.
Вследствие более глубокого осахаривания декстринов выход
спирта повышается.
Технология получения и применения плесневых грибов, выра-
щенных глубинным способом, в спиртовом производстве вместо
солода была разработана группой сотрудников ВНИИФСа сов-
местно с инженерами и техниками Мичуринского и Приволжского
заводов. Проведенные опыты показали, что замена солода плес-
невыми грибами в количестве 20% от объема затора увеличивает
выход спирта и устраняет потери на солодоращение, которые ис-
числяются величиной, эквивалентной 0,6—0,8 дал спирта на 1 т
перерабатываемого крахмала.
Лабораторными опытами показано, что ферменты плесневого
гриба наряду с гидролизом крахмала расщепляют другие полисаха-
риды сырья; продукты распада их частично сбраживаются дрож-
жами, частично остаются в зрелой бражке, чем и объясняется
повышенный выход спирта при одновременном увеличении отбро-
дов.
Исследование вопросов селекции продуцентов ферментов и усо-
вершенствование технологии их культивирования за последние годы
позволили значительно повысить активность ферментов в глубин-
ной культуре грибов и снизить расход этой культуры на осахари-
вание.
37
В настоящее время питательной средой при глубинном культи-
вировании гриба Asp. usamii или других микроорганизмов слу-
жит спиртовая барда, обогащенная 1—2% муки и 0,2—0,25%
магнезита. Добавление этих продуктов в барду дает возможность
существенно повысить ферментативную активность готовой куль-
туры.
В последние 3 года на Мичуринском экспериментальном заводе
силами сотрудников ВНИИФСа и завода проведены работы, позво-
лившие исключить применение солода для осахаривания и пол-
ностью заменить его культурой гриба Asp. batatae, выращенной
«глубинным способом. До 1965 г. эти попытки терпели неудачи из-
за низкой амилолитической активности (15—30 ед. АС/100 мл)
гриба. Путем усовершенствования технологического режима раще-
ния гриба и главным образом путем применения более продуктив-
ных штаммов и уточнения состава питательных сред удалось повы-
сить амилолитическую активность выращенного гриба до 80—100 ед.
АС/100 мл при сохранении на прежнем уровне декстринолитиче-
ской активности (1600—1800 ед. ДС/100 мл).
Сопоставление результатов производства спирта с использова-
нием в качестве осахаривающего материала глубинной культуры
гриба (АС = 80-н100 ед/100 мл\ ДС = 18004-2000 ед/100 мл и МС =
=500-^600 ед/100 мл) и солода (на производство солода были ис-
пользованы ячмень, овес и просо) показало, что потери с нераство-
ренным крахмалом при осахаривании солодом выше на 0,2 г/100 мл
бражки, или на 1,5% к введенному крахмалу.
Расчеты экономической эффективности показывают, что себе-
стоимость 1000 дал спирта при осахаривании плесневыми грибами
глубинного ращения на 70 руб. ниже, чем при осахаривании соло-
дом.
Из зарубежных стран, применяющих ферменты в спиртовой
промышленности, следует отметить Японию, на спиртовых заводах
которой применяются главным образом грибы, выращенные по-
верхностным либо глубинным способом. Реже для осахаривания
крахмальных заторов применяются смеси культур бактерий и гри-
бов, выращенных поверхностным и глубинным способами.
ПИВОВАРЕННАЯ ПРОМЫШЛЕННОСТЬ
Снижение расхода зерна на единицу вырабатываемой продук-
ции при сохранении качества и биохимического состава продукта
является одной из главных задач в производстве пива.
Длительной производственной практикой установлено, что при
переработке ячменя на солод потери сухих веществ зерна в про-
цессе дыхания и образования ростков достигают 10% и более от
веса ячменя. Следовательно, уменьшая расходы солода, можно
тем самым уменьшить потери экстрактивных веществ зерна. Многие
пивоваренные заводы нашей страны перешли на замену 30—50%.
солода несоложеным сырьем. Такой способ предусматривает ис-
38
пользование гриба Asp. oryzae, ферменты которого заменяют в
данном случае ферменты солода.
Этот способ исследован и разработан сотрудниками Украинско-
го научно-исследовательского института пищевой промышленности
(УкрНИИПП) под руководством Е. Я. Калашникова.
По данным Е. Я. Калашникова, применение ферментов плесне-
вых грибов приводит к снижению себестоимости продукции в сред-
нем на 6,4%,, и при переводе всей пивоваренной промышленности
нашей страны на указанный выше метод работы позволит сэконо-
мить 25—30 тыс. т зернового сырья.
Изменения технологии при использовании ферментных препара-
тов касаются только процесса затирания. Согласно инструкции
УкрНИИППа, на затор следует брать 50%, солода. 50% несоложе-
ного сырья, около 1% плесневого гриба Asp. oryzae (препарат
Оризин П) и молочную кислоту для создания требуемого pH. Со-
лод для затирания применяется обязательно самоосахаривающий-
ся. Если применяется большое количество несоложеного сырья, то
рекомендуется обращать особое внимание на правильный режим
отсушки солода с целью сообщения ему аромата и определенных
вкусовых свойств.
При переработке длительно осахаривающихся солодов примене-
ние 50%. несоложеного сырья ухудшает качество пива и поэтому
для сохранения его следует снизить количество несоложеного сы-
рья до 40 или 30%, а иногда повысить против установленной дозу
ферментного препарата.
В качестве несоложеного сырья может применяться ячмень
II и III сорта (до 50%.), кукуруза в виде обезжиренной муки круп-
ного помола, либо в виде крупки (не более 40%), низкобелковис-
тая пшеница с содержанием клейковины не более 15—18%, (не бо-
лее 30—40%), просо (не более 15—20%).
Процесс затирания рекомендуется проводить в 2 стадии. Пер-
вая стадия заключается в подготовке несоложеного сырья, разва-
ривании и клейстеризации содержащегося в нем крахмала. Чтобы
избежать повышения вязкости крахмала при нагревании, его под-
вергают разжижению, прибавляя к несоложеному сырью некоторое
количество ферментного препарата Оризин П и солода.
Обычно на 1 т засипи, состоящей из 500 кг ячменя и 500 кг со-
лода, с ферментным препаратом следует вводить около 10000 ами-
лазных единиц. Количество ферментного препарата на варку рас-
считывают по формуле.
ф _ 1000 . М
“ ОС
где Ф — количество ферментного препарата, кг;
М — вес затираемых материалов (солод+ячмень), т;
ОС — осахаривающая активность препарата в амилазных еди-
ницах на 100 г препарата.
39
Если же несоложеного сырья применяют меньше 50%', то дозу
ферментного препарата и молочной кислоты (в % к весу сырья)
снижают, что видно из следующих данных.
Количество несоложеного сырья на затор . . 30 40
Расход ферментного препарата (при ОС =
= 100 ед./100 г).......................0,1—0,6 0,6—0,8
Расход молочной кислоты..................0,1—0,12 0,12—0,15
Применение 50% несоложеных материалов не следует рассмат-
ривать как возможный предел. Данные УкрНИИППа показали,
что, применяя 4—5% ферментного препарата к весу затираемого
зернового сырья, можно из несоложеного сырья получить сусло,
практически не отличающееся от солодового.
Установлено, что затор из несоложеного ячменя, подвергнутый
предварительной ферментативной обработке препаратом Оризин П,
накапливает редуцирующие сахара и продукты распада белка
(аминокислоты и полипептиды). Если такой затор подвергнуть оп-
ределенной гидротермической обработке, то при соответствующих
условиях он приобретет явно выраженный вкус и аромат солода.
Заторы из несоложеного сырья, приготовленные по указанному ре-
жиму, дают сусло, аналогичное по химическому составу солодово-
му. После сбраживания его получается пиво, по органолептичес-
ким свойствам почти не отличающееся от обычного. Авторы счи-
тают, что после усовершенствования разработанных ими режи-
мов затирания и ароматизации заторов можно будет в дальнейшем
увеличить долю несоложеного сырья до 85—90% или полностью
отказаться от применения солода при производстве пива.
Исследованиями (И. Я. Веселов, Л. С. Салманова с сотрудника-
ми) установлено, что при переработке высокобелковистых и труд-
норазрыхляемых ячменей, солод из которых обладает низкой фер-
ментативной активностью, использование гриба Asp. oryzae не воз-
мещает полностью недостаток ферментов этого солода.
Для лучшего использования сырья необходимы цитолитические
ферменты, которые содействуют разрушению клеточных стенок
ячменя, в результате чего крахмал и белок становятся более доступ-
ными для действия амилаз и протеаз, а в массе зерна накапли-
ваются сахара, декстрины и другие компоненты, обусловливающие
при термической обработке образование ароматических и крася-
щих веществ, характерных для солода. Под воздействием цитоли-
тических ферментов образуются некоторые вещества, в том числе и
особые виды декстринов, которые могут влиять на образование и
стойкость пены.
В настоящее время можно считать установленным, что процесс
разрушения клеточных структур (цитолиз) осуществляется комп-
лексом цитолитических ферментов, в состав которого входят по
крайней мере четыре ферментные системы: целлюлазная, гемицел-
люлазная, разрушающая гумми-вещества и целлобиаза.
Работами Всесоюзного научно-исследовательского института
пиво-безалкогольной промышленности показано, что активным про-
40
дуцентом цитолитических ферментов является плесневой гриб
Trichothecium roseum, культивируемый на отходах крупяного про-
изводства — зерновой шелухе.
Применение этого гриба в производстве пива позволяет пони-
зить вязкость заторов, улучшить осахаривание крахмала, увели-
чить выход экстракта, ускорить такие операции, как фильтрацию,
брожение, осветление пива при выдержке, улучшить биохимический
состав сусла и повысить качество пива.
При использовании цитолитически активной грибной культуры
можно успешно применять повышенные количества несоложеного-
сырья при работе с отечественными ячменями, а также исправлять
солод плохого качества. Плесневой гриб с общей цитолитической
активностью 70 ед. следует задавать из расчета 0,6—0,8% ко всему
сырью в заторе, а количество несоложеного сырья брать в зависи-
мости от качества солода.
При производстве Жигулевского пива с применением цитазы
(т. е. комплекса цитолитических ферментов) на заводах среднеази-
атских и южных республик, работающих на высокобелковистых
и трудноразрыхляемых солодах, целесообразно использовать в
среднем 30% несоложенного сырья, для предприятий РСФСР и
Прибалтики 30—40% и Украины — 50%,, а при работе с солодом
хорошего качества — более 50%,.
За последнее время появилось много работ, рекомендующих
применение протеолитических ферментов для повышения стойкос-
ти пива и глюкозооксидазы для увеличения сроков его хранения.
За рубежом ферментные препараты в производстве пива приме-
няются во Франции, Бельгии, Дании, ФРГ, США и Японии. Ис-
пользуются главным образом амилолитические препараты бакте-
риального происхождения для осахаривания сырья с несоложены-
ми материалами. Как правило, при применении ферментных препа-
ратов количество несоложеных материалов находится в пределах
20—30%,, но иногда достигает и большей величины, например в
Алжире до 90%.
В США, Франции и Бельгии также применяют протеолити-
ческие ферменты, которые вводят в бродящую массу, что устраняет
белковые помутнения в пиве и придает ему большую стойкость.
В ГДР в 1968 г. половина всего выпускаемого пива производи-
лась с применением бактериальных ферментных препаратов. Это
дало возможность использовать вместо солода 33—38% несоложе-
ного сырья. Полученное таким образом пиво отличается хорошим
качеством.
ПРОИЗВОДСТВО плодово-ягодных соков
Пектолитические ферментные препараты в соковом производ-
стве применяются для увеличения выхода сока и его осветления,
Их используют для предварительной обработки плодово-ягодного-
сырья перед прессованием.
41
Первые в нашей стране работы по производству и применению
•пектолитических ферментов были проведены во Всесоюзном научно-
исследовательском институте пиво-безалкогольной промышленнос-
ти.
Еще в 1939 г. (Преображенский, Усачева, Трутко) была пока-
зана целесообразность применения питательной среды из солодо-
вой шелухи для выращивания гриба Asp. niger П, обладающего
пектолитической активностью. Позднее на основании этих данных
была разработана схема производства пектолитических ферментов
(Чекан, Захаров, Славнов и Герасимова).
В 1954 г. предложена схема получения очищенного препарата
пектиназы (Салманова).
При переработке плодово-ягодного сырья пектин, растворимый
в клеточном соке, придает ему желеобразную консистенцию, и сок
не выделяется даже при прессовании.
Препараты, применяемые в соковом производстве, содержат
фермент пектиназу, под воздействием которой пектин расщепляет-
ся до растворимых моногалактуроновых кислот и сахаров, что об-
легчает сокоотдачу.
Пектолитические ферменты в очень небольших количествах
имеются в самих плодах и ягодах. Под их воздействием при вы-
держке измельченного сырья в течение 8—12 ч происходит медлен-
ное разрушение пектиновых веществ, в результате чего начинает
выделяться сок. Но вместе с тем при такой выдержке начинается
процесс брожения, в результате которого значительная часть са-
харов, содержащихся в сырье, теряется. Соки, полученные таким
образом, бывают мутными (за исключением сока черной смороди-
ны) и не поддаются фильтрации. Еще в 1945 г. производственные
опыты (Трусова и Кувикова) показали, что после предварительной
обработки черной смородины, алычи, сливы и абрикосов плесневым
грибом Asp. niger (препарат Нигрин П) в количестве 1—2% к ве-
су сырья и выдержке его в течение 2—3 ч удается получить от 65
до 75%, натурального сока от веса ягод, взятых для прессования.
В 1959 г. на Воронежском и Краснодарском ликеро-водочных
заводах в качестве источника фермента был испытан очищенный
ферментный препарат Нигрин ПК. Опыты показали, что расход та-
кого препарата (0,03—0,05% по весу сырья) в 25 раз меньше, чем
препарата Нигрин П, а выход натурального сока из плодов (чер-
ная смородина, абрикосы, алыча, слива), обработанных им, повы-
шается на 15—20%.
Эти исследования позволили установить оптимальную дозиров-
ку препарата пектиназы (0,03—0,05%)в зависимости от вида, сор-
та и качества перерабатываемого сырья, при которой повышается
выход плодово-ягодных соков на 15—20% и за 3—6 ч после обра-
ботки достигается полное осветление соков.
В последние годы многие предприятия стали применять пекто-
литические препараты для повышения выхода плодово-ягодных
соков и их осветления.
42
Ниже (табл. 1) приводятся данные об увеличении выхода соков
при обработке сырья пектолитическими ферментами
Таблица I
Влияние пектолитических ферментных препаратов на выход сока
Плодово-ягодное сырье Продолжитель- ность выдержки, ч Доза пектиназы, % к весу сырья Выход натурального сока, % Содержание пектиновых веществ в соке, г! 100 мл
сухая культура гриба <и я о, £ о я с
Черная смородина 6 0,0 0,00 52,50 0,049
3 — 0,03 67,60 0,017
3 — 0,05 65,85 0,018
Абрикосы 3 — 0,30 85,50 0,028
3 — 0,10 76,00 0,005
3 — 0,03 84,80 0,060
3 — 0,05 85,50 0,007
Алыча 3 1,0 (24- часовая) — 64,70 0,012
3 1,0 (48- часовая) — 83,40 0,010
6 — 0,03 73,90 0,076
Слива 6 — 0,05 74,00 0,009
6 — 0,10 88,20 0,011
6 0,1 (24- часовая) — 60,30 0,064
6 1,0 (148- часовая) — 68,90 0,048
Применение пектолитических ферментов при производстве
спиртованных соков из клубники и сливы — плодов, которые труд-
но отдают сок при прессовании,— дало возможность перерабаты-
вать их в больших количествах. При этом срок отстаивания соков
сократился с 21—22 до 10 суток, а выход увеличился с 60—70 до
75—80%, потери спирта снизились от 7 до 2,5%..
В 1966 г. сотрудниками ВНИИФСа и Грузинского научно-иссле-
довательского института пищевой промышленности на Батумском
цитрусовом комбинате и Букнерском соковом заводе проведены
промышленные испытания, подтвердившие, что из некоторых пло-
дов, и в частности из хурмы и лавровишни, сок можно выделить
только с применением пектолитических препаратов.
Для получения сока из хурмы ферментный пектолитический
препарат необходимо вносить дробно: при отжатии 0,1%, по весу
43
плодов и для осветления 0,05% от веса сока. Полученный таким
образом на Батумском комбинате сок был полностью осветлен,
с блеском, золотисто-оранжевого цвета, с характерным ароматом
хурмы и терпким вкусом. Он содержал 15% сухих веществ, общая
кислотность 0,4%.. Выход — 60% от веса плодов.
Для получения сока из лавровишни ферментный препарат необ-
ходимо вносить в количестве 0,1% от веса плодов. При этом выход
составляет 40%, сок получается с содержанием сухих веществ 7%.
и кислотностью 0,7%., имеет красивую вишневую окраску, прият-
ный вкус и аромат.
Разработаны требования, предъявляемые к препаратам, приме-
няющимся в производстве соков. Необходимо, чтобы препараты
были освобождены от большей части питательной среды, а экстракт
или очищенная культуральная жидкость либо высушивались на
распылительной сушилке, либо ферменты из них осаждались спир-
том. Применение сухих неочищенных культур грибов для производ-
ства соков не рекомендуется.
За рубежом в таких страна, как США, Дания, Бельгия, Фран-
ция пектолитические ферменты широко применяются при изготов-
лении соков главным образом для устранения их помутнения. В
странах социалистического лагеря — Чехословакии, Венгрии, Бол-
гарии— пектолитические ферменты используют в виде сухих куль-
тур или сиропов. В последнее время во всех странах, входящих в
СЭВ, проводятся работы по созданию схем получения очищенных
пектолитических препаратов в виде порошков.
ВИНОДЕЛИЕ
Использование комплекса пектолитических ферментов при об-
работке виноградного сока и вина позволяет разрушать некоторые
коллоидные вещества, обусловливающие стойкие, трудно устра-
нимые помутнения вин и повышать выход сусла. Для этих целей в
настоящее время применяются очищенные ферментные препара-
ты.
Интересные производственные испытания очищенного пектоли-
тического ферментного препарата были проведены в 1960 г. при
производстве виноградного вина на предприятиях Закарпатского
винтреста. Опыты были проведены на винограде сортов Ноа и
Отелло, плохо отдающих сок при переработке в обычных условиях
(дробление на дробилке-гребнеотделителе, отбор сусла-самотека на
стекателе периодического действия и прессование на прессе не-
прерывного действия). Эти эксперименты позволили сделать сле-
дующие выводы. Пектолитические ферментные препараты целесо-
образно применять при обработке виноградной мезги по-красному
(с настаиванием на мезге); длительность настаивания в этом слу-
чае сокращается до 2—4 ч. При переработке винограда по-белому
требуется применение стекателей.
Для обработки сортов винограда, плохо отдающих сок в обыч-
ных условиях, расход препарата должен составлять 0,04—0,05%
44
по весу сырья, а для сортов, хорошо отдающих сок, эта доза может
быть уменьшена в 2 раза. Такие дозы позволили увеличить общий
выход сусла на 3—5 дал, а качественных фракций сусла (самотек
плюс первая фракция) на 6—8 дал из 1 т винограда. Пектиназа
способствует также извлечению красящих, дубильных и экстрактив-
ных веществ, что очень ценно при изготовлении вин по-красному.
В производственных условиях для отстаивания сусла-самотека и
первой фракции в течение 2—4 ч доза очищенного препарата дол-
жна быть в пределах 0,01—0,015%, от веса сусла.
Результаты многочисленных опытов, проведенных на предприя-
тиях Херсонской области, показали, что лучшее качество осветле-
ния и предупреждение появления нежелательных тонов во вкусе и
аромате дает обработка сусла очищенным препаратом из расчета
0,2 кг на 100 дал сусла.
В работах, посвященных применению пектиназы для увеличения
выхода виноматериалов, рассматривается механизм действия пек-
толитических ферментов, определяется дозировка препаратов раз-
личной степени очистки, приводятся данные о повышении выходов
сусла при обработке винограда или плодов и ягод ферментным
препаратом. Проведенные сотрудниками ВНИИФСа совместно с
работниками винодельческих предприятий (Мосшампанкомбинат,
Симферопольский головной винзавод) в 1963—1964 гг. производ-
ственные испытания показали, что пектолитические ферментные
препараты успешно могут применяться для усовершенствования
технологии сидра и вин, вырабатываемых по-белому.
Добавление 0,05%, пектолитического препарата к виноматериа-
лу позволяет значительно увеличить скорость фильтрации его,
снижает содержание пектина до 0,04%,, не ухудшая органолепти-
ческих свойств сидра. Такая обработка виноматериала при приго-
товлении вина «Белое крепкое» делает его более стабильным и
устойчивым при хранении.
При приготовлении вин по-белому необходимо вносить препарат
в количестве 0,1 %, к весу винограда, контакт препарата с мезгой
должен длиться 40 мин. Такой способ позволяет увеличить выход
сусла-самотека на 26%,, а общий выход сусла — на 9% по сравне-
нию с контрольным. Следует отметить, что скорость фильтрации
сусла, обработанного пектиназой, в 1,4 выше, чем в контроле.
На основании тщательного анализа этих работ следует считать
целесообразным применение в виноделии только очищенных препа-
ратов, расходуя их в количестве 0,03—0,05%, к весу сырья. При
таких условиях выход сусла увеличивается на 5—7%.
МЯСНАЯ ПРОМЫШЛЕННОСТЬ
Нежность мяса является одним из наиболее важных показате-
лей его качества.
В процессе послеубойного созревания (10—14 дней при темпера-
туре 0—2° С) качество мяса значительно улучшается и оно стано-
вится более нежным. Из работ отечественных и зарубежных авто-
45
ров следует, что на нежность мяса оказывают влияние ряд факто-
ров (состояние коллагеновой соединительной ткани; количественное
содержание в мясе эластина; количественное содержание в мыш-
цах миозина, актина, актомиозина; состояние структурных белков
мышечной ткани), связанных с его химическим составом.
Нежность мяса в естественных условиях созревания приобре-
тается в результате частичного протеолиза его белков под воздей-
ствием собственных протеолитических ферментов. Для интенсифи-
кации процесса созревания требуется обработка мяса препаратами
протеолитических ферментов. Такое искусственное созревание мяса
позволит сократить срок, необходимый для получения мяса повы-
шенного качества, и в связи с этим в несколько раз уменьшить пло-
щади холодильных камер.
При обработке мяса протеолитическими ферментами в нем про-
текают следующие биохимические процессы. В белках фракции мио-
зина всегда увеличивается (в 3,5—4 раза) количество N-концевых
групп некоторых аминокислот (чаще всего — лейцина и дикарбоно-
вых кислот). Это, вероятно, связано с начальной стадией протеоли-
за, когда в белковой молекуле расщепляется определенное число
пептидных связей, но еще не образуются в значительных количест-
вах низкомолекулярные продукты распада.
В процессе ферментации мяса изменяются также компоненты
внутримышечной соединительной ткани, что характеризуется уве-
личением развариваемости коллагена в среднем с 17 до 24,8%. и
резким снижением содержания общего количества основного (ме-
жуточного) вещества — с 67,5 до 47% от содержания гексозаминов.
Эти изменения происходят при обработке мяса фицином в дозиров-
ке 0,012% по весу. Такая обработка позволит увеличить выход выс-
ших сортов мяса с 13—15 до 25—27%,.
Последними исследованиями Украинского НИИ мясной и мо-
лочной промышленности показана возможность применения фер-
ментных препаратов микробного происхождения (Оризин ПК»
Терризин ПК) для мягчения мяса. Способ применения их заклю-
чается в следующем. Растворы протеолитического препарата
(Терризин ПК 0,5%, Оризин ПК 1%) вводят в полутуши в парном
состоянии через кровеносную систему, а затем путем дополнитель-
ного шприцевания. Этим достигается равномерное распределение
раствора. Расход раствора 5% по весу мяса. Полутуши или чет-
вертины выдерживают при температуре 2—6° С в течение двух
суток, затем проводят обвалку, жиловку и порционируют на полу-
фабрикаты, реализуемые в обычном порядке. Ферментированное
мясо можно хранить при 2—6° С до 6 суток, а при минус 18° С до
1—2 месяцев; срок хранения полуфабрикатов обычный.
Сроки термической обработки ферментированных полуфабрика-
тов сокращаются примерно на 1/3. Полная инактивация ферментов
наступает при температуре 60° С. Такой способ позволяет значи-
тельно (на 10—12%,) увеличить использование мяса туши для при-
46
готовления полуфабрикатов. Для обработки 1 т мяса требуется
250 г препарата Терризин ПК.
РЫБНАЯ ПРОМЫШЛЕННОСТЬ
Чтобы соленая сельдь приобрела нежную консистенцию, прият-
ный вкус и аромат готового продукта, ей необходимо созреть.
Во время созревания в мясе сельди происходят сложные био-
химические процессы, характерной, частью которых можно считать
расщепление белков собственными ферментами и ферментами
микрофлоры, развивающейся в тузлуке и рыбе. Эти процессы про-
должаются довольно долго— 120—230 дней. Интенсифицировать их
можно путем добавления ферментных препаратов. Исследования
возможности ускорения созревания рыбной продукции проводились
в нескольких научных учреждениях нашей страны. В этих работах,
как правило, использовались сухие концентрированные препараты,
выделенные из культур плесневых грибов Asp. oryzae (штамм КС)
и Asp. terricola (штамм 3374), выращенных поверхностным спосо-
бом на пшеничных отрубях.
По данным Полярного научно-исследовательского института
рыбного хозяйства и океанографии (ПИНРО), добавление в туз-
лук ферментных препаратов Asp. terricola (протеолитическая актив-
ность ПС = 800 ед/г препарата) в количестве 0,03% к весу обраба-
тываемой сельди или Asp. oryzae (ПС = 500 ед/г препарата) в ко-
личестве 0,05%, ускоряет созревание сельди, содействуя расщепле-
нию белковых веществ и вследствие этого размягчению мяса.
Ферментные препараты способствуют равномерному распределе-
нию жира в тканях мяса сельди; это особенно характерно для фер-
ментов из гриба Asp. terricola.
По данным Каспийского научно-исследовательского института
рыбного хозяйства и океанографии (КаспНИРО), добавление фер-
ментных препаратов ускоряет процесс созревания на 1,5—2 месяца,
улучшая качество продукта. Данные опытов, проведенных во
ВНИИФСе Р. В. Фениксовой совместно с сотрудниками Мосрыбо-
комбината, позволили прийти к заключению, что добавление фер-
ментных препаратов в количестве 0,02—0,2% к весу обрабатывае-
мой рыбы при посоле позволяет ускорить процесс посола и созре-
вания сельди в 6—10 раз. Скорость посола и созревания пропорцио-
нальна количеству вводимого препарата и его протеолитической
активности.
Установлено также, что препараты из грибов Asp. oryzae и
Asp. terricola дают одинаковый эффект при посоле и мариновании
свежемороженой рыбы, при приготовлении малосоленой продукции
из соленого полуфабриката и при приготовлении пресервов из
свежемороженой сельди и соленого полуфабриката.
За рубежом, главным образом в США и Японии, в рыбной про-
мышленности протеолитические ферментные препараты применя-
47
ют в основном для утилизации отходов рыбозаводов. При обработ-
ке отходов, содержащих белковые продукты, их превращают пу-
тем гидролиза белков и последующей стабилизации получаемых
растворов в продукты, используемые в качестве добавок в корма
для сельскохозяйственный животных.
СЫРОДЕЛЬНАЯ ПРОМЫШЛЕННОСТЬ
Ферментные препараты применяются в сыроделии для ускоре-
ния созревания сыра и улучшения его качества. Поскольку наи-
более типичными реакциями, протекающими в созревающем сыре,
являются реакции распада белков, то основой большинства «уско-
ряющих» препаратов, применяемых в сыроделии, являются протео-
литические ферменты.
Использовавшийся длительное время в сыродельной промыш-
ленности препарат, условно называемый сычужным ферментом,
представляет собой комплекс различных ферментов, под действи-
ем которых происходит не только свертывание молока, но и час-
тичный гидролиз белков в процессе созревания сыра.
В некоторых зарубежных странах при недостатке сычужного
фермента в производстве мелких сыров применяют пепсин. Рабо-
тами Всесоюзного научно-исследовательского института молочной
промышленности (ВНИМИ) и Московского технологического ин-
ститута мясной и молочной промышленности установлено, что ха-
рактер свертывания молока и гидролиз белка при действии сычуж-
ного фермента и пепсина по существу одинаковы. Было показано,
что повышение концентрации сычужного фермента или пепсина в
сырной массе не способствует ускорению созревания сыра, а мо-
жет привести к ухудшению его качества.
В последнее время в СССР и за рубежом ферменты животно-
го и растительного происхождения стали вытесняться микробными
ферментами. В США запатентовано несколько препаратов, при-
меняемых для усиления специфичного вкуса и аромата сыров. Пре-
парат из автолизата мицелия Penicillium chrysogenum при внесе-
нии в расплавленную массу сыра типа Bel — Paese в количестве
0,01% стимулирует протеолиз и улучшает вкус сыра.
Для созревания сыра используются также липолитические фер-
менты. В США лаборатория Marschall выпускает препараты липа-
зы грибного происхождения, которые используются при выработке
итальянских сыров. Препараты, содержащие комплекс липолити-
ческих ферментов животного происхождения, выпускаются также
в Италии; применение их позволяет гидролизовать жир и значи-
тельно усиливает протеолиз, что приводит к некоторому улучше-
нию качества сыра. Липазы применяются в Южной Африке для
улучшения качества сыра типа чеддар (в частности его вкуса).
Расход препаратов — 5 г на 100 галлонов молока.
Предпринимались попытки использовать в качестве биологи-
ческих активаторов созревания сыров гидролизаты и автолизаты
48
молочнокислых бактерий. В Эстонии в 1957—1959 гг. был получен
ферментный гидролизат, который при дозировке 0,3—0,5% к пере-
рабатываемому молоку сокращает продолжительность созревания
сыров в 1,5—2 раза. Недостатком этого гидролизата является на-
личие в нем живых клеток молочнокислых палочек, которые, раз-
виваясь в сыре, вызывают появление кисловато-пряного вкуса, не
свойственного сырам голландской группы.
Проведенные в 1960 г. во Всесоюзном научно-исследовательском
институте маслодельной и сыродельной промышленности
(ВНИИМС) под руководством И. И. Климовского работы показа-
ли, что гидролизаты, приготовленные на культурах только одних
молочнокислых стрептококков, не дают в готовом сыре кисловато-
пряного вкуса. В 1962 г. во ВНИИМСе получен автолизат, не
уступающий по активности эстонскому гидролизату, но почти не
содержащий живых клеток. Его можно применять при выработке
почти всех сыров голландской группы.
Следует отметить, что широкое использование в промышлен-
ности жидких препаратов не рационально, так как они имеют низ-
кую активность, неоднородны по микробиологическому и химичес-
кому составу и нетранспортабельны. Наиболее рационально при-
менять сухие ферментные препараты.
В 1963 г. во ВНИИМСе получены и испытаны первые образцы
ферментного препарата молочнокислых бактерий в сухом виде.
Биологической основой его служат осадки бактериальной массы
и продукты ферментации белковых веществ культуральной среды.
В 1 г такого препарата содержатся сотни миллиардов неавтолизиро-
ванных бактерий и незначительное количество живых клеток. До-
бавление его в количестве 0,04% к перерабатываемому молоку
позволяет сократить продолжительность созревания сыров в 1,5—
2 раза и улучшить их качество.
Интересные работы были проведены Веселовым И. Я., Чебота-
ревым А. И. и Петиной Т. А. по полной замене сычужного фермен-
та комплексом ферментов гриба Asp. Candidas штамм 11. Варки
сыров проводились в учебно-экспериментальном цехе Вологодско-
го молочного института в ванне емкостью 1000 л, снабженной ме-
ханической мешалкой. Опытные и контрольные сыры (последние
изготовляли с сычужным ферментом животного происхождения)
вырабатывались в соответствии с требованиями инструкции по про-
изводству сыра голландского брускового 45%-ной жирности из нор-
мализованного пастеризованного молока с внесением 0,3—0,5%
закваски чистых культур молочнокислых бактерий.
При варке опытных сыров в ванну вносили грибной фермент в
трех вариантах: одинарное количество (Ф), половинное (Ф/2) и
удвоенное (2Ф).
Все образцы грибного фермента при количестве Ф образуют
при свертывании плотный сгусток через 20—25 мин- Интенсивное
развитие кислотности в сгустке ускоряет варку, но в целом процесс
удлиняется по сравнению с контролем на 10—15 мин за счет уве-
4—826
49
личения времени обработки зерна в ванне. По основным физико-
химическим показателями сыры опытных варок мало отличались
от контрольных.
При варке сыров с количеством фермента (Ф/2) сгусток был
недостаточно плотным и наблюдался большой отход жира в сы-
воротку.
Содержание продуктов распада белка в 40-дневных сырах, при-
готовленных с грибным ферментом, в 1,5—2,0 раза выше, чем в
контрольных.
Наилучшими органолептическими показателями обладали сыры,
приготовленные с уменьшенным (Ф/2) количеством грибной вы-
тяжки, обработанной кизельгуром. Отдельные образцы их в возрас-
те 21 месяца были оценены высшим сортом. Сыры, приготовленные
с количеством фермента (Ф), оценены первым сортом, а с двойным
количеством фермента (2Ф) —забракованы.
После четырехмесячного хранения в сырах появлялся привкус
перезрелых, поэтому они требуют быстрой реализации.
Таким образом, проведенные исследования показали возмож-
ность полной замены сычужного фермента грибным ферментом
при изготовлении голландских брусковых сыров.
ХЛЕБОПЕКАРНАЯ ПРОМЫШЛЕННОСТЬ
В нашей стране для улучшения качества пшеничного хлеба
используются ферменты ячменного солода, а для улучшения вку-
са и аромата ржаного заварного хлеба (Московского и Бородинс-
кого) — ферменты красного ржаного солода. Производство крас-
ного ржаного солода связано с большими потерями (20—25%)
сухого вещества зерна и времени на солодоращение (10—12 су-
ток). С целью замены солода научный сотрудник Центрального
научно-исследовательского института хлебопекарной промышлен-
ности (ЦНИИХП) Р. Р. Токарева провела многочисленные иссле-
дования с ферментными препаратами грибного происхождения. Ее
работы позволили разработать новую технологию получения улуч-
шителя ржаного заварного хлеба. Сущность способа сводится к
интенсификации реакции взаимодействия аминокислот и редуци-
рующих сахаров путем обработки ржаной обойной муки фермент-
ными препаратами, выделенными из гриба Asp. oryzae.
По данным Токаревой, полученная по новой технологии завар-
ка имеет следующие показатели: влажность 75—78%, содержание
сахара в пересчете на мальтозу 50—55%, содержание водораство-
римого азота 55—60% от общего азота. Такая заварка аналогич-
ная заварке, приготовленной с красным ржаным солодом, и до-
бавляется в тесто при замесе (7% от веса муки для Московского
хлеба и 5%—для Бородинского). Преимущество ее состоит в
значительном сокращении продолжительности процесса заварки.
50
Разработана также технология производства пшеничного хле-
ба из муки I и II сортов. Ферментные препараты в количестве
0,002% в виде растворов вносят при опарном способе в опару, а
при безопарном способе — непосредственно в тесто.
Лабораторные исследования в Центральном научно-исследова-
тельском институте хлебопекарной промышленности и на кафедре
биохимии зерна Московского технологического института пищевой
промышленности показали, что при добавлении ферментного пре-
парата из гриба Asp. oryzae с амилолитической активностью
АС = 6004-800 ед/г в количестве 0,003% к весу муки значительно
улучшаются такие технологические показатели качества хлеба,
как удельный объем, пористость, отношение высоты к диаметру
подового хлеба; увеличивается содержание сахара, вызывающее
в сочетании с продуктами гидролиза белка более интенсивную ок-
раску корки, улучшается аромат. Добавление ферментов активи-
рует микрофлору ржаного теста (молочнокислые бактерии и
дрожжи), усиливает размножение дрожжей и улучшает их подъем-
ную силу, увеличивает газообразование. Лабораторные исследова-
ния подтверждены многочисленными заводскими испытаниями. Ус-
тановлено, что применение ферментных препаратов позволяет
интенсифицировать процессы брожения головки теста, сокращает
общую продолжительность приготовления хлеба на 25% и улучша-
ет его качество.
В настоящее время для нужд хлебопечения выпускается препа-
рат Оризин ПК, получаемый при поверхностном культивировании
плесневых грибов Asp. oryzae (штаммы КС или И-476). Этот
комплексный препарат содержит протеиназы, наличие которых не
всегда благоприятно для качества хлеба.
Так, при использовании муки со слабой клейковиной наличие
протеолитических ферментов в препарате отрицательно сказывает-
ся на формоустойчивости хлеба. Поэтому работники хлебопекар-
ной промышленности предъявляют требование, чтобы препарат
Оризин ПК содержал амилолитических ферментов не менее
400 ед/г и протеолитических ферментов не более 300 ед/г. Содер-
жание посторонней микрофлоры должно быть не более 1-Ю5 на 1г,
для стандартизации препарата следует использовать крахмал и
сернокислый аммоний или крахмал и поваренную соль в соотноше-
нии 1 : 1.
С этой точки зрения более перспективен для нужд хлебопекар-
ной промышленности препарат Оризин ГК, получаемый при глубин-
ном культивировании плесневого гриба Asp. oryzae штамм 3-9-45,
который вообще не содержит протеолитических ферментов.
КОНДИТЕРСКАЯ ПРОМЫШЛЕННОСТЬ
Целесообразность применения ферментного препарата инвер-
тина (содержащего фермент сахаразу) в кондитерской промышлен-
ности доказана работами УкрНИИППа. Добавление инвертина в
51
помадные конфеты, вафли и другие кондитерские изделия, быст-
ро теряющие влагу и высыхающие, вызывает медленный гидролиз
сахарозы с образованием инвертного сахара. Обладая большой
гигроскопичностью, он препятствует рысыханию кондитерских из-
делий.
Многочисленными лабораторными и производственными опы-
тами на кондитерских предприятиях Украины и Азербайджана
определена дозировка препарата в зависимости от начальной
влажности кондитерских изделий, установлено влияние темпера-
туры кондитерских полуфабрикатов на активность фермента и
относительной влажности воздуха цеха и складского помещения на
качество продукции с ферментным препаратом и другие показате-
ли.
Показано (А. В- Мильский), что добавление инверта предотвра-
щает резкое подсыхание изделий и препятствует образованию
крупнокристаллической структуры, обусловливающей твердость
этих изделий. Во избежание сильной инактивации фермента реко-
мендуется применять его при температуре не выше 65—70° С. На
1 кг помадки или пастилы рекомендуется добавлять 0,4—0,5 ед.
препарата, а на 1 т продукции (или полуфабриката) — 130—
170 мл; для более эффективного действия необходимо перед упот-
реблением взболтать препарат и затем разбавить в 4—5 раз сахар-
ным сиропом или водой.
В кондитерской промышленности могут применяться и другие
ферментные препараты. Так, в штате Висконсин (США) при произ-
водстве цельного сухого молока применяется препарат липазы. До-
бавление такого молока к шоколаду придает ему особо тонкий
аромат. За границей запатентован ускоренный метод производст-
ва шоколада, повышающий его усвояемость путем обработки шо-
коладной массы ультразвуком с последующим добавлением про-
теолитических ферментов.
КРАХМАЛО-ПАТОЧНАЯ ПРОМЫШЛЕННОСТЬ
Ферментные препараты применяют для выработки различных
крахмалопродуктов. Так, при переработке кукурузной муки на
мальтозную патоку культура плесневых грибов Asp. oryzae в ко-
личестве 2,5—3%, может с успехом заменить применяющийся
для осахаривания зеленый солод (10—15% по весу перерабаты-
ваемой муки). Такой метод Исключает расход высококачественно-
го зерна на солод, дает возможность получить ферменты за более
короткий срок (ращение солода продолжается 9—12 суток, а вы-
работка сухой культуры плесневого гриба — максимум 2 суток),
уменьшает потери сухого вещества в производстве, которые при
солодоращении составляют 20—25%, и, наконец, улучшает качест-
во готовой продукции. Кроме того, применение ферментных пре-
паратов грибного происхождения позволяет регулировать как со-
держание азотистых веществ в мальтозной патоке, так и соотно-
52
шение углеводов, чего нельзя достигнуть при гидролизе минераль-
ными кислотами. Это подтверждено работами УкрНИИППа и Цент-
рального научно-исследовательского института крахмалопродуктов
(ЦНИИКП).
Гидролиз при помощи ферментов позволил сотрудникам
ЦНИИКПа разработать способ получения нового вида патоки —
СКП (советская карамельная патока). При использовании для оса-
харивания комплексного препарата ферментов Asp. oryzae опти-
мальная температура процесса 55—60°С и оптимальная дозировка
препарата 0,15% по сухому веществу муки, полученный сироп со-
держит 47,51% редуцирующих веществ в пересчете на глюкозу
при соотношении 14,01% глюкозы, 43,48% мальтозы и 40,55%
декстринов- При использовании для осахаривания II фракции пре-
парата Asp. oryzae оптимальная температура процесса 45° С, сос-
тав получаемых углеводов — глюкоза 14,47%, мальтоза 40,87%,,
декстрины 47,00%.
Сотрудниками ВНИИФСа разработан способ получения глюко-
зы путем ферментативного гидролиза крахмала. При расходе су-
хой культуры гриба Asp. awamori 5%. по весу зерна этот способ
дает возможность значительно увеличить выход глюкозы из еди-
ницы сырья и улучшить ее качество.
За рубежом для производства глюкозных сиропов, иногда на-
зываемых «кондитерской глюкозой», а также кристаллической
глюкозы за последние годы начинают также применять фермента-
тивный метод. В Японии этот способ почти вытеснил кислотный
гидролиз крахмала.
При ферментативном гидролизе на 100 частей крахмала при-
бавляют 0,1—0,2 части бактериальной амилазы и 120 частей воды.
В получаемом таким образом «крахмальном молоке» pH устанав-
ливается на уровне 5,4—6,0 и дальнейшее разжижение его прово-
дят при температуре 84—90° С до получения красной окраски с
иодом. Затем раствор охлаждают до температуры осахаривания
(50° С) и вносят препарат, содержащий глюкоамилазу, в количест-
ве 0,6%; pH раствора 4,8, длительность осахаривания 24 ч.
ТЕКСТИЛЬНАЯ ПРОМЫШЛЕННОСТЬ
В производстве ткани нити основы подвергаются усиленному
механическому воздействию, для сопротивления которому их укреп-
ляют, шлихтуя клеящими материалами или смазками. Для шлих-
товки хлопковой, вискозной и смешанной пряжи используют крах-
мал, а для пряжи из ацетата целлюлозы — желатин, казеин и дру-
гие'материалы.
Одной из дальнейших операций обработки ткани является их
расшлихтовка путем химической или ферментативной обработки.
При выборе ферментного препарата для расшлихтовки рекомен-
дуется учитывать сорт шлихты, время снятия ее и температуру.
При высоких температурах и ограниченном времени для снятия
53
крахмальной шлихты применяют бактериальную амилазу, а при
относительно низких температурах — амилолитические ферментные
Препараты грибного происхождения. Для снятия белковой шлихты
применяют протеолитические ферментные препараты.
Применение ферментных препаратов для расшлихтовки повы-
шает производительность труда, улучшает качество ткани за счет
повышения ее капиллярности и сорбционных свойств, что способ-
ствует лучшему отбеливанию.
По данным Р. В. Феииксовой и Л. И. Орещенко, ферментные
препараты из гриба Asp. oryzae могут быть использованы для
расшлихтовки штапельных и хлопчатобумажных тканей в концент-
рации 0,1; 0,15, и 0,2 г/л в зависимости от активности. Ферментный
раствор готовится из расчета 1,2—1,5 л на 1 кг ткани.
Следует отметить, что почти все страны Западной Европы, а
также Япония в настоящее время используют только ферментатив-
ный способ расшлихтовки тканей, причем большинство ферментных
препаратов (в основном бактериального происхождения), выра-
батываемых во Франции, Дании и Японии, применяются в текс-
тильной промышленности для расшлихтовки тканей.
Применение амилолитических ферментных препаратов позво-
ляет вести расшлихтовку непрерывно. При таком способе расход
препаратов составляет 0,3—0,6 г на 1 л раствора, температура
ткани 90° С, время обработки 5—15 мин в зависимости от актив-
ности препарата.
КОЖЕВЕННОЕ ПРОИЗВОДСТВО
В производстве кожи особенно трудоемка операция обезволаши-
вания, в процессе которой связи волоса с дермой ослабляются и
шкура освобождается от шерстного покрова. С давних времен для
этой операции применяли водные суспензии извести. Обезволаши-
вание продолжалось довольно долго, причем суспензии извести
и сульфиды вызывали неравномерное набухание кожевой ткани и
другие нежелательные изменения в химическом строении кожи.
Следует также отметить, что едкие щелочи отрицательно влияли
на качество снимаемого шерстного покрова. Это побудило работ-
ников науки и промышленности искать более прогрессивные мето-
ды обезволашивания кожевенного сырья.
В нескольких научно-исследовательских институтах нашей
страны, в частности в Центральном научно-исследовательском
институте кожевенной промышленности (ЦНИИКП), длительное
время исследовалась возможность применения ферментных препа-
ратов для обезволашивания. Еще в 1941 г. установлено (В. Г. Ба-
бакина), что протеазы грибной культуры Asp. oryzae (Оризин П)
способны при соблюдении определенного режима ослаблять связь
корня волоса с дермой, после чего волос легко извлекается из во-
лосяной сумки. Сырье обрабатывали путем погружения в раствор
препарата Оризин П и нанесения его на нижнюю поверхность
54
шкуры (бахтарму) в виде густой «намази». Были испытаны также
различные условия усовершенствования процесса обезволашивания
многочисленных видов кожевенного сырья (овчина, свиное сырье,
сырье крупного рогатого скота для верха и низа обуви.
Широкая производственная проверка препарата Оризин П
подтвердила лабораторные данные и показала, что наиболее целе-
сообразно применять его для обезволашивания овчины, так как
снятая с овчины шерсть имеет высокую ценность. Установлено,
что при ферментативном методе обезволашивания качество снятой
шерсти повышается и выход ее (для русских овчин) увеличивается
на 25—30%..
Поскольку в препарате Оризин П содержатся липолитические
ферменты, то одновременно с процессом обезволашивания проте-
кает и процесс обезжиривания ткани и шерсти-
Дальнейшие работы были направлены на разработку ускорен-
ных методов обезволашивания кожевенного сырья ферментами пле-
сневых грибов и исследование обезволашивающей способности раз-
личных грибных культур и концентрированных ферментных препа-
ратов.
Выяснено, что основное неудобство использования грибных
культур для обезволашивания заключается в том, что требуется
предварительное экстрагирование ферментов из культуры и после-
дующее отделение экстракта от биошрота. Показано, что примене-
нию концентрированных ферментных препаратов следует отдать
предпочтение перед культурой грибов.
С нашей точки зрения, для нужд кожевенного производства,
вероятно, наиболее эффективно применять концентрированные пре-
параты ферментов в виде сиропов, производство которых всегда бу-
дет дешевле, чем концентрированных сухих препаратов.
Наиболее активными обезволашивающими свойствами облада-
ют плесневые грибы из рода Asp. oryzae — flavus. Ферментные
препараты из бактериальных культур безусловно более перспектив-
ны с экономической точки зрения, но пока в нашей стране такого
производства нет.
По мнению Центрального научно-исследовательского институ-
та кожевенной промышленности, препарат Оризин П при навеске
10 г/л должен иметь протеазную активность (по видоизмененному
методу Lohlein — Volhard) не ниже 0,75—0,80 мл 0,1 н, NaOH;
расход препарата такой активности составляет 3—5%. от веса
сырья.
Рекомендуется два метода обезволашивания овчин и козлиных
шкур: в растворе фермента и нанесением кашицеобразной фермент-
ной намазки со стороны бахтармы.
В последние годы в нашей стране для обезволашивания исполь-
зуется протеолитический препарат в виде сиропа (с содержанием
сухих веществ 50%) с протеолитической активностью 35 ед)мл, ко-
торый применяется в дозировке 5%, (намазной способ).
55
За рубежом протеолитические ферментные препараты исполь-
зуются в кожевенной промышленности в виде сиропов и порошков
для мягчения кож и обезволашивания шкур. В странах Западной
Европы и в Японии их применяют в большинстве случаев только
для мягчения.
ПРОИЗВОДСТВО ШЕЛКА
Известно, что протеолитические и липолитические ферментные
препараты можно использовать для частичного удаления серицина
с нитей кокона и обезжиривания холстов. Технологический процесс
очистки шелковой нити довольно сложен и трудоемок. Шелковая
нить, разматываемая с кокона, содержит до 30% белка-серицина,
который удаляется пропариванием и отваркой в мыльно-содовом
растворе в течение 1,5—2 ч. Остаточный серицин мешает дальней-
шей отделке тканей, вызывает неравномерное окрашивание, при-
дает им плохую эластичность. Для удаления серицина с нити мож-
но использовать протеолитические ферментные препараты, гидро-
лизующие белки.
В составе основного шелкового волокна имеется до 0,7%, жира,
а в холстах-одонках (загрязненных куколкой, холст, полученный
с барабана) до 3—4%- Поэтому важнейшей операцией при отвар-
ке является также обезжиривание сырья. Для гидролиза жира в
данном случае можно использовать липолитические ферментные
препараты.
За рубежом (Япония) для этих целей широко применяют фер-
ментные препараты протеазы и липазы. В нашей стране первые
опыты в этом направлении были проведены Шаповаловой с со-
трудниками. В настоящее время ВНИИФСом совместно с Уз-
НИИШП (Узбекский научно-исследовательский институт шелко-
вой промышленности) исследуются различные ферментные препа-
раты и способы их применения в шелковом производстве.
Испытаны различные ферментные препараты протеолитическо-
го и липолитического комплекса: Оризин ПК, Терризин ПК, Римо-
зин ГР, Мезентерии ГР, ГК, Аваморин ГК, липазы (фирмы Light
и фирмы Nagase). Лучшие результаты по удалению серицина были
получены с препаратом Мезентерии ГК (активность 1000 ед ПС/г)
при дозе 8% к весу сырья. При обезжиривании холстов-одонков
наиболее полный гидролиз жира наблюдался в случае исполь-
зования японской липазы (активность 2800 ед ЛС/г) при дозе 1%
к весу сырья. Полупроизводственные опыты на шелкопрядильной
фабрике «Пролетарский труд» показали, что препарат достаточно
полно гидролизует жир, не ухудшая качества нити.
ПАРФЮМЕРНАЯ ПРОМЫШЛЕННОСТЬ
Применение ферментных препаратов при изготовлении косме-
тических средств представляет большой интерес и заслуживает де-
тального изучения. В Японии выпускаются косметические средства,
9S
изготовленные в основном с протеолитическими ферментными пре-
паратами.
Косметическое средство для смягчения кожи «Plassman» хоро-
шо удаляет ороговевшие чешуйки кожи на руках и ногах.
Ферментный лосьон Д-11 «Дзюнес», также приготовленный с
протеолитическими ферментами, усиливает сопротивляемость кожи
бактериям, обезжиривает кожу, делает ее белой и свежей.
Крем для бритья «Плассман» позволяет безболезненно брить
самую густую и жесткую бороду без применения компрессов. Со-
держащиеся в креме ферменты размягчают волос, удаляют орого-
вевшие чешуйки кожи и следы порезов.
Очищающий крем «Плассман» благодаря содержащимся в нем
протеолитическим и липолитическим ферментам делает кожу све-
жей и приятной на вид.
СЕЛЬСКОЕ ХОЗЯЙСТВО
Ферментные препараты можно использовать для повышения
усвояемости питательных веществ кормов двумя способами:
1) при подготовке кормов — для расщепления сложных пита-
тельных веществ корма до простых, легко усвояемых. В специаль-
ных установках для такой подготовки должны быть созданы опти-
мальные условия (pH, давление и температура) для действия фер-
ментов. Этот способ относительно трудоемок и пока не нашел ши-
рокого распространения;
2) добавлением ферментных препаратов в корм, что облегчит
расщепление сложных питательных веществ корма в желудочно-
кишечном тракте животных.
Известно, что значительная часть питательных веществ корма
расщепляется в желудочно-кишечном тракте жвачных животных,
имеющих сложный желудок, под действием ферментов микроорга-
низмов, так как в рубце не обнаружены ферменты, вырабатывае-
мые животным организмом.
Из литературы известно, что в рубце крупного рогатого скота
температура в течение суток удерживается в пределах 39—4Г
вне зависимости от приема животным пищи и воды, а реакция сре-
ды близка к нейтральной (pH 6,5—7,5)-
За рубежом исследована возможность применения ферментов
для повышения питательности кормов. В 1955 г. Ливисом установ-
лено, что добавление к рациону поросят протеолитических фермен-
тов увеличивает привесы на 17% и снижает затраты кормов на 14%.
Сотрудники ВНИИФСа (Н. В. Ездаков) провели работы, на-
правленные на повышение питательной ценности кормов при добав-
лении ферментных препаратов в корм для крупного рогатого ско-
та. Исследовалась также возможность ускорения роста и сниже-
ния затрат кормов на выращивание поросят-сосунков и цыплят.
В опытах на поросятах-сосунках применяли препараты Оризин
ПК, Аваморин ПК, Терризин ПК. Перед скармливанием препара-
ты растворяли в воде и добавляли в корма.
57
Лучшие результаты по приросту живого веса и по сохранности
поросят отмечены при добавлении в корма 0,01% Оризина ПК и
0,01% Аваморина ПК.
Проведенные опыты позволили сделать вывод, что поросята-
сосунки, имеющие несовершенную ферментную систему, хоро-
шо реагируют на добавление в корм комплекса амилолитических
и протеолитических ферментов. Эффективность добавления фер-
ментов в корм совершенно очевидна. Так, на каждого поросенка
было израсходовано препарата на сумму 13—26 коп., а дополни-
тельный прирост их был в пределах 3—6 кг.
Аналогичные опыты были проведены на цыплятах, кормление
которых начинали с однодневного возраста. В корма добавлялись
те же ферментные препараты, что и для свиней-сосунков.
Анализ показал, что ферментные препараты благотворно влия-
ли на увеличение привеса. По показателям среднего живого веса
в 60-дневном возрасте наилучшей была признана комбинация пре-
паратов Оризина ПК и Аваморина ПК в дозе по 0,005%. Добавле-
ние к кормам сухой культуры гриба, в частности Аваморина П в
дозе 0,25% от веса корма, также дало хорошие результаты, привес
в этой группе был выше контрольного па 10%.
Таким образом, проведенные работы показывают высокую эф-
фективность применения ферментов для повышения питательной
ценности кормов и сокращения их расхода-
13 Чехославацкой Социалистической Республике уже в течение
трех лет амилолитические и протеолитические ферменты в виде су-
хой культуры гриба Asp. oryzae применяются в качестве добавок
в комбикорма. Для этой цели ежегодно вырабатывается 300 т
культуры, которую добавляют в комбикорма в количестве 0,4—
0,6% к весу корма. Это позволяет повысить привесы на 6—9%
против контрольных.
КОММУНАЛЬНОЕ ХОЗЯЙСТВО
За рубежом ферментные препараты, главным образом бакте-
риального происхождения, довольно широко применяют при стир-
ке белья, особенно спецодежды, а также для удаления пятен с
материалов при химической чистке.
Так, во Франции широко применяются препараты фирмы «Рапи-
даз», и в частности бактериальная амилаза, имеющая оптимум
действия при pH 6,0—7,0 и температуре 70—75° С, и бактериальная
протеиназа, имеющая оптимум действия при pH 8,0—9,5 и темпера-
туре 70—80° С.
Бактериальные препараты для коммунального хозяйства выпус-
каются японскими фирмами «Нагазе» и «Дайва Касей».
В Дании фирма «Ново Индастри» выпускает препарат бакте-
риальной щелочной протеазы, весьма эффективный при стирке
белья, загрязненного белковыми веществами.
58
МЕДИЦИНА
В медицине фермены с каждым годом получают все более ши-
рокое распространение.
Особенно это видно на примере Японии, где производится срав-
нительно большое количество ферментных препаратов микробного
происхождения с высокой степенью очистки. Это главным образом
различные протеиназы (кислые, нейтральные и щелочные), цел-
люлазы, различные виды амилаз, в том числе и глюкоамилаза,
липазы (кислая, нейтральная и щелочная), лизоцим, глюкозоокси-
даза, цитохром и многие другие.
Для изготовления средств, улучшающих пищеварение у лиц,
страдающих отсутствием определенных ферментов.в организме, ча-
ще всего применяются амилолитические и протеолитические фер-
менты.
В клиниках Японии исследуется эффективность применения
липопротеинлипазы, которая способствует удалению холестерино-
вых бляшек со стенок кровеносных сосудов.
Применяется способ лечения сердечно-сосудистых заболева-
ний и отравления окисью углерода высокоочищенным ферментным
препаратом цитохромом, который эффективно помогает восстанов-
лению деятельности мышц, парализованных при кровоизлияниях
в мозг.
В наибольшем объеме в Японии выпускаются препараты, пред-
назначенные для улучшения пищеварительных процессов.
Такие препараты обычно представляют собой комбинации нес-
кольких ферментов, оформленные в виде гранул и таблеток.
Часто в препараты входят ферменты, улучшающие переварива-
ние балластных веществ пищи, в частности целлюлозы и гемицел-
люлозы, которые затрудняют доступ ферментов к основным пита-
тельным веществам, содержащимся во многих продуктах раститель-
ного происхождения.
В меньших размерах в Японии выпускаются препараты, исполь-
зуемые в хирургии, стоматологии, отоларингологии и др. в качест-
ве противовоспалительных средств и рецептур для ферментного
очищения ран-
В терапии используются главным образом коферментные пре-
параты для лечения сердечно-сосудистых заболеваний.
ЛИТЕРАТУРА
i. Альбом нучно-исследовательских работ в области спиртовой, ликеро-водочной
и ферментной промышленности. ВНИИСП, 1961.
2. Amundstad, «Milchwissenschaft», 1961, № 7, 249.
3. Баба кип а В. Г. Разработка микробного ферментного препарата для обез-
волашивапия кожевенного сырья. Отчет ЦНИИКПа за 1941 г.
4. Ба б а кипа В. Г. Применение ферментов для обезволашивания кожевен-
ного сырья. ЦИНТИлегпром, 1960.
5. Б а б а к и н а В. Г. Применение ферментов в производстве кожи. Ростехиздат,
1962.
59
6. Б о б р а к о в В. П. Применение ферментных препаратов при производстве
яблочного сока. «Консервная и овощесушильная промышленность», 1963, № 2.
7. В on а с, S af а г i с , The Anfluence of come enzymes on the protheolytic de-
composition of the protein in processed Cheese.
8. Бригаденко M. К. Частичная замена солода поверхностной культурой
плесневого гриба. «Спиртовая промышленность», 1961, № 1.
9. Бригаденко М. К. Заводские опыты по частичной замене солода поверх-
ностной культурой гриба Aspergillus awamori. «Спиртовая промышленность»,
1961, № 2.
10. Бригаденко М. К- Оптимальная температура и длительность осахарива-
ния крахмалистых заторов смесью ферментов из поверхностной культуры,
гриба Aspergillus awamori и солода. Труды ЦНИИСПа. Вып. XII, 1962.
11. Б у б н о в Д. В. Влияние пепсина на качество сыра. ВНИМИ. Отчет за 1934 г.
12. Vandamme М Pour avoir une hone conservation fant-ie pasteuriser la biere.
«Fermentatio», 1960, № 2.
13. Ведерникова E. И. Обзор исследований по улучшению качества и по-
вышению биологической ценности пищевых продуктов, Труды УкрНИИППа.
Вып. 2. Харьков, 1959.
14. Ведерникова Е. И. Мальтазная активность ферментных препаратов
плесневых грибов, предназначенных для хлебопекарного производства. «Мик-
робиология». Т. XXXI. Вып. 6, 1962.
15. Ведерникова Е. И., Мякинькова А. Н., Остр ин С. П. Производ-
ство мальтозной патоки с применением ферментов плесневого гриба Аспер-
гиллюс оризе с целью использования ее в хлебопечении. В кн. «Материалы
технической информации». Вып. 5. «Вопросы хлебопекарной и дрожжевой
промышленности». Харьков, 1958.
16. В е с е л о в И. Я., С а л м а н о в а Л. С., Шептун Л. С. Применение гриб-
ной цитазы в пивоварении. Труды ВНИИППа. Вып. VIII, 1961.
17. Веселов И. Я., Салманова Л. С. Разработка технологии получения
стабилизатора для пива. Труды ВНИИППа. Вып. VII, 1959.
18. Виленская Е. И. Новая технология производства осветленных соков с
использованием ферментных препаратов. Сб. «Пищевая промышленность
(консервная, овощесушильная и пищеконцентратная)», № 6. ЦИНТИпище-
пром, 1961.
19. Виленская Е. И. Новая технология извлечения натуральных осветлен-
ных плодоягодных соков с предварительной обработкой сырья ферментными
пектолитическими препаратами. В кн. «Научно-техническая конференция по
вопросам производства плодово-ягодных и виноградного соков». Тезисы док-
ладов. Кишинев, 4961.
20. В ил е н с к а я Е. И. Новая технология производства осветленных натураль-
ных й спиртованных соков с ферментативной обработкой сырья. В кн. «Пу-
ти увеличения выхода соков и использования отходов сокового производ-
ства». Минск, 1960.
21. ВНИИФС. Временная инструкция по выращиванию культур плесневых гри-
бов и использованию их для получения концентрированных препаратов фер-
ментов, 1961.
22. В я т к и н В. В. Применение культуры плесневых грибов при производстве
спирта. В кн. «Внедрение ферментных препаратов в народное хозяйство».
Ч. II. ЦИНТИпищепром, 1961.
23. Г а л к и н а Г. В. Использование ферментов в производстве крахмалопро-
дуктов. «Сахарная промышленность», 1960, № 12.
24. ГапоненковТ. К., Проценко 3. И. О расщеплении пектиновых ве-
ществ ферментами микроорганизмов и химической природе конечных продук-
тов. «Микробиология». Т. XXIX. Вып. 5, 1960.
25. Г а п о н е н к о в Т. К. «Микробиология». Т. XXIII. Вып. 3, 1954.
26. Г о л у б ч и к С. А., Ж о в т о в с к и й Д. Д. Из опыта работы по примене-
нию ферментного препарата и несоложенного сырья при производстве жи-
гулевского пива. В кн. «Материалы технической информации». Вып. 4. Пиво-
варенное производство. Харьков, 1957.
60
27. Горбатов В. М., Долговский В. В. Важнейшие достижения науки
и техники в мясной промышленности. ЦИНТИпищепром, 1962.
28. Д а н и л я к Н. И., Шведов А. Д., К а м и н с к и й Р. С. Способ осаха-
ривания крахмалистого сырья культурой гриба Aspergillus oryzae на пше-
ничных отрубях. Сб. «Пищевая промышленность (пивоваренная, безалко
гольная, спиртовая и ликеро-водочная», № 3 (17). ЦИНТИпищепром, 1960.
29. Enrichissement de Гаготе du chocolat an lait chocolateric Confiserie de France.
№ 132, 1958.
30. Ездаков H. В., Владимирова А. А. Ферментные препараты в рацио-
нах поросят. Труды ВНИИФСа. Вып. XV, 1964.
31. Ездаков Н. В., Кастюк В. Ф. Применение ферментных препаратов
в птицеводстве. Труды ВНИИФСа. Вып. XVI, 1965.
32. Записки Воронежского сельскохозяйственного института. Т. XXVIII. Вып. 1,
1959.
33. И н и х о в Г. С. Ускорение созревания сыров. «Молочное хозяйство на строй-
ке МТФ», 1951, № 11.
34. Калашников Е. Я., Лифшиц Д. Б., Михайловская Б. Ц., Трай-
н и н а Т. И. Сб. «Материалы технической информации». Вып. 4. Пивоварен-
ное производство, Харьков, 1957.
35. Калашников Е. Я., Лифшиц Д. Б., Михайловская Б. Ц., Трай-
н и н а Т. И. Способ производства пива с применением плесневых грибов.
Авт. свид. 128424 (заявка 633618/28). Заявл. 11/VII 1959, опубл. 15/V 1960.
«Бюллетень изобретений», 1960, № 10.
36. Калашников Е. Я , Л и ф ш и ц Д. Б., Михайловская Б. Ц., Т р а й-
н и н а Т. И. Получение пива из несоложеного ячменя с ароматизацией за-
торов. В кн. «Новая техника и технология в пивоваренной промышленности».
ГОСИНТИ, 1960.
37. Калашников Е. Я. Инструкции по производству ферментных^ препара-
тов и применению их в пивоварении. УкрНИИПП. Харьков, 1959.
38. К а л а ш н и к о в Е. Я., Лифшиц Д. Б. Консультации по пищевой про
мышленности. Вып. 3/28. Изд. УкрНИИППа. Харьков, 1949.
39. Калашников Е. Я.» Производство амилолитических и протеолитических
ферментов и применение их в пивоваренной промышленности. ГОСИНТИ,
1959.
40. Калашников Е. Я. Применение ферментных препаратов гриба Asperigi-
lus oryzae в пивоваренном производстве. В кн. «Восьмой Менделеевский съезд
по общей и прикладной химии». Секция химии и технологии пищевых про-
дуктов. Рефераты докладов и сообщений, № 10, 1958.
41. Калашников Е. Я. Применение ферментного препарата и повышенного
количества несоложеного сырья в пивоваренной промышленности. В кн. «Ма-
териалы технической информации». Вып. 4. Пивоваренное производство. Харь-
ков, 1957.
42. К а л у н я н ц К. А. Выделение и концентрирование ферментов. ЦИНТИ-
пищепром, 1963.
43. К а ц А. М., М а ч т и н Д. И., Тишинская И. В. Разработка технологи-
ческой схемы и технического задания на проектирование завода по произ-
водству биопрепаратов для сыродельной промышленности. Раздел «Опреде-
ление потребности молочной промышленности в заквасках, плесневых фер-
ментных препаратах и эффективность использования ферментных препаратов
в сыроделии». ВНИИМС. Отчет по теме № 9-а (6531-с). Углич, 1964.
44. Климовский И. И. Биохимические свойства гидролизатов и изыскание
способов повышения их протеолитической активности в отношении ускорения
созревания сыра. ВНИИМС. Отчет за 1960 г.
45. Климовский И. И. Разработка технологии производства биологически
активных препаратов и методов использования их при выработке сыра уско-
ренного созревания. ВНИИМС. Отчет за 1962 г.
46. Климовский И. И. Изыскание рациональных способов получения сухих
ферментных препаратов молочнокислых бактерий. ВНИИМС. Отчет за 1963 г.
47. К о л м о г о р о в С. Н. Опыт применения для производства пива повышен-
61
ного количества несоложеного сырья и ферментного препарата Aspergillus
oryzae. «Пищевая промышленность Казахстана», 1959, № 3.
48. Коновалов С. А. Применение ферментов микробного происхождения в.
спиртовой промышленности. ЦИНТИпищепром, 1964.
49. Константинова Л. Л., Пахомова К. И. Ускорение созревания со-
леной Атлантической сельди. Отчет ПИНРО. Мурманск, 1963.
50. Ко з л о в с к и й Г. И. Расщепление белков несоложеных материалов под.
действием ферментных препаратов плесневого гриба Aspergillus oryzae (в
пивоварении). Труды УкрНИИППа. Вып. 2, 1959.
51. Козырев А. Г. Применение глубинной культуры плесневых грибов как
заменителя солода при производстве спирта на Гадовском спиртосовхозком-
бинате. В кн. «Производство новых видов продукции *в спиртовой промыш-
ленности». Пищепроиздат, 1961.
52. Кузнецова Н. П. Созревание и качество сыров, выработанных с приме-
менением препарата сычужного фермента и пищевого пепсина. Автореферат
диссертации на соискание ученой степени кандидата наук.
53. Л е в н е в а Л. С. «Рыбное хозяйство», 1961, № 1.
54. Л е о н о в и ч Н. В., Салманова Л. С. Технологические приемы и мето-
ды получения стойкого пива. В кн. «Пивоваренное производство» (сборник
статей). ГОСИНТИ, 1960.
55. Л у ч и ц к а я Е. Н. Применение очищенного пектолитического ферментного
препарата на предприятиях Закарпатского винтреста. В кн. «Обмен опытом
в винодельческой и ликеро-водочной промышленности». ГОСИНТИ, 1962.
56. Макеев Д. М., Я р о вен ко В. Л. Применение смеси культур плесневых
грибов Asp. usami 45 и Asp. awamori в спиртовом производстве. Сб. «Пище-
вая промышленность (спиртовая, ликеро-водочная и ацетоно-бутиловая)»,
№ 6. ЦИНТИпищепром, 1963.
57. М а к у х и н а А. М. Технологические покаазтели брожения крахмалистого
сырья, осахаренного ферментами глубинной культуры гриба Aspergillus niger.
Труды ЦНИИСПа, Вып. VIII, 1959.
58. Л1 а р т а к о в А. /X., Парамонов Ф. Ф. О влиянии ферментации мезги
на выход сусла при производстве белых столовых вин. В кн. «Биохимия
виноделия». Сборник 5, 1957, Изд-во АН СССР.
59. Марта ко в А. А., Молдабаева Р. К. Препараты для осветления сус-
ла из-под прессов непрерывного действия. «Виноделие и виноградарство'
СССР», 1962, № 2.
60. М а р т а к о в А. А. Применение ферментов для увеличения выхода сусла.
«Виноделие и виноградарство СССР», 1962, № 5.
61. McRacF. Р. Some enzyme systems in the brewing process «Canadian Food
Industries. Vol. 32, № 5, 1961.
62. Мильский А. В. Применение инвертина в кондитерской промышленности.
В кн. «Внедрение ферментных препаратов в народное хозяйство». Ч. 11.
ЦИНТИпищепром, 1961.
63. Моисеенко Л. Ф., Белоконь И. И. Применение ферментной обработки
препаратом Аспергиллюс в виноделии. «Виноделие и виноградарство СССР»,
1960, № 7.
64. Моисеенко Л. Ф. Получение ферментного препарата Аспергиллюс нигер
для обработки соков и вин. В кн. «Обмен опытом в винодельческой и лике-
ро-водочной промышленности». ГОСИНТИ, 1962.
65. Петина Т. А. Образование сычужного и протеолитических ферментов гри-
бом Aspergillus candidus шт. 11. Автореферат диссертации на соискание уче-
ной степени кандидата технических наук. Московский технологический ин-
ститут пищевой промышленности, 1966.
66. Phaff and Т о s 1 у n. «Wallerst. Laborat. Communs», 10, 133, 1947.
67. П о п о в а Е. М. Ферментные препараты в виноделии. В кн. «Пятый Меж-
дународный биохимический конгресс». (Рефераты секционных сообщений).
Т. 1, 1961.
68. П о п о в а Е. М. О внедрении ферментных препаратов в виноделие. «Вино-
делие и виноградарство СССР», 1961, № 3.
62
69. П о п о в а Е. М., Выжиги на Л. П. Применение препарата Aspergillus
niger в плодово-ягодном виноделии. Сб. «Пищевая промышленность (пиво-
варенная, безалкогольная, винодельческая, спиртовая и ликеро-водочная)'».
№ 4. ЦИНТИпищепром, 1961.
70. Попова Е. М. Новый источник пектинрасщепляющих ферментов. «Вино-
делие и виноградарство СССР», 1962, № 4.
71. Производство и применение ферментных препаратов в пищевой промышлен-
ности. Доклады (с дискуссиями), прочитанные на симпозиуме, состоявшемся1
1—2 октября 1959 г. в Королевском медицинском обществе. Общество хими-
ческой промышленности 14 Belgrave Square, London, S. W. № 1, 1961. Пере-
вод и редакция д-ра биол наук проф. Р. В. Фениксовой. Пищепромиздат,,
1963.
72. Prooerties and applications of invertase concentrate. «Confectionery Producti-
on».' Vol. 23, № 12, 1957.
73. Proteolytic degradation in the brewing of beer. Fr. 1250017. 27/IX 1959.
«Chemical Abstracts». Vol. 56, № 4, 1962.
73a. Reed G. Ezymes in Food processing New York and London, 1966.
74. Радченко M. С. Производство ферментного пектолитического препарата
на Чудновском спирто-соковом комбинате. В кн. «Обмен опытом в вино-
дельческой и ликеро-водочной промышленности». ГОСИНТИ, 1962.
75. Салманова Л. С., Горбачкова Е. А. Углеводный состав гидролиза-
тов, полученных в результате действия цитолитических грибных культур на
различные субстраты. Труды ЦНИИПБиВП. Вып. IX, 1962.
76. С а л м а н о в а Л. С. Применение ферментных препаратов-стабилизаторов
в пивоваренной промышленности. В кн. «Восьмой Менделеевский съезд по
общей и прикладной химии. Секция химии и технологии пищевых продуктов».
Рефераты докладов и сообщений, № 10, 1958.
77. С а л м а н о в а Л. С., Нуждина Т. Н., Шептун Л. С. Применение ци-
толитических культур грибов в производстве пива. «Известия высших учеб-
ных заведений. Пищевая технология», № 1, 1962.
78. Салманова Л. С. Цитолитические ферменты и их применение в пивова-
рении, 1966.
79. Самсонова А. Н. Как повысить выход и ускорить прессование при извле-
чении сока из перезревших плодов. «Консервная и овощесушильная промыш-
ленность», 1960, № 8.
80. Schaler R. G., М с Adam R. L., В а а 1 m a n М. Т. Process for treating
beer U. S. 2916377, 8/XII 1959. Реферативный журнал. «Химия», 3H249, 1961.
81. Соловьев В. И. Перспективы применения протеолитических ферментов
для повышения качества мяса. В кн. «Внедрение ферментных препаратов в
народное хозяйство». Ч. II, ЦИНТИпищепром, 1961.
82. Соловьев В. И., Пиульская В. И., Боткина А. Г., Михайло-
ва Е. Н. Труды ВНИИМПа. Вып. 5, 1953, стр. 108—138.
83. Соловьев В. И. и Кузнецова Г. Н. Биохимические процессы, проте-
кающие при обработке мяса протеолитическими ферментами. Тезисы докла-
дов Первого всесоюзного биохимического съезда. Вып. 1. Симпозиумы I—XV.
АН СССР. М. — Л., 1963.
84. Соловьев В. И. Размягчение мяса при помощи протеолитических фермен-
тов. «Пищевая промышленность (мясная и птицеперерабатывающая)», № 4
(55), 1961.
85. С о л ь б е р г и др. Труды XIII Международного конгресса работников мо-
лочного дела. ИЛ, 1955, стр. 88—91.
86. Способы обработки несоложеного материала в пивоваренной промышленно-
сти (МППТ РСФСР. Обмен производственно-техническим опытом), 1955.
87. Стабилизация пива глюкозооксидазой. Экспресс-информация (ВИНИТИ).
Серия «Пищевая промышленность». Вып. 45, 1962.
88. Стадхоудерс Дж. XV Международный конгресс по молочному делу.
Пищепромиздат, 1961, стр. 103—104.
89. Сташко С. П., Покровская Н. В. Применение ферментных препара-
тов в пивоваренной промышленности. Обзор. ЦИНТИпищепром, 1961.
63
90. Та н асиенко Г. С., М и л ю т и н а В. 3. Опыты по применению фермен-
тов из гриба Асперегиллюс нигер на предприятиях Херсонского совнархоза.
В кн. «Обмен опытом в винодельческой и ликеро-водочной промышленности».
ГОСИНТИ, 1962.
91 Терехин С. И. Применение культуры плесневых грибов вместо солода
при производстве спирта из крахмалистого сырья на Серебряно-Прудском
спиртозаводе. В кн. «Производство новых видов продукции в спиртовой про-
мышленности». Пищепромиздат, 1961.
92. Т о к а р е в а Р. Р. Исследование ферментных препаратов из новых видов
плесневых грибов для улучшения качества хлеба. Труды ЦНИИХПа. Вып. 8,
1960.
93. Токарева Р. Р. Новая технология приготовления улучшителей заварных
сортов хлеба Труды ВНИИХПа. Вып. 7, 1958.
94. Токарева Р. Р. Применение препаратов ферментов плесневых грибов в
хлебопечении. «Природа», 1959, № 8.
95. Токарева Р. Р. Применение ферментных препаратов в хлебопекарной про-
мышленности. «Пищевая промышленность Казахстана», Сб. № 5, 1961.
96. Т о к а р е в а Р. Р. Применение ферментных препаратов для улучшения ка-
чества хлеба из пшеничной муки пониженного качества. Труды ЦНИИХПа.
Вып. 10, 1962.
97. Т о к а р е в а Р. Р. Применение ферментных препаратов для улучшения ка-
чества хлеба из пшеничной муки пониженного хлебопекарного достоинства.
«Хлебопекарная и кондитерская промышленность», 1961, № 3.
Од. Токарева Р. Р. Применение ферментных препаратов при приготовлении
ржаного хлеба из обдирной муки. «Хлебопекарная и кондитерская промыш-
ленность», 1961, № 7.
99. Т о к а р е в а Р. Р., Кретович В. Л. Применение концентрированных фер-
ментных препаратов из плесневых грибов в хлебопечении. Труды V Между-
народного биохимического конгресса. Симпозиум VIII. Биохимические осно-
вы технологии пищевых производств. 1962.
100. Токарева Р. Р., Кретович В. Л. Применение концентрированных фер-
ментных препаратов из плесневых грибов в хлебопечении. Сб. «Биохимия
зерна и хлебопечения», № 6, 1960.
101. Токарева Р. Р., Кретович В. Л. Улучшение хлебопекарного каче-
ства муки при помощи препаратов ферментов из плесневых грибов. Сб.
«Биохимия зерна», № 4, 1958.
102. The production of Cream centers. «Confectionery Production». Vol. 25, № 10.
1959.
103. Трусова С. А., К у в и ко в а А. Ф., Болотина Ф. Е. Применение очи-
щенных препаратов пектолитических ферментов при переработке плодоягод-
ного сырья. Труды ЦНИИСПа. Вып. IX, 1960.
104. Трусова С. А., Болотина Ф. Е. Новое в рецептурах ликеров, наливок,
настоек, пуншей и десертных напитков. В кн. «Обмен опытом в винодель-
ческой и ликеро-водочной промышленности». ГОСИНТИ, 1962.
105. Ускорить массовое применение ферментов грибов в спиртовом производ-
стве. «Спиртовая промышленность», 1960, № 8.
105а. Устин ников Б. А., Пыхов а С. В., Лазарева А. Н. Ферментатив-
ный гидролиз крахмала в производстве спирта из крахмалистого сырья.
Труды ВНИИФСа. Вып. XVI, 1965.
106. Ухтомская Ф. И. Ускоренное созревание презервов. «Рыбная промыш-
ленность СССР», 1945.
107. Ullmann F. Uber die stabilisierung von Bieren. «Schweizer Brauerei-
Rundschau). Bd. 73, № 3, 1962.
108. Ultraschall und Enzym-Behandlung von Kakao Zucker-Masse, «Revue Inter-
national de la Chocolaterie. Vol 13, № 12, 1958.
109. Ta cob H. T. Enzymes in wine macing. «Australian Wine, Brewing and
Spirit Review», Vol. 79, № 4, 1961.
НО. Факторы, влияющие на действие инвертазы в отливных помадных корпусах.
Экспресс-информация (ВИНИТИ). Серия «Пищевая промышленность».
Вып. 47, № 497, 1961.
64
111. Tanssen F. Invertase and cast cream centers. «Manufacturing Confectio-
ner*. Vol. 40, № 4, 1960.
112. Tanssen F. Watch 7 quality factors: invertase permits longers cream stora-
ge, «Canady Industry and Confectioners Journal». Vol. 117, № 8, 1961.
113. Фениксова P. В., Попова H. В., Герасимова Г. В., Быкова
В. М., Самарина В. М. Применение концентрированных препаратов
протеазы плесневых грибов для ускорения процесса созревания сельди.
Труды ВНИИФСа. Вып. XV, 1964.
114. Фениксова Р. В. Производство ферментных препаратов из культур мик-
роорганизмов. В кн. «Производство новых видов продукции в спиртовой
промышленности». Пищепромиздат, 1961.
115. Фениксова Р. В., О рещен ко Л. И. Применение комплексных препа-
ратов ферментов Aspergillus oryzae в текстильной промышленности для
расшлихтовки тканей. Труды ЦНИИСПа. Вып. IX, 1960.
116. Фениксова Р. В. Применение поверхностной культуры гриба взамен
солода при производстве спирта (реферат доклада). В кн. «Внедрение фер-
ментных препаратов в народное хозяйство», Ч. II. ЦИНТИпищепром, 1961.
117. Фениксова Р. В. Поверхностные культуры плесневых грибов как за-
менители солода при производстве спирта. Труды ВНИИСПа. Вып. 3, 1954.
118. Фениксова Р. В., Шилова А. А. Способ осахаривания крахмалистого
затора ферментами плесневых грибов. Авт. свид. 127632, (заявка 636463/28),
заявл. 14/VIII 1959, опубл. 12/IV 1960. «Бюллетень изобретений», 1960, № 8.
119. Ферментация мезги при производстве ягодных соков. «Экспресс-информация
(ВИНИТИ). Серия «Пищевая промышленность». Вып. 6, № 88, 1960.
120. Фремель В. В., Вяткин В. В., Станьков X. 3., Смирнова А. П.
Получение и применение глубинной культуры плесневых грибов. Труды
ВНИИСПа. Вып. 3, 1954.
121. Фремель В. В., Вяткин В. В., Станьков X. 3. и Смирнова А. П.
Применение глубинной культуры плесневых грибов вместо солода. «Спир-
товая промышленность», 1953, № 1.
122. Чеботарев А. И. Биохимические основы созревания сыров. Вологод-
ское книжное издательство, 1959.
123. Че мерен ко Н. В., Иванов А. С., Сунозова И. К. Использование
ферментных препаратов из плесневых грибов для стимулирования созрева-
ния и повышения качества соленых продуктов из сельдевых рыб. Отчет
КаспНИРО. Астрахань, 1963.
124. Шаройко К. М., Кал итвя некая В. И., Б а т к о в Н. В. Получение
мальтозной патоки из кукурузной и пшеничной муки с применением фер-
ментного препарата Aspergillus oryzae. Сборник трудов УНИИППа. «Новое
в биохимических процессах пищевой промышленности. Киев, 1965.
125. Шпектор С. И. Поточная линия переработки плодов и ягод с примене-
нием ферментной культуры. В кн. «Внедрение новой техники и наиболее
совершенной технологии в винодельческую промышленность Белоруссии».
Минск, 1962.
126. Ю марик А. Ю. Производство эстонского сыра ускоренного созревания.
.«Пищевая промышленность», 1960, № 2.
127. Яровенко В. Л., Пыхов а С. В., Устинников Б. А., Лазаре-
ва А. Н., Макеев Д. М. Ферментативный гидролиз крахмала при непре-
рывном спиртовом брожении. «Ферментная и спиртовая промышленность»,
1965, № 1.
5-826
Глава III. СЫРЬЕ И ОБОРУДОВАНИЕ
ДЛЯ ЕГО ТРАНСПОРТИРОВАНИЯ
С технологической точки зрения сырьем для производства
ферментных препаратов может служить любой материал, содержа-
щий ферменты,. —это главным образом органы и ткани животных,
семена, проростки или отдельные органы растений, а также куль-
туры и культуральные жидкости микроорганизмов.
С точки зрения экономических и хозяйственных требований
сырьем может служить лишь тот материал, который легко досту-
пен, может быть получен в больших количествах и характеризует*
ся высокой концентрацией ферментов.
Ферменты содержатся в разнообразных растениях, однако кон-
центрация их сравнительно низкая, что затрудняет производство
ферментных препаратов из растительного сырья.
Этим требованиям наиболее полно удовлетворяют культуры
микроорганизмов: бактерии, плесневые и лучистые грибы и дрож-
жи,— которые быстро размножаются и накапливают значительные
количества ферментов.
Синтез ферментов в микробной клетке связан с ее жизнедея-
тельностью, а следовательно, и с питательной средой.
В связи с этим в данной главе рассматриваются не только
штаммы микроорганизмов, принятые в качестве продуцентов в про-
мышленном производстве ферментов, но и компоненты питательных
сред.
Питательной средой может служить материал, содержащий
углерод и азот в определенных соотношениях и другие необходи-
мые элементы.
Вопросу подбора питательной среды для микроорганизмов —
продуцентов ферментов — посвящено много работ. В большинстве
из них основным критерием для оценки питательной среды служи-
ло определение веса тела гриба в связи с изменениями состава
среды. Исследования ферментативной активности в выращиваемых
культурах и культуральных жидкостях не проводились.
В ряде работ было показано, что изменение только солевого
состава питательной среды приводило к изменению направления
химической деятельности грибов. Установлено (Л. А. Гончарова),
что крахмал и продукты его гидролиза являются лучшими источ-
66
никами углерода для выращивания гриба Asp. oryzae, обладающе-
го высокой активностью амилазы.
СЫРЬЕ ДЛЯ ПРОИЗВОДСТВА ФЕРМЕНТНЫХ ПРЕПАРАТОВ
ИЗ ПЛЕСНЕВЫХ ГРИБОВ, ВЫРАЩИВАЕМЫХ ПОВЕРХНОСТНЫМ
СПОСОБОМ
Образование ферментов плесневыми грибами в значительной
степени зависит от соотношения углеводов и азота в питательной
среде. Исследованиями Р. В. Фениксовой с сотрудниками установ-
лено, что величина этого соотношения зависит от концентрации
обоих компонентов в питательной среде.
Исследования при поверхностном выращивании гриба Asp-
oryzae на асбесте проводились при изменении концентрации азота
(в виде NaNO3) в среде Чапека с pH 6,47 на фоне увеличивающих-
ся концентраций крахмала.
Наиболее характерные результаты приведены в табл. 2.
Таблица 2
Влияние соотношения крахмала и азота на образование амилазы Asp. oryzae
(по Фениксовой) °
Концентрация, % Отношение крахмала к азоту, приня- тому за единицу Амилолитическая активность, ед. АС pH культуры
азота крахмала
во всей культуре на 1 г сухого вещества на 100 мл питательной среды
0,05 3 60 0,66 0,13 5,3 7,90
6 120 0,81 0,16 6,50 7,90
0,05 9 180 1,12 0,26 8,96 7,95
3 20 0,97 0,19 7,76 8,10
0,15 6 40 3,39 0,66 27,12 8,5
9 60 1,56 0,31 12,48 8,20
3 10 0,56 0,11 4,48 8,1
0,30 6 20 1,02 0,20 8,16 8,7
9 30 3,83 0,76 30,64 8,9
3 6,6 0,61 0,12 4,88 8,5
0,45 6 13,3 0,91 0,18 7,28 8,8
9 20 3,05 0,61 24,40 8,4
3 5 1,07 0,21 8,56 8,3
0,60 6 10 1,26 0,26 10,32 8,7
9 15 1,06 0,21 8,48 8,8
67
Данные табл. 2 показывают, что для максимального образо-
вания амилазы при поверхностном методе выращивания необходи-
мо повысить концентрацию азота в среде Чапека в 3—6 раз, а
концентрацию углеводов — в 2—3 раза.
При поверхностном методе культивирования на фоне высокой
концентрации азота повышение образования амилазы достигалось
только по мере увеличения концентрации крахмала, и максималь-
ное образование ее зафиксировано при определенном соотношении
углеводов и азота. Поэтому пригодность пшеничных отрубей в ка-
честве среды для выращивания плесневых грибов — продуцентов
ферментов, помимо их физической структуры, объясняется благо-
приятным соотношением в них крахмала и азота. Ниже приво-
дятся данные, иллюстрирующие активность культур плесневых
грибов, выращенных поверхностным способом на различных пи-
тальных средах (табл. 3).
Таблица 3
Активность ферментов при поверхностном методе выращивании аспергиллов на
естественных средах (по Фениксовой)
Среда Вид гриба Активность ферментов, ед на 1 г сухой среды
АС ДС маль- таза проте- аза
Пшениченые отруби Asp. oryzae 37,1 0,24 22,0 5,0
То же Asp. niger 1,4 0,24 74,0 0,0
Барда (дробина) Asp. oryzae 5,1 0,12 3,4 1,0
То же Asp niger 0,20 0,13 11,3 0,0
Рожь (крупка) Asp oryzae 6,6 0,21 16,6 0,60
То же Asp niger 0,50 0,24 76,0 0,17
Как видно, лучшей средой для накопления грибами ферментов
являются пшеничные отруби.
К этому же выводу приходит и Е. Я. Калашников, считающий,
что оптимальной для производственных условий является исходная
влажность отрубей в пределах 56—58%, которую необходимо под-
держивать до конца цикла выращивания.
Эффективным мероприятием, направленным на создание опти-
мальных условий для развития гриба и подавления вредной микро-
флоры, является подкисление пшеничных отрубей соляной кислотой
(0,8 л концентрированной НС1 на 100 кг стерилизуемых отрубей).
Этот прием, не влияя на образование амилолитических ферментов,
68
снижает протеолитическую активность гриба, что позволяет регу-
лировать соотношение амилолитической и протеолитической актив-
ности гриба и получаемых из него концентрированных фермент-
ных препаратов.
В настоящее время ВНИИФС и УкрНИИПП рекомендуют для
выращивания поверхностным методом на пшеничных отрубях сле-
дующие штаммы плесневых грибов: Asp. oryzae КС и И-476 как
наиболее активные продуценты амилолитических и протеолитичес-
ких ферментов; Asp. terricola 3374 как наиболее активный проду-
цент протеолитических ферментов; Asp. awamoni 22 и 16 как наи-
более активные продуценты глюкоамилазы и пектиназы.
Пшеничные отруби
Пшеничные отруби являются отходами мукомольно-крупяного
производства. Для целей ферментного производства они должны
удовлетворять следующим требованиям.
Цвет — красно-желтый с сероватым оттенком
Запах — незатхлый, неплесневелый, без посторонних запахов
Вкус — без горьковатого или кисловатого привкуса
Влажность, % не более...........................................15
Вредная примесь, % не более....................................0,05
В том числе
горчака и вязеля (отдельно или вместе) не более . . . 0,04
куколя не более.......................................... 0,10
Примесь семян гелиотропа и триходесма инканум не допускается
Металлопримсси
металлические частицы с остримы концами и краями не
допускаются
металлические частицы до 2 мм, мг/кг отрубей, не более . 5
в том числе размером от 0,5 до 2 мм, не более . . .1,5
Зараженность амбарными вредителями не допускается
Желательно также, чтобы отруби были крупнолопастными с
содержанием крахмала не менее 20%,.
Исследована (С. М. Сосина) возможность замены пшеничных
отрубей другими видами сырья — измельченным картофелем и
прессованной картофельной мезгой — отходом крахмального произ-
водства (табл. 4).
69
Для уменьшения влажности используемых питательных сред
(72—75%) и придания рыхлости и пористости добавлялись дре-
весные опилки, размолотые стержни кукурузных початков, солодо-
вые ростки, пшеничные отруби, сухая бардяная дробина.
Таблица 4
Характеристика плесневого гриба Asp. oryzae, выращенного на картофельной среде
с добавками (по Сосиной)
Компоненты питательной среды Содержа- ние, % Активность воздушно-сухой культуры гриба
АС, г/г/ч ОС (по Вильштетте- ру), гд/100 г культуры ДС, мг/г!ч
Картофель Пшеничные отруби Солодовые ростки 80 16 4 27 78 250
Картофель Пшеничные отруби 85 15 35 115 415
Картофель Пшеничные отруби 80 20 35 111 307
Картофель Сухая дробина барды .... 80 20 25 70 490
Прессованная картофельная мезга Пшеничные отруби 84 16 30 80 340
Прессованная картофельная мезга Пшеничные отруби Солодовые ростки 85 10 или 5 10 или 5 30—33 78—80 315—380
Пшеничные отруби Вода 50 50 27 78 200
Установлено, что картофельные питательные среды с некоторы-
ми добавками можно применять для культивирования плесневых
грибов.
Химический состав питательных сред, на которых получены ак-
тивные культуры грибов, приведен в табл. 5.
Как видно из этих данных, при выращивании плесневых грибов,
содержащих амилолитический комплекс ферментов, пшеничные от-
руби можно на 70—75% заменить картофельной мезгой и солодо-
выми ростками.
Картофельная мезга
Картофельная мезга является отходом производства крахмала
из картофеля и имеет следующий химический состав (табл. 6).
70
Таблица 5
Химический состав питательных сред, на которых получены наиболее активные культуры гриба Asp. oryzae
(средние данные)
Питательная среда Культура гриба
Компоненты питательной среды Содержание, % влажность, % pH крахмал-|- сахар азот влажность, % PH крахмал-4- сахар азот
% к сухому веществу % к сухому веществу
Картофель 80
Пшеничные отруби 16 60,8 6,1 35,8 1,86 49,3 6,5 14,7 2,1
Солодовые ростки 4
Картофель 80
Пшеничные отруби 20 56,4 6,8 38,0 1,62 47,4 7,2 6,8 3,2
Картофель 84 63,4 6,2 37,8 . 0,92 54,5 6,5 12,2 2,26
Сухая дробина барды .... 16
Прессованная картофельная мезга . 84 63,5 6,2 35,5 0,85 53,8 6,5 11,0 2,5
Пшеничные отруби 16 *
Прессованная картофельная мезга Пшеничные отруби 80 10 62,7 6,0 30,5 2,0 57,3 6,5 8,9 2,6
Солодовые ростки 10
Пшеничные отруби Вода 50 50 55 6,5 28,6 2,35 46,8 6,7 4,5 3,0
Таблица 6
Химический состав картофельной мезги (в %)
(средние данные по Попову и Елкину)
Мезга Вода Протеин Жир Клет«атка Безазотистые экстрактивные вешества Зола
Сырая 94,3 0,3 0,02 0,6 4,7 0,1
Сушеная . . . . 14 3,9 3,6 6,2 70,8 1,5
Солодовые ростки (ВТУ № 41—1963)
Солодовые ростки — отход производства ячменного солода, ха-
рактеризующийся следующими показателями:
Цвет — желтовато-сероватый
Запах — специфический, без запаха гнили
Зерновые примеси, %, не более.............................. 5
Минеральные примеси, %, не более..........................0,5
Металлические примеси — не допускается
Зола, %, не более.......................................7—7,5
Влажность, %, не более.....................................10
По данным Л. Ф. Моисеенко, неочищенные ферментные препа-
раты, полученные при выращивании плесневых грибов на пита-
тельных средах, основой которых являются отруби или мука, для
обработки виноградного сусла и вина непригодны, так как вместе
с ними в продукт вносятся инородные вещества, сообщающие ви-
ну несвойственные тона. Максимальное накопление пектолитических
ферментов можно получить, если вести ращение на среде, содер-
жащей те же вещества, которые необходимо разрушить фермен-
тами в соке или сусле. Такой средой являются виноградные вы-
жимки, состоящие из кожицы и семян.
Виноградные выжимки можно использовать в свежем и высу-
шенном виде, без каких-либо добавок, так как в них содержится
достаточное количество органических и минеральных веществ- Так,
в свежеотжатых выжимках содержится (средние данные): воды
до 70%, сухих веществ до 30%, в том числе белков 3,35—3,69, жи-
ров 1,47—3.36; углеводов 13,45—17,45; клетчатки 4,7; минеральных
веществ 2,93—3,61; pH 3,5—4,5. Предлагаемая среда в 4—5 раз де-
шевле, чем среды с отрубями.
По мнению немецких исследователей, питательная среда для
выращивания продуцентов пектиназы должна содержать отруби,
проросший солод, свекольную стружку и виноградные выжимки.
По рекомендации работников В.НИИФСа питательная среда для
72
выращивания гриба Asp. awamori с целью получения очищенных
пектолитических ферментов обязательно должна содержать пше-
ничные отруби и состоять из 30% отрубей и 70% свекловичного
жома. Небольшая часть жома (до 10%) может быть заменена раз-
личными выжимками, и в частности яблочными.
Состав сухого свекловичного жома (средние данные, %): во-
да 13,2; протеин 7,7; белок 7,3; жир 0,5; клетчатка 19,0; безазоти-
стые экстрактивные вещества 55,7; зола 3,9.
Состав свежих яблочных выжимок (средние данные, %); про-
теин 0,5; кальций 0,005; фосфор 0,002; пектин 5,0.
И. Я. Веселовым, Л. С. Салмановой и В. И. Букановой показа-
но, что гриб Trichotheciun roseum на средах, состоящих из равных
частей рисовой шелухи (березовых опилок или стержня кукурузных
початков) с солодовыми ростками и 10% дрожжевого автолизата
к весу сырья, образует значительные количества цитолитических
ферментов. Установлено, что рисовая шелуха, березовые опилки
или стержни кукурузных початков являются источником специфи-
ческих веществ полисахаридной природы, стимулирующих образо-
вание цитолитических ферментов, солодовые ростки — источником
ростовых веществ, а дрожжевой автолизат — источником амино-
кислот и витаминов.
Посевной материал для гриба Trichothecium roseum рекомен-
дуется выращивать на среде, состоящей из трех частей охмеленно-
го сусла и одной части водной вытяжки из солодовых ростков.
Среды следует готовить из отходов крупяного производства (рисо-
вой, ячменной, просяной, овсяной шелухи) в сочетании с равным
количеством солодовых ростков и 10% дрожжевого автолизата к
весу сырья- В этих средах оптимальное значение pH и влажность
сред должны быть соответственно 5,0—5,5 и 50—60%. На таких
средах гриб накапливает значительные количества цитазы за 2,5
суток при 20—25° С.
Состав охмеленного сусла (средние данные, %); сырая маль-
тоза (мальтоза с незначительным количеством глюкозы, фруктозы
и декстринов) 60—70; сахароза 2—8; пентозы 3—4; несбраживае-
мые декстрины 15—26; сырой белок 3—6; зола 1,5—2,0.
Ниже приводится состав отходов крупяного производства
(средние данные, %).
Рисовая шелуха: вода 13,3; протеин 3,4; белок 2,2; жир 0,8;
клетчатка 40,0; безазотистые экстрактивные вещества 25,2; зола 17.
Ячменная шелуха: вода 15,3; протеин 10,4, белок 8,4; жир 1,9;
клетчатка 18,5; безазотистые экстрактивные вещёства 47,1; зо-
ла 6,8.
Просяная шелуха: вода 13,6; протеин 5,6; белок 5,1; жир 2,6;
клетчатка 36,8; безазотистые экстрактивные вещества 31,7; зола 9,7.
Овсяная шелуха: вода 14; белок 2,4; фосфор 0,13.
Дрожжевой автолизат. Точного состава этого продукта
нет. Известно, что он характеризуется относительно высокой актив-
ностью протеолитических ферментов, которые расщепляют протеи-
73
ны плазмы до пептонов и аминокислот. В состав автолизата входят
также гуанин, аденин, лейцин, тирозин и триптофан.
СЫРЬЕ ДЛЯ ПРОИЗВОДСТВА ФЕРМЕНТНЫХ ПРЕПАРАТОВ
ИЗ ПЛЕСНЕВЫХ ГРИБОВ, ВЫРАЩИВАЕМЫХ ГЛУБИННЫМ СПОСОБОМ
Сырье для производства амилолитических ферментов
В качестве питательной среды для глубинного культивирования
продуцентов амилолитических ферментов, используемых в произ-
водстве спирта, ВНИИФС рекомендует барду — отход спиртового
производства.
Барда содержит органические вещества (органические кислоты,
несбраживаемые дрожжами углеводы, глицерин, гемицеллюлозы
и азотистые органические соединения), которые служат источника-
ми углерода и азота для гриба.
Зерновая барда содержит 5—7% органических веществ. Этого
вполне достаточно для роста мицелия с одновременным продуци-
рованием грибом амилолитического комплекса ферментов.
Таблица 7
Химический состав зерно-картофельной барды (средние данные, по Савиной)
Химический состав Вид барды
картофель- ная кукурузная ржаная овсяная ячменная
Вода, % 95,64 93,15 92,65 91,86 93,10
Сухие вещества, % 4,36 6,85 7,35 8,14 6,90
В том числе
растворимые сухие вещества 2,10 2,49 2,89 1,97 2,7
углеводы
РВ (считая на мальтозу) . 0,31 0,53 0,42 0,26 0,44
РВ после гидролиза НС1 (считая
на глюкозу) 0,22 0,55 0,74 0,61 0,40
крахмал • 0,37 0,47 0,28 — —
пентозаны (в фильтрате) 0,45 0,41 0,46 0,23 0,41
Гемицеллюлозы 2,28 0,78 1,73 1,35 1,68
Клетчатка 0,31 0,32 1,48 0,85 0,65
Азот 0,171 0,400 0,267 0,190 0,20
В том числе в фильтрате 0,056 0,040 0,089 0,129 0,067
Зола 0,51 0,40 0,45 0,57 0,57
В том числе в фильтрате 0,42 0,29 0,20 0,30 0,32
Жир — 0,67 — 0,94 0,46
74
Установлено (В. В. Вяткин), что глубинная культура может
быть также выращена на заторе или сусле, но затраты сбражива-
емых углеводов на рост гриба повышают стоимость культуры, хо-
тя заметного увеличения активности по сравнению с выращиванием
на барде не наблюдается.
При выращивании гриба Asp. niger на барде требуется вносить
либо мел, либо известь во избежание подкисления среды, небла-
гоприятно действующего на накопление фермента-
В настоящее время для выращивания глубинным методом на
барде ВНИИФС рекомендует плесневые грибы Asp. usamib
Asp. niger species, Asp. batatae.
Для образования амилолитических ферментов плесневыми гри-
бами в условиях глубинного выращивания предложены также раз-
личные питательные среды, представляющие собой видоизмененные
среды Чапека. В частности (Л. С. Смирнова}, гриб Asp. oryzae
предлагается выращивать на среде Чапека с 6% крахмала и серно-
кислым аммонием (0,85% азота). Для повышения активности
ферментов предложена (Р. В. Фениксова и Е. А. Двадцатова) сре-
да, содержащая 6% крахмала, азотнокислый натрий, солевой сос-
тав среды Чапека и водную вытяжку из солодовых ростков. В
дальнейшем ими же установлена возможность замены растворимо-
го крахмала кукурузной или ржаной мукой. Было показано, что
азот в любой форме (окисленной или востановленной), за исклю-
чением фосфорнокислого аммония, обеспечивает повышенное обра-
зование амилазы; максимальная активность амилолитического
фермента достигается при 6% муки.
Состав кормовой кукурузной муки (в %): вода 14,3; протецн
10,7; белок 9,3; жир 3,5; клетчатка 2,9; зола 1,6; безазотистые
экстрактивные вещества 67,6.
Азотнокислый натрий и сернокислый магний, используемые в
качестве компонентов питательной среды, должны соответствовать
требованиям ГОСТа-
Известно, что плесневые грибы способны использовать различ-
ные источники азота (как органического, так и неорганического).
Наилучшими источниками азота для образования амилазы являют-
ся гидролизаты белков (Шу и Блеквуд). Однако, по некоторым
данным, для образования амилазы вполне достаточно присутствия
в среде нитратного или аммонийного азота. При использовании
азота в результате освобождения анионов изменяется реакция сре-
ды, поэтому для сохранения ферментативной активности необходи-
мо проводить тщательную нейтрализацию анионов.
Р. В. Фениксова и Е. А. Двадцатова показали, что среда с
азотнокислым натрием и водным экстрактом из солодовых рост-
ков может быть благоприятным субстратом для максимального
продуцирования амилазы грибами Asp. oryzae 153 и 3-9-15. По дан-
ным Е. А. Двадцатовой, оптимальной питательной средой для об-
разования грибом активной амилазы является среда с азотнокис-
лым натрием или азотнокислым калием. Для Asp. oryzae штамм
75
3-9-15, принятого в настоящее время ВНИИФСом в качестве про-
дуцента а-амилазы при глубинном культивировании на минераль-
ной среде, оптимальная концентрация источника углерода в среде
равна 6%.
Сырье для производства протеолитических ферментов
Проверка синтетических сред, рекомендованных различными ис-
следователями, с целью изыскания наиболее рациональной пита-
тельной среды для глубинного культивирования плесневых грибов—
продуцентов протеолитических ферментов показала, что наивысшая
протеолитическая активность отмечается на видоизмененной среде
Чапека с 0,15% азота и 6% крахмала (Н. В. Попова).
Наибольшая активность протеазы достигается на среде Дворжа-
ка, состоящей из водной суспензии 2% кукурузной муки, 1% сое-
вой муки и 0,5% СаСО3.
В настоящее время для получения протеолитических фермен-
тов глубинным способом ВНИИФСом принят к использованию
Asp. terricola штамм 3374 на питательной среде такого состава:
водный раствор 3% кукурузной муки, 0,3% кукурузного экстракта,
3% гидрола, 1 %, углекислого кальция. В одной из последних работ
Н. В. Поповой предлагается аналогичная среда с заменой куку-
рузного экстракта рыбной мукой в количестве 0,5% (0,02—0,03 по
общему азоту).
Гидрол имеет pH 4,0—4,2 и содержит в среднем 65—66% сухих
веществ, в том числе редуцирующих сухих веществ 68—72%.; золы
5—6%, из них 2—3% NaCl. Около 70% редуцирующих веществ гид-
рола сбраживается на спирт.
Состав кукурузного экстракта (по ВТУ № 39/53-П)
Содержание сухих веществ, %, не менее....................... 48
Кислотность, % к сухому веществу, не более . . . 14,0
Азотистые вещества, % к сухому веществу, не более . . 50,0
Золы, % к сухому веществу, не более........................24,0
Сернистый газ, %, не более...............................0,5
Соли тяжелых металлов....................................Следы
Состав рыбной муки (средние данные, %): вода 9,4; протеин
59,4; белок 53,6%; жир 1,9; безазотистые экстрактивные вещества
0,4; зола 28,9.
Сырье для производства пектолитических ферментов
При подборе питательной среды для получения пектолитических
ферментных препаратов глубинным способом во ВНИИФСе
(Л. А. Херсонова) была проверена видоизмененная среда Чапека
следующего состава (в %): сахароза 2; пектин 2; NaNOs 0,2; КС!
0.05; КН2РО4 0,1; MgSO4 0,05; FeSO4 0,001. Исследования показали,
что для образования пектолитических ферментов ,на данной среде
76
требуется 0,15% азота, т. е. столько же, сколько необходимо для
синтеза других гидролитических ферментов при глубинном способе
культивирования, причем наиболее пригоден аммонийный азот в ви-
де солей фосфорной кислоты, и в частности двузамещенный фос-
форнокислый аммоний. Присутствие этой соли в среде обеспечивает
получение культуральной жидкости активностью более 800 ед.
ПкС/100 мл, что в 2—2,5 раза превышает пектолитическую актив-
ность культуральных жидкостей, полученных на средах с NaNOs,
(NH4)2SO4 и NH4NO3. Присутствие в среде сахарозы, глюкозы,
крахмала и декстрина в количестве 2% не оказывало заметного
влияния на изменение пектолитической активности.
Наличие в среде углерода и пектина в соотношении 1:1; 1 : 0,75
и 1 :0,5 способствует созданию благоприятных условий для накоп-
ления пектолитических ферментов. Использование свекловичного
жома и кукурузной муки позволяет получать культуральную жид-
кость с активностью, в 3 раза превышающей активность культураль-
ной жидкости, полученной на видоизмененной среде Чапека с 2%.
сахарозы и 2% пектина.
На основе проведенных исследований для глубинного культиви-
рования Asp. awamori штамма 16 (наиболее активного) предложен
следующий состав питательной среды (в %): свекловичный жом 4,
кукурузная мука 0,5, (NH4)2HPO4 0,7; КН2РО4 0,1; MgSCU 0,05;
КС1 0,05-
Соли, используемые как компоненты этой питательной среды,
должны соответствовать требованиям ГОСТа.
Сырье для производства глюкоамилазы
Во ВНИИФСе (А. А. Шилова) проведена работа по подбору пи-
тательной среды с целью получения препаратов, обладающих
глюкоамилазной активностью, при глубинном выращивании плес-
невых грибов. На основании исследования для глубинного культи-
вирования Asp. awamori 22 (наиболее активного по глюкоамилазной
способности из имеющихся штаммов) рекомендуется следующий
состав среды: водный раствор, содержащий 3%, кукурузной муки;
0,01% азотнокислого натрия (по азоту 0,15%), 0,05 сернокислого
магния, 0,05% хлористого калия, 0,1% однозамещенного фосфор-
нокислого натрия и 0,001% сернокислого железа.
Используемые минеральные соли должны соответствовать тре-
бованиям ГОСТа.
Сырье для производства глюкозооксидазы
Для культивирования гриба Penicillium vitale.— продуцента
глюкозооксидазы — в Институте микробиологии АН УССР предло-
жена питательная среда, состоящая из водного раствора сахарозы
и KNO3 при оптимальном отношений углерода к азоту 1 : 10 или
1,5 : 10.
Для выращивания в пленке гриба Asp. niger Н. В. Покровская
77
предлагает следующий состав среды: NaNO3 1%; КН2РО4, К2НРО4,
MgSO4-7H2O и КС! по 0,05%,; глюкоза или сахароза 10%.
В настоящее время для производственных испытаний с целью
получения глюкозооксидазы принят плесневой гриб Pen. vitale, вы-
ращиваемый на питательных средах, предложенных Украинским
научно-исследовательским институтом спиртовой промышленности
(УкрНИИСПом) и институтами микробиологии и биохимии АН
УССР.
Основные конпоненты питательной среды: сахароза, кристалли-
ческая глюкоза и азотнокислый калий, — должны соответствовать
требованиям ГОСТа.
СЫРЬЕ ДЛЯ ПРОИЗВОДСТВА БАКТЕРИАЛЬНЫХ ФЕРМЕНТНЫХ
ПРЕПАРАТОВ
Еще в 1917 г. Буаден и Эфрон предложили выращивать бакте-
рии группы Вас. mesentericus и Вас. subtilis на пшеничных отру-
бях для получения амилолитических ферментов. А. А. Имшенецкий
с сотрудниками предложили для получения термостабильной ами-
лазы выращивать Вас. diastaticus глубинным методом на среде,
состоящей из 5% картофельного отвара и 0,1%. мела.
Фениксова и Кинзбурская рекомендовали культивирование бак-
терий Clostridium pasterianum — продуцентов амилазы, вести на
среде, состоящей из 10% картофеля, нарезанного в виде стружки,
с 0,5% мела; они же установили, что картофельная барда, грубо
фильтрованная после нейтрализации мелом до pH 6,0—6,5, может
служить хорошей средой для образования амилазы, не уступаю-
щей по активности ферменту, полученному на картофеле.
Пшеничные отруби в качестве среды для выращивания Вас.
subtilis поверхностным способом с целью получения амилазы пред-
ложены Е. Е. Рахлеевой, Г. И. Козловским и А. С. Тихомировой.
Последней установлено, что оптимальный средой для выращивания
глубинной культуры Вас subtilis — продуцента, амилазы является
соевая среда, предложенная Номура, с pH 7,2.
Состав среды Номура: крахмал 8%., лимоннокислый натрий
0,04%, (NH4)2HPO4 0,15 Я КС1 0,02 Я MgSO4-7H2O 0,002 Я
СаС12 0,001 Я этиловый спирт 1%, экстракт из соевых бобов 5%.
Компоненты питательной среды для производства бактериальных
ферментных препаратов
Картофель. В клубнях картофеля содержится примерно 25%
сухих веществ и 75% воды. В зависимости от сорта картофеля,
условий его произрастания и других причин химический состав его
довольно сильно изменяется.
В среднем сухие вещества картофеля распределяются так (в %):
белок 1,99; жир 0,15; клетчатка 0,98; зола 1,09; безазотистые экст-
рактивные вещества 20,8.
78
Крахмал картофеля состоит из амилазы (12—23%) и амилопек-
тина (88—77%).
Мел, добавляемый в питательные среды, должен соответство-
вать требованиям ГОСТа 4530—48.
Осадочные пивные дрожжи представляют собой высококачест-
венный пищевой продукт, состоящий из легко усвояемых белков,
углеводов, жиров, богатый витаминами.
Дрожжи содержат следующие витамины (в мг/г сухого вещест-
ва): Bi 40—360; Вб 30—75; В2 15—50; РР 305—930, а также вита-
мин Е и провитамин D.
Вода
На ферментных заводах вода используется для технологичес-
ких целей, питания паровых котлов и охлаждения полупродуктов
производства. Воду, идущую на технологические нужды, следует
рассматривать как сырье, и поэтому необходимо знать требования,
предъявляемые к ней со стороны технологических процессов.
В технологических процессах вода применяется при увлажне-
нии питательных твердых сред и приготовлении водных растворов
для жидких питательных сред; при экстракции ферментов из по-
верхностной культуры гриба; при регенерации силикагеля и ионо-
обменных смол и для мойки аппаратуры. Вода входит в состав
полупродуктов, и ее химический состав оказывает влияние на тех-
нологию получения ферментных препаратов.
По химическому составу вода из разных источников очень раз-
нообразна. На технологические процессы могут влиять только соли,
содержащиеся в воде в относительно больших количествах; к ним
относятся бикарбонаты и сульфаты кальция и магния. Содержа-
ние этих солей характеризует жесткость воды.
В целом к технологической воде предъявляются те же требо-
вания, что и к питьевой, а именно: она должна быть не выше сред-
ней жесткости и микробиологически чиста. С этой точки зрения
лучшей следует считать артезианскую воду с небольшой жест-
костью, а.также воду больших рек, озер и проточных прудов.
Для большинства процессов ферментного производства, в кото-
рых вода является одной из составных частей сырья, требуется
слабокислая или нейтральная реакция среды. Воду, употребляемую
для увлажнения пшеничных отрубей, следует подкислять соляной
или серной кислотой. Жесткая вода имеет щелочную реакцию,
что, естественно, нежелательно. Наличие в воде солей кальция же-
лательно, так как ионы Са предотвращают инактивацию а-амила-
зы при повышенной температуре.
В большинстве случаев для производства ферментов требует-
ся микробиологически чистая вода. Практически микробиологичес-
ки чистой можно считать воду из артезианских колодцев. Вода из
озера, пруда и реки требует дезинфекции, которую удобно прово-
дить хлорированием (50 мг хлора на 1 л воды).
79
Согласно нормам, вода должна быть прозрачной, бесцветной,
не иметь неприятного запаха и вкуса, вредных для здоровья ве-
ществ и особенно патогенных микробов. Количество сапрофитных
микробов не должно превышать 1000 колоний в 1 мл. Если в
300 мл воды будет обнаружено присутствие одной кишечной па-
лочки (Bacillus coli communis), такая вода считается непригод-
ной для употребления.
Состав нормальной воды должен быть примерно следующим:
Окислители (ma 1 л), мг...........................Не более 5
Общая жесткость, мг-экв/л........................... до 8
Хлориды, мг.......................................Не более 50
Сульфаты, мг........................................ До 60
Аммиак, °........................................... До 20
Железо....................................... Следы
Азотная кислота, мг.............................. До 40
Реакция ..................................... Нейтральная
ОБОРУДОВАНИЕ ДЛЯ ТРАНСПОРТИРОВАНИЯ СЫРЬЯ
Подъемно-транспортные механизмы
Транспортирование сырья в производстве ферментных препара-
тов — трудоемкая, специфичная и очень важная операция.
Основным сырьем для приготовления питательных сред служат
сыпучие материалы. Для перемещения в пределах завода или цеха
применяются различные подъемно-транспортные устройства: лен-
точные и пластинчатые транспортеры» нории, винтовые транспорте-
ры и горизонтальные вибротранспортеры.
Опыт первых ферментных заводов показал, что типы применяе-
мого транспортного устройства не во всех случаях соответствуют
требованиям производства, главные из которых заключаются в соб-
людении строгой чистоты и полной герметизации операций, обес-
печивающей устранение пылеобразования.
Применяемые в настоящее время механические транспортно-
подъемные устройства (нории и винтовые транспортеры, открытые
вибролотковые транспортеры) не обеспечивают должной чистоты.
Содержание пыли в 1 м3 воздуха помещений Вышневолоцкого и
Московского заводов ферментных препаратов, в которых установ-
лены нории и шнеки, составляет 18—20 мг, что в 9—10 раз превы-
шает предельно допустимые нормы. Поэтому на заводах и цехах
вынуждены применять аспирирующие устройства, устанавливать
принудительную приточную вытяжную вентиляцию, периодически
проводить дезинфекцию всех помещений, аппаратуры и машин, что
связано с их длительной остановкой.
Тип транспортного устройства рекомендуется выбирать с уче-
том свойств перемещаемого материала: его способности к пылеоб-
разованию, возбуждению зарядов статического электричества, за-
грязнению воздуха конидиями, огне- и взрывоопасности, влажности,
80
насыпной массы *, налипаемости, гранулометрического состава, уг-
ла естественного откоса, коэффициента трения, абразивности и кор-
родирующих свойств (табл. 8 и 9).
Таблица 8
Характеристика некоторых сыпучих материалов
Транспортируемый материал Насыпная масса, кг!м* Влажность, % Угол естественного откоса, 0 Сила отрыва, г/сл2
Пшеничные отруби 292 10—12 25 27,6
Свекловичный жом 165 7—8 36 37,6
Картофельная мезга 515 11—12 35 45
Гречневая лузга 135 9—10 22 32,6
Овсяная лузга 148 10—11 24 27,6
Подсолнечная лузга .... 122 8-9 34 37,6
Солодовые ростки 217 7—8 32 47
Питательная среда из пшеничных от- рубей влажностью 60% . 306 58—60 38 37,6
Мука кукурузная 455 8—9 31 42
Крахмал 800 15,4
Виноградные выжимки .... 236 27 27 53
Кальций углекислый .... 989 0,45 36 183
Среда из 50% отрубей и 50% свек- ловичного жома 290 60 65 372
Угол естественного откоса и сила отрыва определены лабора-
торией очистки и выделения ферментных препаратов ВНИИФСа
на приборе, разработанном М. С. Шульманом.
По общепринятой терминологии к насыпным грузам относят
различные материалы — от пылевидных до крупнокусковых, вели-
чина частиц которых колеблется от 0,5 мм (не менее) до 160 мм.
В производстве ферментных препаратов величина частиц исполь-
зуемых насыпных материалов колеблется от 0,25 (и менее) до 15 мм.
По насыпной массе различают сыпучие материалы легкие, средние,
тяжелые и весьма тяжелые с массой единицы объема от 0,6 до
2 т/м3. Величина насыпной массы сыпучих материалов, исполь-
зуемых в ферментном производстве, колеблется от 0,12 до 1,2т/м3.
Различают насыпную массу свободно насыпанного Р и уплотнен-
ного материала Ру. Отношение Р\РУ называют коэффициентом
уплотнения; величина его колеблется в пределах 1,05—1,52.
* Масса единицы объема сыпучего материала.
6—826
81
Гранулометрический состав транспортируемых сыпучих материалов, %
(по данным ситового анализа)
Таблица 9
Транспортируемый материал Процентное содержание гранул размером, мм Проход через сито с отверстиями 0,5 мм
10 7 5 3 2 1 0,5
Суховоздушные пшеничные отруби — — — 4,8 45 12,6 25,4 12,2
Сухой свекловичный жом — 3,1 49,7 23,6 10,2 1,4 1,3 0,7
Сухая картофельная мезга, измельченная на шаровой мельнице — — — — — — 88 12
Гречневая лузга •— 28 69 1,9 1,1 — — —
Овсяная лузга — — 52 19,2 16,3 1,2 7 4,3
Подсолнечная лузга 11 45,3 19 7 7,2 3,9 4,5 2,1
Солодовые ростки — — — 31,6 42 6 12,6 7,8
Мука кукурузная — — — — — — 86 14
Крахмал — — — — — — — 100
Одно замещенный фосфат аммония — — — — — 9 60 31
Азотнокислый натрий — — 1 — 12 46 42
Ниже рассматриваются основные устройства непрерывного
транспорта, которые применяются или могут быть применены для
перемещения сыпучих материалов в производстве ферментных пре-
паратов. Для вертикального перемещения — нории, вибрационные
транспортеры, пневматические подъемники; для горизонтального
перемещения — ленточные пластинчатые, винтовые, вибрационно-
лотковые и трубные транспортеры; для смешанного перемещения —
пневматический транспорт.
Ленточные транспортеры
Мешки с отрубями, свекловичным жомом, лузгой, мукой и дру-
гие штучные грузы в горизонтальном и наклонном (до 22°) направ-
лениях транспортируются на ленточных транспортерах. Вес одно-
го мешка колеблется от 20 до 60 кг. Длина транспортирования
до 100 м и более, скорость движения штучных грузов от 0,5 до
2,0 м{сек и сыпучих материалов от 1,5 до 3,5 м!сек. Для мешков
с мукой и отрубями скорость транспортирования принимается
1,5—2 м!сек.
Наиболее распространенные ленточные транспортеры имеют
ленты шириной 400, 500, 650, 800, 1000, 1200, 1400 и 1600 мм (в
последнее время появились ленты шириной до 3000 мм). Для сы-
пучих материалов, затаренных в мешки, применяются транспорт-
ные ленты шириной 500—650 мм. Простота конструкции ленточных
транспортеров, высокая производительность, удобство эксплуата-
ции, надежность и безопасность работы позволяют широко приме-
нять их в ферментном производстве-
Винтовые транспортеры
Винтовые транспортеры применяются для перемещения сухо-
воздушных отрубей к стерилизаторам; влажной и сухой измель-
ченной культуры плесневых грибов к диффузорам, сушилкам, авто-
весам; выщелоченной диффузионной массы к приемникам и т. д.
Профиль трассы может быть горизонтальным, слегка наклонным
(до 20° к горизонту) и смешанным.
Различают три типа винтовых транспортеров: собственно вин-
товые, или шнеки, спиральные и лопастные. Для перемещения сы-
пучих материалов применяются транспортеры со сплошными
винтовыми поверхностями. При вращении винта материал под
действием сил тяжести и трения о стенки желоба удерживается от
вращения вместе с винтом и перемещается вдоль желоба.
Практика показала, что при неравномерной подаче материала
в шнеке у подвесных подшипников образуются заторы. При дли-
не более 10 м шнек в процессе перемещения культуры гриба
сильно перетирает ее, что ухудшает процесс диффузии и приводит
к деформации сеток у диффузоров. Поэтому шнек длиной более
10 м для этой цели применять не рекомендуется.
83
Винтовые транспортеры изготавливаются с винтами диаметром
100, 120, 150, 200, 250, 300, 400, 500 и 600 мм при номинальном числе
оборотов винта в минуту 9,5; 11,8; 15; 23,6; 30; 37,5; 47,5; 60; 75;
95; 118 и 150. Шаг винта принимается для сыпучих материалов
равным 0,8—1 его диаметра. Валы винтов бывают сплошные или
трубчатые и собираются из секций длиной 2—4 м> соединяемых
муфтами или соединительными цапфами. Промежуточные подвес-
ные подшипники ставят на расстояние 1,5—3,5 м в зависимости
от диаметра винта. Подвеска подшипников должна быть рассчи-
тана так, чтобы не загромождать живое сечение для прохода пере-
мещаемого материала.
К достоинствам винтовых транспортеров относится их компакт-
ность, простота устройства и обслуживания, к существенным
недостаткам при использовании в ферментном производстве —
истирание перемещаемого материала, недостаточная герметичность
желоба и пылевыделение в процессе транспортирования.
Нории
Нории предназначены для перемещения сыпучих материалов
по вертикали до 40 м и под углом 45—70° к горизонту. На фер-
ментных заводах их применяют для транспортирования сырья на
верхние этажи, где обычно расположены стерилизаторы и смеси-
тели для подготовки питательных сред.
Нория состоит из замкнутого тягового элемента, на котором
закреплены ковши. Для легкосыпучих материалов применяются
глубокие ковши шириной 135—450 мм- Бесконечная лента огибает
верхний приводной и нижний натяжной барабаны. Натяжение лен-
ты производится обычно винтовым натяжным устройством.
Все элементы нории заключены в кожух, который имеет верх-
нюю приводную головку, нижнюю натяжную головку (башмак) и
среднюю часть, состоящую из двух труб. Высота каждой секции
трубы 2—2,5 м. В нижней части кожуха расположена загрузочная
воронка (носок), а в верхней части его — разгрузочный патрубок.
Нория приводится в движение от электродвигателя через редуктор.
Сыпучее сырье, например, отруби, зачерпывается ковшами из
башмака. При переходе через верхний барабан ковши опрокиды-
ваются и содержимое их под действием двух сил — центробежной и
силы тяжести — высыпается в приемный желоб.
Нории могут иметь расставленные или сомкнутые ковши. В
производстве ферментов применяются нории с расставленными ков-
шами емкостью от 0,9 до 1,5 л по 2—3 ковша на погонный метр;
они транспортируют материал со скоростью 0,8—2 м/сек. Для
предотвращения обратного движения ковшей с грузом нории снаб-
жены автоматическим стопорным устройством. Наиболее распрост-
ранены нории с лентами шириной 150, 200, 250, 800 и 400 мм (ши-
рина ленты обычно принимается на 40 мм больше ширины ковша).
Достоинства норий — высокая производительность, простота
84
устройства, несложность эксплуатации и малые габариты (в плане).
Существенный недостаток — отсутствие надежной герметизации и
пылевыделение при транспортировании отрубей и других сыпучих
материалов. Кроме того, шнеки и нории, применяемые в настоящее
время в ферментном производстве, характеризуются низким к. п.д.
вследствие больших потерь энергии на трение в движущихся рабо-
чих органах и приводных механизмах, значительным износом рабо-
чих органов из-за трения о перемещаемый материал и большим
собственным весом на тонну перемещаемого материала. Потери
транспортируемого материала от просыпания и распыления и не-
удовлетворительные санитарно-гигиенические условия при транс-
портировании пылящих материалов, содержащих разнообразную
микрофлору, диктуют необходимость замены их современными
герметичными подъемно-транспортными устройствами.
В настоящее время во ВНИИФСе испытаны более совершенные
типы транспортных устройств — вибрационные транспортеры и
пневмотранспортные устройства.
Вибрационные транспортирующие машины
Вибрационные машины — прогрессивный вид подъемно-транс-
портных устройств. Возможность герметизации транспортируемого
материала, устранение пылеобразования, незначительное соприкос-
новение материала с движущимися частями, простота устройства,
малый износ грузонесущего органа и невысокая энергоемкость этих
конвейеров позволяют считать такой вид транспорта одним из наибо-
лее перспективных. Применение их позволяет достаточно просто
регулировать скорость транспортирования и автоматизировать
управление технологическими операциями в этом процессе.
Вибрационные конвейеры могут перемещать сыпучие материалы
в горизонтальном, наклонном (до 20°) и вертикальном направле-
ниях.
Они различаются по типу привода (вибратора), форме грузоне-
сущего органа, типу упругой системы, способу подвески и т. д.
Основные виды привода: электромагнитные, эксцентриковые и инер-
ционные, в соответствии с чем различают электровибрационные,
эксцентриковые и инерционные виброконвейеры. В электровибра-
ционных конвейерах колебания грузонесущего органа создает элек-
тромагнитный вибратор. Устройство и технические характеристики
отечественных и зарубежных электромагнитных вибраторов описа-
ны И. Ф. Гончаревичем и Л. П. Стрельниковым.
Электровибрационные конвейеры бывают прямолинейные и вин-
товые; открытого и закрытого типа; с верхним и нижним располо-
жением привода; одно- и многоприводными.
В эксцентриковых конвейерах вибрация грузонесущему органу
сообщается при помощи кривошипа или эксцентрика. В инерцион-
ных виброконвейерах вибрация грузонесущему органу передается
вибратором, состоящим из неуравновешенных масс; к ним относятся:
85
дебалансовые, самобалансовые, отдельные спаренные, самосинхро-
низирующиеся мотовибраторы и др.
Для перемещения сыпучих материалов в горизонтальном на-
правлении рекомендуется применять однотрубный вибрационный
транспортер. Однотрубный вибротранспортер ВНИИСтройдормаша
(рис. 4) представляет собой двухмассовую колебательную систему,
которая состоит из опорной рамы для грузонесущей трубы, упругой
системы и кривошипно-шатуннного привода. Сыпучие материалы
транспортируются внутри трубы с помощью вибрации, сообщаемой
трубе приводом. Угол направления колебаний составляет 30° к гори-
зонту. Вибротранспортер выполнен пятисекционным, что позволяет
получать длины транспортирования в 6, 12, 15, и 24 м.
Рис. 4. Вибротранспортер горизонтальный однотрубный:
/ — секции, 2 — кривошипный привод, 3 — опорные резиновые эле-
менты, 4 — спиральные пружины, 5 — пластинчатые рессоры, 6 —
опорная рама, 7 — верхняя рама, 8 — желоб.
Согласно проекту ГОСТа, четыре секции его унифицированы, за
исключением ведущей, 'пятой, секции, на которой установлен криво-
шипный привод. Каждая секция состоит из опорной и верхней рамы,
на которой крепится грузонесущая труба, связанных между собой
спиральными и пластинчатыми пружинками. Рамы состоят из двух
швеллеров и поперечных связей. Верхняя и нижняя опорная рамы
по бокам имеют проушины для соединения с желобом листовыми
рессорами; наклон рессор 60° к горизонту.
Для обеспечения жесткости упругих элементов желоб соеди-
няется с рамой дополнительно спиральными пружинами, имеющими
наклон к горизонту 30°. Утяжеление опорной рамы (реактивной
массы) предусмотрено заливкой внутренней полости ее бетоном.
Каждая секция имеет четыре опорных резиновых элемента, опираю-
щихся на несущие конструкции помещения.
Кривошипный привод состоит из кривошипного вала, двух ша-
тунов, двигателя и клиноременной передачи. Кривошипный вал вра-
щается на роликовых подшипниках, корпуса которых закреплены
86
на раме. Оба шатуна связаны с желобом жесткими упругими эле-
ментами, а с кривошипными валами — через роликовые подшипни-
ки. Для приведения кривошипного вала во вращение применена
клиноременная передача от электродвигателя, закрепленного на
раме.
По данным ВНИИСтройдормаша, горизонтальные однотруб-
ные вибротранспортеры рекомендуется применять для транспор-
тирования сыпучих материалов, в том числе пылящих, абразивных
и горячих (до 500° С), влажностью до 7%. Во ВНИИФСе экспе-
риментально установлено, что сырье ферментного производства
влажностью до 12% при определенных вибропараметрах также
транспортируется на вибротранспортере.
Проект ГОСТа предусматривает выпуск четырех типоразмеров
однотрубных вибротранспортеров со следующей технической ха-
рактеристикой.
I Типоразмеры IV
II III
Диаметр трубы, мм . . . . 160 220 320 426
Производительность, м3/ч ... 6 14 32 70
Частота колебаний, гц . . . . 11,7 11,7 11,7 11,7
Длина транспортера (максимальная), м 18 24 32 48
Тип привода Мощность привода, кет . . . 1,7 Кривошипно-шатунный 2,8 4,5 7,0
Конструкция машин обеспечивает герметизацию трянспортного
устройства, высокую надежность и удобство эксплуатации, а так-
же незначительный износ рабочего органа. Допускается загрузка
и разгрузка' материала в любой точке транспортера, охлаждение,
сушка и подогрев материала в процессе транспортирования путем
подачи в трубу холодного или горячего воздуха, уменьшение дли-
ны транспортера, наклон вверх или вниз (до 10°).
Энерго- и металлоемкость горизонтальных транспортных устройств
Вид транспортного устройства Удельная энергоемкость Удельная металлоемкость
Горизонтальные вибрационные кон-
вейеры 0,001—0,005 3—4
Винтовые транспортеры 0,014—0,016 4
Скребковые пранспортеры 0,003—0,010 3—6
Ленточный конвейеры 0,009—0,018 0,4—0,6
Из приведенных данных видно, что при транспортировании по
горизонтали вибрационные конвейеры характеризуются в основном
меньшей энергоемкостью и пониженной металлоемкостью.
Для перемещения сыпучих материалов вверх применяют верти-
кальные виброконвейеры. Грузонесущий орган их имеет форму
87
Рис. 5. Вертикальный вибротранспор-
тер:
1 — вибратор; 2 ~ опорная
3 —- спиральные пружины;
щий рабочий орган, 5
винта с углом подъема до 10°. Наружный диаметр винтовой линии
предельно равен 3000 мм.
Вертикальный вибротранспортер ВНИИПТмаша (Всесоюзного
научно-исследовательского института подъемно-транспортного
машиностроения) состоит из винтового желоба, вибратора, нижней
и верхней опор и упругой подвески (рис.5).
Рабочий транспортирующий ор-
ган представляет собой сварную
конструкцию, образованную из цент-
ральной стальной трубы, на которой
закреплен винтовой желоб. В ниж-
ней части желоба расположен при-
емный, а в верхней — выдающий ло-
ток. Нижние и верхние опоры пред-
назначены для крепления транспор-
тера к полу и потолку или несущей
конструкции, на которую устанавли-
вается транспортер. Для обеспече-
ния колебаний желоба, а также для
изоляции фундамента или несущей
конструкции от вредного влияния
вибрации, опоры имеют упругие эле-
менты в виде цилиндрических пру-
жин. Общая жесткость пружин вы-
бирается с таким расчетом, чтобы
собственная частота колебаний виб-
ротранспортера на пружинах была
значительно меньше вынуждающей
частоты вибратора.
Вибратор имеет стальной литой
корпус, в котором размещены два
встроенных электродвигателя. Для
обеспечения синфазного вращения
конструкция; ИХ ВЗЛЫ СВЯЗЫВЗЮТСЯ ЦИЛИНДрИЧе-
-7ожух°несу ской косозУбой передачей. По обоим
концам каждого вала электродвига-
теля имеются дебалансы, которые можно устанавливать под раз-
ными углами один к другому.
Для получения транспортного эффекта возмущающие силы, при-
ложенные к противоположным концам вала, должны действовать
в двух плоскостях, пересекающихся по оси вала и направленных
под углом одна относительно другой. От величины этого угла за-
висит направление усилий, приложенных к частицам транспорти-
руемого материала. В результате воздействия возмущающих сил,
возникающих на валах вибратора, рабочий орган совершает коле-
бания, направленные по винтовой линии, ось которой совпадает с
вертикальной осью вибратора. Угол подъема направления колеба-
88
ний превышает угол подъема винтовой линии желоба на вели-
чину р.
Направленное колебание по винтовой линии возникает в ре-
зультате сочетания возвратно-поступательного перемещения в вер-
тикальном направлении и возвратно-поворотного (углового) пере-
мещения вокруг вертикальной оси транспортера в горизонтальной
плоскости.
Согласно проекту ГОСТа, вертикальные вибротранспортеры
предназначены для транспортирования вверх и вниз по винтовому
лотку мелкоштучных грузов и сыпучих материалов, в том числе
абразивных и горячих (до 500—600°С). В процессе транспортиро-
вания допускается охлаждение, сушка и подогрев сыпучих мате-
риалов.
Предусматривается выпуск вертикальных вибротранспортеров
четырех типоразмеров со следующей характеристикой.
С-625 С-626 С-627 С-628
Производительность (по песку), м3!ч 5 8 12 20
Высота подачи, м 4,8 4,8 6,0 6,0
Частота колебаний, гц . . . 16 16 16 16
Наружный диаметр желоба, мм 480 620 800 1000
Внутренний диаметр желоба, мм 280 330 400 500
Мощность двигателя, кет 1,72 2,82 4,52 7,02
Масса, кг 640 1200 1500 2000
Максимальная высота подачи одного звена вертикального
виброконвейера составляет 8 м, При необходимости транспортиро-
вания на большую высоту соединяют последовательно несколько
виброконвейеров. Отношение высоты рабочего органа Н к его
внешнему диаметру D доходит до 10.
Винтовые вибрационные конвейеры бывают желобчатые и труб-
чатые (для транспортирования пылящих, газирующих, ядовитых и
других материалов) с одной и двумя винтовыми нитками. При
необходимости транспортирования материала в разных направле-
ниях устанавливают рабочий орган с двумя навивками; в желобе
с правой навивкой материал перемещается вверх, а с левой навив-
кой — вниз.
Вертикальные и горизонтальные вибротранспортеры применяют-
ся во многих отраслях промышленности для подъема горячих, хи-
мически активных, пылевидных, абразивных, а также сыпучих
материалов, продуктов питания, не допускающих загрязнения, и
Др. При использовании винтовых вибротранспортеров в фермент-
ном производстве желоб необходимо герметически закрывать ко-
жухом.
Вибрационное оборудование изготавливается серийно за ру-
бежом многими фирмами: Locker (Англия), Binder (Австрия),
89
Sinex (Франция), AEC. Schenk (ФРГ), Sintron (США и др. В на-
шей стране его изготавливают различные отраслевые заводы при-
менительно к определенной отрасли промышленности.
Производительность вибрационных конвейеров зависит от
свойств транспортируемого материала, размеров грузонесущего
органа, вибромеханических параметров работы установки и колеб-
лется в широких пределах — от 0,1 до 200 т/ч. Производительность
вибрационных транспортных машин прямо пропорциональна ско-
рости перемещения транспортируемого материала. Средняя ско-
рость его движения является функцией шести параметров: ампли-
туды, и частоты колебания, угла наклона грузонесущего органа,
угла вибрации, коэффициента трения покоя и движения. Большое
влияние на скорость транспортирования оказывают свойства мате-
риала: насыпная масса, влажность, налипаемость, гранулометри-
ческий состав, воздухопроницаемость и другие факторы.
На вибрационном конвейере частицы могут двигаться с отры-
вом от рабочего органа и без него. Характер движения материала
по конвейеру зависит от величены безразмерного коэффициента
режима работы, который определяется по формуле
р__ас»2 sin'fi
g cos 7.
aw2
где — —отношение максимального ускорения грузонесущего
g
органа (асо2) к ускорению силы тяжести g, называемое
динамическим коэффициентом и обозначаемое через Кп:
—отношение, характеризующее направление колебаний,
cos а
называемое коэффициентом конструкции;
(о = — —круговая частота колебаний, рад!сек;
п — число колебаний в минуту;
Р — угол направления колебания, град-,
а — угол наклона вибролотка, град;
g— ускорение силы тяжести, м!сек2.
При Г<\ вибротранспортирование материала происходит без
отрыва от дна грузонесущего органа — скольжением. Г=1 характе-
ризует границу режима работы с подбрасыванием транспортиру-
емого материала и без него. При Г>\ материал отрывается от дна
грузонесущего органа и перемещается преимущественно микроброс-
ками.
В современных конструкциях величину безразмерного коэф-
фициента режима работы Г принимают равной 1,48 4-2,52, а ди-
намический коэффициент Кл = 2,344-5.
В трудах Всесоюзного научно-исследовательского института
подъемно-транспортного машиностроения рекомендуется опре-
S0
делить среднюю скорость транспортирования по формуле
Г-П д
и==з6 ’ acos₽7‘0’
где, кроме ранее приведенных обозначений, т]о— коэффициент
проскальзывания.
По опытам ВНИИСтройдормаша при одних и тех же парамет-
рах вибрации и горизонтальном транспортировании для пылевид-
ных и порошкообразных материалов т)о=0,30,5, а для зернистых
и кусковых грузов т)о=О,574-О,62.
Коэффициенты, установленные для конкретных условий транс-
портирования, не могут быть распространены на сыпучие материа-
лы и питательные среды, применяемые в ферментной промышлен-
ности.
Во ВНИИФСе в 1963 и 1964 г. проводились эксперименталь-
ные исследования транспортирования сыпучих материалов на го-
ризонтальной вибрационной установке Института горного дела, на
вертикальной установке Новочеркасского политехнического инсти-
тута и на универсальном вибростенде института «Механобр». Ско-
рость вибротранспортирования сыпучих материалов, используемых
в производстве ферментов, изучалась в широком диапазоне частот
колебаний (от 5 до 20 гц), амплитуд колебаний (от 1 до 10 мм) и
углов наклона вибрации (от 0 до 90°). Ниже (рис. 6 и 7) приведе-
ны графики зависимости скорости вибрационного транспортирова-
ния воздушно-сухих отрубей и культуры гриба от вибрационных
параметров.
Исследованиями установлено, что при амплитуде колебаний
до 2 мм, частоте колебаний до 10 гц, а также на больших частотах
(до 15 гц), при угле направления колебаний до 20° суховоздушные
отруби влажностью 10—12% не перемещаются на горизонтальном
виброконвейере. С увеличением амплитуды и частоты колебаний
отруби становятся подвижными и скорость транспортирования их
изменяется в пределах от 17 до 300 мм/сек.
С изменением угла направления колебаний от 10 до 30° при по-
стоянных амплитуде и частоте колебаний скорость транспортирова-
ния возрастает, достигая максимума в 300 мм/сек, однако при даль-
нейшем увеличении угла вибрации до 60° она снижается. С увели-
чением амплитуды колебаний от 2 до 5 мм при постоянных угле
направления колебаний и частоте колебаний скорость транспорти-
рования повышается. Аналогичные результаты получены при повы-
шении частоты колебаний от 10 до 16,6 гц при постоянных ампли-
туде и угле направления колебаний.
Основные рабочие параметры вибрационного конвейера: часто-
ту, амплитуду колебаний и угол направления колебаний — выби-
рают в зависимости от назначения установки, однако при этом же-
лательно величину безразмерного коэффициента режима работы
сохранить в пределах 3,3 4-3,7. . .
91
Рис. 6. Зависимость ско-
рости вибрационного
транспортирования воз-
душно-сухих отрубей:
а — от угла направления ко-
лебаний, (Р); б — от
частоты колебаний, v = f (л);
в — от амплитуды колебаний.
v = f (Л).
92
I/, мм]сек
Рис. 7. Зависимость ско-
рости вибрационного
транспортирования куль-
туры гриба Asp. niger
влажностью 45%:
а — от угла направления ко-
лебаний, v = f (|3); А=4 мм;
/ — /2 = 700, 2 — «=800, 3 —
« = 900, 4 — «=1000, 5 —« =
1100, 6 — « = 1200; б — от ча-
стоты колебаний, v <=
1 — А = 2 мм, Р = 40°, 2 — А =
2 мм, р=30°, 3 —- Л=3 мм,
3 = 40°, 4 — Л=3 рм, 3=30°,
5 _ л =4 мм, Р =40°, 6 —
Л =4 мм, Р=30°; в от ам-
плитуды колебаний, v=f
(Л); Р=30°, 1 — «=700, 2 ~
« = 800, 3 — п = 900, 4 — « =
= 1000, 5 -«=1100, 6 — п =
= 1200.
93
Пневматический транспорт
Механический транспорт (нории, шнеки и ленточные транспор-
теры), применяемый в настоящее время в ферментной промышлен-
ности, в будущем, несомненно, должен быть заменен пневмати-
ческими и вибрационными транспортирующими устройствами. Не-
смотря на то что пневматический транспорт потребляет значитель-
но больше электроэнергии, чем механический, он имеет много важ-
ных преимуществ перед ним, главными из которых являются: гер-
метичность транспортных трубопроводов и отсутствие пылевыде-
ления, небольшой диаметр трубопроводов и возможность разме-
щения их в траншеях, под потолком, на столбах, что позволяет наи-
более целесообразно и удобно расположить технологическое обо-
рудование— стерилизаторы, диффузоры, реакторы и прочее; воз-
можность транспортирования по трассе любой сложности на боль-
шие расстояния и с подачей материала из нескольких мест ко мно-
гим аппаратам; простота конструкции и надежность работы. При
использовании пневматики легко полностью автоматизировать про-
цесс транспортирования.
Пневматические устройства разделяют на всасывающие, нагне-
тательные и смешанные. Всасывающая пневматическая установка
состоит из вакуум-насоса или эксгаустера, сопла, всасывающего
трубопровода, разгрузителя, циклона-пылеотделителя, фильтра и
шлюзовых затворов. Вследствие разрежения, создаваемого вакуум-
насосом (или эксгаустером), воздух вместе с сыпучим материалом
засасывается через сопло в трубопровод. Смесь воздуха с материа-
лом по трубопроводу поступает в отделитель, где материал отде-
ляется, а воздух, содержащий мелкую пыль, поступает в фильтр,
очищается и затем вакуум-насосом (или эксгаустером) выбрасы-
вается в атмосферу. Из отделителя и фильтра сыпучий материал
через шлюзовые затворы поступает в приемный мерный бункер или
дозаторы; а оттуда — в приемный аппарат.
Производительность всасывающих установок и расстояния, на
которые материал может транспортироваться, ограничены величи-
ной максимального разрежения.
Нагнетательная установка состоит из воздуходувной машины,
трубопровода, питателя, разгрузителя, батарейного циклона и
фильтра. Сжатый воздух, проходя по трубопроводу, увлекает пода-
ваемый питателем сыпучий материал и направляет эту смесь в от-
делитель; все дальнейшие операции происходят аналогично описан-
ным для всасывающей пневматической установки. В зависимости
от требуемой степени фильтрации в установках могут быть исполь-
зованы центробежные, рукавные матерчатые, электрические и дру-
гие фильтры.
В нагнетательных установках избыточное давление в трубопро-
воде может достигать 4—6 ат, что позволяет транспортировать сы-
пучие материалы на расстояния до 300 м и более из одного пункта
в несколько точек разгрузки по разветвленной сети трубопроводов.
94
В нагнетательных установках имеет место утечка материала и пы-
левыделение через неплотности в соединениях трубопроводов и
установки, поэтому для ферментного производства они применимы
только на вспомогательных операциях.
Устройства смешанного типа позволяют собирать груз из не-
скольких мест и подавать его в несколько пунктов разгрузки. При
пневмотранспортировании скорости воздуха составляют от 8 до
35 м!сек\ концентрация смеси — отношение массового расхода мате-
риала к расходу воздуха 25—30 кг)кг.
Для предохранения воздуходувных машин от преждевременно-
го износа воздух предварительно должен быть очищен от пыли, для
чего необходимы очищающие устройства, которые снижают эффект
всасывающих установок.
Особая ценность всасывающих установок заключается в том,
что вследствие разрежения в системе исключается возможность
пылевыделения. Это позволяет рекомендовать их для транспорти-
рования отрубей, кукурузной муки, зерновой лузги, сухого свекло-
вичного жома, сухой измельченной культуры плесневого гриба на
расстояние до 100 м к одному или нескольким аппаратам. Средняя
скорость движения материала в горизонтальных трубах пневмати-
ческих установок не более 0,75 скорости движения воздуха.
Ниже приведены экспериментальные данные, полученные при
пневмотранспортировании некоторых сыпучих материалов, приме-
няемых в ферментном производстве.
Влажность, % Скорость витания, м/сек Скорость движения м/сек
Суховоздушные отруби . . 13 2,5 20
Свекловичный жом . . 11,4 4,5 15
Лузга овсяная . . . . . . 11,8 2,4 -16,5
Лузга гречневая . . . . . . 11,0 4,6 15,5
В последнее время в пищевой промышленности применяют пнев-
матические установки аэрозольтранспорта нагнетательного типа.
При использовании аэрозольтранспорта порошкообразный мате-
риал перемещается в псевдокипящем состоянии. Расход воздуха при
этом во много раз меньше, чем в установках всасывающего типа.
Концентрация смеси составляет 75—150 кг/кг. что позволяет приме-
нять трубопроводы небольших диаметров, отказаться от сложных
систем очистки воздуха. Скорость воздуха не превышает 7,5 м1сек,
но для работы установки вместо вентиляторов применяются возду-
ходувки ротационного типа, а при избыточном давлении более
КЗ ат — компрессоры. Пылевыделения при аэрозольтранспортиро-
вании не наблюдается, что позволяет рекомендовать этот вид транс-
порта для подачи материала как по вертикали, так и по горизон-
тали.
95
ЛИТЕРАТУРА
i. An-Ch’ing A e. Fungal amylase production by the submergadculture method.
«Chemistry» (Taiwan) 1961; «Chemical Abstracts». 1962. Vol. 59, № 4, p. 3920c.
2. Beckard L., Kneen E. a. Levis K. Bakterial Amylases, Production on
Wheat Bran., «Ind. Eng. Chem.», 37, 692, 1945.
3. Beckard L., Pi 1 tier G. a. Kneen E. Bakterial Amylases, «Ind. Eng.
Chem.», 2, 232, 1946.
4. Б и л а й В. И. Биологически активные вещества микроскопических грибов и
их применение. Изд-во «Наукова думка». Киев, 1960.
5. В о i d i n A. a. E f г о n t J., Patent 227274, 1917.
•6. В о i d i n A. a. E f г о n t J., Patent 505534, 1924.
7. Bindal A. a. Sreenivasava M. Influence of carbohidrate to nitrogen
ration on the formation of diastase by Asp. oryzae. «Current Science», 15, 72,
1946.
8. Блехман И. И. и Джаналидзе Ю. Г. О выборе основных параметров
вибрационных конвейеров. «Обогащение руд», 1959, № 2.
9. Бу реи ан В. Р. Пневматический транспорт на предприятиях пищевой про-
мышленности. Изд. 2-е. Изд-во «Пищевая промышленность, 1964.
10. Буткевич В. С., Тимофеева А. Г. Влияние отдельных минеральных
элементов питательной среды на образование кислот грибом Asp. niger.
.Статья вторая. «Микробиология». Т. IV, Вып. 4, 1935.
11. Буткевич В. С., Тимофеева А. Г. Влияние отдельных минеральных
элементов питательной среды на образование кислот грибом Asp. niger.
Статья третья. «Микробиология». Т. IV, Вып. 4, 1935.
12. Буткевич В. Umwandlung der Eiweisstoffe durch niedere Pilze in Zusom-
menhange mit einigen Bedingungen ihren Entwicklung. «Jahrbuch wiss. Bo-
tan»., 38, 147, 1903.
13. G г e w t h e r W. and L e n о о x F. C., «Nature», 165, 1950, p. 680.
14. Веселов И. Я., Салманова Л. С., Буканова В. И., Нуждина
Т. Н. Труды ВНИИПБ и ВП. Вып. VIII, 1961, стр. 75.
15. Витковская В. А., Вакуленко В. А., Лаврищева Т. Н., Ада-
менко Э. С., Коваль Е. А., Сахарова Н. И. К уточнению режима
поверхностного культивирования продуцента глюкозооксидазы. Труды Укр-
НИИСПа. Вып. X, 1965.
16. Вяткин В. В. Условия роста мицелия и накопления амилолитических фер-
ментов при глубинном выращивании гриба Aspergillus niger. Труды
ВНИИСПа. Вып. III, 1954.
17. Голгер Л. И. Вибрационное транспортирование сыпучих материалов при
производстве ферментных препаратов. «Ферментная и спиртовая 'промышлен-
ность», 1965, № 6.
18. Тонча рев ич И. Ф. Принципиальное устройство привода вибрационных
машин (вибраторов) и направления его развития. Сб. «Применение вибротех-
ники в горном деле». Госгортехиздат, 1960.
19. Г о н ч а р е в и ч И. Ф., Сергеев П. А Вибрационные машины в строитель-
стве. Машгиз, 1963.
‘20 . Тонча ревич И. Ф. и Стрельников Л. П. Электровибрационная
транспортная техника. Госгортехиздат, 1959.
21. Тонча ревич И. Ф. Принципиальное устройство привода вибрационных
машин (вибратор 1) и направление его развития. Применение вибротехники
в горном деле. ИГД АН СССР, Госгортехиздат, 1960.
22. Гончарова Л. А. Влияние среды на активность ферментных препаратов
из плесневых грибов. Диссертация. Ленинградский химико-фармацевтический
институт, 1952.
23. Гончарова Л. А. Влияние состава барды на амилолитические ферменты
глубинных культур грибов. Труды Ленинградского технологического инсти-
тута пищевой промышленности. Т. 12, 1955.
24. Гончарова Л. А. Влияние источников питания углеродом плесневых гри-
бов на активность получаемых из них ферментных препаратов. Труды Ле-
96
нинградского технологического института пищевой промышленности. Т. 11 (X),
1951.
25. Г о р я ч е н к о в а Е. В. Основные принципы препаративного выделения и
очистки ферментов. В кн. «Ферменты». Под ред. акад. А. Е. Браунштейна.
Изд-во «Наука». М., 1964.
26. Гулый М. Ф., Бил ай В. И., Пи до пл ич ко Н. М., Дегтярь Р. Г.,
Никольская Е. А. Фермент глюкозооксидаза и его применение. Изд-во
«Наукова думка». Киев, 1964.
27. Д в а д ц а т о в а Е. А. Влияние источников азота на образование амилазы
глубинными культурами Asp. oryzae 153 и Asp. oryzae 3-9-15. Труды
ЦНИИСПа. Вып. IX, 1960.
28. Д е р м а ш А. Сравнительный анализ питательных смесей, используемых для
приготовления полиферментов. Сообщение 1. Изменение подъемной силы.
«Хлебопекарная и кондитерская промышленность», 1961, № 10.
29. Дзудзио А. М. Пневматический транспорт на зерноперерабатывающих
предприятиях. Заготиздат, 1961.
30. Dworshak R. G., Koepsell Н. J. and Ladoga A. A. «Arch, of Bioch
and Biophys». Vol. 41, № 1, 1952, p. 48.
31. Дьячков В. К- Исследования и основы расчета и проектирования вибра-
ционных конвейеров. Труды ВНИИПТМАШа. Вып. 3(35), 1963.
32. Н о с k е n h u 1 le D., Н е г b е г t D., «Biochem Journ.», 39, 102, 1945.
33. 44 в а но в Н, Осницкая Л. Синильная кислота как источник азота для
Asp. niger «Микробиология». Т. III. Вып. 3, 1934.
34. Имшенецкий А. А. и Солнцева Л. И. Получение препаратов амила-
зы из культур термофильных бактерий. «Микробиология». Т. XIII. Вып. 1
1944.
35. Имшенецкий А. А., Солнцева Л., Кузюрина Л. Термофильные
амилолитические бактерии. «Микробиология». Т. XI. Вып. 1—2, 1942.
36. И м ш е н е ц к и й А. А., Солнцева Л. Термофильные маслянокислые
бактерии. «Микробиология». Т. XIV. Вып. 5, 1945.
37. Калашников Е. Я. Ферменты, их производство и применение в пищевой
промышленности. Труды УкрНИИППа. Вып. 2. Харьков, 1959.
38. Климовский Д. Н., Смирнов В. А., Стабников В. Н. Технология
спирта. Изд. 4-е, Изд-во «Пищевая промышленность», 1967.
39. Костыгов С., Цветкова Е. Ober die Verarbeitung der Nitrate in orga-
nische Stiokstoffverbindungen durch Schimmelpilze. «Zt. fur physiol. Che-
mie, 11, 171, 1920.
40. Левинсон В. H. Транспортные устройства непрерывного действия. Маш-
гиз, Москва — Киев, 1960.
41. Малков А. М., Деева В. Е. Влияние ортофосфата на амилолитическую
активность гриба Aspergillus oryzae. «Известия высших учебных заведений,
Пищевая технология», № 5, 1960.
12. Maxwell М. Е. «Austr. Journ. of Sci. Res.» Series B. «Bioch. Sci.» Vol. 5,
№ 1, 42, 1952.
43. Моисеенко Л. Ф. Получение ферментного препарата Аспергиллюс нигер
для обработки виноградных соков и вин. В кн. «Обмен опытом в винодель-
ческой и ликеро-водочной промышленности». ГОСИНТИ, 1962.
44. Ней бур г И. Г. Некоторые новые виды транспортных устройств для сы-
пучих материалов. Госкомитет Совета Министров СССР по химии. НИУИФ.
1960.
45. Nomura М., Hesoda J., М а г и а В., Akabori Sh. «Journ. Bioch.», 43,
№ 6, 1956, p. 841.
46. Pedhorcky M. Factors affecting amilase fermation by the mould Aspergil-
lus oryzae in Submerged Culture, The effect of nitrogen Sources on the ferma-
tion of Amilase. «Folia Biologica». Vol. 4, 1958, p. 107—111.
47. Pektinasebildung durch einen speziellen Schimmelpilzstamm. «Brauwissen-
schaft». Bd. 15, № 14, 1962, S. 108.
48. П л а н о в с к и й A. H., P а м м В. /М., Каган С. 3. Процессы и аппараты
химической технологии. Госхимиздат, 1962.
7-826
97
49. П о к р о в с к а я Н. В., Воробьева М. Т. Разработка способов получе-
ния препаратов глюкозооксидазы. Труды ЦНИИПБ и ВП. Вып. IX, 1962.
50. Покровская Н. В., Оганезова Н. А., Чистякова Е. А., Кисля-
кова О. В. Способы получения препаратов фермента глюкозооксидазы.
«Ферментная и спиртовая промышленность», 1965, № 7.
51. П о к р о в с к а я Н. В. Динамика образования глюкозооксидазы в культу-
рах некоторых плесневых грибов. В кн. «Внедрение ферментных препаратов
в народное хозяйство». Ч. I. ЦИНТИпищепром, 1961.
52. П о п о в а Н. В. Протеолитическая активность Asp. oryzae при глубинном
культивировании на естественных и синтетических средах. Труды ЦНИИСПа.
Вып. IX, 1960.
53. Попова Н. В. Питательная среда для получения препаратов протеолити-
ческих ферментов при глубинном культивировании плесневых грибов «Фер-
ментная и спиртовая промышленность», 1965, № 5.
54. Raghavendra Rao М. a. Sreenivasava М. Studies on Industrial En-
zymes on the formation of diastase. «Journ. of Scientific and Ind. Research».
Vol. VI, 7, 1947.
55. P a x л e e в a E. E. Поверхностная культура Bacillus subtilis как источник
амилазы и протеиназы. В кн. «Внедрение ферментных препаратов в народ-
ное хозяйство». Ч. I. ЦИНТИпищепром, 1961.
56. Риттер Г. Материалы к физиологии плесневых грибов. Воронеж, 1916.
57. Салманова Л. С., Бук а но в а В. И. Труды ЦНИИПБиВП. Вып. IX,
1962, стр. 48.
58. Салманова Л. С., Б у к а н о в а В. И. Питательная среда для получения
маточной культуры гриба Trichothecium roseum продуцента цитолитических
ферментов. «Известия вузов. Пищевая технология», № 1, 1964.
59. С а л м а н о в а Л. С., Бука но в а В. И. Оптимальные условия культиви-
рования гриба Trichothecium roseum с целью получения цитолитических фер-
ментов «Ферментная и спиртовая промышленность», 1964, № 5.
60. Schelenderger Т., Commercial Production of Enzymes. «Chem Eng.».
Vol. 11, 130, 1947.
61. Сергеев П. А. Вибропривод для конвейеров питателей и других механиз-
мов «Механизация и автоматизация производства», 1962, № 9.
62. Сергеев П. А. Исследования поведения насыпных материалов при вибра-
ционном транспортировании. «Известия АН СССР» (ОГИ) № 5, 1960.
63. Смирнова Л. С. Влияние окисленной и восстановленной формы азота в
среде на выделение амилазы из мицелия Asp. oryzae. «Микробиология».
Т. XXI. Вып. 4, 1956.
64. Смирнова Л. С. Влияние состава среды на образование амилазы Asp.
oryzae. Диссертация на соискание ученой степени кандидата биологических
наук, Институт микробиологии АН СССР, 1957.
65. С о с и н а С. М. Плесневые грибы и их применение в пищевой промышлен-
ности. Минск, 1957.
66. С о с и н а С. М. Выращивание плесневых грибов па отходах крахмального
производства. «Спиртовая промышленность», 1958, № 1.
67. Станьков X. 3. Значение состава питательной смеси для ферментативной
активности различных штаммов грибов. Труды ЦНИИСПа. Вып. VII, 1959.
68. Shu and Blackwood A., «Canad. Journ. of Botany». Vol. 29, 113, 1951;
Steinberg R. «Bot. Rew.» Vol. 5, 327, 1939.
69. Tamija H. Atmung Carung und die sich daran beteiligen den Enzyme von
Aspergillus. «Advances in Ensymology and Relatend Subjects». Vol. 11, 183.
1942.
70. T i 1 d e n E., H u d s a n C. Journ. Bact.» Vol. 43, 527, 1942.
71. Тихомирова А. С. Концентрация крахмала в среде и образование ами:
лазы у Asp. oryzae. «Микробиология». Т. 27. Вып. 2, 1958.
72. Тихомирова А. С. Влияние источников углерода на образование амила-
зы в глубинной культуре Asp. oryzae. В кн. «Внедрение ферментных препа-
ратов в народное хозяйство», № 1, ЦИНТИпищепром, 1961.
98
73. Тихомирова А. С. Влияние источников углерода на образование амила-
зы в глубинной культуре Bacillus subtilis. В кн. «Внедрение ферментных пре-
паратов в народное хозяйство». Ч. I. ЦИНТИпищепром, 1961.
74. Т ру с о в а С. А., К У в и к о в а А. Ф„ Болотина Ф. Е. Применение очи-
щенных препаратов пектолитических ферментов при переработке плодово-
ягодного сырья. Труды ЦНИИСПа Вып. IX, 1960.
75. У л е з л о И. В., Па лицин Н. П. Получение ферментного препарата
супербиолазы. В кн, «Внедрение ферментных препаратов в народное хозяй-
ство». Ч. I. ЦИНТИпищепром, 1961.
76. Фениксова Р. В., Кинзбурская Ф. М., Шилова А. А. Влияние со-
става питательной среды и способов выращивания на образование амило-
литических ферментов у гриба Asp. oryzae. Труды ВНИИСПа. Вып. 3, 1964.
^7. Фениксова Р. В. Амилолитические ферменты грибов из рода Аспергиллюс.
Диссертация на соискание ученой степени доктора биологических наук. Ин-
ститут микробиологии АН СССР, 1956.
78. Фениксова Р. В. Повышение образования амилазы в глубинной культу-
ре Asp. oryzae. В кн. «Международный биохимический конгресс. М., август
1961 г. (Рефераты секционных сообщений. Т. I. М., 1961).
79. Фениксова Р. В. и Двадцатова Е. А. Факторы, стимулирующие об-
разование амилазы в ’глубинной культуре гриба Asp. oryzae 3-9-15. ДАН
СССР. Т. 128, № 5, 1959, стр. 1066.
80. Фениксова Р. В. Получение концентрированных ферментных препаратов.
ЦИНТИпищепром, 1960.
81. Фениксова Р. В., Кинзбурская Ф. М. Получение препаратов бак-
териальной амилазы. Труды ВНИИСПа. Вып. III, 1954.
82. Фениксова Р. В. и Двадцатова Е. А. Получение концентрированных
препаратов амилолитических ферментов из глубинной культуры гриба Asp.
oryzae 3-9-15. ДАН СССР. Т. 128, 1959.
83. Фениксова Р. В., Двадцатова Е. А. Подбор питательной среды,
обеспечивающей максимальное образование амилолитических ферментов.
Труды ЦНИИСПа. Вып. IX, 1960.
84. Ф о р м а н о в с к и й Н. М. Электровибрационные машины института «Меха-
нобр». Применение вибротехники в горном деле. ИГД СССР. Госгортехиз-
дат, 1960.
85. X е р с о н о в а Л. А. Исследование процесса образования пектолитических
ферментов при глубинном культивировании Aspergiilus niger. Диссертация на
соискание ученой степени кандидата наук МТИПП, 1965.
86. Херсон ов а Л. А. Образование пектолитических ферментов при глубин-
ном культивировании Asp. niger. «Ферментная и спиртовая промышлен-
ность», 1964, № 3.
87. Челноков В. Влияние азотистого питания на химическую деятель-
ность гриба Asp. niger. Труды Ленинградского общества испытателей, 59,
90, 1949.
88. Waldmann R. Patent 2302079, 1942.
89. W а 1 1 е г s t е i n L., Enzyme preparations from Microorganismus. Coommer-
zial Production a. Industrial application. «Ind. Eng. Chem.». Vol. 31, 1218,
1939.
90. Шилова А. А., Феоктистова T. А. Влияние состава среды на актив-
ность мальтазы при глубинном выращивании Asp. awamori. ВНИИФС. От-
чет по теме 3, раздел I, 1962.
Глава IV. КУЛЬТИВИРОВАНИЕ МИКРООРГАНИЗМОВ
ПОВЕРХНОСТНЫМ СПОСОБОМ
ОСНОВНЫЕ ТЕХНОЛОГИЧЕСКИЕ ТРЕБОВАНИЯ
При организации (промышленного производства ферментных пре-
паратов необходимо располагать активными продуцентами фермен-
тов и разработанным технологическим режимом их культивиро-
вания.
Плесневые грибы — продуценты ферментов
Повышение ферментативной активности культур плесневых гри-
бов достигается путем установления оптимального состава пита-
тельной среды, точного соотношения между отдельными компонен-
тами ее и введением в среду индукторов, избирательно увеличива-
ющих накопление отдельных ферментов.
Известно, что активность ферментов в культурах плесневых гри-
бов зависит от роста мицелия и накопления биомассы, хотя стро-
гой пропорциональности между ними нет.
В литературе конца 30-х годов, и в частности в работе Фостера,
освещались общие вопросы обмена плесневых грибов, но не изу-
чалась связь между физиологией питания грибов и образованием
в мицелии ферментных комплексов.
Восполняя этот пробел, во ВНИИСПе с 1937 г. начаты иссле-
дования по подбору культур плесневых грибов, обладающих высо-
кой амилолитической способностью, с целью использования их в
спиртовом производстве. На первом этапе работу вели с двумя ви-
дами грибов: Asp. oryzae, который выращивали поверхностным ме-
тодом на пшеничных отрубях, и Asp. niger, который выращивали
глубинным способом на барде — отходе спиртового производства.
В Украинском научно-исследовательском институте пищевой про-
мышленности разрабатывали поверхностный метод выращивания
плесневых грибов на пшеничных отрубях с целью применения их в
пивоваренном производстве.
При разработке оптимальных режимов выращивания плесневых
грибов — продуцентов ферментов — следует учитывать факторы,
влияющие на накопление ферментов. Одним из таких факторов яв-
ляется удачный выбор вида и штамма плесневого гриба, использу-
100
емого в качестве продуцента фермента. Отобранный штамм должен
быть высокопродуктивен по образованию необходимого фермента
или ферментного комплекса, быстро развиваться, быть устойчивым
против инфекции и мало подвергаться изменениям, связанным с
утратой его биохимических свойств.
В течение последних 20 лет во многих академических и отрасле-
вых институтах нашей страны проведена большая работа по отбору
и селекции штаммов микроорганизмов—продуцентов ферментов, в
результате которой ферментная активность многих штаммов была
увеличена в несколько раз.
Ниже (табл. 10) приводятся средние данные об активности фер-
ментов в культурах наиболее активных штаммов плесневых грибов.
Ферментативная активность культур плесневых грибов
Таблица 10
Штамм Активность, ед/г сухого вещества
АС 1 дс 1 мс 1 ПС | ПкС
Asp. oryzae КС 70,0 450,0 30,0 50,000 150,0
Asp. oryzae 3-9-15 65,0 400,0 — — —
Asp. niger species 25,0 450 — — —
Asp. batatae 61 20,0 400 — — —
Asp. niger S4-10—10—ill .... 0,65 437 70,0 0,5 —
Asp. oryzae И-476 (УкрНИИПП) 85,0 665,0 80,0 40,0 —
Asp. awamori 22 14,5 850,0 300,0 0 180,0
Asp. terricola 3374 — — — 60,0 —
Asp. awamori 16 (пектолический) — — — — 1000,0
Питательные среды
Питательные среды, в том числе и пшеничные отруби, использу-
емые для выращивания культур микроорганизмов, содержат споры
различных микроорганизмов. Чтобы предотвратить их развитие и
обеспечить благоприятные условия для развития только определен-
ной культуры, питательные среды необходимо стерилизовать.
Начальная влажность питательной среды имеет существенное
значение для получения высокоактивной культуры. Установлено,
что при культивировании Asp. oryzae на пшеничных отрубях опти-
мальной является влажность 65%. При повышении ее ухудшается
аэрация культуры гриба, а при понижении — тормозится рост ми-
целия и образование ферментов. При выращивании культуры Asp.
oryzae в производственных условиях, при которых не соблюдается
полная стерильность, начальная влажность среды должна быть
58—60%; при такой влажности наблюдается относительное тормо-
101
жение развития посторонней микрофлоры. Следует, однако, пом-
нить, что основным условием предупреждения развития инфекции
при выращивании является тщательная стерилизация среды. На-
чальная влажность среды 58—60% для выращивания Asp. niger,
Asp. awamori, Asp. terricola, Asp. flavus, Trichothecium roseum
и др. подтверждена работами многих исследователей.
Для образования ферментных белков очень важно максимально
возможное сохранение влажности среды в процессе роста. Именно
невозможность сохранить такую влажность при длительном интен-
сивном росте мицелия в большой массе среды является основной
причиной снижения ферментативной активности культур в произ-
водственных условиях. Исследования ВНИИФСа и УкрНИИППа
показали, что в производственных условиях к концу цикла выращи-
вания влажность снижается до 35—40%. Снижение ее наблюдается
даже в том случае, когда в растильной камере поддерживается
относительная влажность воздуха в пределах 100%.
Температурный режим
В процессе роста плесневые грибы потребляют 25—30% сухих
веществ питательной среды и в результате диссимиляции выделя-
ют большое количество теплоты. Если ее своевременно не удалять
из растильных камер, то температура в них интенсивно повышается,
что, помимо других нежелательных явлений, приводит к подсыха-
нию культуры и в конечном итоге к снижению ее ферментативной
активности.
На рис. 8 приведена динамика выделения тепла культурой. Из
этого рисунка видно, что максимальное тепловыделение длится
1—2 ч и составляет 335—377 кдж!кг, считая на сухую массу исход-
ных отрубей. В растильной камере при загрузке в нее 700 кг отру-
бей в процессе роста плесневого гриба выделяется 251 тыс. кдж теп-
ла в час.
Для отвода такого большого количества тепла необходимо ин-
тенсивное вентилирование растильных камер кондиционированным
воздухом. Кондиционирование воздуха преследует несколько целей:
очистку от пыли и насколько возможно — от посторонней микро-
флоры; доведение до определенной температуры; насыщение вла-
гой до содержания 100%. Попадая в растильные камеры, кондицио-
нированный воздух проходит над кюветами с растущей культурой
и под ними, охлаждает их, при этом сам нагревается на 2—3 град
и становится менее насыщенным влагой; в этом состоянии он вновь
способен поглощать воду из более нагретой массы растущей куль-
туры, вызывая подсыхание питательной среды.
Для уменьшения подсыхания питательной среды в процессе ро-
ста плесневого гриба предложены различные способы отвода тепла
и разнообразные конструкции установок.
102
Е. Я. Калашников предложил использовать для выращивания
большие металлические кюветы со сплошным дном, стационарно
устанавливаемые в несколько ярусов. К кюветам снизу приварена
рубашка, через которую пропускается охлаждающая вода с темпе-
ратурой не ниже 26—28°С. Воздухообмен в таких камерах сведен
Рис. 8. Динамика выделения тепла культурой Asp.
oryzae, выращиваемой на пшеничных отрубях с отво-
дом тепла водой через поверхность теплообмена.
к минимуму (2—3 обмена в час). Цель такого воздухообмена сво-
дится к отводу накопившейся углекислоты и обеспечению физиоло-
гической потребности гриба -в кислороде.
С. П. Колосковым .показано, что при выращивании Asp. oryzae
поверхностным способом в замкнутом объеме (без обмена возду-
ха) с отводом тепла водой через поверхность теплообмена потреб-
ность в воздухе составляет 0,55 л на 1 г пшеничных отрубей, считая
на сухую массу.
С целью сокращения расхода воздуха на отвод тепла предло-
жено выращивать плесневые грибы в сушилке системы ВИС-42Д.
На Петровском спиртовом заводе был испытан такой способ, преду-
сматривающий чередование состояния покоя засеянной питательной
среды с последующим пересыпанием ее с полки на полку и аэриро-
ванием паровоздушной смесью. При этом расход воздуха на аэриро-
вание 1 т культуры составляет 3000 м3/ч в отличие от принятого в
промышленности расхода воздуха 22 000 м3/ч. Однако влажность
культуры в процессе роста все же снижалась на 20—25% по срав-
нению с начальной. Уменьшить расход воздуха и тем самым умень-
шить снижение влажности питательной среды в процессе роста гри-
ба возможно при использовании в качестве растильной установки
паровой сушилки СПК. Как показали работы ВНИИФСа, наибо-
103
лее хорошо влажность питательной среды сохраняется при выращи-
вании плесневого гриба в установках с вертикальными каналами.
В большинстве опытов влажность готовой культуры была равна
влажности исходной питательной среды после засева.
Температурный режим оказывает большое влияние на техноло-
гический процесс выращивания. Так, при выращивании, например,
Asp. oryzae наблюдаются 3 периода роста: первый — набухание и
прорастание конидий, сопровождающееся охлаждением засеянной
среды. Чтобы создать благоприятные условия, окружающий воздух
необходимо подогревать; второй период (через 12—20 ч от момента
засева), — интенсивный рост мицелия, характеризующийся быстрым
повышением температуры до 37—47°С, в связи с чем растущую
культуру требуется охлаждать в третий период (36—40 ч от засе-
ва) — температура начинает падать ниже 30°С, что свидетельствует
о прекращении роста гриба.
Отмечено, что по мере увеличения слоя среды длительность
первого периода уменьшается, а второго — возрастает. Повышение
температуры в первые 12 ч роста не оказывает вредного влияния на
активность ферментов, а температура 34°С даже стимулирует рост
плесневого гриба и накопление им ферментов. Во второй период ро-
ста повышение температуры сверх оптимальной приводит к пони-
жению активности; так, поддерживание температуры 45°С в тече-
ние 24 ч снижает ферментативную активность на 40—50%, а по-
нижение температуры ниже оптимальной при выращивании гриба
Asp. oryzae приводит к увеличению его протеолитической активно-
сти. То же наблюдается и при выращивании гриба Asp. terricola
при понижении температуры ниже 30°С. Оптимальной температурой
для роста большинства плесневых грибов на твердых средах яв-
ляется 28—-30°С.
Продолжительность культивирования
Исследование вопроса о продолжительности культивирования
грибов в лабораторных и производственных условиях показало, что
при наличии хорошего аэрирования, а вследствие этого и более эф-
фективного удаления накапливающейся углекислоты, и высокой от-
носительной влажности плесневые грибы за меньший период дают
максимальное накопление ферментов. Так, максимальное накопле-
ние ферментов грибом Asp. oryzae штамм И-476 достигается за
24—25 ч. Гриб Asp. oryzae штамм КС образует максимум фермен-
тов за 30—36 ч. При выращивании гриба Asp. flavus максимальное
количество протеолитических ферментов образуется через 48 ч. Ра-
циональным сроком выращивания гриба Asp. terricola 3374 — про-
дуцента протеолитических ферментов — является 36—40 ч. При
выращивании гриба Asp. awamori для накопления им амилолитичес-
ких ферментов требуется 36 ч. Для накопления пектолитических
104
ферментов грибами Asp. niger П и Asp. awamori 16 продолжи-
тельность выращивания составляет 48 ч. Для накопления цитоли-
тических ферментов гриб Trichothecium roseum необходимо вы-
ращивать в течение 2,5 суток.
Иные условия культивирования требуются для гриба Penicil-
lium vitale — продуцента фермента глюкозооксидазы, отселекцио-
нированного Пидопличко Н. М. и Билай В. И. Выращивание про-
дуцента в матрицах на жидкой среде при 28—30°С дает тонкую ма-
лоскладчатую пленку, богатую ферментом, и культуральную жид-
кость с незначительным содержанием его. Максимум активности
наблюдается на шестые сутки, а с увеличением продолжительности
выращивания до 8 суток активность культуральной жидкости пада-
ет. При снижении температуры культивирования до 24—26°С на
9—10-е сутки выращивания накапливается высокая антибиотиче-
ская активность. Наибольший эффект дает выращивание за 7—8
суток, так как при более длительном выращивании активность глю-
козооксидазы и ее стабильность уменьшаются. Оптимальным приз-
нан следующий режим выращивания: первые шесть суток — при
26°С, последующие двое суток — при 28°С. Снижение температуры
до 24—25°С способствует накоплению в среде каталазы, не разру-
шающейся даже в случае повышения температуры на 7-е сутки до
28°С.
Потери сухих веществ при выращивании плесневых грибов
Накопленных в промышленности данных вполне достаточно, что-
бы судить о потерях и установить временные нормы выхода техни-
ческого ферментного препарата для некоторых культур грибов по
отношению к исходному сырью.
В процессе роста плесневые грибы расходуют различные компо-
ненты среды, уменьшая тем самым выход готовой культуры. Для
гриба Asp. oryzae, выращиваемого на пшеничных отрубях, эти по-
тери составляют 20—30% в зависимости от интенсивности процес-
сов диссимиляции и длительности выращивания.
Следует отметить, что в большинстве случаев интенсификация
процессов диссимиляции сопровождается увеличением активности
культуры гриба, хотя при этом и возрастают потери сухих веществ
среды. При выращивании гриба Asp. oryzae на пшеничных отрубях
активность культуры тем выше, чем выше крахмалистость отрубей.
Так, при увеличении крахмалистости отрубей с 18 до 30% выход
сухой культуры по весу на сухое вещество снижается в среднем на
5%, а амилолитическая активность возрастает на 14—18%. Отсю-
да видно, что на такие «увеличенные потери» сухих веществ пита-
тельной среды следует идти, так как это в конечном итоге повышает
выход ферментных препаратов. Что же касается возрастания потерь
при увеличении срока выращивания, то целесообразность продол-
105
жительного культивирования должна определяться исходя из дан-
ных динамики накопления ферментов в процессе роста данного
гриба.
Основываясь на опыте длительной эксплуатации ферментных
цехов, ВНИИФС рекомендовал установить выход культуры гриба
Asp. oryzae при выращивании на пшеничных отрубях в размере
70%. Госкомитет по пищевой промышленности при Госплане СССР
эту цифру утвердил и включил ее в инструкцию по определению
мощностей ферментных цехов и заводов.
По данным УкрНИИППа, потери сухих веществ при выращива-
нии гриба Asp. flavus на пшеничных отрубях составляют в сред-
нем 32,5%. Потери сухих веществ в пределах 30—33% установлены
сотрудниками ВНИИФСа при выращивании Asp. awamori и Asp.
terricola на пшеничных отрубях.
Потери сухих веществ при выращивании грибов Asp. niger П (пе-
ктолитический) и Asp. awamori 22 (пектолитический) на средах,
состоящих в основном из 50% пшеничных отрубей и 50% свекло-
вичного жома, или 30% пшеничных отрубей и 70% свекловичного
жома, сильно колеблются и лежат в пределах 27—35%.
Кроме технологических потерь сухих веществ питательной сре-
ды, в производстве имеются и механические потери, которые в сред-
нем не превышают 1 %.
Бактерии — продуценты ферментов
Технологические режимы выращивания бактерий на твердых
средах разрабатывались в Институте биохимии им. А. Н. Баха АН
СССР и УкрНИИППе. Установлено, что влажность питательной
среды—пшеничных отрубей — должна находиться в пределах
65—68%.
Изменение температурного режима выращивания Вас. subtilis
может влиять на накопление тех или иных ферментов. На рис. 9
приведены кривые, показывающие влияние температуры на амило-
литическую, осахаривающую и протеолитическую активность. Как
видно из этого рисунка, все кривые имеют максимум в пределах
30°С.
Динамика накопления активности ферментов в единицах ОС и
ПС иллюстрируется рис. 10. Максимальная протеолитическая ак-
тивность при температуре выращивания 30°С достигается за 72 ч,
а при температуре 35°С — за 48 ч; максимальная осахаривающая
активность при температуре 35°С достигается за 60 ч, а при 30°С
продолжает повышаться и через 72 ч.
Оптимальной обычно считают температуру выращивания в пре-
делах 35—37°С, продолжительность выращивания для получения
протеолитических ферментов 48 ч, а для получения ферментных пре-
паратов, обладающих осахаривающей способностью, — 72 ч.
106
Рис. 9. Влияние температу-
ры на активность фермент-
ного препарата:
а — изменение амилолитической
способности; б — изменение оса-
харивающей способности; в —
изменение протеолитической
способности.
Продолжительность ооста бактерий^
1
Рис. 10. Характер накопления ферментов культурой Вас.
subtilis:
а — амилолитические ферменты; б — протеолитические ферменты:
1 — при 30° С,2 — при 35° С.
107
ПРОЦЕССЫ И АППАРАТУРА
ДЛЯ ПОВЕРХНОСТНОГО КУЛЬТИВИРОВАНИЯ
Технологический процесс производства ферментных препарато!
из грибов и бактерий при поверхностном выращивании состоит ш
нескольких стадий: ведение чистой культуры гриба в лабораторные
условиях; приготовление посевного материала в отделении чистой
культуры; подготовка питательной среды для производственно?
культуры; выращивание производственной культуры; дробление го-
товой культуры; сушка; расфасовка и упаковка готовой культуры
гриба или бактерий.
Ведение чистой культуры в лабораторных условиях
Эти операции для различных грибов в принципе аналогичны,
поэтому описание технологии дается на примере Asp. oryzae.
Музейную культуру гриба хранят в лаборатории в пробирках
на сусловом агаре при комнатной температуре. По установившей-
ся практике один раз в месяц проводится пересев культуры в про-
бирку с сусловым агаром с соблюдением правил микробиологичес-
кой техники. Через сутки после пересева на поверхности агара по-
является мицелий в виде беловато-серого налета. На вторые—
третьи сутки весь агар покрывается сероватым пушком, в верхней
части которого появляются споры. На четвертые сутки при полном
плодоношении весь пушок становится желтовато-зеленым.
В дальнейшем пробирки с культурами хранят при комнатной
температуре. В процессе хранения цвет культуры постепенно изме-
няется: споры в двух- и трехнедельных культурах приобретают бу-
роватый оттенок.
Как правило, один раз в 2—3 месяца чистую культуру гриба вы-
писывают из лаборатории чистых культур Всесоюзного научно-ис-
следовательского института ферментной и спиртовой промышлен-
ности. Зрелые культуры грибов хранят в холодильнике при темпе-
ратуре 2—3°С.
Приготовление посевного материала в отделении
чистой культуры
Эта операция проводится в специальном помещении, изолиро-
ванном от других цехов. Пяти-семидневная культура на сусловом
агаре служит посевным материалом для размножения на пшенич-
ных отрубях в колбах Эрленмейера емкостью 300 мл. Для осущест-
вления этой операции 10 г отрубей, увлажненных 10 мл воды, сте-
рилизуют в автоклаве в течение часа при избыточном давлении 1 ат.
Перед засевом приготовленной таким образом среды в пробирку с
культурой наливают 5—6 мл стерильной воды, стерильно размеши-
вают платиновой или нихромовой проволокой и 0,5 мл полученной
суспензии спор стерильной пипеткой переносят в колбу с подготов-
ка
ленной средой. Среду тщательно перемешивают со спорами и ста-
вят в термостат для выращивания в течение трех суток.
Готовая трехсуточная культура из колбы Эрленмейера служит
маточной культурой для засева среды в специальных банках боль-
шего объема. Количество чистой посевной культуры берется из рас-
чета 0,6% по весу воздушно-сухих отрубей среды.
Подготовка питательной среды (отрубей) состоит в увлажне-
нии их, переносе в металлические банки, стерилизации при избы-
точном давлении 1 ат (98 кн{м2) в течение часа, последующем ох-
лаждении и засеве суспензией спор, приготовленной из чистой куль-
туры гриба на отрубях, выращенных в колбе Эрленмейера емко-
стью 250—300 мл. Порядок засева следующий. В колбу с 20 г трех-
суточной культуры на отрубях вносят 100 мл стерильной водопро-
водной воды; хорошо размешивают и полученную водную взвесь
переносят в банку. Можно также использовать небольшие
(300x400 мм) металлические кюветы, с фанерными крышками с
отверстиями; под крышки подкладывают лист плотной бумаги.
Все посевы контролируют микроскопированием для проверки
чистоты культуры. При обнаружении посторонних микроорганизмов
культуру и весь посев из нее уничтожают.
Посуду для питательной среды стерилизуют в автоклаве при
избыточном давлении 1 ат (98 кн!м2) или в электрическом шкафу
при температуре 130°С в течение часа. Водопроводную воду в бу-
тылях также стерилизуют в автоклаве при том же избыточном дав-
лении в течение часа.
Средой для выращивания посевной культуры для производства
служат пшеничные отруби. Их стерилизуют в автоклаве в течение
2 ч при 120°С. Для большего эффекта в воду добавляют серную или
соляную кислоту с таким расчетом, чтобы вся прибавляемая вода
была децинормальной по кислоте. Простерилизованные отруби вы-
гружают на раскладочный стол (обитый оцинкованным железом) и
засевают суспензией спор при температуре 32—35°С. После тща-
тельного перемешивания засеянную среду раскладывают по сте-
рильным кюветам слоем 10—15 мм. Эти кюветы закрывают листа-
ми стерильной бумаги и металлическими крышками и устанавли-
вают в предварительно вымытый и пропаренный растильный шкаф
и доводят температуру в нем до 32—34°С.
После загрузки кювет шкаф закрывают, наблюдая за темпера-
турой. При повышении ее до 35—36°С дверцы открывают. Через
сутки кюветы вынимают и устанавливают на стеллажи в отделении
посевной культуры, поддерживая в нем температуру 28—30°С.
, Спорообразование длится 3—3,5 суток. По истечении этого вре-
мени кюветы переносят в помещение, температура в котором под-
держивается на уровне 8—10°С, снимают крышки и бумагу и хранят
в течение 3—4 дней. За это время культура подсыхает и становит-
ся пригодной для хранения в течение 15—20 дней. В целях поддер-
жания необходимой чистоты в отделении посевной культуры пере-
численные операции выполняются одним человеком, который перед
109
входом в отделение проходит -специальную санитарную обработку.
Технологической инструкцией по производству ферментов из
культур грибов при культивировании их на твердых питательных
средах предусматривается внесение посевного материала из расче-
та 0,6% по весу простерилизованных пшеничных отрубей (считая
на воздушно-сухие), без учета качества посевного материала. По-
лученные в последнее время заводские данные (Калунянц, Евти-
хов) позволяют пересмотреть это положение. Установлено, что для
засева 1 кг воздушносухих отрубей требуется 2,5—3 млрд, конидий
гриба Asp. awamori. В 1 г сухого посевного материала Asp.
awamori, полученного на Вышневолоцком заводе ферментных пре-
паратов, содержится 3—3,5 млрд, конидий. Таким образом, данный
посевной материал можно вносить в питательную среду в количест-
ве 1 г на 1 кг воздушно-сухих отрубей, т. е. 0,1 %.
Установление оптимального для засева количества посевного ма-
териала с учетом его качества дает возможность создавать нор-
мальные условия развития производственной культуры и в ряде
случаев сокращать расход посевного материала.
Выращивание посевной культуры поверхностным способом на
кюветах сопровождается обильным выделением конидий, что при-
водит к ухудшению санитарно-гигиенических условий труда на
предприятии. Избежать этого можно двумя способами: либо раз-
работать механизированные и герметизированные растильные
установки для поверхностного культивирования, предусмотрев тща-
тельную фильтрацию поступающего и отработавшего воздуха, либо
перейти на глубинное выращивание посевной культуры.
Посевной материал выращивают глубинным способом на Мос-
ковском и Мичуринском опытных заводах и Вышневолоцком заво-
де ферментных препаратов.
Для получения посевного материала Asp. oryzae И-476 проводят
последовательные пересевы: на сусло-ростковый агар в пробирки,
а затем в колбы, на отруби в колбы и сусло-ростковую жидкую сре-
ду в качалочные колбы или бидоны для проращивания мицелия в
глубинных условиях. Сусло-ростковая жидкая среда состоит из 3
частей сладкого или пивного сусла концентрацией 7—8% и 1 части
вытяжки из солодовых ростков, которую получают настаиванием
ростков с 5 частями водопроводной воды (18—20°С) в течение часа.
В пробирку с чистой споровой культурой гриба на сусло-рост-
ковом агаре вносят 10—15 мл стерильной водопроводной воды с
соблюдением всех правил стерильности и смывом конидий петлей
или пипеткой готовят суспензию спор. 5 мл полученной суспензии
спор вносят в колбы с сусло-ростковым агаром и обкатыванием рас-
пределяют ее равномерно по стенкам колбы. Выращивание прово-
дят в течение 5 суток при 30°С, а затем до полного созревания об-
разовавшихся конидий колбы выдерживают в течение 10—15 суток
при комнатной температуре в затемненном шкафу.
Для получения большого количества спор делают пересев из
колбы с сусло-ростковым агаром на среду из отрубей. Для этого
НО
в колбы с конидиями гриба на сусло-ростковом агаре вносят 100 мл.
стерильной водопроводной воды и встряхиванием приготовляют су-
спензию спор. 3 мл полученной суспензии засевают среду из отру-
бей и после тщательного перемешивания и встряхивания проращи-
вают в течение 4—5 суток при 30°С.
Затем проводят пересев в качалочные колбы или бидоны для
получения глубинного мицелия. В колбу с проросшим на отрубях
грибом вносят 300—400 мл стерильной водопроводной воды и вра-
щательным движением смывают споры. При засеве жидкой сусло-
ростковой среды в колбы или бидоны вносят 10 мл споровой суспен-
зии на 200 мл среды, устанавливают их на качалку с 200—240 обо-
ротами в минуту и выращивают мицелий 30—36 ч при 28—30°С.
Полученный посевной материал — глубинную 'культуру гриба—
сливают в одну стерильную емкость и разводят ее 19 частями сте-
рильной водопроводной воды. Раствор тщательно размешивают и
затем задают в стерилизатор со стерильными, увлажненными и ох-
лажденными до 30—32°С отрубями из расчета в среднем 2,5% по-,
севного материала к весу воздушносухих отрубей. Использование
такого посевного материала приводит к некоторому замедлению ро-
ста производственной культуры; разогрев культуры и активный рост
начинаются только через 10—12 ч.
Одним из решающих условий непрерывной работы ферментных
заводов является наличие гарантированного запаса посевного ма-
териала. В настоящее время ни одно ферментное предприятие им
не располагает. Выращиваемый посевной материал представляет
собой смесь мицелия, конидий и остатков питательной среды. Его
нельзя длительно хранить и трудно транспортировать, так как тре-
буются большие емкости, герметичная упаковка, специальные тем-
пературные режимы и определенная влажность воздуха.
Если для засева питательной среды использовать такой длитель-
но хранившийся материал, то 'конидии прорастают медленно, что
способствует развитию посторонней микрофлоры.
Наилучшей формой сохранения посевного материала является
отделение конидий от мицелия и питательной среды. Известно, что
хранение конидий Asp. niger и Asp. terricola в течение года при ком-
натной температуре не влияет на скорость их прорастания.
Посевной материал в виде чистых конидий легко контролиро-
вать перед использованием, его можно сохранять длительное вре-
мя и тем самым создавать неограниченные запасы. Для хранения
конидий не требуется больших емкостей и специальных температур-
ных условий. Удобство транспортирования сухих конидий создает
реальную возможность централизованного снабжения посевным
материалом всех ферментных предприятий.
Во ВНИИФСе (Евтихов и Калунянц) был разработан и предло-
жен способ отделения конидий. Как показала практика (Вышне-
волоцкий и другие заводы ферментных препаратов), такой посев-
ной материал содержит морфологически однородные и биохимичес-
ки качественные конидии. Авторами предложена схема получения
111
конидий плесневых грибов с целью централизованного снабжения
ими всех ферментных предприятий.
Посевной материал выращивают обычным способом (конечная
влажность его должна быть 8—9%), затем загружают в специаль-
ную емкость, которая снабжена штуцером, присоединенным через
трубопровод к вакуум-насосу. На линии, идущей к вакуум-насосу,
установлен специальный фильтр для отделения остатков питатель-
ной среды и мицелия. На этой емкости имеется еще один штуцер,
снабженный бактериальным фильтром для воздуха, который будет
поступать в нее при разрежении, создаваемом при включении ваку-
ум-насоса. Специальное устройство позволяет подвергать емкость
вибрации. При этом конидии отделяются от мицелия, проходят
через фильтр и собираются в специальном приемнике, откуда на-
правляются на расфасовку. В 1 г такого спорового материала содер-
жится в среднем 32 млрд, конидий, размер 1 конидии колеблется от
3.3 до 5,6 л//ои, насыпная масса их около 400 кг!м\ Из 5 кг посев-
ного материала можно получить 500 г конидий. Такого количества
достаточно для засева 5 т питательной среды.
Оборудование отделения чистой культуры. Отделение приготов-
ления маточной и чистой культуры располагается в обособленном
светлом изолированном помещении. В условиях промышленного
производства ферментов оно состоит из следующих отделений: под-
готовки питательной среды; автоклавной для стерилизации пита-
тельной среды; мойки и камеры для стерилизации кювет; ультра-
фиолетовой завесы; растильной камеры; сушки и расфасовки по-
севной культуры; хранения посевной культуры; приготовления спо-
ровых суспензий и микробиологической лаборатории.
Боксы отделяются легкими фанерно-стеклянными перегородка-
ми (остекление с уровня рабочего стола). Стены и потолок должны
быть гладкими и окрашены белой масляной краской. Пол должен
быть без щелей; целесообразно покрыть его линолеумом. В той
части помещения, где расположены ультрафиолетовые завесы, раз-
мещают бактерицидные лампы, которые должны работать 4 ра-
за в сутки, не менее чем по 2 ч с четырехчасовым перерывом.
В микробиологической лаборатории размещается необходимое
лабораторное оборудование: термостаты на 30 и 37°С, сушильный
шкаф для стерилизации посуды при 200°С, шкафы медицинские для
хранения посуды, холодильник, приборы контроля, микроскоп, ана-
литические и технические весы, а также лабораторный стол с под-
водкой горячей и холодной воды.
Оборудование отделения чистой культуры большей частью не-
стандартно и специфично.
Кювета посевная. Для приготовления посевного матери-
ала применяются кюветы из дюралюминия размером 550Х650Х
ХЗО мм со сплошным дном и крышками, в центре которых имеется
отверстие диаметром 90—100 мм для ватного тампона. Емкость по-
севной кюветы рассчитана на заполнение ее питательной средой сло-
112
ем 10 мм, что в пересчете на суховоздушные отруби составляет
500—600 е.
После тщательной мойки в ваннах кюветы загружают в стери-
лизатор, где стерилизуют при температуре 120°С в течение 2 ч.
Ш к а ф-с те р и л и'з а то р представляет собой прямоугольный
шкаф размером 2000X1000 и высотой 2000 мм, вмонтированный в
проем между отделениями подготовки кювет и стерильным отделе-
нием раскладки питательной среды в кюветы. Он состоит из метал-
лического сварного каркаса, изготовленного из угловой стали; сте-
ны и потолок его обшиты листовой сталью. Внутри шкафа располо-
жены три секции нагревательных труб с подводкой пара через об-
щие коллекторы. Расстояние между секциями позволяет устанав-
ливать кюветы непосредственно между паровыми трубами по на-
правляющим. В трубы подается пар давлением по манометру
5—6 ат (490—580 кн!м2). Шкаф оборудован четырьмя герметически
закрывающимися дверцами, расположенными по две с каждой сто-
роны, одна против другой. Дверцы снабжены двойными стенками,
между которыми загружается теплоизоляционный слой — стекло-
вата. В шкаф-стерилизатор одновременно загружается по 50 кювет.
После стерилизации дверцы со стороны стерильного отделения от-
крывают и извлекают кюветы. Температура и длительность про-
цесса контролируются с помощью регистрирующих приборов.
Увлажнение отрубей и перемешивание их до однородного состо-
яния при подготовке питательной среды рекомендуется проводить в
смесителях типа СМ (смеситель механический) соответствующей
емкости. В них можно смешивать стерильные отруби со стерильной
холодной водой, стерилизовать их (см. стр. 126), охлаждать среду
путем подачи воды © рубашку, а затем смешивать ее с маточной
культурой грибов.
Переносный автоклав. Вертикальный медицинский ав-
токлав, предназначенный для стерилизации питательной среды,
представляет собой стальной цилиндр с откидной крышкой, герме-
тически закрывающейся с помощью откидных болтов с барашками.
Внутри автоклава расположена водопаровая камера, частично
заполняемая водой для парообразования, и стерилизационная ка-
мера, в которую помещают биксы с питательной средой для стери-
лизации. Из водопаровой камеры пар поступает в стерилизацион-
ную через вырезы в ее борту. Арматура автоклава состоит из во-
допроводного крана с воронкой, предохранительного клапана с си-
фонной трубкой и трехходовым краном, манометра и спускного
крана для слива конденсата. Вода заливается в водопаровую каме-
ру через воронку до ее верхнего края. После загрузки биксов с
питательной средой и герметического закрытия крышки ко дну
автоклава подводят газовые горелки или электрообогрев.
При появлении в отверстии спускного крана непрерывной струи
пара кран закрывают и устанавливают по манометру необходимое
Давление 1,5 ат (147 кк/ж2). Предохранительный клапан должен
быть отрегулирован на необходимое давление пара для стерилиза-
8—826
113
ции, но не более чем на 2 ат (196 кн!м2). По окончании стерилиза-
ции обогрев автоклава прекращают, спускной кран открывают, вы-
равнивают давление и после падения его до нуля осторожно откры-
вают крышку автоклава и извлекают стерильные биксы со средой.
При загрузке биксов в автоклав ободок их устанавливают так,
чтобы отверстия биксов были открыты для доступа пара. При вы-
грузке биксов из автоклава ободок должен закрыть отверстия по
всему периметру. В бикс вмещается питательная среда из 3—3,5 кг
исходных отрубей. В один автоклав одновременно загружается
3 бикса.
Автоклавы бывают горизонтального и вертикального типа. Обо-
гревают их чаще всего паром, реже — электронагревательными эле-
ментами и еще реже — газом. При наличии парового нагрева пар
по трубопроводу -подается в паровую камеру автоклава и отпадает
надобность в подводе обогрева ко дну автоклава и заливе водопа-
ровой камеры водой.
Автоклав горизонтальный АГ-1 (рис. 11) отличается
от описанного выше наличием специального котелка с электрона-
4Г-3 11Ц)
Рис. 11. Автоклав горизонтальный АГ-1:
/ — стойки; 2 — штуцер с вентилем для подачи воды; 3 — электронагреватель; 4 — крышка;
5 — предохранительный клапан; 6 — электрощит; 7 — штуцер с вентилем для подачи пара в
паровую камеру; 8 — кожух; 9 — паровая камера; 10 — стерилизационная камера; // — при-
жим; 12 — крышка; 13 — спускной кран; 14 — котелок.
114
гревателями, вмонтированными в его крышке. В котелке проис-
ходит парообразование, пар по трубопроводу поступает в паровую
камеру автоклава, а образующийся конденсат стекает обратно. Ко-
телок снабжен воронкой для налива воды, манометром и предохра-
нительным клапаном. Автоклавы изготавливаются Ленинградским
объединением медицинской техники «Красногвардеец».
Техническая характеристика автоклава АГ-1
Максимально допустимое рабочее давление по ма-
нометру, кн!м2................................ 196
Температура среды в стерилизационной камере при
максимальном давлении, °C......................... 132
Род тока.........................................Переменный
Напряжение, в....................................... 220
Потребляемая мощность, кет:
при нагреве (максимальная)....................... 6
при стерилизации ................................ 2
Габариты, мм................................... 935X685X1670
Из автоклавного помещения стерильные биксы через стенной
проем или комнату с ультрафиолетовой завесой передаются в отде-
ление растильной камеры. Стерильную питательную среду выгру-
жают на металлический стол для охлаждения и перемешивания с
маточной культурой. Чтобы ускорить охлаждение среды, стол не-
обходимо снабдить водяной рубашкой и аспирационным зонтом
для отвода воздуха и паров.
В дальнейшем раскладочный стол должен будет уступить место
новому виду оборудования, которое обеспечит механическое пере-
мешивание среды с посевной культурой и герметичность процесса.
Термостатный шкаф. В помещении растильной камеры
размещается термостатный шкаф для выращивания посевной
культуры. Для аэрации и отвода физиологического тепла к шкафу
подводится приточно-вытяжная вентиляция с двойной очисткой по-
даваемого и удаляемого воздуха — сначала предварительной, затем
бактериальной. Термостатный шкаф размером 2100X900X1900 мм
с герметическими дверцами изготавливается из алюминия. Внутри
его расположены полки, на которые устанавливают кюветы. В ниж-
ней части расположены нагревательные элементы, обеспечивающие
нагрев воздуха до 30°С.
Отдельное изолированное помещение отводится для сушки по-
севной культуры на стеллажах при температуре 30—35°С и бокс
для герметической выгрузки посевной культуры из кювет. Чтобы
предупредить попадание конидий в помещение, посевную куль-
туру из кювет следует выгружать н специальных герметизирован-
ных манипуляторах.
115
Манипулятор. Камера манипулятора изготавливается из
алюминия или нержавеющей стали. В боковой стенке ее сделан
прямоугольный вырез, в который по направляющим, шарнирно при-
крепленным к внутренней стенке камеры, вдвигается кювета с по-
севной культурой. Поворотом направляющих кювету устанавлива-
ют в положение, удобное для выгрузки. С противоположной сторо-
ны имеются 2 окна со встроенными внутрь камеры гибкими рука-
вами для возможности выгрузки посевной культуры из «кювет вруч-
ную с помощью скребка. Для удобства загрузки к наружной стен-
ке камеры над вырезом прикреплен приемный стол. В верхней и
боковой стенках камеры расположены окна для наблюдения за
выгрузкой посевной культуры.
Выгруженная посевная культура собирается в нижней конус-
ной части камеры, откуда после открытия шибера поступает в гер-
метизированную емкость — кассету или полиэтиленовые мешочки.
Манипулятор необходимо подключать к аспирационной системе, а
удаляемый воздух — фильтровать, как и после термостатного
шкафа.
Мешочки с посевной культурой хранят в холодильнике при тем-
пературе 10°С и по мере надобности разгружают с помощью мани-
пулятора в герметизированные кассеты. К недостаткам данной кон-
струкции манипулятора следует отнести малую пропускную способ-
ность — одновременно можно загружать и выгружать только по од-
ной кювете.
В последнее время разработана конструкция манипулятора,
внутри которого на полочках камеры единовременно загружается
6—8 кювет. В боковой нижней части камеры устанавливается ем-
кость на колесах со стерильной водой, в которую по направляющим
подаются опорожненные кюветы. Манипулятор устанавливается в
стенном проеме так, чтобы одна его часть (где расположена ем-
кость с водой, была в отделении мойки кювет, а вторая (в которой
происходит загрузка и выгрузка посевной культуры) — в стериль-
ном отделении.
Кассета. Кассета выполнена в виде цилиндра из алюминия
и снабжена уплотняющимся шибером. Патрубок кассеты обеспечи-
вает герметичное присоединение ее к манипулятору и к производ-
ственному стерилизатору. Кассета рассчитана на прием из манипу-
лятора 2,1 кг сухой посевной культуры, необходимой для засева
770 кг стерильной среды, или 350 кг в пересчете на воздушно-
сухие отруби.
В тех случаях, когда питательную среду в стерилизаторе засе-
вают не конидиями, а суспензией их, кассеты поступают в стериль-
ную камеру для приготовления суспензии. В некоторых случаях
можно предварительно наливать в кассету стерильную воду и не-
посредственно в нее загружать из манипулятора конидии гриба, что
уменьшает опасность попадания их в воздух помещения.
116
Аппарат для приготовления суспензий кони*
дий (рис. 12) представляет собой герметически закрывающуюся
емкость из алюминия или нержавеющей стали, внутри которой рас-
положена пропеллерная мешалка (стационарная или переносная).
Переносная мешалка работает пе-
риодически и непродолжительное
время, поэтому односторонняя на-
грузка на подшипники существенно-
го значения не имеет.
Под крышкой аппарата располо-
жено цилиндрическое сито, в кото-
рое загружается из кассеты посев-
ная культура в виде конидий гриба.
Туда же по штуцеру через цилинд-
рическое сито подается стерильная
вода, которая при смешении с кони-
диями образует суспензию, поступа-
ющую по нижнему спускному шту-
церу в стерилизатор.
Переносные мешалки к аппарату
серийно изготавливаются бердичев-
ским машиностроительным заводом
«Прогресс». Мощность электродви-
гателя 0,22 кет, число оборотов ме-
шалки 300 в минуту.
Стерилизатор воды. Для
приготовления стерильной воды
применяют цилиндрическую герме-
тизированную стальную емкость,
внутри которой расположен зме-
евик. На крышке установлены шту-
цер для выхода пара, гильза для ______ ______
Термометра И воздушник. На боко- / — корпус; 2—вал с мешалкой; 3 — крыш-
ВОЙ стенке вмонтирована водомер- *а; —редуктор; 5 — электродвигатель;
u м 16 — кассета; 7 — перфорированная емкость
ная арматура, а с другой стороны — для сухих спор.
штуцеры для подвода и отвода пара
и воды. В днище аппарата предусмотрен спускной штуцер для
стерильной воды.
Приступая к стерилизации, аппарат заполняют водой, подают
в змеевик пар, и после кипячения воды в течение часа охлаждают
стерилизованную воду холодной водой, подаваемой в змеевик вме-
сто пара. Стерильная вода при температуре 25°С направляется
по трубопроводу для увлажнения и смешивания со стерильной пи-
тательной средой.
Обычно устанавливают два мерника-стерилизатора воды, рабо-
тающие попеременно.
Рис. 12. Аппарат для приготовления
117
На Рассказовском заводе биохимических препаратов испытан
с положительными результатами стерилизатор, основанный на прин-
ципе обработки воды ультрафиолетовыми лучами. Для этих целей
используется бактерицидная установка типа ОВ-АКХ-1, изготавли-
ваемая серийно Смоленским заводом Министерства коммунального
хозяйства РСФСР.
Установка состоит из нескольких /последовательно соединенных
камер с радиальными перегородками внутри для лучшего переме-
шивания воды.
В центре каждой камеры, вдоль оси цилиндра в кварцевом ци-
линдрическом чехле расположен источник ультрафиолетовых лу-
чей — ртутно-кварцевая лампа высокого давления ПРК-7.
Вода стерилизуется в непрерывном потоке, перетекая через
последовательно соединенные рамеры при тщательном перемешива-
нии.
Эффект стерилизации контролируется бактериологическими ана-
лизами исходной и облученной воды, на основании которых опре-
деляется необходимое число рабочих камер, обеспечивающее сте-
рильность воды при данном бактериальном загрязнении и физико-
химических свойствах исходной воды.
Помещение отделения чистой культуры. Габариты всех помеще-
ний отделения чистой культуры определяются в основном из рас-
чета потребного для производства количества посевного материа-
ла, исходя из продолжительности выращивания посевной культу-
ры 4 суток, а с сушкой и хранением для контрольного анализа —
6—7 суток. Выход посевного материала с одной кюветы составляет
350-400 г.
Следует иметь в виду, что надлежащее санитарное состояние
этого отделения обеспечивает успешную работу предприятия в це-
лом. Поэтому необходимо систематически поддерживать стериль-
ность помещения и находящейся в нем основной и вспомогательной
аппаратуры.
Все помещения отделения чистой культуры должны тщательно
вентилироваться. Подаваемый и удаляемый воздух должен прохо-
дить грубую, а затем бактериальную очистку через специальные
фильтры. Для грубой очистки рекомендуется применять масляные
ситчатые фильтры типа Рекка, а для бактериальной — фильтры
типа ЛАИК, фильтры масляные ячейковые ситчатые применяются
только для очистки воздуха от пыли.
Ячейки фильтра состоят из ряда гофрированных сеток, поста-
вленных последовательно с взаимноперпендикулярным направле-
нием гофров. Перед установкой ячейки фильтра промываются ве-
ретенным маслом 2 или 3.
Фильтр ЛАИК СП-6/15 разработан лабораторией аэрозолей
Института им. Карпова и Московским институтом вирусных rtpena-
118
Модель фильтра
М (малая) Б (большая)
Число сеток в ячейке 12 18
В том числе
№ 2.5—0,5*........................................... 5 8
№ 1,2—0,35 . /........................... 4 6
№ 0,63—0,25 .................................. 3 4
Размер ячейки, мм....................................510x510x50 510х510х
ХЮО
Размер установочной рамки, мм........................520x520x7 520X520 X
i Х120
Масса, кг
установочной рамки........................................ 3 3,5
ячейки................................................ 7 11
общая................................................. 10 14,5
Расход ,масла на 1 ячейку, г......................... 120—200 250—300
Сопротивление ячейки, кг!м3 при производительности,
М31ч
1100................................................. 6 6
1500 10 10
2300 16 20
Степень очистки воздуха при средней запыленности, % 97—98 97—98
* Первая цифра номера обозначает размер стороны квадратного отверстия
сетки, вторая — диаметр нитки (в мм).
ратов и предназначен для обеспыливания и очистки воздуха от ми-
кроорганизмов. Он состоит ( рис. 13) из корпуса и фильтрующей
Рис. 13. Фильтр обеспыливания и очистки воздуха от микроорганизмов ЛАИК:
а — общий вид, б — фильтрующая насадка в металлическом корпусе.
насадки, представляющей собой фанерный короб прямоугольной
формы, внутри которого уложена 61 рамка размером 620X460 мм,
обтянутая фильтрующей перхлорвиниловой тканью Петрянова
ФПП-15-3 (марка ткани расшифровывается следующим образом:
Ф — фильтр, П — Петрянов, П — перхлорвинил, 15 — средний ди-
аметр волокна в десятых долях .микрона, 3 — сопротивление филь-
119
трующего материала, мм вод. ст. при нагрузке 1 см^/сек на 1 см2
поверхности). Между двумя слоями ткани положены бумажные
сепараторы, предохраняющие ткань от слипания.
Площадь фильтрации насадки 15 м2. Стыки соединения стенок и
щели между кожухом и насадкой по всему периметру со стороны
выхода воздуха уплотняются тканью ФПП-15 и резиной, прикреп-
ленной лейкопластырем. Стальной кожух снабжен фланцем для
присоединения к воздуховоду подачи и двумя фланцами со стороны
выхода воздуха. Фильтрующий материал гидрофобен, стоек к агрес-
сивным средам и может работать при температуре не выше 60°С .и
относительной влажности воздуха до 100%. Ткань не стойка к мас-
лам и неорганическим кислотам.
Фильтр ЛАИК может (подавать в помещение стерильный воздух,
отвечающий требованиям Правил техники безопасности и произ-
водственной санитарии при работе в санитарно-бактериологических
лабораториях при санэпидемстанциях системы Министерства здра-
воохранения СССР при нагрузке до 72 м3\ч на 1 м2 поверхности
фильтрации, что обеспечивает непрерывность работы фильтра в те-
чение <2100 ч. При уменьшении удельной нагрузки фильтра до
36 м3/ч срок эффективной работы фильтра значительно удлиняется.
Для обеспечения нормальной работы фильтра ЛАИК нагнетае-
мый воздух до бактериальной очистки должен пройти грубую
предварительную очистку в масляных сетчатых фильтрах. Между
воздуховодом и приемным отверстием кожуха для регулирования
подачи воздуха устанавливается шиберная заслонка. Загрязненный
воздух входит со стороны стерилизующего материала, а выходит
обеспложенным со стороны марлевой прокладки. При удалении
из помещения загрязненного воздуха насадка устанавливается сте-
рилизующим материалом к боксу и между фланцами вместо жалю-
зи ставится металлическая сетка плетения № 16.
Техническая характеристика фильтра ЛАИК марки СП-6/15
Минимальная производительность фильтра при на-
грузке 36 м3/ч на 1 м2, м3................. 546
Минимальный срок непрерывной работы, ч . . 2100
Поверхность фильтрации, м2.................. 15,0
Фильтрующий материал........................ ФПП-15-3
Средний диаметр волокна, мкм .... 1,5
Сопротивление материала, мм вод. ст. . . . 3—12
Габариты, мм................................. 820X695X605
Допустимая относительная влажность воздуха, % 90
Допустимая температура, °C, не более ... 60
Назначение ................................. Очистка воздуха
от пыли и микро-
организмов
Эффективность очистки от обычной воздушной
флоры, %.................................... 99,97
Фильтры ЛАИК (табл. 11) изготавливаются серийно Одесским
экспериментальным заводом медицинской аппаратуры.
120
Таблица 11
Характеристики фильтров ЛАИК, выпускаемых Одесским экспериментальным заводом ЭМА
Показатели СП 3/15; СП 6/15; Сп 12/15 Г=15 м2 СП 3/17; СП 6/17; СП 12/17 F—17 м2 СП 3/21; СП 6/21; СП 12/21 F=21 м2 СП 3/26; СП 6/26; СП 12/26 F=26 м2
Скорость движения возду- ха, см! сек . 1 2 3 4,2 1 2 3 4,2 1 2 3 4,2 1 2 3 *4,2
Удельная нагрузка, м3/ч на 1 м2 36 72 108 150 36 72 108 150 36 72 108 150 36 72 108 150
Производительность, м3/ч . 540 1080 1620 2160 612 1224 1836 2448 756 1512 2268 3024 936 1872 2808 3744
Сопротивление фильтрую- щей насадки (мм вод. ст.) при сопротивлении ткани, мм вод. ст 1,5 -1,7 3 5 10 18 3 6 9 15 4,5 10 16 29 6 14 22 40
3,0 6 12 18 24 5 10 14 21 6,5 14 22 34 7 16 25 46
6,0 12 23 32 44 11 20 28 40 12,5 24 36 52 13 25 40 62
Аналогичные бактерицидные фильтры изготавливаются на дере-
вянном каркасе (табл. 12).
Таблица 12
Типоразмеры фильтров на деревянном каркасе
Марка фильтра Фильтрующая поверхность ткани, м? Нагрузка, м3 воздуха в час Ширина 1 Длина 1 Высота
мм
Д-2,8 2,76 100 295 370 318
Д-6 6,1 220 320 370 636 '
Д-9 9 325 320 520 636
Д-15 15,1 550 355 750 636
Д-16 14,6 560 590 470 636
Д-26 26,3 950 590 750 636
ДК-1,4 1,38 50 350 300 350
ДК-4,5 4,6 165 500 350 645
Примечание. Наибольшая рабочая нагрузка (производительность)
фильтра определяется по формуле Q = Fq м3/ч, где F — фильтрующая поверх-
ность ткани, л2, q — наибольшая удельная нагрузка воздуха 72 м3/ч на 1 л2.
В тех случаях, когда производству необходимы сравнительно
небольшие объемы обеспложенного воздуха (до 1000 м3/ч), целесо-
образно применять комбинированные фильтры типа ДК (деревян-
ный каркас). Они имеют две ступени очистки воздуха, совмещенные
в одном корпусе: первая ступень представляет собой фильтрующий
элемент с насадкой из распушенного штапельного волокна лавсан,
проложенного между двумя винипластовыми сетками, вторая —
рамочный фильтр с тканью ФП.
На заводах ферментных препаратов для обеспечения макси-
мально возможной бактериальной очистки подаваемого и удаляе-
мого воздуха целесообразно устанавливать фильтры исходя из
удельной нагрузки не более 36 м3 воздуха в час на 1 м2 поверхности
ткани.
Подготовка питательной среды для производственной культуры
Подготовка питательной среды заключается в проведении сле-
дующих операций: смешивание компонентов, предварительное ув-
лажнение, стерилизация, охлаждение простерилизованной среды
и засев ее посевной культурой.
Одним из решающих факторов подготовки является стерилиза-
ция. Известны следующие способы стерилизации сред: тепловая
обработка паром (острым и глухим) без вакуума и под вакуумом,
а также горячим воздухом; обработка токами высокой частоты,
122
ультразвуком и инфракрасными лучами; обработка ионизирую-
щим излучением. В настоящее время в производстве ферментов
наиболее распространена тепловая стерилизация. Эксплуатацион-
ный цикл тепловой стерилизации состоит из четырех периодов:
предварительного нагрева — с момента включения стерилизатора
до достижения температуры стерилизации; дополнительного нагре-
ва — с момента достижения температуры стерилизации до установ-
ления ее во всей толще стерилизуемого материала; собственно сте-
рилизации— периода с момента установления стерилизационной
температуры в толще всего материала до конца стерилизации; ох-
лаждения — периода с момента выключения обогрева до охлаж-
дения до нужной температуры. Длительность цикла стерилизации
может быть различной — от нескольких минут до 6 ч и зависит от
аппаратурного оформления и способа тепловой обработки среды.
Предварительно увлажненную питательную среду (пшеничные
отруби, свекловичный жом и т. п.) подвергают обработке острым
паром в герметически закрытом аппарате, работающем по прин-
ципу автоклава.
Цикл стерилизации острым паром на заводах с поверхностным
выращиванием плесневых грибов длится 4—6 ч и проводится в сте-
рилизаторах, конструкция которых разработана Украинским про-
ектным институтом (продовольственного машиностроения (Укр-
гипропрод). Питательную среду нужно стерилизовать острым паром
при температуре Г20°С в течение 90 мин. При стерилизации в ап-
парат вводят 0,2% формалина (40%-ной концентрации) и 0,8%
технической соляной кислоты по весу среды.
Для охлаждения простерилизованной питательной среды при
непрерывном перемешивании ее мешалкой в рубашку подают хо-
лодную воду.
После охлаждения до 40°С при непрерывно работающих мешал-
ках в среду вносят посевной материал в количестве 0,6% по весу
среды и прокипяченную воду с таким расчетом, чтобы конечная
влажность подготовленной таким образом питательной среды была
в пределах 58—60%.
Оборудование для стерилизации твердых питательных сред.
Промышленный стерилизатор Укргипропрода
(рис. 14) имеет горизонтальный стальной корпус корытообразной
формы и полусферическую крышку, на которой расположены люки
для загрузки, штуцеры для подачи стерильной воды, для подачи
•обеспложенного воздуха и для выхода воздуха, гильза для термо-
метра, штуцер для манометра и предохранительный клапан. В бо-
ковой части имеются штуцеры для подачи пара, для выхода конден-
сата и промывных (ВОД.
Стерилизатор снабжен водяной рубашкой. Внутри аппарата
имеются два вала с лопатками, расположенными под углом 45°, ко-
торые приводятся в движение от электродвигателя мощностью
10 кет через редуктор типа РМ-650 1—ЗК. Число оборотов мешалок
123
Д-А
1011
1370
Рис. 14. Стерилизатор твердых пита-
тельных сред Укргипропрода:
1 — крышка; 2 — штуцер для подачи сте-
рильной воды; 3 — люки для мойки и за-
грузки посевной культуры; 4 — люк для
загрузки сырья; 5 — воздухоотвод; 6 —
штуцер для подачи пара; 7 — вал с лопа-
стями; 8—корпус стерилизатора; 9—водя-
ная рубашка; 10 — штуцер для спуска про-
мывных вод; 11 — разгрузочный люк; 12 —
штуцер для конденсата.
to
СП
19—23 в минуту. Емкость стерилизатора рассчитана на единовре-
менную загрузку 300—350 кг в пересчете на суховоздушные отруби..
Внутрь стерилизатора через перфорированный конус, располо-
женный в днище вкладыша, подается острый пар, часть которого1
конденсируется и остается в аппарате, а другая (большая) часть
выводится ino спускному штуцеру. По окончании стерилизации по-
дачу острого пара перекрывают и в рубашку подают снизу холод-
ную воду. Штуцер для выхода воды в верхней части рубашки дол-
жен быть всегда открыт, так как аппарат не рассчитан на работу
под избыточным давлением. При перекрытии выходного водяного
штуцера в рубашке создается избыточное давление, стенки аппара-
та деформируются и мешалки вращаться не могут. Из напорных ба-
ков, расположенных над стерилизатором, подают по трубопроводу
заранее подготовленную охлажденную стерильную воду.
Загрузка посевной культуры в стерилизатор — весьма ответст-
венная операция, так как при выполнении ее вручную в воздух вы-
деляются конидии гриба. Для устранения этого явления предложе-
но простое приспособление в виде герметизированной кассеты, ис-
пользуемой также при разгрузке посевных кювет в манипуляторе.
В случаях засева среды суспензией конидий над стерилизатором
устанавливается аппарат для ее приготовления.
Опыт поверхностного выращивания культур плесневых грибоа
показал, что стерилизатор Укргипропрода имеет существенные не-
достатки. Он не рассчитан на работу при избыточном давлении (по-
рядка 1,5 ат, или 147 кн/м2) и поэтому не может обеспечить надеж-
ной стерилизации. Сальники мешалок не достаточно герметичны и
среда пробивается наружу; выгрузить ее полностью также не
удается.
КБ ВНИИФСа разработало стерилизатор, аналогичный по уст-
ройству стерилизатору Укргипропрода, но лишенный его конструк-
тивных недостатков и рассчитанный на работу под избыточным дав-
лением до 230 кн!м2. Емкость его по отрубям 450 кг. Основное
преимущество стерилизатора ВНИИФСа — надежная стерилизация
отрубей.
Рассмотрим некоторые другие устройства для стерилизации пи-
тательных сред. В Советском Союзе и странах СЭВ — Чехослова-
кии, Венгрии, ГДР — серийно выпускаются механические смесители
типа СМ емкостью от 5 до 2000 л, предназначенные для перемеши-
вания разнообразных паст, клея, мягких кашеобразных и пластичес-
ких масс и т. п.
Смеситель представляет собой аппарат корытообразной формы
из стали либо нержавеющей стали с полусферической крышкой,
снабженный паровой рубашкой. Внутри него размещены два гори-
зонтально расположенные зетообразные лопастные валка, враща-
ющиеся в противоположные стороны со скоростями 35 и 50 об!мин.
Валки приводятся в движение от электродвигателя через редуктор;
возможен и реверсивный привод. С помощью гидравлического*
насоса и особого механизма аппарат легко опрокидывается за
126
30—40 сек в пределах до 110°. Допустимое рабочее давление в ру*
башке корыта аппарата 6—10 ат (588—981 кн!м2), что позволяет
вести стерилизацию теплом радиации.
Испытания СМ во ВНИИФСе показали, что стерилизация отру-
бей теплом радиации при периодическом перемешивании по ре-
зультатам аналогична стерилизации непосредственно паром. Недо-
статки аппаратов типа СМ: периодичность действия, неудобство-
выгрузки среды при опрокидывании аппарата и малая производи-
тельность.
Стерилизатор ВНИЭКИпродмаша. Аппарат
(рис. 15) разработан Всесоюзным научно-исследовательским эк-
спериментальным институтом продовольственного машиностроения.
В отличие от стерилизатора Укргипропрода он имеет внутри цилин-
дрического корпуса сдвоенный полуцилиндр, в котором вращаются
в противоположные стороны два лопастных шнека. Аппарат рас-
считан на работу при избыточном давлении 2 ат (196 кн!м2), и сте-
рилизацию острым паром при температуре 120°С можно проводить
в две стадии: на первой стадии острый пар -подается для тепловой
обработки среды, а конденсат выпускается через спускной штуцер;
на второй стадии выход конденсата перекрывается и давление в
аппарате повышается до 1,5 ат (147 кн!м2).
Стерилизатор рассчитан на единовременную загрузку 400 кг от-
рубей при эксплуатационном цикле 5—6 ч на одну загрузку.
Техническая характеристика стерилизатора ВНИЭКИпродмаша
Количество единовременно загружаемых отру-
бей, кг...................................... 400
Производительность, кг]сутки................... 1600
Допускаемое избыточное давление:
ат............................................... 2
кн!м2............................................. 196
Температура стерилизации, °C........................ 120
Число оборотов мешалок в минуту...................... 15
Материал аппарата.............................. Ст. 3
Масса, кг............................................ 8000
Электродвигатель:
тип............................................ НО-62—4
мощность, кет •................................... 10
число оборотов в минуту.......................... 1460
Размеры, мм:
диаметр......................................... 1800
длина............................................ 2700
Недостатки этого стерилизатора: громоздкость, неполное переме-
шивание и малая поверхность охлаждения.
127
Рис. 15. Стерилизатор ВНИЭКИпродмаша:
/ — корпус; 2 — штуцер для подачи воды в аппарат; 3 — люк для загрузки сырья и посевной культуры; 4 — воздушник; 5 — вал с ло-
пастями; 6 — штуцер для спуска промывных вод; 7 — разгрузочный люк; 8—водяная рубашка; 9 — штуцер для подачи пара; 10 — шту-
цер для выхода воды из рубашки.
Вертикальный стерилизатор. Для стерилизации твер-
дых сред А. П. Левчик, И. А. Самохин и др. предложили приме-
нять вертикальный стерилизатор (рис. 16). Он представляет собой
Рис. 16. Вертикальный стерилизатор:
/—корпус; 2 — рубашка; 5 —вал; 4 — лопасть перемешивающая;
5 — лопасть сбрасывающая; 6 — люк разгрузочный; 7 — смотровое
окно; 8 — люк загрузочный; 9 — штуцер для предохранительного
клапана.
цилиндроконический сосуд емкостью 1,6 м3, рассчитанный на едино-
временную стерилизацию 500 кг отрубей при увлажнении их до
30%. Для предотвращения конденсации пара на стенках и связан-
9—826
129
ного с этим налипания отрубей аппарат снабжен паровой рубаш-
кой. Внутри него по всей высоте проходит мешалка с винтообраз-
ными лопастями оригинальной конфигурации: нижняя полость ло-
пасти расположена горизонтально, а верхняя наклонена под опре-
деленным углом. Отруби передвигаются по ее наклонной плоскости
и таким образом перемешиваются. Расход электроэнергии на пере-
мешивание не превышает 1 кет.
Пар поступает в стерилизатор через полый вал и полую лопасть.
Выходное отверстие для пара расположено в зоне пересыпания от-
рубей и поэтому не забивается >цми, что обеспечивает хороший кон-
такт пара с отрубями.
Лопасть такой конфигурации имеет очень малое лобовое сопро-
тивление и не прессует отруби.
В конусной части стерилизатора расположено приспособление,
обеспечивающее беспрепятственную выгрузку простерилизованных
отрубей.
Из вертикального стерилизатора отруби поступают во вторую
ступень — горизонтальный шнековый аппарат, состоящий из трех
секций труб, соединенных последовательно. Корпуса всех секций
снабжены водяной рубашкой.
В первой секции производится доувлажнение среды охлажден-
ной стерильной водой до 40—50 %-ной влажности и снижение тем-
пературы до 40—50°С. При дальнейшем перемещении среды в нее
подается суспензия конидий гриба или глубинная -посевная культу-
ра, которая перемешивается со средой до однородного состояния
и при этом увлажняется до 60%.
Вертикальный стерилизатор успешно испытан в заводских ус-
ловиях. Преимущество его перед горизонтальным — незначитель-
ная энергоемкость, недостаток — громоздкость (высота 4500 мм) и
периодичность действия.
Гипроспиртвино по заданию ВНИИФСа разработаны циклич-
ные и непрерывнодействующие стерилизаторы отрубей шнекового
и вибрационного типа.
Цикличный стерилизатор. Цикличный шнековый стери-
лизатор (рис. 17) состоит из двух ступеней: верхней, -в которой про-
водится стерилизация, и второй, нижней, ступени, предназначенной
для доувлажнения, охлаждения, засева и перемешивания. Верхняя
ступень состоит из трех секций труб 0 426 мм, соединенных после-
довательно. В корпусе верхней ступени расположен вал с лопатка-
ми, скорость движения его 6 оборотов в минуту. Корпуса всех трех
секций верхней ступени снабжены паровой рубашкой, в которую
подается пар давлением по манометру 5—6 ат (49<Х—589 кн!м2).
Для нагрева и стерилизации отрубей используется тепло ради-
ации. Для обеспечения равномерного нагрева и непрерывного пере-
мешивания отрубей на валу шнека установлены тормозные лопатки
(1—2 лопатки через каждые 5—7 направленных лопаток).
130
Между верхней и нижней ступенью расположен выдерживатель,
представляющий собой аппарат с коническим днищем, снабженный
паровой рубашкой. В конусной части его размещена мешалка. В
выдерживателе отруби находятся заданное время при температуре
125°С, после чего через дозатор турникетного типа поступают в ниж-
нюю, или вторую, ступень.
Рис. 17. Цикличный шнековый стерилизатор:
/ — бункер для сырья; 2 — дозатор сырья; 3 — штуцер для подачи пара; 4 — стерилизатор;
5—паровая рубашка; 6 — накопитель; 7 — дозатор; 8 — штуцер для подачи стерильной
воды; 9 — водяная рубашка; 10 — дозатор стерильной воды с суспензией посевной куль-
туры; 11 — штуцер для выгрузки стерильной среды; 12 — привод шнека увлажнителя;
13 — привод шнека стерилизатора.
Конструктивно нижняя ступень аналогична верхней, корпус ее
снабжен пароводяной рубашкой. В рубашку первой секции нижней
ступени подается пар, а в аппарат — 0,1н. раствор соляной кисло-
ты. В рубашку последующих двух секций нижней ступени подает-
ся холодная вода, а в аппарат —стерильная вода и суспензия ко-
нидий. Длительность цикла стерилизации 500 кг отрубей 5 ч.
131
Техническая характеристика цикличного стерилизатора
Производительность, кг/ч:
стерилизатора (верхней ступени) . . . 150
увлажнителей (второй ступени) .... 250
Емкость выдерживателя, м3................... 2
Скорость движения вала с лопатками, об!мин:
стерилизатора ... .................. 6
увлажнителя............................ 18
Габариты, мм................................... 7000 X 2000 X 3000
Производственные испытания цикличного стерилизатора на
Мичуринском экспериментальном ферментно-спиртовом заводе по-
казали возможность стерилизации сухих сред теплом радиации.
Культура гриба Asp. awamori (штамм 22), выращенная на отрубях,
простерилизованных глухим паром, имела активность, близкую к
контролю, рыхлую, рассыпчатую структуру. По-видимому, при су-
хой стерилизации отрубей тормозится процесс клейстеризации
крахмала и поэтому вначале развитие мицелия затрудняется.
Вибростерилизатор. Непрерывно действующий стерилизатор
вибрационного типа (рис. 18) состоит из горизонтального гермети-
чески закрытого желоба, установленного на раме с помощью стек-
лопластиковых рессор; эксцентрикового вибратора, расположенного
в средней части желоба; муфелей, уплотняющих устройств, пропу-
щенных через стенки муфеля; бункера для сырья и приборов кон-
троля.
Желоб по длине разделен на три части: загрузочную, которая
выполняет функции дозатора, стерилизационную, .расположенную
в муфеле, где происходят нагрев и стерилизация среды при темпе-
ратуре 130—140°С, и засевную, расположенную в другом муфеле; в
этой части стерилизатора происходит охлаждение и увлажнение с
помощью холодной стерильной воды, засев среды и ее перемеши-
вание.
Воздушно-сухие пшеничные отруби из бункера поступают в за-
грузочную часть вибростерилизатора. Высота слоя устанавливает-
ся с помощью регулирующего шибера. Дозирование отрубей регу-
лируется частотой колебаний, сообщаемых вибратором желобу
вибростерилизатора. Отруби или другое сырье, перемещаясь не-
прерывно по виброжелобу, стерилизуются теплом радиации при ус-
тановленной температуре и, попадая в засевную часть, охлажда-
ются водой, поступающей в змеевики, а также стерильной холодной
водой, предназначенной для смешивания с отрубями и их увлаж-
нения. После охлаждения в аппарат подается дозированное коли-
чество суспензии конидий гриба и за счет виброимпульсов, непре-
рывно сообщаемых желобу вибратором, происходит интенсивное
перемешивание среды. Подача стерильной питательной среды в
растильную камеру дозируется этим же вибростерилизатором.
132
13 12
Рис. 18. Вибрационный стерилизатор:
/ — штуцер для подачи продукта; 2 — каркас; 3 — теплоизоляционные плиты; 4 — нагреватель трубчатый; 5 — лоток вибрацион-
ный; 6'— трубы для разбрызгивания стерильной воды; 7 — шту цер для подачи посевной культуры; 8 — штуцер для выхода
продукта; 9 — упругие связи; 10 — рама; // — вибратор; 12— вариатор; 13 — электродвигатель.
Техническая характеристика вибростерилизатора
Производительность по культуре гриба, т!сутки . 3,5
Температура стерилизации, °C.................. 120—140
Частота колебаний, гц . . .... 5—29,5
Амплитуда колебаний, мм ....... 4
Электродвигатель:
тип ........................................... АО51-4
мощность, кет.......................... 4,5
число оборотов в минуту........................ 1440
Вариатор............................................. ВЦ4
Диапазон регулирования.............................. 6
Габариты, мм ;................................ 14000X1500X1400
Масса, кг . .......................... . 5840
Описанные стерилизаторы-'предназначены для проведения сте-
рилизации открытым или глууим паром. В некоторых специальных
случаях применяют вакуум-стерилизаторы, в которых вакуум-насо-
сами создается остаточное давление порядка 399 н!м2. При стери-
лизации сухим жаром в стерилизационном аппарате создается при-
нудительный вихревой поток, горячего воздуха с температурой по-
рядка 140—150°С и механическое перемешивание среды, что способ-
ствует быстрому и равномерному нагреву.
Новые способы стерилизации питательных сред. Представляет
интерес разработка новых конструкций стерилизаторов, основанных
на применении современных способов обработки питательных сред.
Обработка сред токами высокой частоты. Экс-
периментально доказано, что токи высокой частоты обладают спо-
рицидным действием. Под их действием при нагревании до 150°С
конидии полностью погибают за несколько минут. Механизм тепло-
вого воздействия токов высокой частоты отличается от общеприня-
того процесса нагревания тем, что все молекулы тела нагреваются
одновременно, независимо от того, находятся ли они внутри или на
поверхности данного тела.
В настоящее время в зависимости от электрических свойств ма-
териала широко пользуются двумя способами высокочастотного
нагрева: индукционным нагревом в магнитном поле для проводни-
ковых материалов и нагревом в электрическом поле для непровод-
никовых материалов. К непроводниковым материалам относятся
различного рода пищевые продукты, пластмассы, древесина, бумага
и т. п. Нагрев такого материала проводится между пластинами кон-
денсатора или путем облучения электромагнитной волной перед
волноводом.
Технический эффект воздействия токов высокой частоты объяс-
няется изменением внутриатомных и внутримолекулярных сил.
Предполагают, что при внесении в электрическое поле заряды ди-
электрика смещаются, попеременно деформируя молекулы. Частота
приложенного электрического поля определяет количество дефор-
маций молекул в секунду. Каждое изменение направления поля вле-
чет за собой генерирование некоторого количества тепла. Чем вы-
134
ше частота этих изменений, тем большее количество тепла генери-
руется в единицу времени.
Известно, что выбор способа высокочастотного нагрева зависит
от электрофизической характеристики объекта, его диэлектрической
проницаемости (е7) и тангенса угла потерь (tg б). Первая характе-
ристика выражает степень поляризуемости объекта, определяющую
ту часть электромагнитной энергии, которая непосредственно прев-
ращается в тепло.
Электрофизическая характеристика питательных сред зависит
от температуры, влажности, частоты поля, величины приложенного
напряжения и др. Питательные среды, применяемые для выращи-
вания плесневых грибов поверхностным способом, по электропро-
водности относятся к полупроводникам. Голгер Л. И., Боим Б. М.
и др. определяли электрофизические свойства пшеничных отрубей,
свекловичного жома, солодовых ростков и их смесей влажностью
10—12%. Ими установлена функциональная зависимость величины
диэлектрической постоянной и тангенса угла потерь от частоты по-
ля и температуры.
При изменении температуры среды от 20 до 150°С в диапазоне
частот от 10 до 40 мгц величина диэлектрической постоянной сухо-
воздушных пшеничных отрубей изменяется от 2,8 до 1,8. Изменение
частоты поля существенно не влияет на величину диэлектрической
постоянной. Диэлектрическая постоянная свекловичного жома рав-
на 2 при частоте 10 мгц и температуре 20°С; 0,7 при 18 мгц и 160°С.
Изменение частоты поля до 40 мгц при температуре 160°С приводит
к увеличению диэлектрической постоянной до 1,3. Максимальная
величина диэлектрической постоянной среды из 50% отрубей и
50% свекловичного жома составляет 2,5 при температуре 20°С и
1,5 при 150°С. Для среды из 80% пшеничных отрубей и 20% соло-
довых ростков диэлектрическая постоянная составляет соответст-
венно 2,7 при 20°С и 2,0 при 150°С. Максимального значения она до-
стигает при частотах 10 и 30 мгц.
Тангенс угла потерь суховоздушных пшеничных отрубей равен
0,015 при частоте поля 10 мгц и 0,02 при 40 мгц. Соответственно
для свекловичного жома 0,012 и 0,014. Для смеси из 50% отрубей
и 50% свекловичного жома tg 6 = 0,013-4-0,017, а для смеси из 80%
отрубей и 20% солодовых ростков 0,014—0,02. Тангенс угла потерь
солодовых ростков имеет наименьшую величину 0,005 при частоте
поля 10 мгц и достигает 0,012 при частоте 30 мгц.
Опыты ВНИИФСа по стерилизации пшеничных отрубей (влаж-
ностью 10—12%) токами высокой частоты в статических и динами-
ческих условиях показали, что при внесении отрубей в электриче-
ское поле, создаваемое между обкладками конденсаторов с рассто-
янием в 30 мм, при напряженности поля в объекте 300 в/см, частоте
13 мгц и длине волны 23 м температура отрубей устанавливается в
пределах до 120°С. При этих параметрах и экспозиции от 120 до
300 сек во ВНИИФСе и ВНИИКОПе достигнута стерильность воз-
лушно-сухих отрубей.
135
Опыты показали, что при обработке воздушно-сухих отрубей то-
ками высокой частоты в статических условиях и нагреве до 140°С
в течение 180 сек материал становится стерильным. Отруби, про-
стерилизованные токами высокой частоты, увлажняли стерильной
водой и засевали посевной культурой Asp. oryzae И-476, после чего
ставили в термостатную комнату (30°С) на 36 ч для выращивания
гриба и проверки активности. Контрольные опыты ставили на отру-
бях, простерилизованных паром в автоклаве в течение часа при из-
быточном давлении 1 ат (98 кн!м2).
Сравнение показывает, что культура гриба Asp. oryzae И-476,
выращенная на отрубях, стерилизованных токами высокой частоты,
не уступает по активности культуре, выращенной на отрубях, сте-
рилизованных паром.
Опыты стерилизации питательных сред токами высокой частоты
в динамических условиях при температуре 150°С в течение 2 мин по-
казали полную стерильность всех проб.
Испытания выявили возможность стерилизации сухих сред тока-
ми высокой частоты в непрерывном потоке и получения высокоак-
тивных культур плесневого гриба.
На основании испытаний во ВНИИФСе и ВНИИКОПе разрабо-
тана техническая документация на непрерывнодействующий высо-
кочастотный стерилизатор производительностью 100 кг!ч.
Высокочастотный стерилизатор непрерывного дей-
ствия (рис. 19) состоит из высокочастотного генератора, загрузоч-
/ г з у 5 в
11 Ю 9
Рис. 19. Непрерывнодействующий высокочастотный стерилизатор:
/ — каркас; 2 — загрузочный бункер с роторным дозатором; 3 — токоведущая шина;
-/ — механизм перемещения пластин конденсатора; 5 — пластины конденсатора; 6 —
ленточный транспортер; 7 — дозатор стерильной воды; 8 — дозатор посевной суспен-
зии; 9 — двухсекционный шнек; 10 — привод шнека; 11 — привод ленточного транспор-
тера.
ного бункера, дозатора отрубей, герметизированной и экранирован-
ной камеры, ленточного термоустойчивого транспортера, переме-
щающегося между пластинами конденсатора, питаемыми высоко-
частотным генератором, стерильного приемного бункера и смесите-
136
ля. С помощью специального устройства расстояние между пласти-
нами конденсатора можно изменять от 15 до 100 мм, а с помощью
шиберного устройства — устанавливать заданную высоту слоя от-
рубей.
Отруби из приемного бункера поступают на транспортерную
ленту и, проходя между пластинами конденсатора, нагреваются в
течение 3—5 мин до 135—140°С. После этого их охлаждают, сме-
шивают со стерильной водой, засевают и направляют в растильный
агрегат.
Преимущества высокочастотной стерилизации: сокращение дли-
тельности технологического цикла, обеспечение непрерывности про-
цесса, экономия производственной площади, повышение чистоты и
культуры производства.
Многочисленные литературные и экспериментальные данные
подтверждают возможность применения ультразвуковых колебаний
для дезинфекции и стерилизации. Хорошие результаты достигнуты
в жидких средах. Стерилизация инфракрасными лучами применяет-
ся в химико-фармацевтической промышленности СССР и за рубе-
жом. Возможность применения ультразвуковых колебаний и
инфракрасных лучей для стерилизации питательных сред при вы-
ращивании культур плесневых грибов поверхностным способом
еще не исследована.
Обработка ионизирующими излучениями. В оте-
чественной и зарубежной литературе широко освещены бактерицид-
ные свойства ионизирующих излучений большой энергии, их прони-
кающая способность и применяемые установки. Установлено, что
вся микрофлора практически погйбает при ионизации 1,5—3,0
млн. рад.
ВНИИФСом исследована стерилизация твердых питательных
сред на линейном ускорителе электронов в 5 млн. электроновольт
ЛУЭ-5-1 во Всесоюзном научно-исследовательском институте кон-
сервной и овощесушильной промышленности. Твердые питательные
среды: воздушно-сухие пшеничные отруби, свекловичный жом, луз-
га, солодовые ростки, смесь из 50% отрубей и 50% свекловичного
жома и биошрот — упаковывали в мешочки из пленки ПЦ-2 разме-
ром 100X130 мм, концы которых заваривали. Пакеты, подвешен-
ные к цепному транспортеру, при прохождении мимо лучевой труб-
ки линейного ускорителя облучались ускоренными электронами в
дозах от 0,5 млн. до 5 млн. рад с интервалом в 0,5 млн. рад. Облу-
ченные среды подвергали микробиологическому контролю.
Опыты показали, что отруби влажностью 60% с исходной обсе-
мененностью 1-Ю8 бактерийна 1 г становятся стерильными после об-
работки дозой 500 тыс. рад. Лузга и биошрот, содержавшие до об-
лучения 3,2*105 и i2,64О8 бактерий на 1 г, становятся стерильными
после облучения дозой 1 млн. рад. Для всех остальных сред опти-
мальная доза 2 млн. рад.
На полученных таким способом стерильных питательных средах
выращивали плесневые грибы, засевая их посевными культурами
137
Asp. oryzae И-476 и Asp. niger. Выращивание проводилось в термо-
стате в течение 36—48 ч, после чего проверяли ферментативную
активность культуры.
В контрольных опытах использовали отруби, стерилизованные в
автоклаве при избыточном давлении 1 ат (98 кн!м2) в течение часа.
Как выяснилось, гриб Asp. niger, выращенный на питательной
среде, подвергнутой облучению ускоренными электронами в дозах
от 2 до 4 млн. рад, не уступает по активности культуре, выращенной
на отрубях, обработанных паром.
Институтом ядерной физики Сибирского отделения АН СССР
разработаны и изготавливаются ускорители заряженных частиц
большой интенсивности излучений. Они предназначены для про-
мышленных целей; энергия электронов составляет 1,5—2,5 млн. эв,
мощность 25 кет, что соответствует активности нескольких тонн ра-
дия. Ускоритель питается от электросети напряжением 220 в и по-
сле выключения тока совершенно безопасен. Процессы облучения
ускоренными электронами имеют нулевую активность и поэтому
безопасны. Коэффициент полезного действия ускорителя более
90%, а стоимость радиаций практически равна стоимости электри-
ческой энергии той же мощности.
Техническая характеристика сильноточных электронных ускорителей
Модель № 1 Модель № 2
Энергия ускоренных электронов, мэв . 1,5 2,5
С регулировкой от, мэв.......................0,5 0,5
Средняя мощность в пучке, кет . . 15—25 30
С регулировкой от, кет....................... 1 1
Размеры установки без выпускного устрой-
ства, мм:
диаметр ............................. 1200 1600
высота............................... 2200 ' 4000
Масса, кг .............................. 7000 14000
Коэффициент полезного действия, % . . 90—95 90—95
Электропитание от промышленной сети, гц . 50—60
В будущем представляется рациональной и экономичной орга-
низация централизованной стерилизации сырья для заводов фер-
ментных препаратов с помощью ускорителей и направление его для
дальнейшей переработки в полиэтиленовой таре. Стерильность пи-
щевых продуктов в такой упаковке сохраняется не менее года.
Стерилизация у-л у ч а м и. В последние годы появилось
много работ, посвященных использованию радиоактивных излуче-
ний для целей стерилизации. Отмечаются большие преимущества
стерилизации у-лучами перед обычной термической стерилизацией.
В Институте биофизики АН СССР ВНИИФСом проводились опыты
обработки пшеничных отрубей у-лучами в дозах до 5 млн. рад, кото-
рые дали положительные результаты. Испытания, проведенные на-
ми в ЦНИИКОПе по стерилизации пшеничных отрубей, свеклович-
138
ного жома, картофельной мезги и солодовых ростков у-лучами в до-
зах от 300 тыс. до 3 млн. рад на гамма-установке (рис. 20), закончи-
лись успешно и показали возможность применения такого способа
обеспложивания сред.
Рис. 20. Схема у-установки:
/ — пульт управления; 2 — механизм загрузки объекта; 3 — загрузочный контейнер;
4 — направляющие; 5 — кассеты; 6 — подъемник; 7 — транспортный контейнер; 8 — меха-
нический манипулятор.
Рабочие контейнеры, в которые загружается объект, подлежа-
щий облучению, перемещаются в рабочий зал цепным транспорте-
ром. Кассеты с радиоактивным кобальтом, завальцованным в труб-
ки, находятся под водой на глубине 4,3 м, а в момент облучения
поднимаются, охватывая рабочий контейнер с двух сторон. Дли-
тельность облучения зависит от мощности источника и заданной до-
зы. По окончании облучения кассета опускается в исходное положе-
ние, а рабочий контейнер выводится в операторскую.
Установлено, что пшеничные отруби влажностью 10% становят-
ся стерильными при дозе облучения 0,5 млн. рад. остальные пита-
тельные среды — при облучении дозами 1—2 млн. рад.
Питательные среды, обработанные у-лучами, увлажняли сте-
рильной водой до 60%, засевали посевной культурой гриба Asp.
oryzae И-476. Параллельно ставили контрольный опыт на среде,
стерилизованной паром в автоклаве. Испытания показали, что фер-
ментативная активность культуры, выращенной на средах, обрабо-
танных у-лучами, практически не отличается от активности культу-
ры, выращенной на среде, стерилизованной паром.
Проблема холодной стерилизации у-лучами активно разрабаты-
вается; изучается косвенное действие радиации на пищевые про-
139
дукты и проводится сравнительная оценка различных методов сте-
рилизации.
Обобщая приведенный материал, следует подчеркнуть, что хотя
в настоящее время в производственных условиях уже отрабатыва-
ются оптимальные параметры 4—5 типов стерилизаторов для теп-
ловой обработки сред, перспективность применения современных
способов холодной стерилизации безусловно очевидна.
Оборудование для мойки и стерилизации производственных
кювет. Для выращивания плесневых грибов поверхностным спосо-
бом используется большое количество кювет.
Производственные кюветы размером 600x800x30 мм штампу-
ют из дюралюминия или оцинкованного железа. Для лучшей аэра-
ции питательной среды днище кювет перфорировано и имеет отвер-
стия 1 — 1,5x20 мм с расстоянием между ними 5—6 мм. Опыт по-
казал, что перфорация должна быть по всему днищу, до бортов
кюветы. Применение кювет, у которых даже небольшая часть дни-
ща (1—2 см от бортов) не имеет перфорации, приводило к накап-
ливанию влаги в неперфорированной части кювет и инфицирова-
нию культуры в этих местах.
Емкость одной кюветы при загрузке ее питательной средой
слоем 25 мм в пересчете на воздушно-сухие отруби составляет 2 кг.
Масса пустой кюветы 3,3 кг. Перед загрузкой кюветы должны быть
вымыты и простерилизованы. Моют кюветы как в простых ваннах,
так и в моечных машинах.
В металлических прямоугольных ва,ннах кюветы погружают на
20 мин в горячую (75—80°С) щелочную воду (на 1 л воды 25 г
кальцинированной соды), затем вручную щетками очищают от ос-
татков культуры гриба и ополаскивают горячей водой. В последнее
время для мойки кювет начали применять моечные машины.
Моечная машина конструкции ВНИЭКИпродмаша
(рис. 21) состоит из моечной камеры, механизмов для перемещения
9 3
Рис 21 Моечная машина ВНИЭКИпродмаша:
/—кожух с крышкой; 2 — каркас; 3 — реверсивная лебедка троса;
4 — редуктор.
140
и очистки и системы подачи воды. Рамка из нержавеющей стали с
установленной на ней кюветой перемещается в моечную камеру с
помощью привода 'барабана реверсивной лебедки ^ерез систему
блоков с тросами. Кюветы очищаются сверху и снизу механически-
ми щетками с капроновым ворсом и моются под напором воды, по-
даваемой тремя рядами щелевых форсунок, при перемещении рам-
ки вдоль моечной камеры до упора; затем лебедка переключается
на обратный ход, рамка с кюветой перемещается через моечную
камеру в исходное положение и вновь обрабатывается щеткой и
водой.
Техническая характеристика моечной машины
Производительность, кювет в час .... 200
Расход воды, л3/ч.......................... 12
Напор воды, кг/л2........................ 490
Мощность электродвигателя, кет .... 0,6
Габариты, мм................................... 2000 X 900X1400
Производственные испытания машины показали ее работоспо-
собность при условии предварительного замачивания кювет в моеч-
ной ванне.
Использование моечной машины позволяет облегчить эту весьма
трудоемкую операцию, но машина нуждается в дальнейшем кон-
структивном совершенствовании.
Стерилизация кювет проводится в герметизированных камерах
или в специальных стерилизаторах кювет.
Стерилизационная камера представляет собой гер-
метизированное помещение, по периметру которого расположены
трубы диаметром 75 мм; общая поверхность их должна обеспечить
заданную температуру. В трубы подается пар давлением 6 ат
(588 кн!м2). Камера снабжена герметически закрывающимися двер-
цами с двойными стенками, между которыми проложен слой тепло-
изоляции. Кюветы укладывают в стерилизационную камеру в гори-
зонтальном или вертикальном положении. Единовременно в камеру
загружают до 300 кювет. Пар периодически отсасывается вентиля-
тором.
В стерилизационных камерах, эксплуатируемых на Вышне-
волоцком и Московском опытных заводах, температура стерилиза-
ции явно недостаточна и достигает всего 100°С.
Стерилизатор кювет. ВНИИФСом разработана конст-
рукция стерилизатора производственных кювет (рис. 22), который
представляет собой сварную камеру из угловой стали. Стенки и по-
толок камеры обшиты листовой сталью. Внутри расположены обо-
гревательные поверхности, состоящие из системы стальных труб.
Расстояние между секциями труб позволяет устанавливать 500 кю-
вет в вертикальном положении. Трубы служат опорой для кювет и
одновременно поверхностью нагрева. Камера оборудована двумя
герметически закрывающимися дверцами. Стены и дверцы двойные,
141
с прокладкой из теплоизоляционного материала. Для охлаждения
кювет после стерилизации подводится обеспложенный воздух. Сте-
рилизатор успешно эксплуатируется в ферментном цехе Рассказов-
ского спиртового завода.
Рис. 22. Стерилизатор производственных кювет:
1 — каркас; 2 — листовая обшивка; 3 — дверь; 4 — коллектор; 5 — обогре-
вательные трубки tfg ==57 мм; 6 — кюветы; 7 — вытяжное устройство.
Техническая характеристика стерилизатора производственных кювет
Поверхность нагрева, м2 ...... 60
Расположение кювет..............................Вертикальное
Температура стерилизации, °C........................ 130
Габариты, мм.................................. 550X2200X2200
Масса, кг ......................................... 3750
Конвейерная линия. ВНИИФСом разработана и сдана в
эксплуатацию Тукумскому заводу ферментных препаратов конвей-
ерная линия для механической мойки, стерилизации и заполнения
кювет средой. Она состоит из трех секций (рис. 23), через которые
по туннелю последовательно с помощью цепного транспортера пе-
редвигаются кюветы.
142
В первой 'секции кюветы обмываются снизу и сверху водой, очи-
щаются с помощью капроновых щеток от остатков культуры гриба,
а затем ополаскиваются водой. Во второй секции они со всех сто-
рон стерилизуются 2%-ным раствором формалина, а затем бакте-
рицидными лучами ламп БУВ-30.
Из секции стерилизации кюветы попадают в секцию сушки, где
сушатся встречным током горячего воздуха (120°С), после чего
охлаждаются и поступают под дозатор для заполнения стериль-
ной питательной средой. Производительность линии может изме-
няться от 150 до 300 кювет в час (150, 200, 240 и 300) в зависимости
от скорости движения транспортера.
Техническая характеристика конвейерной линии
Температура моющей .воды, °C......................... 55
Расход лара, кг/ч:
на подогрев воды................................ 230
на подогрев воздуха в калориферах . . 300
Давление пара:
ат................................... 6
кн!м2 . z........................... 588
Расход воздуха, л3/ч . . .............. 530
Насос для секции мойки кювет:
тип................................ 2К-6а
производительность, ж3/ч ...... 10
напор, кг!м2........................ 294
мощность электродвигателя, кет ... 2,8
Число калориферов типа КФБ-7.......................... 3
Вентилятор..........................................ЦЧ-70 № 5
Габариты, мм................................... 11500X1240X2405
Масса, кг.......................................... 2722
Конвейерная линия может быть разделена на две-три независи-
мые машины: моечную, сушильную и наполняющую кюветы средой.
Дозаторы питательной среды
Раскладка питательной среды по кюветам — очень трудоемкая
операция. Для механизации ее разработаны специальные дозиру-
ющие устройства.
Дозатор ВНИИФСа (рис. 24) представляет собой аппарат, в
корпусе которого расположены дозирующий барабан с восьмью гре-
бенками и барабан-разрыхлитель с четырьмя гребенками. Скорость
вращения их различна, вследствие чего одновременно с подачей
материала происходит его разрыхление. Зубья гребенок дозирую-
щего барабана при вращении захватывают стерильную питательную
среду из бункера слоем до 15 мм и перемещают ее к выходному па-
трубку. Зубья гребенок барабана-разрыхлителя, двигаясь с боль-
шой скоростью между зубьями гребенок дозирующего барабана,
непрерывно снимают с него небольшое количество среды и переда-
ют ее на движущуюся под ним кювету шириной, равной длине гре-
бенки.
143
144
0—826
Рис. 23. Конвейерная линия ВНИИФСа для мойки стерилизации и заполнения кювет средой:
/ — натяжная станция; 2 — стол для приемки кювет; 3 — камера мойки; 4—рривод к щеткам; 5 — камера
стерилизации антисептиком; 6 — камера стерилизации бактерицидными лампами; 7 — камера сушки
воздухом; 8 — приемный бункер для питательной среды; 9 — дозатор среды; 10— привод конвейера;
11—рольганг; /2 — привод для циркуляции антисептика; 13 — привод для циркуляции воды; 14 — бак с
фильтром для воды.
Разрез Щ-Щ Разрез hl
Рис. 24. Дозатор ВНИИФСа:
1- барабан с восьмью гребешками; 2 — корпус; 3 — барабан с четырьмя гребешками; 4 — вал барабана
Дозатор может быть применен как для непрерывного, так и для
периодического перемещения кювет. В последнем случае на приво-
де следует установить магнитную муфту, включением и отключе-
нием которой регулируется заполнение кювет.
Испытание дозатора в опытной технологической линии показало
его надежную работоспособность.
Техническая характеристика дозатора ВНИИФСа
Производительность, кювет в час, при числе обо-
ротов барабана:
3,2...................................... 120
5,3.................................... 200
Высота слоя отрубей в кювете, мм .... 25—30
Число оборотов барабаи^-разры.хлителя в минуту 350
Габариты, мм ... ^................1145X435X1830
Масса, кг.................................. 274
Электродвигатель:
тип..................................................АОТ 41—6
мощность, кет.............................. 0,6
число оборотов в минуту.................... 960
Дозатор ВНИЭКИпродмаша представляет собой стол, над ко-
торым расположен подвижный бункер, получающий возвратно-по-
ступательное движение вдоль стола от лебедки через трос. Бункер
не имеет дна и содержимое его поддерживается только крышкой
стола. Он шарнирно соединен с разгрузочным патрубком стерили-
затора. Внутри бункера расположена валковая дробилка для из-
мельчения среды, поступающей из стерилизатора. Валки приводят-
ся в движение электродвигателем и вращаются в противоположные
стороны. В центральной части стола имеется вырез для установки
кюветы, по размеру соответствующий ее габаритам.
Установив кювету в вырез стола, включают приводную лебедку.
При перемещении подвижного бункера вдоль стола кювета запол-
няется засеянной стерильной питательной средой. После возвраще-
ния бункера в исходное положение привод лебедки выключают,
заполненную кювету извлекают и технологическая операция пов-
торяется.
Производительность дозатора 200 кювет в час. Габариты 1400Х
X 2200x900 мм.
Вибродозатор. Вибродозатор (рис. 25) состоит из приемного
бункера, лотка, установленного на наклонных под углом 30° плоских
рессорах, электромагнитного вибратора, расположенного на лотке
под углом 30°, и рамы. Питательная среда из бункера под действи-
ем вибрации, сообщаемой лотку вибратором с амплитудой колеба-
ний 1 мм и частотой до 50 гц в минуту, перемещается по лотку; ши-
рина котброго обычно'несколько меньше или равна ширине кюветы.
Изменение производительности аппарата регулируется частотой ко-
лебаний, которая зависит от величины подводимого напряжения, ус-
танавливаемого реостатом в нужных пределах.
147
В настоящее время Цхинвальский завод «Электровибромашина»
Грузинской ССР серийно изготавливает вибропитатели ПЭВ.
Проектом ГОСТа предусматривается выпуск следующих пяти
типоразмеров электромагнитных легких вибропитателей ПЭВ.
Рис. 25. Вибропитатель-дозатор:
/ — электромагнитный вибратор; 2 — желоб.
ПЭВ-1 ПЭВ-2 ПЭВ-З ПЭВ-4 ПЭВ-5
Ширина лотка, мм 125 180 250 360 500
Максимальная производительность,
м?1ч 1,75 5 11 20 45
Максимальная величина гранул
транспортируемого материала, мм 45 60 85 120 170
Напряжение, в 220 220 220 220 220
Сила тока, а 3 5 10 15 30
Масса, кг 40 60 85 155 330
Электромагнитные вибропитатели могут применяться для пода-
чи отрубей, свекловичного жома, лузги, картофельной мезги, сте-
рильной питательной среды, выращенной культуры гриба и других
видов сырья и полупродуктов ферментного производства в различ-
ные технологические узлы и линии дозированными порциями перио-
дически или непрерывно. Вибролоток питателя-дозатора должен
быть герметически закрыт.
Питатели с электромагнитным приводом конструктивно просты,
надежны в экоплуатации; производительность их можно регулиро-
вать в широких пределах.
148
Выращивание производственной культуры
Растильные камеры. Растильные камеры представляют собой
обособленные помещения размерами 2,8x2,5x9,0 м. В одну камеру
загружается 16—20 этажерок с 18 кюветами на каждой. Камеры
герметично закрываются двумя дверьми и снабжаются очищенным
и кондиционированным воздухом, который специальными устройст-
вами распределяется по всем зонам камеры со скоростью 1 —
2 м!сек.
Перед загрузкой растильные камеры убирают и моют; не реже
одного раза в декаду проводят побелку стен и потолков известью
с медным купоросом или другим антисептиком и обработку полов
хлорной известью.
Кюветы, этажерки и растильные камеры перед началом каждо-
го цикла подвергают стерилизации парами формалина. Длитель-
ность выращивания около 48 ч.
Выращивание гриба Asp. oryzae И-476 протекает следующим
образом. Первые 8—10 ч после посева происходит набухание и про-
растание спор; в это время дыхание гриба и связанное с ним выде-
ление тепла практически неощутимы, температура поддерживает-
ся на уровне 32°С путем двух-трехкратного обмена кондициониро-
ванного (относительной влажностью 95—98%) воздуха в час. Затем
температура в среде начинает повышаться, и к 14—15 ч образуется
уже видимый глазом мицелий гриба. Тепловыделение и выделение
углекислоты усиливается, температура прорастающей среды дости-
гает 38—42°С. Начиная с 10-го часа после посева температуру по-
даваемого воздуха постепенно снижают и к 15—16-му часу дово-
дят ее до 27—28°С, а относительную влажность воздуха повышают
до 100%; при этом количество свежего воздуха составляет 10% ко
всему рециркулирующему. На 15—18-м часах роста на каждый ки-
лограмм содержащейся в камере питательной среды (в пересчете
на воздушно-сухое вещество) подается максимальное количество
(20 м?/ч) кондиционированного воздуха. С 22-го часа выделение
тепла резко уменьшается и через 24—26 ч культура гриба считается
готовой; при этом влажность ее достигает 38—40%.
Во ВНИИФСе изучалась энергетика процесса выращивания
плесневых грибов на твердых средах, динамика выделения тепла в
процессе развития культур и определена функциональная зависи-
мость аэродинамических и биоэнергетических факторов от перио-
дов развития микроорганизмов. С. П. Колосков приводит математи-
ческое описание вышеупомянутых процессов, высказывая предпо-
ложение, что процессы тепловыделения и газообмена адэкватны
процессу развития микроорганизмов. Опытами с Asp. oryzae пока-
зано, что ощутимое выделение тепла растущей культурой
[10,9 кдж/(кг-ч)] начинается через 3—4 ч после засева среды ко-
нидиями.
По мере развития культуры количество выделяемого ею тепла
возрастает через 12—44 ч от момента обсеменения среды. К 18—
149
19 часу роста выделение тепла достигает максимума 335—
377 кдж!(кг-ч), затем начинает резко снижаться и к моменту окон-
чания роста падает до 21—25 кдж!(кг*ч). Всего за период роста
гриба Asp. oryzae (36 ч) выделяется 3360—3780 кдж в пересчете
на 1 кг исходной среды.
Для расчетов режимов выращивания культур в установках с от-
водом выделяемого тепла водой и другими хладагентами при огра-
ниченном аэрировании для обеспечения биологической потребности
растущей культуры в кислороде С. П. Колосков на основании иссле-
дования предложил следующие формулы.
Среднее значение скорости выделения тепла культурой в течение
часа на 1 кг пшеничных отрубей влажностью 12%
q = Qoek (х“ 'о),
где — начальное значение тепловыделения — количество тепла,
выделенное растущей культурой в течение первого часа;
qQ= 10,9 кдж/(кг-ч);
е — основание натуральных логарифмов;
то — время, после которого начинается тепловыделение;
То = 3,5 ч;
т — текущее время — время от момента засева среды посев-
ной культурой;
k — коэффициент пропорциональности; экспериментально ус-
тановлено, что в период от начала тепловыделения до
максимума 6 = 0,235.
Подставив значения экспериментально найденных величин, по-
лучим
q = 10,9e°’235 ('“3’5> кдж1(кг-ч).
Для периода затухающей жизнедеятельности микроорганизмов
и снижения тепловыделения (по прошествии максимума) среднее
значение скорости выделения тепла культурой равно
q - 370,8 е~0’2 - 18’5) кдж/(кгч),
где 370,8 — среднее значение удельного тепловыделения в часы
максимума, кдж/ (кг-ч) \
18,5 — время в часах от момента засева до окончания макси-
мума тепловыделения;
0,2 — коэффициент пропорциональности, установленный по
опытным данным для периода затухания жизнедеятель-
ности микроорганизмов. Числовые значения коэффици-
ентов справедливы для процессов выращивания гриба
Asp. oryzae.
(Знак минус перед показателем степени поставлен потому, что
положительному значению приращения времени соответствует от-
рицательное значение приращения скорости тепловыделения).
При изучении динамики потребления кислорода растущей куль-
150
турой Asp. oryzae в отсутствии воздухообмена установлено, что по-
глощение кислорода начинается на шестом часу от момента засева
среды. В дальнейшем, по мере повышения интенсивности биологи-
ческих процессов, потребление кислорода быстро возрастает. В пе-
риод между 18-м и 20-м часами от момента засева наблюдается
максимальное потребление, которое затем резко снижается и к
30- 32-му часу становится незначительным.
Количество кислорода, (поглощаемого микроорганизмами в тече-
ние т-го часа от момента засева среды культурой, определяется по
следующей формуле:
V — Vo ek ~ м31(т • ч),
где Vo — количество кислорода, использованное растущей культу-
рой в течение первого часа потребления. В опытах опре-
делено Vo = O,9 ;и3/(т-ч);
то — время от момента засева среды до начала поглощения
кислорода; по опытным данные, то^б ч;
k — коэффициент пропорциональности; среднее значение его
равно 0,195.
Таким образом,
V - 0,9е°’195(х-5) м3/(т ч).
Максимум скорости поглощения кислорода для гриба Asp.
oryzae приходится на период между 18-м и 20-м часом и составляет
11,5 Л!3/(т*ч), после чего потребление кислорода монотонно убывает.
Для этого (периода удельное потребление кислорода определяет-
ся по следующей формуле:
V- м3/(т-ч),
где VM — среднее значение удельного поглощения кислорода в пе-
риод максимума; по опытным данным, VM =
= 11,5 ж3/(т-ч);
тм — время от момента засева среды до окончания максимума
по опытным данным, тм =20 ч;
k — коэффициент пропорциональности; средняя величина его
равна 0,22.
(Знак минус характеризует отрицательное приращение скорости
удельного потребления кислорода).
Приведенные формулы позволяют определить расчетным путем
удельное и суммарное тепловыделение и потребление кислорода
культурой. Практическое использование этих данных позволит ор-
ганизовать рациональный газообмен и тепловой режим на станции
выращивания культур плесневых грибов и снизить расход дорого-
стоящего кондиционированного воздуха.
151
Экспериментально определены теплофизические характеристики
культур плесневых грибов и установлена зависимость их от темпе-
ратуры среды t и ее влажности w.
Asp. oryzae
Asp. awamori
Asp. niger
Насыпная мас-
са, кг 1м?
332
241
252
T еплопроводность^
em/(jw-apad)
0,0735+ 0,00009/
0,0812+0,00008/
0,083+0,00014/
Теплоемкость
кджЦкгград)
1,302+0,0138/
1,507+0,0113/
1,599+0,0096/
Математическая обработка опытных данных позволила предло-
жить эмпирическую 'формулу для определения функциональной за-
висимости теплофизических характеристик указанных параметров.
Теплопроводность Asp. awamori определяется по формуле
л = 9,92-10-2+-7,39-10~41 — 3’37,10~2-+5’06 10-4<
1 4-1 • Ю—5 7^3,5
теплопроводность Asp. niger П определяется по формуле
к = 8,92-10-2+-7,15- Ю~41---1,94-10-2+5,41-10-4/ вт^м.град^
1 + 1 • 10—5 шЗ.б
удельная теплоемкость Asp. awamori определяется по фор-
муле
1,38+9,63-10-4+ 1,05.10-2^ +
+ 4,19-10<0’036 ^ —2,953) Кдж!(кг-град)\
удельная теплоемкость Asp. niger П определяется по формуле
с= 1,53+7,12-10-4+ 1,26-IO-2 w +
+4,19- lO*0’02^-1-92) кдж!(кг-град).
Формулы применимы в исследованном диапазоне изменения t от 0
до 50°С и w — от 0 до 55 %.
Воздух, подаваемый в растильные камеры во время роста гри-
ба, подвергается кондиционированию по тем/пературе и относитель-
ной влажности в специальных устройствах — кондиционерах — в
две стадии. Первоначально в главном кондиционере подогревают
или охлаждают (в зависимости от времени года) воздух, забирае-
мый из атмосферы, до 22—24°С с помощью обогрева калорифером
или охлаждения водой. Затем воздух очищается на висциновом
фильтре, обеспложивается на групповом ватном и поступает на ин-
дивидуальные фильтры для бактериальной очистки. На этой второй
стадии подготовки очищенный воздух подогревается в калорифере
до 30°С и увлажняется до 100%-ной влажности впрыскиванием ост-
рого пара. Применение пара для увлажнения вполне рационально,
так как им легко насытить воздух до требуемого состояния; кроме
того, это гарантирует от повторного загрязнения воздуха, воз-
можного при увлажнении водой, разбрызгиваемой через форсунки.
Рециркулирующий воздух в основном подвергается той же обра-
ботке. Нагретый при прохождении через камеру, он охлаждается на
воздухоохладителе, затем смешивается с 10% свежего воздуха из
152
главного кондиционера, доводится до нужных параметров и вновь
поступает в камеру. Соответственно количеству подаваемого в ка-
меры свежего воздуха необходимо удалять отработавший воздух
после очистки на масляных фильтрах и бактериальном фильтре
ЛАИК.
Для устранения подсосов в камеры необеспложенного воздуха
внутри них создается небольшое (порядка нескольких миллимет-
ров водяного столба) избыточное давление путем регулирования с
помощью шиберов количеств подаваемого и отсасываемого воздуха.
Кюветы с готовой культурой транспортируют вместе с этажер-
ками через второй стерильный коридор к дробилке.
Кюветный способ культивирования очень трудоемок, так как
многие операции выполняются вручную, малопроизводителен и не-
экономичен. Кроме того, как уже упоминалось, санитарно-гигиени-
ческие условия труда при таком способе довольно низкие.
В настоящее время разработаны различные типы механизиро-
ванных растильных установок, которые в той или иной мере устра-
няют указанные недостатки кюветного способа производства.
Автоматизированные установки для выращивания плесневых
грибов в кюветах. ВНИИФСом и ВНИЭКИпродмашем разработа-
ны автоматизированные установки разной конструкции, но одина-
ковой производительности (1400 кг культуры гриба в сутки).
Автоматизированная установка ВНИЭКИ-
продмаша типа СП-9М состоит из аппаратов и механизмов,
скомпонованных в единую непрерывнодействующую систему. Все
технологические операции: мойка кювет, стерилизация их и запол-
нение отрубями, увлажнение среды, перемешивание со стерильной
водой и посевной культурой, выращивание, сушка, выгрузка гото-
вой культуры и ее измельчение — механизированы.
Основные узлы автоматизированной установки: нагнетательная
пневмоустановка для подачи отрубей в приемный бункер; транспор-
тер подачи кювет на мойку; моечная камера; ленточный дозатор
отрубей в кюветы; электростерилизатор кювет с отрубями, транс-
портер для перемещения кювет при засыпке отрубями, стери-
лизации и охлаждении; транспортер для перемещения кювет к уз-
лу увлажнения и посева; узел перемешивания среды е суспензией
конидий; механизм загрузки кювет в растильную камеру и их вы-
грузки; растильная камера, состоящая из двух отделений по 5 сек-
ций; установка для кондиционирования воздуха; сушилка для куль-
туры гриба; поворотное устройство для опрокидывания кювет с
культурой гриба и подачи их на транспортер мойки; дробилка для
измельчения культуры; поворотное устройство для установки вымы-
тых кювет в рабочее положение.
Техническая характеристика автоматизированной установки
ВНИЭКИпродмаша тип СП-9М
Производительность по культуре гриба, кг!сутки . 1400
Необходимое число кювет.................... 760
153
Размер кюветы, мм................................ 760X1080X35
Длительность ращения, ч............................... 36
Число транспортеров по в-сей линии .... 4
Общая длина транспортерной линии, м . . 22
Способ стерилизации кювет и отрубей . . . Теплом радиации
Длительность нагрева и стерилизации, ч . . 2
Температура стерилизации, °C......................... До 140
Число кювет, вмещающихся в стерилизатор . 40
Габариты, мм...........................6650X11880X11245
Число электродвигателей...................... 19
Общая мощность электродвигателей и элементов,
кет.......................................... 70
Масса установки, кг......................... 37048
Опытный образец автоматизированной установки СП-9М, изго-
товленный орловским заводом «Продмаш», был смонтирован на
Вышневолоцком заводе ферментных препаратов. Установка была
испытана межведомственной комиссией и ввиду сложности и нена-
дежности работы не рекомендована к серийному производству.
Менее сложна по устройству аналогичная установка конструк-
ции ВНИИФСа.
Непрерывн о-д ействующая конвейер н о-л о т к о-
вая установка ВНИИФСа предложена (С. П. Колосков и
Р. В. Фениксова) для поверхностного выращивания культур плесне-
вых грибов. Проектная документация разработана Гипроспиртвино.
Установка (рис. 26) состоит из нагнетательного пневматического
устройства для подачи отрубей; приемного бункера для отрубей с
ворошителем; стального ленточного транспортера камеры стерили-
зации отрубей; двух мерников стерильной воды с поплавковыми ре-
гуляторами уровня; бункера для посевной культуры; узла распре-
деления отрубей по лоткам конвейера и узла перемешивания; пла-
стинчатого конвейера, движущегося в камере выращивания; сушил-
ки для культуры гриба; разгрузочного устройства и моечной каме-
ры; бокса для сушки и стерилизации лотков.
Все технологические операции: мойка лотков, стерилизация лот-
ков, пшеничных отрубей, увлажнение среды и засев посевной куль-
турой, заполнение лотков обсемененной средой, выращивание гри-
ба, выгрузка готовой культуры из лотков и сушка — полностью ме-
ханизированы; транспортные операции и технологические процессы
протекают автоматически при непрерывном движении лотков.
Пшеничные отруби пневмотранспортом подаются из склада
сырья в приемный бункер, из него через дозатор поступают на дви-
жущуюся стальную ленту транспортера, проходят через стерилиза-
тор (длиной 10 jw) , где обрабатываются теплом радиации и конвек-
ции при температуре 140°С и выдерживаются в течение 30 мин.
Внутри стерилизатора расположены трубы, обогреваемые паром
избыточным давлением не менее 6 ат (588 кн1м2). Из напорных мер-
ников подготовленная охлажденная стерильная вода подается че-
рез дозатор на слой простерилизованной среды, увлажняя и охлаж-
дая ее до 40—45°С.
154
апб стерильной tote
Рис. 26. Непрерывно действующая конвейерно-лотковая установка ВНИИФСа:
/ — бункер с ворошителем; 2 — транспортер стальной ленточный; 3 — камера стерилизации отрубей; 4 —
мерник; 5 — поплавковый регулятор уровня (дозатор); 6 — бункер для посевной культуры; 7 — узел распре-
деления; 8 — установка для перемешивания; 9— камера стерилизации кювет; 10 — моечная камера; 11 —
щетка нижняя; /2 — скребковый транспортер; 13 — бункер разгрузочный; 14 — опрокидывающее устрой-
ся ство; -/5 —щетка верхняя; 16 — камера сушильная; 17—сепаратор трехповоротный (для воздуха), 18—
лоток транспортера; 19—цепной транспортер.
При дальнейшем перемещении ленты и сходе ее с концевого ба-
рабана, на увлажненные стерильные отруби подается дозированное
количество посевной культуры или водной суспензии конидий гри-
ба. Засеянная среда ссыпается на два вращающихся распредели-
тельных валика с лопастями, которые распределяют ее по лоткам,
непрерывно подаваемым цепным транспортером, и перемешивают.
Дополнительное перемешивание среды на лотках предусмотрено
на первом горизонтальном участке транспортера с помощью зуб-
чатых ворошителей.
Растильная камера ВНИИФСа состоит из двух замкнутых плас-
тинчатых цепей, приводимых в движение звездочками от электро-
двигателя и 507 алюминиевых лотков, которые свободно подвеше-
ны к звеньям цепей, вплотную один к другому, и перемещаются с
помощью цепного транспортера по сложной траектории. Переходя
с верхнего горизонтального участка на нижележащий, лотки, загру-
женные средой, огибают звездочки. Скорость движения транспорте-
ра с лотками (10 м/ч) установлена с таким расчетом, чтобы от на-
чала перемещения лотков с засеянной средой до прихода их на
нижнюю ветвь транспортера и опорожнения прошло время, необхо-
димое для выращивания культуры гриба (36 ч).
Растильная камера разделена на три зоны, соответствующие
трем фазам роста культуры. В первой зоне расположено шесть вет-
вей транспортера, во второй восемь и в третьей — шесть.
Для поддержания необходимых технологических параметров в
камеру подается от кондиционеров воздух относительной влажно-
стью 98—100% и температурой 28—32°С. 96% общего количества
воздуха подается во вторую зону для отвода физиологического теп-
ла, выделяемого культурой в период активного роста, остальные
4% подаются в первую и третью зоны.
Предусмотрена возможность отвода воздуха, орошения его сте-
рильной холодной водой и возвращения в зону выращивания; при
этом расход воздуха на 1 т снизится с 20 до 5—6 тыс. м3/ч, а влаж-
ность культуры сохранится на уровне 55—56%.
/По окончании выращивания лотки с готовой культурой посту-
пают в сушилку, где подсушиваются воздухом при температуре
60—65°С, а затем в специальное разгрузочное устройство, где куль-
тура гриба с помощью металлической и капроновой щеток выгру-
жается из лотков в разгрузочный бункер и скребковым транспорте-
ром доставляется к месту назначения.
Лотки в опрокинутом виде перемещаются по цепному транспор-
теру в моечную камеру, подвергаются мойке горячей водой
(80°С), а затем направляются в камеру сушки и стерилизации. В
камере стерилизации расположены калориферы, обогреваемые па-
ром давлением 6 ат (588 кн!м2). Здесь лотки стерилизуются теплом
радиации в течение 15 мин. При дальнейшем перемещении через
шахту вертикального участка камеры они охлаждаются встречным
током стерильного воздуха (до 40°С) и вновь поступают на верх-
156
нюю ветвь транспортера под загрузку, после чего технологический
цикл повторяется.
Во ВНИИФСе разработана усовершенствованная конструкция
этой установки, в которой исключены отдельный стерилизатор для
лотков, стальной ленточный транспортер и распределительный узел.
Все технологические операции выполняются на цепном транспор-
тере с добавленной по сравнению с первым вариантом верхней
вегвыо, которая движется в стерилизаторе, где лотки с воздушно-
сухими отрубями стерилизуются теплом радиации при 140°С в те-
чение 30 мин. При выходе из стерилизатора лотки с отрубями на
верхней ветви транспортера охлаждаются стерильной холодной во-
дой, которая одновременно увлажняет среду до 60%'.
При дальнейшем движении лотков на среду через дозатор ав-
томатически подается определенное количество посевной культуры
и все тщательно перемешивается мешалкой до однородного состоя-
ния. Остальные технологические операции совершаются так же, как
и в первом варианте установки.
Техническая характеристика непрерывнодействующей установки
ВНИИФСа
Производительность по сухой культуре гриба,
кг! сутки................................... 1400
Температура стерилизации, °C................. 140
Длительность стерилизации, мин............... 30
Длительность ращения, ч...................... 36
Процесс ращения..........................Непрерывный
Температура среды в процессе ращения, °C . . 32—33
Длина цепей конвейера, м...................... 760
Скорость движения цепи, м!ч.................. 10
Длина стальной транспортной ленты, м . . . 34
Скорость движения ленты, м]ч.................. 8
Число горизонтальных участков растильной камеры 20
Размер кюветы, мм............................... 750X1500 X 35
Масса кюветы, кг............................. 13
Установленная мощность электродвигателей, кет 28
В том числе:
на приводах агрегата...................... 3
на кондиционирование воздуха, подачу воды
и сжатого воздуха...................... 25
Расход:
пара, т/ч............................... 0,42
воды, т/ч............................... 3,25
сжатого воздуха, м3/ч.................... 46
воздуха на аэрирование, м3/ч............ 20000
Габариты стерилизационной части установки, мм 4800 X 20800 x 9500
Масса, кг ......................................... 42610
157
Опытный образец установки смонтирован в ферментном цехе
Рассказовского биохимического завода.
Механизированные растильные установки с применением кювет
неперспективны для нужд ферментного производства. К наиболее
существенным недостаткам их следует отнести: сложность изготов-
ления и эксплуатации, высокую стоимость при малой производи-
тельности, громоздкость; недостаточную синхронность движения
замкнутых цепей, просыпание среды; неподвижность слоя среды на
лотках и его малую высоту; отсутствие герметичности, трудность
мойки и стерилизации установки.
Рассмотрим другие решения аппаратурного оформления про-
цесса выращивания.
Механизированные и непрерывно действующие установки для
выращивания плесневых грибов без кювет. А. В. Соловьев предло-
жил выращивать плесневые грибы вкамерах с вертикальны-
ми каналами. Такая камера представляет собой прямоуголь-
ную металлическую емкость объемом около 1,0 ж3, установленную
на опорной конструкции с помощью упругих связей, с откидными
крышками и днищем. Внутри камеры через каждые 50 мм распо-
ложены перфорированные кассеты для аэрации среды с двойными
стенками. Ячейки вертикального канала, образующиеся между кас-
сетами, напоминают кюветы. Нижняя часть их имеет решетчатые
днище-дверцу, предохраняющую от просыпания среды при за-
грузке.
Камера снабжена штуцерами для подвода пара, воды и отвода
конденсата. К ней прикреплен вибратор, с помощью которого выгру-
жается культура гриба.
Контроль и регистрацию температуры ведут по прибору, с по-
мощью контактного термометра, установленного в одном из расти-
льных каналов, и через пусковое реле, соединяющееся с приводом
вентилятора, автоматически включая и выключая его в зависимости
от заданной температуры.
Установка с вертикальными каналами. КБ
ВНИИФСа разработана унифицированная установка для выращи-
вания плесневых грибов для нужд спиртового производства в каме-
рах с вертикальными каналами производительностью 350 кг воз-
душно-сухой культуры.
Установка состоит из стерилизатора с двумя шнеками для под-
готовки стерильной питательной среды, засева и перемешиванйя,
двух растильных камер с вибраторами, двух вентиляторов общей
производительностью 20 000 м3 воздуха в час, висциновых фильтров
и калориферов.
Растильная камера по устройству аналогична описанной вы-
ше. Она устанавливается в мягком кожухе на четырех упругих опо-
рах и верхней частью соединяется со стерилизатором, а нижней—
с разгрузочной камерой.
158
Техническая характеристика установки КБ ВНИИФСа
Стерилизатор двухшнековый, лопастной
Рабочий объем, м3.......................... 1
Материал................................... Ст. 3
Избыточное давление, кн]м2................. 49,4
Привод.....................................От электродвига-
теля типа АО-63-6
Мощность, кет.............................. 10,0
Число оборотов в минуту ................... 930
Редуктор ..................................Тип РМ-500 с пе-
редаточным числом
48,37
Габариты, мм......................... 2900X1800X1340
Масса, кг................................. 1600
Расход пара на стерилизацию, кг)сутки . . . 227
Расход артезианской воды на охлаждение, м3!ч . 0,7
Растильная камера
Емкость, м3................................. 1
Число каналов.............................. 22
Число кассет . <........................... 23
Габариты канала, мм................... 1200X1000x50
внизу и 40 вверху
Объем канала, м3........................, 0,045
Габариты камеры, мм........................ 1657X1450X1400
Материал................................... Ст. 3
Масса, кг.................................. 220
Вентилятор для аэрации среды тип ЭВР №5
Производительность, м3)ч.................... 10000
Напор, н!м2......................... 871
Мощность электродвигателя, кет .... 4,3
Калорифер типа КФ С-2
Поверхность нагрева, м2 ................. 9,9
Давление пара, кн!м2................ 589
Вибратор к растильной камере тип С-414
(с дебалансами)
Мощность электродвигателя, кет........... 0,8
Число оборотов в минуту.................. 2800
Полумеханизированная камерная установка
с вертикальными каналами конструкции Гипро-
спиртвино. Выращивание плесневого гриба в установке ведет-
ся в металлических камерах с вертикальными каналами для аэра-
ции. Исследования ВНИИФСа, проведенные на Московском опыт-
ном и на Мичуринском экспериментальном ферментно-спиртовых
заводах, показали, что в камере с вертикальными каналами можно
выращивать плесневые грибы— продуценты ферментов. На основе
$тих данных разработана растильная установка (рис. 27), смонти-
рованная на Мичуринском экспериментальном заводе ВНИИФСа.
159
Из склада отруби подвозят к цеху и загружают в приемный бун-
кер, из которого нория подает их в заводской бункер, расположен-
ный на втором этаже. По мере надобности взвешенное на весах ко-
личество отрубей норией и шнеком передается в стерилизатор.
Рис. 27. Растильная установка Гипроспиртвино с вертикальными каналами
производительностью 1,2 т культуры гриба в сутки:
/- приемный бункер; 2 — нория; <? —бункер для отрубей, 4 — весы; 5 — стерилизатор
вертикального типа; 6 — дозатор среды, 7 — засевной шнек, 8 — дозатор стерильной воды;
9 — дозатор посевной культуры; 10 — распределительный механизм; // — растильная ка-
мера; /2 —приемный бункер.
Стерилизованная среда поступает в выдерживатель, затем в
увлажнитель, где смешивается со стерильной водой и с посевной
культурой, приготовленной в виде суспензии. Конечная влажность
засеянных отрубей 60%. Расход посевной культуры составляет
0,5% к массе воздушно-сухих отрубей.
Засеянная среда механически загружается на загрузочной пло-
щадке в одну из растильных камер установки для выращивания
плесневых грибов в вертикальном слое. Загрузочная площадка
представляет собой жесткую металлическую раму на четырех пру-
жинных опорах, на которой закрепляется растильная камера, пред-
назначенная под загрузку.
Для равномерного распределения в растильной камере просте-
рилизованных и засеянных отрубей над ней установлен распредели-
тельный механизм — лопастная мешалка, вращающаяся от элек-
тродвигателя через редуктор с числом оборотов 13 в минуту. Для
лучшего распределения отрубей по всей поверхности камеры она
может перемещаться вдоль камеры. Кроме того, мешалка имеет
также вертикальное движение от ручного привода, посредством ко-
торого она опускается в камеру при загрузке.
Уплотнение среды и полная загрузка ею растильной камеры со-
здаются с помощью вибратора, установленного в середине загру-
зочной площадки.
Основные операции технологического процесса выполняются на
двух ветвях (поточной линии: на первой — загрузка и ращение по
стадиям, на второй—выгрузка, мойка и стерилизация растильной
камеры.
160
Растильные камеры передвигаются на поточных линиях по рель-
сам, на первой ветви с помощью толкателя, на второй — вручную.
Для перевода растильной камеры с первой ветви на вторую и об-
ратно предусмотрены траверзные тележки. Выращивание гриба
проводится в растильной камере вместимостью 500 кг воздушно-
сухих отрубей. В цехе имеется 7 таких камер, из которых 6 всегда
загружены, а одна подготавливается к началу цикла — находится
на разгрузке, мойке, стерилизации или загрузке.
Растильная камера представляет собой ящик прямоугольной
формы размером 1600X4300X1620 мм, изготовленный из алюмини-
евого сплава. Внутри нее имеются 23 вертикальных канала с пер-
форированными стенками для выращивания гриба; размеры канала
1250X1600X55 мм. Диаметр отверстий 3 мм, шаг 40 мм. Сверху
каналы открыты, а снизу закрыты затворами, открывающимися при
разгрузке системой рычагов. Щели между каналами шириной
12 мм предназначены для аэрации растущей культуры и отвода вы-
деляемого ею тепла. Кондиционированный воздух подается с торца
камеры и отводится с противоположной стороны.
Загруженная растильная камера механическим толкателем про-
двигается к воздушным диффузорам, которые автоматически с до-
статочной герметизацией подключаются к растильным камерам.
Герметизация создается пневматически.
Для установления оптимальных температурных режимов в
1964 г. во ВПИИФСе была проведена работа, в процессе которой
определено, что наилучшие показатели по активности всего ком-
плекса ферментов достигаются при выращивании на среде, сред-
няя температура которой 32°С, а средняя температура воздуха,
продуваемого через камеру, 15°С. Этот режим и был принят для
установки Мичуринского завода.
Исследовано также изменение влажности питательной среды в
процессе роста плесневого гриба. При подаче охлаждающего воз-
духа с относительной влажностью 98—*100% подсыхания среды не
наблюдалось и влажность ее оставалась постоянной. При подаче
охлаждающего воздуха с относительной влажностью 65—70%
влажность питательной среды изменяется незначительно. Это —
большое преимущество данного способа по сравнению с кюветным.
Динамика накопления ферментов в процессе роста Asp. awamori
показана в табл. 13.
Из данных табл. 13 видно, что амилолитическая активность фер-
ментов нарастает до 36 ч роста, а затем падает. В соответствии с
этим длительность выращивания плесневого гриба Asp. awamori ус-
тановлена в 36 ч. Потери сухих веществ за это время составляют в
среднем 25%, а полученная готовая культура гриба по активности
не уступает выращенной на кюветах.
Общая продолжительность оборота установки (с учетом време-
ни на мойку, стерилизацию камеры, загрузку и разгрузку) состав-
ляет 48 ч.
11—826
161
Таблица 13
Динамика накопления ферментов растущей культурой
Asp. awamori
АС, ед/г сухого вещества, при длительности выращивания, ч
Номер опыта 24 30 36 42
21 5 7 15 13
5 6 9 14 10
19 5 12 13 8
23 7 10 13 11
13 7 12 12 7
Через равные промежутки времени (6 ч) растильные камеры
проталкиваются толкателем от диффузора к диффузору для аэра-
ции культуры. Растильная камера с выращенной культурой подает-
ся на выгрузочную площадку, которая конструктивно аналогична
площадке загрузки. Готовый продукт из растильной камеры выгру-
жается в бункер, оборудованный специальными устройствами и
шнеками для предварительного дробления сырой культуры, кото-
рая смешивается с водой и насосом подается на экстрактор.
Мойка растильной камеры и ее подготовка к новой загрузке
проводятся в камере стерилизации — горизонтальном цилиндричес-
ком аппарате с двумя герметическими крышками. Внутри камеры
установлены коллекторы.
Установленную в мойке растильную камеру обрабатывают сле-
дующим образом. Включают коллекторы, подающие воду снизу и
сверху, а затем коллекторы, подающие воду с боков. Таким обра-
зом камера полностью промывается водой. Для большей эффектив-
ности мойки вверху моечной камеры установлен кривошипно-шатун-
ный механизм, сообщающий растильной камере возвратно-поступа-
тельное движение.
Вымытую растильную камеру подвергают стерилизации острым
паром при температуре 120°С, после чего с помощью траверзной
тележки направляют ее к столу загрузки.
Техническая характеристика установки с вертикальными каналами
конструкции Гипроспиртвино
Производительность, кг/сутки.................. 1200
Емкость бункеров для отрубей, м3 . ... 0,9
Стерилизатор отрубей .........................Цикличный,
шнековый
Производительность, кг/ч...................... 100—125
Способ стерилизации ........................... Теплом радиации
Температура стерилизации, °C.................. 120—130
Растильные камеры из алюминиевого сплава
АМГ-17 емкостью по отрубям, кг ... . 500
162
Масса камеры, кг.................................... 771
Число растильных камер ....... 7 (
Габариты камеры, мм..............1600X1300X1020
Производительность кондиционеров, м?!ч:
главного, тип КД-60 ..................... 60000
рециркуляционного, тип КД-20 .... 20000
Стерилизатор для растильных камер рассчитан на работу под из-
быточным давлением 278 кн/л<2.
Несмотря на механизацию основных технологических операций
и их герметичность, что важно для охраны труда, установка имеет
небольшую производительность (1,2 т! сутки) и может быть эффек-
тивно использована только на заводах средней мощности.
Существенными недостатками ее являются быстрая деформация
стенок камеры и трудоемкая выгрузка готовой культуры.
Более прогрессивна по конструкции вертикальная растильная ка-
мера с разъемными кассетами размером 1700X1400X1650 мм.
На каркасе камеры подвешены на шарнирах перфорированные
кассеты, напоминающие двойные полукюветы. Между ними имеют-
ся каналы, в которые подается воздух.
Для механической выгрузки готовой культуры камера устанав-
ливается под автоматическое устройство.
За один оборот вала этого устройства обеспечивается проведение
следующих операций: открывание кассеты, опускание планки вы-
талкивателя и выгрузка выращенной культуры из кассеты, подъем
планки выталкивателя и перемещение тележки механизма. При
перемещении тележки ролик входит в зацепление с рейкой, непод-
вижно закрепленной на каркасе, и механизм устанавливается под
разгрузку следующей кассеты.
Устройство снабжено герметическим кожухом с прозрачными
окнами для наблюдения за работой.
Преимущества растильной камеры с разъемными кассетами:
герметизация процесса выращивания; получение культуры с высо-
кой активностью; надежная работоспособность, надежность и долго-
вечность конструкции; устранение потерь при выгрузке.
Большинство описанных выше установок основано на принципе
использования кювет или камер с вертикальными каналами для
поверхностного выращивания' плесневых грибов на неподвижной
питательной среде. Такой способ имеет много существенных недо-
статков: недостаточно развитую поверхность аэрируемой части пи-
тательной среды, ограниченную поверхность кювет; большой рас-
ход кондиционированного воздуха (23 000 м3) на 1 т готовой куль-
туры; необходимость применения холодильных установок для под-
готовки кондиционированного воздуха в летнее время, что ослож-
няет и удорожает производство; громоздкость, сложность, высокую
стоимость и низкую производительность.
Эти недостатки ручной и механизированных кюветных установок
не позволяют рассчитывать на перспективность их применения в
промышленности.
1 6S
Ниже рассмотрены бескюветные промышленные установки для
поверхностного выращивания культур плесневых грибов.
Непрерывнодействующая автоматизированная шахтная сушил-
ка ВИС-42Д, паровые конвейерные сушилки СПК (15, 30, 45 и 90) и
другие типы камерных и ленточных сушилок, широко применяемые
в пищевой промышленности, могут быть без существенного переобо-
рудования приспособлены для поверхностного выращивания плес-
невых грибов.
Растильная установка типа ВИС-42Д. Внутреннее устройство
сушилки при использовании ее для поверхностного выращивания
требует изменения кинематической схемы опрокидывания полок ка-
меры и герметизации загрузки среды на первую полку.
Шахтная непрерывнодействующая растильная установка типа
ВИС-42Д (рис. 28) состоит из камеры, двух калориферов, трех вен-
тиляторов и трех циклонов. Камера имеет металлический каркас,
обшитый листовым железом, и покрыта слоем теплоизоляции. Вну-
три нее через каждые 120 мм по высоте расположено 20 горизон-
тальных подвижных полок, размеры которых соответствуют габари-
там камеры (2000x4100 мм}. Каждая полка состоит из 16 отдель-
ных пластин размером 120x60 мм, которые в заданные промежутки
времени автоматически поворачиваются на угол 90° и затем воз-
вращаются в исходное горизонтальное положение.
Внутренними перегородками камера разделена на 3 части, что
позволяет рационально использовать воздухораспределение по зо-
нам роста. В первой зоне, в верхней ее части, расположено 6 по-
лок, во второй зоне (в средней части) 8 полок и в третьей, нижней,
части 6 полок. В передней боковой части камеры расположены
3 дверцы, к которым имеется свободный доступ; к задней боковой
части подведены воздуховоды от двух вентиляторов и калориферов
и выход отработавшего воздуха к третьему вытяжному вентилято-
ру и циклонам.
При использовании сушилки для выращивания плесневых гри-
бов воздух засасывается по воздуховоду, установленному выше
конька крыши на 4—5 м, фильтруется через фильтр грубой очист-
ки, бактериальный фильтр типа ЛАИК, смешивается в воздухо-
воде с насыщенным паром до заданных технологических парамет-
ров (температура 32—33°С, относительная влажность 96—98%).
На выходе воздуха для очистки его также устанавливаются фильтр
грубой очистки Рекка и бактериальный типа ЛАИК (последний из
них во время стерилизации сушилки отключается). Во всех трех
зонах камеры на входе и выходе воздуха устанавливаются термоза-
писывающие приборы, причем контроль за температурой и влаж-
ностью воздуха и среды проводится круглосуточно.
Загрузка стерильной питательной среды на верхнюю 20-ю пол-
ку камеры герметизируется, и среда транспортерной лентой или ка-
реткой распределяется по полке при движении каретки по направ-
ляющим вдоль полки.
164
Кинематическая схема сушилки устанавливается так, чтобы че-
рез каждые 90 мин рычаги полок, начиная с нижней (первой), ав-
томатически поворачивали все пластины на угол 90°. При этом сре-
да пересыпается с полки на полку, разрыхляясь и перемешиваясь.
Рис. 28. Растильная установка типа ВИС-42Д.
1 — вентилятор, 2 — циклоны, 3 — термометры ТГ-6, 4 — калориферы, 5—психро-
метры, 6 — полки камеры, 7 — растильная камера, 8 — пластины, 9 — дверцы, 10 —
бункер, // — вентиляторы, 12 — фильтр грубой очистки, 13 — фильтр ЛАИК, I. II,
III—зоны роста.
При поступлении среды во вторую зону с помощью верхнего венти-
лятора и подачи пара устанавливается температура паровоздушной
смеси 27—29°С, которая поддерживается и в третьей зоне.
165
Таким образом, за время, необходимое для перемещения среды
по всем 20 полкам, заканчивается рост культуры гриба и накопле-
ние ею ферментов и с первой (нижней) полки выходит уже готовая
культура, которая поступает затем в приемный бункер, на дробил-
ку и на сушку.
Процесс может быть организован непрерывно или периодически
в зависимости от условий подготовки стерильной питательной сре-
ды. Длительность пребывания среды на полке также может быть
различной — от 90 мин при непрерывном процессе до нескольких
часов при периодическом способе производства. На каждую пол-
ку камеры можно загружать 24—27 кг в пересчете на суховоздуш-
ные отруби, и за сутки вырастить до 300 кг культуры.
Как показали испытания, на 1 ж3 камеры ВИС-42Д можно загру-
жать 41 кг воздушно-сухих отрубей вместо 9—10 кг при выращива-
нии в растильных камерах Львовского, Вышневолоцкого и других
ферментных заводов. Соответственно удельный съем с 1 ж2 площа-
ди камеры ВИС увеличивается до 61 кг культуры в сутки вместо
12 кг.
По окончании ращения камеру моют горячей водой и стерили-
зуют в течение 2 ч воздухом, нагреваемым в калориферах до
120— 130°С.
Установки ВИС изготавливаются серийно Шебекинским машино-
строительным заводом.
Растильная установка типа СПК. Устройство паровых конвей-
ерных сушилок СПК, как и сушилок ВИС, позволяет при внесении
незначительных конструктивных изменений приспособить их для
периодического и непрерывного поверхностного выращивания плес-
невых грибов.
Установка типа СПК (рис. 29) представляет собой металличес-
кий шкаф, внутри которого расположены четыре-пять ветвей лент
сетчатого транспортера. Транспортерные ленты выполнены из про-
волочной сетки из нержавеющей стали с ячейками 20Х 1,5 жж и на-
тянуты на металлические барабаны, покоящиеся на шарикоподшип-
никах. Сетчатые ленты целесообразно заменить лентами с ячейка-
ми 20x0,5 жж. Один из барабанов приводной, а второй — натяж-
ной. Размеры транспортерных лент зависят от типа сушилки. Каж-
дая лента может иметь самостоятельный привод с вариатором ско-
рости, либо общий привод, который позволяет изменять скорость
движения лент в пределах от 1,14 до 1,0 м{мин.
Над каждой транспортерной лентой устанавливаются уравни-
тельные планки, позволяющие распределять питательную среду по
всей ленте ровным слоем обусловленной высоты, от 30 до 100 жж.
Для разрыхления среды над верхними лентами установлены валы с
лопастями в виде игл, вращающиеся в направлении движения лент.
Разрыхление проводится при перегрузке среды с верхней ленты на
нижележащую. Под холостыми ветвями транспортерных лент распо-
ложены очистители — валы с лопастями, к которым прикреплены
а 66
Рис. 29. Растильная установка типа СПК:
/ — вентилятор, 2 — фильтр Рекка. 3 — бактериальный фильтр ЛАИК, 4 — кондиционер, 5 — растиль-
ная камера; 6 — сетчатая лента; 7— разрыхлители; 8 — калориферы; 9 — воздуховод для отсоса воз-
духа, 10 — стерилизатор, // — течка, 12 — транспортер.
О
резиновые полосы. Очистители вращаются в направлении, противо-
положном движению холостых лент. В пространстве между ветвями
транспортерных лент установлены секции ребристых паровых ка-
лориферов. Для равномерности нагрева или охлаждения среды по
всей длине ленты (10 м) секции калориферов в центре установки
разъединяются и вводы горячей воды монтируются самостоятельно
для каждой половины. Общая поверхность нагрева калориферов
сушилок СПК-90 равна 1400 м2.
Горячая вода с заданными параметрами для каждого яруса ка-
лориферов первой и второй зоны ращения готовится в специальных
баках, которые должны быть снабжены приборами для регулирова-
ния и контроля температуры. Температура воды, подаваемой в ка-
лориферы под первую (считая сверху) и вторую ветви лент, долж-
на быть 35—40°С, для калориферов третьей и четвертой ветвей
26—30°С. Калориферы пятой ветви лент могут обогреваться отра-
ботавшей горячей водой из верхних ярусов.
Горячая вода подводится параллельно с самостоятельным под-
водом пара к тем же штуцерам калориферов. Пар используется
для мойки и нагрева установки до высокой температуры при ее
стерилизации.
В установке разграничены три зоны: верхняя (первая) зона, где
обеспечивается температура среды 32—35°С, средняя (вторая) с
температурой 30°С и отводом физиологического тепла, выделяемо-
го культурой гриба в процессе активного роста, и нижняя (третья)
с температурой в пределах 28°С.
Сушилка, используемая для выращивания плесневых грибов,
должна быть полностью герметизирована и смонтирована в обособ-
ленном герметичном и стерильном помещении. Растильная установ-
ка монтируется на фундаменте; над ней устанавливается вытяжной
зонт с трубой высотой 3 м; нижняя часть установки герметизирует-
ся для отвода сточных вод. Воздух с относительной влажностью
96—98% подводится с одной боковой стороны установки над вто-
рой, третьей и четвертой ветвями лент и отводится с другой боко-
вой стороны диагонально. На подающей и вытяжной линиях воз-
духа устанавливается фильтр грубой очистки, а за ним фильтр ти-
па ЛАИК для очистки воздуха от конидий.
Стерильная питательная среда подается на верхнюю ленту на-
клонным, герметически закрывающимся транспортером. В тех слу-
чаях, когда установка используется только для выращивания, целе-
сообразно подавать среду из стерилизатора, расположенного над
установкой, непосредственно на верхнюю ленту.
Исключение наклонного транспортера значительно (на 3 м)
уменьшает длину установки, а следовательно, и площадь, необхо-
димую для ее размещения.
Расход кондиционированного воздуха составляет не более
1000 м3 на 1 т культуры, поэтому один кондиционер типа КД-10 мо-
жет обслуживать 2—3 установки СПК-90.
168
После загрузки питательной среды на верхнюю ветвь транспор-
тера привод верхней ленты выключают и среда находится на ленте
в течение 7—9 ч, затем переводится на нижнюю ветвь ленты с од-
новременным разрыхлением всей массы, и здесь также находится
9 ч, а на верхнюю ветвь первой ленты в это время подается новая
порция среды. Таким образом, через каждые 7—9 ч среда перегру-
жается с верхней на нижележащую ветвь транспортера и через
36 ч выгружается в виде готовой культуры.
По окончании цикла растильный агрегат моют горячей водой и
стерилизуют горячим воздухом при температуре 120—130°С в те-
чение 2—3 ч, после чего технологический цикл повторяется. Испы-
тания показали, что на одну ветвь транспортера СПК-90 можно за-
грузить 600—700 кг питательной среды, или 270—300 кг в пе-
ресчете на воздушно-сухие отруби при высоте слоя на ленте 50 мм.
Типоразмер сушилки
пксмо . . .
ПКС-20 . . . .
СПК-45 . . . .
СПК-90 . . . .
Суточная производительность
по культуре гриба, кг
70—80
140—160
280—400
660—900
Сушилки СПК серийно изготовляются Шебекинским машино-
строительным заводом.
Техническая характеристика сушилок СПК
СПК-15 СПК-30 СПК-45 СПК-90
Рабочая площадь сетчатых лент, м2 . . 15 30 45 90
Число лент . . 5 5 5 5
Ширина лент, мм . . 1250 1250 2000 2000
Давление пара в калорифере
ат 3- —8
кн/м2 294,3- —784,8
Мощность электродвигателей, кет . 1,0 1J 2,0 5,1
Габариты, мм
длина . . 5280 7600 7700 11500
ширина . . 2400 2400 2350 3180
высота . . 3100 3100 3100 3100
Масса, кг . . 3384 5501 4775 10750
Проведенные ВНИИФСом опыты выращивания культуры плес-
невого гриба Asp. awamori (штамм 22) на установках ВИС и СПК
показали их преимущество по сравнению с выращиванием в кю-
* С 1966 г сушилки ПКС-10 и ПКС-20 сняты с производства. Новые, более
производительные сушилки того же типа получили марку СПК.
169
ветах: герметизация загрузки, выращивания и выгрузки; механи-
зация трудоемких операций; экономия производственной площади,
затрат средств и времени.
Конвейерно-пластинчатый непрерывно действующий агрегат
ВНИИФСа. На основе обобщения опыта выращивания плесневых
грибов на сушилках типа ВИС и СПК конструкторское бюро
ВНИИФСа разработало конвейерно-пластинчатый агрегат для не-
прерывного выращивания плесневых грибов поверхностным спосо-
бом и сушки.
Агрегат ВНИИФСа (рис. 30) представляет собой герметичную
камеру прямоугольного сечения с непрерывно движущимся конвей-
ером, на пластинах которого протекают iB-се технологические опера-
ции: подготовка питательной среды, стерилизация, выращивание
культуры, ее сушка, а также мойка и стерилизация грузонесущего
транспортирующего органа.
Рис. 30. Конвейерный агрегат ВНИИФСа для выращивания культуры гриба поверхно-
стным способом:
/ — виброконвейер винтового типа; 2 — приемный бункер; 3 — виброконвейер трубчатый; 4 — бункер
отрубей с ворошителем, 5 — стерилизатор, 6 — камера для увлажнения, 7 — дозатор стерильной воды,
Я — дозатор посевной культуры, 9 — перемешивающее устройство, /0 — растильная камера, // — об-
шивка, 12 — цепные звездочки, 13 — поворачивающиеся пластины, 14 — узел дробления культуры.
/5 — сушилка, 16 — камера выгрузки культуры, /7 — вибротранспортер, 18— камера мойки; 19 —
увлажнители; 20 — кондиционер; 2/— вентилятор; 22 — фильтр Рекка; 23 — фильтр ЛАИК; 24 —
мойка посевных кювет; 25 — шкаф для стерилизованных кювет; 26—автоклав; 27 — раскладочный
стол; 28 — растильная камера; 29 — манипулятор.
170
Конвейер состоит из двух пластинчатых цепей, к которым шар-
нирно присоединены поворачивающиеся пластины длиной 210 мм,
образующие в горизонтальном положении сплошное полотно
Конвейер приводится в движение от электродвигателя с помощью
цепных звездочек.
Отруби подаются механическим или пневматическим транспор-
том в бункер с ворошителем, и слоем 50 мм поступают на транспор-
тер, который проходит через закрытый герметичный туннель дли-
ной 8600 мм. Внутри туннеля расположены 4 секции радиаторных
труб, обогреваемых паром. При прохождении через туннель (му-
фель-стерилизатор) транспортер и отруби на нем стерилизуются
теплом радиации при температуре 130—140° в течение часа. По вы-
ходе из муфеля-стерилизатора отруби увлажняются и охлаждаются
стерильной водой, подаваемой форсунками, установленными по
5 штук в 2 ряда. Расстояние между форсунками 500 мм при длине
пути увлажнения 3400 мм.
Отруби с водой перемешиваются ворошителями. После охлаж-
дения среды конидии посевной культуры подаются турникетным
12-ячеечным дозатором и среда с конидиями также перемешивает-
ся ворошителями.
При дальнейшем движении до поворота цепи у звездочки (где
отсутствуют направляющие) пластины с помощью кулачка пово-
рачиваются на угол 90°, принимают вертикальное положение, уда-
ряются дважды о выступы и среда пересыпается с них на нижерас-
положенную ветвь конвейера. Таким же образом пересыпается сре-
да при подходе к каждой поворотной звездочке по всей длине кон-
вейера. При пересыпании среды увлажнители подают на нее тонко
распыленную стерильную воду. Общая длина и скорость движения
конвейера рассчитаны на пребывание среды на лотках в течение
36—48 ч. Перемещаясь по сложной траектории на 10 ветвях со ско-
ростью 4,85 м!ч, конвейер пересыпает среду 10 раз, т. е. через каж-
дые 3.6 ч.
Растильная часть камеры разделена по высоте на три зоны.
Стерильный кондиционированный воздух (20% от общего расхода)
подается в первую и третью зоны, а 80% — во вторую зону для от-
вода тепла и продуктов жизнедеятельности, выделяемых культурой
в период активного роста.
Выращенная культура при дальнейшем движении на конвейере
измельчается в дробилке, а затем поступает в сушилку, где подсу-
шивается воздухом при температуре 70°С в течение часа. Длина
сушильного участка 5000 мм. (При необходимости сушку культуры
гриба можно .исключить).
Далее пластинчатый транспортер поступает в специальный бун-
кер, в котором его пластины, поворачиваясь на 90°, разгружают
культуру гриба. Из бункера она пневмотранспортом подается на
расфасовку. Транспортер проходит через моечную камеру с теплой
водой, очищается капроновыми щетками, промывается водным рас-
твором формалина и поступает на стерилизацию. Отработавший
171
воздух фильтруется, очищается от конидий и удаляется в атмо-
сферу.
Особенности конструкции агрегата; обеспечивают герметич-
ность всего процесса и позволяют компактно проводить сложные
технологические операции в одном агрегате.
Положительные качества агрегата: циклическое чередование пе-
редвижения культуры с последующим разрыхлением и пересыпа-
нием ее во всех трех зонах роста, что позволяет более полно отво-
дить тепло в период активного роста по всей высоте слоя, исключа-
ет опасность перегрева и дает возможность вести процесс выращи-
вания в слое среды высотой до 70 мм без потерь активности; увлаж-
нение стерильной водой растущей культуры во взвешенном состоя-
нии (при пересыпании среды), обеспечивающее поддержание в ней
заданной нормы влажности и лучшей активности; измельчение
культуры гриба до состояния сыпучести вместо пластов, получае-
мых при кюветном методе выращивания; непрерывность технологи-
ческого процесса производства.
Недостатки агрегата: повышенный расход кондиционированно-
го воздуха и трудность стерилизации всей установки.
Техническая характеристика непрерывно действующего
агрегата ВНИИФСа
Производительность по готовой культуре, кг!сутки 2000
Длина цепи транспортера, м.................... 223
Ширина цепи, мм.............................. 2200
Масса цепи, т................................ 19,5
Скорость движения цепи транспортера, м/ч . . 4,85
Шаг пластин, мм............................... 200
Температура стерилизации, °C.................. 140
Длительность стерилизации, мин................ 105
Длительность выращивания, ч................... 36
Мощность электродвигателя, кет:
транспортера..................................... 1,7
дробилки......................................... 4,5
щетки............................................ 0,6
ворошителей...................................... 0,6
Габариты, мм................................... 20400X 4300 X 7000
Масса, т <............................................ 53
В целях дальнейшего совершенствования поверхностного выра-
щивания культур плесневых «грибов в производственных условиях
намечается использование современных вибрационных машин, при-
меняемых при транспортировании сыпучих сред.
Непрерывно действующие вибрационные растильные агрегаты.
Кюветы, лотки, вертикальные камеры и даже конвейерно-пластин-/
чатые элементы растильных установок все же не обеспечивают
активного перемешивания среды на всех стадиях роста гриба. Для
устранения этого недостатка ВНИИФСом предложен динамичес-
172
кий метод выращивания культур плесневых грибов в непрерывно-
движущемся слое питательной среды. Сущность способа заклю-
чается в том, что стерильную питательную среду, смешанную с по-
севной культурой, в процессе непрерывного перемещения подвер-
гают вибрационным колебаниям.
Под действием высокочастотных колебаний порядка 10—17,5 гц
питательная среда, находящаяся на транспортирующем органе,
приобретает специфические свойства: становится более подвижной,
уменьшается коэффициент внутреннего трения ее и снижается со-
противление перемещению; быстро следующие один за другим им-
пульсы передаются слою транспортируемой среды, поддерживая
ее во взвешенном состоянии; среда как бы кипит и течет, как жид-
кость.
Режим транспортирования с подбрасыванием характеризуется
непрерывным обновлением поверхностного слоя: часть пути среда
совершает в контакте с поверхностью грузонесущего органа, затем
отделяется от него, а через некоторое время снова падает и при-
касается к нему.
В результате вибрационного движения, совершаемого транспор-
тирующим органом, среда интенсивно перемешивается и частицы
ее перемещаются в нижнюю, среднюю и верхнюю части слоя. Каж-
дая частица среды находится в непрерывном движении в течение
36 ч. При этом отдельные мельчайшие частицы интенсивно аэри-
руются во взвешенном псевдокипящем состоянии, что в тысячи раз
увеличивает поверхность фазового контакта твердой, жидкой и га-
зообразной среды по сравнению с кюветным способом выращива-
ния. Вследствие аэродинамического напора, создаваемого при пери-
одических колебаниях, через поры питательной среды происходит
периодический отток и приток воздуха.
Физиологическое тепло, выделяемое культурой в процессе ак-
тивного роста, отводится водой, в результате чего расход конди-
ционированного воздуха сокращается с 20 000 до 500—200 м3 на 1 т
культуры.
Применение вибрации позволяет интенсифицировать процессы
массо- и теплообмена и микробиологического синтеза, механизи-
ровать все технологические операции и повысить активность куль-
туры.
Во ВНИИФСе в 1963—1964 гг. были проведены опыты выращи-
вания на вертикальной виброустановке поверхностных культур Asp.
awamori и Asp. oryzae, показавшие возможность проведения этого
процесса в динамических условиях с лучшими результатами, чем
при статическом методе выращивания на кюветах. Испытания по-
казали также необходимость изыскания надежных способов для
устранения сопутствующей адгезии и когезии частиц среды.
Вибрационная растильная установка может иметь горизонталь-
ное и вертикальное исполнение. Институтом Гипроспиртвино по за-
данию ВНИИФСа разработаны два типа вибрационных установок
для выращивания культур гриба.
173
Автоматизированная горизонтальная вибрационная установка
состоит из дозаторов среды, стерильной воды и «суспензии конидий;
вибрационного стерилизатора для термообработки, увлажнения, ох-
лаждения и засева среды и растильной виброкамеры.
В вибростерилизаторе (см. стр. 132—133) протекают все техно-
логические операции подготовки среды, ее стерилизации и дозиро-
вания. Из него стерильная среда поступает по выгрузочному коробу
на верхний поток конвейерной растильной виброкамеры.
Растильная виброкамера состоит из двух основных и двух вспо-
могательных вибрационных конвейеров. Каждый из них имеет по
восемь растильных полок. Полки основных и вспомогательных кон-
вейеров образуют по периметру прямоугольники. Конвейер имеет
две рамы, на каждой из которых установлены четыре технологиче-
ские полки. Рамы с помощью резиновых упругих элементов опи-
раются на несущую конструкцию.
Вибромашина приводится в движение эксцентриковым вибрато-
ром; при этом несущим рамам сообщаются колебания, равные по
величине, но направленные в противоположные стороны. Привод
состоит из двух параллельных эксцентриковых валов, связанных
шестернями, что обеспечивает синхронность их вращения. Эксцен-
трики обоих валов смещены один относительно другого на 180°,
вследствие чего шатуны двигаются в противоположные стороны. Та-
кое смещение обеспечивает одинаковое перемещение желобов в
противоположные стороны, уравновешивает инерционную нагрузку
движущихся частей и динамическую нагрузку на опорные конструк-
ции. Для разгрузки привода вибромашины от инерционных нагру-
зок растильный вибрационный агрегат настраивается на резонан-
сный режим работы.
Стерильная питательная среда под действием виброимпульсов
перемещается из верхнего лотка по всему ряду полок замкнутого
верхнего прямоугольника и затем спускается на лоток нижележа-
щего прямоугольника. Так как на желобах верхнего и нижележа-
щего ряда, установленных на верхней и нижней несущих рамах,
направленность колебаний одинакова, то и транспортирование
происходит только в одну сторону. Питательная среда медленно и
последовательно перемещается сверху вниз по замкнутым перимет-
рам всех восьми прямоугольников в течение 36 ч.
Часть лотков виброрастильной установки, на которых происхо-
дит активный рост культуры гриба, сопровождающийся выделени-
ем физиологического тепла, снабжена водяными рубашками для от-
вода этого тепла водой.
В процессе непрерывного движения среды сверху вниз в ра-
стильную установку подается незначительное количество стериль-
ного кондиционированного воздуха для аэрации среды и отвода
продуктов жизнедеятельности микроорганизмов. С последнего лот-
ка виброрастильной установки непрерывно выгружается выращен-
ная культура.
174
Техническая характеристика автоматизированной горизонтальной
вибрационной установки
Производительность по сухой культуре гриба,
т!сутки..................................... 3,5
Высота слоя питательной среды, мм . . . От 60 до 100
Расположение лотков..........................Горизонтальное
Ширина лотков, мм............................ 700
Основной конвейер
Частота колебаний, гц:
минимальная................................. 5,6
максимальная......................- . 26
Амплитуда колебаний, мм...................... От 0 до 6
Длина, мм.................................... 12800
Масса, кг.....................................11580X2 = 23160
Электродвигатель типа АО-63-4:
мощность, кет............................... 14X2
число оборотов в минуту.................. 1460
Вспомогательный конвейер
Длина, мм......................................... 3800
Амплитуда колебаний, мм............................. 4
Частота колебаний гц\
минимальная .................................. 5,6
максимальная................................... 26
Электродвигатель типа АО-51-6:
мощность, кет................................. 4,5X2
число оборотов в минуту..................‘ 1420
Высота установки, мм.............................. 3780
Масса установки, т................................ 34,3
Автоматизированная вибрационная установка вертикального ти-
па непрерывного действия (рис. 31) состоит из четырех унифици-
рованных растильных камер производительностью по 0,75 т куль-
туры в сутки. Каждые две камеры обслуживаются одним стерили-
затором. Две жестко соединенные камеры располагаются в центре,
а к ним через резино-металлические упругие элементы крепятся
по бокам две другие камеры, также жестко соединенные одна с дру-
гой металлической рамой. Каждая пара растильных камер переме-
щается с помощью эксцентрикового привода противофазно, т. е.
таким образом, что когда центральные камеры перемещаются вверх,
нижние идут вниз, и наоборот. Для предотвращения передачи ди-
намических нагрузок на опорную раму предусмотрены вибрирую-
щие упругие элементы.
Каждая растильная камера (рис. 32) представляет собой прямо-
угольный вертикальный короб с расположенными внутри него 33
наклонными (на 2°) полками в виде елочки. Среда загружается в
камеру сверху и поступает на верхнюю полку. Две верхние полки
снабжены электронагревательными элементами; на них отруби в
процессе перемещения стерилизуются теплом радиации.
Под влиянием виброимпульсов простерилизованные отруби по-
ступают на нижележащую, третью, полку, являющуюся промежу-
175
точной. На следующих двух полках происходит увлажнение среды
стерильной водой и засев суспензией конидий. При дальнейшем пе-
ремещении среды по всем последующим полкам происходит выра-
щивание культуры: на верхних восьми полках — набухание и про-
растание конидий, а на следующих 11 —активный рост. Последние
8 полок предназначены для накопления ферментов в выращенной
культуре.
Рис. 31. Автоматизированная вибрационная установка вертикального типа:
/•—бункер для отрубей с виброворошителем; 2 — рама под бункер; 3 — гибкий рукав для
загрузки; 4 — крайние растильные камеры; 5 — раса с опорной конструкцией; 6 — жест-
кое соединение двух средних растильных камер; 7 — жесткое соединение двух крайних
растильных камер; 8 — вибропривод, 9 — средние растильные камеры.
Полки снабжены водяной рубашкой для отвода физиологическо-
го тепла. Для аэрирования среды в камеру подводится небольшое
количество кондиционированного воздуха.
После непрерывного перемещения среды в течение 36 ч сверху
вниз по полкам камеры из нижней ее части в приемник выходит вы-
ращенная культура гриба.
176
Рис. 32. Вибрационная
растильная камера вер-
тикального типа:
1 — штуцер для подачи про-
дукта; 2 — лотки с электро-
нагревателями для стерили-
зации огрубей; 3 — промежу-
точный лоток; 4 — штуцера
для подачи стерильной воды
с суспензией спор; 5 — ви-
бролоток с охлаждающимся
дном; 6 — вибролоток рас-
тил ьный; 7 — окно для по-
дачи воздуха в растильную
камеру; 8— кожух; 9 — шту-
цер для выпуска продукта.
12—826
177
Техническая характеристика вибрационной установки
вертикального типа
Производительность по готовой культуре, т!сутки 3,5
Способ стерилизации.............................Теплом 'радиации
Температура стерилизации, °C .............. 130—140
Длительность выращивания, ч.......................... 36
Частота колебаний, гц . . . . От 10 до 20
Амплитуда колебаний, мм . . . От 0 до 6
Электродвигатель типа АО2-72-4:
мощность, кет................................. 30
число оборотов в минуту . . ... 1500
Габариты установки, мм ...................... 5100X8040X7226
Винтовая вибрационная установка непрерывного действия
(рис. 33) состоит из вибростерилизатора (см. стр. 132—133) и че-
тырех герметизированных вертикальных вибрационных конвейеров,
выполненных в форме спирали-винта.
Все 4 виброконвейера соединены последовательно, причем соб-
ственно растильной частью установки являются первые три, состав-
ляющие соответственно первую, вторую и третью зоны роста, а
четвертый предназначен для сушки культуры. Каждый виброкон-
вейер снабжен индивидуальным приводом с дебалансовыми вибра-
торами.
Стерильная засеянная питательная среда из вибростерилизато-
ра поступает в приемный лоток первого виброконвейера и под влия-
нием виброимпульсов, сообщаемых желобу, перемещается снизу
вверх. Из верхнего лотка первого виброконвейера среда по трубе
поступает в нижний приемный лоток второго виброконвейера. Кон-
структивно второй виброконвейер отличается от первого только тем,
что лотки его снабжены водяной рубашкой для отвода тепла, вы-
деляемого в период активного роста. С этой же целью во второй
виброконвейер (вторую зону) подается кондиционированный воз-(
дух. Из верхнего лотка этого конвейера среда поступает по трубе
в нижний приемный лоток третьего виброконвейера, по устройству
аналогичного первому.
Скорость движения среды принимается минимально возможной
2—3 мм1сек, а диаметр и число витков всех виброконвейеров рас-
считаны так, чтобы среда находилась в непрерывном движении в
течение всех 36 ч роста. Из верхнего лотка третьего виброконвейера
выращенная культура по трубе поступает в нижний приемный ло-
ток четвертого виброконвёйера — сушилку. По устройству он ана-
логичен второму конвейеру, но в рубашку лотков подается вода тем-
пературой 70°С и дополнительно подводится воздух температурой
90°С. Выращенная и высушенная культура гриба из четвертого виб-
роконвейера поступает к месту назначения, а воздух фильтруется
и удаляется. )
178
Рис. 33. Винтовая виброустановка производительностью 3,5 т гриба в сутки:
/ — рама под бункер; 2 — бункер для отрубей; 3 — вибростерилизатор; 4 — вибропривод; 5—стерилиза-
тор воды; 6 — патрубок выгрузки стерильной питательной среды из стерилизатора и загрузки ее в винто-
вой виброконвейер; 7—8 — электродвигатель с виброприводом; 9, 10, //—материальные трубопроводы для
подачи среды соответственно на II и III виброконвейеры и культуры на IV виброконвейер.
Техническая характеристика растильной винтовой
виброустановки
Производительность по готовой культуре, т/сутки 3,5
Угол подъема винтового лотка (по среднему ди-
аметру) ........................................ 5о40'
Шаг лотка, мм...................................... 219,2
Диаметр желоба, мм:
наружный........................................ 2006
внутренний ..... 1000
средний......................................... 1500
Ширина лотка, мм ................................. 500
Высота лотка, мм.................................. 120
Частота колебаний, гц.........................От 5 до 26
Амплитуда колебаний, мм.............................. 5
Угол направления колебаний....................87°Г; 89°30'
Электродвигатель типа А82-8:
мощность, кет................................. 28—40
число оборотов в минуту.......................... 730
Масса, т............................................ 16
Очищенный кондиционированный воздух, необходимый для
аэрации, подается кондиционером КД-10. Все виброконвейеры рас-
полагаются в обособленном светлом, чистом, хорошо вентилируемом
помещении.
Использование вибрационных установок для выращивания плес-
невых грибов требует надежной виброизоляции и уравновешивания
колеблющихся масс, что несколько усложняет конструкцию. Эксплу-
атация их затрудняется также необходимостью организации пере-
мещения питательной среды по виброоргану с минимально возмож-
ной скоростью и разработки специальных устройств, устраняющих
адгезию и когезию среды.
Из обзора устройств механизированных и автоматизированных
установок для поверхностного выращивания культур плесневых
грибов видны разнообразие конструктивных решений и их целена-
правленность — полностью герметизировать и механизировать все
технологические операции, исключить применение кювет, а следо-
вательно, и ручного труда; интенсифицировать и удешевить произ-
водство.
Дробление культуры гриба
Выращенная культура плесневого гриба содержит от 40 до 55%
влаги и при хранении в толстом слое почти полностью инактиви-
руется в течение 3 ч за счет выделяющегося тепла. Высушенная
культура гриба не инактивируется даже при длительном хранении,
поэтому при необходимости транспортирования культуру гриба
следует сушить. Для ускорения процесса и равномерности сушки
необходимо предварительно измельчить культуру гриба до части-
чек размером 1—2 мм. Дробление проводят путем раздавливания,
удара, истирания или раскалывания, но чаще всего применяют
комбинированное воздействие.
180
Степенью измельчения (п) называется отношение поперечного
сечения (D) наиболее крупных кусков до измельчения к сечению
(d) их после измельчения n = D:d.
Для дробления культуры гриба применяют дробилки ударного
и ударно-центробежного типа. Выбор типа дробилки зависит глав-
ным образом от степени измельчения, необходимой для проведения
последующего процесса сушки или диффузии. Наряду с этим необ-
ходимо учитывать 1и общие требования, предъявляемые к измель-
чающему оборудованию ,в ферментном производстве: сохранение ис-
ходной ферментативной активности; равномерная величина гранул;
герметизация выгрузки культуры гриба из кювет в дробилку; мак-
симальное устранение пылеобразования; непрерывность процесса;
аспирирование дробилки и фильтрация удаляемого воздуха.
ВНИИФСом испытаны различные типы устройств, 'Применяемых
для измельчения культур гриба влажностью 38—55%.
Дробилка КДП-4. На Вышневолоцком заводе ферментных пре-
паратов испытана плодоовощная дробилка КДП-4 (рис. 34).
Дробилка состоит из станины, внутри которой расположен вра-
щающийся цилиндрический барабан; бункера для приема культуры;
направляющих для создания направленного потока к ножам бара-
бана и лотка для отвода измельченного продукта. В пазы барабана
вставлены продольные ножи-гребешки четырех прижимных коло-
док, изготовленных из нержавеющей стали и смонтированных на
общей оси. Вал с ножами приводится в движение от электродвига-
теля. Число оборотов вала 2550 в минуту.
Загруженная в бункер культура гриба вращающимся барабаном
доставляется в регулируемый зазор, где измельчается между про-
дольными ножами и прижимными колодками и через лоток уда-
ляется из машины. Зазор между прижимными колодками и острия-
ми ножей может изменяться от 0,5 до 20 мм. Чем он больше, тем
выше производительность дробилки и больше величина частиц из-
мельченной культуры (табл. 14).
Таблица 14
Зависимость производительности дробилки и гранулометрического состава
культуры гриба Asp. awamori от величины зазора
Величина зазора, мм Часовая производи- тельность по культуре гриба, кг Процентный состав остатка на ситах при величине гранул, мм
10 7 1 5 1 3 2 L 1 1 0,5
17,5 1609 14 16,1 17,3 20,7 17 13,7 1,2
15,0 1590 9,1 13,3 16,4 23,8 15,7 19,6 2,1
13,0 1540 6,9 8,8 12,9 25,8 16,9 22,3 6,4
10 1470 4,9 10,3 13,3 27,1 17,9 20,7 5,8
181
Из данных табл. 14 видно, что с уменьшением зазора от 17,5 до
10 мм содержание гранул размером от 5 до 10 мм уменьшается с
47,4 до 28,4%, тогда как количество более мелких гранул (от 3 до
0,5 мм) возрастает с 52,6 до 71,6%.
Рис. 34. Дробилка КДП-4:
/ — бункер; 2 — прижимная колодка; 3 — ножи; 4 —барабан; 5 —станина; 6 — привод;
7 — выход измельченного продукта; 8— прижимные устройства.
Измельчение культуры на дробилке КДП-4 дает неоднородные
по размерам частицы. Использование этой дробилки для измель-
чения культуры перед сушкой возможно при установлении величи-
ны зазора 8—6 мм; в случае направления культуры гриба на диф-
фузию зазор должен быть до 13—15 мм. Потерь ферментативной
активности культуры гриба при измельчении ее на дробилке КДП-4
не наблюдается.
182
Для герметизации выгрузки культуры гриба из кювет в дробил-
ку КДП-4 устанавливается герметический бункер из листовой ста-
ли. Внутри него расположена рамка, в которую через щель в стен-
ке вдвигается кювета с культурой гриба. Рамка с помощью рукоят-
ки поворачивается вместе с кюветой на угол 180°, до ограничите-
лей. Для полного освобождения кюветы повороты рамки с ударами
об ограничитель повторяют 2—3 раза, после чего возвращают рам-
ку в исходное положение и извлекают пустую кювету. В верхней
части бункера расположен штуцер для аспирации. Во избежание
пылеобразования выгрузочный патрубок герметично присоединяет-
ся к крафт-мешку.
Рекомендуется устанавливать дробилку в обособленном помеще-
нии с приточно-вытяжной вентиляцией, а удаляемый воздух фильт-
ровать через фильтр грубой очистки, а затем через бактериальный
фильтр. Дробилка изготавливается Батумским машиностроитель-
ным заводом.
Дробилка ударного типа. На Московском опытном заводе фер-
ментных препаратов испытана дробилка ударного типа (рис. 35).
Внутри корпуса дробилки расположен горизонтальный вал с при-
варенными по спирали И билами размером 140X10 мм, изготов-
ленными из твердой стали. Вал приводится в движение от электро-
двигателя мощностью 2,8 кет. Число оборотов вала 300 в минуту.
Над бункером мельницы расположено устройство для приема
кювет и герметизированной выгрузки выращенной культуры. В
кожухе сделана прорезь для установки кювет на направляющих,
приваренных к трубе, которая с помощью рукоятки поворачивается
на угол 180°. При повороте кювета опрокидывается, ударяется о
выступы, культура гриба выгружается из нее и поступает на не-
подвижную станину с пальцами.
При вращении вала била проходят между пальцами, измельча-
ют культуру и направляют ее вниз, к приемному бункеру, из кото-
рого она по спуску поступает в диффузоры. Зазор между билами
и пальцами 2,5 мм. Производительность дробилки 2400 кг/ч.
Гранулометрический состав измельченной культуры гриба влажностью 38%
Культура гриба Процентный состав остатка на ситах при величине гранул, мм
10 7 5 1 3 2 1» 1 0,5
Asp. flavus 33,0 12,6 6,6 17,2 14,6 15,6 0,45
Asp. oryzae КС 30,5 12,0 10,5 12,0 12,5 17,0 3,0
Ударная дробилка Московского опытного завода дает более
грубое измельчение, чем дробилка КДП-4: содержание гранул раз-
мером 10 мм и более 33%, тогда как при измельчении на дробилке
КДП-4 от 35 до 14%. Количество гранул размером от 5 до 10 мм
183
составляет 52—53%, тогда как на дробилке КДП-4 при зазоре
17,5 мм таких гранул 47,4%, а при принятом режиме работы дро-
билки с зазором 10 мм всего 28—38%.
Рис. 35. Дробилка ударного типа:
/—штуцер для аспирации; 2 — кожух; 3 — загрузочная щель; 4 — поворотная
ручка; 5 — приемный бункер; 6 — приводной шкив; 7 — опорная рама; 8 — вал;
9 — била; 10 — неподвижная решетка; И — электродвигатель.
Универсальный гранулятор. В целях получения гранул, более
равномерных по величине, был испытан универсальный грануля-
тор, применяемый на заводах химико-фармацевтической промыш-
ленности для гранулирования сухих и влажных материалов.
184
Гранулятор (рис. 36) состоит из станины, загрузочного бункера
с ротором и лопастной головкой, закрепленной на конце вертикаль-
ного вала ротора, сменной сетки и приемного бункера для измель-
ченного материала. Сменные сетки имеют отверстия диаметром от
2 до 10 мм в зависимости от нужной степени измельчения.
Рис. 36. Универсальный гранулятор:
1 — загрузочный конус; 2 — диск; 3 — ротор; 4 — сменная сетка; 5 — узел крепления вала;
6 — ведомый шкив; 7 — шкив ведущий; 8 — электродвигатель.
Культура гриба из загрузочного бункера попадает на лопастную
вращающуюся головку, под действием центробежных сил отбрасы-
вается к периферии лопастями, протирается через отверстия сетки
и направляется в приемный бункер. Производительность универ-
сального гранулятора при измельчении культуры гриба Asp. flavus
влажностью 39% лри диаметре отверстий сетки 8 мм оказалась в
4 раза ниже паспортной и составила 100 кг/ч.
Гранулометрический состав измельченной культуры гриба Asp. flavus
Размер гранул, мм 10 7 5 3 2 1 0,5
Процентное содержание 0 0 7,4 18,8 40,0 33,8 0
185
Гранулометрический состав измельченной культуры показывает,
что на универсальном грануляторе можно получать до 92,6% из-
мельченной культуры гриба с величиной гранул 1—3 мм.
При увеличении числа оборотов и диаметра отверстий сетки мо-
жет быть увеличена производительность аппарата и установлена
необходимая величина гранул. Универсальные грануляторы изго-
тавливает Ждановский машиностроительный завод. Габариты гра-
нулятора 820Х475Х 1150 мм.
Испытания валковой дробилки при числе оборотов валков: пер-
вого 20 и второго 140—160 в минуту, что соответствует скорости
вращения 0,1 и 0,73—0,83 м!сек с штифтами на валках высотой до
10 мм и диаметром 6—8 мм показали возможность получения ос-
новной массы измельченных частиц размером от 2 до 5 мм. Изме-
нение величины частиц может, быть достигнуто за счет изменения
числа штифтов и их диаметра. Производительность дробилки будет
зависеть от ширины и диаметра валков.
Дезинтегратор (рис? 37) относится к группе ударно-дисковых
мельниц и состоит из двух роторов, вращающихся в противополож-
ные стороны с большой скоростью (соответственно 950 и
1440 об)мин) с индивидуальным приводом. Ротор представляет со-
бой два кольцевых диска, соединенных стальными цилиндрически-
Рис. 37. Дезинтегратор:
/ — бункер; 2—дробящее устройство; 3- электродвигатель; 4 — верхняя рама;
5 — нижняя рама.
186
м'и пальцами. Круглые пальцы на роторах диаметром 15 и длиной
55 мм расположены по концентрическим окружностям, причем каж-
дый ряд пальцев одного ротора входит между двумя рядами паль-
цев другого. Число ударных пальцев на каждом роторе увеличи-
вается от центра к периферии.
Культура гриба подается к дезинтегратору шнеком, в котором
она частично измельчается, после чего сверху через загрузочную
воронку поступает вдоль оси роторов и центробежной силой отбра-
сывается к периферии, дополнительно измельчаясь между двумя
вращающимися роторами. Производительность дезинтегратора по
культуре гриба влажностью 45—50% 120—140 кг/ч. Ввиду большой
скорости вращения роторов необходима точная установка их и ба-
лансировка. Следует также предусмотреть защитное приспособле-
ние, предохраняющее от попадания в роторы посторонних твердых
тел.
Гранулометрический состав измельченной культуры гриба Asp. oryzae
(влажность 40%)
Размер гранул, мм 10 7 5 3 2 1 0,5
Процентное содержание 0 0 2 7,8 46,0 42,7 1,5
Как показали испытания в ферментном цехе Львовского пивова-
ренного завода, ударно-дисковая дробилка типа дезинтегратора
позволяет получать 96% гранул размером от 1 до 3 мм.
Поскольку для эффективного процесса сушки желательно иметь
гранулы размером 2—3 мм, то из испытанных типов дробилок наи-
более целесообразно использовать дезинтегратор.
Для процесса экстракции желательно иметь частицы величиной
до 5 мм, в связи с чем для измельчения культуры, направляемой
на экстрагирование, следует использовать валковую дробилку кон-
струкции ВНИИПТхиммаша.
Для загрузки культуры гриба в мельницы любой конструкции
может быть использовано герметизированное устройство, описан-
ное на стр. 183.
Сушка культур грибов и бактерий
Дробленая культура гриба с содержанием влаги от 38 до 55%
направляется на сушку для удаления влаги до остаточного содер-
жания 10—12%. Течение процесса сушки зависит от характера свя-
зи влаги с высушиваемым материалом. Как известно, влага может
быть связана с материалом силами сцепления, капиллярными и др.
В культуре плесневых грибов различают свободную и гигроско-
пическую влагу. Каждый материал можно высушить только до рав-
187
новесной влажности, при которой между давлением пара на по-
верхности материала и парциальным давлением его в окружаю-
щем воздухе устанавливается равновесие. Скорость сушки зависит
от состава среды, на которой был выращен плесневый гриб, степе-
ни измельчения культуры, высоты слоя, начального и конечного
влагосодержания культуры, влажности, температуры и скорости
движения сушильного агента — воздуха, разности температур воз-
духа на входе и выходе из сушилки, конструкции сушилки и от дру-
гих факторов. Поэтому определение скорости сушки культур плес-
невых грибов расчетным путем сравнительно сложно.
Для высушивания культур плесневых грибов применяют прямо-
точные сушилки непрерывного действия. Совместное движение на-
гретого воздуха и культуры гриба в одном потоке способствует со-
хранению ферментативной активности культуры, так как во влаж-
ном состоянии она более устойчива к высокой температуре. Темпе-
ратура выходящей из сушилки культуры сравнительно низка (35—
40°С), так как культура соприкасается с охлажденным и насыщен-
ным влагой воздухом и поэтому меньше инактивируется.
Сушилки, работающие при атмосферном давлении, характери-
зуются непрерывной и равномерной загрузкой и выгрузкой продук-
тов, а также стабильностью процесса в течение длительного вре-
мени.
В настоящее время для высушивания культур плесневых грибов
наиболее распространена барабанная сушилка прямого действия, в
которой воздух температурой 90—95°С непосредственно соприка-
сается с культурой гриба.
Барабанная сушилка (рис. 38) представляет собой цилиндри-
ческий наклонный барабан с внутренним распределительным уст-
ройством — подъемно-лопастной системой, состоящей из наклонных
лопаток длиной 200 и шириной 150 мм. Края лопаток несколько
Рис. 38. Барабанная сушилка:
/ — сушильный барабан; 2 — штуцер для подачи сушильного агента; 3 — штуцер для
загрузки измельченной культуры гриба; 4—приводные ролики; 5 — передающий вал;
6 — холостой ролик; 7 —рама; 8 — штуцер для выхода высушенной культуры гриба;
9 — штуцер для выхода отработавшего воздуха.
188
загнуты вверх. Лопатки расположены по винтовой линии, что обес-
печивает хорошее распределение культуры по всему сечению су-
шилки. Расстояние между лопатками 200—250 мм. Угол наклона
барабана к горизонту находится в пределах 0,5—6°.
Корпус сушилки опирается на специальные опоры с подшипни-
ками качения или скольжения. Вращение барабану передается от
привода через редуктор и зубчатый венец, насаженный на барабан.
Скорость вращения зависит от угла наклона и обычно составляет
до 8 об!мин.
Измельченная культура гриба поступает через питатель, распо-
ложенный над приподнятым концом корпуса, захватывается лопат-
ками и с помощью подъемно-лопастной системы пересыпается и
равномерно распределяется по всему сечению.
В процессе движения внутри сушилки культура гриба контакти-
рует с сушильным агентом, перемещающимся вдоль барабана по
направлению ее движения.
Коэффициент заполнения сушилки культурой гриба составляет
0,2—0,25. Продолжительность сушки 5—7 мин.
Унесенные воздухом частицы материала отделяются от него в
циклоне. Во избежание значительного уноса материала скорость
воздуха должна быть не более 2—3 м!сек.
Производительность сушилки диаметром 1200 и длиной 4200 мм
составляет 65—70 кг культуры гриба в час.
Барабанные сушилки нормализованы и имеют диаметры 1200,
1400, 1600, 1800, 2400 и 2800 мм. Отношение длины к диаметру
— равно 3,5 и 7.
Достоинства такой сушилки: простота устройства и сравнитель-
ная легкость герметизации загрузки и выгрузки продукта. Недо-
статки: громоздкость, металлоемкость и малая производительность.
Отработавший воздух необходимо отфильтровать сначала через
фильтр Рекка, а затем фильтр ЛАИК.
Сушилки выпускаются Уралхиммашзаводом и бердичевским за-
водом «Прогресс».
На Вышневолоцком заводе ферментных препаратов и в Красно-
дарском цехе культуры плесневых грибов сушат на сушилках
ПКС-Юи ПКС-20.
Паровые конвейерные сушилки (ПКС). Устройство сушилки
ПКС описано на стр. 160. Достоинством их является высокая про-
изводительность и простота обслуживания. Однако применять их
для сушки культуры гриба можно лишь при условии полной герме-
тизации и бактериальной фильтрации удаляемого воздуха. Пара-
метры сушки следует установить такими, чтобы потери активности
фермента не превышали 10%.
На Вышневолоцком заводе ферментных препаратов культуру су-
шат на ПКС-20 при температуре воздуха в нижней зоне 40, средней
52 и в верхней 65—70°С. Устанавливать сушилку следует в изоли-
189
рованном, хорошо вентилируемом помещении. Производительность
ее 4 т культуры в сутки.
В сушилках ПКС поверхность каждой ленты используется толь-
ко наполовину, так как нижние ветви лент движутся без материала.
В* многоленточных сушилках этот недостаток устранен, материал
находится на верхней и нижней ветвях лент как при прямом, так и
обратном ходе.
Многоленточная сушилка с опрокидывающимися пластинами
(рис. 39) состоит из прямоугольной камеры, в которой движется
несколько бесконечных цепных транспортеров, надетых на звез-
дочки, приводимые в движение от привода. Ленты транспортеров
выполнены в виде плоской проволочной сетки, обрамленной рамкой
и шарнирно прикрепленной к тяговой цепи. Пластины, составляю-
щие ленту, снабжены выступами и скользят по направляющим
угольникам, которые имеют перед звездочкой прорези. Воздух, на-
гнетаемый вентилятором, нагревается в калорифере, по каналам
подается снизу вверх и после контакта с материалом на всех лен-
тах удаляется по каналам для отработавшего воздуха.
Рис. 39. Многоленточная сушилка:
/ — камера; 2 — цепной транспортер; 3 — опрокидывающиеся пластины; 4 — кана-
лы для отработавшего воздуха; 5 — штуцер для загрузки влажного материала;
6 — каналы для ввода горячего воздуха; 7 — транспортер.
Высушиваемый материал подается через питатель на верхнюю
ветвь и перемещается вместе с пластинами. Подходя к звездочке,
пластины верхней ветви поворачиваются вокруг оси на угол 90°,
и продукт пересыпается на. внутреннюю полость нижних пластин,
уже обогнувших звездочку транспортера, которые перемещают его
в обратном направлении. Дойдя до следующей звездочки, пластины
этой ленты также поворачиваются, и материал пересыпается на ни-
жележащую часть транспортера. Таким образом, материал, пере-
190
двигаясь в камере сверху вниз, полностью высушивается, после чего
ссыпается на разгрузочный транспортер. Фильтрация удаляемого
воздуха аналогична описанной выше.
Конвейерная сушилка ВНИЭКИпродмаша марки А1-ВУС-3.
Для сушки культур плесневых грибов ВНИЭКИпродмаш разра-
ботал конвейерную сушилку, состоящую из дробилки-гранулятора,
транспортера-питателя, конвейерной ленточной сушилки и системы
подготовки воздуха, включающей фильтры, вентиляторы, калори-
феры, узлы воздухоподачи и распределения.
Сушилка (рис. 40) представляет собой металлический шкаф,
внутри которого расположено пять ярусов бесконечных сетчатых
лент, натянутых на барабаны. Каждый конвейер состоит из лент,
натянутых на два барабана, один из которых является ведущим. Все
ветви лент приводятся от общего электродвигателя через редуктор,
кривошипно-шатунный и храповой механизмы, с помощью которых
скорости движения регулируются в соотношении 1:24 (храповой
механизм позволяет регулировать скорость движения каждого кон-
вейера в соотношении 1:6, а кривошипный регулирует скорость дви-
жения одновременно всех конвейеров в соотношении 1:4).
Техническая характеристика конвейерной сушилки марки А1-ВУС-3
Производительность по сухой культуре гриба влаж-
ностью 10%, т] сутки............................. 3,5
Число сетчатых конвейеров ...... 5
Площадь конвейеров, м2.............................. 30
Ширина сетки конвейера, мм......................... 1250
Регулируемая скорость движения конвейеров,
мм!мин........................................От 40 до 5700
Диаметр барабанов конвейеров, мм ... 244
Продолжительность сушки и охлаждения, мин . 40—60
Максимальная температура нагрева культуры
в процессе сушки, °C.......................... 57
Габариты сушилки, мм.......................... 5560X2800X2790
Общая мощность электродвигателей, кет . . 29
Габариты всей установки, мм...................24 400X5000X3950
Масса, кг..................................... 11600
Расход на 1 т высушенной культуры:
воздуха, м?.................................... 17 800
пара (давлением 392 кн!м2), кг . . 6000
электроэнергии, квт-ч ................... 200
В боковых стенках и торце сушилки имеются плотно прилегаю-
щие дверцы. Подвод подогретого воздуха к сушилке, его распреде-
ление и сам процесс сушки происходят в трех зонах. Верхний ярус
является первой, следующие 3 яруса—второй и последний ярус—
третьей зоной.
Выращенная культура гриба влажностью до 55% поступает в
дробилку-гранулятор, где измельчается с помощью шнека и ци-
линдрических неподвижных штырей, закрепленных в стенках кор-
191
192
г з k
Рис. 40. Сушильная установка А1-ВУС-3 ВНИЭКИпродмаша:
1 — транспортер-питатель; 2 — конвейерная сушилка; 3 — калорифер; 4 — фильтр; 5 — дробилка-гранулятор; 6 — фильтр
всасывающий; 7 — вибратор.
пуса. Перемещаясь к фильере, встроенной в торцевой части, она
выпрессовывается через отверстия диаметром 4 мм, разрезается
ножом на кусочки цилиндрической формы длиной и диаметром 4 мм
и подается равномерным слоем через вибрирующий транспортер-
питатель на верхнюю ветвь сушилки. Воздух, подаваемый под сет-
ку первой зоны, имеет температуру 65°С, и за 10 мин перемещения
культуры на первой ленте подсушивает ее до 35%-ной влажности.
При непрерывном 30-минутном перемещении по лентам второй зо-
ны в контакте с воздухом, нагретым до 45°С, культура окончательно
досушивается до 10—12 %-ной влажности. В третьей зоне она ох-
лаждается до 25°С воздухом с температурой 16°С и удаляется. Воз-
дух, подаваемый в сушилку и удаляемый из нее, фильтруется через
масляный и металлические фильтры. Сушилка снабжена прибора-
ми контроля температуры воздуха и культуры, системой автомати-
ческого регулирования и записи температуры в процессе сушки.
Шахтная сушилка ВИС. Во ВНИИФСе проведены испытания
непрерывно действующей автоматической шахтной сушилки
ВИС-42Д, показавшие возможность сушки культур плесневого
гриба без существенной потери ферментативной активности.
При использовании сушилок по прямому назначению (т. е. для
сушки) необходимо изменить кинематическую схему поворота пла-
стин полок с таким расчетом, чтобы общая длительность сушки со-
ставляла 5—40 мин.
Измельченная культура гриба непрерывно подается через при-
емный бункер в течку загрузочного аппарата и автоматически рав-
номерным слоем распределяется на верхней полке камеры сушил-
ки. По истечении заданного времени (для культуры гриба Asp.
awamori 25—40 сек) пластины автоматически поворачиваются
на угол 90° к горизонту и культура перегружается на нижележа-
щую полку. Таким образом, через каждые 25—40 сек происходит
непрерывное перемещение культуры с полки на полку.
Воздух, засасываемый центробежным верхним вентилятором,
нагнетается им в камеру сушилки через калорифер, в котором на-
гревается до 85—90°С. Пройдя параллельным потоком в одном
направлении над полками с культурой гриба, воздух по переходно-
му каналу направляется в промежутки между следующими полка-
ми и движется здесь в обратном направлении, попадая в патрубок
для удаления отработавшего воздуха. Нижний вентилятор подает в
сушилку через калорифер воздух с температурой 60—70°С. Сопри-
касаясь с культурой гриба на нижних 6 полках камеры, воздух до-
сушивает ее до содержания влаги 10—12%.
Отработавший воздух отсасывается вытяжным вентилятором че-
рез 3 последовательных циклона и удаляется в атмосферу, а части-
цы культуры, увлеченные им, отделяются и по мере накопления
периодически выгружаются. Перед удалением воздуха в атмосферу
его необходимо пропустить через фильтр Рекка, а затем фильтр
ЛАИК. Высушенная культура гриба поступает в приемный бункер.
194
Вибрационная сушилка может быть в горизонтальном и верти-
кальном исполнении. Устройство ее в принципе не отличается от
устройства вибротранспортеров (см. стр. 86—88). При использо-
вании вибрационного транспортера для сушки необходимо оборудо-
вать его питателем л подвести теплоноситель, в качестве которого
могут быть использованы горячий воздух, дымовые газы, электро-
обогрев, высокочастотный обогрев и т. д.
В вибрационных сушилках тепло может передаваться за счет
теплопередачи от нагретых поверхностей, по которым транспорти-
руется материал, конвекции нагретого воздуха или газов, радиации
от горячих поверхностей.
При высушивании таких термолабильных продуктов, как куль-
тура гриба, вибрационные сушилки могут работать под вакуумом.
В обычных установках этого типа водяные пары удаляются воз-
духом, который в процессе сушки проходит под продуктом или че-
рез слой его. Количество подаваемого воздуха зависит от его темпе-
ратуры и влажности на входе и выходе.
Сушка на вибрационных сушилках не изменяет внешнего вида
культуры, величины гранул и их цвета.
За рубежом и в СССР такие сушилки применяют для химических
материалов, |Кристаллических и аморфных пищевых продуктов (са-
хара, зерна, шоколада, мелочных продуктов), прочих материалов
(пластмасс, мыльных порошков,песка, минералов и руд).
Фирма Syntron (США) изготавливает вертикальные вибрацион-
ные сушилки для пищевой промышленности следующих типоразме-
ров (табл. 15).
Таблица 15
Характеристика вибрационных сушилок фирмы Syntron
Высота виброжелоба, м Диаметр, мм Высота лотка, мм Мощность электродвига- теля, квпг
наружный внутренний
2,5 500 300 150 0,6
3,0 700 400 150 1,5
4,5 900 500 200 5,0
6,0 1200 600 250 8,0
При использовании вертикальной вибрационной сушилки винто-
вого типа культуру гриба подают вибропитателем на приемный ло-
ток, а воздух, нагретый до 80—95°С, тангенциально подают прямо-
точно с культурой. Воздух последовательно проходит все витки виб-
росушилки и удаляется, причем часть его может быть нагрета и ис-
пользована для рециркуляции. Количество воздуха, подаваемого
на различных стадиях сушки, должно регулироваться. Возможна
195
также организация дополнительного обогрева витков с помощью
водяной или паровой рубашки.
Температура продукта также регулируется с помощью вибропи-
Тателя путем изменения скорости подачи культуры на сушку и вы-
соты ее слоя. Удаляемый воздух направляют в циклон, а затем в
фильтр для отделения спор. Сушилка должна быть установлена в
обособленном помещении с приточно-вытяжной вентиляцией. Все
операции подачи культуры гриба, сушки, выгрузки и упаковки дол-
жны быть герметизированы.
Упаковка культур грибов и бактерий
Сухую культуру гриба или бактерий упаковывают в мешки или
крафт-пакеты по 25—40 кг. Последнему виду упаковки следует от-
дать предпочтение, так как он лучше предохраняет препарат от
•внешних воздействий, что увеличивает сроки его хранения без сни-
жения ферментативной активности.
Заполненные мешки зашивают или заклеивают. На мешок на-
клеивают этикетку с указанием названия продукта, завода-изгото-
вителя, даты выпуска, номера партий, веса нетто и брутто и пока-
зателя ферментативной активности.
Расфасовка ведется вручную. Помещение, в котором проводится
расфасовка и упаковка, должно быть обеспечено приточно-вытяж-
ной вентиляцией. Операции выполняются с применением средств ин-
дивидуальной защиты: очков, респираторов, перчаток.
Удаляемый из помещения воздух должен быть сначала пропу-
щен через фильтр предварительной очистки, а затем бактериаль-
ный фильтр ЛАИК.
ТЕХНОЛОГИЧЕСКИЕ СХЕМЫ ПОВЕРХНОСТНОГО КУЛЬТИВИРОВАНИЯ
В нашей стране разработаны технологические схемы производ-
ства культур микроорганизмов, содержащих амилолитический ком-
плекс ферментов (Asp. awamori), амилолитический и протеолити-
ческий комплексы ферментов ( Asp. oryzae и Вас. subtilis), протео-
литический комплекс ферментов (Asp. terricola), пектолитический
комплекс ферментов (Asp. niger и Asp. awamori) и цитолитический
комплекс ферментов (Trichothecium roseum).
Все указанные выше культуры можно выращивать в основном
по одной технологической схеме, но на питательных средах различ-
ного состава и с изменением технологических параметров.
В настоящее время на большинстве предприятий плесневые
грибы выращивают в растильных камерах, на кюветах. Этот уста-
ревший способ является пока единственным для производства не-
которых культур (Вас. subtilis и Tr. roseum).
В последнее время, главным образом на основании работ
ВНИИФСа, созданы технологические схемы производства культур
грибов с использованием различных механизированных растильных
установок.
196
Приведем 3 варианта технологической схемы производства куль-
тур грибов: 1) с выращиванием в растильных камерах на кюветах,
который сейчас осуществлен на многих предприятиях; 2) с выращи-
ванием в растильных установках с вертикальными каналами, кото-
рый осуществлен на Мичуринском экспериментальном заводе
ВНИИФСа и может быть использован на предприятиях средней
мощности (до 2 т культуры гриба в сутки) и 3) с выращиванием
в непрерывно действующей конвейерно-пластинчатой установке,
предназначаемой для специализированных ферментных предприя-
тий мощностью более 2 т культуры гриба в сутки.
Схема с выращиванием культур грибов в растильных камерах
на кюветах
Культура гриба Asp. niger
Приготовление посевного материала. Эта операция выполняет-
ся в отделении чистой культуры. Чистую .культуру гриба Asp. ni-
ger выращивают на среде, основой которой является морковный от-
вар из свежей или сушеной моркови; в него добавляют 0,1—0,2%
сернокислого аммония и подкисляют серной или молочной кисло-
той до pH 3,5—4,5. Готовый отвар с содержанием сухих веществ
4—6% разливают в металлические банки емкостью 3 л (по 1 л в
каждую) и засевают чистой культурой Asp. niger из расчета — со-
держимое одной колбы на одну банку. Банки помещают в термо-
стат, где протекает выращивание в течение 5 суток при температу-
ре 30—32°С. Посевная культура считается готовой, когда вырос-
шая пленка покрывается конидиями, после чего ее извлекают из
банки, измельчают и приготовляют водную суспензию.
Приготовление среды для производства. Состав среды (%):
морковь (свежая и сушеная) по 10, пшеничные отруби 40, яблоки 10,
выжимки плодовые 30. Сырье поступает в стерилизационное отде-
ление. Стерилизация проводится следующим образом. Сначала в
стерилизатор загружают очищенные и промытые овощи и выжимки,
перемешивают 10—15 мин, а затем добавляют отруби. Стерилиза-
ция проводится в течение часа при температуре 101 — 102°С.
Простерилизованную таким образом среду охлаждают водой
( + 15°С) до температуры 30—32°С, пропуская ее через рубашку
стерилизатора.
Засев питательной среды и выращивание. В охлажденную сре-
ду вносят посевную культуру из расчета 200 мл суспензии на 1 кг
среды. Среду тщательно перемешивают и раскладывают на кюветы
слоем 20—30 мм. Кюветы устанавливают в растильные камеры на
специальные стеллажи. Кондиционирование воздуха не проводится.
Выращивание грибной культуры длится 22—24 ч при температуре
32—34 С.
Сушка, дробление и расфасовка. Выращенную культуру извле-
кают из кювет, измельчают и подают в сушилку ПКС-10 для высу-
шивания при температуре 42°С. Ленты сушилки движутся с неболь-
197
шой скоростью, влажность сухой культуры 7—10%. Высушенную
культуру снова измельчают на молотковой дробилке и расфасо-
вывают в бочки по 50 кг. Активность -препарата 200—300 ед. ПКС
на 1 г.
По этой технологической схеме и режиму производство культуры
гриба Asp. niger было организовано на Старорусском соко-экст-
рактном заводе, однако в 1966 г. Министерство здравоохранения
СССР запретило использование этой культуры в производстве со-
ков и вин, считая, что для этих целей следует применять только
очищенные (Препараты ферментов.
По нашему мнению, изложенная схема представляет интерес
для читателей, так .как именно по ней в 1935 г. впервые в нашей
стране был введен в действие цех для получения культуры гриба,
содержащей пектолитические ферменты.
Культура гриба Asp. awamori
В отделении чистой культуры выращивается посевная культура
плесневого гриба Asp. awamori 22. Технологический режим выра-
щивания подробно изложен на стр. 108—112. Приготовленную по-
севную культуру хранят в пакетах в холодном помещении (8—>10°С)
и по мере необходимости передают в стерилизационное отделение.
Питательной средой для выращивания производственной куль-
туры являются пшеничные отруби. При поступлении <из склада на
производство их взвешивают на весах, после чего норией передают
в бункер, откуда шнеком-питателем через автомукомер подают че-
рез шнек в стерилизаторы (рис. 41).
Рис. 41. Технологическая схема выращивания грибов и бактерий в растиль-
ных камерах на кюветах:
/ — нория; 2 — весы автоматические; 3 — загрузочный бункер; 4 — стерилизатор; 5 — бак
для стерильной воды; 6 — раскладочный стол; 7 — этажерка; 8 — растильная камера;
9 — кондиционер; 10 — шнек-дробилка; 11 — дезинтегратор; 12 — сушилка; 13 — шнек; 14 —
весы; /5 — калорифер; 16 — вентилятор нагнетающий; /7 — вентилятор отсасывающий;
18 — циклон; 19 — мойка для кювет ; 20 — шкаф-стерилизатор.
198
В стерилизаторе (типа Укргипропрод) отруби предварительно
увлажняют до 35—40% и затем обрабатывают острым паром при
температуре 105°С в течение полутора часов, после чего охлаж-
дают до 40°С холодной водой, подаваемой в рубашку стерилизатора
при непрерывно работающей мешалке. Для более надежной стери-
лизации в воду для увлажнения отрубей вносят соляную или сер-
ную кислоту из расчета, чтобы она была децинормальной по кисло-
те. С этой целью на 1 дал воды прибавляют 27 мл крепкой серной
кислоты (относительной плотностью 1,84) или 100 мл соляной ки-
слоты (относительной плотностью 1,19). Вместо кислоты можно до-
бавлять 0,1—0,3% формалина от веса отрубей.
В охлажденную среду вносят посевную культуру в количестве
0,6% от веса воздушно-сухих отрубей, «доувлажняют» стерильной
водой до 60%-ной влажности и вновь перемешивают в течение
20 мин. Подготовленную таким образом среду выгружают из стери-
лизатора на раскладочный стол и распределяют по кюветам, кото-
рые после заполнения направляют в растильные камеры.
Процесс выращивания длится 36 ч при поддержании температу-
ры в растущей культуре 31—33°С. В конце роста (33—36 ч) в ка-
меру в течение 3 ч подается сухой воздух с температурой 30°С для
подсушивания готовой культуры. Выращенную культуру выгружают
из камеры и направляют на дробилку, измельчая до частиц раз-
мером 1—2 мм, после чего сушат до остаточной влажности 12—
14% в сушилке любой конструкции (из изложенных на стр. 187—
196) и упаковывают в крафт-мешки. Потери ферментативной актив-
ности в процессе сушки составляют 8—15%. Готовая культура гри-
ба обладает следующей активностью в (ед /г): амилолитической
АС= 104-14, декстринолитической ДС = 300-г-350, мальтазной
МС= 180-200.
Изложенная схема производства осуществлена первоначально
на Серебряно-Прудском спиртовом, а затем на Тукумском фермент-
ном и Львовском пивоваренном заводах, а также на других пред-
приятиях, имеющих ферментные цехи.
СеребрянонПрудский ферментный цех был построен в 1952 г., на
первом этапе развития ферментной промышленности, когда не бы-
ло никаких навыков проектирования и производственного опыта по-
лучения технических ферментных препаратов. Поэтому выращива-
ние на этом заводе ведется самым простым способом — на кюветах,
большинство операций выполняется вручную, нет никаких уст-
ройств, герметизирующих их проведение.
С современной точки зрения такая схема кажется примитивной
и несовершенной, однако она служила отправной точкой при ис-
пытании и усовершенствовании многих узлов.
В ферментных цехах, построенных в последующие годы во Льво-
ве, Ростове, Батуми, Харькове и других городах, также принята
технологическая схема производства культуры гриба кюветным
способом, ряд операций в них механизирован и по-новому решен
вопрос аэрирования выращиваемой культуры кондиционированным
199
воздухом. Тем не менее и эта схема не лишена, недостатков. Снаб-
жение воздухом выращиваемой культуры происходит неравномер-
но, воздух со скоростью 2 м!сек проходит только в нижней и верх-
ней частях этажерок, а между кюветами, расположенными в сред-
ней части этажерок, скорость его падает до 1 м!сек, иногда и ни-
же, в результате чего здесь создаются так называемые мертвые зо-
ны, что в конечном счете приводит к снижению ферментативной ак-
тивности культуры.
Принятый режим стерилизации (105°С) не обеспечивает полной
стерильности питательной среды, что влечет за собой инфицирова-
ние культуры.
Культура бактерий Вас. subtilis
Продуцентом амилолитических и протеолитических ферментов,
вырабатываемых по излагаемой технологической схеме, является
Вас. subtilis. Схема производства строится следующим образом.
Питательной средой для выращивания бактерий являются пше-
ничные отруби. Из склада их передают на производство пневмо-
транспортом, взвешивают на автоматических весах и направляют в
стерилизатор Укргипропрода, где предварительно увлажняют до
50% и стерилизуют при температуре 105°С в течение 1 ч, а затем
охлаждают водой, подаваемой в рубашку стерилизатора, до темпе-
ратуры 40°С.
В охлажденные отруби вносят посевную культуру в виде жид-
кости из расчета 5% к весу воздушно-сухих отрубей, а затем добав-
ляют стерильную воду для доведения влажности среды до 68%. За-
сеянную среду в течение 30 мин перемешивают в стерилизаторе, а
затем направляют на раскладочный стол, где и распределяют по
кюветам слоем 20—25 мм, и транспортируют в растильные камеры.
Для производства культуры с преобладанием амилолитических
ферментов выращивание ведут 68—72 ч при температуре 30°С или
48 ч при температуре 37°С. При получении культуры с преобладани-
ем протеолитических ферментов выращивание проводят при пере-
менном температурном режиме — в первые 24 ч при 35°С и в после-
дующие 24 ч при 30°С.
Готовую культуру измельчают на частицы размером 1—2 мм,
сушат до влажности 12—14% и расфасовывают в крафт-мешки по
15 кг.
Готовая культура (амилолитическая) должна обладать амило-
литической активностью не менее 150 ед. АС/г и осахаривающей ак-
тивностью не менее 300 ед. ОС/г; протеолитическая готовая куль-
тура должна обладать протеолитической активностью не менее
6 ед. ПС/г (по методу Лейлен — Фольгарда). Технологическая схе-
ма производства протеолитической культуры осуществлена на уста-
новке УкрНИИППа.
200
Культура гриба Trichothecium roseum
Питательной средой являются различные отходы крупяного
производства (рисовая, ячменная, просяная, овсяная и другая ше-
луха) в сочетании с равным количеством солодовых ростков и 10%
дрожжевого автолизата к весу сырья. Компоненты питательной сре-
ды подают в стерилизатор, перемешивают и подвергают стерилиза-
ции при температуре 103—105°С в течение часа. Простерилизован-
ную среду увлажняют водой до 58—59% и вносят посевной матери-
ал. Оптимальный pH среды лежит в пределах 5,0—5,5.
Посевной материал гриба Tr. roseum выращивается в специаль-
ных колбах на качалках на среде, состоящей из трех частей охме-
ленного сусла и одной части вытяжки из солодовых ростков. Среда
предварительно стерилизуется в автоклаве «при температуре 120°С
в течение часа. Выращивание ведется в течение 2,5 суток при тем-
пературе 23°С. За это время гриб образует пленку, которую раз-
мельчают вместе со средой в гомогенизаторе и направляют в произ-
водственный стерилизатор.
Засеянную питательную среду раскладывают на специальные
растильные кюветы слоем 30—35 мм и выращивают в растильной
камере при температуре 20—25°С в течение 2,5 суток. Полученную
готовую культуру измельчают в дезинтеграторе и подают на сушил-
ку ВИС-42, где сушат до влажности 12—14%. Высушенный препа-
рат расфасовывают в крафт-мешки и направляют потребителю.
Недостатки схемы: малая механизация и большая трудоемкость
производственных процессов; большая длительность выращивания
производственной культуры гриба; отсутствие герметизации, нару-
шающее нормальные санитарно-гигиенические условия труда.
Данная схема осуществлена на Львовском пивоваренном заводе.
Схема с использованием растильной установки
с вертикальными каналами
. Культура гриба Asp. oryzae'
Препарат предназначен для применения в спиртовой, пивоварен-
ной и кожевенной промышленности. Посевную культуру плесневых
грибов Asp. oryzae КС и Asp. oryzae И-476 выращивают таким же
образом, как описано на стр. 108—112.
Все дальнейшие операции, связанные с перемещением, стерили-
зацией >среды, добавлением в нее посевного материала и последу-
ющим доувлажнением ее аналогичны описанным для Asp. awamo-
ri (стр. 198). Выращивание ведут в установке с вертикальными ка-
налами. Проводимые на этой установке операции подробно изложе-
ны на стр. 160—163.
Выбор штамма плесневого гриба и режим выращивания зави-
сят от того, преобладание какого комплекса стремятся получить в
готовой культуре. Если готовую культуру желают получить с пре-
обладанием амилолитических ферментов, то выращивают плесневый
201
гриб Asp. oryzae штамм И-476 в течение 24 ч при температуе в слое
растущей культуры 31—32°С. Если хотят в готовой культуре иметь
повышенное содержание протеолитических ферментов, то выращи-
вают плесневый гриб Asp. oryzae КС в течение 36 ч при температуре
в слое растущей культуры 28—30°С.
Потери амилолитической активности в процессе сушки достига-
ют 12—15%, а протеолитической активности — 8—10%.
Готовый продукт имеет вид мелкозернистой крупки зеленовато-
коричневого или желтовато-серого цвета с частицами размером
1—3 мм. Водная вытяжка из сухого препарата не должна быть мут-
ной, но может давать легкую опалесценцию.
Схема с использованием непрерывнодействующей конвейерно-
пластинчатой установки
Культура гриба Asp. terricola
Технический препарат предназначен для применения в кожевен-
ной промышленности. Исходным посевным материалом являются
конидии гриба Asp. terricola штамм 3374, выращенного на сусло-
агаре в пробирках при температуре 30°С в течение 5—7 суток. Посев-
ную культуру выращивают на пшеничных отрубях по такой же схе-
ме, что и Asp. awamori. Выращивание продолжается 70—72 ч при
температуре в слое растущей культуры 32—35°С. Производственную
культуру выращивают в конвейерно^пластинчатой установке не-
прерывного действия. Подробное изложение проводимых операций
приведено на стр. 170.
Расход посевной культуры составляет 0,6% по весу воздушно-
сухих отрубей, идущих на выращивание производственной куль-
туры.
Посевную культуру увлажняют стерильной водой с температурой
25—30°С (расход воды 5—6 л на 1 кг культуры). После тщательно-
го перемешивания и измельчения подготовленный таким образом
материал подается в специальные аппараты—посевной узел, с по-
мощью которого им засевают простерилизованную производствен-
ную среду, движущуюся по пластинчатому конвейеру.
Начальная влажность засеянной среды 60%. Температура в слое
выращиваемой культуры 35—37°С. Продолжительность выращива-
ния 36 ч. Влажность культуры по окончании роста должна быть
не ниже 55%. Сушат культуру непосредственно в установке.
Готовый продукт влажностью 12—14% имеет вид мелкозерни-
стой крупки с частицами размером 1—3 мм. Протеолитическая ак-
тивность ПС = 30 ед)г.
ЛИТЕРАТУРА
1. Ан дер ко флер Л. А. Грибные амилазы В кн. «Бродильные производства»,
Т. 2. Пищепромиздат, 1959.
2. Б а р а и о в а С. А. О расщеплении пектина ферментами микроорганизмов.
«Микробиология». Т. XV. Вып. 4, 1946.
202
3. Beckhorn E. T.— Production of industrial enzymes. Wallerst. Lab. Comm.
Vol 23, 1960.
4. Брицын H. Л. Нагрев в электрическом поле высокой частоты. Гос. изд-во
машиностроительной и судостроительной литературы. Л., 1957.
5. Бурьян Ю. Д., Гарлинская Е. И., Долгополов Я- И., Ковалев
Б. М. К вопросу о спорицидном действии токов высокой частоты. Химическая
лаборатория им. Менделеева и ЦНИГИ, 1954.
6. Важное В. Н. Отчет о симпозиуме по вопросам стерилизации, состоявшем-
ся в ГДР в 1962 г.
7. Витковская В. А., Вакуленко В. А., Лаврищева Т. Н., Адамен-
ко Э. С., Коваль Е. А., Сахарова Н. И. К уточнению режима поверх-
ностного культивирования продуцента глюкозооксидазы. Труды УкрНИИСПа.
Вып. X, 1965.
8. Высоцкая М. А. Получение пектолитических ферментов из отходов про-
изводства лимонной кислоты. В кн. «Внедрение ферментных препаратов в на-
родное хозяйство». Ч. II. ЦИНТИпищепром, 1961.
9. Гауровитц Ф. «Химия и биология белков». Изд-во «Мир». М., 1965.
10. Гипроспиртвино. Проектное задание цеха по производству культуры грибов
Мичуринского экспериментального ферментно-спиртового завода. М., 1963.
11. Голгер Л. И, Шилова А. А. К вопросу выращивания культур плес-
невых грибов в движущемся слое питательной среды. Труды ВНИИФСа.
Вып. XVI, 1965.
12. Голгер Л. И. Механизация и герметизация технологических операций
ферментного производства. ЦИНТИПищепром. 1965.
13. Голгер Л. И., Петрова Н. М., Гончаревич И. Ф. Вибрационные
растильные установки для выращивания культур плесневых грибов. Научно-
техническая информация. Вып. I. ЦИНТИПищепром, 1967.
14. Голгер Л. И., Калунянц К. А., Колосков С. П. К вопросу об из-
мельчении культур плесневых грибов. Труды ВНИИФСа. Вып. XVII, 1967.
15. Государственный комитет по пищевой промышленности при Госплане СССР.
Инструкция по определению производственной мощности цехов по выращи-
ванию культуры плесневых грибов. М., 1963.
16. Гинзбург А. С. Сушка пищевых продуктов. Пищепромиздат, 1960.
17. D rews В., Specht Н. Die Verwendung von Reiskleie zur Pilzmalzherstel-
lung, «Brantweinwirtschaft», Bd. 30, № 17, 1958.
18. Д ж о p о г я н Г. А. Некоторые конструкции аппаратов для сушки зерна и
продуктов его переработки. Хлебоиздат, 1960.
19. Е г и а з а р о в О. Г. О холодной стерилизации молока и молочных продуктов.
«'Молочная промышленность», 1958, № 7.
20. Зарецкая Д. И. Проекты цехов для выращивания плесневого гриба. Ри-
зопус поверхностным способом. «Спиртовая промышленность», 1960, № 4.
21. Зарецкая Д._И. Выращивание плесневого гриба Asp. oryzae поверхност-
ным способом. «Спиртовая промышленность», 1959, № 5.
22. Калашников Е. Я. Ферменты, их производство и применение в пище-
вой промышленности. Труды УкрНИИППа. Вып. 2. Харьков, 1959.
23. Калашников Е. Я- Основы технологии культивирования плесневых гри-
бов в производстве ферментных препаратов. В кн. «Внедрение ферментных
препаратов в народное хозяйство». Ч. II. ЦИНТИпищепром, 1961.
24 Кал итвя некий В. Н., Дегтев В. И. Высокочастотный нагрев неме-
таллических материалов. Госэнергоиздат, 1946.
25. К а л у н я н ц К. А., К о л о с к о в С. П., Г о л г е р Л. И. Выращивание культур
плесневых грибов в сушилке системы ВИС-42Д. «Ферментная и спиртовая
промышленность», 1965, № 5.
26. Калунянц К. А., Колосков С. П., Голгер Л. И., Е в т и х о в П. Н.
Выращивание культур плесневых грибов в паровой сушилке СПК. «Фермент-
ная и спиртовая промышленность», 1965, № 6.
203
27. К о л о с к о в С. П. Теплофизическая характеристика пшеничных отрубей,,
культур плесневых грибов и комплексных препаратов ферментов. Труды
ВНИИФСа. Вып. XV, 19G4.
28. К о л о с к о в С. П., Г о л г е р Л. И. Технологическое оборудование пред-
приятий ферментной промышленности. Труды ВНИИФСа. Вып. XVIII, 1967.
29. К о л о с к о в С. П. Механизация и автоматизация выращивания плесневых
грибов. ЦИНТИпищепром, 1961.
30. Колосков С. П., Р о д з е в и ч В. И. Бродильная промышленность Чехо-
словакии. ЦИНТИпищепром, 1962.
31. Колосков С. П., Лосев Н. А. Потребление кислорода и выделение теп-
ла растущей культурой плесневых грибов. Труды ВНИИФСа. Вып. XV, 1964.
32. Ко м а к и Тосиаки. Развитие производства ферментов. Journ. Ferment.
Assoc. Japan, Vol. 19, № 1, 1961.
33. Лифшиц Д. Б. Потери сухих веществ питательной среды в производстве
ферментных препаратов. «Ферментная и спиртовая промышленность», 1965,
№ 1.
34. М е й с е л ь М. Н. и др. Сессия АМН СССР по мирному использованию
атомной энергии. Материалы заседания отделения биологических наук, 1955,
стр. 105—125.
35. Не ту шил А. В., Мухавицкий Б. Я-, Кудин В. Н. Высокочастотный
нагрев в электрическом поле. М., 1961.
36. П е т к о в А. В. Из опыта работы спиртовой промышленности Чехословакии.
«Спиртовая промышленность», 1959, № 4.
37. П л а н о в с к и й А. Н., Р а м м В. М., Каган С. 3. Процессы и аппараты
химической технологии. Госхимиздат. М., 1962.
38. П о к р о в с к а я Н. В. Динамика образования глюкозооксидазы в культу-
рах некоторых плесневых грибов. В кн. «Внедрение ферментных препаратов
в народное хозяйство». Ч. I. ЦИНТИпищепром, 1961.
39. С а л м а н о в а Л. С., Б у к а н о в а В. И. Оптимальные условия культиви-
рования гриба Trichothecium roseum с целью получения цитолитических фер-
ментов. «Ферментная и спиртовая промышленность», 1964, № 5.
40. С о л о в ь е в А. В. Аппарат для выращивания культур плесневых грибов.
«Ферментная и спиртовая промышленность», 1963, № 7.
41. Соловьев А. В., Беляева Т. Н. Усовершенствование поверхностного
способа выращивания продуцентов ферментов. ВНИИФС. Отчет по теме
№ 6, 1964.
42. С о с и н а С. М. Выращивание плесневых грибов на отходах крахмального
производства. «Спиртовая промышленность», 1958, № 1.
43. Стерилизация инъекционных растворов в ампулах и перевязочного материа-
ла. Отчет № 252 Научно-исследовательского института токов высокой часто-
ты им. проф. Вологдина.
44. Т е р е х и н С. И. Применение культуры плесневых грибов вместо солода при
производстве спирта из крахмалистого сырья на Серебряно-Прудском спирто-
заводе. В кн. «Производство новых видов продукции в спиртовой промышлен-
ности». Пищепромиздат, 1961.
45. Terui Gyoro. Shihasaki I-Sao. Сопротивление поверхности среды прохожде-
нию тока воздуха, Tourn. of Fermentation Technology Japan». Vol 38, № 2,
1960.
46. Tp ай ни на T. И. Получение протеолитических ферментов плесневого гри-
ба Asp. flavus. В кн. «Внедрение ферментных препаратов в народное хозяй-
ство. Ч. I. ЦИНТИпищепром, 1961.
47. Тр ай ни на Т. И., Лифшиц Д. Б., Калашников Е. Я. Влияние ка-
чества пшеничных отрубей на амилолитическую активность ферментных пре-
паратов. «Микробиология». Т. XXX. Вып. 3, 1961.
48. Труды ВНИЭКИпродмаша. Проекты конструкции оборудования для про-
изводства ферментных препаратов. М., 1955—1962.
49. Труды Гипроспиртвино. Проекты конструкции и установок для механизиро-
ванного и непрерывного выращивания культур плесневых грибов. М., 1958—
204
50. Труды Гипромедпрома. Проекты установок и цехов для выращивания куль-
тур плесневых грибов. М., 1957—1960.
51. Труды КБ ВНИИФСа. Проекты конструкции и установок для механизирован-
ного и автоматизированного поверхностного выращивания культур плесне-
вых грибов. М., 1963—1965.
52. УкрНИИПП «Инструкции по производству ферментных препаратов и при-
менению их в пивоварении». Харьков, 1959.
53. Фениксова Р. В., Сегаль Р. Б. Применение Asp. oryzae для осахари-
вания крахмала в спиртовом производстве. «Микробиология». Т. X. Вып. 7—
8. 1941.
54. Ф е н и к с о в а Р. В. Амилолитические ферменты грибов из рода Aspergil-
lus. Докт. диссертация. Институт микробиологии АН СССР, 1956.
55. Фениксова Р. В. Производство ферментных препаратов из культур мик-
роорганизмов. В кн. «Производство новых видов продукции в спиртовой
промышленности», Пищепромиздат, 1961.
56. Фениксова Р. В., Кинзбурская Ф. М., Шилова А. А. Влияние
состава питательной среды и способов выращивания на образование амило-
литических ферментов у гриба Asp. oryzae. Труды ВНИИСПа. Вып. III, 1954
57. Ф е н и к с о в а Р. В., Ш и л о в а А. А. Образование ферментов в поверхност-
ной культуре гриба Asp. awamori. «Ферментная и спиртовая промышлен-
ность», 1965, № 2.
58. Фостер Д. Химическая деятельность грибов. ИЛ. М., 1950.
59. Ф рем ель В. Б. Технологические схемы производства ферментных препа-
ратов поверхностным и глубинным способом, ЦИНТИПищепром, 1964.
60. Худаков Г. Д. Действия ионизирующих излучений на микроорганизмы.
Труды ЦНИГИ, 1960.
61. Цы пер о вич А. С. Исследование денатурации и стабилизации глобуляр-
ных белков. Институт биохимии АН УССР. Киев, 1953.
Глава V. ПРОИЗВОДСТВО ТЕХНИЧЕСКИХ
И ОЧИЩЕННЫХ ФЕРМЕНТНЫХ ПРЕПАРАТОВ
ИЗ ПОВЕРХНОСТНЫХ КУЛЬТУР
Технические и очищенные ферментные препараты представляют
собой либо жидкости с концентрацией сухих веществ не менее
50%, либо порошки белого, серого или желтого цвета с опреде-
ленной стандартной ферментативной активностью. Иногда они со-
держат какой-либо один фермент, но чаще — комплекс их.
Технические препараты в виде сиропов получают путем экстра-
гирования ферментов из культур микроорганизмов и последующе-
го концентрирования экстрактов до содержания сухих веществ не
менее 50% и определенной, установленной техническими условия-
ми, ферментативной активности.
Технические препараты в виде порошков получают путем суш-
ки экстрактов (чаще всего на распылительной сушилке).
Очищенные ферментные препараты получают путем очистки
экстрактов из культур микроорганизмов от нерастворимых и дру-
гих балластных веществ и от посторонней микрофлоры с после-
дующим выделением ферментов из очищенных экстрактов нейт-
ральными солями, органическими растворителями или иным пу-
тем.
Технические и очищенные ферментные препараты имеют ряд
преимуществ по сравнению с сухими культурами грибов и бакте-
рий. Они содержат ферменты в более концентрированном виде;
имеют меньший вес и меньший объем; способны сохраняться бо-
лее длительное время без потерь ферментативной активности.
Очищенные ферментные препараты, кроме того, не содержат
спор продуцентов ферментов.
Способ применения технических и очищенных ферментных пре-
паратов значительно проще, чем культур микроорганизмов.
В настоящее время промышленное производство технических
и очищенных ферментных препаратов освоено на Вышневолоцком
и Московском опытном заводах ферментных препаратов, в фер-
ментных цехах Мичуринского экспериментального спиртового и
Рассказовского биохимического заводов; строится и проектируется
еще несколько предприятий, на которых намечено выпускать фер-
ментные препараты.
206
Значительную роль в разработке промышленной технологии
выделения и очистки ферментов сыграл опыт Московского опытно-
го ферментно-спиртового завода ВНИИФСа, выпускающего очи-
щенные препараты ферментов с 1955 г., и Харьковского фермент-
ного цеха при пивоваренном заводе «Новая Бавария».
Ниже кратко излагаются результаты исследований, которые*
легли в основу разработки технологической схемы и режима про-
изводства очищенных и концентрированных ферментных препара-
тов.
Известно, что нативные белки — очень лабильные, легко из-
меняющиеся соединения. Достаточно даже незначительного воз-
действия— повышения температуры, изменения реакции средыу
наличия солей тяжелых металлов, чтобы вызвать изменение белка,
его денатурацию. Этими свойствами обладают и ферменты, что
следует учитывать при очистке их.
ПРОЦЕССЫ И АППАРАТУРА ДЛЯ ВЫДЕЛЕНИЯ ФЕРМЕНТНЫХ
ПРЕПАРАТОВ
В качестве основных приемов, применяемых в промышленном
производстве ферментных препаратов из культур грибов, выращи-
ваемых поверхностным способом, в настоящее время используются
следующие: дробление культуры, экстрагирование ферментов,,
очистка экстрактов от примесей, концентрирование, фракциониро-
вание, отделение ферментных осадков, сушка, измельчение, стаби-
лизация, стандартизация и расфасовка.
Дробление
Значительная часть препаратов производится путем выделения
ферментов из различных культур грибов, выращиваемых поверх-
ностным способом. Перед экстракцией эти культуры дробят на
частицы размером 5—10 мм. При более тонком измельчении куль-
туры гриба процесс экстракции затрудняется, так как фильтрую-
щие сетки забиваются, давление воды при подаче в диффузоры
повышается, что приводит к деформации сеток.
Из испытанных типов оборудования для этой цели целесооб-
разно использовать валковую дробилку ВНИИПТхиммаш и удар-
ного типа, описание которой дано на стр. 183.
При использовании более совершенных методов экстракции
целесообразно измельчать культуру гриба на частицы размером
2—3 мм.
Экстрагирование
Эта операция является общей для всех способов получения
ферментных препаратов из культур плесневых грибов и бактерий,
выращенных поверхностным способом на твердых средах. При
207
экстрагировании происходит полное или частичное разделение ве-
ществ, обладающих различной растворимостью в том или ином
растворителе. Вследствие диффузии при соприкосновении с обра-
батываемой смесью растворитель, как фаза с более низкой кон-
центрацией, чем вся смесь, насыщается тем компонентом, кото-
рый в нем растворим.
Исходным полупродуктом для извлечения ферментов является
культура микроорганизма, которая может быть использована как
в сыром, так и в высушенном виде; преимущество последней сос-
тоит в том, что ее можно хранить без потери ферментативной ак-
тивности длительное время и получать из нее более концентриро-
ванные ферментные экстракты. Однако сушка культуры связана
с частичной потерей ферментативной активности и выделением
большого количества конидий, загрязняющих воздух. Для оздо-
ровления условий труда на заводах ферментных препаратов целе-
сообразно экстрагировать ферменты из сырой культуры.
Цель экстрагирования сводится к тому, чтобы: возможно пол-
нее перевести ферменты из культуры гриба (твердой фазы) в
раствор и снизить тем самым потери ферментов в биошроте (плот-
ном остатке после экстракции); получить более концентриро-
ванный ферментный раствор и снизить затраты на последующие
операции; перевести в раствор ферменты с возможно меньшим
содержанием балластных веществ.
Во многих случаях удовлетворительным растворителем фер-
ментов является обычная речная и артезианская вода. Исследо-
вания Е. Я. Калашникова с сотрудниками показали, что водные
растворы глицерина, хлористого натрия, сульфата аммония, 40- и
50%-ные растворы этилового и изопропилового спиртов не имеют
никаких преимуществ перед чистой водой в отношении интенси-
фикации процесса экстракции и получения ферментных вытяжек
более высокого качества.
Исключением является 1,5%-ный водный раствор сульфата ам-
мония, повышающий протеолитическую активность экстракта иног-
да даже на 23%. Внесение в готовый экстракт 1,5% сульфата
аммония дает возможность увеличить протеолитическую актив-
ность на 8—10%.
Хотя механизм действия сульфата аммония в этом процессе до
настоящего времени не изучен, мы считаем целесообразным про-
водить экстракцию протеолитических ферментов 1,5%-ным водным
раствором сульфата аммония.
Установки, используемые в технике для извлечения ферментов
из культур плесневых грибов путем молекулярной или конвектив-
ной диффузии, бывают периодического и непрерывного действия.
Согласно закону Фика, при молекулярной диффузии количест-
во вещества, диффундирующего через слой, пропорционально
поверхности этого слоя F ж2,, изменению концентрации по толщи-
208
не слоя Дсл кг!м\ времени т сек и обратно пропорционально тол-
щине слоя S м:
л я DF^сл
М = ----— кг,
s
где D — коэффициент диффузии [г/(см2-сек)\, зависящий от свойств
диффундирующего компонента и среды, в которой про-
исходит диффузия, а также от температуры и давления.
Во ВНИИФСе в 1961 —1963 гг. К. П. Степанищевым и
В. А. Копневой исследован процесс непрерывной диффузии фер-
ментов из грибных культур и предложено следующее уравнение:
JL.2/!lgrWi_.£Л + £ ,
DF WCz kA WJ W\
где т — длительность диффузии, сек;
G — количество культуры гриба, г;
W — количество растворителя, г;
Со — начальная концентрация сухих веществ в культуре,
г!см\
С-—конечная концентрация сухих веществ в биошроте, г!см?-,
D — коэффициент диффузии, г!(см2-сек);
F — поверхность фазового контакта, см2! сек.
Экспериментально установлен коэффициент диффузии для
комплекса ферментов, численно равный 1,8-10-7 г! (см2-сек).
Удельная поверхность вещества, участвующая в процессе диф-
фузии, 7 см21см\ Кинематическая вязкость вытяжки постоянна и
равна 0,013-Ю-4 см21сек. Скорость движения экстрагируемой куль-
туры и экстрагирующей жидкости 0,003 м!сек.
Установки периодического действия, используемые для прове-
дения процесса экстракции ферментов из культур грибов, выра-
щиваемых поверхностным способом, основаны на принципе про-
тивотока.
Диффузионная батарея. В настоящее время ферменты из
культур плесневых грибов извлекают в диффузионной батарее
(рис. 42), смонтированной на общей площадке и соединенной
общей коммуникацией таким образом, что в каждый из диффузо-
ров можно подавать как свежий растворитель, так и вытяжку из
предыдущего диффузора. Кроме того, из каждого диффузора вы-
тяжка может быть подана как в последующей, так и в специаль-
ный приемник.
Все диффузоры батареи унифицированы и имеют форму верти-
кального цилиндра с откидной герметически закрывающейся
крышкой и коническим днищем. В нижней конусной части имеют-
ся штуцеры, предназначенные для подачи воды на диффузию, по-
дачи пара для стерилизации аппарата, спуска промывных вод в
канализацию и для выгрузки биошрота. В верхней боковой ци-
линдрической части предусмотрен штуцер для выхода диффузион-
14—826
209
ной вытяжки. Нижние штуцеры снабжены трехходовыми крана-
ми, что позволяет направлять вытяжку в следующий последо-
вательно соединенный диффузор либо в обводную трубу для спус-
ка. Вентили и краны расположены таким образом, что любой диф-
фузор можно отключить от батареи, не нарушая ее работы.
Рис. 42. Диффузионная батарея:
/ — диффузоры; 2 — перетоки диффузионной вытяжки
из диффузора; 3 — шнек для подачи культуры гри-
ба; 4 — трубопровод для подачи воды на диффузию;
5 — трубопровод для приема диффузионной вытяжки.
6' — спускной штуцер; 7 — сборник вытяжки; 8 — шнек;
9 —• привод шнека; 10 — канализационный трубопровод.
Воздушник на крышке служит пробоотборником при передаче
вытяжки из диффузора в диффузор.
В верхней части диффузора на расстоянии 150—200 мм от пе-
реливного штуцера, расположена двойная сетка с ребрами жест-
кости: нижняя имеет ячейки размером от 10 до 15 мм, верхняя—
0,25—0,5 мм. После загрузки культуры в аппарат сетку с рези-
новой прокладкой по периметру плотно устанавливают «под
замок» в цилиндрической части аппарата.
В настоящее время для подачи измельченной культуры в диф-
фузоры применяют шнеки, причем узел дробилки, транспортного
устройства и диффузоров не аспирируется, что приводит к пыле-
выделению и распространению конидий гриба в воздухе. Для гер-
метизации подачи культуры в диффузор и уменьшения выделения
конидий на спускных патрубках винтового транспортера после
шибера целесообразно закреплять гибкий рукав, а вторую, расши-
ренную часть рукава— на загрузочном люке диффузора. Герме-
тизировать загрузку культуры гриба в диффузор можно с по-
мощью переносной легкой крышки и стационарных рукавов.
Движущей силой диффузионного процесса является градиент
концентрации фермента (и других веществ) в культуре гриба и
в растворителе — воде, поэтому для интенсификации процесса сле-
дует поддерживать разность концентраций на каждой ступени
210
максимальной. Это может быть обеспечено путем увеличения от-
носительного объема растворителя, организацией процесса по
принципу противотока, турбулизацией потока и соответствующим
увеличением массообмена.
Для получения концентрированных экстрактов необходимо при-
менять способ последовательного выщелачивания, который сво-
дится к тому, что при установившемся цикле работы первая кон-
центрированная порция экстракта направляется на промывку све-
жей порции культуры, а частично выщелоченная культура после-
довательно обрабатывается порциями экстракта убывающей кон-
центрации и затем уже чистой водой. Такой процесс может быть
проведен в механизированной непрерывнодействующей установке
или в диффузионной батарее.
Несмотря на то что диффузионный способ хорошо известен и
широко применяется в различных отраслях промышленности,
использование его в ферментном производстве потребовало спе-
циальных разработок. Объясняется это тем, что подлежащая
экстрагированию культура гриба имеет не совсем приемлемую для
этой операции структуру. В высушенном виде она представляет
собой рыхлый объемистый материал, состоящий из мелких, силь-
но набухающих в. воде частиц. Средний насыпной вес культуры
310 г/л; влагоемкость ее достаточно высока: 1 кг поглощает от 3
до 3,5 л воды (до появления над увлажненной массой свободно
отделяющейся влаги); после набухания 1 кг культуры занимает
объем 4,3 л.
При проведении экстрагирования следует стремиться к тому,
чтобы на каждые 100 л объема загружать в диффузор не менее
18 кг абсолютно сухих веществ культуры гриба (такое соотноше-
ние установлено специальными исследованиями ВНИИФСа). Пос-
ле увлажнения и набухания культура заполняет весь объем диф-
фузора. Как показала практика Московского и Вышневолоцкого
заводов, для преодоления возникающих в диффузионной батарее
сопротивлений воду следует подавать насосом, имеющим напор
2—3 кг)см2.
Основным преимуществом данного способа извлечения фермен-
тов является возможность получать прозрачные водные вытяжки,
концентрация ферментов в которых почти не отличается от кон-
центрации их в исходной культуре гриба, так как многократное
экстрагирование приводит к полному извлечению всех раствори-
мых веществ. Недостатком процесса является то, что при этом в
вытяжку переходят не только ферменты, но и другие растворимые
вещества, содержащиеся в культуре гриба и состоящие главным
образом из сахаров, солей, аминокислот и прочих неактивных при-
месей, которые в дальнейшем затрудняют выделение ферментов.
Вода, подаваемая на хвостовой диффузор, проходит последо-
вательно из одного аппарата в другой и в каждом из них обога-
щается ферментами, извлекаемыми из новой порции культуры.
211
Выход ферментов при экстрагировании водой в значительной
степени зависит от количества отобранной вытяжки по отношению
к загруженной в диффузоры культуре.
Следует отметить, что ферменты из культур различных штам-
мов микроорганизмов извлекаются по-разному: из одних доста-
точно легко, из других — гораздо труднее. Кроме того, при экстра-
гировании из культур, содержащих комплекс ферментов, фермен-
ты переходят в водную вытяжку с разной скоростью, поэтому и
количество вытяжки, отобранной при экстрагировании из различ-
ных культур, будет неодинаковым.
Так, достаточно полное извлечение ферментов из культуры
гриба Asp. oryzae КС достигается при отборе вытяжки не менее
220% к абсолютно сухому весу загружаемой массы, а пектиназа
из культуры гриба — Asp. niger — при отборе 350% вытяжки к
весу загруженной массы при 4—5-часовом обороте батареи и
температуре воды в пределах 20—25°С.
На рис. 43, построенном по данным Калунянца и Вагановой,
показана динамика извлечения протеолитических и амилолити-
Количество растворителя, л
Рис. 43. Диффузия ферментов
из культуры гриба Asp. oryzae
КС (Вышневолоцкий завод
ферментных препаратов):
1 — сухие вещества; 2 — амило-
литическая способность; 3 — протео-
литическая способность.
ческих ферментов из культуры гриба Asp. oryzae КС при восьми-
кратном прохождении растворителя через диффузор. Отмечено
также, что протеолитические ферменты извлекаются из культуры
гриба на 79%, а амилолитические— на 90%. Полнота извлечения
амилолитических ферментов из культуры гриба Asp. awamori
достигается при отборе вытяжки 400% к количеству загруженной
культуры.
На концентрацию вытяжки и полноту извлечения ферментов
влияет также длительность контакта воды с культурой гриба и
температура воды, направляемой на диффузию. Опытами на Выш-
неволоцком ферментном заводе установлено, что при однократном
212
обмене воды в диффузоре за 2—2,5 мин концентрация сухих ве-
ществ в вытяжке была в 2—2,2 раза меньше, чем при обмене за
40 мин. Продолжительность контакта воды и культуры в диффузо-
ре около 40 мин оказалась вполне достаточной, так как при мно-
гократном экстрагировании можно подавать на диффузор все но-
вые (с меньшей концентрацией сухих веществ) порции воды и
тем самым достаточно полно извлекать ферменты из культуры
гриба.
Известно, что повышение температуры способствует ускорению
процесса экстракции, но повышать ее более 30°С не рекомендует-
ся, так как при этом развивается инфицирующая микрофлора,
присутствие которой снижает качество вытяжки и конечного про-
дукта, а также частично инактивируются ферменты. Вместе с
тем имеется опыт работы диффузионных установок Вышневолоц-
кого завода при температуре воды 27—30°С и продолжительности
экстрагирования 32 ч с получением вытяжки удовлетворительного
качества.
Наконец, на полноту извлечения ферментов из культуры гри-
ба и на концентрацию водных вытяжек влияет число диффузоров,
работающих в батарее. В данное время для диффузионной бата-
реи периодического действия рекомендуется 10 диффузоров, из
которых 8 находятся в работе, один на загрузке и один на вы-
грузке. Показатели вытяжек, отбираемых из диффузоров
10-членной батареи при 30-минутном контакте, приведены в
табл. 16.
По данным Калашникова, при работе на 14-членной батарее
Таблица 16
Показатели диффузионной вытяжки
Номер диффузора Время запол- нения диф- фузора водой, мин. Содержание сухих веществ, г Температура, °C pH АС, ед/мл
1 10,0 3,2 29 6,5 1,75
2 11,0 7,5 30 6,5 6,0
3 12,0 10,6 31 6,5 8,0
4 12,0 12,3 30 6,5 8,6
5 11,0 13,5 29 6,5 10,0
6 10,0 13,7 28 6,4 12,6
7 11,0 14,2 29 6,4 15,0
8 10,0 14,6 28 6,4 18,5
9 12,0 15,0 29 '6,4 19,2
10 10,0 15,6 30 6,4 20,1
213
и отборе водной вытяжки из 14-го диффузора концентрация
сухих веществ в ней была 34,0%, а активность фермента, выра-
женная в единицах ОС,—120 ед. Эти данные заслуживают вни-
мания, и такой метод работы можно рекомендовать в тех случаях,
когда конечным продуктом является концентрированный фермент-
ный препарат, выпускаемый в виде сиропа.
Процесс экстрагирования ферментов из культуры гриба на
диффузионной батарее периодического действия отличается дли-
тельностью, малой степенью механизации (ручная выгрузка жома—
биошрота), небольшой производительностью и сопровождается
большими потерями, иногда достигающими 25% (культура гриба
Asp. oryzae). Более совершенны установки непрерывного действия.
Диффузионная установка ВНИЭКИпродмаша. На основе ис-
следований ВНИИФСа и по его заданию ВНИЭКИпродмаш раз-
работал диффузионную установку А1-АДФ непрерывного действия
для извлечения ферментов из грибной культуры, (рис. 44).
Она состоит из приемного бункера, прикрепленного к раме на
упругих связях; турникетного дозатора, соединенного гибким рука-
вом с бункером; диффузора колонного типа с приводом и бака
для подогрева воды, поступающей на диффузию; устройства для
дозирования формалина; бака постоянного напора; сборников для
отстаивания вытяжки; насосов, шнекпресса для отжима биошрота;
щита централизованного управления установкой и станции управ-
ления электрооборудованием.
Диффузионный аппарат представляет собой систему стальных,
вертикально расположенных прямоугольных емкостей типа колонн,
соединенных последовательно переходными трубами. Внутри ко-
лонн расположен транспортирующий орган. На нем закреплены
прямоугольные рамки 250X350 мм с сетками из капроновых
10-миллиметровых нитей. Скорость перемещения транспортирую-
щего устройства регулируется в пределах от 1,8 до 3,0 мм!сек.
Втулочно-роликовые цепи приводятся в движение от электродви-
гателя мощностью 1,0 кет через цепной вариатор и редуктор.
Под действием виброимпульсов, сообщаемых электромагнит-
ным вибратором, измельченная культура гриба из бункера равно-
мерно поступает через крыльчатый дозатор-турникет в первую
колонну и последовательно заполняет все ее отделения между дву-
мя, смежными ситами. При загрузке в первую колонну грибную
культуру замачивают ферментной вытяжкой, возвращаемой в диф-
фузор. Вода, нагретая в баке с трубчатым теплообменником до
25—27°С, нагнетается насосом через сито в верхнюю часть послед-
ней колонны и, двигаясь навстречу грибной культуре, постепенно
и непрерывно обогащается ферментами.
Культура гриба движется между рамками сит последовательно
по всем колоннам, а водная вытяжка под действием статического
напора (разности высот ввода воды и выхода вытяжки из диффу-
зора) свободно проходит через сита. Ферментную вытяжку отби-
рают через 100 мин после начала загрузки аппарата.
214
ьо
СП
Рис. 44. Диффузионная установка А1-АДФ ВНИЭКИпродмаша:
/—бункер для приема культуры гриба; 2 - дозатор: 3 — диффузионный ап-
парат; 4 — сито; 5 — насос для подачи диффузионной вытяжки на осаждение и
на смачивание культуры; 6 — отстойник для диффузионной вытяжки; 7 —
фильтр; 8 — насос для подачи жомопрессовой воды на диффузию; 9 — отстой-
ник жомопрессовой воды; 10 — бак для нагрева воды; // — насос для подачи
воды на диффузию; 12—насос для раствора формалина: 13 — бак для раствора
формалина; /-/—дозатор раствора формалина; /5 — привод диффузора;
16 — шнекпресс.
В диффузоре ферментная вытяжка фильтруется через сито,
встроенное в нижней части первой колонны, а по выходе из диф-
фузора отстаивается в специальном отстойнике. Часть очищенной
ферментной вытяжки насосом подается на производство, а другая
часть возвращается через сито верхней части первой колонны для
смачивания вновь поступившей культуры. Фильтрующую способ-
ность сит восстанавливают путем периодической промывки их на
верхнем участке последней колонны. При выходе рамок с ситами
из экстракционной жидкости вытяжка стекает с них и вновь воз-
вращается в диффузор, а биошрот, находящийся между рамками,
при вертикальном положении их выгружается в приемный бункер
пресса. При движении рамок с ситами на верхнем горизонтальном
участке диффузора горячая струя воды, поступающая через встро-
енные форсунки, промывает рамки и смывает с них остатки био-
шрота.
Во избежание инфицирования ферментной вытяжки в воду,
поступающую для экстрагирования, добавляют 0,02%-ный раствор
формалина. Для подготовки его предусмотрен специальный бак,
в который загружается 40%-ный раствор формалина, перекачивае-
мый затем насосом в бак постоянного напора, расположенный на
определенной отметке. Из него раствор формалина самотеком че-
рез дозатор поступает в бак для воды, и в отстойник биошротовой
воды. Отстойник выполнен в виде цилиндрической емкости с кони-
ческим днищем. Внутри него расположена сетка, под которую
подается жидкость для отделения фильтрата от биошрота. Био-
шрот по мере накопления в конической части отстойника насосом
периодически подается в бункер пресса для отжима, после чего
жидкость возвращается в диффузор, а биошрот утилизируется.
На щите управления расположены: вторичные приборы контро-
ля расхода свежей и биошротопрессовой воды, ее температуры,
количества ферментной вытяжки, отобранной и возвращенной в
диффузор для замочки грибной культуры, скорости перемещения
транспортного устройства, pH-метр, рефрактометр, а также
пусковые приборы дистанционного включения автоматических
приборов контроля и сигнализации уровня вытяжки, биошротовой
воды, расхода формалина и культуры гриба.
Техническая характеристика диффузионной установки
ВНИЭКИпродмаша
Производительность по культуре гриба, т!сутки . 3,5
Длина транспортирующей цепи, мм ... 50,8
Скорость движения цепи, мм/сек............... 1,8—3,0
Число носителей.................................... 93
Шаг между носителями, мм.......................... 304,8
Расход воды на диффузию, л/ч....................... 700
Длина пути диффундирования, м...................... 16
Отбор вытяжки, л/ч................................. 365
Температура воды, предназначенной для экстрак-
ции, °C........................................ 25—27
Емкость бака для воды, м3........................... 1
Габариты, жж .................................9185X5000 X 6060
Масса, кг....................................... 19390
216
Шнековая диффузионная установка ВНИИФСа (рис. 45) сос-
тоит из приемного бункера, турникетного дозатора, питателя для
предварительного смачивания культуры гриба, дозаторов воды и
формалина, диффузионного аппарата шнекового типа, скребкового
транспортера и шнекпресса.
Рис. 45. Шнековая диффузионная установка ВНИИФСа:
/ — бункер для загрузки культуры гриба; 2 — питатель; 3 — бак для приема диф-
фузионной вытяжки; 4 — насос для подачи вытяжки на осаждение и замачивание;
5 — привод диффузора; 6 — редуктор; 7 — диффузор; 8— крыльчатый насос для
подачи пульпы; 9 — редуктор; 10 — привод шнекпресса; 11 — шнекпресс; 12 — бак
для формалина; /5 — бак для воды; 14 — дозатор.
Диффузионный аппарат состоит из двух горизонтальных труб
диаметром 530 и длиной 3500 мм, снабженных водяной рубашкой.
Внутри труб расположены валы с лопастями, угол поворота кото-
рых легко изменяется.
Измельченная культура гриба поступает через дозатор в сме-
ситель-питатель, где смачивается возвратной вытяжкой в течение
10—12 мин, после чего подается в диффузор. Перемещаясь ло-
пастным шнеком по первой трубе диффузора, культура гриба пе-
редается во вторую такую же трубу, расположенную в одной
плоскости с первой и параллельно ей. Из второй трубы культура
скребковым транспортером подается в шнекпресс. Противоточно
ей движется вода с температурой 30°С, которая вместе с раство-
ром формалина подается в шнекпресс и оттуда проходит во вто-
рую, а затем в первую трубу шнекового диффузора.
В первой трубе, в месте отбора вытяжки, имеется сетка с ячей-
ками 0,3 мм. Отбирают вытяжку из первого диффузора после
фильтрации через сетку. Перед сеткой установлена крыльчатка
для отвода твердых частиц. Для восстановления фильтрующей
217
способности сетку периодически продувают с обратной стороны
сжатым воздухом.
В процессе противоточного движения экстрагирующая жид-
кость непрерывно обогащается ферментом и после фильтрации
через сито отсасывается*центробежным насосом. Обедненная куль-
тура гриба после отжима в шнекпрессе удаляется из диффузора,
а отделенная при этом вытяжка возвращается хво второй диффу-
зор вместе с водой.
Основные технологические параметры контролируются дистан-
ционными автоматическими регистрирующими приборами и вто-
ричными приборами непосредственно у установки. При испыта-
нии установки выявлены конструктивные дефекты некоторых уз-
лов, после устранения которых будет отработан режим и опреде-
лены оптимальные параметры процесса.
Диффузионная установка типа Гильденбрандта. Проведенные
во ВНИИФСе испытания показали, что непрерывная экстракция
ферментов из культур плесневых грибов может быть проведена
на установке типа Гильденбрандта. Она состоит из двух верти-
кальных колонн, соединенных горизонтальной трубой (рис 46).
Внутри колонн и соединительной трубы расположены шнеки,
приводимые в движение от общего или индивидуальных электро-
двигателей. Скорость перемещения культуры гриба по загрузочной
вертикальной колонне, горизонтальному шнеку и второй верти-
кальной колонне должна быть в соотношении 1:2:3.
Измельченная культура гриба подается автоматическим пита-
телем через дозатор в верхнюю часть первой колонны и с неболь-
шой скоростью транспортируется последовательно через всю ус-
тановку. Для предотвращения проворачивания культуры шнеками
в соединительной трубе и второй колонне по всей их длине рас-
положены прямоугольные планки. Противоточно культуре в верх-
нюю часть второй вертикальной колонны через форсунки подается
нагретая до 27°С вода, содержащая 0,02% формалина. По мере
продвижения вода обогащается ферментами, экстрагируемыми из
культуры гриба. Перед удалением ферментную вытяжку фильт-
руют через сетчатый фильтр, встроенный на выходе из первой ко-
лонны, а биошрот удаляют через разгрузочный штуцер и двухлО'
пастной сбрасыватель на выходе из второй колонны. Фильтр про-
мывают водой, специально подведенной к нему.
Аппараты Гильденбрандта широко применяются в химико-фар-
мацевтической промышленности. Они полностью герметизированы
и управление ими автоматизировано. Внутренний диаметр колонн
1000 мм, высота первой 7500, второй 10500 мм. Производитель-
ность по загружаемой твердой фазе 1000 кг/ч.
Лабораторные испытания показали, что в местах сочленения
первого вертикального и горизонтального поперечного шнеков мо-
гут образовываться «пробки» из культуры, что приводит к слежи-
ванию твердых частиц и замедлению процесса диффузии. Узел
218
фильтрации после 3—5 ч работы засоряется и требует регенера-
ции фильтрующей способности. При установке двух-трех сит в раз-
личных участках колонны можно, не нарушая непрерывности
Рис. 46. Диффузионная установка типа Гильденбрандта:
/—привода колонн; 2 — фильтр для отделения вытяжки; 3 — загрузочная ко-
лонна; 4 — штуцер для загрузки твердой фазы; 5 — штуцер для выхода диффу-
зионной вытяжки; 6 — шнек загрузочной колонны; 7 — рубашка загрузочной
колонны; 8 — шнек горизонтальной колонны; 9 — горизонтальная колонна;4 10 —
экстракционная колонна; // — шнек экстракционной колонны; 12 — рубашка;
13 — штуцер для выхода биошрота; /-/ — подача растворителя
процесса, периодически очищать или заменять фильтрующие эле-
менты.
Для снижения потерь ферментов при водной экстракции био-
шрот необходимо отжимать, полученную вытяжку фильтровать и
219
возвращать во вторую колонну, а обезвоженный биошрот — ути-
лизировать. Испытания опытной модели показали, что отбор
вытяжки 280—300% по весу культуры является оптимальным для
Asp. oryzae; при этом извлекается 88—93% ферментов к исход-
ному содержанию их в культуре. Продолжительность непрерывно-
го процесса составляет около 90 мин. По окончании технологи-
ческого цикла предусматривается возможность проведения перио-
дической промывки антисептиками и стерилизации аппарата и все-
го вспомогательного оборудования паром.
Шнековый экстрактор непрерывного действия состоит из при-
емного бункера, дозатора, горизонтального корпуса, снабженного
паровой рубашкой, и вертикального корпуса, внутри которых рас-
положены шнеки со сплошными перьями. Горизонтальный шнек
приводится в движение от электродвигателя через редуктор
(р.ч. =2; 1 = 40) и может вращаться со скоростью 6,5; 1,5 и
1 об]мин. Вертикальный шнек приводится в движение от электро-
двигателя через редуктор (р.ч. = 3,5; 1 = 24) и вращается со ско-
ростью 11 об)мин. К торцевой части горизонтального корпуса при-
мыкает царга, внутри которой расположен фильтр в виде сетки
с очищающим устройством, представляющим собой вращающий-
ся шнек с прикрепленными к нему 4—8 капроновыми щетками.
При вращении щетки непрерывно или периодически очищают
фильтр и восстанавливают его фильтрующую способность, а оса-
док, находящийся на ситах, основным шнеком подается на экстрак-
цию. Измельченная культура гриба подается шнековым дозато-
ром в горизонтальную часть экстрактора и перемещается шнеком
вначале по горизонтали, а затем по вертикальной колонне. Про-
тивоточно культуре движется подогретая до 25—27°С вода с 0,02%
раствора формалина, которая подается в верхнюю часть верти-
кальной колонны. В процессе непрерывного противоточного дви-
жения твердой и жидкой фаз вода обогащается ферментом. Экст-
ракт после фильтрации через сито поступает на дальнейшую пе-
реработку, а лроэкстрагированная культура, называемая био-
шротом, удаляется через верхний патрубок вертикальной колонны,
после чего направляется на утилизацию.
Техническая характеристика шнекового экстрактора
непрерывного действия
Производительность, кг!ч ....... 150—200
Рабочее давление...............................Атмосферное
Диаметр шнеков, мм:
вертикального .................................. 400
горизонтального ................................. 400
Число оборотов шнеков в минуту:
вертикального.................................. 11,6
горизонтального . '..........................6,5; 1,5; 1,0
Давление в рубашке:
ат..................... .......................... 2
кн1м2................................... 196,2
Габариты, мм................................ 4800X1200X3100
220
Описанные выше экстракционные установки выгодно отлича-
ются от диффузионной батареи тем, что процесс извлечения фер-
ментов из культуры гриба протекает в них значительно быстрее.
Лабораторные исследования и последующие производственные
испытания, проведенные в последнее время во ВНИИФСе, пока-
зали возможность извлечения 85—90% фермента, содержащегося
в культуре гриба, однократной экстракцией.
Процесс длился 30 мин в реакторе с мешалкой при соотноше-
нии воды и измельченной культуры 4:1. Проэкстрагированная мас-
са насосом подавалась на трехколонную фильтрующую центрифу-
гу типа ТН-800 с нижней выгрузкой для отделения вытяжки от
биошрота. Последующая промывка биошрота на центрифуге одним
объемом воды позволяет извлечь дополнительно до 10% содержа-
щегося в культуре фермента. Промывная вода добавляется к ос-
новной вытяжке, а биошрот направляется на сушку для последую-
щего использования на корм скоту. При отсутствии центрифуг для
отделения экстракта от биошрота можно использовать шнекпресс
типа ПНД-59. Продолжительность центрифугирования одной за-
грузки (60—70 кг массы), включая пуск и остановку, 10 мин. Ко-
нечная влажность биошрота 64—65%.
Такой способ экстракции позволяет транспортировать культу-
ру гриба в ъоде, чем ускоряется процесс извлечения из нее фер-
мента (в 2—3 раза по сравнению с диффузионной батареей), и
способствует снижению потерь.
На Мичуринском экспериментальном ферментно-спиртовом заво-
де испытана с положительным результатом экстракционная уста-
новка, состоящая из дробилки для культуры гриба, виброконвейе-
ра, по которому транспортируется культура вместе с водой, пуль-
пообразователя, представляющего собой цилиндр с вращающими-
ся внутри лопастями решетчатого типа, центробежного насоса,
экстрактора, двух шнекпрессов экспеллерного типа и сборника вы-
тяжки. Экстрактор снабжен мешалкой, лопасти которой имеют
оригинальную конфигурацию.
Культура гриба в смеси с водой центробежным насосом по-
дается в экстрактор, после экстракции масса отжимается на экс-
пеллерном прессе; биошрот промывается водой и повторно отжи-
мается, вторичный экстракт направляется в сборник, а затем весь
экстракт насосом направляется в сепаратор и на дальнейшую пе-
реработку. При недостаточном насыщении ферментами экстракт
может быть направлен в экстрактор для обработки свежих порций
культуры.
Такой способ экстракции позволяет интенсифицировать процесс,
увеличить выход ферментов до 95% и обеспечивает механизацию
всех технологических операций.
В процессе экстракции из культуры гриба удаляются фермен-
ты и другие растворимые вещества. Оставшаяся часть ее содер-
жит значительное количество питательных веществ и может слу-
жить добавкой к кормовому рациону животных и птиц. Для этого
221
отходы от станции диффузии необходимо обезводить до содержа-
ния влаги 12—14%’, так как хранение влажной массы в течение
3—4 ч приводит к инфицированию ее и порче, что исключает воз-
можность утилизации.
Установки для обезвоживания биошрота. Биошрот из прием-
ника (рис. 47) подается насосом в шнекпресс для отделения во-
ды, после чего высушивается в сушилках типа аэрофонтанной,
ВИС, вибрационной или другой отходящими дымовыми газами
при температуре от 150 до 250°С или топочными газами. Для от-
жима могут быть использованы шнекпрессы ПНД-59 и ФПК-2А
либо фильтрующие центрифуги типа ОТН-800.
1П 9
Рис. 47. Установка для обезвоживания биошрота:
/ — бункер для сбора биошрота; 2 — шнекпресс ПНД-59; 3 — сушилка
ВИС-2; 4 — осадительный циклон; 5 — рукавный фильтр; 6 — промежуточ-
ный бункер; 7 — весы автоматические; 8 — мешкозашивальная машина
33 Е-М; 9 — вентилятор; 10 — шнек; // — газовая топка; 12 — дымовая труба.
Шнекпресс ПНД-59 состоит из приемного бункера и корпуса,
в цилиндрической части которого расположен шнек с сеткой (на
2/3 длины шнека), камеры прессования с вращающейся на шарни-
ре крышкой у выходного отверстия. На крышке устанавливается
рычаг с передвижными грузами для регулирования степени отжи-
ма. Шнекпресс приводится в движение от электродвигателя через
клиноременную передачу и редуктор. В нижней цилиндрической
части его предусмотрены штуцеры для отвода фильтрата.
222
После включения шнекпресса биошрот подается насосом в
приемный бункер, из него попадает на витки шнека и при пере-
мещении вдоль шнека частично освобождается от воды, которая
тут же удаляется через спускной штуцер. При дальнейшем пере-
мещении материала в цилиндрической камере вода проходит через
отверстия латунной сетки и удаляется через спускной штуцер, а
частично обезвоженный биошрот поступает к выходу из цилинд-
ра. Так как шнек не доходит До конца цилиндрической камеры,
то между крышкой и конусом шнека образуется участок, в кото-
ром происходит окончательное прессование.
Передвижные противовесы, установленные на рычаге у крышки,
тормозят выход биошрота через выходное отверстие, вследствие
чего в цилиндрической камере движение его задерживается и он
отпрессовывается. Во избежание выдавливания биошрота обратно
в бункер на шнеке установлены два лопастных заградительных
диска. Давление, передаваемое шнеком и массой, преодолевает
давление на закрытую крышку, оказываемое противовесом,
и отжатый биошрот постепенно удаляется через небольшую щель,
образуемую отходящей крышкой.
Испытания показали, что отжатый в шнекпрессе ПНД-59 био-
шрот содержит 60—58% влаги.
Техническая характеристика шнекпресса ПНД-59
Производительность по исходному биошроту, кг/ч 2000
Число оборотов в минуту:
привода шкива.......................... 131
шнека ......................................... .12
Емкость бункера, л........................ 10,1
Диаметр шнека, мм.......................... 305
Потребляемая мощность, кет ...... 6,62
Габариты, мм.......................... 2600X870X1260
Масса, кг................................. 1480
Шнекпресс выпускается серийно тбилисским машиностроитель-
ным заводом им. С. Орджоникидзе.
Для отжима биошрота пригоден также горизонтальный двух-
шнековый пресс марки ФПК-2А (рис. 48), редуктор которого име-
ет два вала с удлиненными концами, на которые насаживаются
два шнека, вращающиеся в противоположные стороны. Степень от-
жима характеризуется содержанием остаточной влаги 58—60%.
Техническая характеристика шнекпресса ФПК-2А
Производительность по биошроту исходной влаж-
ности, кг/ч...................................... 1400
Диаметр шнека, мм................................... 160
Число оборотов шнека в минуту..................... 38,2
Редуктор . .............................Цилиндрический
шестеренчатый
Мощность электродвигателя типа АО-63-6, кет . 10
Габариты, мм................................... 2400X856X1317
Масса, кг ... 750
223
В ЛенНИИхиммаше испытана модель шнекпресса, на кото-
ром можно отжать биошрот до влажности 40%, что значительно
уменьшает потери ферментов и расходы на обезвоживание.
Рис. 48. Горизонтальный шнекпресс марки ФПК-2А:
/ — штуцер* для удаления фильтрата; 2 — шнек правый; 3 — шнек левый; 4 —
камера шнеков; 5 — электродвигатель; 6 — редуктор; 7 — бункер; S — кожух;
.9 — камера отжатия; 10 — клапан; // — станина; /2 — лоток.
Очистка ферментных экстрактов
Центрифугирование. Метод очистки ферментных экстрактов от
примесей на непрерывнодействующих центрифугах разработан в
лаборатории технологии ферментных препаратов ВНИИФСа.
Установлено, что при очистке ферментных вытяжек от балластных
веществ оптимальной величиной pH вытяжки при центрифугиро-
вании является 8,5. Добавление солей двухвалентных металлов в
вытяжку перед центрифугированием способствует образованию
внутримолекулярных связей и агрегации белковых молекул, увели-
чивая вязкость раствора. Разветвленные агрегаты образуются при
взаимодействии солей кальция, с белковыми молекулами.
224
Известно, что хлористый кальций при добавлении его в опре-
деленных пределах не оказывает инактивирующего действия на
активность амилаз. В связи с этим была выяснена оптимальная
дозировка этого компонента для коагуляции балластных веществ
из ферментных вытяжек. Установлено, что добавление 1% СаС12 к
водной вытяжке из Asp. oryzae (pH 8,5) и последующее разделе-
ние этой смеси центрифугированием дает возможность удалять
до 6%' балластных веществ от общего содержания сухих веществ
в вытяжке. Добавление СаС12 к вытяжке из Asp. niger нецеле-
сообразно, так как приводит к снижению активности пектиназы.
Поэтому для очистки этой вытяжки рекомендуется доведение pH
до 8 и последующее центрифугирование.
Работами ВНИИФСа в 1966 г. показана возможность очистки
полупродукта от посторонней микрофлоры в процессе отделения
неактивных примесей путем центрифугирования предварительно
обработанной СаС12 ферментной вытяжки.
Обработка вытяжек хлористым кальцием в количестве 1 % с
последующим центрифугированием повышает эффективность очист-
ки до 98—99%, а дополнительная обработка левомицетином с
последующим центрифугированием дает возможность очистить
этот полупродукт от посторонней микрофлоры на 99,9%.Как по-
казала практика Московского опытного завода ферментных пре-
паратов, при центрифугировании на сепараторе ВСС-01 вытяжки
очищаются от посторонней микрофлоры на 93—97%.
Сепарирование. Сепаратор ВСС-0 1 с центробежной
пульсирующей выгрузкой осадка (рис. 49) состоит
из станины, барабана, приемно-отводящего устройства и привода.
Он приводится в движение от индивидуального электродвигате-
ля через фрикционную центробежную муфту и винтовую пару.
На горизонтальном валу привода крепится винтовое колесо, кото-
рое входит в зацепление с винтовой шестерней вертикального вала
сепаратора. Нижняя опора вертикального вала воспринимает осе-
вую нагрузку от веса барабана, а верхняя упругая опора позво-
ляет при разгоне плавно переходить через критическое число обо-
ротов.
На верхнем конусном конце веретена насажен барабан, кото-
рый является основным технологическим органом сепаратора.
Внутри него расположен тарелкодержатель с пакетом конических
тарелок. Между крышкой и пакетом тарелок расположен плаваю-
щий конус, перемещающийся вниз и вверх. При перемещении вниз
он перекрывает разгрузочные щели, препятствуя выбросу осадка
и сепарируемой жидкости из барабана, а при подъеме вверх —
открывает разгрузочные щели, и содержимое барабана под дейст-
вием центробежной силы выбрасывается в приемник шлама.
Опускается конус с помощью буферной жидкости. Под действием
гидростатического давления, образующегося при вращении бара-
бана, буферная жидкость давит на конус, перемещая его вниз.
15—826
225
Рис. 49. Сепаратор ВСС-01:
/ — напорный диск; 2 — пакет конических тарелок; 3 — шламовое пространство барабана; 4 — крышка; 5 —
барабан; 6 — приемник для вытяжки; 7 — чаша; 8 —стопорное устройство; 9 — приемник; 10— станина; 11 —
электродвигатель для передачи вращения барабану; /2 — электрический пульт; 13— сварная рама; 14 — ре-
дуктор; 15 — гидравлический пульт.
По окончании процесса сепарирования подачу буферной жид-
кости в барабан прекращают, плавающий конус под действием
пружины поднимается вверх и открывает разгрузочные щели, че-
рез которые содержимое барабана выбрасывается в приемник
шлама. По наклонному дну приемника осадок сползает и удаляет-
ся из сепаратора. Крышка сепаратора шарнирно соединяется с
приемником шлама и закрывает вращающийся барабан.
Коммуникации для подвода суспензии и буферной жидкости,
отвода фугата и напорный диск образуют приемно-отводящую го-
ловку, которая устанавливается на крышке сепаратора. На комму-
никации подвода буферной жидкости установлены манометр,
фильтр и регулировочный вентиль. На коммуникациях подвода
суспензии и отвода фугата установлены смотровые окна и пробо-
отборные краники.
Процесс сепарирования поступающей в барабан суспензии про-
текает в пакете конических тарелок, собранных с небольшими за-
зорами. Под действием центробежной силы из жидкости выделя-
ются твердые частицы, которые сползают по наклонной образую-
щей тарелки и накапливаются в шламовом пространстве, у пери-
ферии барабана. Осветленная жидкая фракция движется к оси
вращения барабана и по каналам тарелкодержателя поднимается
в напорную камеру барабана, откуда напорным диском под дав-
лением 1,5—2,5 ка/сл2 непрерывно выводится из барабана сепа-
ратора по закрытым коммуникациям.
Процесс протекает непрерывно до тех пор, пока шламовое про-
странство барабана полностью не заполнится осадком, после чего
проводится его выгрузка. Длительность цикла зависит от степени
концентрации взвешенных частиц и регулируется реле времени;
после каждого цикла происходит центробежная выгрузка осадка,
которая может быть автоматической и ручной. Для придания шла-
му большей текучести и его промывки в приемник подводится во-
да, подача которой включается автоматически в момент выброса
шлама из барабана.
Техническая характеристика сепаратора ВСС-01
Производительность сепаратора при освобождении
от посторонней микрофлоры, л/ч .... 200—400
Давление, кн)м2:
на выходе осветленной вытяжки .... 196—245
на выходе буферной жидкости .... 98—117,6
Объем шламового пространства, л ... 30
Скорость вращения барабана, об!мин . 5000
Масса барабана, кг.................................... 238
Число тарелок ........................................ 130
Мощность электродвигателя, кет........................ 10
Габариты механизма автоматического управления,
мм............................................. 945 X1685 X 305
Мощность электродвигателя механизма автомати-
ческого управления, кет . '.................... 0,270
Габариты сепаратора, мм......................... 1250X960X1450
Масса сепаратора, кг.................................. 110
227
Сепаратор ВСС-01 смонтирован на Вышневолоцком и Москов-
ском заводах ферментных препаратов. Испытания показали, что
на нем вместе с балластными веществами можно отделить до 99%
посторонней микрофлоры вытяжки.
Очистка диализом. Диализом называется диффузия растворен-
ных веществ через полупроницаемую мембрану, которая пропуска-
ет только те вещества, размеры молекул которых меньше диамет-
ра ее микропор. Подобрав мембраны соответствующей пористости,
можно очистить раствор от большей части низкомолекулярных ве-
ществ, оставив в нем высокомолекулярные соединения.
В ферментном производстве к диализу прибегают для удале-
ния из ферментных растворов различных низкомолекулярных ве-
ществ, чтобы повысить их чистоту и снизить гигроскопичность
осадков, что значительно облегчает их сушку. Известно, что гигро-
скопичные ферментные препараты при хранении увлажняются, что
сопровождается значительным снижением активности.
В лабораторных исследованиях в качестве полупроницаемых
мембран используют пергамент, приготовленные из коллодия
пленки, животный или рыбий пузырь, а в производственных усло-
виях— марлин, специальную диализаторную ткань, целлофан и
др. Критерием оценки качества материалов для мембраны диали-
затора служат их диализирующая способность и селективность.
По прочности наибольший интерес представляют диализаторные
ткани «палатка» и № 2036, однако, обладая удовлетворительной
диализирующей способностью, они совершенно не подходят по се-
лективности, так как потери ферментативной активности в про-
цессе диализа составляют примерно 50%. Хорошо высыхающие,
негигроскопичные ферментные осадки получаются при извлечении
диализом из концентрированных ферментных вытяжек 50—60%
содержащихся в них экстрактивных веществ. Для этой цели дли-
тельность диализа не будет превышать 20—24 ч.
В процессе диализа всегда происходит некоторое разбавление
диализируемого раствора, причем тем больше, чем выше началь-
ная концентрация очищаемого раствора.
Испытания непрерывнюдействующего диализатора, сконструи-
рованного К. П. Степанищевым, позволили установить, что через
20—22 ч количество примесей в растворе, содержащем ферменты,
резко уменьшается. Это иллюстрируется графиком, приведенным на
рис. 50. Анализ проб, отобранных из последней кюветы, дал следу-
ющие результаты: удалено 90% сахара и 75% сухих веществ от ис-
ходного их содержания. Соответственно повысилась активность
ферментов на 1 г сухого вещества (вытяжка из Asp. oryzae): по АС
на 275%, по ДС на 150% и по МС на 260%.
Процесс диализа можно значительно интенсифицировать, при-
менив метод электродиализа, который представляет собой комби-
нирование двух процессов: электролиза и диализа в электрическом
поле. При проведении этого процесса электролиты в диссоциирован-
ие
ной форме легче проникают через мембраны, что значительно уско-
ряет их удаление.
Теоретически скорость освобождения ферментных растворов от
электролитов можно увеличить в несколько десятков раз путем со-
здания необходимой разности зарядов по обе стороны диализатор-
ной мембраны. Если при обычном
диализе можно лишь частично
избавиться от низкомолекуляр-
ных балластных веществ, содер-
жащихся в ферментных раство-
рах, то путем электродиализа
можно полностью удалять из очи-
щаемого раствора электролиты.
Ускоряя диффузию электрически
заряженных молекул и неэлек-
тролитов, электродиализ не ока-
зывает влияния на скорость «вы-
мывания» электрически нейтраль-
ных соединений.
Особенно эффективен электро-
диализ для очистки ферментных
осадков, получаемых высалива-
нием. Ввиду различной ckodoc-
ти удаления из диализаторной
камеры положительно и отрица-
тельно заряженных ионов может
произойти значительное подкис-
ление либо подщелачивание сре-
ды в камере, что может отрица-
тельно повлиять на сохранение
ферментативной активности. Это
обстоятельство необходимо учи-
тывать при проведении электро-
диализа.
Из диализатора ферментный
Продолжительность диализа
Рис. 50. Очистка диффузионного со-
ка при непрерывном диализе. Ско-
рость поступления сока на диализа-
' тор 2,5 л/ч, скорость воды 38 л/ч:
1 — сухие вещества; 2 — сахар; 3 — декстпи-
раствор, очищенный от большей
части сахаров и других инертных
нолитическая способность; 4 — мальтаз-
ная способность; 5 — амилолитическая спо-
собность.
веществ, направляется на охлаж-
дение и осаждение из него очищенного ферментного препарата.
Концентрирование экстрактов
Водная ферментная вытяжка, получаемая в процессе экстрак-
ции, составляет 200—220% от количества исходной сухой культуры
гриба Asp. oryzae. Амилолитическая активность ее колеблется от
10 до 16 ед. После упаривания вытяжки до 74—1/б первоначального
объема получают концентрированный полуочищенный препарат в
виде сиропа, активность которого в 4—5 раз выше (50—70 ед!мл).
22»
Комплекс ферментов, извлекаемый в процессе экстракции, тер-
молабилен, и поэтому упаривание вытяжки необходимо вести в
условиях среднего вакуума. Эффективность концентрирования фер-
ментных растворов с сохранением каталитической активности зави-
сит от нескольких факторов. Главные из них — это создание мини-
мально возможного с экономической точки зрения давления внутри
аппарата; максимально возможная разность температур обогрева-
ющего агента и точки кипения концентрируемого раствора с учетом
сохранения его ферментативной активности, а также минимальное
время пребывания концентрируемого раствора в аппарате в кон-
такте с обогревающим агентом.
Вакуум-выпаривание позволяет снизить температуру кипения
ферментной вытяжки до 25—30°С, что обеспечивает сохранение ак-
тивности препарата. Для обогрева вакуум-выпарных аппаратов це-
лесообразно применять вакуумный водяной пар и реже — горячую
воду. Испытания, проведенные во ВНИИФСе Л. Н. Аганесовой под
руководством А. Л. Малченко, показали, что при упаривании фер-
ментных вытяжек в обычных, периодически действующих выпарных
аппаратах при температуре выше 36—37°С происходит их частич*
ное инактивирование. Температура греющего агента, в процессе его
контакта с вытяжкой влияет на сохранение активности. Согласно
экспериментальным данным, при использовании в качестве грею-
щего агента воды с температурой 65°С наблюдается потеря актив-
ности вытяжки из грибной культуры Asp. oryzae, выращенной по-
верхностным методом, в размере 23%. Применение греющей воды
с более высокой температурой (до 80°С) приводило к потере 40%
ферментативной активности. При упаривании ферментных вытяжек
в тонкой пленке и сокращении времени воздействия на нее до не-
скольких минут, температура греющего агента может быть значи-
тельно повышена.
Экспериментальным путем определены такие теплофизические
характеристики ферментных растворов, как плотность, вязкость, по-
верхностное натяжение, теплопроводность в диапазоне температур
20—40°С и в пределах содержания сухих веществ 10, 20. 30, 40 и
50% при получении из нее сиропа (табл. 17). Коэффициенты теп-
лопередачи при выпаривании вытяжек в условиях оптимального
режима (температура выпаривания 37°С, температура греющего
агента 50°С) лежат в пределах 3771 кдж! (м2 •ч - град).
Все перечисленные выше теплофизические параметры были ус-
тановлены для вытяжек из культур грибов Asp. oryzae и Asp.
niger. Для вытяжек из других культур оптимальные режимы будут
несколько отличаться.
С целью интенсификации процесса выпаривания ферментных
растворов во ВНИИФСе исследована работа вакуум-выпарной ус-
тановки с принудительной циркуляцией. В данном аппарате в отли-
чие от кубового сочетается энергичное выпаривание с последующим
быстрым охлаждением выпариваемого раствора, что значительно
снижает потери активности ферментов под воздействием тепла. При
230
Таблица 17
Теплофизические параметры ферментных растворов, полученных методом
, диффузии из культур плесневых грибов
Содержа- ние сухих веществ, % Теплоемкость, кджКкгград) Теплопроводность, вт/(м-град} Температуропровод- ность , а-10 м*/ч Температурная депрессия, град
10 3,8816—3,9237 0,5685—0,5974 0,4955—0,5318 0,12—0,13
20 3,6801—3,7090 0,5341—0,5962 0,4792—0,5181 0,43—0,46
30 3,4223—3,4621 0,4964—0,5103 0,4657—0,5166 0,61—0,66
40 3,2431—3,2633 0,465—0,5118 0,4409—0,4830 1,04—1,12
50 3,033—3,1021 0,4338—0,4865 0,4132—0,4615 1,4—1,52
наличии надежного вакуума это позволяет интенсифицировать про-
цесс, применяя в качестве греющего агента пар с температурой
100°С.
Потери ферментативной активности при концентрировании вод-
ных вытяжек из поверхностной культуры гриба Asp. oryzae состав-
ляют 2—3%. При длительном соприкосновении с греющим агентом,
имеющим температуру 55°С, наблюдалась потеря амилолитической
активности через 2 ч на 9,2%, через 3 ч на 13,8% и через 4 ч на
26%. Термолабильность диализованных ферментных растворов вы-
ше, чем неочищенных.
Процесс выпаривания может проводиться периодически или не-
прерывно. При периодическом способе в аппарат загружают опре-
деленное количество ферментной вытяжки и по мере выпаривания
периодически подают в него новые порции. Процесс ведут до дости-
жения заданной конечной концентрации сухих веществ. При непре-
рывном выпаривании уровень ферментной вытяжки в аппарате и
температура процесса остаются постоянными во времени.
Вакуум в выпарных установках создается в результате конден-
сации вторичного пара в конденсаторах, охлаждаемых водой и рас-
солом, а также с помощью вакуум-насосов, которые удаляют воз-
дух, выделяющийся из выпариваемой жидкости, и воздух, проника-
ющий через неплотности в аппаратуре и трубопроводах.
Для упаривания диффузионных вытяжек применяют пленочные
вакуум-выпарные аппараты, в которых выпаривание происходит в
тонком слое. Преимущество их заключается в том, что длительность
контакта раствора с теплоносителем сокращается и создаются бла-
гоприятные условия для сохранения ферментативной активности
термочувствительных препаратов.
Выпарные аппараты состоят из двух основных частей: греющей
камеры, в которой расположена поверхность нагрева, и сепаратора.
231
в котором вторичный пар отделяется от капель жидкости. В аппа-
ратах пленочного типа водная вытяжка, подлежащая концентриро-
ванию, движется вдоль поверхности теплообмена тонкой пленкой.
Государственным проектным институтом медицинской промыш-
ленности (Гипромедпром) разработаны пленочные выпарные ваку-
ум-аппараты с поверхностью нагрева от 0,7 до 5,5 м2.
Пленочная вакуум-выпарная установка роторного типа состоит
из двух мерников для хранения и подачи ферментной вытяжки, по-
догревателя, выпарного аппарата с мешалкой, двух теплообменни-
ков для конденсации экстра-пара водой и рассолом, двух приемни-
ков для хранения конденсата, двух приемников для сиропа, мокро-
воздушного вакуум-насоса для паровой рубашки и суховоздушного
вакуум-насоса.
Пленочный выпарной аппарат роторного типа (рис. 51) пред-
ставляет собой вертикальный цилиндр, изготовленный из нержаве-
ющей стали, со съемной крышкой и коническим днищем. Аппарат
снабжен в цилиндрической части паровой рубашкой для нагрева
вытяжки и водяной рубашкой в конусной части для охлаждения
упаренного концентрата водой.
Внутри аппарата расположена трехлопастная мешалка, приво-
димая в движение от электродвигателя. Число оборотов мешалки
180 в минуту. Расстояние между лопастями и стенками аппарата
должно быть одинаковым по всей высоте цилиндра и равно 2—3 мм.
В верхней части его расположена паросепараторная головка.
Ферментная вытяжка подается самотеком из мерников в подо-
греватель, где нагревается до 25°С, и затем через ротаметр посту-
пает в верхнюю часть аппарата. При вращении мешалки фермент-
ная вытяжка тонкой равномерной пленкой отбрасывается к стен-
кам, выпаривается и в виде сиропа поступает в приемник. Экстра-
пар, отделенный от увлеченных капель вытяжки, поступает в холо-
дильник с водяным охлаждением, затем в холодильник с рассоль-
ным охлаждением и в виде конденсата собирается в приемниках.
Воздух, выделяющийся из вытяжки в процессе упаривания и про-
никающий через неплотности аппарата и коммуникаций, отсасыва-
ется суховоздушным вакуум-насосом ВН-4Г.
Аппарат обогревается паром при вакууме в обогревательном
пространстве, создаваемом мокровоздушным вакуум-насосом.
Вакуум-выпарной аппарат с вертикальными трубками (рис. 52)
установлен на Вышневолоцком ферментном заводе.
Он состоит из корпуса, конического днища с рубашкой и паросе-
параторной головки. Внутри корпуса расположены две решетки с
тремя вертикальными тонкостенными трубками. Ниже верхней ре-
шетки подводится пар, который обогревает межтрубное простран-
ство и в виде конденсата отсасывается мокровоздушным вакуум-
насосом. Общая поверхность испарения 2,2 м2. Над верхней решет-
кой расположена сепараторная головка, состоящая из обечайки,
стакана, отбойника и сливной трубы. Ферментная вытяжка, подле-
232
Рис. 51. Пленочный ваку-4
ум-выпарной аппарат ро-
торного типа:
1 — привод ротора; 2 — ре-
дуктор; 3 — штуцер для за-
грузки жидкости, подлежа-
щей выпариванию: 4 — шту-
цер для подачи пара; 5 —
обечайка; 6 — корпус; 7 — ро-
тор; 8 — обечайка конуса;
9 ~ днище конуса; 10 — шту-
цер для подачи холодной
воды; 11 — штуцер для вы-
хода концентрированной
жидкости; 12 — штуцер для
выхода холодной воды; 13 —
штуцер для выхода конден-
сата; 14 — штуцер для выхо-
да вторичного пара.
Рис. 52. Пленочный вакуум-выпарной аппарат с
вертикальными трубами:
/ — крышка; 2 — штуцер для выхода вторичного пара;
3 — обечайка; 4 — сливная труба; 5 —стакан; 6 — штуцер
для газовой оттяжки; 7 — корпус; 8 — штуцер для выхода
конденсата; 9— штуцер для входа рассола; 10 — днище
рубашки- 11 — штуцер для выхода концентрированного
продукта; /2—конус; 13 — штуцер для выхода рассола;
14 — запасной штуцер: /5 — труба; 16 — штуцер для входа
пара; 17, 19 — штуцеры для водомерного стекла; 18 —
штуцер для входа продукта, подлежащего упариванию;
20 — отбойник.
жащая упариванию, подводится через сепараторную головку с по-
мощью предусмотренного в ней успокоительного цилиндрического
кольца.
Штуцер для отвода неконденсирующихся паров из камеры кало-
ризатора приварен к верхней ее части. Конденсат отводится снизу.
К нижней конусной части камеры подведена холодная вода.
Водная вытяжка в количестве 50—60 л)ч поступает в аппарат
между корпусом и «стаканом и в виде тонкой пленки растекается
вдоль всей поверхности трубок. Пар, отделяемый с помощью отбой-
ников сепараторной головки от капель жидкости, поступает в холо-
дильники с водяным и затем с рассольным охлаждением, конденси-
руется и собирается в приемнике, а капли влаги по сливной трубе
возвращаются в аппарат. Упаренный концентрат (сироп) поступа-
ет в приемники.
Производственные испытания показали, что при подаче на упа-
ривание 50—60 л вытяжки в час с содержанием сухих веществ
10—12% вытяжка концентрируется в 5 раз. Потеря ферментатив-
ной активности в процессе упаривания при вакууме 96,3—97 кн!м2
и температуре упаривания 27—32°С составляла до 12%. Для умень-
шения потерь необходимо вести процесс при более глубоком
вакууме и сократить длительность контакта вытяжки с тепло-
агентом.
Для упаривания водной вытяжки может быть использован ва-
куум-выпарной аппарат с принудительной циркуляцией.
Вакуум-выпарная установка с принудительной циркуляцией пе-
риодического действия (рис. 53) состоит из подогревателя, выпар-
ного аппарата, циркуляционного насоса, ловушки, теплообменников
с водяным и рассольным охлаждением, двух приемников, мокро-
воздушного и суховоздушного вакуум-насосов.
Подогреватель представляет собой снабженный паровой рубаш-
кой аппарат цилиндрической формы с крышкой и коническим дни-
щем. Внутри него для увеличения поверхности нагрева расположе-
на система вертикальных двойных трубок (трубка в трубке), при-
чем верхний конец наружных трубок закрыт, а нижний открыт; у
внутренних трубок оба конца открыты.
Вытяжка подогревается вакуумным водяным паром, поступаю-
щим в паровую рубашку и дополнительно подаваемым в трубки.
Водяной пар подается в нижний открытый конец внутренних тру-
бок, поднимается по ним вверх и движется по пространству между
внутренними и наружными трубками. Таким образом, при малом
диаметре подогревателя и небольшом числе трубок можно получать
развитую поверхность обогрева и большую производительность.
Пар, удаляемый из обогревательной системы, отсасывается плун-
жерным мокровоздушным вакуум-насосом. Одновременно в насос
для конденсации паров подается холодная вода, которая вместе с
водяным конденсатом используется на другие нужды или отводит-
ся в канализацию.
234
После создания в системе вакуума с помощью суховоздушного
поршневого вакуум-насоса вытяжка засасывается в подогреватель
до уровня нижнего смотрового стекла выпарного аппарата, вклю-
чается в работу циркуляционный насос и в межтрубное простран-
ство первого теплообменника подается вода, а второго — рассол или
вода, охлажденная до 5—6°С.
Рис. 53. Вакуум-выпарная установка с принудительной циркуляцией:
1 — подогреватель; 2 — выпарной аппарат; 3 —ловушка; 4 — теплообменник с водяным
охлаждением; 5 — теплообменник с рассольным охлаждением; 7 — суховоздушный
вакуум-насос; 6, 8, 9, 10 — приемники; // — рециркуляционный насос; /2 — привод ре-
циркуляционного насоса; 13 — штуцер для загрузки упариваемой и выгрузки концент-
рированной жидкости; 14 — мокровоздушный вакуум-насос.
Вытяжка непрерывно циркулирует по замкнутому кольцу: подо-
греватель — выпарной аппарат — сепаратор — циркуляционная
труба, а вторичный водяной пар поступает в ловушку, где от него
отделяются капли жидкости, возвращаемые в аппарат, а пар посту-
пает в первый теплообменник, конденсируется и часть его отводит-
ся в приемник.
Несконденсировавшиеся в первом теплообменнике водяные па-
ры поступают во второй теплообменник, где охлаждаются рассолом
или холодной водой и отводятся в виде конденсата во второй при-
емник.
235
Подогреватель, выпарной аппарат, ловушка,, циркуляционная
труба и все коммуникации, соприкасающиеся с ферментной вытяж-
кой, изготавливаются из нержавеющей стали.
По мере упаривания вытяжжи свежие порции ее непрерывно за-
сасываются в подогреватель выпарного аппарата и после кон-
центрирования до заданного объема обогрев и выпаривание пре-
кращают, давление выравнивают и ферментный препарат в виде
сиропа выгружают через тот же штуцер, по которому вытяжка по-
ступала в подогреватель.
Вакуум-выпарная установка снабжена необходимыми прибора-
ми дистанционного контроля для определения вакуума и темпера-
туры водяного пара в обогреваемом пространстве и вторичных во-
дяных паров.
Описанные выше установки широко применяются в химико-фар-
мацевтической промышленности для концентрирования термола-
бильных гормональных препаратов. Для концентрирования фер-
ментных вытяжек в настоящее время целесообразно использовать
аппараты с вертикальными трубками или с принудительной цир-
куляцией.
Одним из важных узлов вакуум-выпарных установок является
вакуум-насос. При выборе вакуум-насоса для выпарной установки
количество воздуха, подлежащее отсасыванию, определяется по
эмпирической формуле
GB = 0,001 (0,025 GBOlbI + 10 Gnapa) кг/сек,
где Оводы — расход охлаждающей воды на конденсацию пара,
кг!сек\
Gnapa —количество конденсирующегося пара, кг!сек.
Объем отсасываемого воздуха вычисляется по уравнению
288 (273 +/в) ч/
VB =----«д—Д—мЧсек,
Рн
где, кроме ранее обозначенных величин, 288 — газовая постоянная
для воздуха, дж/(кг-град); ps —парциальное давление его, н/м2.
Вакуум-насосы. На действующих ферментных заводах для от-
сасывания воздуха в вакуум-выпарных и сушильных установках
применяются ротационные двух.плунжерные ваку-
ум-н а с о с ы ВН-4Г. Они снабжены газобалластным устройством
и пригодны для откачивания воздуха и водяных паров определенной
концентрации. Насосы ВН-4Г и ВН-6Г могут длительное время ра-
ботать при давлении у впускного патрубка около 13,3 кн)м2. Оста-
точное давление, которое создается насосом при работе без нагруз-
ки, при плотно закрытом входном патрубке, равно 0,665 н/м2, и по-
этому данный тип относят к группе насосов среднего вакуума.
236
Корпус вакуум-насоса ВН-4Г (рис. 54) разделен поперечной пе-
регородкой на две роторные камеры, соединенные с клапанными
отделениями. Внутри камеры расположен роторный механизм, со-
стоящий из эксцентриков, закрепленных на валу и смещенных один
относительно другого на 180°. В верхней части корпуса находится
всасывающая камера, в
которой установлена пря- < I' к- ?
моугольная часть плунже-
ров. Хвостовики плунже-
ров надеты на эксцен-
трики. Прямоугольная
часть плунжера соверша-
ет возвратно-поступатель-
ное движение.
При' вращении экс-
центрика плунжер, дви-
гаясь цилиндрической
частью по часовой стрел-
ке, сжимает воздух, кото-
рый открывает клапан и
через выхлопную трубу и
масляный сепаратор уда-
ляется в выхлопной трубо-
провод. В это время воз-
дух из всасывающей ка-
меры поступает в прост-
ранство, образовавшееся
в правой стороне плунже-
ра; во второй роторной
камере совершаются ана-
Рис. 54. Вакуум-насос ВН-4Г:
/ — корпус; 2 — плунжер; 3— направляющая плун-
жера; 4 — эксцентрик; 5 — крышка; 6 — вал; 7 —
выхлопной патрубок; 8 — нагнетательный клапан.
логичные операции, но со сдвигом по фазе на 180°.
Для предотвращения конденсации паров воды применяется
газобалластное устройство, которое с помощью дозатора регулирует
подачу атмосферного воздуха в роторные камеры сжатия балласт-
ного газа. В камеру сжатия насоса до начала сжатия подается бал-
ластный газ, и при достаточном количестве его в камере достигает-
ся давление 101 кн/м2 еще до того, как лар будет сжат до давления
насыщения, т. е. до того как произойдет конденсация. Как только
величина давления достигает атмосферного, открывается выхлоп-
ной клапан и пар вместе с газом выходит из насоса. Чем больше
концентрация пара в парогазовой смеси, тем больше количество
балластного газа надо подавать и тем выше будет достигаемое пре-
дельное давление. В процессе эксплуатации количество подаваемого
балластного газа устанавливается поворотами маховика дозатора.
В масляном сепараторе масло, увлекаемое откачиваемым воз-
духом, отделяется и остается в баке. Качество масла и наличие воды
контролируется с помощью стеклянного отстойника, а уровень ма-
сла в баке — по масломерному стеклу.
237
Избыточное количество масла в баке, выше верхней метки, вы-
брасывается в атмосферу. До пуска насоса в работу необходимо
удалить из него избыток масла, для чего следует перекрыть вентиль
на маслопроводе и провернуть вручную роторный механизм за шкив
насоса.
Насос охлаждается водой, подаваемой в водяную рубашку кор-
пуса шод давлением не менее 2 ат (196,2 кн/м2). Расход воды регули-
руется таким образом, чтобы температура масла в баке была не
выше 70°С. При подключении электродвигателя насоса к сети необ-
ходимо убедиться в правильности направления вращения, которое
должно быть по часовой стрелке (если смотреть со стороны шкива).
Обратное вращение шкива не допускается, так как это приведет к
аварии.
Ротационные вакуум-насосы выпускаются трех типоразмеров:
ВН-4Г, ВН-6Г и ВН-300Г.
Техническая характеристика вакуумных насосов
ВН-4Г ВН-6Г вн-зоог
Величина предельного вакуума, н/м2 . . 0,665 1,33 1,33
Скорость откачки, л!сек .... 59 155 300
Число оборотов вала насоса в минуту . 500 360 260
Габариты, мм:
длина . 1370 1560 2075
ширина 770 970 1610
высота . 1300 1790 1800
Масса насоса, кг . 690 1557 2665
Мощность электродвигателя, кет . 7 20 40
Кроме ротационных вакуум-насосов типа ВН-4Г, для создания
вакуума в системе могут применяться поршневые и многопластин-
чатые вакуум-насосы.
Поршневые вакуу м-н а с о с ы. Наибольшее распростране-
ние получили насосы для создания остаточных давлений порядка
2—5,3 кн!м2.
Пределы производительности применяемых поршневых вакуум-
насосов 45—3500 м3/ч.
Вертикальные вакуум-поршневые насосы более прогрессивны,
чем горизонтальные.
Ниже (табл. 18) приводится характеристика поршневых вакуум-
насосов, которые могут найти применение в ферментной промыш-
ленности (ГОСТ 1867—57).
Л4ногопластинчатые вращательные насосы со
скользящими лопатками могут создавать в системе ваку-
ум порядка 2—3,4 кн/м2 при производительности 200—6000 м3/ч.
Преимущества их перед поршневыми: меньшие габариты, непосред-
ственное соединение насоса с электродвигателем, простота устрой-
ства и высокая надежность в эксплуатации.
238
Таблица 18 Характеристика поршневых вакуум-насосов с принудительным распределением
Типоразмер Номинальная производи- тельность, м?1мин. Потребляемая мощность, кет
Одноступенчатые
ВНП-0,75 .... 1
ВНП-1,5 .... 1,5 1,75
ВНП-3 3 3,4
ВНП-6 6 6,7
ВНП-12 12 13,2
ВНП-25 25 26,5
ВНП-50 .... 50 52
Максимально достигаемый вакуум 1%.
Двухступенчатые
ДВНП-0,75 .... 0,75 1
ДВНП-1,5 .... 1,5 2
ДВНП-3 .... 3 4
ДВНП-6 .... 6 8
ДВНП-12 .... 12 16
ДВНП-25 .... 25 32
Максимально достигаемый вакуум 1%.
Техническая характеристика вакуумных насосов
РВН-8 РВН-30 РВН-60 РВН-75
Скорость откачки при атмосферном дав- лении, л!сек 105 475 940 ИЗО
Предельное давление, кн)м2 33 2 2 2
Расход масла, г/ч 150 250 300 350
Расход воды, л/ч 400 950 1400 1800
Мощность электродвига- теля, КвТ .... 14 50 75 100
Число оборотов в мину- ту 1500 585 485 485
Масса установки, кг 620 3375 5540 8980
Площадь в плане, м2 1,33X0,6 2,31x0,98 3,1X0,09 3,32X1,12
Высота, л 0,9 1,32 1,45 1,5
239
Ниже дается характеристика мнагопластинчатых одноступенча-
тых и двухступенчатых (табл. 19) ротационных вакуум-насосов, ко-
торые могут быть использованы на заводах ферментных препара-
тов.
Таблица 19
Характеристика двухступенчатых пластинчатых
вакуум-насосов
Типоразмеры Номинальная производи- тельность, м?1мин Потребляемая мощность на валу вакуум- насосов, кет
ДРВН-З .... 3 8
ДРВН-6 6 14
ДРВН-12 .... 12 26
ДРВН-25 .... 25 45
ДРВН-50 .... 50 90
ДРВН-75 .... 75 130
Водокольцевые насосы. Для откачивания смеси воздуха
с водяным паром применяются мокровоздушные вращательные ва-
куум-насосы с жидкостным поршнем типа КВН или ВВН. Буквы и
цифры марки насосов означают: К — консольный, В — вакуумный,
Н — насос, цифры — объем отсасываемого воздуха в л/сек (табл.
20). Такие типы насосов применяются для создания вакуума в обо-
греваемом пространстве вакуум-выпарных установок и отсоса пара
вместе с конденсатом.
Таблица 20
Характеристика пластинчатых одноступенчатых вакуум-насосов
Типоразмеры Номинальная производитель- ность, мР/мин Остаточное давление при закрытом вса- сывающем штуцере, кн/м* Вакуум, %, не менее Потребляемая мощность, кет
ВВН-0,75 .... 0,75 14,6 70 1,3
ВВН-1,5 .... 1,5 14,6 70 2,1
ВВН-3 3 10,2 70 6,5 (заменяет РМК-2)
ВВН-6 6 5,8 70 12,5
ВВН-12 12 2,06 70 20 (заменяет РМК-3)
ВВН-25 25 2 70 48 (заменяет РМК-4)
ВВН-50 50 2 70 94
240
Осаждение ферментов органическими растворителями
Для осаждения ферментов могут быть применены различные
органические растворители: этанол, эфиро-альдегидная фракция —
отход при ректификации этилового спирта, метанол, изопропанол,
ацетон и др.
Способ выделения ферментов из водных растворов органически-
ми растворителями принято считать более приемлемым по сравне-
нию с высаливанием, так как он менее сложен, а растворители до-
вольно легко регенерируются путем перегонки на ректификационных
аппаратах периодического или непрерывного действия.
В производстве чаще всего для этих целей применяется этило-
вый спирт. Работы с метиловым спиртом показали, что он вызыва-
ет более быструю инактивацию ферментов. Ацетон 60 %-ной концен-
трации почти полностью осаждает протеолитические ферменты из
культуры Asp. oryzae, тогда как амилолитические, даже при повы-
шении концентрации ацетона до 70—75%, выделяются только на
76—77%. Следует также отметить, что ацетон очень летуч и пары
его, выделяясь в воздух производственного помещения, будут вред-
но действовать на здоровье человека.
Основным фактором, определяющим процесс осаждения фермен-
тов указанными растворителями, является изменение полярности
среды, проявляющееся в изменении ее диэлектрической постоянной.
Применение этих, а реже и других, органических растворителей для
осаждения белков основано на их способности понижать диэлект-
рическую постоянную среды. Как известно, силы электростатическо-
го притяжения и отталкивания обратно пропорциональны диэлек-
трической постоянной; поскольку при смешивании водной вытяжки
ферментов со спиртом происходит понижение этой постоянной, это
способствует взаимодействию белковых молекул; они теряют раст-
воримость, образуют агрегаты и выпадают в осадок.
Вопрос выбора органического растворителя для осаждения фер-
ментов из водных растворов был изучен во ВНИИФСе и
УкрНИИППе.
Действие этилового спирта как осадителя ферментов иллюстри-
руется данными табл. 21.
Таким образом, можно заключить, что этиловый спирт 75 %-ной
концентрации достаточно полно осаждает как амилолитические, так
и протеолитические ферменты.
Так как расход спирта на осаждение ферментов достаточно
большой, предпринимались попытки добиться его снижения, в ча-
стности, путем увеличения концентрации сухих веществ в водной
вытяжке. Проведенные во ВНИИФСе и УкрНИИППе специальные
исследования показали, что с увеличением концентрации сухих ве-
ществ в вытяжке, подвергаемой действию этилового спирта, физи-
ческая структура осадков значительно ухудшается. Они приобрета-
16—826
241
ют вязкую, мазеобразную консистенцию, а в .производственных
условиях забивают трубопроводы, что в конечном итоге приводит к
остановке цеха и трудоемким работам по чистке коммуникаций.
Таблица 21
Осаждение ферментов из культуры Asp. oryzae этиловым спиртом
(по данным Е. Я. Калашникова)
Концентрация этилового спирта в растворе, % об. Выделено ферментов в осадок из 100 мл вытяжки
ОС, ед. ПдС\ ед. % от содержания в вытяжке
ОС ПдС
50 12,8 9,8 10 61
55 37,2 12,3 30 76
60 94,0 13,5 75 83
70 118,0 14,5 94 90
75 120,0 14,7 96 91
* Пептидазная активность.
Во ВНИИФСе установлено, что концентрация сухих веществ в
вытяжках, подвергаемых обработке органическими растворителями,
и в частности этиловым спиртом, не должна превышать 15%. Осаж-
дение ферментов из недиализованной вытяжки с концентрацией су-
хих веществ около 15% позволяет получить очищенные ферментные
препараты в количестве 3—5% от исходной культуры гриба. Сле-
дует отметить, что продолжительность контакта вытяжки со спир-
том влияет на активность ферментов и тем самым изменяет выход
готового ферментного препарата.
В качестве примера приведем данные о влиянии этилового спир-
та на ферментативную активность вытяжки из Asp. oryzae. Этило-
вый спирт в смеси с вытяжкой из этой культуры гриба в концент-
рации 70% об. в течение часового контакта при температуре 10°С
не изменяет ферментативной активности, за 3 ч контакта инактиви-
рует амилазу на 10%, а за 24 ч — на 30%.
Таким образом, с увеличением продолжительности контакта
спирта с ферментным раствором потери каталитической активности
возрастают.
242
Степень очистки ферментов при осаждении их этиловым спиртом
из диффузионных вытяжек
Таблица 22
Сухая культура Очищенный препарат Выход очи- щенного пре- парата, % к культуре гриба Степень концентрирования ферментов в процессах экстракции их из культуры гриба (числитель) и осаждения этиловым спиртом из диффузионных вытяжек (знаменатель)
название активность, ед/г название активность, ед/г
Asp. oryzae КС . . . . AC-30 Оризин ПК АС-600 3,0 3,3 раза 6 раз
Asp. awamori 22 . . . . ДС=300 Аваморин ПК ДС-6000 4,0 3,3 раза 8 раз
Asp. terricola 3374 ПС-20 Терризин ПК ПС-600 4,5 3,3 раза 9 раз
Asp. niger П ПкС-500 Нигрин ПК ПкС-8000 5,0 3,3 раза 5 раз
Эффективно для осаждения ферментов из водных вытяжек при-
менять и изопропиловый спирт (табл.23).
Таблица 23
Результаты осаждения изопропиловым спиртом ферментов из
вытяжек, полученных из Asp. oryzae И-476
Концентрация изопропилово- го спирта, % об. Выделилось ферментов в осадок
амилолити- ческих, ед. ОС протеолитичес- ких, ед. ПС процент от содержания в вытяжке
ОС ПС
40 13 38 10 16
45 21 72 16 30
50 56 149 43 62
55 122 216 94 90
60 123 219 95 91
70 125 221 96 92
Из данных табл. 23 следует, что для выделения 90—94% актив-
ности, содержащейся в диффузионной вытяжке, требуется концент-
рация изопропилового спирта 55% об., т. е. значительно меньшая,
чем этилового спирта, что экономически выгодно. Действительно,
для доведения концентрации изопропилового спирта в растворе
до 55% об. на 1 объем вытяжки требуется 1,37 объема изопропило-
вого спирта, а для выделения ферментов при помощи этилового
спирта для доведения концентрации его в растворе даже до 70% об.
на 1 объем вытяжки требуется 2,8 объема. Осаждение ферментов
изопропиловым спиртом наиболее полню проходит при pH, харак-
терных для ъытяжек (5,8—6,8). Повышение или понижение вели-
чины pH приводит к частичной инактивации ферментов и, следова-
тельно, к снижению ферментативной активности получаемых осад-
ков.
В числе положительных особенностей применения изопропилово-
го спирта следует отметить также его более выраженную по срав-
нению с этиловым спиртом избирательную способность, которая
проявляется в том, что в ферментный осадок увлекается значитель-
но меньше балластных веществ.
Однако этот способ имеет и свои отрицательные стороны. При
работе с изопропиловым спиртом в процессе смешивания с вытяж-
кой в осадителе и последующего отделения ферментного осадка на
центрифугах или сепараторах в воздух выделяется много паров, ко-
торые значительно вреднее паров этилового спирта. Получаемые
244
ферментные осадки очень липкие и мажущиеся, вследствие чего су-
шить их гораздо труднее.
Осадители. Осаждение ферментов из водных вытяжек органиче-
скими растворителями (проводят в специальных аппаратах цилин-
дрической формы с (полусферической крышкой и коническим дни-
щем, называемых осадителями. Внутри осадителя установлена ло-
пастная мешалка. Число оборотов ее 230 в минуту. На крышке рас-
положены штуцера для подачи вытяжки, спирта, кислоты или ще-
лочи, бентонита, а также приборы контроля. В боковой части аппа-
рата предусмотрен пробоотборник, а в днище — спускной штуцер.
Осадитель должен быть снабжен рубашкой для рассольного охлаж-
дения, что позволяет охлаждать всю содержащуюся в нем массу в
процессе осаждения ферментного осадка и обеспечивает снижение
потерь ферментативной активности. Спирт, охлажденный до минус
5—8°С, подают в осадитель, затем при непрерывном перемешивании
загружают охлажденную до 5—6°С водную вытяжку. После крат-
кого перемешивания в течение 15—20 мин смесь подают на сепа-
рирование.
Емкость осадителей и их число выбирают исходя из единовре-
менной загрузки и суточной производительности, принимая во вни-
мание, что каждый аппарат в процессе отделения осадка от водно-
спиртовой смеси будет под нагрузкой определенное время. Практи-
кой установлена 'следующая примерная длительность технологиче-
ских операций (мин)\
Загрузка водной вытяжкой (200—250 л) . . . 16
Подача спирта (до 750 л)..............................30
Перемешивание спирта с вытяжкой.......................15
Выгрузка осажденной смеси (с учетом одновременного
проведения сепарирования) ........................... 60
В целях интенсификации процесса осаждения, устранения потерь
ферментов и уменьшения энергозатрат во ВНИИФСе разработан
непрерывный способ осаждения без применения осадителей. Про-
цесс осаждения ферментов проводится в центробежном поле и про-
должается 20—30 сек. Этот способ испытан и внедрен с положи-
тельными результатами на Московском опытном заводе фермент-
ных препаратов.
Разделение амилолитических и протеолитических ферментов
Разделения амилолитических и протеолитических ферментов мо-
жно в определенной мере достигнуть, применяя фракционное осаж-
дение их из водных вытяжек этиловым спиртом или путем высали-
вания сернокислым аммонием. Разделяющее действие изопропило-
вого спирта весьма невелико, и для фракционирования амилолити-
ческих и протеолитических ферментов он не подходит. При исполь-
зовании этилового спирта получаются значительно лучшие резуль-
таты, хотя полного разделения амилазного и протеазного комплек-
сов также не достигается.
245
Степень обогащения очищенных препаратов амилолитическим
или протеолитическим комплексом может быть повышена путем
повторного фракционирования их этиловым спиртом. Однако в про-
изводственных условиях его попользовать нельзя из-за сложности
и больших потерь ферментов и этилового спирта.
Во ВНИИФСе на основе исследований Л. И. Орещенко был
разработан способ разделения амилолитического и протеолитичес-
кого комплекса триба Asp. oryzae методом фракционного осажде-
ния диализованных ферментных экстрактов органическими раство-
рителями (метанолом, ацетоном, этанолом). Показано, что для раз-
деления амилолитических и протеолитических ферментов гриба
Asp. oryzae наиболее пригоден этанол.
Было установлено, что протеаза в ферментных экстрактах из
культуры гриба Asp. oryzae обладает значительно более низкой рас-
творимостью, чем амилаза, что хорошо видно из рис. 55. Показано,
Рис. 55. Фракционное осаждение амила-
зы 1 и протеазы 2 этанолом.
что амилаза обладает наименьшей растворимостью в интервале
pH 5,5—6,4, а растворимость протеазы значительно меньше зависит
от изменения pH и оптимальной величиной для ее осаждения яв-
ляется pH 8,0, что видно из данных табл. 24.
Наиболее четкое отделение амилазы от протеазы происходит
при pH 5,1, при этом для осаждения первой протеолитической фрак-
ции концентрацию этилового спирта в растворе требуется довести
до 53% об.
246
Т а бл и ц a 24
Результаты фракционного осаждения этанолом амилазы и протеазы Asp. oryzae
из водных экстрактов (в % к содержанию в исходном экстракте)
pH 1 фракция1 II фракция Общий выход
амилаза протеаза амилаза 1 протеаза ; амилаза | протеаза
Исходный экстракт 100 100 100 100 100 100
4,0 6,3 94,5 66,0 5,3 72,3 99,8
4,5 7,5 95,4 76,6 11,5 78,1 106,9
5,5 32,0 96,6 63,0 12,4 95,0 109,0
6,4 40,0 98,3 44,0 4,5 84,0 102,8
7,0 7,9 98,2 57,0 3,8 64,9 102,0
8,0 1,8 99,3 66,0 4,6 67,8 103,9
1 Первая фракция осаждалась при концентрации этанола 56% об.
Данные о влиянии температуры на растворимость амилазы и
протеазы Asp. oryzae приведены в табл. 25.
Таблица 25
Влияние температуры на осаждение амилазы и протеазы этанолом
(активность ферментов выражена в % от содержания в исходном экстракте)
Концентрация этанола, % об. Амилаза Протеаза
0°С 10°С | 20°С 0°С ю°с 20°С
Исходный экстракт 100 100 100 100 100 100
48 11,2 9,6 6,3 97,4 88,4 78,5
52 12,0 16,8 12,5 100,0 99,7 79,0
56 48,4 27,9 21,9 99,7 99,7 83,5
60 78,5 69,8 43,2 100,0 100,0 95,8
64 98,0 90,8 86,1 100,0 99,7 99,7
78 100,0 93,0 98,3 100,0 100,0 99,4
Наилучшее разделение амилазы и протеазы происходит при 0°С.
При этой температуре и концентрации этилового спирта в раство-
ре 48—52% об. протеаза осаждается почти полностью, а амилаза
только на 11 —12%.
Четкое разделение амилолитического и протеолитического ком-
плексов гриба Asp. oryzae достигается при фракционном осажде-
нии ферментов этиловым спиртом из водных вытяжек с низкой ве-
личиной ионной силы. При оптимальных условиях в первой фракции
осаждается 90% протеазы и 5% амилазы, а во второй — 93% ами-
лазы и 7% протеазы.
247
Разработан способ очистки второй амилолитической фракции
от остатков протеазы путем обработки 5% бентонита в течение 3 ч.
Очистка от протеазы наиболее полно проходит при pH раство-
ра 4,5.
Изложенные способы разделения протеазы и амилазы гриба
Asp. oryzae позволяют получать довольно активные препараты:
первая фракция имеет активность 800—1200 ед. ПС/г, а вторая
2000-3000 ед. АС/г.
Отделение ферментного осадка от водно-спиртовых растворов
Отделение ферментного осадка от спиртового раствора может
быть проведено простым отстаиванием. Действительно, жидкие си-
стемы с различной степенью дисперсности часто поддаются разде-
лению под действием одной силы тяжести. Разделение происходит
по законам гравитации, а время, затраченное на такое разделение,
зависит от относительного удельного веса компонентов, вязкости
жидкости, а также от размера и формы частиц. Разделение фер-
ментного осадка и спиртового раствора методом отстаивания потре-
бует много времени, что будет резко снижать производительность
аппаратуры. Для ускорения операции используют центрифугиро-
вание. Поскольку центробежная сила во много раз больше силы
тяжести, то разделение под действием ее происходит гораздо бы-
стрее и полнее. Например, для суперцентрифуг сила центробежно-
го осаждения в 13 000 раз больше силы тяжести.
В промышленных установках центробежное разделение приме-
няют для отделения частиц размером от 25 мм до 0,05 мкм. Во
ВНИИФСе определена дисперсность состава частиц ферментного
осадка Оризина ПК в условиях центробежного поля и установлена
величина наименьшей и наибольшей частиц этого осадка, получае-
мого при осаждении водной вытяжки двумя объемами изопропило-
вого спирта в пределах 0,098—0,426 мкм.
Для разделения ферментного осадка и водно-спиртового раство-
ра применяют отстойные центрифуги, суперцентрифуги и сепара-
торы. При выборе типа центрифуги и сепаратора для разделения
неоднородных жидкостей учитывают фактор разделения, величина
которого для центрифуги определяется по формуле
Ф = —,
ё
где со — угловая скорость вращения барабана, сек;
г — радиус барабана, м\
g — ускорение силы тяжести, равное 9,81 м/сек2.
Чем больше фактор разделения центрифуги, тем выше ее раз-
деляющая способность. Поскольку он пропорционален квадрату чи-
-jr2^2
ела оборотов (со2= -— ), то с увеличением числа оборотов фак-
тор разделения значительно возрастает. По величине фактора раз-
248
деления центрифуги делятся на две группы: нормальные, с факто-
ром разделения менее 3000 и суперцентрифуги, фактор разделения
которых более 3000.
Разделение ферментного осадка и спиртового раствора возмож-
но на центрифугах как с малым, так и с большим фактором разде-
ления.
Отстойная центрифуга периодического действия состоит из
корпуса, внутри которого на валу посажен сплошной барабан, от-
сосной трубки с механизмом для ее 'передвижения, тормоза и при-
вода. Рабочий цикл ее состоит из трех периодов: пуск и наполне-
ние суспензией; вращение барабана с постоянной скоростью и раз-
деление суспензии на осадок и фугат; торможение и разгрузка.
После того как незаполненный барабан приобретает некоторую
скорость вращения, его наполняют суспензией. По окончании отде-
ления осадка в барабан вводится отсосная трубка для удаления ос-
ветленной жидкости. Затем центрифугу останавливают и вручную
удаляют осадок, осевший на стенках барабана.
К недостаткам разделения на этом виде оборудования относит-
ся ручная выгрузка осадка и наличие потерь в процессе разделения,
величина которых достигает 5—10%. В автоматических отстойных
центрифугах поток суспензии контролируется пневматическим кла-
паном, а отсосная трубка и нож для удаления твердой фазы приво-
дятся в движение автоматически. Более полное отделение фермент-
ных осадков от спиртового раствора достигается на суперцентрифу-
гах и сепараторах.
Суперцентрифуга (рис. 56) состоит из литой станины трубчато-
го барабана-ротора, расположенного внутри нее, приводной голов-
ски, эластично соединенной с гибким валом, тормоза и трубок для
приема и отвода жидкости.
Верхний конец ротора на гибком валу подвешен к приводной
головке, а нижний находится в свободно сидящей направляющей
втулке. Вследствие упругой установки ротора центр вращения сво-
бодно следует за центром тяжести — дно ротора перемещается и
находит положение, соответствующее его центру тяжести. Такая
свобода перемещения снижает до минимума дисбаланс, уменьшает
опасность возникновения больших напряжений в подшипниках и
устраняет вибрацию, вызываемую нарушением равновесия. Внутри
ротора имеется вставка с радиальными лопастями, которые препят-
ствуют отставанию жидкости от вращающегося барабана. Нижняя
крышка имеет центральное отверстие для приема разделяемой
жидкости. В верхней части расположены отверстия для отвода ос-
ветленной жидкости. Трубчатые суперцентрифуги работают с чис-
лом оборотов от 8000 до 45000 в минуту.
Жидкая масса, подлежащая разделению, поступает по трубе в
нижнюю часть барабана и по мере продвижения вдоль него разде-
ляется на слои соответственно удельному весу ее составных частей;
при этом из жидкости выделяются твердые частицы, находящиеся
во взвешенном состоянии.
249
Особенностью данной суперцентрифуги является движение жид-
кости через трубчатый ротор параллельно оси вращения. Одинако-
вое расстояние жидкости от стенок вала обеспечивает постоянную
величину центробежной силы в течение всего периода пребывания
Рис. 56. Суперцентрифуга:
/ — приводной шкив; 2 — приводная головка; 3 — крышки; 4 —
штуцер для входа осветленной жидкости; 5 — трехлопастная
мешалка; 6 — тормоз; 7 — штуцер для подачи жидкости; 8 — ста-
нина; 9 — ротор; J0 — прижимной ролик.
жидкости в роторе. Благодаря отсутствию резких изменений напра-
вления движения жидкости и турбулентных завихрений устраняет-
ся возможность попадания частиц обратно в суспензию. По оконча-
нии центрифугирования суперцентрифугу останавливают, вынима-
ют ротор и извлекают осадок. На время выгрузки осадка устанав-
ливается запасной ротор и цикл повторяется. Производительность
250
суперцентрифуги СГО по смеси спирт — экстракт 1000 л/ч. В ро-
торе суперцентрифуги можно получить 12 кг аморфного осадка
Оризина ПК.
Суперцентрифуги компактны, удобны в эксплуатации и имеют
большое число оборотов при малом диаметре ротора. Увеличение
числа оборотов ротора с одновременным уменьшением во столько
о t.d
же раз его диаметра-не изменяет окружной скорости <о= — и на-
пряжения в стенках, тогда как центробежная сила значительно воз-
растает C = KDn2 (здесь К—коэффициент пропорциональности).
При работе суперцентрифуг ускорение центробежных сил превос-
ходит ускорение силы тяжести в 12 000—51 000 раз.
Центрифуги изготовляются серийно сумским заводом им. Фрунзе.
Недостатки суперцентрифуг: периодичность работы, необходи-
мость частой разборки, ручная выгрузка осадка и промывка рото-
ра, наличие ременной передачи и возможность возникновения искр,
что опасно при работе с органическими растворителями.
Сепараторы-осветлители. Отделение ферментного осадка от
смеси проводится также на осветлительных сепараторах.
В отличие от суперцентрифуг, в сепараторах процесс естествен-
ного отстаивания жидкой смеси интенсифицируется в миллионы
раз за счет центростремительного ускорения и уменьшения рабо-
чей высоты отстойника до величины межтарелочного зазора.
Фактор разделения сепаратора определяется его конструктив-
ными показателями и вычисляется по формуле
Ф = Z W2 tga (/?Макс — Ямин),
где z — число тарелок;
со — угловая скорость вращения барабана, 1/сек;
а — угол наклона образующей тарелки к горизонту, °;
Я макс и Ямин —соответственно максимальный и минимальный
расчетные радиусы тарелки, см.
Сепараторы-осветлители тарельчатого типа предназначены для
выделения из жидкости твердых взвесей. Для выделения фермент-
ного осадка из водной вытяжки применяют сепараторы периодичес-
кого действия АСГ-ЗМ и СПВ-12.
По принципу действия и конструкции сепараторы АСГ-ЗМ и
СПВ-12 близки и отличаются лишь способом удаления фугата:
если из первого он удаляется самотеком, то из второго — с по-
мощью напорного диска и под давлением до 3 ат (294,3 кн!м2).
Сепаратор АСГ-ЗМ характеризуется небольшим объемом
шламового пространства барабана (0,6—0,9 л), поэтому его при-
ходится часто останавливать для выгрузки ферментного осадка
и можно использовать только на заводах небольшой мощности.
Сепаратор СПВ-12 состоит из станины с приводным меха-
низмом, барабана и приемно-отводящего устройства. После запус-
ка сепаратора и достижения им 7450 оборотов в минуту (по тахо-
метру) вытяжка из осадителя подается через чашу и питающую
251
трубку в тарелкодержатель вращающегося барабана. Одна часть
ее вводится в шламовую полость через сквозные радиальные ка-
налы тарелкодержателя, а другая подводится к межтарелочным
зазорам через отверстия тарелкодержателя и вертикальные каналы,
образованные отверстиями конических тарелок. Вследствие такого
подвода жидкости происходит гидравлическое торможение турбу-
лентности потока, что способствует полному осаждению тонкодис-
нерсных взвешенных частиц ферментного осадка.
Под действием центробежной силы в шламовом пространстве
барабана оседают грубодисперсные частицы. Неполностью очищен-
ный поток жидкости протекает через пакет конических тарелок,
где происходит сепарация в тонком слое и выделение тонкодис-
персных частиц, которые поступают в шламовое пространство
барабана. Осветленная жидкость через наружные каналы тарелко-
держателя и камеру напорного диска под давлением до 3 ат
(295 кн!м2) выводится по закрытой коммуникации в приемный бак
и направляется на регенерацию.
После сепарирования 400—500 л спирто-водной смеси, содержа-
щей фермент, в шламовом пространстве барабана накапливается
до 5 кг ферментного осадка влажностью 45—50%. Сепаратор вы-
ключают, разбирают и вручную извлекают осадок- При большой
окружной скорости вращения барабана и трении его о воздух теп-
ло через стенку барабана передается жидкости и ферментный оса-
док в процессе сепарирования нагревается до 35—40° С, что приво-
дит к частичной инактивации препарата. Для снижения температу-
ры осадка на вращающийся барабан подается вода.
Техническая характеристика сепараторов
АСГ-ЗМ СПВ-12
Производительность по смеси спирт — экстракт, л!ч 200—300 800—900
Число оборотов барабана в ми- нуту 9000 или 11000 7450
Наружный диаметр барабана, мм 222 400
Число тарелок . . . . Рабочий диаметр тарелки, мм 57—62 135
максимальный 153 220
минимальный . . . . 66 92
Угол наклона образующей та- ре аки, ° 48 48
Величина межтарелочного за- зора, мм 0,3 0,4
Емкость шламовой полости, л Мощность электродвигателя, кет Габариты, мм . Масса, кг . 0,6—0,9 1,0 980 X 425 X 665 116 5 4,5 945x600x1340 938
252
Цикл работы сепаратора состоит из нескольких операций,
ориентировочная продолжительность которых (в минутах) для
спиртовой суспензии Asp. oryzae приводится ниже.
Разгон барабана .............. 10
Сепарирование ................ 45
Остановка без торможения . . 20
Разборка.......................15
Разгрузка и промывка . . .25
Сборка.........................20
Как видно из этих данных, сепаратор СПВ-12 малопроизводи-
телен, так как при сравнительно небольшом объеме шламового
пространства большая часть времени тратится на трудоемкие опе-
рации выгрузки, сборки и т. д. Кроме того, ферментный осадок в
нем нагревается, что недопустимо по технологическим соображе-
ниям.
Для отделения ферментного осадка от водно-спиртовой смеси
использовался также сепаратор ВСС-01, описание которого приве-
дено на стр. 226. Трудность его эксплуатации на этой операции за-
ключалась в отсутствии необходимой герметичности между бара-
баном и плавающим конусом, вследствие чего вода попадала в
шламовое пространство, заполненное отсепарированным осадком,
и растворяла его. Полученный при разгрузке сепаратора водный
раствор фермента необходимо было обрабатывать вновь спиртом
для осаждения ферментов.
В последнее время взамен сепаратора ВСС-01 Плавский завод
выпускает сепараторы ВСС-2 и АСЭ-3 с автоматической выгрузкой
осадка с помощью поршня. Сепаратор снабжается электродвига-
телем во взрывобезопасном исполнении мощностью 14 кет. Произ-
водительность сепаратора 1000—1540 л/ч, объем шламового прост-
ранства 15 л.
Для отделения ферментного осадка от спирто-водной смеси ре-
комендуются также сепараторы АИС плавского завода «Смычка»
и ОТЗМВ-600-НЖ уральского завода «Химмаш» с поддувом инерт-
ного газа, допускаемые для применения во взрывоопасных поме-
щениях класса В1А.
Обработка ферментного осадка спиртом
Ферментный осадок, извлеченный из сепаратора или центрифу-
ги, необходимо обработать спиртом для ускорения последующего
процесса сушки и удаления оставшихся загрязнений. Механизиро-
ванную обработку ферментного осадка спиртом рекомендуется вес-
ти в закрытых аппаратах — механических смесителях СМ, емкость
которых должна быть выбрана в зависимости от производительнос-
ти.
Для охлаждения спирта и ферментного осадка в рубашку аппа-
рата следует подавать охлажденную воду или рассол. Между зето-
253
образными лопастями, расположенными в корпусе» устанавливает-
ся вертикальная перегородка в виде ножа. При вращении лопас-
тей в противоположные стороны ферментный осадок измельчается,
активная поверхность его увеличивается и процессы массообмена
ускоряются. Обработку спиртом проводят 2—3 раза по 10 мин.
Отработавший спирт сливается через фильтрующие сетки, установ-
ленные в днище корытообразной части аппарата, либо при его
опрокидывании. Такой способ обработки ферментного осадка меха-
низирует эту трудоемкую операцию, облегчает условия труда и
ускоряет последующий процесс сушки. Промытый спиртом осадок
сушат. Для ускорения процесса сушки ферментный осадок необ-
ходимо предварительно обезводить на фильтрующей центрифуге
из нержавеющей стали типа ВВ-400-4Н. Центрифуга ВВ-400/300-4Н
герметичная, с поддувом инертного газа и автоматическим тормо-
зом. Исполнение центрифуг ВВ-400/300-4Н допускает работу во
взрывоопасных помещениях класса В1А.
Техническая характеристика центрифуг ВВ-300/400-4Н
ВВ-300-4Н ВВ-400-4Н
Диаметр ротора, мм . 300 400
Рабочая высота ротора, мм 150 200
Емкость ротора, л 5 10
Загрузка ротора максимальная, кг . 10 20
Число оборотов ротора в минуту
I ступень 1500 1500
11 ступень 2440 2440
III ступень 3460 3460
IV ступень 4250 —
Фактор разделения:
I ступень 375 500
II ступень 1000 1300
III ступень 2000 2600
IV ступень 3000
Мощность двигателя, кет 3 3
Габариты, мм:
длина 1060 1060
ширина 700 700
высота 750 750
Масса центрифуги, кг ... 354 383
Центрифуги ВВ-300/400-4Н изготавливаются серийно иркутским заводом
«Химмаш».
254
Сушка ферментных растворов и осадков
К современным методам сушки относятся различные варианты
кондуктивной, конвективной и комбинированной сушки, сушка
сублимацией, инфракрасными лучами, в электрическом поле высо-
кой частоты и т. д.
В соответствии с энергетическими показателями различают два
основных принципа обезвоживания: 1)удаление влаги из материа-
лов в виде жидкости без изменения ее агрегатного состояния и
2) удаление влаги с изменением ее агрегатного состояния, т. е.
при превращении жидкости в пар. Первый принцип может быть
осуществлен механическим способом (прессованием, центрифугиро-
ванием, фильтрацией) или путем непосредственного контакта влаж-
ного материала с веществами, имеющими более низкий потенциал
переноса.
Второй принцип связан с затратой тепла на фазовое превра-
щение воды. В большинстве случаев эта теплота сообщается ма-
териалу извне известными способами: кондукцией, конвекцией ра-
диацией при нагреве материала от поверхности внутрь или за счет
энергии электрического поля высокой частоты при прогреве матери-
ала в массе. Такая сушка называется тепловой. Для твердых ма-
териалов она обычно осуществляется путем испарения влаги с вне-
шней поверхности или чаще всего с перемещением поверхности ис-
парения внутрь высушиваемого материала; для капиллярно-порис-
тых тел поверхность испарения превращается в зону испарения.
При сушке в поле высокой частоты происходит выпаривание
воды во всей массе материала.
Сушка твердых тел при большом вакууме проводится без под-
вода тепла извне; теплота, необходимая для испарения влаги, от-
нимается от высушиваемого материала, температура которого при
этом снижается — материал и оставшаяся в нем влага самозамо-
раживаются. В дальнейшем, при подводе тепла извне, происходит
испарение льда — его возгонка (сублимация).
Диффузионную вытяжку целесообразно сушить методом распы-
ления. Сушка экстрактов из поверхностных культур плесневых
грибов распылением позволяет получать препараты ферментов в
виде порошков без применения органических растворителей и ней-
тральных солей. Процесс сушки диализованных диффузионных вы-
тяжек проходит нормально и в результате получается порошок
фермента светло-желтого цвета. При температуре сушильного
агента (воздуха) на входе 135° С и на выходе 65° С потери фер-
ментативной активности составляют не более 10%. Недиализован-
пая вытяжка слипается в процессе сушки вследствие карамелиза-
ции содержащихся в ней сахаров и при этом происходит почти
полная инактивация ферментов.
Исследования, проведенные во ВНИИФСе, показали возмож-
ность получения ферментных препаратов в виде порошков непо-
средственным высушиванием недиализованных вытяжек из поверх-
255
ностных культур плесневых грибов на распылительной сушилке.
Для устранения слипания в вытяжку необходимо вводить наполни-
тель. При выборе наполнителя в первую очередь необходимо учи-
тывать его способность играть роль стабилизатора ферментов.
Одним из наиболее приемлемых материалов может служить
поваренная соль, которая является активатором амилолитических
ферментов, так как ионы хлора активируют некоторые фермента-
тивные процессы, особенно при щелочных значениях pH. Установ-
лено, что при содержании сахара в вытяжке не более 17,5 мг/мл
и концентрации сухих веществ не менее 6% минимальное коли-
чество NaCl, обеспечивающее нормальный ход сушки, должно быть
не менее 130% к сухим веществам вытяжки.
Большое значение для сохранения активности высушенного
ферментного препарата имеет температура сушильного агента, что
наглядно иллюстрируется данными табл. 26.
Таблица 26
Влияние температуры Па ферментативную активность при сушке вытяжки
из культуры гриба Asp. oryzae с наполнителем (130% NaCl к сухим веществам
вытяжки)
Температура воздуха, °C Водная вытяжка Порошок
сухие ве- щества, % 3 as ЛС, ед/г 6 С 1 влаж- ность, % i АС, ед/г ПС, ед/г активность, % к игх’лпилй nkiTawiro
на входе в сушилку на вы- ходе из сушил- ки АС ПС
120 70 6 17,5 71,3 69 5,65 6,35 66,2 8,5 96
95 65 6 17,5 71,3 69 6,68 14,2 51,1 19,9 74
90 60 6 17,5 71,3 69 7,85 15,5 75 21,7 108
90 47 9,2 11,0 35,5 31,5 8,25 34,1 25,8 96 82
Опытным путем установлены оптимальные температурные ре-
жимы сушки вытяжек из культур плесневых грибов, позволяющие
максимально сохранить ферментативную активность. Так, для Asp.
oryzae температура воздуха на входе в сушилку должна быть90°С,
а на выходе 47СС; для Asp. niger соответственно 150 и 80°С.
Для предотвращения слипания продукта в процессе сушки в вы-
тяжку из Asp. niger необходимо вводить в качестве наполнителя
лактозу в количестве 50% к сухим веществам вытяжки. Потери
при таком режиме не превышают 5—7%. Вытяжки из поверхност-
ных культур грибов Asp. awamori и Asp. terricola следует сушить
с введением в них в качестве наполнителя поваренной соли.
Ферментные осадки, полученные путем обработки водных вы-
тяжек органическими растворителями, необходимо сушить в мяг-
256
ких температурных условиях (при температуре не выше 35° С).
Желательно, чтобы продолжительность процесса была минималь-
ной, так как это исключит заметную инактивацию ферментов.
Следует отметить, что на поверхности ферментных осадков,
главным образом полученных осаждением изопропиловым спир-
том, при высушивании образуется плотная, трудно проницаемая
для паров воды и спирта пленка, в связи с чем толщина высуши-
ваемого слоя не должна превышать 2—3 мм.
Ферментные осадки, полученные при осаждении этиловым спир-
том, имеют значительно более рыхлую структуру и сушатся гораз-
до легче- Толщина слоя их может быть доведена до 15 мм. По
данным Калунянца и Гернет, оптимальным для сушки осадка, по-
лученного после обработки вытяжки из гриба Asp. niger П (пекто-
литического) этиловым спиртом, является следующий режим ра-
боты вакуумной полочной сушилки: остаточное давление в сушил-
ке 1,16 кн)м2, температура теплового агента 35° С, толщина слоя
осадка на полках 15 мм.
Осадки с небольшой степенью очистки можно сушить в аппара-
тах шкафного типа при обычном атмосферном давлении в токе теп-
лого (не выше 35° С) сухого воздуха. Прочное сцепление высушен-
ного продукта с материалом противней, на которых проводится
высушивание, затрудняет съем его. Во избежание этого необходим
подбор соответствующих материалов для изготовления противней
или смазка их веществами, понижающими силы адгезии между
материалом противня и высушенным осадком.
Очищенные ферментные осадки целесообразно сушить в субли-
мационных или в вакуум-сушильных аппаратах при остаточном
давлении 38 h/jw2, используя в качестве теплового агента вакуум-
ный пар.
На заводах влажные осадки сушат в вакуум-шкафных сушил-
ках. Сушка под вакуумом снижает температуру процесса, умень-
шает потери ферментативной активности и позволяет улавливать
пары спирта, выделяющиеся из осадка. При сушке препарата в
вакуум-сушильном шкафу окружающая среда представляет собой
спирто-водяной пар с небольшой примесью воздуха, проникшего
в сушилку через неплотности.
В условиях вакуума процесс протекает более интенсивно, чем
при атмосферном давлении, так как влагосодержание воздуха
при одной и той же относительной влажности его возрастает с
понижением давления.
Интенсивное удаление влаги происходит в первый период (пе-
риод постоянной скорости сушки). Во второй период (период пада-
ющей скорости) температура осадка повышается, приближаясь к
температуре плиты, интенсивность теплопередачи резко падает,
и, если в плиты подавать теплоноситель с высокой температурой,
температура осадка может достигнуть недопустимой величины. Для
устранения перегрева целесообразно подавать внутрь плит вакуум-
ный пар. Увеличение скорости сушки может быть достигнуто пу-
17—826
257
тем обеспечения более глубокого вакуума в системе, так как в этом
случае увеличивается перепад температур между теплоносителем
и осадком.
Вакуум-сушильная шкафная установка состоит из сушильного
шкафа, теплообменника, приемника и вакуум-насоса. Производи-
тельность вакуум-насоса выбирается исходя из допустимой величи-
ны проникновения атмосферного воздуха в сушилку и возможного
газовыделения. При выборе насоса в зависимости от поверхности
нагрева сушилки рекомендуется принимать его производительность
0,9—1,1 м3/ч по давлению всасывания на 1 м2 поверхности нагрева-
Ферментный осадок, обработанный этиловым спиртом, раскла-
дывают тонким слоем (10—15 мм) на противни, которые устанав-
ливают на плиты вакуум-шкафной сушилки. После этого крышку
закрывают, создают в аппарате разрежение, в плиты подают ваку-
умный пар и сушат препарат до конечной влажности 10—12%.
Вакуум-сушильный шкаф. Аппарат типа ЦВШ 7X2,5 (рис.57)
имеет горизонтальный цилиндрический корпус со съемной крыш-
Рис. 57. Вакуум-сушилка ЦВШ 7X2,5:
/ — корпус; 2 —плита; 3 — дверца шкафа; 4 — вход пара; 5 — выход конденсата;
6 — смотровое окно; 7 — штуцер для вакуум-линии.
кой, установленной на поворотном кронштейне. Внутри него рас-
положены полые обогревательные плиты; к одной стороне их под-
водится от коллектора вакуумный пар, а с другой — отводится
конденсат. Сушилки типа ЦВШ выпускаются трех типоразмеров
7X2,5; 9X10; 14X33. Первая цифра указывает число плит, вто-
258
рая — поверхность нагрева. Единовременная загрузка шкафа су-
шилки ЦВШ 7X2,5 составляет 8—10 кг сырого осадка. Для нор-
мальной работы вакуум-сушильного шкафа необходимо, чтобы
теплообменники, приемник и ловушка охлаждались рассолом, а
плиты шкафа обогревались вакуумным паром.
Техническая характеристика вакуум-сушильных шкафов
ЦВШ 7X25 ЦВШ 9X10,6 ЦВШ 1 4X33
Поверхность нагрева, л2 2,24 10,6 33
Число обогревательных плит 7 9 14
Рабочее давление в плитах, кг!см2 . 4 4 2
Размеры плит, мм 730x610 1300x1100 1860x1570
Габариты, мм
длина 1240 2075 2834
ширина 1280 1650 2590
высота 2040 2070 2819
Масса, кг 881 2360 5467
Сушилки снабжены устройствами для автоматического регули-
рования температуры.
Процесс сушки в неподвижном слое длителен, ручная загрузка
и выгрузка ферментного препарата непроизводительны.
С целью выбора рационального сушильного оборудования во
ВНИИФСе проведены испытания вакуум-сушилок типа «Венулет»,
вакуум-вальцовых, сублимационных и других.
Гребковая вакуум-сушилка состоит из горизонтального бараба-
на с паровой рубашкой, имеющего две крышки и люки для за-
грузки и выгрузки. Внутри барабана расположен горизонтальный
вал с насаженными гребками, вращающимися с небольшой ско-
ростью (4—6 об!мин). Одна половина их имеет правое вращение,
другая — левое, вследствие чего материал перемещается от сере-
дины к крышкам и обратно. Привод снабжен автоматическим пере-
ключателем, и через каждые 5—10 мин направление движения ма-
териала меняется.
Гребковые сушилки изготавливаются трех типоразмеров.
Типоразмер D, мм Н, мм Полная емкость, л
СВРЦ 800X2500 .... . . 800 2500 1320
СВРЦ 1000X3200 . . . . . 1000 3200 2600
СВРЦ 1250X4000 . . . . 1250 4000 5040
Процесс сушки в них протекает с перемешиванием материала и
поэтому идет с большой скоростью.
Недостатки гребковых сушилок: налипание ферментного осад-
ка на гребки, громоздкость, сложность эксплуатации, периодич-
ность работы-
259
Ферментные препараты, осажденные изопропиловым спиртом,
можно сушить на вакуум-вальцовой сушилке.
Вакуум-вальцовая сушилка (рис. 58) состоит из сушильной ка-
меры, в которой расположены два вращающихся в противополож-
ные стороны валка, пылеуловителя, теплообменника, приемника,
вакуум-насоса, ловушки, суховоздушного и мокровоздушного ваку-
ум-насосов. Сушильная камера представляет собой цилиндр, снаб-
женный боковой дверцей, смотровыми окнами над валками и не-
обходимыми штуцерами. Над камерой расположена воронка для
приема продукта, подлежащего сушке.
Рис. 58. Вакуум-вальцовая сушилка:
/ — сушилка с двумя валками; 2 — теплообменник; 3 — приемник; 4— привод валков;
5 — приборы контроля; 6 — мокровоздушный вакуум-насос; 7—ловушка; 8 — суховоз-
душный вакуум-насос
После включения мокровоздушного вакуум-насоса и создания
вакуума в обогреваемом пространстве начинается нагревание су-
шилки; включаются суховоздушные вакуум-насосы; в теплообмен-
ник подается вода, и в системе создается вакуум. Промытый спир-
том осадок в виде кашицеобразной подвижной массы подается не-
большими количествами на валки так, чтобы он не проскакивал
между ними. За время оборота валка продукт высыхает, снимается
ножом и попадает в приемные емкости, расположенные под валка-
ми. По окончании процесса давление выравнивают, открывают
дверцу сушильной камеры и извлекают высушенный препарат.
Для сушки ферментных препаратов представляют интерес су-
шильная установка с наклонным барабаном, вращающимся вокруг
вертикальной оси. Она состоит из барабана с паровой рубашкой,
ось которого наклонена на 25° по отношению к горизонтальной
оси вращения, пылеуловителя, конденсатора, приемника и вакуум-
насоса. Для загрузки и выгрузки из барабана предусмотрен один
штуцер. Процесс в такой сушилке ускоряется за счет непрерывно-
го изменения положения материала при вращении барабана. Су-
260
шилка с наклонным барабаном работает при остаточном давлении
до 133 н/м2.
Характерные недостатки вакуумных сушилок — длительный
срок сушки (до 30 ч) и относительно большие (до 20%) потери
ферментативной активности. Этих недостатков лишены дисковые
распылительные и сублимационные сушилки.
Сублимационная сушилка. Процесс сушки сублимацией слагает-
ся из трех периодов: самозамораживания, сублимации и удаления
остаточной влаги. В первый период удаляется 10—20% всей содер-
жащейся в материале влаги. Во второй период лед, образовавший-
ся при самозамораживании, превращается в пар, минуя жидкое
состояние. Температура медленно повышается и к концу периода
близка к 0°С. В период сублимации удаляется 55—60% влаги. В
третий период препарат нагревают до 30°С и удаляют из него оста-
точную влагу с таким расчетом, чтобы в готовом препарате ее со-
держалось не более 10%.
Для нагрева препарата можно использовать различные спосо-
бы: радиационно-контактный, радиационный, высокочастотный и
комбинированный. При радиационно-контактном способе нагрева
препарат помещают на алюминиевых противнях в сублиматор на
пустотелые полки, в которых циркулирует горячая вода. Ввиду
сравнительно низкой температуры полок продолжительность цикла
сушки при толщине слоя 12 мм составляет 15 ч.
При радиационном способе нагрева алюминиевые предваритель-
но зачерненные противни накрывают алюминиевыми зачерненными
листами. Расстояние между греющими элементами и противнем
составляет 6,5—12 мм\ при этом нагрев происходит более интен-
сивно.
В литературе имеются данные о применении высокочастотного
нагрева при сублимационной сушке и комбинированного способа,
при котором вначале используют лучистый нагрев, а затем высоко-
частотный. А. К. Каминарская, С. А. Лившиц и Ю. А. Оленев для
ускорения процесса сушки использовали пластины со стержнями
диаметром 3 мм и шагом 10 мм, изготовленные из латуни. Их по-
мещали в противни и укладывали на них продукт, аналогичный
ферментному осадку, с исходной влажностью 65% слоем 22 мм.
Самозамораживание в сублиматоре длилось 30 мин, период субли-
мации— 4,5 ч и удаление остаточной влаги 3 ч. Процесс проводил-
ся при температурах в сублиматоре минус 19—17° С и остаточном
давлении соответственно НО—133 н!м2- Скорость сушки в период
самозамораживания и сублимации составляла 1,73 кг испаренной
влаги с 1 м2 загрузочной площади сублиматора в час; конечная
влажность продукта через 8 ч составляла 1,4%.
Схема установки для сушки сублимацией аналогична схеме
обычной вакуум-сушилки и отличается от нее лишь тем, что кон-
денсаторы сублимационных сушилок охлаждают рассолом с темпе-
ратурой от минус 10 до минус 40°С. Сублиматор является су-
шильной камерой периодического действия и представляет собой
261
горизонтально расположенный цилиндрический корпус, в котором
размещена этажерка с полыми полками. Внутри полок циркулиру-
ет горячая вода. На полки устанавливаются противни с высуши-
ваемым материалом.
Вакуум, необходимый для сушки сублимацией, должен быть
глубоким. Например, для сушки материалов при минус 50° С
остаточное давление должно составлять 4 н/м2, что соответствует
давлению водяного пара, находящегося в равновесии со льдом.
Для непрерывного удаления из конденсатора образующегося в нем
льда устанавливают два попеременно работающих конденсатора.
Чтобы получать низкие температуры, устанавливают компрессор-
ную или трехступенчатую пароэжекторную холодильную установ-
ку-
Сублимационный способ сушки периодического действия обес-
печивает полное сохранение активности ферментных препаратов,
однако он относительно сложен и дорог.
Во ВНИИФСе успешно проведены испытания по сушке фер-
ментного осадка на дисковой распылительной сушилке. Для суш-
ки ферментного осадка на распылительной сушилке его необходи-
мо предварительно растворить в воде, доведя концентрацию сухих
веществ в растворе до 30%. Оптимальные параметры процесса:
температура воздуха на входе 100—130° С на выходе 45° С и при
этом активность ферментов снижается по амилазе на 6,5% и по
протеазе на 3,4% от исходной.
Коростеньский завод Химмаш изготавливает серийно распы-
лительные сушилки производительностью 10—15 кг испаренной
влаги в час.
Измельчение ферментных препаратов
Высушенные ферментные препараты подвергают тонкому из-
мельчению, чтобы придать им товарный вид и облегчить как раст-
ворение их в воде при употреблении, так и проведение стандарти-
зации различными тонкоизмельченными наполнителями.
К проведению этого процесса и его конечным результатам предъ-
являются следующие основные требования.
1. Величина частиц ферментного осадка и наполнителя не дол-
жна превышать 100 мкм.
2- Измельчение следует вести сухим способом, чтобы фермент-
ный осадок и наполнитель сохраняли первоначальную влажность,
так как повышение влажности может привести к увеличению потерь
ферментативной активности препарата при последующем хранении.
3. С целью создания благоприятных санитарно-гигиенических
условий труда измельчение наполнителя и особенно ферментного
осадка должно проводиться в герметически закрытых аппаратах,
исключающих возможность распространения ферментной пыли.
В лабораторных и производственных условиях сотрудниками
Ё?ЙИИФСа были испытаны аппараты, предназначенные для из-
мельчения различных продуктов, и в частности — кофейные
262
мельницы отечественного производства и венгерские, перцемолки,
молотковые дробилки, изготовляемые заводом им. Ярославского,
шаровые мельницы с фарфоровыми и пластмассовыми шарами, а
также дисмембратор.
Кофейные мельницы оказались непригодными для измельчения
ферментного осадка, так как при работе они сильно разогреваются,
в результате чего ферменты инактивируются на 25—30%. Этот же
недостаток отмечен и при испытании перцемолок и молотковых
дробилок.
Шаровая мельница представляет собой цилиндрический фарфо-
ровый барабан, торцевые стороны которого зажаты кольцами со
втулками. Во втулках укреплены оси, вращающиеся в подшипнико-
вых опорах. Барабан мельницы вращается вокруг горизонтальной
оси, опирающейся на цапфу. Продукт измельчается фарфоровыми
шарами. Наибольшее заполнение барабана шарами не должно пре-
вышать 30—35% его объема. После загрузки шаров через загру-
зочный люк с помощью кассеты загружают препарат, подлежащий
измельчению, примерно на половину емкости барабана, за-
тем закрывают люк и приводят барабан во вращение.
Оптимальным условием получения необходимой степени измель-
чения материала является выбор рационального числа оборотов
барабана в минуту, равного 42,3:}^ Д где D — внутренний диаметр
барабана. При вращении с большими скоростями шары будут при-
жаты центробежной силой к стенкам барабана и не будут измель-
чать материал.
Размер и вес шаров существенно влияют на производительность
мельницы и степень измельчения- ^Максимально допустимые разме-
ры шара лежат в пределах от D : 18 до D : 24 см. Оптимальное со-
отношение между длиной барабана и его диаметром L .D еще не
установлено и принимается в размере 1,564-1,64.
Производительность мельницы зависит от числа оборотов, не-
обходимой степени измельчения, влажности и характера фермент-
ного препарата и многих других факторов и поэтому определяется
экспериментально. Практика показала, что производительность
мельницы емкостью 50 л составляет 15 кг порошка за 8 ч работы.
К- п. д. шаровых мельниц не более 15% и расход энергии при ра-
боте вхолостую почти равен расходу при работе с полной загруз-
кой.
Шаровые мельницы следует устанавливать в обособленном
помещении с приточно-вытяжной вентиляцией и аспирацией загруз-
ки и выгрузки препарата. Обслуживающий персонал должен иметь
индивидуальные средства защиты, санитарную одежду.
Исследованиями показана принципиальная возможность исполь-
зования шаровых мельниц для измельчения ферментного осадка,
однако качество получаемого порошка зависит от материала, из
которого изготавливаются шары. Так, шары из пластмассы недоста-
точно прочны и для ферментного производства непригодны, потому
что в порошок попадают кусочки пластмассы. Мельницы с фар-
263
форовыми шарами дают ферментный порошок высокого качества
с частицами не больше 100 мкм, но они малопроизводительны и
процессы выгрузки готового продукта трудно герметизировать.
Рис. 59. Дисмембратор:
/ — загрузочная воронка; 2 — корпус; 3 —
штифтовый диск вращающийся; 4 — клино-
ременная передача; 5 — разгрузочный шту-
цер; 6 — приемный бункер-мешок; 7 —
крышка с неподвижным диском; 8 — течка
для исходного продукта; 9 — устройство
для регулирования величины гранул; 10 —
смотровое окно.
Для целей ферментного про-
изводства наиболее подходит дис-
мембратор, испытанный при из-
мельчении ферментного осадка,
полученного осаждением этано-
лом из водной вытяжки. Оказа-
лось, что активность амилолити-
ческих и протеолитических фер-
ментов гриба Asp. oryzae в про-
цессе измельчения осадка до час-
тиц размером 100, 50 мкм
(и менее) не изменяется.
Дисмембратор относится к
мельницам ударно-центробежного
типа, в которых измельчение про-
исходит за счет ударов и раска-
лывания. Ферментный препарат
измельчается в нем при помощи
круглых пальцев, насаженных на
быстровращающийся диск.
Измельчающая машина
(рис. 59) состоит из двух дисков,
один из которых закреплен на
валу, а другой неподвижен. На
дисках по концентрическим
окружностям расположены круг-
лые пальцы. Каждый ряд паль-
цев одного диска входит между
пальцами другого с небольшим
зазором. Число пальцев в концен-
трических окружностях увеличивается по направлению от центра
к периферии.
Ферментный препарат подается к оси дисков и отбрасывается
центробежной силой к периферии, измельчаясь пальцами. Измель-
ченный препарат, величина частиц которого меньше ячеек сита,
установленного по периметру дисков, проходит через сито в закры-
тый приемник. Число оборотов подвижного диска 7000—14000 в ми-
нуту. Для улавливания уносимых воздухом частиц устанавливают-
ся мешочные фильтры.
Достоинство этого аппарата состоит в том, что процесс измель-
чения на нем можно герметизировать. Если к тому же учесть, что
производительность его в несколько раз больше производительнос-
ти шаровых мельниц и процесс протекает непрерывно, то дисмем-
братор можно рекомендовать для измельчения сухих ферментных
порошков.
264
Стабилизация и стандартизация ферментных препаратов
Стабилизация. Жидкие ферментные растворы в нормальных ус-
ловиях хранения довольно неустойчивы и быстро теряют актив-
ность. Кроме того, как и всякие белковые растворы, они представ-
ляют собой хорошую питательную среду для микроорганизмов и
подвержены инфицированию.
Стабилизация ферментных препаратов преследует цель примене-
нием различных операций стабилизировать фермент и тем самым
увеличить срок хранения препарата без потерь ферментативной ак-
тивности.
Стабилизация ферментов может быть достигнута следующими
путями: концентрированием ферментных растворов с целью полу-
чения сиропов с определенным содержанием сухих веществ; высу-
шиванием ферментных растворов или ферментных осадков с целью
получения порошков; внесением в ферментные растворы специаль-
ных веществ — стабилизаторов; снижением температуры хране-
ния.
Эти приемы в конечном итоге имеют цель уменьшить диссоци-
ирующую способность функциональных групп белка и тем самым
увеличить стабильность ферментов в препарате.
Потери ферментативной активности при хранении препаратов
могут быть объяснены следующими причинами: 1) инактивацией
ферментов в растворах в результате разрыва нескольких основных
связей, разрушающих общую структуру молекул, в том числе и ту,
которая проявляет активность; дезориентации активных центров
молекул; блокирования активных центров вследствие образования
ассоциаций молекул белка посредством лабильных связей; конку-
рентного торможения активности фермента или полной его инак-
тивации при сохранении структуры, вследствие блокирования ак-
тивных центров; 2) инактивацией ферментов вследствие загрязне-
ния их растворов микроорганизмами.
Предохранить ферменты от инактивации, т- е. стабилизировать
их, можно путем внесения в ферментные растворы некоторых ве-
ществ, блокирующих их функциональные группы.
Высушенные культуры плесневых грибов, выращенных по-
верхностным способом, можно хранить в обычных складских поме-
щениях при нормальных температуре и влажности воздуха. Много-
летний опыт заводов показал, что при хранении культуры гриба
Asp. oryzae (влажность 12—14%) при температуре 18—20° С и от-
носительной влажности воздуха 65—75% в течение 10 месяцев
осахаривающая способность (ОС) снизилась на 15%, амилолити-
ческая (АС) на 16% и декстринолитическая (ДС) на 11%.
Ввиду того что в специальной литературе мало данных о влия-
нии различных факторов на сохранение ферментативной активнос-
ти различных препаратов при хранении, во ВНИИФСе исследова-
но влияние следующих факторов: степени влажности; количества
и вида наполнителя, содержащегося в препарате; вида тары, в ко-
265
торой хранятся ферментные препараты, длительности и темпера-
турных условий хранения. Было показано, что сохранение амилоли-
тической активности находится в обратной зависимости от степени
влажности препаратов.
Такие наполнители, как NaCl, КС1, лактоза, крахмал и тальк,
вполне приемлемы для стабилизации ферментных препаратов, не
изменяют их амилолитической, протеолитической и декстриноли-
тической активности на протяжении года при хранении в герме-
тичной таре. Для хранения препаратов при нормальных темпера-
турных условиях вполне пригодны стеклянные и полиэтиленовые
бутылки, а также полиэтиленовые и хлорвиниловые мешки. В та-
кой упаковке ферментные препараты сохраняют начальную актив-
ность на протяжении 17—34 месяцев.
Изучение условий хранения в УкрНИИППе показало, что
стойкость технических препаратов (высушенных культур плесне-
вых грибов) обеспечивается только в том случае, если их влаж-
ность не превышает 12% и они хранятся в складских помещениях
с относительной влажностью воздуха не более 75%.
Стойкость ферментов при хранении препаратов на холоду и
при нормальной температуре неодинакова. При комнатной тем-
пературе (18—20° С) хранения за один год амилолитическая ак-
тивность спиртоосажденных белков из культуры гриба Asp. oryzae
снизилась в различных образцах от 0 до 8%, а на холоду за это
же время — от 0 до 4%. Протеолитические препараты оказались ме-
нее стойкими. Так, при температуре 18—23° С за год хранения про-
теолитическая активность их снизилась на 18—28%, а при тем-
пературе 4°С — на 7—13%. За 4 года хранения эти потери увели-
чиваются вдвое.
Экспериментально установлено, что ферментные препараты из
культуры гриба Asp. flavus. выпускаемые в виде сиропов с концент-
рацией сухих веществ 25—40% при температуре 18—23°С через
20—25 дней забражйвали в результате интенсивного развития ин-
фицирующей микрофлоры и активность их значительно снижа-
лась-
Образцы сиропов с концентрацией сухих веществ 55 и 68%
оказались стойкими к инфицированию в нормальных температур-
ных условиях (18—23° С) на протяжении 12 месяцев, однако поте-
ри протеолитической активности в них были значительными. Так,
за 4 месяца потери активности в различных образцах составили
22—25%, а за 12 месяцев возросли до 30—36%.
Во ВНИИФСе исследованы препараты в виде сиропов, полу-
ченные из культуры плесневого гриба Asp. terricola. Обнаружено,
что в сиропах, стабилизированных растворами желатина, при хра-
нении в комнатных условиях, скорость падения протеолитической
активности находится в обратной зависимости от концентрации су-
хих веществ. В сиропах с концентрацией сухих веществ 50%, стаби-
266
лизированных растворами желатина или казеина, не наблюдалось
падения протеолитической активности в течение 6 месяцев при
температурах 18—23° С, а при 4—6° С препараты хранятся без по-
терь протеолитической активности в течение 8 месяцев.
Стандартизация ферментного препарата имеет цель получить
препарат определенной активности.
Выпуск препаратов со стандартной ферментативной актив-
ностью имеет большое значение, так как позволяет применять их
в различных отраслях народного хозяйства по строго установлен-
ным дозировкам.
В качестве наполнителей обычно стараются использовать такие
вещества, которые также являлись бы и стабилизаторами фер-
ментов.
Стандартизация препаратов путем добавления различных на-
полнителей проводится в шаровой мельнице, куда вводят фермент-
ный порошок й измельченный наполнитель в установленных рас-
четом количествах. Смешение порошка с наполнителем длится 30—
45 мин. Недостатком такого способа является трудность гермети-
зации процесса выгрузки готового продукта из мельниц и малая
производительность их.
Пектолитические препараты для соковой и винодельческой про-
мышленности, полученные из культур плесневых грибов Asp. niger
(Нигрин ПК и Нигрин ГК) и Asp. awamori (Аваморин ППК,
Аваморин ПГК) стандартизуют бентонитом до активности.3000 ед.
ПкС на 1 г препарата, а Нигрин ПР и Аваморин ППР, Аваморин
ПГР, полученные по другой схеме, до активности 1000 ед. ПкС/г
препарата.
Амилолитические препараты из культур плесневых грибов Asp.
oryzae и Asp. awamori, полученные при поверхностном или глу-
бинном культивировании продуцентов (Аваморин ПК, Аваморин
ГК, Оризин ПК, Оризин ГК, Оризин II), предназначенные для
хлебопекарной промышленности, стандартизуют крахмалом или
поваренной солью до следующей активности: Аваморин ПК, Ава-
морин ГК 6000 ед. ДС/г, Оризин ПК, Оризин ГК, Оризин II —
400 ед АС/г.
Протеолитические препараты из культур плесневых грибов Asp.
oryzae, Asp. terricola и Asp. flavus, предназначаемые для рыбной
и мясной промышленности, стандартизуют поваренной солью до
следующей активности: Оризин ПК, Оризин ГК, Оризин I, Терри-
зин ПК, Терризин ГК, Флавизин ПК 400 ед. ПС/г, Оризин ПР,
Оризин ГР, Терризин ПР, Терризин ГР 100 ед. ПС/г. Стандарти-
зованные таким образом препараты в виде порошков хранятся в те-
чение года с минимальной потерей активности (5—7%).
Ферментные препараты в виде сиропа, предназначаемые для ко-
жевенной промышленности (Оризин ПС, Терризин ПС, Флавизин
ПС) стандартизуют путем концентрирования экстрактов до содер-
267
жания сухих веществ не менее 50% и протеолитической актив-
ности не менее 35 ед. ПС/лы сиропа. Стандартизованные таким об-
разом ферментные сиропы хранятся без потерь активности в тече-
ние 3 месяцев.
Смесители. При выборе типа смесителя для стандартизации
ферментных препаратов необходимо учитывать следующие требо-
вания: гомогенность полученного препарата; герметичность прове-
дения процесса, исключающая пылевыделение; минимальный на-
грев и сохранение исходной активности; минимальный контакт об.
служивающего персонала с ферментом и соблюдение правил сани-
тарии и культуры производства.
В настоящее время ферментное производство не располагает
серийно выпускаемыми смесителями, которые удовлетворяли бы
всем этим требованиям. Из выпускаемого оборудования для стан-
дартизации ферментных препаратов могут быть приспособлены
механические смесители СМ (см. стр. 126), двухвальные вибрацион-
ные смесители периодического и непрерывного действия конструк-
ции Всесоюзного научно-исследовательского института строитель-
ных материалов (ВНИИСМ), центробежные скоростные смесите-
ли ВНИИПТхиммаша, смесители типа «Турбула», «Наутамикс».
Двухвальный вибрационный с м е с и т е л ь непрерыв-
ного действия состоит из корпуса, внутри которого в противополож-
ных направлениях вращаются два лопастных вала, приводимые в
движение от электродвигателя через редуктор. Корпус смесителя со
щеками и противовесом образует жесткую коробчатую конструк-
цию, в которой расположен дебалансный вибратор. Вся система ус-
тановлена на раме с помощью упругих связей. Крутящий момент
передается с помощью гибких элементов — дюритовых шлангов или
винтовых пружин.
Ферментный препарат и наполнитель (например, поваренная
соль) герметически загружаются через закрытый патрубок и в
процессе перемещения к выгрузочному штуцеру смешиваются до
однородного состояния за счет совмещения перемешивания массы
с круговыми колебаниями всей системы, высокочастотного переме-
шивания на малых радиусах, равных амплитуде колебаний смеси-
теля. Сочетание механического и вибрационного воздействия спо-
собствует получению гомогенного продукта.
Скоростной центробежный смеситель представ-
ляет собой цилиндрический сосуд с плоским отбортованным дни-
щем. в нижней части которого вращаются рабочие органы. При
определенных скоростях вращения лопасти их переводят материал
в псевдоожиженное состояние. Характер движения материала за-
висит от скорости движения рабочих органов.
Аппарат испытан ВНИИПТхиммашем совместно с ВНИИФСом
при стандартизации препарата Asp. oryzae в разных режимах
(табл. 27). В ходе проверки отбирали по 20 проб и подвергали их
268
Т а б л и ц а 27
Однородность состава смеси в зависимости от режима работы смесителя
Число Степень загрузки смесителя vc при длительности смешивания, мин
Номер опыта оборотов рабочих органов в минуту 1 2 3 4 5 7
1 1200 0,6 2,5 2,05 1,0 1,4 1,48 —
2 1200 0,8 2,01 1,33 1,32 1,14 1,18 —•
3 700 0,6 — 1,64 1,37 — 1,17 1,2
4 950 0,6 — 1,41 1,29 — 1,35 1,37
5 950 0,465 — 2,6 1,75 — 1,46 1,35
химическому анализу с определением качества смеси по однород-
ности состава. Качество смеси определяли по формуле:
"| / (С; Со)2 П[
-
Со ’ п-1
где vc — коэффициент неоднородности смеси (чем ближе'его вели-
чина к 1, тем выше однородность смеси).
Со — среднеарифметическая концентрация ключевого компо-
нента;
С{ — фактическая концентрация ключевого компонента в про-
бах;
nz — число проб с концентрацией Ct ;
п — общее число проб-
Установлено, что при увеличении скорости вращенйя рабочих
органов от 500 до 700 об/мин циркуляция материала резко воз-
растает. Дальнейшее увеличение скорости не улучшает ни цирку-
ляции материала, ни качества смеси, а расход мощности резко воз-
растает. Наиболее интенсивная циркуляция материала наблюда-
лась при загрузке смесителя на 0,6—0.8 объема. Оптимальная дли-
тельность смешивания компонентов 3—5 мин.
Как видно из табл. 27, дальнейшее увеличение скорости рабо-
чих органов (более 700—800) не приводит к улучшению однород-
ности смеси, тогда как мощность привода с увеличением числа обо-
ротов резко возрастает.
При числе оборотов 700—800 в минуту коэффициент заполне-
ния объема смесителя 0,6-? 0,8 и перемешивании в течение 3—
5 мин амилолитическая активность смеси равна расчетной.
Таким образом, для стандартизации ферментных препаратов
целесообразно применять скоростной центробежный смеситель
конструкции ВНИИПТхиммаша с ведением процесса при невысоких
скоростных режимах — до 700—800 об/мин.
269
Расфасовка и упаковка ферментных препаратов
Вид упаковки ферментных препаратов зависит от их качества
и свойств. Концентрированные препараты более высокой степе-
ни очистки, полученные осаждением органическими растворителя-
ми, и препараты низкой степени очистки, полученные высушивани-
ем экстрактов на распылительных сушилках, имеют влажность 8—
12%. I
Важным условием, обеспечивающим сохранность ферментатив-
ной активности препаратов в процессе хранения, является защита
от увлажнения. Повышение влажности более чем на 13% приводит
к резкому понижению стойкости. Препараты, полученные сушкой
распылением, особенно гигроскопичны, довольно быстро слежива-
ются и комкуются. вследствие чего теряют товарный вид и фермен-
тативную активность. Поэтому их нужно расфасовывать в герме-
тичную тару (полиэтиленовые мешочки) с последующей упаков-
кой в жестяные коробки.
В зависимости от назначения препарат расфасовывают пор-
циями от 0,1 до 5 кг.
В настоящее время расфасовка и упаковка препаратов в виде
сиропов (в молочные бидоны емкостью 30—40 л) и порошков про-
водится вручную. Этот процесс очень трудоемок и его необходимо
механизировать.
Регенерация органических растворителей
Этиловый спирт можно регенерировать как на кубовом
ректификационном аппарате периодического действия, так и на
специальном перегонном аппарате непрерывного действия. При
регенерации на ректификационном аппарате периодического дей-
ствия водно-спиртовую жидкость загружают в куб. На дне куба
расположены змеевики, по которым циркулирует пар, и барботер
для открытой подачи пара.
Водно-спиртовую смесь нагревают паром и доводят до кипения.
Образующиеся спиртовые пары поступают в ректификационную ко-
лонну, установленную непосредственно на кубе. Внутри колонны
размещены ситчатые или колпачковые тарелки (обычно 42—45 шт).
В колонне идет сложный нестационарный процесс перегонки би-
нарной смеси вода — этиловый спирт.
При заполнении тарелок флегмой на них устанавливается не-
которая концентрация спирта, непрерывно изменяющаяся по мере
сгонки и повышающаяся по высоте колонны.
С верхней тарелки наиболее концентрированные спиртовые па-
ры направляются в дефлегматор. В ректификационных аппаратах
периодического действия он чаще всего выполнен в виде кожухо-
трубных теплообменников. Здесь спиртовые пары конденсируются
и в виде флегмы подаются частично снова в колонну для укреп-
ления, а частично — в холодильник, где спирт охлаждается и посту-
270
пает на фонарь, откуда направляется либо на хранение, либо в
цех длй осаждения ферментов.
На регенерацию поступает отработавший этиловый спирт кре-
постью 70—73% об. В процессе регенерации он укрепляется; гото-
вый регенерат на выходе из аппарата должен иметь крепость не
менее 95% об. Потери спирта при регенерации достигают 1%.
При регенерации спирта аппарат работает по следующему ре-
жиму: давление в кубе 1400 мм вод- ст., температура на верхней
тарелке 78° С.
Для регенерации спирта применяют также одноколонные и
двухколонные перегонные аппараты непрерывного действия.
Одноколонный аппарат имеет одну колонну, состоящую из двух
частей. Верхняя часть ее носит название спиртовой и может уком-
плектовываться обыкновенными ситчатыми или колпачковыми та-
релками. Нижняя часть колонны носит название истощающей и
должна укомплектовываться тарелками двойного кипячения. Это
требование вызвано тем, что спирт, поступающий на регенерацию,
содержит примеси белкового характера, которые загрязняют та-
релки и могут забить их полностью, что приведет к остановке аппа-
рата.
Двухколонные аппараты состоят из спиртовой и истощающей
колонн, устанавливаемых отдельно. Флегма, стекающая из дефлег-
матора, собирается в нижней части спиртовой колонны. Она содер-
жит значительное количество спирта и для удаления его направ-
ляется насосом в истощающую колонну.
Регенерация изопропилового спирта в аппаратах
периодического действия протекает несколько сложнее, так как по-
высить концентрацию его с 55 до 95% об. простой дистилляцией
не удается и приходится в качестве водоотнимающего средства
добавлять в куб едкую щелочь из расчета 17,5 г на 100 л регене-
рируемого раствора. Однако это не единственный способ регенера-
ции.
Если для осаждения ферментов использовать изопропиловый
спирт крепостью 83—85% об., разумеется, добавляя его в соответ-
ственно больших количествах, чем 95%-ный, то для регенерации
до 85% об. можно использовать обычные ректификационные аппа-
раты периодического и непрерывного действия, а также бестарелоч-
ные колонны, применяя в качестве насадок кольца Рашига или
алюминиевую стружку.
ТЕХНОЛОГИЧЕСКИЕ СХЕМЫ ПРОИЗВОДСТВА
Оризин ПС
Препарат содержит в основном протеолитические ферменты и
предназначен для применения в кожевенной промышленности. По-
лучение высушенной культуры плесневого гриба Asp. oryzae под-
робно изложено в гл. IV в разделе «Технологические схемы по-
271
верхностного культивирования». Для получения препарата Оризин
ПС (рис. 60) культуру Asp. oryzae штамм КС дробят на частицы
размером 5—7 мм, после чего подают при помощи подвижного бун-
кера на диффузионную батарею для экстракции ферментов водой.
Процесс ведут в диффузионной батарее из 10 диффузоров, соеди-
ненных коммуникациями для воды и водной вытяжки. В каждый
диффузор емкостью 300 л загружают 54—60 кг культуры, счи-
тая на абсолютно сухие вещества.
Нагретая до 25—27° С вода с добавленным в нее формалином
(0,02%) поступает на первый (хвостовой) диффузор батареи. При
появлении из воздушника первого диффузора вытяжки подачу во-
ды на батарею прекращают и содержимое диффузора выдержи-
вают 30 мин. Затем поступление воды на диффузор возобновляют,
в результате чего жидкая фаза из него переходит во второй диф-
фузор, а первый загружают свежей порцией воды и снова вы-
держивают его содержимое 30 мин. Таким образом заполняется
вся батарея.
Из восьмого (головного) диффузора, загруженного свежей
культурой, отбирают вытяжку в мерник-сборник в количестве 2,2
объема (по весу абсолютно сухой культуры, загруженной в диф-
фузор), подачу воды на батарею прекращают, хвостовой диффу-
зор отключают от батареи, освобождают от остатков среды, моют,
периодически (1 раз в 3 дня) стерилизуют и вновь загружают
свежей культурой гриба.
Стерилизацию ведут острым паром, подогревая его до 105° С и
выдерживая при этой температуре 60 мин. Вода после отключения
хвостового диффузора поступает в следующий, второй, диффузор,
который становится хвостовым. Экстракт из восьмого диффузора
передается во вновь подключенный, который после выгрузки остат-
ков и загрузки свежей культурой гриба становится головным.
При установившемся режиме работы батареи каждый диффу-
зор поочередно будет загружаться свежей культурой гриба, запол-
няться экстрактом ферментов из предыдущих диффузоров и после
выдержки из него будет отбираться концентрированный экстракт.
Во избежание образования воздушных пробок в батарее, которые
могут затруднить продвижение вытяжки в диффузоре, концентри-
рованный экстракт должен направляться снизу вверх, чтобы вытес-
нять воздух.
Вытяжка имеет температуру 25—27° С, содержит 10—12% су-
хих веществ, протеолитическая активность ее 10—12 ед1мл. Потери
протеаз в диффузионной батарее достигают 25% (6% с промывны-
ми водами и 19% с биошротом).
После выделения ферментов и других растворимых веществ,
что составляет 30% от общего содержания сухих веществ в куль-
туре, остатки ее выгружают из отключенного диффузора и на-
правляют на обезвоживание- Этот процесс проводится сначала на
272
Отруби
Рис. 60. Технологическая схема производства Оризина ПС и Терризина ПК на Выш-
неволоцком заводе ферментных препаратов:
1 — нория; 2 — бункер; 3—автоматические весы; 4 — загрузочный шнек; 5 — стерилизатор; 6 — раскладочный стол;
7 —этажерка; 8 — растильная камера; 9 — шнек-дробилка; 10 — подвижной бункер; // — диффузор; /2—сборник
жома; /3—сборник диффузионной вытяжки; 14 — центробежный насос; /5 —напорный бачок; 16 — решофер; 17 —
вакуум-выпарной аппарат; 18 — сборник сиропа; 19, 24 — теплообменники; 20—приемник; 21— вакуум-насос; 22
шнекпресс; 23— сушилка; 25 — мерник вытяжки; 26—мерник спирта; 27 — осадитель; 28—сепаратор; 29 — смеситель;
30 — центрифуга; 3/— вакуум-сушильный шкаф; 32 —дробилка.
шнековом прессе (с 90 до 70% влажности), а затем на полочной,
ленточной или аэрофонтанной сушилках (с 70 до 12—14% влаж-
ности). Полученный таким образом биошрот, содержащий боль-
шое количество питательных веществ (по кормовой ценности он не
уступает пшеничным отрубям), расфасовывают в мешки по 25—
30 кг и направляют для использования в качестве корма для жи-
вотных и птиц.
Вытяжку из диффузионной батареи направляют на выпарива-
ние, чтобы повысить содержание в ней сухих веществ до 50%.
Концентрирование ведут на непрерывно действующей пленочной
вакуум-выпарной установке при следующих параметрах: темпера-
тура упаривания 30—32° С, температура греющего пара 80—85° С.
В процессе концентрирования протеолитическая ферментативная
активность возрастает с 10—12 до 40—45 ед ПС в 1 мл раствора,
однако потери ее при этом довольно велики и составляют от 10
до 20%.
Полученный ферментный препарат в виде сиропа разливают в
бидоны и направляют потребителю. Согласно МРТУ препарат
Оризин ПС должен иметь протеолитическую активность не ниже
35 ед 1мл и содержать не менее 50% сухих веществ.
Для получения препарата Оризин ПС, содержащего в основном
амилолитический комплекс ферментов и применяемого в текстиль-
ной промышленности, используют плесневой гриб Asp. oryzae
штамм И-476. Процесс выращивания производственной культуры
этого гриба длится 24 ч. Все остальные операции проводятся по
тем же технологическим режимам, что и при производстве сухой
культуры Asp. oryzae (протеолитической). Потери амилолитичес-
ких ферментов в процессе экстрагирования достигают 18—20%, а
в процессе концентрирования на вакуум-выпарной установке 10—
12%. Согласно МРТУ, препарат Оризин ПС амилолитический дол-
жен содержать сухих веществ не менее 50% и обладать амилоли-
тической активностью не менее 35 ед. кС1мл.
По данной схеме работает Вышневолоцкий завод ферментных
препаратов. К недостаткам ее относятся: трудоемкий процесс выра-
щивания культуры в растильных камерах на кюветах; длительный
процесс экстрагирования ферментов в диффузионной батарее,
вследствие чего может возникать инфицирование вытяжки и в
связи с этим увеличиваться потери ферментативной активности,
особенно протеолитической; относительно высокие потери при кон-
центрировании в вакуум-выпарных установках.
Для усовершенствования этой схемы необходимо механизиро-
вать процесс выращивания, вести экстрагирование ферментов
в непрерывно действующих аппаратах, снизить температуру выпа-
ривания на вакуум-выпарных установках до 28° С, что позволит
значительно интенсифицировать процесс концентрирования и сни-
зить потери ферментативной активности-
274
Нигрин ПР
Препарат содержит пектолитический комплекс ферментов и
предназначен для льноперерабатывающей промышленности. Техно-
логическая схема, разработанная ВНИИФСом, полунепрерывная
и состоит из следующих основных операций (рис. 61): выращива-
ния культуры гриба Asp. niger П; экстракции ферментов; очистки
экстракта от нерастворимых и части растворимых балластных ве-
ществ, а также от бактериальной и грибной микрофлоры; сушки
очищенного экстракта на распылительной сушилке; стандартиза-
ции препарата; упаковки готового продукта.
Схема разработана с учетом опыта освоения Вышневолоцкого
и Московского опытного ферментных заводов. Много внимания уде-
лено улучшению санитарно-гигиенических условий труда путем при-
менения специальных видов оборудования, герметизирующих про-
цессы выгрузки посевной культуры из кювет, приготовления вод-
ной суспензии посевной культуры, выгрузки производственной
культуры и ее дробления. Авторы схемы стремились максимально
механизировать технологические процессы, сократить производст-
венные потери и повысить качество ферментного препарата.
Выращивание посевной культуры ведется обычным образом, но
готовую посевную культуру разгружают в специальном манипу-
ляторе (см. стр. 116).
Питательной средой для гриба Asp. niger П — продуцента пек-
толитических ферментов — служат пшеничные отруби и свекольный
жом в соотношении 1:1. Питательная среда стерилизуется в сте-
рилизаторах Укргипропрода. Производственная культура выращи-
вается в течение 48 ч на аппаратах СПК-90. Потери сухих ве-
ществ при выращивании составляют 30—35%. Готовая культура
имеет влажность 40—42%, пектолитическая активность ее 500—
700 ед- ПкС/г.
Экстракция ферментов проводится на обычной десятичленной
диффузионной батарее. Остатки культуры направляются на шнек-
пресс, а затем в сушилку ВИС, где высушиваются при температуре
300° С.
Биошрот влажностью 12—14% расфасовывают в крафт-мешки
и направляют на корм для птиц и скота.
В процессе экстракции отбирают 300% вытяжки в пересчете на
сухое вещество. Это дает возможность получить экстракт, богатый
ферментами (85% от содержания их в культуре гриба). Он содер-
жит 8—9% сухих веществ и обладает пектолитической активностью
160—250 ед. ПкС/г. Для очистки экстракт направляют на непре-
рывно действующий сепаратор ВСС, а затем фильтры Зейтц или
ФКМ, где он практически полностью освобождается от посторонней
микрофлоры, после чего поступает на распылительную сушилку
непрерывного действия.
Горячий воздух и высушиваемый продукт движутся по принципу
параллельного тока, что позволяет вести процесс без перегрева
275 .
ОтруНи \
Рис. 61. Технологическая схема производства Нигрина ПР:
/ — нория; 2 — бункер; 3 — автоматические весы; 4 — стерилизатор; 5—растильная камера; 6 — дробилка; 7—тележ-
ка; 8 — загрузочный бункер; 9 — диффузор; 10 — сборник биошрота; // — шнекпресс; /2, 16 — загрузочные шнеки;
13 — загрузочная тележка; 14 — сушилка; 15 — разгрузочный шнек; /7, 27 — весы; 18— сборник диффузионной вытяж-
ки; 19 — сепаратор; 20 — фильтр; 2/— сборник отфильтрованной вытяжки; 22 — фильтровальная установка; 23 — шнек;
24 — охлаждающее сито; 25 — емкость для готового препарата; 26 — смеситель; 28—распылительная сушилка.
продукта, так как температура сухих частиц его определяется тем-
пературой воздуха на выходе из сушилки.
Сушку ведут при температуре воздуха на входе в сушилку
150° С и на выходе из нее 80° С. Влажность сухого препарата сос-
тавляет 8—12%, а потери ферментов при сушке не превышают
12%. Высушенный препарат стандартизуют до активности 1000 ед.
ПкС/г добавлением бентонита, расфасовывают в хлорвиниловые
мешки по 5 кг и направляют в склад. К недостаткам схемы сле-
дует отнести использование периодически действующей диффузион-
ной установки, относительно большой расход тепла на сушку м
низкую пектолитическую активность получаемого препарата.
Санитарно-гигиенические испытания, проведенные в Институте
питания АМН СССР, показали, что препарат Нигрин ПР токсичен
и его нельзя применять в соковом производстве. Поэтому во
ВНИИФСе были проведены изыскания новых штаммов продуцен-
тов пектолитических ферментов для нужд пищевой промышленнос-
ти. Были выявлены штаммы Asp. awamori 22 и 16, которые при вы-
ращивании на средах, содержащих до 70% свекловичного жома и
30% пшеничных отрубей, по технологическим режимам, аналогич-
ным для производства сухой культуры Asp. niger, продуцируют
большое количество пектолитических ферментов.
В настоящее время разработаны режимы получения нетоксичных
пектолитических препаратов Аваморин ППР по технологической
схеме для Нигрина ПР. Препарат Аваморин ППК, из штамма 22
проверен Институтом питания АМН СССР и разрешен к использо-
ванию в производстве соков.
Аваморин ПР
Препарат предназначен главным образом для использования
в крахмало-паточной промышленности при получении глюкозы из
крахмала, но может применяться и в хлебопечении.
Культуру гриба Asp. awamori 22 выращивают в камерах с вер-
тикальными каналами. Режим выращивания описан на стр. 160—
162. Готовая сырая культура гидротранспортом подается на экс-
тракционную установку для водной экстракции ферментов. Отбор
вытяжки составляет 400% к весу воздушно-сухой культуры. Вы-
тяжка содержит 8—9% сухих веществ, декстринолитическая актив-
ность ее около 100 ед/мл.
Для удаления балластных веществ и различных бактерий вытяж-
ку направляют на осадительную центрифугу (предварительно до-
бавив в нее СаСЬ из расчета 1% вес.). Если требуется получить
препарат для хлебопекарной промышленности, то фугат направ-
ляют на диализатор, а диализованный раствор сушат на распыли-
тельной сушилке.
Если же требуется получить препарат для крахмалопаточной
промышленности, то фугат смешивают в баке с поваренной солью
(50% NaCl на сухие вещества фугата) и затем подают на распы-
277
лительную сушилку. Температура воздуха на входе в сушилку
140° С, а на выходе из нее 65° С. При таком режиме сушки полу-
ченный препарат имеет влажность 7—9%.
Высушенный препарат стандартизуют до декстринолитической
активности 1000 ed/г и затем расфасовывают в полиэтиленовые ме-
шочки с последующей упаковкой их в картонные или жестяные
коробки-
Общие потери декстринолитической активности составляют
36%, из них при экстрагировании водой 20%, в процессе удаления
балластных веществ и посторонней микрофлоры 1 % и при сушке
распылением до 15%.
По этой схеме работает Мичуринский экспериментальный фер-
ментно-спиртовой завод. Преимущества ее сводятся к следующе-
му: простота (отсутствуют операции обработки растворов спир-
том); закрытый процесс выращивания, что улучшает санитарно-ги-
гиенические условия труда; механизация основных процессов; оди-
наковая влажность культуры и питательной среды, что дает воз-
можность получать технические и очищенные препараты с высокой
ферментативной активностью.
Недостатки схемы: малая производительность и трудности,
возникающие при выгрузке культуры из растильных камер, а так-
же меньшая ферментативная активность на 1 г получаемого пре-
парата по сравнению со спиртоосажденными препаратами.
Терризин ПК
Препарат предназначен для применения в мясной и рыбной
промышленности.
Получение сухой культуры плесневого гриба Asp. terricola 3374
изложено на стр. 202. Готовая культура направляется на диффу-
зионную батарею для извлечения ферментов (см. рис.60). При
этом получают вытяжку с относительно высокой концентрацией
протеаз (10 ед. ПСДил) при содержании сухих веществ 9—10%.
Процесс экстрагирования ведется аналогично описанному для
препарата Оризин ПС. Отбор вытяжки составляет 300% по весу
абсолютно сухой культуры гриба. Потери протеолитических фер-
ментов при диффузии относительно велики и достигают 25%.
Очистка ферментного экстракта от посторонней микрофлоры и
отделение от него части балластных веществ проводятся на непре-
рывнодействующих сепараторах- Перед подачей на сепаратор в вы-
тяжку добавляют раствор аммиака, доводя pH ее до 8,6.
С балластными веществами удаляется и некоторое количество
активного белка (потери протеолитической активности на этой
операции 2%). Осветленный экстракт направляется в осадитель,
где к нему добавляют расчетное количество уксусной кислоты, что-
бы довести pH до 6.
278
Расход этилового спирта концентрацией 90% об. составляет
3 объема на 1 объем вытяжки.
Перед подачей в осадитель спирт охлаждают до температуры
1—5° С, чтобы уменьшить потери активности ферментов при сме-
шивании с экстрактом.
В аппарат вначале загружают растворитель, а затем при рабо-
тающей мешалке добавляют ферментный экстракт, охлажденный
до 5°С. Смесь перемешивают в течение 20 мин, после чего подают
на сепаратор для отделения осадка, а водно-спиртовую жидкость
передают в регенерационное отделение для укрепления до 95% об.
Выгруженный из сепаратора осадок смешивают в смесителях СМ с
этиловым спиртом крепостью 95—96% об. (2 объема на 1 объем
осадка) до получения однородной суспензии. Затем на центрифу-
ге ВВ-400Н проводят окончательное отделение ферментного осад-
ка от спирта. Осадок влажностью 35—40% направляют в вакуум-
сушильный аппарат периодического действия, раскладывают его
в противни слоем 15 мм и устанавливают их на плиты сушиль-
ного шкафа. После загрузки шкафа дверцы закрывают, включают
вакуум-насос, создающий необходимое разрежение (740 мм. рт.
ст.), и в коммуникации, расположенные внутри плит, вводят грею-
щий агент — воду температурой 35°С. Образующийся при испаре-
нии влаги пар отводится в конденсатор. Когда влажность осадка
достигнет 10—13%, сушку прекращают. Длительность ее 16—
24 ч.
Высушенный осадок поступает в шаровую мельницу. Сюда же
из сборника добавляется расчетное (исходя из активности осадка)
количество поваренной соли, смесь измельчается и тщательно пере-
мешивается в течение 3 ч.
Стандартизованный препарат расфасовывают в полиэтиленовые
мешочки весом по 0,5 кг и упаковывают их в жестяные коробки,
отправляемые на склад готовой продукции.
Выход препарата Терризин ПК по такой схеме составляет
6,5% от веса культуры. Потери активности на всех операциях, на-
чиная от дробления сухой культуры, 45—50%. Потери спирта 8—
9% от количества, взятого1 на осаждение. Такие большие потери
объясняются недостаточной герметичностью оборудования. В нас-
тоящее время во ВНИИФСе разрабатываются мероприятия по их
снижению.
Готовый препарат представляет собой порошок коричневого
цвета влажностью не более 13%. Протеолитическая активность
его 400 ед. ПС/г.
Биошрот из диффузоров смешивают с балластными вещества-
ми, выделенными на сепараторе, обезвоживают (аналогично схеме
получения Оризина ПС), после чего реализуют на корм скоту.
По аналогичной схеме можно получать препараты Оризин ПК,
Аваморин ПК и Аваморин ППК.
279
Оризин ПК
Препарат Оризин ПК (выход 4,5% от веса культуры гриба
Asp. oryzae КС) вырабатывается по схеме и режимам для Оризи-
на ПС, включая получение ферментной вытяжки. Дальнейшие опе-
рации проводятся по схеме для Терризина ПК. Препарат этот комп-
лексный и обладает амилолитической активностью 400 ед. АС/а
(стандартизация поваренной сблью и крахмалом в соотношении
1 : 1) и протеолитической активностью не более 300 ед- ПС/г.
Аваморин ПК
Препарат Аваморин ПК (выход 6,0% от веса культуры гриба
Asp. awamori 22) вырабатывается по схеме и режимам для Авамо-
рина ПР, включая получение ферментной вытяжки; дальнейшие
операции аналогичны схеме для Терризина ПК. Расход этилового
спирта (96% об.) на осаждение 4 объема на 1 объем очищенной
вытяжки. Препарат обладает амилолитической активностью 200
ед. АС/г, декстринолитической активностью 6000 ед. ]1£[г и маль-
тазной активностью 2000 МС/г. Стандартизуется крахмалом.
Препарат Аваморин ППК (выход 10%, от веса культуры гриба
Asp. awamori 16 или 22) производится по схеме Нигрина ПР,
включая получение ферментной вытяжки; дальнейшие операции ве-
дут по схеме для Терризина ПК. Расход этилового спирта
(96% об.) на осаждение 3,5 объема на 1 объем очищенной вытяж-
ки. Препарат обладает пектолитической активностью 3000 ед. ПкС/г.
Оризин I и Оризин II
Производство сухой культуры гриба Asp. oryzae изложено на
стр. 201—202.
Данная технологическая схема (рйс. 62) осуществлена на Мос-
ковском опытном заводе ферментных препаратов. Экстракцию фер-
ментов из культуры ведут на диффузионной батарее. Отбор вы-
тяжки, содержащей около 10% сухих веществ, составляет 220% по
весу воздушносухой культуры. Экстракт из головного диффузора
поступает в сборник, где подщелачивается аммиаком до pH 8,6,
затем на сепаратор ВСС. Осветленный экстракт возвращается в
сборник и затем с помощью насоса подается в напорный мерник,
где подкисляется уксусной кислотой (до pH 6) из специального
сборника.
Спирт из регенерационного отделения поступает в мерник и по
мере необходимости передается на холодильник. Охлажденный
до минус 5° С спирт направляется в осадитель в таком количестве,
чтобы концентрация его в смеси с экстрактом составила 53—
57% об.; при такой концентрации в осадок выделяются преиму-
щественно протеолитические ферменты (I фракция). Затем в оса-
дитель при непрерывно работающей мешалке подается из мерника
280
Рис. 62. 1ехн©логическая схема производства Оризина ПК, Оризина I и Оризина II на
Московском опытном заводе:
/ — нория; 2, 9 — шнеки; 3 — стерилизатор; За — бак для воды; 4— бункер; 5 — автоматические весы; 6 — раскладоч-
ный стол; 7 — растильная камера; 8 — дробилка; 10 — диффузор; //—мерник; 12 — шнекпресс; 13, 19 — сборники диф-
фузионной вытяжки; 14, 20 — холодильник; /5 — сборник охлажденной вытяжки; 16 — сепаратор ВСС; /7 — сепаратор
СПВ-12; 18 — сушилка ВИС; 21 — сборник уксусной кислоты; 22, 25 — напорные мерники; 23, 26 — осадители; 24 —
сборник спирта; 27 — смеситель; 28 — центрифуга; 29, 30 — вакуум-сушилки; 31 — шаровая мельница; 3.2 — разгрузчик,
33—весы; 34—стерилизатор производственных кювет; 35 — сборник биошрота; 36 — центробежный насос; 31 — машина
'для мойки кювет; 38 — мост шеститочечный.
экстракт. Содержимое осадителя тщательно перемешивается в тече-
ние 20 мин, после чего полученную смесь направляют на сепаратор.
Отходящая из него водно-спиртовая жидкость собирается в сборни-
ке и насосом передается в мерник, откуда вновь поступает в оса-
дитель.
Осадок выгружают и растирают в специальном аппарате СМ
с небольшим количеством крепкого спирта, затем передают на
центрифугу ВВ-400-4Н для отделения спирта. Из центрифуги оса-
док поступает на вакуум-сушилку, затем высушенный осадок из-
мельчают на шаровой мельнице, смешивают с определенным ко-
личеством наполнителя, расфасовывают и отправляют на склад.
В осадитель с водно-спиртовой жидкостью, полученной на се-
параторе после отделения осадка ферментов I фракции (протео-
литической) из мерника добавляют спирт-регенерат в количестве,
необходимом для доведения концентрации его в смеси до 77% об-
При такой концентрации спирта выпадает II фракция осадка
ферментов (амилолитическая). После добавления спирта содержи-
мое осадителя размешивают 30 мин. Полученная суспензия само-
теком поступает на сепаратор для отделения водно-спиртовой жид-
кости от ферментного осадка.
Фугат из сепаратора поступает на регенерацию в ректифика-
ционное отделение.
Осадок выгружается и передается в сборник, где смешивается
с десятикратным количеством воды и насосом передается в осади-
тель. В осадителе к водному раствору осадка ферментов II фрак-
ции добавляется суспензия бентонита, затем содержимое размеши-
вается и поступает на сепаратор. Фугат, содержащий ферменты,
насосом перекачивается в мерник.
Для получения II (амилолитической) фракции в осадитель из
мерников набирают спирт-регенерат в количестве, равном четырех-
кратному объему водного раствора, содержащего амилолитичес-
кие ферменты. При непрерывно работающей мешалке к спирту в
осадителе добавляют водный раствор ферментов из мерника. По-
лученную смесь перемешивают в течение 10 мин и сразу передают
на сепаратор.
Спирт, отделенный на сепараторе, поступает на регенерацию.
Осадок, содержащий ферменты, выгружается из сепаратора,
растирается в специальном аппарате СМ с небольшим количеством
крепкого спирта и затем поступает на центрифугу ВВ-400-4Н для
отделения спирта от осадка, который снимают вручную, раскла-
дывают слоем 10 мм в противни и загружают их в полочную ваку-
ум-сушилку. Сушка идет при следующем режиме: остаточное дав-
ление в сушилке 20 мм рт. ст., температура греющего агента (воды)
30° С. При таком режиме сушка длится 10—11 ч, а потери актив-
ности по АС не превышают 10%. Высушенный осадок измельчают
на мельнице, расфасовывают в полиэтиленовые мешочки по 0,5 кг,
упаковывают в жестяные банки и направляют на склад.
282
Препарат Оризин I, предназначенный для мясной и рыбной
промышленности, содержит протеолитические ферменты (стандар-
тизуется поваренной солью до активности 400 ед. ПС/г). Выход,
его 2,5% от веса культуры.
Препарат Оризин IL предназначенный для хлебопекарной про-
мышленности, содержит в основном амилолитические ферменты
(стандартизуется поваренной солью и крахмалом в соотношении
1 : 1 до активности 400 ед. АС/г). Выход его 2% от веса культуры.
Как видно из приведенных выше показателей, получение фер-
ментов по такой схеме сопряжено с большими потерями актив-
ности (до 60—65%) и спирта (10—12% от количества регенера-
та, взятого на осаждение).
Большие потери и применение ручного труда на большинстве
операций обусловливают высокую себестоимость выпускаемых
препаратов, что является недостатком схемы.
Нигрин ОП
Препарат предназначен для применения в соковой и винодель-
ческой промышленности.
Отбросный мицелий гриба Asp. niger — отход производства ли-
монной кислоты, содержащий пектолитический комплекс фермен-
тов, транспортируется пневмотранспортом с завода лимонной
кислоты в ферментный цех и поступает после взвешивания в про-
мыватель, где промывается от солей холодной водой (рис. 63).
Расход воды около 15 л на 1 кг воздушно-сухой пленки.
Рис. 63. Технологическая схема производства пектолитических ферментов
на Белгородском заводе лимонной кислоты:
/ — загрузочный бункер; 2 — воздуходувка; 3 — циклон; 4 — распределительный шнек;
5 — диффузор; 6 — сборник пленки; 7 — сборник для вытяжки; 8 — фильтр рамный,
9 — сборник фильтрата; 10 — напорный мерник; // — осадитель; /2 — центрифуга;
13 — сушилка полочная; 14 — шаровая мельница; 15 — весы; 16 — ректификационный
аппарат; /7 — дефлегматор; 18 — холодильник; 19 — сборник спирта; 20— напорный
мерник спирта; 21 — воздушный фильтр; 22 — калорифер; 23 — фильтр для отработав-
шего воздуха.
283
Промытая пленка поступает в диффузионную батарею для
экстрагирования ферментов.
Экстракт с концентрацией сухих веществ 20% поступает на оса-
дительную центрифугу или фильтрпресс для отделения нераство-
римых мелкодисперсных частиц и обрывков мицелия.
Осадок из центрифуги направляется в канализацию, а экст-
ракт поступает в осадитель, где обрабатывается изопропиловым
спиртом. Спирт берут в таком количестве, чтобы концентрация
его в смеси составляла около 55% об. Расход спирта 1,4 объема
на 1 объем ферментного раствора.
По окончании смешивания мешалку выключают и полученную^
смесь оставляют в покое на 10—15 мин для формирования осад-
ка, а затем направляют на осадительную центрифугу, из которой
фугат направляется в отделение для регенерации спирта, а осадок
вручную снимают со стенок ротора, наносят слоем 2—3 мм на пер-
гаментную бумагу и сушат в обычной полочной сушилке в токе
воздуха при температуре 35—40° С. Высушенный продукт после
измельчения расфасовывают в герметически закрывающуюся тару»
Выход очищенного препарата составляет 2,5% от веса сухой плен-
ки
Глюкозооксидаза
Препарат используется в некоторых отраслях пищевой про-
мышленности (винодельческой, пивоваренной, консервной, произ-
водстве яичных порошков и др.) для увеличения сроков хранения
готовых продуктов.
Технологическая схема производства представлена на рис. 64.
Культуру гриба Penicillium vitale Pidopl. et Bilai выращивают
поверхностным способом на жидкой среде — водном растворе са-
хара и азотнокислого калия с оптимальным соотношением компо-
нентов 1:10; 1,5:10. При таком соотношении культуральная жид-
кость почти не содержит каталазы.
Простерилизованную жидкую среду (pH 4>9—5,1) разливают в
стеклянные матрацы в таком количестве, чтобы толщина слоя прн
горизонтальном положении матраца составляла 25—30 мм, и засе-
вают 10 мл споровой суспензии культуры гриба, содержащей
1,2—1,6«107 споровых клеток в 1 мл. Выращивание ведут при тем-
пературе 26—28° С в течение 7—8 суток, из них первые шесть
культивируют при 26° С, а последующие двое — при 28° С. Выбран-
ный режим обеспечивает накопление максимальной активности и
стабильность фермента в культуральной жидкости. Понижение-
температуры культивирования до 24—25’С, способствует накопле-
нию в среде каталазы, а при выращивании при более высокой тем-
пературе (28—30°С) значительно снижается концентрация глюко-
зооксидазы.
284
Рис. 64. Технологическая схема производства глюкозооксидазы:
/ — сборник питательной среды; 2—стерилизатор; 3 — выдерживатель жидкости; 4 — кювета-матрац; 5—растильная камера; 6— сборник
культуральной жидкости; 7 — вакуум-фильтр; 8 — фильтр ФКМ; 9 — сборник фильтрата; 10— адсорбер; 11, /3 — нутч-фильтры; 12, 17—сбор-
ники солей; 14 — сборник ферментного раствора; 15, 19 — сборники-осадители; 20— сборник, 16, /£ 21 — центрифуги; 22 — сублимационная
сушилка; 23 — шаровая мельница; 24 — стандартизатор; 25 — весы; 26 — напорный мерник.
Способ получения очищенных препаратов глюкозооксидазы ос-
нован на молекулярной сорбции фермента безводной окисью алю-
миния из культуральной жидкости при pH 6,8—7,0 с последующей
элюцией аммонийфосфатным буфером. Элюат подвергают обра-
ботке этанолом при минус 10° С для осаждения фермента. Полу-
ченный осадок дважды переосаждают ацетоном при той же тем-
пературе и затем высушивают в сублимационной сушилке.
Мицелий отделяют от культуральной жидкости на барабанном
вакуум-фильтре, затем фильтрат освобождают от посторонней
микрофлоры, пропуская его через керамические фильтры, нейтрали-
зуют 30%-ным раствором едкого натра до pH 6,8—7,0 и направ-
ляют в адсорбер. Здесь в культуральную жидкость добавляют без-
водную окись алюминия из расчета 25 кг на 1 м\ Адсорбирован-
ный на окиси алюминия фермент отделяется от раствора на
нутч-фильтре, после чего фермент элюируют из полученного осад-
ка путем обработки 9%-ным раствором хлористого аммония в
0,3 н. растворе однозамещенного фосфорнокислого калия. Элюция
проводится с таким расчетом, чтобы общий объем элюата состав-
лял 0,1—0,2 от объема исходной культуральной жидкости. Элюат
охлаждают до 0° С и добавляют к нему двойной объем этилового
спирта температурой минус 10°С. Ферментный осадок, отделенный
от спиртового раствора на центрифуге, вновь растворяют в воде,
промывают и вновь центрифугируют, затем осаждают фермент
двойным объемом ацетона- Осажденный фермент растворяют в во-
де, центрифугируют и еще раз обрабатывают двойным объемом
ацетона. Полученный осадок отделяют на центрифуге, вновь раст-
воряют дистиллированной водой и центрифугируют. Фугат сушат
сублимацией. Высушенную лепешку измельчают и расфасовывают
в стеклянные флаконы по 50 г.
Отработавшую окись алюминия регенерируют путем промывки
дистиллированной водой (6 л!кг), подкисленной уксусной кисло-
той (1 мл/л), фильтруют через барабанный вакуум-фильтр, осадок
промывают дистиллированной водой, высушивают в сушильном
шкафу при 120° С и прокаливают в муфельной печи при 420° С в
течение 4—5 ч. Регенерированная окись алюминия может использо-
ваться в качестве сорбента глюкозооксидазы не менее четырех
раз.
Регенерацию этанола и ацетона проводят на ректификационных
аппаратах.
Достоинством схемы является адсорбция глюкозооксидазы
на окиси алюминия, позволяющая в 10 раз увеличить концент-
рацию фермента в растворе и одновременно очистить фермент от
балластных веществ. Однако остальные узлы схемы очень трудоем-
ки. Так, выращивание продуцента в матрацах сложно и требует,
кроме того, больших производственных площадей; многочисленные
операции выделения фермента с последующим растворением осад-
ка и центрифугированием приводят к большим потерям раствори-
телей. Использование двух разных растворителей требует наличия
286
двух ректификационных установок. Наконец, для регенерации
окиси алюминия требуется также специальный цех, так как соглас-
но проектируемой мощности в сутки потребуется подвергать реге-
нерации около 400 кг этого адсорбента. Некоторые из указанных
недостатков устраняются при глубинном культивировании проду-
цента.
ЛИТЕРАТУРА
1. Аганесова Л. Н. Исследование режимов выпаривания и теплофизических
характеристик ферментных растворов. Автореферат канд. диссертации. Воро-
неж, 1964.
Аганесова Л. Н. Выпаривание ферментных растворов под вакуумом.
«Спиртовая промышленность», 1961, № 1.
3. Аганесова Л. Н. Изучение оптимальных условий концентрирования фер-
ментов путем упаривания сред. Сборник работ научной конференции ВЗИИПа.
1961.
4. Аганесова Л. И., Малченко А. Л. Исследование теплопроводности
ферментных растворов. «Ферментная и спиртовая промышленность», 1965,
№ 1.
5. В л а ди миров Г. Е., Л ы з л о в а С. Н. Энзимология. Изд. Ленинградского
государственного университета. Л., 1962.
6. В о й н а р с к и й И. Н., Ку в и ко в а А. Ф., Шульман М. С. Сорбция во-
дяных паров ферментными препаратами. В кн. «Внедрение ферментных пре-
паратов в народное хозяйство». Ч. I, ЦИНТИпищепром, 1961.
7. Войнарский И. Н., Демчук Т. П. Изучение оптимальных условий вы-
сушивания и хранения ферментных осадков и сиропов. ВНИИФС. Отчет по-
теме V, 1962.
8. Г у л ы й М. Ф.. Дегтярь Р. Г. Метод получения очищенных препаратов
глюкозооксидазы. В кн. «Внедрение ферментных препаратов в народное хо-
зяйство». Ч. I. ЦИНТИпищепром, 1961.
9. Гулый М. Ф., Б и л а й В. И.. Пи доп лич ко Н. М., Дегтярь Р. Г.,
Никольская Е. А. Фермент глюкозооксидаза и его применение. Изд-во
«Наукова думка». Киев, 1964.
10. Данил як Н. И., Черевко Н. Г., Клепикова Р. А. Устойчивость
амилолитических ферментов при хранении препарата. «Спиртовая промыш-
ленность», 1962, № 8.
11. Демчук Т. П., О р е щ е н к о Л. И., Ш у л ь м а н М. С. Хранение и стан-
дартизация амилолитических и протеолитических ферментных препаратов.
Труды ВНИИФСа. Вып. XVI, 1965.
12. Демчук Т. П., Близниченко Н. Г., Шульман М. С. Стандартиза-
ция и хранение препарата пектиназы. Труды ВНИИФСа. Вып. XVII, 1966.
13. Диксон М., У э б б Э. Ферменты. Изд-во «Мир», 1966.
14. Добро л и нс кая Г. М., Родзевич В. И. Получение высокоочищенного
препарата глюкоамилазы из культуры Asp. awamori. «Ферментная и спирто-
вая промышленность», 1964, № 7.
15. К а л а ш н и к о в Е. Я. Производственные способы получения очищенных
амилолитических и протеолитических ферментных препаратов плесневых гри-
бов. В кн. «Новая техника и технология в пивоваренной промышленности».
ГОСИНТИ, 1960.
16. Калашников Е. Я., Лифшиц Д. Б. и В ы с о ц к ая М. А. Исполь-
зование отбросной пленки гриба Аспергиллюс нигер в производстве лимонной
кислоты для получения очищенных пектолитических ферментных препаратов.
В кн. «Новая техника и технология в пивоваренной промышленности».
ГОСИНТИ, 1960.
287
17. Калнитский Г., Фридман Л., Лонгнеккер Д. Очистка и свойст-
ва протеиназы, выделенной из Asp. oryzae. Труды V Международного био-
химического конгресса. М., 1962.
18. Калунянц К. А. Выделение и концентрирование ферментов ЦИНТИпище-
пром, 1963.
19. Калунянц К. А., Ваганова М. С. Опыт эксплуатации диффузионной
батареи на Вышневолоцком ферментном заводе. Труды ВНИИФСа. Вып. XVII,
1966.
20. Калунянц К. А., Жеребченко Г. Ф. Очистка ферментных экстрактов
от балластных веществ центрифугированием. Сб. «Пищевая промышленность
(спиртовая, ликеро-водочная и ацетоно-бутиловая)», № 5. ЦИНТИпищепром,
1963.
21. Калунянц К. А., Г е р н ет М. А., Кузнецова С. П. Разработка спо-
собов выделения ферментных препаратов путем высушивания осажденных
спиртом ферментных осадков в вакуум-сушильных аппаратах. ВНИИФС.
Отчет по теме № 4, этап г, 1964.
22. Калунянц К. А., Мелентьева Г. Ф., М ед в е д е в а В. С. Разработка
способов очистки ферментных вытяжек от балластных веществ. ВНИИФС.
Отчет по теме № 4, этап б, 1964.
23. Калунянц К. А., Ваганова М. С., Чугунова Т. В. Разработка
способа выделения ферментных препаратов путем высушивания диффузион-
ных вытяжек на распылительных сушилках. ВНИИФС. Отчет по теме № 4,
этап г, 1964.
24. Калунянц К. А., Ваганова М. С., Жёребченко Г. Ф., Тобол о-
в а Н. А. Очистка и выделение ферментов методом суперцентрифугирова-
ния и сушки. ВНИИФС. Отчет по теме № 3, раздел 2 в/2, 1962.
25. Калунянц К. А., Ваганова М. С. Разработка технологических процес-
сов выделения ферментных препаратов из поверхностных культур. ВНИИФС.
Отчет по теме 4/д, е, ж, 1965.
26. Калунянц К. А., Ваганова М. С. Получение пектолитических фер-
ментных препаратов сушкой распылением. «Ферментная и спиртовая про-
мышленность», 1964, № 6.
27. К а л у н я н ц К. А., В а г а н о в а М. С. Сушка ферментного экстракта из
культуры плесневого гриба без очистки диализом. Сб. «Пищевая промышлен-
ность (спиртовая, ликеро-водочная и ацетоно-бутиловая», № 6. ЦИНТИ-
пищепром, 1963.
28. Калунянц К. А., Г е р н е т М. В. Сушка спиртовых ферментных осадков
в вакуум-аппаратах полочного типа. «Ферментная и спиртовая промышлен-
ность, 1966, № 4.
29. К о д з и м а Кацуёси. Очистка растворов амилолитических ферментов с
применением ионообменных смол. «Food Ind.» vol. 4, № 6, 1961, р. 20—29.
30. К о п н е в а В. А. Отчеты по теме «Выбор и испытание диффузора для по-
лучения ферментных растворов». ВНИИФС, 1961—1963.
31. Кувикова А. Ф. Технология выделения ферментов. В кн. «Производство
новых видов продукции в спиртовой промышленности». Пищепромиздат, 1961.
32. Кувикова А. Ф., Мишина 3. Н. Разработка технологических методов
очистки ферментных растворов и разделения ферментов. ЦНИИСП. Отчет
по теме № 24, 1960.
33. К у в и к о в а А. Ф. Применение очищенных препаратов пектиназы для ос-
ветления плодово-ягодных соков. В кн. «Внедрение ферментных препаратов
в народное хозяйство». Ч. II. ЦИНТИпищепром, 1961.
34. Кувикова А. Ф., Мишина 3. Н. Изучение компонентов пектолитическо-
го комплекса Asp. niger. ВНИИФС. Отчет по теме № 3, раздел 2, п. б, 1962.
35. Левина Л. Ш., Хиль Н. И., Мясина В. В., Гаврилова Г. А., Ку-
ница В. М. Опыт получения очищенных препаратов глюкозооксидазы.
Труды УкрНИИСПа. Вып. X, 1965.
36. Л е в и н а Л. Ш., Коханец Э. М. Разработка основ регенерации адсор-
бента глюкозооксидазы. Труды УкрНИИСПа. Вып. X, 1965.
37. Л о с я к о в а Л. С., Му ш'Н и к о в а Л. Н„ Ми ш и н а 3. Н. Технологический
режим работы диффузионной батареи при извлечении ферментов из куль-
288
туры гриба Asp. niger., Сборник научно-технической информации. ЦИНТИ-
пищепром. Вып. 4, 1965.
38. Л ос я ко в а Л. С., Муш ников а Л. Н., Мишина 3. Н. Изучение со-
става пектинрасщепляющих ферментов в препарате, полученном из поверх-
ностной культуры гриба Asp. niger. «Ферментная и спиртовая промышлен-
ность», 1965, № 3.
39. Л о с я к о в а Л. С., М и р о н о в а Н. С., Г е р н е т М. В., Кузнецова С. П.
Очистка диффузионных экстрактов от посторонней микрофлоры. Труды
ВНИИФСа. Вып. XVII, 1967.
40. Малченко А. Л., Аганесова Л. Н., Мелентьева Г. Ф. Выпарива-
ние ферментных растворов на вакуум-выпарной установке. «Ферментная и
спиртовая промышленность», 1965, № 7.
41. Малченко А. Л., Аганесова Л. Н. Вязкость и плотность ферментных
растворов. «Спиртовая промышленность», 1963, № 7.
42. М и х а й л о в с к а я Б. Ц. Стойкость очищенных ферментных препаратов и
жидких концентратов из плесневых грибов. Сборник трудов УкрНИИППа.
«Новое в биохимических процессах пищевой промышленности». Киев, 1965.
43. Михайловская Б. Ц. Стойкость очищенных ферментных препаратов и
жидких концентратов из плесневых грибов при их хранении. УкрНИИПИ. От-
чет, 1963.
44. Михайловская Б. Ц. Очистка и фракционирование амилолитических и
протеолитических ферментов. Сб. «Пищевая промышленность (пивоваренная,
безалкогольная, винодельческая, спиртовая и ликеро-водочная)», № 9 (107).
ЦИНТИпищепром, 1962.
45. Н о р т р о п Д., К у н и т ц М., X е р р и о т Р. Кристаллические ферменты.
Под ред. и с предисловием проф. В. Н. Ореховича. ИЛ., 1950.
46. Орещенко Л. И. Разработка способа разделения, очистки, стабилизации,
, стандартизации и хранения ферментных препаратов. ВНИИФС. Отчет по те-
ме 5/а, 1964.
47. Орещенко Л. И. Получение препаратов амилолитических ферментов, очи-
щенных от протеаз методом адсорбции на бентоните. Труды ЦНИИСПа,
Вып. IX, 1960.
48. О р е щ е п к о Л. И. Изучение амилолитического и протеолитического комп-
лекса гриба Asp. oryzae методом электрофореза. Труды ВНИИФСа.
Вып. XIV, 1963.
ч9. Орещенко Л. И. Разделение и очистка амилолитических и протеолити-
ческих ферментов гриба Asp. oryzae. Автореферат канд. диссертации.
МТИПП, 1964.
50. Орещенко Л. И. Разделение амилолитических и протеолитических фер-
ментов гриба Asp. oryzae. Бюллетень научно-технической инф9рмации
ВНИИСПа. Вып. 6, 1959.
51. Орещенко Л. И. Разделение амилолитических и протеолитических фер-
ментов гриба Asp. oryzae. В кн. «Внедрение ферментных препаратов в на-
родное хозяйство». Ч. I. ЦИНТИпищепром, 1961.
52. Попова Е. М. Получение препарата пектиназы из Ботритис цинереа для
осветления плодовых соков «Микробиология». Т. IV. Вып. 2, 1935.
53. Радченко М. С. Производство ферментного пектолитического препарата
па Чудновском спирто-соковом комбинате. В кн. «Обмен опытом в винодель-
ческой и ликеро-водочной промышленности». ГОСИНТИ, 1962.
54. Peters W. Der Hochfregen zstruhs. Tung Sherd, Heirung suffung Hasfechnik.
T. 9, N 4 и 5, 1958.
55. Самнер Д., Сомерс Г. Ф. Химия ферментов и методы их исследования.
ИЛ., 1948.
56. Сербинова Н. И., Фролова Т. И. Изучение пектолитической активно-
сти грибов Asp. oryzae и изыскание наилучших способов приготовления и
применения энзимов для осветления плодовых соков. Труды ВНИИ плодо-
овощной промышленности. Киев, 1940.
57. С о с и н а С. М., Пашковская М. Т., Новик В. Г. Разработка мето-
дов получения высокоактивных пектолитических ферментных препаратов.
Отчет БНИИППТ, 1962.
19—826
289
58. Степанищев К. П., Шульман М. С. Аппарат для непрерывного диа-
лиза ферментных растворов. «Спиртовая промышленность», 1960, № 1.
59. С т е п а н и щ е в К. П. Номографическое определение оптимальных условий
диализа и электродиализа ферментных растворов. Труды ВНИИФСа.
Вып. XV, 1964.
60. С т е п а н и щ е в К. П. Очистка ферментных растворов методом диализа и
электродиализа. В кн. «Внедрение ферментных препаратов в народное хо-
зяйство». Ч. I. ЦИНТИпищепром, 1961.
61. Степанищев К- П., Шульман М. С. Промышленный электродиали-
затор пленочного типа для очистки ферментных растворов. «Спиртовая про-
мышленность», 1р61, № 5.
62. У р б а н Я. О некоторых вопросах чехословацкой спиртовой промышленно-
сти. «Спиртовая промышленность», 1957, № 6.
63. Underkofler L. Н., Secerson G. М., Guering R. I., Christen-
sen L. Н. «Cereal chem.6. Vol. 24, N 4, 1947.
64. Фен иксов a P. В. Получение концентрированных ферментных препаратов
ЦИНТИпищепром, 1960.
65. Фен иксов а Р. В., Молодо в а Г. А. Получение очищенных ферментных
препаратов из поверхностных культур плесневых грибов. «Микробиология».
Т. XXX. Вып. 3, 1961.
66. Ф е р т м а н Г. И., К а л у н я н ц К. А. Оптимальный режим работы браго-
ректификационных и ректификационных аппаратов. Труды ВНИИСПа.
Вып. VI., 1958.
67. Шумский И. Вакуумные аппараты и приборы химических машин. Маш-
гиз, 1963.
68. Шульман М. С., Демина А. С., Апатцева В. В. Осаждение амило-
литических ферментов плесневых грибов органическими растворителями. В
кн. «Аннотации научно-исследовательских работ ЦНИИСПа», 1960.
69. Ш у л ь м а н М. С., Де м и н а А. С., Апатцева В. В. Влияние химиче-
ской природы органических растворителей на осаждение ферментного комп-
лекса Asp. oryzae. В кн. «Внедрение ферментных препаратов в народное хо-
зяйство». Ч. I. ЦИНТИпищепром, 1961.
70. Шульман М. С., Демчук Т. П. Стандартизация и хранение фермент-
ных препаратов. «Ферментная и спиртовая промышленность», 1966, № 2.
71. Шульман М. С. Повышение степени чистоты ферментных препаратов.
«Спиртовая промышленность», 1962, № 8.
72. Шульман М. С. Уточнение некоторых вопросов технологии ферментных
препаратов. «Спиртовая промышленность», 1963, № 5.
73. Шульман М. С., Апатцева В. В. Влияние электролитов на осаждение
фермента амилазы из гриба Asp. oryzae. Труды ЦНИИСПа. Вып. XII, 1962.
74. Шульман М. С., Апатцева В. В. Об улучшении качества ферментного
осадка. Сб. «Пищевая промышленность (пивоваренная, безалкогольная, ви-
нодельческая, спиртовая и ликеро-водочная)», № 10 (ПО). ЦИНТИпищепром,
1962.
75. Шул ь м а н М. С. Физико-химические основы производства ферментных
препаратов. Изд-во «Пищевая промышленность», 1967.
Глава VI. КУЛЬТИВИРОВАНИЕ МИКРООРГАНИЗМОВ
ГЛУБИННЫМ СПОСОБОМ
ОСНОВНЫЕ ТЕХНОЛОГИЧЕСКИЕ ТРЕБОВАНИЯ
Основным отличием глубинного метода культивирования от по-
верхностного является погружение микроорганизмов в питательную
среду и систематическое выращивание их в таком состоянии. Глу-
бина погружения микроорганизмов колеблется от нуля до 10 м,
однако для каждого микробного тела она непрерывно изменяется
под влиянием массообмена, вызываемого аэрацией, перемешива-
нием мешалками различной конструкции, перемещением газов бро-
жения.
При поверхностном же выращивании микроорганизмы растут
преимущественно на твердом и реже на жидком субстрате в толщи-
не слоя 25—50 мм. Аэрация помещений и растильных камер служит
только для отвода тепла, выделяющегося во время роста плесневых
грибов и бактерий.
Отмеченные различия условий культивирования при выборе
глубинного метода выдвигают дополнительные технологические
требования к обогащению состава питательной среды и ее стериль-
ности, разработке бессальниковой арматуры и герметичных фермен-
таторов с повышенным массообменом и изоляцией их содержимого
при удалении газов брожения от атмосферного воздуха, а также, к
выбору специальных штаммов микроорганизмов, активно разви-
вающихся в погруженном состоянии.
В научно-исследовательских институтах нашей страны проведет
на большая работа по селекции плесневых грибов — продуцентов
ферментов при глубинном способе культивирования. Поскольку
изложение этих исследований не входит в наши задачи, ограничим-
ся перечислением наиболее активных штаммов, принятых в настоя-
щее время в качестве продуцентов ферментов в промышленном
производстве.
Микроорганизмы — продуценты ферментов
Для производства амилолитических ферментных препаратов,
содержащих в основном а-амилазу, принят штамм Asp. oryzae
3-9-15, отселекционированный во ВНИИФСе Е. А. Двадцатовой.
Для производства культур плесневых грибов, обладающих амило-
литическим комплексом ферментов, используемых в спиртовой про-
291
мышленности, применяются штаммы Asp. batatae 4, Asp. niger
species, Asp. usamii 4. Для получения препаратов, содержащих фер-
менты, обладающие глюкоамилазной активностью, принят штамм
Asp. awamori, отселекционированный во ВНИИФСе Р. В. Фениксо-
вой. Препараты, содержащие протеолитический комплекс фермен-
тов, будут производиться при 'выращивании гриба Asp. terricola
3374, а пектолитические ферментные препараты — при выращивании
гриба Asp. awamori 16, отселекционированных во ВНИИФСе. Пре-
параты, содержащие глюкозооксидазу и каталазу, будут вырабаты-
вать при культивировании гриба Penicillium vitale, полученного
Н. М. Пидопличко и В. И. Билай, а препараты, содержащие инвер-
тазу, — из осадочных пивных дрожжей.
Из штаммов бактерий, принятых для производства ферментных
препаратов, следует назвать Вас. diastaticus, продуцирующий
амилолитические ферменты, полученный в Институте микробиоло-
гии АН СССР, и Вас. mesentericus ПБ, отобранный сотрудниками
ВНИИФСа и образующий амилолитические, протеолитические и
сычужные ферменты. f
Получение концентрированных препаратов из глубинных куль-
тур более удобно, чем из поверхностных, так как жидкая питатель-
ная среда содержит меньше балластных веществ. Поэтому фермен-
ты лучше и легче очищаются от них.
Питательные среды
Исследованиями физиологии питания плесневых грибов во
ВНИИФСе выявлено влияние состава питательной среды на хими-
ческие свойства продуцентов гидролаз. Синтез амилолитических,
протеолитических и пектолитических ферментов зависит от форм
азота, находящегося в среде. При выращивании плесневых грибов
на средах с солями аммония требуется тщательная нейтрализация
образующихся в среде анионов.
Выяснена также роль аминокислот в синтезе гидролитических
ферментов. Так, образование активной а-амилазы грибом Asp.
oryzae 3-9-15 наблюдается только в том случае, если в состав пита-
тельной среды входят три моноаминокислоты (метионин, треонин,
серин). Эти же аминокислоты активируют синтез амилолитических
ферментов и у гриба Asp. awamori.
Белковый и минеральный азот по-разному влияют на рост гри-
бов и образование ими ферментов. Полная замена минеральной
формы азота органической (с казеином или продуктами его гидро-
лиза) приводит к значительному повышению протеолитической ак-
тивности в глубинных культурах грибов Asp. terricola и Asp. oryzae
3-9-15.
Различные источники углерода не в одинаковой степени обеспе-
чивают рост аспергиллов. Наилучшими для роста Asp. oryzae,
Asp. niger и Asp. awamori оказались полисахариды — крахмал и
декстрины и дисахарид мальтоза. Объясняется это тем, что поли-
292
сахариды, являясь индуктором синтеза ферментов, одновременно
служат источником углерода для конструктивных процессов. При
оптимальной концентрации азота и углерода в среде не только по-
вышается активность ферментов, но и резко изменяется потребле-
ние грибом питательных веществ среды.
Важную роль в обмене веществ плесневых грибов играют ми-
неральные элементы. Так, синтез активной а-амилазы наблюдается
только при наличии в среде солей серной кислоты, а для роста не-
которых аспергиллов, образующих активную декстриназу или маль-
тазу, необходимо присутствие в среде магния. Отсутствие в среде
солей фосфорной кислоты часто приводит к резкому падению фер-
ментативной активности. Наряду с углеродом и азотсодержащими
веществами немаловажную роль в синтезе гидролаз играет вита-
минное питание.
Изучение физиологических особенностей плесневых грибов
позволяет направленно воздействовать на них в процессе культиви-
рования и получать те ферменты, которые в данный момент пред-
ставляют для нас наибольший практический интерес. В качестве
примера укажем, что культура Asp. oryzae 3-9-15, выращенная на
синтетической среде Чапека с водным экстрактом из солодовых
ростков, обладает только амилолитической активностью и совершен-
но не содержит протеолитических ферментов, однако при культи-
вировании на среде, содержащей в качестве источника азота казеин
или продукты его гидролиза, она обладает в основном протеолити-
ческой активностью.
Способы культивирования
Глубинный метод культивирования основан на выращивании
микроорганизмов, погруженных и равномерно рассредоточенных в
жидкой питательной среде. Обязательным условием глубинного
культивирования является полная стерильность питательной сре-
ды, используемого для аэрации воздуха, ферментаторов, трубо-
проводов и арматуры.
Различают следующие способы глубинного культивирования:
периодический, непрерывно-циклический и непрерывно-проточ-
ный. Периодический способ характеризуется несменяемостью пита-
тельной среды в ферментаторе, состав которой в процессе развития
культуры постепенно изменяется. Процесс протекает постадийно:
в ферментатор набирают раствор всех питательных веществ, за-
дают посевной материал, происходит размножение микроорганиз-
мов и накопление продуктов их обмена, затем зрелую культуру вы-
гружают, а все оборудование и трубопроводы промывают и стери-
лизуют паром.
При непрерывно-циклическом способе микроорганизмы, располо-
женные на неподвижной насадке в ферментаторе, непрерывно омы-
ваются средой, протекающей в замкнутом контуре, до полного
потребления ими питательных веществ среды. После этого зрелую
293
культуру выгружают, аппарат промывают и стерилизуют и цикл
повторают*? Богатая среда в ходе такой циклической ферментации
постепенно истощается; по времени этбт процесс более длителен,
чем периодический.
Метод непрерывного проточного культивирования микроорга-
низмов более совершенен. Суть его в том, что микробная популяция
развивается непрерывно в проточной питательной среде. Непрерыв-
ный метод условно можно разделить на две разновидности: гомо-
генно-непрерывный и градиентно-непрерывный. К первому типу сле-
дует отнести выращивание кормовых дрожжей в одном фермента-
торе, когда при тщательном перемешивании среды и аэрации обес-
печивается одинаковое состояние культуры во всей толще жидкости.
В ферментатор при этом непрерывно поступает свежая среда, а из
него так же непрерывно вытекает избыток культуральной жидко-
сти.
Градиентно-непрерывный метод осуществляется в батарее фер-
ментаторов, соединенных переточными трубами. В -многоступенча-
той батарее засеянная среда с большим содержанием углеводов
и других ингредиентов непрерывно перетекает от ступени к ступени
и так же непрерывно вытекает в виде готовой культуральной жид-
кости.
Непрерывное культивирование в проточных средах позволяет
выращивать микроорганизмы в постоянных и оптимальных для их
возрастных стадий условиях среды. При этом такие важные факто-
ры, как концентрация питательных веществ, содержание продуктов
обмена, значение pH, содержание растворимого кислорода и др.,
резко изменяющиеся при периодическом способе культивирования,
поддерживаются постоянными на заданном уровне или изменяются
по усмотрению оператора.
Начиная с 30-х годов опубликовано много работ, посвященных
вопросам теории и практики непрерывного культивирования микро-
организмов. К важнейшим из них следует отнести работы С. В. Ле-
бедева (1936); Д. Н. Климовского (1932); И. Малека (1943, 1956,
1962); Моно (1949, 1950); Н. Д. Иерусалимского (1953); А. Л. Мал-
ченко (1952, 1958, 1960); Нортропа (1958); С. В. Пыховой (1963);
Б. А. Устинникова (1963).
Первым шагом на пути к внедрению непрерывного культивиро-
вания в промышленном масштабе явился переход на глубинное
культивирование актиномицетов — продуцентов антибиотиков, а
также плесневых грибов в производстве лимонной 'кислоты. В полу-
заводских условиях отработаны регламенты глубинного культивиро-
вания плесневых грибов Asp. oryzae и Asp. niger, — продуцентов
ферментов амилолитического комплекса и пектиназы.
Разработка технологических параметров культивирования пле-
сневых грибов непрерывно-проточным способом только начата, од-
нако первые данные заводских испытаний позволяют сделать вы-
вод, что такой способ повышает производительность ферментаторов
и значительно сокращает общую продолжительность культивиро-
294
вания. Основной трудностью при культивировании непрерывным
способом является поддержание стерильности выращиваемой куль-
туры.
В настоящее время разработаны основные закономерности не-
прерывного культивирования бактерий, которые кратко можно
сформулировать так. С целью предупреждения развития посторон-
ней микрофлоры интенсифицируют накопление биомассы путем
внесения в первый или второй ферментатор батареи большого ко-
личества посевной культуры (50—85% от его объема). Все фермен-
таторы многоступенчатой батареи через строго установленный про-
межутки времени тщательно промывают и последовательно стерили-
зуют паром, не прекращая непрерывного притока свежей среды в
головной ферментатор и выхода зрелой культуры из последнего в
ряду (хвостового) ферментатора. Нарушение принципа самотека
при последовательном отключении каждого ферментатора на про-
филактическую стерилизацию компенсируется искусственными прие-
мами перемещения культуральной жидкости (насосом, пневмати-
чески). Этим устраняются и вредные последствия задержек старой
жидкости, обусловленных неравномерностью перемещения питатель-
ной среды и культуральной жидкости по батарее.
Стерильность проточной среды поддерживать значительно труд-
нее, чем стационарной. Это связано с общей неравномерностью
движения жидкости при непрерывном ее перемещении в одноступен-
чатой и многоступенчатой системах. За каждый оборот сосуда, т. е.
за время, когда содержащаяся в нем среда (старая жидкость),
сменяется таким же объемом притекающей среды (новой жид-
кости), последняя проскакивает через этот сосуд, потому что неко-
торая часть первой задерживается. Объем задержек старой жид-
кости в сосуде всегда равен объему проскока, и для случая идеаль-
ного перемешивания и турбулентного движения он составляет около
36%, а для ламинарного — меньше 25% от объема сосуда за один
его оборот.
Проскакивающая часть среды находится в реакционной зоне
меньше расчетного времени, поэтому в данном случае не достигается
ее стерильность, и для компенсации в схему вводится дополнитель-
ный аппарат, выдерживающий эти проскоки в течение заданного
времени. Задерживающаяся часть среды, наоборот, остается в
реакционной зоне больше расчетного времени и в ней соответствен-
но глубже протекают гидролитические процессы и, следовательно,
больше изменяется состав; в частности, при культивировании микро-
организмов интенсифицируется развитие посторонней микрофлоры,
сопровождающееся потерей углеводов, физиологическим старением
клеток в этой зоне и др.
Таким образом, возможные последствия, связанные с этой нерав-
номерностью перемещения среды при переходе от стационарных к
проточным или непрерывным формам движения жидкости, необхо-
димо учитывать априори.
295
Режимы культивирования
Выращивание посевного материала и производственной куль-
туры проводится при условиях, оптимальных для данного вида куль-
тивируемого микроорганизма.
Ниже приводятся некоторые характеристики процессов при полу-
чении различных культур микроорганизмов с определенной катали-
тической активностью.
Основой для разработки оптимальных технологических режимов
культивирования продуцентов ферментов служило предварительное
определение параметров процесса: температуры выращивания; pH
среды и готовой культуры, необходимого количества воздуха, пода-
ваемого в процессе роста посевной и производственной культуры,
температуры этого воздуха и способов его очистки, длительности
выращивания посевной и производственной культур, давления в
ферментаторах и инокуляторах и методов перемешивания питатель-
ной среды в процессе выращивания.
Рост микроорганизмов сопровождается потреблением питатель-
ной среды, молекулярного кислорода, вводимого с воздухом, выде-
лением в среду продуктов жизнедеятельности, ценообразованием,
изменением вязкости субстрата и другими явлениями. Интенсив-
ность процесса массообмена в двухфазной системе жидкость — газ
определяется гидродинамическими условиями, а такяНЬ парциаль-
ным давлением компонентов газа и физико-химическими свойствами
жидкой фазы: ее вязкостью, плотностью и поверхностным натяже-
нием.
Перемешивание питательной среды в процессе выращивания
микроорганизмов имеет важное значение и может быть организо-
вано по-разному: путем подачи в аппарат только воздуха, с по-
мощью мешалок специальной конструкции, совместным действием
аэрации и перемешивания мешалками, а также действием только
газов брожения.
Работами ВНИИФСа установлено, что для успешного выращи-
вания плесневых грибов среду необходимо перемешивать воздухом
и мешалкой, работающей непрерывно в течение всего цикла выра-
щивания. Конструкции перемешивающих и аэрирующих устройств,
применяемых при глубинном культивировании, изучались Н. М. Сер-
геевой. Интенсивность перемешивания и аэрации в ферментаторах
характеризовалась временем полного насыщения субстрата кисло-
родом. Количество растворенного кислорода определялось поляро-
графическим методом. Для контроля ставились опыты культивиро-
вания на той же среде в колбах на качалке.
Экспериментальные данные (рис. 65) показывают, что полное
насыщение субстрата (фильтрата зерновой барды) в колбе на ка-
чалке наступало через 90 мин, в ферментаторе с форсуночным
подводом воздуха — через 100 мин, тогда как в ферментаторе с
лопастной мешалкой и форсуночным подводом воздуха всего через
15 мин.
296
Зависимость количества растворенного кислорода в среде от
типа аэрирующего устройства можно проследить по графику
(рис. 66). В ферментаторах с лопастной мешалкой при подаче
воздуха через барботер или форсунки в течение всего процесса
культивирования (54—60 ч) в растворе находилось от 0,8 до 3 мг
избыточного кислорода на 1 л, что указывает на пригодность при-
мененных в данном опыте устройств.
Рис. 65. Зависимость времени насыщения раствора ки-
слородом от типа перемешивающего устройства:
/ — лопастная мешалка с форсуночным подводом воздуха, 2 —
колба на качалке; 3 — форсуночный подвод воздуха
Рис. 66. Зависимость количества растворенного кислоро-
да в среде от типа аэрирующего устройства:
/—лопастная мешалка с барботером; 2—лопастная мешалка с
форсуночным подводом воздуха; 3 — форсуночный подвод воз-
духа ( 3 шт. </ = 6 мм).
При выборе перемешивающих и аэрирующих устройств и оцен-
ке их эффективности пользуются следующими показателями: вре-
менем смешения, коэффициентом массопередачи, величиной по-
верхности фазового контакта, временем растворения кислорода и
расходом энергии.
297
Основным показателем эффективности перемешивания и аэри-
рования при глубинном культивировании продуцентов ферментов
служит ферментативная активность культуры, величина которой
всегда учитывается при выборе конструкций перемешивающих
устройств (табл. 28).
Таблица 28
Показатели работы ферментаторов с различной системой перемешивания
и аэрации
Система перемешивания и аэрирова- ния Ферментативная активность Asp. batatae при выращива- нии на зерно-картофельной t барде, £0/100 мл Удельный расход на 1 м* субстрата
воздуха, м*!ч электроэнер- гии, квт-ч
ДС АС
Пневматическое перемешивание
через 3 форсунки 0 6 мм 1427 30,1 8,2 0,41
через 7 форсунок 0 5 мм 1390 30,4 10,1 0,51
через 4 форсунки 0 & мм 1398,5 23,5 11,0 0,55
•Лопастная мешалка и 3 фор- сунки 0 6 мм 2113 42,3 8,0 1,6
Роторная мешалка 1295,6 22,0 3,0 0,58
Лопастная мешалка и барбо- тер 2251 63,5 49,0 3,5 '
Направляющий цилиндр и 4 форсунки 0 6 мм 1254 16,5 14,7 0,75
Барботер 1428 29 49,5 2,3
Из данных этой таблицы ясно, что наиболее высокая фермен-
тативная активность достигается при использовании ферментато-
ра с лопастной мешалкой при подаче воздуха через барботер или
форсунки, причем применение форсунок позволяет сократить рас-
ход электроэнергии в два и более раз по сравнению с подачей
воздуха через барботер.
Культивирование плесневых грибов, обладающих
' а-амилазной активностью
Состав среды для глубинного культивирования гриба Asp.
oryzae 3-9-15, продуцирующего амилолитические ферменты, изло-
жен в главе III.
Плесневой гриб Asp. oryzae 3-9-15 необходимо культивировать
при температуре 30—32°С. Несоблюдение температурного режима
приводит к снижению ферментативной активности в готовой куль-
туре. Воздух, подаваемый для аэрации питательной среды, должен
298
быть микробиологически чистым и иметь температуру не выше 40°С.
Количество воздуха для гриба Asp. oryzae должно составлять
30 л«3 на 1 mz аэрируемой жидкости в час для инокулятора и
40 л«3 для ферментатора.
При указанных режимах посевной материал Asp. oryzae
3-9-15 выращивается в инокуляторах в течение 48 ч, а производст-
венная культура гриба — в производственных ферментаторах около
48—52 ч. Посевной материал вносят в ферментатор в количестве
8—10% к объему питательной среды. Увеличение количества по-
севного материала сокращает сроки выращивания производствен-
ной культуры, однако экономические расчеты эффективности
длительного использования этого приема в заводских условиях
еще не проведены.
Микробиологическая чистота посевного материала и произ-
водственной культуры в процессе выращивания достигается теп-
ловой стерилизацией среды, установлением избыточного давления
в растильных аппаратах на уровне 0,4—0,5 ат и тщательной очист-
кой подаваемого в них воздуха.
Рис. 67. Потребление азота и крахмала; дина-
мика 1накопления амилазы на среде Чапека
с (NH4)2SO4:
с 2% крахмала: 1 — активность амилазы; 2 — пЬтреб-
ление азота; 3 — потребление крахмала; с 6% крах-
мала — соответственно /а, 2а, За
Оптимальная продолжительность выращивания гриба Asp.
oryzae и влияние источников органического азота и pH среды на
образование амилазы были исследованы Е. А. Двадцатовой. Ре-
зультаты этих исследований иллюстрируются графиками (рис.67)
и данными табл. 29. Кривые рис. 67 показывают, что активность
299
амилолитического комплекса достигает максимума на третьи
сутки.
Таблица 2Э
Влияние органических источников азота и pH среды на образование
амилазы грибами Asp oryzae 3*9-15 и Asp. oryzae 153
Источники азота Штамм гриба Asp. oryzae Активность ед. АС/100 мл pH среды
JNH4)2SO4 153 93,1 6,9
То же-1-солодовые ростки 153 11,5 6,8
То же 3-9-15 195,00 6,4
NaNCb 4-солодовые ростки 153 Следы 7,4
То же- 153 180 8,1
» 3-9-15 Следы 6,8
NH4NO3 3-9-15 360 7,6
То же 4-солодовые ростки 153 Следы 6,2
То же 153 Следы 7,2
» 3-9-15 6 5,8
» 3-9-15 165 7,2
(NH4)2HPO4 153 Следы 7,0
То же 4-солодовые ростки 153 Следы 5,6
То же 3-9-15 95 7,1
» 3-9-15 225 6,4
Приведенные данные показывают, что фосфорнокислый аммо-
ний является таким же хорошим источником азота для образования
амилазы, как и азотнокислый. pH питательной среды должен
быть в пределах 6,0—7,0. Изменение этой величины приводит к
снижению образования ферментов в процессе культивирования
гриба Asp. oryzae 3-9-15. Мицелий гриба, который является отхо-
дом при производстве ферментов, может быть использован в ка-
честве заменителя источника азота в питательной среде. Выращи-
вание гриба на среде с мицелием или его гидролизатом обеспе-
чивает образование амилолитических ферментов на том же уров-
не, что и на среде Чапека с солодовыми ростками, причем для син-
теза активных молекул амилазы, как указывалось ранее, необхо-
димо одновременно присутствие в среде метионина, серина и
треонина.
Культивирование плесневых грибов, обладающих
комплексом амилолитических ферментов,
на зерно-картофельной барде
В ходе установления технологических napaMetpoB выращива-
ния культур грибов рода Aspergillus для использования их в спир-
300
товой промышленности было разработано несколько режимов, ко-
торые непрерывно совершенствовались. В настоящее врейя при-
меняются 3 отличных один от другого технологических режима:
периодический, переточный и непрерывнопоточный.
Периодический способ. При этом способе культивирования
оптимальная температура выращивания находится в пределах
30—ЗГС. Изменение ее приводит к уменьшению ферментативной
активности в готовой культуре. Срок культивирования плесневых
грибов установлен в пределах 68—72 ч при расходе воздуха
10—12 м3/м3 среды в час. Экспериментально установлено, что при
увеличении срока культивирования сверх принятой нормы наблю-
дается лишь незначительное повышение активности культуры, в
связи с чем увеличение срока экономически нецелесообразно. Оп-
тимальный возраст посевной культуры 24—30 ч, температура вы-
ращивания ее 30—ЗГС. Расход посевного материала 10% к объе-
му питательной среды. В ходе культивирования pH среды изме-
няется в пределах 5,5—6,0. Выращенная при таком режиме куль-
тура гриба обладает амилолитической активностью 30—40 ед. и
декстринолитической активностью 1300—1400 ед. на 100 мл фильт-
рата.
В. В. Вяткин установил, что синтез амилолитических фермен-
тов грибом значительно отстает по времени от накопления био-
массы. Так, за сутки роста в глубинных условиях прирост биомас-
сы составляет около 50%, а фермента амилазы за это время синте-
зируется только 20% от общей ее активности. Отмечено также,
что в проточной среде прирост мицелия значительно больше, чем
в стационарных* условиях. Эти факты имеют значение для даль-
нейшего совершенствования методов глубинного культивирования
плесневых грибов.
Переточный способ. При таком способе грибную культуру вы-
ращивают 24 ч в ферментаторе-генераторе при температуре
30—ЗГС, после чего открывают переток частично выращенной
культуры в следующий ферментатор с одновременным заполне-
нием генератора свежей стерильной питательной средой.
Заполненный культурой второй ферментатор отключают для
окончательного доращивания культуры до зрелого состояния.
Такой способ позволяет длительно получать в генераторе мо-
лодую культуру гриба, доращиваемую периодическим способом в
другом ферментаторе, заполнение которого длится 8 ч, а оконча-
тельное доращивание 30 ч, и тем самым значительно сократить
срок культивирования по сравнению с периодическим способом.
Непрерывнопоточный способ. Выращивание проводится в ба-
тарее ферментаторов, соединенных переточными трубами, при тем-
пературе 30—ЗГС. Выращенная в инокуляторе посевная культу-
ра поступает в головной ферментатор, куда подается также сте-
рильная питательная среда в течение 24—30 ч. Расход посевной
культуры на засев среды в головном ферментаторе составляет
40,0% от его объема. Внесение меньшего количества посевной
301
культуры приводит к снижению скорости культивирования в этом
ферментаторе и к дальнейшему снижению мощности всей батареи.
По заполнении первого ферментатора культура, самотеком начинает
перетекать во второй и т. д. Из хвостового ферментатора выходит
готовая культура гриба с регламентной активностью.
Культивирование плесневых грибов, обладающих
глюкоамилазной активностью
Проведенными в 1960 г. во ВНИИФСе работами (Р. В. Феник-
сова, А. А. ^Шилова) было показано, что плесневой гриб Asp.
awamori 22, культивируемый глубинным способом на синтетиче-
ских средах Чапека, является хорошим продуцентом мальтазы и
Рис 68. Динамика образования ферментов
на синтетической среде в глубинной куль-
туре Asp. awamori:
1 — ДС; 2 — АС; 3 — МС; 4 — pH среды
декстриназы (рис. 68). Максимальное образование мальтазы на
оптимальной среде (среда Чапека с 6% крахмала) наблюдается
на третьи сутки при pH 8.
Накопление ферментативной активности в процессе культиви-
рования зависит от величины pH и содержания кукурузной муки
в питательной среде (рис. 69).
Посевная культура наилучшим образом растет при температу-
ре 28—30°С в течение 48 ч при pH среды 7,0—7,2, а производст-
венная культура— в течение 52 ч (и более) при температуре
30—32°С; при нормальных условиях роста pH глубинной куль-
туры к концу выращивания составляет 7,6—8,0.
302
Интересно отметить, что при выращивании гриба Asp. awamori
в глубинных условиях на средах с минеральным азотом протеоли-
тические ферменты не образуются.
Рис. 69. Образование декстриназы и мальтазы грибом Asp. awamori 22:.
а — в зависимости от pH; б — в зависимости от содержания кукурузной муки в среде;
1 - ДС; 2 - МС
Культивирование плесневых грибов, обладающих
протеолитической активностью
Плесневой гриб Asp. terricola штамм 3374 в настоящее время
является наиболее активным продуцентом протеазы при глубин-
ном культивировании. Активность его в 1,5 раза больше, чем
штамма Asp. oryzae 153. Оптимальная протеолитическая актив-
ность Проявляется при температуре 40°С и pH 5—8.
Этот штамм является сильным кислотообразователем,. и ак-
тивность его в значительной степени зависит от pH среды. Для
поддержания слабокислой или нейтральной реакции среды в про-
цессе культивирования гриба в среду вводится углекислый каль-
ций.
Проведенными во ВНИИФСе исследованиями (Н. В. Попова)
установлено, что гриб Asp. terricola образует активные протеоли-
тические ферменты в широком диапазоне pH среды, но оптималь-
ная величина pH лежит в границах 6,2—6,4; при нормальных ус-
ловиях культивирования pH готовой культуры не должен быть
ниже 4,0. Выращивание производственной культуры гриба целе-
сообразно вести в течение 48 ч при температуре 30°С, при непре-
рывной работе мешалки в ферментаторе и непрерывной аэрации
выращиваемой культуры обеспложенным воздухом в количестве
60 м3 на 1 л<3 среды в час.
303
Протеолитическую активность культуры гриба Asp. terricola
можно повысить (Новотельное Н. В. и Кузнецова В. И.), добав-
ляя к питательной среде отходы пивоваренного производства,
содержащие лизингордециновый комплекс (0,5% к объему среды).
Культивирование плесневых грибов, обладающих
пектолитической активностью
Во ВНИИФСе в 1964—1965 гг. изучались (Л. А. Херсонова)
вопросы, связанные с культивированием плесневого гриба Asp.
niger П — продуцента пектолитических ферментов.
Продолжительность выращивания, ч
Рис. 70. Динамика накопления пектолитической
активности в культуральной жидкости:
1 — ПкА; 2 — pH; 3 — биомасса; 4 — сухие вещества
Рис. 71. Изменение состава среды в процессе
выращивания:
/ — общий азот; аммиачный азот; 3— редуцирую-
щие вещества; 4 — аминный азот
Изменение состава среды в процессе роста гриба можно про-
следить по графикам рис. 70 и 71.
304
Пектолитическая активность культуральной жидкости достига-
ет максимума к 65—72-му часу выращивания и составляет в
среднем 30 ед)мл. Гриб энергично потребляет редуцирующие ве-
щества среды и к 72-му часу в 1 мл среды их остается около 2 мг;
pH среды
а
Рис. 72. Зависимость активности пектолитических
ферментов культуральной жидкости от исходного
значения pH среды и от возраста и количества посев-
ного (материала:
а — зависимость от pH; 1 — ПкА; 2 — сухой вес мицелия;
б — зависимость от возраста; /—2% посевного материала;
2-4%; 3 — 6%; 4-8%; 5-10%
общий и аммиачный азот используются к 48—60-му часу в среднем
на 50%; к 72-му часу в среде остается 0,07% растворимого пекти-
на, а протопектин не обнаруживается.
Активность пектолитических ферментов, продуцируемых гри-
бом, зависит от исходного значения pH среды и возраста посев-
ного материала (рис. 72). Исходное значение pH среды от 6 до 7,5
20—826 305
оптимально для синтеза пектолитических ферментов. Применение
в качестве посевного материала мицелия 24-, 32- и 42-часового
возраста обеспечивает максимальную концентрацию ферментов в
1 мл культуральной жидкости, равную в среднем 30 ед. В эт®м
случае изменение количества посевного материала от 2 до 10%
не влияет существенно на величину пектолитической активности.
За последние 2 года во ВНИИФСе разработана технология и
режим культивирования нового пектолитического штамма Asp.
awamori 16 глубинным способом. Питательная среда для этого
штамма содержит свекловичный жом, солодовые ростки, сернокис-
лый аммоний, сернокислый магний и однозамещенный фосфат
кальция. Для засева среды в инокуляторе необходимо использо-
вать посевной материал (4—6% от объема инокулятора), выра-
щенный в лаборатории в колбах на качалке. Температура выра-
щивания должна быть 30°С, pH среды перед засевом в пределах
5,0—6,0. При нормальных условиях роста конечный pH среды
должен быть 4,8—5,0. Длительность культивирования посевного
материала в инокуляторе 30 ч, а в производственном фермента-
торе 65 ч. В питательную среду для производственных фермента-
торов во избежание пенообразования добавляется растительное
масло.
Культивирование бактерий, обладающих
амилазной, протеазной и сычужной активностью
Во ВНИИФСе и Институте биохимии им. А. Н. Баха АН СССР
разработаны оптимальные условия образования амилазы в глу-
бинной культуре Вас. subtilis. Известно, что амилаза Вас. subtilis
относится к характерным экзоферментам: в процессе культивиро-
вания практически весь фермент, синтезируемый клеткой, накап-
ливается в культуральной жидкости.
Исследование динамики образования амилазы на различных
средах (рис. 73) показало, что на вытяжке из отрубей амилаза
синтезировалась очень медленно и на 4-е сутки роста бактерий
количество ее было меньше, чем на соевой среде. Наибольшее коли-
чество амилазы на соевой среде, предложенной Номура, обра-
зуется на третьи сутки роста бактерий, но уже через двое суток
синтезируется 80% ее.
Положение о том, что 80—85% амилазы и 90—95% протеазы
синтезируется за двое суток, подтвердилось в дальнейшем и на
других питательных средах, в частности на таких, основным ком-
понентом которых является кукурузная мука. Поэтому оптималь-
ная длительность выращивания бактерий Вас. suetilis на жидкой
питательной среде глубинным способом может быть в пределах
двух суток.
Исследование процесса стерилизации питательной среды мето-
дом раздельной тепловой обработки отдельных компонентов ее по-
казало положительное влияние такого технологического приема —
306
протеолитическая активность культуральной жидкости при этом
повышалась на 3Q%.
Во ВНИИФСе разработаны также'оптимальные режимы вира*
щивания Вас. mesentericus глубинным способом (А. А. Юлиус) с
целью получения препарата, обладающего амилолитической, про*
теолитической и сычужной активностью. В процессе исследований
выяснялись параметры оптимальных условий культивирования: pH
питательной среды, температура и продолжительность выращива-
ния, количество посевной культуры.
Рис. 73. Динамика накопления амилазы глу-
бинной культурой Вас. subtilis на соевой среде
и вытяжке из отрубей:
1 — АС; 2 - pH
Бактерии группы Вас. suetilis — mesentericus являются хоро-
шими продуцентами как амилолитических, так и протеолитических
ферментов. При подборе питательной среды для них необходимо
изыскать такие источники азота, которые в процессе жизнедея-
тельности бактерий способствовали бы накоплению ими фермен-
тов. Вас mesentericus относится к группе бактерий, способных
использовать углеродный скелет аминокислот, составляющих бел-
ки, отщепляя аммиак, и усваивать аммонийный азот минеральных
солей. Е. Н. Дислер нашла, что Вас. mesentericus 7Ш растет на
аспарагиновой, глютаминовой кислотах, аргинине, пролине и ала-
нине, причем каждая из них была единственным источником уг-
лерода и азота.
Из исследованных во ВНИИФСе 14 культур группы Вас. subti-
lis — mesentericus наибольшей протеолитической активностью об-
ладал штамм Вас. mesentericus ПБ-8. Возраст посевного матери-
ала был установлен 18 ч.
307
Исследования температурного режима показали, что темпера-
тура выше 37°С приводит к снижению активности получаемой куль-
туры, а ниже 37°С — к удлинению сроков выращивания. Таким об-
разом, в качестве оптимальной для посевного материала и произ-
водственной культуры установлена температура 37°С.
, Одним из факторов, сильно влияющих на активность культу-
ральной жидкости, является pH питательной среды (рис. 74).
Рис. 74. Графическая зависимость биосинтеза про-
теолитических 1, амилолитических 2 и сычужного
ферментов 3 от pH среды.
Оптимальное для биосинтеза ферментов начальное значение
pH находится в пределах 7,0—7,8, а конечное 6,3—6,9. Изменение
начального pH выше 7,5 или ниже 7,0 уменьшает скорость синте-
за ферментов, а при pH 8,8—9 культура почти не развивается.
Оптимальная зона pH для синтеза амилазы находится в преде-
лах 6,8—7,5, для протеазы 7,0—7,8. Максимальное накопление сы-
чужного фермента происходит при начальном значении pH среды
в пределах 6,5—7,5. pH культуральной жидкости зависит от ком-
понентов питательной среды; так, при использовании в среде
крахмала, кукурузного и соевого экстрактов среда подкисляется
до благоприятных для образования ферментов значений pH, а
при использовании кукурузной муки и солей среда может незна-
чительно подщелачиваться, что, однако, не влияет резко на обра-
зование ферментов.
308
ПРОЦЕССЫ И АППАРАТУРА ДЛЯ ГЛУБИННОГО КУЛЬТИВИРОВАНИЯ
Процесс приготовления глубинной культуры микроорганизмов,
содержащей ферменты, состоит из нескольких стадий: растворения
составных частей питательной среды в воде, стерилизации пита-
тельной среды, охлаждения ее, Выращивания посевного материа-
ла, выращивания производственной культуры микроорганизмов.
Подготовка и стерилизация жидких питательных сред
Питательную среду для глубинного культивирования микроор-
ганизмов готовят путем растворения отдельных компонентов ее
в воде.
Иногда в процессе подготовки питательной среды воду нагре-
вают до определенной температуры.
В некоторых случаях практикуют частичное разжижение крах-
мала, являющегося компонентом среды, путем введения расчетно-
го количества препарата, содержащего а-амилазу.
Стерилизацию подготовленной питательной среды проводят
путем нагрева ее до температуры 130°С и выдерживания при этой
температуре определенное время, что зависит от вида микроорга-
низма, длительности его культивирования и принятой температуры.
Иногда некоторые компоненты питательной среды стерилизуют
раздельно, чтобы избежать протекания нежелательных реакций.
Для подготовки жидких питательных сред, их стерилизации
и культивирования микроорганизмов глубинным способом нет ти-
пового оборудования, поэтому все операции проводят в специально
разработанной аппаратуре.
Аппараты для подготовки и стерилизации
жидких питательных сред •
Жидкую питательную среду для посевных аппаратов (иноку-
ляторов) и производственных ферментаторов готовят в смесите-
лях.
Смеситель представляет собой вертикальный цилиндрический
аппарат, снабженный паровой рубашкой. Внутри него располо-
жена трехлопастная пропеллерная мешалка, приводимая во вра-
щение от электродвигателя через редуктор. На сферической крыш-
ке аппарата расположены люк для загрузки сырья, штуцеры для
воды, пара, приборов контроля и смотровые окна. В днище аппа-
рата имеется спускной штуцер. Рабочий объем смесителя прини-
мается равным 0,7—0,75 объема инокулятора или ферментатора
(смотря по назначению).
Стерилизатор питательной среды (применительно к установке
производительностью 30 м? культуры в сутки) состоит из двух
последовательно соединенных аппаратов: подогревателя и выдер-
живателя.
309
Техническая характеристика смесителей питательной среды к установке
производительностью 30 м3 культуральной жидкости в сутки
Для фермента- тора Для инокулятора
Объем аппарата, л<3 . . . . 16 2,65
Диаметр, мм 3000 1400
Высота, мм 3345 1960
Материал аппарата Давление в рубашке, Ст.З Ст. 3
ат 1 1
кн/м2 . 98,1 98,1
Скорость движения мешалки, об/мин Электродвигатель 180 180
тип АО-62-4 АО-42-6
мощность, кет число оборотов в минуту 10 1,7
1440 930
Подогреватель среды непрерывного действия (рис. 75)
представляет собой цилиндрический аппарат диаметром 159 и дли-
Рис. 75. Подогреватель среды непрерыв-
ного действия:
i — штуцер для выхода культуральной жид-
кости, 2 — стакан; 3 — трубка перфорирован-
ная; 4—корпус; 5— штуцер для входа пара;
б — штуцер для входа питательной среды.
ной 400 мм, внутри которого
расположена перфорированная
труба диаметром 112 и длиной
290 мм с 240 отверстиями диа-
метром 2 мм. От 30 до 130° С
среду нагревают острым паром
давлением 4 ат (392 кн/м2).
Производительность подогре-
вателя 9’ мР/ч при скорости
движения среды в нем
0,33 м/сек. Из подогревателя
среда поступает в выдержива-
тель, где в течение определен-
ного времени сохраняется тем-
пература стерилизации.
Выдерживатель непре-
рывного действия состоит из
восьми-десяти вертикальных
труб диаметром 325/289 и вы-
сотой 4000 мм, соединенных по-
следовательно. Поверхность
труб для сохранения темпера-
туры стерилизации покрывают
слоем теплоизолирующего ма-
териала. Скорость движения
питательной среды принимает-
ся равной 2 м/мин из расчета
пребывания в нем среды в те-
чение 15 мин.
310
Техническая характеристика выдерживателя
Емкость, м3......................................... 2,3
Производительность, м3/ч.............................. 9
Длительность выдерживамия, мин ..... 15
Температура стерилизации, °C........................ 130
Избыточное рабочее давление:
ат............................................... 3
кн/мг . . 294,3
Установка для непрерывной стерилизации жидких сред. Разра*
ботанная Гипромедпромом установка состоит из приемника несте-
рильной среды, фильтров из нержавеющей проволочной сетки для
очистки среды от возможных включений размером более 0,8 мм,
вихревого насоса для подачи среды, нагревателя-стерилизатора,
выдерживателя среды в потоке при температуре стерилизации,
крана для отбора проб после выдерживателя, теплообменника
( труба в трубе) для охлаждения стерильной среды и приборов
контроля и автоматического регулирования.
Нагреватель-стерилизатор состоит из цилиндрического корпуса,
крышки и двух сопел. Корпус имеет штуцеры для тангенциально-
го ввода среды через щель размером 2X200 мм и водяного пара
через конические сопла, конусность которых 12—15°. Каждое соп-
ло имеет центральное выходное отверстие диаметром 12 мм и по
5 барботажных отверстий диаметром 6 мм, расположенных парал-
лельно оси сопла.
Питательная среда повышенной концентрации ( с учетом пос-
ледующего разведения ее конденсатом при нагреве острым паром
в процессе стерилизации) из приемника через фильтр непрерывно
нагнетается' насосом в нагреватель, куда одновременно подается
водяной пар. Мгновенный нагрев среды до температуры стерили-
зации происходит в нагревателе за счет теплоты конденсации па-
ра.
Тангенциальный ввод среды и пара в нагреватель обусловли-
вает интенсивное их смешивание и улучшает условия конденсации
пара при бесшумной работе.
В результате конденсации пара происходит разбавление среды,
степень которого колеблется в пределах 10—25%.
Среда, нагретая до заданной температуры стерилизации, пос-
тупает в выдерживатель.
Непрерывно двигаясь через выдерживатель и находясь прд оп-
ределенным давлением, среда сохраняет приобретенную в нагре-
вателе температуру в течение времени, необходимого для ее пол-
ной стерилизации. Объем выдерживателя рассчитан таким обра-
зом, что обеспечивает время выдерживания среды в потоке при
температуре стерилизации. Из выдерживателя стерильная среда
по заранее простерйлизованным коммуникациям поступает в теп-
311
лообменник, где охлаждается оборотной водой, и направляется в
стерильный ферментатор.
Контролируемыми параметрами установки являются: уровень
среды в приемнике и ее температура в приемнике, нагревателе и
на выходе из выдерживателя, давление пара, среды после насоса
и на выходе из выдерживателя, а также скорость подачи среды в
нагреватель.
Регулируемыми параметрами являются: температура среды в
нагревателе и давление среды на выходе из выдерживателя.
Подогреватель и стерилизатор среды для инокулятора имеют
аналогичную конструкцию и рассчитаны на подогрев и стерилиза-
цию среды в количестве 10% от объема производственного фер-
ментатора. Стерильная питательная среда до поступления в фер-
ментатор охлаждается в теплообменнике типа «труба в трубе» от
130 до 30°С. На Мичуринском экспериментальном ферментно-
спиртовом заводе для подогрева и стерилизации барды при 130°С
установлены решоферы и выдерживатели. Барда движется по
трубкам решофера, а между трубками находится пар давлением
3—4 ат (294—392 кн/м2).
Техническая характеристика решофера
Производительность, м3/ч............................ 1,5
Общая поверхность нагрева трубок, м2 . . . 3
Температура среды, °C:
начальная........................................ 50
конечная........................................ 130
Диаметр, мм.......................................... 485
Высота, мм.......................................... 2800
Масса, кг............................................ 413
Техническая характеристика выдерживателя
Объем, м3.............................. 0,45
Диаметр трубы, мм....................... 200
Высота, мм............................. 3000
Расстояние между осями труб, мм .... 500
Продолжительность выдерживания среды, мин . 45
Питательная среда после стерилизации охлаждается от 130 до
30°С в инокуляторе с водяной рубашкой за 1,5—2 ч или в ороси-
тельном теплообменнике.
Выращивание посевной культуры
Стерильную посевную культуру гриба выращивают в аппарате,
называемом инокулятором. Питательную среду в инокуляторе за-
севают конидиями плесневых грибов.
312
Инокулятор (рис. 76) представляет собой вертикальный цилин-
дрический аппарат со сферическим днищем и крышкой. На крыш-
ке аппарата расположены штуцеры для загрузки питательной сре-
ды, посевного материала, воздуха, трубы для передавливания,
Рис. 76. Инокулятор КБ
ВНИИФСа:
1 — корпус; 2 — аэратор; 3 — лаз;
4 — гильза для термометра; 5 —во-
дяная рубашка; 6 — диффузор; 7 —
водяная рубашка диффузора; 8 —
спускной штуцер; 9 — труба для пе-
редавливания; 10 — штуцер для за-
грузки; 11 — штуцер для выхода
воздуха; 12 — пробоотборник; 13
смотровое окно; 14 — штуцер для
манометра.
смотровые окна и герметически закрывающийся лаз. Аппарат сна-
бжен водяной рубашкой для отвода тепла, выделяемого микроор-
ганизмами в процессе роста. Внутри него расположен аэратор,
раструб розетки которого сопряжен с нижним конусом, образуя
щелевой проход для выхода воздуха высотой 1,5 мм. Непрерывная
циркуляция аэрируемой среды достигается с помощью диффузора.
При аэрировании масса непрерывно циркулирует, поднимаясь
вверх по диффузору и переливаясь через его верхнюю кромку, а
затем по кольцевому пространству между стенками корпуса и
диффузора направляется вниз.
К инокулятору предъявляются повышенные требования в части
герметичности как самого аппарата, так и его сварных швов, флан-
цевых соединений и арматуры. «Слезинки» и потение сварных
швов при гидравлическом испытании на прочность не допускаются,
так как попадание воды может вызывать инфицирование содержи-
мого. Аппарат считается герметичным, если при дополнительном
(помимо гидравлического) испытании инертным газом или воз-
духом на рабочее давление падение давления за 1 ч не превыша-
ет 0,25%.
315
Техническая характеристика инокулятора для ферментатора
общим объемом 40 м3
Диаметр, мм....................................... 1900
Высота, мм......................................... 3020
Объем, м3............................................ 5
Материал аппарата...............................Сталь 1Х18Н9Т
Рабочее давление, кн]м2:
в аппарате.............................’ . . 186,2
® рубашке...................................... 98,1
Скорость воздуха у 'розетки аэратора, м!сек . 14
Масса, кг.......................................... 1900
Сумским машиностроительным заводом им. Фрунзе серийно
изготавливаются инокуляторы конструкции Г ипромедпрома
Рис. 77. Инокулятор Гипромедпрома:
J — электродвигатель, 2—редуктор; 3 — барботер; 4 — гильза для термометра; 5 — вал с
мешалкой, 6 — штуцер для выхода конденсата или входа охлаждающей воды; 7 — труба
для взятия пробы; 8 — штуцер для входа пара или выхода охлаждающей воды; 9 — труба
для передавливания.
(рис. 77). Для аэрации среды в нем применен барботер с отверсти-
ями диаметром 2 мм, для перемешивания — двухъярусная лопаст-
ная мешалка, а для выгрузки готовой посевной культуры — тру-
ба для передавливания.
314
Техническая характеристика инокулятора Гипромедпрома
Объем, м3.................................... 2
Материал......................................Сталь 1Х18Н9Т
Внутренний диаметр, мм.................... . 1200
Высота, мм............................ 3870
Допускаемое давление:
ат......................................... 3
кн/м2...................................... 294,3
Допускаемое разрежение, н/м2............... 133
Поверхность теплообмена рубашки, м2 . . . 7,0
Расход воздуха при барботаже, м3!м3 среды в минуту 2
Масса, кг................................. 1800
Электродвигатель типа АО-51-4:
мощность, кет............................. 4,5
число оборотов в минуту............... 1500
Выращивание производственной культуры
При выращивании производственной культуры питательную
среду засевают посевным материалов из инокуляторов.
Аппараты, в которых проводится глубинное культивирование
продуцентов ферментов, называют ферментаторами.- К ним предъяв-
ляются высокие технические требования в части герметичности,
плотности сальника у вала, люков, фланцевых соединений и вы-
полнения всех сварных швов. Для обеспечения стерильного про-
ведения процесса в аппарате постоянно поддерживается избыточ-
ное давление в пределах 0,5 ат (49 кн/м2), что исключает возмож-
ность проникновения инфекции.
При культивировании микроорганизмов глубинным способом
используют ферментаторы, различные по типоразмерам, конструк-
ции и способам аэрирования.
Ферментатор с подводом воздуха через барботер представляет
собой вертикальный цилиндрический аппарат, изготовленный из
нержавеющей стали, снабженный пароводяной рубашкой и закры-
тый сферической крышкой. Внутри него расположен вал с ло-
пастной мешалкой, верхний конец которого укреплен в подшипни-
ках, а нижний — в подпятнике. Вал приводится во вращение от
электродвигателя, установленного на крышке ферментатора, через
вертикальный редуктор. Мешалка выполнена в виде диска с
вмонтированными лопастями, число которых колеблется от 4 до 12.
Угол наклона лопастей к диску 90°, реже 60 и 45°. Мешалка
может быть одно-, двух- и многоярусной. Число оборотов ее в за-
висимости от вида ферментного производства 120—200 в минуту.
Диаметр мешалки составляет */з диаметра ферментатора. Для
аэрирования среды под мешалкой расположен кольцевой барбо-
тер, диаметр которого меньше диаметра мешалки, и выходящие из
него пузырьки воздуха сразу попадают под действие этого диспер-
гатора. При этом они движутся по систематически изменяющейся
траектории, подвергаясь дальнейшему измельчению. Разрежение,
создающееся в процессе вращения мешалки за лопастями, вызы-
315
вает подсос среды, а давление оказываемое лопастями на жид-
кость, находящуюся перед ними, способствует обтеканию ею кро-
мок лопастей и смешиванию с окружающей средой, что вызывает
турбулентные завихрения, усиливающие перемешивание во всем
объеме. На внутренних стенках расположены отбойные перегород-
ки прямоугольной формы, ширина которых принимается в преде-
лах от 0,05 до 0,12 диаметра аппарата. Наличие их улучшает об-
щую турбулентность системы.
На крышке ферментатора расположены штуцеры для подачи
питательной среды, воздуха, для установки приборов контроля,
смотровые окна, пробоотборник и люк для мойки и ремонта. В
днище имеется спускной штуцер. Вся коммуникация снабжена
подводкой пара и имеет вывод конденсата для стерилизации всей
системы. Запорная арматура (в основном бессальниковая—силь-
фонная) обеспечивает герметизацию системы коммуникаций и ап-
паратуры.
Недостатки барботажного аэрирования: относительно быстрый
износ металла, сопровождающийся увеличением живого сечения,
зарастание отверстий барботера мицелием, что затрудняет мойку
и стерилизацию, и высокий удельный расход энергии.
Ферментатор КБ ВНИИФСа (рис. 78) представляет со-
бой вертикальный цилиндрический аппарат. На крышке его рас-
положены штуцеры для загрузки питательной среды, посевной
культуры, пеногасителя, для подачи и отвода воздуха, пара, смот-
ровые окна и люк для мойки и ремонта. На цилиндрической час-
ти корпуса находится пробоотборник, а в днище — спускной кран
для выгрузки культуральной жидкости.
Внутри аппарата проходит вал с двухъярусной турбинной ме-
шалкой — диском с шестью профильными лопастями. Для повыше-
ния турбулизации жидкости и предотвращения образования во-
ронок в корпусе аппарата установлены четыре отбойные пласти-
ны 300X2300 мм.
Культуральная жидкость аэрируется через барботер, представ-
ляющий собой кольцевой трубопровод диаметром 680 мм, к кото-
рому по касательной присоединено 12 радиально расположенных
труб. В каждом луче трубы имеется 100 отверстий диаметром
1,5.и.и.
Ферментатор объемом 40 м3 рассчитан на работу под избыточ-
ным давлением до 2 ат (186 кн/м2), внутренний диаметр его
3000 мм, высота цилиндрической части 4620 мм. Аппарат снабжен
водяной рубашкой высотой 3000 мм для отвода тепла, выделяе-
мого культурой в процессе роста. Рубашка не рассчитана для ра-
боты под давлением, поэтому штуцер для выхода воды должен
быть постоянно открытым и не иметь запорных устройств.
При расчете ферментатора приняты: коэффициент теплопро-
водности среды Я=0,6 втЦм-град), плотность среды в начале куль-
316
тивирования q=1042 кг!м\ максимальная плотность среды в про-
цессе культивирования 1179 кг!м3, вязкость среды ц =
=0,00131 н-сек]м2.
Рмс. 78. Ферментатор КБ
ВНИИФСа:
1 — электродвигатель; 2 —
редуктор; 3 — патрубок для
промывки смотрового стекла;
4 — корпус ферментатора;
5 — промежуточный вал; 6 —
бичи; 7 — водяная рубашка;
8 — узел тяг; 9 — вал с ме-
шалкой; 10 — барботер; 11 —
подшипник концевой; 12 —
стойка; 13 — люк; 14 — гиль-
за для термометра; 15 —
смотровое окно; 16 — штуцер
для подачи посевной среды;
17 — штуцер для подачи пи-
тательной среды; 18 — шту-
цер для подачи пеногасите-
ля; 19 — штуцер для выхода
продукта.
Техническая характеристика ферментатора КБ ВНИИФСа
с барботажным подводом воздуха
Объем, м3:
общий........................................ 40
рабочий...................................... 25
Коэффициент заполнения......................... 0,625
Материал аппарата...........................Сталь 1Х18Н9Т
317
Допускаемое избыточное давление:
ат................................................ 2
кн/м2...................................... 196,2"
Число оборотов мешалки в минуту ... 180
Поверхность охлаждения рубашки; м2 28
Электродвигатель типа АО72-6:
мощность, кет.................................... 14
число оборотов в минуту . . . . 930-
Производственные испытания во ВНИИФСе ферментатора с
шестилопастной мешалкой при аэрации через барботер (49 ж3
воздуха в час на 1 м3 среды) показали возможность полу-
чения в нем активной культуры гриба. (В частности, для
Asp. usamii 45 декстринолитическая способность составила от
2106—2396 ед/100 мл, амилолитическая — до 83 ед/100 мл.)
Сумской машиностроительный завод им. Фрунзе изготовляет
ферментаторы конструкции Гипромедпрома объемом до 50 м3 с бар-
ботажным подводом воздуха (рис. 79). В отличие от ферментатора
КБ ВНИИФСа мешалка в нем выполнена трехъярусной, тепло от-
водится змеевиками, расположенными внутри аппарата, которые
одновременно выполняют роль турбулизирующих перегородок.
Следует отметить, что наличие змеевиков затрудняет мойку и
стерилизацию аппарата.
Ферментатор с форсуночным подводом воздуха (рис. 80) кон-
структивно отличается от описанных выше способом подвода воз-
духа для аэрирования. Вместо барботера в его днище по окруж-
ности расположены 3 форсунки диаметром 6 мм для подач» сте-
рильного воздуха в аппарат. Форсунка состоит из сопла (диаметр,
узкого сечения 6 мм), ввинчивающегося в корпус аппарата^
Уплотнение соединения обеспечивается термоустойчивой, резиновой;
прокладкой. К соплу с помощью накидной гайки крепится пат-
рубок для подвода воздуха. Аэрирование ведется сжатым возду-
хом, который подается в форсунку, распыляющую его в виде фа-
кела. Выходя из форсунки с большой скоростью, воздух дисперги-
руется в среде, вследствие чего образуется воздушно-жидкостная,
эмульсия, удельный вес которой меньше удельного веса культуральт
ной жидкости. В связи с этим эмульсия устремляется вверх и возле-
форсунок создается разрежение, в результате чего к их отверстиям
подсасываются свежие порции жидкости, и таким образом около,
каждой форсунки образуется циркуляционный контур.
Вращающиеся с определенной скоростью лопасти мешалок
дополнительно воздействуют на воздушно-жидкостную эмульсию,
усложняя траекторию движения пузырьков воздуха и дробя их.
Это увеличивает фазовый контакт и повышает содержание раство-
ренного кислорода в питательной среде.
318
Рис. 79. Ферментатор Гипромедпрома, V=50 м3:
1 — электродвигатель; 2 — редуктор; 3 — штуцер для барботера;
4— запасной штуцер; 5 — гильза для термометра; 6 — корпус;
7 — гильза для термометра сопротивления; 8 — барботер; Р —
вал с мешалкой; 10 — штуцер для слива; И — змеевики; 12 —
штуцер для входа охлаждающей воды или выхода конденсата;
13 — штуцер для выхода охлаждающей воды.
319
Рис. 80. Ферментатор с фор-
суночным подводом воз-
духа:
1 — электродвигатель; 2 — редук-
тор; 3 — корпус; 4 — промежу-
точный вал; 5 — бичи; 6 — муф-
та; 7 — узел тяг; 8 — вал с ме-
шалкой; 9 — водяная рубашка;
10 — штуцер для подачи воды;
11 — штуцер для выгрузки про-
дукта; 12— подшипник конце-
вой; 13—распиливающее устрой-
ство; 14 — пробоотборник; 15 —
штуцер для выхода воды; 16 —
гильза для термометра; 17 —
смотровое окно; 18 — штуцер
для продувки смотрового окна;
19 — штуцер для выхода воз-
духа; 20 — штуцер для загрузки
посевной культуры; 21 — штуцер
для загрузки питательной сре-
ды; 22 — штуцер для маномет-
ра; 23 — штуцер для подачи
пеногасителя
320
21—826
Типоразмеры ферментаторов, изготавливаемых Сумским машиностроительным
заводом имени Фрунзе
Таблица 30
Полный объем, л Высота | Диаметр Характеристика электродвигателя Способ теплообмена Число оборотов мешалки в минуту
мм тип мощность число оборо- тов в минуту
1000 3030 1100 АО-62-8 2,5;3;3,5 (8/6/4Т) 710; 950; 1420 Рубашка 184; 245; 367
1000 2845 1100 АО-42-4Т 2,8 1420 » 270
2000 3870 1300 АО-62-8 4,5 735 » 190
3200 3960 1500 АО-72-8 10 735 » 190
5000 4140 1700 АО-63-6 10 980 » 180 '
5000 4470 1700 АО-62-4 10 1500 » 180
10000 7130 2000 АО-82-8 20 735 Змеевик 190
50000 11470 3000 АО-94-6 75 1000 » 180
Во ВНИИФСе была также исследована зависимость количест-
ва воздуха, подаваемого через форсунки, от их диаметра, числа
форсунок и давления воздуха. Показано, что применения трех фор-
сунок диаметром 6 мм вполне достаточно для нормального аэри-
рования. Установка дополнительных форсунок не улучшает аэри-
рования и не влияет на качество культуры гриба.
Следует помнить, что недостаточное перемешивание и непра-
вильное расположение форсунок приводят к подъему воздуха
вверх отдельными струями, которые пробивают каналы в вязкой
массе. При этом воздух выходит из среды, не обеспечивая доста-
точного насыщения ее растворенным кислородом.
Техническая характеристика ферментатора с форсуночным подводом
воздуха Мичуринского опытного ферментно-спиртового завода
Объем, м3
общий .......................................... 13
рабочий............................ 10
Коэффициент заполнения ....... 0,77
Материал аппарата................................Сталь 1Х18Н9Т
Допускаемое давление, кн/м2........... 196,2
Число оборотов мешалки в минуту .... 180
Диаметр внутренний, мм................ 2200
Высота, мм............................ 5850
Мощность электродвигателя, кет......... 11
Существенными недостатками ферментаторов, применяемых в
настоящее время в ферментном производстве, являются недоста-
точная интенсивность перемешивания, малый массообмен и, как
следствие, небольшая поверхность фазового контакта. Сальнико-
вые уплотнения не обеспечивают надежной герметичности аппа-
ратуры, вследствие чего часто наблюдается инфицирование выра-
щиваемой культуры.
Интенсивность перемешивания, характеризующая однородность
многофазных систем, выражается критерием Рейнольдса
Re = —,
*7
где v — скорость движения среды;
d — эквивалентный диаметр потока среды;
v — коэффициент кинематической вязкости среды.
Интенсивность перемешивания может быть оценена следующи-
ми значениями чисел Рейнольдса: при Re=0-e-2000— ламинарный
режим (медленное перемешивание взаиморастворимых жидко-
стей); при Re = 20004-10000 — переходный режим (перемешива-
ние тонких суспензий); при Re = 10000-г-40000—турбулентный
режим (перемешивание тонких суспензий); при Re>40000—интен-
322
сивный турбулентный режим (перемешивания жидкости и газов с
образованием пены).
Внешним проявлением интенсивности перемешивания являете®
увеличение поверхности раздела фаз жидкость — газ.
В последнее время в про-
мышленности микробиологиче-
ского синтеза испытываются и
получают распространение ап-
параты с герметическим при-
водом перемешивающего уст-
ройства системы инж. Вишнев-
ского Н. Е., разработанные Ле-
нинградским научно-исследова-
тельским институтом химиче-
ского машиностроения (Лен-
НИИхиммаш).
.Установка ЛенНИИхимма-
ша (рис. 81) состоит из фер-
ментатора, пенного сепаратора,
внутреннего и внешнего цирку-
ляционного контура. Фермента-
тор представляет собой реак-
тор, изготовленный из нержа-
веющей стали, высота которого
в 5 раз больше его диаметра.
Геометрические формы ап-
парата, конструкция перемеши-
вающего устройства, располо-
женного внутри него вместе с
циркуляционной трубой (диф-
фузором), высота которой поч-
ти равна высоте ферментатора,
обеспечивают максимальную
p.ис. 81. Установка для глубинного куль-
тивирования продуцентов ферментов кон-
струкции ЛенНИИхиммаша.
скорость движения среды при
оптимальном эквивалентном
диаметре ее потока. Таким об-
разом, внутри аппарата созда-
ются все условия, необходимые
для образования явно выра-
женного внутреннего циркуля-
ционного контура. Фермента-
тор снабжен пароводяной ру-
башкой, необходимыми штуце-
1 — герметический привод; 2 — штуцер для вы-
хода воздуха; 3 — крыльчатка с лопастями;
4 — сепаратор; 5 — внешний циркуляционный
контур; 6 — штуцер для загрузки среды; 7 —
ре актор-ферментатор; 8 — спускной штуцер,
9 — пробоотборник; 10 — штуцер для подачи
газа; 11 — теплообменник встроенный; 12 —
диффузор; 13 — винтовое перемешивающее
устройство.
рами, надежной запорной арматурой и приборами для контроля
и регулирования технологических параметров.
Отличительной особенностью привода ферментатора является
отсутствие сальника, вследствие чего скорость вращения вала мо-.
21»
323
жет быть увеличена до 3000 об/мин, даже при повышенном дав-
лении, обеспечивая весьма интенсивное перемешивание при полном
отсутствии утечек жидкости и газов. Изменение интенсивности
достигается применением сменных винтов с различным шаговым
отношением варьируемым в пределах от 0,2 до 2,0 при диаметре
50 ч- 600 мм.
Неподвижная экранирующая гильза, выполненная из немаг-
нитной стали или титана, помещается в зазор между ротором и
статором асинхронного электродвигателя и герметически присое-
диняется к ферментатору. Вал ротора расположен в экранирую-
щей гильзе и проходит в аппарат. На конце вала в верхней части
ферментатора расположено перемешивающее устройство.
Привод устанавливается непосредственно на корпус реактора.
Статор помещен в масляную ванну, снабженную охлаждающей во-
дяной рубашкой. Масляный термосифон обеспечивает отвод тепла
ют экранирующей гильзы и обмоток статора. Вращающийся элект-
ромагнитный поток проникает сквозь неподвижную экранирующую
гильзу и приводит во вращение ротор, а с ним и вал перемешива-
ющего устройства, состоящего из винта, направляющих лопастей,
отражателя и диффузора. Электромагнитный привод, герметически
взрывозащищенный, не имеет вращающихся частей, выведенных на-
ружу, и сальника, а его электрообмотки находятся в трансфор-
маторном масле и также загерметизированы. К п.д. электромаг-
нитного привода 0,6—0,7.
Перемешивающее устройство ферментатора представляет собой
встроенный винтовой насос, помещенный в верхней части циркуля-
ционной трубы (диффузора). Для повышения условного к.п.д.
винта он должен работать в паре с направляющим аппаратом,
состоящим из вертикальных ребер, отогнутых навстречу движе-
нию винта.
Назначение перемешивающего устройства — обеспечить не
только местное интенсивное перемешивание, но и перемещение
среды во всем объеме ферментатора. В хорошо сконструирован-
ных ферментаторах 20% энергии затрачивается на местное пере-
мешивание в зоне работы винта, а 80% расходуется на циркуля-
цию жидкости и перемешивание ее во всем объеме аппарата.
Ферментатор работает при коэффициенте заполнения 0,9—1,0.
Гидравлический режим (Re=40000), необходимый для перемеши-
вания подвижных жидкостей и газов, достигается при скорости
циркуляции среды более 0,5 м/сек. При меньшей скорости воз-
можна сепарация крупных газовых пузырьков, т. е. нарушение
однородности системы.
В табл. 31 приведены данные Н. Е. Вишневского о внутрен-
ней циркуляции жидкости в ферментаторах с винтовым перемеши-
вающим устройством.
Представляют интерес данные о гидродинамическом режиме
среды, получаемом в промышленных реакторах конструкции Лен-
НИИхиммаша ( по Н. Е. Вишневскому).
324
Таблица 31
Эффективность винтовых перемешивающих устройств
Диаметр винта, мм
Шаговое отношение Коэффициент скорое- 50 । 75 । 150 1 300 1 450 1 600
винта, Р ти (условный к.п.д.) 7) п—2800 об/мин | л= 4400 об/мин
Л. Внутренняя циркуляция, л/сек
0,2 1,0 — — .— 97 280 660
0,3 1,0 <— — 15 145 430 1000
0,4 1,0 — 5 21 190 360 1350
0,6 0,9 2 7 28 260 760 —
1,0 0,8 3 10 40 390 — —
2,0 0,6 4,5 16 32 — — —
Емкость реактора, л
. < 250 2000 10000 25000
Избыточное давление, аг 40 200 16 16
Температура, °C 250 200 250 250
Удельная поверхность теплообмена, м21м3 8 7 8 8
Диаметр винта и диффузора, мм 150 260 450 600
Скорость вращения винта, об!мин . 1400 1400 1400 1400
Номинальная мощность электромаг- нитного привода, кет 4,5 7(Ю) 40 100
Коэффициент кинематической вязко- сти среды, сст 1 0,6 1 1
Шаговое отношение винта
Л . . . 0,4 1,0 0,3 0,2
Рг • • • 1,0 — 0,6 0,3
Интенсивность перемешивания
Rei . . . 40000 40000 150000 200000
Re, 100000 — 300000 300000
Мощность герметического привода винтового перемешивающе-
го устройства может быть определена по графику, составленно-
му Н. Е. Вишневским (рис. 82) для жидкостей с плотностью,,
близкой к единице, и коэффициентом кинематической вязкости
1 • 10-6 — 1 • 10-4 м2)сек для винта с шаговым отношением Р= 1. На-
пример, для винта диаметром 450 мм при скорости вращения
900 об!мин потребуется привод мощностью около 7 кет.
Достоинством ферментаторов с герметизированным приводом
винтового перемешивающего устройства является возможность,
ведения процесса в стерильных условиях, благодаря чему устра-
няется инфицирование культуральной жидкости.
325
Комплектующий установку пенный сепаратор предназначен
для отделения пены от среды и представляет собой цилиндри-
ческую герметизированную емкость, заканчивающуюся конусооб-
разным днищем. На крышке ее установлен герметический привод,
Рис. 82. График для определения мощности нормализо-
ванного герметического привада .винтового перемешива-
ющего устройства.
на валу которого находится крыльчатка с лопастями. Скорость
вращения крыльчатки 1500—3000 обIмин. Общий объем пенного
сепаратора 10—20% от объема. ферментатора. При работе крыль-
326
чаткй, представляющей собой рабочее колесо газодувки, возни-
кает вихрь, который увлекает пену, разбивая ее о внутреннюю
поверхность сепаратора.
При периодическом ведении процесса питательную среду за-
гружают в ферментатор, стерилизуют паром, подаваемым в ру-
башку аппарата, в течение 1—1,5 ч, после чего охлаждают водой.
По достижении заданной температуры в ферментйтор загружают
посевную культуру, подают через систему фильтров обеспложен-
ный воздух и включают привод перемешивающего устройства и
пенного сепаратора. Винтовое перемешивающее устройство созда-
ет поток жидкости, направленный снизу вверх. Достигнув отра-
жателя, поток разворачивается на 180° и проходит сверху вниз по
кольцевому пространству ферментатора, являющемуся основным
реакционным объемом. Далее поток вновь меняет направление на
180° и по циркуляционной трубе подводится к винту.
Воздух должен подаваться в сформировавшийся жидкостный
поток над винтом перемешивающего устройства. Здесь он диспер-
гируется до мельчайших частиц — пузырьков размеров в доли мил-
лиметра и таким образом питательная среда насыщается кислоро-
дом. Если бы воздух подавался под винт, последний работал бы
в условиях кавитации и циркуляция жидкости была нарушена. Пи-
тательную среду целесообразно подавать в нижнюю часть цирку-
ляционной трубы, тогда обеспечивается хорошее перемешивание
воздуха со средой, находящейся в реакторе еще до подхода к вин-
ту.
Выводить пену из ферментатора в сепаратор целесообразно
в верхней части аппарата. Жидкость, отделившаяся в пенном се-
параторе, возвращается в нижнюю часть ферментатора по спуск-
ной трубе, образуя дополнительный внешний циркуляционный кон-
тур. Отработавший воздух вместе с газами—продуктами жизнеде-
ятельности микроорганизмов из верхней части сепаратора уда-
ляется в атмосферу. Вместе с ним уносится часть испарившейся
жидкости, что может привести к значительному снижению уровня
жидкости в аппарате и холостому ходу перемешивающего устрой-
ства, вызывающему прекращение процесса культивирования. Эту
особенность ферментатора с верхним герметическим приводом
следует учесть, применяя охлаждение удаляемого из сепаратора
воздуха и возвращение стерильно сконденсированной жидкости в
общий циркуляционный контур.
Так как микроорганизмы потребляют только растворенный (мо-
лекулярный) кислород воздуха и большая часть газовых пузырей
проходит транзитом через слой жидкости, целесообразно приме-
нять ограниченное газонаполнение ферментатора — до 5—10%.
Как показали испытания нормализованного реактора, этого коли-
чества воздуха вполне достаточно, чтобы в условиях интенсивного
перемешивания обеспечить насыщение среды кислородом. При
слишком высоком газонаполнении (15—20%) винт перемешиваю-
щего устройства начинает работать в условиях кавитационного
327
режима, а иногда даже «сбрасывает» циркулирующую жидкость,
в связи с чем ухудшается перемешивание и насыщение жидкости
кислородом.
К достоинствам ферментатора ЛенНИИхиммаша следует от-
нести увеличение массообмена в нем. Так, при глубинном культи-
вировании бактерий Вас. diastaticus и Вас. mesentericus и плесне-
вого гриба Asp. terricola (Голгер Л. И., Ашомко Э. Г., Юли-
ус А. А., Кузнецова В. И., Максимова Е. А. и др.) достигнуто уско-
рение этого процесса в два раза по сравнению с обычным фермен-
татором. Ферментативная активность выращенных культур также
была выше.
К недостаткам этой конструкции относится возможность попа-
дания в реактор малых доз смазки из герметичного привода.
Механический стартер не обеспечивает полного пеногашения
сильнопенящихся сред.
Для нужд ферментного производства целесообразно применять
ферментаторы объемом 30 и 50 м3 с герметическим приводом вин-
тового перемешивающего устройства.
Ферментатор горизонтального типа конструкции ЛенНИИхим-
маша (рис. 83) представляет собой замкнутую систему из двух
горизонтально расположенных труб с герметичным приводом вин-
тового перемешивающего устройства и сепаратором для механичес-
кого пеногашения.
Корпус ферментатора состоит из отдельных секций, соединен-
ных между собой на фланцах. Каждая секция снабжена рубашкой
для отвода физиологического тепла, выделяемого микроорганиз-
мом в период активного роста. На одной из секции корпуса фер-
ментатора расположен герметичный электропривод с винтовым
перемешивающим устройством. Внутри ферментатора в двух его
секциях смонтирован пластинчатый успокоитель, представляющий
собой набор тонких вертикальных пластин, расположенных вдоль
потока среды по всей высоте секции. С помощью пластинчатого
успокоителя турбулентное движение среды переходит в ламинар-
ное. Здесь же происходит частичное выделение газовой фазы из
циркулирующей смеси.
Из успокоителя среда с большим количеством пены поступает
в сепаратор, внутри которого на конце консольного вала приво-
да имеется диск, снабженный радиальными лопастями. При быст-
ром вращении диска создается вихрь, разбивающий пену, газ из
сепаратора удаляется, а отсепарированная среда возвращается в
ферментатор.
Для интенсификации перемешивания и регулирования расхо-
дуемой на перемешивание мощности ферментатор снабжен двумя
встроенными дроссельными клапанами. Поворотом дроссельных
заслонок регулируется местное сопротивление потока среды и из-
меняется нагрузка на винт привода. Скорость потока среды в фер-
ментаторе в зависимости от шагового отношения винта доходит
до 2 м!сек.
328
Рис. 83. Горизонтальный ферментатор ‘конструкции ЛенНИИхиммаша:
1 — привод; 2 — сепаратор; 3 — пластинчатый успокоитель; 4 — секции труб; 5 — дроссельная заслонка.
Преимущество горизонтального ферментатора по сравнению с
ферментатором вертикального типа конструкции ЛенНИИхимма-
ша: меньшая металлоемкость и энергоемкость, легкая транспор-
табельность, что имеет особо важное значение для ферментаторов
большой емкости. Наиболее существенным преимуществом фер-
ментатора горизонтального типа является значительно меньший
статический перепад давления, чем у вертикального, что должно
благоприятно влиять на жизнедеятельность микроорганизмов.
Воздуходувные машины
Для воздухоснабжения пригодны ротационные воздуходувки
ВР/АО-25/08, изготовляемые серийно Мелитопольским компрес-
сорным заводом, а также ротационный компрессор РК-6 Сумского
завода им. Фрунзе, воздуходувки системы Руте и Егерь. Выбирать
тип воздуходувной машины следует в зависимости от требующе-
гося часового расхода воздуха и давления.
Воздуходувка ВР/АО-25/08. Воздуходувный агрегат ВР/АО-
25/08 состоит из электродвигателя и воздуходувки, соединенных
упругой муфтой и смонтированных на общей фундаментной раме.
Воздуходувка (рис. 84) состоит из корпуса, внутри которого рас-
Рис. 84. Воздуходувка ВР/АО-25/08:
/ — корпус; 2— рабочие валы; 3 — камера зубчатой пары; 4 — роликовые подшип-
ники; 5 — косозубая пара; 6 — диск центробежной смазки зубчатой пары; 7 — ша-
риковые подшипники; 8 — винтовое уплотнение.
330
положены два ротора диаметром 300 и длиной 380 мм, всасываю-
щей и нагнетательной полости. Корпус закрывается с торцов дву-
мя крышками с расточками для подшипников роторных валов.
Зазор между роторами и стенками статора небольшой, поэтому
смазки рабочей камеры .воздуходувки не требуется. Синхронность
работы роторов обеспечивается зубчатым зацеплением между ва-
лами. Всасывающая и нагнетательная камеры защищены от про-
никновения масла самоподвижным манжетом на валах и резьбо-
вым уплотнением.
Для защиты от перегрузки предусмотрен перепускной клапан,
сбрасывающий избыточное давление. Ротационные воздуходувки
создают при работе большой шум, поэтому на всасывающем и
нагнетательном трубопроводах необходимо установить абсорбци-
онные звукопоглотители или звукопоглощающий колпак. Воздухо-
дувка Вр-40 в отличие от мокровоздушных машин РМК-4 и
ВВН-12 подает сжатый воздух, не требующий дополнительной
осушки.
Таблица 32
Сравнительная характеристика воздуходувных машин при напоре 78,4 кн!м2
Марка воздуходувки Изготови- тель Производи- тельность , л{сек Удельный расход энергии, вш/л Удельная металлоем- кость, кг/л Габариты, мм
Вр-40 СССР 435 124 U 930x 600x680
РМК-4 СССР 350 179 3,65
ВВН-12 СССР 150 253 3,16
Руте 200/420 ГДР 445 135 — 1280x 820x 950
Руте 150/280 ГДР 278 127 — 806X 500X 585
14,8 ФРГ 377 105 1,1 920x 720x660
15,10 ФРГ 347 116 1,73 1053x 805 x 770
Техническая характеристика воздуходувного агрегата ВР/АО-25/08
Производительность объемная, отнесенная к усло-
виям -всасывания, л!сек.................. 420
по атмосферному воздуху, м31мин .... 25
Напор (разность давления по патрубкам), кн)м2 . 80
Параметры воздуха во всасывающем патрубке4
давление, кн/м2...................... 100
температура, °C................., . . 17
плотность, кг)м3..................... 1200
Мощность, кет......................... 55—75
Скорость вращения валов, рад!сек . .1 . . * 154
Регулирование расхода воздуха.................Байпасированием
Степень регулирования, %........................... 50
Габариты, мм.................................... 2040X 900 X 990
Масса, кг . 1450
331
Ротационные воздуходувки системы Руте конструктивно иден-
тичны воздуходувке ВР/АО-25/08.
При необходимости поддержания в ферментаторе большой ем-
кости избыточного давления порядка 0,5 ат (49 кн!м2) целесооб-
разно применять ротационный компрессор типа Р К-6.
Техническая характеристика ротационного компрессора РК-6
Номинальная производительность, м3/мин ... 22
Конечное давление, кн!мг.............................. 245
Число ступеней......................................... 1
Мощность электродвигателя, кет........................ 100
Число оборотов в минуту............................... 735
Габариты, мм.................................... 2695X1040X1195
Масса, кг............................................ 2540
В ГДР изготавливаются однокорпусные радиальные компрес-
соры типа ТК-60 и ТК-150/6 производительностью до 6000 м3/ч.
Воздушные фильтры
После грубой очистки через фильтры системы Рекка воздух
поступает в воздуходувку. При этом температура его повышается
до 107-ь 130°С, затем он охлаждается до 20—30°С в кожухотруб-
ном теплообменнике. Скорость движения воздуха в трубном про-
странстве 10 м!сек. Воздух подается в межтрубное пространство
сверху вниз, а холодная вода течет по трубкам' снизу вверх. До
поступления в ферментатор и инокулятор воздух последовательно
очищается в общем и затем индивидуальном бактерицидных
фильтрах, после чего сухой и стерильный подается для аэрирова-
ния среды.
Фильтр КБ ВНИИФСа (рис. 85) представляет собой стальной
цилиндр со сферическим днищем и разъемной крышкой. Внутри
него расположены сетки, между которыми уложен фильтрующий
материал-стекловолокно. Стерилизуется фильтр паром давлени-
ем 2 ат (196,2 кн/м2) при температуре 133°С в течение 3 ч. Соп-
ротивление стекловолокна при плотности наполнения 10 кг/л<2, вы-
соте слоя 50 мм и удельной нагрузке 1500 м3 воздуха в час на 1 м2
равно 52 кг)м2, а при толщине фильтрующего слоя 500 мм —
525 кг!м2.
Фильтр ВНИИФСа с тканью ФПП-15 (рис. 86) представляет
собой стальной цилиндр с разъемной крышкой и коническим дни-
щем. Внутри аппарата в трубной решетке устанавливают 73 ци-
линдрических перфорированных патрубка, покрытых тканью Пет-
рякова. Воздух, проходя через ткань ФПП-15, бактериально очи-
щается. Стерилизуют фильтр паром с примесью формалина-.
Техническая характеристика фильтра ВНИИФСа с тканью ФПП-15
Производительность по воздуху, м3/ч .... 1000
Скорость воздуха, м!сек
при фильтровании............................ 0,016
на входе и выходе............................ 35,4
Общая поверхность фильтрации, м2 ... . 17,5
Поверхность фильтрации одного стакана, м2 . . 0,24
Число фильтрующих стаканов ........................ 73
332
Рис. 85. Фильтр КБ ВНИИФСа:
1 — крышка рубашки; 2 — крышка
аппарата; 3 — штуцер для выхода
воздуха; 4 — штуцер для входа
острого пара; 5 — рубашка; 6 — кор-
пус; 7 — решетка; 8 — вата или стек-
ловолокно; 9 — штуцер для входа
воздуха; 10— штуцер для выхода
конденсата.
Рис. 86. Фильтр
ВНИИФСа с тканью
Петрякова:
1 — крышка; 2 — корпус;
3 — стакан; 4 — штуцер для
выхода воздуха; 5 — кран
для подвода паров форма-
лина; 6 — штуцер для входа
воздуха.
333
Фильтр ФТО. В последнее время получили распространение
фильтры с особой гидрофобной и термоустойчивой тканью, кото-
рая полностью очищает воздух от бактерий. Фильтры ФТО вы-
пускаются различных типоразмеров, от ФТО-60 до ФТО-ЮОО
(цифры указывают нагрузку фильтра по воздуху в л«3/ч.) Типо-
размер фильтров и их число выбирают в зависимости от произво-
дительности ферментатора и инокулятора.
Фильтрующий элемент фильтра ФТО-750 имеет диаметр 360 мм
и высоту 600 мм. При нагрузке 750 м3 воздуха в час сопротивле-
ние фильтра равно 274—294 н/м2.
Последовательная фильтрация через фильтр Рекка, фильтр со
стекловолокном и фильтр ФТО (общий и индивидуальный) гаран-
тирует получение стерильного воздуха, необходимого для аэрации
субстрата.
Запорная арматура
Для обеспечения герметичности системы, инокуляторов и фер-
ментаторов применяют бессальниковую запорную арматуру. Силь-
фонный вентиль (рис. 87) состоит из литого корпуса, в котором
расположены золотник и шарнирно присоединенный к нему шпин-
дель с сильфоном. К корпусу на шпильках крепится крышка.
Сильфон цельнотянутый, из стали 1Х18Н9Т, приварен аргоноду-
говой сваркой через кольца к шпинделю и к переходной втулке,
расположенной на паранитовых прокладках между корпусом и
крышкой вентиля. Верхняя часть шпинделя соединяется резьбой
со втулкой, расположенной в крышке и уплотненной с помощью
асбестовой набивки.
Таблица 33
Типоразмеры сильфонных вентилей
Тип сильфонной арматуры Условное обозначение Рабочее давление, кн/м* Условный диаметр, мм
Вентиль запорный сильфонный флан- 15Б24р/Ш-24 0,25 25
цевый с колпаком
Вентиль запорный сильфонный ваку- 15Б50р и 0,1 3, 10, 20
умный ' 15Б50р1
Вентиль запорный угловой сильфон- 15а11р 0,3 10
ный цанковый
Вентиль запорный сильфонный флан- 15к45р 0,25 50, 80
цевый
Вентиль запорный сильфонный Флан- 15нж70р 0,6 15, 25, 50,
цевый 15нж70п 10, 20, 25
Вентиль запорный сильфонный ваку- 14нж1р 0,05 4; 10; 20
умный
Вентиль запорный сильфонный флан- 15нис 077ст и 0,5 15, 20, 25,
цевый с патрубками под приварку 15нис 077ст1 40, 50, 70
334
Рис. 87. Сильфонный йентиль:
1 — колпачок; 2 — смазка; 3 — набивка; 4 — армировка втулки резьбо-
вой; 5 — втулка переходная; 6 — лепесток сильфона; 7 — кольцо нижнее;
8 — золотник; 9 — корпус
335
Закрывается вентиль путем прижима золотника к корпусу че-
рез теплостойкое уплотнительное резиновое кольцо с помощью на-
кидной гайки. Вертикальное перемещение золотника (открытие и
закрытие вентиля) происходит по направляющим. Наличие силь-
фона в вентиле обеспечивает полную герметизацию рабочей среды,
протекающей по трубопроводу. Управление вентилем (перемеще-
ние шпинделя) бывает местное — от маховика, дистанционное и от
электродвигателя. Ход сильфона 20 мм. Направление движения
рабочей среды—под золотник.
Сильфонный вентиль со стеллитовым уплотнением и беспрокла-
дочным соединением крышки с корпусом (рис. 88) используется в
качестве запорной арматуры на горизонтальных и вертикальных
трубопроводах для жидкости, воздуха, пара, инертного газа, ваку-
умно-плотный по отношению к внешней среде при вакууме
0,665 н/м2.
ТЕХНОЛОГИЧЕСКИЕ СХЕМЫ
ГЛУБИННОГО
КУЛЬТИВИРОВАНИЯ
Прежде чем излагать схему,
принятую в настоящее время,
считаем целесообразным дать
представление об этапах ее
разработки.
Первые опыты глубинного
культивирования плесневых
грибов в производственных ус-
ловиях проводились под руко-
водством В. В. Вяткина с 1950 г.
на Мичуринском эксперимен-
тальном заводе ВНИИФСа.
В основу был положен перио-
дический способ выращивания
грибов Asp. niger S в горизон-
тальных ферментаторах с гори-
зонтальными тихоходными ме-
шалками (31 об!мин) и аэра-
цией через барботеры.
Начиная с 1958 г. совершен-
ствование аппаратурного офор-
мления глубинного культиви-
Рис. 88. Сильфонный вентиль с беопро-
кладочным соединением:
/ — шкив; 2 — гайка накидная; 3 — корпус;
4 — шток; 5 — стелитовое уплотнение; 6 —
сильфон; 7 — направляющая; 8 — графитовая
смазка
рования шло по двум путям.
На Мичуринском заводе были
установлены новые вертикаль-
ные ферментаторы с аэрацией
через форсунки, затем эта кон-
струкция была дополнена
мешалкой турбинного типа и специальной бессальниковой ар-
матурой с резиновыми термостойкими клапанами. В грибном цехе
336
Приволжского биохимического завода продолжали работать с го-
ризонтальными ферментаторами и горизонтальными мешалками с
упрощенными аэрирующими насадками и продуванием воздуха че-
рез наджйдкостное пространство ферментаторов. Длительный опыт
работы этих заводов привел к выводу, что на данном этапе лучшей
аппаратурной формой является вертикальный ферментатор с тур-
бинной мешалкой и форсуночным распределением воздуха, обес-
печивающий герметичность и тщательное перемешивание среды с
насыщением ее кислородом. Промывка и стерилизация такого обо-
рудования не вызывает затруднений.
Схемы периодического культивирования
Схема Мичуринского спиртового завода (1950 г.). Технологи-
ческий процесс выращивания состоял из следующих операций: при-
готовления конидиальной культуры гриба Asp. niger S на сусло-
вом агаре в пробирках и на пшеничных отрубях в колбах; раз-
множения посевного материала в маточниках или аппаратах чистой
культуры; выращивания глубинной культуры в генераторах и фер-
ментаторах.
После стерилизации всей аппаратуры при температуре 106°С
в течение 3 ч включали насос и питательную среду через варочную
колонку и стерилизатор подавали в ферментатор. Питательной сре-
дой служила зерно-картофельная барда с содержанием 3,5—4% су-
хих веществ, обработанная мелом или известью для нейтрализа-
ции избыточной кислотности до pH 4,85—5,0; в некоторых случаях
в качестве дополнительного питания и пеногасителя прибавляли
1% кукурузной муки. Из стерилизатора среда, подогретая до тем-
пературы 106° С в течение 40 мин, подавалась в трубчатый холо-
дильник и затем в ферментаторы. Температура в ферментаторах
после загрузки была 58—66° С. Для снижения ее до 33° С исполь-
зовали охлаждение поверхности ферментатора водой и аэрацию.
Затем из аппарата чистой культуры (АЧК) стерильно вводили
посевную культуру в виде водной суспензии спор (конидий) и про-
водили выращивание грибной культуры в течение 3 суток при тем-
пературе 33—35° С с непрерывной аэрацией и периодическим от-
бором проб для контрольных анализов.
Зрелое состояние культуры гриба оценивалось по амилолитичес-
кой активности — иодной пробе в 6—7 мин и по показателю осаха-
ривания неклейстеризованного крахмала (450—500 мг сахара)-
Зрелую культуру через сборник и дозатор направляли на осахари-
вание крахмалистого затора спиртового производства. Расход куль-
туры 25% от объема затора.
Основным недостатком схемы была надежность работы энер-
гетических двигателей и малая прочность технологической аппара-
22—826
337
туры, поэтому стерилизацию проводили при низкой температуре
(106°С), не обеспечивающей биологической чистоты культивирова-
ния (в 50% из 100 наблюдалось инфицирование культуры гриба).
Опыт показал, что надежные результаты дает стерилизация среды
при температуре 126—130° С в течение 40—45 мин и оборудования
при температуре 123° С в течение 1,5—2 ч.
Схема Приволжского биохимического завода строилась с уче-
том производственного опыта Мичуринского завода, но, к сожале-
нию, с сохранением того же аппаратурного оформления. Прием пе-
реливного культивирования грибной культуры Asp. botatae и Asp.
usamii, принятый в схеме, явился шагом к полунепрерывному спо-
собу выращивания микроорганизмов. Заполнение двух-трех фер-
ментаторов перетекающей обсемененной средой из генератора уве-
личивает длительность процесса размножения грибной культуры в
потоке, позволяет сократить расход посевной культуры и ускорить
созревание культуры гриба в ферментаторах.
В качестве основной питательной среды используется фильтрат
зерно-картофельной барды, отделенный от дробины на сите фильт-
ра до остаточного содержания ее не более 0,05%.
Для повышения продуктивности и амилолитической активности
гриба к профильтрованной барде перед стерилизацией в смесителе
добавляют 1,0—2,0% муки и около 0,2% окиси магния, нейтрали-
зуют известью до pH 5,0—5,7.
В соответствии с принятой схемой (рис. 89) подготовленную пи-
тательную среду насосом подают в решофер, а затем в выпарной
аппарат для подогрева до 123—128° С. При этой температуре ее
выдерживают в специальном цилиндрическом сосуде-выдержива-
теле в течение 45 мин. Такая выдержка питательной среды должна
обеспечивать полную стерильность ее. Периодически отбирают
пробы среды для микробиологического контроля.
Простерилизованная среда через теплообменник, в котором она
охлаждается до 28° С, постепенно поступает в генератор. После
частичного заполнения питательной средой конидиальную культуру
гриба Asp. usamii 45, выращенную в аппаратах чистой культуры или
маточниках, самотеком передают в этот же генератор. Одновремен-
но сюда же подают около 3 м3 среды, так как при этом достигается
обязательное смешение ее с посевной культурой, что предохраняет
ее от явлений торможения, инактивации и создает оптимальные
условия развития.
После заполнения генератора приток среды в него приостанав-
ливают и при постоянном перемешивании и аэрации в течение су-
ток проводят выращивание. Заметное прорастание конидий посев-
ного материала отмечается примерно через 14 ч от начала засева.
Конидии прорастают в мицелий, и дальнейшее размножение про-
текает за счет обособления его кончиков, которые, в свою очередь,
продолжают расти и ветвиться, давая начало новым колониям.
338
Регулируя количество посевной культуры, подаваемой в гене-
ратор, и скорость притока в него среды, можно искусственно под-
держивать культуру в физиологически незрелом состоянии и тем
самым продлить процесс ее размножения.
Через сутки приток среды в генератор возобновляют, а получен-
ную глубинную культуру используют в качестве посевного материа-
ла для засева среды в ферментаторах, направляя ее перетоком
---/-----/ — Фильтрат барды
--------------Продукт
--------------Экстра-пар
Рис. 89. Технологическая схема глубинного культивирования плесневых
грибов на Приволжском биохимическом заводе: 4
1 — брагоперегонный аппарат; 2 — сборник барды; 3 — фильтр для барДы; 4 — сбор-
ники фильтрата барды; 5 — выпарной аппарат; 6 — циркуляционный насос; 7 — выдер-
живатель; 8 — теплообменник оросительный; 9 — воздуходувка; 10 — генераторы;
// — ферментаторы; 12 — ватные фильтры; 13 — сборник грибной культуры, 14 — цен-
тробежные насосы; 15 — ресивер.
сначала в первый, а затем во второй ферментатор. Продолжитель-
ность загрузки двух ферментаторов через генератор составляет
обычно 24 ч. Если микроскопическим анализом в культуре гриба
не обнаружено посторонней микрофлоры, то переток направляют на
третий и последующие ферментаторы. При наличии сомнений в чис-
тоте выращенной культуры приток среды переводят на второй сте-
рильный, так же подготовленный генератор и все операции повто-
ряют. В дальнейшем ферментаторы поочередно заполняют из обоих
генераторов. После прекращения притока в первую и вторую груп-
пу ферментаторов процесс выращивания плесневых грибов ведут
обычным периодическим способом.
Расход воздуха в горизонтальных ферментаторах Приволжско-
го завода составляет около 10 м3 на 1-и3 культуры в час. Продол-
жительность роста в периодических условиях трое суток, при пе-
22*
339
реливном способе меньше — 36 ч, считая пребывание культуры
только в ферментаторе.
К недостаткам переливного способа следует отнести неустойчи-
вость режима культивирования. С удлинением времени перелива
культура часто инфицируется и вымывается при увеличении коэф-
фициента разбавления (Д).
Схема Мичуринского спиртового завода (1965 г.). По этой схеме
(рис. 90) глубинное культивирование грибов проводится в верти-
кальных ферментаторах и маточниках с пропеллерными мешал-
ками и аэрацией воздуха через форсунки. В этих условиях дости-
гается более полное насыщение питательной среды кислородом воз-
духа, повышение относительной скорости накопления биомассы.
Удаление остатков культуры из таких ферментаторов при промыв-
ке и стерилизации всей аппаратуры не вызывает затруднений.
В глубинных условиях выращиваются следующие штаммы гри-
бов: Asp. usamii 45, Asp. batatae 4, Asp. niger species. Средой слу-
жит фильтрат зерно-картофельно-мелассной барды с добавлением
1 и 2% муки, 0,2% окиси магния и извести для нейтрализации.
Оптимальная концентрация сухих веществ в среде — около 3%
pH 5,2—5,5. Расход воздуха в ферментаторах Мичуринского заво-
да составляет около 12 м3 на 1 л<3 культуры в час. Перед подачей
в ферментаторы воздух предварительно охлаждают, тщательно
фильтруют от механических примесей и микроорганизмов через
специальные фильтры с тканью Петрякова или ватой. Мешалка при
этом работает со скоростью 130—180 оборотов в минуту.
Питательную среду для маточников готовят отдельно из 2%
муки и 0,4% кукурузного экстракта. Посевную культуру выращи-
вают в инокуляторе. Продолжительность периодической фермен-
тации в инокуляторе с продуванием воздуха через форсунку сос-
тавляет 24 ч, а в производственном ферментаторе 65—72 ч.
Установлено, что с увеличением объема посевной культуры гри-
ба соответственно интенсифицируется скорость ферментации и со-
кращается продолжительность выращивания. Так, при увеличении
объема посевной культуры от 1 до 10% период выращивания со-
кращается с 72 до 52 ч. В связи с этим в настоящее время объем
посевной культуры гриба при проектировании новых заводов уве-
личен с 1 до 10%.
Схема непрерывного культивирования
На опытной установке Мичуринского ферментно-спиртового за-
вода осуществлено (В. Л. Яровенко, И. И. Бурачевский и др.) не-
прерывное культивирование плесневых грибов в потоке, схема кото-
рого представлена на рис. 91-
340
Рис. 90. Технологическая схема глубинного культивирования плесневого гриба на
Мичуринском спиртовом заводе (1965 г.):
1—смеситель среды для маточника; 2 — подогреватель среды для маточника; 3 — насос вихревой; 4—выдерживатель среды для ма-
точника; 5 — смеситель среды для ферментатор а;-6 — насос центробежный; 7 — подогреватель среды для ферментатора; 8—выдержи-
ватель среды для ферментатора; 9 — теплообменник; 10— ферментатор с мешалкой и форсуночной подачей воздуха; 11—воздушные
фильтры. 12 — маточники; 13 — пеногаситель; 14 — стерилизатор пеногасителя; 15 — сборник пеногасителя; 16 — воздухоохладители;
/7 — воздуходувки; /5 — промежуточная емкость; 19 — насос; 20 — фильтр масляный ячейковый.
Фильтрат барды, являющийся основным компонентом питатель-
ной среды, с бардяного фильтра подается в один из двух смесителей
для приготовления среды.
В смеситель загружается мука, кукурузный экстракт и магнезит
из расчета содержания в среде 1,25—1,4% редуцирующих веществ
и 220—280 мг общего азота на 100 мл; pH среды поддерживается
на уровне 5,5—5,6.
Приготовленная питательная среда дозировочным плунжерным
насосом подается в греющую колонну, где подогревается до 130—
132° С. Нагретая масса поступает в выдерживатель. Время стери-
лизации, включая пребывание в выдерживателе, составляет 60—
65 мин.
После стерилизации масса охлаждается до 32—34°С в теплооб-
меннике и поступает в головной ферментатор, подготовленный к
работе (т. е. вымытый, простерилизованный и охлажденный) и за-
полненной посевной культурой в количестве 40% от емкости голов-
ного ферментатора.
Во время загрузки первого ферментатора подготавливают к ра-
боте второй ферментатор батареи. После заполнения первого фер-
ментатора растущая культура последовательно поступает во вто-
рой, третий и так до шестого ферментатора. Из последнего готовая
культура поступает в производство для осахаривания крахмалис-
тых заторов.
Выращивание проводится при температуре 30—32° С, с переме-
шиванием воздухом и с помощью мешалок. Расход воздуха 12 м3/ч
на 1 м3 культуры.
Продолжительность созревания определяется скоростью разбав-
ления и применяемым штаммом гриба. При культивировании штам-
мов Asp. niger species и Asp. batatae 61 созревание культуры закан-
чивается соответственно за 42 и 50 ч при оптимальном коэффициен-
те разбавления 0,120 ч_|.
Продолжительность притока среды составляет 48 ч, после чего
культура из головного ферментатора с помощью воздуха передает-
ся в следующие. Освобожденную от содержимого систему промы-
вают водой и вместе с головным ферментатором стерилизуют.
Время, необходимое на подготовку следующего потока, составля-
ет 6 Таким образом разрыв между старым и новым потоками
практически составляет один освобожденный или подготавливае-
мый ферментатор. При необходимости головным ферментатором
может служить второй ферментатор батареи, к которому подведе-
ны посевная и субстратная коммуникации.
Посевная культура готовится в маточниках и генераторах, или
только в генераторах. Для приготовления ее используется специ-
альная среда (2% кукурузной муки, 0,5% кукурузного экстракта,
0,15% магнезита, остальное — вода). Засевают маточник спорами
из колб или пробирок. Время выращивания посевной культуры
32—36 ч.
342
Рис. 91. Технологическая схема глубинного культивирования плесневых грибов непрерывным методом:
/ — чанки для приготовления среды; 2 — насос плунжерный; 3 — греющая колонка; 4 — выдерживатель; 5 — теплообменник оро-
сительный; 6 — магнитный переключатель; 7 — ферментаторы рабочие головные; 8 — ферментаторы рабочие; 9 — маточники; 10 —
посевной ферментатор (генератор); // — фильтр воздушный рабочего ферментатора; 12— фильтры общие; 13— фильтры воздуш-
ного маточника; 14 — фильтры воздушного генератора: 15 — подогреватель воздуха; 16 — конденсаторы; 17 — водоотделитель;
~ 18 — воздуходувки РМК.
Анализ развития грибной культуры в многоступенчатой батарее
показал, что основной биосинтез протекает в головном фермента-
торе батареи. Так, при оптимальном коэффициенте разбавления
О-120 ч~1 в нем накапливается около 60% биомассы, потребляется
45—50% углеводов (по редуцирующим веществам). Накопление
биомассы и потребление питательных веществ по ступеням батареи
для каждого микроорганизма зависит от коэффициента разбавле-
ния (табл. 34).
Таблица 34
Влияние коэффициента разбавления на накопление биомассы плесневого гриба
Asp. niger species 6 многоступенчатой батарее
Коэффициент разбавле- ния, час“ 1 Накопление биомассы, г/100 мл по ферментаторам
№ 1 № 2 К2 3 № 4 № 5 № 6
0,083 1,17 1,46 1,67 1,81 1,81 1,80
0,120 1,12 1,41 1,62 1,75 1,76 1,74
0,153 1,05 1,34 1,52 1,64 1,70 1,71
Созревание культуры, контролируемое по остаточному содер-
жанию редуцирующих веществ в среде, осахаривающей и амило-
литической способности, заканчивается на 8—12 ч позже макси-
мального накопления биомассы. Исследования показали, что наи-
лучший рост и быстрое созревание культуры отмечались при вне-
сении 40% посевной культуры в головной ферментатор (табл. 35).
Активность грибной культуры Asp. niger species, выращенной на
установке в потоке, составляет в среднем 60 ед? АС, 80 ед. ОС
или 2,7 мин и 1143 ед. ДС на 100 мл. При поточном культивирова-
нии сохраняются основные закономерности накопления ферментов,
установленные для тех же культур, микроорганизмов, при выращи-
вании их периодическим способом. Культура грибов, полученная
непрерывным способом, успешно применялась в течение нескольких
месяцев для осахаривания крахмалистых заторов на Мичуринском
заводе.
Следует отметить, что активность грибных культур, полученных
поточным методом, пока еще недостаточно высока. Для эффектив-
ного внедрения этого метода необходимо разрешить вопросы под-
бора и оптимизации условий для осуществления повышенного био-
синтеза ферментов, особенно в период после максимального на-
копления биомассы гриба, оптимальной аэрации, перемешивания и
продления межстерилизационного периода до 48 ч.
Несмотря на все трудности, еще сопутствующие глубинному не-
прерывному культивированию грибов и бактерий для получения
344
Характеристика роста грибной культуры Asp. niger species при оптимальном
разбавлении и 40% посевного материала
Таблица 35
Длитель- ность роста, час Ферментатор № 1 Ферментатор № 2 Ферментатор № 3 Ферментатор № 4 Ферментатор № 5 Ферментатор № 6 '
биомасса, г/100 мл ОС, ед. биомасса, г/100 мл ОС, ед. биомасса, г/100 мл ОС, ед. биомасса, г/100 мл ОС, ед. биомасса, г/100 мл ОС, ед. биомасса, г/100 мл ос АС | | ДС
ед./100 мл
6 1,30 14
12 1,02 21 1,45 18
20 1,18 24 1,32 28 1,62 28
28 0,93 27 1,33 40 1,88 57 1,83 50
36 1,03 25 1,38 40 1,59 50 1,94 57 1,87 57 •
44 1,10 25 1,42 40 1,49 57 1,60 67 1,61 67 1,9 67 43 1102
52 1,12 27 1,42 44 1,65 57 1,64 67 1,77 67 1,83 67 43 —
60 1,10 1,31 1,62 57 1,93 67 1,90 80 1,80 67 60 1305
68 1,38 1,51 67 1,75 80 1,85 80 1,73 80 60 -—
76 84 1,62 1,79 62 1,90 1,82 80 71 1,80 1,75 1,80 80 80 74 60 60 56 1024 1143 ИЗО
Примечание Полужирным шрифтом выделены средние значения.
ферментов, сам метод является весьма перспективным и много-
обещающим именно в главном — в возможности дальнейшего ко-
ренного повышения продуктивности микроорганизмов.
ЛИТЕРАТУРА
1. Андреев К- П. К вопросу о теории непрерывного процесса спиртового
брожения гидролизатов древесины и сульфитных щелоков. Сборник трудов
ВНИИГСа VII, 1959.
2. Бурачевский И. И. Совершенствование технологии глубинный культур
плесневых грибов Aspergillus в спиртовом производстве. Автореферат канд.
диссертации. Воронежский технологический институт, 1967.
3. Вишневский, Глуханов, Ковалев. Аппаратура высокого давления
с герметическим приводом. Машгиз, 1960.
4. Вяткин В. В. Получение и применение глубинной культуры гриба Аспер-
гиллюс нигер. Бюллетень научно-технической информации ВНИИСПа, № 1,
Мичуринск, 1956.
5. Вяткин В. В. Повышение ферментативной активности глубинной культуры
гриба Аспергиллюс нигер путем применения магниевых соединений. Труды
ВНИИСПа. Вып. VI, 1958.
6. Двадцатова Е. А. Получение активных амилолитических ферментов из
Глубинных культур аспергиллов. В кн. «Внедрение ферментных препаратов в
народное хозяйство». Ч. I. ЦИНТИпищепром, 1961.
7. Двадцатова Е. А. Получение активного по амилазе гриба Asp. oryzae
3-9-15 для глубинного культивирования. В кн. «Внедрение ферментных пре-
паратов в народное хозяйство». Ч. I. ЦИНТИпищепром, 1961.
8. Голгер Л. И., Сергеева Н. М., Ашомко Э. Г. ВНИИФС. Отчет по
теме № 18, этап «Г», 1967. »
9. Двадцатова Е. А. Определение амилолитической активности эксперимен-
тального образца Asp. oryzae 3-9-15 при выращивании на различных пита-
тельных средах. Труды ВНИИСПа. Вып. VI, 1958.
10. Двадцатова Е. А. Образование амилазы у экспериментально полученно-
го варианта Asp. oryzae 3-9-15 при глубинном методе выращивания. Бюлле-
тень научно-технической информации ВНИИСПа, № 5. Мичуринск, 1958.
11. Диел ер Е. И. Использование аминокислот некоторыми аммонификатора-
ми. Канд, диссертация, 1964.
12. И е р у с а л и м с к и й Н. Д.’, Неронова П. Н. Количественная зависи-
мость между концентрацией продуктов обмена и скоростью роста микроор-
ганизмов. ДАН СССР. Т. 161, № 6, 1965.
13. К а л а ш н и к о в Е. Я., Лившиц Д. Б., Т р о й н и н а Т. И. Выделение
тепла плесневым грибом при его культивировании. «Микробиология». Т. XIX.
Вып. 6, 1960.
14. Комаров А. Ф. Ротационная воздуходувка и ее применение в спиртовой
и ферментной промышленности. «Ферментная и спиртовая промышленность»,
1965, № 6.
15. Малченко А. Л. О непрерывном производстве спирта на свеклосахарной
патоке. Сб. «Непрерывное брожение» и выращивание микроорганизмов. Пи-
щепромиздат, 1960.
16. Malik I. and Fen cl Z. Theoreticae and methodological basis of continuous
culture of mucroorganisms. Prague. 1966.
17. Николаева П. И. Разработка высокопроизводительного процесса выра-
щивания кормовых дрожжей на средах с жидкими нефтяными парафинами.
Диссертация. МИХМ, 1966.
18. Nomura М., Hosoda I., Akabori S. Effect of aminoacid analogues on
amylase formation by Bacillus subtilis; anapparent competition and normal
cellular protein synthesis. «Journ. Biochem.» Vol. 43, 1956.
19. Новотельное H. В., Кузнецова В. И. Влияние гордецина на актив-
ность бактериальных и грибных протеиназ. «Прикладная биохимия и микро-
биология». Вып. III, 1967.
346
20. Пыхов а С. В. Исследование поточного метода сбраживания при производ-
стве спирта из крахмалистого сырья. Канд, диссертация степени Воронеж-
ский технологический институт. 1963.
21. Рахлеева Е. Е. Поверхностная культура Bacillus subtilis, как источник
амилазы й протеиназы. В кн. «Внедрение ферментных препаратов в народ-
ное хозяйство». Ч. I. ЦИНТИпищепром, 1961.
22. С е р г е е в а Н. М. Исследования и выбор оптимальной конструкции пере-
мешивающего и аэрирующего устройства для глубинного культивирования
плесневых грибов. Канд, диссертация. МТИПП, 1964.
23. Смирнова А. П. Влияние состава среды на ферментативную активность
глубинной культуры плесневых грибов. Труды ВНИИСПа. Вып. VI, 1958.
, 24. С о с и н а С. М., Пашковская М. Т., К у р н е в и ч Л. И. Изучение син-
теза пектиназы при глубинном методе культивирования плесневого гриба
Asp. niger. Труды ВНИИПК. Вып. VIII, 1964.
25. Тихомирова А. С. Влияние источников углерода на образование ами-
лазы в глубинной культуре Bacillus subtilis. В кн. «Внедрение ферментных
препаратов в народное хозяйство». Ч. I. ЦИНТИпищепром, 1961.
26. Труды КБ ВНЙИФС. Проекты конструкции и установки для глубинного и
поверхностного выращивания культур плесневых грибов.
27. Ф е н и к с о в а Р. В., Ш и л о в а А. А. Амилолитические ферменты плесне-
вого гриба Asp. awamori. «Ферментная и спиртовая промышленность», № 5,
1964.
28. F u k u m о t о I., I a m а m о t о Т., D s и г и D. Amylase formation and car-
bon subtilis. Intern. Sumposium on the Enzyme Chemistry, Tokyo-Kyoto, 1957.
29. Херсоне в а Л. А. Образование пектолитических ферментов при глубин-
ном культивировании Aspergillus niger. «Ферментная и спиртовая промыш-
ленность», 1964, № 3.
30. Херсонова Л. А. Исследование процесса образования пектолитических
ферментов при глубинном культивировании Asp. niger П. Канд, диссерта-
ция. МТИПП, 1965.
31. Херсонова Л. А., Калунянц К.А.Производство пектолитическихфер-
ментных препаратов методом глубинного культивирования продуцента. «Фер-
ментная и спиртовая промышленность», 1964, № 3.
32. Юлиус А. А.; Бокова Е. И. Уточнение состава питательной среды для
глубинного культивирования Bacillus mesentericus ПВ. ВНИИФС. Отчет по
теме 2, раздел А, этап 2, 1964.
33. Яровенко В. Л., Нахманович Б. М., Щеблыкин Н П., Синке-
в и ч В. В. Непрерывное брожение в ацетоно-бутиловом производстве. Ка-
бардино-Балкарское книжное издательство, Нальчик, 1963.
34. Яровенко В. Л. Исследование и разработка методов непрерывного спир-
тового и ацетоно-бутилового брожения. Доклад-диссертация, 1963.
Глава VII. ПРОИЗВОДСТВО ТЕХНИЧЕСКИХ
И ОЧИЩЕННЫХ ФЕРМЕНТНЫХ ПРЕПАРАТОВ
ИЗ ГЛУБИННЫХ КУЛЬТУР
ПРОЦЕССЫ И АППАРАТУРА ДЛЯ ВЫДЕЛЕНИЯ ФЕРМЕНТОВ
ИЗ КУЛЬТУР ПЛЕСНЕВЫХ ГРИБОВ
Получение концентрированных и высокоочищенных фермент-
ных препаратов из культур плесневых грибов и бактерий, выра-
щенных глубинным способом, основано на сложной технологичес-
кой обработке больших объемов культуральной жидкости с приме-
нением типового современного технологического оборудования.
Способы производства слагаются из следующих основных опера-
ций: отделения мицелия и очистки культуральной жидкости; кон-
центрирования фильтрата; адсорбции амилазы на силикагеле;
элюирования фермента; осаждения ферментов из растворов орга-
ническими растворителями, отделения ферментного осадка от вод-
но-спиртовой смеси; сушки сиропов и ферментных осадков, измель-
чения, стандартизации и расфасовки готовых Препаратов.
Осаждение ферментов из концентрированной культуральной
жидкости органическими растворителями и последующее отделение
ферментного осадка от водно-спиртовой смеси центрифугировани-
ем отличаются от производства препаратов из поверхностных куль-
тур, тем, что на осаждение ферментов из глубинных культур рас-
ходуется 4 объема этилового спирта (96% об.) на 1 объем фермент-
ного раствора.
Отделение мицелия от культуральной жидкости
Исследованиями ВНИИФСа установлено, что эту операцию мож-
но проводить на фильтрпрессах и барабанных вакуум-фильтрах,
причем на последних процесс идет более эффективно — со ско-
ростью 100 Л/ч через 1 м2 фильтрующей поверхности почти без инак-
тивации ферментов. Из ферментаторов культуральная жидкость
поступает в барабанные вакуум-фильтры для отделения мицелия.
Барабанный вакуум-фильтр с наружной поверхностью фильтра-
ции является фильтром непрерывного действия.
Он представляет собой полый барабан, состоящий из двух дис-
ков, соединенных планками, на которые натянута металлическая
сетка, а поверх нее — фильтрующая ткань. Барабан разделен на
348
изолированные секторы числом от 12 до 24. Каждый из них через
каналы в полых цапфах соединен с неподвижной распределитель-
ной головкой, состоящей из нескольких камер. К одним камерам
подведены трубопроводы для вакуума, к другим — для сжатого
воздуха.
Барабан погружен в ванну и расположен на горизонтальном
валу, который опирается на два подшипника. Культуральная жид-
кость загружается в ванну на Уз ее высоты. При вращении бараба-
на она засасывается в один из его секторов, соединенный с систе-
мой вакуума, и фильтруется через сетку; фильтрат, отделенный от
мицелия, поступает в сборник. После выхода этого сектора из ван-
ны в него засасывается воздух, который просушивает осадок. Под-
сушенный осадок промывается водой, которая отводится отдельно,
а осадок отдувается избыточным давлением, после чего срезается
с фильтрующей ткани ножом или роликом, вращающимся в на-
правлении, обратном вращению барабана фильтра. Оставшаяся
пленка осадка удаляется при продувке фильтра сжатым воздухом.
Затем цикл повторяется. Таким образом, каждый сектор за один
оборот проходит последовательно зоны фильтрации, просушивания,
промывки, отдувки и продувки. На барабане имеются мертвые
зоны, которые препятствуют сообщению рабочих зон между собой.
В ванне фильтра установлена мешалка, а также устройство для
затирания трещин в слое осадка.
Схема установки барабанного вакуум-фильтра (рис. 92) вклю-
чает сборник для приема фильтрата, сборник для приема промыв-
ных вод, барометрический конденсатор, орошаемый водой, вакуум-
насос, центробежные насосы для откачивания фильтрата и промыв-
ных вод, автоматический клапан и поплавки для предохранения
от попадания фильтрата в конденсатор. При заполнении сборника
фильтратом поплавок поднимается, открывает клапан, давление
выравнивается фильтрация прекращается и насос откачивает из
сборника фильтрат. После понижения уровня фильтрата в сборни-
ке поплавок опускается, клапан закрывается и сборник вновь со-
единяется с барометрическим конденсатором; при этом разреже-
ние увеличивается и скорость фильтрации возрастает. При возмож-
ности расположения барометрической трубы высотой 10,5 м необ-
ходимость в установке конденсатора отпадает.
Толщина слоя осадка зависит от вида культивируемого плесне-
вого гриба и колеблется в пределах 5—20 мм, а также от числа
оборотов барабана, которое колеблется в пределах от 0,1 до 1,5
в минуту. Влажность осадка достигает 30%. Характеристика бара-
банных вакуум-фильтров приведена в табл. 36.
В некоторых барабанных фильтрах фильтрующую ткань заме-
няют бесконечные толстые шнуры, которые служат длительный
срок. Осадок с них удаляется с помощью валика.
Барабанный вакуум-фильтр БШП-1-1 непрерывного действия
состоит из ячейкового барабана, установленного консольно, ван-
349
ны, крышки, неподвижной распределительной головки, лопастной
мешалки и ножа для съема осадка. Все основные детали, соприка-
сающиеся с продуктом, изготовлены из винипласта или гуммирова-
ны и вполне пригодны для фильтрации культуральной жидкости
гриба Asp. niger П или Asp. awamori 16, pH которых находится
в пределах 4,1—5,3.
Рис. 92. Схема устройства барабанного вакуум-фильтра:
1, б — подшипники; 2 — вал; 3 — всасывающие трубки; 4 — барабан
с горизонтальной осью; 5 — подшипник; 6 — корыто; 7 — диск с от-
верстиями; 8 — закрепленная плита; 9 — канал баллона-отделителя.
Поскольку культуральная жидкость легко фильтруется на ра-
мочных фильтрпрессах обычного типа, для отделения мицелия от
жидкости можно с успехом пользоваться также автоматическими
фильтрпрессами. Преимущества их заключаются главным образом
в том, что выгрузка осадка механизирована, а все остальные опера-
ции полностью автоматизированы. Трудоемкие вспомогательные
операции при работе на обычных фильтрпрессах отнимают очень
много времени, тогда как в прессе ФПАКМ на них затрачивается
1—2 мин. По данным УкрНИИхиммаша, производительность ка-
мерного автоматического фильтрпресса в 4—10 раз выше произво-
дительности рамных фильтрпрессов, а габариты и металлоемкость
в 3 раза меньше.
350
Характеристика барабанных вакуум-фильтров
Таблица 36
Типоразмер Поверхность фильтрации, м2 Размеры барабана, мм Пределы регулирования числа оборотов в минуту Средняя скорость лопастей мешалки, Mjcen Максимально потребляемая мощность, кет, на валы Масса фильтра с приводом, кг
барабана мешалки
Б5-1,75/0,9 5 0 1750x900 0,13—2,0 0,2 0,1—1,0 1,0 5500
Б10-2,6/1,3 10 0 2600Х13С0 0,13—2,0 0,32 0,15—1,2 1,6 8400
Б20-2.6/2.6 20 0 2600X2600 0,13—2,0 0,32 0,2—1,8 2,2 13500
Б20-3,0/2,2 20 0 3000x2200 0,13—2,0 0,37 0,2—1,8 2,2 12500
Б40-3,0/4,4 40 0 3000X4400 0,13—2,0 0,37 0,3—2,5 2,5 14400
Характеристика автоматических фильтрпрессов ФПАКМ
Таблица 37
Марка фильтрпресса Поверхность фильтрации, м2 Зазор между плитами, мм Максимальное рабочее давление, Мн/м2 Ширина ткани, мм Габариты фильтра, мм Масса, кг Мощность электро- двигателей, квт
длина ширина высота
фильтр- пресса водонасос- ной станции
ФПАКМ 2,5-4,5 2,5 45 ~ 1,5 750 2410 1615 2155 4550 5,5 14
ФПАКМ 5-45 5 45 1,5 850 3000 1850 2430 7000 7,9 14
ФПАКМ 10-45 10 45 1,5 850 3000 1850 3150 9200 7,9 14
ФПАКМ 25-45 25 45 1,5 1100 3530 2410 3740 15000 14,2 28
Автоматический камерный фильтрпресс ФПАКМ (рис. 93)
состоит из фильтровальных горизонтальных плит, расположенных
с зазорами 30 мм между двумя опорными плитами, соединенными
четырьмя плоскими стяжками.
Вис. 93. Автоматический камерный фильтрпресс:
1, 5 — опорные плиты; 2 — фильтровальные плиты; 3 — нажимная
плита; 4 — электромеханический зажим; 6 — штуцер; 7 — нижняя
часть фильтровальной плиты; 8 — эластичные водонепроницаемые
диафрагмы; 9 — перфорированный лист; 10 — верхняя часть фильтро-
вальной плиты.
Верхняя часть фильтрующей плиты покрыта щелевым ситом.
Нижняя часть ее глухая, с конусным днищем для отвода фильтра-
та. Фильтрующая ткань протянута между плитами зигзагообразной
замкнутой лентой и натягивается натяжным приспособлением.
По контуру плит в специальном канале закрепляется резиновый
уплотнительный шланг для перекрытия зазора между плитами. При
подаче в уплотнительный шланг воды под избыточным давлением
768—960 кн!м2 его сечение изменяется,от эллипса к кругу и зажи-
мает фильтрующую ткань, создавая камеру. С помощью электроме-
ханического зажима создается давление на нажимную плиту, кото-
352
рая зажимает фильтровальные плиты. Поступающая через коллек-
тор жидкость под давлением фильтруется через ткань и перфориро-
ванное сито. Фильтрат поступает в камеры и затем через отводящий
'коллектор выводится в приемник, а осадок задерживается на по-
верхности ленты. При необходимости осадок промывают и отжи-
мают резиновыми диафрагмами. Фильтрат и промывные воды из
конусной части плит выводятся через коллектор слива и в коробке
клапанов слива разделяются на фильтрат, крепкие и слабые про-
мывные воды. Затем электромеханический зажим выключают, на-
жимная плита отходит, снимается давление воды и шланг прини-
мает первоначальную форму, открывая зазор для выхода ткани с
осадком. Передвижение ткани осуществляется роликами. Движу-
щаяся ткань выносит осадок из межплиточного пространства, а но-
жи, установленные у роликов, снимают основную часть осадка ина
сходящей ветви ткани ножи подчистки очищают ткань от оставше-
гося на ней осадка. Ткань, минуя последнюю плиту, поступает в ка-
меру регенерации, где промывается водой и очищается скребками.
Зажим всех плит пресса, закрытие, фильтрация, опускание плит,
передвижение фильтрующей ткани с осадком и выгрузка осадка
длятся 1—2 мин.
Управление фильтрпрессом автоматическое, может быть и по-
операционным с помощью кнопок. /
Производительность автоматического фильтрпресса зависит от
физико-химических свойств фильтруемого продукта и колеблется
от 2—5 до 158 кг/м2 в час. Влажность получаемых осадков 25—
70%.
Концентрирование культуральной жидкости
Отфильтрованную культуральную жидкость, за исключением
содержащей амилазу, упаривают в вакуум-выпарных аппаратах до
’/б—1/ю первоначального объема.
Проведенными во ВНИИФСе исследованиями установлено, что
ферменты плесневых грибов, выращенных глубинным способом,
термолабильны и более чувствительны к нагреву, чем ферменты из
поверхностной культуры гриба. Потери активности ферментов в
растворе уже при двухчасовом выпаривании (рис. 94) при темпе-
ратуре греющего агента 45°С превышают 20% от исходной актив-
ности. Дальнейшее увеличение времени выпаривания до 4—5 ч
влечет возрастание потерь до 50—75% и при пятичасовом выпари-
вании при температуре греющего агента 55°С — до 100%. Поэтому
при концентрировании культуральных жидкостей необходимо при-
держиваться одного из двух условий: наиболее низкой температуры
упаривания раствора либо наиболее краткого времени соприкосно-
вения упариваемого раствора с теплоагентом (в последнем случае
температуру теплоагента можно повысить, а значит и ускорить
процесс).
23—826
353
Оптимальной температурой упаривания в периодически дейст-
вующих вакуум-выпарных аппаратах является 30° С, а температура
греющего агента должна быть не выше 40° С; при концентрирова-
нии ферментных растворов в пленочных вакуум-выпарных аппара-
тах температуру теплоагента можно повысить до 80° С, а в аппа-
ратах, сочетающих энергичное выпаривание с последующим быст-
рым охлаждением концентрируемого раствора, — до 100° С.
Рис. 94. Потери активности фер-
ментов в зависимости от дли-
тельности упаривания при раз-
личной температуре (культу-
ральная жидкость гриба Asp.
oryzae):
1 - 45° С; 2 - 50° С; 3 - 55° С.
При введении в культуральную жидкость наполнителей (напри-
мер, NaCl для амилазы) можно повысить температуру выпарива-
ния без увеличения потерь ферментативной активности. Такой
прием повышает концентрацию сухих веществ в фильтратах куль-
туральных жидкостей, что в дальнейшем, во время тепловой обра-
ботки растворов при концентрировании, защищает ферменты от
инактивирующего воздействия высокой температуры, причем сам
процесс концентрирования интенсифицируется.
Для концентрирования культуральной жидкости целесообраз-
но применять выпарные аппараты, конструкция которых обеспечи-
вает глубокий вакуум, минимальную длительность контакта жид-
кости с поверхностью нагрева и наиболее быстрое удаление влаги.
Суточные объемы жидкости, подлежащей концентрированию,
сравнительно велики и составляют 30—100 м3, поэтому поверхность
нагрева выпарных аппаратов должна быть большой. Для этих це-
лей пригодны вертикальные вакуум-аппараты с внутренней нагрева-
тельной камерой и центральной циркуляционной трубой; вертикаль-
ные пленочные вакуум-выпарные аппараты типа Кестнера и центро-
бежные пленочные аппараты типа Центритерм.
Вертикальный выпарной аппарат с внутренней греющей камерой
и центральной циркуляционной трубой (рис. 95) изготавливается
из нержавеющей стали. По высоте он разделен на три части: грею-
щую камеру, сепаратор с отбойником и приемник упаренного
раствора. Греющая камера состоит из двух трубных решеток и ряда
вертикальных цельнотянутых труб. Трубки обычно короткие, при
354
большой производительности их максимальная высота не , более
4000 мм, диаметр 38 и 57 мм. По оси камеры расположенащирку-
.ляционная труба диаметром от 194 до 500 мм. Неконденсирующие-
ся газы удаляются поблизости от верхней трубной решетки.
Культуральная жидкость подает-
ся в верхнюю часть трубного про-
странства так, что жидкость нахо-
дится в трубках, а водяной пар окру-
жает трубки и отсасывается в виде
конденсата мокровоздушным ваку-
ум-насосом. Как только жидкость
закипает, уровень ее в трубках под-
нимается и она стекает вниз через
циркуляционную трубу. Вследствие
большой поверхности теплообмена,
приходящейся на единицу объема
концентрируемой жидкости, в каж-
дой кипятильной трубке парообразо-
вание протекает весьма интенсивно.
Удельный вес раствора в них мень-
ше удельного веса раствора в цент-
ральной трубе, что способствует ес-
тественной циркуляции раствора и
улучшению теплопередачи. После
отделения влаги в сепараторе вто-
ричный пар поступает в конденса-
тор, а сгущенная культуральная
жидкость направляется на дальней-
шие операции. Скорость естествен-
ной циркуляции жидкости зависит от
величины теплового напряжения,
поверхности нагрева, конструктив-
ных размеров аппарата, удельного
веса, вязкости жидкости и других
факторов. Хорошая циркуляция
жидкости наблюдается при запол-
нении трубок на 0,4—0,7 их высоты.
Известны многочисленные кон-
структивные модификации нагрева-
тельной камеры — встроенная и со-
ставляющая одно целое с аппара-
том, подвесная, вынесенная из аппа-
Рис. 95. Вертикальный выпар-
ной аппарат с внутренней гре-
ющей камерой и центральной
циркуляционной трубой:
1 — штуцер для выхода вторичного
пара; 2 — сепаратор с отбойником;
3, 9 — штуцеры для подвода пара;
4 — греющая камера; 5 — централь-
ная циркуляционная труба; 6 — шту-
цер для выхода конденсата; 7 —
приемник упаренного раствора; S —
штуцер для выхода раствора; 10 —-
сепаратор.
рата, применение бокового циркуляционного канала сегментообраз-
ного сечения и др.
В аппаратах большой производительности вместо одной цирку-
ляционной трубы устанавливают несколько, но меньшего диаметра,
которые обогреваются снаружи паром; при этом усиливается поток
23*
355
парожидкостной эмульсии вверх, что тормозит движение выпари-
ваемого раствора вниз.
Выпарные Аппараты этого типа по нормалям Главхиммаша
имеют номинальную поверхность нагрева 25; 50; 100; 150; 250 и
350 м2. Объем сепаратора от 0.7 до 11 м3.
1
Рис. 96. Вакуум-выпарной ап-
парат завода «Комсомолец»:
1 — отбойник; 2, 10 — обечайки; 3 —
смотровое окно; 4 — кольцо укреп-
ляющее; 5 — штуцер для подачи
раствора; 6 — воздушник; 7 — шту-
цер для подачи пара; 8 — трубки;
Р — труба циркуляционная; //—шту-
цер для выхода конденсата; 12 —
днище; 13 — штуцер для спуска
упаренного раствора и промывных
вод; 14 — штуцер для подачи
раствора.
На рис. 96 показан вакуум-выпарной аппарат с внутренней на-
гревательной камерой поверхностью нагрева 53 м2 и центральной
циркуляционной трубой, изготавливаемый тамбовским заводом
«Комсомолец».
356
Техническая характеристика вакуум-выпарного аппарата
завода «Комсомолец»
Поверхность нагрева, Л12..................... 53
Материал аппарата............................Сталь 1Х18Н9Т
Диаметр циркуляционной трубы, мм . 426
Диаметр трубок, мм......................... 38
Число трубок............................... 233
Давление в межтрубном пространстве:
кн/м2..........................................От 49 до 490
ат .... ......................От 0,5 до 5
Остаточное давление в трубном поостранст-
ве, кн/м2..............................1 . . 1—2
Диаметр аппарата, мм....................... 1200
Высота, мм................................. 5045
Масса, кг.................................. 3190
В тех случаях, когда в качестве теплоагента можно использо-
вать пар, для создания вакуума в выпарных и сушильных установ-
ках применяются пароструйные вакуумные насосы.
Пароструйные насосы. Многоступенчатые пароструйные
насосы получили большое распространение для создания 95—99,8%
вакуума и применяются при упаривании культуральной жидкости.
Преимущество их перед механическими заключается в том, что они
просты по конструкции, компактны, лишены движущихся частей, не
требуют ухода, занимают мало места, могут быть смонтированы
вблизи вакуумной установки и т. д. Недостатки — большой расход
пара, медленный пуск и более высокий, чем у механических насо-
сов, общий расход энергии.
1 — штуцер для подачи пара; 2 — сопло; 3 — головка; 4 — диф-
фузор; 5 — штуцер для выхода смеси; 6 — штуцер для воздуха.
Основные части пароструйного одноступенчатого вакуум-насо-
са (рис. 97): головка, сопло, смесительная камера и диффузор, за-
канчивающийся выводным штуцером. Головка снабжена всасываю-
357
щим штуцером для воздуха. Сопло представляет собой суживаю-
щуюся насадку, к которой присоединен конический патрубок для
пара.
Для смешения воздуха с паром рабочий водяной пар достаточ-
но высокого давления подводится к паровому патрубку струйного
насоса, откуда поступает в узкое поперечное сечение сопла, где
скорость его повышается и на выходе из сопла составляет 1000—
1400 м/сек. Давление пара при этом падает, вследствие поверхност-
ного трения пар увлекает засасываемый воздух, смешивается с ним
в смесительной камере и поступает в диффузор, где происходит
сжатие смеси, после чего она выталкивается в нагнетательный
трубопровод.
Насос обеспечивает вакуум порядка 85—87 кн/м2. Для получе-
ния более глубокого вакуума устанавливают последовательно со-
единенные пароструйные насосы; от числа ступеней, естественно,
зависит величина остаточного давления. Для остаточного давле-
ния 0,6—1,3 кн/м2 необходимы четыре ступени.
Многоступенчатые пароструйные вакуум-насосы могут созда-
вать предельное остаточное давление порядка 40 н/м2. Для умень-
шения расхода рабочего пара между каждой ступенью или через
две устанавливают противоточные смешивающие конденсаторы
с барометрической трубой или поверхностные конденсаторы, в ко-
торых отработавший пар конденсируется водой. Конденсат и вода
из конденсаторов Поступают самотеком в барометрический ящик.
Гипронефтемаш разработал, испытал и рекомендовал для се-
рийного производства пароэжекторные вакуум-насосы; некоторые
из них могут быть использованы в ферментной промышленности
(табл. 38).
Культуральную жидкость, содержащую активную а-амилазу,
концентрируют методом сорбции на силикагеле.
Сорбция амилазы на силикагеле
Связывание амилазы с силикагелем происходит в результате мо-
лекулярной сорбции, протекающей без химического взаимодейст-
вия фермента с поверхностью сорбента. Процесс идет главным об-
разом за счет ван-дер-ваальсовых сил и водородных связей меж-
ду силикагелем и белком.
Работами ВНИИФСа (М. С. Шульман с сотрудниками) уста-
новлено, что путем сорбции на силикагеле амилазы из культураль-
ной жидкости, полученной при глубинном культивировании Asp.
oryzae 3-9-15, и последующей десорбции можно увеличить концент-
рацию амилазы в растворе примерно в 10 раз. Сорбция может быть
проведена как в статических, так .и в динамических условиях. При
статической сорбции подготовленную культуральную жидкость в
358
Таблица 38
Характеристика эжекторных пароструйных насосов
Показатели 30-12- 3 эпн 12X3 ЭП 11X5 эпн 11X10 чэ- 65X6 эпм 70X30 ЭП 80X10 ЗЭ 200X40 ЗЭ 400x40 ЗЭ 640 X40; ЗЭ 1000X40
Число ступеней 5 5 4 3 4 2 3 3 3 3 3
Производительность, кг/ч 12 12 И 11 65 70 80 200 400 640 10000
В том числе
конденсирующихся газов 10 10 10 10 65 45 36 125 250 400 600
конденсирующихся паров 2 2 1 1 — 25 54 75 150 240 400
Остаточное давление у входа, 0,4 10,4 0,66 1,33 0,66 4 1,34 5,36 5,36 5,36 5,36
кн/м2
Давление рабочего пара, кн/м2 . 981 981 981 981 981 981 981 981 981 981 981
Общий расход пара, кг/ч 250 260 180 140 740 430 630 900 1800 3000 4000
Расход воды, м3/ч . 25 25 20 11 65 12 42 40 80 125 150
Тип конденсатора .... Пове ‘рхноет ный Смей юния Повер 1ХНОСТНЫЙ ( Смешения
Масса, кг . .’ . ... 1940 1940 1320 990 2260 750 1800 1400 2300 3200 4300
специальном аппарате (рис. 98) смешивают с силикагелем в те-
чение 10—15 мин, затем направляют смесь на центрифугу для от-
деления силикагеля с сорбированной на нем амилазой, после чего
десорбируют фермент с силикагеля путем элюции.
Рис. 98. Схема, сорбции амилолитических ферментов:
а — в динамических условиях: / — емкость для культуральной жидкости; 2 — бункер для
NaCl; 3 — дозатор уксусной кислоты; 4 — дозатор соляной кислоты; 5 — емкость для
элюента; 6—сорбционные колонки; 7 — емкость для элюата; 8 — насосы; 9 — сборник
элюата; 10 — сборник (смеситель) уксусной кислоты; // — сборник соляной кислоты;
б—в статических условиях: / — чан для сорбции; 2 — сборник NaCl; 3—весы; 4 — бун-
кер для NaCl; 5 — вакуум-фильтр с мешалкой; 6 — сборник элюата; 7 — емкость (доза-
тор) для элюента; 8 — чан для элюента; 9— насос; /0—муфельная печь; // — шаровая
мельница.
При динамической сорбции подготовленную культуральную
жидкость пропускают через колонну с силикагелем. Для десорбции
амилазы с поверхности силикагеля через колонну пропускают
элюент.
Кинетика сорбции и десорбции амилазы из культуральной жид-
кости изображена на рис. 99.
Процесс сорбции фермента зависит от ряда факторов, таких как
степень дисперсности силикагеля, pH, ферментативной активности
и специальной подготовленности культуральной жидкости.
Наиболее приемлем для сорбции неизмельченный силикагель
марки МСК (в динамических условиях) и высокодисперсный сили-
кагель той же марки (в статических условиях). Добавление в куль-
туральную жидкость поваренной соли увеличивает сорбционную
способность силикагеля, так как при последующем контакте это-
го раствора с силикагелем изменяется электростатический и элек-
360
Количеств раствора. л
Рис. 99. Кинетика сорбции и де-
сорбции амилазы 'из культураль-
ной жидкости.
1,0 ед/мл. Оптимальным значе-
трокинетический потенциал адсорбента и экранируется заряд кар-
боксильных групп ферментного белка.
При проведении сорбции в динамических условиях в культура-
льную жидкость следует добавлять 20% хлористого натрия, а в
статических — 28%. В динамиче-
ских условиях сорбционная ем-
кость силикагеля (до проскока)
составляет 90 амилолитических
единиц на 1 г; в статических для
сорбции 90—95% амилазы в ра-
створ следует вводить 5—8% вы-
сокодисперсного силикагеля (раз-
меры частиц 4—12 мкм).
Ферментативная активность,
т. е. концентрация амилазы в
культуральной жидкости, влияет
на ход процесса сорбции: с увели-
чением ее процесс идет более эф-
фективно. Установлено, что для
нормальной сорбции с получе-
нием указанных пределов сорб-
ционной емкости сорбента актив-
ность амилазы в культуральной
жидкости не должна быть меньше
нием pH культуральной жидкости для сорбции амилазы на сили-
кагеле является 4,7—4,9. Поэтому перед сорбцией в культуральную
жидкость прибавляют раствор уксусной кислоты.
Процесс десорбции фермента в динамических условиях осу-
ществляется путем пропускания через колонну фосфатного буфера,
имеющего pH 8,4. Количество элюата составляет 10% от объема
культуральной жидкости. Элюция амилазы в статический условиях
проводится путем обработки сорбата раствором ЫагСОз — вначале
4%-ным, а затем 1%-ным. Общий объем элюата не более 10% от
объема культуральной жидкости.
Регенерировать силикагель можно путем термической обработ-
ки в муфельной печи при 400° С в течение часа, или в сушильном
шкафу при 100°С в течение 5 ч, а также химической обработкой
однонормальным раствором соляной кислоты.
Общие потери активности при сорбции, десорбции и последую-
щем осаждении из элюатов изопропиловым спиртом составляют
25%. При осаждении другими органическими растворителями или
сернокислым аммонием они значительно возрастают.
Очистка концентрированной культуральной жидкости
Во ВНИИФСе в 1965 г. исследованы способы очистки концент-
рированных культуральных жидкостей от посторонних микроорга-
низмов путем центрифугирования, фильтрации через фильтры Зейт-
ца и ФКМ.
361
Центрифугирование позволяет очищать культуральные жид-
кости от посторонней микрофлоры на 90%, однако получаемые из
нее препараты содержат ЫО6 микроорганизмов в 1 г и поэтому
не всегда могут быть использованы в пищевой промышленности.
Фильтрация культуральной жидкости, сконцентрированной до
содержания сухих веществ 8—9%, через фильтры Зейтца со спе-
циальными стерилизующими пластинами или керамические фильт-
ры ФКМ со скоростью 100 л/ч позволяет полностью освободить ее от
микроорганизмов.
Сушка культуральных жидкостей и ферментных осадков
Сушка распылением — это сумма процессов, при которых твер-
дые частицы материала выделяются из растворов за Счет испаре-
ния влаги. При помощи специальных приспособлений (вращаю-
щихся дисков, форсунок) растворы диспергируются в сушильной
камере, через которую протекает тепло- и влагоноситель в газооб-
разном состоянии (нагретый воздух, газы продуктов сгорания, пе-
регретый пар и т. п.).
Большая поверхность диспергированных частиц способствует
интенсивному тепло- и массообмену с агентами сушки, и распылен-
ные частицы быстро отдают влагу. Высушенный продукт падает
на дно сушильной камеры в виде порошка и удаляется теми или
иными способами. Остальная часть его отделяется от отработавше-
го теплоносителя в пылеотделителях (матерчатых фильтрах, цикло-
нах, скрубберах). Готовый продукт — сухой порошок чаще всего
состоит из частиц шарообразной формы, которые бывают сплошны-
ми, пустотелыми или имеют губчатую структуру в зависимости от
молекулярной структуры высушиваемого раствора и режима суш-
ки.
Сушка методом распыления может применяться для обезвожи-
вания любых растворов, которые могут быть поданы к распыливаю-
щему аппарату насосом или под давлением.
Способ сушки распылением имеет ряд достоинств по сравнению
с другими способами: процесс идет весьма быстро (15—30 сек),
высушенный продукт получается хорошего качества с почти полным
сохранением исходной ферментативной активности; качественные
показатели готового продукта легко регулировать и изменять в
нужном направлении в зависимости от условий сушки (так, мож-
но регулировать и изменять в определенных границах объемный
вес сухого порошка, величину частиц, их конечную влажность и
температуру); механизирует технологический цикл и значительно
сокращает общую длительность процесса; из технологической схе-
мы исключаются операции центрифугирования, размола препара-
та и т. п.
В распылительных сушилках легко получить продукт, состоящий
из различных компонентов, путем добавления необходимого коли-
чества других растворов или сухих веществ в основной раствор
или путем одновременного распыления этих растворов; процесс не
362
сопровождается пылевыделением, что особенно важно при сушке
вредных для организма веществ.
Исследования, .проведенные во ВНИИФСе (К. А. Калунянц,
М. С. Ваганова, Л. А. Херсонова, Г. В. Бажова), показали возмож-
ность сушки культуральных жидкостей в распылительных сушил-
ках. Качество сушки зависит от содержания сахара в исходном
продукте. Как уже было сказано, диффузионные вытяжки из куль-
тур плесневых грибов, выращенных поверхностным способом, мож-
но сушить распылением лишь при внесении различных наполните-
лей из-за наличия в них относительно большого количества саха-
ров. В этом отношении ферментные растворы культур, выращенных
глубинным способом, более удобны, так как содержат меньшее ко-
личество сахаров (например, в культуре Asp. niger — не более
2 мг/мл).
Испытания сушки распылением культуральной жидкости Asp.
niger П (табл. 39) показали, что потери ферментативной активности
при этом весьма незначительны.
Таблица 39
Потери активности при сушке распылением -
Исходная культуральная жидкость Режим сушки* Сухой продукт
/ температура, теплоносителя, °C производи- тельность по исход- ному про- дукту, л/ч влаж- ность, % пектолити- ческая активность, ед/г потери активно- сти, %
содержание сухих веществ, % pH пектолита - ческая активность, ед/мл
на входе на выходе
1,8 4,9 25 175 70 35 8 1350 2,7
1,5 4,1 26 200 70 40 8 1700 2,0
1,1 4,5 25 225 75 60 10 2300 1 0,0
1,5 5,3 33 225 75 60 10 2200 0,0
1,1 4,4 23 225 75 60 8,7 2000 4,5
* Число оборотов распылительного диска во всех случаях было 18000 в ми-
нуту.
При повышении температуры воздуха на входе в сушилку
со 175 до 225°С производительность установки увеличивается в
1,7 раза.
Температурный режим в активной зоне рабочей камеры сушил--
ки показан на рис. 100. Как видно из характера кривых, темпера-
тура непосредственно за распылительным диском на расстоянии
200 мм от вертикальной оси сушильной камеры равна 65° С, через
300 мм по горизонтали 75° С и еще через 300 мм — 85° С. Это по-
казывает, что в рабочей зоне происходит моментальное понижение
температуры сушильного агента с 225 до 65—70° С, чем объясняют-
ся малые потери ферментативной активности.
363
Исследования влияния температуры сушильного агента на ак-
тивность амилазы (культуральная жидкость Asp. oryzae 3-9-1.5)
показали, что с повышением этой температуры резко снижается ак-
тивность амилазы в получаемых препаратах.
Температура воздуха, °C Активность
на входе в сушилку амилазы, % к на выходе исходной из сушилки
80 115 130 140 50 100 60 1 100 70 60 80 50
Из исследованных наполнителей, предназначенных для защиты
ферментов от тепловой инактивации, наилучшие результаты дал
хлористый натрий; хлористый кальций в процессе сушки вызывает
полную инактивацию амилазы; сернокислый натрий позволяет по-
лучать препараты ферментов без потери амилолитической актив-
ности, но с повышенной гигроскопичностью, а следовательно менее
стойкие.
Рцю. 100. Распределение температур в ак-
тивной зоне сушки.
В целях интенсификации процесса сушки распылением можно
предварительно упаривать культуральную жидкость Asp. oryzae
3-9-15 до содержания сухих веществ 10—15% и сушить ее при тем-
пературе воздуха на входе в сушилку 115—130 и на выходе 60—
65° С при предварительном добавлении хлористого натрия (50% к
сухим веществам жидкости).
Для сушки культуральной жидкости и ферментных экстрактов
чаще всего применяют распылительные сушилки. Процесс проводят
с предварительным упариванием до ‘/s—’/ю первоначального объ-
364
ема либо без него. При мгновенной сушке вытяжка или культураль-
ная жидкость не успевают нагреться выше допустимого предела,
что обеспечивает сохранение ферментативной активности препара-
тов.
В технике применяют центробежный способ распыления жидкос-
ти с помощью диска, вращающегося со скоростью 5000—
20 000 об/мин, механический — при помощи форсунок, в которые
жидкость нагнетается насосом под давлением до 19,6 Мн/м2, и
пневматический, при котором жидкость нагнетается в форсунки
сжатым воздухом под давлением 147—490 кн/м2.
Недостатки дискового распыления: сложность распыливающего
механизма, диски которого вращаются с окружной скоростью 200—
250 м/сек, большой диаметр факела распыла (до 15 м) и расход
электроэнергии в пределах 18 кет • ч/т жидкости. Культуральную
жидкость сушат нагретым воздухом в параллельном токе, что
уменьшает возможность перегрева и потерь ферментативной актив-
ности.
В распылительной сушилке с механическим распылением фор-
сунки расположены на медленно (1—2 об/мин) вращающейся крес-
товине, а воздух движется противоточно жидкости, подаваемой
насосом под давлением до 315 кн/м2. Расход электроэнергии при
механическом распылении 2—10 кет • ч/т жидкости.
При пневматическом распылении жидкость подается насосом
или самотеком к форсунке. Одновременно подается сжатый горя-
чий воздух. Скорость движения воздуха в сушилке 0,2—0,4 м/сек,'
напряжение объема сушильной камеры по влаге от 2—4 кг/(мъ'Ч)
при 130—150° С до 15—25 кг/(см3‘ ч) при 500—700° С. Расход элект-
роэнергии 50 кет« ч/т жидкости.
Распылительная сушилка ВНИЭКИпродмаша.
По заданию ВНИИФСа институтом ВНИЭКИпродмаш разработа-
на дисковая распылительная сушилка для сушки культуральной
жидкости.
Сушилка (рис. 101) состоит из сушильной башни, облицован-
ной внутри нержавеющей сталью; редуктора с распылительным
диском; устройства для удаления порошка; вентилятора с калори-
ферами для подогрева воздуха до 140—160° С, фильтров грубой
и бактериальной очистки для подачи стерильного воздуха; батареи
циклонов и скруббера для улавливания частиц продукта, увлечен-
ных отработавшим воздухом.
Культуральная жидкость из напорного бачка с постоянным
уровнем подается шестеренчатым насосом на распылительный диск
и распыляется им по всему сечению башни. Воздух, засасываемый
вентилятором из атмосферы, после грубой и бактериальной очист-
ки подается в калориферы, где подогревается паром при давлении
10 ат (980 кн/м2) до 140—160° С и затем спиралеобразно по направ-
ляющим поступает прямоточно движению культуральной жидкости
в сушильную башню. В процессе теплообмена жидкость испаряет-
ся, а твердые частицы падают на дно башни и удаляются с по-
365
Рис. 101. Распылительная сушилка ВНИЭКИпродмаша:
/ — бачок для ферментного раствора; 2, 10 — насосы; 3 — распылительный диск; 4 — устройство для удаления порошка, 5, б —калори-
феры; 7 — бактерицидный фильтр; 8, 14, 15 — вентиляторы; 9 — фильтр для грубой очистки воздуха; 11 — фильтр для очистки воздуха;
12 — шлюзовые затворы; 13 — циклоны; 16 — циклон-разгрузитель установки пневмотранспорта; 17 — скруббер; 18 — бункер для гото-
вой продукции; 19 — шлюзовой затвор; 20 — щит управления; 21 — сушильная башня.
мощью пневматического подборщика. Отработавший воздух вместе
с мельчайшйми частицами пыли поступает в две параллельно рабо-
тающие секции из шести циклонов-осадителей, в которых отделяет-
ся основное количество высушенного ферментного препарата. Про-
ходя через скруббер снизу вверх, воздух окончательно очищается
от взвешенных частиц и удаляется в атмосферу, а культуральная
жидкость из скруббера насосом подается через сборник в распыли-
тельную сушилку. Из циклонов ферментный порошок поступает
через шлюзовые затворы в трубопровод пневмоподачи.
Техническая характеристика распылительной сушилки
ВНИЭКИпродмаша
Производительность по испаренной влаге, кг/ч
Напряжение объема сушильной башни, кг/(м3-ч)
Объем башни, м3..............................
Диаметр, мм-
сушильной башни..............................
диска ...................................
Число оборотов распылительного диска в минуту
Окружная скорость диска, м/сек...............
Мощность электродвигателя распылительною ди-
ска, кет ...........
Скорость движения уборщика порошка, об/мин .
Влажность, %
исходного продукта...........................
высушенного ферментного препарата
Количество воздуха, подаваемого в сушильную
башню, м3/ч..................................
Температура воздуха, поступающего в сушильную
башню, ЪС....................................
Повехрность нагрева калориферов, м2 . . .
Расход пара при температуре воздуха 120°С, кг/ч
Температура воздушнопаровой смеси, удаляемой
из сушилки, °C...............................
Общая мощность установленных электродвигате-
лей, кет.....................................
Габариты сушилки, мм........................
Масса, кг....................................
500
2,5
200
6300
280
12000 и 14350
175 и 210
14
1,79—4
90—98
10
25000
120—160
370
1240
50
75
15 540X11 000Х
X12 500
34993
Двухст ул енчатая распылительная сушилка.
Для сушки культуральной жидкости пригодна двухступенчатая
распылительная -сушилка ИСА-ИТЭ6, широко применяющаяся для
сушки антибиотиков.
Агрегат (рис. 102) состоит из приемной камеры, системы под-
готовки воздуха, испарительной и сушильной камер с дисковым
распылением жидкости, циклонов, фильтров и вспомогательного
оборудования.
Культуральная жидкость подается на распылительный диск ис-
парительной камеры, вращающийся со скоростью 18 000 об/мин.
В испарительную камеру подается противоточно отработавший воз-
дух из сушильной камеры, и в процессе теплообмена жидкость упа-
ривается, концентрируясь в 5—6 раз, после чего направляется че-
367
рез циклон на распылительный диск второй ступени — в сушильную
камеру. Здесь она высушивается встречным потоком воздуха и по-
ступает в циклон для отделения продукта от воздуха. Продукт с по-
мощью специальных устройств выгружается в стерильных условиях,
а воздух с температурой 100—110°С, содержащий часть неотделен-
ного продукта, поступает в испарительную камеру.
Рис. 102. Двухступенчатая распылительная сушилка:
/ — патрубок для входа пара; 2 — фильтр входной; 3 — вентилятор; 4 —
фильтр из ткани ФПП; 5 — паровой калорифер; 6 — электрокалорифер;
7 — испарительная камера; 8 — центробежный дисковый распылитель; 9 —
сушильная камера; 10 — штуцеры для вакуума; 11 — выгрузочное устрой-
ство; /2—циклон; 13— циклон мокрый; 14 — штуцер для входа воды;
/5 —сборник; 16 — тепловой барьер; /7 — штуцер для входа раствора.
Отработавший воздух из испарительной камеры с температурой
45—50°С поступает в циклоп для отделения пыли и удаляется в ат-
мосферу.
Техническая характеристика агрегата ИСА-ИТЭ6
Производительность по испаренной влаге, кг/ч . 120—200
В том числе
в испарительной камере..................... 80—145
в сушильной камере...................... 40—55
Температура воздуха, подаваемого в камеру, °C
исп зрительную.............................. 90— 110
сушильную............................... 150—220
Количество воздуха, подаваемого в камеру, кг/ч
испарительную....................... 2000—1800
сушильную.................................... 1800
Расход пара, кг/ч.................................. 276
Давление пара, кн1м2........................ 490
368
Мощность, кет
максимальная............................ 190
.рабочая............................ 120
Диаметр испарительной камеры, мм ... 2500
Высота цилиндрической части, мм . ... 1200
Объем камеры, м?........................ 8
Диаметр сушильной камеры, мм.......... 3200
Высота цилиндрической части, мм .... 1450
Объем камеры, м?....................... 19
Габариты установки (по условно занимаемому объ-
ему), м........................................5,5X9,5X12,5
Масса агрегата, кг..................•. . . 14000
Сушка ферментных осадков в вакуум-сушильном аппарате. Ра-
ботами ВНИИФСа показана возможность высушивания спирто-
осажденных ферментных осадков из культур плесневых грибов, вы-
ращенных глубинным способом, в аппаратах под 'вакуумом.
Скорость сушки под вакуумом зависит от интенсивности подво-
да тепла к высушиваемому продукту, остаточного давления в су-
шильной камере, толщины слоя продукта на противнях, структуры
высушиваемого продукта и степени загрузки аппарата.
При сушке ферментных осадков при температуре теплового
агента выше 30°С наблюдается повышенная потеря активности. На-
иболее сильно это проявляется при сушке осадков для препаратов
Оризин ГК и Аваморин ГК и в меньшей степени — для препаратов
Терризин ГК и Нигрин ГК. Оптимальной толщиной слоя высуши-
ваемого продукта на противнях следует считать 10 мм. Температура
теплового агента при сушке должна быть для Аваморина ГК и Ори-
зина ГК 30°С, а для Терризина ГК и Нигрина ГК 35°С. Процесс
целесообразно проводить с помощью вакуумного пара. При таких
условиях содержание влаги в препарате снижается с 35—40 до 8—
10% в течение 20—25 ч; потери активности в пределам 10—15%.
Сушка сублимацией. Обезвоживание ферментных растворов ме-
тодом сублимации в вакууме представляет большой практический
интерес.
Интенсивность сушки сублимацией зависит от следующих фак-
торов: величины теплового потока и спектральной характеристики
излучателя; общего давления в сублиматоре; температуры конден-
сации, определяющей парциальное давление у поверхности кон-
денсации; физико-химических свойств продукта и, в частности, его
коллоидной природы.
Проведенные во ВНИИФСе и МТИППе исследования сублима-
ционной сушки препаратов, содержащих комплекс протеолитических
и пектолитических ферментов, позволили установить, что в про-
цессе сушки инактивация ферментов минимальна. Предварительно
установлены следующие режимы: замораживание продуктов при
температуре минус 25°С; подогрев сверху керамическим излучате-
лем; толщина слоя высушиваемого продукта 10 мм, давление в суб-
лиматоре 6—20 н/м2, температура конденсатора минус 30°С; темпе-
24—826
369
ратура поверхности материала в конце сушки 30°С. При таком ре-
жиме процесс длится 8 ч.
Ферментные препараты можно сушить в сублимационных уста-
новках периодического действия. Для вновь проектируемых заво-
дов ферментных препаратов большой мощности целесообразно при-
менять сублимационные сушилки непрерывного действия.
Сублимационная сушильная установка непре-
рывного действия. Научно-исследовательским институтом
химического машиностроения (НИИхиммаш) разработана непре-
рывнодействующая сублимационная сушилка, которая пригодна
для сушки ферментных препаратов.
Рис. 103. Сублимационная сушилка непрерывного действия:
/ — насос ВН-4Г; 2 — насос ВН-6МГ; 3 — насос ВН-1; 4 — насос ВВН-12, 5 — фильтр
ФТО; 6 — конденсатор-вымораживатель; 7 — питатель; 8 — выгрузочное устройство;
9 — сублиматор; 10 — электроподогреватель; // — выгрузочная камера; /2 - насос
ВН-1МГ; 13 — насос центробежный.
Установка (рис. 103) состоит из расходного бачка; питающего
устройства; ленточной сублимационной сушилки для высушивания
в условиях высокого вакуума; электроподогревателя для подогрева
воды, поступающей в досушиватель; конденсатора-вымораживате-
ля для вымораживания паров влаги, отсасываемых из сублимаци-
онной сушилки; конденсатора-вымораживателя для осушки воздуха
перед заполнением им емкостей и для вымораживания паров при
вакуумировании емкостей; выгрузочного устройства для непрерыв-
ной передачи высушенного материала из сублимационной сушилки,
370
работающей под вакуумом, в нормальные атмосферные условия.
Воздух из системы откачивается вакуум-насосами ВН-6МГ, ВВН-12
и ВН-4Г.
Продукт в виде суспензии влажностью до 90% подается в рас-
ходный бачок, снабженный регулятором уровня, и из него самоте-
ком поступает в питающее устройство, в котором поддерживается
температура минус 6—7°С. Суспензия замораживается, дробится,
превращаясь в ледяную крошку с частицами размером 0,1—4 мм,
после чего подается в сублиматор на ленту, над которой располо-
жены' нагревательные плиты. В первой зоне поддерживается тем-
пература до 200—250°С, а в последней — около 40°С. Сушка в суб-
лиматоре протекает при остаточном давлении 13,3 н/м2.
Из сублиматора продукт поступает в шнековый досушиватель,
в котором поддерживается то же давление, но при температуре
15—40°С, выходит из него с влажностью 2% и через шлюзовой
затвор подается в одно из выгрузочных устройств, снабженных ва-
лом с лопатками для перемешивания. Отсюда продукт поступает на
расфасовку и упаковку.
Охлаждение и замораживание в питающем устройстве создают-
ся с помощью аммиачной холодильной установки производительно-
стью 10—12 тыс. ккал/ч. Продолжительность сушки продукта 1—3 ч.
Техническая характеристика сублимационной сушилки непрерывного
действия НИИхиммаша
Производительность по испаренной влаге, л/ч . 50
Внутренний объем, м3................................. 86,5
Внутренний диаметр корпуса, мм....................... 2800
Рабочее давление, н/м2......................... 13,3
Рабочая температура, °C........................ 30—40
Установленная мощность, кет.......................... 85,54
В том числе
электродвигателей................................. 4,54 ;
нагревателей.............................. 81
Рабочая поверхность ленты, м2.................. 31,7
Длительность пребывания продукта на ленте, ч . От 1 до 3
Габариты, мм...................................14700X5890X3920
Стандартизация и расфасовка ферментных препаратов, получен-
ных из культур грибов, выращиваемых глубинным способом, про-
водятся таким же образом и на той же аппаратуре, что и при про-
изводстве из поверхностных культур (см. гл. V).
ВЫДЕЛЕНИЕ ФЕРМЕНТОВ ИЗ КУЛЬТУР БАКТЕРИЙ
К операциям выделения ферментов из культур бактерий, выра-
щенных глубинным методом, относятся: отделение микробной мас-
сы и некоторых балластных веществ «путем центрифугирования
предварительно обработанной химически культуральной жидкости;
концентрирование очищенной культуральной жидкости на вакуум-
выпарной установке; сушка упаренных ферментных растворов рас-
пылением, высаливание, осаждение ферментов из растворов орга-
24* 371
ническими растворителями; отделение осадков из растворов на се-
параторе, разделение амилазы и протеазы путем адсорбции амила-
зы на крахмале; очистка растворов от красящих веществ на уголь-
ных и ионообменных фильтрах; сушка осадков сублимацией; из-
мельчение, стандартизация и расфасовка.
Такие операции, как центрифугирование, стандартизация и рас-
фасовка ферментных препаратов выполняются аналогично и на том
же оборудовании, что и при производстве ферментных препаратов
из культур грибов, выращенных поверхностным способом, и изло-
женном в главе V. Остальные операции выполняются на оборудова-
нии, также описанном в гл. V, но отличаются по параметрам.
Концентрирование культуральной жидкости
Проведенные во ВНИИФСе работы показали, что ферменты,
содержащиеся в культуральной жидкости бактерий группы subti-
lis—mesentericus, менее термолабильны, чем ферменты плесневых
грибов. Выпаривание их можно вести под вакуумом при температу-
ре 30—32°С. В этом случае температура греющего агента на пленоч-
ных выпарных аппаратах может быть доведена до 90°С. При ука-
занном режиме потери ферментативной активности составляют по
амилазе максимум 10%, протеазе 5% и сычужному ферменту 6%.
На циркуляционных вакуум-выпарных установках, в которых энер-
гичное выпаривание сочетается с последующим быстрым охлажде-
нием, температура теплового агента может быть доведена до 100°С.
По данным К. А Калунянца и М. С. Вагановой, режим выпари-
вания культуральной жидкости Вас. mesentericus на циркуляцион-
ной вакуум-выпарной установке следующий: температура греющего
пара 100°С, температура кипения концентрируемого ферментного
раствора 30°С. При таком режиме происходит подкисление получа-
емого сиропа, а в конденсат уходят вещества, дающие щелочную
реакцию. В процессе концентрирования резкий неприятный запах,
свойственный культуральной жидкости Вас. mesentericus, ослабева-
ет в сиропе и значительно усиливается в конденсате, что, вероят-
но, связано с переходом в него некоторых ароматических веществ.
В процессе выпаривания из раствора выпадает неактивный осадок,
количество которого возрастает с увеличением кратности упарива-
ния. Поэтому концентрация сухих веществ при выпаривании фер-
ментных растворов в вакуум-выпарных установках увеличивается
медленнее, чем ферментативная активность этих растворов.
Сушка ферментных растворов распылением
Исследованиями, проведенными в ферментном отделении
ВНИИФСа, разработаны оптимальные технологические режимы
сушки распылением ферментных растворов, полученных при куль-
тивировании Вас. mesentericus глубинным способом. На фермента-
тивную активность при сушке распылением влияет температура
воздуха (теплового агента), выходящего из сушилки (рис. 104). При
372
повышении ее более чем до 80° в высушенных порошках сначала
падает активность амилазы, затем сычужная и, наконец, протеазы.
Введение наполнителей (например, поваренной соли) улучшает
процесс, и в ряде случаев такой прием является единственным, при
помощи которого
При содержании сахаров более
1000 мг/л высушиваемый продукт
налипает на стенки сушильной
камеры и ферменты инактивиру-
ются от длительного соприкосно-
вения с горячей поверхностью.
При введении наполнителей соот-
ношение сахаров и сухих веществ
в культуральной жидкости умень-
шается, что дает возможность
сушить раствор без помех. Уста-
новлено (М. С. Ваганова, К. А. Ка-
лунянц), что в целях улучшения
условий сушки к культуральной
жидкости необходимо добавлять
20% NaCl от содержащихся в ней
сухих веществ.
Более рациональна сушка
культуральной жидкости, скон-
центрированной до содержания
сухих веществ 10—12%, проводи-
мая при том же режиме, что и
жидкости.
можно высушить культуральную
жидкость.
Рис 104. Кривые изменения активно-
сти ферментного комплекса Вас.
mesentericus в зависимости от темпе-
ратуры сушильного агента на выходе
из распылительной сушилки:
/ — амилолитическая активность; 2 — сы-
чужная активность; 3— протеолитическая
активность
сушка исходной культуральной
Осаждение ферментов органическими растворителями
В качестве растворителей были испытаны метиловый, этиловый
и изопропиловый спирт и эфиро-альдегидная фракция.
Установлено, что метиловый спирт вызывает сильную инактива-
цию амилолитических ферментов; так, при добавлении 5—7 объе-
мов его на 1 объем ферментного раствора теряется до 50% актив-
ности, а при использовании 6—8 объемов инактивация достигает
70%. Этиловый спирт полностью осаждает ферменты при добавле-
нии 4 объемов на 1 объем концентрированной до 10—12% сухих
веществ культуральной жидкости. Изопропиловый спирт полностью
осаждает ферменты при соотношении 2:1, а эфиро-альдегидная
фракция при отношении ее к концентрированной культуральной
жидкости 3,8:1.
Адсорбция амилазы на крахмале
Эта операция, помимо очистки ферментов амилолитического
комплекса от сопутствующих примесей, позволяет проводить разде-
ление амилазы и протеазы, содержащихся в концентрированной
культуральной жидкости.
373
Адсорбция амилазы проводится на крахмале, прошедшем пред-
варительную тепловую обработку (модифицированный крахмал).
Наибольший эффект получается при разделении амилазы и проте-
азы бактериального происхождения, что обусловлено спецификой
их молекулярной структуры. Сорбция бактериальной амилазы до-
стигает более 5000 ед. АС на 1 г крахмала при добавлении в куль-
туральную жидкость около 20% сернокислого аммония. Сорбция
амилазы крахмалом при пониженной температуре проходит значи-
тельно эффективнее, чем при обычной комнатной температуре.
Очистка ферментных растворов от красящих веществ
Проведенными во ВНИИФСе исследованиями показано, что
очистка ферментных растворов от красящих веществ может быть
осуществлена путем пропускания раствора через слой активирован-
ного угля или ионообменной смолы типа ЭДЭ-10П.
Выделение ферментов высаливанием
Известно, что растворы белков или ферментов в воде состоят из
двух фаз: дисперсионной среды и дисперсной фазы. В результате
ионизации частицы диспергированного вещества приобретают элек-
трический заряд, а гидрофильные группы коллоида (например, NH2,
СО, NH, ОН, СООН) связывают молекулы воды с образованием
гидратной оболочки.
Стойкость коллоидных растворов в значительной мере опреде-
ляется наличием в молекуле коллоида гидрофильных групп. В ре-
зультате действия электростатического притяжения коллоидных
частиц молекулы воды в зависимости от знака их заряда ориенти-
руются в пространстве определенным образом. Поэтому образую-
щиеся вокруг коллоидных частиц гидратные оболочки состоят из
ориентированных диполей воды. Гидратные оболочки являются как
бы промежуточными связующими звеньями между дисперсной фа-
зой и дисперсионной средой и возникающим на поверхности этих
оболочек одноименным электрическим зарядом, которые препятст-
вуют объединению коллоидных частиц.
Коагуляция коллоидов и выделение их в осадок возможны пу-
тем «снятия» гидратных оболочек с коллоидных частиц и лишения
этих частиц электрического заряда, что часто достигается прибав-
лением небольшого количества электролита. К дегидратирующим
средствам относятся некоторые соли, ввиду чего способ осаждения
коллоидов при помощи солей получил название высаливания. Так
как коллоиды при высаливании практически полностью выпадают в
осадок, их можно отделять таким образом от низкомолекулярных
соединений.
734
Высаливание ферментов из 3%-ной культуральной жидкости Вас. mesentericus
о
СС
SJ
X
t?
хо
сз
Ь
1 Выход ферментов, % CG ТГ Щ Ю Ш О £ § 3 £
ПС 05 О О чГ СО —ХГ СО OQ 05 ОО оо со со со Ю Ш
АС Ю СЧ _ 05 тг чГ - * О ’—'СО -Э Ю О 05 00 05 -м СО Ш
Активность ферментов, ед/г абсолютно сухих веществ СС Q Q О О О О 1 8 8 8 8 § S 2 3 g 3 2 iO Ш СО СЧ СЧ
ПС О О СО 05 ю со оо о со ь* сч О О 00 г- ш ю СЧ —«
АС 1700 1300 1015 718 487 448
1 Осадок вес, г/л СЧ СО СЧ СЧ ю ю сч сч со со — СО Ю г* С** 05 о
процентное содержание Ю —’ со сч сч LO-NCOC5- со со ю ю со ю
| Фугат содержание сухих веществ, % to СЧж ю сч 05 оо О СО со со ч^ чг ю ш ю
рн ш оо 00 СО со ю ш ш ш ш
Степень насыщения со 00 СО сч 4f Ю со со г- оо о" о" o' d o~ £
Высаливание широко при-
меняется для фракционирова-
ния белков и в том числе фер-
ментов. Это достигается путем
периодического повышения
концентрации соли в растворе
и соответственно периодичес-
кого отделения образующихся
осадков. Концентрацию соли,
необходимую для высаливания
белков, обычно выражают в де-
сятых долях насыщения рас-
твора. Известно, что для осаж-
дения одних групп белков тре-
буется 0,4—0,5 насыщения, а
для других 0,8, 0,9 и так далее,
вплоть до полного насыщения
раствора.
Наиболее часто высаливаю-
щим средством служит суль-
фат аммония (NH^jSOi, ре-
же — сернокислый натрий
(N2SO4). Метод высаливания
широко используется зарубеж-
ными фирмами—производите-
лями ферментных препаратов
для получения технических и
очищенных, вплоть до кристал-
лических, препаратов.
Экспериментальные данные,
полученные Калунянцем и Ва-
гановой (табл. 40), характери-
зуют эффективность высалива-
ния ферментов из культураль-
ной жидкости Вас. mesenteri-
cus ПБ следующего качества:
содержание сухих веществ
3,0%, АС = 7,32 ед 1мл, ПС =
= 8,75 ед!мл, сычужная актив-
ность 2670 ед[мл\ pH 6,8.
Как видно из данных этой
таблицы, при степени насыще-
ния сернокислым аммонием от
0,53, до 0,61 в осадок выделяет-
ся до 100% амилазы и сычуж-
ный фермент на 97—100%.
Протеазу удается выделить на
81% при степени насыщения
375
0,44. Дальнейшее повышение концентрации сернокислого аммония
вызывает снижение выхода протеазы в осадок.
При высаливании ферментов из 3%-ной культуральной жидко-
сти на одну весовую часть препарата расходуется почти 90 частей
соли.
Для уменьшения расхода сернокислого аммония целесообраз-
но проводить высаливание из более концентрированных ферментных
растворов, предварительно упаренных на вакуум-выпарных аппа-
ратах.
Теми же авторами установлено, что выделение ферментов
комплекса Вас. mesentericus следует проводить из концентрирован-
ной до 30% сухих веществ культуральной жидкости. В этом слу-
чае концентрация сернокислого аммония, обеспечивающая
100%-ный выход ферментов, равна 0,32 от полного насыщения.
Продолжительность высаливания при использовании флотоагента
толуола равна 20 мин, а температура высаливания 3—5°С. При
таких параметрах расход сернокислого аммония составляет 5 г на
i г абсолютно сухого препарата.
Сравнивая высаливание с методом выделения ферментов оса-
ждением органическими растворителями, следует отметить, что при
использовании последнего метода выделение ферментов в осадок
и его последующая обработка лучше всего осуществляются из ра-
створов с относительно небольшой концентрацией сухих веществ
(10—15%). Это требует большого расхода растворителей, что ве-
дет к удорожанию выпускаемого ферментного препарата.
Сушка биопрепаратов сублимацией
Проведенными во ВНИИПК (Э. Р. Ставрова, О. Н. Конева,
В. Л. Мельцер и др.) исследованиями установлен оптимальный ре-
жим сушки биопрепаратов сублимацией.
Автолизаты, направляемые на сушку, необходимо предваритель-
но концентрировать. Разделение на центрифугат и осадок позволя-
ет сконцентрировать основную массу бактериальных клеток и фер-
ментов в белковой части осадка, сократить объем раствора пример-
но в 5 раз и ускорить процесс сушки в 2 раза, что в целом сокра-
щает цикл приготовления биопрепаратов в 10 раз. Сушка осадка
автолизата без предварительного замораживания более рациональ-
на в связи с экономией времени и энергии.
Температура греющих поверхностей электронагревателей мо-
жет быть доведена до +60°С. В конечный период сублимации (при
испарении 60% влаги), когда температура продукта повышается
и близка к нулю, необходимо снизить температуру электронагрева-
телей до 40—45°С во избежание перегрева препарата и его прежде-
временного оттаивания.
Из. данных табл. 41 видно, что около 60% времени биопрепарат
находится в замороженном состоянии, а около 40% составляет пе-
риод досушки. Толщина слоя высушиваемого материала на против-
376
Влияние сушки сублимацией на качество биопрепаратов (по данным ВНИИ ПК)
Таблица 41
Номер варианта
Вариант
Режим процесса
период сублимации период досушки общая дли- тельность сушки, мин
максималь- ная темпе- ратура , °C длитель- ность, мин максималь- ная темпе- ратура, °C длитель- ность, мин
Изменение качества препаратов в
% (±)
протеолитическая
активность количество микрофло- ры
по расщеп-
общая лению ка-
зеина
1 Жидкие автолизаты с предваритель- ным замораживанием —27 180 +43 155 335 +32 — -55
2 Жидкие автолизаты с предваритель- ной дегазацией и самозаморажива- нием —21 225 +43 180 435 +5 — —98
3 Второй вариант при повышенной тем- пературе сублимации .... — 12 105 +25 130 235 —20 — -63
4 Осадок автолизата с предваритель- ным замораживанием .... — 16 55 +43 115 170 +33 —И —91
5 Осадок автолизата с самозаморажи- ванием и максимальной темпера- турой досушки ниже 40°С — 18 85 4-38,8 55 140 +70 +20 —93
6 Осадок автолизата с самозаморажи- ванием и максимальной температу- рой досушки выше 40°С — 16 85 +56,5 50 135 —29,8 -31 —92
7 Пятый вариант при толщине слоя, мм
2,5 — 16 40 + 40 52 92 +59,5 + 17,6 -65
5,0 —22 80 +36,5 30 ПО +59,5 +38 —72
10,0 —27 120 +41 80 200 +82,5 +59,3 —74
нях должна быть 10 мм. В период самозамораживания из препара-
та удаляется 16—17% «лаги, в период сублимации 65—67 и в пери-
од досушки 15—16%.
Оптимальный температурный режим работы сублимационной
сушилки при сушке осадка, выделенного центрифугированием, сле-
дующий: температура сублимации не ниже минус 15—20°С, темпе-
ратура досушки не выше 40°С.
ТЕХНОЛОГИЧЕСКИЕ СХЕМЫ ПРОИЗВОДСТВА ФЕРМЕНТНЫХ
ПРЕПАРАТОВ
Преимущество схем с применением глубинного культивирования
перед схемами производства препаратов с применением поверхно-
стного культивирования микроорганизмов состоит главным образом
в том, что все основные производственные процессы механизирова-
ны и ведутся на герметически закрытом оборудовании, что значи-
тельно облегчает труд и создает нормальные санитарно-гигиениче-
ские условия работы. Кроме того, очистка культуральной эцидко-
сти, ее концентрирование и последующая сушка могут проводить-
ся по непрерывной схеме.
К недостаткам схемы следует отнести относительно низкую кон-
центрацию ферментов в культуральной жидкости (в 5—6. раз мень-
ше, чем в диффузионной вытяжке из поверхностной культуры гри-
ба Asp. niger). Естественно, что для концентрирования культураль-
ных жидкостей требуется большее количество энергии, что в конеч-
ном итоге увеличивает себестоимость полученных препаратов по
сравнению с препаратами из поверхностных культур на 10—15%.
Однако препараты, выделяемые из глубинных культур, наиболее
чисты в микробиологическом отношении и содержат гораздо мень-
ше побочных ферментов, что очень ценно при условии применения
их в пищевой промышленности и медицине.
ТЕХНИЧЕСКИЕ ПРЕПАРАТЫ
Нигрин ГР
Препарат предназначен для льноперерабатывающей промыш-
ленности.
Технологическая схема получения этого пектолитического препа-
рата (рис. 105) состоит из следующих операций: приготовление чи-
стой культуры гриба в пробирках; выращивание посевного мице-
лия в колбах на качалке; выращивание посевного мицелия в ино-
куляторах; приготовление и стерилизация питательной среды; вы-
ращивание культуры гриба — продуцента ферментов в производ-
ственном ферментаторе; отделение мицелия от культуральной жид-
кости и очистка ее от микроорганизмов; концентрирование культу-
ральной жидкости; сушка сиропа (сконцентрированной культураль-
ной жидкости); стандартизация и расфасовка готового препарата.
378
Рис. 105. Технологическая схема производства Нигрина ГР:
/ — бак для питательной среды; 2 — стерилизатор; 3 — пробирка с маточной культурой; 4 — колба с маточной
культурой; 5 — инокулятор; 6 — ферментатор; 7, // — сборники; 8 — вакуум-фильтр; 9 —фильтр Зейтца; /0—-
вакуум-выпарной аппарат; 12— распылительная сушилка; 13 — батарейный циклон; 14 — стандартизатор; /5—весы;
16 — сушилка ВИС-42 D; /7 — холодильник; 18— приемник; 19 — вакуум-насос; 20 — компрессор; 21 — фильтр грубой
очистки; 22 — фильтр с тканью Петрянова.
Приготовление посевного материала в пробирках и выращива-
ние посевного мицелия в колбах проводится в микробиологической
лаборатории завода, где для проведения их имеются соответствую-
щие отделения и боксы, снабженные стерильным воздухом необхо-
димой температуры и влажности, так как все работы проводятся в
стерильных условиях.
Посевной материал 'плесневого гриба Asp. niger штамм П гото-
вится на среде, состоящей из 4% свекловичного жома, 0,5% куку-
рузной муки, 0,7% двузамещенного фосфата аммония, 0,05% серно-
кислого магния, 0,1% однозамещенного фосфата калия и с добав-
лением до 100% водопроводной воды; pH среды лежит в пределах
6—7. Посевной материал в пробирках выращивается на морковном
агаре. Выращивание посевного мицелия в колбах проводят на ка-
чалке (180—200 оборотов в минуту) в течение 42 ч при температу-
ре 42°С.
Посевной материал для производственной культуры выращива-
ют в ферментационном отделении завода в специальных аппара-
тах — инокуляторах. Процесс проводится в несколько стадий: под-
готовка и проверка на герметичность инокуляторов; приготовление
и стерилизация питательной среды; посев; выращивание посевного
мицелия.
Для систематического обеспечения стерильности производства
необходимо проводить тщательную проверку инокуляторов на гер-
метичность после каждого цикла и при необходимости менять про-
кладку на вентилях и фланцах. Для выращивания.посевного мице-
лия в инокуляторах применяется среда того же состава, что и для
выращивания в колбах.
Среду готовят в специальном чане, где компоненты ее растворя-
ют в воде и тщательно размешивают, а полученную смесь насосом
перекачивают в предварительно простерилизованный инокулятор.
Стерилизацию его ведут острым паром под давлением 117—
137 кн!м2 в течение 1,5—2 ч. По такому же режиму стерилизуют
производственные ферментаторы.
Питательную среду стерилизуют непосредственно в инокулято-
ре острым паром при температуре 120°С в течение часа. Для охлаж-
дения ее через рубашку аппарата пропускают холодную воду. По
достижении температуры 32°С охлаждение прекращают и прово-
дят посев при минимальном движении воздуха вокруг инокулятора.
Для соблюдения стерильности вокруг посевного штуцера создают
кольцевую зону пламени при помощи факела с ватой, смоченной
спиртом. Крышку, снятую со штуцера, также держат под пла-
менем.
Посевной материал в количестве 0,8—1,0% от объема питатель-
ной среды выливают из колб в инокулятор. Выращивание прово-
дится при непрерывной работе мешалки и подаче стерильного воз-
духа температурой не выше 40°С при расходе 60 >и3/лс3 аэрируемой
жидкости в час; давление в инокуляторе поддерживается в преде-
лах 0,5—1,0 ат (49—98 kh/m2), температура 30°С, pH 6,0—7,5. При
380
соблюдении указанных условий рост посевной культуры заканчи-
вается за 42 ч.
Посевной материал для засева производственного ферментато-
ра не должен содержать автолизированного мицелия. При обна-
ружении его такой посевной материал (если активность его не ме-
нее 15 ед. ПкС/лм) «передают на фильтрацию и .последующие опе-
рации для получения пектолитичеокого препарата.
Выращивание культуры гриба, образующего активную «пектина-
зу, проводится в производственных ферментаторах, емкость кото-
рых в 10 раз больше емкости инокулятора. Питательная среда для
выращивания производственной культуры имеет тот же состав, что
и для посевного мицелия в колбах, но без однозамещенного фосфата
калия. В качестве пеногасителя используется растительное масло
или олеиновая кислота в количестве 1,5% от веса среды. pH среды
должен находиться в пределах 6,0—7,0.
Питательную среду готовят в специальном смесителе, как и сре-
ду для посевного материала. В смеситель вначале набирают воду,
включают мешалку, а затем вносят двузамещенный фосфат аммо-
ния и сернокислый магний. Затем постепенно добавляют свекло-
вичный жом и кукурузную муку, повышая к концу загрузки темпе-
ратуру до 70—80°С. Такой порядок внесения компонентов среды
позволяет избежать наличия комков в смеси. Среду выдерживают
при температуре 80°С в течение 20 мин и передают на стерилизацию
острым паром в стерилизационную установку непрерывного дейст-
вия. Давление пара перед колонкой 5 ат (490 кн!м2). Стерилизация
длится 20 мин при температуре 130°С; в течение указанного време-
ни среда проходит стерилизатор и выдерживатель и затем через
холодильник, где охлаждается до 32°С, и поступает в ферментатор.
После охлаждения отбирают пробу для определения pH, соста-
ва среды и отсутствия посторонней микрофлоры. Показатели среды
должны быть следующими: углеводы в пересчете на глюкозу после
гидролиза с соляной кислотой 2,0%, общий азот 0,2%, пектиновые
вещества 1 %.
Загрузку простерилизованной питательной среды в ферментатор
ведут при поддержании давления внутри него 38—49 кн!м2; после
покрытия средой нижнего яруса лопастей мешалку включают в ра-
боту. Для засева производственной среды посевным материалом из
инокулятора давление в нем повышают и при создавшемся перепаде
давлений в аппаратах спускают посевной материал в ферментатор.
Количество посевного материала должно составлять 8—10% к объ-
ему среды.
Выращивание производственной культуры проходит при темпе-
ратуре 30—32°С, давлении в аппарате 38 кн!м2 при непрерывной
аэрации среды стерильным воздухом температурой не выше 40°С в
объеме 60 м?1м среды в час и непрерывной работе мешалки. При
соблюдении указанных условий выращивание длится 60—65 ч.
Об окончанйи процесса судят по изменению величины pH, кото-
рая к концу процесса должна быть в пределах 4,8—5,0 и по дина-
381
мике потребления аммиачного азота. Культуральную жидкость
давлением сжатого воздуха передают .в сборник, откуда она непре-
рывно поступает на барабанные вакуум-фильтры с фильтрующей
тканью бельтинг или диагональ-фильтр для отделения мицелия.
Отфильтрованная от мицелия жидкость поступает в промежу-
точный бак, а из него насосом подается на фильтр Зейтца, заря-
женный стерилизующими пластинами.
Мицелий, оставшийся после фильтрации, поступает для сушки
на аппараты ВИС-42Д, где его влажность уменьшается с 75 до 13—
14%. Количество мицелия, получаемого из 1 м3 культуральной жид-
кости, составляет 70—85 кг при влажности 75—80%. Высушенный
мицелий расфасовывают в крафт-мешки и направляют на реали-
зацию в качестве корма для скота.
Культуральная жидкость очищается от посторонней микрофлоры
на фильтрах Зейтца; фильтрат поступает в вакуум-выпарной аппа-
рат пленочного типа непрерывного действия, где концентрация су-
хих веществ в нем повышается в 5 раз путем упаривания при темпе-
ратуре 28—30°С. Греющий пар должен иметь температуру не выше
75°С. Полученный сироп направляется в распылительную сушилку.
Сушильным агентом является воздух, поступающий в сушилку с
температурой 200°С и давлением 2 ат (196 кн/м2). Температура в
зоне сушки продукта 65—70°С, а воздуха на выходе из сушилки
65°С. Сироп поступает в сушилку непрерывно, так же непрерывно
отводится в приемник сухой порошок. Полученный порошок актив-
ностью 1700—2000 ед. ПкС/г стандартизуют добавлением бентони-
та до активности 1000 ед., расфасовывают в хлорвиниловые меш-
ки по 5 кг и упаковывают в жестяные банки.
Препарат Аваморин ГПР (пектолитический) получают по этой
же технологической схеме, но в качестве продуцента используется
гриб Asp. awamori штамм 16, который выращивают на среде, опи-
санной на стр. 76—77.
Пектолитическая активность препарата Аваморин ГПР 1000 ед.
ПкС/г.
Оризин ГР, Аваморин ГР и Терризин ГР
Препараты получают по технологической схеме для Нигрина ГР.,
но выращивают другие штаммы плесневых грибов, на иной среде
и в другие сроки.
Так, для производства Оризина ГР используется штамм Asp.
oryzae 3-9-15; выращивание ведется на среде, содержащей 6% ку-
курузной муки, 0,9% азотнокислого натрия и 0,05% сернокислого
магния; pH среды 6—7; выращивание длится 48—52 ч. Для про-
изводства Аваморина ГР используется штамм Asp. awamori 22; вы-
ращивание ведется на среде, содержащей 3% кукурузной муки,
0,91 % азотнокислого натрия (по азоту 0,15%),по 0,05% сернокисло-
го магния и хлористого калия, 0,1% однозамещенного фосфорно-
кислого натрия и 0,001% сернокислого железа; pH среды 7,0—7,2;
382
выращивание длится 52 ч. В производстве Терризина ГР исполь-
зуется Asp. terricola штамм 3374; выращивание ведется на среде,
содержащей по 3% кукурузной муки и гидрола, 1% углекислого
кальция и 0,3% ‘кукурузного экстракта; pH среды 5,5—6,5; выращи-
вание длится 48 ч.
Мезентерии ГР
Этот комплексный препарат предназначается для кожевенной
промышленности.
Схема его производства в основном аналогична схеме производ-
ства препарата Нигрин ГР (включая выращивание производствен-
ной культуры). Для получения Мезентерина ГР используется куль-
тура бактерии Вас. mesentericus ПБ, выращенная на жидкой пита-
тельной среде методом глубинного культивирования. В качестве пи-
тательной среды используется водный раствор, содержащий 2%
крахмала, 0,89% фосфорнокислого аммония, 0,15% хлористого ка-
лия, 0,05% сернокислого магния, 0,01% хлористого кальция и 1%
кукурузного экстракта.'
Исходным посевным материалом является культура Вас. mesen-
tericus штамм ПБ, выращенная на сусло-мясопептонном агаре при
температуре 37°С в течение 18 ч. Этим посевным материалом засе-
вают питательную среду с pH 7,2; выращивание длится 20 ч при
37°С. Выращенным посевным материалом засевают среду в иноку-
ляторе из расчета 2—3% от объема среды при условии, что в 1 мл
культуры содержится 5«108 бактериальных клеток. Выращивание
посевного материала в инокуляторе длится 18—20 ч при температу-
ре 37°С, при непрерывной работе мешалки и непрерывной аэрации
стерильным воздухом с температурой 30°С в количестве 30 м?1м?
среды в час.
Выращенная в ферментаторе культура бактерий является полу-
продуктом для производства Мезентерина ГР. Для изготовления
препарата ее направляют в промежуточный сборник, а из него —
на распылительную сушилку. Сушка ведется при следующем ре-
жиме: температура воздуха при входе в сушилку 130°С, при выходе
из нее 70°С.. Полученный порошок стандартизуют до активности
100 ед. ПС/г, фасуют в крафт-мешки по 20 кг и направляют по-
требителю.
Более очищенный препарат Мезентерии ГВК можно получать по
схеме, предложенной Калунянцем и Вагановой. Культуральную
жидкость, отделенную от бактериальных клеток, направляют на
вакуум-выпарную установку и концентрируют до содержания су-
хих веществ 30%, затем в осадителе прибавляют к ней сернокислый
аммоний до степени насыщения 0,32.
Полученную смесь сепарируют, отделенный ферментный оса-
док увлажняют до 80% и сушат на распылительной сушилке при
температуре теплоагента на входе в сушилку 100°С и на выходе из
нее 50°С.
383
Активность ферментов в полученном по такой схеме препарате
составляет: амилолитическая 1300 ед. АС/г; протеолитическая
650 ед. ПС/г; сычужная 270 000 ед. СС/г.
ОЧИЩЕННЫЕ ФЕРМЕНТНЫЕ ПРЕПАРАТЫ
Терризин ГК
Препарат предназначается для использования в рыбной и мяс-
ной промышленности. Схема производства его (рис. 106) до кон-
центрирования культуральной жидкости включительно аналогична
схеме производства Нигрина ГР.
Сконцентрированная на вакуум-выпарной установке культураль-
ная жидкость содержит 10% сухих веществ. Ее направляют в оса-
дители, где смешивают с этиловым спиртом в соотношении 1:4. Эта
операция аналогична получению ферментных осадков из диффузи-
онных вытяжек при поверхностном культивировании. Ферментный
осадок отделяют от спиртового раствора на сепараторах или цен-
трифугах, раскладывают на противни слоем 30 мм и сушат в ваку-
ум-сушильном аппарате при остаточном давлении 30 мм рт. ст. и
температуре 35°С. После дробления высушенного осадка активность
его составляет не менее 600 ед. ПС/г, что в 6 раз выше активности
порошка, получаемого при сушке распылением. Следует отметить,
что потери ферментативной активности при производстве Терри-
зина ГК на 12—20% больше, чем при производстве Терризина ГР.
По аналогичной схеме организуется производство препаратов
Аваморин ГК, Аваморин ГПК и Оризин ГК.
Рис. 106. Технологическая схема производства Терр,изина ГК:
/—бак для питательной среды; 2 — стерилизатор; 3 — пробирка с маточной культу-
рой; 4 — колба с маточной культурой; 5 — инокулятор; 6 — ферментатор; 7, 11 — сбор-
ники; 8 — вакуум-фильтр; 9 — фильтр ФКМ, 10 — вакуум-выпарной аппарат; /2 — оса-
дитель; 13—сепаратор ВСС; 14—нутч-фильтр; 15—вакуум-сушилка; 16—шаровая
мельница; 17 — стандартизатор; 18 — весы; 19 — компрессор; 20 — фильтр грубой очи-
стки, 21 — фильтр с тканью Петрянова
384
Мезентерии ГК
Препарат предназначен для сыродельной и мясной промышлен-
ности. Выращивание культуры ведется по схеме и режимам, приме-
няемым при производстве Мезентерина ГР.
Для производства Мезентерина ГК культуру направляют на
фильтрпресс для отделения бактериальных тел, а затем на фильтр
Зейтца или керамический — для отделения посторонней микрофло-
ры. Фильтрат концентрируют на вакуум-выпарной установке до со-
держания сухих веществ 10% и затем направляют в осадитель, где
к нему добавляют спирт крепостью 96% об. (4 объема на 1 объем
раствора). Полученный ферментный осадок отделяют на центрифу-
ге от водно-спиртового раствора, сушат в вакуум-сушильном аппа-
рате, измельчают, стандартизуют и расфасовывают в полиэтилено-
вые мешки по 1, 3 и 5 кг, после чего отправляют потребителю.
Из 1 ж3 культуральной жидкости получается до 4 кг препарата с
протеолитической активностью 400 ед. ПС/г и влажностью 10%.
Глюкозооксидаза и каталаза
Препараты предназначены для использования в различных от-
раслях пищевой промышленности.
Споровую культуру гриба Penicillium vitale выращивают на про-
се. Полученной культурой засевают посевную среду, на которой в
течение 44 ч выращивают мицелиальный посевной материал.
Питательная среда для посевного материала содержит 2% са-
хара, 0,2% азотнокислого калия и 0,6% кукурузного экстракта (по
сухим веществам). Процесс выращивания посевного материала
на такой среде проходит при 26°С и длится 96 ч.
При необходимости получения лабильной глюкозооксидазы ко-
личество посевного материала должно быть 1 % от веса питатель-
ной среды, а для получения в культуральной жидкости только ката-
лазы — 15—20%.
Максимальный расход воздуха при выращивании наблюдается
в период 6—48-го часа, т. е. в период интенсивного накопления
мицелия. Избыточное содержание растворенного кислорода в среде
недопустимо, так как образующаяся глюкозооксидаза окисляет
глюкозу тем интенсивнее, чем больше кислорода содержится в сре-
де. Выделяющаяся при этом перекись водорода инактивирует фер-
мент.
При оптимальных условиях активная кислотность среды к 10-му
часу культивирования нарастает и pH достигает величины 5,8—
5,9; а к 24-<м часам 3,45—3,55. В дальнейшем наблюдается пониже-
ние активной кислотности, и к концу процесса pH среды достигает
величины 3,7—3,9. Выращивание производственной культуры ве-
дется в ферментаторах в течение 72 ч при температуре 28—30°С и
дифференцированном аэрировании среды в соответствии со стади-
ями роста гриба. В таких условиях в 1 мл культуральной жидкости
25—826
385
накапливается по 70—90 ед. глюкозооксидазы и каталазы, а выход
очищенных препаратов этих ферментов составляет по 300—400 мг!л.
Метод получения очищенных препаратов каталазы основан на
сорбции фермента окисью алюминия с последующей десорбцией
0,Ш фосфатным буфером (при pH 6,8), осаждением фермента про-
пиловым спиртом 50%-ной концентрации и высушиванием осадка в
полочной вакуум-сушилке.
При получении очищенных препаратов глюкозооксидазы в каче-
стве сорбента используется каолин, обладающий значитель-
но большей сорбционной емкостью по отношению к этому фер-
менту.
Активность получаемых препаратов (в ед/г): глюкозооксидазы
100 000—200 000 и каталазы 200 000—600 000.
Оризин ГКА
Препарат предназначен для использования в хлебопекарной про-
мышленности.
Технологическая схема получения его (рис. 107) до стадии очи-
стки культуральной жидкости на фильтрах Зейтца аналогична опи-
санным выше. Концентрирование культуральной жидкости прово-
Рис. 107. Технологическая схема производства Оризина ГКА:
1 — бак для питательной среды; 2 — стерилизатор; 3 — пробирка с маточной куль
турой; 4 — колба с маточной культурой; 5 — инокулятор; 6 — ферментатор; 7, 10 —
сборники, 8—вакуум-фильтр; 9 — фильтр Зейтца; 11— дозатор уксусной кислоты,
/2 — бункер для NaCl, 13 — емкость для культуральной жидкости; 14 — дозатор со-
ляной кислоты; /5 — емкость для элюента; 16 — сорбционные колонки; /7 — сборник
элюата; 18—мерник вытяжки; 19 — мерник спирта; 20 — осадитель; 2/— сублима-
ционная сушилка; 22—шаровая мельница; 23 — стандартизатор; 24 — весы, 25 — ком-
прессор, 26 — фильтр грубой очистки; 27 — фильтр с тканью Петрякова.
дится путем адсорбции амилазы на силикагеле по динамической
либо статической схеме. При сорбции в статических условиях сор-
бированная силикагелем амилаза, отделенная от раствора на цент-
рифуге, поступает на сушку в вакуум-сушильный аппарат, после
чего ее дробят и расфасовывают в полиэтиленовые мешки по 2 кг.
При сорбции в динамических условиях сорбированную амилазу
элюируют, пропуская через колонку фосфатный буфер с pH 8,4.
Ферменты из полученного раствора осаждают изопропиловым спир-
386
том, а осадок сушат на сублимационной сушилке. Полученную ле-
пешку измельчают в шаровой мельнице, стандартизуют крахмалом
или поваренной солью и расфасовывают в хлорвиниловые мешки по
1 кг, которые упаковывают в жестяные банки. Эта схема выгодно от-
личается от других схем получения препаратов высокой очистки
значительно меньшим расходом органических растворителей.
Супербиолаза
Препарат содержит амилолитический комплекс ферментов и
предназначается для использования в текстильной и пивоваренной
промышленности.
Технологическая схема производства супербиолазы (рис. 108)
состоит из следующих операций: приготовление посевного материа-
ла в бутылях, выращивание посевного материала в инокуляторах,
Маточник
Рис. 108. Технологическая схема производства супербиолазы из Вас.
diastaticus:
/ — производственный ферментатор; 2 — аппарат для высаливания; 3 — сепаратор;
4 — нутч-фильтр; 5 — сборник маточника; 6 — вакуум-сушильный шкаф; 7 — шаровая
мельницу 8 — весы; 9 — вакуум-выпарной аппарат; /0—рамный фильтр); // — про-
межуточный сборник; 12— кристаллизатор; /3 — центрифуга; /4—пробирка с маточ-
ной культурой; 15 — колба с маточной культурой; 16 — инокулятор.
выращивание производственной бактериальной культуры в фер-
ментаторах, высаливание фермента из культуральной жидкости, от-
деление ферментного осадка на сепараторе, высушивание его и из-
мельчение, регенерация сульфата аммония.
Как видно из изложенного, поточная линия должна обеспечить
выращивание бактерий в стерильных условиях при продувании воз-
духа, выделение фермента из культуральной жидкости, сушку его
и регенерацию сернокислого аммония.
Приготовление посевного материала в бутылях и выращивание
его в инокуляторах проводится в отдельном помещении, называе-
мом малым ферментационным залом. Продуцентом супербиолазы
является бактерия Вас. diastaticus. Музейный штамм ее хранят на
среде, состоящей из 0,5 г пептона, 0,1 г мела, 2 г агар-агара в 100 мл
20%-ного картофельного отвара. Пересевы проводятся раз в 20—
25 дней. Из 18—24-часовой культуры, выращенной в пробирке на
387
этой среде, бактерии смывают водой. Полученную таким образом
бактериальную суспензию используют для засева питательной сре-
ды в бутылях, которую готовят следующим образом: 6 л 5%-ного
раствора картофельного отвара, содержащего 0,1% мела, помеща-
ют в 10-литровую бутыль, ставят ее в автоклав и стерилизуют при
температуре 120°С в течение 30 мин. Простерилизованную среду
охлаждают до 61—62°С, после чего вносят в нее бактериальную су-
спензию, приготовленную по изложенной выше методике.
Бутыль с засеянной питательной средой помещают в термостат
и поддерживают в нем температуру 60°С. Выращивание бактерий
продолжается 10—12 ч, в течение которых культуру периодически
микроскопируют и определяют амилолитическую активность фер-
ментов. При нормальном развитии культура должна состоять из
молодых делящихся клеток. Полученная готовая культура исполь-
зуется для засева среды в инокуляторах, предназначенных для вы-
ращивания посевного материала. Количество ее должно составлять
10% от объема среды в инокуляторе.
Питательную среду готовят непосредственно в инокуляторе, за-
ливая в него 0,7% воды от полного объема. В марлевые мешочки
закладывают очищенный и нарезанный картофель (5% от веса за-
груженной воды), погружают их в воду и экстрагируют питатель-
ные вещества из картофеля путем кипячения в инокуляторе в тече-
ние 40 мин. Затем экстракт охлаждают до 60°С, пропуская воду
через рубашку инокулятора, открывают люк, извлекают мешочки с
разваренным картофелем, добавляют к полученному экстракту мел
(0,1% от веса жидкости) и стерилизуют полученную массу при
1,5 ат (147 кн!м2) в течение 30 мин. После охлаждения до 61—62°С
питательную среду засевают культурой из бутылей.
Выращивание посевного материала ведут при непрерывном про-
дувании через слой среды воздуха в количестве 42 мг1м3 среды в час
и непрерывном перемешивании при температуре 60°С в течение 5—
6 ч. Периодически пробы выращиваемой культуры микроскопиру-
ют и определяют активность амилазы.
Особенность культивирования бактерии по этой схеме — отно-
сительно высокая температура процесса (60°С). Недостаток схе-
мы — довольно низкая механизация процессов и проведение их в
одном помещении, что может вызвать инфицирование посевного ма-
териала и привести к срыву работы предприятия.
В большом ферментационном зале проводится выращивание
бактерий в ферментаторах, высаливание и отделение ферментного
осадка от маточйого раствора.
В качестве питательной среды для выращивания бактерий в
ферментаторах также используется картофельная среда. Очищен-
ный на специальной машине картофель режут и загружают в спе-
циальный аппарат из расчета 5% от веса воды для получения от-
вара. Экстракцию ведут 40 мин при температуре 100°С, после че-
го экстракт направляют в ферментатор, добавляя в него мел
(0,1% от веса среды). Полученную смесь стерилизуют 30 мин при
388
давлении 1,5 ат (147 кн!м2), Охлаждают до 62—63°С и засевают по-
севной культурой из инокулятора из расчета 10% от объема среды
в ферментаторе. Выращивание длится 5—6 ч при температуре 60°С,
непрерывном перемешивании среды и непрерывном аэрировании
подачей воздуха ib количестве 60 м3/м3 среды в час.
Готовую культуральную жидкость направляют для высаливания
фермента в реактор, снабженный мешалкой и рубашкой. После ох-
лаждения культуральной жидкости до 18—<20эС ее смешивают с
сульфатом аммония из расчета 60% по весу жидкости. Полученная
смесь отстаивается 2 ч, а затем направляется на сепаратор для
отделения ферментного осадка от маточника; полученный осадок
переносится на нутч-фильтр для более полного отделения маточ-
ника, который затем поступает в сборники и направляется на реге-
нерацию сернокислого аммония.
Снятый с нутч-фильтра осадок направляют на сушку в обычной
шкафной сушилке при атмосферном давлении с рециркуляцией воз-
духа при температуре 60°С. Высушенный осадок измельчают на ша-
ровой мельнице и расфасовывают по 5 кг .в хлорвиниловые мешки,
укладываемые в жестяные коробки.
В отдельном изолированном помещении завода проводится ре-
генерация сернокислого аммония, состоящая из следующих процес-
сов: упаривания, фильтрации, кристаллизации и сепарирования.
Маточник поступает на выпарной аппарат и концентрируется, а при
последующей горячей фильтрации сульфат аммония очищается
от примесей. Очищенный раствор передается в кристаллизатор.
Здесь он охлаждается и из него выпадают кристаллы сульфата ам-
мония, после чего маточник удаляют декантацией, а кристаллы
отжимают на центрифуге. Полученные кристаллы содержат до
1,5% влаги (маточного раствора). Последующее охлаждение их
приводит к дальнейшей кристаллизации и срастанию. Для лучшей
очистки сульфата аммония отделенные на центрифуге, кристаллы
промывают водой.
ФЕРМЕНТНЫЕ ПРЕПАРАТЫ ИЗ ОТХОДОВ
ДРУГИХ ПРОИЗВОДСТВ
Римозин ГР
Препарат предназначается для использования в кожевенной
промышленности. Технологическая схема получения его из отходов
производства кормового окситетрациклина разработана во
ВНИИФСе Э. А. Шишковой.
Образование протеолитических ферментов при культивировании
Asp. rimosus идет параллельно с образованием антибиотика и за-
канчивается одновременно на пятые сутки, достигая 7—10 ед/мл.
К этому времени практически все количество протеазы накапли-
вается в культуральной жидкости, а 80—85% антибиотика — в ми-
целии, так что путем фильтрации фермент легко отделяется от ан-
тибиотика.
389
В дальнейшем фильтрат, содержащий протеолитические фермен-
ты, концентрируют на вакуум-выпарной установке до содержания
сухих веществ 9—16%, а затем сушат на распылительной сушилке.
Температура воздуха на входе в сушилку 100—110°С, а на выходе
из нее 50—60°С.
Потери протеолитической активности при сушке составляют 7—
10%, а сумма потерь на всех операциях, связанных с выделением,
не превышает 15%. Препарат имеет протеолитическую активность
240—320 ед. ПС/г при влажности 7,5—8,5%.
Инвертин
Препарат предназначен для использования в кондитерской про-
мышленности. Производство его основано на использовании в ка-
честве продуцента фермента осадочных пивных дрожжей — отхода
пивоваренного производства.
Технологическая схема получения препарата, содержащего фер-
мент инвертазу, разработанная сотрудниками УкрНИИППа
(рис. 109), состоит из следующих операций: промывки дрожжей во-
дой, отделения дрожжей путем сепарации, обогащения их инвер-
Рис. 109. Технологическая схема производства инвертина:
/—бак для хранения пивных дрожжей; 2 — чан для промывки дрожжей; 3 — ком-
прессор; 4 — напорный бак; 5, 10 — сепараторы; 6, 11, /5 — сборники; /—обогатитель-
ная колонка; 8 — отстойник; 9 — автолизатор; /2 —напорный мерник; 13 — осадитель;
14 — центрифуга; 16 — напорный сборник, /7 — ректификационный аппарат; 18 — де-
флегматор; 19 — холодильник; 20 — сборник спирта; 2/— напорный мерник спирта;
22 — теплообменник; 23, 24 — напорные мерники мелассы.
тазой, декантации жидкости, отделения дрожжей на сепараторе, ав-
толиза, сепарации, подготовки раствора к выделению фермента,
осаждения инвертазы этиловым спиртом, центрифугирования, стан-
дартизации препарата и его расфасовки.
Дрожжи, поступившие с пивоваренного завода, направляют в
промежуточную емкость для хранения, откуда по мере надобности
подают на промывку водой в специальный чан-промыватель. Для пе-
ремешивания в 'промыватель через барботер подается воздух. По-
лученную смесь воды и дрожжей насосом перекачивают в напор-
ный бак, откуда она самотеком поступает в дрожжевой сепаратор.
390
Отделенные на сепараторе дрожжи направляют на обогащение ин-
вертазой в обогатительные колонки, куда также подается раствор
питательных солей и необходимое количество углеводов. В качест-
ве источника углеводов применяют мелассу (20%-ный раствор по
сахару).
В течение всего периода обогащения, который доится 8—10 ч, в
колонки непрерывно добавляют мелассу из расчета 40 г сахара на
1 кг прессованных дрожжей (влажностью 75%) в час. Среда в ко-
лонках непрерывно аэрируется обеспложенным воздухом из расче-
та 10 л воздуха на 1 кг прессованных дрожжей в минуту. Обога-
щение проводится при температуре не выше 30°С. При указанных
параметрах содержание инвертазы в дрожжах увеличивается по
сравнению с исходным в 6—9 раз.
Из обогатительных колонок масса направляется в отстойник, где
жидкая фракция декантируется, а дрожжи поступают на дрожже-
вой сепаратор. Отсепарированные дрожжи вновь обрабатывают рав-
ным по объему количеством воды и к полученной смеси добавляют
бензол из расчета 3% к объему смеси, предназначаемой для авто-
лиза.
Автолиз проводится в специальном аппарате, оборудованном
мешалкой, в течение 5 суток при непрерывном перемешивании сре-
ды и поддержании температуры около 30°С. По окончании авто-
лиза смесь поступает на сепаратор для отделения автолизата.
Полученный ферментный раствор подкисляют уксусной кисло-
той до pH 5,5—5,0 и охлаждают до 0°С. Затем раствор поступает
в осадители, где смешивается с 96%’ным этиловым спиртом в со-
отношении 1:1,5. Смесь тщательно перемешивают и передают на
центрифугу для отделения выпавшего в осадок фермента инверта-
зы от водно-спиртовой смеси. В осадке определяют активность ин-
вертазы и затем стандартизуют его водой и глицерином до полу-
чения раствора, 1 мл которого имеет активность 3 ёд. Следует
иметь в виду, что содержание глицерина в растворе должно быть в
пределах 16—25%.
В таком виде препарат расфасовывают в стеклянную тару ем-
костью 0,5—3 л и герметически закупоривают. Срок хранения его
не менее двух лет.
Преимуществом схемы является дешевое сырье, недостатком —
применение бензола и этилового спирта, в связи с чем заводы, вы-
пускающие инвертазу, должны располагать ректификационной ус-
тановкой для регенерации отработавшего спирта.
ЛИТЕРАТУРА
1. Аганесова Л. Н. Современные аппараты для выпаривания теплочувстви-
тельных жидкостей. Труды ЦНИИСПа. Вып. XI, 1961.
2. ГельперинН. И. Выпарные аппараты. Госхимиздат, 1947.
3. Ги нзбу рг А. С., Михеева Н. С., Бабье в Н. Н., Грачев Ю. П.,
Журавлев В Ф Процессы и аппараты пищевых производств. Изд-во «Пи-
щевая промышленность», 1964.
391
4. Гинзбург А. С., У л у м и е в А. А., Л я х о в и ц к и й Б. М. Перспективы
применения сублимационной сушки для биологически активных материалов
(пекарские дрожжи, ферменты). В кн. «Материалы Всесоюзного семинара по
теории и технике сублимационной сушки пищевых продуктов» (22—25/V 1965,
Таллин). СНХ Эстонской ССР, 1965.
5. Исполатовская М. С., Благовещенский В. А. Методы очистки и
выделения бактериальных ферментов. В кн. «Внедрение ферментных препа-
ратов в народил хозяйство». Ч. I. ЦИНТИпищепром, 1961.
6. Калашников Е. Я. Производственные способы получения очищенных
амилолитических и протеолитических ферментных препаратов плесневых гри-
бов. В кн. «Новая техника и технология в пивоваренной промышленности».
ГОСИНТИ. М., 1960.
7. Калун,я нц К. А. Выделение и концентрирование ферментов. ЦИНТИ-
пищепром, 1963.
8. Калунянц К. А., Ваганова М. С., Жеребченко Г. Ф., Гурьяно-
ва М. А., Исаева Н. А Разработка способов получения сухих препаратов
ферментов из глубинных культур плесневых грибов. ВНИИФС. Отчет по те-
ме № 10, раздел 6, 1963.
9. Калунянц К. А., Ваганова М. С. Сушка фильтратов культуральных
жидкостей плесневого гриба Asp. oryzae на распылительной сушилке. Научно-
техническая информация (спиртовая, ликеро-водочная, ферментная и ацетоно-
бутиловая промышленность). Сборник 4. ЦИНТИпищепром, 1965.
10. К а м и н а р с к а я А. К., Л и в ш и ц С. А., ОленьевЮ. А. Сублимацион-
ная сушка пищевых продуктов. Госторгиздат, 1963.
11. Касаткин А. Г. Основные процессы и аппараты химической технологии.
Госхимиздат, 1962.
12. Кичигин Н. А., Костенко Г. И. Теплообменные аппараты и выпарные
установки. Госэнергоиздат, 1955.
13. К о з л о в с к и й Г. И., Новикова 3. Н., Аксенова 3. Н., Вату-
ля Л. И. Изучение условий получения активных бактериальных ферментов.
В кн. «Новое в биохимических процессах пищевой промышленности». Сбор-
ник трудов УкрНЦИППа. Киев, 1965.
14. К о л а ч Т. А., Р а д у н Д. В. Выпарные станции. Машгиз, 1963.
15. Колосков С. П., Голгер Л. И. Технологическое оборудование пред-
приятий ферментной промышленности. Труды ВНИИФСа. Вып. XVIII, 1967.
16. Кришнер О. Научные основы техники сушки. Пищепромиздат, 1961.
17. Л ы к о в А. В. Сушка распылением. Пищепромиздат, 1955.
18. Ми л ьс кий А. В. Применение инвертина в кондитерской промышленности.
В кн. «Внедрение ферментных препаратов в народное хозяйство». Ч. I.
ЦИНТИпищепром, 1961.
19. Молодова Г. А.' Получение кристаллической а-амилазы из Asp. oryzae.
В кн. «Внедрение ферментных препаратов в народное хозяйство». Ч. I.
ЦИНТИпищепром, 1961.
20. П о п о в а Н. В. Препараты протеолитических ферментов из поверхностной
и глубинной культуры Asp. terricola. В кн. «Внедрение ферментных препара-
тов в народное хозяйство». Ч. I. ЦИНТИпищепром, 1961.
21. С та в ров а Э. Р., Конева Д. И., Мольцер В. Л., Мочалова К- В.,
Большакова М. Д., Куприяненко Л. И., Перепечко А. В. При-
готовление сухих биопрепаратов, ускоряющих созревание сыров. Труды Все-
союзного научно-исследовательского института по производству пищевых про-
дуктов из картофеля. Вып. VIII, 1964.
22. С т а в р о в а Э. Р., Конева Д. И., Мочалова К- В., Куприянен-
ко Л. П., Б о л ь ш а к о в а М. Д. Приготовление и контроль нового био-
препарата, ускоряющего созревание сыров. Труды ВНИИПКа. Вып. VIII,
1964.
23. Улезло И. В., П а л и ц и н Н. П. Получение ферментного препарата супер-
биолазы. В кн. «Внедрение ферментных препаратов в народное хозяйство».
Ч. I. ЦИНТИпищепром, 1961.
392
24 Фениксова Р. В. Получение концентрированных ферментных препаратов.
ЦИНТИпищепром, 1960.
25 Ф е н и к с о в а Р. В., Кувикова А. Ф., Шилова А. А., Попова Н. В.,
Мишина 3. Н., Гире В. Г. Разработка методов выделения концентриро-
ванных препаратов из глубинной и поверхностной культуры плесневых гри-
бов ВНИИСП. Отчет по теме № 21, 1957.
26 Фениксова Р. В. Технология производства концентрированных препара-
тов ферментов. В кн. «Внедрение ферментных препаратов в народное хозяй-
ство». Ч. I. ЦИНТИпищепром, 1961.
27. Фениксова Р. В., Кинзбурская Ф. М. Получение препаратов бакте-
риальной амилазы. Труды ВНИИСПа.. Вып. III, 1954.
28. Ф р е м е л ь В. Б. Технологические схемы производства ферментных препа-
ратов. ЦИНТИпищепром, 1960.
29. ХерсоноваЛ. А., Бажова Г. В. Получение пектолитических ферментных
препаратов из глубинной культуры Asp. niger П на распылительной сушилке.
«Ферментная и спиртовая промышленность», 1964, № 7.
30. Ч е р н о б ы л ь с к и й И. И., Б о н д а р ь А. Г., Гаевский Г. Г., Г о р о- -
динская Б. А., Ленев Р. Я., Танамайка Ю М.., Миргородский
В. Т. Машины и аппараты химических производств. Изд. 2-е. Машгиз, 1961.
31. Черноусов, Кутин, Федоров. Герметические химико-технологические
машины и аппараты. Изд-во «Машиностроение», 1965.
32. Ш у л ь м а н М. С., А п а т ц е в а В. В. К вопросу о сорбции амилолитиче-
ских ферментов культуральной жидкости. Труды ВНИИФСа. Вып. XV, 1964.
33. Шульман М. С., Демина А. С. Сорбция амилазы из ферментных рас-
творов. «Спиртовая промышленность», 1963, № 3.
34. Шульман М. С., А п а т ц е в а В. В. Сорбция амилазы силикагелем. Тру-
ды ВНИИФСа. Вып. XIV, 1963.
35. Шульман М. С. Стендовая установка для сорбции ферментов. «Фермент-
ная и спиртовая промышленность», 1964, № 1.
36. Шульман М. С. Сорбция амилолитических ферментов. Изд-во «Пищевая
промышленность», 1966.
37. Шульман М. С. Технологическая схема сорбции амилазы силикагелем.
Труды ВНИИФСа. Вып. XVI, 1965.
38. Ш у л ь м а н М. С. Физико-химические основы производства ферментных
препаратов. Изд-во «Пищевая промышленность», 1967.
Глава VIII. ПРОИЗВОДСТВО ФЕРМЕНТНЫХ ПРЕПАРАТОВ
ЗА РУБЕЖОМ
В настоящее время производство ферментных препаратов раз-
вито в некоторых капиталистических странах и начинает разви-
ваться в странах СЭВ. За последние 3 года в странах СЭВ прове-
дены большие экспериментальные работы по созданию технологи-
ческих схем производства ферментных препаратов главным обра-
зом для пищевой промышленности.
Из капиталистических стран следует отметить США, Японию,
Францию, Данию, Англию и др. В США насчитывается более 20
фирм, занимающихся производством ферментов. Выпускаемые ими
препараты предназначены для применения в пищевой и легкой про-
мышленности, сельском хозяйстве и медицине. В последние 5 лет
это производство значительно возросло главным образом за счет
увеличения выпуска ферментов для нужд сельского хозяйства и ме-
дицины.
В Англии ферментные препараты выпускаются для нужд пище-
вой промышленности (большая часть их предназначена для при-
менения в хлебопечении) и для научных исследований (фирма
«Лайт»). В Дании ферментные препараты выпускает несколько
фирм, из которых наиболее крупной является фирма «Ново».
Главным производителем ферментных препаратов во Франции
является фирма «Рапидаз», выпускающая продукцию в основном
для легкой и пищевой промышленности. В Японии около 20 фирм
производят ферментные препараты, предназначаемые для различ-
ных отраслей промышленности, причем многие фирмы вырабаты-
вают их только для использования на своих предприятиях. Из круп-
ных японских фирм следует назвать «Санкио», «Нагазе», «Дайва
Касей», «Синихон Кагаку», «Кинки Якулт», «Мацутани Кагаку»,
«Амано» и др.
В данной главе авторы на основании имеющегося у них мате-
риала излагают сведения о технологии производства ферментов и
применяемом оборудовании, чтобы ознакомить читателя с уровнем
этого производства за рубежом.
394
ПРОИЗВОДСТВО ФЕРМЕНТНЫХ ПРЕПАРАТОВ В СТРАНАХ СЭВ
За последние 3 года здесь проведены глубокие исследования с
целью разработки технологических схем производства амилолити-
ческих препаратов и целлюлазы из культур плесневых грибов и
бактерий, глюкоамилазы и пектиназы из культур плесневых грибов,
инвертазы из дрожжей, протеолитических ферментных препаратов
растительного, грибного и бактериального происхождения и глю-
козооксидазы из культур плесневых грибов.
Амилолитические препараты из культур
плесневых грибов и бактерий
Технологические режимы производства амилазы поверхностным
способом разработаны в ВНР, СРР и ЧССР и глубинным спосо-
бом — в ВНР, ГДР и ЧССР. Продуцентом ферментов при поверх-
ностном и глубинном культивировании является плесневой гриб
Asp. oryzae. При поверхностном культивировании питательной сре-
дой являются пшеничные отруби, а при глубинном — среды, содер-
жащие до 6% крахмала и различные минеральные соли.
В промышленных (масштабах производство амилолитических
ферментов при культивировании плесневых грибов поверхностным
способом осуществлено в ЧССР. Культивирование проводят в каме-
рах на кюветах, но в ЧССР для этой цели в течение нескольких лет
эксплуатировалась конвейерно-кюветная механизированная уста-
новка.
Производство амилолитических ферментов при культивирова-
нии плесневых грибов в промышленных масштабах глубинным спо-
собом в настоящее время осуществлено только в ВНР. Культивиро-
вание проводится в ферментаторах, снабженных барботерами для
подачи воздуха и 'мешалками для перемешивания среды. Выпуска-
емые препараты предназначены для применения в хлебопекарной
промышленности (ВНР), пивоваренной и спиртовой промышленно-
сти (ГДР, СРР) и в сельском хозяйстве (ЧССР).
Из бактерий в качестве продуцента для производства амилоли-
тического препарата в ГДР применяют Вас. subtilis. Препарат
предназначается для пивоваренной промышленности.
Глюкоамилаза
Промышленного производства этого фермента еще нет, однако
в ВНР, ЧССР и ГДР уже разработаны способы глубинного культи-
вирования продуцентов. В ВНР для этой цели используется Asp.
awamori, в ЧССР Asp. niger, в ГДР Endomyces species. Препараты
глюкоамилазы предназначаются для применения в производстве
глюкозы.
395
Инвертаза
Работы по получению препарата инвертазы проводятся в СРР
и ВНР.
В 1967 г. в СРР разработана принципиальная схема производст-
ва инвертазы из хлебопекарных дрожжей,- отличающаяся простотой
исполнения и дающая возможность получать препарат с относи-
тельно низкой себестоимостью.
Основные этапы получения фермента по данной схеме следую-
щие. Хлебопекарные дрожжи влажностью 72—73% подвергают
плазмолизу хлористым натрием (3% к весу обрабатываемых дрож-
жей) при температуре 55°С в течение часа. При этом зимазная ак-
тивность дрожжей полностью подавляется, а инвертазная снижает-
ся на 20%. Автолизат дрожжей (разбавленный водой в соотноше-
нии 4:1) сушат на распылительной сушилке. Температура воздуха,
входящего в сушилку, 135°С, выходящего из нее — 70—80°С.
Получаемый препарат предназначается для применения в кон-
дитерской промышленности.
Целлюлаза и глюканаза
Исследования по разработке технологии получения этих фер-
ментов в ВНР и ГДР только начинаются. В ВНР в настоящее время
подбирают активный штамм—продуцент целлюлозы. Препарат бу-
дет использоваться в качестве добавок в комбикорма для животных
и птиц.
В ГДР для производства глюканазы отобран бактериальный
штамм Вас. subtilis. Культивирование проводится глубинным спо-
собом; в качестве питательной среды используется ячменная кру-
па с добавлением 3% соевой. Препарат предназначается для ис-
пользования в пивоваренной промышленности.
Пектиназа
Промышленный способ поверхностного культивирования плес-
невых грибов уже разработан и внедрен в НРБ, ВНР и ПНР. В
этих странах организовано в заводских условиях культивирование
гриба Asp. niger на среде, содержащей пшеничные отруби и свекло-
вичный жом, а иногда только пшеничные отруби. Выращивание ве-
дется в растильных камерах на кюветах. Готовая культура гриба,
содержащая пектолитический комплекс ферментов, применяется в
соковом производстве.
В последние 2 года исследуются вопросы глубинного культиви-
рования продуцентов пектолитических ферментов и разрабатыва-
ются технологические схемы получения очищенных пектолитических
ферментных препаратов из глубинных культур. В качестве проду-
цента пектиназы в НРБ и ПНР используется Asp. niger, а в ВНР—
Asp. faetidus.
396
Протеаза
В настоящее время внимание исследователей направлено на
изыскание наиболее подходящего источника получения этого фер-
мента. Исследуется возможность получения протеолитических фер-
ментов из растительного сырья, а также из культур грибов и бак-
терий.
В качестве лучшего источника растительного сырья в НРБ и
ВНР признаны листья инжира, отличающиеся наибольшей концент-
рацией протеолитических ферментов по сравнению с другими рас-
тениями.
Протеазы растительного происхождения предполагается приме-
нять в мясной промышленности.
Схемы получения протеолитических ферментов из культур плес-
невых грибов разрабатываются в НРБ, ВНР, ПНР и СРР. В ВНР
для этой цели культивируют штаммы Aspergillus, Rhisopus и Peni-
cillium, в ПНР — Penicillium candidum, в СРР — Asp. terricola и
Asp. oryzae.
Протеолитические препараты грибного происхождения намече-
но применять: в НРБ — в пивоваренной промышленности, в ВНР
и ПНР — в производстве сыра, в СРР — в производстве сельди.
Из бактериальных протеолитических ферментов в ГДР иссле-
дуются ферменты культур Вас. subtillus для производства сыров и
в ПНР — ферменты культур Str. lactis для производства сыров гол-
ландского и тильзитского типа.
Глюкозооксидаза
Работы по производству препарата глюкозооксидазы ведутся
в ВНР, ВНР, СРР и ЧССР. В качестве продуцентов используется
плесневой гриб Asp. niger (ВНР, СРР, ЧССР), культивируемый
глубинным методом. В процессе ферментации глюкозооксидаза кон-
центрируется .в мицелии, откуда затем извлекается экстракцией.
Фермент из экстракта осаждается изопропанолом; полученный оса-
док сушат методом сублимации.
Применение глюкозооксидазы предусматривается в пищевой
промышленности (получение яичного порошка, хранение фруктовых
соков, хранение сублимированного мяса и др.).
ПРОИЗВОДСТВО ФЕРМЕНТНЫХ ПРЕПАРАТОВ
В КАПИТАЛИСТИЧЕСКИХ СТРАНАХ
На первых стадиях развития ферментной промышленности в ка-
питалистических странах (США, Японии, Франции) плесневые гри-
бы и бактерии культивировали поверхностным способом. В насто-
ящее время в США и Японии большая часть ферментных препара-
тов вырабатывается из культур, полученных глубинным способом, а
в таких странах, как Франция, Дания и Англия, главным образом
397
из культур, полученных глубинным способом. Таким образом, по-
верхностное культивирование микроорганизмов — продуцентов
ферментов в настоящее время сохраняется главным образом в США
и Японии.
Имеются данные, что в США плесневые грибы и бактерии куль-
тивируют на твердых питательных средах в растильных камерах
на кюветах, в растильных установках конвейерного типа с прикре-
пленными к цепям кюветами и в специальных растильных ба-
рабанах, где могут быть также проведены процессы стерилиза-
ции питательной среды и экстракции ферментов из готовой куль-
туры.
Процессы выделения ферментов из полученных экстрактов сво-
дятся либо к получению препаратов в виде сиропов путем концент-
рирования экстрактов в вакуум-выпарных аппаратах, либо к полу-
чению препаратов в виде порошков. В последнем случае концент-
рированные ферментные экстракты либо непосредственно высуши-
вают на распылительных сушилках, либо осаждают из них фермен-
ты сернокислым аммонием или одним из органических растворите-
лей (ацетон, этанол, изопропанол) с последующей сушкой выделен-
ного на центрифуге ферментного осадка в вакуумных или субли-
мационных сушилках.
Производство ферментных препаратов при поверхностном куль-
тивировании продуцентов в Японии можно проследить по техноло-
гической схеме завода «Синихон Кагаку», расположенного вблизи
города Нагойя.
Завод выпускает ферментный препарат, содержащий глюко-
амилазу, под названием сумизим. Продуцентом является Rhisopus
neveus.
Чистая культура для засева питательной среды готовится по-
верхностным культивированием продуцента на жидкой среде. Об-
разующуюся пленку с большим содержанием спор выдерживают
в колбах, а затем содержимое колб переносят в посевные танки для
глубинного проращивания спор.
Пшеничные отруби увлажняют, стерилизуют, засевают прора-
щенными спорами и распределяют по кюветам, которые по тран-
спортеру движутся в растильные камеры. На заводе имеется 3 рас-
тильных камеры по 660 м2. Выращивание проводится в закрытых
кюветах в течение 2,5 суток. Кюветы охлаждают путем орошения
холодной водой.
Готовую культуру дробят и направляют на экстракционную
установку для экстрагирования ферментов водой. Ферменты из
полученного экстракта осаждают высаливанием сернокислым ам-
монием, осадок отделяют на фильтрпрессе и высушивают в ва-
куум-сушилке при температуре 40°С.
На некоторых заводах, например на заводе Саке в г. Кобе, куль-
туру гриба Asp. oryzae выращивают на рисе в механизированных ус-
тановках слоем 30—40 см.
398
Производство ферментных препаратов при глубинном способе
культивирования продуцентов в капиталистических странах ведет-
ся по различным схемам, отличающимся в основном способами
выделения ферментов из культуральных жидкостей.
Основными продуцентами амилолитических и протеолитических
ферментов во Франции, Дании и Японии при глубинном культиви-
ровании являются бактерии (Вас. subtilis).
Так как технологические схемы -производства ферментных пре-
паратов являются секретом фирм и не публикуются в печати, то на
основании литературных данных можно составить лишь общее пред-
ставление о схеме производства протеолитических и амилолитиче-
ских ферментных препаратов. Рассмотрение ее даст возможность
читателю судить о некоторых технологических операциях производ-
ства ферментов в капиталистических странах.
Бактериальные ферментные препараты
Данная схема (рис. НО) включает ряд операций, на первой ста-
дии общих для получения протеазы и амилазы и состоящих из вы-
ращивания посевной и производственной культуры, очистки куль-
туральной жидкости от балластных веществ, концентрирования на
вакуум-выпарной установке, фильтрации, разделения амилазы и
протеазы путем адсорбции первой на крахмале. На второй стадии
получение амилазы и протеазы проводится по двум различным схе-
мам, причем основные операции получения амилазы сводятся к
элюции ее с крахмала, очистке активированным углем и ионооб-
менными смолами, высаливанию амилазы сульфатом аммония, от-
делению осадка, сушке осадка сублимацией, измельчению, стандар-
тизации и расфасовке. Операции получения протеазы сводятся к
обесцвечиванию протеазной фракции активированным углем, кон-
центрированию раствора на вакуум-выпарной установке, высалива-
нию протеазы сульфатом аммония, отделению ферментного осадка,
сушке сублимацией, измельчению, стандартизации и расфасовке.
Приготовление питательной среды. Основным компонентом пи-
тательной среды является кукурузная мука. Водный раствор ее
готовят в специальном чане-смесителе (см. рис. ПО), куда залива-
ют воду, а затем при непрерывной работе мешалки загружают по-
следовательно бактериальную амилазу и муку. Подогревают полу-
ченную смесь до 55°С, выдерживают 20 мин, затем повышают тем-
пературу до 100°С, после чего снижают ее до 68—70°С, вновь до-
бавляют бактериальную амилазу и при этой температуре выдержи-
вают смесь в течение 10 ч при непрерывной работе мешалки для
осахаривания крахмала введенной муки до не окрашиваемых
йодом декстринов.
Раствор стерилизуют в аппарате при температуре 130°С в тече-.
ние 15 мин и при этой температуре выдерживают в течение 50 мин
в аппарате, из которого 70% от требуемого количества направляют
на культивирование в инокулятор и ферментатор.
399,
Рис. 110. Технологическая схема производства высокоочищенных бактериальных ферментных препаратов:
/ — сборник питательной среды; 2 — стерилизатор; 3 — выдерживатель; 4 — пробирка и колба с маточной культурой; 5 — ино-
кулятор; 6 — ферментатор; 7, 9, 12, 15 — чаны-смесители; 8 — центрифуга; 10—фильтр Зейтца; И—вакуум-выпарная установка;
13, /6 — вакуум-фильтры; 14, /7 — адсорбционные колонки с модифицированным крахмалом; 18—адсорбционная ионообмен-
ная колонка; 19 — осадитель; 20—сублимационная сушилка; 21 — дисмембратор; 22—стандартизатор; 23 — весы; 24 — сборник
раствора, содержащего протеазу.
Остальные 30% раствора добавляют непрерывно в инокулятор
через 8 ч от момента засева среды, а в ферментатор — через
26 ч.
Такие ингредиенты питательной среды, как сульфат калия, лак-
тоза, хлористый натрий и сульфат магния, растворяют в воде с
температурой 60°С в реакторе, стерилизуют при 130°С в течение
часа и направляют в инокулятор и ферментатор. Отдельно гото-
вят также водные растворы других ингредиентов при непрерывно
работающей мешалке и затем после стерилизации при температуре
120°С подают их в инокулятор или ферментатор.
Культивирование в инокуляторах и ферментаторах. Мешалки
этих аппаратов работают непрерывно с момента подачи первых пор-
ций питательной среды. В рубашку подается охлаждающая вода с
таким расчетом, чтобы температура среды к моменту начала куль-
тивирования была около 37°С. По окончании загрузки инокулятора
питательной средой засевают ее из колбы маточной культурой Вас.
subtilis с соблюдением правил микробиологической техники. Куль-
тивирование длится 15 ч при температуре 37°С при непрерывной
работе мешалки и подаче обеспложенного воздуха в количестве
40 м3 на 1 м3 среды в час.
Загрузив ферментатор питательной средой, включают барботер
и из инокулятора подают посевной материал в количестве 10% от
объема среды в ферментаторе.
Культивирование протекает 48 ч при той же температуре, что и
в инокуляторе, при непрерывной работе мешалки и подаче обеспло-
женного воздуха в количестве 60 м3 на 1 м3 аэрируемой среды в
час. В процессе культивирования бактерия Вас. subtilis продуци-
рует амилазу и протеазу.
Очистка культуральной жидкости. Готовую культуральную
жидкость направляют в чан-смеситель, где при непрерывно рабо-
тающей мешалке добавляют к ней аммиак в таком количестве, что-
бы pH смеси был 8,6, затем 1 % хлористого кальция. Полученную
смесь перемешивают в течение 15 мин и затем подают для отделе-
ния образовавшегося осадка на центрифугу. Центрифугат соби-
рается в специальном резервуаре. Добавлением к нему уксусной
кислоты снижают pH до величины, характерной для готовой культу-
ральной жидкости, и после добавления диатомита направляют на
фильтры Зейтца. Полученный фильтрат должен быть полностью
очищен от бактериальных тел и посторонней микрофлоры.
Концентрирование и вторичная очистка культуральной жидко-
сти. Концентрирование культуральной жидкости до содержания в
сиропе 40% сухих веществ проводят на вакуум-выпарной установке
при температуре кипения жидкости 30°С и температуре теплоагента
75°С.
К полученному сиропу в чане добавляют диатомит и 25% суль-
фата аммония, все тщательно перемешивают и затем направляют
на фильтрацию в барабанный вакуум-фильтр.
26—826
401
Разделение амилазы и протеазы. Эта операция проводится пу-
тем адсорбции амилазы на крахмале. Предварительно крахмал
подвергают специальной тепловой обработке и сортируют на ситах
с таким расчетом, чтобы величина частиц его была в пределах
100 меш.
Очищенный сироп поступает в чан-смеситель, куда также до-
бавляется модифицированный крахмал. Оба компонента тщатель-
но перемешивают в течение 30 мин, затем смесь направляют на
центрифугу, где жидкость отделяется от крахмала с сорбированной
на нем амилазой, причем жидкость возвращается в чан, а осадок—
в бак-смеситель. В чане жидкость вновь смешивается с новой пор-
цией крахмала, перемешивается в течение одного часа и смесь по-
ступает на центрифугу, откуда осадок идет в аппарат, а центрифу-
гат, содержащий протеазу, направляется для получения очищенной
протеазы.
Получение очищенной амилазы. В специальном резервуаре про-
водится элюирование амилазы с крахмала путем обработки полу-
ченного с центрифуги осадка уксуснокислым кальцием и едким
натром, последующей фильтрации смеси на барабанном вакуум-
фильтре и очистке фильтрата на колонках, заполненных активиро-
ванным углем и ионообменной смолой. Обесцвеченную жидкость,
содержащую амилазу, направляют в осадитель для высаливания
амилазы сульфатом аммония. Отделение ферментного осадка от
маточного раствора проводится на центрифуге; центрифугат исполь-
зуется для нужд сельского хозяйства, а осадок распределяют на
противни слоем 25 мм и подают в сублимационную сушилку, где
высушивают до влажности 10%.
Высушенный осадок, содержащий амилазу, измельчают в дис-
мембраторе на частицы величиной 200 мкм, стандартизуют крах-
малом до определенной активности, расфасовывают в полиэтилено-
вые мешки по 0,5 кг и направляют для использования в различных
отраслях промышленности или для медицинских целей.
Получение очищенной протеазы. Центрифугат, содержащий про-
теолитические ферменты, для очистки от красящих веществ напра-
вляют на колонки, загруженные активированным углем. Обесцве-
ченный раствор поступает в вакуум-выпарной аппарат, где концен-
трируется до содержания сухих веществ 40%. Процесс идет при
температуре кипения жидкости 25°С и температуре теплового аген-
та 75°С.
Полученный сироп направляют в сборник, где к нему прибавля-
ют диатомит и смесь фильтруют на барабанном вакуум-фильтре.
Фильтрат подается в осадитель для высаливания протеазы суль-
фатом аммония.
Массу, содержащую осадок протеазы и маточный раствор, на-
правляют для разделения на центрифугу, осадок высушивают при
том же режиме, что и амилазу в сублимационной сушилке, стандар-
тизуют NaCl до определенной активности и расфасовывают в поли-
этиленовые мешки по 0,5 кг.
402
Препарат предназначен для использования в различных отрас-
лях промышленности и для медицинских целей.
АППАРАТУРА ДЛЯ ПРОИЗВОДСТВА
ФЕРМЕНТНЫХ ПРЕПАРАТОВ
В литературе отсутствуют данные об оборудовании, применяе-
мом для промышленного производства ферментов. Поэтому можно
привести лишь краткое описание отдельных видов аппаратуры, при-
меняемой за рубежом для проведения тех или иных процессов. Кро-
ме того, приводится описание некоторых видов оборудования, кото-
рые, по нашему мнению, могут быть успешно использованы в про-
изводстве ферментов.
Растильные установки
Растильная установка для поверхностного культивирования
плесневых грибов (ЧССР). На спиртовом заводе в м. Штетино
смонтирована механизированная растильная установка производи-
тельностью 0,4 т культуры гриба в сутки.
Установка (рис. 111) состоит из стерилизатора жидкой питатель-
ной среды, смесителя-стерилизатора, подающего шнека, дозатора,
растильного аппарата, установки для кондиционирования воздуха,
разгрузочного шнека и пневматического устройства для транспор-
тирования готовой культуры.
Стерилизатор представляет собой цилиндрический аппарат с ко-
ническим днищем и мешалкой. Число оборотов мешалки 1280 в ми-
нуту.
Аппарат снабжен штуцерами для подачи пара, кислоты, выхо-
да конденсата, промывных вод и нижним выгрузочным. Внутри
него проходит перфорированная труба, по которой подается пар
для стерилизации среды. Смесителем служит барабан, вращающий-
ся со скоростью 4 об!мин. Дозатор среды состоит из двух ковшей
емкостью 5 и 7 кг, работающих поочередно.
Наибольший интерес представляет растильная камера длиной
22 000, шириной 1200 и высотой 1800 мм, изготовленная из нержа-
веющей стали. Внутри нее расположена пластинчатая цепь, переме-
щаемая приводными звездочками со скоростью 100 мм]мин. На це-
пи свободно подвешены 170 алюминиевых лотков, из них 85 емко-
стью по 5 и 85 — по 7 кг. Питательная среда, состоящая из 70—
80% дробленой подсолнечной лузги и 30—20% пшеничных отрубей,
из бункера загружается в стерилизатор-смеситель.
Жидкая питательная среда, состоящая из воды, соляной кисло-
ты и кукурузного экстракта, стерилизуется в стерилизаторе, в кото-
рый после охлаждения из циклона подается посевной материал.
Смесь среды с посевным материалом поступает по трубопроводу в
смеситель-стерилизатор для смешивания со стерильной сыпучей пи-
тательной средой. Из смесителя через подающий шнек и дозатор
403
среда загружается в алюминиевые лотки, свободно подвешенные к
бесконечной пластинчатой цепи растильного аппарата. Лотки пере-
мещаются вместе с цепным транспортером с такой скоростью, что-
бы от момента загрузки среды в лотки до выхода их из растильного
Рис. 111. Чехословацкая схема механизированной растильной установки для
выращивания культур плесневых грибов:
/ — бункер для спор; 2 — мешалка; 3 — стерилизатор; 4 — электродвигатель; 6 — бункер; 6 —
стерилизатор-смеситель; 7 — шнек; 8 — распределитель; 9 — растильная камера; 10— камера
для кондиционирования воздуха; // — вентилятор; /2 — цепной транспортер; 13 — разгрузоч-
ные щетки; /-/ — приводной электродвигатель; 15 — разгрузочный шнек; 16 — вентилятор;
17 — циклон; 18 — сепаратор; 19 — эксгаустер
аппарата с готовой культурой прошло время, необходимое для про-
ведения всего технологического процесса. Кондиционированный воз-
дух, необходимый для аэрирования и отвода физиологического теп-
ла, подается в растильный аппарат кондиционером.
Выращенная культура гриба удаляется разгрузочными щетка-
ми из лотков и затем шнеком и вентилятором подается в циклон.
Отработавший воздух проходит через бактериальный фильтр и уда-
ляется в атмосферу. Единовременная загрузка растильной камеры
800—1000 кг.
Растильная установка Христенсена (США) (рис. 112) состоит
из бункера для отрубей, мерника кислоты, смесителя для увлажне-
ния отрубей, скребкового транспортера для перемещения среды в
404
камеру стерилизации, стерилизатора, камеры охлаждения среды,
вентилятора для подачи спор гриба, посевной камеры, скребкового
транспортера для перемещения среды в растильную камеру,, рас-
тильного агрегата, дробилки и барабана для доращивания куль-
туры.
/ — бункер для отрубей; 2 — чанок для раствора кислоты; 3 — смеситель; 4—камера стери-
лизации среды; 5 — транспортер; 6 — камера охлаждения среды; 7 — вентилятор; 8—посев-
ная камера; 9 — первое отделение растильной камеры; 10 — второе отделение растильной ка-
меры; //—барабан для доращивания культуры гриба.
Пшеничные отруби из бункера поступают в смеситель, куда од-
новременно подаются вода и раствор соляной кислоты из мерника.
После перемешивания и увлажнения отрубей среда с помощью
скребкового транспортера поступает в стерилизационную камеру
для стерилизации паром. Затем тем же скребковым транспортером
она перемещается в камеру, где охлаждается до 35°С обеспложен-
ным воздухом, гГодаваемым вентилятором. Стерильная охлажден-
ная питательная среда поступает в посевную камеру, куда одновре-
менно вентилятором подаются сухие споры гриба. После засева
среда с помощью скребкового транспортера перемещается в рас-
тильный агрегат, состоящий из двух отделений. Габариты отделе-
ний таковы, что при непрерывном перемещении с небольшой ско-
ростью среда находится в каждом из них по 12 ч, В каждом отде-
лении создаются заданные технологические параметры температу-
ры, влажности и аэрации.
Из растильного агрегата культура гриба направляется для из-
мельчения и затем поступает во вращающийся барабан для дора-
щивания в течение 24 ч.
405
Установка Христенсена чрезвычайно громоздка, трудно под-
дается мойке и стерилизации, не обеспечивает герметизации всех
технологических операций.
Известно, что в США для механизированного выращивания
культуры гриба ’поверхностным способом применяются также рас-
тильные барабанные установки. Степень заполнения барабана
питательной средой составляет 15—20% от его объема. По оконча-
нии процесса выращивания в барабан подается вода для извлече-
ния фермента, затем вытяжка отделяется, а остаток удаляется из
барабана.
Механизированная растильная установка (Япония) на заводе
Саке в г. Кобе применяется для выращивания культуры гриба Asp.
oryzae. Она представляет собой цилиндрический вертикальный ре-
зервуар, разделенный по высоте на 2 отделения. В каждом из них
расположен сетчатый диск, на который и подается засеянная пита-
тельная среда. На дисках по радиусу установлены шнеки, предназ-
наченные для перемешивания питательной среды в процессе выра-
щивания плесневого гриба и выгрузки материала из первого от-
деления во второе или готовой культуры из второго отделения на
дальнейшие операции. Диаметр установки 4000 мм, высота 5000 мм.
Питательная среда поступает на верхний диск и располагается
слоем 300—400 мм. Под диск подается кондиционированный воздух
температурой 30°С и влажностью 100,%. Среда перемешивается
шнеком. После 28 ч среда перегружается на нижний диск, а на
верхний поступает свежезасеянная среда. На нижнем диске опера-
ции повторяются, и через 20 ч с него выходит готовая культура.
Роторный экстрактор (Япония)
В Японии для извлечения ферментов из культур плесневых гри-
бов предложено применять непрерывно действующий экстрактор
роторного типа (рис. 113).
Экстрактор представляет собой аппарат, разделенный на 16—20
секторов с сетками в днище, на которые через дозатор подается
измельченная культура гриба. В процессе медленного вращения по
часовой стрелке секторы попадают на 4 участка, в одном из кото-
рых происходит обработка культуры водой, после чего водная вы-
тяжка с помощью вакуум-насоса отфильтровывается в приемник, а
оттуда насосом направляется для экстракции во второй сектор со
свежей культурой гриба, снова отфильтровывается во второй при-
емник и затем последовательно таким же способом направляется в
третий и четвертый секторы. Вытяжка, обогащенная ферментом по-
сле 30-минутной экстракции культуры гриба, поступает на даль-
нейшую обработку, а биошрот на определенном участке движения
диска выгружается и поступает на сушку. Таким образом культура
в каждом секторе проходит четырехкратную последовательную об-
406
Рис. 113. Непрерывно действующий экстрактор роторного типа:
/ — питатель; 2— сектора; 3 — сушилка для биошрота; 4 — приемники; 5 —насосы;
6 — материальный трубопровод для концентрированной вытяжки; 7 — штуцер для по-
дачи теплоносителя; 8 — конвейер для подачи биошрота; 9 — приемный бункер; 10 —
трубопровод для подачи воды на диффузию, //-вакуум-насос, 12 форсунки.
работку вытяжкой и водой, после чего биошрот выгружается, сек-
тор промывается и вновь загружается. Такое аппаратурное оформ-
ление процесса позволяет сократить длительность экстракции до
30 мин и возможность инфицирования значительно уменьшается.
Техническая характеристика роторного экстрактора
непрерывного действия
Производительность по вытяжке, л/ч .... 250—500
Длительность, мин
экстракции....................................... 30
полного оборота диска с секторами . . . 2—8
Число секторов в диске......................... 16—20
Диаметр диска, мм.............................. 6200—7570
Общая поверхность фильтрации, м2 ... . 20
Высота слоя измельченной культуры гриба, мм . 50
407
Инокуляторы и ферментаторы
При культивировании микроорганизмов — продуцентов фермен-
тов глубинным способом за рубежом применяется следующая ап-
паратура.
В Японии фирма «Нагазе» применяет инокуляторы и фермента-
торы, представляющие собой вертикальные аппараты, изготовлен-
ные из нержавеющей стали с верхним приводом и барботажным
подводом воздуха. Отношение высоты аппарата к его диаметру 2:1.
Внутри ферментатора расположена двух-трехъярусная лопастная
мешалка с отбойными пластинами, закрепленными по периметру
стенок аппарата.
Ферментаторы емкостью 20—30 ж3 снабжены электроприводами
мощностью соответственно 55 и 90 кет с числом оборотов 180—
200 в минуту.
Аппарат рассчитан на работу при давлении 1 ат (98 кн/л£2), воз-
дух для аэрации подается двухступенчатыми поршневыми компрес-
сорами фирмы Origins производительностью 30 м3/мин, давлением
5 ат (490 кн/м2). Мощность привода компрессора 160 кет.
Во Франции фирма «Рапидаз» применяет инокуляторы и фер-
ментаторы аналогичной конструкции из нержавеющей стали. Ем-
кость промышленных ферментаторов 25—30 м3. Отношение высоты
к диаметру аппарата 1,4: 1. Емкость инокулятора 10% от емкости
ферментатора. Аппарат рассчитан для работы при избыточном дав-
лении до 3 ат (294 кн/м2).
Фирма «Хемап» (Швейцария) изготавливает ферментаторы ем-
костью до 10 ж3 с нижним герметическим приводом и винтовым пе-
ремешивающим устройством для глубинного культивирования
микроорганизмов в условиях интенсивного перемешивания среды
при гидродинамических режимах, характеризуемых большими чис-
лами Рейнольдса. Ферментаторы снабжаются приборами автома-
тического контроля и регулирования температуры, pH, пеногаше-
ния и расхода воздуха.
Фирма Тиссен (ФРГ) изготавливает ферментаторы из нержаве-
ющей стали, полированной до зеркального блеска, общей емкостью
63 м3 при рабочей емкости 50 ж3 (рис. 114).
Для отвода тепла ферментатор снабжается рубашкой, из 5 сек-
ций по высоте или с 3—5 вставными змеевиками. На каждый 1 м3
емкости принята поверхность охлаждения 3 м2.
Привод мешалки верхний. Число оборотов электродвигателя пе-
ременное, в зависимости от требуемой интенсивности перемешива-
ния. Между электродвигателем и приводом устанавливается редук-
тор. Внутри ферментатора расположено перемешивающее уст-
ройство, состоящее из закрытых и открытых турбинок.
Учитывая возможность повреждения микроорганизмов при дли-
тельном перемешивании (до 120 ч), мешалке придается обтекаемая
форма. Сальник снабжен паровой защитой, и если давление в фер-
408
Рис. 114. Ферментатор фирмы Тиссен:
1 — электродвигатель; 2 — редуктор; 3 — соединительная муфта; 4 —
подшипник; 5 — сальник с паровой защитой; 6 — вал; 7 — корпус; 8 —
турбомешалка; 9 — змеевики для нагрева и охлаждения; 10— соедини-
тельная муфта; 11— труба для подвода газа; 12— мешалка; 13 — бар-
ботер; 14 — винтовая мешалка; 15 — опорный подшипник; 16 — обогрева-
емый спускной вентиль.
ментаторе равно (48 кн!м2), то в паровом защитном пространстве
втулки сальника оно равно 72 кн/м2.
Люк снабжается пневматическим затвором открывается за 1 —
2 мин.
В нижней части ферментатора расположен барботер прямо-
угольной формы, легко разбирающийся для чистки и мойки.
Ферментатор снабжен ультразвуковым пеногасителем фирмы
Сонижет (США) или Мацибуси (Япония). При обнаружении при-
бором пены выше допускаемого уровня газ под высоким давлени-
ем поступает в излучатель звуковых волн, которые направляются
на пену и гасят ее.
Для мойки ферментатора предусмотрено особое гидроприспо-
собление с насосом, создающим напор 4,8 Мн!м2, что обеспечивает
быструю и качественную мойку.
Каждый ферментатор емкостью 63 м3 комплектуется аналогич-
ным ферментатором емкостью 50 л и приборами автоматического
контроля и регулирования основных параметров процесса: pH,
гН2, гО2, температуры, расхода воздуха, СО2 и пеногашения.
Ферментатор емкостью 50 л предназначен для предварительной
отработки оптимальных параметров процесса при изменении соста-
ва среды, посевной культуры или условий культивирования.
Имеются данные о возможности управления всеми процессами
культивирования по заданному циклу. Работа аппаратуры по задан-
ному циклу программируется и перфокарта управляет процессом.
Ганс Мюллер предложил ферментатор отличающийся от извест-
ных конструктивных решений перемешивающим органом и внутрен-
ним направляющим устройством.
Наличие нескольких перемешивающих органов, расположенных
по высоте вала, а также двух встроенных направляющих труб зна-
чительно усиливает сложный внутренний циркуляционный контур
жидкостного потока и обеспечивает интенсивное смешивание реак-
ционных компонентов.
Двухкомпонентная смесь (жидкость—газ) с помощью лопаст-
ных колес центробежного насоса непрерывно циркулирует в коль-
цевом сечении ферментатора, и через небольшие отверстия одной из
внутренних направляющих труб к стенке следующей за ней напра-
вляющей трубы и далее проходит через крупные отверстия, распо-
ложенные в зонах между лопастными колесами перемешивающего
устройства.
Пеногасящее устройство расположено внутри ферментатора и
гасит пену механическими средствами.
Недостатком аппарата является загроможденность внутреннего
пространства ферментатора и связанная с этим возможность за-
грязнения решетчатых отверстий субстратом, мицелием и бактери-
альными клетками, трудности мойки и чистки малодоступных мест,
что значительно уменьшает надежность стерильности.
Для очистки воздуха, подаваемого в ферментатор при расходе
1 м3 в минуту, необходимо отделить 25-1012 бактерии. Обычный
410
фильтр необходимо регенерировать каждые 4—5 дней. За рубежом
для грубой очистки воздуха применяют фильтры, состоящие из на-
бора элементов пористой нержавеющей стали. Эти фильтры не про-
пускают частицы, величина которых больше 1 ju/cjk, и отфильтровы-
вают воздух от бактерии на 99,9822%. При сборке фильтров их
следует устанавливать из расчета трехкратного запаса по количест-
ву подаваемого воздуха.
Фильтры грубой очистки изготавливает фирма Халл (США).
После грубой очистки воздух пропускается через фильтры бакте-
риальной очистки, состоящие из набора керамических фильтров ти-
па «Милипор», изготавливаемые фирмой Шумахер (ФРГ). Фильт-
ры «Милипор» не пропускают частицы, величина которых больше
0,008 мкм и полностью стерилизуют воздух.
Для очистки воздуха, удаляемого из ферментатора, его пропус-
кают при температуре 1000°С через печи беспламенного горения из
раскаленного шамотного кирпича.
Установка для мойки ферментаторов
фирмы «Керхер» (ФРГ)
Установка для мойки ферментаторов (рис. 115) состоит из бака
с моющим раствором, передвижной насосной станции, теплообмен-
ника, моечного устройства для погружения в ферментатор, сливной
ванны и фильтров.
Рис. 115 Установка для мойки ферментаторов фирмы «Керхер»
(ФРГ):
1 — бак с моющим раствором; 2 —-передвижная насосная станция; 3 —тепло-
обменник; 4 — ферментатор; 5 — устройство для мойки; 6 — фильтр; 7 — слив-
ная ванна.
411
Моющий раствор из бака с помощью насоса через фильтр по-
дается в теплообменник, нагревается до заданной температуры, по-
сле чего поступает под избыточным давлением 4,8 Л4н/л2 в моечное
устройство, которое укреплено на специальном опорном приспособ-
лении, устанавливаемом непосредственно внутри ферментатора, и
снабжено двумя-четырьмя соплами.
Наличие двух сопел создает длинную струю, и поэтому их ре-
комендуется применять в больших ферментаторах и при сильном
загрязнении.
Разбрызгивающие сопла помимо вращения вокруг собственной
оси вращаются также и вокруг продольной оси аппарата.
Благодаря такому конструктивному принципу струи моющего
раствора достигают всех точек внутренней поверхности аппарата
подлежащего очистке.
Из ферментатора промывная вода поступает в сливную ванну
фильтруется через фильтр и возвращается в бак передвижной на-
сосной станции.
Число оборотов моющего устройства может быть переменным и
колеблется в пределах от 4 до 30 об!мин. Выбор числа оборотов оп-
ределяется видом загрязнения и радиусом действия.
Для трудноудаляемых загрязнений рекомендуется замедленное
число оборотов.
Выбор числа оборотов в зависимости от радиуса действия.
Радиус действия, м 1 2 3 4 5
Наибольшее число оборотов, мин 20 10 7 5 4
Аппарат моется струей жидкости, выбрасываемой при избыточ-
ном давлении 4,8 Мн/м2, на которое также рассчитаны сопла.
Ниже приведены данные о степени очистки аппарата и продол-
жительности мойки при различных условиях работы устройства.
Радиус действия, м 1 2 3 4 5
Число оборотов, об!мин 20 10 6,7 5 4
Длительность рабочего цикла, мин
нормальная очистка 1 1,8 3 4 5
тщательная очистка 3 5,5 9,5 12,5 15,5
особо тщательная очистка 22 45 65 87 108
412
Фильтры
Для отделения культуральной жидкости от мицелия или бакте-
риальных тел в Японии, кроме фильтрпрессов и барабанных ва-
куум-фильтров, применяют ротационный дисковый саморазгружаю-
щийся фильтр непрерывного действия.
Такой фильтр (рис. 116) состоит из набора фольговых дисков
с общей поверхностью фильтрации 62 м2. К культуральной жидко-
сти добавляется порошок и масса под избыточным давлением 4 ат
Рис. 116. Общий вид ротационного дискового
фильтра
(392 кн/м2) фильтруется через дисковый фильтр. После отделения
бактериальных тел от осветленной культуральной жидкости фильтр
автоматически саморазгружается, промывается и цикл повто-
ряется.
Во Франции для отделения бактериальных тел или мицелия при-
меняют барабанные вакуум-фильтры. Фирма РЫИрре изготавлива-
ет вращающиеся барабанные вакуум-фильтры с различным спосо-
бом удаления осадка: с помощью скребка (для масс, образующих
толстые слои осадка), с роликом или наружным выпуском ткани
(для забивающихся и липких осадков) и с пучком шнуров (для
случаев, когда нужно армировать тонкий и забивающий поры
фильтра слой осадка).
При снятии осадка с помощью ролика липкие вещества удаляют-
ся лезвием, край которого изготовлен из резины или пластмассы.
413
Таблица 42
Типоразмеры вращающихся барабанных
фильтров Philippe
Поверхность фильтрации, м2 Диаметр барабана, м Ширина стола барабана, м Число ячеек
0,5 0,9 0,26 16
1,0 0,9 0,43 16
1,5 0,9 0,610 16
2,0 0,9 0,790 16
3,0 1,2 0,880 16
4,0 1,2 1,14 16
5,0 1,2 .1,410 16
6,0 1,5 1,360 18
7,0 1,5 1,580 18
8,0 1,5 1,710 18
10,0 1,5 2,2 18
12,0 2,0 2,010 24
14,0 2,0 2,310 24
15,0 2,0 2,480 24
16,0 2,0 2,630 24
20,0 2,0 3,260 36
25,0 3,0 2,790 36
30 3,0 3,310 36
35 3,0 3,830 36
40 3,0 4,380 36
45 3,0 4,890 36
Сепараторы
В Венгерской Народной Республике отделение мицелия от куль-
туральной жидкости гриба Fusarium проводится на саморзагружаю-
щихся сепараторах «Хемокомплекс» FO-31 производительностью
1000—15 000 л/ч. Удельный вес сепарируемой культуральной жид-
кости 1,014-1,03 • 104 н/м3; содержание сухого вещества в фермент-
ном растворе 1,5%, а мицелия гриба 10%; величина частиц мице-
лия колеблется от 2 до 16 мкм.
Вакуум-выпарные установки
Для концентрирования культуральной жидкости в Японии при-
меняют вакуум-выпарные установки с внутренней нагревательной
414
камерой и центральной циркуляционной трубой, схема которых при-
ведена на рис. 117.
Установка .состоит из генератора вакуумного пара, выпарного
аппарата, трубы для циркуляции раствора, термокомпрессора, ба-
рометрического конденсатора, ловушки, четырехступенчатого ин-
жекторного насоса, отводного сепаратора и насосов.
Рис. 117. Вакуум-выпарная установка с вакуумным обогревом:
1 — паропровод; 2 — водопровод; 3 — барометрический конденсатор;
4 — пароструйный насос; 5— насос; 6 — трубопровод вторичного пара;
7 —ловушка; 8 — вакуум-выпарной аппарат; 9 — приемник конденсата;
10— насос для откачки конденсата; // — насос для перекачки упарен-
ного концентрата; 12 — генератор пара низкого давления; 13 — термо-
компрессор.
Техническая характеристика вакуум-выпарной установки
Производительность, л!ч...................... 400
Поверхность нагрева, м2:
генератора пара низкого давления ... 4
выпарного аппарата ............................. 36
Матерал аппарата................................Нержавеющая
сталь
Масса, кг.......................................... 12500
415
Кроме того, в Японии применяют пленочные вертикальные ваку-
ум-выпарные установки типа Кестнера, работающие без принуди-
тельной циркуляции выпариваемого раствора. Использование их
для концентрирования культуральной жидкости позволит сокра-
тить длительность процесса и контакт продукта с теплоносителем
до нескольких секунд, что очень важно с точки зрения сохранения
ферментативной активности.
Рис. 118. Пленочный вы-
парной аппарат типа Ке-
стнера:
1 — верхняя часть корпуса;
2 — сепаратор; 3 — штуцер
для выхода упаренного рас-
твора; 4—отводная трубка
для воздуха и газов; 5 —
нижняя часть корпуса; 6 —
нагревательная камера; 7 —
штуцер для выхода конден-
сата; 8* 10 — штуцеры для
подачи раствора на упари-
вание; 9 — спускной штуцер;
// — трубная решетка; 12-
штуцер для подачи греюще-
го пара; 13 — штуцер для
выхода вторичного пара.
Выпарной аппарат типа Кестнера (рис. 118) состоит из цилинд-
рического корпуса, внутри которого расположена нагревательная
камера, состоящая из двух трубных решеток и цельнотянутых тру-
бок длиной до 7000 мм и диаметром до 50 мм. Над верхней трубной
решеткой расположена расширенная часть корпуса, внутри которой
над пучком трубок, установлен центробежный разделитель в виде
турбинного колеса с изогнутыми лопатками.
Жидкость, подлежащая упариванию, поступает в аппарат через
два штуцера ниже нижней трубной решетки и поддерживается на
уровне !/4—Vs высоты трубок. Греющий пар поступает в межтруб-
ное пространство по штуцеру, расположенному на !/з высоты от
416
нижней трубной решетки, и отсасывается мокровоздушным вакуум-
насосом через чугунный штуцер. Таким образом, нижняя часть все-
го пучка трубок омывается паром на небольшой высоте.
Жидкость в трубках при остаточном давлении 1,3—4 кн)м2 быст-
ро закипает, и пузырьки вторичного водяного ; пара, поднимаясь
вверх по трубкам, увлекают с большой скоростью жидкость, кото-
рая в виде тонкой пленки «вползает» по всей длине трубок. После
однократного прохождения через трубки вторичный пар выбрасы-
вается вместе с упаренным раствором в виде мельчайших капель в
сепаратор.
Струя вторичного пара, выходящая из трубок со скоростью
30—50 м!сек, приобретает в сепараторе-разделителе вращательное
движение, вследствие чего капли сконцентрированной жидкости,
обладающие большим удельным весом, выбрасываются центробеж-
ной силой из парового потока к периферии и отводятся со дна сепа-
ратора по двум штуцерам. Вторичный пар, пройдя дополнительно
систему каплеуловителей, удаляется в конденсатор через штуцер в
верхней части корпуса.
Вертикальные пленочные аппараты чаще всего рассчитаны на
концентрирование раствора при однократном прохождении его че-
рез нагревательные трубки, и реже — на двукратное, при котором
жидкость по одной части труб поднимается вверх, а по другой вме-
сте с вторичным паром опускается в сепаратор. Такие устройст-
ва называются аппаратами с поднимающейся и падающей плен-
кой.
Поверхность нагрева вертикальных пленочных аппаратов 100—
800 м2. За счет большой скорости движения пленки жидкости
(20 м)сек) и заполнения паром большей части трубок эффектив-
ность теплопередачи весьма высока и производительность аппара-
тов достигает 2000—10 000 л!ч. Существенные недостатки их —
большая высота и сравнительно быстрый износ трубок.
Техническая характеристика вакуум-выпарного аппарата типа
Кестнера
Производительность, л/ч............................ 2000
Диаметр аппарата, мм............................... 2100
Высота, мм........................................ 12000
Материал аппарата.............................Нержавеющая сталь
Остаточное давление, кн!м2.................... 1,3—4
Масса, кг......................................... 10000
Фирма Де-Лаваль изготавливает вакуум-выпарные установки
«Центритерм» СТ-6 и СТ-9 для ультрабыстрого упаривания термо-
лабильных жидкостей. Длительность контакта между обогревающей
поверхностью и упариваемой жидкостью при толщине пленки 0,1 мм
составляет около 1 сек.
27—826
417
Аппарат (рис. 119) представляет собой вертикальный цилиндр,
внутри которого расположен набор пустотелых конических нагре^
вательных элементов из нержавеющей стали, вращающихся на
полом валу. Жидкость, подлежащая упариванию, по трубе подает-
Рис. 119. Вакуум-выпарной аппарат
«Центритерм» фирмы Де-Лаваль:
/ — труба для подачи жидкости на
упаривание; 2 — штуцер для отво-
да вторичного пара; 3 — штуцер
для подачи греющего пара; 4 —
электродвигатель; 5 — вал; 6 —
штуцер для отвода конденсата;
7 — корпус; 8 — конический эле-
мент; 9 — улавливающая труба для
вывода концентрата.
ся в аппарат и под влиянием
центробежной силы тут же
распределяется тонкой (не бо-
лее 1 мм) пленкой по всей на-
гретой поверхности. Концент-
рат собирается на периферии
конусов и отводится через уло-
вительную трубу, а вторич-
ный пар поступает по патруб-
ку в конденсатор и собирается
в приемник. Через полое вере-
тено пар подается в паровую
камеру вокруг конусного паке-
та, а затем внутрь конусов, где
конденсируется проходящей по
другой стороне жидкостью
Конденсат центробежной силой
отбрасывается к верхним внут-
ренним конусным стенкам, сле-
дуя по ним к периферии кону-
сов, и затем поступает в от-
делительный канал, располо-
женный на дне паровой камеры.
Из отделительного канала
конденсат отсасывается ваку-
ум-насосом.
По данным фирмы, центро-
бежное ускорение в и спа ците-
ле достигает 200 g, что создает благоприятные условия для интен-
сивной теплопередачи, (резко увеличивает производительность ап-
парата и позволяет упаривать жидкости вязкостью до 20 н*сек!м2.
Типоразмеры вакуум-выпарных установок «Центритерм»
фирмы Де-Лаваль
СТ-6
Максимальная производительность по
испаренной влаге, л[ч ... . 800
Расход пара, кг!кг выпаренной влаги 1,1
Расход охлаждающей воды, т/ч . 13
Мощность установки, кет ... 10,3
Габариты, мм ...................... 2470x1975x2775
Масса, кг.......................... ‘ 1500
ст-9
2500
1,1
41
18,4
4000x2850x3800
6300
418
Фирмы Luva (Швейцария), Samensreuther (ФРГ) и др. изготав-
ливают вертикальные пленочные вакуум-выпарные аппараты малой
и большой производительности.
Выпарной аппарат фирмы Luva (рис. 120)
состоит из вертикальной трубы, по внутрен-
ним стенкам которой стекает пленка жидко-
сти. Труба снабжена рубашкой, которая в
аппаратах большой производительности раз-
делена на несколько секций. В верхней и
средней частях аппарата расположен вал,
на котором жестко закреплены шесть лопа-
стей.
Рабочий зазор между внутренней по-
верхностью трубы и лопастями (2 мм)
можно изменять путем смены лопастей. В
верхней части вала расположены две попе-
речные пластины, на которых оседают кап-
ли жидкости, уносимые паром и стекающие
вниз для упаривания. В нижней части аппа-
рата расположена конусная камера для
сбора упаренной жидкости.
Жидкость, подлежащая концентрирова-
нию, только один раз проходит по нагретой
поверхности.
Разделение паровой рубашки на секции
позволяет в каждой из них поддерживать
требуемую температуру.
В ФРГ для упаривания термолабильных
Рис.' 120. Выпарной аппа-
рат фирмы Luva:
/ — штуцер для подачи
жидкости; 2 — двигатель ме-
шалки; 3 — крышка; 4 —
выход сокового пара; 5 —
вход, греющего пара; 6 —
лопастная мешалка; 7 — ру-
башка для обогрева; 8 —
выход конденсата; 9 — вы-
ход концентрированного про-
дукта.
растворов применяются пленочные вакуум-
выпарные аппараты системы Sako. В отли-
чие от обычного роторного вакуум-выпарно-
го аппарата они обладают* возможностью
осевого перемещения ротора, что позволяет
изменять толщину пленки и регулировать
длительность пребывания жидкости в аппа-
рате до секунд.
Типоразмеры пленочных выпарных аппаратов системы Sako
Горизонтальные КН-10 КН-40 КН-50 КН-300 КН-45 КН-650
Производительность при 60°С, л/,ч .... 25 90 300 580 870 1225
Поверхность нагрева, м2 0,1 0,4 1,5 3 4,5 6,5
Мощность электродвига-
теля ротора, кет 1,46 4,1 7,3 11,0 14,7 1й,Ь
Габариты, мм
длина .... 1800 2300 4200 4900 5400 6400
высота .... 1350 1550 900 1100 1350 1750
Зак. 826
419
Вертикальные..........KV-100KV-400KV-600KV-800 KV-I200 KV-1500 KV-180Q
Производительность, л!ч 200 750 1150 1450 2000 2500 2900
Поверхность нагрева, м2 Мощность электродвига- 1 4 6 8 12 15 1S
теля ротора, кет . 3,0 4,5 7,36 11,0 14,72 14,72 18,3-
Высота, мм ... . 2400 600 5750 5950 7250 7900 8700‘
Внутренний диаметр, мм 300 4800 600 940 940 1250 125а
Суперцентрифуга FT-150 (Венгрия)
Фирма «Хемокомплекс» (Венгрия) изготавливает суперцентри-
фуги типа FT-150 с турбинным приводом’(рис. 121). Такой тип су-
перцентрифуги успешно заменит взрывоопасную центрифугу СТО,
применяемую для отделения ферментного
осадка от спирта. В отличие от обычных
суперцентрифуг ротор ее приводится в
движение масляной турбиной.
Насос для масла вместе с приводным
электродвигателем располагается вне
взрывоопасного цеха. Масло под давле-
нием подается насосом к приводной тур-
бине по нагнетательной трубке и возвра
щается по всасывающей. Тормозится ро-
тор гидравлическим путем, что умень-
шает местный нагрев, неизбежный при
механическом торможении.
Рис. 121. Суперцентрифу-
га с турбинным приводом
типа FT-150 фирмы
«Хемокомплекс»
Техническая характеристика суперцентрифуги типа FT-150
с турбинным приводом
Производительность, л/ч....................... 1000—2000
Максимальное число оборотов .в минуту . . . 10000
Объем ротора, л...................................... 9,5
Мощность двигателя, кет...................... 3,6
Напряжение, в....................................... 380
Габариты, мм ................................. 960 X 300X1800
Масса, кг............................................ 650
420
Для ферментного производства следует применять суперцентри-
*фуги с турбинным приводом, максимальный седиментационный объ-
ем барабана которых 20—30 л.
Сушйлки
Сушилка. Фирма Escher Wyss (ФРГ) изготавливает горизон-
тальные вибрационные сушилки для сушки в псевдокипящем слое,
которые применяются для сушки культуры гриба. Сушилка «Эшер
Висс» (рис. 122) представляет собой горизонтальный герметически
закрытый вибрационный лоток (желоб) с металлической сеткой, на
^которой сушится материал. Виброимпульсы передаются сетке с
большой частотой и малой амплитудой. Воздух, подогреваемый в
Рис. 122. Схема вибрационной сушилки «Эшер Висс»:
1 — штуцер для подачи продукта на сушку; 2 — штуцер для выхода
воздуха; 3 — штуцер для выхода продукта; 4 — опорная рама, 5 —
(пластинчатые рессоры; 6 — амортизатор; 7 — вибропривод; 8 — штуцер
для подачи воздуха.
калорифере, поступает по воздуховоду под сетку, проходит через
материал в вертикальном направлении снизу вверх и приводит его
во взвешенное состояние.
В случае необходимости воздушный канал разделяется на две
зоны и на конечном участке вибросушилки подается воздух, пред-
назначенный для охлаждения высушенного продукта. Производи-
тельность сушилки до 5 т/ч.
По данным фирмы, эти сушилки пригодны для сушки почти всех
продуктов, которые можно привести в псевдоожиженное состояние,
с частицами размером от 0,05 до 5 мм.
Роторная вакуум-сушилка (Италия). Фирма «Бонопейс» изго-
тавливает роторные вакуум-сушилки, которые могут быть пригод-
ны для сушки ферментных осадков.
На рис. 123 показан общий вид роторной конической вакуум-
сушилки. Корпус ее имеет паровую рубашку и при вращении его
421
вокруг горизонтальной оси материал непрерывно и интенсивно пе-
ремешивается. Соприкасаясь с обогреваемыми коническими стен-
ками, он быстро высушивается в условиях среднего вакуума. Пары
Рис. 123. Роторная вакуум-сушилка «Бонопейс»:
1 — конденсатор; 2 — патрубок для выхода втооичного
пара; 3 — сушилка; 4 — сепаратор; 5 — приемник; 6 —
ловушка; 7 —штуцер к вакуум-насосу; 8 — привод су-
шилки.
спирто-водной смеси конденсируются в теплообменнике и поступают
в приемник.
Суховоздушный вакуум-насос отсасывает воздух, проникающий
в систему через неплотности в соединениях и выделяющийся в про-
цессе сушки.
Остаточное давление в сушилке до 133 н/м2; обогревается сушил-
ка вакуумным паром.
Роторные вакуум-сушилки имеют емкость корпуса от 14 до
14 100 Л.
Большой интерес представляет сублимационная сушка фермент-
ных препаратов, поскольку при таком способе возможно высушить
препарат без потерь активности.
Сублимационные сушилки (Франция). Фирмы «Сожев» и
«Стокс» изготавливают различные типоразмеры сублимационных
сушилок.
Однокамерная лиофильная установка (рис. 124) фирмы «Стокс»
состоит из следующих узлов: цилиндрической рабочей камеры с
изменяющимся числом полок (внутри полок имеются коммуника-
ции, предназначенные для циркуляции термоагента); конденсатора
для паров воды, извлеченных из продукта (конденсатор цилиндри-
ческой формы представляет собой систему охлаждаемых тарелок,
размеры которых изготавливаются сообразно требуемым услови-
ям), системы подогрева и охлаждения, с помощью которой подает-
422
ся холод или тепло; насосной группы, обеспечивающей необходи-
мый вакуум; системы циркуляции термоагентов.
Рис 124 Лиофильная установка фирмы «Стокс:
Микронная сушилка. На предприятиях фирмы «Дайва Касей»
(Япония) после концентрирования культуральной жидкости в ва-
куум-выпарных аппаратах и высаливания ферментов осадок
смешивают с диатомовой землей и подают в микронную су-
шилку.
Установка (рис. 125), применяемая в Японии для сушки фер-
ментных препаратов, состоит из дробилки, питателя, сушилки, си-
стемы подачи подогретого воздуха, циклона с шлюзовым затвором
и приемником, рукавного фильтра и воздуходувки.
Рис. 125. Микронная сушилка:
1 — загрузочная воронка; 2 — дробилка; 3 — питатель; 4 — разгрузочный затвор, 5 — воздухо-
дувка; 6 — выход воздуха; 7 — выход воздуха; 8 — рукавный фильтр; 9 — двойной циклом;
/0—камера сушилки
423
& Типоразмеры лиофильных установок фирмы «Стокс»
21FO* 12FO 24FO 42FO НО FO
Длина, м 1.1 2,1 2,8 3,7 3,4
Высота, м 1,8 1,8 2,5 2,5 2,70
Ширина, м 0,90 1,2 1,5 1,9 4,3
Число обогреваемых полок 1 3 4 7 9
Размеры полок, мм 610x610 610x915 610X915 1,015X1,115
Минимальное расстояние между пол- 50—100 90 100 90 90
ками1, мм
Количество влажного продукта, за- Максимальная
гружаемого в камеру за 24 ч при 3 циклах за 8 ч/цикл, нагрузка 15 кг/м2 полки, кг загрузка за цикл 2 50 100 170 450
Наиболее низкая допускаемая темпе- ратура на полках конденсатора, °C —2J-r40 -204-40 -204-40 -20 4-40 -204-40
Способ обогрева жидкости, циркули- рующей внутри полок Электрический Электрический2 Паровой Паровой Паровой
Мощность, кет
электродвигателя 1,46 4,9 8,0 9,8 21,9
обогрева в момент пуска 3 1 1 1 1
Масса, кг 650 1830 2700 4500* 8900
1 Может изменяться по желанию.
2 Возможен обогрев паром.
Измельченный высол с исходной влажностью 30% подается пи-
тателем через нагнетательный воздуховод в камеру из нержавею-
щей стали, куда одновременно прямоточно поступает воздух, нагре-
тый до 180°С. Воздух подается вентилятором в таком количестве,
чтобы скорость его в сушильной камере была равна скорости вита-
ния. Высушиваемый препарат находится в камере до тех пор, пока
вследствие испарения влаги вес отдельных его частиц не станет
меньше силы давления газового потока, действующего на частицы,
после чего частицы потоком воздуха уносятся из сушильной каме-
ры, причем крупные из них падают обратно на дно сушилки, из-
мельчаются и вновь захватываются потоком подогретого воздуха.
Воздух из камеры сушилки поступает в двойной циклон для отделе-
ния взвешенных частиц, затем проходит рукавный фильтр и после
окончательной очистки от увлеченных частиц продукта удаляется
в атмосферу.
Производительность микронной сушилки 800 кг по сырому ис-
ходному продукту. Конечная влажность ферментного препарата
1-8%.
Начальные мешалки
В фармацевтичес-
кой промышленности
многих стран для сме-
шивания порошков до
однородного состояния
применяют начальные
мешалки «Турбула»
(Италия), которые
вполне пригодны и для
смешивания фермент-
ных препаратов. Про-
цесс смешивания мето-
дом «турбула» прово-
дится с помощью ме-
шалки в любой герме-
тизированной емкости,
в которую предвари-
тельно загружаются
компоненты, подлежа-
щие смешиванию. Ем-
кость с материалом
устанавливается в об-
хватывающее ее
устройство (рис. 126),
которое приводится в
ритмически пульсирую-
щее движение в трех
Рис. 126. Общий вид канальной мешалки «Тур-
була»:
1 — емкость для смешивания; 2 — обхватывающее уст-
ройство; 3 — редуктор; 4 — электродвигатель.
425
измерениях. Вихревое перемешивание при 1500 оборотах в минуту
обеспечивает отклонение средних данных ;по однородности на 0,7%.
По окончании смешивания герметизированную емкость извлекают
из обхватывающего устройства, а на ее место устанавливают дру-
гую емкость с загруженными компонентами.
Преимущество подобного метода заключается в возможности ис-
пользования для смешивания содержимого одной или одновремен-
но нескольких герметизированных емкостей с проведением процес-
са в чистых условиях, вплоть до стерильных, без пылевыделения.
Недостатком является периодичность процесса, необходимость при-
менения ручного труда и неизбежный контакт персонала с препара-
том при загрузке и выгрузке.
Типоразмеры и технические данные начальных мешалок «Турбула»
2П 20 сюо 200 Ф400
Диаметр сосудов, мм .. . . 132 350 520 630 770
Высота, мм . 185 500 720 900 1000
Число оборотов в минуту . 56/71/90 22/30/40 14/19/28 4—24 4—2
Масса сосуда максимальная, кг 5 30 120 250 250
Суммарная масса ингредиентов, кг . 47,5 580 1020 2700 2800
Габариты мешалки, мм .. .
длина . 600 1600 1645 2910 2905
ширина . 440 900 1710 2300 2468
высота . 360 130Э 1850 1620 1760
Смесители «Наутамикс»
В Японии ферментные пре-
параты смешивают в смеси-
телях типа «Наутамикс»
(рис. 127), представляющих со-
бой аппарат конической фор-
мы, внутри которого располо-
жены смесительные винты, вра-
Рис. 127. Смеситель «Наутамикс»:
/ — привод; 2 — мотор; 3 — корпус; 4 —
винтовая мешалка; 5 — вибратор; 6 — шнек
для выгрузки
426
Щающиеся с большой скоростью вокруг своей оси и вдоль коничес-
ких стенок, вследствие чего продукт перемещается из одной части
аппарата в другую и обратно. Аппарат снабжен рубашкой для ох-
лаждения. Процесс перемешивания до однородного состояния длит-
ся 10—15 мин. Емкость изготовляемых смесителей от 10 до 7500 л.
Гибкий механический транспортер
Представляет интерес гибкий механический транспортер Transi-
tube, изготовляемый фирмой ТММ (Франция), широко используе-
мый фирмой «Рапидаз» для механизации загрузки сравнительно
небольших количеств сыпучих материалов.
Рис. 128. Гибкий механический транспортер
Transitube:
/ — электродвигатель с головкой; 2 — выход про-
дукта; 3 — гибкая труба; 4 — винт; 5 — вход
продукта.
Закрытая емкость с сыпучим материалом подвозится на тележке
к аппарату и с помощью Transitube сырье непосредственно загру-
жается в аппарат.
В гибком канале 140x100 мм (рис. 128) вращаются с большой,
скоростью два концентрических винта с разным шагом. Головка
427
специального двухмоторного электродвигателя вращает каждый
винт в противоположные стороны, уничтожая центробежное- дейст-
вие и совмещая при этом осевое действие. Продукт захватывается
концом гибкой трубы, проходит по всей ее длине и выходит с дру-
гого конца через специальное устройство для подачи к месту за-
грузки. По данным фирмы ТММ, Transitube является пыленепрони-
цаемым, обладает большим перепадом давлений и не требует спе-
циального ухода.
ЛИТЕРАТУРА
1. АндеркофлерЛ. А. и ХиккейР. Дж. Бродильные производства.
Т. II. Ч. III. Производство ферментов. Пищепромиздат, 1959.
2. Кирихидэ Рёдзо. Сушка распылением. «Когаку Когаку, Кодаки Кодаки».
Chem. Eng. Japan. Vol. 25, № 9, 690—696, 1961.
3. Мураками Кендзи. Установка для сушки под вакуумом. «Ненрэ оёби
Нэнсе». Vol. 28, № 5, 464—472, 1961.
4. М с Cann Е. Р., Р а г к е г A., Pickles D., Wright D. G. Laboratory and
pilot-plant fermenters. «Man. Chemist». Vol. 32, № 8, 356—357, 378, 1961.
5. Petersen Effrup. De ontwikkeling van het vacuumContactdrogen «Con-
serva», 10, № 4, 82—83, 1961.
6. Petersen Effrup. Aculerated fruze-drying of foods soms European ad-
vances. «Frosted Food Fee Id. Vol. 33, № 3, 11—13, 40, 41.
7. ПрескотС. и Дэн С. Техническая микробиология. ИЛ. М., 1952
8. П е т к о в А. В. Из опыта работы спиртовой промышленности Чехословакии.
«Спиртовая промышленность», 1959, № 4.
9. Синовара Хисами. Сушка во вращающихся сушилках. «Когаку Когаку,
Кодаки Кодаки». Chem. Eng. Japan. Vol. 25, № 9, 699—703, 1961.
JO. Сато Томотаро. Некоторые вопросы современного производства фермен-
тов для осахаривания крахмала. «Хакко Кёкайси». «Journ. Ferment. Assoc».
Vol. 19, № 5, 299—309, 1961.
11. Stengel R. F. Centrifugal action increasis effectiveness of film evaporator.
«Design News». Vol. 16, № 21, 1961.
12. Halder R., Kapp W. Technischer Apparatehau, «VDI—Zeitschrift», Bd. I.
103, N 30, S. 1465—1472, 1961.
13. У p б а н я. О. О некоторых вопросах Чехословацкой спиртовой промышлен-
ности. «Спиртовая промышленность», 1957, № 6.
428
Глава IX. ТЕХНИКА БЕЗОПАСНОСТИ
ТЕХНИЧЕСКИЕ И САНИТАРНЫЕ СРЕДСТВА БОРЬБЫ С ВЫДЕЛЕНИЯМИ
ОРГАНИЧЕСКОЙ ПЫЛИ И КОНИДИЙ ГРИБОВ
.На заводах ферментных препаратов воздух производственных
помещений загрязняется органической пылью, образующейся из
компонентов сырья, полупродуктов и готовой продукции, и кониди-
ями плесневых грибов — продуцентов ферментов, что может ока-
зать вредное влияние на здоровье рабочих. Источником выделения
конидий являются процессы, связанные с приготовлением посевной
культуры гриба, ее перемещением и дроблением. Значительное вы-
деление органической пыли происходит при проведении технологи-
ческих операций, связанных с транспортировкой сырья, полупро-
дуктов и продуктов производства, дроблением культуры гриба, из-
мельчением высушенных ферментных осадков и наполнителей, а
также фасовкой готового продукта.
По данным санитарно-эпидемиологической станции, при отсут-
ствии герметизирующих устройств, вентиляции и аспирации содер-
жание пыли в 1 л3 воздуха составляет 80—125 мг. Органическая
пыль, находящаяся во взвешенном состоянии в воздухе в виде аэро-
золя, огне- и взрывоопасна. Достаточно 8—10 г такой пыли на 1 м3
воздуха, чтобы при наличии источника огня произошел взрыв раз-
рушительной силы.
По степени возгорания пыль разделяется на три класса: 1) лег-
ко воспламеняющаяся — от искры зажженной спички и т. д. с
быстрым распространением пламени; к этому классу относится пыль
от сахара, декстрина, крахмала, пшеничных отрубей и др.; 2) легко
воспламеняющаяся, но требующая для быстрого распространения
пламени мощного источника огня с более высокой температурой
(вольтова дуга, паяльная лампа); к этому классу относятся дре-
весные опилки и др.; 3) пыль в обычных условиях не воспламеняю-
щаяся вследствие содержания большого количества негорючего
вещества.
При отсутствии специальных герметизирующих устройств и аспи-
рации на заводах вместе с пылью в воздухе витают конидии плес-
невых грибов; содержание их в 1 м3 воздуха превышает 20 000.
Длительное загрязнение воздуха пылью и конидиями плесневых
грибов может вызвать у обслуживающего персонала заболевание
слизистой носоглотки, кожного покрова, глаз и других органов, по-
этому на ферментных заводах необходимо осуществить комплекс
429
технических и санитарных мероприятий, обеспечивающих полную
безопасность работы.
Уменьшение запыленности производственных помещений долж-
но достигаться в первую очередь за счет герметизации оборудова-
ния и выбора системы вентиляции. Если герметизация затрудни-
тельна или невозможна, машины или оборудование следует укры-
вать кожухами с аспирацией этих узлов. Производственные процес-
сы, сопровождающиеся значительным пылевыделением, необходимо
проводить в изолированных помещениях, механизировать их и по
возможности выполнять без непосредственного участия людей.
На стр. 116, 184 приведено описание герметизирующих устройств
для проведения таких технологических операций. Испытания пока-
зали, что при применении их содержание пыли в 1 mz воздуха
снижается до нормы, составляя 2 мг и менее. Постоянный контроль
за состоянием воздушной среды в производственных помещениях,
за исправным состоянием герметизирующих устройств оборудова-
ния, коммуникации транспортных средств, вентиляции, аспирации и
других устройств обеспечивает производственные помещения воз-
духом надлежащих кондиций.
Температура, относительная влажность и степень загрязнения
воздуха в производственных помещениях завода согласно проекту
правил и норм допускаются в пределах, указанных в табл. 43.
Таблица 43
Параметры воздуха в цехах заводов ферментных препаратов
Помещения Температу- ра, °C Относи- , тельная влажность, % Загрязненность
вид норма, мг/м3
Приготовления посевного материала 17—22 70—75 Пыль 2
Приготовления питательной среды 17-22 70—75 То же 2
Станции выращивания .... 17—24 96-100 » 2
Загрузочных и выгрузочных коридо- ров 17—22 40—60 » 2
Обработки культуральной жидкости 17-24 70-75 Спирт 1000
Осаждения ферментов ... 17—24 40—60 То же 1000
Регенерации осадителей 17—22 40—60 » 1000
Сушки, измельчения, фасовки 15—17 40—60 Пыль 2
Компрессорной и холодильной уста- новок 15-17 40-60 Аммиак 20
Лаборатории 17-24 40—60 Спирт 1000
Рекомендуется оборудовать ферментные заводы системой при-
точно-вытяжной вентиляции с обеспечением следующей кратности
воздухообмена в час (табл. 44)..
430
Система очистки воздуха в цехах ферментных заводов
Таблица 44
Наименование производственного процесса в помещении или самого помещения Кратность вентиляционного обмена Очистка подаваемого воздуха через фильт- ры типа О чистка удаляемого воздуха перед выбро- сом в атмосферу через фильтры типа
приток вытяжка
При поверхностном культивировании
Выращивание посевного материала в отделении 8 8 Ин ж. Рекка и Инж. Рекка и
чистой культуры ЛАИК ЛАИК
Стерилизация питательных сред 5 5 То же То же
ЛАойки и стерилизации кювет 5 6 Инж. Рекка
Выращивание культуры гриба 8 8 Инж. Рекка То же
и ЛАИК
Измельчение культуры гриба 6 8 Инж. Рекка То же
Сушка и фасовка культуры гриба 7 8 То же »
Извлечение ферментов осаждением органически- 6 8 » »
ми растворителями
Сепарирование и сушка 6 8 » »
Регенерация осадителей, склады для органических 6 8 — —
растворителей
Измельчение, просеивание, стандартизация и фа- 4 6 Инж. Рекка и Инж. Рекка
совка ферментных препаратов в порошке осушка воздуха до
влажности 15%
Склады сырья и готовой продукции Рециркул яция *— —
Лабораторные помещения с вытяжными шкафами 3 3 Инж. Рекка Инж. Рекка и ЛАИК
432
Продолжение табл. 44
Наименование производственного процесса в помещении или самого помещения Кратность вентиляционного обмена Очистка подаваемого воздуха через фильтры типа Очистка удаляемого воздуха перед выбро- сом в атмосферу через фильтры типа
приток вытяжка
Боксы для стерильных работ 8 8 Инж. Рекка и ЛАИК Инж. Рекка и ЛАИК
При глубинном культивировании
Приготовление и стерилизация питательной среды 4 5 Инж. Рекка
Культивирование микроорганизмов 3 4 То же Инж. Рекка и ЛАИК
Обработка культуральной жидкости и фильтра- ция 5 6 » —
Сушка в сушилках (растворитель, вода) 5 6 » —
Осаждение ферментов органическими раствори- телями, сепарирование и сушка 6 8 Инж. Рекка
Регенерация осадителя, склады для органических растворителей 6 8 — —
Измельчение, просеивание и фасовка ферментных препаратов в порошке 6 4 Инж. Рекка и осушка воздуха до влажности 15% Инж. Рекка
Воздух, удаляемый из производственных помещений в атмос-
феру, должен быть очищен от конидий гриба путем двойной фильт-
рации: вначале через масляные фильтры грубой очистки, а затем
через бактериальные фильтры типа ЛАИК или фильтры типа
ФТО-ЮОО и ФТО-750.
Каналы вентиляционных установок целесообразно облицовывать
звукопоглощающими материалами, а электродвигатель и вентиля-
тор изолировать от перекрытий вибропоглощающими прокладками
(из асбеста, войлока, резины и т. п.). Для уменьшения шума, созда-
ваемого вентилятором, следует избегать резких изменений сечения
воздуховодов и крутых поворотов труб. Кроме общеобменной вен-
тиляции, целесообразна аспирация у мест пыле- и газообразования:
в узлах подачи сырья в стерилизатор, у манипуляторов, дробилок
для измельчения культуры гриба, растильных камер, узлов подачи
культуры гриба в диффузоры, сепараторов, центрифуг, нутч-фильт-
ров, мельниц для измельчения готового ферментного препарата, сме-
сителей и в отделениях расфасовки.
Для очистки удаляемого в атмосферу воздуха от большого со-
держания пыли применяются также циклоны и рукавные фильтры.
Рукавные матерчатые фильтры относятся к типу сухих пористых
фильтров, получивших широкое распространение вследствие нали*
чия автоматических встряхивающих приспособлений и большой
эффективности пылезадержания. Ткань для них подбирается в за-
висимости от вида пыли, загрязняющей воздух, ее дисперсности, на-
чальной запыленности воздуха, воздушной нагрузки (т. е. количест-
ва воздуха в л3/ч, проходящего через 1 м2 ткани).
В тех случаях, когда несмотря на принятые выше меры пыль
и конидии в незначительных количествах все же выделяются, произ-
водственному персоналу выдают индивидуальные средства защиты,
к числу которых относится спецодежда, состоящая из комбинезона,
шлема-капюшона, изготовленных из пыленепроницаемых тканей, а
также рукавиц. Глаза защищают противопыльными очками, а для
защиты органов дыхания применяют противопылевые респираторы
Ф-45 и «Лепесток». Респираторы Ф-45 плотно облегают область
носа и рта и обладают высокой поглощающей способностью. Они
гарантируют 100%-ную защиту организма от пыли при различных
физических нагрузках и различной степени запыленности воздуха:
Для защиты лица, головы и шеи от едкой пыли необходимо приме-
нять специальные комбинированные шлемы или капюшоны, изго-
товляемые вместе с респиратором.
По окончании смены рекомендуется принять теплый душ и сдать
спецодежду для обеспыливания, которое проводится в специальной
комнате. Через каждые 5—6 дней спецодежду после обеспыливания
стерилизуют в автоклаве, после чего передают в общую прачеч-
ную.
На предприятиях ферментной промышленности нельзя допускать
к работе лиц с заболеваниями почек, печени, желудочно-кишечного
28—826
43»
тракта, легких, а также склонных к кожным болезням. Все катего-
рии рабочих, занятых на работах в условиях пылевыделения, по
окончании смены должны принимать теплый душ.
СПЕЦИАЛЬНЫЕ ТРЕБОВАНИЯ БЕЗОПАСНОЙ ЭКСПЛУАТАЦИИ
ФЕРМЕНТНЫХ ЗАВОДОВ
Заводы ферментных препаратов целесообразно располагать на
расстоянии 300 м и более от других зданий, с санитарно-защитной
зоной. При размещении цеха ферментных препаратов на одном уча-
стке с другим предприятием рекомендуется расположить его в са-
мостоятельном корпусе. Территорию, свободную от застройки и про-
ездов, следует отводить под зеленые насаждения.
Производственные помещения должны быть достаточно светлы-
ми и просторными для удобного и безопасного обслуживания обо-
рудования. Стены производственных помещений целесообразно по-
крыть облицовочными светлыми плитками на высоту 1,8 м от пола,
а выше окрасить масляной краской. Полы должны быть гладкими,
без щелей и выбоин, водонепроницаемыми и с уклоном в сторону
трапов. Металлическое покрытие площадок для обслуживания ап-
паратов и ступени лестниц во избежание скольжения должны быть
рифлеными.
Производство очищенных ферментных препаратов является по-
жароопасным. Особенно опасны помещения, в которых применяют
органические растворители для процессов осаждения ферментов,
проводят отделение осадка от растворителей, сушку осадка, регене-
рацию спирта, ацетона, склады для их хранения.
Цехи и отделения со взрывоопасными производствами должны
изолироваться от смежных невзрывоопасных глухими (брандмауер-
ными) стенами. Сообщение между ними допускается через специ-
альные переходы.
Помещения, имеющие высоту 10 м и более, обеспечиваются на-
ружной металлической пожарной лестницей с уклоном не более 45°
и шириной не менее 0,7 м. Конструкции покрытий зданий, в которых
проводятся технологические процессы, особо опасные в пожарном
отношении, целесообразно изготавливать из материалов, легко сбра-
сываемых при воздействии взрывной волны. От прямых ударов мол-
ний и вторичных ее проявлений предусматривается оборудование
грозозащиты. Для защиты от проявления статического электриче-
ства вся аппаратура, металлоконструкции, трубопроводы с органи-
ческими осадителями, воздуховоды, резервуары, сливно-наливные
устройства необходимо заземлять.
Электродвигатели и пусковые приборы должны быть гермети-
чески закрытыми, что исключает искрообразование при работе, пу-
ске и остановке. Для предотвращения ожогов и уменьшения тепло-
выделений тепловую аппаратуру и коммуникации теплоизолируют;
температура наружной поверхности термоизоляции не должна пре-
вышать 40°С.
434
Цистерны для хранения органических растворителей необходи-
мо снабжать герметически закрывающимися люками.. Воздушники
цистерн выводят в атмосферу и устанавливают на них огневзрыво-
преградители. Необходимо избегать совместной прокладки трубо-
проводов для легколетучих и взрывоопасных жидкостей с тепло-
проводами и трубопроводами сжатых газов. Материальные и вспо-
могательные трубопроводы целесообразно окрашивать в соответст-
вии с приводимым ниже перечнем.
Цвет окраски
основной колец или полосок
Материальные трубопроводы
Питательная среда Серый
Культуральная жидкость Серый Голубой
Нативный раствор Серый —
Раствор соды Серый Красный
Раствор уксуснокислого калия Серый Зеленый
Растворители
чистые Коричневый —-
отработавшие Коричневый Белый
Посевная линия Синий Красный.
Серная кислота Оранжевый —
Соляная кислота Розовый —
Раствор щелочи Фиолетовый —
Вспомогательные трубопроводы
Пар Красный —
Конденсат Зеленый Синий
Вода питьевая Зеленый —
Вода техническая Бода пожарохозяйственная Сжатый воздух Вакуум Канализация Холод Зеленый Оранжевый Синий Голубой Черный Темно-красный Черный
ОСНОВЫ ТЕХНИКИ БЕЗОПАСНОСТИ ПРИ ЭКСПЛУАТАЦИИ
ТИПОВОГО ОБОРУДОВАНИЯ
Технологическое оборудование заводов ферментных препаратов
состоит из специализированного нестандартного оборудования и
множества видов типовой аппаратуры, применяемой в пищевой и
химической промышленности.
28*
435
Разнообразие и сложность аппаратуры, пожарная взрывоопас-
ность ферментного производства вызывают необходимость тщатель-
ной подготовки обслуживающего персонала, досконального изуче-
ния им аппаратуры, технологии и правил техники безопасности.
Весь персонал завода должен прослушать курс по технике безопас-
ности и промышленной санитарии, а также пройти инструктаж и
обучение безопасным методам работы непосредственно на раоочем
месте. Проверку знаний и повторный инструктаж по технике иез-
опасности рекомендуется проводить не реже 1 раза в квартал.
Инструкции по технике безопасности должны разраиатываться
для каждого рабочего места, выдаваться исполнителям работ на
руки и вывешиваться на видных местах. Целесообразно ежегодно
проводить противопожарный техминимум, а допуск к работе разре-
шать только после прохождения инструктажа о мерах /противопо-
жарной безопасности.
Не имея возможности изложить здесь основы техники иезопас-
ности и противопожарной техники в ферментной промышленности,
считаем необходимым кратко описать некоторые вопросы техники
безопасности при эксплуатации оборудования.
Подъемно-транспортные устройства
Для обеспечения безопасной эксплуатации шнеков, норий, виб-
ротранопортеров и других устройств необходимо, чтобы вокруг них
был проход шириной не менее 0,8 м. Все транспортные устройства
должны быть герметизированы во избежание пыления транспорти-
руемого материала. Загрузка и выгрузка пылящих материалов дол-
жны быть герметизированы, а весь узел — аспирирован.
Для осмотра и очистки целесообразно предусмотреть автомати-
ческую остановку. Для наблюдения за транспортированием реко-
мендуется установить окна из небьющегося, несгораемого и про-
зрачного материала.
Конструкция загрузочной воронки должна исключать возмож-
ность соприкосновения рук рабочего с винтом, шнеком, ковшовой
цепью или лентой нории, с дебалансами вибраторов вибротранспор-
теров. Осмотр, очистку, ремонт рекомендуется проводить только
при полной остановке транспортных устройств. Расчистка завалов
в нориях руками запрещается, так как по мере удаления продукта
нагруженная ветвь ленты нории может дать обратный ход. Нории
должны быть оборудованы автоматическими приспособлениями,
обеспечивающими выключение электродвигателя при обрыве цепи.
Все вращающиеся части приводов должны быть закрыты за-
щитными ограждениями, позволяющими проводить смазку враща-
ющихся и трущихся частей. Целесообразно также ограждать загру
зочные и разгрузочные устройства.
436
Для безопасной эксплуатации пневматических установок необ-
ходимо герметизировать трубопроводы, заземлить их, а также кор-
пуса фильтров и отделителей. При очистке циклона от пыли кате-
горически запрещается пользоваться спичками или другими источ-
никами открытого огня.
Дробильное оборудование (дезинтеграторы, дисмембраторы,
ударные дробилки и шаровые мельницы)
Измельчающее оборудование целесообразно располагать в обо-
собленном помещении. Загрузку и выгрузку рекомендуется гермети-
зировать, а узел измельчения, подачи и выгрузки — аспирировать.
Пуску дробилок должен предшествовать пуск аспирационных уста-
новок. Выключать аспирацию рекомендуется только после останов-
ки дробилки.
При установке дробилок свободные проходы вокруг них должны
быть не менее 1,5 м. Вращающиеся части должны быть надежно
ограждены. Загрузка продукта допускается только после предва-
рительной проверки технического состояния дробилки и после того
как машина проработает (нормально) некоторое время вхолостую.
Категорически запрещается извлекать посторонние предметы, по-
павшие в бункер дробилки, во время работы.
Правилами безопасности запрещается работать на ударных
центробежных мельницах при вращении дисков со скоростью, пре-
вышающей указанную в паспорте. При эксплуатации шаровых
мельниц не допускается загрузка шаров, общий вес которых пре-
вышает нормы, указанные в техническом паспорте данной мельни-
цы. Не допускается эксплуатация мельницы при неплотно закры-
том люке крышки и при отсутствии ограждения.
Стерилизаторы
При нарушении правил технической эксплуатации автоклавов,
применяющихся для стерилизации питательных сред, обслуживаю-
щий персонал может получить травмы, а при неаккуратной эксплу-
атации промышленных стерилизаторов — ожоги. Поверхности кор-
пусов стерилизаторов и автоклавов целесообразно покрыть слоем
теплоизоляции, обеспечивающей температуру поверхности во вре-
мя работы не выше 40°С.
Водяные рубашки стерилизаторов Укргипропрода не рассчита-
ны на работу под давлением, поэтому выходной штуцер рубашки
должен находиться постоянно в открытом положении. Привод ме-
шалок стерилизаторов должен быть огражден.
При эксплуатации стерилизаторов, работающих под избыточным
давлением, необходимо соблюдать требования техники безопасно-
сти, излагаемые ниже.
437
Аппаратура, работающая под давлением
Этот вид оборудования подлежит техническому освидетельство-
ванию, наружному и внутреннему осмотру, гидравлическому испы-
танию с предъявлением органам Госгортехнадзора СССР за без-
опасным ведением работ.
При наружном осмотре аппаратуры устанавливается ее общее
техническое состояние и исправность арматуры. При гидравличе-
ком испытании, которое проводится не реже одного раза в 6 лет,
устанавливаются дефекты и проверяется плотность соединения со-
прягаемых деталей и узлов. Не реже 1 раза в год аппаратура, ра-
ботающая под давлением с применением взрывоопасных жидкостей,
испытывается на герметичность.
Каждый аппарат, предназначенный для работы под давлением,
должен быть изготовлен в соответствии с требованиями органов
Госгортехнадзора СССР. На нем должны быть указаны: завод-из-
готовитель, дата изготовления, величина расчетного и предельно-
допустимого рабочего давления, а также очередной срок освиде-
тельствования.
Аппаратура должна быть снабжена проверенным и опломбиро-
ванным Госкомитетом стандартов, мер и измерительных приборов
при Совете Министров СССР манометром с красной чертой на шка-
ле, соответствующей предельно допускаемому давлению; предохра-
нительным клапаном, отрегулированным на максимально допусти-
мое давление; комплектом регулирующей запорной аппаратуры
для технологических и других трубопроводов, приспособлением для
выпуска воздуха, газа, пара и опускным устройством.
На аппаратах, работающих под давлением с применением взры-
воопасных жидкостей, выхлопная труба предохранительного клапа-
на должна быть выведена из помещения не менее чем на 1 м выше
конька крыши.
Запрещается работать на оборудовании, резервуарах, сосудах,
работающих под давлением, с просроченным сроком периодическо-
го освидетельствования.
К эксплуатации оборудования, работающего под давлением, до-
пускаются только лица, обученные и проинструктированные по пра-
вилам техники безопасности.
Центрифуги и сепараторы
Для отделения ферментного осадка от спирто-водной смеси
следует применять центрифуги и сепараторы, допускаемые к экс-
плуатации во взрывоопасных помещениях класса В1А.
Для предупреждения аварии необходимо контролировать ско-
рость вращения, нагрузку барабана, техническое состояние под-
шипников .и наличие в них смазки. Неисправность аппаратуры и
увеличенная нагрузка достаточно легко устанавливаются по силь-
ной вибрации и характерному шуму.
438
При неисправном состоянии и нарушении режима работы цен-
трифуги и сепараторы представляют большую опасность для об-
служивающего персонала. Авария может произойти в случае ра-
боты с большей скоростью, чем та, на которую они рассчитаны, так
как в подобных случаях центробежные силы намного превышают
предельно-допустимую величину. Разрушение стенок барабана мо-
жет произойти при резком пуске или торможении, поэтому разгон
проводится соответственно в течение 2 и 7 мин.
Большое значение для нормальной работы центрифуги имеет
равномерность загрузки барабана продуктом и объем заполнения
барабана. При неравномерной загрузке продуктом барабан начи-
нает сильно «бить», что может привести к механическому повреж-
дению барабана и кожуха. Обычная загрузка барабана рассчитана
на 0,5—0,6 его объема. При загрузке, больше допустимой по пас-
порту, может произойти разрыв стенок аппарата.
Следует не допускать попадания в аппараты посторонних метал-
лических или других тяжелых предметов, которые могут вызвать
аварию. Аварии в работе центрифуги и сепаратора могут вызвать
неполадки в тормозе.
При центрифугировании спиртовых и ацетоновых растворов и
других легковоспламеняющихся жидкостей необходимо применять
герметизированные центрифуги и сепараторы с взрывозащищенны-
ми или гидравлическими приводами.
Необходимо периодически и тщательно осматривать все ходо-
вые части центрифуг и сепараторов и проверять степень износа ма-
териала барабана. Категорически запрещается работать на сепара-
торе в случаях разбалансировки барабана, обнаружения посторон-
них шумов, ненормального дрожания сепаратора, появления течи
через уплотнения барабана, а также в случае попадания спирто-
осажденной вытяжки или промывной воды в масляную ванну. Раз-
борку коммуникаций и барабана можно проводить только после
полной остановки аппарата.
Нельзя запускать во вращение барабан сепаратора, если в нем
находится жидкость. Перед пуском необходимо освободить тормоз,
и подачу жидкости вести только при достижении нормальных рабо-
чих оборотов.
Необходимо проверять наличие нормального уровня масла в
картере станины и время разгона барабана до рабочих чисел обо-
ротов. При чрезмерном сокращении периода разгона следует пре-
кратить работу до устранения неисправности.
Сушилки
Сушилки для культуры гриба желательно устанавливать в обо-
собленном, хорошо вентилируемом помещении. Вакуум-сушильные
установки, применяемые для сушки готовых ферментных препара-
тов, целесообразно устанавливать в помещении, близко расположен-
ном к отделению измельчения и стандартизации ферментного пре-
439
парата. Для снижения тепловыделения и предупреждения ожогов
наружную поверхность корпусов сушилок и паротрубопроводов,
идущих к ним, термоизолируют.
Для обеспечения безопасности работ необходимо оградить дви-
жущиеся части, проверять техническое состояние приводного меха-
низма, подшипников, наличие смазки в них, исправность питающе-
го механизма и др.
Правилами техники безопасности запрещается чистка на ходу
питающих механизмов, пылеочистительных установок, а также суш-
ка без предварительной очистки сушилок от пыли.
При применении ленточных сушилок необходимо обратить осо-
бое внимание на правильное, без перекосов, натяжение транспорт-
ных лент. Направляющие козырьки, торцовые щиты ограждений
сушилки, разрыхлители должны быть установлены так, чтобы нич-
то (болты, гайки) не цеплялось за транспортерные ленты. Маномет-
ры, установленные на входе пара и выходе конденсата, должны
быть проверены и опломбированы. Необходимо периодически
проводить внутреннюю чистку калориферов, лент, мест залегания
Цродуктов.
Вентиляторы сушилок должны работать плавно и без вибрации
станины. При появлении вибрации и несвойственного шума нужно
остановить вентилятор и провести ремонт, чаще всего — баланси-
ровку турбинного колеса.
Вакуум-фильтры
Безопасная работа вакуум-фильтров обеспечивается наблюдени-
ем за контрольно-измерительными приборами и правильной эксплу-
атацией вакуум-насосной установки. В соответствии с технической
и технологической инструкциями необходимо следить за разреже-
нием в вакуум-фильтре, давлением в зоне отдувки и температурой
фильтрата и воды в барометрической трубе конденсатора.
Особое внимание необходимо обратить на правильную установ-
ку ножа, (предназначенного для снятия осадка с барабана фильтра.
Регенерацию фильтровальной ткани следует проводить с соблюде-
нием мер предосторожности.
Ректификационные аппараты
Основным условием безопасной работы ректификационной ус-
тановки является полная герметизация ее. Для обеспечения без-
опасных условий труда регулировать температуру и давление следу-
ет по возможности автоматически, следя за тем, чтобы эти парамет-
ры не превышали норм, установленных паспортом.
На рубашках аппарата должны быть установлены предохрани-
тельные и вентиляционные клапаны, манометры и термометры. Ко-
лонна и горячие трубопроводы должны .покрываться слоем тепло-
изоляции. Необходимо, чтобы тепловая изоляция не создавала
440
скрытых потоков при утечках. Для обнаружения утечек поверхность
изоляции всегда должна быть чистой.
Особые меры безопасности необходимо соблюдать при ремонте и
очистке ректификационных колонн. Колонны, предназначенные для
осмотра, очистки или ремонта, до начала работ должны быть ос-
вобождены от жидкости и паров легковоспламеняющейся жидко-
сти, промыты, пропарены и хорошо провентилированы через откры-
тые люки, отсоединены заглушками от входящей и выходящей ком-
муникации газа, жидкости, пара, охлаждены до температуры 30°С.
Электродвигатели должны быть обесточены, приводные ремни
сняты.
Для (предотвращения образования внутри колонны взрывоопас-
ной концентрации воздуха с нагретыми легковоспламеняющимися
парами открывать люки колонны надо в строгой последовательно-
сти, начиная с верхнего. После проветривания колонны необходи-
мо провести лабораторный анализ воздуха, пробы которого берут из
разных мест по высоте колонны.
При необходимости проведения работ внутри колонны следует
во всех случаях пользоваться шланговым противогазом, свободный
конец которого должен быть выведен наружу — в зону чистого
воздуха. Длительность пребывания рабочего внутри колонны в
шланговом противогазе не должна превышать 15 мин.
Холодильное оборудование
При монтаже и эксплуатации холодильного оборудования необ-
ходимо правильно и удобно расположить компрессоры, обеспечить
достаточную ширину проходов, оградить приводы и движущиеся
части и постоянно иметь в виду, что неправильная эксплуатация
может привести к несчастным случаям. Большая опарность возни-
кает при прорыве аммиака в помещении, что в зависимости от его
количества может вызвать отравление и ожоги различной степени.
Причинами аварий являются: неправильная эксплуатация —
пуск и остановка компрессора при нарушении определенной после-
довательности; несоблюдение норм заполнения сосудов и трубопро-
водов хладагентом; повышение давления на нагнетательной сторо-
не компрессора выше установленного предела; неисправность си-
стемы смазки; разрыв нагнетательного или всасывающего трубо-
провода от вибрации при неправильном креплении.
Во избежание несчастных случаев к эксплуатации холодильных
установок следует допускать обученных лиц, имеющих свидетель-
ство, выданное квалификационной комиссией. Инструкция по тех-
нике безопасности и обслуживанию должна быть вывешена на вид-
ном месте.
При ремонте арматуры, трубопроводов и оборудования, запол-
ненных хладагентом, следует иметь в виду, что аммиак, хлористый
метил и некоторые другие вещества в присутствии открытого огня
образуют с воздухом взрывоопасные смеси; поэтому проведение
441
сварочных работ воспрещается. При ремонте фреоновых установок
и проведении сварочных работ необходимо пользоваться противо-
газами, так как при разложении фреона в присутствии огня обра-
зуются ядовитые газы.
Транспортирование щелочей и кислот
Для предотвращения несчастных случаев целесообразно щелочи
и кислоты транспортировать и загружать в аппараты с помощью
«транспортного» вакуума, либо специальными насосами. Не допу-
скается в заводских условиях загрузка кислоты в аппарат вручную
из бутылей.
Вентиляционные установки
Приводные ремни, соединительные муфты вентиляционного обо-
рудования, площадки, на которых оно смонтировано и проемы в пе-
рекрытиях должны быть ограждены. Воздуховоды, кронштейны под
вентиляционное оборудование и аппаратуру, зонты и другие виды
вентиляционных систем на рабочих местах и в проходах должны
быть на высоте не менее 1,8 м от уровня пола. Ремонт и чистку
электродвигателей и вентиляторов нельзя проводить до полной
остановки вращающихся частей, для чего необходимо вынуть плав-
кие предохранители.
При обнаружении ударов, шума или вибрации оборудование
должно быть немедленно выключено до полного устранения помех.
ЛИТЕРАТУРА
1. Батурин В. В. Основы промышленной вентиляции. Профиздат, 1956.
2. Временные правила и нормы по технике безопасности и производственной
санитарии для проектирования, строительства и эксплуатации ферментных
предприятий. ВНИИФС, 1967.
3. М а л а к о в Ф. Ф. Основы техники безопасности и противопожарной техники
в пищевой промышленности Пищепромиздат, 1960.
4. Р е й з е н И. С. Техника безопасности и противопожарная техника в хими-
ческой промышленности. Госхимиздат, 1951.
442
ОГЛАВЛЕНИЕ
Предисловие • ....
От авторов . . . .......................................
Введение ......................................................
ГЛАВА Г Ферменты, их свойства и источники получения
Свойства ферментов..........................................
Краткая характеристика ферментов............................
Источники получения ферментов...............................
Определение ферментативной активности ......................
Литература . .......................................
ГЛАВА II. Применение ферментных препаратов в народном хозяйстве
Спиртовая промышленность ...................................
Пивоваренная промышленность.................................
Производство плодово-ягодных соков..........................
Виноделие...................................................
Мясная промышленность.......................................
Рыбная промышленность . . ..........................
Сыродельная промышленность...............................
Хлебопекарная промышленность................................
Кондитерская промышленность.................................
Крахмало-паточная промышленность............................
Текстильная промышленность..................................
Кожевенное производство . .............................
Производство шелка..........................................
Парфюмерная промышленность..................................
Сельское хозяйство .........................................
Коммунальное хозяйство.................................. .
Медицина...............................................’
Литература.....................................................
3
4
6
9
9
19
25
26
33
35
36
38
41
44
45
47
48
50
51
52
53
54
56
56
57
58
59
59
ГЛАВА III. Сырье и оборудование для его транспортирования ... 66
Сырье для производства ферментных препаратов из плесневых грибов,
выращиваемых поверхностным способом ........ 67
Сырье для производства ферментных препаратов из плесневых грибов,
выращиваемых глубинным способом...................................74
Сырье для производства бактериальных ферментных препаратов . . 78
Оборудование для транспортирования сырья........................80
Литература.........................................................96
ГЛАВА IV. Культивирование микроорганизмов поверхностным способом 100
Основные технологические требования................................100
Процессы и аппаратура для поверхностного культивирования . . .108
Технологические схемы поверхностного культивирования . . . .196
Литература............................................................202
Г ЛАВА V. Производство технических и очищенных ферментных препаратов
из поверхностных культур............................................206
Процессы и аппаратура для выделения ферментных препаратов . 207
Технологические схемы производства.................................271
Литература............................................................287
443
ГЛАВА VI. Культивирование микроорганизмов глубинным способом . 291
Основные технологические требования.................................291
Процессы и аппаратура для глубинного культивирования .... 309
Технологические схемы глубинного культивирования................336
Литература.........................................................346
ГЛАВА VII. Производство технических и очищенных ферментных препара-
тов из глубинных культур...............................................348
Процессы и аппаратура для выделения ферментов из культур плесневых
грибов.............................................................348
Выделение ферментов из культур бактерий.........................371
Технологические схемы производства ферментных препаратов . . . 378
Технические препараты ..............................................378
Очищенные ферментные препараты..................................384
Ферментные препараты из отходов други# производств .... 389
Литература........................................................... 391
ГЛАВА VIII. Производство ферментных препаратов за рубежом . . . 394
Производство ферментных препаратов в странах СЭВ................395
Производство ферментных препаратов в капиталистических странах . 397
Аппаратура для производства ферментных препаратов...............403
Литература.........................................................428
ГЛАВА IX. Техника безопасности.....................................429
Технические и санитарные средства борьбы с выделениями органической
пыли и конидий грибов..............................................429
Специальные требования безопасной эксплуатации ферментных заводов 434
Основы техники безопасности при эксплуатации типового оборудования 435
Литература.........................................................442
ВИКТОР ЛЬВОВИЧ ЯРОВЕНКО, КАЛУСТ АКОПОВИЧ КАЛУНЯНЦ,
ЛЕОНИД ИСАЕВИЧ ГОЛГЕР
ПРОИЗВОДСТВО ФЕРМЕНТНЫХ ПРЕПАРАТОВ ИЗ ГРИБОВ
И БАКТЕРИЙ
Редактор А. И. Ковалевская.
Художник М. В. Носов
Худ. редактор С. Р. Нак
Технический редактор Н. И. Матюшина
Корректор Т. Н. Бобрикова
Т-01931 Сдано в набор 31/1 1969 г. Подписано в печать 13/1 1970 г.
Объем 27,75 п. л. Уч. изд. л. 28,56 Формат 60X90/16
Тираж 2000 экз. Изд. '№ 4234 Заказ 826 Цена I р. 61 к.
Тем. план 1969 г. п/№ 37 Бумага № 2
Издательство «Пищевая промышленность», Москва Б-120,
_____________________________Мрузовский пер. 1________________________
Типография НИИМАШ, ст. Щербинка